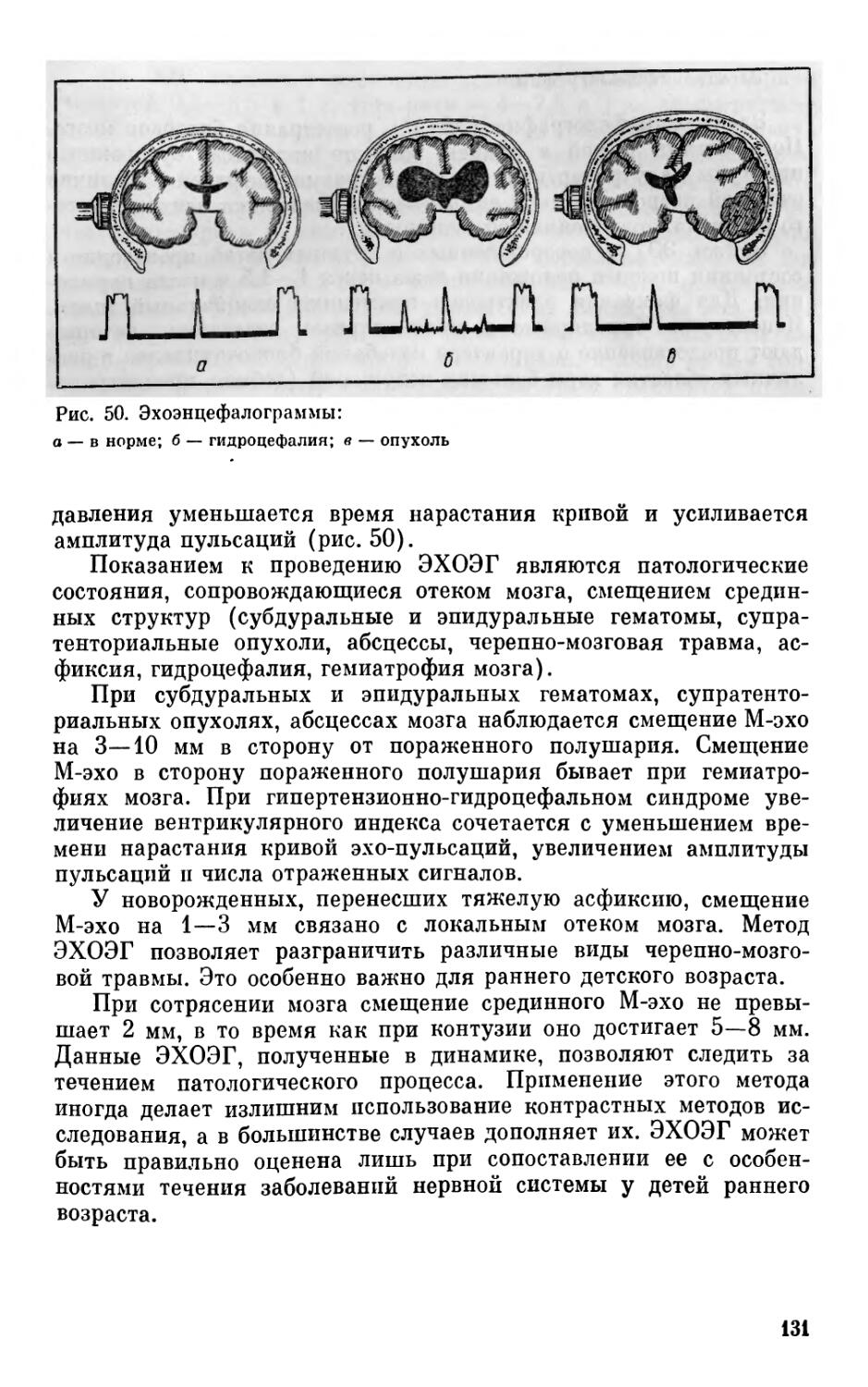
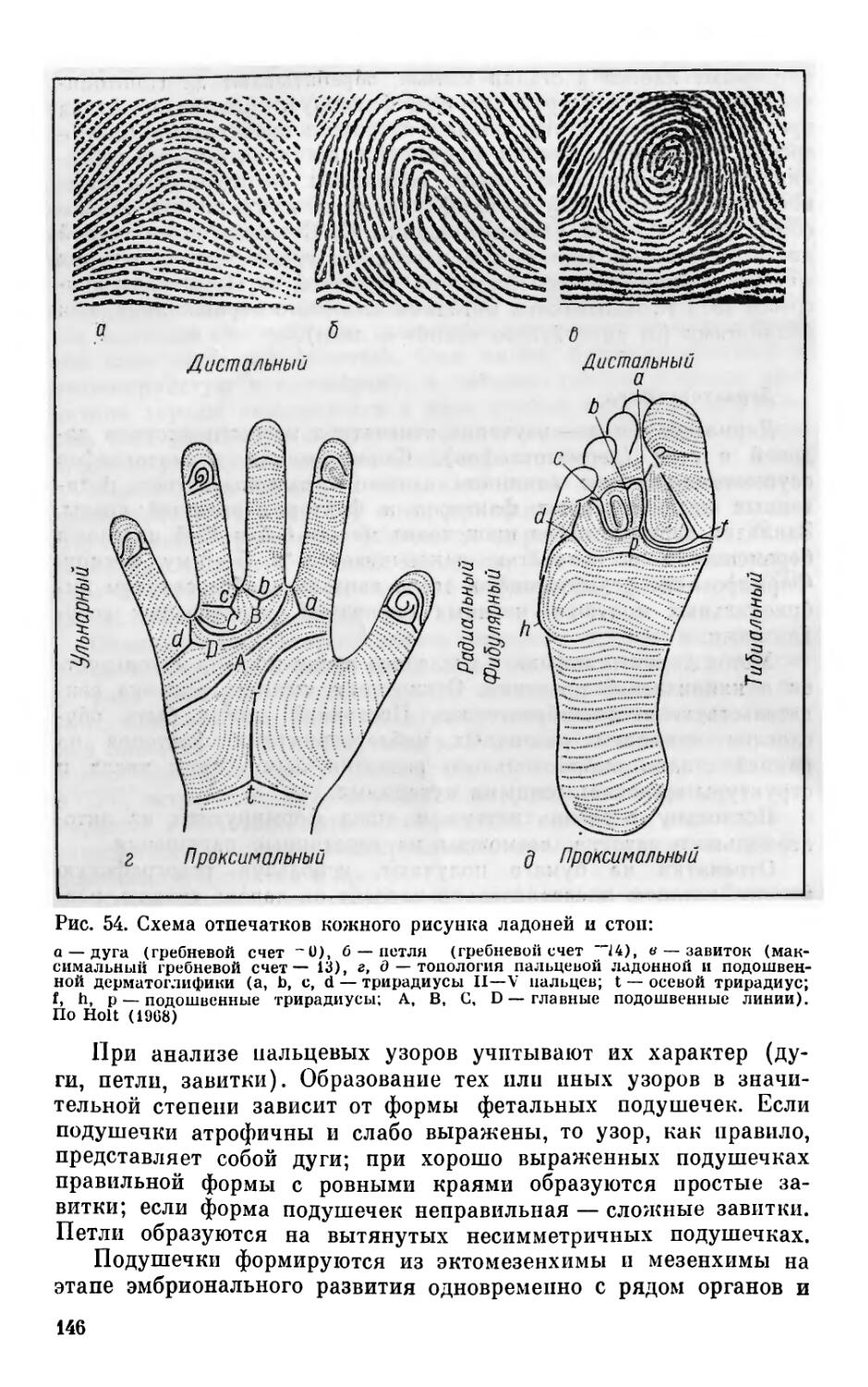
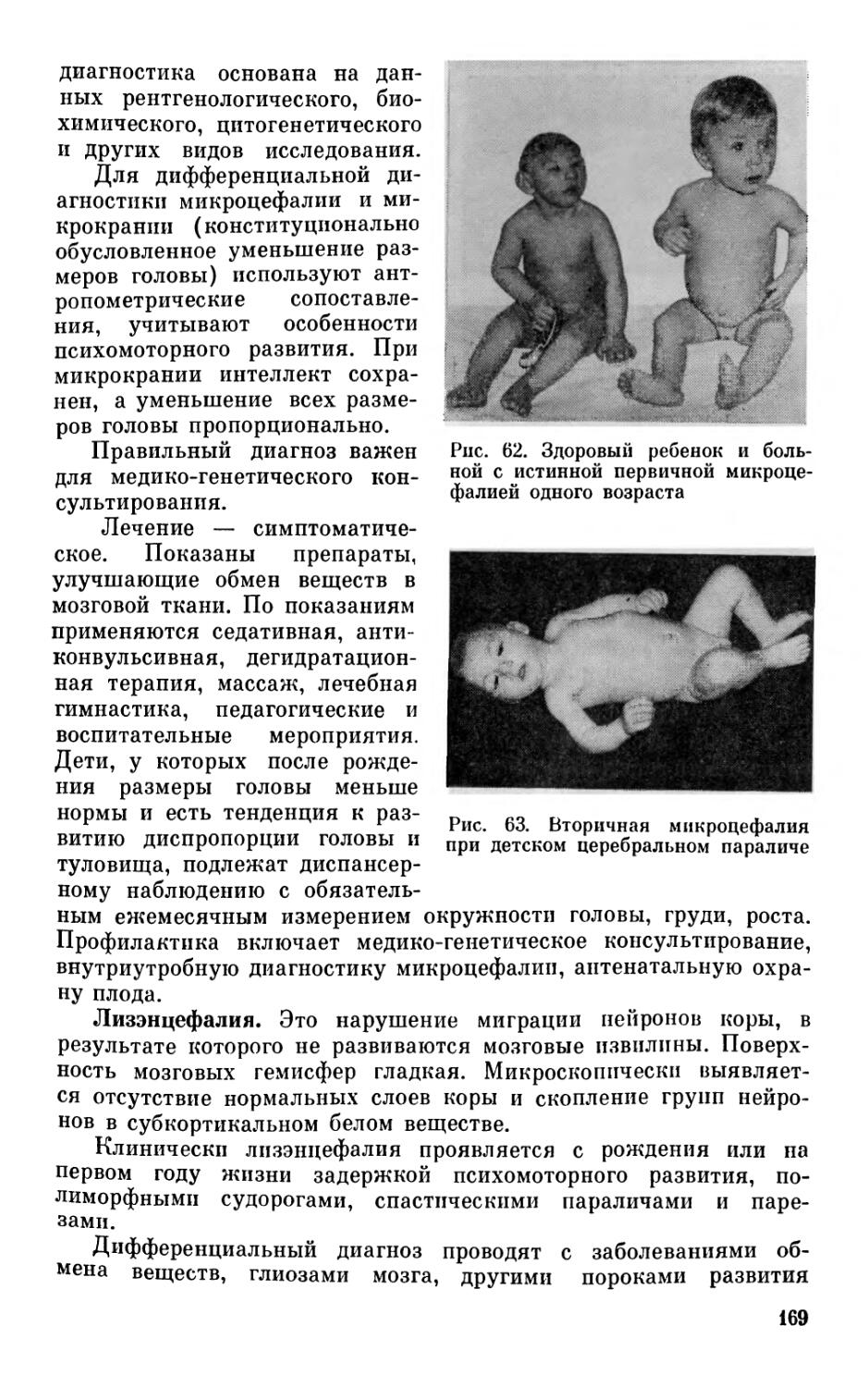
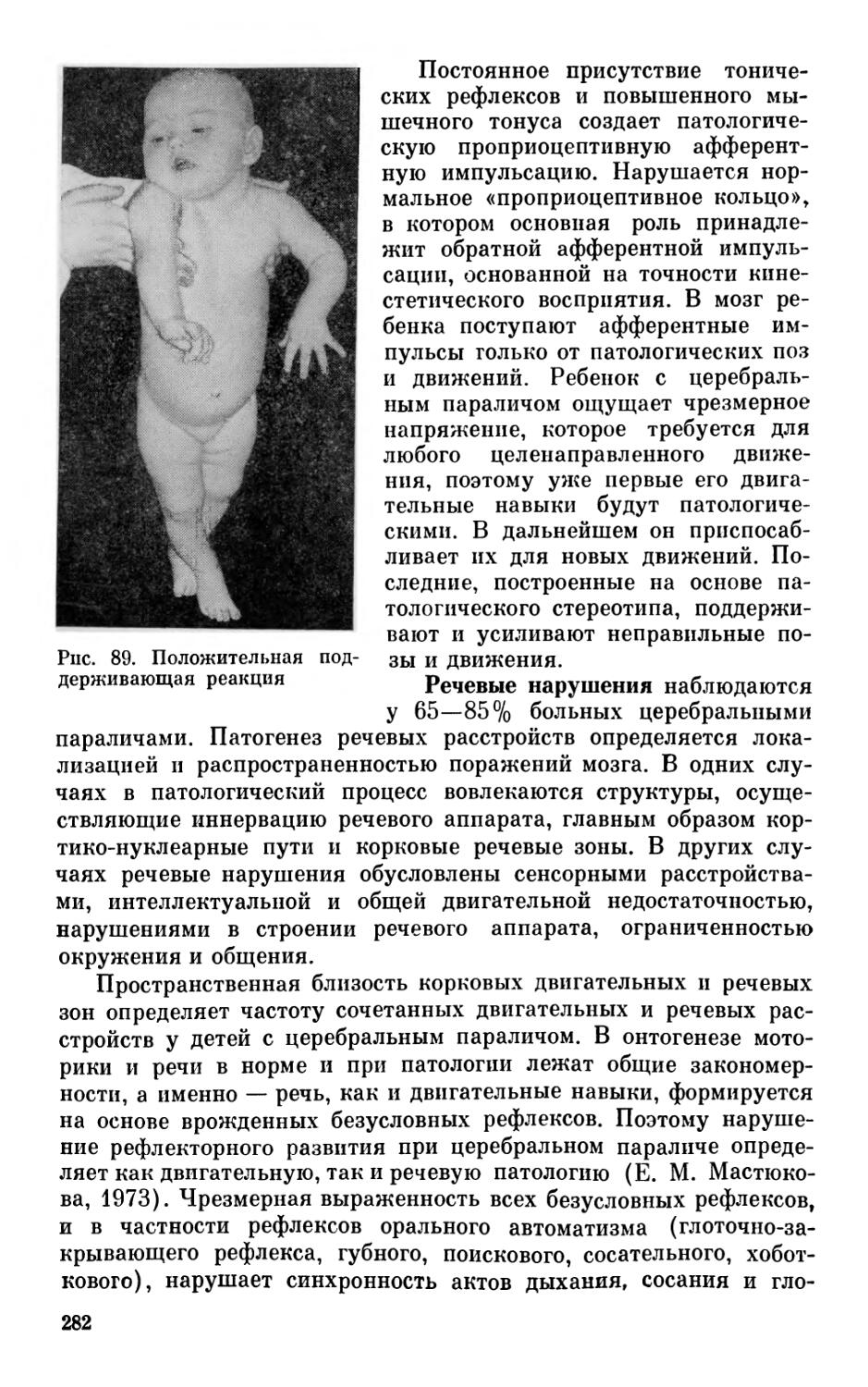
Author: Бадалян Л.О. Журба Л.Т. Всеволожская Н.М.
Tags: фармакология общая терапия токсикология медицина неврология
Year: 1980
Text
Л Ши», .л. Z
«ДОГВО «о невшогнн
НИН8Г0
ДЕТСКОГО NHKD
А.О. Бадалян, Л. Т. Журба, Н.М.Всеволожская
РУКОВОДСТВО
ПО НЕВРОЛОГИИ РАННЕГО
ДЕТСКОГО ВОЗРАСТА
Киев „Здоров’я“ 1980
57.3 + 56.1
618Д + ^17.9
УДК 615.065
Бадалян Л. О., Ж у р б а Л. Т., В с е в о л о ж с к а я Н. М. Руководство по неврологии раннего детского возраста.— Киев : Здоров’я, 1980.-— 528 с. v
Бадалян Л. О.—член-корреспондент АМН СССР, заведующий кафедрой нервных болезней 2-го МОЛГМИ им. Н. И. Пирогова. Журба Л. Т.—кандидат медицинских наук, старший научный >
сотрудник этого же института. Всеволожская Н. М.— кандидат ,
медицинских наук, доцент кафедры нервных болезней лечебного факультета Запорожского медицинского института.
Книга посвящена одной из наиболее актуальных проблем педиатрии — неврологии детского возраста. В ней подробно рассматриваются нервно-психическое развитие детей первых лет жизни в норме и при различных патологических состояниях, формирование двигательных, речевых и психических функций в их онтогенетической связи. Описаны методы исследования нервной системы с учетом динамики возрастного развития и основные заболевания нервной системы, наблюдаемые у детей раннего возраста. С современных позиций освещены этиология, патогенез, < ранняя диагностика. Особое внимание уделено интенсивной терапии, восстановительному лечению и организации специализированной помощи детям раннего возраста с пора- '4‘ * жением нервной системы.
Рассчитана на детских невропатологов, педиатров и врачей других специальностей, работающих с детьми раннего возраста.
Ил. 139. Табл. 12. Список лит.: 519 с.
Рецензенты: д-р мед. наук С. Б. АКСЕНТЬЕВ, д-р мед. наук Е. М. ГРИЩЕНКО
51700-165
М209(04)-80
24. 80. 4124030000
© ИЗДАТЕЛЬСТВО «ЗДОРОВ'Я», 1980
ПРЕДИСЛОВИЕ
Проблемы неврологии раннего детского возраста привлекают настоящее время все большее внимание исследователей; от их }-шения во многом зависит эффективность комплексных мероприятий по охране нервно-психического здоровья подрастающего поколения. Стремительное развитие этой проблемы у нас в стране и за рубежом началось только в последнее десятилетие. Интерес к неврологии новорожденных и грудных детей продиктован возможностью изучить истоки многих заболеваний, начинающихся внутриутробно, в период родов или в первые месяцы жизни, и (упредить их тяжелые последствия.
Совершенствование клинических, биохимических, иммунологических, нейро-рентгенологических и других методов исследования позволило расшифровать ранее неидентифицируемую груп-г > заболеваний, объединявшихся термином «органические пора-: .тпия мозга». Стала возможной диагностика и дифференциальная диагностика многих наследственных и хромосомных синдро-1кв, иммунодефицитных состояний, а также различных заболеваний, обусловленных влиянием на нервную систему неблагоприятных факторов в период беременности и родов.
Физиологическая незрелость нервной системы, эволюционновозрастные особенности развивающегося мозга, недостаточная дифференцированность рефлекторных реакций, отсутствие четких жальных симптомов поражения, большое сходство клинической симптоматики при различных нозологических формах создают значительные трудности при клиническом обследовании и оценке состояния нервной системы ребенка раннего возраста. Для достоверной диагностики требуются не только адекватные методы исследования, большой клинический опыт, но и правильный методологический подход с позиций эволюционно-возрастной динамики развития нервной системы ребенка.
Основное внимание в руководстве уделено заболеваниям, специфическим для раннего возраста— внутриутробным и интрана-тальным поражениям нервной системы наследственного, инфекционного и травматического генеза, освещены влияние этих заболеваний на соматическое и нервно-психическое развитие ребенка, а также критерии ранней диагностики, вопросы лечения и профилактики.
В отдельных главах описаны методы интенсивной терапии при заболеваниях центральной нервной системы и лечебные мероприятия, направленные на стимуляцию возрастного психомоторного развития.
В руководстве обобщены результаты научных исследован проведенных за последние 10 лет на кафедре нервных болезни педиатрического факультета 2-го Московского ордена ЛенвЬ^ государственного медицинского института им. Н. И. Пирогова и опыт организации неврологической помощи детям раннего возра/ ста в Москве. В специализированных клиниках кафедры и Мои ковской консультативной неврологической поликлинике за этот период обследовано более 20 000 детей раннего возраста с различными заболеваниями нервной системы. Для иллюстрации па^ томорфологических изменений в мозге использованы препарат/ из архива центральной прозектуры Московской детской клиничес^ кой больницы № 1 (заведующий — канд. мед. наук А. Г. Таля|-лаев). |
Глава «Ранняя детская нервность» написана доктором медицинских наук Е. М. Мастюковой, а в главах руководства, посвя-) щенных развитию речи и психики, частично использованы материалы ее исследований.
Мы благодарны за помощь в работе над руководством сотрудникам кафедры нервных болезней 2-го Московского ордена Ленина государственного медицинского института им. Н. И. Пирогова и, прежде всего, кандидатам медицинских наук Е. Д. Айн-горн и И. А. Королевой.
Мы надеемся, что руководство окажется полезным для детских невропатологов, психиатров, педиатров и врачей смежны^ специальностей, работающих с детьми раннего возраста. Естественно, что первая попытка обобщения и систематизации столь обширного материала в малоизученной области не может быть лишена недостатков и мы будем благодарны за замечания и пожелания.
Авторы
Хчава I. ЭВОЛЮЦИОННАЯ НЕВРОЛОГИЯ РАННЕГО ДЕТСКОГО ВОЗРАСТА
Развитие нервной системы ребенка — сложный процесс, предопределяемый генетической программой развития и многообразными влияниями среды на плод и ребенка первых лет жизни.
Внутриутробное и постнатальное развитие нервной системы ребенка обусловлено постепенным, поэтапным включением эволюционно более молодых отделов головного мозга и объединением различных регулирующих центров и проводящих путей в функциональные системы, предназначенные для обеспечения жизненно важных функций.
Поэтапность созревания заключается в постепенном переходе от филогенетически древних уровней регуляции к эволюционно более молодым и совершенным уровням, от спинально-стволового и подкоркового уровня к кортикальному. По мере этого происходит усложнение нервной системы, ее функций, возрастает степень морфо-функциональной дифференциации нервных клеток.
Системогенез в общем физиологическом смысле означает поэтапное развитие функциональных систем, обеспечивающее выживание и адекватное приспособление к условиям окружающей среды. Функциональные системы — это замкнутые саморегулирующиеся организации, все компоненты которых путем взаимодействия обеспечивают достижение полезного для организма результата с постоянной сигнализацией о результатах действия. По принципу функциональных систем осуществляется вся деятельность нервной системы (рис. 1). Координация функций основана на сообщении в управляющие центры о том, что делается на периферии. Эта «обратная афферентация» обеспечивает постоянное сличение действия с первоначально заданной программой. Постоянная сигнализация о результатах действия в функциональной системе происходит в первую очередь при участии кинестезий. Кинестезии — своеобразная обратная связь, по которой корковые центры управления осведомляются о выполнении тех приказов, которые посланы на периферию. Без этой обратной связи стало бы невозможным накопление опыта, необходимого для координации функций.
Теория системогенеза дает возможность с новых методологических позиций на основе системного подхода изучить закономерности развития функций здорового и поврежденного мозга.
В историческом аспекте условием возникновения и совершенствования специфической для человека формы деятельности и общения явилось развитие дифференцированных двигательных реакций, в первую очередь развитие руки как органа труда, а
5
Рис. 1. Схема функциональной двигательной системы: I — центральный уровень; II, III, IV —спинальные уровни; V — рецепторный уровень
также речи, которая явилась одним из условий формирования человеческой психики. Для выживания и адекватного приспособления человека к условиям окружающей среды необходимо становление и совершенствование дифференцированных двигательных реакций, речевой и психической деятельности в их сложной функционально-динамической взаимосвязи.
С другой стороны, различные элементы нервной системы могут объединяться не по признаку их эволюционного «возраста», а в зависимости от участия в осуществлении той или иной функции. Понятие о функциональной системе определяется как широкое функциональное объединение различно локализованных структур и процессов на основе получения конечного (приспособительного) эффекта (П. К. Анохин, 1975). При этом элементы функциональной системы созревают
одновременно, независимо от того, к каким «горизонтальным» уровням они принадлежат.
Различие темпов формирования отдельных функциональных систем приводит к нерав
номерности созревания их элементов — гетерохронии роста и развития. Подобная гетерохрония наблюдается в пределах каждого
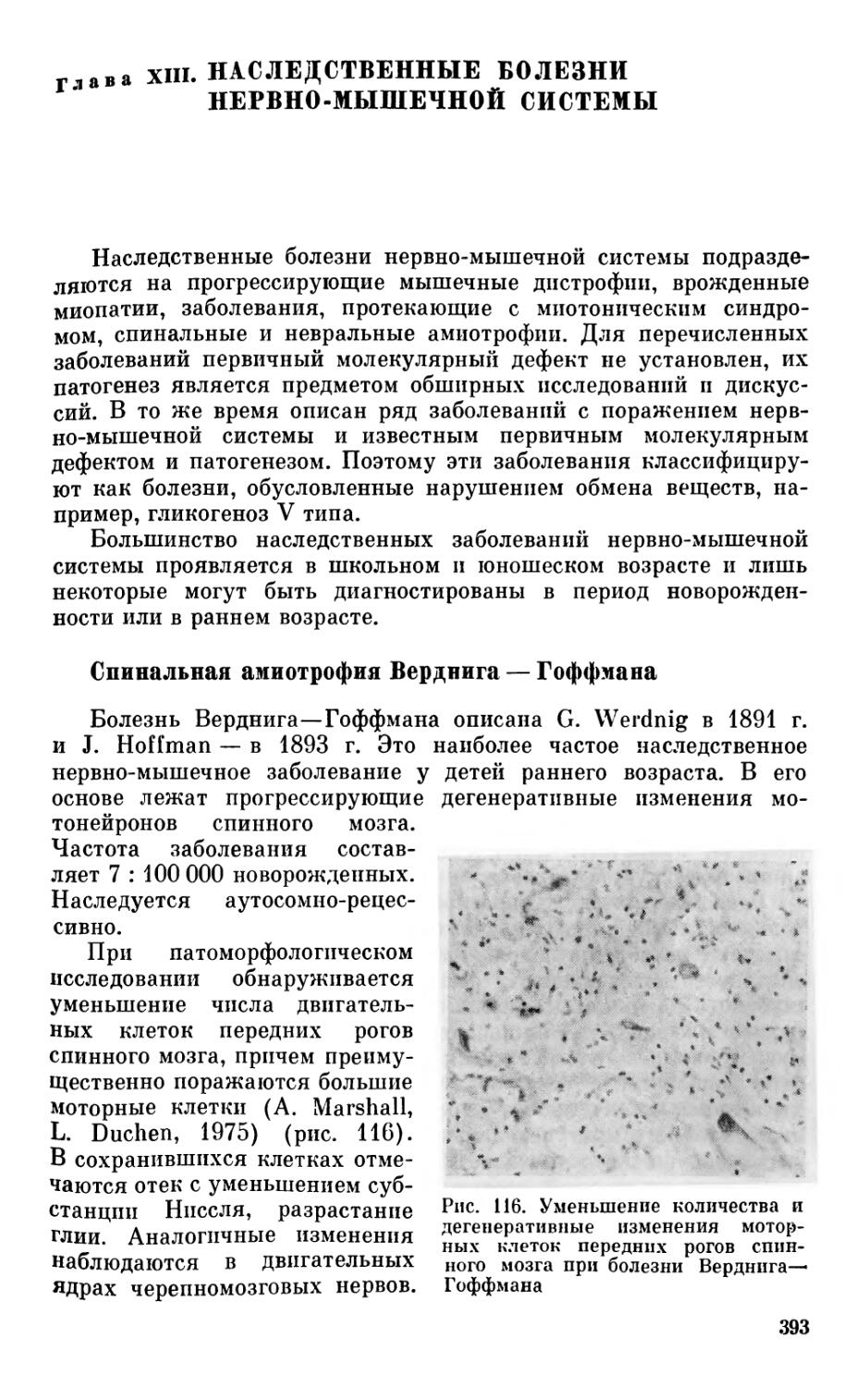
«горизонтального» уровня и даже в пределах одного нервного центра. Наряду со сформированными скоплениями клеток и проводящих путей обнаруживаются морфологически и функционально незрелые структуры. У новорожденных в пределах ядра и волокон лицевого нерва в первую очередь формируются участки ядра и волокна, которые иннервируют мышцы, обеспечивающие акт сосания. Мотонейроны VIII шейного сегмента спинного мозга гораздо раньше обеспечиваются связями со стволом головного мозга, чем соседние спинальные сегменты. Это объясняется участием двигательных клеток VIII сегмента в обеспечении рефлекса схватывания, который срабатывает уже к моменту рождения.
Концепция системогенеза существенно дополнила представ
6
ления о внутриутробном и постнатальном развитии нервной системы, позволила раскрыть сущность многообразных неврологических расстройств у детей раннего возраста. Подверглось пересмотру положение о том, что новорожденный представляет собой незрелое существо, «онтогенетический нуль». В соответствии с особенностями экологии человека новорожденный ребенок «вооружен» достаточным набором функциональных систем, обеспечивающих жизненно важные физиологические акты: дыхание, сердечную деятельность, сосание и т. д. При этом отмечается отчетливая координированность этих актов. Многие функциональные системы мозга оказываются сформированными задолго до рождения и тем самым обеспечивают жизнеспособность в случае преждевременных родов.
К моменту рождения, как правило, достигается минимальное обеспечение функции, усложняющееся в процессе взаимодействия со средой. Исследование безусловных рефлексов показало, что сосательный рефлекс у новорожденного вызывается лишь при непосредственном раздражении ротовой области. В дальнейшем рецепторная зона этого рефлекса расширяется. Положение ребенка под грудью, вид бутылочки с молоком и другие условные раздражители вызывают сосательные движения, открывание рта.
Гетерохрония развития функций мозга позволяет раскрыть сущность парциальных задержек развития (К. В. Судаков, 1976). В клинической практике нередко наблюдаются изолированные задержки формирования тех или иных функций. Наиболее наглядным примером являются различные варианты отставания в двигательном или речевом развитии (рис. 2). Могут наблюдаться моторные алалии и дислалии, дисграфии и дислексии — изолированные задержки формирования центров письма или чтения, обусловленные недоразвитием корковых центров. Встречаются кроме того случаи так называемой моторной дебильности, при которой ребенок, обладая нормальным интеллектом, не в состоянии освоить обиходные двигательные акты: застегивание пуговиц, зашнуровывание ботинок и т. д. Выявление парциальных задержек развития позволяет более целенаправленно проводить коррекционные, лечебные и педагогические мероприятия.
Соотношение генетических и средовых факторов в формировании различных функциональных систем неоднозначно. Становление таких жизненно важных функций, как регуляция дыхания, сердечно-сосудистой деятельности, пищеварения, в норме в основном предопределено генетической программой развития. Результаты исследований однояйцевых близнецов показали, что они чрезвычайно сходны (конкордантны) по показателям частоты дыхания, артериального давления, пульса. Значительно совпадают и сроки формирования таких двигательных актов, как держание головы, сидение, стояние, ходьба. Нередко отмечается отчетливое внутрисемейное сходство в общей организации моторики. Встре-
7
Норма
Задержка развития
///
IV
Запаздывание редукции ранних автоматизмов при сохранении обшей схемы развития
Акцентуация ранних автоматизмов, блокирующих общую схему развития
- примитивная функция;
- промежуточный этап развития функции;
- конечный этап развития функции
Рис. 2. Схема становления двигательной функции в онтогенезе. В норме (I) на фоне угасания примитивной функции развивается более совершенная. Задержка угасания приводит либо к запаздыванию созревания более высокого уровня организации (II), либо, длительно сохраняясь, примитивная функция нарастает и препятствует более совершенной (IV), либо, наконец, на фоне нормального темпа развития конечной функции можно отметить признаки задержки угасания примитивной (-111)
чаются семейные случаи как моторной одаренности, так и двигательной неловкости, «моторной дебильности».
Формирование функциональных систем, связанных с высшей нервной деятельностью, обусловлено в значительно большей степени условиями среды и воспитания. Специальные исследования показывают, что темпы становления зрительного, слухового восприятия, эмоциональных реакций, не говоря уже о речи, существенно зависят от социальной среды. Дети раннего возраста, находящиеся в условиях дефицита зрительно-слуховых раздражений, испытывающие недостаток в контактах со взрослыми, отстают в нервно-психическом развитии. Они отличаются эмоциональной вялостью, пассивностью, снижением познавательной активности.
Наряду с этим наблюдаются двигательные стереотипы, нередко напоминающие акты мастурбации. Подобный синдром часта обозначается как псевдодебильность или госпитализм. Это отста
8
вание является временным, и при соответствующих воспитательных мероприятиях дети «наверстывают» упущенное.
Условия среды, понимаемые в широком смысле, могут оказывать существенное влияние не только на формирование высших корковых функций. Развитие ряда функциональных систем, четко детерминированных генетически, зависит от условий эмбрионального периода и влияния среды в первые месяцы жизни.
Влияние на нервную систему плода физических и химических агентов, особенно промышленных продуктов и лекарственных препаратов, изучено недостаточно. Это обусловлено рядом трудностей. Эксперименты на людях, естественно, невозможны. Перенесенные же на человека данные, полученные на лабораторных животных, не всегда приемлемы, поскольку обнаружена видовая специфичность в реагировании на те или иные вещества. Более того отмечаются внутривидовые индивидуальные колебания в восприимчивости к воздействию тех или иных факторов. Эта индивидуальная особенность организма обусловлена генетически и зависит от нормы реакции. Вредоносный агент вызывает патологические изменения лишь в определенном числе случаев.
Достижения фармакогенетики открывают перспективы в изучении причин индивидуальной вариабельности в реагировании на те или иные химические'вещества, лекарственные препараты. Обнаружено, что генетически обусловленные изменения обмена приводят к неадекватным реакциям на введение определенных медикаментозных средств.
Повреждающее действие физико-химических агентов на мозг плода зависит не только от токсических свойств агента и генетически предопределенных особенностей плода и матери, но и от периода эмбрионального развития. В различные фазы эмбриогенеза нервная система плода может по-разному реагировать на одни^ и те же вредоносные воздействия. Считается, что наиболее ответственным критическим периодом является 5-я неделя внутриутробного развития. Можно предположить, что наряду с глобальными критическими периодами развития плода в целом, существуют критические фазы развития для отдельных функциональных систем. Однако убедительных объяснений того, почему, например, при воздействии одинаковых вредоносных факторов в одном случае у ребенка обнаруживается врожденная атрофия зрительных нервов, а в другом — гиперкинетическая форма детского церебрального паралича, а в третьем — атонически-астати-ческая, до сих пор не найдено. Вопрос о критических периодах в формировании отдельных функциональных систем мозга подлежит дальнейшей разработке (рис. 3).
Повреждающее воздействие различных средовых факторов ня нервную систему плода не всегда проявляется к моменту рождения. В клинической практике нередко встречаются случаи, когда признаки отставания в нервно-психическом развитии обнаруживаются спустя несколько месяцев после рождения. Подобные
9
Рис. 3. Схема формирования в онтогенезе двигательной функции на основе двух примитивных компонентов. В латентный период происходит изолированное формирование примитивных компонентов. В критический период происходит их «комплексирование», в результате которого возникает качественно новая функциональная единица, подвергающаяся затем дифференциации и стабилизации. Отсутствие комплексирования в критическом периоде (II) приводит к обособленному стабильному существованию обеих примитивных реакций. Запаздывание комплексирования (III) сопровождается задержкой дифференциации и стабилизации конечной функции
явления можно объяснить тем, что признаки неполноценности той или иной функциональной системы выявляются лишь в определенном возрастном периоде, когда возникает необходимость в активном осуществлении данной функции.
Анализ раннего онтогенеза показывает, что становление функции нервной системы идет по пути преемственности и стадийности. Для овладения той или иной функцией в полном объеме развитие ребенка должно пройти несколько предварительных этапов, во время которых осуществляется своеобразная закладка фундамента будущей функциональной системы. Так, для форми-^ рования способности к сидению необходимо хорошее удерживание головы, формирование цепных реакций с головы на туловище и с туловища на голову. В свою очередь уверенное удерживание головы возможно при своевременном угасании лабиринтных и шейных тонических рефлексов. В противном случае у ребенка в положении на животе будет доминировать тенденция к сгибанию головы и конечностей, что препятствует подниманию
10
и удерживанию головы. Наблюдая ребенка 2—3 мес с аномальной тонической активностью, можно заранее предположить, что без коррекционных мероприятий его ожидает задержка моторного развития. Неспособность удерживать голову приводит к нарушениям в закладке предпосылок для усложнения двигательных актов: не формируются цепные реакции, зрительно-пространственная координация, контроль за положением туловища и т. д.
Средовые факторы являются важным условием реализации генетической программы развития не только в эмбриональном периоде, но и на этапах постнатального онтогенеза. В этом смысле особый интерес представляют многочисленные исследования, посвященные модифицирующим влияниям среды на врожденные формы поведения. В наблюдениях над животными установлено, что разнообразные зрительные, слуховые, тактильные, температурные и так называемые социальные раздражители, воздействующие в первые часы и дни жизни, способны существенно влиять на поведенческие реакции в течение длительного времени после предъявления. В частности, обнаружен феномен, получивший название «импринтинга», или запечатлевания. Суть его состоит в том, что определенный раздражитель, предъявленный в первые часы или дни после рождения, прочно фиксируется в памяти и в дальнейшем способен устойчиво вызывать ту или иную реакцию, даже если он физиологически неадекватен. Наиболее отчетливо импринтинг обнаруживается у птиц.
Характерной особенностью запечатлевания является то, что оно возникает лишь в течение сравнительно короткого периода жизни — в первые часы, дни, реже месяцы. По истечении этого времени тот же раздражитель способен вызвать лишь ориентировочную реакцию. Наблюдения над млекопитающими показали, что у них явления импринтинга выражены менее отчетливо, чем у птиц, но критический период способности к запечатлеванию оказывается в ряде случаев более продолжительным. Можно допустить, что чем менее автоматизированным является поведение животного, тем менее у него выражена способность к запечатлеванию. В отношении новорожденных детей убедительных данных о существовании импринтинга пока не получено.
В то же время изучение импринтинга позволило установить, что целый ряд средовых условий, воздействующих в ранний постнатальный период, способен значительно видоизменять реактивные системы, влиять на выработку поведенческих норм, хотя в этих случаях запечатлевания как такового не происходит.
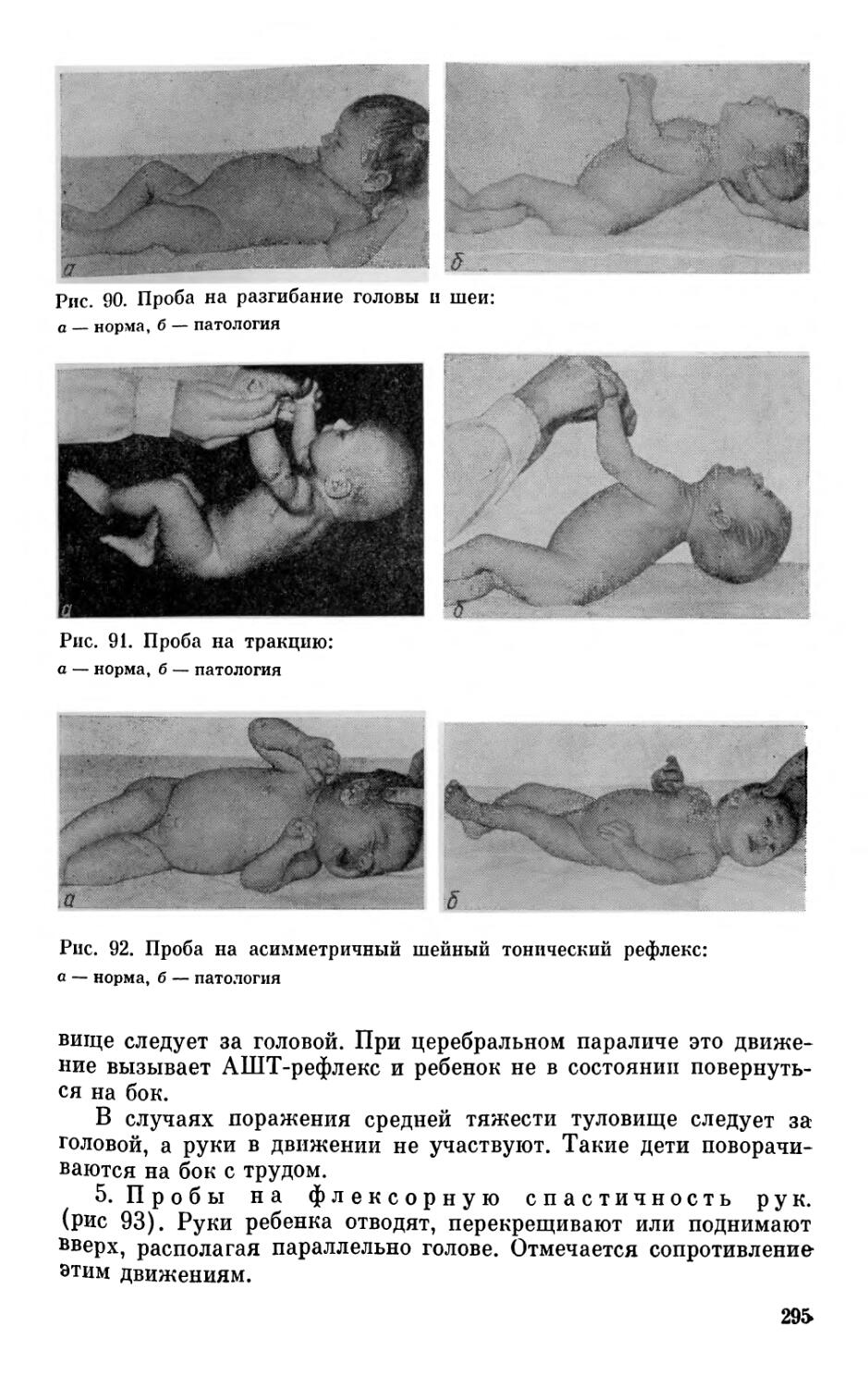
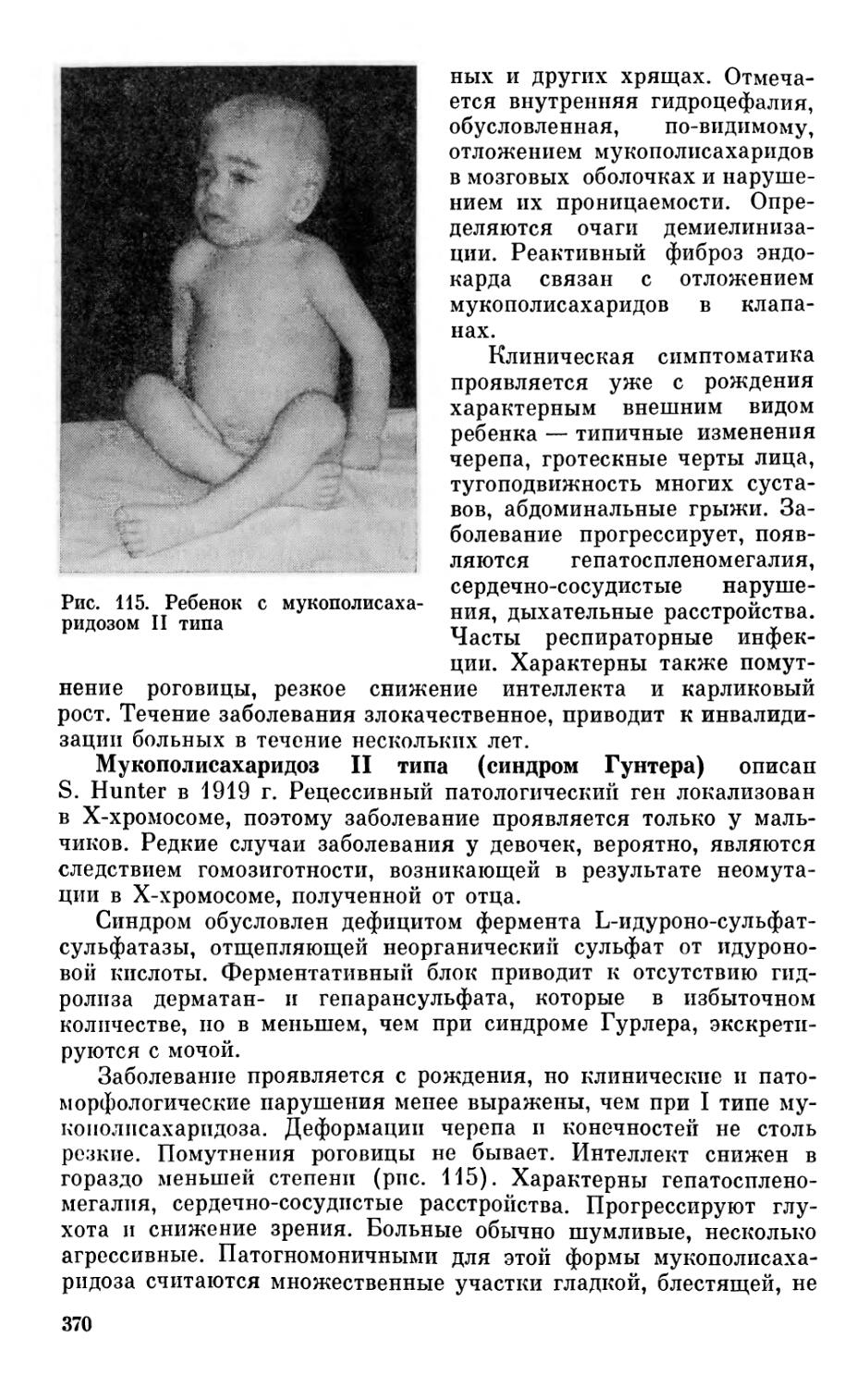
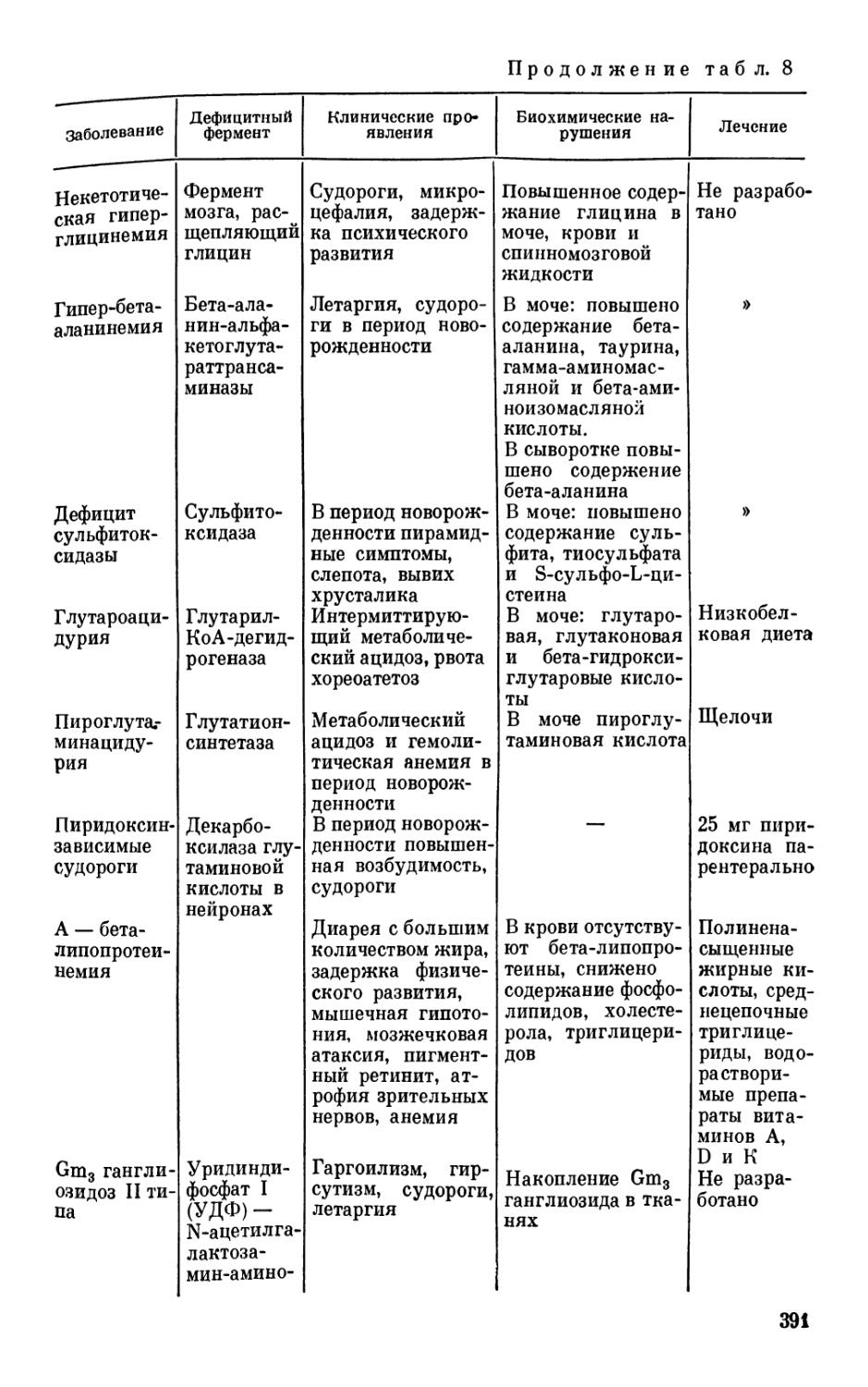
Весьма демонстративна серия экспериментов с ранней изоляцией детенышей обезьян от матери или от сверстников. Детеныши, изолированные от матери, оказывались впоследствии чрезмерно пугливыми, у них слабо был выражен исследовательский инстинкт. В случае ранней изоляции детенышей от сверстников наблюдалось нарушение форм «общественного» поведения: выросшие обезьяны занимали самые низкие ступени в иерархии
И
обезьяннего сообщества, а в дальнейшем у них было слабо выражено сексуальное поведение.
Разумеется, результаты подобных экспериментов можно переносить на человека с большой осторожностью. Каждый вид эволюционно «подогнан» к условиям раннего постнатального развития, поэтому повышенная или пониженная чувствительность к тем или иным влияниям среды не может быть одинаковой у представителей разных видов. Однако детальный анализ средовых влияний на ранний онтогенез ребенка необходим. В настоящее время точно установлено, что специфической потребностью грудного ребенка является постоянный контакт со взрослым. Уже на 3—4-м месяце лицо и голос человека начинают доминировать над другими зрительными и слуховыми раздражителями. Недостаток контакта со взрослыми отрицательно сказывается на нервно-психическом развитии ребенка. В таком же направлении действует сенсорный дефицит вообще — недостаток зрительных, слуховых, тактильных и комплексных обстановочных раздражителей, способных вызывать эмоциональные реакции.
И наоборот, ранняя стимуляция чувствительных анализаторов способствует быстрому созреванию двигательной функции. Установлено, например, что систематическая нагрузка на вестибулярный анализатор в первые месяцы жизни способствует более раннему усвоению навыков сидения, стояния, ходьбы.
Наряду с этим недостаточно выясненным является вопрос о способах и возможных пределах стимуляции развития отдельных функциональных систем. Если подобная стимуляция необходима в случаях отставания в развитии моторики, то остается неясным, приемлемо ли такое искусственное ускорение при нормальных темпах формирования двигательных функций. В настоящее время можно лишь с уверенностью сказать, что поскольку новорожденный ребенок обладает весьма ограниченным набором врожденных форм поведения, специальная организация средовых воздействий в умеренных пределах необходима.
Развитие речи подчинено общим закономерностям системоге-неза. На примере этой важной функции, принадлежащей только человеку, можно попытаться показать роль «включения» отдельных функциональных систем в последовательном становлении ее этапов. Несмотря на то что ребенок родится с органами артикуляции, готовыми к функционированию, однако необходим длительный подготовительный период, прежде чем ребенок овладеет способностью к произнесению членораздельных звуков речи.
Развитие речи начинается с процесса формирования интонации вначале в системе речеслухового, затем речедвигательного анализаторов. Ребенок первых месяцев жизни избирательно чувствителен к звукам человеческого голоса, что имеет большое значение в плане приспособляемости, обеспечивая выживание ребенка только в специфически человеческом социальном окружении. С помощью взрослого ребенок не только удовлетворяет био
12
логические потребности, необходимые для жизни, но и получает многообразные зрительные, слуховые, тактильные, двигательно-кинетические и другие ощущения, являющиеся основой для развития его речи и интеллекта.
Речедвигательный анализатор начинает свое формирование в доречевой период в тесном взаимодействии со слуховым и зрительным анализаторами. Но в то же время доказано, что весь процесс сенсорного восприятия, в том числе и восприятие речи, осуществляется обязательно с участием двигательных импульсов. Поэтому развитие движений у ребенка — важный фактор в формировании его лепета и речи. Например, смена коротких звуков более протяжными звуками гуления, требующими более длительного мышечного сокращения, которое происходит в возрасте 2,5—3 мес, совпадает по времени с новой стадией в развитии движений ребенка. В этот период здоровый ребенок уже хорошо держит голову, поворачивается со спины на бок, начинает тянуться к предмету, ощупывает и осматривает свои руки, может на продолжительное время зафиксировать взгляд и проследить за предметом во всех направлениях. Кроме того, звуки гуления произносятся на выдохе, поэтому они могут быть осуществлены только тогда, когда уже есть двигательная основа для своеобразной тренировки речевого дыхания. Весь дальнейший период становления речи тесно связан с усложнением двигательной функции.
Принцип системогенеза в развитии детской речи проявляется также в том, что семантический уровень развития речевой .системы функционирует сразу по принципу «минимального обеспечения» (Т. Н. Ушакова, 1979), т. е. ребенок вначале начинает понимать, а затем уже произносить слова и предложения, и таким образом система начинает функционировать, обеспечивая приспособление ребенка к специфической социальной среде, не достигнув окончательного созревания.
У детей первых лет жизни имеется количественное несоответствие между понимаемым и используемым активно словарным запасом. Чем меньше ребенок, тем этот разрыв больше. Специальными исследованиями установлено, что речеслуховой анализатор оказывается готовым к функционированию на семантическом уровне, так же как на интонационном, раньше речедвигательного. Речеслуховой анализатор начинает активно функционировать примерно с 7—8 мес, а речедвигательный — к 1 году. Поэтому понимание речи обгоняет развитие произношения. Так, начиная со второго полугодия жизни ребенок, не владея еще ни одним самостоятельным словом, до некоторой степени способен понимать речь взрослых. Существенную роль в этом процессе играют общение со взрослым, развитие ориентировочной деятельности, а также двигательнокинестетический анализатор.
По основным закономерностям системогенеза происходит и формирование экспрессивной речи: ребенок на 2-м году жизни начинает общаться с окружающими при помощи отдельных слов
13
и звукосочетаний, выполняющих для него функцию предложения, добиваясь таким путем конечного результата — речевого общения. Ведущую смысловую нагрузку в таком «высказывании» выполняет интонация. Это еще раз свидетельствует о том, что функциональная речевая система вступает в действие «по принципу минимального обеспечения».
Одним из основных положений теории системогенеза является принцип «экономичности функционирования» системы. Согласно этому положению, система функционирует по принципу динамических временных связей, что позволяет одномоментно включать в деятельность огромное число нейронов и синаптических образований, добиваясь их взаимодействия. Конкретным механизмом взаимодействия компонентов является освобождение их от избыточных степеней свободы, не нужных для получения данного конкретного результата, и, наоборот, сохранение всех тех степеней свободы, которые способствуют получению результата (П. К. Анохин, 1975). Эти закономерности системогенеза могут объяснить принцип лингвистического закона, по которому происходит формирование звуковой стороны речи ребенка. Этот закон в лингвистике проявляется «принципом экономии в артикуляции». Процесс усвоения ребенком родного языка происходит в строго определенной последовательности по мере созревания нервно-мышечного аппарата органов артикуляции.
Необходимым условием функционирования системы в целом является своевременное созревание и включение ее отдельных компонентов. Структурно-функциональная организация механизмов речи достаточно сложна и дефектность любого ее звена приводит к нарушению системогенеза речевой деятельности.
Начальным звеном системы, согласно теории системогенеза, являются рецепторные приборы (рецепторы чувствительности, слух, зрение), воспринимающие исходную информацию. В организации механизмов речи ведущим рецепторным аппаратом служит слуховое восприятие. Неудивительно поэтому, что при его отсутствии или недостаточности процесс становления речи значительно нарушается. Конечным звеном функциональной системы являются эфферентные органы, передающие исходную информацию. В речи это — артикуляционный аппарат. Поражение на этом уровне вызывает различные нарушения звукопроизношения.
Межуточные звенья функциональной системы характеризуются большей пластичностью и способностью к взаимной замене. Согласно теории системогенеза, они включают:
афферентный корковый синтез, где интегрируется полученная мозгом информация. Для речевой функциональной системы эту роль выполняют теменно-височно-затылочные отделы доминантного полушария мозга. На основании экспериментальных и клинических исследований В. Пенфильд и Л. Робертс (1964) пришли к выводу о ведущей роли в осуществлении процесса речи задней височно-теменной области;
14
звено, где реализуется принятие решения и программируется действие. Эту функцию для механизмов речи выполняют премоторнолобные отделы мозга;
аппарат предвидения или так называемый акцептор действия, где составляются программы действия с параметрами реально выполненного действия. Важную роль в функционировании этого звена играют лобные отделы мозга (А. И. Шумилина, 1949; А. Р. Лурия, 1969; П. К. Анохин, 1975; К. В. Судаков, 1976).
Согласно теории системогенеза, при формировании любого приспособительного акта большую роль играет исходная доминирующая мотивация, которая имеет первостепенное значение и в развитии речевой деятельности.
В осуществлении исходной доминирующей мотивации большое значение имеют множественные восходящие активирующие влияния подкорково-стволовых образований на кору головного мозга. Узловым механизмом развития речевой деятельности считается созревание подкорковых восходящих влияний и их динамических взаимодействий.
Различные вредные факторы, действующие в период внутриутробного развития, в период родов или в первые годы жизни, могут нарушить или задержать развитие центральной нервной системы, что в первую очередь отразится на развитии речи ребенка. Речь как наиболее «молодая» функция является наиболее ранимой и ее развитие нарушается под влиянием самых разнообразных неблагоприятных внешних факторов.
С позиций теории системогенеза не представляется возможным рассматривать тяжелые нарушения речи у детей как локальные, изолированные дефекты. Подход к речевой функции с позиции теории системогенеза делает необходимым оценивать развитие речи ребенка в тесной взаимосвязи с формированием его моторики и интеллекта.
Существующая тесная взаимосвязь между развитием речи и мышления проявляется, с одной стороны, в том, что при веек видах речевых нарушений у детей могут создаваться неблагоприятные условия для развития их интеллекта и нередко личности в целом. С другой стороны, при всех формах умственной недостаточности обычно имеет место и речевое недоразвитие. В ряде случаев речевые нарушения у детей могут затруднять реализацию имеющихся интеллектуальных возможностей, что является одной из причин неуспеваемости в школе. Все это часто приводит к различным невротическим состояниям, нарушениям поведения, школьной и социальной дезадаптации ребенка.
Однако, рассматривая нарушения речи как проявление задержки развития мозга, не следует оценивать психические нарушения (интеллектуальные и поведенческие) у детей с тяжелыми расстройствами речи только как «вторичные» явления. Задержка развития мозга и сама по себе приводит к нарушению формирования двигательных и сенсорных функций, тормозит развитие
15
гностических и интеллектуальных процессов, обусловливает ряд поведенческих нарушений.
Столь подробный анализ формирования речи имеет целью продемонстрировать, насколько плодотворным может быть системно-эволюционный подход к оценке нормативных показателей и патологических отклонений в условиях стремительного развития нервной системы, характерного для раннего детского возраста. Поиски конкретных закономерностей формирования каждой функциональной системы и узловых этапов становления межсистемных связей являются одной из важных проблем эволюционной неврологии.
Особенности нервной системы новорожденного и ребенка первых 3 лет жизни предопределяют специфику оценки, границы нормы и патологических отклонений. Многие приемы классического неврологического обследования оказываются неприменимыми для ребенка раннего возраста, например, исследование мозжечковых функций, поверхностной и глубокой чувствительности, гнозиса, праксиса. Основой оценки развития мозга и неврологического статуса являются врожденные двигательные автоматизмы и зрительно-слуховые реакции. При этом следует учитывать, что развитие нервной системы в раннем возрасте происходит стремительно. Фактически для каждого месяца жизни ребенка раннего возраста существуют свои специфические нормативные показатели. В связи с этим трактовка патологических отклонений становится весьма динамичной. Например, в 5—6-месячном возрасте открывание рта, сосательные движения при виде яркой игрушки — так называемое оральное внимание — являются физиологичными. Наличие этих же действий у ребенка 7—8 мес рассматривают как признак задержки формирования ориентировочной исследовательской деятельности: в этом возрасте должна преобладать тенденция к захвату предмета руками, ощупыванию его.
Необходимо подчеркнуть важную особенность нервно-психического развития: оно характеризуется не только появлением новых форм реагирования, но и угасанием первоначальных автоматизмов, реакций, действий. Запаздывание в угасании этих архаических форм может служить важным критерием в оценке уровня нервно-психического развития. Более того, не угасшие своевременно автоматизмы во многих случаях способны препятствовать усложнению рефлекторной деятельности, формированию новых межанализаторных связей.
Трудности в оценке нарушений нервной системы у детей раннего возраста обусловлены не только необходимостью постоянной переоценки критериев нормы и патологии в зависимости от возрастного периода, но и нечеткостью топико-диагностических симптомов. Классический топический диагноз, характерный для общей неврологии, нередко очень трудно поставить у детей раннего возраста, особенно 1-го года жизни...Это .объясняется тем, что нервная система ребенка находится в стадии активного фор-16
мирования, поэтому симптомы выпадения отдельных функций могут быть весьма неотчетливыми. Кроме того, созревание отдельных структур происходит посистемно, а функциональная система включает в себя элементы различной локализации. В связи с этим недоразвитие системы проявляет себя прежде всего дефицитом определенной функции, в котором не всегда возможно выделить ведущий уровень поражения. В качестве примера можно привести варианты длительных нарушений, при которых имеет место системное недоразвитие многих структур, участвующих в формировании двигательных актов. Этим детский церебральный паралич существенно отличается от классических двигательных
пирамидных, экстрапирамидных или мозжечковых синдромов.
Детский церебральный паралич является не только примером трудностей топической диагностики, но и иллюстрацией еще одного характерного варианта патологии нервной системы ребенка раннего возраста, а именно: искаженного развития. Помимо тотальной или парциальной задержки развития, когда ребенок по своим показателям в общем может быть приравнен к более младшему возрасту, встречаются варианты, качественно отличающиеся
по совокупности тех или иных признаков от установленных параметров нормы. В этом смысле детский церебральный пара
лич — не просто отставание в моторном развитии, а качественно особое состояние, характеризующееся стойкой фиксацией аномальных позо-тонических рефлексов, извращением взаимосвязей между двигательными центрами, нарушением взаимодействия систем регуляции произвольных и непроизвольных движений. В течение первых 2 лет жизни, по мере созревания новых регуляторных центров, эта разбалансированность может нарастать, что создает видимость прогредиентности заболевания.
«Псевдопроцессуальность» — еще одна характерная черта неврологической патологии раннего детского возраста. На самом деле прогрессирование дефекта связано не с наличием текущего патологического процесса, а с нарастанием декомпенсации, обусловленным все большим несоответствием между возможностями нервной системы и требованиями, предъявляемыми к растущему организму. Такая «псевдопроцессуальность» особенно наглядна в случаях умственной отсталости, когда создается видимость, что с течением времени ребенок все больше отстает в интеллектуальном развитии. В действительности объем интеллектуальных возможностей нередко увеличивается, но в еще большем темпе растут требования, предъявляемые к умственным способностям.
Особенностью патологии нервной системы у детей раннего
возраста является неадекватная компенсация имеющегося дефекта, или «архаическая гиперкомпенсация». Первичные стереотипы ответных реакций фиксируются очень прочно. И если даже они предназначены для восполнения временного дефекта, после
компенсации они по прежнему могут оставаться доминирующими. Это
своес!^а§^йй^8номе] с патологической фиксации.
Кра:нггэ L-паменч
17
м
ил институт
Наряду с неадекватной стойкостью выработанных рефлексов встречается и повышенная ранимость недавно усвоенных навыков.
Нервно-психическое развитие детей раннего возраста подвержено отрицательным влияниям не только соматических, но и психических потрясений. Различные внешние факторы могут вызвать у него «псевдоорганические» расстройства: недержание мочи, косоглазие, недержание кала, головные боли, расстройства речи вплоть до мутизма, различные жалобы на боли, недомогание и т. д. «Псевдоорганическими» эти расстройства условно названы потому, что в их основе лежат не очаговые поражения нервной системы, а функционально-динамические нарушения по типу невротических, истероподобных.
Среди неврологических заболеваний раннего возраста особую группу составляют болезни, обусловленные генными мутациями и характеризующиеся искажением программы развития. Наряду с заболеваниями, сопровождающимися отчетливой неврологической симптоматикой, встречается немало наследственно обусловленных нарушений обмена, которые проявляются прежде всего отставанием в психомоторном развитии и нередко — судорожным синдромом. В подобных случаях часто возникают диагностические затруднения, поскольку не обнаруживается видимых причин замедленного развития ребенка: акушерский анамнез благополучен, в неврологическом и соматическом статусе не выявляется существенных изменений и т. д. Использование биохимических экспресс-тестов и детальное клиническое исследование позволяют установить характер нарушений, определить прогредиентный характер заболевания, развившегося на фоне видимого благополучия. В этих случаях речь должна идти не о начале болезни, а о ее клиническом дебюте после латентной доклинической фазы.
Оценка уровня развития нервной системы ребенка раннего возраста должна быть не обобщенной, а дифференцированной, структуральной, так как одни функциональные системы формируются быстрее, другие — медленнее (феномен гетерохронности развития мозга).
Наиболее важными объектами дифференцированной оценки являются восприятие (особенно зрительно-слуховое), моторика, эмоциональные реакции, контакты со взрослыми («социабель-ность») и речевая деятельность. На 2-м году жизни особое внимание уделяется таким показателям, как исследовательская деятельность, строительные и подражательные игры, общение со сверстниками. На 3-м году жизни следует оценить такие показатели, как подражательная деятельность ребенка, сюжетные игры, активный контакт с детьми, стремление к самостоятельности и независимости, общение с окружающими при помощи речи.
Глава II. ИССЛЕДОВАНИЕ НЕРВНОЙ СИСТЕМЫ У ДЕТЕЙ РАННЕГО ВОЗРАСТА. СИНДРОМЫ ПОРАЖЕНИЯ
Исследование нервной системы у детей раннего возраста имеет специфические особенности, связанные с возрастной физиологией этого периода развития. Отсутствие речи, неумение передавать свои ощущения, выраженность общих реакций, заметное преобладание общемозговых симптомов над очаговыми создают трудности в оценке неврологического статуса ребенка. Поэтому исследование нервной системы детей раннего возраста требует специальных знаний, большой наблюдательности и умелого подхода к больному ребенку.
Наиболее интенсивно нервная система развивается на первом году жизни. На основе врожденных реакций, обеспечивающих в основном биологическое существование, происходит формирование сложных форм деятельности. Усложняются и качественно изменяются движения ребенка, речь, психика. В связи с этим неврологическое обследование должно строиться с учетом динамики развития (Л. Т. Журба, 1968; A. Thomas и др., 1960; A. Peiper, 1962; Н. Prechtl, Д. Beintema, 1964).
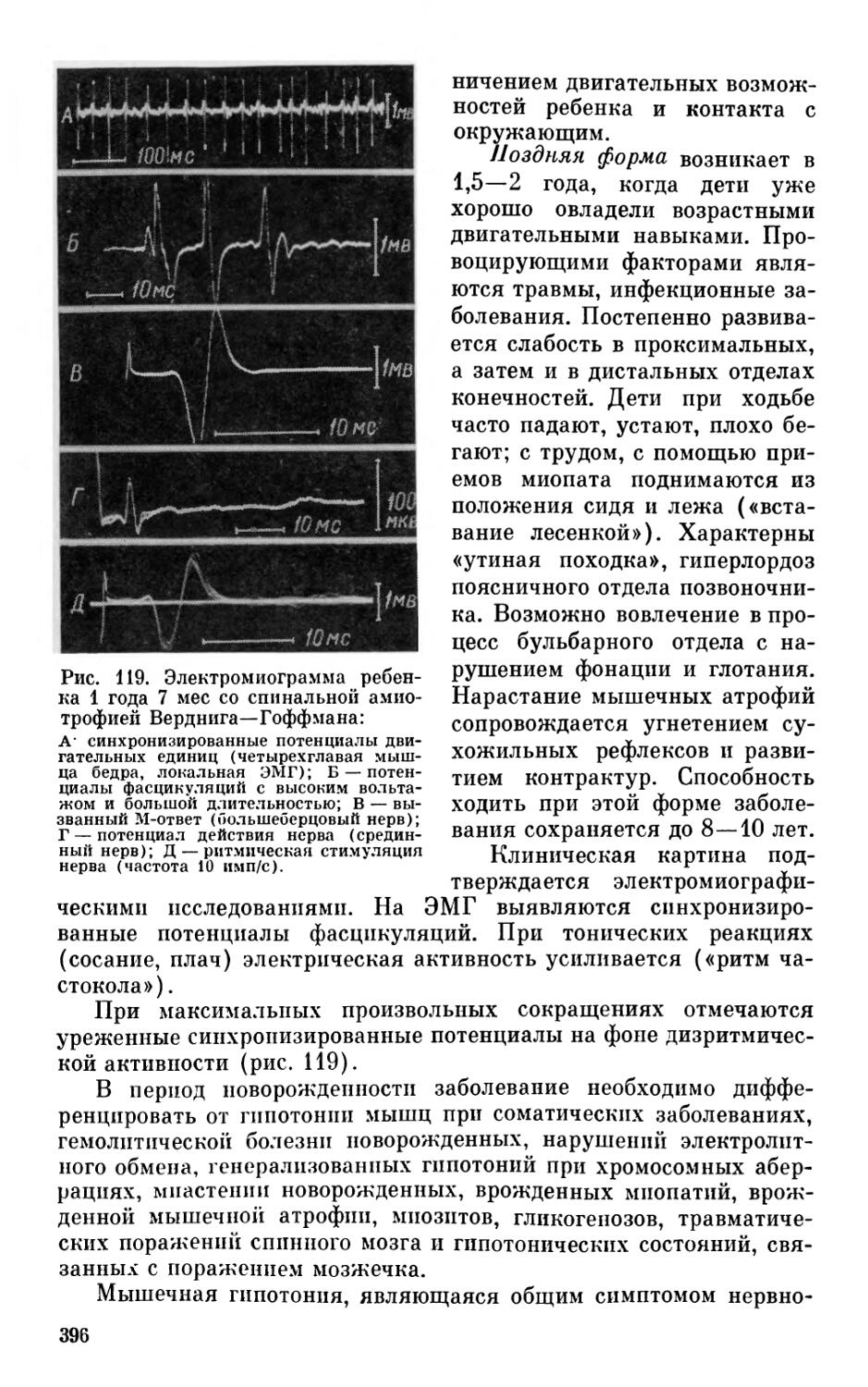
Обследование ребенка включает анализ анамнестических данных, общий осмотр, оценку неврологического речевого и психического статуса, вспомогательные методы диагностики (рис. 4).
Анамнез
В клинике неврологии раннего детского возраста сбору анамнестических данных следует уделять особое внимание, поскольку дифференциальная диагностика неврологических нарушений в этом периоде крайне затруднена из-за неспецифичности клинических проявлений и неумения маленького ребенка дифференцированно выражать свои ощущения. В этих обстоятельствах сведения, полученные от родителей и из медицинских документов, освещающих историю родов и предыдущего развития ребенка, имеют большое значение для установления характера заболевания.
Врач должен выяснить, когда появились первые признаки патологии — непосредс'? зенно после рождения или спустя определенный промежуток времени, начало болезни было острым или постепенным, какова дальнейшая динамика неврологических симптомов. Имеет значение уровень психомоторного развития ребенка до момента выявления неврологических нарушений.
В связи с тем что причиной многих заболеваний нервной системы у детей раннего возраста является патология пренаталь-
19
Допплеросо-нограт ЗЭГ эко -эг РЭГ эмг Рентгенография
Окулист s Отиатр Психиатр Психолог Логопед ' ' Нейрохирург
Нейрохирургические методы
Биохимические методы
Аминокислоты Липиды
Ферменты Гормоны
Катехоламины Иммуноглобулины Микроэлементы Другие
ЛикОородиагностика
Пнебмознцыралография
Аксиальная компьютерная томография
Контрастная рентгенодиагностика ликворных путей
Ангиография каротидная вертебральная
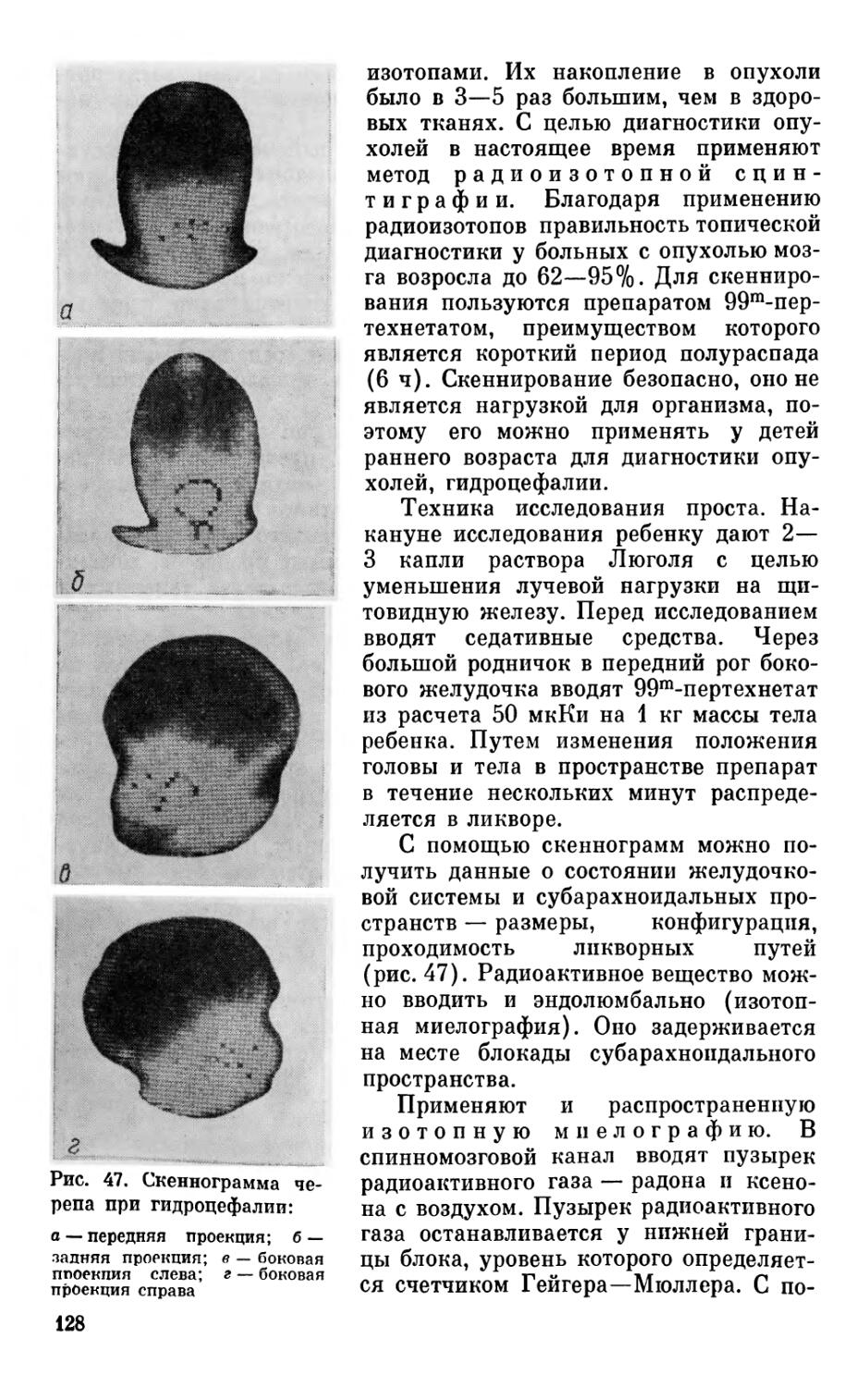
Радиоизотопное скенниродание
Рис. 4. Методы исследования в неврологии
ного и перинатального периодов, следует собрать подробные анамнестические сведения, касающиеся беременности и родов. Определенную роль в возникновении перинатальной патологии может играть возраст матери к моменту рождения ребенка. Известно, что у женщин старше 30 лет более трудно протекают роды, особенно первые. С возрастом происходит гормональная перестройка организма, которая может влиять на развивающийся плод. Статистические данные показывают, что с увеличением возраста женщины растет частота хромосомных аберраций у новорожденного. Отрицательные воздействия на плод могут быть обусловлены производственными вредностями. Радиоактивное облучение, сверхвысокие частоты, химические реактивы, с которыми мать соприкасается на производстве, иногда дают мутагенный и тератогенный эффект. Профессиональные вредности и возраст отца имеют меньшее значение в перинатальной патологии, хотя и в этих случаях физическое и химическое воздействие может вызывать изменения в половых клетках и явиться причиной патологии у ребенка.
Следует тщательно проанализировать акушерский анамнез матери. Наличие дисменореи, самопроизвольных выкидышей, преждевременных родов позволяет заподозрить гинекологическую патологию или другие заболевания. В частности, многие энзимо-патии, гормональные расстройства могут приводить к преждевременному прерыванию беременности.
20
Анализируя течение беременности, важно отметить наличие токсикоза I и II половины, степень его тяжести. Выраженный токсикоз II половины с явлениями нефропатии часто сопровождается хронической гипоксией плода. Это отражается на внутриутробном развитии и течении родов. При токсикозах I половины отчетливой корреляции с перинатальной патологией не обнаруживается, хотя возможно отрицательное воздействие на развивающийся плод.
Среди заболеваний матери заметное влияние на плод могут оказывать пороки сердца, почечная недостаточность, сахарный диабет, тиреотоксикоз. Даже при относительно хорошем состоянии матери во время беременности развитие плода при этих заболеваниях иногда нарушается.
Важно обратить внимание на вирусные инфекции, перенесенные во время беременности. Общеизвестно тератогенное влияние* вируса краснухи, причем тяжесть врожденных дефектов плода зависит от срока беременности, во время которого мать перенесла краснуху. Чем в более ранние сроки было заболевание, тем тяжелее возникшие осложнения. Патогенное воздействие на плод оказывают вирусы гепатита, гриппа. Имеет значение также токсоплазмоз.
В происхождении перинатальной патологии определенная роль принадлежит несовместимости матери и плода по иммунологическим факторам. При этом резус- и групповая несовместимость могут оказывать неблагоприятное влияние на плод даже при отсутствии клинических проявлений гемолитической болезни новорожденных.
При сборе анамнестических данных следует также учесть, принимала ли мать во время беременности лекарственные препараты, которые могли бы нарушить внутриутробное развитие плода.
Существенной частью анамнеза является характеристика родов. Следует выяснить их продолжительность, длительность безводного периода, применяемые методы стимуляции и оперативного родоразрешения. Патологическое течение беременности и родов — наиболее частые причины развития гипоксии плода и асфиксии новорожденного.
О тяжести состояния ребенка при рождении косвенно свидетельствуют длительность асфиксии, применение реанимационных мероприятий, их характер и эффективность, оценка по шкале Апгар и динамика состояния в родильном доме.
Для определения состояния новорожденного в течение 1-й минуты после рождения можно пользоваться шкалой Апгар* (табл. 1). В том случае, если в родильном доме была желтуха, необходимо выяснить, на какой же день она возникла, каковы ее интенсивность и продолжительность.
Имеют значение данные о наличии неврологических нарушений в период пребывания ребенка в родильном доме, времени его выписки или перевода в специализированное учреждение.
21
Таблица 1. Шкала Апгар
Признак Оценка
0 1 2
Частота сердцебиения Отсутствует Менее 100 в 1 мин Свыше 100 в 1 мин
Дыхательные движения Отсутствуют Слабый крик. Единичные дыхательные движения Дыхательные движения хорошие. Крик громкий
Мышечный тонус Отсутствует Незначительные сгибания в конечностях Конечности согнуты, активные движения
Рефлекторная возбудимость (в ответ на раздражение подошвы или полости носа) Реакция отсутствует Гримаса на лице Крик, кашель, чихание, движения
•Окраска кожных покровов Синюшная, бледная Туловище розовое, конечности цианотичны Равномерная розовая окраска
Примечание. Сумма баллов от 1 до 3 указывает на тяжелое состояние, от 4 до 6 — средней тяжести, от 7 до 10 — на удовлетворительное.
Следует уточнить, как протекало развитие ребенка после периода новорожденное™. Для его оценки можно использовать табл. 2.
Следует также выяснить динамику росто-массовых показателей, темп увеличения окружности черепа. Полученные сведения позволяют в ранние сроки выявить признаки нарушения психомоторного развития.
Большое значение имеют сведения о родственниках ребенка. При отягощенной наследственности необходимо составить родословную.
Общий осмотр
Прежде чем приступить к неврологическому обследованию ребенка, необходимо провести его общий осмотр.
Осмотр ребенка раннего возраста проводят в спокойной обстановке, исключая по возможности, отвлекающие факторы. Исследование новорожденных следует проводить через 1,5—2 ч после кормления. Температура воздуха в помещении должна быть 25—27° С. Свет должен быть ярким, но не раздражающим, а поверхность, на которой обследуют ребенка, мягкой, но не прогибающейся.
Положительную эмоциональную реакцию у грудного ребенка вызывает тихая ласковая речь, негромкие звуки, яркие игрушки. 22
Таблица 2. Возрастное развитие ребенка 1-го года жизни
Возрастные навыки Возраст, мес
Держит голову в положении на животе 1-2
Держит голову в вертикальном положении 2—3
Следит за игрушкой 1,5-2
Улыбается 1,5—2
Гулит 2-3
Берет игрушку и тянет в рот 3,5-4,5
Поворачивается со спины на живот 5-6
Узнает «своих» и «чужих» 5-6
Лепечет 5-7
Поворачивается с живота па спину 6—7
Сидит посаженный, без поддержки 7-3
Ползает на животе 7-8
Встает на четвереньки 8-9
Садится из положения на спине 9-10
Ползает на четвереньках 9-10
Понимает обращенную речь 8-10
Стоит с поддержкой 8-11
Произносит «мама» и «папа» 10-12
Стоит 10-12
Ходит 10-14
С детьми старше года легче вступить в контакт в игровой ситуации. Отрицательные эмоции (испуг, плач) во многом затрудняют осмотр и интерпретацию его результатов.
Особенности внешнего вида ребенка, изменения строения черепно-лицевого скелета и опорно-двигательного аппарата, пигментные пятна на коже и слизистых оболочках могут помочь в диагностике целого ряда заболеваний.
При осмотре головы врач должен обратить внимание на форму черепа, его размеры, наличие асимметрий, кефалогематомы, нахождение костей друг на друга. У новорожденного череп имеет долихоцефалическую форму, а через несколько месяцев становится брахицефалическим за счет увеличения поперечного диаметра.
После первого года жизни вновь происходит увеличение продольного диаметра.
Чрезмерное увеличение продольного или поперечного диаметра черепа наблюдается при различных патологических состояниях. Так, долихоцефалическая форма черепа часто наблюдается у недоношенных детей и обусловлена деформацией костей при частом укладывании ребенка на бок. Брахицефалическая форма черепа может быть следствием уплощения затылочной кости при
23
длительном лежании на спине. Долихоцефалическая и брахице-фалическая формы черепа наряду с дефектами ухода могут быть обусловлены нарушением внутриутробного развития. В этих случаях деформации наблюдаются с рождения и сочетаются с другими признаками дизэмбриогенеза.
Изменение формы черепа иногда связано с конфигурацией его в период родов, когда происходит нахождение теменных костей друг на друга или лобные и затылочные кости заходят под теменную. Спустя некоторое время после рождения голова принимает нормальную форму. Иногда резкая конфигурация приводит к деформации черепа, которая сохраняется длительное время.
Форма черепа может быть изменена в результате родовой опухоли или кефалогематомы новорожденного. Родовая опухоль располагается в месте предлежания головки плода, имеет тесто-ватую консистенцию и без четких границ переходит в обычные ткани.
Кефалогематома — кровоизлияние под надкостницу. Она четко отграничена и располагается в пределах одной кости, в некоторых случаях бывает двусторонней. Родовая опухоль исчезает в течение первых 2—3 сут. Кефалогематома рассасывается медленно, иногда может нагнаиваться или обызвествляться.
При осмотре необходимо обратить внимание на состояние родничков. Они расположены в области схождения швов. Передний, большой, расположен между лобными и теменными костями, на месте соединения венечного и продольного швов; задний, малый,— между теменными и затылочными костями, на месте пересечения продольного и ламбдовидного швов. Передние боковые роднички на стыках лобной и теменной костей с большим крылом основной и чешуей височной кости; задние — на месте стыка теменной кости с височной и затылочной. Обычно боковые роднички зарастают уже к моменту рождения или в течение первых недель жизни. Малый родничок закрывается к 2—3 мес жизни. Передний родничок при рождении имеет размеры от 2,5 до 3,5 см, затем прогрессирующе уменьшается к 6 мес и в 8—12 мес закрывается.
При патологических процессах, сопровождающихся повышением внутричерепного давления, роднички закрываются позднее или вновь открываются. Малые размеры переднего родничка могут быть вариантом нормы, если они не сопровождаются уменьшением окружности черепа, темпов его прироста и задержкой психомоторного развития.
Во время осмотра необходимо измерить окружность черепа. Нормальные размеры черепа у детей раннего возраста представлены ниже (табл. 3).
Даже при нормальном развитии ребенка могут быть физиологические отклонения от средних величин, которые часто связаны с конституциональными особенностями. Поэтому при клиниче-
2А
ском осмотре надо обязательно обратить внимание на раз- Таблица 3. Окружность головы у детей раннего возраста
меры черепа родителей и ближайших родственников ребенка. Возрастные особенности Возраст Средняя окружность головы, см Пределы нормальных вариантов
черепа обусловлены как ростом и развитием мозга, так При рожде-и развитием всего организма мес в целом. За 1-й год жизни 2 » ребенка окружность головы 3 » увеличивается в среднем на | » 10—12 см. Наиболее интен- g >у сивный прирост у доношен- 7 » ных детей отмечается в пер- 8 » вые 3 мес после рождения, * затем он несколько снижа- ц » ется. Окружность головы у 12 » недоношенного ребенка уве- 13 » личивается быстрее, чем у ? года доношенного, и к концу 1-го года жизни достигает нор- мальных величин. Исключение составляют дети. Если у доношенного ребенка голова 35,5 37,2 39,2 40,4 41,3 42,2 43,4 44,1 44,8 45,3 45,8 46,2 46,6 47,9 49,0 50,0 глубоко не; растет наиб 33,0-37,5 38,7-43,2 42,1-45,9 43,8-47,8- 44,9—48,9- щношенные-олее интен-
сивно в первые месяцы, то у недоношенного это происходит несколько позже, в период выраженной прибавки массы тела. За 2-й год жизни окружность головы увеличивается на 2 см, за 3-й — на 1 см. До 10-летнего возраста прибавляется еще 2—3 см. Таким образом, если при рождении в среднем окружность головы составляет 34—36 см, то к 10 годам она достигает 51—52 см.
При врожденной микроцефалии размеры черепа малы с рож-
дения, черепные швы сужены, роднички или закрыты, или небольших размеров с плотными краями. В дальнейшем отмечается замедленный темп прироста окружности головы, так что иногда у ребенка 2—3 лет размеры черепа почти такие же, как и при рождении. При микроцефалии череп имеет специфическую форму: мозговой череп меньше лицевого, лоб маленький, покатый, линия лба и носа скошена. У таких новорожденных часто имеются множественные мелкие аномалии строения лица и головы.
Прогрессирующее чрезмерное увеличение размеров черепа наблюдается при врожденной или приобретенной гидроцефалии. Оно происходит за счет расхождения черепных швов и увеличения размеров родничков. Мозговой череп значительно преобладает над лицевым, резко вперед выступает его лобная часть. При этом в области висков и лба выражена венозная сеть.
Даже небольшое увеличение или уменьшение окружности черепа у новорожденною по сравнению с возрастной нормой долж-
25-
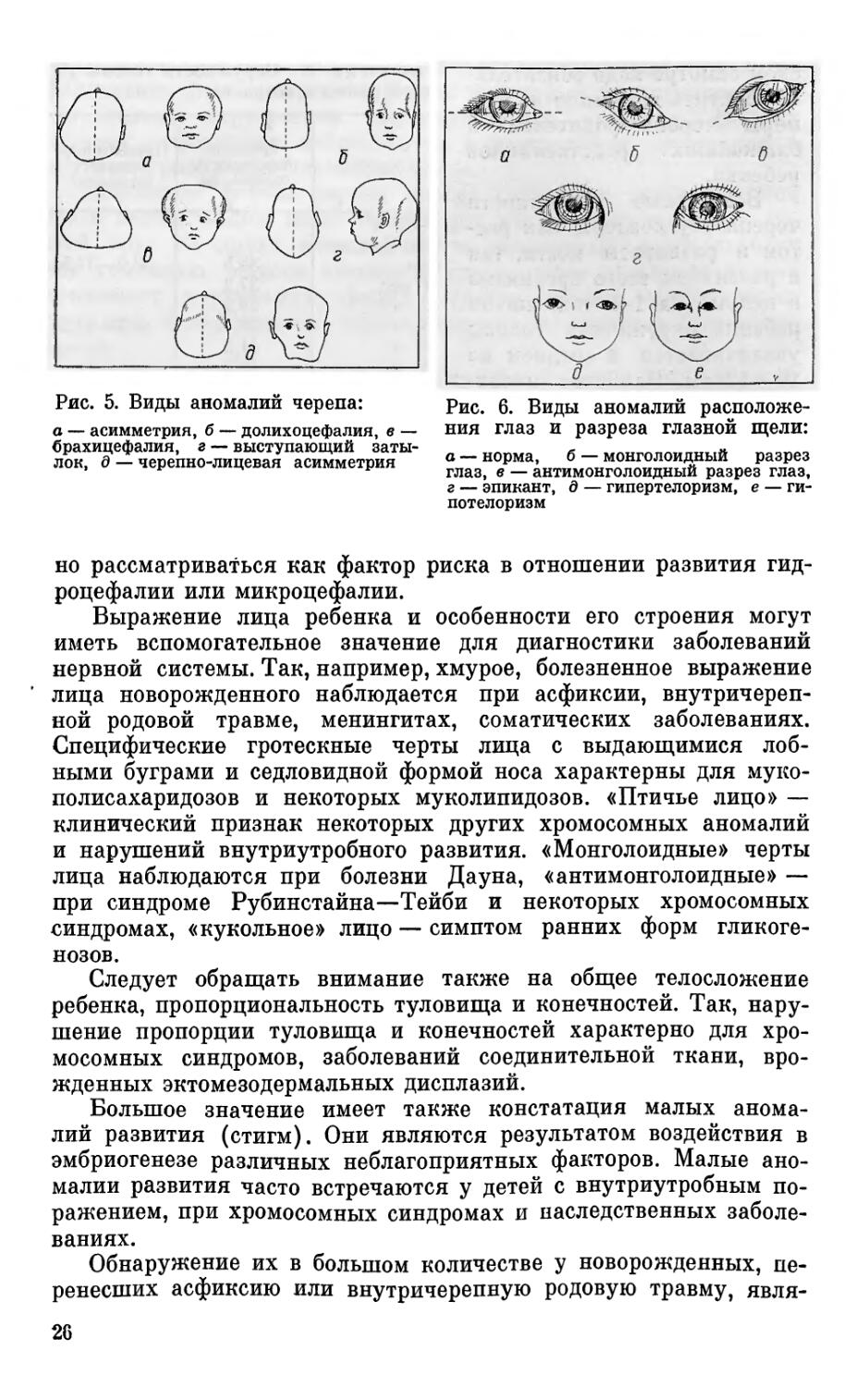
Рис. 5. Виды аномалий черепа:
а — асимметрия, б — долихоцефалия, в — брахицефалия, г — выступающий затылок, д — черепно-лицевая асимметрия
Рис. 6. Виды аномалий расположения глаз и разреза глазной щели: а — норма, б — монголоидный разрез глаз, в — антимонголоидный разрез глаз, г — эпикант, д — гипертелоризм, е — ги-потелоризм
но рассматриваться как фактор риска в отношении развития гидроцефалии или микроцефалии.
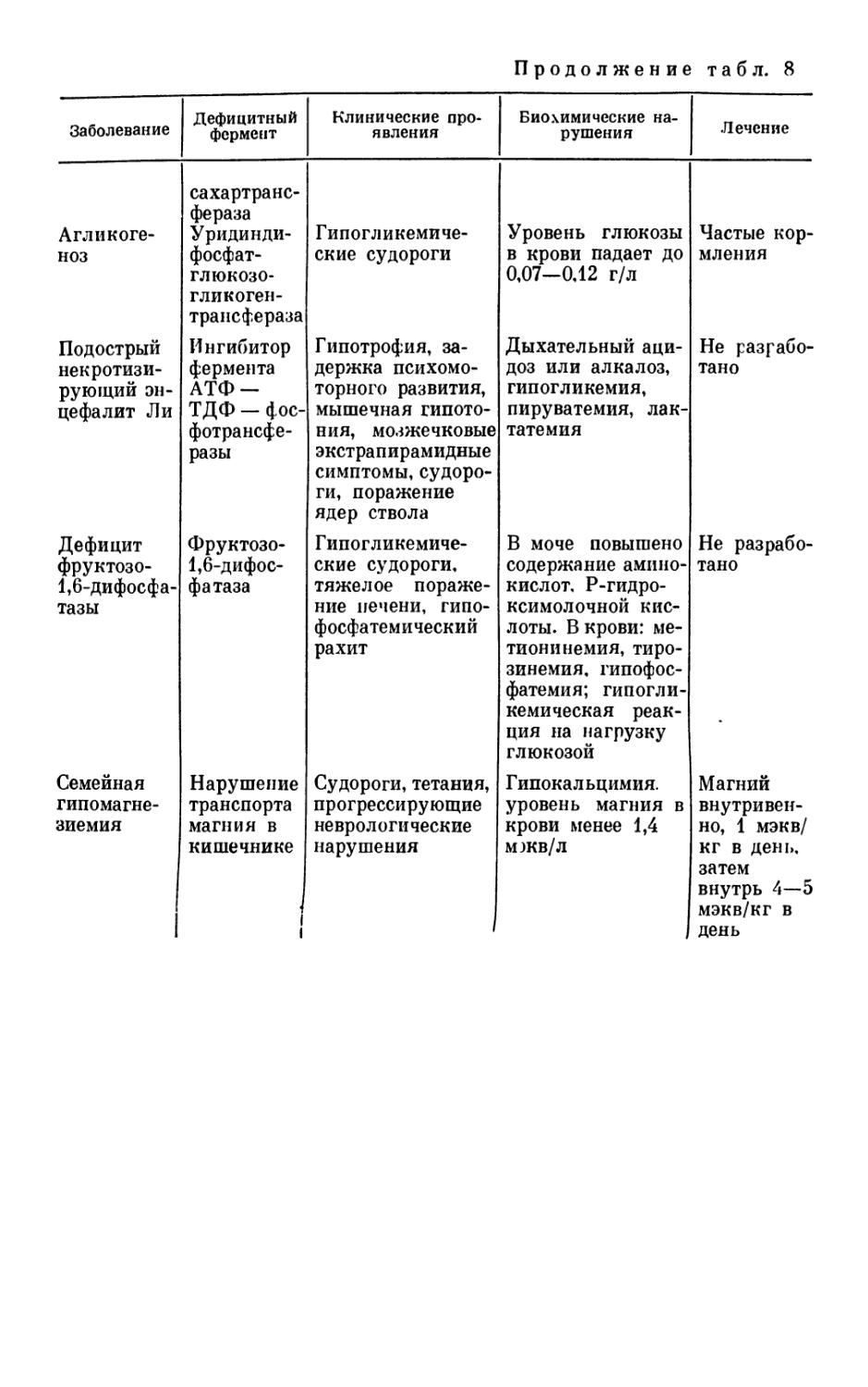
Выражение лица ребенка и особенности его строения могут иметь вспомогательное значение для диагностики заболеваний нервной системы. Так, например, хмурое, болезненное выражение лица новорожденного наблюдается при асфиксии, внутричерепной родовой травме, менингитах, соматических заболеваниях. Специфические гротескные черты лица с выдающимися лобными буграми и седловидной формой носа характерны для мукополисахаридозов и некоторых муколипидозов. «Птичье лицо» — клинический признак некоторых других хромосомных аномалий и нарушений внутриутробного развития. «Монголоидные» черты лица наблюдаются при болезни Дауна, «антимонголоидные» — при синдроме Рубинстайна—Тейби и некоторых хромосомных синдромах, «кукольное» лицо — симптом ранних форм гликоге-нозов.
Следует обращать внимание также на общее телосложение ребенка, пропорциональность туловища и конечностей. Так, нарушение пропорции туловища и конечностей характерно для хромосомных синдромов, заболеваний соединительной ткани, врожденных эктомезодермальных дисплазий.
Большое значение имеет также констатация малых аномалий развития (стигм). Они являются результатом воздействия в эмбриогенезе различных неблагоприятных факторов. Малые аномалии развития часто встречаются у детей с внутриутробным поражением, при хромосомных синдромах и наследственных заболеваниях.
Обнаружение их в большом количестве у новорожденных, перенесших асфиксию или внутричерепную родовую травму, явля-
26
Рис. 7. Готическое нёбо
ется основой для интерпретации этих состояний как вторичных, развившихся на фоне нарушения внутриутробного развития. Клиническая оценка малых аномалий развития важн мозга у детей, поскольку и кож.
Рис. 8. Аномалии расположения и-формы ушей:
а — низко расположенные ушные раковины; б — асимметричное расположение ушных раковин; в — дарвиновский бугорок; г — приросшая мочка уха; 0 — отсутствие завитка; е — заостренная-ушная раковина
а для диагностики заболеваний , и нервная система развиваются
из эктодермального зачатка.
Ниже приводится перечень наиболее часто встречающихся малых аномалий развития у детей раннего возраста.
Череп: асимметричный, долихоцефалический, брахицефаличе-ский, выступающий затылок, черепно-лицевая асимметрия, прогнатизм, микрогнатия и другие дефекты развития верхней и нижней челюсти (рис. 5).
Глаза: монголоидный разрез, антимонголоидный разрез, эпи-кант, гипертелоризм, гипотелоризм, микрофтальм, узкая глазная щель, изменения радужной оболочки глаз (колобомы, гетерохро-мия), неправильная форма зрачка (рис. 6).
Рот: микростомия, макростомия, «карпий рот», высокое нёбо, готическое нёбо, уплощенное нёбо, неправильная форма зубов (рис. 7).
Уши: низкое стояние, асимметричное расположение, различная величина, большие оттопыренные, маленькие, прижатые к черепу, аномалии строения завитка и противозавитка (рис. 8).
Шея: короткая, крыловидные складки, кривошея.
Туловище: длинное, короткое, деформации грудной клетки,, большое расстояние между сосками, диастаз прямых мышц живота, низкое стояние пупка, пупочная и паховые грыжи.
Кисти: брахидактилия, арахнодактилия, синдактилия, короткий изогнутый V палец, поперечная борозда на ладони, сгибательная контрактура пальцев.
27
Рис. 9. Аномалии развития кистей и стоп:
а — брахидактилия; б — арахнодактилия; в — синдактилия; г — искривленный ми-зинец; д — поперечная борозда ладони; е — сандалевидная щель; ж — двузубец; з — трезубец
Стопы: двузубец, трезубец, сандалевидная щель, синдактилия, брахидактилия, арахнодактилия (рис. 9).
Половые органы: крипторхизм, фимоз, недоразвитие полового члена, пахово-мошоночная грыжа, увеличение клитора, недоразвитие половых губ.
Кожа: гемангиомы, депигментированные пятна, избыточное оволосение, большие родимые пятна с оволосением.
Наличие у одного ребенка нескольких стигм (5—7) в области головы, лица, туловища и конечностей определяется как высокая степень стигматизации и с большой долей вероятности дает основание думать о нарушении эмбриогенеза (рис. 10, 11, 12, 13).
Цвет кожных покровов отражает общее состояние ребенка. Постоянно выраженный цианоз обычно свидетельствует о патологии дыхательной и (или) сердечно-сосудистой систем. Преходящий цианоз может быть признаком поражения нервной си-
28
Рис. 10. Сочетание сандалевиДной щели и двузубца
Рис. 11. Сочетание прогнатизма, низкого расположения и аномалии строения ушной раковины
Рис. 12. Сочетание прогнатизма с аномалией развития ушной раковины
Рис. 13. Сочетание эпиканта, аномалии роста волос и ушной раковины
29
стемы. Множественные точечные геморрагии, располагающиеся в области лица, склер и в меньшей степени на туловище, наблюдаются у детей, родившихся в асфиксии. Длительная желтушная окраска кожных покровов у новорожденного указывает на возможность билирубиновой интоксикации нервной системы. Различные пигментные пятна характерны для заболеваний, называемых факоматозами, при которых в различные периоды жизни к имеющимся кожным нарушениям могут присоединиться симптомы поражения нервной системы. Одновременное поражение кожи и нервной системы — нейроэктодермальные дисплазии — обусловлены генетически детерминированным нарушением их общего зачатка — эктодермы.
Крупные пятна цвета кофе с молоком на коже наблюдаются при нейрофиброматозе. Яркие пылающие пятна, располагающиеся по ходу одной или нескольких ветвей тройничного нерва,— признак энцефалотригеминального ангиоматоза. Для атаксии^/ телеангиэктазии характерны «сосудистые паучки» (телеангиэктазии) на коже и слизистых оболочках. Особенно ярко они выражены на склерах. Дети раннего возраста, имеющие отчетливые участки гипер- или диспигментации, должны находиться под динамическим наблюдением врача в связи с возможностью развития факоматозов.
Слабопигментированная кожа в сочетании с проявлениями экссудативного диатеза может быть ранним признаком фенилкетонурии, альбинизма. Избыточное оволосение обнаруживается у больных с некоторыми наследственными заболеваниями соединительной ткани. г
Осматривая ребенку, следует обратить внимание на его позу, которая может быть важным диагностическим йризнаком. Для правильной ее оценки необходимо длительное наблюдение за ребенком. Варианты патологических поз: поза опистотонуса — запрокинутая голова, разогнутые конечности; поза «лягушки» — конечности плоско лежат на поверхности; постоянный поворот головы в одну сторону; поза «легавой собаки» — запрокинутая голова, выгнутое туловище, втянутый живот, руки прижаты к груди, ноги подтянуты к животу, поза «балерины» — ребенок стоит, опираясь на пальцы стоп с перекрестом ног на уровне голеней.
Патологические позы почти однозначно свидетельствуют о поражении нервной системы.
Вышеперечисленные признаки не ограничивают всего многообразия возможных вариантов внешних отклонений у ребенка раннего возраста с поражением нервной системы. Однако следует иметь в виду, что любой необычный вариант внешности требует тщательного обследования ребенка с целью выявления патологии внутриутробного развития, хромосомных синдромов, наследственных заболеваний и интранатальной патологии, а также некоторых приобретенных форм болезней.
30
Исследование функций чувствительных анализаторов
Кожная чувствительность. Во внутриутробный период и непосредственно после рождения ребенка чувствительность кожи имеет важное значение для анализа изменений, происходящих во внешней среде. Восприятие контактных раздражений осуществляется главным образом кожей, которая чувствительна к болевым, тактильным и температурным воздействиям.
Болевая чувствительность на механические раздражения у новорожденных развита слабо, особенно у недоношенных, но в течение первых недель жизни она заметно возрастает. У новорожденных порог раздражения для боли значительно выше, чем у детей более старшего возраста. Доношенные новорожденные уже в 1—2-й день после рождения отвечают на укол иглой средней силы отчетливой болевой реакцией в виде локального движения, крика или сморщивания лица. Область лица у новорожденных и грудных детей особенно чувствительна к болевым раздражениям. У недоношенных новорожденных даже сильные уколы иглой могут не вызвать реакции неудовольствия. Постепенно, с возрастом, чувствительность к болевым раздражениям возрастает, и ответная реакция носит генерализованный характер. После 2 мес жизни общая реакция на болевое раздражение уменьшается, а локальные реакции становятся более отчетливыми. Ребенок стремится избавиться от раздражителя, отодвигая раздражаемый участок, совершает движение конечностями или сильным плачем сигнализирует окружающим. К концу 1-го года жизни он может локализовать место раздражения, болевая чувствительность в этот период уже хорошо развита.
Болевая чувствительность к электрическому току у детей раннего возраста ниже, чем у взрослых и детей старшего возраста. Пониженная чувствительность к раздражению электрическим током сохраняется почти до 6-летнего возраста.
Функциональное развитие тактильной чувствительности опережает развитие остальных органов чувств. К концу 2-го месяца внутриутробной жизни устанавливаются первые реакции на тактильное раздражение. В течение последующих месяцев они завершают свое развитие и у плода 7 мес сходны с реакциями у новорожденного ребенка.
Тактильная чувствительность у детей раннего возраста выражена довольно хорошо, но, как и у взрослого, разные части тела неодинаково чувствительны к прикосновению. Наиболее чувствительны лицо, кожа рук, стоп и менее — кожа предплечья, лопаток, груди, живота, спины, бедер и голеней.
В первые 2 мес у детей отсутствует реакция на щекотание: она появляется обычно после 2 мес и с 9 мес имеется у всех детей. Вначале она вызывается с кожи подмышечной впадины, затем — со стоп и шеи в виде неудовольствия, плача, защитных
31
движений, а позднее в форме положительной эмоциональной реакции, улыбки, смеха.
Температурная чувствительность у новорожденного хорошо развита. Он реагирует как на понижение, так и на повышение температуры. Наиболее выражена ответная реакция при разнице между температурой раздражителя и температурой гела 6—7°. При этом новорожденные сильнее реагируют на снижение температуры, чем на ее повышение.
Болевую чувствительность у новорожденных и грудных детей проверяют, нанося раздражение иглой или электрическим током на определенные участки тела. Ответная реакция в виде отдергивания конечностей или общего беспокойства ребенка свидетельствует о сохранности болевой чувствительности.
Тактильную чувствительность исследуют, нанося на кожу раздражение мягким предметом (ватой, кисточкой). В ответ на него возникают общая и местная двигательные реакции. Так, при поглаживании кончика носа появляются сосательные движения, прикосновение к средней части спинки носа приводит к прищуриванию глаз, поднятию крыльев носа и углов рта; раздражение корня языка и нёба вызывает рвотные движения; раздражение круговой мышцы рта вызывает вытягивание губ (хоботковый рефлекс), а прикосновение к векам, конъюнктиве, ресницам — смыкание глаз. Поглаживание внутренней стороны согнутого мизинца приводит к его разгибанию. При продолжающемся раздражении разгибаются и остальные пальцы (кроме большого). Раздражение внутренней поверхности ладони вызывает хватательный рефлекс.
Температурную чувствительность у грудных детей можно исследовать, раздражая различные участки тела пробирками с холодной и теплой водой. На эти раздражения дети отвечают общим беспокойством или местными двигательными реакциями. Слабые температурные раздражения вызывают сокращение мышц лица и движения ног. Более сильные приводят к генерализованной двигательной реакции, сморщиванию лица, крику.
Все вышесказанное свидетельствует о том, что в раннем детском возрасте можно получить только общие представления о расстройстве чувствительности. Определить границы и тип чувствительных расстройств практически невозможно. Поэтому исследование чувствительности у детей раннего возраста не имеет такого значения, как у взрослых.
При некоторых патологических состояниях (менингит, субарахноидальное кровоизлияние, гипертензионно-гидроцефальный синдром) у детей можно отметить гиперестезию кожных покровов. Даже легкое прикосновение к коже вызывает в таких случаях болезненную реакцию, крик, двигательное беспокойство. Из-за боли дети отказываются идти на руки к матери.
Отсутствие реакции на болевые и температурные раздражи
32
тели чаще всего является следствием пороков развития или травм спинного и головного мозга. Снижение болевой реакции наблюдается в прекоматозном и коматозном состоянии, при тяжелых соматических заболеваниях. Описана врожденная нечувствительность к боли вследствие недоразвития чувствительных путей. Нарушение формирования реакции щекотания (ее отсутствие или запаздывание) наблюдается при органических поражениях мозга, хронических расстройствах питания, тяжелом рахите.
Обоняние. Формирование периферической части обонятельного анализатора начинается на 2-м месяце внутриутробного развития и заканчивается к 7-му месяцу. Новорожденный ребенок реагирует на пахучие вещества. Корковый отдел обонятельного анализатора формируется к 2—3 годам. Однако имеются данные, указывающие на то, что еще во внутриутробный период начинается регрессивное развитие обонятельного анализатора и что грудной ребенок ощущает запахи больше, чем дети более старшего возраста и взрослые (A. Turk, 1954). Дифференциация приятных и неприятных запахов возможна уже на 2—3-м месяце постнатальпой жизни, она хорошо выражена в возрасте 4 мес. Возможность дифференциации различных веществ по запаху развивается к 2—3 годам. Прежде чем исследовать обоняние, надо выяснить, нет ли у ребенка врожденных дефектов носовых ходов и перегородки, насморка. Носовые ходы должны быть чистыми и свободными.
Исследование обоняния у новорожденных и грудных детей производится путем изучения реакции на пахучие вещества. Ребенку подносят поочередно пахучие вещества, не раздражающие слизистую носа (мятные капли, настойку валерианы). При этом исследующий вначале сам нюхает эти вещества.
Новорожденные и грудные дети на запахи реагируют неудовольствием: смыкают веки, морщат лицо, кричат, у них учащается пульс и дыхание. Эта реакция становится более постоянной с 3—4 мес. При обследовании детей 2—3 лет можно просить ребенка нюхать пахучие вещества и охарактеризовать их. Для этого должен быть контакт с ребенком.
Снижение обоняния (гипосмия) может быть врожденным, особенно у детей с органическим поражением центральной нервной системы. Оно чаще одностороннее. Временное снижение обоняния обычно связано с воспалительным поражением слизистой носа при катаре верхних дыхательных путей. Постоянная потеря обоняния наблюдается при тяжелой травме головы, воспалении орбиты, опухолях, поражении периферических рецепторов или их врожденном недоразвитии.
Вкус. Периферическая часть вкусового анализатора к рождению уже хорошо дифференцирована. Специфические вкусовые рецепторы у детей расположены на более широкой поверхности, 2 из 33
чем у взрослых. Помимо языка, задней стенки носоглотки и мягкого нёба, они располагаются также на твердом нёбе, слизистой оболочке губ, внутренней поверхности щек. Порог вкусового ощущения у новорожденного ребенка выше, чем у взрослого. На различные вкусовые вещества новорожденные отвечают по-разному. Вещества, обладающие горьким, соленым и кислым вкусом, вызывают сморщивание лица, закрывание глаз, открывание рта, выпячивание глаз, выпячивание губ, выделение слюны, рвоту, двигательное беспокойство. Вещества сладкого вкуса вызывают сосательные движения, причмокивания. В возрасте 2 мес ребенок дифференцирует 4 основных вкусовых раздражителя. В 3-месячном возрасте ребенок может различать разные концентрации одного и того же раздражителя.
Вкусовые ощущения грудных детей тоньше, чем у новорожденных. Если в пищу вводится вещество непривычного вкуса (овощи), то ребенок отказывается есть. Он должен привыкнуть к новому вкусовому ощущению. Родителям надо на этом настаивать, так как ребенок не в состоянии различать полезную и неполезную для него пищу. Точность дифференциации вкусовых раздражителей совершенствуется в течение раннего и дошкольного возраста.
При исследовании вкуса соответствующую сторону языка смачивают сладким раствором, затем кислым и горьким. Раствор наносят с помощью пипеток. Следует споласкивать рот после каждого вещества. Здоровый ребенок сладкое лучше всего ощущает кончиком языка, кислое — боковыми поверхностями, горькое — задней третью, соленое — всей поверхностью языка. Внимание врача фиксируется на мимической и общей двигательной реакции. Дети 2—3 лет дают осознанный ответ в отношении ощущаемого вкуса.
Нарушение вкуса передних 2/з языка отмечается при поражении лицевого нерва, в области корня языка — при поражении языко-глоточного нерва. Поражение продолговатого мозга вызывает вкусовые нарушения, как правило, на одной половине языка, но иногда и с двух сторон. Полное отсутствие вкуса встречается редко. Оно обусловлено врожденной гипоплазией периферических ганглиев. Расстройства вкуса у детей раннего возраста могут быть причиной стойкой гипотрофии.
Зрение. Эмбриональное развитие глаза в общих чертах заканчивается сравнительно рано — к 4-й неделе внутриутробного периода. Однако зрительный анализатор и морфологически, и функционально еще полностью не сформирован.к рождению. У новорожденного центральная часть сетчатки недостаточно дифференцирована, в желтом пятне преобладают палочки. Процессы миелинизации зрительных путей заканчиваются к 3—4-му месяцу жизни. К концу первого полугодия завершается морфологическое созревание центральной части сетчатки. На протяжении
34
первых 3 лет жизни идет непрерывная дифференциация клеточных элементов коры затылочной доли головного мозга, формируются корковые центры, межполушарные ассоциативные связи. В этот период устанавливаются также связи нервных элементов различных сенсорных систем. Формирование зрительных корковых центров заканчивается лишь к 6—7 годам.
В тесном единстве с развитием морфологических структур зрительного анализатора происходит формирование его функций от примитивного восприятия света до тонкой дифференциации мелких деталей и пространственных взаимоотношений. Зрительная система формируется в тесном взаимодействии с развитием головного мозга, становлением двигательных и психических функций.
Новорожденный ребенок реагирует на свет. Он поворачивает голову и глаза к источнику света, жмурится при ярком свете. Это ориентировочный рефлекс на световые раздражения. Если осветить глаза спящего ребенка, смыкание век усиливается. На сильный свет он реагирует беспокойством, громким криком.
У новорожденных, особенно у недоношенных детей, внезапное освещение сильным светом вызывает тонический защитный рефлекс с глаз на шею. Происходит сужение зрачка, смыкание век, отбрасывание головы назад вплоть до опистотонуса (рефлекс Пейпера). Рефлекс ярче выражен в вертикальном положении. У недоношенных детей он сохраняется в течение 4 мес. Этот рефлекс может отсутствовать при нарушении светового восприятия.
Новорожденный хорошо реагирует на свет, но осознанного зрения еще нет. Он не умеет фиксировать взор на предмете, прослеживать, рассматривать, аккомодировать. Все это ребенок приобретает в результате собственного опыта, основанного на взаимодействии зрительного анализатора с другими сенсорными системами.
V На 2—3-й неделе яркий свет уже побуждает ребенка кратковременно удерживать глаза неподвижно на блестящем предмете. Отчетливая фиксация взора на предмете, координированные движения глаз и прослеживание развиваются к 4—5-й неделе, хотя некоторые новорожденные уже с 10-го дня делают попытки следить за движущимися предметами. Голова при этом чаще остается неподвижной. Фиксация взора на предмете и прослеживание, когда эти функции уже закреплены, дают возможность определить объем движений глазных яблок во всех направлениях и обнаружить глазодвигательные нарушения.
Бинокулярное зрение начинает развиваться с 6—8-й недели и уже хорошо выражено к 4 мес. Совершенствование бинокулярного зрения заканчивается в возрасте 6—12 лет.
Одновременно с развитием ориентации и прослеживания развивается способность отвечать на раздражение периферии сетчатки.
2* 35
Первые признаки периферического зрения появляются уже на 2--3-Й неделе, но выраженными становятся с 3 мес; с этого времени ребенок может бросать быстрый взгляд из стороны в сторону.
На 4—6-й неделе развивается визуальное восприятие: ребенок фиксирует взгляд на лице матери, улыбается и отвечает на раздражитель комплексом двигательных реакций. В это время он воспринимает размеры, форму человеческого лица, что может быть использовано при стимуляции развития ребенка. На 2—3-м месяце происходит фиксация и распознавание таких объектов, как бутылочка, соска. В 4 мес видимый предмет ребенок старается взять в руку, то есть развивается зрительно-моторная координация, которая играет важную роль в познании окружающей среды. В 7—10 мес появляется способность распознавать геометрические формы. С возрастом зрительное восприятие становится все более дифференцированным и обобщенным. Ребенок распознает все большее число объектов. Совершенное восприятие формы предмета развивается у детей только в период школьного обучения.
Цветоощущение интенсивно формируется в первые месяцы жизни. Принято считать, что новорожденные не различают цветов. После 2 мес дети могут дифференцировать резко различающиеся цвета. К 6 мес ребенок распознает 4—5 цветов. Последовательность развития цветоощущения следующая: желтый, синий, красный, зеленый цвет. Дети 3 лет обладают вполне развитым цветовым зрением.
Сетчатка и зрительный нерв формируют афферентную часть рефлекторной дуги зрачковой реакции. Зрачковые реакции выражены с рождения. У недоношенных и детей с низкой массой при рождении зрачковые реакции замедлены.
Данные о состоянии различных отделов зрительного анализатора можно получить при исследовании остроты зрения, полей зрения, цветоощущения и глазного дна. Острота зрения у новорожденных и грудных детей оценивается ориентировочно по общей реакции на свет, реакции зрачков на свет и реакции на окружающие предметы. К лицу новорожденного близко подносят источник света. Ответной реакцией является зажмуривание глаз, двигательное беспокойство. Если новорожденного поместить в темной комнате, а сбоку от него или за его головой поместить источник света, то ребенок повернет голову в его сторону. Одновременно при воздействии света проверяют также зрачковые реакции —• прямую и содружественную, для чего закрывают рукой один глаз или оба на 1—2 с. Вначале зрачковые реакции вялые и непостоянные. Поэтому для получения выраженной реакции зрачков лучше пользоваться сильным источником света в затемненной комнате.
Острота зрения у грудных детей проверяется ориентировочно и путем наблюдения — с какого расстояния ребенок узнает мать,
36
видит предмет, следит за ним, пытается схватить его. В возрасте 2—5 мес можно пользоваться ярким диском (шариком) диаметром 4 см, а в 6—12 мес диаметр диска уменьшают до 0,7 см. Диск постепенно приближают к глазам ребенка и отмечают, с какого расстояния он начинает следить за ним или тянется рукой. В этом же возрасте о наличии или отсутствии зрения у ребенка свидетельствует мигательный рефлекс: смыкание век при приближении предмета к глазам. После года об остроте зрения судят по тому, с какого расстояния ребенок узнает окружающих людей, игрушки. В 3 года остроту зрения уже можно определить с помощью таблиц с картинками, которые показывают ребенку на определенном расстоянии (5 м) вначале при обоих открытых глазах, а затем для каждого глаза отдельно. Используется также тест взятия со стола предмета. Ребенок, точно берущий малень-1 кий предмет со стола, обладает хорошим зрением.
Наряду с вышеуказанными приемами для объективной регистрации остроты зрения у детей раннего возраста применяются методы фотопупиллографии, электроретинографии и электроэнцефалографии, исследуется оптикокинетический нистагм. Фото-пупиллография дает возможность регистрировать движения глаза в ответ на световые раздражители различной интенсивности. По изменению ритма электроретинограммы в ответ на световой раздражитель можно судить о наличии и выраженности зрения. Оптикокинетический нистагм основан на слежении глаза за предметами, различными по величине, интенсивности окраски и освещению, расположенными на различном расстоянии.
В случаях, когда при исследовании полей зрения у детей раннего возраста нельзя применить стандартную периметрию, в поле зрения ребенка медленно двигают яркую игрушку, электрическую лампочку, бутылочку. Ребенок поворачивает голову и глаза к увиденному предмету. О сохранности периферического зрения судят также по ориентировке ребенка в окружающей обстановке, при ходьбе, а также по слежению за движением предметов.
Развитие цветового зрения идет параллельно с совершенствованием остроты зрения, но обнаружить его у детей раннего возраста удается значительно позже. Исследование цветового зрения можно произвести только в возрасте 2—3 лет. Перед ребенком раскладывают ярко раскрашенные в основные цвета картинки и просят показать такую же, какую врач дает ему (красную, зеленую) .
Снижение остроты зрения у детей раннего возраста может быть при кровоизлияниях в сетчатку в результате асфиксии и внутричерепной родовой травмы, при врожденной и вторичной атрофии зрительных нервов, врожденной катаракте, колобоме сетчатки, глаукоме.
Фиксация взора на предмете зависит не только от сохранности зрительного анализатора, но и от уровня психомоторного развития ребенка. При заболеваниях нервной системы, протекающих
37
с грубой задержкой психических функций, фиксация взора на предмете может отсутствовать.
Нарушение полей зрения в раннем возрасте является одним из симптомов краниофарингиомы, оптикохиазмального арахноидита. Полная цветовая слепота встречается редко. Дальтонизм — слепота на зеленый или красный цвета — бывает врожденным и встречается чаще. У детей раннего возраста определить его трудно.
Вестибулярная система. Вестибулярный аппарат начинает функционировать внутриутробно очень рано. Перемещение плода в матке приводит к возбуждению рецепторов вестибулярного нерва, которые посылают импульсы к центрам глазодвигательных нервов, двигательным клеткам мозжечка, ствола мозга и спинного мозга. Нормальное функционирование вестибулярного аппарата имеет большое значение для формирования рефлекторных систем мозга в раннем онтогенезе (Б. Н. Клосовский, 1960). Вестибулярный аппарат играет важную роль в развитии выпрямляющих рефлексов туловища и реакций равновесия, обеспечивая ребенку раннего возраста вертикальное положение.
У новорожденного с первых дней жизни можно наблюдать спонтанный, мелкоразмашистый горизонтальный нистагм, который становится более отчетливым при слабых движениях головы. Он обусловлен перевозбуждением вестибулярного анализатора при движении плода по родовым путям.
Вестибулярная реакция на сотрясение головы у детей первых недель жизни проявляется сильным тремором рук. На 1-й неделе он наблюдается в 60% случаев, на 2-й неделе — реже и на 2—3-м месяце исчезает. Функция вестибулярного аппарата тесно связана с работой других отделов центральной нервной системы, поэтому при их поражении возникают сочетанные синдромы.
Исследование функции вестибулярного аппарата проводится при помощи вращательной и калорической проб.
. Вращательная проба. Мать с грудным ребенком на руках или ребенок 2—3 лет вращается на кресле Барани. После 20-секундного вращения (10 оборотов) в течение 20—25 с отмечается нистагм в противоположную от вращения сторону. Наличие постротационного нистагма свидетельствует о том, что оба лабиринта активны. Если имеется раздражение вестибулярного аппарата, нистагм держится дольше. Угнетение функции вестибулярного аппарата проявляется уменьшением продолжительности нистагма или его полным отсутствием.
Калорическая проба более информативна и позволяет оценить каждый лабиринт отдельно. Вливание в слуховой проход воды температуры ниже температуры тела вызывает нистагм в сторону, противоположную раздражаемому уху. При выключении лабиринта калорическая проба не вызывает нистагма с пораженной стороны.
38
При тяжелом внутриутробном поражении вестибулярного ап* парата в постнатальном онтогенезе нарушается последовательность развития антигравитационных механизмов (реакций выпрямления и равновесия). Сниженная активность лабиринтов наблюдается у глухонемых. Одностороннее повреждение лабиринта может быть связано с инфекцией внутреннего уха. Внутричерепное повреждение вестибулярного нерва наблюдается при травме, опухоли. Наиболее частые симптомы поражения — головокружение, нистагм, нарушение координации движений. При тяжелом внутриутробном поражении мозга, асфиксии, внутричерепных кровоизлияниях у новорожденных и грудных детей можно наблюдать горизонтальный, вертикальный, ротаторный нистагмы, рвоту. Головокружение у детей раннего возраста выявить очень трудно, так как это симптом субъективный.
Слух. Ухо новорожденного ребенка морфологически развито, однако имеет некоторые особенности, отличающие его от уха взрослого: короткий наружный слуховой проход, горизонтальное расположение барабанной перепонки, широкая короткая евстахиева труба, наличие эмбриональной ткани в среднем ухе. Слуховые пути от среднего мозга к корковым центрам еще не миелинизированы.
Новорожденный ребенок слышит. Реакции на звуковые раздражители выявляются даже у недоношенных детей. В ответ на громкий звуковой раздражитель ребенок закрывает глаза, наблюдаются реакции испуга, гримаса плача, изменение дыхания, поворот головы к источнику звука. Если глаза новорожденного были закрыты, то он еще сильнее смыкает веки. В отдельных случаях можно зарегистрировать и другие реакции — вытягивание рук, растопыривание пальцев, напряжение мышц лица, открывание рта, сосательные движения, подергивание глазных яблок, наморщивание лба. Вслед за первыми диффузными, примитивными реакциями на слуховые раздражители, характерными для новорожденных и осуществляемыми на субкортикальном уровне, постепенно развиваются типичные ориентировочные реакции. В 3 мес возникает слуховое сосредоточение, в 4 мес ребенок поворачивает голову к источнику звука. К концу 1-го полугодия жизни тонкость дифференциации звуковых раздражителей достигает возможностей взрослого человека. Последующее развитие происходит в направлении дифференцирования словесных раздражителей и продолжается почти до 7-го года жизни.
У новорожденных исследование слуха основывается на кохлеопальпебральном и кохлеопупиллярном рефлексах, которые имеются у здорового ребенка до 4—5 мес.
Кохлеопальпебральный рефлекс: бодрствующий ребенок в спокойном состоянии с открытими глазами в ответ на резкий хлопок, произведенный на расстоянии 30 см от его уха, закрывает глаза. При многократном повторении звукового раздражителя по
39
рог рефлекса повышается. Поэтому неудачные повторные попытки получить ответ на звук не должны сразу служить основанием для заключения о снижении слуха. Необходимо сделать перерыв и снова повторить исследование.
Кохлеопупиллярный рефлекс: в ответ на звуковое раздражение появляется вначале сужение, а затем расширение зрачка.
Исследование слуха с помощью аудиометра у детей раннего возраста также основано на появлении безусловных кохлеопаль-' пебрального и кохлеопупиллярного рефлексов при воздействии звуков определенной высоты и тона.
К 3 годам дети воспринимают шепотную речь на расстоянии 5 м, поэтому можно исследовать остроту слуха обычными приемами. Ребенку одно ухо закрывают рукой, другое — повернуто к врачу. Произносится какое-либо слово, которое ребенок должен повторить. Если он не слышит, расстояние следует уменьшить. Исследование слуха требует иногда длительного наблюдения за ребенком.
Для предварительной оценки состояния слуха ребенка важно получить от матери ответы на следующие вопросы:
слышит ли ребенок, когда его зовут?
как ребенок реагирует на громкий звук? Пугается, вздрагивает, оборачивается или не обращает внимания? Поворачивается ли он в правильном направлении?
интересуется ли ребенок звуками, подобными шелесту бумаги?
обращает ли он внимание на шумы вне комнаты, например, шум паровозного гудка, самолета, лай собаки и т. д.?
любит ли ребенок какие-либо звуки, музыку, радио и т. д.? Любит ли он играть в озвученные игрушки, пытается ли при этом извлечь из них'звук?
дифференцирует ли ребенок шаги и голоса близких?
У грудных детей с поражением центральной нервной системы реакция на звуковой раздражитель значительно запаздывает. Эти нарушения необходимо рано диагностировать, так как с формированием слухового анализатора тесно связано развитие речи. При жалобах на задержку речевого развития обязательно надо исследовать остроту слуха. Отсутствие ответа на звуковой раздражитель при нормальном психическом развитии и неповрежденном среднем ухе может свидетельствовать о врожденной глухоте. Односторонняя глухота чаще бывает при повреждении слухового нерва.
У детей, родившихся в асфиксии, перенесших тяжелую ядер-ную желтуху, может отмечаться избирательная потеря слуха на высокие тона. Такой ребенок слышит, но не может достаточно понять обращенную к нему речь. По своему речевому поведению он напомина!ет умственно отсталого ребенка или ребенка с психическим заболеванием. Тщательйое обследование слуха помо-* гает дифференциальному диагнозу.
40
Первично сохраненное слуховое восприятие, может сочетаться с отсутствием реакции на слуховые раздражители, а частности, на речь окружающих. Так бывает, например, у детей с проявлением аутизма (органической или шизофренической природы), гипердинамическим синдромом. Внешне эти дети могут напоминать тугоухих или глухих детей. Тщательное общее медико-педагогическое обследование помогает дифференциальному диагнозу.
При обследовании слуха и зрения необходимо помнить, чтр ответные реакции зависят не только от сохранности слухового анализатора, но и от уровня нервно-психического развития ребенка.
Исследование двигательно-рефлекторной сферы
Первые двигательные реакции у зародыша человека возникает приблизительно на 3-м месяце внутриутробного развития. Они носят характер изолированных движений руки при открывании рта, связаны с созреванием спинальных рефлекторных дуг, осуществляющих простые локальные рефлексы. На 3—4-м месяце рефлекторные движения зародыша становятся диффузными с участием головы, туловища и конечностей, но при этом они аритмичны и некоординированы, замедлены, с тенденцией отдельных частей тела к длительному тоническому напряжению. Это ранняя спинальная фаза в развитии рефлекторной деятельности эмбриона.
У более зрелых плодов (4—5 мес и старше) диффузность и генерализованность движений постепенно уменьшаются и проявляется склонность к их ограничению стимулируемой областью тела. Это связано с формированием специфических рефлекторных реакций. У плода 5—6 мес уже можно обнаружить рефлексы с кожи, слизистых оболочек, глубокие шейные, лабиринтные и сухожильные рефлексы. Эта фаза обусловлена созреванием элементов рефлекторных дуг, проходящих через продолговатый мозг.
По мере созревания ядерных образований продолговатого и среднего мозга и их связей со спинным мозгом возникают более сложные интегрированные и специализированные реакции. Плодам на поздней стадии развития свойственны ограничение гене-рализованности движений и интеграция отдельных компонентов рефлексов в более сложные специализированные рефлекторные акты.
У новорожденного и ребенка первых 3 мес жизни преобладает непроизвольная двигательная активность. Первые произвольные движения появляются в возрасте 3—4 мес. В дальнейшем происходит их совершенствование. К 3—4 годам жизни движем ния становятся координированными, плавными, ловкими, эконом-» ными. Это достигается благодаря развитию сложной иерархиче-
41
Рис. 14. Симптом «заходящего солнца»
ской системы организации движения, включающей рецепторно-эффекторные образования, сегментарные структуры, пирамидный путь, подкорковые ядра, мозжечок, ретикулярную формацию и кору головного мозга.
Своевременное становление двигательных функций является одним из основных показателей нормального развития ребенка. Это особенно важно для детей первых лет жизни, у которых движения способствуют развитию психических и речевых навыков. Такие простейшие движения ребенка, как поднятие головы, повороты ее в стороны, осмотр вокруг, зрительно-моторная координация, захват игрушки невозможны при умственной отсталости.
И, наоборот, при тяжелой обездвиженности отмечается отставание умственного развития. Движения совершенствуют функции
центральной нервной системы, оказывают значительное влияние на ее структурно-функциональную организацию. Интеллект также зависит от степени двигательных возможностей ребенка.
Исследование двигательно-рефлекторной сферы ребенка должно проводиться дифференцированно, соответственно определенным этапам возрастного развития. Оно включает оценку двигательных черепномозговых нервов, безусловных рефлексов и произвольной двигательной активности.
Исследование двигательных черепномозговых нервов. Глазо
двигательный, блоковидный и отводящий нервы обеспечивают сочетанные движения глазных яблок, движения верхнего века, кон-
вергенцию, аккомодацию и реакцию зрачков на свет.
Движения глазных яблок у новорожденных некоординирова-ны, хотя иногда можно наблюдать и согласованные движения. Вначале движения глазных яблок толчкообразные, но по мере того как ребенок начинает следить за предметом, они постепенно ста
новятся содружественными.
При исследовании функции глазодвигательных мышц необходимо обратить внимание на ширину глазных щелей, расположение глазных яблок. Движения глаз у новорожденных и грудных детей изучаются в процессе наблюдения за ребенком в спокойном состоянии и при прослеживании за движущимся предметом. В первые дни жизни у здоровых новорожденных, чаще чем у недоношен
42
Рис. 15. Парез отводящей мышцы глаз (сходящееся косоглазие) при поражении отводящего нерва
ных, можно наблюдать периодические движения глазных яблок вниз — симптом «заходящее го солнца» (рис. 14). Он может быть спонтанным или его вызывают быстрым перемещением тела из горизонтального положения в вертикальное. Глазные яблоки при этом опускаются вниз и сходятся кнутри. Спустя несколько секунд глаза возвращаются в исходное положение. Этот симптом наблюдается и при ряде патологических состояний — желтухе новорожденных, гидроцефалии, субдуральной гематоме, тяжелой гипоксии мозга. Симптом «кукольных глаз» — поворот головы в сторону вызывает движение глаз в противоположном направлении. Он наблюдается в первые 10— 14 дней жизни до появления у ребенка фиксации взора на предмете. При врожденном парезе отводящего нерва он асимметричен.
Косоглазие характеризуется ограничением подвижности глаза в одном или нескольких направлениях. У новорожденных косоглазие выявляется при наблюдении за спонтанными движениями глазных яблок. Грудным детям показывают яркую игрушку. Когда ребенок зафиксировал на ней взор, игрушку медленно двигают в стороны, вверх, вниз. У детей старше года методика исследования аналогичная. Ребенку предлагают проследить глазами за предметом во всех направлениях. У новорожденных и детей первых месяцев жизни косоглазие может быть физиологическим. Оно нерезко выраженное, непостоянное и по мере развития фиксации взора и прослеживания исчезает.
Патологическое косоглазие может быть содружественным и паралитическим. При содружественном косоглазии в отличие от паралитического сохраняется подвижность глазных яблок, отсутствует двоение. В основе содружественного косоглазия лежит нарушение условнорефлекторной координации движений глаз, возникающее чаще всего в период формирования бинокулярного зрения в раннем детском возрасте. При поражении нервной системы чаще встречается паралитическое косоглазие, которое развивается в результате поражения соответствующих нервов илй мышц.
43
Рис. 16. Расходящееся косоглазие при поражении глазодвигательного
Косоглазие может быть од* постороннее, двустороннее, сходящееся, расходящееся. Сходящееся косоглазие часто связано с вовлечением в патологический процесс отводящего нерва вследствие особенностей его анатомического расположения на основании мозга (рис. 15). При сходящемся косоглазии ребенок не может отвести глаз в сторону и часто поворачивает голову в направлении паретич-ной мышцы, чтобы скомпенсировать слабость отведения. Дети 2—3 лет делают это, чтобы избежать двоения. При врожденном сходящемся косоглазии ребенок с раннего детства адаптируется воспринимать изобра
нерва
Рис. 17. Односторонний птоз при синдроме Клода Бернара-Горнера
жение на несимметричные, но всегда одни и те же участки сетчатки. В центральном зрительном анализаторе они сливаются в одно изображение. Поэтому при врожденном косоглазии нет двоения.
Расходящееся косоглазие наблюдается при поражении глазодвигательного нерва или его ядер, расположенных в глубине среднего мозга (рис. 16). Поэтому расходящееся косоглазие встречается реже, чем сходящееся. Оно чаще одностороннее, сопровождается птозом, мидриазом и легким экзофтальмом.
Причинами косоглазия могут быть разнообразные врожденные и приобретенные заболевания нервной системы.
Птоз у детей раннего воз
раста может быть обусловлен недоразвитием мышцы, поднимающей верхнее веко, аплазией ядра глазодвигательного нерва или не-разделением в эмбриогенезе крыловидной и поднимающей верхнее веко мышц. В последнем случае птоз наблюдается при открывании рта (жевательно-мигательная синкинезия). В меньшей
44
степени он выражен при синдроме Клода Бернара-Горнера, обусловленном поражением целиоспинального центра или отходящих от него симпатических волокон (рис. 17). У новорожденных этот синдром часто сочетается с дистальным типом акушерского пареза руки.
Поражение блоковидного нерва у детей раннего возраста выявить трудно. О нем косвенно можно судить по наличию «глазной кривошеи», когда ребенок компенсаторно наклоняет голову вниз, чтобы избавиться от двоения. Грудино-ключично-сосковая мышца при этом не напряжена в отличие от спастической кривошеи вследствие укорочения мышцы.
Парезы взора обусловлены поражением ствола мозга или коркового центра взора. У детей раннего возраста парезы взора чаще всего бывают врожденными. При повреждении ствола мозга глаза отклонены в сторону, противоположную очагу. При локализации очага в коре головного мозга глаза отклонены в сторону поражения. Парез взора вверх свидетельствует о поражении четверохолмия, парез взора вниз — о поражении области сильвиева водопровода.
Двигательная порция тройничного нерва иннервирует жевательные мышцы. Ее функцию исследуют, наблюдая за положением нижней челюсти при открывании рта, сосании, жевании. Поражение мышц, иннервируемых тройничным нервом, проявляется затруднением сосания. При сосании молоко выливается изо рта, челюсть смещена в пораженную сторону. У детей 2—3 лет можно выявить атрофию и слабость жевательных мышц. Двустороннее поражение кортико-нуклеарных путей и раздражение двигательной порции тройничного нерва вызывает напряжение жевательных мышц (тризм).
Лицевой нерв иннервирует мимическую мускулатуру, мышцы ушной раковины. Вместе с тройничным он обеспечивает у новорожденных акт поиска, захвата груди и сосания — функцию высокодифференцированную к моменту рождения.
О функции лицевого нерва у новорожденных и грудных детей судят по ширине глазных щелей, плотности их смыкания, выраженности носогубных складок во время сосания, крика, улыбки, а также на основании рефлексов, требующих для своего осуществления участия мимической мускулатуры (корнеальный, конъюнктивальный, орбикуло-пальпебральный, поисковый, сосательный, хоботковый). Детей 2—3 лет просят зажмурить глаза, оскалить зубы, надуть щеки, задуть свечу. При этом врач должен сам проделать все движения и попросить ребенка повторить.
Периферический парез лицевого нерва возникает при поражении ядра, расположенного в варолиевом мосту корешка или нерва (рис. 18). На стороне поражения наблюдается расширение глазной щели (лагофтальм— «заячий глаз»). При крике, когда ребенок пытается зажмурить веки, глазное яблоко синергично смещается вверх, радужка уходит под верхнее веко^
45
глазная щель остается несомкнутой (феномен Белла). Угол рта на стороне пареза опущен, носогубная складка сглажена, при плаче рот перетягивается в здоровую сторону. Грубый парез лицевого нерва затрудняет сосание, ребенок не может плотно захватывать сосок, иногда молоко вытекает из угла рта. На стороне поражения угнетен поисковый рефлекс. Поглаживание в области угла рта вызывает рефлекторный поворот головы в сторону раздражителя, а опускание угла рта затруднено. При перкуссии в обг ласти корня носа и верхней орбиты отсутствует рефлекс смыкания век. Корнеальный, конъюнктивальный рефлексы отсутствуют или снижены. У детей 2—3 лет выявляются затруднения при зажмуривании глаз, наморщивании лба, оскале зубов, надувании щек. Ребенок не может сложить губы хоботком.
Поражение нерва в фаллопиевом канале выше отхожде-
Рис. 18. Парез мышц лица при периферическом поражении лицевого нерва
ния большого поверхностного каменистого нерва сопровождается сухостью глаза, ниже его отхождения — усиленным слезотечением.
Периферический парез лицевого нерва может быть следствием аномалии развития ядра лицевого нерва (синдром Мебиуса), врожденной узости фаллопиевого канала. В таких случаях он выражен с рождения, сочетается с другими аномалиями развития (дополнительные ушные раковины, недоразвитие ушной раковины, слухового прохода). Наложение полостных щипцов в родах часто является причиной травмы периферических ветвей лицевого нерва. У детей грудного возраста периферический парез лицевого нерва может осложнять гнойные отиты и мастоидиты, поскольку воспалительный процесс из барабанной полости легко переходит на нерв. Причинами периферического пареза лицевого нерва у детей 1—3 лот могут быть инфекционные заболевания, черепно-мозговые травмы, переохлаждение.
Центральный парез лицевого нерва наблюдается при поражении кортико-нуклеарных путей. Страдает только мус
46
кулатура нижней части лица, что проявляется сглаженностью носогубной складки, перетягиванием рта в здоровую сторону. Центральный парез лицевого нерва диагностировать трудно в связи с тем, что легкая асимметрия носогубных складок у новорожденных и грудных детей часто не связана с поражением лицевого нерва.
Языко-глоточный и блуждающий нервы имеют исключительно важное значение в координировании акта сосания и глотания, поскольку они иннервируют мускулатуру мягкого нёба, гортани, глотки. Исследование функции этих нервов проводится одновременно, так как они имеют общие ядра в стволе мозга и совместно обеспечивают чувствительную и двигательную иннервацию глотки, гортани и мягкого нёба.
Для оценки функции этих нервов у детей раннего возраста необходимо обратить внимание на подвижность и симметричность мягкого нёба, вызвать нёбный и глоточный рефлексы. У здоровых детей они вызываются с первых дней жизни. Сосание и глотание свободные, крик громкий, с коротким вдохом и длинным выдохом (уа...а).
Оценить функцию языко-глоточного и блуждающего нервов у новорожденных и грудных детей можно также, наблюдая за синхронностью сосания, глотания, дыхания. Соотношение сосательных, глотательных и дыхательных движений в норме составляет 1:1:1 или 2:2:1. Нарушение синхронности этих функций, имеющих жизненно важное значение для новорожденных, приводит к замедлению глотательных движений, увеличению интервалов между ними. Избыточное количество пищи в полости рта может вызвать ее аспирацию.
Патологическое состояние, развивающееся при поражении языко-глоточного, блуждающего и подъязычного нервов или их ядер, называется бульбарным параличом. Для него характерны парез или паралич мягкого нёба, нарушение сосания, глотания, фонации. Ребенок поперхивается, жидкая пища выливается через нос, нёбный и глоточный рефлексы отсутствуют или снижены, голос тихий, с носовым оттенком. Односторонний паралич вызывает свисание мягкого нёба на стороне поражения. При фонации язычок отклоняется в здоровую сторону. В мышцах языка обнаруживают атрофию, фибриллярные подергивания.
Бульбарный паралич наблюдается при различных заболеваниях нервной системы, сопровождающихся поражением продолговатого мозга (энцефалиты, полиомиелит, опухоли, черепно-мозговая травма).
При двустороннем поражении кортико-нуклеарных путей наблюдается псевдобульбарный паралич. Так же, как бульбарный паралич, он проявляется расстройством фонации, сосания, глотания, повышением слюноотделения. Ребенок долго держит пищу во рту, не проглатывая, в старшем возрасте нарушено жевание. Крик монотонный, мало модулированный. У детей 2—
47
3 лет наблюдаются речевые расстройства. Для псевдобульбарного паралича, в отличие от бульбарного, характерно усиление рефлексов орального автоматизма, нет атрофий и фибриллярных подергиваний в мышцах языка. Псевдобульбарный паралич бывает при нарушении внутриутробного развития, асфиксии, внутричерепной родовой травме, прогрессирующих дегенерациях мозга, энцефалитах.
Добавочный нерв осуществляет поворот головы в противоположную сторону, приподнимание плеча, приведение лопатки к позвоночнику. При поражении нерва, Ci—Cs-сегментов спинного мозга и соответствующих корешков затруднен поворот головы в здоровую сторону, плечо на пораженной стороне опущено, лопатка отстает от позвоночника, ограничено поднимание руки выше горизонтального уровня, выражена кривошея. Добавочный нерв чаще всего травмируется в родах при затрудненном выведении головы и плечиков. В 50—60% случаев поражение добавочного нерва сочетается с акушерским парезом.
Подъязычный нерв иннервирует мышцы языка, которые наряду с жировыми тельцами Биша и сосательным валиком губ принимают активное участие в акте .сосания. Положение языка во рту, его спонтанная подвижность и движения при сосании дают представление о состоянии этого нерва у новорожденных. Дети 2—3 лет могут показать язык по просьбе врача или подражая ему. Ребенка просят вначале высунуть язык вперед, затем достать кончиком языка до верхней губы и углов рта. При этом надо также обратить внимание на величину языка и мышечный тонус.
При поражении подъязычного нерва или его ядра язык отклоняется в сторону пораженной мышцы. На той же стороне отмечаются атрофия мышц и фибриллярные подергивания. У новорожденных и грудных детей парез подъязычного нерва может быть причиной затруднения сосания.
При поражении надъядерных путей язык также отклонен в сторону парализованной мышцы, но атрофии и фибриллярные подергивания отсутствуют, возможны нарушения речи (дизартрия) .
Безусловные рефлексы и рефлексы позы. Ребенок рождается с комплексом безусловных рефлексов, которые играют важную роль в его развитии. В дальнейшем по мере развития коры головного мозга они тормозятся и на их базе развиваются многочисленные рефлексы. Поэтому знание процессов становления и угасания безусловных рефлексов имеет большое значение в оценке неврологического статуса ребенка раннего возраста.
В норме безусловные рефлексы обнаруживаются у новорожденных с первых часов жизни и физиологичны до 2—3 мес, а затем начинают ослабевать и исчезают к 4—5 мес. У глубоко недоношенных детей безусловные рефлексы тормозятся на 2— 3 мес позже, в зависимости от степени недоношенности. У здорового новорожденного выраженность ответных реакций, быстро-48
та их появления в ответ на стимуляцию зависят от генетически детерминированного типа высшей нервной деятельности. Кроме того, у одного и того же ребенка возбудимость сменяется утомляемостью, сном, состоянием насыщения. Поэтому в каждом отдельном случае должны быть найдены оптимальные условия исследования безусловных рефлексов. Рефлексы выражены более отчетливо, если они вызываются в спокойной обстановке, когда ребенок не испытывает дискомфорта, а наносимые раздражения не причиняют ему боли. Для повышения достоверности результатов исследования новорожденный должен быть обследован повторно в течение нескольких дней. Если и в этом случае безусловные рефлексы остаются угнетенными или отсутствуют, это указывает на поражение нервной системы. Патологична также задержка угасания рефлексов.
Исследуя безусловнорефлекторную сферу новорожденных и грудных детей, необходимо учитывать не только наличие того или иного рефлекса, но и время его появления с момента нанесения раздражения, его полноту, силу и быстроту угасания (рис. 19).
Поисковый рефлекс (искательный рефлекс Куссмауля) (рис. 20). Положение на спине. Поглаживание пальцем в области угла рта, не прикасаясь к губам, вызывает опускание угла рта и поворот головы в сторону раздражителя. Надавливание на середину нижней губы приводит к открыванию рта, опусканию нижней челюсти и сгибанйю головы. Рефлекс надо вызывать
49
Рис. 20. Поисковый рефлекс
Рис. 21. Хоботковый рефлекс
осторожно, не причиняя боли новорожденному. При болевом раздражении происходит поворот головы в противоположную сторону. Поисковый рефлекс хорошо выражен перед кормлением. Необходимо обратить внимание на симметричность рефлекса с двух сторон. Асимметрия рефлекса наблюдается при парезе лицевого нерва. Поисковый рефлекс выражен у детей до 3—4-месячного возраста, а затем тактильный раздражитель сменяется зрительным, и ребенок оживляется при виде бутылочки с молоком или приготовления матерью груди к кормлению.
Поисковый рефлекс является базой для развития таких мимических движений, как качание головой, улыбка и др. Наблюдая за кормлением ребенка, можно отметить, что новорожденный, прежде чем захватить сосок, совершает ряд качательных движений головой.
Хоботковый рефлекс (рис. 21). Положение на спине. Быстрый удар пальцем по губам вызывает сокращение круговой мышцы рта и губы вытягиваются в хоботок. «Хоботок» является постоянным компонентом сосательных движений. Рефлекс физиологичен до 2—3 мес.
Сосательный рефлекс. Положение на спине. Если поместить соску в рот новорожденному на
глубину 3—4 см, ребенок совершает ритмичные сосательные движения. Рефлекс физиологичен до конца 1-го года жизни.
Ладонно-ротовой рефлекс (рефлекс Бабкина) (рис. 22). Положение на спине. Надавливание на область ладони ближе к ш. tenar вызывает открывание рта, сгибание головы, плеча и предплечья. Ребенок как бы стремится подтянуться к кулачкам. Ладонно-ротовой рефлекс является физиологически древ-
Рис. 22. Ладонно-ротовой рефлекс
50
ним рефлексом, на базе которого формируются разнообразные руко-ротовые реакции. Рефлекс ярко выражен в первые 2 мес жизни, особенно перед кормлением, а затем начинает ослабевать и в возрасте 3 мес можно отметить лишь его отдельные компоненты.
Вялость рефлекса в период новорожденности наблюдается при поражении центральной нервной системы. Быстрое становление рефлекса является прогностически благоприятным признаком у травмированных детей. Ладонно-ротовой рефлекс может отсутствовать при периферическом парезе руки на стороне поражения. Если рефлекс не имеет тенденции к угасанию после 2 мес, а наоборот, усиливается и возникает даже при легком дотрагивании к ладоням или при пассивных движениях рук, это указывает на поражение нервной системы.
Хватательный рефлекс (рис. 23). Положение на спине. Если поместить указательные пальцы врача на ладони новорожденного, не касаясь дорзальной стороны, и надавить на ладони, происходит сгибание пальцев новорожденного и захватывание пальцев врача. Иногда новорожденный так сильно обхватывает пальцы, что его можно приподнять вверх (рефлекс Робинзона) (рис. 24). Такой же тонический хватательный рефлекс можно вызвать и на ногах (рис. 25). Надавливание большим пальцем на поду-
Рис. 23. Хватательный рефлекс
Рис. 24. Рефлекс Робинзона
шечку стопы вызывает подо-
швенное сгибание пальцев. Если нанести штриховое раздражение на подошву стопы, то происходит разгибание стопы и веерообразное расхождение пальцев.
51
Рис. 25. Хватательный рефлекс стоп: а — начальная фаза, б — конечная фаза
Рефлекс физиологичен до 3—4 мес. Затем на базе хватательного рефлекса формируется произвольное захватывание предмета, при этом имеет место смена тактильного раздражителя зрительным. Ребенок видит игрушку и тянется к ней. Развивается зрительно-моторная координация, которая играет большую роль в психическом развитии ребенка. В период новорожденности рефлекс ослаблен или отсутствует при парезах кистей рук. У заторможенных детей реакция вялая, у возбудимых, наоборот, захват усилен. Наличие рефлекса после 4—5 мес свидетельствует о поражении нервной системы.
Рефлекс Моро (рис. 26). Положение на спине. Рефлекс вызывается различными приемами — ударом по поверхности, на которой лежит ребенок, приподниманием разогнутых ног и таза над постелью, внезапным пассивным разгибанием ног. Наилучшими являются следующие приемы: ребенок лежит на левой руке исследующего. Правой рукой голова удерживается в состоянии сгибания. Внезапно голову опускают; вызывается хватательный рефлекс, затем ребенка подтягивают за руки, не отрывая головы от пеленального стола, и внезапно отпускают его руки. Ответной реакцией является отведение рук в стороны и открывание кулачка — I фаза рефлекса Моро. Через несколько секунд руки возвращаются в исходное положение — II фаза рефлекса Моро. Иногда наблюдается разгибание ног и дорзальная флексия больших пальцев. Рефлекс присутствует сразу после рождения, его даже можно наблюдать при манипуляциях акуше-
Рис. 26. Рефлекс Моро
52
Рис. 27. Рефлекс опоры
Рис. 28. Автоматическая походка
ра. У здоровых детей рефлекс хорошо выражен до 4 мес, затем начинает угасать и после 4 мес можно наблюдать лишь отдельные его компоненты. Рефлекс Моро не следует отождествлять с реакцией испуга — внезапным сгибанием рук в ответ на внезапный шум.
У детей с внутричерепной травмой рефлекс в первые дни жизни может быть неполным или отсутствовать. У очень возбудимых детей при вызывании рефлекса Моро возникает тремор вытянутых рук. При гемипарезах, а также при акушерском парезе руки наблюдается асимметрия рефлекса Моро. При резко выраженной мышечной гипертонии имеется неполный рефлекс Моро, когда новорожденный только слегка отводит и выдвигает руки вперед. В каждом случае надо определить порог рефлекса — низкий, высокий. У детей с поражением центральной нервной системы он задерживается надолго, имеет низкий порог, часто возникает спонтанно при беспокойстве, различных манипуляциях.
Рефлекс опоры и автоматическая походка новорожденных (рис. 27). Положение вертикальное, голова вверх. У новорожденного нет готовности к стоянию, но имеется способность к опорной реакции. Если взять ребенка под мышки, удерживая голову со стороны спины указательными пальцами, то он сгибает ноги во всех суставах; поставленный на опору, ребенок выпрямляет
53
Рис. 29. Защитный рефлекс
Рис. 30. Рефлекс Галанта
Рис. 32. Спонтанное ползание
туловище и стоит на полусогнутых ногах на полной стопе. Положительная опорная реакция ног является подготовкой к шаговым движениям. Если новорожденного слегка наклонить вперед, то он делает шаговые движения (автоматическая походка новорожденных) (рис. 28). При шаговых движениях новорожденного руки остаются интактными, нет реакций равновесия. Если его отпустить, он сразу падает. Новорожденный ходит на согнутых в коленных и тазобедренных суставах ногах. В связи с более сильным сокращением аддукторов, физиоло-\ гичным для этого возраста, иногда при ходьбе новорожденные перекрещивают ноги на уровне нижней трети голеней и стоп, что напоминает походку при детском церебральном параличе.
Реакция опоры и автоматическая походка физиологичны до 1,5—2 мес, затем они сменяются физиологической астазией, абазией. И только к концу 1-го года жизни развиваются самостоятельное стояние и ходьба. Готовность к стоянию рассматривается как условный рефлекс и для его осуществления необходима нормальная функция коры больших полушарий. У новорожденных с внутричерепной травмой, родившихся в асфиксии, в первые недели жизни реакция опоры и автоматическая походка часто угнетены или отсутствуют. При наследственных нервно-мышечных заболеваниях, травме спинного мозга, миелодисплазиях они отсутствуют из-за резкой мышечной гипото
54
нии. У грудных детей с поражением центральной нервной системы автоматическая походка задерживается надолго, что является ранним диагностическим симптомом.
Защитный рефлекс (рис. 29). Если новорожденного положить на живот, то происходит рефлекторный поворот головы в сторону. Этот рефлекс физиологичен до конца 1-го месяца жизни. У детей с поражением центральной нервной системы защитный рефлекс может отсутствовать, и, если не повернуть пассивно голову ребенка в сторону, он может задохнуться.
Рефлекс Галанта (рис. 30). Положение на животе. При раздражении кожи спины вблизи и вдоль позвоночника новорожденный изгибает позвоночник так, что он образует дугу, открытую в сторону раздражителя, голова поворачивается в ту же сторону, нога на соответствующей стороне часто разгибается в тазобедренном и коленном суставах и отводится. В первые дни жизни ребенка этот рефлекс ослаблен и хорошо вызывается с 5—6-го дня жизни. Физиологичен рефлекс до 3—4 мес. У детей с поражением центральной нервной системы, при заболеваниях спинного мозга он может быть ослаблен или вовсе отсутствовать в период новорожденности. При детском церебральном параличе задерживается редукция рефлекса и его можно наблюдать во второй половине года и позже.
Рефлекс Переса (рис. 31). Положение на животе. Если провести пальцем, слегка надавливая, по остистым отросткам позвоночника от копчика к шее, ребенок кричит, приподнимает голову, лордозирует туловище, приподнимает таз, сгибает руки и ноги. Этот рефлекс вызывает отрицательную реакцию со стороны новорожденного, поэтому его надо вызывать последним. Рефлекс физиологичен до 3—4 мес. Угнетение рефлекса в период новорожденности имеет место при внутричерепных кровоизлияниях, травмах спинного мозга, наследственных нервно-мышечных заболеваниях, аномалиях развития спинного мозга. Задержка обратного его развития наблюдается у детей с поражением центральной нервной системы.
Рефлекс ползания (Бауэра), Положение на животе, голова по средней линии. В таком положении ребенок совершает ползающие движения — спонтанное ползание (рис. 32). Если к подошвам подставить ладонь, то ребенок рефлекторно отталкивается от нее ногами и ползание усиливается (рис. 33). В положении на боку и на спине эти движения не возникают. Координации движения рук и ног при этом не наблюдается. Ползающие движения у новорожденных становятся выраженными после 3—4-го дня жизни. Физиологичен рефлекс до 4 мес, затем угасает. Самостоятельное ползание начинает развиваться с 7—8 мес, а иногда и позже. В период новорожденности рефлекс угнетен или отсутствует у детей, родившихся в асфиксии, при внутричерепных кровоизлияниях, травмах спинного мозга, спинальных амиотрофиях. Необходимо обращать внимание на асимметрию рефлекса. При
55
Рис. 33. Рефлекс ползания
Рис. 34. Асимметричный шейный тонический рефлекс
заболеваниях центральной нервной системы ползающие движения, как и другие безусловные рефлексы, сохраняются длительно.
Наряду с вышеуказанными безусловными рефлексами у новорожденных и детей первых месяцев жизни важно исследовать тонические лабиринтный и шейные рефлексы.
Тонический лабиринтный рефлекс возникает в результате стимуляции лабиринтов при изменении положения головы в пространстве. В положении на спине отмечается максимальное повышение тонуса в разгиба-тельныГ'группах мышц, в положении на животе — в сгибательных.
Симметричный тонический шейный рефлекс — проприоцептивный рефлекс с рецепторов мышц шеи, связок и суставов шейного отдела позвоночника. Вызывается пассивным или активным движением головы (сгибание, разгибание). Сгибание головы вызывает повышение^^лексорного тонуса в рукахГЮэкстензорного — в ногах, ^разгибание готовы приводит’к^Ттротивопо ложному эффекту.
Асимметричный тонический шейный рефлекс — проприоцептивный рефлекс с рецепторов мышечно-суставных образований шеи (рис. 34). Если ребенку в положении на спине повернуть голову в сторону так, чтобы челюсть находилась на уровне плеча, происходит разгибание руки и ноги, к которым обращено лицо («лицевые конечности»), и сгибание противоположных («затылочные конечности»). Наиболее постоянной является реакция рук.
Тонические лабиринтный и шейные рефлексы в норме можно Наблюдать у здоровых новорожденных, но выражены они не так ярко, как другие безусловные рефлексы.
По мере развития выпрямляющих рефлексов туловища и реакций равновесия, центры которых расположены в области среднего мозга, а также сложной координаторной регуляции коры головного мозга, тоническая активность подавляется. В норме тонические рефлексы можно обнаружитьда^—4 мес.{
У детей грудного возраста с поражением нервной системы, сопровождающимся повышением мышечного тонуса, тонические рефлексы активизируются и доминируют в клинической картине. В этих случаях зависимость мышечного тонуса от положения
56
головы в пространстве и от положения головы по отношению к туловищу становится резко выраженной. Тонические рефлексы препятствуют последовательному развитию возрастных двигательных навыков.
Реакции выпрямления и равновесия. В основе нормального развития движений у ребенка раннего возраста лежат два взаимосвязанных и взаимозависящих процесса.
1. Развитие рефлексов позы (постуральных рефлексов), которые отсутствуют у новорожденного, но позже появляются и со временем становятся более сложными и разнообразными. К ним относятся реакции выпрямления, реакции равновесия, защитные и другие приспособительные реакции, интегрируемые на уровне среднего мозга.
Развитие рефлексов позы обеспечивает ребенку правильный контроль головы в пространстве и по отношению к туловищу. В дальнейшем с помощью этих реакций происходит выравнивание головы, шеи, туловища и конечностей. Ребенок учится сохранять равновесие во время активных движений.
Постуральные реакции тормозят тонические шейные и лабиринтные рефлексы и играют основную роль в сохранении мышечного тонуса умеренной интенсивности, который должен быть достаточно высоким, чтобы противостоять силе земного притяжения и обеспечить фиксацию для движений, и в то же время достаточно низким, чтобы движения были возможны.
Несмотря на субкортикальный уровень интеграции, ребенок быстро начинает использовать эти реакции для произвольной активности.
2. Торможение примитивных рефлекторных автоматизмов спинально-столового уровня, которые имеются у ребенка с рождения (хватательный рефлексл реакция опоры и автоматическая походка новорожденных, рефлекс Моро, тонические шейные и лабиринтные рефлексы и др.), а также торможение и модификация двигательных реакций, которые по мере развития становятся ненужными и мешают произвольной целенаправленной двигательной активности.
К выпрямляющим рефлексам относятся следующие.
Лабиринтный выпрямляющий установочный рефлекс на голо' ву. У новорожденного он отсутствует или слабо выражен. Голова свисает вниз под действием силы тяжести. В течение первых недель жизни на животе и на боку можно отметить кратковременные, толчкообразные движения головы по направлению к средней линии. Ребенок может удерживать ее только несколько секунд. Затем к 3—4-й неделе попытки выпрямить голову становятся все более частыми и энергичными, особенно в положении на животе.
Но отчетливый лабиринтный выпрямляющий рефлекс наблюдается только со 2-го месяца жизни. Исследовать его у детей можно следующим образом: ребенка свободно удерживают и перемещают в воздухе, при этом голова устанавливается так, что
5?
Рис. 35. Развитие выпрямляющих рефлексов туловища и приобретение ребенком навыка поворота со спины на живот
линия рта параллельна площади опоры. В положении на животе или спине ребенок должен поднять и удержать голову.
Лабиринтный выпрямляющий установочный рефлекс на голову стимулирует развитие цепных симметричных рефлексов, направленных на приспособление туловища к вертикальному положению. Он обеспечивает установку шеи, туловища, рук, таза и ног ребенка.
Шейная выпрямляющая реакция. За пассивным или активным поворотом головы в одну сторону следует ротация всего туловища. В результате этого рефлекса ребенок к 4 мес может из положения на спине повернуться на бок. Если рефлекс ярко выражен, то поворот головы приводит к резкому повороту туловища как целого в направлении ротации головы (поворот блоком). Этот рефлекс выражен уже во время родов, когда туловище ребенка следует за поворачивающейся и движущейся-впереди головой. Отсутствие или угнетение этого рефлекса может быть причиной затяжных родов и гипоксии плода.
Выпрямляющий рефлекс туловища, действующий на голову. Эта реакция способствует выпрямлению головы относительно положения других частей тела в пространстве. Так, например, если стопы коснулись опоры, за этим последует выпрямление головы. Этот рефлекс находится в тесном взаимодействии с лабиринтной выпрямляющей реакцией на голову и обеспечивает двойную гарантию нормального положения головы в пространстве.
Выпрямляющий рефлекс туловища, действующий на туловище. Эта реакция становится выраженной в возрасте 6—8 мес, иногда раньше и видоизменяет примитивную шейную выпрямляющую реакцию, вводя ротацию туловища между плечами и тазом. После 4 мес ребенок делает попытку повернуться на бок, затем совершает этот поворот все чаще и чаще. Во втором полугодии он обычно поворачивает вокруг оси тела сначала голову,
58
затем плечевой пояс и, наконец, таз. Туловище больше не следует за головой как единое целое, оно ротируется между плечевым по-
ясом и тазом при повороте на бок, а (рис. 35). Ротация в пределах оси тела дает ребенку возможность повернуться со спины на живот, с живота на спину, сесть, встать на четвереньки и принять вертикальную позу.
Выпрямляющие реакции, сочетаясь друг с другом, образуют ряд последовательных движений, направленных на приспособление головы и туловища к вертикальному положению (рис. 36) — так называемые цепные симметричные рефлексы (А. Пейпер, 1962). Выпрямляющие реакции развиваются с конца первого месяца жизни, достигают согласованной эффективности в возрасте 10—15 мес, затем видоизменяются, совершенствуются.
Видоизменение выпрямляющих рефлексов происходит постепенно и становится выраженным после 1,5 года. Если вначале переход со спины в положение сидя осуществлялся путем ротации туловища, то в возрасте 2—3 лет дети используют ротацию только частично и начинают осваивать методику взрослых приобретать положение сидя, отталкиваясь с помощью рук вперед. Это свидетельствует об ослаблении выпрямляющих рефлексов с туловища на туловище. Спустя некоторое время дети уже не пользуются ротацией, а садятся из положения лежа, как взрослые, путем симметричного вставания. Выпрямляющий рефлекс
Рис. 36. Развитие выпрямляющих рефлексов туловища и приобретение ребенком навыка вставания из положения на животе:
в — новорожденный; б — ребенок в возрасте * мес; в — 2,5—3 мес; г — к—5 мес; д — 5— 6 мес; е 7—8 мес; ж — 8—9 мес; а — 9— 10 мес; и — н—12 мес
в дальнейшем и на живот
59
с туловища на туловище на этой стадии подавлен. Вставание из положения сидя при выраженности выпрямляющих рефлексов проходит через стадию стояния на четвереньках, а к 3 годам дети начинают вставать на ноги с движением вперед. Все реакции выпрямления находятся в тесном взаимодействии, обеспечивая нормальное положение туловища и ног по отношению к голове.
Таким образом, развитие цепных симметричных рефлексов наиболее интенсивно стимулируется из положения на животе. В этом положении ребенок поднимает голову (лабиринтный установочный рефлекс), затем верхнюю часть туловища вначале на согнутых, а затем на вытянутых руках (опорная реакция рук). Положение головы по средней линии вызывает ярко выраженный выпрямляющий рефлекс с шеи и устанавливает туловище в правильное положение относительно головы. Поднятие головы и разгибание верхней части туловища способствуют образованию лордоза позвоночника и разгибанию бедер, голеней и стоп. При этом формируется выраженный цепной рефлекс, распространяющийся от головы к шее, туловищу, рукам и ногам до кончиков пальцев.
Другими словами, выпрямляющие рефлексы туловища — цепь реакций, с помощью которых 10-месячный ребенок из положения на спине поворачивается на живот и затем встает на ноги.
Другая группа рефлексов, наблюдаемых у детей раннего возраста, не относится к истинным выпрямляющим рефлексам, но на определенных стадиях способствует развитию двигательных реакций. К ним относятся защитная реакция руки, рефлекс Ландау.
Защитная разгибательная реакция рук — разведение их в стороны, вытягивание вперед и отведение назад в ответ на внезапное перемещение туловища. Перемещение ребенка вниз вызывает защитное выпрямление рук вперед (4 мес), перемещение в сторону — защитное выпрямление руки (6 мес), перемещение вперед — защитное выпрямление обеих рук (7 мес) и перемещение назад — отведение рук назад (9 мес) — парашютная реакция.
Ребенок в положении сидя может поддерживать свою массу тела руками, вытянутыми вперед, в 6 мес, в стороны — в 8 мес, назад — в 10—12 мес. Вначале при этом руки бывают сжаты в кулак, но вскоре кисть разгибается, создавая опору на ладонь.
Рефлекс Ландау. Этот рефлекс комбинируется с выпрямляющими рефлексами и является их частью. Если ребенка держать свободно в воздухе лицом вниз, то вначале он поднимает голову (результат лабиринтной установочной реакции), так что лицо находится в вертикальной позиции, а рот — в горизонтальной, затем наступает тоническая экстензия спины, затем ног. Иногда она может быть настолько сильной, что ребенок изгибается дугой, открытой кзади. Рефлекс появляется в возрасте 5—6 мес, ба
а. ©го отдельны© элементы раньше. После 1 года жизни рефлекс Ландау начинает угасать и к. 2 годам имеются только его отдельные элементы. . *
Реакция равновесия. Становление вертикальной позы у ребенка требует развития рефлекторного механизма, обеспечивающего функцию сохранения равновесия при сидении, стоянии и ходьбе. Этот механизм состоит из группы автоматических реакций, называемых реакциями равновесия. По сравнению с предыдущими рефлекторными реакциями они имеют более сложные и разнообразные двигательные формы. Их функция зависит от взаимодействия базальных ганглиев, ядер субталамической области, мозжечка и коры больших полушарий. Эти реакции дают возможность ребенку сохранять и, восстанавливать равновесие в процессе двигательной активности. Реакции равновесия считаются наиболее высокой, формой развития автоматических двигательных реакций.
Подобно реакциям выпрямления реакции равновесия развиваются в течение длительного времени в определенной последовательности. Реакции равновесия появляются и нарастают в период, когда реакции выпрямления уже полностью установились и начинают видоизменяться, тормозиться.
Реакции равновесия можно продемонстрировать следующими приемами: положить ребенка на передвижной стол в положении на животе, на спине, сидя, на четвереньках, стоя и наклонять стол в стороны или толкать ребенка осторожно из стороны в сторону, вперед, назад. При наклоне стола 6-месячный ребенок падает без какой-либо защитной реакции в сторону нижней части стола. После 6 мес он наклоняет голову и изгибает туловище по направлению поднятой части стола в результате компенсаторного увеличения тонуса в мышцах поднятой стороны. Если сидящего ребенка легко толкать в сторону, например влево, то голова движется в правую сторону. При этом правая рука и нога отведены и разогнуты, левая рука и кисть разогнуты и готовы поддержать все тело, если равновесие нарушится. Толкание сидящего ребенка вперед вызывает сгибание ног, шея и спина разогнуты, а руки движутся назад. При толкании ребенка назад голова, плечи и руки движутся вперед, а ноги разгибаются.
Имеется взаимосвязь между реакциями равновесия и двигательными возможностями ребенка. Реакции равновесия на спине и на животе становятся выраженными, когда ребенок уже сидит без поддержки (8 мес), в положении сидя они появляются, когда ребенок уже может стоять (10—12 мес), и в положении стоя, когда ребенок уже ходит (10—12 мес). Усовершенствование реакций равновесия не имеет места до тех пор, пока ребенок не продвинулся на более высокую стадию развития выпрямляющих реакций. С 18 мес до 2 лет все реакции равновесия уже сфор-; мироваиы, но еще не совершенны. Развитие и совершенствование реакций равновесия продолжается до 5—6 лет.
61
\
N Таким образом, развитие движений проходит следующие стадии: поднимание головы в положении на животе, поворот со спины на живот, поднимание верхней части туловища вначале на согнутые, а затем на вытянутые руки, ползание на животе, поднимание туловища на вытянутых руках и согнутых ногах, полза-$ ние на четвереньках, свободное стояние и ходьба на разогнутых ногах с сохранением равновесия. В этой последовательности развития движений отражается закон краниокаудального (нисходящего) направления развития.
Реакции выпрямления и равновесия гармонично взаимодействуют друг с другом. Совместно они представляют нормальный постуральный рефлекторный механизм, который формирует необходимую базу для выполнения любых двигательных навыков* Постуральные реакции могут выполнить свою функцию только при наличии нормального мышечного тонуса, и в то же время они гарантируют физиологическую основу мышечного тонуса. При произвольных < движениях реакции выпрямления и равновесия постоянно видоизменяются и адаптируются для. выполнения любых специфических навыков.
Торможение и видоизменение двигательной активности, приобретенной в результате постуральных реакций, является важным этапом в развитии дифференцированных двигательных навыков. Путем интеграции зрительных; слуховых, проприоцептивных и тактильных ощущений ребенок приспосабливает суще-: ствующие формы движений к передвижению и ручной умелости. Чтобы достичь эффекта в более тонкой моторике, ребенок должен научиться использовать только часть . двигательных образцов и комбинировать их в различных видах. Так, вначале ребенок захватывает предмет всей кистью и всеми пальцами. Позже, когда надо взять мелкий предмет, он ограничивает захват только большим и указательным пальцами и лишь при виде большого предмета ребенок раскрывает всю кисть. В этом же возрасте появляются указательные движения пальцами. Развитие все более тонких и точных движений пальцев рук в зависимости от размера и характера предмета свидетельствует не только о совершенствовании двигательной функции руки, но и об усложнении аналитико-синтетической деятельности мозга ребенка. Таким образом, первоначальные примитивные и общие двигательные реакции постепенно видоизменяются, появляются более изолированные и целенаправленные движения.
Двигательные функции. Исследование двигательных функций включает оценку общего мышечного развития, объема и силы активных и пассивных движений, состояния мышечного тонуса и координации.
Общее мышечное развитие. Мышцы к моменту рождения развиты умеренно. Их масса составляет 20—22% общей массы новорожденного. По мере роста ребенка относительная масса мышц постепенно увеличивается и к 5—7 годам достигает
62
40—42%. Общее мышечное развитие определяется путем осмотра, пальпации, измерения симметричных участков сантиметровой лентой.
Атрофии мышц характеризуются уменьшением их объема. Они могут быть диффузными и локальными. Причиной мышечных атрофий могут быть периферические парезы и параличи. У детей раннего возраста они развиваются чаще всего при родовой травме плечевого сплетения или отдельных нервов, полиомиелите. Центральные парезы и параличи также могут приводить к мы-* шечным атрофиям. Атрофии мышц — один из наиболее постоянных симптомов наследственных нервно-мышечных заболеваний.
У новорожденных и грудных детей мышечные атрофии могут наблюдаться при врожденных гемиаплазиях. Гемиаплазия (гемигипоплазия) — недоразвитие одной половины тела, возникающее в результате неполноценного конституционального развития. Определенную роль в их развитии могут играть трофические расстройства при внутриутробных нарушениях маточноплацентарного кровообращения. Атрофия может касаться только "ммйц~"лица.Нриэтом на стороне аплазии уплощены кости лица и черепа, уже глазная щель, уменьшено в размерах ухо. Недоразвитие грудино-ключично-сосковой мышцы может быть причиной кривошеи. В некоторых случаях гемигипоплазия сопровождается дисплазией тазобедренного сустава, недоразвитием стопы. Мышечный тонус на стороне аплазии снижен. Сухожильные рефлексы нормальные, иногда несколько повышены. По мере роста и развития атрофия несколько компенсируется, асимметрия сглаживается. Подобные асимметрии нередко можно выявить у родителей ребенка. Реже наблюдается врожденное недоразвитие отдельных мышц (большой грудной мышцы, мышц живота и др.).
Гипертрофия мышц у детей раннего возраста встречается гораздо реже, главным образом при миотонии Томсена. Дети с гипертрофиями обычно имеют атлетическое телосложение. В некоторых случаях гипертрофии одних мышц сочетаются с атрофией других, как, например, при аутосомно-рецессивной форме миотонии, синдроме Корнелии де Ланге. Псевдогипертрофии внешне выглядят так же, как истинные гипертрофии, но при этом мышцы плотны на ощупь. Локальные псевдогипертрофии наблюдаются при прогрессирующей мышечной дистрофии! Дюшена.
Объем и сила пассивных и а/ктивных движений. Уровень спонтанной и произвольной двигательной активности определяют, наблюдая за новорожденным и грудным ребенком во время бодрствования, игр, кормления. Обращают внимание ца то, как ребенок тянется к игрушке, манипулирует ею, сидит, ползает, ходит. При этом выявляют характер движений, их симметричность.
У новорожденных объем спонтанных движений ограничен мышечной гипертонией. В ногах он несколько больше, чем в руках. В ногах можно наблюдать сгибание, разгибание, отталкивание в
63
положении на животе и на спине, перекрест. Все движения в руках совершаются на уровне груди, пальцы сжаты в кулачок. С ростом и развитием ребенка уменьшается ретракция проксимальных отделов, руки отводятся в стороны, поднимаются выше горизонтального уровня, а затем постепенно включаются и дистальные отделы конечностей.
Увеличение объема активных движений идет параллельно нормализации мышечного тонуса и развитию произвольной двигательной активности. При центральных и периферических параличах и парезах, заболеваниях опорно-двигательного аппарата и мышц наблюдаются ограничение объема активных движений, их асимметрия.
Мышечная сила оценивается при попытке исследователя помешать активным движениям ребенка. У детей раннего возраста исследование активной силы затруднено, так как выполнение инструкции по заданию еще невозможно.
Пассивные движения оцениваются, когда ребенок бодрствует и спокоен. При исследовании пассивных движений определяют степень подвижности суставов, сопротивление, оказываемое при этом ребенком, мышечный тонус. Движение конечностями следует проводить ритмично и одновременно, не применяя силы и не вызывая тем самым отрицательной реакции со стороны ребенка. Если он начинает плакать, беспокоиться, исследование < надо прекратить, так как при возбуждении мышечный тонус по-i вышается.
По сопротивлению пассивным движениям судят о состоянии мышечного тонуса. У новорожденных и детей первых месяцев жизни повышенное сопротивление пассивным движениям является физиологическим. При пассивных движениях физиологическая сгибательная гипертония легко преодолевается. Объем пассивных движений может быть ограничен при резком повышении мышечного тонуса, мышечных и суставных контрактурах. Увеличение объема пассивных движений связано с мышечной гипотонией или со слабостью связочно-суставного аппарата. Сопротивление пассивным движениям, активная сила и объем движений регистрируются отдельно для мышц шеи, туловища, плеча, предплечья, кистей, бедер, голеней и стоп.
Мышечный тонус. Определение мышечного тонуса проводится не только путем его непосредственного исследования, но и при наблюдении за позой ребенка, его движениями.
Правильное расположение головы, туловища и конечностей свидетельствует о нормальном состоянии мышечного тонуса. Для детей первых месяцев жизни характерна физиологическая флексорная мышечная гипертония: руки согнуты во всех суставах и приведены к туловищу, кулачки находятся на уровне грудной клетки, ноги также согнуты во всех суставах и слегка отведены в стороны, в стопе преобладает тыльное сгибание. *
64
Рис. 37. Выраженная мышечная гипотония, «поза лягушки» в положении ребенка:
а—на животе; б —на спине
В разгибателях мышц головы и шеи мышечный тонус выше, чем в сгибателях, поэтому у новорожденного голова может быть слегка запрокинута назад. В приводящих мышцах бедер тонус повышен и при попытке отвести ноги в стороны ощущается сопротивление этому движению. У новорожденного мышечный тонус повышен симметрично. Повышение его держится до периода появления произвольных движений (3—4 мес). Формированию нормальной позы в период новорожденности и первые месяцы жизни придается большое значение, так как оно предшествует своевременному правильному развитию двигательных навыков.
У новорожденных и грудных детей могут иметь место различные патологические позы, свидетельствующие о нарушении мышечного тонуса.
При выраженной мышечной гипотонии наблюдается «поза лягушки»: ноги слегка согнуты во всех суставах, отведены, коленные и голеностопные суставы касаются поверхности, на которой лежит ребенок, руки разогнуты (рис. 37).
Поза опистотонуса обусловлена повышением экстен-зорного мышечного тонуса (рис. 38). Голова запрокинута назад, спина и ноги в состоянии крайнего разгибания, ноги приведены и перекрещены на уровне бедер или голеней; руки могут быть согнутыми или разогнутыми. При патологическом повышении флексорного тонуса наблюдается «общая скованность».
Асимметричное положение конечностей может быть при гемипарезах, акушерских плекситах, а также некоторых врожденных заболеваниях опорно-двигательного аппарата.
Состояние мышечного тонуса определяется при исследовании пассивных движений. Голова ребенка при этом должна находиться по средней линии, чтобы избежать влияния тонических рефлексов на мышечный тонус. Оцениваются выраженность и симметричность мышечного тонуса. Достоверно оценить мышечный тонус у новорожденных и грудных детей можно лишь при проведении повторных исследований и сопоставлении их результатов. Нарушение его может проявляться снижением или повышением.
3 из 65
Рис. 38. Поза опистотонуса
Мышечная гипотония часто наблюдается в период новорожденное™ и может быть обусловлена поражением головного мозга, спинного мозга, периферических нервов, мышц, нарушением обмена веществ. Мышцы дряблые и вялые на ощупь.' Степень выраженности мышечной гипотонии может быть различной— от резкой, приводящей к обездвиженности, до легкой вялости. Зарубежные авторы характеризуют синдром мышечной гипотонии термином «floppy baby» — «вялый ребенок». У гипо-тоничных детей сопротивление пассивным движениям снижено, выражено переразгибание в суставах, особенно коленных, локтевых и лучезапястных. В вертикальном положении ребенок, взятый под мышки, провисает.
У детей, родившихся в асфиксии, мышечная гипотония — частый симптом. Она наблюдается с первых дней жизни. Тяжелая и длительная гипотония в постнатальный период является неблагоприятным прогностическим признаком в отношении развития в дальнейшем неврологических нарушений. При детском церебральном параличе глубокая гипотония наблюдается в ранней стадии заболевания. Мышечная гипотония отмечается также у недоношенных детей, при гемолитической болезни новорожденных, пороках и травмах спинного мозга, хромосомных синдромах, наследственных нервно-мышечных заболеваниях. При изолированном поражении периферических нервов (невриты, плекситы) она носит локальный характер. Синдром мышечной гипотонии является наиболее ранним признаком наследственных нарушений обмена веществ, которые протекают с поражением нервной системы (фенилкетонурия, гистидинемия, гомоцистинурия, липидозы и др.).
Некоторые соматические заболевания (рахит, пороки сердца) также характеризуются снижением мышечного тонуса. В каждом конкретном случае диагноз может быть уточнен на основании
66
специфической картины, биохимических и электромиографических исследований.
Повышение мышечного тонуса у детей ,раннего возраста чагце всего связано с поражением головного мозга. Ран-ним признаком мышечной гипертонии является увеличение сопротивляемости пассивным движениям. Мышечная гипертония сопровождается повышением сухожильных рефлексов, иногда клонусами стоп, коленных чашечек, кистей. Однако клонусы у детей раннего возраста наблюдаются реже, чем у старших.
Резко выраженная гипертония с первых дней жизни бывает при врожденном деструктивном поражении мозга (порэнцефалия, микрогирия, глиоматоз и др.) В этих случаях сразу после рождения мышечный тонус значительно превышает физиологический, отмечаются общая скованность, тугоподвижность, иногда контрактуры в крупных суставах, ограничение спонтанных движений. Мышечную гипертонию можно наблюдать у детей, родившихся в асфиксии, а в более старшем возрасте— при задержках психомоторного развития.
У детей первого года жизни мышечная гипертония наиболее часто наблюдается при детском церебральном параличе.
При оценке состояния мышечного тонуса необходимо учитывать его динамику, степень выраженности и сочетание с другими патологическими симптомами.
Координация. Нарушение координации у детей грудного возраста можно заподозрить лишь после развития произвольной двигательной активности. Наблюдение за тем, как ребенок тянется к игрушке, подносит лояГку ко рту, сидит, стоит, ходит, дает представление о механизмах координации.
Атаксия и ритмический тремор рук определяются с помощью пальце-носовой и коленно-пяточной проб, но они могут быть проведены только у детей старше 2—3 лет. Если с ребенком трудно установить контакт при выполнении определенных проб, можно попросить его коснуться пальцами мелкого предмета (нос куклы, маленький шарик, маленькое пятнышко на одежде). Прома-хивание и тремор при приближении к цели характерны для поражения мозжечка. Пробу на адиадохокинез провести трудно. При атаксии походка неуверенная, ребенок широко расставляет ноги, часто падает.
Мозжечковые нарушения бывают при врожденном недоразвитии мозжечка, атонической форме детского церебрального паралича, опухоли полушарий или червя мозжечка, церебеллитах инфекционного генеза, травмах головного мозга. Нарушение равновесия и координации движений наблюдается также при наследственно-дегенеративных заболеваниях, протекающих с поражением нервной системы (лейкодистрофии, факоматозы, гепато-церебральная дистрофия и др.).
Гораздо труднее выявить у детей раннего возраста нарушение координации тонких движений. Легкие мозжечковые
3* 67
нарушения обычно выявляются в возрасте 2—3 лет, когда у детей вырабатывают навыки самообслуживания и они начинают участвовать в подвижных играх. Дети с мозжечковыми нарушениями медлительны, часто роняют предметы, с трудом обучаются застегивать пуговицы, зашнуровывать ботинки. Эти нарушения иногда неправильно Отождествляют с синдромами неловкости, который может наблюдаться как у гипервозбудимых и двигательно-расторможенных, так и у малоподвижных детей. Неловким детям трудно выполнять упражнения, которые они никогда не делали, но если тренировать какой-либо вид двигательной активности, то можно достичь хорошего эффекта. Иногда, однако, неловкость мо-) жет быть и ранним симптомом прогрессирующего заболевания нервной системы.
У детей раннего возраста можно наблюдать непроизвольные движения. Для периода новорожденности и раннего грудного возраста характерны так называемые массивные движения, которые обусловлены преобладающим влиянием таламо-паллидарной системы. Массивные движения возникают спонтанно и наблюдаются в крупных суставах: плечевых, локтевых, тазобедренных, коленных. Они бывают симметричными и асимметричными. Конечности чаще находятся в различных фазах выполнения движения. Так, на одной стороне нога может быть разогнута, на другой согнута. При повороте головы в сторону возникает асимметричный шейный тонический рефлекс (поза «фехтовальщика»). Во время крика напрягаются все мышцы тела и ребенок приобретает позу опи-стотонуса. Массивные, резкие, б^осковые движения возникают внезапно и следуют друг за другом. При их выполнении в противоположность движениям взрослого отсутствуют плавность, последовательность и экономичность.
У недоношенных и, реже, у доношенных детей в период новорожденности отмечаются атетоидные движения в предплечье и кисти. Пальцы кисти независимо один от другого производят разнообразные движения: сгибание, растопыривание, переразгиба-ние. Атетоидные движения медленные, принятое положение пальцев кисти может долго сохраняться. В стопах атетоидные движения менее ярки. Большой палец стопы может далеко отводиться и разгибаться независимо от остальных. У детей старшего возраста этого не бывает. Описанные непроизвольные движения не являются патологическими, они тормозятся и исчезают по мере созревания стриарной системы и коры головного мозга. На начальных этапах произвольной деятельности (4—5 мес) движения неточны и неловки, но с течением времени они приобретают плавность и мягкость (в возрасте 3,5—4 лет).
При поражении нервной системы (гемолитическая болезнь новорожденных, врожденный атетоз) атетоидные движения могут появиться вновь уже как патологические симптомы. В большинстве случаев они сочетаются с хореическими движениями.
68
Эффективность обследования ребенка раннего возраста в зна-чительной мере зависит от умения воити с ним в контакт,, его доверия и настроения. Это лучше удается врачам, хорошо знающим ребенка. В таких случаях у детей можно выявить гораздо большие возможности, чем при одноразовом исследовании и недостаточном знакомстве с ребенком.
Исследование вегетативной нервной системы
Физиологическая роль вегетативной нервной системы заключается в поддержании трофики всех тканей организма, гомеостаза и приспособления организма к условиям окружающей среды.
В филогенезе парасимпатический отдел вегетативной нервной системы начинает функционировать раньше, чем симпатический. Эта закономерность повторяется и в онтогенезеГТТервые элементы вегетативной нервной системы появляются на 3-й неделе внутриутробного развития. При рождении центральные вегетативные образования и периферические отделы симпатической и парасимпатической нервной системы уже сформированы, но их тонкая морфологическая и функциональная организация еще продолжается в течение длительного времени.
Существование новорожденного ребенка во внешней среде Обеспечивается комплексом безусловных вегетативных рефлексов, регулирующих деятельность дыхательной, сердечно-сосудистой и пищеварительной систем, сон и бодрствование, пищевое поведение, температуру тела, поддерживающих постоянство внутренней среды организма. Однако у новорожденных эти функции еще Далеки от совершенства.
В раннем детском возрасте можно выделить несколько периодов, различающихся по степени функциональной активности и дифференцированности вегетативных реакций. Первый — от момента рождения до 2 мес. Вегетативная нервная система различно дифференцирована в разных органах, вегетативные эффекты склонны к генерализации, непостоянны, быстро переходят из одной системы в другую. Например, зевание, дефекация могут вызвать выраженную брадикардию, плач — тахикардию. Второй период — от 2 до 7 мес. Возбудимость вегетативной нервной системы повышается, значительно расширяются функции ее симпатического отдела. Третий период — от 9 до 12 мес. Вегетативные реакции стабилизируются, активно включается их центральная регуляция. Со 2-го года жизни вегетативные функции становятся все более устойчивыми, но лишь к 11—12 годам достигают се-, вершенства.
В табл. 4 суммированы эффекты парасимпатической и симпатической нервной системы на различные ткани и органы.
Исследование вегетативной нервной системы у детей первых Лет жизни проводится с помощью проб и методов, аналогичных применяемым в более старшем возрасте. Регуляция сосудистого
69
Таблица 4. Влияние симпатических и парасимпатических нервов на органы
Орган Влияние парасимпатических нервов Влияние симпатических нервов
Сердце Сосуды Зрачок Слюнные железы Бронхи Желудок, кишечник Мочевой пузырь: детрузор сфинктер Температура кожи Потовые железы Замедление ритма, уменьшение силы сокращения Расширение Сужение Повышение саливации Сужение Усиление перистальтики, повышение тонуса Сокращение Расслабление Повышение Повышение потоотделения Учащение ритма, увеличение силы сокращения Сужение Расширение Уменьшение саливации Расширение Торможение перистальтики, снижение тонуса Расслабление Сокращение Снижение Уменьшение потоотделения
тонуса изучается при помощи ряда сердечно-сосудистых рефлексов.
Глазо-сердечный рефлекс Даньини—Ашнера вызывается надавливанием на переднебоковые поверхности глазных яблок ребенка в течение 20—30 с. В норме это вызывает замедление пульса на 8—10 ударов в 1 мин. При повышении тонуса парасимпатической нервной системы пульс замедляется более чем на 10 ударов. При симпатикотонии он остается без изменений или учащается. У детей первых дней жизни глазо-сердечный рефлекс проявляется учащением пульса. Обычная реакция в виде его замедления проявляется в 1—3 мес.
Солярный рефлекс. Надавливание на подложечную область вызывает замедление пульса на 4—12 ударов в 1 мин. Более значительное замедление пульса указывает на повышение активности симпатической нервной системы.
Клиностатическая проба. При переводе ребенка из вертикального положения в горизонтальное происходит замедление сердечной деятельности на 4—6 ударов в 1 мин. До 6 мес этот рефлекс выражен слабо. Резкое замедление пульса наблюдается при повышенной возбудимости блуждающего нерва.
Ортостатическая проба также бывает положительной только у детей старше 6 мес. При переходе из горизонтального положения в вертикальное происходит учащение пульса на 8—10 ударов в 1 мин. Пульс нормализуется в течение 1 мин. Более значительное учащение пульса указывает на симпатикотонию.
Замедление пульса происходит также при надавливании на большой родничок. При повышенном тонусе симпатической нервной системы эта реакция может быть сниженной или отсутствовать.
70
Исследование колено-вегетативных реакции включает изучение особенностей дермографизма и пиломоторный рефлекс.
Дермографизм — реакция кожи на раздражение в виде покраснения или побледнения — может быть выявлен е первых часов жизни ребенка. Местный дермографизм вызывается штриховым раздражением кожи тупым предметом. Белый дермографизм указывает на повышение тонуса симпатической нервной системы, красный — парасимпатической. У детей первых месяцев жизни обычно наблюдается смена одного вида дермографизма другим, что указывает на неустойчивость вегетативных реакций. Рефлекторный дермографизм определяется путем проведения иглой по коже. Образуется красная полоса. Выпадение этого рефлекса в зоне определенных сегментов свидетельствует о поражении сегментарного аппарата спинного мозга или периферических нервов.
Пиломоторный рефлекс исследуется быстрым охлаждением кожи эфиром, холодной водой илиее щипковым раздражением в области надплечий. В ответ наступает сокращение гладких волосковых мышц— (феномен «гусиной кожи»). Поражение спинного мозга сопровождается выпадением этого рефлекса.
Исследование терморегуляции и потоотделения. Терморегуляция у детей раннего возраста несовершенна. Они легче перегреваются и переохлаждаются при изменении температуры окружающей среды. Нарушения терморегуляции могут наблюдаться при заболеваниях нервной системы. У таких детей температура тела может изменяться независимо от температуры окружающей среды. Так, например, эмоциональные реакции, связанные с переменой обстановки, могут приводить к стойкой и длительной гипертермии, не поддающейся коррекции антипиретическими средствами. Длительная субфебрильная температура часто наблюдается у детей с неврологическими нарушениями после перенесенных инфекционных заболеваний. Ее происхождение связано \/ с повышенной функциональной лабильностью и чувствительностью центров терморегуляции.
Измерение температуры проводят с помощью ртутных или электрических термометров в симметричных участках тела (под- ( мышечных и паховых складках) или в прямой кишке. Колеба- / ние температуры в течение суток до 1—1,5° в первые 3 нед жизни считается нормой.
Для исследования функционального состояния центральных механизмов терморегуляции применяют метод, предложенный А. Е. Щербаком. У ребенка с помощью ректального термографа измеряют температуру в прямой кишке. Затем руку (нижнюю треть предплечья и кисть) ребенка погружают в ванну с температурой воды 32° С и постепенно доводят ее до 40° С. Ректальную температуру измеряют сразу после ванны, через 15 и 30 мин. При отсутствии расстройств терморегуляции температура повышается на 0,3—0,5° С и через 30 мин возвращается к первоначальной.
71
Высокий подъем ректальной температуры указывает на большую инертность центров по отношению к тепловым афферентным раздражителям.
Потоотделение у новорожденных детей выражено незначительно или отсутствует. В течение первых месяцев жизни спсн собность к потоотделению увеличивается. Повышенная потливость часто наблюдается у детей с поражением нервной системы.
Наиболее распространенным методом исследования потоотделения является электротермометрический. Он позволяет с достаточной быстротой выявить топографию и динамику потоотделения. Методика основана на уменьшении электрического сопротивления кожи при ее увлажнении.
Приведенными пробами не ограничивается все многообразие методов, применяемых для исследования вегетативной нервной системы* Однако в клинике раннего возраста именно эти имеют наибольшее значение, так как легко выполнимы и информативны.
Проявления вегетативной дисфункции у детей раннего возраста связаны с несовершенством центральной регуляции и незаконченностью морфологической и функциональной дифференциации вегетативной нервной системы. Это объясняет особую чувствительность вегетативных образований к воздействию различных неблагоприятных факторов. У новорожденных вегетативные расстройства могут проявляться приступами цианоза, побледнением, покраснением, мраморностью кожных покровов, расстройством ритма и частоты дыхания и сердечной деятельности, «игрой зрачков», икотой, зеванием, частыми срыгиваниями, рвотой, неустойчивым стулом, нарушением сна. s Некоторые из этих реакций могут закрепляться по типу условного рефлекса, как это Наблюдается у детей с ранней детской нервностью. Запаздывание формирования вегетативных функций приводит к нарушению адаптационных механизмов. Дети плохо приспосабливаются к изменяющимся условиям, часто болеют.
Кроме вышеописанных нарушений, патология вегетативной нервной системы в раннем возрасте может проявляться трофическими расстройствами кожи, подкожной клетчатки, костей, как это бывает, например, при врожденной гемиатрофии Пари—Ромберга. Поражение спинного мозга, корешков, сплетений, периферических нервов сопровождается выраженными трофическими расстройствами в зоне их иннервации. Среди нейроэндокринных , синдромов, обусловленных поражением диэнцефальной области, 1 у детей первых лет жизни наблюдаются главным образом ожирение и сахарный диабет.
/ Исследование речи
Речевые и психические функции ребенка осуществляются интегративной деятельностью мозга. Для своевременного становления этих функций в онтогенезе важное значение имеют нор
72
мальное развитие и функционирование всех отделов центральной нервной системы, особенно коры головного мозга. Речь и психи** ческие функции являются сугубо человеческими высшими корковыми функциями, и в их формировании наряду с биологическими факторами большую роль играют социальные (окружение в широком понимании). Оценка развития этих функций очень важна для диагностики заболеваний нервной системы у детей раннего возраста.
В развитии речи ребенка большое значение имеет доречевой период, который длится от рождения до конца 1-го года жизни. В этот период развивается зрительное и слуховое восприятие, формируется первая предметная и игровая деятельность, появляются гуление, лепет, возможность подражания звукам речи, развиваются первые пути довербального общения ребенка с окружающими.
Доречевой период у здорового ребенка условно делится на несколько этапов.
I этап доречевого развития охватывает первые 2 мес жизни. В это время совершенствуются и закрепляются биологические и адаптационные механизмы (функции дыхания, сосания); появляются первые эмоциональные реакции, имеющие приспособительное значение для организма; к концу I этапа крик ребенка начинает приобретать интонационную выразительность, что имеет важнейшее значение для развития общения ребенка со взрослым.
II этап доречевого развития (2,5—3 мес) характерйзуется появлением начального гуления. В ответ на положительные эмоциональные раздражители ребенок гулит. Вместе с гулением появляется й первый смех — повизгивание в ответ на эмоциональное общение со взрослым. Звуки гуления уже отличаются определенным многообразием с преобладанием сочетаний гортанных и гласных звуков («гу, ге, ха» и т. д.).
Смена коротких звуков более протяжными происходит одновременно с новой стадией в развитии движений ребенка. Произношение протяжных звуков гуления требует от ребенка более длительного мышечного сокращения. В этот период здоровый ребенок уже хорошо держит голову, поворачивается со сПины на бок, тянется к предмету, ощупывает и рассматривает свои руки. У него имеется длительная зрительная фиксация (до 5— 7 мин) и прослеживание предмета во всех направлениях. Звуки гуления произносятся на выдохе, так что в этот период происходит своеобразная тренировка речевого дыхания.
Таким образом, на этом этапе развивается общение при помощи недифференцированных движений тела и головы, сопровождающихся отдельными голосовыми реакциями.
Ill этап доречевого развития — период «истинного» гуления. При нормальном развитии этот период ребенок проходит в возрасте 3,5—4 мес.
73
Особенностью истинного гуления является то, что оно не сопровождается общими диффузными движениями ребенка и не является составной частью комплекса оживленияДНапротив, в период истинного гуления общие движения ребенка притормаживаются, ребенок как бы сосредоточивается на новом для него ощущении. Это является важным условием для дифференцировки произносимых звуков как по их акустическим, так и кинестетическим признакам. В этот период образуются первые условные связи между слуховыми и артикуляторными образами произносимых звуков. На этой основе у ребенка формируется самоподражание собственным звукам. Это — качественно новый этап в доречевом развитии. В период истинного гуления звуки становятся продолжительным!^ певучими и более многообразными.'Наряду с гортанными и гласными все чаще появляются губные звуки и сочетания гласных с губными («па», «ба»).
В этот период интенсивно развивается сенсорное восприятие, которое начинает приобретать активный познавательный характер.
IV этап доречевого развития — это период лепета. Уже в возрасте 5—7 мес, когда здоровый ребенок путем самоподражания произносит сочетания гласных с губными согласными в виде цепочек звуков, намечается переход гуления в лепет. В период лепета наряду с самоподражанием более ртчетливьш становится звукам взрослого. ~
доречевого периода невербальные формы общения
ребенка с окружающими усложняются. Общение осуществляется при помощи обеих рук, более дифференцированных мимики и звуков. Пример такого общения: ребенок тянет руки к матери, произносит отдельные звуки, как бы просит «возьми меня».
Затем усложняется мимика. Она становится более выразительной, появляются символические жесты. Ребенок может общаться при помощи одной руки. Появляются разнообразные по интонации лепетные слова. V
Этап первичного усвоения языка у здорового ребенка начинается в конце 1-го года жизни и происходит интенсивно в тече-^ ние всего 2-го года. Этот этап характеризуется появлением первых элементарно понимаемых, вначале непроизносимых, а затем и произносимых слов.
В развитии сенсорной речи ребенка также можно выделить ряд этапов. 3—6 мес начинается формирование предпосылок для понимания речи: выраженность слухового внимания на речь, адекватная реакция на интонацию, узнавание голосов близких. В 6—8 мес начинает развиваться глобальное, ситуационное восприятие обращенной речи. Основное значение в «понимании» на этом этапе имеет акцентно-мелодическая модель предложения и наглядная конкретная ситуация. Существенную роль в этом процессе играет общение со взрослым, развитие ориентировочной деятельности (М. М. Кольцова, 1973).
74
подражание Т? концу
В развитии моторной речи большая роль принадлежит речевому подражанию. После полутора лет ребенок путем подражания легко произносит знакомые и незнакомые слова, как адрессо-ванные ему, так и случайно услышанные от окружающих. Автоматизация навыка речевого подражания резко ускоряет развитие моторной речи. Интенсивное развитие моторной речи обычно начинается со второй половины 2-го года жизни. До 1 года 6 мес ребенок произносит около 30 простых по звуковому составу слов, а к концу 2-го года — 200—300. К 3 годам в речи ребенка насчитывается до 1200—1500 слов, включающих почти все части речи. Имеются наблюдения о более медленном темпе развития речи на 2-м году жизни у мальчиков.
С момента появления у ребенка первых слов можно говорить о предложении, так как слово, включенное в предметную ситуацию, в этот период выполняет функцию предложения. Двухсловные предложения появляются у ребенка в возрасте Ът 1 года ТГмес до1 года 10 мес, трехсловные — через 2—4 мес. Таким образом, в JKOHije 2-го года жизни у ребенка появляются интонационно четкие вопросительные и восДицатёльные предложения, начинается формирование грамматического строя речи. На 3-м году жизни происходит наиболее интенсивное развитие грамматического строя речи, так что к концу 3-го года речь ребенка по форме значительно приближается к речи взрослого.
Таким образом, развитие нормальной детской речи проходит следующие этапы: от 1 года 3 мес до 1 года 10 мес — период предложений, состоящих из аморфных слов-корней; от 1 года 10 мес до 3 лет — период усвоения грамматической структуры предложения; от 3 до 7 лет — период усвоения морфологической системы языка.
Перед началом обследования ребенка с речевыми нарушениями собирают подробный анамнез, где отражаются особенности I доречевого, речевого, моторного и психического развития ребенка, подробно анализируются особенности воспитания, окружения, отмечается наличие речевых нарушений или трудностей в обучении у членов семьи и родственников ребенка.
При оценке артикуляционного аппарата, особенностей дыхания, голосовых реакций ребенка с церебральной патологией в доречевой период необходимо учитывать его общее соматическое состояние, сенсорное развитие. При обследовании детей с двигательными нарушениями (с церебральными параличами) важно найти такое положение тела, при котором уменьшаетсямы-шечное напряжение в артикуляционном аппарате, облегчаются дыхание и голосообразование. Это положение врач должен указать логопеду-воспитателю, работающему с ребенком.
Обследование должно проводиться в положении ребенка на спине, животе, боку, а детей, умеющих сидеть, обследуют в положении сидя. При этом отмечают, в каком из этих положений артикуляционные и голосовые возможности ребенка проявляются
75
в наибольшей степени. Может быть использована следующая рабочая схема обследования.
Безусловные рефлексы. Проверяются рефлексы орального автоматизма: поисковый, ладонно-ротовой, хоботковый, губной, безусловнорефлекторные ротовые движения.
Артикуляционный аппарат. Отмечается положение языка в полости рта, возможность его движений, участие в акте сосания, жевания. Обращают внимание на наличие и характер насильственных движений языка, состояние и положение губ, подвижность мягкого нёба. Особое внимание обращается на состояние мышечного тонуса языка, губ. Выявляют диспластические изменения в строении артикуляционного аппарата (готическое нёбо, микрогнатия, прогнатия, короткая уздечка языка и т. д.).
Голосовые реакции. Оценивается характер крика, гуления и лепета. Отмечают, какие факторы стимулируют звуковую активность, какие тормозят ее. Обращают внимание на интонационный и коммуникативный характер звуковых реакций.
Дыхание. Обращается внимание на частоту, ритм, характер дыхания, отмечается связь вдоха и выдоха с общими изменениями мышечного тонуса. Дыхание обследуется во сне, в бодрству-.ющем состоянии, в покое, при крике и кормлении.
Сосание, глотание. Следует выяснить, нет ли слабости сосания и глотания, не держит ли ребенок длительное время молоко во рту, нет ли поперхивания и вытекания молока через нос, цианоза во время сосания. Важно определить синхронность актов сосания, дыхания и глотания.
Двигательная сфера. Обращают внимание на двигательное развитие ребенка (удержание головы, довороты в стороны, наличие кривошеи, возможность сидения, захвата игрушки, тяжесть поражения рук, какая рука поражена больше, выраженность тонических рефлексов).
Общие психические реакции. Важно оценить психическое развитие ребенка, особенности его сенсорных функций (зрения, слуха), развитие зрительно-моторной координации, эмоциональные реакции, особенности игровой деятельности и поведения. Исследуются память, внимание, гностические функции, состояние интеллекта.
Импрессивная (сенсорная) речь. Обследуется понимание речи как в процессе беседы с ребенком, так и при предъявлении ему специальных картинок.И1ри этом важно оценить пассивный хловарь ребенка, а также выявить, как ребенок понимает простые предложения. Наиболее простой прием исследования понимания речи — выполнение ребенком ряда словесных заданий. Этот прием позволяет выявить не только понимание речи, но и развитие регулирующей, побуждающей к действию функции речи. При оценке выполнения этого задания важно учитывать, что ребенок может его не выполнить по причинам выраженного нарушения слуха, недоразвития импрессивной речи, первичного на
76
рушения контакта с окружающими в результате органического ' поражения мозга, патохарактерологических особенностей и псцг хических заболевании. Бели ребенок правильно выполняет отдельные инструкции, задание усложняется и ребенку предлагается выполнить сразу два действия, сформулированных в одном предложении.
Важно обследовать как понимание отдельных слов, так и их связей в предложении. При обследовании понимания начальных грамматических форм речи используются специально подобранные картинки. При предъявлении ребенку заданий и при оценке полученных результатов всегда надо исходить из возрастных характеристик развития Понимания речи.
Экспрессивная (моторная) речь. При обследовании экспрессивной речи врач должен прежде всего составить представление о речи ребенка в целом, о ее полноте, внятности, темпе, плавности и т. д. Эти Характеристики выявляются в процессе беседы с ребенком. Если ребенок малоконтактный, то просят мать провести эту беседу в присутствии врача. Кроме беседы ребенку даются простые предметные и сюжетные картинки и его просят рассказывать, что на них нарисовано. Во время этого обследования обращают внимание на звукопроизношение (соответствует ли оно возрастной норме или нетУ^оцениваются общая внятность речи, ее темп, плавность, выразительность, состояние лексики и грамматики, а также особенности слоговой структуры слов. Задания всегда предъявляются с учетом возраста ребенка и уровня развития его речи в целом.
Оценка уровня коммуникации. При задержке речевого развития важно определить уровень общения ребенка с окружающими при помощи жестов и мимики. При этом обращают внимание на понимание ребенком выражения лица взрослого, символических жестов. Затем исследуют, как он использует жесты и мимику для обращения к окружающим. Если у .ребенка есть речь, следует выяснить, как он использует мимику и жесты для ее сопровождения.
Семиотика речевых расстройств. Расстройства речи у детей первых 3 лет жизни проявляются главным образом в нарушениях ее формирования, которые могут быть относительно парциальными (например, нарушение формирования главным образом звукопроизносительной стороны речи) и общими (задержка речевого развития — «дисфазия развития», «врожденная афазия», ала-лия). Кроме того, у детей первых 3 лет жизни часто бывают раз- ) личные невротические и неврозоподобные речевые расстройст-J ва — заикание, мутизм.
Нарушения речи в детском возрасте могут быть как относительно самостоятельными, так и симптомами различных нервно-психических заболеваний.
Физиологическое косноязычие — неправильное произношение отдельных звуков и звукосочетаний, наблюдаемое в первые 3—
77
5 лет жизни и обусловленное возрастной незрелостью речедвигательного аппарата. Для него характерно нарушение звукопроизношения, главным образом тех звуков, которые в онтогенезе речи появляются последними (шипящие, свистящие, переднеязычные, аффрикаты и некоторые другие). При физиологическом косноязычии обычно не страдает дифференцировка звуков на слух (фонематическое восприятие). Звукопроизношение по мере роста ребенка самопроизвольно улучшается.
Дислалия — выраженное нарушение звукопроизношения, обусловленное затянувшейся незрелостью или дефектами анатомического строения артикуляционного аппарата. В отличие от физиологического косноязычия дети не произносят большое количество звуков, и возможности спонтанного улучшения ограничены.
Дизартрия — нарушение звукопроизносительной стороны речи, обусловленное патологией иннервации мышц, участвующих в речевых движенияЗГДдыхательной мускулатуры, голосовых связок, гортани, нёба, языка, губ).
При дизартрии нарушаются артикуляция, дыхание и голосо-образование. Нарушение артикуляции вызывает затруднения или невозможность произносить отдельные звуки. Так, при парезе губных мышц затрудняется произнесение гласных «у>Г, «о» и согласных «б», «в», «п», «ф». При парезе мышц языка с трудом произносятся гласные «е», «и» и согласные — «д», «т», «с», «л», «р». Парез мягкого нёба затрудняет произнесение звуков «г», «К», «X».
При дизартрии нарушения звукопроизношения отличаются от физиологического косноязычия и дислалии большей тяжестью и стойкостью, а также чаще отмечается нарушение фонематического восприятия. Поэтому, если при дислалии чаще используется логопедический термин «фонетическое недоразвитие», то при дизартрии — «фонетико-фонематическое», или нарушение формирования фонемной системы языка в целом. Поэтому при дизартрии чаще нарушается формирование письменной речи.
Бульбарная дизартрия возникает при нарушении ядерных образований каудальных отделов мозгового ствола корешков и нервов. Наряду с нарушениями артикуляции и голосо-образования отмечаются расстройства глотания, снижение глоточного рефлекса, атрофии мышц языка, фибриллярные подергивания.
Псевдобульбарная дизартрия наблюдается при двустороннем поражении кортико-бульбарных путей к ядрам блуждающего, языко-глоточного и подъязычного нервов.
Речевые расстройства при псевдобульбарной дизартрии сопровождаются усилением рефлексов~орального автоматизма, глоточного рефлекса, повышением тонуса мышц языка, гиперсаливацией. Атрофии и 'фибриллярные подергивания отсутствуют.
78
Мозжечковая дизартрия возникает при поражении мозжечка и его связей. В этих случаях отмечается выраженная асинхронность между дыханием, фонацией и артикуляцией. Движения языка неточные, с гиперметрией, наблюдается артикуляционная атаксия, грубо нарушается дыхание. Речь становится за- < медленной, толчкообразной, с нарушенной модуляцией ударений, / затуханием голоса к концу фразы — скандированная речь.
При мозжечковой дизартрии в первую очередь страдает произношение тех звуков, для которых требуются достаточная четкость, сила и дифференцированность артикуляторных движений (переднеязычные звуки), а также достаточная сйла сокращения губных и язычных мышц (губные и взрывные звуки). Ввиду паретичности мышц мягкого нёба для этой формы дизартрии обычно характерен носовой оттенок голоса.
Экстрапирамидная, или подкорковая, форма дизартрии возникает при поражении подкорковых узлов и их связей. Дистония или повышение мышечного тонуса в мышцах языка, непостоянное проявление гиперкинезов отличают экстра-пирамидную дизартрию от псевдобульбарной и мозжечковой. Для экстрапирамидной дизартрии характерно отсутствие стабильности артикуляционных нарушений, поэтому и расстройства фонации (звукопроизношония) менее постоянны и более вариабельны, чем при других формах.
Корковая дизартрия наблюдается при поражении двигательных и чувствительных зон коры головного мозга, участвующих в иннервации артикуляционного аппарата. При пора-v/ жении нижних отделов передней центральной извилины возникает эфферентная форма корковой дизартрии. Для нее характерно более изолированное поражение отдельных мышц артикуляционного аппарата, особенно мышц языка^ по типу центрального коркового пареза. В связи с этим при корковой дизартрии страдает произношение тех звуков, которые связаны с наиболее тонкими изолированными движениями отдельных мышечных групп языка, это прежде всего некоторые переднеязычные звуки — «р», «л» и др. При корковой дизартрии в отличие от других форм дизартрии нет V слюнотечения, может не быть нарушений голоса и дыхания. Диа- > гноз корковой дизартрии представляет определенные трудности и ставится на основе общего нейрологического обследования.
При поражени зон задней центральной извилины, где проецируется чувствительность от мышц артикуляционного аппарата, возникает афферентная форма корковой дизартрии. Основным проявлением ее является артикуляторная апраксия (нарушение движений без выраженного пареза артикуляторной мускулатуры) .
Анатомическая близость расположения корковых двигательных и речевых зон, а также проводящих путей определяет то, что при дизартрии особенно часто вовлекаются в процесс двигательные системы мозга, и у ребенка наряду с речевыми наруше-
79
ниями проявляются и двигательные расстройства различной степени выраженности. Наиболее часто дизартрии наблюдаются при детских церебральных параличах. Стертые формы дизартрии отмечаются у детей с так называемой минимальной мозговой дисфункцией. Дизартрия может быть и без других симптомов наследственно-дегенеративных заболеваний нервной системы.
Алалия — недоразвитие речи, обусловленное нарушением коркового уровня речевой функциональной системы в доречевой период. Причиной алалии является поражение или недоразвитие определенных зон коры больших полушарий. Корковые речевые расстройства возникают чаще при поражении доминантного полушария (для правшей — левого).
Поскольку речь у детей раннего возраста находится только в стадии формирования, признаки поражения корковых речевых зон носят иной характер, чем у взрослых.
Моторная а л а л й я возникает при нарушении развития премоторно-лобных отделов доминантного полушария. При моторной алалии наблюдаются проявления речевой апраксии и нарушение формирования программы моторного речевого акта. Поэтому при отсутствии параличей и парезов мышц артикуляционного аппарата у ребенка не формируется «навык» произношения./Правильно выговаривая отдельные слоги и односложные слова, ребенок затрудняется в произнесении многосложных слов и предложений. За счет своеобразной речевой апраксии у него отмечаются выраженные и стойкие нарушения слоговой структуры слов, с трудом формируются линейная последовательность и динамика речевой деятельности. При этой форме речевого недоразвития обычно также наблюдаются недостаточность сенсорной речи и нарушения речевого мышления. Понимание речи при этой форме алалии более сохранно, чем возможность собственной моторной речи.
Сенсорная алалия наблюдается при поражении теменно-височно-затылочных отделов мозга доминантного полушария. При этом нарушен афферентный корковый синтез. Ребенок не понимает обращенную речь при сохранной функции слуха и не может сформировать достаточный пассивный словарь (речевая агнозия). Это приводит к «врожденной словесной глухонемоте». При этом у ребенка нарушено формирование как сенсорной, так и моторной речи и всегда имеются выраженные нарушения слуховой памяти.
Задержка речевого развития — отставание развития речи от возрастного уровня. Темп развития речи замедлен, ребенок позже начинает говорить отдельные слова, предложения. Задержка речевого развития может наблюдаться у недоношенных, соматически ослабленных детей, детей, перенесших асфиксию и родовую травму, при церебральных параличах, судорожном синдроме и др. Важное значение имеют также неблагоприятные условия окружения.
80
М При обследовании ребенка с нарушением речевого развития следует определить основной механизм нарушения, уровень поражения, качественную характеристику речевого дефекта, а также выявить симптомы, связанные с патогенезом основного заболевания, и вторичные симптомы, зависящие от речевой недостаточности и приспособления ребенка к своему речевому дефекту. Во всех случаях необходимо также установить сохраненные звенья в речевой и психической сфере и возможные пути дальнейшего речевого и психического развития ребенка.
При всех формах нарушенного речевого развития необходимо разграничить речевые нарушения, связанные с поражением нервной системы, и отставание речевого развития, обусловленное неблагоприятными условиями окружения и воспитания, соматической ослабленностью, индивидуальными наследственно-конституциональными особенностями, а также различными нервно-психическими заболеваниями.
Заикание — функциональное расстройство _ речи, в основе которого лежит судорога мышц речевого аппарата. Это одна из форм невротических и неврозоподобных нарушений речи у детей. Заикание может иметь характер моносимптомной формы невроза. Оно возникает чаще всего у детей дошкольного возраста с невропатией, ослабленных соматически. У них часто отмечается ускоренный темп умственного развития при общей моторной неловкости и некоторой задержке моторного развития. Дети рано начинают говорить, обычно говорят быстро и много, отличаются повышенной впечатлительностью, возбудимостью. Под влиянием перенапряжения нервных процессов, психической травмы на фоне незрелости моторного звена речевой Системы у них легко может возникнуть заикание.
Заикание может также развиться на фоне органического поражения центральной нервной системы. В этих случаях оно возникает исподволь без предшествующего психического перенапряжения или травмы. ^Гакое задкание называется неврозоподобным . и может быть как симптомом общей церебральной недостаточности, так и результатом преимущественного поражения тех мозговых структур, которые ведают моторной функцией речедвигательного анализатора, a/точнее тех, которые регулируют плавность и темп речи — подкорковых отделов мозга и мозжечка ^Поэтому даже^ негрубая недостаточность этих мозговых структур на данном возрастном этапе предрасполагает к развитию неврозоподобного заикания. Неврозоподобное заикание может возникать при нормальном речевом развитии и на фоне задержки речевого развития и дизартрии. Некоторые авторы выделяют «первичное» заикание, которое может быть у ребенка, еще не имеющего опыта речевого общения, и появляющегося одновременно со становлением его фразовой речи, и «вторичное», возникающее на фоне уже сформированной фразовой речи. В зависимости от характера
81
судорожного спазма заикание бывает тоническим, клоническим и, чаще, клонико-тоническим.
Мутизм — функциональное нарушение речи, характеризующееся отсутствием речевого общения и возникающее обычно под влиянием психической травмы. Острая психическая травма может приводить к общему мутизму. При длительной психической трав-матизации иногда развивается элективный (избирательный) мутизм как проявление пассивной реакции протеста. .
Заикание и мутизм могут быть изолированными речевыми нарушениями, в других случаях они появляются на фоне различных нервно-психических заболеваний (в частности, при детской шизофрении).
При анализе речевых нарушений и постановке диагноза учитываются показатели педиатрического, неврологического, психиатрического обследования, а также данные, полученные при дополнительных методах исследования. Речевой диагноз является частью общего клинического диагноза и никогда не должен основываться только на выявленных у ребенка нарушениях речи.
Исследование психических функций
Стадии психического развития ребенка тесно связаны с этап-ностью созревания мозга и усложняющимися условиями взаимодействия ребенка с окружающей средой. Поэтому для правильного понимания процесса психического развития в норме и патологии важно определить особенности внутриутробного и постнатального созревания мозга, влияние на его развитие наследственных и средовых факторов.
Становление сложных психических функций, какими являются произвольное внимание, активное запоминание, мыслительная деятельность, а также развитие характера и поведения, в значительной степени зависят от окружающей социальной среды, условий воспитания, культурно-бытового окружения, характера общения, форм и способов деятельности и т. д. Ребенок с первых дней своего существования находится под влиянием окружающей его социальной среды, которая, взаимодействуя с генетической программой, определяет его развитие. Поэтому для ребенка среда выступает не только как условие, но и как источник его развития (Л. С. Выготский, 1956).
Психическое развитие ребенка характеризуется тем, что на каждом последующем возрастном этапе происходят не только количественные изменения, но возникают новые свойства и качества личности. При этом формируются и сами психические процессы, и сложная взаимосвязь между ними. Это обеспечивает развитие структуры сознания в целрм^а уровень сознания в свою очередь определяет дальнейшее развитие каждого психического процесса и отдельных форм сознательной деятельности. Для развития психики ребенка характерно неодновременное и неравно-
82
,/мерное формирование различных психических функций. Эта неравномерность особенно выражена в условиях патологии (при раннем органическом поражении мозга), когда имеет место своеобразная гетерохрония постнатального развития, определяющая различные аномалии психической деятельности.
Психическое развитие включает ряд возрастных этапов, каждый из которых характеризуется своими особенностями. Преобладание на каждом этапе тех или иных форм нервно-психического реагирования обусловлено спецификой возрастных нейрофизиологических механизмов (В. В. Ковалев, 1973; Г. К. Ушаков, 1973). Необходимо учитывать, что каждый предшествующий этап как бы подготавливает базу, является одним из звеньев всего хода психического развития ребенка. Нарушение на каком-либо одном возрастном этапе с неизбежностью влечет за собой изменение последующих.
Этапы раннего психического развития детей принято подразделять на младенческий (от рождения до 1 года) и ранний пред-школьный или ясельный (от 1 до 3 лет).
На протяжении всего 1-го года жизни ребенка выступает отчетливая взаимосвязь сенсорного и моторного развития, в связи с чем первый (младенческий) этап психического развития можно считать сенсомоторным. На 1-м году жизни уровень сенсомоторного развития изменяется через каждые 1—2 мес, поэтому процесс развития ребенка 1-го года жизни целесообразно оценивать по месяцам.
Первый период (0—1 мес). Развивается зрительное и слуховое сосредоточение, что вызывает торможение общих импульсивных движений и создает условия для развития спокойного бодрствования. Уже на 1-м месяце жизни примитивные эмоциональные реакции имеют приспособительное сигнальное значение, являются средством для получения ребенком от взрослого всего необходимого для жизни. Так, на этом возрастном этапе отчетливо проявляется отрицательная эмоциональная реакция при запаздывании кормления, выражающаяся в крике и усилении общей двигательной активности, учащении пульса.
Второй период (1—3 мес). На основе зрительного и слухового сосредоточения возникает и закрепляется мимико-соматический комплекс оживления, в системе которого налаживается работа мышц-антагонистов и создаются предпосылки для дальнейшего развития движений.
К 3 мес у ребенка имеются выраженная зрительная фиксация и прослеживание движущегося предмета в горизонтальной плоскости. Ребенок поворачивает глаза и голову к источнику звука. Впервые появляются положительные эмоции: улыбка при общении со взрослым, смех.
Третий период (3 6 мес). Характерной особенностью этого периода является интенсивное развитие комплекса оживления. К 4 5 мес комплекс оживления становится доминирующей
83
системой движения. Полный комплекс оживления включает улыбку, оживленные движения, звуки и обычно он выражен при общении взрослого с ребенком.
Тесная взаимосвязь между сенсорным и моторным развитием на этом возрастном этапе проявляется в том, что преобладающее значение в развитии движений руки ребенка начинает приобретать зрительный раздражитель. Формируются связи между кинестетическим и зрительным анализаторами, развивается зрительно-моторная координация. К шестимесячному возрасту ребенок, лежа на спине, быстро и точно протягивает руки к игрушке, с какой бы стороны от него она ни находилась. Развитие зрительно-моторной координации и начального манипулирования с предметами являются мощными стимулами для психического развития ребенка.
На этом возрастном этапе появляются первые элементы зрительной и слуховой дифференцировки: ребенок начинает различать своих и чужих, хорошо дифференцирует некоторые интонации, правильно определяет направление звука, отдает предпочтение некоторым игрушкам. Развитие дифференцированного восприятия является важной основой для формирования интеллекта.
Эмоциональные реакции также приобретают дифференцированный характер. Появление улыбки уже не зависит от силы и продолжительности зрительных и слуховых раздражителей, а связано с предпочитаемыми раздражителями.
Четвертый период (6—9 мес). Характерной особенностью психических функций на . этом этапе является развитие подражания и начального ситуационного восприятия обращенной речи, дальнейшее совершенствование эмоциональных и сенсорных реакций, начальное восприятие пространства (благодаря ползанию). Комплекс оживления при этом угасает, сменяясь развитием более дифференцированных психических реакций.
Пятый период (9—12 мес). Отличительной чертой этого периода, является интенсивное развитие понимания обращенной речи, дифференцированность сенсорных и эмоциональных реакций, развитие манипулятивной и предметной деятельности. У ребенка формируются первые представления, составляющие категории наглядно-действенного, а затем и образного мышления. Эти первые представления ассоциируются не только между собой,, но и с многочисленными двигательными реакциями ребенка (кинестетическими и проприоцептивными раздражениями). Образование многочисленных временных связей в системе двигательного анализатора является материальной основой формирования обобщенного мышления. Интенсивно продолжается развитие подражания, которое на этом возрастном этапе представляет собой особую форму деятельности ребёнка, обеспечивающую появление и упрочение связей между новыми движениями и представлениями. Разнообразные движения обогащают запас представлений ребен
84
ка и создают возможность их связи (ассоциации). Важную роль в этом процессе играет развитие речи.
Шестой период (1—3 года). Характерной особенностью этого периода является развитие речи. Поэтому ранний преддо-школьный период в целом можно считать периодом развития активных форм общения. На этом этапе развиваются сугубо человеческие особенности психической деятельности: речь, мышление (формируются начальные понятия), возникают первые представления о своей личности (начальные элементы самосознания), а также развивается целенаправленная деятельность. Во всех формах психической деятельности ведущее значение принадлежит речи. Благодаря развитию коммуникативной функции речи у ребенка формируются первые социальные отношения, которые в свою очередь являются мощным стимулом речевого развития. С появлением речи весь предшествующий сенсомоторный этап психического развития ребенка поднимается на новый, качественно более высокий, уровень. Благодаря речи сенсорный опыт ребенка превращается в акт познания. Речь становится важнейшим инструментом мышления и опорой в процессе его формирования.
С развитием речи объектом мысли ребенка становится не только конкретное восприятие, характерное для сенсомоторного этапа развития, но возникает возможность оперировать представлениями. Это является основой для развития важнейшей особен-лости психической деятельности — способности к сопоставлению и противопоставлению воспринимаемых объектов, что определяет возможность формирования первых понятий.
К 3 годам взаимодействия ребенка с окружающей средой становятся все более многообразными и тонкими, значительно расширяется овладеваемое им пространство.
Появляется важная особенность психической деятельности — ребенок начинает противопоставлять себя окружающему, развиваются начальные элементы самосознания, возникает потребность утверждать и завоевывать свою самостоятельность. Стремление взрослых подавлять это стремление вызывает у ребенка протест, который проявляется в различных реакциях негативизма.
В возрасте 2—3 лет развивается игровая деятельность, формируется функция активного внимания.
Речь приобретает истинно второсигнальное значение, становится «сигналом сигналов», слово взрослого направляет и организует всю деятельность ребенка. Развивается регулирующая функция речи.
Быстрым темпом развивается эмоциональная деятельность. Эмоции на этом возрастном этапе характеризуются адекватностью, яркостью проявлений и дифференцированностью, появляются различные оттенки эмоциональных переживаний. Развитие эмоций в онтогенезе проходит ряд стадий в соответствии с общими закономерностями развития психики. Они формируются в
85
прямой связи с усложняющимися требованиями окружающей среды. В разные возрастные периоды качества эмоций неравнозначны. До 3 лет эмоции еще являются диффузными, гомогенными, психически мало дифференцированными, они практически неотделимы от простейших органических потребностей ребенка.
L Формирование после 3 лет первичного представления «Я» и с выделение ребенком себя из окружающего означает не только становление сознания, но и новый качественный уровень в развитии эмоций. На этом возрастном этапе начинают развиваться специфические человеческие, корковые (эпикритические) эмоции.
Исследование психических функций проводится в аспекте развития и включает изучение восприятия, эмоциональных реакций, интеллекта и поведения. Наибольшие трудности в раннем детском возрасте представляет оценка интеллекта.
Состояние интеллекта у детей оценивается с помощью клинико-психологического анализа, предусматривающего совместное обследование ребенка детским психиатром, невропатологом, психологом, педагогом. Система обследования интеллекта включает: клинико-психологическое обследование, обучающий психологический эксперимент, метод педагогической оценки.
Цель клинико-психологического обследования — выявление объема знаний и представлений об окружающем, особенностей мышления, характера интеллектуальной деятельности. Оно включает наблюдения за игровой деятельностью ребенка, его поведением в различных ситуациях, беседу и предъявление специальных заданий (соответственно возрасту узнавание предметов по картинке, их название, понимание смысла простой сказки, рассказа, конструирование из кубиков и т. д.).
Цель обучающего эксперимента и метода педагогической оценки — выявить характер имеющихся дефектов и определить потенциальные возможности развития интеллекта ребенка.
При оценке интеллекта, помимо непосредственных интеллектуальных показателей, обязательно учитываются особенности эмоциональных реакций ребенка, адекватность его поведения. Важное значение придается данным неврологического и соматического исследования.
При обучающем психологическом эксперименте изучению подлежат как произвольные, так и непроизвольные реакции ребенка. Для исследования каждой из основных форм психической деятельности подбирается специальный экспериментальный материал, который предъявляется с учетом возраста ребенка и специфики поражения (табл. 5).
Психологическое обследование проводится в определенных стандартных условиях, учитывается объем помощи, оказываемой ребенку в выполнении каждого задация. Такая комплексная методика делает возможным изучение качественных особенностей интеллектуальных нарушений, что является основой для дифференциального диагноза.
86
Таблица 5. Примеры некоторых заданий, предъявляемых детям в возрасте 2—3 лет при оценке уровня их психического развития
Функция Характер предъявленного задания Оценка
Понимание обращенной Показ предметов, игру- 5 — выполняет задание
речи: названий отдельных предметов, иг- шек, картинок сам 4 — выполняет сам частично
рушек и узнавание их на картинках (простых и сюжетных); 3 —выполняет с помощью легко 2 — выполняет в процессе длительного обучения
названий действий Показ картинок и вопро- 1 — выполняет в процес-
в различных ситуациях и вопросов; сы к ним се длительного обучения частично 0 — не выполняет совсем
содержания корот- Изложение сказки по Оценка по вышеприве-
кого рассказа или сказки Исследование сенсорных функций: возможность узнавания знакомых игрушек и карти- картинке Показ игрушек и картинок денной шкале является 1 вариантом оценки результатов
нок Ребенку показывают 6— 5 — выполняет сам лег-
возможность сли- 8 шариков одинакового ко после 1—2 показов;
чения цветов размера, окрашенных в два цвета, складываются в общую коробку. На 4 — выполняет в процессе длительного обучения (3—5 показов)
Исследование предметной деятельности: стол помещаются две пластмассовые тарелки таких же цветов, как шарики. Взрослый на глазах у ребенка берет красный шарик, кладет его в красную тарелку, затем дает синий шарик ребенку и просит его положить в соответствующую по цвету тарелку. При оценке учитывается объем оказанной ребенку помощи 3 — выполняет в процессе длительного обучения частично с ошибками 2 — выполняет в процессе длительного обучения частично, одновременно со взрослым 0 — не выполняет Оценка по вышеприведенной шкале является II вариантом оценки результатов
исследуется самостоятельная деятельность ребенка, его умение использовать предметы и игрушки по назначению Исследователь наблюдает за самостоятельной игрой ребенка По варианту I
определение воз- Ведущую роль приобре- По варианту II
87
Продолжение табл. 5
Функция Характер предъявленного задания Оценка
можности участия ребенка в совместной игре со взрослым, способность организовать собственную деятельность по указанию взрослого тает .речевая инструкция взрослого Ребенку показывают те же игрушки и дается речевая инструкция — разбери пирамидку; сложи кубики и т. д. Ребенку показывают об- По варианту II
исследование возможности ребенка подражать взрослому способом действий с игрушками Исследование мышления: раз цы действий со следующими игрушками; мяч, кубики, кукла, пирамидка. Ребенок должен использовать каждую игрушку по назначению Ребенку дают две чашки По варианту II
возможность первичного обобщения по назначению или функции предметов по существенным признакам Исследование возмож- красного и желтого цвета и красный платок. Он должен подобрать к красной чашке другой предмет Ребенка просят подобрать По варианту I
ности установления тождества предметов игрушку по образцу, по общей словесной инструкции «дай такую же». Перед ребенком помещают ряд игрушек (не более 4): рыбка, машина, кукла. В руках взрослого машина. Ребенка просят: «дай такую же» Ребенку показывают иг- По варианту I
исследование воз- рушку (кукла) и дают конкретную инструкцию: «дай куклу» Сначала перед ребенком По варианту 1
можности установления тождества картинок исследование пер- кладут две картинки. Точно такие же две в руках взрослого. Затем взрослый закрывает свои картинки, показывает одну из них и просит ребенка дать такую же. Набор картинок может быть увеличен до 3—4 Складывание разрезной По варианту II
вых элементов пространственного мышления картинки из двух частей
88
_ Общие требования к проведению психологического обследования методом обучающего эксперимента:
при обследовании маленького ребенка или ребенка с тяжелыми нарушениями речи и моторики ему необходимо помочь найти адекватные средства общения со взрослым. Общение с ребенком устанавливается путем игрового контакта;
ребенка необходимо заинтересовать обследованием;
усложнение заданий, переход от конкретных ко все более абстрактным не требует от ребенка новых форм ответных реакций;
формы ответных реакций не должны влиять на общую оценку интеллекта;
методы обследования подбираются с учетом дефекта. Детям с речевыми нарушениями можно давать некоторые задания с помощью показа и жестов, не требуя речевого ответа.
Иногда при обследовании детей с повышенной нервной возбудимостью из-за резкого негативизма, агрессивности или упрямства вступление с ними в контакт оказывается невозможным. В этих случаях используется метод свободного наблюдения за игровой деятельностью ребенка при тщательно подобранном игровом материале.
Некоторые дети с минимальной мозговой дисфункцией при правильном отношении к ситуации и эксперименту, нормальном интеллекте или при нерезко выраженной задержке психического развития во время обследования кажутся беспомощными и несамостоятельными. Они отличаются моторной неловкостью, задержкой формирования навыков самообслуживания, невнятной речью. Чрезмерная опека близких развивает у этих детей привычку к несамостоятельности, усугубляет неадекватность их поведения, резко затрудняя приспособление к новой ситуации.
У детей с ранним органическим поражением мозга из-за повышенной психической истощаемости (церебрастенического состояния) могут отмечаться нарушения интеллектуальной деятельности, низкий мотивационный уровень. Поэтому ответы этих детей отличаются неравномерностью: при эмоциональной заинтересованности ребенка, при настойчивости исследователя эти дети дают более высокие показатели. К концу обследования, особенно если нет побуждающих стимулов к выполнению задания, качество ответов резко падает. Эти дети нуждаются в дозированном во времени обследовании, в стимуляции к выполнению задания, похвале, одобрении. Иногда при обследовании этих детей желательно присутствие матери.
Оценка по I варианту предполагает возможность выполнения ребенком задания самостоятельно. При невозможности выполнения задания ребенку оказывается помощь (включается оценка по II варианту). При II варианте ребенка с самого начала обучают определенным умственным действиям.
89
Чтобы составить ориентировочное представление о количественном уровне психического развития, можно общее полученное число оценок разделить на возраст ребенка в месяцах. Это может быть некоторым дополнением к качественной характеристике психического развития и структуре дефекта. Педагогическая оценка проводится педагогом.
Семиотика психических нарушений. Психомоторные расстройства. Среди различных психомоторных нарушений у детей первых 3 лет жизни большой удельный вес принадлежит различным соматовегетативным проявлениям. Почти любое психическое расстройство в раннем детском возрасте влечет за собой изменение функций всего организма: расстройства питания, секреторной, висцеральной и вазомоторной иннервации, нарушения сна.
Другим частым проявлением психомоторных расстройств является нарушение игровой деятельности. Игра представляет собой важнейший механизм формирования психики. При различных психических нарушениях, независимо от вызывающих их механизмов, наиболее ранние изменения отмечаются в характере игровой деятельности ребенка.
При выраженных задержках психического развития и при умственной отсталости (олигофрении) инициативный, творческий сюжетный характер игры не развивается. Игры ребенка отличаются примитивизмом, однообразием, лишены активного творческого характера и осуществляются на основе конкретного простого подражания.
У детей с минимальной мозговой дисфункцией в играх проявляются повышенная психическая истощаемость, непоследователь-\/ ность, недостаточная целенаправленность, нарушения внимания. Дети не могут длительно и сосредоточенно играть, с интересом принимаясь за игру, тут же ее бросают, игрушки предпочитают разбрасывать, ломать. Из-за нарушений целенаправленной игровой деятельности и повышенной психической возбудимости они часто не находят контакта со сверстниками.
Дети с аутизмом предпочитают играть в одиночку, они не тянутся к своим сверстникам, не проявляют к ним эмоционального интереса. При органическом аутизме ребенок играет один, игры его адекватны возрасту. При ранней детской шизофрении игры вычурны, иногда своеобразно символичны и часто сопровождаются патологическим фантазированием. В фантазиях ребенок полностью теряет связь с окружающей реальной действительностью.
Среди психомоторных нарушений большое место у детей раннего возраста занимает синдром психомоторной рас-торможенности. Наиболее часто он наблюдается при раннем органическом поражении мозга. Характер и степень его выраженности могут быть различными. Дети расторможены, постоянно находятся в движении, ломают предметы, рвут, царапают все, что попадается под руку. При утомлении и перед сном дви
90
гательное беспокойство обычно нарастает. Психомоторная растор-моженность органического генеза нередко сопровождается склонностью к ритмическим стереотипам. У одних детей на фоне психомоторной расторможенности преобладает бедность спонтанной деятельности, у других — постоянная потребность к переменам действий.
Психомоторная расторможенность обычно сочетается с частой сменой настроения в сторону раздражительно-мрачного, с повышенной аффективной возбудимостью. Отмечаются также новы- / шейная отвлекаемость, нарушение сна, ряд патологических при- < вычек. Дети долго и упорно грызут ногти, сосут пальцы; иногда ; наблюдаются патологические влечения (элементы садизма, онанизм и т. д.).
Своеобразный синдром психомоторного возбуждения может проявляться и при психических заболеваниях у детей, в частности при шизофрении. Психомоторное возбуждение при шизофрении носит название кататонического. Это пустое, нелепое, немотивированное двигательное возбуждение, которое сопровождается вычурными стереотипными движениями рук, бессвязной речью, реакциями негативизма, эхолалиями (эхообразное повторение слышимых слов), эхопраксией (эхообразное повторение видимых движений). Ребенок в состоянии такого возбуждения обычно не реагирует на окружающую обстановку, совершает ряд импульсивных действий. Для шизофрении характерна смена подобного возбуждения более или менее продолжительными эпизодами застывания, ступора.
Состояние психомоторного возбуждения может быть эквивалентом судорожного припадка. В этих случаях психомоторное возбуждение возникает внезапно, приступообразно, на фоне угнетенного сознания, иногда сопровождается отдельными мышечными подергиваниями. После приступа ребенок не помнит о случившемся. В некоторых случаях, например при глубоких цере-брастенических состояниях, имеет место синдром двигательной заторможенности.
Перцепторные расстройства — нарушение ощущений и восприятия. Многие симптомы и синдромы нервно-психических заболеваний у детей связаны с нарушением перцепции. Перцепторные расстройства могут отмечаться у детей с ранним органическим поражением мозга. Они особенно выражены при церебральных параличах, для которых характерны специфические сенсорные расстройства (зрительные, слуховые, кинестетические), а также нарушение совместной деятельности различных анализаторов. Это в свою очередь приводит к недоразвитию гностических функций, в частности, оптико-пространственного гнозиса. Дети раннего возраста с церебральным параличом испытывают затруднения в различении формы, величины предметов, их пространственного расположения. В дальнейшем могут выявляться более четкие пространственно-временные нарушения.
91
Перцепторные нарушения характерны также для детей с умственной отсталостью, при этом выраженность нарушений соответствует степени снижения интеллекта.
Симптомы перцепторных расстройств у детей раннего возраста могут проявляться в возникновении ложного восприятия (иллюзий и галлюцинаций).
Иллюзии — ошибочное восприятие реально существующих предметов и явлений действительности. У детей раннего возраста иллюзии могут быть физиологическими, что связано с особенностями детского воображения. Для ребенка раннего возраста характерны отсутствие критики к продукции воображения, тенденция к образному, фантастическому восприятию окружающей действительности. Поэтому у впечатлительного, легко возбудимого ребенка могут отмечаться так называемые физиологические иллюзии. Однако сочетание этих иллюзий со страхом приобретает характер болезненных явлений.
Галлюцинации— непроизвольно возникающие, яркие, чувственные образы предметов и явлений, объективно отсутствующих в воспринимаемом окружении. Галлюцинации являются типичным симптомом психозов и не наблюдаются при неврозах. У детей галлюцинации и иллюзии наиболее часто возникают при инфекционных и интоксикационных психозах, на высоте лихорадочных состояний, в период колебаний ясности сознания, а также при шизофрении. У детей раннего возраста они отличаются неопределенностью, неочерченностью, непостоянством.
Эмоциональные (аффективные) расстройства. Особенности эмоций у. детей первых 3 лет жизни определяют структуру эмоциональных расстройств на этом возрастном этапе. Возникающие на 3-м году жизни преходящие реакции протеста, отказа, различные формы негативизма, плаксивость, раздражительность, капризы не следует расценивать как патологические эмоциональные расстройства. Возникая эпизодически и не нарушая контакта ребенка с окружающей действительностью, они носят физиологический характер и связаны с возрастной фазой развития ребенка.
Одним из наиболее частых симптомов аффективных расстройств у детей раннего возраста является ночной страх. Наиболее типично возникновение ночного страха в период первого возрастного криза (2—4 года). Он проявляется состоянием острого возбуждения, сопровождается криком, плачем, вегетативными реакциями. Ребенок беспокоен, на лице выражение ужаса, страха, он кричит и часто пробуждается. Содержание ночных страхов у детей раннего возраста обычно мало дифференцировано и чаще исходит из фабулы рассказов и сказок окружающих. Симптом ночного страха может быть проявлением невротического состояния у впечатлительного, легко возбудимого ребенка, а также начальным проявлением психического (шизофрении) или неврологического (эпилепсии) заболевания.
92
Особенностью страхов у детей является их тенденция к генерализации и рецидивам. Неблагоприятное значение для прогно-* за имеют продолжительность ночных страхов, отсутствие полного пробуждения, распространение ночных страхов на дневное время, постепенное усложнение их содержания, наличие вегетативных реакций (диффузное покраснение или побледнение, потливость, учащенное сердцебиение, нарушение дыхания), а также навязчивый характер.
Наряду с типичными ночными страхами у детей раннего возраста часто отмечаются страх одиночества (ребенок боится оставаться один) и страх темноты. Они могут наблюдаться и у здоровых, но впечатлительных детей, часто возникают при врожденной нервности, а также наряду с другими симптЬмами, характерными для психических заболеваний.
Эмоциональная лабильность является частым симптомом аффективных расстройств у детей раннего возраста. Эмоциональная лабильность проявляется в неустойчивости настроения с неожиданным легким переходом от повышенного к пониженному— от смеха к слезам и наоборот. Настроение меняется быстро, приступообразно и без внешнего повода. Эмоциональная лабильность характерна для церебрастенических состояний у детей с поражением центральной нервной системы, а также наблюдается после перенесенных соматических и инфекционных заболеваний.
При органическом поражении мозга, эпилептиформном синдроме могут развиваться состояния тоскливо-раздраженного характера со злобой, негодованием, агрессивностью. Они чаще возникают приступообразно и носят название дисфории. В некоторых случаях у детей наблюдаются полное безразличие, равнодушие, безучастие. Они пассивны, большую часть времени проводят в постели. Такое состояние называется апатико-абу личе ским синдромом. Он возникает чаще всего при поражении лобно-лимбических отделов мозга, наблюдается у детей с церебральными параличами, при некоторых формах олигофрении и других заболеваниях.
Эйфория — повышенное, радостное, приподнятое настроение со снижением критики. Может наблюдаться при недоразвитии лобных отделов мозга.
Одной из частых форм аффективных расстройств у детей раннего возраста является реакция протеста. Необходимо сужение понятия «реакция протеста*» и исключение из него всех тех форм протеста, которые могут часто возникать в переходный период развития ребенка и являются психологически понятными переживаниями здорового ребенка. К реакциям протеста как проявлениям аффективных расстройств относятся только патологические состояния, нарушающие возможность приспособления ребенка к окружающей среде. Различают две формы реакций протеста: пассивную и активную.
93
Клинические проявления пассивных реакций протеста у детей раннего возраста чаще всего характеризуются синдромом со-матовегетативных расстройств (отказ от еды, насильственный кашель, рвота, запоры, нарушения навыков опрятности — недержание мочи и кала). Одной из частых форм пассивной реакции протеста является также элективный (избирательный) мутизм, когда ребенок перестает разговаривать с определенными лицами.
Активные реакции протеста проявляются в реакциях возбуждения со злобой и агрессией в отношении окружающих. Они обычно возникают внезапно в связи с обидой или неудовлетворением требований и желаний ребенка и сопровождаются бурной аффективной реакцией. На высоте такой вспышки ребенок кричит, падает на пол, стучит ногами, дерется. У детей первых 2 лет жизни подобная реакция протеста может проявляться в аффективных респираторных судорогах. Одной из основных причин реакций протеста является нарушение семейных взаимоотношений и ошибки воспитания.
Лечебно-педагогические мероприятия против реакций протеста должны начинаться как можно раньше, иначе эти реакции постепенно могут превратиться в устойчивое неправильное поведение и явиться исходным моментом в формировании патологического характера.
Интеллектуальные нарушения у детей могут проявляться тремя основными формами:
нарушения интеллектуальной деятельности;
различные варианты задержки психического развития;
недоразвитие познавательной деятельности (олигофрения) и снижение, распад интеллекта, деменция.
Нарушения интеллектуальной деятельности проявляются повышенной психической истощаемостью, нарушением памяти, внимания, недостаточной целенаправленностью. Кроме того, могут наблюдаться нарушения темпа и характера мышления. Наиболее часто у детей с органическим поражением мозга отмечаются замедленность мышления (брадифрения), а также инертность мыслительных процессов^ их малая динамика и нарушенная переключаемость. Нарушения интеллектуальной деятельности имеют место при различных церебрастенических состояниях.
Задержки психического развития характеризуются замедлением темпа становления интеллектуальных функций. Запас знаний и представлений об окружающем у таких детей ниже возрастного уровня. Задержано развитие умственных действий и начальных форм логического мышления. В отличие от олигофрении эти дети имеют большие потенциальные возможности для развития интеллекта. Они правильно используют помощь взрослых и при соответствующих медико-педагогических мероприятиях отставание в психическом развитии может быть в значительной мере скомпенсировано. В зависимости от причины, 94
вызвавшей задержку, различают задержку психического развития при соматических заболеваниях, недоношенности, педагогической запущенности, тяжелых нарушениях речи, слуха, опорнодвигательного аппарата и др.
При олигофрении (недоразвитии интеллекта) интеллектуальный дефект характеризуется двумя особенностями: психическое недоразвитие имеет диффузный «тотальный» характер, страдает не только мышление, но вся психическая деятельность ребенка в целом; на фоне общего психического недоразвития больше всего страдают молодые в онто- и филогенетическом отношении функции мышления.
Стойкая интеллектуальная недостаточность, возникающая у детей старше 2—3 лет после инфекций и травм, обозначается термином «органическая деменция». При органической? деменции, в отличие от олигофрении, происходит распад уже более или менее сформированных интеллектуальных функций. Следующие характерные признаки деменции отличают ее от олигофрении:
отсутствие критики и целенаправленной мыслительной деятельности;
выраженные нарушения внимания, памяти, иногда ряда гностических функций;
более выраженные эмоциональные нарушения, которые не коррелируют со степенью снижения интеллекта;
чаще наблюдаются нарушения инстинктивной сферы: повышенные или извращенные влечения, импульсивные действия или, наоборот, ослабление инстинктов (отсутствие чувства страха, инстинкта самосохранения);
характерна диссоциация между степенью интеллектуального дефекта и нарушением деятельности; поведение ребенка часто неадекватно ситуации, даже при отсутствии резко выраженной интеллектуальной недостаточности.
Интеллектуальные нарушения сложной структуры, включающей в себя признаки органической деменции и олигофрении, наблюдаются при некоторых наследственных заболеваниях обмена: t фенилкетонурии, болезни с запахом мочи кленового сиропа, галактоземии, липоидозах, в частности при болезни Тея — Сакса, и др. В этих случаях речь идет о синдроме слабоумия при наследственных болезнях обмена.
В резидуальной стадии и в отдаленный период после перенесенных инфекций и травмы головного мозга нередко наблюдаются интеллектуальные нарушения, которые могут быть преходящими, легко обратимыми или более-менее стойкими. Временные обратимые нарушения рассматриваются как функционально-динамические расстройства интеллектуальной деятельности, проявляющиеся в следующих клинических синдромах: церебрастени-ческом, апатико-абулическом, брадифрении, эйфории с психомоторной расторможенностью.
95
Органический психосиндром — наиболее часто встречающаяся форма нарушения психических функций у детей первых 3 лет жизни. Во взрослой психиатрии понятие этого синдрома является более широким и включает все признаки острого экзогенного психического расстройства. В детской психиатрии этот термин обычно употребляется в более узком смысле и обозначает психические нарушения, развившиеся после органического поражения головного мозга. Некоторые авторы называют его психоорганическим синдромом или синдромом органического дефекта. Органический психосиндром у детей раннего возраста характеризуется соматовегетативными расстройствами, церебра-стеническими явлениями, нарушением памяти, внимания, явлениями двигательной расторможенности, аффективными расстройствами, а также нарушениями мышления (инертность и замедленность). У детей с органическим синдромом обычно отмечается задержка психического и речевого развития, иногда могут иметь место и более локальные гностические и речевые расстройства. Проявления органического психосиндрома видоизменяются в зависимости от его патогенеза, а также от возрастной фазы развития ребенка.
Синдром детского аутизма. У некоторых детей уже в первые годы их жизни выявляется дисгармония развития отдельных сторон личности. К этой группе относятся дети с ранним аутизмом. Основным признаком аутизма является, отсутствие потребности в общении со сверстниками. Ребенок не стремится к совместным играм с детьми, предпочитая одиночество или общество взрослых. Уже в раннем дошкольном возрасте обращает на себя внимание дисгармония психического, речевого и моторного развития. Так, у ряда детей можно отметить ускоренное интеллектуальное развитие при недостаточности моторики. Такие дети отличаются моторной неловкостью, у них с большим трудом можно развить навыки самообслуживания.
Дисгармония психического развития при аутизме проявляется прежде всего в отсутствии корреляции между состоянием интеллекта и повседневной продуктивностью ребенка, которая всегда оказывается ниже его интеллектуальных возможностей.
Характерной особенностью детей с аутизмом является недостаточное развитие у них навыков подражания и перцепторных процессов. Тактильный, обонятельный и вкусовой анализаторы часто более развиты, чем зрительные и слуховые. Дети не способны реагировать на два или более раздражения сразу. Эти особенности перцепторного развития проявляются в поведении и игре аутичного ребенка. Такой ребенок при виде новой игрушки начинает «исследовать» ее, пробуя на вкус, нюхая, облизывая. Аутичный ребенок как бы зрительно игнорирует новых для него людей, а иногда и новые предметы, он может натыкаться на окружающие предметы, вызывая у взрослых подозрение на недостаточность зрения. Такая же гипореактивность отмечается в
96
первые годы жизни и по отношению к тактильным и болевым раздражителям: ребенок пассивно роняет вложенный в руку предмет, не проявляет особой реакции при ушибах, порезах, как бы не чувствует уколов. Все сенсорное восприятие отличается выраженной дисгармонией: гипореактивность ко многим сенсорным стимулам может сочетаться с повышенной чувствительностью к другим раздражителям. Так, ребенок может не выносить шума пылесоса, иногда даже шелеста бумаги, болезненно затыкая при этих звуках уши, и в то же время сам может часами вызывать ряд крайне неприятных звуков (царапать по стеклу, греметь крышками, скрипеть- зубами и т. д.) Мало реагируя на внешние зрительные стимулы, эти дети иногда часами рассматривают свои руки, пальцы, различные мелкие детали одежды.
Многие движения имеют повторяющийся, стереотипный характер. Дети кружатся, качаются, крутят головой, взмахивают руками, хлопают в ладоши. Своеобразная гиперактивность сменяется периодами неподвижности, при этом длительное время может сохраняться самая неудобная поза. Походка детей с аутизмом имеет свои характерные особенности: они нередко ходят на пальчиках, но в отличие от больных с церебральными параличами не постоянно, а только в период возбуждения. Все эти особенности создают впечатление странного, непонятного, часто вычурного поведения.
У детей с аутизмом описаны нарушения сенсомоторной интеграции с преобладанием перцептуальной активности над перцептуальным анализом. Высказывается точка зрения, что особенности вычурной моторики и игры аутичного ребенка имеют своеобразный компенсаторный характер.
Эмоциональная сфера при аутизме отличается отсутствием непосредственности и цельности переживаний. Среди детей с аутизмом наблюдаются эмоционально холодные, раздражительные, вялые, тихие, маложизнерадостные. Они обычно не высказывают никаких жалоб, но не испытывают и особой радости. У некоторых из них отмечаются повышенная раздражительность, капризность, упрямство или, наоборот, немотивированно приподнятое настроение, повышенная болтливость, суетливость. Во всех случаях отсутствие потребности в общении с другими составляют основной признак клинической картины. Приспособляемость этих детей к окружающей среде, к коллективу всегда в большей или меньшей степени снижена.
Клинические проявления аутизма зависят от заболевания, в рамках которого проявляется данный синдром, а также от возрастной фазы развития. Детский аутизм может наблюдаться при шизофрении, органическом поражении мозга и при своеобразном, часто наследственно обусловленном дисгармоническом развитии личности.
Основные расстройства влечений (инстинктов). Нарушения сложных, безусловнорефлекторных, инстинктивных реакций (вле
4 из 97
чений) нередко наблюдаются у детей раннего возраста при различных нервно-психических заболеваниях.
Расстройства влечений в большинстве случаев формируются постепенно, в течение длительного промежутка времени. Возникают влечения обычно реактивно или путем подражания. В начальный период наблюдается не столько истинное повышение влечения, сколько неспособность к его подавлению. Для ребенка младшего возраста это явление считается физиологичным, так как высшие формы волевой деятельности у него еще не развиты. Поэтому под влиянием различных патогенных агентов у них относительно легко растормаживаются примитивные инстинкты и влечения. При частом повторении действия оно превращается в так называемый патологический привычный акт, и, таким образом, постепенно влечение приобретает стойкий характер.
Среди расстройств влечений у детей раннего возраста наибольшее значение имеет онанизм, диагностика которого у детей раннего возраста затруднительна. Онанизм — форма полового возбуждения, сопровождающаяся напряжением всего тела и вызываемая ребенком умышленно. Другие непроизвольные формы полового возбуждения к онанизму не относятся. Упорный онанизм наблюдается у детей с различными отклонениями • в психическом развитии.
Схема нормального психомоторного развития детей раннего возраста
В развитии детей раннего возраста можно условно выделить 7 периодов: I — 0—1 мес, II — 1—3 мес, III — 3—6 мес, IV — от 6 до 9 мес, V — 9—12 мес, VI — 1—2 года, VII — 2—3 года. Возможные колебания в диапазоне этих периодов могут зависеть от индивидуальных особенностей развития ребенка, его конституции, типа нервной деятельности.
На каждом этапе анализируется развитие сенсорных функций, безусловнорефлекторных реакций, двигательных навыков, речи и психики.
I период (0—1 мес). Сенсорные реакции. Реагирует на болевые и тактильные раздражения. Прикосновение к ресницам вызывает мигательную реакцию.
Развивается начальное слуховое и зрительное сосредоточение. Ребенок реагирует на сильные звуковые и зрительные раздражители, прослеживает за движущимся предметом, который находится в поле зрения. Возможна дифференцировка вкусовых раздражителей (сладкое, горькое).
Безусловные рефлексы. Все безусловные рефлексы ярко выражены: поисковый, хоботковый, сосательный, ладонно-ротовой, слухо-пальпебральный, хватательный, рефлекс Моро, опоры, автоматическая походка, защитный, ползания, рефлексы Галанта, Переса.
93
Влияние тонических шейных и лабиринтных рефлексов выражено слабо. Асимметричный шейный тонический рефлекс на 4— 5-й неделе жизни становится более ярким в связи с развитием экстензорного тонуса. Однако он не нарушает двигательной активности и позы ребенка. При спонтанных движениях «лицевые конечности» имеют тенденцию к разгибанию, а «затылочные» — к сгибанию. Такое положение может сохраняться даже во сне, если голова ребенка повернута в сторону.
В конце 1-го месяца появляются лабиринтный выпрямляющий и установочный рефлексы на голову. Но выпрямляющая лабиринтная реакция еще очень слаба, и поэтому ребенок обладает малой способностью контроля головы.
Двигательные функции. Характерна флексорная мышечная гипертоция. Руки согнуты во всех суставах, приведены к туловищу, кисти сжаты в кулачки и находятся под подбородком. Ноги согнуты также во всех суставах и отведены в бедрах. Мышечная гипертония симметрична и удерживает туловище и конечности в срединном положении. Голова слегка запрокинута назад. В приводящих мышцах бедер тонус повышен, поэтому при попытке отвести разогнутые ноги в стороны ощущается сопротивление этому движению.
Новорожденный двигательно малоактивен. Объем спонтанных движений больше выражен в ногах. Движения импульсивные, некоординированные, с легким атетоидным компонентом в предплечье и кисти. В первые дни жизни в покое наблюдается тремор высокой частоты и низкой амплитуды.
Речь. Произносит звуки, связанные с криком, сосанием, кашлем и чиханием. Издает отдельные гортанные звуки, средние между «а» и «э». Крик громкий с коротким вдохом и удлиненным выдохом (у—ааа), но без интонационцой выразительности.
Психика. Фрагментарно прослеживает и кратковременно фиксирует предмет. Появляется слуховое сосредоточение. Выражено ротовое внимание. Преобладают отрицательные эмоции в виде крика и усиления общей двигательной активности при голоде или дискомфорте.
II период (1—3 мес). Сенсорные реакции. Зрительная фиксация становится четкой и длительной. Следит за предметом, движущимся в горизонтальной плоскости. Появляется начальное восприятие контура (лицо матери). Поворачивает голову к источнику звука. Развивается зрительно-моторная координация. Следит за игрой рук. Вздрагивает при громком звуке. На основе зрительного и слухового сосредоточения возникает и закрепляется мимико-соматический комплекс оживления. Хорошо различает сладкое, горькое и нейтральное. Укорачивается латентный период и появляются более дифференцированные реакции на болевой раздражитель. '
Безусловные рефлексы с конца 2-го месяца жизни начинают угасать. Реакция опоры и автоматическая походка новорожден-4* 99
ных исчезают в начале 2-го месяца, и развивается физиологическая астазия-абазия. Становятся более выраженными тонические шейные и лабиринтные рефлексы, особенно асимметричный шейный тонический рефлекс, который в некоторой степени и определяет асимметрию мышечного тонуса. Тойические рефлексы непостоянны, возникают во время произвольных движений и быстро угасают. К концу II периода контроль' головы приобретает ведущее значение. Лабиринтный установочный рефлекс становится более выраженным с конца 2-го месяца. Ребенок в положении на животе длительнее удерживает голову по средней линии, покачивая ею. Вначале руки находятся под грудью, а к концу 3-го месяца он уже опирается на предплечья, согнутые под острым углом, и приподнимает верхнюю часть туловища. К концу 3-го месяца ребенок хорошо держит голову. Положение головы все меньше влияет на состояние мышечного тонуса. Лабиринтные выпрямляющие рефлексы начинают доминировать в развитии нормальной позы и движений.
Двигательные функции. Уменьшается флексорная гипертония, нарастает объем движений, начинает развиваться экстензорный тонус. Ребенок чаще разгибает руки, отводит цх в стороны, поднимает до горизонтального уровня и выше, потягивается, удерживает вложенную в руку игрушку, тянет ее в рот, иногда разгибает руку, и она лежит свободно вдоль туловища.
При виде яркой игрушки вначале происходит зрительное сосредоточение, затем оживление и вскидывание рук. Ребенок задевает ее, толкает, но еще не захватывает. Таким образом, во II периоде появляется компонент будущего акта хватания — направление руки к объекту, а также зрительно-моторная координация.
В положении на Спине ребенок сгибает голову и тянется вперед. Эта реакция особенно выражена при беспокойстве перед кормлением. Легкая тракция за кисти рук вызывает попытку согнуть голову и подтянуться на руках (цепной рефлекс в положении на спине).
Речь. Начинает гулить, произносит единичные гласные звуки, повторяет короткие цепочки звуков. Появляется дифференцировка гуления от общего комплекса оживления. В момент гуления общие движения ребенка притормаживаются.
Психика. Впервые проявляются положительные эмоциональные реакции, улыбка при общении со взрослыми, начальный смех. В необычной ситуации испытывает беспокойство. На 2-м месяце хорошо фиксирует взор на неподвижном предмете. Реакции фиксации взора, прослеживание за движущимся предметом и конвергенция начинают возникать в разных положениях — на спине, на животе, а вертикальном положении.
К 3 мес у ребенка имеются выраженная зрительная фиксация и прослеживание движущегося предмета в горизонтальной плоскости, Он поворачивает глаза и голову к источнику звука.
100
Ill период (3—6 мес). Сенсорные реакции. Длительно фиксирует предмет и прослеживает его во всех направлениях. Активно переводит взгляд с предмета на предмет. Появляются попытки бинокулярного зрения. К концу этого периода хорошо определяет направление звука в пространстве. Развивается зрительная и слуховая дифференцировка; ребенок различает своих и чужих, хорошо дифференцирует некоторые интонации, отдает предпочтение любимым игрушкам. Совершенствуется зрительно-моторная координация и появляется начальное манипулирование с предметами. Быстро и точно захватывает видимую игрушку, с какой бы стороны она не находилась. Появляется более тонкая вкусовая дифференцировка (отличает слегка подслащенную воду от простой). Сокращается латентный период на болевой раздражитель. Локализует тактильный раздражитель (поворачивает голову в сторону прикосновения).
Безусловные рефлексы в основном заторможены за исключением сосательного рефлекса и отдельных фрагментов рефлекса Моро. Шейный выпрямляющий рефлекс к концу этого периода сменяется выпрямляющим рефлексом туловища, который видоизменяет примитивную шейную выпрямляющую реакцию, вводя ротацию туловища между плечами и тазом. Туловище больше не следует за головой как единое целое. Ротация в пределах оси тела дает ребенку возможность повернуться со спины на живот и с живота на спину. Происходит полное торможение тонических шейных и лабиринтных рефлексов. Мышечный тонус становится снова симметричным.
Двигательные функции. Нормализуется мышечный тонус, развиваются активные движения рук. Поворачивается со спины на бок, а к концу этого периода и на живот. Повороты осуществляются с торсией. Хорошо держит голову, сидит с поддержкой.
В положении на животе опирается на предплечья под прямым углом и приподнимает верхнюю часть туловища. Может следить за движущимся предметом. На спине при тракции за руки сгибает голову, приподнимает плечи и тянется вперед. Хорошо выражена оптическая реакция опоры. Развивается рефлекс Ландау. Поставленный на опору, выпрямляет туловище, иногда становится на пальчики. В этот период наиболее важным является развитие движений рук. В связи с тем что наступило равновесие в соотношении мышц-антагонистов, появилась возможность выпрямления рук, отведения их в стороны, поднятие вверх. Ребенок ощупывает свое тело руками, складывает их вместе, удерживает одну РУКУ другой, тянет в рот. В 4 мес начинает ощупывать пеленки, подолгу удерживает руки у края одеяла, перебирает пальчиками, то есть происходит становление механизма ощупывания.
После этого появляется реакция рассматривания рук. Происходит смена тактильного анализатора зрительным. Ребенок удер
101
живает руку в поле зрения. Эта реакция возникает на 3-м месяце и держится в течение 4—5 мес, а затем исчезает. Функция ощупывания и рассматривания рук для своего осуществления требует длительного удержания рук в одном положении, а следовательно, и длительного сокращения определенных групп мышц.
В 4 мес хватательный рефлекс угасает и развивается произвольное захватывание. При попытке захватывания вначале производится много лишних движений: двигаются руки, ноги, кисть и пальцы принимают полусогнутое положение, открывается рот. Ребенок часто захватывает предмет обеими руками. В дальнейшем идет совершенствование реакции хватания. В возрасте 5— 6 мес она легко возникает при приближении предмета на расстояние рук. Позже ребенок начинает хватать предметы одной рукой, противопоставляя большой палец остальным, совершенствуется и закрепляется зрительно-моторная координация.
Речь. Гуление становится активным и протяжным, появляется лепет, подражание собственным звукам. Варьирует тон голоса. Появляется звук «м», увеличивается число средних и задних гласных звуков.
Психика. Интенсивно развивается комплекс оживления. В 4— 5 мес он становится основной системой движения. Ребенок при общении со взрослыми почти одновременно начинает улыбаться, оживленно двигаться и издавать звуки.
Преобладающее значение в развитии движений руки начинает приобретать зрительный анализатор. Формируются связи между кинестетическими и зрительным анализаторами, развивается зрительно-моторная координация. К 6-месячному возрасту ребенок, лежа на спине, быстро и точно протягивает руки к игрушке, с какой бы стороны от него она ни находилась. Развитие зрительно-моторной координации и начального манипулирования с предметами является мощным стимулом для психического развития ребенка.
Эмоциональные реакции приобретают дифференцированный характер, появляется избирательная улыбка. Появление улыбки уже не зависит от силы и продолжительности зрительных и слуховых раздражителей, а связано с предпочитаемым раздражителем. Развивается общение с помощью жестов (поднимает руку — немой жест, чтобы его подняли). Игры становятся более длительными и постоянными (ребенок манипулирует игрушками, держит один кубик, тянется за другим, находит упавшую игрушку).
IV период (6—9 мес). Сенсорные реакции. Преобладает бинокулярное зрение. Зрительные и звуковые реакции дифференцированы. Узнает лица и голоса знакомых. Более четко локализует слуховые и тактильные раздражители. /
Безусловные рефлексы заторможены, за исключением сосательного*
102
Двигательные функции. Для этого периода характерно полное развитие выпрямляющих рефлексов туловища и появление реакций равновесия. Шейная выпрямляющая реакция уже модифицирована. Ребенок поворачивается со спины на живо г и с живота на спину, используя ротацию между грудной клеткой и тазом (торсия). Ротация и реакции равновесия дают возможность ребенку лежа на животе вытягивать одну руку и в то же время поддерживать себя на другой. Позже ребенок уже свободно перемещает массу, тела с одной руки на другую, лежа на животе, и тянется за игрушкой. Хорошо выражена оптическая опора рук. Движения рук уже контролируются зрением.
Лабиринтная реакция на голову становится настолько сильной, что ребенок в положении на животе хорошо опирается на вытянутые руки и полностью разгибает бедра и голени, выражен поясничный лордоз. Следовательно, цепной симметричный рефлекс распространился от головы к шее, туловищу, рукам и ногам до кончиков пальцев. Цепные симметричные рефлексы хорошо выражены и в других положениях — на спине, в. наклонно-боковом.
Для этого периода характерно развитие функции сидения. В положении на спине ребенок приподнимает голову, поворачивает ее в сторону, за головой следует верхняя часть туловища. Перевернувшись на бок, ребенок, опираясь на руку, садится. Вначале ребенок сидит очень неустойчиво. Стоит ему отвлечься или потянуться за игрушкой, как он падает. Удержаться в положении сидя помогает ребенку защитная разгибательная реакция рук вперед и в стороны.
По мере развития реакций равновесия ребенок учится сидеть устойчиво. Без опоры с прямой спиной и согнутыми в бедрах ногами он сидит в 7—9 мес. Чем быстрее осваивает ребенок поворот со спины на живот с ротацией, тем быстрее садится.
Повороты со спины на живот, хороший контроль головы, опора на предплечья, взор ребенка, обращенный вперед, являются тем исходным положением, которое дает начало ползающим движениям. Ползающий ребенок стремится вперед, чтобы достичь предмета.
Вначале в ползании принимают участие только руки, с помощью которых ребенок подтягивается вперед, ноги остаются вытянутыми и не участвуют в движении. Эта двигательная реакция называется ползанием на животе. Вначале ползающие движения неловкие, иногда ребенок, несмотря на большие усилия, больше продвигается назад, чем вперед.
Ползание на животе появляется в 7—8-месячном возрасте и является основой для развития ползания на четвереньках. Последнее возможно лишь при достаточно выраженной опорной реакции рук и ног. Развитие цепных симметричных рефлексов на животе, хорошая опора на вытянутые руки позволяют ребенку согнуть ноги и встать на четвереньки.
103
Более выраженной становится реакция стояния, которой ранее предшествовала опорная реакция ног. В 7—8 мес ребенок стоит при поддержке за обе руки на выпрямленных ногах. В 7— 9 мес уже может стоять у барьера.
Для этого периода характерно также развитие повторных движений (похлопывание рукой по игрушке, покачивание головой, перекладывание предмета из одной руки в другую, подражательные движения — «ладушки»). Совершенствуются тонкие движения кисти и пальцев. Развивается не только захват,; но и умение разжать кисть и положить предмет, захватить двумя пальцами мелкий предмет, складывать пирамидку и т. д.
Речь. Активное развитие лепета. Ясно произносит звуки «ба», «ма», «да» и другие. В лепете появляются интонации удовольствия и неудовольствия. Начинает повторять звуки окружающих и копирует их интонацию. Лепет и жест выражены как средство общения, начинает понимать жесты других.
Психика. Развиваются подражание и начальное ситуационное восприятие обращенной речи (подражание жестам, взмахивание рукой, качание головой). Ребенок находит глазами названных членов семьи, отчетливо реагирует на чужих, интонацию, тянется к людям, требует к себе ьнимания. Развивается активное манипулирование предметами (стучит ложкой по столу, держит 2 кубика). На этом возрастном этапе комплекс оживления угасает, сменяясь развитием более дифференцированных психических реакций.
V период (9—12 мес).Сенсорные реакции. Развито бинокулярное зрение. Ребенок различает пищу по внешнему виду, хорошо дифференцирует лица, начинает распознавать все большее число объектов и геометрические формы; различает отдельные шумы, звуки, интонацию, слушает музыку, тикание часов; начинает понимать обращенную речь; отрицательно реагирует на неприятные запахи; проявляет неприязнь к тому или другому виду пищи; локализует болевую точку (дотрагивается рукой до места укола).
Безусловные рефлексы не выражены. Ослабевает сосательный рефлекс.
Двигательные функции. Характерно для этого периода совершенствование ползания на четвереньках, стояния и ходьбы.
При ползании туловище удерживается горизонтально над четырьмя конечностями, Голова поднята высоко вверх. Передвигаются одновременно перекрестные рука и нога — реципрокные движения. При ползании на животе ребенок стремится вперед, чтобы достать какой-либо предмет.
В результате развития нормального постурального механизма ребенок все больше отрывает туловище от поверхности, преодолевая земное притяжение, чтобы к концу 1-го года жизни принять вертикальную позу. Стоянию и ходьбе предшествует вставание на ноги. Вставание из положения на спине совершается в 104
том же порядке, в каком осваиваются в процессе развития отдельные движения: ребенок поворачивается на живот, опираясь на руку, садится, и, наконец, сильно оттолкнувшись руками от пола, встает. Иногда дети встают, минуя фазу сидения. Вставание без помощи взрослых ребенок осваивает благодаря активному действию рук. Под контролем зрения он направляет руку к барьеру (или другому предмету), схватывается и подтягивает корпус.
При стоянии и ходьбе руки играют такую же важную роль, как и ноги. Вставая и передвигаясь, ребенок сначала держится за мебель или перила, при этом он приседает, берет игрушку и снова встает. Затем постепенно начинает ходить один, вначале широко расставляя ноги. Верхняя часть туловища, тазобедренные и коленные суставы полусогнуты, что предохраняет ребенка от падения. В 12—13 мес при ходьбе руки приподняты — это помогает ему сохранять равновесие.
От первых попыток ходить самостоятельно без поддержки до хорошей ходьбы проходит 1—2 мес. Затем ребенок ходит самостоятельно, останавливается, поворачивается, сохраняя при этом равновесие. Продолжается совершенствование функции руки. Ребенок может произвольно схватить и отпустить предмет, показать на него пальцем. Захват предмета осуществляется полным противопоставлением большого пальца. Преобладает движение одной руки, чаще правой.
Речь. Эхолалично повторяет слоги, копирует интонацию — воспроизводит мелодичную схему знакомых фраз, приветствий.
Воспроизводит различные тона. Голосом выражает свои биологические нужды, эмоции, удовольствие и неудовольствие. Обращается к своему изображению в зеркале, обращает внимание на лицо говорящего. Отвечает действием на словесные просьбы. Кивает головой в знак утверждения и отрицания. Говорит «мама, да-да, ба-ба». Пытается ими называть знакомые предметы. К концу этого периода развивается речевое общение при помощи однословного предложения. Говорит около 5—6 лепетных слов. Понимает обращенную к нему речь.
Психика. Различает окружающих. Начинает понимать обращенную к нему речь, развиваются речевое общение, игровая манипулятивная и предметная деятельность (играет в прятки, звонит в колокольчик, привлекает внимание взрослых, смеется и закрывает лицо, играет со своим изображением в зеркале). Развиваются подражательные игры: «ладушки», «сорока». Любит играть со звучащими игрушками. Пьет из чашки, ест ложкой. Интенсивно продолжается развитие подражания. Помогает при одевании.
Отличительными чертами этого периода являются интенсивное развитие понимания обращенной к нему речи, дифференцированность сенсорных и эмоциональных реакций, развитие манипулятивной и предметной деятельности. У ребенка формируются
105
первые представления, составляющие категорию наглядно-действенного, а затем и образного мышления. Эти первые представления ассоциируются не только между собой, но и с многочисленными двигательными реакциями ребенка (кинестетическими и проприоцептивными раздражениями).
Интенсивно продолжается развитие подражания, которое на этом возрастном этапе представляет собой особую форму деятельности ребенка, обеспечивающую появление и упрочение связей между новыми движениями и представлениями. Разнообразные движения обогащают запас представлений ребенка и создают возможность их связи (ассоциации). Важную роль в этом процессе играет развитие речи.
VI период (12—24 мес). Сенсорные реакции дифференцированы и избирательны. Развивается дальнейшее восприятие формы и пространства.
Безусловные рефлексы не проявляются.
Двигательные функции. Развивается статическое равновесие, походка приобретает устойчивость и подвижность. К концу этого периода ребенок ходит устойчиво, бегает, ходит вверх и вниз по лестнице с поддержкой, а к концу периода самостоятельно, приставляя ногу. Залезает на большой стул. Ударяет ногой по мячу. Точно захватывает и бросает предметы, ударяет мяч рукой. Переворачивает страницы в книге, строит башню из кубиков, пьет из чашки не проливая, хорошо ест ложкой. Отмечается правильная последовательность в действии: зачерпывает песок совочком и накладывает в ведерко. Помогает при одевании.
Речь. Ребенок узнает имена и названия лиц и предметов, понимает слова «здесь», «сейчас», говорит около 50—70 слов, из них более половины существительные. В речи преобладают восклицания, появляются двух-, трехсловные предложения, личные местоимения.
Психика. Понимает обиходную речь. Говорит фразы из двух-трех слов. Активно играет с игрушками (строит башни из 3— 4 кубиков). Дифференцированно относится к окружающим. Начинает проявлять интерес к детям. Развивается подражательная игра. Воспроизводит по подражанию форму круга, треугольника, квадрата, имитирует круговые линии. К концу периода формируется представление о схеме тела (показывает до 4—5 частей тела).
VII период (24—36 мес). Сенсорные реакции дифференци* рованны и избирательны. В зрительном восприятии начинает доминировать один глаз (обычно правый). Правильно распознает одновременные симметричные раздражения. Дифференцирует предметы по массе, форме, цвету и величине. Происходит дальнейшее формирование представления о схеме тела и восприятия пространства (понимает значение основных предметов). Начинает складывать разрезную картинку из двух частей.
106
Двигательные функции. Развиваются реакции равновесия при ходьбе, но ребенок еще не может стоять на одной ноге. Может ходить, держа предмет в одной руке. Поднимается по лестнице меняя ноги. Бросает мяч и ловит его, сохраняя равновесие. Уверенно переворачивает страницы книги, разворачивает бумажки на конфетах. Имитирует вертикальные и горизонтальные штрихи карандашом, начинает самостоятельно есть, используя ложку и вилку.
Речь — развернутая фразовая. Запоминает стихи и короткие сказки.
Психика. Понимает обиходную речь, содержание сказки. Формируются причинно-следственные связи. Активно общается с окружающими при помощи речи. К концу периода начинает говорить о себе в первом лице и задавать много вопросов. Развивается функция обобщения на наглядно-конкретном уровне (объединяет предметы по цвету, форме, величине). Эмоциональные реакции избирательные и дифференцированные, появляются сюжетные игры. Активно стремится к контакту с детьми. Начинает проявлять самостоятельность и стремление к независимости от взрослых.
Развивается функция самосознания. Характерной особенностью этого периода является развитие речи. Поэтому преддош-кольный период в целом можно считать периодом развития активных форм общения. На этом этапе развиваются сугубо человеческие особенности психической деятельности: речь, мышление (формируются начальные понятия), возникают первые представления о своей личности, появляется чувство «я» (начальные элементы самосознания), а также развивается целенаправленная деятельность. Во всех формах психической деятельности ведущее значение принадлежит речи. Благодаря развитию коммуникативной функции речи у ребенка формируются первые социальные отношения, которые в свою очередь являются мощным стимулом речевого развития. С появлением речи весь предшествующий сенсомоторный этап психического развития ребенка поднимается на новый, качественно более высокий уровень. Благодаря речи сенсорный опыт ребенка превращается в акт познания. Речь становится важнейшим инструментом мышления и опорой в процессе его формирования.
С развитием речи объектом мысли ребенка становится не только конкретное восприятие (как это было на сенсомоторном этапе развития), но возникает возможность оперировать представлениями. Это является основой для развития важнейшей особенности психической деятельности — способности к сопоставлению и противопоставлению воспринимаемых объектов, что определяет возможность формирования первых понятий.
Поведение ребенка 2—3 лет характеризуется активностью и целесообразностью. Он постоянно чем-то занят, интенсивно развивается игровая деятельность (появляются сюжетные игры и
107
игры с перевоплощением). Действия, поступки ребенка начинают подчиняться определенной цели, формируются волевой акт и функция активного внимания.
Ребенок этого возраста склонен к познанию мира. Он активно разбирает игрушки, чтобы узнать природу вещей. Эта познавательная направленность ребенка иногда неверно воспринимается как шалость. Уже в этот период формируются особенности поведения мальчиков и девочек, чувство половой принадлежности.
Развивается регулирующая функция речи, т. е. деятельность ребенка целенаправленно подчиняется словесным инструкциям взрослых.
Эмоции на этом возрастном этапе характеризуются адекватностью, яркостью проявлений и дифференцированностью, появляются различные оттенки эмоциональных переживаний.
Дополнительные методы исследования
Исследование спинномозговой жидкости
Спинномозговая жидкость (ликвор) — специфическая жидкая среда организма, находящаяся в тесном взаимоотношении с головным и спинным мозгом. Спинномозговая жидкость вырабатывается сосудистыми сплетениями желудочков мозга. Через отверстия Мажанди и Люшка из полости IV желудочка она поступает в субарахноидальные пространства головного и спинного мозга, где через арахноидальные ворсины, пахионовы грануляции и щели твердой мозговой оболочки всасывается.
Спинномозговая жидкость играет защитную роль, образуя водяную подушку, предохраняющую головной и спинной мозг от сотрясения, сжатия, изменения давления и других механических воздействий. Центральная нервная система как будто бы погружена в жидкость, заполняющую полости черепа и позвоночного столба.
Во внутриутробный период спинномозговая жидкость является источником питания мозга, необходимого для нарастания его клеточной массы. В постнатальный период ликвор продолжает играть важную роль в процессах жизнедеятельности и обмена веществ нервной ткани. Заполняя периваскулярные и перицеллюлярные пространства, спинномозговая жидкость приходит в тесное соприкосновение с нервными клетками, отдает им необходимые для их жизнедеятельности вещества и поглощает продукты обмена.
Общее количество спинномозговой жидкости у новорожденного составляет 30—60 мл, у детей старшего возраста — 100— 150 мл, из них 50% содержится в желудочках, 30—40% — в субарахноидальных пространствах и цистернах головного мозга, остальное количество — в субарахноидальных пространствах спин-108
Рис. 39. Схема пункции ликворной системы:
а — субокципитальная; б — родничковая; е — люмбальная
ного мозга. В норме за сутки вырабатывается 400—600 мл
Рис. 40. Беспункционный метод измерения внутричерепного давления (тонометрия родничка). Прибор опирается на черепные кости вокруг родничка. Степень вдавления стержня, определяемая по шкале измерительного прибора, отражает напряженность родничка
ликвора, при патологии — до
1000 мл. Спинномозговая жидкость непрерывно циркулирует и в течение суток обменивается 6—8 раз (F. Cockburn, С. Drillien, 1974).
В ее состав входят витамины, гормоны, органические и неорганические Соединения. Спинномозговая жидкость регулирует осмотическое давление, поддерживая его относительное постоянство в тканях мозга. Тесные взаимоотношения между физико-химическими процессами в нервной ткани и составом спинномозговой жидкости выявляются при различных патологических со
стояниях.
Особенно важную роль играет исследование спинномозговой жидкости у детей раннего возраста, когда воспалительные заболевания и нарушения, вызванные асфиксией и внутричерепной родовой травмой, нередко имеют сходную неврологическую симптоматику. Ликвор исследуется при менингитах, менингоэнцефалитах, объемных процессах, асфиксии, внутричерепных кровоизлияниях, судорогах, гидроцефалии, наследственных заболеваниях, а также перед введением контрастных веществ в спинномозговой канал (пневмоэнцефалография, вентрикулография).
Ликвор можно получить при люмбальной или вентрикулярной пункциях (рис 39). Люмбальная пункция у детей раннего возраста проводится в лежачем положении через 2 ч после кормле-
109
ния. Больного укладывают на бок, сгибая голову к груди, а ноги к животу, чтобы увеличить расстояние между позвонками. Ориентиром для введения иглы служит точка пересечения линии, соединяющей гребешки подвздошных костей и позвоночника. Кожу на месте будущего прокола и вокруг него обрабатывают спиртом и йодом. Поясничный прокол у новорожденных и грудных детей делается иглой для внутривенных вливаний между II и III или III и IV поясничными позвонками на глубину 2—3 см. Пункцию проводят иглой с мандреном, так как быстрое вытекание жидкости может привести к резкому падению давления ликвора. Фиксируя пальцем промежуток между остистыми отростками позвонков, вводят иглу быстрым, но осторожным движением непосредственно над нижним остистым отростком. У новорожденных и грудных детей иглу вводят под прямым углом, у детей 2—3 лет — с легким уклоном вверх. В момент прохождения через твердую мозговую оболочку ощущается «провал» иглы в субарахноидальное пространство. Вынув из иглы мандрен, спинномозговую жидкость собирают в стерильную пробирку. При наличии клинических признаков повышения внутричерепного давления выведение спинномозговой жидкости проводят осторожно, не удаляя мандрена. Если игла не попала в субарахноидальное пространство, то ее надо вынуть и повторить прокол. Иногда игла может ранить венозный сосуд оболочек или венозное сплетение и тогда жидкость вытекает с примесью крови («техническая кровь»). Если жидкость после нескольких капель не очищается от примеси крови, пункцию следует прекратить.
Для измерения давления спинномозговой жидкости после удаления мандрена, не теряя ликвора, к игле присоединяют манометр, представляющий собой градуированную стеклянную трубочку длиной 30—40 см и диаметром 1—2 мм, изогнутую под углом 90°. На изогнутый конец надета короткая резиновая манжетка с металлической канюлей, которая плотно подходит к пункционной игле. Жидкость быстро поднимается по трубочке вверх. Уровень спинномозговой жидкости в трубочке измеряется сантиметровой лентой (если трубочка не градуирована). Это и есть высота давления спинномозговой жидкости. После измерения давления у детей раннего возраста берут 2—3 мл ликвора для исследования. При выведении 1 мл ликвора давление понижается на 10—15 мм вод. ст.
После взятия спинномозговой жидкости быстрым движением удаляют иглу, фиксируя позвоночник у ее основания. Место пункции смазывают йодом и накладывают стерильную повязку. Затем ребенка в горизонтальном положении без подушки укладывают на кровать. Кормить ребенка можно спустя 2 ч. В течение 2 дней ему показан постельный режим без резких движений головы. Применять физиотерапевтические процедуры, ЛФК, гимнастику, массаж ортопедические укладки после пункции не рекомендуется. При технически правильно выполненной люмбаль-410
ной пункции у детей раннего возраста ослояснения наблюдают— ся крайне редко. При опухолях задней черепной ямки выведение может вызвать смещение мозга с вклинением миндалин мозжечка в большое затылочное отверстие. В этих случаях пункцию производят с большой осторожностью.
При увеличении размеров большого родничка (гидроцефалии) пункцию можно делать через родничок (вентрикулярная пункция). Место будущей пункции тщательно выстригают и обрабатывают спиртом и йодом. Во время проведения пункции кожу над родничком надо сместить, чтобы отверстия, сделанные иглой на коже и в перепончатом слое кости, не совпадали; в противном случае повышенное внутричерепное давление может привести к ликворее. Иглу вводят, отступя 2 см кнаружи от средней линии, в направлении переднего рога бокового желудочка. У детей старше 1 года вентрикулярную пункцию проводят через трепанационные отверстия. Двустороннюю диагностическую вентрикулярную пункцию производят для определения состава ликвора в обоих желудочках и сравнения ее с составом люмбальной жидкости; для определения давления в желудочковой системе; для установления сообщаемости между желудочками; для проведения вентрикулографии. С лечебной целью вентрикулярную пункцию у детей раннего возраста выполняют для периодической разгрузки желудочковой, системы или введения лекарственных веществ.
При гипертензионно-гидроцефальном кризе вентрикулярную пункцию иногда делают по жизненным показаниям. В этих случаях она является единственным эффективным средством, позволяющим вывести ребенка из тяжелого состояния.
Субокципитальную пункцию у детей раннего возраста проводят очень редко, лишь при наличии особых показаний. Ее делают под наркозом, так как дети реагируют на пункцию двигательным беспокойством. Ребенка укладывают на бок, под голову кладут валик, чтобы средняя линия туловища и головы находилась в одной горизонтальной плоскости. Голову наклоняют кпереди, чтобы увеличить пространство между задней дужкой атланта и задним краем большого затылочного отверстия. Пункционную иглу вводят над остистым отростком II шейного позвонка по средней линии под углом 45—60° к нижней части затылочной кости. Затем по чешуе затылочной кости вводят иглу в большую цистерну. Субокципитальная пункция противопоказана при опухолях задней черепной ямки и спинальных опухолях верхнешейной локализации.
Исследование спинномозговой жидкости включает определение давления, состава клеточных элементов, белка, сахара, хлоридов. У новорожденных й детей первых месяцев жизни давление спинномозговой жидкости равняется в среднем 50—60 мм вод. ст. Иногда у здоровых новорожденных оно снижено до 14 мм вод. ст. У детей 1—3 лет давление колеблется в пределах от 50 до
111
150 мм вод. ст. Примерно о давлении спинномозговой жидкости можно судить по частоте вытекания капель (струя, частые капли, редкие капли). Следует помнить, что давление спинномозговой жидкости подвержено значительным колебаниям. Крик, испуг, напряжение ребенка, чрезмерный наклон головы к груди вызывают повышение давления. Поэтому истинные цифры давления ликвора можно получить только при спокойном состоянии ребенка.
Пункционный метод измерения внутричерепного давления имеет недостатки: невозможность динамического наблюдения; разовое измерение внутричерепного давления не всегда дает представление об истинных его величинах, так как оно может изменяться даже в течение нескольких минут. Поэтому в настоящее время предложены методы беспупкционного измерения внутричерепного давления через большой родничок с помощью различных тонометров (рис. 40).
Нарушение циркуляции ликвора в области спинного мозга устанавливается при помощи ликвородинамических проб, которые основаны на взаимодействии между венозным и ликворным давлением. При повышении венозного давления повышается давление спинномозговой жидкости, и наоборот.
К ликвородинамическим пробам относятся пробы Стукея и Квеккенштедта. Производят обычную спинномозговую пункцию, измеряют начальное давление, затем делают пробы. При пробе Стукея искусственно затрудняют отток в системе нижней полой вены путем надавливания на живот в области пупка. При пробе Квеккенштедта сдавливают яремные вены на шее в течение 5—6 с. В результате повышения давления в мозговых венах и синусах повышается и ликворное давление. Если субарахноидальное пространство проходимо, то обе пробы сопровождаются повышением ликворного давления (пробы отрицательные).
При блоке субарахноидального пространства в шейном или грудном отделах спинного мозга (объемные и воспалительные процессы) при пробе Квеккенштедта ликворное давление не повышается (положительная проба). При блоке субарахноидального пространства в нижнем грудном или поясничном отделах при пробе Стукея оно увеличивается (положительная проба). Блок субарахноидального пространства можно заподозрить, если после вытекания небольшого количества ликвора давление резко падает.
Лабораторное исследование ликвора
Нормальная спинномозговая жидкость прозрачная. У новорожденных она может быть слегка ксантохромной, что связано с переходом билирубина из сыворотки крови в ликвор при повышенной сосудистой проницаемости. Ксантохромия сохраняется 6—8 дней, затем исчезает.
112
Рис. 41
Рис. 41. Варианты патологических изменений на глазном дне. Норма: 1 — новорожденный; 2 — ребенок 1 года; 3 — 3 лет; 4 — недоношенный ребенок (24 нед); 5 — 28 нед; 6 — кровоизлияние I степени; 7 — II степени; 8 — III степени; 9 — IV степени; 10 — отек соска зрительного нерва; И — застой; 12 — атрофия зрительного нерва частичная; 13 — полная; 14 — пигментная дегенерация сетчатки
Рис. 42. Изменения глазного дна при различных
заболеваниях:
1 — туберозный склероз; 2 — болезнь Штурге—Вебера, 3 — нейрофиброматоз Реклингхаузена, 4 — болезнь Гиппель—Линдау; 5 — болезнь Нимана—Пика; 6 — болезнь Тея—Сакса; 7 — токсоплазмоз' а — хориоретинит, б — ретинит; 8 — прогрессирующая гидроцефалия; 9 — гомоцистинурия
Выраженная ксантохромия часто наблюдается у новорожденных с неврологическими нарушениями, родившихся в асфиксии. В 20% случаев она сочетается с плеоцитозом и повышенным белком. У новорожденных с гемолитической болезнью ксантохромия ликвора обусловлена повышением содержания билирубина. Кровянистая окраска спинномозговой жидкости обнаруживается у детей с субарахноидальным кровоизлиянием.
Содержание белка в спинномозговой жидкости у детей раннего возраста колеблется от 0,16 до 0,33 г/л; в желудочковой жидкости его в 2 раза меньше — 0,06—0,16 г/л.
Реакция Панди, которая является полуколичественной пробой на бедок, у новорожденных и грудных детей часто бывает резко положительной, что связано с особенностями проницаемости гематоэнцефалического барьера.
При гнойных менингитах отмечается резкое увеличение содержания белка. Опухоли, серозные менингиты, энцефалиты сопровождаются умеренным повышением его в ликворе. При гидроцефалии содержание белка в ликворе бывает различным в зависимости от стадии развития заболевания. Если воспалительный процесс, послуживший причиной развития гидроцефалии, еще не закончился, оно может быть повышено; при хронически протекающей гидроцефалии — снижено в результате увеличения объема ликвора. При внутричерепных кровоизлияниях содержание белка зависит от количества крови в субарахноидальном пространстве.
Содержание клеток в ликворе новорожденных и грудных детей колеблется от 1 до 5—8 в 1 мкл. Наличие 15—20 клеток и выше в 1 мкл расценивается как нарушение состава ликвора. Клеточный состав спинномозговой жидкости увеличивается при воспалительных заболеваниях. При гнойных менингитах у детей раннего возраста цитоз может достигать нескольких тысяч в 1 мкл, а иногда даже не поддается подсчету (клетки покрывают все поле зрения). В острый период заболевания преобладают полиморфноядерные лейкоциты, в стадии выздоровления появляются лимфоциты. При абсцессах мозга изменения в спинномозговой жидкости неспецифичны. Они зависят от степени инкапсуляции абсцесса.
При вирусных менингитах и менингоэнцефалитах отмечается плеоцитоз с преобладанием лимфоцитов. При менингитах, вызванных вирусом Коксаки, паротита, цитоз может достигать нескольких тысяч. Для полиомиелита характерен вначале небольшой цитоз (100—300 клеток) при нормальном содержании белка. Затем количество клеток уменьшается, а концентрация белка нарастает. При общих детских инфекциях (грипп, пневмония, острые респираторные заболевания) наблюдаются явления менин-гизма с незначительным увеличением лимфоцитов.
Легкие изменения спинномозговой жидкости реактивного характера (небольшой плеоцитоз) могут быть после люмбальной пункции, пневмоэнцефалографии, вентрикулографии.
5 143 113
Белково-клеточная диссоциация (повышенное содержание белка в ликворе при умеренном увеличении количества клеток) характерна для опухолей головного и спинного мозга, клеточно-белковая диссоциация (значительное увеличение количества клеток при умеренном повышении содержания белка) — для менингитов.
Содержание сахара в спинномозговой жидкости в норме колеблется от 0,35 до 0,75 г/л (по Хагедорну — Йенсену). Низкое содержание сахара в ликворе наблюдается в первые дни жизни, а также при гнойном и туберкулезном менингитах. При вирусных менингитах и менингоэнцефалитах оно бывает нормальным или даже повышенным.
Содержание хлоридов в спинномозговой жидкости составляет 109—123 мэкв/л. При менингитах оно уменьшается, при заболеваниях почек (уремия) — повышается.
Важное значение для диагностики имеют также вирусологические и бактериологические исследования спинномозговой жидкости.
Исследование глазного дна
Исследование глазного дна является одним из объективных методов, применяемых в клинике неврологии раннего возраста. Исследование глазного дна у детей раннего возраста затруднено. Для расширения зрачка закапывают 1% гоматропин в конъюнктивальный мешок. У новорожденных и грудных детей голову фиксирует мать или медицинская сестра. Если ребенок очень беспокоен, зажмуривает глаза, врач может пользоваться векоподъем-ником. При хорошем контакте с ребенком 2—3 лет можно заставить его фиксировать взгляд на интересном предмете. Глазное дно осматривают с помощью зеркального или электрического офтальмоскопа.
Глазное дно новорожденного отличается рядом особенностей. Оно окрашено в светло-желтый цвет. Диск зрительного нерва бледно-розовый с сероватым оттенком, границы четкие, отсутствует макулярный рефлекс. У взрослых такое глазное дно бывает при атрофии зрительного нерва. Сероватый цвет макулярной области и депигментация остальных отделов глазного дна сохраняется до 2-летнего возраста. Артерии сетчатки новорожденных нормального калибра, а вены шире обычного (рис.41).
На глазном дне у детей раннего возраста могут быть обнаружены как врожденные аномалии развития, так и изменения, характерные для травмы, асфиксии, объемного процесса, инфекционных и наследственных заболеваний (рис 42). Наличие характерных изменений на глазном дне при различных заболеваниях нервной системы у детей раннего возраста помогает дифференциальной диагностике.
114
У новорожденных, родившихся в асфиксии, на глазном дне можно обнаружить мелкоточечные кровоизлияния вдоль артериол в виде языков пламени, клякс, штрихов, пятен, лужиц. Эти кровоизлияния рассасываются на 6—7-й день жизни. Кровоизлияния в макулярную область и периретинальные кровоизлияния сохраняются дольше. Иногда они возникают повторно на 12—14-й день жизни.
У недоношенных детей, которые находились в атмосфере е повышенным содержанием кислорода, па глазном дне находят ретролентальную фиброплазию — пролиферацию эндотелия капилляров, кровоизлияния, отек нервных волокон. В дальнейшем нервные волокна утолщаются, новообразованные капилляры прорастают в стекловидное тело. Начавшись на периферии, процесс захватывает всю сетчатку и стекловидное тело.
При повышении внутричерепного давления, декомпенсированной гидроцефалии, объемных процессах на глазном дне отмечаются расширение вен, сужение артерий, стушеванность гранпн диска зрительного нерва вследствие отека сетчатки. Отек распространяется также по ходу сосудов. При нарастании гипертензии диск увеличивается в размерах и проминирует в стекловидное тело, сосуды тонут в отечной сетчатке, появляются кровоизлияния из расширенных вен. Длительная внутричерепная гипертензия приводит к субатрофии, а затем и ко вторичной атрофии диска зрительного нерва. Диск становится бледно-серый с нечеткими границами. Сосуды сужены, особенно артерии.
Врожденная атрофия зрительного нерва характеризуется резким побледнением диска зрительного нерва, особенно височных половин. Границы диска четкие в отличие от вторичной атрофии зрительного нерва. Артерии сужены.
Для мозговых липоидозов (ганглиозидозы, сфинголипидозы) и некоторых муколипидозов характерно наличие вишнево-красного пятнышка в макулярной области, которое не изменяется на всем протяжении болезни. Эти изменения на глазном дне связаны с атрофией сетчатки и просвечиванием сосудистой оболочки. Их можно обнаружить уже в первые месяцы жизни, что имеет важное значение для дифференциального диагноза. Хорпоретинит, микрофтальм наблюдаются при врожденном токсоплазмозе.
Более отчетливо все детали глазного дна выступают при офтальмохромоскопии, которая позволяет исследовать глазное дно в различных лучах спектра и выявить изменения, не замеченные при обычном исследовании глазного дна.
Трансиллюмпнация черепа
Трансиллюминация черепа — ценный вспомогательный метод ранней диагностики внутричерепных заболеваний новорожденных и грудных детей. Простота и безопасность позволяют широко использовать его в раннем детском возрасте.
5*
113
Принцип метода заключается в распространении лучей света большой интенсивности в пространстве, заполненном жидкостью. Избыточное накопление спинномозговой жидкости в субарахноидальных пространствах в период новорожденности и в грудном возрасте наблюдается при перинатальной патологии различного генеза: гидроцефалии, гидроанэнцефалии, кистозной дегенерации, гигроме, порэнцефалии и аплазии полушарий. С помощью трансиллюминации черепа можно диагностировать также субдуральную гематому. Ее применяют и для динамического наблюдения за течением некоторых внутричерепных процессов (субдуральная гематома, гидроцефалия и др.).
Показаниями к проведению трансиллюминации являются увеличение размеров головы в период новорожденности и в грудном возрасте, асимметрия черепа, гидроцефалия, микроцефалия. Она показана также всем новорожденным, родившимся от матерей с патологией беременности и родов. Противопоказаний для применения этого метода нет.
Трансиллюминацию черепа проводят в темной комнате. Для просвечивания используют специальный тубус, в который вмонтирована лампочка мощностью в 100 Вт и более. На конце тубуса имеется резиновое кольцо, которое прикладывают к поверхности черепа в различных областях — лобной, теменной, височной и затылочной. В норме у новорожденных и детей первых месяцев жизни вокруг тубуса возникает кольцо свечения шириной от 0,5 до 3 см в зависимости от степени плотности костей. Наиболее интенсивное свечение наблюдается в лобных областях (до 3 см), наименьшие размеры ореола (0,5—1 см) отмечены в затылочной области. Степень свечения зависит от источника света, возраста ребенка, области головы, подвергаемой исследованию, толщины слоя скопившейся жидкости (не менее 0,5 см), пигментной окраски кожных покровов и волос. У грудных детей с темной кожей свечение выражено меньше. При наличии у ребенка редких светлых волос, тонких костей черепа свечение более сильное. Наличие в ликворе большого количества форменных элементов крови затрудняет диагностику. В этих случаях исследование необходимо проводить повторно. При большом количестве эритроцитов в ликворе просвечивания не происходит. Концентрация белка в ликворе не влияет на степень просвечивания.
Увеличение границ свечения возникает при расширении субарахноидального пространства до 0,5 см, а просвечивание желудочков и полостей внутри мозговой ткани возможно только в том случае, если толщина мозговой ткани над полостью меньше 0,5—1 см (рис. 43).
Необходимо учитывать интенсивность свечения и его контуры. Увеличение яркости, неровные границы типа «языков пламени» указывают на органическую патологию. Свечение черепа в области, удаленной от свечения, несомненно, представляет патологический признак. Абсолютным критерием гидроцефалии и гид-
116
роанэнцефалии при трансиллюминации черепа является пан-копвекситальное и сквозное свечение. При гипертензионно-гидроцефальном синдроме, развившемся в результате внутричерепной родовой травмы, свечение равномерно увеличено, характерна своеобразная «лучистость». При внутренней гидроцефалии, когда толщина мозга составляет менее 0,5— 1 см, весь череп просвечивается равномерно. На фоне общего свечения контурируется серповидный отросток, мозжечковый намет, синусы, сосуды и швы. Асимметричное расположение этих теней наблюдается при одностороннем расширении желудочка, опухоли. При открытой гидроцефалии свечение носит диффузный характер. При порэнцефалии отмечается уве-
личение размеров свечения в определенных областях (на месте расположения кисты). Множественные кисты при трансиллюминации выявляются в виде пятен.
Микроцефалия дает увеличение границ свечения в лобнотеменных отделах, часто асимметричное. Это свидетельствует об увеличении пространства между костями черепа и мозгом
Рис. 43. Расширения границ свечения при трансиллюмпнации черепа ребенка:
а — умеренный гипертензионно-гидроце-фальный синдром; б — окклюзионная гидроцефалия
и накоплении в нем жидкости. По мере прогрессирования атрофии мозга может появиться свечение желудочков.
Субдуральная гематома в острый период не дает просвечива
ния и контурируется темным пятном на фоне яркого свечения. При замещении крови ксантохромной жидкостью трансиллюмина-Ция дает положительный результат и при просвечивании можно выяснить размеры полости.
У детей с церебральными параличами чаще отмечается увеличение границ свечения в височных и лобных областях, что дает
117
основание в некоторых случаях подозревать задержку развития этих отделов мозга и увеличение пространства между черепом и мозгом.
При инфекционном поражении мозга и менингитах свечение зависит от стадии заболевания. В острый период, когда спинномозговая жидкость содержит большое количество форменных элементов, свечение черепа отсутствует.
В дальнейшем при развитии гидроцефального компонента увеличиваются границы свечения. При спаечном процессе ореол свечения имеет неровные края.
Краниография
Рентгенологическое исследование костей свода и основания черепа в настоящее время широко применяется в неврологических и нейрохирургических клиниках. У детей раннего возраста кости черепа обладают гибкостью, пластичностью и тонко реагируют на изменения внутричерепного давления, вызванные различными патологическими процессами в мозге. В связи с этим метод краниографии в этом возрасте позволяет диагностировать на ранней стадии ряд заболеваний, протекающих с изменениями в костях черепа.
У детей 1-го года жизни краниографию проводят при определенных показаниях: уменьшение или увеличение размеров черепа (гидроцефалия, микроцефалия), асимметрии и деформации черепа, черепно-мозговые травмы, объемные процессы.
Необходимым условием хорошего качества краниограммы является спокойное состояние ребенка. Поэтому перед краниографией детям раннего возраста назначают клизмы с 2% раствором хлоралгидрата. Снимки делают в следующих основных проекциях: боковой, прямой, аксиальной, передней и задней полуаксиальной.
Боковая рентгенограмма дает представление о размерах черепа, конфигурации его свода и основания, турецкого седла, толщине и структуре костей, их рельефе, состоянии швов, сосудистых борозд, о наличии патологических включений.
У новорожденных на боковой рентгенограмме видны большой и малые роднички, коронарный, ламбдовидный, височный, иногда теменно-сосцевидный и затылочно-сосцевидный швы. С 3-летнего возраста в норме можно видеть отметки артериальных борозд. Большое значение при некоторых патологических процессах (опухоли мозга, гидроцефалия, краниостеноз) имеют обнаружение на рентгенограммах черепа углубления борозд венозных синусов, особенно поперечного, наличие выпускников у места слияния синусов в области бугристости затылочной кости.
Прямая рентгенограмма позволяет судить о размерах и форме черепа, симметрии его, состоянии большого родничка и швов (сагиттального, коронарного, ламбдовидного), форме основания черепа, проекции пирамид. Она дает также возможность сравнить 118
Рис. 44. Рентгенограмма здорового ребенка в возрасте 1 мес:
а — прямая проекция, б — боковая
толщину костей в одноименных участках свода черепа, что может иногда иметь важное диагностическое значение.
Аксиальная рентгенограмма дает представление о костях основания черепа. При этом видны кости передней, средней и задней черепных ямок. Следует обращать внимание на симметрию всех имеющихся отверстий, структуру и воздухоносность костей. Необходимо помнить, что аксиальный снимок у детей раннего возраста не следует делать при подозрении на опухоль задней черепной ямки, так как в связи с сильным запрокидыванием головы при рентгенографии возможны осложнения (надрывы сосудов, вклинение продолговатого мозга в большое затылочное отверстие).
Передняя полу аксиальная рентгенограмма позволяет судить о форме и размерах орбит, деталях образующих их стенок, границах дна передней п средней черепных ямок, сфеноидального гребня, о состоянии придаточных полостей носа и костей лицевого скелета.
Задняя полуаксиалъная рентгенограмма дает возможность оценить чешую затылочной кости с ламбдовидным швом, пирамиды височных костей, сходящиеся к затылочной бугристости борозды поперечного синуса, задний край большого затылочного отверстия.
Выбор необходимой проекции при рентгенографии черепа производится в зависимости от того, какой отдел черепа особенно важен для осмотра и каков предполагаемый диагноз. При необходимости у детей раннего возраста могут быть использованы дополнительные проекции, а также стереография, томография и др.
При оценке рентгенограммы следует помнить, что у новорожденных преобладает мозговой череп, лицевой череп относительно мал вследствие недоразвития верхней и нижней челюстей,
119
Рис. 45. Участки обызвествления на рентгенограмме черепа ребенка с токсоплазмозом
слабого развития гайморовых пазух и отсутствия лобных пазух. Черепные швы у детей первых месяцев жизни открыты. На месте будущих швов имеются узкие полоски перепончатого черепа (рис. 44). Смыкание черепных швов начинается после 3 мес жизни. Толщина костей черепа у детей меньше, чем у взрослых, а полное закрытие большого родничка происходит к 1 году. Кости черепа податливы и пластичны. Пальцевые вдавления, являющиеся отпечатками мозговых извилин, у детей в возрасте до 1 года отсутствуют и появляют
ся на 2-м году жизну. Передние и задние черепные ямки уплощены, средняя сравнительно глубокая. Турецкое седло уплощено. Рентгенологически в костях черепа можно выявить как симптомы повышения внутричерепного давления, так и симптомы его снижения, а также ряд других прямых и косвенных признаков поражения мозга.
Наиболее показательны и многообразны изменения в костях черепа, наступающие под влиянием повышенного внутричерепного давления. При этом отмечаются увеличение размеров черепа за счет расхождения, истончение костей свода и основания, сглаживание дуг черепа, стремящегося к правильной геометрической форме шара или эллипса; усиление пальцевых вдавлений; сглаженность рельефа внутренней костной пластинки; углубление борозд синусов; расширение входа в турецкое седло и другие симптомы. Эти изменения неспецифичны и могут выявляться при гидроцефалии, опухолях мозга и других объемных процессах в мозге, при арахноидитах и пр.
При процессах, сопровождающихся снижением внутричерепного давления п уменьшением объема мозга (микроцефалия), отмечается уменьшение размеров черепа, преобладание лицевого скелета над мозговым, утолщение костей свода, нередко — деформации черепа.
Иногда на рентгенограммах можно обнаружить обызвествления и инородные тела (рис 45). Обызвествления в черепе детей могут быть физиологическими и патологическими. Физиологические располагаются на уровне сосудистых сплетений боковых желудочков, в шишковидной железе, серповидном отростке. У детей раннего возраста они встречаются редко и появляются постепенно с возрастом.
120
К патологическим обызвествлениям относятся опухолевые и неопухолевые. Из опухолей часто обызвествляются краниофарингиомы (70—85%), тератомы, хордомы, дермоиды; из глиальных опухолей — олигодендроглиомы, пинеаломы. При краниофарингиомах известковые массы находятся выше турецкого седла и несколько кзади. Локализация очень типична и не вызывает диагностических затруднений.
К неопухолевым относятся посттравматические, постинфекционные, паразитарные и дизонтогенетические обызвествления.
Дизонтогенетические обызвествления наблюдаются при внутричерепных ангиомах, энцефалотригеминальном ангиоматозе, туберозном склерозе. Ангиоматозные сосуды выглядят как нежные червеобразные обызвествления. При энцефалотригеминальном ангиоматозе обнаруживаются двуконтурные линейные тени обызвествлений, располагающиеся по ходу мозговых извилин, преимущественно в заднетеменных и затылочных областях мозга. Множественные, округлые и тяжистые обызвествления в поверхностных отделах мозга наблюдаются при туберозном склерозе.
К посттравматическим обызвествлениям у новорожденных и грудных детей относятся кефалогематомы. По верхнему контуру кефалогематомы обызвествляется твердая мозговая оболочка в виде тонкой полоски-скорлупы, позже известь можно найти и в толще бывшей гематомы. Иногда кефалогематома оссифицируется и имеет вид костной опухоли.
При эпидуральных гематомах наряду с участками обызвествления наблюдаются истончения внутренней костной пластинки, а иногда — образование участков рассасывания кости. Если ребенок перенес тяжелую черепно-мозговую травму, протекавшую с субдуральным или внутримозговым кровоизлиянием, то при возникновении гематом могут образоваться обширные обызвествления, плоские в виде серпа или полулуния. Субдуральная гематома представляет собой инкапсулированное скопление крови в субдуральном пространстве. Гематома плоская и чаще всего односторонняя. При внутримозговых гематомах наблюдаются единичные множественные «коралловые» петрификаты.
Черепно-мозговая травма, перенесенная в раннем детском возрасте, при которой были отмечены переломы костей и подоболочечные гематомы, может привести к образованию участков рассасывания кости.
Подобные изменения можно наблюдать уже через 3—4 нед после травмы. Костные дефекты в результате рассасывания костей образуются, если травма произошла в возрасте до 3 лет. Это объясняется особенностями кровоснабжения костей черепа в этом возрасте.
К иостипфскционным относятся обызвествления у детей раннего возраста после менингоэнцефалита, туберкулезного менингита, абсцесса мозга. Они могут быть единичные и групповые, крапчатого пли кораллового строения.
121
Паразитарные обызвествления у детей раннего возраста встречаются при токсоплазмозе и цитомегалии. Известковые включения в черепе при токсоплазмозе обнаруживаются у 40—50% больных, а при микроскопическом исследовании — у 85%. Петрификаты бывают множественные, полиморфные и располагаются в разных отделах мозга: теменно-затылочной, височно-лобной, мозжечке, сосудистых сплетениях. Размеры их колеблются от 2 до 10 мм в диаметре, форма — в виде узелков, палочек, черточек, гроздей. В связи с тем что при токсоплазмозе часто поражается орган зрения, кальцификаты можно обнаружить и в пораженном глазу. При цитомегалии обызвествления такие же, как при токсоплазмозе.
У новорожденных иногда можно обнаружить так называемый лакунарный череп. На краниограммах в области костей свода видны крупные овальные истончения, разделенные костными перегородками, напоминающие лакуны.
Лакунарный череп возникает в результате повышения внутричерепного давления или глубоких расстройств костеобразования во внутриутробный период. После рождения процесс не прогрессирует.
Лакунарный череп следует отличать от лакунарного остеопороза. Последний встречается у здоровых новорожденных и в клинике известен как «мягкий череп». Кости свода черепа при пальпации податливы, голова не увеличена в размерах. На краниограммах выражены ячеистые просветления на фоне нормальной картины свода черепа, рисунок костных перегородок между лакунами отсутствует. В возрасте 2—3 мес очаги лакунарного остеопороза исчезают.
Пневмоэнцефалография
Пневмоэнцефалография (ПЭГ) — контрастный метод рентгенологического исследования, основанный на введении воздуха в ликворные пространства головного мозга через субарахноидальное пространство спинного мозга путем поясничного прокола.
ПЭГ широко используют для выявления различных аномалий развития нервной системы, диагностики опухолей и других объемных процессов.
Этот метод применяют в сочетании с диагностической пункцией. Поясничный прокол делают в промежутке между III и IV поясничными позвонками, при этом измеряют давление спинномозговой жидкости, извлекают 2—3 мл ликвора для исследования, а затем вводят медленно воздух или кислород. Последний быстрее рассасывается, поэтому больные его лучше переносят. Количество введенного газа варьирует в зависимости от возраста (15—40 см3) и тяжести патологического процесса. С целью заполнения желудочковой системы и субарахноидального пространства меняется положение головы. При наклоне головы вперед запол-122
няются желудочки, назад — субарахноидальное пространство. Независимо от количества введенного воздуха не всегда удается достичь хорошего наполнения желудочковой системы. Субарахноидальное пространство контрастируется лучше. Это, вероятно, связано с тем, что у новорожденных и грудных детей субарахноидальное пространство шире, чем у детей старшего возраста, а желудочки малы, поэтому их заполнение затруднено. Воздух вводят медленно в течение 10—25 мин со скоростью 2 мл в 1 мин. Это способствует лучшему заполнению полостей мозга и вызывает меньше побочных явлений. При этом методе ПЭГ возможно повышение внутричерепного давления. Оно спонтанно возвращается к исходной величине в течение 2—10 мин в зависимости от количества введенного воздуха, объема ликворного пространства и резорбции ликвора. При краниостенозе и микроцефалии в связи с малой емкостью ликворных пространств и повышением внутричерепного давления, следует вводить небольшое количество воздуха или кислорода — 10—15 мл.
Следует помнить, что введение воздуха в ликворную систему сопровождается вегетативно-сосудистыми нарушениями (бледностью кожных покровов, потливостью, снижением артериального давления, головокружением, головной болью), общим беспокойством., т. к. заполнение субарахноидального пространства является болезненным. Поэтому накануне исследования больному следует провести специальную подготовку. Вечером и утром делают очистительную клизму. Во избежание рвоты последнее кормление проводят в 6 ч утра. В течение суток дают противосудорожные препараты, нейролептики, витамины группы В и С. Непосредственно перед процедурой вводят 0,2—0,4 мл 10% кофеина и 2,5% аминазин из расчета 0,001—0,003 на 1 кг массы тела, либо делают клизму из 2% хлоралгидрата в количестве 20—30 мл. Некоторые авторы рекомендуют общий наркоз. Хорошо проведенная премедикация — гарантия успеха исследования, поскольку при рентгенографии ребенок должегт быть абсолютно спокоен. После пневмоэнцефалографии ребенок должен находиться под строгим наблюдением врача в течение 3—5 дней.
Методом ПЭГ можно диагностировать различные нарушения в ликворной системе: увеличение, деформацию и асимметрию желудочков, порэнцефалию, спаечные процессы в субарахноидальном пространстве, атрофию мозга. При открытой гидроцефалии ПЭГ дает представление о размерах, форме и расположении желудочков и субарахноидальных пространств. Обычно субарахноидальные пространства расширены, желудочки округлой формы. При закрытой гидроцефалии газ не проникает в желудочковую систему и при облитерации субарахноидальных пространств скапливается в цистернах задней черепной ямки. При краниостенозе желудочки мозга небольших размеров, узкие, симметричные, правильно расположенные. Субарахноидальные щели узкие, корот-
123
кие и малочисленные. У детей, перенесших асфиксию и внутричерепную родовую травму, в отдаленный период можно обнаружить асимметрию желудочков, локальные расширения субарахноидальных пространств, рубцово-атрофические изменения в поверхностных отделах мозга, кистозные образования на месте бывших очагов размягчения. При энцефалотригеминальном ангиоматозе на ПЭГ выявляются расширенные субарахноидальные пространства, асимметрия боковых желудочков.
При проведении пневмоэнцефалографического исследования у детей 1-го года жизни необходимо помнить, что мозг ребенка мягкий, легко деформируется. Поэтому при замещении ликвора воздухом он может смещаться в полости черепа. Такое смещение ошибочно можно принять за атрофию мозга.
Наряду с диагностической ценностью пневмоэнцефалография дает лечебный эффект. Она способствует улучшению крово- и ликворообращения, при введении относительно больших количеств спинномозговой жидкости снижает внутричерепное давление. Противопоказаниями к ПЭГ является резкое повышение внутричерепного давления при опухолях задней черепной ямки, III желудочка, абсцессах мозга, окклюзионных формах гидроцефалии; воспалительные заболевания, острые травмы черепа. У детей раннего возраста этот метод надо применять с осторожностью, только после всестороннего клинического обследования.
При процессах в области спинномозгового канала применяют методы миелографии. Эпдолюмбально вводят воздух или йодистые препараты. В связи с тем что опухоли спинного мозга у детей встречаются редко, миелография проводится в единичных случаях. В то же время в раннем возрасте миелография наиболее точно позволяет определить уровень локализации спинномозгового процесса. Миелографию используют также для уточнения блока субарахноидального пространства. В настоящее время применяют нисходящую миелографию с введением 1,5—3 мл йодоли-пола или майодила субокципитально и восходящую пневмомиелографию с введением воздуха эндолюмбально.
Вентрикулография
Вентрикулография — введение контрастного вещества непосредственно в желудочки мозга через специально наложенные трепанационные отверстия. В качестве контрастных веществ при вентрикулографии используют воздух, кислород, йодолипол, май-одил.
Вентрикулография с воздухом или кислородом производится в тех случаях, когда необходимо получить представление о форме, размерах, расположении желудочковой системы, проходимости ликворных путей при гидроцефалии, подозрении на объемный процесс, а также для уточнения локализации процесса. У детей
124
1-го года жизни вентрикулография проводится в редких случаях и при определенных показаниях, когда другие методы исследования не могут помочь диагностике. У детей раннего возраста опухоли чаще локализуются в области задней черепной ямки, вентрикулография в этих случаях является диагностически ценной и дает меньше осложнений, чем пневмоэнцефалография.
У грудных детей, когда роднички и черепные швы еще широко открыты, введение воздуха в желудочки осуществляется через передний родничок или расширенный коронарный шов. Пункционную иглу вводят по латеральному краю переднего родничка через твердую мозговую оболочку в передний рог бокового желудочка. Во втором полугодии 1-го года жизни, когда передний родничок уже выражен незначительно, чрескожная пункция желудочков возможна лишь в случаях расхождения швов. Пункцию проводят через коронарный шов правой стороны на расстоянии 2—3 см от средней линии тупой иглой во избежание травмы сосудов мозга.
При закрытых родничках вентрикулографию осуществляют через трепанационное отверстие в затылочной области на расстоянии 2—2,5 см от средней линии. Воздух или кислород вводят в задние рога боковых желудочков малыми порциями. Пунктируют оба боковых желудочка, затем медленно в одну канюлю вводят шприцем воздух, а через другую — выводят ликвор. Количество вводимого воздуха зависит от общего состояния, возраста ребенка, состояния желудочковой системы, высоты внутричерепного давления и предполагаемого характера патологического процесса. Если желудочки небольших размеров, вводят 20—35 см3, при гидроцефалии — до 100—120 см3 воздуха.
В настоящее время кроме воздуха и кислорода для вентрикулографии используют майодил. После обычной пункции боковых желудочков в передний рог правого бокового желудочка вводят 1—2 мл майодила. Это дает возможность получить более точные контуры ликворной системы мозга и заполнить ее каудальные отделы. С помощью вентрикулографии с майодилом можно получить четкое представление об уровне окклюзии ликворных путей, а также разрешить трудности, встречающиеся при диагностике опухолей задней черепной ямки. Противопоказаниями к проведению вентрикулографии у новорожденных и детей грудного возраста являются тяжелое состояние, симптомы поражения ствола и отек мозга, выраженные ликвородинамические нарушения.
Ангиография
Ангиография — рентгеноконтрастный метод исследования сосудов, который в последние годы широко применяют в нейрохирургии детского возраста, особенно для диагностики сосудистых поражений (рис. 46). Церебральная ангиография позволяет диагностировать па ранних стадиях развития артериальные и
125
Рис. 46. Ангиограмма:
а — каротидная ангио! рамма, прямая проекция; б — каротидная ангиограмма, боковая проекция; в — вертебральная ангиограмма, боковая проекция
артерио-венозные аневризмы, точно определить их локализацию, форму, размеры, своевременно применить нейрохирургическое вмешательство.
Сущность метода заклю-
чается во введении контрастного вещества путем пункции сонной артерии. В качестве контраста используют трийодистые препараты — гипак, йодурон, урографин, верографип, трийотраст.
Контраст в количестве от 4 до 10 мг в зависимости от возраста, цели исследования вводят одномоментно, быстро, под давлением. Это обеспечивает лучшее заполнение сосудов различного калибра и дает их более четкое изображение. Для регистрации прохождения контрастного вещества по мозговым сосудам делается серия снимков.
Дети раннего возраста легче переносят ангиографию, чем взрослые. Это объясняется большей эластичностью их сосудистой системы. Ангиографическое исследование в раннем возрасте производят под наркозом, особенно если ребенок возбудим, расторможен или страдает эпилептиформными припадками.
Показаниями к каротидной ангиографии у детей раннего возраста являются подозрение на наличие субарахноидального кровоизлияния, различных врожденных и посттравматических артериальных, артерио-венозных аневризм, поражения экстракраниальных сосудов. При наличии субарахноидального кровоизлияния ангиографию целесообразно делать спустя некоторое время после
126
прекращения кровотечения, за исключением случаев, когда оперативное вмешательство делается по основным жизненным показаниям.
Каротидная ангиография является ценным методом диагностики субдуральной гематомы любой локализации. Ее используют для дифференциации гематомы и ушиба мозга в случаях острой черепно-мозговой травмы, а также при подозрении на посттравматические кисты, гигромы, абсцессы мозга, опухоли. У детей раннего возраста ангиографию проводят также при гемиплегии, очаговых эпилептиформных припадках, гидроцефалии с целью уточнения причины заболевания.
Ангиографию не следует применять при воспалительных процессах, сердечно-сосудистых заболеваниях, тяжелом состоянии ребенка.
Осложнения при каротидной ангиографии при соответствующей подготовке и соблюдении правил предосторожности незначительны. Иногда могут наблюдаться местные осложнения в виде гематомы на месте введения контрастного вещества.
Вертебральную ангиографию у детей раннего возраста используют для диагностики сосудистых и объемных процессов, локализующихся в задней черепной ямке, задних отделах теменных и височных долей мозга, подкорковых образованиях.
У детей раннего возраста наилучшим является чрезбедренный путь артериографии. Пункция бедренной артерии проводится на 1 — 1,5 см ниже пупартовой связки. Это более простой и безопасный метод катетеризации по сравнению с пункцией других периферических сосудов. В некоторых случаях применяют катетеризацию через подмышечную или плечевую артерии. В зависимости от возраста вводят 6—12 мл контрастного вещества, затем 10—15 мл 5% раствора глюкозы или изотонического раствора натрия хлорида с гепарином. У новорожденных, перенесших внутричерепную родовую травму, обнаруживаются значительные нарушения мозгового кровообращения: замедление скорости кровотока, особенно венозной фазы, расширение поверхностных вен мозга, впадающих в верхний продольный синус, длительную задержку в них контрастного вещества.
При нарастании внутричерепной гипертензии, обусловленной субдуральной гематомой или отеком мозга, иногда отмечается почти полное прекращение артериального мозгового кровообращения, что связано, вероятно, со сдавлением или спазмом артерий. Наблюдается также выраженная извитость внутренних сонных артерий на шее.
Радиоизотопная диагностика
Впервые радиоактивные изотопы были применены для диагностики опухолей. Краски (флуоресцин), которые обладали способностью накапливаться в опухолях, метили радиоактивными
127
Рис. 47. Скеннограмма черепа при гидроцефалии:
а — передняя проекция; б — задняя проекция; в — боковая ппоекпия слева; г — боковая проекция справа
изотопами. Их накопление в опухоли было в 3—5 раз большим, чем в здоровых тканях. С целью диагностики опухолей в настоящее время применяют метод радиоизотопной сцинтиграфии. Благодаря применению радиоизотопов правильность топической диагностики у больных с опухолью мозга возросла до 62—95%. Для скенниро-вания пользуются препаратом 99т-пер-технетатом, преимуществом которого является короткий период полураспада (6 ч). Скеннирование безопасно, оно не является нагрузкой для организма, поэтому его можно применять у детей раннего возраста для диагностики опухолей, гидроцефалии.
Техника исследования проста. Накануне исследования ребенку дают 2— 3 капли раствора Люголя с целью уменьшения лучевой нагрузки на щитовидную железу. Перед исследованием вводят седативные средства. Через большой родничок в передний рог бокового желудочка вводят 99т-пертехнетат из расчета 50 мкКи на 1 кг массы тела ребенка. Путем изменения положения головы и тела в пространстве препарат в течение нескольких минут распределяется в ликворе.
С помощью скеннограмм можно получить данные о состоянии желудочковой системы и субарахноидальных пространств — размеры, конфигурация, проходимость ликворных путей (рис. 47). Радиоактивное вещество можно вводить и эндолюмбально (изотопная миелография). Оно задерживается на месте блокады субарахноидального пространства.
Применяют и распространенную изотопную миелографию. В спинномозговой канал вводят пузырек радиоактивного газа — радона и ксенона с воздухом. Пузырек радиоактивного газа останавливается у нижней границы блока, уровень которого определяется счетчиком Гейгера—Мюллера. С по
128
мощью этого метода в 90% случаев удается правильно поставить диагноз, установить топику процесса, особенно его нижней границы.
Скеннированием можно пользоваться и при исследовании нарушения всасывания спинномозговой жидкости. Измеряя активность вещества над черепом, можно выявить быстрое уменьшение его при гиперсекреторной форме гидроцефалии и замедленное снижение активности при арезорбтивной. Снижение уровня излучения над черепом наблюдается также при окклюзионной гидроцефалии.
Показаниями к радиоизотопной диагностике являются: субдуральные гематомы, опухоли мозга.
При субдуральных гематомах радиоактивное вещество концентрируется в капсуле гематомы. Поэтому скеннирование лучше проводить через 7—10 дней после травмы. На скеннограммах, сделанных через 4—6 ч после введения препарата, хорошо видны размер и локализация полости, что важно при нейрохирургическом вмешательстве. Положительный результат при скеннирова-нии дают астроцитомы, глиобластомы и метастатические опухоли. Медуллобластомы и глиомы ствола мозга не отражаются на скеннограммах.
Исследование радиоактивными изотопами перспективно, оно нетравматично, безвредно, технически легко выполнимо. Оно особенно показано детям раннего возраста, находящимся в тяжелом состоянии, так как это избавляет их от проведения более опасного пневмоэнцефалографического исследования.
Компьютерная томография
Компьютерную томографию проводят с помощью аппарата ЭМИ — Скеннера (EMI — Scanner), в котором использованы чувствительные кристаллические детекторы и миникомпъютер для построения детальных изображений, содержащих в 100 раз больше информации о мозговой ткани, чем при использовании обыкновенных рентгеновских методов. С помощью этого аппарата можно получить точные и детальные изображения мельчайших изменений в плотности мозговой ткани, показывающих характер и локализацию таких заболеваний, как опухоль мозга, кисты, кровоизлияния.
Скеннирующим устройством мозг больного исследуется как серия слоев. Эта система имеет большие преимущества по сравнению с рентгеноконтрастными методами, которые создают много неудобств для больного. Исследование можно проводить амбулаторно в динамике.
Изображение получается через 5 мин после скеннировапия головы больного и может рассматриваться немедленно на экране электронно-лучевой трубки или фотографироваться для последую-
129
Рис. 48. Методика проведения эхо-энцефалографии
Рис. 49. Эхоэнцефалограмма здорового ребенка 3 мес
щпх исследований. Это устройство, вероятно, найдет широкое применение при нейрорентгепологпческом исследовании у детей раннего возраста.
Эхоэнцефа.юграфия
Эхоэнцефалографический метод основан на способности ультразвука при прохождении через ткани черепа и мозга частично отражаться от границ сред, обладающих различными акустическими плотностями. У детей раннего возраста благодаря более тонким костям свода черепа значительно уменьшаются потери ультразвуковой энергии в костях. Поэтому эхоэнцефалограмма (ЭХОЭГ) более информативна, чем у взрослых. Этот метод широко применяется в детской практике, так как может производиться амбулаторно с минимальной затратой времени и безопасен.
Датчик с определенной частотой ультразвуковых колебаний (1,76—2,64 волны в 1 с) попеременно накладывают на боковые поверхности головы справа и слева (рис 48). Измеряют время от подачи ультразвукового сигнала до регистрации отраженных волн на экране эхоэпцефалографа. По степени смещения срединных структур мозга (величина М-эхо) судят о симметричном расположении, полушарий и желудочков мозга. Величина смещения М-эхо в норме составляет 0,5—1 мм (рис. 49). Удаление средин-4 ного М-эхо в сторону от пораженного полушария более чем на 2 мм свидетельствует о смещении срединных структур мозга. Второй характеристикой ЭХОЭГ является вентрикулярный индекс, по которому можно судить о степени выраженности гидро-цефальных изменений желудочковой системы. У здоровых детей он составляет 1,8—1,9. При гидроцефалии вентрикулярный индекс увеличивается. Следующей характеристикой ЭХОЭГ является нарастание крпвой эхо-пульсаций. Амплитуда их колебаний зависит от величины внутричерепного давления. С повышением
130
Рис. 50. Эхоэнцефалограммы:
а — в норме; б — гидроцефалия; в — опухоль
давления уменьшается время нарастания кривой и усиливается амплитуда пульсаций (рис. 50).
Показанием к проведению ЭХОЭГ являются патологические состояния, сопровождающиеся отеком мозга, смещением срединных структур (субдуральные и эпидуральные гематомы, супратенториальные опухоли, абсцессы, черепно-мозговая травма, асфиксия, гидроцефалия, гемиатрофия мозга).
При субдуральных и эпидуральных гематомах, супратенториальных опухолях, абсцессах мозга наблюдается смещение М-эхо на 3—10 мм в сторону от пораженного полушария. Смещение М-эхо в сторону пораженного полушария бывает при гемиатрофиях мозга. При гипертензионно-гидроцефальном синдроме увеличение вентрикулярного индекса сочетается с уменьшением времени нарастания кривой эхо-пульсаций, увеличением амплитуды пульсаций п числа отраженных сигналов.
У новорожденных, перенесших тяжелую асфиксию, смещение М-эхо на 1—3 мм связано с локальным отеком мозга. Метод ЭХОЭГ позволяет разграничить различные виды черепно-мозговой травмы. Это особенно важно для раннего детского возраста.
При сотрясении мозга смещение срединного М-эхо не превышает 2 мм, в то время как при контузии оно достигает 5—8 мм. Данные ЭХОЭГ, полученные в динамике, позволяют следить за течением патологического процесса. Применение этого метода иногда делает излишним использование контрастных методов исследования, а в большинстве случаев дополняет их. ЭХОЭГ может быть правильно оценена лишь при сопоставлении ее с особенностями течения заболеваний нервной системы у детей раннего возраста.
131
Электроэнцефалография
Электроэнцефалография (ЭЭГ) — регистрация биотоков мозга. Показаниями к ней в раннем возрасте являются: судорожные приступы, внутричерепная родовая травма, асфиксия, наличие очаговой неврологической симптоматики, задержка психомоторного развития, повышенная возбудимость.
Запись ЭЭГ у новорожденных и грудных детей производят в состоянии покоя в положении лежа через 1 —1,5 ч после кормления. Для фиксации электродов применяют специальный шлем. Используют биполярные и монополярные отведения, которые дают представление о характере колебаний биопотенциалов в различных областях коры больших полушарий (лобная, прецентральная, височная, теменная, затылочная зоны).
Рис. 51. ЭЭГ здорового ребенка 8 мес
132
На ЭЭГ выделяют несколько основных ритмов: дельта-ритм частотой 0,5—3,5 в 1 с, тета-ритм — 4—7,5 в 1 с, альфа-ритм — 8—13 в 1 с и бета-ритм — 13—30 в 1 с. ЭЭГ грудного ребенка отличается рядом особенностей, главная из которых заключается в преобладании медленных волн. У новорожденного на ЭЭГ больше низкоамплитудных дельта-волн, значительно реже встречается тета-ритм и лишь эпизодически — альфа-волны. Различия между состоянием сна и бодрствования выражены слабо. Во 2-м полугодии жизни тета-ритм становится все более отчетливым, появляется эффект активации, уменьшение амплитуды колебаний при открывании глаз (рис. 51). Смешанная тета-, дельта-активность преобладает в течение 3—4 лет жизни, и лишь на 4-м году начинает формироваться альфа-ритм, который становится отчетливым приблизительно к 8 годам.
Таким образом, общая тенденция возрастных изменений корковой электроактивности заключается в постепенном нарастании удельного веса более быстрых волн.
При общем изменении биоэлектрической активности мозга наблюдаются отклонения ЭЭГ диффузного характера в виде замедления основной деятельности. При очаговых процессах обнаруживаются локальные изменения ЭЭГ, которые характеризуются медленными волнами, иногда снижением вольтажа и уплощением их. У детей раннего возраста локализовать очаг патологической активности на ЭЭГ трудно. У грудных детей даже локальные изменения имеют тенденцию давать генерализованные проявления на ЭЭГ. Основные патологические изменения на ЭЭГ детей раннего возраста можно распределить на несколько групп.
Эпилептиформная, пароксизмальная активность: на ЭЭГ обнаруживаются высокоамплитудные, пикообразные разряды с частотой, соответствующей дельта- или тета-ритму. Эти разряды могут быть единичными или в виде серий и регистрируются во всех либо в отдельных отведениях. Наличие разрядов лишь в определенных отведениях указывает на существование очага эпилептогенной активности.
В некоторых случаях на ЭЭГ у детей раннего возраста выявляется почти постоянная высокоамплитудная пароксизмальная активность — так называемая гипсаритмия. Обычно это дети с малыми пропульсивными припадками типа кивков, вздрагиваний, поклонов. Гипсаритмия является прогностически неблагоприятным симптомом и требует активных терапевтических мероприятий.
По отношению к новорожденным и грудным детям часто используют понятие «повышенная судорожная готовность». При этом на ЭЭГ наблюдаются пикообразные потенциалы.
При судорожных состояниях у детей грудного возраста на ЭЭГ наблюдаются диффузные смешанные судорожные потенциалы. Данные ЭЭГ особенно важны у детей раннего возраста с
133
фебрильными судорогами. Наличие на ЭЭГ пик-волны в меж-приступный период является показанием к назначению противосудорожного лечения. При судорогах электроэнцефалографические исследования используются не только для’диагностики, но и как контроль за лечением.
При органических поражениях центральной нервной системы на ЭЭГ наблюдается стойкая асимметрия колебаний биопотенциалов. Редукция, угнетение электроактивности в определенных отведениях вплоть до полного биоэлектрического молчания могут указывать на локализацию поражения. Помимо асимметрии иногда наблюдается общая дезорганизация электроактивности, при которой трудно выделить доминирующий ритм. Общая дезорганизация нередко сочетается с пароксизмальной активностью.
При задержках психомоторного развития, представляющих собой в клиническом отношении сборную группу, на ЭЭГ на фоне преобладания медленных ритмов могут быть обнаружены дезорганизация электроактивности, асимметрия биопотенциалов. Это указывает на органическое поражение нервной системы.
При повышенной возбудимости ребенка в отдельных случаях на ЭЭГ обнаруживают очаги ирритации, которые не реализуются в судорожные припадки. У других детей на ЭЭГ выявляются признаки органического поражения центральной нервной системы, не определяемые при неврологическом обследовании. Однако у большинства возбудимых детей ЭЭГ бывает нормальной.
При опухолях мозга на ЭЭГ, снятых с участков прилежащих к опухоли, обнаруживаются медленные волны. Сама опухоль электрически неактивна.
Показатели ЭЭГ при любом заболевании необходимо соотносить с другими данными клинического обследования и анамнестическими сведениями.
Реоэнцефалография
В основе метода лежит регистрация электрического сопротивления живых тканей при пропускании через них переменного тока высокой частоты. Электропроводимость тканей находится в прямой зависимости от их кровенаполнения.
Реоэнцефалография (РЭГ) позволяет косвенно судить о состоянии тонуса, эластичности сосудов, их способности к сужению и расширению, величине кровенаполнения. С ее помощью можно также выявить асимметрию кровенаполнения в сосудистых бассейнах головного мозга ребенка.
Методика РЭГ безопасна, не дает отрицательных последствий и ее можно применять у детей сразу после рождения. В последние годы РЭГ часто используют при обследовании новорожденных и грудных детей с церебральными нарушениями. Показаниями к РЭГ-исследованию являются нарушения мозгового кровообращения различного генеза. РЭГ-исследовапие проводят при
134
помощи реографа, который подключают к электрокардиографу или элекгроэнцефалографу. Запись РЭГ производят у новорожденных в состоянии физиологического сна через 1—2 ч после кормления. В этом возрасте наиболее часто используют глобальное фронтомастоидальное отведение с расположением электродов на симметричных участках головы. При этом получают представление о состоянии гемодинамики в соответствующих областях полушарий мозга, питаемых магистральными сосудами.
У детей, перенесших асфиксию или внутричерепную родовую травму, средняя амплитуда колебаний РЭГ вдвое снижена по сравнению с нормой. Снижен также и реографический показатель притока. Это свидетельствует об уменьшении артериального кровотока мозга. Кроме того, на РЭГ обнаруживаются патологические асимметрии амплитуд пульсовых колебаний. Это связано, вероятно, с преимущественным поражением одного из полушарий, что нередко выявляется также клинически и электроэнцефалографически.
У детей с церебральными параличами в 40—50% случаев наблюдаются асимметрии РЭГ. При сосудистых опухолях мозга выявляется значительное увеличение амплитуды РЭГ.
РЭГ в комплексе с клиническими данными и другими дополнительными методами исследования способствует ранней дифференциальной диагностике неврологических заболеваний.
Электромиография
Электромиография (ЭМГ) — метод регистрации электрических потенциалов скелетных мышц.
Он относится к электрофизиологическим методам исследования и характеризует функциональное состояние периферической двигательной единицы (двигательной клетки переднего рога спинного мозга, ее аксона и иннервируемых ими мышечных волокон). ЭМГ широко используется при исследовании физиологических и патофизиологических состояний в раннем детском возрасте и служит цепным вспомогательным методом при дифференциальной диагностике двигательных нарушений различного генеза. В зависимости от цели исследования применяют глобальную или локальную ЭМГ. Метод регистрации потенциалов мышцы и нерва, вызванных электрической стимуляцией нерва, называют электронейромиографией (ЭНМГ).
При локальной ЭМГ с помощью игольчатых электродов изучается биоэлектрическая активность отдельных мышечных волокон и мионевральных окончаний.
При глобальной ЭМГ изучают биоэлектрическую активность группы мышечных волокон, взаимодействие различных мышц при выполнении двигательных актов, изменение биоэлектрической активности при синдромах двигательных расстройств.
135
Рис. 52. ЭНМГ здорового ребенка 2 лет:
Л — интерференционная электромиограмма при максимальном произвольном сокращении (четырехглавая мышца бедра, глобальная ЭМГ); Б — двухфазные потенциалы нормальной амплитуды, формы и длительности (четырехглавая мышца бедра, локальная ЭМГ); В, Г — нормальные, вызванные М-ответ и чувствительный потенциал (срединный нерв); Д — ритмическая стимуляция нерва (срединный нерв)
ЭМГ позволяет изучать скорость проведения импульса в различных участках периферических нервов, характеристики вызванных потенциалов нервов и мышц (рис. 52).
При анализе электромиограмм учитываются величина амплитуды, частота колебаний потенциалов, а также общая структура осциллограмм (монотонность осцилляций или расчлененность ее на залпы).
Современная ЭМГ является ценным параклиническим методом, позволяющим дифференцировать различные уровни поражения. При постановке диагноза, однако, в первую очередь необходимо учитывать клиническую картину, так как данные ЭМГ могут быть неспецифичными.
У детей раннего возраста проведение этого исследования представляет большие трудности, тем не менее с его помощью можно дифференцировать супраспинальные двигательные расстройства, спинальные поражения, функциональные нарушения в мионевральных синапсах, повреждение перифериче
ских нервов, мышечные нарушения, а также составить представление о степени зрелости двигательных систем ребенка.
При поражении периферического нерва и денервации мышцы возникают потенциалы фибрилляций, мопофазные положительные потенциалы. ЭМГ-запись характеризуется низкой амплитудой и урежением осцилляций. По мере регенерации фпбрплляционные потенциалы уменьшаются, группируются и удваиваются. Их сменяют широкие полифазные потенциалы (регенерации).
Признаки восстановления функций на ЭМГ часто опережают клиническое выздоровление. В случае отсутствия регенерации потенциалы фибрилляций исчезают, и на ЭМГ регистрируется полное «биоэлектрическое молчание». При стимуляции выявляется ре-зкое падение электровозбудимости.
При поражении клеток передних рогов спинного мозга наблюдаются редкие полифазные потенциалы осцилляции (потенциалы 136
фасцикуляций). Потенциал активности широкий, полифазный, что связано с денервацией одних мышечных волокон и интактностью других. При максимальных произвольных сокращениях на фоне дизритмической активности отмечаются уреженные (менее 50 осцилляций в 1 с), синхронизированные потенциалы высокой амплитуды и большой длительности.
При прогрессирующих мышечных дистрофиях и врожденных миопатиях наблюдается угнетение электрической активности при отсутствии фибрилляций и потенциалов денервации. При игольчатом отведении (локальная ЭМГ) регистрируются отдельные мышечные потенциалы малой длительности (до 4 мс при норме 8—12 мс) и полифазные потенциалы в виде комплексов коротких пиков, так как моторная единица в результате утраты части мышечных волокон меньше, чем в норме.
Регистрация высокоамплитудных, ритмически повторяющихся, залпоподобных осцилляций на фоне повышенной активности разгибателей в «покое» и при спонтанных движениях указывает на вовлечение в процесс надсегментарных отделов двигательного анализатора. Такие нарушения биоэлектрической активности наблюдаются преимущественно у детей с нарастающей спастичностью. При детском церебральном параличе отмечаются снижение мышечного электрогенеза при спонтанных движениях и повышение его во время рефлекторной возбудимости, а также патологическая импульсация в виде залпов тремора. Экстрапирамидные гиперкинезы проявляются на ЭМГ залпами частых высокоамплитудных колебаний, возникающих на фоне низковольтной кривой.
Метод измерения скорости проведения импульса по периферическим нервам (СПИ) за последние годы нашел широкое применение в детской неврологии. Это объясняется тем, что возрастная динамика показателей СПИ по периферическим нервам отражает главным образом течение процессов миелинизации и поэтому является одним из показателей степени созревания нервных структур. СПИ по периферическим нервам является одним из немногих методов исследования, с помощью которых объективизируются процессы постнатального онтогенеза нервной системы.
Метод может быть использован для дифференциации недоношенности и внутриутробной гипотрофии, оценки двигательного развития ребенка.
При воспалительном и травматическом повреждении периферических нервов СПИ снижена. Измерение СПИ в динамике позволяет проследить за процессами восстановления двигательной функции при применении комплексной терапии.
137
Биохимические методы исследования
Биохимические методы исследования крови, ликвора, мочи наиболее важны для диагностики наследственных болезней обмена веществ. Самым достоверным методом диагностики является определение активности специфического фермента. Если первичный молекулярный дефект не известен или имеются технические трудности в определении активности того или иного фермента,
Таблица 6
Экспресс-тесты для диагностики наследственных болезней обмена веществ
Тест Соединение При каких заболеваниях положительный
Реакция Феллинга (тест с треххлорным железом) Фенилкетокислоты мочи Фени лпирови ногра дная олигофрения, гистидине-мия
Проба с 2,4-динитрофе- Кетокислоты крови и мо- Фен и лпиро виноградная
нилгидразином чи олигофрения, гистидине-мия, болезнь с запахом мочи кленового сиропа
Реакция Легаля Кетоновые тела Заболевания аминокислотного обмена, состояние ацидоза
Нингидриновый тест Гипераминоцидурия Фенилкетонурия, болезнь с запахом мочи кленового сиропа, аргининянтарная аминоацидурия, первичные прогрессирующие мышечные дистрофии
Тест на альфа-аминоазот Альфа-аминокислоты Аминоацидурии (непороговые, транспортные, избыточные)
Реакция Миллона Тирозин, паракетокислоты Тирозиноз
Проба с толуидиновым синим Кислые гликозамингли-каны в моче Мукополисахаридозы
Тест Аустина М етахромати ческ ие включения (сульфатиды) в моче Лейкодистрофия (мета-хроматические формы)
Тест с ацетилтриметил-аммония бромидом Кислые гликозамингли-каны в моче Мукополисахаридозы
Проба Гайнеса Сахар в моче Сахарный диабет, галактоземия фруктоземия
Проба со щелочным раствором аммиака Галактоза в моче Галактоземия
Проба Селиванова с ре- Фруктоза в крови и мо- Непереносимость фрук-
зорцином че тозы
138
можно выявить патологию побочных путей метаболизма, избыток субстрата, недостаточность конечных продуктов реакции и т. д.
Ранняя диагностика врожденных ошибок метаболизма дает возможность провести патогенетическую терапию еще до возникновения неврологических нарушений. Определение биохимического дефекта является также основой медико-генетического консультирования и профилактики повторного рождения больных детей.
С целью диагностики наследственных болезней обмена веществ применяют двухэтапную систему биохимического исследования. На первом этапе с помощью качественных реакций (скрп-нирующих тестов) выявляют контингент детей с отклонениями в том или ином виде обмена (табл. 6). Скринирующие тесты можно также использовать для массового обследования больших групп населения, например новорожденных в родильных домах.
Наряду с биохимическими скринирующими тестами используют микробиологические (тесты Гатри), основанные на избирательном росте бактерий в присутствии определенной аминокислоты.
Модификацией этого метода является определение аминокислотного спектра крови с помощью мутантных штаммов кишечной палочки (Д. М. Гольдфарб, 1968).
Следует помнить, что характер вскармливания непосредственно влияет на содержание аминокислот в крови новорожденных. У детей, находившихся на грудном вскармливании, гиперамино-цидурии встречаются в 1,1% случаев, а у искусственно вскармливаемых — в 2,7%. Для ребенка первых месяцев жизни также характерны транзиторные биохимические нарушения, обусловленные становлением и функциональной незрелостью ферментных систем. В частности, фенилаланин-гидроксилазная система у недоношенных детей формируется позже, чем у доношенных.
Следующим этапом диагностики наследственных нарушений обмена являются полуколичественные и количественные методы оценки содержания метаболитов в биологических жидкостях и активности ферментов в жидкостях и тканях организма. Некоторые из них приведены ниже.
Метод Заболевание
Бумажная хроматография аминокис- Цитруллинемия, фенилпировиноград-лот крови ная олигофрения, гистидинемия, ги-
перлизипемия, гипераргининемия, глицинемия, пролинемия, гипервали-немия, тирозинов, глутаминацидемия, болезнь с запахом мочи кленового сиропа, некетотическая гиперглици-немия, метилмалоновая ацидемия, пропионацидемия
Бумажная хроматография аминокис- Аргининянтарная аминоацидурия, болот мочи лезнь Хартнупа и все вышеперечис-
ленные заболевания
139
Ионообменная хроматография аминокислот мочи
Бумажная хроматография сахаров мочи
Бумажная хроматография мукополисахаридов мочи
Газовая хроматография и спектроскопия экстрактов мочи на органические кислоты
Определение сульфита и тиосульфата в моче
Определение магния в крови
Определение меди в крови
Все вышеперечисленные заболевания
Сахарный диабет, галактоземия, непереносимость фруктозы и других сахаров, врожденный лактатацидоз
М у копо лисахари дозы
Болезнь с запахом мочи кленового сиропа, изовалериановая ацидемия, бета-метилкротонилглицинурия, аль-фа-метил-бета-гидроксимасляная ацидурия, пропионацидемия, глутамина-цидурия. пироглутаминацидурия, ти-розинемия, непереносимость фруктозы, дефицит фруктозо-1,6-дифосфата-зы, врожденный лактатацидоз
Дефицит сульфитоксидазы
Семейная гипомагнезиемия
Синдром курчавых волос Менкеса
Генетические методы исследования
Основными методами медико-генетического исследования являются клинико-генеалогический анализ и определение кариотипа.
Генеалогический метод основан на составлении родословных и их анализе в отношении того или иного признака заболевания, синдрома или аномалии развития, для выявления которых среди членов семьи используются данные анамнеза и весь комплекс клинических и лабораторных исследований.
Родословные составляют с помощью общепринятых условных обозначений, дополнительно к которым обычно для обозначения признака можно вводить собственные, отметив их в легенде, сопровождающей родословную.
При составлении родословной необходимо соблюдать следующие основные правила: представители одного поколения располагаются на одной горизонтали; в брачном союзе женщина обозначается слева от мужчины (исключение делается для повторных браков); родные братья и сестры (сибсы) обозначаются в порядке их рождения.
Порядок составления родословной может быть различным. В медицинской практике наиболее часто родословную составляют начиная с пробанда, то есть с больного, попавшего под наблюдение врача. В этих случаях, чтобы не загромождать родословную, в ней целесообразно обозначать лишь те признаки, которые могут иметь отношение к анализируемому заболеванию или синдрому. Очевидно, что это возможно лишь при том условии, что у пробанда поставлен нозологический диагноз. При
140
этом необходимо учитывать возможную вариабельность клинических проявлений, степень их выраженности (экспрессивность гена, его плейотропизм). В ряде случаев, когда заболевание может проявляться не с рождения, необходимо отметить также возраст представителей семьи.
Первоначально сведения для составления родословной получают путем опроса самого пробанда, его родителей и родственников. Следует, однако, иметь в виду, что, как правило, полученные таким путем данные бывают неполными как вследствие незнания, так и намеренного сокрытия их опрашиваемыми. Поэтому следует стремиться к дополнению этих сведений путем осмотра и, если необходимо, всестороннего обследования возможно большего количества представителей семьи.
Особое внимание следует обратить на возможность кровного родства между родителями пробанда и других членов семьи, и при этом иметь в виду, что об этом косвенно могут свидетельствовать данные о месте их рождения. Выяснение места рождения необходимо также с точки зрения возможного происхождения родителей из изолянтов с высокой концентрацией той или иной мутации или из эндемических районов. Важное значение для анализа родословной имеют также профессиональные вредности родителей пробанда.
Лишь после завершения составления родословной приступают к ее анализу. Прежде всего следует выяснить, имеется ли концентрация анализируемого признака в семье? Ответ на этот вопрос получают сравнением частоты его в данной семье и частоты в популяции. Для редких признаков вопрос сводится к тому, имеются ли повторные случаи данного заболевания или признака в семье. Наличие концентрации признака или заболевания предполагает либо его наследственную обусловленность, либо действие общего внешнего фактора.
Выявленный у больных наследственно детерминированный первичный молекулярный дефект безоговорочно свидетельствует в пользу первой альтернативы. Однако, если он неизвестен, помимо отрицания второй альтернативы в пользу первой могут свидетельствовать: распределение признака среди членов семьи в соответствии с законами Менделя и внутрисемейное сходство проявления и течения заболевания.
Если в семье имеется только один больной с подозрением на наследственное заболевание, то о наследственном характере патологии бесспорно свидетельствует выявленный первичный молекулярный дефект. Косвенными доказательствами наследственной природы могут служить: кровное родство родителей пробан-да или происхождение их из изолята, а также отсутствие других возможных причин патологии.
Установив наследственную детерминированность патологии, необходимо установить тип наследования, то есть определить,
141
a
А A Ao
Рис. 53. Родословные семей:
a — с аутосомно-доминантным типом наследования признака; б — с аутосомнорецессивным; в — с рецессивным сцепленным с полом наследованием признака
локализован ли ген в Х-хромо-соме или в одной пз аутосом, доминирует или является рецессивным.
Аутосомно-доминантное наследование характеризуется следующими показателями: проявление признака «по вертикали» без пропуска поколений (у каждого больного болен по крайней мере один пз родителей); равное распределение больных по полу; соотношение больных и здоровых спбсов — 1:1 (рис. 53а).
Аутосомно-рецессивное наследование можно установить на основе следующих данных: распространение признака «по горизонтали» (то есть родители больного здоровы, заболевание может быть у сибсов пробанда и его сибсов родителей); соотношение здоровых и больных сибсов приближается к 3:1; кровное родство родителей или их происхождение из одного изолята (рис. 536). Очевидно, что последние два положения и частичное первое могут быть использованы при большом количестве больных в семье либо при анализе нескольких родословных с однотипным заболеванием. Применительно к одной семье установить аутосомно-рецессивное наследование чаще
всего точно удается лишь при известном первичном молекулярном дефекте и существовании методов определения гетерозиготности по гену, его детерминирующему.
На рецессивное, сцепленное с Х-хромосомой, наследование указывают следующие данные, выявленные при анализе родословной: проявление признака исключительно или почти исключительно у лиц мужского пола; распространение его «по горизонтали» среди мужчин пз семьи матери пробанда; соотношение больных и здоровых сибсов мужского пола 1 : 1 (рис. 53в).
142
Доминантному, сцепленному с Х-хромосомои, наследованию свойственны все показатели аутосомно-доминантного наследования кроме одного: отсутствие передачи признака от отца к сыновьям.
Помимо наследственных заболеваний, обусловленных одним геном и наследуемых в соответствии с простыми менделевскими закономерностями, существует ряд патологических признаков, главным образом врожденных пороков развития, предрасположенность к которым наследуется полигенно с пороговым эффектом. Для таких патологических состояний также характерна концентрация их среди близких родственников пробанда по сравнению с популяцией в целом, причем тем более выраженная, чем выше степень родства. Кроме того, в этих случаях один пол поражается чаще другого.
Последним этапом анализа родословной является расчет степени риска заболевания или рождения больного потомства для каждого из членов семьи. В случаях моногенного наследования основанием для расчета являются законы Менделя. При поли-генной предрасположенности риск определяют на основе эмпирических данных, если таковые имеются для данной патологии, либо исходя из ее частоты в популяции.
Цитогенетические методы применяют с целью определения кариотипа больного при подозрении на аномалию хромосом.
Показаниями к определению кариотипа могут служить врожденная гипотрофия, не компенсируемая после рождения; высокий уровень стигматизации с грубыми пороками развития или без них; выраженный сдвиг дерматоглифической гистограммы. В более позднем возрасте хромосомные аномалии могут проявляться грубой задержкой физического, моторного и психического развития.
При подозрении на аномалию половых хромосом первым этапом в определении кариотипа должно быть исследование полового хроматина. Половым хроматином или тельцем Барра называется глыбка хроматина, обнаруживаемая в неде-лящихся (интерфазных) соматических клетках женщин. Тельца Барра — это одна из двух Х-хромосом женщин, которая инактивирована и в течение почти всего клеточного цикла находится в гетероппкнотическом состоянии. Количество телец полового хроматина в клетке на единицу меньше суммы всех Х-хромосом.
Глыбки полового хроматина в той пли иной форме выявляются в клетках всех тканей организма. Однако в клинической практике их принято исследовать в клетках слизистой оболочки полости рта. Клетки слизистой получают путем соскоба заостренным, но не острым, металлическим шпателем. Слизистую предварительно, слегка надавливая, протирают ватным тампоном. Полученные клетки наносят на предметное стекло, размазыва-Ют, на мазок наносят 1—2 капли свежеотфильтрованного 2% ацетоорсеина и покрывают покровным стеклом. Покровное стекло
143
следует умеренно придавить пальцем или пинцетом, избыток краски, не сдвигая стекла, убрать концом фильтровальной бумаги. Препарат готов к анализу через 5—10 мин.
Препарат, запаянный в парафине, можно хранить в холодильнике до 2 дней. К анализу пригодны только однослойные мазки, поэтому соскоб не должен быть обильным, покровное стекло следует достаточно придавить, чтобы добиться расправления ядерных оболочек.
Анализ препаратов производят на исследовательском микроскопе под иммерсионным объективом (Х90). Ядра, пригодные для исследования полового хроматина, содержатся только в среднем слое слизистой оболочки. Они имеют ядерную оболочку и мелкозернистую нуклеоплазму, в которой тельце полового хроматина хорошо определяется в виде глыбки овальной, треугольной, или реже, другой формы под оболочкой, иногда в виде местного утолщения ядерной оболочки.
Меняя поля зрения в систематической последовательности, просматривают подряд 100 ядер, пригодных для анализа по вышеуказанным критериям. Обычно у здоровых женщин от 20 до 75 из них содержат половой хроматин. Хроматинположительные ядра в клетках здоровых мужчин встречаются редко — 1 : 3000 (А. М. Пономаренко, 1965).
Оценивая результаты анализа полового хроматина, следует иметь в виду, что нормальные показатели его у женщин зависят от ряда факторов. Во-первых, они закономерно снижены в период новорожденности и достигают своих максимальных значений лишь на 8—10-й день жизни. В дальнейшем показатели полового хроматина могут снижаться при экзогенном введении АКТГ, эстрогенов, гидрокортизона и других гормональных препаратов, некоторых антибиотиков; они несколько варьируют в зависимости от стадии менструального цикла, снижаются при беременности, кахексии и др.
Кроме количества хроматинположительных клеток большое значение имеет также величина глыбок. В норме она колеблется от 0,7 до 1,2 мк. Уменьшение телец наблюдается при деле-циях Х-хромосомы или если одна из них является изохромосомой из коротких плеч. Как правило, именно измененная хромосома находится в состоянии гетеропикноза.
Следует отметить, что исследование полового хроматина рассматривается лишь как вспомогательный или скринирующий метод выявления аномалий половых хромосом. Полученные с его помощью данные о патологии требуют верификации карио-логическим анализом.
Исследование кариотипа в медицинской практике в настоящее время обычно производят в лимфоцитах периферической крови, которые предварительно кратковременно (в течение 56— 72 ч) культивируют с митогенным агентом фитогемагглютинином. По окончании культивирования с помощью колхицина на
144
капливают клетки в стадии митоза, обрабатывают их гипотоническим раствором натрия хлорида, фиксируют, распределяют на предметном стекле и окрашивают ядерными красителями (ацето-орсеин, гематоксилин-эозин и др.). Однако такая окраска позволяет точно распределить лишь хромосомы по группам в соответствии с денверской классификацией и разграничить хромосомы групп А, Е и частично группы С. С целью более точной дифференцировки хромосом в настоящее время применяют ряд методов, которые по номенклатуре, принятой на Парижском конгрессе 1971 г., называются методами дискового окрашивания, или бэндингами (от английского «band» —диск).
Дерматоглифика
Дерматоглифика — изучение отпечатков кожного рисунка ладоней и стоп (дерматоглифов). Формирование дерматоглифов осуществляется под влиянием сложного взаимодействия поли-генных наследственных факторов и факторов внешней среды. Закладка дерматоглифов происходит между 6-й и 19-й неделями беременности и полностью заканчивается к 5—6-му месяцу. Формирование дерматоглифов тесно связано с образованием эмбриональных подушек, нервных окончаний, кровеносных сосудов кожи.
Метод дерматоглифики в последнее время широко используется в клинической практике. Отклонения кожного рисунка свидетельствуют о дезэмбриогенезе. Последний может быть обусловлен влиянием различных неблагоприятных факторов на ранней стадии эмбрионального развития, изменением числа и структуры хромосом, генными мутациями.
Поскольку нервная система и кожа формируются из эктодермального зачатка, возможны их сочетанные нарушения.
Отпечатки на бумаге получают, используя типографскую* краску, которую предварительно наносят на ладонь тонким, равномерным слоем (рис. 54). На них можно проанализировать основные характеристики гребневой кожи.
Кожные гребешки представляют собой линейные утолщения эпидермиса, лежащие почти параллельно друг другу и чередующиеся с кожными бороздами. На основании данных о тонкой структуре кожных гребней, характере узоров, трирадиусов, поперечных складок ладоней и стоп можно судить о степени дифференцированности кожного рисунка.
Изменения тонкой структуры гребней проявляются в нарушении их размеров (тонкие, толстые), формы (Y-, М-, N-образ-ные, крючковидные), общем недоразвитии. Узоры — одна из самых важных характеристик дерматоглифики. Они определяются на пальцах и возвышениях (подушечках) ладоней и стоп: гипо-тенаре, тенаре в I, II, III, IV межпальцевых пространствах и на пятках.
6 из
145
Рис. 54. Схема отпечатков кожного рисунка ладоней и стон:
а — дуга (гребневой счет ~0), 6 — петля (гребневой счет "44), « — завиток (максимальный гребневой счет — 13), г, д — топология пальцевой ладонной и подошвенной дерматоглифики (а, b, с, d — трирадиусы II—V пальцев; t — осевой трирадиус; f, h, р — подошвенные трирадиусы; А, В, С, D — главные подошвенные линии). По Holt (1968)
При анализе пальцевых узоров учитывают их характер (дуги, петли, завитки). Образование тех пли иных узоров в значительной степени зависит от формы фетальных подушечек. Если подушечки атрофичны и слабо выражены, то узор, как правило, представляет собой дуги; при хорошо выраженных подушечках правильной формы с ровными краями образуются простые завитки; если форма подушечек неправильная — сложные завитки. Петли образуются на вытянутых несимметричных подушечках.
Подушечки формируются из эктомезенхимы и мезенхимы на этапе эмбрионального развития одновременно с рядом органов и
146
анатомических структур — производных эктодермы и мезенхимы: мозгом, сердцем и сосудами, глазами, костями скелета.
Трирадиусы являются важным опознавательным признаком дерматоглифики. Они формируются при схождении трех полей гребней в местах наименьшего развития дерматоглифов, совпадающих с границами между эмбриональными подушечками. Величина эмбриональных подушечек отражает характер внутриутробного развития кожного рисунка. Ее выражают в миллиметрах или, что более распространено, при помощи подсчета гребней между центром и трирадиусом (гребневой счет). Общий гребневой пальцевой счет является одной из наиболее важных характеристик дерматоглифики. Величина гребневого счета изменяется при нарушении числа половых хромосом: полисомия па половым хромосомам сопровождается ее уменьшением, синдром ХО — заметным увеличением. Увеличение гребневого счета при синдроме Шерешевского—Тернера, при сахарном диабете L. Penrose, D. Loesch (1969), L. Barta и др. (1970) связывают с увеличением размеров подушечек вследствие их отека на той стадии эмбрионального развития, когда поверхность подушечек интенсивно покрывается гребнями. Гипоплазия подушечек пальцев при синдроме Эдвардса, полиплоидии по половым хромосомам влечет за собой уменьшение гребневого счета.
Большое значение имеет определение характеристик осевого ладонного трирадиуса t и пальцевых трирадиусов a, b, с, d. При многих наследственных заболеваниях t стремится к более дистальному расположению, а пальцевой трирадиус с часто отсутствует (Е. Г. Костылев, 1972; Ю. Д. Шарец, 1973). Количественной характеристикой расположения осевого трирадиуса могут служить-угол atd, гребневой счет fd и другие признаки. Для определения расстояния между пальцевыми трирадиусами используется подсчет гребешков между ними. В зависимости от особенностей конфигурации гребней, размеров узоров, определяемых подсчетом, количества гребней между центром узора и трирадиусом, количества и места расположения узоров и трирадиусов, а также направления главных линий на ладонях и подошвах определяют типы совокупных дерматоглифических признаков.
Большое диагностическое значение имеет дистальная поперечная складка (четырехпальцевая линия) п проксимальная поперечная складка (диснеевская складка), которая не оканчивается в области гипотенера, а тянется через всю ладонь. Эти складки редко встречаются в общей популяции; при целом ряде хромосомных синдромов частота их резко возрастает. Поперечная складка часто сочетается с различными пороками развития.
Применение метода дерматоглифики в клинике неврологии раннего детского возраста помогает распознавать сложные случаи хромосомных аномалий, заподозрить явления мозаицизма у обследуемых и их родителей и изучать фенотипические проявления наследственных болезней.
6*
Глава III. ХРОМОСОМНЫЕ СИНДРОМЫ
Под хромосомными синдромами подразумевается группа врожденных пороков развития, обусловленных аномалиями числа или структуры хромосом, т. е. избытком или нехваткой тех или иных генов. Хромосомные аномалии могут возникать в гаметах родителей вследствие нерасхождения хромосом в процессе деления, их поломки или перестройки под действием биологически активных физических, химических, а также биологических факторов. В результате зигота уже содержит аномалию, которая наследуется всеми клетками развивающегося из зиготы организма. Если аномалия возникает в процессе дробления зиготы, то в развивающемся организме оказывается два клеточных клона, отличных по кариотипу — хромосомный мозаицизм. Мозаицизм иногда бывает очень сложным вследствие повторных хромосомных нарушений.
Фенотипические проявления аномалий хромосом, по-видимому, в большей степени обусловлены больше несбалансированностью кариотипа, чем изменением дозы тех или иных конкретных генов. Поэтому в первую очередь следует иметь в виду семиотику хромосомных синдромов в целом, которая складывается из полного спектра врожденных пороков развития и диз-эмбриогенетических стигм. Патогномоничное их сочетание при определенных хромосомных аномалиях дает картину определенного синдрома. Однако клинический диагноз требует верификации исследованием кариотипа.
Хромосомные синдромы подразделяются на синдромы, обусловленные аномалиями аутосом (любой из 22 пар неполовых хромосом) или половых X- или Y-хромосом.
Синдромы, обусловленные аномалиями аутосом
Синдромы этой группы характеризуются множественными врожденными пороками развития, глубокой задержкой психического и физического развития, сниженной жизнеспособностью. Их классифицируют в соответствии с порядковым номером хромосом, гены которых присутствуют в избытке или в недостатке.
Синдром трисомии 21-й хромосомы (синдром Дауна). Симп-томокомплекс, обусловленный избытком генов, локализованных в 21-й хромосоме, описан в 1866 г. L. Down. Этиологическую значимость хромосомной аномалии при этом синдроме подтвердили J. Lejeune и др. в 1959 г. В 98% случаев синдром обусловлен регулярной трисомией 21-й хромосомы, в 2% —избыточный 148
хромосомный материал транслоцирован на одну из аутосом (чаще из группы D и G). Может быть также мозаицизм.
Частота болезни Дауна среди новорожденных, по данным различных исследователей, колеблется в пределах 1 : 290 — 1 : 1935. По мнению J. Oster, среди новорожденных она составляет 1 : 765, а в популяции — 1 : 4000. Частота транслокационных случаев болезни Дауна в популяции достигает 1 : 37 000— 48 000. С увеличением возраста матери возрастает частота случаев рождения детей с болезнью Дауна. Среди женщин старше 45 лет она составляет 1 : 20 — 1 : 45 новорожденных, в то время как среди матерей моложе 20 лет — 1 : 700 новорожденных. Транслокационный синдром чаще встречается у детей, рожденных от молодых матерей.
Патологоанатомические изменения характеризуются недоразвитием мозга и внутренних органов: аномальное строение головного (микрогирия, пахигирия) и спинного мозга, атрофия мозжечка, задержка процессов миелинизации, нарушения дифференциации различных отделов центральной нервной системы, гетеротопии, врожденные пороки сердца (дефект межжелудочковой или межпредсердной перегородки) и крупных сосудов, пороки развития кишечника, почек, диафрагмальные и паховомошоночные грыжи.
Заболевание проявляется с рождения, и диагноз в большинстве случаев ставится уже в родильном доме. Внешний вид новорожденного характерен: череп округлой формы, затылок плоский, косой разрез глаз, эпикант, широкая переносица, пятна Брушфильда на радужной оболочке, яркий румянец па щеках, маленькие прижатые к черепу уши; нос маленький, приплюснутый; недоразвитие верхней челюсти, готическое нёбо, рот полуоткрыт, углы его опущены, язык толстый и покрыт поперечными бороздами, гипертрофия сосочков языка (рис. 55). Пальцы кистей и стоп укорочены, V палец часто искривлен, синдактилия, сандалевидная щель между I и II пальцами на ногах. В 50% случаев выявляются гипоплазия половых органов, эндокринные нарушения.
Неврологический статус: выражена общая мышечная гипотония, в результате чего увеличен объем пассивных движений. Новорожденные вялы, адинамичны, крик слабый, болезненный, нередко нарушены сосание и глотание; безусловные рефлексы угнетены. Аномалия развития голосовых связок является причиной стридорозного дыхания. При наличии порока сердца могут иметь место повторные приступы асфиксии.
Благодаря характерным внешним признакам диагноз болезни Дауна поставить не трудно, за исключением случаев, когда основные симптомы нечетко выражены.
Характерны дерматоглифические изменения: поперечная ладонная борозда, повышена частота петель на IV и V пальцах, ульнарных петель на I —III пальцах, дуг —- на IV пальцах,
149
завитков — на V пальцах, частота этих узоров на других пальцах снижена; высокий трирадиус, частота истинных узоров в III межпальцевом промежутке на левой руке повышена, на правой — снижена.
Даже при отсутствии сомнения в диагнозе следует проводить исследования кариотипа с целью выявления транслокационных вариантов, обнаружение которых является показанием для исследования кариотипа родителей. Если один из родителей является носителем сбалансированной транслокации, то последующее деторождение без антенатального контроля кариотипа плода не показано.
При стертых формах болезни Дауна иногда выявляется мозаицизм, когда одна часть соматических клеток содержит 46 хромосом, а другая — 47. Для обнаружения мозаицизма иногда необходимо провести исследование кариотипа не только в лимфоцитах периферической крови, но и в фибробластах кожи.
Лечение в период новорожденное™ сводится к стимулирующей и общеукрепляющей терапии, профилактике интер-
курентных заболеваний, рациональному вскармливанию, лечебной гимнастике. В настоящее время с определенным успехом применяют препараты глютаминовой кислоты, церебролизин, тиреоидин, префизон, аминолон, тиамин, пиридоксин, цианокобала-мип, кальция пангамат, АТФ, ниамид. Наряду с медикаментозными препаратами большое значение при болезни Дауна придается медико-педагогическим мероприятиям и воспитанию двигательных навыков.
Синдром трисомии 18-й хромосомы (синдром Эдвардса). Симп-томокомплекс, обусловленный избытком генов, локализованных в 18-й хромосоме, описан J. Edwards с соавторами в 1960 г. Частота синдрома составляет 1 : 3000 — 1 : 4500 живорождений.
4( и и dill
/ 2 3 4-5
rll II п u II IIII
, 6-12
в И *4 Н 'е И а«
/9-20 21-22 /V
5
Рис. 55. Ребенок с синдромом Дауна (а) и его кариотип (б)
150
Более 70% всех детей с трисомией Е — девочки. Это, вероятно, связано с лучшей их выживаемостью. Девочки живут в среднем 282 дня после рождения, в то время как мальчики — только 58,5 дня.
Синдром Эдвардса чаще всего обусловлен регулярной трисомией 18-й хромосомы (47,18+), однако встречаются и транслокационные варианты (рис. 56).
Беременность нередко протекает с токсикозом, многоводием. Дети рождаются в асфиксии, несмотря на нормальное течение родового акта. Плацента уменьшена в размерах, с атрофичными дольками и единственной пупочной артерией.
Клиническая картина характеризуется большим полиморфизмом симптомов, хотя ни один из них по существу не является специфичным для трисомии Е. Каждая из аномалий может встречаться и при других хромосомных аберрациях, однако их сочетание придает больному довольно характерный внешний вид, что позволяет диагностировать трисомию Е уже в периоде новорожденности еще до цитологического обследования (Л. О. Бадалян и др., 1972).
Дети рождаются очень слабыми, с низкой массой, плохо сосут, не прибавляют в массе. Череп деформирован, долихоцефаличе-ской формы, небольших размеров, затылок выступающий, прямая линия скошенного лба и носа, гипертелоризм, эпикант, микрофтальмия. Уши низко посажены, асимметричны, недоразвитие завитка и противозавитка ушной раковины, микрогнатия, гипоплазия нижней челюсти, готическое нёбо, крыловидные складки на коже шеи. Типичными являются флексорные контрактуры II и V пальцев кисти: средний и безымянный пальцы согнуты и приведены к ладони, мизинец и указательный накладываются на них сверху. Грудина укорочена, таз узкий, вальгусные стопы, гипоплазия отдельных групп мышц, врожденные вывихи тазобедренных суставов, крипторхизм. Мышечный тонус снижен, безусловные рефлексы угнетены, быстро истощаются. После периода новорожденности прогредиентность в физическом и психическом развитии больных отсутствует.
Прогноз для жизни неблагоприятный, 70% детей погибают в первый месяц жизни.
При патоморфологическом исследовании обнаруживают дефект межжелудочковой перегородки, открытый артериальный проток, диафрагмальную грыжу, меккелев дивертикул, стеноз привратника, гидронефроз, дольчатую почку, агенезию почек, в головном мозге находят микрогирию, олигогирию, недоразвитие мозолистого тела, атрофию нервных клеток мозжечка и красного ядра.
Характерны дерматоглифические изменения: поперечная складка па ладони, увеличение числа дуг на пальцах, отсутствие пальцевых трирадиусов с, b и d, слабо выраженный узор на мизинце, продольная складка стопы.
151
Окончательный диагноз устанавливается после цитологического исследования, когда выявляется наличие целой дополнительной 18-й хромосомы или ее фрагмента на одной из аутосом.
Специфического лечения нет. Проводимая общеукрепляющая и стимулирующая терапия малоэффективна.
Синдром трисомии D1 (синдром Патау). Симптомоком-плекс, обусловленный избытком генов, локализованных в 13-й хромосоме, описан Т. Bartolini в 1875 г. В 1960 г. К. Patau установил его этиологическую связь с хромосомной аберрацией. Синдром встречается с частотой 1 : 3000 —- 4000 новорожденных. Среди больных преобладают девочки.
нт
12 3 4 5
С и И <1 II н н w “
6-Х-/2
D НИН
13-15 г ° f
f » * • J _ **
Рис. 56. Ребенок с синдромом Эдвардса:
а — общий вид, б — сгибательная контрактура пальцев, в — кариотип
152
Рис. 57. Ребенок с синдромом Патау
Патоморфологически определяются множественные пороки развития нервной системы и внутренних органов. Мозг небольших размеров, микрогирия, атрофия мозжечка, может отсутствовать III желудочек, у 50% детей нет обонятельных луковиц и обонятельного тракта, гетеротопия пирамидных клеток; декстра-позиция сердца, дефект межжелудочковой перегородки, открытый артериальный проток; поликистоз почек, гидронефроз; стеноз общего желчного протока, меккелев дивертикул и другие аномалии желудочно-кишечного тракта, двурогая матка.
Дети рождаются недоношенными, с низкой массой и множественными аномалиями (рис. 57). Характерны: микроцефалия, анофтальмия или микрофтальмия, катаракты, врожденная глухота, незаращение мягкого и твердого нёба, колобома радужной оболочки, деформированные низко расположенные уши, флексорная деформация пальцев кисти, пупочные и пахово-мошоночные грыжи, крипторхизм, синдактилия, полидактилия, деформация стоп, аплазия корня носа, отсутствие XII ребра, гемангиомы кожи и др. Длительно сохраняются фетальный и Gowers-2 гемоглобин, снижена концентрация НЬ Аг, отмечается незрелость лейкоцитов. Безусловные рефлексы угнетены. Дети вяло сосут, плохо глотают. Трудности вскармливания усугубляются расщеплением твердого и мягкого нёба. Мышечный тонус снижен. Новорожденный ребенок распластан на поверхности — «поза лягушки». Иногда наблюдаются судороги различного характера (судорога взора, кивки, миоклонические подергивания, тонические судороги). Психомоторное развитие отсутствует. Ребенок не реагирует на исследователя, игрушку, звук.
При дерматоглифическом исследовании выявляются характерные изменения в виде поперечной складки на ладони, дистального осевого трирадиуса, а также дуги у основания большого пальца стопы.
153
Дети погибают в первые месяцы жизни от сердечно-легочной недостаточности или в судорожном статусе.
При цитогенетическом исследовании в большинстве случаев выявляется регулярная трисомия 13-й хромосомы. В то же время встречаются добавочные транслоцированные фрагменты, а также центрические свободные фрагменты 13-й хромосомы.
Синдром следует дифференцировать от врожденных пороков развития нехромосомной этиологии.
Лечение симптоматическое.
Синдром трисомии D2. Симптомокомплекс обусловлен избытком генов, локализованных в 14-й хромосоме. До недавнего времени описывался как вариант синдрома Патау, и лишь с введением в цитогенетику более точных методов идентификации хромосом было установлено их этиологическое различие. Частота синдрома в популяции не определена.
Клинически проявляется краниоцефальной дисплазией, деформацией ушей, высоким узким входом в таз, присутствием рудиментарного XIII ребра, глубокой задержкой психо-моторного развития.
Цитогенетически может быть выявлена либо добавочная 14-я хромосома, либо ее добавочный фрагмент, транслоцированный на одну из аутосом.
Дифференцировать следует от других хромосомных синдромов и пороков развития нехромосомной этиологии. Лечение симптоматическое.
Синдром Лежена (синдром «крик кошки»). Врожденный комплекс пороков развития, обусловленный нехваткой генов, локализованных в коротком плече 5-й хромосомы, описан в 1963 г. J. Lejeune и др. Частота синдрома среди новорожденных не установлена, одинаково часто поражаются мальчики и девочки.
В большинстве случаев нехватка (5р—) возникает вследствие простой делеции хромосомы в гаметах одного из родителей. Реже она обусловлена сбалансированной транслокацией с участием короткого плеча 5-й хромосомы, носителем которого является отец или мать.
Размеры недостающего участка хромосомы в клетках больного могут быть различны, с чем, по-видимому, связана некоторая вариабельность клинических’ проявлений синдрома. Обычно дети рождаются с низкой массой (до 2500 г) даже при доношенной беременности. Наиболее постоянным симптомом, от которого синдром получил свое название, является специфический тембр голоса, напоминающий кошачье мяуканье. Симптом обусловлен особенностями строения гортани, определяемыми ларингоскопи-чески — маленьким вялым надгортанником, имеющим тенденцию опускаться над голосовой щелью, при этом сами голосовые связки не изменены. Описанная особенность строения гортани проявляется рентгенологически уменьшением воздушного пространства над голосовыми связками. С возрастом особенность
154
крика исчезает, но часто остается стридор и склонность к инфекционным заболеваниям верхних дыхательных путей, а также такие симптомы, как круглое луноподобное лицо, косой разрез глаз с опущенными наружными углами, эпикант, гипертелоризм, несколько уплощенный нос, низко расположенные ушные раковины, впереди которых имеются небольшие (размером 1:3 мм) круглые фиброзные узелки. Мозговой череп относительно малых размеров (микроцефалия), долихоцефальной формы, с выступающими лобными буграми. Обычно внешние особенности дополняются маленькой ретрагированной нижней челюстью и короткой шеей с избыточной кожей, формирующей крыловидные складки. В некоторых случаях может быть расщепление губы и (или) твердого нёба либо высокое готическое нёбо и расщепление мягкого нёба. Офтальмологические нарушения проявляются в виде альтернирующего или постоянного косоглазия, астигматизма. Среди аномалий развития внутренних органов наиболее часты пороки развития сердца и сосудов, почек. У мальчиков часто бывает гипоспадия. Общая мышечная гипотония, характерная для новорожденных с синдромом Лежена, обычно сохраняется в течение года и более. Больные отстают в психомоторном и физическом развитии.
Биохимические нарушения при синдроме Лежена неспеци-фичпы: длительное сохранение фетального гемоглобина, некоторое снижение содержания альбумина в сыворотке крови, умеренная аминоацидемия и аминоацидурия.
Дерматоглпфически в большинстве случаев определяется поперечная борозда на обеих ладонях, дистальный трирадиус отсутствует или его ось находится в положении t.
Средняя продолжительность жизни больных снижена. Больные погибают вследствие сердечной или почечной недостаточности, либо от различных интеркурентных инфекционных заболеваний.
* При цитогенетическом исследовании обычно выявляется де-леция короткого плеча 5-й хромосомы (рис. 58). Иногда 5-я хромосома при рутинном исследовании может казаться интактной или ее короткие плечи могут быть даже увеличенными. С помощью методов дифференциальной окраски хромосом в этих случаях обычно удается установить, что в действительности часть короткого плеча 5-й хромосомы представлена фрагментом другой хромосомы, локализованным в необычном месте в результате транслокации. Может быть кольцевая хромосома 5.
Заболевание следует дифференцировать от других врожденных аномалий развития хромосомной и нехромосомной этиологии. Нозологический диагноз подтверждается кариологическим исследованием с применением одного из методов идентификации хромосом группы В (авторадиографии, флюоресцирующих красителей или специфической обработки для получения «бэндинга»).
155
Рис. 58. Ребенок с синдромом Лежена и его кариотип
Профилактика рождения детей с синдромом Лежена основывается на определении кариотипа родителей, у которых был больной ребенок. Наличие сбалансированной транслокации у одного из них или мозаицизма по делеции является абсолютным показанием для антенатального определения кариотипа плода при последующих беременностях путем амниоцентеза и исследования амниотических клеток. Исследование кариотипа плода целесообразно также при отсутствии хромосомных нарушений в лимфоцитах и фибробластах кожи родителей, т. к. возможно клональное распространение хромосомной аберрации в гаметах. Сбалансированная транслокация у одного из родителей требует также исследования кариотипа у его кровных родственников с целью выявления круга лиц, несущих транслокацию.
Синдром Вольфа — Хиршорна. Симптомокомплекс, обусловленный нехваткой дозы генов, локализованных в коротком плече 4-й хромосомы, описан в 1965 г. независимо О. Н. Wolff с соавторами и К. Hirschorn с соавторами. Частота его в популяции не установлена.
Дети обычно рождаются с малой массой при доношенной беременности, отстают в физическом и психическом развитии. Безусловные рефлексы угнетены. Мышечный тонус снижен. Комплекс аномалий включает микроцефалию, гипертелоризм, маленькие низко расположенные уши, широкий уплощенный нос, рас
156
щепление губы и аномалии нёба. Менее постоянно могут быть: асимметрия черепа, сглаженное переносье, дефекты мозгового черепа по средней линии, гемангиомы на бровях, косоглазие, экзофтальм, эпикант, птоз, антимонголоидный разрез глаз, дефекты радужной оболочки, микрогнатия, крипторхизм, гипоспадия, паховые грыжи, клинодактилия, косолапость, избыток кожи на шее, дисплазия тазобедренных суставов, пороки сердца и внутренних органов.
На дерматоглифах выявляют поперечную складку на ладони, дистальный осевой трирадиус, преобладание простых дуг на пальцах, сглаженность дермальных гребешков.
При цитогенетической верификации синдрома выявляется либо простая делеция короткого плеча 4-й хромосомы (4 р—), либо делеция, замаскированная транслоцированным фрагментом (см. синдром Эдвардса), либо кольцевая хромосома 4.
Дифференцировать синдром следует от других хромосомных синдромом и врожденных пороков развития нехромосомной этиологии. Лечение симптоматическое.
Синдром делеции длинного плеча хромосомы D. Симптомоком-плекс, обусловленный нехваткой генов, локализованных в длинном плече D-хромосомы, описан в 1969 г. К. Allderadice и др. Его частота в популяции не установлена.
Клинически проявляется врожденной гипотрофией, задержкой психического и физического развития, микроцефалией, тригоноцефалией, микрогнатией, большими деформированными ушами, гипертелоризмом, выбухающим переносьем, микрофтальмией и птозом. Реже описывают асимметрию лица, выступающие вперед зубы и крыловидные складки на шее, различные дефекты строения глаз и расщепление нёба, аплазию и гипоплазию больших пальцев рук, пороки сердца, неперфорированное анальное отверстие. В ряде случаев у^этих больных развивается ретинобластома.
При цитогенетическом исследовании обычно находят укорочение длинного плеча одной из D-хромосом (Dq) или кольцевую D-хромосому. Следует отметить, что вариабельность клинических проявлений этого синдрома частично связана с тем, что в одних случаях имеет место нехватка генов 13-й хромосомы, в других — 14-й. Принято считать, что, например, ретинобластома развивается только у больных с делецией хромосомы 14-й.
Синдром следует дифференцировать от врожденных пороков развития нехромосомной этиологии и других хромосомных синдромов.
Синдром делеции короткого плеча 18-й хромосомы. Симпто-мокомплекс, обусловленный нехваткой генов, локализованных в коротком плече 18-й хромосомы. Описан в 1963 г. I. De Grouchy и др. Синдром включает задержку психического развития, гипотрофию, низкорослость, эпикант, птоз, оттопыренные уши, седловидный нос, «карпий рот», кариес зубов. Менее постоянно
157
описывают шейные крыловидные складки и расщелину лица, мышечную гипотонию, алопецию, малые аномалии пальцев рук и ног — синдактилию, микромелию. Нарушено предречевое и речевое развитие. Больные могут жить длительно. Среди больных преобладают женщины. Патологоанатомически определяется аринэнцефалия и отсутствие мозолистого тела.
Диагноз верифицируется исследованием кариотипа, которое обычно выявляет простую или замаскированную делецию.
Дифференцировать синдром следует от других хромосомных синдромов и врожденных пороков развития и олигофрении нехромосомной этиологии.
Синдром делеции длинного плеча 18-й хромосомы. Симпто-мокомплекс, обусловленный нехваткой генов, локализованных в длинном плече 18-й хромосомы, описан в 1964 г. I. De Grouchy и др. Частота в популяции не установлена.
Синдром включает задержку психического развития, микроцефалию, низкорослость, снижение слуха, деформацию ушных раковин и наружных слуховых проходов, микрофтальмию, гипертелоризм, колобомы радужной оболочки, нистагм, ретракцию средней части лица, плоское переносье, «карпий рот», высокое или расщепленное нёбо, аномалии стопы и бедер, клинодакти-лию, пороки сердца, почек, половых органов. -
На дерматоглифах определяется поперечная складка на ладонях и высокая частота завитков на пальцах.
Синдром верифицируется кариологическим исследованием, при котором обнаруживают простую или замаскированную фрагментом делецию.
Дифференцировать синдром следует от других хромосомных синдромов и врожденных пороков развития нехромосомной этиологии.
Синдром кольцевой 18-й хромосомы. Симптомокомплекс, обусловленный частичной нехваткой генов, локализованных в тело-мерных участках 18-й хромосомы, описан в 1964 г. I. De Grouchy и др. Частота в популяции не установлена, однако известно, что она не зависит от возраста матерей.
В клиническом плане синдром вариабелен, по-видимому, вследствие различия размеров делеции короткого и длинного пле-чей 18-й хромосомы (см. выше).
Дети рождаются с низкой массой, в дальнейшем резко отстают в физическом и психомоторном развитии. Характерна микроцефалия, описывают гипертелоризм, уплощенный затылок, эпикант, деформацию ушей и глухоту, косолапость, синдактилию, аномалии бедер.
Синдром верифицируют кариологическим исследованием. Его следует дифференцировать от других хромосомных синдромов и врожденных аномалий развития нехромосомной этиологии.
Синдром «кошачьих глаз» (синдром Шмида—Фраккаро). Симптомокомплекс обусловлен избытком гепов, локализованных, по-158
видимому, в 22-й хромосоме. Частота его в популяции не установлена.
Синдром получил название вследствие характерных аномалий глаз в виде антимонголоидного разреза, колобомы радужной и сосудистой оболочек. Другие симптомы: задержка физического и психомоторного развития, гипертелоризм, эпикант, микрофтальм, косоглазие, катаракта, преаурикулярные фистулы, низко расположенные уши, пороки развития мочеполовой и сердечно-сосудистой системы, атрезия анального отверстия.
При кариологическом исследовании, по крайней мере в части клеток, обнаруживают маленькую добавочную хромосому.
Синдром дифференцируют с другими врожденными пороками развития хромосомной и нехромосомной этиологии.
Синдром делеции хромосом группы G. Симптомокомплекс, обусловленный недостатком генов, локализованных в 21-й хромосоме, включает: антимонголоидный разрез глаз, большие оттопыренные уши, большой нос, мышечную гипертонию, выступающий затылок, микрофтальм, широкое переносье, расщепление язычка, пилоростеноз, пороки сердца и других органов, тромбоцитопению. Больные рождаются с низкой массой, выражены гипотрофия и снижение мышечного тонуса, безусловные рефлексы угнетены. Дети отстают в психо-физическом развитии, низкорослы.
Симптомокомплекс, обусловленный недостатком генов, локализованных в 22-й хромосоме, характеризуется отставанием в психическом развитии, эпикантом, двусторонним птозом, синдактилией пальцев ног.
Оба синдрома следует верифицировать кариологическим исследованием и дифференцировать от других врожденных пороков хромосомной и нехромосомной этиологии.
Синдромы дупликации-делеции с частичной трисомией 9-й хромосомы. Группа врожденных пороков развития, возникающих вследствие несбалансированной транслокации между 9-й хромосомой и одной из других аутосом, в результате которой часть генов, локализованных в 9-й хромосоме, имеется в избытке и соответственно имеется недостаток части генов другой хромосомы, участвующей в транслокации. Симптомокомплекс, определяемый такой хромосомной аномалией, может варьировать в зависимости от того, каких генов недостает. Однако прп этом описывают ряд постоянных симптомов как неспецифических, так и детерминируемых, по-видимому, частичной трисомией 9-й хромосомы: глубокую задержку психического развития, дисплазию лица, энофтальм, легкий гипертелоризм, шаровидный нос, аномалии противозавитка ушных раковин, гипоплазию III и IV фаланг пальцев.
На дерматоглифах совершенно отсутствуют или слиты трира-диусы b и с, аномалии пальцевых складок соответствуют гипоплазии фаланг.
159
Синдромы верифицируются кариологически. Кроме этого, необходимо проводить исследование кариотипа родителей с целью выявления носителя сбалансированной транслокации (см. синдром Эдвардса).
Синдром следует дифференцировать от других хромосомных синдромов и врожденных пороков развития нехромосомной этиологии.
Синдромы, обусловленные аномалиями половых хромосом
Эта группа врожденных аномалий развития чрезвычайно трудна для диагностики в раннем возрасте, поскольку их основные клинические проявления связаны с первичной дисгенезией гонад, а все остальные симптомы нерезко выражены, встречаются более или менее часто и не патогномоничны. К этой группе патологии относятся синдромы Шерешевского—Тернера, Клайн-фельтера, синдром трипло-Х, синдром XYY, а также различные типы мозаицизма по половым хромосомам.
Синдром ХО (синдром Шерешевского—Тернера). Синдром ХО обусловлен нехваткой генетического материала, локализованного в Х-хромосоме. Впервые описан Н. А. Шерешевским в 1925 г., а в 1938 г.— 1. Turner. Встречается с частотой 1 : 2500—1 : 3000 новорожденных девочек.
Патоморфологические исследования указывают на недоразвитие половых желез, которые или вовсе отсутствуют, или имеют вид соединительнотканных тяжей с остатками яичниковой ткани и интерстициальных клеток. Нередко обнаруживают пороки развития сердечно-сосудистой системы (коарктацию аорты, стеноз легочной артерии, дефект межжелудочковой перегородки, незаращение боталлова протока), желудочно-кишечного тракта, мочевыделительной системы (кистозная почка, подковообразные почки).
Диагностировать синдром можно уже в период новорожденное™. Дети рождаются с низкой массой и небольшим ростом, умеренная отечность кистей и стоп может наблюдаться в течение нескольких месяцев; низкий рост волос на шее, шея короткая с крыловидными складками, идущими от сосцевидных отростков к плечам, или избыточная подвижность кожи на шее. Из других аномалий развития можно отметить эпикант, сросшиеся брови, птоз, лагофтальм или экзофтальм, гипертелоризм, микрофтальм, колобомы век, широкую плоскую грудную клетку, имитирующую широко расставленные соски, сращение позвонков, клинодактилию, вальгусное искривление стоп, аномалии прикуса, телеангиэктазии кожи и кишечника, остеопороз.
При офтальмологическом исследовании выявляются облаковидные помутнения и снижение чувствительности роговицы, бледность зрительного нерва, сужение артерий на глазном дне, микрофтальм, катаракта.
160
В неврологическом статусе обычно отклонений не наблюдается, за исключением общей мышечной гипотонии. Психическое развитие в раннем возрасте нормальное или темп его несколько замедлен.
При дерматоглифическом исследовании выявляется изменение кожных узоров пальцев и ладоней. Обычно обнаруживают увеличение частоты ульнарных петель на больших и указательных пальцах. Дистальный осевой трирадиус встречается у 50% больных с синдромом Шерешевского—Тернера. Чаще, чем у здоровых, наблюдается поперечная складка ладони и единственная складка на V пальце. Ладонные узоры очень большие дистальные петли или завитки с большим гребневым счетом.
Комплекс указанных симптомов является показанием для исследования соскобов слизистой оболочки полости рта на половой хроматин. Около 80% больных с синдромом Шерешевского— Тернера являются хроматип-негативными, их кариотип 45, ХО. При делециях Xq-, Хр-, а также при кольцевой Х-хромосоме, мозаицизме ХО/ХХ клинические признаки менее выражены, чем при синдроме ХО. В соскобах со слизистой определяются мелкие тельца Барра в меньшем количестве, чем у нормальных девочек.
Диагноз верифицируется исследованием кариотипа лимфоцитов периферической крови.
В раннем возрасте синдром следует дифференцировать от гипотрофии другой этиологии, гипотиреоза, врожденных аномалий развития нехромосомной природы; при выраженной избыточности кожи на шее — от cutis laxa и синдрома Элерса — Данлоса.
Лечение синдрома Шерешевского—Тернера в раннем возрасте симптоматическое. С целью стимуляции психического и моторного развития применяют церебролизин, аминолон, ацефен, префизон, витамины группы В, массаж, лечебную физкультуру.
Синдром XXY (синдром Клайнфельтера). Синдром обуслов-' лен трисомией половых хромосом вследствие наличия добавочной Х-хромосомы. Встречается с частотой 1 :400—500 новорожденных мальчиков. Описан в 1942 г. A. Klinefelter и др.
Патоморфологически характеризуется первичной дисгенезией гонад. При их гистологическом исследовании обнаруживают сужение или облитерацию семенных канальцев, гиалиновый склероз, разрастание клеток Лейдига. Необлитерированные канальцы заполнены дегенеративными сертолиевыми клетками.
Характерным признаком синдрома в раннем детском возрасте является уменьшение размера яичек и изменение их консистенции (более плотные или, наоборот, более мягкие). Уже в период новорожденности обращают на себя внимание особенности телосложения ребенка — непропорционально длинные ноги и руки, узкая грудная клетка. Психическое развитие чаще нормальное. У ряда больных описывают изменения глаз в виде пигментной дегенерации сетчатки и колобомы увеального тракта.
161
Мальчики с синдромом Клайнфельтера хроматин-положитель-ны. На дерматоглифах может быть смещение осевого трирадиуса, увеличение угла atd, увеличение частоты дуг на пальцах, тенденция к уменьшению гребневого счета.
Диагноз верифицируется исследованием кариотипа в лимфоцитах периферической крови, при котором в большинстве случаев выявляется 47 хромосом вследствие добавочной Х-хромосомы. Однако число Х-хромосом может быть и больше 2. У таких больных все симптомы заболевания более выражены, обязательно отмечается задержка психического развития, тем более глубокая, чем больше Х-хромосом в кариотипе, могут быть гигантизм, акромегалия.
В раннем возрасте синдром диагностируют лишь при скри-нирующем исследовании полового хроматина.
Лечение в раннем возрасте проводят лишь в случаях, протекающих с отставанием в психическом развитии. Назначают препараты, стимулирующие функцию центральной нервной системы (аминолон, церебролизин, витамины группы В), проводят логопедические и педагогические занятия, целенаправленно формирующие высшие корковые функции.
Синдром XYY. Кариотип 47, XYY встречается среди новорожденных мальчиков с частотой 1 : 250—500 и чаще всего не сопровождается патологическим фенотипом. В раннем возрасте особенностей развития не обнаруживают. Может быть случайной кариологической находкой.
Синдром полисомип X. Чаще всего встречается в виде трисомии X (47, XXX) и может не сопровождаться патологическим фенотипом. При числе Х-хромосом больше 3 характерны задержка психического развития и дисгенезация гонад тем более выраженные, чем больше добавочных Х-хромосом.
Глава IV. ПОРОКИ РАЗВИТИЯ
НЕРВНОЙ СИСТЕМЫ
Мозг человека развивается из эмбриональной эктодермы. К концу 3-й недели внутриутробного периода на ней образуется утолщение, из которого формируется длинная полая трубка, лежащая непосредственно под поверхностью эктодермы. На 4-й неделе беременности нервная трубка замыкается и по окончании формирования расширяется на переднем конце, то есть в месте образования будущего головного мозга. Более тонкая каудальная часть ее преобразуется в спинной мозг.
Головной мозг приобретает начальные контуры на 28-й день беременности. Шарообразное выпячивание на переднем конце нервной трубки спустя несколько дней разделяется поперечной бороздой на две части, которые, развиваясь, образуют мозговые гемисферы и желудочки. Дифференциация нейробластов и их миграция в дальнейшем приводят к формированию коры головного мозга. Первые признаки образования мозолистого тела отмечаются на 3-м месяце беременности. Его формирование закан-
чивается к 5-му месяцу внутриутробной жизни. К этому времени на поверхности мозговой коры формируются борозды и извилины, число нервных клеток такое же, как у взрослых (рис. 59). Дальнейшее увеличение массы мозга происходит за счет миелинизации проводящих путей и субкортикального белого вещества.
Интенсивное формирование нервной системы, синхронность развития ее отдельных элементов на ранней стадии эмбриогенеза могут легко нарушаться при воздействии на плод различных неблагоприятных факторов. Основное значение в нарушениях эмбрионального развития придается не столько природе неблагоприятного фактора, сколько временному совпадению его воздействия с периодами интенсивного формиро-
Рис. 59. Формирование борозд головного мозга в онтогенезе:
а — плод 7 мес; б — плод 8 мес; в — новорожденный; г — ребенок 3 лет
163
вания нервной системы плода, так называемыми критическими периодами.
Вирусные заболевания матери, недостаточность маточно-плацентарного кровообращения, прием лекарственных препаратов, ионизирующая радиация, вибрация и другие факторы, действующие в первом триместре беременности, приводят к грубым порокам развития — дефектам смыкания нервной трубки, нарушению роста и дифференциации мозговых гемисфер и желудочковой системы мозга.
Патологические воздействия на поздних стадиях беременности и в перинатальный период, как правило, не вызывают грубых структурных изменений, а приводят к задержке роста мозга в результате нарушения миелинизации, уменьшению роста дендритов и т. д. Общая частота пороков развития составляет от 7,4 до 42 на 1000 родившихся, на долю пороков нервной системы приходится 26—28% (Е. Б. Красовский, 1964; J. Warkany, 1973; A. Rubin, 1976; J. Notake, S. Suzuki, 1977).
Дефекты смыкания нервной трубки
Черепномозговые грыжи. Это сочетанный порок развития головного мозга и черепа вследствие дефекта закрытия переднего конца нервной трубки, проявляющийся выпячиванием в отверстие в черепе вещества мозга и его оболочек (энцефаломенингоцеле). Грыжевое выпячивание может быть образовано только оболочками мозга (менингоцеле).
Черепномозговые грыжи локализуются чаще по средней линии в области смыкания черепных швов. Дефекты имеют различные размеры. Грыжевое выпячивание покрыто кожей, нередко синюшно-багрового цвета или гиперпигментировано. Кожные покровы могут изъязвляться, что сопровождается ликвореей и вторичным инфицированием. В 84% случаев черепномозговые грыжи локализуются в назофронтальной области и обусловлены дефектом развития решетчатой кости. При черепномозговых грыжах, содержащих вещество мозга, наблюдаются неврологические нарушения. При затылочной грыже может быть расстройство жизненно важных функций: сосания, глотания, дыхания. После периода новорожденности отмечаются задержка развития двигательных и психических функций, расстройства координации, обусловленные нарушением формирования различных структур мозга.
При локализации дефекта в области решетчатой кисти грыжи могут располагаться интраназально. В этих случаях в клинической картине заболевания преобладают дыхательные расстройства вследствие отсутствия носового дыхания.
Диагноз черепномозговой грыжи ставится на основании внешнего осмотра ребенка и рентгенологического исследования черепа. Характер содержимого грыжевого выпячивания уточняется 164
Рис. 60. Открытые спинномозговые грыжи различной локализации
с помощью пункции, трансиллюминации; при необходимости проводят контрастные рентгенологические исследования.
Лечение черепномозговых грыж хирургическое. Прогноз определяется протяженностью дефекта и характером грыжевого выпячивания. Прогноз при изолированном выпячивании оболочек (менингоцеле) благоприятный.
Спинномозговые грыжи. Это сочетанный порок развития спинного мозга и позвоночника вследствие дефекта закрытия нервной трубки, проявляющийся грыжевым выпячиванием спинного мозга и его оболочек (миеломенингоцеле) в дефект позвоночного канала. Грыжевое выпячивание может быть образовано только оболочками спинного мозга (менингоцеле). Незаращение спинального канала без грыжевого выпячивания носит название spina bifida occulta. Спинномозговые грыжи встречаются с частотой 1 : 1000 новорожденных. Наиболее часто они локализуются в поясничном отделе позвоночника (60%), в очень редких случаях— в шейном отделе позвоночника (7,5%) (рис. 60).
Грыжевое выпячивание выглядит обычно как пигментированное или синюшной окраски, округлое или продолговатой формы образование в области позвоночника. Кожа над грыжевым выпячиванием истончена, блестящая, нередко мацерирована. Ее изъязвление может приводить к истечению ликвора. При локализации грыжи в области пояснично-крестцового отдела позвоночника и вовлечении в грыжевое выпячивание вещества спинного мозга наблюдаются грубые неврологические нарушения. Характерны вялый парапарез или параплегия ног с выраженными атрофиями мышц и трофическими расстройствами — Цианозом, снижением кожной температуры, отечностью, изъязвлением. Параплегия может сопровождаться сгибательными контрактурами в коленных и тазобедренных суставах, деформацией стоп и их недоразвитием. Истинное недержание мочи и кала отмечается у 80% детей со спинномозговыми грыжами и часто является причиной уросепспса. Ликворея из грыжевого мешка может осложняться гнойным менингитом, носящим подострый
165
пли хронический характер. Спинномозговые грыжи нередко сочетаются с пороками ликворных путей. В этих случаях развивается гидроцефалия. Неврологическая симптоматика отсутствует или минимальна, если в грыжевое выпячивание вовлекаются только оболочки спинного мозга.
Рис. 61. Закрытое расщепление но- Диагноз спинномозговой звонков в сочетании с мпелодпспла- грыжи ставится при рождении, злей и дермальным синусом Характер содержимого грыже-
вого выпячивания уточняется с помощью трансиллюминации, контрастной и радиоизотопной миелографии, характер и распространенность дефекта позвоночника — при рентгенологическом исследовании.
Лечение спинномозговых грыж оперативное. Показанием к нему является сохранность функций спинного мозга и нормальное психическое развитие ребенка. При подтекании ликвора операция показана в первые недели жизни. В случаях невозможности хирургического вмешательства (менингомиелоцеле) проводят консервативную терапию, направленную на улучшение трофики паретичных конечностей, профилактику и предотвращение восходящей гнойной инфекции.
Закрытое расщепление позвонков. Это такой порок развития позвоночника, при котором наблюдается несмыкание дужек позвонков пли реже дефект тел позвонков. Патология обычно локализуется на уровне V поясничного или I крестцового позвонка, но может быть и в любом другом месте.
Расщепление дужек позвонков может клинически не проявляться, оно случайно определяется при рентгенологическом исследовании. Аномалию обнаруживают у 20% больных при рентгенологическом исследовании позвоночника. В месте расщепления позвонков на коже иногда наблюдаются рост волос, липомы, гемангиомы.
Возможно сочетание закрытого расщепления позвонков с миелодисплазией и дермальным синусом (рис. 61). В этих случаях отмечаются односторонние или двусторонние атрофии мышц ног, деформации стоп, слабость сфинктеров мочевого пузыря, нарушения чувствительности в области промежности, выпадение ахиллова рефлекса.
Диагноз ставится на основании рентгенологического исследования позвоночника. Дифференциальный диагноз проводят с полиомиелитом, гематомпелпей, опухолями спинного мозга, костной деформацией стоп.
Закрытое расщепление дужек позвонков при отсутствии неврологических нарушений не требует специальной терапии.
166
Диастематомиелия. Это врожденный порок развития, при котором спинной мозг разделен на две части маленькой костно-хрящевой или фиброзной пластинкой. Обычно при жизни больного такое нарушение диагностируется редко, оно является находкой при операции или секции. Диастематомиелия часто сочетается со спинномозговыми грыжами, расщеплением тел позвонков.
Фиброзные связки пересекают спинной мозг обычно в нижнегрудной или в поясничной области и фиксируют его к позвоночнику. Это в дальнейшем препятствует нормальному росту спинного мозга, чем и обусловлены клинические симптомы.
Клиника диастематомиелии проявляется, когда ребенок начинает ходить или позднее. Характерно прогредиентное нарастание спинальной симптоматики, которая обусловлена нарушением роста и развития спинного мозга. Объем движений позвоночника ограничен, затруднено его сгибание, нарастают слабость в ногах, тазовые и трофические расстройства.
Диагноз ставится с помощью рентгенографии позвоночника: обнаруживается костный выступ (шпоры) по средней линии. Перегородки хрящевого или фиброзного происхождения могут быть выявлены с помощью контрастной или радиоизотопной миелографии.
Лечение — хирургическое: рассекается фиброзный дефект или удаляется аномальный костный выступ. Раннее хирургическое вмешательство определяет хороший прогноз при этом виде порока.
Нейроэнтеральные кисты. Порок представляет собой множественные кисты, выступающие в спинномозговой канал. Они развиваются из эктодермальной ткани при нарушении эмбрионального развития на ранних этапах. Кисты и сопровождающие их тканевые тяжи наиболее часто локализуются в грудном или нижнешейном отделах спинного мозга. В зависимости от распространенности патологического процесса неврологические симптомы могут появляться с рождения или нарастать по мере компрессии спинного мозга, напоминая по клинике опухоль.
Диагноз уточняется с помощью рентгеноконтрастного исследования. Изолированные кисты подлежат хирургическому удалению.
Дермальный синус. Это малый дефект закрытия спинального канала по средней линии. Обычно он располагается в люмбосакральной области, но может быть в любом месте спины. На коже он выглядит в виде точки, часто окруженной волосами или гемангиомой, и может быть входными воротами для проникновения инфекции в субарахноидальное пространство. Лечение — хирургическое.
Пороки развития полушарий головного мозга
Микроцефалия. Это нарушение роста мозга, при котором окружность черепа более чем на 3 стандартных отклонения меньше нормы.
Нарушение развития мозга может быть генетически обусловлено, как это наблюдается при генуинной микроцефалии, наследующейся аутосомно-рецессивно, синдромах, развивающихся в результате нарушения числа и структуры хромосом (болезнь Дауна, синдром Эдвардса и др.), при наследственных болезнях обмена веществ, синдроме Корнелии Де Ланге, синдромах Лемли — Опица, Рубинстайна — Тейби и др. Истинная (аутосомнорецессивная) микроцефалия составляет 7—34% от всех форм микроцефалий, и частота ее в популяции колеблется от 1 : 25 000 до 1 :50 000. Среди умственно отсталых детей микроцефалия диагностируется в 20% случаев. В возникновении микроцефалии имеют значение также и другие факторы: инфекционные заболевания матери (грипп, токсоплазмоз, краснуха), интоксикации (алкоголизм, профессиональные вредности), нарушение витаминного баланса. Причиной микроцефалии может быть гипоксия плода и новорожденного любого генеза.
При патоморфологическом исследовании выявляется уменьшение массы мозга более чем на 25% от нормы. Полушария головного мозга недоразвиты, особенно лобные отделы. Возможны микрогирия, макрогирия, лизэнцефалия, агенезия мозолистого тела, аплазия ядер черепномозговых нервов и проводящих путей, порэнцефалия, расширение желудочков и субарахноидальных пространств. Кора головного мозга при микроцефалии бедна нервными клетками, они не дифференцированы, наблюдаются гетеротопия серого вещества, глиоз, недоразвитие сосудистой системы, нарушение миелинизации нервных волокон.
Характерен внешний вид ребенка (рис. 62). Выражена диспропорция мозгового и лицевого черепа. Мозговая часть черепа недоразвита. Лоб узкий, покатый, надбровные дуги выступающие, большие оттопыренные уши. Неврологические симптомы вариабельны: мышечная дистония, спастические парезы, нарушение координации движений, косоглазие, судороги, задержка развития статических и локомоторных навыков.
Основным в клинической картине является задержка психического развития, степень которой колеблется от легкой дебильности (когда возможно обучение во вспомогательной школе) до тяжелой идиотии с двигательной расторможенностью, грубым нарушением концентрации внимания.
Истинную наследственную микроцефалию следует отличать от микроцефалии как симптома хромосомных аберраций и ранних постнатальных повреждений мозга — обменных, травматических, инфекционных и др. (рис. 63). Дифференциальная 168
диагностика основана на данных рентгенологического, биохимического, цитогенетического и других видов исследования.
Для дифференциальной диагностики микроцефалии и ми-крокрании (конституционально обусловленное уменьшение размеров головы) используют антропометрические сопоставления, учитывают особенности психомоторного развития. При микрокрании интеллект сохранен, а уменьшение всех размеров головы пропорционально.
Правильный диагноз важен для медико-генетического консультирования.
Лечение — симптоматическое. Показаны препараты, улучшающие обмен веществ в мозговой ткани. По показаниям применяются седативная, анти-конвульсивная, дегидратацион-ная терапия, массаж, лечебная гимнастика, педагогические и воспитательные мероприятия. Дети, у которых после рождения размеры головы меньше нормы и есть тенденция к развитию диспропорции головы и туловища, подлежат диспансерному наблюдению с обязатель
Рис. 62. Здоровый ребенок и больной с истинной первичной микроцефалией одного возраста
Рис. 63. Вторичная микроцефалия при детском церебральном параличе
ным ежемесячным измерением окружности головы, груди, роста. Профилактика включает медико-генетическое консультирование, внутриутробную диагностику микроцефалии, антенатальную охрану плода.
Лизэнцефалия. Это нарушение миграции нейронов коры, в результате которого не развиваются мозговые извилины. Поверхность мозговых гемисфер гладкая. Микроскопически выявляется отсутствие нормальных слоев коры и скопление групп нейронов в субкортикальном белом веществе.
Клинически лизэнцефалия проявляется с рождения или па первом году жизни задержкой психомоторного развития, полиморфными судорогами, спастическими параличами и парезами.
Дифференциальный диагноз проводят с заболеваниями обмена веществ, глиозами мозга, другими пороками развития
169
Рис. 64. Гидранэнцефалия с черепномозговой грыжей:
а — внешний вид ребенка, б — трансиллюминация черепа
нервной системы. Уточнение характера патологии возможно только при морфологическом исследовании.
Полимикрогирия. Это дефект миграции нейронов, нарушающий правильное формирование коры головного мозга. Извилины мелкие, недоразвиты, число их увеличено. Такая патология часто наблюдается при цитомегаловирусной инфекции.
Клинические проявления сходны с лизэнцефалией. Диагноз ставится на аутопсии.
Порэнцефалия. Это дефект, развивающийся в результате кистозного перерождения бокового желудочка и распространяющийся на пиа-арахноидаль-ную мембрану. Патоморфологически порэнцефалия представляет собой кисты, чаще односторонние. Наполнение кист со
провождается смещением вещества мозга, что может вторично вызвать повреждение мозговой ткани. Клинические симптомы зависят от локализации и распространенности кист. Это могут быть локальные судороги, геми
парез, гемигипоплазия, задержка психомоторного развития.
Диагноз ставится на основании трансиллюминации, рентгенографии черепа и рентгеноконтрастных методов исследования желудочковой системы. На стороне порэнцефалии наблюдаются расширение ореола свечения, истончение костей черепа.
Заболевание дифференцируют с опухолью мозга, хронической субдуральной гематомой.
Гидранэнцефалия. Это врожденное отсутствие мозговых гемисфер (рис. 64). Мозг замещен большой, наполненной жидкостью полостью. Мозговой ствол и базальные ганглии хорошо сформированы. Имеются рудименты лобных и затылочных отделов коры. Врожденные рефлекторные реакции у таких новорожденных сохранены. Часто наблюдаются судороги. С 2—3 мес выявляется грубый моторный и психический дефект.
При транспллюмипацпп черепа у грудных детей определяется расширенная зона свечения в области мозговых гемисфер. При пневмоэнцефалографии выявляется значительное расширение желудочков мозга, которые иногда занимают практически всю полость черепа. Ангиография указывает на отсутствие мозговых сосудов в области полушарий.
170
Дифференциальный диагноз проводят с врожденной гидроцефалией и двусторонней церебральной гематомой.
Голопрозэнцефалия. Этот дефект развития мозга образуется на стадии разделения мозговых гемисфер. Мозг не разделен на полушария, а мозговые желудочки представлены одной полостью. Патология обычно сочетается с отсутствием обонятельных луковиц и обонятельного тракта, расщеплением губы, микрофтальмией или циклопией. Голопрозэнцефалия может быть проявлением трисомии 13-й хромосомы. Дети обычно умирают в первые месяцы жизни.
Агенезия мозолистого тела. Это дефект развития волокон, соединяющих мозговые гемисферы. В некоторых случаях он может наследоваться как аутосомно-рецессивный признак. Выделяют два клинических синдрома агенезии мозолистого тела. При одном двигательное и психическое развитие нормальное. Нарушение проявляется, например, тем, что больной ребенок правильно не может назвать, предмет, вложенный ему в левую руку, так как нарушена связь правой чувствительной зоны коры с речевыми отделами левой гемисферы.
При другом, более частом варианте агенезия мозолистого тела сочетается с дефектами развития мозга, включающими нарушения миграции нейронов и гидроцефалию. В таком случае у детей наблюдаются тяжелые судорожные припадки, увеличение размеров головы, часто гипертелоризм.
Диагноз ставится с помощью пневмоэнцефалографии.
Мегалэнцефалия. Это дефект развития мозга в виде диспропорционального увеличения глиальных элементов по сравнению с нейронами. Такого рода диспропорция сопровождается увеличением массы и объема мозга и окружности головы без признаков повышения внутричерепного давления. Основные неврологические симптомы: судороги и задержка психического развития. Помимо истинного глиоза, феномен мегалэнцефалии может быть следствием различных нарушений обмена, таких, как болезнь Тея—Сакса, метахроматическая лейкодистрофия, мукополисахаридозы и др.
Заболевание дифференцируют с гидроцефалией, спонгиозны-ми дегенерациями мозга, а также с конституциональной макроцефалией.
Гидроцефалия. Это избыточное скопление спинномозговой жидкости в полости черепа, сопровождающееся расширением желудочков мозга. Гидроцефалия может быть обусловлена врожденным пороком развития ликворной системы, воспалительными изменениями, объемным процессом в головном мозге.
В большинстве случаев гидроцефалия является следствием нарушения циркуляции и абсорбции ликвора. Реже она обусловлена гиперпродукцией жидкости, что имеет место обычно при папилломе хориоидального сплетения или опухолях, активно секретирующих спинномозговую жидкость.
171
По характеру нарушения ликвороциркуляции различают окклюзионную и сообщающуюся гидроцефалию.
При окклюзионной (обструктивной) гидроцефалии нарушается циркуляция ликвора внутри желудочковой системы, в результате чего жидкость из желудочков не поступает в субарахноидальное пространство. Расширение желудочковой системы всегда бывает проксимальнее места окклюзии.
При сообщающейся (коммуникационной) гидроцефалии пути циркуляции жидкости внутри желудочковой системы открыты и она может свободно попадать в субарахноидальное пространство. Нарушение абсорбции ликвора является следствием либо окклюзии субарахноидальной цистерны, либо облитерации субарахноидального пространства на конвекситальной поверхности мозга. Ниже приводятся основные причины окклюзионной и коммуникационной гидроцефалии.
Окклюзионная (обструктивная) гидроцефалия
Стеноз сильвиева водопровода (врожденный, приобретенный постинфекционный)
Срединные опухоли мозга
Порок развития вены Галена
Субдуральная гематома задней черепной ямки
Деформация Денди—Уолкера
Куммуникационная (сообщающаяся) гидроцефалия
Синдром Арнольда—Киари, инфекции (менингиты, токсоплазмоз, цитомегалия)
Субарахноидальное кровоизлияние
Папиллома хориоидального сплетения
Болезни соединительной ткани, синдром Гурлер, ахондроплазия
Отравление витамином А
Наиболее частой причиной окклюзионной гидроцефалии является врожденный стеноз сильвйева водопровода. Последний сужен или замещен многими мелкими, слепо оканчивающимися каналами. В ряде случаев этот порок развития наследуется рецессивно сцепленно с Х-хромосомой. Стеноз в области сильвиева водопровода может быть также следствием воспалительного процесса.
При врожденной аневризме вены Галена и субдуральной гематоме задней черепной ямки гидроцефалия связана со сдавлением нижней части мозгового ствола и обструкцией сильвиева водопровода. При синдроме Денди—Уолкера, характеризующемся дефектом срединных структур мозжечка, гидроцефалия возникает в результате атрезии отверстий Люшка или Мажанди. Развитие окклюзионной гидроцефалии в постнатальный период чаще всего является следствием опухоли мозга, сдавливающей или прорастающей в желудочковую систему.
Сообщающаяся гидроцефалия наблюдается при синдроме Арнольда—Киари, при котором происходит окклюзия субарахноидального пространства вокруг ствола мозга из-за смещения ствола мозга и мозжечка вниз. Сообщающаяся гидроцефалия
172
Рис. 65. Ребенок с врожденной гидроцефалией
может быть также следствием бактериального менингита, токсоплазмоза, цитомегалии и субарахноидального кровоизлияния. В этих случаях наблюдается окклюзия субарахноидального пространства фиброзной тканью.
Частота врожденной гидроцефалии, по данным различных авторов, составляет от 0,2 до 4 на 1000 новорожденных. Стеноз сильвиева водопровода является причиной 30% всех случаев врожденной гидроцефалии.
Патоморфология. При исследовании мозга обнаруживают расширение полостей желудочков, истончение вещества мозга, атрофию сосудистых сплетений, фиброз арахноидальной оболочки, эпендиматит, сращение мозговых оболочек. Степень изменения вещества мозга зависит от степени выраженности гидроцефалии. В тяжелых случаях полушария мозга превращаются в тонкостенные мешки, заполненные жидкостью, количество которой достигает 1—2 л. Извилины мозга уплощены, борозды сглажены. Иногда наблюдается атрофия подкорковых образований. Резко выражены изменения в сосудистой системе мозга: сосуды уменьшены в размерах, деформированы, их стенки истончены, иногда наблюдаются тромбозы вен и синусов мозга вследствие нарушения оттока венозной крови. Кости черепа резко истончены, основание черепа уплощено.
К л и н и к а (рис. 65). Постоянным признаком врожденной гидроцефалии является прогрессирующее увеличение размеров головы. Чрезмерный рост головы может наблюдаться уже во внутриутробный период, и это является фактором, препятствующим нормальному течению родов. В других случаях голова имеет нормальные размеры при рождении, по в дальнейшем теми ее роста чрезвычайно высок. Особенно больших размеров голова достигает при окклюзии сильвиева водопровода. Череп увеличивается во всех направлениях, но преимущественно выступает лобная область. Лицевой череп кажется уменьшенным. Наиболее
173
частая форма черепа при гидроцефалии — брахицефалическая. Иногда череп асимметричен, что обусловлено скоплением жидкости в определенных участках желудочковой системы. Преимущественное выбухание затылочной области наблюдается при синдроме Денди—Уолкера, когда жидкость скапливается в IV желудочке. Роднички увеличены в размерах. Можно пропаль-пировать разошедшиеся швы. При перкуссии определяется феномен «треснувшего горшка». Вены свода черепа расширены, кожа истончена, блестящая. Глазные яблоки повернуты вниз — симптом «заходящего солнца». Могут быть сходящееся косоглазие, нистагм, парез лицевого нерва по центральному типу. Следствием давления ликвора на зрительный нерв и хиазму является атрофия зрительного нерва и снижение зрения. При прогрессировании гидроцефалии развиваются спастические парезы, параличи, отмечается резкое повышение мышечного тонуса, иногда до степени децеребрационной ригидности. В этих случаях ярко выражены тонические шейные и лабиринтные рефлексы. Могут наблюдаться нарушения координации и статических функций вследствие сдавления мозжечка и мозжечковых путей. При гидроцефалии страдают вегетативные функции: расстраивается терморегуляция, повышена потливость, выражен акроцианоз, а также имеет место нарушение различных видов обмена, проявляющееся ожирением или кахексией, полидипсией, булимией или анорексией. Эти изменения обусловлены дисфункцией межуточного мозга.
При врожденной гидроцефалии статические и локомоторные функции развиваются с задержкой. Дети позже начинают держать голову, поворачиваться, садиться, стоять, ходить. В тяжелых случаях эти навыки не развиваются. Отмечается своеобразная задержка психического развития с нарушением деятельности, иногда поведения, при удовлетворительном речевом развитии. Врожденная гидроцефалия часто сочетается с множественными стигмами и аномалиями развития лицевого скелета, спинномозговыми грыжами.
Диагноз. При спинномозговой пункции выявляется повышение давления ликвора до 200—300 мм вод. ст. Однако при стабильной гидроцефалии оно может быть нормальным или сниженным. Клеточный состав ликвора не изменяется, за исключением тех случаев, когда причиной гидроцефалии является воспалительный процесс. Содержание белка в норме или снижено.
При трансиллюмипацип черепа выявляются зоны повышенного свечения. В настоящее время для диагностики различных форм гидроцефалии применяют компьютерную томографию.
Дифференциальный диагноз. Увеличение черепа, не связанное с гидроцефалией, наблюдается при мегалэнцефа-лии. Расширение желудочковой системы мозга может быть при атрофиях коры головного мозга вследствие дегенеративных или метаболических нарушений, но в этих случаях размеры головы 174
нормальны или слегка уменьшены. Гидроцефалию следует дифференцировать от опухолей мозга. Люмбальная пункция, эхоэн-цефалография, нейрорентгенологические методы исследования помогают постановке диагноза.
Лечение. При выборе метода необходимо учитывать причины, вызвавшие заболевание. В том случае, если гидроцефалия возникла в результате перенесенного менингита или менингоэнцефалита, необходимо провести противовоспалительную терапию антибиотиками. При наличии субарахноидального кровоизлияния с явлениями реактивного менингита, когда цитоз носит преимущественно нейтрофильный характер, также следует в острый период применить антибиотики. С целью нормализации ликвородинамических нарушений назначают дегидратирующие средства, рассасывающую терапию. Наиболее эффективным препаратом для длительной дегидратационной терапии является диакарб, подавляющий активность угольной ангидразы и тормозящий секрецию спинномозговой жидкости. Препарат обладает выраженным мочегонным действием. Его назначают из расчета 70—80 мг/кг массы тела в сутки в сочетании с противовоспалительной, десенсибилизирующей и общеукрепляющей терапией. С целью профилактики тканевого ацидоза применяют вместе с натрия бикарбонатом или натрия лактатом.
Диакарб нецелесообразно использовать при острой внутричерепной гипертензии, обусловленной опухолями мозга, так как в этих случаях он усиливает имеющийся метаболический ацидоз. Диакарб можно чередовать с инъекциями 25% раствора магния сульфата по 0,2 мл на 1 кг массы. Его назначают через день или ежедневно, на курс— 10—12 инъекций.
В качестве рассасывающей терапии применяют лидазу, алоэ, пирогенал; при задержке психомоторного развития — препараты, стимулирующие обмен веществ в нервной системе, лечебную гимнастику, массаж.
При отсутствии эффекта от консервативной терапии рекомендуется хирургическое лечение, целью которого является устранение обструкции и создание дополнительного оттока для ликвора (Б. П. Симерницкий, 1974; В. Р. Пурин, Т. П. Жукова, 1976; В. И. Ростоцкая, В. И. Комаров, 1977).
Течение и прогноз. Врожденная гидроцефалия имеет неуклонно прогрессирующее течение, приводящее к летальному исходу, либо спустя некоторое время компенсируется. Однако воздействие таких неблагоприятных факторов, как травмы, инфекции, интоксикации, может приводить к срыву компенсации и обострению процесса. В нелеченных случаях 50—60% детей с врожденной гидроцефалией умирают. Если процесс удается приостановить, у 40% детей интеллект нормальный или близкий к норме, в 60% случаев имеют место двигательные и психические нарушения. Прогноз в случаях сочетания заболевания со спинномозговыми грыжами плохой.
175
Врожденная аплазия ядер черепномозговых нервов (синдром Мебиуса)
В основе заболевания лежит врожденное недоразвитие ядер лицевого нерва. Многие случаи синдрома Мебиуса спорадические, но имеются описания семей с аутосомно-доминантным и аутосомно-рецессивным наследованием.
Синдром описан Мебиусом в 1888 г. Аплазия может распространяться и на ядра V, VI, IX, XII пар черепномозговых нервов. Паралич лицевого нерва иногда сопровождается врожденной глухотой. Поражение чаще двустороннее.
С рождения лицо ребенка маскообразное, с открытым ртом и неплотно закрывающимися глазами; глазные яблоки не отводятся в стороны. Кожа натянутая, гладкая, без морщин даже при плаче. Она не смещается по отношению к подкожной клетчатке. Углы рта опущены. У этих детей могут быть и другие аномалии развития: гипертелоризм, макрогнатия, деформация ушных раковин, нёба, дефекты мышц лица, груди. Иногда наблюдаются аномалии конечностей: косолапость, синдактилия, брахидактилия, добавочные пальцы. Интеллект снижен примерно у 10% больных, степень его снижения варьирует.
Дифференциальный диагноз следует проводить с бульбарным параличом, а при одностороннем поражении — с травматическим поражением лицевого нерва в родах.
Течение благоприятное. Прогноз для жизни хороший. Консервативное лечение малоэффективно, но с возрастом степень выраженности патологии несколько уменьшается.
Профилактика пороков развития нервной системы, как и других пороков развития, складывается из общегигиенических мероприятий по охране окружающей среды, труда на производствах, связанных с воздействием на организм химических и физических факторов, охране беременности, медико-генетического консультирования, а также ранней антенатальной диагностики с помощью таких современных методов исследования, как рентгеноскопия и рентгенография плода, сонография, определение альфа-фотопротеина в амниотической жидкости.
Глава V. АСФИКСИЯ.
РОДОВАЯ ТРАВМА
Гипоксия плода и асфиксия новорожденного
Асфиксия новорожденного — кислородная недостаточность в родах, сопровождающаяся комплексом клинических и биохимических нарушений. Для обозначения состояния кислородной недостаточности плода применяются термины «внутриутробная гипоксия» или «гипоксия плода». В большинстве случаев внутриутробная гипоксия сочетается с асфиксией новорожденною. В структуре перинатальной смертности асфиксия составляет 40% (Е. И. Андреева, 1974).
Этиология. Гипоксия плода возникает при осложненном течении беременности (инфекционные, эндокринные и соматические заболевания матери, токсикозы беременности, иммунологическая несовместимость крови матери и плода, перенашивание, инфицирование плода и др.). Причинами развития асфиксии при рождении являются нарушения маточно-плацентарного кровообращения, обусловленные патологией пуповины, плаценты; несоответствие размеров головки плода и таза матери, внутричерепные кровоизлияния и др. Хроническая гипоксия плода нарушает его компенсаторные механизмы, замедляет и извращает процессы физиологического созревания нервной системы. В связи с этим присоединившаяся в родах асфиксия может вызвать грубые необратимые изменения в центральной нервной системе. Наряду с внутриутробной гипоксией могут быть и другие причины, предрасполагающие к возникновению асфиксии новорожденных — пороки развития центральной нервной системы, сердца, легких, болезнь гиалиновых мембран.
Таким образом, асфиксия — это полиэтиологический клинический синдром, возникающий у новорожденных вследствие действия различных вредных факторов. Асфиксия является одной из частых причин перинатальной смертности. Частота асфиксии в популяции новорожденных составляет 5—6% (Л- С. Персианинов, 1967; Г. М. Савельева, 1973; F. Cockburn, С. Drillien, 1974; J. Brown, 1976).
Патогенез. Различают четыре типа кислородной недостаточности плода. Гипоксическая гипоксия возникает при недостаточном насыщении крови плода кислородом, при легочных процессах у матери, истинных узлах пуповины, выпадении или прижатии ее к костям таза, дегенеративных процессах в плаценте, перенашивании беременности, поздних токсикозах, сахарном диабете у матери, преждевременном отхождении околоплодных вод.
. Гемическая гипоксия развивается у плода в результате резус-конфликта, анемии у матери. Причиной гипоксии в этих случаях
7 из
177
является снижение концентрации кислорода, доставляемого тканям, вследствие уменьшения количества гемоглобина в крови. При гемолитической болезни плода поступающий в кровь непрямой билирубин, кроме того, является блокатором тканевого дыхания.
Циркуляторная гипоксия обусловлена снижением скорости циркуляции крови. Кровь в достаточной мере насыщена кислородом, но ткани все же страдают от гипоксии в результате замедленного кровотока. Циркуляторная гипоксия наблюдается при длительном стоянии головки плода в родовых путях, брадикардии.
Тканевая гипоксия связана с тем, что клетки не могут использовать кислород вследствие нарушения функции ферментных систем, катализирующих окислительные процессы в тканях. Этот тип гипоксии наблюдается при токсикозах беременности в сочетании с другими заболеваниями (поражение почек, сердца), отравлении матери сильными ядами, непрямой билирубинемии.
В клинической практике чаще встречается сочетание различных видов гипоксии.
В результате кислородной недостаточности в организме плода и новорожденного происходит накопление кислых продуктов обмена, нарушается электролитный баланс, развивается гипогликемия, снижается активность ферментов аэробного и анаэробного дыхания.
Кислородная недостаточность и усиливающийся метаболический ацидоз вызывают специфические сосудистые нарушения: расширение сосудов, переполнение их кровью, венозный застой. Под влиянием ацидоза увеличивается проницаемость сосудистых стенок, развиваются отек и набухание мозга, нарушается мозговое кровообращение. Сосуды мозга расширены, общее количество крови в них увеличено. Вены сетчатки также расширены, развивается отек соска зрительного нерва. В таких условиях часто наступает разрыв сосудов, особенно при высоком венозном давлении. В результате снижения симпатического тонуса сосудов, их тромбоза, кровопотери или нарушения сердечной деятельности возникает ишемия мозга. При ишемии накапливаются недоокис-ленные продукты обмена, которые не могут быть удалены, что приводит к выраженному внутриклеточному ацидозу. Нервная клетка погибает.
В условиях недостатка в крови кислорода и избытка углекислоты происходит раздражение дыхательного центра. У плода появляются дыхательные движения по типу внеутробного дыхания. Это приводит к аспирации околоплодных вод, слизи, крови и мекония из родовых путей матери и еще больше усугубляет тяжесть состояния.
Устойчивость различных отделов центральной нервной системы плода к кислородной недостаточности не одинакова. В большей степени поражаются те образования, которые функционально наиболее активны в этот период. У новорожденных, особенно не
178
доношенных, в значительной степени страдают клетки коры, базальные ганглии, ядра вестибулярных нервов, зрительный бугор, оливы, ядра черепномозговых нервов, расположенные в каудальном отделе ствола мозга. Клетки передних рогов спинного мозга также чувствительны к действию гипоксии. Степень повреждения мозга зависит от тяжести и продолжительности внутриутробной гипоксии и асфиксии.
Патоморфология. Изменения мозга в острый и отдаленный периоды кислородного голодания различны. Если ребенок погибает от асфиксии в первые дни жизни, при макроскопическом исследовании обнаруживают отек мозга, расширение сосудов, переполнение их кровью. Микроскопически — периваскулярный и перицеллюлярный отек, микрогеморрагии. Отек и тканевая гипоксия вызывают различные изменения в тканях мозга: исчезновение нейронов, глиоз, набухание и размягчение тела нервной клетки и ее отростков, растворение нисслевской субстанции. Поэтому в мозге детей, перенесших асфиксию и умерших в более позднем возрасте, обнаруживают дистрофические изменения, вызванные циркуляторными расстройствами: очаговый глиоз, кистозные полости, обызвествление ганглиозных клеток, нарушение процессов миелинизации.
В. A. Benker, J. С. Zarroshe (1962) полагают, что для гипоксии, наиболее характерны размягчение перивентрикулярного белого» вещества и диффузная потеря клеток. Нарушение целостности corona radiata является причиной дефекта полей зрения.
Клиническая картина. Неврологические проявления у новорожденных зависят от степени тяжести и длительности кислородного голодания при рождении, наличия или отсутствия внутриутробной гипоксии, а также от особенностей формирования нервной системы во внутриутробный период.
Неврологические симптомы у детей, родившихся в асфиксии,, условно можно подразделить на две группы. К первой относят локальные признаки, связанные со структурными нарушениями мозга. У новорожденных наиболее четко выявляются неврологические изменения, обусловленные поражением стволовых образований, поскольку к моменту рождения они являются наиболее зрелыми. Дру1ую группу симптомов составляют неспецифические общемозговые нарушения, связанные с расстройством гемо- и ликвородинамики.
Нарушение функции черепномозговых нервов. Поражение черепномозговых нервов у детей, родившихся в асфиксии, наблюдает-, ся довольно часто. Оно может быть следствием отека мозга, локальной ишемии, повреждения ядер и нервных стволов.
Нарушение зрительного анализатора возникает в результате кровоизлияний в сетчатую оболочку глаза, которые можно обнаружить при офтальмоскопическом обследовании уже в родильном доме. Кровоизлияния, чаще мелкоточечные, располагаются по ходу артериол, реже они бывают крупными и имеют вид полос или
7*
179
пятен. Иногда наблюдаются геморрагии в зрительный нерв. Рассасываются кровоизлияния к концу первой недели жизни, иногда наблюдаются повторные эпизоды на 7—9-й день.
Ретинальные кровоизлияния могут быть причиной снижения зрения, косоглазия, нистагма, дегенеративных изменений в сетчатке.
Глазодвигательные нарушения наблюдаются у 37% детей, родившихся в асфиксии. Они проявляются преимущественно сходящимся косоглазием. Это связано с анатомической локализацией отводящего нерва, который на большом протяжении проходит на основании мозга и чаще травмируется. Реже наблюдается расходящееся косоглазие вследствие поражения глазодвигательного нерва. Косоглазие может быть легким, преходящим, обусловленным общемозговыми нарушениями.
Грубое, постоянно выраженное косоглазие в сочетании с другими неврологическими симптомами свидетельствует о тяжелом поражении нервной системы.
Наряду с косоглазием иногда отмечается смещение глазных яблок вниз (симптом Грефе). Между верхним веком и радужной оболочкой видна широкая полоса склеры. Симптом Грефе указывает на повышение внутричерепного давления.
Анизокория бывает преходящей в результате отека мозга. Постоянная анизокория наблюдается при поражении глазодвигательного нерва, его вегетативных ядер, цилиоспинального центра и связанных с ним симпатических волокон.
Вялая реакция зрачков на свет или ее резкое угнетение в сочетании с миозом или мидриазом бывает при тяжелом поражении мозга с утратой сознания и нарушением жизненно важных функций организма.
Птоз как изолированный признак при асфиксии наблюдается редко. Он входит в симптомокомплекс поражения глазодвигательного нерва или его ядра. В меньшей степени он выражен при синдроме Клода Бернара-Горнера. У новорожденных птоз значительно чаще связан с врожденной аплазией ядер глазодвигательного нерва.
Нистагм у детей, родившихся в асфиксии, может быть горизонтальным, вертикальным и ротаторным. Непостоянный, мелкоразмашистый горизонтальный нистагм, выявляющийся при крайних отведениях глазных яблок, наблюдается при легких степенях асфиксии и прогностически благоприятен. Грубо выраженный постоянный нистагм может быть связан с повреждением вестибулярных ядер ствола, заднего продольного пучка, лабиринтов.
Периферический парез лицевого нерва у детей, родившихся в асфиксии, обусловлен, как правило, его травматическим повреждением при наложении полостных щипцов. При легких парезах мышцы лица страдают минимально, сосание не нарушено. Выраженные парезы сопровождаются асимметрией лица и расстройством акта сосания. Восстановление функции паретичных мышц
180
при травматических повреждениях лицевого нерва наступает обычно в первые 2—3 нед. В редких случаях восстановительный период может быть более длительным. Центральные парезы лицевого нерва при асфиксии наблюдаются редко.
Нарушение бульбарной группы черепномозговых нервов в первые дни после рождения бывает приблизительно у 40% родившихся в асфиксии и характеризуется угнетением функции глотания, сосания. Дети поперхиваются, молоко выливается через пос. Голос становится глухим, с носовым оттенком. Неврологические изменения могут сочетаться с расстройством дыхания и сердечной деятельности. Нарушается синхронность актов дыхания, сосания и глотания.
Бульбарный паралич обычно наблюдается при асфиксии, осложненной внутричерепной родовой травмой. В этих случаях он обусловлен либо кровоизлиянием в ствол мозга, либо дислокацией последнего в результате отека.
Псевдобулъбарные нарушения обусловлены двусторонним поражением кортико-нуклеарпых путей при асфиксии и проявляются нарушением глотания и фонации. Дети испытывают чувство голода, кричат, но к груди «присосаться» не могут. Сделав несколько сосательных движений, они бросают грудь, затем опять пытаются сосать. Рефлексы орального автоматизма усиливаются. В дальнейшем у этих детей развиваются расстройства речи в форме псевдобульбарной дизартрии, которые наблюдаются значительно чаще, чем бульбарные.
Нарушение мышечного тонуса — один из наиболее частых патологических неврологических синдромов периода новорожденности. Изменение тонуса мышц у детей, перенесших асфиксию, обусловлено антенатальным повреждением центральной и периферической нервной системы, комплексом гуморальных и биохимических нарушений в организме ребенка.
Мышечная гипотония различной степени наблюдается в острый период у 75—90% детей, родившихся в асфиксии (Л. Т. Журба и др., 1971; G. Joppich, F. Schulte, 1968; J. К. Brown, 1976). Мышечная гипотония может быть тотальной или односторонней. Последняя наблюдается при очаговом поражении мозга. Сухожильные рефлексы угнетены, но полностью никогда не исчезают. В некоторых случаях они высокие, с расширенной зоной, сопровождаются клонусами.
Выраженность и динамика мышечной гипотонии являются важными показателями степени тяжести неврологических нарушений у новорожденного. Быстрое восстановление физиологического мышечного тонуса свидетельствует о функциональных расстройствах и прогностически благоприятно. Чем тяжелее и длительнее была мышечная гипотония в неонатальный период, тем с большей вероятностью в дальнейшем развиваются двигательные нарушения в форме детского церебрального паралича.
181
Мышечная гипертония, превышающая в значительной степени физиологическое повышение мышечного тонуса у новорожденных, также является патологическим признаком при асфиксии. Мышечная гипертония может сочетаться с общим выраженным беспокойством ребенка, нарушением сна, тремором подбородка и рук, срыгиваниями, рвотой. Сухожильные рефлексы высокие, клонус стоп. Выраженная стойкая мышечная гипертония с первых дней жизни с преобладанием экстензорного тонуса характерна для детей с антенатальной патологией нервной системы, осложнившейся асфиксией в родах. У таких детей в дальнейшем формируются тяжелые двигательные нарушения. Преходящая мышечная гипертония прогностически более благоприятна.
Патология безусловных рефлексов. Исследование безусловных рефлексов у детей, перенесших асфиксию, важно для определения степени вовлечения мозга в патологический процесс. При легких степенях асфиксии и нарушениях мозгового кровообращения наблюдается угнетение безусловных рефлексов в течение первых 2—4 дней, а затем они постепенно оживляются. Длительное угнетение (свыше 8—15 дней) и сочетание его с нарушением мышечного тонуса, нистагмом, косоглазием свидетельствуют о тяжелом поражении центральной нервной системы и неблагоприятном прогнозе. У таких детей спустя 4—5 нед безусловные рефлексы оживляются и наряду с повышенным мышечным тонусом и патологической тонической рефлекторной активностью препятствуют психомоторному развитию.
Оценка безусловнорефлекторной сферы должна проводиться комплексно с учетом состояния двигательного анализатора и других отделов нервной системы.
Судорожный синдром. Причиной судорог могут быть общемозговые и очаговые изменения центральной нервной системы, возникшие в результате асфиксии и нарушения мозговой ликворо-п гемодинамики. Судороги наблюдаются у 50% детей, родившихся в асфиксии. Отмечаются приступы типа кивков, спазма взора, нистагмоидных толчков глазных яблок, тремора рук, игры вазомоторов, жевательных, сосательных движений, причмокивания, высовывания языка, сокращений мышечных групп. Иногда наблюдаются общие вздрагивания с последующим присоединением крупноразмашистого тремора рук.
Судороги, возникшие в первые часы после рождения и носящие ограниченный характер, в дальнейшем могут не повторяться. В других случаях спустя 3—6 мес приступы возобновляются, судороги становятся более генерализованными. Судорожный синдром, развившийся после 5—8-го дня жизни, имеющий тенденцию к полиморфизму и трансформации, является прогностически неблагоприятным. У одного из тысячи детей, имевших судороги в период новорожденное™, в дальнейшем развивается эпилепсия (J. К. Brown, 1976). Наиболее злокачественным течением отличаются пропульсивные припадки (кивки, вздрагивания), носящие
182
серийный характер. Они вызывают раннюю грубую задержку психомоторного развития.
Гидроцефальный синдром. У новорожденных часто наблюдается при асфиксии, осложненной субарахноидальным кровоизлиянием. Избыточное скопление ликвора обусловлено его гиперсекрецией вследствие раздражения сосудистых сплетений излившейся кровью, а также нарушением всасывания в результате повышенного осмотического давления и окклюзии абсорбционных каналов распавшимися эритроцитами, фибрином. На 10—12-й день кровоизлияние рассасывается, а разрастающаяся соединительная ткань образует спайки между оболочками, облитерируя субарахноидальное пространство.
Гидроцефальный синдром у новорожденных характеризуется увеличением размеров головы, родничков, расхождением черепных швов. На коже лба, висков, волосистой части головы выражена венозная сеть. Проявляются симптом Грефе, усиливающийся при изменении положения головы, легкое сходящееся косоглазие, горизонтальный нистагм. Дети беспокойны, крик болезненный, выражены общая гиперестезия, тремор подбородка и рук, срыгивания, рвота. Нарастает мышечный тонус. Сухожильные рефлексы высокие, с расширенной зоной, клонусы стоп.
Легкий гипертензионно-гидроцефальный синдром у детей, родившихся в асфикции, наблюдается довольно часто. После стихания острых явлений внутричерепная гипертензия компенсируется и размеры головы в дальнейшем увеличиваются соответственно возрасту. В некоторых случаях после кажущейся стабилизации процесса через 3—4 мес окружность головы начинает вновь быстро увеличиваться. Такое течение прогностически неблагоприятно. На глазном дне при гидроцефальном синдроме обнаруживаются расширение вен, иногда стушеванность границ соска зрительного нерва.
Вегетативно-висцеральные нарушения. У новорожденных, родившихся в асфиксии, они связаны с повышенной чувствительностью диэнцефальной области и лимбических образований к недостатку кислорода. Наблюдаются расстройство терморегуляции, сна, желудочно-кишечные дискинезии, лабильность функции дыхательной и сердечно-сосудистой систем.
Дети беспокойны, много плачут, плохо сосут грудь. Часто наблюдаются срыгивания и рвота. Нарушение перистальтики кишечника приводит к поносам или запорам. Желудочно-кишечные расстройства у таких детей являются причиной плохой прибавки в массе. Расстройство регуляции сосудистого тонуса проявляется в периодических приступах общего или локального цианоза, багрово-синюшных пятнах на коже. Изменяется ритм сердечной деятельности и дыхания.
Сомато-вегетативные нарушения у детей, перенесших асфиксию, в дальнейшем могут закрепляться и перерастать в различные невротические расстройства.
183
Малые аномалии развития. При оценке значимости неонатальных неврологических синдромов необходимо учитывать фенотипические особенности ребенка. Наличие большого количества малых аномалий развития (гипертелоризм, эиикант, готическое нёбо, прогнатизм, синдактилия, сандалевидная щель, трезубец и др.) ухудшает прогноз, так как свидетельствует о неблагоприятном течении внутриутробного периода развития. Дизэмбриогене-тические стигмы могут сочетаться с нарушением созревания нервной системы, ее формирования, а это создает благоприятный фон для развития внутриутробной гипоксии и асфиксии в родах.
Неврологические синдромы у детей, перенесших асфиксию при рождении, часто сочетаются друг с другом. Степень их выраженности в острый период и дальнейшая динамика зависят от особенностей формирования нервной системы во внутриутробный период, тяжести поражения мозга, сочетания асфиксии с внутричерепной родовой травмой.
Легкая степень поражения центральной нервной системы. Внутриутробное развитие детей протекает в большинстве случаев благоприятно. Оценка по шкале Апгар — 6—7 баллов. Неврологическая симптоматика обусловлена нарушением гемо- и ликво-роциркуляции. Кожные покровы слегка циапотичны. Отмечается легкое повышение нервнорефлекторной возбудимости: беспокойство, поверхностный сон, вздрагивание, срыгивание. Учащенно дыхания и замедление сердечной деятельности имеют преходящий характер и исчезают спустя 2—3 дня. Мышечный тонус умеренно снижен в первые 2—3 сут, затем нормальный. Спонтанная двигательная активность ограничена. Безусловные рефлексы живые, в отдельных случаях могут быть снижены, быстро истощаются, вызываются после латентного периода и суммации раздражений. Мелкоразмашистый тремор рук носит преходящий характер. Коленные рефлексы оживлены, возможна их асимметрия.
На глазном дне изменений нет или легкое полнокровие вен. Спинномозговая жидкость нормальная, иногда слегка ксантохром-ная. Картина трансиллюмипацпи черепа без отклонений от нормы, в отдельных случаях — незначительное расширение границ свечения в лобно-теменных отделах. На ЭЭГ — уплощение биоэлектрической кривой и появление на этом фоне генерализованных высоковольтных разрядов при движениях ребенка, крике. При РЭГ выявляется легкое повышение сосудистого тонуса. На ЭХОЭГ — умеренное усиление ЭХО-пульсаций.
Изменения со стороны нервной системы нормализуются обычно на 5—7-й день жизни. У отдельных детей восстановительный период затягивается до 10—15 дней. На 7—10-й день жизни при нормализации неврологических нарушений таких детей выписывают домой. В том случае, если симптоматика еще остается выраженной и дети нуждаются в систематическом наблюдении врача, их переводят в отделение патологии нервной системы новорожденных.
184
Детей с легкими неврологическими нарушениями, имевшими место в родильном доме, следует длительное время наблюдать амбулаторно, так как не исключена возможность выявления у них в дальнейшем двигательных, речевых нарушений и своеобразной слабости высших корковых функций.
Среднетяжелая степень поражения центральной нервной системы. При анализе анамнестических данных можно отметить патологическое течение беременности (угрожающий выкидыш, токсикоз, инфекции, интоксикации). Роды затяжные с преждевременным отхождением вод, применением акушерских пособий (вакуум-экстрактор, щипцы) или, наоборот, стремительные. Оценка по шкале Апгар — 5—6 баллов. Кожные покровы синюшные, цианоз носогубного треугольника, усиливающийся при кормлении, беспокойстве. Дыхание в первые часы поверхностное, нерегулярное. Тоны сердца приглушены, брадикардия. Пульс слабого наполнения и напряжения, аритмичный. Зрачковые реакции вялые. Зрачки могут быть расширены или сужены, возможны анизокория, косоглазие, нистагм, симптом Грефе. Мышечный тонус снижен, разгибательное положение конечностей. Спонтанная двигательная активность замедлена. Безусловные рефлексы вызываются с трудом, после повторной стимуляции, быстро истощаются, иногда отсутствуют. Дети вяло сосут и глотают, часто срыгивают. Па фоне общей вялости, адинамии наблюдаются периоды беспокойства, крупноразмашистый тремор рук и ног типа геми-балпзма, судорожные подергивания мимической мускулатуры лица и глаз. Сухожильные рефлексы вначале угнетены, через 2— 3 дня становятся высокими с расширенной зоной, появляются клонусы стоп. Часто наблюдается расстройство сна. К 4—5-у дню жизни может быть выражен гидроцефальный синдром.
На глазном дне расширены вены, отек, геморрагии. Спинномозговая жидкость нормальная, ксаптохромная или с примесью крови. Эритроциты изменены по форме, выщелочены с гематоид-пымн кристаллами. Имеются явления фагоцитоза. При трансил-люмпнации черепа можно выявить изменения в виде обширных очагов свечения, указывающих на гипертензионно-гидроцефаль-ный синдром. На ЭЭГ — значительное уплощение биоэлектрической кривой с периодическими медленными волнами высокой амплитуды или гиперспнхронпзированные колебания, которые носят характер ритмических разрядов и свидетельствуют о заинтересованности стволовых структур. При РЭГ-исследовании — снижение интенсивности кровенаполнения, межполушарные асимметрии, затруднение венозного оттока. На ЭХОЭГ — увеличение желудочкового индекса.
Неврологические нарушения нормализуются более медленно, чем у детей с легкой степенью поражения. Длительное время остается выраженным гипертензионно-гидроцефальный синдром, держится тремор. Мышечная гипотония сменяется гипертонией. У детей этой группы рано могут формироваться задержка
185
психомоторного и речевого развития различной степени, детский церебральный паралич, судорожный синдром.
Тяжелая степень поражения центральной нервной системы. Патология обусловлена сочетанным действием вредных факторов в антенатальный и интранатальный периоды. Асфиксии в родах часто предшествует внутриутробная гипоксия. В 70—80% случаев имеются указания на применение акушерских пособий. Оценка по шкале Апгар — 1—4 балла. У 65% детей этой группы отмечается высокий порог стигматизации, свидетельствующий о нарушении внутриутробного развития. Кожные покровы резко-цианотичны или бледны. Выражены дыхательные и сердечнососудистые нарушения: дыхание при рождении отсутствует или поверхностное, тоны сердца глухие, пульс нитевидный, аритмичный, гипотермия. После оживления дыхание учащено, с втяжением уступчивых мест грудной клетки. Корнеальные и глоточный рефлексы снижены. Дети не сосут, не глотают снижена реакция на болевые раздражители. Крик слабый, болезненный или отсутствует, иногда гримаса плача на лице. Мышечная атония, сухожильные рефлексы не вызываются. Безусловные рефлексы резко угнетены. Наблюдаются судорожные сокращения отдельных групп мышц. Ребенок лежит с закрытыми глазами. Движения глазных яблок плавающие, горизонтальный и вертикальный нистагм. Нарушен ритм сна и бодрствования.
При тяжелой степени поражения мозга ребенок может погибнуть в первые часы. Если он остается жив, то гипотония мышц сменяется их гипертонией. Усиливаются безусловные рефлексы. Асимметричный шейный тонический рефлекс ярко выражен. Ребенок становится возбудимым, лежит с открытыми глазами. Выражены общее двигательное беспокойство, тремор рук, ног, приступы топико-клонических судорог, сходящееся косоглазие, нарушение сосания и глотания. Дыхание учащено, поверхностное. Гипертермия обусловлена нарушением терморегуляции. В этой стадии процесса появляются признаки повышения внутричерепного давления (напряжение большого родничка, расхождение черепных швов, симптом Грефе).
В дальнейшем при благоприятном течении интенсивность этих симптомов начинает постепенно уменьшаться, а затем они исчезают. Неврологические нарушения даже у детей с тяжелым поражением нивелируются к 3—4~й нед. Если течение неблагоприятное, то наступает стадия пониженной активности жизненных процессов. Ребенок снова становится малоактивным, вялым, гппо-тоничным, иногда нарастает общая скованность. Эта стадия возникает на 10—12-й день и может длиться 1—2 мес. В это время уже можно выявить неврологические симптомы, свидетелъ-сповующие об очаговых нарушениях центральной нервной системы.
На глазном дне при тяжелой степени поражения центральной нервной системы в острый период асфиксии выявляются расши
186
рение вен, стушеванность границ диска зрительного нерва, кровоизлияния. Спинномозговая жидкость не изменена или с примесью крови.
При трансиллюминации черепа в первые дни нарушения пе обнаруживаются или границы свечения слегка расширены. В более поздние сроки при наличии гидроцефального синдрома свечение может быть значительно выраженным. На ЭЭГ — диффузное угнетение биоэлектрической активности и возникновение медленных низкоамплитудных волн (17—20 мкв). На РЭГ — снижение кровенаполнения, межполушарные асимметрии. Детей с тяжелой формой неврологических нарушений необходимо переводить из родильных домов в специализированные стационары.
Внутричерепная родовая травма
Этот термин широко используется в клинической практике. Он объединяет различные по этиологии, патогенезу, степени тяжести и локализации патологические изменения в центральной нервной системе, возникающие в результате недостаточности адаптационных механизмов в период родов. Внутричерепная родовая травма составляет в структуре перинатальной смертности около 11% (Е. И. Андреева, 1974).
К проявлениям внутричерепной родовой травмы относят кровоизлияния в вещество мозга и его оболочки, а также другие расстройства мозгового кровообращения, вызывающие структурные изменения в нервной системе. Родовая травма является результатом повреждения тканей плода (разрыв мозжечкового намета, синусов, крупных сосудов) при различной акушерской патологии (затяжные пли стремительные роды, несоответствие между размерами плода и тазом матери, неправильная техника проведения акушерских родоразрешающих операций). В большинстве случаев внутричерепные кровоизлияния возникают на фоне хронической гипоксии плода, обусловленной неблагоприятным течением беременности (токсикозы, сердечно-сосудистые заболевания, эндокринные нарушения, инфекции). Асфиксия и внутричерепная травма взаимосвязаны между собой настолько тесно, что дифференцировать их клинически не представляется возможным, особенно в острый период. Глубокие нарушения гемодинамики при асфиксии, особенно в пределах микроциркуляторного русла, нередко являются причиной множественных петехиальных и массивных внутричерепных кровоизлияний. Кровоизлияния иногда могут быть обнаружены даже при антенатальной гибели плода, когда не применялись оперативные вмешательства, что лишний раз подтверждает мнение о гипоксии как о самостоятельном этиологическом факторе внутричерепных геморрагий (Л. С. Персианинов, 1974; Е. Б. Войт, 1974; G. Joppich, F. Schulte, 1968; A. Decaban, 1970). На фоне гипоксии даже нормальные роды иногда приводят к обширным кровоизлияниям в мозг.
187
Субдуральные кровоизлияния возникают в результате тяжелых родов со сдавлением и смещением костей черепа. Травмируются сосуды, впадающие в верхний сагиттальный и поперечный синусы, сосуды намета мозжечка. Субдуральные гематомы могут быть одно- или двусторонние. Возможно их сочетание с паренхиматозными кровоизлияниями, являющихся следствием гипоксии.
При быстром нарастании гематомы состояние больных крайне тяжелое, кожные покровы бледные, холодные, дыхание учащено, пульс аритмичный, слабого наполнения и напряжения. Мышечный тонус снижен, безусловные рефлексы отсутствуют или резко угнетены, ребенок не сосет и не глотает. Корнеальный и конъюнктивальный рефлексы отсутствуют. Наблюдаются рвота, повторные приступы асфиксии, судороги. Летальный исход наступает в первые несколько суток от сдавления жизненно важных центров ствола мозга.
Иногда непосредственно после рождения неврологические нарушения выражены нерезко и это состояние диагностируют как нарушение мозгового кровообращения I—II степени. После периода кажущегося благополучия состояние постепенно ухудшается. Появляются рвота, срыгивание, напряжение большого родничка, симптом Грефе, косоглазие, анизокория, экстензорная гипертония, повышение сухожильных рефлексов. Характерным является периодическое повышение температуры. Иногда наблюдаются очаговые, судорожные припадки, постепенно увеличиваются размеры головы.
В спинномозговой жизкости при субдуральном кровоизлиянии обнаруживаются ксантохромия, белково-клеточная диссоциация. В острый период при трансиллюминации черепа наблюдается фокальное понижение свечения. После рассасывания крови и образования кисты ореол свечения увеличивается. При эхоэнцефало-графии обнаруживают полушарную асимметрию. Окончательный диагноз можно поставить лишь после субдуральной пункции, ко-юрая производится у наружного угла большого родничка, а при его небольших размерах через венечный шов. В первые дни после рождения из гематомы извлекается жидкая кровь, а позже — жидкость коричневого или желтого цвета с большим содержанием белка (до 1,0 г/л). Субдуральная пункция имеет диагностическое и лечебное значение.
Если гематома диагностирована в первые дни жизни, с помощью повторных пункций удается удалить содержимое гематомы. Это необходимо делать в стационарных условиях. Инкапсулированные субдуральные гематомы удаляются хирургическим путем. Современное хирургическое вмешательство при субдуральных гематомах сохраняет жизнь новорожденному. Консервативное лечение проводится так же, как и при асфиксии.
Дифференциальный диагноз субдуральной гематомы необходимо проводить с менингитом, внутриутробным поражением центральной нервной системы, опухолью мозга, абсцессом.
188
Эпидуральные кровоизлияния наблюдаются редко, главным образом при повреждении костей черепа. Они локализуются между твердой мозговой оболочкой и костями черепа, поэтому их еще называют внутренней кефалогематомой. Эти кровоизлияния проявляются общемозговыми симптомами, которые связаны с нарушением мозгового кровообращения, иногда признаками сдавления ствола мозга, застойными явлениями на глазном дне.
Субарахноидальные кровоизлияния — наиболее частый вид повреждения сосудов головного мозга. В 75% случаев они встречаются у недоношенных детей. Основными причинами субарахноидальных кровоизлияний являются асфиксия, способствующая повышению сосудистой проницаемости, травматическое повреждение мелких вен оболочек при патологическом течении родов с применением щипцов, вакуум-экстрактора. Субарахноидальные кровоизлияния могут наблюдаться также при тромбоцитопении, геморрагическом диатезе, врожденном ангиоматозе, аневризме. Кровоизлияния множественные, преимущественно двусторонние, располагаются в височных областях больших полушарий. При обширном кровоизлиянии вся поверхность мозга покрыта как бы красной шапкой. Мозг отечен, сосуды переполнены кровью. Субарахноидальные кровоизлияния могут сочетаться с мелкими паренхиматозными.
Дети рождаются в синей асфиксии, состояние тяжелое, отмечаются общее возбуждение, срыгивание, рвота, тремор, судороги, нарушение сна, нистагм, симптом Грефе, косоглазие. Мышечный тонус повышен. Выражены общая гиперестезия, ригидность мышц затылка, спонтанный рефлекс Бабинского. Ярко выражены все безусловные рефлексы, особенно асимметричный шейный тонический рефлекс, который фиксирует ребенка в вынужденном положении.
Иногда субарахноидальное кровоизлияние вначале протекает асимпгомпо или неврологическая симптоматика выражена нерезко. Состояние ребенка может ухудшаться на 3—4-й день после прикладывания к груди.
Диагноз субарахноидального кровоизлияния ставится после обнаружения крови в спинномозговой жидкости. Ликвор геморрагический или ксантохромный, в нем определяются свежие или выщелоченные эритроциты. Цитоз увеличен до 50—1000 клеток в 1 мкл. Количество белка повышено. При трансиллюминации черепа в острый период ореол свечения отсутствует. Он появляется после рассасывания крови и увеличивается по мере прогрессирования гидроцефалии. При ЭХОЭГ выявляются усиление пульсаций и увеличение желудочкового индекса.
Течение субарахноидальных кровоизлияний в большинстве случаев благоприятное. Наиболее частым осложнением является гидроцефалия, развивающаяся в результате блокады пахиновых грануляций излившейся кровью и нарушения абсорбции спинномозговой жизкости.
189
Внутрижелудочковые кровоизлияния наиболее типичны для глубоко недоношенных детей, у доношенных встречаются редко. Наблюдаются они при токсикозах второй половины беременности, затяжных или стремительных родах, акушерских пособиях. У некоторых больных кровоизлияние возникает в субэпендимарной области и сопровождается разрывом боковых желудочков и деструкцией подкорковых образований. Внутрижелудочковые кровоизлияния развиваются в большинстве случаев на фоне гипоксии.
Состояние новорожденных тяжелое. Ребенок вял, адинамичен или, наоборот, беспокоен, поза опистотонуса. Периодически возникают тонические судороги. Большой родничок напряжен, выражен горизонтальный, вертикальный и ротаторный нистагм, симптом Грефе. Дети не сосут, не глотают, безусловные и сухожильные рефлексы резко угнетены, нарастает гидроцефальный синдром. В терминальной стадии наблюдается гипертермия. Если кровоизлияние массивное, дети выживают редко. Спинномозговая жидкость геморрагическая, цитоз повышен до 300—1000 клеток в 1 мкл, носит смешанный характер, увеличено количество белка. При трансиллюминации черепа выявляется увеличение границ свечения, на ЭХОЭГ — асимметричное увеличение желудочкового индекса. Прогноз при желудочковых кровоизлияниях неблагоприятный.
Субэпендимарные кровоизлияния чаще встречаются при разрыве концевых вен между хвостатым ядром и зрительным бугром. Кровь разрушает головку хвостатого ядра и прорывается в боковые желудочки.
Клинические проявления такие же, как и при других формах кровоизлияний, поэтому субэпендимарные кровоизлияния трудно диагностировать. Большинство новорожденных погибает в первые дни жизни.
Множественные петехиальные мозговые кровоизлияния наблюдаются при внутриутробной гипоксии и асфиксии в родах. В анамнезе имеются указания на патологическое течение беременности. Кровоизлияния локализуются в полушариях, на основании мозга, в мозжечке.
Клинические проявления похожи на таковые при «чистой» асфиксии и дифференцировать их очень трудно. Выражены беспокойство, срыгивание, рвота, горизонтальный нистагм, судорожные подергивания мышц лица и конечностей, нарушение мышечного тонуса. На глазном дне мелкоточечные кровоизлияния, отек сетчатки. В спинномозговой жидкости изменений может не быть. При трансиллюминации черепа иногда выявляются ограниченные очаги повышенного свечения.
Петехиальные кровоизлияния редко являются причиной смерти новорожденных. В дальнейшем у этих детей могут быть обнаружены симптомы органического поражения центральной нервной системы.
190
Массивные внутричерепные кровоизлияния чище всего воз-никают при разрыве мозжечкового намета, синусов и сосудов хориоидального сплетения. Кровь скапливается между полушариями и на основании мозга, преимущественно в задней черепной ямке. Скопившаяся на основании мозга кровь сдавливает ствол мозга и базальные ганглии. Нарушаются жизненно важные функции.
Крик слабый, дыхание поверхностное, редкое, нерегулярное. Общая мышечная гипотония сменяется гипертонией, наблюдаются частые локальные и генерализованные судорожные припадки, плавающий взор, горизонтальный и вертикальный нистагм. Нарушено сосание и глотание, безусловные рефлексы резко угнетены. Отмечаются повторные приступы асфиксии. Спинномозговая жидкость изменена в тех случаях, когда кровь достигла субарахноидального пространства.
При трансиллюминации черепа в острый период изменений может не быть. На ЭХОЭГ иногда наблюдается смещение срединного комплекса.
Компрессия мозга возникает в результате механического сдавления головки плода в родах. Она не всегда сопровождается внутричерепными кровоизлияниями. В этих случаях наблюдается отек мозга, повышается внутричерепное давление, усугубляющие компрессию. Отек и набухание в незрелом, немиелинизированном мозге вызывают циркуляторные нарушения с исходом в инфаркт. На месте ишемического очага в дальнейшем может образоваться киста (порэнцефалия).
Состояние детей тяжелое. Выражены адинамия, мышечная гипотония, нарушение сосания и глотания. Часто наблюдаются рвота, судороги, дыхательные расстройства, гиперестезия. Ребенок может быть возбужден; в этих случаях преобладает экстен-зорный тонус. Большой родничок напряжен, черепные швы расширены. На глазном дне — отек соска зрительного нерва. В спинномозговой жидкости изменений нет. При ЭХОЭГ патологии не выявляется.
На основе клинических проявлений четко разграничить различные формы внутричерепных кровоизлияний очень трудно из-за сходности симптоматики и возможности сочетания их друг с другом и с гипоксией.
Только тщательные анамнестические данные, анализ течения беременности и родов, динамика неврологических нарушений в острой и восстановительной стадиях, дополнительные биохимические, электрофизиологические и нейрорентгенологические методы исследования могут помочь в каждом отдельном случае утверждать с определенной достоверностью о преобладании гипоксического или травматического фактора.
Течение и прогноз асфиксии и внутричерепной родовой травмы находятся в зависимости от особенностей формирования нервной системы ребенка во внутриутробный период, степени
191
тяжести неврологических нарушений, своевременной и правильной терапии.
У детей, родившихся в легкой асфиксии с явлениями нарушения мозгового кровообращения I—II степени, в дальнейшем могут быть выявлены расстройства речи, мышления, высших корковых функций.
Более глубокие изменения во внутриутробный период, тяжелая интранатальная патология и их сочетание приводят к выраженным неврологическим нарушениям, задержке возрастного психомоторного и речевого развития, детским церебральным параличам, судорогам, гидроцефалии и др.
Вышеописанные синдромы изолированно встречаются редко. Более характерно их сочетание. Но в каждом случае необходимо выделить ведущий симптомокомплекс, который и отражается в диагнозе. Диагностика неврологических нарушений в период новорожденности, их своевременное лечение во многом определяют успех предупреждения двигательных, речевых и психических отклонений.
Лечение. В родильном доме после проведения реанимационных мероприятий, направленных на восстановление дыхания и сердечной деятельности, детей переводят в палату интенсивной терапии. Здесь под наблюдением врача и специально обученного персонала новорожденные получают весь комплекс лечебно-профилактических мероприятий, направленных на восстановление нарушенных функций и предупреждение тяжелых осложнений. Палаты, в которых находятся травмированные новорожденные, оборудованы аппаратами для проведения искусственного дыхания, отсасывания слизи, кислородными палатками и снабжены центральной подачей кислорода. Особое внимание уделяется температурному режиму и цикличности заполнения палат.
Интенсивная терапия включает мероприятия, направленные на лечение и профилактику дыхательных и сердечно-сосудистых расстройств, метаболических нарушений, отека мозга и острой внутричерепной гипертензии, судорог и судорожного статуса, геморрагических проявлений. Методы интенсивной терапии подробно изложены в главе XVIII.
В последние годы при внутричерепных кровоизлияниях у новорожденных предпринимаются попытки нейрохирургического вмешательства. Субдуральные, эпидуральные и внутрижелудочковые гематомы удаляют с помощью чрезродничковых, чресшов-ных и чрескостных пункций (Ю. С. Бродский, 1977; А. И. Осна, 1978).
Если неврологические нарушения не купировались в родильном доме, то для дальнейшего лечения новорожденных переводят в специализированные больницы или отделения многопрофильных больниц. Здесь их осматривают комплексно все специалисты: педиатр, невропатолог, ортопед, врач по лечебной гимнастике, логопед. Всестороннее клиническое, электрофизиологическое, 192
биохимическое, иммунологическое, цитологическое исследования способствуют назначению методов раннего дифференцированного лечения.
Лечебные мероприятия, начатые в родильном доме, продолжаются в стационаре. Медикаментозная терапия проводится с учетом ведущих неврологических синдромов. При повышении внутричерепного давления назначают дегитратационные средства (магния сульфат, диакарб, бренальдикс, глицерол, магнезиальные клизмы). Аптигеморрагические препараты (викасол, аскорутин, кальция хлорид) дают при наличии крови в спинномозговой жидкости и повторных кровоизлияниях на глазном дне.
Основное значение в стационаре придается стимуляции онтогенетически последовательного развития двигательных, речевых и психических функций. Этот принцип должен лежать в основе «работы всех специалистов, которые принимают участие в лечении ребенка. Методисты лечебной гимнастики, массажисты, ортопеды, логопеды, психологи, персонал и мать строго следят за позой ребенка. При наличии парезов, параличей, патологических поз с первых дней жизни начинается лечение «положением». Чтобы создать адекватную сенсорную афферентацию, голове, туловищу и конечностям придают физиологическое положение при помощи лонгет, шин, валиков и других укладок. На 3—4-й неделе при хорошем состоянии кожных покровов после нормализации ликвора, рассасывания геморрагий на глазном дне, эпителизации пупочной ямки ребенку назначают лечебную гимнастику, массаж. Последние направлены па выработку возрастных двигательных навыков: удержание головы, повороты на бок, на живот, захват игрушки, сидение, ползание, вставание на четвереньки, ходьбу. В возрастной последовательности тренируют речевые и психические функции. Параллельно с лечебной гимнастикой и ортопедическим лечением назначают препараты, стимулирующие обменные процессы в центральной нервной системе (тиамин, пиридоксин, цианокобаламин, кальция пангамат, глютаминовая кислота, липоцеребрин, ацефен, церебролизин, амипалоп, ноотропил, дибазол, галантамин). Дозировка медикаментозных препаратов и длительность их назначения определяются врачом индивидуально в зависимости от тяжести поражения, динамики неврологических синдромов и реакции ребенка на введение того или иного препарата.
Травма спинного мозга
Травма спинного мозга наблюдается чаще при ягодичном и ножном • предлежании плода. Сильная тракция за туловище при фиксированной головке может привести к растяжению спинного мозга, его оболочек и корешков. Травматические нарушения обнаруживаются в большинстве случаев в нижнем шейном и грудном отделах, которые испытывают большую нагрузку в родах.
193
Тяжесть повреждения может варьировать от легкого растяжения до тяжелых кровоизлияний и разрывов спинного мозга.
Патоморфология. При исследовании спинного мозга наблюдаются отек оболочек и вещества, мелкоточечные кровоизлияния, надрыв или отрыв корешков. Кровоизлияния бывают эпидуральные, субдуральные, петехиальные в вещество мозга и корешки.
Иногда кровоизлияния сопровождаются трещинами и переломами позвонков. На более поздних стадиях обнаруживают уменьшение числа и размеров нервных клеток, глиальные перерождения, кисты. При больших геморрагиях мозг на этом участке со временем замещается соединительной тканью.
Клиническая картина зависит от локализации и степени поражения. В тяжелых случаях сразу после рождения наблюдается картина спинального шока. Новорожденные вяльте, адинамичпые, выражена общая мышечная гипотония, разгибательное положение конечностей; дыхание затруднено, межреберные мышцы втянуты, живот вздут. Такой ребенок напоминает больного с синдромом дыхательных расстройств. Сухожильные рефлексы угнетены или отсутствуют, снижена болевая чувствительность. Если ребенок остается жив, то в клинической картине преобладают вялые параличи, трофические расстройства, нарушение функции сфинктеров. Сегментарные и проводниковые расстройства чувствительности у новорожденных диагностировать трудно. Более отчетливо они выявляются во втором полугодии жизни.
При извлечении плода за тазовый конец повреждение спинного мозга может комбинироваться с травмой нервов плечевого сплетения.
В клинической картине травматических повреждений спинного мозга у детей раннего возраста нельзя определить четких уровней поражения, как это наблюдается у более старших детей. Это связано с незрелостью нервной системы, а также с растяжением спинного мозга и корешков по всему длиннику и «наличием множественных дпапедезных кровоизлияний. У новорожденных парезы и параличи, «как правило, носят вялый характер. Причиной смерти детей с травматическими кровоизлияниями в спинной мозг является дыхательная недостаточность.
Дифференциальный диагноз травматических повреждений спинного мозга необходимо проводить с его пороками развития, болезнью Верднига—Гоффмана, врожденными миопатиями, атонпчески-астатпческой формой детского церебрального паралича, гликогенозами. При этих заболеваниях мышечная гипотония также выражена с рождения. Дифференциальной диагностике помогают люмбальная пункция, рентгенологическое исследование, электронейромиография.
Лечение. В острый период назначают препараты, повышающие свертываемость крови и уменьшающие проницаемость со-194
судистой стенки (викасол, рутин, аскорбиновую кислоту, препараты кальция). В дальнейшем при наличии парезов и параличей показаны массаж, лечебная гимнастика, ортопедические укладки, препараты, улучшающие нервно-мышечную проводимость (дибазол, галантамин, прозерин), витамины группы В, АТФ, метионин, алоэ, пирогенал.
Прогноз зависит от степени тяжести поражения. При массивных кровоизлияниях новорожденные часто погибают в первые дни жизни. В остальных «случаях после острого периода наблюдается постепенное восстановление двигательных функций. Степень их компенсации зависит от выраженности анатомических изменений. Интеллект у детей с «травматическим повреждением спинного мозга нормален. Задержка психомоторного развития наблюдается при сочетанном поражении головного и спинного мозга.
Акушерские парезы и параличи рук
Акушерские парезы и параличи «новорожденных — разнообразные по локализации и течению нарушения двигательной функции рук, возникшие вследствие повреждения периферического мотонейрона при патологическом течении'родов.
Наиболее часто поражение локализуется в области плечевого сплетения. Однако могут быть затронуты корешки, образующие нервы плечевого сплетения, и «спинной мозг (Л. Т. Журба, 1971; А. Ю. Ратнер, 1978; G. F. Boyer, 1911; В. Grothers, 1923; F. R. Ford, 1966; A. Towbin, 1970; G. Bennet, A. Harold, 1976).
Частота травматического повреждения периферической нервной системы в родах составляет в среднем 2—3 на 1000 новорожденных.
Патогенез. Периферические «парезы и параличи рук наблюдаются преимущественно у детей с большой массой, рождающихся в ягодичном или ножном предлежании. Одной из основных причин травмы плечевого сплетения являются акушерские манипуляции, оказываемые при запрокидывании рук плода, затрудненном выведении плечиков и головки.
Одновременная тракция и ротация головки плода при*фиксированных плечиках и, наоборот, тракция и ротация плечиков при фиксированной головке приводят к травме -плечевого сплетения, натяжению корешков нижнешейных п верхнегрудных сегментов спинного мозга над поперечными отростками позвонков, иногда к их отрыву от «спинного мозга. Сильная тракция за туловище при фиксированной головке также может быть причиной сочетанной травмы плечевого сплетения и шейного отдела спинного мозга. В 95% случаев акушерские парезы и параличи возникают на фоне внутриутробной гипоксии плода и асфиксии новорожденного. В этих условиях спинной мозг и периферическая нервная система особенно чувствительны к травме.
195
Рис. 66. Верхний проксимальный тип акушерского пареза
Патоморфология. При исследовании обнаруживают периневральные геморрагии, мелкоточечные
кровоизлияния в нервные стволы, корешки и спинной мозг. Вторичные нарушения в виде дегенерации нервных волокон обусловлены разрывом оболочки нерва, сдавлением нервных стволов гематомой и реактивным отеком. В тяжелых случаях наблюдаются полный разрыв нервов, образующих плечевое сплетение, отрыв корешков от спинного мозга, повреждение вещества спинного мозга. Реактивное разрастание соединительной ткани вокруг нервных стволов создает серьезные препятствия для их регенерации.
Клиническая картина акушерских парезов рук зависит от локализации повреждения.
Верхний, проксимальный тип акушерского пареза (Эрба—Дюшена) развивается при повреждении верхнего первичного пучка плечевого сплетения или С5—Сб корешков спинного мозга (рис. 66). При этом нарушается функция проксимального отдела руки. Поражаются мышцы, -отводящие плечо, ротирующие его кнаружи, поднимающие выше горизонтального уровня, сгибатели и супинаторы предплечья (m. deltoideus, m. biceps, m. brachialis, m. brachioradialis, m. supraspinatus, m. teres major, m. teres minor, m. supinator).
Мышечный тонус в паретичной руке снижен. Рука ребенка приведена к туловищу, разогнута во всех суставах, ротирована внутрь »в плече, пронирована в предплечье, кисть в ладонном сгибании, голова наклонена к больному плечу, плечо опущено. Рефлекс с двуглавой мышцы не вызывается. Активные движения отсутствуют или ограничены*в плечевом и локтевом суставах, ослаблено тыльное сгибание кисти, движения в пальцах сохранены. На стороне паралича не вызывается ладонно-ротовой рефлекс; рефлекс Моро, хватательный рефлекс ослаблены. Если удерживать ребенка горизонтально лицом вниз или лицом вверх, паре-тичная рука свисает.
При верхнем типе акушерского пареза в результате приведения и внутренней ротации плеча образуется более выраженная и
196
Рис. 67. Симптом «кукольной руки»
удлиненная борозда между плечом и трудной клеткой (симптом «кукольной руки») (рис. 67). Симптом «кукольной руки» выражен незначительно или отсутствует при легком парезе. Установка плеча в положении приведения п внутренней ротации является причиной формирования внутриротаторной мышечной контрактуры. Постоянное положение предплечья в состоянии пронации способствует развитию пронаторной контрактуры. При тяжелой форме верхнего проксимального пареза руки может наблюдаться подвывих или вывих головки плечевой кости вследствие резкого снижения тонуса мышц, фиксирующих плечевой сустав.
Чувствительные нарушения у новорожденных и грудных детей выявить трудно, однако снижение реакции при нанесении болевых раздражений или, наоборот, выраженная гиперестезия косвенно свидетельству
ют о наличии расстройств чувствительности. Верхний тип акушерского пареза может сочетаться с травмой добавочного нерва. В этих случаях наряду с парезом руки наблюдается кривошея, лопатка отстает от позвоночника. Следует помнить, что кривошея может быть также результатом травмы грудино-ключично-сосковой мышцы в родах. При ягодичном предлежании плода и затрудненном выведении плечиков в ряде случаев происходит надрыв, а иногда и полный разрыв мышцы с кровоизлиянием в нее.
В острый период на месте кровоизлияния пальпируется оплот-пение различной формы и величины. В дальнейшем очаг кровоизлияния прорастает соединительной тканью и мышца укорачивается. Выраженность кривошеи может быть различной — от легкой, которая компенсируется в первые месяцы жизни, особенно при рапо начатом лечении, до тяжелой, требующей оперативного вмешательства.
Верхний проксимальный тип акушерского пареза встречается наиболее часто.
Нижний дистальный тип акушерского пареза (Дежерин-Клюмпке) возникает при поражении нижнего и среднего первич-
197
Рис. 68. Нижний дистальный
пых пучков плечевого сплетения или С?—Di корешков спинного мозга (рис. 68). Нарушается функция дистального отдела руки. Поражаются длинные сгибатели кисти и пальцев, межкостные и червеобразные мышцы кисти, мышцы тенара и гипотепара (ш. flexor carpi radialis et ulnaris, m. flexor digitorum communis, m. min-terossei, m. thenar, m. hypothenar).
Мышечный тонус в паретичной руке снижен. Рука разогнута во всех суставах, лежит вдоль туловища, пронирована в предплечье. Кисть пассивно свисает (если преобладает поражение лучевого нерва) или находится в положении когтистой лапы
тип акушерского пареза (если в большей степени поражен
локтевой нерв). Активные движения в локтевом суставе отсутствуют. Кисть уплощена, атрофична, холодна па ощупь. Степень поражения мышц кисти варьирует от легкого нарушения движений в пальцах и лучезапястном суставе до полного их отсутствия. Движения в плечевом суставе сохранены. Паретпчная рука принимает участие в рефлексе Моро, но он менее выражен, чем на здоровой стороне. Хватательный рефлекс па больной стороне отсутствует, не вызывается ладонно-ротовой рефлекс.
В связи с вовлечением в процесс волокон срединного нерва наблюдаются трофические расстройства — отек, гиперемия или бледность кожи кисти, дистрофические изменения ногтей. На внутренней поверхности руки, больше в дистальных отделах, определяется снижение чувствительности.
198
При вовлечении в патологический процесс шейных симпатических волокон на стороне пареза руки отмечается синдром Клода Бернара-Горнера (птоз, миоз, энофтальм). В некоторых случаях имеется нарушение пигментации радужки, сохраняющееся в течение длительного времени.
При нижнем типе пареза проксимальные отделы конечности также поражаются или страдают незначительно, симптом «кукольной руки» отсутствует, не развивается впутри-ротаторпая контрактура плеча. Нижний тип пареза встречается реже, чем верхний.
Тотальный ТПП акушерского па- Рис. 69. Тотальный тпп аку-реза руки возникает в результате шерского пареза повреждения верхнего и пижпего первичных пучков плечевого сплетения или спинного мозга па уровпе С5—Di (рис. 69), отрыва соответствующих корешков от спинного мозга. Это наиболее тяжелый тип поражения. В паретпчной руке мышечная гипотония резко выражена. Рука пассивно свисает вдоль туловища, ее можно легко обвить вокруг шеи («симптом шарфа»; рис. 70). Активные движения отсутствуют, могут быть сохранены очень легкие движения в облегченном положении. Кожа паретичпой руки бледна, холодна на ощупь. Рано развиваются мышечные атрофии, особенно в дистальных отделах. Снижена болевая и температурная чувствительность в области нижней трети плеча, предплечья и кисти. Сухожильные рефлексы не вызываются. Рука не принимает участия в рефлексе Моро, отсутству-
ют
Рис. 70. Симптом шг1рфа
ют хватательный и ладонно-ротовой рефлексы. В связи с тем, что при тотальном параличе поражаются все мышцы, отсутствует патологическая установка руки, особенно характерная для верхнего типа, реже формируются мышечные контрактуры.
При тяжелых формах поражения плечевого сплетения иногда наблюдается снижение мышечного тонуса в ноге на стороне паретичной руки. Нога может несколько отставать при спонтанных движениях. Эти нарушения трудно улавливаются в
острый период и быстро нивелируются. Они, вероятно, являются результатом реперкуссии на соответствующую сторону спинного мозга. Подобный феномен наблюдается и у взрослых при травматическом периферическом парезе руки, особенно при сильной тракции плечевого сплетения.
Следует отметить, что в клинике чаще наблюдаются сочетанные поражения с преобладанием -того или иного типа пареза. Так, при верхнем типе акушерского пареза можно обнаружить изменения в дистальных отделах п наоборот. Это является результатом анатомической близости пораженных отделов. Встречаются также атипичные и двусторонние парезы - (рис. 71).
У новорожденных с акушерскими парезами нередко наблюдаются церебральные нарушения: повышенная возбудимость, тремор, изменения «мышечного тонуса, угнетение безусловных рефлексов. Это связано с комплексным воздействием на организм ребенка асфиксии и родовой травмы. Эти изменения носят преходящий характер и быстро нивелируются, что указывает на их связь с динамическим нарушением мозгового кровообращения и ликвороциркуляции.
В литературе имеются указания на частые изменения шейного отдела позвоночника (смещения, трещины, -переломы позвонков) у детей с акушерскими парезами (А. 10. Ратнер, 1978). При рентгенологическом исследовании шейного отдела позвоночника, проведенном нами у 46 новорожденных с акушерскими парезами, каких-либо нарушений не выявлено.
Течение акушерских парезов и параличей зависит от тяжести поражения. При легком поражении восстановление функции руки начинается с первых дней жизни и в течение 3—5 мес объем активных движений становится полным. Однако в некоторых случаях длительно может оставаться мышечная слабость. Она становится более заметной, когда ребенок переходит в вертикальное
200
положение. Недостаточность функции выявляется при поднимании руки выше горизонтального уровня, отведении ее назад. Снижение силы мышц у грудных детей можно отметить, когда они начинают тянуться к игрушке. В случаях средней тяжести и при тяжелых поражениях восстановление идет медленно и часто бывает неполным из-за дегенерации нервных волокон, мышечных атрофий и
Рис. 71. Двусторонний акушерский паралич
контрактур.
По мере восстановления функции пораженных мышц из-
меняются мышечный тонус и соответственно положение руки. Если вначале плечо опущено, рука приведена, лежит вдоль туловища в состоянии разгибания в локтевом суставе, пронировапа, кисть в ладонном сгибании, то при появлении движений рука не
сколько отведена, согнута в локте, плечо приподнято, ярко выражены внутренняя ротация и пронация. Рука и плечевой пояс отстают в росте, выражены атрофии. Из-за ретракции двуглавой мышцы рука подтягивается и находится в полусогнутом положении, уже начиная со 2-го полугодия жизни. Контрактура двуглавой мышцы — одна из наиболее частых при акушерских парезах проксимального типа. Асимметричное положение плечевого пояса приводит к сколиозу шейно-грудного отдела позвоночника.
Если не проводится регулярная восстановительная терапия, то развившиеся мышечные контрактуры дельтовидной мышцы, большой грудной, над- и подостных затрудняют отведепие плеча, на-
201
Рис. 72. Положение паретичной руки в виде «охотничьего рожка»
При грубой травме спинного
ружную ротацию (внутрирота-торная контрактура). Лопатка на стороне пареза подтянута вверх, а при поднимании руки вперед и вверх уходит кнаружи к подмышечной впадине. Вну-триротаторная контрактура в плече препятствует заведению руки за голову и прикосновению ладонной стороной к затылку. При пронаторной контрактуре в предплечье ребенок не может коснуться ладонью губ. Если попросить ребенка поднести руку ко рту, он отводит локоть кнаружи до уровня плеча и подносит ее тыльной стороной — положение «охотничьего рожка» (рис. 72). В дальнейшем нарушения движений в плечевом и локтевом суставах значительно затрудняют самообслуживание ребенка (одевание, причесывание).
мозга, отрыве корешков от спин
ного мозга, разрыве плечевого сплетения восстановление минимальное, рано развиваются мышечные контрактуры, атрофии, отмечается тенденция к подвывиху в плечевом суставе.
Мышечные контрактуры, трофические нарушения вызывают костные изменения. Они развиваются уже после 8—12 мес и с возрастом становятся более выраженными. Рентгенологически находят замедление окостенения, остеопороз, гипоплазию плечевой кости, деформацию акромиального отростка, укорочение шейки лопатки, сморщивание суставной сумки. Отмечен параллелизм между костными изменениями и степенью пареза.
Диагноз акушерских парезов обычно ставится уже при первом осмотре на основании характерных клинических проявлений и не представляет трудностей. Уточнить локализацию повреждения помогают электромиографические исследования. Обнаружение на электромиограмме залпов фасцикуляций свидетельствует о вовлечении в патологический процесс спинного мозга или корешков. Снижение скорости распространения возбуждения по периферическим нервам указывает на их поражение.
Дифференциальный диагноз акушерских парезов необходимо проводить с переломом ключицы, псевдопараличом Парро, полиомиелитом, остеомиелитом и врожденной гемигипоплазией.
Перелом ключицы. При переломе ключицы движения ограничены лишь в плечевом суставе, отсутствуют патологическая уста
202
новка руки, синдром Клода Бернара — Горнера и другие признаки, характерные для акушерских парезов. Крепитация в области пе-релома и пальпаторное определение отломков свидетельствуют о переломе ключицы.
Псевдопаралич Парро, В основе заболевания лежит врожденное изменение костей (сифилитические остеохондриты), характеризующееся рассасыванием эпифизов в области локтевого, лучезапястного, реже плечевого, суставов. Клинически определяются припухлость суставов, крепитация, болезненность при пальпации, пассивных движениях в суставах, поэтому возникает так называемый рефлекторный вялый парез руки. При псевдопараличах отсутствуют типичные клинические синдромы, характерные для акушерского пареза.
Врожденный полиомиелит в отличие от акушерского -пареза характеризуется распространенными вялыми парезами, причем ноги страдают чаще и в большей степени, чем руки. При полиомиелите иногда наблюдаются бульбарные расстройства. Важное значение для диагноза имеют эпидемиологическая обстановка и серологические исследования.
Остеомиелит у новорожденных наряду с ограничением движений в руке характеризуется припухлостью, отеком, болезненностью, а также повышением температуры, воспалительными изменениями крови, иногда специфическими признаками на рентгенограмме.
Врожденная гемигипоплазия проявляется недоразвитием одной стороны тела. Мышечные атрофии, гипотония не сопровождаются порочной установкой руки и часто сочетаются с черепно-лицевой асимметрией.
Лечение акушерских парезов должно быть ранним, комплексным и непрерывным на всех возрастных этапах. Оно включает ортопедические укладки (лечение положением) как метод профилактики мышечных контрактур, лечебную гимнастику и массаж, физиотерапию, медикаментозную терапию.
Наиболее тяжелым осложнением при акушерских параличах является раннее развитие мышечных контрактур, фиксирующих руку в порочном положении. Поэтому их профилактика должна начинаться уже в родильном доме. Для этой цели используют отводящие шины из гипса, картона, помевика и других материалов (рис 73). Паретичную руку укладывают в положение отведения плеча под прямым углом, наружной ротации, сгибания в локтевом суставе под углом на 100—110°, супинации предплечья (рис 74). Кисть фиксируют лонгетой в тыльном сгибании. Отведение плеча не следует сразу делать под прямым углом, так как это вызывает болевую реакцию у ребенка. Угол отведения плеча первоначально должен составлять 60—70°, постепеннд его доводят до 90°. Таким же образом постепенно увеличивают наружную ротацию плеча, супинацию предплечья и сгибание в локтевом суставе. В нашей клинике Л. Т. Журбой разработана специальная
203
Рис. 73. Отводящие шинки:
А — мягкая шинка, Б — шинка Мизрахи для детей до 4 мес,В—шинка Мизрахи для детей старше 4 мес, корсет мягкой шинки.
мягкая отводящая шинка, которую можно применять в первые 3—4 мес. Преимущество ее состоит в том, что она содержит мягкий стержень, с помощью которого можно менять угол отведения и наружную ротацию плеча, угол сгибания в локтевом суставе и супинацию. Шинка проста в изготовлении, ее может сделать мать под руководством методиста. Менять ее размеры следует в зависимости от возраста ребенка. Корсет шинки мягкий, не нарушает экскурсию грудной клетку, не влияет на общее состояние ребенка. В первые 2—3 пед шинку снимают только на время гигиенических процедур, лечебной гимнастики'!! массажа. Затем по мере восстановления движений ее накладывают на 1 — 1,5 ч 2—3 раза в день, больше времени уделяется лечебной гимнастике, массажу, активным движениям. Через 4—5 мес с нарастанием объема движений
Рис. 74. Положение, в котором надо укладывать паретпчную руку в отводящую шину
204
Рис. 75. Ребенок с акушерским парезом руки в отводящей шине:
а — в возрасте 3,5 мес, б — в возрасте 5 мес, в — в мягкой отводящей шинке, возраст 3 мес
в паретичной руке и развитием двигательных навыков применяют другую шинку, удерживающую руку в вертикальном положении — шинка А. Мизрахи (рис. 75).
Наряду с шинированием руки с первых недель жизни ребенка в комплекс лечебных мероприятий необходимо включать гимнастику и массаж. Лечебная гимнастика при акушерских парезах должна быть индивидуальной в зависимости от типа пареза, стадии заболевания и возраста ребенка. Разработка индивидуальных комплексов при акушерских парезах как в острый, так и в восстановительный периоды должна проводиться невропатологом и врачом ЛФК с учетом патогенеза двигательных нарушений. Лечебная гимнастика в период новорожденное™ носит преимущественно пассивный характер, затем постепенно включаются элементы активности ребенка. Как только ребенок научился сохранять равновесие сидя, стоя и при ходьбе, все упражнения должны носить игровой характер. Положительные эмоциональные реакции во время игр облегчают движения и стимулируют их повторение. В играх, как и при пассивных движениях, необходимо тренировать отведение, наружную ротацию, супинацию, поднимание руки выше горизонтального уровня, отведение ее назад.
Физиотерапевтическое лечение при акушерских парезах включает электрофорез с антихолинэстеразными препаратами (галантамином, прозерином), средствами, улучшающими кровоток в вертебро-базилярной системе (эуфиллином, никотиновой кислотой, компламином), веществами, оказывающими рассасывающее дей
205
ствие (лидазой, пирогеналом, калия йодидом). Широко применяются тепловые процедуры: аппликации озокерита, парафина, горячие укутывания. Они снимают болевой синдром, улучшают кровообращение, уменьшают мышечные контрактуры. При выраженных внутриротаторных и пронаторных контрактурах применяют компрессы с ронидазой. Их удобно делать в домашних условиях. Желательно тепловую процедуру проводить за 30—40 мин до лечебной гимнастики. Начиная с 9—10 мес детям можно назначать электростимуляцию пораженных групп мышц и соответствующих сегментов спинного мозга.
Медикаментозную терапию начинают с периода новорожденности. Показаны тиамин, пиридоксин, цианокобаламин, АТФ, ли-даза, алоэ. Несколько позже подключают галантамин, прозерин, дибазол, пирогенал, компламин.
Лечение акушерских парезов должно быть длительным. Из родильного дома детей переводят в специализированные неврологические отделения, где они находятся в течение 2—5 мес. В стационаре наряду с комплексным лечением проводится обучение родителей ортопедическому режиму и лечебной гимнастике. Это позволяет продолжить лечение ребенка в домашних условиях, В дальнейшем при необходимости дети могут быть повторно госпитализированы. В более старшем возрасте показано санаторно-курортное лечение.
Профилактика акушерских параличей — это рациональное ведение родов и совершенствование акушерской техники.
Парез диафрагмы
Парез диафрагмы развивается при травме диафрагмального нерва, Сз—С5 сегментов спинного мозга или соответствующих корешков (рис 76). Бывает изолированным, но может сочетаться с верхним парезом или тотальным параличом руки. Диафрагмальный нерв чаще травмируется при левостороннем верхнем парезе, так как слева он отделен от плечевого сплетения лишь передней лестничной мышцей, а справа более защищен.
Для пареза диафрагмы характерны дыхательные расстройства: одышка, учащенное нерегулярное дыхание, приступы цианоза. Грудная клетка асимметрична, более выпуклая на стороне пареза, брюшная стенка западает на вдохе и выпячивается на выдохе (парадоксальное дыхание). При аускультации на стороне пареза дыхание ослаблено, иногда прослушиваются единичные хрипы в верхних отделах легких. В период новорожденности и у грудных детей парез диафрагмы может способствовать развитию пневмонии. Парез диафрагмы не всегда выражен клинически и обнаруживается лишь при рентгеноскопии грудной клетки. Купол диафрагмы на стороне поражения стоит высоко и мало подвижен.
При парезах диафрагмы показана активная лечебная гимнастика с акцентом на дыхательных упражнениях. Медикаментоз-
206
Рис. 76. Парез диафрагмы
пая терапия включает витамины группы В, антихолинэстеразные и рассасывающие препараты, средства, улучшающие капиллярный кровоток. На всех этапах лечения необходимо проводить профилактику респираторной инфекции.
Парез лицевого нерва •
В основе заболевания лежит травматическое повреждение периферических ветвей нерва у места выхода из шило-сосцевидного отверстия. Парез лицевого нерва чаще возникает как следствие длительного стояния головки в родовых путях, прижатия ее к костям таза матери, сдавления щипцами, кровоизлияния в ствол нерва или продолговатый мозг. Описаны травматические парезы лицевого нерва, возникшие в результате перелома височной кости в области сосцевидного отростка. Парезы чаще бывают односторонние и проявляются сразу после рождения. Во время крика новорожденного выявляется четкая асимметрия лица, глазная щель на стороне поражения полностью не закрывается, лоб не наморщивается, носогубная складка сглажена, угол рта опущен. Грубый периферический парез лицевого нерва затрудняет сосание, молоко вытекает изо рта. Поисковый рефлекс па стороне пареза угнетен. При поглаживании в области угла рта в сторону раздражителя поворачивается только голова, а угол рта остается неподвижным.
Травматические парезы лицевого нерва следует дифференцировать с врожденной ядерной аплазией (синдром Мебиуса). Па рез лицевого нерва при аплазии бывает двусторонним и в большинстве случаев сочетается с поражением других черепномозговых нервов. Для дифференциальной диагностики можно также использовать электромиографию. При травматическом парезе ли
207
цевого нерва после 10-го дня появляется фибрилляция и улучшается проводимость по нерву. При врожденной аплазии ядер динамики биоэлектрических потенциалов на электромиограмме нет.
Периферические парезы травматического характера имеют тенденцию к быстрому восстановлению иногда и без специфического лечения. При более выраженных изменениях проводится лечение аппликациями озокерита, парафина. Медикаментозная терапия включает тиамин, пиридоксин, цианокобаламин, дибазол, АТФ, лидазу, пирогенал.
Повреждение других периферических нервов
Парез лучевого нерва наблюдается при переломе плеча, некрозе жировой клетчатки на руках. Клиническая картина характеризуется ограничением или полным отсутствием тыльного сгибания кисти и пальцев, невозможностью отведения большого пальца. Прогноз благоприятный. Восстановление наступает в течение 2—3 нед.
Парез седалищного нерва возникает в результате его травмы при внутримышечных инъекциях в ягодичную область или введении аналептиков и кальция хлорида в пупочную артерию новорожденным с последующим тромбозом ягодичной артерии. В таких случаях могут образоваться ишемические некрозы в области ягодиц. Мышечный тонус в ноге снижен, выражена атрофия мышц ягодицы, бедра и голени, ахиллов рефлекс отсутствует, стопа свисает, движения пальцев ограничены. Восстановление функции медленное — в течение нескольких лет.
Парез запирательного нерва у новорожденных и детей раннего возраста встречается редко. Он может быть следствием родовой травмы, а также результатом чрезмерного отведения бедер ребенка в матке. После рождения ноги отведены, ротированы кнаружи и согнуты в коленных суставах, мышечный тонус снижен. Прогноз благоприятный. Восстановление наступает в течение нескольких недель.
глава VI. ПОРАЖЕНИЕ НЕРВНОЙ СИСТЕМЫ ПРИ ГЕМОЛИТИЧЕСКОЙ болезни НОВОРОЖДЕННЫХ
Гемолитическая болезнь новорожденных (врожденный эритробластоз плода) — заболевание, обусловленное несовместимостью крови матери и плода по резус-фактору или группам крови, чаще по системе АВО.
Частота гемолитической болезни новорожденных составляет 1 : 250—1 : 300 родов (В. А. Таболин, 1967; J. Г. Queenan, 1977).
Патогенез. При всех формах гемолитической болезни новорожденных снижена продолжительность жизни эритроцитов вследствие иммуногемолиза. Эритроциты разрушаются внутри сосудов и в ретикулоэндотелиальной системе, высвобождая большое количество непрямого билирубина. Повышение уровня непрямого билирубина обусловлено также недостаточностью ферментных систем печени, участвующих в его инактивации. Имеет значение и нарушение связи билирубина с белком. При нарастании уровня непрямого билирубина в плазме крови истощается ее «билирубинсвязывающая способность» и часть билирубина остается в несвязанном с альбумином состоянии. Непрямой билирубин, проникая через клеточные мембраны, попадает в спинномозговую жидкость, нервную и другие ткани организма, оказывая на них токсическое действие.
Важное значение в патогенезе неврологических нарушений имеет способность непрямого билирубина поражать ткани, богатые липидами, что объясняется повышенной растворимостью непрямого билирубина в липидных субстанциях. Ведущим звеном токсического действия билирубина на ткань является «билирубиновая аноксия». Поражение нервной системы развивается при повышении непрямого билирубина в крови выше 0,1—0,2 г/л. Однако не всегда наблюдается прямая зависимость между уровнем билирубина в крови и тяжестью неврологических нарушений. Поражение нервной системы у недоношенных может наступать и при более низких концентрациях билирубина, поскольку их гематоэнцефалический барьер еще более проницаем для билирубина, чем у доношенных.
Патом орфологи я. Патологические изменения при гемолитической болезни зависят от формы и длительности заболевания. Если ребенок рождается мертвым или умирает в первые сутки после рождения, наблюдается массивный отек плаценты, мозга, паренхиматозных органов и подкожной клетчатки. Выявляются грубые дистрофические изменения в сердечной мышце. При желтушной форме гемолитической болезни в ранней стадии
8 143
209
заболевания обнаруживается интенсивное желтушное прокрашивание подкорковых ядерных образований мозга — зрительного бугра, хвостатого и чечевичного ядер, а также зубчатого ядра мозжечка и ядер ствола мозга. Деструктивные изменения в нервных клетках представлены набуханием клеток и перицеллюлярным отеком, наряду с которым отмечается пикноз протоплазмы и ядер нервных клеток. Характерны также кариоцитолизис с образованием «клеток-теней» и появлением полей опустошения в связи с гибелью нервных клеток. У детей, умерших в возрасте после 1 года, изменения в нервной системе характеризуются обеднением мозга нервными клетками, выраженным реактивным глиозом, образованием полостей и кист, расширением желудочков мозга, микрогирией и, нередко, вторичной микроцефалией.
Клиническая картина гемолитической болезни у новорожденных проявляется в трех формах: общего врожденного отека, тяжелой желтухи и врожденной анемии, симптомы которых могут быть выражены в различной степени и сочетаться друг с другом.
При отечной форме неврологические нарушения проявляются клиникой отека мозга. Дети находятся в глубоком коматозном состоянии, нет реакции на слуховые и зрительные раздражители. Патология со стороны черепномозговых нервов представлена плавающими движениями глазных яблок, отсутствием реакции зрачков на свет, корнеальных и конъюнктивальных рефлексов. Нарушено сосание и глотание. Выражены вегетативные нарушения, проявляющиеся расстройством терморегуляции и сердечно-сосудистой деятельности. Отмечается глубокая степень мышечной гипотонии с отсутствием сухожильных и периостальных рефлексов. Безусловные рефлексы не вызываются. Развивающийся судорожный синдром усугубляет отек мозга, внутренних органов и приводит к летальному исходу в первые часы или сутки после рождения. Диагностике отечной формы гемолитической болезни помогают характерные особенности внешнего вида ребенка: выражен отек подкожной клетчатки, резкая бледность кожных покровов и слизистых оболочек. Для отечной формы не характерна желтушность кожных покровов. Анемия резко выражена (гемоглобин ниже 80 г/л).
Наиболее частым вариантом гемолитической болезни новорожденных (89%) является желтушная форма. Неврологические нарушения при ней характеризуются общемозговыми симптомами: беспокойством, нарушением сна, рвотой, частыми срыгиваниями, тремором рук и подбородка. Периоды возбуждения могут сменяться резко выраженной вялостью, сонливостью ребенка, когда дети малоподвижны, неохотно сосут. Патология черепномозговых нервов представлена глазодвигательными нарушениями (сходящееся косоглазие, парез взора, феномен «кукольных глаз»). Наиболее характерен симптом «заходящего солнца», который ука-210
зывает на повышение внутричерепного давления и вовлечение в патологический процесс четверохолмия.
Двигательные нарушения проявляются мышечной гипотонией, угнетением сухожильных и безусловных рефлексов, снижением уровня спонтанных движений. При тяжелом поражении нервной системы на фоне мышечной гипотонии возникают дистонические атаки (приступообразное повышение мышечного тонуса). Мышечный тонус нарастает в основном в разгибательных группах мышц и ребенок приобретает позу опистотонуса. Длительность дистонической атаки несколько секунд. Она провоцируется возбуждением, болевыми раздражениями, сомато-вегетативными расстройствами.
Ухудшение состояния ребенка в виде нарастающей вялости, судорог, потери сознания и развития коматозного состояния с угнетением всех функций может быть связано с усиливающимся метаболическим ацидозом и развитием отека мозга. В этих случаях нередко наступает летальный исход. Развитию отека мозга при гемолитической болезни новорожденных способствует асфиксия в родах. Ядерная желтуха тяжелее протекает у недоношенных детей.
После острого периода (спустя 5—10 дней) выраженность общемозговых симптомов уменьшается. Постепенно на первый план выступают очаговые неврологические нарушения, формируется клиника детского церебрального паралича. Мышечная дистония становится постоянным симптомом. В периоды нарастания мышечного тонуса активизируются тонические шейные и лабиринтные рефлексы, которые приводят к развитию патологических поз и установок. Уже в грудном возрасте можно отметить гиперкинезы, которые становятся более выраженными на 2—3-м году жизни.
Характерна задержка психо-моторного и речевого развития. Наблюдаются также разнообразные проявления со стороны вегетативной нервной системы: нарушение терморегуляции, питания, снижение адаптационных механизмов.
При анемической форме гемолитической болезни симптомы поражения нервной системы менее выражены и характеризуются нарушением сна, вялостью, срыгиванием, снижением аппетита.
Гемолитическая болезнь, связанная с групповой несовместимостью, у новорожденных протекает часто в форме легкой желтухи, напоминающей физиологическую. Однако в дальнейшем могут развиваться тяжелые нарушения со стороны нервной системы.
Лечение гемолитической болезни должно быть направлено на немедленное удаление из организма ребенка токсических продуктов гемолиза и антител, а также на стимуляцию обменных процессов в печени. Наиболее эффективным средством является заменное переливание крови, проведенное сразу после рождения, в объеме 150—170 мл/кг массы новорожденного. При этом
8*
211
выводится 85—90% резус-положительной крови ребенка. Нейротоксическое действие непрямого билирубина уменьшается введением альбумина (1—2 г/кг) или плазмы до переливания крови. Наряду с заменным переливанием крови дети должны получать дезинтоксикационную терапию: внутривенное или капельное вливание глюкозы, раствора Рингера, плазмы. С целью нормализации функции печени назначаются витамины группы В, метионин. При ацидозе вводят 5% раствор натрия бикарбоната. С целью снижения гипербилирубинемии используется также фенобарбитал и фитотерапия. При наличии антител в молоке матери ребенка в первые 2 нед не прикладывают к груди и кормят донорским молоком с добавлением альбумина. Лечение проводят под контролем билирубина плазмы крови, который измеряют каждые 8—12 ч.
Лечебные мероприятия после периода новорожденности должны быть направлены на профилактику задержки возрастного психомоторного развития, синдрома детского церебрального паралича (лечебная гимнастика, массаж, стимуляторы).
Профилактика гемолитической болезни новорожденных складывается из нескольких этапов. Медико-генетическое консультирование включает тщательный генеалогический анализ, определение резус- и групповой принадлежности супругов. Женщины с резус-отрицательной кровью берутся на учет, за ними устанавливается диспансерное наблюдение. Особое внимание обращается на женщин, имевших в анамнезе переливание крови без учета резус-фактора, предшествующие данной беременности аборты, самопроизвольные выкидыши, мертворождения, а также рождение детей с гемолитической болезнью. На протяжении беременности у этого контингента женщин в динамике исследуется титр антител. При появлении антител проводится профилактическое лечение, которое включает оксигенотерапию, витамины Е, глюконат кальция, поливитамины, применение антирезусного иммуноглобулина.
Глава vil. ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫ
Врожденные инфекционные заболевания с поражением нервной системы
Многие патогенные микроорганизмы бактериальной и вирусной природы, а также простейшие, попадая в организм женщины во время беременности или до нее, могут поражать плаценту и развивающийся плод. В структуре перинатальной заболеваемости и смертности внутриутробным инфекциям принадлежит важное место. Возбудителями внутриутробной инфекции могут быть вирус краснухи, цитомегаловирус, вирусы гриппа, herpes simplex, энтеровирусы, вирусы кори, паротита и другие вирусы, бледная спирохета, палочка Коха и прочие (Г. Фламм, 1962; Н. L. Moffet, 1975; Н. R. Hill, 1977).
Удельный вес различных инфекций в развитии внутриутробной патологии не одинаков. Нет прямой зависимости между частотой и характером инфекционных заболеваний матери и инфицированием плода. При таких сравнительно частых инфекциях, как аденовирусная, грипп, плод поражается редко. В то же время частота нарушений развития плода высока при краснухе, которая у взрослых встречается довольно редко. Сравнительно легкие заболевания матери могут вызывать тяжелые эмбрпопатии и наоборот.
Наиболее частый путь проникновения инфекций к плоду — трансплацентарный. Бактерии и простейшие проникают через плаценту в кровоток плода вследствие деструкции эпителия и стромы ворсин плаценты, а также эндотелия фетальных капилляров. Вирусы могут проникать к плоду через неповрежденную плаценту. Повышение проницаемости плацентарного барьера наблюдается при токсикозах беременности, различных заболеваниях и ослаблении организма женщины.
Другим путем проникновения инфекции является инфицирование околоплодных вод при преждевременном вскрытии плодного пузыря и длительных родах, септических состояниях роженицы и др.
Аспирация и заглатывание инфицированной амниотической жидкости могут привести к заражению плода.
При воздействии возбудителя на плод в период органогенеза и плацентации нарушается нормальный процесс закладки п дифференцировки органов и систем, что приводит в большинстве случаев к нарушениям, не совместимым с жизнью, и самопроизвольному аборту. При более позднем воздействии могут быть врожденные пороки развития, внутриутробная гибель плода или задержка внутриутробного развития с поражением различных тканей и органов.
213
Частота гибели плодов от инфекции составляет 17—34% по отношению к общему показателю перинатальной смертности (А. П. Кирющенков, 1978). При инфекциях, возникших во второй половине беременности, часто наблюдаются преждевременные роды (20% и более). В ряде случаев, преимущественно при воздействии возбудителя на сформированный плод, внутриутробная инфекция проявляется тотчас или вскоре после рождения теми или иными симптомами. Наконец, инфицирование плода может не сопровождаться никакими симптомами и выявляется при серологическом исследовании (высокий титр антител к тому или иному микроорганизму) либо вследствие экскреции возбудителя.
Врожденные инфекционные поражения центральной нервной системы представляют собой группу заболеваний раннего детского возраста.
Врожденная краснуха. Вирус краснухи обладает наиболее выраженным тератогенным действием. Частота поражения плода при заболевании матери краснухой в первом триместре беременности составляет от 16 до 59% (J. A. Forbes, 1969). По данным А. П. Кирющенкова (1978), инфицирование плода при заболевании матери в этот период достигает 70—80%. Этим обусловлена высокая частота пороков развития. Врожденные уродства наблюдаются в 61% случаев при заболевании матери в течение первого месяца беременности, в 26% — в течение второго и в 8% — в течение третьего. Возможно инфицирование плода и в поздние сроки беременности.
Предполагают, что вирус краснухи попадает в плод через кровоток матери в период виремии. При этом он поражает эпителиальные покровы ворсин хориона и эндотелий капилляров плаценты, в виде мельчайших эмболов заносится в кровоток плода и диссеминирует в тканях. Формирование врожденных аномалий развития под воздействием хронической инфекции может быть опосредовано несколькими механизмами: прямым цитодест-руктивным действием возбудителя, селективной ингибицией роста клеток, воздействием вируса на клетку либо на ее генетический аппарат; ишемией и гипоксией тканей плода в результате поражения сосудов плаценты.
Патом орфолог и я. При исследовании плодов и новорожденных, зараженных вирусом краснухи, главным образом выявляют сосудистые изменения в различных органах. Преимущественно поражается эндотелий мелких сосудов и капилляры, что приводит к множественным петехиальным кровоизлияниям и присутствию вокруг очагов поражения фагоцитов, нагруженных гемосидерином.
Воспалительные изменения представлены в основном лимфоцитарной инфильтрацией.
Клиническая картина. Для врожденной краснухи характерны множественные врожденные пороки и аномалии раз-214
вития, а также воспалительные изменения различных органов. «Классический синдром краснухи», описанный еще N. М. Gregg в 1942 г., включает катаракту, пороки сердца и глухоту. Во время эпидемии краснухи в США в 1964—1965 гг. М. Siegel и др. (1971) провели тщательное клиническое обследование 376 детей, родившихся от матерей, перенесших краснуху. Они установили, что хроническая внутриутробная краснушная инфекция нередко поражает и нервную систему. Это проявляется клиникой вялотекущего менингоэнцефалита, микроцефалией, гидроцефалией.
Неврологические симптомы могут обнаруживаться сразу же после рождения ребенка. Характерно повышение мышечного тонуса, резкое звучание лабиринтного и шейных тонических рефлексов. Отсутствие реакции на окружающее может быть связано как с патологией формирования зрительного и слухового анализаторов, так и с нарушением других отделов центральной нервной системы. У большинства больных с врожденными неврологическими нарушениями можно выявить отчетливые признаки дизэмбриогенеза в виде аномалий лицевого скелета, прогнатизма, эпиканта, деформации ушных раковин, высокого нёба и др.
Иногда неврологические нарушения отсутствуют в период новорожденности, а появляются несколько позже. Ребенок становится вялым, сонливым или, наоборот, возбужден. Большой родничок увеличен, напряжен. Повышается мышечный тонус. Могут присоединяться судороги, гиперкинезы.
Характерно отставание в психическом развитии. У детей могут также обнаруживаться пороки развития других органов (сердца, почек, надпочечников, кишечника), а также аномалии развития скелета. Характерное неонатальное проявление краснухи — тромбоцитопеническая пурпура, которая наиболее выражена в течение первой недели жизни. Типичными проявлениями в период новорожденности являются также гепатоспленомегалия, гепатит с высоким содержанием билирубина в крови, гемолитическая анемия с ретикулоцитозом, интерстициальная пневмония.
У детей с врожденной краснухой при рождении снижены масса и рост. В дальнейшем показатели массы и роста отстают от нормы.
Диагноз. В спинномозговой жидкости обнаруживают белково-клеточную диссоциацию. Рентгенологически может быть выявлено разрежение костной ткани, чередующееся с участками уплотнения. В отличие от подобных поражений при сифилисе костные изменения при краснухе исчезают в течение 1— 2 мес.
На ЭКГ — изменения, сходные с таковыми при инфаркте миокарда.
У 89—90% новорожденных, матери которых перенесли краснуху в ранние сроки беременности, можно выделить вирус из
215
носоглотки, крови, ликвора, конъюнктивальной жидкости, костного мозга, мочи. Вирус присутствует в организме от нескольких месяцев до года, поэтому ребенок с врожденной краснухой является источником инфекции. Для диагностики заболевания применяют также серологические исследования.
Профилактика. Заболевание женщины краснухой в первые 3 мес беременности является абсолютным показанием для ее прерывания. В случае контакта беременной женщины с больным краснухой в течение 10—12 дней с момента контакта необходимо провести серологическое обследование.
Врожденная цитомегалия. Основной путь проникновения цитомегаловируса в организм плода беременной женщины — носительницы вируса — трансплацентарный. Однако возможно и заражение ребенка во время родов при прохождении его через инфицированные родовые пути матери. В настоящее время установлено, что частота инфицирования цитомегаловирусом беременных женщин составляет около 6% (А. П. Кирющенков, 1978). Вирус вызывает в плаценте специфические изменения в виде периваскулярных гранулем, содержащих типичные гигантские клетки.
Генерализация инфекции внутриутробно приводит к поражению многих органов, врожденным уродствам и довольно часто заканчивается гибелью плода или новорожденного.
Основными симптомами цитомегаловирусной инфекции у новорожденных являются: гепатоспленомегалия, желтуха, тромбоцитопения, неврологические расстройства, интерстициальные пневмонии с коклюшеподобным течением. Эти нарушения могут сочетаться с пороками развития глаз, внутренних органов и нервной системы. По данным С. А. Демидовой с соавторами (1976), поражение головного мозга наблюдается у 15,7% детей, умерших от цитомегаловирусной инфекции.
Патоморфология. Среди пороков нервной системы при цитомегалии описаны микроцефалия, микрогирия, макрогирпя, порэнцефалпя, пороки развития лимбической системы, аплазия или гиперплазия мозжечка, нарушение архитектоники вещества головного мозга.
Патология нервной системы при цитомегаловирусной инфекции может быть охарактеризована также как подострый или хронический менингоэнцефалит. Патологические изменения выражены в сосудах и веществе головного мозга, мозговых оболочках. Сосуды расширены, полнокровны, вокруг сосудов точечные кровоизлияния. Иногда наблюдаются крупные паренхиматозные субарахноидальные кровоизлияния. Мозговая ткань местами некротизирована, с очагами обызвествления. Характерна узелковая, диффузная и периваскулярная реакция глии. В мягких мозговых оболочках обнаруживаются изменения продуктивного характера, иногда наблюдаются гнойные менингиты. Патологические изменения в нервной системе при цитомегалии распо
216
лагаются преимущественно в периваскулярных зонах больших полушарий.
Клиническая картина. Признаки поражения нервной системы появляются сразу после рождения или в первые месяцы жизни ребенка. Симптомы у новорожденных напоминают внутричерепную родовую травму. Эти состояния бывает очень трудно дифференцировать, тем более, что врожденная цитомегалия часто осложняется внутричерепными кровоизлияниями вследствие тромбоцитопении и поражения сосудов головного мозга.
Дети рождаются вялыми, плохо сосут, мышечный тонус снижен, безусловные рефлексы угнетены, нередки судороги, тремор. Прогрессирует гидроцефалия. Частые рвоты. Дети плохо прибавляют в массе, резко отстают в психическом развитии. Мышечная гипотония постепенно сменяется высоким тонусом. Иногда мышечная гипертония наблюдается с рождения. Отсутствие положительной динамики в состоянии ребенка, наличие множественных диспластических черт, сочетающихся с пороками глаз и внутренних органов, может свидетельствовать о наличии внутриутробной инфекции.
У некоторых детей симптомы поражения нервной системы при рождении отсутствуют, а появляются лишь на 2—3-м месяце жизни. Нарушается сон, аппетит, дети теряют в массе, отмечаются судорожные припадки, частота и тяжесть которых постепенно нарастают. Возможно прогрессирование гппертензион-по-гидроцефального синдрома или, наоборот, формирование вторичной микроцефалии. Больные отстают в психомоторном развитии, часто болеют респираторными заболеваниями, в том числе и бронхопневмониями. Постепенно нарастает гипотрофия. Иногда симптомы поражения нервной системы развиваются на фоне клинически выраженного цитомегаловирусного поражения других органов.
Следует отметить, что проявления врожденной цитомегаловирусной инфекции в период новорожденности и раннего развития могут быть незначительными либо вовсе отсутствовать. Однако в последующем нередко дети с этой патологией плохо успевают в школе, у них могут быть симптомы минимальной мозговой дисфункции.
Е. Rossi (1968) считает, что цитомегаловирусные энцефалиты встречаются чаще, чем диагностируются. Об этом свидетельствуют выраженные патоморфологические изменения мозга у детей с цитомегалией при отсутствии клинических признаков поражения нервной системы.
Диагноз цитомегалии ставится на основании вирусологического исследования крови, мочи, отделяемого пз носоглотки или их цитологического изучения. Для цитомегалии характерно наличие гигантских клеток, превышающих размеры нормальных в 2—4 раза, с гомогенным включением, занимающим почти все ядро. Диагноз подтверждается также с помощью определения
217
Рис. 77. Изменения в мозговой ткани при токсоплазмозе:
а _ петрификация стенки сосуда, б — петрификация ганглиозных клеток
Профилактика. Принимая во внимание опасность заражения вирусом герпеса при прохождении плода через инфицированные родовые пути матери, некоторые акушеры рекомендуют прибегать у таких больных к абдоминальному родоразре-шению. При подозрении на герпетическую инфекцию матери новорожденного следует изолировать на 12—14 дней.
Врожденный токсоплазмоз. Инфицирование плода токсоплаз-мой может происходить в любой период беременности. Источником инфекции является беременная женщина, больная острым или латентным токсоплазмозом. Беременность провоцирует обострение латентной формы заболевания. В период паразитемпи токсоплазмы током крови заносятся в ткани матки пли в плаценту.
При инфицировании плода в период органогенеза токсоплаз-ма вызывает настолько тяжелые изменения, что беременность заканчивается самопроизвольным выкидышем или рождением ребенка с пороками развития, не совместимыми с жизнью. Такие дети обычно погибают в ближайшее время после рождения. При более позднем заражении плода острый период токсоплазмоза может закончиться внутриутробно. В этом случае ребенок рождается с выраженными рубцовыми изменениями мозга, глаз, внутренних органов. Иногда ребенок рождается в период генерализации внутриутробной инфекции с текущими воспалительно-дегенеративными изменениями нервной системы, глаз и внутренних органов. При заражении плода в конце беременности ребенок рождается здоровым, а первичная генерализация и острый период токсоплазмоза наступают уже после рождения.
Патом орфология (рис. 77). При врожденном токсоплазмозе обнаруживают деструктивные изменения и кальцифи-каты в головном и спинном мозге, пигментный хориоретинит. Некротические очаги в коре, базальных ганглиях, мозжечке,
219
перивентрикулярных областях, спинном мозге образуются в результате тромбоваскулита. В очагах некроза и вокруг них обнаруживаются токсоплазмы в виде псевдоцист. В дальнейшем в некротических очагах откладывается известь. Кальцификации могут подвергаться и сами паразиты. Крупные петрификаты можно обнаружить на рентгенограмме, а мелкие — только при гистологическом исследовании. Часто наблюдается обызвествление сосудистой стенки. Степень патологических изменений в мозге широко колеблется от небольших очагов деструкции до глубокого недоразвития мозга с явлениями гидроцефалии При хориорети-ните в области желтого пятна обнаруживают овальной формы, беловато-желтого цвета диск, который образуется на месте воспалительно-некротического очага в результате разрастания соединительной ткани и атрофии сосудов сетчатки. В некоторых случаях очаги некроза находят в печени, почках, легких, миокарде.
Клинические проявления врожденного токсоплазмоза вариабельны — от тяжелых пороков развития и выраженных нарушений со стороны нервной системы и глаз до легких мало-симптомных форм. Среди пороков развития нервной системы при токсоплазмозе наиболее частыми являются анэнцефалия, микроцефалия, гидроцефалия, мозговые грыжи. При заражении в более поздние сроки беременности ребенок родится с текущим менингоэнцефалитом или с его последствиями. Дети беспокойны или, наоборот, вялы, малоактивны, плохо сосут, теряют в массе. Наблюдаются нистагм, косоглазие, мышечная гипертония, судороги, задержка психического развития. При заражении в последние месяцы беременности наиболее выражены симптомы острого заболевания: высокая температура, общая интоксикация, срыгивание, рвота, дыхательные расстройства, повышение мышечного тонуса, судороги, гепато-лиенальный синдром, анемия, лимфоаденопатия.
У детей первых недель и месяцев жизни острые токсоплазмозные энцефалиты протекают особенно тяжело и часто заканчиваются летально. Наряду с этим одним из вариантов течения врожденного токсоплазмоза является субклиническая инфекция, протекающая в течение длительного промежутка времени мало-симптомно, в основном с общесоматическимп проявлениями. Иногда единственным клиническим признаком врожденного токсоплазмоза может быть прогрессирующая гидроцефалия или задержка психического развития.
Кроме поражения центральной нервной системы наиболее частым симптомом врожденного токсоплазмоза является хориоре-тинит. Возможны также неспецифические эндокринные нарушения, нефротический синдром, дисфункция печени, внутрикожные кровоизлияния вследствие тромбоцитопении, миокардит, глухота. Иногда врожденный токсоплазмоз может проявляться эритробластозом и водянкой плода.
220
К резидуальным симптомам врожденного токсоплазмоза относятся задержка физического развития, нарушение порядка и сроков окостенения и прорезывания зубов, замедление полового созревания, гидроцефалия, параличи, парезы, гиперкинезы, речевые нарушения, судороги, отставание в психическом развитии, атрофия зрительного нерва, катаракта, тугоухость, различные эндокринные расстройства и др.
Диагноз врожденного токсоплазмоза сложен вследствие вариабельности клинических проявлений. Наиболее постоянным признаком является неспецифическое изменение спинномозговой жидкости. Даже при отсутствии симптомов инфекции и поражения нервной системы в ликворе обнаруживаются лимфоцитоз и повышение уровня белка, которые стойко сохраняются в течение 3 и более месяцев.
При рентгенологическом исследовании черепа выявляются характерные для врожденного токсоплазмоза кальцификаты. Они чаще бывают множественными, располагаются симметрично, билатерально, могут быть обнаружены в различных отделах мозга, но наиболее часто в сосудистых сплетениях и мозжечке. Размеры кальцифпкатов обычно не превышают 1—2 мм, реже они достигают 3—4 п даже 10 мм в диаметре. Количество и величина кальцифпкатов могут изменяться в разные периоды болезни.
В крови могут быть лейкоцитоз или лейкопения, лимфо- и моноцитоз, эозинофилия. В острый период заболевания с помощью гистологического исследования и реакции иммунофлуоресценции можно обнаружить возбудителя в костном мозге, биологических жидкостях, биопсированных тканях. Существуют также серологические тесты для выявления специфических антител в крови и спинномозговой жидкости. Положительная внутрикожная аллергическая проба с токсоплазмином подтверждает диагноз.
Лечение токсоплазмоза состоит в назначении антима-лярийного препарата пириметамина (дараприм, хлоридин) по 0,2 мг/кг каждые 12 ч, но не более 10 мг в сутки, внутрь. Одновременно назначают сульфадимезин по 25—50 мг/кг в сутки внутрь. Курс лечения — 21 день. В случаях выраженной неврологической спптоматики курс лечения повторяют. Сульфадимезин можно заменять другими сульфаниламидами, по они менее эффективны при токсоплазмозе. Лечение более эффективно, если заражение произошло в последние месяцы беременности.
Проф и л а к т и к а. Если беременная женщина больна токсоплазмозом, то для сохранения беременности и рождения здорового ребенка в начале и в конце беременности проводят по 1—2 курса противотоксоплазмозной терапии.
Врожденный листериоз. Основным источником инфекции являются зараженные листериями продукты питания животного происхождения. Листериоз среди беременных женщин встречается значительно чаще, чем в общей популяции. Это связано
221
Рис. 78. Лимфоцитарная инфильтрация мозга с очагом некроза при листериозе
с повышенной чувствительностью мочеполовых органов беременной женщины к листериям, обусловленной, по-видимо-му, гормональными сдвигами. Листерии проявляют также тропизм к плацентарной и эмбриональной ткани.
Инфицирование плода происходит трансплацентарным путем. С током крови возбудители разносятся по различным органам и тканям плода. Антенатальное заражение в ранние сроки беременности приводит в большинстве случаев к гибели плода. Высокая частота само
произвольных выкидышей при листериозном заражении обусловлена, по-видимому, также особым токсическим веществом, выделяемым возбудителем и усиливающим сократительную функцию матки.
Клиническая картина. Внутриутробный листериоз проявляется в виде генерализованного гранулематоза с поражением многих органов и тканей. На коже, в зеве, гортани, миндалинах, мозговых оболочках, мозге, печени и других внутренних органах обнаруживаются специфические высыпания, представляющие собой узелки, содержащие большое количество возбудителей инфекции (рис. 78).
Листериоз нервной системы — это обычно одно из проявлений генерализованного листериоза. Возбудитель заболевания попадает в мозг с током крови, что приводит к милиарному обсеменению и поражению тканей. Листериоз нервной системы чаще всего бывает в форме менингита пли менингоэнцефалита, реже энцефалита, не отличимых клинически от заболеваний другой этиологии. Листериозный менингит по клиническому течению и показателям ликвора может быть сходен с туберкулезным менингитом. Энцефалит обычно острый и приводит к летальному исходу в течение нескольких дней.
Патоморфологически в мозге детей, умерших от листериозного менингита или энцефалита, обнаруживают гиперемию и пропитывание тканей ликвором. При энцефалите типичные мелкие гранулемы (листериомы) локализуются преимущественно в варолиевом мосту и продолговатом мозге. При менингоэнцефалите субмилпарные и милиарные узелки обсеменяют мягкие мозговые оболочки. Листериозная воспалительная реакция может быть также и гнойной, преимущественно в оболочках мозга.
Диагноз листериозного поражения нервной системы при жизни подтверждается выделением возбудителя из спинномоз
222
говой жидкости, крови, костного мозга, гнойных экссудатов, отделяемого носоглотки, мочи, кала и др., а также серологическими исследованиями.
Лечение проводится антибиотиками, к большинству которых возбудитель листериоза обычно чувствителен.
Эффективно применение ампициллина. При врожденном листериозе его назначают двумя курсами: с 1-го по 7-й день жизни по 250 мг внутримышечно 2 раза в день и с 8-го по 21-й день по 125 мг 3 раза в день внутрь.
Профилактика. При подозрении на листериоз у беременных (лихорадочные состояния, рецидивирующие пиелиты, ранняя детская смертность в анамнезе) показано серологическое исследование и проведение курса профилактической терапии.
Врожденные энтеровирусные поражения центральной нервной системы. Антенатальная патология нервной системы может быть следствием поражений, вызванных вирусом Коксаки или вирусом полиомиелита. Установлено, что эстрогены оказывают тормозящее влияние на восприимчивость организма к вирусу полиомиелита. При беременности действие эстрогенов подавляется прогрессирующей продукцией прогестерона, и восприимчивость к вирусу повышается. Поэтому беременные женщины болеют полиомиелитом в 2—4 раза чаще, чем небеременные. Энтеровирусы попадают в организм плода трансплацентарно и оральным путем при заглатывании инфицированных околоплодных вод.
Пороки развития при энтеровирусных заболеваниях плода наблюдаются редко. Нарушения со стороны нервной системы проявляются либо поражением оболочек, либо полиоэнцефалитами.
Патоморфология. При энтеровирусных поражениях центральной нервной системы находят отек, набухание и легкую клеточную инфильтрацию мозговых оболочек. Поражение головного и спинного мозга обычно диффузное в виде мелких очагов эозинофильной дегенерации нейронов, скоплений одноядерных и глиальных клеток, и периваскулярных муфт. В тяжелых случаях можно обнаружить очаги размягчения спинного мозга, гибель мотонейронов, кисты, вакуолизацию ядер в передних рогах спинного мозга, явления артериита.
Клиническая картина врожденного полиомиелита или полпомиелитоподобного заболевания у новорожденных характеризуется такими симптомами, как выраженная сонливость, малоподвижность, глубокая мышечная гипотония, угнетение безусловных рефлексов, нарушение дыхания, цианоз, нарушение сосания и глотания. Дети погибают обычно в 1-ю неделю жизни от аспирационной пневмонии.
В случаях с преимущественным поражением оболочек мозга клиническое течение может быть более легким. Дети вялые, много спят, плохо сосут, не прибавляют в массе, часты рвоты. Большой родничок выбухает или, наоборот, западает. Могут наблюдаться судороги.
223
Рис. 79. Инфильтрация мягкой мозговой оболочки лимфоидными и плазматическими клетками при сифилитическом менингите. В сосуде явления продуктивного эндарте-риита
В ликворе выявляются ци-тоз лимфоцитарного характера, повышение количества сахара.
Диагноз врожденного полиомиелита или поражения нервной системы, вызванного вирусом Коксаки, подтверждается вирусологическими п серологическими исследованиями.
П р о ф и л а к т и к а. В случаях вспышки заболевания беременным женщинам проводят иммунизацию специфической вакциной и одновременно вводят гамма-глобулин.
Врожденный сифилис. Врожденный сифилис в настоящее время встречается редко. Внутриутробное инфицирование
бледной спирохетой крайне опасно для плода и новорожденного. В 0,3—0,8% случаев врожденный сифилис является причиной рождения мертвого плода.
Инфицирование плода происходит от беременной женщины, страдающей активной или скрытой формой сифилиса. Бледная спирохета попадает в кровоток плода через эпителиальный покров ворсин плаценты обычно между 6-м и 7-м месяцами беременности и реже раньше этого срока. Возбудитель интенсивно размножается в тканях плода, вызывая в них специфические изменения. После развития висцерального сифилиса возможно повторное проникновение спирохет по пупочным артериям в плаценту, приводящее к ее выраженным дистрофическим изменениям. Это способствует развитию хронической гипоксии плода.
Пато морфологи я. Изменения в центральной нервной системе при врожденном сифилисе аналогичны таковым при приобретенном, за исключением паренхиматозного процесса, который наблюдается крайне редко. Поражение мягких мозговых оболочек (рис. 79) имеет характер диффузного или очагового гуммозного менингита. Поражение оболочек приводит к их обесцвечиванию и утолщению вследствие инфильтрации плазматическими клетками и гистиоцитами. Эти изменения локализуются главным образом на основании мозга, особенно в области ствола и хиазмы.
Исходом воспалительного процесса является фиброз с образованием спаек, облитерирующих субарахноидальное пространство.
Поражение тканей мозга обусловлено сифилитическим эндар-териитом с тромбозами и аневризмами, локализация и распро
224
страненность которого могут варьировать. Характерны также дефекты формирования мозга, такие, как микрогирия, порэнцефа-лия, задержка развития тех или иных отделов.
Клиническая картина. Выделяют две клинические формы врожденного сифилиса — раннюю и позднюю. Поражение нервной системы может быть обнаружено как при раннем, так и при позднем врожденном сифилисе. При раннем врожденном сифилисе поражение нервной системы может проявляться в форме острого лептоменингита, подострого менингоэнцефалита или цереброваскулярных синдромов.
Специфический менингит — наиболее частая и типичная форма раннего врожденного сифилиса. Одним из ранних симптомов его является «беспричинный» крик ребенка, связанный с повышением внутричерепного давления. Большой родничок выбухает, обнаруживаются положительный симптом «заходящего солнца», частые рвоты. Преимущественная базальная локализация процесса обусловливает частое поражение черепномозговых нервов. Наиболее демонстративными у детей грудного возраста являются глазодвигательные расстройства. Симптомы обычно нарастают постепенно. При вовлечении в процесс вещества мозга присоединяются судороги, парезы. Облитерация сосудов вследствие артериита или разрыва аневризмы характеризуется внезапным ухудшением состояния ребенка и развитием коматозного состояния.
Значительно чаще поражение мозга в период новорожденности клинически не проявляется, но может сопровождаться изменением состава спинномозговой жидкости: увеличением количества клеток (100—200 лимфоцитов в 1 мкл) и содержания белка. В ряде случаев в ликворе обнаруживается примесь крови. Уже в период новорожденности ликвор обычно дает положительную реакцию со специфическим антителом.
Другими проявлениями раннего врожденного сифилиса могут быть гепатоспленомегалия, генерализованная лимфоаденопатия, анемия, тромбоцитопения, высыпания на коже и слизистых оболочках различного характера, нефроз, болезненное разрежение или переломы костей вследствие сифилитического остеохондрпта (псевдопаралич Парро), хориоретинит и другие изменения глаз.
Поздний врожденный сифилис характеризуется наличием так называемой триады Гатчинсона (неправильная форма верхних средних резцов с полулунной вырезкой, интерстициальный кератит, неврогенная глухота), деформацией черепа в виде выбухания лба («олимпийский лоб»), западением корня носа и Другими нарушениями костей и суставов. Поражение центральной нервной системы прп позднем врожденном сифилисе может варьировать от изолированного изменения состава ликвора до клинических симптомов различной степени выраженности: задержки психического развития, прогрессирующей гидроцефалии, судорог, парезов скелетных мышц, поражения черепномозговых нервов. Череп при сифилитической гидроцефалии характерпзу-
225
ется удлиненной формой вследствие раннего окостенения швов, расхождением венечного шва с типичным уплотнением его краев.
Диагноз врожденного сифилиса подтверждается обнаружением спирохет в спинномозговой жидкости или в кожных высыпаниях, а также серологическими тестами.
Лечение врожденного нейросифилиса: пенициллин каждые 3 ч в течение 10—12 дней, всего — 100 инъекций. Доза на одну инъекцию — 1000 ЕД/кг.
Менингиты
Менингит — воспаление мозговых оболочек. Возбудителями заболевания могут быть бактерии, грибки, простейшие, вирусы. В зависимости от характера изменений спинномозговой жидкости менингиты подразделяются на гнойные и серозные. Гнойные менингиты вызываются главным образом бактериями и грибками, серозные — вирусами. К серозным менингитам относится также и туберкулезный менингит. Если возбудитель, попадая в организм, вызывает изменения в мозговых оболочках без предшествующего заболевания других органов, говорят о первичной форме менингита. Вторичные менингиты развиваются на фоне общего или локального инфекционного процесса. Наиболее распространенной формой первичного менингита у детей раннего возраста является менигококковый менингит. Он встречается преимущественно в возрасте 1—4 лет. У детей до 1 года преобладают вторичные менингиты, причем в возрасте до 2 мес в основном встречаются менингиты, вызванные кишечной палочкой и стрептококком, от 2 до И мес — пневмококковые менингиты.
Серозные менингиты у детей раннего возраста чаще всего обусловлены энтеровпрусами.
Характер поражения оболочек при менингитах определяется спецификой возбудителя и реактивностью организма, так что в отдельных случаях при патоморфологическом исследовании мозга на первый план могут выступать очаговые воспалительные изменения оболочек, в других — генерализованные изменения воспалительно-аллергического характера, в том числе отек мозга и внутренняя гидроцефалия. Эти варианты отражают разнообразие клинической симптоматики при менингитах.
При патологоанатомическом исследовании находят локальное или генерализованное воспаление мозговых оболочек. В одних случаях воспалительная реакция проявляется преимущественно продуктивным процессом (гнойные менингиты), в других —- экссудативным (серозные менингиты), для туберкулезного менингита характерна экссудативно-продуктивная воспалительная реакция по ходу сосудов с вторичным ишемическим поражением тканей и спаечным процессом.
По клиническому течению менингиты подразделяются на молниеносные, острые, подострые и хронические. Для бактериальных 226
и вирусных менингитов более характерно молниеносное и острое течение; для туберкулезных — подострое или хроническое. Однако реактивность организма может изменять характер течения. Кроме того, клинические проявления в значительной мере определяются локализацией воспалительного процесса в том или ином отделе центральной нервной системы и возрастом больного.
Общеинфекционные симптомы могут быть выражены в различной степени. Они проявляются повышением температуры, анорексией, ознобом, учащением дыхания и сердцебиения, диссоциацией между пульсом и температурой, бледностью или гиперемией кожных покровов, вялостью или возбуждением. При отдельных формах менингита могут быть и другие неспецифические симптомы, обусловленные преимущественным поражением того или иного органа (например, надпочечников при менингококковом менингите) или определенной локализацией первичного инфекционного очага (например, выраженная дыхательная недостаточность при заболевании, вызванном пневмококком; тяжелая диарея и эксикоз при энтеровирусном поражении и др.). К вне-оболочечным симптомам относятся также разного рода кожные сыпи, которые могут быть следствием токсического пареза мелких сосудов кожи или их бактериальной эмболии. У детей раннего возраста, особенно у новорожденных и грудных, в клинической картине менингита преобладают общеинфекционные симптомы.
Поражение (раздражение) мозговых оболочек клинически проявляется менингеальным симптомокомплексом, который у детей первого года жизни имеет свои характерные особенности.
Наиболее постоянный симптом — общая гиперестезия. Даже легкое прикосновение к ребенку или перемена положения вызывают болезненный крик. Отрицательная эмоциональная реакция возникает при звуковых и зрительных раздражителях. В основе общей гиперестезии лежит механическое раздражение корешков спинномозговой жидкостью, переполняющей субарахноидальное пространство. К менингеальным симптомам, наблюдаемым у маленьких детей, относятся также выбухание большого родничка вследствие повышения внутричерепного давления, симптом подвешивания Лессажа (поднятый под мышки ребенок подтягивает ноги к животу и держит их некоторое время в таком положении), симптом Бехтерева (при перкуссии по скуловой Дуге возникает гримаса боли на соответствующей половине лица), симптом посадки (невозможность сидеть в кровати с вытянутыми ногами либо спина и выпрямленные ноги при попытке посадить ребенка образуют тупой угол). Эти симптомы при менингите У маленьких детей наблюдаются непостоянно или вообще отсутствуют. Выбухания большого родничка может не быть, если У больного вследствие диареи и рвоты развивается эксикоз.
У детей старше 1 года могут наблюдаться такие менингеальные симптомы, как головная боль, рвота, общая гиперестезия,
227
ригидность мышц затылка и спины, симптомы Кернига, Брудзин-ского.
Головная боль обусловлена токсическим и механическим (вследствие повышения внутричерепного давления) раздражением рецепторов мозговых оболочек. Рвота возникает внезапно, не связана с приемом пищи. Она появляется в результате прямого или рефлекторного раздражения рвотного центра ретикулярной формации продолговатого мозга. Напряжение мышц шеи обусловливает характерную позу больного с запрокинутой назад головой. Ранний и важный менингеальный признак — симптом Кернига: невозможность разогнуть в коленном суставе ногу, согнутую в тазобедренном суставе. Симптом Кернига физиологичен у детей до 3—4-месячного возраста, что связано со своеобразным распределением мышечного тонуса и преимущественно флексорной гипертонией. После 4 мес его следует расценивать как патологический признак. Однако при менингитах у грудных детей он наблюдается редко. Верхний симптом Брудзинского (сгибание ног в коленных и тазобедренных суставах при сгибании головы) и нижний симптом Брудзинского (непроизвольное сгибание одной ноги при сгибании другой в коленном и тазобедренном суставах) у детей раннего возраста непостоянны и чаще выявляются при менингитах в возрасте старше 4 лет.
Наиболее постоянный и обязательный признак менингита — воспалительные изменения спинномозговой жидкости. При всех формах менингитов определяется увеличение числа клеток и умеренно выраженное повышение белка — клеточно-белковая диссоциация (табл. 7).
Таблица 7. Дифференциально-диагностические характеристики спинномозговой жидкости при менингитах различной этиологии
Показатель СМЖ Менингит
бактериальный грибковый и тубер кулезный вирусный
Цитоз Высокий от 500 до нескольких тысяч Низкий, обычно менее 500 От нескольких сотен до 1000 и более
Клеточный состав Преимущественно нейтрофилы Преимущественно одноядерные клетки Преимущественно одноядерные клетки
Содержание сахара Низкое Низкое Нормальное
Уровень белка Повышен Умеренно повышен Умеренно повышен
Показатели спинномозговой жидкости в значительной степени варьируют в зависимости от типа возбудителя и стадии заболевания, на которой производится исследование.
228
Исследование спинномозговой жидкости путем окраски ее по Граму позволяет поставить этиологический диагноз бактериального менингита уже при поступлении больного в стационар. Это исследование должно произодиться вне зависимости от цитоза, так как присутствие бактерий может не сопровождаться клеточной реакцией. Если в ликворе прямыми методами не удается выявить возбудителя, производят его посев на питательных средах.
Наличие изменений в спинномозговой жидкости позволяет диагностировать менингит даже при отсутствии менингеальных симптомов, как это часто наблюдается у новорожденных и грудных детей. В данном случае речь идет о клинически асимптомном ликвороположительном менингите. Этиологический диагноз менингита во многом определяет дальнейшую лечебную тактику.
Следует отметить, что клинически выраженные менингеальные симптомы могут не сопровождаться воспалительными изменениями в спинномозговой жидкости (менингизм). Менингизм наблюдается при субарахноидальных кровоизлияниях вследствие раздражения мозговых оболочек излившейся кровью. При многих врожденных болезнях обмена веществ в спинномозговой жидкости накапливаются токсические продукты, которые могут вызывать явления менингизма. Симптомы раздражения мозговых оболочек могут наблюдаться при различных токсических состояниях: тяжелом течении соматических и инфекционных заболеваний, различных отравлениях. Явления менингизма могут сопровождать заболевания, протекающие с повышением внутричерепного давления. В этих случаях раздражение рецепторов оболочек происходит за счет механического давления ликвора.
Гнойные менингиты
Гнойные менингиты наиболее часто наблюдаются у детей раннего возраста, а у новорожденных они составляют около 10% всех менингитов у детей. Наиболее высокая летальность при гнойных менингитах также наблюдается в этой возрастной группе. Это связано с анатомо-физиологическими особенностями ребенка раннего возраста — повышенной проницаемостью гематоэнцефалического барьера, недостаточностью иммунологической защиты, лабильностью обменных процессов, нередко приводящей к срыву компенсаторных возможностей различных органов и систем организма. Факторы, снижающие реактивность организма у детей раннего возраста, многообразны. Это и внутриутробная гипоксия и асфиксия при рождении, способствующие развитию ацидоза и повышению проницаемости гематоэнцефалического барьера. Это и различные соматические и инфекционные заболевания ребенка, ослабляющие его организм. Это и предшествующие вакцинации, которые у соматически ослабленных детей могут создавать отрицательный аллергический фон. Массивные субарахноидальные
229
кровоизлияния у детей с внутричерепной родовой травмой создают благоприятные условия для развития менингита, благодаря изменению проницаемости гематоэнцефалического барьера и наличию крови в ликворе — хорошей питательной среды для развития бактерий.
Этиология. Патогенез. Возбудителями гнойного менингита могут быть различные микроорганизмы — менингококки, пневмококки, стафилококки, стрептококки, кишечная палочка, протей, синегнойная палочка пли грибы. У новорожденных наиболее частой причиной гнойного менингита является кишечная палочка, у грудных детей — кокковая флора (пневмококк, стафилококк); у детей старше 1 года резко возрастает удельный вес менингококковых менингитов. В последние годы увеличилось число гнойных менингитов, при которых не удается выделить возбудителя. Это связано с ранним назначением антибиотиков, а также с изменением морфологических свойств бактерий и их способности расти на питательных средах при длительном применении антибактериальной терапии. Эти формы менингитов наиболее опасны, так как незнание этиологии может предопределить исход заболевания вследствие неправильного его лечения.
Гнойные менингиты, вызванные всеми видами возбудителей, могут быть как первичными, так и вторичными. При вторичных менингитах инфицирование оболочек мозга происходит гематогенным или лимфогенным путем из первичных очагов воспаления (отиты, пневмонии, сепсис, нагноившаяся кефалогематома, абсцесс и др.) или непосредственно путем прямого контакта с оболочками при открытой черепно-мозговой травме пли гнойных отитах, эпитимпанитах, мастоидитах. Повторные гнойные менингиты у детей раннего возраста могут быть обусловлены врожденными сообщениями между придаточными пазухами носа и мозговыми оболочками.
Возможно внутриутробное инфицирование плода микробами септической группы — кишечной палочкой, протеем, стрептококком, стафилококком. Возбудители инфекции могут передаваться плоду от больных женщин или женщин, имеющих латентные очаги инфекции, трансплацентарно, через амниотическую жидкость или при непосредственном контакте плода с зараженными родовыми путями во время родов.
Патоморфолог и ческ и е изменения при гнойных менингитах неспецифичны для того или иного возбудителя. Мягкие мозговые оболочки мутные, пропитаны серозно-гнойным экссудатом, который располагается как на выпуклой поверхности мозга, так и на основании. На 4—8-й день болезни экссудат превращается в плотную фиброзно-гнойную массу. Воспаление нередко переходит на оболочечные влагалища черепномозговых нервов. В патологический процесс вовлекаются сосуды головного мозга. Флебиты и артерииты ведут к образованию инфарктов 230
мозга с последующим их глиальным перерождением. У детей раннего возраста значительно чаще, чем у старших имеют место воспалительные изменения вещества мозга и эпендимы мозговых желудочков, перивентрикулярный и перицеллюлярный отек, небольшие кровоизлияния, диффузная клеточная инфильтрация. Патологические изменения в оболочках и эпендиме желудочков мозга при несвоевременной и неправильной терапии могут привести к блокаде ликворных пространств, нарушению секреции и абсорбции ликвора и развитию гидроцефалии.
Клинические проявления гнойного менингита зависят от возраста и преморбидного состояния ребенка, индивидуальных свойств организма. У новорожденных клиника гнойного менингита нетипична. На фоне субфебрильной или даже нормальной температуры наблюдается острое или постепенное ухудшение общего состояния, отказ от груди. Дети вялые, сонливые или, наоборот, беспокойные. Крик пронзительный, отмечаются повторные срыгивания, общая гиперестезия, тремор конечностей. Возможны локальные или генерализованные судороги с преобладанием клонического компонента. Рвота у новорожденных детей бывает редко. Иногда отмечаются выбухание и напряжение большого родничка. Однако при выраженном эксикозе, а также при наличии густого гноя на конвекситальной поверхности большой родничок может быть запавшим. Мышечный тонус снижен. Безусловные рефлексы угнетены. Нередко наблюдаются преходящее косоглазие, парез лицевого нерва, непостоянный горизонтальный нистагм. Иногда на первый план выступают симптомы выраженного токсикоза: резкая бледность кожных покровов с сероватым оттенком, цианоз носогубного треугольника, акроцианоз; учащенное, поверхностное, стонущее дыхание; тахикардия, увеличение печени и селезенки, жидкий стул до 5—6 раз в день или запоры, периодические подъемы температуры.
У детей более старшего возраста отмечается изменение поведения, связанное с головной болью и общей гиперестезией. Дети беспокойны, вскрикивают, не находят себе места, отрицательно реагируют на малейшее прикосновение, свет, звук; наблюдается рвота, не связанная с приемом пищи. Больные обычно отказываются от еды, но жадно и много пьют. Нередко отмечается выбухание большого родничка. Беспокойство в дальнейшем сменяется апатией, оглушенностью. Характерны судороги клонико-тонического характера. У грудных детей более постоянно, чем у новорожденных, наблюдается менингеальная поза с запрокинутой назад головой и согнутыми ногами, симптом подвешивания Лессажа, симптом посадки. Симптомы общей интоксикации при гнойных менингитах могут иногда быть единственными клиническими проявлениями.
Диагноз гнойного менингита у детей раннего возраста поставить трудно. Решающая роль принадлежит люмбальной пункции, которую следует производить во всех неясных случаях
231
при малейшем подозрении на менингит. Имеет значение также выявление очагов гнойной инфекции у новорожденных и у матери.
В крови при гнойных менингитах наблюдается значительный лейкоцитоз (до 30 000 и более) со сдвигом формулы влево, повышение СОЭ. Однако у маленьких детей иногда может быть лейкопения.
Ликвор мутный, гнойный, молочно-белый, иногда желтоватозеленый. Количество клеток достигает нескольких тысяч в 1 мкл из них 70—100% составляют нейтрофилы. Содержание белка также повышено со сдвигом в сторону грубодисперсных белков — глобулинов. Количество сахара нормально или резко уменьшено.
Этиологический диагноз ставится на основании бактериологического исследования спинномозговой жидкости.
Менингококковая инфекция. Этиология. Менингококковая инфекция вызывается грамотрицательным диплококком менингококком. Менингококк нестоек во внешней среде. При комнатной температуре он погибает через 20 мин. Низкая температура и отсутствие влажной среды также приводят к его быстрой гибели. Оптимальная температура для размножения менингококка — 37° С. Существует 4 типа менингококка — А, В, С, D. В период эпидемий преобладают заболевания, вызванные типом А.
Менингококковая инфекция может протекать в различных формах: в виде назофарингита, менингококцемип, менингита. Менингококковые менингиты составляют 60—70% всех гнойных менингитов.
Эпидемиология. Преимущественная заболеваемость менингококковой инфекцией наблюдается в зимне-весенние месяцы (февраль—май). Через каждые 10—15 лет отмечается резкое увеличение числа больных. Так, в 1970 г. заболеваемость менингококковой инфекцией в РСФСР возросла в 70 раз по сравнению с 1965 г. (Ю. Я. Венгеров и др., 1973). В межэпидемический период наиболее часто болеют дети до 3 лет (88%). Во время эпидемий возрастает удельный вес больных старшего возраста, что связано с накоплением в течение длительного межэпидеми-ческого периода неимунной прослойки населения.
Во время эпидемии у 70—90% инфицированных клинических проявлений не наблюдается. Генерализованные формы менингококковой инфекции (менингит, менингококцемпя) отмечаются у 0,4—1% инфицированных. У 10—30% наблюдается клиника острого назофарингита.
В период последней эпидемии менингококковая инфекция имела свои особенности: в 2,5 раза увеличился удельный вес менин-гококкемии, в 2—3 раза участились молниеносные и атипичные формы болезни (В. И. Покровский, Ю. Я. Венгеров, 1973; М. Б. Цукер, 1975).
232
Источником менингококковой инфекции являются больные и бактерионосители. Заражение происходит воздушно-капельным путем.
Патогенез. Входными воротами для инфекции являются верхние дыхательные пути. При этом в носоглотке, трахее, бронхах возникают местные, иногда незначительные, изменения. Затем менингококк проникает в кровь, вызывая либо преходящую бактериемию, либо септицемию. Из крови возбудитель через гематоэнцефалический барьер проникает в оболочки мозга, что сопровождается развитием гнойного менингита.
Клиника. Менингококковый менингит у детей раннего возраста имеет ряд клинических особенностей. Начало болезни чаще острое, однако у 8—10% детей признаки болезни нарастают постепенно. Температура в большинстве случаев не повышается. В первые дни болезни преобладают инфекционно-токсические симптомы, особенно у новорожденных и детей 1-го года жизни. Общемозговые симптомы (судороги, потеря сознания) наблюдаются лишь у 15—17% детей.
Менингеальные симптомы нерезко выражены, а у 25—30% вообще отсутствуют. У некоторых больных в первые дни заболевания на коже появляется эритематозная или кореподобная сыпь, которая держится кратковременно. На 3—4-й день болезни на коже и слизистых могут появиться герпетические высыпания. У детей 1-го года жизни они наблюдаются редко.
Изменения в спинномозговой жидкости характерны для гнойного менингита.
Сверхострые формы менингококкового менингита, часто заканчивающиеся летально, наблюдаются у 3—8% больных. Состояние больных очень тяжелое с первых часов болезни. Лицо гиперемпровано или цианотично. Сознание отсутствует. Судороги носят преимущественно тонический характер. Дыхание частое, поверхностное, с нарушением ритма; брадикардия, гипертермия. Тяжесть состояния обусловлена отеком и набуханием мозга и вклинением ствола мозга в большое затылочное отверстие. Острый отек мозга связан в основном с токсикозом, а также с аллергическими и аутоаллергическими процессами в нервной системе. Синдром отека-набухания мозга при молниеносной форме менингита иногда сочетается с острой надпочечниковой недостаточностью, приводящей к коллапсу. Смерть может наступить в 1-е сутки заболевания.
По данным С. Л. Кипнис (1979), у 72% больных, умерших при этой форме заболевания, имели место изменения в надпочечниках: кровоизлияния, дистрофия, некробиоз.
Менингококцемия — другая форма менингококковой инфекции. Основным ее проявлением является резко выраженная интоксикация. Дети бледные, вялые, отказываются от еды, много пьют; Дыхание частое, поверхностное; тахикардия, сухость кожных покровов, рвота, обложенный язык, метеоризм, частый жидкий стул.
233
На фоне повышенной температуры и общего токсикоза через несколько часов на коже появляется геморрагическая сыпь, сочетающаяся нередко с розеолезной или розеоло-папулезной. Сыпь располагается на ягодицах, задней поверхности бедер, веках, реже — на руках и лице. Патоморфологически кожные высыпания представляют собой бактериальные тромбы с перифокальным поражением сосудов и экстравазатами. Такие тромбы могут также быть в синовиальной оболочке суставов, сосудистой оболочке глаз, надпочечниках, реже в эндокарде, печени, почках.
У детей раннего возраста менингококцемия обычно сочетается с менингитом вследствие повышенной проницаемости гематоэнцефалического барьера и низкой иммунобиологической активности организма. При этом кроме воспалительных изменений в оболочках мозга наблюдаются множественные кровоизлияния.
В некоторых случаях менингококцемия протекает сверхостро по типу бактериального эндотоксического шока (синдром Уотер-хаузена—Фридриксена). Среди полного здоровья повышается температура, ребенок резко бледнеет, становится адинамичным. На коже туловища и конечностей появляется обильная, крупная, геморрагическая сыпь с участками некроза. Местами она имеет багрово-синюшную окраску, напоминающую трупные пятна.
Тоны сердца глухие, пульс слабого наполнения, нитевидный, тахикардия. Артериальное давление катастрофически падает. Развиваются сосудистый коллапс, анурия, иногда наблюдаются профузные желудочные кровотечения. В крови отмечается метаболический ацидоз. Значительно повышена свертываемость крови, увеличено количество фибриногена, протромбина. В более поздней стадии свертываемость крови уменьшается, резко снижается количество тромбоцитов. Больные умирают через несколько часов после появления первых симптомов заболевания. При патомор-фологическом исследовании определяются кровоизлияния в надпочечники и другие внутренние органы, очаги некроза в миокарде, почечных канальцах, головном мозге.
В основе механизма развития эндотоксического шока при ме-нингококцемии лежат нарушения гемодинамики, микроциркуляции, вызывающие гипоксию. Нарушение свертываемости крови (феномен повышенной внутрисосудистой коагуляции) приводит к образованию множества мельчайших тромбов. Возникновение кровоизлияний во внутренних органах обусловлено истощением факторов свертывания (коагулопатия потребления). Частое поражение надпочечников связывают с повышенным кровенаполнением этих органов. Полагают, что основным механизмом развития шока является генерализованная анафилактическая реакция.
Пневмококковый менингит. Этиология. Пневмококковый менингит вызывается грамположительным диплококком (пневмо-234
кокком) I и II серологического типов. Эта форма гнойного менингита наиболее часто наблюдается у детей первых месяцев жизни. Пневмококковый менингит в большинстве случаев является вторичным и развивается на фоне пневмоний, бронхитов, синуситов, отитов, а также других гнойных очагов.
Клиническая картина. Заболевание протекает с высокой температурой и выраженной интоксикацией. На фоне общего тяжелого состояния рано возникают судорожные припадки, потеря сознания, нарушение функции черепномозговых нервов. Иногда остро развивается гипертензионно-гидроцефальный синдром. Эти симптомы связаны с вовлечением в патологический процесс не только оболочек, но и вещества головного мозга и эпендимы желудочков.
Кожные покровы резко бледные, выражена одышка, сердечные тоны глухие, пульс ослаблен. Могут быть увеличены печень и селезенка. Как и при менингококцемии при пневмококковом менингите могут наблюдаться поражения суставов и сыпь. Для пневмококковых менингитов более характерно затяжное течение с признаками поражения вещества головного мозга.
Изменения ликвора типичны для гнойного менингита. Этиологию заболевания можно установить только при бактериологическом исследовании спинномозговой жидкости.
Пневмококковый менингит характеризуется наиболее высокой летальностью.
Стафилококковый менингит. Этиология. Стафилококковый менингит чаще является вторичным. У детей раннего возраста он развивается обычно на фоне сепсиса (чаще пупочного) или при наличии гнойного очага в организме (омфалит, фурункулез, отит, флегмона, пневмония и др.). Возможно заражение стафилококком во внутриутробный период от больной матери транс-плацентарно либо при аспирации и заглатывании инфицированной амниотической жидкости. Опасность стафилококковой инфекции возрастает при длительных затяжных родах, раннем отхождении околоплодных вод, кровотечениях во время беременности.
Клинические проявления характеризуются острым началом с высоким подъемом температуры. Состояние детей тяжелое: нарушается сознание, вплоть до комы, могут быть судороги и признаки очагового поражения нервной системы. Однако у новорожденных и грудных детей начало менингита маскируется признаками основного заболевания, на первый плав выступают симптомы токсикоза. Стафилококковые менинги гы часто осложняются тромбозом вен и синусов и склонны к абсцедированию. Этим частично определяется длительное затяжное течение болезни. Стафилококковый менингит оставляет стойкие неврологические нарушения.
Диагноз стафилококкового менингита у детей раннего возраста поставить сложно. Даже небольшие отклонения со стороны
235
нервной системы ребенка при тяжелом соматическом состоянии являются показанием для люмбальной пункции.
Менингит, вызванный кишечной палочкой. Это одна пз наиболее частых форм гнойных менингитов, наблюдаемых в последние годы у новорожденных детей.
Этиология. Менингит обычно носит вторичный характер. Развивается на фоне кишечной инфекции или сепсиса.
Заражение кишечной палочкой возможно во внутриутробный период. Заболевание почек и мочевыводящих путей у беременных в 60—70% случаев вызывается грамотрицательными возбудителями, в том числе кишечной палочкой. При восходящем распространении инфекции кишечная палочка попадает в амниотическую жидкость, которая является хорошей питательной средой. Инфицирование околоплодных вод приводит к развитию хорионамнпо-нитов. В этом случае бактерии попадают к плоду через сосуды плаценты и пуповины. Возможны также заглатывание и аспирация околоплодных вод.
Клиника. Состояние детей обычно тяжелое уже в первые дни после рождения. Они вялые, заторможенные, отказываются от груди. Наблюдаются срыгивания, рвота, частый, жидкий стул. Быстро нарастают признаки эксикоза. Кожные покровы бледные, с сероватым оттенком, сухие; большой родничок запавший. Дыхание стонущее, частое, поверхностное. Дети теряют в массе. Резко снижен тургор тканей. Развивается гипотрофия. Наблюдаются локальные или генерализованные клонико-тонические судороги. Специфические менингеальные симптомы отсутствуют.
Течение менингита тяжелое, часто с летальным исходом. Диагноз таких форм менингита у новорожденных представляет трудности, поскольку подобная клиническая симптоматика может быть расценена как проявление кишечной инфекции, сепсиса или внутричерепной родовой травмы. Тяжелое состояние новорожденных с указанием на возможность септического процесса является показанием для люмбальной пункции.
Спинномозговая жидкость вытекает редкими каплями, гнойная; иногда ее даже не удается получить из-за низкого давления. Содержание белка высокое (7—33 г/л), нейтрофильный цитоз. Возбудитель может быть выделен из крови и ликвора.
Течение гнойных менингитов. При своевременной и рациональной терапии на 3—4-й день болезни состояние больных значительно улучшается. Санация ликвора происходит на 8—15-й день болезни. При благоприятном течении через 2 нед после окончания курса лечения детей выписывают из стационара под наблюдение районного невропатолога. В этих случаях обычно отмечаются негрубо выраженные остаточные явления в виде повышенной истощаемости и возбудимости нервной системы, нарушения концентрации внимания, легких очаговых симптомов, гипертензионно-гидроцефального синдрома. При позднем диагнозе и неправильно проводимой терапии возможно затяжное течение.
23b
Оно может быть связано и с характером возбудителя. При менингитах, вызванных стафилококком, кишечной палочкой, длительное течение заболевания обусловлено склонностью к абсцедированию и наличием гнойного очага в организме. При затяжном течении в оболочках преобладает продуктивный процесс, который приводит в дальнейшем к нарушению секреции, реабсорбции и циркуляции ликвора и развитию гидроцефалии. Гидроцефалия наиболее часто наблюдается после менингитов у новорожденных и грудных детей.
Одним из осложнений менингита является эпендиматит. Он чаще всего возникает при поздно начатой терапии. У больного на фоне улучшения состояния появляются тонические судороги, повышается мышечный тонус в экстензорных группах мышц, развивается поза децеребрационной ригидности. Дети теряют сознание. Прогрессирует гидроцефалия. Течение эпендиматитов неблагоприятное.
К другим осложнениям гнойного менингита, наблюдаемым у детей раннего возраста, относят абсцесс мозга, тромбоз латерального синуса, субдуральный выпот, локальные некрозы тканей в местах сливной геморрагической сыпи, вторичные инфекции дыхательных и мочевыводящих путей, образование множественных пристеночных бактериальных тромбов (рассеянная внутрисосудистая коагуляция). У 20% детей, перенесших гнойный менингит, в дальнейшем имеются признаки очагового поражения нервной системы: эпилептиформные судороги, поражение III, VI, VII, VIII пар черепномозговых нервов, пирамидная недостаточность, вегетативно-обменные расстройства и др.
Лечение гнойных менингитов должно быть начато как можно раньше. От этого зависят исход заболевания и характер остаточных явлений. Антибактериальную терапию следует назначать до получения результатов исследования ликвора, при малейшем подозрении на менингит. Ургентную антибактериальную терапию (до выделения возбудителя) начинают с назначения пенициллина, так как 90% гнойных менингитов вызывается кокками, высокочувствительными к пенициллину. Пенициллин назначают в больших дозах — 200 000—500 000 ЕД на 1 кг массы тела в сутки, в тяжелых случаях — 1 000 000 ЕД на 1 кг массы тела. Инъекции детям первых месяцев жизни делают каждые 2—3 ч, после 1 года — каждые 4 ч.
После установления характера возбудителя назначают антибиотики, к которым он наиболее чувствителен. При менингококковом менингите продолжают лечение пенициллином либо назначают полусинтетические пенициллины. Из них наиболее эффективен ампициллин. Детям до 2 мес его назначают в дозе 100—150 мг на 1 кг массы в сутки внутримышечно или внутривенно, старше 2 мес — 150—200 мг на 1 кг в сутки. Инъекции Делают с интервалом в 6 ч. Оксациллин и метициллин назначают из расчета 200—300 мг/кг в сутки внутримышечно каждые
237
4 ч. Полусинтетические пенициллины назначают больным с повышенной чувствительностью к пенициллину. Они эффективны также при стафилококковом менингите, особенно метициллин.
При стафилококковом менингите рекомендуется определить чувствительность возбудителя к антибиотикам. До получения этих данных целесообразно комбинировать 2 или 3 антибиотика (пенициллин — левомицетин, пенициллин — полусинтетические пенициллины). Если менингит вызван пневмококком, то назначают большие дозы пенициллина — до 1 000 000 ЕД/кг в сутки. Можно применить также спгмамицин — 50 000—100 000 ЕД/кг в сутки внутривенно через 12 ч или внутримышечно через 6 ч. Эффективно также применение гентамицина — 6—8 мг/кг в сутки внутримышечно через 8 ч.
При менингите, вызванном кишечной палочкой, назначают гентамицин или ампициллин в вышеуказанных дозах. Для профилактики кандидамикоза рекомендуется нистатин по 100 000 ЕД 3—4 раза в день.
Длительность лечения антибиотиками новорожденных и грудных детей составляет минимум 3 нед, более старших детей следует лечить до тех пор, пока не нормализовалась температура, и еще 5 дней. Контролем за лечением могут служить показатели спинномозговой жидкости: отсутствие возбудителя, цитоз — менее 30 клеток, нормализация концентрации глюкозы и уровня белка. Контрольную пункцию делают через 3—4 дня от начала лечения. Если тенденция к санации ликвора отсутствует, антибиотик следует заменить.
Курс лечения при менингококковом менингите в среднем составляет 6—8 дней, при менингитах другой этиологии — от 8 до 12 дней. Дозу антибиотиков в процессе лечения недопустимо снижать, так как по мере лечения проходимость гематоэнцефалического барьера для антибиотиков уменьшается.
В редких случаях, когда указанное выше лечение не дает желаемого эффекта, можно прибегнуть к введению антибиотиков под оболочки мозга или в желудочки. Чаще всего к этой мере приходится прибегать при менингите у новорожденных, вызванном грамотрицательными микроорганизмами.
Наряду с антибиотиками необходимо проводить симптоматическую и десенсибилизующую терапию, а также мероприятия, направленные на стабилизацию кровообращения и нормализацию электролитного баланса, борьбу с отеком мозга, лечение дыхательных нарушений, нормализацию кислотно-щелочного равновесия. При наличии судорог назначают противосудорожную терапию, при гипертермии — различные виды охлаждения (обтирание спиртом, клизма из холодной воды, литические смеси), жаропонижающие средства. При молниеносной форме менингита с развитием шокового состояния показано применение кортикостероидов: гидрокортизон (5—30 мг/кг), преднизолон (1—5 мг/кг) в зависимости от степени коллапса.
238
Большое значение при лечении менингитов имеют полноценное питание, введение витаминов, тщательное проветривание помещения и уход за больным ребенком.
Инфекционные осложнения (абсцесс мозга, субдуральный выпот) требуют специфической антибактериальной терапии и хирургического лечения. При рассеянной внутрисосудистой коагуляции проводят коррекцию коагулограммы путем возмещения расхода факторов свертываемости.
Серозные менингиты
Серозные менингиты — полиэтиологическая группа заболеваний, объединяемых на основе серозного характера воспаления мозговых оболочек и вызываемых различными вирусами. Однако в ряде случаев, например, когда менингит развивается при черепно-мозговых травмах, эндогенных и экзогенных интоксикациях, выделить возбудителя не удается. Поэтому предполагают, что серозный менингит может не иметь инфекционного происхождения, а быть проявлением общей неспецифической реакции организма.
У детей раннего возраста в основном наблюдаются 2 группы вирусных серозных менингитов: обусловленные энтеровпрусами Коксаки и ECHO и вызванные вирусом эпидемического паротита.
Серозные менингиты, так же как и гнойные, подразделяют обычно на первичные, то есть те заболевания, где серозный менингит является основным, а иногда и единственным клиническим признаком болезни, и вторичные, когда он развивается на фоне основного заболевания, например при паротите. Серозный менингит также может быть одной из клинических форм других заболеваний нервной системы, например острого полиомиелита.
Патоморфологические изменения при серозных менингитах проявляются отеком и гиперемией мозговых оболочек, наличием в них лимфоцитарных инфильтратов, преобладанием экссудативных проявлений над пролиферативными.
Клиника серозных менингитов характеризуется острым началом и выраженностью гипертензионного синдрома. Внезапно повышается температура. У детей 1-го года жизни наблюдаются беспокойство, болезненный крик, выбухание большого родничка, симптом «заходящего солнца», тремор, судороги. В более старшем возрасте признаками повышенного внутричерепного давления могут быть частые рвоты, головные боли, возбуждение, беспокойство. Дети не находят себе места, мечутся в постели. Реже отмечаются вялость, адинамия, сопорозное состояние. Внутричерепная гипертензия может сопровождаться застойными явлениями на глазном дне, усилением сосудистого рисунка и пальцевыми вдавлениями на снимке черепа.
При люмбальной пункции определяется повышение давления спинномозговой жидкости. Она вытекает частыми каплями или
239
бьющей струей. Жидкость бесцветная, прозрачная, иногда опалесцирует. Клеточный состав ликвора представлен главным образом лимфоцитами, количество которых колеблется от нескольких десятков до нескольких сотен или тысяч в 1 мкл. Иногда в первые дни болезни наблюдается нейтрофильный плеоцитоз, который быстро сменяется лимфоцитарным. Нормальный состав ликвора в первые 1—2 дня болезни еще не исключает менингита. Клеточная воспалительная реакция может появиться через несколько суток. Содержание белка нормальное или слегка повышенное. Люмбальная пункция при серозных менингитах обычно приносит облегчение больным. Вирусологическое и серологическое исследования ликвора в крови позволяют уточнить этиологию заболевания.
В последние годы установлено, что 6—10% менингококковых и пневмококковых менингитов могут начинаться с серозного воспаления оболочек. Поэтому в первые дни болезни следует производить и бактериологическое исследование ликвора даже при наличии в нем воспалительных изменений серозного характера.
Серозные менингиты, вызванные энтеровирусами Коксаки и ECHO. Вирусы Коксаки и ECHO обусловливают целый ряд заболеваний, среди которых особое место занимает серозный менингит.
Эпидемиология. Патогенез. Заболевания встречаются в виде спорадических случаев или отдельных эпидемических вспышек. Эпидемии энтеровирусных менингитов зарегистрированы во всех странах мира. Большой размах эпидемических вспышек и выраженная контагиозность дали основание назвать энтеровирус-ный менингит эпидемическим серозным менингитом. Характерна весенне-летняя сезонность эпидемий с пиком заболеваемости в июне—августе. Заболевают преимущественно дети, находящиеся в организованных коллективах, причем в одни эпидемии преобладают дети дошкольного возраста, в другие — дети 7—14 лет.
Эпидемии энтеровирусного менингита в СССР были довольно часты в период с 1952 по 1965 г. В последние годы число и размер эпидемических вспышек значительно уменьшились, однако спорадические формы заболевания продолжают регистрироваться с прежней частотой. Источником инфекции являются больные и вирусоносители. Среди здоровых людей частота ви-русоносительства достигает 50% и более. Основные пути передачи инфекции — воздушно-капельный или фекально-оральный. Возможна трансплацентарная передача вируса плоду.
Вирус, попадая в носоглотку и желудочно-кишечный тракт, обусловливает начальные симптомы заболевания, воспалительные изменения зева, легкие катары верхних дыхательных путей, лимфаденит, приступообразные боли в животе. Их продолжительность колеблется от нескольких часов до нескольких дней. Далее вирус проникает в кровь. Стадия вирусемии сопровождается подъемом температуры и другими общеинфекционными симптомами. Ге-240
матогенным путем вирус заносится в нервную систему. Наиболее часто он поражает оболочки. Серозный менингит составляет 80%> энтеровирусных заболеваний нервной системы.
Клиническая картина энтеровирусных менингитов характеризуется преобладанием признаков повышения внутричерепного давления. Дети беспокойны, нарушается сои. В первый день болезни появляется повторная рвота. Менингеальные признаки часто отсутствуют, особенно у детей 1-го года жизни. У некоторых больных наблюдаются судороги. Характерен внешний вид робенка: лицо гпперемировано, склеры инъецированы, носогубной треугольник бледный, кожа сухая. В 6—8% случаев бывает полиморфная сыпь, которая нередко дает повод диагностировать заболевание как корь или краснуху. Изменения спинномозговой жидкости такие же, как при других формах серозного менингита. Иногда в первые дни наблюдается нейтрофильный или смешанный цитоз, который затем сменяется лимфоцитарным. Количество белка может быть снижено вследствие увеличения количества циркулирующей жидкости. В периферической крови у многих больных выявляется сдвиг лейкоцитарной формулы влево при нормальном, слегка повышенном или пониженном количестве лейкоцитов. В первые дни болезни СОЭ может быть повышена. Изменения глазного дна в виде расширения, извитости и легкого отека вен обнаруживают у 25—30% больных энтеровирусным менингитом.
Течение менингита обычно доброкачественное. На 2—4-й день исчезают общемозговые симптомы. Состав ликвора нормализуется через 2—3 нед. Иногда через 5—7 дней после падения температуры возможен ее новый подъем и повторное появление общемозговых и менингеальных симптомов. Частота рецидивов при разных вспышках колеблется в больших пределах — 10— 40%. После перенесенного менингита обычно не бывает остаточных явлений. У некоторых детей наблюдается постинфекционный астенический синдром.
Следует отметить, что у детей раннего возраста энтерови-русная инфекция может протекать в виде более распространенного поражения нервной системы с включением головного и спинного мозга и развитием менингоэнцефалита пли менингоэнцефа-ломиелита.
Диагноз энтеровирусного менингита основывается на эпидемиологических данных и вирусологических исследованиях. Массовость, высокая контагиозность и выраженная очаговость не характерны для менингитов другой этиологии. Важным является выявление в эпидемических очагах других форм заболеваний, вызываемых вирусами ECHO и Коксаки, таких, как эпидемическая миальгия, энтеровирусная лихорадка, полиомиелитоподобные паралитические заболевания. Вирусологическое исследование ликвора и крови, подтвержденное результатами серологических реакций парных сывороток крови с ростом титра антител более
9 143
241
чем в 4 раза, позволяет установить этиологию заболевания. Выделение вирусов из носоглоточных смывов и испражнений не является доказательным вследствие широко распространенного вирусоносительства.
Лечение симптоматическое. Назначают средства, снижающие внутричерепное давление. Хороший лечебный эффект оказывает спинномозговая пункция. Снижение давления ликвора приносит значительное облегчение больным.
Показаны также десенсибилизирующие препараты, витаминотерапия, общеукрепляющее лечение. Больных, перенесших вирусный серозный менингит, берут на диспансерный учет.
Острый паротитный менингит и менингоэнцефалит. Поражение мозговых оболочек и нервной системы, обусловленное паротитным вирусом, наблюдается чаще всего у детей дошкольного и младшего школьного возраста. Грудные дети болеют крайне редко. На возраст от 1 до 3 лет приходится 17,9% от всех паротитных менингитов (М. А. Дадиомова, Р. М. Пратусевич, 1974). У мальчиков заболевание наблюдается в 2 раза чаще, чем у девочек. В последние годы случаи поражения нервной системы при паротите участились. Вирус эпидемического паротита из ликвора впервые в СССР выделили А. К. Шубладзе и М. А. Селиванов в 1949 г. Вирус обладает тропизмом к железистым органам и нервной системе.
Эпидемиология. Патогенез. Источником инфекции является больной паротитом. Заражение происходит воздушнокапельным путем. Поражению нервной системы предшествует кратковременный период вирусемии. Возбудитель проникает через гематоэнцефалический барьер и поражает оболочки и вещество мозга. Наиболее часто паротитный менингит развивается на 3— 6-й день после припухания желез, в более редких случаях — одновременно с припуханием или за 2—4 дня до поражения слюнных желез. В 6,9% случаев менингит может протекать без поражения слюнных желез. У некоторых детей возникают боли в животе, связанные с воспалением поджелудочной железы. Считают, что в основе поздних форм поражения вещества мозга (позже 5—6-го дня заболевания) лежит нейроаллергпческий процесс (В. И. Фрейдков, 1972).
Клиническая картина. Для паротитного менингита, как п для других форм серозного менингита, характерны острое начало с высокой температурой, выраженный гииертепзионно-гидроцефальный синдром при незначительных менингеальных проявлениях. У детей первых лет жизни чаще, чем у более старших, с начала заболевания отмечаются общая вялость, сонливость, оглушенность или возбуждение, сопровождающееся судорогами, бредом, галлюцинациями. У некоторых больных наблюдается потеря сознания.
Эти признаки расценивают как энцефалическую реакцию у ребенка с менингитом, однако у маленьких детей могут наблю
242
даться п менингоэнцефалиты, которые помимо вышеописанных симптомов характеризуются очаговым поражением мозга. Часто вовлекаются в процесс черепномозговые нервы, появляются пирамидные, экстрапирамидные и мозжечковые симптомы. Более редко у маленьких детей наблюдаются легкие формы менингита с минимальными клиническими проявлениями и воспалительными изменениями в ликворе.
Давление ликвора высокое. Количество лимфоцитов составляет до 1000 и более в 1 мкл, иногда в первые дни содержится значительное количество нейтрофилов. Содержание белка несколько увеличено или нормальное. Люмбальная пункция на некоторое время значительно облегчает состояние больных.
Течение. Паротитные менингиты текут благоприятно, не оставляя выраженных последствий. Клиническое выздоровление наступает обычно на 7—10-й день болезни, состав ликвора нормализуется через 14—16 дней. В случаях менингоэнцефалита возможны остаточные явления в виде поражения VI, VII и VIII пар черепномозговых нервов, парезов конечностей, мозжечковой атаксии.
Лечение такое же, как при энтеровирусных менингитах. При тяжелом течении с вовлечением в процесс вещества мозга показаны кортикостероиды. Преднизолон назначают из расчета 0,001—0,002 г/кг массы тела в сутки с постепенным медленным снижением дозы. Продолжительность лечения гормонами — 3— 4 нед.
Туберкулезный менингит. Разработка и широкое применение в СССР методов профилактики, ранней диагностики и комплексного лечения туберкулеза значительно снизили распространенность этого заболевания. Резко уменьшилось и число больных туберкулезным менингитом. В настоящее время встречаются только отдельные спорадические случаи туберкулезного менингита. Изменилось также и его течение.
Туберкулезный менингит всегда является вторичным. Он возникает в результате гематогенной диссеминации из первичного очага (легких, бронхиальных желез, костей и др.), который в ряде случаев может не выявляться. Наиболее часто заболевание наблюдается ранней весной — в марте, апреле. Дети до 6 мес болеют редко. Пик заболеваемости приходится на возраст 18 мес — 4 года.
Патоморфология. При остром туберкулезном менингите преобладают воспалительные экссудативные проявления с диффузной инфильтрацией мозговых оболочек лимфоцитами (рис. 80). Эти изменения наиболее выражены вокруг сосудов. В мягких оболочках, сосудистых сплетениях, эпендиме желудочков, веществе мозга могут быть туберкулезные бугорки с типичным строением. Стенки сосудов поражаются редко. При поздно начатом лечении или недостаточных дозах препаратов преобладают продуктивные изменения с поражением стенок сосудов, хориоиди-
9*
243
Рис. 80. Изменения в мозговой ткани при туберкулезном менингите:
а — инфильтрация мягких мозговых оболочек лимфоидными элементами, умеренный склероз мягких мозговых оболочек, гигантские клетки Пирогова—Ланганса; б — туберкул мозга с казеозным некрозом в центре и инфильтрацией лимфоидными клетками по периферии
тами, эпендиматитами, образованием спаек. Возможны очаги размягчения в веществе мозга вследствие выраженных сосудистых нарушений. Наиболее характерная локализация патологического процесса при туберкулезном менингите — оболочки основания мозга и межуточно-гипофизарная область. Однако процесс может быть генерализованным, с вовлечением мягких и твердых мозговых оболочек, вещества мозга, сосудов, эпендимы, с развитием в них в нелеченных случаях необратимых или малообратимых изменений. Казеозный распад мозга в настоящее время наблюдается крайне редко.
Клиническая картина. Заболевание начинается под-юстро с неспецифических симптомов. Длительность продромальной стадии — 1—3 нед или больше. На фоне субфебрильной температуры появляются раздражительность, плаксивость, неустойчивость настроения, снижение внимания, утрачивается интерес к играм, отсутствует аппетит, иногда наблюдаются рвота и другие желудочно-кишечные расстройства. Ребенок теряет в массе. В редких случаях продромальный период очень неотчетлив. Переход ко II, менингеальной, стадии бывает трудно уловить. Усиливаются признаки продромального периода. Температура повышается до 38—39° С. В течение дня могут наблюдаться ее колебания. Более частой становится рвота, выбухает большой родничок. Дети очень беспокойны, держатся руками за голову. Характерен гидроцефальный крик. Вялость сменяется помрачением сознания. Симптомы раздражения оболочек непостоянны. Более характерна общая гиперестезия, в том числе па световые и слуховые раздражители. Более часто, чем в старшем возрасте, наблюдаются судороги. Они могут быть как генерализованными, так и локальными, джексоновскими. Поза с запрокинутой назад головой, согнутыми ногами и втянутым животом, характерная
244
для детей старшего возраста, у маленьких детей наблюдается непостоянно. На фоне описанных симптомов появляются признаки поражения черепномозговых нервов, свидетельствующие о распространении воспалительного процесса на их корешки. Наиболее постоянно вовлекаются глазодвигательные нервыД реже лицевой и слуховой. При этом наблюдаются косоглазие, птоз,- анизокория, снижение или отсутствие реакции зрачков на свет, иногда полная офтальмоплегия. Если лечение начато поздно, то наступает И1 стадия заболевания — менингоэнцефалитическая, характеризующаяся затемнением или утратой сознания, частыми судорогами, признаками поражения ядер черепномозговых нервов, парезами конечностей.
При туберкулезном менингите почти всегда имеются вегетативные нарушения: потливость, стойкий красный дермографизм, пятна Труссо, запоры, изменение ритма сердечной деятельности.
Диагноз туберкулезного менингита подтверждается результатами исследования спинномозговой жидкости. Она прозрачная, бесцветная или слегка опалесцирует. Если жидкость стоит более 12 ч, на поверхности образуется пленка. Давление повышено иногда до 500—600 мм води, ст., цитоз — 100—300 клеток в 1 мкл, смешанного характера (70% лимфоцитов, 30%—нейтрофилов) в первые дни, а в дальнейшем лимфоцитарный. Содержание белка увеличено до 1 — 10 г/л. Сахар снижен до 0,3— 0,4 г/л. Количество хлоридов также снижено.
Этиологический диагноз ставится на основании выделения микобактерий туберкулеза из спинномозговой жидкости и выявления активного туберкулезного процесса в других органах ребенка.
Течение классической формы туберкулезного менингита подострое, медленно прогрессирующее. Однако в последние годы у детей раннего возраста описывают острые формы заболевания с быстрым развитием синдрома менингоэнцефалита. Возникновение таких форм обычно провоцируется такими факторами, как предшествующая инфекция, интоксикация. Хроническое течение, раньше наблюдавшееся редко, в настоящее время бывает у детей, длительно принимающих противотуберкулезные препараты.
В нелеченных случаях дети умирают через 1—2 нед после начала III стадии болезни. При ранней диагностике и правильной современной терапии очаговые симптомы не развиваются и состояние больных постепенно улучшается, не оставляя выраженных резидуальных симптомов. При поздно начатом лечении возможны последствия в виде прогрессирующей гидроцефалии, нарушения зрения и слуха, парезов конечностей, эпилептиформного синдрома.
Лечение туберкулезного менингита рекомендуется начинать с комбинации противотуберкулезных препаратов первого ряда: стрептомицина, ПАСК, фтивазида.
245
Стрептомицин вводят внутримышечно из расчета 0,02—0,03 г/кг в сутки. Суточную дозу стрептомицина вводят одномоментно.
Фтивазид назначают внутрь во время еды из расчета 0,03— 0,04 г/кг в сутки. Суточную дозу делят на 3 приема. Фтивазид рекомендуется сочетать с витамином Вб по 0,05 г в сутки. Фтивазид можно заменить тубазидом 0,006—0,01 г/кг.
ПАСК назначают из расчета 0,2 г/кг на 3—4 приема внутрь. Препарат следует запивать молоком или слабым раствором соды.
Если туберкулезный менингит плохо поддается лечению комбинацией вышеперечисленных препаратов, применяют препараты второго ряда. Этионамид назначают по 0,01—0,02 г/кг циклосерин — 0,01—0,02 г/кг в сутки. Последний препарат токсично влияет на нервную систему, поэтому его следует назначать в комбинации с глутаминовой кислотой, пиридоксином, АТФ. Капамицин назначают в дозе 0,015—0,02 г/кг в сутки. При лечении туберкулезного менингита препаратами второго ряда необходимо включить обязательно один из препаратов первого ряда (фтивазид, тубазид, ПАСК).
Помимо антибактериальной терапии применяют средства, снижающие внутричерепное давление, противосудорожную терапию, десенсибилизирующие препараты, стероидные гормоны, полноценное питание.
Лечение проводят в течение 12—13 мес в стационаре, затем в санатории. Диспансерное наблюдение за детьми, перенесшими туберкулезный менингит, следует проводить в течение 6 лет.
Энцефалиты
Термин «энцефалит» обозначает воспаление головного мозга, но в группу энцефалитов относят в настоящее время и целый ряд таких заболеваний, при которых признаки истинного воспалительного процесса нередко отсутствуют и дистрофические изменения клеток являются вторичными по отношению к инфекционным, аллергическим и токсическим повреждениям стенок сосудов мозга.
Единой общепринятой классификации энцефалитов не существует. Это связано с тем, что этиологический фактор удается документировать лишь в 10—25% случаев заболеваний (М. Б. Цу-кер, 1975). Различают первичные энцефалиты, развивающиеся под воздействием специфических нейротропных возбудителей, и вторичные, являющиеся осложнением различных инфекционных заболеваний или наблюдающиеся после профилактических прививок.
В патогенезе первичных энцефалитов большую роль играет тканевой тропизм вирусов. Параинфекционные вторичные энцефалиты во многом зависят от изменения общей иммунобиологической реактивности организма.
246
В клинике имеет также значение подразделение энцефалитов на формы с преимущественным поражением миелиновых волокон (лейкоэнцефалиты), нервных клеток (полиоэнцефалиты) и энцефалиты, сопровождающиеся тотальным поражением белого п серого вещества (панэнцефалиты). Большинство первичных форм энцефалитов являются полиоэнцефалптами. У детей раннего возраста они представлены главным образом группой полисе-зонных энцефалитов. К ним относят как заболевания с известной этиологией (энтеровирусные энцефалиты Коксаки и ECHO, энцефалиты, вызванные вирусом простого герпеса), так и различные формы энцефалитов, при которых возбудитель до настоящего времени еще не выделен. Среди энцефалитов у детей последние составляют самую многочисленную группу. К первичным полио-энцефаломиелитам с установленной вирусной этиологией относят острый полиомиелит. Другие формы первичных энцефалитов, такие, как клещевой энцефалит, эпидемический энцефалит, комариный энцефалит у детей раннего возраста наблюдаются крайне редко. Вторичные параинфекционные и поствакцинальные энцефалиты являются преимущественно панэнцефалитами (панэнцефаломиелитами) с преобладанием поражения белого вещества мозга.
В отдельную группу лейкоэнцефалитов выделяют хронические медленно прогрессирующие демиелинизирующие заболевания нервной системы с характерным преимущественным поражением субкортикальных отделов больших полушарий. Из нескольких известных клинико-морфологических вариантов лейкоэнцефалитов у маленьких детей описаны лишь подострый склерозирующий лейкоэнцефалит Ван-Богарта и Даусона и острый геморрагический лейкоэнцефалит.
Полисезонные энцефалиты. В эту группу объединены энцефалиты различной этнологии, возникающие в любое время года, с чем связано название «полисезоппые». Клиниколабораторное обследование больных с этими формами патологии позволяет выяснить этиологию лишь в 15—20% случаев. В настоящее время доказана роль энтеровирусов Коксаки и ECHO, вируса простого герпеса в развитии полисезонпых энцефалитов у детей.
Патоморфология. При морфологическом исследовании мозга больных, умерших в острой стадии энцефалита, обнаруживают отек и набухание мозга, выраженные изменения сосудов, набухание и инфильтрацию сосудистых стенок, повышение их проницаемости, мелкие дпапедезные геморрагии, ангионекрозы с распадом аргирофильной сети. Несколько позднее появляются деструктивно-некротические изменения нейронов, экссудативно-пролиферативные реакции в виде периваскулярных плазмоцитарных инфильтратов, разрастания глии. На более поздних стадиях выражены процессы дегенерации и отмирания нервных клеток, глиоз, гиалпноз и обызвествление стенок сосудов, образование полостей и кист.
247
При энцефалитах, вызванных вирусом простого герпеса, возможны массивные очаги некроза с полным лизисом вещества мозга, преимущественно локализующиеся в височных и лобных областях. В некоторых случаях некроз носит геморрагический характер.
Клиническая картина. Выраженность энцефалитов может варьировать от стертых до крайне тяжелых форм, приводящих к летальному исходу уже в первые часы заболевания. Появлению симптомов поражения мозга могут предшествовать продромальные явления в виде анорексии, вялости, субфебрильной температуры, катара верхних дыхательных путей. Затем на фоне внезапного повышения температуры, а в некоторых случаях и без нее, появляются общемозговые симптомы: рвота, судороги, вялость, апатия, потеря сознания, падение артериального давления, нарушение ритма дыхания и сердечной деятельности. Иногда выбухает большой родничок. В зависимости от преимущественной локализации патологического процесса развиваются те или иные очаговые симптомы.
При поражении ствола мозга могут быть глазодвигательные расстройства, бульбарные парезы и параличи, резкое снижение мышечного тонуса в конечностях, сменяющееся затем спастическими тетрапарезами. Нарушаются жизненно важные функции организма: дыхание, сердечная деятельность, сосание.
Для полушарной локализации поражения характерны психомоторное возбуждение, нарушение сознания, фокальные судороги, псевдобульбарные расстройства, спастические парезы и параличи. В первые дни заболевания мышечный тонус обычно снижен, но повышенные сухожильные рефлексы и клонусы свидетельствуют о центральном характере поражения.
Мозжечковый синдром характеризуется острыми координатор-ными нарушениями, интенционным тремором, атаксией. Тонус мышц обычно понижен. Движения рук и ног больного ребенка дис-метричны.
Следует отметить, что чем меньше ребенок, тем менее выражена очаговость и тем более преобладают общемозговые симптомы. Особенно они характерны для полушарной локализации процесса.
Выявить какую-либо специфику очагового поражения при энцефалитах, вызванных определенными типами вируса, или при формах с неустановленной этиологией не удается.
У детей раннего возраста полисезонные энцефалиты значительно чаще, чем у старших, протекают с вовлечением в патологический процесс оболочек мозга. Однако менингеальный синдром выражен в меньшей степени, чем при менингитах, и проявляется такими симптомами, как общая гиперестезия, светобоязнь, выбухание большого родничка. Поставить диагноз менингоэнцефалита клинически не всегда представляется возможным.
248
В патогенезе энцефалитов у маленьких детей большая роль принадлежит гиперергической реакции. Последняя может проявляться тяжелым генерализованным поражением сосудов с диапе-дезными кровоизлияниями в кожу, слизистые оболочки и внутренние органы (особенно в надпочечники).
У больного отмечаются петехиальная сыпь, атопия кишечника и симптомы раздражения брюшины, тяжелая мышечная гипотония, снижение артериального давления, грубые сдвиги баланса электролитов.
Изменения крови в острой стадии энцефалита иеспецифичны. Можег быть типичная воспалительная реакция с высокой СОЭ, лейкоцитозом, сдвигом формулы влево пли, наоборот, лейкопения. При выраженном аллергическом компоненте наблюдается эозинофилия.
При спинномозговой пункции ликвор вытекает под большим давлением (350 см водн. ст. и выше). В нем определяется лимфоцитарный пли смешанный цитоз, может быть повышена концентрация белка. Примесь крови наблюдается при выраженном ка-пплляротоксикозе пли геморрагическом характере некроза ткани мозга. Содержание сахара — в пределах нормы.
На электроэнцефалограмме в острый период заболевания обычно бывают выраженные диффузные изменения в виде дезорганизации ритма.
Длительность острого периода при различных формах может варьировать от нескольких часов до нескольких недель.
Течение. Прогноз. Энтеровируспые энцефалиты, как правило, имеют благоприятное течение. У большинства больных наблюдается полный регресс неврологических нарушений и наступает полное выздоровление.
Клинические формы с необычайно острым и злокачественным, молниеносным течением связывают с вирусом простого герпеса. Имеются указания на возможную роль одновременно двух или большего числа вирусов при таких формах энцефалитов (М. Б. Цу-кер, 1975). Летальный исход при них обусловлен внезапно развившимися отеком и набуханием мозга, сопровождающимися массивными очагами некроза мозговой ткани.
Последствия полисезониых энцефалитов тем вероятнее, чем меньше ребенок к моменту заболевания и чем обширнее поражение мозга. Наиболее часто наблюдаются задержка психического и речевого развития, судорожный синдром, гидроцефалия, микроцефалия, глазодвигательные нарушения, спастические парезы и параличи.
Лечение полисезониых энцефалитов направлено на коррекцию гемоциркуляторных и ликвородинамических нарушений, борьбу с отеком и набуханием мозга. С помощью внутривенного введения жидкостей необходимо стабилизировать кровообращение больного и баланс электролитов, скоррегировать сдвиги кислотно-щелочного равновесия. Показана активная, дегидратациопная
249
терапия. Назначают также тиамин, пиридоксин, аскорбиновую кислоту. Судорожные припадки являются основанием для применения противосудорожной терапии. В тяжелых случаях можно рекомендовать гормональные препараты (гидрокортизон, преднизолон, преднизон). Имеются сообщения о положительном эффекте препарата 5-йодо-2-диоксиуридина (УДИ) при герпетическом энцефалите. Полагают, что он обладает противовирусным действием. На курс лечения герпетического энцефалита вводят 400—600 мг препарата, распределяя его равномерно на 7 дней. Данные об эффективности лечения 5-йодо-2-диоксиуридином пока предварительные.
Несмотря на то что возбудителями энцефалитов в большинстве случаев являются вирусы, в острой стадии показано назначение антибиотиков широкого спектра действия в возрастных дозах. Применение их оправдано тем, что сопротивляемость бактериальной инфекции у детей с энцефалитом значительно снижена и у них часто развиваются вторичные инфекционные осложнения (пневмонии, отиты, бактериальные менингиты, абсцессы мозга и др.).
Для лечения последствий энцефалита применяют массаж, лечебную гимнастику, ортопедические укладки, которые параллельно с препаратами, улучшающими трофику мышц и нервно-мышечную проводимость, назначают, как только миновала непосредственная угроза для жизни ребенка. В последующем обязательно диспансерное наблюдение и применение по показаниям противосудорожной и рассасывающей терапии, препаратов, стимулирующих метаболизм тканей мозга и обменные процессы в скелетных мышцах.
Параинфекционные энцефалиты и энцефаломиелиты. В эту группу относятся поражения центральной нервной системы, развивающиеся при острых инфекционных заболеваниях. У детей раннего возраста они чаще всего наблюдаются при так называемых экзематозных инфекциях — кори, ветряной оспе, краснухе. Поражение мозга при этих заболеваниях носит инфекционно-алдёрг йчёский' характер. Инфекционный агент, меняя иммуно-~биологические свойства организма, служит пусковым моментом аллергической реакции. Роль механизмов аллергии подтверждается патоморфологическими изменениями нервной системы, которые во многом сходны с таковыми при экспериментальном аллергическом энцефаломиелите. В острой стадии поражения центральной нервной системы наблюдается отек мозга, выраженное венозное полнокровие, затем диффузное поражение миелиновых волокон, пролиферация микроглии, фибриноидная дегенерация стенок сосудов. Очаги демиелинизации располагаются перивеноз-но. Макроглиальная пролиферация также носит периваскулярный характер. Осевые цилиндры остаются относительно сохранными. Нервные клетки страдают незначительно.
Об аллергической природе нарушений свидетельствуют также
250
отсутствие продромальных явлений, возникновение неврологических симптомов в определенный период, а также частая их обратимость.
Приведенный патогенез па-раинфекционных энцефалитов является схематичным. Тонкие механизмы развития неврологических нарушений до последне
го времени еще окончательно
не выяснены.
Коревой энцефалит (энцефаломиелит). Коревой энцефалит (энцефаломиелит) может развиться у детей любого возраста как при тяжелой, так и при легкой форме кори. Это наи-
Рис. 81. Пролиферация элементов микроглии вокруг сосудов и в веществе головного мозга при коревом энцефалите
более частые неврологические осложнения заболевания. Значи-
тельно реже в этих случаях наблюдают миелиты и полиневриты.
П а т о м о р ф о л о г п я (рис. 81). Помимо изменений, характерных для инфекционно-аллергических энцефалитов, в мозге детей, погибших от коревого энцефалита, находят множественные мелкие, иногда сливные, кровоизлияния. Они обычно развиваются при тромбозе синусов и вен, который часто осложняет течение коревого энцефалита. Изменения в спинном мозге при энцефаломиелитах аналогичны таковым в головном мозге. Иногда оп
ределяются очаги кровоизлияний в оболочках мозга.
Клиническая картина. Симптомы энцефалита наиболее часто развиваются остро в разгаре болезни, на 3—4-й день после появления сыпи. Однако описаны энцефалиты, возникающие за 3—10 дней до появления сыпи или в период реконвалес-ценцпи. На фоне нового подъема температуры возникают вялость, сонливость, возбуждение, нарушение сознания различной степени — от легкого затемнения до длительного глубокого бессознательного состояния или комы. Судороги — раннее проявление болезни. Они чаще носят генерализованный характер. Очаговая неврологическая симптоматика может быть различной: гемипарезы, тетрапарезы, мозжечковые расстройства, нарушение функции черепномозговых нервов — чаще II, III, VII пар. При
вовлечении в процесс спинного мозга выявляются вялые нижние парапарезы, сочетающиеся с тазовыми расстройствами и нарушением трофики. Д. С. Футер (1965) выделяет несколько синдромов, наиболее часто наблюдающихся при коревом энцефалите: коматозный, энцефалит с судорожными явлениями, гемиплегический, энцефаломиелитический и миелитический.
Прекоревые энцефалиты протекают обычно очень тяжело и оставляют выраженные неврологические нарушения. Предпола-
251
гают, что при этой форме вирус кори непосредственно воздействует на нервную клетку, как при первичных энцефалитах.
Неврологические нарушения, возникающие в самом начале коревой инфекции на фоне общей интоксикации, проявляются вялостью, сонливостью, психомоторным возбуждением, нестойкими очаговыми симптомами, которые обусловлены дисциркуляторными нарушениями. Их следует рассматривать как энцефалическую реакцию или токсическую энцефалопатию.
Энцефалиты, развивающиеся на 3—4-й день после появления высыпаний, носят инфекционно-аллергический характер и оставляют значительные неврологические расстройства.
Поражения мозга, возникающие в период пигментации после нормализации температуры, в большинстве случаев протекает благоприятно. Н. И. Нисевич (1970) предполагает возможную роль в их этиологии вторичной инфекции. По мнению М. А. Да-диомовой и Р. А. Пратусевич (1974), эти формы скорее следует рассматривать как инфекционно-аллергические.
Изменения спинномозговой жидкости при коревом энцефалите (энцефаломиелите) обычно кратковременны, держатся всего несколько дней. Давление ликвора повышено. Количество клеток увеличено до 200—300 в 1 мкл, преимущественно лимфоциты, содержание белка нормально или немного повышено.
Течение. Прогноз. Следует отметить, что тяжесть энцефалита не всегда зависит от течения кори. Летальность при коревых энцефалитах достигает 25%. Тяжелым осложнением коревого энцефалита, часто приводящим к смерти, является тромбоз веп мозга и особенно синус-тромбоз. При полном выздоровлении после коревого энцефалита длительно держится астенический синдром. У многих больных остаются резидуальные неврологические симптомы: парезы, судорожные припадки, снижение памяти и уровня психического развития.
Лечение симптоматическое. Применяют препараты, снимающие отек мозга и понижающие внутричерепное давление. Учитывая значение аллергии в патогенезе коревого энцефалита, назначают десенсибилизирующую терапию (димедрол, пипольфен, тавегил, диазолпн) в возрастных дозах. Применяют также гормоны (преднизолон, триамцинолон) по схеме, постепенно снижая дозу. При тяжелом течении внутривенно вводят гидрокортизон. Активно проводят мероприятия, направленные на нормализацию жизненно важных функций — кровообращения, дыхания. По показаниям назначают противосудорожную терапию. Для предупреждения и лечения пневмонии и септических тромбозов применяют антибиотики.
При судорогах или выраженном психомоторном беспокойстве используют литические смеси, в состав которых могут быть включены 2,5% растворы аминазина и пппольфена, 1—4% раствор амидопирина, 50% раствор анальгина, 0,25% раствор новокаина. Дозы препаратов определяют в зависимости от возраста боль-252
ного. Литическую смесь нужно вводить внутримышечно 3—4 раз» в сутки.
Для профилактики показано введение гамма-глобулина детямг имевшим контакт с больными, особенно детям со склонностью к аллергическим реакциям.
Энцефалиты при ветряной оспе. Поражения нервной системы при ветряной оспе наблюдаются редко. Среди них наиболее велик удельный вес энцефалитов (90%), редко наблюдаются миелиты и полиневриты.
Патоморфология. Изменения мозга при ветряночном энцефалите сходны с таковыми при коревом энцефалите, что является косвенным подтверждением инфекционно-аллергического* генеза заболевания. В тяжелых случаях он может протекать как гнойно-геморрагический, при этом процесс захватывает и мозговые оболочки.
Клиническая картина. Зависимости между тяжестью* ветряной оспы и возникновением энцефалита выявить не удается. Болеют преимущественно дети раннего возраста. Признаки поражения нервной системы имеются обычно на 3—7-й день после появления высыпаний. Однако энцефалит может развиться и в доэкзантемный период, и в более поздние сроки. На фоне высокой лихорадки остро появляются судороги, нарушается сознание. Но иногда этих симптомов нет. У некоторых детей наблюдаются головные боли, сонливость, вялость или психомоторное возбуждение при неизмененном сознании. Для ветряночных энцефалитов характерны мозжечковые и весытбулярные расстройства, которые сравнительно "редко наблюдаются при энцефалитах другой этиологии. Из-за атаксии дети не могут ни стоять, пи сидеть. Отмечаются дрожание головы, тремор рук, нистагм. Иногда эти признаки могут быть единственными очаговыми нарушениями. В некоторых случаях они сочетаются с пирамидными парезами, гиперкинезами. При ветряночном энцефалите описан также неврит зрительных нервов.
Давление спинномозговой жидкости, как правило, повышено. Количество клеток обычно не превышает 100—200 в 1 мкл. Они представлены в основном лимфоцитами, иногда наблюдается нейтрофильный цитоз. Количество белка умеренно повышено.
Течение энцефалита при ветряной оспе обычно благоприятное, в редких случаях — тяжелое, с летальным исходом. Остаточные явления наблюдаются в 15—25% случаев, чаще всего в виде мозжечковых нарушений.
Лечение такое же, как при других форхмах инфекционноаллергических энцефалитов.
Поражение нервной системы при гриппе. Изменение нервной системы у детей при гриппе описаны в конце прошлого века основателем отечественной педиатрии Н. Ф. Филатовым, отметившим, что в раннем возрасте они наиболее постоянны.
253
Этиология. Патогенез. Поражение нервной системы отмечено главным образом при формах заболевания, вызванных штаммами вируса Аг и В.
Высокая частота церебральных нарушений в раннем детском возрасте объясняется несовершенством гематоэнцефалического барьера, низким порогом возбудимости незрелых нейронов и более быстрым, чем у старших, развитием отека и набухания мозга.
Нейротоксические свойства различных видов вируса связаны с воздействием на иннервационный аппарат церебральных сосудов. Изменения в нервной системе возникают вследствие дисциркуляторных расстройств и токсикоза.
Скорее всего этим механизмом объясняется и разнообразие клинических симптомов поражения нервной системы при гриппе. Следует, однако, отметить, что в отдельных случаях из головного мозга лиц, погибших от гриппа, был выделен вирус гриппа. Вирусы гриппа Аг были выделены из спинномозговой жидкости больных (В. М. Жданов, В. В. Ритова, 1959). Установлена также возможность возникновения воспалительного процесса в нервной системе при введении вируса гриппа некоторым животным. Однако вопрос о нейротропности вируса продолжает оставаться дискуссионным, поскольку ни один из известных штаммов вируса гриппа А, В или С не размножается в клетках мозга, то есть истинными нейротропными свойствами не обладает.
Патоморфология. При изучении мозга детей с церебральными нарушениями, погибших от гриппа, обнаруживаются значительный отек и набухание вещества мозга, гиперемия сосудов мозга и мозговых оболочек. При гистологическом исследовании определяются главным образом сосудистые нарушения в виде диапедезных кровоизлияний, тромбозов, стазов, кровоизлияний в мозговые оболочки и вещество мозга. На этом фоне выявляются грубые дегенеративные изменения нервных клеток, инфильтраты, глиоз, которые обычно рассматриваются как вторичные, токсические или токсико-аллергические. Однако в литературе также имеются описания изменений мозга воспалительного характера.
На основании характера имеющихся при гриппозном энцефалите патоморфологических изменений наиболее правомочно его характеризовать как токсико-геморрагический.
Клиническая картина. Выделяют 2 основные формы церебрального поражения при гриппе — энцефалические реакции и токсико-геморрагический энцефалит.
Энцефалические реакции характеризуются наличием главным образом общемозговых расстройств. На высоте гриппозной инфекции возникают рвота, головная боль, судороги, затемнение или потеря сознания. Судороги чаще носят генерализованный, клонический или клонико-тонический характер. Возможно появление менингеальных симптомов в виде гиперестезии кожных покровов, выбухание большого родничка, легкой ригидности мышц затыл
254
ка. Эти симптомы держатся недолго, состояние больных улучшается, проясняется сознание. Вялость или возбуждение могут сохраняться более длительно. В некоторых случаях общемозговые и менингеальные симптомы бывают более выражены: продолжительность потери сознания может быть до 1 — IV2 сут, она более глубокая, судороги повторяются, более отчетливы менингеальные симптомы. Такое течение может сопровождаться расстройством дыхания и сердечно-сосудистыми нарушениями, выраженной мышечной гипотонией, повышением или угнетением сухожильных рефлексов, снижением реакции зрачков на свет, корнеальных и конъюнктивальных рефлексов. У некоторых больных наблюдаются гиперемия и отек сосков зрительных нервов. После прояснения сознания длительно сохраняется вялость или возбуждение.
Давление спинномозговой жидкости повышено. Ее состав нормальный пли имеется небольшой лимфоцитарный плеоцитоз — до 30—40 клеток в 1 мм3.
Токсико-геморрагический энцефалит характеризуется острым, иногда бурным апоплектиформным развитием на 2—7-й день с начала заболевания гриппом. При этом наблюдаются высокий подъем температуры, озноб, судороги, потеря сознания. Могут быть психомоторное возбуждение, бред.
В зависимости от локализации очаговых симптомов у детей раннего возраста выделяют следующие формы токсико-геморрагического гриппозного энцефалита: корковый, в симптоматике которого преобладает выраженное психомоторное возбуждение; корково-подкорковый с моно- и гемипарезами, гиперкинезами; стволовой с геми- или тетрапарезами, выраженными глазодвигательными нарушениями, атаксией (Э. А. Эдельштейн, 1972). Неврологические расстройства могут сохраняться различное время в зависимости от глубины поражения и тяжести заболевания.
Течение. Прогноз. Наиболее тяжело у детей первых лет жизни протекает стволовая форма, при которой отмечается расстройство дыхания, терморегуляции и сердечной деятельности. Прогностически неблагоприятным является длительное выключение сознания.
После энцефалита возможны стойкие последствия: глазодвигательные расстройства, различные двигательные нарушения, задержка психомоторного развития, судороги.
Профилактика и лечение. Во время вспышек эпидемий гриппа с целью повышения сопротивляемости организма назначают аскорбиновую кислоту в дозе 0,3—1 г в зависимости от возраста. Имеются предварительные данные об эффективности применения интерферона в коллективах, где были случаи заболевания гриппом, однако основное значение имеют профилактические мероприятия по уменьшению распространения воздушнокапельной инфекции.
При наличии симптомов поражения нервной системы показаны дегидратирующие препараты, литические смеси, противосудо-
255
Рис. 82. Изменения в тканях мозга при поствакцпнальном энцефалите: а — очаговая пролиферация микроглии, б — периваскулярные инфильтраты
рожная терапия. Проводятся мероприятия, направленные на нормализацию дыхания и кровообращения. Для лечения и предупреждения вторичных инфекций назначают антибиотики.
Поствакцинальные энцефалиты. Широкое применение вакци-нопрофилактики инфекционных заболеваний, наряду с резким снижением заболеваемости и полной ликвидацией некоторых инфекций в ряде стран, привело к появлению неврологических нарушений, связанных с профилактическими прививками. Перед врачами и учеными возникла проблема так называемых прививочных реакций, имеющих большое значение в патологии раннего детского возраста.
Осложнения при применении вакцин могут быть обусловлены целым рядом факторов, среди которых основным является возможность специфической сенсибилизации с последующим развитием аутоиммунных процессов и гиперергических реакций. Наиболее сильное аллергизирующее действие свойственно убитым вакцинам типа коклюшно-дифтерийно-столбнячной, но и живые вакцины, включая полиомиелитную (наименее реактогенную), также приводят к сенсибилизации организма. На фоне измененной реактивности организма прививки могут вызвать тяжелые расстройства. Другими факторами являются: развитие инфекционного процесса при применении живых вакцин, реверсия патогенных свойств вакцинных штаммов.
Вакцинальные энцефалиты могут развиваться после противооспенной и противокоревой вакцинации, введения вакцин КДС и АКДС, при антирабических прививках.
В основе вакцинальных энцефалитов лежит аллергическая реакция тканей мозга, морфологически выражающаяся в воспалительном поражении мозговых сосудов с формированием множественных периваскулярных, прежде всего перивенозных, инфильтратов, диапедезных кровоизлияний, развитием отека мозга.
256
Процесс локализуется преимущественно в белом веществе головного и спинного мозга (рис. 82). Характерно образование очагов демиелинизации. Морфологически вакцинальные энцефалиты являются аллергическими лейкоэнцефалитами (энцефаломиели-
Энцефалит (энцефаломиелит) при противооспенной вакцинации. Выделяют несколько клинических форм вакцинального оспенного поражения нервной системы: серозный менингит, менингоэнцефалит, энцефаломиелит (энцефалит) и миелит. Энцефалиты и энцефаломпелпты составляют около 55% всех поражений нервной системы, связанных с проведением противооспенной вакцинации. Реже встречаются серозные менингиты, полирадику-лоневрпты, поражения отдельных черепномозговых нервов.
Частота поствакцинальных энцефалитов (энцефаломпелитов) в различных странах колеблется в больших пределах: в Англии 1 : 4000, Швеции — 1 : 20 000, Германии — 1 : 100 000 первично прививаемых. В Советском Союзе в 1971 е— 1 : 250 000. В последние годы наблюдается некоторое снижение ее.
Клиническая картина. Первые признаки заболевания обнаруживаются на 3—12-й день после вакцинации. Начало болезни острое, бурное. Температура поднимается до 39—40° С. Наблюдаются озноб, головная боль, судороги, нарушение сознания различной степени. В первые дни могут быть выражены менингеальные симптомы. Очаговую неврологическую симптоматику вначале бывает трудно выявить из-за преобладания общемозговых симптомов. Спустя несколько дней можно обнаружить очаговые церебральные и спинальные нарушения: параличи и парезы центрального, периферического или смешанного характера, расстройства функции сфинктеров.
Мозжечковые нарушения, гиперкинезы, признаки поражения черепномозговых нервов наблюдаются редко. Расстройство функции сфинтеров обычно носит преходящий характер. На 4—6-й день функция тазовых органов нормализуется и только в редких случаях выраженные нарушения держатся более длительно.
Выделяют несколько клинических форм вакцинального оспенного энцефалита: серозный менингит, менингоэнцефалит, энцефаломиелит и миелит.
Спинномозговая жидкость прозрачная, иногда может быть умеренный лимфоцитарный плеоцитоз (до 60—90 клеток в 1 мкл), содержание белка и сахара нормальное или несколько увеличено. Давление в первые дни заболевания повышено.
Изменения крови непостоянны. У некоторых больных выявляются лейкоцитоз со сдвигом формулы влево, повышенная СОЭ.
Течение. Прогноз. Поствакцинальные поражения нервной системы при оспе в большинстве случаев протекают благоприятно. При серозных менингитах клиническое выздоровление наступает на 8—10-й день болезни, изменения в ликворе могут сохраняться до 20-го дня. Энцефалиты и энцефаломиелиты у 60%
257
больных не оставляют грубых очаговых расстройств. В других случаях могут наблюдаться стойкие двигательные нарушения, судороги, задержка психического развития. Возможно тяжелое течение с лавинообразным нарастанием симптоматики, развитием комы и легальным исходом (Н. Я. Покровская и др., 1978).
Лечение. Назначают внутримышечно повторно инъекции противооспенного гамма-глобулина (до 9—12 мл). В тяжелых случаях рекомендуются кортикостероиды.
Энцефалит (энцефаломиелит) при прививках АКДС. Поражения нервной системы после введения АКДС-вакцины наблюдается сравнительно часто. Это связано с высокой реактогенностыо вакцины, которая гораздо выше, чем реактогенность каждого из компонентов в отдельности. И. С. Левенбук с соавторами (1971) считают, что возникновение неврологических осложнений при АКДС-вакцинации обусловлено коклюшным компонентом вакцины. Вакцина оказывает выраженное аллергизирующее действие на организм ребенка. У отдельных детей после АКДС-вакццнацип наблюдаются уртикарная сыпь, синдром ложного крупа, астматический и геморрагический синдромы, в редких случаях — анафилактический шок.
Вакцинальный энцефалит (энцефаломиелит) возникает у детей с различными аллергическими проявлениями на фоне или сразу после перенесенных инфекционных заболеваний, при нарушении сроков вакцинации. Он может развиться после любого введения вакцины, независимо от кратности.
Клиническая картина. Симптомы энцефалита появляются через несколько суток после вакцинации внезапно, остро. Поднимается температура, появляются рвота, судороги, адинамия, нарушается сознание, возможно развитие комы. На фоне общемозговых расстройств могут развиться центральные и периферические двигательные нарушения различной степени, вплоть до параличей, расстройство функции сфинктеров. Однако несмотря на тяжесть острого периода в дальнейшем наступает сравнительно быстрое выздоровление. Нормализуется температура, ребенок приходит в сознание, прекращаются судороги. В течение 1—2 нед исчезает очаговая неврологическая симптоматика.
В течение 2—3 мес после энцефалита держится астенический синдром. Выраженная очаговая симптоматика после энцефалита наблюдается при тяжелых формах, протекающих с длительной потерей сознания, дыхательными и сердечно-сосудистыми нарушениями.
Поражение нервной системы при вакцинации АКДС может быть также в виде преходящих, различной тяжести энцефалити-ческих реакций, главным образом в виде судорожного синдрома. Судороги могут быть однократные или повторные, генерализованные или малые — «кивки», сааламовы судороги, вздрагивания, «обмякания», подергивания лицевых мышц. Судороги обычно сочетаются с беспокойством, расстройством сна или вялостью. Эти
258
нарушения держатся обычно всего в течение 3—5 дней, но сопровождаются последующей длительной астенией.
Лечение и профилактика. При появлении неврологических нарушений назначается комплексная терапия с включением гормонов и других десенсибилизирующих средств, дегид-ратационной терапии. Показано применение витаминов группы В, аскорбиновой кислоты, никотиновой кислоты и др. При появлении бактериальных осложнений назначаются антибиотики.
Поскольку поражения нервной системы, безусловно, чаще развиваются у детей с измененной реактивностью, при определении показаний к вакцинации необходимо тщательное изучение анамнеза, внимательное отношение к жалобам матери, строгое соблюдение правил применения вакцины.
Лейкоэнцефалиты. Это группа демиелинизирующих заболеваний воспалительно-дегенеративного характера. Хотя при лейко-энцефалитах поражается преимущественно белое вещество мозга, обычно в той пли иной степени страдают и нейроны. Поэтому четкой грани между лейкоэнцефалитами и панэнцефалитами провести нельзя. Вопрос об этиологических факторах лейкоэнцефали-тов и этиологической однородности отдельных форм в настоящее время не решен однозначно. Предполагается, что лейкоэнцефалиты относятся к заболеваниям инфекционно-аллергической природы. Остается спорным вопрос о роли миксовирусов, вирусов кори, бешенства п Herpes zoster как пусковых факторов гиперер-гического аутоиммунного процесса.
Патоморфология. При исследовании мозга больных, умерших от лейкоэнцефалита, находят диффузные воспалительно-дегенеративные изменения, очаги демиелинизации и деструкции в белом веществе мозга, иногда в коре, подкорковых ганглиях и мозговых оболочках. Отдельные очаги могут сливаться, выраженность дегенеративных изменений в них варьирует. Деструкции подвергаются нормально сформированный миелин (миелино-кластический тип поражения). В большинстве случаев выражен глиоз, иногда столь значительно, что мозг на разрезе имеет хрящевидную консистенцию.
Клиническая картина. Симптомы появляются исподволь и неуклонно прогрессируют или ремиттируют. К самым ранним относятся психические нарушения, которые у маленьких детей проявляются апатией, вялостью или раздражительностью, капризностью, непослушанием, немотивированным агрессивным Поведением. Дети теряют навыки опрятности, речь становится более скудной, исчезает логика мышления. На фоне психических нарушений постепенно, в течение нескольких недель или месяцев, развивается очаговая неврологическая симптоматика (апраксия, агнозия, зрительные и слуховые галлюцинации, полиморфные гиперкинезы, повышение мышечного тонуса по пластическому типу равномерно в сгибательных и разгибательных группах мышц, что приводит к скованности движений). Позднее разви
259
ваются спастические моно-, геми- или тетрапарезы и параличи. Наблюдаются также нарушения координации движений и неустойчивая походка (мозжечкового или лобного происхождения). Расстройства фонации и глотания обычно сочетаются с высокими нёбным и глоточным рефлексами. Бульбарный паралич бывает редко.
Постоянным симптомом лейкоэнцефалитов являются судороги, чаще в виде малых или абортивных припадков, перемежающихся с редкими развернутыми приступами. В поздней стадии заболевания присоединяются вегетативные и трофические расстройства: кахексия, профузный пот, икота, нарушения терморегуляции, пролежни и т. д. В терминальной стадии больные обездвижены, могут возникать состояния децеребрационной ригидности.
На ЭЭГ регистрируется периодическая пароксизмальная активность с интервалом 5—15 с одновременно в большинстве отведений в виде медленных (1—2 с) высоковольтажных волн. По мере прогрессирования заболевания эти изменения становятся более выраженными.
В крови может быть лейкоцитоз, фракция аг-глобулина повышена. У больных обычно повышен титр антител к коревому вирусу или к миксовирусам — вирусу JC или SV-40.
В спинномозговой жидкости в большинстве случаев не наблюдается цитоза и увеличения содержания белка. При электрофоретическом исследовании белков, однако, обнаруживается, что Y-глобулин составляет до 40 и более процентов от общего количества белка, а фракция альбумина снижена. Коллоидные реакции дают максимальную флоккуляцию в первых пробирках (паралитический тип реакции Ланге).
Течение. При неуклонно прогрессирующем течении больные умирают через 2—12 мес после появления первых симптомов. При длительном течении продолжительность жизни может быть 3 года и более, а ремиссии продолжаются от нескольких месяцев до нескольких лет, в течение которых симптомы заболевания могут уменьшаться.
Существует несколько клинико-морфологических вариантов лейкоэнцефалитов, из которых у маленьких детей описаны лишь подострый склерозирующий лейкоэнцефалит Ван-Богарта и Дау-сона и острый геморрагический лейкоэнцефалит.
Лейкоэнцефалит Ван-Богарта выделен из группы лейкоэнцефалитов на основе регулярного обнаружения в клетках нервной системы характерных включений наряду с типичными для лейкоэнцефалитов изменениями. Выраженность поражения мозга уменьшается в направлении от коры к филогенетически более древним образованиям, но чаще, чем при других формах заболевания, поражены ствол и спинной мозг.
Клиническая особенность этой формы лейкоэнцефалита — раннее проявление и преобладание экстраппрамидных нарушений
260
(гиперкинетическая форма), к которым лишь на поздних этапах присоединяются пирамидные симптомы. Для нее не характерны эпилептические припадки.
Острый геморрагический лейкоэнцефалит по клиническим и патоморфологическим признакам сходен с вирусными и поствакцинальными энцефалитами. В отличие от других форм лейкоэн-цефалита он начинается очень остро и симптомы поражения мозга развиваются молниеносно. Заболеванию часто предшествуют острые респираторные проявления с лихорадкой и лейкоцитозом. Через 2—4 дня вновь повышается температура, появляются головная боль, ригидность мышц шеи, развивается ступор, прогрессирующий иногда до комы. Характерны фокальные или генерализованные судороги, геми- или тетрапарезы, псевдобульбарный паралич. Может быть отек соска зрительного нерва. Обычно заболевание оканчивается летально в течение 2—14 дней, но описаны также подострое и хроническое течение геморрагического лейко-энцефалпта.
В спинномозговой жидкости определяется цитоз, главным образом за счет полиморфноядерных лейкоцитов, встречаются также лимфоциты, содержание белка повышено до 1,0 г/л и более. Макроскопически кровь в ликворе не обнаруживают, но могут быть ксантоматоз и единичные эритроциты.
При типичном молниеносном течении в мозге умерших больных находят очаги распада мозговой ткани мягкой розовато-серой окраски с множественными точечными кровоизлияниями. Микроскопически выявляется фибринозный некроз стенок мелких сосудов, главным образом венул, окруженных экссудатом фибрина, воспалительными клетками и кольцевидными геморрагическими зонами. В этих же периваскулярных зонах демиелинизация с умеренной или выраженной деструкцией осевых цилиндров и, соответственно, вторичными микроглиальными и астроцитарными реакциями. Аналогичные инфильтраты находят в прилежащем к очагам повреждения субарахноидальном пространстве. Встречаются также области с выраженной периваскулярной реакцией и дегенерацией без геморрагий.
Дифференциальный диагноз лейкоэнцефалитов труден. С одной стороны, они сходны с группой наследственно-дегенеративных лейкодистрофий, глиозом и объемными процессами. С другой стороны, при более остром течении их следует дифференцировать от других энцефалитов, менингитов и коматозных состояний метаболического генеза. Окончательный диагноз можно поставить лишь на основе патоморфологического исследования мозга.
Лечение лейкоэнцефалитов симптоматическое, оно направлено главным образом на десенсибилизацию организма. С этой целью применяют кортикостероиды, димедрол, пипольфен, супрастин. По показаниям назначают противосудорожную терапию, препараты, снижающие мышечный тонус. При остром течении
261
геморрагического лейкоэнцефалита показаны средства, уменьшающие отек мозга, укрепляющие сосудистую стенку, а также интенсивные мероприятия по поддержанию жизненно важных функций организма.
Полиомиелит
Полиомиелит — острое инфекционное заболевание, возбудителем которого является нейротропный вирус. Вирус полиомиелита относится к группе энтеровирусов и встречается в трех вариантах: I, II и III, различающихся по антигенным свойствам.
Эпидемиология. До проведения массовых вакцинаций вирус эпидемического полиомиелита был широко распространен на всех континентах. В настоящее время «дикие» штаммы вируса почти повсеместно вытеснены вакцинальными.
Источником __инфекции при полиомиелите является больной или вирусоноситель, которые выделяют вирусы со слюной, фекалиями и мочой. Заражение происходит алиментарным jljih воздушно-капельным путем/Эпидемический подъем заболеваемости в странах с умеренным климатом наблюдается в летне-осенние месяцы.
Патогенез. Попадая в организм, вирус размножается в тканях кишечника и носоглотки, откуда проникает в лимфатическую систему и кровь. Циркуляция вируса в крови сопровождается общеинфекционными симптомами. Если иммунологическая тппоспецифическая нейтрализация вируса оказывается недостаточной, вирус проходит через гематоэнцефалический барьер и избирательно поражает двигательные нейроны центральной нервной системы и (или) оболочки мозга.
Патом орфолог и я. При исследовании мозга больных, умерших в острой стадии полиомиелита, обнаруживаются диффузные несимметричные экссудативно-пролиферативные воспалительные изменения мотонейронов, иногда сопровождающиеся мелкоточечными кровоизлияниями. Преимущественная локализация патологического процесса — поясничное и шейное утолщения спинного мозга, реже поражаются варолиев мост, продолговатый мозг и кора больших полушарий.
Морфологические изменения нарастают с 6—8-го дня болезни. Нервные клетки набухают, теряют свою форму, исчезают внутриклеточные фибриллы, появляются вакуоли, наблюдается перерождение ядер. В связи с гибелью клеток резко выражена нейроно-фагия. Характерно, что рядом с перерожденными и распавшимися нейронами лежат нормальные клетки. Поражение клеток неравномерно по своей интенсивности. В резидуальный период отмечается разрастание волокнистой глии, заполняющей дефект, образовавшийся в результате гибели нервных клеток. Склеротические очажки располагаются в различных отделах центральной нервной системы. При односторонних очагах наблюдается асим
262
метрия серого вещества. Соответствующие пораженным нейронам передние корешки истончены.
Клиническая картина. Длительность инкубационного периода колеблется от нескольких дней до 4—5 нед. Первые симптомы заболевания носят общеинфекционный характер: субфебрильная или высокая температура, интоксикация, катаральные и диспептические явления. При эффективной иммунореактивности больного ребенка через 3—7 дней наступает полное выздоровление. Это абортивная, или висцеральная, форма полиомиелита. Диагноз абортивной формы полиомиелита подтверждается вирусологическими и серологическими исследованиями.
Однако абортивное течение полиомиелитной инфекции нехарактерно для детей раннего возраста, у которых, как правило, спустя 1—5 дней на фоне относительного улучшения состояния появляются признаки поражения центральной нервной системы, сопровождающиеся второй волной температурной реакции. Интервал между температурными волнами обычно колеблется от 3 до 7 дней. В зависимости от преимущественной локализации патологического процесса, которая определяется как тропностью и вирулентностью вируса, так и генотипическим и иммунологическим фоном организма, выделяют несколько клинических форм поражения нервной системы.
Непаралитическая менингеальная форма полиомиелита характеризуется клиническими проявлениями серозного менингита. На высоте второго подъема температуры, а иногда и раньше (на 2— 3-й день болезни), состояние больного ухудшается. Дети вялые, реже беспокойные. Аппетит отсутствует, наблюдается 1—2-кратная рвота. При менингеальной форме полиомиелита, в отличие от серозных менингитов другой этиологии, признаки повышения внутричерепного давления нерезки, менингеальные симптомы могут отсутствовать, особенно у детей 1-го года жизни. .Характерным признаком являются спазмы мышц, чаще икроножных, приводящих мышц бедра, больших грудных мышц/ что выражается в ограничении объема их активных и пассивных движений.
Ликвор прозрачен, иногда может опалесцировать. Давление нормальное или слегка повышено. В первые дни наблюдается нейротрофильный плеоцитоз, который на 6—8-й день сменяется лимфоцитарным. Количество клеток колеблется от 50 до 200, реже _ д0 800—1000 в 1 мкл. При выраженных менингеальных симптомах белок повышен иногда до 0,6—1,5 г/л. Содержание сахара нормально или слегка повышено. Ликвор нормализуется обычно на 3—4-й неделе болезни.
Менингеальную форму полиомиелита дифференцируют от серозных менингитов другой этиологии на основании выделения специфического вируса из крови, спинномозговой жидкости или значительного нарастания титра специфических антител в крови больного.
263
Паралитическая форма полиомиелита характеризуется появлением несимметричных парезов и параличей, преимущественно проксимальных мышц конечностей. Развитию параличей может предшествовать преп; ралитическая стадия, в которой наблюдаются катаральные и желудочно-кишечные расстройства, нерезко выраженные менингеальные симптомы, болезненные спазмы мышц, подергивания отдельных мышечных групп. Выраженные болп_в позвоночнике приводят к резкому ограничению движения. "Ребенок лежит в одной позе, старается не двигаться. При пассивных движениях, например при попытке посадить ребенка, возникает отрицательная эмоциональная реакция. Даже самое легкое прикосновение к коже также может вызывать резкую боль. У многих больных в препаралитической стадии наблюдается потливость. Она наиболее выражена в области головы и шеи и в парализующихся в дальнейшем конечностях. Иногда с первых дней заболевания появляется сонливость, усиливающаяся постепенно до сопора. Дети с трудом просыпаются для приема пищи. Сон неспокойный, прерывается криками, плачем, бредом. У некоторых детей наблюдается мелко-, а иногда и крупноразмашистый тремор конечностей, который особенно резко выражен при скоротечных формах полиомиелита. У отдельных больных наблюдается увеличение печени, селезенки, лимфоузлов.
Препаралитический период, спустя 2—5 дней, сменяется паралитической стадией. Параличи обычно развиваются на фоне падения температуры, иногда на высоте ее, могут появиться внезапно, чаще всего утром после сна, или постепенно нарастают в течение 1—3 дней. Распространенность параличей и степень их выраженности достигают максимума в первые дни болезни. Характерно мозаичное распределение двигательных нарушений. Внутри одной функциональной единицы рядом могут располагаться здоровые и пораженные мышечные волокна.
Характер параличей и их локализация определяются распространенностью и преимущественным поражением структур центральной нервной системы. В большинстве случаев поражаются нижние мотонейроны, поэтому параличи бывают периферические, вялые, со снижением или отсутствием сухожильных рефлексов (рис. 83). Характерны выраженные вегетативно-трофические нарушения, приводящие к быстрой глубокой атрофии мышц.
В то же время реактивный отек тканей вокруг мотонейрона может приводить к сдавлению проводящих путей, что проявляется центральными спастическими парезами мышц ниже уровня поражения. При таком механизме развития спастических парезов они преходящи. Их следует отличать от спастических параличей, обусловленных первичным поражением вирусом двигательных мотонейронов коры больших полушарий (энцефалптическая форма полиомиелита), которые обычно более глубокие и стойкие и часто сопровождаются судорогами и другими общемозговыми симптомами.
264
Рис. 83. Ребенок со спинальной формой полиомиелита
В зависимости от распространенности поражения периферических мотонейронов в центральной нервной системе выделяют следующие варианты паралитической формы полиомиелита — спинальную (шейную, грудную и поясничную), бульбо-спинальную, бульбарную, понтинную и смешанные формы — понто-спинальную и понто-бульбо-сппнальную.
При поражении поясничного отдела спинного мозга помимо» парезов и параличей мышц ног могут быть преходящие тазовые расстройства.
Для поражения шейно-грудного отдела характерны нарушения дыхания вследствие парезов дыхательной мускулатуры. Парез диафрагмы характеризуется так называемым парадоксальным типом дыхания: на высоте вдоха вместо обычного выпячивания подложечной области происходит ее западение, поскольку при отрицательном давлении в грудной клетке парализованная диафрагма как бы всасывается, при выдохе стенка выдается наружу. Нарушение функции межреберных мышц проявляется ограничением экскурсии грудной клетки, активным участием в акте дыхания вспомогательной мускулатуры шеи и плечевого пояса. Дыхание учащенное, поверхностное, кожные покровы бледные. Эти нарушения не сопровождаются застоем крови в легких, отеком легочной ткани и повышенной секрецией в дыхательные пути («сухой тип» нарушения дыхания). У грудных детей часто наблюдаются осложнения со стороны легких. Гиповентиляция, гипоксемия, ателектазы приводят к развитию пневмоний.
Изолированное локальное поражение того или иного отдела спинного мозга наблюдается редко. Множественные очаги могут располагаться по всему длпннику спинного мозга. В этом случае поражение мышц может комбинироваться в самых разнообразных сочетаниях: полная тетраплегия, гемиспндромы, параплегия верх
265
них и нижних конечностей, перекрестные парезы, монопарезы, локальные поражения отдельных мышечных групп.
При бульбарной форме полиомиелита наблюдаются нарушения ритма дыхания, обусловленные поражением дыхательного центра продолговатого мозга. Дыхание становится поверхностным, а при прогрессировании процесса — прерывистым, с резкими вдохами вплоть до полной остановки. Дыхательные расстройства сопровождаются повышенным слюнотечением, скоплением в дыхательных путях обильного вязкого секрета («влажный тип» нарушения дыхания), нарушениями ритма сердечной деятельности, падением артериального давления, расстройством глотания и фонации с отсутствием нёбного и глоточного рефлексов, девиацией языка. Характерно развитие пневмоний и ателектазов. Поражение ядер ствола головного мозга сопровождается выраженными вегетативными расстройствами: пятнистой гиперемией, крапчатым цианозом, бледностью кожи, ее похолоданием и потливостью. Отек в области ретикулярной формации может приводить к выраженной сонливости вплоть до сопора и комы или к резкому возбуждению, переходящему в судорожный статус. Бульбарная форма полиомиелита характеризуется высокой летальностью.
Сочетанная бульбо-спинальная форма является наиболее тяжелой, так как при ней одновременно имеют место и нарушение функции дыхательного центра, и параличи дыхательных мышц.
Понтинная форма полиомиелита характеризуется поражением ядер варолиева моста, которое проявляется асимметрией лица, лагофтальмом, птозом, косоглазием, нарушением конвергенции. Наиболее характерен изолированный одно- или двухсторонний паралич лицевого нерва. Этиологический диагноз в этих случаях является весьма затруднительным. Такое поражение следует дифференцировать от невритов лицевого нерва другой этиологии. Поскольку исследование вкуса и слуха можно произвести лишь у детей после 4—6 лет, дифференциальный диагноз ставят па основании электромиографического исследования, позволяющего разграничить поражение ядра и ствола лицевого нерва.
Исследование спинномозговой жидкости имеет относительное значение, так как патологические сдвиги ее состава наблюдаются только в 40—45% случаев понтинных форм полиомиелита. Наличие соответствующей эпидемической обстановки, ранний возраст ребенка и данные ЭМГ-исследоваиия, подтверждающие поражение ядра лицевого нерва, свидетельствуют о вероятности полиомиелита.
Энцефалитическая форма полиомиелита проявляется симптомами очагового поражения мозга. На фоне вялости, заторможенности, потери сознания развиваются моно- и гемиплегии спастического характера, джексоновские судорожные припадки, гиперкинезы. Эта форма наиболее трудна для распознавания, так как ее проявления сходны с энцефалитами другой этиологии.
266
Паралитическая стадия полиомиелита длится от нескольких дней до 1—2 нед и без четкой границы переходит в III, восстановительную, стадию. В первую очередь и более полно восстанавливаются мышцы, пострадавшие последними. Отдельные мышцы восстанавливаются полностью, другие — лишь частично. Активное восстановление длится 1—2 года, после чего его темп замедляется.
Резидуальная стадия характеризуется стойкими параличами отдельных мышечных групп, формированием контрактур и деформаций конечностей и туловища. Улучшение двигательных возможностей в этот период может быть достигнуто за счет компенсации функции сохранной мускулатурой. Иногда в резидуальный период вследствие роста ребенка и нарастающей декомпенсации создается впечатление, что двигательные нарушения прогреди-ентны (псевдопроцессуальность).
Диагноз паралитических форм полиомиелита подтверждается данными дополнительных методов исследования.
В крови в острый период может быть неспецифическая воспалительная реакция. Давление ликвора повышено, в начале острой стадии определяется клеточно-белковая, а затем белково-клеточная диссоциация. На ЭМГ в острой фазе обнаруживаются уре-жение ритма осцилляций, изменение формы и растянутость во» времени каждого двуфазного колебания. В парализованных мышцах может быть «биоэлектрическое молчание». По мере восстановления нарушенных функций ритм потенциалов учащается, амплитуда их повышается.
Дифференциальный диагноз. Паралитические формы полиомиелита в острой фазе дифференцируют от менингитов, энцефалитов, энцефаломиелитов и невритов другой этиологии, в том числе и от полиомиелитоподобных заболеваний, крупа и инородного тела в дыхательных путях, анафилактической реакции. Дифференциальной диагностике способствуют вирусологические и серологические исследования, подтверждающие этиологию заболевания, а также оценка эпидемиологической обстановки.
Вакцинассоцпированные формы полиомиелита. В настоящее время число выраженных паралитических форм полиомиелита резко сократилось в связи с массовой иммунизацией живой противополиомпелитной вакциной. Однако в ряде случаев у соматически ослабленных детей на фоне измененной иммунологической реактивности организма, а также при нарушении сроков и кратности вакцинации возможно развитие так называемых вакцинассоциированных форм полиомиелита. Частота их составляет 0,06 на 1 000 000 привитых трехвалентной вакциной и 0,7 на 1000 000 привитых вакциной III типа. Клинические симптомы появляются на 4—30-й день после прививки. Продромальный и препаралитический периоды с общеинфекционными и соматическими симптомами у 75% больных отсутствуют. У части детей отмечаются повышение температуры, вялость, сонливость,
267
'боли в мышцах. Развивающиеся двигательные нарушения представлены главным образом легкими спинальными монопарезами или слабостью отдельных мышечных групп. Реже наблюдается понтинная форма полиомиелита в виде изолированного поражения ядра лицевого нерва. У большинства больных патологические изменения нестойки и быстро проходят. У некоторых детей, несмотря на кажущуюся легкость поражения, остаются резидуальные явления в виде гипотрофии мышц, нарушения походки. Тяжелые паралитические формы вакцинассоциированого полиомиелита наблюдаются крайне редко (Е. В. Лещинская, 1978).
В том случае, если полиомиелит развивается через 46 дней после приема живой вакцины, его трудно связать непосредственно с вакцинацией. В этих случаях, по-видимому, речь идет о заражении «диким» вирулентным штаммом вируса. Полиомиелит у детей, привитых живой вакциной, сохранил свои основные эпидемиологические черты, присущие допрививочному полиомиелиту (сезонность, контагиозность, очаговость). Но клиника полиомиелита стала более простой. По данным В. В. Фомина (1974), соотношение тяжелых форм без восстановления утраченных функций и легких форм составляет 3,7 : 1000. Удельный вес спинальной формы полиомиелита увеличился с 59% в 1958 г. до 93% в 1974 г. Продромальный период у 40% детей отсутствует. Температурная реакция наблюдается в 4 раза реже, чем у непривитых. Общеинфекционные симптомы отмечаются лишь у 14—16% детей. Клиника полиомиелита характеризуется отсутствием препа-ралитического периода. В паралитический период наблюдаются преимущественно мозаичные вялые парезы мышц нижних конечностей.
В постановке диагноза имеет значение указание на недавнюю вакцинацию живой полиомиелитной вакциной, а также выделение штаммов полиовируса из глоточных смывов, фекалий и ликвора. Интерпретация результатов серологического исследования затруднена из-за наличия поствакцинального иммунитета. Имеет значение не менее чем 4-кратное нарастание титра антител. Разграничение полиомиелита и сходных с ним заболеваний, вызванных энтеровирусами типов Коксаки, ECHO и аденовирусами, возможно лишь на основании вирусологических исследований.
Лечение. В острой фазе полиомиелита больному показан строгий постельный режим с ограничением двигательной нагрузки. Физическое напряжение способствует усугублению паралича. Температура тела, пульс, дыхание и артериальное давление измеряются каждые 4 ч в течение всего лихорадочного периода, осуществляется постоянный контроль за функцией кишечника и мочевого пузыря. При нарушении дыхания и сердечной деятельности проводится интенсивная терапия. При всех клинических формах назначают аскорбиновую кислоту — 0,05—0,1 г/кг массы тела в сутки.
268
Сразу же после появления первых признаков восстановления движений назначают витамины группы В, прозерин, галантамин. Одновременно показано применение болеутоляющих средств (анальгина, амидопирина, ацетилсалициловой кислоты), а также физиотерапевтических процедур, которые уменьшают мышечное напряжение и таким образом снимают боль. К ним относятся горячие укутывания, озокеритовые и парафиновые аппликации, иопо-гальвапизация с новокаином, поперечная диатермия.
С целью профилактики контрактур туловищу и конечностям больного следует придавать правильное физиологическое положение с помощью различных приспособлений — валиков, мешочков с песком и т. д. На 12—14-й день болезни назначают легкий массаж, пассивные движения. Затем приступают к более активной гимнастике.
В восстановительный период лечение направлено на максимально возможное восстановление и компенсацию функции мышц. Оно проводится курсами в условиях стационара, поликлиники или санатория. Курс лечения включает применение медикаментозных препаратов, физиотерапии, ортопедических методов лечения. Медикаментозное лечение состоит в назначении средств, улучшающих нервно-мышечную проводимость (прозерин, галантамин, оксазил, дибазол), обмен веществ в нервной системе (тиамин, пиридоксин циапокобаламин, амипалон, церебролизин, липоцеребрин, глутаминовая кислота), обмен веществ ь мышечной ткани (токоферола ацетат, МАП, АТФ, метионин, калия оротат, неробол). Показаны также препараты, улучшающие капиллярный кровоток (никотиновая кислота, компламин), рассасывающие препараты (алоэ, лидаза).
Из физиотерапевтических методов лечения эффективны электрофорез прозерипа, кальция хлорида, йодида калия, компла-мппа, лидазы; электростимуляция мышц и периферических нервов; тепловые процедуры, включая гидротерапию, грязе- и торфолечение, аппликации парафина, озокерита.
Лечебная физкультура при полиомиелите должна строиться индивидуально, дифференцированно на основании детального анализа двигательных нарушений у больного. С помощью специальных приемов облегчения выявляют минимальные функциональные возможности каждой мышцы и используют их для включения мышцы в движения. Лечебную физкультуру следует проводить дозированно, не допуская переутомления мышц и нервной системы. Начиная с 3—4 мес после начала заболевания назначают упражнения с нагрузкой.
Ортопедические мероприятия направлены на предупреждение деформации суставов и позвоночника. Применяют специальную обувь, лонгеты, туторы, этапные гипсовые повязки, ортопедические аппараты.
В поздний восстановительный период эффективно санаторно-курортное лечение (Евпатория, Анапа, Одесса, Пятигорск).
269
Профилактика полиомиелита предусматривает применение трехвалентной (I, II, III типа) живой вакцины Сэбина (ЖВС). Ее вводят в виде капель или драже ребенку в возрасте 2 мес, 3,5 мес и 5 мес. Через 1 год проводят ревакцинацию. Массовая профилактическая вакцинация живой полиомиелитной вакциной, начатая в Советском Союзе в 1958 г., привела к практически полной ликвидации полиомиелита.
Полиомиелитоподобные заболевания
Полиомиелитоподобные заболевания — полиэтиологичная группа острых инфекционных заболеваний, клинически сходных с легкими паралитическими формами полиомиелита. Их связывают с энтеровирусами Коксаки А и В, ECHO, вирусами паротита, простого герпеса, аденовирусами. Приблизительно у половины больных этиологический фактор остается невыясненным. Заболевания чаще спорадические. Однако вирусы Коксаки группы В могут вызывать эпидемические вспышки.
До проведения массовых вакцинаций против полиомиелита и сплошных вирусологических и серологических обследований больных эти формы патологии регистрировались как полиомиелит. По клиническим проявлениям полиомиелитоподобные заболевания трудно разграничить от легких форм полиомиелита, наблюдаемых у привитых детей. Клиническая картина характеризуется парезами единичных групп мышц, обратимостью патологических изменений, отсутствием воспалительных изменений в ликворе. Больные с преходящими парезами составляют около 90%. Для инфекции, вызванной вирусом Коксаки В-5, характерны выраженные общепнфекционные симптомы, а также миальгия, герпетическая ангина.
При вирусных инфекциях ECHO-2, ECHO-11, ЕСНО-6 и Коксаки А-4 описаны спинальные и бульбарно-спинальные формы с летальным исходом.
Вирусологические и серологические исследования позволяют разграничить отдельные формы заболеваний внутри этой группы. Как и при легкой спинальной форме полиомиелита, полиомиелитоподобные заболевания следует отличать от очагового миелита, мононевритов, заболеваний опорно-двигательного аппарата, рахита.
Неврит лицевого нерва
Инфекционные поражения периферических нервов у детей раннего возраста встречаются гораздо реже, чем травматические. При инфекционных заболеваниях в патологический процесс может вовлекаться один нерв (мононеврит) или несколько (полиневрит). Из мононевритов в раннем детском возрасте наблюдается главным образом неврит лицевого нерва. Более частое пора-270
жение лицевого нерва обусловлено особенностями его строения и анатомического расположения в полости черепа и в канале пирамидки височной кости, предрасполагающими к проникновению инфекции или сдавлению нерва отечной жидкостью.
Этиология. Инфекционные поражения лицевого нерва делят на первичные и вторичные. Первичные возникают при энтеровирусных инфекциях, гриппе, полиомиелите. Вторичные невриты лицевого нерва обусловлены патологическими изменениями в мозговых оболочках, костной ткани, близко прилежащих к лицевому нерву. Они наблюдаются при отитах, антритах и мастоидитах, менингитах, арахноидитах, воспалительных заболеваниях лимфатических и околоушных желез.
Переохлаждения, острые респираторные заболевания чаще являются провоцирующими факторами, но иногда они могут быть непосредственной причиной поражения. В этом случае в результате воспалительного отека происходит сдавление лицевого нерва в костном канале.
Клиническая картина. Нарушение функции мимических мышц на пораженной стороне проявляется расширением глазной щели, синергичным движением глазного яблока при попытке смыкания век (симптом Белла), сглаженностью носогубной складки, опущением угла рта. Все эти признаки наиболее ярко выражены при улыбке и плаче. У детей грудного возраста парез мимических мышц лица приводит к нарушению сосания. Ребенок не может плотно захватить сосок и молоко вытекает из угла рта. На стороне пареза отмечаются угнетение поискового рефлекса, асимметрия хоботкового рефлекса. Боли в месте выхода лицевого нерва могут быть причиной беспокойства ребенка, нарушения сна, отказа от груди. Они появляются за 4—5 дней до развития клинических симптомов поражения лицевого нерва и держатся в течение 1—2 нед. Парез мимических мышц лица может сопровождаться вкусовыми, секреторными нарушениями и гиперакузией при поражении нерва на различных уровнях в канале височной кости. Однако эти изменения у детей раннего возраста выявить гораздо сложнее, чем у старших.
Диагноз ставится с учетом особенностей клинической картины, характера сопутствующего заболевания, эпидемиологической обстановки и данных вирусологического и серологического исследований. Электронейромпографпя позволяет разграничить поражения ядра и ствола лицевого нерва. Инфекционные невриты лицевого нерва у детей раннего возраста следует дифференцировать с травматическими повреждениями его в родах.
Течение и прогноз неврита лицевого нерва у детей первых лет жизни благоприятные. При ядерном поражении восстановление функции пораженных мышц происходит быстрее, чем при процессах в области ствола нерва. Иногда полное восстановление функции наступает спонтанно без применения специфического лечения.
271
Лечение в раннем детском возрасте начинают с применения тепловых процедур. Эффективны аппликации озокерита, горячие укутывания, полуспиртовые компрессы. Наряду с физиотерапевтическими мероприятиями применяют витамины группы В, антпхолппэстеразные препараты (галантамин, прозерин). Массаж и лечебную гимнастику проводят с осторожностью, избегая перерастяжения паретпчных мышц. При выраженном парезе мышц накладывают специальные маски для временной фиксации пораженных мышц.
Глава VIII. ДЕТСКИЕ ЦЕРЕБРАЛЬНЫЕ ПАРАЛИЧИ
Термин «церебральные параличи» объединяет группу синдро-мов, возникших в результате недоразвития или повреждения мозга в пренатальный, интранатальный и ранний постнатальный периоды. Поражение мозга проявляется нарушением мышечного тонуса и координации движений, неспособностью сохранять нормальную позу и выполнять произвольные движения. Двигательные нарушения часто сочетаются с чувствительными расстройствами, задержкой речевого и психического развития, судорогами. Детские церебральные параличи относят к непрогрессирующим резидуальным состояниям. Однако развитие дефектного мозга может сопровождаться включением новых патологических симптомов на различных возрастных этапах (гидроцефалия, вегетативные расстройства, судороги). Инфекционные заболевания, интоксикации, повторные травмы могут также вызвать ухудшение состояния, что создает впечатление текущего процесса.
Частота. Данные о частоте церебральных параличей разноречивы. На основании обширных статистических исследований W. Phelps (1950) подсчитал, что ежегодно на 100 000 населения рождается около 7 детей с церебральным параличом; по данным Р. Asher и F. Shonell (1950),— 1,7 на 1000 родившихся; по N. Eastman (1955),— 3,5—5,9 на 1000 родов. Обследование, проведенное в г. Ленинграде в 1971—1972 гг., показало, что церебральный паралич встречается с частотой 2,5 на 1000 детского населения (М. Н. Гончарова и др., 1974). По данным Московской консультативной детской неврологической поликлиники, частота церебрального паралича в 1977—1978 гг. составила 3,3 на 1000 детей.
Этиология, патогенез. В развитии церебральных параличей играют роль вредные факторы, воздействующие на мозг ребенка в пренатальный, интранатальный и постнатальный периоды. Из каждых 100 случаев церебрального паралича 30 возникает пренатально, 60— интранатально, 10 — постнатально. S. Brandt и V. Westergaard-Nielsen (1958) проанализировали 628 случаев церебрального паралича и установили, что пренатальные и интранатальные факторы в 87% случаев были причиной заболевания, тогда как постнатальные — только в 13%.
К вредным факторам, действующим на плод внутриутробно и вызывающим недоразвитие или патологическое развитие мозга, относятся инфекционные заболевания (краснуха, цитомегалия, токсоплазмоз и другие вирусные инфекции), сердечно-сосудистые и эндокринные нарушения у матери, токсикозы беременности, им-10 нз 273
мунологическая несовместимость крови матери и плода, психическая травма, физические факторы, некоторые лекарственные препараты.
Инфекционные и соматические заболевания матери вызывают нарушения маточно-плацентарного кровообращения и патологические изменения в плаценте, приводящие к расстройствам питания плода и внутриутробной гипоксии. Изменения в нервной системе зависят не столько от специфических свойств вредных факторов, сколько от периода внутриутробного развития, в котором они действуют (эмбриональный или фетальный периоды). Патогенные факторы, действующие в период органогенеза и плацентации, чаще вызывают аномалии развития мозга. Однотипность аномалий развития, несмотря на различный механизм действия повреждающих факторов, объясняется общим биохимическим звеном патогенеза — торможением окислительных процессов, которые являются основой роста и дифференциации клеток.
На более поздних этапах внутриутробного развития изменения, возникшие в нервной системе под влиянием экзогенных факторов, не носят характера аномалий развития. Хроническая гипоксия на этой стадии может приводить к замедлению процессов миелинизации нервной системы, нарушению дифференциации нервных клеток и их аксонов, патологии формирования межнейрональных связей и сосудистой системы мозга.
В этиологии церебральных параличей немаловажная роль принадлежит иммунологической несовместимости крови матери и плода (по резус-фактору, системе АВО и другим антигенам эритроцитов). Резус или групповые антитела, проникая через плаценту, вызывают гемолиз эритроцитов плода. Непрямой билирубин, образовавшийся в результате гемолиза, оказывает токсическое действие на нервную систему. Наиболее выраженные изменения находят обычно в области базальных ганглиев (ядерная желтуха).
У плодов, перенесших внутриутробную гипоксию, к моменту рождения защитные и адаптационные механизмы оказываются недостаточно сформированными. На этом фоне при рождении могут развиваться асфиксия и внутричерепная родовая травма, усугубляющие изменения, возникшие внутриутробно.
Тяжелые внутричерепные кровоизлияния как следствие родовой травмы обычно приводят к смерти новорожденного, поэтому их удельный вес в неврологических нарушениях у выживших детей незначителен.
Главную роль в патогенезе патологии нервной системы, развивающейся интра- и, частично, постнатально, играют гипоксия, ацидоз, гипогликемия и другие метаболические сдвиги. Продукты нарушенного обмена веществ могут воздействовать на мозг непосредственно или приводить к отеку и вторичным циркуляторным изменениям. Гемодинамические сдвиги происходят в основном в области микроциркуляторного русла. Скопление больших 274
количеств крови в капиллярной сети, замедление циркуляции приводит к падению тонуса сосудов, повышению их проницаемости и выходу жидкой части крови в периваскулярные и перицеллюлярные пространства. Отек и тканевая гипоксия вызывают различные изменения в ткани мозга: набухание тел клеток и их отростков, растворение субстанции Ниссля, отделение окончаний синапсов от тел клеток. У недоношенных детей в результате гипоксии могут наблюдаться перивентрикулярные размягчения.
Паралитическое расширение сосудов при гипоксии, особенно мелких вен и капилляров, переполнение их кровью может быть причиной как микрогеморрагий, так и обширных кровоизлияний. Факторами, предрасполагающими к внутричерепным кровоизлияниям у новорожденных, могут быть также изоиммунная тромбоцитопения, геморрагическая болезнь новорожденного. При изоим-мунной тромбоцитопении тромбоциты ребенка содержат антиген, которого нет в тромбоцитах матери. Во внутриутробный период они проникают в кровоток матери и стимулируют образование антитромбоцитарных антител, которые вызывают тромбоцитопению у плода (до 30 000 в 0,1 мл).
Геморрагическая болезнь новорожденного развивается в результате недостаточности витамина К. Этот дефицит особенно выражен у недоношенных в связи с транзиторной незрелостью печени.
В постнатальный период церебральные параличи могут возникать после инфекционных заболеваний (менингитов, энцефалитов), травм головного мозга. Профилактические мероприятия и раннее начало лечения инфекционных заболеваний нервной системы снизили в настоящее время их удельный вес в развитии церебральных параличей.
Пат оморфология. Характер изменений в нервной системе зависит от времени воздействия патогенных факторов.
Пренатальные повреждения, возникшие на ранних стадиях онтогенеза, проявляются различными аномалиями развития мозга — микрополигирией, пахигирией, гетеротопией, агенезией мозолистого тела, аплазией мозжечка и др. Наиболее часто встречается микрополигирия — большое количество маленьких неправильно расположенных извилин. Пораженный участок имеет гранулярный вид. Нарушена дифференциация молекулярных слоев, отмечается незрелость нейронов. Пахигирия встречается реже и характеризуется уменьшением количества вторичных извилин. В пораженном полушарии нервные клетки образуют толстый недифференцированный слой с неправильно расположенными нервными волокнами и группами гетеротопических клеток. Нервные клетки незрелые, белое вещество истончено. При этом может наблюдаться аномальное развитие кортико-спинального пути. Недоразвитие мозжечка при церебральных параличах бывает неравномерным либо затрагивает только полушария или червь. В области спинного мозга также находят аномалии развития. Обычно
10*
27&
это расширение спинномозгового канала (гидромиелия). Гидро-миелия может быть от локальной и незначительной до больших полостей на протяжении всего спинного мозга. Иногда она сочетается с патологией черепномозговых нервов.
Аномалии развития мозга выявляются у 30% детей с церебральным параличом.
Перинатальные нарушения нервной системы, наблюдающиеся у большинства больных с церебральным параличом, развиваются в результате глубоких циркуляторных расстройств (отека, микрогеморрагий, некрозов), приводящих к дистрофическим изменениям в мозговой ткани. К ним относятся диффузный или очаговый глиоз, кистозная дегенерация, порэнцефалия, олигогирия, обызвествление ганглиозных клеток.
Пролиферация глии сочетается с дегенерацией пирамидных клеток головного мозга и некрозом субкортикального слоя белого вещества. Мягкая мозговая оболочка может быть утолщена и сращена с глиозно перерожденными участками мозга.‘Иногда обнаруживают фибриллярный глиоз, связанный с дегенерацией нервных волокон. Эти изменения чаще асимметричные, но могут быть и двусторонними. В редких случаях встречается церебральная гемиатрофия.
Кистозная дегенерация — наличие мелких полостей в белом веществе, которые могут сообщаться друг с другом, но с желудочками мозга не связаны. Полости располагаются преимущественно в перивентрикулярной области. Локализация кист в этой области связана с повышенной ее васкуляризацией, сохранением эмбриональной ткани и высокой метаболической активностью. Наряду с кистами при микроскопическом исследовании можно обнаружить частичную деструкцию ткани. Причинами кистозного перерождения являются эмболия, тромбоз сосудов и тяжелый отек мозга.
В отличие от кистозной дегенерации порэнцефалия (церебральная киста) образуется в результате тяжелых локальных повреждений мозга (сосудистой ишемии, геморрагий, травматического размягчения). Образовавшаяся полость пересечена глиальными волокнами; в большинстве случаев она не соединяется с желудочком. Такие кисты называют ложной порэнцефалией. Они встречаются чаще, чем истинная порэнцефалия — узкая полость, вершина которой соединена с боковым желудочком, а основание направлено к поверхности мозга. Истинная порэнцефалия образуется в результате дефекта развития невральной трубки на ранних стадиях онтогенеза.
Поражение базальных ганглиев, зрительного бугра, обнаруживаемое при гипоксии и ядерной желтухе, характеризуется избыточной миелинизацией волокон, располагающихся кольцеобразно вокруг сосудов. Это придает мозгу своеобразный пятнистый вид (status marmoratus). Подобные изменения выявляются и в коре головного мозга. При ядерной желтухе наблюдается также 276
Рис. 84. Тонический лабиринтный рефлекс в положении на спине
атрофия клеток бледного шара, ядер гипоталамуса. Вышеуказанные изменения могут сочетаться друг с другом, поскольку детский церебральный паралич нередко является следствием комплексного воздействия различных вредных факторов.
Клиническая картина. Двигательные нарушения при церебральных параличах обусловлены тем, что поражение незрелого мозга изменяет последовательность этапов его развития (постнатальная патологическая гетерохрония). Высшие интегративные центры не оказывают тормозящего влияния на примитивные двигательные рефлекторные реакции. Тонические рефлексы активизируются и сосуществуют с патологическим мышечным тонусом (спастичностью, ригидностью, тоническими спазмами). Это препятствует последовательному становлению реакций выпрямления и равновесия, которые в норме создают основу для развития двигательных навыков.
Лабиринтный рефлекс, асимметричный и симметричный шейные тонические рефлексы, положительная поддерживающая реакция, синкинезии при церебральных параличах ярко выражены и являются причиной формирования патологических поз и движений
Тонический лабиринтный рефлекс. Наличие выраженного лабиринтного рефлекса у детей с церебральным параличом проявляется максимальной экстензорной спастичностью в положении на спине и флексорной — в положении па животе.
При резкой экстензорной спастичности шея и позвоночник напряжены, голова запрокинута назад, ноги разогнуты, приведены, ротированы внутрь, стопы в подошвенном сгибании. Руки могут быть согнуты, плечи оттянуты назад или, наоборот, разогнуты и пронпрованы, пальцы сжаты в кулак (рис. 84). Это тормозит развитие выпрямляющих рефлексов в положении на спине.
Ребенок с выраженным тоническим лабиринтным рефлексом в положении на спине не в состоянии поднять голову пли делает это с большим трудом, не может вытянуть руки вперед, чтобы
277
Рис. 85. Тонический лабиринтный рефлекс в положении на животе
взять предмет, а позже схватиться, подтянуться и сесть, поднести руки ко рту. Затруднен поворот со спины на бок, а затем на живот. В возрасте 7—8 мес поворот со спины на живот осуществляется блоком, отсутствует торсия между тазом и верхней частью туловища. Если ребенок не может согнуть голову в положении на спине, повернуться с торсией, то у него отсутствуют предпосылки для того, чтобы сесть. Выраженность тонического лабиринтного рефлекса находится в прямой зависимости от степени спастичности.
В положении на животе у ребенка с церебральным параличом вследствие патологической выраженности лабиринтного тонического рефлекса голова и спина согнуты, плечи выдвинуты вперед и вниз, руки находятся под грудной клеткой в согнутом положении, кисти сжаты в кулак. Бедра и голени приведены, согнуты, но могут быть и разогнуты (рис. 85). Такая поза тормозит формирование выпрямляющих рефлексов туловища в положении на животе, которые являются наиболее важными в преодолении ребенком силы земного притяжения и приобретении вертикальной позы. Лежа на животе, ребенок не может поднять и разогнуть голову, повернуть ее в стороны, высвободить руки и опереться на них для поддержки верхней части туловища, согнуть ноги и встать на колени, сохраняя при этом равновесие. Затруднен поворот с живота на спину. Постоянно согнутая спина приводит к развитию кифоза в грудном отделе. Если выпрямляющие рефлексы не распространяются на таз и ноги, то поясничный лордоз не формируется, что является существенным препятствием для сохранения равновесия в положении сидя и при ходьбе. Хотя экстензорная спастичность в подавляющем большинстве случаев в большей степени выражена в положении на спине, а флексорная на животе, у некоторых больных влияние тонического лабиринтного рефлекса зависит от первоначального типа спастичности. Иногда экстензорная спастичность настолько силь-
278
Рис. 86. Преобладание разгибательного тонуса в положении на животе
на, что она может быть выражена и в положении на животе (рис. 86).
Симметричный тонический шейный рефлекс. У детей с церебральным параличом его влияние на мышечный тонус становится более заметным, когда в движения включается голова. Из-за влияния тонического шейного рефлекса детям с плохим контролем головы трудно сохранить позу сидя. Разгибание головы усиливает экстензорную спастичность рук, и ребенок падает назад. Сгибание головы усиливает флексорную спастичность, и ребенок падает вперед. Дети старшего возраста при ходьбе используют тонический шейный рефлекс, чтобы избежать падения. Они сгибают голову и туловище вперед, вызывая легкую флексию.
Некоторые дети с выраженным симметричным тоническим шейным рефлексом не могут встать на колени с опущенной головой, так как ноги их при этом разгибаются, а руки сгибаются. При тяжелой двойной гемиплегии из-за влияния тонического лабиринтного рефлекса у ребенка в положении на животе резко выражена флексорная спастичность и на четвереньки он встать не может. Если спастичность нерезкая, то ребенок может встать на колени, используя симметричный тонический шейный рефлекс. Он будет сидеть на пятках с поднятой головой и удерживать свое тело на вытянутых руках. Разогнуть ноги и встать на четвереньки он не может. Такие дети сидят на пятках, но продвигаться вперед они могут, только подтягиваясь с помощью рук.
Асимметричный шейный тонический рефлекс (АШТР). При Церебральных параличах этот рефлекс доминирует в клинической картине. Он может наблюдаться многие годы, препятствуя развитию произвольной двигательной активности. Выраженность АШТ-рефлекса зависит от степени повышения тонуса мышц в
279
Рис. 87. Асимметричный шейный тонический рефлекс в положении на спине («поза фехтовальщика»)
руках. Если при спастической диплегии руки поражены легко, этот рефлекс непостоянный и характеризуется более длительным латентным периодом. У таких детей его можно определить только в тех случаях, когда они возбуждены или пытаются сделать какое-либо движение. При тяжелом поражении рук рефлекс вызывается мгновенно. Если ребенок повернул голову в сторону, он надолго может остаться фиксированным в «позе фехтовальщика» (рис. 87).
При сочетании АШТ-рефлекса с тоническим лабиринтным рефлексом ребенок не может схватить игрушку. Если вложить ему игрушку в руку, не может поднести ее ко рту, так как при попытке согнуть руку голова поворачивается в противоположную сторону. АШТ-рефлекс сильнее выражен на правой стороне, поэтому большинство детей с церебральным параличом пользуются левой рукой. При ярко выраженном АШТ-рефлексе голова и глаза чаще фиксированы в одну сторону, поэтому ребенку трудно проследить за предметом на противоположной стороне. Развивается спастическая кривошея. Сочетаясь с тоническим лабиринтным рефлексом, АШТ-рефлекс затрудняет повороты на бок и на живот: когда ребенок поворачивает голову в сторону, возникает разгибание руки и туловище не следует за головой; в результате ребенок не может высвободить руку из-под туловища. Следствием этого в дальнейшем является нарушение формирования реципрокного ползания.
Синкинезии — это содружественные тонические реакции, вызывающие увеличение спастичности в частях тела, не имеющих непосредственного отношения к движению в данный момент (рис. 88). Например, если больной с двойной гемппле1ией делает усиленное движение одной ногой, то спастичность нарастает во всем теле. При попытке полностью разогнуть спастичную руку
280
у больного с гемиплегией можно усилить экстензорную спастичность в ноге.
Положительная поддерживающая реакция — это явление контракции, то есть одновременного нарастания тонуса мышц флексоров и экстензоров ног при соприкосновении стоп с опорой. Нога становится негибкой и превращается в «колонну» для поддержки. Ребенок с церебральным параличом при ходьбе всегда касается подушечками стоп опоры, и эта реакция постоянно стимулируется и поддерживается. Несмотря на одновременную гипертонию флексоров и экстензоров при стоянии все же отмечается преобладание того или другого вида спастичности в зависимости от формы церебрального паралича. Так, у больного со спастической диплегией гипертония флексоров выражена больше. Поэтому ноги у него полусогнуты в тазобедренных и
Рис. 88. Детский церебральный паралич, оральная синкинезпя
коленных суставах, что в сочета-
нии с аддукторным спазмом обусловливает характерную позу «ножниц» и специфическую походку (рис. 89). При гемипарезе в паретичной ноге преобладает тонус экстензоров с относительным торможением флексоров, поэтому нога находится в положении
разгибания.
Все описанные рефлексы действуют одновременно, поэтому каждый из них в отдельности выявить трудно, но всегда можно отметить доминирование того или другого тонического рефлекса. У детей с гиперкинезами тонические рефлексы появляются внезапно в периоды дистонических атак на фоне повышения мышечного тонуса. В легких случаях спастической диплегии тонические рефлексы выражены незначительно. Дети могут тормозить
тонические реакции и при нормальном интеллекте используют их Для произвольной двигательной активности.
Сила высвободившихся тонических реакций отражает тяжесть состояния. В тяжелых случаях тонические рефлексы ярко выражены, наблюдаются одновременно, не имеют тенденции к торможению и модификации. Тонические рефлексы резко тормозят развитие выпрямляющих рефлексов туловища, реакций равновесия и произвольных движений.
281
Рпс. 89. Положительная поддерживающая реакция
Постоянное присутствие тонических рефлексов и повышенного мышечного тонуса создает патологическую проприоцептивную афферентную импульсацию. Нарушается нормальное «проприоцептивное кольцо», в котором основная роль принадлежит обратной афферентной импуль-сацип, основанной на точности кинестетического восприятия. В мозг ребенка поступают афферентные импульсы только от патологических поз и движений. Ребенок с церебральным параличом ощущает чрезмерное напряжение, которое требуется для любого целенаправленного движения, поэтому уже первые его двигательные навыки будут патологическими. В дальнейшем он приспосабливает их для новых движений. Последние, построенные на основе патологического стереотипа, поддерживают и усиливают неправильные позы и движения.
Речевые нарушения наблюдаются у 65—85% больных церебральными
параличами. Патогенез речевых расстройств определяется локализацией и распространенностью поражений мозга. В одних случаях в патологический процесс вовлекаются структуры, осуществляющие иннервацию речевого аппарата, главным образом кортико-нуклеарные пути и корковые речевые зоны. В других случаях речевые нарушения обусловлены сенсорными расстройствами, интеллектуальной и общей двигательной недостаточностью, нарушениями в строении речевого аппарата, ограниченностью окружения и общения.
Пространственная близость корковых двигательных и речевых зон определяет частоту сочетанных двигательных и речевых расстройств у детей с церебральным параличом. В онтогенезе моторики и речи в норме и при патологии лежат общие закономерности, а именно — речь, как и двигательные навыки, формируется на основе врожденных безусловных рефлексов. Поэтому нарушение рефлекторного развития при церебральном параличе определяет как двигательную, так и речевую патологию (Е. М. Мастюко-ва, 1973). Чрезмерная выраженность всех безусловных рефлексов, и в частности рефлексов орального автоматизма (глоточно-закрывающего рефлекса, губного, поискового, сосательного, хоботкового), нарушает синхронность актов дыхания, сосания и гло
282
тания, затрудняет кормление и тормозит становление первых голосовых реакций.
Одним из ранних нарушений, свидетельствующих о развитии речевой патологии, является псевдобульбарный синдром. Он обусловлен частым вовлечением в патологический процесс кортиконуклеарных путей. Псевдобульбарные расстройства вызывают нарушение функции артикуляционного аппарата вследствие парезов артикуляционных мышц.
На мышечный тонус артикуляционного аппарата оказывают также влияние тонические рефлексы. Лабиринтный тонический рефлекс повышает тонус мышц корня языка, затрудняя формирование произвольных голосовых реакций. При выраженности асимметричного шейного тонического рефлекса мышечный тонус в артикуляционной мускулатуре повышается асимметрично, больше на стороне «затылочных конечностей». Положение языка в полости рта при этом также часто асимметричное. За счет симметричного шейного тонического рефлекса создаются неблагоприятные условия для дыхания, произвольного открывания рта, движения языка вперед. Этот рефлекс вызывает повышение мышечного тонуса в спинке языка, кончик языка фиксирован, плохо выражен и часто имеет форму лодочки. Все выше указанные нарушения артикуляционного аппарата затрудняют формирование голосовой активности и звукопроизносительной стороны речи.
Крик у таких детей тихий, плохо модулированный, нередко с носовым оттенком, иногда в виде отдельных всхлипываний, которые ребенок производит в момент вдоха. Расстройства артикуляционной рефлекторной моторики способствуют позднему появлению гуления и лепета. Гуление и лепет характеризуются фрагментарностью, бедностью звуковых комплексов, малой голосовой активностью. В тяжелых случаях истинное протяжное гуление и лепет могут вовсе отсутствовать.
В период активного развития функции рук и ротовых реакций (2-е полугодие жизни) более отчетливо выявляются оральные синкинезии — непроизвольное открывание рта при движениях рук. Вначале оральные синкинезии имеют характер как бы нередуцированного ладонно-ротового рефлекса, зона которого постепенно расширяется. В дальнейшем открывание рта возникает при любых движениях рук, а также при зрительной стимуляции (показ игрушки). При этом характерны несоразмерно широкое открывание рта и насильственная улыбка. Эти содружественные движения наряду с отсутствием торможения рефлекторного сосания препятствуют развитию произвольной лицевой и артикуляционной моторики.
Речевые нарушения у детей с церебральным параличом в раннем возрасте часто проявляются задержкой речевого развития и дизартрией. Задержка речевого развития характеризуется более поздним формированием моторной речи. Поздно появляются первые слова, медленно увеличивается активный словарь, задержива-
283
ется формирование фразовой речи. В дальнейшем задержка речевого развития сочетается с различными формами дизартрии.
При дизартрии нарушается фонация речи в результате расстройств иннервации речевого аппарата. У детей с церебральным параличом наиболее часто отмечается псевдобульбарпая форма дизартрии. Для этой формы характерно повышение тонуса речевой мускулатуры. Язык в полости рта напряжен, спинка его спастически изогнута, кончик не выражен, часто язык оттянут кзади. Губы спастически напряжены. Активные движения в артикуляционной мускулатуре резко ограничены. Наряду со спастичностью в отдельных мышечных группах артикуляционного аппарата может отмечаться гипотония или дистония. Нарушение мышечного тонуса, парезы и параличи артикуляционной мускулатуры вызывают расстройства звукопроизношения. Часто имеется поражение мышц мягкого нёба, голос в этих случаях приобретает носовой оттенок. Характерными особенностями дизартрии являются также нарушение голосообразования и расстройство дыхания. При псевдобульбарной дизартрии наблюдаются синкинезии в артикуляционной и скелетной мускулатуре.
Наряду с псевдобульбарной дизартрией, которая наиболее часто встречается при всех формах церебрального паралича, могут иметь место и другие формы дизартрии.
При гиперкинетической форме церебрального паралича бывает экстрапирам и дная форма дизартрии, для которой характерны мышечная дистония, появление гиперкинезов в артикуляционной мускулатуре, выраженное нарушение интонационной стороны речи.
При атонически-астатической форме церебрального паралича часто отмечается мозжечковая дизартрия, особенностью которой является выраженная асинхронность между дыханием, фонацией и артикуляцией. Речь замедленная, толчкообразная с нарушенной модуляцией, затуханием голоса к концу фразы — скандированная речь. Для детского церебрального паралича характерно сочетание различных форм дизартрии.
Психические нарушения при церебральных параличах связаны как с первичным поражением мозга, так и с задержкой его постнатального развития. Психические расстройства усугубляются недостаточностью двигательных, речевых и сенсорных функций. Так, глазодвигательные нарушения, недоразвитие статоки-нетических рефлексов способствуют ограничению полей зрения, что обедняет процесс восприятия окружающего и приводит к недостаточности произвольного внимания, пространственного восприятия и познавательных процессов.
Большое значение в психическом развитии ребенка придается деятельности, которая способствует накоплению знаний и представлений об окружающей среде и формированию обобщающей функции мозга. Недостаточное развитие предметного восприятия у детей с церебральным параличом может быть связано с отсут-284
ствием у них предметных действий. У ребенка в силу двигательной недостаточности ограничена манипуляция с предметами, затруднено их восприятие на ощупь. Сочетание этих нарушений с недоразвитием зрительно-моторной координации препятствует формированию предметного восприятия и познавательной деятельности. Двигательные нарушения и ограниченность практического опыта могут быть одной из причин недостаточности высших корковых функций и, особенно, несформированности пространственных представлений.
Важным звеном в патогенезе психических нарушений у этих детей являются также условия воспитания и окружения. Недостаточность коммуникативных связей с окружающим, невозможность полноценной игровой деятельности, педагогическая запущенность способствуют задержке психического развития. Как показывает опыт, в воспитании ребенка, страдающего церебральным параличом, допускаются существенные ошибки. Наиболее частая — чрезмерное внимание родителей к больному ребенку, желание все сделать за него, предупредить любую просьбу. Это приводит к развитию пассивности, неумению преодолевать трудности. В других случаях, наоборот, родители слишком много требуют от больного ребенка, что создает у него чувство неуверенности в своих силах, желание отказаться от непосильного задания. Это формирует реакции протеста, негативизм, упрямство. Большую роль в нарушениях познавательной деятельности у детей с церебральным параличом играют речевые расстройства, которые препятствуют развитию контакта с окружающим и обобщенного мышления.
Клинические проявления психических нарушений при детском церебральном параличе зависят от того, на какой стадии развития отмечалось воздействие отрицательного фактора. Клиническая картина психических нарушений на фоне раннего внутриутробного поражения характеризуется грубым интеллектуальным недоразвитием. При поражениях, развившихся во второй половине беременности или в период родов, психические нарушения имеют более мозаичный, неравномерный характер.
В особенностях психических расстройств существенное значение имеет локализация мозгового поражения. Так, при преимущественном поражении коры головного мозга чаще отмечаются интеллектуальные нарушения и недостаточность высших корковых функций. Для поражения подкорковых отделов мозга характерны большая сохранность интеллекта и выраженные эмоционально-волевые расстройства. Специфическая картина интеллектуальных, эмоциональных и личностных нарушений имеется при поражении лобных отделов мозга. Психические нарушения у детей с церебральным параличом включают ряд относительно характерных состояний.
Психомоторные расстройства на 1-м году жизни проявляются соматовегетат явными нарушениями. В первые
285
месяцы жизни могут отмечаться различные желудочно-кишечные дискинезии (срыгивание, рвота, пониженный или чрезмерно повышенный аппетит, боли в животе, упорные запоры), гипертермия, асимметрия кожной температуры, выраженные сосудистые реакции на малейшее охлаждение или болевое раздражение. Для этих детей характерны также стойкие нарушения сна, которые выражаются в трудностях засыпания, в извращении ритма сна, недостаточной его глубине. Соматовегетативные нарушения часто сочетаются с церебрастеническим синдромом, который характеризуется физической и психической истощаемостью. Чем меньше ребенок, тем больше у него выражена физическая слабость. Эта своеобразная астения характеризуется рядом особенностей: отмечается связь ее со временем суток; она больше выражена во второй половине дня. Выраженность астении во многом зависит от самых разнообразных внешних факторов (приема пищи, погоды, времени года). Часто она сочетается с малой двигательной активностью — адинамией. Больные отличаются вялостью, бездеятельностью, безынициативностью (астено-адинамический синдром). У некоторых детей, напротив, отмечается психомоторное беспокойство (гипердинамический синдром). Обычно при этом более сохранена моторика и уже на 2—3-м году жизни у таких детей можно отметить склонность к психомоторной расторможенности. Двигательное беспокойство сочетается с повышенной аффективной возбудимостью, нарушениями внимания и целенаправленной деятельности. Оно нарастает при утомлении, перед сном. Как адинамический синдром, так и гипердинамический часто сочетаются с ритмическими стереотипными движениями.
G возрастом ребенка соматовегетативные нарушения несколько уменьшаются и создают фон для возникновения вторичных неврозоподобных расстройств. Непосредственным толчком к этому часто являются неблагоприятные внешние воздействия. К наиболее частым симптомам неврозоподобных нарушений относятся привычные рвоты, приступы ларингоспазма и аффективно-респираторные расстройства, страхи. Страхи особенно ярко проявляются в новой для ребенка обстановке, при изменении его привычного жизненного стереотипа (разлука с матерью, помещение в больницу, детские ясли), сопровождаются выраженными соматовегетативными расстройствами и составляют основу дезадаптационного синдрома. У детей старшего возраста синдром страха становится более сложным и разнообразным.
П ерцепторные расстройства при церебральном параличе связаны с нарушением зрительного, слухового и кинестетического восприятий, а также совместной их функции. Нарушение зрительного восприятия обусловлено недостаточностью фиксации взора и прослеживания предмета, расстройством конвергенции, сужением полей зрения, снижением остроты зрения, наличием птоза, диплопии, нистагмом. Нарушения фиксации взора и прослеживания предмета могут быть связаны как с локализацией
286
поражения, так и с влиянием лабиринтного тонического рефлекса на мышцы глаз. Ограничение движения глаз приводит к сужению полей зрения. У детей в дальнейшем может выявиться недостаточность внимания, неумение сосредоточиться на задании, нарушение начальных пространственных представлений и схемы тела.
У детей старшего возраста более отчетливыми становятся нарушения гностических функций — трудности в дифференциации предметов по форме, величине, объему. Выявляются специфические для этого заболевания оптико-пространственные нарушения. Гностические расстройства могут проявляться также не-сформированностыо стереогноза (восприятия предметов на ощупь), различными проявлениями слуховой агнозии.
Эмоциональные расстройства. Для детей с церебральным параличом характерны повышенная эмоциональная возбудимость, сверхчувствительность к обычным раздражителям окружающей среды, склонность к колебаниям настроения. Повышенная эмоциональная лабильность сочетается с инертностью эмоциональных реакций, в некоторых случаях с элементами насильственности. Так, начав плакать или смеяться, ребенок часто не может остановиться, и эмоции как бы приобретают насильственный характер. Повышенная эмоциональная возбудимость в ряде случаев сочетается с плаксивостью, раздражительностью, капризностью, реакциями протеста и отказа, которые значительно усиливаются при утомлении, в новой для ребенка обстановке. Эмоциональные расстройства являются основными в структуре общего дезадаптационного синдрома. Состояние повышенной эмоциональной возбудимости нередко сопровождается страхами.
В противоположность повышенной эмоциональной возбудимости у некоторых детей можно наблюдать состояние полного безразличия, равнодушия, безучастия (апатико-абуличе-ский синдром). Это синдром так же, как и радостное, приподнятое настроение со снижением критики (эйфория), отмечается при поражении лобных отделов мозга.
Эмоциональные нарушения в сочетании с соматовегетативны-ми расстройствами являются благоприятной почвой для внезапного возникновения различных неврозоподобных расстройств (реакции страха, истероформных реакций). Они могут быть вызваны обидой или неудовлетворением требований и желаний ребенка и сопровождаются бурными проявлениями: ребенок падает на пол, кричит, стучит ногами, может проявлять агрессивность в отношении окружающих. Такие вспышки сопровождаются сома-товегетативными нарушениями: резким покраснением или побледнением лица, учащением пульса, повышенной потливостью, иногда энурезом. При ошибках воспитания эти реакции закрепляются и приобретают условнорефлекторный характер. Становясь привычными формами поведения, они могут явиться исходным моментом в формировании патологического характера.
287
Особенности интеллектуального развития. Нарушению Интел-лектуального развития у детей с церебральным параличом способствуют недостаточность ориентировочно-исследовательских реакций, сенсомоторные расстройства.
Одной из форм нарушения интеллектуального развития является его задержка, которая становится очевидной на 2—3-м году жизни. Степень тяжести ее обычно зависит от выраженности речевых расстройств.
Задержка интеллектуального развития характеризуется неравномерностью, нарушением ряда высших корковых функций, непосредственно связанных с двигательным анализатором (пространственных представлений, стереогноза, схемы тела, оптикопространственного гнозиса).
У детей с относительно сохранным интеллектом обычно имеет место достаточно высокий уровень развития эмоциональной сферы. Если ребенок слышит и понимает обращенную к нему речь, но не говорит сам, то на основании его эмоциональных ответных реакций можно судить о том, как он осмысливает содержание прочитанной сказки или рассказа. Эмоциональные ответные проявления выражаются в виде улыбки, радостного возгласа, общего оживления или огорчения и сопровождаются различными сосудистыми и вегетативными проявлениями (покраснение, побледнение лица, гипергидроз, расширение зрачков). Ребенок с сохранным интеллектом, несмотря на тяжелые двигательные нарушения, старается использовать все имеющиеся возможности для познания окружающего мира.
Кроме задержки интеллектуального развития уже в 2—3 года может выявляться недоразвитие познавательной деятельности — олигофрения. Олигофрения у детей с церебральным параличом имеет своеобразный атипичный характер. Для нее характерна неравномерность интеллектуального дефекта, что связано с преимущественным недоразвитием тех или иных мозговых структур. Наиболее часто встречается лобный вариант олигофрении, при котором наряду с общим недоразвитием познавательной деятельности отмечаются нарушение целенаправленности, отсутствие инициативы, недоразвитие функции активного внимания и личностных реакций. Эта форма олигофрении обычно сочетается с эмоционально-волевыми нарушениями в виде эйфории, общей расторможенности, импульсивности или апатико-абуличе-ских расстройств. При олигофрении у детей с церебральным параличом наблюдаются выраженные нарушения интеллектуальной деятельности в виде повышенной психической истощаемости, недостаточности памяти, внимания, замедленности и инертности мышления.
При грубом психическом недоразвитии в сочетании с выраженной микроцефалией постановка диагноза обычно не представляет трудностей. Более сложно выявить стертые формы олигофрении. В этих случаях необходимо провести общее клиниче-288
ское обследование больного с оценкой состояния моторики, интеллекта, речи, эмоциональных реакций, предметной и игровой деятельности, поведения. Кроме того, важное значение имеют клинико-психологическое исследование и педагогическая оценка. Во всех случаях при обследовании интеллекта необходимо выявить уровень его развития, структуру и имеющиеся потенциальные возможности.
Иногда, кроме описанных выше психических нарушений, уже в первые 3 года жизни можно выявить характерную дисгармонию в развитии отдельных сторон личности, которая с возрастом может усиливаться. В таких случаях у детей не формируется потребность общения со сверстниками, их продуктивность во всех видах деятельности ниже интеллектуальных возможностей, эмоциональная сфера отличается отсутствием детской непосредственности и живости эмоций, характерна склонность к фантазированию. Эти особенности в силу специфики заболевания и под влиянием неблагоприятных условий окружения и воспитания могут усиливаться и служить основой для аутического развития личности.
Клинические формы. Классификация клинических форм церебрального паралича учитывает распространенность двигательных нарушений, характер изменения мышечного тонуса, степень выраженности речевых и психических расстройств. Однако четкое подразделение заболевания на клинические варианты в раннем детском возрасте не всегда возможно, так как нервная система еще находится в стадии развития. Некоторые клинические признаки в процессе роста ребенка видоизменяются, другие выявляются в более старшем возрасте при предъявлении к нервной системе повышенных требований. Трудности разграничения отдельных форм обусловлены также и тем, что поражение часто носит смешанный характер. Спастичность и ригидность могут иметь место у одного и того же ребенка. Спастичность нередко сочетается с хореоатетозом и мышечной гипотонией. Мышечный тонус динамичен при различных состояниях ребенка.
В связи с этим приведенное ниже деление церебрального паралича на клинические формы в раннем детском возрасте весьма условно.
Диплегия — наиболее распространенная форма церебрального паралича. В литературе она известна под названием болезни Лит-тля. По распространенности двигательных нарушений это — тетрапарез, при котором ноги страдают больше, чем руки. Степень поражения рук может быть различной — от выраженных парезов до легкой неловкости, которая выявляется, когда у ребенка начинает развиваться манипулятивная деятельность. Распределение мышечного тонуса более или менее симметричное.
В тяжелых случаях неврологическая симптоматика обнаруживается с рождения. Быстро нарастает мышечный тонус, активизируются тонические лабиринтный и шейные рефлексы, выражены глазодвигательные нарушения. Сухожильные и надкостничные
289
рефлексы высокие, иногда вызываются с трудом из-за гипертонуса. Поздно начинают развиваться выпрямляющие рефлексы туловища. Дети с трудом овладевают некоторыми двигательными навыками, не ходят. Двигательные нарушения сочетаются с задержкой психического развития и речевыми расстройствами в виде дизартрии. Диплегия может осложняться судорожным синдромом, однако реже, чем другие формы. В тяжелых случаях диплегию трудно дифференцировать от двойной гемиплегии.
В более легких случаях клинические проявления могут быть обнаружены несколько позже, на 2—3-м месяце, особенно если родители не обращались к врачу. Патологическая тоническая рефлекторная активность не так резко выражена, поэтому наблюдается развитие выпрямляющих рефлексов туловища, реакций равновесия, но дети начинают сидеть и ходить в более позднем возрасте. Речевые и психические отклонения могут быть умеренными. В дальнейшем возможности обучения и социальной адаптации зависят от сохранности интеллекта.
Параплегия — редкая форма детского церебрального паралича с преимущественным распространением двигательных нарушений в ногах. Формирование двигательной активности головы, туловища и рук не нарушено или слегка задержано. Большинство исследователей считают, что чистые формы параплегии встречаются крайне редко. В большинстве случаев это абортивная форма диплегии, при которой руки поражены легко и их недостаточность можно выявить лишь при становлении тонкой моторики. Интеллект при этой форме бывает нормальным или снижен незначительно. Церебральную параплегию необходимо дифференцировать с параплегией спинального происхождения в результате порока развития или родовой травмы. При спинальных нарушениях наблюдаются выраженные трофические расстройства, страдает функция сфинктеров, не бывает судорог и задержки психического развития.
Двойная гемиплегия. По распространению двигательных нарушений это тетрапарез. Руки и ноги поражены в равной степени пли руки больше, чем ноги. Высокий тонус в руках сочетается с чрезмерной активностью тонического лабиринтного и шейных рефлексов, плохим контролем головы. В связи с большей выраженностью АШТ-рефлекса на одной стороне распределение мышечного тонуса часто асимметричное.
Тяжелое поражение рук, лицевой мускулатуры и мышц верхней части туловища влечет за собой выраженную задержку двигательного и речевого развития. Выпрямляющие рефлексы туловища и реакция равновесия почти не развиты. Дети не сидят, не ходят. После первого года жизни, когда двигательная активность становится более выраженной, у некоторых детей возникают ате-тоидный гиперкинез в дистальных отделах рук и в стопах, оральные синкинезии. У большинства детей отмечается псевдобульбар-ный синдром. Задержка психического развития, связанная с пер-290
вичным поражением мозга, усугубляется тяжелой обездвиженностью и невозможностью контактировать с детьми своего возраста. Эта форма церебрального паралича часто осложняется судорожным синдромом. В связи с тяжелыми двигательными нарушениями рано формируются контрактуры суставов и костные деформации.
Гиперкинетическая форма. При этой форме также поражены руки и ноги. Наряду с парезами наблюдаются гиперкинезы. Для клинической картины характерна мышечная дистопия. На фоне мышечной гипотонии возникают приступы повышения мышечного тонуса (перемежающиеся спазмы), обусловленные повышенной активностью тонических рефлексов. Эту форму называют также «дистонической». Гиперкинезы появляются чаще всего в конце 1-го года жизни, за псключением тяжелых случаев билиру-бпновой энцефалопатии, когда их можно наблюдать уже в грудном возрасте. После рождения выражена мышечная гипотония. Начиная с 2 мес, когда ослабевает флексорная гипертония, появляются «дистонические атаки». Приступы повышения мышечного тонуса возникают внезапно как при положительных, так и отрицательных эмоциональных реакциях (громком звуковом раздражителе, испуге). Присоединившиеся хореический и атетоидный гиперкинезы значительно утяжеляют состояние больного и препятствуют развитию статокинетических рефлексов и произвольной моторики. При попытке произвести активное движение нарастает ригидность, усиливаются гиперкинезы. При тяжелом поражении движения непроизвольные, медленные и охватывают в основном руки и ноги. В более легких случаях возникают внезапные резкие сокращения мышц шеи, плеч, туловища типа торсионного спазма. При гиперкинетической форме церебрального паралича часты речевые расстройства. Психическое развитие страдает меньше, чем при других формах. Однако тяжелые двигательные и речевые нарушения значительно затрудняют развитие, обучение и социальную адаптацию ребенка.
Атонически-астатическая форма. По распространенности двигательных нарушений эта форма церебрального паралича также относится к тетрапарезу. Для нее характерен низкий мышечный тонус, который остается основным симптомом в клинической картине в течение всей жизни ребенка. Тонические шейные и лабиринтный рефлексы выражены нерезко. Их можно обнаружить при возбуждении ребенка, когда повышается мышечный тонус. Мозжечковая симптоматика появляется позже и становится заметной при развитии произвольных движений. Наблюдаются расстройства координации, интенционный тремор, туловищная атаксия. У таких детей резко нарушен контроль головы. Задержано развитие выпрямляющих рефлексов и реакций равновесия. Статические функции страдают больше, чем двигательные навыки. В тяжелых случаях дети наливают сидеть очень поздно, не ходят. Следствием мышечной гипотонии являются деформация грудной
291
клетки, искривление позвоночника, вывихи тазобедренных суставов, грыжи. Сухожильные рефлексы оживлены. Часто бывают речевые нарушения в форме мозжечковой или псевдобульбарной дизартрии. Выраженная задержка психического развития является таким же обязательным синдромом при этой форме церебрального паралича, как и гипотония. Характер клинических нарушений зависит, вероятно, от преимущественной локализации патологического процесса в лобных долях, лобно-мозжечковых путях или мозжечке. При поражении лобных долей доминирует глубокая задержка психического развития. В случаях с большей заинтересованностью мозжечка на первый план выступает мозжечковая симптоматика.
В последние годы к атонически-астатической форме церебрального паралича относят и клинические варианты, при которых мышечная гипотония и интеллектуальный дефект не так грубо выражены. Следует также помнить, что на фоне церебральной гипотонии у грудных детей могут развиться спастичность или ригидность, дистония, гиперкинезы.
Г емипаретическая форма характеризуется поражением одноименных конечностей. Рука страдает больше, чем нога. У детей раннего возраста эта форма церебрального паралича встречается реже других.
Клинические проявления в период новорожденности и в грудном возрасте зависят от степени поражения. В тяжелых случаях ограничение спонтанных движений паретичных конечностей можно отметить уже с первых дней жизни. По мере развития ребенка двигательная недостаточность становится более выраженной. Легкий гемипарез трудно диагностировать. Он выявляется позже, когда ребенок начинает пользоваться пораженными конечностями при произвольных движениях.
Для гемипарезов, возникших внутриутробно или в родах, характерен длительный период гипотонии (2—3 мес). Спастичность нарастает постепенно. Повышение мышечного тонуса в сгибателях руки и разгибателях ноги приводит к характерной позе, которая становится выраженной, когда ребенок начинает ходить. При гемипарезах, развившихся постнатально, спастичность формируется быстрее. Тонические шейные рефлексы могут выявляться на паретичной стороне при наличии повышенного мышечного тонуса. На стороне поражения сухожильные рефлексы высокие, с расширенной зоной. Рефлекс Бабинского у детей 1-го года жизни является физиологическим, но в паретичной ноге он ярче выражен и более постоянен. У детей 2—3 лет на стороне пареза всегда наблюдаются рефлекс Бабинского и другие патологические рефлексы.
У детей с гемипарезами развиваются выпрямляющие рефлексы туловища и реакции равновесия, они овладевают возрастными двигательными навыками, хотя и в более поздние сроки.
292
Умственное развитие замедлено. Степень задержки варьирует Она может быть такой же тяжелой, как при спастической диплегии или двойной гемиплегии, но наряду с этим наблюдаются случаи, когда дети развиваются нормально, посещают мае-совую школу. Если гемипарез осложняется эпилептиформными припадками, то уровень интеллектуального развития снижается. Судороги, локальные или общие, при гемипарезах наблюдаются в 30—40% случаев. Речевые нарушения проявляются в виде псевдобульбарной дизартрии.
Монопарез — нарушение двигательной функции одной руки или ноги — у детей раннего возраста почти не встречается. Патология обусловлена поражением коркового отдела двигательного анализатора. При парезе руки или ноги необходимо провести тщательные исследования функции другой конечности, так как в большинстве случаев имеет место стертая фирма гемипареза, при которой одна из конечностей поражена минимально.
Диагноз церебрального паралича у детей после 1 года жизни трудностей не представляет. Однако чем раньше поставлен диагноз и начато лечение, тем эффективнее результаты. В тяжелых случаях диагноз церебрального паралича может быть поставлен в первые недели после рождения. В случаях средней тяжести и легких диагностика в первые месяцы жизни затруднена, так как патологическая тоническая рефлекторная активность выражена нерезко и становится заметной после 2 мес, а задержки возрастного развития может еще не быть. Врач должен хорошо знать возрастные нормы моторного развития ребенка, последовательность становления реакций выпрямления и равновесия, динамику тонических и других рефлексов, их влияние на развитие двигательных навыков при поражении мозга. Это важно для ранней постановки диагноза.
У детей с церебральным параличом в период новорожденное™ флексорный тонус может быть выражен в такой же степени, как и у здоровых. И только к 2 мес, когда начинают активизироваться разгибатели, можно отметить нарастание мышечного тонуса. Тонические рефлексы становятся ярко выраженными. Задерживается угасание безусловных рефлексов (поискового, хоботкового, хватательного, рефлекса Моро, автоматической походки и др.).
Повышение мышечного тонуса не всегда наблюдается с рождения. У детей, родившихся в асфиксии с явлениями нарушения мозгового кровообращения, мышечный тонус часто бывает сниженным, спонтанные движения ограничены, безусловные рефлексы угнетены. Длительность стадии мышечной гипотонии вариабельна, но чаще она держится в течение 6—10 нед и переходит в Дистоническую стадию. Последняя проявляется как будто внезапно, когда ребенок делает попытки удержать голову в вертикальном положении и в положении на животе. Ребенок становится беспокойным, повышается мышечный тонус, руки разогнуты с внутренней ротацией в плечах, предплечья и кисти пронированы,
293
пальцы сжаты в кулак. Ноги вытянуты, приведены, иногда перекрещены, стопы в подошвенном сгибании. Голова, туловище и конечности принимают разгибательное положение, вплоть до позы опистотонуса. Эти дистонические атаки длятся несколько секунд. Они возникают чаще во второй половине дня, вначале 2—3 раза в день, затем частота их нарастает до 10 и более. Иногда дистонические атаки ошибочно принимают за эпилептиформные приступы, но сознание во время этих состояний не нарушается и противосудорожная терапия эффекта не дает. В период дистонической атаки мышечный тонус и тоническая рефлекторная активность нарастают, гипотония сменяется гипертонией. Дети плохо сосут, мало прибавляют в массе, плохо спят, вздрагивают при малейшем шуме. Часто дистоническая атака начинается после внешних раздражителей: громкого стука, плача другого ребенка и т. д. В дистонической стадии вначале больше выражена ригидность, затем по мере миелинизации пирамидного пути развивается спастичность.
Вышеописанная симптоматика ярко выражена в тяжелых случаях. При легком поражении клинические проявления развиваются медленно, незаметно и диагноз часто сомнителен.
В таких случаях повышение мышечного тонуса и тонические рефлексы можно выявить с помощью определенных проб (К. Bo-bath, 1959).
Пробы в положении на спине. В этом положении максимально выражена экстензорная спастичность, обусловленная тоническим лабиринтным рефлексом.
1. Проба на разгибание головы и шеи (рис 90). Врач кладет руку под голову ребенка и пытается приподнять его вперед. В норме голова сгибается и руки двигаются вперед к грудной клетке. У ребенка с церебральным параличом ощущается сопротивление этому движению и голова давит на руку исследователя.
2. Проба на тракцию (рис 91). Врач берет ребенка за кисти и тянет вперед. В норме это движение вызывает сгибание головы и попытку сесть. У ребенка с церебральным параличом чувствуется сопротивление этому движению и голова отбрасывается назад.
3. Проба на АШТ - рефлекс (рис. 92). Голову ребенка поворачивают в сторону. «Лицевая» рука разгибается, «черепная» сгибается. Если поражение тяжелое, ответ немедленный. В легких случаях латентный период удлиняется, АШТ-рефлекс кратковременный, и ребенок его быстро гасит. Иногда изменение мышечного тонуса, возникшее под влиянием АШТ-рефлекса, может быть обнаружено только путем пробы на сопротивление сгибанию и разгибанию руки во время поворотов головы в одну или другую сторону.
4. Проба на отсутствие шейной выпрямляющей реакции. В норме при повороте головы в сторону туло-294
Рис. 90. Проба на разгибание головы и шеи:
а — норма, б — патология
Рис. 91. Проба на тракцию: а — норма, б — патология
Рис. 92. Проба на асимметричный шейный тонический рефлекс: а — норма, б — патология
витце следует за головой. При церебральном параличе это движение вызывает АШТ-рефлекс и ребенок не в состоянии повернуться на бок.
В случаях поражения средней тяжести туловище следует за головой, а руки в движении не участвуют. Такие дети поворачиваются на бок с трудом.
5. Пробы на флексорную спастичность рук. (рис 93). Руки ребенка отводят, перекрещивают или поднимают вверх, располагая параллельно голове. Отмечается сопротивление этим движениям.
295
Рис. 93. Пробы на флексорную спастичность рук в положении на спине: а — норма, б — патология. 1 — отведение рук, 2 — поднимание рук вверх, 3 — скрещивание рук на груди
Рис. 94. Проба на экстензорную спастичность ног в положении на спине: а — норма, б — патология
296
Рис. 95. Проба на спазм приводящих мышц бедер: а — норма, б — патология
Рис. 96. Проба на защитный поворот головы:
а - норма, б — патология
Рис. 98. Проба на флексорную спастичность рук в положении на животе: ° — норма, б — патология
Рис. 97. Проба на флексорную спастичность рук в положении на животе: а — норма, б — патология
297
Рис. 99. Проба на защитную экстензию рук:
а — норма, б — патология
6. Проба па экстен зорную спастичность ног. (рис 94). Врач захватывает ноги ребенка под коленями, поднимает вверх и быстро сгибает их к животу. Отмечается сопротивление этому движению. Если ноги отпустить, то они разгибаются, приводятся и иногда перекрещиваются.
7. Проба на спазм приводящих мышц (рис. 95). Врач берет ребенка за разогнутые ноги в области колен и быстрым движением отводит их в стороны — ощущается сопротивление этому движению. Степень сопротивления зависит от тяжести поражения.
Пробы в положении на животе. В этом положении максимально выражена флексорная спастичность, обусловленная тоническим лабиринтным рефлексом.
1. Проба на защитный поворот головы (рис. 96). Нормальный ребенок, лежа на животе, поворачивает голову в сторону. Этот защитный рефлекс наблюдается с рождения. Если выражена флексорная спастичность, то поворот головы в сторону отсутствует.
2. Проба на флексорную спастичность рук (рис. 97). В положении па животе руки ребенка согнуты и находятся под грудной клеткой. Врач захватывает кисти ребенка и двигает руки вверх, чтобы они находились по обе стороны от головы. Отмечается сопротивление этому движению. Если руки отпустить, они возвращаются в исходное положение. Другая проба (рис. 98). Врач помещает руку под подбородок ребенка и поднимает голову. В норме в возрасте 4—5 мес голова при этом движении поднимается, руки разгибаются, кисти ребенок ставит на опору. При церебральном параличе отмечается сопротивление этому движению в виде давления подбородка на руку исследователя. Руки остаются согнутыми под грудной клеткой.
3. Проба на защитную экстензию рук. Ребенка поднимают, удерживая его в горизонтальном положении лицом 298
Рис. 100. Проба на экстензорную вертикального подвешивания: а — норма, б — патология
спастичность ног в положении
вниз, затем быстро опускают головой к опоре. В норме ребенок 4—6 мес разгибает руки, пытаясь достичь опоры. Ребенок с церебральным параличом держит руки согнутыми (рис. 99). В более легких случаях руки разгибаются лишь тогда, когда голова касается опоры.
Проба в вертикальном положении
Проба на экстензорную спастичность ног (рис 100). Ребенка берут под мышки и опускают на опору — ноги разогнуты, приведены, иногда перекрещены. Ребенок стоит на пальчиках, в тяжелых случаях наблюдается автоматическая походка.
Эти пробы необходимо оценивать только в комплексе с общим неврологическим и педиатрическим осмотром. Ранний диагноз основывается на наличии измененного мышечного тонуса, патологической тонической рефлекторной активности, примитивных рефлекторных реакций, задержки возрастного развития.
Дифференциальный диагноз церебральных параличей у детей грудного возраста представляет большие трудности. Различные по этиологии и патогенезу неврологические заболевания могут проявляться в этом возрасте сходной клинической симптоматикой.
299
Церебральные параличи в раннем детском возрасте необходимо дифференцировать главным образом с наследственными болезнями обмена, протекающими с поражением нервной системы, нервно-мышечными заболеваниями.
При таких наследственных болезнях обмена веществ, как фенилкетонурия, гистидинемия, амавротическая идиотия, неврологические нарушения в отличие от церебрального паралича появляются в более поздние сроки, на 4—5-м месяце жизни. Ребенок после рождения развивается нормально, затем на фоне полного здоровья или после перенесенной инфекции начинает терять приобретенные навыки. В первую очередь утрачиваются психические функции, снижается интерес к окружающему, ребенок перестает улыбаться, гулить, не оживляется при виде яркой игрушки, не реагирует на голос матери. Двигательные нарушения вначале проявляются мышечной гипотонией, которая по мере прогрессирования заболевания сменяется гипертонией. Эти заболевания в отличие от церебрального паралича носят прогредиентный характер. При подозрении на наследственные болезни обмена веществ необходимо провести специальное биохимическое обследование детей.
Лейкодистрофии, начинающиеся в грудном возрасте (метахро-матическая, глобоидноклеточная и суданофильная формы), часто сходны по клинической картине с церебральными параличами. Однако в анамнезе этих больных нет указаний на перенесенную гипоксию или внутричерепную родовую травму. Заболевание неуклонно прогрессирует, несмотря на раннее лечение. Уточнению диагноза помогают исследования активности ферментов липидного метаболизма, изучение спектра липидов плазмы крови, ликвора, мочи и динамическое наблюдение за ребенком.
Для наследственных нервно-мышечных заболеваний (спинальной амиотрофии Верднига — Гоффмана, врожденных миопатий) в отличие от церебрального паралича характерны вялые парезы и параличи, проявляющиеся с рождения или в первые месяцы жизни, отсутствие или резкое угнетение сухожильных рефлексов, прогрессирующая слабость и гипотония мышц. Психическое и речевое развитие у этих детей не нарушено. Наряду с особенностями клинических проявлений дифференциальной диагностике способствуют электромиографические исследования и биопсия мышц.
Течение и прогноз детских церебральных параличей зависят от степени поражения, времени постановки диагноза, начала лечения и его этапности в различные возрастные периоды. Систематически проводимая комплексная терапия, направленная на тренировку двигательного, речевого и психического развития, начиная с первых месяцев жизни, способствует более благоприятному течению. Дети постепенно овладевают двигательными, речевыми и психическими навыками, что помогает им в дальнейшем значительно компенсировать свой дефект и адаптироваться к требованиям окружающей среды.
300
При наличии грубых морфологических изменений, когда с рождения выражены тяжелые двигательные нарушения, судороги, течение может быть стационарным или прогредиентным, несмотря на проводимую терапию. В таких случаях прогноз неблагоприятный.
Лечение церебральных параличей должно быть ранним, комплексным и непрерывным. Необходимость раннего лечения обусловлена тем, что на первом году жизни:
мозг ребенка обладает большой пластичностью;
спастичность мышц нерезко выражена, поэтому легче вырабатываются нормальные позы и двигательные навыки;
отсутствуют порочные позы, контрактуры и деформации;
больной ребенок еще не приобрел патологического двигательного стереотипа и легче поддается тренировке;
ранняя выработка возрастных двигательных, речевых и психических навыков способствует развитию высших интегративных центров, которые оказывают тормозящее влияние на стволовые механизмы;
формирование психических функций находится в прямой зависимости от развития двигательных навыков, поэтому при позднем начале лечения и тяжелой обездвиженности ребенок будет вторично отставать в психическом развитии, даже если его потенциальные возможности были нормальными;
мать становится активным участником лечения, и это дает лучшие результаты, чем в старшем возрасте.
Комплексное лечение при церебральных параличах предусматривает ортопедические мероприятия, направленные на формирование правильной позы ребенка, профилактику контрактур, лечебную гимнастику и массаж, стимуляцию речевого и психического развития, физиотерапию и применение медикаментозных средств.
Успех лечебных мероприятий при церебральных параличах зависит от совместной работы специалистов различного профиля (педиатров, невропатологов, психиатров, логопедов, ортопедов) на протяжении длительного времени.
Ортопедические мероприятия являются важной частью комплексного лечения церебральных пчраличей у детей раннего возраста. Они помогают сохранить правильное физиологическое взаимоотношение головы, туловища и конечностей (лечение положением). Ортопедический режим следует соблюдать с первых дней жизни ребенка, пока еще не сформировались порочные позы, контрактуры, деформации. Ребенок привыкает к режиму и хорошо его переносит. Поэтому больному с церебральным параличом, который еще не ходит, следует в течение дня придавать различные физиологические положения, в зависимости от возраста: выкладывать на живот, удерживать в вертикальном положении, сажать, ставить в специальные приспособления. Прида-
301
Рис. 101. Ортопедические приспособления для придания правильного положения отдельным частям тела
ваемая ребенку поза не должна нарушать общего состояния и вызывать болезненные ощущения.
К ортопедическим средствам, с помощью которых можно придать части тела физиологическое положение, относятся шины, шинки-штанишки, лонгеты, туторы, воротники, валики.
Ортопедические укладки не должны растягивать мышцы, сдавливать конечность, нарушать кровообращение. Шины и лонгеты накладывают после лечебной гимнастики и масса
жа, когда методисту удалось добиться максимального расслабления мышц. Укладки необходимо чередовать с лечебной гимнастикой, массажем и активной деятельностью ребенка. Длительность пребывания ребенка в специальных укладках определяется инди-
видуально и зависит от тяжести поражения, а также от того, как ребенок переносит эту процедуру. Лучше, чтобы периоды пребывания ребенка в шинах и лонгетах были короткими, но в течение дня повторялись несколько раз. Это создает более благоприятные условия для развития активных движений. За ортопедическим режимом должны следить персонал и мать. Мать необходимо обучить применению ортопедических приспособлений.
Уже с периода новорожденности голове, туловищу и конечностям ребенка придают физиологическое положение (рис 101). Голову следует располагать по средней линии слегка согнутой, чтобы ребенок не запрокидывал ее назад, во избежание активизации тонической рефлекторной активности. Голову фиксируют валиками с двух сторон. Если голова долихоцефалической формы, ее необходимо укладывать в специально сшитый круг («бублик»). В противном случае ребенок будет лежать на боку с запрокинутой назад головой. При ярко выраженных топических рефлексах, когда валики не удерживают голову по средней линии, ее можно фиксировать обручем с мягкой пружинящей подкладкой, к которому по бокам (в теменно-височных областях) крепится дуга, соединенная со спинкой кровати. Соединение обруча с дугой может быть подвижным и неподвижным. В таком приспособлении голову фиксируют 3—4 раза в день по 30—40 мин, затем укладывают между валиками. У детей 2—3 лет для удержания головы по средней линии можно пользоваться таким же обручем, который крепится зажимами к специальному штативу, идущему от спинки специального стула.
При постоянном повороте головы в сторону, как это имеет место при травматической или спастической кривошее, для удер-
302
жания ее в правильном положении используют картонно-ватный воротник Шанца, воротники из поливика и вспененного полиэтилена, гипса, папье-маше. Хороший контроль головы у детей с церебральным параличом способствует нормализации мышечного тонуса и торможению патологической постуральной активности.
Для обеспечения физиологического положения конечностей применяют специальные укладки и лонгеты. Лонгеты для кистей и стоп делают из картона, гипса, плексиглаза, поливика и обшивают мягким материалом (рис. 102, 103). Лонгеты для рук при необходимости можно сделать с гпперэкстензией, максимальным отведением большого пальца, с бортиком для коррекции ульнарного отведения кисти и т. д. При нарушении сгибательной функции кисти в руку ребенка вкладывают валик или шарик, затем прибинтовывают лонгету. Указанные приспособления накладывают на 40—60 мин, а затем делают массаж и лечебную I пмнастпку. Для устранения приведения в плечевых суставах между туловищем и плечом вкладывается мягкий валик.
Для профилактики аддукторного спазма бедер у новорожденных и грудных детей можно применять широкое пеленание или шинкп-штанишки (рис 104). Дети свободно в них поворачиваются со спины на живот и встают в кроватке. Их надевают на 2—3 ч. Прокладка между бедрами должна быть мягкой, чтобы не было перерастяжения аддукторов. Родителям рекомендуют носить детей в специальных приспособлениях с отведенными в наружной ротации бедрами. Когда ребенок начинает сидеть, посередине стульчика между бедрами делают специальную распорку, чтобы ноги находились в состоянии отведения. У детей 2— 3 лет с приводящими контрактурами можно пользоваться специальной распоркой.
Для удержания стоп в физиологическом положении применяют лонгеты, которые надевают на носки. Их закрепляют бинтами и оставляют на 40—60 мин.
303
Рис. 104. Ребенок с аддукторным спазмом в шинке-штанишках
Лечение положением начинают с первых дней жизни даже когда из-за тяжести состояния и плохих кожных покровов лечебная гимнастика и массаж еще противопоказаны.
Лечебная гимнастика. Основные цели лечебной гимнастики:
торможение патологической тонической рефлекторной активности, нормализация на этой основе мышечного тонуса и облегчение произвольных движений;
тренировка последовательного развития возрастных двигательных навыков ребенка.
При планировании лечения необходимо выяснить, какие аспекты двигательного развития (контроль головы, повороты, сидение, манипуляции руками, вставание, ходьба) остались
примитивными и отстают от хронологического возраста; соответствует задержка развития двигательных навыков одной возрастной стадии или различным; какие патологические формы движений имеются у ребенка?
Тоническая рефлекторная активность может быть заторможена путем использования рефлексзапрещающих позиций и активизации высших интегративных нормальных постуральных реакций (реакций выпрямления и равновесия). Эти реакции в большинстве случаев имеются у ребенка, но следует облегчить их развитие с помощью специальных приемов лечебной гимнастики. Когда реакции выпрямления и равновесия выработаны и закреплены, они модифицируют и ослабляют тонические рефлексы, сохраняя над ними постоянный контроль.
Рефлексзапрещающая позиция — это поза, которую методист придает ребенку для снижения активности тонических рефлексов и нормализации мышечного тонуса. Она может быть тотальной или частичной. При тотальной рефлексзапреща-ющей позиции методист фиксирует голову, туловище и конечности ребенка в позе, при которой подавляется патологическая постуральная активность, снижается мышечный тонус. Однако возможности активных движений при этом ограничены. Учитывая, что патологическая тоническая рефлекторная активность зависит от положения головы в пространстве и по отношению к туловищу, а формирование нормальных постуральных реакций происхо
304
дит в нисходящем направлении, торможение патологических реакций может быть достигнуто путем изменения позы ребенка только в области ключевых точек шеи, плечевого пояса, позвоночника. Это так называемая частичная рефлексзапрещающая позиция. Преимущество ее состоит в том, что конечности ребенка остаются свободными для произвольных движений. Ключевые точки выбирает методист и постоянно меняет в зависимости от динамики клинической картины. У детей грудного возраста, когда спастичность еще нерезко выражена, вызвать торможение тонической рефлекторной активности не так трудно, как удержать приданную ему позу. Поэтому для фиксации ребенка в рефлексзапрещающей позиции используют различные ортопедические приспособления (валики, мешочки с песком и т. д.). Торможение патологической постуральной активности должно сочетаться с приемами облегчения движений ребенка. Этим достигается более длительное снижение мышечного тонуса, необходимое для выработки поз и двигательных навыков. Рефлексзапрещающая позиция создает условия для использования приемов облегчения. Приемы торможения и облегчения могут следовать друг за другом, использоваться попеременно и одновременно.
Развивая движения ребенка, необходимо начинать с самого низкого уровня, заполняя все пробелы. Но это не значит, что надо доводить до совершенства одну стадию, прежде чем перейти к тренировке другой. При нормальном развитии ребенка имеется фактор перекрывания. Поэтому улучшать одну форму двигательной активности можно только, тренируя следующую.
У детей грудного возраста примитивные позы и движения преобладают над патологическими. Облегчая реакции выпрямления и равновесия, необходимо тренировать нормальные позы и движения, следуя возрастным этапам развития.
Если у ребенка уже выработался патологический двигательный стереотип, при лечебной гимнастике необходимо акцентировать внимание на торможении патологической рефлекторной активности, наряду с этим последовательно тренируя важнейшие физиологические позы и движения.
Для иллюстрации приводим описание некоторых приемов лечебной гимнастики с использованием рефлекторного торможения и облегчения движений.
Положение на спине. Максимально выражена экстен-зорная спастичность в результате влияния тонического лабиринтного рефлекса. Для его торможения и облегчения поднимания головы следует придать ребенку положение полного сгибания (рис. 105). Руки скрещиваются на груди, ноги сгибаются к животу и приводятся (эмбриональная поза). Затем плечевой пояс выносится вперед и слегка поднимается от опоры. Ребенок должен поднять голову.
Положение на животе. Максимально выражена флексорная спастичность в результате влияния тонического лабиринт-
11 143
305
ного рефлекса. Чтобы его затормозить и облегчить поднимание головы, можно использовать два приема:
руки ребенка кладут вдоль туловища в положении разгибания и наружной ротации, ладони на опоре (рис. 106, а). Методист становится позади головы ребенка и поднимает плечевой пояс вверх и назад, прямо или с небольшой ротацией. Ребенок в ответ на это
Рис. 105. Рефлексзапрещающая позиция 1
должен поднять голову; руки ребенка разогнуты над головой (рис. 106,6). Методист становится сбоку, кладет левую руку под грудь ребенка на уровне подмышечных впадин и разгибает позвоночник, поднимая грудную клетку над опорой, правой рукой он фиксирует таз. Подбородок ребенка вначале может находиться на руке методиста. Когда достигнуто достаточное торможение флексорного тонуса, методист отодвигает свою руку немного вперед. Ребенок должен поднять и удер
жать голову самостоятельно.
Положение сидя. Грудного ребенка, раздвинув его ноги, сажают на колени методиста лицом к нему. Руки разогнуты и удерживаются в области кистей или запястья одной рукой методиста, тогда как его другая рука свободна (рис. 107, а). Затем ребенка медленно отклоняют назад, комбинируя это с боковыми движениями или движениями по диагонали. Таким путем стиму
лируют выпрямление головы в положении сидя.
Через несколько дней пробуют движение прямо-назад, но до момента, пока ребенок удерживает голову, страхуя при этом свободной рукой голову от запрокидывания. Если методист чувствует, что контроль головы может быть нарушен, движение делается в обратном направлении и можно поддержать голову свободной рукой. Постепенно амплитуда движений нарастает, но
Рис. 106. Рефлексзапрещающая позиция 2:
а — приподнимание плечевого пояса при вытянутых вдоль туловища руках, б — раз-£ибание туловища при вытянутых вперед руках
306
Рис. 107. Рефлексзапрещающая позиция 3:
а — положение сидя лицом к методисту, б — положение сидя спиной к методисту
всегда движение замедляется в точке, где голове грозит запрокидывание назад.
Ребенок с разведенными ногами находится на коленях методиста лицом вперед. Его руки отведены назад в положении разгибания и наружной ротации (рис. 107,6). Ребенка медленно наклоняют вперед и вниз. Комбинация разгибания плеч, спины и рук тормозит флексорную спастичность и облегчает выпрямление головы и туловища.
Положение на коленях. Поднимание головы в этом положении облегчается следующим образом. Методист находится позади ребенка, берет его за плечи и тянет назад, медленно разгибая спину. Ребенок должен выпрямить голову.
Если флексорная спастичность рук сильно выражена, это упражнение можно модифицировать. Чтобы ослабить флексорную спастичность, руки ребенка разгибают, отводя назад в наружной ротации и удерживают в области локтей. Затем ребенка осторожно двигают вперед до тех пор, пока он не поднимет голову (защитная реакция от падения лицом вниз). Разгибание плеч и спины может вызвать тотальное разгибание, включая ноги. Чтобы предупредить это нежелательное явление, методист должен фиксировать бедра ребенка с помощью своих коленей.
Таким образом, контролируя туловище ребенка в различных ключевых точках, голову оставляют свободной, чтобы регулировать ее нормальное положение в пространстве и по отношению к туловищу. Этими примерами не ограничиваются приемы рефлекс-запрещающих позиций и способов облегчения движения. Они разнообразны, зависят от возраста ребенка, формы спастичности, тяжести поражения (К. Bobath, 1959; К. Bobath, В. Bobath, 1964; К. Bobath, 1966; В. Bobath, 1967).
Облегчая реакции выпрямления и равновесия с первых месяцев жизни ребенка, методист последовательно тренирует контроль головы, повороты со спины на живот, захват игрушки, зрительно-моторную координацию, возможность самостоятельно сесть, встать на четвереньки, ползать, стоять и ходить, сохраняя равпо-
11*
307'
весне. Возрастные двигательные навыки следует тренировать в той же последовательности, в какой они развиваются у здоровых детей.
В 1-м полугодии жизни упражнения чаще носят пассивный характер, в их процессе у ребенка вырабатывается ощущение нормального движения. Скорость и амплитуда движения наращиваются постепенно. Пассивные упражнения способствуют освоению двигательных навыков, пока ребенок еще не может выполнять инструкций. По мере возрастного развития все чаще включаются элементы активного участия ребенка.
Начиная с 6—8 мес важное значение приобретает игровая гимнастика. Положительный эмоциональный фон создает условия для развития разнообразных движений. Двигательные навыки, полученные в результате различных упражнений, совершенствуются и закрепляются в процессе игры. Особенно важное значение имеет игровая гимнастика для развития движений рук.
У детей раннего возраста наряду с лечебной гимнастикой часто применяется общий лечебный и точечный массаж. Воздействуя на нервные окончания, заложенные в тканях и органах, массаж улучшает кровоснабжение, питание мышц, способствует нарастанию мышечной массы, укрепляет паретичные мышцы, стимулирует двигательные функции. У детей первых месяцев жизни массаж предшествует лечебной гимнастике и значительно повышает ее эффективность. , Массаж используют с двоякой целью: для расслабления спастичных и стимуляции паретичных мышц. В первом случае применяют поглаживание, легкое растирание, потряхивание, во втором — глубокий массаж. При выраженных симптомах церебрального паралича лечебный массаж применяют в основном для мышц спины, живота и ягодиц.
В последние годы широкое распространение при лечении церебральных параличей у детей раннего возраста получил точечный массаж, который оказывает рефлекторное воздействие на мышцы, вызывая активизацию мотонейронов разгибателей и торможение сгибателей. В результате восстанавливаются взаимосвязи между мышцами-антагонистами. Точечный массаж используют в комплексе с лечебной гимнастикой, когда необходимо активизировать разгибание рук, ног, отведение плеч, бедер, для укрепления мышц живота, спины, ягодиц.
При выраженной форме церебрального поралича массаж должен быть легким, так как усиленная стимуляция мышц может вызвать нарастание мышечного тонуса.
Подробные рекомендации по вопросам массажа и лечебной гимнастики при детских церебральных параличах изложены в специальных руководствах (М. Б. Эйдинова, Е. Н. Правдина-Ви-нарская, 1959; С. А. Бортфельд, 1971; Н. Р. Робэнеску, 1972; М. Н. Гончарова с соавт., 1974; К. А. Семенова, 1976; К. Bobath, В. Bobath, 1964; В. Bobath, 1967).
Коррекция речевых и психических нарушений.
308
Логопедические и педагогические мероприятия у детей с церебральными параличами должны начинаться с первых месяцев жизни. Они предусматривают онтогенетически последовательное развитие сенсорных функций, речи и интеллекта, предупреждение и коррекцию их нарушений. Методы проведения занятий дифференцируются в зависимости от клинической картины заболевания, возраста ребенка, структуры речевой и психической недостаточности.
Помимо общих мероприятий, стимулирующих речевое и психическое развитие и представленных в главе XIX, при церебральных параличах проводят специальные логопедо-педагогические занятия. При этом логопед и педагог наряду с оценкой структуры речевой и психической недостаточности учитывают уровень двигательного развития ребенка Для нормализации тонуса артикуляционных мышц при выраженности патологических тонических рефлексов необходимо использовать рефлексзапрещающие позиции, индивидуально подобранные для каждого ребенка. С целью расслабления артикуляционных мышц широко используют приемы общей и сегментарной мышечной релаксации, расслабляющий массаж, который сочетается с упражнениями, направленными па преодоление оральных синкинезий.
На фоне расслабления артикуляционной мускулатуры применяют специальные логопедические упражнения для стимуляции физиологических кинезий. Эти упражнения включают стимулирующие виды массажа (поглаживающий, растирающий, вибрационный) и дифференцированную в зависимости от формы дизартрии артикуляционную гимнастику.
Артикуляционную гимнастику сочетают с упражнениями мимических мышц и развитием моторики рук. У ребенка тренируют закрывание и открывание рта и глаз, развивают опорную, хватательную и манипулятивную деятельность рук, дифференцированные движения пальцев. Его учат разминать пластилин, захватывать кончиками пальцев мелкие предметы, складывать мозаику, лепить, рисовать пальцем, растегивать и застегивать пуговицы, пользоваться ложкой и т. д.
Одновременно с массажем и гимнастикой отрабатываются артикуляционные уклады, вызываются первые звуки. Артикуляционные упражнения сочетают с дыхательной гимнастикой, стимуляцией голосовых реакций. Вызывая последовательно отдельные звуки, тренируют правильное звукопроизношение, формируют пассивный и активный словарь и начальный грамматический строй речи.
Для речевого и психического развития важно своевременное становление сенсорных функций, особенно зрительных и слуховых. Методы их стимуляции и коррекции у детей с церебральными параличами основываются на принципе включения в деятельность одновременно нескольких анализаторов с акцентом на более сохранные. При этом предусматривают формирование
309
функции как целостной системы. Так, уже на 1-м году жизни необходимо проводить специальные корригирующие игры-упражнения, направленные на развитие фиксации и прослеживания предмета, чтобы не пострадали все последующие этапы развития зрительной функции. Ребенка учат фиксировать взор и следить за лицом взрослого, игрушкой. Для этого используют яркие звучащие игрушки, которые располагают в направлении наиболее дефектного движения глазных яблок, и всячески стимулируют развитие этого движения. При помощи специальных упражнений у ребенка формируют возможность плавного прослеживания предмета во всех направлениях с произвольным переключением взора с одного предмета на другой.
Наряду с развитием фиксации взора и прослеживания предмета рано начинают работу по развитию восприятия формы. Ребенка учат различать шарик, кубик и другие формы по показу и по словесной инструкции с обязательным подключением тактильного восприятия (все выделяемые формы ребенок не только видит, слышит их названия, но и обязательно ощупывает руками). Постепенно ребенка учат воспринимать одновременно форму и величину предмета, развивают ориентировку в окружающем пространстве и представление о схеме тела.
Для развития мышления при проведении логопедических занятий необходимо следить за тем, чтобы каждый звук и звукосочетание, а тем более слово, имели для ребенка определенное конкретное значение, т. е. развивать прочную связь между словом, предметом и действием. Ребенку называют предмет, показывают его, демонстрируют его применение в повседневной жизни, дают предмет для ощупывания, стимулируют различные манипулятивные и игровые действия с ним. Затем показывают различные варианты этого предмета (различающиеся по форме, величине, цвету и т. д.), привлекают внимание ребенка к общности их назначения. Таким образом развивают обобщающую функцию слова, мышление ребенка.
Для предупреждения речевых и психических нарушений у детей с церебральным параличом важное значение имеет правильное воспитание. Воспитание должно способствовать обогащению практического опыта ребенка, развитию активности, самостоятельности, любознательности.
Физиотерапия. Медикаментозные препараты. В комплексном лечении детей с церебральным параличом широко используют физиотерапевтические методы, которые не только улучшают функцию нервно-мышечного аппарата, но и способствуют повышению реактивности организма, укреплению общего состояния ребенка. Физиотерапевтические процедуры создают благоприятный фон для более эффективного использования методов лечебной гимнастики.
В раннем детском возрасте наиболее часто применяют лечебные ванны, озокеритовые аппликации, горячие укутывания, ле-
310
царственный электрофорез, импульсный ток, электростимуляцию.
Медикаментозная терапия направлена на стимуляцию обменных процессов в нервной ткани, снижение мышечного тонуса, уменьшение гиперкинезов, улучшение нервно-мышечной проводимости, нормализацию обмена мышечной ткани. Основные мероприятия, применяемые для лечения двигательных речевых и психических нарушений в восстановительный период, изложены в главе XX.
Глава IX. ОПУХОЛИ ГОЛОВНОГО МОЗГА
Опухоли головного мозга у детей встречаются в 5—8 раз реже, чем у взрослых, и составляют 16—20% от всех новообразований в этом возрасте.
Около 25% опухолей нервной системы, наблюдающихся у детей, приходится на первые 3 года жизни. Мальчики болеют несколько чаще (58%), чем девочки (42%).
В происхождении опухолей у детей раннего возраста большая роль принадлежит нарушению внутриутробного развития, хотя не исключено влияние и других факторов: различных мутагенных воздействий с конечным канцерогенным эффектом, вирусов и т. д. Опухоли часто зарождаются там, где в онтогенезе нервной системы особенно выражены процессы расщепления, смыкания, от-шнуровывания. О роли дизонтогенеза в происхождении опухолей у детей свидетельствует нередкое сочетание в раннем возрасте опухолей мозга и врожденных пороков развития других органов. Известны дисгенетические синдромы, при которых опухоли нервной системы могут быть одним из ведущих клинических проявлений,— нейрофиброматоз Реклингхаузена, туберозный склероз, ней-рокожный меланоз и др. Рост опухоли провоцируют травмы, воспалительные заболевания и другие эндогенные и экзогенные вредности.
Исследование опухолей мозга у детей первых трех лет жизни выявило характерное своеобразие их частоты, локализации, клинических проявлений и морфологической сущности (А. А. Арендт, С. И. Нерсесянц, 1962; В. И. Ростоцкая, И. В. Спиридонов, 1976; Р. Jones, Р. Campbell, 1976).
Патом орфолог и я. Более 70% всех опухолей головного мозга у детей раннего возраста составляют нейроэктодермальные внутримозговые опухоли-глиомы; это в 2 раза чаще, чем у взрослых. Значительно реже обнаруживаются опухоли мезодермальною происхождения (13%). Врожденные и эмбриональные опухоли (тератомы, холестеатомы) составляют 0,8—2% от всех опухолей нервной системы.
Среди опухолей нейроэктодермального происхождения основную массу (28—50%) составляют астроцитомы. По данным Института нейрохирургии им. Н. Н. Бурденко АМН СССР, астроцитомы составляют 33% среди опухолей нервной системы у детей первых трех лет жизни, а медуллобластомы — 14%, что в 4— 6 раз выше аналогичных показателей у взрослых. Нередкими опухолями у детей являются краниофарингиомы, эпиндимомы
312
хЛ,' * л г«ч« ♦’ V *?; 3 ?.*• д* * X ч' / *
m ^Sagg* "‘;:-;5 <
5?&-4 **^*^£***Йг :-С * л* ISsa^** V*
й- h •» •' хй -«*M
г.Л<> ♦•••♦M&**w гк.<еЛ/^
Ж tj***£*
V
***&-&• *‘ *»/* -НН*
Л- ^Ггт^Ь^Чг Ч>Г^:
Рис. 108. Гистологические препараты различных опухолей:
а — медуллобластома, II гистологический вариант; клетки расположены равномерно, ядра округло-овальной формы, цитоплазма скудная, слабо окрашивающаяся; увеличение Х260; б — дедифференциро-ванная крупноклеточная астроцитома; наряду с крупными «тучными» астроцитами встречаются скопления атипичных клеток с гиперхромными ядрами; увеличение Х160; в — эпендимома; в периваскулярных участках большое количество розеток, вне розеток клетки расположены мозаикообразно; увеличение Х160; г — краниофарингиома; кистозные полости выстланы уплощенным цилиндрическим эпителием, видны участки «ороговения» с образованием плотных слоистых масс и гигантские клетки; увеличение Х260; д — изоморфноклеточная глиобластома; клетки с однообразными ядрами преимущественно округлой формы; увеличение Х260.
Среди мезодермальных опухолей наиболее часто наблюдаются саркомы — в 12,4% случаев. Соотношение между доброкачественными и злокачественными формами зависит от возраста ребенка й локализации опухоли. У детей первых трех лет жизни чащ©
313
наблюдаются доброкачественные опухоли. На долю злокачественных опухолей приходится 39—42%. У детей первого года жизни среди субтенториальных опухолей преобладают злокачественные формы. При злокачественных опухолях в 25% случаев наблюдается метастазирование по субарахноидальным пространствам головного и спинного мозга и в желудочковую систему. Во многих случаях имеется типичное кистозное перерождение опухоли. В раннем возрасте кистообразные опухоли преобладают над узловыми.
Характерно, что опухоли мозга у детей раннего возраста локализуются преимущественно в задней черепной ямке. По отношению к мозжечковому намету они делятся на супратенториальные и субтенториальные. К супратенториальным относятся полушарные опухоли, опухоли шишковидной железы и III желудочка, гипофиза, таламуса, базальных ганглиев, среднего мозга, кармана Ратке.
Субтенториальные опухоли (мозжечка, мозгового ствола, IV желудочка) встречаются наиболее часто у детей: так, по данным Института нейрохирургии имени Н. Н. Бурденко АМН СССР они составляют 68,8%, по материалам Института нейрохирургии имени А. Л. Поленова — 57,8%, по данным Киевского института нейрохирургии — 64 %.
Таким образом, в среднем субтенториальные опухоли у детей раннего возраста встречаются примерно в 1,5 раза чаще, чем супратенториальные, однако у детей первого года жизни преобладают супратенториальные опухоли.
Характерной особенностью опухолей у детей является их преимущественное расположение по средней линии — в черве мозжечка, продолговатом мозге и варолиевом мосту, в III желудочке, кармане Ратке, шишковидной железе и хиазмальной области (70—83%). Опухоли прорастают в желудочковую систему и имеют большую распространенность. Это приводит к раннему развитию сопутствующей внутренней водянки мозга и быстрому развитию внутричерепной гипертензии. Желудочковая система вовлекается в патологический процесс у детей раннего возраста в 39—41% случаев, тогда как у взрослых — лишь в 5—7%.
Опухоли головного мозга у детей раннего возраста характеризуются быстрым развитием. Тяжесть состояния ребенка неуклонно прогрессирует.
Начальными проявлениями опухолей мозга у детей первых трех лет жизни являются неспецифические и общемозговые симптомы, на фоне которых в дальнейшем развиваются объективные признаки повышения внутричерепного давления и очаговые (локальные) симптомы поражения мозга.
«Неспецпфические» симптомы появляются исподволь. К ним относятся адинамия, быстрая утомляемость, снижение аппетита, падение массы тела, диспепсические явления, гипотрофия, отставание в психомоторном развитии. У грудных детей в начальный 314
период заболевания «неспецифические» симптомы преобладают, что затрудняет диагностику опухолей в этом возрасте.
Симптомы, связанные с повышением внутричерепного давления. Внутричерепное давление повышается в результате увеличения объема мозга за счет растущей опухоли, сдавления ликворных путей. Повышение давления может провоцироваться инфекцией, травмой. Избыточное количество ликвора и токсические продукты распада опухоли, раздражая сосудистые сплетения, вызывают дополнительную гиперпродукцию жидкости. Повышение внутричерепного давления приводит к уменьшению мозгового кровотока и развитию гипоксии нервной ткани. Ишемия и гипоксия являются причиной отека мозга, гибели нервных клеток. Степень повышения внутричерепного давления зависит от компенсаторных возможностей ребенка. Последние гораздо выше у детей раннего возраста. Увеличение количества циркулирующей жидкости или объема мозга на 15—20% компенсируется имеющимся пространством в задней черепной ямке и клинически не проявляется. К компенсаторным механизмам относятся также перераспределение крови и увеличение венозного оттока, западение мозга в цистерны, расхождение черепных швов.
У 50% детей ранними симптомами внутричерепной гипертензии являются эмоциональные расстройства и изменение поведения. Нарушается концентрация внимания, снижается память, дети заторможены, вялы, не играют в игрушки, замыкаются в себе, временами как бы отсутствуют. Вначале это нередко воспринимают как особенности характера ребенка. В более поздней стадии развивается ступорозное состояние, ребенок как бы отгорожен от внешнего мира, оглушен, «загружен».
Изменения психики и поведения могут быть и очаговым симптомом при локализации опухоли в лобных, височных или теменных отделах головного мозга.
Имеются данные о цикличности, двухфазности в поведении детей с опухолью мозга: вполне удовлетворительное состояние с ясным сознанием чередуется с периодами выраженной оглушенности, наступающими при резком ухудшении общего самочувствия ребенка. По мере прогрессирования болезни периоды удовлетворительного состояния почти исчезают, нарастают заторможенность, загруженность, оглушенность.
Повышение внутричерепного давления постепенно приводит к формированию гипертензионно-гидроцефального синдрома.
У детей первого года жизни он клинически не отличается от синдрома прогрессирующей гидроцефалии неопухолевого генеза. Уже внешний вид детей позволяет заподозрить наличие гидроцефалии. О ней свидетельствует увеличение размеров головы больше возрастной нормы; перкуторно определяется звук «треснувшего горшка», зияют черепные швы; увеличен, выбухает и напряжен большой родничок; положительный симптом «заходящего солнца»; на лбу, висках, переносице видно расширение венозной сети. Эти
315
признаки нередко возникают относительно рано и долгое время могут быть единственным проявлением болезни ребенка. Как правило, у грудных детей отсутствуют приступы головных болей со рвотой и почти не встречаются застойные изменения на глазном дне либо последние выражены незначительно.
По мере нарастания внутричерепной гипертензии у ребенка увеличиваются вялость, сонливость, наконец, может произойти срыв компенсации и появляются ликворо-гипертензионные кризы. У детей первого года жизни гипертензионные кризы наблюдаются редко.
У детей 2—3 лет гипертензионно-гидроцефальный синдром характеризуется головными болями со рвотой. О головной боли часто приходится судить по косвенным признакам: дети капризничают, кричат или плачут от боли, мечутся в постели, хватаются руками за лицо, голову. Иногда наблюдается негативная реакция на окружающее. Перемещение ребенка вызывает плач. Дети 2—3 лет иногда уже могут определить место головной боли. Последняя усиливается при переходе в вертикальное положение, особенно интенсивна в утренние часы, может сопровождаться рвотой без предварительной тошноты. Рвота приносит некоторое облегчение. У детей раннего возраста в связи с компенсаторными возможностями головная боль и рвота могут уменьшаться илп даже на некоторое время полностью исчезать. Но на фоне относительного благополучия иногда возникают внезапная резкая головная боль и рвота, связанные с окклюзией ликворных пространств. Особенно тяжело протекают пароксизмы головных болей при опухолях задней черепной ямки. Они носят характер припадков Брунса, которые помимо резких головных болей проявляются рвотой, головокружением, нарушением дыхания, пульса. У некоторых больных может быть вынужденное положение головы, изменение которого провоцирует эти приступы.
При очень высоком внутричерепном давлении в результате сдавления кавернозного илп сигмовидного синуса возможно нарушение оттока из венозного синуса орбиты, которое приводит к развитию экзофтальма и других глазодвигательных нарушений.
Сердечно-сосудистые расстройства у детей с опухолями мозга развиваются вследствие непосредственного влияния высокого внутричерепного давления на регуляторные центры. Наблюдаются снижение артериального давления, особенно диастолического, брадикардия.
Важным признаком повышенного внутричерепного давления является отек соска зрительного нерва. У детей раннего возраста он развивается на более поздних стадиях процесса, чем у старших, или может вообще не возникать в случаях, когда субарахноидальное пространство не доходит до глазного яблока (вариант нормы). Отек соска зрительного нерва наиболее характерен для опухолей задней черепной ямки.
316
При остром повышении внутричерепного давления, например при окклюзионно-гидроцефальных приступах, на глазном дне наряду с застойными сосками зрительных нервов обнаруживаются кровоизлияния в сетчатку. Длительная внутричерепная гипертензия может приводить к вторичной атрофии зрительного нерва, снижению остроты зрения.
Ранними рентгенологическими признаками повышения внут-речепного давления у детей первого года жизни являются расхождение черепных швов, увеличение размеров родничков. У более старших детей на ранних стадиях изменений в костях черепа не обнаруживают. При длительной выраженной внутричерепной гипертензии отмечается увеличение размеров головы, расширение швов, а затем их расхождение, усиление рисунка пальцевых вда-влений. Также характерны выраженный венозный рисунок, истончение костей свода черепа, уплощение турецкого седла, остеопороз костей основания черепа.
Гипертензионно-гидроцефальный синдром у детей раннего возраста возникает задолго до появления локальных симптомов. Он может оставаться единственным проявлением опухоли в течение длительного времени. Под влиянием дегидратационной терапии возможна ремиссия гипертензионно-гидроцефального синдрома.
Степень выраженности гипертензионно-гидроцефального синдрома у детей первых 3 лет жизни при локализации опухоли в задней черепной ямке значительно больше, чем при супратенториальных опухолях. Даже небольшие опухоли, расположенные субтенториально, в тесном пространстве задней черепной ямки, сверху ограниченной плотным, нерастяжимым мозжечковым наметом, а снизу затылочной костью, могут быть причиной резко выраженных общемозговых симптомов. В этом случае могут нарушаться венозный отток и всасывание спинномозговой жидкости. При опухолях полушарий мозга, локализованных супратенто-риально, далеко от венозных и ликворных путей, длительное время может не быть признаков повышения ликворного давления.
Локальные симптомы опухолей головного мозга. Развитие очаговых симптомов связано с непосредственным влиянием опухоли на мозговую ткань, нарушением кровообращения в зоне расположения опухоли, смещением и сдавлением мозга. Очаговые симптомы у детей раннего возраста обычно выражены слабо, и чем меньше ребенок, тем реже они наблюдаются. Локальные симптомы отличаются непостоянством. Иногда они появляются на короткое время и могут быстро маскироваться прогрессирующей гидроцефалией. Благодаря большим компенсаторным возможностям раннего возраста опухоли мозга, не проявляясь очаговыми симптомами, могут достигать таких размеров, которые у взрослых не совместимы с жизнью. Особенно это касается полушарных опухолей. Отсутствие четких локальных клинических проявлений при них связано также и с незрелостью высших корковых функций.
317
Субтенториальные опухоли
Опухоли мозжечка. Опухоли мозжечка преобладают по частоте среди опухолей задней черепной ямки (70—78%). Основные клинические симптомы: атаксия, интенционный тремор и мышечная гипотония. Они возникают обычно на фоне резко выраженных симптомов повышения внутричерепного давления. У детей раннего возраста опухоли чаще локализуются в срединных структурах, а именно в черве мозжечка. При поражении червя больше страдает статика и возникает нарушение равновесия. Появляются пошатывание и неуверенность при ходьбе, частые падения на спину. В дальнейшем ребенок предпочитает сидеть, а потом лежать, так как не может удерживать туловище и голову в вертикальном положении.
При локализации опухоли в полушариях мозжечка преобладают нарушения координации и интенционное дрожание. Эти симптомы можно увидеть в момент, когда ребенок берет игрушку. Обычно проявляются они на стороне пораженного полушария мозжечка. Речь больного ребенка спотыкающаяся, растянутая, неравномерно модулированная (скандированная).
На более поздних стадиях развития опухоли часто наблюдаются поражения черппомозговых нервов (тройничного, отводящего, лицевого, слухового), двусторонние или односторонние пирамидные знаки. Спонтанный нистагм, чаще в обе стороны, является почти постоянным симптомом опухоли мозжечка. Наблюдается снижение и в дальнейшем полное отсутствие корнеальных рефлексов с обеих сторон.
При опухолях червя мозжечка во многих случаях возникают гипертензионно-окклюзионные приступы с резкой головной болью, головокружением, рвотой, тоническими судорогами, децеребрационной ригидностью, нарушением функции дыхательного и сосудо-двигательного центров. Они особенно часты у детей раннего возраста. При опухолях полушарий мозжечка они имеют место, когда по мере роста опухоли она начинает давить на ствол мозга. У дете!1 первого года жизни с опухолями задней черепной ямки на первое место выступает прогрессирующая гидроцефалия, которая в какой-то степени маскирует локальные симптомы.
Среди опухолей мозжечка преобладают злокачественные медуллобластомы, склонные к метастазированию, несколько реже наблюдаются доброкачественные опухоли — астроцитомы. Последние медленно растут и могут длительно оставаться малосимптом-ными. Указанные выше локальные признаки появляются, когда образовываются кисты, характерные для этих опухолей. Над локальными симптомами преобладают гипертензпонпые явления с гипертензионно-гидроцефальными кризами, типичными для опухолей субтенториальной локализации, которые появляются внезапно и иногда требуют нейрохирургического вмешательства по жизненным показаниям.
318
Опухоли ствола мозга. Опухоли ствола мозга у детей составляют 13—20% от общего количества опухолей мозга. Чаще наблюдаются глиомы с инфильтративным ростом. При стволовой локализации опухолей рано возникают очаговые симптомы, до-вольно быстро поражаются жизненно важные центры и часто больные погибают раньше, чем у них успевают развиться выраженные признаки повышения внутричерепного давления.
При росте опухоли из варолиевого моста наблюдается поражение отводящего, тройничного, лицевого и слухового нервов, сочетающееся, как правило, с гемипарезом на стороне, противоположной опухоли (альтернирующие синдромы).
При прорастании опухоли в средний мозг или при исходной ее локализации в среднем мозге присоединяются симптомы поражения четверохолмия: отсутствие зрачковой реакции на свет, расширение зрачков, симптом Гертвига—Мажанди (косоглазие по вертикали), парез взора вверх. В последующем развивается повышение мышечного тонуса в экстензорах, приводящее к опи-стонусу.
При локализации опухоли в продолговатом мозге характерными очаговыми симптомами являются рвота, бульбарный паралич с расстройствами глотания и фонации, дизартрия, нарушение ритма дыхания и сердечной деятельности.
Опухоли IV желудочка. Опухоли IV желудочка у детей раннего возраста редки. Долгое время опухоль может протекать бессимптомно, хотя скрытый период заболевания при этой локализации более короткий, чем при опухолях червя и полушарий мозжечка.
Гипертензионные кризы являются ведущими в клинической картине заболевания. Они проявляются также вегетативными и висцеральными, быстро проходящими пароксизмами, стволовыми тоническими судорогами и часто расстройствами дыхания и сердечной деятельности, угрожающими жизни больного (синдром Брунса). Почти постоянным симптомом является горизонтальный нистагм. Выявляются симптомы поражения ядер черепномозговых нервов (тройничного, отводящего, лицевого, слухового). Мозжечковые нарушения при опухолях IV желудочка выражены слабо (причем чаще наблюдается статическая атаксия) и появляются в более поздний период заболевания. В некоторых случаях вследствие давления опухоли на дно ромбовидной ямки развиваются бульбарные расстройства. На глазном дне значительно выражены застойные явления. При гипертензионных кризах быстро падает острота зрения. В ликворе определяется белково-клеточная диссоциация.
Опухоли IV желудочка гистологически чаще астроцитомы, развиваются из крыши и стенок желудочка и врастают всей своей массой в его полость, реже встречаются эпендимомы.
319
Супратенториальные опухоли
Опухоли полушарий мозга. Опухоли полушарий головного мозга у детей составляют 56% супратенториальных опухолей. У детей раннего возраста диагностика полушарных опухолей сложна, поскольку еще не сформированы функции речи, праксиса, гнозиса, отсутствует разница между правой и левой стороной. Клинические симптомы появляются спустя довольно длительный промежуток времени от начала развития опухоли, особенно при локализации в лобных и затылочных областях. Неврологические нарушения, развивающиеся в поздней стадии, обычно не связаны с локализацией опухоли, а возникают вследствие смещения мозга — «симптомы на расстоянии». Наиболее ранними клиническими признаками полушарных объемных процессов являются расстройства поведения ребенка: вялость или повышенная возбудимость, неадекватное поведение, дурашливость. Постепенно снижаются память и активное внимание, утрачиваются навыки опрятности, нарушаются сон и эмоциональные реакции. В некоторых случаях ранним симптомом полушарной опухоли могут быть локальные или общие судороги, вслед за которыми постепенно развивается слабость конечностей. В 25—30% случаев судороги могут быть единственным симптомом опухоли мозговых гемисфер.
Парезы конечностей при поверхностной локализации опухоли обычно негрубые и выявляются более четко при физической нагрузке. При локализации опухолей во внутренней капсуле парезы выявляются рано и клинически более выражены. Локализация опухоли в левом полушарии может сопровождаться задержкой развития речи, расстройствами речи по типу моторной или сенсорной алалии, если речевая функция у ребенка уже развилась. Гемианопсию у детей раннего возраста обнаружить трудно.
При поражении передних отделов мозга выявляются псевдо-бульбарные симптомы. Симптомы повышенного внутричерепного давления развиваются в поздней стадии опухолевого процесса.
Гистологически среди полушарных опухолей значительно преобладают глиомы. В раннем возрасте они чаще кистознопереро-жденные, с большими полостями и обызвествлениями.
Опухоли зрительного перекреста и межуточного мозга. Наиболее часто встречающиеся опухоли этой области — глиома зрительного перекреста, эпидермоид, краниофарингиома. Краниофарингиомы в детском возрасте составляют 7,5% от всех внутричерепных опухолей. Из супратенториальных опухолей у детей это самый частый вид опухоли (56%).
Краниофарингиома представляет собой врожденную опухоль, развивающуюся из эпителия кармана Ратке или краниофарингиального протока. У мальчиков опухоль встречается в 2 раза чаще, чем у девочек. Наиболее частой локализацией является супраселлярная, реже наблюдаются селлярные и субселлярные опу* 820
холи Опухоли по своей природе часто кистообразные. Поражение рядом расположенных образований (хиазмы, гипофиза, III желудочка и паравентрикулярных вегетативных центров) обусловливает характерные особенности клиники краниофарингиом, в которых основными являются гормонально-обменный, хиазмальный и гидроцефальный синдромы.
Гормонально-обменные нарушения проявляются патологией роста, адипозо-генитальной дистрофией, недостаточностью функции щитовидной железы с явлениями микседемы, гипофункцией надпочечников, сахарным диабетом. Иногда нарушается ритм сна. Хиазмальный синдром выражается в снижении остроты зрения с битемпоральной гемианопсией, первичной атрофии зрительных нервов, реже — вторичной атрофии вследствие повышенного внутричерепного давления. У некоторых больных наблюдаются вегетативно-трофические расстройства: мраморность, сухость и истончение кожи, гипертрихоз.
Самопроизвольное опорожнение кист может вызывать уменьшение симптомов и последующую ремиссию.
У детей раннего возраста начальную стадию зрительных нарушений бывает трудно выявить. Гипертензионно-гидроцефаль-пый синдром также длительное время может не проявляться. Поэтому на первый план в клинической картине выступают гормональные и вегетативные расстройства, которые должны быть предметом пристального исследования врача.
Для краниофарингиом характерны изменения на рентгенограммах черепа в виде деструкции и обызвествления турецкого седла и кальцификатов, расположенных внутри или над турецким седлом.
Диагностика и лечение. Диагноз опухолей головного мозга у детей раннего возраста основывается на комплексном обследовании больного — неврологическом, офтальмологическом и отоневрологическом. Собирая анамнез, необходимо выяснить, как протекали беременность, роды, период новорожденное™ и дальнейшее развитие ребенка. Важное значение имеют исходные размеры черепа при рождении и динамика их роста.
При неврологическом исследовании у детей раннего возраста следует обратить внимание на форму черепа, его размеры, конфигурацию, наличие костных асимметрий, состояние родничков, развитие подкожной сосудистой сети. Наблюдая за детьми во время еды, игры, можно проследить за активностью движений, определить реакцию на звуковые и световые раздражители, выявить состояние статической и моторной функций. Чувствительные расстройства значительно сложнее выявить в раннем детстве.
В связи с преобладанием в клинике опухолей гидроцефально-гипертензионного синдрома и малой выраженностью очаговой симптоматики топический диагноз опухоли у детей раннего возраста представляет большие трудности. В связи с этим часто приходится прибегать к комплексу современных параклинических
321
исследований. На глазном дне в 80—90% случаев обнаруживаются застойные явления. Они более характерны для детей 2-го и 3-го года жизни.
С помощью отоневрологического исследования можно получить ценные диагностические сведения при процессах, локализующихся в задней черепной ямке. Из-за трудности контакта с маленькими детьми исследование функции слуха и равновесия значительно затруднено. При опухолях червя мозжечка, как правило, наблюдаются неточность выполнения координаторных проб, тугоухость, горизонтальный или иногда вертикальный нистагм при калорической пробе. При медленно растущих опухолях мозжечка отоневрологическое исследование может и не показывать изменений вследствие значительных возможностей компенсации функций кохлеарного и вестибулярного аппарата.
Трансиллюминация черепа подтверждает наличие гипертен-зионно-гидроцефального синдрома. Важным в диагностике опухолей является исследование спинномозговой жидкости. Люмбальные пункции детям раннего возраста следует делать крайне осторожно. Лучше прибегать к вентрикулярным пункциям (через незакрытый родничок или разошедшийся коронарный шов) и одновременно для сравнения показателей давления и состава ликвора производить поясничный прокол. В диагностике опухолей у маленьких детей сопоставление результатов исследования люмбального и вентрикулярного ликвора имеет большое диагностическое значение. Характерным для опухолей является повышение белка при нормальном или слегка повышенном цитозе (белково-клеточная диссоциация). Давление ликвора при опухолях головного мозга у детей всегда повышено и иногда достигает 600— 800 мм вод. ст. и выше. Цитоз не изменен или несколько увеличен. Количество сахара нормальное. Достоверным признаком опухоли может быть лишь наличие опухолевых клеток в осадке ликвора, но они выявляются крайне редко.
Рентгеноскопия черепа позволяет обнаружить признаки повышения внутричерепного давления. Могут быть также выявлены местные изменения костей вблизи опухоли, например, экзостозы, расширение и уплощение турецкого седла, изменение его спинки. Весьма важное значение имеют обнаруживаемые на рентгенограмме обезвествленные очаги. У детей особенно часто наблюдается отложение солей в области турецкого седла при краниофарингиомах. Отложение извести характерно для глиом.
Эхоэнцефалография оказывает значительную помощь в диагностике супратенториальных полушарных опухолей, при которых ЭХОЭГ указывает на смещение срединных структур мозга. При субтенториальных процессах эхограмма выявляет двустороннюю симметричную гидроцефалию.
При пневмоэнцефалографии и вентрикулографии выявляют недостаточное наполнение воздухом субарахноидального пространства на стороне опухоли и уровень окклюзии ликворных путей. 322
Ангиография применяется для определения точной локализации опухоли и ее характера. Основным показанием к ангиографии является подозрение на сосудистую опухоль или арахноэндо-телиому. В зависимости от локализации опухоли на ангиограмме выявляются различные изменения сосудов. Дифференциальная диагностика опухолей мозга на основании ангиографических данных в детском возрасте относительно трудна. Менингиома, дающая типичную картину, у детей встречается редко. Однако при некоторых разновидностях сарком можно обнаружить типичную картину патологических сосудов опухоли, заполненных контрастным веществом. Для множественной глиобластомы характерно одновременное изображение вен и артерий (артерио-венозное «шунтирование»). Кровоснабжение опухоли сосудами мозга наиболее свойственно астроцитомам.
Радиоизотопная диагностика позволяет выявить накопление изотопа в области патологического очага. Наиболее часто этим методом выявляют астроцитомы, глиобластомы и метастатические опухоли.
В последние годы для диагностики опухолей применяется компьютерная томография, позволяющая выявить точную локализацию и характер опухоли.
Дифференциальный диагноз опухолей у детей раннего возраста проводят с врожденной гидроцефалией, воспалительными заболеваниями (арахноидитами, энцефалитами), абсцессами мозга. Необходимо исключать объемные процессы, вызванные паразитами (цистицерком, эхинококком).
Лечение опухолей головного мозга у детей раннего возраста включает хирургическое удаление опухоли, лучевую и химиотерапию. Перед операцией ребенку с гипертензионно-гидроцефальным синдромом проводят массивную дегидратационную терапию, сочетая ее с общеукрепляющими препаратами.
Прогноз более благоприятный при ранней постановке диагноза, когда можно радикально удалить опухоль.
Глава X. ЧЕРЕПНО-МОЗГОВАЯ ТРАВМА
Травмы головы являются частой причиной смерти и инвалидизации в детском возрасте. На ранний возраст приходится 25— 45% всех травматических повреждений мозга у детей.
В возрасте до 1 года черепно-мозговая травма составляет 80% от всех травм, в 1—2 года —60%, старше 2 лет —43%. Среди больных с черепно-мозговой травмой от 4,3 до 20% — дети первого года жизни (И. Г. Алмазова, О. С. Горбачев, 1978). Это связано с особенностями анатомического строения ребенка, большими размерами головы по отношению к туловищу, а также несовершенством системы координации движений. Травмы головного мозга в раннем детском возрасте чаще возникают вследствие падения с небольшой высоты (дивана, кровати, стула) и случайных ушибов во время игр. Особенно часты травмы в период, когда дети учатся ходить.
Несколько реже, чем черепно-мозговые травмы, встречаются травмы периферических нервов и еще реже — повреждения спинного мозга.
Классификация. Черепно-мозговые травмы делятся на закрытые и открытые. Частота закрытой черепно-мозговой травмы у детей раннего возраста достигает 83,5% всех черепно-мозговых повреждений. Среди закрытых черепно-мозговых травм синдромологически выделяют сотрясение мозга (commotio cerebri), ушиб мозга (contusio cerebri), сдавление мозга (compressio cerebri).
Патогенез черепно-мозговой травмы обусловлен механическим воздействием на череп и мозг. Нарушения кожных покровов и костей черепа, оболочек и вещества мозга зависят от характера и силы механического воздействия. Одновременно с локальным повреждением механическая сила действует и на отдаленные участки головного мозга. Это связано с гидродинамическим влиянием ликворной волны. Возникает цепь патофизиологических процессов, среди которых ведущая роль принадлежит рефлекторно-вазомоторным реакциям, ликвородинамическим нарушениям, функциональной асинапсии мозга, дисфункции нейронов. Сосудистые изменения в головном мозге носят диффузный характер, являются следствием нарушения функции высших вазомоторных центров. В патогенезе черепно-мозговых травм придается значение повреждению гипоталамо-стволовых отделов мозга, которые, будучи относительно фиксированными и хорошо васкуляризированными, наиболее ранимы при черепно-мозговой травме. Поскольку этому отделу нервной системы принадлежит ведущая роль в обес
824
печении адаптации организма к условиям внешней среды, повреждение его ведет к нарушению функции приспособительных систем.
Ведущей адаптационной системой организма является симпа-то-адреналовая система. В ответ на травму в первые сутки острого периода у детей отмечается повышение экскреции адреналина с мочой. При этом степень повышения коррелирует с тяжестью клинических проявлений травмы. К концу острого периода экскреция катехоламинов падает ниже нормальных цифр. В момент кажущегося выздоровления ребенка еще не происходит нормализации состояния адаптационных систем организма. Восстановление функции симпато-адреналовой системы завершается лишь спустя год-полтора после травмы, даже если она была легкой. В посттравматическом периоде у ребенка выявляется чрезвычайная лабильность приспособительных механизмов, которая обусловливает ранимость организма, сниженную сопротивляемость к различным воздействиям, таким, как инфекции, физические, психические и эмоциональные перегрузки и др.
Повреждение ретикулярной формации приводит к блокаде активирующей ретикуло-кортикальпой системы. С нарушением функции ретикулярной формации связывают наиболее частые клинические проявления острого периода травмы (потерю сознания, адинамию, вялость, заторможенность).
В патогенезе черепно-мозговой травмы у детей раннего возраста имеют также значение нарушение иннервации сосудов, возникновение рефлекторных изменений в жизненно важных отделах мозга, нарушение дыхания и сердечно-сосудистой деятельности, повышение проницаемости гематоэнцефалического барьера, отек и набухание мозга. Рефлекторно-вазомоторные реакции проявляются сменяющими друг друга ангиоспастическими и ангио-паралитическими явлениями. Снижается тонус сосудистой стенки, замедляется кровоток, повышается проницаемость капилляров, что приводит к плазморрагиям, точечным кровоизлияниям, развитию отека мозга. Расстройство кровообращения распространяется и на сосудистые сплетения мозговых желудочков, вызывая ликвородинамические нарушения с гиперпродукцией спинномозговой жидкости и нарушением ее нормального оттока. Возникает гипоксия мозга, ведущая к нарушениям обмена, сдвигу кислотно-щелочного равновесия в сторону метаболического ацидоза. Изменяются белковые структуры, разбухают коллоиды, усиливается отек и набухание мозга.
Анатомо-физиологические особенности раннего детского возраста обусловливают своеобразие течения черепно-мозговых травм у маленьких детей и расширяют возможности компенсации (К. П. Кирдан и др., 1974; В. П. Немсадзе, 1974). Подвижность костей черепа в результате отсутствия сращений черепных швов у детей до 1 года в значительной степени снижает силу удара. Этому же способствует и относительно больший объем
325
субарахноидального пространства у детей раннего возраста, в связи с чем симптомы сдавления ствола при отеке и набухании мозга выражены меньше и появляются позже, чем у детей старшего возраста. Однако отек и набухание головного мозга у детей раннего возраста возникает легче, что связано с повышенной проницаемостью сосудистой стенки, несовершенством нейрогумораль-ной регуляции, обменными расстройствами.
Патом орфологи я. Патоморфологические изменения определяются характером травмы. Они более выражены при тяжелых травмах, когда возникают обширные кровоизлияния с нарушением целостности сосудов, мозговых оболочек и мозга. Такие травмы редки у детей раннего возраста. Чаще при закрытых травмах черепа сосудистые изменения сводятся к диапедезным кровоизлияниям, выявляются отек и набухание мозга.
Закрытая черепно-мозговая травма
Закрытая черепно-мозговая травма у детей составляет 22— 50% всех травматических повреждений в детском возрасте (Н. Г. Дамье, 1960; В. П. Киселев, В. А. Козырев, 1971; Н. Н. Голыш, В. Н. Байрак, 1972).
Особенностью клинической картины закрытой черепно-мозговой травмы у детей раннего возраста является малосимптомность (кратковременность и слабая выраженность общемозговых и почти полное отсутствие очаговых симтомов) и легкое течение острого периода. В связи с этим нередко возникают трудности в диагностике и определении степени тяжести повреждения. Общемозговые и особенно очаговые симптомы у детей первого года жизни могут отсутствовать даже при нарушении целостности черепа. При падении с небольшой высоты дети раннего возраста в большинстве случаев не теряют сознания, оболочечные симптомы отсутствуют. Общая оглушенность быстро сменяется двигательным беспокойством. Иногда отмечаются диспептические расстройства.
Двигательные нарушения у грудных детей не всегда легко определить. Изменения мышечного тонуса и рефлексов неотчетливы, о двигательных нарушениях судят по меньшей активности паретичных конечностей. Симптомы поражения черепно-мозговых нервов выражены нерезко или вовсе отсутствуют. Наиболее часто отмечаются нарушения глазодвигательного, отводящего и лицевого нервов. В остром периоде черепно-мозговой травмы у детей раннего возраста могут преобладать общемозговые симптомы: рвота, беспокойство, вялость, сонливость, бледность кожных покровов. В детском возрасте повышена проницаемость гематоэнцефалического барьера, поэтому черепно-мозговая травма у детей чаще, чем у взрослых, может осложняться проникновением инфекции в субарахноидальное пространство и развитием гнойного или серозного менингита.
326
Лабильность симптомов, их кратковременность, смена одних другими настолько характерна для острого периода травмы, что Н. Н. Бурденко назвал этот период травмы хаотическим.
Сотрясение мозга характеризуется общемозговыми симптомами при отсутствии четких локальных выпадений. Критерием степени тяжести сотрясения мозга у детей раннего возраста является общее состояние и длительность общемозговых симптомов.
Потеря сознания при сотрясении мозга кратковременна (секунды, минуты), а у грудных детей ее можно вообще не заметить. Иногда отмечаются оглушенность, двигательное беспокойство, быстро сменяющееся вялостью, сонливостью. Дети 2—3 лет могут жаловаться на головную боль, тошноту, иногда наблюдается одно- или двухкратная рвота. Симптомов локального поражения мозга, изменения давления спинномозговой жидкости, явлений застоя на глазном дне не отмечается. В легких случаях уже через несколько часов после травмы или на вторые сутки общее состояние заметно улучшается: прекращается рвота, дети становятся активными.
В тяжелых случаях рвота и тошнота держатся в течение 1—2 дней, старшие дети длительно жалуются на головную боль. У детей грудного возраста иногда отмечаются тремор, кратковременные судороги; у старших — бред, психомоторное возбуждение. На фоне общемозговых симптомов выявляются преходящие очаговые расстройства: легкое сходящееся косоглазие, асимметрия мышечного тонуса и рефлексов. С 3—5-го дня состояние улучшается. Однако еще длительное время остаются повышенная исто-щаемость, легкая возбудимость, раздражительность, нарушение концентрации внимания.
Ушиб мозга в детском возрасте наблюдается значительно реже. Он проявляется сочетанием сотрясения, общемозговых, оболочечных симптомов и нарушений со стороны стволово-базальных отделов головного мозга (расстройство дыхания и гемодинамики) с симптомами очагового поражения. Склонность к генерализованным общемозговым реакциям у новорожденных и грудных детей служит причиной относительной «стушеванности» очаговой симптоматики.
Определенной зависимости между выраженностью общемозговых симптомов п тяжестью ушиба мозга нет. Грубые структурные изменения могут сопровождаться неглубоким нарушением сознания, а коматозное состояние иногда сочетается с легкими очаговыми симптомами. Очаговые симптомы могут появиться на 2—3-и сутки после травмы, вслед за постепенным уменьшением гемо- и ликвороциркуляторных расстройств, отека мозга.
В остром периоде ушиба мозга у детей на фоне нарушенного сознания возникают вегетативные нарушения. Отмечаются резкая бледность кожных покровов или их покраснение, потливость, повторная рвота, брадикардия, снижение артериального давления,
327
иногда дыхательная аритмия. Судороги в остром периоде могут быть локальными или генерализованными. В связи с рассасыванием некротизированной ткани спустя 1—2 дня после травмы повышается температура, могут появиться симптомы токсикоза, в крови нарастает лейкоцитоз со сдвигом формулы крови влево. По мере убывания общемозговых симптомов четче выявляются очаговые неврологические нарушения: гемипарезы, судороги, речевые расстройства.
Ушибы мозга могут сопровождаться субарахноидальными кровоизлияниями. Клиника субарахноидальных кровоизлияний у детей раннего возраста описана в главе «Нарушения мозгового кровообращения».
Сдавление мозга. Синдром компрессии является одним из тяжелейших осложнений черепно-мозговой травмы. В острый период травмы сдавление обусловлено отеком и набуханием мозга; оно может быть вызвано также гематомой. В зависимости от локализации различают эпидуральные и субдуральные гематомы.
Эпидуральные гематомы возникают при повреждении средней оболочечной артерии ее ветвей. При переломах черепа источником кровотечения служат также диплоэтические вены и венозные синусы.
Эпидуральные гематомы у детей раннего возраста наблюдаются гораздо реже, чем субдуральные. Клинические проявления развиваются остро, сразу после травмы. Больные теряют сознание, иногда развивается глубокая кома. Характерны рвота, локальные судорожные приступы. Дети бледные, частый пульс, липкий холодный пот. Реакция зрачка на свет на стороне гематомы отсутствует. Нарастает анемия. Если источником эпидуральной гематомы является артериальное кровотечение, быстро прогрессирует нарушение жизненных функций и требуется безотлагательное хирургическое вмешательство.
Субдуральная гематома — это массивное скопление крови в субдуральном пространстве. Источником субдурального кровоизлияния служат вены, впадающие в верхний сагиттальный и поперечный синусы, сосуды мозжечкового намета, средняя мозговая артерия.
В клинической картине субдуральной гематомы различают три периода: острый, обусловленный непосредственно воздействием травмы. Он обычно протекает с симптоматикой сотрясения или ушиба мозга; латентный период — «светлый» промежуток между затихшими уже явлениями сотрясения и еще не сформированным синдромом компрессии; собственно фазу компрессии мозга.
У детей раннего возраста клиническое течение внутричерепной гематомы может быть нетипичным. Первая фаза выражена непостоянно, непосредственной реакции на травму может не быть. Особенности анатомического строения черепа и ликворных пространств обусловливают постепенное нарастание симптомов сдавления ствола мозга.
328
В зависимости от характера клинического течения различают острую и хроническую субдуральные гематомы.
Острая субдуральная гематома в отличие от хронической чаще односторонняя. Она может сформироваться сразу после черепномозговой травмы. Ребенок оглушен, наблюдается повторная рвота, большой родничок напряжен, могут быть судороги клонико-тонического характера. К частым клиническим проявлениям относят также расширение зрачка на одноименной очагу поражения стороне, симптом Грефе, косоглазие, мышечную гипотонию, повышение сухожильных рефлексов. Кожные покровы бледные, холодны на ощупь, дыхание поверхностное, пульс аритмичный. Возможны кровоизлияния в сетчатку, в крови — легкая анемия. При обширных субдуральных гематомах сдавление жизненно важных центров продолговатого мозга и дислокация мозговых структур приводят к смерти ребенка.
Хроническая субдуральная гематома наиболее часто встречается у детей от двух до шести месяцев. Ее образованию способствуют недостаточность витаминов К и С, эксикоз, нарушение свертываемости крови. В 78% случаев хронические субдуральные гематомы у детей бывают.двухсторонними. Размеры хронической гематомы могут медленно увеличиваться в результате кровоизлияний из капилляров грануляционной ткани, а также абсорбции жидкости вследствие более низкого осмотического давления в гематоме.
Для хронической субдуральной гематомы характерен длительный «скрытый» период, в течение которого ребенок плохо ест, теряет в массе, сонлив. На этом фоне увеличиваются размеры головы, появляются рвота и судороги. Нарастает напряжение большого родничка, расходятся черепные швы. У части детей выявляются легкая форма анемии, кровоизлияния в сетчатку. У более старших детей постепенно нарастают признаки повышения внутричерепного давления: головная боль, рвота, усиление венозного рисунка на висках, веках, коже лба, отек на глазном дне.
Первые симптомы компрессии мозга появляются при объеме гематомы 50—70 мл. Типичным проявлением клинически развернутой компрессии мозга является внезапное резкое ухудшение состояния больного с нарушением сознания вплоть до комы. Острое развитие комы крайне затрудняет диагностику внутричерепной гематомы, особенно если не было достоверных указаний на травму. Как правило, выявляются стволовые симптомы: анизокория, косоглазие, «плавающие движения» глазных яблок, нистагм, брадикардия, дыхательная аритмия, снижение корнеальных и глоточных рефлексов. В тяжелых случаях наблюдаются горметония, тонико-клонические судороги.
Спинномозговая жидкость при субдуральном кровоизлиянии не изменена или отмечаются легкая ксантохромия и белково-клеточная диссоциация. Трансиллюминация черепа в остром периоде кровоизлияния выявляет пониженное свечение, но по мере рассасывания гематомы оно становится все более ярким, широким,
329
фокальным. На ЭХОЭГ при супратенториальной локализации наблюдается смещение М-эхо. Смещение срединных структур головного мозга увеличивается пропорционально величине внутричерепной гематомы и может доходить до 1 см. Помимо определения внутричерепных кровоизлияний, эхоэнцефалография может быть использована для диагностики ушиба головного мозга, при этом нужно принимать во внимание минимальные смещения М-эхо (до 0,3 см). В остром периоде черепно-мозговой травмы у большинства детей первого года жизни на эхограмме отмечаются дополнительные эхо-выбросы, расцениваемые как проявление отека мозга. РЭГ показывает асимметричное уменьшение кровенаполнения на стороне кровоизлияния. При рентгенологическом исследовании черепа выявляется увеличение бипариетального диаметра, углубление средней черепной ямки на пораженной стороне. Иногда можно обнаружить кальцификаты в области гематомы. Большое диагностическое значение имеет пункция субдурального пространства в области предполагаемой гематомы.
В последние годы большой вклад в диагностику черепно-мозговой травмы внесла компьютерная томография. Это исследование нетравматично, его можно повторять несколько раз, что имеет важное значение для детей, находящихся в тяжелом состоянии или при прогрессировании неврологических нарушений.
Переломы черепа. Повреждение костей черепа возникает в результате приложения механической силы на сравнительно небольшом участке. Гидродинамический удар распространяется в полости черепа равномерно и может вести к костным повреждениям не только в области травмы, но и на значительном расстоянии от нее. Повреждения костей черепа обычно связаны с тяжелой травмой, приводящей одновременно и к ушибу мозга. Возможны также внутричерепные кровоизлияния различной локализации.
Примерно 70% случаев переломов черепа у детей первого года жизни составляют переломы костей свода черепа. Наиболее характерны для детей грудного возраста — вдавленные переломы костей свода черепа по типу «целлулоидного мячика». При падениях и ударах головой о твердый предмет происходит расхождение швов, иногда трещины свода черепа находятся на большом протяжении.
Патогномоничным симптомом перелома костей свода черепа является гематома мягких тканей головы. Часто она бывает единственным симптомом, заставившим родителей обратиться к врачу. Для трещин черепа у детей характерно проникновение под апоневроз спинномозговой жидкости. Возникающая припухлость иногда пульсирует. Она держится 10—20 дней и затем полностью исчезает.
При трещинах свода черепа бывают кровотечения из диплоэти-ческих вен с развитием эпидуральной гематомы или гематомы под апоневрозом, достигающих иногда значительных размеров. Трещины свода черепа могут спускаться на основание.
330
Изолированные переломы основания черепа у детей раннего возраста встречаются редко. Они возникают при падении с высоты на голову, а также при сильных ударах в переносье или нижнюю челюсть. Переломы основания черепа чаще бывают в средней черепной ямке, реже — в задней и передней.
Клиническая симптоматология переломов основания черепа довольно разнообразна и тяжела. Одним из признаков перелома основания черепа является возникновение кровоподтека вокруг глаз, имеющего вид очков. Такие кровоподтеки могут быть и односторонними. При переломах пирамидной кости отмечается кровотечение изо рта и ушей, при переломе решетчатой кости — носовое кровотечение.
Для перелома основания черепа характерно поражение черепно-мозговых нервов в результате их ущемления или сдавления гематомой. Поэтому на фоне общемозговых симптомов отмечаются четкие симптомы повреждения мозгового ствола, особенно его бульбарного отдела. Различные сочетания поражения черепномозговых нервов могут указывать на локализацию трещины основания черепа или расположение гематомы.
При переломах основания черепа может развиться ликворея через нос и уши. Это происходит вследствие плотного сращения мозговой оболочки с костями черепа и разрыва ее при костных повреждениях. Ликворея сопряжена с опасностью инфицирования и развития гнойного менингита. В связи с ликвореей может отмечаться гипотензивный синдром. При переломах основания черепа, переходящих на основную и решетчатые кости, создаются сообщения между их полостями. Трещины пирамиды высочной кости ведут к сообщению полости черепа со средним ухом. В этих случаях также возможно инфицирование оболочек с развитием гнойного менингита. При наличии симптомов, указывающих на внутричерепное инфицирование, необходима диагностическая люмбальная пункция.
Открытая черепно-мозговая травма
Открытая черепно-мозговая травма — результат механического удара большой силы, для детей раннего возраста не характерна. При ударе повреждаются мягкие ткани головы и возникаю! оскольчатые или вдавленные переломы костей свода черепа. Костные осколки вместе с травмирующим предметом разрывают мозговые оболочки и ранят головной мозг. Через раневой канал могут вытекать разрушенная мозговая ткань, ликвор, кровь. Основная опасность открытой черепно-мозговой травмы связана с постоянной угрозой проникновения инфекции и развития гнойного менингита, менингоэнцефалита или абсцесса мозга.
Клиническая картина открытых травм черепа складывается из общемозговых и очаговых симптомов сотрясения или ушиба мозга. При вдавливании в полость черепа костных обломков или
331
в случае внутричерепного кровоизлияния могут присоединиться и симптомы сдавления мозга.
Течение и исход черепно-мозговых травм зависят от характера травмы черепа (открытая или закрытая), локализации и степени повреждения мозга.
При легкой черепно-мозговой травме, особенно если в острый период не было потери сознания, течение благоприятное. Подтверждением сохранения сознания является крик ребенка сразу после травмы. Если травма сопровождалась потерей сознания, рвотой, то после острого периода наблюдается иногда выраженный цереб-растенический синдром, повышение внутричерепного давления. Дети становятся раздражительными, плаксивыми, быстро утомляются, сон поверхностный, неспокойный.
При травмах, осложненных повреждениями костей черепа, нарушением целостности оболочек, кровоизлияниями, менингитом или абсцессом, прогноз всегда более тяжелый. Кроме вышеописанных симптомов наблюдаются резидуальные явления в виде парезов, эпилептиформного синдрома, речевых и зрительных нарушений, значительных психических отклонений и изменения поведения. Черепно-мозговая травма является одной из причин ранней детской нервности.
Течение черепно-мозговой травмы и ее последствия у детей раннего возраста зависят не только от характера травмы, но и от пре-морбидных особенностей нервной системы ребенка, которые тесно связаны с течением пренатального и перинатального периодов развития. При черепно-мозговой травме, развившейся у детей, перенесших внутриутробную гипоксию, асфиксию в родах, внутричерепную родовую травму, отдаленные последствия наблюдаются гораздо чаще.
Лечение. При легкой черепно-мозговой травме, то есть если не было потери сознания и в результате тщательного обследования исключены серьезные внутричерепные повреждения, назначается постельный режим на 7—10 дней. Дети, особенно грудного возраста, могут находиться дома под наблюдением родителей и врача.
Из медикаментозных препаратов назначают легкие дегидратирующие (диакарб, микстура с цитралыо) и седативные (бромиды, валериана) средства, витамины.
Дети, у которых была потеря сознания даже на короткое время, а также дети с неврологическими нарушениями, переломом костей черепа должны быть обязательно госпитализированы. В стационаре им следует проводить активную дегидратирующую (лазикс, диакарб, магния сульфат, маннитол) и десенсибилизирующую (димедрол, супрастин, тавегил, пипольфен) терапию, вводить средства, укрепляющие сосудистую стенку (кальция хлорид, кальция глюконат, аскорутин, викасол, плазму). При субарахноидальных кровоизлияниях назначают также гемостатическую и антибактериальную терапию.
332
При наличии у больного стволовых нарушений, судорог проводят интенсивную терапию, направленную на коррекцию дыхательных и гемодинамических расстройств, борьбу с отеком мозга, купирование судорожного синдрома. Интенсивное лечение отека мозга способствует уменьшению ишемии и гипоксии, что является решающим в предупреждении тяжелых посттравматических осложнений.
При внутричерепной гематоме показано срочное хирургическое вмешательство с целью опорожнения гематомы и декомпрессии мозга. При открытых черепно-мозговых травмах необходимо хирургическое лечение, желательно в первые 6—12 ч после травмы.
Наличие у ребенка вдавленного перелома черепа диаметром более 0,5 см служит показанием к операции. У неоперированных детей, получивших травму в возрасте до 3 лет, нередко на месте вдавленного перелома спустя 3—6 мес, иногда 1—1,5 года, образуется обширный, неправильной формы костный дефект с выстоя-щими склерозированными краями.
При наличии отдаленных последствий черепно-мозговой травмы применяют симптоматическую терапию: препараты, стимулирующие обменные процессы в нервной ткани, витамины, противосудорожные, дегидратирующие средства, массаж, лечебную гимнастику.
Глава XI. НАРУШЕНИЯ МОЗГОВОГО
КРОВООБРАЩЕНИЯ
Нарушения мозгового кровообращения — недостаточность кровоснабжения мозга вследствие поражения сосудов мозга или крупных магистральных сосудов, а также в результате патологических изменений состава крови. Среди детей они встречаются значительно реже, чем среди взрослых, что обусловлено более благоприятными условиями кровоснабжения мозга в детском возрасте, эластичностью мозговых сосудов, свободным оттоком крови из полости черепа. Сосудистая патология мозга у детей составляет 4—5% среди заболеваний нервной системы. По данным J. Kurtzke (1969), у 10% детей, умерших в неврологических стационарах, обнаруживают острое нарушение мозгового кровообращения.
Характер поражения мозговых сосудов может быть различным. Нарушения кровообращения вызываются закупоркой сосудов тромбами или эмболами, разрывом сосудов или повышением их проницаемости. Указанные формы поражения редко выступают в изолированном виде. Так, сужение просвета сосудов сопровождается повышением проницаемости сосудистой стенки. Образование пристеночных тромбов в большинстве случаев приводит к снижению концентрации факторов свертывания крови и множественным петехиальным кровоизлияниям.
Наиболее частыми формами нарушения мозгового кровообращения у детей раннего возраста являются субарахноидальное кровоизлияние и множественные диапедезные кровоизлияния в вещество мозга. У детей первых трех лет жизни на их долю приходится около 80% всех случаев расстройств мозгового кровообращения (A. Decaban, 1970). Тромбозы и эмболии встречаются редко и составляют 8,7% среди сосудистых поражений мозга, причем в 80% случаев они обусловлены врожденными пороками сердца и крупных сосудов.
При всех формах нарушения мозгового кровообращения основным механизмом поражения мозга является гипоксия. Ежеминутно в головной мозг поступает около 15% крови, выбрасываемой сердцем за этот период. Через 5—7 мин с момента возникновения аноксии наступают необратимые изменения в нервных клетках и они погибают. Даже минимальное расстройство кровоснабжения приводит к нарушению обменных процессов в нервной системе. Нарастание гипоксии сопровождается развитием ацидоза. Повышается проницаемость сосудистых стенок. Жидкость выходит в периваскулярное пространство. Развивается отек мозга. Возникший венозный застой и нарушение функции сосудодвигательного центра с развитием ангиоспазма и ангиопареза усугубляет имею-334
щуюся гипоксию. Нарушение регуляции сердечной деятельности и дыхания в свою очередь отражается на мозговом кровообращении. Гипоксия вызывает также изменения активности гипофизарно-адреналовой системы, обусловливающие дальнейшее нарушение регуляции сосудистого тонуса.
По данным клиники нервных болезней 2-го МОЛГМИ им. Н. И. Пирогова, у новорожденных и грудных детей наиболее частыми причинами нарушения мозгового кровообращения являются внутриутробная гипоксия и асфиксия в родах, внутричерепная родовая травма, врожденные пороки сердца, пороки развития артерио-венозной и ликворной системы мозга, септические состояния. На втором и третьем году жизни сосудистые расстройства возникают обычно вследствие инфекционно-аллергических процессов, геморрагических диатезов, гриппа, врожденных пороков сердца, патологии магистральных сосудов и черепно-мозговых травм. Острые нарушения мозгового кровообращения у маленьких детей, так же как и в старшем возрасте, проявляются кровоизлияниями, тромбозами, эмболиями и преходящими расстройствами.
Сосудистые аномалии нервной системы — одна из наиболее частых причин острых нарушений мозгового кровообращения у детей младшего возраста.
Врожденные аномалии сосудов головного мозга
Врожденные пороки сосудов формируются вследствие нарушения развития сосудистой системы и могут быть в виде аневризм или аномалий строения капилляров между артериальной и венозной системой.
Артериальные и артерио-венозные аневризмы — это дефект стенки сосуда в месте бифуркации артерий или вен. Нарушение строения сосудистой стенки сопровождается ее мешотчатым расширением (аневризма).
У детей раннего возраста наиболее частой аномалией является дефект развития вены Галена. Порок представляет собой прямой анастомоз между задней мозговой или верхней мозжечковой артерией и веной Галена. Аневризматическое расширение сдавливает сильвиев водопровод, III желудочек, пластинку четверохолмия. В результате артерио-венозного шунтирования и переполнения венозной системы у ребенка с рождения развивается сердечная недостаточность. Сдавление III желудочка и сильвиева водопровода приводит к формированию гидроцефалии. На первом году жизни она проявляется быстрым нарастанием окружности черепа без клинических признаков повышения внутричерепного давления. Заподозрить возможность аневризмы помогает наличие других сосудистых аномалий на лице, черепе, туловище, конечностях, а также изменения со стороны сердца. На 2—3-м году Жизни ребенка основным в клинике заболевания является синдром повышения внутричерепного давления. Дети малоактивны,
335
плохо спят, страдают головной болью, рвотой. В области лба, висков — расширение поверхностных вен, их извитость. При больших размерах аневризмы наблюдается односторонний, реже двусторонний, различной степени выраженности «пульсирующий экзофтальм». Артерио-венозное шунтирование сопровождается шумом в голове, который нередко отмечается ребенком и может быть прослушан врачом. Шум бывает локальным или диффузным, интенсивность его изменяется синхронно с пульсом. Очаговая неврологическая симптоматика проявляется птозом, косоглазием, вялой реакцией зрачков на свет, снижением зрения. Эти симптомы возникают в результате сдавления аневризмой черепномозговых нервов, часто бывают «мерцающими». На глазном дне — выраженные застойные явления, отек соска зрительного нерва, возможны аномалии развития сосудов глазного дна.
Наличие артерио-венозного шунта подтверждается повышением парциального давления кислорода в яремной вене. Это простой и демонстративный тест для диагноза аномалии вены Галена. Диагноз уточняется с помощью пневмоэнцефалографии, которая позволяет выявить наличие масс, проецирующихся кпереди от III желудочка. Ангиография устанавливает характер и размер аневризмы.
Артерио-венозные аневризмы, локализующиеся на поверхности гемисфер, в бассейнах передней и средней мозговых артерий, у детей раннего возраста могут быть «немыми». Однако в некоторых случаях отмечаются периодические мигренозные головные боли, очаговые неврологические симптомы. Основные из них — фокальные моторные и сенсорные припадки. Они могут быть единственным симптомом в течение многих лет, не сопровождаются изменениями биоэлектрической активности мозга в межприступный период.
Артериальные аневризмы у детей раннего возраста обычно клинически не проявляются. В редких случаях отмечаются головная боль, нарушения сна. Головная боль усиливается после физического или эмоционального напряжения. В неврологическом статусе возможно изолированное преходящее одностороннее поражение черепномозговых нервов, чаще глазодвигательных. Диагноз артериальной или артерио-венозной аневризмы уточняется с помощью ангиографии.
Разрыв аневризмы наступает внезапно или может быть спровоцирован физическим напряжением, травмой. О возможности разрыва аневризмы всегда следует подумать, когда тяжелое состояние — потеря сознания, судороги — развивается у ребенка после легкой травмы головы. Разрыв артериальной и артерио-венозной аневризмы характеризуется клиникой внутричерепного кровоизлияния. Наиболее часто наблюдаются субарахноидальные кровоизлияния.
У детей раннего возраста наблюдаются и другие типы пороков развития сосудов головного мозга: телеангиэктазии, кавернозные 336
гемангиомы. Они могут быть изолированными, но чаще являются одним из проявлений генетически детерминированных заболеваний, таких, как энцефалотригеминальный ангиоматоз (болезнь Штурге — Вебера), цереброретинальный ангиоматоз Гиппеля-Лин-дау, сосудисто-костная дизэмбриоплазия и др.
Внутричерепные кровоизлияния
У детей раннего возраста внутричерепные кровоизлияния составляют 56—60% острых расстройств мозгового кровообращения. Субарахноидальные кровоизлияния наиболее часты, на них приходится от 28 до 30% всех случаев острых нарушений мозгового кровообращения. Внутримозговые кровоизлияния составляют 8— 12%.
Причинами внутричерепных кровоизлияний у детей раннего возраста являются разрывы аневризм, черепно-мозговые травмы, болезни крови (лейкозы, анемии, тромбоцитопении и другие нарушения системы свертывания), геморрагические васкулиты, опухоли мозга. Разрыв аневризмы в большинстве случаев сопровождается субарахноидальным кровоизлиянием, в то время как для болезней крови, асфиксии новорожденных более характерны паренхиматозные мелкоточечные, париваскулярные кровоизлияния. Массивные кровоизлияния в вещество мозга и внутрижелудочковые кровоизлияния обычно бывают следствием разрыва аневризмы или тяжелой черепно-мозговой травмы и, кац правило, не совместимы с жизнью.
Клинические проявления кровоизлияний у новорожденных описаны в главе «Внутричерепная родовая травма».
Субарахноидальные кровоизлияния у детей более старшего возраста характеризуются внезапной резкой головной болью, рвотой, нарушением или потерей сознания, судорогами. Наиболее глубокая и длительная потеря сознания бывает у детей до 1 года. В неврологическом статусе основными являются симптомы раздражения мозговых оболочек и повышения внутричерепного давления. У детей первого года жизни особенно выражены беспокойство, общая гиперестезия. Перемена положения ребенка (пеленание, одевание) сопровождается отрицательной эмоциональной реакцией. Большой родничок выбухает, резко болезненна перкуссия головы; положительный симптом Грефе, умеренно выражены ригидность мышц затылка и симптом подвешивания. На 2—3-м году жизни, как правило, бывает выражен менингеальный синдром: головная боль, рвота, ригидность мышц затылка, симптомы Кернига, Бруд-зинского, общая гиперестезия и др. Оболочечные симптомы обычно развиваются к концу первого дня, достигают максимума на 3—4-е сутки и исчезают через 2—3 нед. Если количество крови, излившейся в субарахноидальное пространство, незначительно, как это бывает при подтекании артерио-венозной аневризмы, менингеальные симптомы могут отсутствовать.
12 из
337
Субарахноидальные кровоизлияния обычно сопровождаются повышением температуры в первые дни болезни до 38—39° С.
На глазном дне обнаруживают отек соска зрительного нерва.
Диагноз субарахноидального кровоизлияния подтверждается данными исследования спинномозговой жидкости, в которой в 1-е сутки определяется примесь свежей крови, а на 3—5-й день — ксантрохромия и измененные эритроциты. Количество белка в ликворе умеренно увеличено, плеоцитоз — 100—300 клеток в 1 мкл. В первые дни цитоз носит смешанный характер, в дальнейшем преобладают лимфоциты. В крови — лейкоцитоз до 10 000— 12 000, сдвиг лейкоцитарной формулы влево, повышение СОЭ. Течение и прогноз субарахноидальных кровоизлияний во многом зависят от источника кровоизлияния и возраста ребенка. При разрыве артериальных аневризм течение болезни неблагоприятное, часто с летальным исходом. При разрыве артерио-венозных аневризм субарахноидальные кровоизлияния протекают менее тяжело, но при них возможны повторные кровоизлияния. Менее острое начало с постепенным нарастанием общемозговых и менингеальных симптомов характеризует кровоизлияние при ангиомах. Очень тяжело протекают кровоизлияния при септико-токсических процессах у детей первого года жизни.
При паренхиматозных кровоизлияниях тяжесть клинического состояния зависит от локализации и распространенности патологического процесса. Состояние ребенка тяжелое, потеря сознания, судороги, повторные рвоты. У грудных детей наблюдаются выбухание большого родничка, положительный сиптом Грефе. Очаговые симптомы соответствуют зоне нарушенного кровоснабжения пли являются дислокационными вследствие отека, смещения вещества мозга и сдавления мозгового ствола. У детей раннего возраста в коматозном состоянии трудно выявить локальные неврологические симптомы. Синдром компрессии мозга проявляется падением артериального давления, нарушением ритма и глубины дыхания. Отмечаются плавающие движения глазных яблок, расходящееся косоглазие, грубый нистагм. Раздражение вегетативных центров ствола головного мозга сопровождается гиперсаливацией и гиперсекрецией слизистых дыхательных путей. Тяжелая мышечная гипотония является следствием угнетения ретикулярной формации. Тонические судороги могут быть обусловлены либо кровоизлиянием в ствол, либо его отеком и смещением. Паренхиматозные кровоизлияния часто сопровождаются менингеальными симптомами и внутричерепной гипертензией вследствие прорыва крови в субарахноидальное пространство.
Внутрижелудочковые кровоизлияния протекают крайне тяжело, с глубокими, несовместимыми с жизнью нарушениями терморегуляции, дыхания, сердечной деятельности, гормеотоническими судорогами.
338
Тромбоз мозговых вен и синусов
Тромбоз мозговых вен и синусов у детей раннего возраста развивается как осложнение различных заболеваний: гнойных процессов в области лица, внутреннего уха, остеомиелита костей черепа или септикопиемии. Изменение стенки сосудов вследствие токсико-инфекционного или инфекционно-аллергического процесса предрасполагает к развитию тромбоза. При этом тромбы бывают множественными, могут инфицироваться в результате контактной или гематогенной диссемипации микроорганизмов. На образование тромбов расходуются факторы свертывания крови и тромбоциты (коагулопатия потребления). Их недостаточный уровень в крови может служить причиной множественных кровоизлияний, сопровождающих тромбозы при септических состояниях. Этот феномен носит название рассеянной внутрисосудистой коагуляции.
Тромбозы мозговых вен и синусов развиваются при врожденных пороках сердца «синего типа» и таких болезнях крови, как полицитемия, тромбоцитоз, серповидно-клеточная анемия. Благоприятные условия для образования тромбов создают опухоли, расположенные на основании черепа, костные выросты (краниомета-физарные дисплазии), которые могут сдавливать сосуды и замедлять кровоток. Тромбы вен и синусов у детей раннего возраста чаще бывают пристеночными. В свежих случаях тромботическая масса имеет серо-красный цвет, в более старых — серо-желтый или зеленовато-коричневый и даже белый. В них содержится гной. Стенки вен и синусов инфильтрированы, некротически размягчены. Реже тромбы образуются при неизмененной сосудистой стенке, это бывает при недостаточности сердечной деятельности, болезнях крови.
У детей раннего возраста чаще всего наблюдается тромбоз поверхностных вен. Тромбоз внутренних вен мозга бывает редко и обычно быстро приводит к летальному исходу.
Поверхностные вены мозга имеют обширные анастомозы, поэтому постепенная закупорка даже нескольких вен может быть хорошо компенсирована у ребенка и не сопровождается неврологическими нарушениями. При закупорке крупных вен, снабжающих большие участки, постепенно нарастают неврологические симптомы вследствие ишемии мозга и дисциркуляторных расстройств. На фоне основного заболевания повышается температура, появляются головная боль, негативная реакция на окружающее. Ребенок становится вялым, отказывается от пищи. Появляется рвота, нарастает гипертензионно-гидроцефальный синдром. У детей первого года жизни увеличивается окружность черепа, выбухает большой родничок. У более старших детей выражены подкожные вены в области лба и волосистой части головы. Характерны судороги, которые чаще носят локальный характер. Состояние, как правило, продолжает ухудшаться, развивается отек мозга.
12*
339
Однако возможно и ремиттирующее течение, «мерцание» неврологических симптомов.
Тромбоз вен мозга может сочетаться с тромбозом венозных синусов. Наиболее тяжело протекает тромбоз верхнего сагиттального синуса. Полная его окклюзия проявляется генерализованными тоническими судорогами или ритмическими подергиваниями мышц лица и рук. Голова резко запрокинута назад, мышечный тонус повышен в экстензорах конечностей и длинных мышцах спины. Наблюдаются повторная рвота, выбухание большого родничка. Быстро развиваются потеря сознания и глубокая кома, приводящая к летальному исходу. Иногда тромбоз развивается медленно. В этом случае постепенно нарастает отек в области лба и век; расширенные и извитые подкожные вены имеют характерный вид «головы медузы». Возможны также обильные носовые кровотечения, рвота, судороги. Двигательное возбуждение сменяется заторможенностью, снижается реакция на окружающее, наступает потеря сознания.
Для тромбоза кавернозного синуса характерны экзофтальм на стороне патологического процесса, отек конъюнктивы, век, глазодвигательные нарушения, расстройство зрения. При тромбозе поперечного синуса преобладают симптомы повышения внутричерепного давления, которые могут сочетаться с болезненностью при глотании и иррадиацией болей в область сосцевидного отростка, иногда возникает отечность в заушной области.
Тромбозы вен и синусов сопровождаются менингеальными симптомами и выраженными признаками интенсификации.
При токсико-септических состояниях окклюзия мозговых вен и синусов может протекать с множественными тромбозами сосудов кожи и внутренних органов. Возможно сочетание тромбоза верхнего сагиттального синуса с тромбозом верхней полой вены; в таких случаях развивается застойная декомпенсация сердца.
Течение тромбозов зависит от характера основного патологического процесса, локализации и степени окклюзии. Во многих случаях возможны компенсация нарушенного кровотока за счет коллатерального кровоснабжения и восстановление нормального гомеостаза.
Быстрый и обширный тромбоз крупных вен и синусов сопровождается ксантохромией и высокими цифрами давления спинномозговой жидкости (400 и более мм водн. ст.). В крови обычно определяется уменьшение концентрации II, V факторов свертывания вследствие их расхода на тромбообразование, затем появляются продукты расщепления фибрина.
На рентгенограммах черепа — признаки повышения внутричерепного давления. При тромбозах, не связанных с рассеянной внутрисосудистой коагуляцией, для уточнения диагноза проводят флебографию: тромбированные вены не заполняются контрастным веществом.
340
Тромбоз вен мозга и синусов дифференцируют с другими фор-мами расстройств кровообращения, менингитами, опухолями, врожденной гидроцефалией, абсцессами мозга.
Артериальные тромбозы
Окклюзия мозговых артерий у детей раннего возраста является следствием заболеваний, поражающих артериальную систему. Это частое осложнение коллагенозов (красной волчанки, узелкового периартериита), церебральных артериитов при острых инфекционных заболеваниях, врожденном сифилисе. Артериальный тромбоз может быть причиной смерти при прогерии, синдроме Марфана, врожденных расслаивающихся аневризмах артерий.
Клиника артериального тромбоза варьирует в зависимости от сосудистого бассейна, быстроты развития процесса, компенсаторных возможностей коллатерального кровотока и эффективности механизмов поддержания артериального давления. У детей раннего возраста наиболее часто тромбируется внутренняя сонная или передняя мозговая артерии. Развивается очаговая симптоматика, чаще всего гемиплегия на контралатеральной тромбозу стороне. В связи с этим в литературе артериальный тромбоз у детей известен как «идиопатическая» или «спонтанная» гемиплегия. Общее состояние может не нарушаться, но иногда бывают: головная боль, судороги, реже — потеря сознания и кома. Для тромбоза внутренней сонной артерии характерны «перемежающаяся» гемиплегия, а также снижение или отсутствие пульсации выше уровня тромбоза.
На реоэнцефалограммах при артериальных тромбозах определяется межполушарная сосудистая асимметрия. Ликвор нормальный или отмечается незначительный плеоцитоз нейтрофильного характера. На электроэнцефалограмме иногда можно обнаружить очаг медленной активности над пораженной областью. При закупорке крупной артерии временами фиксируются снижение амплитуды фоновой активности, единичные патологические волны.
С помощью ангиографии в ранние периоды заболевания выявляется полная закупорка артерий, а в более поздний период — обильная сеть коллатералей.
При артериальном тромбозе определенную диагностическую Ценность представляет термограмма области головы: «холодная область» указывает на плохую перфузию вследствие окклюзии внутренней сонной артерии. В острый период артериального тромбоза рентгенологические признаки могут отсутствовать. Спустя некоторое время обнаруживаются расширение лобных и основных пазух, асимметрия височных костей.
Дифференциальный диагноз артериальных тромбозов проводят с другими видами расстройства мозгового кровообращения, прежде всего с кровоизлиянием в опухоль и разрывом аневризмы.
341
Эмболии сосудов мозга
Эмболии сосудов мозга у детей наблюдаются редко. Мозговая артерия может закупориваться фрагментом организованного тромба, бактериями, паразитами, воздухом, жиром, опухолевыми частицами илп инородными телами. Наиболее часто эмболы располагаются в маленьких сосудах у основания разветвлений. Из крупных сосудов чаще других страдает средняя мозговая артерия, хотя сосудистая катастрофа может произойти в любой другой артерии. Скорость закупорки настолько стремительна, что компенсаторная коллатеральная циркуляция не успевает развиться, в результате чего образуется церебральный инфаркт.
Основными причинами церебральной эмболии у детей раннего возраста являются септические процессы, врожденный порок сердца с цианозом («синий» порок) и бородавчатый эндокардит, при которых происходит закупорка эмболом крупной артерии мозга. У новорожденных описана церебральная эмболия вследствие отрыва некротизированных тканей плаценты во время родов.
Жировая эмболия, возникающая у детей, обычно связана с переломом трубчатых костей. Жировые частицы приносятся к капиллярам легких п продвигаются к легочной вене, откуда они могут проникнуть в мозг через левое предсердие.
При операциях на сухом сердце в условиях гипотермии могут быть нарушения мозгового кровообращения различного характера, в том числе и воздушная эмболия (Л. О. Бадалян, 1975).
Септическая эмболия обычно связана с воспалительными процессами в легких (абсцесс легких, пневмония). В редких случаях наблюдается паразитарная и опухолевая эмболия.
Церебральная эмболия характеризуется острым появлением судорог и нарушением сознания различной степени. Клиническая картина достигает максимального развития в течение нескольких секунд. Опа может развиться в любое время суток, независимо от физической активности. Очаговая неврологическая симптоматика зависит от пораженной артерии. Эмболы у детей, как и у взрослых, локализуются чаще всего в бассейне средней мозговой артерии, поэтому могут возникнуть гемиплегия, афазия, если ребенок до этого уже говорил. Преходящая слепота — самое характерное проявление воздушной эмболии.
Жировая эмболия обычно наступает через 12—24 ч после травмы длинных трубчатых костей. У ребенка повышается температура, нарушаются ритм и глубина дыхания, появляются кровавая мокрота, цианоз. Спустя несколько часов выявляются неврологические нарушения в виде головной боли, рвоты или бреда, комы, шока. Очаговые симптомы зависят от локализации эмбола.
Септическая эмболия сосудов мозга сопровождается значительным подъемом температуры и симптомами интоксикации. Нередко она бывает множественной.
342
Диагноз эмболии мозговых сосудов подтверждается ангиографией. На церебральной ангиограмме эмболы обнаруживаются чаще во внутренней сонной, передней или средней мозговых артериях. При ангиографии закупоренная артерия нормального размера вплоть до окклюзии, где контрастное вещество подчеркивает дефект наполнения.
Жировую эмболию можно заподозрить при обнаружении капелек жира в ретинальных сосудах и моче.
Венозное полнокровие мозга
Это преходящее нарушение мозгового кровообращения, развивающееся у детей раннего возраста при сильных приступах кашля, например при коклюше, а также резком натуживании при запорах. Лицо становится отечным, сосуды глаз инъецированы, вены головы и шеи набухшие, появляется головная боль, иногда эпилептиформные припадки. Прогноз при нарушениях такого рода обычно благоприятный.
Застойное венозное полнокровие в сосудах мозга при «синих пороках» сердца приводит к нарушению эндотелия капилляров, мелкоточечным кровоизлияниям в вещество мозга, дистрофическим изменениям в нервных клетках. Дети часто жалуются на головную боль, малоактивны, отмечаются снижение памяти и нарушение концентрации внимания. В неврологическом статусе выявляется рассеянная очаговая микросимптоматика, связанная с хронической недостаточностью мозгового кровообращения. При резком повышении венозного давления возможны судороги, потеря сознания. Применение хирургического лечения детям с врожденными пороками сердца значительно уменьшило число неврологических осложнений.
Лечение нарушений мозгового кровообращения у де гей строится с учетом характера основного патологического процесса. В острый период проводят терапию, направленную на борьбу с отеком мозга и внутричерепной гипертензией, стабилизацию жизненно важных функций: дыхания, кровообращения, кислотно-щелочного равновесия и баланса электролитов, купирование судорожного синдрома.
При кровоизлияниях следует также назначать гемостатические средства: викасол, рутин, аскорбиновую кислоту, кальция хлорид и кальция глюконат, эпсилон-ампнокапроновую кислоту.
При тромбозах синусов и вен проводят противовоспалительную терапию.
Внутричерепные аневризмы, тромбозы крупных сосудов и синусов подлежат хирургическому лечению.
В восстановительный период корригирующая терапия направлена на компенсацию двигательных, речевых и психических нарушений.
Глава XII. НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ НЕРВНОЙ СИСТЕМЫ, ОБУСЛОВЛЕННЫЕ НАРУШЕНИЯМИ ОБМЕНА
Наследственные болезни нервной системы обусловлены генными мутациями, приводящими к нарушению структурных белков или ферментов, непосредственно или опосредованно связанных с функционированием нервной системы. Основными патогенетическими механизмами поражения нервной системы при наследственных заболеваниях являются: токсическое действие на ткань мозга избыточного количества субстрата, не метаболизирующегося в организме вследствие недостатка фермента; токсическое действие продуктов побочных биохимических реакций; отсутствие конечных продуктов реакции вследствие блока на определенной ступени метаболизма и др. Конечным проявлением нарушенного обмена веществ является дегенеративный процесс в нервной системе.
В настоящее время при многих наследственных заболеваниях установлен специфический биохимический дефект, обусловливающий возникновение и развитие патологического процесса. В связи с этим более целесообразно построение классификации наследственных болезней по биохимическому принципу, поскольку это позволяет целенаправленно разрабатывать методы доклинической диагностики наследственных заболеваний и проводить их теоретически обоснованную коррекцию. Однако до настоящего времени существует классификация, основанная на принципе преимущественного поражения той или иной системы. Такая рубрикация используется для форм патологии, при которых неизвестен первичный биохимический дефект.
Значительная часть наследственных заболеваний нервной системы проявляется в раннем детском возрасте. Анатомо-физиологические особенности, функциональная незрелость нервной системы и лабильность ферментативной активности обусловливают характер неврологической симптоматики на 1-м году жизни. Для наследственных заболеваний нервной системы в раннем детском возрасте характерны нарушение поведения в виде заторможенности или возбуждения, снижение показателей роста и массы, полиморфный судорожный синдром, мышечная дистония, отставание ребенка в психомоторном развитии. Таким образом, в начальных стадиях клинические проявления неспецифичны. Они могут наблюдаться при поражениях нервной системы в результате внутриутробной гипоксии, асфиксии в родах, внутричерепной родовой травмы и других заболеваниях.
Наследственные заболевания характеризуются истинным неуклонно прогредиентным течением.
344
Патоморфологические нарушения в нервной системе представлены симметричными деструктивными, дистрофическими изменениями. В ряде случаев они являются строго специфичными. При многих формах отмечаются сочетанные поражения нервной системы, глаз, внутренних органов, кожи, опорно-двигательного аппарата.
Диагностика наследственных болезней нервной системы основывается па клинико-генеалогическом исследовании, причем оно должно включать также анализ биохимических, электрофизиологических данных, а в ряде случаев и изучение биопсировапного материала.
Наиболее эффективной в отношении профилактики и лечения наследственных болезней обмена веществ является интранаталь-ная диагностика, которая основывается на биохимическом и гистохимическом исследовании амниотической жидкости и амниотических клеток. Однако амниоцентез только начинает внедряться в клиническую практику, а пока наиболее оптимальным периодом для профилактики неврологических нарушений при наследственных заболеваниях нервной системы является ранний, особенно первые 2 мес. С целью диагностики в этом возрасте используется двухэтапная система клинического и биохимического скринирова-ния.
Успехи молекулярной биохимии являются основой патогенетической терапии, эффективность которой зависит от сроков начала коррекции и степени тяжести биохимического дефекта. Профилактика наследственных заболеваний строится на основе медико-генетического консультирования, определения характера наследования заболевания, степени его тяжести. Важное значение имеет выявление гетерозиготных носителей патологического гена.
Из многочисленных генетически детерминированных нарушений обмена веществ с поражением нервной системы в настоящей главе описаны наиболее характерные для раннего детского возраста. Заболевания распределены на несколько групп:
наследственные нарушения обмена аминокислот;
наследственные нарушения обмена липидов;
мукополисахаридозы;
муколипидозы;
наследственные нарушения обмена углеводов;
наследственные нарушения обмена микроэлементов.
Наследственные нарушения обмена аминокислот
Наследственные нарушения обмена аминокислот представляют собой наиболее изученную группу генетически детерминированных энзимопатий. Они обусловлены рецессивными мутациями генов, локализованных в аутосомах. При большинстве заболеваний известны молекулярные механизмы, приводящие к формированию патологии.
345
В основе патогенеза заболеваний этой группы лежит избирательное снижение активности фермента, участвующего в метаболизме той или иной аминокислоты. В результате энзиматического дефекта аминокислоты не утилизируются в организме, а в тканях и биологических жидкостях накапливаются недоокисленные продукты нарушенного метаболизма, обладающие токсическим действием на ткани и органы, в первую очередь на нервную систему.
Большинство нарушений обмена аминокислот проявляется в первые недели и месяцы жизни диспептическим синдромом, неврологическими симптомами и изменениями кожи.
Совершенствование методов диагностики позволило установить частоту этой группы заболеваний и определить их значение и удельный вес в структуре патологии раннего возраста (Л. О. Бадалян и др., 1971; Ю. И. Барашнев, Ю. Е. Вельтищев, 1978; J. Stanbury, 1972; R. Sparkes, S. Wright, 1974). Частота наследственных нарушений обмена аминокислот колеблется от 1 : 10 000 до 1 : 100 000 новорожденных. Частота гетерозиготных носителей патологического гена составляет в общей популяции 1 : 100 — 1 : 400.
В настоящее время апробирована и внедряется в практику лечебных учреждений этапная биохимическая система диагностики наследственных нарушений обмена аминокислот. Первый этап обследования с помощью качественных проб и полуколичественных методов ставит своей целью выявление группы детей с повышенным содержанием аминокислот в крови и увеличенной экскрецией их с мочой (тотальный скрининг). Эти дети подлежат динамическому наблюдению. Им проводят количественное биохимическое исследование крови и мочи (второй этап), целью которого является идентификация патологии.
Усилия, направленные на раннюю диагностику, оправданы возможностью патогенетической терапии, основным принципом которой является «разгрузка» дефектной ферментной системы посредством исключения из рациона аминокислоты, не метаболизирующейся в организме.
В профилактике заболеваний, обусловленных нарушением обмена аминокислот, большое значение имеют медико-генетическое консультирование, выявление гетерозиготных носителей патологического гена и антенатальная диагностика. Гетерозиготные носители определяются с помощью нагрузочных тестов, выявляющих слабость той или иной ферментной системы. При гетерозиготности мутантного гена активность детерминируемого им фермента, хотя и обеспечивает нормальную жизнедеятельность организма, но ниже, чем у гомозигот по нормальному гену.
Фенилппровиноградная олигофрения (ФПО). Наследственное заболевание, обусловленное нарушением обмена фенилаланина, описано A. Folling в 1934 г. Встречается с частотой 1 : 10 000 новорожденных.
346
В основе патогенеза заболевания лежит дефект (отсутствие или инактивация) фермента фенплаланин-4-гидрокси-дазы в печени, катализирующего реакцию гидроксилирования фенилаланина в тирозин. Накопление в организме фенилаланина и его патологических производных приводит к вторичным нарушениям обмена веществ. Накопление в мозговой ткани кетокислот блокирует ферментный метаболизм мозга. Недостаточное усвоение фенилаланина приводит также к дефициту тирозина и нарушению синтеза меланина и катехоламинов.
Патоморфологическое исследование выявляет демиелиниза
Рис. 109. Ребенок с фенилпировиноградной олигофренией из восточной семьи. Доминантные гены темной окраски радужной оболочки глаз и
цию и глпозное перерождение центральной нервной системы.
Признаки заболевания появляются в период новорожденности или несколько позже.
волос маскируют один из характер ных симптомов заболевания — гипо
пигментацию
Характерен внешний вид больных: светлые волосы, голубые
глаза, отсутствие пигментации
кожи. Часто наблюдаются экссудативный диатез, дерматиты, экземы (рис. 109). От больных исходит специфический «затхлый мышиный» запах. Дети вялые, адинамичные или, наоборот, беспокойные, беспричинно кричат, тревожно спят, плохо сосут, часто
срыгивают.
Основной клинический симптом болезни — задержка психического развития, которая может быть выражена в различной степени. У некоторых детей на фоне снижения общего уровня психического развития отмечаются периоды улучшения: появляется улыбка, гуление, слежение за предметом. Спустя короткий промежуток времени эти функции снова угасают. Часто наблюдаются развернутые или малые судорожные припадки, которые появляются обычно во втором полугодии жизни. Двигательные нарушения на ранней стадии характеризуются снижением мышечного тонуса. В более старшем возрасте у некоторых больных отмечаются мышечная дистония и гипертония. Сухожильные рефлексы высокие с расширенными зонами, клонусы стоп. Затем могут присоединяться координаторные нарушения, гиперкинезы. Дети поздно начинают сидеть, ходить. Походка спастпко-атактическая.
347
Изменения со стороны черепномозговых нервов включают косоглазие, нистагм. Отмечается нарушение зрительно-моторной координации.
В плазме крови больных повышен уровень фенилаланина (до 0,15 г/л и выше) и кетокислот. Встречаются также менее тяжелые формы заболевания, обусловленные патогенетически иными нарушениями метаболизма фенилаланина.
Скринирующими тестами на ФПО являются проба Феллинга и тест с 2,4-дпнитрофенилгидразином. Следует отметить, что эти тесты могут быть положительными и при других нарушениях обмена аминокислот, а также при отсутствии клинических признаков заболевания. Более специфическим является тест Гатри.
Дифференциальный диагноз ФПО у детей раннего возраста проводят с другими нарушениями аминокислот, последствиями асфиксии, внутричерепной родовой травмы и инфекционных поражений центральной нервной системы. ФПО дифференцируется от транзиторной фенилкетонурии и нарушения обмена других аминокислот с помощью хроматографии.
Патогенетическое лечение основано на «разгрузке» дефектной ферментной системы. Назначается диета с ограничением фенилаланина, с добавлением углеводов, минеральных солей, витаминов. Широкое применение получили белковые гидролизаты, такие, как лофенолак, кетонил, гппофенат, цимогран, минафен, а также смеси альфа-аминокислот.
Из рациона должпы быть исключены продукты с большим содержанием белка: мясо, яйца, сыр, творог, орехи, бобы и др. Молоко и картофель даются в строго ограниченных количествах. В пищу следует включать продукты с малым содержанием фенилаланина — морковь, капусту, помидоры, салат, виноград, яблоки, апельсины, мед, варенье. Лечение проводится под контролем биохимических исследований и наиболее эффективно, если начато до появления клинических симптомов (Б. В. Лебедев, М. Г. Блюмина, 1972; В. Clayton, 1977). Диетический рацион считается правильным, если уровень фенилаланина в крови не превышает 0,02— 0,06 г/л.
Гетерозиготные носители патологического гена выявляются с помощью нагрузочных тестов с фенилаланином. Частота их в популяции составляет в среднем 1 : 50—1 : 70. Предпринимаются попытки антенатальной диагностики ФПО путем определения концентрации фенилаланина в амиотической жидкости (А. Эмери, 1977).
Гистидинемпя. Гистпдинемия описана A. Ghadimi и др. в 1961 г. Заболевание встречается с частотой 1 : 17 000 новорожденных.
В основе заболевания лежит врожденный дефект фермента гистидазы, который в норме превращает гистидин в уроканино-вую кислоту. Гистидин является незаменимой аминокислотой, которая обязательно должна входить в состав продуктов питания 348
Рис. 110. Ребенок 3 лет с гистидп-немией. Выражена общая мышечная гипотония
для детей раннего возраста. Минимальная суточная потребность в ней для детей раннего возраста составляет 16— 34 мг/кг (по данным L. Holt, 1967). Обычно эта потребность покрывается за счет молочного питания, так как в 100 мл молока содержится примерно 30 мг гистидина, а суточное потребление 30—1000 мг этой аминокислоты в норме полностью утилизируется гистидазой. Однако при отсутствии или дефиците фермента это количество гистидина оказывает токсическое воздействие, поскольку в тканях накапливается имидазолпировиноградная, имидазолмолочная и имидазолуксусная кислоты, которые оказывают токсическое действие на центральную нервную систему. В крови повышается содержание гистидина.
Патология проявляется на 1-м году жизни. Так же, как
при ФПО, дети светловолосые, голубоглазые. Тяжесть клинических проявлений вариабельна. При полном отсутствии фермента в первые 3—4 мес жизни симптоматика характеризуется полиморфным судорожным синдромом, ребенок отстает в психическом развитии, преобладает отрицательный эмоциональный комплекс. Отмечается задержка становления двигательных функций; характерна мышечная гипотония различной степени выраженности (рис. 110). Постепенно нарастает клиника отека мозга, что приводит в недиагпостированпых случаях к летальному исходу.
При частичной инактивации фермента в первые месяцы жизни дети развиваются нормально, но в некоторых случаях наблюдается задержка становления статических и двигательных функций. Характерными симптомами являются задержка формирования речевых навыков, снижение слуха, легкая возбудимость, агрессивность, боязнь новых ситуаций. В крови больных повышено содержание гистидина до 0,1—0,15 г/л и выше.
Скрпнирующими тестами на гистидинемию и гпстпдппурпю являются проба Феллинга, которая бывает положительной лишь при полной инактивации гистидазы, а также полуколичественный хроматографический анализ и микробиологический тест Гатри. Последние два теста служат также и для дифференциального
349
диагноза. В легких случаях необходимо провоить нагрузку гистидином с целью выявления снижения активности фермента.
Дифференциальный диагноз проводят прежде всего с фенилпировиноградной олигофренией и другими нарушениями обмена аминокислот.
Патогенетическое лечение состоит в «разгрузке» дефектной ферментной системы. Рацион составляется из расчета минимальной потребности гистидина на 1 кг массы тела ребенка (в пределах 16—34 мг).
Лечение проводится под контролем содержания гистидина в крови — его максимальный уровень на фоне терапии не должен превышать 0,04—0,05 г/л. Необходимо достичь исчезновения из мочи недоокпсленных продуктов гистидина (производных имидазолового ряда). Для вскармливания детей с гистидинемией может быть рекомендовано грудное молоко в сочетании со специально адаптированными смесями «хМалютка» и «Малыш». В дополнение к молочному питанию в рацион следует включать фруктовые соки, пюре, безбелковый хлеб, кисели, говяжьи почки, треску, кукурузную муку, лук, картофель, растительное масло. Следует подчеркнуть, что продукты животного происхождения включаются в рацион строго под контролем содержания гистидина в крови.
После года в организме активно начинает синтезироваться гистидин, что необходимо учитывать при диетической коррекции. Успешность лечения обусловлена характером биохимического нарушения и во многом — степенью неврологических отклонений к моменту начала лечения.
Профилактика заболевания основана на выявлении гетерозиготных носителей патологического гена с помощью нагрузочных тестов и на ранней биохимической диагностике патологии, то есть выявлении биохимического дефекта до возникновения клинических симптомов. Последнее осуществляется с помощью программы тотальных скринирующих исследований.
Лейциноз (болезнь Менкеса, болезнь с запахом мочи кленового сиропа). Заболевание описано J. Menkes и др. в 1954 г., частота его в популяции составляет 1:340 000 (В. Е. Clayton, 1977).
В основе патогенеза болезни с запахом мочи кленового сиропа лежит энзиматический блок в процессе декарбоксилирования аминокислот с разветвленной цепью — лейцина, изолейцина, валина.
При отсутствии декарбоксилирования эти аминокислоты подвергаются дезаминированию, превращаясь в альфа-кетокислоты — кетоизокапроновую, кетоизовалериаповую. Повышение концентрации последних ведет к гипогликемии, нарушению синтеза цереброзидов. Накапливающиеся кетокислоты оказывают токсическое действие на ткани мозга, печени, почек.
350
Патоморфологически определяются отек и набухание мозга, деструктивные процессы в клетках головного мозга и в проводящих системах.
Болезнь проявляется в первые дни жизни рвотой, резким беспокойством новорожденного, быстро присоединяются неврологические симптомы. Патология со стороны черепно-мозговых нервов вариабельна: вялая реакция зрачков на свет, расходящееся косоглазие, гиперсаливация, повышение нёбного и глоточного рефлексов, нистагм, девиация языка. При исследовании выявляется повышение тонуса преимущественно в экстензорных группах мышц, которое носит постоянный характер и быстро приводит к опистотонусу. Характерен судорожный синдром, имеющий тенденцию к полиморфизму и трансформации. Развивается клиника нейротоксикоза с приступами тяжелого цианоза, нарушением ритма дыхания и сердечной деятельности. Моча ребенка пахнет кленовым сиропом пли отваром овощей.
Если ребенок не погибает в первые недели жизни, в последующем формируется отставание в психическом и двигательном развитии, однако выраженность этих нарушений может варьировать.
В сыворотке крови и моче больных обнаруживают большое количество валина, лейцина, изолейцина и их производных — 3-кетокислот, 3-альфа-оксикислот. Эти метаболиты и придают моче специфический запах, давший название болезни. Реакция мочи с 2,4-динитрофенилгидразином резко положительна; положительна также проба Феллинга.
Дифференциальный диагноз проводят с фенилпировиноградной олигофренией и другими нарушениями обмена аминокислот с помощью хроматографии, с внутричерепной родовой травмой, инфекционными поражениями нервной системы, пороками развития мозга.
Патогенетическое лечение состоит в замене белковой пищи белковыми гидролизатами, лишенными лейцина, изолейцина и валина. Жиры вводятся в виде кукурузного масла, а углеводы — в виде декстранмальтозы. Необходимо также добавлять минеральные соли и витамины.
Метилмалоновая ацидурия. Заболевание описано A. Oberholzer и др. в 1967 г.
В основе патогенеза метилмалоновой ацидурии лежит блок реакции превращения метилмалонил-ко-А в сукцпнил-ко-А, осуществляемый в норме с помощью двух ферментов: метилмалонил-ко-А-рацемазы и мутазы. Вторая ступень идет при посредстве кофактора кобамида, являющегося производным цианокобаламина. Первичным дефектом при метилмалоновой ацидемии может быть снижение активности каждого из этих ферментов, а также недостаток кобамида (В. Б. Спиричев, Ю. И. Барашнев, 1977).
Первые симптомы патологии проявляются в период новорожденности в виде приступов рвоты, инверсии сна, негрубой гиперестезии, симптома Грефе, мелкоразмашистого нистагма и
351
других признаков внутричерепной гипертензии. Мышечная дистония со склонностью к гипотонии больше выражена в мышцах шеи, длинных мышцах спины. Угнетена активность безусловных рефлексов, особенно рефлексов орального автоматизма, кроме сосательного; снижена также реакция на свет (отсутствует оптический феномен Пейпера).
В тяжелых случаях дебютом заболевания является неукротимая рвота, которая приводит к тяжелому метаболическому нейротоксикозу: судорожный статус, грубые глазодвигательные нарушения, угнетение всех безусловных рефлексов, вялая реакция зрачков на свет, тяжелая мышечная гипотония, арефлексия; нередки менингеальный синдром, летаргия. Эпизоды недиагностиро-ванных метаболических кризов быстро приводят к задержке психического развития ребенка. Часто приступы сочетаются с гипогликемией и провоцируются инфекционным заболеванием или введением в рацион питания продуктов с высоким содержанием белков (сыр, рыба, TBopof и др.).
В возрасте 2—3 лет наряду с задержкой развития высших корковых функций иногда формируется хореоатетоидный гиперкинез. Нарушение мышечного тонуса проявляется дистоническими атаками.
Менее постоянными симптомами являются нейтропения, тромбоцитопения и рентгенологически выявляемый остеопороз.
С помощью биохимических исследований (проба Фелинга, тест с 2,4-динитрофенилгидразином, хроматография аминокислот) удается обнаружить метилмалоновую ацидурию, длинноцепочечные кетокислоты, выделяемые с мочой. Экскреция метилмалоновой кислоты увеличивается в 1000 раз и достигает 5 г в сутки (в норме 5 мг в сутки). Метилмалоновая кислота определяется также в плазме крови (0,02—0,03 г/л) и спинномозговой жидкости. Кроме того, в биологических жидкостях увеличено в 2—3 раза содержание глицина, а в период метаболического криза повышено также содержание валина, лейцина и изолейцина. Экскреция оксалатов с мочой снижена.
Дифференциальный диагноз проводят с патологическими состояниями, сопровождающимися метаболическими кетотическими кризами, прежде всего с диабетическим кетоацидозом, гиперглици-немией, а также с менингитами, вирусными энфалитами и др.
В о.снове лечения лежит диетическая коррекция. Патогенетически обосновано назначение больным низкобелковой диеты из расчета 0,1—0,15 г/кг массы тела в день (при норме около 1 г/кг) п больших доз цианокобаламина 1000 мкг в день. В период ацидоза показана симптоматическая терапия: внутривенное введение жидкости, щелочных растворов, глюкозы, литических смесей. Недиагностированные варианты метилмалоповой ацидемии приводят к летальному исходу в раннем возрасте. Диетическая коррекция делает прогноз более благоприятным, однако, если лечение начато до клинических проявлений со стороны нервной
352
системы, то есть при отсутствии задержки психического развития.
Гиперлизинемия. Заболе-нпе описано A. Colombo и др. в 1967 г.
В основе патогенеза лежит снижение активности в печени NAD-оксидоредуктазы — фермента, катализирующего процесс окислительного декарбоксилирования альфа-лизина; в крови увеличивается содержание аммиака.
Заболевание проявляется на 1-м году жизни, обычно с введением прикорма, богатого белком. У ребенка появляется рвота, к которой быстро присоединяется судорожный синдром, отмечаются подергивания отдельных мышечных групп, особенно в мимических мышцах
лица, дистальных отделах ко- Рис ш Ребенок и мес с нечностеи. Мышечный тонус кой психомоторного развития вслед-снижен (рис. 111). Описывают ствие гиперлизинемии пароксизмы прекоматозных со-
стояний, развивающихся внезапно, но провоцируемых большим содержанием белка в пище. Течение гиперлизинемии носит ремит-тирующий характер. Некупирующееся коматозное состояние приводит к отеку мозга и легких. Диагноз ставится на основании повышения содержания в крови лизина п оргинпна, определяемых с помощью хроматографии. В момент пароксизма в крови также резко повышено содержание аммиака — до 5,0—5,5 г/л.
Дифференциальный диагноз проводят прежде всего с другими нарушениями обмена аминокислот и состояниями, приводящими к метаболическим комам, а также с нейроинфекциями, острыми заболеваниями желудочно-кишечного тракта.
В некоторых случаях гиперлизинемия при своевременном диагнозе коррегируется длительным применением диеты, содержащей низкое количество лизина (не выше 0,1 г на 1 кг массы тела); в рацион вводят картофель, морковь, рисовую муку, яичный белок, декстрамальтозу, растительные масла, витамины.
Гипервалинемня. Заболевание описано в 1963 г. J. Wada. Оно обусловлено снижением активности фермента, участвующего в метаболизме валина (валпнтрансаминазы), что приводит к дисбалансу аминокислот, повышению в крови и моче уровня валина и кетоацидозу.
353
Клинически проявляется в первые месяцы жизни, характеризуется нарастанием неврологических симптомов, основными из которых являются тяжелая мышечная гипотония, полиморфные судороги, нистагм, дистонические атаки. Быстро проявляется грубая задержка моторного и психического развития. В крови повышено содержание валина и кетокислот, выявляется валину-рия и кетоацидурия. Заболевание дифференцируется главным образом с помощью биохимических исследований (хроматография аминокислот) от других нарушений метаболизма, нейроинфекций.
Своевременная коррекция диетой с ограничением содержания валина до 75—100 мг/кг дает хороший терапевтический эффект: купируется судорожный синдром, дети начинают прибавлять в массе, нормализуются биохимические показатели.
Болезнь Хартнупа. Заболевание обусловлено нарушением обмена триптофана, описано D. Baron и др. в 1956 г., частота в популяции составляет 1 : 15 000.
В основе патологии лежит изменение транспортной функции слизистой оболочки кишечника и проксимальных отделов почечных канальцев, в результате которого у больных нарушается адсорбция триптофана и большой группы других моноаминомонокарбоновых аминокислот с нейтральной, ароматической и гетероциклической цепями. Следствием недостаточного всасывания триптофана из кишечника является эндогенный дефицит никотиновой кислоты. Вместе с тем усиливаются процессы бактериального разложения триптофана в кишечнике, что ведет к избыточному накоплению индольных продуктов, которые всасываются в кровь, а затем в повышенном количестве экскретируются с мочой. Частично триптофан в неизмененном виде выводится со стулом. Характерной аномалией обмена является генерализованная гппераминоацидурия почечно-тубулярного происхождения без других нарушений тубулярной функции почек и повышения уровня содержания аминокислот в крови.
При патолого-анатомических исследованиях обнаруживаются кахексия, гепатоспленомегалия, острый язвенный энтероколит. Гистологически определяются ранний цирроз печени с образованием гигантских клеток, эндокардит, гиалиноз почек. При исследовании мозга установлено уменьшение клеток Пуркинье в мозжечке, а также периваскулярная глиальная инфильтрация.
Заболевание проявляется, как правило, в школьном возрасте, однако в литературе описаны случаи проявления патологии в первые месяцы жизни. Характерна эритематозная, иногда пеллагроподобная сыпь, располагающаяся на открытых участках тела (лицо, руки). Иногда она носит везикуло-папуллезный характер, на месте пузырей, особенно на носу, остаются характерные атрофические изменения и небольшие рубчики.
Нарушения со стороны желудочно-кишечного тракта проявляются диареей, на фоне которой выявляется неврологическая сим
354
птоматика- нистагм, мышечная дистония, повышение сухожильных пефлексов характерны кратковременные обморочные состояния В возрасте 2—3 лет патология проявляется в период повышенной инсоляции пароксизмом нарушения движений в виде мозжечкового атактического синдрома. Выражены эмоциональная лабильность, кожные проявления в виде эритематозной сыпи, нередки жалобы на резкую головную боль Нарушения со стороны желудочно-кишечного тракта выражаются в клинике спастического колита, болевом синдроме, диарее. Отмечаются пароксиз-мальпо возникающие нарушения психики: депрессия, аутизм, фобии, галлюцинации, состояния аффекта. Психическое развитие детей несколько задерживается или нормальное.
Диагноз основывается на данных биохимического исследования, основополагающими в которых являются: генерализованная аминоацидурия без гипераминоацидемии, повышенное выделение с мочой индольных соединений (индикана до 400 мг в сутки при норме не более 100 мг, индолуксусной, индолмолочной, индолак-риловой, индолпировиноградной кислот), отсутствие триптофана в крови. В 10 и более раз повышена суточная экскреция аминоазота, отмечается низкая экскреция с мочой кинуренина. Диагноз подтверждается нагрузочной пробой с триптофаном, содержание которого после нагрузки в сыворотке крови нарастает медленно и так же медленно он экскретируется.
При диагностике это заболевание следует отличать от других нарушений обмена аминокислот, сопровождающихся синдромом гипераминоацидурии, пеллагры, порфирии, новообразований желудочно-кишечного тракта.
Лечение включает диету с обязательным введением в рацион фруктово-сахарных дней, назначение никотиновой кислоты и ее амида, а также натрия бикарбоната, который усиливает выделение из организма индольных соединений. Целесообразно ограничить пребывание больных на солнце. Дополнительно к диетотерапии рекомендуются большие дозы пиридоксина и другие витамины группы В, сода, неомицин. С возрастом улучшается способность организма ребенка усваивать триптофан, что делает прогноз при болезни Хартнупа относительно благоприятным.
Аргининемия. Заболевание описано Н. Terheggen и др. в 1969 г. Встречается среди новорожденных с частотой 1 : 50 000— 1 : 70 000.
В основе патогенеза заболевания лежит нарушение последнего этапа синтеза мочевины вследствие дефицита фермента аргиназы в печени и эритроцитах.
Патоморфологически обнаруживают дегенартпвные изменения в центральной нервной системе в виде набухания нейронов, их гибели, глиозного перерождения, распада миелина.
Заболевание проявляется вскоре после рождения приступами рвоты, судорогами, мышечной гипотонией. Дети отстают в физическом и психическом развитии. Позднее формируются спастиче-
355
ские парезы и параличи, увеличивается печень. Ухудшение состояния, эпизоды диспептических расстройств й судорог связаны с приемом белковой пищи.
В плазме крови и ликворе повышена концентрация аргинина и снижена концентрация орнитина. После приема пищи с обычным содержанием белка уровень аргинина возрастает с 1— 1,2 г/л до 7—8 г/л (при норме менее 0,033 г/л). В моче определяется повышение количества орнитина, цистина, аргинина, лизина.
Заболевание следует дифференцировать от других нарушений аминокислотного обмена, что возможно лишь на основании биохимического исследования, а также от нейроинфекций, острых заболеваний желудочно-кишечного тракта, последствий внутриутробной асфиксии и родовой травмы.
Лечение состоит в назначении низкобелковой диеты: до 0,1 г на 1 кг массы тела в день.
Выявление гетерозигот проводится на основании снижения активности аргиназы в эритроцитах и некоторого повышения содержания аргинина и аммония в крови.
Тирозинемия (тирозиноз, тирозинурия). Заболевание описано G. Medes в 1932 г.
Первичный молекулярный дефект — снижение активности р-гидроксифенилпировиноградной оксидазы печени. Патогенез заболевания обусловлен накоплением в крови тирозина и токсическим действием на ткани мозга, почек, печени дериватов его метаболизма: р-гидроксифенилуксусной, альфа-фенилмол очной, альфа-фенилпировиноградной кислот.
Заболевание проявляется на 1-м году жизни ребенка. Описано 2 клинических варианта тирозиноза с острым и хроническим течением.
Основными симптомами -остро текущего заболевания являются прогредиентный судорожный синдром с рождения в сочетании с рвотой, поносом; появляются отеки, формируется гепатоспленоме-галия. Ребенок резко отстает в физическом развитии, присоединяются симптомы вит. D-резистентного рахита. Общее тяжелое соматическое состояние сочетается нередко с задержкой психического развития — ребенок вялый, малоактивен, плохо реагирует на окружающее. Тяжесть состояния усугубляется почечной недостаточностью, водно-солевым дисбалансом и недостаточностью де-зинтоксикационной функции печени. В недиагностированных случаях острого течения тирозиноза смерть наступает в 1-м полугодии жизни ребенка вследствие отека легких, мозга и недостаточности печени.
Тирозиноз с подострым и хроническим течением на 1-м году жизни проявляется рахитоподобными изменениями костей, умеренной гепатоспленомегалией, почечной недостаточностью. Характерно отставание показателей роста и массы. Неврологические симптомы нередко включают умеренную гипотонию, гидроцефаль-ную конфигурацию черепа, симптом Грефе, задержку двигатель-356
ного и психического развития. Нередко описывают гиперпигментацию кожи, иногда желтоватое окрашивание ногтевых лож.
Диагноз ставится на основании повышения содержания в крови тирозина более 0,03 г/л и концентрации его производных в биологических жидкостях. Широко используются с этой целью микробиологические тесты и тонкослойная хроматография.
Заболевание следует дифференцировать от нарушений обмена других аминокислот, синдромов нарушения кишечного всасывания, вит.— D-резистентного рахита, обширной группы гепатолие-нальных синдромов, нейроинфекций.
Лечение тирозинемии состоит в назначении диеты с ограниченным содержанием тирозина и фенилаланина, так как обмен этих аминокислот находится в тесной взаимосвязи. Потребность растущего организма ребенка в тирозине составляет 25—40 мг/кг массы тела, а содержание этой аминокислоты в крови не должно превышать 0,015—0,02 г/л. Дефицит других аминокислот в рационе может быть покрыт за счет препаратов типа цимограна. В последующем в диету вводят фрукты, пшеничную, кукурузную или рисовую муку, молоко, сахар. В общем примерно 20% кало-ража в диете обеспечивается малокалорийным белком, 25% — жиром, 55% — углеводами. Дополнительно назначают минеральные смеси, витамин D (10 000—20 000 ME).
Своевременное лечение дает положительные результаты, поэтому важно с помощью скринирующей программы диагностировать дефект до появления клинических симптомов. Предпринимаются попытки антенатальной диагностики поражения плода исследованием аминокислот амниотической жидкости.
Аргининянтарная аминоацидурия. Заболевание описано J. Allan в 1958 г. Первичным молекулярным дефектом является энзиматический блок в цикле синтеза мочевины вследствие отсутствия аргининсукциназы, участвующей в расщеплении аргининянтарной кислоты. Дефицит фермента приводит к накоплению в крови и ликворе не только аргининянтарной кислоты, но и ее предшественников.
Симптомы заболевания (частая рвота, повышение температуры, судороги, увеличение печени) появляются уже в первые недели жизни. В дальнейшем у больных отмечается характерное печальное выражение лица, отставание в нервно-психическом развитии, ломкость и сухость волос, растущих пучками.
Заболевание следует дифференцировать от других нарушений аминокислотного обмена, болезни Гоше, болезни Нимана—Пика, внутричерепной родовой травмы, кишечных и нейроинфекций.
Предприняты попытки лечения заболевания диетой с ограничением белка и аргинина. Показаны симптоматическая терапия, применение глютаминовой кислоты, натрия бикарбоната.
Гомоцистинурия. Заболевание описано N. Carson и Н. Neil в 1962 г. Частота в популяции новорожденных — 1 : 50 000 — 1 : 100 000.
357
Развитие заболевания связано с энзиматическим блоком в обмене метионина.
Гомоцистинурия гетерогенна в генетическом и патогенетическом отношении. Она может быть обусловлена дефицитом фермента цпстатионинсинтетазы, нарушениями метаболизма цианокобаламина, дефицитом N-метилентетрагидрофолат редуктазы. В первом случае в мозговой ткани и печени больных активность цистатионинсинтетазы может быть снижена или полностью отсутствует. В любом случае происходит накопление метионина и гомоцистина в крови и тканях, а также уменьшается содержание цистатионина и цистина. Страдает также обмен соединительной ткани, нарушается синтез кислых мукополисахаридов (гли-козамингликанов).
При патоморфологическом исследовании определяется обли-терапия артерий, вероятно, вследствие повторных тромбозов с последующей фиброэластической организацией тромбов. В веществе мозга определяются очаги некроза и глиоза, иногда спонгиозная дегенерация. В определенных случаях находят жировое перерождение печени.
Клинические симптомы появляются в раннем возрасте. В первую очередь у детей отмечается задержка психомоторного разви-вития. Токсическое воздействие на нервную систему приводит к нарушению тонуса мышц (спастичность, реже мышечная гипотония), судорожным состояниям, гиперкинезам, вегетативным расстройствам. Нередко отмечаются также катаракта, глаукома. Характерен марфаноподобный синдром — арахнодактилия, длинные конечности, костно-суставные нарушения (кифосколиозы, деформации грудной клетки, плоскостопие, склонность к переломам и анкилозированию суставов, остеопороз), подвывих хрусталика, миопия. Больные обычно светловолосые, голубоглазые. Могут отмечаться телеангиэктазии, краснота кожи в области скуловых дуг, нередко тромбозы вен, артерий среднего калибра.
Для диагностики гомоцистинурии используют хромотографию аминокислот крови и мочи, высоковольтный электрофорез аминокислот. В крови, ликворе и моче обнаруживается большое количество метионина и гомоцистина. Положителен экспресс-тест с цианид-нитропруссидом на присутствие в моче серусодержащих аминокислот. Диагностическими тестами могут служить также отсутствие повышения содержания неорганического фосфата в моче при нагрузке метионином и его нормальное повышение при нагрузке цистином.
Гомоцистинурию следует дифференцировать от синдрома Марфана, последствий внутриутробной асфиксии и нейроинфекций, родовой травмы, других нарушений объема аминокислот.
Патогенетическое лечение состоит в назначении диеты, обогащенной цистином и лишенной метионина. Ограничивают продукты животного происхождения, богатые метионином (мясо, рыба и др.). Отмечен некоторый эффект от применения пиридоксина, 358
стимулирующего другие пути метаболизма серусодержащих аминокислот, особенно при тех формах заболевания, при которых не страдает интеллект.
Лечение наиболее эффективно, если начато в доклинической стадии заболевания. Ранней диагностике способствует программа тотального скрининга. Эффективность диагностики может быть повышена выявлением гетерозиготных носителей генов гомоци-стинурии, у которых в стимулированных ФГА фибробластах кожи, растущих in vitro, а также в биоптатах печени может быть снижена активность цистатионинсинтетазы. О наличии гетерозиготности можно судить и по концентрации гомоцистина и цистеингомоцистиндисульфида в плазме крови после нагрузки L-ме-тионином. Предпринимаются также попытки антенатальной диагностики заболевания исследованием аминокислот амниотической жидкости и обнаружением нарушения обмена мукополисахаридов в амниотических клетках.
Наследственные болезни, обусловленные нарушениями обмена липидов
В эту группу относят наследственные заболевания, сопровождающиеся накоплением липидов в клетках нервной системы и других тканях, в результате чего клетки подвергаются дегенеративным изменениям.
Катаболизм липидов — многоэтапный процесс, в котором учас-ствуют десятки ферментов. В настоящее время показано, что дефицит любого из них приводит к тяжелым нарушениям в организме. Поскольку метаболические сдвиги в какой-то мере общие для всех ферментов, сходны и их клинические проявления. С другой стороны, ряд ферментов катаболического расщепления липидов участвует также и в других метаболических звеньях, например, в катаболизме кислых гликозамингликанов. Нарушение активности таких ферментов ведет к полисистемности поражения и делает обусловленные ими внутриклеточные липидозы клинически сходными с заболеваниями других групп (Н. Haller, М. Hanefeld, 1975; Н. Mehnert, Н. Forster, 1975; N. Jaubay, 1975; М. Malone, 1976).
Изучение патогенетических механизмов накопления липидов показало, что в основе нарушения активности того или иного фермента могут лежать несколько аллельных или неаллельных мутаций, в различной степени нарушающих активность фермента. Это является дополнительным источником клинического полиморфизма внутриклеточных липидозов.
Таким образом, диагностика и нозологическая дифференциация заболеваний, связанных с нарушением катаболизма липидов, которые чрезвычайно важны для разработки патогенетической терапии и медико-генетического консультирования, в настоящее время Должны основываться на точном выявлении энтиматического
359
блока и определении степени инактивации фермента. Такая диагностика осуществляется с помощью комплекса реакций субстрат-фермент, в которых в качестве источника фермента используются биологические жидкости и ткани больного. Эти же реакции пригодны для выявления состояния гетерозиготности (у гетерозиготных носителей мутантных генов активность ферментов обычно снижена), а также для антенатальной диагностики поражения плода путем исследования амниотических клеток и амниотической жидкости. Все это в целом является комплексом мероприятий, направленных на профилактику рождения детей с наследственными нарушениями катаболизма липидов.
В настоящее время заболевания этой группы пытаются лечить путем введения дефицитного фермента, однако пока эти исследования не вышли за рамки эксперимента; применяют симптоматическое лечение.
Ниже приводится описание некоторых наиболее дифференцированных заболеваний из группы внутриклеточных лппидозов, проявляющихся в раннем возрасте и характеризующихся глубоким поражением нервной системы. Все они наследуются по аутосомно-рецессивному типу с полной пенетрантностью.
В табл. 10 приведена краткая характеристика некоторых других форм нарушения метаболизма липидов.
Амавротическая идиотия Тея—Сакса. Это внутриклеточный ли-ппдоз пз группы ганглиозидозов. Описан W. Тау в 1881 г., В. Sachs в 1887 г. Частота заболевания составляет 1 : 250 000. Чаще случаи амавротической идиотии этого типа наблюдаются в еврейской популяции (1 :6000).
В основе заболевания лежит дефицит фермента (3-гсксозами-нидазы-А в плазме крови, мозге и внутренних органах, что приводит к накоплению в клетках нервной системы и внутренних органах ганглиозов Gni2.
Патоморфологически наряду с общим увеличением объема мозга обнаруживаются участки атрофии в коре больших полушарий, гидроцефалия. Нервные клетки заполнены мелкозернистым веществом липоидного характера, субстанция Ниссля распадается, ядра сморщиваются. Дегенерация ганглиозных клеток, их атрофия сопровождается разрастанием глиальных элементов. Аналогичные изменения обнаруживаются в области желтого пятна. В нервных волокнах наблюдаются явления демиелинизации. Гистохимическое исследование мозговой ткани больных выявляет увеличение ганглиозидов Gm2 в 3,5 раза в сером веществе и в 10 раз в белом веществе мозга. Ганглиозид Gm2 накапливается также в клетках печени, селезенки и в эритроцитах.
Клинические симптомы появляются в возрасте 4___6 мес. Ребе-
нок, ранее активный, постепенно утрачивает интерес к окружающему, перестает играть, смеяться, не узнает родителей, становится вялым, мышечный тонус снижен. Рано обнаруживается снижение зрения. Ребенок не может фиксировать взгляд, не 360
Рис. 112. Ребенок в ранней стадии болезни Тея — Сакса (а, б) и гистологическая картина его мозга (в)
следит за игрушкой (рис. 112). Одновременно с развитием слепоты наблюдается снижение интеллекта. Появляются судорожные припадки, преимущественно тонические пли малые пропульсивные, характерна повышенная реакция на слуховые раздражения. Прогрессируют центральные двигательные расстройства, псевдо-бульбарные нарушения. В конечной стадии болезни развиваются кахексия и состояние децеребрационной ригидности. При исследовании глазного дна обнаруживают характерный симптом —
361
«вишневую косточку» — вишнево-красное пятно в центре макулы, окруженное серовато-белым ободком; в поздней стадии — атрофию диска зрительного нерва. Течение заболевания быстро прогрессирующее. В тяжелых случаях через 1—2 года дети погибают, обычно от интеркурентных заболеваний.
У гетерозиготных носителей патологического гена снижена активность фермента гексозаминидазы А. Частота носителей рецессивного гена составляет в общей популяции 1 : 380, среди евреев — 1 : 40.
Возможна антенатальная диагностика болезни Тея—Сакса посредством исследования активности гексозаминидазы А в амниотической жидкости. При снижении активности фермента показано прерывание беременности.
Реже, чем болезнь Тея—Сакса, встречаются другие формы ганглиозидозов.
Врожденная амавротическая идиотия Нормана—Вуда характеризуется нарушением катаболизма ганглиозидов Сшз, которые накапливаются преимущественно в клетках центральной нервной системы. Заболевание проявляется с рождения прогрессирующей гидроцефалией или микроцефалией, судорогами, параличами, резким отставанием в психическом развитии, слепотой. Массивная деструкция паренхимы мозга, определяемая при морфологическом исследовании, является причиной быстрого нарастания неврологических симптомов и летального исхода.
Амавротическая идиотия Сандхоффа сходна клинически с болезнью Тея—Сакса, но отличается еще более злокачественным течением. В основе болезни Сандхоффа лежит дефицит изоферментов А и В (3-гексозаминидазы.
Помимо других ганглиозидозов и наследственных нарушений катаболизма липидов амавротические идиотии следует дифференцировать от нейроинфекций, поствакцинальных энцефалитов, а также от глиоза мозга и нарушений других видов обмена с поражением нервной системы.
Глюкоцереброзидоз (болезнь Гоше). Заболевание описано Е. Gaucher в 1882 г.
В основе патогенеза болезни Гоше лежит дефицит фермента Р-глюкоцереброзидазы.
При патоморфологическом исследовании выявляются дегенеративные изменения в нервной системе, особенно в коре больших полушарий, базальных ганглиях, таламусе, стволе мозга, мозжечке и спинном мозге. В этих же областях отмечается скопление больших круглых овальных или полигональных клеток, содержащих большое количество глюкоцереброзидов (клетки Гоше). Реактивом Шиффа эти клетки окрашиваются в пурпурный цвет. Тяжелые нарушения обнаруживаются в селезенке. Она резко увеличена, плотная. На срезах видно множество желтых пятнышек, некротических и кавернозных очажков. В желтых пятнышках при микроскопии определяются клетки Гоше. Эти клетки
362
являются ретикулярными клетками и гистиоцитами, в которых накапливается глюкоцереброзид-керазин. Аналогичные изменения находят в печени, значительно увеличенной и потерявшей свою дольчатую структуру. Клетки Гоше скапливаются в около-дольчатых пространствах и в центре долек. В лимфатических узлах, костном мозге, легких, почках и других органах также обнаруживаются клетки Гоше.
Известны 3 клинические формы заболевания, различающиеся временем начала и преобладанием той или иной симптоматики. Для детей раннего возраста характерна острая форма болезни Гоше, отличающаяся быстрым злокачественным течением. С рождения отмечаются выраженная гипотрофия, бульбарные расстройства (беззвучный крик, нарушение глотания), поражение глазодвигательных нервов, чаще в виде сходящегося косоглазия. Наблюдаются тонико-клонические судороги, тризм, сменяющийся отвисанием нижней челюсти. Прогрессирующее снижение зрения связано с пигментной дегенерацией сетчатки. Смерть наступает от аспирации пищевых масс, пневмонии и дыхательных расстройств.
Подострая форма также наблюдается у детей раннего возраста, но характеризуется более медленным прогрессированием. Неврологическая симптоматика нарастает постепенно в течение ряда лет. Помимо неврологических симптомов имеются нарушения функции печени и селезенки, тромбоцитопения, анемия и геморрагический синдром.
Хроническая форма заболевания является генетически отличной нозологической единицей и встречается лишь у детей более старшего возраста.
Диагноз подтверждается исследованием активности глюкоце-реброзидазы в лейкоцитах и кожных фибробластах. У детей раннего возраста она составляет более 15% от нормы.
В настоящее время обнадеживающими являются попытки применить заместительную патогенетическую терапию введением больным глюкоцереброзидазы, выделенной из ткани плаценты. Симптоматическое лечение состоит в назначении противосудорожных средств, оказании помощи больным при дыхательных расстройствах, затрудненном глотании и др. Должное внимание следует уделять профилактике инфекций, организации ухода и питания больных. При выраженном геморрагическом синдроме показана спленэктомия.
У гетерозиготных носителей патологического гена в лейкоцитах снижена активность глюкоцереброзидазы.
Сфингомиелинов (болезнь Нимана—Пика). Заболевание описали A. Niemann в 1914 г. и в 1922 г. L. Pick.
Первичным биохимическим дефектом является дефицит фермента, катализирующего гидролиз сфингомиелина; при этом происходит накопление и отложение сфингомиелина и холестерина в клетках ретикуло-эндотелиальной системы и в мозге. По-видимо-
363
Рис. 113. Ребенок 8 мес с болезнью Нимана — Пика
му, холестерин играет особую роль как липид-ортанпзатор. обеспечивающий взаимодействие липидных молекул. Поэтому задержка одного липида в цитоплазме клеток может приводить ко вторичному повышению других липидов.
При патоморфологическом исследовании обнаруживается значительное увеличение размеров печени, селезенки, надпочечников, пятнистый рисунок легких. Гистологически в этих органах, а также в нервной системе находят множество бледных клеток, цитоплазма которых содержит большое количество маленьких капелек, отчего клетки имеют пенистый вид (клетки Нимана—Пика). Эти клетки хорошо окрашиваются красками, выявляющими липиды (судан III, осмий).
Обширные дегенеративные
изменения в головном мозге проявляются демиелинизацией, набуханием нейронов, глиальным перерождением.
Болезнь Нимана—Пика обычно проявляется в раннем детском возрасте и характеризуется сочетанием неврологической симптоматики и гепатоспленомегалии. В начале болезни периодически появляется рвота, ребенок отказывается от пищи, увеличиваются печень и селезенка. Кожные покровы принимают сероватожелтый оттенок, ребенок отстает в психическом развитии, форми-
руются спастические парезы, нарушается координация, развиваются глухота и слепота (рис. ИЗ). При осмотре глазного дна в 20—30% случаев наблюдается симптом «вишневой косточки».
Болезнь Нимана—Пика имеет несколько клинических вари
антов.
Тип А рассматривается как классическая болезнь Нимана-Пика с началом в раннем детском возрасте и летальным исходом в возрасте от 1 до 3 лет. Он характеризуется сочетанием резко выраженной гепатоспленомегалии с тяжелым поражением центральной нервной системы.
Тип В также наблюдается в раннем детском возрасте, характеризуется тяжелыми висцеральными поражениями (гепатолие-нальный синдром), но без поражения нервной системы.
Тип С дебютирует в подростковом возрасте пли у взрослых, отличается более доброкачественным течением, наименьшим уве-
364
Рис. 114. Ребенок с лейкодистрофией. Резкое повышение тонуса в разгибательных группах мышц
личением печени и селезенки и поздним развитием поражения центральной нервной системы.
Тип D — атипичные случаи, протекающие по типу подострого гепатита с переходом в цирроз печени.
Дифференциальный диагноз проводится с другими внутриклеточными липпдозамп, лейкодистрофиями, гепатитами.
Лечение симптоматическое. Некоторая стабилизация процесса и улучшение общего состояния наблюдаются при назначении витаминов, переливании крови, плазмы, введении тканевых экстрактов.
Лейкодистрофии. Группа наследственных заболеваний нервной системы, характеризующихся прогрессирующим распадом белого вещества мозга вследствие дефекта ферментов, участвующих в катаболизме липидов и синтезе миелина.
Лейкодистрофии — редкая патология, наследующаяся по аутосомно-рецессивному или рецессивному, сцепленному с полом типу. Большинство описанных в литературе больных — мальчики.
Головной мозг при всех формах лейкодистрофий поражается диффузно, симметрично; преимущественная локализация поражения — ствол мозга, мозжечок. Значительные изменения постоянно находят в пирамидных путях. Нередко в процесс вовлекается спинной мозг. Гистологически обнаруживается демиелинизация (распад аномального миелина); в ряде случаев может быть накопление аномального миелина в паренхиматозной ткани, глии и макрофагах. Серое вещество изменено мало.
Характерными клиническими признаками лейкодистрофий являются нарастающие пирамидные, мозжечковые, экстрапирамид-ные расстройства, бульбарные и псевдобульбарные симптомы, снижение зрения и слуха, эпилептиформные припадки, прогрессирующее слабоумие (рис. 114). Нарушения чувствительности наблюдаются редко.
Лейкодистрофии начинаются чаще всего в дошкольном возрасте, некоторые формы проявляются уже в первые месяцы и годы
365
жизни. Клиническая дифференциация отдельных форм лейкодистрофии крайне сложна. Особенностями являются возраст начала заболевания и темп его прогрессирования. На нервом году жизни может дебютировать метахроматическая и глобоидноклеточная лейкодистрофии.
Основополагающими для диагностики являются биохимические и патоморфологические исследования.
Дифференциальную диагностику лейкодистрофий в раннем возрасте следует проводить с детскими церебральными параличами, поствакцинальными поражениями центральной нервной системы, с наследственными заболеваниями нервно-мышечной системы и другими нарушениями обмена веществ, опухолями мозга. Для опухоли мозга характерны внутричерепная гипертензия и более четкая очаговость неврологической симптоматики. Детские церебральные параличи отличаются отсутствием прогрессирования и, часто, асимметричностью поражения. Диагностические трудности представляет разграничение этих заболеваний на 1-м году жизни, когда симптомокомплекс детского церебрального паралича только формируется, и может возникнуть впечатление прогредиентности болезни.
В таких случаях изучение акушерского анамнеза, биохимические исследования и динамическое наблюдение позволяют уточнить диагноз.
Наиболее трудна дифференциальная диагностика лейкодистрофий и лейкоэнцефалитов. Патогенетически лейкоэнцефалиты — аутоиммунные заболевания, а лейкодистрофии — наследственно обусловленные аномалии обмена, но клинические различия могут быть минимальными, поскольку и в том и в другом случае нарушается процесс миелинизации. Диагностике лейкодистрофий помогает биохимическое исследование состава липидов крови и ликвора, активности ферментов (А. И. Берестов, Е. И. Гусев, 1974).
Метахроматическая лейкодистрофия описана R. Scholz в 1925 г. Название заболеванию дали метахроматические включения, обнаруживаемые в нервных стволах и клетках при гистологическом исследовании. В основе патогенеза заболевания лежит дефицит фермента арилсульфатазы-А, участвующей в катаболизме сульфатидов. Накапливающиеся в нервной системе и внутренних органах цереброзиды представляют собой метахроматическп окрашивающиеся вещества.
Симптомы болезни появляются в возрасте 2—3 лет, а иногда и на 1-м году жизни. Ранним симптомом являются двигательные нарушения: мышечная гипотония со снижением сухожильных рефлексов, задержка моторного развития, неустойчивая атактическая походка. Дети отстают в психическом развитии. В дальнейшем появляются судороги, гиперкинезы, мышечная гипотония сменяется гипертонией, нарастает атаксия. В поздней стадии снижаются зрение и слух, присоединяются бульбарные и
366
псевдобулъбарные нарушения, нарастает децеребрационная ри-гидностЬкворе определяется белково-клеточная диссоциация. Количество белка — 1—2 г/л. В плазме крови, ликворе, моче, биоп-сированном материале периферических нервов увеличено содержание сульфатидов.
Течение заболевания острое, быстрое. Летальный исход наступает через 2—3 года после появления первых симптомов.
Антенатальный диагноз заболевания не может быть поставлен в ранние сроки беременности в связи с низкой активностью арилсульфатазы в амниотической жидкости даже в норме. Поэтому в основе профилактики лежит выявление гетерозиготных носителей патологического гена, у которых обычно определяется половинная активность фермента в лейкоцитах, кожных фибробластах, сыворотке крови и моче.
Глобоидно-клеточная лейкодистрофия (острая детская форма Краббе — Бенеке) описана F. Beneke в 1908 и К. Krabbe в 1916 г. Морфологически характеризуется скоплением шарообразных крупных многоядерных клеток (глобоидных) в участках демиелинизации. В основе заболевания лежит дефицит фермента p-галактозидазы цереброзидов, осуществляющего второй этап катаболизма сульфатидов. В клетках нервной системы накапливаются галактозилцерамид и галактозилсфингозин.
Заболевание проявляется в первые месяцы жизни приступами судорог, сопровождающихся громким криком, гипертермией. Быстро нарастает мышечная ригидность, рано обнаруживается атрофия зрительных нервов. Летальный исход наступает вследствие бульбарных расстройств, тяжелых судорожных приступов, приводящих к отеку мозга. Заболевание прогрессирует очень быстро.
Лейкодистрофия Пелицеуса — Мерцбахера описана A. Paeli-zeus в 1885 г. и A. Merzbacher в 1909 г. Болеют ею только мальчики, поскольку патологический ген рецессивен и локализован в Х-хромосоме.
Патогенез заболевания не изучен. При патоморфологических исследованиях выявляют диффузную демиелинизацию белого вещества мозга с сохранением его только вокруг сосудов. В гораздо меньшей степени поражаются мозжечок, ствол мозга, спинной мозг, периферические нервы. .В белом веществе мозга снижены все фракции миелиновых липидов.
Заболевание проявляется на 1-м году жизни. Наиболее ранний симптом — непостоянный необычный горизонтальный, вертикальный и ротаторный нистагм, создающий впечатление блуждающих глазных яблок. Он может сопровождаться подергиванием головы и кивками. Заболевание прогрессирует медленно. Постепенно присоединяются расстройства координации, спастические парезы, паркинсоноподобный синдром, миоклонии и другие
367
гиперкинезы, со временем нарастает атрофия зрительных нервов, снижается интеллект. В поздней стадии наблюдается ремитти-рующее, а иногда и стационарное течение.
Мукополисахаридозы
Наследственные болезни обмена мукополисахаридов — это группа заболеваний соединительной ткани, характеризующихся сочетанным поражением опорно-двигательного аппарата, внутренних органов, глаз и нервной системы. В основе системного поражения лежит нарушение обмена мукополисахаридов (кислых гликозамингликанов), играющих важную роль в функционировании соединительной ткани.
В настоящее время выделено 9 патогенетических различных заболеваний этой группы, различающихся по клиническому течению, а также по фракциям гликозамингликанов, которые накапливаются в клетках больных и частично экскретируются с мочой (Е. И. Гусев, 1971; V. Mckusick, 1972; G. Hughes, 1977). Большинство генов, мутации которых лежат в основе мукополисахаридов, локализованы в аутосомах.
Патоморфологически при заболеваниях этой группы обнаруживают изменения различных органов и систем. Накопление высокомолекулярных липидно-полисахаридных соединений приводит к значительному поражению костной системы: нарушено энхондральное окостенение, отмечается разрастание кровеносных сосудов и хрящевой ткани. В печени откладываются мукополисахариды и нейтральные жиры. Страдают почки, сердце, крупные сосуды, селезенка, сетчатка глаза. В нервных клетках мозга п периферических ганглиев обнаруживаются набухание, накопление мукополисахаридов и ганглиозидов. Твердая мозговая оболочка утолщена, развиваются явления гидроцефалии.
Клиническая характеристика всех форм мукополисахаридозов однотипна в отношении внешнего вида больных и костного дисформизма, обозначаемого термином «гаргоилизм», который, однако, может быть выражен в большей или меньшей степени.
Термин «гаргоилизм» произошел от названия уродцев, изображенных на Соборе Парижской богоматери. Черты лица детей огрубленные, гротескные, рост небольшой, конечности укорочены. Грубые черты лица наблюдаются с рождения. Характерны нависающий лоб, гипертелоризм, запавшее переносье, деформация ушных раковин, неправильный рост зубов, большой язык.
Грудная клетка деформирована, выражен кифоз в дорзальном или дорзо-люмбальном отделе. Пальцы широкие и короткие, тугоподвижность в мелких суставах; живот большой, отмечается гепатоспленомегалия, часто пупочная и паховая грыжа. Поражение сердца проявляется расширением границ относительной тупости, сердечными шумами, аритмией, электрокардиографическими признаками диффузного поражения миокарда. У больных по-368
степенно снижаются слух и зрение, развивается помутнение роговиц, на глазном дне — застойные явления, иногда атрофия зрительных нервов. Интеллект может быть сохраненным или снижен.
Рентгенологическая картина скелета характеризуется термином дизостоз: деформация костей свода и основания черепа, черепные швы растянуты, края их истончены; турецкое седло уплощено, вход у него расширен; пястные кости и фаланги пальцев деформированы, структура их грубопетлистая; в трубчатых костях — нарушение энхондрального и перихондрального окостенения; тела позвонков в грудном и поясничном отделах позвоночника деформированы.
Диагноз мукополисахаридоза подтверждается комплексным биохимическим исследованием. Разработаны биохимические экс-пресс-методы определения повышенной экскреции мукополисахаридов с мочой: образование преципитата при добавлении аце-тилтриметиламмоний бромида к моче больного; образование метахромазинового пятна на фильтровальной бумаге, пропитанной толуидиновым синим, при нанесении на нее мочи больного и др. Скринирующим тестом может служить также метахроматическое окрашивание цитоплазмы лимфоцитов и кожных фибробластов толуидиновым синим после фиксации клеток метиловым спиртом. Выявление мукополисахаридурии или метахромазии лимфоцитов является показанием к фракционированию экскретируемых гликозамингликанов и определению активности ферментов, участвующих в их катаболизме.
В настоящее время предпринимаются попытки заместительной терапии путем посадки ткани или введения недостающего фермента. Однако пока эти исследования не вышли за рамки эксперимента, для лечения применяются АКТГ, кортикостероиды, большие дозы витамина А, диета с ограничением витамина С, а также сердечные и другие симптоматические средства (Е. И. Гусев, 1972).
В гетерозиготном состоянии мутантные гены клинически не проявляются. Гетерозиготных носителей патологического гена выявляют по снижению активности фермента.
Мукополисахаридоз I типа (синдром Гурлер) описан G. Hurler в 1919 г. Наследуется аутосомно-рецессивно.
В основе патогенеза лежит дефицит фермента а — L-идурони-дазы, который приводит к нарушению катаболизма дерматансульфата и гепарансульфата, накапливающихся в клетках и экскретируемых с мочой.
При патоморфологическом исследовании выявляется отложение мукополисахаридов в виде зернистой массы в паренхиме печени, ретикулярных клетках селезенки, эпителии почечных канальцев; сетчатке, склере, роговице глаз; нервных клетках, периферических ганглиях, в интиме коронарных артерий, бронхиаль-
13 НЗ
369
ных и других хрящах. Отмечается внутренняя гидроцефалия, обусловленная, по-видимому, отложением мукополисахаридов в мозговых оболочках и нарушением их проницаемости. Определяются очаги демиелинизации. Реактивный фиброз эндокарда связан с отложением мукополисахаридов в клапанах.
Клиническая симптоматика проявляется уже с рождения характерным внешним видом ребенка — типичные изменения черепа, гротескные черты лица, тугоподвижность многих суставов, абдоминальные грыжи. Заболевание прогрессирует, появляются гепатоспленомегалия,
„ сердечно-сосудистые наруше-
птлпл л1г5*ттРе^пН0К С мукополисаха" ния, дыхательные расстройства, ридозом II типа тт т
Часты респираторные инфекции. Характерны также помутнение роговицы, резкое снижение интеллекта и карликовый рост. Течение заболевания злокачественное, приводит к инвалидизации больных в течение нескольких лет.
Мукополисахаридоз II типа (синдром Гунтера) описан S. Hunter в 1919 г. Рецессивный патологический ген локализован в Х-хромосоме, поэтому заболевание проявляется только у мальчиков. Редкие случаи заболевания у девочек, вероятно, являются следствием гомозиготности, возникающей в результате неомутации в Х-хромосоме, полученной от отца.
Синдром обусловлен дефицитом фермента L-идуроно-сульфат-сульфатазы, отщепляющей неорганический сульфат от идуроно-вой кислоты. Ферментативный блок приводит к отсутствию гидролиза дерматан- и гепарансульфата, которые в избыточном количестве, по в меньшем, чем при синдроме Гурлера, экскретируются с мочой.
Заболевание проявляется с рождения, по клинические и пато-морфологические нарушения менее выражены, чем при I типе мукополисахаридоза. Деформации черепа и конечностей не столь резкие. Помутнения роговицы не бывает. Интеллект снижен в гораздо меньшей степени (рис. 115). Характерны гепатоспленомегалия, сердечно-сосудистые расстройства. Прогрессируют глухота и снижение зрения. Больные обычно шумливые, несколько агрессивные. Патогномоничными для этой формы мукополисахаридоза считаются множественные участки гладкой, блестящей, не
370
покрытой волосами кожи в области лопаток на фоне общего гир сутизма и утолщения кожи.
Течение заболевания медленно прогрессирующее. Средняя продолжительность жизни больных составляет около 30 лет.
Мукополисахаридоз III типа (синдром Санфилиппо, полидис-трофическая олигофрения). Описан S. Sanfilippo в 1963 г.
Это гетерогенная группа клинически сходных нозологических форм, наследующихся аутосомно-рецессивно, при которых нарушен катаболизм гепарансульфата.
Патогенетически выделяют 3 подтипа мукополисахаридоза III типа. Тип Ша обусловлен дефицитом фермента гепаран-N-сульфатазы. В основе Шв-типа лежит дефицит фермента a-N-ацетилглюкозаминидазы. Тип II 1с обусловлен дефицитом а-глю-козаминидазы.
Патоморфологически определяют умеренное увеличение печени, селезенки, мезентериальных лимфоузлов, снижение массы мозга за счет выраженной атрофии белого вещества и легкой атрофии всех слоев коры, расширение желудочков мозга. Гистохимически находят отложение липидов в нейронах и метахромати-ческого материала в макрофагах. Отложение кислых: мукополисахаридов происходит также в купферовских клетках печени, соединительнотканных элементах прямой кишки, собирательных канальцах почек.
Развернутая картина заболевания формируется к 2—3 годам. Характерна глубокая умственная отсталость при относительно легких соматических симптомах. Дети возбудимы, неспособны к сосредоточению, иногда агрессивны. Плохо развиваются речевые навыки, может быть глухота. Гротескность черт лица, изменения скелета и гепатоспленомегалия выражены умеренно.
Течение заболевания медленно прогрессирующее. Продолжительность жизни больных — 20—25 лет.
Мукополисахаридоз IV типа (синдром Моркио—Ульриха) описан L. Morquio и J. Brailsford в 1929 г., наследуется аутосомно-рецессивно.
В основе патогенеза заболевания лежит дефицит фермента Х-ацетилгексозамин-6-ЗО4-сульфатазы, приводящий к нарушению гидролиза кератансульфата и, в меньшей степени дерматансульфата.
Заболевание проявляется на 1—2-м году жизни. Характеризуется деформациями скелета, особенно позвоночника, вальгусной деформацией коленных суставов, относительно коротким туловищем и шеей, бочковидной грудной клеткой с выступающей килевидной грудиной и разболтанностью некоторых суставов (например, запястных). У детей обычно широкая нижняя челюсть. Заболевание медленно прогрессирует. Характерное уплощение тел позвонков обнаруживается на 4—5-м году. К 10-годам появляется помутнение роговиц, а к 15—20 годам могут отмечаться регургитация аорты и неврологические нарушения, обусловленные
13*
371
сдавлением спинного мозга деформированным позвоночником. Может быть также тетраплегия, связанная с дислокацией I шейного позвонка вследствие гипоплазии или аплазии зубовидного отростка II шейного иозвонка. Интеллект страдает в незначительной степени. Кожные изменения отсутствуют. В моче больных обнаруживают большое количество кератансульфата и хондроитинсульфата.
Мукополисахаридоз V типа (синдром Шейе) описан И. Scheie в 1962 г. и A. Emerit в 1966 г. Наследуется аутосомно-рецессивно. Этот синдром обусловлен мутацией гена, гетероаллельного гену, лежащему в основе мукополисахаридоза I типа Гурлера. Поэтому в некоторых классификациях синдром Шейе называется не мукополисахаридозом V типа, а мукополисахаридозом I типа Шейе.
В основе заболевания лежит дефицит фермента a-L-гиалуро-нидазы, который, однако, менее выражен, чем при синдроме Гурлера.
Характерны тугоподвижность крупных и мелких суставов, деформация стоп, вальгусное искривление коленных суставов. Эти симптомы выражены уже у новорожденных. Дети обычно растут нормально. Интеллект не страдает. Больные имеют специфическое лицо с большим ртом, кожные проявления характеризуются гирсутизмом и утолщением кожи на пальцах.
С мочой в избыточном количестве экскретируется дерматансульфат, однако в отличие от синдромов Гурлера и Гунтера это вещество не выявляется в клетках периферической крови.
Мукополисахаридоз VI типа (синдром Марото—Лами, поли дистрофический нанизм). Описан Р. Maroteaux и М. Lamy в 1965 г. Обусловлен рецессивным геном, локализованным в аутосоме.
В основе патогенеза заболевания лежит дефицит фермента М-ацетилгексозамин-4-8О4-сульфатазы (арилсульфатазы В).
Заболевание проявляется с рождения. Скелетные аномалии и поражение глаз выражены в той же степени, что при синдроме Гурлера. Может развиваться гидроцефалия. Однако психическое развитие страдает незначительно. С мочой экскретируется исключительно дерматансульфат. Большинство больных умирает в возрасте до 10—15 лет от сердечно-легочной недостаточности и повторных инфекций.
Мукополисахаридоз VII типа. Описан Н. Sly и др. в 1973 г. Наследуется аутосомно-рецессивно.
При этой форме нарушен катаболизм всех трех фракций гли-козамингликанов вследствие дефицита фермента P-D-глюкурони-дазы.
Характерная гротескность черт лица наблюдается уже при рождении. Дети отстают в росте, увеличиваются печень и селезенка. Наблюдаются повторные легочные инфекции. Интеллект сохранен или снижен умеренно. В моче определяется мукополи-сахаридурия за счет всех трех функций мукополисахаридов.
372
В периферической крови обнаруживаются необычно гранулированные гранулоциты. Течение заболевания медленно прогрес сирующее.
Муколипидозы
Эта группа системных заболеваний характеризуется накоплением мукополисахаридов, а также липидов (сфинголипидов, гликолипидов) в висцеральных и мезенхимальных клетках. Липиды накапливаются также в клетках нервной системы. Исторически эти заболевания описывались либо как мукополисахаридозы без избыточного выведения с мочой кислых гликозамингликанов либо как атипичные формы липидозов.
Клинически муколипидозы сходны с мукополисахаридозами в отношении дисморфизма, обозначаемого термином гаргоилизм, и деформаций скелета. С другой стороны муколипидозам свойственны некоторые черты ганглиозидозов (амавротических идиотий) — вакуолизация лейкоцитов, клеток костного мозга и других органов, симптом «вишневой косточки» на глазном дне и мета-хроматическая дегенерация периферических нервов.
По классификации, предложенной J. Spranger и Н. Wiedeman (1970), выделяют следующие клинико-морфологические типы му-колипидозов: ганглиозидозы Gmi I и II типов (нейровисцеральный липидоз Нормана—Ландинга и болезнь Дерри), фукозидов, манно-зидоз, ювенильный сульфатидоз аустиновского типа, муколипидозы I, II и III типов (липомукополисахаридоз, болезнь J-клеток и псевдополидистрофия). Позднее были описаны III и IV типы ганглиозидов Gmi, муколипидоз IV типа и ряд других недифференцированных форм.
Ганглиозидоз Gmi I типа (нейровисцеральный липидоз, болезнь Нормана—Ландинга). Заболевание описано В. Landing и др. в 1964 г. Наследуется по аутосомно-рецессивному типу.
В основе патогенеза заболевания лежит дефицит лизосомного фермента кислой [J-галактозидазы (всех трех ее изоферментов — А, В и С), который в норме отщепляет терминальную галактозу от ганглиозидов Gmi и от кератансульфата. При дефиците фермента эти вещества не катаболизируются и накапливаются внутриклеточно.
Заболевание проявляется вскоре после рождения общей мышечной гипотонией, отставанием физического и психомоторного развития. Появляются отек и гротескность черт лица, как при синдроме Гурлера или гипотиреозе, с западением корня носа, гипертелоризмом, высоким нёбом, длинной верхней губой и мак-роглоссией. Десны гипертрофированы, кисти рук короткие и толстые, рано появляется кифосколиоз и развиваются множественные флексорные контрактуры суставов. Па 2-м полугодии жизни Увеличивается печень и у 80% больных определяется спленомегалия. При офтальмоскопическом исследовании в 50% случаев
373
выявляется симптом «вишневой косточки» на глазном дне. Выраженность указанных симптомов постепенно нарастает. В начале 2-го года жизни появляются и быстро прогрессируют мозговые симптомы: сначала повышается реакция на звук, затем реакция на окружающее постепенно утрачивается, нарушается глотание вплоть до необходимости питания через зонд, появляются тонико-клонические судороги и развивается амавроз. Больные погибают в возрасте до 2—3 лет.
Рентгенологическая картина скелета описывается термином тяжелый множественный дизостоз (см. мукополисахаридозы).
При исследовании форменных элементов крови выявляются вакуолизированные лимфоциты, фракция которых составляет от 10 до 80%. В костном мозге присутствуют вакуолизированные гистиоциты. В мочевом осадке — одноядерные пенистые клетки. В биоптатах печени определяются вакуолизированные купферов-ские клетки, в почках — вакуолизация клеток клубочкового эпителия (поражение почек характерно только для этой формы липи-доза), вакуолизированы также кожные фибробласти. Гистохимически все эти клетки дают положительную реакцию на кислый мукополисахарид (кератансульфат) и суданофильны (богаты липидами — ганглиозидами Gnu).
Помимо описанного выше заболевания известен другой тип генерализованного ганглиозидоза Gmi, характеризующийся большей остаточной активностью кислой [J-галактозидазы в лейкоцитах и кожных фибробластах (A. Benson, S. Babarik, 1976).
Ганглиозидоз Gmi II типа (болезнь Дерри). Заболевание описано М. Gonatas и др. в 1965 г., наследуется аутосомно-рецессивно.
В основе патогенеза ганглиозидоза Gmi II типа, так же как и при I типе, лежит дефицит кислой р-галактозидазы, однако в отличие от последнего снижается активность только изоферментов В и С. Поэтому нарушение катаболизма ганглиозидов и кера-тансульфата не столь генерализованное и течение заболевания более длительное.
На 1-м году жизни ребенок развивается нормально, однако у него может быть повышенная реакция на звук и другие раздражители. Заболевание проявляется на 2-м году жизни синдромом прогрессирующего поражения мозга. Походка ребенка становится неловкой, затрудняется речь. При неврологическом исследовании выявляются локомоторная атаксия, мышечная гипотония и повышение сухожильных рефлексов. Указанные нарушения быстро прогрессируют, нарастает атаксия, спастическая тетраплегия, появляются клонические судороги пли миоклонии, может развиться амавроз. Больной перестает реагировать на окружающее. Терминальная стадия характеризуется развитием децеребрационной ригидности. Длительность жизни больного — до 10 лет.
Фукозидоз. Фукозидоз описан Р. Durand и др. в 1967 г., наследуется по аутосомно-рецессивному типу.
374
В основе патогенеза фукозидоза лежит генерализованное отсутствие лизосомного фермента a-L-фукозидазы, участвующего в расщеплении фукозосодержащих соединений — гликолипидов и др. В результате в печени и в мозге больных накапливаются фукозосодержащие церамид олигогексозиды (гликосфинголипиды).
Клинически заболевание подразделяется на 2 варианта. Первый вариант проявляется на 2-м году жизни задержкой психомоторного развития. Затем появляются и прогрессируют неврологические симптомы: спастический тетрапарез, тремор, постепенное снижение реакции на окружающее. Обычно гаргоилоподобные деформации выражены умеренно. В потовой жидкости повышена концентрация натрия и хлоридов.
При втором варианте неврологическая симптоматика менее выражена и прогрессирует медленнее; концентрация электролитов в потовой жидкости нормальная. Однако для этой формы помимо неврологических и гаргоилоподобных нарушений характерны кожные симптомы в виде диффузной ангиокератомы туловища.
При обеих формах заболевания течение быстро прогрессирующее, больные погибают на протяжении 2—4 лет.
Рентгенологически выявляется легкий множественный дизостоз с микроцефалией, пониженной прозрачностью костей черепа и передневерхней гипоплазией тел позвонков.
Лимфоциты периферической крови вакуолизированы. Клетки костного мозга и кожные фибробласты нормальные. В гепатоцитах и купферовских клетках повышено содержание суданофиль-ных веществ. Аналогичные включения содержат также нейроны.
Маннозидоз — болезнь Окермана. Описана Р. Okerman в 1967 г., а также В. Kjellman в 1969 г., наследуется по аутосомнорецессивному типу.
В основе патогенеза заболевания лежит почти полное отсутствие активности лизосомного фермента а-маннозидазы в мозге, печени, селезенке. Накапливающиеся внутриклеточно мукополисахариды содержат большое количество маннозы.
Нейроны коры больших полушарий, ствола мозга и спинного мозга увеличены и содержат кислые мукополисахариды. Изменения со стороны белого вещества мозга характеризуются генерализованной дегенерацией миелина.
Первые клинические симптомы в виде гепато- и спленомегалии, мышечной гипертонии и гиперрефлексии появляются вскоре после рождения. Психомоторное развитие замедлено, а затем прекращается. Клиническое течение характеризуется повторными инфекциями верхних дыхательных путей. Гаргоилоподобные черты появляются на втором году жизни и напоминают таковые при муколипидозе I типа.
Рентгенологически определяются раздутые ребра, грубая тра-бекуляция костей, овальность тел позвонков, которые в области грудино-поясничного отдела несколько угловаты.
375
Лимфоциты периферической крови вакуолизированы, содержат включения, дающие положительную реакцию с перйодной кислотой и реактивом Шиффа. Экскреция кислых мукополисахаридов с мочой нормальна или слегка повышена.
Ювенильный сульфатидоз. Заболевание описано Е. Austin в 1965 г., наследуется по аутосомно-рецессивному типу.
В основе его патогенеза, по-видимому, лежит дефицит в печени и мозге всех трех изоферментов арилсульфатазы А, участвующих в катаболизме сульфатированных кислых мукополисахаридов и сфинголипидов.
Заболевание проявляется с рождения замедленным психомоторным развитием. К 2 годам дети могут сидеть, иногда ходить и говорить отдельные слова. Затем появляются и постепенно нарастают явления спастического тетрапареза, миоклонические судороги, грубый тремор при возбуждении, нистагм. Характерна слабо выраженная гротескность черт лица, «куриная грудь», низкорослость. Печень и селезенка не увеличиваются. Роговицы прозрачны, но определяется бледность дисков зрительных нервов и гипопигментация сетчатки. В терминальной стадии (больные погибают до наступления пубертатного периода) отмечаются тяжелые флексорные контрактуры суставов и арефлек-сия.
Рентгенологическая картина характеризуется большим черепом с широким турецким седлом, дисплазией тел позвонков, деформацией костей таза и расширением диафизов длинных трубчатых костей (легкий множественный дизостоз).
Лимфоциты периферической крови вакуолизированы и наполнены необычными гранулами. В костном мозге наряду с гранулированными миелоидными клетками присутствуют типичные клетки Buhot. С мочой выделяется повышенное количество дерматан-и гепаран-сульфата, а также сульфатидов. В ликворе повышен уровень белка. Могут быть неспецифические отклонения на ЭЭГ и ЭМГ. В биопсированном икроножном нерве определяется мета-хроматическая дегенерация миелина.
Муколипидоз I типа (липомукополисахарпдоз). По-видимому, первым описанным случаем муколипидоза этого типа был больной S. Sanfilippo (1962). Позднее заболевание описано Р. Berard и др. (1963), J. Spranger и др. (1968). Тип наследования аутосомно-рецессивный.
Патогенез муколипидоза I типа не установлен. Предполагается, что повышение активности ряда лизосомных гидролаз в межклеточных жидкостях этих больных свидетельствует о структурном дефекте лизосом, снижающем прочность комплекса структурных элементов и ферментов и приводящем к нарушению катаболизма липидов и мукополисахаридов.
Заболевание проявляется во 2-м полугодии жизни замедлением моторного развития. На 2—3-м году появляются гаргоилопо-добные симптомы, слабо выраженные по сравнению с таковыми 376
при синдромах Гурлер и Гунтера (см. мукополисахаридозы). Грыжи, гепато- и спленомегалия встречаются непостоянно. Физическое развитие до 10 лет нормальное, но затем замедляется. Подвижность суставов вначале повышена, а после 4 лет становится несколько ограниченной. Отмечается задержка психического развития, однако дети обычно умеют ходить, играть, говорить отдельные слова, некоторые могут посещать специальную школу. У ряда больных наблюдаются прогрессирующие неврологические нарушения в виде мышечной гипотрофии, гипотонии, локомоторной атаксии. Могут отмечаться симптомы «вишневой косточки» на глазном дне и помутнение роговиц.
Рентгенологическая картина скелетных нарушений соответствует легкому множественному дизостозу, как при синдроме Санфилиппо.
Лимфоциты периферической крови вакуолизированны. В костном мозге встречаются особые клетки с грубыми вакуолями и гранулами. В культивируемых фибробластах кожи с помощью фазового контраста выявляются регулярные светопреломляющие включения, окрашивающиеся толуидиновым синим в голубой цвет. Экскреция с мочой кислых гликозамингликанов, сульфати-дов и ганглиозидов нормальная. Иногда может быть повышено количество гексозамина, содержащего уромукоиды. В биопсиро-ванном икроножном нерве выявляется метахроматическая дегенерация миелина в печени — вакуолизированные гепатоциты и купферовские клетки.
Муколипидоз II типа (болезнь J-клеток). Заболевание описано Р. Demars и J. Leroy в 1967 г., наследуется по аутосомно-рецессивному типу.
Патогенез его до конца не изучен. Установлено, однако, что некоторые лизосомные гидролазы, экскретируемые фибробластами больных в культуре, электрофоретическп отличаются от соответствующих внутриклеточных ферментов и ферментов, экскретируемых нормальными фибробластами. Это различие, возможно, связано с наличием в молекуле аномального фермента избыточного остатка сиаловой кислоты и отражает неспособность (или сниженную способность) этих гидролаз проникать внутрь клеток путем адсорбтивного пиноцптоза.
Клинически заболевание весьма сходно с мукополисахаридозом I типа — синдром Гурлер, но отличается еще более злокачественным течением. Больные низкорослы, умственно отсталы, отмечается тугоподвпжность суставов. Характерны утолщения десен, избыточная плотность кожи, постоянный насморк, частые респираторные инфекции, охриплость голоса, легкая гепатомегалия, грыжи. С помощью щелевой лампы в роговицах можно обнаружить специфическую грануляцию, хотя истинного помутнения нет. Данные рентгенологического исследования костей соответствуют таковым при синдроме Гурлер. Мукополисахаридурия отсутствует.
377
При исследовании кожных фибробластов в цитоплазме обнаруживают темные сферические включения диаметром 0,5—1 мкм вокруг ядра. Гистохимический анализ свидетельствует о накоплении в этих клетках (J-клетки) мукополисахаридов и липидов, содержание которых может быть повышено в 3 раза. Показано, что в кожных фибробластах больных отсутствует активность ряда ли-зосомных гидролаз, а в среде культивирования клеток и в сыворотке крови больных эти ферменты присутствуют в избытке.
Муколипидоз III типа (псевдополидистрофия). Заболевание описано V. McKusick и др. в 1965 г., наследуется по аутосомнорецессивному типу.
Первичный молекулярный дефект при этом заболевании не установлен.
Первые симптомы заболевания в виде скелетно-мышечных нарушений (ограниченная подвижность суставов, ревматоидный артрит без признаков воспаления, низкорослость, короткая шея, сколиоз, дисплазия бедер) отмечаются обычно на 2-м году жизни или несколько позднее. Гротескность черт лица непостоянна и появляется обычно к 6—7 годам. Сначала больные незначительно отстают в психическом развитии, но затем наблюдается интеллектуальная деградация. С помощью щелевой лампы определяется помутнение роговиц особого типа в виде тонких инфильтратов по периферии роговиц. У ряда больных описаны пороки сердца, декомпенсирующиеся к 20 годам.
Рентгенологическая картина характеризуется значительным поражением костей таза и позвоночника. Наблюдается гипоплазия подвздошных костей и низкое расположение подвздошных крыльев, уплощение проксимальных эпифизов бедренных костей, вальгусное положение шейки бедренных костей, шершавость контуров тел позвонков, недоразвитие их задних отделов в грудных сегментах и гипоплазия передних отделов в поясничных сегментах, узость вертебрального конца ребер. Характерна гипоплазия зубного края альвеол. Рентгенологические изменения выражены в большей степени у мальчиков, чем у девочек.
Лимфоциты периферической крови больных нормальны. В костном мозге встречаются клетки с вакуолизированной цитоплазмой, содержащие гликолипиды и кислые мукополисахариды. Характерно внутриклеточное снижение активности лизосомных гидролаз, повышение их активности в сыворотке крови и в среде культивирования клеток больных.
Муколипидоз IV типа. Описан A. Berman и др. в 1974 г., наследуется по аутосомно-рецессивному типу.
Патогенез заболевания не изучен.
Проявляется на втором полугодии жизни глазными симптомами в виде постепенно нарастающего билатерального помутнения роговиц, снижения зрения. Затем присоединяются двигательные нарушения, формируется задержка моторного и психического развития.
378
В пунктате костного мозга обнаруживаются многочисленные вакуолизированные гпстиоцитоподобные клетки с липидными включениями, дающие слабоположительную реакцию на кислые гликозамингликаны. При выраженном изменении клеточной морфологии активность лизосомных гидролаз в кожных фибробластах и лейкоцитах не изменена.
Помимо приведенных выше дифференцированных форм муко-липидозов, описаны другие варианты, не укладывающиеся в классификацию.
Наследственные болезни, обусловленные нарушением обмена углеводов
К наследственным нарушениям обмена углеводов относятся различные патологические состояния, обусловленные неспособностью организма усваивать углеводы или катаболизировать их. Эти формы патологии обмена часто проявляются в раннем возрасте. Патогенез поражения нервной системы при наследственных заболеваниях обмена углеводов связан с развитием частых гипер- и гипогликемических состояний, нарушением электролитного и водного баланса, с образованием токсических продуктов метаболизма (кетокислот и др.), вызывающих метаболические и структурные нарушения в ткани мозга, с дегенерацией клеток вследствие накопления в них некатаболизируемых углеводов.
Учитывая большие возможности диетотерапии и возрастное становление ферментных систем, профилактика неврологических нарушений тесно связана с вопросами раннего диагноза.
Диспансерное наблюдение за больными и успехи в организации специализированной помощи позволили реально решить вопрос о доклинической диагностике, рассматривая каждого ребенка, рожденного в семье, где есть патология углеводного обмена, как потенциального больного. Гетерозиготные носители патологического гена выявляются с помощью нагрузочных тестов и исследования активности ферментов. Эти данные используются при решении вопросов медико-генетического консультирования.
Среди заболеваний, обусловленных нарушением обмена углеводов, выделяют состояния, проявляющиеся непереносимостью того или иного углевода, входящего в состав продуктов питания, и заболевания, обусловленные нарушением метаболизма гликогена.
Галактоземия. Наследственная непереносимость галактозы описана К. Reuss в 1908 г., наследуется аутосомно-рецессивно, частота в популяции — 1 : 70 000, частота гетерозиготных носителей — 1 : 268.
Патология обусловлена резким снижением активности фермента галактозо-1-фосфат уридилтрансферазы (ГФУТФ), что приводит к накоплению в крови и тканях галактозы и галакто-
379
зо-1-фосфата. В патогенезе важное место принадлежит формированию гипогликемического синдрома, ацидоза, гипокалиемии.
Патоморфологические изменения при галактоземии наиболее типичны в печени. Они характеризуются жировой дистрофией, околодольчатым некрозом, циррозом. Выявляется также отек и набухание мозга, вздутие ядер олигодендроглии в больших полушариях мозжечка.
Первые клинические симптомы непереносимости галактозы появляются вскоре после рождения, как только ребенок начинает получать молоко. При полном отсутствии ГФУТФ у новорожденного возникают неукротимая рвота, желтуха, быстро нарастает гипотрофия, развиваются гепатомегалия, асцит. Прогрессирующие диспептические нарушения сопровождаются симптомами нейротоксикоза, которые проявляются судорожным синдромом, нистагмом, грубыми глазодвигательными нарушениями (плавающие движения глазных яблок), затруднением сосания и глотания.
Синдром мышечной гипотонии различной выраженности сочетается с арефлексией. Снижены или отсутствуют рефлексы новорожденного, особенно рефлекс Моро, хватательный, группа защитных рефлексов. Нарастает отек мозга и легких, летальный исход наступает через несколько месяцев.
При частичном снижении активности ГФУТФ течение заболевания может быть ремиттирующим. Патология проявляется в первые месяцы жизни, ее дебют обусловлен расширением молочной диеты. Характерны эпизоды рвоты, показатели роста и массы ниже нормы, отмечаются субиктеричность кожных покровов, легкое или умеренное увеличение печени, характерны формирующиеся катаракты (чаще двусторонние). Патология черепномозговых нервов вариабельна: сходящееся косоглазие, нистагм. Ребенок отстает в двигательном развитии, однако наличие патологических поз и установок не характерно. Синдром мышечной дистонии нередко сменяется гипотонией со снижением сухожильных рефлексов. Лицо гипомимично. Преобладает отрицательный эмоциональный комплекс. Снижение зрения приводит к запаздыванию формирования ориентировочно-познавательных реакций. Отмечается задержка психического развития. Эпизоды судорожных пароксизмов делают еще более сомнительным прогноз психического развития.
Описывают также «асимптомную» форму галактоземии, которая характеризуется отказом ребенка от груди, не сопровождается соматическими и неврологическими нарушениями и, как правило, диагностируется только в семьях, где есть больной галактоземией.
Прй биохимическом обследовании больных галактоземией обнаруживаются галактозурия, протеинурия, гипераминоацидурия (тотальная); повышение содержания галактозы в крови при гипогликемии. Характерны патологическая кривая при нагрузке га-380
лактозой, ацидоз. Диагноз подтверждается хроматографической идентификацией галактозы, накоплением в эритроцитах галакто-зо-1-фосфата и снижением или отсутствием активности фермента галактозо-1-фосфат-уридилтрансферазы.
Дифференциальный диагноз проводят со всеми меллитуриями (избыточным выделением углеводов с мочой), в том числе и сахарным диабетом, с гипогликемией новорожденных, гепатитами, цистинозом, синдромами гипераминоацидурий.
Лечение диетическое. Из рациона исключается молоко и продукты, содержащие галактозу. Детям раннего возраста рекомендуется пища без галактозы: смесь яиц с сахаром, маргарин, рисовая мука, белки животного происхождения, обогащенные экстрактами овощей, мяса, витаминами. В тяжелых случаях показана симптоматическая терапия, направленная на уменьшение ацидоза, противосудорожная терапия, обменное переливание крови. С возрастом непереносимость галактозы снижается, что обусловлено повышением активности УДФ-Гал-пирофосфорилазы, способствующей превращению галактозы побочным путем. Активирующим действием на УДФ-Гал-пирофосфорилазу обладают прогестерон и тестостерон. При ранней диетической коррекции физическое и психическое развитие детей нормальное.
Фруктоземия. Наследственная непереносимость фруктозы описана R. Chambers и R. Pratt в 1965 г. Частота его составляет 1 : 100 000 — 130 000 новорожденных. Наследуется заболевание аутосомно-рецессивно.
В основе патогенеза непереносимости фруктозы лежит дефицит фермента фруктозо-1-монофосфат-альдолазы, поэтому превращение фруктозы задерживается на этапе фруктозо-1-фосфата, который накапливается в тканях. Фруктоземия сопровождается резкой гипогликемией.
Заболевание проявляется в первые месяцы жизни, когда ребенку начинают давать соки и пищу, содержащую фруктозу (овощные и фруктовые пюре, фруктовые соки). После каждого кормления отмечается упорная рвота. Дети становятся вялыми, адинамичными, кожные покровы бледны. Периодически развиваются гипогликемические кризы со снижением мышечного тонуса, отсутствием сухожильных и безусловных рефлексов, плавающими движениями глазных яблок, комой. Характерны желудочно-кишечные расстройства: рвота, диарея. Несколько позднее увеличивается печень. Появляются гипоальбуминемия, стойкая Желтуха. Дети отстают в физическом и психическом развитии.
При нагрузке фруктозой (1—2 г/кг массы) происходит резкое повышение ее уровня в крови (до 1,7 г/л) с одновременным снижением концентрации глюкозы (до 0,04—0,1 г/л).
Фруктоземию дифференцируют от других нарушений обмена сахара, муковисцидоза, врожденного адрепогенитального синдрома, синдромов малабсорбции, доброкачественной фруктозурии, гипогликемии новорожденных, а также кишечных инфекций.
381
Лечение состоит в назначении диеты, из которой исключают продукты, содержащие фруктозу (сахар, фрукты, мед), и обогащенной витаминами и легко усвояемыми белками.
Нарушения нервной системы при гликогенозах. Гликогенозы — группа наследственных энзимопатий, характеризующихся избыточным накоплением гликогена в различных органах и тканях в связи с нарушением процесса его распада и синтеза. Первое заболевание из этой группы описано A. Lerevoillet в 1910 г. В 1929 г. Von Gierke установил накопление гликогена в печени и в почках.
В соответствии с клинико-биохимическими нарушениями выделяют следующие типы гликогенозов (Е. Л. Розенфельд, 1979):
I тип — гепаторенальный гликогеноз (болезнь Гирке), обусловлен дефицитом фермента глюкозо-6-фосфатазы в печени и почках;
II тип — генерализованный гликогеноз (болезнь Помпе); обусловлен дефицитом фермента альфа-1, 4-глюкозидазы;
III тип — лимитдекстриноз (болезнь Форбса, болезнь Кори1);
IV — амилопектиноз (болезнь Андерсена), обусловлен дефицитом амило-1, 4-1, 6-трансглюкозидазы;
V тип — мышечный гликогенез (болезнь Мак-Ардля), обусловлен дефицитом фермента миофосфорилазы;
VI тип — гликогенез печени (болезнь Херса), обусловлен дефицитом фермента гепатофосфорилазы;
VII тип — мышечный гликогеноз (тип Томсона), обусловлен дефицитом фермента фосфоглюкомутазы;
VIII тип — мышечный гликогеноз (тип Таруи), обусловлен дефицитом фермента фосфофруктокпназы;
IX тип — гликогеноз печени, обусловлен дефицитом фермента киназафосфорилазы в печени (болезнь Хача).
Описаны и другие менее дифференцированные формы глико-геноза.
Частота гликогенозов в разных странах колеблется 1 : 100 000 до 1 : 300 000 новорожденных. Большинство фо^ос ыи* когенозов проявляется с рождения и наследуется аутосомно-рецессивно. Развитие неврологической симптоматики при некоторых формах гликогенозов обусловлено тем, что катаболизм гликогена невозможен в связи с отсутствием специфических ферментов. Поэтому в промежутках между кормлениями развивается гипогликемический синдром с рвотой, тоническими судорогами, вегетативными нарушениями, кетонурией вплоть до тяжелой гипогликемической комы. Прием пищи значительно улучшает состоя
1 В зависимости от первичного молекулярного дефекта выделяют 4 формы лимитдекстриноза: форма А — дефицит амило-1,6-глюкозидазы и олиго-1,4-1,4-глюкантрансферазы в печени и мышцах; форма В — отсутствие обоих ферментов только в печени; форма С — дефицит амило-1,6-глюкозидазы в мышцах; форма Д — дефицит олиго-1,4-1,4-глюкантрансферазы в печени п мышцах.
382
ние. Периодически повторяющаяся кетонемия приводит к токсическому поражению центральной нервной системы. Дети вялые, адинамичные или, наоборот, легко возбудимы. Часто отмечаются нарушение сна, неврогенные рвоты, астения. Такие нарушения особенно характерны для I, II и III типов гликогенозов.
При II, III и IV типах гликогеноза патология нервной системы обусловлена также хронической гипоксией мозговой ткани вследствие гликогеновой дегенерации сердечной мышцы. Описано гипоксическое глиозное перерождение мозга с формированием бульбарных и псевдобульбарных нарушений, спастических парезов, снижением интеллекта. При V и VII типах гликогенеза наблюдается изолированное поражение мышц вследствие дефицита ферментов, участвующих в метаболизме мышечного гликогена. При мышечной нагрузке гликоген не превращается в молочную кислоту. Характерны мышечная слабость, особенно после физической нагрузки, болевые спазмы мышц «крампи». Нередко мышцы бывают плотными на ощупь и «гипертрофированными». Боли в мышцах у детей раннего возраста могут быть первыми признаками гликогеноза. В меньшей степени мышцы поражаются при II и III типах гликогеноза.
Диагноз гликогенозов ставится на основании характерной клиники, гистологического исследования биопсированного материала мышц, печени, в которых дифференцированно для каждой формы обнаруживается отложение аномального или неизмененного гликогена и снижение активности ферментов, участвующих в метаболизме гликогена.
Дифференциальный диагноз гликогенозов проводится с другими формами болезней накопления, сопровождающимися увеличением печени и селезенки и неврологическими нарушениями, такими, как болезнь Нимана-Пика, болезнь Гоше, мукополисахаридозы. Мышечные формы гликогенозов следует дифференцировать с прогрессирующими мышечными дистрофиями, миотонией, заболеваниями опорно-двигательного аппарата.
В настоящее время обнадеживающие терапевтические результаты получены при введении больным недостающих ферментов. Профилактика гипогликемических состояний основана на соблюдении диетического режима: частые приемы пищи, богатой углеводами, с низким содержанием жира. В некоторых случаях получены положительные результаты при применении гликогена. Лечение неврологических нарушений и мышечных расстройств симптоматическое.
Нарушения нервной системы при сахарном диабете. Сахарный диабет является одной из наиболее часто встречающихся форм нарушения углеводного обмена. Частота патологии в различных популяциях — 1—2%.
Сахарный диабет патогенетически гетерогенен, однако в конечном итоге при всех формах нарушается метаболическое пре-нращение глюкозы в организме, что сопровождается высоким
383
содержанием глюкозы в крови и накоплением в биологических жидкостях и тканях кетокислот и других метаболитов, оказывающих токсическое действие на нервную и сосудистую систему, печень, почки.
Сахарный диабет у детей раннего возраста проявляется, как правило, тяжелым коматозным состоянием, которое часто развивается на фоне инфекционного заболевания или через 5—6 дней после перенесенного острого респираторного заболевания. Оно может быть также спровоцировано травмой и эмоциональным стрессом. Ребенка обычно доставляют в больницу машиной скорой помощи. В неврологическом статусе: вялая реакция зрачков на свет, нистагм, плавающие движения глазных яблок, выраженные вегетативные нарушения, гипертермия, сухость слизистых оболочек, неукротимая рвота; умеренно выражен менингеальный синдром; двигательные нарушения обусловлены отеком и набуханием мозга. Может быть полиморфный судорожный синдром с преобладанием тонического компонента. Характерны рвота с запахом ацетона, анурия и полиурия.
Значительно реже у детей в возрасте 2—3 лет диабет протекает подостро и проявляется такими симптомами, как снижение аппетита, полидипсия, полифагия, полиурия. Ребенок становится малоактивным, жалуется на головную боль, боль в руках и ногах. Часто при сахарном диабете наблюдаются дерматиты, зуд в области влагалища. Патология нервной системы при подостро протекающем сахарном диабете в основном касается периферической нервной системы и характеризуется моно- и полиневритами. Описывают преходящий неврит отводящего нерва, проявляющийся сходящимся косоглазием, неврит лицевого нерва, при котором асимметрия лица обычно негрубая. Для полиневрита при сахарном диабете характерна диссоциация между ярким болевым синдромом, в основном в виде чувства жжения, и умеренной выраженностью двигательных нарушений (W. Bradley, 1974).
Патология периферического отдела нервной системы подтверждается данными электромиографии.
Астено-невротический синдром является одним из наиболее характерных нарушений центральной нервной системы при сахарном диабете.
Лечение неврологических нарушений является частью комплексной терапии сахарного диабета. По показаниям назначают седативные препараты. При поражениях периферической нервной системы показаны антихолинэстеразные препараты, витамины группы В. Рекомендуются массаж, лечебная физкультура, физиотерапия и бальнеотерапия.
Профилактика поражений нервной системы у детей при сахарном диабете основывается на диспансерном наблюдении. Большое значение имеет проведение генеалогического анализа, который в сочетании с нагрузочными тестами является необхо
384
димым условием для диагностики скрытых форм сахарного диа-беТИдиопатическая семейная гипогликемия (синдром Мак-Карри). В 1954 г. McQuarrie описал наследственное нарушение углеводного обмена, обусловленное энзиматическим блоком в инсулин-активирующей системе.
Заболевание проявляется в период новорожденности судорогами, вялостью, комой. При исследовании нервной системы выявляются миозит, косоглазие, отсутствие корнеальных, конъюнктивальных, нёбного и глоточного рефлексов. Тяжелая мышечная гипотония сочетается с отсутствием сухожильных и периостальных рефлексов. Безусловные рефлексы у новорожденных вызвать не удается. Эти симптомы являются следствием отека мозга, который быстро приводит также к нарушению дыхания и сердечной деятельности. В тяжелых случаях смерть наступает в 1-е сутки после рождения.
В более легких случаях идиопатическая семейная гипогликемия протекает пароксизмально. Проявляется чаще в возрасте 2— 3 лет тремором, эпизодами судорог. Приступы провоцируются большим содержанием белка в пищевом рационе, особенно лейцина. После криза отмечаются потливость, слабость, полифагия. Иногда тяжелые рецидивирующие кризы приводят к задержке психического развития. Обычно имеют место спонтанные ремиссии в возрасте 6—10 лет.
Диагноз подтверждается тестом толерантности к глюкозе, пробой с нагрузкой лейцином.
Дифференциальный диагноз проводят с инсуломой, недостаточностью гипофиза, надпочечников, голоданием и др.
Гипогликемия корригируется назначением АКТГ в течение 2—3 нед в убывающих дозах, начиная с 4 ED/кг. Биохимическим критерием адекватности терапии является содержание сахара натощак не менее 0,4 г/л, а также отсутствие клинических проявлений гипогликемии.
Лактатацидоз. Заболевание описано F. Hartmann в 1962 г. Патогенез заболевания обусловлен нарастающим ацидозом вследствие ферментативного дефекта в цикле Кребса. Однако неясно, представляет ли лактатацидоз истинную энзимопатию пли сущность патологии сводится к генетически обусловленному запаздыванию созревания ферментных систем.
Лактатацидоз проявляется с первых дней жизни ребенка дыхательными расстройствами: полипноэ, диспноэ, иногда с затрудненным выдохом. Нередки бронхопневмонии с вялым течением. Приступы нарушения дыхания приводят к коматозному состоянию. Резко выражен цианоз, особенно носогубного треугольника. В неврологической симптоматике доминирует судорожный синдром, очаговые неврологические симптомы отсутствуют. Мышечный тонус во время приступа резко повышен, вплоть до описто-тонуса, в межприступный период — мышечная гипотония вплоть
385
до атонии. Безусловные рефлексы угнетены, отмечается повышение рефлексов орального автоматизма; резко повышена механовозбудимость мышц. В первые 3—4 мес выявляется задержка психического развития, отмечаются гипомимия, снижение эмоций, ребенок не реагирует на яркие игрушки. Двигательные функции недоразвиты. В последующем дети отстают в психическом и, значительно меньше, в двигательном развитии.
В крови резко снижено содержание стандартных бикарбонатов (до 6 ммоль/л), pH достигает крайних значений — 6,78 при норме 7,35—7,45. Содержание молочной кислоты повышено в 10—12 раз и составляет 10—12 мэкв/л при норме 1—2 мэкв/л. Содержание сахара в крови чаще повышено. Может быть гиперала-нинемия. При оксигемометрии обнаруживается гипоксия.
Заболевание следует дифференцировать от муковисцидоза, аномалий развития легких, а также от других нарушений обмена, приводящих к ацидозу.
Лечение основано на постоянном введении растворов натрия бикарбоната из расчета 12 мэкв/кг в сутки. При судорожном статусе показаны внутривенное введение кальция глюконата, а также кокарбоксилаза, тиамин, пантотеновая кислота.
С возрастом обычно кризы становятся более редкими и менее тяжелыми или полностью прекращаются.
Наследственные болезни, обусловленные нарушениями обмена микроэлементов
Гипофосфатазия. Наследственное нарушение обмена фосфора в организме описано A. Ruthbun в 1948 г., наследуется аутосомно-рецессивно.
В патогенезе основную роль играет отсутствие или снижение активности ферментов, обеспечивающих отщепление неорганического фосфата от фосфорорганических соединений (щелочной фосфатазы). В результате резко нарушаются процессы минерализации органической матрицы кости.
Гистологическая структура костей и хрящей сходна с изменениями, наблюдаемыми при рахите. Отмечается нарушение процессов оссификации, особенно выраженное в метафизах трубчатых костей, чередование участков обызвествленной и хрящевидной ткани. Диафизы оссифицируются удовлетворительно.
При I типе гипофосфатазии симптомы заболевания присутствуют при рождении, что свидетельствует о развитии гипофосфатазии во внутриутробный период. При осмотре обращают на себя внимание множественные черты дизэмбриогенеза: диспропорция головы и окружности грудной клетки, гидроцефальная конфигурация черепа с выступающими лобными буграми. Расширены черепные швы, открыты боковые и малый родничок. Конечности маленькие, деформированные. Кости черепа и скелета мягкие. В неврологическом статусе: симптом Грефе, асимметрия лица и
386
черепа различной степени выраженности, иногда вегетативные нарушения — сухость кожи, ломкость ногтей и волос, гипертермия центрального генеза.
При исследовании двигательной сферы выявляются: олигоди-намия, синдром мышечной гипотонии, симметричное снижение сухожильных рефлексов. Патологическое положение деформированных конечностей иногда сопровождается болевым синдромом. Дети беспокойны, крик болезненный. Анорексия и рвота приводят нередко к выраженной дегидратации, эксикозу, что в значительной степени осложняет течение заболевания. Смертность при врожденной форме метаболического дефекта достигает 70%.
При II типе гипофосфатазии первые симптомы нарушения утилизации фосфорорганических соединений проявляются, как правило, в возрасте 6—7 мес. Они характеризуются рахитоподобными изменениями костей, которые выражены умеренно. Патологии со стороны черепномозговых нервов не выявляется. Отмечаются задержка темпа двигательного развития, диффузная гипотония с переразгибанием в локтевых и коленных суставах. Мышечная гипотония остается стабильной и не прогрессирует. Сухожильные рефлексы нормальные. Темп угасания безусловных рефлексов не изменен, однако физиологические астазия и абазия нередко сохраняются до 5—6 мес. Медленнее формируются активные повороты туловища. Мышечная гипотония компенсируется по мере того, как ребенок овладевает двигательными навыками. При нарастании физической нагрузки более отчетливыми становятся рахитоподобные искривления костей, особенно длинных трубчатых. Прорезывающиеся зубы мелкие, измененные по форме, коричневого или даже черного цвета.
При исследовании крови обнаруживаются снижение активности щелочной фосфатазы, гиперкальциемия (до 0,18—0,2 г/л при норме 0,08—0,12 г/л). Содержание неорганического фосфора в крови, печеночные пробы не изменены. В крови определяются также лейкоцитоз, анемия. Повышается экскреция с мочой фос-фоэтаноламина, однако следует помнить, что аналогичные изменения экскреции могут быть при целиакии, гипертериозе и цинге.
Дифференциальный диагноз гипофосфатазии проводят с другими рахитоподобными заболеваниями, артрогрипозом, синдромом голубых склер, врожденными миопатиями, патологией эндокринной системы. Комплексное лечение включает рациональное питание, ортопедические мероприятия. Иногда проводится противора-хитическое лечение в сочетании с активной терапией другими витаминами.
Пароксизмальные семейные параличи. Пароксизмальный паралич описан в 1882 г. русским врачом И. Шахновичем. В последующие годы было установлено, что существует несколько форм патологии, неоднородных по генетическому происхождению и клиническим симптомам: гиперкалиемический пароксизмальный паралич (болезнь Гамсторп), нормокалиемический пароксизмаль
387
ный паралич и гипокалиемический паралич (болезнь Вестфаля). У детей раннего возраста встречается только одна форма — периодический нормокалиемический паралич, который наследуется аутосомно-доминантно с полной пенетрантностью патологического гена (Н. А. Ильина, 1973; Р. Becker, 1977).
При патоморфологическом исследовании изменений в нервной системе не обнаруживают. При исследовании мышцы, биопсиро-ванной во время приступа, выявляется отложение гликогена.
Заболевание проявляется в возрасте 2—5 лет, иногда позднее, пароксизмами, нарастающей слабостью мышц конечностей, туловища, лица, жевательных мышц. В процесс вовлекается и дыхательная мускулатура, что при быстром нарастании мышечной слабости может привести к асфиксии и летальному исходу. Параличи обычно симметричные, характеризуются выраженной мышечной гипотонией, снижением или отсутствием сухожильных и надкостничных рефлексов. Механическая или электрическая возбудимость мышцы также снижается или исчезает (так называемая трупная реакция). Электромиографически во время приступа определяются короткий полифазный потенциал, снижение амплитуды кривой. Проксимальные мышцы поражаются в большей степени, чем дистальные. Чувствительных расстройств не наблюдается. Во время приступа отмечаются усиленное потоотделение, гиперемия лица, слюнотечение, мидриаз. Пароксизмы начинаются утром или после длительного отдыха, провоцируются приемом калия и продолжаются от нескольких дней до нескольких недель.
Содержание натрия и калия в период пароксизма остается нормальным, однако при назначении натрия хлорида состояние больных улучшается.
Заболевание у детей младшего возраста следует дифференцировать от полиомиелита и диэнцефальной эпилепсии.
Лечение должно быть направлено на задержку натрия в организме. С этой целью назначают ацетозолампд и 9-альфа-фторгид-рокортизон, внутривенное введение физиологического раствора.
Профилактика приступов состоит в назначении диеты, богатой солью, и натрийзадерживающих гормонов.
Синдром кудрявых волос Менкеса (трихополидистрофия). Наследственное заболевание обмена меди. Описано J. Menkes в 1962 г. Наследуется рецессивно сцепленно с Х-хромосомой.
В основе патогенеза трихополидистрофии лежит дефект всасывания и транспорта меди в кишечнике. В сыворотке крови снижена активность церулоплазмина, уменьшено содержание меди в тканях печени. Дефицит меди в организме приводит к нарушению формирования эластических и коллагеновых волокон, не синтезируются дисульфиды, входящие в состав кератина. Поражение мозга, вероятно, связано с нарушением мозгового кровообращения и с дефицитом цитохромоксидазы (фермента, содержащего медь). В плазме крови повышено содержание глутаминовой кислоты, снижено содержание токоферола.
388
При патологоанатомическом исследовании в мозговой ткани обнаруживают глиоз, кистозную дегенерацию белого вещества головного мозга. В артериях всего тела выявляются фрагментация и редупликация внутренней эластической оболочки и нарушение расположения эластических волокон среднего слоя. Отмечаются также уменьшение числа ганглиозных клеток в сетчатке глаза и глиальное перерождение зрительных нервов.
Наиболее ранним симптомом является нарушение терморегуляции в виде гипертермии, а затем гипотермии. Дети отказываются от пищи, плохо прибавляют в массе, затем анорексия приводит к тяжелым соматическим нарушениям. Одним из частых проявлений нарушений обмена меди является транзиторная желтуха. Резко выражены нарушения периферического кровотока, на фоне которых развиваются приступы миоклонических судорог. Частые рецидивы судорог приводят к тяжелой мышечной дистонии вплоть до опистотонуса. Очаговая неврологическая симптоматика разнообразна, нередко носит мерцающий характер. Отмечаются спастический тетрапарез, гемипарез, парезы дистальных отделов конечностей, чаще кистей, косоглазие, мелкоразмашистый нистагм, «стеклянные глаза». Снижается зрение, что приводит ко вторичной задержке психического развития.
Волосы у детей в период новорожденности нормальные, однако вновь растущие волосы гипопигментированы, крупно закручены, ломкие. Микроскопическая картина волос обозначается термином pili torti (волосы, закрученные вдоль своей оси).
При рентгенографии выявляется мозаицизм строения костей черепа, метафизарные шпоры бедра, реже плечевой и лучевой костей. Вдоль стволов длинных трубчатых костей может быть субпериостальная кальцификация. Артериографически определяются удлинение и извилистость всех сосудов, неравномерность просвета артерий и их окклюзия.
Заболевание протекает тяжело и в недпагностпрованных случаях заканчивается смертью у детей в возрасте до 3 лет. Причинами смерти являются острые нарушения мозгового кровообращения и сердечно-сосудистая декомпенсация.
Заболевание дифференцируют от внутричерепной родовой травмы, аномалий развития сосудистой системы, других обменных нарушений и дефектов кишечного всасывания.
Патогенетическая терапия состоит в парентеральном введении меди в дозах, обеспечивающих нормальное содержание микроэлемента в крови. Поддерживающая терапия: 190—220 мг солей меди на 1 кг массы тела в день. Рассчитанную дозу вводят двумя инъекциями в неделю. Проводится симптоматическая терапия, направленная на предотвращение сердечно-сосудистых нарушений и инфекционных заболеваний.
Цель медико-генетического консультирования — диагностика заболевания и его профилактика па основе выявления гетерозиготных женщин и антенатального определения пола плода.
389
Таблица 8. Редкие врожденные нарушения метаболизма, проявляющиеся у детей раннего возраста
Заболевание Дефицитный фермент Клинические проявления Биохимические нарушения Лечение
Гипераммониемия Карбамил-фосфатсин-тетаза Орнитинтранскарбамилаза Приступы рвоты и летаргии, провоцируемые белковой пищей, вплоть до тяжелой комы Такие же, как при предыдущей, но заболевание наследуется рецессивно, сцепленно с Х-хро-мосомой. Мальчики умирают на первой неделе жизни, у девочек проявления менее тяжелые Гипераммониемия Гипераммониемия, оротацидурия Ограничение альфа-кетокислот в пище То же
Цитруллине- Синтетаза Варьируют от ле- Г ипераммониемпя, Низкобел-
МИЯ аргининянтарной кис- лоты таргии, комы и смерти в период новорожденности до периодической рвоты, судорог, задержки психического развития цитруллинемия, цитруллинурия ковая диета
Ишвалери- Изовалерш- Метаболический В моче: изовале- Диета с низ-
ановая аци- Ко А-деги • ацидоз?, шгаргия и риановая кислота, ким содер-
демия дрогеназа другие неврологические симптомы, запах потных ног изовалерил-гли-цин, бета-гидро-ксиизовалериано-вая кислота жанием лейцина
Бета-метил- Бета-метил - Метаболический В моче: бета-ме- Большие
кротонил- кротонил- ацидоз, рвота, повышенная возбудимость, запах кошачьей мочи тилкротонил-гли- дозы биоти-
глицинурия КоА-карбо-ксилаза цин, бета-гидро-ксиизовалериано-вая кислота на
Альфа-ме- Альфа-ме- Варьируют в ран- В моче: альфа-ме- Низкобел-
тил-бета-гидрокси-масляная ацидурия тилацето-ацетил-КоА-бета-кето-тиолаза нем возрасте, могут быть метаболический ацидоз, рвота, гипотрофия тилацетоуксусная кислота, альфа-ме-тил-бета-гидрокси-масляная кислота и тиглилглицин ковая диета
Пропиона- Пропионил- Метаболический В моче: пропионо- Низкобел-
цидемия КоА-карбо-ксилаза ацидоз, рвота, гипотрофия вая кислота, бета-гидроксипропионовая кислота, метиллимонная кислота, пропионилглицин, глицин; гипергли-цинемия ковая диета, большие дозы биотина
390
Продолжение табл. 8
Заболевание Дефицитный фермент Клинические проявления Биохимические нарушения Лечение
Некетотическая гипер-глицинемия Фермент мозга, расщепляющий глицин Судороги, микроцефалия, задержка психического развития Повышенное содержание глицина в моче, крови и спинномозговой жидкости Не разработано
Гипер-бета-аланинемия Дефицит сульфиток-сидазы Глутароаци-дурия Пироглута,-минациду-рия Пиридоксин-зависимые судороги Бета-ала-нин-альфа-кетоглута-раттранса-миназы Сульфито-ксидаза Глутарил-КоА-дегид-рогеназа Глутатион-синтетаза Декарбоксилаза глутаминовой кислоты в нейронах Летаргия, судороги в период новорожденности В период новорожденности пирамидные симптомы, слепота, вывих хрусталика Интермиттирующий метаболический ацидоз, рвота хореоатетоз Метаболический ацидоз и гемолитическая анемия в период новорожденности В период новорожденности повышенная возбудимость, судороги В моче: повышено содержание бета-аланина, таурина, гамма-аминомасляной и бета-ами-ноизомасляной кислоты. В сыворотке повышено содержение бета-аланина В моче: повышено содержание сульфита, тиосульфата и S-сульфо-Ь-ци-стеина В моче: глутаровая, глутаконовая и бета-гидрокси-глутаровые кислоты В моче пироглутаминовая кислота » » Низкобелковая диета Щелочи 25 мг пиридоксина парентерально
А — бета-липопротеи-немия Диарея с большим количеством жира, задержка физического развития, мышечная гипотония, мозжечковая атаксия, пигментный ретинит, атрофия зрительных нервов, анемия В крови отсутствуют бета-липопро-теины, снижено содержание фосфолипидов, холесте-рола, триглицеридов Полинена-сыщенные жирные кислоты, среднецепочные триглицериды, водорастворимые препараты витаминов А,
Gm3 ганглиозидоз II типа Уридиндифосфат I (УДФ)-N-ацетилга-лактоза-мин-амино- Гаргоилизм, гирсутизм, судороги, летаргия Накопление Gm3 ганглиозида в тканях D и К Не разработано
391
Продолжение табл. 8
Заболевание Дефицитный фермент Клинические проявления Биохимические нарушения Лечение
сахартранс-фераза Уровень глюкозы
Агликоге- Уридинди- Гипогликемиче- Частые кор-
ноз фосфат-глюкозо-гликоген-трансфераза ские судороги в крови падает до 0,07—0,12 г/л мления
Подострый Ингибитор Гипотрофия, за- Дыхательный аци- Не разрабо-
некротизи- фермента держка психомо- доз или алкалоз, тано
рующий эн- АТФ - торного развития, гипогликемия,
цефалит Ли ТДФ — фосфотрансферазы мышечная гипотония, мозжечковые экстрапирамидные симптомы, судороги, поражение ядер ствола пируватемия, лак-татемия
Дефицит Фруктозо- Гипогликемиче- В моче повышено Не разрабо-
фруктозо- 1,6-дифос- ские судороги, содержание амино- тано
1,6-дифосфатазы фатаза тяжелое поражение печени, гипо-фосфатемический рахит кислот, Р-гидро-ксимолочной кислоты. В крови: ме-тионинемия, тиро-зинемия, гипофосфатемия; гипогликемическая реакция на нагрузку глюкозой
Семейная Нарушение Судороги, тетания, Гипока л ьцимия. Магний
гипомагне- транспорта прогрессирующие уровень магния в внутривен-
зиемия магния в неврологические крови менее 1,4 но, 1 мэкв/
кишечнике нарушения mjkb/л кг в день, затем внутрь 4—5 мэкв/кг в день
Г14.а ХШ. НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ
НЕРВНО-МЫШЕЧНОЙ СИСТЕМЫ
Наследственные болезни нервно-мышечной системы подразделяются на прогрессирующие мышечные дистрофии, врожденные миопатии, заболевания, протекающие с миотоническим синдромом, спинальные и невральные амиотрофии. Для перечисленных заболеваний первичный молекулярный дефект не установлен, их патогенез является предметом обширных исследований и дискуссий. В то же время описан ряд заболеваний с поражением нервно-мышечной системы и известным первичным молекулярным дефектом и патогенезом. Поэтому эти заболевания классифицируют как болезни, обусловленные нарушением обмена веществ, например, гликогеноз V типа.
Большинство наследственных заболеваний нервно-мышечной системы проявляется в школьном и юношеском возрасте и лишь некоторые могут быть диагностированы в период новорожденности или в раннем возрасте.
Спинальная амиотрофия Верднига — Гоффмана
Болезнь Верднига—Гоффмана описана G. Werdnig в 1891 г.
и J. Hoffman — в 1893 г. Это нервно-мышечное заболевание у основе лежат прогрессирующие тонейронов спинного мозга. Частота заболевания составляет 7 : 100 000 новорожденных. Наследуется аутосомно-рецессивно.
При патоморфологическом исследовании обнаруживается уменьшение числа двигательных клеток передних рогов спинного мозга, причем преимущественно поражаются большие моторные клетки (A. Marshall, L. Duchen, 1975) (рис. 116). В сохранившихся клетках отмечаются отек с уменьшением субстанции Нпссля, разрастание глии. Аналогичные изменения наблюдаются в двигательных ядрах черепномозговых нервов.
заиболее частое наследственное детей раннего возраста. В его дегенеративные изменения мо-
Рис. 116. Уменьшение количества и дегенеративные изменения моторных клеток передних рогов спинного мозга при болезни Верднига-Гоффмана
393
Рис. 117. Ребенок с врожденной формой болезни Верднига—Гоффмана
В отдельных случаях находят дегенеративные изменения в мозжечке, зрительных буграх, задних столбах. Передние корешки истончены. A. Marchall, L. Duchen (1975) и Н. Drac (1977) описали дегенеративные изменения в сенсорных невронах. Периферические нервные волокна также изменены, особенно их концевые структуры. Последние расширены, утолщены.
Мышечные волокна истончены и атрофичны. Поражается преимущественно I гистохимический тип мышечных волокон, которые в норме имеют высокую оксидазную и сукцинилдегидро-геназную активность, низкую активность фосфорилазы и незначительное содержание гликогена. II тип мышечных волокон остается относительно интактным. Эти волокна при болезни Верднига-Гоффмана гипертрофируются. С. Н. Оленев и др. (1972), I. Hausmanova, A. Fidzianska (1976), I. Hausmanova (1977) обнаруживали незрелые мышечные волокна на миотубулярной стадии.
Заболевание проявляется с рождения или в раннем детском возрасте. Различают три клинические его формы: врожденную, раннюю детскую и позднюю.
Врожденная форма диагностируется непосредственно после рождения. В некоторых случаях женщины к концу беременности отмечают ослабление движения плода. Спонтанная двигательная активность новорожденных резко ослаблена, их поза напоминает глубоко недоношенных детей: ноги разогнуты, ротированы кнаружи и плоско лежат на поверхности — поза лягушки (рис. 117). Руки также разогнуты, плечи приподняты, сопротивление пассивным движениям отсутствует. В пальцах рук мелкий тремор, они атрофичны, истончены. Из-за резкой гипотонии мышц отмечается плоскостопие с выступающей назад пяткой. На тыле стопы жировые подушечки с признаком отека. Лицо гипомимично.
Экскурсия грудной клетки ограничена из-за нарушения иннервации межреберных мышц, при относительной сохранности мышц диафрагмы. Поэтому во время вдоха происходит выпячивание живота, грудная клетка остается неподвижной. Ослабленное поверхностное дыхание является причиной возникновения
394
Рис. 118. Ребенок с ранней детской формой болезни Верднига—Гоффмана повторных пневмоний. Ранние признаки бульбарных расстройств у новорожденных могут проявляться в форме повышенной фибрилляции языка, отсутствия нёбного и глоточного рефлексов, слабого крика. В редких случаях дети рождаются с выраженными бульбарными нарушениями, которые вначале нередко диагностируются как аплазия ядер черепномозговых нервов. Дети, как правило, умирают в первые годы жизни от присоединившейся ип-теркурентной инфекции.
Ранняя детская форма проявляется чаще во втором полугодии жизни. Вначале ребенок развивается нормально. Начинает держать голову, сидеть. Состояние ухудшается в большинстве случаев после лихорадочного заболевания, травмы, прививки. Появляется слабость в ногах. Ребенок перестает становиться на ноги, сидеть, поворачиваться со спины на живот. Постепенно утрачиваются все двигательные навыки. Руки поражаются в более поздней стадии. Сухожильные рефлексы угасают. Появляются мышечные атрофии, мелкий тремор рук, фибрилляции языка. Тонус мышц резко снижен (рис. 118). Нарушение дыхания приводит к развитию гипостатической пневмонии. Заболевание в тяжелых случаях быстро прогрессирует и приводит к полной обездвиженности больных. Возможен также и более медленный темп течения заболевания, когда развиваются некоторые возрастные двигательные навыки. Однако это «улучшение» только кажущееся, так как процесс атрофии мышц нарастает и постепенно приводит на протяжении ряда лет к утрате двигательных и статических функций. Психическое развитие обычно соответствует норме. Возможна вторичная задержка психического развития в связи с огра-
395
Рис. 119. Электромиограмма ребенка 1 года 7 мес со спинальной амио-трофией Верднига—Гоффмана:
ничением двигательных возможностей ребенка и контакта с окружающим.
Поздняя форма возникает в 1,5—2 года, когда дети уже хорошо овладели возрастными двигательными навыками. Провоцирующими факторами являются травмы, инфекционные заболевания. Постепенно развивается слабость в проксимальных, а затем и в дистальных отделах конечностей. Дети при ходьбе часто падают, устают, плохо бегают; с трудом, с помощью приемов миопата поднимаются из положения сидя и лежа («вставание лесенкой»). Характерны «утиная походка», гиперлордоз поясничного отдела позвоночника. Возможно вовлечение в процесс бульбарного отдела с на-
А* синхронизированные потенциалы двигательных единиц (четырехглавая мышца бедра, локальная ЭМГ); Б — потенциалы фасцикуляций с высоким вольтажом и большой длительностью; В — вызванный М-ответ (большеберцовый нерв); Г — потенциал действия нерва (срединный нерв); Д — ритмическая стимуляция нерва (частота 10 имп/с).
рушением фонации и глотания. Нарастание мышечных атрофий сопровождается угнетением сухожильных рефлексов и развитием контрактур. Способность ходить при этой форме заболевания сохраняется до 8—10 лет.
Клиническая картина подтверждается электромиографи-
ческими исследованиями. На ЭМГ выявляются синхронизированные потенциалы фасцикуляций. При тонических реакциях (сосание, плач) электрическая активность усиливается («ритм ча-
стокола»).
При максимальных произвольных сокращениях отмечаются уреженные синхронизированные потенциалы на фоне дизритмической активности (рис. 119).
В период новорожденности заболевание необходимо дифференцировать от гипотонии мышц при соматических заболеваниях, гемолитической болезни новорожденных, нарушений электролитного обмена, генерализованных гипотоний при хромосомных аберрациях, миастении новорожденных, врожденных миопатий, врожденной мышечной атрофии, миозитов, гликогенозов, травматических поражений спинного мозга и гипотонических состояний, свя
занных с поражением мозжечка.
Мышечная гипотония, являющаяся общим симптомом нервно
396
мышечных заболеваний, в каждом отдельном случае имеет характерные клинические особенности. Наибольшие трудности представляет дифференциальная диагностика болезни Верднига—Гоффмана с врожденными миопатиями и гликогенозами. В этих случаях решающими при диагностике являются ЭМГ и биопсия мышц.
Травматические поражения спинного мозга в стадии спинального шока клинически сходны со спинальной мышечной атрофией, но общее состояние этих детей очень тяжелое и имеются характерные изменения в ликворе.
Лечение включает препараты, улучшающие обмен веществ в центральной нервной системе (аминалон, церебролизин, липоце-ребрин); средства, улучшающие трофилу мышц (токоферола ацетат, метионин, аевит, глютаминовая кислота, калия оротат, МАП) препараты, улучшающие нервно-мышечную проводимость (галантамин, прозерин, оксазил, витамины группы В, дибазол) и улучшающие капиллярный кровоток (компламин, никотиновая кислота). Показаны также АТФ, анаболические стероиды (неро-бол, дианабол, ретаболил), легкий массаж, умеренная лечебная гимнастика, углекисло-сульфидные ванны, оксигенотерапия. Для предупреждения контрактур больным в ранней стадии заболевания проводят ортопедические мероприятия в сочетании с тепловыми процедурами.
В 1900 г. А. Оппенгейм описал форму спинальной мышечной атрофии с более доброкачественным течением. В настоящее время считают, что это заболевание по своей этиологии и патогенезу сходно с болезнью Верднига—Гоффмана.
Врожденные миопатии
Врожденные миопатии — группа наследственно детерминированных аномалий развития и дифференцировки поперечнополосатой мышечной ткани. Заболевания этой группы проявляются врожденной гипотонией и слабостью скелетной мускулатуры, которая может быть выражена в различной степени и сопровождается снижением сухожильных рефлексов. Это приводит к задержке моторного развития.
Детей с врожденными миопатиями трудно вскармливать. У них нередко наблюдается дыхательная недостаточность, приводящая к частым пневмониям.
Течение врожденных миопатий стационарное. Иногда с возрастом слабость мышц может уменьшатся. Отдельные формы характеризуются прогрессирующим течением.
На основе гистологического исследования биопсированных мышц среди заболеваний этой группы выделяют следующие формы.
397
Врожденная миопатия с кристаллическими внутриядерными включениями описана Е. Jenis и др. в 1969 г., наследуется аутосомно-рецессивно. При гистологическом исследовании мышцы в ядрах и саркоплазме мышечных клеток выявляются кристаллические включения. Больные, как правило, погибают в первые месяцы жизни от рецидивирующей пневмонии и прогрессирующей дыхательной недостаточности.
Болезнь центрального стержня описана G. Shy и К. Magee в 1956 г., наследуется аутосомно-доминантно с неполной пенетрантностью. Специфическую ультраструктуру мышцы, характерную для этого заболевания, впервые описал A. Engel в 1961 г. Волокна II гистохимического типа отсутствуют. В волокнах I типа имеется характерная гомогенная центральная зона, окрашивающаяся реактивом Гомори в голубой цвет, тогда как периферическая часть волокна окрашивается в розовый цвет. При электронной микроскопии видно, что и в центральных участках мышечного волокна почти полностью отсутствуют митохондрии, уменьшено количество элементов саркотубулярной системы и гликогена. Между нормальным строением мышечного волокна по периферии и грубыми структурными изменениями в центре его существует переходная зона с умеренно выраженными нарушениями. Z-линия зигзагообразно расширена или полностью размыта.
При этой форме миопатии преимущественно страдают проксимальные мышцы конечностей. Больные хотя и медленно, но все же приобретают двигательные навыки. У них часто наблюдаются скелетные деформации: полая стопа, эквиноварусная деформация стоп, кифосколиоз. Течение заболевания относительно стационарное.
Немалиновая миопатия описана G. Shy и др. в 1963 г., наследуется аутосомно-доминантно. Гистологически в мышцах, преимущественно в волокнах I типа, обнаруживают скопление телец типа «прутьев», иногда превышающих по размерам длину миофибрилл. Ультраструктурно это фибриллярные элементы с продольной псчерченностыо, исходящие из материала Z-зоны мышечной клетки. Немалиновые структуры определяются почти во всех мышечных волокнах. В остальном строение мышечных волокон не изменено.
По внешнему виду больные несколько напоминают больных с синдромом Марфана: узкое удлиненное лицо, высокое готическое нёбо, прогнатизм нижней челюсти, килевидная грудная клетка, относительная арахнодактилия. Преимущественно страдают проксимальные мышцы конечностей, мышцы лица и туловища. Течение заболевания доброкачественное.
Врожденная диспропорция типов волокон описана М. Brooke и W. Engel в 1969 г. По-видимому, это группа заболеваний, при которых в одних случаях наступает гипертрофия волокон одного гистохимического типа, в других — гипотрофия одного из типов
398
волокон. Обычно наряду с диспропорцией волокон имеют место неспецифические дистрофические изменения в виде центрально расположенных ядер, фрагментации и гомогенизации миофибрилл, изменения Z-линий, митохондрий, саркоплазматического ретикулума.
С рождения отмечается выраженная мышечная гипотония. Двигательные функции развиваются с опозданием. С возрастом двигательный дефект значительно компенсируется.
Миотубулярная миопатия описана A. G. Spiro и др. в 1966 г., наследуется аутосомно-рецессивно. Свое название заболевание получило в связи с тем что 30—85% мышечных волокон имеют центрально расположенные ядра, чем напоминают мышцу на мио-тубулярной стадии развития зародыша (8—10 нед). По-видимому, такое строение мышечных волокон является следствием задержки их созревания, а не результатом дегенеративного процесса.
Заболевание проявляется с рождения или в раннем детском возрасте прогрессирующей слабостью проксимальных, а иногда и дистальных групп мышц конечностей. Затем присоединяются атрофии дыхательной мускулатуры, мышц туловища, мимических и глазодвигательных мышц, нарушаются дыхание и глотание.
Заболевание быстро прогрессирует. У гетерозиготных носителей патологического гена наблюдается субклиническое поражение мышечной ткани с меньшим процентом пораженных волокон.
Врожденная злокачественная мышечная дистрофия описана в 1957 г. В. Banker, наследуется аутосомно-рецессивно. При пато-морфологическом исследовании определяются выраженная атрофия мышечных волокон конечностей и туловища, вплоть до полного их исчезновения и замещения мышцы соединительной тканью. Сохранившиеся мышечные волокна разнокалиберны. Ядра расположены в центре мышечной клетки. Признаков регенерации или воспаления мышцы не отмечается.
Для этой нозологической формы характерны птоз и нарушение акта глотания, раннее появление сгибательных контрактур. Дети обычно погибают на 1-м году жизни от инфекции дыхательных путей.
Мышечная дистрофия с офтальмоплегией описана у новорожденных Е. К. Hurwitz и др. в 1969 г., тип наследования — аутосомно-рецессивный.
При гистологическом исследовании биопсированной мышцы обнаруживают изменения, характерные для первичного миоди-строфического процесса: центрально расположенные ядра, их вакуолизацию, гиалиновую дегенерацию п атрофию мышечных волокон.
Симптомы поражения мышц появляются в первые месяцы жизни или пепосредствено после рождения. Ограничен объем движения глазных яблок, иногда вплоть до полной офтальмоплегии. Мышечный тонус скелетных мышц снижен, дети вяло сосут, крик тихий. В дальнейшем функция мышц несколько улучшается, но
399
офтальмоплегия и слабость проксимальных групп мышц конечностей остаются постоянными симптомами. Течение заболевания — медленно прогрессирующее.
Митохондриальные миопатии. К врожденным миопатиям относится также группа так называемых митохондриальных миопатий, клинически отличающихся от выше описанных главным образом прогредиентностью течения.
Мегаконеальная миопатия описана G. Shy и N. Go-natas в 1964 г., наследуется аутосомно-рецессивно. Гистохимически и при электронной микроскопии в мышцах выявляются митохондрии, увеличенные до 1—2ц в диаметре, особенно в волокнах I гистохимического типа. Каких-либо других изменений, указывающих на дистрофический процесс в скелетной мышце, не обнаруживают.
Заболевание быстро прогрессирует и в течение нескольких лет приводит к почти полной обездвиженности больных. Угасают сухожильные рефлексы, развиваются мышечные атрофии и деформации скелета. Сердечная мышца остается интактной.
Мегаконеальная миопатия с гиперметаболизмом описана A. Ernster и др. в 1959 г., наследуется аутосомнорецессивно. Гистологически определяются умеренные дегенеративные изменения в мышечных волокнах. При электронной микроскопии выявляется большое количество митохондрий различной величины с необычными зигзагообразными или шаровидными включениями и измененной внутренней структурой. В митохондриях повышены общее содержание белка, и активность ци-тохромоксидазы. В изолированных митохондриях определяется гиперметаболизм вследствие нарушения фосфатных акцепторов и повышения активное??! эндогенной магнийзависимой АТФ. Помимо мышечных нарушений у детей отмечаются гипотрофия несмотря на повышенный аппетит и жажда без полиурии.
Плеокониальная миопатия описана G. Shy и др. в 1966 г., наследуется аутосомно-рецессивно. При цитохимическом исследовании мышцы выявляется большое количество митохондрий нормального размера, нарушающих фибриллярную архитектонику мышечной клетки. Встречаются также волокна с центрально расположенными ядрами, умеренно выражено разрастание соединительной ткани.
На фоне имеющейся мышечной слабости у больных эпизодически наблюдаются приступы жажды, рвоты, профузного пота. Во время приступа мышечная слабость усиливается вплоть до вялой тетраплегии с отсутствием сухожильных рефлексов. Клинически заболевание напоминает периодический нормокалиемиче-ский паралич, но отличается отсутствием терапевтического эффекта при введении солей натрия. Течение прогредиентное, однако с возрастом темп прогрессирования несколько замедляется.
При всех врожденных миопатиях изменения на ЭМГ указывают на первично-мышечный характер патологии. Заболевания этой 400
группы следует дифференцировать от спинальной амиотрофии Верднига — Гоффмана, травмы шейного отдела позвоночника в родах, врожденных миелодисплазий; болезней, обусловленных нарушением обмена аминокислот и липидов; травматических невритов и инфекционных поражений нервной системы. Дифференциальный диагноз проводится на основании гистологического исследования биопсированных мышц (V. Dubowitz, М. Brooke, 1973). Лечение аналогично таковому при болезни Верднига — Гоффмана.
Прогрессирующие мышечные дистрофии (ПМД)
ПМД — обширная группа наследственных заболеваний, у детей рассматриваемого возраста встречаются лишь немногие из них.
В целом группа ПМД характеризуется прогрессирующей сла-
бостью, утомляемостью и атрофиями скелетных мышц, причем иногда поражается и сердечная мышца. При электромио-графическом исследовании отмечается снижение амплитуды осцилляций, большое число полифазных потенциалов (рис. 120). При исследовании биопсированных мышц в них определяются дистрофические изменения, иногда сопровождающиеся разрастанием соединительнотканных элементов, нарушениями структуры и проницаемости стенки сосудов.
Патогенез ПМД, по-видимому, неоднозначен для всех нозологических форм. Предполагается, что наряду с первичным нарушением структуры и метаболизма мышечного волокна при ряде заболеваний генетически детерминированный первичный молекулярный дефект приводит к нарушению нейротрофического влияния на мышечную ткань; в других случаях имеет место первичное нарушение структуры мембран клеток; не исключено, что в ряде случаев источником дистрофических изменений в мышце являются нарушения трофики,
Рис. 120. Электромиограмма ребенка 2,5 лет с прогрессирующей мышечной дистрофией Дюшенна:
А — запись максимального произвольного сокращения (большеберцовая мышца, глобальная ЭМГ); Б — многофазный потенциал и низкоамплитудные двухфазные потенциалы малой длительности, В — вызванный М-ответ (срединный нерв); Г — потенциал действия нерва (срединный нерв); Д — снижение величины амплитуды М-ответа после ритмической серии раздражений
14 143
401
обусловленные сосудистой патологией или дефектом соединительной ткани (Л. О. Бадалян, 1971, 1974; W. Bradley, 1975; A. McComas, 1977; I. Hausmanova-Petrusewicz, 1977).
При биохимических исследованиях могут выявляться усиленный распад мышечных белков, нарушения трансмембранного транспорта ионов и полимерных молекул. В крови могут быть сдвиги кислотно-щелочного равновесия метаболического и дыхательного генеза. Описывают также неспецифические изменения углеводного обмена, гипераминоацидурию, накопление в мышцах липидов и др. Постоянными характерными симптомами грубого дистрофического процесса являются повышение активности креатинфосфокиназы в сыворотке крови и повышение содержания креатинина в моче.
ПМД дифференцируют с амиотрофией Верднига—Гоффмана, врожденными прогрессирующими миопатиями, гликогенозами, миопатиями вследствие накопления липидов, последствиями полиомиелита и других нейроинфекций, дерматомиозитом.
Лечение ПМД аналогично лечению спинальной амиотрофии Верднига—Гоффмана.
Прогрессирующая псевдогипертрофическая мышечная дистрофия Дюшена — наиболее часто встречающаяся форма ПМД у детей раннего возраста (27:100 000 новорожденных). Заболевание описано G. Duchenne и S. Cruveilheir в 1853 г. Болеют почти исключительно мальчики, поскольку рецессивный ген локализован в Х-хромосоме. Пенетрантность мутантного гена — 100%. Редкие случаи заболевания у девочек связывают либо с инактивацией Х-хромосомы, содержащей нормальный аллель, либо с существованием клинически аналогичного заболевания, но обусловленного аутосомным геном.
Особенностью гистологических изменений при этой форме патологии являются выраженные дегенеративные изменения мышечных волокон с наличием некроза, фагоцитоза и замещение их жировой и соединительной тканью.
Заболевание проявляется слабостью проксимальных мышц ног и тазового пояса. Одновременно или несколько позже в патологический процесс вовлекается мускулатура плечевого пояса и верхних конечностей. Характерны осиная талия, крыловидные лопатки, симптом свободных надплечий, утиная, раскачивающаяся походка. Уже на ранних стадиях заболевания наблюдаются псевдогипертрофии мышц, особенно ягодичных и икроножных. Рано формируются контрактуры. Угасают сухожильные и надкостничные рефлексы. В поздних стадиях поражаются мышца сердца, дыхательная мускулатура, мышцы лица. Кроме этого, нередко наблюдаются такие вегетативные и эндокринные расстройства, как ожирение, гипергидроз. Характерно снижение интеллекта по типу органической деменции.
Учитывая локализацию мутантного гена в Х-хромосоме, предложена профилактика рождения больных детей путем антенаталь-
402
ого определения пола плода гетерозиготных женщин. Сыновья этих женщин оказываются пораженными с вероятностью 50%. Высокий риск и тяжесть заболевания оправдывают прерывание беременности при плодах мужского пола.
Поясно-конечностная прогрессирующая мышечная дистрофия Эрба—Рота. Первые сообщения об этом заболевании принадлежат W. Erb (1882) и В. К. Роту (1890). Заболевание дебютирует не только в дошкольном или юношеском возрасте, как предполагали описавшие его исследователи, возможно начало его и в раннем детском возрасте. Наследуется заболевание аутосомно-рецессивно. Первыми симптомами являются слабость и атрофия мышц тазового пояса и проксимальных групп мышц ног. Появляются трудности при подъеме на лестницу, при вставании из положения сидя. При попытке подняться из положения лежа больной совершает это действие в несколько этапов с помощью рук (вставание «лесенкой»). Позже вовлекаются в патологический процесс мышцы туловища и верхних конечностей. Лопатки выступают, особенно при отведении рук в стороны («крыловидные» лопатки). Если попытаться приподнять больного, держа его за подмышечные области, то плечи у него свободно поднимаются вверх и голова как бы проваливается между ними (симптом свободных надплечий). Походка больных становится переваливающейся (утиная походка), выражен поясничный лордоз, грудь и живот выпячиваются вперед. Лицо гипомимично («лицо сфинкса») с выступающими губами (губы тапира). Характерна осиная талия. Значительно реже у детей раннего возраста наблюдается нисходящий тип поражения. Динамика распространения патологического процесса у детей раннего возраста лишь начинает выявляться. Более четко она прослеживается в последующие годы.
Болезнь медленно прогрессирует. Угнетаются и исчезают сухожильные рефлексы. Постепенно диффузное поражение мышечной ткани распространяется и на гладкую мускулатуру, сердечную мышцу: обнаруживаются дистрофия миокарда, вялая перистальтика кишечника. При значительной обездвиженности развиваются дыхательная недостаточность, обусловленная также атрофией межреберных мышц, и застойные явления в легких. В таких случаях респираторные инфекции являются весьма опасными для жизни. Однако у детей раннего возраста эта стадия заболевания, как правило, не встречается.
Прогрессирующая мышечная дистрофия с контрактурами Дрейфуса описана J. Drefus в 1928 г. Заболевание наследуется рецессивно, сцеплено с Х-хромосомой, болеют только мальчики. Необычно интенсивное разрастание соединительной ткани в мышцах — отличительная патоморфологическая особенность этой формы патологии.
Заболевание начинается на 3—4-м году жизни с нарастающей слабости в мышцах тазового пояса, позднее присоединяется поражение мышц плечевого пояса. Характерные клинические
14*
403
черты — относительно медленное прогрессирование мышечной слабости и быстрое формирование контрактур. Первыми формируются сгибательные контрактуры локтевых суставов. Укорочение мышц голени и стопы приводит к изменению походки с опорой на большие пальцы. Дистрофические изменения захватывают и сердечную мышцу.
Течение заболевания — медленно прогрессирующее. Эту форму ПМД необходимо дифференцировать с полиартритами, миозитами, деформирующими артрозами.
Нервно-мышечные заболевания, сопровождающиеся миотомческим феноменом
Под миотоническим феноменом, на основе которого объединяется группа различных по своему генезу нозологических форм, подразумевается неспособность мышцы быстро расслабляться после однократного сокращения или серии резких сокращений.
На ЭМГ при миотониях находят длительный потенциал последействия, который остается выраженным как при непосредственном раздражении мышцы, так и при воздействии на мышцу через нерв.
Заболевания этой группы включают несколько генетически различных форм: собственно миотонии, миотоническую дистрофию и некоторые другие нозологические формы.
Первичные биохимические дефекты при миотонических синдромах и их патогенез не установлены. У ряда больных обнаружено снижение содержания в мышцах арахидоновой, олеиновой и линолиновой кислот, тогда как содержание жирных кислот С 20 : 2 и С 20 : 3 резко увеличено, что свидетельствует о патологии мембран. В некоторых случаях в крови больных увеличена концентрация калия, может быть слегка повышена утилизация кальция и замедлено его пассивное выведение с мочой (Р. Becker, 1977). Однако прямой зависимости между этимч изменениями и выраженностью миотонического феномена обычно не отмечают.
Характерными для миотонического феномена считаются пато-морфологические изменения, обнаруживаемые в терминальной иннервации мышечных волокон. Это могут быть чрезмерные ветвления концевых нервных окончаний или увеличение размеров концевых пластинок. Соответственно концевой иннервации изменяются элементы субневрального аппарата.
Из заболеваний, характеризующихся миотоническим феноменом, у детей раннего возраста встречаются аутосомно-доминантно наследуемая врожденная миотония Томсена, аутосомно-рецессивная миотония и миотоническая дистрофия.
Врожденная миотония Томсена описана J. Thomsen в 1876 г. Заболевание проявляется уже на 1-м году жизни. Больные имеют атлетическое телосложение, у них хорошо контурируются мышцы плечевого пояса, особенно дельтовидные, жевательные мышцы.
404
Трудность расслабления глоточных мышц вызывает нарушение глотания и нередко расценивается как неврогенный спазм. Миото
ническая реакция в мимических мышцах усиливается при сосании и на холоде. У грудных детей чаще наблюдается перкуссион-
ная миотония: при постукивании по мышцам на месте удара образуется валик или ямка. Активная миотония, то есть трудность расслабления мышц в начале произвольного движения, появляется в более позднем возрасте. Однако если она бывает у маленьких детей, то преимущественно локализуется в жевательных, глотательных, мимических мышцах и в кистях. Проявление активной миотонии в мускулатуре лица приводит к мимическим спазмам, а в руках она может быть ошибочно расценена как отсутствие редукции хватательного рефлекса.
Врожденная миотония прогрессирует крайне медленно. В молодом возрасте нередко наступает стабилизация процесса. При этой форме часто наблюдаются боли в мышцах, особенно в холодное время года. Миотоническая реакция на протяжении всего периода заболевания остается локальной главным образом в мускулатуре лица, жевательной, глотательной и в мышцах верхних конечностей.
Аутосомно-рецессивная миотония выделена Р. Becker в 1977 г. От предыдущей формы помимо характера наследования, она отличается более поздним началом (2—15 лет), генерализованностью поражения мышц и прогрессирующим течением. Прогредиентность выражается не только в постепенной генерализации перкуссионной и механической миотонической реакции, но и в развитии, спустя 6—8 лет от начала заболевания, слабости и атрофии мышц, главным образом мышц плечевого пояса и проксимальных мышц рук. Соответственно при гистологическом исследовании биопси-рованных мышц на поздней стадии заболевания помимо признаков, свойственных миотониям, обнаруживают умеренно выражен-
ные дегенеративные изменения, сходные с изменениями мышц в ранней стадии прогрессирующей мышечной дистрофии. При этой форме описано также расширение саркотубулярной системы в мышце.
Миотоническая дистрофия Куршмана—Штейнерта—Баттена описана Н. Steinert, F. Batten, Н. Curschmann в 1909 г., наследуется аутосомно-доминантно.
Начальные клинические проявления миотонии и миотонической дистрофии у детей раннего возраста очень схожи. У новорожденных она может проявляться только наличием миотонической реакции. По мере роста ребенка и прогрессирования заболевания все более четкими становятся клинические признаки, с помощью которых удается разграничить эти формы патологии.
Миотоническая дистрофия характеризуется выраженной прогредиентностью течения в виде нарастающей мышечной слабости, мышечных атрофий с преимущественной дистальной локализацией, эндокринными нарушениями, вегетативно-трофическими
405
расстройствами (облысение, половой инфантилизм, себорея). У всех больных к 20 годам развиваются катаракты. Клиника заболевания полиморфна. Иногда на первый план выступают симптомы миотонии, а дистрофические изменения присоединяются в поздней стадии. Однако встречаются формы с преимущественно дистрофическими изменениями. Их можно назвать дистрофической миотонией.
Разграничение миотонии и миотонической дистрофии может быть проведено посредством гистологического исследования биоп-сированной мышцы. Изменения мышц при миотонической дистрофии занимают промежуточное положение между мышечными дистрофиями и неврогенными амиотрофиями. Помимо дистрофических изменений, характерных для первично-мышечных заболеваний, наблюдается группировка атрофированных мышечных волокон, указывающая на вовлечение в патологический процесс периферического мотонейрона.
В ряде случаев при миотонической дистрофии отмечается поражение периферических нервов.
При электронейромиографическом исследовании определяется резкое снижение скорости проведения импульса, преимущественно в ногах. Это можно, по-видимому, связать с преобладанием в нижних конечностях миотонических спазмов, мышечной ригидности и усилением тонической импульсации, проходящей по нерву (И. А. Скворцов и др., 1977).
Описана также врожденная форма миотонической дистрофии, которая проявляется в период новорожденности (Н. Sarnat, S. Silbert, 1976). У детей могут быть артрогриппозоподобные деформации нижних конечностей, генерализованная мышечная гипотония, слабость мышц глотки, лица, диафрагмы, гладкой мускулатуры кишечника. Поражается также сердечная мышца, характерны врожденные катаракты. Заболевание постепенно приводит к развитию дыхательной недостаточности.
В отношении нозологической самостоятельности врожденной миотонической дистрофии нет единого мнения. Одни исследователи полагают, что это заболевание определяется другой мутацией рецессивного характера. По мнению других, раннему проявлению заболевания способствует наличие заболевания у матери, иногда в субклинической форме. Косвенным свидетельством в пользу последней точки зрения может быть тот факт, что при наличии у пробанда врожденной формы заболевания оно в подавляющем большинстве случаев наследуется по линии матери.
Диагноз заболеваний, характеризующихся миотоническим феноменом, в раннем возрасте может быть поставлен только при тщательном генеалогическом анализе и использовании электрофизиологических и гистологических исследований. Эти заболевания следует дифференцировать с парамиотонией, гипотиреозом, синдромом Корнелии де Ланге, синдромом Адье, парадоксальной миотонией, нейромиотонией. При гипотиреозе, синдромах Корне-
406
де Ланге и Адье наряду с миотонической реакцией мышц я имеется еще клиническая картина, характерная для этих заболеваний.
A. Eulenburg в 188о г. описал заболевание, характеризующееся миотонической реакцией мускулатуры лица и мышц языка, особенно резко выраженной у новорожденных при холодовых раздражениях. У детей более старшего возраста заболевание проявляется преимущественно миотонической реакцией лицевой мускулатуры на холоду. Наследуется аутосомно-доминантно. При парамиотонии Эйленбурга миотоническая реакция не индуцируется движением и исчезает в тепле.
При парадоксальной миотонии наряду с миотонической реакцией, индуцируемой холодом и движением, бывают эпизоды мышечной слабости длительностью от 1 мин до 3 дней. Хотя слабость агравируется холодовым раздражением, но она не исчезает и в тепле. Сила мышц несколько повышается при нагрузке калием, а глюкозо-инсулиновая нагрузка, которая снижает уровень калия в крови, наоборот, усиливает слабость мышц.
Для нейромиотонии характерны мышечные фасцикуляции, болезненные длительные тонические спазмы, часто в начале движения, повторные движения не сопровождаются полным расслаблением мышц. Постепенно развиваются легкие флексорные контрактуры, лицо становится маскоподобным, появляется мышечная ригидность, сохраняющаяся даже во сне. На ЭМГ, записанной с покоящейся мышцы, обнаруживается активность различной плотности, короткая группа потенциалов с высокой частотой разряда. При этой форме патологии удовлетворительный эффект дают препараты гидантоина.
Лечение миотонических синдромов симптоматическое. Рекомендуется диета с ограничением калия, повышенным содержанием продуктов, содержащих кальций. В период новорожденности необходимо исключить холодную пищу и другие виды охлаждения. В более старшем возрасте назначаются медикаментозные препараты: стероидные гормоны, АКТГ, препараты кальция, хинина, тропацин, а также массаж и дозированные упражнения, тепловые процедуры.
Миастения
Миастения — группа заболеваний, связанных с нарушением проводимости в мионевральных синапсах, клинически проявляющихся преходящей мышечной слабостью. У новорожденных различают 2 основные их формы:
миастению у детей, рожденных от матерей, страдающих этим заболеванием. Эти дети в 10—15% случаев имеют преходящие симптомы заболевания, так как вещество, блокирующее синапсы, проникает через плаценту и в последующем в организме ребенка по образуется;
407
врожденную форму миастении, когда матери в большинстве случаев здоровы, а у детей с рождения наблюдается развернутая клиника заболевания. Она встречается очень редко. В настоящее время в литературе описано около 20 случаев.
В основе заболевания лежит нарушение проведения нервного импульса в результате функциональной недостаточности синаптического ацетилхолина. Имеется несколько точек зрения относительно патогенеза нарушения нервно-мышечной передачи.
Снижение активности ацетилхолина может быть связано с увеличением холинэстеразы, разрушающей ацетилхолин. Согласно аутоиммунной теории, гиперплазированная вилочковая железа вырабатывает специфические антитела против рибонуклеопротеина, являющегося акцептором ацетилхолина, что патофизиологически аналогично недостаточности последней. У больных в 30— 50% случаев находят специфические антитела к скелетным мышцам и вилочковой железе. Но все же в настоящее время еще не доказано, что выявленные аутоимунные антитела специфически влияют на мионевральный синапс. Следует также учесть, что образование аутоантител может быть следствием, а не причиной заболевания.
Гистологически в мышцах определяются разрастание и удлинение концевых нервных окончаний.
Клинические симптомы могут появляться сразу после рождения, в отдельных случаях через несколько часов или дней. Симптомы у новорожденных полиморфны: общая мышечная гипотония, ослабленный болезненный крик, нарушение дыхания, угнетение безусловных рефлексов. Характерна постепенно развивающаяся утомляемость мышц лица и бульбарной мускулатуры, приводящая к нарушению глотания. Постепенно нарастает слабость-наружных глазных мышц, развивается птоз. Моносинапти-ческие рефлексы мышц сохраняются, в то время как тонические, миотатические отсутствуют, так как физическое сокращение мышц дольше остается интактным, чем тоническое.
При транзиторных формах миастении симптоматика исчезает через несколько дней. Если миастенические симптомы остаются длительно, то надо думать о врожденной форме миастении. По степени тяжести клинические проявления могут варьировать от незначительных, диагностируемых только электромиографически, до тяжелых параличей. Дети от матерей с миастенией, даже если они кажутся здоровыми после рождения, должны в течение первых дней жизни тщательно наблюдаться. При ЭМГ находят быстрое «уставание» мышц при повторном раздражении фарадическим током, что обозначается как миастеническая реакция.
Дифференциальная диагностика не представляет трудностей, если у матери, страдающей миастенией, рождается гппотоничный ребенок. Редкие случаи врожденной миастении следует дифференцировать с другими неонатальными мышечными гипотониями, такими, как болезнь Верднига—Гоффмана, гликогенезы, мие
408
лит, врожденные миопатии, травматическое повреждение спинного мозга при рождении, супраспинальная гипотония, возникшая в результате перенесенной асфиксии или внутричерепной родовой травмы, нарушение электролитного баланса, гипотонии при хромосомных заболеваниях.
В противоположность болезни Верднига—Гоффмана сухожильные рефлексы при миастении сохранены и только тоникомиотатические отсутствуют. Быстрая утомляемость лицевой мускулатуры и сохранная ее функция непосредственно после сна — важный признак миастении.
Диагностике помогают электромиографические исследования, а также проба с прозерином. Через 10—15 мин после введения 0,1 мл 0,05% раствора прозерина миастеническая реакция исчезает.
Транзиторная форма миастении обычно проходит самопроизвольно в течение нескольких дней, редко длится — 3—6 нед, в отдельных случаях — до 16 нед. Тяжелые врожденные формы нуждаются в постоянном наблюдении и лечении антихолинэстераз-ными препаратами. Детям назначают диету, богатую солями калия, или проводят эндогенную стимуляцию калиевого градиента антагонистами альдостерона. Для улучшения обмена веществ в мышечной ткани применяются витамин Е, калия оротат, анаболические гормоны, АТФ, МАП.
Глава xiv. ФАКОМАТОЗЫ
Факоматозы — группа заболеваний, при которых отмечается сочетанное поражение нервной системы, кожных покровов и иногда внутренних органов. Facos — обозначает пятно. Пигментированные, депигментированные пятна, ангиомы кожных сосудов, фибромы, папилломы и целый ряд других кожных изменений являются характерными симптомами факоматозов и имеются уже при рождении.
Нервная система и кожные покровы формируются из одного эктодермального зародышевого листка, поэтому при нарушениях эмбрионального развития возникают сочетанные нейрокожные поражения. Факоматозы относят к экто-, мезодермальным дисплазиям (кровеносные сосуды и внутренние органы происходят из мезодермы), но в отличие от пороков развития при этих заболеваниях наблюдается прогрессирование отдельных симптомов. Генетические факторы играют определенную роль в происхождении факоматозов, но каковы молекулярные механизмы этой патологии, остается неясным.
В группу факоматозов входят довольно редкие заболевания, однако знание их клинических особенностей имеет практическое значение, так как помогает решать дифференциально-диагностические вопросы при обследовании больных с судорогами, слабоумием, подозрением на опухоль мозга и т. д. Несколько чаще, чем другие факоматозы, встречаются: нейрофиброматоз Реклингаузе-на, туберозный склероз Бурневиля—Прингля, энцефалотригеми-нальный ангиоматоз Штурге—Вебера, атаксия-телеангиэктазия Луи-Бар, цереброретинальный ангиоматоз Гиппель-Линдау. Последнее заболевание у детей младшего возраста проявляется глазными симптомами, а неврологические нарушения появляются значительно позднее. Ниже приведено описание факоматозов, при которых изменения со стороны нервной системы выявляются в раннем возрасте.
Нейрофиброматоз (болезнь Реклингаузена). Прогрессирующее системное заболевание, описанное F. Recklingausen в 1882 г., наследуется по аутосомно-доминантному типу.
При патоморфологическом исследовании выявляют опухоли нервных стволов в коже, подкожной клетчатке. Наиболее частая локализация опухолевидных образований — туловище и конечности. Нередки случаи локализации опухолей на черепномозговых нервах, спинномозговых корешках, во внутренних органах брюшной полости и средостении. Деструкция костей черепа, позвоночника и ребер является результатом давления на них прилежащих
410
узлов. Часто обнаруживают углубление дна турецкого седла, участки обызвествления. Узлы состоят из нервных элементов волокнистой соединительной ткани (отсюда и название неиро-фиброматоз). При центральном фиброматозе это— невриномы, арахноэндотелиомы, астроцитомы, эпендимомы, фибромы, гли-ОМЫ.
Первые характерные симптомы — пятна кофейного цвета на коже _ обнаруживаются у детей сразу после рождения. Опухолевые образования по ходу нервных стволов появляются на 2-м полугодии жизни, но в отдельных случаях их можно обнаружить в период новорожденности. Опухоли по ходу черепномозговых нервов проявляются парезами соответствующих мышц. Часто поражаются слуховой и зрительный нервы.
Нейрофиброматозные узлы могут быть обнаружены в области верхних век, в склере, роговой оболочке, радужке, на диске зрительного нерва. Глазные симптомы при болезни Реклингаузена наблюдаются в 20% случаев и иногда бывают единственным признаком заболевания.
При внутримозговой локализации опухолей появляются двигательные и общемозговые нарушения. Нейрофибромы могут локализоваться в полушариях мозга, черве и полушариях мозжечка. Клинические проявления идентичны симптомам интрацеребральных опухолей той же локализации. Часто пораженными оказываются корешки шейного отдела спинного мозга и конский хвост. Поскольку опухоли в этих случаях развиваются в замкнутом пространстве, наряду с корешковыми нарушениями возникают симптомы компрессии ствола мозга, спинного мозга, расстройства зрения. У детей со спинальной формой развиваются вялые парезы нижних конечностей с потерей сухожильных рефлексов, чувствительными нарушениями. Описаны случаи заболевания с локализацией нейрофибром в средостении, забрюшинном пространстве.
У больных с нейрофиброматозом нередко можно наблюдать диспластические черты развития: асимметрию лицевого скелета, эпикант, прогнатизм, деформацию грудной клетки, синдактилию, что косвенно подтверждает дизонтогенетическую теорию развития заболевания.
Течение заболевания прогрессирующее. Прогноз зависит от распространенности нейрофиброматоза и его локализации.
Показана симптоматическая терапия. В случаях, доступных оперативному вмешательству (единичные узлы), опухоли удаляют. Иногда эмпирически применяют гормональную терапию.
Энцефалотригеминальный ангиоматоз (Болезнь Штурге—Вечера). Заболевание относится к наследственно обусловленным ангиоматозам. Характеризуется классической триадой симптомов: ангиомой лица, глаукомой, ангиомой сосудистой оболочки моз-Га и судорогами. Первые описания клиники заболевания принадлежат офтальмологу В. Стурге (1879). Ф. Вебер в 1922 г.
411
Рис. 121. Ребенок 10 мес с энцефалотригеминальным ангиоматозом
обнаружил у этих больных на краниограммах двухконтурные тени, которые были обусловлены отложением кальция в сосудах. Заболевание наследуется по аутосомно-доминантному типу, однако имеются данные о возможности аутосомно-рецессивного наследования.
Патоморфологически находят ангиоматоз кожи лица, конъюнктивы, склеры, мозговых оболочек. Аневризматические расширения вен могут распространяться на кору мозга и мозжечка, спинной мозг, которые в этих местах часто бывают атрофированы.
Заболевание в большинстве случаев проявляется с рождения. Ангиома на лице располагается по ходу одной или нескольких ветвей тройничного нерва, распространяясь иногда на кожу век и конъюнктиву глаза (рис. 121). В период новорожденности ангиома бледно-розового цвета, позже она становится более яркой. В отдельных злокачественно протекающих случаях наблюдаются изъязвляющиеся ангиомы по типу сухого некроза. Ангиомы чаще односторонние.
Другим наиболее частым симптомом у новорожденных являются судороги. Вначале они могут проявляться отдельными подергиваниями мимической мускулатуры на стороне, противоположной ангиоме. Затем судороги принимают генерализованный характер. Наряду с выраженными судорожными приступами наблюдаются отдельные пароксизмы в виде общих вздрагиваний, застывания, кивков. Двигательные нарушения проявляются нестойкими парезами, часто возникающими после судорожного приступа. В дальнейшем по мере прогрессирования заболевания парезы становятся более выраженными, нарастает мышечный тонус, повыша-
412
Рис. 122. ЭЭГ ребенка с энцефалотригеминальным ангиоматозом
ются сухожильные рефлексы. Дети отстают в психическом развитии.
Глакуома формируется обычно в более поздней стадии заболевания и встречается в 70% случаев.
При болезни Штурге—Вебера часто наблюдаются другие аномалии развития: высокое нёбо, трезубец, грыжи, крипторхизм, катаракта, гетерохромия и гиперплазия радужных оболочек. Классическая триада симптомов (ангиомы лица, судороги, глаукома) встречается приблизительно в 20% случаях, чаще наблюдаются бисимптомные и моносимптомные формы (Л. В. Калинина, 1973). Для выявления последних необходимо динамическое наблюдение и дополнительные методы исследования: краниография, электроэнцефалография, повторный осмотр глазного дна, люмбальная пункция. На краниограмме уже у новорожденных
413
иногда обнаруживают отдельные петрификаты, двухконтурные кальцинаты выявляются несколько позже. На ЭЭГ — диффузные и очаговые изменения биоэлектрической активности, в ликворе — повышение концентрации белка (рис. 122). Некоторые исследователи при болезни Штурге—Вебера находили хромосомные нарушения: трисомию 22-й хромосомы, дополнительную 5-ю хромосому. Однако эти нарушения, по-видимому, не имеют этиологического значения.
При тщательном генеалогическом анализе у родственников больных иногда можно обнаружить ангиомы кожи, судороги, двигательные нарушения.
Лечение симптоматическое: общеукрепляющее, противосудорожное. В отдельных случаях у детей старшего возраста благоприятный эффект дает рентгенотерапия, при необширных кожных и мозговых ангиомах — хирургическое лечение.
Туберозный склероз (болезнь Бурневиля—Прингля). Заболевание описано D. Burneville в 1862 г. В 1880 г. J. Pringle выделил его в самостоятельную нозологическую форму. Заболевание наследуется по аутосомно-доминантному типу с неполной пенетрантностью мутантного гена. Частота патологии среди умственно отсталых составляет 0,3 % •
При патоморфологическом исследовании в мозге обнаруживают узелки или бугорки белесоватого цвета, склонные к обызвествлению. Бугорки могут локализоваться в коре и белом веществе полушарий, в стволе мозга, мозжечке, спинном мозге. Гистологически в мозговой ткани определяются разрастание глиальных волокон, а также атипичные гигантские мультиполярные клетки, встречающиеся главным образом в тубероидных очагах. Часто обнаруживаются опухоли внутренних органов.
Основными клиническими проявлениями туберозного склероза являются изменения кожи, судорожные припадки, психические и эндокринные расстройства, пороки развития внутренних органов. Симптомы заболевания чаще появляются на 1-м году жизни. У детей возникают полиморфные судорожные приступы: большие развернутые припадки, малые припадки по типу абсансов, кивков, салаамовых судорог. Больные резко отстают в психическом развитии, так что в более поздней стадии на первый план в клинической картине выступает снижение интеллекта до степени идиотии. Нередко обнаруживаются гидроцефалия, пирамидные и экстрапирамидные симптомы, адипозо-генитальный синдром. В возрасте 2—6 лет, а изредка и на 1-м году жизни, появляются разнообразные кожные изменения. Наиболее характерны аденомы сальных желез, располагающиеся на щеках в форме «бабочки» и имеющие вид розовато-желтоватых или красных папул. Встречаются также пигментированные и депигментированные пятна, подкожные фибромы, папилломы, пигментированные бляшки. В поясничной области иногда обнаруживается своеобразная шероховатость («шагреневая кожа»).
414
Среди ДРУгих симптомов следует отметить опухоли внутренних органов, прежде всего почек и сердца (рабдомиома). На глазном дне определяется новообразование в виде тутовой ягоды, у 50% больных — застойные диски зрительных нервов.
При рентгенологическом исследовании черепа у 50% больных обнаруживаются петрификаты в области боковых и III желудочков, а также в мозжечке (R. Haslam, 1977). На ЭЭГ — диффузные и очаговые изменения биоэлектрической активности.
Заболевание прогрессирует медленно, но вследствие тяжелого слабоумия больные нуждаются в постоянном наблюдении.
Туберозный склероз следует дифференцировать от других форм олигофрении, эпилепсии и заболеваний, приводящих к органической деменции.
Лечение симптоматическое: противосудорожное, седативное, общеукрепляющее.
Атаксия-телеангиэктазия (синдром Луи-Бар). Заболевание описано D. Louis Ваг в 1941 г. Наследуется аутосомно-рецессивно. Определенную роль в его патогенезе играет нарушение Т- и В-им-мунных систем (Ю. М. Лопухин и др., 1978).
При патоморфологическом исследовании обнаруживают дегенеративные изменения в мозжечке — уменьшение количества и дистрофические изменения клеток Пуркинье, атрофию белого вещества. Отмечается избыточное ветвление мелких вен мягких мозговых оболочек мозжечка, сосудов кожи и слизистых оболочек. Вилочковая железа маленькая, отсутствует деление ее на корковое и мозговое вещество; количество телец Гассаля и лимфоцитов резко снижено. Размеры селезенки и лимфатических желез также уменьшены.
Первые клинические симптомы возникают в раннем детском возрасте, чаще в 1—3 года. Походка становится неустойчивой, отмечается неловкость движений. Позднее выявляются значительная атаксия, интенционное дрожание, нистагм, скандированная речь, мышечная гипотония. Иногда появляются гиперкинезы, носящие атетоидный или хорееформный характер. Из других неврологических симптомов могут встречаться снижение или отсутствие сухожильных рефлексов, паркинсоноподобный синдром, бульбарные нарушения. Дети отстают в умственном развитии.
Важным, а иногда и самым ранним, признаком заболевания являются сосудистые изменения на конъюнктиве глазных яблок, слизистой оболочке рта, на коже туловища и конечностей в форме телеангиэктазий — характерных сосудистых паучков. Эти сосудистые образования могут иметь артериальное и венозное происхождение. У многих больных описывают также пигментированные пятна цвета кофе с молоком на коже, участки депигментации, кератоза, склеродермии.
Наряду с кожными и неврологическими проявлениями при синдроме Луи Бар наблюдается склонность к инфекционным заболеваниям легких и дыхательных путей, хроническое течение
415
которых может привести к бронхоэктазиям, пневмосклерозу. Частые заболевания системы органов дыхания обусловлены имеющейся у больных дисгаммаглобулинемией.
Дети отстают в росте и массе. У многих из них имеются дис-пластические черты развития: незаращение дужек позвонков, фридрейхоподобные стопы и др.
При рентгенологическом исследовании черепа у многих больных обнаруживается усиление пальцевых вдавлений. На ЭЭГ — диффузные изменения биоэлектрической активности. При пневмоэнцефалографии выявляется атрофия мозжечка. В крови отсутствует иммуноглобулин-А и снижено содержание у-глобулина.
Течение заболевания неуклонно прогрессирующее. Летальный исход обычно обусловлен заболеваниями легких и развивающейся легочно-сердечной недостаточностью.
Дифференциальный диагноз следует проводить с врожденными и приобретенными атаксиями, с селективной недостаточностью иммуноглобулина-А.
Для лечения синдрома Луи-Бар помимо симптоматической терапии в последние годы применяется пересадка вилочковой железы, разработанная во 2-м Московском государственном медицинском институте им. Н. И. Пирогова. Тимус с частью грудины экстирпируют у погибшего новорожденного и подсаживают под кожу бедра. В результате операции частично корригируется иммунодефицитное состояние, что приводит к улучшению состояния больных (Ю. М. Лопухин и др., 1976).
Г л а в а
XV. СУДОРОЖНЫЕ СОСТОЯНИЯ
Судороги — это непроизвольные, пароксизмально возникающие церебральные симптомы, являющиеся следствием чрезмерных разрядов нейронов и сопровождающиеся нарушением сознания, двигательными, сенсорными, вегетативными и эмоциональными проявлениями.
Данные о частоте судорожных пароксизмов у детей раннего возраста разноречивы, поскольку одни исследователи относят их к эпилепсии, другие — к судорожным состояниям неэпилептического характера, а чаще они рассматриваются в общей группе судорог, наблюдаемых в период с рождения до 15 лет.
Судорожные пароксизмы у детей раннего возраста могут возникать при самых разнообразных заболеваниях и состояниях, приводящих к повышению судорожной готовности мозга.
У одних детей они носят характер единичных или нескольких повторных эпизодов, а затем прекращаются; у других — повторяются и в дальнейшем трансформируются в эпилепсию. В связи с тем, что прогноз судорог в каждом конкретном случае предопределить трудно, в раннем возрасте предпочтительнее употреблять термины «судорожные приступы», «судорожные состояния», «эпилептиформные приступы», а не эпилепсия. Это тем более правомерно, что у детей первых 3 лет жизни еще трудно выявить специфические эпилептические изменения личности, составляющие наряду с судорогами ядро эпилептической болезни. Кроме того, термин «эпилепсия» для многих родителей обозначает тяжелое душевное заболевание, умственную неполноценность и в какой-то степени обреченность.
Но даже при легком однократном судорожном приступе имеется определенная доля вероятности, что судороги в дальнейшем могут повториться. Поэтому дети, имевшие в раннем возрасте хотя бы один судорожный пароксизм, должны быть отнесены в группу высокого риска по развитию эпилепсии как прогредиентного заболевания.
Во всех случаях судорожных приступов у детей раннего возраста следует определить их причину, что важно для выбора метода лечения и профилактики эпилепсии.
Этиология, патогенез. В развитии судорожных припадков у детей раннего возраста играют роль различные вредные факторы, действующие на мозг в антенатальный, интранаталь-ный и постнатальный периоды.
Среди факторов, действующих в антенатальный период, важное значение придается внутриутробной инфекции, токсикозам
417
беременности, сердечно-сосудистым и эндокринным заболеваниям, иммунологической несовместимости крови матери и плода и другим метаболическим нарушениям, физической и психической травме матери, лекарственным интоксикациям. Среди инфекционных заболеваний основная роль принадлежит вирусным эмбрио- и фе-топатиям, поражающим мозг на ранних стадиях онтогенеза. Вредные факторы, оказывающие влияние непосредственно на плод или опосредованно через организм матери, приводят к внутриутробной гипоксии и нарушению трофики жизненно важных органов и систем.
Неблагоприятные условия внутриутробного развития способствуют нарушению адаптационно-приспособительных механизмов плода, что осложняет течение родового акта.
Патологическое течение родов (слабость родовой деятельности, затяжные и стремительные роды, применение акушерских операций) вызывает нарушение маточно-плацентарного кровообращения и как следствие — гипоксию плода и новорожденного, внутричерепные геморрагии.
Действие вредных факторов в перинатальный период приводит к нарушению созревания нервной системы, различным сосудистым, ликвородинамическим и метаболическим расстройствам, которые при определенных условиях создают почву для развития судорожного синдрома.
В постнатальный период в генезе судорожного синдрома играют роль нейроинфекции (менингиты, энцефалиты, менингоэнцефалиты), общие инфекционные заболевания (грипп, пневмония, острая респираторная инфекция), вакцинальные осложнения, черепно-мозговая травма. Генетически обусловленные нарушения метаболизма также во многих случаях сопровождаются судорожным синдромом.
При опухолях мозга судороги возникают как следствие внутричерепной гипертензии или как очаговый симптом.
Таким образом, среди причин возникновения эпилептиформных припадков у детей раннего возраста и условий, предрасполагающих к ним, значительное место занимает патология в перинатальный и постнатальный периоды.
Ниже представлены факторы, способствующие развитию судорог в различные возрастные периоды.
До 6 мес: метаболические нарушения (гипогликемия, гипокальциемия, гипомагнезиемия, гипербилирубинемия, пиридоксин-зависимость и недостаточность);
гипоксия, внутричерепная родовая травма;
аномалии развития мозга;
нейроинфекции (менингиты, энцефалиты), сепсис;
другие причины.
6 мес — 1,5 лет: острая респираторная инфекция, грипп, пневмония;
нейроинфекции;
418
аномалии развития мозга;
последствия гипоксии, внутричерепной родовой травмы; гипокальциемия;
наследственные болезни обмена веществ;
другие причины.
1,5—3 года: нейроинфекции;
аномалии развития мозга;
последствия гипоксии внутричерепной родовой травмы; черепно-мозговая травма;
идиопатическая эпилепсия;
наследственно-дегенеративные заболевания центральной нервной системы;
опухоли мозга;
другие причины.
К другим менее частым причинам судорог относятся: врожденные цитомегалия, краснуха, токсоплазмоз, ангиоматоз мозга, врожденные пороки сердца синего типа, абсцесс мозга, лекарственные отравления.
В возникновении судорожных пароксизмов у детей раннего возраста определенную роль играет генетическая предрасположенность, наследование определенных особенностей обмена и нейродинамики в виде пониженного судорожного порога. К факторам, провоцирующим припадки, относятся инфекции, нарушение электролитного баланса, резкое возбуждение, стрессовые ситуации.
Несмотря на значительное число работ, посвященных изучению механизма судорожной готовности, сущность его до конца не раскрыта. В последние годы исследованы отдельные звенья метаболических, сосудистых гемо- и ликвородинамических нарушений при эпилепсии у взрослых. Показана роль гамма-аминомасляной кислоты (ГАМК) и связанных с ней аминных соединений в развитии судорожной активности. Одни из них (гуанидин, гамма-гуанидинмасляная кислота) повышают судорожную готовность, другие (гидрокси-гамма-аминомасляная кислота) — снижают ее. Даже незначительные отклонения в метаболическом балансе этих веществ могут способствовать развитию судорожного разряда. Остаются, однако, трудности в определении первичных обменных нарушений, способствующих проявлению припадка, и вторичных, возникающих в результате припадка.
Сосудистые нарушения наблюдаются преимущественно в области микроциркуляторного русла. Расширение капилляров сменяется их спазмом, что приводит к недостаточности мозгового кровообращения и гипоксии. Ликвородинамические изменения также могут понижать порог судорожной готовности мозга.
Интимные механизмы, лежащие в основе патофизиологии судорожных пароксизмов у детей раннего возраста, вероятно, еще более сложные, чем у взрослых. Это обусловлено особенностями развивающегося организма: несовершенством высших интегри-
419
рующих отделов головного мозга, повышенной иррадиацией процессов возбуждения, недостаточностью гомеостаза, лабильностью обменных процессов, высокой проницаемостью гематоэнцефалического барьера для различных токсических и бактериальных агентов, повышенной потребностью мозговой ткани в кислороде.
Патоморфология. Характер патоморфологических изменений в нервной системе при судорогах у детей раннего возраста зависит от основного патологического процесса. У детей, перенесших внутриутробную гипоксию, асфиксию в родах, внутричерепную родовую травму, находят деструктивные изменения: микрогирию, микроцефалию, пахигирию, порэнцефалию, кистозную дегенерацию белого вещества, очаговые уплотнения в области таламуса, гидроцефалию. При гистологических исследованиях обнаруживают дегенеративные изменения нервных клеток, замещение их глиальной тканью, дезорганизацию волокон в белом веществе мозга, сморщивание нейронов с распадом их отростков, пролиферацию гигантских астроцитов, очаговые некрозы. После инфекционных заболеваний имеют место оболочечно-мозговые спайки, рубцы, очаги деструкции.
При наследственных заболеваниях наблюдаются специфические изменения: при фенилкетонурии — демиелинизация, при туберозном склерозе — узелковые глиальные массы, которые могут обызвествляться, при энцефалотригеминальном ангиоматозе — гемиатрофия полушарий мозга и мозжечка, аномалии развития сосудов, обызвествления и т. д.
Наряду с резидуальными изменениями нервной системы обнаруживают нарушения, вызванные непосредственно судорожными припадками. К ним относятся дистрофия нервных клеток коры головного мозга, мозжечка, ядер таламуса, височных областей и лимбической системы, которые нарастают по мере учащения припадков. Вначале изменения носят обратимый характер, а затем развиваются структурные нарушения — очаги запустения, кариоцитолиз, клетки-тени. Они неспецифичны и возникают вследствие гипоксии мозга, которая сопутствует судорожным припадкам.
Клиническая картина судорожного синдрома во многом определяется уровнем развития нервной системы ребенка. В связи с этим структура припадков у новорожденных, грудных и детей более старшего возраста имеет свои особенности.
Судороги новорожденных
Частота судорог у новорожденных составляет 4—12 на 1000 родившихся (J. Keen, D. Lee, 1973; J. Jabboure, 1976; J. Dennis, 1978).
Функционирование нервной системы новорожденного осуществляется на спинальном и стволовом уровнях. Несмотря на полностью сформированные кортикальные нейроны, нервные клетки 420
еще выраженной цитоплазматической и мембранной ^жЗГоенциации. Образование дендритов, межсинаптических свя-дифФ миелинизация еще не закончены. Отсутствуют нормальные 3еИ соотношения между глиальными элементами и нейронами. Особенностями морфологической и функциональной организации мозга обусловлено количественное и качественное разнообразие судорог у новорожденных.
J Генерализованные судорожные припадки у новорожденных проявляются не в форме последовательно сменяющих друг друга тонической и клонической фаз, как это наблюдается у более старших детей и взрослых, а носят более локальный характер. Клонические подергивания следуют беспорядочно от одной части
тела к другой на той же стороне или захватывают и противоположную. Такой мигрирующий характер судорог создает впечатление генерализованных. Судороги начинаются обычно с локальных подергиваний глаз, мимической мускулатуры, затем присоединяются рука, нога, ребенок теряет сознание, может быть цианоз. Этот тип судорог называют генерализованными фрагментар-
ными. Иногда локальные клонические подергивания принимают за обычные мимические движения мышц лица ребенка, и, таким образом, начало судорог не улавливается (L. Rose, С. Lambroso, 1970).
Очаговые клонические припадки — это второй наиболее рас-
пространенный тип судорожных приступов у новорожденных. В отличие от генерализованных они захватывают одну половину тела. Иногда по своему характеру судороги напоминают джексоновские. Наблюдаются адверсивные повороты головы, глазных яблок, тоническое отведение руки в сторону поворота головы, оперкулярные симптомы (гримасы, сосание, жевание, причмокивание). Патологические движения часто сопровождаются вазомоторными расстройствами в виде бледности, цианоза, покраснения лица, слюнотечения. При незначительной выраженности этих
судорог их легко пропустить или принять за спонтанные движения новорожденного. В этих случаях дифференциальной диагностике помогает динамическое наблюдение за детьми и ЭЭГ.
Миоклонический тип судорог характеризуется одиночными или многочисленными подергиваниями верхних или нижних конечностей с тенденцией к их сгибанию. Эти судороги в дальнейшем могут перейти в массивные инфантильные миоклонические спазмы. Иногда у новорожденных наблюдаются отдельные вздрагивания с последующим крупноразмашистым тремором рук или ног. Эти приступы могут сопровождаться вскрикиваниями, изменением окраски кожных покровов.
У недоношенных и детей с низкой массой судороги в период новорожденности наблюдаются реже, чем у доношенных, и всегда свидетельствуют о тяжелом поражении нервной системы. Судороги у недоношенных носят абортивный характер; при этом характерны подергивание глаз, повторяющееся моргание, дрожание
421
век, повышенная саливация, тоническое напряжение конечностей, приступы апноэ.
Характер судорожных пароксизмов во многом определяется основным патологическим процессом.
Гипогликемические судороги. Гипогликемия наблюдается у новорожденных от матерей с сахарным диабетом или преддиабе-том, при внутриутробной гипотрофии, длительном голодании в результате нарушения сосания и глотания, сепсисе, менингитах, гипоксии, внутричерепной травме, галактоземии, фруктоземии, гликогенозах. У новорожденных с низкой массой гипогликемические судороги возникают в результате пониженного запаса гликогена в печени и мышцах. Синдром гипогликемии у доношенных новорожденных развивается при уровне сахара крови ниже 0,3 г/л, у недоношенных — 0,2 г/л. Гипогликемические судороги носят клонический характер, начинаются с тремора рук, затем присоединяются подергивания мимической мускулатуры, вздрагивания глазных яблок. Судороги могут появиться через несколько часов после рождения или на 3—5-й день жизни. Ребенок вял, адинамичен, мышечный тонус снижен, иногда наблюдаются повторные приступы асфиксии или резкого возбуждения со вскрикиваниями.
Диагноз подтверждается данными анамнеза и низким содержанием сахара крови при повторных исследованиях. Прогноз благоприятный у детей, рожденных от матерей, больных сахарным диабетом. При гипогликемии, осложненной асфиксией, родовой травмой, в 32—40% случаев в дальнейшем наблюдается задержка психомоторного развития и судороги могут повторяться.
Гипокальциемические судороги. Гипокальциемия наблюдается при гипотиреозе новорожденного, гиперпаратиреозе, сахарном диабете у матери, многоплодной беременности, нефропатии, тяжелых родах, внутриутробной гипотрофии, у недоношенных при почечной недостаточности. Судорожный синдром возникает при уровне кальция в сыворотке крови ниже 0,07 г/л. Гипокальциемические судороги составляют около 14% от всех судорог у новорожденных. Они носят тетанический характер, болезненные, сопровождаются тремором подбородка и рук, инспираторной одышкой. Положительны симптомы Хвостека и Труссо. Для гипокальциемии характерен синдром гипервозбудимости: ребенок беспокоен, часто срыгивает, вскрикивает. Наблюдается мышечная дистония, сухожильные рефлексы высокие, клонусы коленных чашечек и стоп. Новорожденный часто застывает в экстензорной позе. Кисти и предплечья пронированы, стопы в варусной позиции. АШТ-рефлекс ярко выражен. Гипокальциемические судороги обычно начинаются на 5—8-й день жизни, но могут быть и раньше. В межприступный период у новорожденных никогда не бывает мышечной гипотонии и вялости. Если эти симптомы имеют место, то следует предположить наличие гипокаль-422
рмии сочетающейся с другой патологией нервной системы. Для Ц агностики гипокальциемии требуется определить кальциево-Досфорный коэффициент и сывороточный белок. У новорожденных установление первичной гипокальциемии затруднено, так как большинстве случаев она сочетается с внутриутробной гипоксией, асфиксией в родах, внутричерепной родовой травмой.
Гипомагнезиемические судороги. Гипомагнезиемия может со
путствовать гипокальциемии. Если у новорожденного отсутствует эффект на введение кальция, необходимо исключить гипомагне-зиемию. Она может быть у детей, рожденных от матерей, больных сахарным диабетом. Клиническая картина характеризуется повышенной возбудимостью на фоне мышечной гипотонии, тре-
мором, судорогами клонического и тонического характера.
Пиридоксин (витамин Вб)-зависимые судороги. Пиридоксин — единственный витамин, при дефиците которого наблюдаются судороги у новорожденных. Пиридоксин принимает участие в обмене триптофана, метионина, цистеина, глютаминовой кислоты, гистамина. Основной дефект заключается в недостатке коэнзима пиридоксаль-5-фосфата, принимающего участие в синтезе гамма-аминобутировой кислоты. ГАМК повышает порог судорожной активности мозга. В норме суточная потребность доношенного ребенка в пиридоксине составляет 0,2—0,4 мг. При метаболической и алиментарной недостаточности (гипотрофия, искусственное вскармливание), когда поступление пиридоксина составляет меньше 0,1 мг в день, могут появиться судороги, которые носят характер общих вздрагиваний, кивков. Ребенок возбужден, судороги возникают при звуковых раздражителях, пеленании. Пиридоксинзависимость или недостаточность следует
заподозрить в том случае, если антиконвульсивное лечение не эффективно; при этом в анамнезе у братьев и сестер больного были судороги в неонатальный период или имеется задержка психомоторного развития. Диагноз ставится на основании снижения уровня пиридоксаль-5-фосфата в крови. Диагностическим тестом является прекращение судорог и нормализация ЭЭГ после введения 50—100 мг пиридоксина в сутки.
Гипербилирубинемические судороги. Гипербилирубинемия развивается при гемолитической болезни новорожденных, которая является следствием резус- или групповой несовместимости крови матери и плода. Судорогам предшествуют общее тяжелое состояние, выраженная желтуха, мышечная дистония, симптом заходящего солнца и беспокойство, нарушение сна, срыгивание. Судороги возникают на 2—4-й день жизни. В крови определяется высокий уровень (0,13—0,15 г/л) непрямого билирубина.
Судороги начинаются с резкого беспокойства, клонических подергиваний рук, затем присоединяется тонический компонент, ребенок запрокидывает голову назад, руки вытянуты, пронированы, ноги перекрещены (поза опистотонуса). На высоте судорог усиливается симптом «заходящего солнца» и появляются нистагмоид
423
ные подергивания глаз. Иногда судороги носят характер крупно-размашистого тремора в руках и ногах.
Из других метаболических нарушений, которые также могут являться причиной судорог у новорожденных, следует отметить болезнь кленового сиропа, гликогенез, галактоземию, гиперглици-немию. Судорожный синдром при этих заболеваниях носит характер инфантильных спазмов.
Судороги при гипоксии и внутричерепной родовой травме. Наиболее часто они встречаются у новорожденных. Гипоксия, сопровождающаяся, как правило, нарушением мозговой гемо- и ликвородинамики, приводит к общему или локальному отеку мозга, ацидозу, диапедезным кровоизлияниям.
Судороги у таких детей появляются сразу после рождения или на 2—3-й день, при субарахноидальном кровоизлиянии они возникают чаще всего после прикладывания к груди. Судороги развиваются на фоне неврологических нарушений: беспокойства, расстройства сна, повышения мышечного тонуса и сухожильных рефлексов, угнетения безусловных рефлексов, затруднения сосания и глотания, парезов черепномозговых нервов. Они чаще всего носят клонический характер, начинаются с мышц лица и затем распространяются на конечности. Течение судорог различно. Они могут полностью купироваться в родильном доме или вновь возникают через несколько месяцев. Иногда, начавшись в родильном доме, они периодически повторяются.
Судороги при аномалиях развития нервной системы. Микроцефалия, гидроцефалия, порэнцефалия, атрофия коры головного мозга, гипоплазия мозжечка могут сопровождаться в период новорожденное^ судорогами. Пороки развития нередко сочетаются с внутриутробной гипоксией, асфиксией в родах и внутричерепной родовой травмой. Судороги носят тонико-клонический характер и возникают на фоне выраженных очаговых изменений нервной системы (парезы, параличи, резкое угнетение безусловных рефлексов, нарушение питания). Нейрорентгенологические исследования подтверждают диагноз.
Судороги при инфекционных заболеваниях. В период новорожденности судороги наиболее часто наблюдаются при сепсисе. Они также имеют место у 30—50% новорожденных с менингитом и обычно возникают при выраженных изменениях в спинномозговой жидкости. Судороги начинаются с подергивания глаз, мышц лица, а затем по мере нарастания тяжести состояния переходят в генерализованные. Судорожные приступы при менингите сопровождаются повышением температуры, воспалительными изменениями крови и ликвора.
424
Судороги у детей раннего возраста
После периода новорожденности двигательный к0МД^е®Т падка становится более выраженным. Однако у грудных детей классическая последовательность судорожных приступов так же как и у новорожденных, наблюдается редко. Для детей 1-го года жизни наиболее характерными являются: миоклонический тип (инфантильные спазмы), генерализованные и парциальные судороги. У детей 2—3 лет чаще отмечаются большие судорожные припадки, реже инфантильные спазмы. Психомоторные автоматизмы наблюдаются реже, чем другие формы припадков и в раннем возрасте их диагностика трудна.
Миоклонический тип судорожных приступов (малые пропульсивные припадки или инфантильные спазмы) наблюдаются в основном у грудных детей. Частота пропульсивных припадков 1 :4000—6000 новорожденных, среди детей 1-го года жизни с судорожным синдромом они составляют 30,8%. Для этого типа судорог характерны: молниеносные судорожные пароксизмы; задержка психического развития; специфические изменения на ЭЭГ. Классическая картина инфантильных спазмов характеризуется двусторонним симметричным сокращением мышц. Спазмы бывают флексорного, экстензорного или смешанного типа.
При флексорном спазме происходит внезапное сгибание шеи, туловища и конечностей с одновременным их отведением или приведением последних. Флексорные спазмы известны в литературе как «салаамовы припадки», поскольку сгибание туловища при них похоже на восточное приветствие. При экстензорном спазме резко разгибаются голова и туловище, руки и ноги отводятся. Смешанный тип характеризуется сгибанием или разгибанием туловища, руки и ноги разгибаются. Флексорный спазм встречается наиболее часто, более редко наблюдается смешанный и еще реже экстензорный. У одного и того же ребенка одновременно могут быть различные формы спазмов. К инфантильным спазмам относят также частичные фрагментарные формы — кивки, вздрагивания, сгибание и разгибание рук и ног, поворот головы. При этом возможна латерализация — преимущественное сокращение мышц одной стороны тела. Кивки выглядят как быстрый наклон головы вперед. Они нередко сочетаются со вздрагиваниями и предшествуют флексорному или экстензорному спазму или сменяют его. Наиболее характерной чертой инфантильных спазмов является склонность к серийности. Реже наблюдаются единичные спазмы. Продолжительность судорог от доли секунды до нескольких секунд. Длительность серии приступов может быть от нескольких секунд до 20 мин и более. За сутки число пароксизмов колеблется от единичных до нескольких сот и даже тысяч. Выключение сознания при этой форме судорог кратковременное.
425
Инфантильные спазмы иногда сопровождаются криком, гримасой улыбки, испуганным выражением лица, закатыванием глаз, нистагмом, расширением зрачков, дрожанием век, конечностей, бледностью или покраснением лица, остановкой дыхания. После судорог наблюдается сонливость, особенно если серия приступов была продолжительной. В межприступный период дети раздражительны, плаксивы, нарушен сон. Судороги возникают чаще всего перед засыпанием или после просыпания. К факторам, провоцирующим пароксизмы, относят испуг, различные манипуляции, кормление.
Инфантильные спазмы начинаются в грудном возрасте и исчезают в раннем детстве. В возрасте до 6 мес они составляют 67% от общего числа пароксизмальных эпизодов; от 6 мес до 1 года — 86%; после 2 лет — 6%.
Инфантильные спазмы могут быть первым проявлением судорожного синдрома у ребенка. Первые приступы носят абортивный характер и могут быть приняты родителями за реакцию испуга, проявление болей в животе и т. д. Сначала они единичные, затем частота их нарастает. На этой стадии могут быть ремиссии и обострения, которые трудно предвидеть. По мере роста и развития ребенка частота судорог снижается. Средняя продолжительность инфантильных спазмов — от 4 до 30—35 мес. После 3 лет они встречаются редко. По данным Р. Jeavons и др. (1973), у 25% детей инфантильные спазмы прекращаются в возрасте до 1 года, у 50% — до 2 лет, у остальных — до 3—4, иногда 5 лет.
Изменения на ЭЭГ (гипсаритмия) не всегда коррелируют с началом судорог, иногда они появляются несколько позже. Гипсаритмия характерна для развивающегося мозга и наблюдается только при инфантильных спазмах у детей раннего возраста (рис. 123).
Универсальным сопутствующим признаком инфантильных спазмов является задержка психического развития, которая наблюдается у 75—93% больных, нарушается также формирование двигательных навыков. Поэтому у детей раннего возраста правильнее говорить о задержке психомоторного развития, которое отмечается уже в начальной стадии заболевания. Оно становится более отчетливым, когда появляются серии припадков. Степень задержки зависит как от времени начала судорог, так и от пре-морбидных особенностей ребенка. Нормальное психомоторное развитие до появления судорог наблюдается у 10—16% детей.
Очаговые неврологические нарушения (парезы, параличи, косоглазие, нистагм) встречаются в 34—70% случаев. Как правило, они наблюдаются у детей с церебральным параличом, микроцефалией, аномалиями развития центральной нервной системы.
Прогноз при инфантильных спазмах благоприятный у детей с нормальным психомоторным развитием, при кратковременных судорогах, неосложненных другими формами припадков. При ран-
426
Рис. 123. ЭЭГ ребенка с малыми пропульсивными припадками (гипсаритмия)
нем начале, серийности и продолжительности, сочетании с другими типами судорог, наличием неврологических и психических нарушений наблюдается глубокая задержка психомоторного развития.
Абсансы — форма малых припадков, которые также наблюдаются у детей раннего возраста и характеризуются кратковременной остановкой взора. Иногда в это время ребенок производит сосательные, жевательные движения, причмокивания, облизывания языком. Приступ может сопровождаться покраснением или побледнением лица, легким отведением глазных яблок. Они наблюдаются реже, чем пропульсивные припадки.
Большие судорожные приступы у детей раннего возраста чаще носят абортивный характер. В структуре припадка преобладает тонический компонент. При повороте головы в сторону де-
427
ти грудного возраста часто фиксируются в асимметричной позе. Приступы могут сопровождаться подъемом температуры, рвотой, болями в животе и другими вегетативными симптомами. Непроизвольное мочеиспускание наблюдается реже, чем у детей старшего возраста. После припадка ребенок вял, оглушен, засыпает или наоборот возбужден, выражена мышечная гипотония.
Парциальные судороги у детей раннего возраста проявляются клоническими подергиваниями мимической мускулатуры, мышц языка, дистальных отделов конечностей. Припадок, начавшись локально, может перейти в генерализованный. Нередко в этом возрасте наблюдаются адверсивные судорожные припадки, сопровождающиеся поворотом головы и глаз, а иногда и туловища, в сторону. Припадок часто сопровождается тоническим напряжением руки и ноги на стороне поворота головы.
Судороги при наследственных заболеваниях чаще всего возникают в грудном возрасте уже на фоне выраженной задержки психомоторного развития и значительно реже являются первым признаком заболевания. Они наблюдаются при наследственных болезнях обмена аминокислот, липидов, углеводов, при факомато-зах и связаны с метаболическими нарушениями в нервной системе.
При фенилкетонурии частота судорожного синдрома достигает 20—40% (Б. В. Лебедев, М. Г. Блюмина, 1972). Судороги возникают эпизодически в возрасте 4—9 мес или после 1 года, повторяются на протяжении нескольких месяцев, затем могут самопроизвольно исчезнуть. В тяжелых случаях они наблюдаются регулярно на протяжении нескольких лет. У детей первых месяцев жизни судороги проявляются общими вздрагиваниями, кивками, с 6—И мес сменяются салаамовыми, в возрасте 2—3 лет преобладают генерализованные тонико-клонические и реже миоклонические. Судороги осложняют течение основного заболевания и усугубляют задержку психомоторного развития. Прекращаются они после применения диетотерапии белковыми препаратами с низким содержанием фенилаланина.
При болезни с запахом мочи кленового сиропа судороги носят тонико-клонический характер, возникают с рождения. Повышение мышечного тонуса по экстензорному типу и тонические судороги фиксируют ребенка в позе опистотонуса. Дифференциальной диагностике помогает специфический запах мочи, напоминающий кленовый сироп или отвар овощей. Динамику судорожного синдрома проследить трудно, так как дети погибают в первые месяцы жизни в связи с тяжелым поражением мозга. Эффективность лечения судорог зависит от специфической диетотерапии.
При амавротической идиотии развитию судорог предшествует гиперакузия — своеобразное повышение реакции на звуковые раздражители. Уже в период новорожденности наблюдаются общие вздрагивания на громкий звук, в грудном возрасте они протекают по типу испуга с отведением рук в стороны (I фаза реф-428
Моро). Судороги возникают обычно на фоне неврологи-Ле ких нарушений, носят тонико-клонический характер. Короткая ЧоНИческая фаза сменяется более длительной клонической. Иногда наблюдаются только клонические судороги. Чем старше ребенок, тем разнообразнее по характеру становятся судороги. Генерализованные припадки сочетаются с малыми пропульсивными (вздрагиваниями, кивками, салаамовыми). В связи с прогредиентным характером течения заболевания дети погибают в раннем возрасте. В терминальной стадии припадки учащаются.
При лейкодистрофиях судороги появляются на фоне выраженных неврологических нарушений — парезов, параличей, нарастающей деменции, атрофии сосков зрительных нервов — и учащаются по мере прогрессирования заболевания. Судороги полиморфные, вначале наблюдаются общие вздрагивания, кивки, затем
присоединяются генерализованные приступы тонико-клонического характера.
При факоматозах (энцефалотригеминальном ангиоматозе, туберозном склерозе) частота судорожного синдрома достигает 75— 85%. Судороги появляются в грудном возрасте и носят очаговый характер, несмотря на то, что обычно в этом возрасте выражена склонность к генерализации. Начинаясь с дистальных отделов руки, они распространяются на мышцы лица, языка, губ. Иногда
судороги проявляются кратковременными подергиваниями только мышц лица или руки. В том и другом случае припадок может перейти в генерализованный. При локальных судорогах ребенок
не теряет сознания.
При одностороннем расположении ангиомы на лице судороги локализуются па контрлатеральной стороне. После припадка может быть обнаружена пирамидная симптоматика в одноименных конечностях. Наибольшей устойчивостью отличаются очаговые приступы, возникшие до 3-летнего возраста.
При туберозном склерозе судороги являются одним из основных симптомов заболевания и отличаются полиморфностью. У одного ребенка можно наблюдать несколько различных форм пароксизмов: генерализованные тонико-клонические, очаговые, малые пропульсивные и др. Их динамика зависит от возраста ребенка. На 1-м году жизни преобладают малые пропульсивные, затем присоединяются генерализованные тонико-клонические. Последние становятся доминирующими в клинической картине после 3 лет.
Судороги при органическом поражении нервной системы в большинстве случаев возникают уже на фоне различных двигательных нарушений (парезов, параличей), задержки психомоторного и речевого развития.
При детском церебральном параличе судороги наблюдаются в 40—50% случаев. Они начинаются преимущественно в возрасте 3—10 мес, иногда позже. Характер судорог полиморфный с преобладанием инфантильных спазмов в грудном возрасте, генера
429
лизованных и парциальных припадков в 2—3 года. Присоединение судорог всегда ухудшает течение основного заболевания.
Судороги при менингитах и энцефалитах сочетаются с очаговыми неврологическими симптомами — парезами, параличами, нарушениями координации, а также изменениями спинномозговой жидкости. Приступы появляются в начале заболевания, особенно у грудных детей, или на 2—3-й день, носят генерализованный, реже локальный характер, сопровождаются потерей сознания. Они бывают единичные или повторяются в течение заболевания несколько раз. В тяжелых случаях наблюдается статусоподобное течение приступов.
Судороги при поствакцинальных осложнениях встречаются чаще других неврологических нарушений. Сроки появления и их характер при различных прививках не одинаковы. При оспенной вакцинации они возникают на 7—9-й день после прививки на фоне высокой температуры. Судороги бывают генерализованные тонико-клонические, однократные, повторные или имеют статусоподобное течение. Локальные пароксизмы встречаются реже.
При АКДС-вакцинации припадки могут возникать через несколько часов после прививки, на 1—3-й день и лишь в единичных случаях в более поздние сроки. Лихорадочная реакция не всегда имеет место. Судороги в 50% случаев локальные или малые пропульсивные со склонностью к серийности.
После вакцинации против кори судороги наблюдаются в период подъема температуры до 39—40° С на 6—7-й день и носят характер одиночных тонико-клонических приступов.
Поствакцинальный судорожный синдром в 60% случаев развивается у детей с неблагоприятным преморбидным анамнезом. Это диктует необходимость индивидуального подхода при отборе детей для профилактических прививок.
Фебрильные судороги возникают впервые на фоне заболеваний, протекающих с высокой температурой,— острой респираторной инфекции, гриппа, отита, пневмонии и др. В эту группу не следует относить судороги, возникающие при нейроинфекциях, вакцинальных реакциях, острой дегидратации. Частота фебрильных судорог составляет 29 : 1000 детского населения. Среди детей 1-го года жизни с судорожным синдромом фебрильные судороги составляют 18,7% (J. Chevril, J. Aicardi, 1977). Наблюдаются они в возрасте от 1 мес до 5—7 лет. Средний возраст возникновения фебрильных судорог 16—22,7 мес. Повышение температуры, вызывая метаболические и сосудистые нарушения, снижает порог судорожной готовности мозга. Судороги могут быть генерализованными и локальными. Возникают они при умеренном повышении температуры или на ее высоте. Припадок начинается внезапно с тонической фазы, за которой следует генерализованная клоническая фаза. Иногда за несколько часов или минут до появления судорог ребенок становится беспокойным, прижимается к матери, кричит, на лице появляется испуг, затем психомоторное
430
б ждение сменяется судорогами. Приступ сопровождается по-В°3 сознания, пеной у рта, непроизвольным мочеиспусканием. pe«ce отмечаются чисто тонические судороги с выраженным циа-* е ом лица, нарушением сознания различной степени. Локальные Я°лороги проявляются поворотами головы и глаз в сторону, подергиванием глазных яблок. Иногда адверсия переходит в генерализованный припадок. В большинстве случаев фебрильные судороги бывают одноразовые, но иногда повторяются в течение 24—48 ч. Судорожный статус наблюдается редко, но всегда свидетельствует о тяжелом течении заболевания, при котором возможен летальный исход или развитие неврологических нарушений.
Течение простых фебрильных судорог обычно благоприятное. После приступа не отмечается очаговых неврологических нарушений. Изменения на ЭЭГ непостоянны (преходящие остроконечные волны в задних отведениях). Если приступ был длительный, с выраженным очаговым компонентом или повторялся несколько раз в сутки, то после него в острый период можно обнаружить асимметрию мышечного тонуса, повышение сухожильных рефлексов, клонусы стоп, снижение двигательной активности, раздражительность, эмоциональную лабильность, нарушение поведения. В этих случаях на ЭЭГ выявляется диффузная дисритмия с наличием медленных дельта-волн, быстрые и медленные пики.
Для прогноза фебрильных судорог имеет значение повторный характер припадков, наличие афебрильных припадков, неврологических нарушений и задержки психического развития. По данным Aicardi, Chevrie (1976), Nelson, Ellenberg (1978), у 5,3— 10,5% детей до первого припадка можно обнаружить различные отклонения в развитии. Динамические наблюдения за детьми, перенесшими фебрильные судороги, показали, что риск возникновения повторного фебрильного припадка составляет 30%, афебрильного — 2—2,9%. Вероятность рецидива фебрильных судорог значительно выше, если первый припадок был у ребенка до 1 года. В этом случае повторные приступы наблюдаются у 50% детей. При возникновении первых пароксизмов после 1 года повторные эпизоды судорог отмечаются у 28% детей.
Наличие в семейном анамнезе фебрильных и афебрильных припадков повышает риск их повторения и развития в дальнейшем эпилепсии. У детей с задержкой психомоторного развития более часто наблюдаются повторные судороги.
Спазмофилия (тетания) характеризуется повышением нервно-мышечной возбудимости в результате снижения концентрации ионов кальция в сыворотке крови ниже 0,06—0,07 г/л. При тетании гипокальциемия может сочетаться с гипомагнезиемией.
Наиболее частыми причинами спазмофилии в раннем возрасте являются рахит, нарушение питания, хроническая почечная недостаточность, целиакия. Имеет также значение недостаточность Паращитовидных желез, регулирующих кальциевый обмен. При нормлении детей грудного возраста коровьим молоком с относи
431
тельно высоким содержанием фосфора экскреция фосфатов оказывается недостаточной, что связано с незрелостью почек. Поэтому уровень фосфатов в крови повышен, а кальция соответственно снижен.
У детей 1-го года жизни спазмофилия возникает на фоне раннего органического поражения нервной системы. Истинные спаз-мофильные судороги в настоящее время наблюдаются редко. При подозрении на спазмофилию дети должны быть тщательно обследованы для выяснения причин, вызвавших судороги.
Спазмофилия может проявляться в форме тетании, ларинго-спазма, эклампсии.
Тетания — одна из наиболее частых форм спазмофилии. Для нее характерны карпопедальные спазмы: кисть согнута, большой палец приведен к ладони, остальные разогнуты и напряжены (рука акушера). Стопы в эквиноварусной позиции. Эти судороги длятся несколько часов, а иногда и дней, болезненны. На конечностях часто появляются отеки. Карпопедальные спазмы могут сочетаться с общими тоническими судорогами, сходящимся косоглазием, напряжением мимической мускулатуры (тетаническое лицо) и мышц шеи. Тетанические судороги могут быть генерализованными или очаговыми.
Ларингоспазм проявляется судорожным напряжением голосовых связок и закрытием гортани, что ведет к нарушению дыхания (экспираторное апноэ). Ребенок запрокидывает голову назад, бледнеет, появляется цианоз слизистых оболочек. Затем спазм ослабевает, наступает шумный вдох и состояние ребенка улучшается. Если спазм продолжается длительное время, то могут быть потеря сознания и общие тонико-клонические судороги.
Эклампсия. При повышенной температуре или среди полного здоровья возникают судороги тонико-клонического или клонического характера с потерей сознания.
Вышеописанные клинические проявления относятся к категории тяжелых и могут угрожать жизни ребенка. Поэтому важно рано диагностировать латентную форму, для которой характерны симптомы повышенной нервно-мышечной возбудимости.
Симптом Хвостека - поколачивание щеки между скуловой дугой и углом рта у места выхода лицевого нерва вызывает молниеносные сокращения мускулатуры рта, носа, наружного угла глаза. Симптом Труссо — сдавление нервно-сосудистого пучка в области борозды двуглавой мышцы при помощи манжетки вызывает судорожное сведение пальцев (рука акушера). Симптом Люста — надавливание на перинеальный нерв ниже головки малоберцовой кости вызывает сгибание и отведение стопы. Симптом Эрба (повышенная возбудимость на гальванический ток) — при наложении катода на область перинеального или срединного нерва, мышечное сокращение появляется при силе тока ниже 5 мА. Этот симптом обнаруживается наиболее часто.
432
В клинической картине можно также отметить повышенную озбудимость, эмоциональную лабильность, двигательное беспокойство, нарушение сна, вегето-сосудпстые расстройства, желудочно-кишечные дискинезии. Для постановки диагноза тетании имеет значение низкий уровень кальция в сыворотке крови.
Респираторные аффективные судороги наблюдаются у детей с повышенной возбудимостью в возрасте от 7 — 8 мес до 2 лет. В 30% случаев они носят семейный характер и провоцируются психогенным фактором: испугом, сильпой болью, гневом. Ребенок начинает кричать, затем наступает задержка дыхания на вдохе (инспираторная остановка дыхания), развивается цианоз, голова запрокинута назад, зрачки расширены, сознание утрачивается на несколько секунд. Мышечный тонус обычно снижен, но иногда отмечается гипертония. Если это состояние не ликвидировать, то в результате гипоксии могут начаться генерализованные судороги. В конце приступа наблюдается непроизвольное мочеиспускание, ребенок вял, сонлив, по может быть и в нормальном состоянии. При переключении его внимания до появления цианоза приступ может купироваться на этом этапе.
Психомоторное развитие в большинстве случаев не страдает, однако в анамнезе иногда имеются указания на патологию пре-и перинатального периода. В неврологическом статусе можно обнаружить мпкросимптоматпку (асимметрию мышечного тонуса, повышение сухожильных рефлексов, непостоянный симптом Бабинского и др.). На ЭЭГ в 38—45% случаев обнаруживаются изменения, характерные для органического поражения,— фоновая кривая с многочисленными медленными волнами, разрядами пиков, асимметрия колебания биопотенциалов. У 50% детей с аффективными судорогами наблюдаются эмоциональные и поведенческие нарушения. Диагноз этого вида судорог не представляет трудностей, так как они всегда следуют за отрицательной эмоциональной реакцией. Если имеются изменения на ЭЭГ, такой ребенок должен быть отнесен в группу «высокого риска» по развитию в дальнейшем эпилепсии.
Диагноз судорожного синдрома у новорожденных и грудных детей представляет в некоторых случаях затруднение. Это связано с атипичным течением, абортивпостыо, кратковременностью пароксизмов. У новорожденных не всегда четко выражен двигательный компонент. Такие судороги часто принимают за обычные движения новорожденного и диагностируют их лишь после трансформации в генерализованные или выраженные локальные пароксизмы.
У детей грудного и более старшего возраста родители, как правило, отмечают судороги с момента их возникновения. Генерализованные судорожные припадки фиксируются сразу. Малые припадки, особенно если это касается абсансов, улавливаются не всегда, так как ребенок не падает, не теряет сознания. И только по мере их повторения родители обращаются к врачу.
15 143
433
С целью подтверждения клинических данных и уточнения этиологии заболевания используется ряд дополнительных методов обследования.
У новорожденных с судорожным синдромом необходимо провести тщательное биохимическое исследование крови на содержание кальция, натрия, фосфора, глюкозы, пиридоксина, аминокислот. Важное значение имеет люмбальная пункция. Она делается для исключения менингита и субарахноидального кровоизлияния. Повышенный клеточный состав указывает на воспалительные изменения, эритроциты — на субарахноидальное кровоизлияние, повышенное давление ликвора — на внутричерепную гипертензию.
Нейрорентгенологическое исследование следует проводить во всех случаях судорожного синдрома у детей раннего возраста. Оно включает краниографию, пневмоэнцефалографию. С их помощью можно получить информацию о состоянии костей черепа, желудочковой системы, субарахноидальных пространств и выявить гидроцефалию, порэнцефалию, атрофию полушарий мозга и другие аномалии развития. Локальное расширение ликворных пространств свидетельствует о корковой атрофии. Задержка газа перед каким-либо участком субарахноидального пространства указывает на слипчивый процесс в оболочках. На краниограммах можно обнаружить внутричерепные очаги обызвествления вследствие паразитарных заболеваний, кровоизлияний. В последние годы для обследования больных с судорожными пароксизмами начинает применяться компьютерная томография. С ее помощью можно обнаружить кальцификаты, атрофические процессы, гидроцефалию, опухоли.
Ангиография позволяет диагностировать сосудистые аномалии (аневризмы, ангиомы), которые могут быть причиной судорожного синдрома.
Наиболее важное значение как дополнительный метод исследования при судорожном синдроме имеет электроэнцефалография (ЭЭГ). На ЭЭГ можно выявить более тонкие функциональные изменения, которые связаны с механизмом, провоцирующим возникновение припадка. Метод ЭЭГ как наиболее безопасный широко применяется в раннем детском возрасте. ЭЭГ позволяет не только установить наличие пароксизмальной активности мозга, но в некоторых случаях определить и локализацию патологического очага. Следует отметить, однако, что данные ЭЭГ не всегда коррелируют с тяжестью заболевания. При выраженных изменениях на ЭЭГ у больного могут быть редкие припадки, и, наоборот, частые припадки могут сочетаться с незначительными или мало выраженными дезорганизованными кривыми. ЭЭГ-исследование следует проводить в динамике для оценки эффективности лечения.
В зависимости от характера судорожных пароксизмов и изменений нервной системы, при которых они возникли, на ЭЭГ
434
можно обнаружить различные отклонения. Судорожные припадки возникшие у новорожденного в результате родовой травмы, характеризуются наличием остроконечных волн, которые в дальнейшем сменяются высоковольтными волнами и пиками или комплексами «пик—волна» с атипичной следовой волной.
Для детей с различными вариантами малых пропульсивных припадков характерна гипсаритмия (нерегулярные генерализованные высокоамплитудные медленные волны и разряды пиков, различной длительности и изменяющейся локализации). На фоне гипсаритмии возникают разряды пиков с гиперсинхронными медленными волнами (2—2,5 колебания в 1 с).
При органическом поражении центральной нервной системы на фоне общих диффузных изменений, характерных для этого вида поражения, обнаруживается диффузная дисритмия медленного типа с наличием гиперсинхронпых тета- и дельта-колебаний. Патологическая картина более выражена в затылочной области, что характерно для детского возраста.
Комплексное клинико-электроэнцефалографическое и нейро-рентгенологические исследования способствуют ранней этиологической диагностике и целенаправленному лечению.
Дифференциальный диагноз. Судорожные состояния у детей раннего возраста необходимо дифференцировать с несудорожнымп возрастными или патологическими двигательными реакциями.
У новорожденных, особенно у недоношенных, наблюдаются физиологические движения, обусловленные незрелостью мозга: атетоидные движения кистей и предплечий, отведение рук в стороны (спонтанный рефлекс Моро), асимметричный шейный тонический рефлекс, сокращение отдельных мышц или групп мышц, гримасничание, размашистые движения руками типа гемибализ-ма. У недоношенных эти движения ярче выражены в руках, так как мышечный тонус у них ниже по сравнению с доношенными, движения которых скованы мышечной гипертонией. Следует также отметить, что у новорожденных при крике во время осмотра может возникать тремор рук высокой частоты и низкой амплитуды, который тоже иногда неправильно относят к судорогам. Отведение глазных яблок в сторону, задержка их на некоторое время в этом положении может напоминать судорогу взора у детей старшего возраста. Эти движения, свойственные незрелому мозгу, отличаются от судорог тем, что они непостоянны, возникают при определенных ситуациях (манипуляции, осмотр, беспокойство ребенка). Судорожные пароксизмы часто сочетаются с различными неврологическими нарушениями, задержкой психического развития и наблюдаются в любое время суток. Дистонические атаки у детей с церебральными параличами иногда принимают за тонические судороги. При дистонических атаках дети не теряют сознания, а напряжение мышечного тонуса можно снизить, придав ребенку рефлексзапрещающую позицию.
15*
435
Течение и прогноз судорожных пароксизмов у детей раннего возраста зависят от причин, вызвавших последние, возраста, в котором они впервые появились, характера приступов и эффективности лечения.
Течение судорог, возникших в результате преходящих изменений ликвородинамики, неосложненных метаболических нарушений, может быть благоприятным. Они кратковременные, эпизодические и не нарушают общего состояния новорожденного. После коррекции метаболических нарушений, проведения дегидрата-ционной и противосудорожной терапии судороги исчезают, и ребенок развивается нормально.
Если в перинатальный период была патология (гипоксия, родовая травма), то судороги, возникшие в результате метаболических нарушений, в дальнейшем могут перейти в эпилепсию. Благоприятное течение наблюдается при простых фебрильных судорогах, не имеющих неврологических нарушений. Если фебрильные судороги возникают повторно или трансформируются в афебрильные, то такое течение может рассматриваться как начало эпилепсии и прогноз в этих случаях неблагоприятный. Судороги у детей с неврологическими изменениями (парезы, параличи, гидроцефалия, микроцефалия), задержкой психического развития, наследственно дегенеративными заболеваниями имеют тенденцию к прогредиентному течению. Вначале они отличаются кратковременностью, абортивностью, затем становятся полиморфными, учащаются и всегда утяжеляют течение основного заболевания.
Прогноз зависит также от характера судорожных приступов. Наиболее неблагоприятной формой их у детей раннего возраста являются малые пропульсивные припадки, которые резистентны к противосудорожной терапии и приводят к выраженной задержке психического развития в течение нескольких месяцев. Прогноз неблагоприятен также при частых генерализованных, длительных локальных приступах и судорожном статусе. Рано начатое дифференцированное лечение, успешный подбор эквивалентных соотношений лекарственных препаратов приводят к длительным ремиссиям и улучшают прогноз заболевания.
Противосудорожная терапия у детей раннего возраста предусматривает индивидуальный подход с учетом характера судорожных пароксизмов, их частоты, приуроченности ко времени суток, динамики клинических проявлений в процессе лечения. Следует уделить внимание анализу факторов, вызвавших судороги или обостривших их течение. Своевременная патогенетическая терапия основного заболевания нередко является основополагающей в лечении симптоматических судорог.
Важным принципом лечения судорог является выбор адекватной дозы лекарственных препаратов, при которой припадки уре-жаются или полностью прекращаются. Последняя зависит от характера и частоты судорожных пароксизмов.
436
Лечение рекомендуется начинать с меньших доз, постепенно Ь1шая их до полного прекращения припадков. Противосудо-П°жные средства в течение суток каждому больному следует Распределять индивидуально в зависимости от времени возникновения припадков. Для учета судорожных пароксизмов предлагается следующая схема.
Схема учета судорог
Дата Тип припадков Количество приступов после первой дозы лекарств Количество приступов после второй дозы лекарств Количество приступов после третьей дозы лекарств Всего приступов за сутки Противосудорожная терапия
Схема заполняется матерью ребенка или медицинской сестрой.
Точный учет судорожных пароксизмов позволяет проследить за их динамикой в течение определенного промежутка времени и обосновать изменение дозы или замену одного лекарственного препарата другим при проведении противосудорожной терапии.
Судорожные приступы у детей раннего возраста всегда являются показанием для экстренных лечебных мероприятий, так как они могут привести к отеку мозга и угнетению жизненно важных функций организма. В связи с тем, что судороги у новорожденных чаще всего обусловлены нарушением обмена веществ, купирование их до выяснения этиологического фактора следует начинать с введения метаболитов. Их применяют в определенной последовательности до полного прекращения приступов. Вначале вводят внутривенно 2—4 мл/кг 10—20% раствора глюкозы. Если судороги не прекратились, вводят внутривенно медленно под контролем ритма сердечной деятельности и ЭКГ 1 — 2 мл 10% раствора кальция глюконата и 0,2 мл/кг 25% раствора магния сульфата внутримышечно. Далее при отсутствии эффекта назначают 25—50 мг пиридоксина гидрохлорид внутривенно. Если судорожные приступы не купировались при введении метаболитов, применяют диазепам (седуксен) 0,3—0,5 мг/кг медленно внутривенно в 10 мл 26% раствора глюкозы.
Для длительной терапии судорожных состояний используют противосудорожные препараты. Фенобарбитал является одним пз основных средств при лечении судорог у детей раннего возраста. Он оказывает успокаивающее, противосудорожное, дегидратаци-онное и снотворное действие. Лечение фенобарбиталом начинают о возрастных доз 1—2 раза в день в зависимости от частоты приступов. Если спустя 2—3 дня число припадков не уменьшается, дозу постепенно наращивают. При отсутствии эффекта к люминалу можно добавить натрия бромид, кофеин, дифенин, хлоракон, бензонал и другие препараты, в зависимости от ха
437
рактера судорог. При передозировке люминала или индивиду, альной непереносимости могут наблюдаться побочные явления: сонливость, вялость, снижение аппетита, горизонтальный нистагм, тремор рук, гипотония, повышенная возбудимость. Уменьшение дозы люминала, добавление тиамина, рибофлавина, пиридоксина, аскорбиновой кислоты, димедрола снимает нежелательные явления интоксикации. Если люминал вызывает сонливость в воз-растных дозах или ребенок с рождения отличается вялостью, малой подвижностью, то фенобарбитал можно сочетать с кофе-ином.
При генерализованных судорожных припадках, малых и смешанных, протекающих с вегетативно-сосудистыми проявлениями, а также у детей с преобладанием тормозных процессов показано применение люминала в сочетании с дифепином. Дифенин оказывает действие на область межуточного мозга и, в отличие от фенобарбитала, не обладает снотворным действием. Эти качества дифенина делают его применение эффективным у детей с органическим поражением нервной системы, возникшим в результате перинатальной патологии или после перенесенного менингоэнцефалита. Дифенин стимулирует эмоциональные и психические реакции. Дети становятся более активными, дольше бодрствуют. Следует соблюдать осторожность при назначении его возбудимым детям. Дифенин не обладает кумулятивным действием, но может давать побочные токсические явления — нистагм, тошноту, снижение аппетита, раздражение слизистой рта, гиперплазию десен, стоматиты. При наличии изменений со стороны слизистой и десен дозу дифенина следует снизить или постепенно заменить его другим препаратом. Детям, длительно получающим дифенин, надо ежемесячно делать анализы крови и мочи, следить за общим состоянием. Противопоказан препарат при заболеваниях печени, почек, истощении. Для смягчения побочных действий назначают никотиновую кислоту, аскорбиновую кислоту, цианокобаламин, препараты кальция; при поражении десен — полоскание, массаж. При усилении явлений экссудативного диатеза дозу дифенина следует уменьшить.
У больных с частыми генерализованными судорожными припадками иногда эффективен гексамидин, особенно в сочетании с фенобарбиталом или дифенином. У заторможенных больных он улучшает психическое состояние. Противопоказан при заболеваниях печени, почек, кроветворных органов.
В раннем детском возрасте при лечении судорожных состояний часто применяется смесь Серейского и ее модификации. Основной составной частью смеси Серейского, оказывающей противосудорожный эффект, является сочетание люминал—кофеин— папаверин. Эти препараты, обладая спазмолитическим действием, улучшают трофику нервных клеток.
Смесь Серейского эффективна при больших и малых, судорожных припадках, полиморфных, а также у больных с диэн-
438
Жальным компонентом. Смесь Серейского обладает высокой Ц оапевтической эффективностью и малой токсичностью. Эти свой-\ва позволяют комбинировать ее с другими препаратами. Недостатком смеси Серейского является трудность маневрирования различными дозировками при отрицательном воздействии какого-либо ингредиента (жидкий стул при даче буры, быстрое окостенение черепных швов и артриты при длительной даче кальция глюконата, возбуждение при даче кофеина). В этих случаях вышеуказанные препараты выписываются отдельно и добавляются к основной смеси в нужной дозировке или исключаются вовсе.
Приводим основную пропись смеси Серейского ребенку 1 года: фенобарбитал — 0,01; бромурал — 0,01; кофеин-бензоат натрия — 0,002; папаверин — 0,002; кальция глюконат — 0,25.
Дозировки отдельных антиконвульсантов могут изменяться в зависимости от возраста и индивидуальной переносимости. Детям в смеси Серейского бромурал часто заменяют дифенином. При преобладании тонического компонента и сочетании генерализованных припадков с малыми добавляется бура. Разовая доза буры детям до 6 мес — 0,005—0,015; от 6 мес до 1 года — 0,015—0,025; 1—3 лет — 0,03—0,05. При наличии жидкого стула буру давать не следует. У детей, страдающих эпилептиформными припадками, часто наблюдаются запоры и бура в этих случаях оказывает благоприятный эффект. При небольших размерах родничков кальция глюконат часто исключается из смеси Серейского во избежание раннего окостенения черепных нервов. Высшие разовые дозы кальция глюконата у детей до 6 мес — 0,25; от 6 мес до 1 года — 0,25; 1—3 года — 0,5—1,0.
При наличии диэнцефального компонента к смеси Серейского можно добавить экстракт белладонны. Высшие разовые дозы для детей: до 6 мес — не назначается; от 6 мес до 1 года — 0,002; от 1 года до 3 лет — 0,003.
У детей раннего возраста чаще применяется так называемая
сложная смесь.
Ребенку 1 года: фенобарбитал — 0,01; дифенин — 0,06; бура — 0,015; кальция глюкопат — 0,25.
Дети хорошо переносят смесь Серейского и ее аналоги.
При фокальных корковых припадках, а также клонических генерализованных судорогах рекомендуется бензонал или его комбинации с другими противосудорожными средствами (фенобарбиталом, гексамидином). Бензонал не обладает снотворным Действием, мало токсичен. Снижает заторможенность, вялость, головную боль, вызываемую фенобарбиталом.
При малых пропульсивных припадках применяются хлоракон, гуксилеп, эпимид, тропацин, однако они не всегда эффективны. Хлоракон обладает седативным действием, не имеет снотворного эффекта, не токсичен, но противосудорожный эффект достигается только при применении больших доз. Поэтому хлоракон применяют в сочетании с люминалом, дифенином.
439
В последние годы для лечения этой формы припадков используются производные бензодиазепина — нитразепам (эуноК-тин, радедорм) и диазепам (седуксен). Доза нитразепама — 0, 1 мг/кг в сутки. Иногда приступы снимаются более высокими дозами. При этом могут наблюдаться сонливость, мышечная гипотония, атаксия. Снижение дозы препарата после купирования судорог снимает эти симптомы. Нитразепам оказывает благоприятное действие в 63% случаев, в 23% эффект минимальный или отсутствует, у 17% больных отмечается повышенная чувствительность к препарату (J. Lacy, J. Решу, 1976). Диазепам менее эффективен. Его доза — 0,5—0,8 мг/кг в сутки.
При отсутствии эффекта в течение 5—7 дней переходят на гормональную терапию (АКТГ, гидрокортизон, преднизолон, дексаметазон). Одни исследователи рекомендуют большие дозы АКТГ — 120—240 ЕД ежедневно (J. Gamstorp, 1970; В. Hagberg, 1976), другие — более умеренные — 24—40 ЕД (Р. Jeavons, В. Bower, 1974). Такую дозу Р. Jeavons и др. (1973) предлагают давать до прекращения судорог и еще в течение 4 нед. Затем на протяжении 3 мес дается поддерживающая доза, равная половине первоначальной. Наша клиника располагает опытом ле-*чения гормонами 58 детей раннего возраста с инфантильными спазмами. Первоначальную дозу АКТГ, равную 5 ЕД, мы постепенно увеличивали каждые 3—4 дня до 40—60 ЕД. После достижения терапевтического эффекта препарат вводили в этой же дозе в течение 10—15 дней. Затем ее медленно снижали. По нашим данным, АКТГ наиболее эффективен у детей 1-го года жизни. Гидрокортизон мы назначали из расчета 5 мг/кг массы тела, затем при отсутствии эффекта увеличивали дозу до 10— 20 мг/кг ежедневно. При формах, устойчивых к лечению, и рецидивах иногда рекомендуется наращивать дозу гидрокортизона до 40 мг/кг в сутки. Длительность лечения — от 2 до 12—18 нед. К концу лечения дозу препарата медленно снижают.
Преднизолон назначают в дозе 2 мг/кг, а дексаметазон — в дозе 0,3 мг/кг ежедневно. Длительность лечения — от 2 до 12 нед. Затем медленно снижают до полной отмены или оставляют поддерживающие дозы еще несколько недель или месяцев.
Оптимальная доза гормонального препарата и длительность лечения зависят от реакции и возраста ребенка, времени начала лечения, тяжести неврологических и психических отклонений. Уменьшение частоты или полное исчезновение приступов наступает обычно через 1—3 нед с начала лечения. Иногда наблюдается исчезновение судорог уже с первых дней. Стероидная терапия более эффективна у детей с нормальным психомоторным развитием и при раннем начале лечения. При наличии неврологических нарушений и задержки психического развития положительный эффект наблюдается реже и чаще бывают рецидивы, по и в этих случаях гормоны, купируя судороги, приводят к оживлению эмоциональных и психических реакций.
440
Перед началом лечения гормонами ребенка обследуют. Побоч-явления и противопоказания обычные для стероидов. Гормо-ПЬльную терапию следует проводить в стационаре, где имеется "озможность проследить за динамикой судорожного синдрома и &бщим состоянием ребенка. Для предупреждения побочных явлений необходимо ограничить поступление в организм натрия хлорила вводить препараты калия. Пища должна быть богата витаминами, минеральными веществами, белками.
Детям, у которых наряду с инфантильными спазмами имеют
ся другие пароксизмы, кроме гормонов назначают и противосудорожные препараты (табл. 9).
При отсутствии эффекта от лечения или плохой переносимости препарата возникает необходимость замены одного лекарства другим. В таких случаях следует учитывать эквивалентные соотношения основных противосудорожных средств (табл. 10):
для бензонала и люминала они составляют 2 : 1, хлоракона и люминала — 15 : 1, дифенина и люминала — 1,5 : 1. Знание их помогает избежать учащения припадков при различных модифика-
циях лечения.
При лечении судорог наряду с антиконвульсантами следует периодически назначать дегидратационную терапию: диакарб, глицерол, бринальдикс, лазикс (фуросемид), магния сульфат.
Если в результате лечения припадки прекратились, его следует продолжать еще не менее 2 лет. Затем под контролем ЭЭГ дозы препаратов постепенно снижают до полной отмены.
При резком снижении дозы припадки могут возобновиться, возможно развитие эпилептического статуса. Не рекомендуется снижать дозу в период соматических или инфекционных заболеваний. При длительном применении необходимы контроль за общим состоянием ребенка, анализами крови и мочи.
При фебрильных судорогах в острый период наряду с жаропонижающими средствами и антибиотиками необходимо назначать антиконвульсанты соответственно массе и возрасту ребенка, дегидратирующие средства при наличии симптомов повышенного внутричерепного давления, отека мозга. Вопрос о целесообразности назначения противосудорожных средств после первого фебрильного припадка с целью предупреждения повторных приступов, трансформации фебрильных судорог в эпилепсию, развития неврологических и психических нарушений в каждом случае должен решаться индивидуально в зависимости от возраста ребенка, семейного анамнеза, преморбидного состояния, характера и длительности судорожного приступа, изменений на ЭЭГ. Если приступ был кратковременный и пет факторов повышенного риска в отношении возникновения афебрильных судорог, то антиконвульсанты не назначаются до второго фебрильного припадка. Если фебрильные судороги возникли у ребенка Раннего возраста с объективными признаками первичного поражения мозга, лечение фенобарбиталом следует начинать после
441
Таблица 9. Высшие разовые дозы основных противосудорожных препаратов
Препарат Возраст
до 6 мес 6 мес — 1 гол 1 — 3 года
Люминал 0,005—0,01 0,01—0,02 0,01—0,03
Дилантин 0,003— 0,005 0,005—0,008 0,008—0,015
Гексамидин 0,01—0,03 0,03—0,06 0,05-0,09
Бензонал 0,005-0,015 0,02—0,03 0,03-0,05
Хлоракон 0,02—0,025 0,03-0,07 0,1-0,25
Тегретол 0,05-0,07 0,07-0,1 0,1-0,15
Суксилеп 2—3 кап. 3—4 кап. 4 — 6 кап.
Таблица 10. Примерные эквивалентные соотношения различных противосудорожных препаратов (по Е. С. Ремезовой, 1965)
Препарат Доза
Люминал 0,007 0,01 0,015 0,025 0,03 0,04
Дифенин 0,01 0,013 0,02 0,037 0,05 0,05
Гексамидин 0,025 0,03 0,045 0,08 ОД 0,12
Бензонал 0,015 0,02 0,03 0,05 0,07 0,08
Хлоракон 0,125 0,15 0,25 0,4 0,5 0,6
первого приступа. При наличии у ребенка второго афебрильного припадка его надо лечить как больного эпилепсией.
Лечение фенобарбиталом проводится в течение 2 лет после фебрильного припадка, а при повторении судорог — до 3 лет. Терапия прерывистыми курсами неэффективна.
Профилактика судорожных пароксизмов у детей раннего возраста сводится к предупреждению пренатальных, перинатальных и постнатальных повреждений мозга, ранней диагностике и патогенетическому лечению основного заболевания, вызвавшего судороги. Важным является предупреждение трансформации судорожных припадков в эпилепсию. Наличие повторных приступов, а также выявление на ЭЭГ признаков эпилептической активности является основанием для назначения превентивной противосудорожной терапии. Поэтому детей, у которых был хотя бы один судорожный приступ, необходимо взять на диспансерный учет и наблюдать в течение длительного времени.
XVI ИЗМЕНЕНИЯ НЕРВНОЙ СИСТЕМЫ глаВ# * ПРИ ОСТРЫХ ОТРАВЛЕНИЯХ
ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Отравления лекарственными препаратами встречаются преимущественно в дошкольном возрасте. По данным И. Г. Алма-зовой (1971), на их долю приходится 76% от общего числа лекарственных отравлений, причем дети до 3 лет составляют около 42%. Отравления, как правило, происходят дома и обусловлены отсутствием должного контроля за детьми, которых обычно привлекает оригинальная упаковка и яркая окраска таблеток, напоминающая конфеты или драже витаминов, а также неосторожным храпением лекарств. В последние годы значительно возросло число лекарственных отравлений препаратами седативного и психофармакологического действия (В. А. Михельсон и др., 1970; R. Reytremann, 1968; R. Goulding и др., 1968). В ряде стран смертность от острых лекарственных отравлений в детском возрасте занимает одно из первых мест среди прочих причин смерти (М. Gaultier и др., 1964).
Лекарственные вещества всасываются слизистой оболочкой тонкого и толстого кишечника и, попадая в организм в избыточном количестве, нарушают нормальный обмен веществ, вызывают функциональные или анатомические изменения различных органов и систем. Большинство лекарств всасывается быстро, и в течение 30—60 мин в крови создается их максимальная концентрация. Принятые в больших дозах препараты могут долго задерживаться в желудке и кишечнике. В течение этого времени продолжается их всасывание, в результате чего концентрация яда в крови длительно может оставаться высокой.
Токсические вещества разносятся током крови и распределяются в органах и тканях неравномерно. Степень поглощения их различными тканями зависит от интенсивности кровообращения и от растворимости данного вещества в тканевой жидкости. Большая часть лекарственных веществ поражает нервную систему. Следствием многообразных патологических токсических воздействий являются тканевая гипоксия, метаболический и респираторный ацидоз.
К возникающей кислородной недостаточности наиболее чувствительны ткани центральной нервной системы. Выделение токсических веществ происходит через почки, желудочно-кишечный тракт, сальные и потовые железы, слизистые оболочки. Некоторые яды (например, морфин, элениум), выделяясь стенкой желудка или с желчью в двенадцатиперстную кишку, могут вновь всасываться из кишечника, совершая, таким образом, в орга
443
низме своеобразный круговорот и длительно поддерживая па определенном уровне токсическую концентрацию лекарственного вещества. Скорость выделения ядов из организма различна. Задержке и накоплению отравляющих веществ способствуют заболевания почек, легких и других органов выделения.
Дети раннего возраста наиболее чувствительны к различным интоксикациям. Низкая толерантность к ядовитым веществам объясняется анатомо-физиологическими особенностями детского организма, незрелостью ряда систем и органов, в частности центральной нервной системы, лабильностью нейрогуморальных процессов. Особенно тяжело протекают отравления у ослабленных и больных детей. Удельный вес летальных исходов при отравлении сравнительно высок.
Причинами отравлений у детей раннего возраста могут быть нейролептические препараты, транквилизаторы, атропинсодержащие вещества, барбитураты, антигистаминные препараты. Общим для всех этих отравлений является нарушение сознания от оглушения до сопора или различной глубины коматозного состояния, наблюдаемые в острый период интоксикации. Ниже будут описаны особенности неврологических расстройств, характерные для отдельных видов отравлений.
Нейролептические средства
Аминазин. Отравление средней тяжести возникает у детей, принявших 125—175 мг аминазина (5—7 таблеток), тяжелое — при приеме 200—575 мг (8—23 таблетки). При отравлениях средней тяжести наблюдается повышенная сонливость. Сон, как правило, неглубокий. Больных можно легко разбудить, но они тотчас засыпают вновь. Сомнолентность или сопорозное состояние длится в течение 30 ч с момента приема препарата.
При тяжелом состоянии наблюдается неглубокая кома, которая через 8—10 ч сменяется сопором продолжительностью до 20—30 ч с момента интоксикации. У отдельных больных наблюдается психомоторное возбуждение.
Для острого отравления аминазином, кроме нарушения сознания, характерны другие неврологические нарушения: сужение зрачков и ослабление их реакции на свет, снижение тонуса мышц, тремор конечностей, сухожильная и периостальная гипер-или гипорефлексия, снижение кожных рефлексов. Вегетативные нарушения, связанные с адренолитическим эффектом аминазина, проявляются бледностью кожных покровов, снижением температуры тела, артериальной гипотензией. Такие симптомы, как сухость кожи и слизистых оболочек, тахикардия, учащение дыхания, связаны с холинолитическим действием аминазина. При тяжелых отравлениях выявляются нарушения функций дыхательной и сердечно-сосудистой систем, вызванные угнетающим действием больших доз аминазина на центры продолговатого
444
озга. Дыхание вначале учащенное, затем сменяется редким, аритмичным. Может произойти остановка дыхания. Сердечная деятельность ослабляется, пульс частый, слабого наполнения и напряжения, артериальное давление снижается вплоть до коллапса.
При ЭЭГ-исследовании на фоне негрубой дезорганизации альфа-ритма отмечаются периодически возникающие высокоамплитудные острые волны.
Диагноз отравления подтверждается качественным определением производных фенотиазина в моче больных в течение первых 2 сут интоксикации.
Трифтазин, галоперидол, френолон, мажептил. Эти средства обладают сильным нейроплегпческим действием. Их токсическое действие у детей раннего возраста возможно даже при приеме нескольких, а иногда и одной таблетки. Препараты оказывают избирательное действие на ростральные отделы сетевидной формации ствола мозга.
Характерен длительный латентный период (до 20 ч) от момента приема лекарств до появления выраженных неврологических симптомов. В клинической картине отравления преобладают экстрапирамидные нарушения: повышение мышечного тонуса по пластическому типу, гиперкинезы типа торсионной дистонии и спастической кривошеи. Для тяжелых форм отравления характерен акинетпко-ригидный синдром. Мышечный тонус повышается главным образом в экстензорных группах, иногда вплоть до состояния децеребрационной ригидности. У больных наблюдаются также тризм, насильственный крик, повышенная потливость, учащение пульса и дыхания.
Нарушения сознания проявляются в основном повышенной сонливостью в начальном периоде интоксикации.
Резерпин, раувазан, раунатин. Алкалоиды из растения рау-вольфия, обладающие психоседативным действием, у детей раннего возраста могут приводить к интоксикации при разовом приеме 1—6 таблеток (0,25—1,5 мг). У больных наблюдается повышенная сонливость в течение 10—12 ч, прерывающаяся периодами нерезкого психомоторного возбуждения. Характерны яркая гиперемия кожных покровов лица, шеи, верхней части туловища, конъюнктив, набухание слизистой носа с затруднением носового дыхания. Отмечаются сужение зрачков, мышечная гипотония, снижение пли повышение сухожильных рефлексов. Артериальное давление уменьшается, иногда возникают коллапс, брадикардия. Наблюдаются жидкий стул и рвота, иногда недержание мочи и кала. Соматовегетативные проявления свидетельствуют о преобладании тонуса парасимпатических отделов вегетативной нервной системы. Последнее обусловлено уменьшением количества серотонина в центральной нервной системе, а также катехоламинов в окончаниях симпатических нервов, что ослабляет влияние на эффекторные системы периферических органов.
445
Транквилизаторы
Элениум. Легкие отравления развиваются у детей после приема 50—70 мг (5—7 таблеток), отравления средней тяжести и тяжелые — после приема 80—400 мг препарата (8—40 таблеток). Элениум избирательно влияет на стволовые отделы мозга и мозжечок. Спустя 20 мин — 1ч после приема препарата появляется статическая и динамическая атаксия. Ребенок не может сидеть, стоять, ходить. Движения рук неточны. При попытке взять предмет выявляется интенционное дрожание. Мышечный тонус снижен. Речь растянута, скандированная. Наблюдаются также ограничение взора вверх, частичный птоз, горизонтальный п вертикально-ротаторный нистагм. Мозжечковые симптомы остаются выраженными в течение 5—10 дней с момента отравления. Нарушения сознания может не быть, либо оно появляется через 2—5 ч после приема таблеток. Степень его различна: оглушенность, сомнолентность, сопор, реже — кома с угнетением дыхания и сердечной деятельности. На фоне оглушения, сонливости возможны периоды психомоторного возбуждения. При анализе ЭЭГ отмечается преобладание низкоамплитудного бета-ритма, на фоне которого имеются четко локализованные участки с частотой 20-25 Гц.
Антидепрессанты
Мелппрамин (тофранил, имизин). Драже мелипрамина по форме и окраске напоминает шоколадное драже, чем привлекает особое внимание детей. Выраженные симптомы интоксикации наблюдаются у детей при приеме 20 мг/кг мелипрамина. Смертельной дозой для ребенка считают 350 мг.
При отравлениях средней тяжести после приема мелипра-мипа отмечается длительный латентный период (до 20 ч), во время которого дети вялы, сонливы. После этого появляются судорожные подергивания шеи, рук, туловища. Мышечный тонус повышается по пластическому типу. Сухожильные рефлексы высокие. При тяжелых отравлениях первые симптомы появляются через V2—1 ч после приема препарата. Больные вялые, сонливые или, наоборот, наблюдается выраженное психомоторное возбуждение. Дети кричат, пытаются бежать, что-то ловят руками. На фоне возбуждения возникают приступы генерализованных клонико-тонических судорог с непроизвольным мочеиспусканием и последующим сном, иногда переходящим в кому. У больных наблюдаются гиперемия и сухость кожных покровов и слизистых оболочек, учащенное дыхание, тахикардия, расширение зрачков и вялая их реакция на свет. Неврологические симптомы исчезают спустя 3—4 дня.
446
Алкалоиды группы атропина и содержащие их растении
Отравления атропином и другими алкалоидами этой группы (скополамином, апоатропипом) у детей раннего возраста наблюдаются при приеме внутрь токсических доз атропина сульфата, аэрона, астматола, келлатрппа, экстракта белладонны. В летний период возможны отравления вследствие употребления ягод белены, дурмана, красавки, содержащих алкалоиды группы атропина.
Наиболее чувствительны к препаратам группы атропина дети первых месяцев жизни. В возрасте до 3 мес отравление может развиться от приема 0,1 мг атропина сульфата, у детей 3 мес — 1 года интоксикация развивается после приема 3—5 суточных доз. Однако в некоторых случаях возможно появление признаков отравления при однократном закапывании атропина в глаза, то есть при терапевтических дозах последнего. Это свидетельствует о широком спектре индивидуальной чувствительности детей к атропину, которая в известной мере определяется преморбидным состоянием больного. Атропиновая интоксикация при приеме возрастных доз препаратов наблюдается чаще у детей, имеющих какое-либо общее пли неврологическое заболевание.
Патогенез острых отравлений алкалоидами группы атропина тесно связан с токсическим воздействием их на задние отделы гипоталамической области и ретикулярную формацию ствола мозга.
Клинические признаки развиваются через 15—20 мин после приема токсической дозы препарата. Ведущим симптомом первой фазы отравления является психомоторное возбуждение, сопровождающееся яркими зрительными галлюцинациями. Ребенок кричит, мечется в постели, встает, пытается бежать. Наблюдаются сухость кожных покровов, покраснение лица и туловища, инъекция склер, расширение зрачков, повышение температуры тела. Могут быть одышка и артериальная гипертония. В этот период выявляются признаки пирамидной недостаточности в виде повышения мышечного тонуса, сухожильных и периостальных рефлексов, появления патологических рефлексов, снижения или отсутствия брюшных рефлексов. Иногда наблюдаются тремор конечностей и локомоторая атаксия.
Во второй фазе отравления (через 6—10 ч) преобладают симптомы угнетения центральной нервной системы: потеря сознания вплоть до комы, гипотония мышц, снижение или отсутствие сухожильных рефлексов. Смерть наступает от паралича Дыхательного центра.
Основной особенностью острого отравления скополамином является большая, чем при отравлении атропином, выраженность явлений угнетения нервной системы. В начале интоксикации Развивается фаза сомнолентности длительностью от 2 до 7 ч, после которой наблюдается делириозное состояние, сменяющееся в свою очередь сомнолентностью, сопором или комой.
447
Седативные средства
Препараты барбитуровой кислоты (фенобарбитал, этаминал-натрий, барбитал-натрий). Дети первых 3 лет жизни особенно чувствительны к барбитуратам. Прием 1—2 таблеток, содержащих обычную снотворную дозу для взрослых, может привести к летальному исходу. Индивидуальная чувствительность к препаратам этого ряда колеблется в широком диапазоне. Отравление средней тяжести может развиваться при приеме от 1 до 6 таблеток снотворных, тяжелое — при приеме 2—10.
Патогенез отравления барбитуратами связан с нарушением передачи импульсов в синапсах и патологией генерации возбуждения.
Основным в клинической картине этого отравления является нарушение сознания, проявляющееся с первых минут интоксикации. Развиваются сонливость, оглушенность продолжительностью 10—30 часов, а при тяжелых отравлениях коматозное состояние различной глубины, длящееся от 10 до 50 ч.
Неврологическая симптоматика варьирует в зависимости от периода интоксикации. Во время засыпания отмечаются нарушения координации движений, невнятная, смазанная речь, сужение зрачков, нистагм, повышение сухожильных рефлексов. В стадии глубокой комы рефлексы отсутствуют, мускулатура расслаблена, исчезает реакция на сильные болевые раздражители, расширяются зрачки, реакция их на свет отсутствует.
Особую опасность представляют наблюдающиеся при тяжелых отравлениях барбитуратами расстройства функции дыхания и кровообращения. При поверхностной коме отмечается аспирационно-обтурационная форма нарушения дыхания, обусловленная гиперсаливацией, бронхореей, аспирацией рвотных масс и ла-рингоспазмом, к которому наиболее склонны дети до 3 лет. Эти проявления обусловлены адренолитическими свойствами барбитуратов. При глубокой коме присоединяются дыхательные расстройства центрального типа. Учащенное шумное дыхание уре-жается, уменьшается его глубина, ритм становится неправильным (типа Чейна—Стокса). Сначала частый пульс постепенно замедляется, артериальное давление падает вплоть до коллапса. Может развиться отек легких. Для периода восстановления сознания характерны феномен «игры зрачков», глазодвигательные нарушения, постепенное повышение мышечного тонуса, тремор конечностей, расстройства координации, повышение сухожильных рефлексов.
Тяжесть интоксикации может усугубиться присоединением трахеобронхита, пневмонии, флебита, пиелонефрита.
Имеется определенная зависимость между концентрацией барбитуратов в крови и состоянием сознания. Коматозное состояние развивается при концентрации препарата в крови свыше 0,03 г/л, а при отравлении этаминал-натрпем — около 0,01 г/л.
448
При ЭЭГ-исследованпп обнаруживается преобладание учаще-бета-ритма в среднем до 18—24 Гц. Бета-ритм носит вере-НеНОобразный характер, что соответствует фазе сна.
Беллоид,белласпон, беллатаминал. В состав этих препаратов входят барбитураты, алкалоиды белладонны и эрготоксин. Индивидуальная чувствительность к этим средствам у детей раннего возраста различна. Отравления могут возникнуть при приеме от 2 до 40 таблеток. Несмотря на наличие в составе этих препаратов алкалоидов группы атропина, в клинической картине преобладают симптомы барбитуровой интоксикации в виде нарушения сознания разной степени вплоть до глубокой комы. «Атропиновое возбуждение» как бы приглушено и наблюдается на фоне сомнолентности или сопора лишь при проведении манипуляций. Вегетативные расстройства при отравлениях средней тяжести такие же, как при воздействии атропиноподобных веществ — расширение зрачков, гиперемия и сухость кожи и слизистых оболочек, учащение дыхания, тахикардия, гипертермия, повышение артериального давления. Доминирование парасимпатических отделов вегетативной нервной системы, наблюдающееся при тяжелых отравлениях и присущее токсическому действию барбитуратов, проявляется сужением зрачков, бледностью кожных покровов, гиперсаливацией, повышенной секрецией слизи в бронхах, урежением дыхания и сердцебиения, цианозом, снижением артериального давления.
На ЭЭГ выявляется общая дисритмпя, преимущественно в передних отделах, с участками высокоамплитудного бета-ритма частотой 20—25 Гц. При тяжелых отравлениях доминирует высокоамплитудная медленная активность частотой 2—3 Гц.
Тяжесть интоксикации при отравлении беллоидом и белас-поном определяется в основном токсическим действием барбитуровой кислоты. Имеется прямая зависимость между концентрацией барбитуратов (бутобарбитала) в крови и степенью нарушения сознания. При концентрации препарата 0,0165—0,02 г/л больные находятся в состоянии комы пли сопора, содержание 0,005—0,015 г/л соответствует состоянию сомнолентности. Прояснение сознания происходит при концентрации препарата ниже 0,005 г/л.
Антигистаминные препараты
Пипольфен, димедрол, супрастин. Тяжесть отравления определяется не только количеством принятого внутрь вещества, но и степенью индивидуальной чувствительности к нему. Дети раннего возраста особенно чувствительны к этой группе препаратов. Клиника отравления во многом сходна с картиной отравления нтропинсодержащпми веществами, что может быть связано с Холинолитическим действием антигистаминных средств. Они избирательно влияют на такие образования центральной нервной
449
системы, как ретикулярная формация ствола мозга, вестибулярный анализатор, мозжечок. Имеется также выраженный тропизм по отношению к сосудистой системе.
Основным в клинической картине отравления является психомоторное возбуждение с яркими зрительными галлюцинациями. Продолжительность этого состояния составляет 10—12 ч. Оно может предшествовать фазе нарушения сознания пли развиться после нее. Клиника нарушения сознания проявляется чаще оглушенностью или повышенной сонливостью, при тяжелых отравлениях может быть кома различной глубины. У большей части больных в фазе возбуждения наблюдаются различного характера судороги: миоклонические подергивания отдельных мышечных групп, единичные или повторные генерализованные припадки. В период возбуждения наблюдаются также такие неврологические симптомы, как мидриаз, повышение мышечного тонуса и сухожильных рефлексов, тремор конечностей, динамическая и статическая атаксия. Сопор или кома сопровождается сужением зрачков, снижением мышечного тонуса, гипорефлекспей. Вегетативные расстройства включают гиперемию и сухость кожных покровов и слизистых оболочек, учащение дыхания, тахикардию, повышение артериального давления.
На ЭЭГ регистрируются отдельные высокоамплитудные острые и медленные волны, возникающие в любом участке коры мозга.
Неотложная терапия при острых лекарственных отравлениях включает мероприятия по выведению токсического агента из организма, детоксикации яда с помощью антидота и мер по поддержанию основных жизненных функций. Выведению яда из организма способствуют промывание желудка, дача солевого слабительного, очистительная клизма. У детей раннего возраста промывание желудка лучше проводить изотоническим раствором натрия хлорида с целью профилактики нарушений водно-солевого обмена (2—3 столовые ложки натрия хлорида на 5—10 л воды). Основным методом борьбы с отравлениями является форсированный диурез, так как при этом ускоряется процесс удаления яда из организма. Форсирование диуреза достигается при легких отравлениях обильным питьем щелочных вод, при отравлениях с нарушением сознания — внутривенным введением 5% раствора глюкозы, изотонического раствора глюкозы, изотонического раствора натрия хлорида, раствора Рингера. Жидкость вводят из расчета 100—200 мл на 1 кг массы тела под постоянным контролем за количеством выделяемой мочи.
Соотношение глюкозы и солевых растворов у детей до 3 лет должно составлять 3:1. Между количеством вводимой жидкости и диурезом должно быть равновесие. Максимальная задержка жидкости не должна превышать 1,5—2% массы тела. Для усиления выделительной функции почек следует применять диуретические препараты (лазикс, фуросемид), а также осмотические
450
упетики (маннитол). Проводятся мероприятия по нормали-ции кислотно-щелочного равновесия. У больных в коматозном ^стоянии дезинтоксикационную терапию начинают после пред-Сапцтельного установления адекватной вентиляции легких.
Вс С целью ликвидации сердечно-сосудистых нарушений применяют сердечные гликозиды, прессорные амины, гормоны. Ана-лептики (кофеин, кордиамин) следует назначать с осторожностью,
так как они могут истощить резервные возможности дыхательного центра, а у детей до 3 лет могут вызвать судорожный синдром. При отравлениях снотворными и транквилизаторами применяют бемегрид. Для борьбы с гипертермическим синдромом следует использовать как физические методы охлаждения тела, так и антипиретические средства (анальгин, амидопирин). При
наличии судорожного синдрома проводят противосудорожную терапию. В случае присоединения септических осложнений назначают антибиотики. С целью ликвидации метаболических нарушений следует применять аскорбиновую кислоту, витамины группы В, кокарбоксплазу.
Своевременное и комплексное проведение дезинтоксикацион-ной и симптоматической терапии острых лекарственных отравлений в большинстве случаев приводит к выздоровлению детей.
Глава XVII. РАННЯЯ ДЕТСКАЯ НЕРВНОСТЬ
Ранняя детская нервность — это особый тип развития нервной системы, который иногда называют также врожденной нервностью, невропатией, конституциональной нервностью, невропатической конституцией, нервным диатезом и др. Во всех случаях речь идет о конституционально обусловленных врожденных ре-акциях нервной системы. Это отличает невропатию от невроти-ческих реакций, которые имеют приобретенный характер и обусловлены неблагоприятными условиями окружающей среды, недостатками воспитания, режима, психическими травмами.
Таким образом, врожденная детская нервность (невропатия) не является болезнью в истинном смысле слова, а лишь фоном, предрасполагающим к возникновению различных невротических и психопатических расстройств.
Важность изучения невропатий раннего детского возраста определяется чрезвычайно высокой частотой этих состояний у детей, а также необходимостью разработки специальных профилактических мероприятий по предупреждению различных нервно-психических заболеваний у детей с невропатией.
Этиология. Причины врожденной нервности различны. Имеются указания на роль наследственных факторов в ее происхождении. Так, Т. П. Симеон (1929) отметила повышенную нервную возбудимость одного или обоих родителей в 78,8% случаев врожденной детской нервности. На роль наследственных факторов в происхождении врожденной нервности указывает и Г. Е. Сухарева (1959). Она отметила в семьях детей-невропатов наличие так называемых нервных субъектов с признаками повышенной эмоциональной возбудимости, астении, тревожности, мнительности. Признавая роль наследственных факторов, Г. Е. Сухарева указывает в то же время на трудности обоснования в каждом конкретном случае непосредственных причин невропатии.
Наряду с наследственными факторами причинами детской нервности могут быть различные неблагоприятные влияния в перинатальном или раннем постнатальном периодах. Нервные потрясения матери во время беременности, токсикозы, хронические и эндокринные заболевания, асфиксия в родах, диспепти-ческие и желудочно-кишечные расстройства, инфекционные заболевания, возникающие в первые месяцы жизни ребенка.— наиболее частые экзогенные факторы, способствующие развитию невропатии.
452
Таким образом, при изучении причин невропатии выявляется сложная взаимосвязь между эндогенными и экзогенными факторами.
В зависимости от этиологии можно выделить конституциональную, врожденную невропатию и невропатию на фоне раннего органического поражения мозга. В первой группе невропатия является основным клиническим проявлением, во второй — она сочетается с общей церебральной дисфункцией, обусловленной органическим поражением мозга.
Патогенез. В основе врожденной нервности лежит нарушение функции вегетативной нервной системы — снижение порога ее возбудимости, состояние своеобразной вегетативной дистонии (В. В. Ковалев, 1974).
Клиническая картина. Для детей раннего возраста наиболее характерны проявления невропатии в форме вегетатив-пой дистонии. характеризующейся нарушением ряда сомато-ве-гетативных функций (процессов пищеварепия, терморегуляции, регуляции сна и бодрствования и т. д.), общей ^возбудимостью и истощае_мостыо нервной системы.
ТТевропатия может проявляться уже в первые дни жизни. Ребенок с врожденной детской нервностью мало спит, проявляет общее беспокойство, кричит и успокаивается только при кормлении. В дальнейшем общая повышенная возбудимость нервной системы становится еще более выраженной. Несмотря на правильный режим и уход, а также достаточное количество пищи, ребенок остается беспокойным, много плачет и требует к себе постоянного внимания. Часто мать считает беспокойство ребенка проявлением голода и старается дать ему лишний раз грудь. Однако кормление еще больше ухудшает состояние ребенка, усиливает его беспокойство.
Одним из первых симптомов невропатии является отказ ребенка от груди матери, который может быть проявлением своего рода защитной реакции на какие-либо неприятные ощущения во время кормления, например, на чувство боли при неврогенном пилороспазме. Эти ощущения прочно ассоциируются во времени с актом сосания по типу отрицательного условного рефлекса и требуется много усилий для его подавления.
Наряду с нарушением сосания отмечается предрасположенность к срыгиваниям, которые у детей с невропатией носят нерегулярный характер. При наличии функционального, неврогенного пилороспазма может наблюдаться рвота. Для невропатии характерны и кишечные расстройства. Последние проявляются обычно диспептическими нарушениями. Склонность к поносам связана с повышенной возбудимостью кишечной стенки, приводящей к усилению перистальтики кишечника под влиянием даже незначительных раздражителей. Реже отмечаются ослабление перистальтики и склонность к запорам. Поносы могут чередоваться с запорами. Возможны также позывы без последующего опо-
453
рожнения кишечника. Нарушения со стороны кишечника у детей с невропатией возникают под влиянием различных психогенных факторов и легко закрепляются по типу условной связи. Так, склонность к привычным запорам может возникнуть, если ребенок под влиянием эмоций страха однажды задержал акт испражнения. Этот симптом фиксируется и закрепляется. Особенно легко запоры или, наоборот, недержание кала (эпкопрез) у детей с невропатией возникают в новой для них обстановке. Нередко при невропатии отмечается недержание мочи (энурез).
Нарушения аппетита — характерный признак невропатии. У некоторых детей наблюдается полная анорексия. Наряду с нарушением аппетита возможны расстройства глотания п жевания. Дети с трудом пережевывают пищу, отказываются от твердой пищи, сам процесс еды является для них трудным и тягостным. Пережеванную пищу дети не глотают, а задерживают во рту иногда в течение нескольких часов. Это может быть связано со страхом глотания, развившимся в связи с какими-либо неприятными ощущениями в процессе глотания (слишком горячая пли холодная пища, боль в горле и т. д.). На раздражитель легко возникает отрицательная условная связь, которая прочно фиксируется в сознании. В некоторых случаях нервная анорексия может иметь характер реакции протеста против поступления в детское учреждение, насильного кормления или каких-либо запретов.
С нервной анорексией тесно связана привычная рвота. Ребенок отказывается от глотания густой пли твердой пищи и при всяком насильственном кормлении, а иногда и при кормлении жидкой пищей у него появляется рвота, особенно если в пищу попадают пенка, комочек каши и т. д. Иногда привычная рвота может возникать только при виде пищи. У детей с невропатией рвотный рефлекс образуется с чрезвычайной быстротой. Иногда достаточно однократной рвоты, чтобы все раздражители, действующие на ребенка в этот момент (вид и запах пищи, окружающие предметы, слова и т. д.), образовали связь со рвотным центром. Особенно легко возникает рвотный рефлекс после некоторых соматических заболеваний, во время которых наблюдалась рвота. Образовавшийся условный рефлекс угасает с большим трудом.
В связи с желудочно-кишечными расстройствами, снижением аппетита, длительным отказом от еды у детей раннего возраста нарушается трофическая функция. Последние еще более усиливаются и отличаются стойкостью, если имеются нарушения обмена, связанные с дисфункцией гипоталамических образований. В этих случаях возникают проявления церебральной гипотрофии.
Для детей с невропатией также характерна избирательность в еде. Многие из них предпочитают жидкую пищу и отказываются от твердой, у других имеет место боязнь новых блюд, в некоторых случаях отмечается стремление есть несъедобные 454
вещи (уголь, известь, песок и т. д.). Иногда нарушения аппетита сочетаются с повышенной жаждой. При биохимическом исследовании у таких детей иногда обнаруживаются склонность к глюкозурии, лабильность концентрации сахара крови, фосфатурия, оксалурия.
Среди других сомато-вегетативных нарушений для детей с невропатией характерны функциональные сосудистые расстрой-ства, которые выражаются в быстрых ^колебаниях сосудистого тонуса (смена побледнения и покраснения кожных покровов, преходящие приступы цианоза). Лабильность вазомоторного аппарата вызывает повышенную склонность к обморочным состояниям, что обычно проявляется уже в более старшем возрасте.
Для детей с невропатией характерна плохая приспособляемость к изменяющимся метеорологическим условиям. В периоды понижения барометрического давления, повышенной влажности воздуха, сильных ветров у них усиливаются описанные выше сомато-вегетативные нарушения, могут появляться головные боли.
У некоторых детей отмечается повышенная склонность к аффективным респираторным приступам, которые развиваются под влиянием различных психогенных факторов — раздражения, страха, радости, возбуждения. Нередко приступы возникают после плача или крика. Ребенок задерживает дыхание на вдохе, синеет. Иногда после длительной задержки дыхания появляются генерализованные судороги.
У детей с невропатией могут быть приступы, напоминающие бронхиальную астму. Они развиваются после перенесенного коклюша, а иногда и после обычных бронхитов, фарингитов, ларингитов и продолжаются в течение многих месяцев. После ложного крупа у ребенка также может длительное время оставаться сильный лающий кашель.
Характерна реакция ребенка с невропатией на инфекцию. Она проявляется резко выраженными явлениями возбуждения в виде беспокойства, крика, иногда судорогами и бредом. В некоторых случаях, напротив, отмечаются вялость, апатичность, сопливость, заторможенность. Все соматовегетативные расстройства в период любого инфекционного заболевания резко усиливаются, часто возникают явления токсикоза с нарушением сердечной Деятельности и коллапсом.
Отмечена повышенная склонность детей с невропатией к проявлениям позднего рахита.
Важным признаком детской нервности в грудном и ясельном возрасте является нарушение сна в виде затруднения при засыпании, беспокойного сна, иногда очень раннего пробуждения. Ребенок долго не может уснуть, становится капризным, дви-гательно беспокойным. Расстройства сна иногда перерастают в бессонницу: ребенок не спит всю ночь, беспрерывно кричит. Если вначале крик вызван каким-либо неприятным раздражением, то уже позднее ребенок кричит без всякой причины (фик-
455
сированный крик). У некоторых детей как бы вырабатывается отрицательный условный рефлекс на ночной сон. Вначале бес-сонпица возникает как реакция на неудобное положение в кроватке, шум или тишину, свет или темноту, чувство голода, боли в животе, перегрев или охлаждение тела и т. д. Один раз прерванный сои фиксируется в психике ребенка длительное время.
Иногда затрудненное засыпание зависит от эмоционального перевозбуждения ребенка перед сном. Это бывает в тех случаях, когда взрослые оказывают ему чрезмерное внимание вечером, ласкают, обнимают, целуют. В результате ребенок не только перевозбуждается, но и, стремясь получить больше внимания и продлить удовольствие от общения с близкими, долго не засыпает. Ребенок с невропатией особенно чувствителен к ласке, но ласку и внимание ему надо оказывать не в часы засыпания, а в течение дня и бодрствования.
В силу пониженного порога возбуждения нервной системы дети с невропатией спят беспокойно, вздрагивают и просыпаются от малейшего шума, в более старшем возрасте (со 2-го полугодия жизни) иногда кричат во сне. Нарушения сна обычно усиливаются после любого заболевания, во время которого ребенку оказывается усиленное внимание в ночное время. Дети с невропатией в момент засыпания и сна нередко ритмично покачиваются, сосут пальцы, грызут ногти, чешутся, у некоторых из них наблюдается постоянное качание головой в сторону. Во сне могут быть вздрагивания под влиянием различных резких раздражителей, особенно звуковых.
На 2-м году жизни у детей с невропатией отмечаются устрашающие сновидения, ночные эпизоды в форме приступов испуга и снохождений. При ночном испуге у ребенка возникает своеобразное состояние, переходное между сном и бодрствованием. Ребенок, не просыпаясь полностью, начинает кричать, иногда пытается куда-то бежать. Широко раскрытые глаза выражают состояние страха, по выражению лица и по отдельным высказываниям ребенка можно заключить, что он видит что-то страшное. В этом состоянии он не всегда узнает близких, плохо ориентируется в окружающей обстановке. На следующий день ребенок обычно не помнит о ночном эпизоде или у него сохраняются только отдельные отрывочные воспоминания. Ночной испуг возникает под влиянием ничтожных психогенных факторов, которые приобретают более выраженное патогенное значение в тех случаях, если они действуют перед засыпанием пли в ночное время. Раз возникнув, ночные страхи по типу упрочившейся условной связи сохраняются обычно в течение длительного времени.
Для многих детей характерен фобический синдром (синдром страха). Страхи обычно возникают под влиянием различных экзогенных факторов — физических или психических. Так, у детей, переживших какую-либо болезненную манипуляцию, надолго 456
тается страх перед всем, что с ней связано. После инъекций лекарственных веществ ребенок может длительно бояться белых халатов. Ребенок с невропатией, обучающийся ходить, после падения долго испытывает страх перед процессом ходьбы п длительное время не возобновляет ее снова.
Наряду со страхами для детей с невропатией характерна повышенная склонность к онанизму.
Моторное и речевое развитие у детей с невропатией нормальное, иногда даже ускоренное по сравнению со здоровыми сверстниками. Они рано начинают поднимать голову, сидеть, ходить, говорить. У некоторых детей обращают на себя внимание грациозность движений, недетски серьезное выражение лица. Часто отмечаются акроцианоз, похолодание конечностей, повышенная потливость, склонность к аллергическому насморку и проявлениям кожного диатеза.
В неврологическом статусе этих детей наблюдаются лабильность и чрезмерная живость сухожильных и кожных рефлексов наряду с ослаблением или исчезновением глоточного и корнеального рефлексов. Характерна также лабильность мышечного тонуса. Перед началом обследования из-за повышенной возбудимости ребенка мышечный тонус повышается и может создаться ложное впечатление о спастичности мышц. Кроме того, дети с невропатией иногда имеют склонность ходить на пальчиках, особенно в период общего возбуждения. Однако в отличие от детей с церебральными параличами все эти нарушения тонуса и моторики преходящи и зависят от общего возбужденного состояния ребенка.
При невропатии может быть понижен порог болевой и тактильной чувствительности. При обследовании зрачковых реакций нередко выявляют расширение зрачков (мидриаз), неравномерность их реакции на свет, беспокойство зрачков (прыгающий мидриаз).
При исследовании вегетативной нервной системы обнаруживается вегетативная дистония: значительные колебания пульса при изменении положения тела, неустойчивость артериального давления, дыхательная аритмия, резкий дермографизм (чаще красный, иногда белый). Интеллектуальное развитие при невропатии обычно нормальное.
Психические особенности проявляются раздражительной слабостью, легкой возбудимостью и быстрой истощаемостью в сочетании с повышенной впечатлительностью. Дети отличаются любознательностью, с интересом и желанием принимаются за различную деятельность, но в силу повышенной психической истощаемостп не доводят начатое дело до конца.
Клинические варианты детской нервности. По особенностям психической деятельности выделяют два клинических варианта детской нервности. При первом — у детей преобладают повышенная возбудимость и раздражительность. Де-
457
ти двигательно беспокойны, склонны к раздражительности, к колебаниям настроения, суетливости, часто проявляют грубость, непослушание, внимание их крайне неустойчиво. Повышенная раздражительность и суетливость мешают их контакту со сверстниками. В их аффективных вспышках по существу отсутствуют настоящая злоба, аффект их нестоек, после проявления грубости раскаиваются, просят прощения. Они крайне истощены, двинь тельное беспокойство усиливается при общем утомлении, склонны к примитивным реакциям истероидного типа, в случае неудовлетворения их желаний бросаются на пол, болтают ногами и могут кричать несколько часов подряд, добиваясь желаемого. Течение этого клинического варианта детской нервности часто длительное.
При втором варианте преобладают явления повышенной псто-щаемости. Дети пугливы, легко тормозятся в новой обстановке, малоактивны, избегают трудностей, плохо приспосабливаются к изменению окружающей обстановки. Они отличаются повышенной ранимостью п чувствительностью, поэтому стараются оберегать себя от столкновений с действительностью, в связи с чем часто находятся в стороне от детского коллектива. Дети не уверены в себе, очень тревожны. Боязнь оказаться несостоятельными часто бывает причиной плохого настроения. Достаточно незначительного повода, чтобы вызвать у них чувство страха. Течение этой формы невропатии обычно благоприятное. При проведении лечебно-педагогических мероприятий дети постепенно становятся увереннее, жизнерадостнее и работоспособнее.
Психические особенности детей с ранней детской нервностью характеризуются особой динамикой, что объясняется в первую очередь повышенной чувствительностью этих детей к различным раздражителям, главным образом отрицательного характера. Поэтому на фоне невропатии легко возникают различные симптомы реактивного, невротического характера с преобладанием вегетативно-соматических или двигательных расстройств, которые имеют несколько различную структуру в зависимости от возрастной фазы развития и выделенных двух вариантов психических особенностей.
У детей ясельного возраста наиболее часто возникают описанные выше невротические желудочно-кишечные расстройства, нервная анорексия, энурез, энкопрез, нарушение сна, страхи, двигательное беспокойство со склонностью к реакциям истероидного типа, иногда заторможенностью (С. В. Аксентьев, 1974). Кроме того, у детей первых 3 лет жизни легко возникает заикание часто под влиянием незначительных факторов.
В период первого возрастного криза (к 3 годам) у детей с невропатией могут отмечаться патологически усиленные проявления общего или частичного негативизма.
Диагноз врожденной нервности обычно не представляет трудностей. Основными признаками являются симптомы вегета-458
ТЙВно-сосудистой недостаточности, которые в последующие возрастные периоды усложняются характерными психическими особенностями.
Дифференциальный диагноз врожденной нервности проводится с различными формами приобретенных астенических состояний (соматического, инфекционного, травматического пли психогенного генеза), а также с психопатией и неврозами.
При отграничении врожденной нервности от других форм приобретенных астенических состояний прежде всего необходимо обратить внимание на время появления патологических симптомов. При врожденной детской нервности они нередко проявляются с рождения без видимой причины, несколько видоизменяясь на различных возрастных этапах. Приобретенные астенические состояния возникают после каких-либо определенных экзогенных вредностей (болезней, травм и т. д.). Кроме того, приобретенные астенические состояния отличаются определенными особенностями в зависимости от характера экзогенного воздействия. Астенические состояния после тяжелых инфекций и травм характеризуются сенсорными нарушениями (расстройством восприятия величины и формы предметов и их пространственных отношений), более выраженными нарушениями памяти и расстройствами настроения. Для постгриппозной астении характерны выраженные нарушения сна и настроения, которые приобретают депрессивный оттенок. При посттравматической астении особенно выражены раздражительность, склонность к аффективным взрывам, нарушения памяти.
В отличие от приобретенных астенических состояний при невропатии отмечаются большая живость и дифференцированность эмоциональных реакций и большая сохранность памяти, нарушения работоспособности более обратимые.
Наибольшие затруднения в диагнозе возникают при отграничении врожденной нервности от приобретенных астенических состояний психогенной природы и от неврозов. Для дифференциального диагноза важно установить связь между клиническими проявлениями и содержанием психической травмы, а также учесть время появления синдрома.
Трудности диагноза усугубляются тем, что психогенные и соматогенные расстройства наиболее часто возникают на фоне врожденной нервности: характерная для нее недостаточность регуляции функций вегетативной нервной системы предрасполагает к их возникновению. На основе тщательного анализа клинической картины заболевания важно решить, что является главным на данном этапе — невропатия или психическая травма.
При разграничении врожденной нервности и психопатии важно учитывать тот факт, что плохая приспособляемость к условиям окружающей среды при невропатии связана главным образом с сомато-вегетативной дисфункцией, а не с патологией поведения, как при психопатии. Воспитание детей с невропатией
459
обычно не представляет значительных трудностей. В отличие от детей с психопатией они характеризуются целенаправленным поведением, стремлением к контакту со сверстниками, нормаль-ными эмоциональными реакциями. Основные проявления психопатии — неумение регулировать свое поведение и правильно строить социальные взаимоотношения в результате патологии характера и влечений — у детей с невропатией отсутствуют.
Лечение. Профилактика. При наличии невропатии для ее компенсации и предупреждения возникновения неврозов первостепенное значение имеет правильное воспитание ребенка. Учитывая повышенную истощаемость нервной системы, важно избегать нервных перегрузок детей, проводить мероприятия по физическому и психическому закаливанию, тренировать вегетативно-сосудистые функции. Таким образом, лечение в первую очередь сводится к укреплению организма ребенка. В этом отношении большое значение имеют правильные режим и питание, физкультура (гимнастика, спортивные игры), различные водные процедуры (обтирания, души, ванны).
Прежде, чем выбрать метод лечения, необходимо попытаться выяснить причины невропатии и устранить неблагоприятные психогенные факторы, действующие на ребенка. Так, при нарушениях аппетита родители должны принять меры, чтобы у ребенка не было отвращения к еде, а наоборот, пробуждался голод, формировалось нормальное отношение к еде и вырабатывался положительный рефлекс на процесс кормления. Важно установить четкий режим кормления. Пища не должна быть слишком холодной или горячей. Категорически запрещается кормить ребенка насильно, особенно при недомогании, перекармливать его, кормить, чередуя угрозы и обещания, а также кормить во сие или отвлекая внимание ребенка от еды при помощи рассказывания сказок или дачи игрушек. Иногда этого трудно бывает добиться в домашней обстановке, и в этих случаях показано пребывание ребенка в детском коллективе.
При наличии у ребенка страха ни в коем случае нельзя смеяться над ним или путем грубого насилия стараться его преодолеть. Надо пытаться вводить пугающий объект в сферу его познавательных интересов, подкрепляя это каким-либо приятным для ребенка моментом. Не следует рассказывать на ночь сказки, разрешать просмотры телепередач. Перед сном все резкие раздражители должны быть устранены. Категорически запрещается запугивать детей различными реальными и мифическими «пугалами». Ребенка надо последовательно и осторожно знакомить с окружающим миром, постепенно вводить новые для него объекты, давая им соответствующие объяснения.
Помимо воспитательных мероприятий показано применение седативных средств (препараты брома, валерианы).
При сочетании общей возбудимости с проявлениями аллергии применяется десенсибилизирующая терапия (препараты кальция, 460
имедрол, супрастин, тавегил). При состояниях двигательного беспокойства назначают также электрофорез с кальцием, бромом, новокаином.
Для лечения невропатии широко используется гидротерапия — ванны, душ, обтирания, укутывания, растирания. При наличии повышенной возбудимости показаны теплые ванны (36— 37° С), при общей вялости, заторможенности применяют тонизирующие ванны индифферентной температуры. В качестве закаливающей процедуры следует рекомендовать систематические обтирания по утрам водой комнатной температуры, душ с постепенным понижением температуры.
При невропатии, возникающей на фоне органического поражения мозга, и наличии гипертензионного синдрома показано применение дегидратационной терапии.
При невротических расстройствах наряду с указанными седативными препаратами применяют малые транквилизаторы. Так, при невротических расстройствах следует назначать седуксен, при эмоциональном возбуждении и аффективных вспышках — триоксазин, при повышенном двигательном беспокойстве — со-напакс или меллерил. Необходимо отметить, что многие дети с невропатией отличаются чрезмерной чувствительностью к указанным препаратам, поэтому лечение всегда проводят под наблюдением врача.
Профилактика ранней детской нервности сводится к системе мероприятий по антенатальной охране плода.
Глава XVIII. ИНТЕНСИВНАЯ ТЕРАПИЯ
ПРИ ЗАБОЛЕВАНИЯХ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
При многих заболеваниях центральной нервной системы инфекционного, метаболического, травматического или токсического генеза дети погибают на ранних стадиях патологического процесса вследствие сердечной пли дыхательной недостаточности, сдвигов гомеостаза, отека мозга. Пусковые механизмы этих нарушений могут быть различными, конечные звенья патогенеза во многих случаях едины. На них направлены обычно экстренные меры, принимаемые для поддержания жизни больного до того момента, пока не удастся взять под контроль основной патологический процесс и применить патогенетическую терапию.
Ниже будут рассмотрены лечебные мероприятия, направленные на нормализацию жизненно важных функций организма независимо от причины, вызвавшей их нарушение.
Регидратационная терапия
и коррекция водно-солевого равновесия
Одним из основных патогенетических звеньев нарушения жизненно важных функций в организме является уменьшение объема циркулирующей крови — гиповолемия. Причинами его могут быть недостаточное поступление жидкости в организм при тяжелом состоянии больного, повышенное выведение ее вследствие диареи, рвоты, гппервентиляцип, усиленного потоотделения, ускоренного метаболизма при гипертермии и др. Уменьшение эффективного объема циркулирующей крови наблюдается также при отеке тканей и сосудистом коллапсе. Расстройство кровообращения приводит к недостаточному снабжению тканей кислородом, в результате чего вторично развивается тканевая гипоксия, нарушаются обмен веществ и функции жизненно важных органов.
Регидратационная терапия показана детям раннего возраста при состояниях, протекающих с выраженным эксикозом: кишечных инфекциях, интоксикациях, наследственных болезнях обмена аминокислот, аномалиях синтеза мочевины, непереносимости дисахаридов. Эксикоз может развиться у ребенка с повторными рвотами, как это наблюдается, например, при менингитах, опухолях. Отек мозга при травме, инфекциях, а также другие тяжелые формы поражения центральной нервной системы, сопровождающиеся гипертермией, гипервентиляцией, повышенным
462
потоотделением, падением сосудистого тонуса, являются пока-займем для регидратационной терапии.
Целью регидратационной терапии является восстановление потери воды и электролитов. Для восстановления объема циркулирующей крови используют три группы препаратов: кровь, кровезаменители и белковые препараты. Кровь применяют в консервированном виде или используют прямое переливание от донора к больному. В том и другом случае необходимо строгое соблюдение всех правил определения совместимости. Показаниями к переливанию крови у детей раннего возраста являются уменьшение объема циркулирующей крови вследствие массивной кровопотери, шок, септико-токсические состояния. В ряде случаев цельную кровь целесообразно заменять, полностью или частично, плазмой, изогенной сывороткой, альбумином, эритроцитарной массой или взвесью и другими фракциями крови. Например, при высоком гематокрите (выше 40%) лучше не вводить чужеродные эритроциты и использовать плазму и, наоборот, при выраженной анемии можно наряду с кровью вводить эритроцитарную массу. Выраженное снижение онкотического давления крови является показанием для введения альбумина.
Для восполнения объема циркулирующей крови применяют полиглюкин, реополиглюкин, препараты альбумина, желатины, эквилибрированные солевые растворы. С целью дезинтоксикации используют неокомпенсан, гемодез, поливинилпирролидон. Их применяют в экстренных случаях при эксикозе, увеличении вязкости крови и т. п. Эквилибрированные солевые растворы значительно быстрее выходят в ткани, чем препараты декстрана (полиглюкин, реополиглюкин), поэтому их лучше вводить при общем эксикозе, а при сочетании гиповолемии с местным отеком тканей (например мозга, легких) лучше использовать препараты декстрана. При применении в качестве кровезаменителей растворов глюкозы следует помнить, что у детей раннего возраста часто бывает снижена толерантность к глюкозе, поэтому ее растворы следует вводить с осторожностью под контролем показателей сахара крови, тем более, что стресс значительно снижает ее утилизацию.
Жидкости вводят внутривенно с помощью иглы илп венозного катетера. Количество жидкости, которое необходимо ввести, является суммой суточной потребности, дефицита воды и продолжающихся патологических потерь.
Суточная потребность в жидкости определяется возрастом ребенка, его массой, площадью поверхности тела и количеством расходуемых калорий.
При повышении температуры тела на 1° суточная потребность возрастает на 10 мл/кг, при учащении дыхания на каждые Ю дыхательных движений расходуется сверх нормы 10 мл/кг. Сочетание длительной высокой температуры, гипервентиляции и высокого мышечного тонуса утраивает суточную потребность в жидкости.
463
Возраст
Количество мл жидкости на 1 кг массы, тела
1 день —
2 » 25
3 » 40
4 » 60
5 » 80—90
6 » 100—115
7 дней — 3 мес 140
3 мес — 1 год 120
1—3 года 100-110
Водный дефицит рассчитывается по формулам на основе содержания натрия и белка в крови или гематокрита. Однако наилучшим показателем величины дефицита воды в организме является потеря массы, которая при острых состояниях практически равна потере воды. Однако, если точная масса ребенка до заболевания не известна, степень дефицита воды можно приблизительно определить по клиническим симптомам.
Потеря воды в количестве, равном 1 —1,5% массы тела, сопровождается жаждой. Первые объективные признаки дефицита воды появляются при потерях воды, равных 5—8% массы тела, и характеризуются вялостью или возбуждением, тахикардией, сухостью слизистых оболочек, уменьшением диуреза.
Клинические признаки выражены отчетливо при потерях воды, эквивалентных 10% массы тела. Ребенок возбужден, кожа сухая, тургор снижен, слизистые оболочки сухие, «запавшие» глаза, большой родничок западает, голос осиплый, могут быть мра-морность и цианоз кожных покровов, тахикардия, лихорадка, аритмия дыхания, олигурия.
При дефиците жидкости, эквивалентном 15% массы тела, резко выражены проявления эксикоза, нередко наблюдается скле-ремия. Сухожильные рефлексы угнетены. Развивается сопор пли кома. Кожные покровы бледные с цианотичным оттенком, пульс частый, артериальное давление низкое. Потеря воды, равная 20—22%, несовместима с жизнью.
Патологические потери жидкости определяются путем прямого измерения количества мочи, кала, рвотных масс, экссудатов и др.
Общее количество жидкости также может быть рассчитано следующим образом: к количеству жидкости, равному потере массы тела или степени дегидратации, прибавляется 30 мл/кг для восполнения суточных потерь, 30 мл/кг при олигурии, 50 мл/кг при неудовлетворительном диурезе, 10 мл/кг на каждый градус повышения температуры тела и 20 мл/кг для коррекции потерь при продолжающейся рвоте (Ю. Е. Вельтищев, 1971).
Степень обезвоживания в большинстве случаев коррелирует с уровнем электролитов в плазме крови. При потерях жидкости, не превышающих 5% массы тела, осмотическое постоянство с ре-
464
bI еще сохраняется (изотонический тип обезвоживания). При дефиците жидкости, равном 10% массы тела, потеря воды преобладает над потерей электролитов, осмотическое давление в кровяном русле повышено (гипертонический или вододефицитный тип обезвоживания).
При потерях жидкости, достигающих 15%, преобладает потеря электролитов (гипотонический или соледефицитный тип обезвоживания).
Однако в ряде случаев потери электролитов не коррелируют с массой утраченной жидкости. У детей раннего возраста чащег чем у более старших детей, бывает так называемая гипернатриемическая дегидратация, при которой уровень натрия в сыворотке крови достигает 150 мэкв/л и выше. Высокий уровень натрия при дегидратации свидетельствует о преимущественной потере внутриклеточной жидкости и относительной сохранности внеклеточной. Поэтому при гипернатриемической дегидратации с увеличением количества потерянной воды в первую очередь появляются и нарастают такие симптомы поражения центральной нервной системы, как сонливость в сочетании с повышенной у возбудимостью на внешние раздражители, мышечная гипертония, миоклонии, тремор, генерализованные судороги. Кожа живота при этом на ощупь бархатистая или тестообразной консистенции. Симптомы нарушения кровообращения появляются, когда масса потерянной воды превышает 10% массы тела или уровень натрия в сыворотке превышает 180 мэкв/л.
Развитию гипернатриемической дегидратации способствуют ранний возраст, питание концентрированной пищей, длительная высокая температура, жаркая сухая окружающая среда и форсированное дыхание.
Самым редким вариантом является гипонатриемическая дегидратация, при которой потери электролитов непропорционально велики по сравнению с потерей жидкости. В этом случае нет параллелизма между относительно небольшим дефицитом жидкости в организме и клинически выраженными признаками нарушения кровообращения.
Для ликвидации гиповолемии рассчитанное количество жидкости вводят за 24 ч. В первые 8 ч восполняют дефицит жидкости и дополнительно вводят около 7з суточной потребности. В оставшиеся 16 ч вводят остальное количество жидкости. Исключение составляет гипернатриемическая дегидратация, которая требует введения большого количества бессолевых растворов. Чтобы при этом избежать отека мозга, рассчитанное количество жидкости равномерно распределяют по крайней мере на 48 ч.
От общего количества назначаемой на сутки жидкости 10— 15% должно быть в виде коллоидных растворов, в том числе кровь и ее компоненты, остальное — глюкозо-солевые растворы. Коллоидные препараты, увеличивающие объем циркулирующей
16 ИЗ
465
крови и повышающие осмотическое давление, вводят в первый час, а затем вливают глюкозо-солевые растворы.
Соотношение растворов глюкозы и солей определяется типом дегидратации. При изотоническом типе обезвоживания оно со-ставляет 3—4 : 1 у детей до 3 мес, 2—3 : 1 — у детей до 3 лет, при вододефицитном типе — 4—3 : 1, при соледефицитном типе 1 : 3—4. Не рекомендуется применять концентрированные растворы глюкозы, так как они могут вызвать полиурию и дегидратацию. Расчет количества применяемых солевых растворов проводится на основании имеющегося дефицита электролитов и характера применяемого раствора (табл. 11).
Таблица 11. Состав солевых растворов, используемых для регидратационной терапии
Раствор Натрий Калий Хлор Другие ионы
мэкв/л
Изотонический раствор натрия хлорида Гипертонический раствор 5% на- трия хлорида Раствор Рингера Раствор Дарроу Изотонический раствор 1,1% калия хлорида Изотонический 1,3% раствор натрия гидрокарбоната 145 855 145 123 150 4 35 145 145 855 155 105 145 Кальций-6, Лактат-153 Гидрокарбонат-150
Постоянство уровня натрия в организме поддерживается посредством восполнения суточной потребности (3 мэкв/л) и дефицита, рассчитанного по формуле: Na долженствующий — Na больного. Приблизительный дефицит натрия у детей раннего возраста также может быть рассчитан по формуле (140 — Na фактический) X 0,3 X массу тела (140 — нормальный уровень натрия в плазме, 0,3 — доля экстрацеллюлярной жидкости в массе тела). Рассчитанное количество натрия для коррекции дефицита целесообразно добавлять в растворы глюкозы в виде гипертонического раствора.
Вводить растворы внутривенно следует с определенной скоростью. Ее вычисляют посредством умножения суточного объема переливаемой жидкости в литрах на 14. Если суточное количество жидкости вводят в несколько приемов, скорость капель-л „ объем жидкости, мл
ного вливания в 1 мин определяют по формуле □---------------
г 'г г j з х продолжитель-
ность вливания, ч
Следствием достаточной дегидратации являются прирост массы тела, тенденция к нормализации гемодинамики, показателей гематокрита, азота мочевины сыворотки крови.
466
Коррекция кислотно-щелочного равновесия
Поддержание постоянства кислотно-щелочного равновесия — необходимое условие успешности интенсивной терапии. Оптимальная концентрация водородных ионов pH в норме составляет у 35—7,45 ед. Регуляция кислотно-щелочного равновесия осуществляется в основном почками и легкими. Почки регулируют содержание гидрокарбоната в крови, а легкие поддерживают определенную концентрацию углекислого газа (рСОг).
Нарушения кислотно-щелочного равновесия могут быть связаны либо с нарушением дыхания (респираторный ацидоз и алкалоз), либо с нарушением обмена веществ (метаболический ацидоз и алкалоз). У маленьких детей приходится чаще сталкиваться со сдвигом кислотно-щелочного равновесия в сторону ацидоза. Причиной дыхательного ацидоза является снижение легочной вентиляции, которое может наблюдаться при заболеваниях легких, ослаблении дыхательной мускулатуры при полиомиелите, спинальной амиотрофии Верднига—Гоффманна, при бульбарном параличе, угнетении дыхательного центра при отравлении барбитуратами. Метаболический ацидоз развивается при гипоксии, экси-козах, инфекционных заболеваниях, судорожном статусе, шоках, наследственных болезнях обмена аминокислот. Следует иметь в виду, что большинство респираторных нарушений сопровождается метаболическим компонентом и наоборот, и здесь было бы правильнее говорить о смешанных формах ацидоза.
Основными элементами коррекции кислотно-щелочного равновесия являются устранение патологического процесса и стимуляция естественных механизмов регуляции. Для коррекции ацидоза используют 4% раствор натрия бикарбоната. При витальных показаниях его первоначально можно ввести эмпирически из расчета 1—3 мэкв/кг. Перед употреблением натрия бикарбонат разводят стерильной водой. Первоначальный расчет можно также произвести по формуле: масса тела больного X X 4 мл 4% раствора NaHCOs или с учетом дефицита буферных оснований: BE (дефицит основания) X массу тела : 2 — 3. Эти расчеты представляют собой максимальную корригирующую дозу. Поскольку показатели кислотно-щелочного равновесия у детей раннего возраста очень лабильны, с целью избежания алкалоза рекомендуется ввести только 1/г расчетной дозы, а затем исследование повторить. Последующий расчет корригирующих доз натрия бикарбоната проводится с учетом исходного pH крови,. рСОг в мм рт. ст. и содержания НСОГ — в мэкв/л по уравнению Г ендерсона—Г ессельберга:
pH = 6,1 + 0,064 мл/мм рт. ст. —
где 6,1 — константа при 38° С, 0,064 — коэффициент растворимости СО2.
16* 467
Используя это уравнение, рассчитывают, какова должна быть концентрация НСОз” при данном уровне рСОг (данные лаборатории) и pH, до которого желательно довести концентрацию ионов водорода больного:
НСО7 =
(pH - 6,1) рСО2 0,064
Умножив разницу между полученной концентрацией НСОз~ и данными лаборатории о концентрации НСОГ в крови больного на 0,6 массы тела, получают величину корригирующей дозы натрия бикарбоната.
Растворы соды целесообразно вводить вместе с растворами кальция глюконата. Кроме раствора натрия бикарбоната применяют также М раствор натрия лактата; 6 мл последнего эквивалентно 1 мэкв натрия бикарбоната. После частичной коррекции метаболического ацидоза рекомендуется вводить препараты, способствующие улучшению периферического кровообращения (гемодез, реополиглюкин, компламин, гепарин и др.).
Острый респираторный ацидоз может сопровождаться гиперкалиемией и нарушением внутрисердечной проводимости. В этих случаях внутривенно вводят 5—10 мл раствора натрия лактата.
В случаях передозировки щелочных растворов (pH крови 7,5 и выше) показано введение диуретиков—ингибиторов карбоангидразы (диакарб) — и назначение 10% раствора аскорбиновой кислоты.
Лечебные мероприятия при отеке мозга и острой внутричерепной гипертензии
Отек мозга — состояние, сопровождающееся увеличением объема головного мозга вследствие избыточного накопления жидкости в межклеточных пространствах и набухания клеток. Причиной развития его у детей раннего возраста могут быть различные заболевания нервной системы: инфекции, интоксикации, опухоли, гипоксия, внутричерепная родовая травма, судорожный статус, а также нарушения обмена веществ, заболевания сердечно-сосудистой и дыхательной систем и др. В патогенезе отека мозга при всех этих состояниях основную роль играют грубые метаболические сдвиги в мозговой ткани, приводящие к нарушению проницаемости мембран, повышению сосудистой проницаемости, изменению внутрисосудистого и внутриклеточного осмотического давления.
Немаловажная роль в развитии отека мозга принадлежит острой внутричерепной гипертензии, затрудняющей венозный отток и усугубляющей гипоксию мозговой ткани.
Отек мозга характеризуется расстройством сознания различной глубины и продолжительности, судорогами, нарушением дея-
468
ельности сердечно-сосудистой п дыхательной систем. Как правило, отмечаются менингеальные явления: напряжение и пульсация большого родничка, ригидность затылочных мышц, у более старших детей — симптомы Кернига и Брудзинского.
Лечение отека мозга должно быть комплексным. Оно направлено на устранение основного заболевания, включает также применение дегидратацпонной терапии, средств, улучшающих мозговой кровоток н энергетический обмен мозга, и мероприятий по поддержанию витальных функций.
Нормализация мозгового кровотока в первую очередь обеспечивается посредством восполнения имеющегося дефицита жидкости в сосудистом русле и ликвидации сердечно-сосудистой недостаточности.
Дегидратационная терапия основана на применении препаратов, повышающих осмотическое давление крови (осмотические диуретики), и средств, обладающих быстрым диуретическим эффектом (салуретпки). Преимущество осмотических диуретиков (мочевины, маннитола) состоит в том, что они не включаются в обмен веществ, длительно сохраняют осмотический градиент плазмы и в меньшей степени вызывают вторичное повышение внутричерепного давления.
Маннитол (10—-30% раствор) вводят внутривенно капельно 2 раза (0,5—1 г сухого вещества на 1 кг массы тела ребенка). Растворяют его в 10% растворе глюкозы или в изотоническом растворе натрия хлорида. Через несколько минут после введения маннитола повышается осмотическое давление плазмы, что обусловливает приток интерстициальной жидкости в кровеносное русло. Фильтрация препарата почками совпадает по времени с его выраженным диуретическим воздействием. Диуретический эффект маннитола обусловлен повышением осмотического давления внутри почечных канальцев и уменьшением реабсорбции жидкости в их проксимальных отделах. Диурез сопровождается экскрецией натрия без существенного воздействия на выделение калия.
Мочевину с целью уменьшения отека мозга вводят внутривенно из расчета 0,5—1 г на 1 кг массы тела. Раствор для внутривенного применения готовят асептически перед введением. Применяют 30% раствор, приготовленный на 10% растворе глюкозы. Вводят его капельно внутривенно. Мочевину у детей до 1 года следует использовать с ограничением, так как повышение уровня небелкового азота плазмы может оказывать токсическое действие на почки. Препарат не показан также при подозрении на внутричерепные кровоизлияния, поскольку, обладая способностью повышать артериальное давление, может вызвать ухудшение состояния ребенка.
ПерспективнЫхМ является применение в раннем детском возрасте многоатомного спирта сорбитола. Его дозируют из расчета 0,5 г на 1 кг массы в сутки, разводят в 5% растворе глюкозы. Снижая внутричерепное давление, сорбитол не обладает свой-
469
ством выводить из организма минеральные вещества, в том числе и калий. Сорбитол, как и маннитол, свободно фильтруется в гло-мерулах почек, не подвергается реабсорбции. Основная масса его выделяется из организма в первые 24 ч.
К препаратам, обладающим быстрым диуретическим действием, относят фуросемид (лазпкс) и урегпт. При отеке мозга лазикс вводят внутримышечно или внутривенно из расчета 1—3 мг иа 1 кг массы.
При повторном применении препарат может вызвать гипокалиемию, поэтому его назначают одновременно с препаратами калия (панангин, калия хлорид, калия оротат).
Урегпт (этакриновая кислота) обладает выраженным про-тивоотечным действием, но в связи с тем, что вызывает резкое нарушение обмена электролитов, применение его в раннем детском возрасте следует ограничить.
С целью дегидратации применяют также 25% раствор магния сульфата — 0,2—0,3 г на 1 кг массы в сутки внутримышечно.
Дегидратационным эффектом обладает многоатомный спирт глицерол. При отеке мозга его вводят внутривенно в дозе 0,5— 1,0 на 1 кг массы в сутки. Готовят 30% раствор глицерола в 20% растворе аскорбиновой кислоты. Больным в коматозном состоянии глицерол можно вводить через желудочный зонд. Преимуществом препарата является выраженное дегидратацион-ное действие при отсутствии сдвигов в электролитном составе крови.
У новорожденных широко применяется гипертонический раствор плазмы: 8—10 мл на 1 кг массы внутривенно. Для усиления противоотечного действия плазму вводят одновременно с 20% раствором глюкозы из расчета 10—15 мл на 1 кг массы. Но эффект их действия непродолжителен. Растворы глюкозы и белков скорее следует использовать для коррекции водно-электролитных нарушений, чем для дегидратации.
При лечении отека мозга используют также глюкокортикостероиды, препятствующие нарастанию отека и клеточной декомпенсации. Наиболее эффективен дексаметазон. Его вводят из расчета 0,1—0,2 мг на 1 кг массы в сутки. Рассчитанную дозу вводят внутримышечно 4 порциями. Первая инъекция составляет половину суточной дозы.
На фоне дегидратационной терапии чрезвычайно важным является поддержание водно-электролитного баланса. Поэтому терапию отека мозга следует осуществлять на фоне введения изотопического раствора натрия хлорида (0,85%) или гипертонического (10%) раствора глюкозы с калия хлоридом в дозах, равных V2—2/з суточной потребности в жидкости.
При тяжелом отеке мозга показано применение искусственной краниоцеребральной гипотермии. Ее также широко применяют с целью профилактики отека мозга и понижения уровня метаболических процессов у детей, родившихся в асфиксии 470
/р М. Савельева, 1973). Используется отечественный аппарат <Х*олод». На голову ребенка надевают шлем на расстоянии 2,0 см оТ кожных покровов. От шлема отходит муфта, которую закрепляют тесьмой вокруг головы ребенка. Образуется подшлемное пространство, в котором благодаря циркуляции жидкого фреона создается охлаждение воздуха до 10°. Гипотермия уменьшает потребность мозга в кислороде и «защищает» мозг от отека.
При проведении сеанса краниоцеребральной гипотермии температуру тела ребенка поддерживают на постоянном уровне. С этой целью его помещают в инкубатор. Шлем монтируют на боковой стенке колпака инкубатора. Внутри кювеза температура составляет 33° С, влажность — 70%, длительность сеанса гипотермии 1,5 2 ч.
В зависимости от состояния ребенка сеанс гипотермии можно повторить в последующие 2 дня.
Краниоцеребральная гипотермия проводится на фоне средств, оказывающих седативное действие на центральную нервную систему. Гамма-оксимасляная кислота (ГОМК) применяется из расчета 50—80 мг на 1 кг массы. Готовят 20% раствор натрия оксибутирата на 5—10% растворе глюкозы. Дроперидол назначают из расчета 0,5 мг на 1 кг массы. В 1 мл 0,25% раствора содержится 2,5 мг дроперидола. Препараты вводят внутривенно капельным путем. Они повышают устойчивость ткани мозга к гипоксии, эффективны при гипоксическом отеке мозга.
Одним из эффективных методов снижения внутричерепной гипертензии является искусственная вентиляция легких воздушно-кислородной смесью в режиме умеренной гипервентиляции (парциальное напряжение углекислоты 27—32 мм рт. ст.). Нормализация мозгового кровотока и уменьшение гипоксемии снижают внутричерепное давление. Искусственная вентиляция легких осуществляется респираторами объемного типа под контролем газового состава крови.
Поддержание дыхания и кровообращения является непременным условием успешной терапии отека мозга.
Мероприятия, направленные на поддержание кровообращения
Интенсивная терапия, направленная на стабилизацию кровообращения, включает коррекцию гиповолемии и ацидоза, восстановление сосудистого тонуса, улучшение функции миокарда.
При острых неврологических заболеваниях нарушения кровообращения в большинстве случаев корригируются восстановлением объема циркулирующей жидкости и устранением метаболических сдвигов (ацидоза). Однако, если эти мероприятия оказываются неэффективными, что чаще всего бывает при токсических и инфекционно-токсических процессах, показано применение сосудоактивных препаратов п сердечных гликозидов.
471
Применение сосудоактивных препаратов зависит от механизма расстройства экстракардиального кровообращения. Основным объ_ ективным критерием для дифференциации этих механизмов являются показатели артериального давления крови.
Симпатотонический коллапс характеризуется нормальным или повышенным давлением крови в сосудах. При нем показано применение аминазина 0,1—0,2 мг/кг с новокаином 0,5—2 мл 0,5% раствора внутривенно. Паралитический коллапс характеризуется снижением давления крови в сосудах. При ваготоническом коллапсе отмечается большая разница между максимальным и минимальным артериальным давлением. При паралитическом и ваготоническом коллапсах показано введение прессорных аминов. Адреналин (0,1% раствор) вводят струйно, а затем капельно внутривенно вместе с корригирующими растворами. Разовая доза для детей 1-го года жизни — 0,1—0,15 мл (но не более 0,5 мл в сутки), для детей 2-го года — 0,2 (максимальная суточная доза— 0,6 мл); детям 3-го года — 0,25 мл (максимальная суточная доза — 0,75 мл). Норадреналин (0,2% раствор) вводят внутривенно со скоростью 20—30 капель в 1 мин в 5% растворе глюкозы: детям 1-го года — 0,05—0,1 мл; детям 2-го года —0,1 — 0,15 мл; 3-го года — 0,1—0,2 мл. Мезатон 1% раствор в дозе 0,05—0,1 мл на 1 год жизни вводят внутривенно капельно.
При выраженном падении артериального давления показано назначение кортикостероидных гормонов: преднизолона — 1—2 мг на 1 кг массы в сутки, гидрокортизона — 4—5 мг на 1 кг массы в сутки внутривенно или внутримышечно.
В качестве средств, улучшающих сократимость миокарда, применяют: строфантин, коргликон, дигоксин. Раствор строфантина 0,05% назначают в дозе 0,05—0,2 мл 1—2 раза в сутки внутривенно вместе с раствором глюкозы. Раствор коргликона 0,06% вводят внутривенно с глюкозой в дозе 0,025 мл на 1 кг массы в сутки. Суточная доза дигоксина составляет 0,2 мл 0,025% раствора на 1 кг массы. Нужно помнить, что из суточной введенной дозы дигоксина на следующий день в организме остается 80% (элиминация 20%), а коргликона и строфантина — 40% (элиминация 60%). На следующий день можно ввести только то количество, которое было элиминировано.
Для улучшения обменных процессов в сердечной мышце показано применение кокарбоксилазы. Новорожденным назначают 25—50 мг, более старшим детям — до 300 мг 1 раз в сутки.
При перегрузке правых отделов сердца в комплекс лечебных мероприятий необходимо включать 2,4% раствор эуфиллина по 0,1—0,15 мл на 1 кг массы детям 1-го года жизни, затем — по 1 мл на год жизни; панапгип — 1—2 мл на год жизни; 5% раствор унитиола — 1 мл на год жизни; поляризующую смесь: 10 % раствор глюкозы, инсулин и калия хлорид (инсулин — 1 ED на 4 г глюкозы, калия хлорид — не более 40 мэкв/л). Все указанные препараты вводят внутривенно.
472
При угрозе остановки сердца сократимость миокарда можно повысить внутривенным введением 1—2 мл 10% раствора кальция хлорида или ингаляцией 0,5—1,0 мл изадрина. Если эффект отсутствует, вводят 0,1—0,3 мл 0,1% раствора адреналина внутривенно или внутрисердечно. Внутрисердечное введение лекарственных препаратов производят на фоне непрямого массажа сердца.
Наилучшим объективным критерием эффективности мероприятий по поддержанию кровообращения являются показатели центрального венозного давления, которое у здоровых детей составляет примерно 12 см води. ст. Для определения центрального венозного давления в верхнюю или нижнюю полую вену вводят катетер. Непосредственно после рождения катетер можно ввести через пупочную вену, у более старших детей — через подключичную, наружную или внутреннюю яремные вены.
Показатели центрального венозного давления используются также для дифференциации механизмов нарушения кровообращения. При первичной сердечной недостаточности центральное венозное давление высокое, тогда как при сосудистом коллапсе и сердечной недостаточности вследствие гиповолемии центральное венозное давление снижено.
Лечение острой дыхательной недостаточности
Непосредственными причинами острой дыхательной недостаточности при заболеваниях нервной системы у детей раннего возраста являются: уменьшение проходимости дыхательных путей вследствие аспирации крови и рвотных масс при нарушении глотания или спазме и парезе голосовых связок; нарушение центральной регуляции дыхания различного генеза (отек, травма, опухоль, энцефалит, токсикоз и др.); парезы и параличи дыхательной мускулатуры при полиомиелите, полиневрите, наследственных болезнях нервно-мышечной системы; метаболические нарушения при коматозных состояниях, некоторых болезнях обмена веществ.
Симптомами дыхательной недостаточности являются учащение дыхания, уменьшение отношения частоты пульса и дыхания (в норме примерно 4:1), увеличение минутного объема дыхания, снижение парциального напряжения кислорода, увеличение парциального напряжения углекислого газа, снижение pH крови, резерва дыхания. Изменение этих показателей может быть выражено в различной степени, что клинически проявляется цианозом от легкого до землисто-серого цвета кожи и слизистых оболочек, акроцианозохм и багрово-синюшными пятнами на конечностях, постепенно все большим вовлечением в дыхательные движения вспомогательной мускулатуры, повышением артериального давления, потоотделением, беспокойством или угнетением сознания.
Первым этапом оказания экстренной помощи при острой дыхательной недостаточности является очищение дыхательных пу
473
тей с помощью отсоса и катетера или пальцем, предварительно повернув голову ребенка в сторону. При легких степенях дыхательной недостаточности показана оксигенотерапия с помощью маски, кислородной палатки, головного тента или катетером, введенным через нижний носовой ход до носоглотки. Содержание кислорода во вдыхаемой смеси при длительной оксигенотерапии не должно превышать 50—60% и лучше применять смесь кислорода (30—40%) с гелием или воздухом. При угнетении дыхательного центра показаны дыхательные апалептики: кордиамин из расчета 0,1 мл на год жизни, камфора 0,5 мл 20% масляного раствора на 1 год жизни до 3-летнего возраста подкожно, этими-зол 0,06—0,1 мг на 1 кг массы в виде 1% или 1,5% раствора внутримышечно или внутривенно медленно. Можно использовать также вдыхание смеси углекислоты (5—7%) с кислородом (95-93%).
При недостаточной функции дыхательной мускулатуры показаны дибазол (0,0001 на 1 мес жизни, 0,001 на 1 год жизни) и препараты стрихнина. Стрихнин детям до 2 лет не назначают, детям 2—3 лет — 0,1 мг; официнальный 0,1% раствор разводят в 100 раз и вводят под кожу 0,1 мл. При всех типах острой дыхательной недостаточности с целью улучшения углеводного обмена назначают внутривенно аскорбиновую кислоту и тиамин в 10—15 мл 10% раствора глюкозы ежедневно в течение 7— 10 дней.
Лечение тяжелой дыхательной недостаточности, угрожающей остановкой дыхания, требует экстренной искусственной вентиляции легких. Кратковременно можно использовать метод рот в рот или рот в нос. Затем следует переходить на аппаратное дыхание. Параллельно необходимо восстановить объем циркулирующей крови, назначить сердечные гликозиды, скорригировать кислотно-щелочное равновесие.
Аппараты для искусственного дыхания подразделяются на те, которые подают воздух в легкие под давлением, и те, что создают отрицательное давление вокруг грудной клетки. Последние можно применять лишь при отсутствии угрозы закупорки дыхательных путей, при сухом типе расстройства дыхания, не сопровождающемся обильной секрецией в дыхательных путях, как например при спинальной форме полиомиелита; при отсутствии бульбарных нарушений и связанного с ним риска аспирации; при отсутствии спазма или пареза голосовых связок. В большинстве же случаев применяют аппараты, подающие вдыхаемую смесь под давлением с помощью маски или катетера. Маску используют лишь кратковременно, заменив ее в последующем назотрахеальным катетером или трахеостомической трубкой. Используя такой вид искусственного дыхания, необходимо насыщать подаваемую дыхательную смесь водными парами. При развитии отека легких или предотечного состояния следует начинать с управляемого дыхания в сочетании с ингаляцией 100% кислорода
474
с парами спирта; с целью уменьшения секреции слизи применяют пеногаситель-антифомсилан. Одновременно назначают средства, улучшающие сократимость миокарда, например, внутривенное введение строфантина.
Частота дыхательных движений при искусственной вентиляции у детей раннего возраста — 20—40 в 1 мин, объем вдыхаемой смеси в зависимости от возраста — 25—200 мл, максимальное давление в легких на вдохе — 15—20 мм рт. ст., концентрация кислорода во вдыхаемой смеси — 40—60%.
Судорожный статус и его лечение
Судорожный статус — клиническое состояние, при котором у больного наблюдается серия повторяющихся судорог без восстановления сознания между эпизодами. Судорожный статус может быть при любом типе припадков. Приведенное определение судорожного статуса исключает частые фокальные судороги, при которых нет нарушения сознания, и серийные генерализованные судороги, при которых между приступами восстанавливается сознание.
Судорожные припадки при эпилептическом статусе следуют друг за другом почти непрерывно, иногда продолжаясь много часов и даже дней. Развивается коматозное состояние, повышается температура тела, в моче определяется белок, появляются нарушения сердечной деятельности (частый аритмичный пульс слабого наполнения, артериальная гипотония) и дыхания (учащение, аритмия), признаки отека и набухания мозга. Эти нарушения делают судорожный статус состоянием, опасным для жизни, в особенности, если с самого начала не были приняты необходимые меры лечения. Летальный исход при нем наблюдается в 15% случаев. Следствием судорожного статуса также могут быть пеоб-ратим-ые изменения мозга, проявляющиеся ослаблением памяти, нарушением психики, расстройствами речи, очаговыми неврологическими симптомами. Более 50% детей с судорожным статусом составляют дети до 2 лет.
Судорожный статус может быть ранним проявлением менингита, энцефалита, гипертензионпой энцефалопатии, травмы головы, окклюзионного цереброваскулярного нарушения, уремии, острого дисбаланса электролитов, экзогенной интоксикации и в редких случаях опухоли мозга. К развитию судорожного статуса также предрасполагают слишком быстрая илп преждевременная отмена противосудорожных средств, резкое изменение состава или дозы антиконвульсантов. Лечение судорожного статуса Должно включать: возможно более быстрое купирование судорог, общую поддерживающую терапию, проведение мер по ликвидации состояния, вызвавшего судорожный статус.
До проведения специфического лечения ребенка нужно освободить от стесняющей одежды, обеспечить доступ свежего возду
475
ха или вдыхание кислорода, положить холод на голову, отсосать слизь из верхних дыхательных путей.
Противосудорожная терапия в период судорожного статуса имеет первостепенную важность. Специфические противосудорожные препараты всегда следует давать в больших дозах, достаточных для полного подавления судорожной активности. Показано немедленное внутривенное введение антиконвульсантов. Неправильным является первоначальное введение лекарств внутримышечно и использование малых доз.
В качестве основного противосудорожного препарата при лечении любых типов судорожного статуса следует использовать диазепам (седуксен). Он обладает способностью подавлять судорожную активность п при его применении редко бывают такие побочные явления, как угнетение дыхания и снижение артериального давления. Доза препарата 0,3—0,5 мг/кг (но не более 5 мг в сутки для детей 5 лет и младше) является и безопасной и эффективной при условии, что ее вводят медленно внутривенно. Скорость введения должна быть 1 мг в 1 мин. В 2 мл официнального буферного раствора содержится 10 мг диазепама. Припадки могут прекратиться до того, как введена вся рассчитанная доза. Если первая доза оказывается неэффективной, то ее следует повторить спустя 15 мин. Иногда для купирования статуса может потребоваться и третья доза.
Диазепам может нарушать связь билирубина с альбумином. Это действие обусловлено бензойной кислотой, которая входит в состав стабилизирующей основы. В результате развивается гипербилирубинемия, которая опасна для новорожденных. В этом возрасте диазепам следует вводить с осторожностью.
При отсутствии диазепама можно использовать 2,5% раствор аминазина, который вводят внутримышечно или внутривенно в дозе от 0,15 мл новорожденным до 0,35 мл детям 3—4 лет вместе с такой же дозой 2,5% раствора пипольфена и 0,5% раствора новокаина. Эффективно также применение дроперидола. Его назначают из расчета 0,5 мг па 1 кг массы (0,2 мл 0,25% раствора). Применяют также клизмы из 2—3% раствора хлоралгидрата. Грудным детям вводят 10—15 мл, детям 1—3 лет — 20—30 мл каждые 6—8 ч. Раствор натрия фенобарбитала (10%) вводят в клизме в количестве 0,1—0,2 мл через 36 ч, если нет угнетения дыхательного центра и ослабления дыхательной мускулатуры.
В качестве основного противосудорожного средства используется также 20% раствор натрия оксибутирата (ГОМК) — 50— 100 мг на 1 кг массы внутривенно капельно или очень медленно струйко в 30—50 мл 5—10% раствора глюкозы. ГОМК не угнетает дыхательного центра, улучшает обмен в клетках мозга, делает их более устойчивыми к гипоксии, способствует гипотермии. При тяжелом течении эпилептического статуса показано введение глюкокортикоидных гормонов. Гидрокортизон вводят внутримышечно или внутривенно из расчета 3—5 мг на 1 кг массы. Пре-
476
парат вводят вместе с изотоническим раствором натрия хлорида пли с 5—10% раствором глюкозы. Преднизолон назначают из расчета 1—2 мг на 1 кг массы тела.
Очень важно для купирования судорожного статуса провести дегидратацию мозга и нормализовать кислотно-щелочное равновесие. Следует подчеркнуть, что коррекцию кислотно-щелочного равновесия следует проводить под строгим лабораторным контролем, поскольку судорожный статус при некоторых заболеваниях нервной системы (например, первичные энцефалиты) может сопровождаться алкалозом, хотя в большинстве случаев наблюдается сдвиг в сторону ацидоза. При отсутствии эффекта от указанной терапии можно прибегнуть к люмбальной пункции и ингаляционной анестезии. Показана также краниоцеребральная гипотермия. Она проводится с помощью аппаратов «Холод-2» и «Флюидотерм». Длительность сеанса гипотермии — 6—16 ч. Температура на поверхности мозга около 30° С. Краниоцеребральная гипотермия снижает толерантность эпилептического очага к противосудорожным средством.
Противосудорожную терапию следует проводить параллельно с мерами, направленными на поддержание жизненно важных функций — дыхания, кровообращения, терморегуляции.
Как только ребенок начинает глотать, одновременно с экстренными мерами целесообразно начинать давать противосудорожные препараты per os в дозах соответственно возрасту и характеру припадков.
Одновременно с проведением экстренной терапии следует выяснить причину судорожного статуса. Необходимо взять пробы крови для определения содержания электролитов, глюкозы, кальция и азота мочевины. Обязательно нужно исследовать спинномозговую жидкость, провести энцефалографию, эхоэнцефалогра-фию, рентгенографию черепа, компьютерную томографию. У детей, получающих длительно противосудорожные препараты, при возможности следует определить их концентрацию в крови. Недостаточный уровень является показателем того, что применяемая доза была малой, а адекватное содержание указывает па необходимость введения другого антиконвульсанта.
Терапия гипертермического синдрома
У детей с поражением центральной нервной системы при судорогах, инфекционных заболеваниях, синдроме дезадаптации и других патологических состояниях может развиться гипертермия, обусловленная нарушением центральной терморегуляции. Гипертермический синдром характеризуется повышением температуры выше 38,5° С, вялостью, отказом от еды, жаждой, дыхание частое, поверхностное, тахикардия. При длительной гипертермии имеющиеся у ребенка неврологические нарушения усугубляются, появляются судороги, двигательное и речевое возбуждение, галлюци
477
нации. Отек мозга, падение артериального давления, нарушение микроциркуляции, развившиеся при гипертермии, могут привести к летальному исходу.
Лечение гипертермии включает нормализацию центральных механизмов терморегуляции, применение физических методов охлаждения, а также нормализацию кислотно-щелочного равновесия и водно-электролитного баланса.
С целью уменьшения возбудимости гипоталамуса, улучшения периферического кровотока, усиления потоотделения и вентиляции легких применяют антипиретические средства. Разовая доза анальгина — 0,1 мл 50% раствора на 1 год жизни; новорожденным и детям первых месяцев — 0,05—0,1 мл. Амидопирин применяют из расчета 0,5 мл 1% раствора на 1 кг массы тела. Ацетилсалициловую кислоту дают внутрь в дозе 0,05—0,1 на 1 кг массы.
При гипертермии применяют также аминазин, который не только снижает температуру, но и уменьшает двигательное беспокойство, снимает судороги (0,001—0,002 мг на 1 кг массы в виде 2,5% раствора).
Аминазин можно комбинировать с антигистаминными препаратами, которые усиливают его гипотермическое и седативное действие. Примерная пропись литической смеси: аминазин 2,5% — 1,0, пипольфен 2,5% —1,0 или новокаин 0,25—0,5% — 4,0—6,0.
Расчет дозы проводится по аминазину. Суточная доза аминазина (0,001—0,002 на 1 кг массы) соответствует 0,4—0,8 мл указанной смеси на 1 кг массы. Эту дозу вводят в 4—6 приемов.
При отсутствии эффекта применяют гидрокортизон в дозе 3— 5 мг или преднизолон— 1—2 мг на 1 кг массы тела внутримышечно.
К физическим методам охлаждения относятся воздушные ванны, прикладывание пузырей со льдом к голове и паховым областям, обтирание кожных покровов спиртом, обдувание ребенка вентилятором, промывание желудка и кишечника холодной водой.
глава XIX. ПРИНЦИПЫ ВОССТАНОВИТЕЛЬНОЙ ТЕРАПИИ ПРИ ЗАБОЛЕВАНИЯХ НЕРВНОЙ СИСТЕМЫ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Восстановительное лечение детей раннего возраста с заболеваниями нервной системы в отличие от лечения детей старшего возраста и взрослых направлено не только на компенсацию утраченных в результате болезни функций, но и на стимуляцию нормального развития ребенка.
Патогенные воздействия в раннем онтогенезе нарушают закономерности формирования мозга и приводят к дисфункции их созревания. Это определяет особенности течения заболевания нервной системы в возрасте первых лет жизни. В клинической картине признаки очагового поражения мозга обычно сочетаются с симптомами задержки двигательного, речевого и психического развития. Поэтому при разработке лечебных мероприятий наряду с патогенетической терапией следует уделять внимание последовательному развитию возрастных навыков.
Широкое внедрение в практику здравоохранения достижений в области возрастной физиологии, биохимии, иммунологии, электрофизиологии позволило разработать научно обоснованную систему лечебных мероприятий при заболеваниях нервной системы у детей раннего возраста.
Большие потенциальные возможности мозга ребенка раннего возраста, способность нервной системы активно реагировать и перестраиваться под влиянием внешних стимулов являются залогом эффективности терапии. Применение ее в ранней стадии заболевания предупреждает развитие необратимых изменений в нервной, мышечной и костной тканях.
Лечение заболеваний нервной системы на различных возрастных этапах должно быть комплексным и непрерывным. Принцип комплексности предусматривает участие в лечении ребенка специалистов различного профиля: невропатолога, ортопеда, окулиста, врача и методиста лечебной гимнастики, психолога, логопеда, педагога.
Непрерывность терапии обеспечивается преемственностью различных служб и учреждений, участвующих в лечении ребенка: родильные дома, специализированные больницы и неврологические отделения многопрофильных больниц, районные детские поликлиники, городская консультативная неврологическая поликлиника, специализированные ясли, сады, санатории местного и союзного значения.
Особо важная роль принадлежит специализированному уходу и лечению на 1-м году жизни, когда идет наиболее интенсивное развитие нервной системы. Лечение не следует рассматривать
479
как занятие с ребенком только в определенный промежуток времени (20—30 мин). Его следует проводить ежедневно в течение всего периода бодрствования ребенка как в стационаре, так и в домашних условиях.
В стационаре наряду с врачами, методистами лечебной гимнастики активными участниками лечения ребенка должны быть медицинские сестры. В их обязанности, помимо общегигиенпческого ухода, входит организация ортопедического режима, применение некоторых элементов лечебной гимнастики, стимуляция речевого и психического развития. Медицинский персонал должен быть ознакомлен с механизмами развития тех или иных неврологических нарушений у детей и основными методами их коррекции. В постоянном контакте с окружающими ребенок приобретает двигательный опыт, осваивает навыки речевого общения, у него развиваются эмоциональные, психические реакции и первые элементы социальной адаптации.
Большую роль в лечении ребенка раннего возраста играют родители. Они должны представлять себе, что лечение ребенка с поражением нервной системы — это длительный процесс, не ограничивающийся только определенными курсами терапии, что оно требует постоянных занятий с ребенком, во время которых стимулируется двигательное, речевое и психическое развитие. Мать следует обучить навыкам специализированного ухода за больным ребенком, основным приемам массажа, лечебной гимнастики и правилам ортопедического режима, которые она может выполнять дома.
Если ребенок находится дома, районный невропатолог периодически контролирует правильность лечения, проводимого матерью, корригирует его соответственно возрастному развитию. Полезно рекомендовать родителям вести записи, отражающие даже малейшие изменения в состоянии ребенка. Информация матери в свою очередь может быть полезной для врача в оценке эффективности проводимого лечения.
Комплекс восстановительного лечения детей раннего возраста с поражением нервной системы включает организацию общего режима, полноценное питание и специфическую диетотерапию, ортопедические мероприятия, лечебную гимнастику, массаж, физиотерапию, стимуляцию речевого и психического развития, медикаментозное лечение.
Общеоздоровительные мероприятия
Соблюдение режима сна, бодрствования, кормлений и общегигиенического режима для ребенка раннего возраста с поражением нервной системы еще более важно, чем для здорового. От организации режима во многом зависит эффективность проводимого лечения. Порядок проведения лечебных процедур, назначаемых ребенку, следует составить так, чтобы они не нарушали его фи-
480
экологических ритмов. Массаж, лечебную гимнастику, электрофорез, инъекции следует проводить во время бодрствования ребенка в промежутках между кормлениями. Ортопедические укладки, тепловые процедуры можно назначить на время сна. В отделениях для детей раннего возраста должен быть составлен индивидуальный график проведения мероприятий в зависимости от возраста и режима ребенка.
Воздушные ванны, обтирания водой, прогулки на свежем воздухе должны быть обязательными для больных детей даже при условии их стационарного лечения. Они способствуют нормальной работе органов дыхания, кровообращения, улучшают обмен веществ и состояние кожных покровов. Закаливающие водные процедуры — обтирания, обливание и купание можно совместить с лечебными ваннами. Воздушные ванны проводят одновременно с лечебной гимнастикой.
Особенно тщательный уход требуется за кожей ребенка. Наличие опрелости, царапин, ссадин, потницы является противопоказанием для проведения многих видов лечения.
Одежда детей должна быть свободной. Недопустимо тугое пеленание, которое может усугубить имеющиеся дыхательные и сердечно-сосудистые нарушения и тормозить развитие двигательных функций.
Бодрствование ребенка раннего возраста следует организовать таким образом, чтобы он получал оптимальную информацию из окружающей среды. Небольшое количество ярких игрушек, картинок, спокойная речь, негромкая музыка положительно влияют на психомоторное развитие. Нарушение режима перевозбуждает и быстро истощает нервную систему. Общеоздоровительный режим для каждого ребенка должен быть индивидуальным с учетом специфики основного заболевания и характера реагирования на те или иные раздражители.
Питание и диетотерапия
Правильная организация питания детей раннего возраста с поражением центральной нервной системы является важным фактором восстановительного лечения. При расчете питания необходимо учитывать не только возраст ребенка, но и характер имеющихся нарушений.
Наряду с обеспечением оптимальных условий для нормальной деятельности желудочно-кишечного тракта необходимо дополнительно вводить ингредиенты, способствующие улучшению функции нервной системы, мышц. В других случаях, наоборот, следует исключить продукты, которые при снижении активности определенных ферментов в организме не расщепляются и оказывают токсическое влияние на нервную систему.
При заболеваниях нервной системы количество белка в суточном рационе должно быть максимально допустимым.
481
Возраст
Потребность в белке, г/кг
1 мес 2,52
2 » 3,1
3 » 2,36
4 » 2,18
5 » 1,94
6 » 1,82
6 мес — 1 год 1,8—2,1
1—1,5 года 2,0—2,5
2—3 года 2,5—3
Белок необходим как для общего роста и развития организма ребенка раннего возраста, так и для нормальной функции нервных и мышечных клеток. При его недостатке нарушается усвоение микроэлементов — кальция, фосфора, магния, меди, калия, изменяются иммунобиологические свойства организма. Богатое белком питание является одним из методов патогенетической терапии при прогрессирующих мышечных дистрофиях. Избыточное выведение аминокислот с мочой у этих больных требует постоянной коррекции белкового обмена. Добавочное количество белка может быть введено с творогом, яйцом, а после 5-месячного возраста — с мясным фаршем, печенью и другими видами прикорма.
Нормальная функция нервной системы обеспечивается при достаточном поступлении в организм микроэлементов. При неизмененном метаболизме суточная потребность в кальции составляет 600 мг — 1 г, в железе — не менее 1 мг/кг массы тела у детей до 6 мес и 0,6 мг/кг у детей более старшего возраста. Потребность в меди у детей выше, чем у взрослого человека, и в среднем составляет 0,1—0,2 мг/кг массы тела в сутки. Уровень фосфора в крови поддерживается нормальным при поступлении его в количестве 1,8—2,0 г в день. Для обеспечения достаточного уровня микроэлементов в плазме крови в рацион питания ребенка следует включать молоко, творог, яйца, овощи.
Пища больных детей должна быть в достаточной степени витаминизирована. Важную роль для поддержания нормальной функции нервной системы играют витамины группы В (тиамин, рибофлавин, пиридоксин, цианокобаламин, кальция пангамат), никотиновая кислота. Обмен веществ в мышце тесно связан с каталитическими функциями токоферола ацетата. Поэтому при заболеваниях нервно-мышечной системы в питание необходимо включать продукты, содержащие токоферола ацетат. Аскорбиновая кислота необходима для нормального тканевого обмена и тканевого дыхания, она регулирует проницаемость сосудистой стенки, тонизирует симпатическую нервную систему, активизирует гуморальные процессы.
Достаточный уровень витаминов в организме поддерживается витаминсодержащими продуктами или обогащением пищи витаминными препаратами.
482
При заболеваниях нервной системы, особенно у обездвиженных детей, не следует допускать избыточного употребления продуктов питания. Ожирение затрудняет лечение двигательных нарушений и даже усугубляет последние.
При наследственных заболеваниях обмена веществ диетотерапия является патогенетическим методом лечения. С помощью диетотерапии можно предупредить развитие болезни и поражение нервной системы. Питание больных с наследственными заболеваниями обмена веществ строится по принципу исключения из рациона тех или иных веществ, утилизация которых в организме нарушена. В настоящее время диетотерапия используется при лечении врожденных нарушений аминокислотного обмена, таких, как фенилпировиноградная олигофрения, тирозинемия, гипергли-цинемия, гистидинемия, гиперлизинемия, гипервалинемия, гомо-цистинурия. Диетотерапия основана на комбинированном применении питательных препаратов и набора естественных или специализированных продуктов.
Диеты с ограничением тех или иных видов сахаров в пищевом рационе разработаны в настоящее время для питания детей с синдромами нарушения всасывания углеводов — непереносимости лактозы, галактозы, сахарозы.
Ортопедические мероприятия
Ортопедическое лечение заболеваний нервной системы у детей раннего возраста направлено главным образом на предупреждение развития аномальных поз, контрактур и деформаций. Причиной патологических поз является нарушение мышечного тонуса. Преимущественное поражение одних групп мышц и относительная сохранность других приводят к постоянной фиксации отдельных частей тела в неправильном положении. Длительное бездеятельное состояние мышц, находящихся в стадии интенсивного развития, нарушает обменные процессы в них и рост, приводит к укорочению и вторичным изменениям связочно-суставного аппарата. Нервно-мышечные контрактуры значительно осложняют течение восстановительного периода.
В острый период полиомиелита контрактуры носят нервно-рефлекторный характер и связаны с выраженным болевым синдромом. В дальнейшем при полиомиелите, а также при спинальных амиотрофиях, полиневритах чаще всего развиваются сгибательные контрактуры стоп, обусловленные нарушением функции мышц-разгибателей стопы и пальцев, иннервируемых малоберцовым нервом. Сгпбательно-отводящая контрактура в тазобедренном суставе связана с поражением мышц, приводящих бедро.
При верхнем типе акушерского пареза вследствие нарушения Функции мышц, отводящих плечо, ротирующих его кнаружи, супинаторов предплечья возникают приведение и внутренняя ротация плеча и пронация предплечья (внутриротаторная контрактура
483
Рис. 124. Приспособление для удерживания головы в правильном положении при кривошее
проприоцептивной импульсации,
плеча и пронаторная контрактура предплечья). Укорочение двуглавой мышцы плеча приводит к сгибательной контрактуре в локтевом суставе.
При детских церебральных параличах патологические позы обусловлены влиянием на мышечный тонус нередуцированных тонических шейных и лабиринтного рефлексов. Если с первых дней жизни не проводится правильное лечение, то у ребенка формируются спастическая кривошея, приводящие контрактуры в плечевых и тазобедренных суставах, сгибательные контрактуры кистей, «эквпноварусная стопа» и т. д.
С целью предупреждения порочных поз, контрактур и деформаций с первых дней жизни применяют лечение положением. Правильная поза ребенка способствует физиологической что создает предпосылки для
нормального развития статических и локомоторных навыков. Ту-
ловищу и конечностям следует придавать такое положение, при котором создается оптимальное физиологическое соотношение мышц-антагонистов. Так, например, при верхнем, проксимальном, типе акушерского пареза плечо должно быть в положении отведения и наружной ротации, локтевой сустав слегка согнут, предплечье суппнировано, кисть в тыльном сгибании. При спазме приводящих мышц бедер ноги ребенка фиксируют в положении отведения и наружной ротации.
Сохранение физиологического положения обеспечивают различными ортопедическими приспособлениями: валиками, ремнями, а также лонгетами, шинами, туторами, которые изготавливают из гипса, винипласта, желатины, вспененного полиэтилена, плексигласа, поливика и других материалов (рис. 124). Ортопедические приспособления накладывают 2—3 раза в день на 40— 60 мин, обычно после лечебной гимнастики. Правильная поза больных в положении сидя обеспечивается с помощью стульчиков или кресел, в которых имеются приспособления для фиксации головы, туловища и конечностей в правильном положении (рис. 125). К стульчику прикрепляют специальный столик для занятий и кормления ребенка.
484
Рис. 125. Подвесной стульчик для тренировки навыка сидения
Рис. 126. Приспособление для ношения ребенка за спиной с разведенными бедрами
Ношение ребенка в вертикальном положении с разведенными бедрами является лечебным мероприятием при аддукторном спазме и дисплазии тазобедренных суставов (рис. 126).
Своевременное проведение ортопедических мероприятий создает благоприятные условия для лечения двигательных нарушений у детей раннего возраста.
Лечебная гимнастика, массаж
Лечебная гимнастика является одним из основных методов лечения двигательных нарушений у детей. Физические упражнения улучшают обмен веществ и трофику скелетных мышц, стимулируют рост мышцы и нервно-мышечную проводимость. Под их влиянием улучшаются функции внешнего и тканевого дыхания, кровообращения, общее физическое развитие, адаптационные возможности организма.
Физические упражнения для детей раннего возраста делятся на пассивные, рефлекторные и активные. Использование того или иного вида гимнастических упражнений зависит от возраста ребенка и характера патологии. У детей первых месяцев жизни применяются главным образом пассивные упражнения, которые
485
выполняются методистом, медсестрой, родителями. С их помощью вырабатывается устойчивая взаимосвязь между центральным отделом двигательного анализатора и определенной группой мышц.
Многократное повторение движения из одинакового исходного положения приводит к выработке двигательного стереотипа и автоматизации двигательного навыка. Эти автоматизмы в дальнейшем играют важную роль при развитии произвольной двигательной активности. При пассивных упражнениях в движение включаются попеременно все суставы. Упражнения производятся в медленном или среднем темпе с соблюдением физиологического направления и объема движений в суставе, чтобы не вызвать отрицательной реакции ребенка.
Рефлекторные гимнастические упражнения основаны на включении в движение определенных групп мышц при вызывании врожденных безусловных рефлексов. Эти упражнения применяются в первые 3—4 мес жизни, когда примитивные рефлекторные механизмы еще не редуцировались. Хватательный рефлекс используют для стимуляции мышц кисти, рефлекторное ползание — при слабости мышц нижних конечностей, рефлекс Галанта — для укрепления мышц спины, рефлекс опоры — для тренировки вертикальной установки тела. Следует помнить, что рефлекторные гимнастические упражнения нельзя проводить при
Рис. 127. Упражнения для тренировки разгибания головы и опорной реакции рук перед зеркалом
486
Рис. 128. Тренировка цепного симметричного рефлекса. Упражнения на мяче перед зеркалом
487
Рис. 129. Тренировка ползания перед зеркалом
Рис. 130. Тренировка стояния на четвереньках перед зеркалом
Рис. 131. Тренировка цепных симметричных рефлексов из положения на спине
активизации безусловных рефлексов у детей в ранней стадии церебрального паралича. Активные упражнения подразумевают включение ребенка в выполнение произвольных движений, что стимулируется игрушкой, словесной инструкцией.
В связи с тем что при большинстве неврологических нарушений имеется задержка психо-моторного развития, важное значение приобретают методы лечебной гимнастики, направленные на тренировку развития возрастных статических и локомоторных функций.
При задержках развития у детей последовательно вырабатывают цепные рефлексы в различных положениях. Наиболее важным для стимуляции цепного симметричного рефлекса является положение на животе, в котором тренируют установоч-
488
пый рефлекс на голову, приподнимание головы с опорой на предплечья, затем на вытянутые руки, вставание на четвереньки и реципрокное ползание (рис. 127, 128, 129, 130). Из положения на спине вырабатывают умение приподнимать голову и верхнюю часть туловища при тракции за руки или за плечевой пояс (рис. 131), повороты на бок и на живот, вначале блоком, а затем с торсией, возможность
сесть (рис. 132). В наклонно- Рпс. 132. Тренировка поворота со» боковом положении стимулиру- спины на живот с торсией ют асимметричный цепной реф-
лекс и тренируют удержание головы и реакции равновесия. В вертикальном положении вырабатывают готовность к стоянию и развивают навык ходьбы (рис. 133, 134).
В комплексе лечебной гимнастики особое внимание следует уделить развитию хватательной функции рук. Тренируют супина
цию и пронацию, захватывание игрушек в положении на спине, на животе, сидя, одной или двумя руками (рис. 135). Формирующаяся при этом зрительно-моторная координация является фактором, стимулирующим психическое развитие ребенка.
Наряду с упражнениями, проводимыми методистами лечебной гимнастики, для развития возрастных двигательных навыков при задержке развития можно использовать специальные приспособления, в которых ребенок находится в период бодрствования. Прыгалки способствуют развитию вертикальной установки туловища, опорной функции ног, реакций равновесия (рпс. 136). С помощью прыгалок, двигающихся по рельсу, можно тренировать навык ходьбы (рис. 137). Опорную функцию ног и стояние тренируют, фиксируя ребенка к специальному вертикальному приспособлению. Для формирования реакций равновесия используют качели, наклонные плоскости и различные качалки. Положительные эмоциональные реакции, испытываемые ребенком во время таких упражнений, побуждают его к двигательной активности и способствуют психическому развитию.
При задержках развития у детей раннего возраста лечебная гимнастика проводится в сочетании с массажем. Массаж улучшает крово- и лимфообращение, увеличивает массу мышц, повышает тканевой обмен, рефлекторно воздействует на нервную систему и внутренние органы, повышает адаптационные функции организма. Поглаживания, растирания, разминания и поколачивания отдельных частей тела производят в направлении тока лимфы. Правильно выполненный массаж успокаивающе действует па ребенка, создает радостное настроение, побуждает его к активности.
489
Рис. 133. Тренировка опорной реакции ног: а — начало упражнения, б — конец упражнения
Рис. 135. Приспособление для тренировки супинации и пронации кисти и предплечья
Рис. 134. Тренировка навыка стояния. Упражнения на мяче
При периферических парезах различной этиологии (полиомиелит, акушерские парезы, инфекционные невриты) в лечебной гимнастике используют методические приемы, обеспечивающие повышение тонуса и максимальное включение ослабленных мышц в произвольные двигательные акты. Пассивные движения способствуют восстановлению функции пораженных мышц, растя-
490
Рис. 136. Тренировка вертикальной установки тела, реакции опоры и равновесия с помощью прыгалок:
а — момент отталкивания, б — момент подпрыгивания
жению укороченных мышц-антагонистов. Их производят в направлении функции парализованной мышцы. Пассивные движения можно сопровождать легкой вибрацией.
Возникающие при этом кинестетические раздражения активизируют спинальные рефлексы.
При восстановлении функции в паретичной мышце стимулируют активные движения. Вначале упражнения проводят в облегченном положении. Облегчение движений для отдельных сегментов конечности может быть достигнуто в воде, на плоскости, подбором специальных упражнений.
Для улучшения функции пораженных групп мышц при периферических парезах показано применение стимулирующих методов массажа (разминание, растирание, поколачивание, похлопывание, точечный массаж). Мышцы-антагонпсты, находящиеся в состоянии ретракции, расслабляют путем легкого растяжения, потряхивания, перетирания, поглаживания.
При прогрессирующих нервно-мышечных заболеваниях лечебную гимнастику и массаж проводят дозированно, избегая переутомления мышц. В комплекс лечебных упражнений включают пассивные и активные движения, дыхательную гимнастику. Занятия с больными при прогрессирующих нервно-мышечных заболеваниях целесообразно проводить в бассейне или ванне.
При детских церебральных параличах используют приемы лечебной гимнастики, направленные на стимуляцию
491
Рис. 138. Схема точечного массажа
Рис. 137. Тренировка навыка ходьбы с помощью прыгалок, двигающихся вдоль рельса
возрастных двигательных навыков (а не отдельных групп мышц) и торможение патологической тонической рефлекторной активности. Торможение тонических шейных и лабиринтного рефлексов достигается путем использования рефлексзапрещаю-щих позиций, в которых нормализуется мышечный тонус и облегчаются произвольные движения.
Для расслабления спастических мышц применяют точечный массаж (рис. 138). Постепенное изменение интенсивности вращательных движений с ослаблением давления до пуля при сравнительно длительном воздействии па определенные точки приводит к снижению мышечного тонуса. Точечный массаж может применяться перед лечебной гимнастикой с расчетом на его последействие. Для укрепления мышц спины, живота, ягодиц используют общий стимулирующий массаж.
Наряду с индивидуальными занятиями у детей раннего возраста при лечебной гимнастике широко используют групповые методы с активным включением игровых элементов.
Стимуляция психического и речевого развития
В общей системе реабилитационных мероприятий у детей раннего возраста с неврологическими нарушениями важное значение имеет предупреждение нарушений психического и речевого развития. Для этого на 1-м году жизни большое внимание следует уделять сенсорному воспитанию, которое осуществляется одновремен
492
но с последовательным моторным развитием ребенка и формированием голосовых реакций.
Сенсорное воспитание включает три последовательных этапа. На первом этапе формируются ориентировочно-исследовательские реакции на различные зрительные и слуховые раздражители. Ребенка учат фиксировать взор на предмете и прослеживать его во всех направлениях, сосредоточиваться на звуке и локализовать его в пространстве. Наряду с этим стимулируют начальные звуки гуления.
На втором этапе формируют начальное предметное восприятие. Для его развития необходимо сочетание зрительного и слуховых раздражителей с предметно-практической деятельностью. Для этого ребенок должен не только видеть яркую игрушку, слышать ее звук, но обязательно прикасаться к ней руками. Различные по форме, величине, фактуре игрушки вкладывают в руку ребенка или стимулируют их захват. При этом ребенок всегда должен смотреть на игрушку, находящуюся в руке. При ярко выраженной тонической рефлекторной активности для облегчения захвата игрушки с одновременной зрительной фиксацией ее необходимо использовать рефлексзапрещающие позиции.
На этом этапе большое внимание также уделяется развитию лепета, воспитанию слухового внимания на речь и формированию начальных элементов ее восприятия. Для этого с ребенком постоянно разговаривают, привлекая его внимание к речи взрослого, показывают предметы, одновременно их называя, стимулируют повторение звуков и жестов по подражанию. Эту работу начинают с детьми со 2-го полугодия жизни.
На третьем этапе у ребенка развивают возможность вычленения отдельных предметов из целой ситуации, формируют избирательность следовых реакций, развивают восприятие образа предмета, учат дифференцированно использовать различные игрушки, интенсивно стимулируют понимание речи и коммуникативную функцию речи. Для этого не только активизируют предметноигровую и практическую деятельность ребенка, но и проводят специальные занятия с предметными и сюжетными картинками. Эти занятия начинают со 2-го года жизни. Для многих детей с ранним поражением нервной системы, особенно при церебральном параличе, этап сенсорного восприятия является очень сложным.
Наряду с сенсорным восприятием большое место в лечебнопедагогической работе отводится формированию обобщающей функции мозга. На первом этапе развития этой функции у ребенка формируют наглядные обобщения по наиболее доступному внешнему признаку предмета, который зависит от большей сохранности того или иного типа восприятия (цвет, форма, объем, размер предметов). Второй этап развития обобщения тесно связан с образованием образа предмета путем формирования интерсенсорных связей, особенно зрительно-кинестетических. Вначале
493
ребенок, выделяя знакомые предметы из общей ситуации, обобщает их глобально, без определения существенных и несущественных признаков предмета. Для развития возможности выделения существенных признаков необходима предметная, игровая и практическая деятельность. Третий этап становления обобщения — формирование понятий — происходит уже в дошкольном и школьном возрасте, ведущее значение при этом имеет развитие речи.
В предупреждении нарушений речевого и психического развития важную роль играет правильная организация режима, предусматривающая создание условий для максимального обогащения двигательного и сенсорного опыта детей. Персонал следует инструктировать о необходимости выработки у детей самостоятельности, активности. Взрослые должны постоянно разговаривать с детьми. В специальных учреждениях детей в возрасте старше 2 лет подбирают в группы таким образом, чтобы они могли помогать друг другу, и эта помощь всячески поощряется взрослыми.
Персонал должен принимать активное участие в обучении детей жеванию, приему пищи, развитию у них навыков самообслуживания, игровой деятельности и речи.
Необходимо следить за оформлением помещения, в котором находится ребенок. Над кроваткой ребенка, начиная с первых месяцев жизни следует подвешивать различного цвета и формы игрушки, на стенах размещать яркие картинки, привлекающие внимание ребенка. Важно следить за сменой игрушек в кроватке и помещении. В то же время недопустимо чрезмерное обилие игрушек, которое утомляет нервную систему. Оно особенно нецелесообразно в залах лечебной гимнастики, где ребенок получает большой комплекс раздражителей. В помещении, где находится больной ребенок, следует избегать излишне громких разговоров, криков.
Для детей с поражением нервной системы следует проводить специальные музыкальные игры, занятия. Музыка успокаивает ребенка, развивает у него способность слушать, прислушиваться, а в более старшем возрасте (9—10 мес) дифференцировать мелодии. Музыка вызывает положительные эмоции, способствует формированию речи и психики.
Для развития речи и психической деятельности важное значение имеет «ручная умелость». Для ее формирования у детей с двигательными нарушениями необходимо использовать различные корригирующие приспособления, например, специальный стул с приставной доской, на которой смонтированы различные предметы для развития манипулятивной деятельности кисти и пальцев.
При проведении всех педагогических занятий важно следить, чтобы руки ребенка находились на столе в правильном физиологическом положении.
494
Мероприятия по развитию речи и психики проводятся как групповым методом, так и индивидуально. При индивидуальной работе с детьми, страдающими церебральными параличами, особенно важно использовать рефлексзапрещающие позиции, в которых проводятся массаж и артикуляционная гимнастика, стимулируется звукоподражание и развиваются сенсорные функции.
Физиотерапевтические методы
Физиотерапевтическое лечение является составной частью комплексных лечебных мероприятий, проводимых при заболеваниях нервной системы у детей раннего возраста на различных стадиях восстановительного периода. Оно применяется в сочетании с лечебной гимнастикой, ортопедическими укладками, медикаментозными препаратами, улучшает функциональное состояние нервной системы и повышает эффективность комплексного лечения. К физиотерапевтическим методам относятся: водолечение, озокерит, горячие укутывания, грязевые аппликации, электрофорез лекарственных веществ, импульсный ток, электростимуляция.
Водотерапия. Благоприятно влияет на состояние центральной нервной системы, нормализует процессы возбуждения и торможения, улучшает сон. В теплой воде уменьшается спастичность мышц, стихают болевые ощущения и гиперкинезы, увеличивается объем активных движений, улучшается кровоснабжение органов и тканей. Теплую ванну можно сочетать с пассивными и активными движениями под водой.
Хвойные ванны. Жидкий хвойный экстракт (25—50 г) вливают в ванну с температурой воды 36—36,5° С. Продолжительность процедуры — 5—10 мин в зависимости от возраста. После ванны ребенка обливают водой. Ванны проводят через день; на курс лечения — 8—10 ванн. Через 1—2 мес курс можно повторить. Эфирные масла, находящиеся в хвое, успокаивают нервную сипему, рефлекторно воздействуя на рецепторы кожи, дыхательных путей и обонятельный анализатор. Хвойные ванны показаны при различных заболеваниях нервной системы, сопровождающихся повышенной возбудимостью, нарушением сна.
Солено-хвойные ванны. К пресной воде добавляют морскую неочищенную соль из расчета 100—200 г на ведро воды (10 л). Соль в полотняном мешочке опускается в воду до полного растворения. Затем добавляют хвойный экстракт. Температура воды 35—36° С зимой и 34—35° С летом. Продолжительность ванны — 5—10 минут. Ванны делают через день; на курс — 8—10 ванн. Солено-хвойные ванны возбуждают центральную нервную систему, ее вегетативный отдел, улучшают обменные процессы, повышают общий тонус организма. Их применяют у детей с церебральным параличом, ослабленных соматически, с проявлением рахита; особенно эффективны солено-хвойные ванны при атони
495
чески-астатическом синдроме, акушерских парезах, последствиях полиомиелита, травмах спинного мозга.
Морские ванны. Температура морской ванны вначале должна быть 37,5° С, затем ее постепенно снижают до 36° С. Продолжительность ванны — 5—8—15 мин. Их проводят два дня подряд с отдыхом на 3-й день. Курс лечения — 8—10—15 ванн. Морские ванны действуют общеукрепляюще на организм, способствуют закаливанию, улучшают кровоснабжение головного, спинного мозга и мышц, снижают возбудимость нервной системы.
Ванны из настоя трав. Для их приготовления используют концентрированный настой из трав (корень валерианы, пустырник, душица, хмель, зверобой, шалфей, ромашка, полынь и др.) в количестве V2—1—2 стакана на ванну. Температура ванны 36— 36,5° С. Продолжительность — 8—15 мин, через день. Курс лечения — 8—10 ванн. Ванны из трав оказывают седативное действие на нервную систему.
Озокеритолечение. Озокерит (горный воск) оказывает биологическое, термическое и механическое действие. Он обладает большой теплоемкостью, низкой теплопроводностью и более медленно, чем другие вещества (парафин, грязь), отдает тепло организму, вызывая расширение сосудов. При остывании озокерит уменьшается в объеме и оказывает компрессионное действие. Биологически активные вещества, содержащиеся в озокерите, обладают ацетилхолиноподобным, экстрогенным и противовоспалительным эффектом. Озокерит стимулирует регенеративные процессы в соединительной ткани, способствует рассасыванию рубцов.
Озокерит оказывает выраженное действие на вегетативные отделы центральной нервной системы, нормализуя соотношение между симпатическим и парасимпатическим ее компонентами. От действия тепла увеличивается лимфо- и кровоснабжение, снижается возбудимость нервно-мышечного аппарата. Мышцы и связочный аппарат расслабляются, становятся более растяжимыми и эластичными. При воздействии на воротниковую область озокерит стимулирует кровообращение в сосудах головного мозга путем активизации функции шейных симпатических узлов.
При лечении детей чаще применяют кюветно-аппликационный метод. Расплавленный озокерит в смеси с парафином наливают в кювет (на дно которого положена клеенка) слоем 2—3 см. После охлаждения до температуры 38—40° С теплый, мягкий озокерит вынимают вместе с клеенкой и накладывают на соответствующий участок (сустав, стопу, шейный отдел). Затем завертывают фланелевой пеленкой или специально сшитым ватником. Продолжительность процедуры — 10—20—30 мин в зависимости от возраста. На курс — 15—30 процедур, через день. Озокеритолечение дети переносят хорошо. Через 30—40 мин после процедуры показана лечебная гимнастика. Озокерит применяют при тугопо-движности в суставах и их контрактурах, мышечных контрактурах, выраженной спастичности мышц, болевом синдроме.
496
Горячие шерстяные укутывания. Куски шерстяного трикотажа, соответствующие размеру конечности, подогревают на водяной бане до температуры 70—80° С, отжимают, встряхивают и охлаждают до 38—45° С. Теплую ткань накладывают на соответствующие части тела, затем заворачивают клеенкой, фланелью и одеялом. Продолжительность процедуры — 10—20—30 мин, ежедневно или через день. Курс лечения — 10—15 процедур. Горячие укутывания показаны при всех видах двигательных нарушений центрального или периферического происхождения. Они также эффективны при различных формах гиперкинезов.
Грязевые аппликации. У детей до 3 лет грязевые аппликации применяются редко. Их можно заменить более щадящей процедурой — гальваногрязью или электрофорезом грязевого отжима. Марлевый мешочек с грязью температуры 38° С накладывают на соответствующую область, поверх него помещают электрод и укутывают как при грязелечении. Второй электрод накладывают поперечно пли продольно в зависимости от характера процедуры. Плотность тока — 0,03—0,05 мА/см2, продолжительность — 5— 8—10 мин, через день, на курс — 8*—10—12 процедур.
Грязевые аппликации оказывают местное сосудорасширяющее, трофическое, рассасывающее действие. При шейно-воротниковой методике грязь улучшает кровоснабжение и обменные процессы в мозговой ткани.
Лекарственный электрофорез. Это метод, при котором на организм одновременно действует гальванический ток и вводимые с его помощью лекарственные вещества. Введение лекарств методом электрофореза нашло широкое применение у детей раннего возраста, так как прием лекарств внутрь часто вызывает снижение аппетита, рвоту. Отрицательная болевая реакция ребенка при внутримышечных инъекциях нарушает его контакт с врачом п методистом ЛФК. Методом электрофореза можно вводить препараты кальция, брома, йода, церебролизин, пирогенал, галантамин, прозерин, дибазол и другие вещества.
Под матерчатую прокладку с металлической пластинкой кладут фильтровальную бумагу, смоченную лекарственным раствором. Концентрация вводимого раствора, сила тока и продолжительность процедуры зависят от возраста ребенка и характера патологии. Если в организме необходимо создать большие концентрации лекарственных веществ, пользуются 5—10% растворами. Если электрофорез рассчитан на сегментно-рефлекторное воздействие, используют растворы малой концентрации (1—2%). Плотность тока — 0,01—0,03 мА/см2, продолжительность процедуры при электрофорезе лекарств — 10—15—20 мин в зависимости от возраста, курс — 10—15 процедур, через день.
Электрофорез по глазнично-затылочной методике. Электроды круглой формы из 10—12 слоев марли диаметром 3—5 см накладывают на глазницы при закрытых глазах. Электрод размером 5 X Ю см располагают на задней поверхности шеи. Плотпос1Ь
17 из
497
тока — 0,02—0,03 мА/см2, длительность процедуры — 8—10— 15 мин, курс — 12—15 процедур, через день. По глазнично-затылочной методике детям раннего возраста можно вводить калия йодид, лидазу, магний, кальций.
Нбвокаин-электрофорез по методике Новожилова. Один электрод с прокладкой (50—100 см2) смачивают 0,5—1% раствором новокаина и накладывают на область позвоночника с захватом паравертебральных отделов: для рук — от С< до Д4, для ног — от L5 до S2. Второй электрод, индифферентный, располагают продольно выше или ниже первого. Плотность тока — 2—5—8 мА/см2. Длительность процедуры — 5—8—10 мин.
Новокаин вызывает торможение патологических афферентных импульсов, поступающих в центральную нервную систему, нормализует возбудимость двигательных зон головного мозга. На этом основан эффект снижения мышечного тонуса и уменьшения гиперкинезов при его применении. Новокаин-электрофорез показан при двигательных нарушениях, сопровождающихся повышением мышечного тонуса.
Магний-электрофорез на воротниковую зону. Один электрод в форме воротника с прокладкой, смоченной в 2—10% растворе магния сульфата, помещают на воротниковую зону (верхняя часть спины, надплечья, надключичные области). Второй электрод, индифферентный, накладывают на пояснично-крестцовую область. Плотность тока — 0,03—0,05—0,1 мА/см2, продолжительность — 10—15—20 мин, через день, на курс — 15—20 процедур. Магний оказывает успокаивающее действие на нервную систему, тормозит нервно-мышечную передачу, снижает тонус мышц. Гальванический ток рефлекторно расширяет сосуды головного мозга, сочетанное действие гальванического тока и магния улучшает функциональное состояние. Применение магний-электрофореза показано при заболеваниях нервной системы, протекающих с повышением мышечного тонуса. Его можно чередовать с озокеритовыми аппликациями на воротниковую зону. Таким же методом можно вводить кальций, бром (2—5% растворы), лидазу.
Лид аза-электрофорез на приводящие мышцы бедер. Два электрода (100—150 см2), смоченные в растворе лидазы с новокаином (30 мл 0,5% новокаина + 64 ЕД лидазы), накладывают на внутренние поверхности бедер. Другой электрод (200—300 см2), индифферентный, накладывают на пояснично-крестцовую область. Плотность тока — 0,03—0,05 мА/см2, продолжительность процедуры — 15—20 мин, через день, курс — 15—20 процедур. При выраженном аддукторном спазме электрофорез с лидазой можно чередовать с озокеритовыми аппликациями.
Действие лидазы основано на увеличении проницаемости тканей. Лидаза в сочетании с гавальническим током оказывает рассасывающее действие. Плотность соединительной ткани уменьшается, мышцы становятся более растяжимыми, увеличивается угол отведения бедер, уменьшается перекрест ног.
498
Галантамин (прозерин)-электрофорез. Один электрод смачивают 2—5% раствором калия йодида и накладывают на область нижнешейного или верхнегрудного отдела позвоночника, другой — (0,05—0,1% прозерина или 0,25—0,5% раствора галантамина) — на кисть. Плотность тока — 0,03—0,05 мА/см2, продолжительность сеанса — 10—15—20 мин, на курс — 10—15 процедур. Сочетанное применение препаратов калия и антихолинэстеразных средств эффективно при акушерских парезах рук, последствиях полиомиелита.
Электрофорез никотиновой кислотой и эуфиллином. Электрод, смоченный 0,5—1% раствором никотиновой кислоты, накладывают на область шейного отдела позвоночника. Другой электрод с 1 — 2% раствором эуфиллина помещают на область грудины. Плотность тока — 0,03—0,05 мА/см2, продолжительность сеанса — 10—15—20 мин, на курс—10—15 процедур. Положительный эффект основан на улучшении кровотока в вертебро-базиляр-ной системе. Применяется при травмах спинного мозга, акушерских парезах.
Импульсный ток, воздействуя на проприоцептивные окончания, уменьшает афферентную импульсацию, что приводит к снижению мышечного тонуса и уменьшению гиперкинезов. Источником импульсных токов являются аппараты АСМ-2 и АСМ-3, УЭИ.
На тыльные поверхности ногтевых фаланг кистей и стоп накладывают смоченные в теплой воде электроды в виде узкой полоски (ширина — 1 —1,5 см, длина — 5 см). Сила тока увеличивается постепенно с 2 до 5 мА, частота импульсов 80 в 1 с, длительность импульса — 3 мс. В середине процедуры полярность тока изменяется. Продолжительность процедуры — 5—10 мин, на курс лечения — 20—25 процедур.
Противопоказанием являются выраженные контрактуры, частые судорожные припадки. Импульсный ток оказывает наибольший эффект при детских церебральных параличах.
Электростимуляция мышц и периферических нервов показана при периферических парезах различной этиологии. При центральных параличах ее используют для стимуляции ослабленных групп мышц, антагоничных спастичным. Синусоидальные модулированные токи для электростимуляции получают с помощью аппаратов «Амплипульс», «Стимул». Частота импульсов, сила тока и длительность процедуры определяются индивидуально в зависимости от возраста ребенка, глубины поражения мышц и нервов.
Медикаментозная терапия
Медикаментозная терапия является составной частью комплексных мероприятий, проводимых в восстановительный период неврологических заболеваний у детей раннего возраста. Выбор и применение тех или иных препаратов определяются характером имеющихся нарушений, степенью их выраженности, возрастом и
17*
499
индивидуальной реакцией ребенка. Поскольку при заболеваниях нервной системы у детей первых лет жизни ведущим является нарушение созревания отдельных функциональных систем, медикаментозная терапия должна быть направлена прежде всего на стимуляцию нормального развития мозга. С этой целью применяют медикаментозные средства, улучшающие обмен веществ в нервной системе.
t Препараты аминокислот (гаммалон, аминолон, церебролизин, глютаминовая кислота и др.) стимулируют белковый обмен и энергетические процессы в тканях мозга, повышают их дыхательную активность, улучшают кровоснабжение, удаляют токсические продукты обмена.
\/Ноотропил (пирацетам) повышает энергетический обмен клеток головного мозга, развивая их потенциальные нейрофизиологические возможности и облегчая формирование ассоциативных связей.
Цианокобаламин, кальция пангамат и липоцеребрин участвуют в метаболизме липидов. Их применение способствует процессам миелинизации нервной системы. Кальция пангамат, кроме того, устраняет явления гипоксии, способствуя усвоению кислорода тканями.
Тиамин и кокарбоксилаза принимают участие в белковом и углеводном обмене, улучшают проведение нервного возбуждения в синапсах, способствуют процессам миелинизации.
Пиридоксин участвует в синтезе триптофана, метионина, цистина, гамма-аминобутировой кислоты, катехоламинов и гистамина. Он играет важную роль в обеспечении нервной ткани необходимым количеством серотонина.
Ацефен, являясь предшественником ацетилхолина, включается в медиаторный обмен, а также участвует в метаболизме центральных и периферических нейронов. Препараты этой группы оказывают положительное влияние на функцию вегетативной нервной системы, что чрезвычайно важно при лечении неврологических заболеваний у детей раннего возраста.
Средства, улучшающие метаболизм в нервной системе, назначают при задержках моторного, речевого и психического развития, церебрастеническом синдроме после черепно-мозговых травм, инфекционных заболеваний. При повышенной возбудимости нервной системы, судорогах их следует давать осторожно, постепенно повышая дозу и сочетая с седативными и противосудорожными препаратами.
Другие виды медикаментозной терапии назначают с учетом имеющейся неврологической симптоматики.
При повышении мышечного тонуса у детей раннего возраста применяют мидокалм, реже — норакин, амедин, тропацин. Мидо-калм угнетает каудальный отдел ретикулярной формации ствола мозга, что приводит к уменьшению спастичности и ригидности
500
мышц. Вызывая умеренное торможение нервного возбуждения в вегетативных ганглиях, он оказывает также слабое спазмолитическое и сосудорасширяющее действие, способствует улучшению трофики мышц.
Норакин, амедин, тропацин оказывают центральное и периферическое холинолитическое действие. Они показаны при мышечной гипертонии экстрапирамидного происхождения. Учитывая возможность побочных реакций (сухость во рту, учащение пульса), на первом году жизни их следует применять с осторожностью.
Снижение мышечного тонуса отмечается также при приеме некоторых седативных средств, таких, как элениум (напотон), седуксен (диазепам).
Для лечения гиперкинезов в последние годы стали широко применяться нейролептические средства (амизил, терален, ме-тамизил и галоперидол). Их эффект обусловлен участием в обмене катехоламинов, который нарушен при многих формах гиперкинезов.
Уменьшению гиперкинезов способствует также амедин, тропацин, норакин. Детям до 1 года при гиперкинезах назначают препараты брома, элениум, напотон, седуксен, дилантин.
Для улучшения передачи импульсов в синапсах центральной нервной системы и нервно-мышечных синапсах применяют анти-холинэстеразные средства (прозерин, галантамин, оксазил). Они показаны при периферических парезах и параличах различной этиологии, наследственных нервно-мышечных заболеваниях, синдроме мышечной гипотонии, а также при вялой форме детского церебрального паралича.
По действию к антихолинэстеразным препаратам близок дибазол. Однако он эффективен, главным образом, при заболеваниях, протекающих с поражением мотонейронов спинного мозга и ствола головного мозга.
Препараты, улучшающие обменные процессы в мышечной ткани, являются средством патогенетической терапии при прогрессирующих нервно-мышечных заболеваниях. Они показаны также при периферических параличах и парезах, сопровождающихся нарушением трофики мышц. АТФ необходима для нормального энергетического обмена в мышце. По механизму действия к ней приближается МАП (мышечно-адениловый препарат). Для улучшения трофики скелетных мышц применяют токоферола ацетат.
Препараты аминокислот (глютаминовая кислота, метионин) участвуют в обмене мышечных белков. Способность анаболических стероидов метандростенолона (неробола, ретаболила) и калия оротата стимулировать синтез структурных и ферментных белков мышц определяет их широкое применение при наследственных нервно-мышечных заболеваниях, а также при лечении Детей с выраженной общей гипотрофией.
501
При повышении внутричерепного давления используют дегидратирующие средства. В случаях остро развивающегося гипер-тензионного синдрома показано назначение лазикса или фуросемида, обладающих сильным и быстрым диуретическим действием. При умеренном повышении внутричерепного давления применяют глицерол. Маленьким детям его дают в соотношении 1:1с лимонным соком. Для длительного применения можно также использовать диакарб, эффект которого связан не только с усилением диуреза, но и со способностью подавлять секрецию ликвора.
Дегидратирующие препараты следует давать прерывистыми курсами, чтобы избежать нарушения электролитного баланса и кислотно-щелочного равновесия. Их обязательно сочетают с препаратами калия (калия ацетат, калия оротат, панангин). Дегидратирующим свойством обладает также магния сульфат, который можно назначать внутримышечно или в виде клизмы. Для приготовления клизмы берут столовую ложку сернокислой магнезии и 2 ложки теплой кипяченой воды. Клизмы делают через день. Во избежание раздражения слизистой прямой кишки через каждые 3—4 лечебные клизмы делают 1 масляную.
При умеренном повышении внутричерепного давления хороший эффект оказывают микстуры, в состав которых входят магния сульфат, цитраль, препараты брома, валериана, димедрол.
Длительность дегидратационной терапии определяется состоянием больного, степенью повышения внутричерепного давления и его компенсации.
При повышенной нервнорефлекторной возбудимости детям раннего возраста назначают седативные препараты. Можно рекомендовать начинать лечение с успокаивающих трав (пустырника, корня валерианы), которые применяют в виде настоя. Настой корня валерианы детям до 3 лет назначают из расчета 2 г на 100 мл, пустырника — 3—4 г на 100 мл. Дают по 1 чайной или 1 столовой ложке 3—4 раза в день. При выраженном возбуждении, нарушении сна можно использовать 1% раствор натрия бромида, седуксен, мелерил, элениум.
Многие заболевания нервной системы у детей раннего возраста сопровождаются аллергическими проявлениями. В этих случаях восстановительную медикаментозную терапию следует сочетать с применением десенсибилизирующих средств (димедрола, диазолина, супрастина, тавегила и др.).
Повышение проницаемости сосудистой стенки является показанием для назначения аскорбиновой кислоты, аскорутина, кальция хлорида, кальция глюконата.
При последствиях кровоизлияний, травм и воспалительных процессов в комплекс медикаментозной терапии необходимо включать препараты, обладающие рассасывающим действием (алоэ, лидаза, пирогенал).
Сочетание препаратов, назначаемых ребенку, должно быть оптимально направленным на коррекцию всех имеющихся невро-
502
Таблица 12. Основные лекарственные препараты, применяемые при восстановительном лечении заболеваний нервной системы у детей раннего возраста
Препарат Форма выпуска Разовая доза Количество назначений
до 6 мес 6 мес — 1 год 1 — 3 года
П репараты, стимулирующие обменные процессы в нервной системе
Тиаминахлорид Таблетки по 0,0005— 0,001— 0,003— 2-3
(витамин Bi) 0,002, 0,005, 0,01 Ампулы по 1 мл 5% раствора внутримышечно 0,001 0,3 мл 0,003 0,5 мл 0,005 1 мл 1
Кокарбоксилаза Флаконы по 50 мг внутримышечно 25 mi 25—50 мг SO- 75 мг 1
Пиридоксин (витамин Вв) Таблетки по 0,002; 0,005; 0,01 Ампулы по 1 мл 1% раствора внутримышечно 0,0005-0,001 0,3 мл 0,001— 0,003 0,5 мл 0,003— 0,005 1 мл 2—3 1
Цианокобаламин (витамин В12) Фоликобаламин Ампулы по 100, 200, 500 мкг внутримышечно Официнальные таблетки 50—100 мкг 100— 200 мкг по 0,5—1 100— 300 мкг таблетке 1
Кальция пангамат (витамин В1в) Таблетки по 0,05 0,005 0,01 0,025 2
Амина л он (гамма -л он) Таблетки по 0,25 0,1— 0,25 0,25 0,25— 0,5 2—3
Церебролизин Ампулы по 1 мл внутримышечно .от 0,3 до увеличив; 1 МЛ, ПО1 1Я дозу степенно 1
Глютаминовая кислота Таблетки по 0,25; 0,5 0,Об-ОД 0,1— 0,15 0,15-0,25 2-3
Линоцеребрин Таблетки по 0,15 0,075 0,1 0,15 2
Ацефен (люци-дрил) Ноотропил (пирацетам) 1 Таблетки по 0,1 Капсулы по 40Э мг 1 репараты, снижаю 0,05 щ ие мыше' 0,1 30-50 mi гный тону< 0,15 7кг в сут: р 2 ки
Мидокалм Таблетки по 0,0f^ 0,008 0,025 0,05 2
Амедин Таблетки по 0,0015 0,0002 0,0004— 0,0006 0,0006— 0,001 1-2
503
Продолжение табл. 12
Препарат Форма выпуска Разовая доза Количество назначений
до 6 мес 6 мес — 1 год 1—3 года
Тропацин • Таблетки по 0,001; 0,003; 0,005; 0,01 0,0001 на 1 мес жизни 0,001— 0,002 1—2
Норакин Таблетки по 0,002 0,0001— 0,0002 0,0003 0,0005 2—3
Циклодол Таблетки по 0,001 Не наз начают 0,0001— 0,0002 1-2
Напотон (элениум) Таблетки по 0,005 0,0005— 0,0007 0,001 0,0015— 0,002 1-2
Препараты, способствующие уменьшению гиперкинезов
Амизил Таблетки по 0,001 и 0,002 Не назначают о,cool-о.0003 1-2
Метамизил Таблетки по 0,001 » 0,0001— 0,0003 1-2
Тералев' Таблетки по 0,005 » 0,0005— 0,0008 1-2
Галоперидол Таблетки по 0,0015 и 0,005 » 0,0005 1-2
Препараты, улучшающие нервно-мышечную проводимость
Прозерин Таблетки по 0,015 Не назначают 0,0006— 0,001 0,001-0,003 1-2
Ампулы 1 мл 0,05% раствора подкожно 0,1 мл 0,1-0,3 мл 1
Галантамина гидробромид (нива-лин) Ампулы по 1 мл 0,25% раствора подкожно Не назначают 0,1— 0,2 мл ОД-0,3 мл 1
Оксазил * Таблетки по 0,001, 0,005 и 0,01 Не назначают 0,001— 0,002 1
Дибазол Таблетки по 0,002; 0,003 и 0,004 0,0005 0,001 0,002— 0,003 1
Препараты, улучшающие обмен веществ > в мышечной ткани
АТФ Ампулы по 1 мл 1% раствора внутримышечно 0,5 мл 0,7 мл 1 мл 1
МАП Флаконы по 10Э мл По 1 nai IHOJ Л0Ж1 <е 2—3
Метионин Таблетки по 0,25 и 0,5 0,05-0,07 0,07-ОД ОД-0,25 2-3
504
Продолжение табл. 12
Препарат Форма выпуска Разовая доза Количество назначений
до 6 мес 6 мес — 1 гол 1—3 года
Витамин Е (токоферола ацетат) Флаконы по 10,25 и 50 мл 5% раствора внутрь 2 капли 3 капли 4 капли 1
Калия оротат Таблетки по 0,25 и 0,5 10—20 мг на 1 кг массы в сутки
Метандростенолон (неробол) Таблетки по 0,001 и 0,005 0,05—0,1 мг на 2 кг массы в сутки
Ретаболил Флаконы по 1 мл 5% раствора внутримышечно Не назначают 0,1— 0,15 мл 1 раз в 3—4 нед
Дегидратирующие препараты
Диакарб (ацетазоламид) Таблетки по 0,25 0,04— 0,06 I 0,06— 0,08 0,125— 0,25 1
Магния сульфат Ампулы 25% раствора внутримышечно 0,2 мл массь на 1 кг I тела 1—3 мл 1
Фуросемид Таблетки по 0,04 0,001—0,003 на 1 1 тела в сутк кг массы и 1
Бринальдикс Таблетки по 0,02 0,002— 0,003 0,005 0,006 1
Глицерин (глипе-рол) Флаконы внутрь По 0,5— с Фр 1,5 г на 1 уктовым с кг массы ЮКОМ 1—2
Лазикс Ампулы по 2 мл 1% раствора внутримышечно, внутривенно Седативнъ 0,1—0,3 мл на 1 кг массы в сутки ie средства 1
Натрия бромид Микстура 2% 5 мл 5— 10 мл 5- 10 мл 2-3
Диазепам (седуксен) Таблетки 0,005 0,0005— 0,0007 0,0006— 0,001 0,001— 0,003 1-2
Xлордиазе поксид (элениум напотон) Таблетки 0,005; 0,01; 0,025 0,0005— 0,0007 0,0008— 0,001 0,001— 0,002 1-2
Тазепам (оксазепам) Таблетки 0,01 0,001 0,001— 0,003 0,003— 0,005 1-2
Тиоридазин (мел-лерил) Таблетки 0,01; 0,025 Не наз качают 0,003-0,008 1-2
Триоксазин Таблетки 0,3 0,03-0,05 0,06— 0,08 0,08— 0,15 1-2
505
Продолжение табл. 12
Препарат Форма выпуска Разовая доза Количество назначений
до 6 мес 6 мес — 1 год 1—3 года
Гемостатические препараты
Кальция хлорид 10% раствор 5 мл 5 мл 5 мл 2-3
Капьция глюконат Таблетки по 0,5 0,25-0,3 0,3-0,5 0,5—1,0 2-3
Викасол Таблетки по 0,001— 0,002- 0.003 2—3
0,015 0,002 0,0025
Ампулы по 1 мл 0,4 мл 0,8 мл 0 8- 1-2
1% раствора внутримышечно 0,1 мл
Аскорбиновая Таблетки по 0,05 0,025 0,05 0,05-0,1 2
кислота (витамин С) Ампулы по 1 мл 5% раствора 0,5 мл 1 мл 1—2 мл 1
внутримышечно, внутривенно 0,008 0,01
Рутин Таблетки по 0,02 0,04 2
Рассасывающие препараты
Пирогенал Ампулы по 100, Начальная доза 10 МПД с дальней-
250 МПД. внут- шим увеличением на 5 МПД каждые
римышечно 2—3 дня в зависимости от темпера-
турнои реакции и состояния больного.
Максимальные разовые дозы
50 МПД 75 МПД 125— 150 МПД 1
Лидаза 64УЕ стерильного 0,3- 0,5 мл 1 мл 1
сухого вещества растворяют в 1 мл 0,5% новокаина 0,5 мл
подкожно
Алоэ Ампулы по 1 мл, 0,3 мл 0,5 мл 0,5- 1
подкожно 1 мл
логических нарушений. Дозы препаратов подбираются лечащим врачом индивидуально с учетом возможности парадоксальной реакции у детей раннего возраста и нецелесообразности комбинации ряда препаратов друг с другом. Например, нежелательно сочетанное применение цианокобаламина с аминазином, аскорбиновой кислотой, пиридоксином, прозерином и кокарбоксилазой; аскорбиновой кислоты с прозерином; дибазола с сульфатом магния и др. Средняя продолжительность курса лечения составляет 1—1,5 мес. Перерывы между курсами должны быть не менее 2—3 мес.
Ниже приведены дозы основных лекарственных препаратов, применяемых при восстановительном лечении заболеваний нервной системы у детей раннего возраста (табл. 12).
506
Вопросы медицинской деонтологии и врачебной этики в клинике раннего детского возраста
Основные принципы медицинской деонтологии, сформулированные еще в клятве Гиппократа, в условиях современной медицины не только сохраняют, но и приобретают все большее значение.
Деонтологические аспекты наиболее остро встают в стационаре, где ребенок оторван от дома п окружен поначалу незнакомыми ему людьми. Возникает ситуация так называемой острой разлуки, которую чувствуют даже дети раннего возраста. Наиболее эффективным выходом из такой ситуации большинство специалистов считает усиление психотерапевтической направленности врачебной деятельности. При этом речь идет не только о непосредственно врачебной деятельности — общении с больным,— но и о соответствующей подготовке медицинского персонала, контакте с родителями и родственниками больного, наконец, о такой организации работы клиники, при которой бы все травмирующие моменты максимально сглаживались. Иными словами, межличностная система врач — больной дополняется рядом других важных систем: врач — больничный персонал, врач — родители и родственники больного, сестра — больной, санитарка — больной.
В клинике раннего возраста, особенно при наличии детей с неврологической патологией, все перечисленные звенья приобретают особо важное значение. Благоприятная эмоциональная обстановка в клинике оказывает на детей общеоздоровляющее влияние, воздействует па нервно-психическое развитие.
Многочисленные исследования показывают, что даже при хорошей сохранности основных функциональных систем мозга грудной ребенок нуждается в организующих воздействиях взрослого для получения достаточного объема информации из внешней среды. Речь идет прежде всего об оптимальном количестве и разнообразии зрительных, слуховых, тактильных раздражителей, активизации манипулятивной деятельности, эмоционально-речевом общении со взрослым. При отсутствии достаточного объема этих социально опосредованных раздражителей наступает состояние сенсорной депривации, приводящее к угнетению познавательной активности ребенка. Возникают двигательные стереотипы и монотонные самораздражения, потребность в общении со взрослым снижается. В тяжелых случаях ребенок выглядит полностью отгороженным от внешнего мира и даже безучастным к своим основным физиологическим потребностям. Такое состояние некоторые зарубежные исследователи обозначают термином р е-с и г н а ц и я (отрешенность).
Понятно, что если у ребенка имеется то или иное поражение нервной системы, приводящее к задержке нервно-психического развития, сенсорная депривация способна заметно усилить существующие расстройства. Наши наблюдения показывают^ что даже
507
дети с незначительными неврологическими отклонениями гораздо быстрее, чем контрольная группа, «привыкают» к безречевому общению со взрослым в эксперименте: у них скоро исчезает реакция протеста и попытки привлечь к себе внимание взрослого.
Сенсорная депривация у детей раннего возраста с патологией нервной системы не может быть устранена только при помощи развешивания игрушек над каждой кроваткой или занятий с методистом по ЛФК. Поэтому большие задачи возлагаются на средний и младший медицинский персонал, который постоянно контактирует с детьми. Врач обязан тщательно контролировать степень и качество эмоционального общения с ребенком всего больничного персонала и проводить соответствующий инструктаж.
Следует учитывать, что угроза сенсорной депривации — лишь одна из сторон эмоционального дискомфорта ребенка. Значительное травмирующее воздействие могут оказывать сам факт госпитализации, разлука с близкими, проведение болезненных диагностических и лечебных процедур. Дети с поражениями нервной системы часто повышенно чувствительны, отличаются чрезмерной ранимостью. Если проводить различные процедуры без подготовки, не учитывая эмоционального настроя ребенка, то возможны возникновение и фиксация таких аномальных реакций, как упорная рвота, анорексия, нарушения сна, приступы психомоторного возбуждения. Эти реакции в дальнейшем вызываются условнорефлекторно, иногда даже при появлении медицинского работника. Поэтому максимальное щажение психики ребенка — одна из важнейших задач, касающаяся всего медицинского персонала.
Большое значение в клинике раннего детского возраста приобретают взаимоотношения врача и всего больничного персонала с родителями больного. Здесь очень важным моментом является присутствие матери в отделении. С одной стороны, присутствие матери создает наиболее благоприятные условия для ухода за ребенком, но с другой,— предоставляет возможности для постоянных вопросов и критических замечаний. Более того, мать, наблюдая за другими детьми с аналогичными, по ее мнению, заболеваниями, может прийти к ошибочным выводам о неизлечимости ее ребенка, о грозящей ему инвалидности. От врача требуется большой такт и умение, чтобы доступно объяснить матери, в чем сущность заболевания ребенка и какой предполагается прогноз. В особо тяжелых случаях, быть может, и нет смысла внушать необоснованные надежды или, по крайней мере, ориентировать на быстрое выздоровление. В подобных случаях уместна рекомендация перевода в специализированный дом ребенка.
Если ребенку предстоит длительное восстановительное лечение, важно внушать родителям необходимость его проведения и веру в успешный исход. При этом следует обратить внимание, чтобы у матери и отца ребенка не возникало расхождений во взглядах на прогноз заболевания. В противном случае возможны семейные разлады, в конечном счете отрицательно сказывающие-508
ся на состоянии ребенка. Этот же момент имеет значение при анализе родословных, при определении типа наследования болезни. Неверные представления родителей о степени их «вины» в возникновении наследственного заболевания у ребенка способны привести к тяжелым семейным конфликтам.
Во взаимоотношениях больничного персонала и родителей немаловажное значение приобретает роль медицинской сестры. Дело касается возможного неблагоприятного влияния медсестры на родителей больного. В настоящее время наряду с ятрогенными влияниями, ятрогениями, исходящими от врача, различают соро-ригенные влияния, сороригении, исходящие от медицинской сестры (soror — сестра). Важно учитывать, что неосторожный разговор медсестры с родителями больного способен посеять сомнения, вызвать необоснованную тревогу, неверие в эффективность лечения. Поэтому и в этом психологическом звене врач должен быть очень внимательным.
Забота о внутрисемейных отношениях — серьезная задача врача и после выписки ребенка из больницы. У родителей необходимо по-возможности ослабить чувство неполноценности, обде-ленности, стимулировать их к активной общественной жизни. Родителям следует дать ряд советов о недопустимости чрезмерной опеки больного, всяческих поблажек его прихотям, капризам. В семье к больному ребенку следует относиться так же, как к здоровому. Это дает ему возможность формироваться как личности.
Учет деонтологических аспектов работы клиники раннего детского возраста — необходимое условие эффективного проведения всех лечебно-восстановительных мероприятий.
Глава XX. УПРАВЛЕНИЕ И ОРГАНИЗАЦИЯ ДЕТСКОЙ НЕВРОЛОГИЧЕСКОЙ СЛУЖБЫ. ПРОФИЛАКТИКА ЗАБОЛЕВАНИЙ НЕРВНОЙ СИСТЕМЫ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Охрана детей всегда была и остается в центре внимания Коммунистической партии Советского Союза и Советского правительства. Решениями партии и правительства предусматриваются мероприятия по охране здоровья матери и ребенка, совершенствованию специализированной помощи, методов диагностики, лечения и профилактики заболеваний у детей.
Развитие специализированной помощи детям в нашей стране определило перспективы дальнейшего развития детской неврологической службы. В последние годы стал более широким круг вопросов, подлежащих компетенции детских невропатологов. Успехи возрастной физиологии, эмбриологии, биохимии, генетики и молекулярной биологии позволяют диагностировать уже в первые дни жизни, а иногда и в антенатальный период многие наследственные и врожденные заболевания нервной системы. Достижения в области фармакологии, реанимации, интенсивной терапии и хирургии способствуют выживанию детей, ранее считавшихся нежизнеспособными. Значительно расширился арсенал средств для лечения заболеваний нервной системы.
Кафедрами медицинских институтов, научно-исследовательскими институтами совместно с органами здравоохранения разработана система поэтапной помощи детям раннего возраста с поражением нервной системы, включающая родильные дома, специализированные неврологические стационары, неврологические отделения многопрофильных больниц, районные поликлиники, городские консультативные поликлиники, специализированные ясли, сады, дома ребенка, санатории (рис. 139). Деятельность этих учреждений в масштабе крупных административно-территориальных единиц координируется соответствующими органами управления здравоохранения — министерствами, краевыми, областными и городскими управлениями и неврологическими комиссиями во главе с главными специалистами. Совместно с кафедрами медицинских вузов и институтами усовершенствования врачей они планируют и осуществляют подготовку детских невропатологов и врачей смежных специальностей, ориентированных в вопросах неврологии раннего детского возраста. Эти учреждения внедряют в практику новейшие достижения науки, направленные на улучшение качества диагностики и лечения детей с поражением нервной системы. Большую помощь в этом могут оказать медицинские вузы, которые при подготовке педиатров общего профиля должны уделить соответствующее внимание вопросам неврологии раннего детского возраста. Об этом свидетельствует
510
Рис. 139. Схема специализированной помощи детям раннего возраста
опыт преподавания этого раздела на кафедре нервных болезней педиатрического факультета 2-го МОЛГМИ им. Н. И. Пирогова.
Впервые система помощи детям раннего возраста с поражением нервной системы была создана и апробирована в Москве. Многолетний опыт ее работы в настоящее время обобщен и распространен во многих городах и областях нашей страны.
Важным этапом оказания помощи детям с поражением нервной системы является период новорожденности. Персонал родильных домов, обслуживающий новорожденных, проходит специальную подготовку по диагностике и лечению заболеваний нервной системы и уходу за детьми с неврологическими нарушениями. В настоящее время в родильных домах проводятся клиническое, биохимическое, иммунологическое исследования новорожденных. Схема краткого неврологического обследования новорожденных, применяемая в родильных домах Москвы, позволяет врачу на основании имеющихся патологических признаков отнести ребенка в группу высокого риска по развитию того или иного заболевания нервной системы. Качественное биохимическое исследование мочи и крови дает возможность уже в родильном доме выявить детей с наследственными нарушениями обмена веществ.
В родильных домах функционируют специальные палаты для детей, родившихся в асфиксии, перенесших внутричерепную родовую травму, иммуноконфликтных, недоношенных. Палаты оборудованы центральной подачей кислорода, в них круглосуточно соблюдается постоянный температурный режим, для недоношенных имеются кювезы. Медицинские сестры обучаются выхаживанию тяжелобольных новорожденных, кормлению через зонд,
511
аппаратному отсасыванию слизи, внутривенному капельному вливанию жидкости, пользованию дыхательной аппаратурой. Тяжелобольных детей консультируют различные специалисты — детский невропатолог, нейрохирург, ортопед, отоларинголог, окулист, хорошо знающие патологию новорожденных. Лаборатории родильных домов оборудованы современной аппаратурой для определения основных биохимических показателей крови, кислотнощелочного равновесия и пр. В ряде крупных родильных домов имеются цитогенетические лаборатории.
Травмированным новорожденным в родильных домах проводится интенсивная терапия, направленная на нормализацию метаболических показателей, компенсацию сердечно-сосудистой и дыхательной недостаточности, коррекцию неврологических нарушений. В настоящее время созданы крупные объединения родильный дом — стационар для выхаживания недоношенных, в которых имеются отделения для детей с поражением нервной системы. Сосредоточение в едином комплексе акушерского, педиатрического и неврологического стационаров позволяет обеспечить полный объем специализированной помощи недоношенным детям.
Из родильных домов новорожденных с патологией нервной системы переводят в специализированные стационары или отделения многопрофильных больниц. В настоящее время это главным образом отделения консервативной терапии, но уже сделаны первые шаги в направлении организации и нейрохирургической помощи новорожденным с внутричерепными кровоизлияниями. Созданы также специализированные центры интенсивной терапии новорожденных. Открытие специализированных неврологических стационаров для новорожденных и грудных детей улучшило диагностику и создало возможность для проведения ранних лечебно-коррекционных мероприятий.
Главным управлением здравоохранения Мосгорисполкома совместно с кафедрой нервных болезней педиатрического факультета 2-го МОЛГМИ им. Н. И. Пирогова организованы стационары для новорожденных и грудных детей с пороками развития нервной системы, хромосомными синдромами, наследственными заболеваниями, неврологическими нарушениями, возникшими в результате асфиксии и родовой травмы, детскими церебральными параличами.
Наряду с этим для больных с церебральными параличами в Москве создан всесоюзный центр реабилитации. Лечение детей в этих учреждениях осуществляется специалистами различного профиля — педиатрами, невропатологами, окулистами, ортопедами, врачами ЛФК и функциональной диагностики, логопедами.
Из родильных домов детей переводят в неврологический стационар на 8—12-й день жизни. При наличии у новорожденного сопутствующего заболевания его помещают сначала в боксовое
512
отделение. В стационарах проводится комплексное обследование с целью ранней дифференциальной диагностики различных форм патологии нервной системы. Результаты неврологического обследования фиксируют в специальной карте, с помощью которой можно проследить за динамикой неврологических синдромов, оценить эффективность лечения. Биохимическое исследование позволяет выявить наследственную патологию обмена веществ и уточнить ее характер. С этой целью применяют качественные эксп-ресс-тесты и современные методы аналитической биохимии. Диагностика хромосомных синдромов основывается на определении полового хроматина, анализе дерматоглифических показателей, исследовании кариотипа больных и их родителей с использованием всех современных методик идентификации хромосом. В стационарах проводится весь комплекс электрофизиологических и рентгеноконтрастных исследований, которые играют важную роль в дифференциальной диагностике врожденных, наследственных и приобретенных заболеваний нервной системы. Методически наиболее сложные исследования выполняют в комплексе со специализированными учреждениями — городской биохимической лабораторией, Институтом медицинской и биологической химии АМН СССР, Институтом полиомиелита и вирусных энцефалитов АМН СССР, Институтом общей генетики АН СССР, Институтом нейрохирургии им. Н. Н. Бурденко АМН СССР и др.
В специализированных стационарах проводится комплексное восстановительное лечение, включающее ортопедический режим, лечебную гимнастику, массаж, физиотерапию, медикаментозные препараты, диетолечение. Все это способствует своевременному развитию возрастных двигательных, речевых, психических навыков ребенка и предупреждению задержки психомоторного развития и тяжелой инвалидности. Длительность пребывания детей в стационаре составляет 2—4 мес, а иногда и более продолжительное время. В отделении с ребенком находится мать. Здесь она обучается специальному уходу и основным приемам лечебной гимнастики, которые следует продолжать дома.
При необходимости специализированной коррекции имеющихся дефектов дети могут быть переведены в хирургические, нейрохирургические, ортопедические и другие стационары.
Эффективность лечения неврологических заболеваний у детей раннего возраста во многом зависит от его непрерывности и преемственности на различных этапах. После выписки ребенка пз стационара лечение продолжается амбулаторно под наблюдением районного невропатолога. В соответствии с приказом Министерства здравоохранения СССР № 240 от 30/Ш 1973 г. «О состоянии и мерах по дальнейшему улучшению амбулаторно-поликлинической помощи детскому населению» основными задачами врача-невропатолога детской поликлиники являются профилактика, своевременная диагностика и лечение заболеваний нервной системы на уровне достижений медицинской науки.
513
Районный невропатолог продолжает проводить лечение, нача-тое в стационаре, а также наблюдает за детьми, выписанными из родильного дома домой, выявляет детей с неврологической патологией среди детского населения района. Он осуществляет взаимосвязь со специализированными стационарами и городской неврологической консультативной поликлиникой, проводит амбулаторное лечение и определяет необходимость повторного стацио-нирования, оказывает необходимую помощь заболевшим на дому. Районный невропатолог берет на диспансерный учет детей с заболеваниями нервной системы, обеспечивает их систематическое этапное лечение до снятия с учета по медицинским показаниям. Важной функцией районного невропатолога является организация амбулаторного лечения детей с относительно легким поражением нервной системы, которое более эффективно в домашних условиях. Совместно с детским психиатром поликлиники или диспансера невропатолог осуществляет лечение детей раннего возраста с задержкой психического развития различного генеза.
Важным звеном в организации специализированной помощи детям раннего возраста с поражением нервной системы является городская консультативная неврологическая поликлиника. Она создана в 1970 г. Главным управлением здравоохранения Мосгорисполкома по инициативе и при участии кафедры нервных болезней педиатрического факультета 2-го МОЛГМИ им. Н. И. Пирогова. В соответствии с приказом № 165 по Главному управлению здравоохранения Мосгорисполкома от 9/IV 1975 г. «О дальнейшем улучшении неврологической помощи детям г. Москвы» городская консультативная неврологическая поликлиника является организационно-методическим центром, осуществляющим связь с районными невропатологами, координирующим работу всех звеньев детской неврологической службы. Ее основными задачами являются: проведение всех видов высококвалифицированной консультативной помощи детям с неврологическими заболеваниями; обеспечение плановой госпитализации в неврологические стационары г. Москвы; организационно-методическая работа, которая предусматривает осуществление связи с районными детскими невропатологами; организация лекций, семинаров и конференций по наиболее актуальным вопросам детской невропатологии для педиатров и невропатологов г. Москвы.
С целью повышения уровня диагностики в поликлинике проведена специализация кабинетов. В кабинетах раннего возраста, нервно-мышечной патологии, наследственно-дегенеративных заболеваний, судорожных состояний, детского церебрального паралича больных консультируют ведущие специалисты вузов и НИИ в области детской невропатологии совместно с врачом, ответственным за работу кабинета.
Врач кабинета раннего возраста осуществляет учет детей с неврологическими заболеваниями, контроль за их лечением, ведает школой матерей, организованной при поликлинике. В про-514
цессе бесед и лекций, с помощью наглядных пособий матерей обучают методам ухода и лечения, которые они могут проводить в домашних условиях. За 9 лет работы поликлиники (1970— 1979 гг.) в кабинете раннего возраста осмотрено 16 000 детей первых 3 лет жизни, что составляет 60,3% от всех больных, прошедших через поликлинику за этот период, из них 40% — в возрасте до 1 года.
В кабинете церебрального паралича осуществляется учет и наблюдение за детьми с церебральными параличами, а также комплектование санаториев местного и союзного значения.
В поликлинике функционирует кабинет Всесоюзного центра по изучению прогрессирующих нервно-мышечных заболеваний, организованного в соответствии с приказом министра здравоохранения СССР № 13 от 25/1 1977 г. В его задачи входят ранняя диагностика и лечение нервпо-мышечной патологии, консультативная помощь лечебным учреждениям, медико-генетическое консультирование родителей и родственников больных.
Городская консультативная неврологическая поликлиника обеспечивает осмотр детей, подлежащих усыновлению в родильных домах п домах ребенка в соответствии с приказом Главного управления здравоохранения Мосгорисполкома № 586 от 24/Х 1978 г. «О порядке усыновления детей из родильных домов, домов ребенка, больниц». Вопрос о возможности усыновления ребенка решается комиссией в составе педиатра, невропатолога, психиатра. До вынесения решения комиссией ребенок должен быть осмотрен окулистом, ортопедом, дерматологом, логопедом, а по показаниям и другими специалистами. Комиссии по усыновлению должна быть представлена карта с данными о нервно-психическом развитии ребенка и лабораторными показателями; в карте также должны быть подробно отражены сведения о родителях ребенка — наследственно-семейных заболеваниях, вредных привычках, акушерском анамнезе матери.
В результате организационно-методической, консультативной и лечебной работы, проводимой детской городской консультативной неврологической поликлиникой, значительно повысился уровень детской неврологической помощи в Москве.
Впебольнпчная сеть неврологических учреждений включает также специализированные детские ясли и санатории, в которых продолжается этапное лечение, начатое в родильных домах, стационарах и поликлиниках. Если родители по каким-либо причинам не могут взять больного ребенка домой, государство берет его под временную пли постоянную опеку. В специализированных домах ребенка для детей с пороками развития, наследственными заболеваниями нервной системы, церебральными параличами, задержкой психомоторного развития также проводится восстановительное лечение. В ряде случаев оно позволяет добиться столь значительных результатов, что становится возможным возвращение ребенка в семью.
515
Опыт медицинских учреждений Москвы был использован при организации этапной помощи детям раннего возраста с неврологическими заболеваниями в Минске, Запорожье, Новокузнецке, Челябинске, Казани и других городах.
Создание сети специализированных учреждений для детей раннего возраста с поражением нервной системы способствует ранней диагностике неврологических заболеваний, своевременному лечению и профилактике тяжелых осложнений. Однако вышеуказанные мероприятия не всегда позволяют ликвидировать тяжелые последствия. Это касается главным образом детей с антенатальным поражением нервной системы, осложненным асфиксией и родовой травмой, и больных с наследственной патологией. Поэтому профилактика поражений мозга остается одной из главных задач в борьбе за здоровое поколение.
Профилактика пренатальных и перинатальных повреждений мозга является комплексной проблемой, включающей широкий круг вопросов, касающихся как непосредственного влияния вредных факторов на плод, так и опосредованного организмом матери. Оздоровление окружающей среды, повышение материального благосостояния и санитарной культуры общества представляют важную часть мероприятий, проводимых государством по охране здоровья матери и ребенка.
Охрана здоровья будущей матери начинается еще в раннем детском возрасте. Она включает полноценное физическое и психическое развитие, профилактику и лечение детских инфекционных и соматических заболеваний, обеспечение хорошего питания, предупреждение травматизма и др.
Подростковый возраст является особенно важным для формирования организма. Интенсивные биологические и психические изменения, характерные для этого периода, делают подростков чрезвычайно чувствительными к воздействию физических и психосоциальных факторов окружающей среды. Поэтому в этот период следует осуществлять контроль не только за их здоровьем, но и за полноценным гармоничным развитием. Профилактика курения, употребления алкогольных напитков и наркотиков во многом способствует здоровой репродуктивной функции. Девочки-подростки с «высоким риском» патологии беременности, т. е. с иммунологическими, обменными, гормональными, антропометрическими и другими отклонениями нуждаются в диспансерном наблюдении.
Следующим этапом мероприятий по профилактике неврологических нарушений является контроль за течением беременности, особенно у женщин, в анамнезе которых отмечались выкидыши, мертворождения, бесплодие, а также имевших больных детей. Во время беременности необходимо исключить влияние различных химических и физических факторов на развивающийся плод. Своевременно проведенное иммунологическое обследование беременных женщин во многих случаях предотвращает появление
516
неврологических нарушений, обусловленных резус- и групповой несовместимостью крови матери и плода. Важна профилактика и ранняя диагностика внутриутробных инфекций, являющихся частой причиной поражения нервной системы.
При патологическом течении беременности и высоком риске поражения нервной системы плода необходима постоянная коррекция имеющихся нарушений. Для беременных с сердечно-сосудистыми заболеваниями, резус-отрицательных женщин и женщин с невынашиванием беременности, угрозой выкидыша, туберкулезом, сахарным диабетом, вирусным гепатитом, почечной патологией открыты специализированные родильные дома, оснащенные современной диагностической и реанимационной аппаратурой. Они являются важным этапом профилактики анте- и инт-ранатальных повреждений мозга.
Постоянное совершенствование родовспомогательной службы направлено на предупреждение внутриутробной гипоксии и асфиксии в родах — наиболее частых факторов патологического состояния плода. В клиническую практику внедряются методы гипербарической оксигенации беременных женщин и новорожденных, родившихся в асфиксии. Оживление новорожденных в специальных барокамерах, краниоцеребральная гипотермия способствуют профилактике тяжелых неврологических нарушений и быстрой ликвидации тканевой гипоксии.
Хорошо поставленное обслуживание беременной женщины и новорожденного в значительной мере уменьшает тяжесть человеческих и экономических потерь, обусловленных физической и умственной неполноценностью.
Важной частью профилактики заболеваний нервной системы у детей раннего возраста является предупреждение рождения детей с наследственными заболеваниями, поскольку на современном этапе лечение большинства из них представляет серьезные трудности. Оценка риска рождения больного ребенка составляет одну из основных задач медико-генетического консультирования. Обычно этот вопрос приходится решать в тех случаях, когда при наличии в семье больного с наследственной патологией родители хотят иметь ребенка. Расчет вероятности рождения больного ребенка производится на основе типа наследования заболевания, о котором идет речь, и пенетрантности мутантного гена или на основе эмпирических данных, если тип наследования заболевания не установлен. Точность определения риска заболевания, определяемого рецессивным геном, может быть значительно повышена, если есть возможность выявить гетерозиготных носителей последнего. В настоящее время уже разработаны методы диагностики гетерозиготности для многих наследственных заболеваний обмена веществ, протекающих с поражением нервной системы.
В последние годы все большее развитие приобретает медикогенетическое консультирование лиц, вступающих в брак, и семей,
517
отягощенных теми или иными наследственными заболеваниями. Медико-генетические консультации, созданные в Москве, Ленинграде, Киеве, Уфе, Воронеже и в ряде других крупных республиканских, краевых и областных центров, являются важным звеном в системе мероприятий, направленных на профилактику наследственных поражений нервной системы.
В плане профилактики наследственных и внутриутробных поражений нервной системы весьма перспективными являются методы внутриутробной диагностики. Исследование амниотической жидкости и амниотических клеток, полученных с помощью амниоцентеза, позволяет уже в ранние сроки беременности определить нарушение числа или структуры хромосом плода, снижение активности ферментов, изменение концентрации тех или иных метаболитов, нарушение структуры клеток и т. п. и тем самым подтвердить или отвергнуть предполагаемое поражение плода. Показанием к амниоцентезу является наличие в семье ребенка с транслокацпонными вариантами хромосомных синдромов, с заболеваниями,* определяемыми рецессивным геном, локализованным в Х-хромосоме или с обменным нарушением, для которого разработаны методы антенатальной диагностики. Амниоцентез необходимо делать при наличии у женщины илп ее мужа сбалансированной транслокации, в случаях, когда точно известно, что оба родителя являются гетерозиготными носителями одного и того же мутантного гена и его гомозиготное состояние у плода можно определить на ранних сроках беременности. Антенатальное определение кариотипа плода весьма желательно при беременности у женщин старше 40 лет.
Выявление наследственных нарушений на ранней стадии онтогенеза является показанием к прерыванию беременности. Беременность целесообразно прерывать и при установлении мужского пола у плода в тех случаях, когда патология определяется рецессивным геном, локализованным в Х-хромосоме.
В настоящее время с помощью амниоцентеза можно диагностировать внутриутробно свыше 60 наследственных нарушений обмена веществ, большинство которых сопровождается поражением нервной системы. Открытые черепно-мозговые травмы и спинно-мозговые грыжи у плода могут быть выявлены па основании определения альфа-фетопротеина в амниотической жидкости.
Внутриутробная диагностика пороков развития нервной системы может быть осуществлена с помощью рентгенологического (фетоскопия) и ультразвукового (сонография) исследований.
СПИСОК ЛИТЕРАТУРЫ
Аксентьев С. В. Клинические варианты нарушения поведения у детей и подростков с перинатальными повреждениями центральной нервной системы.— В кн.: Материалы 1-й Всесоюзн. конф, по неврологии и психиатрии детского возраста. М., 1974, с. 3—7.
Алмазова И. Г. К семиологии поражений нервной системы при острых отравлениях некоторыми лекарственными веществами у детей.— В кн.: Проблемы детской анестезиологии, реанимации и интенсивной терапии. М.: Медицина, 1971, с. 145—150.
Алмазова И. Г., Горбачев О. С. Черепно-мозговая травма у детей 1-го года жизни.— В кн.: Материалы 4-й Всерос. конф, по неврологии и психиатрии детского возраста. М.: Медицина, 1978, с. 6—8.
Андреева Е. И. Клинико-анатомический анализ анте-, интра- и постна-тальной гибели плодов и новорожденных.— Вопр. охр. мат., 1974, № 5, с. 50—56.
Анохин П. К. Очерки по физиологии функциональных систем.— М.: Медицина, 1975, с. 446.
Бадалян Л. О. Лекции по клинической генетике.— М.: Медицина, 1974.— 208 с.
Бадалян Л. О. Детская неврология.— М.: Медицина, 1975.— 415 с.
Бадалян Л. О. Неврологические синдромы при болезнях сердца. — М.: Медицина, 1975.— 336 с.
Бадалян Л. О. Проблемы перинатальной неврологии.— Журн. невропа-тол. и психиатр., 1976, № 10, с. 1441—1446.
Бадалян Л. О., Айнгорн Е. Д., Тимонина О. В. Дифференциально-диагностическое значение патоморфологических изменений при прогрессирующих нервно-мышечных заболеваниях.— М.: Медицина, 1979.- 112 с.
Бадалян Л. О., Таболин В. А., Вельтищев Ю. Е. Наследственные болезни у детей.— М.: Медицина, 1971.— 366 с.
Б а и р о в Г. А. Неотложная хирургия детей.— Л.: Медицина, 1973.— 466 с. Барашнев Ю. И., Вельтищев Ю. Е. Наследственные болезни обмена веществ у детей.— Л.: Медицина, 1978.— 319 с.
Берестов А. И., Ковригин А. Е. К биохимической и цитохимической характеристике болезни Гоше у детей.— Педиатрия, 1972, № 8, с. 33—38.
Берестов А. И., Гусев Е. И. Лейкодистрофии у детей.— Журн. невро-патол. и психиатр., 1974, № 10, с. 1490—1496.
Б и с я р и н а В. П. Клинические лекции по педиатрии.— М.: Медицина, 1975.- 383 с.
Божинов С. Миопатия.— София, 1977.— 324 с.
Б о н д а р е н ко Е. С. Клиника опухолей головного мозга у детей первых трех лет жизни.— Вопр. охр. мат., 1962, № 2, с. 17—23.
Бортфельд С. А. Двигательные нарушения и лечебная физическая культура при детском церебральном параличе.—Л.: Медицина, 1971.— 246 с-
Бродский Ю. С. Клинико-диагностические особенности субдуральных кровоизлияний у новорожденных.— В кн.: Нейрохирургия, вып. 10. Киев : Здоров’я, 1977, с. 59—63.
Волков М. В., Дедова В. Д. Детская ортопедия.— М.: Медицина, 1972 — 237 с.
Волкова О. В. Нейродистрофический процесс.— М.: Медицина, 1978.— 254 с.
519
Волохов А. А. Очерки по физиологии нервной системы.— Л.: Медицина, 1968 — 308 с.
Выготский Л. С. Избранные психологические исследования.— М.: Изд. АПН РСФСР, 1956.- 234 с.
Г и л у л а И. О. Заболевания нервной системы у детей раннего возраста. Киев, 1965.— 218 с.
Гончарова М. Н., Гринина А. В., Мирзоева И. И. Реабилитация детей с заболеваниями и повреждениями опорно-двигательного аппарата.— Л.: Медицина, 1974.— 205 с.
Гусев Е. И. Клиническое и биохимическое изучение некоторых болезней обмена веществ с поражением нервной системы.— Журн. невропатол. и психиатр, 1971, № 10, с. 1475—1481.
Дадиомова М. А., Пратусевич Р. М. Острые серозные менингиты и энцефалиты у детей.— Л.: Медицина, 1974.— 192 с.
Д а м ь е Н. Г. Основы травматологии детского возраста.— М.: Медгиз, I960.— 260 с.
Демидова С. А., Семенова Е. И., Жданов В. М., Гаврилов В. И. Цитомегаловирусная инфекция человека.— М.: Медицина, 1976.— 167 с.
Д о л е ц к и й С. Я., Г а в р ю ш о в В. В., Матвеев В. П., Акопян В. Г., Рошаль Л. М. Диагностика и лечение неотложных состояний у детей.— М.: Медицина, 1977.— 680 с.
Жданов В. М., Р и т о в а В. В. К патогенезу гриппа.— Клин, мед., 1959, т. 37, № 12, с. 45—48.
Журба Л. Т. Лечение церебральных параличей в раннем возрасте.— В кн.: 2-й Международный симпозиум по детскому церебральному параличу. Прага, 1967, с. 82.
Журба Л. Т. Неврологическое обследование новорожденных.— Педиатрия, 1968, № 10, с. 17-22.
Журба Л. Т. Клиника и лечение повреждений плечевого сплетения у детей раннего возраста.— В кн.: Проблемы нейровирусных заболеваний и реабилитации паралитических последствий.—М.: Медицина, 1971, с. 108-110.
Журба Л. Т., Мастюкова Е. М. Ранние неврологические проявления минимальной мозговой дисфункции у детей.— Журн. невропатол. и психиатр., 1976, № 10, с. 1450—1454.
Ивановская Т. Е., Цинзерлинг А. В. Патологическая анатомия (болезни детского возраста).— М.: Медицина, 1976.— 431 с.
Ильина Н. А. Пароксизмальная миоплегия и миоплегические синдромы.— М.: Медицина, 1973.— 188 с.
Исаков Ю. Ф., Михельсон В. А., Острейков И. Ф., Черно-бельский А. М. Пособие по детской реанимации и интенсивной терапии.— М.: Медицина, 1973.— 239 с.
Калинина Л. В. Неврологические синдромы при факоматозах у детей.— Журн. невропатол. и психиатр., 1976, № 10, с. 1487—1492.
Кирдан К. П., Иванов Л. Б., Гальперин-Кац В. А. Нарушение кровотока головного мозга у детей с черепно-мозговой травмой.— Педиатрия, 1974, № 4, с. 49—52.
Кирющенков А. П. Влияние вредных факторов на плод.— М.: Медицина, 1978.— 212 с.
Киселев В. П., Козырев В. А. Черепно-мозговая травма у детей.— М.: Медицина, 1971.— 244 с.
Кисляк Н. С., Махонова Л. А., Ивановская Т. Е. Клиническое течение и лечение острого лейкоза у детей.— М.: Медицина, 1972.— 208 с.
Ковалев В. В. Принципиальные вопросы клиники и систематики резидуальных нервно-психических расстройств в детском возрасте.— В кн.: 1-я Всесоюзн. конф, по неврологии и психиатрии детского возраста. М.: Медицина, 1974, с. 145—149.
Ковалевский Е. И. Детская офтальмология.— М.: Медицина, 1970.— 312 с.
520
Кольцова М. М. Двигательная активность и развитие функций мозга ребенка.— М.: Педагогика, 1973 — 142 с.
Красовский Е. Б. Уродства центральной нервной системы. М.: Медгиз, 1964.— 206 с.
Лебедев Б. В., Блюмина М. Г. Фенилкетонурия у детей.— М.: Медицина, 1972.— 158 с.
Левенбук И. С., Чеботарева С. В., Черткова Ф. А. Клинико-анатомический анализ некоторых послепрививочных осложнений у детей.— Журн. микробиол., эпидемиол., иммунол., 1971, № 9, с. 55—56.
Лещинская Е. В. Острый полиомиелит.— В кн.: Клиническая невропатология детского возраста. / Под ред. М. Б. Цукер. М.: Медицина, 1978, с. 47—61.
Лопухин Ю. М., Петров Р. В., Арион В. Я. Актуальные проблемы пересадки органов.— М.: Медицина, 1978.— 287 с.
Лурия А. Р. Высшие корковые функции человека и их нарушения при локальных поражениях мозга.— М.: Медгиз, 1962.— 218 с.
М а с т ю к о в а Е. М. Диагностика нарушений доречевого развития у детей с церебральными параличами и пути логопедических и педагогических мероприятий в этом периоде. Методические рекомендации.— М.: 1973, М3 СССР.- 17 с.
Наследственные болезни нервно-мышечной системы. / Под ред. Л. О. Бадаляна.— М.: 1974.— 219 с.
Немсадзе В. П., Кузнечихин Е. П., Горбачева О. С. Черепномозговая травма у детей раннего возраста.— В кн.: Материалы 3-й Все-союзн. конф, детских хирургов. Алма-Ата, 1974, с. 168—172.
Новикова Е. Ч., Полякова Г. П. Инфекционная патология плода и новорожденного,— М.: Медицина, 1979.— 221 с.
Оленев С. Н., Савельева-Васильева Е. А., Завьялова Н. С. Иннервация мышц при спинальной амиотрофии.— Журн. невропатол. и психиатр., 1972, № 10, с. 1445—1449.
О с н а А. И. Организация нейрохирургической помощи новорожденным с внутричерепными кровоизлияниями.— В кн.: Матер. 4-й Всесоюзн. конф, по неврологии и психиатрии детского возраста. М.: Медицина, 1978, с. 30-32.
Основы нейрохирургии детского возраста. / Под ред. А. А. Арендта и С. И. Нерсесянц.— М.: Медицина, 1968.— 483 с.
П е р с и а н и н о в Л. С. Асфикция плода и новорожденного.— М.: Мир, 1970.—384 с.
Покровская Н. Я., Г у р в и ч 3. Б., О з е р е ц к о в с к и й Н. А. Неврологические осложнения при оспопрививании.— Педиатрия, 1978, № 12, с. 45-49.
Покровский В. И., Венгеров Ю. Я. Лечение тяжелых форм менин-гокковой инфекции.— Тер. арх., 1973, № 7, с. 70—77.
Проблема развития мозга и влияния на него вредных факторов. / Под. ред. Б. Н. Клосовского.— М.: Медгиз, I960.— 239 с.
Пурин В. Р., Жукова Т. П. Врожденная гидроцефалия.— М.: Медицина, 1976.— 213 с.
Ратнер А. Ю. Родовые повреждения спинного мозга у детей.— Казань: Изд-во Казанского Университета, 1978.— 215 с.
Ремизова Е. С. Дифференцированное лечение больных эпилепсией.— М.: Медгиз, 1965 — НО с.
Р о з е н ф ел ь д Е. Л., Попова И. А. Гликогеновая болезнь.— М.: Медицина, 1979.— 286 с.
Ростоцкая В. И., Спиридонова И. В. Особенности диагностики и хирургического лечения опухолей головного мозга у детей первых трех лет жизни.— В кн.: Матер. 2-го Всесоюзн. съезда нейрохирургов. М.: Медицина, 1976, с. 653—657.
Ростоцкая В. И., Комаров В. И. Результаты операции окклюзионной гидроцефалии различной этиологии у детей.— Вопр. нейрохирургии, 1974, № 1, с. 23-30.
521
Савельева Г. М. Реанимация новорожденных.— М.: Медицина, 1973.— 238 с.
Сараджишвили П. М., Геладзе Т. Ш. Эпилепсия.— М.: Медицина, 1977.— 303 с.
Семенова К. А. Лечение двигательных расстройств при детских церебральных параличах.— М.: Медицина, 1976.— 180 с.
Симерницкий Б. П. О технике вентрикуло-перинеостомии при лечении открытой и отдельных форм закрытой водянки мозга у детей.— Вопр. нейрохир., 1974, № 3, с. 11—13.
Скворцов И. А., Журба Л. Т., Каменных Л. Н., С е п п Е. К. Электромиографическое изучение синдрома мышечной гипотонии у детей раннего возраста.—В кн.: Матер. IV Всерос. конф, по неврол. и психиатр, детского возраста, 1978, с. 81—84.
Спиричев В. Б., Барашнев Ю. И. Врожденные нарушения обмена витаминов.— М.: Медицина, 1977.— 216 с.
Студеникин М. Я. Пути развития педиатрии.— М.: Медицина, 1974.— 224 с. .
Судаков К. В. Доминирующая мотивация как ведущий компонент функциональной системы в мобилизации приобретенных навыков.— В кн.: Теория функциональных систем физиологии и психологии. М.: Наука, 1976, с. 11—47.
Сухарева Г. Е. Клинические лекции по психиатрии детского возраста.— М.: Медгиз, 1959.— 358 с.
Таболин В. А. Билирубиновый обмен и желтуха новорожденных.— М.: Медицина, 1967.— 227 с.
Тимощенко Л. В., Бондарь М. В., Дашкевич Е. В. Гемолитическая болезнь плода и новорожденных.— М.: Медицина, 1968.— 236 с.
Уманский К. Г. Периферическое поражение лицевого нерва.— В кн.: Клиническая невропатология детского возраста. / Под ред. М. Б. Цу-кер.— М.: Медицина, 1978, с. 67—77.
Ушаков Г. К. Детская психиатрия.— М.: Медицина, 1973.— 391 с.
Ушакова Т. Н. Функциональные структуры второй сигнальной системы.— М.: Наука, 1979.— 247 с.
Фрейдков В. И. О патогенезе серозного менингита и менингоэнцефалита, вызванных вирусом эпидемического паротита у детей.— Журн. не-вропатол. и психиатр., 1972, № 10, с. 1466—1470.
Футер Д. С. Заболевания нервной системы у детей.—М.: Медицина, 1965.- 554 с.
Ц у к е р М. Б. Менингиты и энцефалиты у детей.— М.: Медицина, 1975.— 341 с.
Ц у к е р М. Б. Клиническая невропатология детского возраста. М.: Медицина, 1978.— 461 с.
Ш а р е ц Ю. Д. Дерматоглифика в медицине.— Вести. АМН СССР, 1973, № 7, с. 61-69.
Шухова Е. В. Реабилитация детей с заболеваниями нервной системы.— М.: Медицина, 1979.— 255 с.
Эдельштейн Э. А. Поражения нервной системы при гриппе.— В кн.: Клиническая невропатология детского возраста. М.: Медицина, 1972, с. 112-116.
Эйдинова М. Б., Правдина-Винарская Е. Н. Детские церебральные параличи и пути их преодоления.— М.: Изд-во АПН РСФСР, 1959.— 215 с.
10 с е в и ч Ю. С. Очерки по клинической электромиографии.— М.: Медицина, 1972.— 95 с.
Якунин IO. А., Ямпольская Э. И., Кипнис С. Л., Сысоева И. М. Болезни нервной системы у новорожденных и детей раннего возраста.— М.: Медицина, 1979.— 275 с.
Aicardi J., Chevrie J. Febrill convulsion: neurological sequelae and mental retardation.—In: Brazier M. (Ed.).
522
Brain Dysfunction in infantill febrile convulsion.— New York, 1976, p. 247— 257.
Barta L., V a r i A., S u s a E. Dermatoglyphic patterns of diabetic children.— Acta Paediat. Acad. Sci. Hung., 1970, v. 11, N 1, p. 71—74.
Becker В. E. Myotonia congenita and syndromes associated with myotonia.— Stuttgart, 1977.— Ill p.
Bennet G., Harrold A. Prognosis and Early Management of Berth Injures to the Brachial Plexus.— Brit. med. J., 1976, Bd. 1, v. 6024, p. 1520— 1527.
Bradley W. G. Disorders of peripheral nerves.— Oxford, 1974.— 202 p.
Bradley W. G. Recent advances in myology.— New York, 1975.—233 p.
Brazier M. А., С о с 1 a n i F. Brain Dysfunction in infantile febrile convulsion.— New York, 1976.— 350 p.
Brown J. K. Perinatal Asphyxia.— In Recent Advances in paediatrics.— Edinburg, 1976, p. 57—88.
Carter S., Gold A. Neurology of Infancy and childhood.— New York, 1974.— 326 p.
Chevrie J. J., A i c a r d i J. Convulsive disorders in the frist year of life: Etiological factors.— Epilepsia, 1977, Bd. 18, v. 4, p. 489—498.
Clayton В. E. Screening and Management of Infants with Amino acid Disorders.— In: Recent Advances in Paediatria, Edinburg, 1976, p. 154— 167.
Cock burn F., Dr il lien С. M. Neonatal medicine.—Edinburgh, Oxford — London, 1974, p. 873.
Decaban A. Neurology of early childhood.— Baltimore, 1970.— 488 p.
Dennis J. Neonatal Convulsion. Aetiology, Late Neonatal Status and Longterm Outcome.— Developmental medicine and child neurology, 1978, Bd. 20, v. 2, p. 143-159.
Disorders of voluntary muscle, (edited by Walton G. H.) — London, 1969.— 284 p.
D u b о w i t z V., Brooke M. H. Muscle biopsy a modern approach.— London, 1973.- 475 p.
(Emery А.) Эмери А. Антенатальная диагностика генетических болезней. Пер. с англ.— М.: Медицина, 1977.— 201 с.
Farmer Т. W. Pediatric neurology, 1974.— 674 р.
Forbes J. A. Rubella: historical aspects.—Am. J. Dis. Child., 1969, v. 118, p. 5—11.
Freeman J. M. Febrile seizures: An end to confusion.— Pediatrics, 1978, Bd. 61, v. 5, p. 806—808.
Golnitz G. Pranatai Hirnschaden. Neurophysiatrie des Kinds und Jugen-dalters.— Jena, 1975.— 210 p.
Haller H., M. Hanefeld. Lipidstoffwechselstorungen. Diagnostik, Klinik, The-rapie.— Jena, 1975.— 224 p.
H a r i Maria, А’ К о s H a г о 1 у. Konduktiv Pedagogia, Petorenszer. Kot. 1.—Budapest, 1971.— 250 p.
Haslam Rh. Neurocutaneous Syndromes.—In: Introduction to Clinical Pediatric.— Philadelphia, 1977.— 443 p.
Hausmanova-Petrusewicz I. Choroby miesni.— Warszawa, 1977.— 338 S.
Hill H. R. Prenatal Infectious Diseases.—In: Introduction to Clinical Pediatrics ed. by Smith.— Philadelphia, 1977, p. 122—129.
Hughes G. R. Connective tissue diseases.— Oxford, 1977.— 266 p.
Jabboure J. T. Pediatrie neurology.— Bern, 1976.— 220 p.
Jaubay N. Zur Klassifikation und Nomenklatur der Neurolipidosen.—Bonn, 1975.— 123 S.
J e a v о n s P. M., Bower B. D., Dimitrakoudi M. Long — term prognosis of 150 cases of “West Syndrome”.— Epilepsia, 1973, v. 14, p. 153—164.
Jones P. G., C a m p b e 11 P. Tumors of infancy and childhood.— Oxford, 1976.— 310 p.
Keen J., L e e D. Sequelae of Neonatal Convulsion.— Archives disease in childhood, 1973, Bd. 48, v. 7, p. 542-546.
523
(Cohen H., В r u m 1 i к J.) Коуэн X., Б p у м л и к Дж. Руководство по электромиографии и электродиагностике. Пер. с англ.— М.: Медицина, 1975.— 192 с.
Kurtzke J. Epidemiology of Cerebrovascular Diseases.— Berlin, 1969.— 110 p.
Lacy J. R., J. K. Penry. Infantile spasm.—New York, 1976.— 147 p.
Lesny I. Beitrage zur Entwicklung neurologischer Symptome und Syndrome in Kindesalter.— Leipzig, 1975.— 207 S.
McComas A. Neuromuscular function and disorders.— London-Boston, 1977.— 364 p.
McKusick V. Heritable disorders of connective tissue.— Saint Louis, 1972.— 878 p.
Malone M. J. The Cerebral Lipidoses.— “Pediat. Clin, of North Am.”, 1976, Bd. 23, v. 2, p. 303-326.
Marshall A., Duchen L. Sensory system Involvement in Infantile Spinal Muscular Atrophy.—J. Neurol. Sci., (Amst.), 1975, Bd. 26, v. 3, p. 349.
M e h ne r t H., Forster H. Stoffwechselkrankheiten. Biochemie und Klinik.— Stuttgart.— 570 S.
Menkes J. Textbook of child neurology.— Philadelphia, 1974, p. 583.
M о f f e t H. L. Pediatric infectious diseases. A problem oriented approach.— New York, 1975,— 504 p.
Muller D. Pneum-enzephalographische Anatomie des Kindergehirns.— Leipzig, 1976,— 260 c.
Nelson W. S. Texook of Pediatrics.— Philadelphia, London, Toronto, 1975,— 486 p.
Nelson К. В., E11 e n b e r g J. H. Progresis in children with febrile seizures.— Pediatrics, 1978, Bd. 16, v. 5, p. 720—727.
Natake J. Suzuki S. Biological and clinical Aspects of the fetus.— Tokyo, 1977.— 403 p.
N у h a u W. C. Genetic and malformation syndromes in clinical medicine.— Philadelphia, 1976,— 499 p.
(P a r a i c z E., J. S z e n a s у). Э. П a p а й ц, Й. С e н а ш и. Неврологические исследования в грудном и детском возрасте.— Будапешт, 1970,— 216 с.
Pette Н., Bauer Н. Demyeliniserende Encephalomyelitis.— Stuttgart, 1964,— 198 S.
Pollack M. A. Continuous phenobarbital treatment after a simple febrill convulsion.—Am. J. of disease of children, 1978, Bd 132, v. 1, p. 87—95.
Queenan J. T. Modern Management of the Rh problem. New York, 1977. 272 p.
(Rob an e s c u N.) РобэнескуН. Нейромоторное перевоспитание. Бухарест, 1972, 267 с.
Rose A. L., L о m Ь г о s о С. Т. Neonatal seuzure states. A study of clinical pathological and EEG factores in 137 full term babies witt long term follow up.— “Pediatrics”, 1970, Bd. 45, v. 3, p. 404—425.
.Rubin A. Handbook of congenital malformations.— London, 1976. 398 p.
S a r n a t H. B., Sh. W. Silbert. Maturational arrest of fetal muscle in neonatal myotonic dystrophy,— “Arch. Neurol.”, 1976, Bd. 33, v. 7, p. 466.
Siegel M., F u e r s t H. M., G u i n e 1 V. F. Rubella epidemicity and embryopathy.—“Am. J. Dis. Child.”, 1971, v. 121, p. 469-473.
Smith D. W. Introduction to Clinical Pediatrics.— Philadelphia, 1977. 452 p.
Solomon G. E., H i 1 a 1 S. K., Gold A. P. Natural history acute hemiplegia of childhood.— Brain, 1970, 93, 107.
S p a r k e s R. A., Wright S. W. Determinants of metabolic disease.— In: Metabolic, Endocrine and genetic disorders of children. New York, 1974, v. 1, p. 3-63.
Stanbury J. B. (Ed.). The metabolic basis of inherited disease.—New York, 1972.— 854 p.
Ту r e r J. H. Anticonvulsant therapy.—London, 1974.— 152 p.
W a r k a n у J. Congenital malformations.— New York, 1973.— 1309 p.
524
СОДЕРЖАНИЕ
Предисловие .....................*............
Глава I. Эволюционная неврология раннего детского возраста . . 5
Глава II. Исследование нервной системы у детей раннего возраста.
Синдромы поражения.............................................. 19
Анамнез . :..................................................... 19
Общий осмотр.................................................... 22
Исследование функций чувствительных анализаторов . . • . . 31
Исследование двигательно-рефлекторной сферы..................... 41
Исследование вегетативной нервной системы....................... 69
Исследование речи............................................... 72
Исследование психических функций................................ 82
Схема нормального психомоторного развития детей раннего возраста 98
Дополнительные методы исследования..............................108
Исследование спинномозговой жидкости........................108
Лабораторное исследование ликвора .......................... 112
Исследование глазного дна...................................114
Трансиллюминация черепа.....................................115
Краниография................................................118
Пневмоэнцефалография........................................122
Вентрикулография............................................124
Ангиография.................................................125
Радиоизотопная диагностика..................................127
Компьютерная томография.....................................129
Эхоэнцефалография...........................................130
Электроэнцефалография.......................................132
Реоэнцефалография...........................................134
Электромиография............................................135
Биохимические методы исследования...........................138
Генетические методы исследования............................140
Дерматоглифика..............................................145
Глава III. Хромосомные синдромы.................................14гЗ
Синдромы, обусловленные аномалиями аутосом......................148
Синдромы, обусловленные аномалиями половых хромосом .... 160
Глава IV. Пороки развития нервной системы.......................163
Дефекты смыкания нервной трубки.................................164
Пороки развития полушарий головного мозга.......................168
Врожденная аплазия ядер черепномозговых нервов (синдром Мебиуса) 176
Глава V. Асфиксия. Родовая травма...............................177
Гипоксия плода и асфиксия новорожденного........................177
Внутричерепная родовая травма ................................ 187
Травма спинного мозга..........................................193
Акушерские парезы и параличи рук................................195
Парез диафрагмы.................................................206
Парез лицевого нерва............................................207
Повреждение других периферических нервов.....................• 208
Глава VI. Поражения нервной системы при гемолитической болезни новорожденных 209
525
Глава VII. Инфекционные заболевания нервной системы .... 213
Врожденные инфекционные заболевания с поражением нервной системы .........................................................213
Менингиты......................................................226
Гнойные менингиты.........................................229
Серозные менингиты........................................239
Энцефалиты : : :..............................................246
Полиомиелит ; :...............................................‘ >г‘2
Полиомиелитоподобные заболевания...............................270
Неврит лицевого нерва......................................... 270
Глава VIII. Детские церебральные параличи . ...................273
Глава IX. Опухоли головного мозга..............................312
Субтенториальные опухоли.......................................318
Супратенториальные опухоли.....................................320
Глава X. Черепно-мозговая травма...............................324
Закрытая черепно-мозговая травма...............................326
Открытая черепно-мозговая травма...............................331
Глава XI. Нарушения мозгового кровообращения...................334
Врожденные аномалии сосудов головного мозга....................335
Внутричерепные кровоизлияния...................................337
Тромбоз мозговых вен и синусов.................................339
Артериальные тромбозы..........................................341
Эмболии сосудов мозга..........................................342
Венозное полнокровие мозга.....................................343
Глава XII. Наследственные болезни нервной системы, обусловленные нарушениями обмена.........................................344
Наследственные нарушения обмена аминокислот....................345
Наследственные болезни, обусловленные нарушениями обмена липидов : : : :..................................................359
Мукополисахаридозы.............................................368
Муколипидозы :.................................................373
Наследственные болезни, обусловленные нарушением обмена углеводов : : : :.................................................
Наследственные болезни, обусловленные нарушениями обмена микроэлементов ; : :...............................................
Глава XIII. Наследственные болезни нервно-мышечной системы . 393
Спинальная амиотрофия Верднига—Гоффмана.......................393
Врожденные миопатии......................................... 397
Прогрессирующие мышечные дистрофии (ПМД)......................401
Нервно-мышечные заболевания, сопровождающиеся миотоническим феноменом : : :...............................................404
Миастения . ; :...............................................407
Глава XIV. Факоматозы.........................................410
Глава XV. Судорожные состояния................................417
Судороги новорожденных........................................420
Судороги у детей раннего возраста.............................425
Глава XVI. Изменения нервной системы при острых отравлениях лекарственными препаратами ...................................443
Нейролептические средства ................................... 44*
Транквилизаторы...............................................446
Антидепрессанты . ............................................446
Алкалоиды группы атропина и содержащие их растения............447
Седативные средства...........................................448
Антигистаминные препараты.....................................449
Глава XVII. Ранняя детская нервность (невропатия).............452
Глава XVIII. Интенсивная терапия при заболеваниях центральной нервной системы..................................................462
Регидратационная терапия и коррекция водно-солевого равновесия . 462
Коррекция кислотно-щелочного равновесия..........................467
Лечебные мероприятия при отеке мозга и острой внутричерепной гипертензии : : ................................................468
Мероприятия, направленные на поддержание кровообращения ... 471
Лечение острой дыхательной недостаточности.......................473
Судорожный статус и его лечение..................................475
Терапия гипертермического синдрома...............................477
Глава XIX. Принципы восстановительной терапии при заболеваниях нервной системы у детей раннего возраста....................479
Общеоздоровительные мероприятия..................................480
Питание и диетотерапия...........................................481
Ортопедические мероприятия.......................................483
Лечебная гимнастика, массаж......................................485
Стимуляция психического и речевого развития......................492
Физиотерапевтические методы......................................495
Медикаментозная терапия..........................................499
Вопросы медицинской деонтологии и врачебной этики в клинике раннего детского возраста ......................................... 507
Глава XX. Управление и организация детской неврологической службы. Профилактика заболеваний нервной системы у детей раннего возраста......................................................510
Список литературы................................................519
Левон Оганесович Бадалян
Любовь Трофимовна Журба
Наталия Михайловна Всеволожская
РУКОВОДСТВО ПО НЕВРОЛОГИИ РАННЕГО
ДЕТСКОГО ВОЗРАСТА
Научный редактор О. В. Тимонина
Редактор издательства Л. А. Ф и а л о в а
Оформление художника А. Л Омельянюка
Художественный редактор Т. С. Федорова
Технический редактор В. П. Бойко
Корректоры И. А. Старикова, Н. К. Сопиженко, Т. И. Черныш
Информ, бланк 1740
9£апп.,в ”аб°Р 26.11.79. Подп. к печ. 09.10.80. БФ 08151. Формат wXJO'/h. Бумзгэ тип № 1. Гарн. обыкн. новая. Печ. выс. Усл. печ. л. 33,25. Уч.-изд. л 37,31. Тираж 25 000 экз. Зак. 143. Цена 2 р. 30 к.
Издательство «Здоров’л», 252021, г. Киев —21, ул. Кирова, 7. тел. 93-64-73
Головное предприятие Республиканского производственного объединения «Полиграфкнига» Госкомиздата УССР, 252057, Киев-57 Ул. Довженко, 3.
Б15 Бадалян Л. О., Журба Л. Т., Всеволожская Н. М. Руководство по неврологии раннего возраста.— Киев : Здоров’я, 1980.—528 с., ил., 2,75 л. ил.
Книга посвящена одной из наиболее актуальных проблем педиатрии — неврологии детского возраста. В ней подробно рассматриваются нервно-психическое развитие детей первых лет жизни в норме и при различных патологических состояниях, формирование двигательных, речевых и психических функций в их онтогенетической связи. Описаны методы исследования нервной системы с учетом динамики возрастного развития и основные заболевания нервной системы, наблюдаемые у детей раннего возраста. С современных позиций освещены этиология, патогенез, ранняя диагностика. Особое внимание уделено интенсивной терапии, восстановительному лечению и организации специализированной помощи детям раннего возраста с поражением нервной системы.
51700—165
Б М209(04)—80 24,8°* 4124030000
ББК 57.3+56.1 618Д +617.9