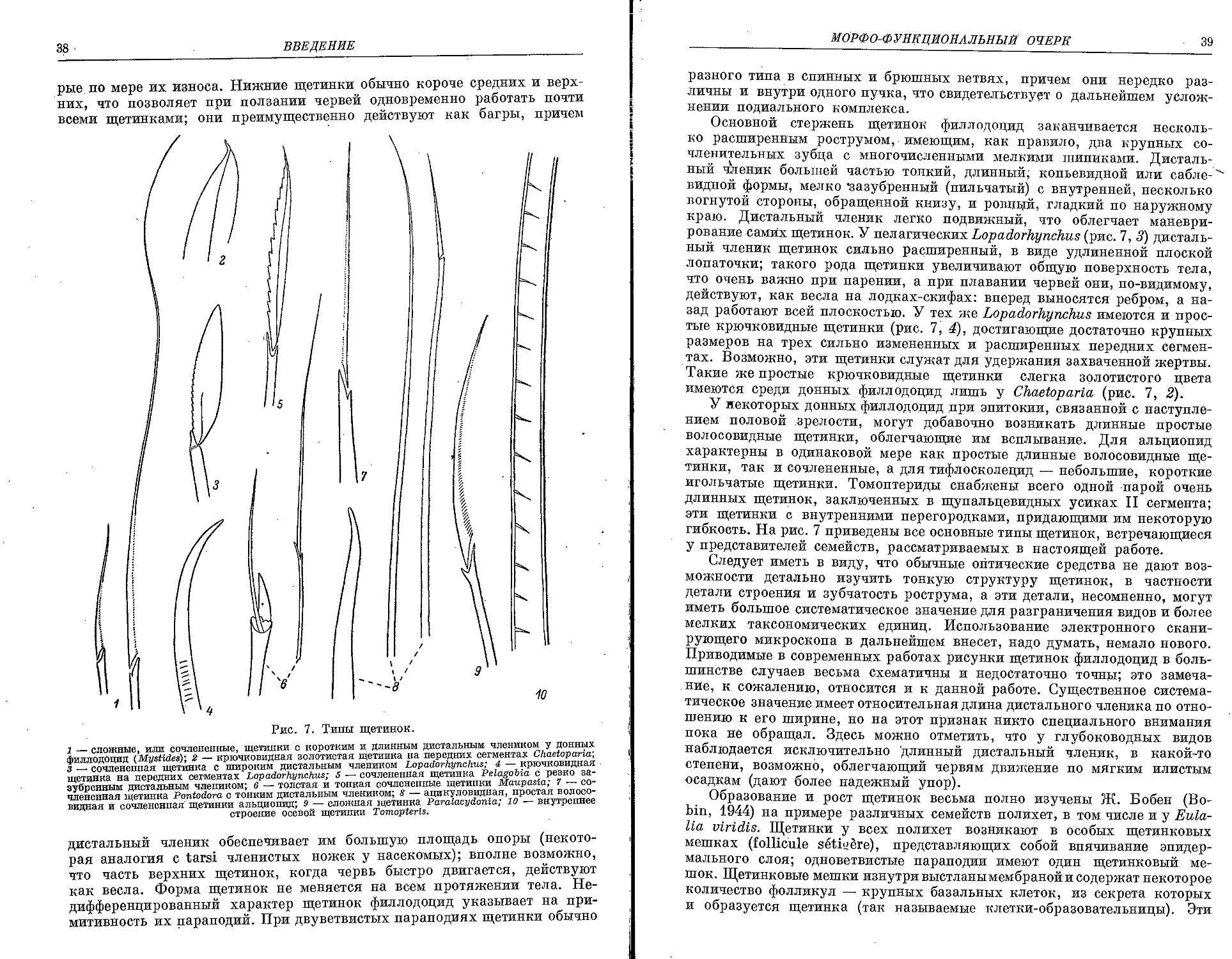
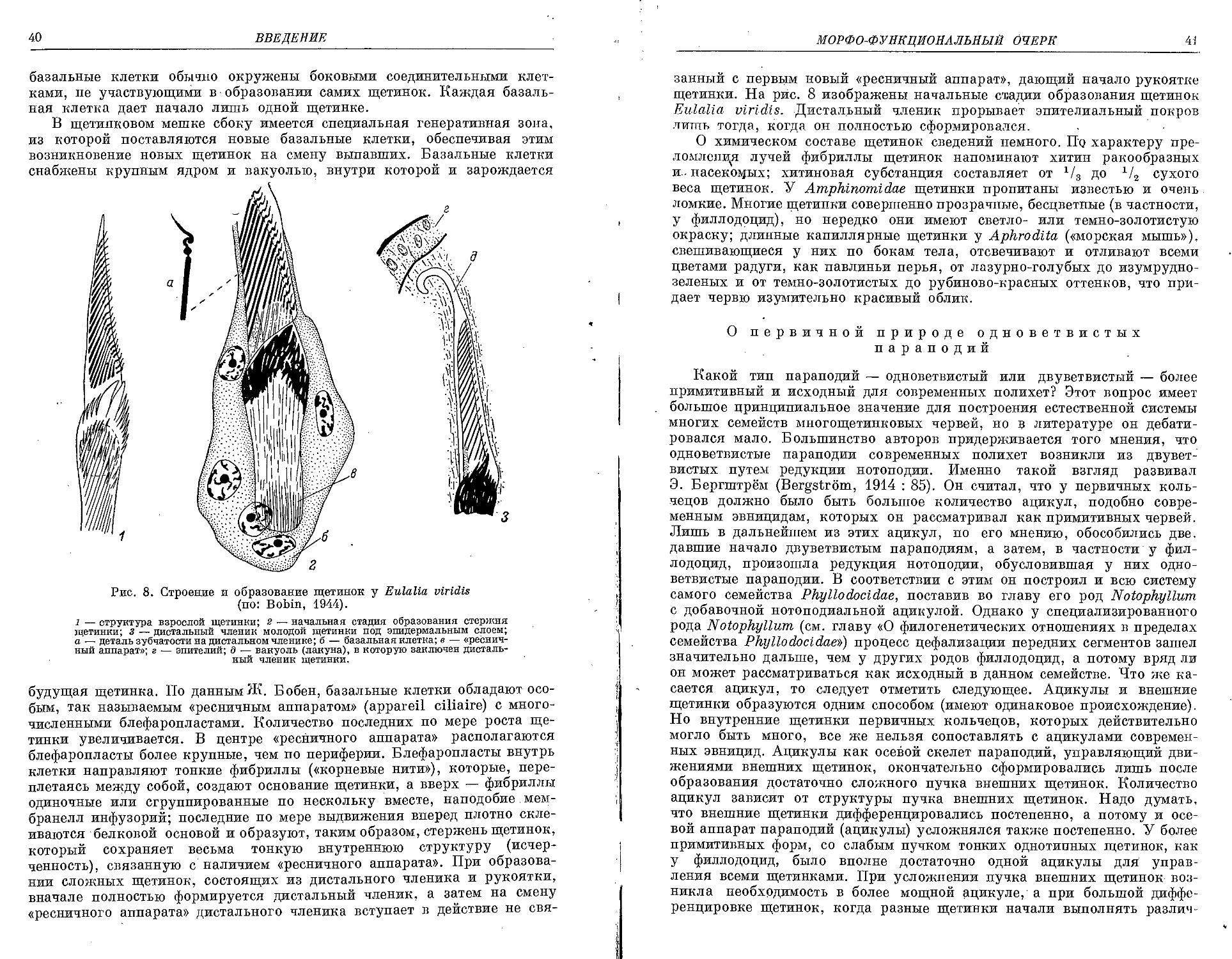
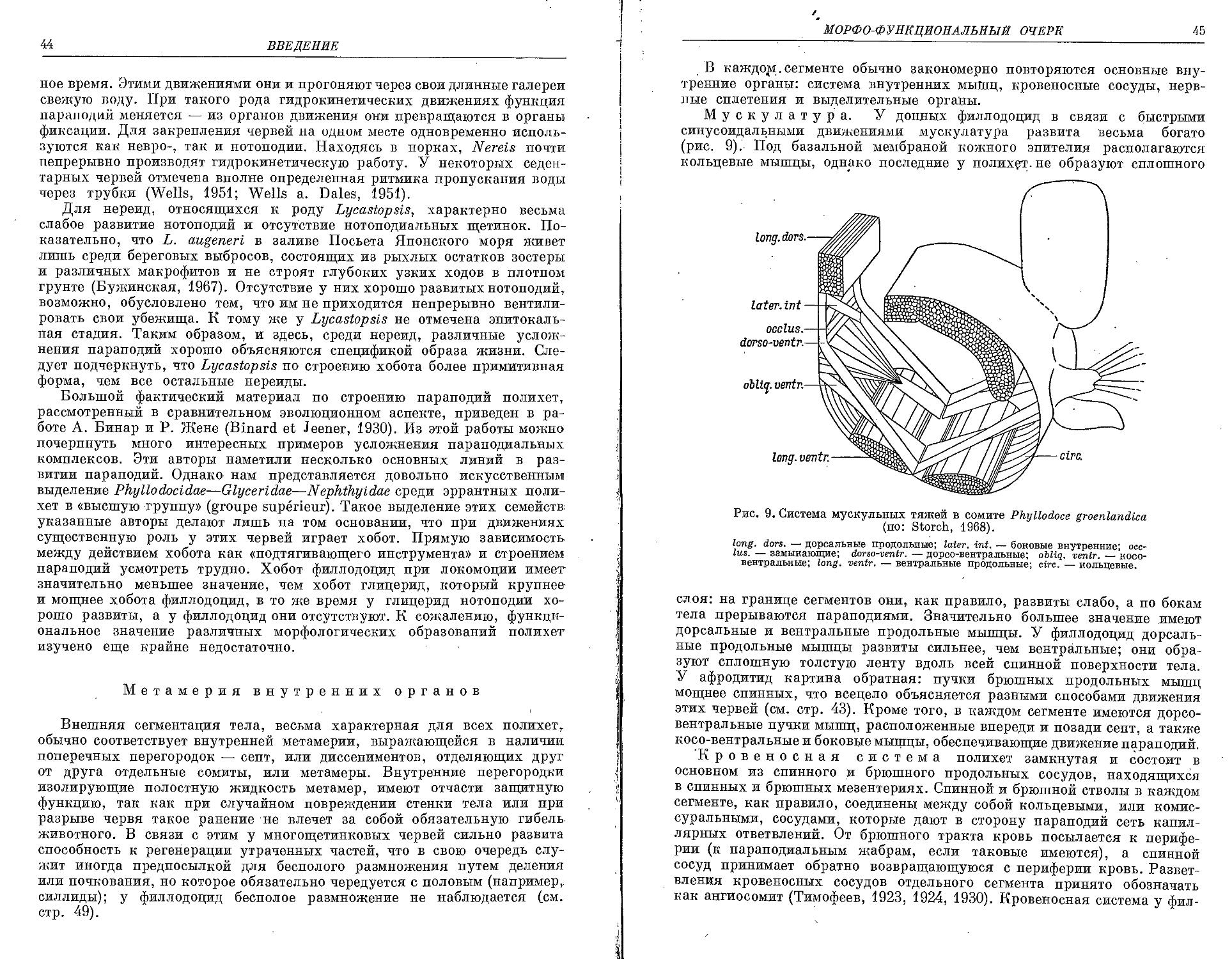
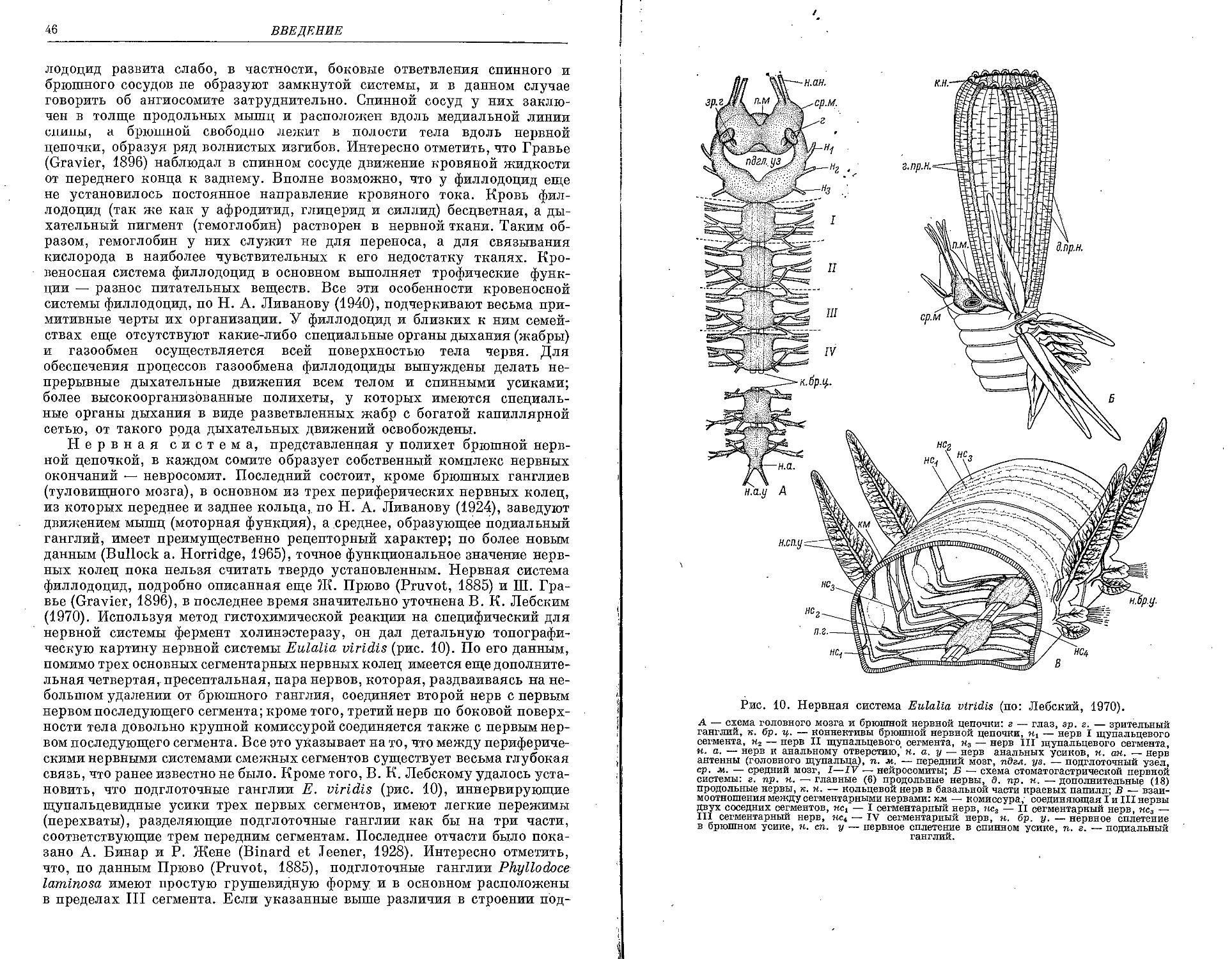
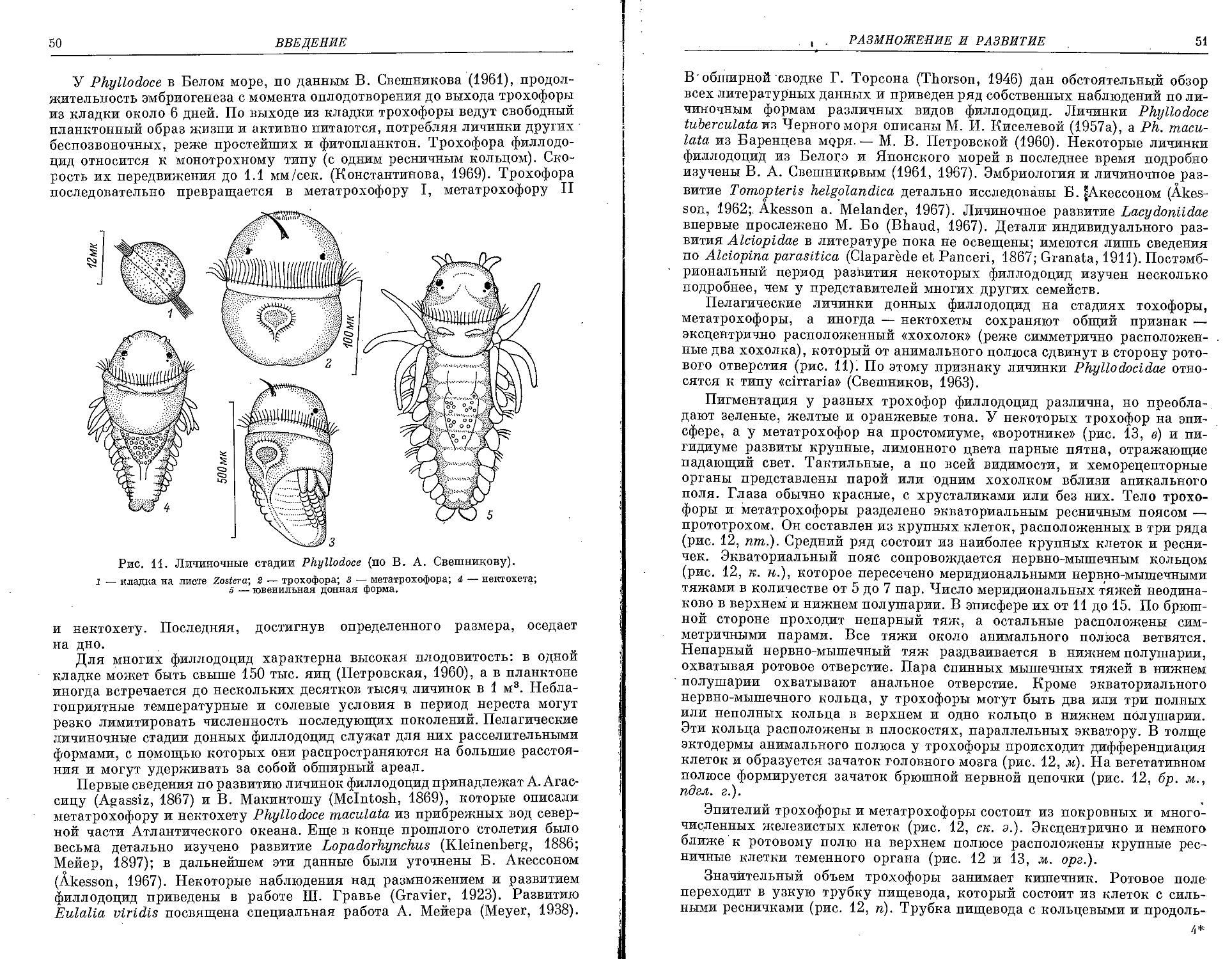
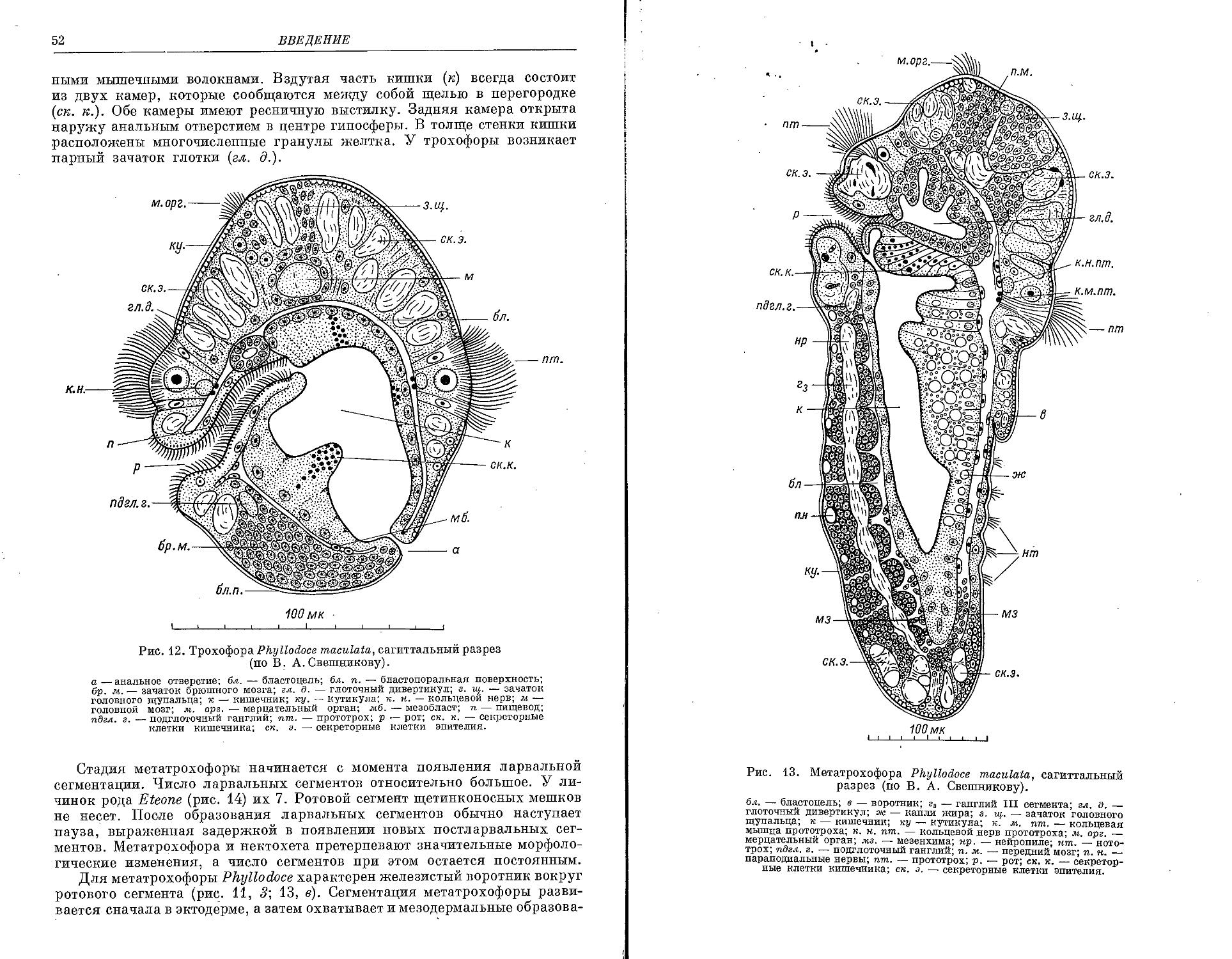
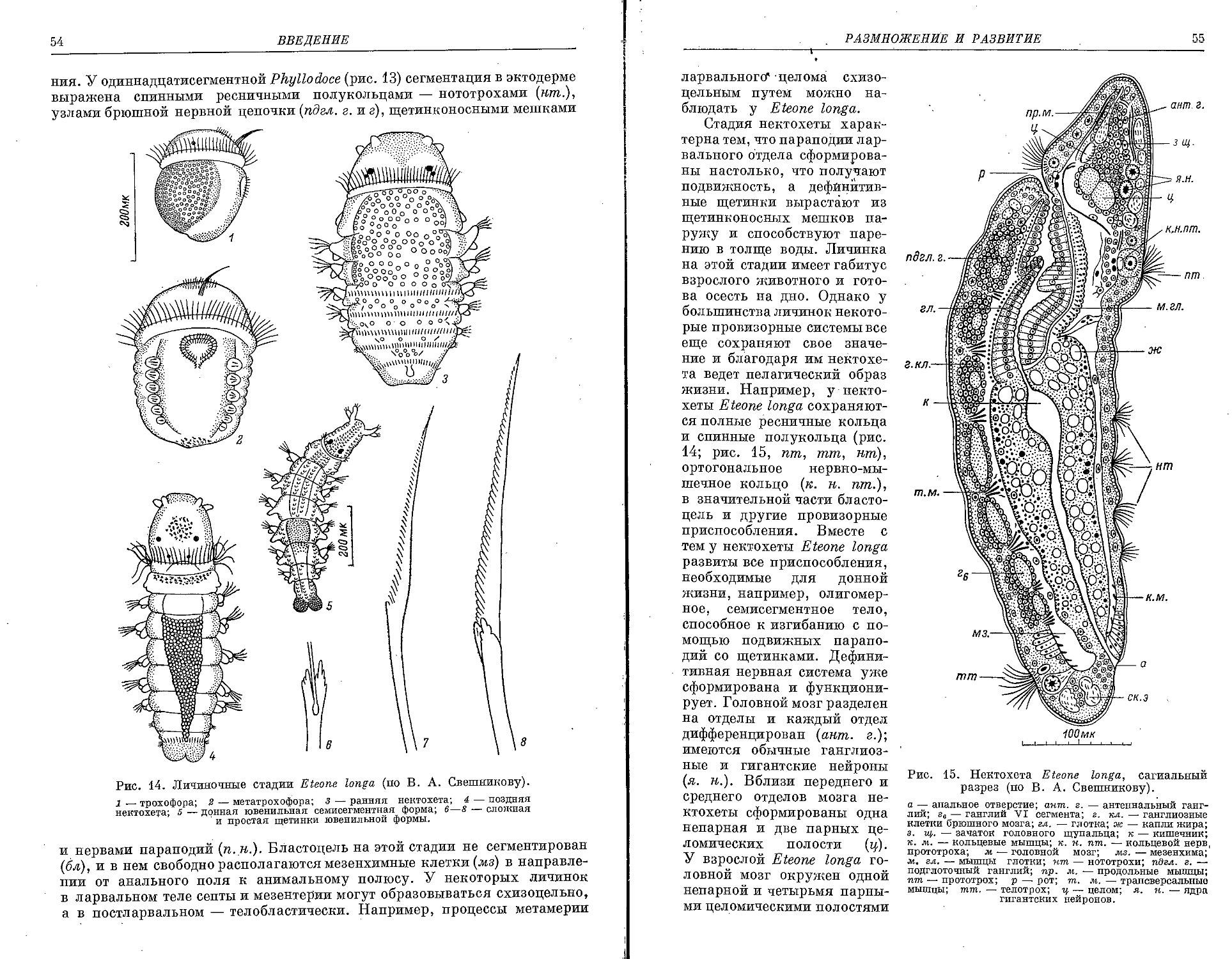
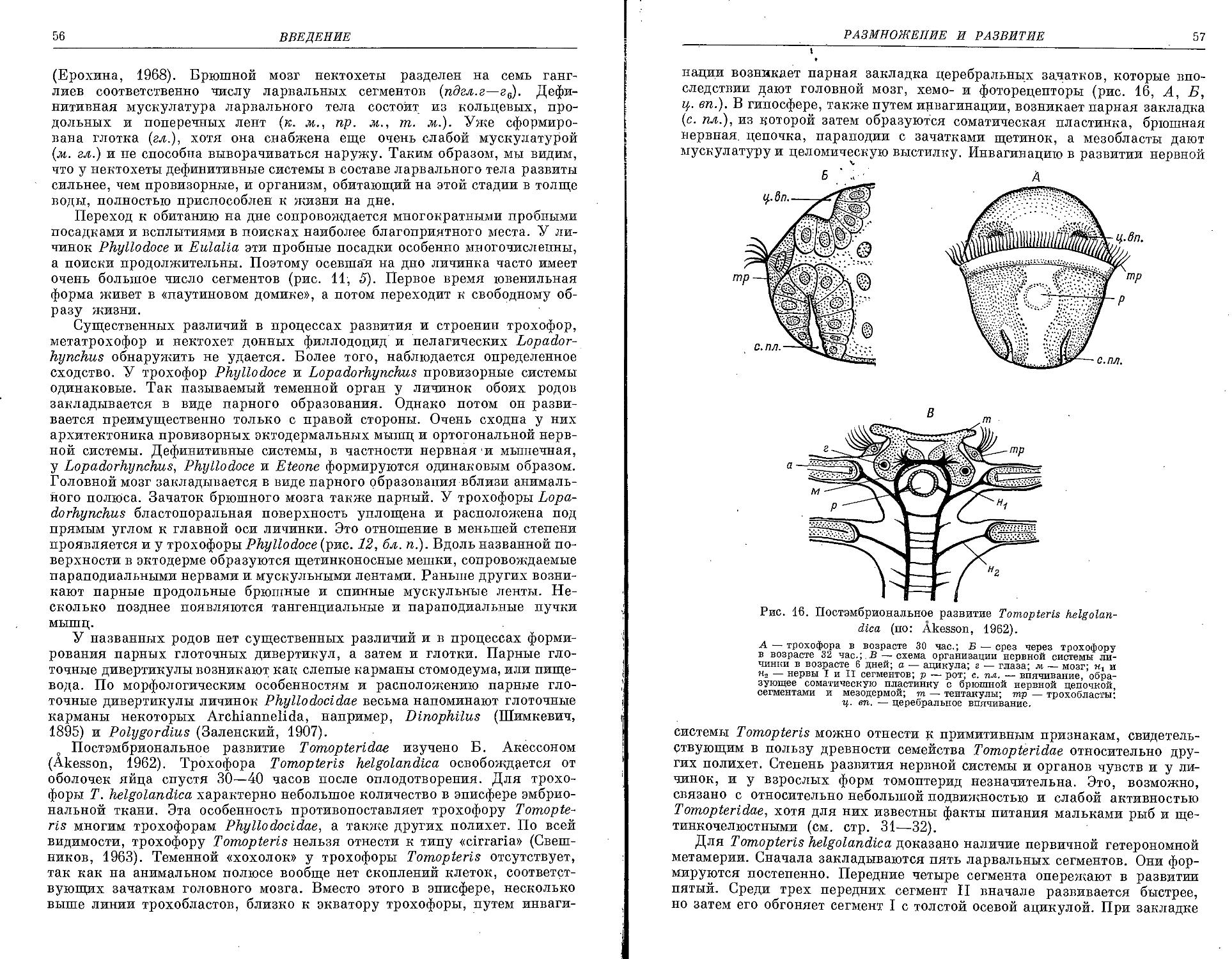
Similar
Text
ФАуНА СССР
МНОГОЩЕТИНКОВЫЕ ЧЕРВИ
I
АКАДЕМИЯ НАУК СССР
ЗООЛОГИЧЕСКИЙ ИНСТИТУТ
НОВАЯ СЕРИЯ, № 102
ФАУНА СССР
МНОГОЩЕТИНКОВЫЕ ЧЕРВИ
Том I
П. В, УШАКОВ
МНОГОЩЕТИНКОВЫЕ ЧЕРВИ ПОДОТРЯДА PHYLLODOCIFORMIA ПОЛЯРНОГО БАССЕЙНА И СЕВЕРО-ЗАПАДНОЙ ЧАСТИ ТИХОГО ОКЕАНА
( СЕМЕЙСТВА PHYLLODOCIDAE; ALCIOPIDAE, TOMOPTERIDAE, TYPHLOSCOLEC1DAE И LACYDONIIDAE )
ИЗДАТЕЛЬСТВО «НАУКА» ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ Ленинград • 1972
ACADEMY OF SCIENCES OF THE USSR
ZOOLOGICAL INSTITUTE
FAUNA OF THE USSR
POLYCHAETES
Vol. I
P. V. USCHAKOV POLYCHAETES OF THE SUBORDER PHYLLODOCIFORMIA OF THE POLAR BASIN AND THE NORTH-WESTERN PART OF THE PACIFIC (FAMILY PHYLLODOCIDAE, ALGIOPIDAE, TOMOPTERIDAE, TYPHLOSGOLEGIDAE AND LAGYDONIIDAE)
Главный редактор академик Б. Е. Баховский
Редакционная коллегия
И. М. Громов, А. С. Мончадский, О. А. Скарлато, А. А, Стрелков (редактор тома), А. А. Штакелъберг
УДК 595. 142. 2281.232 (265. 51/.53 + 268) (083. 7)
Многощетинковые черви подотряда Phyllodociformia Полярного бассейна и северо-западной части Тихого океана (семейства Phyllodocidae, Alcio-pidae, Tomopteridae, Typhloscolecidae и Lacydoniidae). У ш a-ков П. В. В серии: Фауна СССР (Новая серия, № 102), Многощетинковые черви, том I. 1972. Изд-во «Наука», Ленингр. отд., Л. 1—272.
В работе рассматриваются особенности морфологии,/систематики, экологии и географического распространения пяти семейств многощетинковых червей, которые по мнению автора обладают наиболее примитивными чертами строения. Эти семейства им выделены в подотряд Phyllodociformia в составе отряда Phyllodocemorpha. Обсуждаются положение филлодоцид и близких к ним семейств в общей системе полихет и филогенетические отношения в пределах семейства Phyllodocidae s. lato. В систематической части работы дано описание, иллюстрированное преимущественно оригинальными рисунками, около 100 видов, из них 10 новых с абиссальных глубин Тихого океана. Приведены таблицы для определения родов и видов. Илл. — 22 рис. + 34 табл. рис.4-11 карт, табл. — 1, библ.—423 назв.
2-10-6; 2-10-4
856-32
ПРЕДИСЛОВИЕ
За последние годы накопились многочисленные новые данные по много-щетинковым червям из различных районов Мирового океана. Большая часть семейств полихет нуждается в настоящее время в широкой ревизии. Наша работа представляет собой попытку в какой-то степени суммировать сведения по Phyllodocidae, Alciopidae, Tomopteridae, Typhloscolecidae и Lacydoniidae из морей, омывающих северное побережье Европы, Полярного бассейна и северо-западной части Тихого океана, начиная от Берингова моря на севере и кончая Тонкинским заливом на юге. В основу этой сводки положены коллекции, собранные отечественными морскими экспедициями в разные годы и ныне хранящиеся в Зоологическом институте Академии наук СССР (Ленинград). В работе дано описание почти 100 видов и более мелких таксономических единиц, принадлежащих к указанным выше семействам. По сборам э/с «Витязь» преимущественно на абиссальных глубинах Тихого океана обнаружено 10 новых видов и 1 новый род, что указывает, между прочим, на недостаточную изученность открытых районов океана. Описания большинства видов составлены на основе собственных материалов ц иллюстрированы оригинальными рисунками: лишь диагнозы немногих видов, отсутствующих в наших коллекционных фондах, заимствованы из литературных источников. В систематический обзор включены, как исключение, некоторые пелагические виды, пока обнаруженные лишь в северо-восточной части Тихого океана, но нахождение которых в западной его половине вполне вероятно. Имевшийся в нашем распоряжении материал в ряде случаев заставил заново пересмотреть часть родовых диагнозов. В определительные таблицы в целях уточнения систематического положения отдельных таксономических единиц иногда включены виды и роды, не встреченные в пределах Полярного бассейна и северной части Тихого океана (во всех таблицах они отмечены знаком *). В синонимии преимущественно даны ссылки на работы, в которых имеются прямые сообщения о нахождении вида в пределах изученной акватории.
Рассматриваемые в настоящей работе семейства многощетинковых червей неравноценны по количеству видов, входящих в их состав, и весьма различны по своей экологии. Семейство Phyllodocidae s. lato наиболее богато видами, оно представлено главным образом донными червями, часто образующими большие поселения в прибрежных зонах. Самостоятельность семейства Lacydoniidae, насчитывающего крайне небольшое количество исключительно донных форм, признана большинством исследователей лишь в самое последнее время; это семейство, включавшееся ранее в состав Phyllodocidae, представляет собой как бы промежуточное звено между филлодоцидами и Nephthyidae. Три остальных семейства — Alciopidae, Tomopteridae и Typhloscolecidae — состоят исключительно из планктонных обитателей, встречающихся преимущественно в открытых районах морей. Из них первое семейство, несомненно, имеет тесные генети-
1 *
4
ПРЕДИСЛОВИЕ
ческие связи с донными филлодоцидами, а два других — весьма аберрантные черви, обнаруживающие своеобразные приспособления к пелагическому образу жизни. Tomopteridae, — по всей видимости, очень древняя, сильно специализированная группа, а некоторые Typhloscolecidae, возможно, представляют собой неотенические формы в связи с переходом этих червей к эктопаразитическому образу жизни. Все перечисленные здесь семейства, несмотря на их разные биологию и внешнюю морфологию, мы объединяем в подотряд Phyllodociformia. Это название без разъяснения его систематического ранга (надсемейства, подотряда) в свое время было предложено еще Левинсеном (Levinsen, 1882). В настоящей работе мы уточняем объем этой систематической группы. Подотряд Phyllodociformia входит в состав отряда Phyllo docemorpha (Ливанов, 1940), включающего многощетинковых червей, обнаруживающих наиболее примитивные черты строения. Некоторые виды, описанные в настоящей работе, мы имели возможность сопоставить с аналогичными видами из других акваторий, в частности по коллекциям, полученным из Швеции от А. Элиазона (A. Eliason, Naturhistoriska Museet, Goteborg) и из США от М. Джонес и М. Петтибон (М. Jones and М. Pettibone, Smithsonian Institution, Washington), а также сравнить часть наших видов с типовыми экземплярами профессора П. Фо-веля (Р. Fauvel), которые после его смерти были депонированы в Национальном музее естественной истории в Париже, где мне было оказано большое внимание со стороны профессора А. Шабо (A. Chabaud, Museum National d'Histoire Naturelle, Paris). При описании и характеристике пелагических полихет существенное значение имели планктонные коллекции Советской антарктической экспедиции на д/э «Обь», определенные Н. Тэбблом (N. Tebble, British Museum) и хранящиеся сейчас в Зоологическом институте АН СССР.
Всем советским и иностранным специалистам, предоставившим нам свои материалы приношу глубокую признательность. Считаю своим долгом выразить сердечную благодарность за неизменное содействие всему коллективу Лаборатории морских исследований Зоологического института, где я проводил в течение долгого времени все свои работы по морской фауне. При написании данной книги большую помощь своими ценными советами мне оказали проф. А. А. Стрелков и проф. А. В. Иванов. Весьма признателен В. А. Свешникову, составившему по моей просьбе описания личиночных форм, сопроводив их собственными оригинальными рисунками. Значительная часть иллюстраций к настоящему изданию подготовлена для печати Т. Н. Шишловой.
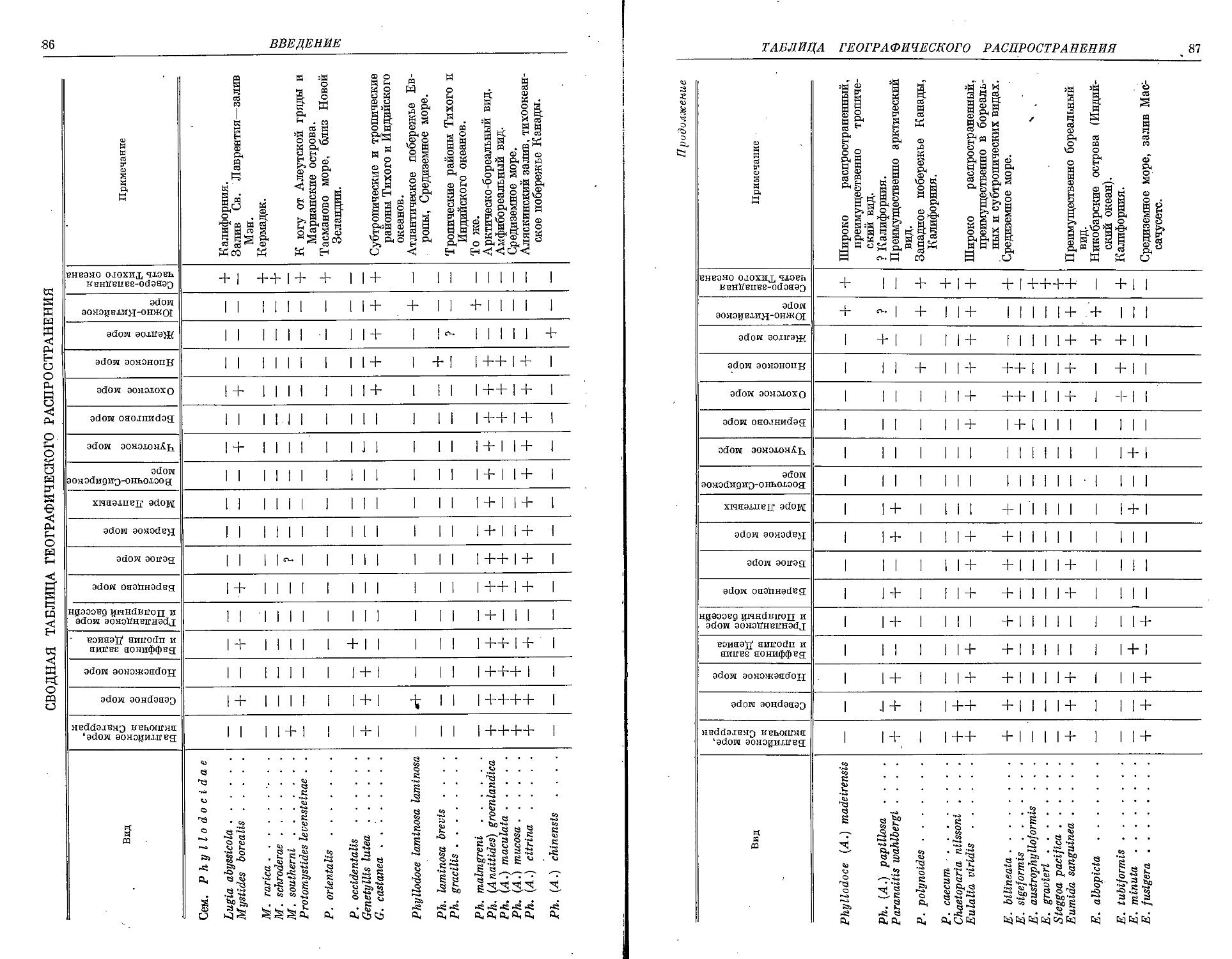
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ ВИДОВ
Отряд Phyllodoeemo гpha
Подотряд Phyllodociformia
I. Семейство Phyllodocidae Oersted, 1843
1. Подсемейство Phyllodocinae Oerst 1843
1. Род L и g i a Quatrefages, 1865
Стр.
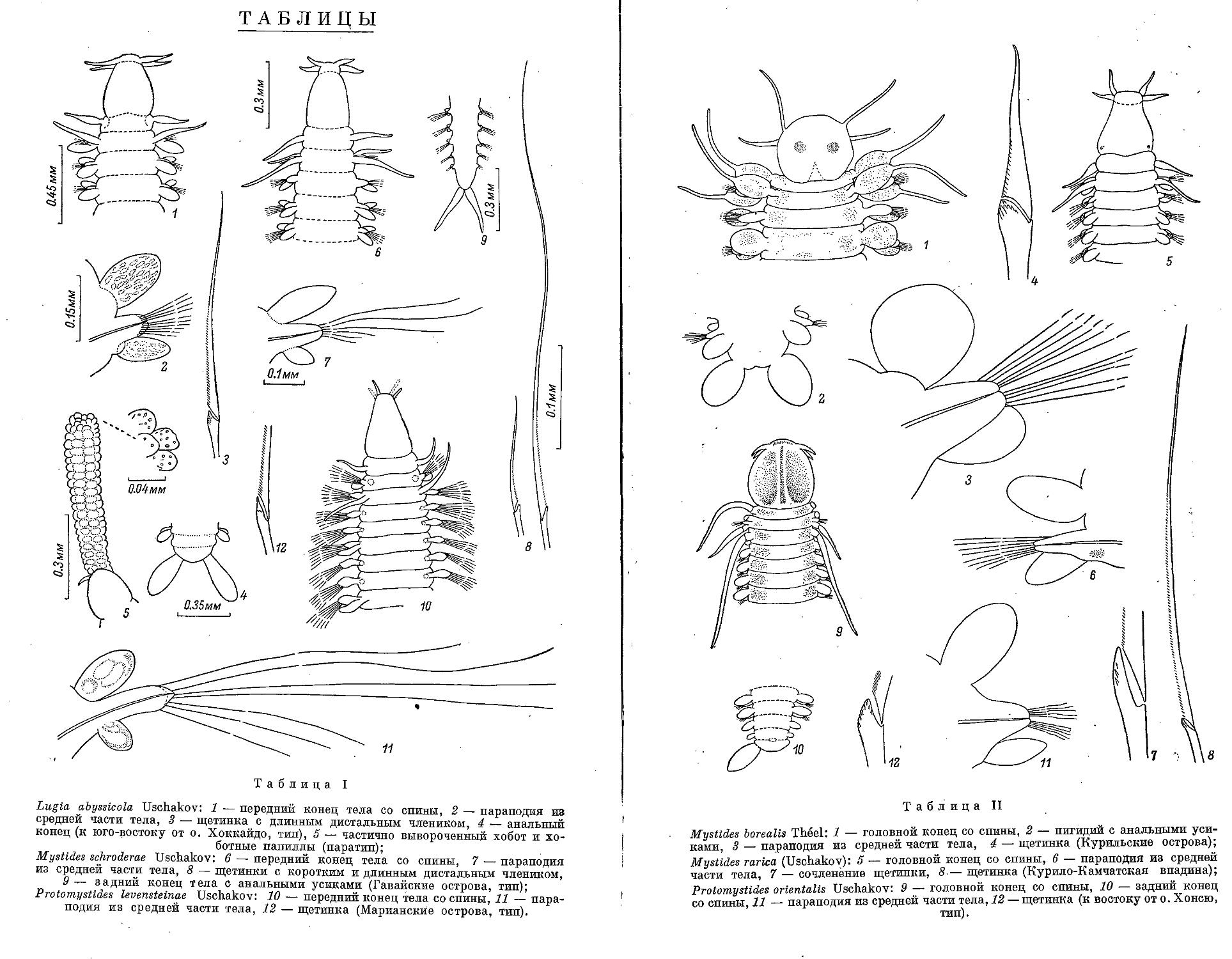
1. L. abyssicola Uschakov sp. nov....................................... 116
2. Род Mystides Theel, 1879
1. M. borealis Theel, 1879 .............................................. 120
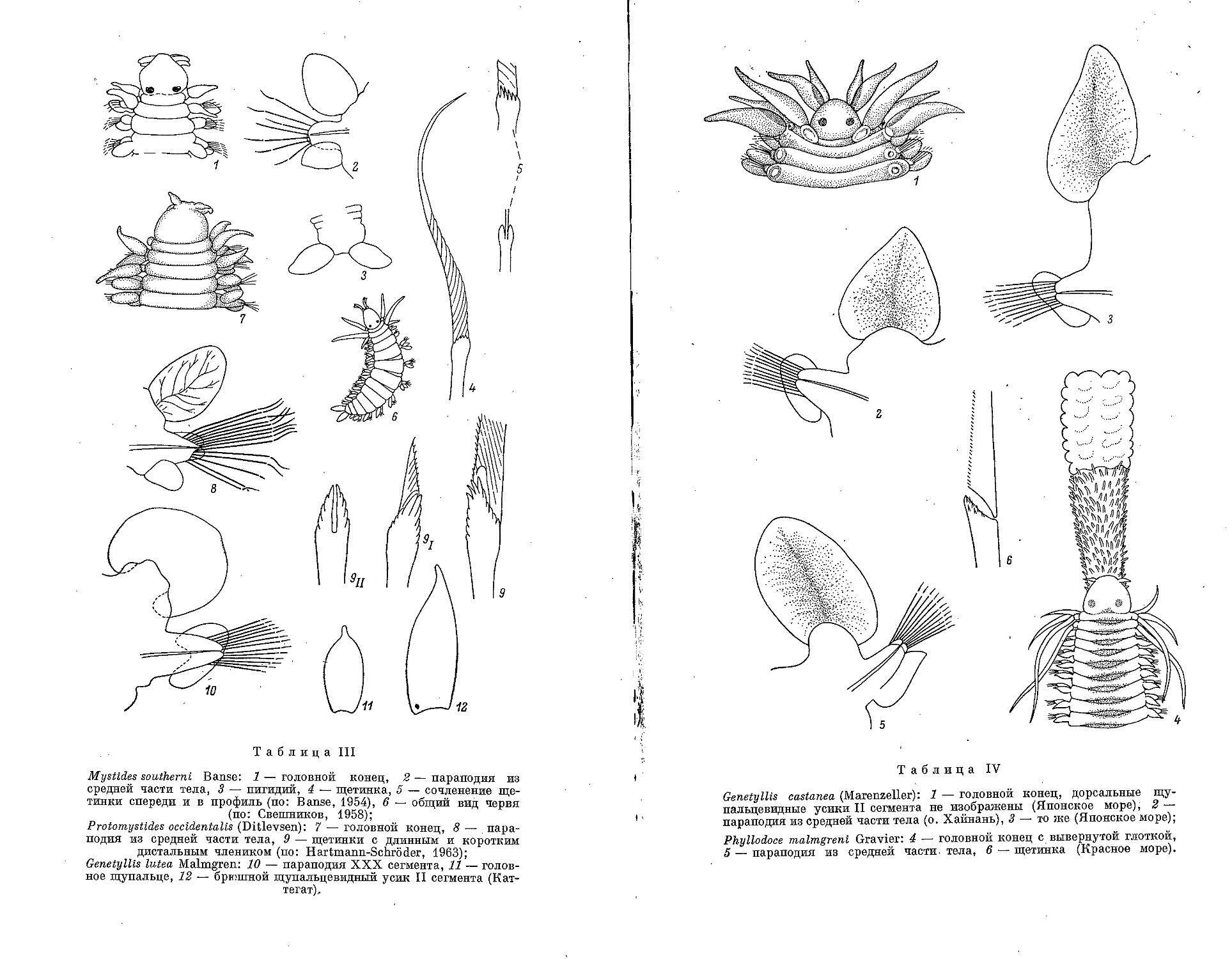
2. M. rarica (Uschakov, 1958)............................................ 121
3. M. schroderae Uschakov sp. nov..................................... . 121
4. M. southerni Banse, 1954 ............................................. 122
3. Род Protomystides Czerniavsky, 1882
1. P. levensteinae Uschakov sp. nov...................................... 124
2. P. orientalis Uschakov sp. nov........................................ 125
3. P. occidentalis (Ditlevsen, 1917)..................................... 126
4. Род Genetyllis Malmgren, 1865
1. G. lutea Malmgren, 1865 .............................................. 127
2. G. castanea (Marenzeller, 1879)....................................... 127
5. Род Phyllodoce Savigny, 1818 Подрод Phyllodoce Savigny, 1818, s. str.
la. P. laminosa laminosa Savigny, 1818............................................' 130
16. P. laminosa brevis Zachs, 1933 ............................................... 131
2. P. gracilis Kinberg, 1866 .................................................... 131
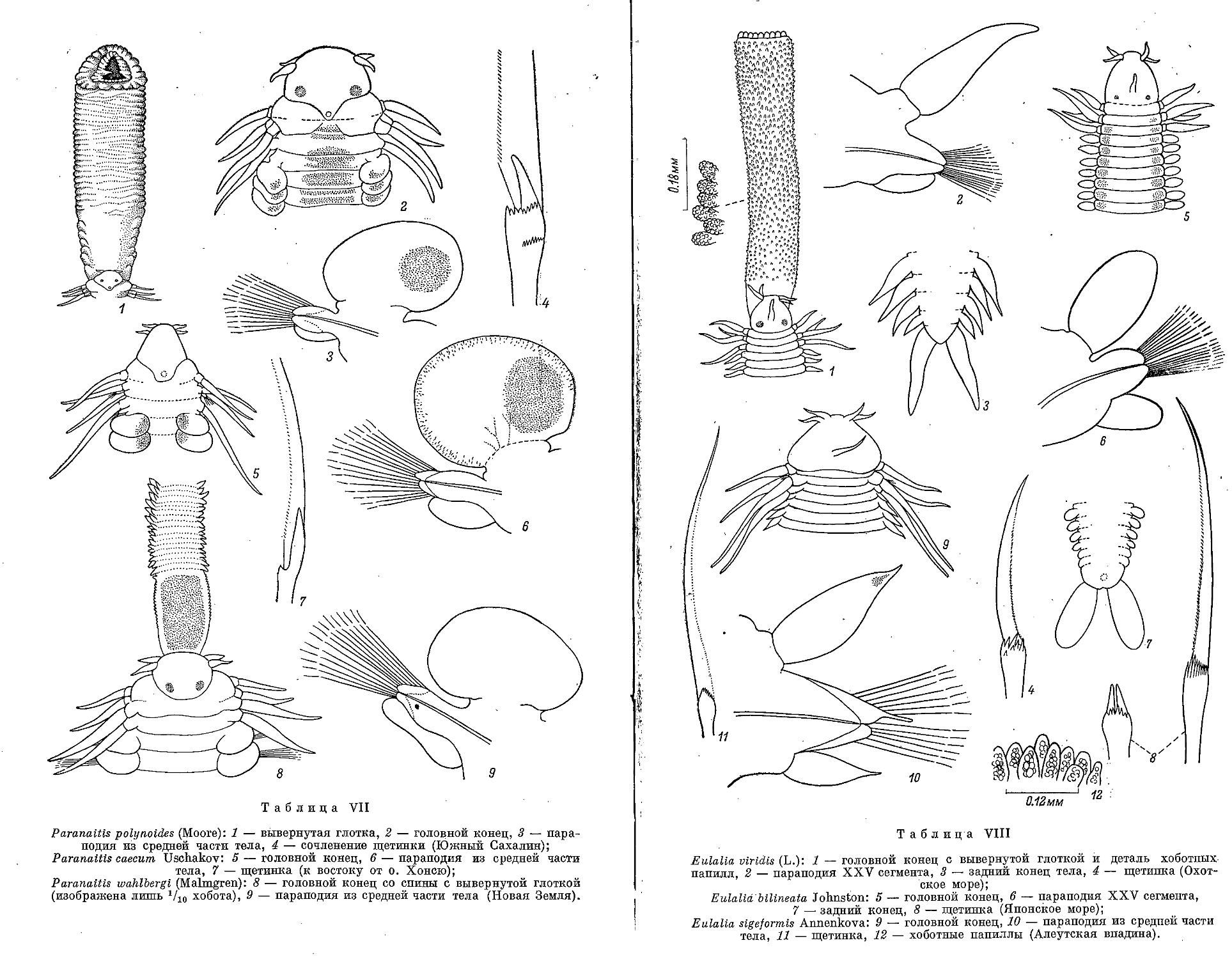
3. P. malmgreni Gravier, 1900 ................................................... 132
Подрод Anaitides Czerniavsky, 1882
4. P. (Anaitides) groenlandica Oersted, 1842 ..................................... 133
5. P. (A.) maculata (Linne, 1767)............................................... 134
6. P. (A.) mucosa Oersted, 1843 .............................................. 135
7. P. (A.) citrina Malmgren, 1865 .............................................. 136
8. P. (A.) chinensis Uschakov et Wu, 1959 ...................................... 137
9. P. (A.) madeirensis Langerhans, 1880 ........................................ 138
10. P. (A.) papillosa Uschakov et Wu, 1959 ....................................... 139
6
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ
6. Род Paranaitis Southern, 1914
Стр.
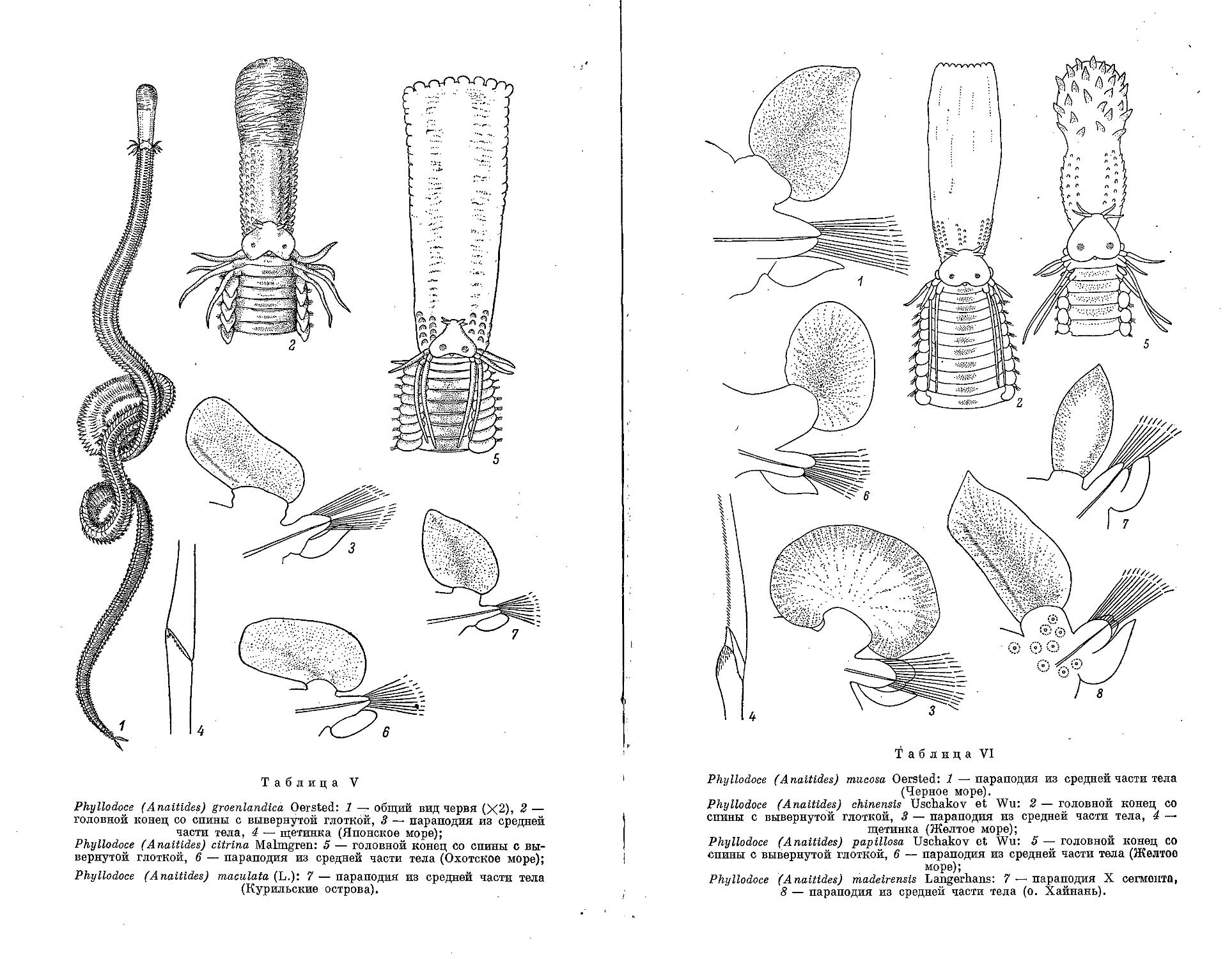
1. Р. wahlbergi (Malmgren, 1865)...................................... 140
2. Р. polynoides (Moore, 1906)........................................ 141
3. Р. caecum Uschakov sp. nov......................................... 142
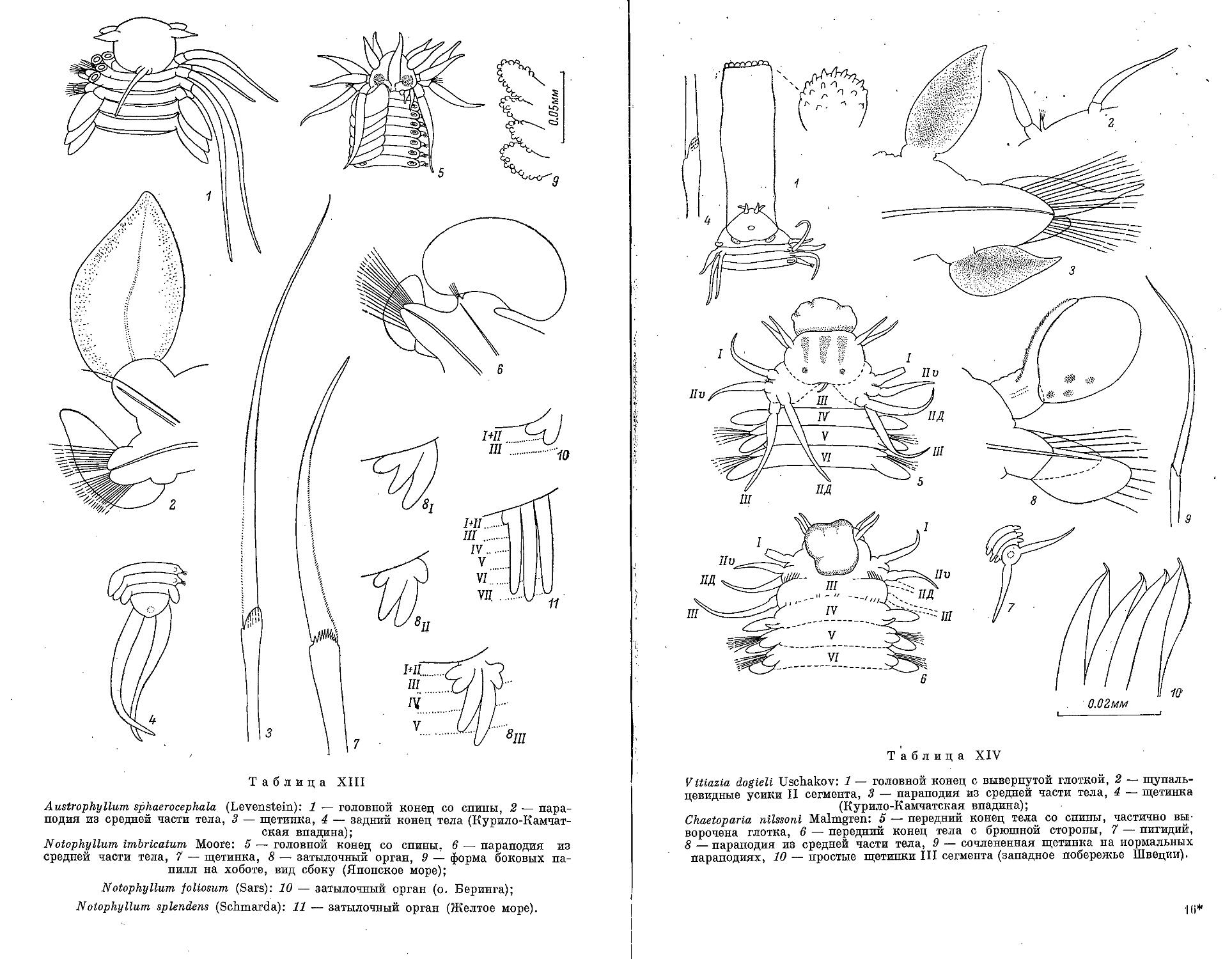
7. Род Chaetoparia Malmgren, 1867
1. C. nilssoni Malmgren, 1867 ................ ............ 143
8. Род Eulalia Savigny, 1817
1. E. viridis (Linne, 1767)........................................... 146
2. E. bilineata (Johnston, 1840)............................ 148
3. E. sigeformis Annenkova, 1937 ............................ 149
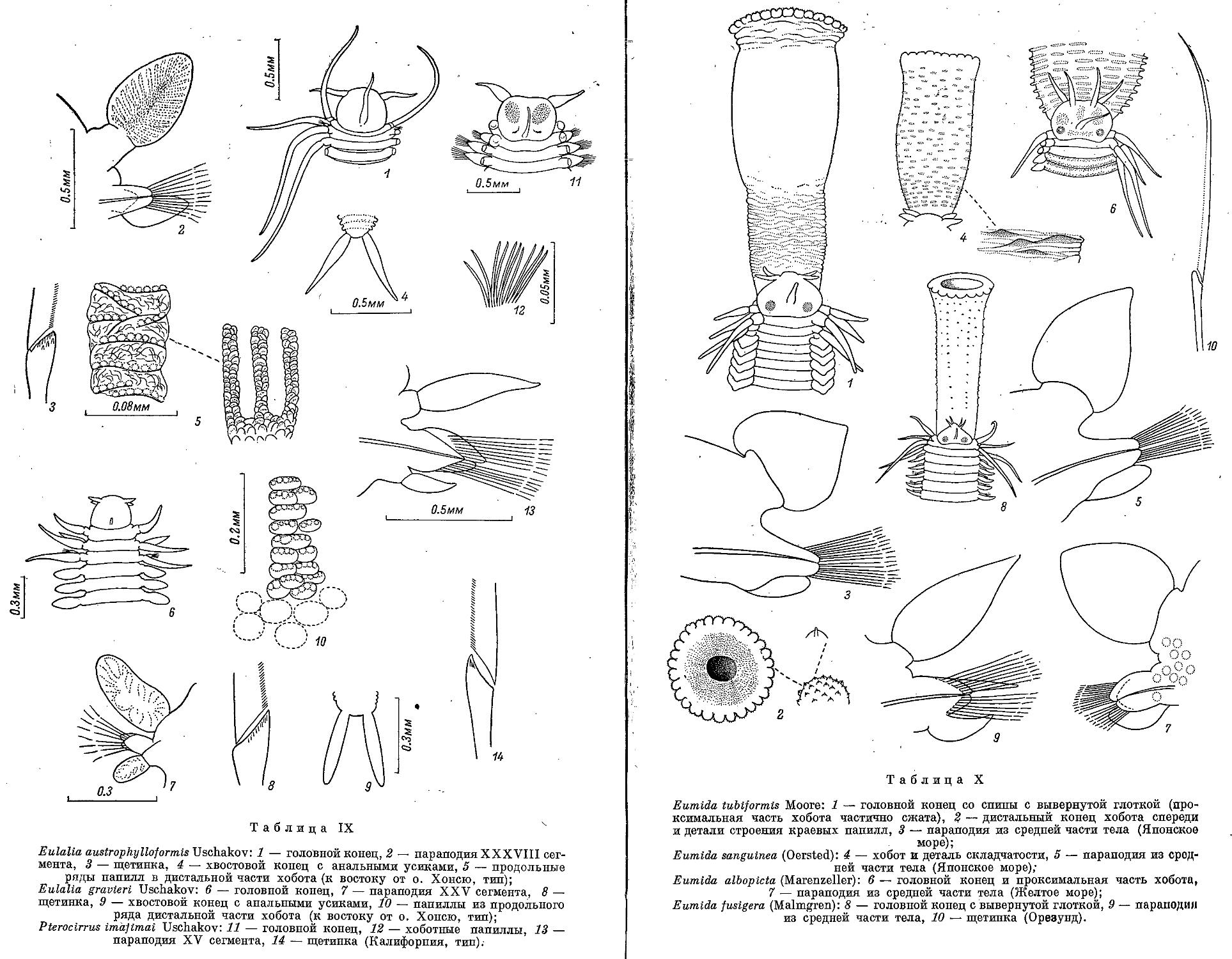
4. E. austrophylloformis Uschakov sp. nov............................ 150
5. E. gravieri Uschakov sp. nov........................... 150
9. Род S t e g g о a Bergstrom, 1914'
1. S. pacifica Imajima, 1964 ....................................... 152
10. Род E и m i d a Malmgren, 1865
1. E. sanguinea (Oersted, 1843)...................................... 153
2. E. albopicta (Marenzeller, 1879).................................. 154
3. E. tubiformis Moore, 1909 . ..................................... 155
4. E. minuta (Ditlevsen, 1917)....................................... 156
5. E. fusigera (Malmgren, 1865) ................................... 156
6. E. nigrimaculata (Moore, 1909).................................... 157
11. Род Pterocirrus Claparede, 1868
1. P. macroceros (Grube, 1860) . . ................................. 160
2. P. slastnikovi Annenkova, 1946 ................................... 161
3. P. notoensis (Imajima, 1967)...................................... 161
4. P. imajimai Uschakov sp. nov...................................... 162
12. Род A ustrophyllum Bergstrom, 1914
1. A. sphaerocephala (Levenstein, 1961).............................. 164
13. Род Vitiazia Uschakov, 1953
1. V. dogieli Uschakov, 1953 ......................................... 165
14. Род Vitiaziphyllum Uschakov gen. nov.
1. V. nuchalum Uschakov sp. nov....................................... 167
45. Род Notophyllum Oersted, 1843
1. N. foliosum (M. Sars, 1835)........................................ 169
2. N. imbricatum Moore, 1906 ........................................ 170
16. Род Nipponophyllum Imajima et Hartman, 1964
1. N. japonicum (Marenzeller, 1879) . ................................ 171
2. N. sagamianum (Izuka, 1912)........................................ 172
17. Род E tea n e Savigny, 1820
Подрод Eteone Savigny, 1820, s. str.
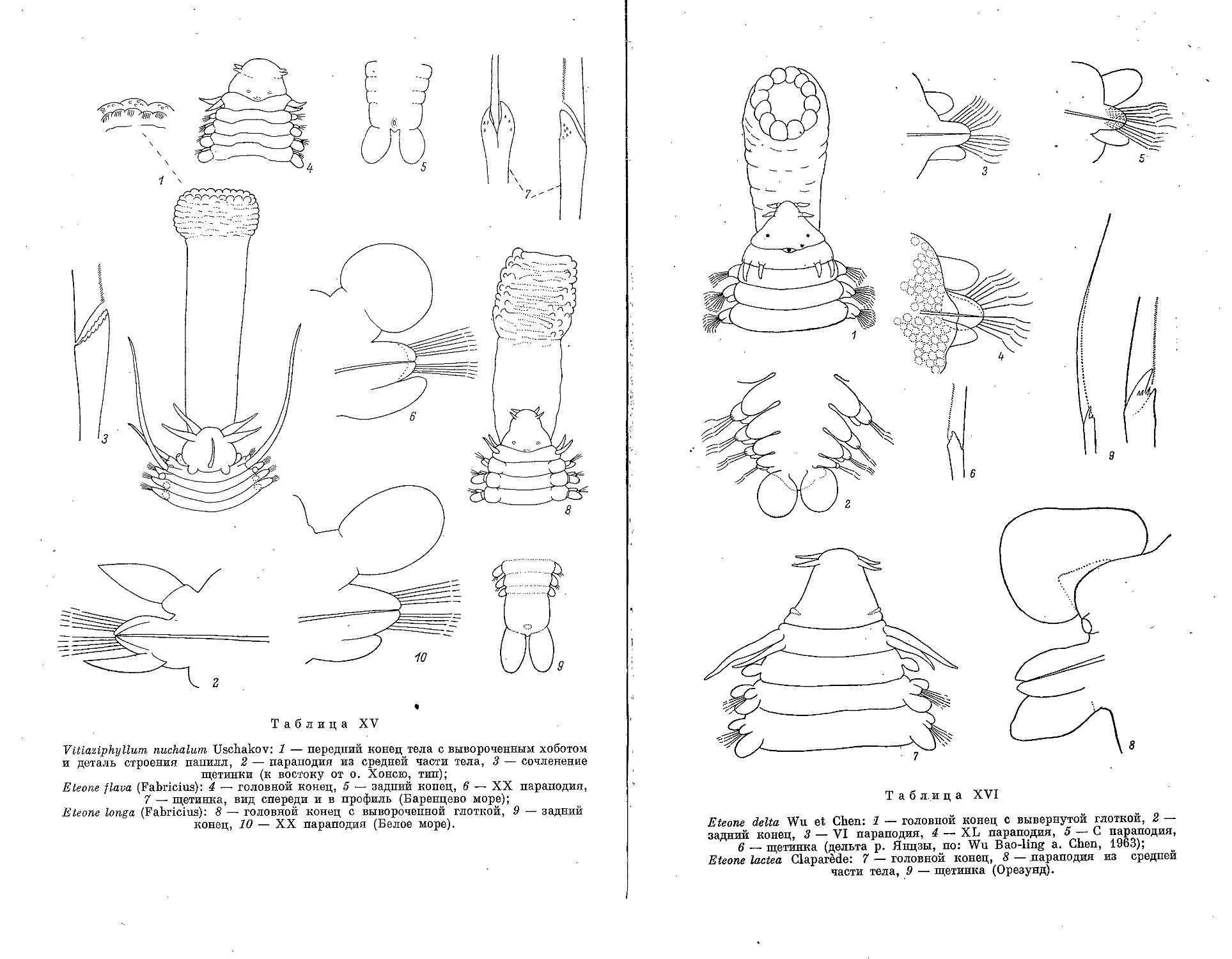
1. E. flava (Fabricius, 1780)....................................... 174
2. E. longa (Fabricius, 1780)........................................ 175
3. E. delta Wu et Chen, 1963 ..... ..... ........................... 176
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ 7
Стр.
4а. Е. spetsbergensis spetsbergensis Malmgren, 1865 .................. 177
46. Е. spetsbergensis bistrlata Uschakov, 1953 ...........;........... 177
5. E. vitiazi Uschakov sp. nov..................................... 178
6. E. lactea Claparede, 1868 ........................................ 179
Подрод Mysta Malmgren, 1865
7. E. (Mysta) barbate, Malmgren, 1865 ................................ 179
8. E. (M.) ornata Grube, 1877 ................ . '.................. 181
9. E. (M.) maculata (Treadwell, 1920).............................. 182
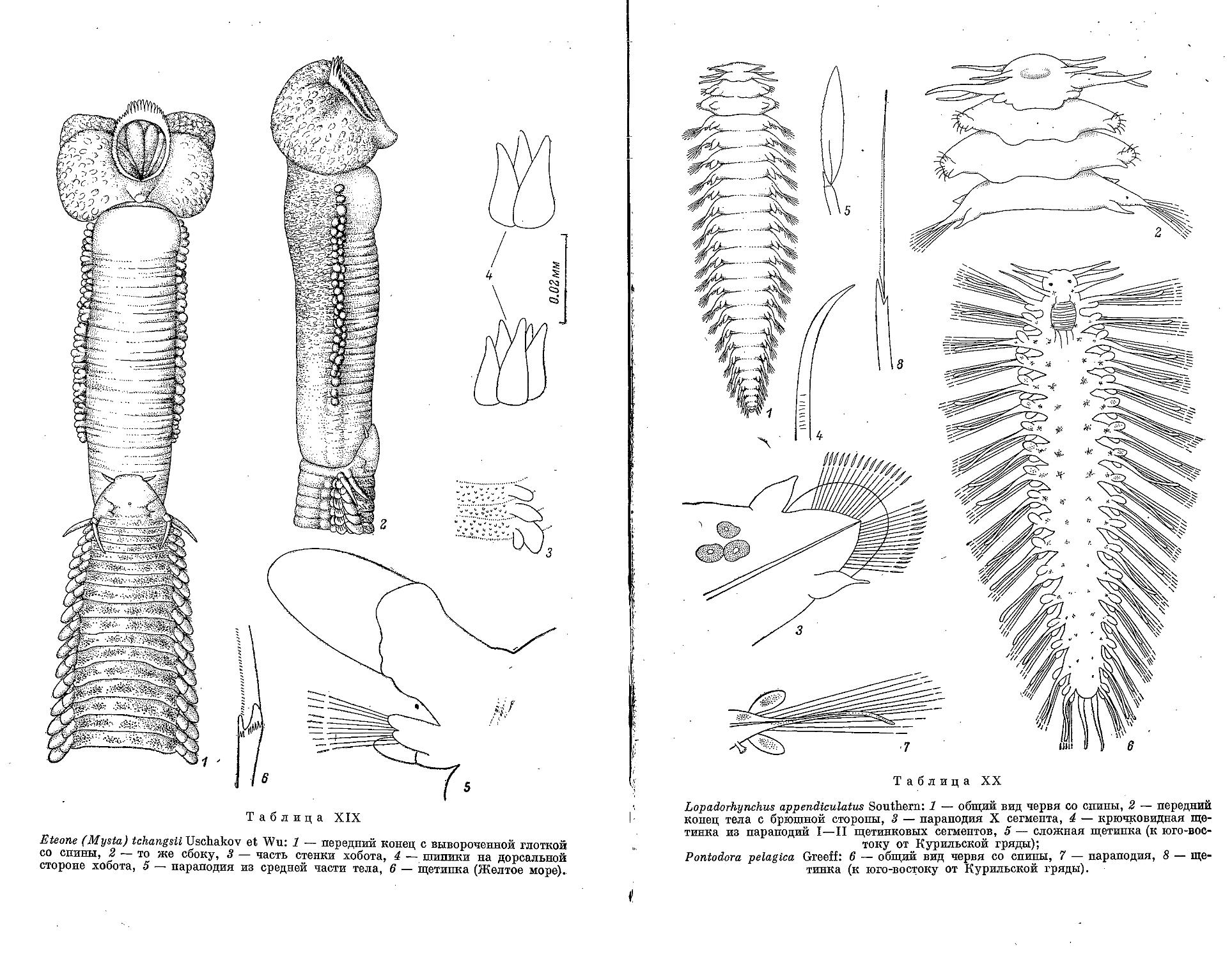
10. E. (M.) tchangsii Uschakov et Wu, 1959 .....’.................... 183
2. Подсемейство Lopadorhynchinae Claparede, 1870
18. Род Lopadorhynchus Grube, 1855
1. L. appendiculatus Southern, 1909 ................................. 185
2. L. brevis Grube, 1855 ............................................ 186
<3. L. krohnii (Claparede, 1870)...................................... 186
4. L. uncinatus Fauvel, 1915......................................... 187
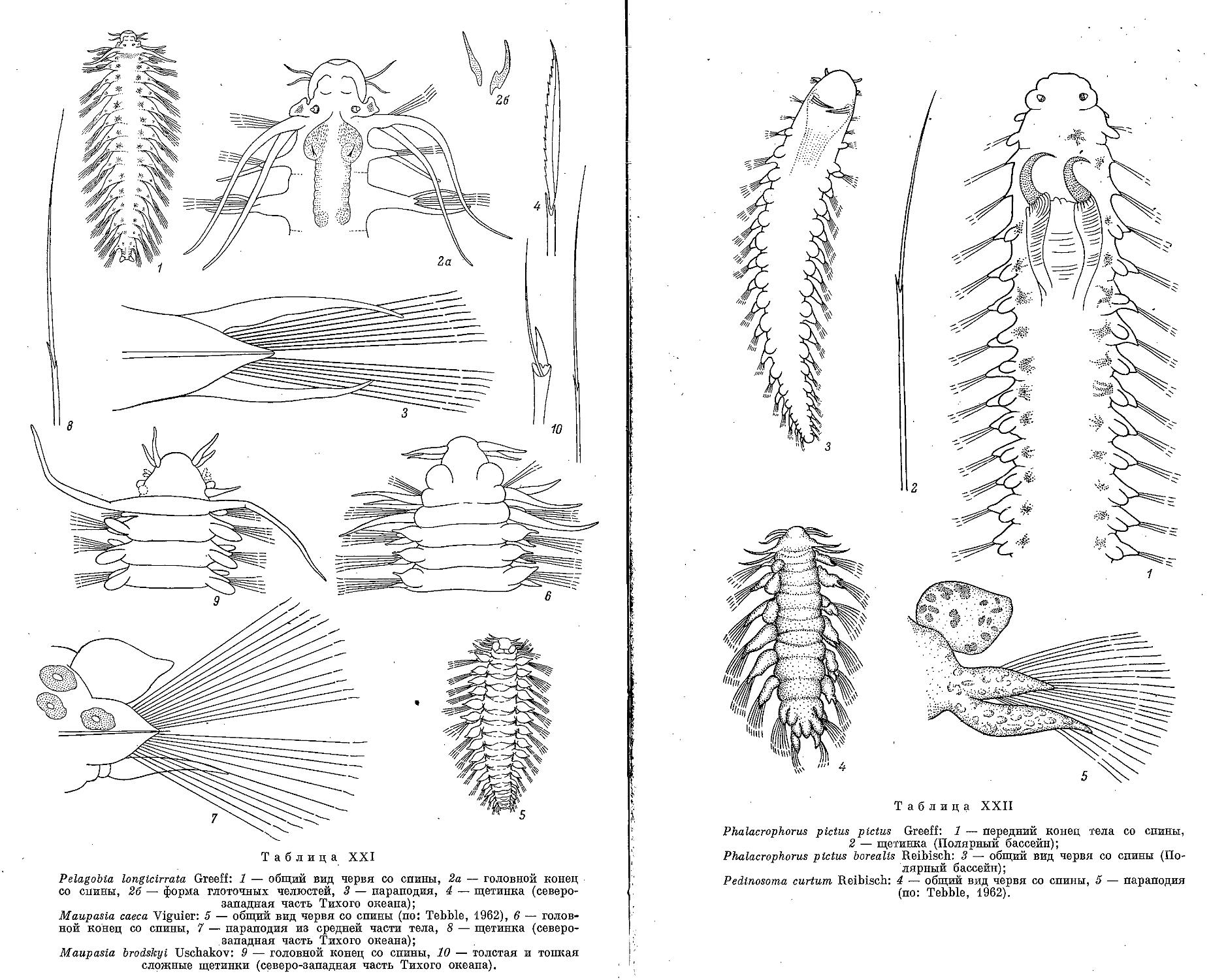
19. Род P e I a g о b i a Greeff, 1879
1. P. longicirrata Greeff, 1879 ..................................... 188
20. Род Maupasia Viguier, 1886
1. M. caeca Viguier, 1886 ............................................ 190
2. M. brodskyi Uschakov, 1957 ....................................... 190
21. Род Pedinosoma Reibisch, 1895
i. P. curtum Reibisch, 1895 ......................................... 191
3. Подсемейство Pontodorinae Bergstrom, 1914
22. Род Pontodora Greeff, 1879
4. P. peiagica Greeff, 1879 .......................................... 192
4. Подсемейство lospilinae Bergstrom, 1914
' 23. Род Phalacrophorus Greeff, 1879
la. Ph. pictus pictus Greeff, 1879 ................................... 194
16. Ph. pictus borealis Reibisch, 1885 . ............................. 194
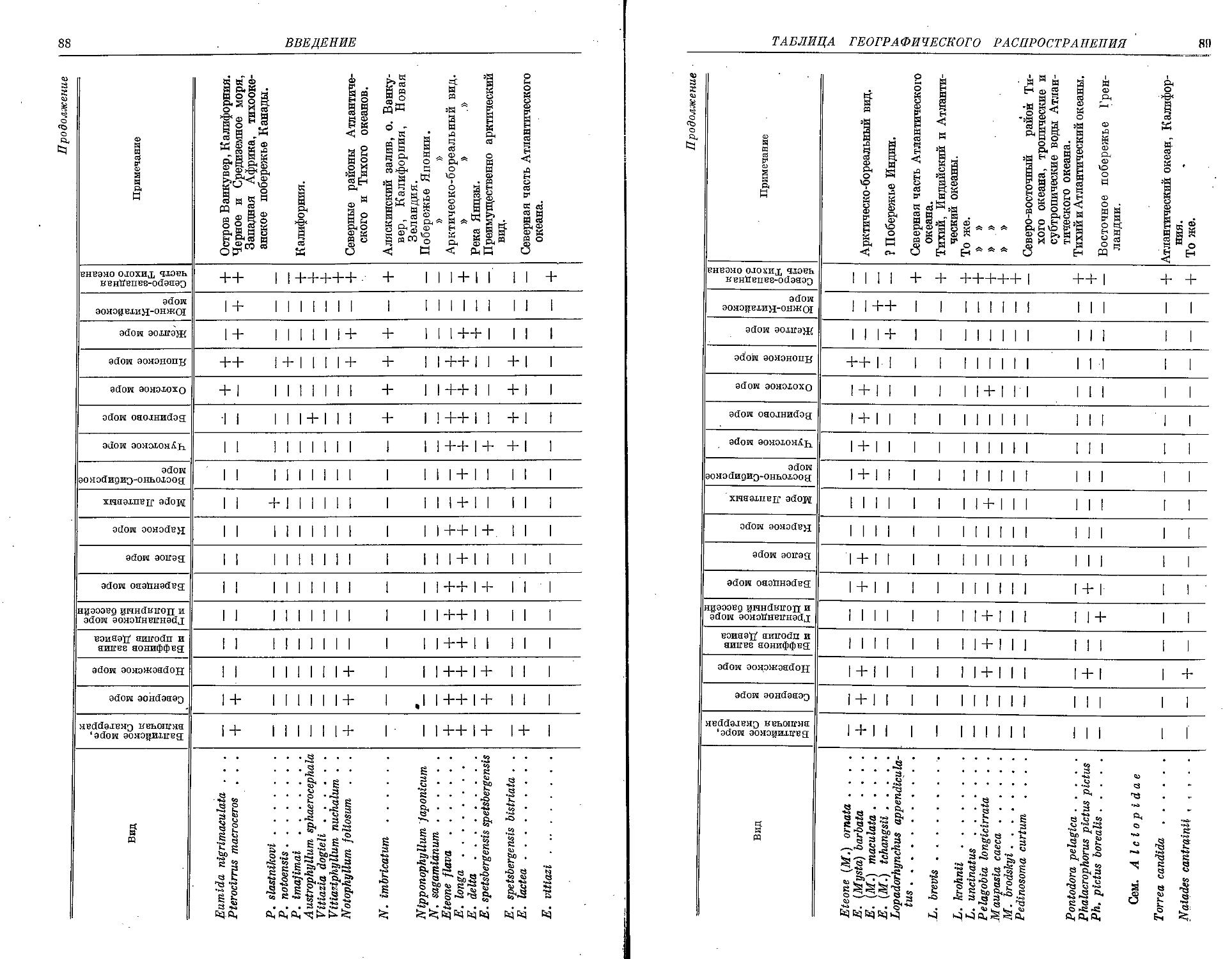
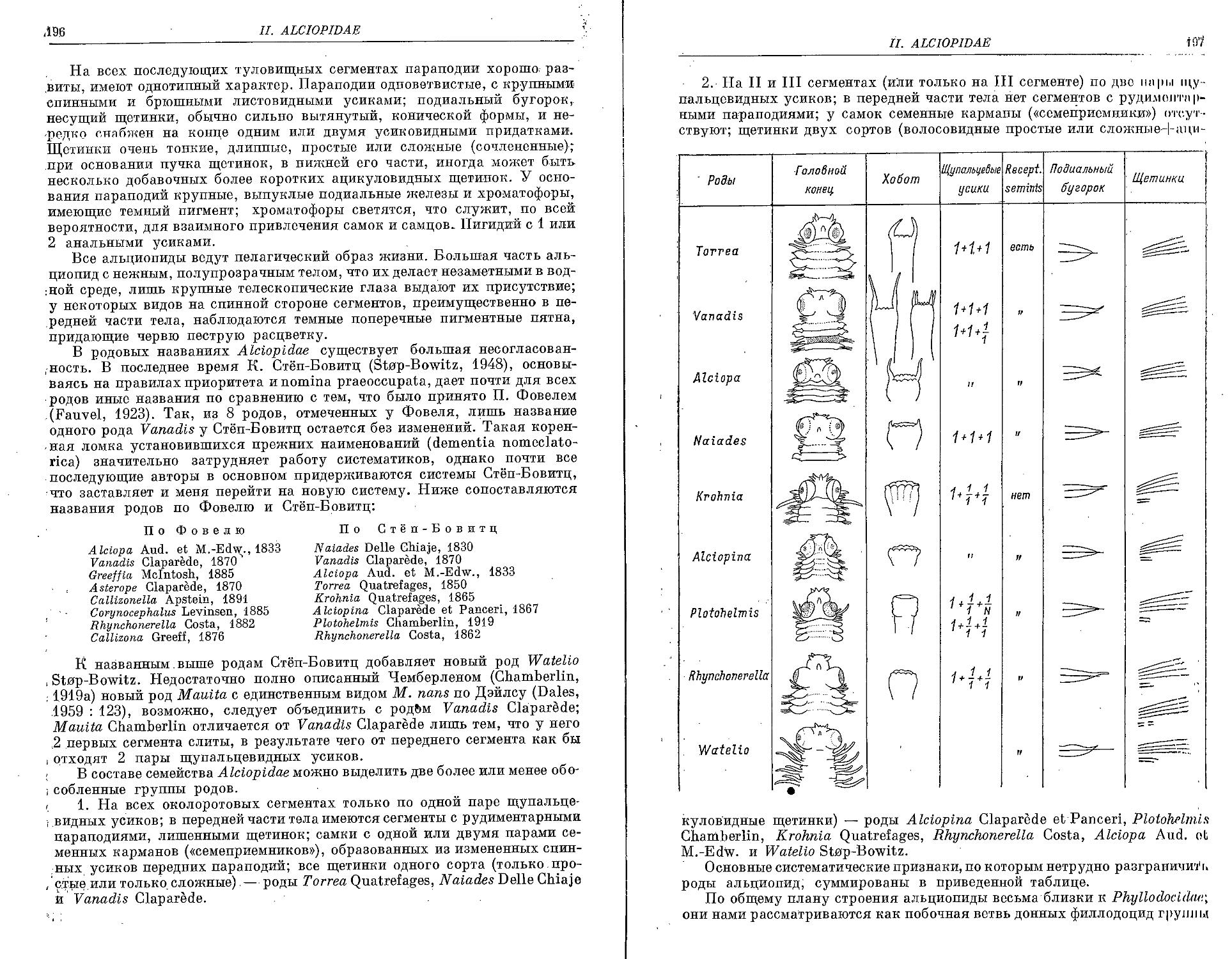
II. Семейство Alciopidae Ehlers, 1864
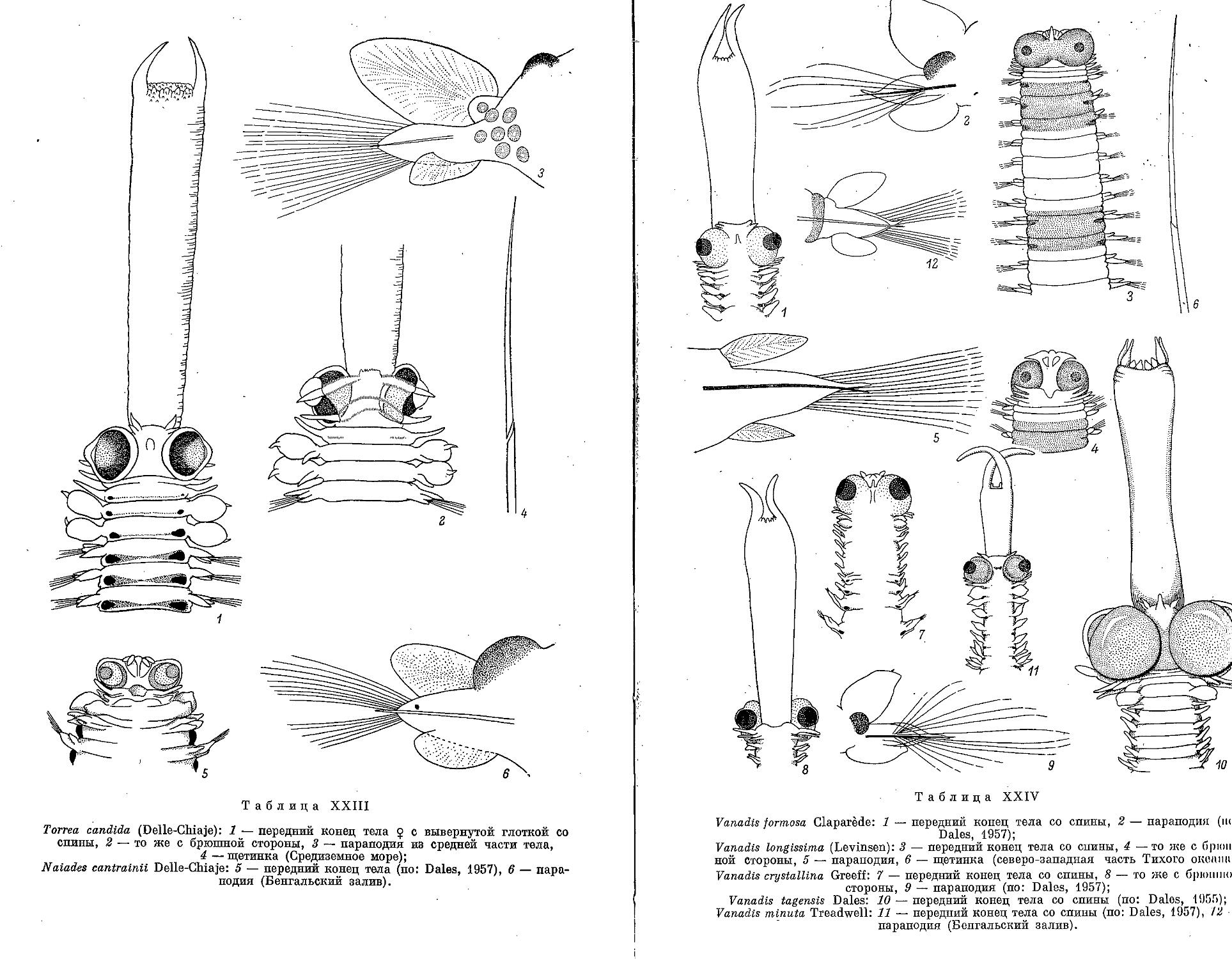
1. Род T о r r e a Quatrefages, 1850
1. T. Candida (Delle Chiaje, 1841)................................... 199
2. Род Naiades Delle Chiaje, 1830
4. N. cantrainti Delle Chiaje, 1830 ................................. 200
3. Род V a n a d i s Claparede, 1870
4. V. formosa Claparede, 1870 ....................................... 202
2. V. longissima (Levinsen, 1885)................................... 203
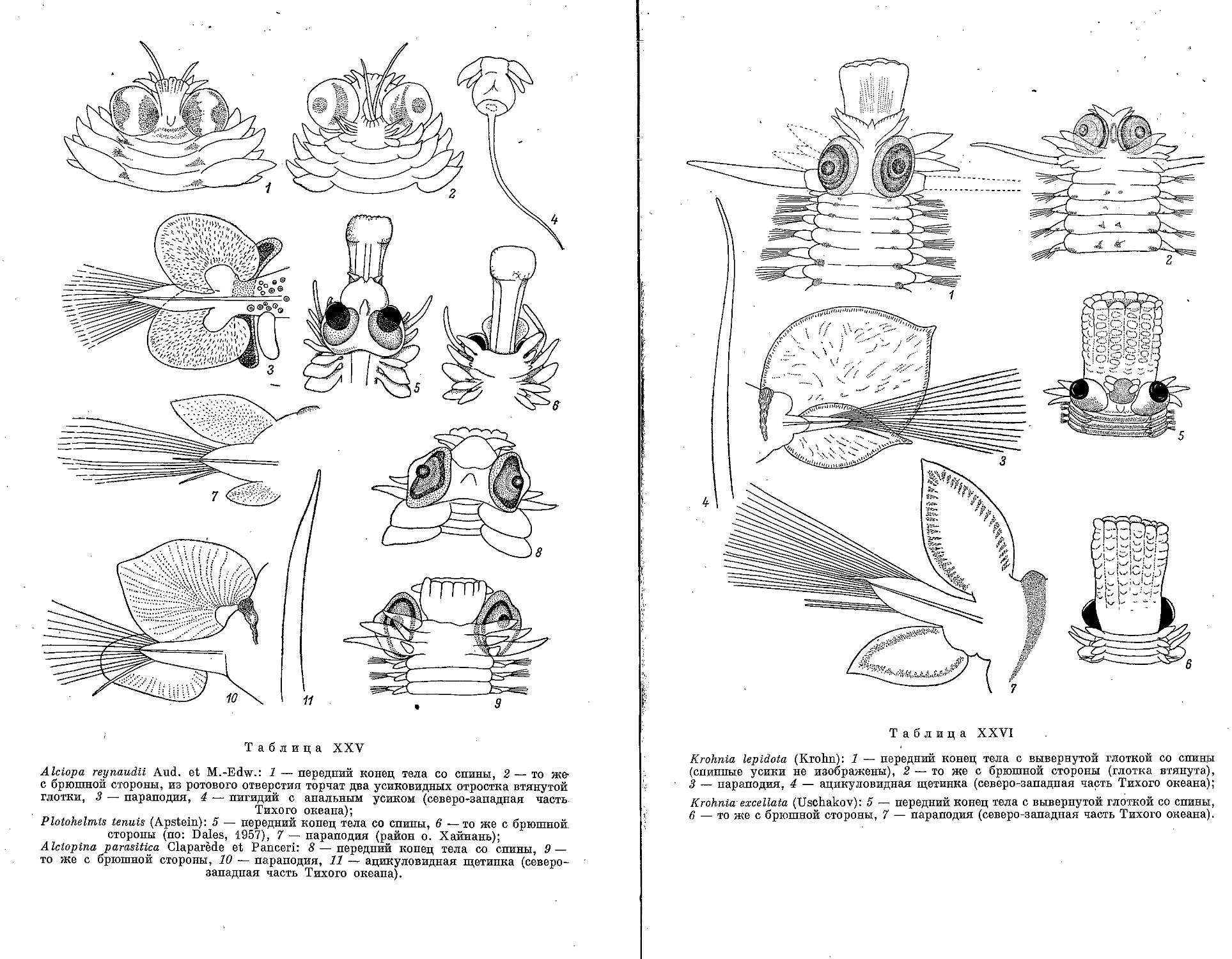
4. Род A I c i о p a Audouin et M.-Edw., 1833
1. A. reynaudii Audouin et M.-Edw., 1833 .......................... 204
8
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ
5. Род Plotohelmis Chamberlin, 1919
1. Р. tenuis (Apstein, 1900)........................................., . 205
6. Род A Iclopina Claparede et Panceri, 1867
1. A. parasitica Claparede et Panceri, 1867 ............................. 206
7. Род К г о h n i a Quatrefages, 1865
1. K. lepidota (Krohn, 1845)............................................. 207
2. K. excellata (Uschakov, 1955)......................................... 208
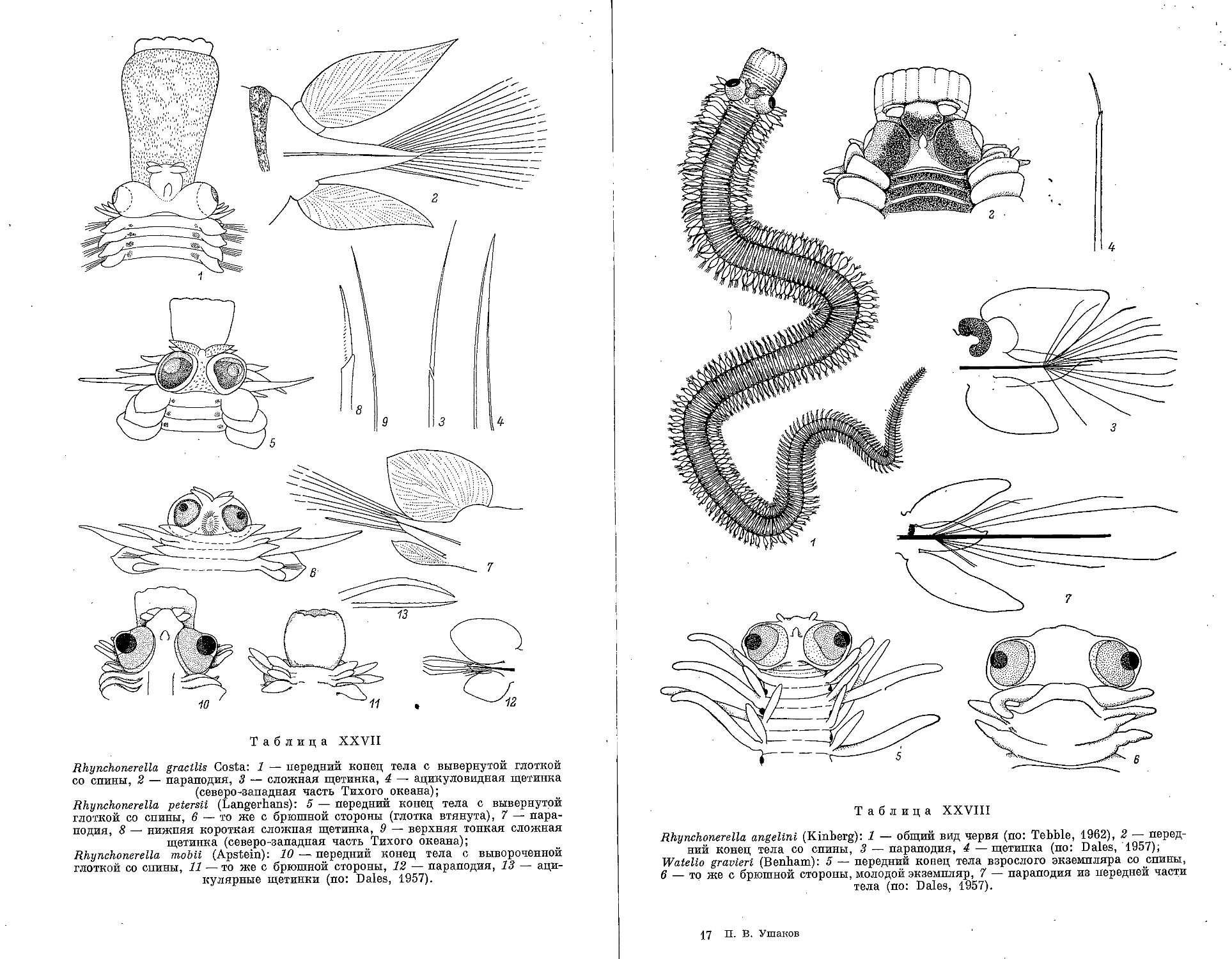
8. Род Rhynchonerella Costa, 1864
1. R. gracilis Costa, 1862 .............................................. 210
2. R. petersii (Langerhans, 1880)............................ ,......... 210
3. R. angelini (Kinherg, 1866) .......................................... 211
9. Р’од W a t e I i о Stnp-Bowitz, 1948
1. W. gravieri (Benham, 1929)............................................ 212
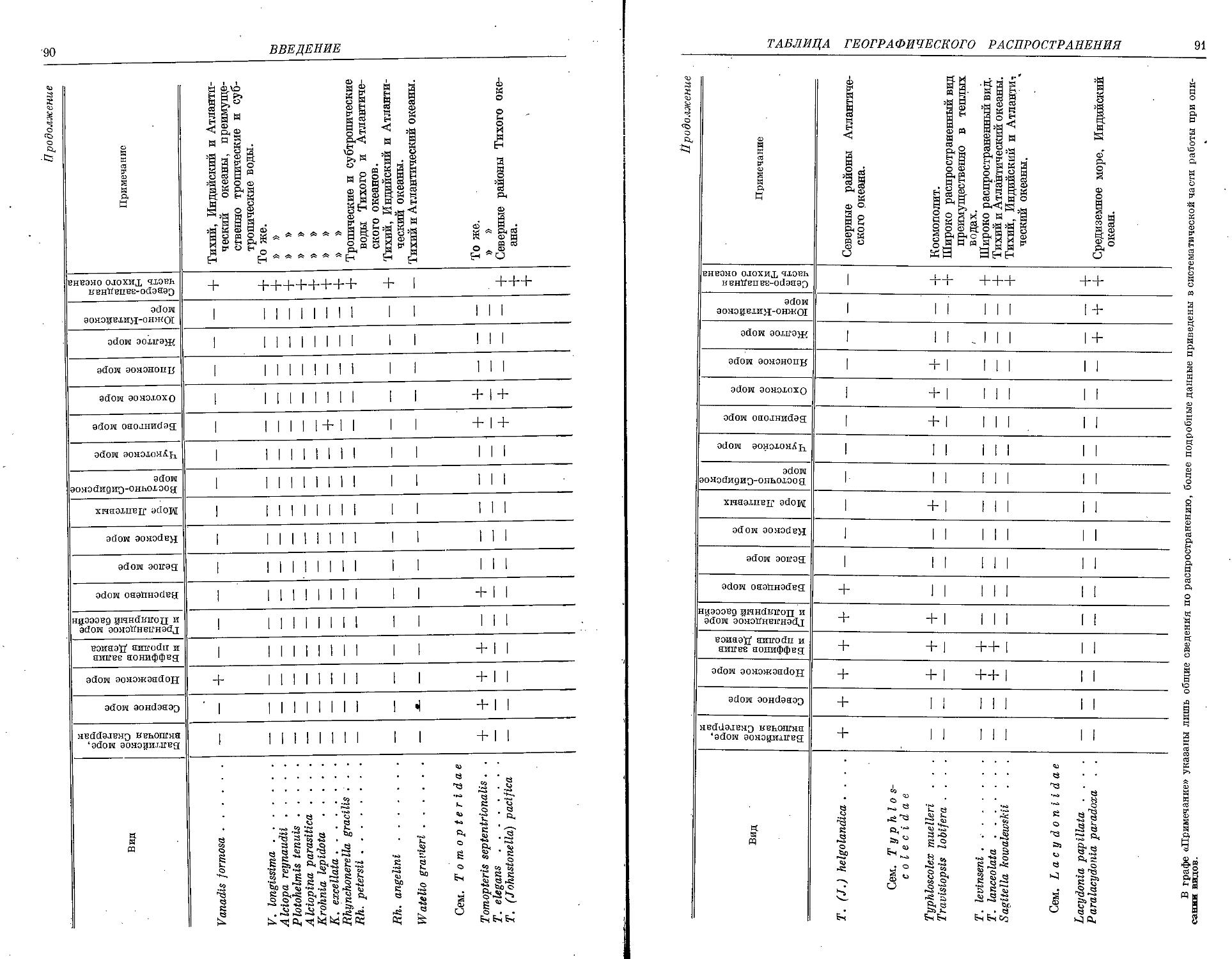
. III. Семейство Tomopteridae Grube, 1848
1. Род Tomopteris Eschscholzt, 1825
Подрод Tomopteris Eschscholzt, 1825, s. str.
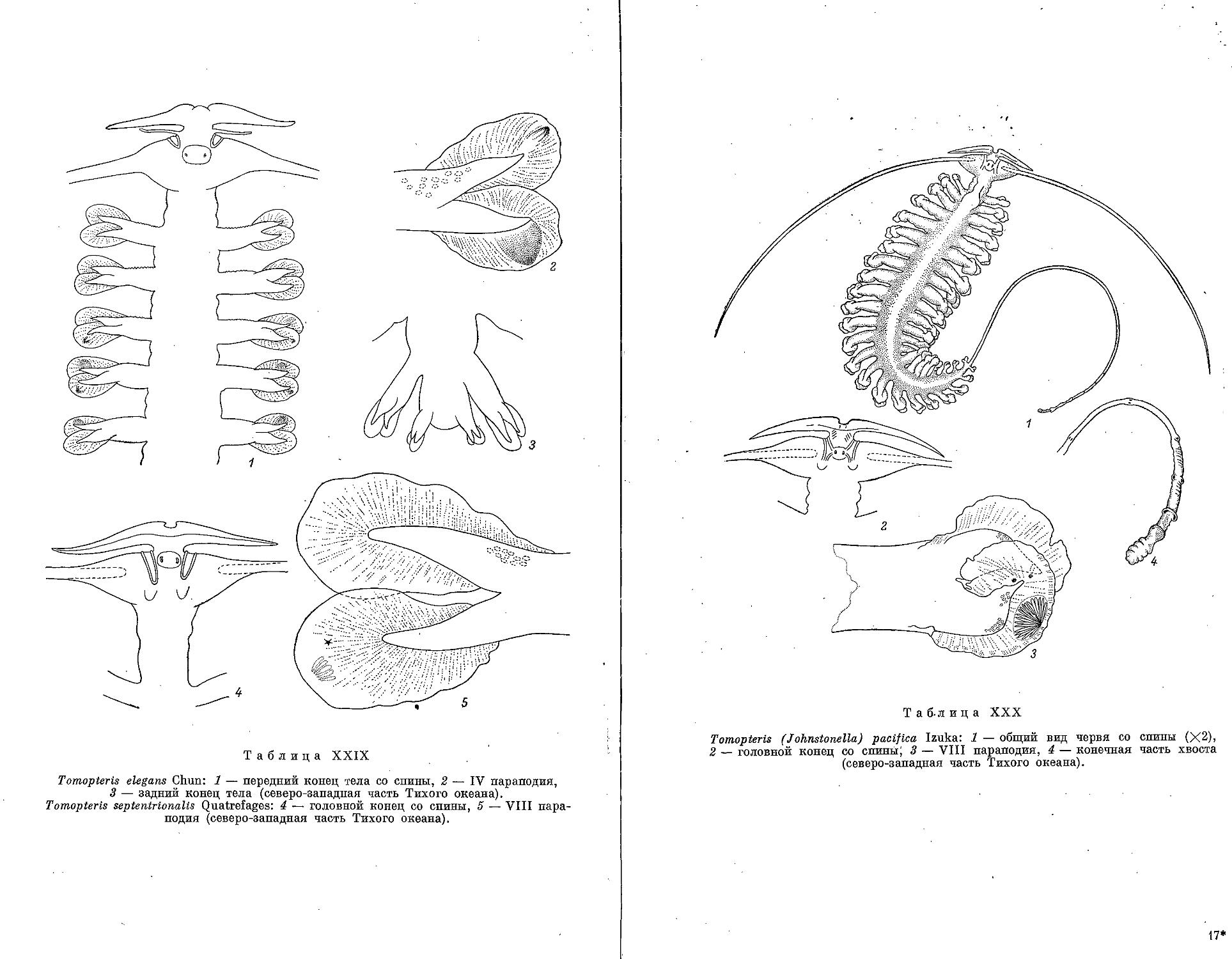
1. T. septentrionalis Quatrefages, 1865 ................................. 216
2. T. elegans Chun, 1888 ............................................... 217
Подрод Jqhnstonella Gosse,1853
3. T. (Johnstonella) pacifica Izuka, 1914................................ 218
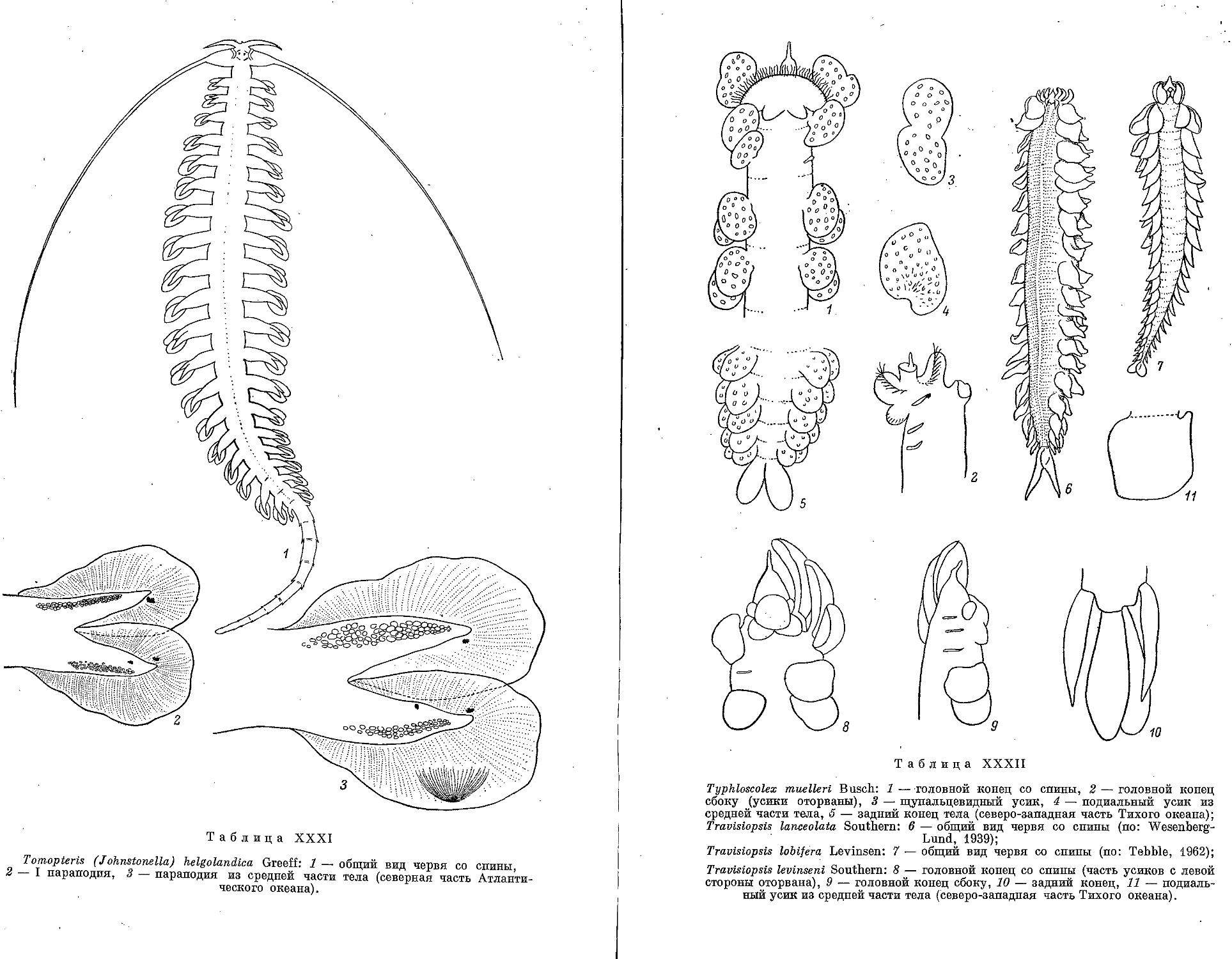
4. T. (J.) helgolandica Greeff, 1879 . .................................. 219
IV. Семейство Typhloscolecidae Uljanin, 1878
1. Род Typhloscolex Busch, 1851
1. T. muelleri Busch, 1851 ............................................ 221
2. Род Travisiopsis Levinsen, 1885
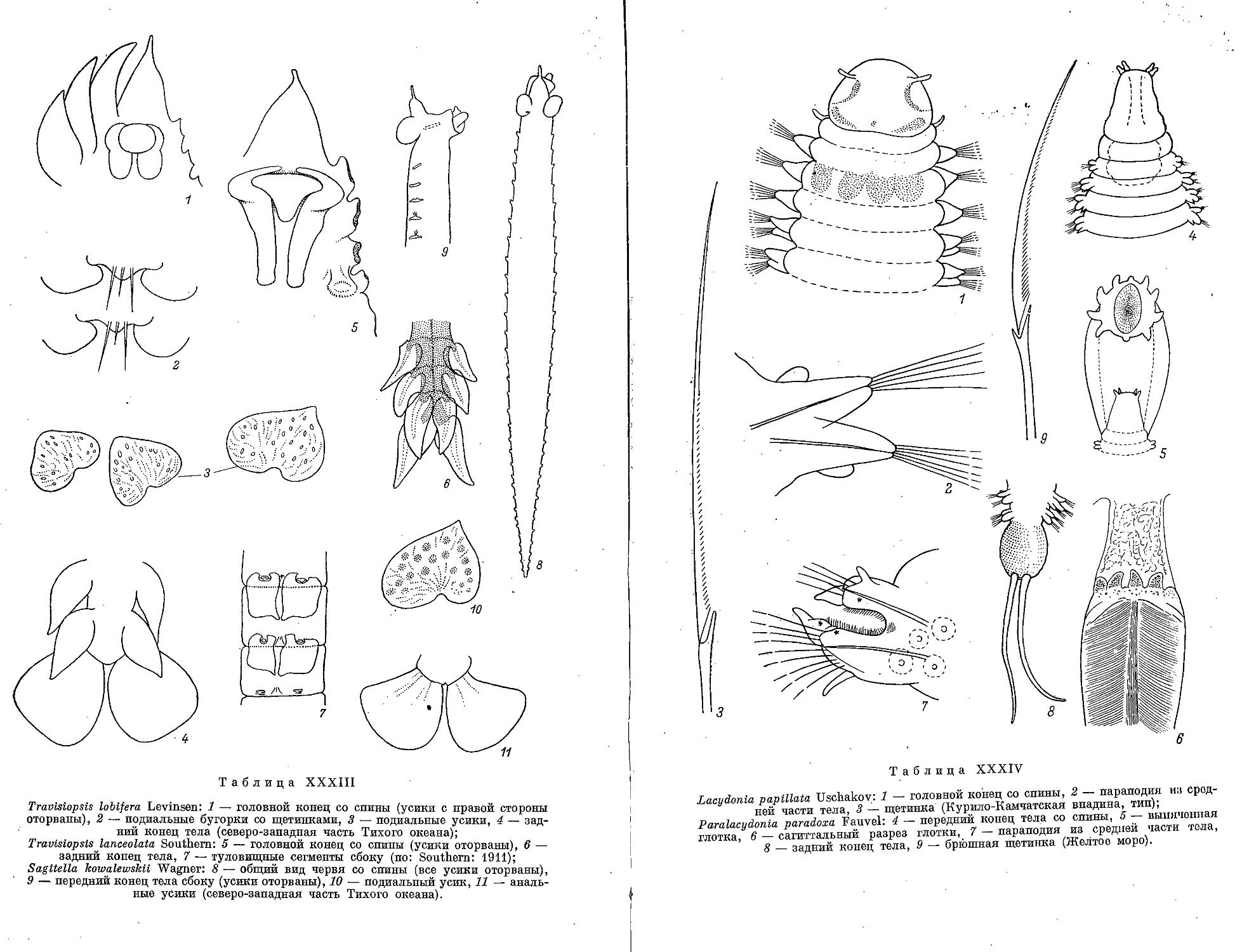
1. T. lobtfera Levinsen, 1885 .......................................... 223
2. T. levinseni Southern, 1910.......................................... 223
3. T. lanceolata Southern, 1910........................................ 224
3. Род S a g i t e I I a N. Wagner, 1872
1. S. kowalewskii N. Wagner, 1872 ................................... 225
V. Семейство Lacydoniidae Bergstrom, 1914
1. Род Lacydonia Marion et Bobretzky, 1875
1. L. papillata Uschakov, 1958 .................................. . . . 227
2. Род Paralacydonia Fauvel, 1913
1. P. paradoxa Fauvel, 1913........................................... ... 228
ВВЕДЕНИЕ
НЕКОТОРЫЕ ОБЩИЕ СВЕДЕНИЯ
Морские кольчецы характеризуются исключительно разнообразным внешним видом, и нет ничего удивительного в том, что они издавна вызывали неподдельное восхищение многих исследователей. Полихеты, безусловно, самые привлекательные беспозвоночные с эстетической стороны, и сухими словами современных таксономистов трудно описать их внешнюю красоту и изящество. А потому позволю себе привести небольшую выдержку из книги Гартвига «Море и его жизнь» (пер. с нем., М., 1860), которая хотя и имеет более чем столетнюю давность, но даёт довольно яркое и правдивое представление о некоторых особенностях многощетинковых червей. Начиная с того, что «со словом червь соединяют обыкновенно понятие несовершенства; червь почитается совсем неинтересным, отвратительным созданием. . .», далее Гартвиг пишет: «Какое изумительное богатство органов! Какое роскошное образование! Верно, здесь неуместна всякая жалоба на скудость или недостаток. По внешнему виду морские кольчецы принадлежат к великолепнейшим созданиям всего животного мира. Радужные отливы колибри, искрящийся, металлический блеск красивейших жуков вы встретите у них. В особенности отличаются красотою свободно живущие роды, которые, подобно змеям, извиваются сквозь трещины скал, или кружатся, ныряют на дне моря, в песке, в тине. Восхищенные ими натуралисты величают их нежными именами языческих божеств: Нереиды, Евфрозины, Альционы, Афродиты». В этой же книге он цитирует и слова Катрфажа, крупнейшего французского специалиста по полихетам начала прошлого века: «Не зовите фиалку символом стыдливости, а взгляните лучше на наших кольчецов. Чего недостает им для блеска! Притом, без всякого сомнения, еще многие неизвестны нам, некоторые только открывают свои тайные чудеса, иные прячутся под камнями, повитыми водорослями, или в песке, в илу морского дна». Эти восторженные слова полностью приложимы и к тем видам, которые описываются, однако не с таким живым энтузиазмом, в моей работе. Пользуясь более современным научным языком, можно все же без всяких преувеличений сказать, что ни в одном классе морских беспозвоночных мы не имеем такой экологической пластичности, такого богатства и разнообразия морфологических структур, как у многощетинковых червей — Polychaeta, относящихся к типу кольчатых червей — Annelida. Это крайне затрудняет, делает даже почти невозможным в сжатой форме охарактеризовать все их особенности.
Роль многощетинковых червей в общей экономике моря огромна. Они представляют собой очень существенное звено во всех процессах продуцирования живого вещества. В частности, они служат основной, при этом высококалорийной, пищей многих промысловых рыб. Один
10
ВВЕДЕНИЕ
грамм сухого вещества Nereis diversicolor .содержит свыше 5.5 тыс. калорий (Виноградов, 1948). Некоторые полихеты используются человеком в качестве прямых продуктов питания. Хорошо известен промысел тихоокеанского палоло (Eunice viridis) в период его массового размножения у островов Фиджи и Самоа, когда в сборе червя участвует почти все население этих островов. В Японии и Вьетнаме употребляется в пищу так называемый японский палоло — Tylorhynchus chinensis (Nguyen-Gong-Tieu, 1931). Многие виды полихет в приморских странах специально собираются как наживка для рыбной ловли (Okuda, 1933). Но имеются и вредные виды, наносящие ущерб народному хозяйству. Например, существенный вред рисовым посевам наносят нереиды, проникающие на рисовые поля и разрушающие корневую систему (Kaburaki, 1926). Отрицательную роль иногда играют многие серпулиды, участвующие в обрастаниях днищ кораблей и различных подводных сооружений, а также портящие слоевища ламинарий и других водорослей, используемых как пищевой продукт. Встречаются также виды, опасные (ядовитые) для здоровья человека (Halstead, 1965).
Многощетинковым червям посвящено огромное количество работ как сравнительно морфологического, так и систематического (таксономического) характера; в последнее время появилось много работ по развитию и размножению, по жизненным циклам и т. д.; многощетинковые черви служат объектами весьма углубленных эколого-физиологических исследований, и уже сделаны первые попытки по их «обучению»; привлекают внимание ученых некоторые вопросы нейросекреции, связанные с явлениями эпитокии; особый интерес вызывает нервная система полихет, которая в некоторых случаях может служить принципиальной схемой для кибернетических расчетов. При всем этом, конечно, не остаются в стороне и вопросы филогении, построения естественной системы и классификации полихет, однако последние, к сожалению, пока находятся на первых ступенях разработки. Поток научной информации по всем этим разделам знаний возрастает с каждым годом.
Полихетами в разных странах мира в настоящее время занимается свыше 200 ученых (см.: Newsletter of Polychaete research, University of Maine, Marine Laboratory, v. 1, 1968; v. 2, 1969). К 1958 г. было описано 1366 родов полихет (принято 720) и 10 812 видов (принято 5341), а за последние пять лет дополнительно описано более 100 новых родов и около 1000 новых видов (Hartman, 1959, 1965а). Количество семейств около 70. Но этими цифрами, конечно, не исчерпывается все разнообразие фауны полихет. Много интересных мелких полихет недавно было обнаружено и будет еще найдено при изучении прибрежной интерстициальной фауны, а особенно большие и неожиданные дополнения, надо думать, будут получены при детальном исследовании глубоководной фауны, используя для этого новые, более совершенные орудия лова»
НЕБОЛЬШОЙ ИСТОРИЧЕСКИЙ ЭКСКУРС
Уже Линнеем в «Systema naturae» (1767, 12-е издание) были отмечены Nereis maculate, и N. viridis, которые в настоящее время считаются типами двух основных родов филлодоцид — Phyllodoce Savigny и Eulalia Savigny. Несколько позже, в 1780 г., в «Fauna Groenlandica» Фабрициус (Fabricius) описал Nereis flava, в дальнейшем послужившим типом для третьего рода филлодоцид — Eteone Savigny.
Филлодоциды были выделены в обособленную группу впервые А. Орсте-дом (Oersted, 1843 : 25). Этот исследователь известные к тому времени
СОСТОЯНИЕ РАБОТ ПО СИСТЕМАТИКЕ ФИЛЛОДОЦИД И
роды филлодоцид Phyllodoce, Eulalia, Eteone sNotophyllum объединил в особое «divisio Phyllodoceae», но он рассматривал их в-общем составе семейства Nereidae, которое в тот период понималось очень широко и включало также представителей Alciopidae, Syllidae, Hesionidae, Glyceridae и Nephthyidae. Первая наиболее дробная система полихет была разработана А. Грубе (Grube, 1850).1 В частности, он предложил самостоятельное семейство Phyllodocea, однако оставил в нем роды, относимые ныне к семействам Hesionidae и Alciopidae. Последние окончательно были отделены от филлодоцид лишь Э. Элерсом (Ehlers, 1864) и А. Мальмгреном (Malmgren, 1865, 1867). Семейство Tomopteridae выделено тем же Грубе, причем для него он создал особую группу Gymnocopa, которая противопоставлялась Ghaetopoda, включавшей все остальные семейства полихет. Семейство Туphloscaleddae установлено русским зоологом В. Ульяниным (Uljanin, 1878).
Литература по рассматриваемым в настоящей работе семействам полихет огромна и здесь нет возможности дать полный исторический обзор всех исследований. Однако все же хотелось бы особо отметить работу Ш. Гравье (Gravier, 1896), посвященную филлодоцидам. Хотя она опубликована давно и в некоторых отношениях значительно устарела, в ней впервые были подробно освещены основные сравнительно-анатомические особенности данной группы червей. Несколько позднее специальная монография по филлодоцидам опубликована Э. Бергштрёмом (Bergstrom, 1914). В ней была предложена весьма дробная классификация родов, не всегда вполне оправданная. К сожалению, в этой монографии допущены и некоторые неточности чисто систематического характера. Из более новых исследований, преимущественно таксономического характера, содержащих многочисленные сведения по филлодоцидам атлантического и тихоокеанского побережий Северной Америки, следует указать работы Э. и К. Беркли (Е. Berkeley а. С. Berkeley, 1942—1964), О. Гартман (Hartman, 1936—1968), М. Петтибон (Pettibone, 1963). Полихеты района Японии подробно рассмотрены в монографии М. Имаджима и О. Гартман (Imajima a. Hartman, 1964).
Пелагическим полихетам посвящен ряд специальных исследований, и они обычно изучались отдельно. Большое значение для понимания систематики пелагических полихет имеют работы П. Фовеля (Fauvel, 1916), Е. Везенберг-Лунд (Wesenberg-Lund, 1935, 1939), К. Стёп-Бовитца (Stop-Bowitz, 1948), Р. Дэйлса (Dales, 1955а, 1957) и Н. Тэббла (ТеЬЫе, 1962).
СОВРЕМЕННОЕ СОСТОЯНИЕ РАБОТ ПО СИСТЕМАТИКЕ ФИЛЛОДОЦИД
Широкий размах экспедиционной деятельности и связанное с этим обилие фаунистических материалов ставит перед систематиками вполне определенную задачу: найти внешние, достаточно надежные и удобные морфологические признаки, позволяющие быстро разграничивать виды и более мелкие таксономические единицы. Огромное количество новых видов, описанных за последние десятилетия, значительно осложнило многие вопросы систематики, и, казалось бы, достаточно четкие классификации отдельных семейств уже перестали удовлетворять и отвечать нашим современным знаниям. Таксономия и систематика — понятия не вполне однозначные: таксономия лишь описание основных признаков
1 В работе А. Катрфажа (Quatrefages, 1865) приведен краткий исторический обзор различных систем классификации аннелид, начиная с Кювье и Ламарка.
12
ВВЕДЕНИЕ
(диагностика), а систематика включает некоторые вопросы построения естественной системы, т. е. попытку выяснения возможных филогенетических отношений. Но для последнего совершенно необходимы сравнительно-анатомические исследования, каковых еще очень мало. В частности, для построения естественной системы филлодоцид большое значение имеет характер строения нервной системы передних сегментов,, на что указывал еще Прюво (Pruvot, 1883), но таковая в сравнительном аспекте остается изученной крайне слабо. В основном современным систематикам приходится довольствоваться лишь внешними морфологическими признаками, в ряде случаев весьма ненадежными.
Филлодоциды, в особенности донные, для систематиков представляют собой одну из наиболее трудных и в некоторых отношениях неблагодарных групп. Они характеризуются крайне небольшим разнообразием морфологических признаков. Все они имеют единый, относительно простой план строения и все это сильно затрудняет их определение, в частности, когда имеешь дело с фиксированным материалом.
Основные морфологические признаки, принимаемые во внимание при описании филлодоцид, следующие: форма головной лопасти, головные щупальца, характер перистомиальных сегментов (насколько четко они отделены друг от друга и от головной лопасти), количество и расположение перистомиальных усиков, строение хобота, форма параподий с их спинными и брюшными усиками, щетинки и анальные усики. Все эти морфологические особенности в сравнительном аспекте довольно подробно рассматриваются в нашем кратком морфо-функциональном очерке (стр. 13—49). Для видовой диагностики большое значение имеет окраска тела и придатков, но у фиксированных экземпляров она сохраняется плохо и нередко при длительном хранении в спирте исчезает нацело. Следует также иметь в виду, что многие перечисленные выше признаки очень вариабельны, к тому же форма мягких придатков нередко зависит от характера фиксации.
Для точного описания вида необходимо иметь дело с живым материалом, а такая возможность предоставляется далеко не всегда. К сожалению, все наши исследования в основном выполнены на спиртовом коллекционном материале, причем некоторые фиксированные экземпляры были деффектными, т. е. не всегда имели все подиальные и головные придатки, которые легко отпадают при фиксации. Лишь при работе на Мурманских биологических станциях в Кольском заливе и Дальних Зеленцах, а также отчасти в Японском и Желтом морях и на о. Хайнань я имел дело с живыми экземплярами, что позволило мне более детально познакомиться с их морфологией, экологией и биологией.1
1 Для длительного содержания червей в неволе, помимо обычных садков, можно рекомендовать небольшой портативный аквариум с продуванием, предложенный Д. Рейшем (Reish, 1966). Для анестезии червей в морскую воду добавляют сернокислый или хлористый магний до получения 4—8%-го раствора, в котором червей выдерживают от 10 мин. до 1 часа (в зависимости от их величины). При этом у них довольно быстро освобождается кишечник от содержимого, а глотка непроизвольно-выворачивается наружу; если выпячивания глотки не происходит, следует произвести легкое надавливание пинцетом на переднюю часть тела. Анестезия червей достигается также помещением их в смесь из 1 части спирта и 10 частей морской воды. Для сохранения прижизненной окраски Ж. Беллан (Bellan, 1964) предложил фиксировать и хранить червей в следующей смеси: 450 частей морской воды, 400 частей пресной воды и 150 частей продажного 40%-го формалина, предварительно нейтрализовав; эту жидкость карбонатом кальция, доведя pH до 7; по его опыту даже при очень долгом (свыше 15 лет) хранении черви хорошо сохраняют окраску и достаточную мягкость тела.
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК 13
Как в старой литературе, так и в более поздних работах некоторые виды описаны крайне кратко и по существу представляют собой incertae sedis. В силу слабой разработанности диагностических признаков не исключена возможность, что в ряде случаев под одним и тем же видовым названием объединяются различные подвиды. В результате этого для многих видов отмечено чрезвычайно широкое географическое распространение, что при более тщательном изучении может не подтвердиться. Значительный интерес в дальнейшем представило бы сравнительное изучение на массовом материале популяций широко распространенных видов из экстремальных районов их ареала. В частности, это относится к таким банальным видам, как Eulalia vlrtdls и Eumida sanguinea, отмеченным для весьма различных районов Мирового океана. Исследований по внутривидовой изменчивости полихет вообще крайне мало.'
По мировому каталогу видов, составленному О. Гартман (Hartman, 1959, 1965) в настоящее время семейство Phyllodocidae насчитывает 29 родов и около 250 видов, Alciopidae соответственно 10 и 42, Lopadorhynchi-dae — би 21, Lacydoniidae — 3 и 6, Jospilidae — 4 и 7, Pontodoridae — 1 и 1, Typhloscolecidae — 3 и 14, Tomopteridae — 2 и 40. Здесь мы придерживаемся несколько иной классификации по сравнению с указанным выше каталогом, и Lopadorhynchidae, Jospilidae и Pontodoridae трактуются нами как подсемейства внутри Phyllodocidae s. lato (подробнее об этом говорится в главе о филогенетических отношениях в пределах семейства Phyllodocidae — стр. 71).
КРАТКИЙ МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК Размеры и форма тела
Среди Phyllodocidae имеются крохотные формы, например, пелагическая Pedinosoma curturn и многие представители интерстициальной фауны — Hesionura [=Eteonldes] jragilis~a др., измеряемые всего 1—2 мм. Но существуют и настоящие гиганты, как Phyllodoce laminosa, длина которого достигает свыше 750 мм. Наиболее обычная средняя величина большинства донных филлодоцид около 50—100 мм. Среди Alciopidae встречаются как виды с относительно коротким телом, не превышающим 20—30 мм (Plotohelmis tenuis'), так и виды, достигающие в длину свыше 300 мм ( Vanadis formosa). К сожалению, в планктонных материалах редко сохраняются целые экземпляры альциопид. Наиболее крупный когда-либо пойманный Tomopteris имел в длину 135 мм (ТеЬЫе, 1962 : 386), обычно же они имеют 20—40 мм. Все Typhloscolecidae — относительно небольшие черви — не свыше 30 мм, причем Typhloscolex muellerl, как правило, менее 5—7 мм. Довольно редко встречающиеся Lacydoniidae также никогда не достигают сколь-нибудь значительных размеров: максимальная их длина 40 мм.
Весьма разнообразные размеры червей наблюдаются и в других семействах. Так, среди Eunicidae s. lato наряду с карликовыми Ophryotrocha (менее 10 мм) встречается Eunice gigantea длиной до 1 и даже 3 м. Гигантских размеров среди Aphroditidae s. lato достигают некоторые Polyodontes (до 1 м длины). Аналогичные примеры можно было бы привести и для столь высоко специализированных семейств, как Sabellidae и Serpulidae.
Наиболее крупные филлодоциды имеют и наибольшее количество сегментов (у Phyllodoce laminosa их до 800); то же можно сказать и о Eunicidae. Однако это, конечно, не есть общее правило для всех полихет. У Aphroditidae s. lato размер тела не зависит от количества сегментов!
14
ВВЕДЕНИЕ
так, длина тела у Eulagisca gigantea свыше 150 мм, а у Harmothoe Imbricata всегда мепее 50 мм, в то время как количество сегментов у них одинаковое — 37—38; далее, Laetmatonice producta с 42—50 сегментами достигает свыше 135 мм, a Pholoe minuta с 70 сегментами — не более 20 мм.
Длина филлодоцид зависит от состояния их кожно-мускульного мешка. При передвижениях они сильно вытягиваются, причем с удлинением тела одновременно происходит и его сужение, а при укорочении — утолщение всего туловища или отдельных его частей. Однако объем тела всегда сохраняется постоянным. Основную опорную (скелетную) функцию у полихет выполняют не наружные покровы, а целомическая жидкость, которая в результате сокращения мышц может перекачиваться у видов со слабо развитыми диссепиментами из одной части тела в другую.
Для донных филлодоцид характерно сильно вытянутое тело, несколько расширенное на переднем конце и постепенно заостряющееся к заднему; оно заметно сплющено дорсо-вентрально, причем спинная сторона более выпуклая, чем брюшная. На брюшной стороне иногда наблюдается продольный медиальный желобок, облегчающий в какой-то степени ползание по грунту. Такая «червеобразная» форма тела характерна и для представителей многих других семейств, ведущих свободный подвижный образ жизни. Однако бывают полихеты с очень коротким и широким, овальным или яйцевидным телом (некоторые Amphinomidae), которое лишь незначительно изменяется при ползании червей. Постоянная форма тела наблюдается у многих Aphroditidae, что следует рассматривать как прогрессивный момент в эволюции полихет.
Исключительно разнообразная форма тела у многих тубикольных червей, что всецело обусловлено особенностями жизни в прикрепленных и переносных трубках. У них различные участки тела, выполняющие разные функции, нередко по своей внешней морфологии резко отличаются друг от друга, например, у Chaetopteridae, Sabellariidae, Pectinariidae и др. (см. стр. 21). Форма тела у донных филлодоцид наиболее простая. Это вполне соответствует их общему примитивному строению, которое хорошо выражено как во внешней морфологии (гомономность сегментов, упрощенное вооружение головы, одноветвистые параподии и т. д.), так и во внутренней организации (протонефридии, отсутствие разветвленной кровеносной системы, субэпителиальное положение брюшной нервной цепочки), а также примитивности онтогенеза и типов личинок, о чем речь будет в последующих разделах настоящей главы.
Окраска и покровительственное еез. начение
Многощетинковые черви иногда имеют очень пеструю окраску со сложным цветовым рисунком, который с трудом поддается описанию; нередко различные части тела окрашены по-разному. Покровы у большинства полихет сильно иризируют — имеют особый металлический отблеск и отливают всеми цветами радуги, что определяется микроструктурой их кутикулярного слоя. Окраска нередко связана с наличием в кожных покровах специфических пигментов, в частности, зеленый цвет Eulalia vtridis обусловлен филлодоцином. При тонком кутикулярном слое часто просвечивают внутренности — кишечник и его содержимое, половые продукты, кровяная жидкость и т. д. Окраска червей иногда варьирует в зависимости от степени зрелости половых продуктов, и у половозрелых самцов и самок она может быть разной. Например, половозрелые самки
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК 15
Eteone longa имеют темно-зеленую или коричневую окраску, а самцы — светло-бежевую. В этом отчасти проявляется половой диморфизм, который у филлодоцид, однако, никогда не бывает столь резко выраженным, как у силлид, спионид и в некоторых других семействах.
Насколько разнообразна окраска филлодоцид, отчасти свидетельствуют их весьма удачные видовые названия: Eulalia viridis — преимущественно ярко-зеленого цвета, Eumida sanguinea — с доминирующими красноватыми оттенками, Phyllodoce maculata — имеет пятнистый шахматный рисунок серого цвета, Eteone (Mysta) picta — с пятнистым рисунком в виде многочисленных-мелких поперечных пятнышек на каждом сегменте, Е. lactea — молочно-белого или бежевого цвета, и т. д. Некоторые филлодоциды ярко-оранжевые, другие цвета киновари, причем спинные усики у них обычно окрашены несколько иначе (темнее или светлее), чем спинная сторона. Цветовой рисунок у всех филлодоцид, как правило, остается неизменным вдоль всей длины тела. Окраска тела и придатков имеет большое систематическое значение, но в спирту, к сожалению, быстро выцветает. Следует отметить, что у филлодоцид наиболее яркая окраска наблюдается у форм, живущих среди донной растительности, а у глубоководных и зарывающихся в грунт видов более однообразная, в большинстве случаев бледно-бежевая или палевая.
Чрезвычайно яркая пестрая окраска, например «венчика щупалец» сабеллид, возможно, производит отпугивающий эффект (защитная роль?), в большинстве же случаев мы имеет дело с покровительственной (крипти-ческой) окраской. Так, в частности, преобладающая у филлодоцид зеленоватая и темно-бурая окраска прекрасно укрывает их среди водной растительности, а совершенно прозрачное как кристалл тело пелагических полихет делает их совершенно незаметными в водной толще: многие альцио-пиды распознаются лишь по темным телескопическим глазам, а томопте-риды — по небольшим темно-оранжевым розетковым органам на плавничках.
Маскировка полихет достигается и более сложными путями. Элитры некоторых афродитид, помимо пестрой окраски, имеют очень сложную скульптуру и на них иногда поселяются мелкие гидроиды и мшанки, в результате чего сами черви становятся незаметными на общем фоне субстрата. Наружные покровы роющихся в песке форм бывают с помощью специальных кожных желез настолько густо и прочно обклеены мелкими песчинками (Psammolyce, Brada, Stylarioides и некоторые другие), что червей лишь с большим трудом удается обнаружить в грунте. Иногда имеет место и настоящая мимикрия, т. е. внешнее сходство с другими хорошо защищенными животными. Это отчасти наблюдается у комменсалов губок Euphrosyne и Spinther. Губки защищены не только скелетом из игол, они по некоторым данным выделяют в воду особые ядовитые вещества. Попутно отметим, что закапывающиеся в грунт Travisia forbesii и A ricia foetida сами издают резкий, неприятный запах сероводорода, который, служит защитным действием. У филлодоцид подобного рода явления не наблюдаются; у них имеет место лишь самая обычная покровительственная (критическая) окраска.
Биолюминесценция
Биолюминесценция — излучение довольно яркого света фиолетовых, голубых и зеленоватых оттенков, отмечена для многих полихет как эр-рантных, так и седентарных: Alctopidae, Tomopteridae, Aphroditidae, Syllidae, Chaetopteridae, Cirratilidae и Terebellidae. Биолюминесценция среди Alciopidae наблюдалась у Corynocephalus и Calizonella (=Krohnia),
16
ВВЕДЕНИЕ
но она, надо думать, имеет место и у других видов этого семейства. У Tomoptertdae светятся специальные розетковые органы на параподиях, состоящие из желтых фотогенных клеток, окруженных слоем из высоких прозрачных клеток, под которыми располагается ганглий, дающий отростки к прозрачным клеткам (свечение, по-видимому, внутриклеточное). По всей видимости, светятся Pontodora pelagica и другие мелкие пелагические филлодоциды. Наиболее подробно среди эррантных червей процессы биолюминесценции изучены для афродитид (Bonhomme, 1942; Nicol, 1953, 1954; Коштоянц, 1957).
Биологический смысл биолюминесценции заключается во взаимном привлечении самок и самцов, что для пелагических форм, не образующих плотных популяций, имеет огромное значение. У многих силлид явление биолюминесценции наблюдается лишь в период эпитокии — «роения», или «брачных танцев», т. е. именно тогда, когда самкам надлежит встретиться с самцами.
У донных полихет свечение иногда служит защитной реакцией. В одних случаях это просто отпугивающий эффект, в других — более сложный. Так, при нападении на полипоид у них мгновенно „загораются11 задние элитры, которые червь тотчас же сбрасывает (пример автотомии), и, пока эти элитры продолжают некоторое время излучать свет, сам червь «обманным путем» незаметно ускользает от врага.
Наружные покровы, слизистые чехлики и трубки
Многощетинковые черви характеризуются мягкими наружными покровами, которые не несут прямых скелетных функций, и в соответствии с этим у них никогда не наблюдается линька, связанная с ростом, столь типичная для членистоногих и некоторых круглых червей, у которых их наружные покровы служат основным скелетом. Упругость тела полихет всецело определяется внутренним тургором полостной жидкости, изолированной от внешней среды («гидравлический скелет»).
Кожный (эпидермальный) покров полихет состоит из однослойного рпителия, который сверху прикрыт эластичной кутикулой, а изнутри подостлан тонкой базальной мембраной, или перепонкой, гомогенной структуры. Кутикулярный слой сложен из тончайших фибрилл, скрещивающихся под прямым углом, что и обусловливает особый металлический (радужный) отблеск покровов многих червей.
Ресничный эпителий, весьма характерный для более низкоорганизованных паренхиматозных червей (плоских червей, немертин), у полихет- строго локализован и встречается преимущественно на головных и подиальных придатках, жаберных отростках и т. д., а также на дне чувствительных ямок и бороздок (нухальных органов). У филлодоцид мерцательный эпителий представлен относительно богато и в какой-то степени способствует постоянному омыванию кожных покровов, через которые осуществляются процессы дыхания. Поля мерцательного эпителия у филлодоцид имеются на подиальных выростах, опоясывая их характерными лентами. Особенно обширны они на спинных усиках, причем у видов рода Phyllodoce они концентрируются на задней стороне усиков у нижнего края, образуя выпуклые широкие валики с серией мембран из склеенных ресничек. Кроме того, мерцательный эпителий у филлодоцид имеется и на спинной стороне самих сегментов в виде многочисленных обручей, совпадающих в большинстве случаев со вторичной кольчатостью. Подобные поперечные пояски на спинной
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
17
стороне сегментов наблюдаются также у . некоторых мелких силлид, а среди Eunicidae — у Ophryotrocha puerilis, которая многими рассматривается как неотеническая форма. Такие же ресничные поля отмечены для большинства архионнелид — Protodrilus, Nerilla и др. Личинки
полихет нередко имеют сплошной покров из мерцательного эпителия.
Сохранение у взрослых филлодоцид во многих местах их покровов большого количества ресничного эпителия отчасти свидетельствует о' примитивной природе этих червей.
В эпидермальном слое, между опорными эпителиальными клетками, имеющими удлиненную призматическую или кубическую форму, находятся многочисленные чувствительные клетки и большое количество железистых клеток, выделяющих обильную слизь, которая секретируется наружу через мельчайшие поры, пронизывающие кутикулу. Железистые клетки у филлодоцид разбросаны в кожном покрове равномерно. В редких случаях 2 или 3 железистые клетки группируются вместе, лишь у основания параподий при экскреторной поре иногда наблюдаются плотные их скопления наподобие железистых органов.
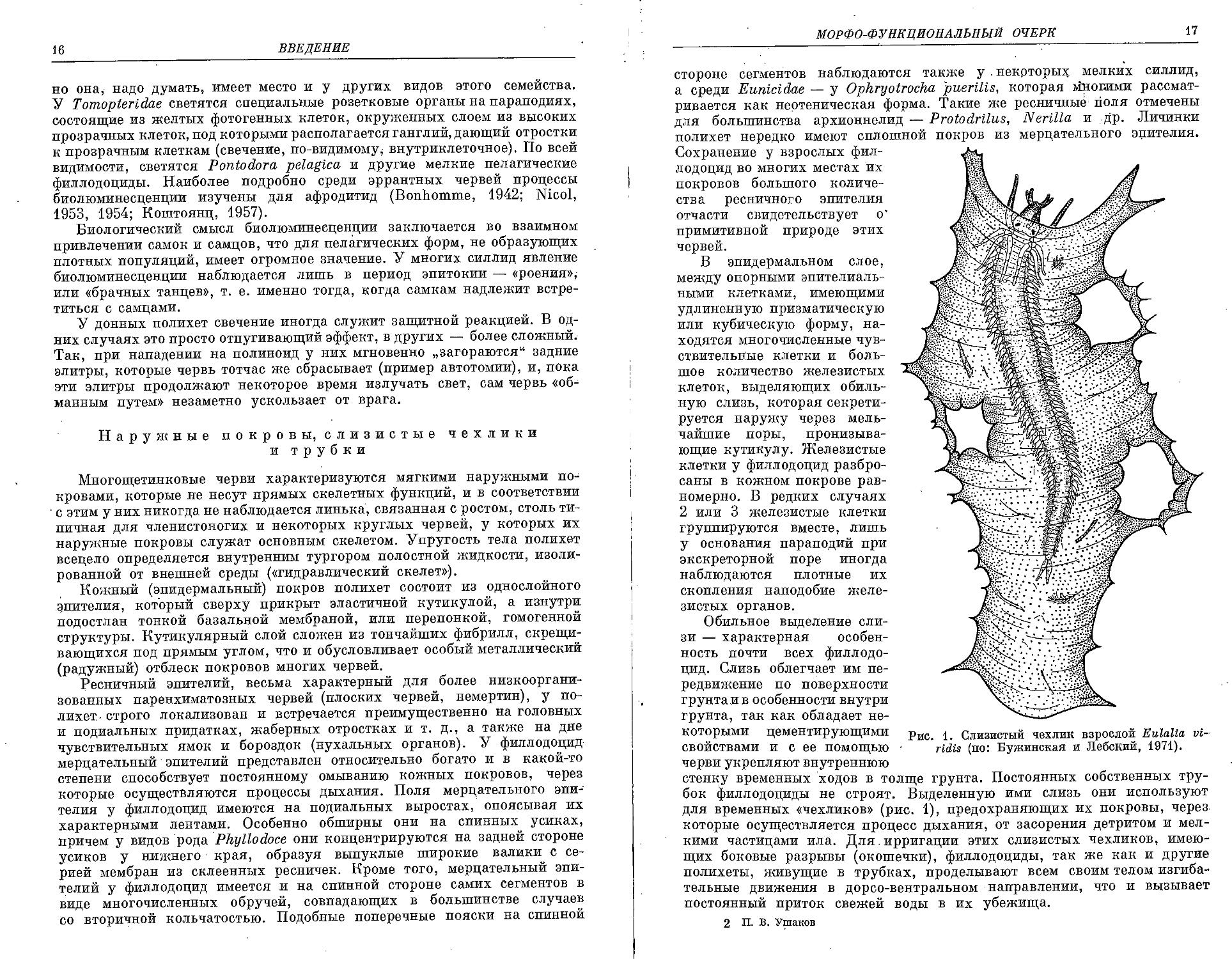
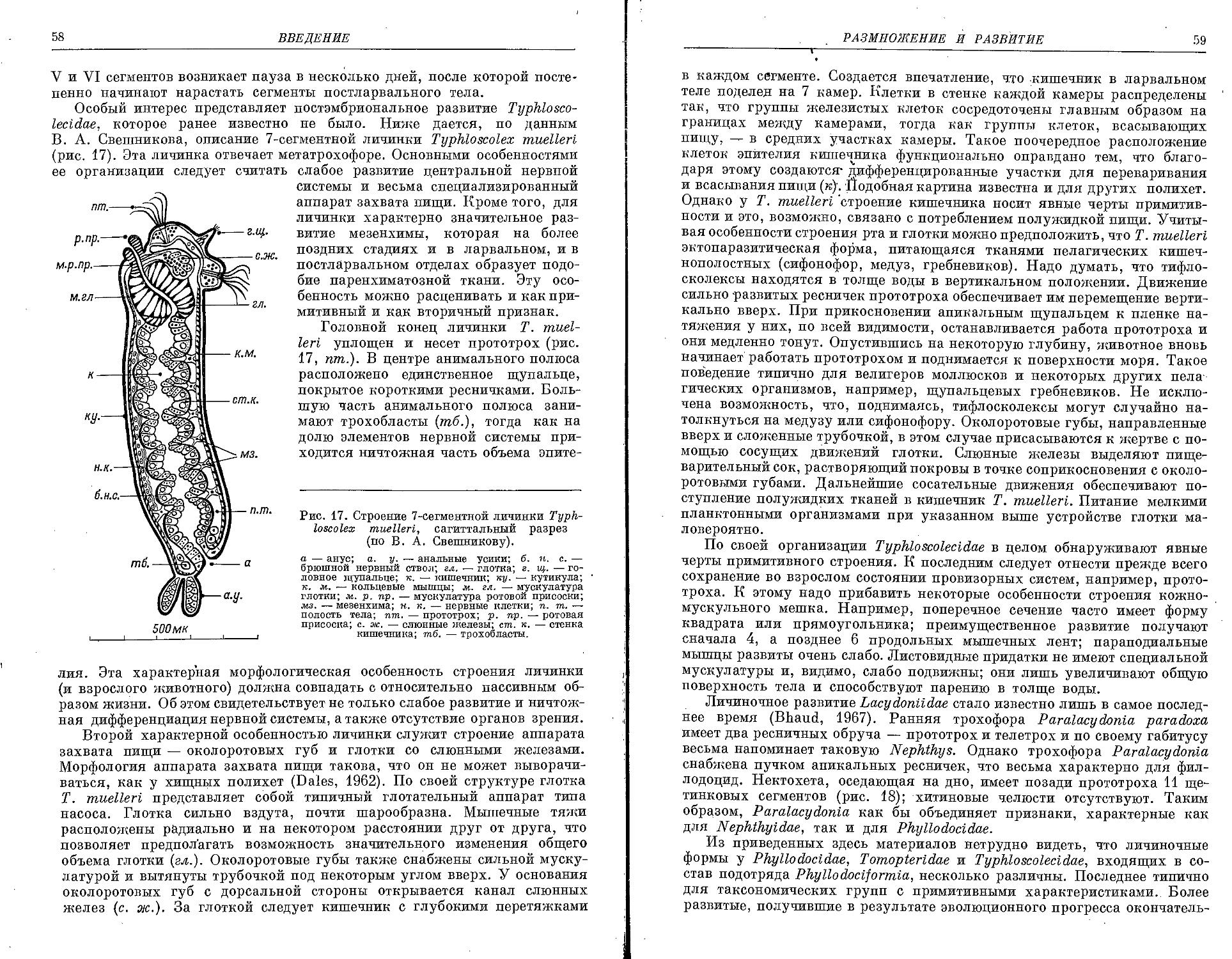
Обильное выделение слизи — характерная особенность почти всех филлодоцид. Слизь облегчает им передвижение по поверхности грунтаив особенности внутри грунта, так как обладает не
которыми цементирующими Рис. * слизистый чехлик взрослой Eulalia vi-своиствами и с ее помощью ridis (по: Вужинская и Лебский, 1971). черви укрепляют внутреннюю
стенку временных ходов в толще грунта. Постоянных собственных трубок филлодоциды не строят. Выделенную ими слизь они используют для временных «чехликов» (рис. 1), предохраняющих их покровы, через которые осуществляется процесс дыхания, от засорения детритом и мелкими частицами ила. Для. ирригации этих слизистых чехликов, имеющих боковые разрывы (окошечки), филлодоциды, так же как и другие полихеты, живущие в трубках, проделывают всем своим телом изгиба-тельные движения в дорсо-вентральном направлении, что и вызывает постоянный приток свежей воды в их убежища.
2 П. В. Ушаков
'18
ВВЕДЕНИЕ
Временные слизистые чехлики филлодоцид — как бы прототип постоянных трубок. У полихет, строящих долговременные трубки, выделенная ими слизь быстро затвердевает, в результате чего образуются прочные «пергаментные» прослойки, которые по своей структуре напоминают кутикулярный слой самих червей. При постройке трубок некоторые полихеты используют частицы грунта, присоединяя их к выделяемой слизи. В качестве вспомогательного строительного материала, помимо минеральных зерен, нередко служат обломки различных раковин моллюсков, домики фораминифер, иглы ежей, спикулы губок, обрывки водорослей и т. д. При этом у многих червей наблюдается строгая избирательная способность к подбору строительного материала. Так, Onuphis conchylega для постройки своих трубок преимущественно используют битую ракушку, о чем красноречиво свидетельствует видовое название этого червя. Колчанообразные трубки Pectinarta, имеющие форму бивней слонов, сложены из одного слоя крепко сцементированных песчинок, подобранных таким «искусным образом», что напоминают мозаичные панно или красивые витражи средневековых храмов. У небольших червей Myriochele (Owentidae') их тонкие, длинные трубки состоят в основном из прозрачных сникул губок, между которыми на некотором расстоянии вкраплены продолговатые минеральные частицы черного цвета, придающие всему сооружению характерный полосатый рисунок. Эвнициды Hyalinoecia tubicola в прозрачных хитиноидных домиках, напоминающих гусиное перо, причем эти черви таскают их вместе с собой, так же как и Pectinarta. У многих полихет трубки совершенно прямые, одинакового диаметра на всем протяжении или сужающиеся к обоим концам, нередко они извилистые и весьма неправильной формы. В большинстве случаев трубки глубоко закопаны в грунт и наружу торчат лишь небольшие их концы. Часто можно встретить огромные колонии из густо переплетенных трубок, прочно прикрепленных к твердому субстрату. Трубки серпулид пропитаны известью, чем они отличаются от всех остальных, и имеют молочно-белый или нежный розовый цвет, реже они полупрозрачные, как халцедон; для многих из них характерна особая скульптура в виде многочисленных поперечных складок, продольных ребер и волнистых килей, которые делают их весьма ажурными. Трубки серпулид прикреплены к камням, раковинам моллюсков, панцирям крабов, слоевищам водорослей и т. д.; среди них лишь Dttrupa, которых рыбаки во Франции метко называют «острием шила», свободно находятся в илистом грунте (незадачливые натуралисты их часто путают с лопатоногим моллюском Dentalium). ^Структура и форма трубок в ряде случаев настолько специфичны, что они могут служить хорошим добавочным систематическим признаком, и уже только по одной трубке нередко удается безошибочно определить вид самого червя. Довольно сложный процесс строительства трубок во всех деталях описан в специальных работах для многих видов (Ziegelmeier, 1952; Hedley, 1958, и др.). Исключительно своеобразный способ постройки трубок у Panthalts (Polyodontidae). Эти черви снабжены особыми крупными «паутинными железами», выделяющими тонкие, длинные и эластичные золотистые нити, которые используются в качестве основы для стенок трубок; «паутинные железы» в виде огромных закрученных жгутов находятся внутри пара-подий (Watson, 1895).
Трубки характерны не только для специализированных семейств седентарных червей, они наблюдаются и у многих представителей эр-рантных полихет. Из вышеприведенных примеров, указывающих на крайне большое разнообразие типов трубок, хорошо видно, что способ
МОРФО-ФУНКЦИОПАЛЬНЫЙ ОЧЕРК
19
ность к их строительству вырабатывалась независимыми путями в разных семействах. Филлодоциды, как уже отмечалось, такой способности еще не приобрели. Некоторые из них (Eteone) в илисто-песчанистом грунте проделывают лишь глубокие ходы, стенки которых как по цвету, так и по консистенции отличаются от остального грунта. Для укрытия филлодоциды чаще пользуются естественными пустотами в грунте или прячутся среди водорослей. Лишь для некоторых глубоководных видов [Notophyllum ( = Austrophyllum) caecum,? Lugia abyssicola] отмечены трубки, однако, по всей вероятности, это не собственные, а чужие трубки, в которые они залезли случайно.
Особенности наружной сегментации
Тело у всех полихет сегментировано, но сегментация может быть весьма различной не только по своей морфологии, но и по происхождению. По способу закладки (образованию) сегментов различают ларвальные и постларвальные сегменты (Иванов, 1944). Ларвальные сегменты образуются одновременно при метаморфозе личинки, постларвальные сегменты возникают постепенно по мере роста червя из предпигидиальной зоны роста.
Количество ларвальных сегментов у полихет по сравнению с членистоногими, для которых характерна определенная стабилизация их количества (2—4), относительно большое, причем оно неодинаковое в разных семействах. Так, у Polynoidae их 7, Sigalionidae 3, Nereidae и Syl-lidae от 3 до 4. Весьма большое их количество отмечено и у некоторых седентарных полихет — до 13 (Spionidae, Chaetopteridae}. У Phyllodocidae количество ларвальных сегментов 7, Tomopteridae 5 (см. главу «Размножение и развитие»). С ларвальными и постларвальными сегментами связана первичная гетерономность. Последняя в дальнейшем нередко-сказывается на анатомии самих метамер (ларвальные сегменты обычно не образуют половых желез), но не всегда определяет окончательную внешнюю гетерономность сегментов, которая в основном, как это будет видно из дальнейшего изложения, имеет приспособительный характер, будучи обусловлена спецификой обитания и образом жизни ( чисто адаптивные приспособления).
У филлодоцид, хотя и имеется 7 ларвальных сегментов, лишь 2 или 3 передних, так называемых околоротовых сегмента, по внешней морфологии отличаются от всех последующих сегментов, имеющих весьма гомономный облик. Таким образом, у филлодоцид по внешней морфологии четкой разницы между ларвальными и постларвальными сегментами не наблюдается. У нереид различия между ларвальными и постларвальными сегментами, напротив, в процессе постларвального развития усугубляются: все 4 ларвальных сегмента, из которых три щетинконосных, сливаются и образуют очень крупный перистомиум (Свешников, 1960).
Общее количество туловищных сегментов сильно варьирует. Имеются виды, у которых количество сегментов непрерывно увеличивается по мере роста самого животного и может достигать весьма большой величины (несколько сот), у других же видов число сегментов ограниченное. У видов >'с неопределенным количеством сегментов образования новых сегментов из предпигидиальной зоны роста не прекращается при наступлении половой зрелости. Большое количество сегментов — признак, по своему характеру довольно примитивный, но это имеет место не только среди филлодоцид, а наблюдается также во многих других семействах, в частности Eunicidae, Terebellidae, Sabellidae и Serpulidae. Лишь в уз-2*
20
ВВЕДЕНИЕ
неспециализированном семействе Pectinariidae все виды имеют почти одинаковое количество сегментов (около 30).
Среди донных филлодоцид встречаются как виды, для которых характерно относительно небольшое количество сегментов, всего несколько десятков (мелкие Mystides, Protomystides), так и виды с количеством сегментов в несколько сот (например, Phyllodoce laminosa — свыше 800 сегментов). Для большинства альциопид свойственно большое количество сегментов, однако у многих пелагических полихет оно стабилизируется, и в ряде случаев используется как дополнительный видовой признак (Lopadorhynchus, Tomopterts).
Помимо основной кольчатости отвечающей внутренней метамерии (см. дальше), нередко наблюдается вторичная кольчатость (нсевдосег-ментация), не связанная с истинной сегментацией тела. Вторичная кольчатость обычно представлена в виде неполных бороздок, преимущественно на спинной стороне сегментов. В большинстве случаев имеется 2—3 таких бороздки на каждом сегменте, но их может быть и больше. Вторичная кольчатость, встречающаяся у представителей весьма различных семейств, может рассматриваться как ложная метамерия или метамерия низшего порядка. У филлодоцид со вторичной кольчатостью нередко связаны расположение ресничных поясков и различный характер пигментации спинной стороны червя.
В тех случаях, когда туловищные сегменты имеют на всем протяжении тела более или менее одинаковое строение, такую сегментацию называют гомономной. Чаще же туловищные сегменты устроены по-разному — имеют разную внешнюю морфологию на различных участках тела. Последний тип сегментации обозначают как гетерономный. Самым простым, а потому исходным типом наружной сегментации многощетинковых червей следует считать гомономность, при которой все подиальные придатки туловищных сегментов выполняют один и тот же комплекс функций, сводящийся в основном к локомоторно-дыхательной деятельности. Такая гомономность сегментов отчасти имеет место у ряда эррантных семейств. Но и у них абсолютной гомономности всех сегментов все же нет: самые передние, так называемые околоротовые сегменты, принимающие в той или иной степени участие в обнаружении пищи, своими более удлиненными усиковидными придатками заметно отличаются от остальных туловищных сегментов; самые задние сегменты обычйо недоразвиты.
Наиболее полная, классическая гомономность сегментов наблюдается у донных филлодоцид. У пелагических форм отмечается уже некоторая дальнейшая дифференциация сегментов. Примерно такое же, как у филлодоцид, гомономное строение туловищных сегментов и у большинства 'Hestonidae, Syllidae и Nereidae, однако у представителей последнего семейства гомономность сегментов резко нарушается в период эпитокии.
Начальная стадия образования вторичной гетерономности, связанная с разделением функций между отдельными сегментами, обнаруживается у Aphroditidae s. lato: часть сегментов у них снабжена чешуйками (элитрами), другая — усиковидными придатками. Последнее обусловлено тем, что, помимо двигательных функций, на некоторые сегменты возлагаются дополнительные задачи по предохранению кожных покровов от засорения, а на другие — осязательные и дыхательные. У всех афро-дитид в пределах с V по ХХШ сегменты наблюдается весьма строгое чередование чешуек и усиков через один сегмент. Такое чередование чешуйчатых и усиковых сегментов В. Н. Беклемишев (1964) назы
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
21
вает «метамерией 2-го порядка». Однако после - ХХШ сегмента чешуйки, как правило, располагаются через два сегмента, а у видов с длинным телом, и этот порядок исчезает (в частности, у комменсалов, Arctonoe vittata, в особенности Polyeunoa laevis). Таким образом, если и можно говорить в данном случае о метамерии 2-го порядка, то только в отношении передней части тела.
Возникновение гетерономности у Nephthyidae в основном связано с появлением на некоторых сегментах жаберных полуцеломических отростков, причем степень иХ развития не на всех сегментах одинаковая. Процесс нарушения гомономности сегментов в семействе Glyceridae s. lato заходит еще дальше: у Goniada и Glycin.de 40—70 передних сегментов одноветвистые, а остальные двуветвистые, и все тело червя у них подразделяется на два резко различных в морфологическом отношении участка. В пределах семейства Eunicidae s. lato имеются все постепенные переходы от почти полной гомономности сегментов (у свободнороющих форм, например, Lumbriconereis) до весьма резко выраженной гетерономное™ (в частности, Onuphis, Marphysa и некоторые другие, обитающие в трубках). Таким образом, мы видим, что во многих эррантных семействах наблюдается вполне определенная тенденция к образованию гетерономное™ в целях лучшего обеспечения различных функций, которые возлагаются на параподиальный комплекс. Лишь донные филлодоциды сохраняют довольно стойко первоначальную гомономность, что может служить одним из доказательств их общей примитивности.
Наиболее ярко выражена гетерономное™ у тубикольных седентар-ных червей, в связи с чем их переднюю обособленную часть тела нередко условно обозначают как «грудь», или торакс (thorax), а заднюю часть как «брюшко», или абдомен (abdomen). Крайняя форма дифференциации и специализации сегментов наблюдается у представителей семейств Chaetoptertdae и Sabellariidae, связанная с особенностями жизни в сложно устроенных трубках, которые черви не способны покидать. При этом у них никаких морфологических параллелей в строении отдельных частей тела провести не удается. Единого эволюционного плана образования внешней гетерономное™ не существует, и в разных семействах она проявляется по-своему, будучи целиком определена спецификой условий обитания и образом жизни самих червей. Однако, как всякая специализация, гетерономиость все же указывает на более высокий уровень развития. При дифференциации сегментов, вызванной различными добавочными функциями, возникает дополнительное разнообразие морфологических структур и происходит усложнение внешней морфологии.
Деление тела на отделы
Тело многощетинковых червей можно подразделить на три основные части: 1) головной отдел, 2) туловище и 3) хвостовой отдел.
Головной отдел включает головную лопасть, или простомиум (prostomium), и несколько передних измененных сегментов, так называемые околоротовые, которые, сливаясь у некоторых эррантных полихет, образуют четко обособленный перистомиум (peristomium). Головная лопасть возникает из верхнего полушария (эписферы) трохофоры, а потому имеет независимое от всех остальных сегментов происхождение. Ротовое отверстие всегда находится на брюшной стороне I сегмента, на границе с головной лопастью. Головной отдел снабжен различными тактильными и дистанционными органами чувств, которые более подробно
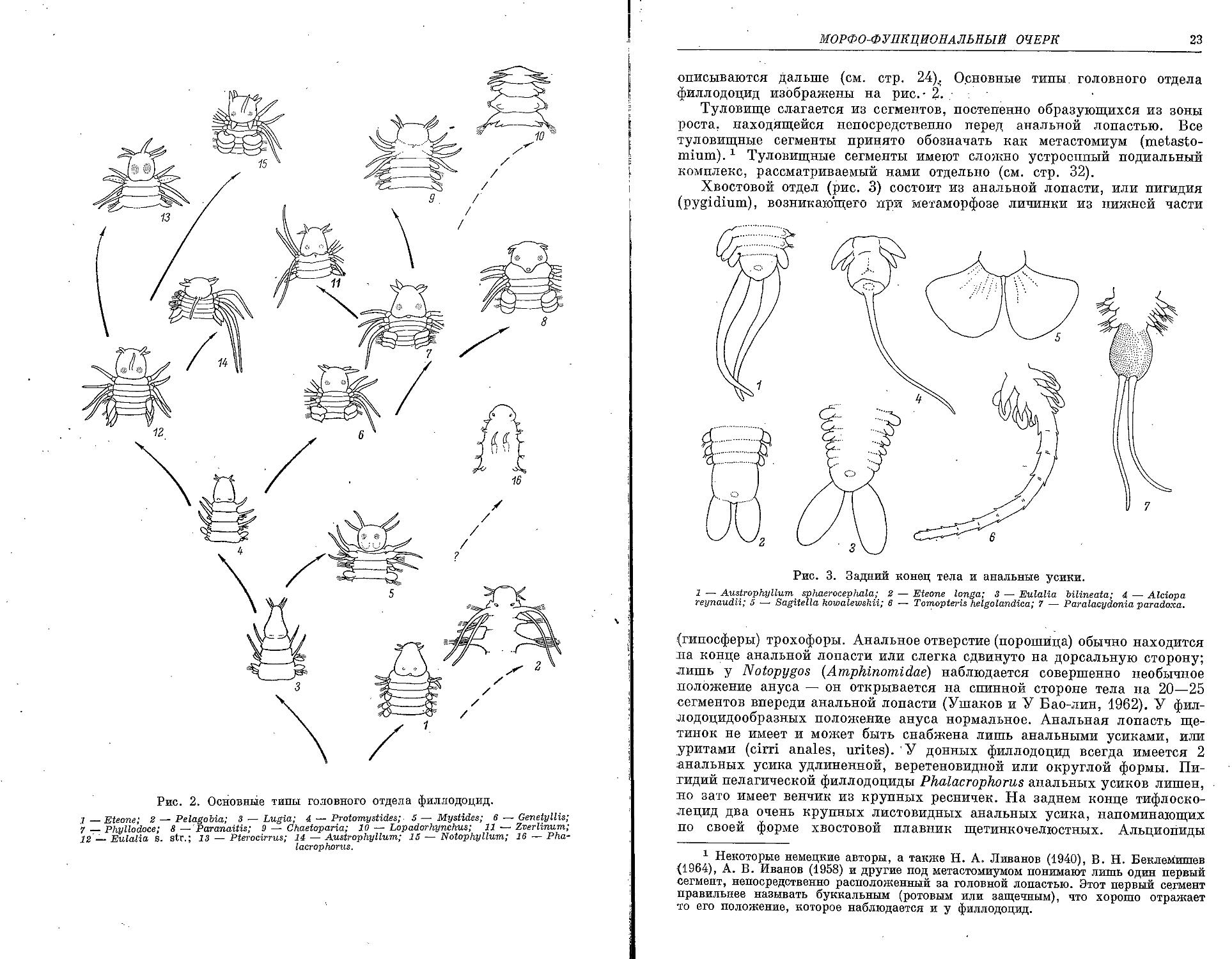
Рис. 2. Основные типы головного отдела филлодоцид.
— Eteone' 2 — PelagoMa; 3 — Lugia; 4 — Protomystides; 5 — Mystides; в — Genetyllis; __Phyllodoce; 8 — Paranaitis; 9 — Chaetoparia; 10 — Lopadorhynchus; 11 Zverhnum, 2 Eulalia, s. str.; 13 — Pterocirrus; 14 — Austrophyllum; 15 — Notophyllum; 16 Ptia-lacrophorus.
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
23
описываются дальше (см. стр. 24)< Основные типы головного отдела филлодоцид изображены на рис. - 2. :
Туловище слагается из сегментов, постепенно образующихся из зоны роста, находящейся непосредственно перед анальной лопастью. Все туловищные сегменты принято обозначать как метастомиум (metasto-mium).1 Туловищные сегменты имеют сложно устроенный подиальный комплекс, рассматриваемый нами отдельно (см. стр. 32).
Хвостовой отдел (рис. 3) состоит из анальной лопасти, или пигидия (pygidium), возникающего при метаморфозе личинки из нижней части
Рис. 3. Задний конец тела и анальные усики.
1 — Austrophyllum sphaerocephala; 2 — Eteone longa; 3 — Eulalia bilineata; 4 — Alciopa reynaudii; 5 — Sagitella kowalewskii; 6 •— Tomopteris helgolandica; 7 — Paralacydonia paradoxa.
(гипосферы) трохофоры. Анальное отверстие (порошица) обычно находится на конце анальной лопасти или слегка сдвинуто на дорсальную сторону; лишь у Notopygos (Amphinomidae) наблюдается совершенно необычное положение ануса — он открывается на спинной стороне тела на 20—25 сегментов впереди анальной лопасти (Ушаков и У Бао-лин, 1962). У фил-лодоцидообразных положение ануса нормальное. Анальная лопасть щетинок не имеет и может быть снабжена лишь анальными усиками, или уритами (cirri anales, urites). У донных филлодоцид всегда имеется 2 анальных усика удлиненной, веретеновидной или округлой формы. Пигидий пелагической филлодоциды Phalacrophorus анальных усиков лишен, но зато имеет венчик из крупных ресничек. На заднем конце тифлоско-лецид два очень крупных листовидных анальных усика, напоминающих по своей форме хвостовой плавник щетинкочелюстных. Альциопиды
1 Некоторые немецкие авторы, а также Н. А. Ливанов (1940), В. Н. Беклемишев (1964), А. В. Иванов (1958) и другие под метастомиумом понимают лишь один первый сегмент, непосредственно расположенный за головной лопастью. Этот первый сегмент правильнее называть буккальным (ротовым или защечным), что хорошо отражает то его положение, которое наблюдается и у филлодоцид.
24
ВВЕДЕНИЕ
с 2 или только с 1 анальным усиком (рис. 3, 4). К хвостовому отделу причисляют также сильно видоизмененные, специализированные задние сегменты, которые чаще всего наблюдаются у трубчатых седентарных форм. Так, Pectinarta на заднем конце тела имеют резко обособленный, сильно расширенный придаток в виде ложковидной пластинки, так называемую скафу, образованную из 5—6 сегментов. Еще более любопытен специализированный задний конец представителей Sabellariidae, живущих в плотно сцементированных трубках, которые иногда образуют в прибрежной зоне настоящие рифы (Dollfus, 1960). У них он наподобие длинной колбасовидной кишки, по размерам почти равной длине самого червя, и загнут в обратную сторону, т. е. направлен к наружному отверстию трубки; благодаря такому хвостовому придатку экскременты выбрасываются прямо в воду и трубка не засоряется ими. У филлодоцид никакого специализированного хвостового отдела нет, иногда лишь некоторое количество задних сегментов остается недоразвитыми. Довольно длинный «хвостовой придаток» из недоразвитых сегментов имеется у некоторых Tomopteris (рис. 3, б). Как своеобразное уродство в результате повреждения и последующей регенерации описан Eulalia viridis с двумя хвостовыми концами (Wilson, 1937).
Головной отдел и органы чувств
Головной отдел, в состав которого входят головная лопасть и несколько передних околоротовых сегментов, испытывает весьма глубокие изменения в различных семействах, и единого, общего плана строения головного конца для всех многощетинковых червей нет. Особенно сложные приспособления, тесно связанные с тубикольным образом жизни, наблюдаются у многих седентарных червей, причем в ряде случаев установить у них аналогию и гомологию между различными их морфологическими образованиями весьма затруднительно. Головная лопасть, имеющая независимое от всех остальных сегментов происхождение, четко обособлена и хорошо различима преимущественно у эррантных червей, у седентарных полихет она, напротив, в большинстве случаев, в сильной степени редуцирована. Остановимся несколько подробнее на головном отделе донных филлодоцид.
Головная лопасть донных филлодоцид обычно имеет вытянутую, слегка заостренную форму; она значительно крупнее последующих сегментов. На переднем ее конце находятся две пары небольших фронтальных щупалец, причем одна пара слегка сдвинута на дорсальную сторону, а другая имеет вентральное положение. У ряда видов на дорсальной стороне головной лопасти, кроме того, имеется непарное (среднее, или медиальное) щупальце, как правило, несколько сдвинутое к заднему краю головной лопасти; большей частью непарное щупальце расположено на уровне глаз. В головные щупальца, состоящие в основном из эпителиальных клеток, заходят нервные волокна, отходящие от средней части головного мозга. Головные щупальца, или антенны (antennae), служат органами осязания и химического чувства (механо- и хеморецепторами).
Количество головных щупалец для большинства эррантных семейств довольно постоянное. Так, для Nereidae характерно 2 головных щупальца, Hesionidae — 2 или 3, Syllidae и Aphroditidae — 3, Glycertdae и Nephthyi-dae — 4. Однако в семействе Eunicidae количество головных щупалец сильно варьирует: Lumbriconereis вообще лишен каких-либо головных придатков, но это вторичное явление, вызванное роющим образом жизни; у тех же эвницид, но живущих в трубках (Onuphisи др.), количество головных щупалец достигает 5—7, причем некоторые из них очень длинные, что
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
25
позволяет червям, не покидая трубок, ощупывать поверхность грунта на значительной дистанции. У многих эррантных полихет головные щупальца сидят на особых подставках (церафорах), которые придают им большую подвижность; у филлодоцид щупальца без подставок. Для филлодоцид характерно отсутствие щупиков, или пальп (palpi), которые имеются у большинства эррантных полихет. В отличие от головных щупалец в пальпы, расположенные всегда близ ротового отверстия, заходит целомическая полость. Пальпы, возможно, более совершенные, чем щупальца, хеморецепторы.
С головной лопастью, помимо щупалец, связаны различные нухальные (затылочные) органы в виде втягивающихся папилл или ямок и бороздок, выстлайных мерцательным эпителием. Этим органам приписывается функция обоняния. У Phyllodoce, помимо затылочной папиллы, расположенной в заднем сердцевидном вырезе головной лопасти, имеются две втягивающихся боковых папиллы несколько впереди щупальцевидных усиков. Наиболее сложное строение приобрели нухальные органы у No-tophyllum, у которого они представлены парными удлиненными отростками, заходящими на спинную сторону червя, иногда почти до VII сегмента (так называемые «эполеты»); таких парных выростов может быть до 7.
У донных филлодоцид два или три самых передних туловищных сегмента, непосредственно примыкающих к головной лопасти, обычно отличаются по строению подиальных придатков от всех последующих сегментов, имеющих весьма сходный характер. Эти передние сегменты принято называть околоротовыми (перистомиальными), а по наличию у них удлиненных щупальце видных усиков, или тентакулярных циррусов (cirri tentaculares), — щупальцевыми, или тентакулярными сегментами. На I сегменте обычно имеется лишь одна пара удлиненных щупальцевидных усиков, только у родов Eteone—Pelagobia их две пары; на II сегменте как норма две пары щупальцевидных усиков, подиальный бугорок сильно редуцирован и щетинки могут отсутствовать; III сегмент обычно со спинными щупальцевидными усиками и хорошо развитыми подиальными бугорками, а брюшные усики нормального типа. Все эти три передних сегмента нередко четко отделены друг от друга и по своим размерам мало отличаются от остальных туловищных сегментов. Однако имеются многочисленные виды, у которых границы между передними сегментами со спинной стороны исчезают, длина самих сегментов сильно сокращается, т. е. происходит как бы их редукция и одновременно с этим частичное слияние. Указанные изменения передних сегментов филлодоцид тесно связаны с перестройкой нервной системы: передним трем сегментам соответствует лишь одна пара крупных подглоточных ганглиев, иннервирующих все щупальцевидные усики, причем у видов с раздельными сегментами {Eulalia) подглоточные ганглии имеют легкие пережимы (см. стр. 46). Во всем этом мы видим самые первые, начальные этапы цефализации — образования обособленного перистомиума. У филлодоцид четко выраженного самостоятельного перистомиума, образовавшегося из слияния нескольких передних сегментов, еще нет. Последний имеется у более высокоорганизованных эррантных полихет — Aphroditidae и Nereidae. По сравнению с этими семействами головной отдел филлодоцид имеет значительно более простой план строения. Некоторые возможные пути усложнения головного отдела филлодоцид в процессе эволюционного развития схематично показаны на рис. 2 (подробнее об этом см. главу «О филогенетических отношениях в пределах семейства Phyllodocidae»).
Головной отдел альциопид принципиально мало отличается от такового филлодоцид, но количество видоизмененных передних сегментов у них
26
ВВЕДЕНИЕ
может быть больше, чем у филлодоцид; головная лопасть альциопид сильно маскируется гипертрофированными телескопическими глазами. Головной отдел Lacydoniidae типичного для филлодоцид строения, в связи с чем они первоначально и объединялись с филлодоцидами. Несколько необычный характер имеет головной отдел томоптерид и тифлосколецид. Головная лопасть у них подверглась значительной редукции и слиянию с передними сегментами. Отличительной чертой томоптерид служат исключительно длинные щупальцевидные усики, так называемые «усы», а головная лопасть тифлосколецид заканчивается весьма своеобразным удлиненным, пальцевидным придатком — пальподом. Но эти добавочные морфологические образования, по-видимому, следует рассматривать как чисто адаптивные приспособления, связанные с пелагическим образом жизни.
На головной лопасти располагаются органы зрения, в большинстве случаев в виде одной пары темных пятен в задней ее части. Размеры этих пятен сильно варьируют в зависимости от вида. Иногда они настолько малы и так глубоко находятся под эпидермальным слоем, что распознаются с большим трудом. Глубоководные филлодоциды, как правило, лишены глаз —Austrophyllum, Vitiazian некоторые другие; аналогичное наблюдается у глубоководных афродитид — Ilarmothoe derjugini, Pholoe caeca, Weberia nodulosa, большинство Macellicephala и Macelltcephaloides, а также в других семействах. Наряду с этим редукция глаз отмечается и у роющих форм, зарывающихся в грунт: например, у Eteone глаза очень небольшие и едва заметные, а у представителей интерстициальной фауны — Hesionura [ = Eteonides} они исчезают нацело (Hartmann-Schroder, 1964). То же самое наблюдается у Lumbrlconerets из Eunicidae.
У филлодоцид глаза находятся под кутикулярным слоем и имеют форму замкнутого пузырька, стенки которого состоят из удлиненных призматических клеток, особенно сильно вытянутых на нижней его стороне (на дне глазного пузырька). Эти клетки, снабженные темным пигментом, представляют собой ретину. Внутренность пузырька заполнена студенистым прозрачным веществом — стекловидным телом, образующим в центре пузырька линзу — хрусталик (последний имеется не у всех видов), способный преломлять свет. Весь глазной пузырек окружен многочислен-* ными разветвлениями относительно короткого оптического нерва, связанного со средним мозгом. Кутикулярный слой наружных покровов в местах, где находятся глаза, обычно лишен пигмента. Аналогичного характера, но значительно более сложного строения, глаза альциопид (Greeff, 1876b; Demoll, 1909), достигающие огромных размеров (так называемые телескопические глаза), причем оба глаза у них связаны пучками мышц, которые способны изменять направление глазных осей, что очень существенно для пелагических видов, так как позволяет им обозревать пространство в разных направлениях. Глаза альциопид, по всей видимости, могут определять не только интенсивность света и его направление, но и контуры и размеры видимого объекта (жертвы). У томоптерид, напротив, глаза весьма небольшие и они имеют иное строение, чем у филлодоцид и альциопид; глаза Tomopteris лишены стекловидного тела и линза, ^преломляющая свет, образуется у них из клеток эпидермального слоя (Akes-son, 1964).
Глотка и способы питания
Пищеварительный канал, как правило, в виде прямой трубки, открывающейся ротовым отверстием на переднем конце (на границе головной лопасти и первого сегмента) и заканчивающейся анусом на заднем конце.
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
27
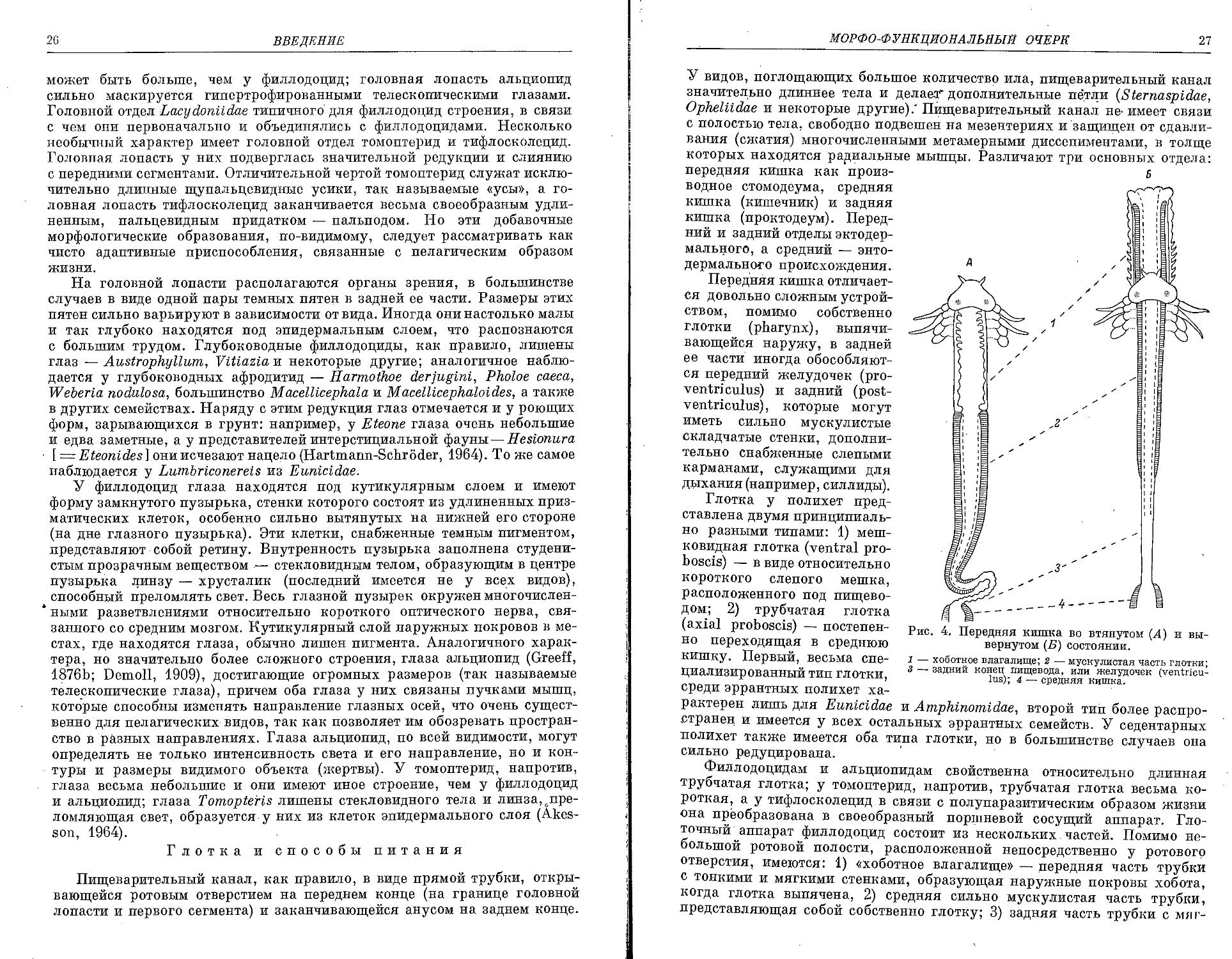
У видов, поглощающих большое количество ила, пищеварительный канал значительно длиннее тела и делаем дополнительные петли (Sternaspidae, Opheliidae и некоторые другие).' Пищеварительный канал не- имеет связи с полостью тела, свободно подвешен па мезентериях и защищен от сдавли
вания (сжатия) многочисленными метамерными диссепиментами, в толще которых находятся рариальные мышцы. Различают три основных отдела:
передняя кишка как производное стомодеума, средняя кишка (кишечник) и задняя кишка (проктодеум). Передний и задний отделы эктодермального, а средний — энто-дермального происхождения.
Передняя кишка отличается довольно сложным устройством, помимо собственно глотки (pharynx), выпячивающейся наружу, в задней ее части иногда обособляются передний желудочек (proventriculus) и задний (postventriculus), которые могут иметь сильно мускулистые складчатые стенки, дополнительно снабженные слепыми карманами, служащими для дыхания (например, силлиды).
Глотка у полихет представлена двумя принципиально разными типами: 1) мешковидная глотка (ventral proboscis) — в виде относительно короткого слепого мешка, расположенного под пищеводом; 2) трубчатая глотка (axial proboscis) — постепенно переходящая в среднюю кишку. Первый, весьма специализированный тип глотки, среди эррантных полихет ха-
Б
Рис. 4. Передняя кишка во втянутом (А) и вывернутом (Б) состоянии.
1 — хоботное влагалище; 2 — мускулистая часть глотки;
3 — задний конец пищевода, или желудочек (ventriculus); 4 — средняя кишка.
рактерен лишь для Eunicidae и Amphinomidae, второй тип более распространен и имеется у всех остальных эррантных семейств. У седентарных полихет также имеется оба типа глотки, но в большинстве случаев она сильно редуцирована.
Филлодоцидам и альциопидам свойственна относительно длинная трубчатая глотка; у томоптерид, напротив, трубчатая глотка весьма короткая, а у тифлосколецид в связи с полупаразитическим образом жизни она преобразована в своеобразный поршневой сосущий аппарат. Глоточный аппарат филлодоцид состоит из нескольких частей. Помимо небольшой ротовой полости, расположенной непосредственно у ротового отверстия, имеются: 1) «хоботное влагалище» — передняя часть трубки с тонкими и мягкими стенками, образующая наружные покровы хобота, когда глотка выпячена, 2) средняя сильно мускулистая часть трубки, представляющая собой собственно глотку; 3) задняя часть трубки с мят-
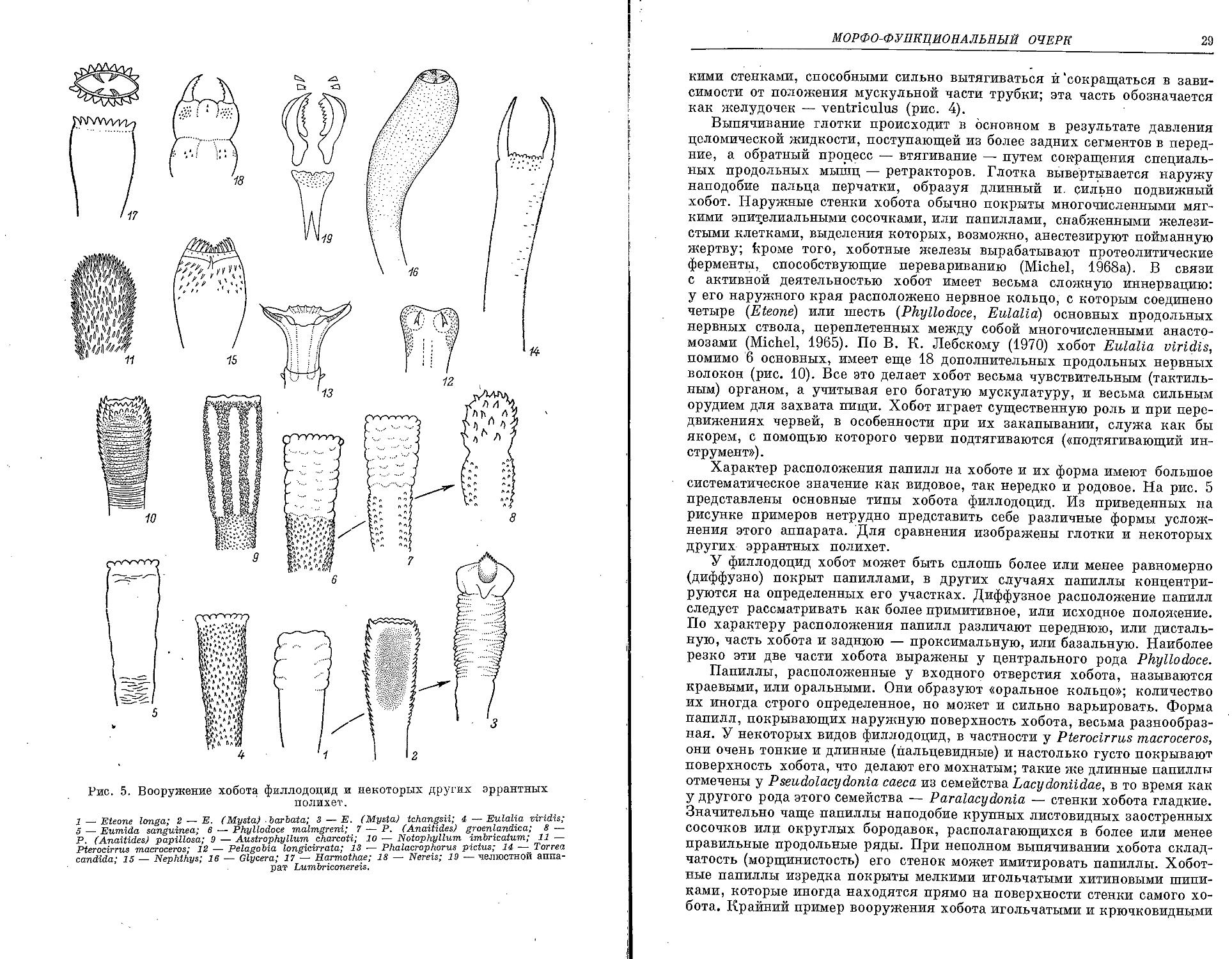
Рис. 5. Вооружение хобота филлодоцид и некоторых других эррантных полихет.
1 — Eteone longa; 2 — Е. (Mysta) .barbata; 3 — Е. (Mysta) tchangsii; 4 — Eulalia -viridis;
5 — Eumida sanguinea; 6 -— Phyllodoce malmgreni; 7 — P. (Anaitides) groenlandica; 8 P. (Anaitides) papillosa; 9 — Austrophyllum charcoti; 10 — Notophyllum imbricatum; 11 Pterocirrus macroceros; 12 — Pelagobia longicirrata; 13 — Phalacrophorus pictus; 14—Tcrrea Candida; IS — Nephthys; 16 — Glycera; 17 — Harmothae; 18 — Nereis; 19 — челюстной anna-рат Lumbriconereis.
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
29
кими стенками, способными сильно вытягиваться й ‘сокращаться в зависимости от положения мускульной части трубки; эта часть обозначается как желудочек — ventriculus (рис. 4).
Выпячивание глотки происходит в основном в результате давления целомической жидкости, поступающей из более задних сегментов в передние, а обратный процесс — втягивание — путем сокращения специальных продольных мышц — ретракторов. Глотка вывертывается наружу наподобие пальца перчатки, образуя длинный и. сильно подвижный хобот. Наружные стенки хобота обычно покрыты многочисленными мягкими эпителиальными сосочками, или папиллами, снабженными железистыми клетками, выделения которых, возможно, анестезируют пойманную жертву; кроме того, хоботные железы вырабатывают протеолитические ферменты, способствующие перевариванию (Michel, 1968а). В связи с активной деятельностью хобот имеет весьма сложную иннервацию: у его наружного края расположено нервное кольцо, с которым соединено четыре (Eteone) или шесть (Phyllodoce, Eulalia) основных продольных нервных ствола, переплетенных между собой многочисленными анастомозами (Michel, 1965). По В. К. Лебскому (1970) хобот Eulalia viridis, помимо 6 основных, имеет еще 18 дополнительных продольных нервных волокон (рис. 10). Все это делает хобот весьма чувствительным (тактильным) органом, а учитывая его богатую мускулатуру, и весьма сильным орудием для захвата пищи. Хобот играет существенную роль и при передвижениях червей, в особенности при их закапывании, служа как бы якорем, с помощью которого черви подтягиваются («подтягивающий инструмент»).
Характер расположения папилл на хоботе и их форма имеют большое систематическое значение как видовое, так нередко и родовое. На рис. 5 представлены основные типы хобота филлодоцид. Из приведенных на рисунке примеров нетрудно представить себе различные формы усложнения этого аппарата. Для сравнения изображены глотки и некоторых других эррантных полихет.
У филлодоцид хобот может быть сплошь более или менее равномерно (диффузно) покрыт папиллами, в других случаях папиллы концентрируются на определенных его участках. Диффузное расположение папилл следует рассматривать как более примитивное, или исходное положение. По характеру расположения папилл различают переднюю, или дистальную, часть хобота и заднюю — проксимальную, или базальную. Наиболее резко эти две части хобота выражены у центрального рода Phyllodoce.
Папиллы, расположенные у входного отверстия хобота, называются краевыми, или оральными. Они образуют «оральное кольцо»; количество их иногда строго определенное, но может и сильно варьировать. Форма папилл, покрывающих наружную поверхность хобота, весьма разнообразная. У некоторых видов филлодоцид, в частности у Pterocirrus macroceros, они очень тонкие и длинные (пальцевидные) и настолько густо покрывают поверхность хобота, что делают его мохнатым; такие же длинные папиллы отмечены у Рseudolacydonia caeca из семейства Lacydonttdae, в то время как у другого рода этого семейства — Paralacydonia — стенки хобота гладкие. Значительно чаще папиллы наподобие крупных листовидных заостренных сосочков или округлых бородавок, располагающихся в более или менее правильные продольные ряды. При неполном выпячивании хобота складчатость (морщинистость) его стенок может имитировать папиллы. Хоботные папиллы изредка покрыты мелкими игольчатыми хитиновыми шипи-ками, которые иногда находятся прямо на поверхности стенки самого хобота. Крайний пример вооружения хобота игольчатыми и крючковидными
30
ВВЕДЕНИЕ
шипиками наблюдается у Glycinde (Goniadidae ). Хобот последнего напоминает до мельчайших деталей радулу моллюсков (любопытнейшая морфологическая конвергенция). Среди филлодоцид имеется лишь два, достаточно аберрантных пелагических рода, у которых на переднем конце хобота находятся небольшие парные хитиновые крючья (челюсти) — это Phalacrophorus и Pelagobia. Челюстные зубья у них возникли как приспособительные образования в связи с пелагическим образом жизни для захвата быстро передвигающихся планктонных организмов; в обоих родах, относящихся к двум разным подсемействам, они развились независимо (параллельно). Дистальный конец хобота некоторых альциопид заканчивается очень длинными усиковидными придатками с большим количеством клейких железистых клеток, что также следует признать как особые приспособления к захвату преследуемой жертвы. Усиковые придатки альциопид имеют некоторую аналогию с подобными образованиями у Macellicephaloides (Aphroditidae).
Хобот, как орудие захвата пищи, определяющее возможности питания червей, у полихет играет весьма прогрессивную роль в эволюционном развитии. Для большинства эррантных семейств характерен хобот строго определенного строения. Так, у всех Nephthyidae (рис. 5,15) хобот покрыт снаружи мягкими сосочками и имеет 2 очень крупных внутренних хити-ноидных зуба, служащих для удержания жертвы. У полипоид (рис. 5, 17) имеется 4 таких же очень крупных черных челюстных крючка, направленных попарно друг против друга и расположенных ближе к наружному отверстию. Глицериды (рис. 5, 16) обладают наиболее мощным хоботом, превосходящим по длине половину длины самого червя, причем 4 крепких крючка, расположенных крест-накрест на дистальном конце хобота, полностью выдвигаются наружу. Хобот нереид (рис. 5, 18), помимо двух изогнутых дистальных крючков с зазубренным режущим краем, действующих наподобие клешней, а иногда в качестве грабель, имеет по всей своей окружности многочисленные мелкие хитиноидные зубчики — параг-наты, концентрирующиеся в «парагнатные группы». Наиболее сложно устроен челюстной аппарат у Eunicidae (рис. 5, 19); он состоит из нижней челюсти в виде 2 пластинок с удлиненными ножками, причем передний край этих пластинок обызвествлен, и верхней челюсти из 5, а иногда из большего количества парных хитиновых пластинок разной формы и размера. Хобот филлодоцид не обладает столь сложным устройством и его вооружение мягкими сосочками очень вариабельно.
Несмотря на то что хобот большинства эррантных полихет имеет строго определенное строение, иногда все же наблюдаются примеры совершенно неожиданных конвергенций. Так, Э. и К. Беркли (Е. Berkeley а. С. Berkeley, 1963) описали хобот нереиды Lycastopsis catarractarum, который мягкими папиллами, черепицеобразно налегающими друг на друга, наподобие чешуек еловой шишки, отчасти напоминает, как указывают сами авторы, хобот филлодоцид. Такое внешнее сходство всецело обусловлено спецификой питания и не указывает на родственные связи. В дальнейшем, в главе о филогенетических отношениях в пределах семейства Phyllodocidae, мы еще остановимся на случаях параллелизма в строении хобота среди филлодоцид.
Для полихет известны весьма разнообразные способы питания: все эррантные черви — это преимущественно активные хищники, проворно охотящиеся за добычей, но среди полихет имеются и фильтраторы — пассивные улавливатели сестона с помощью очень сложно устроенного специального ловчего аппарата (сабеллиды, серпулиды), собиратели детрита с поверхности грунта, для чего i спользуются длинные и широко
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
31
расставленные щупальца (теребеллиды). Значительная часть видов относится к грунтоедам, или лимнофаГам, питающимся мелкими органическими частицами, находящимися в илу .(все роющие формы). При этом условно различают формы, заглатывающие грунт без выбора, и формы, в той или другой степени активно отбирающие органические остатки. При так называемом безвыборочном заглатывании грунта черви питаются в основном бактериями, находящимися в огромных количествах на минеральных частицах грунта. К сожалению, роль бактерий в питании червей изучена &ще крайне слабо. Червей безвыборочно заглатывающих грунт, по-видимому, немного и у большинства имеются те или другие специальные приспособления, которые мы еще знаем плохо, помогающие им отбирать наибольшее количество органических остатков в виде детрита, находящихся в грунте (например, песчаная воронка у Arenicola служит для того, чтобы в нее скатывался лишь самый поверхностный слой грунта, наиболее богатый детритом).
Филлодоциды, как правило, активные хищники, выслеживающие свою добычу из засады и нередко нападающие на превосходящую их по величине жертву, которую они захватывают с помощью быстро выбрасываемого хобота. В их желудках находили остатки разнообразных организмов, в том числе и щетинки полихет, относящиеся к различным семействам. Весьма любопытную картину выслеживания и нападения на крупных Spio filicornis наблюдал В. В. Хлебович (1959) у Eteone longa на литорали Курильских островов.
Среди филлодоцид {Eulalia viridis, Eumida sanguinea, Phyllodoce lami-nosd) отмечены случаи каннибализма (Gravier, 1896), причем у Е. viridis в Белом море имеет место избирательный каннибализм: самцы поедают друг друга, но никогда не нападают на самок; самки же нападают на самцов, но других самок не трогают (Бужинская и Лебский, 1971). Каннибализм наблюдается и среди других полихет, в частности, он широко распространен у нереид (Reish a. Alosi, 1968). Нравы нереид иногда чрезвычайно «коварны»: самка и самец Nereis caudata первоначально совместно строят слизистую трубку, продырявленную для лучшей вентиляции небольшими боковыми «окошечками», а затем, когда самка кончает откладывать в трубке яйца, самец ее поедает. Однако всю дальнейшую заботу о потомстве он берет на себя и отложенные яйца постоянными движениями своих параподий непрерывно омывает свежей водой (Herpin, 1923).
При отсутствии животной пищи филлодоциды, по-видимому, в равной мере используют и растительную, в их пищеварительном тракте были обнаружены обрывки водорослей. То же отмечено и для Nereis (Беклемишев, 1950). Смешанное питание, надо думать, весьма широко распространено у полихет. Суточный пищевой рацион филлодоцид пока не изучен, и мы не знаем, существует ли у них ритмика в питании, как это наблюдается у Harmothoe imbricata (Стрельцов, 1966а, 1968). Некоторые поли-хеты, в частности филлодоциды, способны выдерживать длительные «голодания», но в этих случаях они, по-видимому, используют растворенные в воде аминокислоты, что имеет место у Nereis (Taylor, 1969).
Альциопиды, судя по их поведению и наличию мощного хобота, весьма активные хищники, но прямых наблюдений в этом отношении пока нет. Для отыскания добычи им помогают телескопические глаза, позволяющие легко ориентироваться в водной толще в разных направлениях (вверх и вниз) и различать размеры и форму жертвы. Хотя у томоптерид глоточная трубка крайне короткая, но это нисколько не мешает им быть также весьма прожорливыми хищниками. В кишечнике томоптерид находили остатки мальков сельдей, обрывки сифонофор Agalmopsis elegans (Akes-
32
ВВЕДЕНИЕ
son, 1962) и аппепдикулярий Oikopleura diotca (Rakusa-Suszczewski, 1968). Но в основном, по наблюдениям последнего автора, Tomopteris helgolandica в Атлантическом океане нападают на щетинкочелюстных Parasagitta elegans и Sagitta setosa, проделывая на их теле дырки, через которые высасывают содержимое жертвы; лишь в редких случаях в кишечнике томоптерид находились остатки и самих сагитт. Тифлосколецид, имеющих вместо хобота своеобразный поршневой аппарат, по всей видимости, следует рассматривать не как хищников, а скорее как сосальщиков, ведущих полупаразитический образ жизни (см. стр. 59).
Будучи активными хищниками, филлодоциды сами часто становятся жертвами других червей. Так, в частности, свободноподвижная Eteone была найдена в желудке тубиколыюго червя Diopatra cuprea (Mangum, Santos a. Rhodes, 1968). Филлодоцид весьма охотно поедают различные рыбы, в том числе промысловые (Ушаков, 1955а).,
Параподии и характер движения червей
Боковые выросты стенки тела — параподии, вооруженные многочисленными щетинками, представляют собою весьма сложные морфологические образования, выполняющие одновременно различные функции, но служащие главным образом для передвижения (локомоторные органы), действуя в основном как простые рычаги. Помимо подиальных усиков, играющих в большинстве случаев осязательную роль, на параподиях нередко находятся специальные жаберные придатки (целомические у Glyceridae, с богато разветвленной системой капилляров у Eunicidae), а также многочисленные разнообразные папиллы, ктенидии, стилоды и т. д., точное назначение которых пока еще не установлено; иногда на параподиях имеются даже небольшие светочувствительные глазные пятнышки (Opheliidae). С параподиями тесно связана и выделительная система, нефридиальные папиллы (нефропоры), которые обычно открываются на их брюшной стороне. В полости параподий нередко вынашиваются половые продукты.
Параподиальный комплекс устроен весьма различно в разных семействах, „что тесно связано с особенностями экологии самих червей и с общим усложнением их организации. Параподии в высшей степени пластичные и адаптивные органы. В строении подиальных комплексов хорошо усматривается их узкоприспособительный характер, в первую очередь к способам передвижения.
Движения многощетинковых червей разнообразны. Бывает медленное ползание и спокойное плавание, а также очень быстрое активное бегство, стремительное зарывание в грунт и молниеносное втягивание в специальные убежища — трубки, под защитой которых некоторые черви проводят значительную часть своего жизненного цикла. Черви, живущие в трубках, прочно прикрепленных к субстрату, и не способные покидать свои домики, ведут в полном смысле «оседлый», или «сидячий», — сесильный образ жизни.
Различают следующие способы передвижения: синусоидальное, или змеевидное, т. е. волнообразное изгибание тела параллельно плоскости субстрата (весьма характерно для донных филлодоцид), настоящую греблю параподиями (альциопиды и томоптериды) и, наконец, перистальтику, или «гидравлическое движение» (Зенкевич, 1944); последний тип движения свойствен многим роющим формам. Нередко наблюдается совмещение различных способов передвижения.
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК 33
Донные филлодоциды передвигаются по твердому субстрату обычно синусоидальным, или змеевидным; способом. Помимо изгибания самого тела в горизонтальной плоскости, при таком движении большую роль играют подиалъные выросты со щетинками, которые работают наподобие байдарочных весел. Таким же способом передвигаются и нереиды. Иногда при очень быстрых движениях донные филлодоциды способны отрываться от субстрата и непродолжительное время плавать в придонном слое. Последнее значительно легче удается нереидам, так как рабочая поверхность и<х Параподий больше.
Прежде чем начать двигаться, передний конец тела донных филлодоцид поочередно выдвигается в разные стороны, как бы выбирая своими органами зрения и осязательными придатками нужное направление (Bohn, 1906). Лишь после этого червь начинает производить изгибатель-ные волнообразные движения всем телом, которые распространяются от заднего конца к переднему; головной конец служит как бы рулевым устройством, определяющим направление движения. Под влиянием возбуждения длина волн изгибания тела и их амплитуда резко увеличиваются, а в связи с этим и скорость продвижения вперед самих червей быстро возрастает. Выделяемая червем слизь облегчает.скольжение по субстрату и предохраняет его нежные покровы от поранений. При волнообразных движениях в горизонтальной плоскости параподии на вогнутой (левой или правой) стороне тела в результате сокращения продольных мышц уменьшаются, при этом частично втягиваются внутрь и щетинки, а весь параподиальный комплекс выносится вперед. Одновременно на противоположной — выгнутой — стороне тела подиальные выросты заметно увеличиваются в размерах, щетинки максимально выдвигаются наружу, в результате чего увеличивается общая рабочая поверхность параподии, и в таком состоянии она производит толчок назад. При синусоидальном движении последовательно сокращаются и расширяются целомические полости, находящиеся с правой и левой стороны каждого сомита. Один волнообразный изгиб тела обычно захватывает до 10 и свыше смежных сегментов. Цри уклонении движения от прямой линии симметричная форма изгибания тела переходит в асимметричную. Наиболее подробно синусоидальное движение разобрано в работе Грэй (Gray, 1939) на примере Nereis. К сожалению, прямых наблюдений над поведением многощетинковых червей в природе, за скоростью их движения, реакциями на различные раздражители и т. д. пока очень мало, что сильно затрудняет понимание функционального значения многих весьма сложных морфологических образований, которыми так богаты полихеты.
В качестве «классического» примера строения параподий бродячих полихет нередко рассматривают таковые Nereis (рис. 6, 15). Они состоят из нерасчлененной базальной части и двух самостоятельных ветвей: верхней — спинной ветви, или нотоподии (notopodium), и нижней — брюшной ветви, или невроподии (neuropodium), причем каждая ветвь вооружена обособленным пучком сочлененных щетинок (с подвижным дистальным члеником) и поддерживается крупной внутренней щетинкой — ацикулой (acicula), обычно темно-коричневого, почти черного цвета. Ацикулы выполняют как бы роль осевого скелета параподии. От нижней части ацикулы отходят многочисленные тонкие мускульные фибриллы к основаниям наружных щетинок, а также к стенкам самой параподии. При сокращении этих небольших ретракторов и протракторов щетинки могут частично втягиваться внутрь или, наоборот, максимально выдвигаться наружу, что имеет большое значение при поступательном движении червей. Как спинная, так и брюшная ветви параподий снабжены соответственно
3 П. В. Ушаков
Рис. 6. Параподии филлодоцид и некоторых других эррантных полихет. й“«»
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
36
спинным (cirrus dorsalis) и брюшным (cirrus ventralis) усиками. Кроме того, нотоподия имеет две и невроподия одну удлиненные подиальные лопасти, так называемые язычки, а подиальный бугорок невроподии прикрыт небольшой подиальной губой. Все это значительно увеличивает общую поперечную гребную поверхность параподии. У некоторых тропических нереид (Dendronereis, Dendronereides) на передних сегментах при спинных усиках развиваются разветвленные жабры, состоящие из большого количества удлиненных отростков. При наступлении половой зрелости и эпитокиипараподии нереид, как правило, претерпевают настолько серьезные морфологические перестройки, что половые стадии нереид первоначально были описаны как самостоятельный род. В частности, у половозрелых форм гипертрофируются глаза, происходит гистолиз некоторых тканей, а все подиальные лопасти сильно разрастаются и на смену старых щетинок появляются новые, так называемые плавательные щетинки с широким дистальным члеником. Все это облегчает червям всплывание на поверхность и позволяет им вести некоторое время пелагический образ жизни, во время которого и происходит вымет половых продуктов (такие стадии называют гетеронереидными).
Указанный выше тип двуветвистых параподий нереид со сходно устроенными нотоподиями и невроподиями среди полихет встречается довольно редко. Аналогичным образом отчасти организованы параподии Nephthyidae (рис. 6, 13). У Aphroditidae невроподии и нотоподии имеют разное строение (рис. 6, 14', см. также стр. 43). У всех седентарных червей, живущих в трубках, параподии претерпевают весьма сложные изменения. В их организации хорошо видна узкая специализация, связанная с тубикольным образом жизни. Спинные и брюшные ветви у них сильно раздвинуты, причем невроподии преобразованы в поперечные валики (torus uncinigerus), снабженные одним или несколькими рядами очень мелких зубчатых пластинок (uncini), с помощью которых черви плотно цепляются за стенки своих трубок. Если обе ветви параподий, как это имеет место у большинства бродячих полихет, отходят от одного общего ствола, то такие параподии называются моностикными, если же спинная и брюшная ветви сильно отодвинуты друг от друга и при этом модифицированы — дистикными.
Наряду со сложно устроенными имеются и простые параподии — одноветвистые, с одним подиальным бугорком, вооруженным лишь одной аци-кулой и одним пучком щетинок. Одноветвистые параподии у полихет в общем встречаются реже, чем двуветвистые, — с обособленными невро-подиальными и нотоподиальными ветвями и с двумя раздельными пучками щетинок, которые, по-видимому, лучше выполняют различные функции, возлагаемые на параподии. Одноветвистые параподии имеются у Sphaero-doridae и у многих Syllidae. У тех же силлид наблюдаются также параподии переходного типа, так называемые ложнодвуветвистые: с добавочной нотоподиальной ацикулой, но лишенные специального пучка спинных щетинок; лишь при наступлении половой зрелости у них появляются тонкие, волосовидные нотоподиальные щетинки, облегчающие всплывание червей. Параподии многих Eunicidae имеют несколько ацикул, однако четкого разделения на нотоподию и невроподию у них нет. Glyceridae обладают параподиями как типично одноветвистыми, так и двуветвистыми.
Для филлодоцид характерны параподии одноветвистые — с одним подиальным бугорком, вооруженным одной ацикулой и одним пучком щетинок (рис. 6, 1—5). Форма параподий донных филлодоцид меняется незначительно. Подиальный бугорок, как правило, сильно вытянутый; на дистальном его конце имеется небольшое углубление, в которое и упи
3*
36
ВВЕДЕНИЕ
рается ацикула. Ацикула обычно светлая, более слабая, чем у афродитид, и нереид. Незначительное развитие ацикулы связано с тем, что наружные щетинки весьма тонкие и недифференцированные.
Подиальпый бугорок филлодоцид снабжен одним спинным и одним брюшным усиком сильно сплющенным, листовидной формы. Брюшные усики, отходящие от вентральной стороны подиального бугорка, как правило, короче самого бугорка. Спинные усики сильно сдвинуты на спинную сторону червя, большей частью прикреплены к специальным подставкам — циррофорам, представляющим собой простое выпячивание стенки тела; циррофоры придают спинному усику большую подвижность. Существенно отметить, что у наиболее примитивных родов филлодоцид, таких как Lugta и Protomy slides, циррофоры почти незаметны и усики как бы непосредственно отходят от спинной поверхности тела. Спинные усики широкоовальной, (.сердцевидной или ланцетовидной формы, нередко с заостренным кончиком. Спинные усики частично налегают друг на друга и отчасти прикрывают собой наподобие черепицы боковые стороны тела червя аналогично спинным чешуйкам (элитрам) афродитид.
Спинные и брюшные усики филлодоцид богаты железистыми клетками, . выделяющими обильную слизь; кроме того, они снабжены густо разветвленными нервными окончаниями, что свидетельствует о их осязательной функции. Спинные усики постоянно находятся в ритмичном движении (биении) даже тогда, когда червь не передвигается; этим путем они прогоняют вдоль тела свежую воду. Последнее доказывает, что спинные усики филлодоцид не только осязательные органы, но в какой-то мере обеспечивают и респираторную деятельность.
Лишь у немногих филлодоцид — Austrophyllum, Hesporophyllum, No-tophyllum, N ipponophyllum и Zverlinum — при основании спинного усика появляется добавочная ацикула и одна или две небольшие волосовидные нотоподиальные щетинки; они могут быть на всех сегментах или только на задних. Наличие нотоподиальной ацикулы следует рассматривать как первые этапы возникновения двуветвистых параподии. Необходимо заметить, что добавочная нотоподиальная ацикула среди филлодоцид отмечена лишь для родов, у которых в той или другой степени передние сегменты претерпели слияние, т. е. наметился процесс цефализации, а не у примитивных форм с малоизмененными околорото-выми сегментами. Среди рассматриваемых здесь семейств типичные двуветвистые параподии мы имеем только у Lacydoniidae (рис. 6, 10), включавшихся одно время в состав семейства Phyllodocidae. По своей форме параподииLacydoniidae отчасти напоминают таковые Nephthyidae (рис. 6,13).
Параподии альциопид вполне соответствуют типу, описанному выше для филлодоцид, но в связи ю планктонным образом жизни брюшные усики у них по размерам не уступают спинным, а количество очень длинных тонких щетинок заметно увеличивается, что, несомненно, облегчает парение в толще воды (рис. 6, 9).
У небольших аберрантных пелагических тифлосколецид подиальные бугорки почти полностью редуцированы, сохранились всего 1—2 небольшие, короткие щетинки игольчатого типа, но зато спинные и брюшные усики приобрели гипертрофированные размеры, приняв форму весьма широких пластинок, с помощью которых черви и поддерживаются в вертикальном положении в толще воды (рис. 6, 11), Еще большую и крайнюю адаптацию к парению приобрели параподии томоптерид (рис. 6, 12)\ щетинки исчезли, сохранившись только в щупальцевидных усиках II сегмента («усы»), а сильно вытянутые двулопастные подиальные выросты на дистальном конце снабжены особыми плавничками (пин-
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
37
пулами). Можно ли полностью гомологизировать плавнички со спинными и брюшными усиками, пока не вполне ясно.
Несколько дальше (см. стр. 41) мы специально останавливаемся на вопросе, какой тип параподии — одноветвистый или двуветвистый — следует считать более примитивным и исходным для полихет.
Щетинки
Щетинки (chaetae, или setae) — основное вооружение параподий; они имеются на всех туловищных сегментах (исключение представляют лишь томоптериды). Щетинки многощетинковых червей чрезвычайно разнообразны по форме и структуре и служат нередко хорошими систематическими признаками, как для семейств и родов, так и для отдельных видов. Для большинства семейств характерен вполне определенный набор щетинок. Различают два основных типа щетинок: простые — имеющие всего одну часть, и сложные, или сочлененные,— состоящие из двух частей, а именно из рукоятки, или основного стержня, иначе древка, и сочлененного с ним дистального членика. Если сочленительные зубцы древка, к которому присоединяется дистальный членик, имеют равную величину — щетинки называются гомогомфными, если же они разной длины — гетерогомфными. Здесь нет возможности и надобности описывать все виды щетинок, многие из которых в силу своей специфической формы получили специальные названия: волосовидные (капиллярные), игловидные, ацикуловидные, остистые, опушенные, перистые, гребенчатые, гарпунные, штыкообразные, клювовидные, крючковидные, мотыгообразные и т. д. Наиболее разнообразны щетинки седентарных червей, причем в разных отделах их тела они могут быть весьма различными. Особенно сильно модифицированы у них щетинки на передних, реже на самых задних сегментах (например, на скафе пектинарий). На передних сегментах сильно измененные щетинки иногда образуют подобие султана (Stylarioides), в других случаях широкоразвернутый веер, или опахало (Pectinariidae, Ampharetidae), или округлую крышечку, прочно прикрывающую входное отверстие трубки (JSabellaritdae). Крупные, слегка изогнутые золотистые щетинки, так называемые палены, находящиеся на переднем конце пектинарий, играют роль бороны, или грабель, когда червь со своей трубкой передвигается в толще грунта (Wilcke, 1952). Достаточно большой набор щетинок у эвницид, живущих в трубках. В частности, у Rhamphobrachium, трубки которых глубоко погружены в грунт, три передних сегмента снабжены исключительно длинными щетинками с загнутым крючковидным дистальным концом и многочисленными боковыми шипиками. При втянутом состоянии эти щетинки простираются внутри тела животного до ХХХ^сегмента и даже дальше (Е. Berkeley а. С. Berkeley, 1938). По всей видимости, они представляют собой своеобразный «ловчий аппарат», подтягивающий застрявшие на них организмы и детрит к ротовому отверстию наподобие щупалец теребеллид. Столь глубоко втягивающиеся щетинки у других полихет неизвестны.
Для филлодоцид характерен в основном один тип щетинок — сложные, с удлиненным дистальным члеником (рис. 7,1). В одном пучке в среднем их до 20—30, иногда может быть и значительно больше. Щетинки выходят с задней стороны подиального бугорка по дуговой линии, которая отчасти напоминает лошадиную подкову. Они образуют слегка вогнутый веер. За основным вертикальным рядом крупных щетинок располагается второй ряд из более молодых, постепенно заменяющих ста
38
ВВЕДЕНИЕ
рые по мере их износа. Нижние щетинки обычно короче средних и верхних, что позволяет при ползании червей одновременно работать почти всеми щетинками; они преимущественно действуют как багры, причем
Рис. 7. Типы щетинок.
1 — сложные, или сочлененные, щетинки с коротким и длинным дистальным члеником у донных филлодоцид (Mystides)-, г — крючковидная золотистая щетинка на передних сегментах Ch.aetopa.ria-, 3 — сочлененная щетинка с широким дистальным члеником Lopadorhynchus; i — крючковидная щетинка на передних сегментах Lopadorhynchus; 5 — сочлененная щетинка Pelagobia с резко зазубренным дистальным члеником; в — толстая и тонкая сочлененные щетинки Mav.pasia; 1 —• сочлененная щетинка Pontodora с тонким дистальным члеником; 8 — ацикуловидная, простая волосовидная и сочлененная щетинки альциопид; 9 — сложная щетинка Paralacyd.on.ia; 10 — внутреннее строение осевой щетинки Tomopterts.
дистальный членик обеспечивает им большую площадь опоры (некоторая аналогия с tarsi членистых ножек у насекомых); вполне возможно, что часть верхних щетинок, когда червь быстро двигается, действуют как весла. Форма щетинок не меняется на всем протяжении тела. Недифференцированный характер щетинок филлодоцид указывает на примитивность их параподий. При двуветвистых параподиях щетинки обычно
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
39
разного типа в спинных и брюшных ветвях, причем они нередко различны и внутри одного пучка, что свидетельствует о дальнейшем усложнении подиального комплекса.
Основной стержень щетинок филлодоцид заканчивается несколько расширенным рострумом, имеющим, как правило, два крупных со-членительных зубца с многочисленными мелкими шипиками. Дистальный членик большей частью тонкий, длинный; копьевидной или сабле-' видной формы, мелко 'зазубренный (пильчатый) с внутренней, несколько вогнутой стороны, обращенной книзу, и ровный, гладкий по наружному краю. Дистальный членик легко подвижный, что облегчает маневрирование самих щетинок. У пелагических Lopadorhynchus (рис. 7, 3) дистальный членик щетинок сильно расширенный, в виде удлиненной плоской лопаточки; такого рода щетинки увеличивают общую поверхность тела, что очень важно при парении, а при плавании червей они, по-видимому, действуют, как весла на лодках-скифах: вперед выносятся ребром, а назад работают всей плоскостью. У тех же Lopadorhynchus имеются и простые крючковидные щетинки (рис. 7, 4), достигающие достаточно крупных размеров на трех сильно измененных и расширенных передних сегментах. Возможно, эти щетинки служат для удержания захваченной жертвы. Такие же простые крючковидные щетинки слегка золотистого цвета имеются среди донных филлодоцид лишь у Chaetoparia (рис. 7, 2).
У некоторых донных филлодоцид при эпитокии, связанной с наступлением половой зрелости, могут добавочно возникать длинные простые волосовидные щетинки, облегчающие им всплывание. Для альциопид характерны в одинаковой мере как простые длинные волосовидные щетинки, так и сочлененные, а для тифлосколецид — небольшие, короткие игольчатые щетинки. Томоптериды снабжены всего одной парой очень длинных щетинок, заключенных в щупальцевидных усиках II сегмента; эти щетинки с внутренними перегородками, придающими им некоторую гибкость. На рис. 7 приведены все основные типы щетинок, встречающиеся у представителей семейств, рассматриваемых в настоящей работе.
Следует иметь в виду, что обычные оптические средства не дают возможности детально изучить тонкую структуру щетинок, в частности детали строения и зубчатость рострума, а эти детали, несомненно, могут иметь большое систематическое значение для разграничения видов и более мелких таксономических единиц. Использование электронного сканирующего микроскопа в дальнейшем внесет, надо думать, немало нового. Приводимые в современных работах рисунки щетинок филлодоцид в большинстве случаев весьма схематичны и недостаточно точны; это замечание, к сожалению, относится и к данной работе. Существенное систематическое значение имеет относительная длина дистального членика по отношению к его ширине, но на этот признак никто специального внимания пока не обращал. Здесь можно отметить, что у глубоководных видов наблюдается исключительно длинный дистальный членик, в какой-то степени, возможно, облегчающий червям движение по мягким илистым осадкам (дают более надежный упор).
Образование и рост щетинок весьма полно изучены Ж. Бобен (Bobin, 1944) на примере различных семейств полихет, в том числе и у Eulalia viridis. Щетинки у всех полихет возникают в особых щетинковых мешках (follicule setrjere), представляющих собой впячивание эпидермального слоя; одноветвистые параподии имеют один щетинковый мешок. Щетинковые мешки изнутри выстланымембраной и содержат некоторое количество фолликул — крупных базальных клеток, из секрета которых и образуется щетинка (так называемые клетки-образовательницы). Эти
40
ВВЕДЕНИЕ
базальные клетки обычно окружены боковыми соединительными клетками, пе участвующими в образовании самих щетинок. Каждая базальная клетка дает начало лишь одной щетинке.
В щетипковом мешке сбоку имеется специальная генеративная зона, из которой поставляются новые базальные клетки, обеспечивая этим возникновение новых щетинок на смену выпавших. Базальные клетки снабжены крупным ядром и вакуолью, внутри которой и зарождается
Рис. 8. Строение и образование щетинок у Eulalia viridis (по: Bobin, 1944).
1 — структура взрослой щетинки; 2 — начальная стадия образования стержня щетинки; 3 — дистальный членик молодой щетинки под эпидермальным слоем; а — деталь зубчатости на дистальном членике; б — базальная клетка; в — «ресничный аппарат»; г — эпителий; д — вакуоль (лакуна), в которую заключен дистальный членик щетинки.
будущая щетинка. По данным Ж. Бобен, базальные клетки обладают особым, так называемым «ресничным аппаратом» (appareil ciliaire) с многочисленными блефаропластами. Количество последних по мере роста щетинки увеличивается. В центре «ресничного аппарата» располагаются блефаропласты более крупные, чем по периферии. Блефаропласты внутрь клетки направляют тонкие фибриллы («корневые нити»), которые, переплетаясь между собой, создают основание щетинки, а вверх — фибриллы одиночные или сгруппированные по нескольку вместе, наподобие мем-бранелл инфузорий; последние по мере выдвижения вперед плотно склеиваются белковой основой и образуют, таким образом, стержень щетинок, который сохраняет весьма тонкую внутреннюю структуру (исчер-ченность), связанную с наличием «ресничного аппарата». При образовании сложных щетинок, состоящих из дистального членика и рукоятки, вначале полностью формируется дистальный членик, а затем на смену «ресничного аппарата» дистального членика вступает в действие не свя
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК 4'1
занный с первым новый «ресничный аппарат», дающий начало рукоятке щетинки. На рис. 8 изображены начальные стадии образования щетинок Eulalia viridis. Дистальный членик прорывает эпителиальный покров лишь тогда, когда он полностью сформировался.
О химическом составе щетинок сведений немного. По характеру пре-ломлеш^я лучей фибриллы щетинок напоминают хитин ракообразных и., насекомых; хитиновая субстанция составляет от 1/3 до 1/2 сухого веса щетинок. У Amphinomidae щетинки пропитаны известью и очень ломкие. Многие щетинки совершенно прозрачные, бесцветные (в частности, у филлодоцид), но нередко они имеют светло- или темно-золотистую окраску; длинные капиллярные щетинки у Aphrodita («морская мышь»), свешивающиеся у них по бокам тела, отсвечивают и отливают всеми цветами радуги, как павлиньи перья, от лазурно-голубых до изумруднозеленых и от темно-золотистых до рубиново-красных оттенков, что придает червю изумительно красивый облик.
О первичной природе одноветвистых параподий
Какой тип параподий — одноветвистый или двуветвистый — более примитивный и исходный для современных полихет? Этот вопрос имеет большое принципиальное значение для построения естественной системы многих семейств многощетинковых червей, но в литературе он дебатировался мало. Большинство авторов придерживается того мнения, что одноветвистые параподии современных полихет возникли из двуветвистых путем редукции нотоподии. Именно такой взгляд развивал Э. Бергштрём (Bergstrom, 1914 : 85). Он считал, что у первичных кольчецов должно было быть большое количество ацикул, подобно современным эвницидам, которых он рассматривал как примитивных червей. Лишь в дальнейшем из этих ацикул, по его мнению, обособились две. давшие начало двуветвистым параподиям, а затем, в частности у филлодоцид, произошла редукция нотоподии, обусловившая у них одноветвистые параподии. В соответствии с этим он построил и всю систему самого семейства Phyllodocidae, поставив во главу его род Notophyllwn с добавочной нотоподиальной ацикулой. Однако у специализированного рода Notophyllum (см. главу «О филогенетических отношениях в пределах семейства Phyllodocidae») процесс цефализации передних сегментов зашел значительно дальше, чем у других родов филлодоцид, а потому вряд ли он может рассматриваться как исходный в данном семействе. Что же касается ацикул, то следует отметить следующее. Ацикулы и внешние щетинки образуются одним способом (имеют одинаковое происхождение). Но внутренние щетинки первичных кольчецов, которых действительно могло быть много, все же нельзя сопоставлять с ацикулами современных эвницид. Ацикулы как осевой скелет параподий, управляющий движениями внешних щетинок, окончательно сформировались лишь после образования достаточно сложного пучка внешних щетинок. Количество ацикул зависит от структуры пучка внешних щетинок. Надо думать, что внешние щетинки дифференцировались постепенно, а потому и осевой аппарат параподий (ацикулы) усложнялся также постепенно. У более примитивных форм, со слабым пучком тонких однотипных щетинок, как у филлодоцид, было вполне достаточно одной ацикулы для управления всеми щетинками. При усложнении пучка внешних щетинок возникла необходимость в более мощной ацикуле, а при большой дифференцировке щетинок, когда разные щетинки начали выполнять различ
42
ВВЕДЕНИЕ
ные задачи, одной ацикулы уже оказалось недостаточно и возникли добавочные. Наличие у современных эвницид большого количества аци-кул нисколько не указывает на их примитивный характер, а объясняется тем, что у них весьма сложный набор специализированных щетинок. Во всех последующих работах одноветвистые параподии филлодоцид также рассматривались как с редуцированной нотоподией (Fauvel, 1923; Day, 1967), но специально этот вопрос никем не разбирался. По поводу того, какие параподии — одноветвистые или двуветвистые — следует считать исходными для современных полихет Н. А. Ливанов (1955 : 136) пишет довольно уклончиво: «. . . двуветвистые параподии. . . это, собственно, обычное состояние для современных полихет, и те случаи, когда параподии являются как бы примитивными, одноветвистыми, обычно связано с редукцией нотоподия, как например у Eunicidae».
В последнее время вопрос об исходном типе параподий вновь был поднят В. Шторхом (V. Storch, 1968), который в своих филогенетических построениях исходит из теории примитивности амфиномид (см. стр. 69). За исходный тип он принимает двуветвистые параподии Amphinomidae— Aphroditidae, считая, что защитная, или оборонительная, роль ното-подий, достаточно хорошо выраженная у амфиномид, будто бы представляет собой одну из первичных функций параподий. Для доказательства своего положения он проводит аналогию с защитными образованиями примитивных моллюсков, в частности с иглами Solenogastres и спинными щитками хитонов. Но последнее нам представляется малоубедительным, так как спинные защитные образования у моллюсков возникли в результате их медленного ползания, а первичные кольчецы укрывались от врагов, надо думать, путем быстрых движений. Защитная роль параподий, с нашей точки зрения,— это вторичная, дополнительная функция, образовавшаяся в процессе эволюции лишь у некоторых, к тому же у весьма немногих полихет. Нотоподии нельзя рассматривать лишь как защитные приспособления, назначение их в функциональном отношении значительно более разнообразное. Параподии амфиномид по своей морфологии очень сложные, в высшей степени специализированные комплексы, вряд ли сохранившие какие-либо примитивные черты.
Наиболее просто устроенные параподии среди современных эррантных полихет мы имеем у донных филлодоцид (стр. 36). При этом одноветвистые их параподии не являются результатом регрессивного процесса (редукции нотоподии), а представляют собой начальное для них положение. В онтогенезе донных филлодоцид никогда не была констатирована закладка параподий в виде двух или нескольких раздельных зачатков (у их нектохет всегда имеется лишь один пучок щетинок). Примитивный характер одноветвистых параподий филлодоцид хорошо согласуется и со многими другими примитивными чертами их строения, которые достаточно подробно освещены в разных разделах данного очерка. Все это заставляет нас считать, что исходный тип параподий у полихет одноветвистый. Двуветвистые параподии, весьма типичные для большинства современных многощетинковых червей, возникли в связи с общим усложнением экологии полихет. В частности, это произошло в результате того, что на параподиальный комплекс, помимо локомоторных задач, в процессе эволюционного развития постепенно возлагались и различные другие функции. Совершенно естественно, что в некоторых случаях одноветвистые параподии могли возникнуть и из двуветвистых путем редукции ранее имевшейся нотоподии, т. е. не все одноветвистые параподии современных полихет обязательно примитивные. Но такой регрессивный процесс в семействе Phyllodocidae не наблюдается. На
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК 'ь'1
против, в этом семействе в тесной связи с начальными этапами цефали зации удается проследить и параллельный процесс образования зача точных нотоподий в виде добавочный нотоподиальных ацикул.
Насколько разнообразно функциональное значение'параподиальпого комплекса хорошо видно на примере Harmothoe и Nereis.. По сравнению с филлодоцидами их параподии выполняют более сложные задачи. Параподии Harmothoe imbricata типично двуветвистые, с резко обособленными и широко раздвинутыми невро- и нотоподиями (рис. 6, 14). Эти черви не зарываются в ил и передвигаются по поверхности субстрата с помощью лишь брюшных щетинок, которые действуют как ходули (такой способ движения принято называть «маршировкой»). Спинные подиальные ветви у них вооружены многочисленными прямыми или слегка изогнутыми, очень крупными щетинками, направленными вверх в виде широкого веера. Никакой роли при передвижениях червей эти щетинки не играют. Они служат для обеспечения «респираторного канала» под элитрами, в котором нередко вынашиваются яйца, нуждающиеся в постоянном притоке свежей воды. Указанные нотоподиальные щетинки, с одной стороны, подпирают элитры и этим путем сохраняют под ними свободное пространство, а с другой стороны — предохраняют «респираторный канал», проходящий с боков тела вдоль всей спины, от засорения посторонними частицами; они выполняют как бы назначение «вентиляционных решеток». Напомним, что у филлодоцид их кожные покровы, через которые осуществляются процессы дыхания, защищены от засорения «слизистым чехликом» (см. стр. 17). Афродитиды как ведущие более активный и подвижный образ жизни не выделяют большого количества слизи, а потому им приходится иметь дополнительные устройства для обеспечения бесперебойного газообмена, каковыми и являются указанные выше «вентиляционные решетки». Сколь-нибудь серьезного оборонительного значения нотоподиальные щетинки, по-видимому, не имеют: при нападении хищника черви нередко сбрасывают элитры и этим путем спасаются от врага. У афродитид комменсалов, например, у Arctonoe vittata, поселяющихся в мантийной полости моллюсков, нотоподии развиты весьма слабо — спинных щетинок мало или они отсутствуют вовсе. Последнее можно объяснить тем, что необходимость в защите «респираторного канала» от засорения у них в значительной степени отпадает, так как это в данном случае берет на себя сам моллюск.
Строение параподий Nereis уже было подробно описано выше (см. стр. 33). Обе сильно развитые подиальные ветви у них действуют одновременно как двигательные рычаги, что позволяет им не только быстро передвигаться по грунту, но иногда и всплывать. Нотоподии по размерам своих подиальных лопастей даже крупнее невроподий. Это в какой-то степени связано и закреплено эпитокией, весьма типичной для нереид. В период эпитокии, во время которой происходит массовый нерест, черви переходят от бентического образа жизни к пелагическому. В этот момент они претерпевают значительные морфологические изменения, в частности, у них сильно разрастаются подиальные лопасти, которые и обеспечивают крупным червям быстрое плавание в поверхностных слоях моря. Но сильно развитые нотоподии им нужны не только для плавания. Когда неполовозрелые черви находятся внутри V-образных норок, построенных в плотном илистом грунте, иногда на глубине 10—15 см от поверхности грунта, им приходится для ирригации (аэрации) своих убежищ делать сильные изгибательные движения в спинно-брюшной плоскости всем телом. Последнее легко наблюдать, поместив нереид в стеклянные трубки, в которых они способны жить в аквариальных условиях длитель
44
ВВЕДЕНИЕ
ное время. Этими движениями они и прогоняют через свои длинные галереи свежую воду. При такого рода гидрокинетических движениях функция параподий меняется — из органов движения они превращаются в органы фиксации. Для закрепления червей на одном месте одновременно используются как невро-, так и нотоподии. Находясь в норках, Nereis почти непрерывно производят гидрокинетическую работу. У некоторых седентарных червей отмечена вполне определенная ритмика пропускания воды через трубки (Wells, 1951; Wells a. Dales, 1951).
Для нереид, относящихся к роду Lycastopsis, характерно весьма слабое развитие нотоподии и отсутствие нотоподиальных щетинок. Показательно, что L. augeneri в заливе Посьета Японского моря живет лишь среди береговых выбросов, состоящих из рыхлых остатков зостеры и различных макрофитов и не строят глубоких узких ходов в плотном грунте (Бужинская, 1967). Отсутствие у них хорошо развитых нотоподии, возможно, обусловлено тем, что им не приходится непрерывно вентилировать свои убежища. К тому же у Lycastopsis не отмечена эпитокаль-ная стадия. Таким образом, и здесь, среди нереид, различные усложнения параподий хорошо объясняются спецификой образа жизни. Следует подчеркнуть, что Lycastopsis по строению хобота более примитивная форма, чем все остальные нереиды.
Большой фактический материал по строению параподий полихет, рассмотренный в сравнительном эволюционном аспекте, приведен в работе А. Бинар и Р. Жене (Binard et Jeener, 1930). Из этой работы можно почерпнуть много интересных примеров усложнения параподиальных комплексов. Эти авторы наметили несколько основных линий в развитии параподий. Однако нам представляется довольно искусственным выделение Phyllodocidae—Glyceridae—Nephthyidae среди эррантных полихет в «высшую группу» (groupe superieur). Такое выделение этих семейств указанные авторы делают лишь на том основании, что при движениях существенную роль у этих червей играет хобот. Прямую зависимость-между действием хобота как «подтягивающего инструмента» и строением параподий усмотреть трудно. Хобот филлодоцид при локомоции имеет значительно меньшее значение, чем хобот глицерид, который крупнее-и мощнее хобота филлодоцид, в то же время у глицерид нотоподии хорошо развиты, а у филлодоцид они отсутствуют. К сожалению, функциональное значение различных морфологических образований полихет изучено еще крайне недостаточно.
Метамерия внутренних органов
Внешняя сегментация тела, весьма характерная для всех полихет, обычно соответствует внутренней метамерии, выражающейся в наличии поперечных перегородок — септ, или диссепиментов, отделяющих друг °т ДРУга отдельные сомиты, или метамеры. Внутренние перегородки изолирующие полостную жидкость метамер, имеют отчасти защитную функцию, так как при случайном повреждении стенки тела или при разрыве червя такое ранение не влечет за собой обязательную гибель животного. В связи с этим у многощетинковых червей сильно развита способность к регенерации утраченных частей, что в свою очередь служит иногда предпосылкой для бесполого размножения путем деления или почкования, но которое обязательно чередуется с половым (например, силлиды); у филлодоцид бесполое размножение не наблюдается (см. стр. 49).
МОРФО-ФУНКЦИОНАЛЬНЫЙ ОЧЕРК
45
В каждом, сегменте обычно закономерно повторяются основные внутренние органы: система внутренних мышц, кровеносные сосуды, нервные сплетения и выделительные органы.
Мускулатура. У донных филлодоцид в связи с быстрыми синусоидальными движениями мускулатура развита весьма богато (рис. 9). Под базальной мембраной кожного эпителия располагаются кольцевые мышцы, однако последние у полихет. не образуют сплошного
Рис. 9. Система мускульных тяжей в сомите Phyllodoce groenlandica (по: Storch, 1968).
long. dors. — дорсальные продольные; later, int. — боковые внутренние; осс-lus. — замыкающие; dorso-ventr. — дорсо-вентральные; obliq. ventr. — косовентральные; long, ventr. — вентральные продольные; circ. — кольцевые.
слоя: на границе сегментов они, как правило, развиты слабо, а по бокам тела прерываются параподиями. Значительно большее значение имеют дорсальные и вентральные продольные мышцы. У филлодоцид дорсальные продольные мышцы развиты сильнее, чем вентральные; они образуют сплошную толстую ленту вдоль всей спинной поверхности тела. У афродитид картина обратная: пучки брюшных продольных мышц мощнее спинных, что всецело объясняется разными способами движения этих червей (см. стр. 43). Кроме того, в каждом сегменте имеются дорсо-вентральные пучки мышц, расположенные впереди и позади септ, а также косо-вентральные и боковые мышцы, обеспечивающие движение параподий.
Кровеносная система полихет замкнутая и состоит в основном из спинного и брюшного продольных сосудов, находящихся в спинных и брюшных мезентериях. Спинной и брюшной стволы в каждом сегменте, как правило, соединены между собой кольцевыми, или комиссуральными, сосудами, которые дают в сторону параподий сеть капиллярных ответвлений. От брюшного тракта кровь посылается к периферии (к параподиальным жабрам, если таковые имеются), а спинной сосуд принимает обратно возвращающуюся с периферии кровь. Разветвления кровеносных сосудов отдельного сегмента принято обозначать как ангиосомит (Тимофеев, 1923, 1924, 1930). Кровеносная система у фил-
46
ВВЕДЕНИЕ
лодоцид развита слабо, в частности, боковые ответвления спинного и брюшного сосудов не образуют замкнутой системы, и в данном случае говорить об ангиосомите затруднительно. Спинной сосуд у них заключен в толще продольных мышц и расположен вдоль медиальной линии спины, а брюшной свободно лежит в полости тела вдоль нервной цепочки, образуя ряд волнистых изгибов. Интересно отметить, что Гравье (Gravier, 1896) наблюдал в спинном сосуде движение кровяной жидкости от переднего конца к заднему. Вполне возможно, что у филлодоцид еще не установилось постоянное направление кровяного тока. Кровь филлодоцид (так же как у афродитид, глицерид и силлид) бесцветная, а яы-хательный пигмент (гемоглобин) растворен в нервной ткани. Таким образом, гемоглобин у них служит не для переноса, а для связывания кислорода в наиболее чувствительных к его недостатку тканях. Кровеносная система филлодоцид в основном выполняет трофические функции — разнос питательных веществ. Все эти особенности кровеносной системы филлодоцид, по Н. А. Ливанову (1940), подчеркивают весьма примитивные черты их организации. У филлодоцид и близких к ним семействах еще отсутствуют какие-либо специальные органы дыхания (жабры) и газообмен осуществляется всей поверхностью тела червя. Для обеспечения процессов газообмена филлодоциды вынуждены делать непрерывные дыхательные движения всем телом и спинными усиками; более высокоорганизованные полихеты, у которых имеются специальные органы дыхания в виде разветвленных жабр с богатой капиллярной сетью, от такого рода дыхательных движений освобождены.
Нервная система, представленная у полихет брюшной нервной цепочкой, в каждом сомите образует собственный комплекс нервных окончаний — невросомит. Последний состоит, кроме брюшных ганглиев (туловищного мозга), в основном из трех периферических нервных колец, из которых переднее и заднее кольца, по Н. А. Ливанову (1924), заведуют движением мышц (моторная функция), а среднее, образующее подиальный ганглий, имеет преимущественно рецепторный характер; по более новым данным (Bullock a. Horridge, 1965), точное функциональное значение нервных колец пока нельзя считать твердо установленным. Нервная система филлодоцид, подробно описанная еще Ж. Прюво (Pruvot, 1885) и Ш. Гравье (Gravier, 1896), в последнее время значительно уточнена В. К. Лебским (1970). Используя метод гистохимической реакции на специфический для нервной системы фермент холинэстеразу, он дал детальную топографическую картину нервной системы Eulalia viridis (рис. 10). По его данным, помимо трех основных сегментарных нервных колец имеется еще дополнительная четвертая, пресептальная, пара нервов, которая, раздваиваясь на небольшом удалении от брюшного ганглия, соединяет второй нерв с первым нервом последующего сегмента; кроме того, третий нерв по боковой поверхности тела довольно крупной комиссурой соединяется также с первым нервом последующего сегмента. Все это указывает на то, что между периферическими нервными системами смежных сегментов существует весьма глубокая связь, что ранее известно не было. Кроме того, В. К. Лебскому удалось установить, что подглоточные ганглии Е. viridis (рис. 10), иннервирующие щупальцевидные усики трех первых сегментов, имеют легкие пережимы (перехваты), разделяющие подглоточные ганглии как бы на три части, соответствующие трем передним сегментам. Последнее отчасти было показано А. Бинар и Р. Жене (Binard et .Teener, 1928). Интересно отметить, что, по данным Прюво (Pruvot, 1885), подглоточные ганглии Phyllodoce laminosa имеют простую грушевидную форму и в основном расположены в пределах III сегмента. Если указанные выше различия в строении под-
Рис. 10. Нервная система Eulalia viridis (по: Лебский, 1970).
А — схема головного мозга и брюшной нервной цепочки: г — глаз, ар. г. — зрительный ганглий, и. бр. ц. — коннективы брюшной нервной цепочки, щ — нерв I щупальцевого сегмента, н2 — нерв II щупальцевого сегмента, н3 — нерв III щупальцевого сегмента, и. а. — нерв к анальному отверстию,' н. а. у — нерв анальных усиков, н. ан. — нерв антенны (головного щупальца), п. м. — передний мозг, пдгл. уз. — подглоточный узел, ср. м. — средний мозг, I—IV — нейросомиты; Б — схема стоматогастрической нервной системы: г. пр. н. — главные (6) продольные нервы, д. пр. н. — дополнительные (18) продольные нервы, к. н. — кольцевой нерв в базальной части краевых папилл; В — взаимоотношения между сегментарными нервами: км — комиссура; соединяющая I и III нервы двух соседних сегментов, Het — I сегментарный нерв, мс2 — II сегментарный нерв, нс3 — Ш сегментарный нерв, мс4 — IV сегментарный нерв, н. бр. у. — нервное сплетение в брюшном усике, н. сп. у — нервное сплетение в спинном усике, п. г. — подиальный ганглий.
48
ВВЕДЕНИЕ
глоточных ганглев Eulalia и Phyllodoce не обусловлены методикой исследований, то они достаточно принципиальны и хорошо согласуются с особенностями строения передних сегментов этих двух родов: у Eulalia все три передних сегмента четко отделены друг от друга, а у Phyllodoce I сегмент со спилы редуцирован и частично слит со II сегментом. Из этого следует, что подглоточный ганглий Eulalia по сравнению с таковым Phyllodoce находится на более начальных ступенях цефализации. На личиночных стадиях филлодоцид (метатрохофора) каждый ларвальный сегмент имеет самостоятельный узел брюшной нервной цепочки. Таким образом, степень внешней цефализации взрослых форм хорошо коррелируется со строением их нервной системы. К сожалению, последняя изучена достаточно полно лишь для немногих родов.
Нейрональный состав и структура нейрохорд у филлодоцид, в том числе Eulalia, пока остаются не исследованными, что затрудняет сопоставление по этому признаку филлодоцид с афродитидами, у которых М. М. Ромм (1960) установила на примере Harmothoe imbricata сильно дифференцированные нервные образования. По Н. М. Ерохиной (1968), головной мозг филлодоцид (Eteone longa) построен значительно проще, чем у афродитид (Harmothoe imbricata) — отсутствуют стебельчатые тела, слабее дифференцирован, а общее количество нервных клеток меньше на несколько порядков; последнее Н. М. Ерохина ставит в связь с особенностями экологии указанных червей, но наряду с этим здесь отчасти проявляется и общая большая примитивность филлодоцид по сравнению с афродитидами. В широком эволюционном аспекте нервная система полихет рассматривается в сводке Т. Баллока и Г. Хорриджа (Bullock а. Ног-ridge, 1965).
Выделительная система. В соответствии с внутренней сегментацией метамерно расположены и органы выделения (нефридии), а также гонады. Нефридии у филлодоцид представлены слегка изогнутыми парными канальцами, открывающимися наружу небольшими нефропорами на вентральной стороне у основания параподий. Замкнутый внутренний их отдел с многочисленными крупными концевыми клетками — соленоцитами, пронизывая стенку диссепимента, проникает в соседний, расположенный впереди сегмент. Нефридии у филлодоцид отсутствуют лишь на передних сегментах и на двух-трех задних. При наступлении половой зрелости происходит некоторое усложнение — к нефридиальному каналу присоединяется независимо от него возникающая широкая мерцательная воронка (гоностом), служащая для выведения половых продуктов наружу. Характер строения выделительной системы у разных родов филлодоцид (Eulalia, Phyllodoce, Notophyllum) один и тот же; имеются лишь небольшие отклонения в деталях расположения соленоцитов (Fage, 1906). Аналогичный тип выделительной системы свойствен альциопидам и томоптеридам. Glyceridae и Nephthyidae также имеют протонефридии с соленоцитами, но вместо мерцательной воронки к их нефридиальному канальцу присоединяется особый фагоцитарный орган. У остальных же полихет (за исключением Capitellidae) типичные метанефридии с самого начала объединены с целомодуктами и внутренний конец начинается постоянно действующей открытой воронкой — нефростомом. Существенно отметить, что у всех личиночных форм выделительная система закладывается в виде протонефридиев. Последнее подчеркивает, что протонефридии следует рассматривать как наиболее примитивный и исходный тип выделительной системы.1
1 А. Лямер (Lameere, 1925), исходя из своей теории происхождения аннелид из Anthozoa (Ceria.ntha.rta.), которая идет вразрез со взглядами Е. Гудрича (Goodrich,
РАЗМНОЖЕНИЕ И РАЗВИТИЕ 49
' Из внутренних органов не имеет строго метамерного строения у полихет лишь кишечник, представленный в виде прямой, а иногда сильно извилистой трубки, но у некоторых афродитид и он обнаруживает признаки метамерии — в большинстве сегментов имеются парные боковые слепые выросты (карманы).
Внутренняя метамерия у филлодоцид нарушается лишь в передней части тела. Последнее 'обусловлено тем, что эти черви снабжены очень длинным и весьма подвижным пищеводом, который частично выворачивается наружу, образуя хобот. У филлодоцид он может занимать свыше . половины длины тела червя (то же и у Glyceridae). В силу большой подвижности массивной глотки у этих червей происходит почти полная редукция внутренних перегородок — септ во всей передней части тела и целомическая жидкость, обычно изолированная в отдельных сомитах, у них в передней части тела свободно перекачивается из одного отдела в другой, что способствует быстрому выбрасыванию хобота наружу.
РАЗМНОЖЕНИЕ И РАЗВИТИЕ1
Многощетинковые черви весьма лабильны по способам размножения. Для большинства полихет типична свободноплавающая личиночная стадия трохофора, претерпевающая очень сложный метаморфоз. Иногда личиночная планктонная стадия подавлена, наблюдается прямое развитие. Отмечены случаи живорождения, связанные с гермафродитизмом и партеногенезом. Для ряда силлид и цирратулид характерно бесполое размножение путем почкования (образования столонов), при этом имеет место строгое чередование поколений.
Для Phyllodocidae, Alciopidae, Tomoptertdae, Typhia scaled dae и La-cydoniidae известно лишь половое размножение, и оплодотворение у них всегда наружное. У всех планктонных полихет весь цикл развития протекает в толще воды. Донные филлодоциды имеют пелагические личинки, но начальные стадии эмбриогенеза у них частично связаны с бентосом. Иногда наблюдается вынашивание яиц под прикрытием спинных усиков, например, у Notophyllum. Такой способ заботы о потомстве наиболее широко распространен среди афродитид: у них яйца развиваются до стадии свободной трохофоры под элитрами, но это наблюдается преимущественно у особей, живущих в малоблагоприятных арктических условиях. Большей частью самки донных филлодоцид делают слизистые кладки, прикрепляя их к водорослям, гальке и другим подводным предметам (рис. 11, 7). В эти кладки в момент их откладывания проникает самец и оплодотворяет яйцеклетки. В этом случае первые стадии развития протекают под защитой оболочки слизистой кладки,, предохраняющей эмбрионов от неблагоприятных воздействий внешней среды. Начальные стадии онтогенеза наиболее чувствительны ко всем малейшим изменениям внешних факторов. Так, если взрослые Eulalia viridisB Белом море, по данным В. Я. Бергера и В. К. Лебского (1969), способны выдерживать опреснение до 6—8°/00, то их трохофоры не переносят уже солености порядка 14°/00. Непрсшицае-мые стенки слизистых кладок смягчают губительное влияние низких соленостей.
1900), а также ряда других современных исследователей, считает наиболее архаичным типом выделительной системы полихет нефромиксии, а протонефридии, по его мнению, возникли лишь в результате дальнейшего развития, но с этим согласиться весьма трудно. .
1 Раздел составлен В. А. Свешниковым.
4 п. В. Ушаков
50
ВВЕДЕНИЕ
У Phyllodoce в Белом море, по данным В. Свешникова (1961), продолжительность эмбриогенеза с момента оплодотворения до выхода трохофоры из кладки около 6 дней. По выходе из кладки трохофоры ведут свободный планктонный образ жизни и активно питаются, потребляя личинки других беспозвоночных, реже простейших и фитопланктон. Трохофора филлодоцид относится к монотрохному типу (с одним ресничным кольцом). Скорость их передвижения до 1.1 мм/сек. (Константинова, 1969). Трохофора последовательно превращается в метатрохофору I, метатрохофору II
Рис. 11. Личиночные стадии Phyllodoce (по В. А. Свешникову).
1 — кладка на листе Zostera', 2 — трохофора; 3 — метатрохофора; 4 — нектохета;
5 — ювенильная донная форма.
и нектохету. Последняя, достигнув определенного размера, оседает на дно.
Для многих филлодоцид характерна высокая плодовитость: в одной кладке может быть свыше 150 тыс. яиц (Петровская, 1960), а в планктоне иногда встречается до нескольких десятков тысяч личинок в 1 м3. Неблагоприятные температурные и солевые условия в период нереста могут резко лимитировать численность последующих поколений. Пелагические личиночные стадии донных филлодоцид служат для них расселительными формами, с помощью которых они распространяются на большие расстояния и могут удерживать за собой обширный ареал.
Первые сведения по развитию личинок филлодоцид принадлежат А. Агас-сицу (Agassiz, 1867) и В. Макинтошу (McIntosh, 1869), которые описали метатрохофору и нектохету Phyllodoce maculata из прибрежных вод северной части Атлантического океана. Еще в конце прошлого столетия было весьма детально изучено развитие Lopadorhynchus (Kleinenberg, 1886; Мейер, 1897); в дальнейшем эти данные были уточнены Б. Акессоном (Akesson, 1967). Некоторые наблюдения над размножением и развитием филлодоцид приведены в работе Ш. Гравье (Gravier, 1923). Развитию Eulalia viridis посвящена специальная работа А. Мейера (Меуег, 1938).
I
РАЗМНОЖЕНИЕ И РАЗВИТИЕ
51
В'обширной сводке Г. Торсона (Thorson, 1946) дан обстоятельный обзор всех литературных данных и приведен ряд собственных наблюдений по личиночным формам различных видов филлодоцид. Личинки Phyllodoce tuberculata из Черного моря описаны М. И. Киселевой (1957а), a Ph. maculata из Баренцева моря.— М. В. Петровской (1960). Некоторые личинки филлодоцид из Белого и Японского морей в последнее время подробно изучены В. А. Свешниковым (1961, 1967). Эмбриология и личиночное развитие Tomopteris helgolandica детально исследованы Б. ^Акессоном (Akes-son, 1962;. Akesson a. Melander, 1967). Личиночное развитие Lacydoniidae впервые прослежено М. Бо (Bhaud, 1967). Детали индивидуального развития Alciopidae в литературе пока не освещены; имеются лишь сведения по Alciopina parasitica (Claparede et Panceri, 1867; Granata, 1911). Постэмбриональный период развития некоторых филлодоцид изучен несколько подробнее, чем у представителей многих других семейств.
Пелагические личинки донных филлодоцид на стадиях тохофоры, метатрохофоры, а иногда — нектохеты сохраняют общий признак — эксцентрично расположенный «хохолок» (реже симметрично расположенные два хохолка), который от анимального полюса сдвинут в сторону ротового отверстия (рис. 11). По этому признаку личинки Phyllodocidae относятся к типу «cirraria» (Свешников, 1963).
Пигментация у разных трохофор филлодоцид различна, но преобладают зеленые, желтые и оранжевые тона. У некоторых трохофор на эписфере, а у метатрохофор на простомиуме, «воротнике» (рис. 13, в) и пи-гидиуме развиты крупные, лимонного цвета парные пятна, отражающие падающий свет. Тактильные, а по всей видимости, и хеморецепторные органы представлены парой или одним хохолком вблизи апикального поля. Глаза обычно красные, с хрусталиками или без них. Тело трохофоры и метатрохофоры разделено экваториальным ресничным поясом — прототрохом. Он составлен из крупных клеток, расположенных в три ряда (рис. 12, пт.). Средний ряд состоит из наиболее крупных клеток и ресничек. Экваториальный пояс сопровождается нервно-мышечным кольцом (рис. 12, к. н.), которое пересечено меридиональными нервно-мышечными тяжами в количестве от 5 до 7 пар. Число меридиональных тяжей неодинаково в верхнем и нижнем полушарии. В эписфере их от 11 до 15. По брюшной стороне проходит непарный тяж, а остальные расположены симметричными парами. Все тяжи около анимального полюса ветвятся. Непарный нервно-мышечный тяж раздваивается в нижнем полушарии, охватывая ротовое отверстие. Пара спинных мышечных тяжей в нижнем полушарии охватывают анальное отверстие. Кроме экваториального нервно-мышечного кольца, у трохофоры могут быть два или три полных или неполных кольца в верхнем и одно кольцо в нижнем полушарии. Эти кольца расположены в плоскостях, параллельных экватору. В толще эктодермы анимального полюса у трохофоры происходит дифференциация клеток и образуется зачаток головного мозга (рис. 12, м). На вегетативном полюсе формируется зачаток брюшной нервной цепочки (рис. 12, бр. м., пдгл. г.).
Эпителий трохофоры и метатрохофоры состоит из покровных и многочисленных железистых клеток (рис. 12, ск. э.). Эксцентрично и немного ближе к ротовому полю на верхнем полюсе расположены крупные ресничные клетки теменного органа (рис. 12 и 13, м. орг.).
Значительный объем трохофоры занимает кишечник. Ротовое поле переходит в узкую трубку пищевода, который состоит из клеток с сильными ресничками (рис. 12, п). Трубка пищевода с кольцевыми и продоль-4*
52
ВВЕДЕНИЕ
ними мышечными волокнами. Вздутая часть кишки (к) всегда состоит из двух камер, которые сообщаются между собой щелью в перегородке (ск. к.). Обе камеры имеют ресничную выстилку. Задняя камера открыта наружу анальным отверстием в центре гипосферы. В толще стенки кишки расположены многочисленные гранулы желтка. У трохофоры возникает парный зачаток глотки (гл. д.).
100 мк
Рис. 12. Трохофора Phyllodoce maculata, сагиттальный разрез (по В. А. Свешникову).
а —анальное отверстие; бл. — бластоцель; бл. п. — бластопоральная поверхность; бр. м. — зачаток брюшного мозга; гл. д. — глоточный дивертикул; з. щ. — зачаток головного щупальца; к — кишечник; ку. — кутикула; к. н. — кольцевой нерв; м — головной мозг; м. орг, — мерцательный орган; at.6. — мезобласт; п — пищевод; пдгл. г. — подглоточный ганглий; пти. — прототрох; р — рот; ск. к. — секреторные клетки кишечника; ск, э. — секреторные клетки эпителия.
Стадия метатрохофоры начинается с момента появления ларвальной сегментации. Число ларвальных сегментов относительно большое. У личинок рода Eteone (рис. 14) их 7. Ротовой сегмент щетинконосных мешков не несет. После образования ларвальных сегментов обычно наступает пауза, выраженная задержкой в появлении новых постларвальных сегментов. Метатрохофора и нектохета претерпевают значительные морфологические изменения, а число сегментов при этом остается постоянным.
Для метатрохофоры Phyllodoce характерен железистый воротник вокруг ротового сегмента (рис. 11, 5; 13, в). Сегментация метатрохофоры развивается сначала в эктодерме, а затем охватывает и мезодермальные образова-
м.орг.—
Рис. 13. Метатрохофора Phyllodoce maculata, сагиттальный разрез (по В. А. Свешникову).
бл — бластоцель; в — воротник; г3 — ганглий III сегмента; гл. д. — ДивеРтикУл; ж — капли жира; з. щ. — зачаток головного SS ца’ к — кишечник; ку — кутикула; к. м. пт. — кольцевая мышца прототроха, к. н. птп. — кольцевой нерв прототроха; м орг _
мерцательный орган; мз. — мезенхима; нр. — нейропиле; нт. — ното-трох, пдгл. г. — подглоточный ганглий; п. м. — передний мозг- п н — параподиальные нервы; пт. — прототрох; р. — рот; ск. к. — секретоп-ные клетки кишечника; ск. э. — секреторные клетки эпителия.
54
ВВЕДЕНИЕ
ния. У одиннадцатисегментной Phyllodoce (рис. 13) сегментация в эктодерме выражена спинными ресничными полукольцами — нототрохами (нт.), узлами брюшной нервной цепочки (пдгл. г. иг), щетинконосными мешками
Рис. 14. Личиночные стадии Eteone longa (по В. А. Свешникову).
1 — трохофора; 3 — метатрохофора; 3 — ранняя нектохета; 4 — поздняя нектохета; 5 — донная ювенильная семисегментная форма; 6—8 — сложная ' и простая щетинки ювенильной формы.
и нервами параподий (п. н.). Бластоцель на этой стадии не сегментирован (бл), и в нем свободно располагаются мезенхимные клетки (мз) в направлении от анального поля к анимальному полюсу. У некоторых личинок в ларвальном теле септы и мезентерии могут образовываться схизоцельно, а в постларвальном — телобластически. Например, процессы метамерии
РАЗМНОЖЕНИЕ И РАЗВИТИЕ
ларвальногст целома схизо-цельным путем можно наблюдать у Eteone longa.
Стадия нектохеты характерна тем, что параподии ларвального отдела сформированы настолько, что получают подвижность, а дефинитивные щетинки вырастают из щетинконосных мешков наружу и способствуют парению в толще воды. Личинка на этой стадии имеет габитус взрослого животного и готова осесть на дно. Однако у большинства личинок некоторые провизорные системы все еще сохраняют свое значение и благодаря им нектохета ведет пелагический образ жизни. Например, у нектохеты Eteone longa сохраняются полные ресничные кольца и спинные полукольца (рис. 14; рис. 15, пт, тт, нт), ортогональное нервно-мышечное кольцо (к. н. пт.), в значительной части бластоцель и другие провизорные приспособления. Вместе с тем у нектохеты Eteone longa развиты все приспособления, необходимые для донной жизни, например, олигомерное, семисегментное тело, способное к изгибанию с помощью подвижных параподий со щетинками. Дефинитивная нервная система уже сформирована и функционирует. Головной мозг разделен на отделы и каждый отдел дифференцирован (ант. г.); имеются обычные ганглиозные и гигантские нейроны (я. н.). Вблизи переднего и среднего отделов мозга нектохеты сформированы одна непарная и две парных целомических полости (ц). У взрослой Eteone longa головной мозг окружен одной непарной и четырьмя парными целомическими полостями
Рис. 15. Нектохета Eteone longa, сагиальный разрез (по В. А. Свешникову).
а — анальное отверстие; ант. г. — антеннальный ганглий; г6 — ганглий VI сегмента; г. кл. — ганглиозные клетки брюшного мозга; гл. — глотка; ж — капли жира; з. щ. — зачаток головного щупальца; к — кишечник; к. м. — кольцевые мышцы; к. н. пт. — кольцевой нерв, прототроха; ж — головной мозг; мз. — мезенхима; jh. гл. — мышцы глотки; нт — нототрохи; пдгл. г. — подглоточный ганглий; пр. м. — продольные мышцы; пт — прототрох; р — рот; т. м. — трансверсальные мышцы; тт. — телотрох; ц — целом; я. н. — ядра гигантских нейронов.
56
ВВЕДЕНИЕ
(Ерохина, 1968). Брюшной мозг нектохеты разделен на семь ганглиев соответственно числу ларвальных сегментов (пдгл.г—гв). Дефинитивная мускулатура ларвального тела состоит из кольцевых, продольных и поперечных лент (к. м., пр. м., т. м.). Уже сформирована глотка (ел.), хотя она снабжена еще очень слабой мускулатурой (л. гл.) и не способна выворачиваться наружу. Таким образом, мы видим, что у нектохеты дефинитивные системы в составе ларвального тела развиты сильнее, чем провизорные, и организм, обитающий на этой стадии в толще воды, полностью приспособлен к жизни на дне.
Переход к обитанию на дне сопровождается многократными пробными посадками и всплытиями в поисках наиболее благоприятного места. У личинок Phyllodoce и Eulalia эти пробные посадки особенно многочисленны, а поиски продолжительны. Поэтому осевшая на дно личинка часто имеет очень большое число сегментов (рис. 11, 5). Первое время ювенильная форма живет в «паутииовом домике», а потом переходит к свободному образу жизни.
Существенных различий в процессах развития и строении трохофор, метатрохофор и нектохет донных филлодоцид и пелагических Lopadorhynchus обнаружить не удается. Более того, наблюдается определенное сходство. У трохофор Phyllodoce и Lopadorhynchus провизорные системы одинаковые. Так называемый теменной орган у личинок обоих родов закладывается в виде парного образования. Однако потом он развивается преимущественно только с правой стороны. Очень сходна у них архитектоника провизорных эктодермальных мышц и ортогональной нервной системы. Дефинитивные системы, в частности нервная и мышечная, у Lopadorhynchus, Phyllodoce и Eteone формируются одинаковым образом. Головной мозг закладывается в виде парного образования вблизи анималь-ного полюса. Зачаток брюшного мозга также парный. У трохофоры Lopadorhynchus бластопоральная поверхность уплощена и расположена под прямым углом к главной оси личинки. Это отношение в меньшей степени проявляется и у трохофоры Phyllodoce (рис. 12, бл. п.). Вдоль названной поверхности в эктодерме образуются щетинконосные мешки, сопровождаемые параподиальными нервами и мускульными лентами. Раньше других возникают парные продольные брюшные и спинные мускульные ленты. Несколько позднее появляются тангенциальные и параподиальные пучки мышц.
У названных родов нет существенных различий и в процессах формирования парных глоточных дивертикул, а затем и глотки. Парные глоточные дивертикулы возникают как слепые карманы стомодеума, или пищевода. По морфологическим особенностям и расположению парные глоточные дивертикулы личинок Phyllodocidae весьма напоминают глоточные карманы некоторых Archiannelida, например, Dinophilus (Шимкевич, 1895) и Polygordius (Заленский, 1907).
Постэмбриональное развитие Tomopteridae изучено Б. Акессоном (Akesson, 1962). Трохофора Tomopteris helgolandica освобождается от оболочек яйца спустя 30—40 часов после оплодотворения. Для трохофоры Т. helgolandica характерно небольшое количество в эписфере эмбриональной ткани. Эта особенность противопоставляет трохофору Tomopteris многим трохофорам Phyllodocidae, а также других полихет. По всей видимости, трохофору Tomopteris нельзя отнести к типу «cirraria» (Свешников, 1963). Теменной «хохолок» у трохофоры Tomopteris отсутствует, так как на анимальном полюсе вообще нет скоплений клеток, соответствующих зачаткам головного мозга. Вместо этого в эписфере, несколько выше линии трохобластов, близко к экватору трохофоры, путем инваги-
РАЗМНОЖЕНИЕ И РАЗВИТИЕ
57
нации возникает парная закладка церебральных зачатков, которые впоследствии дают головной мозг, хемо- и фоторецепторы (рис. 16, А, В, ц. вп.). В гипосфере, также путем инвагинации, возникает парная закладка (с. пл.), из которой затем образуются соматическая пластинка, брюшная нервная, цепочка, параподии с зачатками щетинок, а мезобласты дают мускулатуру и целомическую выстилку. Инвагинацию в развитии нервной
Рис. 16. Постэмбриональное развитие Tomopteris helgolandica (по: Akesson, 1962).
А — трохофора в возрасте 30 час.; Б — срез через трохофору в возрасте 32 час.;.В — схема организации нервной системы личинки в возрасте 6 дней; а — ацикула; г — глаза; да — мозг; н, и н2 — нервы I и II сегментов; р — рот; с. пл. — впячивание, образующее соматическую пластинку с брюшной нервной цепочкой, сегментами и мезодермой; т — тентакулы; тр — трохобласты; ц. вп. — церебральное впячивание.
системы Tomopteris можно отнести к примитивным признакам, свидетельствующим в пользу древности семейства Tomopteridae относительно других полихет. Степень развития нервной системы и органов чувств и у личинок, и у взрослых форм томоптерид незначительна. Это, возможно, связано с относительно небольшой подвижностью и слабой активностью Tomopteridae, хотя для них известны факты питания мальками рыб и щетинкочелюстными (см. стр. 31—32).
Для Tomopteris helgolandica доказано наличие первичной гетерономной метамерии. Сначала закладываются пять ларвальных сегментов. Они формируются постепенно. Передние четыре сегмента опережают в развитии пятый. Среди трех передних сегмент II вначале развивается быстрее, но затем его обгоняет сегмент I с толстой осевой ацикулой. При закладке
58
ВВЕДЕНИЕ
V и VI сегментов возникает пауза в несколько дней, после которой постепенно начинают нарастать сегменты постларвального тела.
Особый интерес представляет постэмбриональное развитие Typhloseo-lecidae, которое ранее известно не было. Ниже дается, по данным В. А. Свешникова, описание 7-сегментной личинки Typhloscolex muellerl (рис. 17). Эта личинка отвечает метатрохофоре. Основными особенностями
ее организации следует считать
500мк
слабое развитие центральной нервной системы и весьма специализированный аппарат захвата пищи. Кроме того, для личинки характерно значительное развитие мезенхимы, которая на более поздних стадиях и в ларвальном, и в постларвальном отделах образует подобие паренхиматозной ткани. Эту особенность можно расценивать и как примитивный и как вторичный признак.
Головной конец личинки Т. muel-leri уплощен и несет прототрох (рис. 17, пт.). В центре анимального полюса расположено единственное щупальце, покрытое короткими ресничками. Большую часть анимального полюса занимают трохобласты (шб.), тогда как на долю элементов нервной системы приходится ничтожная часть объема эпите-
Рис. 17. Строение 7-сегментной личинки Typhloscolex muellerl, сагиттальный разрез (по В. А. Свешникову).
а — анус; а. у. — анальные усики; б. н. с. — брюшной нервный ствол; гл. — глотка; г. щ. — головное щупальце; к. — кишечник; ку. — кутикула; к. м. — кольцевые мышцы; м. гл. — мускулатура глотки; м. р. пр. — мускулатура ротовой присоски; мз. — мезенхима; и. к. — нервные клетки; п. т. — полость тела; пт. — прототрох; р. пр. — ротовая присоска; с. ж. — слюнные железы; ст. к. — стенка кишечника; тб. — трохобласты.
лия. Эта характерная морфологическая особенность строения личинки (и взрослого животного) должна совпадать с относительно пассивным образом жизни. Об этом свидетельствует не только слабое развитие и ничтожная дифференциация нервной системы, а также отсутствие органов зрения.
Второй характерной особенностью личинки служит строение аппарата захвата пищи — околоротовых губ и глотки со слюнными железами. Морфология аппарата захвата пищи такова, что он не может выворачиваться, как у хищных полихет (Dales, 1962). По своей структуре глотка Т. muellerl представляет собой типичный глотательный аппарат типа насоса. Глотка сильно вздута, почти шарообразна. Мышечные тяжи расположены радиально и на некотором расстоянии друг от друга, что позволяет предполагать возможность значительного изменения общего объема глотки (гл.). Околоротовые губы также снабжены сильной мускулатурой и вытянуты трубочкой под некоторым углом вверх. У основания околоротовых губ с дорсальной стороны открывается канал слюнных желез (с. ж.). За глоткой следует кишечник с глубокими перетяжками
РАЗМНОЖЕНИЕ И РАЗВИТИЕ
59
в каждом сегменте. Создается впечатление, что кишечник в ларвальном теле поделен на 7 камер. Клетки в стенке каждой камеры распределены так, что группы железистых клеток сосредоточены главным образом на границах между камерами, тогда как группы клеток, всасывающих пищу, — в средних участках камеры. Такое поочередное расположение клеток эпителия кишечника функционально оправдано тем, что благодаря этому создаются- дифференцированные участки для переваривания и всасывания пищи (к)'. Подобная картина известна и для других полихет. Однако у Т. muellerl ’строение кишечника носит явные черты примитивности и это, возможно, связано с потреблением полужидкой пищи. Учитывая особенности строения рта и глотки можно предположить, что Т. muellerl эктопаразитическая форма, питающаяся тканями пелагических кишечнополостных (сифонофор, медуз, гребневиков). Надо думать, что тифлосколексы находятся в толще воды в вертикальном положении. Движение сильно развитых ресничек прототроха обеспечивает им перемещение вертикально вверх. При прикосновении апикальным щупальцем к пленке натяжения у них, по всей видимости, останавливается работа прототроха и они медленно тонут. Опустившись на некоторую глубину, животное вновь начинает работать прототрохом и поднимается к поверхности моря. Такое поведение типично для велигеров моллюсков и некоторых других пела гических организмов, например, щупальцевых гребневиков. Не исключена возможность, что, поднимаясь, тифлосколексы могут случайно натолкнуться на медузу или сифонофору. Околоротовые губы, направленные вверх и сложенные трубочкой, в этом случае присасываются к жертве с помощью сосущих движений глотки. Слюнные железы выделяют пищеварительный сок, растворяющий покровы в точке соприкосновения с около-ротовыми губами. Дальнейшие сосательные движения обеспечивают поступление полужидких тканей в кишечник Т. muellerl. Питание мелкими планктонными организмами при указанном выше устройстве глотки маловероятно.
По своей организации Typhloscolecidae в целом обнаруживают явные черты примитивного строения. К последним следует отнести прежде всего сохранение во взрослом состоянии провизорных систем, например, прототроха. К этому надо прибавить некоторые особенности строения кожномускульного мешка. Например, поперечное сечение часто имеет форму квадрата или прямоугольника; преимущественное развитие получают сначала 4, а позднее 6 продольных мышечных лент; параподиальные мышцы развиты очень слабо. Листовидные придатки не имеют специальной мускулатуры и, видимо, слабо подвижны; они лишь увеличивают общую поверхность тела и способствуют парению в толще воды.
Личиночное развитие Lacydonildae стало известно лишь в самое последнее время (Bhaud, 1967). Ранняя трохофора Paralacydonla paradoxa имеет два ресничных обруча — прототрох и телетрох и по своему габитусу весьма напоминает таковую Nephthys. Однако трохофора Paralacydonla снабжена пучком апикальных ресничек, что весьма характерно для филлодоцид. Нектохета, оседающая на дно, имеет позади прототроха 11 щетинковых сегментов (рис. 18); хитиновые челюсти отсутствуют. Таким образом, Paralacydonla как бы объединяет признаки, характерные как для Nephthyidae, так и для Phyllodocidae.
Из приведенных здесь материалов нетрудно видеть, что личиночные формы у Phyllodocidae, Tomopterldae и Typhloscolecidae, входящих в состав подотряда Phyllodociformia, несколько различны. Последнее типично для таксономических групп с примитивными характеристиками. Более развитые, получившие в результате эволюционного прогресса окончатель
60
ВВЕДЕНИЕ
ное свое оформление таксономические группы обладают относительно большим однообразием строения личиночных и дефинитивных форм. Весьма характерно, что у всех личиночных форм Phyllodociformia цефали-
Рис. 18. Личиночные стадии Paralacydonia paradoxa (по: Bhaud, 1967).
А — ранняя трохофора; Б — нектохета; В — параподия; Г — простая спинная и сложная брюшная щетинки.
зация находится на низком уровне. Необходимо подчеркнуть, что в группе Phyllodociformia личинкам свойствен всегда только эволютивный тип метаморфоза. Никаких признаков некротического метаморфоза, подобно тому что происходит у Amphinomidae и Owenitdae, здесь нет.
ЭКОЛОГИЯ
Для многощетинковых червей в целом весьма характерна чрезвычайно широкая эврибионтность, и в то же время многие их представители обладают очень узкой экологической специализацией. Семейства полихет, рассматриваемые в настоящей работе, не образуют обособленную экологическую группу. Семейство Phyllodocidae состоит в основном из донных червей, но одновременно в его состав входят и некоторые пелагические виды. Бентосный образ жизни ведут и взрослые формы, относящиеся к крайне небольшому семейству Lacydoniidae. Остальные три семейства Alciopidae, Tomopteridae и Typhloscolecidae — голопланктонные организмы, и. весь жизненный цикл этих червей протекает в толще воды.
Полихеты в основной своей массе типично морские обитатели, они представляют собой доминирующие формы морского бентоса. По существу нет ни одного морского биоценоза, в котором не играли бы существенную роль те или другие представители многощетинковых червей.
Экологическая пластичность многощетинковых червей исключительно большая. Наряду с морскими формами существует немало видов, обитающих в солоноватых водах, в особенности в устьях рек тропической зоны (в частности, нереиды). Имеются также чисто пресноводные виды, живущие во внутренних континентальных водоемах; например, в пределах СССР встречается в озерах Таймыра, Байкале и р. Ангаре Мапауип-kia baicalensis, а в подземных реках и озерах Югославии обитает Mari-fugia cavatica, причем обе указанные здесь полихеты относятся к наиболее
экология
61
специализированным семействам: первая — к Sabellidae, а вторая — к Serpultdae. •"
Для солоноватых и пресных водоемов в общей сложности констатировано 130 видов (Wesenberg-Lund, 1958), из них 43 вида отмечены в пресных континентальных водах. Солоноватоводные и пресноводные виды составляют от общего •количества известных видов полихет (свыше 6000) менее 2%. Ни одного семейства, характерного лишь для солоноватых биотопов, не имеется; последнее указывает на то, что полихеты проникли в пресные воды относительно недавно. В сильно опресненных районах Полярного бассейна и морей северо-западной части Тихого океана (в прибрежных лагунах, устьях рек) встречено около 20 специфических солоноватоводных видов, относящихся к 6 морским семействам (Okuda, 1935; Ушаков, 19486; Rullier, 1957; Ключерева и др., 1964; Данг Нгок Тхань, 1967). Как в списке Е. Везенберг-Лунд, так и во всех остальных работах по солоноватоводной фауне филлодоциды отсутствуют. Однако способность некоторых филлодоцид переносить временные значительные опреснения довольно велика. Это характерно в основном для видов, обитающих в осушной зоне (Eulalia viridis, Phyllodoce maculata), которые во время отлива нередко попадают в условия резкого опреснения. Защитным приспособлением в таких случаях, по-видимому, служит обильная слизь, выделяемая червями. Лишь недавно У Бао-лином и Чэном (Wu Bao-ling a. Chen, 1963) была найдена Eteone в р. Янцзы близ Шанхая при постоянных низких соленостях, которую они описали как новый вид — Е. delta (см. стр. 176). Кроме того, в последнее время Г. Н. Волова (1969) обнаружила в сильно опресненных прибрежных озерах Южного Приморья небольших Eteone, по внешнему виду напоминающих Е. longa, которые обитали совместно с типичными солоноватоводными Nereis japonica и Prionospio japonicus. Других указаний о нахождении филлодоцид в пресных или сильно опресненных водоемах нет. Интересно отметить, что некоторые нереиды (Lycastis, Lycastopsis и даже Nereis) в тропической зоне (Суматра, Филиппины) приспособились к настоящему наземному, амфи-биотическому образу жизни и обитают во влажной земле, среди корней и коры различных пальм и листьев бананов значительно выше уровня моря на расстоянии до 25 миль от уреза воды (Pflugfelder, 1933; Е. Berkeley а. С. Berkeley, 1963).
Многие полихеты (Capitella capitata и др.) выносят довольно сильное загрязнение морских вод и способны существовать в почти анаэробных условиях (Якубова и Мальм, 1930; Bellan, 1967, 1968; Bellan-Santini, 1968). Филлодоциды в этом отношении, по-видимому, более требовательны и в сильно загрязненных биотопах пока не найдены.1
Наиболее богатая и разнообразная фауна многощетинковых червей отмечена в пределах морского шельфа, в особенности в районе низких широт. Полихеты, обитающие в осушной зоне морей, адаптированы к крайне изменчивым и часто весьма неблагоприятным условиям существования. У некоторых литоральных форм наших северныхморейнаблюдается исключительная морозостойкость. Так, на Восточном Мурмане, в морских ваннах супралиторали и осушной зоны, в зимних условиях Eulalia viridis
1 На нефтеперерабатывающих заводах, на которых для охлаждения используют морскую воду, в целях борьбы в искусственных бассейнах с биологическими обрастаниями в морскую воду добавляют хлор, сильно снижающий pH. Как сообщают Г. Зиб-ровиус и Ж. Беллан (Tethys, v. 1, № 2, 1969 : 375—382) в этих случаях полностью уничтожаются ранее существовавшие обрастания из моллюсков Mytilus и Ostrea, однако в огромных количествах разрастаются серпулиды (Pomatoceros triqueter) и сохраняются многие другие полихеты, в частности Eulalia viridis.
62
ВВЕДЕНИЕ
выдерживают временное переохлаждение до —3° С (Жюбикас, 1969), а, по данным В. В. Хлебовича (1957), взрослые литоральные Eteone longa на Курильских островах в условиях опыта восстанавливали вполне нормальные двигательные реакции после замораживания в течение трех суток до —4° С. Степень холодостойкости различных видов, полихет отчасти коррелирует с условиями, в которых они обитают. По экспериментальным наблюдениям Ю. И. Полянского (1950) на Мурмане, Spirorbis borealis, живущий в осушной зоне на фукусах и подвергающийся во время отлива непосредственному воздействию весьма низких зимних температур воздуха, оказывается значительно более холодостойким, чем Sp. spirillum, обитающий в сублиторали, а потому не испытывающий влияния крайне низких температур. В частности, в условиях опыта Sp. borealis легко переносит —12° и —14° в течение 3 суток и лишь температура порядка —18 и 20°, да и то после нескольких часов воздействия, для него легальна; что же касается Sp. spirillum, то замораживание до —5 и —7° довольно быстро вызывает гибель этих червей. Неблагоприятные внешние факторы отрицательно сказываются в первую очередь на личиночных формах (см. стр. 49).
Многие виды полихет нередко образуют массовые поселения. О плотности поселений полихет можно судить из следующих данных: общая их биомасса у западного побережья Камчатки достигает 272 г на 1 м2 (Гордеева, 1948), а в Беринговом море (Анадырский залив) — до 220 г на 1 м2, причем основная масса в последнем случае приходится на Maldane sarsi — до 2000 экземпляров на 1 м2 (Левенштейн, 1960). В Баренцевом море количество мальданид на 1 м2 может доходить до 90 тыс. экземпляров (Свешников, 1968). Небольшие спиониды Pygospio elegans в Балтийском море образуют поселения до 100 тыс. экземпляров на 1 м2 (Arndt, 1964). В осушной зоне на Шантарских островах Охотского моря отмечены поселения мелких сабеллид Oridia rivalarls до 40 тыс. экземпляров на 1 м2 (Закс, 1929), а на Мурмане аналогичные мелкие сабеллиды Fabricia sabella — до 167 тыс. (Матвеева и др., 1955). Филлодоциды столь больших поселений никогда не образуют, хотя на литорали и в верхних горизонтах сублиторали Мурмана и Белого моря Eulalia viridis и Phyllodoce maculata в период откладывания яиц (образования кладок) нередко собираются в плотные группы. В прибрежных биоценозах залива Посьета Японского моря, по данным Г. Н. Бужинской (1967), количество филлодоцид на 1 м2 достигает: мелкие Phyllodoce — до 50, Eteone longa — до 50, Eulalia viridis — до 20 экземпляров.
Многощетинковые черви в морях распространены до максимальных глубин — порядка 10 000 м. Начиная с глубины 2000 м наблюдается резкое обеднение видового состава полихет. Так,щ Тихом океане на глубинах 2000—3000 м обнаружено 109 видов, 3000—4000 м — 67, 4000— 5000 м — 56, 5000-6000 м - 16, 6000-7000 м - 19, 7000-8000 м - 14, 8000—9000 м — 17, свыше 9000 м — 9 видов (Левенштейн, 1969).1 Наряду с этим, судя по материалам дночерпательных проб, [относительная
1 Эти сведения, надо думать, далеко неполные из-за недостаточной изученности абиссальной фауны. Значительный интерес представляют данные Р. Гесслера и Г. Сандерса (Hessler a. Sanders, 1967), применивших для исследования фауны мягких грунтов на больших глубинах новой конструкции «эпибентический салазочный трал» (epi-benthic sled). За одно траление этим новым прибором ими было добыто в Атлантическом океане 89 видов и 10 765 экземпляров полихет на глубине 1400 м, а на глубинах порядка 2500—4700 м — от 43 до 58 видов и от 305 до 720 экземпляров. К сожалению, по их данным нельзя судить о плотности поселений на 1 м2, однако они наглядно свидетельствуют о большом видовом разнообразии фауны как батиали, так и абиссали.
экология
63
роль полихет по сравнению с другими группами бентоса с глубиной несколько возрастает. Так, по Р. Я. Левенштейн (I960),"в Беринговом море па глубинах 0—100 м полихеты от общей биомассы бентоса составляют всего около 6%, а на глубинах 3000—5000 м — до 50%; приморпо такие же цифры дает А. П. Кузнецов (1963 : 60) для южных районов Камчатки; аналогичная .картина наблюдается и у берегов Антарктики (Беляев и Ушаков, 1957)’.“
Фауна полихет абиссальных глубин весьма специфична. В частности, особенно характерны для абиссали многочисленные виды афродитид, принадлежащие к абиссальным родам Macellicephala и Macellicephaloides (Ушаков, 19556). Большая часть видов филлодоцид, обнаруженных на больших глубинах, пока остается эндемичной для абиссали. Для больших глубин Тихого океана отмечены и эндемичные роды: Vitiazia (см. стр. 165) и Vitiaziphyllum (см. стр. 166). Однако многие роды филлодоцид, в особенности наиболее примитивные, обладают чрезвычайно широким батиметрическим диапазоном (широкоэврибатные); так, представители Lugia, Mystides, Protomystides и Eteone встречены на глубинах от 0 и почти до 6000 м. Для глубоководных филлодоцид типичны исчезновение органов зрения и слабая пигментация тела, а также весьма длинные щетинки, облегчающие им, по всей видимости, движения по мягким грунтам. Кроме того, у некоторых глубоководных филлодоцид, в частности у Vitiazia dogieli (см. стр. 166), отмечается сильная вариабельность подиальных придатков, указывающая на то, что систематические признаки у глубоководных видов еще окончательно не установились в связи с относительно недавним их проникновением на большие глубины (указанный вид встречен на глубинах 6157—8100 м).
Большинство многощетинковых червей — донные (бентические) животные, но в период наступления половой зрелости некоторые из них (нереиды, силлиды, эвнициды, а также некоторые донные филлодоциды), приобретая дополнительные морфологические приспособления — плавательные щетинки, сильно вытянутые подиальные выросты и т. д. — поднимаются в поверхностные слои моря и ведут временно пелагический образ жизни, что обеспечивает более надежную встречу самок и самцов. Такие формы называются эпитокными. О морфологических изменениях нереид в период эпитокии уже говорилось при описании их параподиалъного комплекса (см. стр. 35). У силлид и эвницид морфологические перестройки при наступлении половозрелости идут еще значительно дальше, чем у нереид. В частности, силлиды Autolytus всплывают на поверхность моря с сильно измененным головным концом, при этом возникает резко выраженный половой диморфизм, в связи с чем пелагические самцы Autolytus с крупными двойными щупиками первоначально относились к самостоятельному роду Polybostrichus, а пелагические самки, лишенные щупиков и снабженные большими карманами на брюшной стороне, в которых вынашиваются отложенные яйца, выделялись в самостоятельный род Sacconereis. Огромные тихоокеанские палоло (Eunice viridis'), живущие на коралловых рифах у островов Фиджи и Самоа, при созревании половых продуктов всплывают не целиком. К поверхности поднимаются лишь задние их части, набитые половыми продуктами, а передние — атокные участки — остаются на дне и в дальнейшем восстанавливают недостающие части. Аналогичным образом ведет себя атлантический палоло (Е. fucatd), обитающий у Антильских островов.
В период эпитокии на поверхности моря наблюдаются так называемые «роения», или «брачные танцы», которые часто приурочены к определенным фазам луны и происходят ночью (Киселева, 19576; Хауэншильд,
64
ВВЕДЕНИЕ
1964; Cazaux et Labourg, 1967). В такие моменты червей легко собирать на свет, для чего используют простую забортную лампу, но лучшие результаты дает подводный источник света (Gravier et Dantan, 1936). Среди филлодоцид любопытная «лунная периодичность» наблюдалась у Eulalia punctijera на атлантическом побережье Франции (Fage et Legendre, 1926). Эпитокные формы, всплывающие на поверхность, образуют также Eteone longa (Rasmussen, 1956). Однако филлодоциды никогда не претерпевают столь резких морфологических изменений, как нереиды, силлиды и эвни-циды; все морфологические изменения при эпитокии у них в основном сводятся к появлению лишь добавочных длинных капиллярных щетинок, облегчающих парение. Процесс эпитокии у филлодоцид находится на самых начальных стадиях.
Среди полихет имеются и виды, постоянно находящиеся во взвешенном состоянии в толще воды (голопланктонные организмы). К ним, как уже отмечалось, относятся рассматриваемые в настоящей работе семейства Alcioptdae, Tomopteridae и Typhloscolecidae, а также отдельные представители из семейства Phyllodocidae. Факультативно планктонными обитателями считаются некоторые Aphroditidae.1 Большая часть планктонных полихет принадлежит к батипелагическим видам. Все они весьма глубоко адаптированы к жизни в толще воды (парению) и в этом отношении обнаруживают ряд интересных конвергентных признаков с другими пелагическими беспозвоночными, в частности с пелагическими немертинами и щетинкочелюстными, или «морскими стрелками» (Chaetognatha). Например, «усы» Tomopteris отчасти напоминают таковые Nectonemertes (они, возможно, играют ту же роль, что и антенны Copepoda), а анальные усики Travisiopsis — хвостовой плавник Sagitta. Эти придатки выполняют роль направляющих (рулевых) устройств. Некоторые чисто конвергентные сходства в функциональном отношении имеются между плавничками параподий Tomopteris и плавниками пелагических моллюсков — киленогих (Heteropoda) и крылоногих (Pteropoda), но морфологически ничего общего у этих образований нет. Об адаптивных приспособлениях параподий пелагических полихет к парению и передвижению в толще воды говорилось ранее (см. стр. 36). Как одно из дополнительных приспособлений к парению у пелагических полихет, так же как и у других пелагических организмов, служит обилие жировых включений, отмеченных, в частности, у Pelagobia и Phalacrophorus (Friedrich, 1949). Многие пелагические- полихеты совершенно прозрачны, что весьма характерно для большинства свободноплавающих обитателей пелагиали, в результате чего они становятся как бы невидимыми в толще воды. Наряду с этим , Sagitella, добытая с больших глубин, имела ярко-багряную окраску (Southern, 1910а). Аналогичное явление наблюдается и у глубоководных пелагических немертин.
Наличие среди филлодоцид как донных, так и типично пелагических форм — характерная особенность семейства Phyllodocidae, и столь широкая эврибионтность его представителей подчеркивает лишний раз общую примитивность всего семейства (отсутствие семейственной специализации). Все остальные семейства полихет в той или другой степени адаптированы к вполне определенным условиям обитания. Вопрос о том, какие формы —
1 Из Aphroditidae в планктонных материалах обнаружены Nectochaeta grimaldi (?=Quetleria pelagica), Drieschla pelagica и Podarmus ploa (=P. atlanticus), представляющие собой, возможно, затянувшиеся постларвалыше стадии Lepidasthenia. Во взвешенном состоянии в толще воды могут периодами находиться и некоторые взрослые донные афродитиды, например, Antionoella sarsi (Arndt, 1964).
ПАРАЗИТИЗМ И ПАРАЗИТЫ
G5
пелагические или донные — служат исходными в семействе Phyllodocidae, разбирается дальше (см. стр. 77).
Все донные филлодоциды — свободно подвижные черви, предпочтительно поселяющиеся среди донной прибрежной растительности, колоний баланид (усоногих раков), в друзах двустворчатых моллюсков и на смешанных грунтах — галька, гравий и щебень с примесью ила. В качестве укрытия используют ’различные естественные пустоты в грунте, и лишь немногие способны глубоко зарываться в песок или песчанистый ил {Eteone). Филлодоциды не строят в грунте постоянных галерей и не имеют собственных трубок, как многие седентарные полихеты, а образуют лишь временные слизистые домики. Как по своей внешней морфологии, так и по экологии донные филлодоциды не обнаруживают какой-либо узкой специализации.
ПАРАЗИТИЗМ И ПАРАЗИТЫ
Паразитизм среди полихет наблюдается довольно редко. Наибольшее количество примеров паразитизма отмечено в семействе Eunicidae (Clark, 1956; Pettibone, 1957). В большинстве случаев полихеты паразитируют в полости тела самих же полихет (в силлидах, спионидах, теребеллидах, серпулидах), иногда в эхиуридах. В качестве особого примера эктопаразитизма можно отметить мелких Ichthyotomus sanguinarius (сем. Ichthyoto-midae), которые посредством двух стилетов, образующих как бы ножницы, прикрепляются к плавникам угрей, и с помощью глотки, действующей наподобие помпы, сосут кровь.
Среди донных филлодоцид паразитические формы не выработались, однако они охотно залезают в различные пустые трубки полихет, что может рассматриваться как начальные этапы возникновения комменсализма, особенно широко распространенного среди афродитид. Весьма любопытный паразитизм наблюдается у альциопид: молодые стадии Alciopina parasitica часть своего жизненного цикла проводят в гребневиках Cydippe (Claparede et Panceri, 1867). Те же альциопиды были найдены в жаберной полости гигантских японских крабов Macrocheira кат-phert (Paris, 1956). Мелкие тифлосколециды — Typhloscolex muelleri, по. И. Райбиш (Reibisch, 1895), возможно, сосут аппендикулярий, а по В. А. Свешникову (см. стр. 61) — сцифомедуз и других крупных пелагических кишечнополостных, используя для этих целей ретортообразный орган, представляющий собой как бы поршень. Точно разграничить паразитизм и комменсализм не всегда легко. Сожительство различных афродитид с иглокожими, как правило, одностороннее, с явным преимуществом для червей.
Наряду с этим сами полихеты нередко служат хозяевами как для экто-, так и для эндопаразитов, причем установлена некоторая специфичность паразитов, и изучение паразитофауны полихет в дальнейшем сможет послужить дополнительным критерием для разделения близких видов, а также для уточнения общей проблемы становления специфичности паразитофауны в эволюционном аспекте. Особенно большое количество комменсалов и паразитов — различные инфузории, в частности из группы Suctoria, колониальные и одиночные Kamptozoa, паразитические Copepoda и др. — обитают на афродитидах. У филлодоцид также отмечены самые разнообразные паразиты. В полости тела Pterocirrus macroceros обнаружены Rhopalurapterocirri из Orthonectida (Gravier, 1896). Ha Phyllodoce и Eulalia паразитируют Copepoda, относящиеся к семейству Phyllocolidae (Laubier, 1961). Между параподий и на спинных усиках филлодоцид поселяются
5 П. В. Ушаков
66
ВВЕДЕНИЕ
многочисленные инфузории из отряда Peritricha-, в частности, по данным А. Янковского, на Phyllodoce maculata из района Курильских островов и Южного Сахалина были встречены Vorticella, а также инфузории типа Intranstyllum и Scyphidia. В целомической полости Eulalia viridis из Средиземного моря найдены цисты споровиков Haplosporidium (Theodo-rides et Laubier, 1964), а у той же E. viridis из Белого моря — паразитические нематоды Contracaecum aduncum (Бужинская и Лебский, 1971).
Как совершенно особый и своеобразный пример паразитизма можно отметить весьма интересные личиночные стадии наркомедузы Cunina lativentris, поселяющиеся в полости тела Tomopteris nisseni (Damas, 1936); наличие зародышей наркомедузы «вызывает кастрацию червей.
ОСНОВЫ КЛАССИФИКАЦИИ
Основные черты примитивности строения и биологии полихет
Хищнический способ питания и .свободноподвижный образ жизни предковых форм полихет, по-видимому, были исходными для всех современных многощетинковых червей. Вся дальнейшая эволюция полихет шла путями адаптивной радиации. Пресс хищников повел к выработке у полихет способности зарываться в грунт, строить специальные убежища в виде постоянных трубок. Таким образом, во многих случаях произошел регрессивный процесс — потеря свободноподвижного образа жизни и переход к пассивному питанию.
У полихет, безусловно, имела место чрезвычайно ранняя дивергенция, или радиация, почти всех их семейств, во всяком случае всех основных групп. При этом во многих группах, в частности у червей, живущих в трубках (Мейер, 1893), проявляются моменты явного параллелизма развития, имеющие в процессе эволюции вполне закономерный характер (Светлов, 1962). Наряду с этим у полихет наблюдаются многочисленные конвергентные образования чисто адаптивного свойства. Все это, естественно, сильно затрудняет выявление истинных филогенетических отношений внутри 1 класса полихет и, в частности, осложняет установление, какие признаки и черты строения следует считать наиболее примитивными. За таковые, исходя из данных вышеприведенного морфо-функционального очерка,-по-видимому, следует признать следующие особенности, достаточно четко выраженные у донных филлодоцид.
1. Высокая гомономность сегментов взрослых животных. Большое и неопределенное их число. Одноветвистые парацодии, вооруженные одним типом щетинок по всей длине тела и внутри каждого пучка; ацикулы тонкие и слабые. Осязательные функции на туловищных сегментах выполняют спинные и брюшные усики, гомономно развитые на всех сегментах. Кожные покровы богаты ресничным эпителием, образующим на спинной стороне ресничные кольца.
2. Хорошо выраженная первичная [гетерономия [тела. Число ларвальных сегментов относительно большое.
3. Процессы цефализации находятся на самых первых этапах развития: ротовой сегмент четко обособлен от головной лопасти, передние сегменты остаются малоизмененными и не сливаются в обособленный, специализированный перистомиум.
4. Нервная система имеет субэпителиальное положение. Головной мозг невелик по относительному объему и числу клеток и дифференциро
ОСНОВЫ КЛАССИФИКАЦИИ
67
ван слабо; крайне незначительно развит передний отдел мозга, ассоциативные центры (грибовидные тела) и связанные с ними щупики (пальпы) полностью отсутствуют..
5. Выделительная система представлена протонефридиями.
6. Кишечник и особенно производные стомодеума дифференцированы относительно слабо:' ‘Трубчатая глотка лишена хитиновых челюстей, а средний отдел кишечника — карманов.
7. Кровеносная система развита незначительно. Дыхание кожное, жабр нет. Гемоглобин- растворен в нервной системе.
8. Эпитокия встречается редко и существенных изменений морфологии тела и сегментов за собой не влечет.
9. Забота о потомстве выражена слабо; плодовитость и степень элиминации потомства высокие.
10. Личиночные формы пелагические. Кроме обычных провизорных систем — ортогональной нервно-мышечной системы, протонефридиев, бла-стоцеля, — личинки не имеют специализированных приспособлений.
11. Родовая дифференциация недостаточно четкая.
12. Широкая эврибионтность взрослых форм (присутствие в одном семействе и донных, и пелагических представителей). Активный безвы-борочный способ питания каку взрослых, таки у личиночных форм. Отсутствие специально построенных защитных убежищ — постоянных трубок.
Некоторые из указанных здесь особенностей строения и биологии полихет, которые мы считаем примитивными признаками, могут наблюдаться в весьма различных семействах, но в наибольшем объеме и наиболее четко они выражены преимущественно у филлодоцид, что и заставляет рассматривать последних как наиболее [архаичную группу современных многощетинковых червей.
Положение филлодоцид и близких к ним семейств в общей системе полихет
Филогенетические отношения между отдельными семействами внутри класса полихет пока остаются далеко не ясными и, по существу, мы еще не имеем сколько-нибудь детально разработанной и общепринятой единой системы полихет с подразделениями на отряды и подотряды. Отчасти в связи с этим большинство авторов в своих систематических и фаунистических работах предпочитает избегать употребление ранга отрядов; по этой же причине отряды отсутствуют и в каталоге видов О. Гартман (Hartman, 1959).
Палеонтологические данные из-за плохой сохранности червей, к сожалению, немногочисленны и не всегда достаточно достоверны (Геккер и Ушаков, 1962). Нередко приходится довольствоваться лишь предполагаемыми следами их жизнедейтельности (палеоихнология). Но все же был найден и ряд вполне хороших отпечатков самих червей, свидетельствующих о том, что уже в нижнем кембрии существовала разнообразная фауна полихет (Walcott, 1911). В силуре обнаружены отложения толщиной в несколько метров, состоящие из известковых трубок, принадлежащих к весьма специализированному семейству серпулид, а также многочисленные, остатки хитиновых челюстей полихет, так называемые сколекодонты, которые мало чем отличаются от таковых современных Eunicidae. Хорошо, сохранившиеся отпечатки целых эвницид (Eunicites) описаны из юры (Ehlers, 1869). Все это говорит в пользу того, что полихеты весьма древняя группа.
5*.-
68
ВВЕДЕНИЕ
Особый интерес для нас представляет находка австралийским ученым М. Глесспером (Glaessner, 1958, 1962) в нижнем кембрии Австралии своеобразной полихеты, которую он выделил в новое семейство Sprigginidae. Хорошей сохранности отпечаток этой полихеты был найден совместно со следами различных пелагических животных (медуз), и Глесснер высказал предположение, что его червь близок к Tomopteridae, с чем нельзя не согласиться. От современных Tomopteridae его черви отличаются в основном лишь тем, что на конце каждого подиального выроста имеется по щетинке, которые у современных томоптерид окончательно исчезли. А. Г. Шаров (1965) рассматривает найденную М. Глесснером Spriggina
Phyllodoclformia
Glyceriforrma Aphroditiformia.
Рис. 19. Филогенетическая схема филлодоцидообразиых.
1 — Phyllodocidae s. lato; 2 — Alciopidae; 3 — Typhloscolecidae; 4 — Tomopteridae; 5 — Lacydoniidae; 6 — Nephthyidae; 7 — Glyceridae; 8 — Goniadidae; 9 — Sphaerodoridae;
10 — Pisionidae; 11 — Aphroditidae s. lato; 12 — Chrysopetalidae,
floandersi как предковую форму Spinther. Этот взгляд представляется нам мало обоснованным с морфологической и филогенетической точек зрения.
По мнению Н. А. Ливанова (1940), к предковым формам пелагических филлодоцид или близких к ним семейств относятся Canadia и Worthenella, описанные Ч. Уолкоттом (Walcott, 1911) из среднего кембрия Британской Колумбии. Если прекрасный отпечаток Worthenella в какой-то степени условно еще может быть отнесен к пелагическим полихетам, то Canadia по огромным пучкам очень крупных щетинок с несомненностью представляет собой донную полихету и, в частности, весьма напоминает афродитид; действительно, на отпечатке отсутствуют следы элитр, характерные для афродитид, но умершие афродитиды (а захоронены мертвые) обычно теряют элитры, а само тело у них сильно сужается, т. е. принимает именно ту форму, которая изображена на фотографиях в работе Уолкотта. Вполне возможно, что Canadidae (в котором надо оставить лишь один род Canadia) дали начало современным Aphroditidae s. lato (рис. 19). Достаточно достоверные предковые формы самих филлодоцид нам пока неизвестны. Последнее следует отнести за счет того, что кожные покровы у них крайне нежные, а щетинки очень тонкие, едва заметные невооруженным глазом.
ОСНОВЫ КЛАССИФИКАЦИИ
69
В свое время было предложено несколько таксономических систем современных полихет, при этом довольно разных по содержанию. У большинства немецких авторов (Hemplemann, 1931; Friedrich, 1938; Kaestner, 1955) филлодоциды включены в обширный подотряд Nereimorpha, фактически объединяющий все семейства эррантных полихет, за исключением Amphtnomidae s. lat-d/ которые выделяются в отдельный подотряд отряда Errantia. В подотряде Neretmorpha немецких авторов филлодоциды поставлены после Aphroditidae. В каталоге О. Гартман (Hartman, 1959), в котором отряды не выделены, Phyllodocidae стоят на 12-м месте, после Aphroditidae и Amphtnomidae.
Несколько иную систему дает Н. А. Ливанов (1940). Эта система с некоторыми изменениями была принята и мной (Ушаков, 1955а). Н. А. Ливанов, наряду с Nereimorpha, выделяет самостоятельный отряд Phyllod-ocemorpha и в этом отряде на первое место он ставит Phyllodocidae, а вслед за ними Aphroditidae.
В последнее время появились две новые системы — Р. Дэйлса (Dales, 1962, 1963) и С. А. Милейковского (1968). В основу своей классификации Р. Дэйле положил весьма специализированные органы, производные стомодеума. В частности, им показано, что ранее принимавшийся отряд Drilomorpha представляет собой весьма искусственную группу, объединяющую семейства, не имеющие близкого родства. Он выделяет 14 самостоятельных отрядов, которые весьма неравноценны по количеству входящих в них семейств. Наиболее обширная у него группа — Phyllodo-ctda, в состав которой включено свыше 15 семейств, в том числе Sylltdae, Hesionidae, Pelargidae и Nereidae. Его Phyllodocida почти однозначны Neretmorpha немецких авторов, за исключением лишь того, что всех Eunicidae s. lato он выделяет в самостоятельную группу Eunicida, которую ставит после Spionida и рядом с Amphinomida.
Классификация С. А. Милейковского опубликована несколькими годами позже работы Р. Дэйлса, но разработана была независимо от последней. С. А. Милейковский исходит из принципов «биогенетического закона» и в основу своей системы положил особенности строения ранних стадий нектохет, только что завершивших метаморфоз. Его система отличается от ранее применявшихся в основном более дробными делениями. Существенно отметить, что С. А. Милейковский предлагает отряд Amphtno-morpha возвысить в ранг надотряда, равный по своей значимости Errantia и Sedentaria, а Р. Дэйле вообще не использует деление полихет на Errantia и Sedentaria.
Если сопоставить между собой предложенные указанными авторами системы, то нетрудно заметить, что между ними существуют довольно глубокие различия. Без особых изменений в них сохраняются лишь Eunicemorpha, Amphinomorpha и Terebellomorpha, состав и объем остальных групп, а также порядок их расположения весьма различны. Однако в обеих системах Phyllodocidae'поставлены на первое место, в связи с чем можно считать, что оба автора, по-видимому, рассматривают филлодоцид как наиболее примитивных червей, хотя этого вопроса специально они не касаются.
На совершенно иных позициях стоит В. Шторх (Storch, 1968), который в своих филогенетических воззрениях полностью солидаризуется со своим предшественником О. Шторхом (Storch, 1914, 1915), создавшим теорию примитивности амфиномид, исходя из тетраневрии. Однако еще Г. Густафсон (Gustafson, 1930) высказался за то, что тетраневрйю скорее следует рассматривать как вторичное явление, а не как примитивный признак. Никакого филогенетического значения за тетраневрией не при
70
ВВЕДЕНИЕ
знают и Н. А. Ливанов (1940) и В. Н. Беклемишев (1964). Несостоятельность высказываний Шторхов доказывается также данными по развитию амфииомид, опубликованными в работе В. А. Свешникова и Цю Вень-жень (1963). По их наблюдениям, первоначально закладывается всего два нервных ствола.
Приведенная в работе В. Шторха (Storch, 1968) схема родственных связей между эррантными полихетами, построенная на принципе «гомологичных мостов», все же в некоторых отношениях представляет определенный интерес. В качестве «центрального типа» он выдвигает Amphinomidae— Aphroditidae и считает, что среди полихет имело место два различных и самостоятельных направления развития: 1) Nephihyidae—Glyceridae—Phyllodocidae и 2) Chrysopetalidae—Nereidae—Hesionidae—Syllidae. Такие две обособленные линии вполне согласуются с моим мнением о существовании двух отрядов — Phyllodocemorpha и Nereimorpha (см. ниже). Но согласиться с основным положением В. Шторха о примитивности амфион-мид весьма трудно, о чем уже отчасти говорилось при разборе параподиаль-ных комплексов (стр. 42). Если же приведенную в работе В. Шторха (Storch, 1968 : 329) схему повернуть влево на 90°, то такая перевернутая схема будет хорошо совпадать с моими представлениями и тогда она будет, с одной стороны, наглядно иллюстрировать исходный примитивный характер Phyllodocidae и, с другой — подчеркивать узкую специализацию семейства Amphinomidae, образующего слепую ветвь развития.
В связи со взглядами обоих Шторхов следует упомянуть о работе А. Г. Шарова (1965), который считает наиболее примитивной формой среди полихет род Spinther, ранее включавшийся в состав Amphinomidae. Теоретическая концепция' последнего автора подверглась всесторонней критике со стороны С. Мэнтон (Manton, 1967). Напомним, что представители рода Spinther, преимущественно комменсалы, обитающие на губках, а полупаразитический образ жизни вряд ли мог послужить толчком к пышному развитию разнообразных свободноживущих форм.
Отряд Phyllodocemorpha мной понимается более узко, чем Phyllodo-cida по Р. Дэйлсу. Семейства Syllidae, Hesionidae, Pilargiidae (Otopsidae) и Nereidae, имеющие настоящие метанефридии, я отношу к отряду Nereimorpha. Отряд Phyllodocemorpha, в моем понимании, как это видно из рис. 19, состоит из трех подотрядов (или надсемейств) — Phyllodociformia, Glyceriformia и Aphroditiformia. Из них первый и третий, без пояснения их систематического ранга, уже были выделены Г. Левинсеном (Levinsen, 1882), но в дальнейшем систематиками не использовались. Aphroditiformia я понимаю здесь именно так, как это было указано самим Левинсеном. В подотряд Glycertformia я включаю 5 семейств: Glyceridae, Goniadidae, Pisionidae, Sphaerodoridae и Nephthyidae. Подотряд Phyllodociformia мной предложен в следующем составе: Phyllodocidae (s. lato), Alciopidae, Tomopteridae, Typhloscolecidae и Lacydoniidae, которые более подробно и рассматриваются в специальной части настоящей работы.
Если Aphroditiformia и отчасти Glycertformia представляют собой относительно компактные группы, то подобная мономорфность не характерна для Phyllodociformia. В состав Phyllodociformia входят семейства весьма архаичные. Центральное место в нем занимают Phyllodocidae, сохраняющие наиболее примитивные черты строения. Семейство Alciopidae довольно близко примыкает к современным донным филлодоцидам и, вполне возможно, они имеют общие корни с предковыми формами Eulalia—Eumida—Pterocirrus (рис. 21). Семейство Tomopteridae наиболее древняя и сильно специализированная группа морских червей, которую трудно увязать с какими-либо определенными представителями совре
ОСНОВЫ КЛАССИФИКАЦИИ
71
менных Phyllodocidae. Эти два семейства имеют весьма различные морфологические планы как во взрослом, так и в личиночном состоянии. В частности, они отличаются и количеством ларвальных сегментов (см. стр. 57). По всей видимости, томоптериды обособились весьма рано, причем адаптация к пелагическому образу жизни у них шла по совершенно другому пути, чем у альциопид. Особое положение занимают и Typhloscolecidae, ли-
Рис. 20. Филогенетические отношения в пределах семейства Alciopidae (по: Dales, 1955).
чинки которых, по В. А. Свешникову (см. стр. 58), обнаруживают ряд специфических особенностей, причем часть их провизорных органов переходит ко взрослым животным (например, прототрох у Typhloscolex). Вполне возможно, что их следует рассматривать как неотенические формы, приспособившиеся к эктопаразитическому образу жизни и произошедшие, как полагает Дэйле (Dales, 1955b), от предков свободноплавающих пелагических филлодоцид.
Немногочисленные представители Lacydoniidae по строению параподий и хобота, а также по личиночному развитию образуют промежуточное звено между Phyllodocidae и Nephthyidae и, по-видимому, произошли от каких-то предковых форм филлодоцид, у которых впервые обнаружилась тенденция к образованию двуветвистых параподий, связанных с роющим образом жизни.
Филогенетические отношения внутри семейства Alciopidae разработаны Р. Дэйлсом (Dales, 1955b). В основу его схемы (рис. 20) положены особенности строения хобота и парйподий. Остановимся теперь более подробно на принципах классификации семейства Phyllodocidae.
О филогенетических отношениях в пределах семейства Phyllodocidae
Объем семейства Phyllodocidae различными авторами понимается по-разному. Э. Бергштрём (Bergstrom, 1914) в своей монографии, посвященной филлодоцидам, выделил из его состава три новых семейства — Lacydoniidae, Pontodoridae и lospilidae. Этому последовали и некоторые другие исследователи (Day, 1967). Кроме того, О. Гартман (Hartman,
72
ВВЕДЕНИЕ
1959) предложила семейство Lopadorhynchidae. П. Фовель (Fauvel, 1923, 1959) трактует Phyllodocidae более широко и все указанные выше семейства рассматривает как подсемейства.
В основном я придерживаюсь классификации Фовеля, за исключением лишь того, что Lacydoniidae считаю самостоятельным семейством. Что же касается остальных предложенных семейств, объединяющих различные пелагические формы, то оснований для их выделения пока недостаточно, и в моей работе они рассматриваются как подсемейства в составе Phyllodocidae s. lato. Многие аберрантные черты, свойственные пелагическим формам, обусловлены в основном чисто адаптивными приспособлениями, связанными с особенностями жизни в толще воды. Хорошо изученное развитие Lopadorhynchus мало чем отличается от такового прочих донных филлодоцид (см. стр. 56). Именно адаптивными приспособлениями следует объяснить наличие исключительно длинных подиальных выростов у Pontodora pelagica (у единственного вида подсемейства Ponto-dorinae). Интересно отметить, что своеобразные, отсутствующие у всех остальных родов, хитиновые крючья на глотке одновременно возникают как у Phalacrophorus (подсемейство lospilinae), так и у Pelagobia (подсемейство Lopadorhynchinae). Указанные хитиновые крючья — конвергентные образования, предназначенные для удержания захваченной жертвы. Нам представляется, что само подсемейство Lopadorhynchinae весьма сборное, включающее роды, имеющие разное происхождение (об этом см. далее). То, что в состав Phyllodocidae s. lato наряду с многочисленными донными формами, имеющими однообразную морфологию, входят и различные сильно адаптированные пелагические виды, хорошо согласуется с общей архаичной природой данного семейства, которое еще не выработало узкую специализацию.
Выделенные Бергштрёмом (Bergstrom, 1914) для Phyllodocidaes. str. подсемейства Phyllo docinae, Mystidinae, Protomystidinae, Lugiinae и Eteoninae никем из последующих исследователей приняты не были. Они не используются и мной, как не имеющие/ реального филогенетического значения. Лишь Гартманн-Шрёдер (Hartmann-Schroder, 1963) употребляет название Eteoninae, включая в это подсемейство роды Mystides, Eteonides, Eteone и Mysta. Однако такое сближение этих родов довольно искусственное, так как у Mystides—Eteonides на I сегменте лишь одна пара щупальцевидных усиков, a Eteone—Mysta имеют две пары, чем последние резко отличаются от всех остальных донных филлодоцид. Если сохранять указанное подсемейство, то только для родов, имеющих на I сегменте две пары щупальцевидных усиков. В этом случае в него, по-видимому, должны войти пелагические Pelagobia и, возможно, Maupasia и Pedinisoma. Но для окончательного решения вопроса необходимы сравнительно-анатомические исследования нервной системы для уточнения строения передних сегментов.
У филлодоцид, как весьма примитивной группы червей, родовая дифференциация выражена не всегда четко. Для разграничения родов служат: количество и расположение щупальцевидных усиков, степень редукции и слияния передних сегментов, количество головных щупалец и строение хобота. Иногда учитывается форма самих щупальцевидных усиков.
Хобот довольно изменчив и образует иногда значительные вариации в пределах одного рода. В строении хобота наблюдаются и весьма интересные конвергентные образования у совершенно разных, далеко отстоящих друг от друга родов. Так, например, крупные боковые сосочки на дистальном конце хобота появляются, с одной стороны, у подрода Mysta в роде Eteone, а с другой — у Notophyllum, стоящих по нашей классифика
ОСНОВЫ КЛАССИФИКАЦИИ
ТА
ции на разных концах филогенетического древа. Далее,, среди Eulalia, имеются виды Е. semenovi и Е. sotniki из Антарктики (Аверинцев, 1972), которые по весьма своеобразному шестирядному расположению папилл на дистальной части хобота должны быть отнесены к роду Austrophyllum, однако они не могут быть к нему причислены, так как не имеют добавочной ацикулы, характерной для Austrophyllum. Конвергентный характер имеют и хитиновые крючья на глотке Phalacrophorus и Pelagobia, которые относятся к различным подсемействам (см. стр. 28, рис. 5). Таким образом, хобот не всегда служит надежным критерием для обособления родов. Если у Alciopidae, как у более специализированной группы, хобот достаточно хорошо вскрывает филогенетические отношения внутри этого семейства (см. стр. 71, рис. 20), то этого нельзя сказать в отношении Phyllodocidae. У последних хобот еще не получил окончательную родовую специализацию, что хорошо согласуется с остальными примитивными чертами данной группы червей.
Форма щупальцевидных усиков передних сегментов, используемая для разграничения родов Eulalia—Steggoa и Eumida—Pterocirrus, — также крайне нечеткий признак (в особенности на фиксированном материале). Так, в частности, у типичных Eulalia viridis и Eumida sanguinea, для которых характерны брюшные щупальцевидные усики II сегмента веретеновидной формы, в период половой зрелости у самок эти усики могут принимать несколько сплющенную форму. Попутно отметим, что у видов примитивных родов Protomystides и Mystides брюшные усики II сегмента весьма разнообразной формы. Итак, форма щупальцевидных усиков большого филогенетического значения не имеет, однако этот признак в некоторых случаях удобен для таксономии — для разделения родов, насчитывающих большое количество видов. В последнее время у систематиков наметилась общая тенденция ко все более дробному делению таксономических групп, чему в какой-то степени поддался и я в настоящей работе.
Наиболее существенным моментом для родовой диагностики является характер строения передних сегментов и головной лопасти, т. е. степень цефализации. Этот принцип весьма удачно вскрывает филогенетические отношения в пределах всего семейства. Для наглядного обозначения особенностей строения передних сегментов еще Э. Бергштрёмом была предложена специальная формула, которая широко использовалась всеми последующими исследователями. Один из примеров такой формулы следующий: 1 +О^ + 5^, где знаком «плюс» условно отделены сегменты, дробной чертой — спинные и брюшные подиальные придатки, 1 — щупальцевидный усик, N — нормальный подиальный усик, S — пучок щетинок, а — ацикулы и О и о — отсутствие щетинок и ацикул. В данном случае из вышеприведенной формулы вытекает, что на I сегменте имеется лишь одна пара щупальцевидных усиков; на II — две пары, причем щетинки отсутствуют, а ацикулы лишь при брюшных щупальцевидных усиках; на III — одна пара спинных щупальцевидных усиков и одна пара нормальных брюшных усиков, причем подиальный бугорок вооружен щетинками, а ацикулы имеются как при спинных, так и брюшных придатках.
Как показывают многочисленные новые материалы, наличие или отсутствие ацикул при основании щупальцевидных усиков не является родовым критерием. В лучшем случае это может служить лишь видовым признаком. Щетинки при II и III сегментах также иногда не имеют диагностического значения, так как наличие или отсутствие их у некоторых видов связано
74
ВВЕДЕНИЕ
с возрастными изменениями. Значительно большее значение для обособления родов имеет степень редукции и слияния- самих передних сегментов, что и положено мной в основу построения системы семейства. В связи с этим при родовых диагнозах мы исключаем из формулы Бергштрёма указания о наличии или отсутствии ацикул, тем более что это не всегда удается точно установить, но наряду с этим в формулу мы вводим дополнительные условные обозначения. В случае, если передний сегмент со спины редуцирован и.частично слит со вторым, то два передних сегмента мы заключаем в скобки, как например для Eumlda-. Если же
скобки отсутствуют,то это значит, что все сегменты полностью развиты и четко отделены друг от друга, а если дана лишь одна правая скобка — имеется в виду, что головная лопасть в той или иной степени сливается с околоро-товым сегментом. Когда на передних сегментах имеются специализированные крючковидные щетинки, букву S мы заменяем на С, чтобы подчеркнуть специфический характер данных родов.
О степени редукции передних сегментов мы судим, к сожалению, лишь по внешним морфологическим особенностям, которые не всегда дают достаточно четкую картину. Для уточнения степени цефализации, как это совершенно правильно отмечал в свое время еще Прюво (Pruvot, 1883, 1885), требуется детальное сравнительное изучение нервной системы передних сегментов у различных представителей филлодоцид. Такого рода исследования могли бы вскрыть более тонкие взаимоотношения между родами. Приведенные в работе Бергштрёма рисунки нервной системы слишком схематичны (по всей видимости, эта часть работы им не была закончена полностью). Обращает лишь на себя внимание его указание, что у Eteone имеет место редукция нервных корешков подглоточных комиссур, иннервирующих у остальных филлодоцид первую пару щупальцевидных усиков. В связи с этим Бергштрём считает, что у Eteone I сегмент полностью сливается со II и из щупальцевидных усиков сохраняются лишь две пары II сегмента. Если это так, то Eteone стоят на более высокой ступени развития, чем многие другие роды филлодоцид. Но данные Бергштрёма не подтверждаются изучением личиночных форм. У метатрохофоры Eteone сразу образуется более длинный первый (ротовой) ларвальный сегмент с двумя парами тентакулярных усиков (см. стр. 54). По-видимому, наличие у них двух пар щупальцевидных усиков на I сегменте все же следует считать как признак примитивный, унаследованный от предковых форм, у которых все сегменты имели одинаковое количество подиальных придатков.
Нам представляется, что у первичных форм филлодоцид передние (околоротовые) сегменты вначале мало отличалцрь от последующих и только в дальнейшем, сначала I, затем II и, наконец, III сегмент, претерпели изменения — появились удлиненные щупальцевидные усики, как дополнительные осязательные органы, непосредственно связанные с функциями головной лопасти. Именно лишь такой эволюционный процесс увеличения количества щупальцевидных усиков мог быть у наиболее примитивных червей, для которых исходным типом сегментации служила гомономность туловищных сегментов. Последующим этапом цефализации следует считать частичное слияние двух передних сегментов, однако до образования обособленного перистомиума с одновременной интеграцией количества щупальцевидных усиков, как это имеет место у Aphroditidae и Nereidae, у филлодоцид дело не дошло.
Первичные филлодоциды на головной лопасти имели всего две пары фронтальных щупалец. Непарное медиальное головное щупальце у них
ОСНОВЫ КЛАССИФИКАЦИИ
75
в эволюционном развитии появляется' значительно позже. Последнее хорошо доказывается онтогенезом: у 'всех форм, имеющих во взрослом состоянии 5 головных щупалец, среднее непарное головное щупальце на стадиях ранней нектохеты еще отсутствует. Количество же щупальцевидных усиков на стадии нектохеты равно тому, которое имеется у взрослых форм. Так, все нектохеты Phyllodoce и Eulalia снабжены 4 парами щупальцевидных усиков, Му slides — 3 парами, a Eteone — 2 парами.
Eulalia
Eumida
Steggoa
Nipponophullum <0
Notophyllum
V / Pterocirrus / /
/ Vitiaztphyllum (HSfrSp
Prochaetoparia
Chaetoparia
(i+cfrcfcc*
Austrophyllum 1+S^Sy
Zverlinum (pslbip
Lopadorhynchus
Vitiazia
Paranaitis
Pontodora
Eenetyllis
Phylladoce
/ Pedtnosoma
/ ofrs*
?
Protomustid.es , Mystides
I N4 PSj+St ^sl
Р№°?а Maupasia
Lugia
Eteone 01kS°n /
, <;н a. q а
Рис. 21. Филогенетические отношения в пределах семейства Phyllodocidae.
Больше всего гипотетической исходной форме отвечает Lugla (рис. 2, 3 и рис. 21). У этой небольшой филлодоциды, встречающейся как на малых, так и на больших глубинах, лишь два передних сегмента подверглись частичным изменениям, причем слияния и редукции самих сегментов еще не наблюдается. Некоторое дальнейшее усложнение отмечается у рода Protomystides — у него уже три передних сегмента снабжены щупальцевидными усиками, но все сегменты еще четко отделены друг от друга. Примитивный характер этих родов подчеркивается также строением параподий — отсутствием четко выраженных циррофор, которые имеются у большинства других филлодоцид; кроме того, у этих родов отсутствует
76
ВВЕДЕНИЕ
пятое медиальное головное щупальце. Род Mystides тоже сохраняет ряд примитивных черт, но занимает несколько обособленное положение, так как лишь у него на III сегменте исчезают спинные усики, что закреплено онтогенезом. Аналогичное явление наблюдается в семействе Syllidae у рода Sphaerosyllis-, каковы причины исчезновения на III сегменте спинных усиков у этих двух родов, относящихся к разным семействам, пока остается совершенно не ясным.
Центральное место среди бентических филлодоцид занимают два рода — Eulalia и Phyllodoce, давшие две.самостоятельные ветви развития, в значительной степени параллельные. В группу «Eulalia» нами включены роды с 5 головными щупальцами, причем в этой группе легко проследить от Eulalia s. str. к Eumida и Pterocirrus постепенное слияние двух передних сегментов и частичную их редукцию, а по линии Vitiazia—Notophyllum— N ipponophyllum, кроме того, и возникновение нухальных органов и зачатков нотоподий в виде добавочной ацикулы и 1—2 нотоцодиальных волосовидных щетинок. Наивысшая степень цефализации в этой группе отмечается у Nipponophyllum (см. стр. 171).
Группа «Phyllodoce» объединяет роды, у которых отсутствует медиальное щупальце, но здесь гомологом его служит затылочная папилла, расположенная позади головной лопасти. В этой группе также наблюдается возникновение двуветвистых параподий у рода Zverlinum, выделенного В. Г. Аверинцевым по материалам из Антарктики для Austrophyllum monroi Hartman. Процесс возникновения нотоподий, по-видимому, шел независимо и параллельно в обеих группах. Слияние передних сегментов наиболее отчетливо выражено в группе «Phyllodoce» у рода Paranaitis, для которого характерен своеобразный «ошейник», а также у рода Chaeto-paria с сильно измененными передними сегментами, снабженными простыми крючковидными щетинками. Последний через промежуточный род Prochaetoparia тесно увязывается с центральным, или узловым, родом Phyllodoce.
Несколько обособленное положение в системе бентических форм занимает Eteone с 2 парами щупальцевидных усиков на I сегменте, в то время как у всех остальных родов бентических филлодоцид на I сегменте всего одна пара усиков. Если две пары щупальцевидных усиков на I сегменте есть результат слияния двух передних сегментов, как это считает Берг-штрём (см. выше), то Eteone в этом отношении отчасти приближается к аф-родитйдам и, возможно, является одной из предковых форм последних, т. е. Eteone занимает одну из.высших ступеней иерархической лестницы в семействе филлодоцид. Если же предположить, что одна пара щупальцевидных усиков на I сегменте у всех остальных родов образовалась в результате интеграции ранее имевшихся у предковых,форм на этом сегменте двух пар, то Eteone, напротив, — более примитивный род, чем все остальные. Во всяком случае его следует поставить отдельно.
Изложенные нами филогенетические связи схематично изображены на рис. 21. Совершенно иных взглядов придерживается Бергштрём. Считая, что первичный тип параподий у филлодоцид был двуветвистый, род Notophyllum он рассматривает как исходный для всего семейства. Но с этим согласиться никак нельзя, ибо Notophyllum — один из наиболее специализированных родов, у которого степень цефализации передних сегментов-зашла весьма далеко.
Систематическое положение пелагических форм, значительная часть которых проявляет черты глубокой специализации, еще не вполне ясно. Род Lopadorhynchus в некоторых отношениях — по характеру слияния головной лопасти с передними сегментами, по наличию на передних сег
ЗООГЕОГРАФИЧЕСКИЕ ЗАМЕЧАНИЯ 77
ментах специфических золотистых крючковвидных щетинок — довольно близок к бентическому роду Chaetoparia, который, как указывалось выше, через промежуточный род Prochaetoparia примыкает к центральному роду Phyllodoce. Р. Дэйле (Dales, 1955b) высказывает предположение, что Lopadorhynchus произошли от Protomyslides и Mystides, однако никаких веских доказательств в пользу этого не приводит. Роды же Pelagobia и Maupasia, относимые к тому же подсемейству Lopadorhynchinae, по строению своих передних сегментов (наличию двух пар щупальцевидных усиков на I сегменте) весьма близки к бентическому роду Eteone. Вполне возможно, что они совместно с последним представляют собой самостоятельную, независимую от Lopadorhynchus ветвь в семействе филлодоцид, которая, однако, не получила широкого развития. Систематическое положение пелагического рода Pedinosoma, причисляемого к этому же подсемейству остается наименее ясным, так как строение его передних сегментов различными авторами трактуется по-разному (см. стр. 191). То же самое следует сказать о Phalacrophorus и Potodora, которые выделяются в особые подсемейства. Таким образом, пелагические роды не образуют компактную группу и, возможно, имеют разные корни.
Некоторые авторы (Reibisch, 1895; Gravier, 1896) считают, что пелагические филлодоциды служат предковыми формами донных филлодоцид. Последнее нам представляется маловероятным. Все пелагические филлодоциды в силу особых условий существования — сильно специализированные формы, и крайне трудно допустить, что они могли дать начало более примитивным родам донных филлодоцид, которые в свою очередь послужили исходными формами для ряда других полихет. Нам думается, более правильно предполагать, что пелагические филлодоциды произошли от донных, причем, по всей вероятности, — от разных предков и представляют собой слепые ветви развития, как это показано на рис. 21.
Предложенная здесь схема родственных взаимоотношений филлодоцид носит чисто провизорный характер, но эта схема может послужить рабочей гипотезой для дальнейших исследований.
ЗООГЕОГРАФИЧЕСКИЕ ЗАМЕЧАНИЯ
Остановимся на некоторых особенностях географического распространения Phyllodociformia,- причем представители донной и пелагической фауны будут рассмотрены отдельно. Вначале коснемся донных обитателей (карты 1—7). 1
Для районов Полярного бассейна (см. таблицу на стр. 86—91) отмечено 15 видов филлодоцид (семейство Lacydoniidae в Полярном бассейне отсутствует). Имеется три вида эндемичных для арктических вод: Рго-tomystides occidentalis — пролив Девиса, глубина 580 м; Eutnida minuta — пролив Девиса, 122 м, море Лаптевых, 45—65 м, Чукотское море, 29— 135 м; Pterocirrus slastnikovi —' море Лаптевых, 22—869 м. К преимущественно арктическим видам следует отнести Paranaitis wahlbergi, хотя он и указан для Северного моря (Friedrich, 1938). В Северном море этот вид, возможно, заменяется Р. kosteriensis (Malmgren) (см. стр. 141). Все остальные виды, отмеченные в Полярном бассейне, обладают более широким географическим распространением и встречаются также в северных районах как Атлантического, так и Тихого океана. В самом Полярном бассейне они, по-видимому, циркумполярны. Наиболее обычные
1 На картах отмечены лишь основные районы местонахождений.
Карта 1. Распространение представителей Lu%ia Quatrefages, Mystides Theel и Protomystides Czerniavsky.
1 — Lugia abyssicola; 2 — Mystides borealis; 3 — M. borealis coeca; 4 — M. rarica; 5 — M. schroderae;
6 — Protomystides- levensteinae; 7 — Pr. orientalis; 8 — Pr. occidentalis.
Карта 2. Распространение представителей Phyllodoce Savigny.
1 — Phyllodoce (Anaitides) groenlandica; 2 — Ph. (A.) maculata; 3 — Ph. (A.) citrina; 4 — Ph. (A.) chinensis; 5 — Ph. (A.) madeirensis; 6 — Ph. (A.) papillosa.
Карта 3. Распространение представителей Paranaitis Southern и Genetyllis Malmgren.
2 .— Paranaitis wahlbergi; 2 — P. polynoides; 3 — P. caecum; 4 — Genetyllis lutea; 5 — G. castanea.
Карта 4. Распространение представителей Eulalia Savigny.
1 — Eulalia viridis; 2 — E. bilineata; 3 — E. sigeformis; 4 — E. austrophylloformis; 5 — E. gravieri.
Карта 5. Распространение представителей Eumida Savigny и Pterocirrus Claparede.
2 — Eumida sanguinea; 2 — E. tubiformis; 3 — E. minuta; 4 — E. fusigera; 5 — E. nigromaculata;
6 — Pterocirrus macrocerros; 7 — P. slasinikovi; 8 — P. notoensis;±9 — P.^imajimai.
Карта 6. Распространение представителей Notophyllum Oersted и N ipponophyllum Imajima et Hartman.
1 — Notophyllum foliosum; 2 — Not. imbricatum; 3— Nipponophyllum japonicum; 4 — Nip. sagamianum'
Карта 7. Распространение представителей Eteone Savigny s. lato.
1 — Eteone fiard; 2 — E. longa; 3 — E. spetsbergensis spetsbergensis; 4 — E. spetsbergensis bistriata; S — E. (Mysta) barbata; 6 — E. (M.) ornata; 7 — E. (M.) maculata; 8 — E. (M.) tchangsii.
Карта 8. Распространение пелагических филлодоцид в северо-западной части Тихого океана.
1 — Pelagobia longicirrata; 2 — Maupasia caeca; 3 —• M. brodskyi; 4 — Lopadorhynchus appendicu-latus; 5 — L. uncinatus; в — Pontodora pelagica; 7 — Phalacrophorus pictus; 8 — среднегодовая изотерма 5° на глубине 400 м.
ЗООГЕОГРАФИЧЕСКИЕ ЗАМЕЧАНИЯ
81
в Полярном бассейне следующие виды: Phyllodoce (Anaitides) groenlan-dica, Ph. (4.) citrina, Eteone longa, E. flava, E. 'spetsbergensis spetsbergensis, E. {Mysta) barbata, отчасти Eulalia bilineata. Значительно более ограниченно распространены Phyllodoce (Anaitides) maculata и Eumida sanguinea, которые проникают в арктические воды лишь до Баренцева и Белого морей и к востоку от Новой Земли пока не найдены, но обитают в северных районах Тихого океана; у берегов Северной Америки первый из них доходит до побережья Западной Гренландии и Гудзонова залива, а второй — до залива Св. Лаврентия. В собственно арктические воды не проникает и Notophyllum foliosum, обитающий в Средиземном, Северном и Норвежском морях и у атлантического побережья Северной Америки в районе Новой Англии, а также отмеченный в северной части Тихого океана — Аляскинский полуостров, о. Беринга, Японское и Желтое моря. Такое же амфибореальное распространение имеет Pterocirrus macroceros: с одной стороны, Средиземное море, западный берег Африки, атлантическое побережье Европы и, с другой — Японское, Желтое и Южно-Китайское моря, а также тихоокеанское побережье Канады.
Фауна донных филлодоцид дальневосточных морей — Берингова, Охотского и Японского — несколько богаче, чем в Полярном бассейне. В этих морях, не учитывая побережье собственно Японий и открытых районов северо-западной части Тихого океана, встречено 22 вида, из них 8,
Карта 9. Распространение альциопид в северо-западной части Тихого океана.
1 — Vanadis formosa; 2 — V. longissima; 3 — Alciopina parasitica; 4 — Plotohelmis tenuis; 5 — Kroh-nia lepidota; 6 — K. exellata; 7 — Rhynchmerella gracilis; S — Rh. angelini; 9 — Rh. petersii; 10 — Alciopa reynaudii; 11 — средняя годовая изотерма 5° на глубине 400 м.
6 П. В. Ушаков
82
ВВЕДЕНИЕ
общих с Полярным бассейном. Часть видов может быть охарактеризована как широко распространенные тихоокеанские. К последним относятся: Paranaitis polynoides, Eumida tubiformis, E. nigrimaculata и Notophyllum imbricatum. Эндемиков для дальневосточных морей немного. Таковым служит Eulalia sigeformis, пока обнаруженный лишь в Японском море на глубине 480—936 м, Охотском — 443—645 м, Беринговом — 510 м и в Алеутской впадине — 2685—7185 м. Еще более ограниченный ареал, возможно, имеет Phyllodoce laminosa brevis, описанный И. Г. Заксом (1933) из Японского моря (залив Петра Великого). Широко распространенный' в арктических водах Eteone spetsbergensis spetsbergensts в дальневосточных морях заменяется Е. spetsbergensis bistriata, причем в Чукотском море четкой границы между этими двумя подвидами цока установить не удалось, а у тихоокеанских берегов Северной Америки живет третий подвид — Е. spetsbergensis pactftca (см. стр. 178).
Для побережья собственно Японии указано 15 видов (Imajima a. Hartman, 1964; Imajima, 1967), из них в дальневосточных морях не обнаружены Phyllodoce japonica Imajima,? Ph. macroleptdota Schmarda, Ph. violacea Treadwell (l=Ph. pruvoti Fauvel), Ph. (Anaitides) elongata Imajima, Ph. (A.) madeirensis Langerhans, Nipponophyllum iaponicum (Marenz.) и TV. sagamianum (Izuka), т. e. около половины всех видов. Столь значительная разница в составе фауны филлодоцид дальневосточных морей и побережья Японии объясняется тем, что дальневосточные моря характеризуются в основном относительно холодными водами,
Карта 10. Распространение томоптерид в северо-западной части Тихого океана.
1 — Tomopteris septentrionalis; 2 — Т. elegans; S — Т. (Johnstonella) pacifica Izuka; 4 — средняя годовая изотерма 5° на глубине 400 м.
ЗООГЕОГРАФИЧЕСКИЕ ЗАМЕЧАНИЯ
83
образующимися в результате местного резкого зимнего охлаждения, а побережье Японии омывается теплыми водами Куро-Сиво, поступающими с юга.
В Желтом море состав филлодоцид по сравнению с дальневосточными морями заметно меняется. Из северных форм здесь сохраняется лишь Eteone longa. Весьма характерные для многих районов Японского моря Phyllodoce (Anaitides) groenlandica и Ph. (A.) maculata в Желтом море заменяются Ph. (Л.) chinensis и Ph. (Л.) papillosa. Впервые на литорали Желтого моря появляются очень крупные Eteone (Mysta) tchangsii, характерные также для Южно-Китайского моря и, по-видимому, для побережья Индии. Как уже отмечалось нами ранее на основе анализа всех многощетинковых червей Errantla (Ушаков и У Бао-лин, 1965), в Желтом море происходит как бы замена одной фауны другой, причем южные тепловодные формы преобладают в самых верхних, лучше всего прогреваемых горизонтах (литораль и сублитораль), а в более глубоких горизонтах в соответствии с остаточными холодными придонными водами сохраняются некоторые холодолюбивые формы, которые здесь фактически изолированы от своего основного ареала (имеют реликтовый характер).
Южно-Китайское море (о. Хайнань, Тонкинский залив) характеризуется из всех исследованных нами районов наиболее тепловодной фауной. В частности, лишь здесь обнаружены Phyllodoce malmgreni и Ph. (Anaiti-des) madeirensis.
Специфичный состав филлодоцид оказался на больших глубинах в открытых районах северо-западной части Тихого океана. Здесь нами
Карта 11. Распространение тифлосколецид в северо-западной части Тихого океана.
1 — Typhloscolex muelleri; 2 — Sagitella kowalewskii; 3 — Tramsiopsis lobifera; 4 — T. lemnseni;
5 — T. lanceolata', 6 — средняя годовая изотерма 5° на глубине 400 м.
6*
84
ВВЕДЕНИЕ
были обнаружены: Lugia abyssicola, Mystides rarica, M. schroderae, Protomystides levensteinae, P. orientalis, Paranaitis coecum, Eulalia austrophylloformis, E. gravieri, Pterocirrus imajimai, Vitiazia dogteli, Vitiaziphyllum nuchalum, Eteone vitiazi. Два. из них пришлось выделить в новые роды Vitiazia и Vitiaziphyllum.
Некоторый интерес представляет сопоставление видового состава филлодоцид дальневосточных морей с таковым у берегов Калифорнии. Из- района Калифорнии описано разными авторами (Moore, 1906, 1909а, 1909b; Chamberlin, 1919а; Hartman, 1936а, и др.) весьма большое количество филлодоцид. По сводке О. Гартман (Hartman, 1968), их здесь не менее 35 видов. Однако глубокой ревизии они еще не подвергались. Общих видов с дальневосточными морями из 35 видов только 8 — Phyllodoce (Anaitidea) groenlandica, Eulalia viridis, Eumida sanguinea, E. tubiformis, E. nigrimaculata, Genetyllis castanea, Notophyllum imbricatum, Paranaitis polynoides, — что составляет менее 25% от всей фауны Калифорнии. Последнее указывает на незначительные фаунистические связи между дальневосточными морями и побережьем Калифорнии. Среди указанных форм имеются амфипацифические виды (с разорванным ареалом). К ним, в частности, относятся Eumida tubiformis, Е. nigrima-culata.1
Большинство пелагических многощетинковых червей обладает еще более широким географическим распространением, чем донные филлодоциды. Значительная их часть приурочена к теплым водам Атлантического, Индийского и Тихого океанов, имея циркумтропическое распространение; некоторые из них, по существующим указаниям, характеризуются' почти всесветным распространением. Состав и распространение пелагических полихет в северных частях Атлантического и Тихого океанов освещены в работах К. Стёп-Бовитца (Stpp-Bowitz, 1948), А. Трэдвуелла (Treadwell, 1943), Р. Дэйлса (Dales, 1957), Н. Тэббла (Tebble, 1962) и С. А. Милейковского (1962, 1969). На приложенных картах (8—11) мы постарались суммировать как наши, так и литературные данные по основным видам пелагических полихет для северо-западной части Тихого океана.
Пелагические филлодоциды (карта 8) представлены немногими видами. Один из наиболее обычных и широко распространенных видов — Pelagobia longicirrata. Его следует рассматривать как космополит. В частности, он отмечен в центральных районах Полярного бассейна и нередок в северо-западной части Тихого океана. Такое же широкое распространение имеет и Phalacrophorus pictus. Значительно реже в планктонных пробах встречаются Maupasia и Lopadorhynchus. В Полярном бассейне представители двух последних родов отсутствуют. Из северо-западной части Тихого океана описан новый вид Maupasia brodskyi, пока известный лишь из данного района. Кроме того, здесь встречается и широко распространенный вид М. caeca. В субтропических водах близ Японии отмечены единичные находки Lopadorhynchus nationalis, L. uncinatus, L. krohnii и L. brevis (Dales, 1957; Tebble, 1962); в наших материалах из фронтальной зоны Куро-Сиво к югу от Курильской гряды впервые обнаружен один экземпляр L. appendiculatus, ранее известный лишь из Атлантического океана и Средиземного моря. На нескольких станциях к югу от Курильской гряды оказался Pontodora pelagica, который также не был указан для дан
1 Более подробно амфипацифическее распространение полихет разбирается мной в недавно опубликованной статье (см.: Journ. Fish. Res. Board of Canada, v. 29, № 10, 1971).
ЗООГЕОГРАФИЧЕСКИЕ ЗАМЕЧАНИЯ
85
ного района (этот вид был известен из экваториальных районов Атлантического океана и восточной части Тихого океана от. Канады до'Перу). Весьма редкий вид Pedinosoma curtum; он, так же как предыдущий, описан из тропических и субтропических районов Атлантического океана, в Тихом океане имеются единичные находки. Из всех приведенных здесь видов наиболее обычны в северной части Тихого океана лишь три — Pelagobia longicirrata, Maupasia caeca и Phalacrophorus pictus, которые проникают и наиболее далеко на север в холодные воды (см. карту 8; на всех картах для разграничения различных водных масс схематически приведена среднегодовая изотерма 5° на глубине 400 м, взятая из «Морского атласа», т. И, Л., 1953).
Семейство Alciopidae состоит в основном из тропических и субтропических видов. Альциопиды не образуют массовых скоплений и в планктонных пробах обычно представлены единичными экземплярами. Наибольшая численность отмечена для Vanadis longissima — 21 экземпляр на 1000 м3 (ТеЬЫе, 1962). Большинство видов приурочено к верхним горизонтам водной толщи; по-видимому, лишь V. tagensis придерживается глубинных слоев. Для северо-западной части Тихого океана отмечено свыше 15 видов. Наиболее обычны здесь Vanadis longissima, Rhynchone-rella gracilis, Rh. angelini, Plotohelmis tenuis и Krohnia lepidota. Дальше всего на север (к району Алеутской гряды) проникает Rhynchonerella angelini. Из северо-западной части Тихого океана, района Курильской гряды, описан Krohnia exellata, в дальнейшем найденный также в Беринговом море. Возможно, он специфичен для холодных вод северо-западной части Тихого океана. В Полярном бассейне альциопиды не обнаружены.
Tomopteridae — наиболее массовые пелагические полихеты. Для северной части Тихого океана (к северу от 30° с. ш.) отмечены Tomopteris elegans, Т. septentrionalis, Т. planctonis, Т. ligulata, Т. nisseni, Т. (J ohnstonella) apsteini и Т. (/.) pacifica. Особенно часто в северо-западной части Тихого океана встречаются Т. elegans, Т. septentrionalis и Т. (Jbhnstonella) pacifica (карта 10), при этом первый вид придерживается субтропических вод, а два других приурочены к холодным водам, обитая и в Охотском и Беринговом морях. Если Т. septentrionalis весьма широко распространенный вид, то ареал Т. (Johnstonella) pacifica, напротив, ограничен лишь относительно холодными водами северной части Тихого океана. Количество Т. elegans в северо-восточных районах Тихого океана может достигать 500 экземпляров на 1000 м3 (ТеЬЫе, 1962). Томопте-риды проникают также в холодные воды северной части Атлантического океана и частично в Северный Ледовитый океан. В Баренцевом море отмечены Т. septentrionalis и Т. (Johnstonella) helgolandica, а в проливе Девиса — Т. planktonis, Т. nisseni, Т. cavallil, Т. krampi и Т. septentrionalis.
К Typhloscolecidae относятся немногочисленные, преимущественно широко распространенные виды. В северо-западной части Тихого океана встречается 5 видов (карта 11), из которых наиболее массовый — Typhlos-colex muelleri, заходящий в Охотское и Берингово моря. Этот же вид встречается в Баренцевом море. Sagitella kowalewskii и представители рода Travisiopsis, по-видимому, преимущественно глубоководные виды.
СВОДНАЯ ТАБЛИЦА ГЕОГРАФИЧЕСКОГО РАСПРОСТРАНЕНИЯ
06
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых Восточно-Сибирское море Чукотское море Берингово море Охотское море || Японское море || Желтое море | Южно-Китайское море Северо-западная часть Тихого океана Примечание
Сем. Phyllodocidae Lugia abyssicola + Калифорния.
Mystides borealis — + — + — + — — — — + — + — — — — Залив Св. Лаврентия—залив
M. rarica . . — + Мэн. Кермадек.
M. schroderae — +
M. southerni + ? К югу от Алеутской гряды и
Protomystides levensteinae . . +
P. orientalis + Марианские острова. Тасманово море, близ Новой
P. occidentalis + Зеландии.
Genetyllis lutea + + + Субтропические и тропические
G. castanea . — •— — — + + + + +
Phyllodoce laminosa laminosa + районы Тихого и Индийского океанов. Атлантическое побережье Ев-
Ph. laminosa brevis .... + ропы, Средиземное море.
Ph. gracilis ? — — Тропические районы Тихого и
Ph. malmgreni + — Индийского океанов. То же.
Ph. (Anaitides) groenlandica + + + + + + + + + + + + + + — — — Арктическо-бореальный вид.
Ph. (A.) maculata + + + + — + + — — — — + + + — — — Амфибореальный вид.
Ph. (A.) mucosa + + + Средиземное море.
Ph. (A.) citrina + + — + — + + + + + + + + + — — — Аляскинский залив, тихоокеанское побережье Канады.
Ph. (A.) chinensis .... — — + — —
П родолжение
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых 1 Восточно-Сибирское море Чукотское море Берингово море Охотское море Японское море Желтое море Южно-Китайское море Северо-западная часть Тихого океана Примечание
Phyllodoce (A.) madeirensis — + + Широко распространенный, преимущественно тропический вид.
Ph. (A.) papillosa .... + ? — ? Калифорния.
Paranaitis wahlbergi .... .+ + + — + — + + — Преимущественно арктический вид.
P. polynoides — + — + + Западное побережье Канады, Калифорния.
P. caecum . . +
Chaetoparia nilssoni .... + +
Eulalia viridis + + + + — + + + — — + + + + + + Широко распространенный, преимущественно в бореальных и субтропических видах.
E. bilineata + + + + + + + + + — — — + + — — — Средиземное море.
E. sigejormis + + + — — —
E. austrophylloformis . . . + ч
E. gravieri +
Steggoa pacifica +
Eumida sanguinea + + + — — + + — — — — — + + + + + Преимущественно бореальный ВИД.
E. albopicta — — — — — —- — — — —— — — — — + + — Никобарские острова (Индийский океан).
E. tubiformis — — — — — — — — — — — — + + + — + Калифорния.
E. minuta — — — + — — —- — + — +
E. fusigera + + + + Средиземное море, залив Массачусетс.
ВВЕДЕНИЕ j ТАБЛИЦА ГЕОГРАФИЧЕСКОГО РАСПРОСТРАНЕНИЯ
Продолжение gg
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых Восточно-Сибирское море Чукотское море Берингово море Охотское море Японское море Желтое море Южно-Китайское море Северо-западная часть Тихого океана Примечание
Eumida nigrimaculata . . . Pterocirrus macroceros . . . P. slastnikovi P. notoensis Austrophyllum sphaerocephala Vitiazia dogieli Vitiaziphyllum nuchalum . . Notophyllum foliosum . . . N. imbricatum Nipponophyllum japonicum N, sagamianum ...... Eteone flava E. longa E. delta E. spetsbergensis spetsbergensis E. spetsbergensis bistriata . . E. lactea E. vitiazi ......... i + 1 1 1 1 1 1 + 1 1 1++ 1 + 1+ 1 1+ III 111+ 1 ,1 I++1+ II 1 1 11 +1++11 1 +111111 II 1 11 11++11 1 II11111 II II 1 1 1 1 1 1 1 1 1 1 ++ 1 1 II 1 II 1 1 1 1 1 1 1 1 1 1++ 1 + III II II 1 1 1 1 1 1 111 +11 II 1 II 1 1 1 1 1 1 1 1 II ++ 1 +. 1 1 1 1 1 + 1 1 1 1 1 1 1 1 1 1 + 1 1 II 1 1 II 11 +111 1 II 1 1 1 1 1 II, 1 1+ +1++1 1 1 II Illi! II 1 1+ 1 I++I 1 + II 1 + 1 1 I II- + 1 1 1 1 1 1 1 1 + 11++1 1 +1 1 ++ |+||11+ + 11++11 +1 1 1 II 1 ++ 1 1 1 + +1 1 I I । । +1 1 II 1 1 1 1 1 1 1 1 1 1 1 1 1 1 +1 ++ 11+++++ + 111+11 11 + Остров Ванкувер, Калифорния. Черное и Средиземное моря, Западная Африка, тихоокеанское побережье Канады. to Калифорния. tq to Северные районы Атлантике- &з ского и Тихого океанов. Аляскинский залив, о. Ванкувер, Калифорния, Новая Зеландия. Побережье Японии. » » Арктическо-бореальный вид. » » .» Река Янцзы. Преимущественно арктический вид. Северная часть Атлантического океана.
Продолжение
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых Восточно-Сибирское море Чукотское море Берингово море Охотское море Японское море Желтое море Южно-Китайское море Северо-западная 1 часть Тихого океана Примечание to §
Eteone (М.) ornata .... Е. (Mysta) barbata .... Е. (М.) maculata Е. (М.) tchangsii Lopadorhynchus appendicula-tus . L. brevis . . ...... . L. krohnii L. uncinatus Pelagobia longicirrata . . . Maupasia caeca M. brodskyi Pedinosoma curtum .... Pontodora pelagica Phalacrophorus pictus pictus Ph, pictus borealis Сем. A Iciopidae Torrea Candida Naiades cantrainil , , , . . + + + + + + + + + + + + — + + + + + + + + 1 1 1+ 1 1 1 1 1 1 1 1 III 1 1 1I++ 1 1 111111 III 1 1 + + 1++ 1+++++ + + 1111 § Арктическо-бореальный вид. § ? Побережье Индии. £ © Северная часть Атлантического океана. § Тихий, Индийский и Атланти-ческий океаны. 5» То же. » » ° » » » » [ь. S Северо-восточный район Ти- 5g хого океана, тропические и о субтропические воды Атлан-тического океана. g Тихий и Атлантический океаны. ts Восточное побережье Грен-ландии. § Атлантический океан, Калифорния. То же. 1
П родолжение
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых Восточно-Сибирское море Чукотское море Берингово море Охотское море Японское море Желтое море Южно-Китайское море Северо-западная часть Тихого океана Примечание
Vanadis formosa V. longissima A leiopa reynaudii Plotohelmis tenuis Alciopina parasitica .... Krohnia lepidota K. excellata Rhynchonerella gracilis . . . Rh. petersii Rh. angelini Watelio gravieri Сем. Tomopteridae Tomopteris septentrionalis . . T. elegans T. (Johnstonella) pacifica + Л- + + + + — + — — Ml II 1 1 1 1 1 1 II 1 III II II 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 II III + + + + + 1 1 1 1 1 1 1 II II । । । III II 1 1 1 1 1 1 1 1 1 1 Illi Illi 11 III + ++++++++ + 1 .+++ Тихий, Индийский и Атлантический океаны, преимущественно тропические и субтропические воды. То же. » » » » » » » » » » » » Тропические и субтропические воды Тихого и Атлантического океанов. Тихий, Индийский и Атлантический океаны. Тихий и Атлантический океаны. То же. » » Северные районы Тихого океана.
Вид Балтийское море, включая Скагеррак Северное море Норвежское море Баффинов залив и пролив Девиса Гренландское море и Полярный бассейн Баренцево море Белое море Карское море Море Лаптевых
Т. (J.) helgolandica .... + + + + + + — — —
Сем. Typhloscolecidae
Typhloscolex muellerl . . . Travisiopsis lobifera .... — — + + + — — — +
T. levinseni . T. lanceolata Sagitella kowalewskii . . . — — + + + + — — — — —
Сем. Lacydoniidae
Lacydonia papillata .... Paralacydonia paradoxa . . — — — — — — — — —
Продолжение
но-Сибирское :кое море ово море ое море :ое море море о-Китайское западная ихого океана Примечание
Р1 О к к о ф о оН
S В
2 & О Q к а о И о К н ф й g, д о
и О и а S g О F
— — — — — — — Северные районы Атлантического океана.
— —. + + + + Космополит.
— — . + Широко распространенный вид преимущественно в теплых водах.
— — — — — — — + Широко распространенный вид.
— — — — + Тихий и Атлантический океаны.
+ + Тихий, Индийский и Атлацти, ческий океаны.
— — — — — + + + Средиземное море, Индийский океан.
ВВЕДЕНИЕ | ТАБЛИЦА ГЕОГРАФИЧЕСКОГО РАСПРОСТРАНЕНИЯ
<<Примечаниев Указаны лишь общие сведения по распространению, более подробные данные приведены в систематической части работы при опи-
92
ВВЕДЕНИЕ
ОСНОВНЫЕ ТЕРМИНЫ
Абдомен (abdomen) — задний видоизмененный участок тела (иначе брюшко) седентарных червей, расположенный позади торакса (грудного отдела) и заканчивающийся иногда особым хвостовым придатком.
Анальная лопасть, или пигидий (pygidium), — задний сегмент тела, образующийся из нижней сферы трахофоры; на анальной лопасти никогда не имеется щетинок.
Анальные усики (cirri anales) — порошицевые усики, или уриты (urites), расположенные по краю анальной лопасти.
Антенны (antennae) — тактильные выросты на головной лопасти, иначе головные щупальца.
А ц и к у л a (aciculum, acicula) — внутренняя осевая щетинка, поддерживающая ветви параподий; к ацикуле прикреплены мускульные волокна, обеспечивающие втягивание и выдвижение наружных щетинок.
Ацикуловидные щетинки (acicular seta) — толстые простые щетинки, напоминающие ацикулы, иначе игловидные щетинки.
Брюшной отдел (брюшко) — см. абдомен.
Брюшной, или вентральный, усик (cirrus ventralis) — усик на нижней (брюшной) стороне параподий.
Буккальный, или ротовой, сегмент — первый после головной лопасти. Войлочный покров (felt) — сильно переплетенные, нередко засоренные илом, тонкие длинные нотоподиальные щетинки, прикрывающие спинную сторону у некоторых афродитид.
Гетерогомфные щетинки — тип сложных (сочлененных) щетинок, у которых основной стержень (рукоятка) на дистальном конце имеет два неравных по величине сочленительных зубца.
Гетеронереидные стадии — сильно видоизмененные половозрелые формы нереид, всплывающие в поверхностные слои моря для нереста.
Гиалиновая железа (hyaline gland) — трубчатые железы на плавничках томоптерид.
Глотка (pharynx) — часть пищевода, обычно сильно мускулистая, иногда снабжена хитиновыми челюстями.
Головная лопасть, или простомиум (prostomium), — первый сегмент червя, образующийся из верхней сферы трохофоры.
Головные щупальца — см. антенны.
Гомогомфные щетинки — тип сложных (сочлененных) щетинок, у которых основной стержень (рукоятка) на дистальном конце имеет два одинаковых по величине сочленительных зубца.
Грудной отдел (грудь), или торакс (thorax), — передний отдел тела седентарных червей, расположенный впереди брюшного отдела, или абдомена (abdomen).
Двуветвистая параподия (biramous parapodium) — параподия, разделенная на две ветви: спинную, или нотоподия, и брюшную, или невроподия, каждая из которых снабжена собственным пучком щетинок.
Дорсальный, или спинной, усик (cirrus dorsalis) — усик на верхней (спинной) стороне параподий.
Жабры (branchiae) — различного рода отростки (усиковидные, древовидные и т. д.) преимущественно при нотоподиях; различают целомические жабры в виде простых выпячиваний стенки тела и жабры с богато разветвленной системой капиллярных сосудов. *
Затылочный, или нухальный, орган — различного рода ямки и выросты, покрытые ресничным эпителием, находящиеся у заднего края головной лопасти; пб-видимому, выполняют обонятельные функции.
Затылочная папилла (occipital papilla) — округлая папилла у заднего конца головной лопасти.
Капиллярные, или волосовидные, щетинки — простые тонкие длинные щетинки.
Карункул (caruncul) — чувствительный орган в виде продольного валика, расположенный позади головной лопасти.
Краевые, или оральные, глоточные папиллы — окружающие входное отверстие хобота.
Крышечка (operculum) — специальные образования, закрывающие входное от-' верстие трубок: у серпулид видоизмененный жаберный луч, у сабеллариид (хермеллид) крупные, расположенные полукругом на переднем конце тела, золотистые щетинки.
Ктенидий (ctenidium) — различной формы небольшие выросты на головной лопасти и параподиях; преимущественно чувствительные органы.
ОСНОВНЫЕ ТЕРМИНЫ
93
Ларвальные сегменты — одновременно закладывающиеся при метаморфозе трохофорной личинки и расположенные в передней части тела.
Л о б н ы.е, или фронтальные, рога — заостренные выступы на дольках головной лоиасти у некоторых афродитид.
Ложнодвуветвистые параподии (sesquiramous, sub-biramous) — но-топодия представлена лишь спинным усиком, ацикулой и иногда 1—2 волосо-. видными щетинками. .
Медиальное, или непарное, головное щупальце — расположено на дорсальной стороне головной лопасти, большей частью между глазами (у филлодоцид).
.Метастомиум (metastomium) — совокупность всех туловищных сегментов. Невроподия (neuropodium) — нижняя, или вентральная, ветвь параподий. Нектохета — последняя стадия планктонных личинок полихет.
Нефропора, или нефридиальная папилла (nephridial papilla) — выходное отверстие нефридий, находится на нижней и задней стороне невропо-дий.
Нотоподия (notopodium) — верхняя, или дорсальная, ветвь параподии.
Нухальный орган (nuchal organ) — см. затылочные органы.
Одноветвистая параподия (uniramous parapodium) — параподия с одним подиальным бугорком, вооруженным одним пучком щетинок.
Юмматофоры (ommatophore) — выросты на головной лопасти, заканчивающиеся глазами (глазные подставки).
Оральные глоточные папиллы — см. краевые глоточные папиллы. Осевая щетинка — см. ацикула.
Палены (palea) — крупные, крепкие, слегка сплющенные золотистые щетинки на передних сегментах у амфаретид, пиктинарий и сабеллариид, образующие опахало (веер) или своеобразную крышечку, прикрывающую наружное отверстие трубки.
П а л ь п ы, или щупики (palpi), — парные придатки головной лопасти, расположенные у эррантных форм с брюшной стороны близ ротового отверстия (внутрь пальп заходит целомическая полость).
П а л ь п о д' — заостренный вырост на переднем конце головной лопасти у Typhlosco-lecidae.
Пальпостиль (palpostyle) — дистальная часть двучленистых пальп.
П альпофор (palpophore) — базальная часть двучленистых пальп.
Парагнаты (paragnathae) — мелкие хитиновые зубчики на глотке нереид и глицерид.
Параподия (parapodium, parapodia) — боковые выросты сегментов, несущие щетинки и обычно спинные и брюшные усики; параподии выполняют главным образом двигательную функцию.
П е ристомиальные, или щупальцевидные, усики (cirri peristo-miales), иначе тентакулярные циррусы (cirri tentaculares) — осязательные органы в виде усиковидных придатков на передних видоизмененных сегментах метастомиума.
Перистомиум (peristomium) — видоизмененный передний сегмент, получившийся из слияния ротового буккального сегмента с 1—3 последующими сегментами метастомиума.
Пигидий (pygidium) — см. анальная лопасть.
Пиннулы, или плавнички (pinnules), — кожистые оторочки на параподиях . томоптерид.
Подиальная губа — листовидные выросты подиального бугорка впереди (presetal) или позади (postsetal) щетинок.
Подиальный бугорок (setigerous lobe) — вырост, несущий щетинки.
Подиальный ствол (parapodial trunk) — вытянутое основание параподий до их разделения на нотоподию и невроподию.
Подиальный язычок — сильно вытянутые, заостренные части ното- или невроподии, находящиеся поверх или снизу подиального бугорка.
П р о ст о м и у м (prostomium) — см. головная лопасть.
Простая щет ин к а — щетинки весьма различной формы, состоящие из одной части (см. сложные щетинки).
Прототрох (prototroch) — поясок ресничек в передней части трохофоры.
Ретортообразный орган (retort organ) — у Typhloscolecidae крупная железа, открывающаяся в ротовую полость.
Розетковая железа (rosette gland) — темноокрашенные железы на параподиях томоптерид, органы свечения.
Рострум — дистальная расширенная часть стержня (древка) сложных щетинок, обычно заканчивающаяся двумя сочленительными зубцами, поддерживающими конечный членик щетинок.
94
ВВЕДЕНИЕ
Рукоятка щетинок — основной стержень, или древко, у сложных щетинок, служащий подставкой для дистального членика.
Семеприемник (receptaculum seminis) — у самок альциопид сильно расширенные спинные усики на передних сегментах, образующие объемистые карманы, служащие для сохранения спермий.
С к а ф a (scapha) — сильно измененные задние сегменты Pectinariidae, образующие обособленный хвостовой сегмент.
С л о ж и а я, или сочлененная, щетинка (compound seta, soie compo-see) — состоящая из двух частей: основного стержня, или рукоятки, и сочлененного с ним дистального членика.
Спинигерные щетинки (setae spinigerae) — сложные (сочлененные) щетинки с дистальным члеником в виде клинка.
Спинная чешуйка, или э л и т р a (elytra), — сильно сплющенные дорсо-вентрально, наподобие лепестков, спинные усики на некоторых сегментах у афродитид; налегая черепицеобразно друг на друга, они прикрывают собой значительную часть спинной поверхности червя; наружная их сторона нередко покрыта многочисленными хитиновыми папиллами.
С т и л о д ы (stylode) — различные, преимущественно пальцевидной формы выросты на параподиях.
Стомодеум (stomodeum) — передняя кишка.
Телескопические глаза — крупные глаза с хрусталиками у Alciopidae. Телотрох — поясок ресничек в задней части трохофоры.
Тентакулярный циррус (cirrus tentacularis) — см. перистомиальные усики.
Торакальная мембрана — тонкая кожистая оторочка, окружающая торакальные сегменты у серпулид.
Торакс (thorax) — см. грудной отдел.
Торы (tori uncinigeri) — у седентарных червей брюшные подиальные ветви параподий в виде поперечных валиков с одним или несколькими рядами мелких крючковидных щетинок (uncini).
Тубикольный — трубчатый.
Туловищные сегменты — сегменты между головной лопастью и пигидиу-мом (см. метастомиум).
У р и т ы (urites) — см. анальные усики.
Усиковые сегменты — снабженные спинными усиками (в отличие от чешуйчатых сегментов, снабженных спинными чешуйками, или элитрами).
Фальцигерные щетинки (setae falcigerae) — сложные (сочлененные) щетинки с дистальным члеником в виде серпа или крючка.
Фронтальные головные щупальца — расположенные на переднем крае головной лопасти.
Фронтальные рога — см. лобные рога.
Хобот (proboscis) — выворачивающаяся наружу часть глотки.
Хоботное влагалище — передняя часть пищевода, образующая наружную стенку хобота при выпячивании глотки.
Хоботные папиллы — различного рода мягкие выросты на наружной стенке хобота.
Хроматофоры (chromatophore) — специальные клетки или группы клеток, снабженные пигментом.
Хромофильная железа (chromophile gland) — плотно расположенные трубчатые железистые клетки на брюшных плавничках томоптерид.
Челюсти (machoire, jaw) — хитиновые образования на глотке в виде мощных крючков и различного рода зубчиков. ’
Чешуйчатые сегменты (elytrigerous segment) — снабженные спинными чешуйками, или элитрами (в противоположность усиковым сегментам, снабженным спинными усиками).
Цератостиль (ceratostyle) — дистальная часть головных щупалец.
Цератофор (ceratophore) — подставка головных щупалец.
Цирростиль (cirrostyle) — удлиненная, дистальная часть циррусов, или усиков.
Циррофор (cirrophore) — подставка циррусов, или усиков.
Циррус (cirrus) — усик.
Шеврон (chevron) — ««« -образной формы хитиновые пластинки на хоботе Goniada.
Шпоровидн ая железа (spur gland) — небольшие железы на брюшных плавничках томоптерид, обйчно расположенные рядом с хромофильными железами.
Щетинки (chaetae, setae) — основное вооружение параподий; могут быть весьма различной формы (волосовидные, церистые, крючковидные, клювовидные, шпателевидные, гарпунные, мотыговидные и т. д.), в основном подразделяются на сложные, или сочлененные, и простые.
ЛИТЕРАТУРА
95
Щет и н к о в ы й мешок (follicule setigere) — эпидермальные вдавления кожного покрова, содержащие особые базальные клетки,' из которых образуются щетинки. .
Щупальцевидные усики — см. перистомиальные усики, или тентакуляр-ные циррусы.
Щупики — см. пальпы.
Э л и т р a (elytra) — см. спинная чешуйка.
Элитрофор (elytrophore) — подставка (ножка) элитр, или спинных чешуек. Эпитокные формы — видоизмененные половозрелые стадии донных червей, всплывающие на поверхность моря для нереста.
Эполеты — удлиненные выросты позади головной лопасти (одна из форм нухаль-ных органов).
ЛИТЕРАТУРА
Аверинцев В. Г. 1972. Донные многощетинковые черви Errantia Антарктики и Субантарктики по материалам советских антарктических экспедиций. В сб.: Результаты биол. исслед. Сов. антаркт. экспедиций, 5. Исслед. фауны морей, XI (XIX) : 98—292.
Анненкова Н.П. 1932а. К фауне Polychaeta, Земли Франца-Иосифа. Тр. Арктич. инет., т. II : 153—194.
Анненкова Н. П. 19326. К фауне Polychaeta моря Лаптевых. Исслед. морей СССР, выл. 15 : 133—139.
(Анненкова Н. И.) Annenkova N. Р. 1934. Kurze Ubersicht der Polychae-ten der Litoralzone der Bering-Insel (Komandor-Inseln) nebst Beschreibung neuer Arten. Zool. Anz., Bd. 106, H. 12 : 322—331.
Анненкова H. П. 1937. Фауна Polychaeta северной части Японского моря. Исслед. морей СССР, вып. 23 : 139—216.
Анненкова Н. П. 1938. Полихеты северной части Японского моря и их фациальное и вертикальное распределение. Дальневост, филиал АН СССР. Тр. Гидробиол. эксп. Зоол. инет. АН СССР 1934 г. на Японское море, вып. 1 : 81—230.
Анненкова Н.П. 1946. Новые виды многощетинковых червей Polychaeta из. Северного Ледовитого океана. Тр. дрейф, экспед. Главсевморпути на л/п «Седов» 1937—1940 гг., т. III : 185—188.
Анненкова Н. П. 1952. Многощетинковые черви (Polychaeta) Чукотского моря и Берингова пролива. В сб.: Крайний Северо-Восток Союза ССР. Т. II. Фауна* и флора Чукотского моря. Изд. АН СССР : 112—137.
Беклемишев В. Н. 1964. Основы сравнительной анатомии беспозвоночных.. Т. 1 — Проморфология, т. 2 — Органология. Изд. «Наука», М. : 1—432 4-1— 446.
Беклемишев К. В. 1950. Питание Nereis pelagica и функциональное значение-его челюстного аппарата. ДАН СССР, т. 73, № 5 : 1093—1095.
Беляев Г. М. 1966. Донная фауна наибольших глубин (ультраабиссали) Мирового океана. Изд. «Наука», М. : 1—247.
Беляев Г. иУшаков П. 1957. Некоторые закономерности количественного распределения донной фауны в водах Антарктики. ДАН СССР, т. 112, № 1 : 137—140.
Бергер В. Я. иЛебский В. К. 1969. Изменение соленостной устойчивости в онтогенезе полихеты Eulalia viridis (L.). ДАН СССР, т. 181, № 6 : 1427—1428.
Бобрецкий Н. В. 1870. Материалы для фауны Черного моря. Аннелиды, Annelida Polychaeta. Зап. Киевск. общ. естеств., Т : 1—26, 188—274.
Бужинская Г. Н. 1967. К экологии многощетинковых червей (Polychaeta) залива Посьет Японского моря. Исслед. фауны морей, V (XIII) : 78—124.
Бужинская Г. Н. иЛебский В. К. 1971. К экологии Eulalia viridis (L.) (Polychaeta, Annelida) залива' Посьета Японского моря и Кандалакшского за-, лива Белого моря. Исслед. фауны морей, VIII (XVI) : 137—143.
Вагнер Н. 1872. Новая группа кольчатых червей (Sagitella kowalewskii). Тр. СПб. общ. естеств., т. III : 344—347.
Виноградов К. А. 1948. К вопросу об использовании полихет в качестве корма рыб. ДАН СССР, т. 60, № 7 : 1273-1276.
Виноградов К. А. 1949. К фауне кольчатых червей (Polychaeta) Черного моря. Тр. Карадагской биол. станции АН УССР, № 8 : 13—84.
Виноградов К. А. и Досовская Г. В. 1968. Класс многощетинковые. черви — Polychaeta. Определитель фауны Черного и Азовского морей, т. 1. Изд. «Наукова думка», Киев : 251—360.
Волова Г. Н. 1969. Бентос некоторых пресных и солоноватых водоемов Южного-Приморья. Автореф. дисс. Дальневост. гос. упив., Владивосток : 1—26.
96
ВВЕДЕНИЕ
Теккер Р. Ф. и У таков П. В. 1962. Vermes. В кн.: Основы палеонтологии: губки, археоциаты, кишечнополостные, черви. Изд. АН СССР, М. : 435—464. .Горбунов Г.П. 1946. Донное население Новосибирского мелководья и центральной части Ледовитого океана. Тр. дрейф, экспед. Главсевморпути на л/п «Седов» 1937—1940 гг., т. III : 30—138.
.Гордеева К. Т. 1948. Материалы по количественному изучению зообентоса западнокамчатского шельфа. Изв. Тихоокеанск. н.-иссл. инет. рыбн. хоз. и океа-ногр., т. 26 : 131—198.
Данг Н г о к Тхань. 1967. Фауна пресноводных беспозвоночных Северного Вьетнама. Автореф. дисс. Изд. МГУ : 1—38.
Дерюгин К. М. 1915. Фауна Кольского залива и условия ее существования. Зап. АН, сер. VII, т. 34, № 1 : 1—929.
Дерюгин К. М. 1924. Баренцево море по Кольскому меридиану. Тр. Сев. научнопром. эксп., вып. 19 : 1—102.
Дерюгин К. М. 1928. Фауна Белого моря и условия ее существования. Исслед. морей СССР, вып. 7—8 : 1—511.
Ерохина Н. М. 1968. О плане строения мозга полихет. ДАН СССР, т. 179, № 4 : 986—989.
Жюбикас И. И. 1969. Эколого-фаунистическая характеристика биотопа морских ванн литорали и супралиторали Восточного Мурмана. Автореф. дисс. Изд. ЛГУ : 1—22.
- Закс И. Г. 1929. К познанию донных сообществ Шантарского моря. Изв. Тихоокеанск. научно-пром, ст., т. 3, вып. 2 : 3—112.
- Закс И. Г. 1933. К фауне кольчатых червей Северо-Японского моря. Исслед. морей СССР, вып. 19 : 125—137.
(Заленский В.) Salensky V. 1907. Morphogenetische Studien an Wurmern. Зап. АН физ.-мат. отд., т. 19, № 11 : 1—348.
- Зацепин В. И. 1948. Многощетинковые черви. Определитель фауны и флоры северных морей СССР. Изд. «Советская наука», М. : 94—167.
- Зенкевич Л. А. 1925. Polychaeta Белушьей губы. Тр. Пловучего морск. инет., вып. 6 :1—12.
- Зенкевич Л. А. 1944. Очерки по эволюции двигательного аппарата животных. Ч. 1. Общие положения эволюции движения животных. Журн. общ. биол., т. 5, № 3 : 129—171.
Иванов А. В. 1958. Тип Annelida — кольчатые черви..В кн.: Большой практикум по зоологии беспозвоночных, ч. 1. Изд. «Советская наука», М. : 402—531. Иванов П. П. 1944. Первичная и вторичная метамерия тела. Журн. общ. биол., т. 5, № 2 : 61—94.
Киселева М. И. 1957а. Пелагические личинки многощетинковых червей Черного моря. Тр. Севаст. биол. ст. АН СССР, т. 9 : 58—112.
'Киселева М. И. 19576. Лунная периодичность в роении гетеронереидных форм Platynereis dumerilii (And. et Edw.) и Nereis zonata Malmgren в Черном море. ДАН СССР, т. 117, № 4 : 713—716.
Ключарева О. К., Коренева Т. А., Сокольская Н. Л., Старо-богатов Я. И. 1964. Донные беспозвоночные озер Южного Сахалина. В сб.: Озера Южного Сахалина и их ихтиофауна. Изд. МГУ : 47—80.
Константинова М. И. 1969. Движение личинок полихет. ДАН СССР, т.188, № 4 : 942—945.
'Коштоянц X. С. 1957. Основы сравнительной физиологии. Т. II. Сравнительная физиология нервной системы. Изд. АН СССР, М. : 1—635.
Кузнецов А. П. 1963. Фауна донных беспозвоночные прикамчатских вод Тихого океана и северных Курильских островов. Изд. АН СССР, М. : 1—271. 'Кузнецов В. В. и М атвеева Т. А. 1948. Материалы к биоэкологической характеристике морских беспозвоночных Восточного Мурмана. Тр. Мурм. биол. ст. АН СССР, т. 1 : 242—260.
-Л е б с к и й В. К. 1970. Строение нервной системы Eulalia viridis (L.) (Polychaeta, Phyllodocidae). ДАН СССР, т. 190, № 6 : 1486—1489.
Левенштейн Р. Я. 1960. Количественное распределение полихет в северо-западной части Берингова моря. Тр. Инет, океанол. АН СССР, т. 34 : 104—122. -Левенштейн Р. Я. 1961. Многощетинковые черви (Polychaeta) глубоководной части Берингова моря. Тр. Инет, океанол. АН СССР, т. 46 : 147—178.
Левенштейн Р. Я. 1966. Многощетинковые черви (Polychaeta) западной части Берингова моря. Тр. Инет, океанол. АН СССР, т. 81 : 3—113.
-Левенштейн Р. Я. 1969. Многощетинковые черви (Polychaeta). В кн.: Тихий океан. Биология. Кн. II. Глубоководная донная фауна. Изд. «Наука», М. : 52-62.
ЛИТЕРАТУРА
97
Ливанов Н. А. (1913) 1914. Пограничные образования Polychaeta и общее морфологическое значение таких образований. Тр.’ Общ. естеств. Каз. упив., т. XLVI, вып. 2 : 3—286, табл. 1—7.'
Ливанов Н. А. 1924. Исследования по анатомии нервной системы в сомите Polychaeta; Арх. анат., гистол. и эмбр., т. 3, вып, 1 : 1—78.
Ливанов Н. А. 1940. Класс полихет {Poly chaeta). Руководство по зоологии, т. 2. Изд. АН СССР, М.—Л. : 10—136.
Ливанов Н. А. 1955. Пути эволюции животного мира. Анализ организации главнейших типов многоклеточных животных. Изд. «Советская наука», М. : 1—400.
Матвеева Т. А., Никитина Н. С. иЧерновская Е. Н. 1955. Причины и следствия неравномерности распределения червей Fabrtcia sabella и Arentcola marina на литорали. ДАН СССР, т. 105, № 2 : 370—373.
Мейер Э. А. 1890. О сегментальных и половых органах у Lopadorhynchus. Протокол засед. отд. биол. Варш. общ. естеств., № 9 : 1—6.
Мейер Э. А. 1893. Организация трубчатых червей семейства Serpulidae и Hermel-lidae как результат их сидячего образа жизни. Тр. Общ. естеств. Каз. унив., т. XXVI, вып. 3 : 1—131, табл. I—II.
Мейер Э. А. 1897 (1898). Исследования над развитием кольчатых червей. Тр. Общ. естеств. Каз. унив., т. XXXI, вып. 4 : 1—356, табл. I—VI.
Милейковский С. А. 1961. Полихеты Sphaerosyllis erinaceus Clap, и Phalacrophorus pictus Greeff в планктоне Баренцева моря. Зоол. журн., т. XL, вып. 7 : 1099—1102.
Милейковский С. А. 1962. Распространение пелагических полихет в Норвежском и Баренцевом морях. Океанология, т. II, вып. 6 : 1060—1074.
Милейковский С. А. 1968. Морфология личинок и систематика Polychaeta. Зоол. журн., т. XLVII, вып. 1 : 49—51.
Милейковский С. А. 1969. Вертикальное распределение, размножение и численность массовых пелагических полихет в северо-западной части Тихого океана. Океанология, т. IX, вып. 4 : 676—685.
Петровская М. В. 1960. К экологии многощетинковых червей Восточного Мурмана и некоторые данные о периодах их размножения и личиночных формах. Тр. Мурм. морск. биол. инет. АН СССР, вып. 1 (5) : 28—67..
Петровская М. В. 1963. Многощетинковые черви {Polychaeta) Баренцева моря. Автореф. дисс. Зоол. инет. АН СССР : 1—20.
Полянский Ю. И. 1950. Сравнительное изучение стойкости многощетинковых кольчецов Spirorbis borealis Daudin и Spirorbis spirillum (L.) к некоторым внешним факторам. ДАН СССР, т. 73, № 2 : 389—392.
Ромм М. М. 1954. Туловищный мозг полихеты Harmothoe imbricata. Автореф. дисс. Каз. гос. унив. : 1—12.
Ромм М. М. 1960. Невросомит полихеты Harmothoe imbricata. Уч. зап. Каз. гос. унив., т. 120, кн. 6 (Тр. Общ. естеств., т. XIII) : 33—51.
Светлов П. Г. 1962. К анализу понятий параллелизма и дивергенции. В сб.: Вопросы общ. зоологии и мед. паразитологии, Медгиз, М. : 215—228.
Свешников В. А. 1958. Новые для Белого моря виды полихет. Зоол. журн., т. XXXVII, вып. 1 : 20—26.
Свешников В. А. 1960. Пелагические личинки некоторых полихет Белого моря. Зоол. журн., т. XXXIX, вып. 3 : 343—355.
Свешников В. А. 1961. Пелагические личинки полихет Белого моря. Зоол. журн., т. XL, вып. 2 : 164—177.
Свешников В. А. 1963. О типах личинок полихет (Polychaeta). ДАН СССР, т. 150, № 6 : 1393—1396. у
Свешников В. А. 1966. Эволюция личиночного развития архианнелид и'поли-хет. Зоол. журн., т. XLV, вып. 9 : 1369—1381.
Свешников В. А. 1967. Личинки архианнелид и полихет залива Посьет Японского моря. Исслед. фауны,морей, V (XIII) : 125—159.
Свешников В. А. 1968. Класс многощетинковые кольчецы {Polychaeta). В кн.: Жизнь животных, т. 1. Изд. «Просвещение», М. : 473—488.
Свешников В. А. и Ц ю Вень-жень. 1963. Рострария — личинка No-topygos sp. (Amphinomidae, Polychaeta) из Южно-Китайского моря. ДАН СССР, т. 149, № 3 : 738—741.
Стекольщиков М. Г. 1954. Строение и эволюция органов дыхания полихет. Уч. зап. Каз. гос. унив., т. 114, кн. 1.: 23—53.
Стрельцов В. Е. 1966а. Биология питания плотоядного многощетинкового червя Harmothoe imbricata (L.) в Дальнезеленецкой губе Баренцева моря. Тр. Мурм. морск. биол. инет. АН СССР, вып. 11 (15) : 115—121.
Стрельцов В.Е. 19666. Количественное распределение многощетинковых червей {Polychaeta) в южной части Баренцева моря. Тр. Мурм. морск. биол. инет. АН СССР, вып. 11 (15) : 71—91.
7 П. В. Ушаков
98
ВВЕДЕНИЕ
Стрельцов В. Е. 1968. Количественная характеристика питания Harmothoe imbricata (L.) (Polychaeta,. Errantia). Tp. Мурм. морск. биол. инет. АН СССР, выл. 17 (21) : 96—104.
Тимофеев С. И. 1923. К морфологии Polychaeta. III. Кровеносная система. Сб. тр. Иркутского унив., вып. 4 : 79—89.
Тимофеев С. И. 1924. К морфологии Polychaeta. IV. Кровеносная система Не-sione siciila D. Ch. Русск. зоол. журн., т. IV, вып. 3—4 : 198—219.
Тимофеев С.' И. 1930. К морфологии Polychaeta. VII. Кровеносная система Ari-cia foetida С1р. Изв. Биолого-геогр. н.-иссл. инет, при Иркутском унив., т. IV, вып. 3—4 : 149—180.
Т э б б л Н. 1968. Пелагические полихеты Советских антарктических экспедиций. Исслед. фауны морей, вып. VI (XIV) : 25—34.
Ушаков П. В. 1925. Сезонные изменения на литорали Кольского залива. Тр. Лен. общ. естеств., т. 44 : 47—72.
Ушаков П. В. 1939. Некоторые новые данные по фауне полихет Белого моря. Тр. Гос. гидрол. инет., вып. 8 : 81—84.
Ушаков П. В. 1948а. Мурманская биологическая станция Академии Наук СССР в губе Дальне-Зеленецкой и ее первые научные работы. Тр. Мурм. биол. ст. АН СССР, т. 1 : 10-32.
Ушаков П. В. 19486. Фауна беспозвоночных Амурского лимана и соседних опресненных участков Сахалинского залива. В сб.: Памяти акад. С. А. Зернова, Изд. АН СССР : 175—191.
Ушаков П. В. 1950. Многощетинковые черви (Polychaeta) Охотского моря. Исслед. дальневост, морей СССР, вып. II : 140—234.
Ушаков И. В. 1952. Батипелагические и глубоководные формы многощетинковых червей (Polychaeta) из прикамчатских вод Тихого океана. Исслед. дальневост, морей СССР, вып. III : 103—112.
Ушаков И. В. 1953. Новые виды многощетинковых червей из семейства Phyllodocidae (Polychaeta). Тр. Зоол. инет. АН СССР, т. XIII : 207—209.
Ушаков П. В. 1955а. Многощетинковые черви дальневосточных морей СССР. Определ. по фауне СССР, № 56. Изд. АН СССР : 1—445.
Ушаков П. В. 19556. Многощетинковые черви сем. Aphroditidae Курило-Камчатской впадины. Тр. Инет, океанол. АН СССР, т. XII : 311—321.
Ушаков П. В. 1957. К фауне многощетинковых червей (Polychaeta) Арктики и Антарктики. Зоол. журн., т. XXXVI, вып. 11 : 1659—1672.
Ушаков П. В. 1958а. Два новых вида многощетинковых червей из семейства Phyllodocidae (Polychaeta) с абиссальных глубин Курило-Камчатской впадины. Тр. Инет, океанол. АН СССР, т. XXVII : 204—207.
Ушаков П.В. 19586. О нахождении редкого вида многощетинкового червя (Ра-ralacydonia paradoxa Fauvel из сем. Phyllodocidae) в Желтом море. Acta Zool. Sinica, vol. 10, № 4 : 416—420.
Ушаков П. В. 1959. Многощетинковые черви. Список фауны морских вод Южного Сахалина и южных Курильских островов. Исслед. дальневост, морей СССР, вып. VI : 201—208.
Ушаков П. В. 1962. Многощетинковые черви сем. Phyllodocidae и Aphroditidae из антарктических и субантарктических вод. Исслед. фауны морей, I (IX) : 129—189.
Ушаков П. В. и У Б а о - л и н. 1959. Многощетинковые черви семейств Phyllodocidae и Aphroditidae (Polychaeta, Errantia) из Желтого моря. Arch. Inst. Осеа-nol. Sinica, v. 1, № 4 : 1—40, I—X.
Ушаков П. В. иУБао-лин. 1962а. Многощетинковые черви Желтого моря. VI. Дополнения к фауне бродячих червей (Polychaeta) Errantia). Studia Marina Sinica, 2 : 110—137.
Ушаков П. В. иУБао-лин. 19626. К фауне многощетинковых червей побережья провинции Фуцзянь и Чжэцзян. Studia Marina Sinica, 1 : 89—108.
Ушаков П. В.иУБао-лин. 1962в. Новый вид рода Notopygos (Amphtnomidae, Polychaeta) из Южно-Китайского моря с островов Сишацюньдао (Парасельские острова). Acta Zool. Sinica, vol. 14, № 2 : 261—265.
Ушаков П. В. иУБао-лин. 1965. Бродячие многощетинковые черви (Polychaeta, Errantia) Желтого моря. Исслед. фауны морей, вып. Ill (XI) : 145— 258.
Федотов Д. М. 1966. Эволюция и филогения беспозвоночных животных. Изд. «Наука», М. : 5—404 (Аннелиды : 171—189).
Хауэншильд К. 1964. Лунные ритмы. В кн.: Биологические часы. Изд. «Мир», М. : 682—691.
Хлебович В. В. 1957. Наблюдения над морозостойкостью многощетинковых червей Курильской гряды. ДАН СССР, т. 112, № 3 : 542—544.
Хлебович В. В. 1959. Новый случай хищничества у полихет. Природа, № 9 :118.
ЛИТЕРАТУРА
1)1)
Хлебович В. В. 1961. Многощетинковые черви {Polychaeta) литорали Курильских островов. Исслед. дальневост, морей СССР, вып. VII : 151—260.
Хлебович В. В. 1962. Пелагические половые стадии полихет, пойманные па свет в районе Курильской гряды. Исслед. дальневост, морей СССР, вып. VIII : 167—180.
Хлебович В. В. 1964. Многощетинковые черви {Polychaeta) из северной части Гренландского моря и района островов Шпицбергена и Земли Франца-Иосифа. Тр. Аркт. и Аптаркт. н.-иссл. инет., т. 259 : 167—180.
Шаров А. Г. 1965. Происхождение и основные этапы эволюции членистоногих (Arthropoda). I. От аннелид к членистоногим. Зоол. журн., т. XLIV, вып. 6 : 803—817.
(Ш и м к е в и ч В.) Schimkewi tsch W. 1895. Zur Kenntnis des Banes und das Entwicklung des Dinophilus vom Weissen Meere. Zeitschr. Wiss. Zool., Leipzig, Bd. 59 : 46—79.
Якубова Л. И. и E. H. M а л ь м. 1930. Явление временного анаэробиоза у некоторых представителей бентоса Черного моря. ДАН СССР, А, № 14 : 363— 366.
Я ш н о в В. А. 1940. Планктическая продуктивность северных морей СССР. Изд. Москов. общ. испыт. природы; М. : 1—84.
Agassiz А. 1867. On the young stages of a few Annelids. Ann. Mag. Nat. Hist., ser. 3; v. 19 : 203—218, 242—257.
Akesson B. 1962. The Embryology of Tomopteris helgolandica {Polychaeta). Acta Zoologica, Bd. XLIII : 135—200.
Akesson B. 1964. On the eyes of Tomopteris helgolandica {Tomopteridae, Polychaeta). Acta Zoologica, Bd. XLVI : 179—189.
Akesson B. 1967. On the nervous system of the Lopadorhynchus larva (Polychaeta). Arkiv for Zool., Ser. 2, Bd. 20, № 2 : 55—78.
Akesson В. a. M elan der Y. 1967. A preliminary report on the early development of the polychaete Tomopteris helgolandica. Arkiv for Zool., Ser. 2, Bd. 20, № 6 : 141—146.
Apstein C. 1893. Die Alciopiden der Berliner Zoologischen Sammlung. Arch. Naturg. Berlin, Bd. LIX : 141—150.
Apstein C. 1900. Die Alciopiden und Tomopteriden der Plankton-Expedition. Erg. d. Plankton-Exp. d. Humboldt-Stift., Bd. II, H. b, Kiel und Leipzig : 3—62, Taf. I-XIV.
Arndt E. A. 1964. Tiere der Ostsee. Die Neue Brehm-Bucherei : 1—199.
Audouin J. et Milne-Edwards H. 1834. Annelides, pt. I. Recherches pour servir a 1’hist. nat. du littoral de la France, Paris : 1—290, pls. 1—8.
A u g e n e г Hj. 1913. Polychaeta, I. Errantia. Die Fauna Siidwest-Australiens. Bd. IV, Lief. 5 : 65-304, Taf. II—III.
A u g e n e r Hj. (1922) 1924. Ueber litorale Polychaeten von Westindien. Sitzber. Ges. Naturf. Freunde zu Berlin, Jahrg. 1922 : 38—63.
Augen er Hj. 1924. Polychaeten von Neuseeland. I. Errantia. Vid. Medd. Dansk Naturh. Foren. Kobenhavn, Bd. 75 : 241—441.
A u g e n e г Hj. 1927a. Die Polychaeten der Sammlung Thilenius von Neuseeland und Samoa. Mitt. Zool. Museum Berlin, Bd. 13, H. 2 : 339—363.
A u g e n e г Hj. 1927b. Polychaeten von Neu-Pommern. Sitzber. Ges. Naturf. Freunde, Jahrg. 1926 : 119—152.
A u g e n e г Hj. 1928. Die Polychaten von Spitzbergen. Fauna Arctica, Bd. V : 649— 834, Taf. XI.
A u g e n e г Hj. 1929. Beitrage zur Planktonbevolkerung der Weddellsee. Intern. Hydrobiol. u. Hydrographie, Bd. 22, H. 5/6 : 273—312.
Baldasseroni V. 1909. Typhlodrilus ducalis n. gen. n. sp. di Tifloscolecide raccolto dalla Regia Nave «Liguria» (Camagna 1903—1905). Monitore Zoologica Italiano,, XX Anno, № 6 : 227—228.
В a n s e K. 1954. Mystides {Pseudomystides) southerni sp. nov. {Phyllodocidae, Polychaeta). Zool. Anz., Bd. 153, H. 11—12 : 313—318.
В a n s e K. 1959. Uber die Polychaeten-Besiedlung einiger submariner Hohlen. Pubbl-Staz. Zool. Napoli, v. XXX, Suppl. : 417—469.
Banse K. a. Hobson K. 1968. Benthic Polychaetes from the Puget Sound, Washington, with remarks on four other species. Proc. U. S. Nat. Mus., Smiths. Instit., v. 125, № 3667 : 1—53.
Banse K. a. Nichols F. 1968. Two new species and three new records of benthic Polychaetes from Puget Sound (Washington). Proc. Biol. Soc. Washington, v. 81 222—230.
7*
100
ВВЕДЕНИЕ
В е 1 1 а n G. 1964. Contribution a 1’etude systematique, bionomique et ecologique des Annelides Polychetes de la Mediterranee. Theses pres, a la Fac. Sc. de 1’Univ. d’Aix-Marseille : 1—371.
В e l 1 a n G. 1967. Pollution et peuplements benthiques sur substrat meumble dans la region de Marseille. Rev. Intern. Oceanogr. Med., t. VIII : 51—95.
В e 1 1 a n G. 1968. Contribution a la connaissance des peuplements de substrat meuble etablis dans les zones polluees de la region de Marseille. Rapp. Comm. Int. Mer. Med., t. 19, № 2 : 91—92.
В ellan-Santini D. 1968. Influence de la pollution sur les peuplements bethi-ques. Rev. Intern. Oceanogr. Med., t. X : 27—53.
Benham W. B. 1927. Polychaeta. British Antarctic («Terra Nova») Expedition, 1910. Nat. Hist. Rep., Zool., v. VII, № 2 : 47—182, pls. I—VI.
Benham W. B. 1929. The pelagic Polychaeta. British Antarctic («Terra Nova») Expedition, 1910. Nat. Hist. Rep., Zool., v. VII, № 3 : 183—201, pls. I—II.
Bergstrom E. 1914. Zur Systematik der Polychaeten Familie der Phyllodociden. Zool. Bidrag, Uppsala, Bd. Ill : 37—324.
Berkeley E. 1924. Polychaetous annelids from the Nanaimo district. Pt. 2. Phyllodocidae to Nereidae. Contr. Canad. Biol. N. S., v. II, № 12 : 287—293.
Berkeley E. a. Berkeley C. 1938. Rhamphobrachium longisetosum, sp. n., with some observations on the regeneration of the specialized anterior setae. Ann. Mag. Nat. Hist., set. 11, v. 1 : 428—435.
Berkeley E. a. Berkeley C. 1942. North Pacific Polychaeta, chiefly from the west coast of Vancouver island, Alaska, and Bering sea. Canad. Journ. of Research, v. 20 : 183—208.
Berkeley E. a. Berkeley C. 1948. Annelida. Polychaeta errantia. Canadian Pacific Fauna, № 9b (1) : 1—100.
Berkeley E. a. Berkeley C. 1956. On a collection of polychaetous annelids from northern Banks Island, from the south Beaufort sea, and from northwest Alaska; together with some new records from the east coast of Canada. Journ. Fish. Res. Board Can., v. 13, № 2 : 233—246.
Berkeley E. a. Berkeley C. 1957. On some pelagic Polychaeta from the Northeast Pacific north of latitude 40° N and east of longitude 175° W. Canad. Journ. Zool., v. 35 : 573—578.
Berkeley E. a. Berkeley C. 1958. Some notes on a collection of Polychaeta from the Northeast Pacific south of latitude 32° N. Canad. Journ. Zool., v. 36 : 399-407.
Berkeley E. a. Berkeley C. 1960. Some further records of pelagic Polychaeta from the Northeast Pacific north of latitude 40° N and east of longitude 175° W. Canad. Journ. Zool., v. 38 : 787—799.
Berkeley E. a. Berkeley C. 1961. Notes on Polychaeta from California to Peru. Canad. Journ. Zool., v. 39 : 655—664.
Berkeley. E. a. Berkeley C. 1963. The proboscis of Lycastopsis catarractarum Fuerborn. Canad. Journ. Zool., v. 41 : 907—908.
Berkeley E. a. Berkeley C. 1964. Notes on some pelagic and some swarming Polychaeta taken of the [coast of Peru, canad. Journ. Zool., v. 42 : 121—134.
В h a u d M. 1967. Etude du developpement de quelques larves d’Annelides Polychetes a Banyuls-sur mer. Vie et Milieu, ser. A, t. XVIII, fasc. 3 : 531—558.
Binard A. etJeener R. 1928. Morphologie du lobe preoral des Polychetes. Rec. de Inst. Zool. Torley-Rousseau, t. II, fasc. 1 : 117—240.
Binard A. etJeener R. 1930. Recherches sur 1’evolution adaptative de 1’appareil locomoteur des Polychetes. Rec. Inst. Zool. Torley-Rousseau, t. Ill, fasc. 1 : 17— 87.
В о b i n G. 1944. Morphogenese des soies chez les Annelides Polychetes. Ann. de 1’Inst. Oceanogr., t. XXII : 1—106, pls. 1—6.
Bohn G. 1906. Attitudes et mouvements des Annelides. Essai de psychophysiologie ethologique. Ann. Sci. Nat. Paris. IX ser., Zool., t. Ill : 35—144.
Bonhomme C. 1942. Recherches sur 1’histologie de 1’appareil lumineux des Poly-noines. Bull. Inst. Oceanogr. Monaco, № 823 : 1—8.
Bullock Th. H. a. Horridge G. A. 1965. Structure and function in the nervous systems of invertebrates. Chap. 14. Annelida : 661—789.
Casanova L. 1953. Les annelides du plankton dans le Golfe de Marseille. Rec. Trav. Stat. Mar. d’Endoume, fasc. 8 : 29—36.
C az aux Cl. 1965. Etude d’un Phyllodocidae peu connu Phyllodoce pusilia (Claparede). Bull. Inst. Oceanogr. Monaco, v. 65, № 1340 : 1—15.
C az aux Cl. 1969. Etude morphologique de developpement larvaire d’Annelides Polychetes (Bassin d’Arcachon). 2. Phyllodocidae, Syllidae, Nereidae. Arch. Zool. Exper. Gen., t. 110, fasc. 2 : 145—202.
ЛИТЕРАТУРА
101
С a z a u х Cl. et L a b о u г g P. J. 1967. Observations preliminair.es.sur 1’essaimago de Platynereis dumerilii dans le bassin d’Arcachon. Actes Soc. Linn, de Bordeaux, ser. A, t. 104, № 4 : 1—8.
Chamberlin R. V. 1919a. The Annelida Polychaeta. Mem. Mus. Comp. Zool., Harvard College, v. 48 : 1—514, pls. 1—80.
Chamberlin R. V. 1919b. New polychaetous annelids from Laguna Beach, California, Journ. Entom. Zool. Pomona Coll., v. 11 : 1—23.
Claparede Ed. 1868. Les Annelides Chetopodes du Golfe de Naples. Mem. Soc. Phys., Geneve, t. XIX et XX : 1—500, pls. 1-32.
Claparede Ed. 1870. Les Annelides Chetopodes du Golfe de Naples. Mem. Soc. Phys. Geneve, t. XX, Suppl. : 1—178, pls. 1—14.
Claparede E. et Panceri P. 1867. Nota sopra un Alciopide parassito della Cydippe densa Forskftl. Soc. Ital. sci. nat. Atti., v. 10 (Mem. Soc. Ital., Sci. Milano, v. 3, № 4) : 257—258.
Clark R. B. 1956. Capitella capitate. as a commensal, with a bibliography of parasitism and commensalism in the Polychaetes. Ann. Mag. Nat. Hist., ser. 12, v. 9, № 102 : 431—448.
Clark R. B. 1962. On the structure and functions of polychaete- septa. Proc. Zool. Soc., London, v. 138, part 4 : 543—578.
Dales R. Ph. 1955a. The pelagic Polychaetes of Monterey bay, California. Ann. Mag. Nat. Hist., ser. 12, v. 8, № 90 : 434—444.
Dales R. Ph. 1955b. The evolution of the pelagic phyllodocid and alciopid polychaetes. Proc, Zool. Soc., London, v. 125, part.2:411—420.
Dales R. Ph. 1956. An annotated list of the pelagic Polychaeta. Ann. Mag. Nat. Hist., ser. 12, v. 9 : 289—304.
Dales R. Ph. 1957. Pelagic Polychaetes of the Pacific Ocean. Bull. Scripps Inst. Oceanogr. Univ. California, v. 7, № 2 : 99—168.
Dales R. Ph. 1959. Pelagic Polychaetes from the Malacca Straits and South China sea. Ann. Mag. Nat. Hist., ser. 13, v. 2, Ns 20 : 481—487.
Dales R. Ph. 1962. The polychaete stomodeum and the inter-relatioships of the families of Polychaeta. Proc. Zool. Soc. London, v. 139, part 3 : 389—428.
Dales R. Ph. 1963a. Pelagic Polychaetes from waters off the coasts of Kenya and Tanganyika. Ann. Mag. Nat. Hist., ser. 13, v. 6, № 68 : 501—503.
Dales R. Ph. 1963b. Annelids. Hutchins. Univers. Library, London : 1—200.
Damas D. 1936. Une Narcomeduse parasite d’un ver Polychete. Mem. Mus. R. d’Hist. Nat. Belgique, ser. 2, fasc. 3 : 1177—1197.
Day J. H. 1953. The Polychaet Fauna of South Africa, pt. 2. Ann. Natal Museum, v. XII, pt. 3 : 397—441.
Day J. H. 1957. The Polychaet Fauna of South Africa, pt. 4. New species and records from Natal and Mosambique. Ann. Natal Museum, v. XIV, pt. 1 : 59—129.
Day J. H. 1960. The Polychaet Fauna of South Africa, pt. 5. Ann. South Afr. Museum, v. XLV : 261—373.
Day J. H. 1967. A Monograph on the Polychaeta of Southern Africa, part 1. Errantia. Brit. Museum, Nat. Hist., London : 1—458, I—XXIX.
D e m о 1 1 R. 1909. Die Augen von Alciope cantrainit. Zool. Jahrb., Abt. Anat., Bd. 27 : 651-686.
Ditlevsen Hj. 1914. Polychaeta Annelider. Consp ectus Faune Groenlandicae. Medd. om Gronland, XXIII : 659—741.
Ditlevsen Hj. 1917. Annelids. The Danish Ingolf-Exp., v. IV, № 4:1—71, pls. I-VI.
Dollfus R. Ph. 1960. Sur un recif actuel: le banc des Hermelles de la baie du Mont-Saint-Michel, Quelques renseignements documentaires. Bull. Soc. Geol. France, ser. 7, t. II : 133—140.
Ehlers E. 1864—1868. Die Borstenwiirmer nach systematischen und anatomischen Untersuchungen dargestellt. Leipzig : 1—748.
Ehlers E. 1869. Uber fossile Wiirmer aus dem lithographischen Schiefer in Bayern. Palaeontographica, Bd. XVII, H. 4 : 145—175.
Ehlers E. 1897. Polychaeten. Hamburger Magalhaensische Sammelreise : 1—148, pls. I—IX.
Ehlers E. 1912. Polychaeta. National Antarct. Exp., 1901—1904. Nat. Hist., v. 6, Zool. : 1—32, pls. I—III.
Ehlers E. 1913. Die Polychaeten-Sammlungen der Deutschen Siidpolar-Expo-ditiori 1901—1903. Deutsche Siidpol.-Exp., Bd. XIII, Heft IV : 397—598, pls. 26— 46.
Eliason A. 1920. Polychaeta. Biol.-faun. Unters. aus dem Oresund. Lunds Univ. Arsskr., N. F., Avd. 2, Bd. 16, № 6 : 2—103.
102
ВВЕДЕНИЕ
Eliason А. 1962а. Weitere Untersuchungen uber die Polychaetenfauna des Oresunds. Lunds Univ. Arsskr., N. F., Avd. 2, Bd. 58, № 9 : 1—98.
Eliason A. 1962b. Die Polychaeten der Skagerak-Expedition 1933. Zool. Bidrag, Uppsala, Bd. 33 : 207—293.
F a g e L. 1906. Recherches sur les organes segmentaires des Annelides Polychetes. Ann. Sei. Nat. Zool. Paris, ser. IX, t. Ill : 261-407.
Fage L. et Legendre R. 1926. Essaimage et ry thine lunaire d’un Phyllodocien (Eulalia, punctlfera Gr.). C. R. Acad. Sci., Paris, t. 182 : 721—723.
F a u v e 1 P. 1911. Annelides Polychetes. Campagne Arctique du Due d’Orleans de 1907, Bruxelles : 1—45, I—IV, pl. I.
F a u v e 1 P. 1913. Quatrieme note preliminaire sur les Polychetes provenant des cam-pagnees de 1’Hirondelle et de la Princesse-Alice. Bull. Inst. Oceanogr. Monaco, № 270 : 1—80.
F a u v e 1 P. 1914. Annelides polychetes non-pelagiques provenant des campagnes de 1’Hirondelle et de la Princesse-Alice (1885—1910). Res. Camp. Sci. Monaco, fasc. 46 : 1—432, pls. I—XXXI.
F a u v e 1 P. 1916. Annelides Polychetes pelagiques provenant des campagnes des yachts Hirondelle et Princesse-Alice (1885—1910). Res. Camp. Sci. Monaco, fasc. 48 : 1—152, pls. I—IX.
F a u v e 1 P. 1919. Annelides Polychetes de Madagascar de Djibouti et du golfe Persi-que. Arch. Zool. Exper. Gen., t. 58 : 315—473.
F a u v e 1 P. 1923. Polychetes errantes. Faune de France, 5 : 1—486.
F a u v e 1 P. 1930. Annelides polychetes de Nouvelle Caledonie recueillies par Mme. A. Pruvot-Fol en 1928. Arch. Zool. Exper. Gen., t. 69, fasc. 5 : 501—562.
F a u v e 1 P. 1932. Annelida Polychaeta of the Indian Museum, Calcutta. Mem. Indian Mus., v. 12, № 1 : 1—262.
Fauvel P. 1933. Annelides Polychetes du Golfe du Pei-Tcheu-Ly de la collection du Musee Hoang-ho-Pai-ho. Publ. du Mus. Hoang-ho-Pai-ho de Tien-Tsin, № 15 : 1—67.
Fauvel P. 1936. Annelides Polychetes du Japon. Mem. College Sc. Kyoto Imp. Univ., ser. B, v. XII, № 1, Art. 3 : 41—92.
Fauvel P. 1938, Analogies des Annelides polychetes pelagiques de I’ocean Indien et de 1’Atlantique. C. R. Soc. Biogeogr. Paris, v. 15, № 126 : 30—31.
Fauvel P. 1939. Annelides Polychetes de 1’Indochine recueillies par Dawydoff. Comment. Pontificia Acad. Sci., anno III, v. Ill, № 10 : 243—368.
Fauvel P. 1953. Annelida Polychaeta. The fauna of India, Allahabad : 1—507.
Fauvel P. 1959. Classe des Annelides Polychetes. Traite de Zoologie, t. V, fasc. 1 : 13-196.
Fauvel P. etRullier F. 1957. Nouvelle contribution a la faune des Annelides Polychetes du Senegal. Bull. Inst. Fr. Afr. Noire, t. XIX, ser. A, № 1 : 24—96.
Friedrich H. 1938. Polychaeta. Die Tierwelt der Nord- und Ostsee, Lief. XXXII, Teil VI, b : 1-201.
Friedrich H. 1939. Polychaeten-Studien. IV. Zur Polychaetenfauna der Barents-See. Kieler Meeresforsch., Bd. 3, H. 1 : 122—132.
Friedrich H. 1949. Lebensformtypen bei pelagischer Polychaeten. Zool. Anz., Suppl., Bd. 13 (Verh. Deutsch. Zool. in Kiel) : 188—204.
Friedrich H. 1950a. Beitrage zur Kenntnis der Polychaetenfamilie Typhloscoleei-dae. (Die pelagischen Polychaeten der Meteor-Expedition, II). Zool. Jahrb., Abt., Syst., Bd. 79, H. 3 : 309—320.
Friedrich H. 1950b. Vorkommen und Verbreitung der pelagischen Polychaeten im Atlantischen Ozean. Auf Grund der Fange der «Mbteors-Expedition. Kieler Meeresforsch., Bd. 7, № 1 : 5—24.
Friedrich H. 1956. Mitteilungen liber neue und wenig bekannte Polychaeten aus Mittel- und Siidamerica. Senckenbergiana Biologica, Bd. 37, № 1/2 : 57—68.
Glaessner M. F. 1958. New fossils from the base of the Cambrian in South Australia. Trans. Roy. Soc. South Australia, v. 81 : 185—188.
Glaessner M. F. 1962. Pre-cambrian fossils. Biol. Rev., v. 37 (4) : 467—494.
Goodrich E. S. 1900. On the nephridia of the Polychaeta. III. The Phyllodocidae, Syllidae, Amphinomidae etc., with summary and conclusions. Quart. Journ. of microsc. sci. (N. S.), v. XLIII : 699—748.
Grainger E. H. 1954. Polychaetous annelids of Ungawa Bay, Hudson Strait, Frobisher Bay and Cumberland Sound. Journ. Fisher. Research Board of Canada, v. XI, № 5 : 507—528.
Granata L. 1911. Osservazioni su alcuni stadi di sviluppo di Corynocephalus albomaculatus Lev. Monit. Zool. Ital. Firenze, Anno 22 : 151—158.
Gravier Ch. 1896. Recherches sur les Phyllodociens. Bull. Sci. France et Belg., t. 29 : 298—389.
ЛИТЕРАТУРА
103
Gravier Ch. 1900. Contribution a 1’etude des Annelides Polychetes de la mer Rouge. Nouvelles Arch. Mus. d’Hist. Nat., Paris, ser. 4, t. II, fasc. 2 :137—282, pls. 9—14.
Gravier Ch. 1907. Annelides Polychetes. Expedition Antarct. Fran§.(1903—1905), Paris : 1—75, pls. I—V.
Gravier Ch. 1911. Annelides Polychetes recueillis par la seconde expedition antarcti-que frangaise (1908—1910). Deuxieme Exp. Antarct. Franc,;., t. I : 1—165, pls. I-XII.
Gravier Ch. 1923. La ponte et 1’incubation chez les Annelides Polychetes. Ann. Sci. Nat. Zool., Paris, ser. 10, t. 6 : 153—247.
Gravier Ch. etDantan J. L. 1936. Peches nocturnes a la lumiere artificielle sur les cotes de 1’Indochine, Annelides polychetes. Inst. Ocean, de 1’Indochine, 29 note : 67—72.
Gray J. 1939. Studies in animal locomotion. VIII. The kinetics of locomotion of Nereis diverstcolor. Journ. Exp. Biol., v. 16 : 9—17.
Greeff R. 1876a. Untersuchungen fiber die Alciopiden. Nova Acta d. Ksl. Leop. Carol. Deutschen Akad. d. Naturf., Bd. XXXIX, № 2 : 33—132.
Greeff R. 1876b. Ueber das Auge der Alciopiden. Sitzungsb. Gesellsch. Beford. Na-turw. Marburg : 3—24.
Greeff R. 1879. Ueber pelagische Anneliden von der Kiiste der Canarischen Inseln. Zeitschr. Wissensch. Zool., Bd. 32 : 237—284, pls. XIII—XV. '
Greeff R. 1882. Ueber die rosettenformigen Leuchtorgane der Tomopteriden. Zool. Anz., Bd. 5 : 384—387.
Greeff R. 1885. Ueber die pelagische Fauna an den Kiisten der Guinea Inseln. Zeitschr. Wissensch. Zool., Bd. 42 : 432—458.
Grube A. E. 1850. Die Familien der Anneliden. Arch. Naturgesch. Berlin, Bd. 16 : 249—364.
Grube A. E. 1855. Beschreibung neuer oder wenig bekannter Anneliden. Arch. Naturgesch. Berlin, Bd. 21:63—158..
Grube A. E. 1860. Beschreibung neuer oder wenig bekannter Anneliden. Arch. Naturgesch. Berlin, Bd. 26 : 71—118.
Grube A. E. 1878. Einige neue Anneliden aus Japan. Jahresber. Schles. Gesells. Vaterland Kultur Breslau, Bd. 55 : 104—106.
Gustafson G. 1930. Anatomische Studien fiber die Polychaeten familien Amphinomidae und Euphrosynidae. Zool. Bidrag, Uppsala, Bd. 12 : 305—471.
Guy A. 1964. Contribution a 1’etude des Annelides Polychetes de la cote d’Ivoire. Rec. Trav. St. Mar. End., Mars., Bull. 34, fasc. 50 : 167—210.
Hacker V. 1898a. Die pelagischen Polychaeten- und Achaetenlarven der Plankton Expedition. Erg. der Deutsch. Plankton-Exp., Bd. 2, H. d. : 1—50.
Hacker V. 1898b. Pelagische Polychaetenlarven. II. Zur Biologie der atlantischen Hochseeformen. Biol. Centralbl., 18 : 39—54.
Halstead B.W. 1965. Poisonous and venomous marine animals of the World, v. I. Invertebrates. Washington : 1—994.
Hansen G. A. 1882. Annelida. Den Norske Nordhavs-Expedition 1876—1878. VII. Christiania : 1—54, tab. I—VII.
Hartman O. 1936a. A review of the Phyllodocidae (Annelida Polychaeta) of the coast of California, with descriptions of nine new species. Univ. Calif., Publ. Zool., v. 41 : 117—132.
Hartman O. 1936b. Nomenclatorial changes involving California polychaete worms. Wash. Sci. Acad. Journ., v. 26 : 31—32.
Hartman O. 1944. Polychaetous annelids from California, including the description of two new genera and nine new species. Allan Hancock Pacific Exp., v. 10, № 2 : 239—310.
Hartman O. 1948a. The Polychaetous Annelids of Alaska. Pacific Science, v. II, № 1 : 1—58.
Hartman O. 1948b. The marine Annelids erected by Kinberg with notes on some other types in the Swedish State Museum. Arkiv for Zool., Bd. 42A, № 1 : 1—137, pls. I—XVIII.
Hartman O. 1951. The littoral marine annelids of the gulf of Mexico. Publ. Inst. Mar. Sci., v. II, № 1 : 7—124.
Hartman O. 1956. Polychaetous annelids erected by Treadwell, 1891 to 1948, together with a brief chronology. Bull. Amer. Museum Nat. Hist., v. 109, art. 2 : 245-310.
Hartman O. 1959. Catalogue of the Polychaetous Annelids of the World. Allan Hancock Found. Publ., occas. paper, № 23, pt. I, II : 1—628.
Hartman O. 1961. Polychaetous Annelids fronj. California. Allan Hancock Pacific Exp., v. 25:1—226.
Hartman O. 1963. Submarine canyons of Southern California, pt. Ill, Polychaotos. Allan Hancock Pacific Exp., v. 27, pt. 3 : 1—93.
104
ВВЕДЕНИЕ
Hartman О. 1964. Polychaeta Errantia of Antarctica. Antarct. Res. Series, Amer. Geoph. Union, v. 3 : 1—131.
Hartman 0. 1965a. Catalogue of the Polychaetous Annelids of the World. Allan Hancock Found. Publ., occas. paper, № 23, Suppl. 1960—1965 a. index : 1—197.
Hartman 0. 1965b. Deep-water benthic Polychaetous Annelids off New England to Bermuda and other North Atlantic areas. Allan Hancock Found. Publ., occas. paper, № 28 : 1—378.
Hartman 0. 1966. Polychaetous Annelids of the Hawaiian Islands. Occas. papers of Bishop Museum, Honolulu, v. XXIII, № 11 : 163—252.
Hartman 0. 1968. Atlas of the Errantiate Polychaetous Annelids from California. Allan Hancock Found., Univ, of South. Calif., Los Angeles : 1—828.
Hartman 0. a. Barnard J. I960. The benthic fauna of the deep basins off Southern California. Allan Hancock Pacific Exp., v. 22, № 2 : 69—297.
Hartman 0. a. Reish D. 1950. The marine annelids of Oregon. Oregon State Monographs, Studies Zool., № 6 : 1—64.
Hartmann-Schroder G. 1958. Einige Polychaeten aus dem Kiistengrund-wasser der Bimini-Inseln (Bahamas). Kieler Meeresforsch., Bd. XIV, H. 2 : 233—240.
Hartmann-Schroder G. 1963. Revision der Gattung Mystides Theel (Phyllodocidae-, Polychaeta Errantia). Mit Bemerkungen zur Systematik der Gattungen Eteonides Hartmann-Schroder und Protomystides Czerniavsky und mit Beschrei-bungen zweier neuer Arten aus Mittelmeer und einer neuen Art aus Chile. Zool. Anz., Bd. 171, H. 5/8 : 204—244.
Hartmann-Schroder G. 1964. Zum Problem der Anpassung von Polychaeten an das Leben im Kiistengrundwasser. Mitt. Hamburg. Zool. Mus. Inst., Kosswig-Festschrift : 67—78.
Hedley R. H. 1958. Tube formation by Pomatoceros trlqueter (Polychaeta). Journ. Mar. Biol. Ass. U. K., v. 37 : 315—322.
Hering E. 1892. Zur Kenntniss der Alciopiden von Messina. Sitzber. K. Akad. Wiss. Wien, Math.-Nat. KI., Bd. 101 : 713—768.
Her pin R. 1923. Ethologie et developpement de Nereis (Neanthes) caudata Delle Chiaje. C. R. Acad. Sci., Paris, t. 177 : 542—544.
Hessler R. a. Sanders H. 1967. Faunal diversity in the deep-sea. Deep-Sea Research, v. 14 : 65—78.
Horst R. 1923. On three remarkable Annelida Polychaeta. Zool. Medd. Leyden, deel VII : 221-224.
Huntsman A. G. 1921. Eastern Canadian plankton. The distribution of the Tomopteridae obtained during the Canadian Fisheries Expedition 1914—15. Contr. Canad. Biol., Toronto : 85—91.
Imajima M. 1961. Notes on some pelagic Polychaetes collected in the Japan Trench. Journ. Hokkaido Gak. Univ., v. 12, № 1 : 4—10.
Imajima M. 1963. Polychaetous Annelids collected off the west coast of Kamchatka. II. Notes on species found in the collection of 1959. Publ. Seto Mar. Biol. Labor., v. XI, № 2 : 345-372, pls. XII—XV.
Imajima M. 1964. Benthic Polychaetes collected by the second cruise of the Japanese Expedition of Deep-Seas (JEDS-2). Bull. Nat. Sci. Mus., v. 7, № 3 : 235—254.
Imajima M. 1967. Errant Polychaetous Annelids from Tsukumo Bay and vicinity of Noto Pininsula, Japan. Bull. Nat. Sc. Museum, Tokyo, v. 10, № 4 : 403—441.
Imajima M. a. Hartman 0. 1964. The Polychaetous Annelids of Japan, pt. I, Allan Hancock Found. Publ., occas. paper, № 26 : 1—166, pls. 1—35.
Izuka A. 1912. The Errantiate Polychaeta of Japan. Journ. Coll. Sci., Imp. Univ. Tokyo, v. 30, art. 2 : 1—262. «
Izuka A. 1914. On the pelagic Annelids of Japan. Journ. Coll. Sci., Imp. Univ. Tokyo, v. 36, art. 51—14.
Jeener R. 1932. Evolution morphologique et fonctionelle du stomodeum des Poly-chetes. Rec. de 1’Inst. Zool. Torley-Rousseau, t. IV, fasc. 1 : 5—30.
Kaburaki T. 1926. Nereis injurious to the seedlings of rice. Proceed. 3 Pan.-Pacific Sci. Congr., Tokyo, v. 2 : 2114—2115.
Kaestner A. 1955. Klasse Polychaeta. Lehrbuch der Speziellen Zoologie, Jena. Teil I, Lief. 2 : 364—404.
Kao Ch. and oth., 1959. On the Polychaeta along North China coast. Journ. Sci. Inst. Oceanol. Shangtung, vol. 1 : 131—201 (на китайском языке).
Kim In-bae. 1967. A study of the genus Lopadorrhynchus (Polychaeta, Lopadorrhyn~ chidae). Vidensk. Medd. fra Dansk Naturh. Forening, v. 130 : 217—232.
К in berg J. G. Hj. (1866) 1910. Annulater. Konglica Svens. Freg. Eugenies resa omkr. jorden. II. Uppsala : 33—78, Tafl. IX—XXIX.
KU t a m о r i R. 1965. Two new species of rare families, Disomidae and Paralacydonidae (Annelida : Polychaeta).. Bull. Tokai Reg. Fish. Res. Lab., № 44 : 41—44.
ЛИТЕРАТУРА
105
K.leinenberg N. 1886. Die Entstehung des Annelids aus der Larve von Lopadorhynchus. Zeitschr. Wissensch. Zool., Bd. XLIV : 1—227, Taf. I—XVI.
Knox G. A. 1960. Polychaeta Errantia. Biol. Results of the Chatham Islands 1954 Expedition. Part. 3. New Zealand Oceanogr. Inst. Memoir, № 6 : 1—143.
Lameere A. 1925. Les organes segmentaire des Polychetes. Ann. Soc. Zool. de Belg., t. 56 : 113—119.
Langerhans P. 1880. Die Wurmfauna von Madeira. II. Zeitschr. Wissensch. Zool., Bd. 33 : 267—316.
L я u b i er L. 1961. Phyllodicola petiti (Delamare et Laubier, 1960) et la famille des Phyllodicolidae, Copepodes parasitas d’Annelides Polychetes en Mediterranee occidentale. Crustaceana, v. 2, part 3 :'228—242-.
Laubier L. 1962. Mystides (Pseudomystides) limbata- Saint-Joseph, Phyllodocidae nouveau pour la Mediterranee. Vie et Milieu, t. XIII, fasc. 2 : 388—390.
Laubier L. 1965. Sur la presence d’Eteonides augeneri dans les sables du Bassin d’Arcachon. Actes de la Societe Linneenne de Bordeaux, t. 102, № 3 : 1—3.
Laubier’ L. 1967. Adaptations chez les Annelides Polychetes interstitielles. Ann.
Biol., t. VI, fasc. 122 : 1—16. -•
Levins, en G. M. R. 1882. Sy sterna tisk-geografisk-Oversigt over de nordiske Annulate, Gephyrea, Chaetognathi og Balanoglossi. Vitensk. Medd. Naturh. Foren., Kjobenh., Pt. 2 : 92—348, tab. II—III.
L e v i n s e n G. M. R. 1885. Spolia atlantica. Om nogle pelagiske Annulata. Skr. Vidensk. Selsk., Kjob., 3 (2) : 321—344.
Levinsen G. M. R. 1887. Kara-Havets Ledorme (Annulata). Dijmphna-Togtets zool.-bot. Udbytte., Kjobenhavn : 288—303.
Magnum С. P., Son t os S. L. a. R h о d e's W. R. 1968. Distribution and feeding in the onuphid polychaete, Diopatra cuprea (Bosk). Marine Biol., v. 2 : 33—40.
Malmgren A. J. 1865. Nordiska Hafs-Annulater. Ofvers. Kongl. Vetensk. Akad.
Forhandl., v. 22, № 1 : 51—110; №2 : 181—192; № 5 : 355-410; Tafl. 8-15, 18—29.
Malmgren A. J. 1867. Annulata polychaeta Spetsbergiae, Gronlandiae, Islandiae et Scandinaviae. Ofvers. Kongl. Vetensk. Akad. Forhandl., v. 24 : 127—235, tafl. 2—15.
M a n t о n S. M. 1967. The polychaete Splnther and the origin of the Arthropoda. Journ. Nat. Hist., v. 1, № 1 : 1—22.
Marenzeller E. 1879. Siidjapanische Anneliden. I. Denkschr. math.-naturwiss. Cl., Acad. Wiss., Wien, Bd. 41 : 109—152.
Marenzeller E. 1890. Annulaten des Beringmeeres. Ann. К. K. Naturhist. Hof-museums, Bd. V : 1—8.
Marenzeller E. 1892. Die Polychaeten der Bremer Expedition nach Ostspitzbergen im Jahre 1889. Zool. Jahrbiicher, Abt. Sjrst., Bd. VI, H. 2 : 397—434.
Marion A. etBobretzky N. 1875. Etude des Annelides du golfe de Marseille.
Ann. Sc. Nat. Paris, ser. 6, Zool., t. II : 1—106.
McIntosh W.C. 1869. Early stages in the development of Phyllodoce maculata. Ann. Mag. Nat. Hist., ser. 4, v. 4 : 104—108.
McIntosh W. C. 1908. A monograph of the British Annelids, v. II, pt. 1 : 1—232, pls. XVIII—L, LVII—LXX.
McIntosh W.C. 1910. A monograph of the British Annelids, v. II. pt. 2 : 233—524, pls. LI—LXI, LXXI—LXXXVIL
Meek A. a. Storrow. B. 1924. On a pelagic phase of Arenicola marina and Eteone arctica. Ann. Mag. Nat. Hist. ser. 9, v. 14, № 2 : 453—455.
Meyer A. 1924. Ueber die Segmentalorgane von Tomopteris helgolandica nebst Berner-, kungen uber das Nervensystem und die rosettenformigen Organe. Zool. Anz., Bd. 60 : 83—88.
Meyer A. 1926. Die Segmentalorgane von Tomopteris Catharina (Gosse) nebst Bemer-kungen fiber das Nervensystem, die rosettenformigen- Organe und die Coelombe-wimperung. Zeitschr. Wiss. Zool., Bd. 127, H. 2 : 297—402.
Meyer A. 1929. On the coelomic cilia and circulation of the body fluid in Tomopteris helgolandica. Journ. Mar. Biol. Ass. U. K., Plymouth, v. 16 : 271—276.
Meyer A. 1930. Vergleichende Untersuchung der SegmentalorganevonTomopteriden des Mittelmeeres, ein Nachweis eines Substitutionsprogresses. Zeitschr. Wiss. Zool., Bd. 136 : 140—153.
Meyer A. 1938. Der Rogen und die Entwicklung der Trochophora von Eulalia viridis. Biol. Gener., Wien, Bd. 14, H. 2 : 334—389.
Meyer E. 1901. Studien uber der Korperbau der Anneliden. Mitt. Zool. St. Neapel, Bd. 14 : 247—585.
Michel C. 1964. Histologie, histochimie et innervation de la trompe <Г Eulalia viridis (Muller). Bull. Lab. Dinard, № 49-50 : 62—95.
106
ВВЕДЕНИЕ
Michel С. 1965. Cytologie et histochimie des glandes prepharyngiennes et du pharynx Eulalia viridis (Muller). Bull. Soc. Zool. France, t. 90, № 1 : 57—66.
Michel C. 1966a. Comparaison du pharynx et des masses prepharyngiennes A'Eulalia viridis (Miiller) et de Phyllodoce mucosa (Oerst.) (Polychetes Errantes, Phyllodocidae}. Arch. Zool. Exp. Gen. t. 107, fasc. 2 : 348—356.
Michel C. 1966b. Sur la presence de cellules nerveuses multipolaires dans la gaine de la trompe A'Eula.lia viridis (Muller) {Phyllodocidae}. Bull. Soc. Zool. France, t. 91, № 2 : 149—153.
Michel C. 1968a. Enzymes digestives de la trompe A'Eulalia viridis (Miiller) et de Glycera convoluta (Keferstein), Annelides Polychetes Errantes. Ann. Histochim, t. 13, № 2 : 123—133.
Michel C. 1968b. Complements sur 1’innervation de la trompe &’Eulalia viridis (Mill!.) (Annelide Polychete Errante, Phyllodocidae). Bull. Soc. Zool. France, t. 93, № 3 : 367—374.
Monro С. C. A. 1930. Polychaete worms. Discovery Rep., v. II : 1—222.
Monro С. C. A. 1931. Polychaeta, Oligochaeta, Echiuroidea and Sipunculoidea. Great Barrier Reef Exped. 1928—1929, v. IV, № 1. Brit. Museum (Nat. Hist.) : 1—37.
Monro С. C. A. 1934. On a collection of Polychaeta from the coast of China. Ann. Mag. Nat. Hist., ser. 10, v. 13 : 353—380.
Monro С. C. A. 1936. Polychaete worms. II. Discovery Reports, v. XII : 59—198.
Monro С. C. A. 1937. Polychaeta. The John Murray Expedition 1933—34. Sc. Reports, v. 4, № 8 : 243—321.
Monro С. C. A. 1939. On some tropical Polychaetes in the British Museum, mostly collected by Dr. C. Crossland at Zanzibar, Tahiti and the Marquesas. I. Fam. Amphinomidae to Phyllodocidae. Ann. Mag. Nat. Hist., ser. 11, v. IV : 161—184.
Moore J. P. 1906. Additional New Species of Polychaeta from the North Pacific. Proc. Acad. Nat. Sci. Philad., v. 58 : 217—352.
Moore J. P. 1908. Some polychaetous annelids of the northern Pacific coast of North America. Proc. Acad. Nat. Sci. Philad., v. 60 : 321—364.
Moore J. P. 1909a. Polychaetous Annelids from Monterey Bay and San-Diego, California. Proc. Acad. Nat. Sci. Philad., v. 61 : 235—295.
Moore J. P. 1909b. The Polychaetous Annelids drelged by U.S.S «Albatross» off the coast of southern California in 1904. I. Syllidae, Sphaerodoridae, Hesionidae and Phyllodocidae. Proc. Acad. Nat. Sci. Philad., v. 61 : 321—351.
M u u s B. J. 1953a. Polychaeta. Families: Aphroditidae, Phyllodocidae and Alciopidae. Conseil Intern. Expl. Mer, Fiches d’identif. du Zooplankton, № 52 : 2—6.
Muus B. J. 1953b. Polychaeta. Families: Tomopteridae and Typhloscolecidae. Conseil Intern. Expl. Mer, Fiches d’identif. du Zooplankton, № 53 : 2—5.
Muus B. J. 1967. The fauna of Danish Estuaries and Lagoons. Distribution and ecology of dominating species in the shallow reaches of the mesohaline zone. Medd. Danm. Fisk.-Navunders, Ny Serie, Bind 5, № 1 : 1—316 (Polychaeta : 71—95).
N a v i 1 1 A. 1933. Quelques formes epitoques d’annelides polychetes nouvelles ou peu connues pechees a la lumiere dans la bale de Banyuls. Ann. Sci. Nat. Zool., Paris, ser. 10, t. 16 : 168—208.
Nguyen-Cong-Tieu. 1931. Note sur un Palolo du Tonkin. Institut Oceanogr. de 1’Indochine, Station Marit. de Cauda, Note 16 : 33—39.
Nicol J. A. C. 1953. Luminescence in Polynoid worms. Journ. Mar. Biol. Assoc. U. K., v. 32 : 65—85.
Nicol J. A. C. 1954. The nervous control of luminescent responses in Plynoid worms. Journ. Mar. Biol. Assoc. U. K., v. 33 : 225—255. '
Nolte W. 1938. Annelidenlarven. II. Nordisches Plankton, Lief XXIV ; 171—282. Oersted A. S. 1843. Annulatorum danicorum conspectus, fasc. 1. Maricolae : 1—52, pls. I—VII.
Okada Yo K. 1930. Incubation habit in a phyllodocid polychaete, Notophyllum foliosum Sars. Journ. Mar. Biol. Assoc. U. K., v. 16 :476—477.
О к u d a Sh. 1933. Some polychaete annelids used as bait in the inland sea. Annot. Zool Japan., v. 14 : 243—253.
О к u d a Sh. 1935. Some lacustrine Polychaetes with a list of brackish-water Polychaetes found in Japan. Ann. Zool. Japan, v. 15, № 2 : 239—246.
О к u d a Sh. 1937a. Note on two unrecorded pelagic polychaetes from Japan. Annot. Zool. Japon., v. 16 : 75—77.
О к u d a Sh. 1937b. Polychaetous annelids from the Palau Islands and adjacent waters, the South Sea Islands. Bull. Biogeogr. Soc. Japan, v. 7, № 12 : 257—316.
О к u d a Sh. 1938. Polychaetous annelids from the vicinity of the Mitsui Institute of Marine Biology. Japan, Journ. Zool. v. 8 : 75—105.
О к u d a Sh. 1939. Annelida Polychaeta in Onagawa bay and its vicinity. 2. Sci. Rep. Tohoku Univ., ser. 4, Biol., v. 14 : 219—244, pls. 1—14.
ЛИТЕРАТУРА
107
Ok'uda Sh. a. Yamada M. 1954. Polychaetous Annelids from Matsushima Bay. Journ. Fac. Sci. Hokkaido Univ., ser. VI, v. XII, № 1—2 : 175—199.
Paris J. 1956. Commensalisme et parasitisme chez des Annelides Polychetes. Vie et Milieu, t. VI, fasc. 4 : 525-536. ' "
Pettibone M. H. 1954. Marine Polychaete worms from Point Barrow, Alaska, with additional records from the North Atlantic and North Pacific. Proc. U. S. Nat. Mus., v. 103, № 3324 : 203—356. .
Pettibone M. H. 1956. Marine Polychaete worms from Labrador. Proc. U. S. Nat. Mus., v. 105, № 3361 :531—584.
Pettibone M.H. 1957. Endoparasitic Polychaetous Annelids of the family Arabel-lidae with descriptions of new species. Biol. Bull., v. 113, № 1 : 170—187.
Pettibone M.H. 1963. Marine Polychaete worms of the' New England region. I. Smiths. Inst., U. S. Nat. Mus., bul. Ks 227 : 1—356.
Pflugfelder O. 1933. Landpolychaeten aus Niederlandisch-Indien. Ergebnisse der Sunde-Exped. der Notgemeinschaft der deutschen Wissenschaft 1929—1930. Zool. Anz., Bd. 105, H. 3/4 : 65-76.
Plessis J. 1957. Observation sur la reproduction de Phyllodoce mucosa, Oerst. Bull. Mus. Nat. Hist. Paris, t. XXIX, 2 ser. : 340—344.
P r e n a n t M. 1926. Sur deux Annelides peu connus retrouves a Roscoff: 1 — Mystides borealis-, 2 — Josophella marenzelleri. Bull. Soc. Zool. France, t. 51 : 490—492.
P r u v о t G. 1883. Sur le systeme nerveux et la classification des Phyllodocien. C. R. Acad. Sci. Paris, t. 97 : 1224—1226.
P r u v о t G. 1885. Recherches anatomiques et morphologiques sur le systeme nerveux des Annelides polychetes. Arch. Zool. Exp. Gen., ser. 2, t. 3 : 211—336.
Quatrefages M. A. 1865. Histoire naturelie das Anneles matins et d’eau douce, Paris, t. I : 1—588; t. II : 1—794, pls. 1—20.
Rakusa-Suszczewski S. 1968. Predation of Chaetognatha by Tomopteris helgolandica Greeff. Journ. du Conseil, v. 32, № 2 : 226—231.
Rasmussen E. 1956. Faunistic and biological notes in marine invertebrates. III.
Biol. Medd. Dan. Vid. Selsk., 23, № 1 : 1—84.
Reibisch J. G. 1894. Die pelagischen Phyllodociden der Plankton-Expedition der Huwboldstiftung. Inang.-Dissertation, Halle : 1—23.
Reibisch J. G. 1895. Die pelagischen Phyllodociden und Typhloscoleciden der Plankton-Expedition. Erg. der Deutsch. Plankton-Exped., Bd. 2, H. c. : 1—63.
Reibisch J. G. 1905. Anneliden. Nordisches Plankton, Lief. 3 : 1—10.
R e i s h D. J. 1966. A culture method for maintaining large populations of Polychaetous Annelids in the laboratory. Turtox News, v. 44, № 1 : 16—17.
R e i s h D. J. a. A 1 о s i M. C. 1968. Aggressive behavior in the Polychaetous Annelid family Nereidae. Bull. Soc. Calif. Acad. Sci., v. 67, № 1 : 21—28.
В ullier Fr. 1957. Quatre Annelides Polychetes des rizieres du Viet-Nam. Bull. Soc. Zool. France, t. LXXXI, № 2—3 : 158—163.
R u 11 i e r Fr. 1964. Annelides Polychetes. Res.' Sci. Campagnes «Calypso», fasc. VI : 113-218.
R u 11 i e r Fr. 1965a. Contribution a la faune des Annelides Polychetes du Danomey et d® Togo. Cahiers Off. Rech. Sc. et Techn. Outre-Mer, Oceanographie, v. Ill, № 3: 5-66.
R u 11 i e r Fr. 1965b. Contribution a la Faune des Annelides Polychetes de 1’Australie. Univ. Queensland Papers, Depart. Zool., v. II, № 9 : 163—201.
R u 11 i e r Fr. 1965c. Quelques Annelides Polychetes pelagiques d’Anno-Bon (Golfe de Gainee). Bull. Inst. Fr. Afr. Noire, ser. A, t. XXVII, № 3 : 866-875.
Schwartz M. 1905. Beitrage zu einer Naturgeschichte der Tomopteriden. Zeitschr. Naturg. Jena, Bd. 40 : 497—536.
Southern R. 1909. Polychaeta of the coasts of Ireland. Pelagic Phyllodocidae. Fish. Ireland Sci. Invest. 1908, Dublin, № 3 : 1—11.
Southern R. 1910a. The marine worms (Annelida) of Dablin Bay and the adjoining districts. Proc. Roy. Irish Acad., sect. B, v. 28, № 6 : 215—264.
Southern R. 1910b. A preliminary note on the A Iciopinae, Tomopteridae and Typhloscolecidae from the Atlantic adjacent to Ireland. Ann. Mag. Nat. Hist., ser. 8, v. 5 : 428-429.
Southern R. 1911. Polychaeta of the coasts of Ireland. The Alciopinae, Tomopteridae and Typhloscolecidae. Fish. Ireland Sci. Invest. 1910, Dublin, № 3 : 1—37.
Southern R. 1914. Archiannelida and Polychaeta. Proc. Roy. Irish Acad., Dublin, v. 31, pt. 47 : 1—160.
Stop-Bowitz C. 1948. Polychaeta from the «Michael Sars» North Atlantic Deep-sea Expedition 1910. Rep. Sc. Res. «Michael Sars» North Atland. Deep-sea Expod. 1910, v. V, № 8 : 1—91.
108
ВВЕДЕНИЕ
ч n_g ° w i tz С- 1949. Polychetes pelagiques des expeditions norvegiennes antar-cticrues de la «Norvegia» 1927—1928, 1928—1929 et 1930—1931. Sci. Res. Norw. Ant. Exped., Oslo, № 31 : 1—25.
4 tnrrh 0. 1914. Vergleichend-anatomische Polychaetenstudien. II. Verh. Ges. Nat. Arzte Berlin, Bd. 85 : 709-711.
Storch O- 1915. Ein Beitrag zur Anatomie von Hermodice carunculata. Zool. Anz., Bd. 45:35-44.
Storch V. 1968. Zur vergleichenden Anatomie der segmentalen Muskelsysteme und zur Verwandtschaft der Polychaeten-Familien. Zeitschr. Morph. Tiere, Bd. 63 : 251—342.
Taylor A. G. 1969. The direct uptake of amino acids and other small molecules from s sea water by Nereis virens Sars. Compar. Biochem. a. Physiol., v. 29, № 1 : 243—250.
Tebble N. 1960. The distribution of pelagic Polychaetes in the South Atlantic Ocean. Discovery Reports, v. XXX : 161—300.
Tebble N. 1962. The distribution of pelagic Polychaetes across the North Pacific Ocean. Bull. Brit. Museum (Nat. Hist.), Zool., v. 7, № 9 : 373—492.
Theodorides J. et Laubier L. 1964. Sur la presence d’une Haplosporidie chez 1’Annelide Polychete Eulalia viridis (L.) a Banyuls. Vie et Milieu, t. XV, fasc. 4 : 1057—1060.
Theel Hj. 1879. Les Annelides Polychetes des mers de la Nouvelle-Zemble. Kongl. Svenska Vetensk.-Akad. Handlingar, Bd. 16, № 3 : 3—75, pls. 1—4.
Thorson G. 1946. Reproduction and larval development of danish marine bottom invertebrates. Medd. Komm. Danmarks Fisk.-Havunder-Sogels., ser. Plankton, v 4 : 1—523.
T h о r s' о n G. 1950. Reproductive and larval ecology of marine bottom invertebrates, giol. Rev. Cambridge Philos. Soc., v. 25 (1) : 1—46.
Treadwell A. L. 1906. Polychaetous annelids of the Hawaiian Islands, collected by the steamer «Albatross» in 1902. Bull. U. S. Fish. Com., v. 23 : 1145—1181.
Treadwell A. L. 1920. Polychaetous annelids collected by the United States Fisheries steamer «Albatross» in the waters adjacent to the Philippine Islands in 1907— 1910. Bull. U. S. Nat. Mus., v. 100 : 589—602.
Treadwell A. L. 1922. Polychaetous annelids collected"at Friday Harbor, State of Washington. Publ. Carnegie Inst. Washington, № 312 : 173—181.
Treadwell A. L, 1926. Polychaetous annelids from Fiji, Samoa, China and Japan, proc. U. S. Nat. Mus. v. 69, № 15 : 1—26, pls. 1—2.
Treadwell A. L. 1943. Polychaetous Annelids. Sc. Res. of. Cruise VII of the Carnegie during 1928—1929. Biology, IV, pt. Ill : 29—59.
IT 1 i a n i n M. 1878. Sur le genre Sagitella N. Wag. Arch. Zool. Exp. et Gen., J t, VII : 1—32, pls. 1—4.
Veidovsky F. 1878. Beitrage zur Kenntnis der Tomopteriden. Zeitschr. Wiss.
J Zool., Bd. XXXI : 81-100.
V i g u i e r C. 1886. Etudes sur les animaux inferieurs de la Baie d’Alger. Recherches sur les Annelides pelagiques. Arch. Zool. Exp. Gen., Paris, ser. 2, t. IV: 347—442, pls- 21-27.
V i g u i 6 г C- 1920. Nouvelles etudes sur le plankton de la Baie d’Alger. Annelides S pelagiques. Ann. Sci. Nat., Paris, ser. 10, t. 3 : 256—266, pls. 1—3.
Walcott C. D. 1911. Cambrian geology and paleontology. Middle Cambrian annelids. Smiths. Misc. Collect., v. 57, № 5 : 107—147.
Watson A. T. 1895. Observations on the tube-forming habits of Panthalis oerstedi. proc. Liverpool. Biol. Soc., v. 9 : 169—188. ,
Webster H. a. Benedict J. 1884. The Annelida Chaetopoda from Provincetown and Wellfleet, Mass. U. S. Com. of Fish., a. Fisheries, pt. IX, Rep. for 1881, Washington : 699—744, pls. I—VIII.
Webster H. a. Benedict !. 1887. The Annelida Chaetopoda, from Eastport, Maine. U. S. Com. of Fish. a. Fisheries, pt. XIII, Rep. for 1885, Washington : 707-755, pls. I—VIII.
Wells G. 1951. On the behavior of Sabella. Proc. Roy. Soc. London, v. 138:278—299.
Wells G. a. Dales R. 1951. Spontaneous activity patterns in animal behaviour. The irrigations of the burrow in the Polychaetes Chaetopterus variopedatus and Nereis diversicolor. Journ. Mar. Biol. Assoc. U. K., v. 29 : 661—680.
Weselberg-Lund E. 1935. Tomopteridae and Typhloscolecidae. Danish Ingolf-Exped., v. 4, № 11 : 1—17, 1 pl., 1 chart.
Wesenberg-Lund E. 1936. Tomopteridae and Typhloscolecidae. Medd. om Gron-land, Bd. 80, № 3 : 1-17.
Wesenberg-Lund E. 1939. Pelagic Polychaetes. Rep. Danish Oceanogr. Exped. 1908—1910 to the Mediterranean and adjacent seas, v. II, E, 1 : 1—46.
ЛИТЕРАТУРА
109
W ese n b erg - Lun d E. 1949. Polychaetes of the Iranian Gulf. Danish Sci. Invest. Iran, pt. 4 : 247—400.
Wesenberg-Lund E. 1950a. Polychaeta. The Danish Ingolf-Expedition, v. IV, pt. 14 : 1—92, pls. I-X. '
Wesenberg-Lund E. 1950b. The Polychaeta of West Greenland. Medd. om Gronland, Bd. 151, № 2 : 1—171, charts 1—37.
Wesenberg-Lund E. 1951. Polychaeta. The Zool. of Iceland, v. II, pt. 19 : 1— 182.
Wesenberg-Lund E. 1953. Polychaeta; The* Zool. of East Greenland. Medd. om Gronland, Bd. 122, № 3 : 1—169, charts 1—27.
Wesenberg-Lund E. 1958. Lesser antilleqn polychaetes, chiefly from brackish water, with a survey and a bibliography of- fresh and brackish-water Polychaetes. Stud. Тайпа Curasao a. other Caribbean Islands, v. VIII : 1—41.
Wesenberg-Lund E. 1962. Polychaeta Errantia. Rep. Lund Univers. Chile Exped. 1948—1949. Lunds Univ. Arsskrift, N. F., Avd. 2, Bd. 57, № 12 :1—139.
Wilcke D. E..1952. Beobachtungen liber den Bau und die Funktion des Rohren-und Kammersystems der Pectinarta korenl. Malmgren. Helgolander Wiss. Mee-resunters., Bd. 4, H. 2 : 130—137.
Willey A. 1902. Polychaeta. Report on the collections of natural history made in the Antarctic regions during the voyage of the «Southern Cross». London, XII : 262—283, pls. 41—46.
Wilson D. P. 1937. A double-tailed Eulalia. Journ. Mar. Biolog. Assoc. U. K., v. XXI, № 2 : 663-672.
W ir en A. 1883. Chaetopoder fran Sibiriska Ishafvet och Berings Haf insamlade under Vega-Expeditionen 1878—79. Vega-Exped. Vetensk. laktt., Bd. II, Stockholm : 383—428.
Wu Bao-ling a. Chen Mu. 1963. Some fresh-water and mixohaline water Polychaeta from China. Oceanol. et Limnol. Sinica, v. 5, № 1 : 18—34.
Z i egelm ei er E. 1952. Beobachtungen fiber den Rohrenbau von Lanice conchilega (Pallas) im Experiment und am natiirlichen Standort. Helgolander Wiss. Meeresun-ters., Bd. 4, H. 2 : 107—129.
СИСТЕМАТИЧЕСКАЯ ЧАСТЬ
Отряд PIHLL OJD ОСЕМОЕРНА
Подотряд PHYLLODOCIFORMIA
В подотряд входят как наиболее просто организованные бентические формы — донные филлодоциды и Lacydoniidae, так и ряд сильно специализированных пелагических многощетинковых червей — планктонные филлодоциды, Alciopidae, Tomopteridae и Typhloscolecidae.
Головная лопасть хорошо развита и резко отделена от ротового (буккального) сегмента, лишь у некоторых пелагических форм она в той или другой степени сливается с передними сегментами. Процессы цефализации находятся на самых начальных этапах — обособленного перистомиума нет. Головная лопасть имеет лишь головные щупальца, пальпы отсутствуют. Глотка трубчатая, частично выпячивается наружу, образуя хобот, служащий основным орудием захвата пищи; хитиновые челюсти отсутствуют (они появляются лишь у пелагических Phalacrophorus и Pelagobia в виде двух крючьев на переднем конце хобота).
Все туловищные сегменты имеют строго гомономное строение. Параподии одноветвистые, в редких случаях наблюдается образование начальных стадий двуветвистых параподий. Подиальный пучок щетинок не дифференцирован; набор щетинок весьма ограниченный. Подиальные придатки наиболее простой усиковидной или листовидной формы. Кожные покровы во многих местах сохраняют ресничный эпителий. Дыхание происходит через кожные покровы по всей поверхности тела, локализованных специальных органов дыхания в виде жабр с разветвленной капиллярной системой нет. Кровеносная система развита слабо, кровь бесцветная, гемоглобин сконцентрирован в нервной системе. Выделительная система представлена протонефридиями с соленоцитами. Брюшная нервная цепочка тесно связана с эпителиальным покровом —«имеет примитивное субэпителиальное положение. Пелагические личинки, помимо обычных провизорных органов, никаких специализированных приспособлений не имеют. Преимущественно активные хищники. Донные формы постоянных убежищ и трубок не строят.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ СЕМЕЙСТВ
1 (8). Туловищные сегменты вооружены щетинками.
2 (7). Подиальные выросты хорошо развиты, снабжены большим количеством тонких, длинных щетинок.
3 (6). Пароподии имеют лишь один пучок щетинок.
4 (5). Головная лопасть с одной парой очень крупных, телескопических глаз. Пелагические виды........II. Сем. Alciopidae !(стр. 195).
I. PHYLLODOCIDAE
111
5 (4). Головная лопасть с небольшими субэпителиальными глазами или их нет вовсе. Преимущественно бентические виды . . ...............
........................ . . . • I.. Сем. Phyllodocidae (стр. 111).
6 (3). Параподии имеют два раздельных пучка щетинок... (нотоподию и невроподию). Бентические виды ,. '...............................
...............................V. Сем. Lacydoniidae (стр. 225).
7 (2). Подиальные выросты редуцированы, имеется всего 1—3 короткие игловидные щетинки. Спинные и брюшные усики широкие листовидной формы; пелагические виды ..................................
. . . .....................IV.1 Сем. Typhloscolecidae (стр. 220).
8 (1). Тулбвищные сегменты щетинок не имеют, подиальные выросты окаймлены лишь тонкой кожистой оторочкой («плавничками»). — II пара щупальцевидных усиков преобразована в очень длинные «усы», направленные немного вбок и назад и почти достигающие заднего конца тела. Пелагические виды.............................
.........................III. Сем. Tomopteridae (стр. 212).
I. Семейство PHYLLODOCIDAE Oersted, 18431
Семейство Phyllodocidae объединяет большое количество однотипно организованных донных видов многощетинковых червей; в его состав входят также немногочисленные пелагические формы, отличающиеся многими аберрантными чертами.
Тело у бентических филлодоцид обычно длинное и тонкое, заметно сплющенное дорсо-вентрально, состоящее, как правило, из большого количества однородно построенных сегментов. Количество сегментов у некоторых видов может достигать свыше 700.
В живом состоянии филлодоциды отличаются яркой окраской и пестрым цветовым рисунком. Последнее имеет большое систематическое значение, однако окраска, к сожалению, плохо сохраняется в спирту.
Головная лопасть хорошо обособлена, коническая, овальная, округлая или сердцевидная, лишь у пелагических форм она сливается с передними сегментами. На головной лопасти от 2 до 5 головных щупалец (тентакулы); щупиков нет. Глаза в большинстве случаев имеются (как правило, одна пара, преимущественно у заднего края головной лопасти).
Глотка трубчатая; вывернутая наружу передняя ее часть образует удлиненный хобот, служащий орудием захвата пищи. Наружная стенка хобота обычно покрыта многочисленными мягкими папиллами (эпителиальными сосочками), которые распределяются равномерно (диффузно) или образуют правильные продольные ряды; иногда имеются весьма небольшие хитинизированные шипики; у аберрантных пелагических родов Phalacrophorus и Pelagobia на переднем конце хобота по 2 хитинизирован-ных крючка, причем у первого из них они довольно крупные, а у второго небольшие (рис. 5, 12, 13).
На первых 2 или 3 разделенных или частично слившихся и редуцированных со спины околоротовых («перистомиальных») сегментах имеются
1 Название семейства, возможно, заимствовано из мифологии и дано в честь Фил-лодоки — морской нимфы, дочери Нерея и Дориды; морские нимфы, по преданию, постоянно сопровождали греческого морского бога Посейдона, культ которого у римлян перешел к богу моря Нептуну. Если же дать дословный перевод с греческого, то оно означает «кажущийся листьями», что хорошо передает особенности внешнего облика червей, так как спинные усики у них сильно сплющенные и имеют листовидную форму; иногда этих червей называют «листоножками».
112
I. PHYLLODOCIDAE
удлиненные щупальцевидные усики (тентакулярные циррусы) в количестве 2—4 пар; они большей частью шнуровидной или веретеновидной формы. Все остальные туловищные сегменты, ширина которых значительно больше их длины, построены по одному типу и мало отличаются друг от друга. Параподии в виде удлиненного подиального бугорка, как правило, одноветвистые, т. е. с одной ацикулой и одним пучком щетинок, но иногда (Austrophyllum, Notophyllum, Nipponophyllum) имеется доба-
Рис. 22. Основная терминология, принятая при описании видов филлодоцид.
А — головной конец с вывернутой глоткой; Б — ложнодвуветвистая параподия; В — одноветвистая параподия; Г — сложная, или сочлененная, щетинка при разных положениях. 2 — краевые, или оральные, папиллы; 2 — передняя (дистальная) часть хобота с гладкой или слабо бугристой стенкой; 3 — нижняя (проксимальная) часть хобота с правильными продольными рядами конических папилл; 4 — головная лопасть; 5 — парные головные щупальца; 6 — затылочная нухальная папилла; 7 — боковые затылочные органы; 8 — нормальные туловищные сегменты; а — первая пара щупальцевидных усиков на I сегменте; 10 — вторая и третья пары щупальцевидных усиков на II сегменте; 11 — четвертая пара щупальцевидных усиков на III сегменте; 12 — бобовидный, или почковидный, спинной усик; 13 — удлиненный ланцетовидный спинной усик; 14 — подставка спинного усика (циррофор); 15 — зачаточная спинная ветвь параподий (ното-подия); 16 — брюшной усик; 17 — ацикула; 18 — дистальный членик щетинки; 19 — рукоятка, или стержень, щетинки; 20 — верхняя, несколько расширенная часть рукоятки щетинки с сочленительными зубцами (рострум).
вочная нотоподиальная ацикула с 1—2 небольшими волосовидными щетинками; в этом случае параподии иногда называют двуветвистыми, но правильнее их именовать ложнодвуветвистыми, так как нотоподиальная ветвь лишь намечается, а фактически имеется только один подиальный бугорок, вооруженный одним пучком щетинок, расположенных веером. У бентических форм параподии обычно снабжены листовидными (сплющенными латерально), относительно крупными спинными усиками; они нередко черепицеобразно находят друг на друга и частично прикрывают спинную сторону червя, наподобие спинных чешуек афродитид. Снизу подиальный бугорок прикрыт брюшным усиком, по своим размерам значительно уступающим спинным. У пелагических видов спинные и брюшные усики нередко сильно редуцированы. Форма подиальных усиков, имеющих большое систематическое видовое значение, несколько варьирует в зависимости от местоположения, и на передних, средних и задних сегментах
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ . 113
они могут заметно отличаться, а потому сравнивать спинные и брюшные усики следует из одних и тех же участков тела. Спинные усики могут быть строго симметричными по отношению к'основанию (подставке, или циррофору) или асимметричными. О положении основной оси спинного усика легко судить по характеру «жилкования», т. е. по расположению основных нервных окончаний и железистых клеток, что хорошо видно при проходящем свете. На задней стороне спинных усиков иногда имеются полоски из ресничного эпителия (см. род Phyllodoce, стр. 129). На заднем конце тела $ва, обычно удлиненных анальных усика.
Щетинки тонкие, длинные, состоят из двух частей: из удлиненного стержня, или рукоятки, заканчивающейся несколько расширенным рост-румом, и сочлененного с ним тонкого, длинного дистального членика, мелко зазубренного с внутренней стороны; такие щетинки называются сложными или сочлененными. В редких случаях имеются на передних сегментах простые крючковидные щетинки {Lopadorhynchus, Chaetoparia).
В основу современной систематики филлодоцид положены особенности строения переднего конца тела. У филлодоцид процесс цефализации (образования перистомиума) находится на первых стадиях. У некоторых родов видоизменениям подвергаются лишь два передних сегмента, у других этот процесс в той или другой степени затрагивает три передних сегмента. Передние видоизмененные сегменты в одних случаях могут быть четко отделены друг от друга и от головной лопасти, в других — они подвержены частичному слиянию и редуцированию (рис. 2). Для наглядного обозначения особенностей строения головного отдела пользуются
1 1
формулой, например, (1+5 j-)+<S , которая нами пояснена на стр. 73. Основная терминология, употребляемая для описания видов, приведена при рис. 22.
Семейство Phyllodocidae в принятом мною объеме насчитывает по каталогу О. Гартман (Hartman, 1959, 1965а) около 40 родов и 275 видов, однако систематическое положение многих видов и даже р.одов пока остается не вполне ясным. В рассматриваемых нами акваториях встречены представители 23 родов с двумя подродами.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ПОДСЕМЕЙСТВ, РОДОВ И ПОДРОДОВ СЕМЕЙСТВА PHYLLODOCIDAE S. LATO
1 (38)- Бентические формы [подсем. Phyllodocinae Oersted],
2 (9). Два или лишь один передний сегмент с щупальцевидными усиками.
3 (6). На I сегменте лишь одна пара щупальцевидных усиков.
4 (5). На III сегменте спинной усик имеется......................
............................1. Род Lugia Quatrefages (стр. 116).
5 (4). На III сегменте спинной'усик отсутствует '............. . .
...............................2. Род Mystides Theel (стр. 117).
6 (3). На I сегменте две пары щупальцевидных усиков..............
..............................17. Род Eteone Savigny (стр. 172).
7 (8). Хобот гладкий или бугристый, с неясно определенными крупными мягкими папиллами по всей его поверхности. Щупальцевидные усики короткие........................Подрод Eteone Savigny s. str.
8 (7). Хобот с 2 боковыми продольными рядами крупных мягких папилл наподобие «боковых сосочков»; остальная часть поверхности хобота покрыта многочисленными очень мелкими зубчатыми папиллами. Щупальцевидные усики длинные . . : Подрод Mysta Malmgron.
8 П. В. Ушаков
114
I. PHYLLODOCIDAE
9 (2). Три передних сегмента с щупальцевидными усиками.
10 (37). На передних сегментах нет крючковидных щетинок.
И (30). Позади головной лопасти нет специальных затылочных выростов (эполетов).
12 (21). Головная лопасть с 4 фронтальными щупальцами (медиальное дорсальное щупальце отсутствует).
13 (14). Все три первых сегмента отделены друг от друга и не редуцированы со спины . . . .3. Род Protomystides Czerniavsky (стр. 123).
14 (13). Два первых сегмента со спины слиты.
15 (16). Головная лопасть продолговатой или округлой формы, без затылочной папиллы .... 4. Род Genetyllis Malmgren (стр. 126).
16 (15). Затылочная папилла имеется.
17 (20). Головная лопасть сердцевидной формы; затылочная папилла находится в заднем вырезе головной лопасти.........................
..................5. Род Phyllodoce Savigny s. lato (стр. 128).
18 (19). Папиллы в базальной части хобота расположены диффузно ................................. Подрод Phyllodoce Savigny s. str.
19 (18). Папиллы в базальной части хобота образуют продольные ряды ........................................Подрод Anaitides Czerniavsky.
20 (17). Головная лопасть округлая, с задним продолговатым выростом («язычком»), заходящим на I сегмент; затылочная папилла находится на конце заднего выроста головной лопасти ....... ..............................6. Род Paranaitis Southern (стр. 140).
21 (12). Головная лопасть с 5 щупальцами.
22 (29). Параподии с 1 ацикулой.
23 (26). Все три первых околоротовых сегмента развиты полностью и хорошо различимы со спины.
24 (25). Все щупальцевидные усики одной формы (преимущественно цилиндрические или веретендвидные) ................................
. ...........................8. Род Eulalia Savigny (стр. 145).
25 (24). Нижние щупальцевидные усики II сегмента сильно сплющенные, с задней боковой оторочкой (наподобие тесака), остальные веретеновидные .......................9. Род Steggoa Bergstrom (стр. 151).
26 (23). Первый околоротовой сегмент редуцирован со спины и слит со вторым сегментом (первая пара щупальцевидных усиков отходит как бы от заднего края головной лопасти).
27 (28). Все щупальцевидные усики одной формы: или веретеновидные, или слегка сплющенные..............10. Род Eumida Savigny (стр. 152).
28 (27). Нижние щупальцевидные усики II сегмента сильно сплющенные, с задней боковой оторочкой (наподобие тесака), остальные веретеновидные ................... .11. Род Pterocirrus Glaparede (стр. 159).
29 (22). Параподии с 2 ацикулами..................................
....................12. Род Austrophyllum Bergstrom (стр. 163).
30 (11). Позади головной лопасти имеются затылочные выросты (эполеты).
31 (34). Параподии с 1 ацикулой.
32 (33). Все три передних сегмента полностью развиты..............
.........................13. Род Vitiazia Uschakov (стр. 165).
33 (32). Первый сегмент со спины редуцирован......................
....................14. Род Vitiaziphyllum Uschakov (стр. 166).
34 (31). Параподии с 2 ацикулами (ложнодвуветвистые).
35 (36). Один или два первых сегмента со спины редуцированы .... ............................ 15. Род Notophyllum Oersted (стр. 168).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ
115
36 (35). Три первых сегмента со спцны редуцированы................
........16. Род Nipponophyllunr Imajiftia et Hartman (стр. 171).
37 (10). На передних сегментах- имеются простые крючковидные щетинки ......................7. Род Chaetoparia Malmgren (стр. 143).
38 (1). Пелагические формы.
39 (48). Параподии хорошо развиты на всех сегментах.
40 (41). Подиальный бугорок сильно вытянутый, в виде тонкого, длинного пальцевидного выроста [подсем. Pontodorinae Bergstrom] . . . ...................22. Род Pontodora Greef (стр. 192).
41 (40). Подиальный бугорок короткий [подсем. Lopadorhynchinae Cla-parede].
42 (45). При основании щупальцевидных усиков щетинки имеются.
43 (44). Щупальцевидных усиков 2 пары (на одном сегменте). На II сегменте спинные усики отсутствуют. Подиальные усики очень длинные, пальцевидной формы . . 19. Род Pelagobia Greeff (стр. 187).
44 (43). Щупальцевидных усиков 3 пары (на двух сегментах). Подиальные усики небольшие..................20. Род Maupasia Viguier (стр. 189).
45 (42). При основании щупальцевидных усиков щетинок нет.
46 (47). Параподии на всех сегментах одного типа; щетинки только сочлененные ....................21. Род Pedinosoma Reibisch (стр. 191).
47 (46). Параподии на первых 2 или 3 туловищных сегментах сильно видоизменены и снабжены крупными простыми крючковидными щетинками...................18. Род Lopadorhynchus Grube (стр. 184).
48 (39). Параподии на передних сегментах сильно редуцированы [подсем, lospilinae Bergstrom],
49 (50). Глотка вооружена двумя крупными хитиновыми крючками . . . ...........................23. Род Phalacrophorus Greeff (стр. 193).
50 (49). Глотка без хитиновых крючков.
51 (52). До 11 передних сегментов с редуцированными параподиями ......................................*Род lospilopsis Augener, 1922.
Вест-Индия (о. Тортуга)-
52 (51). Нормально развитые параподии с V сегмента.
53 (54). На II и III сегментах спинные и брюшные усики рудиментарные. ;.................................*Род Pariospilus Viguier, 1911.
Средиземное море.
54 (53). На II и III сегментах спинные и брюшные усики отсутствуют .....................................*Род lospilus Viguier, 1866.
Атлантический океан (Канарские острова, о. Мадейра), Средиземное море.
Подсемейство PHYLLODOGINAE Oersted, 1843
[incl. Eteontnae Bergstrom, 1914; Lugiinae Bergstrom, 1914; Mystidinae Bergstrom, 1914; Protomystidlnae Bergstrom, 1914]
Головная лопасть крупная, обычно хорошо обособлена от I сегмента. 4 или 5 головных щупалец. От 2 до 4 пар удлиненных щупальцевидных усиков. Спинные подиальные усики на всех туловищных сегментах хорошо развиты; спинные усики крупнее подиального бугорка. Анальная лопасть с 2 анальными усиками. Тело длинное, состоит из большого количества сегментов (обычно свыше 100). Бентические формы.
8*
116
I. PHYLLODOCIDAE
1. Род LUGIA Quatrefages, 1865
Головная лопасть удлиненная, слегка заостренная, 4 фронтальных головных щупальца; среднее головное щупальце и затылочная нухаль-ная папилла отсутствуют. Хобот с мягкими папиллами. I сегмент снабжен одной парой удлиненных щупальцевидных усиков, щетинок нет; II сегмент имеет одну пару удлиненных спинных цилиндрических усиков, подиальные бугорки со щетинками и брюшные листовидные усики, которые не отличаются или лишь немного крупнее брюшных усиков на последующих сегментах; III сегмент нормального строения. Формула передних 1 TV 1 7V
сегментов: 1 S -]- 8 или 1 8 у + 8 Параподии одновет-
вистые, щетинки сочлененные, с тонким длинным дистальным члеником. Тонкие небольшие черви.
Типовой вид: Eteone pterophora Ehlers, 1864.
Pop,. Lugia по характеру строения передних сегментов мы рассматриваем как одну из наиболее примитивных форм филлодоцид, от предков которых могли произойти с одной стороны представители рода Mystides Theel, а с другой — виды рода Protomystides Czerniavsky.
1 Род до последнего времени был представлен всего одним видом — L. pterophora, обитающим в Средиземном море среди прибрежных водорослей; в настоящей работе описывается второй вид этого рода — L. abys~ sicola, встреченный в северо-западной части Тихого океана, на глубине свыше 5000 м. Ранее описанный нами (Ушаков, 1958а) из Курило-Камчатской впадины L. rarica переносится в род Mystides (см. ниже, стр. 118).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА LUGIA QUATREFAGES
1 (2). Одна пара глаз у заднего края головной лопасти...............
...... ................ *L. pterophora (Ehlers, 1864).
Fauvel, 1923 ; 178—179, fig. 63, i.
Средиземное море.
2 (1). Глаз не,т..................1. L. abyssicola Uschakov, sp. nov.
1. Lugia abyssicola Uschakov sp. nov.
(Табл. I, IS,
Передняя часть головной лопасти, несущая фронтальные щупальцы, легким пережимом отделена от задней; головная лоиасть неясно отделена от I сегмента. Глаза отсутствуют. Хобот густо покрыт крупными, мягкими папиллами, которые образуют 6 более или менее правильных продольных рядов. I сегмент несет одну пару цилиндрических, удлиненных, несколько расширенных у основания и заостренных к дистальному концу щупальцевидных усиков. На II сегменте спинные щупальцевидные усики такого же типа, как и на I сегменте, но немного крупнее; брюшные усики на II сегменте листовидные, овальной, слегка удлиненной формы, почти в два раза крупнее, чем на последующих сегментах. III сегмент не отличается от всех остальных туловищных сегментов. Спинные усики на туловищных сегментах овальные, длина их в 2 раза больше ширины, с притупленным округлым концом; брюшные усики такой же формы, как и спинные, но меньше размером; спинные и брюшные усики имеют грубую альвеолярную структуру. Подиальный бугорок на конце раздвоен, ацикула светлая.
1. LUGIA, 2. MYSTIDES ' 4 x 117
Щетинки в верхней части пучка с очень длинным, тонким дистальным члеником, который имеет едва заметную пильдатость; щетинки в нижней части пучка со значительно более коротким дистальным члеником (примерно в 2 раза). Анальные усики удлиненно-овальные.
Окраска спиртовых экземпляров желтовато-бежевая, бёз каких-либо пигментных пятен. Типовой экземпляр был извлечен из плотного илистого комочка слежавшейся красной глины; часть его тела, находившаяся в трубке, имела равномерную темно-бурую окраску. Небольшие, тонкие черви. Количество сегментов около 70. Длина тела до 17 мм, ширина 0.6 мм, включая параподии.
Тип хранится в ЗИН АН СССР, инв. № 1/15955.
Примечание. По внешнему виду — вытянутой головной лопасти, строению параподий — L. abyssicola весьма напоминает Mystides rarica (Uschakov) (см. стр. 121), но отличается от него более крупными брюшными усиками II сегмента. Следует отметить, что спинные усики III сегмента, присутствие или отсутствие которых имеет родовое значение (см. стр. 118), при фиксации могут оказаться потерянными, причем как у L. abyssicola, так и у большинства видов Mystides спинные усики не имеют четко обособленных подставок и не всегда оставляют хорошо заметные следы прикрепления, что делает в ряде случаев затруднительным отнесение дефектных экземпляров к тому или другому роду. В связи с последним некоторые экземпляры в нашем материале с глубоководных станций остались бёз точного определения.
Распространение. К юго-востоку от о. Хоккайдо — 38°02' с. ш. и 146°33' в. д’, глубина 5475 м, грунт — мелко алевритовый ил с примесью пемзовой гальки («Витязь», ст. 3575, 7 V 1957 — тип и 9 обрывков) и у побережья Калифорнии, немного к югу от Сан-Франциско — 34°54' с. ш. и 123°56' з. д., глубина 4200—4231 м («Витязь», ст. 4213, 1 экз.).
2, Род MYSTIDES Theel, 1879 (emend. Hartmann-Schroder, 1963)
[incl. Mesomystides Czerniavsky, 1882; Pseudomystides Bergstrom, 1914]
Головная лопасть удлиненная или округлая, 4 фронтальных головных щупальца; среднего непарного головного щупальца и затылочной нухаль-ной папиллы нет. Одна пара глаз, иногда они могут отсутствовать. Хобот с мягкими папиллами. На I сегменте одна пара щупальцевидных усиков, подиального бугорка и щетинок нет; на II сегменте спинной щупальцевидный усик, подиальный бугорок со щетинками и нормальный или нередко сильно увеличенный брюшной усик; на III сегменте спинной усик отсутствует. Все три передних сегмента четко отделены друг от друга и от головной лопасти: i SS или 1 + Ху -|- S-^-. Параподии одноветвистые. Щетинки сочлененные, однако у половозрелых форм (М. limbata S.-Joseph) наряду с последними были отмечены очень длинные плавательные капиллярные щетинки. Весьма небольшие черви.
Типовой вид: Mystides borealis Theel, 1879.
При характеристике своего нового рода- Mystides X. Тель (Theel, 1879) не указал, имеются или нет спинные усики на III сегменте (из приведенных им рисунков это также не ясно). В дальнейшем Р. Саутзерн (Southern, 1914) вторично весьма подробно описал М. borealis с побережья Ирландии, причем он специально подчеркнул, что спинные усики па III сегменте отсутствуют. Однако Э. Бергштрём (Bergstrom, 1914) в своей
118
I. PHYLLODOCIDAE
монографии по филлодоцидам, вышедшей одновременно с работой Саут-зери, для рода Mystides указывает наличие спинных усиков на III сегменте (!). Такую же, как Бергштрём, трактовку этого рода принял и П. Фовель (Fauvel, 1923), а впоследствии и М. Петтибон (Pettibone, 1954, 1963), которая на рисунках головного конца М. borealis четко изображает спинные усики на III сегменте. В связи с этим возникла некоторая путаница не только в отношении понимания вида М. borealis, но и в отношении характеристики самого рода. Лишь недавно Г. Гартманн-Шрёдер (Hartmann-Schroder, 1963) вновь переисследовала типовой экземпляр Теля и установила, что у М. borealis спинной усик на III сегменте отсутствует. Нами исследован экземпляр М. borealis из Чукотского моря (мыс Барроу), полученный от М. Петтибон из коллекций Смитсонианского института (Вашингтон); у него тоже спинных усиков на III сегменте нет, хотя, как указывалось выше, Петтибон их изображает. В результате произведенной ревизии Гартманн-Шрёдер уже в 1963 г. аннулировала подрод Pseudomyslides, который, так же как Mystides, характеризуется отсутствием спинных усиков на III сегменте. Несколько раньше она же (1958) выделила новый род Hesionura (=Eteonides Hartmann-Schroder, 1960), отличающийся от Mystides лишь отсутствием щетинок на II сегменте. Два последних рода, несомненно, представляют весьма близкую группу.
У представителей рода Mystides в понимании Г. Гартманн-Шрёдер брюшной усик на II сегменте подвержен значительным изменениям, в некоторых случаях он сильно увеличен и представляет собой 3-ю пару щупальцевидных усиков, в других случаях он мало изменен по сравнению с нормальными брюшными усиками и по существу мы имеем лишь 2 пары
1 0 I
щупальцевидных усиков, т. е. может быть: 1 4- Sу -ф- S или 1 -ф- 8-^ -ф--ф- 8 ~. При такой трактовке рода Mystides описанный мной ранее новый вид из района Курильских островов Lugia rarica Uschakov, 1958, у которого на II сегменте имеется округлый брюшной усик, мало отличающийся от последующих брюшных усиков, а на III сегменте спинной усик отсутствует, должен быть перенесен в род Mystides. Для рода Mystides наиболее характерным признаком служит отсутствие спинных усиков на III сегменте.
В состав рода Mystides Г. Гартманн-Шрёдер включает 4 вида с 1 подвидом. В синонимию М. borealis Theel она включает М. caeca Langerhans, 1880, однако нам представляется более правильным последний сохранить в качестве особого подвида М. borealis caeca (см.: Laubier, 1962). Кроме того, Гартманн-Шрёдер в синонимию М. borealis включает М. notialis Ehlers, 1913, с чем также трудно согласиться. На основании имеющихся у нас материалов из Антарктики (Ушаков, 1962) мы склонны рассматривать М. notialis как самостоятельный вид; последний отличается от М. borealis наличием простых щетинок на задних сегментах (у М. borealis они отсутствуют). Уже после опубликования сводки Гартманн-Шрёдер был описан О. Гартман (Hartman, 1965) дополнительный новый подвид Pseudomyslides llmbata punctata из района Новой Англии и Бермудских островов, глубина 200—4950 м, который при указанной выше трактовке рода также должен быть включен в род Mystides, и я его рассматриваю как самостоятельный вид. Кроме того, в нашем новом материале с абиссальных глубин из северо-западной части Тихого океана оказался новый вид — Mystides schroderae (см. стр. 121). Ниже приводим таблицу для определения всех известных в настоящее время видов и подвидов рода Mystides.
2. MYSTIDES
119
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА MYSTIDES. THEEL
1 (6). Головные щупальца длиннее головной лопасти. Щупальцевидные усики на I и II сегментах длиннее ширины сегментов, у основания сильно расширены, с тонкими, сильно вытянутыми и нитевидными окончаниями (бутылковидной формы).
2 (5). Простых щетинок нет.
3 (4). Глаза имеются............. . . 1. М. borealis borealis Theel.
4 (3). Глаза отсутствуют . . . *М. borealis caeca Langerhans, 1880.
Остров Мадейра/Ла-Манш, Средиземное море.
5 (2). На 2—5 задних сегментах имеется по 1 простой щетинке . . . ........................................ *М. notialis Ehlers, 1913.
Побережье Антарктиды, Кергелен, Фолклендские острова.
6 (1). Головные щупальца короче головной лопасти.
7 (16). Головная лопасть сильно вытянутая (длина превосходит ширину).
8 (11). Брюшные усики II сегмента маленькие, аналогичные брюшным усикам остальных сегментов.
9 (10). Щупальцевидные усики на I сегменте веретеновидные, длинные ...........................................2. М. rarica (Uschakov).
10 (9). Щупальцевидные усики на I сегменте листовидные, короткие
. .................................*М. punctata (Hartman, 1965).
У Новой Англии и Бермудских островов, глубина 200—4950 м.
11 (8). Брюшные усики II сегмента крупнее брюшных усиков остальных сегментов.
12 (13),. Брюшные усики II сегмента веретеновидные, сильно вытянутые, заостренные . ...........................3. М. schroderae Uschakov.
13 (12). Брюшные усики II сегмента листовидные, сплющенные.
14 (15). Окраска тела равномерно коричневая; дистальная часть рукоятки - щетинки резко зазубренная..........................................
........................*М. limbata limbata Saint-Joseph, 1888.
Ла-Манш, побережье Ирландии, Средиземное море, Черное море.
15 (14). На спинной стороне тела выделяется средняя медиальная темная полоса; дистальная часть рукоятки щетинки слабо зазубрена .............................. *М. limbata nigrolineata Rioja, 1925.
Атлантическое побережье Испании.
16 (7). Длина головной лопасти меньше ее ширины.
17 (18). Щупальцевидные усики значительно короче ширины сегмента; брюшной щупальцевидный усик II сегмента листовидной формы ..............................................4. М. southern! Banse.
18 (17). Щупальцевидные усики длиннее ширины сегмента; щупальцевидные усики II сегмента цилиндрические ...............................
................................. *М. angolaensis Augener, 1918.
Западное побережье Африки (Ангола).
120
I. PHYLLODOCIDAE
1. Mystides borealis Theel, 1879
(Табл. II, 1—4)
Theel, 1879 : 35—37, pl. II, figs. 29—32; Дерюгин, 1915 : 322; Зенке-в и ч, 1925 : 3; Augener, 1928 : 711; Wesenberg-Lund, 1950b : 37; Pettibone, 1954 : 232 (non fig. 27, b); Хлебович, 1961 : 164—165; Pettibone, 1963 : 74—75 (non fig. 17, с); Hartmann-Schroder, 1963 : 207—209 (синонимия, part.).
Головная лопасть короткая, округлая. Головные щупальца тонкие,, очень длинные, нитевидные; они несколько длиннее головной лопасти. 2 больших темных глаза. Хобот равномерно покрыт небольшими мягкими кеглевидными папиллами. 3 пары щупальцевидных усиков примерно, одинаковой величины: одна пара на I сегменте и 2 пары на II сегменте. Щупальцевидные усики характерной бутылковидной формы, сильно расширенные у основания и с удлиненным нитевидным концом. Спинные усики относительно небольшие, толстые, широкой овальной формы или округлые; брюшные усики той же формы, что и спинные, нонесколько меньшего размера; они лишь немного выступают за пределы подиального бугорка. Подиальный бугорок на конце слабо раздвоен. Щетинок 10—15 в одном пучке; рострум щетинок несколько расширен и зазубрен; дистальный членик удлиненный, ре,зко заостренный, иногда немного закручен или загнут (по-видимому, очень тонкий и мягкий). Анальные усики крупные, овальной формы.
Окраска тела желтовато-коричневая, спинные усики темные, красновато-коричневые. Количество сегментов до 70—75. Маленькие, нежные черви; длина тела до 12—15 мм, ширина 1 мм.
П римечания. В работе X. Теля (Theel, 1879) на рисунке головного конца М. borealis изображены очень маленькие глаза, но в тексте он отмечает «большие черные глаза»; по-видимому, рисунок неточный..
Наши экземплярыиз района Курильских островов хорошо согласуются с подробным описанием этого вида по Р. Саутзерну (Southern, 1914 : 71— 72, pl. VIII, fig. 17, А—D), за исключением лишь того, что у его экземпляров отсутствуют глаза. П. Фовель (Fauvel, 1923) считает, что у этого* вида глаза могут выцветать, однако Л. Лобье (Laubier, 1962 : 461) склонен экземпляры, приведенные в работе Саутзерна, рассматривать как самостоятельный подвид М. borealis caeca Langerhans. Мы имели возможность наши курильские экземпляры сопоставить с экземпляром М. borealis из района мыса Барроу (Чукотское море) по материалам Смитсонианского. института, и они оказались вполне идентичными.
В работах К. М. Дерюгина (1915), Л. А- Зенкевича (1925), X. Ауген-нера (Augener, 1928) и Е. Везенберг-Лунд (Wesenbprg-Lund, 1950b) описание самих червей не дается, но эти экземпляры мы,относим к типичным М. borealis, так как они были найдены примерно в тех же районах,, откуда описан тип. Указанный в работе М. Пренана (Prenant, 1926) М. borealis для района Роскофа (Бретань), несомненно, относится к какому-то-другому роду, так как автор отмечает спинной усик на III сегменте.
Распространение. В коллекциях ЗИН имеется 13 экземпляров из района Курильских островов (литораль о. Парамушир, Симуширг Шикотан, и с глубины 30—100 м). По литературным данным отмечены единичные находки у арктического побережья Аляски, Новой Земли, Шпицбергена, в Кольском заливе, у западного побережья Гренландии; по данным М. Петтибон (Pettibone, 1963), встречается от зал. Св. Лаврентия до зал. Мэн. У побережья Ирландии, Франции, в Средиземном море и у о. Мадейра распространен М. borealis caeca (Laubier, 1962).
2. MYSTIDES
121
2. Mystides rarica (Uschakov, 1958)
(Табл.
Ушаков, 1958a : 204—205, рисунок, jA—В (Lugia).
Головная лопасть удлиненная, коническая, спереди немного притупленная. Головные щупальца на самом переднем конце головной лопасти; они значительно короче головной лопасти. 1 пара небольших глаз, расположенных по бокам головной лопасти у заднего ее края, глубоко под эпителием (не всегда видны). На I сегменте одна пара удлиненных щупальцевидных усиков; они лишь немного короче ширины сегмента, веретеновидной формы, постепенно заостряющиеся к дистальному концу. На II сегменте спинные, щупальцевидные усики такой же веретеновидной формы, как и щупальцевидные усики I сегмента, лишь немного длиннее их; брюшные усики короткие, сплющенные, округлой или слегка вытянутой формы, они такой же величины или лишь немного крупнее брюшных усиков остальных сегментов. На всех последующих туловищных сегментах (с IV) спинные усики удлиненно-овальной формы, длина их больше ширины; брюшные усики короче спинных. Спинные усики значительно крупнее подиального бугорка. Последний конический, на конце раздвоен. Ацикула одна, светлая. Щетинки с длинным, тонким и гибким дистальным члеником (10—12 щетинок в одном пучке); край дистального членика зазубрен (мелкопильчатый); верхние щетинки имеют более длинный дистальный членик, чем нижние щетинки.
Окраска тела бледно-желтовато-зеленая, спинные усики несколько темнее тела; у основания параподий с брюшной стороны на многих сегментах заметны небольшие темные пятнышки. Количество сегментов до 95. Длина тела 15 мм, ширина с параподиями до 1 мм.
Примечание. На одном просветленном экземпляре был хорошо виден втянутый хобот с крупными мягкими папиллами; хобот простирался до XXX сегмента.
Тип хранится в ЗИН АН СССР, инв. № 1/1621.
Распространение. Курило-Камчатская впадина — 46°1Г с. ш. и 154°56' в. д., глубина 5070 м («Витязь», ст. 2119 — тип); там же, глубина 4850 м (ст. 2118, деф. экз.); к югу от о. Хоккайдо — 39°44' с. ш. и 143°20' в. д., глубина 1673—1748 м (ст. 3223, 1 экз.); в районе о. Бонин — 26°04' с. ш. и 141 °56' в. д., глубина 3305 м (ст. 3890, 1 экз.); к северо-западу от о. Кермадек — 35°15' ю. ш. и 172°14' в. д., глубина 1125 м (ст. 3840, 1 экз.). По новым материалам оказался широко распространенным видом на больших глубинах в Тихом океане (возможно, встречен и на других глубоководных станциях, но материал дефектный).
3. Mystides schroderae Uschakov sp. nov.
(Табл. I, 6—9)
Головная лопасть вытянутая, слегка заостренная, длина ее примерно в 2 раза больше ширины; передний край легким пережимом отделен от остальной части головной лопасти. Фронтальные головные щупальца короткие. Глазные пятна отсутствуют. Хобот втянут (на просветленном тотальном препарате заметны многочисленные мягкие папиллы). Все три пары щупальцевидных усиков на 2 передних сегментах сильно вытянутые, цилиндрической или веретеновидной формы, заостряющиеся к дистальному концу; наиболее длинные — спинные на. II сегменте; при основании щу
122
I. PHYLLODOCIDAE
пальцевидных усиков II сегмента имеется небольшойподиальный бугорок со щетинками. Нормальные спинные усики начиная с IV сегмента, они удлиненно-овальной формы, по своей величине превосходят подиальный бугорок; брюшные усики той же формы, но значительно меньше. Щетинки немногочисленные (до 10 в одном пучке), причем верхние щетинки с очень длинным дистальным члеником, а нижние — с заметно более коротким дистальным члеником (примерно в 5 раз); край дистального членика пильчатый, сочленительные зубцы рострума с крупными шипиками. Анальные усики очень длинные, заостренные.
Окраска тела равномерно желтовато-бежевая, у основания параподий более темная; анальные усики коричневые. Количество сегментов 103. Длина тела 21 мм, ширина с подиальными бугорками 0.5 мм.
Тип хранится в ЗИН АН СССР, инв. № 1 /16133.
Вид назван в чёсть Г. Гартманн-Шрёдер, опубликовавшей ревизию рода Mystides. От глубоководных представителей этого рода из Атлантического океана — М. punctata (Hartman, 1967) и из Тихого океана — М. rarica (Uschakov, 1958) описанный здесь вид отличается в основном формой щупальцевидных усиков.
Распространение. Район Гавайских островов — 25°48' с. ш. и 174°12' з. д., глубина 3095 м, светлый глобигериновый ил («Витязь», ст. 3781 — тип) и к востоку от о. Хоккайдо — 37°38' с. ш. и 156°25' в. д., глубина 5800 м («Витязь», ст. 3240 — экземпляр без заднего конца).
4. Mystides southern! Banse, 1954
(Табл. Ill, 1-6)
В a n s е, 1954 : 313—318, Abb. 1—7; Свешников, 1958 : 20, рис. 1; Н а г t-mann-Schroder, 1963 : 213—214, Abb. 15—17.
Головная лопасть широкая, несколько суженная к переднему концу. Головные щупальца короткие (короче половины длины головной лопасти). 2 больших коричневых глаза близ заднего края головной лопасти. Щупальцевидные усики короткие (короче ширины сегментов); брюшные щупальцевидные усики II сегмента наиболее крупные; они несколько сплющены и расширены. Спинные и брюшные усики овальные. Стержень щетинок на дистальном конце с острыми зубчиками; конечный членик с косой штриховкой. 2 толстых удлиненно-овальных анальных усика.
Количество сегментов до 20. Длина тела 1.6 мм.
Примечание. Описанный К. Банзе (Banse, 1954) из Кильской бухты Mystides southernl представляет собой донную личиночную форму, у которой, как это типично для рода Mystides (см. выше), на III сегменте спинные усики отсутствуют. В своей работе Банзе высказывает предположение, что его личиночная форма, возможно, так же как и Mystides sp. Thorson, 1946, относится к М. borealis Theel, sensu Southern, 1914 (non Bergstrom, 1914), и во избежание путаницы предложил новое название. В работе Г. Торсона (Thorson, 1946) на рисунке Mystides sp. на I сегменте изображены щетинки, но это, безусловно, ошибка. В Белом море, в ризоидах ламинарий, В. А. Свешникову (1958) также удалось обнаружить молодую Mystides, которую он обозначил М. southerns, однако как его экземпляр, так и Г. Торсона отличаются от экземпляра, изображенного в работе Банзе, значительно более длинными щупальцевидными усиками; возможно, что это личиночные стадии двух разных видов.
Распространение. Кильская бухта, Каттегат, Белое море.
3. PROTOMYSTIDES
123
3. Род PROTOMYSTIDE S Czerniavsky, 1882
[char, emend. LaGreca, 1947; Hartmann-Schroder, 1962, 1963]
Головная лопасть продолговатая или округлая, без заднего выреза и затылочной нухальной папиллы; она не всегда ясно отделена от I сегмента. 4 фронтальных головных щупальца, среднего непарного головного щупальца нет. 1 пара глаз, иногда- они отсутствуют. Хобот с мягкими папиллами. ,3 или 4 пары щупальцевйдных усиков на трех передних сегментах; все 'околоротовые сегменты четко отделены друг от друга; щетинки со II сегмента. Формула передних сегментов: 1 -ф- S-|- S ~ или
1 + 5.р + S jy. Параподии одноветвистые (с одной ацикулой). Щетинки сочлененные, но у половозрелых особей могут появляться простые плавательные щетинки. Небольшие черви.
Типовой вид: Mystides bidentata Langerhans, 1880.
Г. Гартманн-Шрёдер причисляет к этому роду некоторые виды, у которых брюшной усик на II сегменте заметно отличается от брюшных усиков на остальных сегментах, в то время как у типа рода этот усик имеет нормальную форму; в соответствии с этим для данного рода я даю две формулы передних сегментов, с 3 и 4 щупальцевидными усиками. Следует отметить, что брюшные усики на II сегменте листовидной формы, а не цилиндрической. Кроме того, Гартманн-Шрёдер (см. также: Day, 1960 : 306) считает, что у представителей этого рода I сегмент может сливаться с головной лопастью; последнее сильно расширяет первоначальную трактовку этого рода. Виды, у которых I сегмент со спины слит с головной лопастью (например, Protomystides capensis Day, 1960), по внешнему виду не отличаются от представителей рода Genetyllis Malmgren, 1865 (см. стр. 126), так как у последних I сегмент также со спины неразличим, но считается, что он слит со II сегментом. Во всех этих случаях необходимы тщательные анатомические исследования.
Род Protomystides, по Гартманн-Шрёдер, насчитывает 7 видов. В настоящее время мной обнаружен с абиссальных глубин из района Марианских островов новый вид — Pr. levensteinae Uschakov, а к востоку от о. Хоккайдо — Pr. orientalis Uschakov.
Ниже даем определительную таблицу для всех известных в настоящее время видов рода Protomystides.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА PROTOMYSTIDES CZERNIAVSKY
1 (12). Все три передних сегмента отделены друг от друга и от головной лопасти.
2 (3). Дорсальные щупальцевидные усики III сегмента очень длинные (достигают X—XI сегментов) .... 2. Р. orientalis Uschakov.
3 (2). Дорсальные щупальцевидные усики III сегмента короткие (максимум по длине достигают V—VI сегментов).
4 (5). Подиальный бугорок сильно вытянутый .....................
............................. 1. Р. levensteinae Uschakov.
5 (4). Подиальный бугорок нормального типа.
6 (7). Брюшные щупальцевидные усики на II сегменте по размерам не отличаются от брюшных усиков остальных сегментов. Длина
124
I. PHYLLODOCIDAE
головной лопасти в 2 раза больше ширины.........................
...............................*Р. bidentata (Langerhans, 1880)..
Ла-Манш, Средиземное море, о. Мадейра,, у побережья Бразилии, Новой Англии,, до глубины 4950 м (Hartman, 1965).
7 (6). Брюшные щупальцевидные усики на II сегменте крупнее, чем на последующих сегментах. Головная лопасть короткая, длина ее меньше или лишь немного больше ширины.
8 (9). Глаз нет. Сочленительные зубцы рострума щетинки с многочисленными крупными шипиками . . . . 3. Р. occidentalis (Ditlevsen).
9 (8). 2 глаза. Сочленительные зубцы рострума щетинки с мелкими шипиками.
10 (11). Длина головной лопасти немного больше ее ширины. С III сегмента по бокам спинной стороны тела 2 волнистые темные линии ...................................... *Р. bilineata La Greca, 1947.
Средиземное море.
11 (10). Длина головной лопасти меньше ее ширины. Тело равномерно покрыто коричневыми пигментными пятнами..............................
............................ *Р. brunnea Hartmann-Schroder, 1963.
Средиземное море.
12 (1). Первый сегмент полностью или частично слит с головной лопастью.
13 (14). Первый сегмент полностью слит с головной лопастью. Спинные усики сердцевидной формы.....................*Р. capensis Day, 1960.
Западное побережье Южной Африки.
14 (13). Первый сегмент частично слит с головной лопастью.
15 (16). Спинные усики овальные. . *Р. confusa Hartmann-Schroder, 1962,.
Побережье Перу.
16 (15). Спинные усики ланцетовидные ................................
........................ *Р. lanceolata Hartmann-Schroder, 1962.
Побережье Перу.
1. Protomystides levensteinae sp. nov.
(Табл. I, 70-72)
Головная лопасть коническая, сильно вытянутая, длина ее больше ширины. Фронтальные головные щупальца короткие. Глаз нет. Хобот у типового экземпляра втянут (на тотальном препарате он имеет до XI сегмента темно-бурую окраску). Все три передних сегмента четко отделены друг от друга и головной лопасти; они имеют примерно такую же длину,, как и остальные передние туловищные сегменты. На I сегменте одна пара цилиндрических щупальцевидных усиков, по длине немного больше половины ширины сегмента. На II сегменте спинные щупальцевидные усики не сохранились, но хорошо заметны следы их прикрепления, которые сдвинуты на спинную сторону червя; подиальные бугорки на этом сегменте относительно короткие, вооружены длинными щетинками, а брюшные усики имеют плоскую округлую форму, заметно крупнее, чем на остальных сегментах. На III сегменте спинные щупальцевидные усики имеют цилиндрическую форму и их длина равна примерно длине трех сегментов; по своей длине они крупнее первой пары щупальцевидных усиков.
3. PROTOMYSTIDES
125
На большинстве туловищных сегментов спинные усики не сохранились; на VI и XI сегментах они сильно вытянутой формы и йфдлиие заметно превосходят подиальный бугорок, однако на средних и задних сегментах спинные усики короче подиального бугорка (табл. 1,11). На всех туловищных сегментах подиальный бугорок удлиненный. Брюшные усики на туловищных сегментах маленькие, округлой формы. Как спинные, так и брюшные усики с крупноячеистой структурой. Щетинки очень длинные и тонкие, дистальный их членик длиннее рукоятки; в одном пучке до 10 щетинок,', причем имеются также простые длинные волосовидные щетинки (до 2 в одном пучке); длина щетинок до 0.7 мм. Сочленительный зубец сложных щетинок с небольшими шипиками, дистальный членик пильчатый. Анальные усики не сохранились.
Количество сегментов около 115. Длина тела 13 мм, ширина 0.2 мм без параподий, длина подиальных бугорков 0.1 мм. Окраска тела равномерно желтовато-бежевая, в передней части тела просвечивает темная часть хобота.
Описание дано по типовому экземпляру. Вид назван в честь Р. Я. Левенштейн (Институт океанологии АН СССР), обрабатывающей абиссальных полихет по сборам э/с «Витязь».
Тип хранится в ЗИН АН СССР, инв. № 1 /16138.
П р и м е ч а н и е. Кроме типового экземпляра, в коллекциях ЗИН АН СССР имеется 2 экземпляра из района Алеутских островов, весьма близкие к типу, но спинные усики у них более удлиненной формы, а щетинки не столь длинные; при этом, у одного экземпляра вентральные щупальцевидные усики II сегмента были несколько более вытянутой формы.Один экземпляр со ст. 4066 оказался с выпяченной глоткой — хобот густо покрыт плоскими округлыми папиллами, сильно гранулированными. Описанный здесь вид отличается от всех остальных сильно вытянутыми подиальными бугорками.
Распространение. Район Марианских островов — 15°04' с. ш. и 141 °50' в. д., глубина 4549 м («Витязь», ст. 3900 — тип) и северная часть Тихого океана, немного к югу от Алеутской гряды — 47°19' с. ш. .и 175°49' з. д., глубина 5681—5740 м («Витязь», ст. 4066, 2 экз.).
2. Protomystides orientalis Uschakov sp. nov.
(Табл. II, 9-12}
Головная лопасть округлая, сильно пигментирована, особо выделяется темная медиальная полоска. Фронтальные усики толстые, короткие, с заостренным кончиком. Глаз нет. Хобот втянут (остался не исследованным). Все три передних сегмента четко отделены друг от друга и головной лопасти. Все щупальцевидные усики веретеновидной формы, удлиненные; щупальцевидный усик на I сегменте по длине достигает VI сегмент, на III сегменте — X—XI сегменты. На II сегменте имеется подиальный бугорок со щетинками. На туловищных сегментах спинные усики продолговато-овальной формы; на передних сегментах они более короткие и широкие, чем на средних сегментах; подиальный бугорок относительно небольшой; брюшные усики удлиненные, слегка заостренные, выступают за пределы подиального бугорка. Как спинные, так и брюшные усики с крупноячеистой структурой. Щетинки с длинным, очень тонким дистальным члеником, способным к закручиванию; сочленительныйзубец с крупными шипиками. Анальная лопасть поперечно овальная, анальные усики продолговато овальные.
126
I. PHYLLODOCIDAE
Червь находился в тонкой песчанистой трубке.
Головная лопасть и боковые части спинной стороны тела коричневатые, средняя линия спины, а также головные и подиальные придатки более светлые. Количество сегментов до 110. Длина тела 13 мм (целый экземпляр), ширина 1 мм.
Тип хранится в ЗИН АН СССР, инв. № 1/16448.
Экземпляр из района Новой Зеландии с яйцами в параподиях (0.012 мм).
Этот вид резко отличается от всех остальных видов рода Protomystides своими очень длинными щупальцевидными усиками (такие усики характерны для рода Phyllodoce).
Распространение. К востоку от о. Хонсю — 38°36' с. ш. и 142°12' в. д., глубина 598 м («Витязь», ст. 3579 — тип) и у северной части Новой Зеландии, глубина 1225 м («Витязь», ст. 3840, 1 экз.).
3. Protomystides occidentalis (Ditlevsen, 1917)
(Табл. Ill, 7—9)
Ditlevsen, 1917 : 62, pl. IV, figs. 8, 11, 15 (Mystides); Wesenberg-L u n d, 1950a : 11; 1950b : 37 (Mystides); Hartmann-Schroder, 1963 233—234, Abb. 48—50.
Головная лопасть полукруглая, длина равна ширине. Фронтальные головные щупальца короткие. Глаз нет. Хобот не исследован. Все три перистомиальных сегмента четко отделены друг от друга и от головной лопасти. I сегмент с одной парой щупальцевидных усиков, длина которых примерно равна половине ширины сегмента. II сегмент с двумя'парами щупальцевидных усиков, причем дорсальные щупальцевидные усики немного длиннее вентральных, между ними подиальный бугорок со щетинками. На III сегменте одна пара дорсальных усиков, несколько длиннее, чем на II сегменте, и подиальный бугорок со щетинками и брюшным усиком. Длина щупальцевидных усиков не превышает длину трех сегментов. Спинные усики на туловищных сегментах удлиненно-овальные, несколько крупнее подиальных бугорков; брюшные усики немного меньше подиальных бугорков. Передняя губа подиального бугорка двулопастная. Параподии снабжены 11—15 щетинками. Сочленительные зубцы рострума щетинки с многочисленными мелкими и 4—5 длинными шипиками; дистальный членик зазубренный и с косой штриховкой; наряду со щетинками с удлиненным дистальным члеником имеются 1—2 щетинки с весьма коротким дистальным члеником.
Количество сегментов 160 (экземпляр неполный^, длина тела 36 мм.
Типовой экземпляр переисследован Гартманн-Шрёдер (Hartmann-Schroder, 1963). В коллекциях ЗИН отсутствует.
Распространение. Известен лишь из пролива Девиса, глубина 580 м.
4. Род GENETYLLIS Malmgren, 1865
[=Carobia Quatrefages, 1865]
Головная лопасть округлая, без затылочной нухальной папиллы. 4 фронтальных головных щупальца, среднее непарное головное щупальце отсутствует. 2 глаза. Хобот с мягкими диффузно расположенными папиллами. 4 пары щупальцевидных усиков на трех передних сегментах; первый сегмент отделен от головной лопасти, однако I и II сегменты слиты
4. GENETYLLIS
127
между собой, причем со спины они сильно редуцированы; III сегмент развит нормально; щетинки со II сегмента. Формула передних сегментов:
Параподии одноветвистые (с одной ацикулой); щетинки только сочлененные.
Типовой вид: Genetyllis lutea Malmgren, 1865.
Род Genetyllis Malmgren весьма близок к Nereiphylla Blainville, 1828, и отличается'от него лишь тем, что у первого все щупальцевидные усики веретеновйДные, в то время как у последнего некоторые из них слегка сплющенные; последнее вряд ли служит достаточным основанием для их разделения;
Род насчитывает около 10 видов. В наших коллекциях имеется два вида — Genetyllis lutea Malmgren и G. castanea (Marenzeller).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА GENETYLLIS MALMGREN
1 (2). Длина спинных усиков меньше их ширины .....................
........................................1. G.. lutea Malmgren.
2 (1). Длина спинных усиков равна или больше их ширины...........
.................................. 2. G. castanea (Marenzeller).
1. Genetyllis lutea Malmgren, 1865
(Табл. Ill, 10—12)
Malmgren, 1865 : 93—94, tab. XIV, 32 (в тексте и на рисунке головная лопасть ошибочно помечена с 5 головными щупальцами, что было исправлено им же в работе 1867 г.); М с I n to sh, 1908 : 95—96, pl. LXVIII, figs. 18—19; 1910: pl. LXXVII, fig. 13; Bergstrom, 1914 : 160—161, Textfig. 54, Taf. 1, figs. 2—3 (синонимия); Eliason, 1920 : 25; Wesenberg-Lund, 1951 : 25—26.
Головные щупальца толстые, массивные, с резко заостренными кончиками. 2 очень крупных черных глаза. Брюшные щупальцевидные усики II сегмента сильно сплющенные. Спинные усики на туловищных сегментах широкие, слегка гофрированные, с глубоким вырезом у основания; длина спинных усиков меньше их ширины. Подиальный бугорок удлиненно-конический, на конце слабо раздвоен. Брюшные усики овальные, с глубоким вырезом у основания. Рострум щетинок с мелкими шипиками, дистальный членик с мелкой зубчатостью.
Червь имеет интенсивную равномерную оранжево-коричневую окраску, хорошо сохраняющуюся в спирту. Количество сегментов до 180. Длина тела до 40 мм, ширина до 3—4 мм, включая параподии.
Распространение. Каттегат, Скагеррак, у побережья Норвегии, Исландии и Шотландии, В коллекциях ЗИН имеется 1 экземпляр из Каттегата, глубина 43 м, песок (coll. A. Eliason).
2. Genetyllis castanea (Marenzeller, 1879)
(Табл. IV, 1—3)
Marenzeller, 1879 : 19—20, Taf. Ill, Fig. 2 (Carobia); Moore, 1909a : 239—240; 1909b : 339 [Phyllodoce (Carobia)]-, Izuka, 1912:199—200, pl. XXI, fig. 3 (Carobia); Bergstrom, 1914 : 158—160, fig. 53; Fauvel, 1919 : 359—360 (Phyllodoce) [синонимия]; 1932 : 68 (Phyllodoce); 1933 : 15 (Phyllodoce); 1936 : 56—57 (Phyllodoce); О k u d a, 1938 : 88 (Phyllodoce); Hartman, 1944 : 247; E. В о r k ley a. C. Berkeley, 1948 : 44—45 [Phyllodoce (Genetyllis)]; У ш а к о и,
128
I. PHYLLODOCIDAE
1950 : 170, табл. 1, фиг. 4 [Phyllodoce (Genetyllis)]; 1955a : 93, рис. 2, D, E [Phyllodoce (Nereiphylla)]; Хлебович, 1961 : 161 —162 [Phyllodoce (Nereiphylla)]; Ima jima a. Hartman, 1964 : 65; Ушаков и У Б а о - л и и, 1965 : 150—151 [Phyllodoce (Nereiphylla)]; Б ужинская, 1967 : 79 [Phyllodoce (Nereiphylla)]; I majima, 1967 : 410.
Головные щупальца крупные, веретеновидные, по своей длине могут превосходить головную лопасть. 2 крупных округлых или слегка продолговатых черных глаза. У заднего края головной лопасти иногда наблюдается легкое вдавление. Щупальцевидные усики несколько сплющенные, заостренные к дистальному концу; наиболее длинные — дорсальные усики II сегмента, по длине достигающие VI сегмент. Спинные усики слегка асимметричные, сердцевидной формы, заостряющиеся к вершине; длина спинных усиков равна или больше их ширины; в передней части тела спинные усики полностью прикрывают спинную сторону червя. Подиальный бугорок короткий, с двумя небольшими закругленными губами. Брюшные усики овальные, крупнее подиального бугорка. Анальные усики толстые, вытянутые, их длина в 3—4 раза превосходит ширину. Рострум щетинок на дистальном конце с мелкими шипиками, дистальный членик с 'мелкой зубчатостью.
Окраска тела и придатков темно-красная или оранжево-коричневая; на спинной стороне сегментов наблюдаются более светлые, желтоватые поперечные полосы, иногда с зеленоватым оттенком. Количество сегментов до 150—200. Длина тела до 40 мм, ширина до 3 мм, включая параподии.
Распространение. В наших коллекциях имеется из Охотского, Японского, ЖелтоТо и Южно-Китайского морей, преимущественно с мелководий, однако в Охотском море спускается на глубины до 500 м (всего около 40 экз.). Широко распространенный вид, преимущественно в субтропических и тропических водах — побережье Японии, Индии, Цейлона, Персидский залив, Красное море, побережье Калифорнии, острова Галапагос, Австралия, Новая Зеландия.
5. Род PHYLLODOCE Savigny, 1818, s. lato
[incl. Anaitides Czerniavsky, 1882] A
Головная лопасть сердцевидной формы, с задним затылочным вырезом, в центре которого находится небольшой затылочный бугорок или бородавка — нухальная папилла. На переднем конце головной лопасти 4 небольших головных щупальца. 1 пара довольно крупных глаз. Позади головной лопасти с боков имеется 1 пара втягивающихся нухальных выростов. Хобот цилиндрический или шестигранный; передняя (дистальная) часть хобота обычно гладкая или сильно бугристая, иногда с неправильно разбросанными папиллами; задняя (проксимальная) часть хобота покрыта многочисленными мягкими, удлиненными или коническими папиллами, которые или располагаются правильными продольными рядами (подрод Anaitides), или диффузно рассеяны (подрод Phyllodoce s. str.); у наружного края хобота до 16—20 крупных, округлых краевых (терминальных) папилл. I сегмент частично редуцирован со спинной стороны и плохо различим. 4 пары цилиндрических (веретеновидных) или слегка сплющенных, удлиненных щупальцевидных усиков на трех передних сегментах. Первая пара щупальцевидных усиков, если смотреть сверху, отходит как бы снизу и с боков головной лопасти, так как последняя частично налезает на I сильно редуцированный сегмент. Наиболее длинные щупальцевидные усики на II сегменте верхние, как и на III сегменте.
5. PHYLLODOCE
120
Щетинки на II и III сегментах у некоторых представителей имеются, у других отсутствует. Формула передний-сегментов: (1 ,
(1 + О у-) + S или (1 + О -у-) + О .
Параподии одноветвистые (с одной ацикулой). На туловищных спинных усиках вдоль их спинного края по задней стороне имеется хорошо выраженный ресничный поясок, образующий подобие мембраны (последний особенна хорошо заметен у крупных Ph. groenlandica). Щетинки многочисленные, только сочлененные; рострум рукоятки щетинок немного расширен и покрыт мелкими шипиками; дистальный членик удлиненный, саблевидной формы и с мелкой зубчатостью по слегка вогнутой стороне.
Типовой вид: Nereis maculata Linne, 1767.
Ряд авторов (Hartman, 1959, и др.) рассматривают Anaitides Gzer-niavsky в качестве самостоятельного рода. Основным отличием между Anaitides и Phyllodoce s. str. принято считать характер расположения папилл в проксимальной части глотки. Однако в последнее время описан Anaitides variabilis Hartmann-Schroder, 1965, у которого характер расположения папилл в нижней части глотки очень изменчивый (иногда продольные ряды папилл хорошо выражены, в других случаях папиллы располагаются диффузно). Г. Гартманн-Шрёдер для разграничения указанных родов предлагает дополнительный признак: она считает, что у Phyllodoce s. str. на II и III сегментах щетинки имеются, а у Anaitides на II или на II и III сегментах щетинки отсутствуют. Но и этот признак недостаточный, ибо у Ph. malmgreni Gravier, имеющего диффузно расположенные папиллы в нижней части глотки, щетинки на II и III сегментах отсутствуют. Anaitides в лучшем случае может быть сохранен лишь в качестве подрода.
Недавно О. Гартман (Hartman, 1966 : 187) описала новый род Prophyllo doce, который, по ее данным, отличается от Phyllodoce Sav. лишь наличием на I сегменте добавочной пары крохотных щупальцевидных усиков; для этого рода она дает следующую формулу передних сегментов; 1 1 1 7V _
q—Нт+дГ + S~N~’ °ДнаК0 Добавочная пара «щупальцевидных усиков» на I сегменте, по нашему мнению, представляет собой ничто иное, как выпячивающиеся нухальные органы, отмеченные для ряда.представителей рода Phyllodoce} в связи с этим мы считаем выделение нового рода Prophyllo doce нецелесообразным.
Род Phyllodoce насчитывает большое количество видов (свыше 50), но многие из них описаны недостаточно полно, и систематическое положение их неясное. В западной части Балтийского моря, встречаются Ph. (Л.) mucosa Oerst. и Ph. (Л.) maculata (L.), в морях Полярного бассейна и Дальнего Востока — Ph. (Л.) maculata (L.), Ph. (Л.) groenlandica Oerst., Ph. (Л.) citrina Mgrn., а из Японского моря, кроме того, описан Ph. laminosa brevis Zachs; для Желтого моря отмечены Ph. gracilis Kinberg, Ph. (Л.) chinensis Uschakov et Wu и Ph. (Л.) papillosa Uschakov et Wu, для Восточно-Китайского и Южно-Китайского морей — Ph. laminosa Sav., Ph. malmgreni Gravier, Ph. (Л.) madeirensis Lang, и Ph. (A.) papillosa Uschakov et Wu. Для побережья Японии M. Имаджима и О. Гартман (Imajima a. Hartman, 1964; Imajima, 1967) приводят Ph. та-crolepidota Schmarda, Ph. violacea Treadwell (?=Pfe. pruvoti Fauvel), Ph. japonica Imajima и Ph. (Л.) elongata Imajima, нов наших коллекциях последние виды отсутствуют.
9 П. В. Ушаков
130
I. PHYLLODOCIDAE
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ПОДРОДОВ И ВИДОВ РОДА PHYLLODOCE SAVIGNY, S. LATO
1 (8). Базальная (проксимальная) часть хобота покрыта многочисленными папиллами, расположенными диффузно [подрод Phyllodoce s. str. Savigny).
2 (7). На II и III сегментах щетинки имеются.
3 (6). Спинйые усики асимметричные или сердцевидной формы.
4 (5). Спинные усики в средней части тела асимметричные; длина их немного больше ширины ...............................................
..................la. Ph. (s. str.) laminosa laminosa Savigny.
5 (4). Спинные усики в средней части тела симметричные (сердцевидные); длина их меньше ширины. . 16. Ph. (s. str.) laminosa brevis Zachs.
6 (3). Спинные усики ланцетовидные
............................ 2. Ph. (s. str..) gracilis Kinberg.
7 (2). На II и III сегментах щетинки отсутствуют. Спинные усики неправильной ромбовидной формы.......................................
............................3. Ph. (s. str.) malmgreni Gravier.
8 (1). На базальной (проксимальной) части хобота папиллы образуют правильные боковые продольные ряды [подрод Anaitides Czerniavsky].
9 (10). Базальная часть хобота с 8 продольными рядами папилл (по 4 ряда с каждой латеральной стороны хобота); в одном продольном ряду 3—6 папилл. Спинные усики сильно заходят на спинную сторону червя ...... 7. Ph. (Anaitides) citrina Malmgren.
10 (9). Базальная часть хобота с 12 продольными рядами папилл.
11 (12). Дистальная часть хобота с крупными сосочковидными папиллами ..................10. Ph. (Anaitides) papillosa Uschakov et Wu.
12 (11). Дистальная часть хобота гладкая или бугристая (без сосочковидных папилл).
13 (18). На III сегменте щетинки имеются.
14 (17). Спинные усики незначительно заходят на спинную сторону червя.
15 (16). Брюшные усики удлиненные, заостренные....................
..............................6. Ph. (Anaitides) mucosa Oersted.
16 (15). Брюшные усики короткие, закругленные.....................
..............................5. Ph. (Anaitides) maculata (L.).
17 (14). Спинные усики сильно заходят на спинную сторону червя . . .
...................... 4. Ph. (Anaitides) groenlandica Oersted.
18 (13). Ha III сегменте щетинки отсутствуют.
19 (20). Спинные усики широкоовальной или бобовидной формы .... ..................... 8. Ph. (Anaitides) chinensis Uschakov et Wu.
20 (19). Спинные усики сильно вытянутые, заостренные..............
.................. 9. Ph. (Anaitides) madeirensis Langerhans.
Подрод PHYLLODOCE Savigny, 1818, s. str.
Папиллы в базальной части хобота расположены диффузно.
la. Phyllodoce (s. str.) laminosa laminosa Savigny, 1818
Bergstrom, 1914 : 150—152, fig. 48 (синонимия); F a u v e 1, 1923 : 145— 146, fig. 51, a—e', 1939 : 274-275.
Головная лопасть с крупным задним сердцевидным вырезом и затылочной папиллой. Передняя часть хобота шестигранная, поперечноморщинистая с 16—20 краевыми округлыми папиллами; проксимальная
5. PHYLLODOCE
131
часть покрыта многочисленными, мягкими, заострёнными, диффузно рассеянными папиллами. Щупальцевидные усики, оттянутые назад, достигают XIV—XVIII щетинковых сегментов. Щетинки на-II и III. сегментах имеются. Формула передних сегментов: (1 + 5-^ + 5.
Спинные усики крупные, вначале продолговатоовальные, в средней части тела неправильной сердцевидной формы, асимметричные; длина спиппых усиков больше их ширины. Брюшные усики удлиненные, их дистальный конец выдается за пределы подиального бугорка; вначале они более тупые, а в средней части тела более заостренные.
Спинная сторона голубовато-аспидная, иризирующая, с поперечными зеленоватыми и коричневатыми пятнами; спинные усики зеленовато-оливковые, в спирту — коричневато-зеленые или коричневато-красные. Количество сегментов до нескольких сот. Длина тела до 150—750 мм (Fauvel, 1923).
Примечание. Ph. laminosa Savigny отмечен для юго-западной части Баренцева моря (Зацепин, 1948 : 111—112), однако последнее нуждается в подтверждении. В коллекциях ЗИН имеется экземпляр из Средиземного моря.
Распространение. Северное море, атлантическое побережье Европы, Средиземное море, побережье Индокитая (Fauvel, 1939).
16. Phyllodoce (s. str.) laminosa brevis Zachs, 1933
Закс, 1933 : 127; А и н e и к о в a, 1938 : 141; Ушаков, 1955а : 91.
От Ph. laminosa laminosa Savigny отличается: 1) более короткими и симметричными спинными усиками; их высота меньше ширины и 2) более коротким телом. Количество сегментов до 115. Длина тела до 40 мм, ширина до 3.5 мм (Закс, 1933).
В коллекциях ЗИН отсутствует.
Распространение. Залив Петра Великого в Японском море.
2. ? Phyllodoce (s. str.) gracilis Kinberg, 1866
К inb erg (1866) 1910 : 55, tafl. XXII, fig. 3, A. G; [non V e r r i 1 1, 1873]; Fauvel, 1932 : 69, textfig. 12; ? Monro, 1939 : 173—175, fig. 3; Hartman, 1948b : 49, pl. VII, figs. 4—6 (Genetyllis); Fauvel, 1953 : 117, fig. 57; Ушаков и У Б а о - л и н, 1962а: 123—124; 1965 : 149—150.
Головная лопасть округлая, с легким задним вдавлением. 2 крупных темных глаза. Глотка у нашего экземпляра была втянута и осталась неисследованной. Передних два сегмента со спины слиты. Наиболее длинные щупальцевидные усики достигают IX сегмента.'На II сегменте (1 \ 1
1-|-5 у) + 5 —. Спинные усики сидят на высоких подставках, небольшие, удлиненной формы (ланцетовидные); длина спинных усиков больше их ширины. Брюшной усик крупнее подиального бугорка, с заостренным вытянутым кончиком.
Головная лопасть, спинные усики и вся поверхность тела как со спины, так и с брюшной стороны густо покрыты мелкими, четко ограниченными, слегка вытянутыми темными коричневыми пигментными пятнышками, причем они наиболее интенсивные на передних сегментах, головной лопасти и спинных усиках; спинные усики благодаря этим пятнышкам кажутся темно-коричневыми; на головной лопасти у ее заднего конца бросается в глаза небольшое белое пятно в виде вдавления там, где обычно
9*
132
I. PHYLLODOCIDAE
наблюдается затылочная папилла. Количество сегментов около 35. Длина , червя около 5 мм, ширина 0.5 мм.
Описанный здесь экземпляр, добытый в Желтом море (Тангу), хранится в Институте океанологии Академии наук КНР (Циндао).
Примечание. Типовой экземпляр Кинберга Ph. gracilis был персисследован О. Гартман (Hartman, 1948b : 49) и отнесен ею к роду Genetyllis Malmgren на основании того, что I и II сегменты слиты и со спины редуцированы. Однако она отмечает у этого экземпляра наличие нухаль-ной папиллы, что заставляет меня рассматривать этот вид в составе рода Phyllodoce Sav. По Гартман, базальная часть хобота диффузно покрыта многочисленными папиллами (см. также рисунок Кинберга).
Этот вид Монро (Monro, 1939) приводит для района Маркизских островов и Таити, но у своих экземпляров он не обнаружил на II сегменте щетинок. П. Фовель (Fauvel, 1932) для исследованного им экземпляра из района Адаманских островов указывает наличие щетинок на II сегменте. В этом отношении наш экземпляр совпадает с описанием Фовеля, однако у него спинные усики менее вытянутые; последнее заставляет наше определение поставить со знаком «?».
О. Гартман (Hartman, 1959) в синоним этого вида включает Ph. ovali-fera Augener, 1913, описанный с юго-западного'побережья Австралии, а Ч. Монро (Monro, 1939) — Ph. fakaravana Chamberlin, 1919, описанный из района островов Паумоту.
Распространение. Тропический вид — Бенгальский залив (Адаманские острова), острова Полинезии, возможно, Австралия.
3. Phyllodoce (s. str.) malmgreni Gravier, 1900
(Табл. IV, 4—6)
Gravier, 1900:207—209, pl. X, figs. 29—31, textfigs. 66—69; Fauvel, 1919 : 360—361; Augener, 1927b : 130—131; Monro, 1931 : 9; Fauvel, 1932 : 68—69; Monro, 1934 : 360; Fauvel, 1953 : 117, fig. 56, h; D a y, 1957 : 68; R u 11 i e r, 1965b : 172—174, fig. 3; Day, 1967 : 147, fig. 5, 2, n—p.
Головная лопасть с небольшим задним вырезом, затылочная нухаль-ная папилла плохо заметна. Глаза с небольшими линзами. Хобот в проксимальной части покрыт многочисленными диффузно расположенными папиллами (они не образуют строгих продольных рядов); в дистальной части хобот с 6 широкими продольными бугристыми валиками (имеет шестигранную форму). Спинные щупальцевидные усики II и III сегментов веретеновидные, длинные, будучи оттянутыми назад могут достигать XV сегмента; щупальцевидные усики I и ^рюшные щупальцевидные усики II сегментов более короткие и несколько сплющенные. На II •
(1 \ 1
1 О у \ — .
Спинные усики неправильной ромбовидной формы, длина их больше ширины; спинные усики с крупными удлиненными железистыми клетками. Брюшные усики заостренные, выступают за пределы подиального бугорка. Рострум щетинки вооружен мелкими острыми шипиками; дистальный членик с хорошо заметной косой, очень тонкой штриховкой.
По средней линии на спинной стороне сегментов выделяются темные поперечные пятна, которые, сливаясь между собой, образуют в передней части тела сплошную продольную темную полосу; спинные усики имеют в центре легкую бурую пигментацию; у половозрелого экземпляра с многочисленными крупными яйцами в полости тела и в параподиях (8 VII 61) ,
5. PHYLLODOCE
133
пигментация была выражена расплывчато. Количество сегментов до 200 и свыше. Тело тонкое, длинное, длина около 60—70 мм, ширина 1—2 мм.
Примечание. Наши, экземпляры не отличаются от Ph. mal-mgreni Gravier, 1900, из района Джибути (Красное море) по коллекциям П. Фовеля. Интересно отметить, что Дж. Дэй (Day, 1967) для своих экземпляров с побережья Мозамбика указывает щетинки на III сегменте, в то время как по П. Фовелю и Ф. Рулье и у наших экземпляров щетинки на III сегменте отсутствуют. По О. Гартман' (Hartman, 1959 : 162), Ph. malmgrent Gravier, 1900 близок к Ph. novae-hollandiae Kinberg, 1866, описанному с юго-восточного побережья Австралии.
Распространение. В коллекциях ЗИН АН СССР имеются 5 экземпляров с побережья о. Хайнань (Хайкоу, средний горизонт илистого пляжа, лужа с молодыми Llmulus) и из Тонкинского залива, глубина 28—53 м. По литературным данным: Красное море, Мадагаскар, Мозамбик, побережье Индии, Восточно-Китайское море (Амой), Новая Гвинея, восточное побережье Австралии.
Подрод ANAITIDES Czerniavsky, 1882
Папиллы в базальной части хобота образут продольные ряды.
4. Phyllodoce (Anaitides) groenlandica Oersted, 1842
(Табл. V, 1—4)
Malmgren, 1867 : 21, tab. II, fig. 9; 22, tab. II, fig. 6 (Ph. badia); 24, tab. II, fig. 10 (Ph. luetkeni); Theel, 1879 : 34—35; Hansen, 1882 : 31, tab. Ill, figs. 21—23 (Ph. arctica); McIntosh, 1908 : 86—88, pl. LVIII, fig. 5, pl. LXVIII, figs. 4—6, pl. LXXVIII, fig. 7 (синонимия); ? Izuka, 1912 : 198—199, pl. XXI, fig. 2; Bergstrom, 1914 : 141—143, fig. 42 (Anaitides); Ditlevsen, 1917 : 56; Fauvel, 1923 : 153—154, fig. 54, f—i; Augener, 1928 : 703—705 г(синонимия); Дерюгин, 1928 : 239; Анненкова, 1932a : 167; 1937 : 156; Горбунов, 1946 : 38; Зацепин, 1948 : 111, табл. XXIX, 2, b—d (Anaitides); Hartman, 1948a : 19 (Anaitides); E. Berkeley a. C. Berkeley, 1948 : 46, fig. 66; У ш flit о в, 1948a : 27; 1950 : 170; Wesenberg-Lund, 1950a : 10, chart 13,
1950b : 32; 1951 : 28; Pettibone, 1954 : 236—238, fig. 27, d (синонимия); Ушаков, 1955:91, рис. 2, A, Б, рис. 3, А, Б; Е 1 i a s о п, 1962а : 19 (Anaitides); Petti b о n е, 1963 : 80—81, fig. 18, е; I m a j i m а, 1963 : 351 (Anaitides); Hartman, 1965 : 59 (A naitides).
Головная лопасть с крупным задним сердцевидным вырезом и хорошо заметной затылочной папиллой в углублении; у заднего края головной лопасти, при основании I пары щупальцевидных усиков — небольшие втягивающиеся нухальные выросты. Дистальная часть хобота бугристая (бугры большей частью располагаются в 6 более или менее отчетливых продольных полос); краевых папилл 17. Проксимальная часть хобота с обеих латеральных сторон имеет по 6 (всего 12) продольных рядов конических папилл, окрашенных в желтовато-коричневый цвет; в каждом продольном ряду до 12—15 папилл (у молодых экземпляров папилл в одном продольном ряду может быть меньше — всего 8—10, а самих продольных рядов — всего 4—5). Спинные щупальцевидные усики II сегмента наиболее длинные (оттянутые назад они достигают IX—XI щетинковых сегментов). На II сегменте щетинки отсутствуют, на III сегменте имеются. Формула передних сегментов: (1 Д-O-pl-j-A — .
Спинные усики на передних сегментах овально-удлиненные, немного заостренные; на средних сегментах неправильной, ромбической формы,
•134
I. PHYLLODOCIDAE
с усеченным концом, они сильно оттянуты на спинную сторону и частично прикрывают спинную сторону сегментов. Брюшные усики вначале при- ' тупленные, затем заостренные, с асимметричным заостренным кончиком, по величине превосходят подиальный бугорок.
Окраска тела коричневато-зеленоватая, с темными поперечными . полосами на спинной стороне сегментов; спинные усики зеленоватые с коричневыми пятнами, иногда темно-коричневые со светлой каймой; в спирту окраска серо-аспидная, иризирующая (с радужным отливом).
Количество сегментов до 700. Достигают нередко весьма крупных размеров: длина тела до 300 мм; ширина до 6 мм, включая параподии.
Половозрелые самки с большим количеством яиц в параподиях отмечены в дальневосточных морях с апреля по сентябрь.
Примечание. Для дальневосточных морей И. Заксом (1933) выделена цветовая вариация orientalis, отличающаяся тем, что пигментные пятна на спинной стороне, сливаясь между собой по медиальной линии, образуют в передней части тела одну темную продольную полосу. Как показал исследованный материал наблюдается весьма различная степень пигментации и четко выделить orientalis не всегда удается.
Распространение. В коллекциях ЗИН АН СССР представлен большим количеством экземпляров как из северных, так и из дальневосточных морей (около 500 местонахождений); предпочитает небольшие глубины (до 200 м), однако в Японском море отмечен и на глубине около 1000 м; селится предпочтительно на илистых грунтах с примесью гальки и камней; у берегов Южного Сахалина образует поселения до 12 экземпля-.-ров на 1 м2.
Широко распространенный арктическо-бореальный вид: в Арктике циркумполярен, в северной части Атлантического океана спускается на юг до залива Массачусетс и Ла-Манша, а в Тихом океане — до Японского моря и побережья Калифорнии (общая глубина распространения до 1500 м).
5. Phyllodoce (Anaitides) maculata (Limie, 1767)
(Табл. V, 7)
Malmgren, 1865:97, tab. XIV, fig. 30 (Ph. teres)-, 1867:21—22, tab. II, fig. 8 (Ph. pulchella); 23, tab. Ill, fig. 16; 23—24, tab. II, fig. 11 (Ph. rinki); McIntosh, 1908 : 89—92, pl. XLV, fig. 2, pl. XLVIII, fig. 3, pl. LVIII, figs. 21, 24, pl. LXVIII, figs. 7—8, pl. LXXVIII, figs. 23-24; Bergstrom, 1914 : 145—147, fig. 45 (синонимия); Дерюги и, 1915 : 332; Ditlevsen, 1917 : 59—60; Fauvel, 1923 : 152, fig. 53, a—e; Дерюги и, 1928 : 239; Закс, 1933 : 127; Зацепин, 1948 : 111, табл. XXIX, 3, b, с (Anaitides); Е. Berkeley а. С. Berkeley, 1948 : 46, fig. 67; Ушаков, 1948а : 27; 1950 : 170;’ Wesenberg-Lund, 1950b : 34—35, chart 8; 1951 : 27; Ушаков, 1955a : 91, рис. 3, В; Хлебович, 1961 : 161; Pettibone, 1963 : 78—80, fig. 18, d (синонимия); Imajima a. Hartman, 1964 : 59, pl. 12, figs, a—c (Anaitides); Левенштейн, 1966 : 6.
Головная лопасть с неглубоким задним вырезом и небольшой затылочной папиллой. Дистальная часть хобота шестигранная, с поперечными складками; краевых папилл 16 —17; проксимальная часть хобота с 12 продольными рядами коричневых папилл по 6—8 папилл в одном ряду. Щупальцевидные усики, оттянутые назад, достигают VI—X щетинковых сегментов. На II сегменте щетинки отсутствуют, на III имеются; формула передних сегментов: ^1 + О -0 + S -i-.
Спинные усики на передних сегментах овально-удлиненные, на средних сегментах асимметричные, со слегка заостренным кончиком, не
5. PHYLLODOCE
135
сколько оттянуты на спинную сторону червя. Брюшные.'усики широкоовальные, закругленные, по длине лишь немного превосходят подиальный бугорок.
Окраска тела желтовато-зеленая, с небольшими темными, коричневыми, поперечными полосками и пятнами на спинной стороне сегментов и у основания упараподий; спинные усики с легкой точечной коричневой пигментацией. Количество сегментов до 200—250. Длина тела до 100 мм, ширина до '3 мм.
Зрелые яйца в полости тела у Ph. maculata в Кольском заливе наблюдались в январе—марте, кладки на прибрежных водорослях — в апреле (Ушаков, 1925); в губе Дальне-Зеленецкой (Восточный Мурман) кладки были находимы с мая по октябрь (Кузнецов и Матвеева, 1948); в Белом море половозрелые самки с большим количеством яиц в параподиях отмечены в мае. Кладки имеют зеленоватую окраску.' Количество зародышей в одной кладке до 150 тысяч (Петровская, I960). На Курильских островах половозрелые особи на литорали были отмечены в декабре и апреле (Хлебович, 1961).
Распространение. В коллекциях ЗИН имеется около 200 экземпляров из Баренцева, Белого, Берингова, Охотского и Японского морей и из района Южных Курильских островов, общая глубина 0—300 м, но преимущественно на глубинах до 50 м; в Анадырском заливе Берингова моря образует поселения в сублиторали до 40 экземпляров на 1 м2 или 4.7 г/м2 (Левенштейн, 1966). По литературным данным отмечен для тихоокеанского побережья Канады (Ванкувер), побережья о. Хоккайдо; в северной части Атлантического океана распространен от западного берега Гренландии вдоль атлантического побережья Северной Америки до залива Массачусетс, а также в районе Исландии, Фарерских островов, побережья Норвегии, в Северном море, с заходом в западную часть Балтийского моря, Ла-Манш; в последнее время был указан для западного побережья Африки — Берега Слоновой Кости (Guy, 1964), встречается в Черном море (Виноградов, 1949).
6. Phyllodoce (Anaitides) mucosa Oersted, 1843
(Табл. VI, I)
Malmgren, 1867 : 21, tab. II, fig. 7; Webster a. Benedict, 1887 : 710; Bergstrom, 1914 : 143—144, fig. 43; Fauvel, 1923 : 152—153, fig. 54, a—e; Hartman, 1948a : 19; E. Berkeley a. C. Berkeley, 1948 : 46, fig. 68; S t 0 p - В о wi tz, 1948 : 16; Wesenberg-Lund, 1950a : 10, chart 13, pl. I, fig. 3; Banse, 1959 : 422; Eliason, 1962a : 19; Pettibone, 1963 : 81—82, fig. 18 f, g.
Головная лопасть того же,типа, что и Ph. maculata. Дистальная часть хобота шестигранная с поперечными складками; проксимальная часть хобота с 12 продольными рядами папилл, по 8—10 папилл в одном ряду. Щупальцевидные усики, оттянутые назад, достигают VIII—X щетинковых сегментов. На II сегменте щетинки отсутствуют, на III сегменте (1 \ 1
1 -ф- Oj- + sir-
На передних туловищных сегментах спинные усики овально-удлиненные; на средних сегментах неправильной, вытянутой, заостренной, формы, длина их в l1/^ раза больше ширины; брюшные усики сильно вытянутые, заостренные, по длине почти в два раза превышают подиальный бугорок.
136
I. PHYLLODOCIDAE
Окраска тела грязновато-серая, с коричневыми полосками (пятнами) по середине и по бокам (у основания параподий) на каждом сегменте, образующими три продольные темные полосы на спинной стороне червя; спинные усики светлые, слегка пигментированные или с темными пятнами посредине. Количество сегментов 100—200. Длина тела до 100—150 мм, при ширине 2—3 мм. •
Примечание. От Ph. maculata (Linne) отличается более вытянутыми и заостренными брюшными усиками. Указания о нахождении Ph. mucosa Oersted в Белом море (Дерюгин, 1928; Свешников, 1951) и в Баренцевом море (Зацепин, 1948) нуждаются в подтверждении; возможно, в данных случаях за Ph. (Л.) mucosa Oerst. были приняты молодые Ph. (Л.) groenlandica Oerst.
Распространение. В коллекциях ЗИН имеются экземпляры из Черного моря — Керченский пролив, Одесский залив, побережье Румынии, глубина 41—87 м, и с атлантического побережья Франции (Роскоф). По литературным данным встречается по восточному побережью Америки от побережья Лабрадора (Гудзонов залив) до Мексиканского залива; у побережья Исландии, Фарерских островов, в Северном море, в районе Орезунда, Ла-Манш, в Средиземном море, у Азорских островов, западного берега Африки, а также в Тихом океане от побережья Аляски до побережья Южной Калифорнии и Мексики. Общая глубина 0—425 м.
7. Phyllodoce (Anaitides) citrina Malmgren, 1865
(Табл. V, 5—6}
Malmgren, 1865 : 45, tab. XIII, fig. 24; Theel, 1879 : 35; Marenzeller, 1900 : 2; Moore, 1908 : 328; Bergstrom, 1914 : 140—141, fig. 41; Fauvel, 1923 : 150, fig. 52, k—1; Berkeley, 1924 : 287; Augener, 1928 : 705; Дерюгин, 1928 : 239; 3 а к c, 1929 : 42; Hartman, 1948a : 19—20; Зацепин, 1948 : 111, табл. XXIX, 5, b, с; E. В e r k e 1 e у а. С. В e r k e 1 e у, 1948 : 45, fig. 63; W e sen b erg - L und, 1960b : 32, chart 8; У ш а к о в, 1955а : 91, рис. 3, Г; Eliason, 1962а : 18.
Головная лопасть широкая, затылочная папилла хорошо видна. Дистальная удлиненная часть хобота цилиндрическая, совершенно гладкая или с 6 продольными рядами неясно обозначенных поперечных складок и бугров; краевых папилл 17. В проксимальной части хобота 8 продольных рядов из 3—6 темно пигментированных папилл (продольные ряды папилл расположены с боков глотки, по 4 ряда с каждой стороны). Щупальцевидные усики, оттянутые назад, достигают X—XII щетинковых сегментов. На II сегменте щетинки отсутствуют, на III сегменте имеются. Формула передних сегйентов: ^1 -|- О у) +5-^-.
На передних туловищных сегментах спинные усики округлые, на средних сегментах поперечно-овальные, сильно оттянутые на дорсальную сторону червя. Брюшные усики широкие, равны или немного длиннее подиального бугорка.
Окраска тела зеленовато-желтая или коричневатая (в спирту сероаспидная), с темными поперечными пятнами по середине спинной стороны сегментов, образующими сплошную темную продольную полосу вдоль средней линии тела; спинные усики желтоватые, светлее спинной стороны сегментов. Количество сегментов до 150—200. Длина тела до 200 мм, ширина до 6 мм.
Примечание. Для этого вида отмечены (Fauvel, 1923; Е. Berkeley а. С. Berkeley, 1948) глаза небольшие, однако в нашем материале
5. PHYLLODOCE
J 37
имелись экземпляры с весьма крупными глазами, такими- я?е, как и у Ph. groenlandtca Oersted.
Распространение. В наших коллекциях 60 экземпляров; встречается во всех северных и дальневосточных морях, но значительно реже, чем Ph. groenlandtca Oerst.; общая глубина 10—270 м. По литературным данным отмечен для западного берега Гренландии (Wesenberg-Lund, 1950b), Северного моря (Friedrich, 1938), района Орезунда (Eliason, 1962а), а также для Аляскинского залива (Hartman, 1948а) и западного берега Канады (Е. Berkeley а. С. Berkeley, 1948).
8. Phyllodoce (Anaitides) chinensis Uschakov et Wu, 1959
(Табл. VI, 2—4)
Ушаков иУБао-лин, 1959 : 22—23, табл. I, А—В; 1965 : 147—148, рис. 1, А—В.
Головная лопасть широкая, с неглубоким затылочным вырезом и затылочной папиллой. По бокам головной лопасти хорошо выраженные нухальные папиллы. Хобот очень крупный, цилиндрический (до 7 мм длины); в проксимальной части с боков по 6 сильно сближенных продольных рядов папилл; в каждом продольном ряду до 9 удлиненных папилл; на дорсальной стороне хобота добавочная обособленная группа папилл, состоящая из 2 продольных рядов (до 5 папилл в каждом ряду). У наружного края хобота 17 краевых папилл. Наиболее длинные щупальцевидные усики — спинные усики II и III сегментов; они достигают по длине XI сегмент. На II и III сегментах щетинки отсутствуют. На III сегменте вместо оформленной невроподии имеется лишь небольшой бугорок. Формула передних сегментов: (1 -}- О + О .
Спинные усики широкоовальной или бобовидной формы; ширина их значительно больше высоты. Брюшные усики слегка заостренные, несколько выступают за пределы подиального бугорка. По краю спинных и брюшных усиков большое количество удлиненных желез.
Спинные усики желтовато-зеленого оттенка, вдоль спинной стороны тела проходит продольная темная полоса [как у Ph. (Anaitides) groenlan-dica n. orientalis Zachs]. Количество сегментов свыше 200. Длина тела до 160 мм, ширина 5 мм, включая параподии.
Примечание. Характеризуется отсутствием нормально развитой невроподии на III сегменте, в соответствии с чем в приведенной формуле на III сегменте вместо N проставлен О ( в вашей работе 1965 г. в указанную формулу вкралась ошибка и О поставлен на II сегменте). По форме своих спинных усиков отчасти напоминает Ph. (A.) groenlan-dica и Ph. (A.) citrina. но отличается от них отсутствием щетинок на III сегменте и количеством продольных рядов папилл в проксимальной части хобота. Наличие дополнительных непарных рядов папилл на дорсальной стороне хобота отмечено для ряда видов, в частности для Ph. (A.) madeirensis (см. стр. 138), но последний имеет иную форму спинных усиков.
Распространение. Желтое море — Циндао, литораль и верхние горизонты сублиторали до глубины 8 м (в коллекциях ЗИН хранится котип; типовой экземпляр — в Институте океанологии КНР в Циндао),
138
I. PHYLLODOCIDAE
9. Phyllodoce (Anaitides) madeirensis Langerhans, 1880
(Табл. VI, 7—8)
Langerhans, 1880 : 307, pl. XVII, fig. 44; Fauvel, 1919 : 361—364, fig. II (синонимия); 1923:150—151, fig. 23, d—h; Treadwell, 1926:12—13, pl. 2, figs. 19—21 (Ph. pulla); Fauvel, 1932 : 70 (синонимия); Okuda, 1937b : 269—270, fig. 10; Fauvel, 1939 : 275; [non E. Berkeley a. C. Berkeley, 1948 : 45; cm.: Hartman a. R e i s li, 1950 : 11, -=A n.o.itldes medipapillata (Moore, 1909)]; Wesenberg-Lund, 1949 : 272—273; Fauvel, 1953 : 120—121, fig. 59, d—h; [non Friedrich, 1956 : 57—58]; Fauvel et R oilier, 1957 : 60—62 (синонимия); Day, 1960 : 296—297; Imajima a. Hartman, 1964 : 60 (Anaiti-des); R u 1 1 i e r, 1964 : 197; 1965a : 21.
Головная лопасть с глубоким задним вырезом и хорошо заметной затылочной папиллой. 2 очень крупных черных глаза. Хобот в проксимальной части с 12 продольными рядами папилл (по 6 продольных рядов с каждой латеральной стороны); в одном продольном ряду до 8—12 папилл; кроме того, на дорсальной стороне хобота иногда имеется добавочный 13-й ряд из 4—6 папилл. На II и III сегментах щетинки отсутствуют: (1 + О -(-О — . Спинные щупальцевидные усики II сегмента, отогнутые назад, достигают XII сегмента. Спинные усики на передних сегментах относительно небольшие, правильной ланцетовидной формы; в средней части' тела они очень крупные, сильно вытянутые, заостренные, неправильной’ формы; брюшные усики заостренные, несколько крупнее подиального бугорка.
Спинная сторона сегментов у наших спиртовых экзмпляров слабо пигментирована (с едва заметными поперечными штрихами), спинные усики несколько светлее спинной стороны сегментов. Для экземпляров с побережья Японии (Imajima a. Hartman, 1964) отмечена светло-желтовато-серая окраска до коричневой с темным фиолетовым отливом; усики, параподии и брюшная сторона коричневые. Количество сегментов может быть свыше 300 (Okuda, 1937b). Размеры: длина тела достигает свыше 100 мм (наш не целый экземпляр с о. Хайнань имел в длину почти 90 мм, при ширине около 2 мм).
Примечание. По Гартман (Hartman, 1959: 143), Ph. (A.) madeirensis весьма близок к Anaitides erytrophyllus (Schmarda, 1861), встречающемуся в районе Вест-Индии и Мексиканского залива (Hartman, 1951). Указания о нахождении Ph. (A.) madeirensis в антарктических и субантарктических водах (Ehlers, 1897, 1913; Willey, 1902; Benham, 1927) ошибочны и экземпляры из указанных вод относятся к Ph. (A.) patagonica (Kinberg, 1886), у которого на III сегменте всегда имеются щетинки, в то время как у типичных Ph. (A.) madeirensis на III сегменте они отсутствуют (Ушаков, 1962 : 138).
Распространение. В коллекциях ЗИН имеется один половозрелый (с большим количеством яиц в параподиях) экземпляр со. Хайнань, риф из мертвого полипняка, май 1958, и 4 экземпляра из Тонкинского залива, глубина 29—42 м, январь 1960.
Широко распространенный, преимущественно тропический вид: побережье Франции, Испании, западное побережье Африки, Мадагаскар, у побережья Индии, Индокитай, Малайский архипелаг, Филиппинские острова, Япония, Австралия, Новая Каледония, острова Галапагос, побережье Калифорнии.
5. PHYLLODOCE
139
10. Phyllodoce (Anaitides) papillosa Uschakov et Wu, 1959
(Табл. VI, 5—6) :
Ушаков и У Б а о - л и п, 1959 : 23—24, табл. 1, Г, Д; К а о, 1959 : 141, pl. VI, fig. 1, а—с (Phyllodoce sp.); Ушаков и У Б а о - л и п, 1965 : 148—149, рис. 1, Г, Д', [non Paranaitis papillosa (Ehlers, 1887)].
Головная ^опасть немного вытянутая, с затылочным вырезом и очень маленькой,' плохо заметной затылочной папиллой; 2 крупных глаза, иногда хорошо виден хрусталик. По бокам головной лопасти, у ее заднего края, имеются втягивающиеся нухальные выросты (на экземплярах со втянутой глоткой они плохо заметны). Хобот резко поделен на дистальную и базальную части. В базальной части хобота 12 продольных рядов пигментированных папилл (по 6 рядов с каждой боковой стороны). Дистальная часть хобота покрыта со всех сторон очень крупными, сосочковидными папиллами, придающими этой части глотки мохнатый вид. Наиболее длинные щупальцевидные усики — спинные усики II и III сегментов; они достигают по длине IX сегмент. На II и III сегментах щетинки отсутствуют. Формула передних сегментов: (1 -|- О -0 -|- О .
Спинные усики на туловищных сегментах неправильной, слегка вытянутой формы (длина их несколько превышает ширину); сидят на высоких подставках. Брюшные усики заостренные, несколько выступают за пределы подиального бугорка. На спинной стороне сегментов хорошо выражена вторичная кольчатость.
Окраска спиртовых экземпляров весьма равномерная, от светло- до темно-бежевого пвета; наиболее темно окрашены HI—V сегменты; по середине спинных усиков иногда наблюдается легкая пигментация. У половозрелых экземпляров в результате просвечивания яиц окраска брюшной стороны и параподиальных выростов красноватая. Количество сегментов до 270. Длина тела до 120 мм, ширина 2.5 мм, включая параподии.
Половозрелый экземпляр, набитый яйцами, отмечен в июне; у него спинные усики более широкие, чем у остальных экземпляров.
Примечание. В последнее время Имаджима (Imajima, 1967) с западного побережья Японии (полуостров Ното) описал новый вид Ph. japonica Imajima, 1967, который по его же указаниям отличается от нашего вида лишь следующим: 1) отсутствием нухальиых выростов с боков головной лопасти у ее заднего края (но эти органы втягивающиеся, и, возможно, у экземпляра Имаджима они находились в сокращенном состоянии, почему он и не заметил их), 2) более темной окраской передних сегментов, 3) дистальные папиллы на хоботе у Ph. japonica сферические, а у нашего заостренные, и 4) в базальной части папиллы сгруппированы в 10 рядов, а не в 12, как у нашего вида. Последний признак наиболее существенный, но Имаджима, к сожалению, имел экземпляр со втянутым хоботом и о количестве рядов папилл он мог судить лишь по препарату рассеченного хобота, что не дает четкой картины. Во всяком случае, если это не идентичные, то очень близкие виды. Кроме того, О. Гартман (Hartman, 1961 : 63) отметила для побережья Калифорнии Phyllodoce sp., который, по ее мнению, также весьма близок к Ph. papillosa Uschakov et Wu и отличается от него лишь меньшими размерами. По наличию крупных ланцетовидных папилл на дистальной части хобота наш вид отчасти напоминает Ph. macropapillosa Saint-Joseph, 1895, но отличается от него отсутствием щетинок на II и III сегментах.
Тип хранится в Институте океанологии в Циндао (КНР).
140
I. PHYLLODOCIDAE
Распространение. В коллекциях ЗИН имеется 19 экземпляров из Желтого моря — заливы Циндао и Чифу, литораль и верхние горизонты сублиторали; один очень близкий экземпляр найден на литорали о. Хайнань. Вид пока эндемичный для субтропических вод северо-западной части Тихого океана.
6. Род PARANAITIS Southern, 1914
[=sAnaitis Malmgren, 1865 (praeoccup. Duponohel, 1829, pro Lepidoptera)]
Головная лопасть широкоовальная; задний ее край округлый или конический, с затылочным язычком, на конце которого находится нухаль-ная папилла. 4 головных щупальца. Одна пара глаз, нередко с хорошо заметными хрусталиками, или глаза отсутствуют. Хобот с боковыми продольными рядами крупных папилл. Граница между I и II сегментами обычно неразличима; они значительно крупнее последующих сегментов и образуют подобие «ошейника», охватывающего головную лопасть с боков. 4 пары цилиндрических или слегка сплющенных щупальцевидных усиков. Формула передних сегментов: Параподии одно-
ветвистые. Спинные усики широкие, бобовидные, очень крупные, частично прикрывающие спинную сторону червя (при беглом взгляде они отчасти напоминают спинные чешуйки полипоид). Щетинки только сочлененные.
Типовой вид: Anaitis wahlbergi Malmgren, 1865.
Род насчитывает около 12 видов. В наших водах встречается 2 вида: в арктических морях — Р. wahlbergi (Malmgren) и в дальневосточных морях — Р. polynoides (Moore); кроме того, к востоку от о. Хонсю в материалах э/с «Витязь» обнаружен новый вид — Р. caecum sp. nov.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА PARANAITIS SOUTHERN
1 (4). Глаза имеются.
2 (3). Головная лопасть с округлым задним краем без резко выраженного затылочного язычка и нухальной папиллы. Тело зеленовато-коричневого цвета, спинные усики желтовато-оливковые ..............
.................................1. Р. wahlbergi (Malmgren).
3 (2). Головная лопасть на заднем конце имеет удлиненный затылочный язычек с нухальной папиллой. Тело светло-бежевое с продольной медиальной полосой красновато-коричневого цвета на спинной стороне; спинные усики также светло-бежевые, ро имеют по одному темному центральному пятну, которые, сливаясь между собой, образуют две боковые продольные полосы вдоль всего тела...........
.................................. 2. Р. polynoides (Moore).
4 (1). Глаза отсутствуют ...............3. Р. caecum Uschakov.
1. Paranaitis wahlbergi (Malmgren, 1865)
(Табл. VII, 8—9)
Malmgren, 1865 : 94, tab. XIV, fig. 31 (Anaitis); Theel, 1879 : 35 (Anaitis); W i r e n, 1883 : 401 (Anaitis); Marenzeller, 1892 : 405—407 (Anaitis); Fauvel, 1911 : 26 (Anaitis); Bergstrom, 1914 : 155—156, Textfig. 51 (Anaitis); A u g e n e r, 1928 : 705—706 (Anaitis); Анненкова, 1932a : 168 (Anaitis); Горбунов, 1946 : 38 (Anaitis); Зацепин, 1948 : 112 (Anaitis); Wesenberg-L u n d, 1950a : 10, chart 13; 1951 : 25; 1953 : 30 (Anaitis); Hartman, 1965a : 62.
6. PARANAITIS
141.
Головная лопасть с широким округлым задним краем, без резко выраженного затылочного язычка; нухальная папилла различима с трудом. 2 крупных глаза. Хобот тонкий и очень длинный, в небольшой проксимальной своей части он гладкий и сильно пигментирован с дорсальной стороны, в остальной своей части имеет 2 продольных ряда боковых папилл. Слившиеся со спины I и II сегменты почти в 2 раза шире головной лопасти. Щупальцевидные усики по длине достигают примерно V щетиикового сегмента. На спинной стороне туловищных сегментов заметна вторичная кольчатость? Спинные усики на передних сегментах менее крупные, чем на последующих; в средней части тела спинные усики широкоовальные, бобовидные, очень крупные, прикрывают значительную часть спины; подставки спинных усиков низкие и широкие. Брюшные усики крупные, листовидные, нижний их край с вырезом. Подиальный бугорок раздвоен на конце, причем верхняя губа немного крупнее нижней; губы закругленные. Ацикула светло-желтая, очень длинная и упругая; иногда она заметно изогнута и прижата к дорсальному краю подиального бугорка. Щетинки длинные, тонкие, весьма многочисленные (свыше 100 в одном пучке). Сочленительные зубцы рострума щетинок с шипиками разной величины; дистальный членик длинный.
Окраска спиртовых экземпляров: тело зеленовато-коричневое с легким иризирующим отливом, брюшная сторона немного светлее спинной; спинные усики желтовато-оливковые. Весьма крупные черви: количество сегментов свыше 200, длина тела достигает более 125 мм, ширина — до 15 мм, включая параподии и щетинки (бёз щетинок 12 мм); тело сильно сплющенное.
Половозрелые экземпляры отмечены в сентябре; яйца заходят в полость подиального бугорка.
Примечание. Некоторые авторы (Southern, 1914; Ditlevsen, 1917) объединяют Р. wahlbergi (Malmgren) и Р. kosteriensis (Malmgren) в один вид, однако сопоставление наших экземпляров Р. wahlbergi из арктических морей с Р. kosteriensis из района Каттегата по материалам А. Элиазона заставляет считать, что это разные виды. У Р. wahlbergi задний край головной лопасти округлый, у Р. kosteriensis с язычком; кроме того, Р. kosteriensis не достигает таких крупных размеров, как Р. wahlbergi. Окраска у этих видов также разная: Р. wahlbergi имеет зеленоватую пигментацию, а Р. kosteriensis — красновато-коричневую. Р. kosteriensis отмечен для западного берега' Швеции, у побережья Дании, Шотландии и Ирландии, а в последнее время и для района Лабрадора (Pettibone, 1956, 1963).
Распространение. В коллекциях ЗИН имеется около 60 экземпляров из Баренцева моря, района Земли Франца-Иосифа, Новой Земли, Карского моря, района Новосибирских островов; общая глубина 30— 460 м. По литературным источникам указан для района Шпицбергена, Гренландии, Ян-Майен, Исландии и Северного моря до Каттегата; в Норвежском море добыт с глубины 1200 м (Hansen, 1882:22). Преимущественно арктический вид.
2. Paranaitis polynoides (Moore, 1906)
(Табл. VII, 1—4)
Moore, 1909а : 339—342, pl. XVI, figs. 19—21 (Anaitis)', Berkeley, 1924 : 287 (Anaitis)', Закс, 1933 : 127 (Anaitis)' Анненкова, 1937 : 156; 1938 : 141—142 [Phyllodoce (Anaitis)]; E. Berkeley a. C. Berkeley, 1948 : 44, fig. 62 [Phyllodoce (Paranaitis)]; Ушаков, 1955a : 94, рис. 2, В, Г и рис. 3, Д, Е (Anaitis).
142
I. PHYLLODOCIDAE
Головная лопасть сзади имеет хорошо выраженный затылочный язычок, лежащий в углублении первого сегмента; на заднем конце затылочного язычка хорошо различима нухальная папилла; длина головной лопасти, без затылочного язычка равна примерно половине ее ширины. 2 крупных глаза, иногда хорошо виден хрусталик. Хобот имеет трехграп ное очертание, входное отверстие обрамлено многочисленными краевыми папиллами, из которых выделяются две наиболее крупные конические папиллы, обращенные внутрь отверстия; дистальная часть глотки с многочисленными резкими, поперечными складками, которые располагаются в 6 продольных полос, из них боковые полосы наиболее выпуклые; проксимальная часть хобота с боковыми продольными рядами из немногочисленных округлых папилл. Первый сегмент со спины слит или едва заметной и неполной бороздкой отделен от II сегмента. Щупальцевидные усики цилиндрические, слабо сплющенные, сидят на высоких подставках (цир-рофорах); верхние щупальцевидные усики II сегмента и щупальцевидные усики III сегмента заметно длиннее остальных; оттянутые назад, они достигают VI—VIII щетинковый сегмент. На передних сегментах спинные усики округлые, на последующих — поперечно овальные, весьма крупные, несколько оттянуты на спинную сторону и прикрывают собой значительную часть спины; брюшные усики продолговато-овальные, примерно такой же величины, как подиальный бугорок. Подиальный бугорок раздвоенный, верхняя губа немного крупнее нижней. Ацикула светло-желтая. Щетинки многочисленные, около 50 в одном пучке. Сочленительный зубец рострума щетинки с двумя поперечными рядами мелких шипиков; дистальный членик длинный, с очень мелкими зубчиками по внутреннему краю. Анальные усики сильно вытянутые — длина их более, чем в 3 раза превышает ширину.
Окраска червя весьма характерная: на светло-бежевом фоне спинной стороны выделяется продольная медиальная полоса красновато-коричневого цвета с голубоватым отливом; кроме того, каждый спинной усик в центре имеет по темному пигментному пятну того же цвета; сливаясь между собой, эти пятна образуют две боковые продольные полосы; брюшная сторона червя не окрашена; щупальцевидные усики имеют легкую красноватую пигментацию. Количество щетинковых сегментов до 85. Длина тела до 45 мм, максимальная ширина 4 мм, включая параподии со щетинками.
Примечание. Р. polynoides отчасти напоминает Р. speciosa, (Webster, 1880), указанный для атлантического побережья Северной Америки — Чесапикский залив (Pettibone, 1963), но последний не имеет нухальной папиллы и, кроме того, у этого вида на IX и X сегментах наблюдаются широкие темные поперечные пигментные полосы, отсутствующие у Р. polynoides. w
Распространение. Наши экземпляры добыты в Японском море (залив Петра Великого, Татарский пролив, побережье Южного Сахалина), у южных Курильских островов и в Тонкинском заливе, глубина 8—286 м (34 экз.). Северотйхоокеанский вид; отмечен для юго-восточного побережья Камчатки, западного побережья Канады и побережья Калифорнии — залив Монтерей, Лос-Анжелес.
3. Paranaitis caecum Uschakov sp. nov.
(Табл. VII, 5—7)
Головная лопасть с хорошо выраженным затылочным язычком; нухальная папилла крупная. Глаза отсутствуют. Хобот втянут (остался не исследованным). У более крупного экземпляра I сегмент тонкой,
7. CHAETOPARIA . ’ 143
слабо заметной линией отделен от II, у более мелкого экземпляра граница между двумя.первыми сегментами не видна. I сегмент значительно шире головной лопасти. Щупальцевидные усики III сегмента по длине достигают VIII—IX сегменты. Спинные усики широкие, слегка асимметричной, бобовидной формы, прикрывают значительную часть Спинной поверхности червя; спинные убики с крупными железистыми клетками, преимущественно вдоль наружного края. Брюшные усики немного короче подиального бугорка. Верхняя губа подиального бугорка крупней нижней. Ацикула светлая, крупная. Щетинки многочисленные, с длинным дистальным члеником; рострум щетинки имеет очень крупный сочленительный зубец; дистальный членик с мелкой пильчатостыо.
Тело светлое, неокрашенное; спинные усики наполовину светлые, наполовину желтовато-зеленые, образуя вдоль медиальной линии спины две продольные темные полосы. Количество сегментов у более крупного экземпляра 62. Длина тела до 20 мм, ширина с параподиями без щетинок 2 мм; длина дистального членика щетинок до 0.1—0.5 мм.
В коллекции имеется 2 экземпляра, более крупный выделен как тип. Тип хранится в ЗИН АН СССР, инв. № 1/16140 («Витязь», ст. 3580). Примечания. Отчасти напоминает Р. polynoides (Moore), но отличается от него отсутствием глаз, более длинными щупальцевидными усиками и несколько иной формой спинных усиков.
Распространение. Северо-западная часть Тихого океана — к востоку от о. Хонсю: 38°38' с. ш. и 141 °53' в. д., глубина 239 м («Витязь», ст. 3580, май 1957 — тип) и 38°36' с. ш. и 142°12' в. д., глубина 598 м («Витязь», ст. 3579, 1 экз.).
7. Род CHAETOPARIA Malmgren, 1867
Головная лопасть неясно отделена от I сегмента. 4 фронтальных головных щупальца, у самого заднего края головной лопасти медиальная удлиненная папилла. Хобот диффузно покрыт мелкими папиллами. I и II сегменты слиты, III сегмент отделен неясно. 4 пары щупальцевидных усиков. Формула передних сегментов: (1 Д- Су1 Д- С Д- С — Д- . На II—IV сегментах простые золотистые крючковидные щетинки, на последующих сегментах щетинки сочлененные (с удлиненным дистальным члеником).
Род представлен всего одним видом — Chaetoparia nilssoni Malmgren, 1867.
Наш диагноз рода Chaetoparia несколько отличается от такового, приведенного в работе Э. Бергштрёма (Bergstrom, 1914 : 88—90); обоснования приведены при описании вида. Описание вида дано по экземпляру, добытому в районе Кристинбергской биологической станции (Швеция) на глубине 35 м и любезно присланному мне А. Элиазоном (Естественно-исторический музей в Гётеборге); экземпляр хранится в ЗИН, инв. № 1/15184.
1. Chaetoparia nilssoni Malmgren, 1867
(Табл. XIV, 5—10)
Malmgren, 1867 : 29, tab. II, fig. 5, a—d; Bergstrom, 1914 :169—172, Taf. II, Fig. 2, Taf, III, Fig. 3, Textfig. 60.
Головная лопасть с одной парой погруженных, неясно различимых глаз. Хобот у нашего экземпляра лишь частично вывернут наружу;
144
I. PHYLLODOCIDAE
в нижней своей части его поверхность покрыта мелкими гранулами. I и II сегменты образуют с боков головной лопасти широкий «ошейник», как у Paranaitis', они несут 3 пары удлиненных щупальцевидных усиков. Впереди и несколько снизу от вентральных щупальцевидных усиков II сегмента находится небольшая поперечная складка, из которой слабо высовываются небольшие, прямые, золотистые игловидные щетинки (по 5—6 с каждой стороны). На брюшной стороне III сегмента хорошо заметны боковые бугры (подушечки), из переднего края которых высовываются наружу крупные простые, несколько изогнутые, золотистые щетинки с боковой оторочкой (табл. XIV, 10), образующие плотный поперечный ряд. На III сегменте имеется лишь 1 пара щупальцевидных усиков, невроподии нет (!). Наиболее длинные щупальцевидные усики — II дорсальные и III; они по длине достигают VII сегмента. На IV сегменте имеются спинной усик, аналогичный по форме и размерам спинным усикам, остальных туловищных сегментов (Бергштрём указанный спинной усик рассматривает как брюшной усик III сегмента) и очень небольшой брюшной усик (последний Бергштрём, по-видимому, не заметил); между спинным и брюшным усиками подиального бугорка на IV сегменте не , но на переднем крае IV сегмента, на границе с III сегментом, на его брюшной стороне торчат несколько коротких простых игловидных щетинок по 3—4 более крупных ближе к бокам сегмента и 4 очень крохотные, едва заметные щетинки в медиальной части сегмента (эти щетинки Бергштрём относит к III сегменту). Все последующие сегменты нормального строения. Спинные усики овальной ложковидной формы, сидят на высоких подставках, имеющих удлиненный вырост, охватывающий спинную сторону самого усика более чем на половину его длины; по наружному краю этого выроста проходит тяж из ресничного эпителия. Брюшные усики заметно крупнее подиального бугорка. Подиальный бугорок на дистальном конце слабо раздвоен, имеет одну ацикулу и пучок из приблизительно 12 сложных щетинок; последние с удлиненным гибким дистальным члеником. Анальные усики сильно вытянутые, длина их примерно в 10 раз больше ширины, с заостренным концом (длина около 0.5 мм).
Окраска тела спиртового экземпляра светло-бежевая; на спинной стороне каждого сегмента по одной более темной поперечной полосе, протянутой от параподии до параподии; спинные усики немного темнее тела; на некоторых спинных усиках сохранились небольшие темные пигментные точки. Количество сегментов около 100, последние сегменты недоразвитые. Длина тела 30 мм, ширина 2 мм, включая параподии со щетинками.
Примечание. Этот вид отличается от всех остальных видов донных филлодоцид наличием крючковидных золотистых щетинок на II—IV передних сегментах. Причины появления крупных крючковидных щетинок на передних сегментах в морфо-функциональном отношении не ясны (последнее было бы отчасти понятно, если бы они жили в трубках, но указаний об этом нет). Подобные, но еще более крупные крючковидные щетинки на 2—3 передних туловищных сегментах отмечены лишь у пелагических Lopadorhynchus (возможно, эти щетинки у последних служат для удержания захваченной добычи). Наличие простых крючковидных щетинок на передних сегментах у Chaetoparia и Lopadorhynchus, а также слияние головной лопасти с I сегментом несколько сближает оба указанных рода, несмотря на то что первый из них — донные филлодоциды, а второй — типично пелагический, сильно специализированный род (см. стр. 184). Возможно, что в данном случае мы имеем какие-то указания
8. EULALIA ’ . 145
__________________________________________________—________v ' :
на родственные связи и общность происхождения; предположить параллелизм в развитии значительно труднее, обе ’указанные формы обладают совершенно разной, экологией.
Распространение. Пролив Каттегат.
8. Род EULALIA Savigny, 1817
[incl. Hypoeulalla Bergstrom, 1914]
Головная лопасть немного вытянутая, округлая или слегка заостренная спереди. 5 головных щупалец: 4 на переднем конце и 1 на спинной стороне головной лопасти ближе к заднему краю. Одна пара обычно крупных глаз, иногда с добавочными, небольшими глазными пигментными пятнами, или глаза отсутствуют вовсе. Три передних сегмента полностью обособлены, т. е. четко отделены друг от друга и от головной лопасти; 4 пары щупальцевидных усиков веретеновидной формы. На II сегменте щетинки имеются или отсутствуют, на III сегменте они всегда имеются: 11 11
15у5 — или 1 + Оу -f- S-^-. Хобот с папиллами, диффузно расположенными или образующими в дистальной части 6 продольных полос. Параподии одноветвистые. Щетинки только сочлененные, но у эпитока-льных половозрелых форм иногда появляются добавочные простые, длинные, волосовидные щетинки.
Типовой вид: Nereis viridis Linne, 1767 (О. F. Muller, 1776).
Описано около 40 видов, систематическое положение многих из них пока остается не вполне ясным. В Полярном бассейне и северо-западной части Тихого океана встречается 5 видов. Выделенный Р. Я. Левенштейн (1961) новый вид — Eulalia sphaerocephala перенесен в род Austrophyllum (см. стр. 163).
В состав рода Eulalia Savigny П. Фовель (Fauvel, 1923) и некоторые другие авторы включают в качестве подродов Eumida Malmgren и Pterocirrus Claparede, однако последние в Настоящей работе мной рассматриваются как самостоятельные роды, отличающиеся от Eulalia s. str. редукцией I сегмента.
Э. Бергштрёмом (Bergstrom, 1914) был предложен новый род Ну-poeulalia для двух видов — Eulalia bilineata (Johnston, 1840) и Е. subulifera Ehlers, 1897 — на основании того, что у них I сегмент сливается с головной лопастью. Однако у Е. bilineata при внимательном изучении обычно удается заметить границу между головной лопастью и I сегментом, а потому этот вид следует считать как представитель рода Eulalia s. str. Что же касается Eulalia subulifera, отмеченного для Антарктики многими авторами, то, по нашему мнению, в данном случае смешиваются два различных вида. Э. Элерс (Ehlers, 1897), описавший данный вид, указывает, что у его молодых экземпляров все три передних сегмента отделены друг от друга и головной лопасти, а у взрослых — I и II сегменты слиты. Такого рода возрастные изменения нам представляются маловероятными, во всяком случае это нуждается еще в тщательной проверке. Следует отметить, что у наших весьма небольших, всего около 0.5 см длины, экземпляров Eulalia subulifera из Антарктики (Ушаков, 1962) два первых сегмента со спины слиты и по этому признаку они должны быть отнесены к роду Eumida Malmgren. Наряду с этим Ш. Гравье (Gravier, 1907) под этим же названием описывал экземпляры, у которых все три передних сегмента четко отделены друг от друга, т. е. как у типичных представителей рода Eulalia s. str.
10 П. в. Ушаков
146
I. PHYLLODOCIDAE
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА EULALIA SAVIGNY
1 (G). Хобот с диффузно рассеянными папиллами.
2 (3). Спинные усики овально-продолговатые, с тупым закругленным концом ................................ 2. Е. bilineata Johnston.
3 (2). Спинные усики сильно вытянутые, с тонким заостренным концом.
4 (5). Глаза имеются. Подиальный бугорок с короткими, равной величины, закругленными верхней и нижней губами . . 1. Е. viridis (L.).
5 (4). Глаза отсутствуют. Подиальный бугорок с удлиненной, заостренной верхней и короткой закругленной нижней губами ...............
...................................3. Е. sigeformis Annenkova.
6 (1). Хобот в дистальной части имеет 6 продольных рядов крупных папилл.
7 (8). Щупальцевидные усики длинные (достигают XII сегмент) . . . .
........................... 4. Е. austrophylloformis Uschakov.
8 (7). Щупальцевидные усики короткие (достигают VII сегмент) . . . . ....................................... 5. Е. gravieri Uschakov.
1. Eulalia viridis (Linne, 1767)
(Табл. VIII, 1—4)
Malmgren, 1865 : 98, tab. XV, fig. 39; McIntosh, 1908 : 55—60, pl. XLIV, fig. I, pl. LXIII, fig. 3, pl. LXVII, figs. 10-11, pl. LXXVIII, figs. 2—2a (синонимия); Izuka, 1912 : 205—206, pl. XXI, fig. 6; D i t le v sen, 1914 : 686; Bergstrom, 1914 : 123—125, fig. 32; Дерюгин, 1915 : 322; Fauvel, 1923 : 160, fig. 57, a—h; A u g e n e r, 1928 : 706; Дерюгин, 1928 : 239; Annenkova, 1934 : 322; Fauvel, 1936 : 58; Анненкова, 1937 : 157; 1938 : 142; Горбунов, 1946 : 38; Ушаков, 1948a : 27; Зацепин, 1948 : 112, табл. XXIX, 8, b, с, d; Hartman, 1948a : 20, fig. 5; E. В erkeley а. С. В e r k e 1 e y, 1948 : 48—49; Виноградов, 1949 : 3.1—32; Ушаков, 1950 : 168; W e s e n-berg-Lund, 1950a : 10, chart 14; Ушаков, 1955 a : 98, рис. 5, Г—Е-, Хлебович, 1961 : 162; Pettibone, 1963 : 85—86, fig. 19 (синонимия); Ушаков и УБао-лин, 1965 :152—153; Imajima a. Hartman, 1964 : 63; Левенштейн, 1966 : 8; Б у ж и н с к а я, 1967 : 80.
Головная лопасть слегка вытянутая. 2 больших черных глаза (иногда по бокам имеются два дополнительных небольших пигментных пятна). Непарное головное щупальце длиннее парных; оно находится между глазными пятнами или немного впереди линии глаз. Хобот диффузно покрыт многочисленными мелкими, слегка гранулированными папиллами (в базальной части хобота папиллы иногда отсутствуют); 14—17, иногда больше крупных краевых папилл. Щупальцевидные усики цилиндрические, шнуровидные, с постепенно заостряющимся концом; лишь наиболее короткие брюшные усики II сегмента бывают немного сплющенными (в особенности у половозрелых самок); спинные щупальцевидные усики II и III сегментов, оттянутые назад, достигают X—XII щетинковых сегментов. На II сегменте щетинки обычно отсутствуют, но иногда они имеются.
На туловищных сегментах спинные усики узколанцетовидной формы, с заостренным концом; брюшные усики маленькие, обычно не выдаются за пределы подиального бугорка, овальные, притупленные или слабо заостренные. Подиальный бугорок с короткими, равной величины, закругленными верхней и нижней губами. Рукоятка щетинок на конце несколько расширена, с крупными шипиками у сочленения; дистальный членик
8. EULALIA
ма
тонко зазубренный. Анальные усики крупные, заостренные, примерно в 4 раза длиннее своей ширины.
Окраска в живом состоянии, травянисто-зеленая у самок и более светлая, желтоватая, у самцов; в спирту оливковая или темно-бурая; на спинной стороне у заднего края сегмента иногда наблюдаются мелкие темные пятнышки и поперечные полоски. Различают цветовые вариации аигеа Gravier и ornata Saint-Joseph (см.: FauVel, 1923). Экземпляры из Желтого моря и с о. Хайнань при фиксации резко окрашивали спирт в темно-фиолетовый цвет. Количество сегментов.до 150—200. Длина тела до 150 мм, ширина 2—3 мм.
Половозрелые особи отмечены, на Мурмане в марте—июле (Ушаков, 1925; Петровская, 1960), в Японском море и на Курильских островах — в июле—августе (Хлебович, 1961; Бужинская, 1967), в Желтом море — в июне—июле (Ушаков и У Бао-лин, 1965), у атлантического побережья Северной Америки — в июле (Pettibone, 1963). Откладывают на водоросли и галечный грунт слизистые кладки; яйца обычно зеленоватого цвета.
Примечание. Э. Бергштрём (Bergstrom, 1914 : 124) почему-то усомнился в данных таких замечательных исследователей, как Макинтош, Клаперед и Элерс и на основании имевшихся в его распоряжении экземпляров пришел к категорическому заключению, что у Е. viridis на II сегменте щетинки всегда имеются. К сожалению, и П. Фовель, следуя Берг-штрёму, в своем определителе дает формулу передних сегментов со щетинками на II сегменте. Однако в действительности это далеко не так, и у исследованных нами многочисленных экземпляров Е. viridis как из северных, так и дальневосточных морей щетинки на II сегменте в большинстве случаев отсутствуют; нами не были обнаружены щетинки на II сегменте и у экземпляров Е. viridis из района Роскофа (4 экз.) и с побережья Швеции (6 экз.). Далее, 10 экземпляров Е. viridis, полученные от М. Петтибон из района Аляски и Вудс-Хола (атлантическое побережье Америки),, также не имели щетинок на II сегменте. Исходя из указанных выше не вполне правильных утверждений Э. Бергштрёма, что у типичной Е. viridis на II сегменте всегда имеются щетинки, в последнее время М. Има-джима и О. Гартман (Imajima a. Hartman, 1964) экземпляры Е. viridis с побережья Японии, у которых они не обнаружили щетинки на II сегменте, выделили в особый подвид japonica. Но, учитывая все сказанное выше, мы считаем, что для выделения тихоокеанских Е. viridis в особый подвид необходимы дополнительные более детальные сравнительно-анатомические исследования, а наличие или отсутствие щетинок на II сегменте в данном случае не может служить критерием для выделения подвида (этот признак, возможно, является возрастным — см. примечание к роду Eteone, стр. 173).
Распространение. В коллекциях ЗИН имеется из Баренцева и Белого морей, района Ново-Сибирских островов, Берингова моря, района Камчатки, Курильских островов, Охотского, Японского, Желтого и Южно-Китайского морей (свыше 400 экз.); встречается преимущественно в осушной зоне (в литоральных ваннах) и в сублиторали среди водорослей, балянусов, моллюсков, асцидий, под камнями и галькой, единичные находки отмечены и на глубинах свыше 50 м (до 240 м); один из наиболее массовых видов, нередко образующий большие скопления.
По литературным данным Eulalia viridis имеет весьма широкое, почти всесветное распространение, но в основном, по-видимому, предпочитает бореальные и субтропические воды.
10*
148
I. PHYLLODOCIDAE
2. Eulalia bilineata (Johnston, 1840)
(Табл. VIII, 5—8)
Malmgren, 1865 : 99, tab. XIII, fig. 26, tab. XIV, fig. 29 (E. problema); M c-I n I о s h, 1908 : 50—53, pl. XLIII, fig. 5, pl. L, fig. 4, pl. LXVII, figs. 6-7, pl. LXXVII, figs. 23-24; Bergstrom, 1914:165—166, fig. 57 (Hypoeulalla); Ditlevsen, 1917:54, pl. IV (E. tjalfiensis); Fauvel, 1923 : 162—163, fig. 58 a—e; Augener, 1928 ; 707—708; Дерюгин, 1928 : 239; Анненкова, 1938 : 143; Горбунов, 1946 : 38; Зацепин, 1948 : 112, табл. XXIX, 9, b—d (Hypoeulalia)', Ушаков, 1948 : 27; Е. Berkeley а. С. Berkeley, 1948 : 48, fig. 71; У ш а к о в, 1950 : 169; Wesenberg- Lund, 1950а : 10—11, chart 14, pl. I, fig. 5; У ш а к о в, 1955а : 98, рис. 5, А—В; Хлебович, 1961 : 162; Pettibone, 1963 : 86—88, fig. 20 (синонимия); Ушаков иУБао-лин, 1965 : 152; Imajima, 1967 : 411; Day, 1967 : 154, fig. 5, 4, g—j.
Головная лопасть (удлиненная; передний {ее конец между парными щупальцами иногда имеет легкую перетяжку. 2 небольших глаза у заднего края головной лопасти. Головные щупальца удлиненные; среднее непарное головное щупальце длиннее парных и расположено несколько впереди линии глаз. Хобот с мягкими, крупными папиллами. Первый сегмент со спины частично сливается с головной лопастью (часто отделен от нее лишь очень слабой, едва заметной бороздкой). Все щупальцевидные усики веретеновидные, заостреные к дистальному концу; спинные щупальцевидные усики II и III сегментов, оттянутые назад, достигают VI—VIII щетинковых сегментов. На II и III сегментах щетинки имеются.
На туловищных сегментах спинные усики толстые, удлиненно-овальные, с закругленным притупленным концом; брюшные усики той же формы, но значительно меньше. Подиальный бугорок с короткими, закругленными, примерно одинаковой величины, верхней и нижней губами. Рукоятка щетинок с шиповатым концом; дистальный членик относительно короткий, тонко зазубренный. Анальные усики удлиненно-овальные, с закругленным дистальным концом; длина анальных усиков примерно в 2 раза больше их ширины.
Тело светло-бежевого или желтовато-бурого цвета разной интенсивности, у основания каждой параподии обычно наблюдаются небольшие темные пятнышки, образующие две темные продольные полосы (в спирту эти пятнышки выцветают); (спинные усики иногда темно-бурого цвета. Количество сегментов до 100—150. Тело тонкое и длинное: длина тела до 30—50 мм, ширина 2—3 мм.
Половозрелые экземпляры в Баренцевом море отмечены в июне, в Желтом море — в конце мая, а в британских водах (McIntosh, 1908) — с мая по июль. «
Примечание. В работе Дж. Дэйя (Day, 1967) изображен головной конец Е. bilineata со слившимися I и II сегментами, однако у всех наших экземпляров все сегменты хорошо отделены друг от друга. Е. problema Malmgren, 1865 из района западного побережья Гренландии и Е. tjal-fiensts Ditlevsen, 1917 из района пролива Девиса, имеющие дополнительные волосовидные щетинки, представляют собой, по всей видимости, эпитокальнуюформу Е. bileneata (Johnston). Е. Везенберг-Лунд (Wesenberg-Lund, 1950а : 11) у экземпляра из района Ян-Майена отмечает три анальных усика, однако в данном случае третий усик, несомненно, нечто иное как остатки экскрементов.
Распространение. В морях СССР встречен: в юго-западной части Баренцева моря (до глубины 290 м), у побережья Мурмана (Дальние Зеленцы), у берегов Шпицбергена, в Белом море, к Северу от
8. EULALIA 1.4.9
Ново-Сибирских островов (глубина 45—91 м), в северной и северо-западной части Охотского моря (глубина 27—60 м), у-южных Курильских островов (глубина 0—S3 м), в заливе Анива (глубина 23—30 м и на литорали в бухте Буссе) и Японском море (глубина 70—711 м); предпочитает песчанистые грунты,'нередко залезает в пустые трубки других полихет; в наших коллекциях свыше 100 экземпляров. По литературным данным, в атлантическом секторе распространен от пролива Девиса до Южной Каролины, у побережья Европы, в Средиземном море, у западного побережья Африки; в тихоокеанском секторе — помимо Охотского и Японского морей, отмечен для литорали Желтого моря, побережья о. Ванкувер и Южной Калифорнии; общая глубина от 0 до 2350 м.
3. Eulalia sigeformis Annenkova, 1937
(Табл. VIII, 9—12)
Анненкова, 1937 : 157—158, рис. 7; Ушаков, 1950 : 168; 1955а : 98, рис. 5, Ж, 3; Левенштейн, 1966 : 8.
Головная лопасть треугольной формы, сильно расширена у заднего края; ширина головной лопасти больше ее длины. Глаз нет. Головные щупальца удлиненные, заостренные; среднее непарное головное щупальце несколько длиннее парных и находится в центре головной лопасти. Хобот густо покрыт многочисленными, диффузно рассеянными слегка вытянутыми папиллами; они имеют гладкую поверхность и легкую внутреннюю ячеистость. Краевых глоточных папилл 16. I сегмент частично прикрыт нависающим задним краем головной лопасти, а потому не всегда хорошо различим со спины. На II и III сегментах щетинки имеются; граница между сегментами не всегда четко видна. Щупальцевидные усики цилиндрические, постепенно заостряющиеся в тонкий, длинный кончик; спинные щупальцевидные усики II и III сегментов, оттянутые назад, достигают X—XIII сегментов.
На туловищных сегментах спинные усики сильно вытянутые, ланцетовидные, с острым кончиком; брюшные усики той же формы, но меньше по размерам. Подиальный бугорок имеет длинную заостренную верхнюю и короткую закругленную нижнюю губу. Рукоятка щетинок с несколько расширенным и шиповатым концом; дистальный членик длинный, тонкий, с едва заметной зубчатостью по краю.
Окраска тела и усиков спиртовых экземпляров светло-коричневато-оливковая, равномерная; у некоторых экземпляров на кончике спинных усиков сохранились обособленные темные пятна. Количество сегментов до4 80. Длина тела до 35 мм, ширина до 5 мм, включая параподии.
Тип хранится в ЗИН АН СССР, инв. № 1/20400.
Описание несколько уточнено по дополнительным материалам из Охотского моря и Алеутской впадины.
Примечание. Спинные усики параподий Eul. sigeformis Annenkova отчасти напоминают таковые Pterocirrus macroceros Grube (см. стр. 160), но данный вид хорошо отличается от последнего отсутствием глаз и тем, что все щупальцевидные усики одной формы — веретеновидные.
Распространение. В коллекциях ЗИН имеется 12 экземпляров: Японское море — район залива Петра Великого (глубина 480— 936 м), Охотское море — у мыса Терпения на Сахалине (глубина 443— 645 м) и Алеутская впадина (глубина 2685—7185 м); указан также для Берингова моря — Олюторский залив, глубина 510 м (Левенштейн, 1966).
150
I. PHYLLODOCIDAE
5. Eulalia austrophylloformis Uschakov sp. nov.
(Табл. IX, 1—5)
Головная лопасть округлая. Глаза отсутствуют, лишь при очень внимательном рассмотрении можно заметить в затылочной части головной лопасти весьма легкое потемнение покровов в виде двух крохотных пятен. Непарное головное щупальце очень большое (его длина больше длины головной лопасти), прикреплено почти к самому заднему краю головной лопасти; фронтальные головные щупальца также очень большие, их длина равна ширине головной лопасти, причем вторая (нижняя) пара головных щупалец (на рисунке она не изображена) отходит с вентральной стороны головной лопасти. Хобот у нашего экземпляра был втянут, однако на рассеченном препарате хорошо видно, что в дистальной части папиллы образуют 6 четких продольных рядов, как у рода Austrophyllum', эти папиллы крупные, продолговатой формы, с хорошо выраженными округлыми образованиями по краю. Все щупальцевидные усики веретенообразные, длинные; спинные усики III сегмента достигают XII сегмент. На II сегменте щетинки имеются. Все туловищные сегменты со вторичной межсегментарной кольчатостью. Спинные усики на туловищных Сегментах сидят на крупных, высоких подставках; сами усики продолговато-овальной формы, некоторые из них сохранили легкую коричневатую пигментацию. Подиальный бугорок небольшой, с двумя примерно одинаковой величины округлыми губами. Брюшной усик крупнее подиального бугорка. Анальные усики очень длинные, заостренные; длина анальных усиков превышает их ширину более чем в 6 раз. Рострум рукоятки щетинки с мелкими шипиками; дистальный членик пильчатый.
Окраска спиртового экземпляра светло-бежевая, за исключением спинных и анальных усиков, которые имеют легкую коричневатую пигментацию. Количество сегментов около 95. Длина тела около 15 мм, ширина тела с параподиями 1.5 мм, ширина головы меньше 0.5 мм.
Тип вида хранится в ЗИН АН СССР, инв. № 1/16146.
Примечание. Наш вид по строению хобота, положению непарного головного щупальца, наличию крупных подставок для спинных усиков весьма близок к Austrophyllum sphaerocephala (Levenstein), однако он не может быть отнесен к роду Austrophyllum, так как у него отсутствуют добавочные нотоподиаль'ные ацикулы. Интересно отметить, что В. Г. Аверинцев (1972) в материалах из Антарктики обнаружил два новых вида Eulalia — Е. semenovi Aver, и Е. sotniki Aver., у которых также хобот имеет шестирядное строение, характерное для рода Austrophyllum. Возможно, в дальнейшем все эти виды следовало бы выделить в особый подрод Eulalia или даже в самостоятельный род.’Описанный здесь вид весьма близок к Е. sotniki Aver, из района Южных Оркнейских островов, однако отличается от него формой папилл на дистальной части хобота.
Распространение. К востоку от о. Хонсю — 39°44' с. ш. и 142°18' в. д., глубина 366—423 м, грунт — крупный алеврит, сильно заиленный, со значительной примесью мелкой пемзовой гальки («Витязь», ст. 3569, 27 IV 1957, 1 экз.).
5. Eulalia gravieri Uschakov sp. nov.
(Табл. IX, 6—10)
Головная лопасть полукруглая. Глаза отсутствуют. Непарное головное щупальце маленькое, едва заметное, находится у самого заднего края v головной лопасти. Фронтальные головные щупальца короткие. Хобот
9. STEGGOA
llrl
следующего строения: на рассеченном препарате хорошо видно, что ди стальная часть хобота имеет в продольных рядов из крупных продолен ватых папилл со светлыми округлыми образованиями .по краю (ср. с Е. austrophylloformis'), а проксимальная часть густо покрыта еще более крупными, округлыми прозрачными папиллами. Все щупальцевидные усики веретенообразные, заостренные, короткие; по длине щупальцевидные усики III сегмента едва достигают VII сегмента; вентральные усики II сегмента несколько расширены у основания. На II сегменте щетинки имеются у обоих экземпляров. На туловищных сегментах спинные усики продолговато-овальной формы, длина их превышает ширину более чем в 2 раза, они полупрозрачные, сильно ячеистые, резко выраженной подставки нет. Подиальный бугорок короткий, с двумя примерно одинаковыми по величине верхней и нижней губами. Брюшной усик продолговатоовальный, немного больше подиального бугорка. Анальные усики длинные, длина их примерно в 6 раз больше ширины, дистальный их конец тупой (не заостренный). Щетинки с длинным пильчатым дистальным члеником, рострум рукоятки с мелкими шипиками; в одном пучке около 10 щетинок. Все параподии с одной ацикулой.
Окраска спиртовых экземпляров светло-бежевая, равномерная. Количество сегментов до 165. Длина тела до 30 мм; ширина 1—1.5 мм, включая параподии.
х В коллекциях ЗИН имеется 2 экземпляра. Вид назван в честь французского специалиста по полихетам, который впервые описал аналогичный шестирядный хобот у Austrophyllum charcoti (Gravier, 1911).
Тип вида хранится в ЗИН АН СССР, инв. № 1/16 271.
Примечание. Наш вид наиболее близок к Е. semenovi Averincev, описанный из района Южных Оркнейских островов (Аверинцев, 1971), однако отличается от него проксимальной частью хобота; у нашего вида в проксимальной части хобота папиллы очень крупные, а у Е. semenovi они мелкие и многочисленные.
Распространение. К востоку от о. Хонсю — 38°35' с. ш. и 142°53' в. д., глубина 1641 м, грунт — крупный алеврит («Витязь», ст. 3578, 11 X 1957 — тип) и у южной оконечности Камчатки — 51°06' с. ш. и 158°56' в. д., глубина 3107—3265 м («Витязь», ст. 3271, 19 V 1955, 1 экз.).
9. Род STEGGOA Bergstrom, 1914
[incl. Natalia Bergstrom, 1914]
Головная лопасть с 5 головными щупальцами. Одна пара крупных глаз. Все три первых сегмента полностью развиты и отделены друг от друга. 4 пары щупальцевидных усиков, из них брюшные II сегмента короче остальных и сильно сплющены, остальные веретеновидные. На II и III сегментах щетинки могут присутствовать и могут отсутствовать. Фор-
11 11 1
мула передних сегментов: 1 + 5 у + 5 —, 1 -ф- О у -ф- S или 1 -ф- О у -ф--ф- О . Хобот диффузно покрыт многочисленными папиллами. Параподии одноветвистые. Щетинки сочлененные.
Типовой вид: Eulalia magalhaensis Kinberg, 1866.
Типовой вид был описан из субантарктических вод и имеет циркумполярное распространение в антарктической зоне (Ушаков, 1962). П. Фоволь (Fauvel, 1919) этот вид понимал весьма расширительно и в синоним ого
152
I. PHYLLODOCIDAE
включил Eulalia tenax Grube и Pteroclrrus ceylonicus Michaelsen, описанные из тропической области. С последним согласиться весьма трудно; у Eulalia magalhaensis Kinberg, как показал еще Ч. Монро (Monro, 1937 : 266) на II сегменте щетинки отсутствуют, и этим он хорошо различается от вышеуказанных видов.
Род Steggoa насчитывает около 12 видов. Для северо-западной части Тихого океана указан всего один вид — S. pacifica Imajima, 1964.
1. Steggoa pacifica Imajima, 1964
(Табл. XII, 12—18)
Imajima, 1964:239—240, figs. 8—14.
Головная лопасть треугольной формы. Глаза отсутствуют. Непарное головное щупальце расположено в задней половине головной лопасти. Хобот на дистальном конце имеет кольцо из 13 конических папилл; поверхность хобота густо покрыта двумя типами папилл: в дистальной части — шаровидными папиллами, в базальной — удлиненными, сосковидными. I перистомиальный сегмент уже головной лопасти, четко отделен от II сегмента и несколько длиннее его. Щупальцевидные усики I сегмента примерно равны длине головной лопасти. II сегмент имеет щетинки, брюшной усик короткий, асимметричный. Формула передних сегментов: 1 1
1 + 5 у -ф- S —. Спинные усики слегка заостренные, ширина их равна высоте; брюшные усики не выходят за пределы подиального бугорка.
Окраска фиксированного экземпляра: тело желтовато-коричневое, спинные усики красновато-коричневые. Количество сегментов 120. Длина червя 27 мм, ширина 1.3 мм, включая параподии.
В коллекциях ЗИН отсутствует.
Описание дано по М. Имаджима (Imajima, 1964).
Распространение. К востоку от Японии — 37°55' с. ш. и 143°25' в. д., глубина 2230—2350 м.
10. Род EUMIDA Malmgren, 1865
[incl. Pirakia Bergstrom, 1914]
Головная лопасть с 5 головными щупальцами. Одна пара обычно крупных глаз. Первый сегмент редуцирован со спины и слит со II сегментом. 4 пары щупальцевидных усиков, причем первая пара отходит как бы с боков головной лопасти; все щупальцевидные усики одной формы: или веретеновидные, или слегка сплющенные. Щетинки на II и III сегментах имеются: ^1 + S —) -|- S . Хобот гладкий, поперечно морщинистый в зависимости от степени его сжатия, а иногда покрыт мелкими папиллами. Параподии одноветвистые. Щетинки сочлененные.
Типовой вид: Eulalia sanguinea Oersted, 1843.
Eumida Malmgren некоторыми авторами (Fauvel, 1923, и др.) рассматривался как подрод Eulalia Savigny s. lato, однако он резко обособляется редукцией I сегмента. Род насчитывает около 10 видов.
10. EUMIDA
153
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОф РОДА
EUMIDA MALMGREN
1 (10). Щупальцевидные усики цилиндрические, веретеновидные, постепенно заостряющиеся к дистальному концу.
2 (3). Спинные усики сильно вытянутой, ланцетовидной формы, длина их превышает ширину более чем в 2 раза; верхняя подиальная губа пальцевидной формы.......................5. Е. fusigera (Malmgren).
3 (2). Спинные усики сердцевидно-заостренной или продолговато-овальной формы, длина их менее чем в 2 раза превышает ширину; подиальные губы закругленные.
4 (9)., Спинные усики сердцевидной формы, с заостренным дистальным концом.
5 (8). Длина спинных усиков немного больше их ширины.
6 (7). Все сегменты имеют одинаковую пигментацию.................
....................................1. Е. sanguinea (Oersted).
7 (6). Два передних сегмента со спины не пигментированы..........
.................................. 2. Е. albopicta (Marenzeller).
8 (5). Длина спинных усиков равна или немного короче их ширины .........................................3. Е. tubiformis Moore.
9 (4). Спинные усики продолговато-овальные, с закругленным концом ....................................... 4. Е. minuta (Ditlevsen).
10 (1). Щупальцевидные усики сплющенные, с резко обособленным дистальным тонким кончиком . . . . 6. Е. nigrimaculata (Moore).
1. Eumida sanguinea (Oersted, 1843)^
(Табл. X, 4—5)
Oersted, 1843 : 28, fig. 80, 82 (Eulalia)-, Malmgren, 1865 : 97—98, tab. XIV, fig. 28; M с I n t о s h, 1908 : 66—70, pl. XLIII, figs. 9—10, pl. XLIV, fig. 4, pl. XLVIII, figs. 1—2, pl. LVIII, fig. 22, pl. LXVII, figs. 14-15; ? Izuka, 1912 : 202—203, pl. XXI, fig. 4; Bergstrom, 1914 : 131—133, fig. 37; Дерюгин, 1915 : 332; Fauvel, 1923 : 166—167, fig. 59, f—k (Eulalia (Eumida)]; A u g e n e r, 1928 : 708; Дерюгин, 1928 : 239; Закс, 1933 : 127; Анненкова, 1934 : 322 (Eulalia); Fauvel, 1936 : 58; Анненкова, 1937 : 158; 1938 : 143 [Eulalia (Eumidia)]; Ушаков, 1939 : 83; Зацепин, 1948 : 112, табл. XXIX, 10, b—d; E. Berkeley a. C. Berkeley, 1948 : 47—48, tig. 69 [Eulalia (Eumida)]; Ушаков, 1948a : 27; Виноградов, 1949 : 32 [Eulalia (Eumida)]; О k u d a a. Y a-m a d a, 1954 : 182 [Eulalia (Eumida)]; Ушаков, 1950 : 169; 1955 : 98, рис. 6, Г [Eulalia (Eumida)]; Хлебович, 1961:163 [Eulalia (Eumida)]; Pettibone, 1963 : 88—89, fig. 21, a, b (синонимия); Imajima a. Hartman, 1964 : 64—65, pl. 13, fig. e; У ш а к о в и У Б а о - л и и; 1965 : 153 [Eulalia (Eumida)]; Левенштейн, 1966 : 8 [Eulalia (Eumida)]; Бужинская, 1967 : 80—81 [Eulalia (Eumida)].
Головная лопасть округлая или несколько заостренная спереди, со слабым вдавлением у заднего края; длина головной лопасти примерно равна ее ширине. Помимо 2 крупных черных глаз, расположенных в задней половине головной лопасти, немного впереди их или сбоку иногда имеются небольшие пигментные темные пятнышки (дополнительные глазки?). Парные головные щупальца с заостренным кончиком несколько расширены у основания; среднее непарное головное щупальце крупнее парных, находится между глазами или впереди линии глаз. Хобот гладкий или слабо морщинистый в зависимости от степени сжатия, частично покрыт продолговатыми коническими бугорками (папиллами); у наружного входного отверстия до 20—25 крупных краевых папилл (некоторые раздвоенные). Все щупальцевидные усики цилиндрические, веретеиовид-
154
1. PHYLLODOCIDAE
ные, постепенно заостряющиеся к дистальному концу, однако наиболее короткий вентральный усик II сегмента иногда может быть заметно сплющен. Спинные щупальцевидные усики II и III сегментов, оттянутые назад, по длине достигают XI—XIII сегментов. На туловищных сегментах в средней части тела спинные усики сердцевидные, слегка заостренные, почти симметричные, с выемкой у основания; их длина немного больше ширины; в задней части тела спинные усики более вытянутые и заостренные, чем на сегментах в средней части тела. Брюшные усики небольшие, овальные, слегка заостренные, короче подиального выроста. Подиаль-пый бугорок с тупыми, закругленными верхней и нижней губами. Рукоятка щетинок с шиповатым концом, дистальный членик слабо зазубренный. Анальные усики веретеновидные, заостренные.
Окраска тела и спинных усиков сильно варьирует, преимущественно коричневато-красноватая. В Японском море различаются две цветовые вариации (Закс, 1933): var. аигеа — в передней части тела на каждом сегменте у переднего и заднего края сегмента на спинной стороне имеется по две поперечных темно-коричневых полосы, а средняя часть сегмента непигментирована; var. olivacea — в средней части каждого сегмента проходит по одной грязно-оливковой поперечной полосе, а межсегментарная поверхность более светлая.
Количество сегментов до 100—140. Длина тела около 30 мм (максимальная 60 мм), ширина 2—3 мм.
Половозрелые экземпляры с яйцами в параподиях в Желтом море отмечены в мае—июле, у Южного Сахалина и на Курильских островах — в августе; яйца зеленоватого или красновато-бурого цвета.
Распространение. В коллекциях ЗИН имеется из Баренцева (побережье Мурмана) и Белого морей, района юго-восточного побережья Камчатки, из Охотского, Японского и Желтого морей, а также из Черного моря; преимущественно в ,прибрежной полосе до 30 м глубины, среди водорослей (120 экз.). Широко распространенный вид, довольно обычен в бореальной области, отмечен в субтропических и тропических районах и в антибореальной области.
2. Eumida albopicta (Marenzeller, 1879)
(Табл. X, 6—7)
Marenzeller, 1879:128—129, Taf. Ill, Fig. 3, A—C (Eulalia); Izuka, 1912 : 207—208 (Eulalia); Fauvel, 1932 : 71 (Eulalia); О k u d a, 1938 : 88, fig 9 [Eulalia (Eumida) sanguinea]; F a u v e 1, 1939 : 275; 1953 : 123, fig. 60, a, b (Eulalia); Imajima a. Hartman, 1964 : 64; Ушаков иУБао-лин, 1965 : 153 (Eulalia). «
Головная лопасть такая же, как у Е. sanguinea. Хобот в проксимальной части сильно морщинистый, с четко выраженными поперечными бугорками наподобие валиков. Спинные щупальцевидные усики II сегмента достигают XI сегмента. Спинные усики овально-сердцевидной формы, со слегка заостренным концом, в передней части тела более широкие, в задней части — более вытянутые. Брюшные усики овальные.
Окраска червя серая с красноватым оттенком; спинная сторона темнее брюшной и усиков; два первых сегмента не пигментированные (светлые). Для этого вида считается характерным наличие светлых (белых) небольших пятнышек — бляшек, в беспорядке разбросанных на спинной стороне сегментов (по 1 или 2 на одном сегменте); у нашего экземпляра они выражены слабо. Количество сегментов около 80. Длина червя 18—20 мм, ширина 2—3 мм.
10. EUMIDA , ' ' I Г)! I
Половозрелые самки в Желтом море отмечены в мае—июне (Ушаков и У Бао-лин, 1965).
Примечание. Вид, весьма близкий к Е. sanguinea (Oersted), и, возможно, представляет собой лишь одну из цветовых вариаций последнего. В коллекциях ЗИН один экземпляр.
Распространение. Южное побережье Японии, Желтое море, побережье Индокитая, Никобарские острова (Индийский океан).
3. Eumida tubiformis Moore, 1909
•ч
(Табл. X, 1—3)
Moore, 1909b : 342—344, pl. XVI, figs. 22, 23; Заке, 1933 : 127; Hartman, 1936a : 118; Анненкова, 1937 : 158; 1938 : 143—144 [Eulalia [Eumidia)]; Ушаков, 1955a : 99, рис. 6, A—В [Eulalia [Eumida)]; Hartman a. Barnard, 1960 : 85; Хлебович, 1961 : 163 [Eulalia [Eumida)]; I m a j i m a, 1963 : 352; Ушаков иУ Бао-лин, 1965 : 153—154 [Eulalia [Eumida)]; Бужинская, 1967 : 81 [Eulalia [Eumida)].
Головная лопасть несколько шире своей длины. Глаза с хорошо заметными стекловидными хрусталиками. Парные головные щупальца короткие, толстые; нижняя пара несколько крупнее верхней. Среднее непарное головное щупальце тоньше и длиннее парных, расположено между глазными пятнами или немного впереди линии глаз. Хобот гладкий или слабо морщинистый (без каких-либо четко выраженных папилл); у наружного края до 25—30 мягких, округлых, иногда частично раздвоенных краевых папилл; поверхность последних покрыта коническими бугорками. Все щупальцевидные усики веретеновидные, толстые, с коротким заостренным кончиком. Спинные щупальцевидные усики II и III сегментов, оттянутые назад, достигают IX сегмента. На туловищных сегментах спинные усики крупные, широко-сердцевидные, с заостренной верхушкой, слегка асимметричные, с широким основанием; длина спинных усиков меньше их ширины; в передней части тела спинные усики более широкие, в задней части тела более вытянутые и заостренные. Подставки спинных усиков широкие, низкие. Брюшные усики овальные, со слабо заостренным кончиком, на передних сегментах более крупные, чем на задних. Рострум рукоятки щетинок покрыт мелкими шипиками; дистальный членик длинный, с очень мелкой зубчатостью по краю.
Окраска тела и усиков темно-коричневая, зеленовато-коричневая или желтовато-бежевая; на спинной стороне каждого сегмента заметны более темные пятна или поперечные полосы, простирающиеся от параподии до параподии. Количество сегментов до 135. Длина тела до 85 мм, ширина до 7 мм, включая параподии.
Половозрелые экземпляры с большим количеством яиц в параподиях и в вывороченном хоботе отмечены в Японском море, в Татарском проливе и у Южного Сахалина — в августе — сентябре; яйца красноватого цвета.
Примечание. От весьма близкого вида Е. sanguinea отличается более короткими и широкими спинными усиками, а также более темной окраской тела.
Распространение. В коллекциях ЗИН имеется свыше 25 экземпляров из Японского моря (залив Петра Великого, Татарский пролив), юго-западной части Охотского моря и района Курильских островов; общая глубина 2—80 м, грунт — песок, гравий и ракушка. Вид описан с побережья Калифорнии (глубина 359—617 м).
156
I. PHYLLODOCIDAE
4. Eumida minuta (Ditlevsen, 1917)
(Табл. XI, 4—5)
Ditlevsen, 1917 : 56, pl. IV, figs. 10, <12, 14 {Eulalia}) Горбунов, 1946 : 64 (Eulalia)-, А п n e it к о в a, 1946 : 185, 187, рис. 1, a—c (Eulalia arctica); Pettibone, 1954 : 238—239, fig. 27, с (синонимия).
Головная лопасть округлая; ее ширина равна длине. Головные щупальца тонкие, длинные; непарное головное щупальце несколько крупнее парных, расположено впереди линии глаз. Глотка осталась не исследованной. I сегмент со спины редуцирован и первая пара щупальцевидных усиков отходит от боков головной лопасти. Спинные щупальцевидные усики с расширенной базальной частью и вытянутым длинным тонким кончиком (бутылковидной или кеглевидной формы); брюшные щупальцевидные усики II сегмента короче спинных, с коротким заостренным кончиком. Спинные подиальные усики овальной формы; брюшные усики несколько крупнее подиального бугорка. Щетинковый бугорок с двумя неравной величины губами. Щетинки с расширенной на конце рукояткой; конечный членик тонко зазубренный.
Окр.аска спиртового экземпляра желтоватая. Наш экземпляр не целый — 20 сегментов, длина 3 мм, ширина 0.75 мм. По М. Петтибон (Pettibone, 1954), окраска живых экземпляров красноватая с брюшной стороны, зелено-красноватая со спины. Количество сегментов до 36, максимальная длина 8 мм (половозрелые самки).
Примечание. Экземпляр из района Ново-Сибирских островов был сличен с экземплярами Е. minuta (Ditlevsen) из района мыса Барроу (Чукотское море) по материалам М. Петтибон; никаких различий между ними обнаружить не удалось. Рисунок, приведенный в работе Н. П. Анненковой (1946), не вполне точный; у этого вида I сегмент со спины редуцирован. Все это заставляет согласиться с ранее высказанным Петтибон (Pettibone, 1954) мнением о тождестве Eulalia arctica Annenkova, 1946 и Eulalia minuta Ditlevsen, 1917.
E. Везенберг-Лунд (Wesenberg-Lund, 1950a : 10) склонна рассматривать E. minuta Ditlevsen как молодые E bilineata Johnston, однако они отличаются положением непарного головного щупальца и формой щупальцевидных и подиальных усиков.
Распространение. Отмечен для трех районов Арктики: море Лаптевых—Ново-Сибирские острова, глубина 45—65 м (Анненкова, 1946), пролив Девиса, глубина 122 м (Ditlevsen, 1917) и у мыса Барроу, глубина 29—135 м (Pettibone, 1954). В коллекциях ЗИН 1 экземпляр из района Ново-Сибирских островов.
5. Eumida fusigera (Malmgren, 1865)
р (Табл. X, S—<10)}
Malmgren, 1865:100, tab. 14, fig. 27 (Sige)\ Levinsen, 1882:205; Bergstrom, 1914:136—138, fig. 40 (Sige macroceros, part.); Дерюгин, 1915 : 331; В a n s e, 1959 : 424—425 (Eulalia)-, Eliason, 1962a : 18; Pettibone, 1963 : 90, fig. 21, e.
Головная лопасть слегка заостряется к переднему концу, ширина ее немного больше длины. Среднее головное щупальце расположено на линии глаз. Хобот на дистальном конце несколько расширен, имеет кольцо из 18 мягких краевых папилл; стенка хобота покрыта очень мелкими, микроскопическими папиллами, которые образуют несколько
10. EUMIDA
157
правильных продольных рядов. Щупальцевидные усики веретеновидные, цилиндрические, постепенно заостряющиеся к дистальному концу; дорсальный щупальцевидный усик II сегмента достигает IX сегмента, вентральный щупальцевидный усик II сегмента наиболее короткий, в базальной части очень незначительно сплющен. На II сегменте щетинки имеются. Спинные усики туловищных сегментов сильно вытянутой, заостренной формы, длина их более чем в 2 раза превосходит ширину. Брюшные усики также вытянутые, с заостренным концом. Подиальный бугор с длинной пальцевидной верхней губой и короткой, закругленной нижней губой.
Спиртовой экземпляр имел красновато-коричневую пигментацию как на головной лопасти, так и на спинной стороне сегментов; на каждом сегменте четко обособляется поперечная пигментная полоса, несколько суженная в медиальной части и расширенная у основания параподий; спинные усики темнее спинной стороны тела. Количество сегментов 45 (экземпляр не целый). Длина тела около 15 ммЩЗ мм хобот; ширина 1.5 мм, включая параподии со щетинками.
Описание дано по экземпляру из района Орезунда.
Примечание. Э. Бергштрём (Bergstrom, 1914) Sige fusigera Malmgren, 1865, ввел в риноним Phyllodoce (Eulalia)l macroceros Grube, 1860, дав последнему мальмгреновское родовое название Sige. Как пишет Бергштрём, он переисследовал мальмгреновский экземпляр Sige fusigera, хранящийся в Стокгольме, и обнаружил, что вентральный усик II сегмента у него сплющенный; в связи с этим он усомнился в правильности рисунков, приведенных в работе Мальмгрена. К. Банзе (Banse, 1959) на основании изучения Pterocirrus macroceros из Неаполитанского залива, откуда был описан тип грубевского вида, пришел к выводу, что Pt. macroceros и S. fusigera — несомненно два совершенно разных вида, причем fusigera он отнес к подроду Sige, a macroceros к подроду Pterocirris в составе рода Eulalia, но он не имел в своем распоряжении Sige fusigera и ничего о вентральном усике II сегмента у этого вида не говорит. По его данным, эти виды хорошо различаются между собой как положением среднего непарного головного щупальца, так и формой спинных усиков.
Описанный здесь экземпляр, любезно присланный А. Элиазоном из района Орезунда, т. е. из района, откуда имел материал А. Мальмгрен, вполне отвечает рисункам последнего автора. Вентральный усик II сегмента у этого вида не сплющенный, а веретеновидного характера, как и у остальных Eumida. Возможно, что у Э. Бргштрёма был сильно попорченный экземпляр или с ошибочной этикеткой. Помимо формы брюшного усика II сегмента, fusigera отличается от Pterocirrus macroceros следующими особенностями: 1) наличием щетинок на II и III сегментах; 2) сильно вытянутой, наподобие пальца, верхней подиальной губой и 3) сильно вытянутыми ланцетовидными спинными усиками.
Распространение. Средиземное море (?), Северное море, побережье Норвегии, Баренцево море, залив Массачусет (Северная Америка).
6. Eumida nigrimaculata (Moore, 1909)
(Табл. XI, 1—3)
Moore, 1909b : 344—346, pl. XVI, figs. 24—26 {Eulalia)', Berkeley E., 1924 : 288 (Eulalia); Hartman, 1936 : 117 (Genetyllis); Анненкова, 1938 : 144 {Eulalia (Eumida)]; E. Berkeley a. C. Berkeley, 1948 : 49 (Eulalia); У ш fl-ко в, 1950 : 169, табл. 1, 3 [Eulalia (Clavadoce) annenkovae]; Ушаков, 1955a : 99— 100, рис. 6, Д, рис. 7, А—В [Eulalia (Eumida)]; Бужинская, 1967 : 81 [Eulalia (Eumida)].
158
I. PHYLLODOCIDAE
Головная лопасть округлая, небольшая. Глаза нередко с хорошо заметными стекловидными хрусталиками. Парные головные щупальца широко расставлены и сильно сдвинуты назад; среднее непарное головное щупальце немного крупнее парных, его основание находится на линии глаз; длина сродного непарного головного щупальца почти равна ширине головной лопасти. Все головные щупальца кеглевидной формы, с резко заостренным тонким кончиком. Хобот покрыт мелкими папиллами, у входного отверстия около 30 краевых папилл с мелкими бугорками. Все щупальцевидные усики сильно сплющены, широкие, с небольшим заостренным тонким кончиком; оттянутые назад достигают VIII—IX сегментов (по Муру они достигают XII сегмент). Спинные усики на туловищных сегментах вначале удлиненно-овальной формы, с закругленным концом, в средней части тела — с заостренным, вытянутым концом, асимметричные. Спинные усики весьма крупные, в особенности на передних сегментах, где они почти полностью прикрывают спинную сторону; они весьма легко отпадают и у большинства фиксированных экземпляров не сохраняются (особенность, весьма характерная для данного вида). Брюшные усики широкой почковидной формы, значительно крупнее подиального выроста. Рострум рукоятки щетинок с двумя сочленительными зубцами, покрытыми мелкими шипиками; дистальный членик тонко зазубренный.
Спинная и брюшная сторона сегментов от бледно-желтоватого до красновато-коричневого и темно-серого цвета с синеватым оттенком; головные и подиальные придатки ярко-красноватого или оранжевого цвета, обычно темнее спинной стороны. Количество сегментов до 100. Длина тела до 60 мм, ширина до 5 мм, включая параподии.
Половозрелые самки с большим количеством тёмных яиц в районе Южного Сахалина отмечены в июле—сентябре.
Примечание. По форме головной лопасти с крупными парными головными щупальцами, по слиянию двух первых околоротовых сегментов, окраске спинных усиков Eumida nigrtmaculata Moore весьма напоминает Genetyllis castanea (Marenzeller), но отличается от него наличием среднего непарного головного щупальца. Если материал дефектный и неполноценный, то оба указанных вида могут быть легко спутаны.
Э. Бергштрём (Bergstrom, 1914 : 165) высказывает предположение, что Eul. (Eumida) nigrtmaculata Moore представляет собой новый род, а О. Гартман (Hartman, 1936а : 117) по непонятным причинам относит этот вид к роду Genetyllis, у которого среднее непарное головное щупальце отсутствует. По сильно уплощенным (листовидным) щупальцевидным усикам Eul. (Eumida) nigrimacuZaZaMoorc напоминает CZavadoce Hartman, 1936, но у последнего I и II сегменты co спины полностью редуцированы.
У исследованных мной экземпляров форма щупалвдевидных усиков сильно варьирует; на моем рисунке изображены щупальцевидные усики, наиболее сплющенные и широкой фомы. К сожалению, Дж. Мур не дает рисунка головного конца с щупальцевидными усиками и указывает лишь, что они сплющены. На выпяченной глотке у одного из наших экземпляров хорошо было видно, что вся стенка хобота покрыта многочисленными, мелкими, слегка притупленными, мягкими папиллами с ячеистой структурой (см. табл. XI, 2). Мур при описании своего вида также указывал, что хобот покрыт небольшими тупыми плоскими папиллами. По всей видимости, наши экземпляры из дальневосточных морей сходны с американскими, однако необходимо дальнейшее более детальное сличение морфологических признаков.
Распространение. В коллекциях ЗИН имеется из Японского (залив Петра Великого, западное побережье Южного Сахалина) и Охот
11. PTEROCIRRUS
15»
ского морей и из района южных и северных Курильских островов; общая глубина 7—127 м (43 экз.). По литературным данным отмечен у о. Ванкувер и у побережья Калифорнии — залив Монтерей, глубина 129 м (Moore, 1909b; Е. Berkeley а. С. Berkeley, 1948).
11. Род PTEROCIRRUS Claparede, 1868
Головная лопасть с 5 головными щупальцами. Глаза имеются или они отсутствуют. I сегмент редуцирован со спины и слит со II сегментом» 4 лары щупальцевидных усиков, из них брюшные II сегмента сильно сплющены и имеют боковую оторочку наподобие тесака или резака. Щетинки на II и III сегментах имеются'или отсутствуют. Формула передних сегментов: (1 -ф- S' у) + £ у, (1 + О у) + S-^- или (1 + Оу) + О . Хобот диффузно покрыт многочисленными папиллами, Параподии одноветвистые. Щетинки сочлененные.
Типовой вид: Phyllodoce (Eulalia) macroceros Grube, 1860.
Род насчитывает около 10 видов. В наших материалах имеется 3 вида, причем один из них описывается как новый — Pt. imajimai. Кроме того, недавно с побережья Японии М. Имаджима (Imajima, 1967) описал другой новый вид Pt. notoensis (Imajima), отличающийся относительно короткими спинными усиками и сосковидными папиллами на хоботе. Из района Пьюджет-Саунд К. Банзе и К. Гобсон (Banse a. Hobson, 1968) в последнее время приводят новый вид Pt. parvoseta, который также характеризуется очень короткими папиллами на хоботе.
Примечание. П. Фовель (Fauvel, 1923) рассматривал Pterocirrus как подрод рода Eulalia Savigny s. lato. Э. Бергштрём (Bergstrom, 1914) виды с видоизмененными щупальцевидными усиками II сегмента предложил объединить под родовым названием Sige Malmgren, ошибочно считая, что Sige fusigera Malmgren, 1865 — синоним Ph. (Eulalia) macroceros Grube (см. стр. 157). В дальнейшем этому последовала и О. Гартман (Hartman, 1959), которая все виды, описанные как Pterocirrus, перевела в род Sige Malmgren. Однако в действительности Sige fusigera относится к роду Eumida Malmgren, 1865, так как он не имеет характерных для данной группы видов сплющенных усиков на II сегменте. В соответствии с этим все виды со сплющенными усиками на II сегменте и с редуцированным I сегментом должны быть объединены не под родовым названием Sige Malmgren, а под. родовым названием Pterocirrus Claparede, 1868, которое как подродовое впервые было употреблено для Eulalia (Pterocir-rus) velifera Claparede [-=Phyllodoce (Eulalia) macroceros Grube)].
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА PTEROCIRRUS CLAPAREDE
1 (6). Спинные усики сильно вытянутые, с заостренным дистальным концом (длина их больше ширины).
2 (5). Непарное головное щупальце находится на переднем крае головной лопасти.
3 (4). Брюшные усики заостренные . . . . 1. Р. macroceros (Grube). 4 (3). Брюшные усики бобовидные . . . . 2. Р. slastnikovi Annenkova. 5 (2). Непарное головное щупальце находится у заднего края головной лопасти ...............................4. Р. imajimai Uschakov.
6 (1). Спинные усики сердцевидной формы (длина их равна ширине) .......................................3. Р. notoensis (Imajima).
160
7. PHYLLODOCIDAE
1. Pterocirrus macroceros (Grube, 1860)
(Табл. XI, 6—9) '
Grub o, 1860 : 82, Taf. Ill, Fig. 4 [Phyllodoce (Eulalia)]; Claparede. 1868 : 250—252, pl. XVII, fig. 2 [Eulalia (Pterocirrus) velifera]; Bergstrom, 1914 : 136 —137, fig. 40 (Sige, part.); F a u v e 1, 1923 : 167 —168, fig. 60, d—g [Eulalia (Pterocirrus), part.]; ?E. Berkeley a. C. Berkeley, 1948 : 48, fig. 70 [Eulalia (Sige)]; Виноградов, 1949 : 32—33 [Eulalia (Pterocirrus)]-, Ушаков, 1955a : 100 [Eulalia (Pterocirrus)]-, Banse, 1959 : 423—426, fig. 2 [Eulalia (Pterocirrus)]-, Ушаков иУБао-лин, 1965 : 154, рис. 1, Ж—И [Eulalia (Pterocirrus)]; Day, 1967 : 152, fig. 5, 4, a—c [Eulalia (Pterocirrus)]; Banse a. Nichols, 1968 : 223— 225, fig. 1, a—c [Eulalia. (Pterocirrus)].
Головная лопасть округлая; ширина головной лопасти примерно равна ее длине. 2 очень крупных продолговатых темных глаза, расположенных по бокам головной лопасти. Головные щупальца длинные, шнуровидной формы, заостренные к дистальному концу, по длине превосходят головную лопасть; среднее непарное головное щупальце наиболее крупное, находится впереди глаз на уровне парных щупалец у переднего края головной лопасти. Хобот густо покрыт многочисленными длинными, сосочковидными папиллами («мохнатый»). Первый околоротовой сегмент со спинной стороны сильно редуцирован, два следующих сегмента развиты полностью. Брюшные щупальцевидные усики II сегмента листовидной формы (с боковой оторочкой наподобие тесака); остальные щупальцевидные усики шнуровидной (веретеновидной) формы, при этом спинные щупальцевидные усики II сегмента наиболее длинные. Щетинки на II и (1 \ 1
1 + ) + О .
Спинные усики в средней части тела ланцетовидные, сильно вытянутые, заостренные к дистальному концу; брюшные усики той же формы, но значительно меньше. Подиальный щетинковый бугорок рассеченный, причем верхняя губа несколько крупнее нижней. Рукоятка щетинок со слабо расширенным и зазубренным дистальным концом; конечный членик щетинок удлиненный, зазубренный.
Окраска тела серовато-зеленая, при этом спинная сторона немного темнее брюшной и спинных усиков. На головной лопасти между глазами иногда наблюдается весьма характерное треугольное пигментное пятно. Все наши экземпляры небольшие: количество сегментов до 65—70, длина тела 15—18 мм, ширина 1 мм.
Примечание. Для macroceros Э. Бергштрём (Bergstrom, 1914) дает следующую формулу: 1 + S Однако К. Банзе (Banse, 1959)
убедительно показал, что у macroceros щетинки на ll и III сегментах отсутствуют. То же указывает Дж. Дэй (Day, 1967) для macroceros с побережья Африки. Наши материалы из Черного моря совпадают с данными Банзе. У черноморских экземпляров щетинки на передних сегментах обнаружить не удалось. Черноморские особи, по-видимому, идентичны средиземноморскому экземпляру Банзе, лишь у некоторых из них на III сегменте имелись ацикулы, не указанные Банзе.
С побережья Японии (о. Хоккайдо) М. Имаджимой и О. Гартман (Imajima a. Hartman, 1964) описан вариетет orientalis (по 2 экземплярам), который отличается от типичной формы наличием щетинок на III сегменте (в своем описании они пишут, что их вариетет отличается от типичной формы отсутствием щетинок на II сегменте, так как для типичной формы ими принята формула, предложенная Бергштрёмом). Имевшиеся у нас
11. PTEROCIRRUS
161
4 экземпляра macroceros из района о. Хайнань, Желтого моря и зал. По-сьета Японского моря щетинок на III сегменте не имели, причем экземпляр из зал. Посьета достаточно хорошей сохранности.. Возможно, что в северо-западной части Тихого океана имеются как типичная форма, так и особый вариетет.
Распространение. В коллекциях ЗИН имеются экземпляры из Черного моря, района о. Хайнань и зал. Посьета Японского моря (12 экз.). По литературным данным указан для атлантического побережья Европы, Средиземного моря и тихоокеанского побережья Канады.
2. Pterocirrus slastnikovi Annenkova; 1946
(Табл. XII, 6-11)
Анненкова, 1946 : 186, 188, рис. 2 [Eulalia (Pterocirrus)].
Головная лопасть коническая, сильно расширенная у основания и притупленная на переднем конце; ширина немного превышает длину. Глаза отсутствуют, но на спинной стороне головной лопасти имеется два крупных продолговатых темных пятна, имитирующие глаза. Среднее непарное и верхние парные головные щупальца тонкие и длинные; нижние парные головные щупальца короче и массивнее верхних. Среднее непарное головное щупальце расположено вблизи переднего края головной лопасти; длина его больше длины головной лопасти. Хоботе длинными, многочисленными папиллами («мохнатый»). Щупальцевидные усики, за исключением брюшных усиков II сегмента, имеют расширенное основание и длинный вытянутый кончик; брюшные щупальцевидные усики II сегмента очень крупные, листовидные, сплющенные, несколько асимметричные и заостренные на конце. Формула передних сегментов: (1 Щ S + А (см. ниже примечание). На туловищных сегментах спинные усики в средней части тела удлиненные, ланцетовидные, с коротким заостренным кончиком; на передних сегментах они несколько короче, чем на средних сегментах. Брюшные усики плоские, бобовидные, прикрывающие с задней стороны щетин-ковый бугорок. Щетинковый бугорок с двумя закругленными губами, причем верхняя губа несколько крупнее нижней. Щетинки длинные, концевое расширение рукоятки с тонкими шипиками; конечный членик удлиненный, тонкий и ясно зазубренный.
. Спинная сторона тела темно-оливковая, брюшная желтоватая. Количество сегментов 34—40. Тело короткое и широкое, передний конец притупленный, заметно шире заднего; длина до 10 мм, ширина до 2 мм.
Примечание. При описании этого вида Н. П. Анненкова (1946) указывает щетинки на II сегменте, однако при повторном просмотре имеющихся экземпляров обнаружить щетинки на II сегменте мне не удалось, на III сегменте они имеются (экземпляры в плохой сохранности).
Распространение.' Море Лаптевых, глубина 22—869 м, грунт — песчанистый ил' (3 экз.).
3. Pterocirrus notoensis (Imajima, 1967)
(Табл. XII, 1—5)
Imajima, 1967 : 411—412, fig. 3 (Sige).
Головная лопасть округлая, с небольшим вдавлением на заднем конце; ширина головной лопасти больше ее длины. 2 крупных округлых глаза. Головные щупальца крупные, заостряющиеся к. дистальному концу,
И П. В. Ушаков
162
I. PHYLLODOCIDAE
длиннее головной лопасти; среднее непарное головное щупальце расположено на уровне глаз (у заднего края головной лопасти). Хобот густо покрыт сосочковидными папиллами; дистальный конец хобота с 17 крупными округлыми папиллами. Первый сегмент со спины редуцирован, два следующих сегмента развиты полностью. Брюшные щупальцевидпыс усики II сегмента сплющенные, с боковой оторочкой. На II и III сегментах щетинки имеются. Формула передних сегментов: -|- S-j- S. На всех туловищных сегментах спинные усики сердцевидные, с заостренным концом, их ширина равна длине; брюшные усики овальные. Подиальный бугорок округлый, с небольшим вырезом. Рострум щетинки с мелкими шипиками; дистальный членик тонко зазубренный.
Окраска спиртового экземпляра желтовато-коричневая, спинная сторона и спинные усики с мелкими коричневыми пятнами. Количество сегментов 44. Длина 6 мм, ширина 1 мм, включая параподии.
В коллекциях ЗИН отсутствует.
Описание дано по М. Имаджима (Imajima, 1967).
Распространение. Западное побережье Японии, полуостров Ното, литораль.
К
4. Pterocirrus imajimai Uschakov sp. nov.
(Табл. IX, 11—14)
. Головная лопасть округлая, ширина ее примерно равна длине; на переднем и заднем концах небольшие вдавления. В передней части головной лопасти два крупных пигментных пятна, имитирующих глаза; в задней две полукруглые пигментные полоски. Фронтальные головные щупальца очень крупные, заостряющиеся к дистальному концу; непарное головное щупальце длинное и тонкое, находится у заднего края головной лопасти. Хобот густо покрыт нитевидными папиллами. Брюшные щупальцевидные усики II сегмента (Уп) сплющенные, типичные для Pterocirrus. Первый сегмент со спины не различим. На II сегменте щетинки имеются. Формула передних сегментов: Р + + Параподии
с высокой подставкой для спинных усиков, последние сильно вытянутые, с тонким заостренным кончиком. Подиальный бугорок крупный, с двумя неравной величины губами, верхняя губа крупнее нижней. Брюшной усик тонкий, заостренный. Щетинки с пильчатым дистальным члеником, до 20—25 щетинок в одном пучке.
В наших коллекциях имеется всего 2 нецелых экземпляра: у наиболее крупного обрывка сохранилось 32 сегмента; длищз. 6 мм, максимальная ширина тела 2 мм,, включая параподии со щетинками.
Вид назван в честь японского исследователя М. Имаджима, описавшего ряд глубоководных полихет из северо-западной части Тихого океана (Imajima, 1964).
Тип хранится в ЗИН АН СССР, инв. № 1 /16273.
Примечание. Указанный здесь вид по «мохнатому» типу хобота и наличию на головной лопасти двух крупных пигментных пятен, имитирующих глаза, отчасти напоминает Pt. slastnikovi Ann., но отличается от него тем, что непарное центральное головное щупальце находится у заднего края головной лопасти, а не на переднем крае, как у Pt. slastnikovi', кроме того, брюшные подиальные усики маленькие, в то время как у Pt. slastnikovi они очень большие и полностью прикрывают подиальный бугорок.
12. AUSTROPHYLLUM
163
Распространение. К востоку от о. Хонсю — 38° с. ш. и 146°30' в. д., глубина 5460 м, ил («Витязь», ст. 3575, 1957 г., 1 экз.) и у побережья Калифорнии — 24°58' с. ш. и.113°25' з. д., глубина 3260 м, ил («Витязь», ст. 4265, 1959 г. — тип).
12. Род AUSTROPHYLLUM Bergstrom, 1914
Головная лопасть квадратная, с закругленными углами. 5 головных щупалец;.среднее непарное головное щупальце у заднего края головной лопасти. Глаза отсутствуют. Хобот в проксимальной части с диффузно расположенными мягкими папиллами, в дистальной части они образуют 6 продольных полос. Первый щупальцевый сегмент частично редуцирован со спины и прикрыт головной лопастью. 4 пары щупальцевидных усиков: 1 1
1 -|- S — + S jy-. Параподии ложно двуветвистые, т. е. с двумя ацикулами, причем добавочная нотоподиальная ацикула расположена при основании спинного усика; при ней иногда на передних сегментах имеются 1—2 волосовидные щетинки; подиальный бугорок вооружен сложными (сочлененными) щетинками. Спинные усики удлиненно-овальной или неправильно сердцевидной формы.
Типовой вид — Eulalia charcoti Gravier, 1911.
До недавнего времени род считался монотипичным. В 1964 г. О. Гартман (Hartman, 1964) отнесла к этому роду как новый вид экземпляры из Антарктики, описанные Ч. Монро (Monro, 1930) под названием Phyllodoce longipes Kinberg, 1866, дав им соответственно новое название — Austrophyllum monrol Hartman, 1964. О. Гартман это сделала на основании того, что параподии у них с 2 ацикулами. Однако, как показали наши материалы из Антарктики (Аверинцев, 1972), этот вид по форме головной лопасти (отсутствию среднего головного щупальца) не может быть отнесен к роду Austrophyllum и, учитывая особенности строения хобота, должен быть выделен в особый род Zverlinum Averincev.
В коллекциях ЗИН имеются как Austrophyllum charcoti (Gravier, 1911) из районов Антарктики (по материалам д/э «Обь»), так и два экземпляра Austrophyllum sphaerocephala (Levenstein, 1961) с болыпйх глубин из района Курильских островов, которые по строению головной лопасти и хобота весьма напоминают A. charcoti, однако отличаются от него наличием волосовидных щетинок при спинном усике. К этому же роду я склонен отнести и Notophyllum caecum Fauvel, 1913, описанный из района Азорских островов с глубины 5000 м, так как у него хобот имеет в дистальной части 6 лент из плоских папилл и медиальное головное щупальце расположено у самого заднего края головной лопасти, что очень характерно для Austrophyllum, а нухальные затылочные органы, которые считаются, основным признаком для рода Notophyllum, у N. caecum отсутствуют. У N. caecum Fauvel нотоподиальные ацикула и добавочная нотойодиаль-ная щетинка появляются лишь с XX—XXV щетинкового сегмента, а у Austrophyllum — с первых сегментов, но этот признак, с моей точки зрения, второстепенный.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА AUSTROPHYLLUM BERGSTROM, 1914
1 (2) У основания спинного усика имеются 1 или 2 нотоподиальпыо волосовидные щетинки. Спинной усик с одной медиальной прожилкой ..........................1. A. sphaerocephala (Levenstein).
11*
164
I. PHYLLODOCIDAE
2 (1). Нотоподиальных волосовидных щетинок нет. Спинной усик имеет разветвленное жилкование..................*А. charcoti (Gravier, 1911).
Антарктика.
1. Austrophyllum sphaerocephala (Levenstein, 1961) (Табл. XIII, 1-4)
Левенштейн, 1961:150—151, рис. 2; 1965:8 (Eulalia).
Головная лопасть весьма характерная для рода Austrophyllum'. парные головные щупальца находятся у переднего края, среднее непарное головное щупальце — у самого заднего края головной лопасти. Парные головные щупальца несколько расширены у основания и имеют заостренный кончик; среднее непарное головное щупальце нитевидное, по длине несколько превосходит длину головной лопасти. Задний край головной лопасти прямой, ровный, слабо закругленный, несколько находит на первый щупальцевый сегмент; затылочных выростов нет. Хобот у наших экземпляров втянут внутрь, однако на препарате хорошо видно, что в проксимальной его части папиллы расположены диффузно, а в дистальной части папиллы образуют 6 продольных широких лент, причем у этого вида эти папиллы имеют примерно такую же форму, как это было изображено для A. charcoti (Gravier), т. е. они широкоовальные, листовидные, с крупными железистыми клетками по наружному краю; проксимальная часть хобота по длине примерно равна дистальной (у A. charcoti дистальная часть почти в 7 раз длиннее проксимальной); на дистальном конце хобота резко выраженных краевых (оральных) папилл нет и он лишь слабо волнистый. Щупальцевидные усики длинные, нитевидные, с заостренным кончиком: первая пара щупальцевидных усиков (на I сегменте), оттянутая назад, достигает VIII—IX сегментов, вторая пара (спинные усики II сегмента) — XV сегмента, третья пара (брюшные усики II сегмента) — VI сегмент, четвертая пара — XV сегмент. На средних параподиях при основании спинного усика, помимо. нотоподиальной ацикулы, имеются 1—2 волосовидные щетинки, выходящие наружу книзу от спинного усика. Спинные усики вначале более вытянутые, чем на средних сегментах, и имеют более или менее правильную овально-продолговатую форму (длина передних спинных усиков примерно в 2 раза больше их ширины); на средних сегментах спинные усики удлиненной, неправильно-сердцевидной формы; вдоль медиальной линии спинных усиков протягивается легкая желтоватого цвета прожилка; спинные усики с многочисленными удлиненными железистыми клетками. Брюшные подиальные усики с заостренным кончиком, крупнее подиального бугорка; дистальный конец направлен вверх. Подиальный бугорок короткий, толстый, с равными по величине верхней и нижней губами. Щетинки многочисленные, с тонким длинным конечным члеником, слабо зазубренным по краю; несколько расширенная дистальная часть рукоятки (рострум) имеет легкую шиповатость. Анальные усики длинные. Сегменты имеют хорошо выраженную вторичную кольча-тость.
Спинная и брюшная сторона темно-серая с зеленоватым оттенком; подиальные придатки более темные; некоторые спинные усики в верхней части имеют темную точечную пигментацию (окраска более крупного экземпляра была более светлой). Количество сегментов около 125 и 170 (последние сегменты очень маленькие, их трудно точно подсчитать). Длина тела 30 и 70 мм, ширина 3 и 3.5 мм.
13. VITIAZIA
165’
Примечание. Описание дано по 2 экземплярам, добытым в Курило-Камчатской впадине (ЗИН АН СССР, инв. № 172263). Наши экземпляры, судя по весьма характерной форме головной лопасти, мы считаем идентичными с Eulalia sphaerocephala Levenstein, 1961, описанным из Берингова моря. К сожалению, Р. Левенштейн дает весьма краткий диагноз, в частности, ею не отмечается строение хобота и она ничего не говорит о наличии добавочной нотоподиальной ацикулы, хотя последняя, как это подтвердилось при повторном изучении, имеется у ее экземпляров.
От A: charcoti (Gravier), помимо наличия нотоподиальных щетинок, отличается относительно меньшими размерами тела при том же количестве сегментов.
Распространение. Берингово море — западная котловина, глубина 2440 и 3680 м, грунт — глинисто-диатомовый ил, 2 экз. (Левенштейн, 1961); Курило-Камчатская впадина, глубина 3800—4130 м («Витязь», 1953 г., ст. 2209, 2 экз.).
13. Род VITIAZIA Uschakov, 1953
Головная лопасть широкой треугольной формы, е 4 фронтальными головными щупальцами; на дорсальной стороне головной лопасти в центре имеется округлая папилла (недоразвитое медиальное головное щупальце). Позади головной лопасти 2 затылочных органа (наподобие эполет Notophyllum Oersted). Глаза отсутствуют. Хобот гладкий, с крупными краевыми (оральными) папиллами. Все три передних щупальцевых сегмента отделены друг от друга и полностью развиты. 4 пары щупальцевидных 1 1
усиков. Формула передних сегментов: 1 + S -у + 5 Параподии одноветвистые; подиальный бугорок конический, с очень крупной верхней губой, заканчивающейся удлиненным пальцевидным выростом. Щетинки только сложные (сочлененные).
Род представлен одним видом — Vitiazia dogieli Uschakov, 1953 (тип рода).
1. Vitiazia dogieli Uschakov, 1953
(Табл. XIV, 1—4)
Ушаков, 1953 : 207—208, рис. 1, А— В’, 1955а : 96, рис. 4, Г—Е.
Головная лопасть немного шире своей длины; фронтальные щупальца небольшие, сильно сближены и находятся на самом переднем конце головной лопасти. У одного сильно мацерированного экземпляра близ заднего конца имелись две небольшие пигментные точки, — возможно, остаточные глазные пятна. Затылочные органы (эполеты) полукруглой формы, слабо пигментированные, заходят на I сегмент. Хобот массивный, поверхность его гладкая или морщинистая в зависимости от степени сжатия, у наружного края 16—18 округлых краевых папилл, покрытых микроскопическими сосйчками. I щупальцевый сегмент очень крупный, шире головной лопасти. Нижние усики II сегмента немного сплющены, остальные цилиндрические; первая пара усиков и нижние усики II сегмента заметно короче верхних усиков II сегмента и усиков III сегмента; наиболее длинные щупальцевидные усики достигают VII сегмента. Щупальцевидные усики на II сегменте сильно раздвинуты; подиальный бугорок, вооруженный небольшими сложными щетинками, находится при вентральном усике. На туловищных сегментах форма и величина спинных усиков весьма изменчивая: они могут иметь удлиненную ланцетовидную форму или же
166
I. PHYLLODOCIDAE
они весьма короткие и длина их не превышает ширину. Брюшные усики крупные, заостренные, несколько длиннее подиального бугорка. Передняя лопасть подиального бугорка раздвоенная, верхняя губа значительно крупнее нижней, с удлиненным пальцевидным выростом. Ацикула одна, очень длинная. На одной параподии до 50 и свыше щетинок; их рострум немного расширен, сочленительный зубец с многочисленными мелкими шипиками; дистальный членик тонкий, длинный, с едва заметной мелкой зубчатостью.
Окраска тела серо-бежевая, со слабой точечной пигментацией, спинная сторона немного темнее брюшной; спинные и брюшные усики большей частью со слабой точечной пигментацией. Количество сегментов до 65. Длина тела свыше 50 мм (экземпляр нецелый), ширина с параподиями до 8 мм; длина хобота до 15 мм, ширина 4 мм.
Тип хранится в ЗИН АН СССР, инв. № 2/15833 («Витязь», ст. 5616).
Примечание. Vitiazia dogieli был описан мной (Ушаков, 1953) по одному экземпляру. В настоящее время Р. Я. Левенштейн передала мне 5 новых экземпляров этого вида значительно лучшей сохранности, добытые примерно в том же районе и на тех же глубинах, что и первый экземпляр. Новые экземпляры позволили несколько уточнить первоначальное описание. Округлая папилла в центральной части головной лопасти при описании этого вида мной была принята как остаток непарного медиального головного щупальца, однако и у всех остальных экземпляров на этом же месте имелась лишь короткая папилла, которую следует рассматривать как начальную стадию образования щупальца; у других же родов с затылочными эполетами уже имеется нормального типа среднее головное щупальце. Далее, у червей из нового материала наблюдалась очень большая изменчивость формы параподий и спинного усика.
Сильно удлиненная форма параподий, изображенная мной при описании первого экземпляра (Ушаков, 1953), не вполне нормальная (это подтверждается и положением ацикулы); более типичная, укороченная форма параподий приведена на табл. XIV, 3 в настоящей работе. Вне зависимости от степени вытянутости параподий для этого вида весьма характерен сильно удлиненный пальцевидный вырост на верхней по-диальной губе. Большая вариация формы спинного усика не только у разных экземпляров,- но и на одном и том же индивидууме, по-видимому, служит специфической особенностью данного вида. Как своеобразный артефакт можно отметить, что у одного экземпляра в средней части тела имелся один усик в два раза длиннее всех остальных. Создается впечатление, что форма параподий у этого глубоководного вида еще окончательно не стабилизировалась.
Распространение. Северо-западная чаЪть Тихого океана — к юго-востоку от Курильской гряды и Сангарского пролива, глубина 6157-8100 м (6 экз.).
14. Род VITIAZIPHyLLUM Uschakov gen. nov.
Головная лопасть слегка заострена к переднему концу и заметно расширена к заднему. 5 головных щупалец. Глаза отсутствуют. У заднего края головной допасти два затылочных органа (эполеты). Хобот гладкий, с округлыми краевыми (оральными) папиллами. I сегмент со спины редуцирован. 4 пары веретеновидных щупальцевидных усиков: (15 -4-5-^-. Параподии одноветвистые. Спинные усики заостренно-ланцетовидной формы.
14. VITIAZIPHYLLUM
11)7
Типовой вид — V ttiaziphyllum nuchalum Uschakov.
Примечание. Парные затылочные органы имеются лишь у Notophyllum Oersted, Nipponophyllum Imajima et Hartman, Hesperophyllum Chamberlin, Vitiazia Uschakov и у нашего нового рода Vttiaziphyllum. Род Hesperophyllum, описанный с побережья Калифорнии (Chamberlin, 1919а), отличается от Notophyllum в основном сплющенной формой вентрального усика II сегмента; диагноз этого рода крайне неполный, а описание его единственного вида не сопровождено рисунками (возможно, Hesperophyllum тождествен Notophyllum). У Vitiazia все три передних сегмента полностью развиты и четко отделены друг от друга, параподии одноветвистые; у Vttiaziphyllum I сегмент со спины редуцирован, параподии одноветвистые; у Notophyllum и Nipponophyllum два передних сегмента со спины слиты и частично или полностью редуцированы, параподии двуветвистые. Таким образом, мы имеем как бы прямой ряд в усложнении головного конца и параподий: Vitiazia.—Vttiaziphyllum—Notophyllum и Nipponophyllum.
1. Vitiaziphyllum nuchalum Uschakov sp. nov.
(Табл. XV, 1—3)
Головная лопасть конической формы. Фронтальные головные щупальца крупные, заостряющиеся к дистальному концу, лишь немного короче максимальной ширины головной лопасти; медиальное головное щупальце тонкое, длинное, отходит от заднего края головной лопасти. Одна пара широких округлых коротких нухальных органов. Хобот длинный (равен примерно 20—25 туловищным сегментам), в дистальной своей части сильно бугристый — морщинистый, что, по-видимому, вызвано тем, что он не полностью выпячен; на оральном конце около 20 округлых краевых папилл. I сегмент со спины не различим, основания первой пары щупальцевидных усиков расположены по бокам головной лопасти (сами щупальцевидные усики у наших экземпляров не сохранились). II сегмент нормально развит; вентральные щупальцевидные усики в 2 раза короче дорсальных, последние по длине достигают примерно XV сегмента; щупальцевидные усики цилиндрические. При щупальцевидных усиках II сегмента имеются щетинки. Подставки спинных усиков на всех туловищных сегментах очень крупные, резко обособленные. Лишь на одном сегменте средней части тела сохранился спинной усик — он заостренной, ланцетовидной формы, по длине немного превосходит подиальный бугорок. Подиальный бугорок массивный, с очень крупной и длинной ацикулой. Брюшной усик тонкий, длинный, сильно заостренный, по длине превосходит подиальный бугорок. Самые задние сегменты не сохранились. В одном пучке до 15 щетинок, дистальный членик тонкий, длинный, слабо зазубренный, рострум имеет двойной зубчатый край.
Окраска равномерно бледно-бежевая. Количество сегментов 40 (экземпляр нецелый). Длина тела 7 мм, ширина 1.5 мм, включая подиальные бугорки без щетинок, длина хобота — 2 мм.
Описание дано по двум экземплярам.
Тип хранится в ЗИН АН СССР,, инв. № 1 /16 439.
Распространение. К востоку от о. Хонсю — 38°02' с. ш. и 146°33' в. д., глубина 5475 м (тип) и северо-восточная часть Тихого океана — 48°21' с. ш. и 144°16' з. д., глубина 3704 м (котип).
168
I. PHYLLODOCIDAE
15. Род NOTOPHYLLUM Oersted, 1843
Головная лопасть округлая с 5 головными щупальцами. От заднего края головной лопасти отходят затылочные (нухальные) органы наподобие эполет. Одна пара крупных глаз. Хобот с боковыми продольными рядами листовидных папилл. Один или два первых сегмента со спины редуцированы. 4 пары удлиненных веретеновидных щупальцевидных
усиков. Формула передних сегментов: + S + S .
Параподии ложнодвуветвистые, т. е. с двумя ацикулами; при ното-подиальном усике могут быть одна или несколько волосовидных щетинок. Подиальный бугорок вооружен многочисленными сочлененными щетинками. Спинные усики крупные, широкоовальные (почковидные), черепицеобразно налегают друг на друга и почти полностью прикрывают спинную сторону червя; в этом отношении род Notophyllum отчасти напоминает род Paranaitis Southern (см. стр. 140).
Типовой вид: Phyllodoce foliosa М. Sars, 1835.
У Notophyllum наблюдается выметывание яиц на спинную сторону, где они проходят первые стадии развития под защитой спинных усиков (Okada, 1930; Бужинская, 1967), подобно тому, как это происходит у некоторых Polynoidae под прикрытием спинных чешуек.
Род насчитывает около 6 видов. Из северных и дальневосточных морей в наших коллекциях имеется всего два вида: N. foliosum (М. Sars) и N. imbricatum Moore. Указанный нами (Ушаков и У Бао-лин, 1965) для Желтого моря N. splendens (Schmarda) хранится в Институте океанологии Академии наук КНР (Циндао) и нуждается в более подробном описании. Синонимия последнего вида довольно запутанная. X. Аугенер (Augener, 1913 : 140) и П. Фовель (Fauvel, 1930 : 515) в синонимию N. splendens включают N. multtcirris Grube, 1878, из района Филиппинских островов. У последнего вида Грубе на спинных усиках изображает какие-то бородавки (?); возможно, он имел в виду крупные железистые клетки, но ни Аугенер, ни Фовель об этих образованиях ничего не говорят. В синонимию N. splendens Фовель (Fauvel, 1953), кроме того, включает и N. imbricatum Moore, 1906, но последнее нам представляется ошибочным. Согласно Дж. Дэйю (Day, 1953, 1967), для N. splendens (Schmarda) характерно отсутствие при нотоподиальной ацикуле волосовидных щетинок, на что предшествующие исследователи не обращали внимание; у N. imbricatum Moore они имеются (см. стр. 170).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ В И ДОЯ РОДА NOTOPHYLLUM OERSTED
1 (2). Затылочный орган в виде 1 пары коротких закругленных или раздвоенных выростов.........................1. N. foliosum (М. Sars).
2 (1). Затылочный орган из 2—4 и более пар удлиненных выростов. 3 (4). При нотоподиальной ацикуле имеется 1—2 тонкие волосовидные щетинки.................................2. N. imbricatum Moore.
4 (3). При нотоподиальной ацикуле волосовидных щетинок нет .... ..................................*N. splendens (Schmarda), 1861.
Day, 1967 : 151, fig. 5, 3, k—n.
Южная Африка, Красное море, побережье Индии, Цейлон, Филиппинские острова, Желтое море, Новая Каледония, юго-западный берег Австралии.
15. NOTOPHYLLUM
169
1. Notophyllum foliosum (M. Sars, 1835)
(Табл. XIII, 10)
Malmgren, 1865:98, tab. XIV, fig. 33 (.V. polynoides)', Levinsen, 1882 : 209—211, tab. VII, fig. 1—3 (Trachelophyllum liitkeni)-, McIntosh, 1908 : 46— 50, pl. XLV, fig. 1, pl. LXVII, fig. 5, pl. LXXVII, fig. 21 (синонимия); Bergstrom, 1914 :120—123, Textfig. 31 (синонимия); Fauvel, 1923:170—171, fig. 61, a—e; 1933 : 16; Hartman, 1948a : 18, fig. 3, d—f; Wesenberg-Lund, 1950a : 10, chart 14, pl. I, fig. 4; У ш а к о в 1955а : 95; Pettibone, 1963 :83—84, fig. 17е; Guy, 1964 : 181; Ушаков и У Б ао-лин, 1965 : 151, рис. 1, 8.
Головная лопасть спереди закругленная. Глаза нередко с хорошо заметными линзами (хрусталиками). Головные щупальца крупные, веретеновидные или немного сплющенные, заостренные к дистальному концу; непарное головное щупальце заметно крупнее и длиннее парных, расположено на уровне глаз. От заднего края головной лопасти отходит одна пара коротких, округлых затылочных выростов, в редких случаях они раздвоенные. Лишь один I сегмент со спины редуцирован. Щупальцевидные усики по своей форме похожи на головные щупальца, но крупнее последних. Спинные щупальцевидные усики II и III сегментов наиболее длинные и, будучи оттянутыми назад, могут достигать IX—X сегментов. На туловищных сегментах спинные усики очень крупные, толстые, с сильно оттянутым внутренним краем, ширина их в 2 раза больше длины; наружный край спинных усиков с большим количеством крупных удлиненных железистых клеток. Брюшные усики поперечно овальные, по величине заметно превосходят подиальный бугорок. У основания спинного усика имеются ацикула и 1—2 тонких волосовидных щетинки. Брюшной подиальный бугорок вооружен многочисленными сочлененными щетинками. Рострум рукоятки щетинки с крупными, острыми шипами; саблевидный дистальный членик тонко зазубренный.
Спиртовые экземпляры имеют преимущественно коричневатую окраску, причем на спинных усиках вдоль их наружного края спорадически наблюдаются характерные темные пятна.
Количество сегментов до 115. Длина тела до 50—60 мм, ширина до 5 мм, включая параподии (наши экземпляры из дальневосточных морей не превышают 20 мм).
Примечание. П. Фовель (Fauvel, 1933) в синоним N. foliosum (М. Sars) включает N. japonicum Marenzeller, 1879 (Izuka, 1912), однако М. Имаджима и О. Гартман (Imajima a. Hartman, 1964) переописали N. japonicum и для него установили новый род Nipponophyllum (см. далее, стр. 171).
Раздвоенные затылочные органы у N. foliosum изображены Е. Везен-берг-Лунд (Wesenberg-Lund, 1950а, pl. I, fig. 4) для экземпляра из Норвежского моря; аналогичного типа затылочные органы имелись у экземпляра из Желтого моря и из района о. Беринга (см. табл. XII], 10).
Распространение. По нашим материалам встречается в Желтом море (Циндао, литораль), Японском море (залив Петра Великого), в районе Курильских островов и у о. Беринга; глубина 0—52 м (И экз.). По литературным данным распространен главным образом в атлантическом секторе: восточное побережье Северной Америки (Чесапикский залив). Фарерские острова, атлантическое побережье Европы, Средиземное море, западный берег Африки; в тихоокеанском секторе отмечены единичные находки —Желтое море (Fauvel, 1933) и Аляскинский залив (Hartman, 1948а); общая глубина распространения до 1750 м.
170
I. PHYLLODOCIDAE
2. Notophyllum imbricatum Moore, 1906
(Табл. XIII, 5—9)
M о о г в, 1906 : 217—219, pl. X, figs. 1—3; 1908 : 329; Berkeley, 1924 : 287; Анненкова, 1934 : 322; F a u v e 1, 1936 : 59; Анненкова, 1937 : 159; 1938 : 146; [non Okuda, 1939 : 227, fig. 4]; Hartman, 1948a : 18, fig. 3,a — c; E. Berkeley a. C. Berkeley, 1948:42—43, figs. 60—61; Ушаков, 1955a : 95, рис. 4, A—B; ? Knox, 1960 : 113—114, figs. 141—142; Ушаков иУ Бао-лин, 1965 : 152; Бужинская, 1967 : 80.
Головная лопасть спереди закругленная или слабо коническая; в задней своей части она нередко имеет хорошо выраженную припухлость в виде полукруглой подушки, которая частично прикрывает глаза и служит основанием для .среднего непарного головного щупальца. Глаза, головные придатки и щупальцевидные усики такие же, как у N. foliosum. От заднего края головной лопасти отходят затылочные выросты, поделенные на 3, реже на 4 и более долек неравной величины. Обычно два передних сегмента со спины частично редуцированы и слиты. Глотка у большинства наших экземпляров втянута, лишь у двух она была частично выворочена наружу; в проксимальной своей части хобот гладкий и только на некотором расстоянии появляются два боковых продольных ряда папилл; вначале эти папиллы крохотные, затем они постепенно становятся более крупными и вытянутыми и их количество в каждом ряду увеличивается; передняя часть хобота, как это можно было видеть на вскрытой глотке, сплошь, т. е. по всей окружности, покрыта многочисленными крупными папиллами; как крупные боковые папиллы, так и вся остальная дорсальная «гладкая» поверхность хобота густо покрыты многочисленными микроскопическими шаровидными образованиями с тонкой гранулированной поверхностью (эти мелкие образования видны лишь при большом увеличении); кроме того, дорсальная сторона имеет поперечную складчатость. Общий характер вооружения хобота N. imbricatum отчасти напоминает таковой у подрода Mysta рода Eteone (пример конвергенции у далеко отстоящих друг от друга родов филлодоцид). На туловищных сегментах спинные усики широкие, почковидные, черепицеобразно налегающие друг на друга и почти полностью прикрывают спинную сторону червя; у фиксированных экземпляров наружный край спинных усиков слабо волнистый (гофрированный), брюшные усики широкоовальные (по своей форме спинные и брюшные усики не отличаются от таковых N. foliosum). У основания спинного усика имеется небольшой бугорок с ацикулой и обычно с 2—3 короткими волосовидными щетинками. Брюшная ветвь параподий содержит до 40 и свыше сочлененных щетинок.
Тело серовато-оливковое или грязновато-коричнёвое, спинные и брюшные усики темно-оливковые или зеленовато-коричневые, обычно темнее спинной поверхности тела.
Количество сегментов до 125. Длина тела до 75 мм, ширина до 7—8 мм, включая параподии со щетинками.
Примечание. Notophyllum imbricatum Moore, 1906, отчасти напоминает N. americanum Verrill, 1885, описанный из района Массачусетс; у последнего вида нухальные затылочные органы имеют до 4—7 выростов (Pettibone, 1963). Возможно, это лишь подвиды, но для окончательного решения этого вопроса необходимо детальное сопоставление экземпляров.
Распространение. По нашим материалам встречается в Желтом и Японском морях, в проливе Лаперуза, заливе Анива и районе Курильских и Командорских островов; глубина 0—75 м, предпочитает
16. NIPPONOPHYLLUM
171
галечные грунты (62 экз.). По литературным данным известен из Аляскинского залива, района о. Ванкувера и побережья Калифорнии; отмечен для района Новой Зеландии (Knox, 1960).
16. Род NIPPONOPHYLLUM Imajima et Hartman, 1964
Головная лопасть с 5 головными щупальцами. Одна пара крупных глаз. От заднего края головной лопасти отходят парные затылочные (нухальные) органы. Три передних сегмента со спины редуцированы и полностью слиты. 4 пары щупальцевидных усиков. Хобот с мягкими папиллами. Параподии ложнодвуветвистые; при нотоподиальной ацикуле наблюдаются волосовидные щетинки. Брюшной подиальный бугорок с многочисленными сочлененными щетинками.
Типовой вид: Notophyllum japonicum Marenzeller, 1879.
Указанный род весьма близок к Notophyllum Oersted, но М. Имаджима и О. Гартман для него дают совершенно необычное расположение щупаль-1 1
цевидных усиков: «У-р + 5-р. Возможно и несколько иное, чем предложенное Имаджима и Гартман, толкование расположения перистомиальных усиков: как и у всех других близких родов, у представителей этого рода, надо думать, также имеются 3 сегмента, снабженных щупальцевидными усиками, но они подверглись слиянию, при этом невроподия III сегмента редуцировалась; в результате слияния сегментов все щупальцевидные усики сильно сблизились, что и создает впечатление, будто бы от I сегмента отходят два щупальцевидных усика; в этом случае формула перед-них сегментов у представителей этого рода будет следующая: (1 + 5 — -ф-
-ф- S , а дальше следуют нормальные сегменты. Но последнее можно точно установить лишь на срезах.
Род Nipponophyllum, по данным Имаджима и Гартман, насчитывает всего два вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА NIPPONOPHYLLUM IMAJIMA ET HARTMAN
1 (2). Затылочный орган состоит из 2 пар выростов ...............
...............................1. N. japonicum (Marenzeller).
2 (1). Затылочный орган состоит из 4 пар выростов................
...................................2. N. sagamianum (Izuka).
1. Nipponophyllum japonicum (Marenzeller, 1879)
Marenzeller, 1879 : 126—127, Taf. 3, Fig. 1 (N otophyllum); Izuka, 1912 : 209—210 (Notophyllum); Fauvel, 1936 : 59 (Notophyllum); О k u d a, 1939:227, textfig. 4 (Notophyllum imbricatum); Imajima a. Hartman, 1964 : 67—68, pl. 14, figs, a, b.
Головная лопасть с округлым передним краем; ее задняя средняя часть слегка вогнута. Глаза находятся в наиболее широкой задней части головной лопасти. Парные головные щупальца расположены немного вентрально; среднее непарное головное щупальце находится на уровне глаз и по длине равно 2/3 головной лопасти. Хобот по всей поверхности густо покрыт папиллами. Затылочный орган состоит из двух пар нухаль-ных выростов, причем наружные выросты примерно в 2 раза длинное
172
I. PHYLLODOCIDAE
внутренних. Передние сегменты слиты. Щупальцевидные усики цилиндрические, с заостренным концом. Спинные усики на туловищных сегментах крупные, бобовидной формы, налегают друг на друга. Каждая нотоподии имеет по капиллярной щетинке, выходящей наружу поверх ацикулы. Брюшной подиальный бугорок на дистальном конце с небольшим вырезом и вооружен пучком сочлененных щетинок (12—18). Дистальный членик щетинок с тонкой зубчатостью; рострум рукоятки щетинок с шипиками.
Окраска червя желтовато-коричневая. Количество сегментов до 70. Размеры: длина тела до 15 мм, ширина — 2.5 мм.
Диагноз составлен по М. Имаджима и О. Гартман (Imajima a. Hartman, 1964), в наших коллекциях отсутствует.
Распространение. Побережье Японии — Хакодате, залив Сагами, Онагава, южная часть Японии.
2. Nipponophyllum sagamianum (Izuka, 1912)
Izuka, 1912:210—211, pl. XXI, fig. 7—9 (Notophyllum)', Imajima a. Hartman, 1964 : 68.
Головная лопасть вытянутая, пятиугольная; ее передне-боковые края немного вогнуты. Глаза очень крупные, овальные. Передние головные щупальца слегка сплющены; среднее щупальце на уровне глаз. Затылочный орган состоит из 4 пар удлиненных, тонких нухальных выростов, причем в каждой группе крайние наружные и внутренние выросты немного короче остальных. Передние сегменты слиты. Задние щупальцевидные усики примерно в 2 раза длиннее передних вентральных. Нотоподия рудиментарная. Спинные усики на туловищных сегментах крупные, бобовидной формы, полностью прикрывают спинную сторону червя.
Спинная сторона червя белая, с синеватым отливом. Количество сегментов 116. Длина тела 43 мм, ширина — 3.5 мм, включая параподии.
Диагноз составлен по Имаджима и Гартман (Imajima a. Hartman, 1964), в наших коллекциях отсутствует.
Распространение. Побережье Японии — залив Сагами, глубина 73 м (Izuka, 1912).
17. Род ETEONE Savigny, 1820, s. lato
[incl. Mysta Malmgren, 1865; Eteonella McIntosh, 1874; Hypereteone Bergstrom, 1914].
Головная лопасть имеет на переднем конце 4 небольших, направленных в сторону фронтальных головных щупальца; у'заднего края головной лопасти небольшая, округлая, не всегда хорошо различимая цухальная папилла. Одна пара глаз, иногда с добавочными небольшими глазными пятнышками, но они на фиксированном материале плохо различимы. Хобот в дистальной своей части гладкий, иногда сильно морщинистый (бугорчатый) или с крупными мягкими папиллами по всей окружности (подрод Eteone s. str.) или же с 2 четко выраженными боковыми рядами крупных папилл наподобие «боковых сосочков», а остальная спинная поверхность хобота покрыта многочисленными очень мелкими шипиками и зубчиками (подрод Mysta). Наружное отверстие хобота снабжено округлыми или нитевидными оральными папиллами. 2 пары щупальцевидных усиков веретенообразной формы на I сегменте; II сегмент без спинного усика, но с брюшным усиком и подиальным бугорком; на I сегменте щетинок нет, на II — в большинстве случаев имеются ацикулы и щетинки. Формула передних сегментов: Д- S .
17. ETEONE
173
Параподии одноветвистые, подиальный бугорок с двумя короткими губами. Спинные усики небольшие, не прикрывающие спинную сторону червя. Щетинки сочлененные.
Виды различаются главным образом по форме спинных усиков и по окраске тела; у некоторых видов форма спинных усиков сильно варьирует. Существенный видовой признак—-форма анальных усиков и некоторые детали строения глотки.
Описано свыше 30 видов, однако систематическое положение многих из них остается не вполне ясным.
Типовой вид: Nereis flava Fabricius, 1780.
Примечание. Э. Бергштрёмом (Bergstrom, 1914 : 209) был предложен новый род Hypereteone для Eteone lactea Claparede, 1868, на том основании, что у этого вида на II сегменте отсутствуют щетинки и ацикулы. Это предложение Бергштрёма последующими авторами поддержано не было. Как хорошо видно на примере рода Phyllodoce (стр. 129), присутствие или отсутствие щетинок и ацикул на передних сегментах служит лишь одним из видовых признаков. Несостоятельность выделения рода Hypereteone вытекает также из данных А. Элиазона (Eliason, 1962а), который подметил, что у крупных экземпляров Е. lactea Clap, из района Орезунда щетинки на II сегменте отсутствуют, но у мелких экземпляров они иногда наблюдаются, причем в некоторых случаях они могут быть лишь на одной (левой или правой) стороне сегмента; таким образом, этот признак у Е. lactea до известной- степени возрастной.
Некоторыми авторами Mysta Malmgren рассматривается в качестве самостоятельного рода, однако я склонен считать его лишь подродом, так как его представители .отличаются от видов Eteone Sav. s. str. лишь папиллами на хоботе; к тому же хобот подробно изучен далеко не для всех видов.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ETEONE SAVIGNY S. LATO
1 (14). Дистальная часть хобота без боковых рядов крупных сосковидных папилл [подрод Eteone s. str. Savigny].
2 (3). На II сегменте подиальный бугорок отсутствует..............
...................... . . . . 6. Е. (s. str.) lactea Claparede.
3 (2). На II сегменте подиальный бугорок имеется.
4 (7). Спинные усики асимметричные, широкие (нижний край у них свисает над циррофором в виде уха).
5 (6). Спинная сторона червей равномерно бурая или зеленовато-коричневая, немного более темная по бокам, чем вдоль медиальной линии .............4а. Е. (s. str.) spetsbergensis spetsbergensis Malmgren.
6 (5). На светлом бежевом фоне спинной стороны выделяются две боковых коричнево-фиолетовых продольных полосы
.............. 46. Е. (s. str.) spetsbergensis bistriata (Uschakov). 7 (4). Спинные усики симметричные.
8 (13). Спинные усики продолговато-овальные (ширина их меньше длины или равна длине).
9 (10). Длина спинных усиков почти в 2 раза больше их ширины; глаза отсутствуют ........................ 5. Е. (s. str.) vitiazi Uschakov.
10 (9). Длина спинных усиков лишь немного больше их ширины; глаза имеются, но плохо различимы.
11 (12). Анальные усики широкоовальные ............................
............................. 2. Е. (s. str.) longa (Fabricius).
174
I. PHYLLODOCIDAE
12 (11). Анальные усики сферические.................................
................................ 3. Е. (s. str.) delta Wu et Chen. 13 (8). Спинные усики широкие, бобовидной (почковидной) формы (ши-
рина их больше длины)............1. Е. (s. str.) flava (Fabricius).
14 (1). Дистальная часть хобота с боковыми рядами крупных папилл
в виде сосочков [подрод Mysta Malmgren].
15 (16). Спинные усики широкие, бобовидной (почковидной) формы; ширина их больше длины . . . . 7. Е. (Mysta) barbata (Malmgren).
16 (15). Спинные усики продолговато-овальные или конические; ширина их меньше или равна длине.
17 (18). Спинные усики сидят на сильно вытянутых подставках (цирро-форах).......................10. Е. (Mysta) tchangsii Uschakov et Wu.
18 (17). Спинные усики сидят на коротких широких подставках.
19 (20). Спинные усики продолговато-овальные. На спинной стороне тела имеется три четко очерченные продольные темные полосы. .........................................8. Е. (Mysta) ornata Grube.
20 (19). Спинные усики конические. Спинная сторона тела имеет точечную пигментацию, образующую неправильные поперечные ряды .................................9. Е. (Mysta) maculata (Treadwell).
Подрод ETEONE Savigny, 1820, s. str.
Хобот гладкий или сильно бугристый по всей его окружности; в дистальной его части нет обособленных боковых рядов из крупных сосковидных папилл.
1. Eteone (s. str.) flava (Fabricius, 1780)
(Табл. XV, 4—7}
Malmgren, 1865 : 102—103, tab. XV, figs. 35—36 (E. flava et depressa}' 1867 : 28, tab. II, fig. 14 (E. sarsi) et 29, pl. II, fig. 13 (E. lentigera}',T heel, 1879 : 32, pl. II, fig. 20 (E. depressa}', Bergstrom, 1914 : 196—199, Textfig. 74 (синонимия); Дерюгин, 1915 : 322; Ditlevsen, 1917 : 65, pl. V, figs. 2, 15, 16; Eliason, 1920:27; Fauvel, 1923 : 173—174, fig. 62, e—f; Augener, 1928:709—710 (синонимия); Анненкова, 1932a : 168; Закс, 1933 : 127; Анненкова; 1937 : 158; 1938 : 145; Зацепин, 1948 : 113, табл. XXIX, 12, b, с, е; Ушаков, 1948а : 27; 1950 : 171; Wesenberg-Lund, 1950а : 11, chart 15, pl. II, fig. 7, с; 1951 : 30; 1953 : 33, chart 5; Анненкова, 1952 : 121; Grainger, 1954 : 511; Pettibone, 1954 : 235, fig. 27, g (синонимия); Ушаков, 1955a : 101, рис. 8, Б', E. Berkeley a. C. Berkeley, 1956 : 235; Хлебович, 1961 : 163; Pettibone, 1963 : 74, fig. 16, f (синонимия); Левенштейн, 1966 : 8—9.
Головная лопасть спереди закругленная, задний ее конец несколько налегает на I сегмент; ширина головной лопасти Дольше ее длины. Глаза плохо заметны. Хобот в своей дистальной части сильно бугристый, иногда с крупными мягкими папиллами по всей окружности. Щупальцевидные усики короткие, по длине едва достигают III сегмент; они примерно одинаковой длины. На II сегменте подиальный бугорок со щетинками. Спинные усики в средней части тела симметричные, их длина меньше ширины; на передних сегментах они могут быть несколько асимметричны. Брюшные усики овальные, закругленные на конце, по своим размерам примерно равны подиальному бугорку. Рукоятка щетинок заканчивается двумя одинаковыми по размерам сочленительными зубцами с мелкими шипиками; дистальный членик щетинок имеет тонкую зазубренность (пильчатость). Анальные усики короткие, широкоовальные.
Окраска тела и придатков у фиксированных экземпляров темнобурая. Количество сегментов до 300. Размеры: длина тела 40—60 мм,
17. ETEONE
175
Щирина 2—4 мм, включая параподии (по литературным данным, длина тела до 120 мм).
Примечание. Указание Э. Бергштрёма (Bergstrom, 1914 : 106) о том, что хобот у Е. flava гладкий, не вполне точное. На рисунке у Мальм-грепа, давшего первое хорошее изображение этого вида, хобот показан в дистальной части сильно бугристым (Malmgren, 1865, tab. XV, 35). У большинства просмотренных мной экземпляров Е. flava из северных и дальневосточных морей хобот имел явственные крупные бугристые папиллы, расположенные по всей окружности хобота; такие же папиллы были у экземпляра Е. flava из района мыса Барроу по материалам Смит-сонианского института США (определение М. Петтибон).
Распространение. В коллекциях ЗИН 50 экземпляров из Баренцева, Карского, Чукотского, Берингова, Охотского и Японского морей; глубина 0—170 м. Арктическо-бореальный, по-видимому, циркумполярный вид; в Атлантическом океане спускается на юг до залива Мэн и Ла-Манша, в Тихом океане — до Японского моря (у побережья Японии и тихоокеанского побережья Северной Америки отсутствует).
2. Eteone (s. str.) longa (Fabricius, 1780)
(Табл. XV, 8—10)
Malmgren, 1867 : 26—28, tab. Ill, fig. 22 (E. lilljeborgi), fig. 23 (E. islandica), tab. II, fig. 12 (E. arctica), fig. 15 (E. leuckarti); Theel, 1879 : 32, pl. II, figs. 23—24 (E. arctica)', Webster a. Benedict, 1884 : 705, pl. I, figs. 1—5 (E. einerea); Bergstrom, 1914 : 192—195, Textfig. 72 (синонимия); Дерюгин, 1915 : 333 (E. arctica); Eliason, 1920 : 26—27; Treadwell, 1922 : 174, figs. 7—10 (E. tu-berculata); F a u v e 1, 1923 : 172—173, fig. 62, a—d; Зенкевич, 1925 : 3; Augener, 1928 : 710; Fauvel, 1933 : 16; 3 а к c, 1933 : 27; Анненкова, 1934 : 322; 1937 : 158; 1938 : 145; Ушаков, 1939 : 83; Горбунов, 1946 : 38; Зацепин, 1948 : 113, табл. XXIX, 13, в, с, е; Е. В е г k е 1 е у а. С. В е г к е 1 е у, 1948 : 41, figs. 57—58; Ушаков, 1948а : 27; 1950 : 170—171; Wesenberg-Lund, 1950а : 11, chart 15, pl. II, figs. 6, 7, а—b; 1951 : 29; Анненкова, 1952 : 120; Pettibone, 1954 : 234, fig. 27, h (синонимия); Ушаков, 1955a : 101, рис. 8; А. Хлебович, 1961 : 163—164; Pettibone, 1963 : 73—74, fig. 16, e (синонимия); В e 11 a n, 1964 : 47; Imajima a. Hartman, 1964 : 61; Ушаков и У Б а о - пин, 1965 : 154—155; Левенштейн, 1966 :9; Бужинская, 1967 :81.
Головная лопасть по сравнению с Е. flava более вытянутая, ширина примерно равна длине. Глаза маленькие, плохо заметны. Хобот в дистальной части сильно морщинистый, иногда с неясно выраженными буграми. Щупальцевидные усики короткие, верхние и нижние примерно одинаковой величины. На II сегменте подиальный бугорок со щетинками. На туловищных сегментах спинные усики удлиненно-овальной формы, почти симметричные; в передней части тела они более широкие, в задней более узкие. Брюшные усики маленькие, овально закругленные или слабо заостренные. Анальные усики короткие, толстые, широкоовальные. Щетинки того же типа, что и у Е. flava.
Тело и придатки светло-коричневого или желтовато-бежевого цвета; иногда окраска пятнистая и спинная поверхность местами покрыта много численными очень мелкими темными фиолетовыми поперечными черточками; по данным В. Хлебовича (1961), у половозрелых самцов тело с беловатым оттенком, а зрелые самки имели темно-зеленую или коричневую окраску. Количество сегментов до 350. Длина тела обычно около 40 — 50 мм, максимальная 160 мм, ширина 0.5—3 мм.
Примечание. Eteone faponensis McIntosh, 1901, описанный Макинтошем из Японского моря (описание весьма общего характера, при
176
I. PHYLLODOCIDAE
веден лишь рисунок параподии), напоминает Et. longa (Fabricius) и, возможно, синоним последнего; М. Имаджима и О. Гартман (Imajima a. Hartman, 1964) в своих коллекциях этот вид не имели, но считают, что он отличается от Et. longa более длинными щупальцевидными усиками.
Экологические данные и размножение. Преимущественно мелководный вид, но отдельные находки были отмечены на глубинах до 400—500 м. Предпочитает песчанисто-илистые грунты, встречается на смешанных фациях, среди балянусов и биссусов мидий, в ризоидах ламинарий и корневищах филлоспадикса. В осушной зоне во время отлива зарывается в песчанистый грунт на глубину 10 см и свыше; выносит значительные опреснения. В дальневосточных морях образует поселения плотностью до 50 экземпляров (Левенштейн, 1960; Бужинская, 1967), а в датских водах — до 216 экземпляров на 1 м2 (Muus, 1967). Активный хищник, нападающий на других многощетинковых червей, которые нередко крупнее его самого (Хлебович, 1959).
Черви со зрелыми половыми продуктами в полости тела на южных Курильских островах отмечены в марте—апреле, а на северных островах — несколько позже, что, возможно, объясняется температурным фактором (Хлебович, 1961). Планктонные личинки Е. longa в заливе Посьета Японского моря встречены в мае при температуре от 3 до 8° С (Свешников, 1967). На Мурмане половозрелые особи наблюдались преимущественно в м:ае—июле. В Белом море размножение начинается с мая при температуре около 0° С. У атлантического побережья Северной Америки половозрелые экземпляры найдены в апреле (Pettibone, 1963). У берегов Дании нерест указан для мая—-июня. Половозрелые экземпляры способны всплывать в поверхностные слои, где и происходит вымет яиц (Meek a. Storrow, 1924; Rasmussen, 1956). Развитие Е. longa подробно изучено для Белого моря и залива Посьета Японского моря (Свешников, 1961, 1967). По данным В. А. Свешникова, на стадии нектохеты личинка имеет 7 ларвальных сегментов и достигает в длину 450—500 мк. На Bcexvcer-ментах, кроме ротового, интенсивно работают на спинной и брюшной стороне ресничные кольца — нототрохи, а на округлом пигидиуме — телотрох; благодаря этим ресничным кольцам и жировым каплям, размещенным в кишечнике, личинка удерживается в толще воды около 2— 3 дней, а затем оседает на дно (подробное описание строения личинки приведено на стр. 55).
Распространение. В коллекциях ЗИН представлен большим количеством экземпляров (свыше 240 станций) из всех северных и дальневосточных морей. Широко распространенный арктическо-бореальный, циркумполярный вид; в атлантическом секторе спускается на юг до залива Массачусетс и Средиземного моря, в тихоокеанском ректоре — до о. Хоккайдо и Желтого моря.
3. Eteone (s. str.) delta Wu et Chen, 1963
(Табл. XVI, 1—6)
W u and Chen, 1963 : 30, pl. I, fig. A—E, pl. II, fig. A.
Головная лопасть треугольной формы. Глаза хорошо заметны. На дистальном конце хобота 12 крупных глоточных папилл, стенка хобота гладкая, слабо морщинистая. Щупальцевидные усики короткие. На II сегменте подиальный бугорок со щетинками. Спинные усики очень маленькие, слегка вытянутые, длина их немного больше ширины, на передних сегментах они короче подиальных бугорков, на задних крупнее. 12—15 ще
17. ETEONE
ill
тинок в одном пучке. Анальные усики короткие, толстые, округлой формы (сферические).
Количество сегментов до 109. Длина тела до 27 мм (половозрелые экземпляры).
Примечание. Довольно близок к Е. longa (Fabricius), но отличается своими округлыми (сферическими) анальными и очень небольшими спинными усиками. В коллекциях ЗИН отсутствует.
Распространение. Дельта р. Янцзы, близ Шанхая (соленость О.12°/оо).
4а. Eteone (s. str.) spetsbergensis spetsbergensis Malmgren, 1865
Malmgren, 1865 : 102, tab. XV, fig. 38; Theel, 1879 : 31—32, pl. II, figs. 21—22; McIntosh, 1908:104—106, pl. LXIX, figs. 5—6, pl. LXXVII, figs. 16—16b; Bergstrom, 1914 : 202—204, Textfig. 77 (синонимия); Ditlevsen, 1917 : 66, pl. V, figs. 12, 14, 18; E 1 i a s o n, 1920 : 27; A u g e n e r, 1928 : 708— 709 (синонимия); Анненкова. 1932a : 168; Зацепин, 1948 : ИЗ, табл. XXIX, 17, с, е; Wesenberg - Lund, 1951 : 31; Pettibone, 1954 : 235; fig. 27, f.
Головная лопасть слегка вытянутая. Хобот в дистальной части сильно бугристый или с мягкими крупными папиллами по всей окружности. Щупальцевидные усики короткие, одинаковой величины или нижние немного крупнее верхних. Щетинки на II сегменте развиты слабо, иногда отсутствуют вовсе. Спинные усики широкие, бобовидные, ширина их почти в 2 раза больше длины, асимметричные — с нависающим нижним краем. Брюшные усики широкоовальные, немного крупнее подиального бугорка. Анальные усики веретеновидные, длина их в 3—4 раза больше ширины. Сочленительные зубцы на ростр уме щетинки неодинаковой величины.
Спинная сторона сегментов имеет равномерную зеленовато-коричневую пигментацию, немного более темную по бокам, чем вдоль’медиальной линии (спиртовые экземпляры, хранящиеся в коллекциях ЗИН, окраску не сохранили)» Количество сегментов до 200. Длина тела до 80—100 мм, ширина до 4 мм.
Распространение. В коллекциях ЗИН имеется 6 экземпляров из Баренцева моря, района .Новой Земли, Земли Франца-Иосифа и Шпицбергена. По литературным данным, в атлантическом секторе спускается на юг до побережья Шотландии. Отмечен для арктического побережья Аляски (Pettibone, 1954). Указание о' нахождении этого вида у южного побережья Африки (Day, 1934 : 31) нуждается в подтверждении; возможно, в данном случае Дэй имел дело с Е. aurantiaca Schmarda. В дальневосточных морях распространен подвид Е. spetsbergensis bistriata Uschakov (см. ниже); у западного побережья Канады — Е. spetsbergensis pacijica Hartman, 1936 [=£'. maculata Treadwell, 1922].
46. Eteone (s. str.) spetsbergensis bistriata Uschakov, 1953
(Табл. XVII, 1—5)
Ушаков, 1953 : 208—209, рис. 2; 1955a : 104—105, рис. 9, A—В [E. (Mysta) bistriata)', Левенштейн, 1966 : 9 [E. (Mysta) bistriata).
От типичной формы отличается главным образом окраской тела. Хобот с мягкими папиллами, образующими многочисленные продольные ряды. Щетинки на II сегменте развиты слабо, иногда отсутствуют. Спинные усики на средних сегментах широкоовальные, почковидные, асимметричные;
12 И. В. Ушаков
178
I. PHYLLODOCIDAE
на задних сегментах спинные усики более вытянутые и удлиненные, чем на средних сегментах. Брюшные усики крупные, овально-округлые, по длине равны подиальному бугорку. Анальные усики сильно вытянутые, примерно в 3—4 раза длиннее своей ширины. Рукоятка щетинки с двумя неравной величины сочленительными зубцами; большой сочленительный зубец у основания имеет мелкие шипики.
На спинной стороне, у основания каждой параподии по одному большому коричневато-фиолетовому пятну, которые, сливаясь между собой, образуют по бокам тела две бросающиеся в глаза темные продольные полосы, средняя линия спины остается светлой; на брюшной стороне, на каждом сегменте по 3 небольших, менее ярких, пигментных пятна, причем расположенные по медиальной линии пятна образуют сплошную продольную полосу, а боковые — прерывистую. Пигментация спинной стороны хорошо сохраняется у спиртовых экземпляров, на брюшной стороне пигментация выражена не у всех экземпляров. Спинные усики не пигментированы (светлые). Эта окраска весьма типична для всех экземпляров из дальневосточных морей, лишь у одного экземпляра (восточное побережье Южного Сахалина, глубина 187 м) спинная сторона сегментов имела сплошную темную окраску (var. fuscodorsata Uschakov, 1953). Е. spetsbergensis pacifica Hartman, 1936, отмеченный для западного побережья Канады отличается неправильной пятнистой окраской (Е. Berkeley а. С. Berkeley, 1948 : 42).
Примечание. И. Г. Заксом (1933) для Японского моря был отмечен Е. aurantiaca Schmarda, 1861, ранее известный лишь из южного полушария; этот вид по форме спинных усиков весьма напоминает Е. spetsbergensis Malmgren, и нам думается, что Закс имел дело с какой-либо отклонившейся формой Е. spetsbergensis. О. Гартман (Hartman, 1959 : 154) в своем каталоге вслед за А. Катрфажем (Quatrefages, 1865 : 152) относит Е. aurantiaca к роду Lugia Quatrefages, 1865, однако никаких оснований для этого нет, ибо на I сегменте имеется 2 пары щупальцевидных усиков, что характерно для рода Eteone, а у Lugia всего 1 пара (Fauvel, 1923 : 178); в дальнейшем она же (Hartman, 1965а : 17) аннулировала это и оставила aurantiaca в роде Eteone.
Распространение. Встречается как в Японском, так и в Охотском, Беринговом и Чукотском морях; общая глубина 5—200 м (28 экз.).
5. Eteone (s. str.) vitiazi Uschakov, sp. nov.
(Табл. XVIII, 8—10)
Головная лопасть слегка вытянутая; длина немного больше ширины. Фронтальные щупальцы крупные. Глаз не видно. Граница между головной лопастью и I сегментом неясная. Хобот у нашего экземпляра втянут; на тотальном препарате на протяжении 8 передних сегментов стенки его светлые, а на протяжении последующих 5 сегментов боковые его стенки более темные (видимо, просвечивают боковые папиллы, характерные для Mystw, если это действительно так, то в дальнейшем, возможно, этот вид придется перенести в подрод Mysta). На I сегменте щупальцевидные усики разной длины: спинные — более тонкие и короткие, брюшные — значительно крупнее и длиннее. На II сегменте подиальный бугорок со щетинками. Спинные усики продолговатой формы, их длина почти в 2 раза больше ширины; брюшные усики более короткие, закругленные. Подиальный бугорок крупный, далеко выступает наружу, начиная примерно с XXV сегмента он почти равен ширине тела. В одном пучке до 10—12 ще
17. ETEONE
179
тинок. Щетинки резко гетер огомфные, дистальный членик мелкопильчатый.
Обрывок передней части тела, состоящий из 33. сегментов. Окраска светло-бежевая, без следов какой-либо пигментации. Длина обрывка 5 мм, ширина тела 0.6 мм, включая подиальные бугорки без щетинок.
Тип хранится в ЗИН АН СССР, инв. № 1/16326.
Примечание. От других видов отличается относительно крупными фронтальными щупальцами, сильно вытянутыми подиальными бугорками, удлиненными спинными усиками и отсутствием глаз.
Распространение. К востоку от о. Хонсю — 38°02' с. ш. и 146°33' в. д., глубина 5475 м, ил с примесью пемзовой гальки («Витязь», ст. 3575, 7 V 1957, 1 экз.).
6. Eteone (s. str.) lactea Claparede, 1868
(Табл. XVI, 7—9)
Bergstrom, 1914 : 209—211, fig. 81 (Hypereteone); Fauvel, 1923 : 175— 176, fig. 63, a—d (синонимия); Pettibone, 1963 : 70—71, fig. 16, a—с (синонимия).
Головная лопасть вытянутая, передний край закругленный. Глаза небольшие, черные, плохо заметные (сильно погруженные). В задней части головной лопасти с боков 2 небольших продольных желобка (чувствительные органы?). Хобот у наших экземпляров втянут (по литературным данным — гладкий). Верхние щупальцевидные усики заметно короче нижних. На II сегменте подиальный бугорок отсутствует. Спинные усики на средних сегментах неправильной почковидной формы, длина их меньше ширины; подставка вдается в спинной усик. Брюшной усик немного крупнее подиального бугорка. Анальные усики длинные, заостренные. Сочленительные зубцы щетинок с мелкими шипиками (по П. Фовелю они гладкие).
Окраска тела и придатков светло-бежевая, местами наблюдается мелкая точечная пигментация. Количество сегментов, по литературным данным, до 400. Длина тела до 230 мм.
Распространение. В коллекциях ЗИН имеется 2 экземпляра — из района Орезунда и с атлантического побережья Северной Америки (Вудс-Хол). Встречается в северной части Атлантического океана на американском побережье от залива Св. Лаврентия до Флориды, а также у побережья Европы.— западная часть Балтийского моря, Северное и Средиземное моря, общая глубина 0—200 м.
Подрод MYSTA Malmgren, 1865
Хобот с двумя боковыми рядами из крупных папилл наподобие сосочков; остальная поверхность хобота покрыта мелкими шипиками.
к
7. Eteone (Mysta) barbata (Malmgren, 1865)
(Табл. XVII, 6—10)
Malmgren, 1865 : 101, tab. XV, fig. 34 (Mysta); 1867 : 26, tab. Ill, fig. 20 (Mysta); Theel, 1879 : 34 (Mysta); W i r e n, 1883 : 400 (Mysta); McIntosh, 1908 : 108—109, pl. LVIII, fig. 10, pl. LXIX, fig. 10, pl. LXXVIII, fig. 19 (Mysta); Southern, 1914:75 (Mysta); Bergstrom, 1914:207—208, Textfig. 79, синонимия (Mysta); Ditlevsen, 1917 : 66, pl. 5, figs. 12, 17, 19 (Eteone striata);
12*
180
I. PHYLLODOCIDAE
Eliason, 1920 : 28 (Mysta); Fauvel, 1923 : 176; Augener, 1928 : 711 (Mysta); Анненкова, 1937 : 159; 1938 : 146; E. Berkeley a. C. Berkeley, 1942 : 190; Зацепин, 1948 : 113, табл. XXIX, 14, в, с, е, к (Mysta); Ушаков, 1948а : 27 (Mysta); 1950 : 171; Wesenberg-Lund, 1951 : 31; Анненкова, 1952 : 121; Pettibone, 1954 : 233—234, fig. 27 (синонимия); Ушаков, 1955а : 102, рис. 9, Г—Е; Левенштейн, 1966 : 9.
Головная лопасть широкая и короткая, ширина ее немного больше длины. Глаза обычно плохо различимы. Хобот в передней части с 2 боковыми продольными рядами очень крупных мягких папилл («боковые сосочки»), с каждой стороны их до 30—50; вся остальная поверхность хобота густо покрыта очень мелкими папиллами довольно разнообразной формы, они могут иметь грубо гранулированную структуру или снабжены мелкими игловидными шипиками. Щупальцевидные усики цилиндрические, верхние почти вдвое длиннее нижних; по длине верхние щупальцевидные усики достигают V—VI сегменты. На II сегменте подиальный бугорок со щетинками. Спинные усики широкие, округлые, симметричные; ширина усиков больше их высоты. Брюшные усики широкоовальные, несколько превышают подиальный бугорок. Анальные усики удлиненные, длина их примерно в 3 раза больше ширины. Рострум рукоятки щетинок с 2 несколько изгонутыми сочленительными зубцами, покрытыми мелкими шипиками; конечный членик щетинок удлиненный, мелкопильчатый по краю.
Наши спиртовые экземпляры с побережья Швеции и из Белого моря имели светло-бежевую окраску с тремя более темными продольными полосами на спинной стороне; экземпляры из Чукотского моря и дальневосточных морей имели темную и равномерную зеленовато-бурую окраску. Количество сегментов до 175. Длина тела до 120 мм, ширина до 7 мм, включая параподии.
Примечание. На табл. XVII, 8 изображена параподия с наиболее низким и широким спинным усиком; форма спинных усиков может несколько варьировать, но высота их всегда меньше ширины. Для Е. (Mysta) barbata характерны удлиненные спинные щупальцевидные усики, которые всегда длиннее брюшных, чем этот вид хорошо отличается от Е. (s. str.) flava, имеющего примерно такие же спинные усики.
Некоторые вариации наблюдаются в вооружении хобота, в частности в отношении мелких папилл, покрывающих дорсальную сторону хобота. Так, у исследованного мной экземпляра из района Орезунда (примерно откуда был описан тип вида) на дорсальной стороне хобота в промежутке между крупными боковыми папиллами имелись как очень мелкие округлые (всего 2 мк), так и более крупные (свыше 8 мк) треугольной формы папиллы с гранулированной, слегка шиповатой поверхностью, причем мелких папилл значительно больше, чем крупных. «У экземпляра из Белого моря все папиллы были одинаковой величины (около 8 мк), при этом все они имели на своей округлой поверхности хорошо заметные игловидные шипики (табл. XVII, 10^. Аналогичные папиллы с острыми шипиками наблюдались и у экземпляра из Охотского моря (70ш). У экземпляра из Берингова пролива и залива Анива (Сахалин) эти папиллы были той же величины (8—12 мк), но с грубо гранулированной поверхностью, без явных шипиков (701Т и 70v). Сильно вытянутые и очень крупные папиллы (до 40 мк) с гранулированной поверхностью отмечены у экземпляра из района северных Курильских островов (10Г1), который отличался весьма крупными размерами тела (длина тела 120 мм). Возможно, что исключительно большие размеры папилл у этого экземпляра были связаны с размером самой особи, однако степень шиповатости самих папилл во всех
17. ETEONE
181
остальных случаях не коррелируется с размерами особей и эти вариации не могут рассматриваться как возрастные изменения. По всей видимости, в пределах наших морей мы сталкиваемся с несколькими обособленными популяциями, по ограниченность материалов пока но позволяет четко их охарактеризовать. У исследованных экземпляров из Белого и Охотского морей хоботные папиллы по форме своих шипиков чрезвычайно напоминают такие папиллы, изображенные для Mysta papilltfera Theel с побережья Новой Земли (Theel, 1879 : 33—34, pl, II, figs. 25—28). Признать видовую или подвидовую самостоятельность за Mysta papilltfera Theel пока весьма затруднительно; указанное для него крайне незначительное количество крупных боковых папилл (всего 7) на нашем материале не подтверждается и последнее, возможно, объясняется тем обстоятельством, что хобот у новоземельского экземпляра не был полностью вывернут наружу (см.: Bergstrom, 1914 : 208). П. Фовель (Fauvel, 1923 : 176) М. papilltfera Theel со знаком вопроса относит к Е. {Mysta) picta Quatr., что нам представляется ошибочным, ибо форма спинных усиков у них совершенно разная и к тому же Е. {Mysta) picta Quatr. к северу от Ла-Манша не обнаружен.
По удлиненным спинным щупальцевидным усикам, форме параподиаль-ных усиков и окраске Е. {Mysta) barbata Mgrn. отчасти напоминает Е. triltneata Webster et Benedict, 1887, распространенный у атлантического побережья Северной Америки от залива Св. Лаврентия до Массачусетс (Pettibone, 1963).
Распространение. В коллекциях ЗИН 40 экземпляров из Баренцева, Белого, Восточно-Сибирского, Чукотского, Берингова, Охотского и Японского морей; общая глубина 10—418 м, предпочитает глубины менее 50 м. Арктическо-бореальный вид, в атлантическом секторе спускается до Северного моря и побережья Ирландии, в тихоокеанском секторе отмечен лишь у азиатского побережья до Японского моря включительно.
8. Eteone (Mysta) ornata Grube, 1877
(Табл. XVIII, 1—4)
Grube, 1877 : 106; I z u k a, 1912 : 201; Анненкова, 1937 : 159, 1938 : 146; Ушаков, 1955a : 105, рис. 10, A—В; Imajima a. Hartman, 1964 : 65—66 (Mysta); [non Fauvel, 1932 : 73—74; 1933 : 17—18; 1953 : 128, fig. 65, a—d; non Day, 1967 : 140, fig. 5, 1, f—i].
Головная лопасть широкая, почти треугольной формы. Глаза на фиксированном экземпляре едва различимы. Хобот с двумя боковыми продольными рядами папилл (по данным Н. П. Анненковой, вскрывшей глотку; хобот в коллекциях не сохранился). Верхние щупальцевидные усики достигают V сегмент, нижние немного короче. На II сегменте подиальный бугорок со щетинками. Спинные усики продолговато-овальные, почти симметричные; в передней части тела они более короткие, в задней части более вытянутые. Брюшные усики удлиненные, по длине несколько превосходят подиальный бугорок. Анальные усики крупные, примерно в 2 раза длиннее своей ширины. Щетинки с 2 сочленительными зубцами примерно одинаковой величины; у основания сочленительных зубцов мелкие шипики.
Окраска весьма характерная: тело и все усики бледного желтоватобежевого цвета; на этом общем фоне на спинной стороне резко выделяются три продольные темные коричнево-фиолетовые полосы, из них две боковые у основания параподий и одна медиальная; на брюшной стороне также
182
I. PHYLLODOCIDAE
три темные продольные полосы, но не столь резкие. Количество сегментов около 150. Длина тела около 35 мм, ширина 1.5—2 мм.
Примечание. Синонимия этого вида, к сожалению, сильно запутана. Указанные Фовелем (Fauvel, 1932, 1933, 1953) Е. (Mysta) ornata Grube с побережья Индии и из Желтого моря мы относим к описанному нами новому виду — Е. (Mysta) tchangsii Uschakov et Wu (см. стр. 183). Приведенный в работе Дж. Дэя (Day, 1957, 1967) Е. ornata Grube с побережья Мозамбика (Южная Африка), судя по его описаниям и рисункам, совершенно другой вид, чем наш Е. ornata Grube, который мы имели из того же района, откуда этот вид впервые был описан самим Грубе (Grube, 1877). Африканский экземпляр Дэя отличается весьма низкими и широкими спинными усиками, отсутствием щетинок на II сегменте и строением хобота — в базальной его части 4 продольных ряда папилл. К сожалению, Грубе дал очень краткое описание своего вида и не сопроводил его рисунками, что и послужило причиной указанных недоразумений. Наш экземпляр — второе нахождение грубовского вида.
Распространение. В коллекциях ЗИН имеется один экземпляр из залива Петра Великого, глубина 18—20 м; вид описан Грубе без указания точного местонахождения, отмечено лишь «Северное Японское море».
9. Eteone (Mysta) maculata (Treadwell, 1920)
(Табл. XVIII, 5—7)
Treadwell, 1920 : 593—594, figs. 1—4 (Mysta) [non Oersted, 1843 : 29 (incertae sedis); non Treadwell, 1922 : 174,-=£’. spetsbergensis pacifica Hartman, 1936].
Головная лопасть широкая, спереди закругленная. Глаза крупные, черные. Хобот у наших экземпляров втянут и остался не исследованным. I перистомиальный сегмент, несущий щупальцевидные усики, значительно крупнее остальных. II сегмент с подиальным бугорком, вооруженным щетинками. На последующих нескольких передних сегментах спинные усики очень маленькие. В средней части тела спинные усики сидят на широких подставках, симметричные или слегка асимметричные, ширина спинных усиков равна или немного меньше их длины. Подиальные бугорки конические, сильно вытянутые, по своей длине почти равны спинному усику. Брюшные усики ложковидной формы. Рострум щетинок с 2 неравной величины сочленительными зубцами; дистальный членик с мелкой зубчатостью (пильчатый). ,
Спинная сторона сегментов покрыта мелкой точечной пигментацией, образующей неправильные поперечные ряды; брюшная сторона светлая; в средней части тела спинные усики имеют в центре небольшие пигментные пятна. Количество сегментов свыше 100 (экземпляры нецелые). Длина тела до 30 мм (по Трэдвуеллу — до 60 мм), ширина до 3 мм.
Примечание. В коллекциях ЗИН имеется один экземпляр из Тонкинского залива, который вполне совпадает с описанием этого вида по А. Трэдвуеллу (Tredwell, 1920), в частности по наличию двух крупных глаз, характеру пигментации, форме параподий с удлиненным подиальным бугорком и ложковидным брюшным усикам, деталям строения щетинок; другой наш экземпляр с литорали о. Хайнань менее типичный — имеет более вытянутую головную лопасть, пигментация сегментов очень слабая.
П. Фовель (Fauvel, 1932) рассматривает Е. (Mysta) maculata Treadwell, 1920 как синоним Е. (Mysta) ornata Grube, однако с этим согласиться
17. ETEONE
183
очень трудно; для Е. (Mysta) ornata, в частности, характерны 3 продольные темные полосы на спинной стороне (см. стр. 181), и наш материал заставляет нас считать, что имеется два раздельных вида — Е. (М.) maculata Treadwell, 1920 и Е. (М.) ornata Grube, 18?7.
Распространение. Филиппинские острова, глубина 44 м (Treadwell, 1920), Тонкинский залив и о. Хайнань, глубина 0—93 м (материал ЗИН АН СССР).
10. Eteone (Mysta) tchangsii Uschakov et Wu, 1959
(Табл. XIX, 1-6)
Fauvel, 1933 : 17—18 [Eteone (Mysta) ornata,]; Ушаков иУБао-лин, 1959 : 27—28, табл. 2, Г—Ж; Као, 1959 : 143, табл. VI, рис. 3, a—f (Eteone sp.); Ушаков иУБао-лин, 1965 : 155—156, рис. 2, А—Г.
Головная лопасть слабо коническая, широкая. Головные щупальца короткие. Глаз не видно. Имеется небольшая затылочная папилла. Щупальцевидные усики относительно короткие; верхние немного длиннее нижних; по длине достигают IV щетинковый сегмент. На II сегменте щетинки имеются. Хобот очень большой (до 15 мм длины), с боковыми рядами крупных мягких папилл, имеет легкую поперечную складчатость и густо покрыт с дорсальной стороны мелкими темными бугорками с хитиновыми шипиками. Передняя часть хобота сильно расширена, с большим дорсальным соском; входное отверстие в верхней части окружено мягкими тонкими пальцевидными отростками (дольчатым бордюром). Спинные усики сидят на крупных удлиненных подставках, относительно небольшие, овально вытянутые (высота их равна или даже меньше длины циррофора). Брюшные усики маленькие, тупые. В одном пучке около 30 щетинок. Рострум щетинки имеет два неодинакового размера сочленительных зубца с мелкими шипиками.
Окраска тела и спинных усиков желтовато-коричневая; спинная сторона заметно темнее брюшной; спинная сторона у некоторых экземпляров с синеватым отливом, иризирующая. На спинной стороне поперек каждого сегмента многочисленные неправильно разбросанные темные пятнышки (фиолетового оттенка), которые частично заходят на подставки спинных усиков; у экземпляров с о. Хайнань пигментные пятнышки образуют на каждом сегменте две четкие поперечные полосы. У спинных усиков наиболее .сильно пигментирован верхний край. Количество сегментов до 300. Длина тела до 160 мм, ширина 8 мм.
Половозрелые экземпляры с крупными красноватого цвета яйцами в параподиях отмечены в Желтом море 11 XI и 23 XII 1950.
Примечание. Этот вид ранее был отмечен П. Фовелем (Fauvel, 1933) для Желтого моря под названием Е. (Mysta) ornata Grube. Мне удалось сличить в Национальном музее естественной истории в Париже наш экземпляр Е. (Mysta) tchangsii с его Е. (Mysta) ornata из Желтого моря и никаких существенных различий я не обнаружил. Как мы уже отмечали выше (стр. 181), Е. ornata Grube — самостоятельный вид, который достаточно хорошо отличается от Е. (Mysta) tchangsii как окраской (три продольные темные полосы на спинной стороне тела), так и спинными усиками (они сидят на коротких циррофорах). Как указывал сам Фовель, его Е. (Mysta) ornata из Желтого моря (т. е. наш Е. (Mysta) tchangsii) по форме параподий и размерам весьма близок к Е. (Mysta) siphonodonta (Delle Chiaje) из Средиземного моря, отличаясь от него в основном лини, окраской и деталями строения хобота.
184
I. PHYLLODOCIDAE
Распространение. В коллекциях ЗИН имеется 8 экземпляров из Желтого моря (Циндао) и Южно-Китайского моря (о. Хайнань), добытые в осушной зоне на песчанистых пляжах. По всей видимости, этот же вид П. Фовель (Fauvel, 1953) имел и с побережья Индии.
Подсемейство LOPADORHYNGHINAE Claparede, 1870
Головная лопасть небольшая, частично или полностью слита с I, а иногда и со II сегментом. 4 головных щупальца. 2 или 3 пары щупальцевидных усиков. Два или три передних туловищных сегмента иногда с очень крупными параподиями, снабженными простыми крючковидными щетинками (род Lopadorhynchus). Пигидий с рудиментарными анальными придатками или их нет вовсе. Тело короткое, состоит из небольшого количества сегментов (не свыше 35). Пелагические формы.
Подсемейство Lopadorhynchlnae включает 4 рода: Lopadorhynchus Grube, Pelagobia Greeff, MaupasiaNiguier и Pedinosoma Reibisch, имеющие, возможно, весьма разное происхождение (см. стр. 77).
К. Стёп-Бовитц (Stnp-Bowitz, 1948) отнес к этому подсемейству и род Nans Chamberlin, 1919, у которого сложные щетинки отсутствуют вовсе и имеются лишь ацикуловидные и простые крючковидные. Систематическое положение этого рода не вполне ясное. Чемберлен рассматривал его как самостоятельное подсемейство Nantinae. Нам представляется, что род Nans Chamberlin в некоторых отношениях ближе к семейству Typhlos-colecidae, чем к семейству Phyllodocidae.
18, Род LOPADORHYNCHUS Grube, 1855
£(nom. corr. Kleinenberg, 1886)
\Lopadorrhynchus Grube, 1885; Hydrophanes Claparede, 1870; Mastlgethus Chamberlin, 1919]
Головная лопасть спереди притупленная, очень короткая, ее ширина значительно больше длины. Головная лопасть слита с двумя первыми сегментами. Дорсальная пара головных щупалец отходит с боков преднего края головной лопасти, а вентральная — располагается близ ротового отверстия. Глаза (одна пара) имеются лишь у молодых, а затем они редуцируются. Глотка короткая, гладкая или с боковыми мягкими пальцевидными папиллами, снабжена 3 (реже 4) крупными железами, Три пары щупальцевидных усиков, из которых третья пара, находящаяся на брюшной стороне, рудиментарная, в виде небольшой окрутчтой папиллы; щетинок и ацикул при основании щупальцевидных усиков нет. Формула
1 7V
передних сегментов: 1 + О— + С-^. Два, иногда три передних щетинковых сегмента заметно крупнее остальных, с сильно видоизмененными параподиями, снабженными крупными, простыми, загнутыми щетинками. Нормальные туловищные сегменты имеют конический подиальный бугорок, прикрытый спереди очень крупной, округлой губой. Щетинки образуют широко развернутый веер. Дистальный членик щетинок в виде широких лезвий, с зубчиками на одной стороне. Спинные и брюшные усики короче подиального бугорка. Анальная лопасть без придатков. Количество сегментов небольшое. Пелагические формы.
Типовой вид: Lopadorrhynchus brevis Grube, 1855.
Ряд авторов выделяет 2 подрода — Lopadorhynchus Grube s. str. и Prolopadorhynchus Bergstrom на основании наличия или отсутствия
18. LOPADORHYNCHUS
185
брюшного усика на передних видоизмененных сегментах, однако этот признак весьма не четкий (Tebble, 1960; Kim In-bae, 1967). Род насчитывает 7 видов. Сводная таблица для определения всех известных в настоящее время видов Lopadorhynchus приведена в работе Р. Дэйлса (Dales, 1957). Для северо-западной части Тихого океана отмечено 4 вида: L. appendiculatus Southern, L. uncinatus Fauvel, L. krohnii (Clap.) и L. brevis Grube.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА LOPADORHYNCHUS GRUBE
1 (2). Три первых сегмента с измененными параподиями ................
..............................................2. L. brevis Grube.
2 (1). Два первых сегмента с измененными параподиями.
3 (4). Параподии на двух передних сегментах имеют оторочку в виде-гребня или воротничка.......................4. L. uncinatus Fauvel.
4 (3). Параподии на двух передних сегментах не имеют оторочки.
5 (6). Брюшные усики с сильно вытянутым тонким кончиком. Начиная с IV сегмента простые щетинки отсутствуют ..........................
................................ 1. L. appendiculatus Southern.
6 (5). Брюшные усики постепенно заостряющиеся. На всех туловищных сегментах имеется по 1—2 простой крючковидной щетинке при брюшном усике.............................3. L. krohnii (Claparede)..
1. Lopadorhynchus appendiculatus Southern, 1909
(Табл. XX, 1-5)
S anther и, 1909 : 7—9, pl. II—III, figs. 12—20; Bergstrom, 1914 : 179, Textfig. 66 (Prolopadorhynchus)-,- F a u v e 1, 1923 : 187—188, fig. 69, a—i; Wesen-berg-Lund, 1939 : 17—19, figs. 13—14; St0p-Bowitz, 1948 : 20—21; Ушаков, 1957 : 271—272, рис. 2, a—д, карта 1; Kim In-bae, 1967 : 228— 230, figs. 4, d, 5, a, b, c.
Верхние головные щупальца значительно крупнее нижних. Щупальцевидные усики (не считая третьей рудиментарной пары, расположенной на брюшной стороне) крупнее головных щупалец. Два первых щетинковых сегмента крупнее остальных, с массивными, притупленными подиаль-ными выростами, на дистальном конце которых имеется волнистая оторочка (брыжжи); из-под нее полукругом отходят крупные, простые,, крючковидные щетинки с сильно загнутым кончиком; эти щетинки частично желтовато-коричневого цвета; на каждой параподии до 6—7 таких щетинок. Брюшные усики на двух передних измененных параподиях неясно различимы и представляют собой обособленную часть оторочки. На всех последующих параподиях брюшной усик с резко оттянутым нитевидным кончиком, чем этот вид хорошо отличается от остальных. Параподии нормальных сегментов имеют конический подиальный бугорок с аци-кулой, широкую переднюю полукруглую губу и пучок в виде веера сложных щетинок. На третьей паре параподий в нижней части пучка имеются 1—2 простые светлые щетинки, на остальных туловищных сегментах простые щетинки отсутствуют. Сочленительный зубец сложных щетинок асимметричный; дистальный членик очень широкий, в виде лезвия ножа, тонкий, совершенно прозрачный, с небольшими зубчиками на одной стороне. Анальная лопасть полукруглая, анальных усиков нет.
Окраска тела желтоватая. Количество щетинковых сегментов 24. Длина тела 10 мм, ширина 2.5 мм, включая параподии и щетинки.
186
I. PHYLLODOCIDAE
Исследованный нами экземпляр половозрелый, с яйцами в параподиях (13 IX 1953).
Распространение. В коллекциях ЗИН имеется один экземпляр из северо-западной части Тихого океана, прилегающей к Курильской гряде — 43°20' с. ш. и 155°47' в. д., горизонт 0—50 м. По литературным данным, встречается в Атлантическом океане в районе Ирландии, Азорских и Канарских островов, а также в Средиземном море; сравнительно редкий вид.
2. Lopadorhynchus brevis Grube, 1855
Grube, 1855 : 100, pl. 3, figs. 13, 15, 16; R e i b i s c h, 1895 : 38, pl. 3, figs. 10— 15 (nationalis); Chamberlin, 1919a : 114—119, pl. 17, figs. 1—7 (parvurn et nans)’, Fauvel, 1923 : 184, fig. 69, k; M onr o, 1930 : 78; 1937 : 266—267; 1939 : 347; W es enb erg - Lund, 1939 : 12—15, figs. 8—10, chart 7; Stop-Bowitz, 1948 : 18; D a 1 e s, 1957 : 104—105, figs. 7—8; E. Berkeley a. C. Berkeley, 1958 : 401; Tebble, 1960 : 200—201, 259—261, fig. 52; 1962 : 416—417; E. Berkeley a. C. Berkeley, 1964 : 122; R u 11 i e r, 1965c : 867—868; Kim I n -b a e, 1967 : 219—221, figs. 1—3 (синонимия).
Верхние и нижние головные щупальца примерно одинаковой длины. Три первых пары параподий крупнее остальных, снабжены лишь крупными, простыми, слегка изогнутыми щетинками (до 7—10 щетинок на одной параподии). Брюшные усики различимы лишь с III щетинкового сегмента; брюшной усик вначале шиловидно-конический, а затем удлиненногрушевидный (форма брюшного усика изменяется на XII—XIV сегментах). С IV сегмента параподии со сложными (сочлененными) щетинками и обычно имеют, кроме того, 1—2 простые щетинки. Количество сегментов до 35. Длина червей до 35 мм, ширина — до 7 мм.
Распространение. В коллекциях ЗИН имеется 2 экземпляра из Средиземного моря, а также 14 экземпляров по материалам Советской антарктической экспедиции на д/э «Обь» из южных районов Тихого океана и тропической зоны Индийского океана (Тэббл, 1968). По литературным данным, приурочен к тропическим и субтропическим водам Атлантического, Индийского и Тихого океанов. В северной части Тихого океана отмечен для района Японии и Калифорнии; в последнем районе совершает суточные вертикальные миграции, встречаясь в поверхностных слоях лишь ночью (Dales, 1957).
3. Lopadorhynchus krohnii (Claparede, 1870)
Claparbde, 1870:100—102, pl. XI, fig. 2 (Hydfophanes)’, Reiblsch, 1895 : 35, 37—38, pl. 4, fig. 4 (yiguieri); Bergstrom, 1914 : 180—182, fig. 68; Wesenberg-Lund, 1939 : 15—16, fig. 11, chart 8; Dales, 1957 : 105—106, figs. 9, 10; T e b Ы e, 1960 : 202, 259—261, fig. 52; 1962 : 418—419, fig. 21; E. В e r-keleya. C. Berkeley, 1964 : 122; Kim I n-b a e, 1967 : 226—228, fig. 4, c (синонимия).
Дорсальная пара головных щупалец несколько крупнее вентральной. Две первые пары параподий заметно толще остальных и вооружены лишь крупными, загнутыми простыми щетинками, однако последние не окружены оторочкой (воротничком), как у L. uncinatus Fauvel. Брюшные усики на первых двух сегментах слиты с задней подиальной лопастью и хорошо различимы лишь с III сегмента. На нормальных туловищных сегментах параподии с многочисленными сложными и 1—2 крючковидными простыми щетинками близ брюшного усика. Количество сегментов до 20. Длина червей до 9 мм.
19. PELAGOBIA
187
Распространение. В коллециях ЗИН имеется 19 экземпляров из тропической зоны Индийского океана и южных районов Тихого океана по материалам д/э «Обь» 1956—1958 гг. (Тэббл, 1968). В литературе указан для тропических и субтропических районов Атлантического, Индийского и Тихого океанов; в северной части Тихого океана отмечен близ берегов Японии и Калифорнии.
4. Lopadorhynchus uncinatus Fauvel, 1915
F a u v e 1, 1915 : 3, fig. 2; 1923 : 184—185, fig. 67, a—g; Wesenberg-Lund, 1939 : 10—12, figs. 6—7, chart 6; ,T r e a d w e 1 I, 1943 : 32—33, pl. 1, figs. 7—10 (varius); S t ap-Bowi t z, 1948 : 17—18, fig. 11; Dales, 1957 : 101— 104, figs. 1—6; E. Berkeley, a. C. Berkeley, 1958: 400-401; 1960 : 788; Tebble, 1960 : 259—261, fig. 52; 1962 : 417; E. Berkeley a C. Berkeley, 1964: 122; Kim In-bae, 1967 : 225, fig. 4, a, b.
Дорсальная пара головных щупалец длиннее вентральной. Две первые пары параподий значительно крупнее остальных; они не имеют брюшных усиков и вооружены 4—7 очень крупными загнутыми простыми щетинками, которые окружены хорошо заметной подиальной оторочкой наподобие гребня или воротничка. На остальных сегментах многочисленные сложные щетинки, но наряду с ними иногда 1—2 простые щетинки. Количество сегментов до 32. Длина червей до 25 мм, ширина до 7 мм.
Распространение. В коллекциях ЗИН имеется 1 экземпляр из тропической зоны Индийского океана (д/э «Обь», 1957 г.). Преимущественно в тропических и субтропических водах Атлантического, Индийского и Тихого океанов; в северной части Тихого океана встречен в районе берегов Японии.
19. Род PELAGOBIA. Greeff, 1879
Головная лопасть слегка вытянутая, спереди закругленная, неясно отделена от I сегмента. Глаза отсутствуют или имеются и снабжены хрусталиками. Глотка снабжена двумя хитиновыми крючками наподобие стилетов и многочисленными железами. Две пары длинных щупальцевидных усиков на I сегменте; у основания щупальцевидных усиков пучок длинных щетинок. Спинные усики-на II сегменте отсутствуют. Формула передних сегментов: S у Д- S ^-Д- S Параподии одноветвистые, сильно вытянутые. Спинные и брюшные усики удлиненные, цилиндрические, пальцевидной формы, значительно длиннее подиального выроста. Щетинки только сложные (сочлененные), с зазубренным дистальным члеником. Анальная лопасть с 2 анальными усиками. Количество сегментов не свыше 25. Небольшие черви, ведущие пелагический образ жизни, тело полупрозрачное.
Типовой вид: Pelagobia longicirrata Greeff, 1879.
Род представлен двумя видами. Отмеченная в литературе Р. erinensis Nolte, 1938 представляет собой лишь постларвальную стадию с 4 щетин-ковыми сегментами.
Достаточно подробное описание глотки Pelagobia longicirrata с изображением небольших крючков впервые дано Г. Фридрихом (Friedrich, 1949). Наличие крючков на глотке Pelagobia сближает последнюю с таковой Phalacrophorus (стр. 193).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА PELAGOBIA GREEFF
1 (2). Глаза имеются. Дистальный конец рукоятки щетинки гладкий или с очень мелкими (микроскопическими) шипиками...........
................................ 1. Р. longicirrata Greeff.
188
I. PHYLLODOCIDAE
2 (1). Глаза отсутствуют. Дистальный конец рукоятки щетинки с крупными шипиками......................*Р. serrata Southern 1909.
Southern, 1909 : 3, pl. I, figs. 2—3.
Побережье Ирландии, Азорские острова, Средиземное море (Монако).
1. Pelagobia longicirrata Greeff, 1879
(Табл. XXI. 1—4)
Greeff, 1879:247, pl. XIV, figs. 23—25; Reibisch, 1895:21, pl. II, figs. 1—9 (P. longecirrata); Gravier, 1911 : 62—65, pl. II, figs. 22—25 (P. viguieri); Ehlers, 1913 : 460—462; В ergstrom, 1914 : 186—187, Textfig. 70; Cha m-b e r 1 i n, 1919a : 122—124 (P. viguieri); Benham, 1921 : 57, pl. 7, figs. 59—60 (P. viguieri)-, Fauvel, 1923 : 192, fig. 72, a—e; Benham, 1927 : 78 (P. viguieri); Augener, 1929 : 291—294; О k u d a, 1937a : 75—76, fig. 1; Я ш н о в, 1940 : 58; Treadwell, 1943 : 33 (Р. viguieri); Stap-Bowi’tz, 1948 : 21; 1949 : 4—5; Wesenberg-Lund, 1950b : 37—38, chart 9; Ушаков, 1952 : 103—104, рис. 1 (P. viguieri); 1955a : 105—106, рис. 11, А— В (P. viguieri); 1957a : 268, карта 1; D.ales, 1957 : 107—108, figs. 11—13; T e b bl e, 1960:202—204, 237—242, figs. 37—44, tabl. 18, 19; E. Berkeley a. C. Berkeley, 1960 : 788; Imajima, 1961 : 6; T e b b 1 e, 1962 : 419—420, fig. 22; E. В e r k e 1 e у а. С. В e r k e 1 e у, 1964 : 123.
Одна пара глаз, снабженных хорошо заметной, небольшой линзой (хрусталиком). 2 крупных пигментированных затылочных органа, расположенных по бокам головной лопасти. 2 пары длинных, цилиндрических щупальцевидных усиков, равных по длине 4—6 передним щетинковым сегментам; при основании щупальцевидных усиков крупный пучок сложных щетинок. Параподии с коническим подиальным выростом и пучком длинных сложных щетинок. Первая пара параподий без спинного усика; все последующие параподии снабжены длинным, цилиндрическим спинным усиком. Брюшные усики на всех сегментах такой же формы, что и спинные усики, и лишь немного короче последних. Спинные и брюшные усики по длине значительно превосходят подиальный бугорок. Щетинки только сложные (сочлененные), резко гетерогомфные, с двумя разной величины сочленительными зубцами; конечный членик длинный, с крупными редкими зубчиками по одному краю и с тонким нежным лезвием,, или каймой, по другому краю; дистальная часть стержня гладкая или с очень мелкими, микроскопическими шипиками (у моих экземпляров стержень совершенно гладкий). Щетинки очень длинные, далеко выступают наружу. Анальная лопасть с рудиментарными придатками.
Тело полупрозрачное, желтовато-серого цвета; у некоторых экземпляров наблюдаются яркие оранжево-желтые пятна по бокам сегментов и у основания подиальных усиков. Количество щетинковых сегментов 14— 17 (до 25). Размеры: длина тела до 8—12 мм, ширина — до 2 мм.
Распространение. В коллекциях ЗИН представители этого вида имеются из Норвежского моря, Полярного бассейна, Охотского моря, северо-западной части Тихого океана и из различных районов южного полушария (со 140 станций). В районе Курильской гряды наибольшие концентрации отмечены на горизонтах 200—1000 м, максимальная плотность 1 экз. на 1 м3 (Милейковский, 1969). Широко распространенный батипелагический вид.
20. MAUPASIA
J 89
20. Род MAUPASIA Viguier, 1886
(Halyplanes Reibisch, 1893; Haliplanes Reibisch (1894) 1895; Haliplanella Treadwell, 1943]
Головная лопасть очень короткая, спереди закругленная, слита с I сегментом. Глаза отсутствуют. Глотка короткая, без папилл, но имеет крупные железы. 3 пары щупальцевидных усиков, при этом 2 пары на 1 сегменте, а третья пара — на II сегменте, более или менее четко отделенном от I сегмента. При щупальцевидных усиках ацикулы и щетинки. Формула
1 \ 1 ZV
передних сегментов: S+ SТретья пара щупальцевидных
усиков иногда очень длинная, значительно крупнее двух первых пар. Параподии одноветвистые со спинными и брюшными усиками. Щетинки сложные, с удлиненным тонким конечным члеником; на первом сегменте могут быть простые щетинки. Анальная лопасть с рудиментарными придатками. Количество сегментов небольшое (обычно не превышает 20). Очень мелкие пелагические формы — максимальная длина 7—8 мм.
Примечание. У представителей рода Maupasia с боков головной лопасти у заднего ее края нередко наблюдаются сильно вытянутые нухальные папиллы (vibratile organs), которые могут быть спутаны с щупальцевидными усиками В частности, Н. Тэббл (ТеЬЫе, 1962 : 421) для рода Maupasia указывает 4 пары щупальцевидных усиков и дает 1 1
следующую формулу: -j—|--р. Но это, по-видимому, обусловлено именно тем, что удлиненные нухальныевы росты он посчитал за первую пару щупальцевидных усиков; на приведенном им рисунке хорошо видно, что II сегмент имеет лишь одну пару щупальцевидных усиков. Все мои экземпляры хорошо согласуются с формулой, предложенной П. Фовелем (Fauvel, 1923).
Типовой вид: Maupasia caeca Viguier, 1886.
Род включает 4 вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА МА UP A SIA VIG UIER
1 (2). Спинные щупальцевидные усики на II сегменте примерно такой же длины, что и усики на I сегменте. Спинные подиальные усики листовидные — широкие, с оттянутым сосковидным кончиком; брюшные — вытянутые и заостренные...................1. М. caeca Viguier.
2 (1). Спинные щупальцевидные усики на II сегменте значительно длиннее щупальцевидных усиков I сегмента.
3 (4). Спинные подиальные усики листовидные........................
.........................................*М. gracilis (Reibisch).
Reibisch, 1895 : 25—26, pl. II, figs. 10—14 (Hallplanes)', Southern, 1909 : 5, pl. I, fig. 6, pl. II, figs. 7—11 (Haltplanes magna); Treadwell, 1943 : 32, pl. I, figs. 4—6 (Haliplanella pacifica); Dales, 1957 : 108.
Атлантический океан (от 10° ю. ш. до 40° с. ш.) и экваториальные районы Тихого океана.
4 (3). Спинные подиальные усики удлиненно-овальные.
5 (6). Все щетинки на всех сегментах примерно одной толщины .... ........................................... * М. isochaeta (Reibisch).
Reibisch, 1895 : 26—27, pl. II, fig. 14 (Haliplanes). Атлантический океан (Саргассово море) и Средиземное море.
190
I. PHYLLODOCIDAE
6 (5). На передних параподиях имеется по нескольку очень толстых и коротких сложных щетинок; на задних сегментах все щетинки более или менее одинаковой толщины . . . 2. М. brodskyi Uschakov.
1. Maupasia caeca Viguier, 1886
(Табл. XXI, 5—8)
Viguier, 1886 : 382-385, pl. XXI, figs. 14—20; Ehlers, 1913 : 462; F a u-v e 1, 1923 : 190—191, fig. 71, a—d; 1939 : 276—277; Wesenberg-Lund, 1939 : 19—20, chart И; У шаков, 1957a : 268—270, рис. 1, в—д, карта 1; Е. В е г-keley а. С. Berkeley, 1958 : 401; Т е b b 1 е, 1960 : 204—205, 242, fig. 44; 1962 : 421—423, figs. 23, 24; Е. В е г k е 1 е у а. С. В е г k е 1 е у, 1964 : 123.
У заднего’края головной лопасти на спинной стороне с боков два крупных округлых вздутия (нухальные органы). Первый сегмент неясно отделен от головной лопасти и имеет две пары удлиненных щуиальцевидных усиков, у основания которых небольшой пучок из щетинок. Второй сегмент имеет одну пару удлиненных щупальцевидных усиков, подиальный бугорок со щетинками и короткий брюшной усик (заметно более короткий, чем на остальных сегментах). Щупальцевидные усики II сегмента примерно равны ширине тела. На последующих сегментах спинной усик имеет широкую листовидную форму, с резко оттянутым заостренным кончиком; брюшной усик сильно вытянутый, заостренный, по длине он превосходит подиальный бугорок. Щетинки многочисленные, длинные, тонкие, широко расставленные; все щетинки одного типа, сочленение гетерогомфные, конечный членик тонкий, длинный. К заднему концу тело заметно утончается. Количество сегментов 15, Наши экземпляры половозрелые, с крупными яйцами в полости тела и параподий. Тело не пигментировано, имеет светло-бежевую окраску. Длина тела до 4 мм, ширина 1.5 мм (без щетинок).
Распространение. В коллекциях ЗИН 2 экземпляра, добытые к востоку от Курильской гряды — 43°08' с. ш. и 156°08' в. д., горизонт 0—600 м (23 VII 1953), и 6 экземпляров из Индийского океана и Антарктики по материалам д/э «Обь» 1956—1958 гг. Широко распространенный, пелагический вид: у побережья Ирландии, Бискайский залив, Средиземное море, экваториальные и южные районы Атлантического океана, у побережья Индокитая, Тихий океан от Берингова моря до побережья Перу.
2. Maupasia brodskyi Uschakov, 1957
(Табл. XXI, 9—10)
Уша|ов, 1957:270—271, рис. 1, а—б, карта 1.,
С боков головной лопасти два разветвленных затылочных нухальных органа. Первый сегмент слит с головной лопастью и с каждой стороны имеет по два небольших коротких щупальцевидных усика; при основании щупальцевидных усиков I сегмента с трудом различимы небольшие щетинки (по всей видимости, простые). II сегмент резко отделен от I сегмента и имеет с боков очень длинные спинные щупальцевидные усики, которые по своим размерам превосходят ширину тела; брюшные подиальные усики на II сегменте очень небольшие. Все последующие сегменты одинаковые; спинные и брюшные усики на них удлиненно-овальные. Щетинки сложные, гетерогомфные, разной толщины. На передних сегментах наряду с тонкими сложными щетинками имеется несколько (2—3) очень толстых и более коротких сложных щетинок с небольшим конечным члеником; на
21. PEDINOSOMA
191
задних сегментах все щетинки примерно одинаковой толщины и длины. Количество сегментов 14. Тело почти совершенно прозрачное. Длина тела около 2 мм, ширина 1 мм.
Тип хранится в ЗИН АН СССР, инв. № 1/16862.
Распространение. Северо-западная часть Тихого океана — 34°02' с. ш. и 148°49' в. д., горизонт 50—0 м (1 экз.).
21. Род PEDINOSOMA Reibisch, 1895
Головная лопасть спереди закругленная, очень короткая, слита с I сегментом. Глотка гладкая (без папилл). 2 пары щупальцевидных усиков на I сегменте, щетинки при щупальцевидных усиках отсутствуют. Формула передних сегментов: Параподии одноветвистые. Спинные
усики округлые небольшие, а брюшные вытянутые, заостренные. Щетинки сложные (сочлененные). Анальная лопасть без придатков. Пелагические черви, весьма небольших размеров.
Типовой вид: Pedlnosoma curtum Reibisch, 1895.
Род монотипический.
Строение переднего конца тела у Pedlnosoma не вполне ясное: по П. Фовелю (Fauvel, 1923), головная лопасть сливается с одним передним сегментом, снабженным 2 парами щупальцевидных усиков, а по Э. Берг- ’ штрёму (Bergstrom, 1914) с двумя передними редуцированными сегментами, т. е. в первом случае мы имеем Оу), а во втором—1
Если принять первую формулу,то Pedlnosoma весьма близка к Maupasia и Ре-la gobia, если же вторую — то она, напротив, стоит ближе к Lopadorhynchus,
у которого головная лопасть слита с двумя передними сегментами (см. стр. 184).
1. Pedinosoma curtum Reibisch, 1895
(Табл. XXII, 4~5)
Reibisch, 1895:21, 27—30, pl. II, fig. 17, pl. Ill, figs. 1—4; Fauvel, 1916 : 64; 1923 : 188—189, fig. 70, c—f; E.Berkeley a. C. Berkeley, 1960 : 789; T e b Ы e, 1962 : 424—425, figs. 25—26.
Головная лопасть широкая, у заднего ее края 2 боковых чувствительных органа в виде небольших бугорков, покрытых ресничками. Щупальцевидные усики крупные, заостренные, по своей длине они несколько превосходят ширину тела; щетинки при щупальцевидных усиках отсутствуют. Параподии с крупной конической подиальнбй лопастью. Спинные усики округлые или овальные, сплющенные; брюшные сильно вытянутые, цилиндрические, с заостренным концом. Дистальный членик щетинок очень тонкий, длинный.
Весьма небольшие черви: длина 1—3 мм. Количество щетинковых сегментов 7—8.
Распространение. В коллекциях ЗИН 1 экземпляр из северо-западной части Тихого океана — 31° с. ш. и 155° в. д. Весьма редкий вид, единичные находки известны из северо-восточной части Тихого океана, тропических и субтропических вод Атлантического океана, Средиземного моря.
192
I. PHYLLODOCIDAE
Подсемейство PONTODORINAE Bergstrom, 1914
Головная лопасть небольшая, слита с двумя первыми сегментами. 2 головных щупальца. 2 пары щупальцевидных усиков. Все туловищные сегменты с сильно вытянутым подиальным бугорком наподобие усиковидного придатка; спинные и брюшные усики весьма небольшие. 2 анальных усика. Тело короткое, количество сегментов небольшое (не свыше 20). Пелагические формы.
Подсемейство представлено всего одним родом — Pontodora Greeff, 1879.
22. Род PONTODORA Greeff, 1879
(Epitoka Treadwell, 1943]
Головная лопасть на переднем конце имеет 2 очень длинных головных щупальца. Глотка короткая, бочковидная, мускулистая, с удлиненными папиллами. Две пары удлиненных щупальцевидных усиков, при этом первая пара сильно сдвинута вперед и расположена близ ротового отверстия; при щупальцевидных усиках щетинки отсутствуют. Формула передних сегментов предположительно следующая: 1 Д- 1) -[- S На всех туловищных сегментах подиальные бугорки в виде длинных, пальцевидных -отростков с крупной внутренней щетинкой (ацикулой); спинные и брюшные усики расположены у основания подиального бугорка. На I щетин-ковом сегменте спинной усик отсутствует. Анальная лопасть с 2 очень длинными анальными усиками. Щетинки сложные, с тонким дистальным члеником. Количество сегментов небольшое (менее 20); тело прозрачное; весьма небольшие пелагические черви.
Типовой вид: Pontodora pelagica Greeff, 1879.
Род монотипический.
А. Трэдвуеллом (Treadwell, 1943) был описан новый рода Epitoka, ^который он отнес к семейству Syllidae. Описания и рисунки этого рода недостаточно подробные и базируются, как отмечает автор, на мацерированном экземпляре. Однако, судя по основным признакам, описанный им червь относится к роду Pontodora Greeff.
1. Pontodora pelagica Greeff, 1879
(Табл. XX, 6—8)
Greeff, 1879 : 245—247, pl. XIV, figs. 19—22; Viguier, 1886 : 388—392, pl. XXII, figs. 17—19; Reibisch, 1895 : 17—18; Viguier, 1920 : 256—259, pl. I, figs. 4—6; Fauvel, 1923 : 197, fig. 73, f—k; ? Treadwell, 1943 : 40 (Epitoka pelagica)' Ушаков, 1957 : 273—274, рис. 3, a—в, карта 1; E. Berkeley a. C. Berkeley, 1960 : 728; 1964 : 121—122.
Головная лопасть с тупым, слегка закругленным передним краем; 1 пара небольших красноватых глаз. Головные щупальца и щупальцевидные усики примерно одинаковой формы и длины, причем первая пара щупальцевидных усиков сильно сдвинута вперед и находится почти на уровне головных щупалец. Подиальные бугорки с пальцевидным выростом по длине превосходят ширину тела. Спинные и брюшные усики небольшие, продолговато-овальные, сплющенные; у основания подиального выроста имеются небольшие ресничные органы (ктенидии). На первом щетинковом сегменте всего одна пара подиальных усиков; на наших препаратах они имеют неясное вентральное или дорсальное положение. Щетинки многочисленные, тонкие, длинные, только сложные: рукоятка
22. PONTODORA, 23. PHALACROPHORUS
193
щетинки с двумя неравной величины сочленительными зубцами; дистальный членик тонкий, с мелкими зубчиками на одной стороне. Тело прозрачное, с большим количеством жировых включений; на каждом сегменте хорошо заметны, в особенности в передней части тела, оранжево-желтые, звездчатые пигментные пятна; их по 4 на каждом сегменте — два у основания параподий и два на спинной стороне сегмента; кроме того, небольшие такие же пятна на самих подиальных выростах. Количество согмен • тов 17—18. Длина тела 2—5 мм, ширина 0.2—0.5 мм без подиальных'. выростов и щетинок.
Распространение. В коллекциях ЗИН 15 экземпляров из северо-западной части Тихого океана, к югу от Курильской гряды и к востоку от о. Хонсю. Описан из субтропических районов Атлантического океана (Канарские острова) и Средиземного моря; встречается в северо-восточной части Тихого океана (Е. Berkeley а. С. Berkeley, 1960) и у побережья Перу (Е. Berkeley а. С. Berkeley, 1964).
Подсемейство IOSPILINAE Bergstrom, 1914
Головная лопасть небольшая, слита с I сегментом. 2 головных щупальца (? щупика). 2 пары щупальцевидных усиков, Два или большее количество передних сегментов с редуцированными параподиями. Спинные и брюшные усики небольшие. Анальные усики отсутствуют. Тело короткое, количество сегментов небольшое (не свыше 60). Пелагические формы.
Подсемейство включает 4 рода: Phalacrophorus Greeff, 1879, lospilus Viguier, 1886, Pariospills Viguier, 1911 и lospilopsis Augener, 1922, из которых первый имеет глотку, снабженную двумя крупными хитинизирован-ными крючками, что совершенно не свойственно филлодоцидам и наблюдается лишь у Pelagobia (стр. 187). В наших материалах имеются представители лишь первого рода.
23. Род PHALACROPHORUS Greeff, 1879
Головная лопасть с 2 очень небольшими щупальцами, расположенными на вентральной стороне около ротового отверстия (? щупики). Глаза имеются или отсутствуют. Глотка с двумя крупными боковыми хитиновыми крючками. 2 пары небольших щупальцевидных усиков, при этом при первой паре щетинки отсутствуют, а при второй паре небольшой подиальный бугорок с пучком щетинок. Два или большее количество передних щетинковых сегментов лишены подиальных усиков. Спинные и брюшные подиальные усики на последующих сегментах весьма небольшие, короче подиального бугорка. Щетинки только сложные (сочлененные), с тонким длинным конечным члеником. Границы между сегментами выражены слабо. Количество сегментов от 30 до 60. Тело прозрачное, с пигментными пятнами у основания параподий.
Типовой вид: Phalacrophorus pictus Greeff, 1879.
Род представлен 2 видами с одним подвидом. Описанный А. Трэдвуол-лом (Treadwell, 1943) для побережья Перу и экваториальных районов Тихого океана Ph. niger Treadwell относится к роду lospilus Viguier (см.: Dales, 1957 : 108).
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА PHALACROPHORUS GREEFF
1 (4). Лишь 4 передних сегмента с редуцированными параподиями. Количество сегментов не свыше 20—30.
2 (3). Глаза имеются................la. Ph. pictus pictus Greoff.
13 П. В. Ушаков
194
I. PHYLLODOCIDAE
3 (2). Глаза отсутствуют ........16. Ph. pictus borealis Reibisch.
4 (1). Около 8—10 передних сегментов с редуцированными параподиями.
Количество сегментов до 60 . . . . *Ph. uniformis Reibisch, 1895.
Reibisch, 1895 : 15—17, pl. I, figs. 10—16; Treadwell, 1943 : 34, fig. 14 (Ph. attenuatus); T e Ь Ы e, 1962 : 426—428, fig. 27, a, b.
Тропические и субтропические районы Атлантического и Тихого океанов.
la. Phalacrophorus pictus pictus Greeff, 1879
(Табл. XXII, 1—2)
Greeff, 1879 ; 249—251, pl. XIV, figs. 26-30; Viguier,. 1886 395—402, pl. XXIII, figs. 7—18; Reibisch, 1895:10—12, pl. I, figs. 4—7; Ehlers, 1913 : 460; Fauvel, 1923 : 196, fig. 72, f; Augener, 1929 : 290—291; Treadwell, 1943 : 34, pl. I, figs. 11—13 (Ph. maculatus)-, Dales, 1957 : 109; Ушаков, 1957a : 274—275, рис. 3, г—д, карта 1; Е. Berkeley а. С. Berkeley, 1957 : 573—574; 1964 : 123; Мипейковский, 1961 : 1101—1102, рис. 3—4; Т е b b 1 е, 1962 : 426, fig. 27, с.
Одна пара темно-бурых глаз с небольшими линзами (хрусталиками). Глотка массивная, мускулистая, с 2 крупными, резко изогнутыми хитини-зированными крючками на переднем конце. Первая пара щупальцевидных усиков значительно короче второй пары; щетинки лишь при второй паре в количестве 2—3. Два следующих сегмента с рудиментарными пара-подиями, вооружены 2—3 щетинками, спинные и брюшные усики на них отсутствуют. Границы между сегментами неясные. Размеры подиальных бугорков постепенно увеличиваются и на средних сегментах они в виде-крупных конических выростов с пучком очень тонких и длинных сложных щетинок. Спинные и брюшные усики небольшие, округлые, короче подиальных бугорков. Анальная лопасть закругленная, сильно пигментированная. Тело полупрозрачное, на спинной стороне при основаниях параподий желтовато-бурые пигментные пятна. Количество сегментов 20—30. Размеры: длина тела до 6 мм.
Распространение. В коллекциях ЗИН имеется из Норвежского и Баренцева морей, а также из северо-западной части Тихого океана (6 экз.). В литературе указан для северной части Атлантического океана, Средиземного моря, южной части Атлантического океана (Рио-де-Жанейро), а также для северных районов Тихого океана и побережья Южной Америки (Чили).
16. Phalacrophorus pictus borealis Reibisch, 1895 (Табл. XXII, 3) ’
Reibisch, 1895 : 12—15, pl. I, figs. 8—9, pl. VI; Ditlevsen, 1914 : 690; Wesenberg-Lund, 1953 : 31; Ушаков, 1957 : 1662, рис. 2.
Глаза отсутствуют. Глотка массивная, с 2 слабо изогнутыми хитинизи-рованными крючками. 2 пары небольших щупальцевидных усиков, причем щетинки в количестве 2—3 лишь при II паре. 2 передних туловищных сегмента с редуцированными параподиями. Параподии в виде конических выростов с пучком тонких и длинных щетинок; конечный членик щетинок тонкий и длинный. Спинные подиальные усики округлой формы, короче подиальных бугорков. Тело полупрозрачное, в отличие от Ph. pictus pictus пигментных пятен не имеется. Количество сегментов до 20. Максимальная длина червей 3 мм (наши экземпляры не превышали 2 ми).
II. ALCIOPIDAE
195
Примечание. P. Дэйле (Dales, 1957) склонен рассматривать Ph. borealis Reibisch. как молодые экземпляры Ph. pictus Greeff, от которого они отличаются более мелкими размерами, отсутствием глаз и более прямыми глоточными крючками, однако нам думается, что они представляют собой особую форму, приуроченную к холодным северным водам; такую возможность допускает и Н. Тэббл (ТеЬЫе, 1962 : 466).
Распространение. В наших материалах 2 экземпляра из центральных районов Полярного бассейна (горизонты 275—0 и 925—275 м). Ранее был отмечен у восточного побережья Гренландии.
II. Семейство ALCIOPIDAE Ehlers, 18641
Тело относительно тонкое, длинное, несколько расширенное на переднем конце и постепенно заостряющееся к заднему; обычно состоит из большого количества сегментов.
Головная лопасть с двумя огромными телескопическими глазами, снабженными крупными линзами (хрусталиками); расстояние между глазами меньше диаметра самих глаз. Глаза у живых особей нередко красные, у фиксированных темно-коричневые или черные. Глазная ось направлена прямо вперед или вбок, иногда вверх или вниз.
На головной лопасти обычно 5 небольших головных щупалец, из них 4 находятся на ее переднем крае и образуют верхнюю и нижнюю пары фронтальных щупалец; среднее непарное щупальце, расположенное между глазами на дорсальной стороне головной лопасти, иногда редуцировано в небольшой округлый бугорок.
Глотка выпячивающаяся; хобот с мягкими краевыми папиллами и нередко с 2 удлиненными боковыми усиковидными придатками (рогами) на дистальном конце; хитиновые челюсти отсутствуют.
Три передних околоротовых сегмента снабжены щупальцевидными усиками в количестве 3—5 пар, при этом на I сегменте всегда лишь одна пара щупальцевидных усиков, а на II и III сегментах (или только на
III сегменте) их может быть по две пары, т. е. мы имеем 1 4---7-4-
' М г- > । о или 1 ।
^УйжТймТ?’ где так же’ как и в Ф°РмУле Для филлодоцид (см. стр. 73) 1 — щупальцевидный усик, О — его отсутствие, N — нормальный подиальный усик, знаком «плюс» отделены сегменты, дробью — спинные и брюшные подиальные придатки.
При основании щупальцевидных усиков у молодых экземпляров иногда имеются одна или две небольшие щетинки, но у взрослых особей они всегда отсутствуют. Несколько передних туловищных сегментов, расположенных непосредственно за околоротовым, у ряда родов имеют сильно редуцированные параподии, с небольшим количеством щетинок или вовсе лишенные последних. У половозрелых самок некоторых видов спинные усики на двух сегментах (IV—VI) нередко преобразованы в крупные семенные карманы, или семеприемники (receptacula seminis), в которых скапливается сперма, а у половозрелых самцов на этих сегментах имеются удлиненные половые папиллы; по-видимому, у них происходит нечто вроде спаривания (псевдокопуляция).
1 В переводе с греческого означает могучие или сильные внешним видом, что действительно соответствует несколько устрашающему облику этих червей благодари наличию у них огромных телескопических глаз. ,,
13«
<196
II. ALCIOPIDAE
На всех последующих туловищных сегментах параподии хорошо развиты, имеют однотипный характер. Параподии одноветвистые, с крупными спинными и брюшными листовидными усиками; подиальный бугорок, несущий щетинки, обычно сильно вытянутый, конической формы, и нередко снабжен на конце одним или двумя усиковидными придатками. Щетинки очень тонкие, длиппыо, простые или сложные (сочлененные); при основании пучка щетинок, в нижней его части, иногда может быть несколько добавочных более коротких ацикуловидных щетинок. У основания параподий крупные, выпуклые подиальные железы и хроматофоры, имеющие темный пигмент; хроматофоры светятся, что служит, по всей вероятности, для взаимного привлечения самок и самцов. Пигидий с 1 или 2 анальными усиками.
Все альциопиды ведут пелагический образ жизни. Большая часть альциопид с нежным, полупрозрачным телом, что их делает незаметными в вод-:Ной среде, лишь крупные телескопические глаза выдают их присутствие; у некоторых видов на спинной стороне сегментов, преимущественно в передней части тела, наблюдаются темные поперечные пигментные пятна, придающие червю пеструю расцветку.
В родовых названиях Alciopidae существует большая несогласован-,ность. В последнее время К. Стёп-Бовитц (St0p-Bowitz, 1948), основываясь на правилах приоритета nnomina praeoccupata, дает почти для всех родов иные названия по сравнению с тем, что было принято П. Фовелем .(Fauvel, 1923). Так, из 8 родов, отмеченных у Фовеля, лишь название одного рода Vanadis у Стёп-Бовитц остается без изменений. Такая коренная ломка установившихся прежних наименований (dementia nomeclato-rica) значительно затрудняет работу систематиков, однако почти все последующие авторы в основном придерживаются системы Стёп-Бовитц, что заставляет и меня перейти на новую систему. Ниже сопоставляются названия родов по Фовелю и Стёп-Бовитц:
По Стёп-Бовитц
Naiades Delle Chiaje, 1830
Vanadis Claparede, 1870
Alciopa Aud. et M.-Edw., 1833
Torrea Quatrefages, 1850
Krohnia Quatrefages, 1865
Alciopina Claparede et Panceri, 1867
Plotohelmis Chamberlin, 1919
Rhynchonerella Costa, 1862
По Фовелю
Alciopa Aud. et M.-Edw., 1833
Vanadis Claparede, 1870'
Greeffia McIntosh, 1885
, Asterope Claparede, 1870 Callizonella Apstein, 1891 Corynocephalus Levinsen, 1885 Rhynchonerella Costa, 1882 Callizona Greeff, 1876
К названным выше родам Стёп-Бовитц добавляет новый род Watelio , St0p-Bowitz. Недостаточно полно описанный Чемберленом (Chamberlin, : 1919а) новый род Mauita с единственным видом М. nans по Дэйлсу (Dales, .1959 : 123), возможно, следует объединить с родЬм Vanadis Claparede; Mauita Chamberlin отличается от Vanadis Claparede лишь тем, что у него ,2 первых сегмента слиты, в результате чего от переднего сегмента как бы , отходят 2 пары щупальцевидных усиков.
; В составе семейства Alciopidae можно выделить две более или менее обо-; собленные группы родов.
< 1. На всех околоротовых сегментах только по одной паре щупальце-
i .видных усиков; в передней части тела имеются сегменты с рудиментарными параподиями, лишенными щетинок; самки с одной или двумя парами семенных карманов («семеприемников»), образованных из измененных спинных усиков передних параподий; все щетинки одного сорта (только про-
, с.тцге или только, сложные). — роды Torrea Quatrefages, Naiades Delle Chiaje и Vanadis Claparede.
II. ALCIOPIDAE
2. На II и III сегментах (или только на III сегменте) по две пары щу-пальцевидных усиков; в передней части тела нет сегментов с рудиментарными параподиями; у самок семенные карманы («семеприемники») отсутствуют; щетинки двух сортов (волосовидные простые или сложныеЧ-ацм-
Род:Ы Головной конец. Хобот Щупальцевые усики Recept sernims Подиальный бугорок Щетинки
Torrea Vanadis Alciopa Naiades Krohnia Alciopina Plotohelmis Rhynchonerella Watelio (р: п П 9 1+1.+1 1Ф1 1 н л 1 1 ' + 7 +7 ft 1 + 1+1 1 7 N у 7 1 1 7 7 1 + 1 + 1 1 1 1 есть n г/ и нет » г/ г/ t 1» . Il U li t; w
куловидные щетинки) — роды Alciopina Claparede et Panceri, Plotohelmis Chamberlin, Krohnia Quatrefages, Rhynchonerella Costa, Alciopa Aud. et M.-Edw. и Watelio Stop-Bowitz.
Основные систематические признаки, по которым нетрудно разграничив к роды альциопид, суммированы в приведенной таблице.
По общему плану строения альциопиды весьма близки к Phyllodocidae:, они нами рассматриваются как побочная ветвь донных филлодоцид группы
198
II. ALCIOPIDAE
Eulalia, приспособившаяся к пелагическому образу жизни (см. стр. 75). Адаптация к планктонному образу жизни альциопид шла по линиям преобразования подиальных усиков в плавательные придатки и образования весьма сложных гипертрофированных глаз, позволяющих червям быстро отыскивать жертву. В процессе эволюции значительным усложнениям подвергся хобот, на дистальном конце которого образовались усиковидные выросты с большим количеством железистых клеток, выделяющих слизь; хобот с такого рода придатками, несомненно, помогает легче схватывать планктонных рачков, быстро передвигающихся в толще воды. Как особые приспособления к планктонному образу жизни следует рассматривать и образование своеобразных семеприемников у самок, так как встреча самок и самцов в водной толще при разреженной популяции затруднена'.
Родственные отношения в пределах семейства Alciopidae схематично изображены на рис. 20 (стр. 71). Исходной формой альциопид Р. Дэйле (Dales, 1955b) считает род Rhynchonorella, представители которого во многом напоминают донных филлодоцид. У них хобот еще без усиковидных придатков, семеприемники отсутствуют. Наиболее специализированными и адаптированными формами являются Vanadis и Тоггеа. Род W atelia занимает промежуточное положение между двумя основными группами альциопид.
Представители семейства Alciopidae встречаются преимущественно в открытых частях океана (голопелагические формы) и приурочены в основном ц теплым, тропическим водам. В северо-западной части Тихого океана, примыкающей к прикурильскому району, по сборам отечественных экспедиций обнаружены представители следующих родов: Vanadis Claparede, Alciopa Aud. et M.-Edw., Alciopina Claparede, Krohnia Quatrefages и Rhynchonorella Costa.
Многие виды альциопид характеризуются весьма широким географическим распространением. Обычные планктонные орудия лова приносят, как правило,- лишь обрывки альциопид, но по характеру строения головного конца удается определить червей до вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА ALCIOPIDAE
1 (6). В передней части тела имеется несколько сегментов с рудиментарными параподиями.
2 (3). Щетинки только простые, волосовидные .....................
.............................2. Naiades Delle Chiaje (стр. 200).
3 (2). Щетинки только сочлененные (сложные), с тонким дистальным члеником. «
4 (5). Подиальный бугорок без усиковидных придатков..............
............................ 1. Тоггеа Quatrefages (стр. 199).
•5 (4). Подиальный бугорок с одним усиковидным придатком.........
; .............................3. Vanadis Claparede (стр. 201).
6 (1). В передней части тела сегментов с рудиментарными параподиями нет.
7 (8). Подиальный бугорок с двумя усиковидными придатками. Щетинки одного сорта: тонкие, длинные, сочлененные (сложные) . . .
..........................4. Alciopa And. et M.-Edw. (стр. 203).
8 (7). Подиальный бугорок без усиковидных придатков или лишь с одним усиковидным придатком. Щетинки двух сортов: к волосовидным простым или сложным щетинкам в нижней части пучка добавляется несколько более коротких ацикуловидных щетинок.
1. TORREA
199
9 (12). Щетинки простые волосовидные и ацикуловидные.
10 (11). Подиальный бугорок с одним усиковидным придатком . . . . ...................................7. Krohnia Quatrefages (стр. 207).
11 (10). Подиальный бугорок без усиковидных придатков . .........
............................. 6. Alciopina Claparede (стр. 206).
12 (9). Щетинки сложные и ацикуловидные.
13 (14). Подиальный бугорок без усиковидных придатков............
..........................5. Plotohelmis Chamberlin (стр. 205).
14 (13). Подиальный бугорок с одним усиковидным придатком.
15 (16). Ацикула незначительно выступает за пределы подиального бугорка ........................8. Rhynchonerella Costa (стр. 209).
16 (15). Ацикула очень крупная, далеко выступает за пределы подиального бугорка.......................9. Watelio Stnp-Bowitz (стр. 211).
। 1. Род TORREA Quatrefages, 1850
[Liocapa Costa, 1862; Asterope Claparede, 1870]
Хобот цилиндрический, длинный, с двумя боковыми усиковидными отростками на дистальном конце. 3 пары щупальцевидных усиков, расположенных на 3 передних околоротовых сегментах: 1+1+1. 2 первых туловищных сегмента с рудиментарными параподиями. У самок спинные усики на первых двух туловищных сегментах изменены в объемистые семенные карманы. Параподии с крупными листовидными спинными и брюшными усиками; подиальный бугорок без пальцевидного придатка. Все щетинки одного сорта — сложные, с удлиненным шиловидным ди-стальным члеником. Подиальные железы крупные, пигментированные.
( 2 анальных усика.
Типовой вид: Alciopa Candida Delle Chiaje, 1841.
Род включает всего 2 вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА TORREA QUA TR ЕЕ AGES
1 (2). Дистальный край хобота между боковыми усиковидными отрост-, ками с небольшими краевыми папиллами .........................
............................. . . 1. Т. Candida (Delle Chiaje).
2 (1). Дистальный край хобота между боковыми усиковидными отростками гладкий (без папилл) . ... *Т. pelagica Chamberlin, 1919.
Chamberlin, 1919а : 131—133, pl. 24, figs. 4—9; 1 Dale s, 1957 : 111.
Единичные находки в северо-западных и юго-восточных ' районах Тихого океана.
1. Тоггеа Candida (Delle Chiaje, 1841)
' (Табл. XXIII, 1—4)
Quatrefages, 1865 : t. II, 159—160, pl. IV, figs. 6—7, pl. IX, figs. 15—16 '(Torea vitrea); Greeff, 1876a : 62—65, pl. II, figs. 7—13, pl. Ill, figs. 22—27 (Aste-
rope); Hering, 1892 : 747, pl. V (Alciopa vlttata)- I z u k a, 1914 : 2—3, pl. I, fig. 10 (Asterope)-, Fauvel, 1923 : 202—203, fig. 75, a—d (Asterope)-, Monro, 1930 : 82; 1936 : 119; Wesenberg-Lund, 1939 : 22—25, chart 13, figs. 17—18; S t и p -В о witz, 1948 : 22—23, figs. 13, 14; Dales, 1957 : 111, figs. 14—16.
, Непарное головное щупальце в виде небольшого бугорка; парные
1 головные щупальца слегка удлиненные, при этом верхние заметно короче
200
II. ALCIOPIDAE
нижних. Глаза темного красновато-коричневого цвета; хрусталики глаз, направлены вбок; расстояние между глазами меньше диаметра самих глаз.
Хобот очень длинный (по длине равен 12 и более передним сегментам); на переднем конце хобота 2 длинных боковых усиковидных отростка,, между которыми несколько коротких краевых папилл (по 4—5); последние трехдольчатые, с более удлиненной средней частью.
Первая пара щупальцевидных усиков находится на траверзе глаз,, две остальные пары — позади глаз; с брюшной стороны щупальцевидные усики первой и второй пары соединены между собой волнистой складкой. Два первых туловищных сегмента заметно отличаются от остальных; спинные усики на них или сильно редуцированы (у самцов), или, напротив, образуют весьма объемистые, пузырчатые семенные карманы (у самок).
Параподии, начиная с III туловищного сегмента, имеют удлиненный ланцетовидный спинной усик и несколько меньших размеров овальный брюшной усик; подиальный бугорок конический, с ацикулой, выступающей наружу, и пучком тонких и длинных сложных щетинок. С задней стороны параподий крупная, сильно пигментированная подиальная железа; начиная с III туловищного сегмента на 10—15 сегментах пигментация подиальных желез распространяется на спинную сторону и образует весьма характерный поперечный темный рисунок (поперечные полосы), на прозрачном теле. Количество сегментов до 270. Длина тела до 150— 250 мм, ширина тела 2—3 мм.
Распространение. В коллекциях ЗИН имеется из Средиземного моря. Широко распространенный вид: Атлантический океан, Средиземное море, Индийский океан; в Тихом океане отмечен у побережья. Японии и Калифорнии (в последнем районе довольно обычен); придерживается поверхностных вод.
2. Род NAIADES Delle Chiaje, 1830
Хобот короткий, с двумя небольшими боковыми усиковидными отростками. 3 пары щупальцевидных усиков на 3 околоротовых сегментах: 1+1+1. Три первых туловищных сегмента с рудиментарными парапо-диями, которые вооружены лишь ацикулой; у самок спинные и брюшные усики на втором (? или первом) туловищном сегменте видоизменены в объемистые семенные карманы. Спинные и брюшные усики листовидные. Подиальный бугорок без пальцевидного придатка. Щетинки только простые, волосовидные.' Подиальные боковые железы ^пигментированные.
Типовой вид: Naiades cantrainii Delle Chiaje, 1830.
Род монотипический.
1. Naiades cantrainii Delle Chiaje, 1830
(Табл. XXIII, 5—6)
Greeff, 1876a : 57—60, pl. II, figs. 1—4, pl. Ill, figs. .14—18 (Alciopa); V ь-g u i e r, 1886 : 404—405, pl. XXIV, figs. .1—5 (Alciope microcephala); Ap.stein, 1900 : 7—8, pl. V, fig. 53 (Alciopa); Izuka, 1914 : 2—3, pl. I, fig. 9 (Alciopa); Fauvel, 1923 : 203—204, fig. 76, a—c (Alciopa); Monro, 1936 : 115 (Alciopa); Wesen-berg-Lund, 1939 : 25—28, chart 13, fig. 19 (Alciopa); Treadwell, 1943 : 35, pl. I, figs. 16, 17, pl. II, fig.. 18 (Alciopa distorta); Stop-Bowi tz, 1948 : 24—25, fig. 15—16; Dales, 1957 : 113—115, figs. 18-19; T e b b 1 e,. 1960:257; 1962.: 388—389.
2. NAIADES, 3. VANADIS
201-
Непарное головное щупальце небольшое, яйцевидной формы, сдвинуто к переднему краю; парные головные щупальца веретеновидные, небольшие, одинаковой величины. Глаза красные; хрусталики глаз направлены вбок и немного вперед. Хобот короткий, с трехдольчатыми небольшими краевыми папиллами и двумя боковыми усиковидными отростками, которые лишь немного длиннее краевых папилл. Первая пара щупальцевидных усиков, расположенная под глазами, крупнее двух остальных пар щупальцевидных усиков и с брюшной стороны соединена волнистой складкой; вторая и третья пары щупальцевидных усиков очень небольшие и нередко трудно различимы. Три первых туловищных сегмента сильно редуцированы (подиальный бугорок на них очень небольшой, обычно лишен щетинок); у самок на II туловищном сегменте подиальные усики преобразованы в пузырчатые семенные карманы. Параподии, начиная с IV туловищного сегмента, имеют удлиненный спинной усик и более короткий брюшной усик; подиальный бугорок конический, сильно вытянутый, с ацикулой, далеко выступающей наружу, и пучком длинных, тонких, волосовидных простых щетинок. Подиальные железы крупные, хорошо заметные,' темные (коричневые). Тело прозрачное. Количество сегментов 70—120. Длина тела до 40—110 мм, ширина 2—5 мм.
Распространение. В коллекциях ЗИН имеется из Средиземного моря. Широко распространенный вид в теплых водах, преимущественно в поверхностных слоях Атлантического; Индийского и Тихого океанов; встречается у побережья Японии и Калифорнии.
3. Род VANADIS Claparede, 1870
[Cleta Claparede, 1870]
Хобот цилиндрический, длинный, с двумя очень крупными боковыми усиковидными отростками наподобие щупалец или хобот более короткий и на дистальном его конце лишь корона из заостренных папилл одинако-вой величины. 3 или 4 пары щупальцевидных усиков: 1 + 1+1 и 1+1+ р. Передние туловищные сегменты (от 4 до 10) обычно с рудиментарными (недоразвитыми) параподиями, лишенными щетинок. У самок спинные усики на одном или двух передних туловищных сегментах видоизменены в объемистые семенные карманы. Спинные и брюшные усики на нормально развитых параподиях листовидные, крупные. Подиальный бугорок заканчивается одним пальцевидным выростом. Щетинки все одинаковые;, сложные, с тонким дистальным члеником. Подиальные железы крупные,, пигментированные. 1—2 анальных усика.
Типовой вид: Vanadis formosa Claparede, 1870.
Род насчитывает свыше 10 видов. Для субтропических вод северной части Тихого океана отмечено,5 видов.
Примечание. Количество щупальцевидных усиков для одного и того же вида иногда указывается разное. Последнее объясняется тем, что некоторые авторы причисляют к щупальцевидным усикам часть подиальных усиков недоразвитых параподий передних туловищных сегментов, которые по своей форме слабо отличаются от щупальцевидных усиков. Так, Ицука (Izuka, 1914) считает, что у V. grandis Izuka [=V. lon-gissima (Levinsen)] щупальцевидных усиков 10 пар, но в действительности их, по всей видимости, всего 3 пары, а остальные недоразвитые подиальные усики. Количество недоразвитых параподий точно установить трудно, так как имеются весьма постепенные переходы и щетинки могут быть, обломлены.
:202
II. ALCIOPIDAE
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА VANADIS CLAPABEDE
1 (8). Хобот с боковыми усиковидными придатками.
2 (3). Хобот с 2 парами усиковидных придатков; 4 пары щупальцевидных усиков.......................*V. tagensis Dales (табл. XXIV, 10).
Dales, 1955а : 436—439, fig. 1, а—с; Tebble, 1962 : 394—395, fig. 9.
Северная часть Тихого океана, глубинные ловы.
3 (2). Хобот с 1 парой усиковидных придатков. 3 пары щупальцевидных усиков.
4 (5). Головная лопасть с 4 головными щупальцами...................
......................*V. minuta Treadwell (табл. XXIV, 11—12).
Tre adwell, 1906 : 1158—1159, figs. 25—28; Dales, 1957 :119—121, figs. 28—30; Tebble, 1962 : 390—391, fig. 7.
Тропические и субтропические воды Тихого океана.
5 (4). Головная лопасть, с 5 головными щупальцами.
6 (7). 2 первых туловищных сегмента с редуцированными параподиями. ..........................................1. V. formosa Claparede.
7 (6). 6—9 первых туловищных сегментов с редуцированными параподиями ....................*V. crystalline Greeff (табл. XXIV, 7—9).
Dales,, 1957 : 118—119, figs. 25—27.
Широко распространен в умеренных и тропических водах Атлантического и Тихого океанов.
8 (1). Хобот без усиковидных придатков; на дистальном конце хобота имеется 10—12 небольших, равной величины краевых папилл .... ................................. 2.V. longissima (Levinsen).
1. Vanadis formosa Claparede, 1870
(Табл. XXIV, 1—2)
Greeff, 1876a : 67, pl. Ill, figs. 33—34 (7. pelagica)-, Apst ein, 1900 : 8, pl. I, figs. 1—6; Southern, 1911:2—3; Chamberlin, 1919:134—135; Fauvel, 1923 : 205—206, fig. 77, a—c; Monro, 1930 : 81; 1936 : 116; W e s e m berg-Lund, 1939 : 28—32, figs. 20—21, chart 15; S t и p - В owitz, 1948 : 25—26, fig. 17; Dales, 1957 : 117, figs. 21—24; Tebble, 1960 : 185—186, 252—255, fig. 49; 1962 : 389—390, fig. 40. i
Хобот длинный, цилиндрический; на его дистальном конце два удлиненных боковых усиковидных отростка и небольшие трехдольчатые папиллы. 3 пары щупальцевидных усиков, при этом первая пара крупнее двух остальных и с брюшной' стороны соединена кожистой складкой. Один или два первых сегмента позади щупальцевидных усиков с рудиментарными параподиями, лишенными щетинок. У самок спинные усики на IV и V сегментах видоизменены в объемистые семенные карманы. Все последующие сегменты имеют удлиненный подиальный бугорок -с длинным пальцевидным выростом и выдающейся наружу ацикулой; спинные подиальные усики удлиненно-сердцевидной формы, брюшные более короткие, овальные. Щетинки тонкие, длинные, с тонким длинным .дистальным члеником. Подиальные железистые органы на всех сегментах, исключая лишь самые передние; они выпуклые, темные, хорошо заметные. Тело полупрозрачное. Количество сегментов, по литературным данным, .до 200 и свыше. Длина тела до 200—300 мм, ширина до 5—6 мм.
4. ALCIOPA
203
Распространение. Из северо-западной части Тихого океана имеется один экземпляр 39°44' с. ш. и 151°53' в., д., горизонт 0—50 м. По литературным данным, широко распространенный вид, характерный для теплых, преимущественно поверхностных вод Атлантического, Индийского и Тихого океана.
2. Vanadis longissima (Levinsen, 1885)
(Табл. XXIV, 3—6)
Levinsen, 1885 : 330—331, figs. 7—10 (Rhynchonorella); A p s t e i n, 1900 : 1, pl. I, figs. 8—9; I z u k a, 1914 : 5—7, pl. I, figs. 1—7 (7. grandis); Fauvel, 1923 : .207, fig. 77, f—g; Monro, 1930:79—80, fig. 24; Ушаков, 1957:275—277, рис. 4, a—г, карта 2 (7. pacifica)- Dales, 1957 : 121—123, figs. 31—33; Tebble, 1960 : 187—188, 224, fig. 27; 1962: 392-394, figs. 8, 38; P e t t i b о n e, 1963 : 91—93, .fig. 22.
Хобот без удлиненных боковых усиковидных отростков и на дистальном конце имеет 10—12 заостренных краевых папилл. 3 пары щупальце-видных усиков, примерно одинаковой длины. На передних туловищных сегментах параподии частично недоразвитые; щетинки на I туловищном сегменте, как правило, отсутствуют. У половозрелых самок спинные усики на второй и третьей параподиях преобразованы в крупные семенные карманы. Начиная с VIII и IX сегмента, параподии хорошо развиты: подиальный бугорок удлиненный, с небольшим пальцевидным выростом и выходящей наружу ацикулой; спинные и брюшные подиальные усики удлиненные, при этом спинные усики крупнее брюшных, но заметно короче подиальных бугорков. Щетинки тонкие, длинные, с удлиненным дистальным члеником. Боковые, сильно пигментированные, подиальные железистые органы не на всех сегментах: сегменты с подиальными железами чередуются с сегментами, лишенными таковых (порядок чередования варьирует). Сегменты, снабженные подиальными железистыми органами, окрашены в темный коричневый цвет, остальные сегменты светлые, в результате чего черви отличаются бросающейся в глаза пестрой поперечной расцветкой. Количество сегментов, по литературным данным, до 200. Длина тела до 120—200 мм, ширина 1—2 мм.
Распространение. В наших материалах 2 обрывка из северо-западной части Тихого океана (38°21' с. ш. и 151°57' в. д., горизонт 0—100 м). Широко распространенный вид, встречающийся преимущественно в тропических и субтропических водах как Атлантического, так и Индийского и Тихого океанов; на юг доходит до Антарктической конвергенции.
4. Род ALCIOPA Audouin et М.-Edwards, 1833
i[ffalodora Greeff, 1876; Nauphanta Greeff, 1876; Greeffia McIntosh, 1885]
Хобот короткий, с 2 тонкими усиковидными отростками на дистальном j
’конце. 3 или 4 пары щупальцевидных усиков: 1Д-1 Д-1и1-|-1-Д —. Параподии на передних туловищных сегментах полностью развиты. У самок брюшные усики на передних сегментах видоизменены в семенные карманы. Спинные и брюшные усики крупные, листовидные (спинные усики частично прикрывают спинную сторону червя). Подиальный бугорок с двумя пальцевидными выростами. Параподии вооружены большим количеством тонких сложных щетинок с удлиненным дистальным члеником. Подиальные железистые органы крупные, пигментированные, в виде двух валиков
204
II. alciopidae
(спинного и брюшного). Тело в противоположность большинству других альциопод относительно короткое и широкое.
Типовой вид: Alciopa reynaudii Audouin et M.-Edw., 1833.
Под родовым названием Alciopa было описано в разное время большое количество видов, которые ныне отнесены к различным другим родам (Hartman, 1959). В отношении синонимии и видовой характеристики A. reynaudii And. et M.-Edw. (Nauphanta eelox Greeff, 1876) в литературе существует большая путаница. В первоначальном описании этого вида было отмечено 4 пары щупальцевидных усиков, однако это указание К. Стёп-Бовитц (St0p-Bowitz, 1948) взял под сомнение и в синонимию этого вида ввел Greeffia oahuensis McIntosh, для которого отмечено всего 3 пары щупальцевидных усиков. В соответствии с этим он изменил и видовой диагноз A. reynaudii Aud. et M.-Edw., считая характерным для этого вида наличие лишь 3 пар щупальцевидных усиков. Этому последовал и Дэйле (Dales, 1956, 1957), а также Тэббл (ТеЪЫе, 1960). Однако у моего экземпляра из северо-западной части Тихого океана отчетливо имеется 4 пары щупальцевидных усиков, что совпадает с первоначальным описанием Alciopa reynaudii Aud. et M.-Edw. {—Nauphanta eelox Greeff). Последнее заставляет меня восстановить самостоятельность обоих видов: A. reynaudii And. et M.-Edw. и A. oahuensis (Mclnt.). В настоящее время род насчитывает всего 3 вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА ALCIOPA AUDOUIN ET M.-EDWARDS.
1 (2). Под основной парой глаз имеется добавочная пара рудиментарных глаз ...................... *А. quadrioculata McIntosh, 1885.
Тихий океан, Гавайские острова.
2 (1). Добавочных рудиментарных глаз нет.
3 (4). 4 пары щупальцевидных усиков................................
................................1. A. reynaudii And. et M.-Edw.
4 (3). 3 пары щупальцевидных усиков..............................
................................ *А. oahuensis (McIntosh, 1885).
Атлантический океан, Средиземное море, Тихий океан.
1. Alciopa reynaudii Audouin et M.-Edwards, 1833
(Табл. XXV, 1—4)
Audouin et Milne-Edwards, 1834:214—£16, pl. V, figs. 6—117 Greeff, 1876a : 69, pl. Ill, figs. 40—42, pl. IV, figs. 43—55 {Nauphanta eelox)’ A p s-t e i n, 1900 : 12, Taf. II, Fig. 10 {Greeffia eelox)’, Chamberlin, 1919a : 139—140 {Halodora); Southern, 1911:3 {Greeffia eelox); Fauvel, 1923:208, fig. 78, a—c {Greeffia eelox); Dales, 1957 : 124—125, figs. 34—35 (синонимия).
Передний край головной лопасти слегка волнистый (фестончатый). Фронтальные головные щупальца конические, заостренные, примерно одинаковой величины; среднее непарное головное щупальце в виде небольшого, низкого бугорка. Глаза крупные, сферические; хрусталики глаз направлены вбок и вниз. Хобот у нашего экземпляра втянут, но из ротового отверстия торчат два его длинных усиковидных придатка (см. табл. XXV, 7). 4 пары коротких щупальцевидных усиков, из них три первые пары веретенообразные, а последняя листовидная. Все туловищные параподии хорошо развиты. Подиальный бугорок конический, с двумя небольшими
5. PLOTOHELMIS 205
пальцевидными выростами на дистальном конце. Крупная ацикула заключена между пальцевидными придатками и едва выдается наружу. Спинные и брюшные усики очень крупные, листовидные, округлой формы, примерно одинаковой величины; они пигментированы мелкими бурыми точками. Последний сегмент сильно редуцирован. На анальной лопасти один анальный усик, расположенный с брюшной стороны. Подиальные железистые органы крупные, причем они состоят из двух раздельных образований: из темного, сильно пигментированного спинного поперечного валика и из более светлого брюшного валика. Щетинки многочисленные, тонкие, сочлененные, с длинным дистальным члеником. При внимательном рассмотрении в нижней части пучка можно было обнаружить несколько небольших тонких простых щетинок (без дистального членика), что ранее для этого вида отмечено не было.
Количество сегментов 48. Длина тела 35 мм, ширина 9 мм, включая параподии, и 4 мм без параподий (по литературным данным: длина до 60 мм, ширина до 12 мм).
Распространение. Описание дано по £> из северо-западной части Тихого океана — 46°06' с. ш. и 170°00' в. д. Указан для Атлантического, Индийского и Тихого океанов; в последнем отмечен к северу от Сан-Франциско (Dales, 1957).
5. Род PLOTOHELMIS Chamberlin, 1919
[Rhynchonerella Costa, 1862, part.]
Хобот без боковых усиковидных отростков и имеет на терминальном конце лишь небольшие краевые папиллы. 4 или 5 пар щупальцевидных усиков: 1-|--р-[--1-и1-|-у-|-у. Все туловищные сегменты с хорошо развитыми параподиями. Семеприемники (семенные карманы) у самок не отмечены. Спинные подиальные усики крупнее брюшных. Подиальный бугорок без пальцевидного придатка. Щетинки двух сортов: простые ацикуловид-ные и сложные (сочлененные), с тонким шиловидным дистальным члеником. Подиальные железы не всегда четко выражены. 2 анальных усика.
Типовой вид: Plotohelmis alata Chamberlin, 1919.
Род включает 3 вида: Plotohelmis alata Chamberlin, 1919, Pl. capitata (Greeff, 1876) и Pl. tenuis (Apstein, 1900), которые лишь незначительно отличаются друг от друга длиной щупальцевидных усиков (Dales, 1957); в коллекциях ЗИН имеется лишь Pl. tenuis (Apstein).
1. Plotohelmis tenuis (Apstein, 1900)
(Табл. XXV, 5—7)
Apstein, 1900 : 14, pl. 2, figs. 14—16 (Corynocephalus); ? I z u k a, 1914 : 8—9, pl. I, figs. 11—12 (Rhynchonerella fulgens)-, Chamberlin, 1919a : 141 (Coryno-cephalus); Dales, 1957 : 125—128, figs. 36—39; T e b b 1 e, 1962 : 403—404.
Фронтальные головные щупальца короткие, ланцетовидные; среднее непарное головное щупальце немного крупнее фронтальных. Глаза очень крупные. 5 пар щупальцевидных усиков на 3 околоротовых сегментах: 1 + —+ причем спинные усики на II и III околоротовых сегментах наиболее длинные, а брюшные короткие, плохо заметные. Спинные усики на туловищных сегментах крупные, листовидные, вытянутые; брюшные маленькие, меньше подиального бугорка. Подиальный бугорок коиичо-
206
//. ALCIOPIDAE
ский, без пальцевидных придатков, с выдающейся наружу крупной аци-кулой. На первых туловищных сегментах лишь ацикуловидные щетинки (до 12 на одной параподии), на последующих сегментах — многочисленные тонкие, длинные сложные (сочлененные) щетинки и по 1 ацикуловидной щетинке в нижней части пучка. Подиальные железистые органы красновато-коричневого цвета; на передних сегментах они плохо заметны. Количество сегментов до 80. Длина тела до 25 мм.
Распространение. В коллекциях ЗИН всего один экземпляр довольно плохой сохранности из района о. Хайнань. По литературным данным, встречается в Атлантическом океане и Средиземном море, в Тихом океане на север доходит до 50° с. ш.; приурочен в основном к тропическим и субтропическим водам.
6. Род ALCIOPINA Claparede et Panceri, 1867
[Corynocephalus Levinsen, 1885]
Хобот короткий, на дистальном конце гладкий или с небольшими округлыми папиллами одинаковой величины, без боковых удлиненных выростов. 5 пар щупальцевидных усиков на трех передних (околоротовых) сегментах, причем на первом сегменте одна пара усиков, на остальных: 1 1
двух — по две пары: —. Рудиментарных параподий в пе-
редней части тела нет. Семеприемники у самок не отмечены. Подиальный бугорок без пальцевидного выроста на дистальном конце. Подиальные спинные и брюшные усики листовидные, крупные. Щетинки только простые, но в нижней части пучка, состоящего из длинных тонких волосовидных щетинок, имеется несколько более коротких и толстых щетинок ацикуловидного-типа. Подиальные пигментированные железы имеются. Пигидий с двумя анальными усиками. Тело относительно короткое.
Примечание. По Левинсену (Levinsen, 1885), всего 4 пары щупальцевидных усиков; нижние щупальцевидные усики на III сегменте настолько малы, что Левинсен, возможно, их не заметил.
Типовой вид: Alciopina parasitica Claparede et Panceri, 1867.
Род монотипический.
1. Alciopina parasitica Claparede et Panceri, 1867
(Табл. XXV, S—11)
’Apstein, 1893 : 148, pl. V, figs. 13—14 (Corynocephalus gazellae)-, Apstein,. 1900 : 14, pl. II, figs. 17—18 (Corynocephalus albomaculatus)-, Chamberlin, 1919a : 141—143, pl. 23, figs. 1—3 (Corynocephalus paumotanusf, Fauvel, 1923 : 208— 209, fig. 78, d—i (Corynocephalus albo-maculatus); Treadwell, 1943 : 37 (Corynocephalus paumotdnus)-, S t 0 p - В о wi tz, 1948 : 32; Ушаков, 1957 : 277—278, рис. 4, д—з, карта 2 (Corynocephalus paumotanus)-, Dales, 1957 : 128—129.
Головная лопасть спереди закругленная. Среднее непарное головное щупальце короткое, маленькое, толстое; парные головные щупальца крупные. Глаза направлены вбок. Хобот по своей длине примерно равен лишь трем передним сегментам. Первая пара щупальцевидных усиков; короче верхней пары щупальцевидных усиков II сегмента, которые-в свою очередь короче верхней пары щупальцевидных усиков III сегмента; нижние, или брюшные, щупальцевидные усики на II и III околоротовых сегментах очень маленькие, особенно на III сегменте, и они значительно-короче первой пары щупальцевидных усиков. На туловищных сегментах
6. ALCIOPINA,' 7. KROHNIA
207/
подиальный бугорок конический, без пальцевидного выроста па дистальном конце; ацикула выступает за пределы подиального бугорка. Подпал ь-ные спинные и брюшные усики очень крупные, в особенности cjihiiiii.io, имеющие сердцевидную форму. Спинные подиальные усики в сродной части тела, черепицеобразно налегая друг на друга,' полностью прикрывают спинную сторону червя (наподобие спинных ’чешуек афродитид). Щетинки только простые, но наряду с тонкими волосовидными имеются грубые, толстые ацикуловидные щетинки; на передних 4—5 сегментах ацикуловидных щетинок по 2—3, а затем их количество уменьшается до 1 на каждой параподии; волосовидные щетинки в большом количество с V—VI сегмента. Ацикуловидные щетинки слегка изогнутые. Подиальные железистые органы на спинной стороне с темным пигментом. Тело бесцвот ное, полупрозрачное.
Количество сегментов до 50. Длина тела до 30 мм, ширина до 3.7 мм (наши экземпляры нецелые).
Распространение. В коллекциях ЗИН имеется 2 экземпляра из северо-западной части Тихого океана — 34° с. ш. и 148°49/ в. д.; 30°30' с. ш. и 138° в. д. Широко распространенный вид, приурочен к теплым водам Тихого океана, встречается также в Атлантическом океане и, возможно, в Индийском океане.
7. Род KROHNIA Quatrefages, 1865
[Callizonella Apstein, 1890; non Krohnia Langerhans, 1880, pro Chaetognatha],
Хобот короткий, с небольшими краевыми папиллами; без боковых длинных усиковидных отростков, 5 пар щупальцевидных усиков на трех передних (околоротовых) сегментах, причем на первом сегменте одна пара 1 1
усиков, на остальных двух — по два пары: l+f + Т' РуДиментаРных параподий в передней части тела нет. Семеприемники у самок не отмечены. Спинные и брюшные подиальные усики листовидные, крупные. Подиальный бугорок с пальцевидным отростком на терминальном конце. Щетйнки простые, тонкие, волосовидные, однако на передних сегментах и в нижней части пучка на остальных сегментах имеются более толстые короткие простые ацикуловидные щетинки. Подиальные железы крупные. Пигидий с 1 анальным усиком.
Типовой вид: Alciopa lepidota Krohn, 1845.
Род включает всего 2 вида.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА KROHNIA QUATREFAGES .
1 (2). Верхние щупальцевидные усики III околоротового сегмента очень, крупные и значительно длиннее верхних щупальцевидных усиков
II сегмента................................1. К. lepidota (Krohn).
2 (1). Верхние щупальцевидные усики III сегмента небольшие, по своим размерам не отличаются от верхних щупальцевидных усиков II сегмента ...................................2. К. excellata (Uschakov).
1. Krohnia lepidota (Krohn, 1845)
(Табл. XXVI,, 1—4),
Krohn, 1845:175 (Alciopa)-, Apstein, 1900:12—13, pl. II, figs. 11 13 (Callizonella); Chamberlin, 1919a : 146—147 (Rhynchonerella cincinnata); I1 II' u u-v e 1, 1923:211—212, fig. 79, e—h (Callizonella); W e sen b erg-b un a, 1939 :
208
II. ALCIOPIDAE
38—40, fig. 25 (Callizonella); Treadwell, 1943:38, pl. II, fig. 25 (Callizonella pigmenta); S t 0 p-B о wi tz, 1948 : 33; У in а к о в, 1957 : 278, рис. 5, карта 2 (Callizonella}-, Dales, 1957 : 129; Tebble, 1962 : 406—407, fig. 18.
Фронтальные головные щупальца крупные, заостренные. Хрусталики глаз направлены вбок и немного вниз. Краевые папиллы на дистальном конце хобота небольшие, одинаковой величины. Верхние щупальцевидные усики III сегмента очень длинные и значительно крупнее остальных (по своей длине они больше ширины тела). Параподии на всех туловищных сегментах хорошо развиты. Спинные подиальные усики очень крупные, широкой листовидной формы, с небольшим заостренным кончиком наподобие сосочка; брюшные подиальные усики также листовидные, с заостренным кончиком, но значительно меньше спинных усиков. Подиальный бугорок сильно вытянутый, с пальцевидным придатком на дистальном конце и с крупной выступающей наружу ацикулой. Все щетинки простые, но двух сортов: одни очень тонкие, волосовидные, другие более грубые, ацикуловидные; на передних сегментах преобладают грубые ацикуловидные щетинки, количество которых постепенно уменьшается, и на задних сегментах на каждой параподии всего одна ацикуловидная щетинка. Подиальные железистые органы темные. Тело полупрозрачное, с многочисленными мелкими пигментными пятнами, причем на брюшной стороне они образуют две характерные продольные полосы; темная пигментация наблюдается по краю спинных и брюшных усиков. Количество сегментов— до 100—120. Длина тела до 100 мм.
Распространение. Описание дано по экземплярам из северо-западной части Тихого океана — 34°02' с. ш. и 148°49' в. д., 38°21' с. ш. и 151°57' в. д. Широко распространенный вид в тропических и субтропических водах Атлантического и Тихого океанов.
2. Krohnia excellata (Uschakov, 1955)
(Табл. XXVI, 5—7}
Ушаков, 1955а : 108, рис. 11, г—д (Callizonella).
Головные щупальца короткие, толстые. Глаза направлены вперед и немного вбок. Хобот на дистальном конце с 12 округлыми краевыми папиллами одинаковой величины; стенка глотки бугристая. Щупальцевидные усики короткие, веретеновидные, с заостренным кончиком. Верхние щупальцевидные усики на III сегменте наиболее длинные, но меньше половины ширины тела; нижние, или брюшные, щупальцевидные усики на II и III сегментах примерно в 2 раза короче верхних щупальцевидных усиков и равны щупальцевидным усикам I сегмента* Брюшные щупальцевидные усики III сегмента заметно сплющены и по своей форме напоминают брюшные подиальные усики. Параподии на всех щетинковых сегментах хорошо развиты. Спинные и брюшные подиальные усики листовидные, удлиненные, с заостренным кончиком; спинные усики крупнее брюшных усиков; на передних 5—10 сегментах спинные усики более короткие и широкие, чем на последующих сегментах; спинные усики у половозрелого экземпляра с нижней стороны (у подиального бугорка) заметно утолщены. Подиальный бугорок сильно вытянутый, с пальцевидным выростом на дистальном конце и крупной ацикулой. Щетинки только простые, но наряду с тонкими, длинными волосовидными щетинками на средних сегментах имеются 2—3 более крепких и коротких щетинки ацикуловидного типа; тонких волосовидных щетинок свыше 50 в одном пучке. Подиальные же
8. RHYNCHONERELLA 209
лезистые органы выпуклые, охватывают основание параподий сверху и сзади; на передних сегментах они выражены заметно слабее. Спинная сторона тела коричневатая, наиболее темная окраска на передних сегментах; спинные и брюшные подиальные усики светлые, со слабой точечной пигментацией; подиальные органы темно-коричневые, почти черные; передняя часть головной лопасти темная, головные щупальца бесцветные; глаза красновато-коричневые. Количество сегментов свыше 100. Длина тела свыше 70 мм, ширина до 6 мм. Яйца заходят в подиальный бугорок и в основание спинного усика.
Распространение. В коллекциях ЗИН имеется 3 экземпляра из северо-западной части Тихого океана, прилегающей к Курильской гряде (сквозной лов пелагической сеткой 4000—0 м и 500—0 м) и 1 экземпляр из юго-западной части Берингова моря («Витязь», ст. 1418).
8. Род RHYNCHONERELLA Costa, 1862
[Callizona Greeff, 1862]
Хобот короткий, без боковых длинных усиковидных отростков и имеет на дистальном конце лишь небольшие папиллы одинаковой величины. 5 пар щупальцевидных усиков на трех передних (околоротовых) сегментах: 1 у . Рудиментарных параподий в передней части тела нет. Се-меприемники у самок не отмечены. Спинные и брюшные подиальные усики листовидные. Подиальный бугорок с пальцевидным отростком на конце. Верхние щетинки тонкие, сложные (сочлененные), с тонким длинным конечным члеником, а нижние толстые, короткие, простые или сложные, ацикуловидного типа. Подиальные железистые органы пигментированные. 1 или 2 анальных усика.
Типовой вид: Rhynchonerella gracilis Costa, 1862.
Описано 7 видов этого рода, но для северных частей Тихого и Атлантического океанов отмечено лишь 4.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ БИДОБ РОДА RHYNCHONERELLA COSTA
1 (4). Ацикуловидные щетинки простые.
2 (3). На каждой параподии по 1—2 толстых и коротких простых щетинок и многочисленные тонкие сложные щетинки; ацикуловидные щетинки гладкие...............................1. Rh. gracilis Costa.
3 (2). На передних 5—10 параподиях только толстые и короткие простые щетинки в количестве 3—6; на последующих сегментах как тонкие сложные щетинки, так и по 1 ацикуловидной щетинке; последние зазубренные . . . *Rh. mobii (Apstein, 1893) (табл. XXVII, 10—IS).
А р s t е i п, 1900 : 16—17, pl. Ill, figs. 23—30 [Callizona)', F a u v e 1, 1923 : 213—214, fig. 80, a—d [Callizona)' Stpp-B о w i t z, 1948 : 34; Dales, 1957 : 131—132, figs. 39—43; Tebble, 1962:396—398, fig. 11.
Атлантический и Тихий океаны, тропические и субтропические воды.
4 (1). Ацикуловидные щетинки сложные.
5 (6). Верхние щупальцевидные усики на III сегменте короткие; ацикуловидные щетинки с тонким гладким конечным члеником...............
..................................3. Rh. angelini (Kinberg).
14 п. В. Ушаков
210
II. ALCIOPIDAE
6 (5). Верхние щупальцевидные усики на III сегменте длинные (значительно длиннее всех остальных); ацикуловидные щетинки со слабо зазубренным конечным члеником . . . 2. Ph. petersii (Langerhans).
1. Rhynchonerella gracilis Costa, 1862
(Табл. XXVII, 1—4)
Greeff, 1876a : 72, pl. 5, figs. 60—62 (Callizona nasuta); Apstein, 1900 : 19, pl. Ill, figs. 31—32; 20, pl. V, figs. 44—50 (C. nasuta-\-C. henseni); Izuka, 1914 : 7— 8, pl. I, fig. 8 (C. japonica); Fauvel, 1923 : 215—216, fig. 81, a—с (C. nasuta)- W e-senberg-Lund, 1939 : 42—43, figs. 27—28 (C. nasuta); S tap-B о wi t z, 1948 : 36; Ушаков, 1957 : 279—281, рис. 6, а—г, карта 2 (C. nasuta); Dales, 1957 : 131; T e b b 1 e, 1962 : 396, fig. 10, a, b.
Головные щупальца толстые, удлиненные. Хрусталики глаз направлены вбок. Хобот с 12 небольшими, равной величины краевыми папиллами на дистальном конце. Наиболее короткая первая пара щупальцевидных усиков отходит от I сегмента; от двух последующих сегментов отходит по две пары щупальцевидных усиков, при этом верхние усики заметно крупнее нижних; верхние щупальцевидные усики II и III сегментов наиболее крупные, но по длине не превышают ширину тела. На всех туловищных сегментах спинные подиальные усики немного вытянутые, заостренные; брюшные подиальные усики такие же, как и спинные, но меньшего размера. Подиальный бугорок удлиненный, с пальцевидным отростком на дистальном конце и с выступающей наружу ацикулой. Щетинки на всех сегментах двух сортов: 1) многочисленные тонкие и длинные сложные щетинки с тонким удлиненным конечным члеником и 2) единичные (1—2), более короткие и толстые простые ацикуловидные щетинки, расположенные в нижней части пучка. Тело беловатое, с темными, бурыми боковыми пятнами (железистые органы); глаза красноватые. Количество сегментов до 100. Длина тела до 30—60 мм, ширина 0.5—1 мм.
Распространение. В северо-западной части Тихого океана встречен к востоку от о. Хонсю (34°02' с. ш. и 148°49' в. д., 39°22' с. ш. и 148°48' в. д. — горизонт 0—50 м, 1953 г.). В литературе отмечен для тропических и субтропических вод Атлантического и Тихого океанов.
2. Rhynchonerella petersii (Langerhans, 1880)
(Табл. XXVII, 5—9)
Langerhans, 1880 : 312, pl. XVII, fig. 49 (A Iciopa); Greeff, 1885 : 449, pl. XIII, fig. 26 (Vanadis); Viguier, 1886 : 405—408, pl.»XXIV, figs. 6—13 (Vanadis heterochaeta); Apstein, 1900 : 18, pl. IV, figs. 39—43 (Callizona setosa); Fauvel, 1923 : 214, fig. 80, e—k (Callizona setosa); Step-Bowitz, 1948 : 34; У m a-к о в, 1957 : 281, рис. 6, 9—и, карта 2 (Callizona setosa); Dales, 1957 : 133; T e b b 1 e, 1962 : 398—400, fig. 12, a—c.
Головные щупальца крупные. Хрусталики глаз направлены вперед и вбок. Хобот с 12 небольшими, равной величины краевыми папиллами на дистальном конце. Первая пара щупальцевидных усиков отходит от I сегмента; они небольшие, веретеновидные. От двух последующих сегментов отходит по две пары щупальцевидных усиков, при этом верхние щупальцевидные усики заметно крупнее нижних; наиболее длинные верхние щупальцевидные усики на III сегменте (их длина равна ширине тела). Спинные подиальные усики очень крупные, листовидные, нежные; вначале они сердцевидные, затем широкоовальные. Брюшные подиальные
9. WATEL10
211
усики в несколько раз меньше спинных, ланцетовидные, слегка заостренные. Подиальный бугорок вытянутый, с пальцевидным отростком на дистальном конце и с выступающей наружу ацикулой. Все щетинки сложные, но разного характера: на передних сегментах в верхней части пучка тонкие, длинные щетинки с тонким, длинным конечным члеником, а в нижней части пучка толстые, более короткие щетинки с коротким, слабо зазубренным конечным члеником (зазубренность на конечном членике заметна лишь при очень большом увеличении); на передних сегментах коротких и толстых сложных щетинок порядочно, а на сегментах в средней части тела их количество уменьшается до 1—2. Тело полупрозрачное, беловато-желтоватое, с темными, коричневыми пятнами по бокам сегментов (подиальные железистые органы); глаза темно-коричневые. Количество сегмейтов 40—60. Длина тела до 15—20 мм, ширина до 0.5—1 мм. В нашем распоряжении имелись обрывки передних частей тела.
Распространение. В коллекциях ЗИН имеются экземпляры из северо-западной части Тихого океана, к востоку от о. Хойею (34°02' с. ш. и 148°49' в. д., 39°22' с. ш. и 148°48' в. д. — горизонт 0—50 м, 1953 г.). Встречается в тропических и субтропических водах Атлантического и Тихого океанов.
3. Rhynchonerella angelini (Kinberg, 1866)
(Табл. XXVIII, 1—4)
Kinberg, (1866) 1910 : 56 (Krohnia); Apstein, 1900 : 18—19, pl. IV, figs. 33—38 (Callizona)', Moore, 1908 : 340—341 (Callizona)', Chamberlin, 1919a : 147—150, pl. 25, figs. 7—8, pl. 29, figs. 1—6 (Rhynchonerella pycnocera); Fauvel, 1923 : 215, fig. 81, d—i (Callizona); Wesenberg-Lund, 1939 : 41—42, fig. 27, chart 21 (Callizona); Treadwell, 1943 : 36—37 (Rhynchonerella pycnocera); Stap-Bowitz, 1948:34—36, fig. 22; E. Berkeley a. C. Berkeley, 1948:40—41, fig. 56 (Callizona); Dales, 1957:133, figs. 44—46; Imajima, 1961 : 8—9, fig. 3; T e b b 1 e, 1962 : 400—403, figs. 13, 14, a—c.
Вид, весьма близкий к предыдущему виду и отличается от него в основном более короткими щупальцевидными усиками. Спинные подиальные усики широкие, крупнее подиального бугорка; брюшные подиальные усики ланцетовидные, заостренные, короче подиального бугорка. Нижние короткие и толстые сложные щетинки с очень небольшим, тонкими гладким дистальным члеником. Подиальные железистые органы хорошо заметны, темно-коричневые. Количество сегментов 100—150. Длина тела до 120 мм.
Распространение. В коллекциях ЗИН имеются лишь экземпляры из Тасманова моря (Тэббл, 1968). По литературным данным, встречается в тропических и субтропических водах Атлантического, Индийского и Тихого океанов; в северной части Тихого океана распространяется на север до Алеутской гряды.
9. Род WATELIO Stap-Bowitz, 1948
Хобот с ланцетовидными папиллами по окружности наружного конца, без удлиненных боковых усиковидных придатков. Щупальцевидные усики на трех передних сегментах в количестве 4 пар, короче подиальных усиков на туловищных сегментах. Спинные и брюшные усики на туловищных сегментах вытянутой, заостренной формы; брюшные несколько крупнее спинных. Из подиального бугорка наружу торчит огромная ацикула (свободный ее конец равен длине самой ножки); на терми
14*
212
III. TOMOPTERIDAE
нальном конце подиального бугорка обособляется небольшой пальцевидный придаток, расположенный дорсально по отношению к ацикуле. Щетинки тонкие, длинные, сочлененные (сложные); в нижней части пучка 1—2 простые щетинки. Подиальные железистые органы с первых сегментов.
Типовой вид: Callizona gravieri Benham, 1929 (монотипический род).
1. Watelio gravieri (Benham, 1929)
(Табл. XXVIII, 5—7)
Benham, 1929 : 190—191, pl. 1, figs. 13—17 {Callizona gravieri); S t ap-B о w i t z, 1948 : 37—38, fig. 32 (Watelio longifoliata); Dales, 1957 : 134—135, figs. 47—50.
Головная лопасть широкая, с 5 небольшими щупальцами. Глаза у взрослых экземпляров широко расставлены. Хобот с 12 терминальными папиллами. На передних туловищных сегментах щетинки могут отсутствовать. Количество сегментов до 190. Длина тела до 150 мм при максимальной ширине 3 мм (без параподий).
В коллекциях ЗИН отсутствует.
Распространение. Отмечен для северо-восточной части Тихого океана (40—45° с. ш.), района Новой Зеландии, а также для Атлантического океана, к югу от Азорских островов,
III. Семейство TOMOPTERIDAE Grube, 18481
Весьма аберрантное и монолитное семейство, сильно специализированное к планктонному образу жизни. Тело стекловидно-прозрачное, параподии лишены щетинок и снабжены листовидными плавничками. Характернейшей особенностью представителей этого семейства служат очень длинные «усы», направленные назад.
Тело разделено на 3 отдела: головной, туловищный и хвостовой (последний иногда отсутствует). Голодная лопасть снабжена одной парой крупных, широких, постепенно заостряющихся к дистальному концу головных щупалец, направленных вбок или немного назад (так называемые «лобные рога» — prostomial horns). Обычно имеется 2 небольших глаза и 2 затылочных (нухальных) органа наподобие эполет, покрытых ресничным эпителием. Глотка невооруженная, короткая. Головная лопасть слита с двумя последующими сегментами, несущими две пары щу-пальцёвидных усиков. Первая из них (anterior cirrus) небольшая, находится на брюшной стороне, немного впереди ротового отверстия (имеется не у всех видов и может отсутствовать у взрослых форм), вторая — очень крупная и снабжена длинной, жесткой внутренней щетинкой. Вторая пара щупальцевидных усиков (так называемые «усы») направлена немного вбок и назад и почти достигает заднего конца червя.
За щупальцевидными усиками расположен относительно узкий удлиненный участок, лишенный подиальных выростов («шея»). Параподии туловищного отдела с сильно вытянутым стволом и заканчиваются двумя заостренными, примерно одинаковой величины ветвями, которые окружены листовидными, гофрированными пластинками — плавнички или пиннулы. На параподиях не только отсутствуют щетинки, но редуцированы и ацикулы.
1 По-гречески — черви с разрезными крыльями, что довольно хорошо отвечает их внешнему виду.
III. TOMOPTERIDAE
21»
На подиальных ветвях и плавничках наблюдаются различные железы,, имеющие большое систематическое значение. Различают 4 типа желез: 1) хромофильные (chromophile glands) — наиболее крупные, бросающиеся в глаза железы, состоящие из ряда вытянутых трубочек, направленных к одному общему отверстию; эти железы хорошо окрашиваются гематоксилином и имеются лишь на брюшных плавничках, начиная с III или IV пары параподий; они нередко хорошо видны при определенном освещении без окрашивания; 2) гиалиновые (hyaline glands) — небольшие железы, как на брюшных, так и спинных плавничках, или только на одном из них; они состоят из небольших трубочек и имеют темно-коричневый или красноватый пигмент в центре (эти железы не окрашиваются гематоксилином); 3) розетковые (rosettes) — модификация предыдущих желез, очень маленькие образования, в центре которых находятся сферические тельца с темным пигментом; последний, как и у гиалиновых желез, при долгом хранении в спирту может выцветать; эти железы обычно встречаются лишь у видов, имеющих хвостовой конец с редуцированными параподиями; на первых двух туловищных сегментах они находятся на самом подиальном стволе или на брюшной его ветви (хорошо заметны лишь тогда, когда подиальный ствол рассматривается сбоку), а на последующих сегментах располагаются у дистальных конических концов подиальных ветвей; в тех случаях, когда имеются розетковые органы, гиалиновые железы отсутствуют; 4) шпоровидные (spur glands) — бывают лишь на брюшных плавничках рядом с хромофильными железами; так же как и последние, хорошо окрашиваются гематоксилином; они отмечены далёко не у всех видов. Розетковые железы — органы свечения.
Количество параподий до 30 пар (не считая недоразвитые хвостового отдела), у некоторых видов количество параподий более или-менее постоянное. Задний конец тела нередко с сильно редуцированными параподиями и преобразован в особый хвостовой отдел.
Гонады заходят в подиальные выросты, при этом они могут быть или в обеих подиальных ветвях, или только в дорсальных (иногда отдельные яйца случайно проникают в брюшную ветвь, лишенную гонад, и при невнимательном изучении они могут быть ошибочно приняты за гонады),.
Основными видовыми признаками служат: 1) наличие или отсутствие первой пары щупальцевидных усиков, 2) расположение и характер подиальных желез и 3) наличие или отсутствие хвостового конца с редуцированными параподиями.
Все представители этого семейства ведут исключительно пелагический образ жизни. В целоме некоторых Tomopteris отмечены паразитические стадии наркомедуз Cunina lativentris (Damas, 1936).
Взрослые формы томоптерид передвигаются с помощью синхронных волнообразных движений плавничков; вторая пара щупальцевидных усиков («усы») не выполняет локомоторной функции, а служит чувствительными органами и регулирует балансирование и парение (Schwartz, 1905).
Систематическое положение Tomopteridae пока остается не вполне ясным. Ш. Гравье (Gravier, 1896) и А. Мейер (Meyer, 1926) сближают Tomopteridae с Phyllodocidae через Alciopidae. У этих семейств, по Мейеру, нефридиальный аппарат имеет весьма сходное строение. Кроме того, у Tomopteridae мезодерма образуется в виде двух удлиненных зачатков на заднем конце тела, аналогично тому, как это наблюдается у Lopadorhynchus. Однако тип головных придатков у Phyllodocidae и Alciopidae иной, чем у Tomopteridae. Существенные различия имеются и в отношении строения глаз (Akesson, 1964).
214
III. TOMOPTERIDAE
В составе семейства Tomopteridae различают лишь два рода — Enapte-ris Rosa и Tomopteris Eschscholtz.
В последнее время М. Глесснеру (Glaessner, 1958) удалось обнаружить в кембрийских отложениях Южной Австралии хорошо сохранившиеся отпечатки многощетинковых червей, которые по внешнему виду (наличию двух рогов на головном конце) весьма напоминают современных Tomopteridae:, свои находки Глесснер описал в качестве нового семейства Spriggi-nidae Glaessner.
Томоптериды широко распространены в различных районах Мирового океана. Для северных частей Атлантического океана Везенберг-Лунд (Wesenberg-Lund, 1935, 1936, 1950в) указывает 7 видов: Tomopteris hel-golandica Greeff, T. nisseni Rosa, T. cavallii Rosa, T. septentrionalis Quatrefages, T. kejersteini Greeff, T. krampi Wesenberg-Lund и T. planctonis Apstein. По нашим данным, T. helgolandica вместе с теплыми водами проникает в Баренцево море. Для побережья Японии Ицука (Izuka, 1914) отмечает 4 вида: Tomopteris pacifica Izuka, Т. elegans Chun, T. septentrio-nalts и T. apsteini Rosa, но нахождение последнего вида нуждается в подтверждении, так как Ицука имел дело, по всей видимости, с молодым экземпляром. Весьма подробные сведения о составе и количественном распределении Tomopteris в водах северной части Тихого океана приведены в работах Дэйлса (Dales, 1955а, 1956, 1957) и Тэббла (ТеЬЫе, 1962). По нашим коллекциям констатировано 3 вида: Tomopteris septentrionalis Quatrefages, Т. elegans Chun и T. (Johnstonella) pacifica Izuka, при этом наиболее обычным оказался первый вид. К сожалению, не всегда все экземпляры удается точно определить до вида, так как у фиксированных экземпляров плавнички, имеющие основное систематическое значение, часто сильно попорчены.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА TOMOPTERIDAE
1 (2). Подиальные выросты окружены лишь с наружной стороны тонкими листовидными плавничками (пиннулами). «Усы» значительно длиннее тела.................................*Enapteris Rosa, 1908.
Род представлен всего одним видом — E.euchaeta (Chun, 1887), описанным из Средиземного моря; довольно обычен в теплых водах Атлантического океана (Stnp-Bowitz, 1948).
2 (1). Подиальные выросты окружены со всех сторон тонкими листовидными плавничками (пиннулами). «Усы» короче тела или лишь незначительно длиннее его...................1. Tomopteris Eschscholtz.
1. Род TOMOPTERIS Eschscholtz, 4825
Головная лопасть слита с двумя последующими сегментами; спереди она имеет небольшую выемку в виде складки, глубина которой может сильно варьировать. С боков головной лопасти два крупных и широких головных щупальца («лобных рога»), слабо изогнутых и заостренных к дистальному концу. Передний край головных щупалец более тонкий и острый, чем задний. Позади головных щупалец на спинной. стороне наблюдается небольшое вдавление, на дне которого располагаются 2 темных глаза. Затылочные органы в виде удлиненных желобков (эполетов) начинаются позади головных щупалец и простираются по спинной стороне до глазных ямок или немного дальше их; затылочные органы частично заходят и на брюшную сторону. Форма и длина затылочных органов имеет систематическое значение для распознавания видов. Первая пара щупаль
1. TOMOPTERIS
215
цевидных усиков очень небольшая и часто отсутствует (если они имеются, длина их никогда не превышает-длину головных щупалец). Вторая пара щупальцевидных усиков, так называемые «усы», очень длинная, направлена назад и по длине иногда равна длине тела и даже превосходит ее (но незначительно); основание их сильно расширено. Внутренние (осевые) щетинки второй пары щупальцевидных усиков большей частью с поперечными засечками через более или менее равные интервалы. Параподии туловищного отдела с удлиненным стволом и заканчиваются двумя остроконечными ветвями, снабженными листовидными плавничками (пиннулами). Последние окаймляют подиальные ветви сверху и снизу и частично заходят на подиальный ствол. Тело совершенно прозрачное. Длина червей до 70 мм (имеется единичное указание о нахождении экземпляра до 135 мм).
Род подразделяется на два подрода: Tomopteris s. str. и Johnstonella Gosse, которые отличаются друг от друга главным образом тем, что у первого розетковые органы и хвостовой отдел с редуцированными параподиями отсутствуют, а у второго они имеются; Тэббл (ТеЬЫе, 1960) не считает эти признаки достаточными для четкого разделения подродов, однако большинство авторов признает указанные подроды.
Типовой вид: Tomopteris onisciformis Eschscholtz, 1825.
Род насчитывает около 40 видов. Наиболее полные таблицы для определения видов Tomopteris приведены в работах Стёп-Бовитца (St0p-Bo-witz, 1948) и Дэйлса (Dales, 1957). Ниже мы даем таблицу для видов, указанных для северных районов Атлантического и Тихого океанов.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА TOMOPTERIS ESCHSCHOLTZ
1 (14). Розетковые органы отсутствуют [подрод Tomopteris s. str. Eschscholtz ].
2 (5). Хвостовой придаток иногда имеется; гиалиновые железы на обоих плавничках.
3 (4). Плавнички со светлой центральной и. темной краевой частью; хвостовой придаток может быть длинным ..........................
...............................*Т. (s. str.) nisseni Rosa, 1908.
Wesenberg-Lund, 1935 : 6—9, figs. 13—15;
S t 0 p-B о w i t z, 1948 : 44—46, figs. 29—30; Dales, 1957 : 141—142, figs, 52, d (синонимия); Tebble, 1962 : 384—385.
Атлантический, Индийский и Тихий океаны (субтропические районы Японии- и у побережья Калифорнии).
4 (3). Плавнички не делятся на светлую и темную части; хвостовой придаток только короткий........................................
....................*Т. (s. str.) krampi Wesenberg-Lund, 1936.
W esenberg-Lund, 1936 : 8—11, figs. 1—3; S t 0 p -В 0 w i t z, 1948 : 48—49, figs. 34—35; Dales, 1957 : 142, figs. 51, d, 52, e.
Северная часть Атлантического океана, в Тихом океане у побережья Калифорнии.
5 (2). Хвостового придатка никогда не имеется.
6 (9). Гиалиновые железы на брюшных плавничках отсутствуют.
7 (8). Гиалиновые железы имеются на спинных плавничках III и IV параподий ..............................2. Т. (s. str.) elegans Chun.
216
III. TOMOPTERIDAE
8 (7). Гиалиновых желез на спинных плавничках нет.....................
................................*Т. (s. str.) cavallii Rosa, 1907.
St0 p-Bowitz, 1948 : 46, figs. 31—32; Wesen-berg-Lund, 1951 : 33. Северная часть Атлантического океана (заходит в пролив Девиса), Индийский океан.
9 (6). Гиалиновые железы только на брюшных плавничках.
10 (И). Хромофильные железы расположены апикально, небольшие .......................... 1. Т. (s. str.) septentrionalis Quatrefages.
11 (10). Хромофильные железы расположены вентрально, крупные.
12 (13). Плавнички окаймляют ствол параподий дорсально и вентрально ...................................*Т. (s. str.) ligulata Rosa, 1908.
Stnp-Bowitz, 1948 : 52, fig. 38; T e b b 1 e, 1962 : 384. Субтропические и тропические районы Атлантического и Тихого океана.
13 (12). Плавнички не окаймляют ствол параподий.........................
...........................*Т. (s. str.) planktonis Apstein, 1900.
S t a p - В ow i tz, 1948 : 52—54, figs. 39—40; Wesen-berg-Lund, 1950a : 43—44; T e b b 1 e, 1962 : 383—384.
Широко распространенный вид (в северо-западной части Тихого океана доходит до 45° с. ш.).
14 (1). Розетковые органы имеются [подрод Johnstonella Gosse].
15 (16). Тело заканчивается тонким, длинным, нитевидным придатком ...................................3. Т. (Johnstonella) pacifica Izuka.
16 (15). Тонкого нитевидного придатка на конце тела нет.
17 (18). На I и II параподиях розетковые органы на стволах параподий ............................*Т. (Johnstonella) apsteini Rosa, 1908.
S t 0 p - В о wi tz, 1948 : 39—42, figs. 26—27; Dales, 1957 :139; T e b bl e, 1962 : 385.
Субтропические и тропические воды Атлантического, Индийского и Тихого океанов.
18 (17). На I и II параподиях розетковые органы на брюшных ветвях параподий ......................4. Т. (Johnstonella) helgolandica Greeff.
Подрод TOMOPTERIS s. str. Eschscholtz, 1825
Розетковые органы отсутствуют; гиалиновые железы обычно имеются. Хвостового отдела с редуцированными параподиями, как правило, нет. Половые продукты преимущественно в спинных ветвях параподий.
1. Tomopteris (s. str.) septentrionalis Quatrefages, 1865
(Табл. XXIX, 4—5)
Greeff, 1879 : 276—277, pl. XV, figs. 42, 48, 51 (T. eschscholtzii); Apstein, 1900 : 41, Tafel XI, Figs. 16—17; Reibisch, 1905 : 9; Izuka, 1914 : 13; Fa u-v e 1, 1923 : 224, fig. 84, d; Berkeley, 1924 : 5; A u g e n e r, 1929 : 301—302; Benham, 1929 : 195; Monro, 1930 : 86—87; 1936 : 121—122; Wesenberg-L u n d, 1935 : 12, pl. I, figs. 7—9, textfig. 2; 1936 : 4—7; Treadwell, 1943 : 39; S t я p - В о w i t z, 1948 : 49—51, figs. 36—37; E. Berkeley a. C. Berkeley, 1948 : 26—27, fig. 33; Wesenberg-Lund, 1950a : 43, chart 11; 1950b : 12—13; Ушаков, 1955a : 110, рис. 13, Г, Д\ Dales, 1957 : 145, figs. 51, f, 52, g, 54; T e b b 1 e, 1960 : 176—177, fig. 8; a, b, figs. 32—33; Imajima, 1961 : 9; T e b b 1 e, 1962 : 382—383, fig. 5; Pettibone, 1963 : 97—98, fig. 25, c.
Затылочные органы (эполеты) крупные, удлиненной формы, простираются далеко назад (значительно дальше глаз). Первая пара щупальцевидных усиков всегда отсутствует. Вторая пара щупальцевидных усиков («усы») немного длиннее половины длины тела. Осевые щетинки второй
1. TOMOPTERIS
217
пары щупальцевидных усиков с хорошо заметными поперечными засечками через более или менее равные интервалы (рис. 7,10). Параподии с коническими, расходящимися в разные стороны, заостренными ветвями. Плавнички закругленные, особенно брюшные. На спинных плавничках железы отсутствуют. Хромофильные железы в виде пучка диффузно расположенных удлиненных трубочек находятся на апикальном конце брюшных плавничков, начиная с III—IV пары параподий; кроме того, на брюшных плавничках имеется некоторое количество отдельно разбросанных железистых клеток, которые так же, как и хромофильные железы, окрашиваются гематоксилином. Розетковые органы отсутствуют. На брюшных плавничках имеются маленькие гиалиновые железы, которые расположены несколько выше апикальных хромофильных желез; как правило, они имеют коричнево-желтую окраску (однако это явно не розетковые органы). 2 первые пары параподий обычно не имеют никаких желез. Гонады только в спинных ветвях параподий, начиная со II и кончая XIII — XVI параподиями. Хвостового отдела с редуцированными параподиями нет, но последняя пара параподий значительно меньше параподий средних сегментов. Количество параподий 20—24. Размеры: длина тела до 28 мм, ширина — 8 мм.
Примечание. По Р. Дэйлсу (Dales, 1955а, 1957), наибольшее количество Т. septentrionalis у побережья Калифорнии (залив Монтерей) наблюдается в середине лета и в середине зимы (до 2 экз. на 1 м3), в связи с чем он предполагает наличие у этого вида полугодового цикла развития. По Е. Везенберг-Лунд (Wesenberg-Lund, 1936), в водах Западной Гренландии период размножения Т. septentrionalis весьма растянут, максимум приходится на осень. В районе Курило-Камчатской впадины личиночные стадии в порядочных количествах (до 0.2 экз. на 1 м3) отмечены в августе преимущественно в поверхностных слоях (0—200 м), а взрослые в этот же период в основном концентрировались на горизонтах 100—750 м (Милейковский, 1969).
Распространение. В коллекциях ЗИН имеются экземпляры из Норвежского моря, северо-западной части Тихого океана и по материалам д/э «Обь» из различных районов южного полушария (всего около 150 экз.); по С. А. Милейковскому (1962), встречается в Баренцевом море. Широко распространенный вид, придерживается преимущественно холодных вод. В северной части Тихого океана встречен от Берингова моря до побережья Калифорнии и восточного побережья Японии (примерно 30° с. ш.); указан также для побережья Чили. В Атлантическом океане отмечен как в северных, так и южных его районах; на север доходит до Баффинова залива.
2. Tomopteris (s. str.) elegans Chun, 1888
(Табл. XXIX, 1—3)
Izuka, 1914 : 12—13; Benham, 1929 :196—197, pl. II, figs. 24—26; S t и p-B о w i t z, 1948 : 46—48, figs. 32—33; Ушаков, 1955a : 110; Dales, 1957 : 142—143, figs. 51, a, 52, a, 53; T e b b 1 e, 1960:179—180, fig. 11, a—c, fig. 48; 1962 : 380-382, fig. 4, b.
Затылочные органы короткие (заканчиваются у начала глазной ямки). Первая пара щупальцевидных усиков всегда имеется как у молодых, так и у взрослых экземпляров; она расположена сразу позади головных щупалец и значительно короче и тоньше их (около 2/3 их длины). Вторая пара щупальцевидных усиков по длине примерно равна 2/3 длины тела.
218
III. TOMOPTERIDAE
Осевые щетинки второй пары щупальцевидных усиков с хорошо заметными поперечными засечками через более или менее равные интервалы. Параподии с коническими заостренными ветвями. Хромофильные железы с IV пары параподий, очень крупные, хорошо заметные, расположены с нижней стороны брюшных плавничков у окончания подиальной ветви. Гиалиновые железы лишь на спинных плавничках III и IV пар параподий. Гиалиновые железы не всегда хорошо видны. Розетковые органы отсутствуют. Гонады только в спинных подиальных ветвях, начиная с III и по VIII туловищный сегмент. Задний конец тела без хвостового придатка с редуцированными параподиями. Количество сегментов 13—15. Размеры половозрелых экземпляров: длина тела около 5—8 мм, ширина 4 мм, включая параподии.
Распространение.В коллекциях ЗИН имеется 7 экземпляров с двух станций из северо-западной части Тихого океана к востоку от о. Хонсю: 34°02' с. ш. и 148°44' в. д., 39°44' с. ш. и 151°53' в. д., горизонты О—50 м. По литературным данным, в северной части Тихого океана распространен преимущественно в субтропических и тропических водах; в Атлантическом океане не встречен севернее Азорских островов; указан для Средиземного моря, района Новой Зеландии и побережья Чили.
Подрод JOHNSTONELLA Gosse, 1853
Розетковые органы имеются. Гиалиновые железы отсутствуют. На заднем конце тела хвостовой придаток с редуцированными параподиями. Половые продукты как в спинных, так и брюшных подиальных ветвях.
3. Tomopteris (Johnstonella) pacifica Izuka, 1914
(Табл. XXX)
Izuka, 1914 : 11—12, figs. 1—4; Berkeley, 1924 : 289—290, pl. I, figs. 1—2 (7. elegans, nom. praeoccup.); 1930 : 75—76 (7. renata); E. В e r k e 1 e у а. С. Ветке 1 e у, 1948 : 26, figs. 31—32 (T. renata)-, Ушаков, 1952 : 106—109, рис. 3—5 (T. renata); 1955a : 110, рис. 12 и рис. 13, А—В (Т. renata); 1957 : 285—286, карта 3 (Т. renata-]-T. pacifica); Dales, 1955а : 440; 1957 :141, fig. 51, е, fig. 52, f; Е. В е г-keley а. С. Berkeley, 1957 : 576 (Т. renata); 1960 : 791 (Т. renata); Т е b b 1 е, 1962 : 385—387, fig. 6.
Затылочные органы удлиненные; на траверзе глазной ямки они дают ответвление в сторону последней. Первая пара щупальцевидных усиков имеется, но у крупных экземпляров может отсутствовать; они находятся на брюшной стороне, немного ниже головных щупалец («лобных рогов). Длина второй пары щупальцевидных усиков поцти равна длине тела. Осевые щетинки второй пары щупальцевидных усиков с внутренней продольной штриховатостью и с неясно выраженными, очень тонкими поперечными засечками (рис. 7,10). Параподии имеют массивный ствол и заканчиваются двумя короткими заостренными ветвями примерно одинаковой длины. Кончики обоих ветвей остриями направлены внутрь и заходят друг на друга. Плавнички подиальных ветвей начинаются еще на самом стволе параподий, край плавничков слегка волнистый. Железистые образования хорошо видны без окрашивания. Розетковые органы на двух передних параподиальных сегментах находятся на подиальных стволах, а на последующих — у основания кончиков подиальных ветвей (с их внутренней стороны). Хромофильные железы на брюшных плавничках очень большие, компактные, слегка бобовидной формы и образованы из крупных удлиненных железистых клеток. Гонады как в спинных, так
1. TOMOPTERIS 21!)
и брюшных подиальных ветвях. Хвостовой отдел резко обособлен, в виде длинного, нитевидного тонкого придатка, который почти равен длине тела. Кончик хвоста несколько раздут (наподобие бульбуса) и окрашен в темный красновато-коричневый цвет. Хвостовой придаток, состоит по меньшей мере из 12 рудиментарных сегментов. Тел.о полупрозрачное. Количество туловищных параподий до 21—25. Размеры наших экземпляров: длина тела без хвостового придатка до 37 мм, ширина — до 14 мм с параподиями.
Примечание. Данный вид характеризуется резко обособленным хвостовым придатком. Подобный хвостовой придаток отчасти имеется у Tomopteris eura Chamberlin, 1919, который, к сожалению, описан недостаточно полно. Возможно, Т. eura Chamberlin и Т. pacifica Izuka представляют собой один вид. Во всяком случае в пределах северной части Тихого океана то, что обозначает А. Трэдвуел (Treadwell, 1943) как Т. eura Chamberlin, несомненно, относится к Т. pacifica Izuka. Н. Тэббл (ТеЬЫе, 1962) имел в своем материале самый крупный когда-либо отмеченный экземпляр Tomopteris длиной до 135 мм, который он предположительно относит к Т. pacifica Izuka.
Распространение. В коллекциях ЗИН имеется 21 экземпляр из Берингова и Охотского морей и прилегающих районов Тихого океана (преимущественно глубинные ‘ тотальные ловы). Встречается лишь в северной части Тихого океана, к северу от 40° с. ш.; по-видимому, глубоководный вид.
4. Tomopteris (Johnstonella) helgolandica Greeff, 1879
(Табл. XXXI)
Apstein, 1900:38—39, Tafel X, Fig. 1—6; Fauvel; 1923:221—222, fig. 83, h—i; Wesenberg-Lund, 1935 : 5—6, figs. 4—6; S t я p - В о wi t z, 1948 : 42—43, fig. 28 (синонимия); Pettibone, 1963 : 95—97, figs. 24, 25, a—b.
Затылочные органы удлиненные. Первая пара щупальцевидных усиков отсутствует. Вторая пара щупальцевидных усиков достигает 2/3 длины тела. Осевые щетинки второй пары щупальцевидных усиков с легкими поперечными засечками. Параподии с удлиненным стволом и с заостренными ветвями равной величины. Плавнички широкие, со слабо волнистым краем, полностью охватывают подиальные ветви и немного заходят на подиальный ствол. На всех плавничках имеются желтовато-бурые розетковые органы вблизи дистального конца подиальных ветвей с их внутренней стороны; на двух передних сегментах розетковые органы находятся на брюшных подиальных ветвях. Хромофильные железы на всех брюшных плавничках, довольно крупные. Гонады как в спинных, так и брюшных подиальных ветвях. Хвостовой отдел имеется, но не резко обособлен (не имеет четкой границы, как у Т. pacifica)} тело, постепенно заостряясг к заднему концу, весьма незаметно переходит в хвостовой отдел, который вначале снабжен небольшими подиальными выростами с плавничками. Хвостовой отдел не превышает длины тела, состоит из 10—14 рудиментарных сегментов. Тело полупрозрачное, слабой желтоватой окраски у одного экземпляра под бинокуляром была хорошо заметна на спинной стороне тонкая точечная медиальная пигментная линия, при этом микро скопические пигментные точки имелись и на параподиях. Количество хо рошо развитых туловищных сегментов 17—20. Размеры: длина тела bkjiio чая хвостовой отдел — до 40 мм, ширина тела — до 3 мм без параподий 1 до 12 мм включая параподии.
220
IV. TYPHLOSCOLECIDAE
Примечание. Для этого вида указано (Fauvel, 1923; Step-Bowitz, 1948) наличие гонад в параподиях с I по XIII сегменты, однако у наших двух экземпляров из Атлантического океана гонады имелись и в XVII сегменте; по всей видимости, последнее не имеет систематического значения и зависит от степени половозрелости.
Распространение. В коллекциях ЗИН имеется 5 экземпляров из северной части Атлантического океана и Баренцева моря. Широко распространенный вид в северной части Атлантического океана, встречается в Средиземном море, у берегов Англии, в Северном море, к северу от Исландии, в заливе Мэн и у Ньюфаундленда.
IV. Семейство TYPHLOSCOLECIDAE Uljanin, 1878 1
Тело полупрозрачное, цилиндрическое, веретенообразное, заостряющееся к обоим концам. Головная лопасть не четко отделена от первого сегмента, она имеет коническую форму и заканчивается одним удлиненным нитевидным придатком — пальподом. На головной лопасти два затылочных (нухальных) органа в виде боковых выростов («боковые щупальца»); у некоторых форм, кроме того, имеется средняя папилла (некоторыми авторами обозначается как карункул). Глаза отсутствуют. Глотка короткая, при ней имеется особый ретортообразный орган с большим количеством железистых клеток; вместе с глоткой ретортообразный орган может частично выдвигаться наружу (поршневое устройство). Два или три передних сегмента несут по одной паре листовидных усиков (тентакулярные, или щупальцевидные, усики), прикрывающих головную лопасть с боков. Последующие сегменты снабжены широкими листовидной формы спинными и брюшными усиками, примерно равной величины. Усики имеют весьма характерное ячеистое строение (с многочисленными железистыми клетками). Подиальный бугорок сильно редуцирован, очень маленький, с одной ацикулой и двумя, реже тремя простыми, игловидными гладкими щетинками; на передних сегментах щетинки отсутствуют вовсе. 2 анальных усика. Небольшие черви — около 5—15 мм (максимум 35—40 мм).
Весьма аберрантная группа пелагических полихет, отличающаяся сильной редукцией подиального бугорка, почти полным исчезновением щетинок и преобразованием спинных и брюшных подиальных усиков в крупные листовидные придатки, выполняющие роль гребных органов. Спинные и брюшные усики при фиксации легко отпадают и большая часть фиксированных экземпляров, как правило, лишена придатков.
Семейство представлено всего тремя родами — Typhloscolex Busch, Travisiopsis Levinsen и Sagitella Wagner. Самостоятельность рода Typhlo-drilus Baldasseroni, 1909 взята под сомнение, и Г. Фридрих (Friedrich, 1950) считает его за синоним Typhloscolex Busch. Роды различаются в основном формой и строением головного конца. Наиболее подробный критический разбор всех существующих видов тифлосколецид дан в упомянутой работе Фридриха. Систематическое положение семейства не вполне ясное. Дэйле (Dales, 1955) рассматривает Typhloscolecidae как неотениче-ские формы, произошедшие из пелагических филлодоцид.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА TYPHLOSCOLECIDAE
1 (2). Головная лопасть с дорсальной и вентральной стороны окаймлена ресничными валиками . . . .1. Typhloscolex Busch (стр. 221).
2 (1). Головная лопасть не окаймлена ресничными валиками.
1 Перевод с греческого — слепые черви.
1. TYPHLOSCOLEX
221
3 (4). Средняя папилла имеется . . 2. Travisiopsis Levinsen (стр. 222). 4 (3). Средняя папилла отсутствует ................................
..................... 3. Sagitella Wagner (стр. 22/i).
1. Род TYPHLOSCOLEX Busch, ’1851
Тело удлиненное, цилиндрическое, полупрозрачное, спереди несколько расширенное, к заднему концу постепенно утончается. Головная лопасть заканчивается одним средним головным щупальцем, сидящим на массивном основании (пальпод), и снабжена спинным и брюшным, валиками, образующими широкую оторочку. Края валиков с длинными ресничками, которые выполняют роль коловращательного аппарата, в какой-то степени напоминающего таковой коловраток (Rotatoria). Под спинным валиком два небольших боковых выроста (затылочные органы). Три первых сегмента несут по одной паре широких листовидных усиков (щупальцевидные усики); все последующие сегменты снабжены двумя парами усиков, примерно одинаковой величины (спинные и брюшные усики). 2 удлиненных анальных усика. Подиальный бугорок с небольшой ацикулой и с 1—3 небольшими, едва выдающимися наружу щетинками (преимущественно на задних сегментах).
Весьма небольшие черви длиной менее 15 мм, в толще воды держатся в вертикальном положении.
Типовой вид: Typhloscolex muellerl Busch, 1851.
Описано несколько видов этого рода, которые отличаются друг от друга в основном характером ресничных валиков и положением нухального органа (Step-Bowitz, 1948; Friedrich, 1950). Однако форма ресничных валиков сильно меняется в зависимости от фиксации, а потому вряд ли этот признак может служить надежным критерием для разграничения видов. Наиболее обычный широко распространенный вид Typhloscolex muellerl Busch.
1. Typhloscolex muelleri Busch, 1851
(Табл. XXXII, 1-5)
R e i b i s c h, 1895 : 52—53, pl. V, figs. 1—5; Ehlers, 1913 : 530; Fauvel, 1923 : 226—227, fig. 85, f—h; Augener, 1929 : 307—308; Monro, 1930a : 90; Я ш н о в, 1940 : 58; T r e a d w e 1 1, 1943 : 38, fig. 27; S t яр - В о wi t z, 1948 : 55; 1949 : 17—18, fig. 8; E. Berkeley a. G. Berkeley, 1948 : 30, fig. 39; Ушаков, 1952 : 110; 1955a : 112, рис. 14, A—B\ 1957 : 286, карта 4; D a 1 e s, 1957 : 146— 147, fig. 55, a—b; Tebble, 1960 : 195—196, 231—236, figs. 34—36, tables 16, 17; Imajima, 1961 : 7, fig. 2; Tebble, 1962 : 408—409.
Спинные и брюшные ресничные валики на головной лопасти весьма крупные, в виде широкой оторочки (их высота почти равна диаметру головной лопасти). Реснички длинные и образуют густую щетку. Под спинным ресничным валиком два хорошо заметных боковых выроста — затылочных органа. Первая пара щупальцевидных усиков, прикрывающая головную лопасть с боков, с небольшим срединным надрезом (двудольчатые). Спинные и брюшные подиальные усики округлые, слабо вытянутые. Щетинки иногда появляются с V сегмента (т. е. со II сегмента, снабженного как спинными, так и брюшными усиками), но чаще они наблюдаются лишь на задних сегментах. На каждом подиальном бугорке всего 2, редко 3 щетинки. Щетинки игольчатого типа, слабо выступают за пределы подиального бугорка. Анальные усики удлиненно-овальной формы, крупнее задних подиальных усиков. Тело серовато-белое, полупрозрачное. Количество сегментов до 25—35. Длина тела 5 мм, в редких случаях до 10—15 мм.
222
IV. TYPHLOSCOLECIDAE
Распространение. В коллекциях ЗИН имеются экземпляры из Норвежского моря, юго-западной части Баренцева моря, центральных районов Полярного бассейна, Берингова и Охотского морей и северо-западной части Тихого океана, а также по материалам д/э «Обь» 1956— 1958 гг. из различных районов южного полушария (свыше 250 экз.). Широко распространенный вид; весьма обычен в северной части Тихого океана.
2. Род TRAVISIOPSIS Levinsen, 1885 (emend. ТеЬЫе, 1962)
[Plotobia Chamberlin, 1919]
Тело цилиндрическое, веретенообразной формы. Головная лопасть коническая, заметно заостренная, заканчивающаяся пальцевидным выростом (пальподом). На дорсальной стороне задней части головной лопасти имеется средняя крупная папилла (иногда последняя выражена нечетко или может отсутствовать у Tr. dubia) и два затылочных (нухаль-ных) органа, охватывающих среднюю папиллу спереди и продолжающихся в виде двух свободных удлиненных выростов. На передних трех сегментах по одной паре листовидных щупальцевидных усиков, прикрывающих головную лопасть с боков. На последующих сегментах спинные и брюшные усики листовидной формы, примерно одинаковой величины. 2 широких анальных усика. Щетинки ацикулярного типа, небольшие, в количестве 1—3, преимущественно на задних сегментах.
Типовой вид — Travisiopsis lobifera Levinsen, 1885.
Род насчитывает 6 видов (см. таблицу); указанный для Южной Африки Travisiopsis capensis McIntosh, 1924 остается inc. sedis.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА TRAVISIOPSIS LEVIN SEN
1 (10). Средняя папилла крупная, четко выраженная.
2 (3). Затылочные органы разветвленные............................
...................................*Tr. coniceps (Chamberlin).
Chamberlin, 1919а : 156—157, pl. 66, figs. 2—4 (Plotobia)-, Stnp-Bowitz, 1948 : 61; Dales, 1957 : 150.
Южная часть Атлантического океана, в Тихом океане у побережья Перу ив районе Сан-Франциско (залив Монтерей).
3 (2). Затылочные органы не разветвленные.
4 (5). Затылочные органы не имеют боковых выростов позади средней папиллы................................*Tr. Itftnbricoides Reibisch.
Reibisch, 1895 : 57, pl. V, figs.10 —12.
Атлантический океан (Саргассово море).
5 (4). Затылочные органы с боковыми выростами позади средней папиллы. 6 (7). Боковые выросты затылочных органов длинные, доходят до IV сегмента; средняя папилла с задним пальцевидным выростом . . . . .......................................3. Tr. lanceolata Southern.
7 (6). Боковые выросты затылочных органов короткие; средняя папилла округлая или прямоугольная (без заднего пальцевидного выроста).
8 (9). Боковые выросты затылочных органов параллельные; сегментов 21 .........................................1. Tr. lobifera Levinsen.
9 (8). Боковые выросты затылочных органов направлены в стороны; сегментов 25.............................2. Tr. levinseni Southern.
2. TRAVISIOPSIS
223
10 (1). Средняя папилла отсутствует или выражена нечетко.........
.................................... . .*Tr. dubia Step-Bowitz.
S t гр - В owitz, 1948 : 60—61, fig. 48; Tebble, 1962 : 414—415, fig. 20.
Атлантический океан (40—48° с. ш.), Малаккский пролив, субтропические воды северной части Тихого океана.
1. Travisiopsis lobifera Levinsen, 1885
. (Табл. XXXII, 7, XXXIII, 1—4)
Levinsen, 1885 : 336—340, pl. I, figs. 17—20; Reibisch, 1895 : 95; Fauvel, 1923 : 229, fig. 86, a—d; 1932 ; 66—67; S t и p-B owitz, 1948 : 57— 58, fig. 44; У ш а к о в, 1957:286—287, рис. 7, г—ж; Е. Berkeley а. С. Berkeley, 1957:577—578; Dales, 1957:148—150, figs. 58—60 (part); Tebble, 1960 : 196—197, 245, fig. 13, a, fig. 45; 1962 : 411, fig. 19.
Средняя папилла округлой, слегка поперечно-овальной формы. Затылочные органы частично охватывают спереди среднюю папиллу и образуют позади нее два коротких параллельных выроста. Головная лопасть с боков прикрыта тремя парами щупальцевидных усиков, которые соответствуют трем первым околоротовым сегментам. Щупальцевидные усики широкие, вогнутые, ложковидные. На последующих сегментах спинные и брюшные подиальные усики широкие, неправильной сердцевидной формы. Подиальный бугорок вооружен ацикулой и 1—3 небольшими щетинками (начиная с V сегмента). Анальные усики очень крупные, широкие, прямоугольной формы, с несколько закругленными углами. Окраска фиксированных экземпляров желтовато-серая. Количество сегментов 21. Длина тела около 5—10 мм, ширина 1 мм (по литературным данным, черви могут достигать 25 мм длины).
Распространение. В коллекциях ЗИН имеется 2 экземпляра из северо-западной части Тихого океана и 5 экземпляров из южного полушария (Тэббл, 1968). По литературным данным, широко распространенный вид, встречается как в южных, так и северных частях Атлантического океана, северная граница распространения в Тихом океане в основном совпадает с субтропическими водами (Tebble, 1962).
2. Travisiopsis levinseni Southern, 1910
(Табл. XXXII, 8—11)
Southern, 1910b : 429; 1911 : 32—33, pl. II, figs. 7—10; ? Ehlers, 1913 : 529, pl. XXXIX, figs. 16—17 (Sagitella opaca); Fauvel, 1923:229—230, fig. 86, h—k; Benham, 1927 : 80—81, pl. II, figs. 33—34 (Sagitella kowalewskii); Monro, 1930 : 89—90 (Sagitella kowalewskii); Wesenberg-Lund, 1935 : 13—14; 1936 : 12—16, figs. 4—5; Monro, 1936 :123—124, fig. 17 (Tr. benhami); S top-B o-w i t z, 1948 : 59—60, figs. 46, 47, ,a—b; Ушаков, 1955a : 114, рис. 14, Г—Ж; 1957 : 288, карта 4; Dales, 1957 : 150; Tebble, 1960 : 197—198, 236—237, figs. 13, b, 36; 1962:412—413.
Средняя папилла прямоугольная, немного расширяющаяся к заднему краю. Затылочные органы образуют позади средней папиллы два коротких полукруглых выроста, направленных в стороны; спереди и немного сбоку средней папиллы две округлые бородавки, которые, по Е. Везенберг-Лунд (Wesenberg-Lund, 1936), представляют собой единое образование с затылочными выростами. Головная лопасть с боков прикрыта тремя парами крупных щупальцевидных усиков, имеющих ложковидную форму; щупальцевидные усики направлены прямо
224
IV. TYPHLOSCOLECIDAE
вперед. Спинные и брюшные усики на передних сегментах слегка заостренные, на средних сегментах они почти квадратные, с широким основанием, а на задних сегментах спинные усики сильно вытянутые и заостренные, значительно длиннее брюшных. Подиальный бугорок маленький, едва заметный. Небольшие ацикулярного типа щетинки в количество 2—3 на каждой параподии появляются не ранее VI сегмента. Анальные усики широкой шпателевидной формы, крупнее спинных усиков задних сегментов. Окраска фиксированных экземпляров желтовато-розовая. Количество сегментов 25. Длина тела до 20 мм, ширина 2 мм (по Тэбблу, длина тела может достигать 35 мм).
Распространение. В коллекциях ЗИН имеется 1 экземпляр из района Курильской гряды («Витязь», 1949 г., ст. 166, тотальный лов 4000—0 м) и 54 экземпляра из различных районов южного полушария (Тэббл, 1968). Широко распространенный вид, в северной части Атлантического океана доходит до Денисова пролива (ИЗО—3500 м); указан для северной части Тихого океана, где придерживается, по-видимому, глубинных горизонтов (ТеЬЫе, 1962).
3. Travisiopsis lanceolata Southern, 1910
(Табл. XXXII, б; XXXIII, 5—7)
Southern, 1910b : 428; 1911 : 30—32, pl. I, figs. 3, 5, 6; ? Ehlers, 1913 : 527—529, pl. XXXIX, figs. 8—14 (Sagitella cornuta); Chamberlin, 1919a: 155— 156, pl. 65, figs. 6—11, pl. 66, fig. 1 (Plotobia simplex)' Fauvel, 1923 : 229, fig. 86, e—g; Wesenberg-Lund, 1935 : 13; 1939 : 20—21, fig. 16; Treadwell, 1943 : 38 (Plotobia simplex); Stnp-Bowitz, 1948 : 58—59, figs. 45—46; Wesenberg-Lund, 1950 : 44; Dales, 1957 : 148—150, figs. 58—60 (Tr. lobifera, part.); T e b bl e, 1960 : 198—199, 246, figs. 13, c, 45; 1962 : 413.
Средняя папилла Т-образной формы, с вытянутым узким задним концом. Затылочные органы частично охватывают спереди среднюю папиллу; их длинные задние выросты простираются до IV сегмента. Спинные и брюшные подиальные усики вначале квадратные, а затем вытянутые. Анальные усики шпателевидной формы. Количество сегментов 22. Размеры: длина тела до 38 мм.
Распространение. В коллекциях ЗИН имеется 1 экземпляр из южной части Тихого океана, района о. Пасхи, 37°55' ю. ш. и 109°24' з. д. (Тэббл, 1968). По литературным данным, Атлантический океан — от южной субтропической конвергенции до 60° с. ш., северная часть Тихого океана (до 50° с. ш.).
«
3. Род SAGITELLA N. Wagner, 1872
Тело цилиндрическое, веретенообразное, удлиненное. Головная лопасть коническая, заканчивающаяся удлиненным нитевидным придатком (пальподом). Головная лопасть имеет два затылочных органа (некоторые авторы обозначают их как боковые щупальца). Средняя папилла (карункул) отсутствует; на спинной стороне головной лопасти наблюдается лишь небольшое утолщение. На трех передних сегментах по одной паре щупальцевидных усиков; последующие сегменты несут спинные и брюшные усики. Все усики широкой листовидной формы. Два крупных анальных усика. Подиальные бугорки маленькие, с одной ацикулой и 1—3 небольшими игловидными щетинками, слабо выступающими наружу.
Типовой вид — Sagitella kowalewskii N.Wagner, 1872.
3. SAGITELLA
225
Род монотипический. Описанные В. Ульяниным (Uljanin, 1878) Sag. barbata и Sag. ргаесох относятся к роду Typhloscolex Busch. Описание Sag. ораса Ehlers, 1913, недостаточное, но во всяком случае этот вид не относится к роду Sagitella и, возможно, синоним Travisiopsis levinseni Southern. Два других описанных Элерсом вида — Sag. lobilifera Ehlers, 1912 и Sag. cornuta Ehlers, 1913 — также относятся к роду Travisiopsis Levinsen.
1. Sagitella kowalewskii Wagner, 1872
(Табл. XXXIII, 8—11)
Вагнер, 1872 : 344—347, рис. (форма A); Uljanin, 1878 : 1, pl. IV; Reibisch, 1895 : 56, pl. 5, fig. 9; Southern, 1911 : 33—34, pl. 2, figs. 11—12; E h-1 e r s, 1913 : 526, pl. XXXIX, fig. 15; F a u v e 1, 1923 : 128, fig. 85, a—с; О k u d a, 1937a : 76—77, fig. 2; Treadwell, 1943 : 38, pl. II, fig. 26 (Plotobia paucichaeta)', Stap-Bowitz, 1948:56—57, fig. 43; E. В e r k e 1 e у a. C. Berkeley, 1948 : 31, fig. 40; У ш а к о в, 1952 : 109; 1955a : 114, рис. 14, 3—Я; 1957 : 288—289, карта 4; D а 1 е s, 1957 : 147—148, figs. 56, 57, 60; I m a j i m a, 1961 : 7—8; T e b b 1 e, 1962 : 410.
Головная лопасть коническая, с пальцевидным придатком (пальпо-дом) на дистальном конце и двумя затылочными органами в виде двух боковых округлых выростов. Щупальцевидные усики на 3 первых сегментах широкой листовидной формы. Первая пара щупальцевидных усиков частично прикрывает головную лопасть. Последующие сегменты снабжены спинными и брюшными листовидными усиками неправильносердцевидной формы, примерно одинаковой величины. Анальные усики очень широкие, плоские, почти квадратной формы. Параподии снабжены 2—3 короткими ацикулярными щетинками; на первых 4 сегментах щетинки отсутствуют. Окраска тела желтовато-розовая. Количество сегментов до 50. Длина тела до 15 мм.
Половозрелые особи (со зрелыми яйцами) у Курильской гряды отмечены в октябре.
Примечание. Недостаточно полно описанный Plotobia paucichaeta Treadwell (1943 : 38—39), судя по рисунку головного конца, весьма напоминает Sagitella kowalewskii Wagner и не исключена возможность, что является синонимом последнего.
Р а сп ространение. В наших коллекциях имеется из северо-западной части Тихого океана — район Курильских островов (Ушаков, 1957) и по материалам Советской антарктической экспедиции на д/э «Обь», 1956—1958 гг. из района о. Пасхи, юго-восточной части Тихого океана и тропических районов Индийского океана (Тэббл, 1968). Широко распространенный вид, встречается преимущественно в тропических и субтропических водах.
V. Семейство LACYDONIIDAE Bergstrom, 1914
{Paralacydontidae Pettibone, 1963]
Тело тонкое, длинное, состоит из небольшого количества однотипных туловищных сегментов. Головная лопасть округлая или вытянутая (коническая). 4 головных щупальца на переднем конце головной лопасти. Первый (околоротовой) сегмент лишен каких-либо придатков и щетинок или имеет лишь одну пару крохотных щупальцевидных усиков. Хобот с мягкими краевыми (оральными) папиллами (Lacydonia, Paralacydonia) или сплошь покрыт многочисленными нитевидными папиллами (Pseudola-
15 П. В. Ушаков
226
V. LACYDONIIDAE
cydonia); хитиновых челюстей нет; имеется мускулистый провентрику-лус. Параподии двуветвистые на всех сегментах или 1—3 передних сегмента с одноветвистыми параподиями. Спинные и брюшные усики относительно небольшие, папиллообразные или листовидные; жаберных отростков нет. Спинная ветвь параподий вооружена длинными простыми щетинками, брюшная — сочлененными (сложными). Донные черви.
В состав семейства входит всего три рода: Lacydonia Marion et Во-bretzky, 1875, Paralacydonla Fauvel, 1913 и Pseudolacydonia Rullier, 1964, с весьма небольшим количеством видов.
Указание Э. Бергштрёма (Bergstrom, 1914) о наличии у Lacydoniidae хитиновых челюстей не подтверждается.
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ РОДОВ СЕМЕЙСТВА
LA CYDONIIDAE
1 (2). Щупальцевидные усики имеются. На 2 или 3 передних щетинковых сегментах параподии одноветвистые.............................
.................1. Род Lacydonia Marion et Bobretzky (стр. 226).
2 (1). Щупальцевидных усиков нёт.
3 (4). Головные щупальца маленькие, двучленистые. Параподии на I ще-тинковом сегменте одноветвистые, на всех остальных двуветвистые .............................2. Род Paralacydonia Fauvel (стр. 228).
4 (3). Головные щупальца тонкие, длинные. Параподии на I щетинковом сегменте двуветвистые, как и на всех остальных....................
............................ *Род Pseudolacydonia Rullier, 1964.
Род представлен всего одним видом Ps. caeca Rullier, обнаруженным у западного побережья Африки (Rullier, 1964).
1. Род LACYDONIA Marion et Bobretzky, 1875
Головная лопасть округлая, головные щупальца очень маленькие. Хобот с 10—24 мягкими краевыми папиллами. Первый околоротовой сегмент с одной парой коротких щупальцевидных усиков, щетинок нет. Следующие два или три сегмента с одноветвистыми параподиями, на всех остальных сегментах двуветвистые параподии, с резко расставленными подиальными ветвями. Спинные и брюшные усики маленькие, папиллообразные. Спинные щетинки простые, слегка изогнутые; брюшные сочлененные, гетерогомфные.
Типовой вид: Lacydonia mlranda Marion et Bobretzky, 1875.
Род насчитывает 4 вида. Недавно описанный с западного побережья Африки Lacydonia incognita Rullier, 1965а, как говорит само название, отнесен Ф. Рулье к роду Lacydonia предположительно, ибо этот вид описан по обрывку, не сохранившему головной конец. L. incognita по характеру строения параподий резко отличается от всех ранее известных видов Lacydoniidae, но систематическое положение его остается далеко неясным. Мне представляется, что принадлежность его к роду Lacydonia весьма сомнительна и по своим параподиям он скорее относится к роду Paralacydonia', до получения новых целых экземпляров я все же условно оставляю его в роде Lacydonia.
Для района Орезунда, глубина 271—487 м, А. Элиазон (Eliason, 1962b : 235) указал 3 экземпляра Lacydonia, которые он обозначил как близкие к miranda Mar. et Bobr., но у них, по его данным, была хорошо заметна на головной лопасти непарная папилла (!); по последнему признаку его экземпляры, возможно, должны быть выделены в самостоятельный род.
1. LACYDONIA
227
ТАБЛИЦА ДЛЯ ОПРЕДЕЛЕНИЯ ВИДОВ РОДА LACYDONIA MARION ET BOBRETZKY
1 (6). Подиальные бугорки не прикрыты спереди и сзади листовидными лопастями. '
2 (5). Глаза имеются.
3 (4). Глаза крупные. На первых трех щетинковых сегментах параподии одноветвистые .... *L. miranda Marion et Bobretzky, 1875.
Fauvel, 1923 : 198, fig. 74, a—d.
Средиземное море, Ла-Манш, у побережья Ирландии.
4 (3). Глаза небольшие. Лишь на первых двух щетинковых сегментах параподии одноветвистые.......................*L. mikrops Ehlers.
Ehlers, 1913 : 459—460, pl. XXIX, figs. 5-10. Антарктика (Земля Вильгельма II).
5 (2). Глаза отсутствуют..................1. L. papillata Uschakov.
6 (1). Подиальные бугорки прикрыты спереди и сзади крупными листовидными лопастями.......................*L. incognita Rullier, 1965.
Rullier, 1965a : 22—24, fig. 2.
Западная Африка, побережье Дагомеи.
1. Lacydonia papillata Uschakov, 1958
(Табл. XXXIV, 1—3)
Ушаков, 1958a : 206—207, рисунок, Г—Е.
Головная лопасть широкая, спереди полукруглая; верхняя пара головных щупальцев немного крупнее нижней, которая при рассмотрении со спины не видна. На спинной стороне головной лопасти, позади головных щупалец сбоку два больших вдавления (чувствительные ямки?), оконтуренные коричневатой пигментацией; такая же темная пигментация у заднего края головной лопасти. Глаза отсутствуют. Глотка осталась не изученной (втянута). Головная лопасть резко отделена от I бесщетинкового околоротового сегмента, снабженного одной парой очень небольт ших щупальцевидных усиков. Три последующих сегмента (II—IV) имеют одноветвистые параподии, с одним пучком сочлененных щетинок, все остальные сегменты с двуветвистыми параподиями, с резко расставленными спинными и брюшными ветвями. Спинные ветви параподий вооружены тонкими простыми волосовидными щетинками; брюшные ветви со сложными (сочлененными) щетинками с очень тонким и длинным дистальным члеником. Спинные и брюшные усики рудиментарные, папиллообразные, плохо заметны. Позади I щетинкового сегмента у типового экземпляра на спинной стороне было хорошо видно 4 крупных папиллообразных темных пятна. На анальной лопасти папилл не видно (возможно, не сохранились).
Окраска тела светло-оливковая. Количество сегментов 33. Длина тела 5.5 мм, ширина — 0.5 мм.
Тип хранится в ЗИН АН СССР, инв. № 1/1622.
Распространение. Курило-Камчатская впадина, 41°11' с. ш.. и 154°56' в. д., глубина 5070 м («Витязь», 1953 г., ст. 2119, тип); кроме того, имеется два обрывка передней части тела, добытые на двух станциях к юго-востоку от о. Хонсю — глубина 3352 и 5690 м («Витязь», ст. 3886. и 3517).
15*
228
V. LACYD0NI1DAE
2. Род PARALACYDONIA Fauvel, 1913
Головная лопасть вытянутая, головные щупальца небольшие, двучленистые. Хобот с 10 мягкими краевыми папиллами. Первый околорото-вой сегмент без щупальцевидных усиков и щетинок. На втором сегменте параподии одноветвистые, на всех последующих сегментах двуветвистые, с широко расставленными подиальными ветвями. Спинные и брюшные усики небольшие, заостренные. Нотоподия вооружена простыми щетинками, невроподия — сочлененными, иногда с 1—2 добавочными простыми щетинками в нижней части пучка.
Типовой вид: Paralacydonia paradoxa Fauvel, 1913.
В литературе отмечено всего 2 вида этого рода: Р. paradoxa Fauvel, 1913 и Р. weberi Horst, 1923 (=Р. mortenseni Augener, 1924), которые я склонен рассматривать как один вид (см. ниже).
По общей форме тела и строению параподий, а также по форме глотки Paralacydonia отчасти напоминает молодых Nephthys. Личиночные стадии Paralacydonia лишь недавно описаны М. Во (Bhaud, 1967); ранняя тро-хофора объединяет признаки, характерные для филлодоцид и нефтиид (см. стр. 59 и рис. 18).
1. Paralacydonia paradoxa Fauvel, 1913
(Табл. XXXIV, 4—9)
Fauvel, 1913 : 54—55, fig. 10; 1914 : 118-121, pl. 7, figs. 1-9; 1923 : 198—199, fig. 74, a—d; Ушаков, 1958:416—419, рис. 1, A—Г; Hartman a. Barna r d, 1960:86—87, pl. 6, figs. 1—3; Hartman, 1963:11; Pettibone, 1963 : 184—186, fig. 46; УшаковиУБао-лин, 1965 : 156—157, рис. 2, Д—3; Day, 1967 : 350—351, fig. 15, e—h.
Головная лопасть вытянутая (длина примерно в 2 раза больше ширины). Головные щупальца двучленистые. На дорсальной стороне головной лопасти два продольных желобка. Глаза отсутствуют. От заднего края головной лопасти отходит небольшой щиток (припухлость), распространяющийся на три передних сегмента. Хобот короткий; наружные его стенки гладкие, без папилл. На дистальном конце хобота две толстые губы; по наружному их краю с боков находится по 4 удлиненные сосковидные папиллы, а спереди и сзади, кроме того, имеется по одной короткой папилле. Краевые сосковидные папиллы хобота иногда имеют темнобурую окраску, в других случаях они бесцветные. Провентрикулус длинный, толстый, сильно мускулистый (с кольцевой мускулатурой), с темным продольным тяжем, а у одного экземпляра хорошо были видны мелкие округлые утолщения, расположенные в поперечные ряды, как у некоторых силлид. Первый сегмент лишен параподий, на II сегменте параподии развиты неполностью (с одним пучком щетинок). На всех последующих сегментах параподии двуветвистые, с широко расставленными спинной и брюшной ветвями. Передние лопасти нотоподий и невроподий удлиненные, с небольшим вырезом, соответствующим ацикуле; задние лопасти более короткие, закругленные. Спинная ветвь параподий несколько короче брюшной и снабжена пучком простых, коротких щетинок. Брюшная ветвь параподий вооружена сложными (сочлененными) щетинками, но в нижней части пучка, кроме того, встречаются 1 или 2 простые щетинки; эти простые щетинки наблюдались не у всех наших экземпляров. Брюшных щетинок больше, чем спинных, и они несколько длиннее. Сочленение брюшных щетинок гетерогомфное; конечный членик очень длинный, тонко зазубренный. С внутренней стороны нотоподии и невроподии по
2. PARALACYDONIA
I
крыты мелкими ворсинками. Анальная лопасть бочковидной формы, с 2 длинными анальными усиками. Окраска тела бледно-желтоватая; у некоторых экземпляров из Желтого моря на подиальных выростах мм» лисп небольшие темные пятна, а у экземпляров из Тихого океана с^глубо ководных станций — мелкие темные точки как на спинной, так и на. брюшной стороне самого тела, но не у всех экземпляров. Количество сегментов до 60. Длина до 15 мм, ширина — 1.5 мм, включая параподии (наибольшая ширина тела наблюдается в передней ‘части тела в районе нахождения глотки).
Яйца весьма крупного размера; половозрелые экземпляры в Желтом море отмечены в июле, в экваториальной зоне Тихого океана — в конце августа.
Примечание. Различия между Р. paradoxa Fauvel и Р. weberi Horst (=Р. mortenseni Augener) недостаточно четкие. По П. Фовелю (Fauvel, 1932), эти виды в основном различаются между собой тем, что у Р. weberi простые щетинки в нижней части невроподии отсутствуют, в то время как у Р. paradoxa они имеются. Однако в нашем материале были экземпляры как с простыми щетинками в невроподии, так и без них, причем никакой корреляции между наличием или отсутствием простых щетинок и величиной особи, глубиной обитания или географическим районом установить не удалось; в частности, в наших коллекциях имеется экземпляр с простыми щетинками в невроподии из района Новой Гвинеи с глубины 530 м, т. е. примерно из того же района, откуда был описан Р. weberi, для которого характерно отсутствие простых щетинок. Возможно, простые щетинки не всегда удается найти из-за плохой сохранности материала. Нами уже было высказано предположение (Ушаков, 1958), что эти два вида представляют собой синонимы.
В последнее время Р. paradoxa обнаружен в различных районах Мирового океана, причем этот вид характеризуется значительной эврибат-цостью. Так, он найден у побережья Калифорнии на глубине свыше 1750 м (Hartman a. Barnard, 1960), а на атлантическом побережье Северной Америки на глубине 105—122 м (Pettibone, 1963), на глубинах менее 100 м обнаружен и у побережья Южной Африки и Мозамбика (Day, 1967). По нашим данным, встречается на глубине от 7 до 5498 м. Вполне вероятно, что между отдельными популяциями существуют какие-то различия, которые пока нами не учитываются. В частности, по Дж. Дэй (Day, 1967), у африканских экземпляров имелась одна пара плохо различимых глаз; у типичных экземпляров из Средиземного моря П. Фовелом они отмечены не были, так же как и у наших фиксированных экземпляров; некоторые различия, возможно, наблюдаются в характере пигментации червей.
С побережья Японии недавно описан новый подвид — Р. paradoxa . japonica Kitamori, 1965, отличающийся от основной формы следующими особенностями: 1) наличием на переднем конце простомиума небольшого углубления и 2) наличием на пигидиуме, помимо двух удлиненных анальных усиков, небольшой средней папиллы.
Распространение. В коллекциях ЗИН АН СССР 62 экземпляра — Желтое море (глубина 7—25 м), Южно-Китайское море, Тонкинский залив (глубина 48—130 м)< западная часть Тихого океана, к югу от 40° с. ш. до экватора (глубина 260—5498 м). Широко распространенный вид, встречается в Средиземном море, у побережья Марокко, Южной Африки, в районе атлантического и тихоокеанского побережий Северной Америки; Р. weberi отмечен для районов Индии, Индонезии и северной части Новой Зеландии.
ТАБЛИЦЫ
Таблица I
Lugia abyssicola Uschakov: 1 — передний конец тела со спины, 2 — параподия из средней части тела, 3 — щетинка с длинным дистальным члеником, 4 — анальный конец (к юго-востоку от о. Хоккайдо, тип), 5 — частично вывороченный хобот и хоботные папиллы (паратип);
Mystides schroderae Uschakov: 6 — передний конец тела со спины, 7 — параподия из средней части тела, 8 — щетинки с коротким и длинным дистальным члеником, 9 задний конец тела с анальными усиками (Гавайские острова, тип);
Protomystides levensteinae Uschakov: 10 — передний конец тела со спины, 11 — параподия из средней части тела, 12 — щетинка (Марианские острова, тип).
Таблица II
Mystides borealis Theel: 1 — головной конец co спины, 2 — пигидий с анальными усиками, 3 — параподия из средней части тела, 4 — щетинка (Курильские острова); Mystides rarica (Uschakov): 5 — головной конец со спины, 6 — параподия из средней части тела, 7 — сочленение щетинки, S — щетинка (Курило-Камчатская впадина); Protomystides orientalis Uschakov: 9 — головной конец со спины, 10 — задний конец со спины, 11 — параподия из средней части тела, 12 — щетинка (к востоку от о. Хонсю, тип).
Т а б л и ц a III
Mystides southerni Banse: 1 — головной конец, 2 — параподия из средней части тела, 3 — пигидий, 4 — щетинка, 5 — сочленение щетинки спереди и в профиль (по: Banse, 1954), 6 — общий вид червя (по: Свешников, 1958);
Protomystides occidentalis (Ditlevsen): 7 — головной конец, 8— пара-подия из средней части тела, 9 — щетинки с длинным и коротким дистальным члеником (по: Hartmann-Schroder, 1963);
Genetyllis lutea Malmgren: 10 — параподия XXX сегмента, 11 — головное щупальце, 12 — брюшной щупальцевидный усик II сегмента (Каттегат),
Таблица IV
Genetyllts castanea (Marenzeller): 1 — головной конец, дорсальные щупальцевидные усики II сегмента не изображены (Японское море), 2 — параподия из средней части тела (о. Хайнань), 3 — то же (Японское море); Phyllodoce malmgreni Gravier: 4 — головной конец с вывернутой глоткой, 5 — параподия из средней части, тела, 6 — щетинка (Красное море).
Таблица V
Phyllodoce (Anaitides) groenlandtca Oersted: 1 — общий вид червя (X2), 2 — головной конец со спины с вывернутой глоткой, 3 — параподия из средней части тела, 4 — щетинка (Японское море);
Phyllodoce (Anaitides) citrina Malmgren: 5 — головной конец со спины с вывернутой глоткой, 6 — параподия из средней части тела (Охотское море);
Phyllodoce (Anaitides) maculata (L.): 7 — параподия из средней части тела (Курильские острова).
Таблица VI
Phyllodoce (Anaitides) mucosa Oersted: 1 — параподия из средней части тела (Черное море).
Phyllodoce (Anaitides) chinensis Uschakov et Wu: 2 — головной конец co спины с вывернутой глоткой, 3 — параподия из средней части тела, 4 — щетинка (Желтое море);
Phyllodoce (Anaitides) papillosa Uschakov et Wu: 5 — головной конец co спины с вывернутой глоткой, 6 — параподия из средней части тела (Желтое море);
Phyllodoce (Anaitides) madeirensis Langerhans: 7 — параподия X сегмента, 8 — параподия из средней части тела (о. Хайнань).
Таблица VII
Paranaitis polynoides (Moore): 1 — вывернутая глотка, 2 — головной конец, 3 — параподия из средней части тела, 4 — сочленение щетинки (Южный Сахалин);
Paranaitis caecum Uschakov: 5 — головной конец, 6 — параподия из средней части тела, 7 — щетинка (к востоку от о. Хонсю);
Paranaitis wahlbergi (Malmgren): 8 — головной конец со спины с вывернутой глоткой (изображена лишь 1/10 хобота), 9 — параподия из средней части тела (Новая Земля).
0.18мм
Т а б л и ц а VIII
Eulalia viridis (L.): 1 — головной конец с вывернутой глоткой и деталь хоботных, папилл, 2 — параподия XXV сегмента, 3 — задний конец тела, 4 — щетипка (Охотское море);
Eulalid'bilineata Johnston: 5 — головной конец, 6 — параподия XXV сегмента, 7 — задний конец, 8 — щетинка (Японское море);
Eulalia sigeformis Annenkova: 9 — головной конец, 10 — параподия из средней части тела, 11 — щетинка, 12 — хоботные папиллы (Алеутская впадина).
Таблица IX
Eulalia austrophylloformis Uschakov: 1 — головной конец, 2 — параподия XXXVIII сегмента, 3 — щетинка, 4 — хвостовой конец с анальными усиками, 5 — продольные ряды папилл в дистальной части хобота (к востоку от о. Хонсю, тип);
Eulalia gravieri Uschakov: 6 — головной конец, 7 — параподия XXV сегмента, 8 — щетинка, 9 — хвостовой конец с анальными усиками, 10 — папиллы из продольного ряда дистальной части хобота (к востоку от о. Хонсю, тип);
Pterocirrus imajimai Uschakov: 11 — головной конец, 12 — хоботные папиллы, 13 — параподия XV сегмента, 14 — щетинка (Калифорния, тип).
Таблица X
Eumida tublformis Moore: 1 — головной конец co спины с вывернутой глоткой (проксимальная часть хобота частично сжата), 2 — дистальный конец хобота спереди и детали строения краевых папилл, 3 — параподия из средней части тела (Японское море);
Eumida sanguinea (Oersted): 4 — хобот и деталь складчатости, 5 — параподия из сродней части тела (Японское море);
Eumida albopicta (Marenzeller): 6 — головной конец и проксимальная часть хобота, 7 — параподия из средней части тела (Желтое море);
Eumida fusigera (Malmgren): 8 — головной конец с вывернутой глоткой, 9 — параподия из средней части тела, 10 — щетинка (Орезунд).
Т а б ллц a XI
Eumida nigrtmaculata (Moore): 1 — головной конец co спины, 2 — часть хобота и хоботные папиллы, 3 — параподия из средней части тела (Охотское море);
Eumida mtnuta (Ditlevsen): 4 — головной конец со спины, 5 — параподия из средней части тела к северу от Новосибирских островов);
Pterocirrus macroceros (Grube): 6 — головной конец со спины, 7 — параподия из средней части тела, 8 — щетинка (Желтое море), 9 — не полностью вывернутая глотка и форма папилл (Черное море).
Таблица ХП
Pterocirrus notoensis (Imajima): 1 — головной конец со спины с вывернутой глоткой, 2 — форма папилл на хоботе, 3 — брюшной щупальцевидный усик II сегмента, 4 — параподия XXV сегмента, 5 — щетинка (по: Imajima, 1967);
Pterocirrus slastnikovi Annenkova: 6 — головной конец со спины, 7 — хобот, 8 — брюшной щупальцевидный усик II сегмента, 9 — параподия передних сегментов, 10 — параподия средних сегментов, 11 — щетинка (по: Анненкова, 1946);
Steggoa pacifica Imajima: 12 — передний конец тела со спины, 13 — папиллы в базальной части хобота, 14 — папиллы на дистальной части хобота, 15 — брюшной усик II сегмента, 16 — параподия XX сегмента, 17 — сочлененная щетинка, 18 —-ацикула (по: Imajima, 1964).
16 П. В. Ушаков
Таблица ХШ
Austrophyllum sphaerocephala (Levenstein): 1 — головной конец со спины, 2 — параподия из средней части тела, 3 — щетинка, 4 — задний конец тела (Курило-Камчатская впадина);
Notophyllum imbricatum Moore: 5 — головной конец со спины, 6 — параподия из средней части тела, 7 — щетинка, 8 — затылочный орган, 9 — форма боковых папилл на хоботе, вид сбоку (Японское море);
N otophyllum foliosum (Sars): 10 — затылочный орган (о. Беринга);
N otophyllum splendens (Schmarda): 11 — затылочный орган (Желтое море).
Иttiazia dogieli Uschakov: 1 — головной конец с вывернутой глоткой, 2 — щупальцевидные усики II сегмента, 3 — параподия из средней части тела, 4 — щетинка (Курило-Камчатская впадина);
Chaetoparta nilssoni Malmgren: 5 — передний конец тела со спины, частично выворочена глотка, 6 — передний конец тела с брюшной стороны, 7 — пигидий, 8 — параподия из средней части тела, 9 — сочлененная щетинка на нормальных параподиях, 10 — простые щетинки III сегмента (западное побережье Швеции).
Ki*
Vttiaziphyllum, nuchalum Uschakov: 1 — передний конец тела с вывороченным хоботом и деталь строения папилл, 2 — параподия из средней части тела, 3 — сочленение щетинки (к востоку от о. Хонсю, тип);
Eteone jlava (Fabricius): 4 — головной конец, 5 — задний конец, 6 — XX параподия, 7 — щетинка, вид спереди и в профиль (Баренцево море);
Eteone longa (Fabricius): 8 — головной конец с вывороченной глоткой, 9 — задний конец, 10 — XX параподия (Белое море).
Т а б л,и ц а XVI
Eteone delta Wu et Chen: 1 — головной конец с вывернутой глоткой, 2 — задний конец, 3 — VI параподия, 4 — XL параподия, 5 — С параподия, 6 — щетинка (дельта р. Янцзы, по: Wu Bao-ling a. Chen, 1963);
Eteone lactea Claparede: 7 — головной конец, 8 — параподия из средней части тела, 9 — щетинка (Орезунд).
Таблица XVII
Eteone spetsbergensis bistriata Uschakov: 1 — головной конец, 2 — задний конец, 3 — XL параподия, 4 — ХС параподия, 5 — щетинки (Японское море);
Eteone (Mysta) barbata (Malmgren): 6 — головной конец с вывернутой глоткой, 7 — задний конец, 8 — XL параподия, 9 — щетинка, 10 — мелкие папиллы на поверхности хобота (Орезунд — 10т, Белое море — 10и, Охотское море — 10и1, Берингов пролив — 101N, залив Анива — 10N, северные острова Курильской гряды — 10NI).
Таблица XVIII
Eteone (Mysta) ornata Grube: 1 — головной конец, 2 — задний конец, 3 — параподии из средней части тела, 4 — щетинки (Японское море);
Eteone (Mysta) maculata (Treadwell): 5 — головной конец, 6 — параподия из сродной части тела (XXV сегмент), 7 — щетинка (Тонкинский залив);
Eteone vltiazi Uschakov: 8 — головной конец, 9 — параподия XXXIII сегмента, 10 -щетинка (к востоку от о. Хонсю, тип).
Таблица XIX
0.03 мм
Eteone (Mysta) tchangsii Uschakov et Wu: 1 — передний конец с вывороченной глоткой со спины, 2 — то же сбоку, 3 — часть стенки хобота, 4 — шипики на дорсальной стороне хобота, 5 — параподия из средней части тела, в — щетинка (Желтое море).
Таблица XX
Lopadorhynchus appendiculatus Southern: 1 — общий вид червя со спины, 2 — передний конец тела с брюшной стороны, 3 — параподия X сегмента, d — крючковидная щетинка из параподий I—II щетинковых сегментов, 5 — сложная щетинка (к юго-востоку от Курильской гряды);
Pontodora pelagica Greeff: 6 — общий вид червя со спины, 7 — параподия, 8 — щетинка (к юго-востоку от Курильской гряды).
Таблица XXI
Pelagobia longicirrata Greeff: 1 — общий вид червя со спины, 2а — головной конец со спины, 26 — форма глоточных челюстей, 3 — параподия, 4 — щетинка (северо-западная часть Тихого океана);
Maupasia caeca Viguier: 5 — общий вид червя со спины (по: ТеЬЫе, 1962), 6 — головной конец со спины, 7 — параподия из средней части тела, 8 — щетинка (северо-западная часть Тихого океана);
Maupasia brodskyi Uschakov: 9 — головной конец со спины, 10 — толстая и тонкая сложные щетинки (северо-западная часть Тихого океана).
Таблица XXII
Phalacrophorus pictus pictus Greeff: 1 — передний конец тела co спины, 2 — щетинка (Полярный бассейн);
Phalacrophorus pictus borealis Reibisch: 3 — общий вид червя со спины (Полярный бассейн);
Pedinosoma curturn Reibisch: 4 — общий вид червя со спины, 5 — параподия (по: ТеЬЫе, 1962).
Таблица XXIII
Torrea Candida (Delle-Chiaje): 1 — передний конец тела $ с вывернутой глоткой со спины, 2 — то же с брюшной стороны, 3 — параподия из средней части тела, 4 —щетинка (Средиземное море);
Naiades cantrainii Delle-Chiaje: 5 — передний конец тела (по: Dales, 1957), в — параподия (Бенгальский залив).
Таблица XXIV
Vanadis formosa Claparede: 1 — передний конец тела со спины, 2 — параподия (п< Dales, 1957);
Vanadis longissima (Levinsen): 3 — передний конец тела со спины, 4 — то же с брюп ной стороны, 5 — параподия, 6 — щетинка (северо-западная часть Тихого окоапц Vanadis crystallina Greeff: 7 — передний конец тела со спины, 8 — то же с брюшко стороны, 9 — параподия (по: Dales, 1957);
Vanadis tagensis Dales: 10 — передний конец тела со спины (по: Dales, 1955);
Vanadis minuta Treadwell: 11 — передний конец тела со спины (по: Dales, 1957), 12 параподия (Бенгальский залив).
Таблица XXV
Alciopa reynaudii Aud. et M.-Edw.: 1 — передний конец тела co спины, 2 — то же с брюшной стороны, из ротового отверстия торчат два усиковидных отростка втянутой глотки, 3 — параподия, 4 — пигидий с анальным усиком (северо-западная часть Тихого океана);
Plotohelmis tenuis (Apstein): 5 — передний конец тела со спины, 6 — то же с брюшной стороны (по: Dales, 1957), 7 — параподия (район о. Хайнань);
Alciopina parasitica Claparede et Panceri: 8 — передний конец тела со спины, 9 — то же с брюшной стороны, 10 — параподия, 11 — ацикуловидная щетинка (северо-западная часть Тихого океана).
Таблица XXVI
Krohnia lepidota (Krohn): 1 — передний конец тела с вывернутой глоткой со спины (спинные усики не изображены), 2 — то же с брюшной стороны (глотка втянута), 3 — параподия, 4 — ацикуловидная щетинка (северо-западная часть Тихого океана); Krohnia esccellata (Uschakov): 5 — передний конец тела с вывернутой глоткой со спины, 6 — то же с брюшной стороны, 7 — параподия (северо-западная часть Тихого океана).
Таблица XXVII
Rhynchonerella gracilis Costa: 1 — передний конец тела с вывернутой глоткой со спины, 2 — параподия, 3 — сложная щетинка, 4 — ацикуловидная щетинка (северо-западная часть Тихого океана);
Rhynchonerella petersii (Langerhans): 5 — передний конец тела с вывернутой глоткой со спины, 6 — то же с брюшной стороны (глотка втянута), 7 — параподия, 8 — нижняя короткая сложная щетинка, 9 — верхняя тонкая сложная щетинка (северо-западная часть Тихого океана);
Rhynchonerella mobii (Apstein): 10 — передний конец тела с вывороченной глоткой со спины, 11 —то же с брюшной стороны, 12 — параподия, 13 — аци-кулярные щетинки (по: Dales, 1957).
Таблица XXVIII
Rhynchonerella angelini (Kinberg): 1 — общий вид червя (по: Tebble, 1962), 2 — передний конец тела со спины, 3 — параподия, 4—щетинка (по: Dales, 1957);
Watelio gravieri (Benham): 5 — передний конец тела взрослого экземпляра со спины, в — то же с брюшной стороны, молодой экземпляр, 7 — параподия из передней части тела (по: Dales, 1957).
17 П. В. Ушаков
Таблица XXIX
Т а б-л и ц а XXX
Tomopteris (Johnstonella) pacifica Izuka: 1 — общий вид червя со спины (Х2), 2 — головной конец со спины; 3 — VIII параподия, 4 — конечная часть хвоста (северо-западная часть Тихого океана).
Tomopteris elegans Chun: 1 — передний конец тела со спины, 2 — IV параподия, 3 — задний конец тела (северо-западная часть Тихого океана).
Tomopteris septentrionalis Quatrefages: 4 — головной конец со спины, 5 — VIII параподия (северо-западная часть Тихого океана).
17*
1
Таблица XXXI
Tomopteris (Johnstonella) helgolandica Greeff: 1 — общий вид червя co спины, 2 — I параподия, 3 — параподия из средней части тела (северная часть Атлантического океана).
Таблица XXXII
Typhloscolex muelleri Busch: 1 —головной конец co спины, 2 — головной конец сбоку (усики оторваны), 3 — щупальцевидный усик, 4 — подиальный усик из средней части тела, 5 — задний конец тела (северо-западная часть Тихого океана); Travisiopsis lanceolata Southern: в — общий вид червя со спины (по: Wesenberg-Lund, 1939);
Travisiopsis lobifera Levinsen: 7 — общий вид червя со спины (по: ТеЬЫе, 1962);
Travisiopsis levinseni Southern: 8 — головной конец со спины (часть усиков с левой стороны оторвана), 9 — головной конец сбоку, 10 — задний конец, 11 — подиальный усик из средней части тела (северо-западная часть Тихого океана).
Таблица ХХХШ
Travisiopsis lobifera Levinson: 1 — головной конец со спины (усики с правой стороны оторваны), 2 — подиальные бугорки со щетинками, 3 — подиальные усики, 4 — задний конец тела (северо-западная часть Тихого океана);
Travisiopsis lanceolata Southern: 5 — головной конец со спины (усики оторваны), в — задний конец тела, 7 — туловищные сегменты сбоку (по: Southern: 1911);
Sagitella kowaleivskii Wagner: 8 — общий вид червя со спины (все усики оторваны), 9 — передний конец тела сбоку (усики оторваны), 10 — подиальный усик, 11 — анальные усики (северо-западная часть Тихого океана).
Таблица XXXIV
Lacydonia papillata Uschakov: 1 — головной конец co спины, 2 — параподия из сродней части тела, 3 — щетинка (Курило-Камчатская впадина, тип);
Paralacydonia paradoxa Fauvel: 4 — передний конец тела со спины, 5 — выпяченная глотка, 6 — сагиттальный разрез глотки, 7 — параподия из средней части тела, 8 — задний конец тела, 9 — брюшная щетинка (Желтое моро).
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ1
abyssicola, Lugia 5, 19, 78*, 84, 86, 116, 117, I
alata, Plotohelmis 205
albomaculatus, Corynocephalus 206
albopicta, Eumida 6, 87, 153, 154, X
Alciopa 7, 71*, 196, 197*, 198, 200, 203, 204, 207, 210
— Candida 199
— distorta 200
— lepidota 207
— microcephala 200
— oahuensis 204
— quadrioculata 204
— reynaudii 7, '23*, 81*, 89, 204, XXV
— vtttata 199
Alciopidae 3, 7, 11, 13, 15, 34, 49, 51, 60, 64, 68*, 70, 71*, 75*, 110, 195, 196, 198 213
Alciopina 8, 196, 197*, 198, 199, 206
— parasitica 8, 51, 65, 81*, 190, 206, XXV
americanum, Notophyllum 170
Ampharetidae 37
Amphinomida 69
Amphinomidae 14, 23, 27, 41, 42, 60, 69, 70
Amphinomorpha 69
Anaitides 5, 114, 128, 129, 130, 133, 134— 139
— erytrophyllus 138
— medipapillata 138
— variabilis 129
Anaitis 140, 141
— wahlbergi 140
angelini, Rhynchonerella 8, 81*, 85, 90, 209, 211, XXVIII
angolaensis, Mystides 119
annenkovae, Eulalia (Clavadoce) 157
Aphrodita 41
Aphroditidae 13—15, 20, 24, 25, 30, 35,
42, 64, 68*, 69, 70, 74
Aphroditiformia 68*, 70
appendiculatus, Lopadorhynchus 7, 80*, 85, 89, 185, XX
apsteini, Tomopteris 85, 214, 216
arctica, Eteone 175
arctica, Eulalia 156
arctica, Phyllodoce 133
Aricia foetida 15
Arctonoe vittata 21, 43
Arenicola 31
Asterope 196, 199
attenuatus, Phalacrophorus 194
augeneri, Lycastopsis 44
aurantiaca, Eteone 177, 178
aurea, Eumida sanguinea 154
austrophylloformis, Eulalia 6, 79*, 84, 87, 146, 150, 151, IX
Austrophyllum 6, 22, 26, 36, 73, 75*, 112, 114, 145, 150, 163, 164
— charcoti 28, 151, 163, 164, 165
— monroi 76, 163
— sphaerocephala 6, 23, 88, 150, 163, 164, XIII
Autolytus 63
badia, Phyllodoce 133
baicalensis, Manayunkia 60
barbata, Eteone (Mysta) 7, 28, 80*, 81, 88, 174, 179, 180, 181, XVII
barbata, Sagittella 225
benchami, Travisiopsis 223
bidentata, Mystides 123
bidentata, Protomystides 124
bilineata, Eulalia 6, 23, 79*, 81, 87, 145,
146, 148, 156, VIII
bistriata, Eteone (Mysta) 177
bistriata, Eteone spetsbergensis 7, 80*, 82, 88, 173, 177, XVII
borealis, Mystides 5, 78*, 86, 117, 118,
120, 122, II
borealis borealis, Mystides 119
borealis caeca, Mystides 78*, 118, 119, 120
borealis, Phalacrophorus pictus 7, 89, 194, 195, XXII
borealis, Spirorbis 62
Brada 15
brevis, Lopadorhynchus 7, 84, 89, 184, 185, 186
brevis, Phyllodoce laminosa 5, 82, 86, 129, 130 131
brodskyi, Maupasia 7, 80*, 84, 89, 190, XXI
brunnea, Protomystides 124
caeca, Maupasia 7, 80*, 84, 89,189,190, XXI
caeca, Mystides 118
caeca, Mystides borealis 78*, 118, 119, 120
caeca, Pholoe 26
1 Названия таксономических единиц выше рода выделены жирным шрифтом, синонимы — курсивом. Жирные цифры указывают страницу, на которой приведено описание данного таксона; звездочкой при цифре отмечены страницы «Введения», на которых даны рисунки или карты, относящиеся к названной форме; римские цифры — номера таблиц в конце книге с рисунками данного вида. В указатель включены лишь названия многощетинковых червей.
УКАЗАТЕЛЬ
265
caeca, Pseudolacydonia 29
caecum, Notophyllum (=Austrophyllum) 19, 163
caecum, Paranaitis 6, 78*, 84, 87, 140, 142, VII
Callizona 196, 209—211"
— - gravieri 212
— henseni 210
— japonica 210
— nasuta 210
— setosa 210
Callizonella 15, 196, 207, 208
— pigmenta 208
Canadia 68
Canadidae 68*
Candida, Alciopa 199
Candida, Torrea 7, 28, 89, 199, XXIII
capensis, Protomystides 123, 124
capensis, Travisiopsis 222
capitata, Capitella 61
capitata, Plotohelmis 205
Capitella capitata 61
Capitellidae 48
Carobia 126, 127
castanea, Genetyllis 5, 78*, 84, 86, 127, 158, IV
catarractarum, Lycastopsis 30
cantrainii, Naiades 7, 89, 200, XXIII
caudata, Nereis 31
cavallii, Tomopteris 85, 214, 216
cavatica, Marifugia 60
eelox, Greeffia 204
eelox, Nauphanta 204
ceylonicus, Pterocirrus 152
Chaetoparia 6, 22, 38*, 39, 75*, 76, 77,
113, 115, 143, 144
— nilssoni 6, 87, 143, XIV
Chaetopteridae 14, 15, 19, 21
charcoti, Austrophyllum 28, 151, 163, 164, 165
charcoti, Eulalia 163
chinensis, Phyllodoce (Anaitides) 5, 78*, 83, 86, 129, 130, 137, VI
Chrysopetalidae 68*, 70
cinerea, Eteone 175
cincinnata, Rhynchonerella 207
Cirratulidae 15
citrina, Phyllodoce (Anaitides) 5, 78*, 81, 86, 129, 130, 136, 137, V-
Clavadoce 158
Cleta 201
conchylega, Onuphis 18
confusa, Protomystides 124
coniceps, Travisiopsis 222
cornuta, Sagitella 224, 225
Corynocephalus 15, 196, 205, 206
— albomaculatus 206
— gazellae 206
— paumotanus 206
crystalline, Vanadis 202, XXIV
cuprea, Diopatra 32
curtum, Pedinosoma 7, 13, 85, 89, 191, XXII
delta, Eteone 6, 88, 174, 176, XVI
Dendronereides 35
Dendronereis 35 t
depressa, Eteone 174 derjugini, ’Harmothoe 26
Dinojphilus 56
Diopatra cuprea 32
distorta, Alciopa 200
Ditrupa 18
diversicolor, Nereis 10
dogieli, Vitiazia 6, 63, 84, 88, 165, 166,
XIV
Drilomorpha 69
dubia, Travisiopsis 222, 223
elegans, Pygospio 62
elegans, Tomopteris 8, 82*, 85, 90, 214, 215, 217, 218, XXIX
elongata, Phyllodoce (Anaitides) 82, 129
Enapteris euchaeta 214
Epitoka 192
— pelagica 192
Errantia 69, 81
erytrophyllus, Anaitides 138
eschscholtzii, Tomopteris 216
Eteone 6, 10, 11, 19, 22*, 25, 26, 29, 32, 34*, 52, 61, 63, 65, 72, 74, 75*, 76, 77, 80*, 113, 147, 170, 172, 173—183'
— arctica 175
— aurantica 177, 178
— cinerea 175
— delta 6, 88, 174, 176, XVI
— depressa 174
— flava 6, 80*, 81, 88, 174, 175, 180, XV
— . islandica 175
— japanensis 175
— lactea 7, 15, 88, 173, 179, XVI
— lentigera 174
— leuckarti 175
— lllljeborgi 175
— longa 6, 15, 23, 28, 31, 48, 54*, 55*, 55, 61, 62, 64, 80*, 81, 88, 173, 175, 176, 177, XV
— pterophora (=Lugia) 116
— sarsi 174
— spetsbergensis 178
— spetsbergensis bistriata 7, 80*, 82, 88, 173, 177, XVII
— spetsbergensis pacifica 82, 177, 178, 182
— spetsbergensis spetsbergensis 7, 80*, 81, 88, 173, 177
— striata 179
— trilineata 181
— tuberculata 175
— vitiazi 7, 84, 88, 173, 178, XVIII
Eteone (Mysta) barbata 7, 28, 80*, 81, 87, 174, 179, 180, 181, XVII
__ ____ Viictpi a tя J 77
----1 maculata 7, 80*, 89, 174, 177, 182, 183, XVIII
----ornata 7, 80*, 89, 174, 181, 182, 183, XVIII
— — picta 15, 181
— — siphonodonta 183
— — tchangsii 7, 28, 80*, 83, 89, 174, 182, 183, XIX
Eteone Ila 172
266
УКАЗАТЕЛЬ
Eteonides 72 (см. Hesionura)
Eteoninae 72, 115
euchaeta, Enapteris 214
Euiagisca gigantea 14
Eulalia 6, 10, 11, 22, 25, 29, 34, 56, 65, 70, 73, 75*, 76, 79*, 114. 145, 146—150. 152—157, 159—161, 163, 164, 198
— arctica 156
— (Clavadoce) annenkovae 157
— austrophylloformis 6, 79*, 84, 87, 146, 150, 151, IX
— bilineata 6, 23, 79*, 81, 87, 145, 146, 148, 156, VIII
— charcoti 163
— gravieri 6, 79*, 84, 87, 146, 150, IX
— magalhaensis 151, 152
— minuta 156
— problema 148
— punctifera 64
— sanguinea 152
— sigeformis 6, 79*, 82, 87, 146, 149, VIII
— semenovi 73, 150, 151
— sotniki 73, 150
— sphaerocephala 145, 165
— subulifera 145
— tenax 152
— tjalfiensis 148
— viridis 6, 13—16, 24, 28, 29, 31, 39, 40*, 41, 46, 47*, 49, 50, 61, 62, 63, 66, 73, 79*, 84, 87, 146, 147, VIII
— (Eumida) nigrimaculata 158
— (Eumida) sanguinea 154
— (Pterocirrus) velifera 159, 160
Eumida 6, 70, 73, 74, 75*, 76, 79*, 114, 145, 152, 153, 159
— albopicta 6, 87, 153, 154, X
— fusigera 6, 79*, 87, 153, 156, X
— minuta 6, 77, 79*, 87, 153, 156, XI
— nigrimaculata 6, 79*, 82, 84, 88, 153, 157 158 XI
— sanguinea 6, 13, 15, 28, 31, 73, 79*, 81, 87, 153, 154, 155, X
— sanguinea aurea 154
— sanguinea olivacea 154
— tubiformis 6, 79*, 82, 84, 87,153, 155, X
Eunicemorpha 69
Eunicida 69
Eunicidae 13, 17, 19, 21, 24, 26, 27, 30, 32, 35, 42, 65, 67, 69
Eunice fucata 63
— gigantea 13
— viridis 10, 63
Eunicites 67
Euphrosyne 15
eura, Tomopteris 219
excellata, Krohnia 8, 81*, 85, 90, 207, 208,
XXVI
Fabricia sabella 62
fakaravana, Phyllodoce 132
filicornis, Spio 31
flava, Eteone 6, 80*, 81, 88, 174, 175, 180,
XV
flava, Nereis 10, 173
floandersi, Spriggina 68
foetida, Aricia 15
foliosa, Phyllodoce 168
foliosum, Notophyllum 6, 79*, 81, 88, 168, 169, 170, XIII
forbesii, Travisia 15
formosa, Vanadis 7, 81*, 90, 201, 202, XXIV
fragilis, Hesionura (=Eteonides) 13
fucata, Eunice 63
fulgens, Rhynchonerella 205
fuscodorsata var., Eteone spetsbergensis hIh 178
fusifera, Eumida 6, 79*, 87, 153, 156, X
fusifera, Sige 157, 159
gazellae, C orynocephalus 206
Genetyllis 5, 22, 75*, 78*, 114, 123, 126, . 127, 128, 131, 132, 157, 158
— castanea 5, 78*, 84, 86, 127, 158, IV
— lutea 5, 78*, 86, 127, III
gigantea, Euiagisca 14
gigantea, Eunice 13
Glycera 28
Glyceridae 11, 21, 24, 32, 35, 44, 48, 49, 68*, 70
Glyceriformia 68*, 70
Glycinde 30
Goniada 21
Goniadidae 30, 68*, 70,
gracilis, Maupasia 189
gracilis, Phyllodoce 5, 86, 129, 130, 131,132
gracilis, Rhynchonerella 8, 81*, 85, 89, 209, 210, XXVII
grandis, Vanadis 201, 203
gravieri, Callizona 212
gravieri, Eulalia 6, 79*, 84, 87,146, 150, IX
gravieri, Watelio 8, 90, 212, XXVIII
Greeffia 196, 203
— eelox 204
— oahuensis 204
groenlandica, Phyllodoce (Anaitides) 5, 28, 45*, 78*, 81, 83, 84, 86, 129, 130, 133, 136, 137, V
groenlandica orientalis, Phyllodoce (Anaitides) 134, 137
Haliplanes 189
— magna 189
Haliplanella 189
— pacifica 189
Halodora 203
Harmothoe 28, 34* 43
— derjugini 26
— imbricata 14, 31, 43, 48
helgolandica, Tomopteris (Johnstonella) 8, 23, 32, 51, 56, 57*, 85, 91, 214, 216, 219, XXXI
henseni, Callizona 210
Hesionidae 11, 20, 24, 69, 70
Hesionura (=Eteonides) 26, 118
---fragilis 13
Hesperophyllum 36, 167
heterochaeta, Vanadis 210
Hyalinoecia tubicola 18
Hydrophanes 184, 186
Hypereteone 172, 173, 179
Hypoeulalia 145, 148
УКАЗАТЕЛЬ
267
Ichthyotomus sanguinarius 65
imajimai, Pterocirrus 6, 79*, 81, 88, 159, 162, IX
imbricata, Harmothoe 14, 31, %3, 48
imbricatum, Notophyllum 6, 28, 79*,'
82, 88, 168, 170, 171, XIII
incognita, Lacydonia 226, 227
lospilidae 13, 71
lospilinae 7, 72, 115, 193
lospilopsis 115, 193
lospilus 115, 193 •'
islandica, Eteone 175
isochaeta, Maupasia 189 .
japanensis, Eteone 175
'japonica, Callizona 210
japonica, Nereis 61
japonica, Paralacydonia paradoxa 229
japonica, Phyllodoce 80, 129, 139
japonicum, Nipponophyllum 6, 79*, 82,
88, 171
japonicum, Notophyllum 169, 171
japonicus, Prionospio 61
Johnstonella 8, 215, 218
kosteriensis, Paranaitis 141
kowalewskii, Sagitella 8, 23, 83* 85, 91, 223, 225, XXXIII
krampi, Tomopteris 85, 214, 215
• Krohnia 8, 34, 71*, 196, 197*, 198, 199, 207, 211
— exellata 8, 81*, 85, 90, 207, 208, XXVI — lepidota 8, 81*, 85, 90, 207, XXVI krohnii, Lopadorhynchus 7, 84,89, 185, 186
lactea, Eteone 7, 15, 88, 173, 179, XVI
Lacydonia 8, 225, 226, 227
— incognita 226, 227
— mikrops 227
— miranda 226, 227
— papillata 8, 91, 227, XXXIV
Lacydoniidae 3, 8, 13, 26, 29, 34, 36, 49, 51, 59, 60, 68*, 70, 71, 72, 75*, 77, 91, 110, 111, 225, 226
Laetmatonice producta 14
laevis, Polyeunoa 21
laminosa, Phyllodoce 13, 20, 46, 129, 131
laminosa, Phyllodoce laminosa 5, 86, 130, 131
lanceolata, Protomystides 124
lanceolata, Travisiopsis 8, 83*, 91, 222, 224, XXXII, XXXIII
lentigera, Eteone 174
lepidota, Alciopa 207
lepidota, Krohnia 8, 81'*, 85, 90, 207, XXVI
leuckarti, Eteone 175
levensteinae, Protomystides 5, 78*, 84, 86, 123, 124, I
leviseni, Travisiopsis 8, 83*, 91, 222, 223, 225, XXXII
ligulata, Tomopteris 85, 216
lilljeborgi, Eteone 175
limbata, Mystides 117
limbata, Mystides, limbata 119
Liocapa 199
lobifera, Sagitella 225 '
lobifera, Travisiopsis 8, 83*, 91, 222, 223, 224, XXXII, XXXIII
longa, Eteone 6, 28, 31, 48, 54*, 55*, 61, 62, 64, 80*, 81, 88, 173, 175, 176, 177, XV
longicirrata,' Pelagobia 7, 28, 80*, 84, 89, 187, 188, XXI
longifoliata, Watelio 212
longlpes, Phyllodoce 163
longissima, Vanadis 7, 81*, 85, 90, 201, 202, 203, XXIV
Lopadorhynchidae 7, 13, 72, Lopadorhynchinae 72, 77, 115, 184
Lopadorhynchus 7, 20, 22, 34, 38*, 39, 50, 56, 72, 75*, 76, 77, 113, 115, 144, 184, 185, 191, 213
— appendiculatus 7, 80*, 84, 89, 185, XX — bervis 7, 84, 85, 184, 185, 186 — krohnii 7, 84, 89, 185, 186 — nationalis 84
— uncinatus 7, 80, 84, 89, 185, 186, 187
Lopadorrhynchus 184
luetkeni, Phyllodoce 133
Lugia 5, 22, 36, 63, 75, 78*, 113, 116, 121, 178
— abyssicola 5, 19, 78*, 84, 86, 116, 117, I
— pterophora 116
— rarica 116, 118, 121
Lugiinae 72, 115
Lumbriconereis 21, 24, 26, 28 lumbricoides, Travisiopsis 222 lutea, Genetyllis 5, 78*, 86, 127, III lutkeni, Trachelophyllum 169 Lycastis 61 Lycastopsis 44, 61 — augeneri 44 — catarractarum 30
Macellicephala 26, 63
Macellicephaloides 26, 30, 63
macroceros, Phyllodoce (Eulalia) 157, 159
macroceros, Pterocirrus 6, 28, 29, 65, 79*, 81, 88, 149, 157, 159, 160, XI
macroceros, Sige 156
macrolepidota, Phyllodoce 80, 129
macropapillosa, Phyllodoce 139
maculata, Eteone (Mysta) 7, 80, 89, 174, 177, 182, 183, XVIII
maculata, Nereis 10, 129
maculata, Phyllodoce (Anaitides) 5,15, 50, 52*, 53*, 61, 62, 66, 78*, 81, 86, 129, 130, 134, 135, 136, V
maculatus, Phalacrophorus 194
madeirensis, Phyllodoce (Anaitides) 5, 78*, 83, 87, 129, 130, 137, 138, VI
magalhaensis, Eulalia 151, 152
magna, Haliplanes 189
Maldane sarsi 62
malmgreni, Phyllodoce 5, 28, 83, 86, 129, 130, 132, 133, IV
Manayunkia baicalensis 60
Marifugia cavatica 60
268
УКАЗАТЕЛЬ
Marphysa 21
Mastigethus 184
Mauita nans 196
Maupasia 7, 38*, 72, 75*, 76, 84, 115, 184, 189, 191
— brodskyi 7, 80*, 84, 89, 190, XXI — caeca 7, 80*, 84, 89, 189, 190, XXI — gracilis 189 — isochaeta 189
medipapillata, Anaitides 183
Mesomystides 117
microcephala, Alciopa 200
mikrops, Lacydonia 227
minuta, Eulalia 156
minuta, Eumida 6, 77, 79*, 87, 153, 156, XI
minuta, Pholoe 14
minuta, Vanadis 202, XXIV
miranda, Lacydonia 226, 227
mobii, Rhynchonerella 209, XXVII
monroi, Austrophyllum 76, 163
mortenseni, Paralacydonia 228, 229
mucosa, Phyllodoce (Anaitides) ,5, 86, 129, 130, 135, 136, VI
muelleri, Typhloscolex 8, 58*, 59, 65, 83*, 85, 91, 221, XXXII
multicirrus, Notophyllum 168
Myriochele 18
Mysta 7, 72, 113, 170, 172—174, 177, 178, 179, 180—183
— papillifera 181
Mystides 5, 20, 22, 38*, 63, 72, 73, 75*, 77, 78, 113, 116, 117, 118, 119, 122, 126
— anglolaensis 119
— bidentata 123
— borealis 5, 78*, 86, 117, 118, 120, 122, II
— borealis borealis 119
borealis caeca 78*, 118, 119, 120
— limbata 117
— limbata limbata 119
— limbata nigrolineata 119
— notialis 118, 119
— punctata 119, 122
— rarica 5, 78*, 84, 86, 117, 119, 121, 122, II
— schroderae 5, 78*, 84, 86, 118, 119, 121, I
— southerni 5, 86, 119, 122, III
Mystidinae 72, 115
Naiades 7, 71*, 196, 197*, 198, 200
— cantrainii 7, 89, 200, XXIII
Nans 184
nans, Mauita 19,6
Nantinae 184
nasuta, Callizona 210
nationalis, Lopadorhynchus 84
N auphanta 203
. cclox 204
Nephthyidae 3, 11, 21, 24, 30, 34—36, 44, 48, 59, 68*, 70, 71
Nephthys 28, 34, 59, 228
Nereidae 11, 20, 24, 25, 34, 69, 70, 74
Nereimorpha 69, 70
Nereiphylla 127, 128
Nereis 28, 31, 33, 34, 43, 44, 61
— caudata 31
— diversicolor 10
— flava 10, 173
— japonica 61
— maculata 10, 129
— viridis 10, 145
Nerilla 17
niger, Phalacrophorus 193 nigrolineata, Mystides limbata 119 nigrimaculata, Eumida 6, 79*, 82, 84, 88, 153, 157, 158, XI
nilssoni, Chaetoparia 6, 87, 143, XIV Nipponophyllum 6, 36, 75*, 76, 79*, 112, 115, 167, 169, 171
— japonicum 6, 79*, 82, 88, 171
— sagamianum 6, 79*, 82, 88, 171, 172-nisseni, Tomopteris 66, 85, 214, 215 nodulosa, Weberia 26
Natalia 151
notialis, Mystides 118, 119 notoensis, Pterocirrus 6, 79*, 88, 159, 161, XII
Notophyllum 6, 11, 22, 25, 34, 36, 41, 48, 49, 72, 75*, 76, 79*, 80, 112, 114, 163, 165, 167, 168, 171, 172 — americanum 170 — caecum 19, 163 — foliosum 7, 79*, 81, 88, 168, 169, 170,
XIII
— imbricatum 6, 28*, 79, 82, 88, 168,' 170, 171, XIII
— japonicum 169, 171
— multicirrus 168
— polynoides 169
— splendens 168, XIII
Notopygos 23
novae-hollandiae, Phyllodoce 133 nuchalum, Vitiaziphyllum 6, 84, 88, 167, XV
oahuensis, Alciopa 204
oahuensis, Greeffia 204
occidentalis, Protomystides 5, 77, 78*, 86, 124, 126, III
olivacea, Eumida sanguinea 154 onisciformis, Tomopteris 215 Onuphis 21, 24 — conchy lega 18
opaca, Sagitella 223, 225
Opheliidae 27, 32
Ophryotrocha 13
— puerilis 17
orientalis, Phyllodoce (Anaitides) groen-landica 134, 137
orientalis, Protomystides 5, 78*, 84, 86, 123, 125, II
orientalis, Sige macroceros 160
ornata, Eteone (Mysta) 7, 80*, 89, 174, 181, 182, 183, XVIII
Otopsidae 70
ovalifera, Phyllodoce 132
Oweniidae 18, 60
pacifica, Eteone spetsbergensis 82, 177, 178, 182
pacifica, Haliplanella 189
pacifica, Steggoa 6, 87, 152, XII
УКАЗАТЕЛЬ
ИНН
pacifica, Tomopteris (Johnstonella) 8, 82*, • 85, 90, 214, 216, 218, 219, XXX pacifica, Vanadis 203
Panthalis 18
papillata, Lacydonia 8, 91, 227, XXXIV papillifera, Mysta 181
papillosa, Paranaitis 139
papillosa, Phyllodoce (Anaitides) 5, 28, 78*, 83, 87, 129, 130, 139, VI
paradoxa, Paralacydonia 8, 23, 59, 60*, 91, 228, 229, XXXIV
paradoxa japonica, Paralacydonia 229
Paralacydonia 8, 29, 34, 38*, 59, 225, 226, 228
— mortenseni 228, 229
— paradoxa 8, 23, 59, 60*, 91, 228, 229, XXXIV
— paradoxa japonica 229
— weberi 229
Paranaitis 6, 22, 75*, 76, 78*, 114, 140, 141, 144, 168
— caecum 6 , 78*, 84, 87, 140, 142, VII
— kosteriensis 141
— papillosa 139
— polynoides 6, 78*, 82, 84, 87, 140, 141, 142, 143, VII
— spesiosa 142
— wahlbergi 6, 77, 78*, 87, 140, 141, VII parasitica, Alciopina 8, 51, 65, 81*, 90, 206, XXV
Pariospilus 115, 193
parvoseta, Pterocirrus 159
patagonica, Phyllodoce (Anaitides) 138
paucichaeta, Plotobia 225
paumotanus, Corynocephalus 206
Pectinaria 18, 24
Pectinariidae 14, 20, 37
Pedinosoma 7, 72, 75*, 77, 115, 184, 191
— curtum 7, 13, 85, 89, 191, XXII
pelagica, Epitoka 192
pelagica, Pontodora 7, 16, 72, 82,-83, 192, XX
pelagica, Torrea 199
pelagica, Vanadis 202
Pelagobia 7, 22, 25, 30, 34, 38*, 64, 72, 73, 75*, 77, 110, 111, 115, 184, 187, 191 193
— longicirrata 7, 28, 80*, 84, 89, 187, 188, XXI
— serrata 188
— viguieri 188
petersii, Rhynchonerella 8, 81*, 90, 210, XXVII
Phalacrophorus 7, 22, 23, 30, 64, 72, 73, 77,. 110, 111, 115, 193
— attenuatus 194
— maculatus 194
— niger 193
— pictus borealis 7, 89, 194, 195, XXII
— pictus pictus 7,28, 80*, 84,-89, 193, 194, 195, XXII
— uniformis 194
Pholoe caeca 26
— minuta 14
Phyllodoce 5, 10, 11, 16, 22, 25, 28*, 29, 34, 45*, 50*, 52*, 53*, 56, 60, 62, 65, 66, 75*, 76, 77, 78*, 113, 114, 126,
127, 128, 129—139, 141, 157, 159, 173 — arctica 133
— badia -133
— fakaravana 132
— foliosa 168
— gracilis 5, 86. 129—132
— japonica. 80, 129, 139
— laminosa brevis 5, 82, 86, 129, 130, 131
— laminosa laminosa 5, 13, 20, 31, 46, 86, 129—131
— longipes 163
— luetkeni 133
— macrolepidota 80, 129
— macropapillosa 139
— malmgreni 5, 28, 83, 86, 129, 130, 132, 133, IV
— novae—hollandiae 133
— ovalifera 132
— pruvoti 82, 129
— pulchella 134
— pulla 138
— rinki 134
— teres 134
— tuberculata 51
— violacea 82, 129
Phyllodoce (Anaitides) chinensis 5, 78*, 83, 86, 129, 130, 137, VI
---citrina 5, 78*, 81, 86, 129, 130, 136, 137, V
— — elongata 82, 129
— — groenlandica 5, 28*, 45*, 78*, 81, 83, 84, 86, 129, 130, 133, 136, 137, V
— — groenlandica orientalis 134, 137 ---maculata 5, 15, 50, 52*, 53*, 61, 62, 66, 78*, 81, 86, 129, 130, 134, 135, 136, V
— — madeirensis 5, 78*, 83, 87, 129, 130, 137, 138, VI
---mucosa 5, 86, 129, 130, 135, 136, VI ---papillosa 5, 28, 78*, 83, 87, 129, 130, 139, VI
— — patagonica 138
Phyllodocemorpha 4, 5, 70, 110
Phyllodociformia 4, 5, 59, 60, 68*, 70, 77, 110
Phyllodocida 69, 70
Phyllodocidae 3, 5, 13, 19, 25, 30, 36, 41, 42, 44, 49, 51, 56, 59, 60, 64, 65, 68*, 69—73, 75*, 86, 111, 113, 184, 197 213
Phyllodocinae 5, 72, 113, 115
picta, Eteone (Mysta) 15, 181
pictus, Phalacrophorus pictus 7, 28*, 80*, 84, 89, 193, 194, 195, XXII
pigmenta, Callizonella 208
Pilargidae 69, 70
Pirakia 152
Pisionidae 68*, 70
planctonis, Tomopteris 85, 216
Plotobia 222
— paucichaeta 225
— simplex 224
Plotohelmis 8, 71*, 196, 197*, 199, 205 — alata 205
— capitata 205
— tenuis 8, 13, 81*, 85, 90, 205, XXV Polybostrichus 63
270
УКАЗАТЕЛЬ
Polygordius 57
Polyeunoa laevis 21
Polyodontes 13
Polynoidae 19
polynoides, Notophyllum 169
polynoides, Paranaitis 6, 78*, 82, 84, 87, 140, 141, 142, 143, VII
Polynoinae 168
Pomatoceros triqueter 61
Pontodora 7, 34, 38*, 75*, 77, 115, 192 — pelagica 7, 16, 72, 80*, 84, 89, 192, XX Pontodoridae 13, 71
Pontodorinae 7, 72, 115, 192
praecox, Sagittella 225
Prionospio japonicus 61
problema, Eulalia 148
Prochaetoparia 75*, 76, 77
producta, Laetma tonice 14 Prolopadorhynchus 184, 185 Prophyllodoce 129
Protodrilus 17
Protomystides 5, 20, 22, 34, 36, 63, 73, 75*, 76, 78, 114, 116, 123, 124—126 — bidentata 124 — bilineata 124 — brunnea 124
— capensis 123, 124
— confusa 124
— lanceolata 124
— levensteinae 5, 78*, 84, 86, 123, 124, I — occidentalis 5, 77, 78*, 86, 124, 126, III — orientalis 5, 78*, 84, 86, 123, 125, II Protomystidinae 72, 115, pruvoti, Phyllodoce 82, 129
Psammolyce 15
Pseudolacydonia 225, 226
— caeca 29, 226
Pseudomystides 117
— limbata punctata 118
Pterocirrus 6, 22, 70, 73, 75*, 76, 79*, 114, 159, 160—162
— ceylonicus 152
— imajimai 6, 79*, 84, 88, 159, 162, IX
— macroceros 6, 28, 29, 65, 79*, 81, 88, 149, 157, 159, 160, XI
— notoensis 6, 79*, 88, 159, 161, XII — parvoseta 159
— slastnikovi 6, 77, 79*, 88, 159, 161, 162, XII
pterophora, Eteone (=Lugia) 116
puerilis, Ophryotrocha 17
pulchella, Phyllodoce 134
pulla, Phyllodoce 138
punctata, Mystides 119, 122
punctata, Pseudomystides limbata 118 punctifera, Eulalia 64
pycnocera, Rhynchonerella 211
Pygospio elegans 62
quadrioculata, Alciopa 204
rarica, Lugia 116, 118
rarica, Mystides 5, 78*, 84, 86, 117, 119,
121, 122, II
renata, Tomopteris 218
reynaudii, Alciopa 7, 23, 81*, 89,-204, XXV
Rhamphobrachium 37
Rhynchonerella 8, 71*, 196—199, 203,
205, 209, 210, 211
— angelini 8, 81*, 85, 90,209,-211,'XXVIII
— cincinnata 207
— gracilis 8, 81*, 85, 89, 209, 210, XXVII
— fulgens 205
— mobii 209, XXVII
— petersii 8, 81*, 90, 210, XXVII
— • pycnocera 211
rinki, Phyllodoce 134
sabella, Fabricia 62
Sabellariidae 14, 21, 24, 37 Sabellidae 19, 61,
Sacconereis 63
sagamianum, Nipponophyllum 6, 79*, 82, 88, 171, 172
Sagitella 8, 64, 220, 221, 224, 225
— barbata (=Typhloscolex) 225
— cornuta (=Travisiopsis) 224, 225
— kowalewskii 8, 23, 83*, 85, 91, 223, 225, XXXIII
— lobifera (=Travisiopsis) 225
— opaca (= Travisiopsis) 223, 225
— praecox (=Typhloscolex) 225 sanguinarius, Ichthyotomus 65 sanguinea, Eulalia 152
sanguinea, Eumida 6, 28, 31, 73, 79*, 81, 87, 153, 154, 155, X
sarsi, Eteone 174
sarsi, Maldane 62
schroderae, Mystides 5, 78*, 84, 86, 118, 119, 121, I
Sedentaria 69
semenovi, Eulalia 73, 150, 151
septentrionalis, Tomopteris 8, 82, 85, 90, 214, 216, 217, XXIX
Serpulidae 19, 61
serrata, Pelegobia 188
setosa, Callizona 210
Sigalionidae 19
Sige 156, 157, 159, 160, 161
— fusifera 157, 159
— macroceros 156
— macroceros orientalis 160
sigeformis, Eulalia 6, 79*, 82, 87, 146
149, VIII
simplex, Plotobw 224
siphonodonta, Eteone (Mysta) 183
slastnikovi, Pterocirrus 6, 77, 79*, 88
159, 161, 162, XII
sotniki, Eulalia 73, 150
southerni, Mystides 5, 86, 119, 122, III speciosa, Paranaitis 142
spetsbergensis, Eteone 178
spetsbergensis, Eteone spetsbergensis 7, 80*, 82, 88, 173, 177
sphaerocephala, Austrophyllum 6, 23, 88, 150, 163, 164, XIII
sphaerocephala, Eulalia 145, 165
Sphaerodoridae 35, 68*, 70
Sphaerosyllis 76
Spinther 15, 71
Spionida 69
УКАЗАТЕЛЬ
Ч'!\
Spionidae 19
Spio filicornis 31
spirillum, Spirorbis 62
Spirorbis borealis 62
— spirillum 62 .
splendens, Notophyllum 168
Spriggina floandersi 68 '
Spriggiuidae 68*, 68
Steggoa 73, 75.*, 114, 151, 152
— pacifica 6, 87, 152, XII
Sternaspidae 27
striata, Eteone 179
Stylarioides 13, 37
subulifera, Eulalia 145
Syllidae 15, 19, 20, 24, 35, 69, 70, 76, 192
tangensis, Vanadis 85, 202, XXIV
tchangsii, Eteone (Mysta) 7, 28, 80*, 83, 89, 174, 182, 183, XIX
tenax, Eulaia 152
tenuis, Plotohelmis 8, 13, 81*,. 85, 90, 205, XXV .
Terebellidae 15, 19
Terebellomorpha 69
teres, Phyllodoce 134
tialftensls Eulalia 148
Tomopteridae 3, 4, 8, 15, 16, 19, 34, 49, 56, 57, 59, 60, 64, 68*, 70, 82, 90, 110, 111, 212, 213, 214
Tomopteris 8, 20, 24, 34, 38*, 56, 57, 64, 213, 214, 215, 216, 219
— cavallii 85, 214, 216
— elegans 8, 82, 85, 90, 214, 215, 217, 218, XXIX '
— eschscholtzii 216
— eura 219
— krampi 85, 214, 215
— ligulata 85, 216
— nisseni 66, 85, 214, 215
— onisciformis 215
— planktonis 85, 216
— renata 218
— septentrionalis 8, 82, 85, 90, 214, 216, 217, XXIX
Tomopteris (Johnstonella) apsteini 85, 214, 216
— — helgolandica 8, 23, 32, 51, 56, 57*, 85, 91, 214, 216, 219, XXXI
---pacifica 8, 82*, 85, 90, 214,. 216, 218, 219, XXX
Torrea 7, 71*, 196, 197*, 198, 199
— Candida 7, 28, 89, 199, XXIII
— pelagica 199
— . vitrea 199
Trachelophyllum luetkeni 169
Travisia forbesi 15
Travisiopsis 8, 34, 64, 85, 221, 222, 223— 225
— benhami 223
— capensis 222
— coniceps 222
— dubia 222, 223
— lanceolata 8, 83*, 91, 222, 224, XXXII, ' XXXIII
— levinseni 8, 83*, 91, 222, 223, 225, XXXII
— lobifera 8, 83*, 91, 222, 223, 224, XXXII, XXXIII-
— lumbricbides 222
trilineata, Eteone 181
triqueter, Pomatoceros 61
tuberculata, Eteone 175
tuberculata, Phyllodoce 51
tubicola, Hyalinoecia 18
tubiformis, Eumida 6, 79*, 82, 84, 87, 153, 155, X
. Typhlodrillus 220
Typhloscolecidae 3, 4, 8, 34, 49, 58—60, 64, 68*, 70, 71, 85, 91, 110, 111, 184, 220
Typhloscolex 8, 71, 220, 221, 225 — muelleri 8, 58*, 58, 59, 65, 83*, 85, 91, 221, XXXII
uncipatus, Lopadorhynchus 7, 80*, 84, 89, 185, 186, 187
uniformis, Phalacrophorus 194
Vanadis 7, 71*, 196, 197*, 198, 201, <202, 210
— crystalline 202 XXIV
— formosa 7, 81*, 90, 201, 202, XXIV
— grandis 201, 203
— heterochaeta 210
— longissima 7, 81*, 85,90,201,202, 203, XXIV
— minuta. 202
— pacifica 203
— pelagica 202
— tangensis 85, 202, XXIV
variabilis, Anaitides 129
velifera, Eulalia (Pterocirrus) 159, 160
viguieri, Pelagobia 188
violacea, Phyllodoce 82, 129
viridis, Eunice 10, 63
viridis, Eulalia 6, 13—16, 24, 28, 29, 31, 39, 40*, 41, 46, 47*, 49, 50, 61, 62, 63, 66, 73, 79*, 84, 87, 146, 147, VIII
viridis, Nereis 10, 145
Vitiazia 26, 63, 75*, 76, 84, 114, 165, 167
dogieli 6, 63, 84, 88, 165, 166, XIV
Vitiaziphyllum 63, 75*, 84, 114, 166, 167
— nuchalum 6, 84, 88, 167, XV
vittata, Arctonoe 21, 43
vitiazi, Eteone 7, 84, 88, 173, 178, XVIII
vitrea, Torrea 199
vittata, Alciopa 199
vittata, Arctonoe 21, 43
wahlbergi, Anaitis 140
wahlbergi, Paranaitis 6, 77, 78*,’87, 140,
141, VII
Watelio 8, 71*, 196,197*, 198,199, 211, 212
— gravieri 8, 90, 212, XXVIII
— longifoltata 212
weberi, Paralacydonia 229
Weberia nodulosa 26
Worthenella 68
Zverlinum 22, 36, 75*, 76, 163
СОДЕРЖАНИЕ
Стр.
Предисловие ............................................................ 3
Систематический указатель видов....................................... 5
Введение .............................................................. '9
Некоторые общие сведения................................................ 9
Небольшой исторический экскурс ........................................ 10
Современное состояние работ по систематике филлодоцид.................. 11
Краткий морфо-функциональный очерк..................................... 13
Размеры и форма тела............................................. 13
Окраска и покровительственное ее значение........................ 14
Биолюминесценция .................................................15
Наружные покровы, слизистые чехлики и трубки.................... 16'
Особенности наружной сегментации ................................ 19
Деление тела на отделы........................................... 21
Головной отдел и органы чувств................................... 24
Глотка и способы питания......................................... 26
Параподии и характер движения червей............................. 32
Щетинки ......................................................... 37
О первичной природе одноветвистых параподий...................... 41'
Метамерия внутренних органов..................................... 44
Размножение и развитие................................................. 49
Экология ..................................................\ ......... 60
Паразитизм и паразиты ................................................. 65
Основы классификации .................................................. 66
Основные черты примитивности строения и биологии полихет......... 66
Положение филлодоцид и близких к ним семейств в общей системе полихет 67
О филогенетических отношениях в пределах семейства Phyllodocidae . . 71
Зоогеографические замечания ........................................ 77
Сводная таблица географического распространения.................. . 86
Основные термины ................................................ . 92
Литература ............................................................ 95
Систематическая часть ................................................. 110
Семейство Phyllodocidae................................................ Ill
Подсемейство Phyllodocinae....................................... 115
Подсемейство Lopadorhynchinae .................................. 184
Подсемейство Pontodorinae ....................................... 192
Подсемейство lospilinae ................................... . 193
Семейство Alciopidae ................................................. 195
Семейство Tomopteridae ............................................... 212
Семейство Typhloscolecidae............................................ 220.
Семейство Lacydoniidae ................................................ 225
Таблицы I—XXXIV....................................................... 230
Указатель латинских названий .......................................... 264
Павел Владимирович Ушаков
МНОГОЩЕТИНКОВЫЕ ЧЕРВИ ПОДОТРЯДА PHYLLODOCIFORMIA ПОЛЯРНОГО БАССЕЙНА И СЕВЕРО-ЗАПАДНОЙ ЧАСТИ ТИХОГО ОКЕАНА
Фауна СССР. Многощетинковые черви, т. I
Новая серия, № 102
Утверждено к печати
Зоологическим институтом Академии наук СССР
Редактор издательства Э. А. Гутникова. Технический редактор Г. А. Бессонова Корректоры Л. Б. Жукоборская, Н. В. Лихарева и Т. Г. Эдельман
-Сдано в набор 3/П 1972 г. Подписано к печати 12/V 1972. г. Формат бумаги 70X1081/ie- Печ. л. 17=23.8 усл. печ. л. Уч.-изд. л. 26.11. Изд. 4555. Тип. зан. № 807. М-09823. Тираж 1300. Бумага № 2.
Цена 3 р. 01 к.