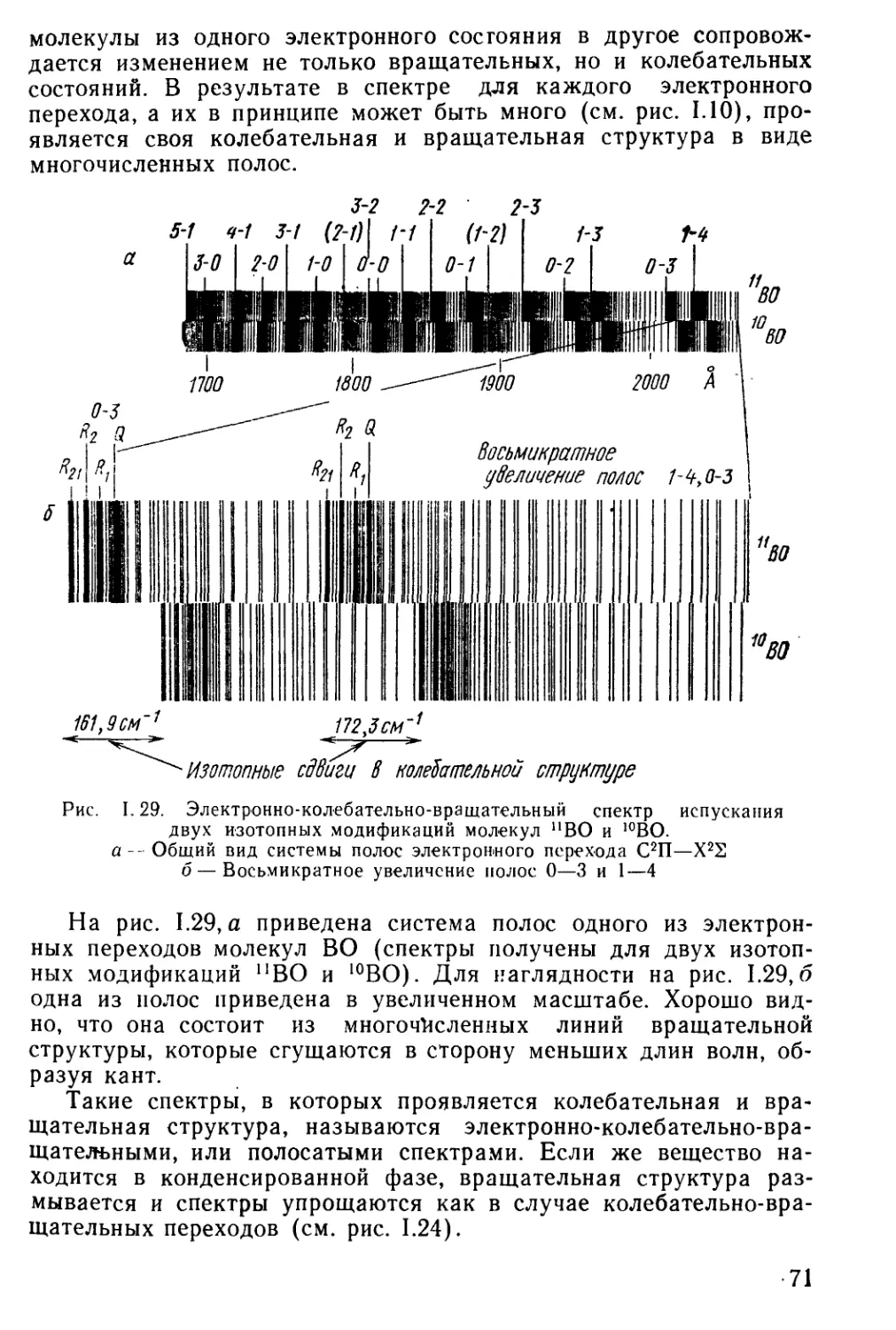
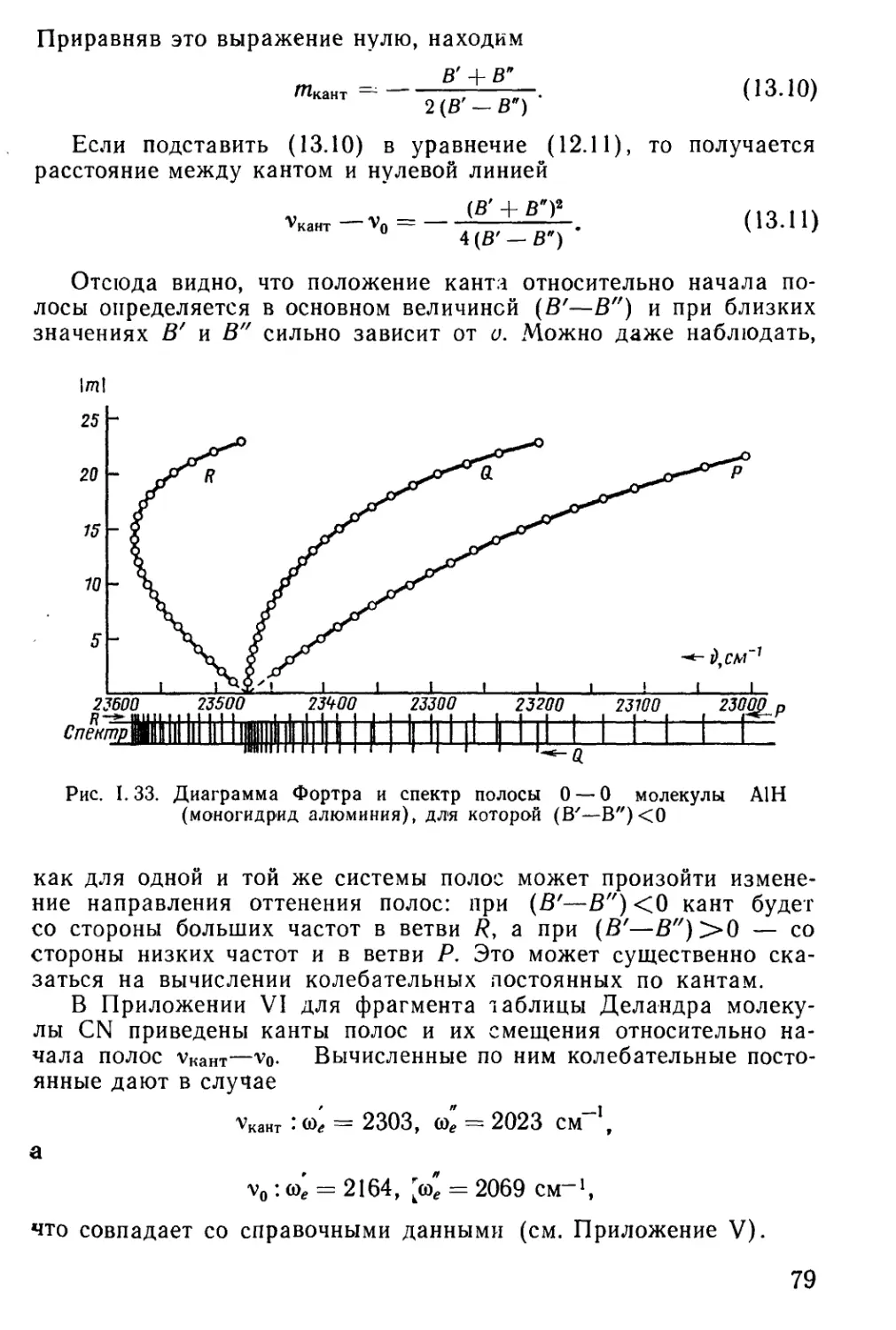
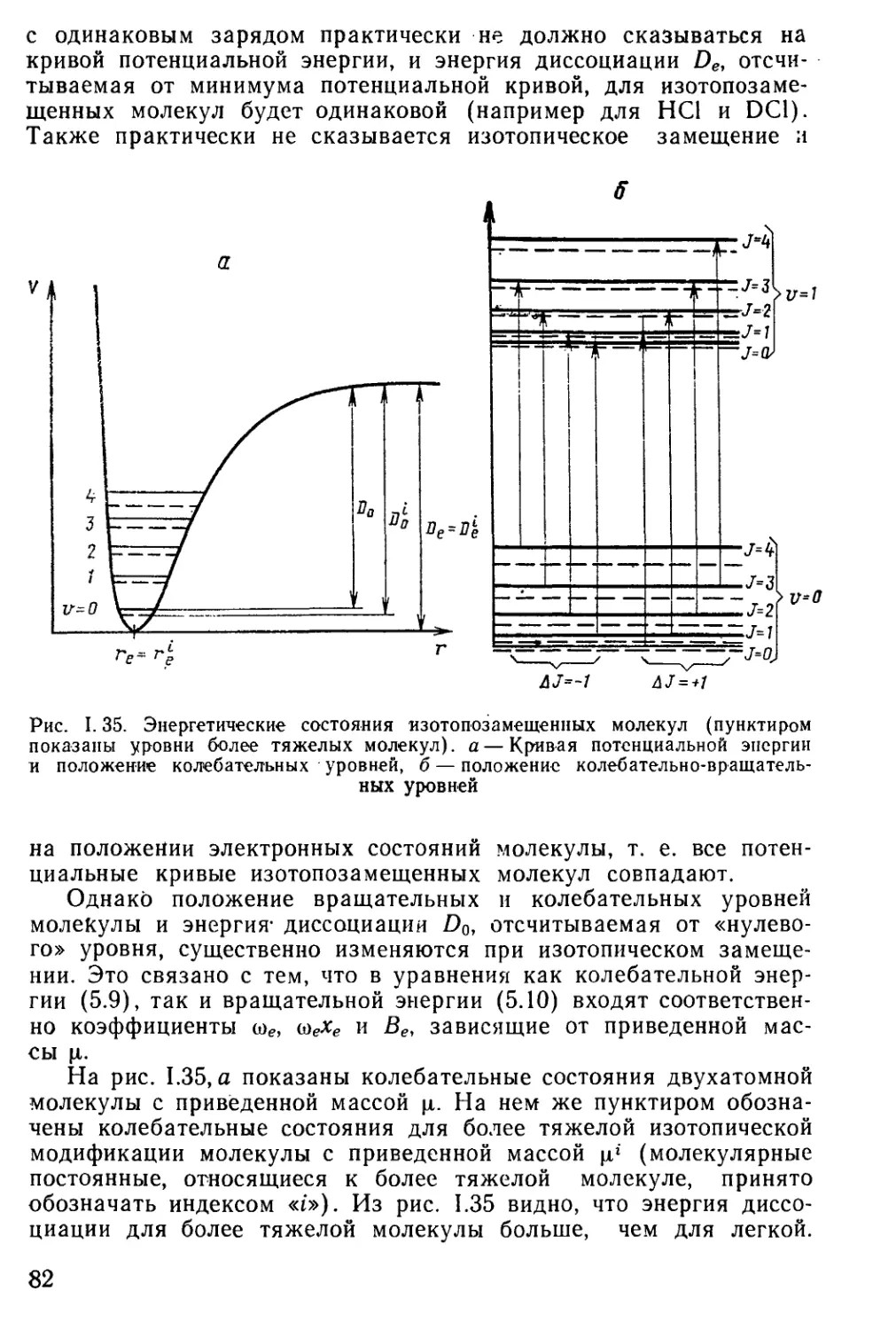
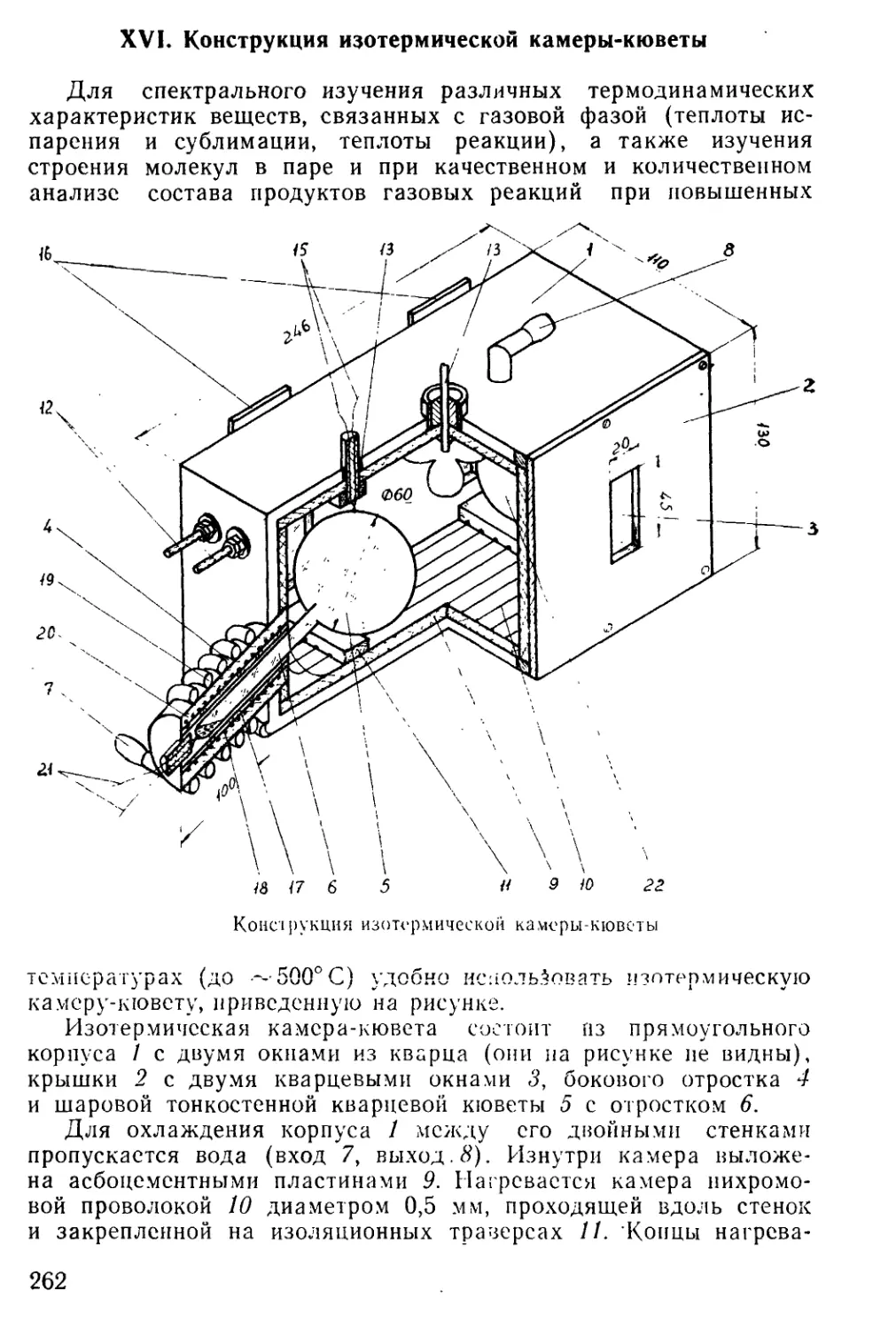
Author: Мальцев А.А.
Tags: распространение световых лучей отражение преломление поглощение излучение оптика спектроскопия
Year: 1980
Text
А. А. МАЛЬЦЕВ
МОЛЕКУЛЯРНАЯ
СПЕКТРОСКОПИЯ
(ТЕОРИЯ, ПРАКТИЧЕСКИЕ РАБОТЫ, ЗАДАЧИ)
Допущено Министерством
высшего и среднего
специального образования СССР
в качестве учебного пособия
для студентов химических,
химико-технологических
и физических специальностей
высших учебных заведений
ИЗДАТЕЛЬСТВО
МОСКОВСКОГО УНИВЕРСИТЕТА
1980
УДК 535.3 + 539.19 + 543.4
Рецензенты:
кафедра физической химии МХТИ
им. Д. И. Менделеева;
проф. Л. В. Г у р в и ч
Мальцев А. А.
Молекулярная спектроскопия. М., Изд-во Моск,
ун-та, 1980, 272 с. с ил. Библиография, 20503
В учебнике впервые собраны в единое целое: теория,
техника и методы молекулярной спектроскопии, серии конт-
рольных вопросов для программированного обучения, 7 прак-
тических работ, более 100 расчетных задач и справочный
материал.
20503—109
М “115—80 1704050000
077 (02)—80
(С) Издательство Московского университета, 1980 г.
ПРЕДИСЛОВИЕ
В настоящее время молекулярная спектроскопия широко ис-
пользуется в различных областях знаний как для качественного
и количественного анализа вещества, так и для изучения его
строения и физико-химических свойств в различных агрегатных
состояниях. Поэтому освоение методов молекулярной спектроско-
пии студентами (химиками, физиками, биологами и др.) стано-
вится обязательным. Не менее важна и переподготовка специа-
листов, окончивших вузы ранее.
К сожалению, число учебных пособий по практической моле-
кулярной спектроскопии весьма ограничено, и они большей ча-
стью посвящены исключительно вопросам структурно-группового
анализа органических соединений по ИК- и электронным спект-
рам [1—6].
В настоящем учебнике делается попытка представить молеку-
лярную спектроскопию в более общем виде.
Книга состоит из следующих четырех самостоятельных разде-
лов.
В разделе I «Введение в теорию молекулярных спектров» рас-
сматриваются энергетические состояния молекул и переходы
между ними, которые дают все многообразие спектров, позволяю-
щих получать обширную информацию о строении молекул. Для
простоты понимания все это делается сначала на базе двухатом-
ных молекул, а затем переносится на многоатомные.
Раздел II «Введение в технику и методы молекулярной спект-
роскопии» связан с практикой. Он дает общие представления о
приборах, с помощью которых изучаются спектры поглощения,
испускания и рассеяния, а также о методике получения спект-
ров. Рассмотрены отдельные отечественные спектральные прибо-
ры (ИСП-51, СФ-4А, СФ-16, СФ-14, ИКС-14, ИКС-22), круг ко-
торых определялся аппаратурными возможностями вузовских
практикумов, а не выпускаемыми промышленностью приборами
сегодняшнего дня. В соответствии с этим ограничением составле-
ны и практические работы следующего раздела.
В конце I и II разделов приведены серии вопросов для само-
контроля и ссылки на дополнительную литературу. Каждый
вопрос сопровождается четырьмя ответами, из которых только
один правильный или наиболее полный. Эти вопросы могут быть
также использованы как для программированного обучения, так
и для контроля подготовленности студентов к практическим ра-
ботам. Номера правильных ответов приведены в Приложении
XVIII.
Раздел III содержит 7 практических работ, связанных с изу-
чением строения простых молекул и применением молекулярной
спектроскопии в физической химии и физике. В частности, зна-
чительное внимание уделено определению молекулярных посто-
янных (работы № 1—3), по которым можно воспроизвести си-
стему энергетических состояний молекул, вычислить энергию дис-
социации и произвести соответствующие расчеты термодинамиче-
ских функций, необходимые для нахождения равновесного соста-
ва продуктов химических реакций. Работы № 4, 5 связаны с
традиционными методами структурно-группового анализа и
идентификации молекул по ИК- и КР-спектрам. Работы № 6, 7
посвящены изучению газовых равновесий и определению тепло-
вого эффекта реакции по молекулярным спектрам.
К сожалению, практические работы приходится пока приспо-
сабливать к имеющейся в вузе спектральной аппаратуре, которая
обычно бывает весьма устаревшей и самых различных моделей.
Поэтому предлагаемые здесь практические работы следует рас-
сматривать как базовые. Например, работу № 3 можно также по-
ставить на спектрографе (ИСП-51, ИСП-30 и др.) или монохро-
маторе (УМ-2, ДМР-4, МДР-2 и др.) с фотоэлектрической реги-
страцией. Эта проблема вызвала большие затруднения у автора
при написании раздела II.
В разделе IV собрано более 100 расчетных задач по всем ос-
новным теоретическим разделам, за исключением задач по
структурно-групповому анализу, по которому уже имеется не-
сколько пособий [1—6]. Эти задачи полезны как для закрепле-
ния теоретического материала, так и для того, чтобы разнообра-
зить практические работы (№ 1—3), когда наряду с обработкой
собственных экспериментальных результатов, ограниченных 2—
3 молекулами, привлекаются более точные литературные данные
по широкому кругу молекул, включая данные по чисто враща-
тельным спектрам и спектрам комбинационного рассеяния паров,
недоступных пока для общего практикума в условиях вуза.
Для уменьшения объема обрабатываемых чисел практически
все используемые в расчетных задачах экспериментальные дан-
ные содержат сокращенное число спектральных линий или полос
(часто сокращено и число значащих знаков) по сравнению с на-
блюдаемыми. Поэтому ответы не совпадают с принятыми моле-
кулярными постоянными, часть которых приведена в Приложе-
нии V, составленном по данным справочников' [23] и частично
[12]. Расхождения могут достигать нескольких см1 или сотых А.
При составлении задач было обращено внимание на их многова-
риантность, чтобы обеспечить самостоятельность работы студен-
4
тов. Во всех случаях желательно привлекать статистическую
обработку экспериментальных данных [20], [21], которая в на-
стоящее время не столь трудоемка, если использовать малые
ЭВМ типа 15ВСМ-5, ДЗ-28, «Мир», Проминь» и др.
Завершается учебник «Приложением», в котором приведен
разнообразный справочный материал, необходимый для выполне-
ния практических работ и решения расчетных задач. В частно-
сти, приведено подробное описание конструкции изотермической
камеры-кюветы (Приложение XVI), использующейся в рабо-
тах № 6 и 7. Приведена программа коллоквиума.
Учитывая, с одной стороны, настоятельную необходимость пре-
подавания молекулярной спектроскопии студентам и слушателям
факультетов повышения квалификации химических и ряда дру-
гих специальностей, а с другой стороны, имеющиеся сложности
в приобретении спектрального оборудования для учебных прак-
тикумов, можно рекомендовать следующее.
В тех случая, когда нет возможности проводить практические
занятия на приборах, следует организовать занятия с использо-
ванием наборов готовых спектров (записей на бумажной ленте и
фотопластинок). С просьбой получить их можно обратиться в
научные лаборатории или в другие вузы, где имеется практикум
по молекулярной спектроскопии, или даже в научно-исследова-
тельские институты. Набор спектров можно составить и по пе-
риодической литературе (ею, кстати, широко пользовался автор
при написании раздела IV). Как показал опыт, целесообразно
давать наиболее сильным студентам оригинальные статьи из на-
учных журналов, по которым они проводят обработку небольшой
части экспериментальных данных. Такой подход повышает инте-
рес к занятиям.
Для того чтобы студенты представляли себе методику полу-
чения спектров и сам спектральный прибор, весьма желательно
показать его и объяснить принципы работы основных элементов
конструкции.
Данная книга была первоначально написана для студентов
II—III курсов (IV—V семестры), которые только начинали изу-
чение курса «Физическая химия» и не были знакомы с курсом
«Строение молекул». Практикум по молекулярной спектроскопии
велся в рамках общего практикума по физической химии. Одна-
ко в дальнейшем, в связи с изменением учебных программ на
Химическом факультете МГУ (они отличаются от учебных про-
грамм других университетов), книга была расширена в расчете
на студентов III и IV курсов (V—VII семестры), которые уже
прослушали или слушают упомянутые лекционные курсы. Сле-
дует заметить, что в 1979 г. впервые на Химическом факультете
МГУ были проведены семинарские занятия и практикум по лек-
ционному курсу профессора В. М. Татевского «Строение моле-
кул» [7], в котором использовались практические работы и за-
дачи из данной книги.
5
Необходимо отметить, что работа № 5 является усовершенст-
вованием задачи, поставленной ранее О. Д. Ульяновой, а рабо-
ты № 6 и 7 разработаны совместно с В. Ф. Шевельковым и
Е. Д. Баевой.
В наладке практических работ и подготовке рукописи боль-
шую помощь оказали Р. Л. Щербаков, В. И. Савченко, А. М. Со-
колов, Т. И. Брянцева, Е. Д. Баева — этот труд вызывает глу-
бокую и искреннюю признательность автора.
Автор благодарит В. М. Татевского, В. А. Коряжкина и
II. Ф. Степанова за полезные советы по ряду разделов рукописи;
всех преподавателей практикума по молекулярной спектроскопии
за' советы и замечания, которые были сделаны или будут сдела-
ны в будущем.
Раздел I
ВВЕДЕНИЕ В ТЕОРИЮ МОЛЕКУЛЯРНЫХ СПЕКТРОВ
§ 1. СПЕКТРОСКОПИЯ, ЕЕ КЛАССИФИКАЦИЯ И ПРИМЕНЕНИЕ
Для успешного решения фундаментальных проблем химии,
физики, биологии и других наук, а также многочисленных задач
повседневной практики необходимо располагать методами иссле-
дования, позволяющими определять качественный и количествен-
ный составы вещества, его строение, свойства и другие парамет-
ры в широких пределах температур и давлений, в различных аг-
регатных состояних, при малых и больших концентрациях и т. д.
Универсальным методом, который удовлетворяет всем этим
условиям, является спектроскопия. Спектроскопия — раздел фи-
зики (а теперь и химии) занимающийся изучением качественного
и количественного составов электромагнитного излучения, погло-
щенного, испущенного, рассеянного или отраженного веществом.
Электромагнитное излучение, разложенное по длинам волн или
по энергии, образует спектр.
Спектроскопию, как и спектры, можно классифицировать по
целому ряду признаков.
I. В зависимости от характера взаимодействия излучения с
веществом все спектры делятся на спектры поглощения, испуска-
ния, рассеяния и отражения (подробнее см. § 9). В последнее
время возникло подразделение еще на классическую спектроско-
пию (спектроскопия некогерентного излучения) и лазерную спект-
роскопию (спектроскопия когерентного излучения).
II. По областям электромагнитного излучения спектроскопия
разделяется на следующие основные виды (рис. 1.1).
1) Резонансная у-спектроскопия (эффект Мёссбауэра) —
длины волн 10-10—10“11 м.
2) Рентгеновская спектроскопия — длины волн 10-8—10-10 м.
3) Оптическая спектроскопия — длины волн 10~3—10-8 м.
4) Радиоспектроскопия (в нее включается микроволновая
спектроскопия, спектроскопия электронного парамагнитного резо-
нанса и спектроскопия ядерного магнитного резонанса) — длины
волн 10~4—102 м.
В дальнейшем будут рассматриваться только оптическая спек-
троскопия и частично микроволновая. Их более детальная клас-
сификация видна из рис. 1.1, а также будет разбираться в раз-
деле II, § 3.
7
III. По изучаемым объектам оптическая спектроскопия под-
разделяется на атомную и молекулярную. Атомные спектры ле-
жат в основе таких аналитических методов, как эмиссионная
спектроскопия, атомно-абсорбционный анализ, атомная флюорес-
ценция. Методами атомной--спектроскопии определяются элемен-
ты, из которых состоит вещество. Существенно, что оно должно
м io'0 id9 10 9 id7 ids ю'3 10* т3 10? 10* 1 /0 IB2
10 * ,‘р I id' 1 1 10 1 ю3 ,> 1 10 5 1 ю 6 1 10 7
Длина волны, < 10 ' 1 10 io3 I 10 7 n'° to io"
1 1 I 10 I ю7 I 10 " ! P 10
волновое числ Unrmnmn Г/ д 10е I W1 1 10 1 1 id' I 10г 1 id*
1 ю'г 1 ю" 10’° ! 10s 1 10 9 ios
Д*/ /молекула Дж/моль I -17 ю ю~гг id23 id*
Энергия, 1*9 *7 10 й* t ю2 1 10 1 1 id' 1 1dz ,<p
1 I I 1 1 I 1 I I I 1 1 I '
Область спектра:
Рентген овсна в
Далекая УФ
УФ
видимая
ближняя ММ
ИН
Далекая ММ
Микроволновая
Радио
Опр)
(ЯМР)
Рис. 1.1. Спектр электромагнитных колебаний
быть хотя бы в очень малых количествах разложено до атомов
или ионов.
Спектры молекул содержат более детальную информацию о
веществе. В ней имеются данные не только об элементном соста-
ве вещества, но и как эти элементы соединены между собой в
молекулу. Например, в парах над треххлористым алюминием мо-
гут одновременно сосуществовать молекулы А1С13 и А12С1б, раз-
личить которые можно только по молекулярным спектрам.
Другое важное преимущество молекулярной спектроскопии со-
стоит в том, что в процессе получения спектров вещество остается
неизменным.
IV. В зависимости от того, какие энергетические состояния
молекул участвуют в образовании спектров, они делятся на вра-
щательные, колебательные (колебательно-вращательные), элект-
ронные (электронно-колебательно-вращательные) (подробнее см.
§ 9).
Классификация спектров проводится также по фазовому со-
стоянию вещества (спектроскопия твердого тела, плазмы), по
температуре, давлению, по технике и методам исследования (см.
раздел II, § 3) и т. д.
8
Спектроскопия считается прикладной наукой и отличается
большой информативностью. В молекулярной спектроскопии мож-
но выделить следующие основные направления ее применения в
науке и технике.
1. Идентификация (отождествление) веществ. Она основана
на том, что каждое соединение, включая изомеры, имеет свой
собственный и только ему присущий спектр. Это свойство исполь-
зуется для качественного анализа тех веществ, спектры которы:
уже известны.
2. Количественный анализ. Измерение интенсивностей молеку
лярных спектров позволяет проводить с очень высокой чувстви
тельностью количественный анализ различных веществ, не раз-
рушая их. Поэтому, в частности, возможны исследования без
отбора отдельных проб непосредственно в условиях потока ве-
щества.
3. Структурно-групповой (функциональный) анализ. Система-
тическое изучение молекулярных спектров веществ с одинаковы-
ми структурными группами, такими, как, например, —О—Н,
/Н 1
— CZ , —, —С—С1 и т. д., показало, что в их спект-
х \Н |
рах имеются характерные полосы, с помощью которых можно
решать обратную задачу — по характеристичным полосам опре-
делять в исследуемом соединении наличие той или иной струк-
турной группы. Детальное исследование молекулярных спектров
в широком диапазоне длин волн позволяет тем самым находить
структурные элементы впервые синтезированных веществ.
4. Определение энергетических состояний (уровней) молекул
и связанных с ними таких молекулярных постоянных, как межъ-
ядерные расстояния, частоты колебаний, энергии электронных
переходов, энергии диссоциации и т. д. Эти данные важны для
расчета термодинамических функций веществ в газовой фазе ме-
тодами статистической термодинамики, что позволяет определять
состав продуктов различных химических реакций, не прибегая к
сложным экспериментам.
5. Определение строения молекул и вещества, т. е. простран
ственного расположения ядер и расстояний между ними.
6. Кинетические исследования химических реакций, в том чис
ле таких быстрых, которые протекают за времена порядка 10“12 с
а также измерения времен жизни молекул в возбужденных со-
стояниях и путей переходов в более низколежащие состояния,
т. е. различных релаксационных процессов. Во всех случаях изу-
чается изменение интенсивностей спектров во времени.
7. -Определение различных тепловых эффектов (например,
теплот испарения или сублимации, теплот реакции и т. д.) по из-
менению интенсивности спектров в зависимости от температуры
вещества.
9
8. Дистанционные исследования качественного и количествен-
ного состава и температуры газов, пламен, плазмы, атмосферы
небесных тел, газов, загрязняющих атмосферу, и т. д.
9. Исследования малых объемов веществ (до 0,01—0,001 мм3),
позволяющие производить локальный анализ биологических объ-
ектов, приэлектродных слоев и т. д.
10. Исследования поверхностных слоев веществ, в частности
адсорбированных молекул.
11. Исследования межмолекулярного взаимодействия и, в ча-
стности, водородной связи.
Подлинную революцию в молекулярной спектроскопии совер-
шили оптические квантовые генераторы когерентного излуче-
ния — лазеры, впервые созданные в 1960 г. В результате суще-
ственно расширились возможности техники спектроскопии (были
разработаны разного типа высокоинтенсивные когерентные моно-
хроматические источники света в широком диапазоне длин волн,
работающие в импульсном и непрерывном режиме, лазеры, пере-
страиваемые по длинам волн, и т. д.); качественно изменились
многие методики классической спектроскопии (спонтанное комби-
национное рассеяние света, флуоресценция, резонансное комби-
национное рассеяние света, спектры возбуждения и т. д.) и,
самое главное, были созданы принципиально новые методы ис-
следования вещества (обращенное комбинационное рассеяние,
когерентное активное комбинационное рассеяние света, внутри-
резонаторное поглощение и т. д.). Сейчас еще трудно предска-
зать все возможности дальнейшего развития лазеров. Ясно одно,
что чувствительность, разрешающая способность, временное раз-
решение и т. д. изменились всего за полтора десятилетия на-
столько, что многое, казавшееся ранее фантастичным, как, на-
пример, регистрация одиночных атомов в газовой фазе, уже реа-
лизовано. У лазерной спектроскопии молекул многое впереди.
Одной из сдерживающих причин практической реализации ее
идей является сложность их внедрения в серийное производство.
Говоря о лазерах, следует заметить, что сейчас зарождается
новое направление и в самой химии — лазерная химия, которая
занимается изучением химизма воздействия лазерного излучения
на вещество и использованием его специфического воздействия
на определенные химические связи для получения новых соеди-
нений, очистки веществ, разделения изотопов и т. д.
Фактически нет ни одного направления современной науки,
особенно химии, которое не соприкасалось бы в той или иной
степени с молекулярной спектроскопией. Она стала повседневным
практическим методом, с помощью которого решаются многие
вопросы, связанные со строением вещества, с его качественным
и количественным анализом.
Таким образом, каждый исследователь должен знать как тео-
рию спектров и спектральных приборов, чтобы квалифицирован-
но выбирать для своей работы как тог или иной спектральный
10
метбд, так и иметь практические навыки по технике и методам
молекулярной спектроскопии.
§ 2. ЕДИНИЦЫ ИЗМЕРЕНИЯ И НЕКОТОРЫЕ ОБОЗНАЧЕНИЯ,
ПРИНЯТЫЕ В СПЕКТРОСКОПИИ
Оптический и микроволновой диапазоны занимают на шкале
электромагнитных колебаний интервал, равный двенадцати по-
рядкам (рис. 1.1). Поэтому вполне естественно, что каждая об-
ласть спектра — ультрафиолетовая, видимая, инфракрасная и
микроволновая — измеряется в своих наиболее удобных едини-
цах. В спектроскопии распространены следующие сокращенные
обозначения областей спектра: ультрафиолетовая — УФ, инфра-
красная — ИК, ультрафиолетовая, видимая и близкая инфра-
красная (в целом) — УВИ.
Длина волны X используется в УВИ-области спектра. В систе-
ме СИ длины волн выражаются в нанометрах (1 нм —10-9 м) и
микрометрах (1 мкм = 10-6 м). Раньше они обозначались как
миллимикрон (1 ммк=1 нм) и микрон (1 мк (или ц) = 1 мкм).
В спектроскопии и при измерении межъядерных расстояний в
молекулах еще широко используется внесистемная единица —
Ангстрем (1 А=10~В * 10 м=10-8 см=10-1 нм).
Волновое число v (иногда обозначается как v) используется в
ИК-области спектра и в теоретической спектроскопии. Оно яв-
ляется обратной величиной длины волны в вакууме и выражает-
ся в обратных сантиметрах (см~!), показывая, сколько длин волн
укладывается в 1 см:
v = (2.1)
лвак
В спектроскопии предпочитают использовать волновые числа,
потому что они прямо пропорциональны энергии квантов света
E — hcv, (2.2)
где h — постоянная Планка; с — скорость света. (Численные
значения основных физических постоянных приведены в Прило-
жении I, а связь волновых чисел с энергией — в Приложении II).
Кроме того, численные значения волновых волн не столь велики,
как у частот колебаний (сравните их величины на рис. 1.1). В фи-
зической литературе пока еще часто в ИК-области пользуются
длинами волн в микронах, несмотря на то что в спектрофотомет-
рии УВИ-диапазона уже наметилась тенденция изображать спек-
тры в шкале волновых чисел, так как они пропорциональны
энергии (2.2). В Приложении III приведены формулы для пере-
вода длин волн в воздухе к длинам волн в вакууме и волновым
числам.
Интервалы волновых чисел переводятся в длины волн по фор-
муле
Av = — — в-ак (2.3)
Х2вак ’
получающейся при дифференцировании уравнения (2.1). Обрат-
ный перевод
ДХ.ак = —(2.4)
V-
Частота колебаний v' используется в микроволновой и радио-
частотной областях спектра. Она измеряется в герцах (Гц) (раз-
мерность с-1). Иногда она обозначается через v, как и волновое
число. В связи с тем что численные значения частот колебаний
в герцах даже в микроволновом и радиодиапазоне очень велики,
обычно пользуются мегагерцами (1 МГц=106 Гц) и гигагерца-
ми (1 ГГц=109 Гц). Частота колебаний связана с длиной волны
и волновым числом соотношениями
V' = S-, (2.5)
Л
v' — cv, (2.6)
где с — скорость света; 1 МГц = 3,3-10-5 см-1.
В молекулярной спектроскопии термин «частота колебаний»
может относиться и к колебанию молекул (буквенное обозначе-
ние to, а единица измерения см-1). Также встречается термин
«частота перехода» атома или молекулы с одного энергетического
уровня на другой (буквенное обозначение v). В этом случае речь
идет не о числе переходов, а о энергии перехода, измеряемой в‘
единицах частоты электромагнитных колебаний у':
Е — hy' = hey. (2.7у
Часто частота перехода выражается в см-1 (см. (2.6)).
Энергия Е. Шкала электромагнитных колебаний (см. рис. 1.1)
связана с энергией уравнениями (2.2, 2.7). Для расположения все-
возможных энергетических состояний атомов и молекул на шка-
ле энергии используются следующие единицы энергии Е: см-1,
электроновольты (эВ), килокалории (ккал), а сейчас в связи с
внедрением системы СИ — килоджоули (кДж). Соотношения
между ними приведены в Приложении П.
Спектр — это последовательность квантов энергии электро-
магнитных колебаний, поглощенных, выделившихся или рассеян-
ных при многочисленных переходах атомов или молекул из одних
энергетических состояний в другие.
В спектроскопии принято обозначать энергетические состоя-
ния с большей энергией одним штрихом Е', а с меньшей — двумя
штрихами Е". Тогда уравнение (2.2) можно записать как
&Е — Е'—E* = hcy. (2.8)
12
Для удобства представления спектра как разности энергии
двух состояний широко используется понятие терм.
Терм (спектральный) Т — это внутренняя энергия атома или
молекулы, выраженная в см-1:
Т = —. (2.9)
he
Если систему энергетических состояний представить через тер-
мы Т, то, комбинируя их и учитывая правила отбора (см. § 10),
можно простым вычитанием определить волновое число любой
спектральной линии
V_T'—T". (2.10)
Изображение спектров. Спектры испускания, в том числе и
спектры комбинационного рассеяния, изображаются графически
таким образом, что по оси абсцисс откладываются Z или v, а по
оси ординат — интенсивность /, которая равна количеству вы-
делившейся световой энергии за 1 секунду при переходе молекул
из состояния Е' в состояние Е".
В случае спектров поглощения по оси ординат откладывается
пропускание
Т (2.11)
/о
где /0 — интенсивность падающего на вещество излучения; / —
интенсивность прошедшего излучения. Пропускание выражается
в относительных единицах или процентах (7’ = ///0-100%). При
количественных измерениях интенсивность спектров поглощения
лучше представить через оптическую плотность А:
Л-lg-y- il 'g-j-. (2.12)
Для изображения спектров поглощения в УВИ-диапазоне часто
по оси ординат откладывается логарифм молярного коэффициен-
та погашения, 1g е. Величина
где b — толщина поглощающего слоя (см); с — концентрация
(г/л); М — молекулярный вес (г/моль); ее размерность см2/моль;
подробнее см. раздел I, § 20.
§ 3. НЕКОТОРЫЕ ОСНОВНЫЕ ПОНЯТИЯ И ПОСТУЛАТЫ
КВАНТОВОЙ механики
Прежде чем приступить к изучению молекулярных спектров,
необходимо кратко в постулативной форме рассмотреть некоторые
элементы квантовой механики, без которых нельзя понять строе-
ние, энергетические состояния и спектры атомов и молекул.
13
Свойства микрочастиц (электронов, ядер, атомов, молекул,
ионов и др.) хорошо описываются с помощью квантовой механи-
ки, а поведение макротел проще и с достаточно высокой степенью
точности можно представить уравнениями классической физики.
Квантовая механика базируется на следующем ряде постула-
тов и понятий, которые подтверждаются экспериментальными
данными.
1. Принципиальное отличие квантовой механики от классиче-
ской состоит в вероятностном подходе ко всем измеряемым вели-
чинам. Наглядно это можно проиллюстрировать на примере гипо-
тетического измерения расстояния между электроном и ядром в
невозбужденном атоме водорода. Если бы имелся точный метод
такого измерения, то при многократном его применении мы полу-
чили бы набор различных значений, причем наиболее часто по-
вторяющейся величиной было бы расстояние 0,53 А, которое по-
лучается из воровской планетарной модели атома, не связанной
с вероятностными представлениями.
Чтобы подчеркнуть вероятностный «размазанный» характер
распределения электронов около ядра, в квантовой механике ис-
пользуется термин «орбиталь» в отличие от классического поня-
тия\ орбита вращения электрона. Такая орбиталь для атома во-
дорода в состоянии 1s изображена на рис. 1.2, а. Она имеет
сферическую симметрию. Из рис. 1.2,6 видно, что максимум элек-
тронной плотности приходится на расстояние 0,53 А. Другие более
сложнее орбитали будут рассмотрены в § 4, рис. 1.5.
В случае молекул появляется новая степень свободы — рас-
стояние! между ядрами. Молекула представляет собой, так же как
и атом,(устойчивую динамическую систему из электронов и ядер,
а
Рис. 1.3. Схематическое изображение
распределения «ядерной плотности»
(вероятности нахождения ядер друг от-
носительно друга) в зависимости от по-
тенциальной энергии молекулы LiNC.
По мере повышения энергии (от рис. а
к в) «размазанность» ядра Li резко по-
вышается, достигая такого положения,
что оно как бы вращается вокруг груп-
пы NC. Схема показывает сеченце, про-
ходящее через ось молекулы. Детали
распределения «ядерной плотности» в
зависимости от колебательных и вра-
щательных состояний (см., например,
рис. I. 31) на схеме не отлажены
в которой нельзя проследить за путем движения частиц, а можно
только рассматривать вероятность нахождения электронов и
ядер в различных частях пространства. Таким образом, ядра в
молекуле также «размазаны», как и электроны, но обычно в го-
раздо меньшей степени. Поэтому можно и к распределению ядер
в пространстве применять термин «ядерная плотность» в смысле
подобном электронной плотности в атомах и молекулах.
Например, согласно квантовомеханическим расчетам молеку-
ла изоцианата лития более устойчива, чем цианистый литий
(речь идет о газовой фазе). На рис. 1.3 приведена схема строения
LiNC. Ядра углерода и азота «размазаны» в пространстве до-
вольно мало, а ядро лития — значительно. При повышении тем-
пературы «размазанность» ядра лития настолько повышается,
что оно как бы совершает «вращательное» движение вокруг груп-
пы NC. Следует подчеркнуть, что «размазанность» ядер в прост-
ранстве — общее явление, а не исключение. Частным примером
15
движения ядер с большими амплитудами колебаний, т. е. с боль-
шой «размазанностью» ядер, являются молекулы типа этана со
свободным вращением групп СН3 вокруг связи С—С. В качестве
других примеров молекул с большой подвижностью ядер могут
служить пары солей (КВО2, CsNOa, CsSO4 и т. д.), в которых
анион и ядра катионов подвижны друг относительно дру(а, т. е.
можно рассматривать катионы вращающимися вокруг аниона и
одновременно анион проворачивается около катиона. Подобная
картина наблюдается и в комплексах ArHCl, LiBH4 и т. д., а в
молекуле NH3 происходит инверсия атомов по направлению оси
симметрии.
2. Если в классической механике положение и скорость дви-
жущегося тела можно определить в любой момент времени (т. е.
одновременно точно известны его координаты, например х, и им-
пульс р), то в квантовой механике, базирующейся на вероятност-
ном принципе, одновременное измерение положения частицы и
ее импульса всегда связано с некоторой погрешностью. Количе-
ственно она выражается через так называемый принцип неопре-
деленности Гейзенберга:
Ах Ар > h/2n — h, (3.1)
где Ах — неопределенность положения частицы (среднеквадра-
тичное отклонение от среднего значения х); Ар — неопределен-
ность импульса частицы.
Таким образом, чем точнее измеряется положение частицы,
тем неопределеннее значение импульса (или, соответственно, ско-
рости, так как p = mv), и наоборот, чем точнее измеряется им-
пульс или скорость, тем неопределеннее положение частицы в
пространстве. Принцип неопределенности на макротелах практи-
чески не сказывается, так как величина h очень мала.
3. В квантовой механике с ее вероятностным подходом к из-
меряемым параметрам микромира основной «величиной», с по-
мощью которой можно описать поведение микросистем из ядер и
электронов, является волновая функция Ч', зависящая от коорди-
нат частиц (х, у, z) и времени I. Волновую функцию часто можно
рассматривать как стационарную, не зависящую от времени, и
тогда она обозначается через ф.
Волновая функция ф не имеет наглядного физического пред-
ставления и не может быть наблюдаемой величиной. Однако в
квантовой механике имеется постулат, который связывает волно-
вую функцию ф с вероятностью dW нахождения электронов и
ядер в том или ином элементе пространства dV с координатами
х, у, z\
dW - ф*фб/У -|ф|2^, (3.2)
где ф* — комплексно-сопряженная волновая функция. Это равен-
ство показывает, что величина ф*ф, или | ф |2, являются плотно-
стью вероятности.
На рис. 1.2, б приведены зависимости величин гр, 4лг2 и dW=
= 4^tr21 гр 12dr для атомов водорода в состоянии 1s со сферически-
симметричным распределением электронной плотности. Величина
dW Доказывает вероятность нахождения электрона в бесконечно
тонкое слое в зависимости от г.
Каждая частица (атом, молекула и т. д.) и даже их совокуп-
ность ^например, объем газа) характеризуются своими волновы-
ми функциями, которые описывают распределение частиц в про-
странстве и их поведение, например, распределение электронов
в атоме, электронов и ядер в молекуле и т. д. Другими словами,
волновая функция определяет состояние системы.
4. Экспериментально наблюдаемым физическим величинам
<L>, например, импульсу, координате, энергии, дипольному мо-
менту и т. д., в квантовой механике соответствует свой линейный
оператор L. Оператор представляет собой математическую запись
действия, которое должно быть выполнено над функцией, сле-
дующей за ним. Составив и решив уравнение типа
Л г|э = Z, гр, (3.3)
можно определить так называемые собственные значения физи-
ческих величин — числа L и собственные функции гр. Уравнению
(3.3) удовлетворяет ряд функций гр с различными значениями L.
Чтобы искомое решение имело физический смысл, собственные
функции гр должны быть конечными, непрерывными, однозначны-
ми, дифференцируемыми, существовать во всем интервале изме-
нения переменных и, кроме того, они должны быть решениями
уравнения Шредингера.
Наблюдаемая величина <Х> является средним значением ве-
личины L и определяется интегралом
(L)- f гр* L^dV, (3.4)
где гр — функция описывающая некоторое состояние.
Таким образом, если известна волновая функция системы ча-
стиц, то квантовая механика позволяет в принципе предсказать
ее свойства.
• 5. Из всех свойств атомов и молекул наиболее важно знание
их внутренней энергии Е. Частным случаем операторного уравне-
ния вида (3.3) для энергии является хорошо известное и наибо-
лее часто используемое в квантовой механике и спектроскопии
стационарное уравнение Шредингера
Я гр = Е гр, <3-5)
где Н— оператор полной энергии, который называют оператором
Гамильтона (гамильтониан).
17
Гамильтониан состоит из суммы операторов Т кинетической и
потенциальной V энергии. Оператор Т равен сумме операторов
кинетической энергии каждой частицы
N
-*-У v?
2ше
t=l
/г2
2
а:
(3.6)
где гпе — масса электрона; N — число электронов; та -г масса
ядра а; К — число ядер; Vf— оператор Лапласа (лапласиан),
„ д2 , д2 , д2 2
по координатам электронов равный---------1-------1-----, va —
дх?. ду2 дг2
оператор Лапласа по координатам ядер.
Оператор V равен сумме операторов всех электростатических
взаимодействий между всеми частицами системы. Например для
молекулы
а,р=1
а<₽
ZaeZP е
га$
(3-7)
где Zae и Zpe — заряды ядер с номерами аир, е — заряд элект-
рона, rap — расстояния между ядрами а и р, ria — расстояние
между ядром а и электроном i, гц — расстояние между электро-
нами i и /.
Уравнение Шредингера является таким же. фундаментальным
в квантовой механике, как уравнение движения Ньютона в клас-
сической механике.
Для того чтобы теоретически определить возможные стацио-
нарные энергетические состояния системы частиц (атома, моле-
кулы или их ионов), а затем по ним рассчитать спектры или тер-
модинамические функции, необходимо составить оператор Га-
мильтона Н и решить уравнение Шредингера (3.5). При этом
должны одновременно получаться нс только собственные значе-
ния полной энергии системы Е = Е\, Е2, Ез ... Ek, но и соответст-
вующие им собственные волновые функции ф = фь фг, фз ••• фь>
определяющие возможные стационарные «варианты» распределе-
ния частиц (электронов и ядер) в пространстве, т. е. «электрон-
ную» и «ядерную» плотность в атомах и молекулах. Однако точно
в аналитическом виде уравнение Шредингера (3.5) решается
только для одноэлектронной системы атома водорода и некото-
рых простейших модельных систем, например, гармонического ос-
циллятора, жесткого ротатора и немногих других. Поэтому обыч-
но квантовомеханические уравнения для реальных систем реша-
18
Потенциальная энергия
отдельно взяты* злентронов
и ядер А и В, находящихся на
ют^я различными приближенными методами, и одна из основных
за^ач современной квантовой химии — поиск наиболее простых»
но в то же время достаточно точных приближенных методов ре-
шение уравнения Шредингера. Благодаря созданию мощных ЭВМ
в этом направлении достигнуты определенные успехи, и системы
с чиелрм электронов порядка 60 уже не представляют труда на
сегодняшний день. Дальнейший прогресс очевиден. Отсюда и по-
вышенный интерес к квантовомеханическим расчетам, которые-
становятся доступными широким кругам физиков, химиков и био-
логов. Для последних особенно важны различные полуэмпириче-
ские и ^качественные методы
расчетов\
6. Одним из следствий Знергия
квантовой механики является
неразличимость электронов в Е=о
атомах и молекулах. Можно
говорить только об электрон-
ной плотности, но нельзя оп-
ределить, какой электрон при-
надлежит какому ядру даже в
случае самых больших моле-
кул. Вероятность застать лю-
бой электрон молекулы в дан-
ном элементе объема одинако-
ва. В этом смысле разделение _£
электронов в молекуле на о-
и л-электроны (это представ-
ление широко распространено Рис.
в химии) противоречит осно- ний ‘
вам квантовой механики. Од- со°
на-ко электронная плотность в
разных частях молекулы различна и фактически понятия о- и
л-электроны или о- и л-орбитали относятся к характеру ее рас-
пределения.
7. Критерием устойчивости любой системы частиц, начиная с
атома водорода и кончая сложными молекулами и их ионами,
является понижение полной энергии этой системы по сравнению
с полной энергией отдельно взятых частиц. Чем больше разность
энергий, тем прочнее связаны между собой частицы, составляю-
щие систему. Это видно на примере образования двухатомной
молекулы АВ из отдельных ядер А и В и соответствующего чис-
ла электронов (рис. 1.4).
От раздельных частиц к молекуле АВ можно прийти двумя
путями. 1) Через образование атомов А и В, а из них молекулы
АВ. 2) Прямым путем, когда в поле двух ядер А и В помещается
соответствующее число электронов. Во всех случаях энергия от-
дельных систем А, В и АВ последовательно понижается. Более
подробно основы квантовой механики изложены в [7—10].
Энергия атома А
Энергия атома В
Энергия моленулы А 8
1.4. Схема энергетических состоя-
истемы из двух ядер (А и В) и
тветствуклцего числа электронов
19
§ 4. ОДНОЭЛЕКТРОННЫЕ И МНОГОЭЛЕКТРОННЫЕ АТОМЫ И ИОНЫ.
СИСТЕМА ЭНЕРГЕТИЧЕСКИХ СОСТОЯНИИ АТОМА И АТОМНЫЕ СПЕКТРЫ
Атом представляет собой положительно заряженное ядро, в
поле которого находятся электроны, удерживаемые силами элек-
трического взаимодействия. Их число соответствует числу единиц
заряда ядра. Если число электронов больше или меньше заряда
ядра, то такая система частиц называется соответственно отрица-
тельным или положительным ионом.
Как уже отмечалось, решение уравнения Шредингера для та-
кой системы частиц дает собственные волновые функции ф и соб-
ственные значения энергии атома Е, однако точно в аналитиче-
ской форме это можно сделать только для атома водорода и
одноэлектронных ионов Не1+, Li2+, Ве3+ и т. д. Уравнение Шре-
дингера в этом наиболее простом случае имеет вид
—z^V2--------—U = E^, (4.1)
2те г )
где первый член соответствует оператору кинетической энер-
гии электрона в поле ядра, а второй член — потенциальной. Ре-
шив это уравнение и определив ф, можно найти распределение
электронной плотности. Наглядная картина распределения элект-
ронной плотности (формы атомных орбиталей) для разных энер-
гетических состояний атома водорода приведена на рис. 1.5.
Уравнение (4.1) решается в сферических координатах (г, В,
ср), так как в декартовых координатах г — V%2 - у2 |-г2 , и по-
этому нельзя провести разделение переменных. В сферических
координатах собственная волновая функция представляется как
произведение трех функций
ф(г, 9, ф)-/?(г)0(0)ф(ф). (4.2)
Функция R(r) называется радиальной волновой функцией, опре-
деляющей изменение электронной плотности в зависимости от
расстояния до ядра при постоянных азимутальных волновых
функциях 0(0) и Ф(ср). Каждая из функций зависит от одного
или двух целочисленных квантовых чисел п, I и а именно R —
от п, /, 0 — от I, mi и Ф — от mi.
Главное квантовое число п принимает значения п=\, 2, 3 и
т. д.
Орбитальное квантовое число Z = 0, 1, 2, ..., (п—1). Вместо
чисел для обозначения I используются буквенные символы s, р, d
и т. д.
Магнитное квантовое число тг = 0, ±1, ±2, ..., ±/.
Не вдаваясь в детали, следует заметить, что для полной ха-
рактеристики атомной волновой функции ф необходимо учитывать
еще и спин электрона, т. е. спиновую волновую функцию ф(о),т. с.
ф — ф (г, 0, ср) ф (о), (4.3)
20
где о — так называемая спиновая координата. Спиновая волно-
вая функция зависит от полуцелых спиновых квантовых чисел
ms = ± 1 /2.
Рис. 1.5. Атомные орбитали для различных со-
стояний атома водорода
Собственные значения энергии, получающиеся при решении
уравнения (4.1), равны
Е =
те 2g е4 1
2А2 л2
(4-4)
Знак минус показывает, что отсчет энергии идет от уровня раз-
дельных частиц.
21
Таким образом, энергия электрона в атоме водорода (и одно-
электронных ионах) определяется только главным квантовым
числом. Состояния, соответствующие различным значениям кван-
товых чисел I, пц и ms, имеют одну и ту же энергию и поэтому
называются вырожденными. Вырождение состояний может быть
снято, например, при помещении атомов в магнитное поле (см.
§ 7). Число состояний, образующихся при снятии вырождения в
магнитном поле, определяется квантовыми числами /, и ms.
Переход атома водорода из основного, самого низкого состоя-
ния, соответствующего энергии Е\, в го или иное возбужденное
состояние с энергией £2, £з, •. •, Еп происходит при взаимодей-
ствии атома с какой-либо частицей, в частности, с другими ато-
мами или квантом света. С увеличением главного квантового чис-
ла энергетические уровни сходятся к ионизационному пределу,
который для атома водорода равен 13,6 эВ (рис. 1.6). При сооб-
щении атому больших энергий происходит отрыв электрона
(ионизация).
В возбужденном состоянии атом находится всего около 10~8 с
и спонтанно (самопроизвольно) переходит в одно из нижележа-
щих состояний, выделяя при этом энергию в виде кванта света
E=hcv. В связи с тем, что у атома может быть очень большое
число различных возбужденных состояний (см. рис. 1.6), отвечаю-
щих уравнению (4.4), он может испускать или поглощать различ-
ные кванты энергии Ei = hcvi, которые и образуют соответственно
атомный спектр испускания или поглощения, состоящий из ряда
линий. Атомные спектры часто называют линейчатыми.
На рис. 1.6 приведены переходы между энергетическими со-
стояниями атома водорода. Образующиеся при этом спектры ис-
пускания или поглощения состоят из нескольких серий линий,
которые закономерно сходятся к ионизационному пределу. Со
стороны коротких длин волн после схождения серий линий наблю-
дается непрерывный спектр. Он обусловлен тем, что энергия от-
рыва электрона от атома водорода (в заштрихованной зоне
ионизации) не квантована.
Следует отметить, что квантовомеханический расчет энергети-
ческих состояний атома водорода и его спектра очень хорошо
согласуется с экспериментально наблюдаемым спектром.
В случае многоэлектронных атомов и ионов резко возрастает
сложность решения уравнения Шредингера, которое принимает
вид
(4.5)
если сделать соответствующие подстановки в уравнения (3.6) и
(3.7) для операторов кинетической и потенциальной энергии. За-
труднения вызваны необходимостью учета межэлектронного вза-
22
имодействия (третий член в уравнении (4.5)) и его можно ре-
шать только приближенно, например, в одноэлектронном при-
ближении.
Рис. 1.6. Система энергетических состояний атома водорода и его
спектр
В основе одноэлектронного приближения лежит представление
о существовании индивидуальных состояний каждого электрона
(по существу, отказ от неразличимости электронов — см. § 3,
П. 6), который находится в некотором эффективном поле, созда-
ваемом ядром и всеми остальными электронами. Эти стационар-
23
ные состояния электрона описываются соответствующими одно-
электронными волновыми функциями (атомными орбиталями,
сокращенно АО), из которых определенным образом строится
полная волновая функция многоэлектронного атома или иона.
В результате такого приближения обычно классифицируют волно-
вые функции многоэлектронных атомов по так называемым элек-
тронным конфигурациям (например, для атома углерода она
записывается как ls22s22p2). Однако правильнее (последователь-
нее) классифицировать состояния электронов в атоме (состояние
атома) по орбитальному моменту количества движения всех элек-
тронов в атоме; такие состояния обозначаются заглавными латин-
скими буквами S, Р, D. В общем случае одной и той же элект-
ронной конфигурации в результате межэлектронного взаимодей-
ствия может соответствовать несколько состояний с существенно
различающейся энергией.
В многоэлектронных атомах и ионах межэлектронное взаимо-
действие снимает вырождение состояний с одинаковыми /, mz, ms,
и энергия электрона определяется уже четырьмя квантовыми чи-
слами — п, /, mi, ms.
Из квантовой механики следует, что переходы между много-
численными состояниями атома подчиняются так называемым
правилам отбора, согласно которым переходы из одного энергети-
ческого состояния в другое возможны только при вполне Опреде-
ленных изменениях четырех квантовых чисел. ,В результате в
спектре проявляются не все возможные линии, а только опреде-
ленные, разрешенные правилами отбора. С увеличением числа
возможных энергетических состояний с различающейся энергией
сильно возрастает число линий в атомных спектрах (см., напри-
мер, атомный спектр ртути в Приложении VIII). Еще сложнее
спектр атома железа и других переходных элементов.
В таком многолинейчатом спектре уже трудно визуально вы-
делить четкие серии линий, как это наблюдается в спектре' атома
водорода (см. рис. 1.6).
Таким образом, каждый атом, как и ион, имеет сугубо инди-
видуальную систему уровней энергии и характерный только для
него спектр. Это свойство широко используется в спектроаналити-
ческой практике для анализа веществ на элементы. Кроме того,
по наблюдаемому экспериментально спектру можно установить
систему энергетических состояний атома, а по ней, например, ис-
пользуя методы статистической термодинамики, определить тер-
модинамические характеристики атомного газа (пара) соответст-
вующего элемента.
§ 5. МОЯЕКУЛА. ЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ ДВУХАТОМНОЙ МОЛЕКУЛЫ.
ИХ РАЗДЕЛЕНИЕ НА ЭЛЕКТРОННЫЕ, КОЛЕБАТЕЛЬНЫЕ И
ВРАЩАТЕЛЬНЫЕ СОСТАВЛЯЮЩИЕ
Энергетические состояния и спектры молекул лучше всего рас-
сматривать на наиболее простом примере двухатомных молекул.
24
Поэтому им уделено много внимания (§ 5—15), хотя химики в
подавляющем большинстве случаев имеют дело с многоатомны-
ми молекулами, теория спектров которых намного сложнее.
Молекула — это устойчивая система из ядер и электронов,
удерживаемая силами электрического взаимодействия межжу ча-
стицами. Потенциальная энергия молекулы должна быть мень-
ше, чем энергия составляющих ее частиц (см. § 3, п. 7).
Следует подчеркнуть, что атомов в молекуле как таковых нет.
Можно говорить только об «эффективных» атомах в молекуле,
Рис. 1.7. Схема распределения электронной плотности, выраженной в
атомных единицах е/а^ (<? —заряд электрона, ао — радиус первой бо-
ровской орбиты 0,53 А), для молекул: а — HF, б — LiF
так как распределение электронной плотности вокруг ядра при
образовании молекулы из свободных атомов существенно изме-
няется и четкой границы между электронной плотностью атомов
А и В нет. Например, на рис. 1.7 приведено распределение элект-
ронной плотности для молекул HF и LiF.
Наличие в молекуле двух или более положительно заряжен-
ных ядер существенно усложняет рассмотрение поведения систе-
мы заряженных частиц. Если в атоме с помощью квантовой ме-
ханики рассматривается распределение вероятности нахождения
электронов в поле только одного ядра, то в случае молекулы не-
обходимо рассматривать как распределение вероятности нахож-
дения электронов в поле двух или большего числа ядер, так и
вероятность нахождения ядер в пространстве относительно за-
данной системы координат. Для молекулы уравнение Шредин-
гера (3.5) настолько усложняется, что его точное аналитическое
решение возможно телека для простейшей двухатомной молеку-
лы— иона Нг при фиксированных ядрах. Для того чтобы опре-
делить все возможные стационарные состояния молекулы с боль-
шим числом электронов, приходится искать те или иные прибли-
женные методы решения.
25
Для упрощения задачи определения возможных энергетиче-
ских состояний молекулы можно с достаточной степенью прибли-
жения представить полную молекулярную волновую функцию ф
(пренебрегая поступательным движением и соответствующей
волновой функцией ф<) как произведение двух отдельных волно-
вых функций
ф = (5.1)
Они связаны соответственно с распределением электронной и
ядерной плотности в молекуле (индекс п от первоначальной бук-
вы английского слова nuclear — ядерный): Такое приближение
называется адиабатическим, так как «скорость» движения элект-
ронов в молекуле во много раз больше, чем «скорость» смещения
ядер, и электроны адиабатически, без изменения энергии следуют
за положением ядер.
В следующем приближении волновую функцию фп также мож-
но представить как произведение двух волновых функций
Фп = ФЛг» (5-2)
где волновую функцию фг, связанную с вероятностью застать яд-
ра на определенном расстоянии друг от друга, принято историче-
ски называть колебательной волновой функцией (индекс v от
первоначальной буквы английского слова vibration — колебание),
а другую волновую функцию фг, связанную с азимутальным рас-
пределением ядер в пространстве (индекс г — rotation — враще-
ние), — вращательной. Такое представление ядерной волновой
функции ф„ в какой-то мере напоминает разделение волновой
функции атома на радиальную и азимутальную составляющие
(см. § 4), а терминология берет начало от классической модели
двухатомной молекулы, которая представляет собой два колеб-
лющихся шарика, связанных пружинкой и совершающих одновре-
менно вращательное движение вокруг центра тяжести. Однако
всегда следует помнить, что понятия «колебание» и «вращение»
молекул условны и на самом деле никаких колебаний ядер (в
классическом смысле) в молекуле нет, как нет и вращения. Это
только очень приближенное представление распределения ядер
в пространстве, которое носит такой же вероятностный характер,
как и распределение электронов (см. § 3, п. 3 и рис. 1.2, 1.3, 1.5).
Таким образом, полная волновая функция молекулы в доста-
точно высоком приближении для большинства задач молекуляр-
ной спектроскопии может быть представлена как произведение
Ф = ФеФиФг- (5.3)
Это позволяет решать уравнение Шредингера отдельно для
электронной, колебательной и вращательной волновой функции,
т. е. уравнение (5.3) разбивается на три уравнения
= (5.4)
26
= (5.5)
Я, i|>, = £,?,. (5-6)
При их решении определяются соответствующие собственные
волновые функции фе), фей, феЗ, • • феЬ Фг2, фгЗ, - -J фгЬ Фг2, фгЗ,
... и собственные значения энергии Е!;\, Еег, Ер3, ...; Eri, EV2, Ev3>
..., Eri, Er2, Ег3, ....
В рассматриваемом приближении (5.3) полную энергию моле-
кулы Е можно представить как сумму отдельных видов энергии
Е = Ее--Еп = Ее —Ev Ег, (5.7)
где ЕР — энергия электронной оболочки молекулы; Еп — энергия
ядерного остова молекулы; Ev — энергия «колебания» ядер мо-
лекулы; Ег — энергия «вращения» молекулы.
Разделение полной волновой функции по типу (5.3) возможно
при условии, что
Ее » Ev » (5.8)
На практике встречаются случаи, когда Ee<^Ev, например, для
молекулы Сг, и тогда такого разделения полной волновой функ-
ции ф делать нельзя.
Энергия первых вращательных состояний двухатомных моле-
кул составляет величину порядка 0,1—200 см-1, а колебательных
порядка 50—4000 см-1. Энергия электронных состояний еще выше
и обычно лежит в пределах от 10 000 до 100000 см-1. На рис. 1.8
приведена схема энергетических состояний молекулы (их часто
сокращенно называют уровни).
Решение квантовомеханического уравнения Шредингера (5.5)
дает следующее приближенное выражение для уровней колеба-
тельной энергии двухатомных молекул
Ev — he [соДи + 1/2) — <dexe(v-r 1/2)2], (5.9)
где сое — частота колебаний (см-1); ыехе — коэффициент ангар-
моничности колебаний (см-1) (подробнее см. § 6); v — колеба-
тельное квантовое число, принимающее значения 0, 1, 2, 3 ... Сле-
дует заметить, что по историческим причинам величина
рассматривается как один коэффициент и о(. за скобки не выно-
сится, а индекс «е» (первая буква латинского слова equilibrium —
равновесие) соответствует минимуму потенциальной энергии.
Всегда d)e^*<oext.>0, и поэтому с увеличением v расстояния меж-
ду дискретными колебательными уровнями постепенно уменьша-
ются, т. е. они сходятся (см. рис. 1.8).
Для вращательной энергии двухатомной молекулы решение
Уравнения (5.6) дает следующее приближенное выражение:
Er — hc[BvJ(J + 1)], (5.10)
27
где Bv — вращательная постоянная (см-1) для данного колеба-
тельного состояния v; J — вращательное квантовое число, прини-
мающее значения 0, 1, 2, 3 ...
Расстояния между дискретными вращательными уровнями с
увеличением J возрастают, т. е. вращательные уровни расходят-
ся (см. рис. 1.8), причем они «заходят» за более высоколежащие
Рис. 1.8. Схема энергетических состояний двухатомной молекулы: Ее —
различные электронные состояния; Ev— различные колебательные со-
стояния; Ег — различные вращательные состояния; ve, г — переходы,
соответствующие электронно-колебательно-вращательному спектру; vv, г—
переходы, соответствующие колебательно-вращательному спектру; vr —
переходы, соответствующие вращательному спектру
колебательные состояния. (Физический смысл коэффициентов <ог,
(дРхе и Bv будет рассмотрен в §6, 11, 12.)
Система уровней электронной энергии двухатомных молекул
имеет довольно сложный вид и для нее нет простых выражений
через квантовые числа. Поэтому положение электронных уровней
не носит такого регулярного характера, как в колебательных и
вращательных состояниях. Электронные уровни кажутся распо-
ложенными хаотично, хотя в их положении и имеется своя слож-
ная закономерность.
Таким образом, реально существующая система всех энерге-
тических состояний двухатомной молекулы может быть довольно
точно отражена наборами равенств (5.9, 5.10) для каждого воз-
28
можного электронного состояния. Графически система уровней
представлена на рис. 1.8. Каждое электронное состояние Ее имеет
свой набор сходящихся колебательных состояний Ег, а каждое
колебательное состояние — свой набор расходящихся вращатель-
ных состояний Ег. В результате молекула имеет гораздо больше
энергетических состояний, чем атом. С увеличением энергии мо-
лекулы плотность уровней (число состояний, приходящихся на
единицу энергии) существенно возрастает. За начало отсчета
принимаются как самое низкое электронное состояние с ц = 0 и
/ = 0, которое называется основным, так и минимум потенциаль-
ной кривой основного состояния (см. § 6). Разность между ними
составляет величину Л Е = И.с(1/2(де— 1/4(0е хе), получающуюся
при подстановке в уравнение (5.9) значения ц = 0.
§ 6. ЗАВИСИМОСТЬ ПОТЕНЦИАЛЬНОЙ ЭНЕРГИИ ДВУХАТОМНОЙ МОЛЕКУЛЫ
ОТ МЕЖЪЯДЕРНОГО РАССТОЯНИЯ
При сближении двух атомов из бесконечности до малых рас-
стояний их потенциальная энергия либо проходит через минимум,
либо непрерывно возрастает — отталкивательная потенциальная
кривая (1.9). В первом случае образуется устойчивая молекула
с межъядерным расстоянием ге, которое соответствует минимуму
потенциальной энергии.
Во втором случае никаких устойчивых молекулярных систем
не образуется.
Для описания реальных потенциальных кривых, получаемых
из экспериментальных данных, существует много различных при-
ближенных функций, однако наиболее часто используется функ-
ция Морзе, которая имеет следующий вид:
V(r-r,) = D,(l— (6.1)
где DP — энергия диссоциации, отсчитываемая от минимума по-
тенциальной кривой; ге — межъядерное расстояние, соответст-
« - - Q / 2л2Ц с \ 1/2
вующее минимуму потенциальной кривой; р = сое I----£— —
\ )
коэффициент, связанный с шириной потенциальной кривой.
Для практических расчетов по формуле (6.1) можно пользо-
ваться значением р — 0,12177 ю, (рц/DJ1/-, где ц.л — приведенная
масса (см. далее) в углеродных единицах; De в см-1; значения
(г—ге) в А.
Кривая потенциальной энергии, соответствующая функции
Морзе, представлена на рис. 1.9 пунктиром. Она отличается от
реальной потенциальной кривой (непрерывная линия) в области
высоких колебательных уровней. Энергия диссоциации De являет-
ся чйсто теоретической величиной и соответствует переходу мо-
лекулы из гипотетического состояния, соответствующего миниму-
му потенциальной кривой при ге (начало отсчета энергии) в со-
стояние двух невзаимодействующих атомов, находящихся на бес-
29
конечном удалении друг от друга (г—>оо). Экспериментально же
измеряется только величина DG, так как молекула не может нахо-
диться в состоянии ниже, чем основное состояние с г=0, энергия
которого (в см-1) согласно уравнению (5.9) равна
£о = 1/2со^— 1/4 (я,хе. (6.2)
Тогда
De = D0+ 1/2ое-1/4со,л'е. (6.3)
Рис. 1.9. Кривая потенциальной энергии и
колебательные уровни
молекулы водорода
В дальнейшем будет показано, чго все величины (ге, и>е,
ыехе, De), относящиеся к равновесному состоянию, получаются
только путем экстраполяции, а не следуют непосредственно из
эксперимента.
30
Молекула диссоциирует, когда сумма ее собственной потенци-
альной энергии и сообщенной превосходит Do, что соответствует
заштрихованной области на рис. 1.9.
Каждое электронное состояние молекулы имеет свою собствен-
ную форму кривой потенциальной энергии, включая и отталкива-
тельные потенциальные кривые. Молекула может образовывать-
ся при взаимодействиии двух атомов в возбужденных состояниях
или из одного атома в возбужденном состоянии, а другого — в
основном. В результате так же, как в случае невозбужденных
атомов, образуется набор кривых потенциальной энергии. Сле-
дует заметить, что обычно потенциальные кривые строятся для
вращательных состояний / = 0. В возбужденных вращательных
состояниях ее форма изменяется, и при очень больших кванто-
вых числах J она переходит в отталкивательную (происходит так
называемая вращательная предиссоциация).
Таким образом, каждой молекуле соответствует большое се-
мейство кривых потенциальной энергии, которые образуются из
двух атомов в том или ином электронном состоянии. На рис. 1.10
приведена только небольшая часть потенциальных кривых наи-
более простой из двухатомных молекул — молекулы водорода.
Более подробно этот рисунок будет обсужден в конце § 13.
Как уже отмечалось (§ 5), для упрощения расчетов энергети-
ческих состояний молекул используется классическая модель мо-
лекулы. Например, при рассмотрении уровней колебательной
энергии двухатомную молекулу можно представить в первом при-
ближении как два шарика, связанных пружинкой и колеблющих-
ся с постоянной частотой сое. Такая очень упрощенная система
называется гармоническим осциллятором.
В этом случае зависимость потенциальной энергии от межъ-
ядерного расстояния можно получить при разложении ее в ряд
Тейлора по степеням (г—ге)
V(r) = V(r,)+ (Г_Г,).Н_Е(-£Е.\ <r-r,y+ ...(6.4)
\ dr )r^re 2 \ dr2 ]r=re
При небольших отклонениях ядер от положения равновесия ос-
тальными членами разложения можно пренебречь, а в минимуме
потенциальной энергии производная 0.
Значение V (ге) является фактически началом отсчета потен-
циальной энергии и тоже может быть приравнено нулю. В ре-
зультате
И<г) = -Н-7г),-, ('•-''J’- <6-5>
Это и есть зависимость потенциальной энергии гармонического
осциллятора от межъядерного расстояния; на рис. 1.9 она обо-
значена точками. Если обозначить смещение атомов двухатомной
молекулы из положения равновесия через q = г—ге, уравнение
31
(6.5) можно переписать в следующей форме, заменив обозначе-
ние функции V на U:
= Ч-- (6.6)
2 \ dq2 / 4=0
Сравнивая уравнение (6.6) с известным из механики выраже-
нием для потенциальной энергии упругой пружины
и = — fa;’,
2
где k — упругая постоянная, находим, что
(6-7)
(6.8)
16-
10-
12-
10'
8
6
4
1
( d?u \ _ ( d2V \
\ dq2 /<7=о \ dr2 )r=re
VI11III
Hinn
hunt;
Энергия возбуждения
атома водорода
н+н
1 1S+1S(l54s}
Энергия
диссоциации
н ______________
Продукты
диссоциации
Н + Н (1s+3s,ptd)
н + н
'5 +S им 1Р
(1з^или^2р)
9
Непрерывный
спектр
'Дискретный
спектр
Межъядерное расстояние
JL
9
1000
6 18
Г, %
5000 A
1650 2000
Рис. 1.10. Потенциальные кривые молекулы водорода и схема образова-
ния непрерывного спектра испускания. (Символы и т. д. обо-
значают тип электронных состояний молекулы подобно типу электронных
состояний атомов 3, Р и т. д.)
1
32
Таким образом, силовая постоянная молекулы в минимуме
потенциальной энергии, обозначаемая ke, соответствует второй
производной от потенциальной энергии по изменению межъядер-
ного расстояния q.
Частота колебания гармонического осциллятора — с(йе
(й)с — частота колебаний в см-1) связана с упругой постоянной
пружины (силовой постоянной молекулы ke):
(6.9)
или
ke — 4л2рс2а>2 — 5,8894- 10-2рл(о2 дин/см, (6.10)
где р. = -ГП1-'2--приведенная масса молекулы, представляющая co-
ni! 4- сла-
бой такую массу, которая, будучи присоединенной к той же са-
мой пружине, связанной с неподвижной стенкой, будет колебать-
ся с той же самой частотой; цЛ — приведенная масса, выражен-
ная в углеродных единицах.
Когда рассматривается вращательная энергия молекулы, то
проще всего рассматривать модель жесткого ротатора, т. е. систе-
му двух шариков, связанных жестким стержнем и вращающихся
вокруг центра тяжести. Обе эти модели довольно грубы, и их
энергетические состояния существенно отличаются от наблюдае-
мых. Поэтому используются другие модели, дающие более вы-
сокую степень приближения, например, модель ангармонического
осциллятора. Согласно этой модели степень сжатия и растяжения
пружинки не одинакова и характеризуется постоянной ангармо-
ничности (осхс, связанной со степенью отклонения эксперименталь-
но наблюдаемой потенциальной кривой от параболического вида
(см. рис. 1.9). Система энергетических состояний ангармоническо-
го осциллятора передается уравнением колебательной энергии
(5.9), которое также приближенно.
§ 7. ШИРИНА ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ И ВРЕМЯ НАХОЖДЕНИЯ
МОЛЕКУЛ В ВОЗБУЖДЕННЫХ СОСТОЯНИЯХ. ВЛИЯНИЕ ЭЛЕКТРИЧЕСКИХ И
МАГНИТНЫХ ПОЛЕЙ НА ЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ МОЛЕКУЛ.
ВЫРОЖДЕНИЕ УРОВНЕЙ
Энергия атомов и молекул, связанная с волновой функцией
уравнением Шредингера (3.5), также вероятностная величина.
Частица в каком-либо дискретном энергетическом состоянии при-
нимает во времени разные, не очень отличающиеся значения
энергии с максимумом, приходящимся на определенное значение,
Которое и принимается за уровень энергии. Эта неопределенность
Энергии во времени аналогична неопределенности положения
Электрона относительно ядра (см. соотношение (3.1)).
2 А. А. Мальцев
33
«Ширина» энергетического уровня (ДЕ) связана со временем
жизни частицы в данном состоянии (Д/) через известное соотно-
шение неопределенностей Гейзенберга, но записанное в другой
форме:
ДЕД*>Й. (7.1)
Экспериментальные данные показывают, что среднее время меж-
ду возбуждением молекулы и последующим спонтанным (само-
произвольным) излучением составляет обычно величину порядка
10-8 с. В этом случае неопределенность (среднеквадратичное
. — отклонение) ДЕ в энергии уров-
Без поля Поле 1000 В/см
Рис. 1.11. Эффект Штарка для вра-
щательных уровней двухатомной мо-
лекулы НС1
ня будет больше, чем 3-10_4см-1,
т. е. энергетические уровни име-
ют конечную ширину (см. далее
рис. 1.16).
Из уравнения (7.1) следует,
что с увеличением времени жиз-
ни частиц в каком-либо состоя-
нии уменьшается неопределен-
ность (ширина) этого состояния,
т. е. уровень становится уже.
Поэтому основной самый низкий
уровень энергии имеет теорети-
чески ширину, приближающуюся
к бесконечно малой величине.
Следует заметить, что для га-
зов ширина уровней зависит от
температуры и давления паров
веществ. Для конденсированной
фазы все это еще намного слож-
нее.
Если двухатомную молекулу
поместить в электрическое поле большой напряженности, то ее
энергетические состояния изменят свое положение, а вращатель-
ные уровни не только сместятся, но и расщепятся на ряд компо-
нент. Этот факт хорошо известен и называется эффектом Штар-
ка. На рис. 1.11 приведена картина влияния электрического поля
на вращательные уровни двухатомной молекулы.
В отсутствие электрического поля Каждое вращательное со-
стояние вырождено. Степень вырождения g зависит от враща-
тельного квантового числа J и равна
Я = 2/+1.
(7.2)
Колебательные состояния двухатомных молекул невырожде-
ны, т. е. g=l. Электронные состояния могут быть как вырожден-
ными, так и невырожденными.
При наложении электрического поля вырождение снимается
только частично; каждый вращательный уровень расщепляется
34
на (J+1)-компоненту. Таким образом, расщепленные состояния
имеют одно состояние с g=l, а остальные с g = 2 (см. рис. 1.11),
т. е. J уровней дважды вырождены.
Подобным же образом, если поместить молекулу в сильное
магнитное поле, произойдет смещение и расщепление энергетиче-
ских состояний (но другое по величине и числу компонент). Это
явление называется эффектом Зеемана. Его природа состоит в
том, что при «вращении» электронов в молекуле создается так
называемый орбитальный магнитный момент электронов. Кроме
того, спины электронов и ядер имеют собственные магнитные мо-
менты. В результате взаимодействия всех этих магнитных момен-
тов молекулы как с магнитным полем, так и между собой сни-
маются вырождения состояний и уровни энергии смещаются и
расщепляются.
В результате воздействия электрических и магнитных полей
возникает так называемая сверхтонкая структура уровней. В ней
заложена информация о спинах электронов и ядер.
Рассмотренные эффекты сверхтонкого расщепления уровней
в магнитных полях лежат в основе радиоспектроскопии, включа-
ющей ядерный магнитный резонанс (ЯМР) и электронный пара-
магнитный резонанс (ЭПР), которые в данном практикуме не
рассматриваются. Следует подчеркнуть, что они имеют широкое
практическое применение в химии для установления структуры
молекул.
§ 8. СТАТИСТИЧЕСКОЕ РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ЭНЕРГЕТИЧЕСКИМ
СОСТОЯНИЯМ. РАСЧЕТ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИИ ЧЕРЕЗ СУММЫ
ПО СОСТОЯНИЯМ
До сих пор рассматривалась одна отдельно взятая молекула
и все возможные состояния, в которых она может находиться.
Реально же приходится изучать спектры большой совокупности
молекул (вещества) и определять по ним набор энергетических
состояний отдельной молекулы, выражая их с определенной сте-
пенью приближения через небольшое число молекулярных по-
стоянных. Межмолекулярные взаимодействия при этом не учи-
тываются из-за своей малости.
Молекулы всегда (кроме температуры абсолютного нуля) на-
ходятся в тепловом движении и при соударениях непрестанно об-
мениваются энергией, т. е. осуществляется динамическое распре-
деление молекул по всем возможным энергетическим состояниям.
Для равновесных условий оно подчиняется статистическому за-
кону распределения Больцмана:
Nt = (----------\gte~E‘,tT
(8.1)
35
где Ni — число молекул в данном энергетическом состоянии с
энергией £г-; N — общее число молекул; gi — степень вырожде-
ния (или статистический вес) состояния с энергией £г; k — по-
стоянная Больцмана, Т — температура в Л.
Число молекул, находящихся в данном энергетическом состо-
янии (в спектроскопии широко распространен термин «заселен-
ность состояния»), зависит от температуры вещества, энергии и
степени вырождения состояния.
В статистической-термодинамике сумма
e=E^-£‘rtr (8-2)
i
для всех возможных состояний молекулы называется молекуляр-
ной суммой по состояниям (или функцией распределения).
Распределение молекул по состояниям обычно рассматривает-
ся как заселенность данного состояния по отношению к заселен-
ности основного состояния и тогда формула распределения Больц-
мана (8.1) приобретает более простой вид:
J/388(T(.-T.)
А = = ii,, ? (8.3)
Ао go go
удобный для расчетов; в этой формуле 7\ и TQ — термы энергии
в см-1; Т — абсолютная температура.
Если все состояния рассматриваемой системы не вырождены
(т. е. £г=1), например, колебательные состояния двухатомной
молекулы, то наиболее заселены состояния с низкими энергиями
£г-, причем максимально заселено состояние Ео. По мере повыше-
ния температуры растет относительная заселенность состояний с
более высокими значениями Е{ за счет обеднения основного и
низколежащих состояний. Легко показать, что для равновесного
состояния газа заселенность уровня £?+i не может быть больше
заселенности уровня £г, если для них gt=l. Следует помнить, что
для неравновесных процессов может иметь место инверсия засе-
ленности состояний (т. е. что, например, с успехом ис-
пользуется в лазерах (см. раздел II, § 10).
На рис. 1.12 приведен график теплового распределения моле-
кул йода по колебательным состояниям для разных температур,
который показывает, как с увеличением температуры изменяет-
ся относительная заселенность Nj/N0 колебательных состояний с
различными значениями колебательного квантового числа v.
Распределение молекул по вращательным состояниям имеет
более сложный вид из-за того, что вращательные состояния вы-
рождены. Статистический вес вращательного состояния с кван-
товым числом J равен ^г = 2/+1. Тогда формулу (8.3) можно
представить как
ft— е9
(8.4)
36
На рис. 1.13 приведены графики зависимости от J статистиче-
ского веса gi (рис. 1.13, а), больцмановского множителя
— -J{J^)hC" (рис. 1.13,6) и относительной заселенности АГ,7#о
(рис. 1.13, в) для вращательных состояний молекулы СО при
комнатной температуре и температурах 1000 и 2300 К. Максимум
заселенности для СО при комнатной температуре приходится на
Рис. Т. 12. Относительное распределение молекул йода по колеба-
тельным состояниям для температур 30 К, 300 К и 1000 К. Энергия
первого возбужденного колебательного состояния молекулы 12 равна
- 213 см-1
состояние с / = 7. С повышением температуры максимум расши-
ряется, повышается и смещается в сторону больших значений J,
как видно на рис. 1.13, в. Максимум заселенности состояния зави-
сит и от природы молекулы, точнее ее вращательной постоянной:
чем меньше В, тем при больших значениях J будет максимум за-
селенности. Площадь под кривыми на рис. 1.13, в равна сумме
(см. (8.2)) по вращательным состояниям, Qr, для данной темпе-
ратуру.
Абсолютные значения заселенности вращательных состояний
определяются по формуле (8.1). В этом случае (рис. 1.14) кри-
вые распределения пересекаются, а площадь над ними остается
постоянной, так как она пропорциональна общему числу молекул.
37
Рис. 1.13. Графики а — стати-
стического веса; б — больцма-
новского фактора; в — относи
тельной -заселенности вращг
тельных уровней энергии мо-
лекулы СО при 300 К, 1000 К
и 2300 К в зависимости от
вращательного квантового чи-
сла J
he
нт
О
30 kOJ
20
Система энергетических состояний молекул и заселенность
этих состояний используется не только при интерпретации спект-
ров. Развитие методов статистической термодинамики позволяет
рассчитывать через суммы по
состояниям и термодинамиче-
ские функции веществ, столь
необходимые для определения
состава продуктов химических
реакций, протекающих в газо-
вой фазе. Расчетные методы
выгодно отличаются от экспе-
риментальных тем, что отпа-
дает необходимость в прове-
дении сложных и трудоемких
исследований, которые подчас
требуют очень высоких тем-
ператур и давлений.
Суммы по состояниям, не-
обходимые для вычисления
термодинамических функций
веществ в газовой фазе, обыч-
но вычисляются либо непо-
(*; /Н)Ч.
Рис. 1. 14. Абсолютная заселенность
вращательных состояний молекулами
СО при разных температурах. Общее
число молекул принято за 100%
средственным суммированием
по всем известным и оцени-
ваемым состояниям, либо по
молекулярным постоянным,
которые фактически являются
сжатой формой записи системы энергетических состояний моле-
кулы.
Для расчета сумм по состояниям через молекулярные посто-
янные можно энергию Ei в выражении (8.1) представить как
сумму поступательной Et и внутренней Евп энергии молекулы
Е< = Е^ЕВЯ, (8.5)
а внутреннюю энергию как сумму вращательной Ег, колебатель-
ной Еъ и электронной Ее энергии
£вн = £.Н Ev | Ег, (8.6)
считая, что энергия ядер в химических реакциях не изменяется.
Тогда полная сумма по состояниям в приближении «жесткий
ротатор-гармонический осциллятор» может быть представлена
для двухатомных молекул как
Q = QtQeQvQn (8-7)
где
I = / 2nMkT \3/2 RT .
4 ~ \ Nh* ) р ’
(8.8)
39
hcT.
hc(£>o
Qr=-—-,
cr hcBQ
(8.9)
(8.10)
(8.П)
M — молекулярный вес; p — давление газа; 7\ — терм элект-
ронной энергии; too — частота колебаний; Во — вращательная по-
стоянная; о — число симметрии, равное двум для гомоядерных
молекул и единице — для гстероядерных.
В случае многоатомных молекул полная сумма по состояниям
Q вычисляется также по формуле (8.7), где для линейных моле-
кул вместо выражения (8.10) берется
ЗАЛ—5 _ hc(i>i
Z=1
(Qr при этом вычисляется по формуле (8.11), как и для двух-
атомных молекул), а для нелинейных молекул вместо выражений
(8.10) и (8.11) берутся соответственно (8.12) и (предел ЗЛГ—6)
В этих формулах приняты обозначения (см. также § 16):
N — число атомов в молекуле; ац — частота нормального колеба-
ния (см. § 16); di — степень вырождения нормального колеба-
ния; Ао, Во, Со — вращательные постоянные, связанные с тремя
главными моментами инерции 1Л, 1В, 1с следующим образом:
Ао = h/8n2 с!а, Во = h/8n2 clв, Со = 1г/8л2 clc- (8.14)
Основные термодинамические функции связаны с суммами по
состояниям следующим образом:
Энтропия
S°(T) = # ln^> т RT ldln-Q{T} } ; (8.15)
N \ дТ )р V
Теплосодержание (энтальпия)
Я°(Г) ^Я°(0) 4-/?Т2 fd lnQ(7l\ . (8.16)
\ дТ /Р
Приведенная энергия Гиббса
O0(r) = /?ln^ = _^ZZ^=S0(T)
7 N Т
Н° (Т) — Н° (0).
Т
(8.17)
40
Теплоемкость
С° (Г) - RT2 + 2%т (~. (8.18)
Константы равновесия К(Т) химических реакций типа
viA + 'v2^2 I- • • • I• V2A2-7- ... (8.19)
обычно рассчитываются по формуле
Я In К(Т) = Д,Ф(Т) — кгН (0)/Т, (8.20)
где Аг обозначает изменение термодинамического свойства в ре-
зультате реакции (8.19). Например,
ДГФ (Т) = [^Ф(Аь Т) + (Аг, Т) -у- ...] —
-КФИпТ) I Т2Ф(Д2, Т) -I-...].
Для проведения практических расчетов формулы (8.15) —
(8.18), (8.20) приводятся к более удобному и простому виду.
Более детально методика расчетов изложена в [11 —13].
Таким образом, зная энергетические состояния молекул, ко-
торые обычно определяются из молекулярных спектров, можно с
помощью теории статистической термодинамики осуществить
очень важный для химии переход от свойств отдельных микро-
частиц (молекул) к свойствам их совокупности (веществу).
§ 9. ВОЗМОЖНЫЕ ТИПЫ ПЕРЕХОДОВ МОЛЕКУЛ ИЗ ОДНИХ
ЭНЕРГЕТИЧЕСКИХ СОСТОЯНИЙ В ДРУГИЕ. ВЗАИМОДЕЙСТВИЕ ИЗЛУЧЕНИЯ
С ВЕЩЕСТВОМ. СПЕКТРАЛЬНЫЕ ЛИНИИ. ОБРАЗОВАНИЕ СПЕКТРОВ
МОЛЕКУЛ И ИХ КЛАССИФИКАЦИЯ
Молекулы вещества всегда находятся в непрерывном тепло-
вом движении и при соударениях между собой обмениваются
энергией. При этом одни молекулы отдают свою энергию и за-
медляются или переходят в более низкие энергетические состоя-
ния, а другие, поглощая ее, ускоряются или возбуждаются. Из
возбужденных состояний молекула может также переходить в
более низкие состояния и самопроизвольного испускания кванты
света. За небольшой промежуток времени молекула может мно-
го раз побывать в различных энергетических состояниях. Чем
выше температура вещества, тем чаще и в более высоковозбуж-
денные состояния переходят молекулы и соответственно излуча-
ют кванты большей энергии. В возбужденные состояния молеку-
лы могут переходить и при взаимодействии с другими частица-
ми- •— электронами, ионами и фотонами (квантами света). Эти
нроц^сы особенно характерны для плазменного состояния веще-
ства. Молекулы могут также обмениваться энергией между собой
• с внешней средой за счет излучения.
41
Таким образом, квантовые переходы между энергетическими
состояниями можно подразделить на безызлучательные, когда
молекула изменяет свое энергетическое состояние без поглоще-
ния или испускания квантов света (рис. 1.15,а, б), и излучатель-
ные, когда молекула испускает или поглощает фотоны
(рис. 1.15, в, г, д). И те и другие переходы играют большую роль
в различных химических и физических процессах. Хотя молеку-
Безызличательные Излучательные переводы
Рис. 1.15. Схема безызлучательных — а, б и однофотонных излучатель-
ных — в, г и д переходов
лярная спектроскопия и изучает в основном переходы, связан-
ные с излучением, поглощением или рассеянием квантов элект-
ромагнитных колебаний, однако для понимания работы кванто-
вых генераторов, процессов тушения, люминесценции и т. д.
необходимо учитывать и безызлучательные переходы.
Воздействие поля электромагнитного излучения на молекулу
может сопровождаться поглощением света (фотона), если энер-
гия квантов излучения совпадает с энергией возможных перехо-
дов в молекуле и такой переход разрешен правилами отбора (см.
§ 10). При этом молекула «вынужденно» переходит из состояния
п с энергией Е" в возбужденное состояние т с энергией Е'
(рис. 1.15,в). Из состояния т молекула может перейти обратно в
состояние п двумя путями. 1) Самопроизвольно (спонтанно)
(рис. 1.15, г) через ~10~6—10-9 с, при этом образуется квант
электромагнитного излучения (следует обратить внимание на то,
что излучение отдельных молекул пространственно разделено и
происходит в разные моменты времени и в произвольных направ-
лениях, т. е. некогерентно). 2) Вынуждено (рис. 1.15,д) под дей-
ствием кванта той же самой энергии, при этом действующий
квант и «рожденный» распространяется в том же направлении и
42
в одной фазе, т. е. как бы происходит усиление света — вместо
одного образуются два когерентных фотона.
Если создать такие условия, что в возбужденном состоянии
будет избыток молекул по сравнению с равновесным больцма-
новским распределением, то один «вынуждающий» квант света
вызовет цепную реакцию «умножения» квантов. Этот процесс
практически реализуется в квантовых генераторах — лазерах, со-
здающих мощное когерентное узконаправленное излучение, кото-
рое находит широкое практическое применение в науке и техни-
ке (подробнее см. раздел II, § 10).
В равновесных условиях вынужденные переходы (их еще на-
зывают индуцированными или стимулированными) можно прак-
тически наблюдать только при больших плотностях «вынуждаю-
щего» излучения и низких частотах (см. § 10).
Рассмотренные переходы (см. рис. 1.15) называются однофо-
тонными (или одноквантовыми), так как в каждом из них прини-
мает участие только один квант света. Каждому переходу меж-
ду двумя состояниями соответствует определенный испущенный
или поглощенный квант энергии. Следует заметить, что вынуж-
денные переходы относятся к однофотонным. Поглощенные кван-
ты определяются по тому, насколько уменьшается интенсивность
падающего на вещество излучения, представляющего последова-
тельность квантов с мало отличающейся энергией (непрерывный
спектр). Совокупность таких квантов, прошедших через спект-
ральный прибор, разлагающий электромагнитное излучение по
длинам волн, образует спектральную линию поглощения
(рис. 1.16). Ее ширина (разность волновых чисел на высоте
1/2 интенсивности) зависит от «ширины» энергетических состоя-
ний (см. § 7), теплового движения молекул (эффект Допплера),
столкновений молекул, напряженности электрических и магнит-
ных полей и т. д. При увеличении температуры и давления шири-
на линий растет. Минимальная ширина спектральной линии,
связанная с шириной энергетических состояний, называется есте-
ственной шириной (пунктирный контур на рис. 1.16) и составляет
величину порядка ДА—10~4 А.
Для регистрации спектральных линий поглощения, как уже
отмечалось, необходим источник непрерывного излучения. Его из-
лучение направляется на вещество, а затем прошедший свет ана-
лизируется на спектральном приборе. Может быть и другая по-
следовательность — излучение непрерывного света разлагается
спектральным прибором на монохроматические составляющие
интенсивности /о, которые последовательно направляются на ве-
щество, и регистрируется интенсивность излучения I, вышедшего
из вещества. Зависимость отношения 1]Iq=T от длины волны или
волнового числа дает спектральную линию поглощения
(РйСйЛ.16, в). Чем больше вещество поглощает квантов энергии,
меньше величина пропускания Т. После поглощения света
Молекулы вновь переходят в нижележащие состояния за счет
43
излучательных или безызлучательных переходов (последние пре-
обладают в конденсированной фазе). В связи с тем, что излуче-
ние спонтанно, оно происходит в разные стороны, а в направле-
нии, совпадающем с IQ, приходится только очень малая доля,
практически не сказывающаяся на результатах измерения I.
Т= 1/10- пропускание вещества
' '-интенсивность излучения
h'X'EcmecmfL
/1 1Д ширина
/ j i \ Уширен
/ / I \Эффек~
I' V Естественная
ширина
Уширение за счет
''эффекта Допплера
и даВления
Спектральная линия ?
испускания
100°/д^
Спектральная линия
поглощения
5
Естественная
ширина линии
---------
10 -интенсивность света,дтадающего
- но вещества
!- интенсивность
'света, прошедшего
через вещество
О
Рис. 1.16. Схема образования спектральных линий: а—испускания; б —
поглощения
Справа от энергетических состояний показана их «ширина», т. е. веро-
ятность того, что молекула имеет значение энергии Е' (или Е'') ±&Е
Последовательность спектральных линий, образующихся при
различных однофотонных переходах молекул из нижних состоя-
ний в более высокие и расположенных по длинам волн или вол-
новым числам, называется спектром поглощения (или абсорбци-
онным спектром). В качестве примеров различных типов спект-
ров поглощения можно привести вращательный спектр НС1 в га-
44
зоной фазе (см. далее рис. 1.20), ИК- (колебательно-вращатель-
ный) спектр СО в газовой фазе (см. рис. 1.23) и ИК-спектр
жидкого 1,3,5-триметилбензола (см. рис. 1.44). Линии поглощения
веществ в жидкой фазе (их часто называют полосами поглощения
из-за большой ширины) обычно составляют величину порядка
5—15 см-1. В газовой фазе они даже при атмосферном давлении
намного уже (порядка 0,05—0,2 см-1).
Спектральные линии испускания регистрируются спектраль-
ными приборами как зависимость интенсивности (она прямо
пропорциональна числу испущенных квантов) от длины волны
или волнового числа (рис. 1.16, а). Последовательность спектраль-
ных линий, образующихся при различных однофотонных перехо-
дах молекул из возбужденных состояний в нижележащие и рас-
положенных по длинам волн или волновым числам, называется
спектром испускания (или эмиссионным спектром). Для перево-
да молекул в возбужденные состояния необходимы либо высокая
температура, либо условия газового разряда, когда имеется мно-
го свободных электронов и ионов с большой энергией, либо
электромагнитное излучение, либо экзотермическая химическая
реакция. В последних двух случаях спектры испускания назы-
ваются спектрами люминесценции (иногда фотолюминесценций)
и хемилюминесценции. Спектры люминесценции подразделяются
в зависимости от времени жизни молекул в возбужденном со-
стоянии на спектры фосфоресценции (времена жизни более чем
10-3—10-2 с) и спектры флуоресценции (времена жизни 10-6—
10-9 с). Далее на рис. 1.29 приведен электронно-колебательно-
вращательный спектр испускания молекулы ВО в условиях газо-
вого разряда, а на рис. 1.34 схема образования спектра флуорес-
ценции.
Рассмотренные спектры поглощения и испускания относятся
к классической оптической спектроскопии, обычно имеющей дело
с излучением, в котором доля вынужденного весьма мала. Одна-
ко широкое развитие лазерной техники привело к тому, что кван-
товые генераторы внедряются в классическую спектроскопию как
мощные источники монохроматического и непрерывного когерент-
ного излучения (см. раздел II, § 10), и при работе с ними необ-
ходимо учитывать вынужденные переходы.
Кроме однофотонных переходов существуют двух-, трех- и
многофотонные переходы, характерной особенностью которых яв-
ляется одновременность поглощения или испускания двух и бо-
лее фотонов. Например, при двухфотонных переходах (см.
рис. 1.17, а, б) при каждом элементарном акте взаимодействия
фотонов с молекулой одновременно поглощаются или излучаются
Два фотона с энергией /icvi, сумма энергий которых совпадает
с энергией возбуждения молекулы, т. е. hcv—hcvi-}-hcvi.
Этот процесс существенно отличается от последовательного
(ступенчатого) поглощения фотонов, разделенного по времени
(рис. 1.17,в), когда молекула сначала переходит в какое-либо
45
двухфотонное
поглощение испускание
Двухступенчатое
поглощение
г dew
Рис. I. 17. Схема двухфотонных и двухступенчатых пе-
реходов: а, б — двухфотонное поглощение и испуска-
ние; в — двухступенчатое возбуждение; г — рслссвское
рассеяние; д, е—комбинационное рассеяние; ж —
флуоресценция
Яром ;жуточное стационарное состояние, а затем в последующее.
Таки; переходы называются ступенчатыми и используются, на-
пример, для изучения вращательных спектров поглощения коле-
бательно- или электронно-возбужденных молекул. В этом так
называемом методе двойного резонанса исследуемое вещество
облущется лазером, который переводит молекулы в возбужден-
ное состояние, и в нем с помощью микроволнового спектрометра
ведется исследование тонкой вращательной структуры.
Многофотонные и многоступенчатые процессы взаимодействия
излучения с веществом только начинают изучаться, но уже сейчас
ясно, что они внесут существенные изменения во многие направ-
ления науки и техники. Например, позволят повысить чувстви-
тельность анализа веществ до нескольких атомов в 1 см3.
Двухфотонные переходы могут быть не только типа v=vo+vi.
Существуют еще и разностные двухфотонные переходы v=vo—vi
(рис. 1.17, д, е), при которых одновременно один квант света с
частотой vo поглощается, а другой излучается. К такого типа
двухфотонным переходам относится эффект комбинационного
рассеяния света. Вероятности двухфотонных переходов очень
малы. Если одна молекула совершает за 1 с в среднем 108 одно-
фотонных переходов, то число двухфотонных переходов состав-
ляет примерно только 103. Поэтому интенсивности спектров ком-
бинационного рассеяния (сокращенно КР-спектров) очень малы,
и они наблюдаются с большим трудом по сравнению со спектра-
ми флуоресценции.
Остановимся более подробно на КР-спектрах и спектрах флу-
оресценции, которые довольно широко используются в спектро-
скопии.
Обычно КР-спектры наблюдаются, когда энергия кванта све-
та, взаимодействующего с молекулой (обозначим ее через /icv0),
меньше энергии электронного возбуждения молекулы, т. е. hcv0<
<ZEe (рис. 1.18); иначе возникает флуоресценция (рис. 1.17,ж),
превосходящая во много раз по своей интенсивности спектр ком-
бинационного рассеяния, и «закроет» его.- Рассмотрим подробнее
образование КР-спектра на схеме электронно-колебательных со-
стояний двухатомной молекулы (рис. 1.18).
При облучении вещества монохроматическим светом частоты
Vo, молекулы, находящиеся в состоянии и" = 0, взаимодействуют
со световым полем по двухфотонному механизму; и в результате
возникают кванты либо с той же самой частотой vo, а молекула
остается в прежнем энергетическом состоянии v" = 0, либо кван-
ты более низкой частоты vo—vi, при этом молекула переходит в
возбужденное колебательное состояние v"=l.
Этот процесс можно упрощенно представить как нарастающее
Возмущение (смещение) энергетических уровней молекулы под
Действием поля излучения частоты vo до такого состояния (его
Иногда называют виртуальным), что один из уровней возмущен-
47
ной молекулы может совпасть с v0 и происходит как бы поглоще-
ние фотона.
Из этого предельно возмущенного состояния молекула «выде-
ляет» либо фотон той же самой энергии, либо фотон меньшей
энергии hc(vQ—vi), переходя одновременно в возбужденное со-
стояние v"=l.
v^f------------------------------------•
Е‘
1
О
Стоксов Релеевское Антистоксов
переход рассеяние переход
Е
Линия релеевского
рассеяния
Рис. I. 18. Схема образования колебательного спектра
комбинационного рассеяния
Вероятность первого перехода намного больше, чем второго
(примерно на 4—5 порядков). В связи с тем что при комнатной
и более высоких температурах часть молекул находится в первых
возбужденных колебательных состояниях v"=l, 2, ..., возможны
48
дву^квайтовые переходы и другого типа, когда частота фотона,
излученного молекулой, больше, чем частота монохроматического
излучения, на величину vi, т. е. молекула отдает энергию своего
колебательного возбуждения кванту монохроматического излуче-
ния^ В результате образуется квант с частотой vo+vi, но число
таких переходов еще меньше, чем переходов с частотой vo—Vi,
так оно определяется более низкой заселенностью колебательно
возбужденных состояний.
(Таким образом, при облучении вещества направленным мо-
нохроматическим излучением его большая часть пройдет без из-
менения, а очень небольшая доля (порядка 10~5) рассеется по
различным направлениям, так как вероятность двухквантовых
переходов очень мала. В рассеянном излучении будет наблю-
даться излучение трех частот: vo, v0—Vi, vo + vi, если считать что
заселенность состояния v" = 2 пренебрежимо мала. Рассеяние без
изменения частоты называется рэлеевским рассеянием, а рассея-
ние с измерением частоты vo±vi называется комбинационным
рассеянием, так как возбуждающая частота vo комбинирует с
частотой колебания молекулы vi.
При исследовании этого излучения с помощью высокочувстви-
тельного спектрального прибора (техника метода описана в раз-
деле II, § 9, 10) в спектре наблюдается сравнительно интенсивная
линия рэлеевского рассеяния (см. рис. 1.18) и с обеих сторон от
•нее на равных расстояниях слабые линии комбинационного рас-
сеяния, причем более высокочастотная компонента vo+vi будет
более слабой. В литературе принято называть низкочастотные
КР-линии стоксовыми линиями (по аналогии с правилом Стокса,
по которому спектры люминесценции смещены в сторону более
низких частот от возбуждающей частоты), а высокочастотные
линии — антистоксовыми.
Следует отметить, что в зарубежной литературе КР-спектры
называют Раман-спектрами по имени индийского ученого Рама-
на, который одновременно с советскими учеными Ландсбергом и
Мандельштамом обнаружил эффект комбинационного рассеяния.
Таким образом, линии КР-снектра можно представить урав-
нением
v^VoiVp (9.1)
Подробнее теория КР-спектров рассмотрена в § 11, 12.
Если энергия возбуждающего света совпадает с каким-либо
из многочисленных электронно-колебательно-вращательных пере-
ходов, разрешенных правилами отборг! (см. § 10), т. е. частота
возбуждающей спектральной линии настроена в резонанс, то мо-
лекула может перейти в возбужденное состояние. На рис. 1.17, ж
приведен пример такого резонансного возбуждения без учета
вращательной структуры и других колебательных состояний. (В
$ 13 и на рис. 1.34 эти переходы рассмотрены более детально.)
В результате таких переходов это состояние будет «перезаселе-
49
но» относительно теплового распределения Больцмана. При мощ-
ном облучении можно перевести до нескольких десятков процен-
тов всех молекул в возбужденное состояние. Из этого состояния
молекулы спонтанно переходят в более низколежащие состояния
(в соответствии с правилами отбора, см. § 10). Образующиеся
при этом спектры испускания называются спектрами флуорес-
ценции. Схема их образования и спектр приведен далее на
рис. 1.34.
Хотя и КР-спектры, и спектры флуоресценции возбуждаются
монохроматическими спектральными линиями, природа их, как
видно из рис. 1.17, различна. Комбинационное рассеяние связа-
но с двухфотонными переходами, а резонансная флуоресценция —
с двумя последовательными однофотонными переходами: сначала
поглощением, а затем испусканием фотонов. Поэтому они суще-
ственно различаются по числу переходов в единицу времени.
При комбинационном рассеянии за 1 с одна молекула может со-
вершать до 103 переходов, а при резонансной флуоресценции —
108. Поэтому интенсивность спектров резонансной флуоресценции
во много раз больше, чем КР-спектров.
Следует отметить, что чем ближе частота колебания (энергия)
монохроматической спектральной линии, возбуждающей КР-
спектр, к частоте (энергии) электронного перехода молекулы,
т. е. к условиям резонанса, тем интенсивнее КР-спектр. В преде-
ле он может перейти в спектр флуоресценции. Такие переходные
спектры называются спектрами резонансного комбинационного
рассеяния. В них наблюдается по несколько обертонов, т. е. пе-
реходы на уровни с v'=2, 3 и т. д.
При переходе молекул из одних энергетических состояний в
другие происходит перераспределение электронной и ядерной
плотности, т. е. изменение электрических и магнитных дипольных
и квадрупольных моментов молекул. По этим моментам сущест-
вует еще одна классификация спектров. Оптические спектры
практически все связаны с электрическими дипольными перехода-
ми, а магнитные дипольные и электрические квадрупольные пе-
реходы наблюдаются главным образом методами радиоспектро-
скопии (в этой же области проявляются и электрические диполь-
ные переходы). В § 10 рассмотрены правила отбора для элект-
рических дипольных переходов.
Итак, все квантовые переходы можно разделить на безызлу-
чательные и излучательные. К излучательным переходам отно-
сятся переходы как с поглощением квантов света, так и с испус-
канием. Испускание света (фотонов) может быть спонтанным и
вынужденным. Кроме того, квантовые переходы подразделяются
на одно-, двух- и многофотонные. В зависимости от того, как из-
меняются электронная и ядерная плотности в молекуле при кван-
товых переходах, они называются электрическими дипольными,
магнитными дипольными и электрическими квадрупольными пе-
реходами.
50
Классическая оптическая молекулярная спектроскопия, кото-
рая внедрена в повседневную практику научных исследований и
на Промышленных предприятиях, имеет дело со спектрами элект-
рических дипольных переходов, связанных с однофотонным по-
глощением (УВИ- и ИК-спектры поглощения) и спонтанным од-
но- и двухфотонным излучением (УВИ-спектры испускания и
КР-'Спектры). Другие типы взаимодействия излучения с вещест-
вом, которые благодаря созданию квантовых генераторов только
начинают внедряться в лабораторную практику, мы рассматри-
вать не будем и ограничимся в дальнейшем только использовани-
ем лазеров в качестве мощных источников монохроматического
излучения для получения классических КР-спектров.
§ 10. ПРАВИЛА ОТБОРА. ВЕРОЯТНОСТИ ПЕРЕХОДОВ.
ИНТЕНСИВНОСТИ СПЕКТРАЛЬНЫХ ЛИНИЙ
Излучательные квантовые переходы молекул из одних энерге-
тических состояний в другие возможны не для всех, а только
для вполне определенных сочетаний пар уровней. Для одних они
разрешены, а для других запрещены. Эти правила называются
правилами отбора. Однако даже если переходы разрешены пра-
вилами отбора, они могут сильно отличаться вероятностями пере-
ходов. Фактически малые вероятности переходов являются своего
рода дополнительными менее строгими правилами отбора.
Правила отбора зависят от: 1) свойств симметрии волновых
функций состояний, между которыми происходит переход, 2) опе-
ратора перехода (электрического или магнитного дипольного или
квадрупольного моментов перехода, одно- или двухквантовых пе-
реходов) и его симметрии.
Переход считается разрешенным по симметрии, если отличен
от нуля, хотя бы один из интегралов:
J ifedV', (10.1)
где Фт — комплексно-сопряженная волновая функция возбуж-
денного состояния т, фп — волновая функция основного состоя-
ния п, 2ЙХ, Му, Mz — операторы проекций вектора момента на
одну из осей х, у, z (для электрических дипольных моментов он
обозначается через ц). Величины R'x", R’yn, RT1 называются мат-
ричными элементами момента перехода и связаны с моментом
перехода следующим образом:
| |2 = | |2 + | |2 + | %™ |2. (10.2)
Правила отбора связаны с изменением квантовых чисел, опре-
деляющих состояние системы (молекулы).
Для одноквантовых электрических дипольных переходов, т. е.
Для оптических спектров поглощения и испускания (вращатель-
51
ных, колебательно-вращательных) двухатомных молекул получе-
ны следующие правила отбора (см. также табл. 1.1).
Таблица 1.1
Правила отбора для электрических дипольных переходов
двухатомных молекул
Вращательные переходы
И К- и микроволновые спектры поглощения имеют только полярные моле-
кулы;
Д J = J'J" =+ 1.
КР-спектры имеют все двухатомные молекулы, но их интенсивность выше
у неполярных и обычно убывает с увеличением дипольного момента;
Д У = J’ — Jtt =0, +2.
Колебательно-вращательные переходы
ИК-спектры поглощения и испускания имеют только полярные молекулы,
для которых
Д J = J’ — J" = ± 1.
Дополнительные правила отбора связаны с разными вероятностями коле-
бательных переходов &v = v'—v". С ростом Ди при и = 0 интенсивность спек-
тров быстро падает, примерно на порядок от v' к v' +1.
КР-спектры имеют все двухатомные молекулы, так как для них
(da/dq) g=o=#O, 'но их интенсивность выше для неполярных и обычно убывает
е увеличением дипольного момента и уменьшением поляризуемости:
ДУ = J' — J” =0, ±2.
Дополнительное правило отбора Ди = + 1 связано с резким падением веро-
ятностей переходов. Для спектров резонансного комбинационного рассеяния
(см. § 9). Это ограничение становится более слабым и наблюдаются переходы
-с Да= 10—15.
Электронно-колебательно-вращательные переходы
Спектры поглощения и испускания наблюдаются для всех молекул
ДУ = J' — J” — 0, ±1 (кроме переходов S — S, когда Д У — ± 1),
ДЛ = 0, ±'1,
Д S = 0.
Дополнительное правило отбора связано с изменением колебательных кван-
товых чисел (Ди) и определяется принципом Франка'—Кондона.
Для чисто вращательных переходов, образующих длинновол-
новые ИК- и микроволновые спектры поглощения (рис. 1.19),
интегралы типа (10.1) отличны от нуля только для полярных мо-
лекул при условии
ду = Г— JH = + 1, (Ю.З)
независимо от спектров испускания или поглощения.
Для колебательно-вращательных переходов, принадлежащих
одному и тому же электронному состоянию (рис. 1.22) и образую-
52
щих ИК-спектры (см. подробнее § 12), интегралы типа (10.1)
отличны от нуля для полярных молекул при условии
AJ = J' — Г = ±1 (10.4)
и не зависят от изменения колебательных квантовых чисел Ди =
—.и'—и", однако с ростом Av вероятность переходов сильно па-
дает, и этим накладывается дополнительное правило отбора.
Для электронно-колебательно-вращательных переходов (рис. 1.8),
образующих так называемые полосатые спектры (см. подробнее
§ 13), правила отбора еще более усложняются, так как необхо-
димо учитывать типы электронных состояний.
Классификация электронных состояний молекул ведется как
по квантовому числу Л — проекции на межъядерную ось вектора
суммарного орбитального момента количества движения электро-
нов L, так и по квантовому числу суммарного спина S или его
проекции 2. По своим принципам она близка классификации
атомных состояний. Квантовое число Л принимает значения 0, 1,
2, ..., обозначаемые заглавными греческими буквами 2, П, Д, в
отличие от атомных состояний, обозначаемых латинскими буква-
ми S, Р, D, ..., Спиновые квантовые числа S и 2 принимают
полуцелые значения 1/2, 3/2, 5/2 ... для молекул с нечетным чис-
лом электронов (часто их называют радикалами) и целые — 0,
1, 2 ... для молекул с четным числом электронов.
Для электронно-колебательно-вращательных спектров матрич-
ные элементы электрических дипольных моментов переходов бу-
дут отличны от нуля для полярных и неполярных молекул (в
отличие от вращательных и колебательно-вращательных перехо-
дов) при следующих условиях:
ДА = 0, ±1; (10.5)
AS = 0; (10.6)
AJ — J' — Г = 0, ±1 (10.7)
для всех электронных переходов, кроме 2—2, для которого
Д<7 =• J' _ J" = ± 1. (Ю.8)
Переходы, отличающиеся по величине Av = v'—v", правилами
отбора разрешены, но они ограничиваются вероятностями пере-
ходов, определяемыми для электронно-колебательных спектров
принципом Франка — Кондона (см. § 13).
Правила отбора для двухквантовых электрических дипольных
переходов, т. е. для спонтанных КР-спектров, необходимо рас-
сматривать с точки зрения поведения дипольногб момента, наве-
денного электромагнитным полем возбуждающего излучения. Ве-
личина наведенного дипольного момента ц определяется поляри-
53
зуемостью молекулы а и напряженностью электромагнитного
поля Е:
р = аЕ. (10.9)
Направления векторов у, и Е не обязательно совпадают, и по-
этому для полного описания системы, состоящей из молекулы и
возмущающего ее электромагнитного поля, необходимо рассмат-
ривать три компоненты каждого из них, т. е.
Их = ахх^х + -г ахЛ (10.10)
Mr/ ~ аух^х Н- ауу^у ~ ^уг^г*
На ^гх^х ®гуЕу ~ azz^2’
В результате получается девять компонент сц;, составляющих
так называемый тензор поляризуемости, в котором шесть членов
попарно равны, ац — ац.
Правила отбора и интенсивности КР-спектров определяются,
как и в случае одноквантовых переходов, величиной матричного
элемента
= J ЧЙ (10.11)
где atj — оператор поляризуемости молекулы.
Таким образом, активность (проявление) и интенсивность
КР-спектров определяется поляризуемостью молекул, в то время
как активность ИК-спектров поглощения зависит от наличия
собственного дипольного момента молекулы. Например, неполяр-
ные молекулы Ns, О2 не имеют длинноволновых вращательных и
ИК-спектров поглощения (это не распространяется на электрон-
ные спектры поглощения и испускания), но имеют интенсивный
КР-спектр, а полярные молекулы типа НС1, СО и т. д. имеют
интенсивный ИК-спектр и слабый КР-спектр.
Не вдаваясь в детали вычислений, можно сформулировать
следующие правила отбора для КР-спектров двухатомных моле-
кул.
Для чисто вращательных переходов
\J = J' —J" = 0, -2, (10.12)
где Д/ = 0 совпадает с несмещенной линией рэлеевского рассея»
ния.
Для колебательно-вращательных переходов
= Г=0,±2. (10.13)
Переходы с разными значениями &v=v'—v" сильно отличаются
по своим вероятностям. Обычно полосы с Ду=+2 уже практиче-
ски не наблюдаются, хотя разрешены правилами отбора. Для
54
спектров резонансного комбинационного рассеяния вероятности
переходов отличаются меньше и для них наблюдаются полосы до
v=10—15.
Электронные КР-спектры наблюдаются практически редко и
в основном в кристаллах, содержащих ионы редкоземельных эле-
ментов.
Рассмотренные правила отбора по симметрии являются стро-
гими правилами отбора. Однако если переход разрешен, то это
еще не значит, что в спектре будет наблюдаться соответствую-
щая линия, так как при небольших значениях интегралов (10.1)
и (10.11) переходы могут быть крайне маловероятны. Таким об-
разом, матричные элементы моментов переходов определяют не
только правила отбора, но и интенсивность спектральных линий.
Правила отбора для вращательных и колебательных перехо-
дов многоатомных молекул будут рассмотрены в § 17.
Если рассматривать взаимодействие между электромагнитным
полем излучения и различными электрическими и магнитными
моментами молекулы, то наиболее сильно взаимодействуют меж-
ду собой электрическая компонента поля и электрический ди-
польный момент. Соответственно высоки и вероятности переходов,
связанных с изменением электрического дипольного момента мо-
лекулы. Они на 5—8 порядков выше, чем вероятности остальных
переходов, при которых изменяются магнитные дипольные и
электрические квадрупольные моменты. Поэтому при изучении
оптических спектров наблюдаются практически спектральные ли-
нии, обусловленные только электрическими дипольными перехо-
дами. Однако в длинноволновой области спектра (радиодиапазо-
не) интенсивности всех трех типов спектров становятся срав-
нимы.
Вероятности спонтанных и вынужденных однофотонных пере-
ходов при взаимодействии излучения с веществом были рассмот-
рены Эйнштейном. Примем, что в поглощаемом излучение объе-
ме 1 см3 вещества имеется Nn молекул в состоянии п (см.
рис. 1.15). Тогда число молекул Znm, перешедших за 1 с из со-
стояния п в состояние т при воздействии излучения частоты vnrn
и спектральной плотностью p(vnm), равно
Znm = B„mNnp(vnni), (10.14)
где Впт — коэффициент Эйнштейна для поглощения.
Мощность поглощения света веществом l/Хл равна энергии,
необходимой для возбуждения Znm молекул, находящихся в 1 см3
из состояния Еп в состояние Ет в единицу времени, т. е.
(Логл — (Ет — Еп) Znm = hcvnmznm = BnmNnp (упт) hcv„m. (10.15)
Для равновесной системы число поглощенных фотонов долж-
но быть равно числу испущенных фотонов, как в результате
спонтанных, так и вынужденных переходов. Число вынужденных
56
переходов Zmn выражается формулой, аналогичной числу пере-
ходов для поглощения (они 'ведь также вынужденные):
4 = (Ю.16)
где Nm — число молекул в возбужденном состоянии; Втп — ко-
эффициент Эйнштейна для вынужденного испускания. Число
спонтанных переходов
Zmn = AmnNm, (10.17)
где Атп — коэффициент Эйнштейна для спонтанного испускания.
Для равновесной системы
ДиЛр= Мш 4- ВтпМтр (упт). (10.18)
Отсюда можно показать, что для невырожденных состояний п
и т
В„т = Втп, (10.19)
= 8nhv’e„„. (10.20)
Таким образом, мощность спонтанных спектров испускания
1ДЙ=ЛГ„1ЛтлЛст,т1. (10.21)
Согласно квантовой механике для дипольных переходов коэф-
фициенты Эйнштейна равны
В„т = Вп„,=(10.22)
А™ = -^р^г1|Я'""|2, (10.23)
где J^nn—j^ntn — момент электрического дипольного перехода.
Коэффициенты Эйнштейна являются такими же молекулярны-
ми постоянными, не зависящими от внешних условий (темпера-
туры, давления, плотности излучения), как и частоты колебаний,
межъядерные расстояния и т. д. Они зависят от природы моле-
кул и уровней, между которыми совершается переход. Вероятно-
сти переходов тем больше, чем сильнее изменяется дипольный
момент при спектральном переходе. В большинстве случаев для
электронных спектров испускания Лтп^ 106—109 с-1. Коэффици-
ент Эйнштейна для спонтанного испускания связан со временем
жизни молекулы в возбужденном состоянии соотношением
т = ——. (10.24)
А пт
В свою очередь, время жизни т связано с шириной энергетическо-
го состояния соотношением (7.1), т. е.
56
ЛЕ [Дж] ДЕ [см-1] ’ 7
^E — h2cAmn. (10.26)
Для ИК-спектров величина коэффициента Атп понижается в
103—106 раз из-за уменьшения волнового числа (в 10—100 раз).
При этом считается, что момент пере,хода Rmn меняется мало.
Для вращательных спектров коэффициент Эйнштейна Атп еще
больше уменьшается и становится сначала сравнимым с Втп, а
затем и меньше его, т. е. доля спонтанного излучения существен-
но понижается по сравнению с вынужденным излучением.
Теперь рассмотрим интенсивности (энергии) спектров погло-
щения и спонтанного испускания. В случае спектров поглощения
удобно вместо спектральной плотности p(vnm) падающего на ве-
щество излучения пользоваться потоком энергии
/o--=cp(vnI„), (10.27)
выраженным в Дж/м2.
Тогда для поглощающего слоя вещества толщиной b из
(10.15), (10.22) и (10.27) следует
= (10.28)
мс
Для спектров спонтанного испускания из (10.21) и (10.23)
C = (10.29)
Из этих формул следует, что интенсивность спектральных ли-
ний поглощения и испускания прямо пропорциональна заселен-
ности уровней (см. § 8), с которых совершается переход (погло-
щение или испускание), и квадрату. электрического дипольного
момента перехода. Наиболее существенное различие между ними
состоит в том, что спектры поглощения слабо зависят от v, а
спектры испускания — очень сильно, так как прямо пропорцио-
нальны V4. Например, при переходе от спектров испускания в об-
ласти 6000 А к области 3000 А (при постоянном Rnm) интенсив-
ность излучения увеличивается в 16 раз. Эта зависимость отно-
сится и к КР-спектрам, поэтому в качестве возбуждающих линий
лучше брать линии максимально высокой частоты, но такой,
чтобы не возникала флуоресценция.
§ 11. ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
Для модели жесткого ротатора энергетические состояния мо-
лекулы описываются формулой (5.10), которой соответствует сле-
дующее выражение для термов вращательной энергии:
= (11.1)
he
57
где
h _ h _ 27,98-1О~*о
8л2с/е 8л2ф/^ 4
(11.2)
— вращательная постоянная в см-1, относящаяся к минимуму
кривой потенциальной энергии; 1е — момент инерции в г-см2; р,—
приведенная масса в г; ге — межъядерное расстояние в см; 7 = 0,.
1, 2, 3 ... — вращательное квантовое число.
Таким образом, энергетические состояния молекулы зависят
от ее приведенной массы и межъядерного расстояния.
Выражение (11.1) является только первым приближением,
так как не учитывает изменения межъядерного расстояния при
колебаниях молекулы.
Рассмотрим более точную модель молекулы —г колеблющийся
ротатор. Если колебания и вращения были бы независимы, то
энергия колеблющегося ротатора выражалась бы суммой коле-
бательной и вращательной энергии, и для каждого колебатель-
ного уровня существовал бы стереотипный набор вращательных
уровней. Однако даже из рис. 1.9, где приведена потенциальная
кривая, видно, что для каждого колебательного состояния сред-
нее межъядерное расстояние увеличивается с ростом v и поэтому
должна уменьшаться величина вращательной постоянной В. За-
висимость вращательной постоянной В от колебательного кван-
тового числа v можно выразить следующим образом:
Bv = Be-ae(v+l/2), (11.3)
где ае — постоянная колебательно-вращательного взаимодей-
ствия.
Учитывая взаимодействие вращения и колебания, можно пред-
ставить вращательные термы для любого колебательного со-
стояния формулой
Г(7) = В„7(7+1), (11.4)
где
—среднее межъядерное расстояние для состояния v.
Переходы между вращательными состояниями подчиняются
правилу отбора Д7=7'—/"= + 1. Если принять 7"=7, а //=/+1,
то положение линий во вращательном спектре поглощения или
испускания может быть представлено выражением
i Е е’
= (7") = Bv(J + 1)(J н- 2)-
he he
— В„7(7 + 1) = 2В„(7 + 1). (11.6)
58
На рис. 1.19 показаны разрешенные переходы между враща-
тельными уровнями в спектре поглощения молекулы НО. Рас-
стояния между соседними состояниями отвечают величинам 2В,„
4BV, 6BV и т. д., т. е. вращательные уровни с увеличением / рас-
ходятся, а расстояния между соседними линиями во вращатель-
ном спектре остаются постоянными:
V(J + I)-v(J) = 2BV(J -4- 2) -2BV(J + 1) = 2BV, (Il.7)
причем первая линия находится
при v = 2Bv.
На рис. 1.20 приведена запись
вращательного спектра погло-
щения паров НС1 в длинноволно-
вой ИК-области.
При точных измерениях вра-
щательных спектров наблюдается
уменьшение расстояний между
соседними линиями с ростом J.
Это вызвано тем, что реальные
вращательные состояния распо-
ложены ниже, чем это следует
из формулы (5.10) для жесткого
ротатора. Поэтому была введе-
на модель нежесткого ротатора,
которая учитывает этот эффект
через постоянную центробежно-
го растяжения Dr. Уровни вра-
щательной энергии для нежестко-
го ротатора представляются вы-
ражением
F(J) = B/(J+1)-D/2(J+1)2.
(11.8)
°рЫЧН0 ПОР"*- Рис. I. 19. Система энергетических
ка 10 СМ-1 При Bv ОКОЛО 1— уровней и вращательный спектр по-
2 СМ-1 и поэтому поправка на глощения двухатомной молекулы
центробежное растяжение сказы-
вается только при больших значениях J. У легких молекул Dv
надо учитывать уже при малых J.
В случае вращательных КР-спектров правило отбора Д/ = 0,
+ 2. На рис. 1.21 приведена схема образования вращательного
КР-спектра. Характерно, что первая вращательная линия нахо-
дится на расстоянии 6ВГ от возбуждающей линии vo, а расстоя-
ние между линиями вращательной структуры равно 4ВГ.
Следует напомнить, что ИК-спектр поглощения может быть
только у полярных молекул НС1, СО и т. д., а КР-спектр как у
полярных, так и неполярных молекул, например, Ог, N2 и т. д.
59
Вращательные спектры содержат в себе очень ценную инфор-
мацию о межъядерных расстояниях г и моментах инерции /=цг2,
которые определяются из вращательной постоянной В, а она, в
НС1
свою очередь, вычисляется по расстояниям между соседними ли-
ниями спектра, измеряемого с большой точностью.
В качестве примера можно привести данные по чисто враща-
тельным спектрам (табл. 1.2).
Табл ица 1.2
Вращательные постоянные и межъядерные расстояния ряда
двухатомных молекул в основном электронном состоянии
Молекула см-1 О ге А ае, см-1 De\0*, см-1
н2 60,86 0,741 3,07 46 600
н+ 29,95 1,057 1,59 19 900
HF 20,96 0,917 0,796 2 153
IICI 10,59 1,275 0,307 532
НВг 8,471 1,414 0,233 346
Н1 6,511 1,609 0,169 206
L1F 1,345 1,564 —. —
CsI 0,0236 3,315 .— —
n2 1,998 1,098 0,017 5,48
О2 1,445 1,207 0,016 5,0
F2 0,8902 1,413 0,014 3,3
12 0,0374 2,665 0,0001 0,005
Mg2 0,1480 3,890 0,0013 0,33
Са2 —— 4,28 —. —
Хе2 0-0134 4,37 0,0003 0,02
С&г 0,0117 4,65 — —
60
Для большинства известных двухатомных молекул межъядер-
ные расстояния находятся в диапазоне 0,74 А (Н2) — 4,5 A (Cs2),
а расстояние между линиями вращательного спектра примерно
от 0,01 до 120 см-1.
СтоксоМы релеедское
переходы рассеяние.
Антистоксоды
переходы
Рис. 1.21. Схема образования чисто вращательного КР-спектра
Зависимость интенсивности линий вращательного спектра по-
глощения от температуры определяется заселенностью состояний
(см. § 8). При этом статистический вес берется как средняя ве-
61
личина от статистических весов обоих состояний, между которы-
ми происходит переход:
Р<+»+.(2Г+1)=у . 2 _
2
Таким образом, согласно (10.28) интенсивность линий погло-
щения можно представить как
/погл = v (2J-И 2) е kT -const. (11.10)
При малых значениях J интенсивность линий вращательной
структуры определяется главным образом членом 2/-J-2 и часто-
той v, т. е. она возрастает с увеличением /, однако при больших
значениях главенствующую роль начинает играть экспоненциаль-
ный член и интенсивность линий начинает убывать (см. § 8).
Значение J для максимума интенсивности можно приближенно
оценить, продифференцировав выражение (8.4) по / и приравняв
dNi/dJ нулю:
Лзк«=1/-^—4=°’5895 у/4- -°-5- (U11>
у 2Впс 2 V В
Например, для молекулы СО и CsI при комнатной температу-
ре максимумы интенсивности приходятся на /=7 и 65 соответст-
венно.
§ 12. КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
ДВУХАТОМНЫХ МОЛЕКУЛ
Чисто колебательных спектров не существует, так как моле-
кулы в основном и возбужденном колебательном состояниях рас-
пределены по ряду вращательных состояний, и при переходе мо-
лекулы из одного колебательного состояния в другое одновремен-
но происходит изменение их вращательных состояний. Поэтому
при рассмотрении колебательных переходов необходимо учиты-
вать вращательные состояния. Термы колебательно-вращатель-
ных состояний являются суммой термов колебательных и враща-
тельных состояний. Согласно уравнениям (5.9) и (5.10) термы ко-
лебательной энергии равны
G(y) 1/2) —1/2)2+ ...
а вращательной —
F(J) = BVJ(J+1).
Поэтому в общем виде колебательно-вращательный терм имеет
вид
-^ = G(») + F(J) = <#,(»+ l/2)-wex<(o+ l/2)2 + B„J(J+ 1).
ПС
(12.1)
62
На рис. 1.22 приведена система вращательных уровней для
двух колебательных состояний и' и и". Переходы между уровня-
ми с различными значениями v и / дают колебательно-враща-
тельные спектры (рис. 1.23), для которых правила отбора
Ду = -|- 1,4-2, -1-3, ... ; (12.2)
+ (12.3)
Для упрощения рассмотрения колебательно-вращательных
спектров пренебрегаем пока вращательной структурой и рассмат-
Рис. 1.22. Система уровней и колебательно-вра-
щательный спектр двухатомной молекулы
риваем только колебательные переходы. Подобная картина наб-
людается в спектрах конденсированной фазы или растворенных
газов, где велико межмолекулярное взаимодействие. В результа-
те вращательные энергетические уровни «размываются» и в
спектре наблюдаются только широкие полосы или линии, как
показало на рис. 1.24, которые соответствуют колебательным пе-
реходам.
По правилам отбора (12.2) при колебательных переходах нет
Никаких формальных ограничений по Ду, однако при увеличении
63
как v, так и Ди общая интенсивность полос резко падает, что яв-
ляется своего рода дополнительным правилом отбора. При ком-
натных температурах в спектрах обычно проявляются всего
,3с'6о= 1,1%,
Рис. 1.23. Колебательно-вращательный спектр поглощения молекулы
12С16О в газовой фазе (сверху отмечены слабые линии 13С16О)
Рис. 1.24. Колебательный
спектр поглощения молекулы
СО:
1 — в газе при давлении око-
ло 0,2 атм; 2—в газовой сме-
си с N2 при давлении 20 атм;
3— растворенной в жидкости
Г-1 Г-10 1-100 гюоо
v=’j v.ii_ ^,см-1
------ ------Г1----Г"1---1~“—Г~ ’
0 5000 10000
Рис. 1.25. Схема ИК-спектра поглоще-
ния молекулы НО (вращательная
структура не показана). В действитель-
ности интенсивность полосы первого
обертона 2—0 примерно в 10 раз, вто-
рого обертона 3—0 в 100 раз и треть-
его обертона 4—0 в 1000 раз меньше,
чем основной полосы 1—0
два — три таких перехода. Переходы 2—0, 3—0 и т. д. называют-
ся обертонами. Основной тон (основная полоса) соответствует
переходу 1—0. (В обозначении колебательных переходов сначала
приводится v', а затем и".) Полосы обертонов получаются только
при больших концентрациях вещества. На рис. 1.25 приведено
64
соотношение интенсивностей между основной полосой и оберто-
нами. Переходы между возбужденными состояниями (например,
2—1, 3—2) дают так называемые горячие полосы. Частоты ко-
лебаний обертонов легко получить из разности термов, пренебре-
гая вращательными термами, т. е.
= G (v) — G (0) = <0, v — (де xev — со, xev2 = [<oe — ыехе (v I- 1)] v.
(12.4)
Полосы, которые образуются с участием только возбужденных
состояний (например, полосы 2—1, 3—2), называются «горячи-
ми», так как достаточная заселенность состояний с и=1, 2 и т. д.
достигается только при нагреве вещества.
Из значений частот обертонов и основной частоты можно вы-
числять колебательные частоты соР и ангармоничности соЛ. Для
этого сначала вычисляются первые разности между первым обер-
тоном и основной частотой, вторым обертоном и первым оберто-
ном и т. д.
В общей форме первые разности равны
A Gv+1 /2 = G (v + 1) — G (и) = — 2а\, хе — 2(о(, xev =
-co. — 2(оехДи+ 1) (12.5)
и по своему физическому смыслу представляют собой расстоя-
ние между соседними термами колебательных состояний (см.
рис. 1.9).
Если по первым разностям AGr+i/2 определить вторые разно-
сти
Д2 G — А 6^14.1/2 — A Gt>+i/2 = — 2сое хе, (12.6)
то тогда можно вычислить постоянную ангармоничности соехе, а,
зная ее, по формуле (12.5) определить колебательную частоту
<ос. Сумма первых разностей по всем колебательным квантовым
числам (до иМакс) равна энергии диссоциации Do (см. § 15). Меж-
ду прочим введение индекса и+1/2, а не и в первые разности
связано с определением энергии диссоциации (см. § 15).
Теперь обратимся к вращательной структуре колебательно-
вращательных спектров. По правилам отбора А7 = ±1, и поэто-
му осуществляются две серии переходов между вращательными
состояниями разных колебательных уровней. Соответственно и в
спектре наблюдаются две серии линий, которые называются вет-
вями полос: Р-ветвями, если А/= +1, и Р-ветвями, если AJ= —1
(см. рис. 1.22 и 1.23). Между сериями Р- и Р-ветвей находится
так называемый нулевой промежуток (начало полосы) vo- Он со-
ответствует чисто колебательному переходу v0 G' —
— 6" (г^)(7»=0), который запрещен правилами отбора, так как для
него AJ = O. Поэтому отсчет P-линий начинается с J=J"—L
Ветвь Р всегда расположена со стороны больших частот от vo, а
первая наблюдаемая линия соответствует / = 0.
3 А. А. Мальцев
65
Линии Р-ветви, для которой /'=/"4-1, можно представить
уравнением
= + = 1)р + 2)-В^и+1)-
-vo + 2B;+ (3bL-Bv)J . (Bv-B”0)J2, (12.7)
где вращательные квантовые числа /=/" принимают значения
О, 1, 2, 3, .... Соответственно для Р-вегви, для которой /'=/"—1,
vP-v0+F' (Р)-Р'(Л- v0 ^b;(J-1)J-B>(J+ 1) =
= v0-(B;+ Bv)J + (By —By) J2, (12.8)
где J = J" принимает значения 1, 2, 3, ...
Величина Bv— Bv в случае колебательно-вращательных спек-
тров всегда имеет отрицательное значение, так как ВУ<ВО.
Поэтому с ростом J линии вращательной структуры в Р-ветви
постепенно сходятся, а в Р-ветви расходятся (см. рис. 1.22, 1.23).
Разность В'—В" мала, и потому для малых значений J в ря-
де случаев можно пренебречь взаимодействием колебания с вра-
щением, приняв Ву^ Bv ~ В. Тогда
V/? = v0 ; 2В4 2BJ, (12.9)
vP = v0 — 2BJ. (12.10)
В этом приближении расстояние между двумя соседними ли-
ниями вращательной структуры равно 2В, как и в чисто враща-
тельных спектрах.
Иногда для удобства расчетов две ветви выражают одной
формулой:
V —v0 ; (By -| By) m 4 (By — By) tn2, (12.11)
где m=\, 2, 3, ... для Р-ветви (m — /+1) и m = — 1, —2, —3, ...
для Р-ветви (m=—J).
На рис. 1.23 видно распределение интенсивностей линий вра-
щательной структуры в колебательно-вращательных спектрах.
Оно характерно тем, что с увеличением вращательного кванто-
вого числа J интенсивность линий вращательной структуры в Р-
и Р-ветвях сначала возрастает, а потом постепенно падает. Такое
распределение интенсивностей связано главным образом с засе-
ленностью вращательных состояний (см. § 8 и рис. 1.13,в). При
увеличении температуры газа заселенность состояний с большими
J увеличивается и соответственно максимумы интенсивностей в
Р- и Р-ветвях смещаются в разные стороны от центра полосы.
При этом число наблюдаемых линий вращательной структуры
увеличивается, а интенсивность линий в максимуме падает. Кван-
товое число максимума интенсивности оценивается по той же
формуле (11.11), что и для чисто вращательного спектра. На
66
рис. 1.26 приведен пример перераспределения интенсивностей в
зависимости от температуры. Обычно удобнее наблюдать ИК-
спектры поглощения, чем испускания, так как заселенность воз-
бужденных состояний меньше, чем основного.
Для случая колебательно-вращательных спектров интенсив-
ность поглощения мало зависит от v (см. формулу 10.28), так как
в пределах одной полосы величина v изменяется мало. Следует
Рис. 1.26. Распределение интенсивностей ,в колебательно-вращатель-
ном спектре при 100 К, 300 К и 1000 К; а — для В= 10,44 см-1 (НО);
б — для В «20 см-1 (СО, CN)
отметить, что при небольшой разрешающей силе спектральных
приборов вращательная структура полос не разрешается, и в
спектре газов наблюдаются только огибающие Р- и /?-ветвей, на-
поминающие по внешнему виду спектры растворенных газов
(см. рис. 1.24).
Из колебательно-вращательных спектров можно определять
как колебательные постоянные cof;, со(>хР, v.o, так и вращательные
постоянные Bv, связанные с межъядерным расстоянием и момен-
том инерции молекулы.
Для определения вращательных постоянных Bv и Bv из коле-
бательно-вращательных спектров используются так называемые
комбинационные разности Дг£(/), которые представляют собой
разность между двумя вращательными состояниями, располо-
женными через один вращательный уровень, как это показано на
рис. 1.27, а.
Легко показать, что уравнения
b^F'(J) =--F'(J . 1)_F(J —1)-/?(/) — P(J) (12.12)
и
Д 2 F" (J) = F" (J + 1) — F"(J — 1) = R (J — 1) — P (J + 1) (12.13)
3* 67
связаны с вращательной постоянной В и / следующим образом:
b2F(J) = 4Bv(J 1/2). (12.14)
Если для ряда значений J вычислить АгЕД/) или А2Е"(/), то
можно графически или методом наименьших квадратов опреде-
лить Bv или с достаточно высокой точностью. На рис. 1.27,6
Рис. 1.27. а — Схема образования комбинационных разностей
б—График зависимости комбинационных разностей Д2^(-0 от У-Р/г
приведен график зависимости А2Е (7) от / 4-1/2, из которого по
углу наклона можно определить величину 4BV.
Для легких молекул, а также больших значений J необходимо
учитывать постоянную центробежного растяжения Dv (см. урав-
нение (11.8)) и тогда
A2F(J) = (4By-6Dj (J+ \/2) — 8Dv(J -I- 1/2)3^
^4BV(J [l/2) — 8Dv(J = I 2)3. (12.15)
Для .практических вычислений (в частности, графическим мето-
дом или методом наименьших квадратов на ЭВМ) удобно вос-
пользоваться следующей зависимостью А2Е(/)/(/-]-1/2) от (/ +
+ 1/2)2:
--2-(/) = 4BV — 8D (J j 1.2)2, (12.16)
(У 4-1/2) v v ’ '
которая эквивалентна линейному уравнению у = а-\-Ьх, где
а = 4BV, b = —8D0 и x = (J j- 1 /2)2.
68
Для определения молекулярных постоянных v0, Bv и Bv с по-
мощью ЭВМ можно также воспользоваться общим уравнением
(12.11) для ветвей Р и R, для которого методом наименьших квад-
ратов находятся коэффициенты vQ, (В'-\-В") и (В' — В").
Спектры комбинационного рассеяния газов, полученные при
большом разрешении, содержат кроме вращательной структуры
„ п Линия реяeeScHozo рассеяния
Стоксова -
область
У
.Arnk А
М БВБВЬВ _______4В6В SMB . OB BBSBtf
Колебательно- Вращательный Чисто Вращательный Колебательно-вращательный
спектр спектр спектр
Рис. 1.28. а — Схема вращательных и колебателыю-вращательпых перехо-
дов при комбинационном рассеянии
б — Вращательный и колебательно-вращательный КР-спектры
(§ 11) также более слабые колебательно-вращательные полосы,
у которых А/ = 0, ±2, а Av = +1, +2, ... (практически наблю-
дается только наиболее интенсивный переход с Av== + 1). Ветви
вращательной структуры с А/=-+-2 называются 5-ветвями, а с
А/ = —2 — О-ветвями. На рис. 1.28 приведена схема образования
колебательно-вращательного КР-спектра. Для соединений, нахо-
дящихся в конденсированной фазе, КР-спектры (как и ИК-спект-
ры) состоят из одной широкой полосы.
Частоты колебаний ще у двухатомных молекул (см. табл. 1.3)
изменяются от 4400 см-1 для Н2 до21 см-1 для Хе2, а ангармонич-
ности (оехе соответственно от 121 до 0,63 см-1. В Приложении V
69
имеется таблица основных молекулярных постоянных некоторых
двухатомных молекул, в которой также приведены значения
И (ОеХе.
Таблица 1.3
Колебательные постоянные ряда двухатомных молекул в основном
электронном состоянии
Молекула ые, см-1 ыехе’ CM~l еяе
н2 4400 121 0,72
н+ 2323 67,5 0,94
HF 4139 90,0 0,93
HCI 2991 52,8 0,22
НВг 2649 45,2 —0,003
HI 2309 39,6 —0,02
LiF 910 7,9 —
CsI 120 —
n2 2358 14,1 —0,02
o2 1580 12,0 0,05
F2 917,5 11,8 —
ci2 559,7 2,7 -0,003
Br2 325,3 1,1 —0,002
I2 214,5 0,6 0,00007
Mg2 51,1 1,64 —'
Ca2 40 —• —
Cs2 42,0 0,08 —0,0002
Xe, 21,1 0,63 —
§ 13. ЭЛЕКТРОННО-КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ (ПОЛОСАТЫЕ)
СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ. ПРИНЦИП ФРАНКА — КОНДОНА
При больших энергиях возбуждения (обычно свыше
~ 10 000 см-1) молекула может переходить в электронно-возбуж-
денные состояния с энергией Те, которые имеют свой набор коле-
бательных, G(и), и вращательных, F(J), состояний, описываемых
через молекулярные постоянные Ве.
Таким образом, в общем виде систему всех возможных энер-
гетических состояний двухатомной молекулы (см. рис. 1.8) мож-
но представить уравнением
Е
—^ = Te + G(v) + F(J)= (13.1)
= Л + ®е(^ + 1/2)-шех?(1Н- l/2)* + B0J(J Ч 1),
где Тс — терм чисто электронного возбуждения, который для ос-
новного электронного состояния равен нулю.
Как и в случае колебательно-вращательных спектров, чисто
электронные переходы в спектрах не осуществляются. Переход
70
молекулы из одного электронного состояния в другое сопровож-
дается изменением не только вращательных, но и колебательных
состояний. В результате в спектре для каждого электронного
перехода, а их в принципе может быть много (см. рис. 1.10), про-
является своя колебательная и вращательная структура в виде
многочисленных полос.
3-2 2-2 2-3
1М,9см~1 172,3 cm~J
Изотопные сдвиги 8 колебательной структуре
Рис. 1.29. Электронно-колебательно-вращательный спектр испускания
двух изотопных модификаций молекул ИВО и 10ВО.
а-- Общий вид системы полос электронного перехода С2П—X2S
б — Восьмикратное увеличение полос 0—3 и 1—4
На рис. 1.29, а приведена система полос одного из электрон-
ных переходов молекул ВО (спектры получены для двух изотоп-
ных модификаций ИВО и 10ВО). Для наглядности на рис. 1.29,6
одна из полос приведена в увеличенном масштабе. Хорошо вид-
но, что она состоит из многочисленных линий вращательной
структуры, которые сгущаются в сторону меньших длин волн, об-
разуя кант.
Такие спектры, в которых проявляется колебательная и вра-
щательная структура, называются электронно-колебательно-вра-
щательными, или полосатыми спектрами. Если же вещество на-
ходится в конденсированной фазе, вращательная структура раз-
мывается и спектры упрощаются как в случае колебательно-вра-
щательных переходов (см. рис. 1.24).
71
Для лучшего понимания сложной картины полосатых спект-
ров будем сначала пренебрегать вращательными термами в урав-
нении (13.1), так как их энергия намного меньше, чем для тер-
мов Те и G(y). Фактически остановимся только на колебательной
структуре электронных спектров. В этом случае положение коле-
бательных полос описывается следующим уравнением:
v уэл"+- ®<dv' + 1.2) —ю, xe(v' + 1/2)2 —
— ae(v г 1/2) Г2)2, (13.2)
где v3JI = (Те — Те)— чисто электронный переход. Частота коле-
баний о)е и ангармоничность хе могут быть как больше, так
и меньше и cot, хе соответственно.
А. А А Ж
3
£
Прогрессия прогрессия
по и' по и"
Диагональные группы
(секвенции)
&и=0 &v=-1
Рис. 1.30. Схема энергетических уровней и переходов между ними для
электронно-колебательных спектров двухатомных молекул
Никаких правил отбора на переходы с разными значениями v
не накладывается (см. § 10 и табл. 1.1) — каждый колебатель-
ный уровень одного электронного состояния может комбинировать
с любым колебательным уровнем другого электронного состояния
(рис. 1.30).
Серии полос с постоянным значением v" называются прогрес-
сиями по v' (см. рис. 1.30), а с постоянным v' — прогрессиями
72
Рис. 1.31. Распределение «ядер-
нон плотности», пропорциональ-
ное |фи|2, ДЛЯ различных КОЛС-
бательных состояний двухатом-
ной молекулы. Вероятность како-
го-либо межъядерного расстоя-
ния пропорциональна высоте кон-
тура, покрытого точками. Верти-
кальные линии ограничивают зо-
ну, в которой интегралы пере-
крывания при переходах из ос-
новного состояния и" = 0 имеют
конечное значение
no v". Серии полос с 'Постоянным значением Ди = и'— и" называ-
ются диагональными сериями (секвенциями).
Однако в спектре проявляется довольно ограниченное число*
таких переходов. Это связано с тем, что существует принцип
Франка — Кондона, который формулируется следующим обра-
зом. При переходе молекулы из
одного электронного состояния
в другое перераспределение элек-
тронной плотности происходит
настолько быстро, что расстоя-
ние между более тяжелыми яд-
рами не успевает измениться.
При объяснении интенсивно-
стей переходов, подчиняющихся
принципу Франка — Кондона,
необходимо рассмотреть распре,
деление «ядерной плотности»
для различных колебательных со-
стояний, которая пропорциональ-
на | фг, |2. Под распределением
ядерной плотности подразумева-
ется вероятность застать два
ядра на каком-то определенном
расстоянии. На рис. 1.31 показа-
но распределение ядерной плот-
ности для различных колебатель-
ных уровней основного и воз-
бужденного электронного состо-
яний.
На рис. 1.31 видно, что с уве-
личением v ядерная плотность со-
средоточивается на расстояниях,
соответствующих максимумам
амплитуд колебаний (точкам воз-
врата) классического гармони-
ческого осциллятора (кроме со-
стояния с и = 0). Для состояний с
о>1 имеется вероятность застать
жуточных межъядерных расстояниях, но эта вероя-тность мень-
ше. Для и>0 существуют и такие межъядерные расстояния, для
которых |фД2 = 0. Относительные вероятности электронно-колеба-
тельных переходов определяются интегралом перекрывания (его
еще называют фактором Франка — Кондона)
(13.3)
Чем больше его величина, тем более вероятен переход. Например,
на рис.. 1.31 двумя вертикальными линиями ограничена зона наи-
более вероятных переходов из основного электронного состояния
молекулу и при других проме-
73
в возбужденное. Судя по перекрыванию колебательных волновых
функций, наиболее вероятны переходы 1—0 и 2—0.
Потенциальные кривые различных электронных состояний мо-
гут быть смещены друг относительно друга, как это показано на
рис. 1.32. В том случае, когда ге = ге (рис: 1.32,а), в спектре
наблюдаются интенсивные полосы поглощения с Ду=0, т. е. об-
6
Непрерывный спектр
поглощения
Рис. 1.32. Иллюстрация принципа Франка—Кондона на спектрах погло-
щения для различных положений потенциальных кривых друг относи-
тельно друга
разуется так называемая диагональная группа полос с перехода-
ми 0—0, 1 — 1, 2—2, .... Если же ге > ге (рис. 1.32,6), то наи-
более интенсивна полоса 1—0, соответствующая переходу по
вертикальной линии. Полосы 0—0 и 2—0 будут слабее или сов-
сем не проявятся в спектре. При большой разности между гги ге
и малой энергии диссоциации возбужденного состояния
(рис. 1.32, в) может образоваться непрерывный спектр, так как
74
при вертикальном переходе (по принципу Франка — Кондона)
молекула перейдет в такое состояние, что ее потенциальная энер-
гия станет больше диссоциационного предела, а молекула диссо-
циирует на два атома.
Таким образом, для каждого разрешенного правилами отбо-
ра электронного перехода может наблюдаться система полос, ин-
тенсивность которых, а следовательно и их число, ограничиваются
принципом Франка — Кондона. Для всех молекул наблюдается
от нескольких до одного-двух десятков систем полос. Теоретиче-
ски же их должно быть еще больше, но интенсивность многих
настолько мала, что они не регистрируются спектральными при-
борами. Если при электронном переходе одно из состояний от-
талкивательное или сильно смещено (еще более, чем, например,
на рис. 1.32,в), то в спектре наблюдается непрерывное поглоще-
ние или испускание.
На рис. 1.29, а приведена одна из систем полос (электронный
переход С2П—X2S) молекулы ВО. Из спектра видно, что предель-
ное значение v'=6, a v" = 4, причем полоса 1—2 не видна, так как
маловероятна по принципу Франка — Кондона. Однако для дру-
гих молекул, например 1г (см. рис. 1.37), можно наблюдать очень
длинные прогрессии вплоть до диссоциационного предела.
Все наблюдаемые в спектрах полосы, принадлежащие одному
электронному переходу, можно представить в виде так называе-
мой таблицы Деландра. Фрагмент такой таблицы для молекулы
11 ВО приведен в табл. 1.4.
Т абл ица 1.4
Фрагмент таблицы Деландра для С2П — системы полос (в см-1)
молекул ПВО и 10 В О (в скобках), приведенной на рис. 1.29
°" У* 0 1 2 3 4
0 55 084,2 (55 077,4) 53 222,2 (53 162,8) 51 383,8 (51 272,1) 49 569,0 (49 407,1) 47 778,4 (47 566,2)
1 56 376,7 (56 406,4) 54 516,2 (54 491,4) — 50 863,5 (50 735,4) 49 067,1 (48 894,3)
2 57 648,2 (57 713,0) 55 789,8 (55 792,5) 53 947,9 (53 908,3) 52 185,6 (52 042,5)
3 58 896,1 (58 994,8) 57 035,1 (57 079,8) 55 169,9 (55 189,6)
4 60 124,7 (60 255,1) 58 261,4 (58 340,0)
В ~табл. 1.4 каждая клетка заполняется значением волнового
числа соответствующего электронно колебательного перехода;
Составление таблицы Деландра сводится фактически к отнесению
наблюдаемых кантов полос (см. рис. 1.29), которые образуют ко-
75
лебательную структуру электронного перехода к тому или иному
переходу и'—и". Расшифровка колебательной структуры элект-
ронных спектров обычно начинается с отыскания перехода 0—О,
относительно которого уже легче найти прогрессии по v' и v"
(см. рис. 1.29, а и 1.30). Каждая прогрессия (продольная и попе-
речная строчка в таблице Деландра) имеет свой мало изменяю-
щийся колебательный интервал, который определяется величиной
первых разностей Дби+[/2 или AGy-f-i/2 (см. уравнение 12.5), за-
висящих в основном от (де и (де. Поэтому полоса 0—0 должна
быть на том месте, где резко меняется «шаг» прогрессии, как это
хорошо видно на рис. 1.29, а и из табл. 1.4. Полосу 0—0 можно
отождествлять и по изотопному эффекту (см. § 14) —для нее он
минимален (см. рис. 1.29, а).
По таблице Деландра можно довольно просто произвести рас-
чет значений и ыехе для основного и возбужденного электрон-
ного состояний и величину электронного возбуждения
^ЭЛ ~ Те Те.
Для определения сое и мехе сначала находятся первые разности
между числами в соседних клетках по горизонтали и вертикали
(см. табл. 1.5). Эти разности соответствуют известной величине
(12-5)
AGo+i/2 = (де — 2о)ехДг/ + 1).
Если вычислить вторые разности, то они соответствуют удвоен-
ной постоянной ангармоничности
Д2б = — 2сое хе,
т. е. все вычисления аналогичны определению и (дехе из коле-
бательных спектров (см. § 12).
Усреднив вторые разности в горизонтальных и вертикальных
рядах, можно определить соответственно <ое хе и (де хе, а затем,
подставляя найденные величины в уравнение первых разностей,
найти также усредненные значения <ое и <ое.
Величину чисто электронного перехода уэл можно вычислить
как среднее из ряда экспериментальных значений vV'V", если в
уравнение (13.2) подставить найденные постоянные сое, юехе и со-
ответствующие значения квантовых чисел v.
Возможен и более общий метод определения молекулярных
постоянных, если воспользоваться ЭВМ и методом наименьших
квадратов вычислить коэффициенты уравнения (13.2), составив
предварительно таблицу Деландра.
Следует заметить, что из-за погрешностей определения кан-
тов полос (см. далее уравнение (13.11)) и некоторых других при-
чин точность определения колебательных частот по кантам полос
не отличается большой точностью и часто составляет величину
порядка 1 см-1 и более.
76
Таблица 1.5
Расчет молекулярных постоянных по таблице Деландра
\ V* V' X 0 Первые разности 1 Первые разности 2 Среднее no строкам
0 *оо п AG,,. / 2 *01 *02
Первые разности AG1/3 AG72 AG‘/2 1!.П — о о о 3 7 < II 1
1 *10 AG, р *л AG3/2 *12 11 1 11 > 1 I > > ,r I ' C) Q О Ю м 4» ч > I 11
Первые разности Д(73/2 ag3/2 AG3/2 AG3/a= -(De- - 4(0^;
2 *20 ч, *21 AG3/2 *22 II 1 II ‘ Q) C> bO ’* * o' 4 II , II 1
Среднее по столб- цам до"/!= tt - - С0е - П ft -^ехс । н X 1 * л 11 01 О ft ft w ft - СЧ о О о I Д* <J <J 1 < II 1 J 1 I1 > »£* o w ft e К i и II । 'I > । > > О w О q °, £ “ « «а II "l Ь
Чтобы рассмотреть тонкую вращательную структуру полос, свя-
занную с изменением вращательных состояний молекул, следует
принять постоянной величину
^эл + 4<ол = AW = v0. (13.4)
Тогда вращательная структура электронно-колебательно-враща-
тельной полосы опишется уравнением
= + • (13.5)
77
которое подобно уравнениям (12.7 и 12.8) в случае колебатель-
но-вращательных спектров.
Для вращательных переходов в электронно-колебательно-вра-
щательных спектрах действуют правила отбора (10.7), (10.8).
Поэтому в общем случае в спектре могут проявляться три ветви:
Р-, Q- и Р-ветви, которые соответствуют Д/ = —1, 0, +1.
Линии каждой ветви имеют свои уравнения
вещь Р: vP = vv-v" — (Bj + Bv) J + (Bv — Bt))J2, (13.6)
ветвь Q: vq = vv‘v» 4 (Bv — Bv) J -k (Bv — Bv) J2, (13.7)
ветвь R: v# = vv>v« + 2BV b (3BV — Bv) J + (Bv — B„) J2,
(13.8)
которые выводятся подобно уравнениям для колебательно-враща-
тельных спектров (см. § 12). Видно, что уравнение для ветвей Р
и Р подобны уравнениям (12.7) и (12.8). Отличие между ними
состоит в том, что vV'V» содержит не только ¥Кол, но и ¥эл, а раз-
ность (Bv—Bv) может принимать как положительные, так и от-
рицательные значения, поскольку межъядерные расстояния в воз-
бужденном электронном состоянии могут быть как больше, так
и меньше, чем в основном состоянии.
Характерным для электронно-колебательно-вращательных
спектров является наличие кантов полос (см. рис. 1.29). Это выз-
вано тем, что абсолютная величина разности Bv —Bv для боль-
шинства электронных переходов значительно больше, чем в коле-
бательных переходах, где канты практически не наблюдаются.
Если (Bv — Bv) < 0, то с ростом J или | т | (см. уравнение
(12.11)) квадратичный член в уравнении (13.8) «обгоняет» ли-
нейный член (3BV — BV)J, и волновые числа линий в Р-ветви по-
степенно перестают возрастать, а затем «поворачивают» в обрат-
ную сторону и начинают уменьшаться. На рис. 1.33 приведена
так называемая диаграмма Фортра, отражающая зависимость по-
ложения линий вращательной структуры от квантового числа /
(или т) для одной из полос молекулы А1Н. На ней хорошо вид-
но, как Р-ветвь поворачивает, образуя кант с оттенением в сто-
рону меньших частот.
Если (Bv — Bv)>0, то кант образуется в Р-ветви, опять-таки
за счет быстрого роста квадратичного члена в уравнении (13.6).
Квантовое число вершины параболы Фортра (канта) легко
получается при дифференцировании общего уравнения ветвей
(12.11), которое может быть распространено на электронно-коле-
бательно-вращательные спектры
4^- = (В- + В") 2(В'—В")ткант. (13.9)
ат
78
Приравняв это выражение нулю, находим
“ 2 (В'— В*) ( Х 0)
Если подставить (13.10) в уравнение (12.11), то получается
расстояние между кантом и нулевой линией
V Т - (В' + В'Г (13 ID
" 4(В'-В')- ( '
Отсюда видно, что положение канта относительно начала по-
лосы определяется в основном величиной (В'—В") и при близких
значениях В' и В" сильно зависит от и. Можно даже наблюдать,
Рис. 1.33. Диаграмма Фортра и спектр полосы 0 — 0 молекулы А1Н
(моногидрид алюминия), для которой (В'—В")<0
как для одной и той же системы полос может произойти измене-
ние направления оттенения полос: при (В'—В") <0 кант будет
со стороны больших частот в ветви R, а при (В'—В")>0 — со
стороны низких частот и в ветви Р. Это может существенно ска-
заться на вычислении колебательных постоянных по кантам.
В Приложении VI для фрагмента таблицы Деландра молеку-
лы CN приведены канты полос и их смещения относительно на-
чала полос vKaHT—v0. Вычисленные по ним колебательные посто-
янные дают в случае
vKaHT • <«><? = 2303, (ое = 2023 см-1,
а
v0: (ое = 2164, [а)е = 2069 см-1,
что совпадает со справочными данными (см. Приложение V).
79
При расшифровке тонкой вращательной структуры электронно-
колебательно-вращательных спектров можно определить враща-
тельные постоянные Bv и Во, а из них и межъядерные расстоя-
ния молекул в основном и возбужденных электронных состояни-
ях, как это делалось в случае колебательно-вращательных спект-
ров (см. § 12).
В случае электронных спектров довольно часто наблюдаются
непрерывные спектры испускания и поглощения, которые связа-
ны с отталкивательными электронными состояниями. Механизм
образования такого непрерывного спектра испускания можно ра-
зобрать на примере молекулы водорода, система потенциальных
кривых которого приводилась на рис. 1.10.
В условиях газового разряда молекулы водорода при столк-
новении с электронами и ионами переходят с различных колеба-
тельных уровней основного электронного состояния Хх5^ в раз-
личные возбужденные электронные состояния, в частности в со-
стояния b3Zt и /i3Sg~ (система обозначений электронных со-
стояний довольно сложна и в данном учебном пособии не рас-
сматривается). При переходе в нестабильное состояние b3%f
молекула диссоциирует на два атома водорода в основном ls-со-
стоянии (см. § 4). При переходе в устойчивое состояние
образуется возбужденная молекула, которая стремится спонтан-
но перейти в более низкое состояние Xх 2^ или b3Xf. Переход
в состояние Xх 5^ дает дискретный спектр, расположенный в об-
ласти около 100 нм, а переход в состояние сопровождается
непрерывным спектром испускания (165—320 нм), так как это
состояние не имеет квантованных уровней. Этот спектр широко
используется в практической спектроскопии в качестве источника
непрерывного спектра испускания для получения на его фоне
спектров поглощения в УФ-области спектра (см. раздел II, § И).
Кроме рассмотренных полосатых спектров испускания и погло-
щения существуют спектры флуоресценции паров двухатомных
молекул, возбуждаемые мощными монохроматическими лампами
или лазерами. Если узкая монохроматическая линия совпадает
с каким-либо электронно-колебательно-вращательным переходом,
разрешенным правилами отбора (см. § 10), то при поглощении
света существенная часть молекул переходит в возбужденное
электронное состояние Е/ с квантовыми числами v' и J'
(рис. 1.34), а оттуда через примерно 10~8 с молекулы спонтанно
переходят в нижележащие состояния согласно- общим правилам
отбора (см. § 10). Если электронный переход относится к типу
2—2, то в спектре будет наблюдаться серия постепенно сходя-
щихся дублетов (см. рис. 1.34). Компоненты дублетов обусловле-
ны линиями Р- и Е-ветвей (согласно правилу отбора Л/ = ±1).
Расстояния между дублетами примерно равны Дбг+1/2. По схож-
дению дублетов в сторону больших длин волн можно определить
80
энергию диссоциации основного состояния молекулы (см. § 15).
Таким образом, наиболее полная информация об энергетиче-
ских состояних двухатомных молекул содержится в электронно-
колебательно-вращательных спектрах. В настоящее время иссле-
Антистоксовы
линии
Стоксовы
линии
Возбуждающая линия
Рис. 1.34. Схема спектральных переходов и спектр резо-
нансной флуоресценции двухатомной молекулы
дованы спектры почти всех окислов, фторидов, гидридов, многих
галогенидов и халькогенидов элементов Периодической системы
элементов. Из примерно 4000 возможных двухатомных молекул
уже иёследовано около 500.
§ 11 ИЗОТОПИЧЕСКИЙ ЭФФЕКТ В СПЕКТРАХ ДВУХАТОМНЫХ МОЛЕКУЛ
В связи с тем что силы взаимодействия между частицами в
молекуле имеют электрическую природу, влияние массы атомов
81
с одинаковым зарядом практически не должно сказываться на
кривой потенциальной энергии, и энергия диссоциации De, отсчи-
тываемая от минимума потенциальной кривой, для изотопозаме-
щенных молекул будет одинаковой (например для НС1 и DC1).
Также практически не сказывается изотопическое замещение и
Рис. 1.35. Энергетические состояния изотопозамещенных молекул (пунктиром
показаны уровни более тяжелых молекул), а — Кривая потенциальной энергии
и положение колебательных уровней, б — положение колебательно-вращатель-
ных уровней
на положении электронных состояний молекулы, т. е. все потен-
циальные кривые изотопозамещенных молекул совпадают.
Однако положение вращательных и колебательных уровней
молекулы и энергия- диссоциации Do, отсчитываемая от «нулево-
го» уровня, существенно изменяются при изотопическом замеще-
нии. Это связано с тем, что в уравнения как колебательной энер-
гии (5.9), так и вращательной энергии (5.10) входят соответствен-
но коэффициенты ме, мехе и Ве, зависящие от приведенной мас-
сы ц.
На рис. 1.35, а показаны колебательные состояния двухатомной
молекулы с приведенной массой ц. На нем же пунктиром обозна-
чены колебательные состояния для более тяжелой изотопической
модификации молекулы с приведенной массой р? (молекулярные
постоянные, относящиеся к более тяжелой молекуле, принято
обозначать индексом «i»). Из рис. 1.35 видно, что энергия диссо-
циации для более тяжелой молекулы больше, чем для легкой.
82
С увеличением колебательного квантового числа разница между
колебательными состояниями изотопозамещенных молекул посте-
пенно увеличивается.
Если обозначить отношение р/рЛ через р2, то легко показать,
что
-V =р< 1.
так как силовая постоянная k — ------ для изотопозаме-
\ дг2 )г=ге
щенных молекул одна и та же. Отношение ангармоничностей
(14.1)
-С-С = р2.
техе
(14-2)
На рис. 1.35,6 приведена схема колебательно-вращательных
состояний для изотопозамещенных молекул. На рис. 1.36 показа-
но изотопное расщепление в колебательно-вращательном ИК-
Рис 1.36. Колебательно-вращательный спектр поглощения молекул Н35С1 и
Н37С1, полученный с большим разрешением для природной (естественной) сме-
си изотопов хлора (35С1— 76%, 3'С1— 24%)
спектре поглощения молекул НО35 и НС137. Изотопический эф-
фект наблюдается и в спектре молекулы СО (см. рис. 1.23). Вра-
щательные состояния для более тяжелой молекулы расположены
ниже, как и в колебательных состояниях, и с увеличением враща-
тельного квантового числа расстояния между уровнями легкой
и тяжелой молекулы возрастают.
Легко показать, что
В'е
~ =Р-
D
(14.3)
83
Для сравнения можно привести следующие молекулярные
стояпные для изотопозамещенных молекул:
по-
Н2 = 4400 см-1 Do = 4,48 эВ Ве - 60,809 см-1.
HD ме = 3820 см-1 Do = 4,51 эВ Ве = 45,655 см-1
Р2 — 3120 см-1 Р0=4,56эВ Ве — 30,429 см-1.
Между минимумом потенциальной энергии и диссоциацион-
ным пределом размещается 14 колебательных уровней для Н2
(см. рис. 1.9) и 21 — для D2.
С увеличением приведенной массы молекулы величина изото-
пических эффектов в спектрах резко уменьшается, так как они
пропорциональны р или р2, а р — 1/ —— •
г И1
На рис. 1.29 приведен пример сдвигов в колебательной струк-
туре электронно-колебательно-вращательного спектра молекулы
ВО.
§ 15. ЭНЕРГИЯ ДИССОЦИАЦИИ ДВУХАТОМНЫХ МОЛЕКУЛ
Энергия диссоциации — очень важная характеристика моле-
кулы, особенно при определении теплот реакций различных хи-
мических процессов. Энергия
диссоциации двухатомных моле-
кул определяется следующими
спектральными методами.
1. По границе непрерывного
спектра, наблюдаемого в элект-
ронно - колебательно - вращатель-
Рис. 1.37. Схема образования не-
прерывного спектра поглощения
12 и определения по нему энер-
гии диссоциации
ных спектрах.
На рис. 1.37 рассмотрен случай,
когда при переходе молекулы
из основного электронного состо-
яния в возбужденное образуется
непрерывный спектр. Согласно
принципу Франка — Кондона
(см. § 13 и рис. 1.32,в) при пе-
реходе молекулы в возбужденное
состояние может произойти дис-
социация и образоваться непре-
рывный спектр. Вид этого спект-
ра показан под схемой потенци-
альных кривых на рис. 1.37. Если
обозначить границу непрерыв-
ного спектра через Vrp, а энергию
возбуждения продуктов диссо-
84
циации через Еат, которая берется из таблиц атомных состояний,
то легко составить уравнение
£>о = vrp — Еат/Яс. (15.1)
Подобным образом можно определить также энергию диссоциа-
ции молекулы в возбужденном состоянии
Do = vrp — v00. (15.2)
Однако непрерывные спектры проявляются далеко не для всех
молекул и поэтому этот метод не всегда применим.
Рис. 1.38. а — Определение энергии диссоциации молекулы Li2 методом графи-
ческой экстраполяции (заштрихованная площадь дает нижний предел Z)Q); б и
в — фрагменты графиков, на которых значения AG отсчитываются от Щ-’/г и
ОТ V
2. Методом . графической экстраполяции (метод Берджа —
Шпонер). Строится график зависимости колебательных интерва-
лов Д<К+1/2 (см. уравнение 12.5) от у-!-1/2, который экстраполи-
руется до пересечения с осью абсцисс. Площадь под этой кривой
имакс
соответствует энергии диссоциации Do = А 1/2 • На
рис. 1.38, а приведена такая кривая для молекулы Ы2-
Из рис. 1.38, б и рис. 1.38, в видно, почему колебательные ин-
тервалы Д<?г+1/2 относятся к о+1/2, а не к v. В последнем случае
энергия диссоциации всегда была бы завышена за счет суммар-
ной площади «избыточных» треугольников.
Этот метод может быть использован для тех молекул, у ко-
торых в электронных спектрах поглощения (например, I2, Вг2 и
т. д.рили спектрах резонансной флуоресценции, возбуждаемых
лазерами -(например, Li2, NaLi и т. д.), наблюдаются «длинные»
серии электронно-колебательных переходов, связанных с высоки-
ми значениями v' или v".
85
(15.3)
3. По приближенной формуле линейной экстраполяции
ш2
De — ----------------------------—
4(i)g хе
Это выражение можно получить исходя из того, что колеба-
тельные интервалы Д6г+1/2 (12.5) линейно зависят от v (если не
учитывается вторая (£>еуе и другие ангармоничности) и стремятся
к нулю при приближении v к своему максимальному значению
<^макс. Поэтому МОЖНО ПРИНЯТЬ, ЧТО
A Gv -|.j /2 — — 2(0^ Хс 2(0 Хе Умакс — О,
откуда
(15.4)
2(йе Хе 2(йе Xg
так как хе < сое.
Подставляя иМакс в выражение для энергии термов (5.9),
можно определить энергию, при которой происходит диссоциация
молекулы
D = G(o„aK) = о>„ / -2^- + 1/2) (—2^ + 1/2? s .
\ 2о)^ хе j \ 2d)g хе /
..2 z,2 ,.2
__ “>e________4? =
2(£)g хе 4a)g xe 4(s)g хе
Следует заметить, что формула (15.3) довольно приближенная
и дает точность около 20%.
§ 16. ЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ МНОГОАТОМНЫХ МОЛЕКУЛ
Как и в случае двухатомных молекул, поведение электронов
и ядер в многоатомной системе, связанной силами электрического
взаимодействия в единое целое, определяется теми же законами
квантовой механики. Стационарным энергетическим состояниям
Ее> Ev и Ет многоатомной молекулы соответствуют свои волновые
функции фР, фи и ф,, причем распределение электронной плотности
пропорционально |фс|2, а ядерная плотность (вероятность обна-
ружить ядро в том или ином элементе объема) пропорциональна
| фгфг |2-
Определение волновых функций многоатомной молекулы еще
более сложная проблема, чем для случая двухатомной молекулы.
Поэтому, чтобы приближенно описать систему энергетических со-
стояний, связанных с ядерной составляющей полной энергии мо-
лекулы, приходится прибегать к представлениям классической
механики, которые позволяют упростить задачу и найти методику
практических расчетов колебательных и вращательных состояний,
если нет сильного взаимодействия между ф<>, ф^ и фг.
86
Ядра в пространстве можно упрощенно представить системой
шариков, связанных пружинками. Шарики совершают около по-
ложения равновесия (минимума потенциальной энергии) слож-
ное колебательное движение с малыми амплитудами колебаний.
Одновременно вся эта система вращается в пространстве вокруг
центра тяжести.
Любое сложное колебательное движение можно рассматри-
вать как суперпозицию сог- ряда гармонических осцилляторов. Та-
кие колебания называются «нормальными». Классическая меха-
ника позволяет рассчитать как частоты нормальных колебаний,
так и направления и величины смещения ядер-шариков, если из
эксперимента или путем оценок известно их расположение в про-
странстве для равновесного состояния и упругие силы (силовые
постоянные) пружинок.
Энергия каждого нормального колебания (о,- квантована и, ес-
ли пренебречь ангармоничностью, выражается, как и для двух-
атомной молекулы, формулой
Е(и() =/1сш((ц( + 1/2), (16.1)
где колебательное квантовое число о» принимает значения 0, 1,
2, 3, .... Полная энергия колебания многоатомной молекулы (си-
стемы, состоящей из i гармонических осцилляторов) равна сумме
энергий их нормальных колебаний
ЗУ—6(5)
E(vi, и2, v3> • • • » vi) =~ hc £ ®((Ц + 1 2). (16.2)
i=i
Число возможных нормальных колебаний соответствует числу
колебательных степеней свободы в системе из N частиц (ато-
мов). Из механики известно, что в системе из N материальных
точек, не лежащих на одной прямой, имеется 3N степени свобо-
ды, из которых 3 степени свободы приходится на поступательное
движение и 3 — на вращательное, т. е. молекула имеет (3/V—6)
колебательных степеней свободы. Линейные молекулы имеют
только две вращательные степени свободы, и для них число ко-
лебательных степеней свободы равно (3N—5).
Таким образом, для любой молекулы можно легко подсчитать
число нормальных колебаний, которые дают серии колебательных
состояний Vi —0, 1, 2, 3, ...
На рис. 1.39 приведена схема образования колебательных со-
стояний для двух нормальных колебаний — о и и сог- Из рисунка
видно, что каждое колебательное состояние с ^ = 0, 1, 2, 3, ...
является началом новой серии состояний с различными значения-
ми £>2 = 0, 1, 2, 3 ... Таким образом, картина колебательного спек-
тра очень усложняется даже для простейшего гипотетического
случая двух нормальных колебаний.
На рис. 1.40 приведен фрагмент схемы колебательных состоя-
ний для трехатомной молекулы, где показаны далеко не все
87
уровни, соответствующие составным частотам типа (у 1(01+^2(02),
(и 1(01+^2(02 + ^3(03) и т. д.
Колебательные состояния многоатомных молекул обозначают-
ся через последовательный ряд колебательных квантовых чисел
соответствующих частот. Например, состояние с ^1 = 0, ^2=1 и
iz2
3
Разностный
составной
переход
и-2
Уг
Обертоны
Основной
переход
Составные
переходы
5-
Рис. 1.39. Схема колебательных состояний для случая двух нормаль-
ных колебаний (щ и «2. Пунктиром показаны повторяющиеся со-
стояния
9--------
8-------
7-------
6-------
5-------
4-------
3-------(300)
2-------(200)
1------(100)
О-------------
3-------(030)
-------(020)
*-------(010)
6-------
5-------
4-------
3-------(003)
2-------(002)
1------(001)
6-------
5-------
4-------
3-------(013)
2-------(012)
1------(011)
о-------------
6-------
5-------
Ч-------
3------(023)
2------(022)
J------(021)
О------------
5-------
Ч-,-----
3-------(ИЗ)
2------(112)
1-----(111)
О-------
---------(ООО)
l/jCU,
U3(xJj (j-}z + vr3O>3 ci)j +Ujiijj u)i +(о?* V3CU3
Рис. 1.40. Фрагмент схемы колебательных состояний для трехатомной
молекулы. Пунктиром показаны повторяющиеся состояния. В скобках
приведено обозначение термов
и3=0 обозначается как состояние 010, а основное состояние —
как ООО.
Многоатомная молекула, вращаясь вокруг центра тяжести,
имеет в общем случае три главных момента инерции 1А, 1В, 1С-
В зависимости от того, каковы соотношения между моментами
инерции, все молекулы можно разделить на следующие типы:
88
1) молекулы типа сферического волчка (СН4, UFe), когда
1л — 1в — ^с',
2) молекулы типа симметричного волчка (BF3, NH3),
когда 1А = 1в^1с,
3) молекулы типа асимметричного волчка (Н2О, NO2),
когда 1а^1в^=1с,
4) линейные молекулы (СО2, С2Н2), когда 1а = 1в и 1с = $-
Соответственно типу молекулы уравнения термов вращатель-
ной энергии многоатомной молекулы должны содержать враща-
тельные постоянные А, В, С, в которые входят моменты инерции
1л, 1в> 1с Для простейшего случая линейной многоатомной мо-
лекулы уравнение вращательных термов имеет вид
F(J) = BVJ(J+ 1), (16.3)
который совпадает с уравнением термов для двухатомной моле-
кулы (11.4). Для линейных многоатомных молекул
/8 = Ш (16.4)
где Mi — масса /-го атома, гг — расстояние от z-ro атома до
центра тяжести молекулы. Такой же вид уравнения термов и для
сферического волчка. Остальные типы молекул имеют более
сложные уравнения термов, особенно молекулы типа асимметрич-
ного волчка (см. [7, 8]).
Если учесть, что многочисленные колебательные состояния со-
держат свои наборы вращательных состояний (кроме того, мо-
лекула может иметь еще много электронных состояний), то ста-
новится ясным, что общая система энергетических состояний
многоатомных молекул чрезвычайно сложна. Правда, правила от-
бора несколько упрощают картину спектра, но опа остается все
же очень сложной.
§ 17. ВРАЩАТЕЛЬНЫЕ И КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ
МНОГОАТОМНЫХ МОЛЕКУЛ
Чисто вращательные спектры многоатомных молекул иссле-
дуются методами микроволновой радиоспектроскопии. Большие
аппаратурные трудности и сложность расшифровки спектров пока
ограничивают круг молекул, для которых достаточно хорошо изу-
чены вращательные спектры.
Чисто колебательных спектров многоатомных молекул не су-
ществует. Из-за большой заселенности нижних вращательных со-
стояний всегда наблюдаются колебательно-вращательные спектры.
Как и в двухатомных молекулах, каждое колебательное состоя-
ние имеет свой собственный (и довольно сложный в случае асим-
метричного волчка) набор вращательных состояний. Поэтому ко-
лебательно-вращательпые спектры многоатомных молекул имеют
весьма сложную структуру. При недостаточно высокой разрешаю-
щей способности спектральных приборов вращательную структуру
89
многоатомных молекул в газовой фазе разрешить не удается, и в
спектре наблюдается только ее общий контур в виде широкой
полосы. Поэтому в дальнейшем вращательные состояния много-
атомных молекул рассматриваться не будут. В конденсированной
фазе из-за .межмолекулярного взаимодействия, приводящего к
смещению и уширению линий, вращательная структура вообще
отсутствует.
Правила отбора при переходе многоатомных молекул из одно-
го колебательного состояния в другое осуществляются как по
квантовым числам Auj= 1, 2, 3..., так и по активности колебаний
в ПК- и КР-опектрах (см. § 10). Если при нормальном колебании
происходит такое движение ядер, что частная производная от соб-
ственного дипольного момента молекулы ц по нормальной коор-
динате Qi
(д ц
~dQi
Q.= o
(17.1)
то это колебание наблюдается (активно) в ИК-спектре погло-
щения.
Нормальные координаты Qi являются линейной комбинацией
естественных координат qi (т. е. изменений межъядерных рас-
стояний и углов по отношению к равновесному состоянию) и вы-
бираются таким образом, чтобы выражение для потенциальной и
кинетической энергии содержало только квадратичные члены,
например:
V — — k1± ql -j — k22 4 ^12^1^2
и
V = A K1Ql+±KiQl
Если при том или ином нормальном колебании частная производ-
ная от поляризуемости молекулы а по координате Qi не равна
нулю:
f—у=0, (17.2)
\ dQi )q.=o^
то это колебание наблюдается (активно) в КР-спектре.
Таким образом, чтобы получить полный набор нормальных
колебаний (а следовательно, и положение колебательных уровней
энергии) многоатомной молекулы, необходимо изучить ее ПК- и
КР-апектры.
Каждому нормальному колебанию соответствуют определенные
смещения атомов из положения равновесия. Рассмотрим в качест-
ве простейшего примера формы колебаний трехатомных моле-
кул— линейной молекулы СОг (рис. 1.41) и угловой молекулы
НгО (рис. 1.42), для которых соответственно должно быть четыре
90
и три нормальных колебания. Пунктиром показаны смещения в
противофазе, а длина стрелок пропорциональна величине смеще-
ния из положения равновесия.
Для трехатомных молекул принято называть колебание vi—
полносимметричным или симметричным валентным колебанием,
Е
о 0,= 1337см-'
_} 1337СМ-'
667см~'
j)j = 23*>9 см
23Ь9 см~'
спектр
1000 2000 см'1
кр-спектр
Рис. 1.41. Формы нормальных колебаний, система уровней ь спектр молеку-
лы СОг
Е
так как колебание совершается вдоль направления линии, соеди-
няющей ядра, или близко к ней; V2 — деформационным колеба-
нием, так как колебание направлено перпендикулярно к линии,
соединяющей ядра, и V3 — антисимметричным валентным колеба-
нием. Для молекулы СОг имеются два колебания V2 'в двух взаим-
но перпендикулярных плоскостях. Поскольку их формы совпадают,
то и их частоты должны быть одинаковыми, т. е. колебание яв-
ляется” дважды вырожденным. В нелинейных молекулах ни одна
форма колебаний не является чисто валентной или деформацион-
ной (см. рис. 1.42) —эти названия во многом условны.
91
Кэ'к уже отмечалось, в ИК-спектрах проявляются не-все воз-
можные частоты нормальных колебаний, а только те, при которых
(~dQ- )<?•—о ~ Соответственно в КР-спектрах активны те коле-
i)j= 3652см'1
E
___} 1596см'1
^$3 = 3756 CM'1
ИК- спектр
WOO
Рис. 1.42. Формы нормальных колебаний,
кулы НгО
2000 3000 4000 СМ'1
HP- спектр
система уровней и спектр моле-
E
E
бания, для которых о^ьО.
люстрируется на примере молекул
1.42).
Это правило активности ил-
СОг и НгО (см. рис. 1.41 и
92
Рис. 1.43. Графическое изоб-
ражение возможных вариан-
тов изменения дипольного мо-
мента ц и поляризуемости а
молекулы в зависимости от
смещения ядер из положения
равновесия по нормальной ко-
ординате Q.
На рис. 1.43 показаны графики возможных вариантов измене-
ния дипольного момента или поляризуемости в зависимости ог
изменения нормальной координаты Qi. Например, в случае моле-
кулы СОг при полносимметричном колебании vi дипольный мо-
мент не изменяется при изменении Qi (кривая 1 на рис. 1.43),
и поэтому это колебание не проявляется в ИК-епектре, так как
/_дн_\ — q Однако поляризуемость (степень деформации
\ dQi / Qr=o
электронной оболочки относительно ядер) изменяется соответ-
ственно кривой 2 (см.рис. 1.43), где нет минимума! -г~) #0,
\ dQi / Qi 0
и поэтому колебание vi активно в КР-спектре. При антисим-
метричном колебании V3 дипольный
ственно кривой 3, а поляризуе-
мость соответственно кривой 4.
Поэтому колебание v3 активно в
ИК-спектре и неактивно - в КР-
спектре. Подобным же образом
можно показать, что деформаци-
онное колебание активно в ИК-спек-
тре и неактивно в КР-спектре.
Существует так называемое
правило альтернативного запрета,
согласно которому у молекул, име-
ющих центр симметрии, колеба
ния, активные в ИК-спектре, неак-
тивны в КР-спектре, и наоборот.
В нелинейных трехатомных мо-
лекулах, например Н2О (см.
рис. 1.42), все колебания активны
как в ИК-, так и КР-спектрах
По активности колебаний можно
судить о симметрии мюлекулы,
например, линейны они или нет,
как для молекул СО2 и Н2О.
Все рассмотренное существенно
усложняется при переходе к
молекулам с большим числом ато-
мов.
В своей практической работе химики в основном имеют дело
со сложными молекулами в конденсированной фазе, где враща-
тельной структуры не наблюдается, а многочисленные колеба-
тельные полосы имеют ширину порядка нескольких см-1.
На рис. 1.44 приведены ПК- и КР-спектры, 1,3,5-триметилбен-
зола ц. одном масштабе, чтобы иллюстрировать колебательные
спектры и активность отдельных колебаний.
В сложных молекулах большие затруднения вызывает отнесе-
ние наблюдаемых полос к той или иной форме колебаний, а также
93
отделение основных полос от обертонов и составных частот. Одна-
ко, несмотря на это, колебательные спектры дают обширную ин-
формацию о строении молекул.
h/i
100
шо гооо 2ооо
1000 500
200 СМ
Рис. 1.44. ИК- и КР-спектры 1, 3, 5-триметилбензола, зарегистрированные
на одном бланке
§ 18. ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ МНОГОАТОМНЫХ МОЛЕКУЛ
При воздействии видимого или ультрафиолетового излучения
на вещество молекулы переходят из основного электронного со-
стояния Ео в более высокие энергетические состояния Е\, Е2,
Е3,...,Еп. Каждый такой переход сопровождается также измене-
нием колебательных и вращательных состояний. Образующиеся
электронные спектры поглощения во многом похожи на элек-
тронно-колебательно - вращательные
Рис. 1.45. Электронные спек-
тры поглощения растворов
бензола и пиридина
спектры двухатомных молекул, но
они гораздо сложнее и для них ча-
ще наблюдаются области непре-
рывного поглощения из-за много-
численных отталкивательных элект-
ронных состояний. Расшифровка
вращательной структуры таких
спектров и определение по ним
молекулярных постоянных является
очень сложной проблемой, кото-
рая решена для довольно ограни-
ченного круга соединений.
Поэтому при исследовании га-
зовой фазы и сильно разбавлен-
ных растворов чаще ограничива-
ются расшифровкой ' колебатель-
ной структуры наблюдающихся
электронных переходов. В элект-
ронно-колебательных спектрах, со-
гласно правилам отбора, прояв-
ляется только часть нормальных
94
колебаний молекулы (обычно они связаны с полносимметричны-
ми и деформационными колебаниями).
В растворах колебательная структура проявляется довольно
редко, чаще наблюдаются широкие полосы, связанные с электрон-
ным переходом (рис. 1.45). По ним можно судить в основном
только об энергии электронных состояний, информация же о час-
тотах колебаний очень ограничена. В этих случаях необходимо
исследовать ИК- и КР-спектры.
В многоатомных молекулах переход в возбужденное электрон-
ное состояние связан не только с изменением межъядерных рас-
стояний (как в двухатомных молекулах), но и сопровождается
изменением их формы. Например, молекула ацетилена из линей-
ной конфигурации Н—С^С—Н переходит в нелинейную транс-
Н
конфигурацию С=С . Подробнее об электронных спект-
Н
рах многоатомных молекул см. [2—6, 9, 18].
§ 19. ХАРАКТЕРИСТИЧНОСТЬ ЧАСТОТ КОЛЕБАНИЙ
И ЭЛЕКТРОННЫХ ПЕРЕХОДОВ
До сих пор при расомотрении различных типов спектров основ-
ное внимание уделялось энергетическим состояниям молекул и
методам определения молекулярных постоянных из спектров, что-
бы с их помощью описать наиболее точно всю систему уровней
в молекуле. Знание энергетических состояний молекулы позволяет
не только понять ее строение, но рассчитать методами статисти-
ческой термодинамики различные термодинамические характери-
стики газовой фазы.
Не менее важны для химии и другие применения молекуляр-
ной спектроскопии, в частности использование характеристичности
частот колебаний и электронных переходов для определения со-
става молекул.
Любая молекула имеет свой, только ей присущий колебатель-
ный спектр, состоящий из набора полос разной частоты и интен-
сивности. Это свойство широко используется в химии для иденти-
фикации всего обширного круга различных химических соедине-
ний. В настоящее время имеются атласы и автоматизированные
картотеки спектров, с помощью которых можно отождествить лю-
бое соединение, если оно было раньше известно, и для него полу-
чен колебательный спектр. Таким образом, колебательные спект-
ры являются как бы паспортом химических соединений. Действи-
тельно, каждая молекула имеет свой набор колебательных
энергетических состояний и поэтому переходы между ними долж-
ны иметь спектр, характерный только для данного соединения.
95
Эти свойства спектров широко используются для целей идентифи-
кации веществ.
Однако, несмотря на такие различия в спектрах, в них имеют-
ся и некоторые общие черты. Если рассматривать колебательные
спектры (ИК-спектры поглощения и КР-спектры) родственных со-
единений, содержащих в своей структуре одинаковые структурные
элементы, то в спектрах можно выделить частоты нормальных
колебаний, которые характерны только для той или иной группи-
ровки атомов. Такие колебательные частоты называются харак-
теристическими.
Например, для гидроксильной группы —ОН в спиртах харак-
терны широкие полосы поглощения в области 3100—3500 см-1, для
карбонильной группы характерны полосы в области
1600—1800 см-1, для ароматических соединений и соединений с
сопряженной связью характерны полосы в области 1500—1600см-1
и т. д. По характеристическим полосам можно судить о месте
замещения в бензольном кольце. Отсутствие в спектре какого-
либо поглощения в области характеристической полосы говорит
о том, что исследуемое соединение не может относиться к дан-
ному классу. Например, отсутствие поглощения в области 1600—
1800 см-1 говорит о том, что в молекуле пет карбонильной группы.
Для подобного рода анализа органических соединений сущест-
вуют специальные корреляционные таблицы, которые приведены
в Приложении XIV.
Таким образом, колебательные спектры позволяют химикам
не только идентифицировать химические соединения, по и, ис-
пользуя характеристичность ряда частот, проводить структурно-
групповой (функциональный) анализ ‘довольно сложных органи-
ческих соединений.
Электронные спектры поглощения менее характеристичны, но
и они могут использоваться для целей идентификации и структур-
но-группового анализа многих классов соединений. Электронные
спектры выгодно отличаются от колебательных спектров погло-
щения тем, что их интенсивность больше и поэтому они чаще ис-
пользуются для количественных определений в аналитической
химии. Этому же способствует и простота работы с ними. Элект-
ронные полосы довольно характеристичны не только по частоте
(положению в спектре), но и по интенсивности, однако их боль-
шая ширина в конденсированной фазе ухудшает характеристич-
ность.
Электронные спектры всегда характеризуются двумя парамет-
рами: Хмакс — длина волны максимума полосы поглощения и
£макс — молярный коэффициент поглощения в максимуме полосы
поглощения (см. также § 20).
Насыщенные углеводороды, спирты и простые эфиры имеют
электронные полосы поглощения в вакуумной УФ-области и по-
этому широко используются в качестве растворителей при иссле-
96
дованиях электронных спектров поглощения других соединений
в области 186—2500 нм, в которой обычно работают серийные
с пе ктр оф ото метры.
Изолированные функциональные группы, не сопряженные с
другими подобными группами, называют хромофорами, если они
проявляют характеристическое поглощение в видимой и УФ-об-
ластях. Характеристики ХМакс и еМакс ряда простых и сопряженных
хромофорных групп имеются в справочной литературе.
Используя электронные спектры поглощения совместно с коле-
бательными ИК- или КР-спектрами, можно довольно точно делатп
выводы о функциональных группах, входящих в состав исследуе-
мого вещества.
§ 20. ЗАКОНЫ СВЕТОПОГЛОЩЕНИЯ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
ПО СПЕКТРАМ ПОГЛОЩЕНИЯ
В основе количественного молекулярного анализа по спектрами
поглощения (электронным и ИК) лежит закон Бугера—Ламбер-
та—Бера, который связывает интенсивности света, падающего на
вещество и прошедшего его, с концентрацией вещества и толщи-
ной поглощающего слоя. Эта связь выражается следующим урав-
нением:
4 = /»^-°^, (20.1)
где /ох — интенсивность света с длиной волны X, падающего на
вещество; /х —интенсивность света с длиной волны л, прошед-
шего вещество; а% —коэффициент поглощения для данной длины
волны (л/моль см); с — концентрация вещества (моль/л); b —
толщина поглощающего слоя (см).
Таким образом, с увеличением толщины слоя или концентра-
ции вещества интенсивность света, вышедшего из вещества, убы-
вает по экспоненциальному закону. Например, поток /х ослаб-
ляется по сравнению с Ах в ё~а^Ьс раз.
Отношение/х//ох = называется пропусканием и выражается
обычно в процентах. Из закона Бугера—Ламберта—Бера следует,
что пропускание вещества Тх не зависит от интенсивности .падаю-
щего света, по является функцией длины волны. Подстрочный
индекс X обычно опускают.
Для практических целей удобнее логарифмическая форма за-
кона Бугера—Ламберта—Бера:
>l=lgy = lg-^-^ete, (20.2)
где А — оптическая плотность; е = 0,4343а— коэффициент погаше-
ния или экстинкция. К сожалению, единой твердо установившейся
терминологии пока пет. Часто е называют также молярным коэф-
фициентом поглощения, и тогда его не надо путать с а\ .
В этой форме суть закона Бугера—Ламберта—Бера состоит
в том, что оптическая плотность вещества прямо пропорциональна
4 А. А. Мальцев
97
концентрации вещества, толщине поглощающего слоя и коэффи-
циенту погашения (или поглощения).
Следует подчеркнуть, что коэффициент е в максимуме полосы
поглощения (или вообще его функция от длины волны) является
такой же молекулярной постоянной, как и все ранее рассматри-
вавшиеся. Величина е не зависит от концентрации вещества и тол-
щины поглощающего слоя. Это свойство используется (как и
характеристические частоты) для идентификации различных сое-
динений по их электронным спектрам поглощения.
Обычно величина е относится к максимуму полос поглощения.
В зависимости от соединения в может меняться в широком диа-
пазоне, начиная с 0 и до 103— 105.
Закон Бугера—Ламберта—Бера выполняется далеко не всегда.
Отклонения связаны обычно либо с химическим или межмолеку-
лярным взаимодействием растворенного вещества, либо с инстру-
ментальными ошибками, когда полосы поглощения уже или срав-
нимы с выделяемым щелью монохроматора спектральным интер-
валом длин волн.
Например, в системах, связанных с окислами азота, могут обра-
зовываться димерные молекулы N2O4, поглощение которых отлича-
ется от поглощения NO2, поэтому при изучении концентрационных
зависимостей будет наблюдаться отклонение от закона Бугера —
Ламберта — Бера, если не учитывать наличие молекул N2O4.
В этой же системе могут быть отклонения от линейной зави-
симости и из-за неправильно выбранной ширины щели регистри-
рующего монохроматора. Например, когда щели широкие, интен-
сивность полос в максимуме понижается и оптическая плотность
с увеличением концентрации вещества не дает линейной зависи-
мости. Если же щели узкие, то начинает проявляться вращатель-
ная структура и опять получается нелинейная зависимость опти-
ческой плотности полос от концентрации. При очень низких дав-
лениях вещества избежать инструментальных ошибок в спектрах
поглощения практически невозможно.
Наиболее существенны инструментальные искажения спект-
ральных линий при работе в ИК-области спектра, где спектраль-
ный интервал, выделяемый монохроматором, велик из-за малой
чувствительности приемников, а собственная ширина колебатель-
ных полос поглощения мала. Поэтому количественный анализ на
призменных ИК-спектрофотометрах довольно сложен и проводит-
ся по градуировочным графикам.
Точность количественных измерений резко падает, если изме-
ряемое пропускание образца выходит за пределы 10—85% (опти-
ческая плотность 0,07—1,00). Поэтому при большом поглощении
необходимо уменьшить либо концентрацию вещества, либо тол-
щину поглощающего слоя.
Таким образом, молекулярная абсорбционная спектроскопия
позволяет по зависимости пропускания (или коэффициента про-
пускания) от волнового числа (или длины волны) определять
98
качественный состав вещества, а измерение пропускания (или оп-
тической плотности) при известном коэффициенте поглощения и
толщине поглощающего слоя дает возможность определять коли-
чественный состав вещества.
В качестве дополнительной литературы к разделу I можно
рекомендовать [7—13, 16—18].
КОНТРОЛЬНЫЕ ВОПРОСЫ К РАЗДЕЛУ I
Серия 1 (§ 2, 5, 8, 9)
1/1. В каких единицах измеряются волновые числа?
1) см; 2) с-1; 3) см-1; 4) мкм.
2/1. В каких единицах обычно выражаются термы (энергетические
состояния) в молекулярной спектроскопии?
1) см; 2) с-1; 3) см-1; 4) мкм.
3/1. Как связано волновое число с длиной волны?
А ДХ
!'• = —; 3)Av = ——;
he X2
2) V = ; 4) V — ——.
^вак Л'вак
4/1. В каких областях спектра проявляются переходы между вра-
щательными состояниями молекулы?
1) В УФ-, видимой и близкой ИК-областях.
2) В ИК-области.
3) В микроволновой и длинноволновой ИК-областях.
4) Во всех областях спектра, кроме УФ-области.
5/1. В каких областях спектра проявляются переходы между ко-
лебательными состояниями молекулы?
1) В УФ-, видимой и близкой ИК-областях.
2) Во всех областях спектра, кроме УФ-области.
3) В микроволновой и длинноволновой ИК-областях.
4) В ИК-области.
6/1. В каких областях спектра проявляются переходы между
электронными состояниями молекулы?
1) В ИК-области.
2) В УВИ-области.
3) В микроволновой и длинноволновой ИК-областях.
4) Во всех областях спектра, кроме УФ-области.
7/1. В каких областях спектра проявляются 'переходы между
электронными, колебательными и вращательными состояниями
молекул?
1) Колебательные — в ИК-области, вращательные — в УВИ-
области, электронные — в микроволновой.
2) .Колебательные — в микроволновой, электронные в УВИ-
области, вращательные—в ИК-области.
3) Колебательные — в ИК-области, вращательные — в микро-
волновой, электронные — в УВИ-области.
4*
99
4) Колебательные — в УВИ-области, электронные — в ИК-об-
ласти, электронные — в микроволновой.
8/1. Какова примерно энергия в (см-1) для электронных состоя-
ний молекулы (см-1)?
1) 0,1 —200; 3) 10000—100000;
2) 50 — 4000; 4) 10— 100000.
9/1. Каково соотношение между энергиями электронных Ее, коле-
бательных Ег, и вращательных Ег состояний молекулы?
1) Ee>Ev>Er‘, 3) Er>Ee>Ev-,
2) Ev>Er>Ee-t 4) Er>Ev>Ee.
10/1. Какова примерно энергия для первых вращательных состоя-
ний молекулы (в см-1).
1) 10— 100000; 3) 10000—100000;
2) 50 — 4000; 4) 0,1 — 200.
11/1. Какова примерно энергия для первых колебательных состоя-
ний молекулы (в см-1)?
1) 0,1 —200; 3) 50 — 4000;
2) 10 000— 100 000; 4) 10— 100 000.
12/1. Как изменяются расстояния между колебательными термами
молекулы с увеличением вращательного квантового числа?
1) Закономерно уменьшаются.
2) Закономерно увеличиваются.
3) Не изменяются.
4) Имеют очень сложную зависимость и кажется, что носят
произвольный характер.
13/1. Как изменяются расстояния между вращательными термами
молекулы с увеличением вращательного квантового числа?
1) Закономерно уменьшаются.
2) Закономерно увеличиваются.
3) Не изменяются.
4) Имеют очень сложную зависимость и кажется, что носят
произвольный характер.
14/1. Как изменяются расстояния между колебательными термами
молекулы при приближении к диссоциационному пределу?
1) Не изменяются.
2) Имеют очень сложную зависимость и кажется, что носят
произвольный характер.
3) Закономерно уменьшаются.
4) Закономерно увеличиваются.
15/1. Как изменяются расстояния между электронными термами
молекулы с увеличением электронной энергии?
1) Имеют очень сложную зависимость и кажется, что носят
произвольный характер.
2) Закономерно увеличиваются.
3) Не изменяются.
4) Закономерно уменьшаются.
100
16/1. На рисунках приведена схема энергетических состояний
двухатомной молекулы (расстояние между электронными состоя-
ниями Е' и Е" очень сильно уменьшено). Какие переходы, указан-
ные стрелками, соответствуют спектрам комбинационного рас-
сеяния?
17/1. На рисунках приведена схема энергетических состояний
двухатомной молекулы (расстояние между электронными состоя-
ниями Е' и Е" очень сильно уменьшено). Какие переходы, указан-
ные стрелками, соответствуют спектрам резонансной флуорес-
ценции?
101
18/1. На рисунках приведена схема энергетических состояний
двухатомной молекулы (расстояние между электронными состоя-
ниями Е' и Е" очень сильно уменьшено). Какие переходы, указан-
ные стрелками, соответствуют электронным спектрам испускания?
19/1. На рисунках приведена схема энергетических состояний
двухатомной молекулы (расстояние между электронными состоя-
ниями Е' и Е" очень сильно уменьшено). Какие переходы, указан-
ные стрелками, соответствуют инфракрасным спектрам погло-
щения?
102
20/1. Как изменяется относительная заселенность Ni/N0 враща-
тельных состояний молекулы с увеличением вращательного кван-
тового числа J?
1) Возрастает.
2) Уменьшается.
3) Не изменяется.
4) Проходит через максимум.
21/1. Как изменяется относительная заселенность NJNq колеба-
тельных состояний молекулы с увеличением колебательного кван-
тового числа v?
1) Уменьшается.
2) Возрастает.
3) Проходит через максимум.
4) Не изменяется.
22/1. Как изменяется относительная заселенность Ni/No колеба-
тельных состояний молекулы с повышением температуры?
1) Не изменяется.
2) Уменьшается.
3) Возрастает.
4) Проходит через максимум.
23/1. Как перераспределяется заселенность вращательных состоя-
ний молекулы с повышением температуры?
1) При малых J растет, а при больших J падает.
2) Не изменяется.
3) Для всех состояний растет.
4) При малых J уменьшается, а при больших J увеличи-
вается.
24/1. Переходы между электронными состояниями молекул прояв-
ляются в ультрафиолетовой и видимой областях спектра примерно
от 100 до 1000 нм. Какова примерно энергия этих переходов в см-1?
1) 10000—100000; 3) 100— 1000;
2) 10—100000; 4) 10—100.
25/1. Переходы между вращательными состояниями молекул про-
являются в далекой ПК- и микроволновой области спектра при-
мерно от 50 до ЮОООО мкм. Какова примерно энергия этих пере-
ходов в см-1?
1) 10— 100000; 3) 0,1 —200;
2) 50 — 4000; 4) 10000 — 200000.
26/1. Переходы между колебательными состояниями молекул про-
являются в ИК-области (примерно от 50 до 4000 см-1).
Какова спектральная область этих переходов в мкм?
1) 5000 — 400000; 3) 0,25 — 20;
2) 250 — 200; 4) 2,5 — 200.
103
Серия 2 (§ 10—13)
1/2. Каковы правила отбора для переходов между колебательны-
ми состояниями в случае ИК-спектров поглощения двухатомных
молекул?
1) Да = v' — v" = 4~ 1, I 2> + 3, ...
2) Ди = v’ — и* — 0, ± 1.
3) Да = а' — а" = 0, 4 1.
4) Да — а' — а" = 0, ± 1, ±2, ± 3,. ..
2/2. Каковы правила отбора для переходов между колебательными
состояниями полосатых (электронно-колебательно-вращательных)
спектров двухатомных молекул?
1) Да = а' — а" = -j- 1, , - 2, ' 3, ...
2) Да ~ а' — а" = 0, ± 1.
3) Да = а' —а" = 0, ±2.
4) Да — а' — а" = 0, ± 1, ±2, ± 3, ...
3/2. Каковы правила отбора для переходов между вращательными
состояниями двухатомных молекул в случае спектров поглощения
в далекой ИК-области?
1) д/= = 0, 4 1.
2) Д/ = // —Г = 0, ±1.
3) Д/ = — = - 1.
4) Д/ = /'—J* —0, ± 1, ±2, ±3, ...
4/2. Каковы правила отбора для переходов между вращательными
состояниями двухатомных молекул в случае колебательно-враща-
тельных спектров поглощения?
1) = J' — J” = ± 1, ±2, ±3, ...
2) AJ -Z — Г- ± 1.
3) ДУ- J' —J" = 0, ±2.
4) = Г = 0, ±1.
5/2. Каковы правила отбора для переходов между вращательными
состояниями двухатомных молекул в случае вращательных КР-
спектров?
1) Д/ = Г—Г- ± 1.
2) Д/ = /'—J* = 0, ±2.
104
3) AJ = J' — J" = 0, +2.
4) A<7 — J' —‘J" — 0, -4- 1, +2, -4-3, ...
6/2. Каковы правила отбора для переходов между колебательными
состояниями в КР-спектрах?
1) Аи = v' —v = 4- 1.
2) Да = v' — v" = 0, 4-2.
3) Аи = и' —у" = 0, 4-1, 4-2, 4-3, ...
4) Аи = и' — = ±1, ±2, +3, ...
7/2. Каковы правила отбора для переходов между вращательными
состояниями двухатомных молекул в случае колебательно-враща-
тельных КР-слектров?
1) AJ = J'—Г-±1.
2) AJ = J' — J" = 0, ±2.
3) = = 4- 2.
4) AJ = J'—J" = 0, ±1, ±2, ±3, ...
8/2. Чем ограничиваются правила отбора Ау = 0, ±1, ±2, ±3...
в случае электронно-колебательно-вращательных спектров?
1) Ничем не ограничиваются.
2) Принципом Паули.
3) Заселенностью состояний.
4) Принципом Франка-Кондона.
9/2. Зависит ли сумма по состояниям (а следовательно, и термо-
динамические функции) от-правил отбора?
1) Зависит.
2) Не зависит.
3) Зависит только ее электронная составляющая.
4) Зависит только ее вращательная составляющая.
10/2. Проявляются ли (активны) колебания неполярных двухатом-
ных молекул (например N2) в ИК-спсктрах и спектрах КР?
1) Проявляются только в ИК-спектрах.
2) Проявляются только в спектрах КР.
3) Проявляются и в ИК- и в КР-спектрах.
11/2. Проявляются ли (активны) колебания полярных двухатом-
ных молекул (например НС1| в ИК-спектрах и спектрах КР?
1) Проявляются только в ИК-спектрах.
2) Проявляются только в КР-спектрах.
3) Проявляются в ИК-спектрах и в спектрах КР.
4) Не'проявляются ни в ИК-спектрах, ни в спектрах КР.
12/2. Каково выражение для термов вращательной энергии двух-
атомной молекулы?
105
О ®Л»+ 1/2)-—“Л(у+ 1/2)2 + BJV(J + 1).
2) B/(J+1).
3) De(l — e~₽(r~^)2.
4) ©Ди + 1/2)— члДа-г 1/2)2.
13/2. Каково выражение для термов колебательной энергии двух-
атомной молекулы?
1) Ми + 1/2) —со^хДу-г 1'2)2.
2) BDJ(J+ 1).
3) De(l— е“Р(г"^)2.
4) ®Ду+ 1/2)1/2)2 4-Bv/(<7 + 1).
14/2. Каково выражение для термов колебательно-вращательной
энергии двухатомной молекулы?
1) DJ1 — е-₽(г“^)2.
2) (ое (v + 1/2) — (v + 1/2)2.
3) МН- 1/2)-<мД» + l/2)2 + B/(J+ 1).
4)ВД(У+1).
15/2. Каково выражение для термов электронно-колебательной
энергии двухатомной молекулы?
1) Лл + Мя-1- 1/2) — со^агДуч- 1/2)2.
2) De(\—
3) Тм + <»,(»+ 1/2)-ол(»+ 1/2)г + В„/(/+ 1).
4) «,(«+ 1/2) — ®А(»+ l/2)2 + B/(J+ 1).
16/2. Как изменяются расстояния между линиями вращательной
структуры в электронно-колебательно-вращательных спектрах с
увеличением вращательного квантового числа J?
1) Расстояния между линиями равны 2В и не зависят от I.
2) Расстояния в Р-ветви увеличиваются, а в Р-ветви умень-
шаются.
3) Расстояния в Р- и Р-ветвях увеличиваются.
4) Расстояния в одной ветви (Р или Р) увеличиваются, а в
другой (Р или Р) сначала уменьшаются до нуля, а затем также
увеличиваются.
17/2. Как изменяются расстояния между линиями вращательной
структуры в колебательно-вращательном спектре'с увеличением
вращательного квантового числа J?
1) Расстояния между линиями равны 2В и не зависят от /.
106
2) Расстояния в Р-ветви увеличиваются, а в Р-ветви — умень-
шаются.
3) Расстояния в Р-ветвях, уменьшаются, а в Р-ветви увели-
чиваются.
4) Расстояния в Р- и Р-ветвях увеличиваются.
18/2. Как изменяются расстояния между линиями чисто враща-
тельного КР-спектра двухатомной молекулы (в приближении
жесткого ротатора) при увеличении вращательного квантового
числа 7?
1) Расстояния между линиями равны 4В и не зависят от J.
2) Расстояния между линиями увеличиваются.
3) Расстояния между линиями равны 2В и не зависят от J.
4) Расстояния между линиями уменьшаются.
19/2. Как изменяются расстояния между линиями чисто враща-
тельного ИК-спектра поглощения (в приближении жесткого рота-
тора) при увеличении вращательного квантового числа 7?
1) Расстояния между линиями равны 4В и не зависят от J.
2) Расстояния между линиями увеличиваются с ростом 7.
3) Расстояния между линиями равны 2В и не зависят от J.
4) Расстояния между линиями уменьшаются.
20/2. Каковы расстояния между линиями с одинаковыми значения-
ми J во вращательном спектре молекул HF и NO? Вращательная
постоянная В у HF больше, чем у NO.
1) Одинаковы.
2) У HF больше.,
3) У HF меньше.
4) Для малых J больше у HF, а для больших J больше у NO.
21/2. Для молекулы СО основная частота колебаний <л>е=2170 см*1,
а ее ангармоничность (&схе= 15 см*1. Определите положение цент-
ров полос в колебательном спектре для основного перехода и
первого обертона в см*1.
1) v - 2140; 2v = 4280;
2) V-2110; 2v = 4250;
3) v - 2140; 2v = 4250;
4) v = 2170; 2v = 4340.
22/2. Как изменяется величина AC?c4-j/2, соответствующая разности
между энергиями двух соседних колебательных состояний, с уве-
личением колебательного квантового числа v.
1) Растет
2) Уменьшается.
3) Проходит через максимум.
4) Не изменяется.
23/2. С какого значения J начинается Р-ветвь в колебательно-
вращательном спектре двухатомной молекулы?
1) 7 = 0; 2) 7=1; 3) 7 = 2; 4) 7 = 3.
1071
24/2. Каково расстояние между линией релеевского рассеяния и
первой стоксовой линией вращательного КР-спектра?
1) В; 2) 2В; 3) 4В; 4) 6В.
25/2. Могут ли в полосах колебательно-вращательных спектров
поглощения двухатомных молекул существовать канты и при ка-
ких условиях?
1) Канты могут наблюдаться при высокой температуре,
когда проявляются переходы с большими значениями J.
2) Канты в колебательно-вращательных спектрах ни при
каких условиях не образуются.
3) Канты образуются при переходе вещества в конденсиро-
ванную фазу.
4) Канты могут наблюдаться только в условиях электриче-
ского разряда.)
26/2. В каком примерно диапазоне изменяются величины межъ-
ядерных расстояний в двухатомных молекулах в зависимости от
атомов, из которых они состоят?
1) 100—4000 см-’; 2) 0,7—5 А; 3) 0,7—5нм; 4) 0,1—10 А.
27/2. В каком примерно диапазоне изменяются величины частот
основных колебаний в двухатомных молекулах в зависимости от
атомов, из которых они состоят?
1) 100—4000 см-’;
2) 0,7—5 А;
3) 1—8000 см-’;
4) 0,7—5 нм.
28/2. При рассмотрении каких спектров необходимо учитывать
принцип Франка—Кондона?
1) Колебательных.
2) Вращательных.
3) Комбинационного рассеяния.
4) Электронных.
29/2. Какой из приведенных рисунков удовлетворяет принципу
Франка—Кондона?
108
30/2. Изменяются ли межъядерные расстояния двухатомных мо-
лекул при их переходе в возбужденные электронные состояния?
1. Межъядерные расстояния не 'изменяются.
2. Межъядерные расстояния всегда только увеличиваются.
3. Межъядерные расстояния могут как увеличиваться, так и
уменьшаться.
4. Межъядерные расстояния всегда только уменьшаются.
31/2. Изменяются ли частоты колебаний со и силовые постоянные
k двухатомных молекул при их переходе в возбужденные элект-
ронные состояния?
1. co и k не изменяются.
2. (о и k всегда только увеличиваются.
3. со и k могут как увеличиваться, так и уменьшаться.
4. со и k всегда только уменьшаются.
32/2. Какой из приведенных на рисунке спектров является коле-
бательно-вращательным спектром поглощения двухатомной моле-
кулы?
3) 1 4) э
33/2. Какой из приведенных на рисунке спектров является враща-
тельным спектром поглощения двухатомной молекулы?
109
34/2. Какой из приведенных на рисунке спектров является элект-
ронно-колебательно-вращательным спектром испускания двухатом-
ной молекулы?
35/2. Какой из приведенных на рисунке спектров является вра-
щательным КР-спектром двухатомной молекулы?
0-2 0-1 0-0 1-0 2-0
.лллг Л °'2 °'1 °'0 1~°
Ж WWMV
36/2. Какой из приведенных спектров соответствует колебательно-
вращательному ИК-спектру поглощения двухатомной молекулы?
ШЛА
0-2 0-1 0-0 1-0 2-0
т
1 го
Серия 3 |§ 7, 14, 15)
1/3. Чем. отличается ход кривых потенциальной энергии для изо-
топных разновидностей молекул, например Н2 и D2?
1) Кривые потенциальной энергии у изотопных молекул иден-
тичны.
2) В области диссоциационного предела кривая потенциаль-
ной энергии молекулы Н2 расположена выше, чем у D2, а в об-
ласти минимума они совпадают.
3) Минимум кривой потенциальной энергии D2 находится при
меньших межъядерных расстояниях.
4) В области диссоциационного предела кривая потенциаль-
ной энергии молекулы D2 расположена выше, чем у Н2, а в об-
ласти минимума они совпадают.
2/3. Отличаются ли энергии диссоциации (Do) изотопных молекул,
например Н2 и D2?
1) Энергии диссоциации одинаковы.
2) На вопрос ответить нельзя, так как нс приведены данные
об их частотах колебаний ,и ангармоничностях.
3) Энергия диссоциации у D2 больше, чем у Н2.
4) Энергия диссоциации у Н2 больше, чем у D2.
3/3. Чему равна силовая постоянная k* изотопозамещенной моле-
кулы, если силовая постоянная более легкой молекулы равна k?
1) kl > k.
2) k‘ меньше k на величины — от,----— cojg.
3) V - k.
4) k( < k.
4/3. Чему равна энергия диссоциации .изотопозамещенной молеку-
лы/^,если энергия диссоциации более легкой молекулы равна Д?
1) Dle>De.
2) Д =Д.
3) Д < Д.
4) De меньше Д, на величину — ые----~о)схе.
2 4
5/3. Как расположены термы колебательных состояний более тя-
желой изотопной молекулы относительно ^егкой?
1) Термы тяжелой молекулы совпадают с термами легкой.
2) Термы тяжелой молекулы расположены ниже, чем у
легкой?
3) Термы тяжелой молекулы сначала располагаются ниже
легкой, а затем с ростом колебательного квантового числа начи-
нают располагаться выше.
111
4) Термы тяжелой молекулы расположены выше,. чем у
легкой.
6/3. Каково положение первого колебательного состояния (и = 0)
относительно минимума кривой потенциальной энергии для двух
изотопных молекул, например Н2 и D2?
1) Энергии первого колебательного состояния у Н2 и D2 оди-
наковы.
2) Энергия первого колебательного состояния Н2 ниже, чем
у D2.
3) Энергия первого колебательного состояния Н2 выше, чем
У D2.
4) На вопрос ответить нельзя, так как не приведены данные
об энергиях диссоциации Н2 и D2.
7/3. Частоты колебаний молекул Н2 и D2 равны соответственно
(ое=4400 см1 и (о* =3120 см*"1, а межъядерные расстояния
в минимуме кривой потенциальной энергии одинаковы и равны
0,74А. Будут ли различия в колебательных и вращательных со-
стояниях этих молекул и каковы эти различия, если они есть?
1) Колебательные и вращательные состояния Н2 будут выше,
чем у D2.
2) Колебательные состояния Н2 будут выше, чем у D2, а вра-
щательные состояния ниже.
3) Колебательные состояния Н2 будут выше, чем у D2, а вра-
щательные состояния одинаковы.
4) Колебательные и вращательные состояния у Н2 и D2 оди-
наковы.
8/3. Как расположены термы вращательных состояний более тя-
желой изотопной молекулы относительно легкой?
1) Положение термов тяжелой и легкой молекулы совпадают.
2) Термы тяжелой молекулы расположены выше, чем у
легкой.
3) Термы тяжелой молекулы сначала располагаются ниже
легкой, а затем с ростом вращательного квантового числа начина-
ют располагаться выше.
4) Термы тяжелой молекулы расположены ниже, чем у
легкой.
9/3. Для следующих четырех гипотетических двухатомных моле-
кул приведены частоты колебаний и их ангармоничности.
1) (йе — 500 см-!; (Dexe = 10 см-1.
2) (ое— 1000 см-1; ыехе — 100 см-1.
3) (йе = 500 см-1; аехе = 1000 см-1.
4) со() = 100 см-1; (Dexe — 10 см-!.
В каком из перечисленных случаев энергия диссоциации больше?
10/3. Колебательные частоты молекул РЬН и О2 близки, а коэф-
фициент ангармоничности у РЬН примерно в два раза больше, чем
О2. Какая из этих молекул более прочна?
112
1) Молекула Ог прочнее РЬН.
2) На вопрос ответить нельзя, так как нет данных о межъ-
ядерных расстояниях.
3) Молекула РЬН прочнее Ог.
4) На вопрос ответить нельзя. Нет данных о максимальном
значении колебательного квантового числа v для этих молекул.
11/3. Каково приближенное значение энергии диссоциации в см-1
для двухатомной молекулы, если ее колебательная частота сое=
= 1000 см-1, а ангармоничность wex(>==25 см-1?
1) 6250; 3) 25000;
2) 10000; 4) 1000.
12/3. На какую величину отличается энергия диссоциации двух-
атомной молекулы Do определяемая экспериментально, от энергии
диссоциации De, отсчитываемой от минимума кривой потенциаль-
ной энергии?
1) Dp больше £>0 на —-—;
’ е 0 8л2с/ ’
2) De меньше Do на -у (ое;
3) De больше Dq на ("у®«----
4) De больше Do на + -у).
13/3. Каково выражение для потенциальной энергии двухатомной
молекулы в виде функции Морзе?
1)
2)
1
8л2с/
1);
3) ®в(^+ 1/2) —(и i- 1/2)2;
14/3. Каково выражение для энергии диссоциации двухатомной
молекулы?
1) В.-а (г + 1/2);
2) DJ1 —е~₽(г'^)2;
ЗГ®е(»+ 1/2) —ад, (и + 1/2)2;
4) _
4(деХе
113
15/3. Какую молекулярную постоянную можно определить из гра-
фика зависимости AGr+i/2OT а-Ь’/г?
1) а,; 2) 3) Do; 4) D,.
16/3. В электронно-колебательно-вращательном спектре испуска-
ния двухатомной молекулы видна граница (vrp) между дискрет-
ным и непрерывным спектром. Определите энергию диссоциации
основного состояния (Do)» если известна энергия возбуждения од-
ного из атомов (£ат), который образуется при диссоциации моле-
кулы в .возбужденном электронном состоянии.
1) Dq — Е аХ ^гр,
2) Do = £aT b vrp;
3) Do = vrp —£ат;
4) Данных недостаточно.
17/3. Энергия диссоциации первого возбужденного электронного
состояния двухатомной молекулы равна при этом один из
атомов получается в возбужденном состоянии с энергией £ат.
Чему равна энергия диссоциации основного электронного состоя-
ния Z)o. если для него продукты диссоциации образуются в не-
возбужденпОхМ состоянии, а энергия электронного перехода v00?
1) Do = v00 + D* 4“ £ат;
2) Do = ты, 4- Do— £aT;
3) Do = v00 Do £aT;
4) Do = Vqo Do 4- £aT.
18/3. Как меняется интенсивность стоксовых и антистоксовых ли-
ний в колебательном КР-опектре двухатомной молекулы при по-
вышении температуры?
1) Интенсивность стоксовых и антистоксовых линий воз-
растает.
2) Интенсивность стоксовых линий возрастает, а антисток-
совых падает.
3) Интенсивность линий комбинационного рассеяния не за-
висит от температуры.
4) Интенсивность стоксовых линий уменьшается, а интен-
сивность антистоксовых увеличивается.
19/3. Каковы относительные интенсивности стоксовых и антисток-
совых линий в колебательных и вращательных КР-спектрах двух-
атомных молекул при комнатных температурах? В каком случае
эти различия больше? Приведите наиболее полный ответ.
1) В колебательнОхМ и вращательном спектрах интенсивности
стоксовых и антистоксовых линий примерно одинаковы.
114
2) В колебательном и вращательном спектрах стоксовы ли-
нии гораздо интенсивнее антистоксовых.
3) В колебательном и вращательном спектрах антистоксовы
линии сильнее стоксовых.
4) В колебательном спектре стоксовы линии интенсивнее
антистоксовых, а во вращательном близки по интенсивности.
20/3. Как изменяются интенсивности вращательных линий коле-
бательно-вращательного спектра поглощения двухатомной моле-
кулы с повышением температуры?
1) Максимумы интенсивности в Р- и /?-ветвях смещаются
к центру полосы и их интенсивность уменьшается.
2) Максимумы интенсивности в Р- и 7?-ветвях смещаются
от центра полосы и их интенсивности уменьшаются.
4) Максимумы интенсивности в Р- и /?-;ветвях смещаются
к центру полосы и их интенсивности увеличиваются.
21/3. Как изменяются интенсивности вращательных линий в чисто
вращательном ИК-спектре поглощения при понижении темпера-
туры?
1) Интенсивность линий в максимуме полосы поглощения
уменьшается, а положение максимума смещается к большим
значениям J.
2) Интенсивность линий в максимуме полосы поглощения
увеличивается, а положение максимума смещается к большим
значениям /.
3) Интенсивность линий в максимуме полосы поглощения
уменьшается, а положение максимума смещается к меньшим
значениям /.
4) Интенсивность линий в максимуме полосы поглощения
увеличивается, а положение максимума смещается к меньшим
значениям J.
Серия 4 (§ 16—20)
1/4. Сколько поступательных, вращательных и колебательных сте-
пеней свободы у тетраэдрической молекулы СН4?
1) Поступательных — 3, вращательных — 3, колебательных — 9.
2) Поступательных — 3, вращательных — 2, колебатель-
ных— 10.
3) Поступательных — 3, вращательных — 3, колебательных — 3.'
4) Поступательных — 3, вращательных — 3, колебательных — 5.
2/4. Сколько поступательных, вращательных и колебательных сте-
пеней свободы у линейной молекулы цианистоводородной кислоты
HCN?
М Поступательных — 3, вращательных — 3, колебательных — 3.
2) Поступательных — 3, вращательных — 2, колебательных — 3.
3) Поступательных — 2, вращательных — 3, колебательных — 4.
4) Поступательных — 3, вращательных — 2, колебательных — 4.
115
3/4. Сколько поступательных, вращательных и колебательных сте-
пеней свободы у линейной молекулы ацетилена С2Н2?
1) Поступательных — 3, вращательных — 2, колебательных — 7.
2) Поступательных — 3, вращательных — 3, колебательных — 6.
. 3) Поступательных — 2, вращательных — 2, колебательных — 8.
4) Поступательных — 3, вращательных — 3, колебательных — 3.
4/4. Сколько поступательных, вращательных и колебательных сте-
пеней свободы у пирамидальной молекулы аммиака NH3?
1) Поступательных — 2, вращательных — 3, колебательных — 3.
2) Поступательных — 2, вращательных — 3, колебательных — 1.
3) Поступательных — 3, вращательных — 3, колебательных — 6.
4) Поступательных — 3, вращательных — 2, колебательных — 7.
5/4. Какие колебания угловой молекулы НгО проявляются в ИК-
спектре, а какие в КР-спектре?
1) Все колебания vi, V2 и V3 активны в ИК- и КР-спектрах.
2) Полносимметричное валентное колебание vi активно в КР-
спектре, а деформационное тг и антисимметричное тз— в ИК-
спектре.
3) Полносимметричное валентное колебание vi активно в
ИК-спектре, а деформационное V2 и антисимметричное V3 — в
КР-спектре.
4) Все колебания vi, V2 и тз активны только в ИК-спектре.
6/4. Какие колебания молекулы СОг проявляются в ИК-спектре,
а какие в КР-опектре?
1), Полносимметричное валентное колебание vi активно в
ИК-спектре поглощения, а деформационное колебание V2 и анти-
симметричное валентное колебание V3 активны в КР-спектре.
2) Все колебания vi, V2 и v3 активны в ИК-и КР-спектрах.
3) Все колебания vb V2 и V3 активны только в ИК-спектре.
4) Полносимметричное валентное колебание vi активно в
КР-спектре, а деформационное колебание V2 и антисимметричное
валентное колебание v3 активны в ИК-спектре.
7/4. Какие колебания угловой молекулы NO2 проявляются в ИК-
спектре, а какие в КР-спектре?
1) Полносимметричное валентное колебание vi активно в
КР-спектре, а деформационное V2 и антисимметричное v3— в ИК-
спектре.
2) Все колебания vi, V2 и тз активны в ИК- и КР-спектрах.
3) Полносимметричное валентное колебание vi активно в
ИК-спектре, а деформационное тг и антисимметричное v3—в КР-
спектре.
4) Все колебания vi, V2 и тз активны только в ИК-спектре.
8/4. Какие колебания линейной молекулы CS2 проявляются в
ИК-спектре, а какие в КР-спектре?
1) Полносимметричное валентное колебание vi активно в
ИК-спектре поглощения, а деформационное колебание тг и анти-
симметричное валентное колебание тз активны в КР-спектре.
2) Все три колебания vi, V2 и уз активны в ИК- и КР-спектрах.
116
3) Полносимметричное валентное колебание vi активно в
КР-апектре, а деформационное колебание V2 и антисимметричное
валентное колебание v3 активны в ПК-спектре.
4) Все колебания vb V2 и V3 активны только в ПК-спектре.
9/4. В ИК-епектре поглощения, многоатомной молекулы прояв-
ляются 4 частоты, а .в КР-спектре также 4, две из которых сов-
падают с частотами ИК-спектра. Все частоты колебаний невы-
рождены. Сколько атомов в молекуле?
1) 6; 2) 3; 3) 4; 4) 8.
10/4. Какое соотношение между моментами инерции в молекулах
типа асимметричного волчка?
1) 1а = 1в = 1с\ 3) 1а = 1вф1с\
2) 1А = /в, 1с = 0, 4) Ia^Ib^Ic.
11/4. Какое соотношение между моментами инерции в молекулах
типа сферического волчка?
1) 3) /д = /в, /с = 0;
2) /л = /в = /с; 4) 1А = 1вф1с.
12/4. Какое соотношение между моментами инерции в молекулах
типа симметричного волчка?
1) Ia^Ib=£-Ic\ 3) 1а = 1в, 1с — 0;
2) 1а = 1в = 1с\ 4) Iа — 1в=£-1с-
13/4. Какое соотношение между моментами инерции в линейных
молекулах?
1) 1а = 1в> 1с = 0; 3) 1а = 1вФ Ici
2) Ia — Ib~Ic\ 4) Ia^Ib^Ic-
14/4. Во сколько раз уменьшится интенсивность света /, прошед-
шего через кювету с веществом, если концентрация вещества рав-
на 10-3 моль/л, длина поглощающего слоя 2 см, а коэффициент
поглощения а=0,5-103 л/моль-см?
1) в 1/е раз; 3) в е раз;
2) в 1g 2 раз; 4) в 1g е раз;
15/4. От каких параметров кюветы с веществом зависит ее про-
пускание?
1) От толщины и поперечного сечения.
2) От толщины.
3) От поперечного сечения.
4) От освещенного объема.
16/4. Во сколько раз уменьшится интенсивность света /, прошед-
шего через кювету с веществом по сравнению с интенсивностью
117
падающего света /о, если концентрация вещества равна
2-Ю-3 моль/л, длина поглощающего слоя 0,5см, а коэффициент
поглощения а— МО3 л/моль-см?
1) в е раз; 3) в 1/е раз;
2) в 1g 2 раз; 4) в 1g е раз.
17/4. Когда выполняется закон Бугера—Ламберта—Бера, если
нет инструментальных ошибок?
1) Всегда.
2) Для неполярных соединений.
3) Для малых толщин поглощающего образца.
4) При отсутствии межмолекулярного и химического взаимо-
действия.
18/4. Для чего необходимо химикам знать межъядерные расстоя-
ния и моменты инерции молекул? Приведите наиболее полный
ответ.
1) Чтобы определить энергию диссоциации.
2) Чтобы определить энергию электронного возбуждения.
3) Чтобы рассчитывать термодинамические функции.
4) Чтобы рассчитывать ангармоничность колебания.
19/4. Какие молекулярные постоянные можно рассчитать по чисто
вращательным спектрам, проявляющимся в микроволновой и да-
лекой инфракрасной области спектра?
1) Частоту колебания, коэффициент ангармоничности.
2) Энергию диссоциации.
3) Момент инерции, межъядерное расстояние.
4) Массу молекулы.
20/4. Какие молекулярные постоянные могут быть рассчитаны из
данных по колебательно-вращательным спектрам, проявляющимся
в инфракрасной области?
1) Частоту колебаний, момент инерции, межъядерное рас-
стояние.
2) Энергию диссоциации, момент инерции, массу.
3) Энергию возбужденного электронного состояния, частоту
колебаний, коэффициент ангармоничности, энергию диссоциации.
4) Коэффициент ангармоничности, межъядерное расстояние.
21/4. Какие молекулярные постоянные можно определить из ИК-
и КР-спектров веществ в конденсированном состоянии?
1) Энергия перехода молекул в возбужденные электронные
состояния.
2) Вращательные постоянные и межъядерные расстояния.
3) Частоты колебаний и ангармоничность.
4) Энергию диссоциации и межъядерные расстояния.
22/4. Для чего необходимо знать химикам колебательные частоты
в многоатомных молекулах?
1) Чтобы определять энергию диссоциации, межъядерные
расстояния и вращательные суммы по состояниям, необходимые
для статистического расчета термодинамических функций.
118
2) Чтобы определять энергию диссоциации.
3) Чтобы вести идентификацию и структурно-групповой ана-
лиз и рассчитывать термодинамические функции.
4) Чтобы определять энергию электронного возбуждения,
вести идентификацию и структурно-групповой анализ, рассчиты-
вать термодинамические функции.
23/4. Какую информацию можно получить из ИК-спектров погло-
щения в конденсированной фазе? Укажите наиболее полный ответ.
1) О качественном и количественном составе вещества.
О частотах колебаний молекул (но не во всех случаях) и энергии
электронных переходов.
2) О качественном и количественном составе веществ. О час-
тотах колебаний молекул, активных в данном виде спектров.
3) О качественном и количественном составе вещества.
О межъядерных расстояниях, частотах колебаний молекул и энер-
гии электронных переходов.
4) О качественном и количественном составе вещества.
О моментах инерции (но не во всех случаях) и частотах колеба-
ний молекул, активных в данном виде спектров.
24/4. Какую информацию можно получить из электронных спект-
ров поглощения в конденсированной фазе? Укажите наиболее пол-
ный ответ.
1) О качественном и количественном составе вещества.
О частотах колебаний молекул (но не во вёех случаях) и энергии
электронных переходов.
2) О количественном и качественном составе вещества.
О частотах колебаний молекул, активных в данном виде спектров.
3) О качественно ,м и количественном составе вещества.
О межъядерных расстояниях, частотах колебаний молекул и энер-
гии электронных переходов.
4) О качественном и количественном составе вещества.
О моментах инерции (но не во всех случаях) и частотах колеба-
ний молекул, активных в данном виде спектров.
25/4. Какую информацию можно получить из КР-спектров веществ
в конденсированной фазе? Укажите наиболее полный ответ.
1) О качественном и количественном составе вещества.
О частотах колебаний молекул (но не во всех случаях) и энергии
электронных переходов.
2) О качественном и количественнОхМ составе веществ.
О частотах колебаний молекул, активных в данном виде спектров.
3) О качественном и количественном составе вещества.
О межъядерных расстояниях, частотах колебаний молекул и энер-
гии электронных переходов.
4) О качественном и количественном составе веществ.
О моментах инерции (но не во всех случаях) и частотах колеба-
ний молекул, активных в данном виде спектров.
26/4. Какую информацию можно получить из ИК-спектров погло-
щения в газовой фазе? Укажите более полный ответ.
119
1) О качественном и количественном составе веществ.
О частотах колебаний молекул (но не во всех случаях) и энергии
электронных переходов.
2) О качественном и количественном составе веществ.
О частотах колебаний молекул, активных в данном виде спектров.
3) О качественном и количественном составе веществ.
О межъядерных расстояниях, частотах колебаний молекул и энер-
гии электронных переходов.
4) О качественном и количественном составе веществ.
О моментах инерции и частотах колебаний молекул, активных в
данном виде спектров.
Раздел II
ВВЕДЕНИЕ В ТЕХНИКУ И МЕТОДЫ МОЛЕКУЛЯРНОЙ
СПЕКТРОСКОПИИ
Успех решения той или иной проблемы, связанной с изучением
спектров, во многом зависит от правильного выбора спектраль-
ного прибора и методики исследования. Быстрое развитие спект-
рального приборостроения способствует тому, что сейчас в распо-
ряжении исследователей имеются приборы самых различных клас-
сов, которые охватывают спектральный диапазон, начиная с
вакуумной УФ-области спектра, и кончая длинноволновой ИК-об-
ластыо. Даже для одного спектрального диапазона имеется до
десятка различных типов спектральных приборов. Поэтому необ-
ходимо знать не только теорию молекулярной спектроскопии, но
и уметь правильно выбрать метод исследования и аппаратуру,
с помощью которых можно наиболее успешно решать поставлен-
ные задачи.
В настоящем разделе будут рассмотрены только самые рас-
пространенные спектральные приборы, выпускавшиеся в начале
1970-х гг. и используемые в практике химических и физических
лабораторий по сегодняшний день.
§ 1. ПРИНЦИПИАЛЬНАЯ ОПТИЧЕСКАЯ СХЕМА СПЕКТРАЛЬНЫХ ПРИБОРОВ
Основное назначение спектральных приборов — разложение
электромагнитного излучения на его монохроматические состав-
ляющие. Спектральные приборы используются для: 1) качествен-
ного анализа спектрального состава излучения; 2) выделения
излучения данной длины волны.
Особенно важно их первое назначение, когда по спектрам ис-
пускания, поглощения, отражения или рассеяния света веществом
можно определить качественный и количественный состав вещест-
ва, а также судить о его различных физико-химических свойствах
и строении. Выделение излучения данной длины волны важно
при изучении различных фотохимических процессов.
Если оптические приборы дают информацию о свойствах, раз-
мерах^, форме или положении различных физических тел в макро-
мире, то спектральные приборы являются инструментом для иссле-
дования микромира — атомов и молекул. Изменение энергетичес-
кого состояния молекулы сопровождается излучением или погло-
121
щением квантов света. Энергия кванта E=hcv определяет
положение спектральной линии на шкале электромагнитных коле-
баний, а число квантов — ее интенсивность. Изучая с помощью
спектральных приборов спектр и интенсивности спектральных ли-
ний, можно получать обширную информацию о энергетических
состояниях молекул и определять концентрацию вещества.
Оптическая схема спектральных приборов, как правило, содер-
жит следующие основные элементы (рис. II. 1).
1) Узкая регулируемая входная щель 3, на которую линзой 2
проецируется сложное исследуемое излучение 1 с Xi+Хе4-...
2) Коллиматорный объектив 4. Он находится на фокусном рас-
стоянии от щели и дает параллельный пучок спектрально нераз-
ложенного света. Это необходимо для того, чтобы диспергирующий
элемент работал в оптимальных условиях, позволяющих получать
максимальное разрешение спектральных линий.
3) Диспергирующий элемент 5 — призма или дифракционная
решетка. Он разлагает свет на его составляющие в виде веера
широких монохроматических пучков.
4) Камерный (фокусирующий) объектив 6. Он собирает (фо-
кусирует) параллельные монохроматические пучки света и создает
в некоторой фокальной плоскости 7 последовательный ряд изобра-
жений щели в монохроматическом свете, совокупность которых
образует спектр из отдельных линий Аь Аг, ...
5) Фокальная плоскость, с которой совмещается фотопластинка
(такие приборы называются спектрографами, см. рис. II.1) или
выходная щель (в случае монохроматоров, рис. II.2).
Таким образом, спектральная линия — это изображение вход-
ной щели спектрального прибора в монохроматическом свете.
В частных случаях отдельные элементы спектрального прибора
могут быть как-то видоизменены или совмещены с другими эле-
ментами прибора. Например, во многих монохроматорах исполь-
зуется автоколлимационная схема (см. рис. 11.16, 11.22, 11.24),
которая характерна тем, что объективы камеры и коллиматора
совмещены, а через призму свет проходит дважды.
122
На рис. II.2 приведена принципиальная оптическая схема авто-
коллимационного монохроматора с дифракционной решеткой. Свет
от источника света 1 проецируется сферическим зеркалом 2 на
входную щель 3. Расходящийся пучок параболическим зеркалом 4
превращается в параллельный и падает на дифракционную решет-
Рис. II. 2. Принципиальная оптическая схема автокол-
лимационного монохроматора с дифракционной ре-
шеткой
ку 5. Дифрагированный свет снова попадает на параболическое
зеркало 4 и фокусируется на выходную щель 6, за которой нахо-
дится эллиптическое зеркало 7 и приемник монохроматического
излучения 8. Поворотом дифракционной решетки вокруг оси О
можно выделить излучение желаемой длины волны - и измерить
его интенсивность. При фотографической регистрации спектра
вместо выходной щели устанавливается фотопластинка.
Более детально оптические схемы будут обсуждены далее при
рассмотрении конкретных приборов.
§ 2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ СПЕКТРАЛЬНЫХ ПРИБОРОВ
Прежде чем приступить к более детальному рассмотрению
спектральных приборов, необходимо кратко рассмотреть основные
параметры, с помощью которых можно сравнивать и характери-
зовать их возможности и класс.
Такими параметрами являются: спектральный диапазон рабо-
ты, дисперсия, разрешающая способность и светосила (или отно-
сительное отверстие).
Спектральный диапазон. Диапазон работы спектрального при-
бора определяется материалом его призм и объективов или об-
ластью работы дифракционной решетки. Например, стекло поз-
воляет-работать в области 360—2500 нм, а плавленый кварц — в
области 170—3600 нм. Дифракционные решетки охватывают боль-
ший диапазон и работают от вакуумной УФ-области (~ 100 нм)
До далекой ИК-области (~1 мм).
123
Дисперсия. Линейной дисперсией называют величину D=dlld'kt
где X — длина волны в А или нм, а /—расстояние в мм. Числен-
ное значение dlldh соответствует расстоянию по спектру в мм
между двумя спектральными линиями, различающимися на 1А
Рис. II. 3. Контур двух близких спектральных линий: а —
с небольшой и большой дисперсией; б — с небольшим и
большим разрешением
или нм. Линейная дисперсия определяет размеры спектра: чем
она больше, тем более растянут спектр (рис. П.3,а).
Линейная дисперсия призменного спектрального прибора оп-
ределяется следующей формулой:
dl 2sina/2 / dn \ - ,гт ,,
--- — ---------------ГлГ I I / > ( I * • 1)
dX (1- n2sin2a/2) \ dX / '
где пг — число призм или сколько раз свет проходит через одну
и ту же призму (например, в случае автоколлимационной схемы
с одной призмой m = 2); a — преломляющий угол призмы (см.
рис. II.1); п— показатель преломления материала призмы;
dnld'K — дисперсия материала призмы, которая характеризует сте-
пень изменения показателя преломления призмы с длиной волны;
f — фокусное расстояние объектива камеры.
Таким образом, линейная дисперсия тем больше, чем больше
число (или кратность прохождений) призм, преломляющий угол
призмы (см. рис. II.1), показатель преломления, дисперсия мате-
риала призмы и фокусное расстояние камеры спектрографа. Раз-
мер призмы при неизменном преломляющем угле на дисперсии
не сказывается. Большая дисперсия прибора облегчает расшиф-
124
ровку сложных спектров. На практике же в большинстве случаев
для характеристики .спектрального прибора пользуются более
удобной величиной дисперсии — обратной линейной дисперсией
D = dKldl, соответствующей разности длин волн в А или нм, кото-
рую имеют две спектральные линии, расположенные на расстоя-
D, нм/мм
Й00 б00 800 1000 Л,нм
а
Рис. II. 4. Обратная линейная дисперсия: а — для спектрографа ИСП-51
с тремя призмами* из стекла, работающего в видимой и близкой УФ-об-
ласти спектра; б — для ИК-спектрофотомстра ИКС-14 с одной призмой
из монокристалла NaCl или LiF
нии 1 мм. В ИК-спектроскопии удобнее пользоваться обратной
линейной дисперсией, выраженной в см-1/мм. В связи с тем что
дисперсия материала призмы сильно зависит от длины волны,
обратная линейная дисперсия спектральных приборов для види-
мой и УФ-области спектра сильно увеличивается (т. е. ухудшает-
ся) с увеличением длины волны (рис. П.4,а). В ИК-спектральных
приборах наблюдается обратная зависимость (рис. 11.4,6).
Линейная дисперсия дифракционного спектрального прибора
равна
— - —-— /, (II.2)
d\ d cos <р
где k=\, 2, 3... — порядок спектра; d — постоянная решетки
(расстояние между штрихами); ср — угол дифракции; f — фокусное
расстояние объектива камеры.
Как следует из уравнения (II.2), линейная дисперсия дифрак-
ционных приборов мало меняется с длиной волны (см.
125
рис. П.4,а — пунктирная линия). Диспе.рсия прибора сильно за-
висит от порядка спектра, однако работа при больших значениях
k затруднительна из-за наложения спектров соседних порядков.
Поэтому дифракционные решетки обычно работают в I—II по-
рядках, где спектры перекрываются не так сильно. Для увеличе-
ния дисперсии и разрешения желательно работать с решетками,
у которых больше число штрихов, приходящихся на 1 мм. Однако
в ПК-области спектра используются решетки с малым числом
штрихов на 1 мм (50—300), так как длина волны изучаемого
спектра становится сравнимой с постоянной решетки d.
Большая часть спектральных исследований в видимой и УФ-
области спектра ведется на приборах малой и средней дисперсии
(1—50 нм/мм).
Разрешающая способность. Реальная разрешающая способ-
ность спектрального прибора характеризует ту наименьшую раз-
ность в длинах волн 'АЛ или волновых числах Av двух очень
близких спектральных линий равной интенсивности, которая поз-
воляет их различать, а не считать за одну линию. Для количест-
венной оценки разрешающей способности используется следующее
соотношение:
R = ~ или R = (П.З)
ДХ Av
где разрешение R является безразмерной величиной.
Если дисперсия характеризует расстояние между спектральны-
ми линиями, то разрешающая способность определяет величину
провала между двумя близкими линиями. На рис. П.З,а приведе-
ны две близкие спектральные линии с одинаковым разрешением
Ri=R2, но с разной дисперсией D\<D2, а на рис. П.З,б показаны
две спектральные линии с одинаковой дисперсией D\=D2, но раз-
ной разрешающей силой Чем больше разрешающая сила,
тем более подробной получается картина спектра.
В теории спектральных приборов широко используется теоре-
тическая разрешающая способность, которая не учитывает таких
реальных факторов, как ширина щели, аберрации оптической си-
стемы, искажения за счет приемника света и т. д. Она относится
к условиям бесконечно узкой щели, при этом две спектральные
линии равной интенсивности считаются разрешенными только
в том случае, если величина провала между ними больше 20%
от их интенсивности (см. R\ на рис. П.З,б).
Теоретическая разрешающая способность может быть пред-
ставлена через геометрические размеры призмы следующей фор-
мулой:
R = mt-^-, (П.4)
аК
где т — число призм или прохождений призмы; t — ширина осно-
, т т .. dn
вания призмы (см. рис. 11.1); —--дисперсия материала призмы.
ал
126
Таким образом, разрешающая сила прибора повышается с уве-
личением числа и размеров призмы, но не зависит от преломляю-
щего угла призмы и фокусного расстояния объектива камеры.
Разрешающая способность дифракционной решетки равна
7? = kN, (П.5)
где k=\, 2, 3... — порядок спектра; N— общее число штрихов.
Для повышения R желательно работать в более высоких по-
рядках, с большим числом штрихов на мм и большими размерами
решеток.
Следует отметить, что реальная разрешающая способность
меньше теоретической. Спектральные приборы малой и средней
дисперсии имеют разрешающую способность порядка 1000—
100 000.
Светосила. Светосила спектрального прибора характеризует
освещенность (или световой поток), которую создает оптическая
система в плоскости изображения спектра. От светосилы спект-
рального прибора зависит экспозиция, с которой фотографируется
спектр на спектрографе, и ширина щели, 'когда спектр регистри-
руется на спектрофотометре. В зависимости от способа регистра-
ции света и источника света (линейчатого или непрерывного)
светосила определяется через различные параметры спектрально-
го прибора, но во всех случаях она пропорциональна квадрату
относительного отверстия d/f объектива камеры (d — диаметр,
f — фокусное расстояние, см. рис. II. 1) и коэффициенту пропуска-
ния т (отношению монохроматического светового потока, прошед-
шего через прибор, к падающему на входную щель).
Таким образом, светосила спектрального прибора тем выше,
чем короче фокусное расстояние и больше диаметр камерного
объектива, а также меньше число оптических элементов, например
призм и линз, на которых происходит потеря света. При большой
светосиле резко увеличиваются аберрации оптической системы.
Обычно относительное отверстие спектральных приборов средней
дисперсии бывает порядка 1/5—1/25. Все ПК-спектрофотометры
имеют относительное отверстие примерно 1/5.
Между основными параметрами спектрального прибора суще-
ствует следующее соотношение
R = (dlf) (dl/dl), (II.6)
согласно которому при данном диспергирующем элементе, т. е.
при постоянном разрешении R, которое определяется дисперги-
рующим элементом, нельзя выиграть в светосиле, пропорциональ-
ной (d/f)2, не ухудшая дисперсию dl/dX, и наоборот.
При регистрации спектров, особенно узких линий вращатель-
ной структуры, спектральный прибор может существенно иска-
жать спектр. В результате теряется разрешение, уменьшается ин-
тенсивность линий, смещается максимум линии, искажается ее
контур и т. д. Степень искажения спектра зависит не только от
127
основных характеристик самого прибора, а и от условий, при
которых ведется регистрация спектра (ширина щели, скорость
записи и т. д.). Поэтому всегда надо обращать особое внимание
на выбор оптимальных условий регистрации спектров.
§ 3. КЛАССИФИКАЦИЯ СПЕКТРАЛЬНЫХ ПРИБОРОВ И ИХ ПРИМЕНЕНИЕ
В ХИМИИ
В зависимости от поставленной задачи, связанной с примене-
нием спектроскопии в химии, обычно используются приборы раз-
личных типов. Существующая классификация спектральных при-
боров довольно разнообразна и может проводиться по ряду приз-
наков: 1) способу диспергирования света, 2) методу регистрации
спектра, 3) рабочей области спектра и т. д.
По способу диспергирования света спектральные приборы
делятся на три основных типа.
1. Призменные спектральные приборы, в которых используется
зависимость показателя преломления материала призмы от длины
волны. Эти приборы до последнего времени составляли основную
массу спектральных приборов, однако они вытесняются прибора-
ми с дифракционными решетками. Основной недостаток призмен-
ных спектральных приборов заключается в довольно узком спект-
ральном диапазоне работы отдельных призм, т. е. на каждую
спектральную область требуется своя призма, причем призм на
область ниже 120 нм и выше 50 мкм не существует. Сильная за-
висимость дисперсии призмы от длины волны приводит к тому,
что линейная дисперсия призменных приборов изменяется больше,
чем па порядок при изменении длины волны (см., например,
рис. II.4). К недостаткам призменных приборов относится также
их относительно невысокая разрешающая способность.
2. Дифракционные спектральные приборы, в которых исполь-
зуется зависимость угла дифракции света от длины волны. Ди-
фракционная решетка представляет собой стеклянную подложку,
покрытую зеркальным слоем алюминия, на котором выдавлено
большое число узких и строго параллельных штрихов (на 1 мм
поверхности от 50 до 2400). Приборы с дифракционными решетка-
ми все больше вытесняют призменные приборы. Дифракционные
решетки охватывают большой спектральный диапазон — от мягко-
го рентгеновского излучения (~10 нм) до дальней ИК-области
спектра (1мм). Большое разрешение (до 1 000 000), очень малое
изменение дисперсии с длиной волны и достаточно большой коэф-
фициент отражения в заданной области спектра (до 70%)—вот
их основные достоинства. Основной недостаток — перекрывание
спектров различных порядков.
3. Интерференционные спектральные приборы очень перспек-
тивны, но пока нс очень распространенные с большой светосилой
и разрешающей способностью. В них используется принцип ин-
терференции параллельных пучков света.
128
В зависимости от метода регистрации спектральные приборы
можно разделить на следующие.
1) Спектроскопы, у которых регистрация спектра ведется
глазом. Они работают в видимой области 400—700 нм. Эти прибо-
ры устарели и практического применения в молекулярной спект-
роскопии не находят.
2) Спектрографы, у которых регистрация спектров ведет-
ся на фотоэмульсии. Большим достоинством спектрографов яв-
ляется возможность одновременной регистрации широкой области
спектра, для которой имеются светочувствительные фотоматериа-
лы. Их 'Кумулятивные свойства особенно ценны для исследований
слабых спектров.
3) Монохроматоры, у которых в фокальной плоскости на-
ходится выходная щель, за которой помещается фотоэлектричес-
кий или тепловой приемник света.
4) Спектрометры и с п е к т р о ф о т о м е т р ы. С помощью
спектрометров регистрируются абсолютные интенсивности спект-
ров, а на спектрофотометрах обычно измеряются спектры погло-
щения непосредственно в процентах пропускания или в единицах
оптической плотности (см. Раздел I, § 20).
5) Квантом стры или по л и хро маторы — спектраль-
ные приборы с фотоэлектрической регистрацией, у которых в фо-
кальной плоскости имеется целый ряд выходных щелей (от 2
до 20). Эти приборы предназначены для быстрого эмиссионного
анализа металлов и сплавов сразу на несколько элементов.
По спектральному диапазону спектральные приборы делятся
следующим образом.
1) Спектрографы и спектрометры для коротковолновой (ваку-
умной УФ-области спектра (10—200 нм).
2) Спектрографы, монохроматоры, спектрометры и спектро-
фотометры для видимой и УФ-области спектра (200—1000 нм).
3) Спектрометры и спектрофотометры для ПК-области спектра
(2—50 мкм).
4) Спектрометры и спектрофотометры для длинноволновой
ПК-области (50—1000 мкм).
В практике массовых измерений молекулярных спектров наи-
большее распространение нашли следующие спектральные при-
боры.
1) Спектрограф ИСП-51 для съемки спектров комбинационно-
го рассеяния и электронных спектров испускания в видимой об-
ласти спектра.
2) Спектрофотометры СФ-16 и СФ-4А для регистрации элект-
ронных спектров поглощения в видимой и УФ-области спектра.
3) Автоматический спектрофотометр СФ-14 и его дальнейшая
модификация СФ-18 для регистрации электронных спектров погло-
щения и отражения в видимой области спектра.
4) ПК-спектрофотометры ИКС-14 и ИКС-22 для регистрации
колебательных спектров поглощения.
5 А. А. Мальцев 129
Эти приборы фактически охватывают весь спектральный диа-
пазон, который обычно бывает необходим для идентификации
химических соединений, а также их структурно-группового и ко-
личественного анализа. В настоящее время на смену им приходят
более совершенные приборы с дифракционными решетками. На-
пример, спектрограф СТЭ-1, спектрофотометры СФ-20 и СФ-26
для видимой и УФ-области, ИК-спектрофотометры ИКС-17,
ИКС-24, ИКС-29, спектрометр ДФС-24 для фотоэлектрической
регистрации КР-спектров и т. д.
§ 4. ФОТОГРАФИЧЕСКАЯ РЕГИСТРАЦИЯ СПЕКТРОВ ИСПУСКАНИЯ
И ПОГЛОЩЕНИЯ. СПЕКТРОГРАФ ИСП-51
Для регистрации интенсивных молекулярных спектров испуска-
ния, получаемых в условиях газового разряда или дуги, исполь-
зуются те же самые спектральные приборы, что и для эмиссион-
ного спектрального анализа. Изучение слабых КР-спектров необ-
ходимо проводить на светосильных приборах, которые имеют
обычно более низкую дисперсию и разрешение.
Рис. II. 5. Стеклянный трехпризменный спектрограф ИСП-51
Стеклянный трехпризменньщ спектрограф ИСП-51, работающий
в области 360—1000 нм, наиболее удачно сочетает в себе хорошее
разрешение с большой светосилой. Общий вид спектрографа
ИСП-51 показан на рис. II.5, где 1 — входная щель спектрографа;
2 — коллиматор; 3— призменный кожух; 4 — камера; 5 — кассет-
ная часть. Из сменных камер, придаваемых к прибору, для ре-
гистрации КР-спектров обычно используется камера с фокусным
расстоянием /кам—270мм (фокусное расстояние коллиматора
/кол = 304 мм) и относительным отверстием 1/5, 2.
Обратная линейная дисперсия прибора ИСП-51 с камерой f=
=270 мм была приведена на рис. II.4. Спектр наиболее растянут
и имеет лучшее разрешение в фиолетовой области.
Оптическая схема прибора изображена на рис. II.6, где 1 —
источник света; 2 — линза-конденсор; 3 — входная щель; 4 — объ-
ектив коллиматора; 5 — диспергирующая система прибора, состоя-
130
щая из трех стеклянных призм; 6 — объектив камеры; 7 — плос-
кость изображения спектра (фотопластинка).
Ход лучей в приборе следующий. От щели свет расходящимся
пучком попадает на коллиматорный объектив, который преобра-
зует его в параллельный пучок, падающий на диспергирующую
систему призм. Призмы разлагают параллельный пучок белого
света в спектр, т. е. на ряд монохроматических пучков. Одновре-
Рис. II. 6. Оптическая схема спектрографа ИСП-51
менно призменная система поворачивает центральный луч на 90°.
Параллельные пучки монохроматического света с помощью объек-
тива камеры фокусируются на фотопластинку. Так как /КОл>/кам,
то на фотопластинку проектируется обратное и уменьшенное изо-
бражение входной щели спектрографа. Следует отметить, что
фокусировка коллиматорного и камерного объективов осущест-
вляется с помощью винтов кремальерного механизма 6 (см.
рис. II.5) и должна соответствовать паспортным данным, иначе
спектр будет расфокусирован.
Ширина щели спектрографа регулируется с помощью микро-
метрической головки 7 (всегда в сторону увеличения щели)
® пределах от 0 до 0,4 мм с точностью 0,001 мм. Оптимальная
f
ширина щели sH устанавливается такой, чтобы s = X—, где % —
d
5*
131
средняя длина волны для исследуемой области и —------обратная
d
величина относительного отверстия спектрографа. Принято такую
ширину щели называть нормальной. Высота щели устанавливается
фигурной диафрагмой, показанной на рис. II.7, а. Щель спектро-
графа закрывается крышкой с крестообразной маркировкой в
круге для контроля положения источника света.
Кассетная часть 5 (см. рис. II.5) спектрографа состоит из
плато, по которому в вертикальном направлении перемещается
а
о - 6
Рис. II. 7. а — Фигурная диафрагма щели.
б, в — Два варианта взаимного расположения исследуемых полосатых спек-
тров и стандартного спектра железа
кассетная рамка с кассетой 8, заряженной фотопластинкой разме-
ром 6X9 см. Кассета укрепляется в подвижной рамке зажимом 9Г
а сама кассетная рамка фиксируется винтом 10. Положение фото-
пластинки определяется по шкале слева. Включение и выключе-
ние светового затвора производится рукояткой 11. При ее верти-
кальном положении свет перекрыт.
Для того чтобы устанавливать на оптическую ось различные
источники света и линзы-конденсоры, к корпусу прибора со сто-
роны коллиматора крепится рельс, который выставлен параллель-
но оптической оси.
При изучении спектров поглощения источник излучения должен
давать непрерывный спектр, чтобы на его фоне можно было ре-
гистрировать дискретные линии или непрерывные полосы погло-
щения. Обычно при фотографической регистрации спектра погло-
щающее вещество устанавливается между источником излучения
и щелью спектрографа.
132
§ 5. ИСТОЧНИКИ СВЕТА
В настоящее время все большее значение приобретают хими-
ческие реакции, протекающие при высоких температурах, в част-
ности высокотемпературная химия *и плазмохимия. Исследования
молекулярного состава нагретых паров и низкотемпературной
плазмы лучше всего вести по их электронным спектрам испуска-
ния.
Для получения спектров испускания двухатомных и простых
многоатомных молекул используются различные источники света
(пламена, печи, электрические дуги, газоразрядные трубки и т. д.).
Наиболее просты и удобны в работе различные типы газового
разряда, которые подразделяются на плазму высокого и низкого
давления. Их различие состоит в том, что в плазме высокого дав-
ления все частицы находятся в термодинамическом равновесии,
а в плазме низкого давления (обычно давление газа ниже 1 —
10 мм рт. ст.) равновесия между нейтральными и заряженными
частицами нет; нет также равновесия между поступательной
энергией! частиц и энергией их колебания и вращения. К первому
типу разряда относятся дуговой и искровой разряды, а ко второ-
му— тлеющий и высокочастотный разряд и разряд в полом
катоде. ' -
Наиболее распространенным источником линейчатых и поло-
сатых спектров является активизированная дуга переменного тока,
в плазме которой развивается температура до нескольких тысяч
градусов. Если подвести переменный ток к металлическим элект-
родам, то дуга между ними не возникает, так как в паузах тока
(при частоте 50 Гц) электроды успевают остыть настолько, что
прекращается термоэлектронная эмиссия. Только графитовые
электроды малой теплопроводности позволяют получить дуговой
разряд переменного тока. Однако дуга горит стабильно только
при большом токе.
Чтобы дуга переменного тока не гасла, ее активизируют высо-
кочастотным разрядом малой мощности и высокого напряжения
(10000—12000 В), который ионизирует дуговой промежуток.
Электрическая схема активизированной дуги переменного тока
приведена на рис. II.8.
Высокая частота вводится в цепь переменного тока (127/220 В
и 50 Гц), питающую дуговой разряд (контур I на рис. II.8) с по-
мощью индукционной катушки Трь которая связана с высоко-
частотным контуром II. Контур питается от трансформатора не-
большой мощности Тр2, напряжение которого регулируется сопро-
тивлением /?2. Цепь вторичной обмотки замкнута через конденса-
тор С2 и сопротивление 7?з. По мере повышения напряжения сети
переменного тока в начале каждого полупериода (т. е. 100 раз
в секунду) конденсатор заряжается. Зарядка продолжается до
тех пор, пока напряжение на нем не достигнет напряжения пробоя
вспомогательного разрядного промежутка Раз2. В этОхМ контуре
133
возникают затухающие высокочастотные колебания, которые че-
рез повышающую индукционную катушку Tpi подаются на раз-
рядный промежуток дуги Раз^ где происходит ионизация. Емкость
Ci предназначена для закорачивания токов высокой частоты,
иначе они попадут в питающую цепь и будут вызывать электриче-
ские помехи в соседних лабораториях.
Чтобы избежать случайного соприкосновения с высоким напря-
жением, а также воздействия яркого ультрафиолетового излучения
Рис. II. 8. Электрическая схема активизированной дуги переменного тока
на глаза, рабочая часть штатива, где крепятся электроды, защи-
щена кожухом 12 с темными окнами (см. рис. II.5). Электроды 13,
закрепленные в держателях 14, могут перемещаться в разных
направлениях с помощью регулировочных 'винтов.
Для получения молекулярных спектров в угольных электродах
делаются отверстия, которые наполняются исследуемым вещест-
вом. Следует отметить, что линейчатый (атомный) спектр от же-
лезных электродов используется как эталонный спектр, по кото-
рому измеряются все остальные спектры. Дуга также широко
используется как источник света для эмиссионного спектрального
анализа по атомным спектрам.
Источники света низкого давления характерны не только отсут-
ствием термодинамического равновесия, но и тем, что температу-
ра газа, при которой происходит разряд, не на много отличается
от комнатной, достигая в пределе 100—300°С, что существенно
сокращает в полосатых спектрах число линий вращательной струк-
туры по сравнению с другой. Ширина вращательной структуры
полос в источниках низкого давления гораздо меньше, чем .в дуге.
Полосы не так сильно перекрываются, и в спектре можно разли-
чать больше деталей.
На рис. П.9,а представлена гейслеровская разрядная трубка
низкого давления для исследования газов в положительном столбе
134
тлеющего разряда, сосредоточенного в капилляре. Она работа-
ет при давлениях порядка 0,1 —10 мм рт. ст. при напряжении
переменного или постоянного тока не'менее 500—1000 В. Последо-
вательно с разрядной трубкой включается балластное сопротив-
ление, чтобы ограничить силу тока. Наличие металлических элект-
родов внутри разрядной трубки может вызывать нежелательные
Рис. II. 9. Газоразрядные трубки низкого давления: а—Гейслеровская разряд-
ная трубка; б — разрядная трубка для высокочастотного разряда; в — разряд-
ная трубка с полым катодом
химические реакции, поэтому для возбуждения активных газов
стали широко использовать безэлектродные разрядные трубки
(рис. П.9,б), свечение в которых возбуждается высокочастотным
(105— 109 Гц) электромагнитным полем.
Если катод в гейслеровской трубке, наполненной инертным
газом при давлении несколько мм рт. ст., изготовить в виде не-
большого цилиндра диаметра порядка 5—10 мм, а. анод в виде
кольца приблизить к катоду, чтобы уменьшить зону тлеющего раз-
ряда, образуется новый тип разряда — разряд в полом катоде
(рис. П.9,в). В этом разряде проявляются интенсивные линии
материала полого 'катода с высокими энергиями возбуждения.
Такого типа разрядные трубки в виде ламп применяются в качест-
ве стандартных источников спектров различных металлов, в част-
ности железа. Спектр железа в полом катоде имеет более узкие
линии, чем в дуговом разряде.
В качестве источников непрерывного спектра в видимой об-
135
ласти используются лампы накаливания, а в УФ-области — газо-
разрядные водородные или дейтериевые лампы, которые дают
довольно интенсивный спектр в области ниже 320 нм.
§ 6. ОСВЕЩЕНИЕ ЩЕЛИ СПЕКТРОГРАФА
Для наилучшего использования излучения от источников света
обычно используются одно- или многолинзовые конденсоры (про-
ектирующие системы). Методику работы с такой однолинзовой
системой можно рассмотреть на примере дугового источника света.
Свет от дуги (см. рис. П.5) собирается и направляется на щель
спектрографа линзой-конденсором 15. Конденсор, как и дуга, ук-
репляется на рельсе спектрографа на определенном расстоянии
от щели. Обычно плазма дуги проектируется на входную щель
с увеличением 1:1, т. е. расстояние между дугой и щелью должно
быть равным примерно четырем фокусным расстояниям конден-
сора. Так как плазма дуги неоднородна по высоте и ее ядро не
заполняет всю щель по высоте, необходимо изображение электро-
дов расфокусировать, пододвинув конденсор к источнику света
На 3—5 см.
Для полного заполнения светом объектива коллиматора необ-
ходимо установить источник света и линзу-конденсор на оптичес-
кую ось спектрографа. Для этого сначала с рельса убирают кон-
денсор, щель открывают до 2 мм и ограничивают по высоте
фигурной диафрагмой до 2 мм. Затем пододвигают дугу к щели
и электроды устанавливают по центру щели (для этого можно
воспользоваться перекрестьем колпачка щел.и). Отодвинув штатив
на прежнее место, включают дугу и рассматривают через кассет-
ную часть изображение электродов (плазму). При правильной
установке дуги на оптическую ось в центре освещенного объекти-
ва будет видно яркое пятно плазмы. Затем устанавливают кон-
денсор и добиваются, чтобы изображение электродов приходилось
на центр перекрестья колпачка щели. После того как конденсор
установлен на оптическую ось, можно менять электроды без пов-
торения всех операций, так как теперь вполне достаточно (не
трогая линзы) установить положение электродов с помощью ре-
гулировочных винтов таким образом, чтобы их изображение было
по центру цели.
Методика установки газоразрядных источников света с протя-
женной (объемной) зоной разряда точно такая же, как это делает-
ся в случае кювет для комбинационного рассеяния (см. § 9).
§ 7. ФОТОГРАФИЧЕСКИЕ МАТЕРИАЛЫ И ИХ ОБРАБОТКА
Фотографический метод регистрации спектра основан на фото-
химическом действии света на галоидные соли серебра. Свето-
чувствительный слой фотографических материалов состоит из
мельчайших кристаллов галоидного серебра (обычно AgBr), ко-
136
юрые взвешены в желатине. Тонкий слой такой эмульсии наносит-
ся на подложку из стекла или пленку.
При воздействии света на эмульсию кристаллики AgBr, затро-
нутые светом, частично восстанавливаются до металлического се-
ребра. При этом происходит образование так называемого скры-
того изображения. Чтобы оно стало видимым, «дефектные» крис-
таллы AgBr необходимо полностью превратить в свободное сереб-
ро (этот процесс называется проявлением), а кристаллики AgBr,
не подвергшиеся воздействию света, нужно вымыть из желатины
(этот процесс называется закреплением или фиксированием).
В результате получается негативное изображение, так как засве-
ченные участки фотоэмульсии непрозрачны из-за поглощения и
рассеяния света кристалликами серебра.
Интенсивность спектральных линий можно измерять по степе-
ни почернения их изображения на фотопластинке, оДнако следует
иметь в виду, что плотность почернения зависит от интенсивности
света довольно сложным образом и нелинейна при малых и боль-
ших интенсивностях.
Чувствительность фотографических материалов увеличивается
с ростом размеров зерен AgBr, однако при этом уменьшается
контрастность изображения и разрешающая способность эмульсии.
При спектральных исследованиях интенсивных источников света
обычно пользуются мелкозернистыми фотографическими материа-
лами с малой чувствительностью, но с большим разрешением
(минимальное расстояние • между разрешаемыми линиями
~0,02 мм) и высокой контрастностью.
Чувствительность эмульсий определяется по действию на нее
неразложенного белого света. Для спектральных исследований
этого недостаточно. Необходимо знать спектральную чувствитель-
ность в зависимости от длины волны падающего света. Обычные
(несенсибилизированные) эмульсии чувствительны в области
2300—5000 А с максимумом около 4000 А. На такие эмульсии
красный свет не действует, и при нем их можно обрабатывать
(проявлять, фиксировать и т. д.).
Для работы в более длинноволновой области спектра эмульсии
сенсибилизируются различными красителями. Фотоматериалы,
очувствленные к желтой области спектра (до 5800 А), называются
ортохроматическими, а к близкой красной (до 7000А)—изохро-
матическими. Панхроматические фотоматериалы чувствительны
вплоть до области 7000 А, однако имеют провал чувствительности
от 5000 до 6200 А. Наиболее равномерна чувствительность у изо-
панхроматических эмульсий. Сенсибилизированные эмульсии не-
обходимо проявлять в полной темноте.
Процесс обработки фотографических материалов (их проявле-
ние и фиксирование) может сильно влиять на контрастность и
разрешающую способность фотоэмульсии.
Проявление ведется обычно в темноте по времени, которое
указывается на упаковке фотопластинок. При проявлении фото-
137
пластинку кладут эмульсией вверх, а саму кювету с проявителем
осторожно покачивают, чтобы процесс шел равномерно.
Фиксирование обычно проводится в два раза дольше, чем про-
явление. При работе с проявителем и фиксажем следует избегать
попадания одного раствора в другой. Для этого при перенесении
фотоматериалов из проявителя в фиксаж их промывают в кювете
с водой.
После фиксирования фотопластинку или фотопленку тщатель-
но (не менее 20 мин) промывают в проточной воде и сушат на
воздухе.
§ 8. РАСШИФРОВКА И ИЗМЕРЕНИЕ СПЕКТРОГРАММ
Измерение длин волн (или волновых чисел) спектральных ли-
ний или кантов в полосатых спектрах проводится методом интерпо-
ляции либо по внутреннему стандарту, когда в исследуемом спект-
ре хорошо известны длины волн ряда характерных линий, либо по
эталонному (стандартному) спектру железной дуги или ртутной
лампы, который фотографируют рядом с измеряемым спектром
так, чтобы они несколько перекрывались.
Для фотографирования эталонного спектра рядом с исследуе-
мым спектром необходимо пользоваться фигурной диафрагмой,
показанной на рис. П.7,ц. Диафрагма помещается непосредствен-
но перед щелью спектрографа и при продольном перемещении
может открывать или закрывать различные участки щели, высота
которой около 15 мм. Левая часть фигурного (в виде ласточки-
ного хвоста) выреза диафрагмы (см. рис. П.7,а) ограничивает
высоту щели сверху и снизу, оставляя открытой лишь среднюю
ее часть. Положение этого выреза перед щелью отсчитывают по
верхней шкале. Одно деление шкалы соответствует высоте щели
в 1,2 мм. Правая часть выреза, наоборот, закрывает среднюю
часть щели, оставляя открытой верхнюю и нижнюю части ее.
Положение выреза отсчитывают по правой нижней шкале. Такой
фигурный вырез позволяет снимать в средней части щели (левая
часть выреза) спектр исследуемого вещества, а сверху и снизу
от него (правая часть выреза)—спектр сравнения, например,
спектр железной дуги. При этом оба выреза устанавливаются на
одном и том же делении обеих шкал или так, чтобы спектры
немного перекрывались, как это видно из рис. II.7, б. Перекрыва-
ние спектров необходимо для того, чтобы точнее измерять спектры.
Два промежуточных выреза в средней части диафрагмы слу-
жат для ограничения высоты щели в ее центральной части. Эти
вырезы устанавливаются по двум длинным штрихам, расположен-
ным в левой нижней части диафрагмы. С помощью косого выреза
можно получить последовательно до семи соприкасающихся
спектров одинаковой (но небольшой) высоты (см. рис. II.7,в).
Следует обратить внимание на то, что при фотографировании
эталонного спектра сравнения нельзя трогать кассету (в част-
138
ности, закрывать или открывать ее выдвижную шторку), так как
в этом случае спектры могут сместиться друг относительно друга
и измерения будут неверны. Чтобы избежать нежелательной под-
светки фотоэмульсии в промежутках между экспозициями, кас-
сетную часть закрывают поворотной шторкой 11 (см. рис. II.5).
Перед тем как начать измерения спектра, необходимо провести
отождествление линий эталонного спектра железа. Обычно для
этого используются спектропроекторы ПС-18 (рис. 11.10) или
СПП-2 (рис. 11.11), которые проектируют изображение фотоплас-
тинки с двадцатикратным увеличением на белый экран.
На экран помещают фотографии спектра железа в том же
масштабе. На них приведены значения длин волн наиболее рез-
ких линий или имеется шкала длин волн. Более точные значения
даются в прилагаемых к атласам таблицах.
При такой расшифровке спектрограммы фотопластинку кладут
эмульсией вверх на подвижной столик 1 (см. рис. П.10) включен-
ного спектропроектора и закрепляют зажимом. Фокусировка спект-
ра на экране 2 осуществляется вращением объектива 3, находя-
щегося под подвижным столиком. Перемещение верхнего столика
139
при помощи двух длинных рукояток 4, 5 позволяет вывести в
поле зрения любой участок спектрограммы и сравнить его с фото-
графией спектра железа или ртути из атласа. Не имея навыка,
не всегда легко определить длинноволновую сторону спектрограм-
мы, поэтому отождествление спектра железа вызывает некоторое
затруднение, так как не ясно, как располагать фотографию спект-
ра— по возрастанию или уменьшению длин волн. Обычно это
Рис. II. 11. Спектропроектор СПП-2
решается эмпирически — спектр «прогоняется» перед спектрограм-
мой и если совмещений нет, то он поворачивается на 180° и все
повторяется. Следует иметь в виду, что по ряду технических при-
чин очень трудно точно подогнать проектируемый спектр к спект-
ру атласа. Обычно к краям спектр сжат или растянут, однако на
расшифровке спектра это существенно не сказывается.
Спектропроектор СПП-2 (рис. 11.11) имеет более современную
конструкцию и удобнее в работе. Его можно использовать также
и для точного (±0,01 мм) измерения расстояний между спект-
ральными линиями, перемещая столик с закрепленной фотоплас-
тинкой микрометрическим винтом и проектируя Линии между
двумя параллельными штрихами экрана.
140
После того как спектр железа отождествлен, необходимо по-
метить на спектрограмме чернилами или острым карандашом те
линии спектра железа, которые будут в дальнейшем служить
реперами для расчета линий или кантов исследуемого спектра.
Длины волн реперов записываются в рабочий журнал.
Для грубой оценки длин волн неизвестного спектра можно
воспользоваться фотографиями спектра железа, на которых отме-
чены длины волн большинства линий. «На глаз» или с помощью
линейки можно провести линейную интерполяцию измеряемой
линии или канта по двум соседним известным.линиям эталонного
.спектра железа.
Для точного измерения спектров используются измерительные
микроскопы МИР-12 или компаратор ИЗА-2.
Измерение длин волн спектральных линий основано на том,
что между длиной волны спектральной линии X и положением ее
на спектрограмме I, отсчитанным от некоторого (произвольного)
начала, за которое может быть езят, например, нуль шкалы изме-
рительного прибора, существует определенная зависимость. Для
ряда случаев связь между Ли/ можно считать линейной:
Л = я0 + Я]/, (П.7)
где а0 и ах — постоянные.
Для определения «о и а\ надо знать длины волн Л1 и Лг каких-
либо двух линий на концах измеряемого интервала спектра и
определить для них /1 и /2. Тогда из системы уравнений
+ (Н.8)
%2 ~ Яр 4“ ^1^2
получаются коэффициенты
. (П 9)
‘1 ‘— ‘2
И
= = (П.10)
/1 — /2 11 — 12
Физический смысл а\ — обратная линейная дисперсия, усреднен-
ная для измеряемого интервала длин волн; Яо— длина волны,
соответствующая началу шкалы измерительного прибора.
Подставив численные значения этих коэффициентов в уравне-
ние II.7, можно определить длину волны Л любой линии, если
известно ее положение /. Это же уравнение II.7 можно использо-
вать и для экстраполяции, но она должна быть небольшой.
В елучае спектрограмм, полученных на призменных спектрогра-
фах, интервал интерполяции не может быть большим. Его вели-
чина определяется ходом кривой дисперсии (см. рис. П.4,я) и тре-
буемой точностью, измерений. Для спектрографа ИСП-51 с каме-
141
(11.13)
рой f=270 мм и не очень точных измерений можно рекомендовать
интервал порядка 10—50 нм.
Для повышения точности и оасширения одновременно измеряе-
мого интервала спектрограмм, полученных на призменном спект-
рографе, следует пользоваться формулой Гартмана:
Л = Хо - Л , (П.11)
/-/о
где Д, Ло и /о — постоянные.
Для определения этих постоянных необходимо знать длины
волн Xi, Хг, Хз трех линий и измерить для них /], /2, /з- Решая
систему уравнений
д
7ГТ' (П.12)
^2 ~ ~ = X® Ч >
1% — to ‘3— ‘0
можно определить коэффициенты уравнения 11.11
(Xi — Х3)_____
/2 *— G \ / Xi — Х2
Х2 Х3 / \ /j —
lo ~ ’L —г- (^з ^о)> ^4 = (Х3 Хо) (/3 /0),
Л2 — *''3
а затем рассчитать длину волны любой линии, находящейся в
диапазоне от Xi до Хз.
Измерительный микроскоп МИР-12 (рис. II.12,а) снабжен гори-
зонтальным столиком 1, на котором закрепляется фотопластинка.
Корпус микроскопа 2 сделан подвижным и может перемещаться
при помощи микрометрического винта 3 в горизонтальном направ-
лении. Фотопластинку закрепляют на столике так, чтобы движе-
ние каретки микроскопа было направлено вдоль спектра. Имею-
щийся в поле зрения микроскопа тонкий крест или параллельные
штрихи (рис. II. 12,6) устанавливают последовательно на каждую
спектральную линию.
Для установки в поле зрения микроскопа нужного участка
спектра подвижный столик 1 имеет продольное (вдоль хода ка-
ретки) и поперечное (перпендикулярно ходу каретки) перемеще-
ния. Для освобождения продольного хода столика необходимо на-
жать педаль 4. Поперечное перемещение производится от руки.
Для точной установки оси спектра параллельно ходу каретки
служит винт 5, при помощи которого столик может вращаться
вокруг вертикальной оси на небольшой угол (~2°).
Резкость изображения (фокусировка) спектра достигается вра-
щением объектива 6. Окуляр 7 снабжен сеткой с двойными штри-
хами (рис. 11.12, 6), устанавливаемыми параллельно спектральным
142
линиям поворотом окуляра (при ослабленном хомутике 8), кото-
рый затем зажимают.
Установку резкости сетки окуляра производят вращением оп-
равы окулярной линзы 9. Отсчеты расстояний делают по милли-
метровой шкале 10 и барабану 11. Цена деления барабана 0,01 мм,
точность отсчета +0,005 мм. Освещение спектрограммы регулиру-
Рпс. 11.12. а — Измерительный микроскоп МИР-12; б — сетка в поле зрения
измерительного микроскопа
ют при помощи зеркала 12. Каретка микроскопа имеет ход 50 мм.
Увеличение микроскопа 20 раз.
Помимо измерительных микроскопов для измерения спектро-
грамм используются компараторы, например ИЗА-2, которые
позволяют вести измерение с большей точностью.
Как отмечалось ранее (см. раздел I, § 2), волновые числа яв-
ляются обратной величиной длины волны в вакууме. Поэтому для
точного определения электронных, колебательных и вращательных
состояний молекул в см-1 по полосатым спектрам необходимо
длины волн приводить к вакууму (см. Приложение III), так как
линии “стандартного спектра железа в области 2000—10 000 А,
имеющиеся- в атласах и таблицах, даются для атмосферного дав-
ления воздуха. В случае ИК-спектров все стандартные длины волн
уже приведены к вакууму.
143
§ 9. МЕТОДИКА ФОТОГРАФИРОВАНИЯ И ИЗМЕРЕНИЯ СПЕКТРОВ
КОМБИНАЦИОННОГО РАССЕЯНИЯ, ВОЗБУЖДАЕМЫХ РТУТНОЙ ЛАМПОЙ
Установка для получения спектров комбинационного рассеяния
состоит из трехпризменного спектрографа ИСП-51 (см. § 4) и ос-
ветителя, в который входит ртутно-кварцевая лампа, кювета с ве-
ществом и линза-конденсор.
Осветитель (его схема представлена на рис. 11.13) состоит из
эллиптического цилиндра /, внутренняя поверхность которого хро-
Рис. II. 13. Схема осветителя для съемки КР-спектров, возбуждаемых ртутной
лампой:
а — продольное сечение, вид сверху; б — поперечное сечение, вид по направле-
нию к спектрографу
мирована и отполирована до зеркального блеска. На одной иа
его фокальных осёй помещается источник света 2 —ртутная Газо-
разрядная лампа ПРК-2 с оболочкой из кварца. Эллиптическая
зеркальная поверхность концентрирует свет на кювете 3 с иссле-
дуемым веществом, расположенной вдоль второй фокальной оси
эллиптического цилиндра. Внутри кожуха осветителя непрерывно
циркулирует вода для отвода тепла, выделяющегося при работе
лампы ПРК-2. Между лампой и кюветой с исследуемой жид-
костью помещается тепловой фильтр в виде рамки с двумя стек-
лами, между которыми циркулирует вода. Он предохраняет иссле-
дуемое вещество от нагревания. Чтобы напор воды был постоян-
ным и небольшим, а пузырьки растворенного в воде воздуха не
мешали работе, воду для охлаждения пропускают через стеклян-
ный сосуд — отстойник, установленный над осветителем. Для
устранения или существенного уменьшения флюоресценции образ-
ца, которая очень часто возникает в результате воздействия ультра-
фиолетового излучения ртутной лампы на само исследуемое ве-
щество или на малейшие его примеси и сильно мешает наблюде-
нию КР-спектров, устанавливается жидкостной фильтр 5 из насы-
щенного раствора KNO2. Он поглощает ультрафиолетовое
излучение ниже длины волны 'возбуждающей линии ртути 435,8 нм.
Спектр и длины волн' наиболее интенсивных линий излучения
ртутной лампы приведены в Приложении VIII, IX.
Кювета для комбинационного рассеяния света 3 имеет с одной
стороны плоское окно, а с другой — зачерненный рог (рог Вуда),
который поглощает излучение возбуждающей линии ртути, отра-
женное от внутренних стенок и окон кюветы. Этот свет сильно
мешает наблюдению слабого КР-спектра. Чтобы излучение от ис-
точника возбуждения не мешало наблюдению малоинтенсивного
КР-спектра, рассеянный свет фотографируется под углом 90°. Рас-
сеянный свет от кюветы собирается и направляется на щель спект-
рографа 6 линзой-конденсором 7. Конденсор, как и осветитель,
укрепляется на рельсе спектрографа на строго определенном рас-
стоянии от щели. Обычно передняя часть кюветы (дно) проеци-
руется на объектив коллиматора, а задняя (начало рога Вуда) —
на щель спектрографа. Для стандартных кювет длиной около
Юсм и при фокусном расстоянии конденсора /=9,5см этому тре-
бованию удовлетворяет расстояние от щели до задней части кю-
веты— примерно 33 см. В связи с тем что линии КР-спектра очень
слабы и времена экспозиции при фотографировании достигают
нескольких часов, необходимо устранить все посторонние источ-
ники света. Для этого на конденсор надеты выдвижные свето-
защитные кожухи, а кассетную часть рекомендуется прикрывать
черной материей. Кроме того, необходимо устанавливать более
широкие входные щели (порядка 50 мкм), чем в случае полоса-
тых спектров испускания двухатомных молекул. В спектре ртут-
ной лампы наряду с возбуждающей линий Л=435,8 нм содержатся
еще ряд более слабых линий, и в КР-спектре они могут прояв-
ляться ка-к линии релеевского рассеяния. Для того чтобы эти ли-
нии идентифицировать на фотопластинке рядом с КР-спектром
снимают также и спектр ртутной лампы.
145
Измерение линий КР-спектра ведется точно таким же образом,
как и полосатых спектров (см. § 8). Для определения частот
колебаний Vi из волнового числа возбуждающей линии ртути вы-
читается волновое число линии комбинационного рассеяния.
§ 10. МЕТОДИКА ВОЗБУЖДЕНИЯ СПЕКТРОВ КОМБИНАЦИОННОГО
РАССЕЯНИЯ И ФЛУОРЕСЦЕНЦИИ С ПОМОЩЬЮ ЛАЗЕРОВ
Бурное развитие лазерной техники последних лет позволило
использовать различные типы лазеров в качестве идеальных мо-
нохроматических источников света большой интенсивности. Одно-
временно совершенствовалась и техника регистрации спектров.
Поэтому приборы для изучения КР-спектров претерпели большие
изменения. В частности, регистрация спектров ведется не на
спектрографах, а на двойных монохроматорах с фотоумножителем
Рис. II. 14. Схема газового лазера и осветителя для съемки спектров ком-
бинационного рассеяния и резонансной флуоресценции
в качестве приемника света, сигнал от которого усиливается и
записывается на бумажном бланке.
Большим преимуществом современных КР-спектрометров с ла-
зерным возбуждением является очень малое количество вещества
(порядка 0,1—0,5 мл), необходимое для регистрации спектра,
быстрая запись спектра, высокое разрешение. КР-спектры не толь-
ко дополняют ИК-спектры, но и позволяют решать ряд принци-
пиально новых задач. Например, в КР-спектрах проявляются
линии полносимметричных колебаний, которые в ИК-спектрах за-
прещены. С помощью лазерной КР-спектроскопии проще иссле-
довать водные растворы и монокристаллы небольших размеров.
Следует отметить, что если энергия линии лазера равна энер-
тии возбуждения электронного состояния исследуемого соедине-
ния, то может возникнуть резонансная флуоресценция, которая
по своей интенсивности во много раз больше интенсивности КР-
спектра. В этом случае для получения КР-спектра следует исполь-
зовать лазер с большей длиной волны.
На рис. П.14 приведена схема лазера и осветителя для съемки
КР-спектров.
146
Газовый лазер, в котором активной средой являются ионы
аргона, создает мощное излучение до 1 Вт (этого достаточно,,
чтобы от лазера можно было зажечь спичку) с длиной волны
Х==488нм в зеленой области спектра. Лазер состоит из высоко-
вольтного источника питания /, разрядной трубки 2 с капилляром
3 и электродами 4. Трубка закрыта двумя окнами 5, наклонен-
ными к оси трубки под углом Брюстера 55°. При таком наклоне-
значительно уменьшаются потери при многократном прохождении
излучения через окна. Разрядная трубка наполняется аргоном до
давления 0,5—1 мм рт. ст.
Для создания активной среды, которой являются ионы аргона,,
через трубку пропускается высоковольтный разряд. В связи с
тем что в электрическом разряде низкого давления нет условий
равновесия, верхние состояния с временем жизни ионов 10~®c
могут быть перезаселены по отношению к более низколежащим
состояниям с временем жизни ЗЛО-10с, т. е. больцмановское рас-
пределение ионов аргона по уровням не выполняется.
Если на частицы, находящиеся в перезаселенном состоянии,,
воздействовать квантом света той же энергии E=hcv, что и энер-
гия перехода, то возникает вынужденное излучение и все возбуж-
денные частицы, встречающиеся на пути этого кванта, мгновенно*
переходят в основное энергетическое состояние, испуская при этом
многочисленные строго монохроматические кванты света-hey, т. о.
фактически происходит усиление света. Для усиления эффектив-
ности этого процесса (увеличения числа фотонов, вызывающих
вынужденное излучение) разрядная трубка устанавливается меж-
ду двумя плоскими или вогнутыми зеркалами 6 и 7, одно из
которых (зеркало 7) является полупрозрачным и через него вы-
ходит усиленное электромагнитное излучение, т. е. лазерный луч.
Эта система зеркал называется резонатором, так как она создает
условия для многократного прохождения света через разрядную*
трубку и, повышая число вынужденных переходов, образует мощ-
ный лазерный луч.
Для регистрации КР-спектров параллельный пучок света ла-
зерного излучения с помощью плоского зеркала 8 направляется
на линзу 9, которая фокусирует излучение на кювету с веществом.
Чтобы собрать излучение комбинационного рассеяния и напра-
вить его на щель 12 спектрального прибора, устанавливается кон-
денсор 11.
Флуоресценция также представляет большой интерес для хи-
миков (см. раздел I, § 9), так как позволяет проследить колеба-
тельные уровни до очень высоких значений колебательных кван-
товых чисел и тем самым довольно точно определять энергию-
диссоциации двухатомных молекул.
Спектры флуоресценции так же, как и КР-спектры, наблю-
даются под углом 90° к направлению луча источника возбуж-
дения.
147
§ 11. ФОТОЭЛЕКТРИЧЕСКАЯ РЕГИСТРАЦИЯ СПЕКТРОВ ПОГЛОЩЕНИЯ.
СПЕКТРОФОТОМЕТРЫ СФ-16 и СФ-4А
Изучение электронных спектров 'поглощения обычно проводится
на спектрофотометрах с фотоэлектрической регистрацией спектра,
которая по сравнению с фотографической регистрацией спектра
более удобна в работе и позволяет существенно повысить точность
количественных измерений.
Рис. II. 15. Общий вид спектрофотометра СФ-15
Спектрофотометры состоят из следующих основных элементов:
1. Источника непрерывного света, на фоне которого измеряется
исследуемое вещество.
2. Монохроматора.
3. Кюветного отделения, в которое помещается исследуемое
вещество и эталон (кювета сравнения).
4. Приемно-регистрирующего устройства, преобразующего све-
товой сигнал, попадающий на фотоэлемент, в электрический, ко-
торый затем подается на отсчетный прибор или самописец.
5. В некоторых конструкциях имеется еще фотометрическая
часть.
Однолучевой нерегистрирующий (неавтоматический) спектро-
фотометр СФ-16 (его предшествующая модель СФ-4А, а после-
дующая СФ-26) предназначен для измерения коэффициента про-
пускания или оптической плотности жидких, твердых и газообраз-
ных веществ в ультрафиолетовой, видимой и близкой инфракрас-
ной области спектра. Спектрофотометры этой серии являются
основными лабораторными приборами для качественных и коли-
чественных измерений электронных спектров поглощения.
Общий вид спектрофотометра СФ-16 представлен на рис. 11.15.
Следует подчеркнуть, что в оптической схеме, конструкции и
работе спектрофотометров СФ-16 и СФ-4А нет принципиальных
отличий, за исключением источника непрерывного спектра (в мэ-
148
дели СФ-4А установлена водородная лампа) и материала призмы,
что позволило несколько расширить область работы в сторону
меньших длин волн.
Основные параметры спектрофотометра СФ-16 следующие:
Рабочий диапазон в нм
Относительное отверстие монохроматора
Фокусное расстояние сферического зеркала объек-
тива в мм
Преломляющий угол и материал призмы
Обратная диспе^ия (линейная) монохроматора
(нм/мм)
Длина волны (нм)
195
220
440
950
1200
Пределы измерения оптической плотности
пропускания
Источники излучения
186—1100
1 : 11
500
30°
плавленый кварц
0,9
1,6
11,6
103,4
126
0—2
100—0%, 10—0%
ЮО—90%
дейтериевая лампа
(186—320 нм), лампа на-
каливания (320— 1100 нм)
Приемники излучения
сурьмяно-цезиевый фото-
элемент (186—650нм), кис-
лородно-цезиевый фото-
элемент (600—1100 нм)
Спектрофотометры содержат следующие основные блоки (см.
рис. 11.15): осветитель I, монохроматор II, кюветное отделение Ш,
камера с двумя приемниками и усилителем IV, собранные в одно
целое, и блок стабилизованного питания V. Расположение кювет-
ного отделения с образцами после монохроматора позволяет из-
бежать 1нежелательных фотохимических реакций, которые могут
иметь место при освещении вещества интенсивным и не разложен-
ным по спектру ультрафиолетовым излучением газоразрядной
дейтериевой или водородной лампы (спектр водорода приведен
на рис. 1.10).
На рис. 11.16 приведена оптическая схема спектрофотометра
СФ-16, которая почти не отличается от оптической схемы модели
СФ-4А. Расходящийся пучок света от источника 1 или Г попадает
на зеркало-конденсор 2, которое собирает и направляет свет на
плоское поворотное зеркало 3. Повернутый на 90° луч проходит
через защитную кварцевую линзу 4 и фокусируется на входную
Щель 5 монохроматора, собранного по автоколлимационной схеме.
Объективы коллиматора и камеры совмещены в одном зеркаль-
ном объективе. Вогнутое зеркало 6, в фокусе которого расположе-
на щель, направляет параллельный пучок света на кварцевую 30°
149
призму 7 с отражающей алюминированной задней гранью. Приз-
ма разлагает свет в спектр и направляет его обратно на объек-
тив 6. Лучи, прошедшие призму под углом, близким к углу наи-
меньшего отклонения, т. е. параллельные основанию призмы, по-
падают на выходную щель 8, расположенную над входной щелью.
Поворачивая призму вокруг оои с помощью рукоятки 1 (см.
рис. 11.15), можно получить на выходе монохроматора лучи раз-
личных длин волн.
Выходящий монохроматический пучок света проходит через
защитную кварцевую линзу 9, фильтр 10, уменьшающий рассеян*
Рис. II. 16. Оптическая схема спектрофотометра СФ-16:
а — вид сбоку; б — вид сверху
ный свет, эталон или измеряемый образец 11, защитную пластин-
ку 12 и попадает на сверхчувствительный слой фотоэлемента 13.
Входная и выходная щели монохроматора расположены одна
над другой и конструктивно составляют одно целое. Рабочая вы-
сота каждой щели—13 мм. Раскрытие щелей осуществляется
одновременно микрометрическим винтом 2 (см. рис. 11.15) в пре-
делах от 0 до 2 мм. Величина раскрытия щели отсчитывается
с точностью 0,001 мм по шкале, нанесенной на микрометрическом
винте.
Осветительная система состоит из источника света и конден-
сорного зеркала. В приборе имеются два источника непрерывного
спектра: газоразрядная дейтериевая лампа — для проведения из-
мерений в области 186—350 нм и лампа накаливания для измере-
ний в области 320—1100 нм. Смену источников производят пово-
ротом сферического зеркала 2 (см. рис. II. 16) с помощью рукоят-
ки, расположенной на задней стенке блока осветителя I (см.
рис. II.15).
150
Для обеспечения работы .прибора в широком диапазоне спектра
используются также два приемника: сурьмяно-цезиевый фотоэле-
мент для области 186—650 нм и кислородно-цезиевый.фотоэлемент
для области 600—1100 нм. Фотоэлементы расположены в камере
IV и в рабочее положение их устанавливают при помощи руко-
ятки 3..
В положении «Ф» в схему включается сурьмяно-цезиевый фото-
элемент, а в положении «К» — кислородно-цезиевый. При длинах
волн 600 нм следует переходить от измерений сурьмяно-цезиевым
фотоэлементом к измерениям с .кислородно-цезиевым фотоэлемен-
том. Чтобы не испортить фото-
элементы, когда открывается
крышка кюветного отделения, пе-
ред ними имеется светонепрони-
цаемая шторка, которая закры-
вается с помощью переключа-
теля 4.
В кюветное отделение III
(см. рис. 11.15) на подвижную ка-
ретку устанавливают исследуе-
мые образцы (например, раствор
и растворитель). . Каретка имеет
четыре фиксированных положе-
ния от «1» до «4», которые ус-
танавливаются рукояткой 5.
Для исследования жидкостей
в комплекте прибора имеются
кюветы двух типов (рис. 11.17):
прямоугольные с постоянной тол-
щиной поглощающего слоя 10 мм
Рис. II. 17. Жидкостные кюветы для
спектрофотометров.
a — неразборные прямоугольные кю-
веты; б — разборные цилиндриче-
ские кюветы с оправой
и разборные цилиндрические
кюветы длиной от 4 до 100 мм, состоящие из стакана 1 и кры-
шек 2. Для получения меньших слоев поглощения в стаканы
вставляются вкладыши, позволяющие получить слои от 0,05 до
1 мм за счет разности высот вкладыша и стакана.
На спектрофотометрах измеряется коэффициент пропускания
или оптическая плотность образца относительно эталона, про-
пускание которого принимается за 100%, а оптическая плотность
за ноль. В случае измерения растворов эталоном служит раство-
ритель.
Принцип действия спектрофотометра СФ-16 основан на том,
что на монохроматоре устанавливается определенная длина волны
А] и в этот пучок света сначала вводится эталон (растворитель),
который принимается за 100% пропускания, а затем образец
(раствбр).
Отношение сигнала, регистрируемого фотоэлементом от свето-
вого потока /, прошедшего через образец, к сигналу светового
потока /о, прошедшего через эталон, определяется по шкале от-
151
счетного потенциометра в процентах пропускания Тк = ///о* 100%
(или как оптическая плотность А к = 1g 1/7\ ). Затем устанавли-
вается другая длина волны Лг и все операции измерения 7\
(или Ла ) повторяются. Таким образом, измерения «по точкам»
проводятся по всем длинам волн, для которых необходимо опре-
делить коэффициент пропускания (оптическую плотность). Ре-
зультаты наносятся на график зависимости Га (или Ла) от Л
и получается спектр.
Такой неавтоматический метод регистрации спектров, конечно,
очень несовершенен, например, по сравнению со спектрофотомет-
ром СФ-14, однако для ряда спектроаналитических задач, когда
измерения ведутся на одной длине волны,, вполне пригоден.
При количественных измерениях следует обращать внимание
на то, что как при больших оптических плотностях (более 0,7),
так и малых (менее 0,2) существенно уменьшается точность из-
мерения оптической плотности. Поэтому обычно желательно под-
бирать такие толщины кювет или концентрации веществ, чтобы
не выходить далеко за пределы оптической плотности 0,3—0,7.
§ 12. ПОРЯДОК РАБОТЫ НА СПЕКТРОФОТОМЕТРЕ СФ-16
1. Убедиться, что щель и приемник спектрофотометра закрыты.
На шкале щели 2 (см. рис. 11.15) должно быть деление «0», а ру-
коятка 4 шторки фотоэлемента должна стоять в положении «за-
крыто». Во время работы следует помнить, что нельзя открывать
кюветное отделение, не закрыв при этом шторки фотоэлемента,
иначе он будет выведен из строя.
2. Включить под наблюдением преподавателя или лаборанта
прибор и дать ему прогреться около 20 мип.
3. Открыть крышку кюветного отделения и установить в него
на подвижную каретку кюветы с исследуемым раствором (кювета
помечена красной точкой) и растворителем. Обычно кювета с
растворителем устанавливается в положение. «1» перемещением
ручки 5 переключателя каретки. Плотно закрыть крышку кювет-
ного отделения.
4. Поставить рукоятку 6 потенциометра чувствительности в
среднее положение, а переключатель чувствительности 7 в поло-
жение «2». Ступени переключения чувствительности «1» — «4»
соответствуют работе со щелями различной ширины. При переходе
от положения «1» к «4» щели уменьшаются примерно в три раза,
но снижается точность установки нуля по шкале миллиампер-
метра 8. Узкими щелями обычно пользуются для того, чтобы
регистрировать спектры с большим разрешением, например для
разрешения линий колебательной структуры в электронных спект-
рах. Во время одной серии измерений изменять чувствитель-
ность нельзя, так как это может привести к ошибкам в из*
мерен иях.
152
5. Вращая рукоятку 1 в сторону увеличения длин волн, уста-
новить по шкале 9 требуемую длину волны. Если при этом шкала
по'вернется на большую величину, то необходимо возвратить ее
назад на 3—4 деления и снова осторожно подвести ее к требуе-
мому делению, чтобы избежать ошибок за счет люфта.
6. Перемещая рукоятку 5 каретки кюветодержателя, устано-
вить в положение «1» эталон (кювета с растворителем), световой
лоток через который соответствует 100% пропускания.
7. Поставить переключатель 10 измерительного реохорда в по-
ложение «выключено».
8. При закрытой шторке фотоэлемента скомпенсировать его
темновой ток грубо рукояткой 11 и тонко рукояткой 12, установив
стрелку миллиамперметра 8 на условный ноль. При переключении
чувствительности необходимо вновь компенсировать темновой ток.
9. Открыть шторку фотоэлемента.
10. Вращая рукоятку 2 механизма изменения ширины щели,
установить стрелку миллиамперметра на условный ноль, что со-
ответствует 100% пропускания кюветы сравнения. Относительно
этого сигнала затем будет измеряться пропускание исследуемого
образца.
11. Перемещая рукоятку 5 каретки с кюветами до положения
«2», установить на пути светового пучка исследуемый образец
(раствор), если используются прямоугольные кюветы постоянной
толщины. В случае цилиндрических кювет каретка устанавливает-
ся в положение «4».
12. Установить рукоятку 10 в положение «1».
13. Поворачивая движок реохорда отсчетного потенциометра
рукояткой 13, установить стрелку миллиамперметра 8 на уело з-
ный ноль и записать отсчеты по шкале длин волн и шкале 14 про-
пускания 7\ или оптической плотности Ах = \g\IT\.
Если требуется с большей точностью измерить коэффициент
пропускания при Т<10% или Т>90%, то рукоятка переключа-
теля 10 устанавливается соответственно в положение «2» или «3».
В первом случае снятый по шкале пропускания отсчет умножает-
ся на 0,1 (к показаниям оптической плотности прибавляется еди-
ница), а во втором случае отсчет также умножается на 0,1, но
к нему прибавляется еще 90%.
14. Ввести эталон (растворитель) снова в пучок света, уста-
новив предварительно рукоятку 10 в положение «включено»; при
этом стрелка миллиамперметра должна остаться на нуле. Если
она отклонилась, то измерения повторить снова.
15. Установить следующую длину волны и повторить операции,
начиная с пункта 9.
16. После окончания измерений закрыть фотоэлемент и вынуть
кюветы-.
17. Выключение спектрофотометра производится под наблюде-
нием преподавателя или лаборанта.
Работа на спектрофотометре СФ-4А практически аналогична.
153
§ 13. АВТОМАТИЧЕСКИЙ СПЕКТРОФОТОМЕТР СФ-14
ДЛЯ ВИДИМОЙ ОБЛАСТИ СПЕКТРА
Двухлучевой регистрирующий (автоматический) спектрофото-
метр СФ-14 (новая модель идет под шифром СФ-18) предназна-
чен для измерения коэффициентов пропускания, оптической плот-
ности и коэффициентов отражения твердых и жидких веществ
в видимой области спектра (400—750 нм).
Основные параметры спектрофотометра СФ-14 следующие:
Область работы в нм
Монохроматор
Относительное отверстие монохроматора
Обратная линейная дисперсия монохроматора
(нм/мм)
при длине волны 400 нм
» 500 нм
» 600 нм
» 750
Пределы измерения коэффициентов пропускания
в %
Источник излучения
Приемник энергии
Продолжительность записи одного спектра в мин.
400—750
призменный, двойной
1 :7
1,6
4,0
7,8
16,5
1—100 и 0—10
лампа накаливания
мультищелочной фото-
элемент
от 2 до 12
Общий вид спектрофотометра СФ-14 представлен на рис. 11.18:
1— осветитель; 2 — двойной монохроматор с фотометрическим
устройством; 3— кюветное отделение; 4 — интегрирующая сфера
с фотоэлементом; 5 — блок усилителя; 6 — записывающее устрой-
ство; 7 — пульт управления.
На рис. 11.19 приведена оптическая схема спектрофотометра
СФ-14. Нить лампы накаливания 1 проецируется конденсором
2 через входную щель 3 на объектив коллиматора 4 первого моно-
хроматора (в отличие от других приборов, где источник проеци-
руется на входную щель). Параллельный пучок света после кол-
лиматора диспергируется призмой 5, а затем сложный камерный
объектив 6 дает спектральное изображение входной щели в плос-
кости промежуточной щели двойного монохроматора. Она пред-
ставляет собой сочетание зеркала 7 и перпендикулярного к ней
ножа 8. Перемещая целиком зеркало 7 и нож 8 по направлению
стрелки, можно выделять определенный интервал длин волн. Свет,
выделенный первым монохроматором и содержащий малую долю
рассеянного света, проходит через второй монохроматор (объек-
тивы 9, 11 и призма 10), становится еще более монохроматичным
и фокусируется на выходную щель 12.
После выходной щели расположена фотометрическая часть
прибора, назначение которой разделить световой пучок на две
равные части, чтобы можно было в одном пучке поставить кювету
с растворенным образцом, а в другом — кювету с растворителем.
154
Рис. IL 18. Общий вид спектрофотометра СФ-14
Рис. II. 19. Оптическая схема спектрофотометра СФ-14
Вышедший из второго монохроматора неполяризованный пучок
света разделяется с помощью линзы 13 и двоякопреломляющей
призмы Рошона 14 на два взаимно перпендикулярных плоско-
поляризованных пучка, причем один из них (необыкновенный
луч е) срезается диафрагмой /5, а другой (обыкновенный луч о),
проходя через призму Волластона 16 и линзу /7, снова делится
на два пучка (обыкновенный о и необыкновенный е), поляризо-
ванных во взаимно перпендикулярных плоскостях, которые под
некоторым углом проходят через две линзы 18, находящиеся внут-
ри барабана-модулятора 19 с окнами. Интенсивность пучков света
за призмой Волластона 16 определяется угловым положением
призмы Рошона 14, которая может вращаться. Далее лучки света
в двух каналах поочередно перекрываются модулятором 19 с час-
тотой 50 Гц и, отклоняясь на 90°, призмой 20 попадают в интегри-
рующую сферу 21, пройдя предварительно кювету с образцом 22
и кювету сравнения 23.
Свет в интегрирующей сфере многократно отражается и по-
падает на регистрирующий фотоэлемент 24. Фотоэлемент за счет
модуляции освещается поочередно потоками, прошедшими либо
через кювету сравнения, либо через измеряемый образец. Если
световые потоки равны, освещенность фотоэлемента будет постоян-
на в любой момент времени, и переменный сигнал на входе усили-
теля переменного тока создаваться не будет. При поглощении
света в одном из каналов световые потоки в канале образца и в
канале сравнения будут разными, и на фотоэлементе возникнет
переменный сигнал с частотой 50 Гц. Этот сигнал попадает на
вход усилителя, который связан с мотором отработки, поворачи-
вающим призму Рошона 14 до тех пор, по.ка не исчезнет сигнал
на входе усилителя, т. е. не уравняются световые пучки после
кювет. Одновременно с поворотом призмы! Рошона 14 происходит
перемещение пера, фиксирующего на бланке процент пропускания
образца. Такой принцип работы спектрофотометра, ког^а вырав-
ниваются сигналы в каналах образца и каналы сравнения, назы-
вается нулевым методом.
Таким образом, автоматическая регистрация спектра иссле-
дуемого образца (в виде кривой пропускания или оптической
плотности) сводится к одновременному перемещению промежуточ-
ной щели двойного монохроматора и выравниванию света в кана-
лах образца и канале сравнения с помощью поворота призмы
Рошона.
Конструкция и принцип работы спектрофотометра СФ-14 очень
близки другим приборам этого класса СФ-10 и СФ-18.
§ 14. ПОРЯДОК РАБОТЫ НА СПЕКТРОФОТОМЕТРЕ СФ-14
1. Поставить все переключатели на панели спектрофотометра
в положение «выключено» (нижняя позиция) и включить питание
прибора на щитке (это делается под наблюдением преподавателя).
156
2. Включить прибор выключателем «сеть»; при этом на панели
должна загореться красная сигнальная лампочка.
3. При поднятом пере (оно поднимается оттягиванием штока
с кнопкой 8, см. рис. 11.18), установить рукояткой 9 начальное
деление 400 нм шкалы длин волн 10.
4. Укрепить бланк на барабане 11 записывающего устройства.
Для этого поднять прижим 12, подсунуть бланк снизу под бара-
бан, (шкала длин волн на бланке должна быть справа) и плотно
обмотать бланк вокруг барабана, сдвигая его вплотную к бортику
барабана справа. При этом на бланке деление длин волн 400 нм
должно быть установлено так, чтобы оно приходилось напротив
пера. Опустить прижим. Если при опускании пера его кончик не
совпадает с делением 400 нм, провернуть барабан, взявшись за
него рукой, так, чтобы перо совпало с началом шкалы длин волн.
Поднять перо.
5. После того как прибор прогрелся в течение 15—20 мин,
включить на панели 7 источник света выключателем «лампа».
6. Включить на панели 7 выключатели «прерыватель» и «от-
работка».
7. Установить рукоятку «усиление» 13 (это делается под конт-
ролем преподавателя) так, чтобы оно не было слишком велико
(при этом начинаются автоколебания пера) и не слишком мало
(перо вяло перемещается при перекрывании канала образца).
Установку усиления следует производить при поднятом пере.
.8 . Установить шкалу записи и проверить ноль шкалы (это
делает преподаватель).
9. Установить образец в левый канал кюветного отделения,
а кювету сравнения в правый. Закрыть крышку кюветного отделе-
ния.
10. Установить на панели 7 переключатель «скорость развертки
спектра» в положение «3».
11. Включить на панели 7 выключатель «развертка спектра»,
опустив предварительно до упора перо на бланк.
12. После окончания записи выключить выключатель «разверт-
ка спектра» и прокрутить (осторожно) барабан до деления 400 нм
в том же направлении, что и велась запись. При этом перо авто-
матически поднимается и линейка* прижима проходит под ним..
13. Установить следующий образец и начать новую запись.
14. После окончания работы убрать кюветы, поднять перо и
выключить все выключатели справа налево.
§ 15. ОСНОВЫ ТЕХНИКИ ИК-СПЕКТРОСКОПИИ
Одна из основных особенностей техники ИК-спектроскопии
состоит, в том, что стекло и кварц в средней ИК-области спектра
не прозрачны. Поэтому вместо линзовых объективов используются
зеркальные, а в качестве призм и окон различного назначения
используются кристаллы таких солей, как NaCl, KBr, CsJ, LiF,
157
CaFs и т. д., которые отличаются главным образом своей грани-
цей пропускания в ИК-о’бласти (в видимой и УФ-области они все
прозрачны). Кристаллы КВт используются до 400см-1, a NaCl
только до 650 см-1. Гигроскопичность и растворимость в воде
кристаллов большинства солей вызывает большие затруднения
при работе с ними.
Основные принципы работы ИК-спектрофотометров и технику
ИК-спектроскопии, с помощью которой исследуются колебатель-
ные спектры молекул, можно рассмотреть на примере призменных
ИК-спектрофотометров ИКС-14 и ИКС-22. В настоящее время
выпускаются спектрофотометры с дифракционными решетками
ИКС-29, ИКС-24, ИКС-31. Спектрометры, например ИКС-21,
ИКС-31, менее удобны в работе, так как для получения ИК-спект-
ра исследуемого вещества необходимо произвести измерения двух
спектров: сначала зарегистрировать спектр испускания источника
излучения и принять его за /о, а затем установить образец, и на
фоне кривой /о записать спектр пропускания, т. е. получить вели-
чину I. После этого по точкам строится кривая пропускания
T=I!Iq 100% в зависимости от волнового числа v (см-1). Кроме
того, при регистрации спектров на однолучевом приборе возника-
ют большие трудности, связанные с наложением ИК-спектров
поглощения атмосферных паров Н2О и СО2, поэтому спектрометр
ИКС-31 вакуумирован. Наличие двух одинаковых пучков в двух-
лучевых спектрофотометрах позволяет компенсировать атмосфер-
ное поглощение и регистрировать спектр непосредственно в про-
центах пропускания. Двухлучевые спектрофотометры также позво-
ляют компенсировать поглощение окон кювет и растворителей,
если регистрируются спектры растворов.
Двухлучевые ИК-спектрофотометры состоят из следующих ос-
новных частей:
1. Двухлучевой осветитель с источником непрерывного спектра.
2. Кюветное отделение.
3. Фотометрическая система, которая позволяет регистриро-
вать спектры поглощения в процентах пропускания.
4. Монохроматор, который диспергирует попадающее в него
излучение и выделяет из него узкий интервал спектра.
5. Приемник ИК-излучения.
6. Усилитель переменного тока.
7. Записывающее устройство.
В связи с тем что в ИК-спектроскопии используются главным
образом спектры поглощения, необходим источник ИК-излучения
с непрерывным спектром. Для этих целей наиболее удобны нагре-
тые твердые тела с температурой 1200°С и выше. Распределение
интенсивности в спектре испускания таких тел приближается к
излучению абсолютно черного тела (рис. II.20).
В спектрофотометрах ИКС-14 и ИКС-22 в качестве источника
света используется штифт Глобара (обычно его называют «гло-
бар»), изготовленный из карбида кремния (силита), через кото-
158
Рис. 11.20. Распределение энергии
излучения абсолютно черного тела
при разных температурах. Пункти-
ром показано положение максимума
интенсивности излучения в зависи-
мости от температуры
рый для нагрева до температуры 1200— 1400°С пропускается
электрический ток 3—5 А. Для отвода 'выделяющегося тепла гло-
бар помещается в охлаждаемый водой корпус с окном. Максимум
интенсивности излучения глобара приходится на область 5000—
5500 см-1 (1,8—2 мкм), а в об-
ласти 600 см-1 (16,7 мкм) интен-
сивность снижается примерно
в 600’раз.
В качестве приемника ИК-из-
лучения в спектрофотометрах
ИКС-14 и ИКС-22 используется
болометр. Принцип его работы
основан на изменении электричес-
кого сопротивления тонкой плен-
ки висмута (0,1 — 1 мкм) при теп-
ловом воздействии ИК-радиации.
Для более эффективной работы
приемная площадка размером
0,2X2 мм покрывается чернью и
помещается в вакуумный корпус
с окном из кристалла КВг, в
котором поддерживается дав-
ление порядка 10~2 мм рт. ст.
Из-за недостаточно высокой
чувствительности тепловых при-
емников ИК-радиации, и в част-
ности болометров, измерения ИК-
спектров ведутся при довольно
широких щелях (они в несколь-
ко раз больше ширины нормаль-
ной щели см. § 4), поэтому разрешающая способность призмен-
ных ИК-спектрофотометров невелика (существенно ниже теоре-
тической см. § 2).
Работа спектрофотометров, основанная на принципе оптичес-
кого нуля, будет детально рассмотрена в § 16 на примере спектро-
фотометра ИКС-14.
§ 16. ИНФРАКРАСНЫЙ СПЕКТРОФОТОМЕТР ИКС-14
Двухлучевой инфракрасный спектрофотометр ИКС-14 со смен-
ными призмами предназначен для регистрации спектров поглоще-
ния (в процентах пропускания) твердых, жидких и газообразных
веществ.
Он состоит из двухлучевого осветителя I (рис. 11.21), монохро-
матора II (под его крышкой находятся также фотометрическая
часть и приемник), входного блока усилителя III, выходного бло-
ка усилителя IV и записывающего устройства V. Между освети-
159
телем и монохроматором находится открытое кюветное отделение.
Основные параметры спектрофотометра ИКС-14 следующие:
Диапазон работы (в см-1)
с призмой из стекла
с призмой из LiF
с призмой из NaCl
с призмой из КВг
Монохроматор
Относительное отверстие
Коллиматорное зеркало
Диапазон раскрытия щелей
Источник излучения
Осветитель
Приемник энергии
Разрешающая способность в области
1000 см-1
3800—13 300
1800—5000
650—2000
400—700
одинарный призменный, построенный
по автоколлимационной схеме Литтрова
1 :5,5
внеосевая парабола с фокусным рас-
стоянием 270 мм
0,01—3 мм
стержень из карбида кремния (глобар)
при температуре 1300—1400°С
двухлучевой
висмутовый болометр
около 3—4 см-1
Спектр записывается на рулонной бумаге и требует градуировки.
Оптическая схема прибора показана на рис. 11.22. Свет от
источника инфракрасной радиации 1 разделяется на два пучка
вогнутыми зеркалами 2, 3 и 4, 5 по каналам I и II, которые на-
Рис. 11.21. Внешний вид инфракрасного спектрофотометра ИКС-14
зывают соответственно каналом образца и каналом сравнения.
В канал образца устанавливается кювета 6 с исследуемым вещест-
вом, а в канал сравнения — пустая кювета 7, которая позволяет
вычесть свет, поглощаемый окнами кюветы образца.
160
В плоскости, в которой установлены фотометрический клин 8
и компенсирующий клин 9, фокусируется увеличенное вдвое изо-
бражение истопника.
В канале I световой пучок с помощью плоских зеркал 10 и
И направляется на вогнутое зеркало 12, которое создает второе
изображение источника в плоскости, отражающей поверхности
вращающегося зеркального прерывателя (молудярота) 13 в виде
двух секторов. В зависимости от положения зеркала модулятопа
28 9 10 11 12 15 13 П 29 18 29 23 22 26 25 19
Рис. II. 22. Оптическая схема инфракрасного спектрофотометра ИКС-14
световой пучок либо перекрывается им, либо попадает на вогнутое
зеркало 14.
. В канале 11 плоское зеркало 15 направляет световой пучок на
вогнутое зеркало 16, которое дает изображение источника на том
же самом месте отражающей поверхности модулятора 13, что и
зеркало 12 канала I. При вращении модулятора пучок света от
вогнутого зеркала 16 или проходит за модулятор и теряется на
стенках прибора, или, отразившись от зеркальной поверхности
модулятора, попадает на вогнутое зеркало 14. Таким образом, при
вращении секторного модулятора световые пучки из обоих кана-
лов попеременно попадают на вогнутое зеркало 14, а затем на-
правляются плоским зеркалом 17 на входную щель 18 автоколли-
мационного монохроматора, т. е. модулятор является своего рода
«смесителем» двух пучков.
В монохроматоре световой пучок, расходящийся от входной
щели, попадает на вогнутое (внеосевое параболическое) зеркало
19 и, отразившись от него, падает параллельным пучком на приз-
му 20. Призма разлагает инфракрасное излучение в спектр.
Диспергированный свет, отразившись от плоского зеркала 21 (его
называют зеркало Литтрова), вторично проходит призму и фоку-
сируется тем же самым внеосевым параболическим зеркалом 19
на выходную щель 23, изменив предварительно свое направление
6 А. А. Мальцев 161
на плоском поворотном зеркале 22. Поворачивая зеркало Литтро*
ва 21, можно направить на выходную щель лучи различных длин
волн, которые затем попадают на плоское зеркало 24 и вогнутое
зеркало 25, проектирующее изображение выходной щели с двенад-
цатикратным уменьшением на приемную площадку болометра 26.
Для равномерного освещения щели по .всей высоте применяют-
ся сменные линзы-коллективы 27, 28, 29 из кристаллических ма-
териалов.
Регистрация спектров на спектрофотометре ИКС-14 основана
на принципе оптического нуля, заключающемся в выравнивании
интенсивностей пучков света в I и II каналах.
Если интенсивность пучков света в обоих каналах одинакова
(например,, когда в канале I нет поглощающего образца), на
болометр поступают одинаковые сигналы и поэтому усилитель
переменного тока не реагирует на постоянный сигнал. При этом
перо записывающего устройства показывает 100% пропускания.
При наличии поглощающего образца в канале I на болометр по-
переменно направляются пучки различной интенсивности из кана-
лов I и II.
В результате формируется переменный сигнал, частота кото-
рого равна частоте прерывания световых пучков модулятором (его
частота 9 Гц). Этот сигнал после усиления и преобразова-
ния попадает на обмотку электродвигателя отработки 30, ко-
торый перемещает фотометрический клин 8, уменьшая до нуля
возникшую разность интенсивностей пучков. Фотометрический
клин механически связан с пером 31 записывающего устройства.
Величина перемещения пера (пропорциональная величине пере-
мещения клина) показывает в процентах поглощение исследуемого
образца. Когда образец полностью поглощает в данной области
спектра проходящую через него радиацию (это эквивалентно пе-
рекрыванию канала I), перо записывающего устройства показы-
вает отсутствие пропускания (0% пропускания).
Для первоначального уравнивания пучков в обоих каналах при
отсутствии поглощающего образца имеется компенсирующий клин
9 (см. рис. 11.22), который устанавливается рукояткой 26 (см.
рис. 11.21).
Одновременно с работой фотометрического блока, который ре-
гистрирует отношение сигналов в каналах I и II, происходит авто-
матическое сканирование (перемещение) спектра перед выходной
щелью монохроматора. Сканирование осуществляется при враще-
нии мотора развертки спектра по длинам волн, механически
связанного с вращением зеркала Литтрова 21. Одновременно вра-
щается валик 33, на котором находится бумажная лента для ре-
гистрации спектра.
Требуемая длина волны на выходной щели монохроматора
может устанавливаться вручную с помощью барабана длин волн
13 (см. рис. 11.21), на котором имеется относительная шкала,
разбитая на 20 больших и 100 малых делений.
162
Интенсивность источника излучения сильно меняется в зави-
симости от длины волны (см. рис. 11.20), и это затрудняет работу
спектрофотометров. Для нормальной работы приемно-усилитель-
ного устройства необходимо, чтобы энергия, подаваемая на боло-
метр, была почти постоянной. Это осуществляется за счет раскры-
тия входной и выходной щели по такому закону, который позволил
бы иметь на выходе примерно постоянную энергию излучения.
Одновременное раскрытие входной и выходной щели производится
фигурным кулачком 25, который поворачивается вместе с разво-
ротом зеркала Литтрова от мотора длин волн. Величина раскры-
тия щели показывается на шкале микрометра 23. Головкой 24
можно устанавливать определенную программу раскрытия щелей,
чтобы работать либо при малых, либо при больших щелях.
Для призм, используемых в ИК-области, дисперсия резко умень-
шается в сторону коротких длин волн (см. рис. II.4), и поэтому
для перекрывания большего спектрального диапазона необходимо
использовать ряд призм из различных материалов. Например,
призма из NaCI используется в области от 650 до 2000 см-1, приз-
ма из LiF от 1800 до 5000 см-1 и т. д.
Из-за того, что дисперсия призмы изменяется с длиной волны,
а спектральные измерения желательно проводить так, чтобы шка-
ла волновых чисел была линейной, необходимо вращать зеркало
Литтрова с переменной угловой скоростью за счет того, что вме-
сте с вращением барабана длин волн вращается также и кулачок
22, имеющий такой профиль, что график зависимости волнового
числа от делений барабана длин волн становится линейным.
Спектр может быть записан с различными скоростями, уста-
навливаемыми по шкале коробки скоростей барабана длин волн.
Запись спектра производится в направлении от больших волновых
чисел к меньшим, что соответствует движению барабана от деле-
ния «0» к «20». Скорость прохождения спектра для призмы из
LiF может меняться от 4см-1/мин (скорость 2) до 37 см-1/мин
(скорость 4). Скорость подачи бумажной ленты меняется от
1,5 мм/мин (скорость 2) до 25 мм/мин (скорость 4).
Следует заметить, что использование больших скоростей скани-
рования спектра приводит к его искажению и поэтому необходимо
для каждого конкретного случая подбирать свою скорость записи
спектра. Чем уже регистрируемая линия спектра, тем медленнее
должна быть скорость сканирования. Оптимальную скорость за-
писи спектра можно подбирать эмпирически, сделав ряд записей
какой-либо линии с различными скоростями. При большой ско-
рости интенсивность регистрируемой линии уменьшается. Опти-
мальной будет та скорость, при которой линия достигает макси-
мального значения и при дальнейшем уменьшении скорости своей
интенсивности не меняет.
Следует отметить также, что оптимальная скорость записи
спектра зависит также существенным образом от ширины щели
(щелевой программы) и усиления спектрофотометра.
6*
163
Спектрофотометр ИКС-14 не имеет шкалы волновых чисел и
требует предварительной градуировки. Для этого строится график,
связывающий деления барабана длин волн с волновыми числами
в см-1. Другие же спектрофотометры, например ИКС-22, которые
регистрйруют спектр на стандартном бланке со шкалой волновых
чисел, требуют периодической проверки правильности этой шкалы,
т. с. той же самой градуировки.
Градуировка спектрофотометра производится по спектрам
стандартных веществ, у которых спектральные линии достаточно
узкие и положение их максимумов мало зависит от разрешающей
способности прибора и ширины щели.
В качестве таких эталонных веществ (спектры которых хорошо
измерены) могут быть использованы полосы поглощения газов
(НгО, СО2, НС1, НВг, СО и т. д.), полосы поглощения жидкостей
(инден) и пленок полимеров (полистирол, тефлон).
Калибровка по спектрам жидких и полимерных веществ менее
точна, но позволяет получать спектр в более широком интервале
длин волн. В Приложении X и XI приведен спектр пленки поли-
стирола и волновые числа наиболее точно измеренных линий,
которые используют для градуировки. Градуировочный график
строится в координатах волновое число — деления барабана длин
волн. Его построение можно заменить математической обработкой
результатов измерений и вычислением коэффициентов линейного
уравнения типа у=а0-\-а\Х.
В тонких пленках полистирола, используемого для градуиров-
ки, часто наблюдается интерференция, которая особенно четко
проявляется в области 2000—5000 см-1 в виде регулярного «часто-
кола» (см. спектр полистирола в Приложении X и XI).
§ 17. ПОРЯДОК РАБОТЫ НА СПЕКТРОФОТОМЕТРЕ ИКС-14
1. Проверить, стоят ли все тумблеры на пульте прибора и бло-
ка усилителя в положении «выкл.». Тумблер 1 (рис. 11.21) пере-
ключения разбаланса должен быть в течение всей работы в поло-
жении «разбаланс».
2. Включить питание спектрофотометра от сети.
3. Включить усилитель (тумблер 2) и дать ему прогреться
20 мин. В это время сделать подготовительные операции 4—9.
4. Проверить работу пера записывающего устройства.
5. К концу бумажной ленты подвесить груз для того, чтобы
она не затягивалась под валик подачи бумаги.
6. Открыть крышки осветителя.
7. Включить источник непрерывного спектра (глобар) тумбле-
ром 3, предварительно проверив, стоит ли переключатель 4 в по-
ложении «2». При этом должен загораться красный сигнал 5 на
пульте осветителя, связанный с гидроконтактом.
8. Включить постепенно воду, чтобы потухла красная лампоч-
ка 5 и вода выливалась из стока небольшой струей, но не с очень
164
большим напором. (За подачей воды внимательно следить во
время работы.)
9. После прогрева усилителя поставить потенциометр усили-
теля 8 на деление 1—2 и установить разбаланс моста. Для этого
осторожно поворачивают потенциометр 6 и на экране индикатора
7 устанавливают угол теневого сектора примерно 45°. На индика-
торе имеются две метки, соответствующие углу 45°. В дальнейшей
работе необходимо следить за величиной этого угла и не допус-
кать больших отклонений, которые появляются при дальнейшем
прогреве усилителя. При углах более 80° и меньше 10э обязатель-
на корректировка.
10. Включить электродвигатель прерывателя тумблером 9 и
нажать кнопку пуска 10.
11. Включить электродвигатель отработки тумблером 11.
12. Подобрать усиление таким образом, чтобы при перекрыва-
нии рукой канала образца перо самописца перемещалось доста-
точно быстро и воспроизводимо, по в то же самое время не воз-
никали автоколебания пера из-за большого усиления. Автоколе-
бания проявляются на записи спектра в виде правильной «пилы»
или синусоиды около какого-то среднего положения.
13. Если при закрытых заслонках канала образца и канала
пучка сравнения перо будет систематически смещаться в какую-
либо одну сторону относительно середины шкалы (деления 40—
60), то вращением рукоятки «баланс усилителя» 12 добиться, что-
бы перо было неподвижным в интервале делений 40—60 (при
этом положение потенциометра устанавливается где-то между
делениями 3—6).
14. Вынуть заслонки из обоих каналов и ручкой 26 установить
перо на 100%.
15. Установить барабан 13 развертки и спектра па деление, с
которого будет производиться запись.
Барабан поворачивается вручную, если поставить рукоятку
переключения скоростей (она находится с правой стороны прибо-
ра и не видна на рис. 11.21) в нейтральное (промежуточное) по-
ложение между делениями шкалы коробки скоростей. В связи
с тем, что при переключении скоростей шестерни не могут сразу
выйти из зацепления, необходимо барабан длин волн покачивать
слегка в стороны, пока он не начнет вращаться. Для этого левой
рукой слегка покачивают барабан длин волн, а правой переключа-
ют рукоятку скоростей.
16. Установить требуемую скорость движения бумажной ленты.
Для этого левой рукой переключают скорости (рукоятка 14),
а правой поворачивают валик подачи бумаги ручкой 15.
17. Установить исследуемый образец в направляющие кювето-
держаделя 17 (дальний от себя канал).
18. Включить мотор движения бумаги тумблером 18 и пуско-
вой кнопкой 19, а мотор развертки спектра тумблером 20 и пуско-
вой кнопкой 21.
165
19. Произвести запись спектра, записав карандашом на спект-
рограмме скорости записи спектра и бумаги и деление барабана
длин волн, с которого начата запись.
20. Во время записи спектра необходимо постоянно следить за
положением пера и, когда оно достигает максимума поглощения
(минимальное деление по шкале пропускания), отмечать это по-
ложение штрихом карандаша. Одновременно по барабану длин
волн считываются его показания и записываются рядом с регист-
рируемой полосой. Можно также ставить метки около пера, когда
положение барабана длин волн соответствует каким-либо кратным
значениям (например, 16,00; 16,20; 16,40 и т. д.), а затем методом
интерполяции определять положение максимумов полос поглоще-
ния. Автоматический отметчик реперов, включаемый тумблером
16, обычно работает очень плохо.
21. Остановка записи спектра осуществляется выключением
тумблера развертки спектра и подачи бумаги.
22. Выключение прибора производится в обратной последова-
тельности: останавливают моторы барабана длин волн и подачи
бумаги, затем мотор отработки и мотор прерывателя, переключа-
тель отметочных реперов ставят в нейтральное положение, выклю-
чают глобар, далее усилитель и общее питание прибора на щитке,
перекрывают воду. Убирают исследуемый образец и световые ка-
налы закрывают заслонками.
23. После окончания работы барабан длин волн устанавлива-
ют на деление около 10.
§ 18. ИНФРАКРАСНЫЙ СПЕКТРОФОТОМЕТР ИКС-22
Автоматический двухлучевой инфракрасный спектрофотометр
ИКС-22 предназначен для регистрации и измерения спектров пог-
лощения веществ в различных агрегатных состояниях. Запись
спектров ведется в процентах пропускания на калибровочном
бумажном бланке.
Основные параметры спектрофотометра ИКС-22:
Диапазон работы
Монохроматор
Относительное отверстие
Коллиматорное зеркало
Призма
Диапазон раскрытия щелей
Источник излучения
Осветитель
Приемник энергии
Точность градуирования шкалы волно-
вых чисел для X = 1000 см'1
Воспроизводимость измерения пропус-
кания
Разрешение в области 1000 см-1
Время записи спектра
650-5000 см"1
одинарный призменный, построенный
по автоколлимационной схеме Литтрова
I : 5,2
внеосевая парабола с фокусным рас-
стоянием 270 мм
из NaCl с углом 60°
0,01—3 мм
глобар при температуре 1300— 1400°С
двухлучевой
висмутовый болометр
±5 см'1
±0,5%
3—4 см-1
15 и 120 мин
166
Общий вид спектрофотометра ИКС-22 приведен на рис. 11.23.
Он имеет те же самые основные элементы, что и спектрофотометр
ИКС-14. Их различие состоит главным образом в разных способах
записи спектра на бумаге. В ИКС-22 имеется калиброванный по
волновым числам и % пропускания бланк, а в ИКС-14-некалибро-
ванная бумажная лента. Его оптическая схема (рис. 11.24) также
Рис. 11.23. Общий вид спектрофотометра ИКС-22
очень похожа на оптическую схему спектрофотометра ИКС-14
(рис. 11.21) за исключением небольших и не очень принципиаль-
ных деталей.
Спектрофотометр ИКС-22 очень прост в работе и позволяет
регистрировать за 15 мин ИК-спектры в области 650—5000 см~’
с хорошей воспроизводимостью. Спектрофотометр ИКС-22 термо-
статируется при 33°С, чтобы избежать конденсации влаги на
призме, продлить срок ее службы и улучшить воспроизводимость
спектра.
Следует отметить, что в настоящее время лучшие ИК-спектро-
фотометры работают с дифракционными решетками и имеют раз-
решение лучше 1 см-1.
§ 19. ПОРЯДОК РАБОТЫ НА СПЕКТРОФОТОМЕТРЕ ИКС-22
1. Включить усилитель (тумблер 1 на блоке питания, рис. 11.23)
и дать ему. прогреться 15 мин. (Термостатирование прибора рабо-
тает круглосуточно). Во время прогрева усилителя сделать подго-
товительные операции 2—7.
167
2. Проверить работу пера записывающего устройства, проведя
по нему полоской бумаги, и оставить его в поднятом положении.
3. Установить калиброванный в см 4 бланк на столе записы-
вающего устройства так, чтобы верхний и нижний край левого
зажима 2 прошел через линию 5000 см-1. При этом линия 100%
пропускания должна быть на 1—2 мм ниже угла зажима. Затем
расправить бланк и прижать его правым зажимом.
4. Согласовать волновые числа бланка с волновыми числами
шкал 3. В зависимости, какое волновое число стоит на шкалах —
Рис. И. 24. Оптическая схема спектрофотометра ИКС-22
больше или меньше 4000 см-1, тумблер 4 устанавливается соот-
ветственно в положение «рабочий ход» или «обратный ход» и
включается двигатель развертки спектра тумблером 5. Всегда
надо помнить, что переключение тумблера 4 следует производить
только при выключенном тумблере 5. Если волновые числа на
шкале изменяются в сторону уменьшения, то, когда будет точно
достигнуто значение 4000 см-1, включают тумблер 5. В случае
увеличения волновых чисел необходимо пройти волновое число
4000 см-1 на 100—200 см-1, остановить тумблером 5 сканирование
спектра, переключить тумблер 4 в положение «рабочий ход» и,
включив снова мотор сканирования спектра, установить волновое
число 4000 см-1.
Вращением маховичка 6 переместить стол так, чтобы при лег-
ком опускании пера оно устанавливалось на линию 4000 см-1.
Поставить тумблер 4 в положение «обратный ход», и, включив
тумблер 5, перевести стол с бланком в исходное положение
5000 см-1 (перо при этом остается поднятым).
5. Открыть заслонки осветителя.
6. Включить источник непрерывного спектра (глобар), повер-
168
нув на блоке питания переключатель 7 в положение «36», соот-
ветствующее минимальному нагреву глобара. При этом должен
загореться красный сигнал на пульте прибора.
7. Включить постепенно воду, чтобы потух красный сигнал,
2. вода выливалась из стока небольшой струей, но не с очень
большим напором, иначе может сорвать шланги. За подачей воды
внимательно следить во время работы. При недостаточном напоре
воды на пульте прибора вновь загорается красный сигнал. Через
30—40 с после включения глобар начинает светиться.
8. После прогрева усилителя установить баланс моста потен-
циометром 8. Угол светового сектора на экране индикатора 9
должен быть примерно 15—20° (это соответствует хорде 5—8 мм).
В дальнейшей работе необходимо следить за величиной этого
угла и не допускать больших отклонений, которые появляются
при дальнейшем прогреве усилителя. При углах более 20° и менее
15° необходима корректировка.
9. Включить электродвигатель прерывателя (модулятора)
тумблером 10.
10. Включить электродвигатель отработки тумблером 11.
11. Подобрать усиление следующим образом. Открыть оба ка-
нала (при этом перо должно перемещаться в направлении линии
100% пропускания) и установить потенциометр усилителя 12 в
такое положение (обычно это 1—2 деления), при котором после
кратковременного перекрывания канала образца перо будет
возвращаться в прежнее положение достаточно быстро и без пе-
риодических колебаний (автоколебаний) из-за большого усиления.
Автоколебания проявляются па записи спектра в виде правильной
«пилы» или синусоиды около какого-то среднего положения. Вы-
бирать усиление следует на таком участке спектра, где нет интен-
сивных полос поглощения атмосферной воды и углекислого газа.
12. Закрыть оба канала заслонками так, чтобы перо останови-
лось на середине шкалы. Если перо будет перемещаться в какую-
либо сторону относительно середины шкалы, то вращением рукоят-
ки «баланс» усилителя 13 добиться, чтобы перо колебалось около
среднего положения («шумело»), не сдвигаясь в целом и оста-
ваясь (как бы неподвижным) в интервале 40—60%.
13. Вынуть заслонки из обоих каналов. Если перо нс остано-
вится на делении 100%, отрегулировать его положение винтом 14.
14. Установить тумблером 15 скорость передвижения бланка
(масштаб) на «1» или «2». (В положении «2» скорость передви-
жения бланка в 4 раза быстрее; при этом можно записывать
только отдельные участки спектра на специальном бланке.)
15. Установить исследуемый образец в направляющие кювето-
держателя (ближний от себя канал).
16. ЗЭпустить перо. Убедиться, что тумблер 4 стоит в положе-
нии «рабочий ход», и, включив электродвигатель развертки
спектра тумблером 5, произвести запись спектра. Запись спектра
продолжается 15 мин, если тумблер 16 стоит в положении
169
«быстро». Положение «медленно» соответствует записи спектра
120 мин и рекомендуется для регистрации спектров с очень узки-
ми линиями или для исследования спектров с большим разреше-
нием.
17. Остановка записи спектра происходит автоматически.
18. Если на этом же бланке необходимо записать еще один
спектр, тумблер 5 становится в положение «выключено», а тумб-
лер 4 — в положение «обратный ход». Поднимается перо и снова
включается тумблер 5. Стол с бланком возвращается в исходное
положение к 5000 см-1 и автоматически останавливается. Прибор
готов к записи следующего спектра. При повторных записях
нельзя трогать маховик 6 ручного перемещения стола с бланком.
19. Выключение прибора производится в следующем порядке:
тумблер 5 поставить в положение «выключено», тумблер усилите-
ля I также выключить. Переключатель глобара поставить на де-
ление «0». Нельзя выключать тумблеры «сеть» и «термостатирова-
ние». Выключить воду и закрыть заслонками кюветное отделение
и монохроматор. Перо с чернилами вынуть и положить в бюкс
с водой на дне, чтобы чернила не засыхали.
§ 20. КЮВЕТЫ, МЕТОДИКА ПРИГОТОВЛЕНИЯ ОБРАЗЦОВ
И СЪЕМКА ИК-СПЕКТРОВ ГАЗООБРАЗНЫХ, ЖИДКИХ И ТВЕРДЫХ ОБРАЗЦОВ
Газы и пары. Кюветы для съемки спектров газов (рис. 11.25)
очень просты и представляют собой стеклянный цилиндр длиной
10—15 см с окнами из кристаллов солей NaCl или КВг на торцах
и двумя вакуумными кранами для откачки и наполнения кюветы
исследуемым газом. В ряде случаев для исследования ИК-спект-
ров в области свыше 2100 см-1 удобно использовать тазовые кю-
веты в виде тонкостенных шаров из кварца. Такие газовые кюве-
ты химически стойки, просты в обращении и могут нагреваться
в специальных печах-ячейках до высоких температур (см., напри-
мер, Приложение XVI).
Жидкости и растворы. В связи с тем что плотность веществ
в конденсированной фазе намного больше, чем в паре, толщина
поглощающего слоя жидких или твердых образцов составляет от
долей миллиметра до нескольких микрометров. Обычно чистая
жидкость исследуется между двумя круглыми пластинками (окна-
ми) из соли без прокладки. Сдавливая жидкую пробу между
плоскими пластинками винтами оправы кюветы, получают пленку
толщиной 0,01 мм или меньше, причем пластинки удерживаются
вместе капиллярными силами. Требуется 1—10 мг пробы. Толстые
слои чистых жидкостей поглощают настолько сильно, что не позво-
ляют получать удовлетворительные спектры.
Летучие жидкости исследуются в герметических кюветах с
очень тонкими прокладками, задающими толщину поглощающего
слоя. Прокладки между окнами делаются из амальгамированного
свинца, алюминия, тефлона и т. д.
170
Жидкостные кюветы бывают постоянные и разборные. Кюветы
постоянной толщины обычно используются для количественных
измерений, они имеют в одном окне два отверстия, через одно из
Рис. II. 25. Кюветы для ИК-спектрофотометров:
а — газовая кювета; б — разборная жидкостная кювета
которых наполняются с помощью шприца исследуемым веществом
(через другое выходят пузырьки воздуха). Оба отверстия закры-
ваются пробками. Конструкция разборных кювет отличается от
кювет постоянной толщины только тем, что в них нет отверстий
для наполнения, а кюветодержатель имеет гайки с накаткой, за-,
кручиваемые от руки.
171
Работу по сборке кюветы необходимо производить в резино’
вых перчатках или напальчниках, так как гигроскопические окна
из кристаллов NaCl или КВг могут помутнеть от влаги пальцев,
а кроме того на них могут оставаться следы пальцев. Не следует
дышать прямо на окна. Окна кювет обычно хранятся в сухих
эксикаторах.
Растворы исследуются в кюветах толщиной 0,1—1 мм. Для
разборных кювет, с которыми очень легко работать, требуются
объемы 0,1—1 мл при 0,05—10%-ных растворах. В пучок сравне-
ния помещается компенсирующая кювета, содержащая чистый
растворитель. Полученный таким путем спектр является спектром
растворенного вещества, за исключением тех областей, в которых
велико поглощение растворителя. Например, толстый слой образ-
ца четыреххлористого углерода сильно поглощает около 800 см-1;
компенсация для этой полосы неэффективна, так как сильное
поглощение в обоих пучах задерживает излучение и приемник не
дает никакого сигнала.
Выбранный растворитель должен быть сухим и достаточно
прозрачным в интересуемой области. Когда необходимо знать весь
спектр, используют несколько растворителей. Спектры от-
дельных растворителей приведены в Приложении XII. Не
следует забывать, что между растворяемым веществом и раство-
рителем могут возникать химические реакции. В случае исследо-
вания водных растворов необходимо брать окна из устойчивых к
воде материалов (CaF2, AgCl) или кристалла бромид-йодид тал-
лия (TIBrI), который называют KRS-5.
Твердые вещества. Съемка ИК-спектров твердых веществ в
виде пленок не представляет каких-либо затруднений. Следует
только иметь в виду, что при плоских и параллельных поверхнос-
тях пленки в спектре могут наблюдаться регулярные полосы ин-
терференции.
Растворимые твердые вещества можно изучать в виде раство-
ров. Выбор растворителя во многом определяется областями его
поглощения, приведенными в Приложении XII.
Съемка спектров поглощения порошкообразных и мелкокрис-
таллических веществ усложнена тем, что грани частичек располо-
жены хаотично по направлению к падающему свету и от них
происходит отражение и преломление света по всем направлениям
(рис. 11.26, а), т. е. происходит рассеяние света. В то же самое время
плоско-параллельные окна, между которыми находятся частички,
не изменяют направление света. Поэтому, если пространство
между частичками заполнить жидкостью, показатель преломления,
которой близок к их показателю преломления, то полное внут-
реннее отражение резко уменьшается и первоначальный ход лучей
не будет искажаться (рис. II.26, б). В результате такая кювета как
бы «просветлится». Такие жидкости называются иммерсионными.
В качестве иммерсионных сред можно использовать и пластичные
172
твердые вещества, которые под давлением заполняют пустоты
между частичками исследуемого вещества.
Обычно применяются следующие методики: растирание ве-
щества с инертными жидкостями или прессование таблеток с бро-
мистым калием или полиэтиленом.
Для приготовления взвесей (суспензий или паст) в качестве
иммерсионной среды используется вазелиновое масло — высоко-
кипящая фракция углеводородов (за рубежом используется по-
Па дающее излучение
Прошедшее и частично
рассеянное излучение
а
Падающее излучение
Прошедшее излучение
б
Рис. 11.26. а - Прохождение света через кювету с мелкими кристалли-
ками; б — прохождение света через кювету с мелкими кристалликами,
помещенными в иммерсионную среду
добное же масло под названием «нуйол»), В его ИК-спектре со-
держится очень мало полос поглощения (см. рис. в Приложении
XIII). Когда же надо исследовать спектры в области 1350—1500 см-1
и 2700—2950 см-1, где у вазелинового масла имеются собственные
полосы поглощения, используются полностью фторированные угле-
водороды или гексахлорбутадиен.
Приготовление взвесей производится следующим образом. Об-
разец (5—10 мг) тщательно растирают в небольшой агатовой или
яшмовой ступке в течение 4—10 мин и добавляют в конце расти-
рания 1—2 капли иммерсионной жидкости. Получившуюся суспен-
зию наносят краем пестика или шпателем на окно из NaCl или
КВг и прижимают другим окном. При этом необходимо стараться
наносить суспензию по центру окна в виде ровного бугорка и
прижимать второе окно таким образом, чтобы суспензия равно-
мерно растекалась к краям, образуя тонкую -пленку без пузырь-
ков воздуха. Если пузырьки образовались, их можно попытаться
выдавить к краям, сжимая кювету или слегка поворачивая окно
вокруг оси. Когда же и эта мера не помогает, то следует удалить
с окон взвесь и снова повторить все операции. Собранные окна
173
укрепляются и сдавливаются в кюветодержателе, но не сильно, так
как кристаллы легко трескаются.
Чтобы повысить контрастность спектра, в канал сравнения
ставится кювета сравнения с вазелиновым маслом. Следует за-
метить, что взвеси можно использовать только для качественных
изменений спектров.
Кроме данной методики широко используется прессование под
большим давлением (~20 тонн/см2) тонких круглых или прямо-
угольных пластинок из смеси исследуемого вещества и бромистого
калия в отношении 1 : 100. Прозрачность бромистого калия, кото-
рый используется как иммерсионная среда в широкой области
спектра, позволяет получать качественные спектры без посторон-
них полос поглощения при условии, что нет взаимодействия между
исследуемым веществом и КВг.
В качестве дополнительной литературы к разделу II можно
рекомендовать [14—18].
Контрольные вопросы к разделу II
Серия 1 (§ 1—3)
1/1. Каково назначение призмы или дифракционной решетки в
спектральном приборе?
1) Диспергировать (разлагать) излучение по длинам волн.
2) 'Превращать свет, идущий от щели, в пучок параллельных
лучей.
3) Фокусировать на фотопластинку или выходную щель моно-
хроматора параллельные пучки монохроматического света, иду-
щие от диспергирующего элемента (призмы или дифракционной
решетки!.
4) Фокусировать излучение источника света на входящую
щель спектрографа. .
2/1. Каково назначение коллиматорного объектива в спект-
ральных приборах?
1) Фокусировать на фотопластинку или выходную щель моно-
хроматора параллельные пучки монохроматического света, идущие
от призмы или дифракционной решетки.
2) Фокусировать излучение источника света на входящую
щель спектрографа.
3) Диспергировать (разлагать) свет по длинам волн.
4) Превращать свет, идущий от щели, в пучок параллельных
лучей.
3/1. Каково назначение камерного объектива в спектральных
приборах?
1) Фокусировать на фотопластинку или выходную щель моно-
хроматора параллельные пучки монохроматического света, идущие
от диспергирующего элемента (призмы или дифракционной ре-
шетки).
174
2) Диспергировать (разлагать) свет по длинам волн.
3) Превращать свет, идущий от щели, в пучок параллельных
лучей.
4) Фокусировать излучение источника света на входную щель
спектрографа.
4/1. Каково назначение кондепсорной линзы, устанавливаемой
перед щелью спектрографа?
1) Диспергировать (разлагать) свет по длинам волн.
2) Превращать свет, идущий от щели, в пучок параллельных
лучей.
3) Фокусировать излучение источника на входную щель спект-
рографа.
4) Фокусировать на фотопластинку или выходную щель моно-
хроматора параллельные пучки монохроматического света, идущие
от диспергирующего элемента (призмы или дифракционной решет-
ки).
5/1. Что называется обратной линейной дисперсией спектраль-
ного прибора?
1) Величина d'k/dl, соответствующая разности волн в А, кото-
рую имеют две спектральные линии, расположенные на расстоя-
нии I мм.
2) Величина dl/d'k, соответствующая расстоянию между двумя
линиями в мм, различающимися по длине волны на 1 А.
3) Величина X/AX=v/Av, где АХ и Av характеризуют наимень-
шую разность в длинах волн или волновых числах между двумя
очень близкими спектральными линиями, которые еще можно раз-
личать, а не считать за одну широкую линию.
4) Величина пропорциональная квадрату относительного от-
верстия d/f и коэффициенту пропускания т.
6/1. Что называется линейной дисперсией спектрального при-
бора?
1) Величина пропорциональная квадрату относительного от-
верстия d/f и коэффициенту пропускания т.
2) Величина d'K/dl, соответствующая разности длин волн в А,
которую имеют две спектральные линии, расположенные на рас-
стоянии 1 мм.
3) Величина X/AX=v/Av, где АХ и Av характеризуют наимень-
шую разность в длинах волн или волновых числах между двумя
очень близкими спектральными линиями, которые еще можно
различать, а не считать за одну широкую линию.
4) Величина dl/d'K, соответствующая расстоянию между двумя
линиями в мм, различающимися по длине волны на 1 А.
7/1. Что называется разрешающей способностью спектрального
прибора?
1)- Величина dl/dX, соответствующая расстоянию между двумя
линиями в мм, различающимися по длине волны на 1 А. .
2) Величина X/AX=v/Av, где АХ и Av характеризуют наимень-
шую разность в длинах волн или волновых числах между двумя
175
очень близкими спектральными линиями, которые еще можно раз-
личать, а не считать за одну широкую линию.
3) Величина dk/dl, соответствующая разности длин волн в А,
которую имеют две спектральные линии, расположенные на рас-
стоянии 1 мм.
4) Величина пропорциональная квадрату относительного от-
верстия d/f и коэффициенту пропускания т.
8/1. Что называется светосилой спектрального прибора?
1) Величина dljd\, соответствующая расстоянию между двумя
линиями в мм, различающимися по длине волны на 1 А.
2) Величина A/AA=v/Av, где АЛ и Av характеризуют наимень-
шую разность в длинах волн или волновых числах между двумя
очень близкими спектральными линиями, которые можно еще раз-
личать, а не считать за одну широкую линию.
3) Величина пропорциональная квадрату относительного от-
верстия и коэффициенту пропускания т.
4) Величина dh]dl, соответствующая разности длин волн в А,
которую имеют две спектральные линии, расположенные иа рас-
стоянии 1 мм.
9/1. Какими основными параметрами определяется линейная
дисперсия призменного спектрального прибора?
1) Числом призм, шириной основания призмы и дисперсией
материала призмы.
2) Квадратом относительного отверстия и коэффициентом про-
пускания оптики.
3) Отношением фокусных расстояний объективов камеры и
коллиматора.
4) Числом, преломляющим углом, и показателем преломления
призмы, дисперсией материала призмы и фокусным расстоянием
камерного объектива.
10/1. Какими основными параметрами определяется светосила
призменного спектрального прибора?
1) Числом призм, шириной основания призмы и дисперсией ма-
териала призмы.
2) Квадратом относительного отверстия и коэффициентом про-
пускания оптики.
3) Отношением фокусных расстояний объективов камеры и
коллиматора.
4) Числом, преломляющим углом, и показателем преломления
призмы, дисперсией материала призмы и фокусным расстоянием
камерного объектива.
11/1. Какими основными параметрами определяется обратная
линейная дисперсия призменного спектрального прибора?
1) Числом призм, шириной основания призмы и дисперсией
материала призмы.
2) Квадратом относительного отверстия и коэффициентом про-
пускания оптики.
176
3) Отношением фокусных расстояний объективов камеры и
коллиматора.
4) Числом, преломляющим углом и показателем преломления
призмы, дисперсией материала призмы и фокусным расстоянием
камерного объектива.
12/1. Какими основными параметрами определяется разрешаю-
щая способность призменного спектрального прибора?
1) Числом призм, шириной основания призмы и дисперсией ма-
териала оптики.
2) Квадратом относительного отверстия и коэффициентом
пропускания оптики.
3) Отношением фокусных расстояний объективов камеры и
коллиматора.
4) Числом, преломляющим углом и показателем преломления
призмы, дисперсией материала призмы и фокусным расстоянием
камерного объектива.
13/1. Спектрограф ИСП-51 имеет три призмы. Как изменилась
бы его светосила, если оставить в нем только одну призму? При-
нять, что коэффициент пропускания спектрографа не зависит от
числа призм.
1) Уменьшится в три раза. 3) Не изменится.
2) Увеличится в три раза. 4) Увеличится в 32=9 раз.
14/1. Спектрограф ИСП-51 имеет три призмы. Как изменились
бы его дисперсия и разрешающая способность, если оставить в
нем только одну призму?
1) Дисперсия и разрешающая способность не изменяется.
2) В три раза уменьшится и дисперсия и разрешающая способ-
ность.
3) В три раза уменьшится дисперсия, а разрешающая способ-
ность не изменится.
4) Дисперсия не изменится, а разрешающая способность
уменьшится в три раза.
15/1. В автоколлимационном монохроматоре свет через призму
проходит дважды. Как изменятся его дисперсия и разрешающая
способность, если число призм увеличить до двух?
1) Дисперсия и разрешающая способность увеличатся в два
раза.
2) Дисперсия увеличится в два раза, а разрешающая способ-
ность не изменится.
3) Дисперсия и разрешающая способность не изменяется.
4) Дисперсия не изменится, а разрешающая способность умень-
шится.
16/1. Как изменяется дисперсия и разрешающая способность
автоколлимационного инфракрасного спектрофотометра, если
уменьшить диаметр светового пучка, проходящего через призму
или дифракционную решетку?
1) Дисперсия и разрешающая способность увеличатся в два
раза.
177
2) Дисперсия увеличится, а разрешающая способность нс из-
менится.
3) Дисперсия и разрешающая способность не изменятся.
4) Дисперсия не изменится, а разрешающая способность умень-
шится.
17/1. Какими основными параметрами определяется разрешаю-
щая способность дифракционного спектрального прибора?
1) Числом штрихов на 1 мм и порядком спектра.
2) Общим числом штрихов.
3) Общим числом штрихов й порядком спектра.
. 4) Общим числом штрихов, порядком спектра и фокусным рас-
стоянием объектива камеры.
18/1. У спектрального прибора дифракционная решетка имеет
разрешающую способность в первом порядке J?i = 60 ООО. Как из-
менится ее разрешающая способность при работе в III порядке?
1) /?ш=20 000; 3) £ш=180 000;
2) /?ш=60000; 4) /?ш= (60 000) 3.
19/1. Какими основными параметрами определяется линейная
дисперсия дифракционного спектрального прибора?
1) Размером дифракционной решетки и фокусным расстоянием
объектива камеры.
2) Общим числом штрихов.
3) Общим числом штрихов в порядке спектра.
4) Общим числом штрихов, порядком спектра и фокусным рас-
стоянием объектива камеры.
20 /1. Чем характерна автоколлимациониая оптическая схема?
1) Нет коллиматорного объектива.
2) Есть входная и выходная щели.
3) Объективы камеры и коллиматора совмещены.
4) Автоматически регистрируется спектр.
21/1. Какими основными параметрами определяется светосила
дифракционного спектрального прибора?
1) Числом штрихов па 1 мм и порядком спектра.
2) Размером дифракционной решетки.
3) Размером дифракционной решетки и фокусным расстоянием
объектива камеры.
4) .Общим числом штрихов, порядком спектра и фокусным
расстоянием объектива камеры.
22/1. Как изменится светосила спектрального прибора, если
дифракционную решетку перевести из I во II порядок?
1) Светосила не изменится.
2) Светосила увеличится в 2 раза.
3) Светосила уменьшится в 2 раза.
4) Светосила увеличится в 4 раза.
23/1. Как изменится обратная линейная дисперсия спектраль-
ного прибора d^dl, если дифракционную решетку установить так,
чтобы она работала во II порядке вместо I?
178
1) = (dK/dl)u; 3) (dKldl)i = 2 (dX/dZ)n;
2) 2 (dk/dl)i = (dX/d/)n; 4) (dK/dfy = 4 (dX/dZ)n.
24/1. Как изменится линейная дисперсия автоколлимационного
спектрального прибора, если фокусное расстояние объектива уве-
личится в два раза?
1) dl/dk увеличится в 2 раза. 3) dl/dK уменьшится в 2 раза.
2) dlld'K не изменится. 4) dlldk уменьшится в 4 раза.
25/1. Какие спектральные приборы называются спектрофото-
метрами?
1) Приборы с фотографической регистрацией спектра.
2) Приборы с визуальной регистрацией спектра.
3) Приборы, регистрирующие абсолютные интенсивности спект-
ров.
4) Приборы, регистрирующие пропускание или оптическую
плотность.
26/1. Какие спектральные приборы называются монохромато-
рами?
1) Приборы с фотографической регистрацией спектра.
2) Приборы с визуальной регистрацией спектра.
3) Приборы с фотоэлектрической регистрацией, у которых в
фокальной плоскости установлено несколько выходных щелей.
4) Приборы, у которых в фокальной плоскости установлена
выходная щель.
27/1. Какие спектральные приборы называются спектрогра-
фами?
1) Приборы с фотографической регистрацией спектра.
2) Приборы с визуальной регистрацией спектра.
3) Приборы с фотоэлектрической регистрацией, у которых в
фокальной плоскости установлено несколько выходных щелей.
4) Приборы, у которых в фокальной плоскости установлена
выходная щель.
28/1. Какие спектральные приборы называются спектромет-
рами?
1) Приборы с фотографической регистрацией спектра.
2) Приборы с визуальной регистрацией спектра.
3) Приборы с фотоэлектрической регистрацией, у которых в
фокальной плоскости установлено несколько выходных щелей.
4) Приборы, у которых в фокальной плоскости установлена
выходная щель, а за ней приемник излучения.
Серия 2 (§ 4—20]
1/2. В какой области спектра работает спектрограф ИСП-51?
1) В ИК-’области (2,5—50 мкм).
2) В ближней УФ, видимой и ближней ИК-области спектра
(360—1000 нм).
179
3) В видимой области (400—750 нм).
4) В микроволновой области (100—1000 мкм).
2/2. В какой области спектра работают спектрофотометры ти-
па СФ-26?
1) В ИК-области (2,5—50 мкм).
2) В микроволновой области (100—1000 мкм).
3) В УВИ-области (186—1100 нм).
4) В видимой области (400—750 нм).
3/2. В какой области спектра работают спектрофотометры
ИКС-14 и ИКС-22 с призмой из NaCl?
1) В ИК-области (2—15,5 мкм).
2) В УВИ-области (186—1100 нм).
3) В видимой области (400—750 нм).
4) В далекой ИК-области (50—1000 мкм).
4/2. В какой области работают спектрофотометры СФ-14,
СФ-18?
1) В ИК-области (2,5—50 мкм).
2) В микроволновой области (100—1000 мкм).
3) В УВИ-области (186—1100 нм).
4) В видимой области (400—750 нм).
5/2. Для каких целей используются химиками спектрофото-
метры типа СФ-26, работающие в УВИ-областях спектра (186—
1100 нм)?
1) Для получения спектров комбинационного рассеяния.
2) Для качественного и количественного анализов по электрон-
ным спектрам поглощения.
3) Для фотографирования электронных спектров испускания
простых молекул.
4) Для получения колебательных спектров поглощения.
6/2. Для каких целей используются химиками инфракрасные
спектрофотометры ИКС-14, ИКС-22 и др.?
1) Для получения колебательных и колебательно-вращатель-
ных спектров поглощения.
2) Для получения спектров комбинационного рассеяния.
3) Для фотографирования электронных спектров испускания
простых молекул.
4) Для качественного и количественного анализов по элек-
тронным спектрам поглощения.
7/2. Для каких целей используется химиками спектрограф
ИСП-51, работающий в близкой УФ, видимой и близкой ИК-об-
ласти спектра (360—1000 нм)?
1) Для получения колебательных спектров поглощения.
2) Для фотографирования электронных спектров испускания
простых молекул и спектров комбинационного рассеяния.
3) Для получения микроволновых спектров поглощения.
4) Для качественного и количественного анализов по элект-
ронным спектрам поглощения.
180
8/2. Для каких целей используется химиками спектрофото-
метры СФ-14 и СФ-18, работающие в видимой области спектра
(400—750 нм)?
1) Для получения колебательных спектров поглощения.
2) Для получения электронных спектров испускания простых
молекул.
3) Для получения спектров комбинационного рассеяния.
4) Для получения электронных спектров поглощения и отра-
жения.
9/2. Что служит источником непрерывного спектра в инфракрас-
ной области спектра?
1) Лазер. 3) Лампа накаливания.
2) Водородная лампа. 4) Штифт Глобара.
10/2. Что служит источником непрерывного спектра <в видимой
области спектра?
1) Ртутная лампа. 3) Лампа накаливания.
2) Водородная лампа. 4) Штифт Глобара.
11/2. Что служит источником непрерывного спектра в ультра-
фиолетовой области спектра?
1) Лазер. 3) Штифт Глобара.
2) Водородная лампа. 4) Лампа накаливания.
12/2. Что служит источником монохроматического излучения
для получения спектров комбинационного рассеяния?
1) Ртутная лампа, лазер. 3) Штифт Глобара.
2) Водородная лампа. 4) Лампа накаливания.
13/2. Какой приемник излучения используется в спектрофото-
метрах типа СФ-26, предназначенных для работы в УВИ-области?
1) Болометр или термоэле- 3) Фотоэлемент.
мент. 4) Фотопластинка или
2) Фотоумножитель. фотопленка.
14/2. Какой приемник инфракрасного излучения используется
в области 2,5—50 мкм?
1) Болометр или термоэле- 3) Фотоумножитель.
4) Фотоэлемент.
мент.
2) Фотопластинка или фо-
топленка.
15/2. Какой приемник излучения используется в спектрографе
ИСП-51, предназначенном для съемки спектров испускания в
близкой УФ, видимой и близкой ИК-области?
1) Болометр или термоэле- 3) Фотоэлемент.
мент. 4) Фотопластинка или
2) Фотоумножитель. фотопленка.
16/2. Какой приемник излучения используется в спектрофото-
метре для видимой области СФ-14, СФ-18?
1) Фотоумножитель. 3) Фотопластинка или
2) Фотоэлемент. фотопленка.
4) Болометр или термоэле-
мент.
181
17/2. Зачем при съемке ИК-спектров поглощения порошкооб-
разных или мелкокристаллических веществ используются иммер-
сионные среды вазелинового масла или КВг (соответственно пас-
ты— взвеси или таблетки)?
1) Чтобы предохранить вещество от воздействия ИК-излучения.
2) Для повышения пропускания образцов и устранения рассеи-
вания подающего на них излучения.
3) Чтобы выполнялся закон Бугера-Ламберта-Бера.
4) Чтобы порошки давали слой одинаковой толщины.
18/2. С какой целью инфракрасные спектрофотометры ИКС-14
и ИКС-22 построены по двухлучевой схеме?
1) Чтобы исключить спектр растворителя из спектра раствора.
2) Чтобы исключить спектр поглощения атмосферных паров
воды и углекислого газа.
3) Чтобы регистрировать спектр в процентах пропускания.
4) Чтобы вести запись спектра в процентах пропускания, устра-
нить полосы поглощения атмосферных паров воды и углекислого
газа и можно было исключить спектр растворителя из спектра
раствора.
19/2. Какого порядка ширина щелей относительно нормальной
ширины щели s = i4/d при регистрации ИК-спектров на спектро-
фотометрах ИКС-14 и ИКС-22?
1) Ширина щели всегда намного больше нормальной щели.
2) Ширина щели равна нормальной ширине щели.
3) Ширина щели меньше нормальной щели.
4) Ширина щели постоянна и не изменяется с длиной волны.
20/2. Какие оптические материалы используются в ИК-спектро-
скопии в области 2,5—50 мкм (200—4000 см-1)?
1) Кварц плавленный. 3) Кристаллы солей.
2) Стекло. 4) Кварц кристаллический.
21/2. Для чего необходим светофильтр из раствора KNO2 при
съемке спектров комбинационного рассеяния, возбуждаемых ртут-
ной лампой?
1) Чтобы ослабить интенсивность возбуждающей линии.
2) Чтобы избежать нагрева образца.
3) Чтобы устранить УФ-излучение и избежать люминесценции
образца.
4) Чтобы устранить рассеянный свет в спектрографе.
22/2. Каково выражение для нормальной ширины щели, кото-
рую необходимо установить для фотографирования спектров ис-
пускания на спектрографе ИСП-51?
2sina/2 dn - л 1 &
1) т — ----— /. 3) А Н------.
V 1л2 sin2 a/2 dX 1 — с
4)Х4-
ал, а
23/2. Для чего необходим фильтр с проточной водой при
съемке КР-спектров?
182
1) Чтобы ослабить интенсивность возбуждающей линии.
2) Чтобы избежать нагрева образца.
3) Чтобы устранить УФ-излучение и избежать люминесценции
образца.
4) Чтобы устранить рассеянный свет в спектрографе.
24/2. Почему в спектрофотометрах для видимой и ультрафио-
летовой области спектра (например, СФ-26) кювета с веществом
помещается после монохроматора перед приемником света, в то
время как в случае инфракрасных спектрофотометров (например,
ИКС-14, ИКС-22) кювета устанавливается перед монохроматором
после источника непрерывного спектра?
1) Потому, что неразложенное в спектр УФ-излучение может
вызвать фотохимическую реакцию.
2) По чисто техническим (конструкционным) соображениям.
3) Потому, что приемники в ИК-области имеют малую чувст-
вительность по сравнению с фотоэлементами для УФ-области.
4) Потому, что ИК-излучение лучше проходит через порошки и
мелкокристаллические вещества, чем УФ-излучение.
Раздел III
ПРАКТИЧЕСКИЕ РАБОТЫ
РАБОТА № 1
ИК-спектры поглощения двухатомных молекул.
Определение межъядерных расстояний, частот колебаний
и термодинамических функций
Цель и содержание работы
Ознакомление с техникой ИК-спектроскопии. Освоение мето-
дики работы на ИК-спектрофотометре. Ознакомление с ИК-спект-
рами поглощения газов и системой энергетических состояний, свя-
занных с колебанием и вращением двухатомных молекул. Изме-
рение вращательной структуры ИК-полосы одного из газов (СО,
НС1, НВг) или их смеси с целью определения межъядерного рас-
стояния, частоты колебания, силовой постоянной и термодинами-
ческих функций.
Аппаратура
Инфракрасный спектрофотометр. Две газовые кюветы: пустая
и с двухатомным газом.
Теоретическая подготовка к работе
Ознакомьтесь по учебному пособию с системой энергетических
состояний и ИК-спектрами простых молекул (см. I, § 5, 8, 10, 12)
и техникой ИК-спектроскопии (см. II, § 15, 20). Прочтите описа-
ние ИК-спектрофотометра и четко представьте себе порядок рабо-
ты на нем (II, § 16, 17).
Порядок выполнения работы и пояснения к ней
1. Включите спектрофотометр ИКС-14 с призмой из LiF и под-
готовьте его к работе (см. II, § 17). Для градуировки барабана
длин волн спектрофотометра в области от 1800 до 3200 см-1 по
стандартному спектру поглощения полистирола установите сле-
дующий режим работы.
1) Усиление—1—3.
184
2) Баланс усилителя устанавливается так, чтобы при закрытых
световых каналах перо самописца оставалось неподвижным в пре-
делах 40—60% поглощения.
3) Скорость записи спектра — 4.
4) Скорость подачи бумаги — 4 (или 3).
5) Начало записи спектра по барабану длин волн—11,50.
2. Установите рамку с пленкой полистирола в направляющие
кюветодержатсля канала образца. Включите моторы подачи бу-
маги и длин волн. Запишите спектр полистирола.
Во время записи спектра постоянно следите за положением
пера и, когда оно достигает максимума отклонения (минимального
деления по шкале пропускания), отмечайте это положение каран-
дашным штрихом. Одновременно по барабану длин волн считы-
ваются его показания и записываются рядом с регистрируемой
полосой. Для повышения точности, которая составляет ±(1—2)
деления, запись градуировочного спектра необходимо повторить,
учтя те неточности в определении максимума, которые были допу-
щены в первый раз. Записи на спектрах рекомендуется делать ка-
рандашом, а не чернилами, так как потом их можно стереть и
переписать цифры 'более аккуратно, придав спектру опрятный вид.
Сравните полученный спектр со стандартным спектром поли-
стирола, для которого точно измерены волновые числа полос (эти
данные приведены в Приложении XI), и проведите отождествле-
ние полос. Результаты запишите в табл. Ш.1.
Таблица III. 1
Градуировочная таблица
Деление барабана Волновое число
длин волн п V, см-1
Для призмы из LiF таблица должна охватывать спектральную
область примерно 1800—3200 см-1.
3. Постройте на большом листе миллиметровой бумаги (раз-
мером ~ 70x80 см) градуировочный график, на котором по оси
абсцисс откладываются деления шкалы барабана длин волн (одно
малое деление=1 мм), а по оси ординат волновые числа (1 см-1 =
= 0,5 мм) полос поглощения полистирола, приведенные в Прило-
жении XI.
По согласованию с преподавателем можно графическую обра-
ботку заменить численной, определяя методом наименьших квад-
ратов ца ЭВМ коэффициенты а0 и (ц линейного уравнения
v = а0 г
и их среднеквадратичную ошибку или дисперсию.
185
Градуировочный график (или коэффициенты уравнения пря-
мой) необходим для того, чтобы в дальнейшем по относительным
числам п барабана длин волн определять волновые числа v в см-1.
4. Запишите спектр поглощения неизвестного двухатомного
газа, выданного преподавателем или лаборантом. Для этого газо-
вая кювета с веществом устанавливается на подставке в канал
образца, а пустая (вакуумированная) кювета — в канал сравнения.
Следует обратить внимание на то, что шары-кюветы сделаны
из тонкого кварца и находятся при пониженном давлении или
вакуумированы, поэтому с ним необходимо обращаться очень осто-
рожно.
Чтобы ускорить работу и не писать широкий интервал длин
волн с небольшой скоростью, которая необходима для разрешения
вращательной структуры полос, спектр сначала записывается с
большой скоростью.
Скорость записи спектра — 5.
Скорость подачи бумаги — 3.
Записываемый интервал (по калибровочному графику) от
~2000 см-1 до ~3500 см-1.
На полученном спектре определите положение наиболее интен-
сивной полосы с неразрешенной или частично разрешенной вра-
щательной структурой. Затем запись повторяется, но только в
более узкой области полосы поглощения (ее можно согласовать
с преподавателем) на малой скорости с точной отметкой макси-
мумов линий вращательной структуры.
Скорость записи спектра — 2.
Скорость подачи бумаги — 3.
После окончания регистрации спектров выключите спектро-
фотометр.
5. По градуировочному графику (или уравнению, полученному
методом наименьших квадратов) определите с точностью до
1 см-1 волновые числа первых 8—10 линий, отсчитываемых в обе
стороны от центра полосы.
Отнесите спектральные линии к Р- и Р-ветвям и припишите им
соответствующие значения вращательных квантовых чисел /. Ли-
нии Р-ветви должны начинаться с 7=0, а их волновые числа уве-
личиваться в сторону больших частот. Р-ветвь начинается с 7=1.
Результаты запишите в 1—3 графы табл. III.2 или III.3 в за-
висимости от того, будете ли вы (по заданию преподавателя)
определять Bv или Во. Остальные графы заполняются при выпол-
нении пункта 9.
6. Определите волновое число центра полосы поглощения
v0 = 1/2 [v/? (0) 4- vP(l)].
Центры полосы поглощения обычно называют нулевым проме-
жутком, так как на этом месте отсутствует линия, соответствую-
щая переходу между состояниями с 7'=0 и J"—0 и запрещенная
по правилам отбора (см. I, § 12).
186
Таблица III.2
Результаты измерений линий вращательной структуры и определение В'
J Vp (J) vp(J) = vp(J) — Vp(J) BV}~ 4(J+‘/±) B’ — B'(J) [в' - B'(J)¥
...
SB'(7) В - —— m £[B'-B'(J)]* s= m—1
Т аб л ица III.3
Результаты измерений линий вращательной структуры и определение В"
J Vp(j) vp(J) = vp{J-l)-vp(J + l) „ ЬгЕ"(.) D't - 4(J+‘/2) B" — B"(J) [B"_ B"(J)P
• • • .. .
о» D — m S2 _ gg( J)l2
7. Используя значение v«, определите по таблицам молекуляр-
ных постоянных двухатомных молекул, в частности по частотам
колебаний сое, приведенным в Приложении V, какой газ находит-
ся в кювете. При этом следует помнить (см. I, § 12), что
vo = — 2 (дехе сое,
так как
2 ыехс <Z ше.
8. По формуле
k — 4 л2 цс2 со2 = 5,89 • 10~2 рд <й2 дин/см,
где p=AfiAf2/(Afi + Af2),
(All, Л42 — массы атомов молекулы);
рА — приведенная масса в углеродных единицах,
(ое — частота колебаний в см-1,
определите силовую постояную k (в единицах 105 дин/см) иссле-
дуемой двухатомной молекулы, используя значение ые из Прило-
жения V.
187
9. По измеренным линиям вращательной структуры спектра ис-
следуемой молекулы определите для основного состояния и = 0
или возбужденного и=1 вращательную постоянную Bv или Bv
и межъядерное расстояние rv или rv. Обычно для этих целей ис-
пользуются так называемые комбинационные разности
= 2B’ + 4B’J = 4B„(J+ 1/2),
или
Д2 Р (J) = Р (J + 1) - Р (J - 1) = (J) - vp (J) =
= 2BL + 4B'/ = 4B'(J + 1/2),
которые соответствуют расстояниям между двумя термами, от-
стоящими друг от друга через один терм. В случае легких моле-
кул пренебрежение постоянной центробежного растяжения Dv (см.
формулы (11.8) и (12.15)) приводит к тому, что Bv —
становится зависимым от J.
Погрешность определения Bv по комбинационным разностям
зависит также от числа используемых значений &2F(J) и точности
измерения линий вращательной структуры. Поэтому для опреде-
ления Bv желательно брать максимальное число значений Дг/Д/).
В случае данной учебной задачи можно ограничиться 8—10 значе-
ниями ^2F(J), которые записываются в графу 4 табл. III.2 или
III.3. В графу 5 заносятся значения Br=A2F^/)/4(/+1/2), из ко-
торых затем находится среднее значение Bv из т измерений.
В графе 5 число значащих цифр после запятой берется с запасом
(два знака). Заполните графы 6, 7 и определите дисперсию зна-
чения Bv по общепринятой методике обработки эксперименталь-
ных данных. _ „
По полученному значению вращательной постоянной Bv или Bv
определите межъядерное расстояние r'v или rv, используя фор-
мулы (см. I, § 11)
D h 27,98-10~40
BD =--------= —---------см
v 8 л2 с I I
4,106 8
; _ .io-8 см.
/ ^aB
Дополнительно (по согласованию с преподавателем) можно
воспользоваться ЭВМ и методом наименьших квадратов по урав-
нению (12.16) не только уточнить полученные постоянные для
легких молекул (НС1, НВг), но и одновременно определить Dv.
Для повышения точности необходимо брать по 3—5 линий в нача-
ле и конце ветвей, или вообще все линии полосы. Следует пом-
нить, что спектрофотометр ИКС-14 имеет малое разрешение и низ-
кую точность, поэтому погрешность получаемых постоянных ве-
лика.
188
10. Нарисуйте схему колебательных и вращательных энергети-
ческих состояний двухатомной молекулы и обозначьте на ней не-
сколько наблюдаемых переходов.
11. (Этот пункт делается по согласованию с преподавателем.)
Используя полученное значение Bv, определите (см. I, § 11) для
комнатной температуры Т=300К наиболее заселенное состояние
= V- 0.5 = 0,5895 1/-Г------------------0,5.
т ZBvhc 9 Dy
Для значения /макс, а также для значений /=1 и /=/макс+10
рассчитайте относительную заселенность вращательных состояний
(см. I, § 8)
_ hcBI(I+l) 1,4388Ву/(/+1)
—i- = (2 J-|-1)е —kr—=:(2J-rl)e----------------т-----.
No
Результаты расчетов сравните с распределением интенсивностей
во вращательной структуре изученного спектра.
12. Выпишите молекулярные постоянные, полученные в пунк-
тах 6, 8, 9, и литературные данные, приведенные в Приложении V,
в следующую сводную табл. II 1.4.
Собственные измерения должны сопровождаться их дисперсией
или оценкой точности. Для сравнения собственных измерений с
литературными данными проведите расчет молекулярных постоян-
Таблица Ш.4
Результаты измерений молекулярных постоянных
Собственные измерения (пункты 7—9) Молекулярные постоянные равновесного состояния (табл, данные Приложения V) Молекулярные постоянные для состояния V' или v" (пересчет по табл, данным)
Энергия колебательного перехода, со- ответствующая нулевому промежут- ку, см-1 ^Gu-\-42 = vo± ЫеХе = Vo =
Силовая" постоянная, 105 дин/см ke ± ие =
Вращательная постоянная, см"1 By ± !! II By —
Межъядерное расстояние, А г± ге = rv =
189
ных vo, В и г (последняя графа табл. III.4) по табличным данным,
используя формулы (12.4, 11.3 и 11.5) раздела I.
13. Методами статистической термодинамики вычислите для
исследуемого газа в приближении «жесткий ротатор — гармониче-
ский осциллятор» сумму по состояниям, приведенную энергию
Гиббса и их поступательные, вращательные, колебательные и
электронные составляющие при стандартных условиях
(Т=298, 15К, Р = 1 атм), используя формулы (8.7) — (8.11), (8.17).
По согласованию с преподавателем можно произвести расчет
и других термодинамических функций, воспользовавшись допол-
нительной литературой [11-13].
Полученные значения сопоставьте с табличными данными
«Краткого справочника физико-химических величин» [22] или
справочника [12] и выпишите их в рабочую тетрадь.
14. В отчет о проделанной работе входят: ИК-спектр полисти-
рола, градуировочный график или градуировочное уравнение,
запись ИК-спектра исследуемой молекулы, таблицы: III.1, Ш.2
или III.3, Ш.4, схема колебательных и вращательных состояний;
поступательная, вращательная, колебательная и полная сумма по
состояниям и приведенная энергия Гиббса для стандартного со-
стояния. Результаты собственных измерений и расчетов должны
сопровождаться оценкой их погрешности.
РАБОТА не 2
Полосатые спектры испускания двухатомных молекул.
Определение частот колебаний, энергии электронного
возбуждения и термодинамических функций
Цель и содержание работы
Ознакомление с полосатыми спектрами двухатомных молекул
и методикой расшифровки их колебательной структуры на приме-
ре спектров испускания молекул CN, АЮ, ВО и др., возбуждае-
мых в электрической дуге. Определение молекулярных постоянных
(о<?, toeXe и энергии возбужденного электронного состояния Те. По-
строение кривых потенциальной энергии и оценка энергии диссо-
циации. Расчет по молекулярным постоянным термодинамических
функций.
Освоение методики работы на спектрографе и измерение спект-
ральных линий и кантов в спектрах.
Аппаратура
Спектрограф, электрическая дуга переменного тока, измери-
тельный микроскоп или компаратор, спектропроектор.
Теоретическая подготовка к работе
Ознакомьтесь по учебному пособию с системой энергетических
состояний и полосатыми спектрами двухатомных молекул (см. I,
§ 5, 6, 8,-10, 13). Прочтите описание спектрографа ИСП-51 и ме-
тодику регистрации и измерения спектров испускания (см. II,.
§ 4-8).
Порядок выполнения работы и пояснения к ней
1. Убедитесь, что питание дуги выключено (кнопочный выклю-
чатель и щиток питания), и установите электроды из железа на
оптическую ось. Для этого нужно убрать линзу-конденсор и
пододвинуть штатив к входной щели, закрытой колпачком. За-
крепите верхний электрод в таком положении, чтобы его заост-
ренный конец был выше центра перекрестья крышки щели спектро-
графа примерно на 1—1,5 мм. Затем точно напротив него поставь-
191
те нижний электрод таким образом, чтобы зазор между ними со-
ставлял величину 2—3 мм.
2. Отодвиньте штатив от щели на учетверенное фокусное рас-
стояние конденсора (оно указано на оправе линзы или рейтере)
и закрепите его (расстояние измеряется от концов электродов).
3. Установите на оптическую ось конденсорную линзу между
электродами и щелью таким образом, чтобы изображение концов
электродов зажженной дуги (дуга включается кнопочным выклю-
чателем) было резким и приходилось на центр перекрестья кол-
пачка щели. Затем конденсор пододвиньте в сторону штатива на
3—5 см, чтобы изображение электродов размылось и равномерно
осветило щель спектрографа по высоте.
4. Поставив ширину щели, равную удвоенной ширине нормаль-
ной щели s = 2Xj/d(~5 .мк), зажгите дугу и убедитесь 'в чистоте
щели, рассматривая изображение спектра в плоскости кассетной
части через лупу (линии спектра железа при этом должны быть
тонкими и видны с достаточной четкостью). При загрязнении
щели прочистите ее совместно с преподавателем или лаборантом.
5. Зарядите в фотокомнате кассету фотопластинкой. Для этого
сначала на свету откройте заднюю крышку кассеты (передняя
шторка должна быть плотно задвинута) и ознакомтесь с ее
устройством. Погасите свет, откройте коробку с фотопластинками
и вставьте одну из них в кассету эмульсией вниз. Сторона с
эмульсией шероховата на ощупь и прилипает к влажным паль-
цам (проверять эмульсию следует около края фотопластинки,
чтобы не испортить ее). Закройте крышку кассеты, проверьте на-
дежность упаковки фотопластинок и только после этого вклю-
чайте свет.
6. Подберите экспозицию эталонного спектра сравнения же-
лезной дуги. Для этого ограничьте высоту щели фигурной диа-.
фрагмой до деления «4» (по верхней шкале диафрагмы) и сними-
те ряд пробных спектров железной дуги с экспозициями 1,3, 10 с.
Свет во время экспозиции открывается затвором в кассетной час-
ти. Нс забывайте открыть шторку кассеты и колпачок щели. Кас-
сета передвигается после каждой экспозиции на 5 делений.
7. Смените электроды из железа па графитовые или электроды
из алюминия для получения спектра соответствующих исследуе-
мых двухатомных молекул CN или АЮ.
При смене электродов обязательно выключайте щиток пита-
ния генератора дуги.
Замену электродов лучше всего производить последовательно.
Например, сначала убирается нижний электрод из железа и на его
место устанавливается исследуемый электрод относительно верх-
него электрода. Затем таким же образом меняется другой элект-
род. Если сбились оба электрода, необходимо повторить опера-
ции 4 и 5, но с исследуемыми электродами.
8. Подберите экспозицию для получения зачетного спектра ис-
следуемого вещества, повторяя операции, приведенные в пункте 6.
-192
9. Проявите (5 мин), отфиксируйте (10 мин) и промойте в про-
точной воде (15 мин) фотопластинку. При этих операциях фото-
пластинка должна лежать в кювете эмульсией вверх, а кювету с
раствором следует время от времени покачивать.
10. Зарядите кассету новой фотопластинкой и сфотографируйте
контрольный спектр двухатомной молекулы CN или АЮ. Для
этого с выбранной экспозицией снимите спектр исследуемой мо-
лекулы в центре (фигурная диафрагма устанавливается на деле-
ние «4» по верхней шкале), а затем спектр сравнения железной
дуги (фигурная диафрагма устанавливается на деление «4» по
нижней шкале).
1-1. Полученную зачетную пластинку проявите, отфиксируйте
и промойте. На фотопластинке подписывается фамилия студента,
и пластинка остается сушиться на штативе до следующего занятия.
Выключите установку. По согласованию с преподавателем, для
расшифровки спектра можно взять другую, уже сухую спектро-
грамму, чтобы не терять рабочее время.
12. На спектропроекторе ПС-18 или СПП-2 проведите расшиф-
ровку спектра железа, пользуясь атласом стандартных спектров.
Наиболее резкие и характерные атомные линии спектра железа,
расположенные в области группировки кантов молекулярного
спектра, пометьте с обратной стороны фотопластинки (сторона
без эмульсионного слоя) чернильной точкой и поставьте номер.
Длины волн (в атласе они приведены для атмосферного давле-
ния воздуха и температуры 20°С) и номер линии запишите в ра-
бочую тетрадь в табл. III.5.
Таблица Ш.5
Результаты измерений атомных линий и кантов молекулярных полос
№ линии или канта X. А по атласу 1, мм по микроскопу X. А в воздухе V, см-1
Fe № CN №
13. Грубо под спектропроектором оцените по атласу положе-
ние кантов в спектре и пронумеруйте полосы. Результаты оценок
запишите (в скобках) в табл. III.5.
14. Установите фотопластинку на измерительный микроскоп
МИР-12 и проведите измерение расшифрованных атомных линий
железа и кантов полосатого спектра. Канты измеряются по рез-
кой границе между светлым фоном и максимумом почернения.
Результаты запишите в табл. III.5.
15. Пользуясь методом линейной интерполяции, рассчитайте
положение указанных преподавателем линий или кантов в А
(в воздухе).
7 А. А. Мальцев
193
По таблицам (или на ЭВМ (см. Приложение III)) переведите
длины волн (в воздухе) измеренных кантов в волновые числа в
СМ"1.
16. В связи с тем что на стеклянном спектрографе ИСП-51
можно фотографировать спектры только в ограниченной области
(от 3600 до 10 000 А), а полосы спектров молекул CN и АЮ рас-
положены в основном в ультрафиолетовой области, преподаватель
после проверки работы по пунктам 1—16 выдает список кантов
полос и их отнесение либо для исследованной молекулы, либо
для какой-то другой, взятой из раздела IV. Дальнейшая работа
ведется с этими литературными данными.
17. Полученные волновые числа кантов vv> v« располагаются
по клеткам таблицы Деландра (см. табл. 1.5). Затем находятся
значения AGu+i/2=G1)+i—G15=we—2^ехе—2<s)exev и A2G=—2^ехе>
соответствующие первым и вторым разностям между соседними
полосами в таблице Деландра, и записываются в таблицу.
В случае молекулы CN следует обратить внимание на то, что
канты полос расположены тесными группами, в которых Ди =
— v'—v" — const. Такие группы называются диагональными (см.
рис. 1.30).
18. По усредненным первым и вторым разностям определите
значения и о}ехе для основного и возбужденного электронного
состояний. Оцените точность полученных значений.
19. Оцените энергию диссоциации Do исследуемой молекулы,
пользуясь приближенной формулой
4со6. хе
и соотношением
De = Do 1/2 сог — 1/4 со^х,.
Полученную величину сравните с литературными данными, при-
веденными в Приложении V.
20. Определите величину чисто электронного перехода Те, ис-
пользуя формулу
= 1/24-1/4 о; 1/2(0^ 1/44<.
Нарисуйте потенциальные кривые для обоих электронных состоя-
ний и укажите стрелками переходы между наблюдаемыми колеба-
тельными уровнями.
21. Используя методы статистической термодинамики, рассчи-
тайте для исследуемого соединения в приближении «жесткий ро-
татор — гармонический осциллятор» сумму по состояниям, приве-
денную энергию Гиббса и их поступательные, вращательные, коле-
бательные и электронные составляющие при стандартных условиях
(Т=298, 15 К, р=1 атм), используя формулы (8.7) — (8.11),
(8.17).
194
По согласованию с преподавателем можно произвести расчет
и других термодинамических функций, воспользовавшись допол-
нительной литературой [11-13].
Полученные результаты сопоставьте с табличными данными
справочника [22] или [12], выписав их в рабочую тетрадь.
22. В отчет о проделанной работе входят:
1) Фотопластинка с молекулярным спектром и спектром
железа.
2) Результаты измерения спектрограмм.
3) Таблица Деландра.
4) Рассчитанные и табличные (см. Приложение V) значения:
со*, ©х, ш'х*, те, d0-
5Q Потенциальные кривые и переходы между колебательными
уровнями.
6) Поступательная, вращательная, колебательная, электронная
и полная сумма по состояниям и приведенная энергия Гиббса
для стандартного состояния.
Результаты собственных расчетов должны сопровождаться
оценкой их погрешности.
7*
РАБОТА № 3
Электронный спектр поглощения галогенов.
Определение энергии диссоциации и других молекулярных
постоянных
Цель и содержание работы
Ознакомление с электронными спектрами поглощения двух-
атомных молекул на примере паров йода. Определение энергии
диссоциации (в основном и возбужденном состояниях) и молеку-
лярных постоянных ш', со'х', г'е. Построение потенциальных кри-
вых.
Освоение методики работы на регистрирующем спектрофото-
метре.
Аппаратура
Автоматический спектрофотометр для видимой облачи спект-
ра. Нагреваемая кювета с йодом. Термопара с потенциометром.
Теоретическое введение
(Предварительно прочтите в разделе I, § 5, 6, 8, 10, 13, 15).
В электронных спектрах поглощения паров йода и брома (ви-
димая область) имеется большое число (несколько десятков)
резких кантов полос, которые сходятся к границе с непрерывным
спектром (см. I, § 13, 15). На рис. 1.37 представлена схема потен-
циальных кривых, электронно-колебательные переходы и спектр.
Длинная прогрессия полос образуется в результате того, что
молекула переходит из первых колебательных состояний с и"=0,
1, 2 (их заселенность приведена на рис. 1.12) основного электрон-
ного состояния A15g" в многочисленные колебательные состоя-
ния и' возбужденного электронного состояния В3П Следует
заметить, что согласно правилам отбора (см. табл. 1.1) переходы
между синглетными и триплетными электронными состояниями
запрещены, однако для йода и ряда других молекул наблюдается
нарушение этого правила. Для возбужденного электронного со-
стояния межъядерное расстояние г' почти на 0,4 А больше,
чем г", и поэтому наблюдаемые переходы приходятся на левую
196
«крутую» часть потенциальной кривой (см. рис. 1.32 и 1.37). Ин-
тенсивность полос определяется принципом Франка — Кондона,
т. е. наиболее вероятными будут переходы, для которых макси-
мально перекрываются волновые функции основного и возбужден-
ного электронных состояний для одного и того же значения
межъядерного расстояния г". При температурах, близких к ком-
натной, большая часть молекул (~65%) находится в основном
колебательном состоянии и"=0 (основного электронного состоя-
ния). Поэтому наиболее интенсивными будут те переходы, у кото-
рых вертикальная линия, соответствующая постоянному межъядер-
ному расстоянию, проходит через максимумы (или вблизи их)
квадратов волновых функций |tf>v|2, т. е. интегралы перекрывания
волновых функций основного и возбужденного электронных со-
стояний будут максимальны. Несмотря на то что состояния с
и"=1, 2 менее заселены, вероятность переходов из этих состояний
также достаточно высока и в спектре наблюдаются прогрессии с
и"== 1,2,3...
В спектре паров йода наблюдаются две перекрывающиеся се-
рии полос: высокочастотная с и"=0 и низкочастотная с и"=1.
В том месте, где они перекрываются, наблюдается «сбой» в регу-
лярной структуре. На начало прогрессии с v"=l накладываются
другие прогрессии с v"=2, Зит. д., но их колебательные интер-
валы близки, и поэтому в низкочастотной области наблюдается
только уширение полос, и отделить прогрессии друг от друга при
небольшом разрешении спектрального прибора нельзя. При боль-
шом поглощении наблюдаются такие полосы, как 3—9, 4—9.
Из спектров поглощения йода можно определить границу
между дискретным и непрерывным спектрами, т. е. Vrp, выше кото-
рой происходит диссоциация молекулы. По спектру можно также
оценить и волновое число начало системы полос voo путем графи-
ческой экстраполяции прогрессии и"=0 к и'=0, используя дан-
ные Приложения XVII. Экстраполяция будет короче, если в нее
включить колебательные интервалы из прогрессий v"=l, 2, 3. Из
рис. 1.37 видно, что разность
vrp —v00 =^Р0.
При диссоциации йода из основного электронного состояния
образуются невозбужденные атомы в состояниях 2Рз/г«
А диссоциация из возбужденного электронного состояния В3 П х
°и
приводит к тому, что один из атомов образуется в возбужденном
СОСТОЯНИИ 2Р1/2, а Другой — В ОСНОВНОМ СОСТОЯНИИ 2Рз/2. Поэтому
для определения энергии диссоциации Ро необходимо из vrp
вычесть энергию возбуждения атома Ват/he.
Если провести анализ колебательной структуры электронного
перехода, используя данные Приложения XVII, и определить для
каждой полосы значения v' и и", то можно построить график ин-
197
тервалов между полосами, которые соответствуют величине
Д(^4-1/2, в зависимости от y-j-1/2 (см. § 12 и 15). Затем этот
график экстраполируется и по площади под кривой определяется
энергия диссоциации возбужденного электронного состояния Do-
Этот метод называется экстраполяцией Берджа — Шпонер. Из
энергии возбуждения продуктов диссоциации E^jhc и величины
voo (см. § 15) определяется энергия диссоциации основного со-
стояния Do Из этого же графика можно по наклону кривой опре-
делить 2(о'х',
Из распределения интенсивностей в спектре можно оценить
разницу в равновесных межъядерных расстояниях основного и
возбужденного состояний, т. е. г' — г*. Максимум поглощения,
согласно принципу Франка — Кондона, приходится на полосы,
которые находятся в месте пересечения вертикальной линии, про-
веденной из точки г*, с верхней потенциальной кривой.
Волновое число (или энергию) такого электронно-колебатель-
ного перехода можно обозначить как vMaKc> а потенциальную
энергию колебательного состояния и'макс, приходящегося на точку
пересечения (максимум интенсивности), как
V (О = +1/2) -«>;< «„с +1/2)*.
Это фактически потенциальная энергия молекулы в возбужден-
ном электронном состоянии (отсчет ведется от минимума потен-
циальной кривой V'(r')) ПРИ межъядерном расстоянии г' равным
межъядерному расстоянию г* основного электронного состояния.
Численное значение V'(r*) в см-1 можно определить следующим
образом:
У' (<) = VMaxc — Voo + ®'/2 =* VMaKC — V00. (1)
Величиной (i)'e/2 можно пренебречь, так как она порядка оши-
бок измерений ¥Макс и voo-
Потенциальная кривая возбужденного электронного состояния
хорошо описывается потенциалом Морзе (см. § 6).
V(r) = De[l—е-₽(г-ге)]2, (2)
где
₽ = 0)в (-2Пр~С- f Ю-8 = 1,2177- 107-о)Дрл/ад/2 Л-1,
если De и toe выражаются в см-1, а г в А.
Величины De и 0 легко определить из предшествующих изме-
рений Do — De—co'e/2^De и о)в. Тогда в функции Морзе (2)
остаются неизвестными V(r) и (г—ге). Однако из уравнения (1)
следует, что при (г* — г') потенциальная энергия V(г") «¥Макс—voo,
и получается следующее уравнение:
198
V"(rj = O«[l- 'e’]2
(3)
для функции Морзе.
Из (3) следует, что
Г(<) \ 1/2
т,п11+Нг)
(4)
Если известно ге, то очень просто построить кривую потен-
циальной энергии для возбужденного электронного состояния.
Таким образом, из распределения интенсивностей в спектре
можно получить информацию о взаимном расположении потен-
циальных кривых и межъядерном расстоянии возбужденного
электронного состояния. Подобно можно обрабатывать электрон-
ные спектры поглощения и флуоресценции молекул Br2, Li2, Na2
и т. д.
Порядок выполнения работы
и пояснения к ней
1. Прочтите описание спектрофотометра СФ-14 и порядок ра-
боты на нем (см. II, § 13, 14). Подготовьте его к работе.
2. Установите в кюветное отделение нагреваемую кювету дли-
ной 40 мм с боковым отростком, наполненным несколькими крис-
талликами йода. В другой (компенсирующий) канал установите
два окна или пустую кювету.
Включите нагреватель кюветы, рассчитанный на температуру
около 80°С. Отросток кюветы, температура которого на 20—30°
ниже, чем сама кювета, необходим для того, чтобы избежать кон-
денсации йода пй окнах. Обычно температура окон понижена за
счет конвекционных потоков холодного воздуха и теплового излу-
чения.
3. После нагрева кюветы установите совместно с преподавате-
лем или лаборантом «ноль» шкалы оптической плотности (вся
шкала рассчитана на оптическую плотность, равную 1), выведя
предварительно шкалу длин волн на 750 нм.
4. Установите область 400 нм и зарегистрируйте спектр погло-
щения паров йода на скорости записи 2 или 3.
5. После окончания работы выключите прибор и нагреватель
кюветы.
6. По спектру определите начало непрерывного спектра vrp и
экстраполяцией положение полосы voo- Рассчитайте энергию дис-
социации йода для основного и возбужденного электронных со-
стояний (Do и Р^) по границе непрерывного спектра. Энергия воз-
буждения атома йода (2Pi/2 — 2Рз/г) 7603 см-1. Полученные ре-
зультаты запишите в табл. III.6.
7. Используя Приложение XVII, проведите отнесение полос в
полученном вами спектре, измерьте их положение в нм и переве-
199
Таблица III.6
Результаты измерений спектра поглощения паров йода
Энергия диссоциации
Экспериментальные данные Таблич- ные дан- ные По грани- це непре- рывного спектра Метод Берджа— Шпонер Линейная экстра- поляция
s 5 5 S 8 -3 В й S II II II II 11 II II <°е = <Ме = г' — г" = г' — „ II н II II II II II Q з з з з < < Л) = ^0 =
дите в волновые числа. Постройте график зависимости AGv_|_i/2
от vf + 1/2, проведите графическую экстраполяцию Берджа — Шпо-
нер и определите энергию диссоциации возбужденного электрон-
ного состояния. По началу и наклону графика определите вели-
чины со' и 2<о'х'. Оцените предельное значение t£aKC.
8. Определите длину волн максимума поглощения и, используя
ее значение и собственные измерения ©' и D’, определите
«-<)•
9. Определите энергию диссоциации De методом линейной
экстраполяции (см. § 15) и сравните с величинами, полученными
другими методами.
10. Постройте приближенно по 6—8 точкам (через 0,2 А) кри-
вые потенциальной энергии для основного и возбужденного элек-
тронных состояний, взяв значения ге, ($е, Do из Приложения V.
11. В отчет о проделанной работе входят:
1) Запись спектра.
2) Графики экстраполяции прогрессии и"=0 к и'=0 и
&G'v+i/z от и'+1/2.
3) Табл. III.6.
4) Схема потенциальных кривых.
РАБОТА № 4
Идентификация органических соединений по их инфракрасным
спектрам поглощения
Цель и содержание работы
Получение ИК-спектров поглощения органических соединений
и их идентификация по основным структурным (функциональным)
группам. Ознакомление с техникой ИК-спектроскопии. Освоение
методики работы на ИК-спектрофотометре и проверка его градуи-
ровки.
Аппаратура
Инфракрасный спектрофотометр.
Теоретическая подготовка к работе
Ознакомьтесь по учебному пособию с колебательными спектра-
ми многоатомных молекул (см. I, § 17, 19). Прочтите об основах
техники ИК-спектроскопии и принципах работы ИК-спектрофото-
метров (II, § 15), об ИК-спектрофотометре ИКС-22 (II, § 18, 19)
и методике съемки ИК-спектров (II, § 20). Для более детального
знакомства с методом следует прочесть одно из специальных по-
собий [1—6].
Порядок выполнения работы и пояснения к ней
1. Включите спектрофотометр и подготовьте его к работе (см.
II, §18, 19).
2. Для проверки градуировки прибора снимите спектр поли-
стирола (толщина пленки около 25 мкм) при следующих пара-
метрах:
Усиление — около 1,5 (устанавливается так, чтобы при закры-
вании канала образца перо быстро достигало «нуля», а при от-
крывании возвращалось обратно, но не совершало частых авто-
колебаний).
. Баланс — около 3,5 (устанавливается так, чтобы перо само-
писца оставалось неподвижным в пределах 40—60% поглощения
при закрытых каналах образца и сравнения).
201
Накал глобара — 36.
Скорость развертки спектра — «быстро».
Полученный спектр сравните со спектром полистирола, приве-
денным в Приложении X. При наличии систематического сдвига
в градуировке его необходимо учитывать в дальнейшей работе.
3. Получите у преподавателя образцы двух органических сое-
динений для их идентификации. При этом указывается их состав
(структурная формула), но не известно, к какому из образцов они
относятся. Идентификация состоит в том, чтобы по ИК-спектру
сделать отнесение исследуемых соединений.
4. Подготовьте образцы к работе.
В случае жидкого образца нанесите 1—2 капли на окно кюве-
ты, закройте его вторым окном и осторожно, чтобы не раздавить
окно из кристалла NaCl, соберите кювету. Установите ее в кювето-
держатель и проведите запись спектра исследуемого соединения.
В случае твердых образцов, когда они снимаются в виде взвеси
в вазелиновом масле, необходимо сначала записать спектр вазе-
линового масла, чтобы в дальнейшем исключить его полосы по-
глощения из спектра взвеси. Для этого кювета наполняется вазе-
линовым маслом (1—2 капли) и записывается его спектр, исполь-
зуя перо с синими чёрнилами. Затем приготавливается взвесь ис-
следуемого образца в вазелиновом масле и красными чернилами
регистрируется спектр на том же самом бланке. При регистрации
твердых веществ в вазелиновом масле необходимо установить в
канале сравнения кювету с вазелиновым маслом, чтобы частично
компенсировать поглощения света кюветой, в которой находится
образец. После окончания регистрации спектров выключите уси-
литель спектрофотометра. Осторожно вытрите окна из NaCl сухой
ватой, но не мойте водой.
5. Пользуясь корреляционными таблицами ИК-спектров по-
глощения, имеющимися в Приложении XIV, найдите характерис-
тичные частоты для функциональных групп исследуемых соедине-
ний и с их помощью идентифицируйте полученные образцы.
6. В отчет о проделанной работе входит спектр полистирола,
спектры исследуемых соединений, их структурные формулы и
характеристичные частоты функциональных групп, по которым
проводилась идентификация соединений.
РАБОТА № 5
Спектры комбинационного рассеяния, возбуждаемые
ртутной лампой
Идентификация органических соединений
Цель и содержание работы
Ознакомление со спектроскопией комбинационного рассеяния.
Освоение фотографической методики съемки КР-спектров на
спектрографе ИСП-51 и измерения спектрограмм на измеритель-
ном микроскопе МИР-12. Получение КР-спектра одного из жид-
ких органических соединений, измерение его и идентификация
вещества по таблицам.
Аппаратура
Спектрограф ИСП-51, осветитель с ртутной лампой для съемки
КР-спектров, спектропроектор ПС-18 или СПП-2, измерительный
микроскоп МИР-12.
Теоретическая подготовка к работе
Ознакомьтесь по учебному пособию с КР-спектрами (см. I, §9)
и колебательными спектрами многоатомных молекул (см. I, § 17,
19). Прочтите разделы, связанные с регистрацией и измерением
КР-спектров (см. II, § 4—10).
Порядок выполнения работы и пояснения .к ней
1. Включите воду для охлаждения кожуха и теплового фильтра.
Уровень воды в бачке должен поддерживаться постоянно в пре-
делах ±10 см около красной черты.
2. На пульте питания осветителя включите лампу ПРК-2 вы-
ключателем справа. Если лампа не загорается, нажмите кнопку
включения конденсатора.
3. Зарядите в фотокомнате кассету фотопластинкой. Для этого
Сначала на свету откройте заднюю крышку кассеты (передняя
шторка^должна быть плотно задвинута) и ознакомьтесь с ее
устройством. Погасите свет, откройте коробку с фотопластинками
и вставьте одну из них в кассету эмульсией вниз. Сторона с эмуль-
сией шероховата на ощупь1 и прилипает к влажным пальцам
203
(проверять эмульсию следует около края пластинки, чтобы не ис-
портить ее).
Закройте крышку кассеты, проверьте надежность упаковки
фотопластинок и только после этого включите свет.
4. Когда напряжение на лампе достигнет ПО—120 В, снимите
спектр ртутной лампы, который необходим для того, чтобы в даль-
нейшем исключить его из КР-спектра. При фотографировании
спектра ртути крышка-рефлектор с белым экраном должна за-
крывать левую часть кюветного отделения осветителя. Ширина
щели при съемке спектра ртутной лампы берется 0,01 мм=10мкм.
Высота щели 2—4 (по верхней шкале фигурной диафрагмы).
Экспозиция 5 мин. Не забывайте во время экспозиции открыть
шторку кассеты и колпачок щели. Экспозиция дается с помощью
затвора в кассетной части прибора. Кассета должна находиться
вверху на делении 5. Для более надежной защиты фотопластинки
от света кассетная часть прикрывается куском черной материи.
5. Получите у преподавателя или лаборанта кювету с иссле-
дуемым веществом и осторожно, не переворачивая и не взбалты-
вая ее, вставьте в осветитель.
6. Сфотографируйте КР-спектр. Для этого опустите кассету на
20 делений и установите ширину щели 50 мкм, а высоту на деле-
ние 4 по верхней шкале фигурной диафрагмы. Экспозиция состав-
ляет 0,5—2 ч для камерного объектива с фокусом /=270 мм и
10—20 мин для /=120 мм. Экспозиция также зависит от чувст-
вительности фотопластинки.
Во время работы установку нельзя оставлять без присмотра
и необходимо внимательно следить за подачей воды.
Во избежании ожога глаз не смотрите на ртутную лампу без
защитных очков.
7. Снимите стандартный атомный спектр испускания железа
для измерения КР-спектра. Для этого после окончания экспози-
ции выключите ртутную лампу и выньте кювету с веществом. При
этом шторку кассеты не закрывайте. Установите фигурную диаф-
рагму в положение 4 по нижней шкале, а ширину щели уменьшите
до 0,01 мм=10 мкм. В связи с тем что установка щели всегда
ведется в сторону увеличения ее ширины, необходимо сначала
уменьшить ее ширину до 0, а затем увеличить до 10 мкм. Сними-
те спектр сравнения железа с экспозицией 1 мин.
8. Проявите (5 мин), отфиксируйте (10 мин) и промойте в про-
точной воде (15 мин) фотопластинку. При этих операциях фото-
пластинка должна лежать в кювете эмульсией вверх, а кювету с
раствором следует время от времени покачивать. На фотоплас-
тинке подписывается фамилия, и пластинка остается сушиться в
штативе до следующего занятия. Выключите установку.
По согласованию с преподавателем, для расшифровки спектра
можно взять другую уже сухую спектрограмму, чтобы не терять
рабочее время и продолжить работу в этот же день.
9. Пользуясь спектром ртути, приведенным в Приложениях
204
VIII—IX, расшифруйте визуально спектр ртутной лампы на фото-
пластинке. Найдите линию ртути 4358 А, которая является воз-
буждающей линией КР-спектра. Перенёсите на КР-спектр чер-
нильными точками линии спектра ртути, которые обусловлены
релеевским рассеянием. Тогда оставшиеся линии будут линиями
комбинационного рассеяния.
10. Поставьте пластинку на спектропроектор ПС-18 или
СПП-2 (эмульсией вверх) и расшифруйте по атласу более слож-
ный спектр железа, который является стандартным спектром срав-
нения для КР-спектров. Расшифровку спектра следует начинать
с области известной линии ртути 4358 А. Около КР-линий отметь-
те характерные линии железа, и их длины волн запишите в
табл. III.7.
11. Установите фотопластинку на измерительный микроскоп
МИР-12 и измерьте положение реперных линий спёктра железа
и КР-линий. Результаты запишите в таблицу.
Таблица III.7
Результаты измерений КР-спектра
№ линии
железа или
КР-спектра
X. А
по атласу
I, мм
по измери-
тельному
микроскопу
измеренное
= Av^ =
1 1
Sep Sb©36
Fe №
КР №
12. Проведите вычисление длин волн КР-линий, пользуясь ли-
нейной интерполяцией. В связи с тем что в данной работе практи-
ческая точность измерений КР-спектра невелика (~0,2—0,5, А),
а сдвиг спектра в воздухе относительно спектра в вакууме мало
изменяется с длиной волны (см. Приложение III), можно не пере-
водить длины волн в волновые числа, а взять их обратные числа,
размерность которых будет см-1. Таким образом, для вычисления
частот колебаний исследуемого вещества можно воспользоваться
выражением
. 1
©. = Av = -—
Sep
13. Сравните полученный спектр (частоты колебаний) со спект-
рами ряда соединений, приведенных в Приложении XV, и опреде-
лите соединение, которое было дано для исследования. Его фор-
мулу запишите в журнал.
14. В отчет о работе входят: фотопластинка с ртутным и
КР-спектрами, табл. IIL7, название идентифицированного соеди-
нения.
-----[см-1].
**ВОЗб
РАБОТА № 6
Изучение теплового эффекта реакции N2O4^2NO2
по ИК-спектрам поглощения
Цель и содержание работы
Ознакомление с методикой определения термодинамических
характеристик (теплоты реакции) химических реакций в газовой
фазе по ИК-спектрам поглощения на примере реакции диссоциа-
ции четырехокиси азота. Освоение методики работы на ИК-спек-
трофотометре и знакомство с количественным анализом по ИК-
спектрам.
Аппаратура
ИК-спектрофотометр. Нагреваемая камера с двумя шаровыми
кюветами, одна из которых наполнена двуокисью азота, а другая
вакуумирована (см. Приложение XVI). Термометр или термопара.
Краткое теоретическое введение
Для выбора оптимальных условий проведения того или иного
химического процесса, протекающего с участием газовой фазы, не-
обходимо знать состав газовой фазы при различных давлениях и
температурах. Экспериментальное моделирование таких процес-
сов, особенно при высоких температурах и давлениях, связано с
большими трудностями определения состава газовой фазы, так как
обычные аналитические методы позволяют проводить анализ
только при комнатных температурах. Вывод же вещества из на-
гретой реакционной зоны для его анализа связан со смещением
равновесия и искажением результатов. Поэтому спектральные
методы, которые позволяют определять качественный и количест-
венный состав газовой фазы в нагретых оптически прозрачных
объемах, представляют большую ценность для изучения различ-
ных высокотемпературных процессов.
Однако нет смысла изучать систему в широком диапазоне тем-
ператур и давлений, если для всех ее компонент известны термо-
динамические функции, с помощью которых довольно просто вы-
числяется состав газовой фазы в любых равновесных условиях.
206
Термодинамические функции можно определять либо путем
экспериментальных исследований равновесий в некотором интер-
вале температур и давлений, либо расчетными методами статисти-
ческой термодинамики, если известны молекулярные постоянные
всех продуктов рассматриваемой реакции.
Спектральные методы используются в обоих случаях. В первом
случае по спектрам изучается зависимость концентрации одного
или нескольких продуктов реакции от температуры, а во вто-
ром — по спектрам определяются молекулярные постоянные (час-
тоты колебаний, межъядерные расстояния и т. д.).
В данной практической работе на примере гомогенной газо-
вой реакции
°ч
с/
о
N—
2
О
О
симметрия молекулы NaO4 D$h
r(N=O)=l,190 A, (N—N) = 1,782 A,
-4 ONO = 135°
симметрия молекулы NO2 Civ
r(N—O) = 1,197 A,
4 pNO = 134°
рассматриваются экспериментальные методы определения теплоты
реакции ДЯ.
Реакция диссоциации четырехокиси азота N2O4 при повышении
температуры или понижении давления, как и обратная реакция
димеризации окиси азота NO2 при понижении температуры или
повышении давления, является классическим примером обратимой
химической реакции, равновесие которой в сильной степени за-
висит от температуры и давления.
В табл. III.8 и III.9 приведены данные по степени диссоциации
четырехокиси азота при различных температурах и давлениях.
Таблица III.8
Зависимость степени диссоциации N2O4 от температуры
1°, с —20 -10 0 10 30 70 100 280
а (при Р-1атм) 0,08 0,09 0,11 0,13 0,22 0,62 0,88 0,999
Из табл. III.8 видно, что при температуре выше ЗОО°С (при
атмосферном давлении) в газовой фазе практически находится
только двуокись азота. При дальнейшем нагревании она, в свою
очередь, также диссоциирует по реакции
NO2^ NO+ уО2.
207
Не менее существенно на составе газовой фазы сказывается и
давление (см. табл. III.9). Его понижение ведет к смещению рав-
новесия в сторону образования NO2. Эта реакция играет сущест-
венную роль в процессе получения азотной кислоты и поэтому
хорошо изучена.
Таблица III.9
Зависимость степени диссоциации N2O4 от давления
Р, атм (при 1 = 49,7°С) 0,0353 0,1234 0,2403 0,3440 0,6545
а 0,91 0,78 0,68 0,62 0,48
Расчет равновесного состава газовой фазы ведется через кон-
станту равновесия КР, которая, с одной стороны, связана с пар-
циальными давлениями реагирующих веществ и их продуктами,
а с другой стороны, с термодинамическими функциями. Например,
для реакции N2O4^2NO2 по закону действующих масс
„ _ Рио, _ 4а2 р
, 2 * общ»
*Но4 1 — а
где а — степень диссоциации, РОбщ — общее давление,
2а
Pno2 = —-
(О
р
1 общ’
1 — а
Pn,o4 = ——
1 4- а
Константа равновесия может быть также выражена
термодинамические функции:
Д77?. ( Д S°T
RT 1 R ’
р
1 общ*
через
(2)
и
где &Нт и Д-Sr— соответственно тепловой эффект реакции и
изменение энтропии при давлении 1 атм и температуре Т.
Если из (1) известно Кр, то по температурной зависимости
уравнения (2) можно определить к Нт и Д5г, Для этого обычно
строится график зависимости 1пКр от \/Т и из наклона прямой на-
ходится ktfr, а по началу графика (1/7')==0 — значение Д5?.
Из спектров поглощения можно определить парциальные дав-
ления веществ р, если известен коэффициент поглощения е. Пар-
циальное давление связано с концентрацией уравнением Кла-
пейрона — Менделеева
ри = nRT,
208
или
р= = cRT.
V
(3)
По закону светопоглощения Бугера — Ламберта — Бера (см. I,
§ 20) концентрация связана с оптической плотностью следующим
образом:
А — 1g ~~ = есЬ.
(4)
Подставляя (4) в (3), получаем
p=-*_RT.
eb
(5)
Константа равновесия для реакции N2O4^2NO2, выраженная
через оптические плотности и коэффициенты поглощения, будет
иметь вид
^NO2 eN2O4
4n,o*8n2o
А2
N2O 'J'(2
^N2O4
(6)
где
c =^- 4- = const.
®no. b
Таким образом, можно связать спектральные измерения опти-
ческой плотности А и 8 с константой равновесия и термодинами-
ческими функциями. В большинстве случаев измерения величины в
связаны с большими экспериментальными трудностями, когда ис-
следуемое вещество находится в равновесии с другими компонен-
тами и не может быть выделено в чистом виде или неизвестна его
концентрация в равновесной смеси.
Поэтому из уравнения (2) обычно определяют спектральными
методами только ДЯг. Для этого используется следующее урав-
нение (оно приведено для рассматриваемого равновесия
N2O4^2NO2):
In К = In Т + 1пС = — + р ЛЫ2О4 RT R
или А2 1П 4^- дк,о4 где a s?. , „ ая2 1пС = — + С12 RT R RT &S° = — In С. 1 R
8 А. А. Мальцев
209
В случае десятичных логарифмов
lg hO< Т =------------т—
Л1Ч2о4 19,147 Г
(7)
1g 4.
Построив график —Т от 1/Т, можно по наклону прямой
лм2о4
определить средний тепловой эффект реакции для измеряемого
интервала температур.
Порядок выполнения работы и пояснения к ней
1. Включите спектрофотометр и подготовьте его к работе.
2. В случае работы на спектрофотометре ИКС-14 необходимо
произвести градуировку прибора в области 2600—3200 см-1 по
стандартному спектру полистирола. Для этого установите рамку
с полистиролом в направляющие пазы кюветодержателя канала
образца и запишите спектр.
Запись спектра ведется в следующем режиме.
Усиление — около 3. Оно устанавливается обычно таким, чтобы
при закрывании канала образца перо быстро достигало «нуля»,
а при открывании возвращалось обратно, по не совершало при
этом частых автоколебаний.
Баланс усилителя подбирается таким, чтобы при закрытых све-
товых каналах перо самописца оставалось неподвижным в преде-
лах 40—60% поглощения.
Скорость записи спектра — 4.
Скорость подачи бумаги — 4.
Начало записи — 11,30 (деления барабана длин волн).
Конец записи — 13,50.
Во время записи спектра необходимо постоянно следить за по-
ложением пера и, когда оно достигнет максимума поглощения
(минимального деления по шкале пропускания), отметить это по-
ложение штрихом карандаша. Одновременно по барабану длин
волн считываются его показания и записываются рядом с регист-
рируемой полосой. Постройте градуировочный график размером
30x25 см (по оси ординат — см-1, я по оси абсцисс — деления
барабана длин волн) или проведите численную обработку полу-
ченных результатов на ЭВМ, используя программу метода наи-
меньших квадратов для линейного уравнения
v — а0 Ч-
где а0 и — определяемые коэффициенты, а п — деления бара-
бана длин волн.
3. Совместно с преподавателем или лаборантом установите в
кюветное отделение спектрофотометра нагреваемую камеру с
двумя шаровыми кюветами. В канал образца помещается кювета
210
с двуокисью азота, а в канал сравнения — пустая (вакуумирован-
ная) кювета. Включите воду, чтобы она охладила камеру до тем-
пературы порядка 5—10°С. Измерение температуры производится
термометром или термопарой.
4. В области 2800—3000 см-1 (в делениях барабана длин волн
она определяется по калибровочному графику или из линейного
уравнения) зарегистрируйте спектр поглощения исследуемой смеси
N2O4—NO2. В наблюдаемом спектре полоса в области 2900 см-1
относится к составной частоте vi + v3 молекулы NO2 и расщеплена
на Р- и R-ветви. Одиночная полоса 2960 см-1 относится к состав-
ной частоте vs+v» молекулы N2O4.
Перед началом записи спектра и в конце запишите небольшой
участок «нулевой» линии, перекрыв капал образца. Рядом со
спектром карандашом записывается температура в камере с точ-
ностью до Г. Режим работы спектрофотометра, как при градуи-
ровке.
5. Включите нагреватель и установите ЛАТРом по градуиро-
вочному графику температуру кюветы около 25—30°С; выждите
10 мин, чтобы температура кюветы установилась, и запишите
спектр поглощения в области 2800—3000 см-1. Затем повторите
эту операцию при температурах около 35—40, 45—50, 55—60°С.
Точный отсчет температуры производится в момент записи полос
поглощения.
6. После окончания работы выключите нагреватель кюветы,
воду и спектрофотометр.
7. По полученным данным составьте табл. 111.10. Величина ин-
тенсивности падающего излучения /о измеряется линейкой от
средней нулевой линии до базовой линии 100%-ного пропускания,
проведенной через основания полос NO2 и N2O4. Отсчет прошед-
шего излучения ведется между максимумом соответствующей по-
лосы поглощения и нулевой линией.
8. Определите средний тепловой эффект реакции Д7/о в изме-
ренном интервале температур, используя уравнение (7).
Для нахождения А Нт строится график зависимости
/А2 \
1g . -NO* Т от обратной температуры 1/7. Наклон прямой
\ лмго4 /
Таблица III. 10
8*
211
(с учетом коэффициента 19,147) дает величину ЛН°Т (Дж/моль).
По согласованию с преподавателем теплота реакции рассчиты-
вается также методом наименьших квадратов на ЭВМ и опреде-
ляется погрешность полученных данных.
9. Пользуясь таблицами термодинамических функций [12],
рассчитайте тепловой эффект исследуемой реакции для Гер и
сравните с экспериментальными данными. (По таблицам [22]
расчет более грубый).
10. В отчет о проделанной работе входят записи спектров,
табл. III. 10, значение &Нт из эксперимента и расчета.
РАБОТА № 7
Определение энергии водородной связи (теплоты ассоциации)
паров уксусной кислоты по ИК-спектрам поглощения
Цель и содержание работы
Ознакомление со спектральной методикой определения термо-
динамических характеристик паров по второму закону термоди-
намики на примере теплоты ассоциации уксусной кислоты. Зна-
комство с водородной связью. Освоение методики работы на
ИК-спектрофотометре и количественными измерениями.
Аппаратура
ИК-спектрофотометр. Изотермическая камера-кювета с двумя
кварцевыми шаровыми кюветами, отросток одной из которых со-
держит уксусную кислоту, а вторая пустая (см. Приложение
XVI). Термостат. Система стабилизации нагрева камеры.
Краткое теоретическое введение
Одной из разновидностей слабой химической связи, близкой по
энергии к межмолекулярному взаимодействию, является так назы-
ваемая водородная связь. Она обычно возникает в системах, со-
держащих группы-доноры протонов и атомы (или группы)-акцеп-
торы протонов. Группами-донорами протонов в органических мо-
лекулах являются карбоксильные —C\qH ’ гидРоксильные—
аминогруппы — NH2 или амидогруппы —Н. Атомами-акцепто-
рами протонов обычно являются кислород, азот и галогены. Не-
насыщенные фрагменты молекул, как, например двойная связь,
также могут выступать как акцептор протонов.
Исследования строения соединений с водородной связью, в
частности органических кислот, показывают, что они состоят из
Димерных и полимерных ассоциатов, которые устойчивы даже в
213
газовой фазе. Например, уксусная кислота в парах имеет димер-
ное циклическое строение
О—Н—Ох
н>с-с<о_н-о>с-сн’
Геометрические параметры мономерных и димерных молекул
уксусной кислоты приведены в’ табл. III.11. Следует обратить
внимание на то, что при димеризации изменяется не только рас-
Таблица III. 11
Геометрические параметры молекул мономеров и димеров
уксусной кислоты
Параметр Уксусная кислота
CHjCOOH (СН.СООН),
г (С=О) 1,214(3)1 1,231(3)1
г (С-О) 1,364(3)1 1,334(4)1
г (О-Н) — —
г (Н2С-С) 1,520(5)1 1,506(5)*А
г (Н3С-С) — —
г (О-.-Н-О) — 2,68(1)
^ОС=О 122,8°(0,5) 123,4’(0,5)
^ссо 110,6в(0,6) 113,0*(0,8)
стояние в гидроксильной группе —О—Н, но и
>С=О и ^с-о-,
причем в последнем случае межъядерное расстояние уменьшается.
Эти изменения проявляются и в частотах колебаний, наблюдаемых
в ИК- и КР-спектрах (см. далее).
Энергия диссоциации димера на две молекулы уксусной кисло-
ты (разрываются две связи) составляет 58 кДж/моль, что близко
к общепринятой энергии слабой химической связи молекул, не со-
держащих водород. Например, энергия диссоциации молекулы
Na2=71, Rb2=41,XeO=34, XeN=23, Mg2=4,8 кДж/мрль.
Это еще раз подтверждает то, что классификация соединений
по типам химической связи весьма условна, и водородная связь
находится в ряду слабых химических связей, приближаясь по
своей энергии к энергии межмолекулярных (вандерваальсовских)
взаимодействий молекул в конденсированной фазе.
Следует заметить, что фтористый водород существует в виде
димеров, тримеров и полимеров до п=6
214
о о о
1,00 А / Г \ 1,55 Л
Н 1400 'н
Спирты также образуют полимерные ассоциаты.
В молекулах, содержащих одновременно группировки доноров
и акцепторов протонов, при близком их пространственном распо-
ложении друг относительно друга может образоваться внутри-
молекулярная водородная связь. Например,
о-нитрофенол
салициловая кислота
Интересно, что температура кипения о-нитрофенола ниже на
-—50°, чем у п- и л-нитрофенолов, так как в последних образуют-
ся межмолекулярные водородные связи, а в о-нитрофеноле они
замкнуты сами на себя.
Большое значение имеет водородная связь в различных биоло-
гических объектах. Например, витки а-спирали полипептидов удер-
живаются в скрученном состоянии за счет водородной связи между
группами /N—Н и уС=О.
На прочность водородной связи влияют: напряженность коль-
ца, геометрия молекулы, относительная «кислотность» и «основ-
ность» групп — доноров и акцепторов протонов.
Степень диссоциации димерных молекул (устойчивость водо-
родных связей)' зависит как от температуры, так и степени раз-
бавления (или давления пара) вещества. Последнее влияние на
межмолекулярную и внутримолекулярную связь различно. Полосы,
обусловленные межмолекулярной водородной связью, исчезают
при больших разбавлениях (>0,01 М в неполярных растворите-
лях), в то время как при внутримолекулярном взаимодействии
концентрационная зависимость отсутствует.
О прочности водородной связи можно судить по теплотам испа-
рения. Так, например, теплоты испарения углеводородов значи-
тельно ниже, чем спиртов, карбоновых кислот и др. Большая теп-
215
лота испарения воды — 40 кДж/моль объясняется сильными во-
дородными связями.
Одним из основных методов исследования водородной связи
является спектроскопия.
При образовании соединений с водородной связью силовые
постоянные групп, между которыми образуется водородная связь,
заметно изменяются. Например, полосы валентных колебаний
групп-доноров протонов смещаются в сторону более низких час-
тот, чем у мономера, причем смещение обычно сопровождается
увеличением интенсивности и ширины полос. Если для мономерных
молекул характеристическая частота колебаний гидроксильной
группы составляет около 3600 см-1, то при ассоциации она может
смещаться в область 2500—3300 см-1. Для слабой межмолеку-
лярной связи частоты колебаний гидроксильной группы ОН по-
нижаются на 300—400 см-1, а сильной — на величину >500 см-1.
При этом следует учитывать, что на прочность водородной связи
может оказываться сильное воздействие используемый раствори-
тель. По величине сдвига часто судят о прочности водородной
связи. Например, для фенолов существует следующая эмпириче-
ская зависимость:
— Д7/ (ккал/моль) = 0,016 Avon (см-1) Н 0,63.
Изучая по колебательным спектрам относительные концентра-
ции мономерных и димерных (полимерных) молекул в зависи-
мости от температуры, можно получать такие термодинамические
свойства системы, как теплота димеризации (ассоциации) и теп-
лота испарения соединений с водородной связью.
Информация о водородной связи содержится не только в часто-
тах валентных колебаний гидроксильной группы (в принципе и
любой другой группе — доноре протонов), айв других видах
колебаний.
Частоты колебаний акцептора протона, например, группы
С = О (область 1700 см-1), также понижаются (межъядерное рас-
стояние увеличивается, см. табл. П1.11), но в меньшей степени,
так как и масса кислорода больше, чем водорода, и силовая по-
стоянная двойной связи С=О велика. В то же время частоты де-
формационных колебаний, как правило, несколько смещаются в
сторону больших частот за счет большей «упругости» образовав-
шегося цикла. При димеризации в длинноволновой области спект-
ра (для уксусной кислоты около 180 см-1) проявляется частота
валентных колебаний водородной связи О ...Н—О.
Энергию водородной связи можно измерять по ИК-спектрам
аналогично определению теплоты димеризации окиси азота (см.
практическую работу № 6). При этом часто пренебрегают горячи-
ми полосами (разностными переходами) и изменением контура
полос от температуры и давления пара.
При выполнении данной работы желательно прочесть практи-
ческую работу № 6 и ознакомиться с Приложением XVI.
216
Порядок выполнения работы и пояснения к ней
1. Включите спектрофотометр и подготовьте его к работе.
Режимы работы спектрофотометров ИКС-14 и ИКС-22 приведены
в разделе II, § 16—19.
2. Совместно с преподавателем или лаборантом вставьте в кю-
ветное отделение спектрофотометра нагреваемую камеру и уста-
новите такое напряжение, чтобы ее температура была выше тем-
пературы отростка и составляла около 30°С. Внутри камеры в ка-
нале образца установлена кювета с уксусной кислотой, а в канале
сравнения вакуумированная (пустая) кювета (см. Приложе-
ние XVI).
3. Затем включите термостат, нагревающий отросток кварцевой
шаровой кюветы с уксусной кислотой, и установите начальную
температуру около 20—25°С.
4. После стабилизации температуры в камере и отростке изме-
ряется теплота димеризации уксусной кислоты. Для этого темпе-
ратура отростка шарика с уксусной кислотой поддерживается
постоянной, а температура шарика меняется ступенчато (пример-
но через 7—10°) в интервале 30—100°С. Удовлетворительная точ-
ность получается для 6—8 точек. Первая запись спектра в интер-
вале 4500—2000 см-1 делается при температуре кюветы около
30°С. Для повышения точности запись повторяется 2—3 раза.
Любые изменения температуры кюветы во время записи спектров
фиксируются в лабораторном журнале. Результаты измерений
записываются в табл. III.12.
Интенсивность падающего излучения /0 измеряется линейкой
от нулевой линии, получающейся при закрытом канале образца,
Таблица III. 12
Результаты измерений теплоты димеризации уксусной кислоты
t°, с t°, с
отровтка шара
до базовой линии, соединяющей основания полос поглощения.
Интенсивность прошедшего излучения I измеряется от нулевой
линии до максимума (пика) полосы поглощения.
Следует обратить внимание на то, что величина пропускания
полос мономера и димера не должна выходить за пределы 10—
85%, иначе точность измерений будет плохой.
5. После окончания измерений выключите термостат, нагре-
ваемую кювету и спектрофотометр.
217
6. Пользуясь данными табл. III.12, определите графически или
методом наименьших квадратов среднюю теплоту ассоциаций
(димеризации) Д#тср уксусной кислоты для исследуемого интер-
вала температур по уравнению изобары Вант—Гоффа (см. прак-
тическую работу № 6). Это так называемый метод определения
теплот реакций «по второму закону термодинамики» (см. [12]).
7. В отчет о проделанной работе входят записи спектров,
табл. III.12, экспериментальное значение Д/7тср «по второму за-
кону» и рассчитанное по термодинамическим функциям.
Раздел IV
РАСЧЕТНЫЕ ЗАДАЧИ
1. ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ (§11)
Задача № 1/1
Рассчитайте с точностью до трех значащих цифр положение
(в см-1, мм и МГц) первых пяти линий вращательного спектра
поглощения молекулы 12С1вО, расположенного в длинноволновой
ИК-области спектра, если известно межъядерное расстояние
Го=1,13 А. Нарисуйте схему вращательных уровней и спектр.
В каком направлении будет смещена система уровней и спектр
для изотопозамещенной молекулы 12С18О?
Задача № 2/1
Рассчитайте с точностью до трех значащих цифр положение
(в см-1, мм и МГц) первых трех линий поглощения вращательного
спектра молекулы НЭТС1 в длинноволновой ИК-области, если
межъядерное расстояние г0=1,27 А. Нарисуйте систему враща-
тельных уровней, возможные переходы между ними и спектр.
В каком направлении будет смещена система уровней и спектр
для изотопозамещенной молекулы Н35С1?
Задача № 3/1
Рассчитайте с точностью до трех значащих цифр положение
(в см-1, мм и МГц) первых трех линий поглощения вращательного
спектра молекулы D^Cl в длинноволновой ИК-области, если
межъядерное' расстояние го=1,27 А. Нарисуйте систему враща-
тельных уровней, возможные переходы между ними и спектр.
В каком направлении будет смещена система уровней и спектр
для изотопозамещенной молекулы Н37С1?
Задача № 4/1
Рассчитайте положение в (А) первых трех линий (стоксовых
и антистоксовых) вращательного КР-спектра молекулы Ог от воз-
буждающей линии ртути АВОЗд=4358 А. Межъядерное расстояние
г0= 1,21 А.
219
Нарисуйте систему вращательных уровней, схему переходов
и спектр комбинационного рассеяния.
Задача Ха 5/1
Постройте систему первых пяти вращательных состояний мо-
лекулы HF, используя таблицу молекулярных постоянных (При-
ложение V). Основываясь на правилах отбора для Д/, рассчитайте
и нарисуйте схему ИК- и КР-вращательных спектров (в см-1).
Задача № 6/1
Постройте систему первых пяти вращательных состояний моле-
кулы НС1, используя таблицу молекулярных постоянных (Прило-
жение V). Основываясь на правилах отбора для Д/, рассчитайте
и нарисуйте схему ПК и КР-вращательных спектров (в см-1).
Задача № 7/1
Постройте систему первых пяти вращательных состояний мо-
лекулы НВг, используя таблицу молекулярных постоянных (При-
ложение V). Основываясь на правилах отбора для ДУ рассчитайте
и нарисуйте схему ИК и КР-вращательных спектров (в см-1).
Задача № 8/1
Постройте систему первых пяти вращательных состояний моле-
кулы HI, используя таблицу молекулярных постоянных (Прило-
жение V). Основываясь на правилах отбора для ДУ, рассчитайте
и нарисуйте схему ИК и КР-вращательных спектров (в см-1).
Задача № 9/1
Постройте систему первых пяти вращательных состояний моле-
кулы NO, используя таблицу молекулярных постоянных (Прило-
жение V). Основываясь на правилах отбора для ДУ, рассчитайте
и нарисуйте схему ИК- и КР-вращательных спектров (в см-1)г
Задача № 10/1
Постройте систему первых пяти вращательных состояний мо-
лекулы SO, используя таблицу молекулярных постоянных (При-
ложение V). Основываясь на правилах отбора для ДУ, рассчитайте
и нарисуйте схему ИК и КР-вращательных спектров (в см-1).
Задача № 11/1
Постройте систему первых пяти вращательных состояний моле-
кулы СО, используя таблицу молекулярных постоянных (При-
ложение V). Основываясь на правилах отбора для ДУ, рассчитай-
те и нарисуйте схему ИК и КР-вращательных спектров (в см-1).
220
Задача № 12/1
Волновые числа первых трех линий вращательного спектра по-
глощения молекулы Н35С1 в длинноволновой ИК-области равны
20,88; 41,74 и 62,58 см-1. Определите вращательную постоянную
BQ (в см-1), момент инерции /0 (в г-см2-10-40) и межъядерное
расстояние г0 (в А) с точностью до трех значащих цифр.
Задача № 13/1
Волновые числа первых трех линий вращательного спектра
окиси углерода 12С16О равны 3,85; 7,69 и 11,53 см-1. Определите
с точностью до трех значащих цифр вращательную постоянную
Во (в см-1), момент инерции Д (в г-см2-10-40) и межъядерное рас-
стояние г0 (В А).
Задача № 14/1
Во вращательном КР-спектре окиси углерода, возбуждаемом
линией ртути ХВОзд=4358 A (v=22 944,5 см-1), получены линии со
следующими волновыми числами: 22 933,0; 22 925,3; 22 917,6;
22 909,9. Определите вращательную постоянную Во, момент инер-
ции /0 и межъядерное расстояние г0.
Задача № 15/1
Во вращательном КР-спектре водорода наблюдаются линии
со следующими смещениями Av относительно возбуждающей ли-
нии: 354,38; 587,06; 814,41 и 1034,65 см-1. Рассчитайте вращатель-
ную постоянную Bq, момент инерции /0 и межъядерпое расстоя-
ние г0, пренебрегая эффектом центробежного растяжения.
Задача № 16/1
Во вращательном КР-спектре дейтероводорода (HD) наблю-
даются линии со следующими смещениями относительно возбуж-
дающей линии: 267,09; 443,08; 616,09 и 784,99 см-1. Рассчитайте
вращательную постоянную Во, момент инерции /0 и межъядерное
расстояние го, пренебрегая эффектом центробежного растяжения.
Задача № 17/1
Во вращательном КР-спектре дейтерия наблюдаются линии
со следующими смещениями Av относительно возбуждающей ли-
нии: 179,06; 297,52; 414,66 и 529,91 см-1. Рассчитайте вращатель-
ную постоянную Bq, момент инерции /0 и межъядерное расстоя-
ние Го, пренебрегая эффектом центробежного растяжения.
221
Задача № 18/1
Во вращательном КР-спектре паров HF наблюдаются следую-
щие стоксовы линии:
Av (см-1) 123,5; 205,5; 287 и 368,5. Определите вращательную
постоянную Во и межъядерное расстояние для молекулы HF.
Задача № 19/1
В микроволновом спектре поглощения D8tBr измерены следую-
щие первые линии вращательных переходов
Переход J' — J" Волновые числа, см'1
I «—0 8,49083
2*—1 16,9795
34—2 25,4640
44—3 33,942
5 <—4 42,411
64—5 50,870
74—6 59,317
Определите вращательные постоянные (в см-1) BQ и Dfc, связан-
ные с волновыми числами линий через выражение
v = F' (J + 1) - Г (J) = 2BV (/ -•-!) — 4D0 (J + I)3.
Для упрощения расчетов можно рассматривать зависимость
v/(/+l) от (7+1)2. Определите также межъядерное расстояние
Го и примерное значение вращательного квантового числа J для
наиболее интенсивной линии при температурах 200 и 300 К. Оце-
ните погрешность полученных молекулярных'постоянных. Атомный
вес 0=2,014102; 81 Вг = 80,916292.
Задача 20/1
В микроволновом спектре поглощения паров монобромида
висмута найдены следующие линии поглощения, отнесенные к ко-
лебательному состоянию v= 1 одной из изотопных модификаций
молекулы Bi79Br.
Переход J' —J” Частота, МГц
27—26 27—27 69 621,000 72 198,205
36-^35 37—36 38—37 39—38 92 816,040 95 385,695 97 961,170 100 536,450
222
Определите вращательные постоянные Bi и Dt (в см'1), свя-
занные с волновыми числами линий через выражение
v = F' (J + 1) - F" (J) = 2В0 (J -j-1) - Wv (J -Ь I)3.
(Для упрощения расчетов можно поделить левую и правую Часть
на (/+1)). Определите также g и оцените погрешность получен-
ных молекулярных постоянных. Масса 209Bi = 208,9804,
79Вг = 78,9183.
Задача № 21/1
В микроволновом спектре поглощения паров монобромида вис-
мута найдены следующие линии поглощения, отнесенные к коле-
бательному состоянию и=0 одной из изотопных модификаций мо-
лекулы Bi81Br.
Переход /' —J*
Частота, МГц
27-26
28—27
37—36
38—37
39—38
68 585,135
71 124,030
93 966,975
96 504,195
99 041,240
Определите вращательные постоянные Во и Do (в см4), свя-
занные с волновыми числами линий через выражение
v = F’ (J+ \)-Fn(J) = 2Bv(J± 1)-4DP(J Ь I)3.
(Для упрощения расчетов можно поделить левую и правую части
на (/+1)). Определите также г0 и оцените погрешность получен-
ных молекулярных постоянных. Массы 209Bi = 208,9804 и 81Вг =
= 80,9163.
Задача № 22/1
Во вращательном КР-спектре фтора измерены следующие сред-
ние значения первых линий в стоксовой и антистоксовой областях:
J Avcp. см-1 J Avcp, см-1 J avcp, см-1
0 5,2746 3 15,8947 6 26,4805
1 8,8244 4 19,4359 7 30,0167
2 12,3692 5 22,9664 8 33,5501
9 37,0710
(Интенсивности линий с нечетными значениями / выше, чем с
четными, так как ядерный спин 19F равен 1/2.)
223
Определите вращательные постоянные BQ и DQ (в см~’), связан-
ные с волновыми числами через выражение
Avcp = ± [(4В0 - 6D0) U + 3/2) - 8D0 (J + 3/2)3].
(Для упрощения расчетов можно поделить левую и правую части
на (74-3/2).) Определите межъядерное расстояние г0 и примерное
значение J для наиболее интенсивной линии при температуре
300 К. Оцените погрешность полученных молекулярных постоян-
ных. Масса 19F= 18,99840.
Задача № 23/1
Во вращательном КР-спектре смешанной изотопной модифика-
ции хлора (35С137С1) измерены следующие средние значения поло-
жений линий в стоксовой и антистоксовой областях
J Avcp, см-i J Avcp, см-i J Avcp, см-1
44 42,9426 48 46,7047 52 50,4443
45 43,8894 49 47,6447 53 51,4043
46 44,8278 50 48,5709 54 52,3256
47 45,7678 51 49,5045 55 53,2423
56 54,2178
Определите вращательные постоянные Во и Do (см-1), связан-
ные с волновыми числами линий через выражение
Avcp = F' (J + 2) - F” (J) - (4В0 - 6D0) (7 + 3/2) - 8D0 (J 4- 3/2)3.
(Для упрощения расчетов можно поделить левую и правую части
на (74-3/2)). Определите также межъядерное расстояние г0 и
примерное значение 7 для наиболее интенсивной линии при тем-
пературе 300 К. Оцените погрешность полученных молекулярных
постоянных. Массы 35С1 = 34,96885 и 37С1 = 36,96590.
Задача № 24/1
Во вращательном КР-спектре изотопной модификации хлора
35С12 измерены следующие средние значения положения линий в
стоксовой и антистоксовой областях
J Avcp. см-1 J Avcp, см-1 J Avcp’ см'1
15 16,0452 20 20,8945 25 25,7446
16 17,0143 21 21,8703 26 26,7125
17 17,9858 22 22,8367 27 27,6965
18 18,9571 23 23,8116 28 28,6559
19 19,9253 24 24,7843 29 29,6245
224
Интенсивности линий с нечетными значениями I выше, чем с
четными значениями, так как ядерный спин ^Cl равен 3/2.
Определите вращательные постоянные Во и (в см-1), свя-
занные с волновыми числами линий через выражение
Avcp = F' (J + 2) — F* (J) = (4В — 6D0) (J + 3/2) — 8D0 {J 4- 3/2)3.
(Для упрощения расчетов можно поделить левую и правую части
на (/+3/2)).
Определите межъядерное расстояние г0 и примерное значе-
ние / для наиболее интенсивной линии при температуре 300 К.
Оцените погрешность полученных молекулярных постоянных. Мас-
са 35С1 = 34,96885.
Задача № 25/1
В микроволновом спектре поглощения паров фторида лития
(6LiF) измерены следующие линии поглощения, отнесенные к ко-
лебательным состояниям ц = 0, 1, 2 и 3
Состояние v Переход J'—J" Частота, МГц
0 1-0 89 740,46
0 3-2 269 179,18
0 4—3 358 856,19
0 5-4 448 491,07
0 6—5 538 072,65
1 1—0 88 319,18
1 2—1 176 627,91
1 3—2 264 915,79
1 4—3 353 172,23
1 5-4 441 386,83
2 1—0 86 921,20
2 2—1 173 832,06
2 3-2 260 722,24
2 4—3 347 581,39
3 2—1 171 082,27
3 3—2 256 597,84
3 4—3 342 082,66
Определите вращательные постоянные Bv и Dv (в см-1), свя-
занные с волновыми числами линий через выражение
v = F' (J + 1) - F" (J) = 2BV (/ + 1) - 4D„ (J + I)3.
(Для упрощения расчетов можно поделить левую и правую части
на (/-|-1)). Определите также молекулярные постоянные Ве, De,
Ое, ге и оцените колебательную частоту сое через Ве. Оцените по-
грешности полученных вами молекулярных постоянных и сравните
их с литературными данными. Массы 6Li=6,01512 и 19F= 18,99840.
225
2. КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ (§ 5, 12)
Задача № 1/2
Пользуясь табличными значениями юе и соехе (см. Приложе-
ние V), определите энергии колебательных состояний молекул Г2
и /2 и для и = 0, 1, 2, 3.
Задача № 2/2
В ИК-спектре поглощения молекулы НВг наблюдаются следую-
щие колебательно-вращательные полосы поглощения 1—0 и 2—О
с центрами при 2558,53 и 5026,60 см-1. Определите сое и wexe-
Задача № 3/2
В ИК-спектре поглощения молекулы Н35С1 наблюдается после-
довательный ряд колебательно-вращательных полос поглощения,
интенсивность которых сильно уменьшается с увеличением волно-
вых чисел полос. Центры полос находятся при 2885,98; 5667,98;
8346,78; 10 922,80 и 13 396,22 см-1. Проведите отнесение колеба-
тельных полос к соответствующим колебательным переходам
v'—v" и определите частоту колебания <ое, постоянную ангармо-
ничности (дехе и силовую постоянную ke молекулы H^Cl.
Задача № 4/2
В спектре поглощения молекулы HF в близкой ИК-области
наблюдается ряд колебательно-вращательных полос поглощения,
интенсивность которых резко падает с возрастанием их волнового
числа, т. е. наблюдаются полосы основного колебания и его обер-
тоны. Центры полос находятся при 3961,60; 7750,98; 11 372,92;
14 831,75; 18 131,10 см-1. Проведите отнесение полос к соответст-
вующим колебательным переходам и'—v" и определите частоту
колебания сое, постоянную ангармоничности (дехе (пренебрегая
(НеУе) и силовую постоянную ke молекулы HF.
Задача № 5/2
В ИК-спектре поглощения молекулы HI наблюдается ряд ко-
лебательно-вращательных полос поглощения, интенсивность кото-
рых резко падает с возрастанием их волнового числа, т. е. наблю-
даются полосы основного колебания и его обертона. Центры полос
находятся при 2229,6; 4379,2; 6448,0 и 8434,7 см-1. Проведите от-
несение полос к соответствующим колебательным переходам
и'—v" и определите частоту колебания ioe, постоянную ангармо-
ничности (деХе и силовую ПОСТОЯННУЮ ke МОЛвкулЫ HI.
226
Задача № 6/2
В ИК-спектре поглощения молекулы СО наблюдаются полосы
vo=2143,3; 4260,1 и 6350,4 см-1, интенсивность которых резко па-
дает в сторону больших частот. Определите колебательную часто-
ту (Ое, ангармоничность а)ехе и силовую постоянную ke молеку-
лы СО.
Задача 7/2
В ИК-спектре поглощения молекулы D35Cl наблюдается ряд
колебательно-вращательных полос поглощения, интенсивность
которых резко падает с возрастанием их волновых чисел. Центры
полос находятся при 2091,0; 4128,6; 6112,8 см-1. Проведите отнесе-
ние колебательных полос к соответствующим колебательным пере-
ходам v'—v" и определите частоту колебания сое, постоянную ан-
гармоничности соеХе и силовую постоянную ke молекулы D35C1.
Задача 8/2
В ИК-спектре поглощения молекулы D37C1 наблюдается ряд
колебательно-вращательных полос поглощения, интенсивность ко-
торых резко падает с возрастанием их волновых чисел. Центры
полос находятся при 2088,0; 4122,7 и 6104,3 см-1. Проведите отне-
сение наблюдаемых полос к соответствующим колебательным
переходам v'—v" и определите частоту колебания сое, постоянную
ангармоничности (оехе и силовую постоянную ke молекулы ЭЭТС1.
Задача 9/2
В ИК-спектре поглощения молекулы DBr наблюдаются три ко-
лебательно-вращательные полосы с центрами при 1839,82; 3634,10;
5382,01 см-1. Проведите отнесение полос и определите частоту
колебания <ое и ангармоничность (оехе.
Задача № 10/2
В ИК-спектре поглощения молекулы DI наблюдаются .три
колебательно-вращательные полосы поглощения, интенсивность
которых сильно снижается при переходе к первому и второму обер-
тонам. Центр полосы основного тона (переход 1—0) находится
при 1599,76 см-1, а центры полос первого обертона 2—0 при
3159,35 и второй) обертона 3—0 при 4678,53 см-1. Определите
колебательную частоту «е и ангармоничность toexe.
227
3. КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
ДВУХАТОМНЫХ МОЛЕКУЛ (§ 12)
Задача № 1/3
В колебательно-вращательном ИК-спектре поглощения полосы
1—0 окиси углерода среднее расстояние между десятью линиями
вращательной структуры, расположенными около нулевого проме-
жутка, составляет 3,83 см-1.
Пренебрегая изменением межъядерного расстояния при пере-
ходе из одного колебательного состояния в другое, определите
с точностью до трех значащих цифр, вращательную постоянную
В, момент инерции I и межъядерное расстояние г.
Задача № 2/3
Для молекулы Н35С1 определены следующие значения враща-
тельных постоянных (в см-1):
Во =10,440
В2= 9,835
В3=9,535
В4=9,237
Определите вращательную постоянную Ве и постоянную коле-
бательно-вращательного взаимодействия ае.
Задача № 3/3
Вращательные постоянные молекулы Н2: Bq=59,339, Bi = 56,364,
В2 — 53,475, В3=50,628 см-1. Определите Ве и постоянную колеба-
тельно-вращательного взаимодействия ае.
Задача № 4/3
Используя молекулярные постоянные (см. Приложение V),
рассчитайте положение первых трех вращательных линий Р- и
/?-ветвей в инфракрасном колебательно-вращательном спектре по-
глощения молекулы NO (в состоянии Х2П1/2) для перехода 1—0.
Задача № 5/3
В таблице приведена часть линий вращательной структуры
ИК-полосы поглощения 2—0 молекулы 12С16О в области 4200—
4300 см-1 (первый обертон 2v)
4294,6
91,5
88,3
85,0
81,7
4278,2
74,8
71,2
67,5
63,8
4256,2
52,3
48,3
44,3
40,2
4236,0
31,7
27,4
23,0
18,5
4214,0
228
Определите начало полосы v0 и сделайте отнесение линий враща-
тельной структуры к Р- и Р-ветвям, приписав им вращательные
квантовые числа Л Вычислите вращательные постоянные Во, Вз,
Ве и ае и межъядерное расстояние. Постройте систему энергети-
ческих состояний и обозначьте на ней переходы, в результате
которых образуется полоса поглощения 2v молекулы 12С16О.
Задача № 6/3
По приведенной в таблице вращательной структуре колеба-
тельно-вращательной полосы 3—1 ИК'Спектра поглощения моле-
кулы 12С1вО проведите отнесение линий к Р- и Р-ветвям, найдите
нумерацию по J, определите вращательные постоянные, Ве, Blt
В3, ае и межъядерные расстояния г для состояний и'=3, v"—l,
величину колебательного перехода и постройте систему первых
энергетических уровней.
4174,74 4195,53 4218,18 4235,12
79,04 99,48 21,71 38,29
83,26 4203,36 25,17
87,42 10,91 28,55
91,51 14,58 31,87
Задача № 7/3
В колебательно-вращательном ИК-спектре поглощения паров
DI (длина поглощающего слоя 100 см, давление 300 мм рт. ст.)
получен с большим разрешением ряд линий вращательной струк-
туры (приведено только 15 линий в см4).
3108,73 3146,09 3171,63 3193,20
16,69 52,85 77,39 97,96
24,40 65,62 82,91 3202,48
31,87 88,19
39,10
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа Л Отнесите полосу к ос-
новному тону или обертону, сравнив полученное значение vo с
табличным значением а>е (см. Приложение V). Рассчитайте вра-
щательные постоянные Bv, Ве, ае.
Задача № 8/3
В колебательно-вращательном ИК-спектре поглощения паров
НВг (длина поглощающего слоя 10 см, давление 140 мм рт. ст.)
получены следующие линии вращательной структуры (в см-1).
2687,2 2620,8 2524,9 2432,6
74,9 06,0 07,3 12,9
62,2 2590,7 2489,2 2392,8
48,9 75,0 70,8
35,1 42,0 51,9
229
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа J. Отнесите полосу к ос-
новному тону или обертону, сравнив полученное значение vo с таб-
личным значением юе (см. Приложение V). Рассчитайте враща-
тельные постоянные Bv, Ве, ае-
Задача № 9/3
В колебательно-вращательном ИК-спектре поглощения паров;
DBr (длина поглощающего слоя 10 см, давление 60 мм рт. ст.)
получены следующие линии вращательной структуры (в см-1).
1908,4 1872,1 1822,6 1777,0
01,6 64,2 13,8 67,4
1894,4 56,2 04,8 57,6
87,2 48,2 1795,8 47,7
79,8 31,3 86,4 37,6
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа J. Отнесите полосу к ос-
яовному тону или обертону, сравнив полученное значение vo с таб-
личным значением сое (см. Приложение V). Рассчитайте враща-
тельные постоянные Bv, Ве, ае-
Задача № 10/3
В колебательно-вращательном ИК-спектре поглощения паров
HI (длина поглощающего слоя 100 см, давление 280 мм рт. ст.)
получены следующие линии вращательной структуры (в см-1).
2102,18 2161,99 2216,72 2277,51
17,60 76,17 42,09 88,62
32,71 90,02 54,26 99,33
47,5 2203,54 66,07
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа J. Отнесите полосу к основ-
ному тону или обертону, сравнив полученное значение vo с таблич-
ным значением <ое (см. Приложение V). Рассчитайте вращательные
постоянные Bv, Ве, ае.
Задача № 11/3
В колебательно-вращательном ИК-спектре поглощения паров
хлористого водорода (длина поглощающего слоя 300 см, давление
5 мм рт. ст.) наблюдается ряд линий вращательной структуры
естественной смеси Н^С! и H^Cl. По следующим линиям (в см-1)
молекулы H^Cl:
5406,878 5577,332 5723,302 5799,969
38,056 5601,767 39,265 5808,220
68,148 25,029 53,967 15,148
97,127 47,108 67,396 20,752
5525,004 87,650 79,551
51,738 5706,093 90,414
230
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа J. Отнесите полосу к ос-
новному тону или обертону, сравнив полученное значение vb с
табличным значением сое (см. Приложение V). Рассчитайте вра-
щательные ПОСТОЯННЫе Bv, Ве, Ое-
Задача № 12/3
В колебательно-вращательном ИК-спектре поглощения паров
HI (длина поглощающего слоя 100 см, давление 280. мм рт. ст.)
получен ряд линий вращательной структуры (приведено только
20 линий в см-1).
4239,428 4323,742 4402,875 4449,676
57,604 38,626 13,652 56,891
75,121 52,844 23,714 63,394
91,973 66,369 33,076 ' 69,153
4308,190 91,390 41,731 74,184
Определите начало полосы vo, отнесите линии к ветвям и опре-
делите вращательные квантовые числа /. Отнесите полосу к ос-
новному тону или обертону, сравнив полученное значение v0 с
табличным значением <ое (см. Приложение V). Рассчитайте вра-
щательные постоянные Bv, Ве, ае.
Задача № 13/3
В колебательно-вращательном ИК-спектре поглощения паров
НС1 (длина поглощающего слоя 600 см, давление 1 мм рт. ст.)
наблюдаются два ряда линий, обусловленных изотопическими мо-
дификациями хлора H^Cl и НЭТС1, присутствующих в хлористом
водороде естественного изотопного состава (отношение концентра-
ции “Cl :37С1 = 3 : 1). В таблице приведена часть линий (в см-1)
наблюдаемой вращательной структуры. Определите положение
«нулевых линий» для обеих изотопических модификаций, сделайте
отнесение ветвей и определите их вращательные квантовые чис-
ла Л Рассчитайте вращательные постоянные Bv и Dv для основ-
ного (v"—0) и возбужденного колебательного состояния Н35С1 и
НЭТС1. Используя таблицы молекулярных постоянных (Приложе-
ние V), определите значение v'.
Н36С1
2703,019
27,790
52,047
75,768
2798,952
2821,575
43,628
65,101
2906,252
25,910
44,924
63,300
2981,021
98,070
3014,437
30,103
45,070
231
Н37С1
2701,198
25,930
50,142
73,833
2904,118
23,743
42,739
61,081
2706,976
2819,566
41,587
63,024
2978,774
95,790
3012,141
27,800
Задача № 14/3
В колебательно-вращательном ИК-спектре поглощения паров-
DBr естественного изотопного состава (длина поглощающего слоя
10 см, давление 60 мм рт. ст.) получены при большом разрешении
следующие линии вращательной структуры (в см-1).
1894,76 1864,57 1822,93 1786,67
94,17 64,01 22,40 86,16
87,48 56,58 14,10 77,22
86,90 56,02 13,57 76,72
80,02 48,42 05,12 67,61
79,45 47,87 04,60 67,11
72,38 31,59 1795,97
71,81 31,95 95,46
Определите положение нулевой линии, отнесите линии к изото-
пическим модификациям молекул D79Br и Z)81Br. Сделайте отне-
сение линий к Р- и /?-ветвям и определите их нумерацию по вра-
щательным квантовым числам /. Рассчитайте значения враща-
тельных постоянных Bv обеих изотопических молекул для основ-
ного (и"=0) и возбужденных (и'=1) колебательных состоя-
ний молекул D79Br и D78Br. Определите молекулярные постоянные
Ве, В\ и ае. Рассчитайте отношение приведенных масс р= (р/р,1)1/2
из молекулярных весов и сравните его с расчетным значением
Bie/Be.
Задача № 15/3
Используя данные таблицы молекулярных постоянных (Прило-
жение V), рассчитайте положение (в см-1) трех первых линий
вращательной структуры (О- и S-ветвей) в колебательно-врдща-
тельном КР-спектре молекулы С12. Частоту возбуждающей линии
примите равной 20 000 см-1. Нарисуйте схему переходов между
энергетическими состояниями.
Задача № 16/3
Используя данные таблицы молекулярных постоянных (Прило-
жение V), рассчитайте положение (в см-1) трех первых линий
вращательной структуры (О- и S-ветвей) в колебательно-враща-
тельном КР-спектре молекулы Вг2. Частоту возбуждающей линии
примите равной 20 000 см-1. Нарисуйте схему переходов между
энергетическими состояниями.
232
Задача № 17/3
В колебательно-вращательном КР-спектре водорода наблю-
даются Q-линии вращательной структуры, смещения (Av) которых
относительно возбуждающей равны: 4161,13; 4155,20; 4143,39 и
4125,83 см-1. Определите постоянную колебательно-вращательного
взаимодействия ае=В'—В" и частоту vo колебательного перехода
1—0, который запрещен в ИК-спектрах поглощения.
Задача № 18/3
В колебательно-вращательном КР-спектре дейтероводорода
(HD) наблюдаются Q-линии вращательной структуры, смещения
(Av) которых относительно возбуждающей линии равны: 3632,06;
3628,20; 3620,51; 3608,99 см-1. Определите постоянную колеба-
тельно-вращательного взаимодействия ае—В'—В" и частоту vb
колебательного перехода 1—0, который запрещен в ИК-спектрах
поглощения.
Задача № 19/3
В колебательно-вращательном КР-спектре дейтерия наблю-
даются Q-линии вращательной структуры, смещения (Av) которых
относительно возбуждающей линии равны: 2993,55; 2991,45;
2987,23; 2980,88; 2972,56 см’1. Определите постоянную колеба-
тельно-вращательного взаимодействия ае=В'—В" и частоту у0
колебательного перехода 1—0, который запрещен в ИК-спектрах
поглощения.
4. ЭЛЕКТРОННО-КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
ДВУХАТОМНЫХ МОЛЕКУЛ (§ 13)
Задача № 1/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы СО для электронного
перехода Д1!!—с изменением колебательных состояний v' и v"
от 0 до 3. Полученные волновые числа расположите в таблицу Де-
ландра. Нарисуйте схему рассчитанных переходов.
Задача № 2/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр иона СО+ для электронного
перехода В22—X2S с изменением колебательных состояний v' и и"
от 0 до 3. Полученные волновые числа расположите в таблицу
Деландра. Нарисуйте схему рассчитанных переходов.
233
Задача № 3/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы Na2 для электронно-
го перехода В’П—с изменением колебательных состояний vr
и и" от 0 до 3. Полученные волновые числа расположите в таб-
лицу Деландра. Нарисуйте схему рассчитанных переходов.
Задача № 4/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы Кг для электронного-
перехода 63S~—X3S_ с изменением колебательных состояний v' и
и" от 0 до 3. Полученные волновые числа расположите в таблицу
Деландра. Нарисуйте схему рассчитанных переходов.
Задача № 5/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы N2 для электронного
перехода а1!!—с изменением колебательных состояний v' и v"
от 0 до 3. Полученные волновые числа расположите в таблицу
Деландра. Нарисуйте схему рассчитанных переходов.
Задача № 6/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы SO для электронного
перехода —X3S_ с изменением колебательных состояний v' и
и" от 0 до 3. Полученные волновые числа расположите в таблицу
Деландра. Нарисуйте схему рассчитанных переходов.
Задача № 7/4
Рассчитайте по молекулярным постоянным (Приложение V)
электронно-колебательный спектр молекулы Р2 для электронного
перехода А 41—с изменением колебательных состояний v' и
и" от 0 до 3. Полученные волновые числа расположите в таблицу
Деландра. Нарисуйте схему рассчитанных переходов.
Задача № 8/4
Определите молекулярные постоянные Те, о)', со", со'х\о"х" для
молекулы A1F, используя фрагмент таблицы Деландра, в которой
расположены канты полос, наблюдаемые в полосатом спектре
испускания. Положение кантов полос дано в А в вакууме.
234
V* v* 0 1 2 3 4 5
0 1842,6 1869,9 1897,6 1925,8
1 1814,3 1840,6 1867,5 1894,8 1922,6
2 1787,3 1812,8 1838,8 1856,3 1892,2 1919,6
3 —> 1786,4 1811,6 1837,2 1863,3 1889,8
4 —> 1785,7 1810,5 1835,7 1861,5
5 — — — 1785,2 1809,7 1834,6
Задача № 9/4
Используя нижеприведенный фрагмент таблицы Деландра
для электронно-колебательного спектра испускания молекулы
10В16О, определите по кантам следующие молекулярные постоян-
ные:, энергию электронного перехода Те, колебательные частоты
со* и ангармоничности со'х*, а>*х\ Положение кантов полос
приведено в см-1.
9 1 2 3 4
0 55 077,4 53 162,8 51 272,1 49 407,1 47 566,2
1 56 406,4 54 491,4 — -» 50 735,4 48 894,3
2 57 713,0 55 792,5 53 908,3 52 042,5
3 58994,8 57 079,8 55 189,6 — —
4 60 255,1 58 340,0 — — —
Задача № 10/4
Используя нижеприведенный фрагмент таблицы Деландра
для электронно-колебательного спектра испускания молекулы
’’В^О, определите по кантам следующие молекулярные постоян-
ные: энергию электронного перехода Те, колебательные частоты
<о', со' и ангармоничности со"х*. Положение кантов полос
приведено в см-1.
2 3 4
и' • 0 1
0 55 084,2 53 222,2 51 383,8 49 569,0 47 778,4
1 56 376,7 54 516,2 .— 50 863,5 49 067,1
2 57 648,2 55 789,8 53 947,9 52 135,6
3 58 896,1 57 035,1 55 169,9 — 51 590,5
4 60 124,7 58 261,4
Задача № 11/4
Используя данные таблицы Деландра, определите молекуляр-
ные постоянные (ое, (оехе для основного и возбужденного электрон-
235
ного состояния молекулы CS, а также энергию электронного
возбуждения Те. Положение кантов полос дано в А в воздухе.
о' . V* 0 1 2 3 4
0 2576,75 2664,09 2756,60
1 2509,47 2592,55 2680,07 2772,67
2 2523,99 2606,78 2694,35 2786,99
3 2539,42 2622,45 2710,14
4 2477,36 2556,31
Задача № 12/4
Определите молекулярные постоянные Те, со', со', co'xg и со'х*
для молекулы А1Вг (электронный переход А’П—X’S), используя
фрагмент таблицы Деландра, в которой приведены канты полос
электронно-колебательно-вращательного спектра испускания. По-
ложение полос дано в А в воздухе.
о' V* 0 1 2 3 4
0 2789,53 2819,08 2849,00 2879,40 2910,28
1 2767,71 2796,78 2826,29 2856,15 2886,48
2 2747,45 2776,18 2805,25 2834,68 2864,48
3 — 2757,41 2786,10 2815,18 2844,65
Задача № 13/4
Проведите расчет молекулярных постоянных Те, со', со*, со'х',
со'х' молекулы BF, используя фрагмент таблицы Деландра для
полос поглощения электронного перехода А'П—X!S. Положение
кантов полос дано в А в вакууме.
v* D' 0 1 2 3 4
0 1957,3 2011,7 2068,0
1 1911,0 1962,7 2016,4 2072,1 —
2 1867,8 1917,1 1968,3 2021,3 2076,4
3 — • 1874,6 1923,4 — 2026,5
4 — — 1881,8 1930,1 ——
Задача № 14/4
и
Проведите расчет молекулярных постоянных Те, сов, (ае>(аехе
(ОеХе иона N*» используя фрагмент таблицы Деландра, в ко-
236
торой приведены канты полосатого спектра испускания. Положе-
ние кантов полос дано в А в воздухе.
О* и* 0 1 2 3 4
0 3914,4 4278,1 4709,2 5228,3 5864,7
1 3582,1 3884,3 4236,5 4651,8 5148,8
2 3308,0 3563,9 3857,9 4199,1 4599,7
3 3078,2 3298,7 3548,9 3835,4 4166,8
4 — 3076,4 3293,4 3538,3 3818,1
Задача № 15/4
Проведите расчет молекулярных постоянных Те, со*, со’.со'х', со*х*
молекулы PN, используя фрагмент таблицы Деландра, в
которой приведены канты полосатого спектра испускания. Поло-
жение кантов полос дано в А в воздухе.
0 1 2 3 4
0 2518,21 2604,98 2696,90
1 2451,07 2532,99 2620,07 2712,07 ——•
2 2388,24 2466,19 — 2635,15 2727,52
3 2403,26 2481,36 — 2650,85
4 2418,75 — 2579,45
Задача № 16/4
Проведите расчет молекулярных постоянных Те, со', со*,®ехе, со'х*
для иона СО+, используя экспериментальные данные, све-
денные в таблицу Деландра. Положение кантов полос дано в А
в воздухе.
о' 0 1 2 3 4
0 2189,8 2299,6 2419,4 2550,3 2693,9
1 2112,4 2214,5 2325,2 2445,8 2577,7
2 2042,3 2137,8 2240,4 2352,5 2474,2
3 — 2067,9 2164,3 ’ 2268,6 2381,5
4 — 2004,7 2095,3 — 2298,2
Задача № 17/4
Произведите
®еХе МОЛекуЛЫ
др а для полос
расчет молекулярных постоянных со*, со*, со'х',
SiO, используя фрагмент таблицы Делан-
поглощения электронного перехода D1!!—
237
Положение кантов полос дано в А в воздухе.
0 1 2 3 4
0 2344,3 2413,8 2486,8 2563,8 2644,8
1 2298,9 2365,7 2436,3 2509,9 2587,2
2 2255,9 — 2388,0 2459,0
3 2215,4 2277,2 2342,4 2410,2 2481,9
4 2176,6 2236,3 2364,5 —
Задача № 18/4
Произведите расчет молекулярных постоянных Те, а)'е,
соД для электронного перехода D1!!—X1S+ молекулы
SnO, используя экспериментальные данные, сведенные в таблицу
Деландра. Положение кантов полос дано в А в воздухе.
V' V” 0 1 2 3 4
0 3388,26 3484,50 3585,40 3691,39 3802,70
1 3323,45 3415,84 3512,9 3614,75 3721,23
2 3262,37 3351,14 3444,64 3542,39 — -»
3 3205,79 3291,80 3381,72 — —
Задача № 19/4
По данным таблицы молекулярных постоянных (Приложе-
ние V) постройте кривые потенциальной энергии и рассчитайте
положение первых четырех колебательных уровней основного и
первого возбужденного электронного состояния молекулы СО.
На полученной схеме укажите, какие электронно-колебательные
переходы будут наиболее интенсивны в спектре испускания, а ка-
кие в спектре поглощения.
5. ПОТЕНЦИАЛЬНЫЕ КРИВЫЕ, ЭНЕРГИИ ДИССОЦИАЦИИ
И ИЗОТОПИЧЕСКИЕ ЭФФЕКТЫ В СПЕКТРАХ
ДВУХАТОМНЫХ МОЛЕКУЛ [§ 6, 14, 15)
Задача № 1/5
Пользуясь табличными данными (см. Приложение V), по-
стройте кривые потенциальной энергии (в приближении функции
Морзе) для основных состояний молекул Н2 и N2, беря три точ-
ки с r<je и пять точек с г>ге).
Проведите уровни колебательной энергии для о = 0, 1, 2, 3, 10
и определите графически наиболее вероятные межъядерные рас-
стояния для состояний с о=1 и 10.
238
Задача № 2/5
Пользуясь табличными данными (см. Приложение V), по-
стройте для молекул НС1 и DC1 кривую потенциальной энергии
(по функции Морзе). Построение кривой потенциальной энергии
можно вести приближенно, используя три точки с г<ге и пять
точек с г>ге. Вычислите уровни колебательной энергии для со-
стояний от и = 0 до и = 5 и проведите их на рисунке.
Задача № 3/5
В спектре флуоресценции молекулы Li®, возбуждаемого ла-
зером, наблюдаются отдельные прогрессии по линиям вращатель-
ной структуры, из расстояния между которыми найдены приве-
денные в таблице экспериментальные значения G(v") для значе-
ний v" от 2 до 21.
V’ G (о*) (см-1. о* G (и*) (вм-1) Р* б (и) (см-1)
2 928,2 9 3323,5 16
3 1288,8 10 3639,5 17 5646,7
4 1643,7 11 —. 18 5900,5
5 1992,3 12 4251,2 19 6145,3
6 13 4545,9 20 6380,7
7 2670,8 14 4832,9 21 6605,7
8 3000,4 15 5112,9
Определите энергию диссоциации молекулы Li® методом гра-
фической экстраполяции и методом линейной экстраполяции, если
<1)е=378,72 см-1, (оех<? = 2,98 см-1. Результаты сравните. Нарисуйте
систему переходов между электронно-колебательными состояния-
ми.
Задача № 4/5
Для молекулы И2 измерены все интервалы между соседними
колебательными состояниями AGr+i/2 (в см-1) .
V' — Vя Дбу + см-1 v- -Vя AGV + i/a см-1 и’ —Vя Лбу + 1/! СМ-1
1—0 4161 6—5 3014 11 — 10 1737
2—1 3926 7-6 2782 12—11 1415
3—2 3695 8—7 2543 13—12 1049 -
4—3 3468 . 9—8 2293 14-13 622
5—4 3242 10-9 2026
239
Определите энергию диссоциации молекулы Н2 методом экс-
траполяции Берджа — Шпонер и рассчитайте энергию диссоциа-
ции ее изотопа Z)2, пренебрегая второй ангармоничностью.
Задача № 5/5
Для молекулы D2 измерены все интервалы между соседними
колебательными состояниями AGv+i/2 (в см-1)
V' — Vя Дб„ + 1/г см-1 V’ — Vя Д60 1 д см-1 V' — Vя Дб0 4- i/2 см-1
1—0 2994 8— 7 2188 15—14 1311
2—1 2874 9— 8 2073 16—15 1159
3—2 2757 10— 9 1956 17—16 995
4—3 2642 11—10 1837 18—17 815
5—4 2528 12—11 1714 19—18 616
6-5 2415 13—12 1586 20—19 391
7—6 2301 14—13 1453 21—20 142
Определите энергию диссоциации молекулы D2 методом экс-
траполяции Берджа — Шпонер и рассчитайте энергию диссоциа-
ции водорода Н2, пренебрегая второй ангармоничностью.
Задача Яг 6/5
Для молекулы HI (De=2308,901 см-1, a DI (ое= 1639,655 см ’.
Определить вращательную постоянную молекулы DI, если для HI
Be =6,5111 СМ"1.
Задача № 7/5
В ИК-спектре поглощения молекулы Н35С1 наблюдаются по-
лосы, центры которых находятся около 2885,98; 5667,98; 8346,78;
10922,80 и 13396,22 см-1 (интенсивность полос резко падает в сто-
рону больших частот).
Определите колебательные постоянные ((ое, (оехе) и силовую
постоянную ke изотопозамещенной молекулы D35C1.
Задача № 8/5
В ИК-спектре поглощения молекулы Н35С1 наблюдаются по-
лосы, центры которых находятся около 2885,98; 5667,98; 8346,78;
10922,80 и 13396,22 см-1 (интенсивность полос резко падает в
сторону больших частот).
Определите колебательные постоянные ((ое, (аехе) и силовую
постоянную ke изотопозамещенной молекулы Н37С1.
240
Задача № 9/5
Пользуясь табличными данными для молекулы Н35С1, рассчи-
тайте колебательный спектр молекул Н37С1 до v = 4 и определи-
те изотопные сдвиги относительно спектра молекулы Н35С1.
Задача № 10/5
В инфракрасном спектре поглощения молекулы Н35С1 наблю-
даются полосы, центры которых находятся около 2885,98; 5667,98;
8346,78; 10922,80 и 13396,22 см-1 (интенсивность полос резко па-
дает в сторону больших частот).
Определите колебательные постоянные (w,., юл) и силовую
постоянную ke изотопозамещенной молекулы Т37С1.
Задача № 11/5
В ИК-спектре поглощения молекулы Н35С1 наблюдаются по-
лосы, центры которых находятся около 2885,98; 5667,98; 8346,78;
10 922,80 и 13 396,22 см-1 (интенсивность полос резко падает в
сторону больших частот).
Определите колебательные постоянные ((ое, и силовую
постоянную ke изотопозамещенной молекулы D37C1.
Задача № 12/5
При большом разрешении в колебательно-вращательном ИК-
спектре поглощения молекулы НВг наблюдается расщепление ли-
ний вращательной структуры за счет изотопного состава НВг
(содержание 79Вг = 50,7°/о, 81Вг=49,3%). Рассчитайте величину
изотопного сдвига для центра полосы v0 и первых линий Р- и R-
ветвей. Необходимые молекулярные постоянные имеются в При-
ложении V.
Приведенные в нем данные относятся к средним величинам.
Массы атомов 79Вг = 78,918, 81Вг=80,916.
Задача № 13/5
Рассчитайте величину изотопного расщепления первых трех
линий чисто вращательного спектра молекулы НС1, приведенного
на рис. 1.20, если его зарегистрировать на приборе высокого раз-
решения. Необходимые молекулярные постоянные имеются в
Приложении V. Приведенные в нем данные относятся к наиболее
распространенному изотопу. Массы атомов з5С1 = 34,969, 37С1 =
= 36,966.
9 А. А. Мальцев
241
Задача № 14/5
При большом разрешении в колебательно-вращательном ИК-
спектре поглощения молекулы НС1 наблюдается расщепление
линий вращательной структуры (см., например, рис. 1.36) за счет
изотопного состава НСГ (содержание 35С1=75,8°/о, 37С1 = 24,2%).
Рассчитайте величину изотопного сдвига для центра полосы v0 и
первых линий Р- и /?-ветвей. Необходимые молекулярные посто-
янные. имеются в Приложении V. Приведенные в нем данные от-
носятся к наиболее распространенному изотопу. Массы атомов
35С1 =.34,969, 37С1 = 36,966.
6. ИНТЕНСИВНОСТИ СПЕКТРОВ И ЗАСЕЛЕННОСТЬ ЭНЕРГЕТИЧЕСКИХ
СОСТОЯНИЙ ДВУХАТОМНЫХ МОЛЕКУЛ (§ 8, 10)
Задача № 1/6
Рассчитайте распределение молекул F2 и Вгг по первым пяти
колебательным состояниям при температурах 300, 600 и 1500 К,
приняв заселенность основного' состояния за 1. Рассчитайте так-
же суммы по состояниям Qkoa-. Колебательные частоты F2 и Вг2
приведены в Приложении V.
Задача № 2/6
Рассчитайте распределение молекул С12 и 12 по первым пяти
колебательным состояниям при температурах 300, 600 и 1500 К,
приняв заселенность основного состояния за 1. Рассчитайте так-
же суммы по состояниям фкол- Колебательные частоты С12 и 12
приведены в Приложении V.
Задача № 3/6
Определите максимально заселенные вращательные состояния
для молекул С12 и 12 при температурах 10, 300 и 1000 К. Рассчи-
тайте суммы по состояниям QBp- Необходимые молекулярные по-
стоянные возьмите из Приложения V.
Задача № 4/6
Определите максимально заселенные вращательные состояния
для молекул F2 и Вг2 при температурах 10, 300 и 1000 К. Рассчи-
тайте суммы по состояниям QBp- Необходимые молекулярные по-
стоянные возьмите из Приложения V.
242
Задача № 5/6
Определите значение J и NilN^ для максимально заселенного
вращательного состояния молекул Ш и НВг при температурах
300, 1300 и 2000 К. Рассчитайте суммы по состояниям QBp. Необ-
ходимые молекулярные постоянные возьмите из Приложения V.
Задача № 6/6
Определите значение J и Ni/N$ для максимально заселенного
вращательного состояния молекул НС1 и HI при температурах
300, 800 и 1500 К. Рассчитайте суммы по состояниям QBp. Необ-
ходимые молекулярные постоянные возьмите из Приложения V.
Задача № 7/6
Какова относительная интенсивность первых линий (7=1, 3,
5, 7, 9) чисто вращательного спектра поглощения молекулы Н35С1
при комнатной температуре (~300 К) и температуре 1000 К, ес-
ли принять, что интенсивность линий определяется только часто-
той перехода и заселенностью состояний? При каких значениях
J интенсивность линий будет максимальной?
Необходимые молекулярные постоянные имеются в Приложе-
нии V.
Задача № 8/6
Какова относительная интенсивность первых линий (7=1, 3,
5, 7, 9, 11) чисто вращательного спектра поглощения молекулы
12С16О при комнатной температуре ( — 300 К) и температуре
1000 К, если принять, что интенсивность линий определяется толь-
ко частотой перехода и заселенностью состояний? При каких
значениях 7 интенсивность линий будет максимальной?
Необходимые молекулярные постоянные имеются в Приложе-
нии V.
Задача № 9/6
Во сколько раз будет отличаться интенсивность стоксовых ли-
ний по сравнению с антистоксовыми в случае вращательного (2—
0 и 22—20) и колебательного (1—0) КР-спектров молекулы О2
при температуре 300 и 1000 К, если принять, что интенсивность
спектра определяется только заселенностью уровней. Молекуляр-
ные постоянные приведены в Приложении V.
9*
243
Задача № 10/6
Во сколько раз будут отличаться интенсивности стоксовых ли-
ний по сравнению с антистоксовыми в случае вращательного (2—
0 и 22—20) и колебательного (1—0) КР-спектров молекулы N2
при температуре 300 и 1000 К, если принять, что интенсивность
спектра определяется только заселенностью уровней. Молекуляр-
ные постоянные приведены в Приложении V.
7. КОЛЕБАТЕЛЬНЫЕ И ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ
МНОГОАТОМНЫХ МОЛЕКУЛ (§ 17, 18)
Задача 1/7
Молекула ацетилена в основном электронном состоянии имеет
линейное строение Н—С = С—Н, а в возбужденном электронном
состоянии принимает нелинейную т/ямс-конфигурацию
Н
С=с/ .Одинаково ли число основных частот колебаний
HZ
этих двух состояний?
Задача 2/7
В ИК-спектре молекулы CS2 наблюдаются две основные часто-
ты v2 = 399 см-1 и V3=1552 см-1, а в КР-спектре — одна vi —
= 671 см-1. В то же самое время для молекулы H2S в ИК- и К.Р-
спектрах имеется по три частоты vi = 2611, v2=1290 и vg=
= 2684 см-1. На основании этих данных укажите, какова симмет-
рия молекул CS2 и H2S (линейная или угловая).
Задача 3/7
В таблице приведены первые пять линий вращательного длин-
новолнового ИК-спектра поглощения цианистого водорода
(HCN), имеющего линейное строение:
J' -J" V СМ-1 J' - J" v см-1
1—0 2,9564 4 3 11,8250
2—1 5,9128 5-4 14,7808
3—2 8,8690
Определите вращательную постоянную Во (в см-1) и момент
инерции /о (в г*см2-10~40). Достаточно ли этих данных для того,
чтобы определить межъядерное расстояние г (НС) и r(CN)?
244
Задача 4/7
На основании данных микроволнового спектра поглощения
линейной молекулы COS v = 24 325,9; 36488,8; 48 651,6;
60814,1 МГц. Определите вращательную постоянную Во. Доста-
точно ли этих данных для того, чтобы определить межъядерное
расстояние г(СО) и r(CS)?
Задача 5/7
Ряд линий Р-ветви колебательно-вращательной полосы погло-
щения газообразного метана (СН<) имеют волновые числа:
3032,30; 3043,15; 3054,00; 3064,85; 3075,70 см”1. Вычислите вра-
щательную постоянную, считая, что молекула имеет симметрию
правильного тетраэдра.
Задача 6/7
В КР-спектре сероуглеводорода (CS2), возбуждаемом линией
ртути 4358,4 А, наблюдается линия, располагающаяся между ли-
ниями железа с длинами волн 4484,2 и 4494,6 А. Расстояние
между линиями железа равно 0,764 мм, а расстояние между пер-
вой линией железа и линией комбинационного рассеяния состав-
ляет 0,141 мм. Определите частоту колебания (волновое число)
молекулы CS2 и укажите, к какому тину колебания (vi, V2 или
V3) она относится, если молекула CS2 имеет линейное строение.
Задача 7/7
Характер'истическая частота полносимметричного колебания
двойной связи в алкенах составляет около 1620 см-1. При какой
длине волны она будет проявляться в КР-спектре, если в качест-
ве источника возбуждения воспользоваться линией 488,0 нм арго-
нового лазера?
Задача 8/7
В КР-спектре паров над треххлористым галлием GaCh при
960°С, возбуждаемых линией 514,6 нм аргонового лазера, наблю-
даются три линии: 518,0; 524,9 и 527,0 нм, относящиеся к основ-
ным колебаниям плоской симметричной модели молекулы GaCU.
Определите частоты основных колебаний в см"1.
Задача 9/7
Из вращательной структуры ИК-спектров двух изотопных мо-
дификаций молекул H12C14N и H12C15N, имеющих линейное строе-
ние, определены вращательные постоянные Во= 1,4782 см-1 и
245
Во =1,4352 см'1 соответственно. Определите межъядерные рас-
стояния Го (НС) и Го (CN). При изотопозамещении геометриче-
ские параметры молекулы не изменяются, центр тяжести смеща-
ется к 15N на величину A=(15N—14N)c/M, где с — расстояние от
центра тяжести молекулы H12C14N до атома 14N; М — полная
масса молекулы H,2C15N. Определите величину Д из уравнений
моментов относительно центра тяжести.
Задача 10/7
В ИК колебательно-вращательном спектре поглощения СОг
среднее расстояние между линиями составляет около 1,6 см-1.
Учитывая, что в спектре линии вращательной структуры через од-
ну отсутствуют (это вызвано тем, что ядерный спин кислорода
равен нулю, см. Приложение IV), определите вращательную по-
стоянную и расстояние между атомами линейной молекулы СОг.
Задача 11/7
Сколько поступательных, вращательных и колебательных сте-
пеней свободы у линейной молекулы HCN и угловой — НО2 (по-
рядок атомов НОО)? Одинаково ли у них число основных частот
колебаний?
ПРИЛОЖЕНИЯ
I. Некоторые физические константы, единицы и численные множители,
используемые в спектроскопии и физической химии
Число Авогадро (по углеродной шкале) Атомная единица массы (по углеродной шкале) Постоянная Больцмана Постоянная Планка Скорость света в вакууме Универсальная газовая постоянная Мольный объем идеального газа при нор- мальных условиях Вторая радиационная постоянная Силовая постоянная Вращательная постоянная Межъядерное расстояние NA = 6,0220-Ю23 моль~1 а. е. м. = 1,6606-1О-27 кг к~ 1,3807-10'23 Дж-К-1 /i - 6,6262-10-31 Дж-с с-2,9979-108 м-с"1 Я -8,3144 Дж-моль~1-К“1= — 1,9872 кал • моль-1 - К-1 vm -- 22,413 см3/моль-1 hc/k -= 1,4388 см-К ке = 4л2с2цл(о* = 5,8894 -10-2 дин/см, где цл — приведенная масса в угле- родных единицах; ые — колебательная частота, см-1 h Ве^ = е 8л2с/ 2,7993-10-3» - см-1, / где/ — момент инерции, г*см2 / hNA \‘А /16,858\*/* Ге ~ \ 8л2ср,АВе J ~ \ цАВе ) А» гдерд — приведенная масса в угле- родных единицах; Ве — вращательная постоянная см-1
247
II. Переводные множители для единиц энергии
Единица эрг-молекула Дж-моль-1 кал-моль-7 эВ-молекула- см-1
эрг молекула-1 Дж-моль-1 кал-моль-1 эВ-молекула-1 см-1 1 1,6606-1о-1’ 6,9478-10-17 1,6022-10-1* 1,9865-10-1* 6,0220-10» 1 4,184 96485 11,963 1,4393-10» 0,23901 1 23060 2,8591 6,2415-10» 1.0364.10-» 4,3364-10“5 1 1,2399-10-* 5,0340-10» 8,3594-10-» 3,4976-1О-1 8065,6 1
III. Перевод длин волн в воздухе в волновые числа
Во всех справочниках и атласах положение спектральных ли-
ний в области 200—1000 нм (2000—10 000 А) дается в длинах
волн в воздухе ЛВОзД стандартного состава при стандартной тем-
пературе и давлении. Величина А%=%Вак—А,ВОзд= '(п—1)-А,В03д ме-
няется в области 200—1000 нм от 0,06 нм до 0,27 нм (Av — от
16 до 2,7 см-1). Поэтому для определения волновых чисел v =
= 1Авак= 1МХВозд необходимо воспользоваться зависимостью по-
казателя преломления воздуха от длины волны. Она дается фор-
мулой Эдлена:
(п—1) 10е - 272,599 :
1,5358 0,01318
^ак (мкм] (мкм]
Перевод ХВ03д в v осуществляется либо по таблицам, изданным
за рубежом, либо на простейших ЭВМ, например, 15ВСМ-5,
ДЗ-28. Алгоритм программы сводится к тому, что в формулу Эд-
лена вместо %Вак подставляется ХВОзд и в первом приближении
находится (п—1) и!Вак- Затем это промежуточное значение под-
ставляется в формулу Эдлена и во втором приближении опреде-
ляется Хвак и т. д., пока величина АХ не перестанет изменяться.
Обычно достаточно сделать всего несколько итераций.
Для очень грубых расчетов можно воспользоваться сокра-
щенной таблицей в книге Пирса и Гейдена [19] (см. 238).
248
IV. Атомные массы изотонов некоторых химических элементов,
распространенность изотопов и ядерные спины
Атомный номер Элемент Массовое число Распростра- ненность, % Атомная масса Ядерный спнн
1 Н 1 99,985 1,007825 1 - •• 2
D 2 0,015 2,014102 1
3 Li 6 7,5 6,015123 1
7 92,5 7,016004 3Л,
5 В 10 20 10,012938 3
11 80 11,009305 3 ' 1 2
6 С 12 98,89 12,000000 0
13 1,11 13,003355 г/2
7 N 14 99,64 14,003074 1
15 0,36 15,060109 1 ' 2
8 О 16 99,76 15,994915 0
17 0,04 16,999133 5 / / 2
18 0,20 17,999159 0
9 F 19 100 18,998404 х/з
13 А1 27 100 26,981540 6/2
17 С1 35 75,77 34,968853 3/2
37 24,23 36,965903 3/2
35 Вг 79 50,69 78,918332 3/2
81 49,31 80,916292 3/2
53 I 127 100 126,904475 5/2
83 Bi 209 100 208,980401 ’/а
250
V. Основные молекулярные постоянные ряда двухатомных молекул в основном
и некоторых возбужденных электронных состояниях
Молекула или ион Электрон- ное состояние Стат, вес Те> см-1 см 1 ьлехе> см~1 аеУе> см-1 Ве, см-1 а-е, см-1 О ге- А п Dq, ккал/моль
А1О №2 2 0 978 7,2 0,6415 0,0058 1,6176 120
А22 2 20699,2 870,1 4,0 0,6042 0,0045 1,6668
Вг2 Х1^ 1 0 • 323,33 1,08 0,0811 0,00032 2,281 45,43
взп 6 15891,3 167,85 1,73 0,0585 0,0004 2,686
CN Х2Х 2 0 2068,7 13, 1 1,8991 0,0174 1,1719 180,6
В2Х 2 25751,8 2164,1 20,2 1,9701 0,0222 1,1506
СО Х1^ 1 0 2170,12 13,37 0,019 1,9313 0,0175 1,1282 256,?
АХП 2 65075,6 1515,61 17,25 1,6116 0,0223 1,2351
СО+ Х2Х 2 0 2215,10 15,44 0,024 1,9772 0,0190 1,1151 192,9
А2П 4 20733,2 1562,06 13,53 0,013 1,5894 0,0194 1,2437
В22 2 45876,7 1734,18 27,93 0,328 1,7999 0,0302 1,1687
С12 Х1£ 1 0 564,9 4,0 0,2407 0,0017 1,988 57,21
F2 Х1^ 1 0 924 16 - 0,882 0,014 1,418 37,0
Н2 Х1^ 1 0 4396,55 117,97 0,043 60,848 3,0664 0,741 103,27
НВг X4S 1 0 2649,60 45,11 8,469 0,2313 1,414 86,6
НС1 Х1^ 1 0 2989,74 52,05 10,5909 0,3019 1,2747 102,2
DC1 XIX 1 0 2090,78 - 5,445 0,112 1,275 102,2
HF Х1^ 1 0 4139,03 90,44 20,9486 0,7971 0,9168 135,2
HI х1^ 1 0 2309,53 39,73 6,512 0,172 1,609 70,4
Молекула или ион Электрон- ное состояние Стаг. вес 'Г -1 T , см <0?, см 1
1а X’S 1 0 214,519
взп 6 15770,6 125,273
к2 x1! 1 0 92,64
ArS 1 11682,6 69,09
Li 2 X1^ 1 0 351,34
Bin 2 20439,4 270,94
N2 X’2 1 0 2359,43
а Ш 2 69285,6 1693,70
NO X2n 4 0 1916,54
Nclo Xi2 1 0 159,23
ВШ 2 20328,2 123,79
o2 X3S 3 0 1579,78
OH Х2П 4 0 3737,90
p2 XIS 1 0 780,9
А’П 2 34515,3 618,9
s2 X3S 3 0 725,7
so X3S 3 0 1148,2
O1S 1 10510,0 1067,7
Продолжение
, СМ 1 ®еУе, см-1 вг, см 1 ае, см"1 О V А tt Dq, ккал/моль
0,6074 —0,009 0,0374 0,00012 2,667 35,570
0,7016 0,0290 0,00016 3,028
0,35 0,0562 0,002 3,92 12,8
0,15 — -- —
2,55 —0,0097 0,6729 0,00072 2,67 23,66
3,13 —0,0637 0,5577 0,00089 2,93 ——
14,95 0,051 1,9983 0,0171 1,0975 225,0
13,82 — 1,6181 0,0183 1,2196 ——•
14,42 — 1,705 — 1,1508 149,8
0,73 —0,003 0,1547 0,0008 3,08 17,0
0,63 — 0,1259 0,0009 — —
11,699 -0,0072 1,44567 0,01579 1,2075 117,97
84,965 0,5397 18,867 0,708 0,9707 101,3
2,82 —0,005 0,3036 0,0015 1,8931 116,1
2,97 — . 0,2752 0,0017 1,9882 .—
2,85 - 0,2955 0,0016 1,889 100,7
6,1 — 0,7208 0,0057 1,4810 123,6
7,8 _— 0,7026 0,0063 1,5004 —-
VI. Таблица Деландра для кантов полос (в А и см-1) молекулы CN.
В скобках приведены значения (vKaHT — v0), см-1
Х. и" о' 0 1 2 3 4 5 6
0 3883,4 25743,4 (—54,0) 4216,0 23712,5 (-42,7) 4606,2 21703,8 (—35,2)
1 3590,4 23841,1 (-78,9) 3871,4 25823,2 (—56,9) 4197,2 23818,7 (—44,2) 4578,0 21837,5 (-36,3)
2 3585,9 27879,1 (—86,2) 3861,9 25886,7 (—60,2) 4181,0 23911,0 (-46,2) 4553,1 21956,9 (—37,2)
3 3583,9 27994,6 (—95,4) 3854,7 25935,0 (-64,2) 4167,8 23986,7 (-48,2) 4531,9 22059,6 (-38,4)
4 3851,0 25959,9 ( -69.0) 4158,1 24042,7 ( -50.5) 4514,8 22143,2 (—39,7)
5 4152,4 24075,7 (-53,3)
VII. Таблица Деландра для кантов полос (в А и см-1) молекулы AIO
vn v' 0 1 2 3 4 5 6
0 4842,3 20645,6 5079,4 19681,9 5337,0 18731,9
1 4648,2 21507,7 4866,4 20543,4 5102,1 19594,3 5357,7 18659,6
2 4470,5 22362,6 4672,0 21398,1 5123,3 19513,2 5376,8 18593,3 5651,6 17689,2
3 4494,0 22545,7 4694,6 21295,1 5142,9 19438,9 5394,1 18533,6 5666,2 17643,63
4 4330,5 23085,6 *4516,4 22135,3 4715,5 21200,8 5161,0 19370,7 5409.5 18480,9
5 4352,6 22968,3 4537,6 22031.9 4735,8 21109,9 5177,3 19309,7
6 4373,7 22857,5 4557,6 21935,2
VIII. Спектр излучения ртутной лампы
3650,1
606-6,6
1^1
6358,6
IX. Наиболее интенсивные линии атомного спектра ртути
о л, А V, см-1 Интенсивность А Z, см-1 Интенсивность
3650,1 27 388 100 5025,6 19 892 2
3654,8 27 353 500 5045,8 19813 2
3662,8 27 293 40 5102,4 19 593 1
3906,4 25 592 20 5121,6 19 520 3
3984,0 25 093 10 5316,7 18 804 3
4046,6 24 705 100 J 5354.0 18 672 4
4077,8 24516 30 5365,1 18 633 3
4108,1 24 335 5 I 5384,7 18 566 2
4339,1 23 039 з : .5405,8 18 494 2
4347,5 22 995 12 1 5460,7 18 307 100
4358,4 22 938 юо ! 5549,8 18014 2
4890,3 20 443 2 1 5675,9 17614 4
4916,0 20 336 5769,6 17 328 40
4960,3 20 154 s 5790,7 17 264 20
254
X. ИК-спектр поглощения пленки полистирола толщиной 20 мкм,
используемый для градуировки ИК-спектрофотометров с призмой
из NaCl в области 650 — 4000 см-1
Волновые числа полос поглощения (в см-1) пленки полистирола,
используемые для градуировки ИК-спектрофотометров с призмой из NaCl
№ полосы Волновое число № полосы Волновое число
1 3027,1 ±0,3 8 1583,1 ±0,3
2 2924 ±2 9 1181,4 ±0,3
3 2850,7 ±0,3 10 1154,3 ±0,3
4 1944,0 ±1,0 11 1069,1 ±0,3
5 1871,0 ±0,3 12 1028,0 ±0,3
6 1801,6 ±0,3 13 906,7 ±0,3
7 1601,4 ±0,3 14 698,9 ±0,3
255
XI. ИК-спектр поглощения пленки полистирола толщиной 20 мкм,
используемый для градуировки ИК-спектрофотометров с призмой
- из LiF в области 1800—3100 см"1
Волновые числа полос поглощения (в см"1) пленки полистирола,
используемые для градуировки ИК-спектрофотометров с призмой из LiF
№ полосы Волновое число № полосы Ba i новое число
1 3082 5 2924
2 3060 6 2851
3 3027 7 1944
4 3002 8 1871
256
XII. ИК°спектры поглощения растворителей
3600 2800 2000 1600 1200 1000 800 см'1
4000 3200 2400 , 1800 1400 . 1100 . 900 . 700 650
1 1 1 ~ |~Г '1~ ~ Г 1 111111'1 Г-1-Г—Г-Т-1 I I ГТ 1 г
1 МА М//////////////////А YA V/7/A 1
Ацетон 0,1мм
1 VA В 1Ж1 УЛ 1
Ацетонитрил 0,1мм
Г' _JE2
Бромоформ 0,2ММ
и мл z
сероуглерод 0,1мм
1 Х/////А 1
четыремлористый углерод 0,1мм
1 И И
хлороформ 0,1мм
IT" " 1 1 "УХ Р/ЖЖа1 1
дионсан 0,1 Мм
f и , _ и и»л И И ' " У^А
Дихлорэтан ' о,1мм
1 V/AWA и ' WA
нитрометан 0,1мм
Вода
0,01мм
ХШ. Спектр поглощения вазелинового масла
720
XIV. Характеристические частоты функциональных групп
органических соединений в ИК-области спектра
(C=N)~(C=N=O), (C=N=S) I
С =N изонитрилы и аром, нитрилы
№С=0, N=N=N, N=C=N
C=n алифат. нитрилы
С=С
si-h
р-н
S-н
NГ-н
N - н связ. вод. связями
N - н, nh2 свободные
О - н связ. вад. связями
0-н свободные
С-н
С-Н2иС-Н3 группы I ।
N - CHj в разл. кислород, соедин. Bi I
С = С-н,л - замещен, и иинл. соедин.
С = С-н I |1_И-----
3000
4000
С-Н валентные нолейан и я
0-Н валентные нолебания
Валентные нолебания водорода
связанного с гетероатомами
Валентные нолебания нратнык связей
20
00 см'1
N - о бал.
С=С алленовые
2000
С-F вал.
5=0 дал.
С=8 дал.
С-вгвал.
Si-арил
__, Р-0-арил Р-0-алкил
Р-алкил
Si-арил
_______________м Si-алкил
ы-0 вал.
n-h deep, внеппоскостные
шшшшшяш С-и валалкиламцнов
с=ы вал, виикл.,сопряженные с-ы вал нитрп^^я^л->>р1тп
N - н deep, плоскостные
С-Н вап.ариламан.шшш
о-н deep, плоек.
С=о вал
С-0 вал.
вал. нол. силиконового
скелета
Si-алкил
б-н deep. внеплоск.
С-С разные .шшбшшял
ос аром, а сопряженные
С=С алиерат. j______________
с-н аром, деер.плоск.
С-н аром, веер (обертоны') | с-н аром. деф. внеплоск.
с-нг маятн. внеплоск. деф.^шшш
с-нг ножничные деф. плоек.
1800 1600 1400
С-н деформационные колебания
Скелетные колебания
С-С и С=С связей
Колебания, связанные
с атомом кислорода
1200 1000 800 650 см
Колебания,связанные с атомом азота
Колебания, связанные с атомами _____________ .
кремния и сросерора
Колебания, связанные с атомами ____________.____
серы и галогенов
XV. Таблицы КР-спектров некоторых органических соединений
(приведены наиболее интенсивные линии)
1. Четыреххлористый 2. Хлороформ СНС13
углерод СС14 ------------------------
Av, см 1 Интенсивность Av. см 1 Интенсивность
— 261 270
220 244 366 230
307 280 669 230
460 277 769 125
756 150 1215 85
792 150 3019 100
3. Дихлорэ тан СоН^С! 2 4. н-гексан С6Нц
Av, см-1 Интенсивность Av, см-1 Интенсивность
124 5 371 10
301 10 871 10
410 5 893 15
653 12 901 15
676 5 1040 10
753 15 1082 10
943 1305 15
1207 5 1440 33
1302 6 1460 33
1428 5 2852 170
1442 5 2863 170
2956 10 2877 250
3002 6 2901 200
2916 200
2940 180
2966 ПО
5. Циклогексан CeHi2 6. Бензол СвН*
Av, см 1 Интенсивность Av, см 1 Интенсивность
427 12 607 130
802 250 850 34
1029 105 992 1200
1158 25 1178 120
1267 90 1586 85
1348 13 1606 50
1445 85 2951 45
2665 15 3047 260
2852 560 3062 630
2886 140
2895 180
2924 500
2941 480
260
7. Толуол C,HgCH3
Av, см 1 Интенсивность Av, см-1 Интенсивность
217 130 1380 45
346 15 1586 44
521 96 1605 90
623 90 2870 55
729 22 2920 140
786 250 2981 42
1004 500 3002 30
1031 120 3032 100
1156 40 3054 330
1181 22 3067 150
1211 110
XVI. Конструкция изотермической камеры-кюветы
Для спектрального изучения различных термодинамических
характеристик веществ, связанных с газовой фазой (теплоты ис-
парения и сублимации, теплоты реакции), а также изучения
строения молекул в паре и при качественном и количественном
анализе состава продуктов газовых реакций при повышенных
температурах (до •--•500°С) удобно использовать изотермическую
камеру-кювету, приведенную на рисунке.
Изотермическая камера-кювета состоит нз прямоугольного
корпуса / с двумя окнами из кварца (они на рисунке не видны),
крышки 2 с двумя кварцевыми окнами 3, бокового отростка 4
и шаровой тонкостенной кварцевой кюветы 5 с отростком 6.
Для охлаждения корпуса / между его двойными стенками
пропускается вода (вход 7, выход. 8). Изнутри камера выложе-
на асбоцементными пластинами 9. Нагревается камера нихромо-
вой проволокой 10 диаметром 0,5 мм, проходящей вдоль стенок
и закрепленной на изоляционных траверсах 11. Концы нагрева-
262
теля подводятся к токовводам 12. Ток через нагреватель состав-
ляет 2—3 А при напряжении 30—50 В.
Изотермические условия внутри камеры создаются за счет
вентилятора 13, перемешивающего воздух и релейной схемы, вы-
ключающей напряжение питания, когда температура достигнет
заданной и вновь включающей его при переостывании. В качестве
датчика для релейной схемы стабилизатора могут использоваться
либо контактный термометр, вводимый через отверстие 14, либо
термопара 15. Они же служат для измерения температуры газа
в кювете. Для установки изотермической камеры в кюветное от-
деление имеются направляющие пластинки 16, которые входят в
кюветодержатели канала образца и канала сравнения. В центре
пластин сделаны отверстия для прохождения светового потока
от выходного окна.
Окна из кварца вставляются в углубления в асбоцементных
пластинах и плотно прижимаются к охлаждаемой внутренней
стенке корпуса. Размер выходного отверстия (окна), плохо вид-
ного на рис. 11.27, равен 15X30. Толщина окон около 3 мм. Они
хорошо пропускают излучение до 2300 см-1. При возможности
выбора сорта кварца следует отдать предпочтение «ИК».
Боковая крышка корпуса 2 крепится на винтах и с внутренней
стороны закрыта асбоцементной пластинкой с отверстиями для
окон. При работе с низкими температурами порядка 100—200° С
водой не охлаждается, а при более высоких на нее необходимо
напаять змеевик из медной трубки, через который пропускается
вода.
Исследуемое вещество запаивается под вакуумом в тонкостен-
ный шарик-кювету 5 диаметром 60—70 мм из оптического квар-
ца. Давление пара в шарике задается температурой Tj отрост-
ка 6 диаметром около 10 мм и длиной 100—120 мм. При установ-
ке шарика-кюветы в изотермическую камеру следует обращать
внимание на то, чтобы вещество находилось только в отростке.
Отросток шаровой кюветы вставляется в кварцевую трубку
17, на которую намотан нагреватель 18 с увеличенным числом
витков ближе к шарику, чтобы поле температур не имело «глу-
бокого провала», где может произойти конденсация вещества.
Между кожухом 4 бокового отростка корпуса, охлаждаемого
змеевиком 19 с водой, и нагревателем 18 набивается асбест 20.
Для выравнивания поля температур в зоне вещества можно на
конец отростка 6 надеть металлический наконечник. Температу-
ра отростка измеряется термопарой 21, которая одновременно
служит и датчиком для релейной стабилизации температуры.
Выводы нагревателя 18 подсоединяются к паре токовводов, рас-
положенных симметрично токовводам 12. При относительно низ-
ких температурах для стабилизации температуры испаряемого
вещества удобно пользоваться термостатом. Тогда перемычка в
системе охлаждения корпуса камеры п отростка размыкается и
термостатирующая жидкость пропускается через змеевик 19.
263
При этом для уменьшения инерционности системы нагреватель
и изолирующий асбест необходимо убрать и на их место вста-
вить металлический блок.
В качестве кюветы сравнения используется второй шарик 21
с коротким отростком, служащим держателем. Размеры и конст-
рукция изотермической камеры-кюветы приведены для спектро-
фотометра ИКС-14. Для других отечественных ИК-спектрофото-
метров изменения будут незначительными. Например, для ИКС-
22 отросток корпуса должен располагаться с другой стороны,
так как канал образца находится ближе к исследователю.
Для изучения газов, например, равновесия N2O4^2NO2, когда
отсутствует конденсированная фаза, отросток нагревателя мож-
но исключить, и вся конструкция существенно упрощается.
XVII. Таблица Деландра для молекулы I,
и* о" 0 1 2 _ 3
X нм V см-1 X нм V СМ1 X нм ' V см”1 X нм v ем”1
6 632,5 15806
7 627,9 921
8 623,5 16033
9 619,2 145
10 607,1 16 467 615,1 280
11 595,6 16785 603,2 573 611,0 362
12 591,9 891 599,4 680 607,0 469
13 588,2 995 595,7 783 603,2 573
14 584,7 17099 592,0 886
15 581,3 199 588,5 987
16 577,9 298 585,1 17086
17 567,8 17 607 574,7 395 581,8 183
18 564,7 703 572,6 490 578,7 275
19 561,7 797 568,5 584 575,3 377
20 558,9 888 565,6 675
21 556,1 977 562,8 761
22 553,4 18 065 560,0 852
23 550,8 150 557,3 937
24 548,3 234 554,8 18021
25 545,8 316 552,3 102
26 543,5 395 549,8 183
27 541,2 473 547,5 261
28 539,0 548 545,2 335
29 ' 536,9 621
30 534,8 693
31 532,8 762
32 530,9 829
33 529,1 894
34 527,4 956
35 525,6 19 019
36 524,1 076
XVIII. Ответы к контрольным вопросам
К разделу I
Серия 1 (§ 2, 5, 8, 9)
1 — 3:3, 3, 4, 16—19 : 2, 1, 4, 3
4 — 7:3, 4, 2, 3 20 — 23:4, 1, 3, 4
8— 11 : 3, 1, 4, 3 24 — 26 : 1, 3, 4
12—15 : 1, 2, 3, 1
Серия 2 (§ 10—13)
1 — 4 : 1, 4, 3, 2 21 —25 : 3, 2, 2, 4, 1
5— 8:3, 1, 2, 4 26 — 29 : 2, 1, 4, 2
9—11 : 2, 2, 3, 30—31 : 3, 3
12— 15 : 2, 1, 3, 1 32 — 36 : 3, 1, 2 , 4 , 3
16 —20 : 4, 2, 1, 3, 2
265
Серия 3 (§ 7, 14, 15)
1 — 4 : 1, 3, 3, 2 13 — 17 : 1, 4, 3, 3, 2
5— 8:2, 3, 1, 4 18 — 21 : 4, 4, 2, 4,
9—12 : 1, 1, 2, 3
Серия 4 (§ 16—20)
1 — 4 : 1, 4, 1, 3 14 — 17 : 3, 2. 1, 4
5— 9:1, 4, 2, 3, 3 18 — 22 : 3, 3, '1, 3, 3
10— 13:4, 2, 4, 1 23 —26 : 2, 1, 2, 4
К раздел у II
Серия 1 (§ 1—3)
1 — 4 : 1, 4, 1, 3 17 — 20 : 3, 3, 4, 3
5— 8 : 1, 4, 2, 3 21 — 24 : 3, 1, 3, 1
9—12:4, 2, 4, 1 25-^ 28:4, 4, 1, 4
13— 16 : 3, 2, 1, 4
Серия 2 (§ 4—20)
1 — 4 : 2, 3, 1,4
5—8:2, 1, 2, 4
9— 12 : 4, 3, 2, I
13 — 16 : 3, 1, 4, 2
17—20 : 2, 4, 1, 3
21 — 24 : 3, 4, 2, 1
XIX. Программа коллоквиума по молекулярной спектроскопии
1. Спектры и строение молекул
Система энергетических состояний атома. Система электрон-
ных, колебательных и вращательных энергетических состояний
двухатомных дюлекул. Распределение молекул по энергетическим
состояниям и зависимость его от температуры. Принципы расче-
та термодинамических функций методами статистической термо-
динамики.
Возникновение спектров при изменении энергетического со-
стояния молекулы. Единицы измерения в спектроскопии. Области
спектра (шкала магнитных колебаний), которые соответствуют
изменениям различных энергетических состояний молекулы. Пра-
вила отбора для переходов между энергетическими состояниями.
Вращательные, колебательные и электронные спектры поглоще-
ния и испускания. Спектры резонансной флюоресценции и комби-
национного рассеяния.
Вращательная энергия двухатомной молекулы. Микроволно-
вые спектры и вращательные спектры -комбинационного рассея-
ния. Определение межъядерных расстояний из вращательных
спектров. Соотношение между главными моментами инерции в
многоатомных молекулах.
Колебательная’ энергия двухатомных молекул. Зависимость
потенциальной энергии двухатомной молекулы от межъядерного
расстояния. Функция Морзе. Энергия диссоциации.
266
Колебательно-вращательные спектры (инфракрасные и ком-
бинационного рассеяния) двухатомных молекул. Определение
частот колебаний и межъядерных расстояний. Колебательные
спектры многоатомных молекул в конденсированной фазе. Кри-
терий проявления различных форм колебаний (активность коле-
баний) в ИК- и КР-спектрах на примере молекул СО2 и Н2О. За-
висимость интенсивности линий в ИК- и КР-спектрах от темпе-
ратуры. Инфракрасная спектроскопия и структурно-групповой
(функциональный) анализ.
Электронная энергия двухатомных молекул. Электронные
(полосатые) спектры двухатомных молекул. Колебательная и
вращательная структура электронных спектров. Таблица Деланд-
ра. Определение частот колебаний. Спектральные методы опреде-
ления энергии диссоциации двухатомных молекул. Принцип
Франка — Кондона на примере двухатомных молекул.
Изотопические эффекты в молекулярных спектрах на приме-
ре двухатомных молекул.
Электронные спектры поглощения многоатомных молекул.
Закон светопоглощения Бугера — Ламберта — Бера и усло-
вия его выполнимости. Пропускание, оптическая плотность, ко-
эффициент поглощения. Количественная спектроскопия.
Применение спектроскопии в химии (изучение строения моле-
кул, качественный и количественный анализ по колебательным
и электронным спектрам, термодинамика, кинетика и т. д.).
2. Техника и методы молекулярной спектроскопии
Принципиальная схема спектральных приборов. Дисперсия,
разрешающая способность, светосила. Классификация спектраль-
ных приборов.
Устройство спектрографа ИСП-51 и его оптическая схема.
Различные источники света. Методика измерения длин волн
на фотопластинках. Спектропроекторы ПС-18 и СПП-2. Измери-
тельный микроскоп МИР-12. Фотографические материалы и их
обработка.
Методика съемки спектров комбинационного рассеяния с по-
мощью ртутной лампы и лазера. Устройство осветителя. Кюветы.
Светофильтры.
Техника инфракрасной спектроскопии. Источники и приемни-
ки инфракрасного излучения. Принципиальная оптическая схема
и устройство ИК-спектрофотометров. Градуировка приборов по
эталонным спектрам.
Измерение электронных спектров поглощения. Устройство и
оптическая схема спектрофотометров для ультрафиолетовой, ви-
димой и близкой ИК-области.
Источники непрерывного спектра и приемники для ультрафио-
летовой и видимой области спектра.
267
ЛИТЕРАТУРА
1. Наканиси К. Инфракрасные спектры и строение органических соеди-
нений. М., «Мир», 1965.
2. Бранд Д„ Э г ли нт он Г. Применение спектроскопии в органической
химии. М., «Мир», 1967.
3. Дайер Д. Р. Приложения абсорбционной спектроскопии органических
соединений. М., «Химия», 1970.
4. Казицина Л .А., Куплетская Н. Б. Применение УФ-, ИК-, ЯМР-
и масс-спектроскопии в органической химии. М., Изд-во Моск, ун-та, 1979.
5. Иоффе Б. В., Костиков Р. Р„ Разин В. В. Физические методы
определения строения органических молекул. М., Изд-во Ленингр. ун-та, 1976.
6. Сильверстейн Р., Басслер Г., Моррил Т. Спектрометрическая
идентификация органических соединений. М„ «Мир», 1977.
7. Татевский В. М. Строение молекул. М., «Химия», 1977.
8. Ельяшенич М. А. Атомная и молекулярная спектроскопия. М.,
ГИФ-МЛ, 1962, гл. 1—5, 17—27.
9. Герцберг Г. Спектры и строение простых свободных радикалов. М.,
«Мир», 1974.
10. Бейзер А. Основные представления современной физики. М., «Атом-
издат», 1973, гл. 3—15.
11. Еремин Е. Н. Основы химической термодинамики. М., «Высшая шко-
ла», 1974, гл. VI.
12. Гурвич Л. В. и др. Термодинамические свойства индивидуальных
веществ. М., «Наука», 1978.
13. Годнее И. Н. Вычисление термодинамических функций по молеку-
лярным данным. М., Гостехиздат, 1956.
14. Лебедева В. В. Техника оптической спектроскопии. М., Изд-во
Моск, ун-та, 1977.
15. Зайдель А. Н., Островская Г. В., Островский Ю. И. Тех-
ника и практика спектроскопии. М., «Наука», 1976.
16. Кросс А. Введение в практическую инфракрасную спектроскопию.
М., ИЛ, 1961.
17. Кесслер И. Методы инфракрасной спектроскопии в химическом ана-
лизе. М., «Мир», 1964.
18. Пешкова В. М., Громова М. И. Методы абсорбционной спектро-
скопии в аналитической химии. М., «Высшая школа», 1976.
19. П и р с Р., Г е й д о н А. Отождествление молекулярных спектров. М.,
ИЛ, 1949, с. 238.
20. Зайдель А. Н. Ошибки измерений физических величин. Л., «Наука»,
1974.
21. Деденко Л. Г., Керженцев В. В. Математическая обработка и
оформление результатов эксперимента. М., Изд-во Моск, ун-та, 1977.
22. Краткий справочник физико-химических величин. М.—Л., «Химия»,
1965.
23. Rosen В. Spectroscopic data relative to diatomic molecules. Pergamon
Press, 1970.
268
содержание
Предисловие............................................................................................................. 5
Раздел I. Введение в теорию молекулярных спектров
§ 1. Спектроскопия, ее классификация и применение .... 7
§ 2. Единицы измерения и некоторые обозначения, принятые в
спектроскопии ................................................................................................ Ц
§ 3. Некоторые основные понятия и постулаты квантовой меха-
ники ............................................................13-
§ 4. Одноэлектронные и многоэлектропиые атомы и ионы. Систе-
ма энергетических состояний атома и атомные спектры . . 20
§ 5. Молекула. Энергетические состояния двухатомной молекулы.
Их разделение на электронные, колебательные и вращатель-
ные составляющие.................................................24-
§ 6. Зависимость потенциальной энергии двухатомной молекулы
от межъядерного расстояния........................................29
§ 7. Ширина энергетических уровней и время нахождения моле-
кул в возбужденных состояниях. Влияние электрических и
магнитных полей на энергетические состояния молекул. Вы-
рождение уровней..................................................33
§ 8. Статистическое распределение молекул по энергетическим со-
стояниям. Расчет термодинамических функций через суммы
по состояниям....................................................35-
§ 9. Возможные типы переходов молекул из одних энергетических
состояний в другие. Взаимодействие излучения с веществом.
Спектральные линии. Образование спектров молекул и их
классификация.....................................................41
§ 10. Правила отбора. Вероятности переходов. Интенсивности
спектральных линий............................................................................................51
§ 11. Вращательные спектры двухатомных молекул..................................................................57
§ 12. Колебательно-вращательные спектры двухатомных молекул . 62
§ 13. Электронно-колебательно-вращательные (полосатые) спектры
двухатомных молекул. Принцип Франка'—Кондона ... 70
§14. Изотопический эффект в спектрах двухатомных молекул . . 81
§ 15. Энергия диссоциации двухатомных молекул........................................................................84
§ 16. Энергетические состояния многоатомных молекул .... 86
§ 17. Вращательные и колебательные спектры многоатомных мо-
лекул ........................ . . . .......................89
§ 18. Электронные спектры поглощения многоатомных молекул . 94
§ 19. Характеристичность частот колебаний и электронных пере-
ходов ......................... ......................................
§ 20. Законы светопоглощения и количественный анализ по спек-
трам поглощения....................................................97
Контрольные вопросы к разделу I.......................................................................................99
Серия 1 (§ 2, 5, 8, ............................................................................................»
Серия 2 (§ 10—13) ... 104
Серия 3 (§ 7, 14, 15)..........................................................................................ПО
Серия 4 (§ 16—20) . . . .......................115
269
Раздел II. Введение в технику и методы молекулярной спектроскопии
•§ 1. Принципиальная оптическая схема спектральных приборов
§ 2. Основные характеристики спектральных приборов .
§ 3. Классификация спектральных приборов и их применение
химии .......................................................
§ 4. Фотографическая регистрация спектров испускания и погло
щения. Спектрограф ИСП-51....................................
§ 5. Источники света........................................
§ 6. Освещение щели спектрографа............................
§ 7. Фотографические материалы и их обработка ....
§ 8. Расшифровка и измерение спектрограмм...................
§ 9. Методика фотографирования и измерения спектров комбина
ционного рассеяния, возбуждаемых ртутной лампой .
§ 10. Методика возбуждения спектров комбинационного рассеяния
и флуоресценции с помощью лазеров............................
§ 11. Фотоэлектрическая регистрация спектров поглощения. Спек
трофотометры СФ-16 и СФ-4А...................................
§ 12. Порядок работы на спектрофотометре СФ-16 ....
§ 13. Автоматический спектрофотометр СФ-14 для видимой обла
сти спектра .................................................
§ 14. Порядок работы на спектрофотометре СФ-14 ....
§ 15. Основы техники ИК-спектроскопии........................
§ 16. Инфракрасный спектрофотометр И КС-14...................
§ 17. Порядок работы на спектрофотометре ИКС-14
§ 18. Инфракрасный спектрофотометр ИКС-22....................
§ 19. Порядок работы на спектрофотометре ИКС-22
§ 20. Кюветы, методика приготовления образцов и съемка
ИК-спектров газообразных, жидких и твердых образцов
Контрольные вопросы к разделу II.................................
Серия 1 (§ 1—3)...............................................
Серия 2 (§ 4—20)..............................................
121
123
128
130
133
136
136
138
144
146
148
152
154
156
157
159
164
166
167
170
174
174
179
Раздел III. Практические работы
Работа № 1. ИК-спектры поглощения двухатомных молекул. Опре-
деление межъядерных расстояний, частот колебаний и термо-
динамических функций.............................................184
Работа № 2. Полосатые спектры испускания двухатомных молекул.
' Определение частот колебаний, энергии электронного воз-
буждения и термодинамических функций..............................191
Работа № 3. Электронный спектр поглощения галогенов. Определе-
ние энергии диссоциации и других молекулярных постоянных 196
Работа № 4. Идентификация органических соединений по их инфра-
красным спектрам поглощения.......................................201
Работа № 5. Спектры комбинационного рассеяния, возбуждаемые
ртутной лампой. Идентификация органических соединений . 203
Работа № 6. Изучение теплового эффекта реакции N2O4^2NO2 по
ИК-спектрам поглощения............................................206
Работа № 7. Определение энергии водородной связи (теплоты ассо-
циации) паров уксусной кислоты по ИК-спектрам поглоще-
ния ............................................................. 213
Раздел IV. Расчетные задачи
1. Вращательные спектры двухатомных молекул (§11) . . 219
2. Колебательные спектры двухатомных молекул (§ 5, 12) . 226
3. Колебательно-вращательные спектры двухатомных молекул
(§12).................................................... 228
4. Электронно-колебательно-вращательные спектры двухатомных
молекул (§13).............................................233
270
5. Потенциальные кривые, энергии диссоциации и изотопические
эффекты в спектрах двухатомных молекул (§6, 14, 15) . 23ft
6. Интенсивности спектров и заселенность энергетических * со-
стояний двухатомных молекул (§ 8, 10) . . . . * 242
7. Колебательные и вращательные спектры многоатомных * мо"
лекул (§ 17, 18)........................................' 244-
Приложения
I. Некоторые физические константы, единицы и численные мно-
жители, используемые в спектроскопии и физической химйи 247
II. Переводные множители для единиц энергии .... 248
III. Перевод длин волн в воздухе в волновые числа . 24ft
IV. Атомные массы изотопов некоторых химических элементов'
распространенность иазотопов и ядерные спины ... * 249-
V. Основные молекулярные постоянные ряда двухатомных мо-
лекул в основном и некоторых возбужденных электронных
состояниях................................................. 250
VI. Таблица Деландра для кантов полос (в А и см~!) молеку-
лы CN ............................................252
VII. Таблица Деландра для кантов полос (в А и см1) молеку-
лы А1О.................................................. 25$
VIII. Спектр излучения ртутной лампы............................254
IX. Наиболее интенсивные линии атомного спектра ртути . . 254
X. ИК-спектр поглощения пленки полистирола толщиной
20 мкм, используемый для градуировки ИК-спектрофотоме-
тров с призмой из NaCl в области 650—4000 см-1 . . . 255
XI. ИК-спектры поглощения пленки полистирола толщиной
20 мкм, используемый для градуировки ИК-спектрофотомет-
ров с призмой из LiF в области .1800—3100 см-1 .... 256
XII. ИК-спектры поглощения растворителей.......................257
ХШ. Спектр поглощения вазелинового масла........................257
XIV. Характеристические частоты функциональных групп органи-
ческих соединений в ИК-области спектра................. 25ft
XV. Таблицы КР-спектров некоторых органических соединений 260
XVI. Конструкция изотермической камеры-кюветы...................261
XVII. Таблица Деландра для молекулы1 h...........................264
XVIII. Ответы к контрольным вопроса-м.......................... 264
XIX. Программа коллоквиума по молекулярной спектроскопии . 265
1. Спектры и строение молекул.............................265
2. Техника и методы молекулярной спектроскопии . . . 266
Литература . ......................... . . . 26&