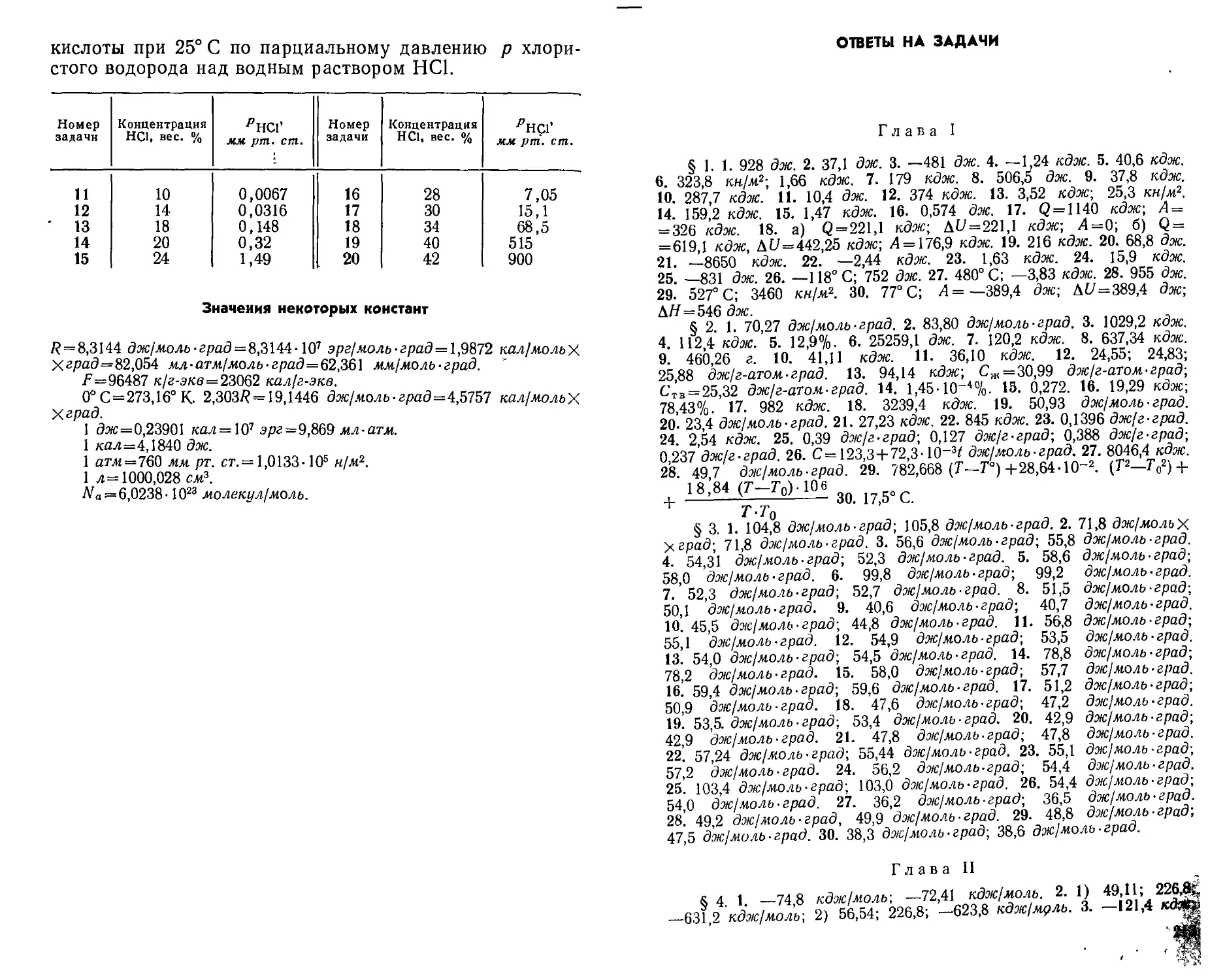
Author: Стромберг А.Г. Картушинская А.И. Лельчук Х.А.
Tags: термодинамика энергетика химия химическая термодинамика
Year: 1973
Text
А И. КАРТУШИНСКАЯ, Х.А ЛЕЛЬЧУК. А.Г. СТРОМБЕРГ
СБОРНИК ЗАДАЧ
ПО ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКЕ
А. И. КАРТУШИНСКАЯ, X. А. ЛЕЛЬЧУК, А. Г. СТРОМБЕРГ
СБОРНИК ЗАДАЧ
ПО ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКЕ
Под редакцией проф. А. Г. Стромберга
Допущено
Министерством высшего
и среднего специального
Образования СССР
в качестве учебного пособия
для студентов химических
и химико-технологических
специальностей вузов
ИЗДАТЕЛЬСТВО «ВЫСШАЯ ШКОЛА» МОСКВА 1973
541
К27
УДК 536.7:54(0.75)
Картушинская А. И. и др.
К27 Сборник задач по химической термодинамике. Под
ред. А. Г. Стромберга. Учеб, пособие для химико-техно-
логических вузов. М., «Высш, школа», 1973.
224 с илл.
Перед заглавием авт/. Картушинская А. И., Лель-
чук X. А., Стромберг А. Г.
В сборнике содержится около 900 задач, которые от-
ражают основные разделы химической термодинамики
Рассматриваются два метода приближенного вычисления
тепловых эффектов, расчеты термодинамических функ-
ций и химического равновесия, закономерности фазового
равновесия в одно- и двухкомпанентных системах и
термодинамика растворов. Каждому разделу предпосла-
но краткое теоретическое введение, которое содержит
математическое обоснование изучаемого вопроса, приво-
дятся примеры решений задач, величины в которых вы-
ражены в системе СИ.
0254
Рецензенты: докт. хим. наук Т. Н. Резухина (МГУ) и
кафедра физической химии МХТИ им. Мен-
делеева (зав. кафедрой проф. С. В. Гор-
бачев)
0251—212
К -----------65-73
001(01)—73
ПРЕДИСЛОВИЕ
В курсе физической химии для студентов химико-тех-
нологических вузов и химико-технологических факуль-
тетов политехнических вузов и особенно в разделе курса
химическая термодинамика большое значение имеет вы-
полнение расчетных задач.
Данное пособие более десяти лет использовалось на
кафедре физической и коллоидной химии Томского поли-
технического института для самостоятельной работы сту-
дентов химико-технологического факультета (и некото-
рых других факультетов и специальностей). Многолетний
опыт преподавания курса физической химии убедил нас
в том, что без индивидуальных расчетных упражнений по
химической термодинамике невозможно научить студен-,
тов творчески применять полученные знания для решения
конкретных вопросов.
Каждому параграфу предпослано теоретическое ’вве-
дение, в котором кратко обоснованы основные понятия и
количественные закономерности, по которым приводятся
задачи. В сборнике использованы единицы измерения
международной системы СИ.
Выражаем благодарность преподавателям кафедры
доц. К. 1Р. Вороновой и доц. В. С. Смородинову, участво-
вавшим в составлении отдельных задач, а также препо-
давателям кафедры физической и коллоидной химии.
Авторы приносят искреннюю благодарность доц. МГУ,
докт. хим. наук Т. Н. Резухиной, проф. МХТИ, докт. хим.
наук С. В. Горбачеву и доц. МХТИ, канд. хим. наук
Е. В. Киселевой за внимательный просмотр сборника за-
дач и ценные замечания.
Авторы сознают, что данное пособие не свободно от
недостатков и будут благодарны всем лицам и коллекти-
вам, приславшим свои замечания.
СПИСОК ВАЖНЕЙШИХ ОБОЗНАЧЕНИЙ
U — внутренняя энергия, дж, кдж.
Q — теплота, дж, кдж.
И — энтальпия, дж, кдж.
G — изобарный потенциал, дж, кдж.
F — изохорный потенциал, дж, кдж.
S—энтропия, дж/моль-град.
С, Ср, Cv, С, Си —теплоемкость, дж/моль-град.
. Ср
G v
с — удельная теплоемкость, дж/г-град.
R —универсальная газовая постоянная,
равная 8,314 дж/моль-град.
Т — абсолютная температура, °К.
t — температура, °C.
р — плотность, г/мл, кг/м3.
К — константа равновесия; коэффициент
распределения.
М — молекулярный вес, г, кг.
пг — число молей i-го компонента.
Nt — мольная доля i-ro компонента.
Р — давление, н/м2.
V — объем, мл, м3.
0 — характеристическая температура, °К.
е — энергия разрыва связи, кдж/моль.
л — осмотическое давление, н/м2.
п — приведенное давление.
т — приведенная температура.
f — летучесть, н/м2.
рг — парциальное давление i-ro компонен-
та, н/м2.
Д — конечное приращение свойства (раз-
ница свойства между конечным и на-
чальным состоянием).
Pi, Pi—парциальные давления пара компо-
нентов раствора, где индекс 1 отно-
сится к растворителю, а индекс 2 — к
растворенному веществу, н/м2,
мм рт. ст.
[Pi, Р°2—давление насыщенного пара соответ-
ствующего компонента в' чистом со-
стоянии, н/м2, мм рт. ст.
П\', tii — число молей компонентов в паре.
IV/, Nz — мольная доля компонентов в паре.
gi, gi —весовые количества компонентов,
/(зам — криоскопическая постоянная.
Ккип — эбулиоскопическая постоянная.
а — активность.
•у — коэффициент активности.
Н{ — парциальная мольная энтальпия «-го
__ компонента, дж/моль, кдж/моль.
St — парциальная мольная энтропия i-ro
компонента, дж/моль • град.
Vi — парциальный мольный объем i-ro ком-
_ понента, мл/моль, м^/моль.
G, — парциальный мольный изобарный по-
тенциал i-ro компонента;
кдж/моль.
ц, — химический потенциал i-ro компонен-
та, кдж/моль.
т, м — моляльная концентрация, моль/1000 г
растворителя.
С, М — молярная концентрация, моль/л.
g — весовой процент.
— нормальная концентрация, г-экв/л.
Э—грамм-эквивалентный вес.
I — коэффициент растворимости.
а — степень диссоциации, коэффициент ад-
сорбции.
v — число частиц, образующихся в резуль-
тате диссоциации одной молекулы.
v+ — число катионов, образующихся в ре-
зультате диссоциации одной молеку-
лы.
V- — число анионов, образующихся в ре-
зультате диссоциации одной молеку-
лы.
F — число Фарадея.
г — число электронов, участвующих в
электродном процессе.
АЯ°298, AS^gg, AF°29g, AG°298 — изменение энтальпии, энтропии, изо-
хорного и изобарного потенциала при
протекании реакции в стандартных
условиях при 298° К.
Д7/°е, 298 —теплота сгорания при 298° К
&H°f, гм —теплота образования при 298° К.
fi°t — стандартный химический потенциал,
кдж/моль.
Глава I
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ТЕПЛОЕМКОСТЬ
§ 1. ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА.
ПРОЦЕССЫ В ИДЕАЛЬНЫХ ГАЗАХ
Математическое выражение 1-го начала термодинами-
ки для процессов, связанных с бесконечно малыми изме-
нениями состояния системы, имеет вид
8Q = dU + 8A, (1,1)
где Q — теплота; U — внутренняя энергия; А— работа.
Это означает, что элементарное изменение внутренней
энергии есть полный дифференциал, т. е. что изменение
внутренней энергии однозначно определяется начальным
и конечным состоянием системы и не зависит от пути про-
цесса. Функции, которые однозначно определяют состоя-
ние системы, называются функциями состояния. Внутрен-
няя энергия U, а также энтальпия Н, которая выражает-
ся уравнением
H=U + PV, (1,2)
являются функциями состояния. (
Теплота и работа таким свойством не обладают, они
служат формами передачи энергии и связаны с процес-’
сом, а не с состоянием системы. Обозначения SQ и 6А в.
уравнении (1,1) лишь указывают на бесконечно малое
количество теплоты и работы. В двух частных случаях
теплота и работа приобретает свойства функций состоя-
ния:
Qv = &.Uv(V — const, Т = const); (1,3)
f Qp = AHP(P = const, T = const). (1,4)
Математическое выражение первого начала термоди- >
намики в интегральной форме имеет вид ?
(2 = Д(7 + А. (1,5)/
Теплота считается положительной, если она подводит-
ся к системе; At/— приращение внутренней энергии сис-
темы равно разности между значениями внутренней энер-
гии в конечном и начальном состоянии системы; работа
считается положительной, если она совершается систе-
мой, Если из всех внешних сил на систему действует
только внешнее давление Р, то при переходе системы из
состояния 1 в состояние 2 обратимым путем работу рас-
ширения можно вычислить по уравнению
2
A = (1,6)
1
Уравнения (1,1) — (1,6) справедливы для любой тер-
модинамической системы с веществами в любом агрегат-
ном состоянии.
Выражения для зависимости теплоты и работы от па-
раметров Р, V, Т системы в конечном (индекс 2) и на-
чальном (индекс 1) состоянии системы в четырех основ-
ных процессах с идеальным газом приведены в табл. 1.
Таблица 1
Выражения для работы и теплоты в четырех основных процессах
с идеальными газами
Процесс Работа Теплота Уравнение состоя- ния газа
Изотермный V, 2,3w/?7'Ig—т- v 1 2,3n/?Hg-^- PV = const
Изохорный . 0 nCjz (Т2 — Tj) Р —— = const Т
Изобарный Р(У2-У1) (Т^ — Fj) V = const Т
Адиабатный nCjz (Г 1 — Т2) 0 рул* = const Т’уТ—1 = const
- 1-т TP т = const
» т Ср т . cv
7
Выражение для взаимосвязи мольной (или атомной)
теплоемкости идеальных газов при постоянном давлении
Ср и при постоянном объеме С„ имеет вид
Ср — Су = /?. (1,7)
Мольная теплоемкость идеального газа при постоян-
ном объеме без учета энергии колебательного движения,
т. е. при сравнительно невысоких температурах, равна:
для одноатомных молекул Су = 3/2/?;
для двухатомных и линейных трехатомных молекул
Су = 5/2/?;
для нелинейных трехатомных и многоатомных моле-
кул Су = 3 /?.
При решении задач следует обращать внимание на
размерность исходных и искомых величин. Так, напри-
мер, для проверки размерности объема при расчете по
уравнению Менделеева — Клапейрона исходя из размер-
ностей исходных величин Я = дж/моль-град {дж—н-м)\
Т—град; Р=н)м2-, п=моль, получаем:
моль-дж-град-м2
V --------------------= м3.
моль-град-н
Пример. Двуокись углерода в количестве 100 г находится при
0°С и давлении 1,013-105 н/м2. Определить Q, A, AU и АН: а) при
изотермном расширении до объема 0,2 м3; б) при изобарном расши-
рении до того же объема; в) при изохорном нагревании до достиже-
ния давления 2,026-105 н/м2; г) при адиабатном сжатии до 2,026Х
X Ю5 н1м2-
Принять, что СО2 подчиняется законам идеальных газов, а ис-
тинная мольная теплоемкость СО2 при постоянном давлении постоян-
на и равна 37,1 дж/моль -град *.
Решение, а) для изотермного расширения Д(/=0 и АН=0
У.2
Q = 4 = 2,3n/?T lg—S
И
Число молей СО2 в 100 г составляет
т 100
п = — =-----= 2,27 моль.
М 44,0
* Молекулы СО2 линейны. Поэтому без учета энергии колеба-
тельного движения атомов в молекуле Ср = 7/2/?=3,5-8,314=
=29,1 дж/моль-град. Значение 37,1 дж/моль-град получается пото-
му, что у двуокиси углерода уже при комнатной температуре доста-
точно велика энергия колебательного движения.
8
Первоначальный объем определяют по уравнению
,г пРТ 2,27-8,314-273 л _
у ==--------= ---------= 0,0509 м3.
1 Pj 1,013-10’
Количество теплоты равно
0,200
Q = Л = 2,3-2,27-8,314-273 1g=7070 6ж=7,07 кдж;
б) для изобарного процесса
= АН = пСР (Т2 - TJ = (V2 - Vt).
У 1
Отсюда QP = АН = 2’^273 (0,200 — 0,0509) = 67 400 дж:
0,0509
= 67,4 кдж.
Работа расширения газа в изобарном процессе
Л = P(V2 — Vi) = 1,013-105 (0,200 — 0,0509) =
= 15 000 дж = 15,0 кдж.
Из уравнения (1,5)
At/ = Q — А — 67,4 — 15,0 =.52,4 кдж;
в) для изохорного процесса
Л = 0 и Qv = W = пСу (Г2 —7%) (Р2-PJ.
Теплоемкость при постоянном объеме Cv равна:
Су — Ср — R = 37,1 — 8,31 =28,8 дж]моль-град.
Отсюда
„ 2,27-28,8-273
Qv = At/ = —’------------(2,026-105 — 1,013-105) = 17900 дж =
v 1,013-105 ' ’
= 17,9 кдж.
Из уравнения (I, 2) имеем для изохорного процесса:
АН = \U + V(P2 — Рг).
Отсюда
AH = 17,9 + 0,0509(2,026 —1,013)-105-10-3 = 23,1 кдж;
г) для адиабатного сжатия
пРТ
Q = 0 и 4 = = пСу (7\ — Г2) = •
7-1-1
9
Коэффициент
7 = —
Су
37,1
—= 1,29,
28,8
1,29-1 -|
2,27-8,314-273
А = — ДС7 =
1,29
= — 2970 дж —
1,29—1
=—2,97 кдж.
Из уравнения (1, 2) имеем
Д/7 = ДУ + Д (PV) = ДУ + (Р2И2 — Pi И!).
Выражая конечный объем V2 из уравнения адиабаты PjVj =
= ^2^2,- получим
\Н = Ш + РУх
= 2,97 + 1,013-105 X
1 —
— 1
I
Г 1,29—1
J /203\ 1129
X °,0509- -1
10—5 — 3,83 кдж.
Задачи *
1. Какое количество тепла потребуется для нагрева-
ния 1 м3 воздуха от 0 до ГС при постоянном объеме и
начальном давлении Р= 1,013-105 н/л2? Плотность возду-
ха при нормальных условиях 1,29 кг/л3, удельная тепло-
емкость при постоянном давлении Ср=1,01 дж{г-град.
2. Определить количество теплоты, необходимое для
нагревания 5 г азота от 15 до 25° С при постоянном объ-
еме.
3. Газ, расширяясь от 0,01 до 0,016 м3, при постоянном
давлении 1,013-105 н/л2 поглощает 126 дж тепла. Опре-
делить изменение внутренней энергии.
4. Смешано 4,03 а водорода и 32 г кислорода. Их
удельные теплоемкости Ср соответственно равны 14,3 и
0,912 дж!г- град. Определить потерю тепла при охлаж-
дении этой смеси на 20° при постоянном объеме.
5. Определить количество теплоты, которое необходи-
мо для нагревания при V = const 25 г кислорода, находя-
щегося при 350°С, от 1,013-105 до 5,065-105 н[м2.
6. При нормальных условиях 0,005 м3 криптона нагре-
вают до 600° С при постоянном объеме. Каково конечное
* При решении задач предполагается, что газы подчиняются за-
конам идеальных газов.
10
давление газа и количество тепла, затраченное на нагре-
вание?
7. В резервуаре емкостью 0,05 л3 при 10° С и избытбч-
- ном давлении 5,065-105 н/м2 содержится азот. Определить
максимальное количество теплоты, которое можно сооб-
• Йцить газу, если стенки резервуара выдерживают давле-
ние, не превышающее 20,26-105 н/м2.
8. Вычислить работу, совершаемую при расширении
газовой системы на 0,005 м3 и давлении 1,013-105 н/м2.
9. Какое количество работы будет совершено 1 кг СОг
. при повышении его температуры на 200° при постоянном
i давлении?
10. При постоянном давлении 9,59-104 н/м2 нагревают
* 5 м3 азота. Определить совершенную работу, если газ
расширился до 8 м3.
'э 11. Какое количество теплоты потребуется, чтобы на-
греть 10 г паров ртути на 10° при постоянном давлении?
, (Пары ртути одноатомны.)
I, 12. В цилиндрическом сосуде, закрытом невесомым
’''(Подвижным поршнем, 1 м3 водорода находится при 0°С.
^Внешнее давление 9,72-104 н/м2. Какое количество тепло-
ты потребуется на нагревание водорода до 300° С?
13. Под давлением 1,013-Ю5 н/м2 и при 15° С 0,025 м3
-воздуха расщиряется до 0,1 м3. Определить работу и ко-
нечное давление газа.
< 14. Найти изменение внутренней энергии при испаре-
' йии 0,2 кг этанола при температуре его кипения под дав-
лением 1,013-105 н/м2. Теплота парообразования спирта
при температуре кипения равна 857,7 дж/г, а удельный
объем пара равен 0,607 м3/кг. Объемом жидкости прене-
бречь.
15. Найти изменение внутренней энергии гелия, изо-
барно расширяющегося от 0,005 до 0,01 м3 под давлени-
ем 1,96-105 н/м2.
16. Вычислить работу расширения при нагревании 2 г
воздуха от 0 до 1°С при давлении 1,013-105 н/м2. Плот-
ность воздуха при нормальных условиях 1,29 кг/м3.
'• 17. Определить количество теплоты и работу при на-
тревании азота от 0,5 до 4 л3 при 26,8° С и 9,32-104 н/м2.
18. При 25°С и 1,013-105 н/м2 в сосуде находится 1 кг
азота. Вычислить Q, AU и А при изохорном увеличении
Давления до 2,026-105 н/м2 и при изобарном расширении
удо трехкратного объема.
19. Вычислить работу расширения, если 100 г водо-
рода при 50° С расширяются от 0,04 до 0,2 м3.
20. При 100° С 6 г кислорода занимают объем 0,004 м3.
Вычислить работу при изотермном расширении до объ-
ема 0,0045 м3.
21. Определить работу, необходимую для изотермно-
го сжатия 1 кг-моль двуокиси углерода при 20° С и дав-
лении от 1,02-105 до 35,70-105 н/м2.
22. Какое количество тепла выделится при изотерм-
ном сжатии 0,015 м3 идеального газа при 36,8° С и
1,013-105 н/м2, если объем его уменьшится в 5 раз?
23. При 0° С и 5,065-105 н/м2 0,002 м3 азота расширя-
ются изотермно до давления 1,013-105 н/м2. Вычислить
работу и количество поглощенной теплоты.
24. Определить изменение внутренней энергии при ис-
парении 20 г этанола при температуре кипения, если
удельная теплота испарения его равна 857,7 дж/г, а
удельный объем пара при температуре кипения —
607 см3/г. Объемом жидкости пренебречь.
25. Определить работу адиабатного сжатия 1 моль
двухатомного идеального газа при повышении температу-
ры от 15 до 25° С.
26. При 27°С и 10,13-105 н/м2 8г кислорода расширя-
ются адиабатно до давления 1,013-105 н/м2. Вычислить
конечную температуру и работу, совершенную кислоро-
дом.
27. Определить температуру и работу при адиабат-
ном сжатии 0,01 м3 азота до 1/10 его первоначального
объема, если начальные температура 26,8° С и давление
1,013-105 н/м2.
28. Вычислить работу адиабатного расширения 1 моль
одноатомного идеального газа при понижении темпера-
туры от 100 до 25°С. Начальное давление. 10,13-105 н/м2,
конечное 2,026-105 н/м2.
29. В цилиндре при 18°С и 1,013-105 н/м2 находится
гремучая смесь. При изменении объема от 3,77-10~4 до
0,302 • 10~4 м3 произошел взрыв. Определить температуру
и давление в момент взрыва, если сжатие происходит без
обмена теплоты с окружающей средой.
30. При 17° С 10 г кислорода сжимаются адиабатно
от 0,008 до 0,005 м3. Определить конечную температуру,
затраченную работу, изменение внутренней энергии и из-
менение энтальпии.
12
§ 2. РАСЧЕТЫ, ОСНОВАННЫЕ НА СООТНОШЕНИЯХ
МЕЖДУ ТЕПЛОЕМКОСТЬЮ И ТЕПЛОТОЙ ПРОЦЕССА,
ВНУТРЕННЕЙ ЭНЕРГИЕЙ ИЛИ ЭНТАЛЬПИЕЙ СИСТЕМЫ
। Истинная теплоемкость при постоянном объеме и при
постоянном давлении определяется соотношениями:
/ 6Q \ __ / &U \
' dT 'у ' дТ 'у
/6Q\ /дН\
' dT' р ' дТ 'р
(1,8)
Средняя теплоемкость С в интервале температур от
Ti до Т? определяется соотношением
где Q — количество теплоты, вызвавшее изменение тем-
пературы от Ti до Т2.
Различают мольную (атомную) й удельную теплоем-
кость.
Размерности теплоемкостей:.
мольной С = дж/моль-град;
удельной с = дж[г-град.
Зависимость теплоемкости от температуры для прак-
тических расчетов выражают обычно эмпирическими (ин-
терполяционными) формулами в виде степенных рядов
от температуры:
С = а + ЬТ + cP + dP, (1,10)
или
С = а + ЬТ + с'Т-\ (1,11)
где а, Ь, с, с', d — эмпирические коэффициенты *, справед-
ливые для данного интервала температур.
Для определения средней теплоемкости по истинной
пбльзуются соотношениями:
* Для обоих рядов коэффициенты а, b имеют различные зна-
чения.
13
1,13
I
I t ] T
c = y—^CdT (1,12)
1 h 1T1
для вычисления истинной теплоемкости по средней — со-
отношениями:
d[C(/-zt)] d[c(T-Л)]
dt ’ dT
Количество теплоты, затраченное на нагревание п мо-
лей вещества от Л до Т2, определяется из соотношений:
т2
QV = \U = n^CvdT^=nCv(T2-Ti), (1,14)
Ti
Т,
Qp = ДЯ = п § Ср dT = пСр (Т’г — 7\). (1,15)
Т1
Учитывая, что теплоемкость является функцией темпе-
ратуры, для расчета количества теплоты используют
уравнение
г 1 22 т2 — л 1
Q₽ = n| а(7'2-Л) + -6(Т22-Т1)+С'-1—— I . (1,16)
L 2 /1/2 J
Пример J. Вычислить среднюю мольную теплоемкость NH3 в ин1-
тервале температур от 200 до 300° К, если выражение для зависимо-
сти его истинной теплоемкости от температуры в этом температурном’
интервале имеет вид
Ср = 24,8 -|-37,5-Ю-3?4 — 7,36’10—бГ2 дж^мольград.
Решение. Среднюю мольную теплоемкость рассчитывают пп
уравнению (1,12) с учетом (1,10):
С = а + — (Т2 -Н Г]) Я- — (Т| + ТХТ2 + Г|) с.
Z о
Отсюда
С = 24,8 + -i- (300 + 200)-37,5- 10~з — — (3002 + 200 300 +
2 3
+ 2002)-7,36 10-6 = 33,7 дж1моль град.
14
Пример 2. Средняя удельная теплоемкость Т1О2 (рутил) в интер-
вале от 0 до t° С выражается уравнением
CjIO’ = 0,782+ 1,41-10-4* — 0,557- 1CW—2 дж!моль-град. .
Рассчитать истинную удельную теплоемкость рутила при 500° С.
, ‘ Решение Среднюю удельную теплоемкость вычисляем по
уравнению (1,13) с учетом (1,11)'
Ср = а + 2W — с 7-2.
Отсюда
Cj10’ = 0,782 + 2-1.41-10-4-500 + 0,557-103 500-2 =
= 0,883 дж)г-град.
Пример 3. Определить количество теплоты, поглощенное при на-
гревании 1 кг а-АЬОз (корунд) от 298 до 1000° К, если его моль-
ная теплоемкость в интервале температур 298—1800° К может быть
выражена уравнением
СР = 115+ 12,8-10-37 — 35,4-1057-2 дж/мольград.
Решение Из уравнения (I 16) находим
1000 Г 1
= — 115 (1000 — 298) + — 12,8- Ю-з (Ю002 — 2982) __
1000 — 298 1
— 35,4-105 —-—------ = 766 000 дж = 766 кдж.
298-1000 J
Задачи
1. Зависимость мольной энтальпии двуокиси олова от
температуры в интервале 298-+1500° К выражается урав-
нением
Нт - Н238 = 73,8891 + 5,021 • Ю-’Т2 +
21,589-10* ,
-I-----------дж/моль.
Получить выражение зависимости истинной мольной
теплоемкости при Р = const от температуры. Вычислить
Ср при 500° С и результат сопоставить со значением
Ср = 71,077 дж/моль-град.
2. Зависимость истинной мольной теплоемкости от
температуры для сульфида серебра в интервале 298-+
+-452° К можно выразить уравнением
Ср == 42,38+ 110,46-10~37’ дж/моль-град.
15
Рассчитать среднюю теплоемкость в указанном интер-
вале температур.
3. Средняя мольная теплоемкость твердого едкого
натра в интервале температур 298-4-595° К составляет
80,32 дж/моль-град и жидкого едкого натра в интерва-
ле 595—900° К — 85,35 дж/град-моль. Определить коли-
чество теплоты, поглощенное при изобарном нагревании
1 кг едкого натра от 298 до 700° К, если теплота плавле-
ния равна 8363 дж/моль и температура плавления 595° К.
4. Зависимость мольной теплоемкости фосфата каль-
ция Са3(РО4)2 от температуры выражается уравнением
СР = 203,3+170,1 • 10-3?-26,11 • IO5?-2 дж/моль-град в ин-
тервале температур 273+1373° К. Найти изменение эн-
тальпии при нагревании этого вещества от 600 до 900° К.
5. Рассчитать мольную теплоемкость Ср хлорида ни-
келя при 25° С, пользуясь правилом Дюлонга и Пти в со-
четании с правилом аддитивности. Опытная мольная теп-
лоемкость хлорида никеля от температуры приближенно
выражается уравнением
СР — 54,81 + 54,81 • IO-3/1 дж/моль-град.
Вычислить расхождение между расчетной и опытной теп-
лоемкостями хлорида никеля.
6. Зависимость мольной теплоемкости газообразной
двухатомной серы от температуры можно выразить урав-
нением
Ср = 36,108+ 1,506- 10-3Т — 3,515-1057'-2 дж/моль-град
в интервале температур 273+2000° К.
Получить выражение для зависимости энтальпии от
температуры для 1 моль этого газа в этом интервале
температур (принять 7'1 = 273°К). Рассчитать изменение
энтальпии при нагревании 1 моль газообразной серы от
273 до 1000° К.
7. Вычислить изменение энтальпии азота при охлаж-
дении 1 м3 дымовых газов от 230 до 15° С. Содержание
азота в дымовых газах 80 об.%. Зависимость истинной
мольной теплоемкости азота от температуры имеет вид
Ср = 27,2 + 0,004187’ дж/моль-град.
8. Истинная атомная теплоемкость меди выражается
уравнением
Ср = 22,64 + 6,28- Ю-3?1 дж/моль-град.
16
Удельная теплота плавления меди равна 179,9 дж/г. Ка-
кое количество тепла выделится при затвердевании 1 кг
расплавленной меди и охлаждении ее от температуры
плавления 1065 до 15° С.
9. Истинная удельная теплоемкость твердой меди мо-
жет быть рассчитана по уравнению
ср — 0,3563 + 9,88- Ю-5? дж/моль-град-,
медь плавится при 1065°, теплота плавления равна
179,9 дж!г. К 1 кг меди, взятому при 15° С, подведено
541,2 кдж. Какое количество меди расплавилось?
10. Истинная удельная теплоемкость свинца может
быть рассчитана по уравнению
с ~ 0,1233 + 5,682 • 10~s^ дж/г • град.
Температура плавления свинца 326° С. Какое количество
теплоты необходимо подвести, чтобы расплавить 1 кг ме-
талла, взятого при 17° С?
11. Истинная мольная теплоемкость водяного пара
может быть выражена уравнением
СР — 28,83+ 13,74-10~3Т — 1,435-®Т2 дж/моль-град.
Какое количество теплоты выделится при охлаждении
90 г пара от 307 до 100° С при постоянном давлении
1,013-105 «Ли2.
12. Проверить правило Дюлонга и Пти для меди, цин-
ка и кадмия при 17° С. Даны истинные удельные теплоем-
кости при постоянном давлении:
для Си с — 0,3849 + 8,891 • 10-5£ дж/г-град,
для Zn с = 0,3795 + 18,58-10~6^ дж/г-град,
для Cd с — 0,2285 + 9,904- Ю-5^ дж/г-град.
13. Истинная удельная теплоемкость жидкого цинка
выражается уравнением
с(ж) = 0,362 + 26,78 • 10~5£ дж/г - град,
а твердого цинка
с(Т) = 0,3795 + 18,58- 10~+ дж/г-град.
Какое количество теплоты выделится при охлаждении
300 г этого металла от 500 до 0° С, если температура
плавления цинка 419°С и удельная теплота плавления
117,2 дж!г.
17
Рассчитать теплоемкости 1 г-атом твердого и рас-
плавленного цинка при температуре плавления.
14. Вычислить отношение работы расширения к коли-
честву теплоты, затраченной при нагревании 1 кг меди
от 0 до 250° С. Коэффициент объемного расширения меди
равен 5,01-10~5 град-1, плотность меди 8,93 г!см3', удель-
ная теплоемкость в указанном интервале температур
0,392 дж/г-град.
15. Вычислить отношение работы расширения к погло-
щенной теплоте при нагревании 0,02 м3 воздуха от 27
до 227° С и постоянном давлением 1,013-105 н/л2. Для
кислорода и азота истинная мольная теплоемкость рас-
считывается по уравнению
СР = 27,2 + 0,004187 дж/моль-град.
16. Средняя удельная теплоемкость для СО2 в интер-
вале температур от 0 до 200° С выражается уравнением
Ср = 0,8485 + 28,95-10-^ — 6,82-1О-8/2 дж/г-град.
Найти зависимость истинной мольной темплоемкости от
абсолютной температуры и количества теплоты, которое
пойдет на нагревание 220 г СО2 от 0 до 100° С при посто-
янном давлении. Какая часть этого тепла идет на повы-
шение внутренней энергии газа?
17. Комната имеет площадь 20 л2 и высоту 4 м. Какое
количество теплоты потребуется, чтобы нагреть воздух в
этой комнате от 10 до 20° С при полной термоизоляции,
если для азота и кислорода истинная мольная теплоем-
кость
Ср — 27,19 + 4,18-10-37 дж/моль-град.
18. Металлический хром может быть получен восста-
новлением хлорида хрома водородом по уравнению реак-
ции
3
СгС13 (т) + — Н2 (г) = Сг (т) + ЗНС1 (г)
Эффективность использования водорода 50%. Истинные
мольные теплоемкости
Ср2= 27,19 + 3,766- Ю-3? дж/моль-град
и С₽гС1’ = 8,340 4-29,41 • 10~37 дж/моль-град.
Определить минимальное количество теплоты, необходи-
мое для нагревания от 25 до 900° С исходных веществ
для получения 1 кг хрома.
19. Средняя мольная теплоемкость двуокиси углерода
(в пределах температур 2734-1200° К) выражается урав-
нением
СР = 43,26 + 5,732- IO'3? +8,18- 10-5Р дж/моль-град.
Определить истинную мольную теплоемкость СОг при по-
стоянном давлении и 0°С.
20. Истинная атомная теплоемкость ромбической се-
ры выражается уравнением
СР— 14,98 +26,11 • Ю-3? дж/г-атом-град.
Определить значение средней атомной теплоемкости се-
ры в пределах от 0 до 95,6° С.
21. Зависимость истинной атомной теплоемкости ме-
таллического ниобия от температуры выражается урав-
нением
СР = 23,81 + 3,816-10-3Г дж/г-атом-град,
которое справедливо в интервале 2734-1573° К. Получить
зависимость энтальпии ниобия от температуры в виде
уравнения. Вычислить изменение энтальпии Я1273—Я273
для 1 г-атом ниобия.
22. Какое количество теплоты поглощается при нагре-
вании 2 кг меди от 25 до 1000° С, если мольная теплоем-
кость меди выражается уравнением
СР = 22,64 + 6,28-10~3Т дж/г-атом-град.
23. Количество теплоты, выделяющееся при остыва-
нии 1 г платины от Т до То, рассчитывается по уравнению
Q = 0,1322(7 — Го) + 12,23 (Т2- 7?)10“® дж/г.
Вывести уравнение зависимости средней и истинной атом-
ной теплоемкости платины от температуры в интервале
Го—Г. Рассчитать истинную атомную теплоемкость пла-
тины при 30° С.
24. Истинная удельная теплоемкость ртути выражает-
ся уравнением
с = 0,1479 — 2,89- 10~Я дж/г-град.
Определить количество теплоты, необходимое для нагре-
вания 50 г ртути от 0 до 357° С.
19
25. Истинные удельные теплоемкости ряда металлов
могут быть выражены уравнениями:
для Си с = 0,385 4- 8,891 • 10~5/ дж/г-град,
для РЬ с = 0,124 4- 5,682- \Q~4 дж/г-град,
для Zn с — 0,379 4- 1,858- 10-4/ дж/г-град,
для Cd с = 0,228 4- 1,858- 10-4/ дж/г-град.
Рассчитать величины средних теплоемкостей в интерва-
ле 0—100° С.
26. Количество теплоты, расходуемое на нагревание
1 кг окиси железа (РегОз) от 0 до t° С, выражается урав-
нением
Q = 770,7/ 4- 0,226/2 дж/кг.
Получить уравнение зависимости истинной мольной теп-
лоемкости окиси железа от температуры.
27. Истинная мольная теплоемкость окиси кальция
выражается уравнением
Сра0= 48,83 4-4,519- 10-3Т- 6,527- Ю5?-2 дж/моль-град.
Определить количество теплоты, необходимое для нагре-
вания 10 кг СаО от 0 до 900° С.
28. Средняя удельная теплоемкость СОг при постоян-
ном давлении в интервале температур от 0 до 1000° С вы-
ражается уравнением
ср= 1,003 4- 10,27-Ю-5? 4~ 19,41 -103Т~2 дж/г-град.
Найти истинную мольную теплоемкость СОг при 500° С.
29. Мольная теплоемкость кварца SiO2 выражается
уравнением
СР = 46,95 4-34,36-10-3T4- 11,3-105Т-2 дж/моль-град.
Получить уравнение для вычисления теплоты, расходуе-
мой на нагревание 1 кг кварца от Л до TV
30. В калориметре смешаны 50 г льда, взятого при
0°С, и 150 г воды, взятой при 50° С. Определить конеч-
ную температуру, если удельная теплота плавления
льда 334,7 дж/г и удельная теплоемкость воды
4,184 дж!г-град.
20
§ 3. РАСЧЕТ МОЛЬНОЙ ТЕПЛОЕМКОСТИ ГАЗОВ
ПО УРАВНЕНИЮ ЭЙНШТЕЙНА
Мольная теплоемкость идеальных газов вычисляется
по формуле Эйнштейна
CP = ^±^R + 2 0’17)
т'
где т — число вращательных степеней свободы (враще-
ние всей молекулы); т' — сумма чисел степеней свободы
колебательного движения атомов в молекуле; 0 — харак-
теристическая температура, зависящая от частоты давно-
(0 \
— j — функция Эйнштейна.
Для газов с линейной структурой (двухатомные газы, СОг,
COS, HCN, СгН2, CS2 и др.) т=2, для прочих многоатом-
ных газов т = 3. Число степеней свободы т' подсчитыва-
ется по уравнению
т' = Зп — (3 4- т). (1,18)
(6 \
— j
приводятся в физико-химических справочниках.
Пример. Вычислить истинную мольную теплоемкость СН4 при
P = const и 1300° К, пользуясь таблицей функций Эйнштейна. Срав-
нить полученные значения с величиной, вычисленной по эмпириче-
ской формуле
С™1 = 14,3+ 74,9-10-37’ — 17,5-Ю-бП дж/моль-град.
Решение. Значения характеристических температур для мета-
на: 0, = 1870 (3); 02 = 2170 (2); 03=4320 (3); 04=44ОО (цифры в скоб-
ках показывают число вырожденных колебаний в молекуле, т. е.
имеющих одинаковые значения 0).
Принимая т=3, рассчитываем теплоемкость при постоянном
давлении по формуле (1,17).
„ 5 + 3„ /1870\ „„ /2170Х _ /4320\
Ср = 8,314 + 367р I --I + 2С е I--• I + 367 f I-I +
Р 2 £ \13ooj £\1300У £V1300j
/4400\
+ СЕ 7^ 1 = 33,3 + 3Cg-(1,44) + (1,67) +
\ louU /
+ ЗСг (2,23) +Се (3,38).
21
Значения Се
находим по таблицам функций Эйнштей-
на *. Если эти значения не совпадают с табличными, то пользуются
линейной интерполяцией. Так, например, для определения СЕ. соот-
ветствующего х=0/Т=1,44, в таблице функций Эйнштейна находят
значения СЕ -7,079 и 7,000, соответствующие х=1,40 и х=1,45.
Искомое значение х лежит внутри этого интервала. Зависимость СЕ
от х внутри интервала приближенно является линейной, поэтому
можно составить пропорцию
0,05-----0,079
0,01 —ДС£.
Отсюда ДСЯ = —0,079-0,01/0,05= —0,016 и искомое значение Св
7,000+0,016=7,016.
Аналогично определяем остальные функции и получаем:
Ср = 33,3 + 37,02 + 2-6,61 + 3-3,56 + 3,47 = 81,7 дж[моль• ajrod.
По эмпирической формуле
Ср = 14,3 + 74,9-Ю-з. 1300— 17,5-10-6-13002 =
= 81,9 дж1моль-град.
Разница значений мольной теплоемкости метана, вычисленной по
формуле Эйнштейна и по эмпирической формуле, составляет
Задачи
1—30. Вычислить мольную теплоемкость газов Ср, ис-
пользуя функции Эйнштейна при указанных температу-
рах. Вычисленное значение теплоемкости сравнить с теп-
лоемкостью, полученной по интерполяционным уравнени-
ям (1,10) и (1,11)
* См. «Краткий справочник физико-химических величин», под
ред. К. М. Мищенко и А. А. Равделя. Изд-во «Химия»,
М. — Л., 1967.
22
Номер задачи Га з T, °K 0i 6. 6a e4
1 ссц 1000 341(2) 440(3) 630 1114(3)
• 2 сн4 1000 1870(3) 2170(2) 4320(3) 4400
3 cos 1000 746(2) 1230 2936 —
4 со2 1000 960(2) 1830 3380 ——
5 cs2 1000 568(2) 939 2194 —
6 СС14 600 341(2) 440(3) 630 1114(3)
7 сн4 600 1870(3) 2170(2) 4320(2) 4400
8 HCN 1000 1020(2) 2290 4710 —
9 Н2О .1000 2290 • 5730 5510 ——
10 H2S 1000 1810 3750(2) —. —
11 NH3 1000 1367 2336(2) 4176 4776(2)
12 n2o 1000 844(2) 1842 3195 —
13 so2 1000 750 1650 1950 —
14 сн4 1200 1870(3) 2170(2) 4320(3) 4400
15 cos 1200 746(2) 1230 2936 —
16 cs2 1200 568(2) 939 2194 —
17 cos 600 746(2) 1230 2936 ——
18 co2 600 960(2) 1830 3380 —
19 HCN 1200 1020(2) 2290 4710 —
20 H2O 1200 2290 5730 5510 —
21 H2S 1200 1820 3750(2) — —
22 n2o 1200 344(2) 1842 3195 —
23 so2 1200 750 1650 1950 —
24 CO2 1200 960(2) 1830 3380 —
25 ССЦ 800 341(2) 440(3) 630 1114(3)
26 cs2 600 568(2) 939 2194 Ч !»
27 H2O 600 2290 5730 5510
28 NH? 800 1357 2336(2) 4276 4776(2)
29 HCN 800 1020(2) 2290 4710 —
30 H2O 800 2290 5730 5510 —
Глава II
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ТЕРМОХИМИЯ
§ 4. ЗАКОН ГЕССА
Согласно закону Гесса тепловой эффект реакции не
зависит от промежуточных стадий, а определяется лишь
начальным и конечным состоянием системы при условии,
что давление или объем в течение всего процесса остают-
ся неизменными. Математическая формулировка закона
Гесса является непосредственным следствием первого на-
чала термодинамики и выражается уравнениями
Qv = &U, (11,1)
QP = \H. (11,2)
Таким образом, тепловой эффект при постоянном
объеме Qv и тепловой эффект при постоянном давлении
Qp являются функциями состояния, т. е. не зависят от'"
пути процесса (закон Гесса).
Взаимосвязь изобарного и изохорного тепловых эф-
фектов описывается уравнением
кН = \U + \nRT, (11,3)
где Дл— приращение числа молей газообразных веществ,
принимающих участие в реакции, т. е.
прод исх
Дл = 2л(г) — 2л(г); (11,4)
прод
Sn(r) —число молей газообразных продуктов реакции
ИСХ
(по уравнению реакции); 2л(г) —число молей газооб-
разных исходных веществ (по уравнению реакции).
Уравнение (11,3) справедливо в предположении, что
газообразные реагенты и их смесь в газовой фазе подчи-
няются законам идеальных газов.
Тепловой эффект реакции может быть определен по
закону Гесса методом термохимических схем. Например,
реакцию образования двуокиси углерода из углерода и
кислорода можно провести через промежуточную стадию
24
образования окиси углерода:
Отсюда согласно закону Гесса
. Q1 = Q2+Q3. (11,5)
Из уравнения (II,5), зная два тепловых эффекта, можно
вычислить третий.
Термохимические уравнения реакций — это уравнения,
в которых около символов химических соединений указы-
ваются агрегатные состояния этих соединений или крис-
таллографическая модификация и в правой части урав-
нения указываются численные значения тепловых эффек-
тов. На основании закона Гесса с термохимическими
уравнениями можно оперировать так Же, как и с алгеб-
раическими.
Пример. Рассчитать теплоту образования Мп(МО3)2-6Н2О(т) из
элементов при стандартных условиях по термохимическим урав-
нениям:
Мп (т) + 2Н+а^ = Мп2+а^ + Н2 (г) — 227,7 кдж (Д/Ур (1)
Н2 (г) 4-N2 (г) 4-ЗО2 (г) = 2Н+а^ 4-NP^a^— 409,4 кдж (ДН2) (2)
Mn(NO3)2-6H2O (т) = Mn2+ay 4- 2NO~a^ 4-
4-6Н2О (ж) — 21,3 кдж (Д/73) (3)
Н2(г) 4- г|2О2(г) = Н2О(ж) —285,84 кдж (ДН4) (4)
Решение. Составляем термохимическое уравнение образования
Мп(МО3)2-6Н2О(т) из простых веществ:
Мп (т) + N2 (г) + 6О2 (г) 4- 6Н2 (г) = Мп (NO3)2-6H2O (т) 4- Д/7Л (5)
Для определения теплового эффекта ДЯХ реакции производим
соответствующие алгебраические действия с термохимическими урав-
нениями, чтобы получить искомое уравнение. Аналогичные алгебраи-
ческие действия производим и с тепловыми эффектами.
Суммируем уравнения (1) и (2):
Мп (т) 4- N2 (г) 4- ЗО2 (г) = Мп2+а<? 4- 2NOpz^ 4- Д77х 4- Д/72 (6)
25
Вычитаем уравнение (3) из (6):
Мп (т) + N2 (г) + ЗО2 (г) + 6НгО (ж) = Мп (NO3)2-6H2O (т) 4-
4-ДА^Ч-Д//2-Д//3. (7)
Суммируем уравнение (7) и уравнение (4), умноженное на 6:
Мп (т) + N2 (г) + 6О2 (г) + 6Н2 (г) = Мп (NO3)2-6H2O (т) +
4- ДТ/^ Ч- Д/72 — ДА/3 4- 6Д7/4 (За)
отсюда Д/7^ = Д/71 + Д//2—ДАГ3 4- 6Д//4 = —227,7 — 409,4 4-
4-21,3— 1715,0 = —2330,8 кдж.
Этот пример можно решить также методом термохимических
схем:
ДТЛе
Мп (т), N2(r), 6O2(r), 6Н2(г)-Мп (NO3)2-6H2O (т)
-ДА73 |
Д/У2 Мп2+а^, 2NO^a9, 6Н 2О (г)
6ДЯ4 |
Мп (т), 2Н+л^, 2NO~a^ 1 —-^Mr^+aq, WO~aq,
ЗО2, 5Н2(г) / ЗО2(г), 6Н2(г)
Отсюда Д/7Х = Д//24-Д7/1 + 6Д7/4 — ДА7з.
Задачи *
1. Теплоты образования жидкой воды и газообразной
двуокиси углерода соответственно равны —285,8 и
—393,5 кдж/моль, теплота сгорания метана при тех же
условиях —890,3 кдж/моль. Рассчитать теплоту образова-
ния метана из элементов при условиях: 1) Р=const;
2) P=const, 7=298° К.
2. Теплота сгорания жидкого бензола равна
—3267,7 кдж/моль. Теплота сгорания газообразного аце-
тилена при тех же условиях равна —1299,6 кдж/моль.
Вычислить теплоты образования жидкого бензола и га-
зообразного ацетилена, а также теплоту образования бен-
зола из ацетилена при условиях: 1) P=const и 2) V=
=const, если.теплоты образования СО2 (г) и Н2О (ж)
соответственно равны —393,5 и —285,8 кдж/моль.
* В ряде задач тепловые эффекты реакций, теплоты образова-
ния и сгорания даны при стандартных условиях, т. е. при 25° С
и 1 атм, которые в условиях не указываются.
26
3. Тепловые эффекты реакций при 0° С и постоянном
давлении 101,3 кн/м2:
С + О2 = СО2 - 405,8 кдж (1)
СО + ‘/гОг = СО2 — 284,5 кдж (2)
Н2 + у2О2 = Н2О (г) - 246,8 кдж (3)
Рассчитать при тех же условиях тепловые эффекты сле-
дующих реакций:
С (граф) + */2О2 = СО + Д/fi кдж (4)
С + 2Н2О(г) = СО2+2Н2+ЛН2 кдж (5)
С + Н2О (г) = СО + Н2 + АН3 кдж (6)
2СО = СО2 + С + ДН4 кдж (7)
4. Теплота образования этилена С2Н4 (г) равна
52,3 кдж/моль. Какова теплота сгорания этилена при:
1) P = const; 2) V=const, если теплоты образования
СО2 (г) и Н2О (ж) соответственно равны —393,5 и
—285,8 кдж/моль?
5. Рассчитать теплоту образования жидкого сероугле-
рода по следующим данным:
S (мон) + О2(г) = SO2(n)— 296,9' кдж
С52(ж) +ЗО2(г) = СО2(г) +2SO2(r)~ 1109,0 кдж
С (граф) + О2(г) = СО2(г) — 393,5 кдж
6. Теплота образования Fe2O3 (т) —821,3 кдж/моль,
а теплота образования A12O3 —1675,0 кдж/моль. Рассчи-
тать тепловой эффект реакции восстановления 1 моль
Fe2O3 металлическим алюминием.
7. На основании следующих данных рассчитать теп-
лоту образования безводного А12С1б (т):
2А1(т) +бНСЬад = А12С16а(7 + ЗН2(г)- 1003,2 кдж (1)
Н2(г)+С12(г) = 2НС1(г)—184,1 кдж (2)
НС1 (г) + aq = НС1 aq — 72,45 кдж (3)
А12С16(т) + а<7 = А12С16а<7 — 643,1 кдж (4)
8. На основании следующих данных рассчитать те-
плоту образования твердого As2O2:
As2O3(t)+ЗН2О(ж)+ag = 2HsAsO3ag + 31,59 кдж (1)
27
As(r) + 3/2CI2(r) = AsCl3(r) —298,7 кдж (2)
AsCI3(r) + ЗНгО (ж) + aq = H3AsO3a<7 +
+ 3HCIa<7 — 73,58 кдж (3)
1/2Н2(г) + 1/2С12(т)= НС1(г) —92,31 кдж (4)
НС1(г) + aq = HCIa<7 — 72,45 кдж (5)
Н2(г) + ‘/2О2(г) = Н2О(ж)-285,8 кдж (6)
9. На основании следующих данных рассчитать тепло-
ту образования: 1) газообразного аммиака; 2) водного
раствора аммиака:
4NH3(<r) + ЗО2(г) = 2N2(r) + 6Н2О(ж)- 1516,3 кдж (1)
2Н2(г) + О2(г) = 2Н2О (ж) - 571,7 кдж (2)
NH3(r)4-a<7 = NH3a</ — 35,15 кдж (3)
10. Рассчитать теплоту образования безводной СиС12,
пользуясь следующими данными:
СнО(т) +2НС1щ/= СиС12а</+ Н20(ж) — 63,89 кдж (1)
СиС12(т) + aq = CuCl2a<7 — 46,36 кдж (2)
Си (т) + */2О2 = СиО (т) - 155,2 кдж (3)
Н2(г) + С12(г) + aq = 2НС1а</ — 328,9 кдж (4)
Н2(г) + ‘/2О2(г)= Н2О (ж) —285,8 кдж (5)\
11. Теплота нейтрализации соляной кислоты раство-
ром едкого натра — 55,9 кдж, а монохлоруксусной кислоты
СН2С1СООН тем же раствором едкого натра —59,75 кдж.
При прибавлении к раствору, содержащему 1 г-экв моно-
хлоруксуснокислого натрия, 1 г-экв НС1 поглощается
1,904 кдж теплоты. Какая часть взятой соли при этом
разлагается?
12. Теплота нейтрализации азотной кислоты раство-
ром едкого натра —55,9 кдж, а двухлоруксусной кислоты
СНС12СООН тем же раствором едкого натра —62,05 кдж.
Если прибавить 1 же NaOH к раствору, содержащему
по 1 же HNO3 и СНС12СООН, то выделяется —58,41 кдж
теплоты. Рассчитать количество грамм-эквивалентов
HNO3, прореагировавших с NaOH.
13. Теплоты нейтрализации NaOH и NH4OH соляной
кислотой соответственно равны —55,9 кдж!моль и
— 51,34 кдж/моль. Какова теплота диссоциации NH4OH,
если он в растворе практически не диссоциирует?
28
14. Теплоты нейтрализации соляной, уксусной и мас-
ляной кислот едким натром соответственно равны —55,9;
— 56,07 и —57,74 кдж!моль. Какова теплота диссоциации
уксусной и масляной кислот, если они в водном растворе
практически не диссоциируют?
15. Теплоты растворения MgSCU, MgSCU-HgO и
MgSO4-7H2O соответственно равны —84,85; —55,64 и
15,9 кдж/моль. Какова теплота гидратации при переходе:
a) MgSO4 в M.gSO4-H2O; б) M.gSO4 в M.gSO4-7H2O;
в) MgSO4 • Н2О в MgSO4 • 7Н2О?
16. Теплота растворения ВаС12 — 8,66 кдж/моль, а
теплота гидратации этой соли при переходе в
ВаС12-2Н2О—29,16 кдж!моль. Какова теплота растворе-
ния ВаС12-2Н2О?
17. Теплоты образования воды и водяного пара равны
соответственно —285,8 и —241,8 кдж/моль. Рассчитать
теплоту испарения воды при 25 °C.
18. Вычислить тепловой эффект реакции
С2Н4(г) + Н2О(г)= С2Н5ОН(г)
если теплоты образования этилена, водяного пара и газо-
образного этанола соответственно равны 52,28; —241,8 и
—235,3 кдж/моль.
19. Теплота сгорания ‘ паров пропанола
—2064,0 кдж/моль. Вычислить теплоту сгорания жидкого
пропанола, если теплота его испарения составляет от
41,84 до 48,12 кдж/моль. Рассчитать расхожде-
ние между вычисленным и табличным значением
—2016,7 кдж/моль.
20. Рассчитать теплоту перехода ромбической серы в
моноклиническую, если теплота сгорания ромбической
серы —297,5 кдж/г-атом, а теплота сгорания моноклини-
ческой серы —300,1 кдж/г-атом.
21. Теплоты сгорания аморфного углерода, графита и
алмаза соответственно равны — 409,2; —394,6 и
—395,3 кдж/г-атом. Рассчитать теплоту аллотропного
превращения: 1) аморфного углерода в графит;
2) аморфного углерода в алмаз; 3) графита в алмаз.
22. Теплота образования раствора хлорида цинка
—478,2 кдж/моль, а теплота образования раствора-хлори-
да меди (II) —262,3 кдж/моль. Вычислить теплоту реак-
ции
CuCl2(p—р) + Zn = ZnCl2(p—р) + Си
29
23. Теплота сгорания бензойной кислоты
С6Н5СООН(т) —3227,5 кдж/моль. Теплоты образования
воды и двуокиси углерода из элементов при тех же усло-
виях соответственно равны —285,8 и —393,5 кдж/моль.
Вычислить теплоту образования СбН5СООН (т).
24. Рассчитать- теплоту образования газообразного ам-
миака на основании следующих данных:
4NH3(r) + ЗО2(г) = 2N2(r) + 6Н2О(г)- 1266,9 кдж/моль
2Н2(г) + О2(г) = 2Н2О(г) — 483,7 кдж/моль
25. Вычислить тепловой эффект реакции восстановле-
ния окиси железа (II) водородом, пользуясь следующими
данными:
РеО(т)+ СО(г) = Ре(т)+ СО2(г) — 13,18 кдж/моль
СО (г) + 1/2О2(г) = СО2 (г) — 283,0 кдж/моль
Н2(г) + ‘/2О2(г) = Н2О(г) — 241,8 кдж/моль
26. Определить тепловой эффект реакции
С2Н5ОН (ж) + СНзСООН (ж) =
= СН3СООС2Н5(ж)+ Н20(ж)
если теплоты сгорания С2Н5ОН(ж)ДН1 =
- — 1366,7 кдж/моль-,
СНзСООН (ж) ДН2 = —871,5 кдж/моль,
СН3СООС2Н5(ж) ДН3 = — 2254,2 кдж/моль.
27. Вычислить теплоту образования MgCO3 (т) из
MgO(T) и СО2, пользуясь следующими данными:
С (граф) + О2 (г) = СО2 (г) — 393,5 кдж/моль
Mg (т) + ‘/гОг(г) = MgO (т) — 601,7 кдж/моль
Mg(T)+ С (граф) + 3/2О2(г) =
= MgCO3 (г) — 1113,0 кдж/моль. ,
28. Определить теплоту образования гексагидрата ни-
трата магния Mg(NO3)2-6Н2О(т), если известны следую-
щие данные:
Mg (г) + 2Н+й7 + fl7~>Mg2+ai7 + Н2 (г) —465,8 кдж (1)
Н2 (г) + N2 (г) + ЗО2 (г) + aq -> 2Н+а? +
+ 2NO3-a<7 — 409,4 кдж (2)
30
M.g(NO3)2-6H2O(T)+ -> M.g2+a<7 + 2NO3-a<7 +
+ 6Н2О(ж) + 21,3 кдж (3)
H2(г) + УгОг(г)-> Н20 (ж) — 285,8 кдж. (4)
29. В топке сгорает каменный уголь, содержащий 65%
углерода. В топочных газах содержится 13 об.%СО2 и
1 об. % СО; остальное азот и кислород. Определить теп-
лоту сгорания 1 кг угля, если теплота образования
СО2 (г) —393,5 кдж/моль, а теплота образования СО (г)
—110,5 кдж/моль.
' 30. Теплота растворения Na2SO3(T) при 18° С
— 11,30 кдж/моль, а теплота гидратации этой соли при
переходе в Na2SO3-7H2O(T) —58,16 кдж/моль. Опреде-
лить теплоту растворения Na2SO3-7H2O (т).
§ 5. РАСЧЕТ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
ПО СТАНДАРТНЫМ ТЕПЛОТАМ ОБРАЗОВАНИЯ
ИЛИ СГОРАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Из закона Гесса вытекают два следствия: 1) Тепловой
Эффект реакции равен разности между суммой теплот
образования продуктов реакции и суммой теплот образо-
вания исходных веществ: '
ДЯ - 2пДЯ/Р°д— 2пД/^сх ; (11,6)
2) тепловой эффект реакции равен разности между сум-
мой теплот сгорания исходных веществ и суммой теплот
сгорания продуктов реакции:
ДЯ = 2пДЯсгор - 2пДЯс?о°р- (П.7)
Пример 1. Пользуясь стандартными теплотами образования со-
единений, вычислить тепловой эффект реакции при 25° С:
Fe2O3 (т) + ЗСО (г) = 2Fe (т) 4- ЗСО2 (г) + ЬНХ
* если теплоты образования веществ следующие
(т) __ — 821,32 кдж/моль;
д/уСО(г) = —110,5 кдж/моль;
д//Ре (т) = 0,00 кдж/моль; ДЯу0’^ = —393,51 кдж/моль.
31
Решение. Согласно первому следствию из закона Гес<
[уравнение (11,6)] искомый тепловой эффект реакции равен
АН = 2ДЛ^е (т) + ЗДЛ^°2 (г> — (т) — ЗД//у 0 (г) =
= -3-393,51 + 821,32 + 3-110,5 = —27,71 кдж.
Пример 2. Пользуясь стандартными теплотами сгорания соед
нений, вычислить тепловой эффект реакции при 25° С:
С2Н5ОН (ж) + СНдСООН (ж) = СН3СООС2Н5 (ж) + Н2О (ж)
если теплоты сгорания веществ следующие:
д^сгот>5°Н = — 1366,9 кдж/моль;
kHcwp'0011 = —873,8 кдж/моль;
A«pC00C2Hs (Ж) = —2254,2 кдж/моль.
Решение. Согласно второму следствию закона Гесса искомг
тепловой эффект реакции равен [уравнение (11,7)]
ди __ ллуСаН5ОН (ж) I ЛЛ/СН8СООН (ж)_ AWCHSCOOC2H5 (ж) __
'crop ' crop 'crop
— ДЯ'гг2®(ж) = — 1366,9 — 873,8 + 2254,2 = 13,5 кдж.
Задачи
1-30. Вычислить тепловые эффекты химических реа
ций при стандартных условиях по стандартным теплоте
образования.
Термохимическое уравнение реакции
1
2
3
4
5
6
7
8
9
10
11
12
13
14*
15
4NH3 (г) + 5О2 (г) = 6Н2О (г) + 4NO (г)
2Mg(NO3)2 (т) = 2MgO (т) + 4NO2 (г) + О2 (г)
4НС1 (г) + О2 (г) = 2Н2О (г) + 2С12 (г)
2NaHCO3 (т) = Na2CO3 (т) + Н2О (г) + СО2 (г)
СаСОз (т) = СаО (т) + СО2 (г)
магнетит Fe3O4 (т) + Н2 (г) = 3FeO (т) + Н2О (г)
Са(ОН)2 (т) + СО2 (г) = СаСОз (т) + Н2О (г)
2СО (г) + SO2 (г) = S (т) + 2СО2 (г)
Са3(РО4)2 (т) + 3SiO2 (т) + 5С (т) = 3CaSiO3 (т) + 2Р
(белый) (т) + 5СО (г)
2NO2 (г) + О3 (г) = О2 (г) + N2O5 (г)
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г)
2AgNO3 (т) = 2Ag (т) + 2NO2 (г) + О2 (г)
Н2 (г) + СО2 (г) = Н2О (г) + СО (г)
СОа (г) + 4Н2 (г) = СН4 (г) + 2Н2О (г)
СО (г) + ЗН2 (г) = СН4 (г) + Н2О (г)
32
Номер
задачи
16
17
18
19
20
21
22
23
24
25
26
27*
28*
29*
30
Термохимическое уравнение реакции
4СО (г) + 2SO2 (г) = S2 (г) + 4СО2 (г)
Н2 (г) + НСОН (г) = СНзОН (г)
H2S (г) + СО2 (г) = Н2О (г) + COS (г)
H2S (г) + COS (г) = Н2О (г) + CS2 (г)
2H2S (г) + СО2 (г) = 2Н2О (г) + CS2 (г)
4H2S (г) + 2SO2 (г) = 3S2 (г) + 4Н2О (г)
СН4 (г) + 2H2S (г) = CS2 (г) + 4Н2 (г)
СНзОН (г) + СО (г) = СНзСООН (г)
FeO (т) + СО (г) = Fe (т) + СО2 (г)
2С10Н8 (т) = СиНк, (т) (фенантрен) + С6Н6 (г)
2NaNO3 (т) = 2NaNO2 (т) + О2 (г)
С6Н6 (ж) + ЗН2 (г) = C6Hi2 (ж)
С2Н5ОН (ж) = С2Н4 (г) + Н2О (ж)
СН4 (г) + СО2 (г) = 2СО (г) + 2Н2 (г)
РС15 (т) + Н2О (г) = РОС18 (ж) + 2НС1 (г)
* Тепловые эффекты вычислять по теплотам сгорания.
$ 6. РАСЧЕТ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
В РАСТВОРАХ ПО СТАНДАРТНЫМ ТЕПЛОТАМ
ОБРАЗОВАНИЯ ИОНОВ
При расчете тепловых эффектов химических реакций,
протекающих в водных растворах, следует учитывать дис-
социацию химических соединений. Для тех химических
соединений, которые диссоциируют в растворе, в расчетах
нужно брать стандартные теплоты образования соответ-
ствующих ионов, а для тех, которые не диссоциируют, —
стандартные теплоты образования соединений. Стандарт-
ная теплота образования иона в водном растворе — это
тепловой эффект образования гидратированного иона из
простых веществ.
Тепловой эффект вычисляется также по уравнению
(11,6). Ион гидроксония Н3О+ условились писать в термо-
химических уравнениях в виде Н+си/. Теплота образова-
ния иона H+aq условно принята равной нулю.
Пример 1. Определить тепловой эффект реакции, протекающей
в растворе при 25° С, если реагирующие вещества находятся в виде
ионов:
3Fe (NO3)2fl^ + 4HNO3atf = 3Fe (NO3)3a0 + NO (г) + 2H2O (ж)
Д//р2+= —87,9 кдж[г-ион, ЬНf 3 = —206,57 кдж(г-иой.\
2—1741
33
Atfp3+ = —47,7 кдж^-ион, ДН^О(Г) = 90,37 кдж/моль;
д^н.О (ж) _ —285,84 кдж/моль.
Решение. В ионном виде данное уравнение примет вид
3Fe2+a^ 4- 10NO~a^ 4- 4Н+а^ = 3Fe3+a0 + 9NO~a^ 4.
4- NO (г) + 2H2O (ж)
После приведения подобных членов
3Fe2+O0 4- NO^Ti^ 4- 4Н+а0 = 3Fe3+fl9 + NO (г) 4- 2Н2О (ж)
Согласно первому следствию закона Гесса [уравнение (11,6)]
Д/7 = Зд/7^е3+а? + ДЛ^° <г) 4- 2ДЛ^’° (ж) — ЗД/7р2+й» —
— Д/7^°ГЯ? — UH^+a<r = 3 (— 47,7) 4- 90,37 4- 2(— 285,84) —
— 3( — 87,9) — ( — 206,57) = — 154,14 кдж.
Задачи
1-30. Вычислить тепловые эффекты-химических реак-
ций в растворах при 25° С по стандартным теплотам об-
разования химических соединений и ионов.
Уравнение реакций
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
ЗСи (т) + 8HNO3 aq = 3Cu(NO3)2 aq 4- 2NO (г) 4- 4Н2О (ж)
А1г(5О4)з (т) = АЬ (SO4) з а?
2As (т) + 5С12 (г) 4- 8Н2О (ж) = 2H3AsO4 aq 4- ЮНС1 aq
NO (г) + NO2 (г) 4- 2NaOH aq = 2NaNO2 aq 4- H2O (ж)
2HNO2 aq 4- 2HI aq = I2 (r) 4- 2NO (r) 4- 2НгО (ж)
Ag (t) 4- FeC13fl<7=AgCl (t) 4- FeCl2a<7
SO2 (r) 4- H2O (ж) 4- NO2 (r) = H2SO4 aq 4- NO (r)
3P (t) + 5HNO3 aq 4- 2H2O (ж) = 3H3PO4 aq 4- 5NO (г)
HNO3 aq 4- 3HC1 aq = 2H2O (ж) 4- NOCI (r) 4- Cl2 (r)
2NO2 (г) + H2O (ж) = HNO3a<7 4- HNO2o<7
Al2(SO4)3 (T)4-6NaCI а<7=2А1С13 a<74-3Na2SO4 aq
Na2CO3 aq 4- Ca(OH)2 (т) = СаСОз (т) + 2NaOH aq
3Hg (ж) + 8HNO3a? = 3Hg(NO3)2<i<7 4- 2NO (r) 4- 4H2O (ж)
2NaOHa<? + Hg(NO3)2a<7 = 2NaNO3a<? + HgO (t) 4-
4-H2O (ж)
CaSO4 (t) 4- Na2COsa<7 = СаСОз (т) + Na2SO4a<?
2KMnO4 aq 4- 16HC1 aq = 2KC1 aq 4- 2MnCl2 aq 4-
4- 8H2O (ж) 4- 5Ch (r)
34
Уравнение реакций
1 17
IS
19
20
2f
22
23
24
25
26
27
28
2)
30
10FeSO4 aq 4- 2KMnO4 aq 4-8H2SO4 aq = 5Fe2(SO4)3 aq 4-
+ 2MnSO4 aq 4- K2SO4 aq 4- 8H2O aq
Cd (t) + CuSO4 aq = CdSO4 aq + Си (t)
Cu (t) + 2H2SO4 aq = CuSO4 aq 4- SO2 (г) + 2H2O (ж)
H2O (ж) + SO3 (г) = H2SO4 aq
12(г)+Н2О (ж) + Ыа25О3 a?=2HI ao4-Na2S04 aq
2HMnO4a<7 + 5HNO2a<7 = 2Mn(NO3)2 ш? + HNO3a<? +
+3H2O (ж)
2NO2 (r) + 2NaOH aq = NaNO3 aq + NaNO2 aq + H2O (ж)
SO2 (г) + H2O (ж) + NO2 (r) - H2SO4 aq 4- NO (r)
NaOH aq + HC1 aq = NaCl aq + H2O (ж)
2NaOH aq + H2SO4 aq = Na2SO4 aq + 2H2O (ж)
Cu (t) + 2AgNO3a<? = Cu(NO3)2a<? + 2Ag (t)
2Li (t) + CuSO4 aq = Li2SO4 aq 4- Cu (t)
3Fe(NO3)2a<7 + 4HNO3a<? = 3Fe(NO3)3a? + NO (r) 4-
+ 2H2O (ж)
MnO2 (т) + 4HC1 aq = MnCl2 aq + Cl2 (г) + 2H2O (ж)
§ 7. МЕТОДЫ ПРИБЛИЖЕННОГО РАСЧЕТА ТЕПЛОВЫХ ЭФФЕКТОВ
При отсутствии данных о теплотах образований или
сгорания веществ, участвующих в реакции, можно вы-
числить тепловой эффект реакции, используя для этого
' методы приближенного расчета тепловых эффектов, на-
пример по энергиям химических связей, или по методу по-
правок.
1. Расчет теплоты образования вещества по энергиям
химических связей. В этом методе расчета сначала пред-
полагают разложение исходных простых веществ на ато-
мы, а затем образование из них конечного газообразного
соединения. Первый этап связан с затратой энергии на
разрыв связей в исходных простых веществах, а второй —
С выделением энергии образования новых связей. Поэто-
му теплота образования газообразного вещества в соот-
ветствии с законом Гесса может быть определена по
уравнению
= 2петсх + 2п*(?возг — £иепр°я, (11,8)
где п — число связей данного вида; е — энергия разрыва
дли образования связи; п* — число атомов твердых эле-
ментов; QB03r — теплота возгонки твердого элемента.
Энергия химической связи — это доля поглощенной
2* 35
энергии, которая приходится на данную связь при полной
диссоциации молекулы на свободные атомы.
2. Расчет теплоты образования органических веществ
методом поправок. При расчете ДН^ 298 методом поправок
выбирается простейшее (основное) вещество в данном го-
мологическом ряду. Теплота образования этих простей-
ших веществ приведена в справочных таблицах. В этом
веществе производится замена атомов водорода на груп-
пы СН3, необходимые для построения углеродного скеле-
та химического соединения. Затем группы СН3 замещают
на другие группы и в случае необходимости заменяют
одинарные связи двойными или тройными связями. При
всех этих замещениях указываются тепловые поправки,
которые берутся из соответствующих таблиц*. Тепловые
поправки суммируются с теплотой образования основного
вещества. Полученная сумма и есть искомая теплота об-
разования вещества в газообразном состоянии.
При внесении поправок на замещение Н на СН3 в ис-
ходном веществе следует различать поправки на первич-
ное и вторичное замещение. При вторичном замещении
поправки следует вносить, исходя из типовых чисел ато-
ма углерода, у которого произведено замещение (А), и
соседнего атома углерода (В). Типовое число определяет-
ся по числу связей данного атома углерода с другими
атомами углерода:
1 2 3 4 5
-сн3 \сн2 —СН — С— С
Z / I
в бензольном или
нафталиновом кольце
При наличии нескольких соседних атомов углерода
выбирают поправку для того атома, типовое число кото-
рого максимально.
Пример 1. Вычислить по энергиям химических связей стандарт-
ную теплоту образования этилового эфира при 25° С в жидком со-
стоянии, если _ 2р(29 кдж/моль. Полученное значение
теплоты образования сравнить с табличным значением Д/7у 298 —
* Таблицы тепловых поправок приведены, например, в «Кратком
справочнике физико-химических величин», под ред. К. П. Мищенко
и А. А. Равделя. Изд-во «Химия», 1967. При помощи этих таблиц
(с использованием других поправок) можно вычислить также тепло-
емкость и абсолютные энтропии химических соединений.
36
— 273,20 кдж/моль и рассчитать расхождение между табличной
и вычисленной величинами
Решение Составляем уравнение реакции образования этило-
вого эфира из простейших веществ
4С(граф) + 5Н2 (г) + 1/2O2 (г) = (С2Н5)2О (ж) + ЬНХ
Теплота возгонки углерода 523 кдж/г-атом;
ен_н= 431,9 кдж/моль', е0_0 = 493,8 кдж/моль;
ес_н =357,98 кдж/моль; гс_с = 262,30 кдж/моль;
ес_0= 314,0 кдж/моль.
В соответствии с уравнением (11,8)
А^/,298 = 4(0возг)с + 5sH-H + 1/2е0-0 ЮеС—Н %еС—С —
— 2ес_0 = 4-523 + 5-431,9+ 1/2439,8- 10 357,98 — 2 262,3 —
— 2-314,0= —234,0 кдж/моль.
Полученное значение ЬНд2д8 относится к газообразному эти-
ловому эфиру, Д//д298 жидкого этилового эфира равно
ДТ//,298 (^2^5)2® (ж) = ДЯ/,298 (^2^5)2® (г) ДТ/исп =
= —234,0 — 26,29 = —260,29 кдж/моль.
Рассчитываем расхождение между табличной и вычисленной вели-
чинами
273,2—260,29 „
---Н—-----:--- 100 = 4,72%.
273,2 /0
Пример 2. Вычислить стандартную теплоту образования жидко-
го этилового эфира (СгНд^О методом поправок при 25° С, если
Д<п!”з)2° =26,29 кдж/моль. Полученное значение теплоты обра-
зования сравнить с табличным значением ЬНf 29g — 273,20 кдж/моль
и вычислить расхождение между ними
Решение За простейшее вещество принимаем диметило-
вый эфир
ДТ//,298 s),° = —185,4'кдж/моль.
Вносим тепловые поправки при получении диэтилового эфира из
Диметилового путем замещения 2Н на две группы СНз, которые со-
ставляют —29,3 кдж/моль каждая.
Суммируя Д///,298 простейшего вещества с тепловыми поправ-
ками для двух приведенных замещений, получаем теплоту образова-
ния газообразного этилового эфира
ДЯ^298= — 185,4 — 58,6= —244,0 кдж/моль.
37
Теплота образования жидкого этилового эфира равна
Д/Zj 298 = —244,0 — 26,29= —270,29 кдж/моль.
Расхождение между вычисленной и табличной величиной составляет
273,2 — 270,29
273,2
100 = 1,07%.
Пример 3. Вычислить стандартную теплоту образования жидко-
го бутилового спирта методом поправок, если =
=43,80 кдж/моль. Рассчитать расхождение между полученным и таб-
личным значением ДЛ/у298, равным —327,80 кдж/моль.
Решение. За простейшее вещество принимаем метан.
Д^/?298 = —74,9 кдж/з/оль.Последовательность замещения в про-
стейшем веществе:
Производимые замещения Структурная формула Типовые числа А-В Тепловая поправка, кдж1моль
Первичное замеще- ние Н на СНз СНз—СН3 1—1 —9,2
Вторичное замещение Н на СНз СНз—СНз—СНз 1—2 —18,8
Вторичное замещение Н на СНз СНз—СН2—СН2—СНз 1—2 —21,8
Вторичное замещение Н на СНз Замещение СНз на ОН Общая тепловая попрг СНз—СН2—СН2—СН2— —СНз • СН3-СН2-СН2— —СН2ОН вка составляет — 208,4 кд. ж /моль —21,8 -136,8
Суммируя ДТ/у, 298 простейшего вещества с тепловыми поправ-
ками, получаем теплоту образования газообразного бутилового
спирта:
Д^у 298= —74,9 — 208,4= —283,3 кдж/моль.
Теплота образования жидкого бутилового спирта равна
д77/,298~ —283,3 — 43,8= —327,1 кдж/моль.
Расхождение между вычисленным и_ табличным значением
составит
327,8 — 327,1
327,8
100 = 0,21%.
38
( Пример 4. Вычислить стандартную теплоту образования твердо-
го стирола СвНбСН = СН2 (т) при 25° С методом поправок, если
Д/7”“рола = 37,28 кдж/моль, Д7/Пл = 10,95 кдж/моль.
* Полученное значение теплоты образования сравнить с табличным
Значением Д/Уу1298 = 99,13 кдж/моль.
Решение. За простейшее вещество принимаем бензол;
= 82,8 кдж/моль. Последовательность замещения в про-
стейшем веществе:
Производимые вамещения *4, Структурная формула Типовые числа А—В Тепловая поправка, 'лкдж/молъ
Первичное замещение i-H на СНз (В) (А) С6Н5СН3 1—5 — 18,8
Жторичное замещение Г Н иа СНз C6Hj—СНз—СНз 1—2 -25,5
Вымещение одинар- Is ной связи двойной С6Н5—СН = СН2 125,5
Замещение двойной ' связи, смежной с ‘ ароматическим “ кольцом —21,3
Общая тепловая поправка
составляет 59,9 кдж-моль.
поправ-
Суммируя ДТ/д2д8 простейшего вещества с тепловыми
ками для различных замещений, получаем теплоту образования газо-
образного стирола.
Д//у>298 = 82,8 + 59,9 = 142,7 кдж/моль.
Теплота образования твердого стирола составляет -*
Д7/д298 = 142,7 — 37,28 — 10,95 = 94,47 кдж/моль.
|Рассчитываем расхождение между вычисленным и т"бличным зна-
чениями:
99,13 — 94,47
—------------ 100 = 4,66%.
Задачи
ч
1-30. Вычислить теплоты образования органических
веществ по методу поправок и по энергиям связей • при
* Таблицы значений энергий связей приведены в «Кратком спра-
вочнике физико-химических величин», под редакцией К. П. Мищен-
ко и А. А. Равделя. Изд-во «Химия», М. — Л., 1967.
39
256 С. По полученным Значениям теплот образования *
для газов вычислить теплоты образования для указанно-
го агрегатного состояния и рассчитать расхождение меж-
ду вычисленными и табличными данными.
S ЕГ Л н л я Q <U S о X Органическое соединение Формула Агрегатное состояние Теплота обра- зования, кдж/моль (в с и S А Я о 5 «5. ф ф г© СО я е л я о н о « S 5 s & а а ч Ь ч ье
1 Глицерин СзН8Оя Ж —659,4 76,023
2 Бутиловый спирт (трет) OjHjoO Ж —369,5 39,67 —-
3 Метилэтилкетои С4Н8О Ж —278,99 37,45 —-
4 Амиловый спирт (тре- тичный) С5н]2о Ж —398,73 46,024 —
5 Валериановая кисло- та с5н10и2 Ж —548,1 44,016 —
6 Гексиловый спирт (н) С6н14о Ж -395,15 64,85 —
7 Бензиловый спирт С7Н6О Ж — 161,04 50,46 —-
8 Амиловый спирт (н) С5Н12О Ж —360,1 52,09 —-
9 Циклогексанол С6Н]2О ж —350,83 45,48 —
10 Фенол С6н6о ж —162,76 48,116 11,255
11 Нитрометан CH3O2N ж — 113,0 38,271 —
12 Пропиловый спирт (н) c3N8o ж —306,6 46,233 —-
' 13 Бензойная кислота С7н6о т - 385,2 86,107 23,305
14 Диэтиламин C4HnN ж — 125,94 31,982 —
15 Уксусиоэтиловый эфир С4Н8О2 ж —469,5 36,39 —*
15 Этиловый спирт С2Н5ОН ж —278,32 43,22 —-
17 Уксусная кислота С2н4и2 ж —484,9 47,5
18 Гидрохинон С6Н6О2 т —362,9 99,15 27,11
19 2,4-диметилрентан С7Н]6 ж —231,7 29,62 —
20 Циметилацетилен c4Hg ж —119,8 26,53 —
21 Зпирт аллиловый С3н6о ж -186,2 39,67 —
22 Ацетальдегид С2Н4О ж —190,4 24,4 —
23 Этиленгликоль С2Н8О2 ж —454,8 56,9 —
24 Метилацетилен (н) С3Н4 г —185,43 — —>
25 Читроэтан С2Н3О2^ ж —140,1 38,07 —
26 -нитропропан C3H7O2N ж —167,6 43,38 —
27 Гнитропропан c3h7o2n ж —183,2 41,34 —
28 2,2-диметилбутан ОбНи ж —211,9 26,36 —
29 <лорбензол С6Н5С1 ж — 10,65 41,48 —-
30 Ацетон (СН3)2СО ж -247,7 35,3 —
* Определение теплот образования по энергиям связей для аро-
матических соединений ие дает удовлетворительных результатов.
40
§ в. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА ХИМИЧЕСКОЙ РЕАКЦИИ
ОТ ТЕМПЕРАТУРЫ (ЗАКОН КИРХГОФА)
Зависимость теплового эффекта реакции от температу-
ры (при постоянных давлении или объеме) определяется
уравнениями Кирхгофа:
I dQp\ / дкН \
I--/ — I-----«Г ) - ДС'
\ дТ / р \ дТ > р
(11,9)
(П.Ю)
моляр-
где ДС=2 (пС) пр°Д— 2(пС)исх— разность сумм
ных теплоемкостей (Ср или Cv) продуктов реакции и
исходных веществ,- взятых с учетом стехиометрических
коэффициентов.
Уравнения (11,9) и (11,10) дают возможность вычис-
лять тепловые эффекты реакций при любой темпе^агу-
‘ ре Т, если известна зависимость теплоемкостей всех
реагентов в рассматриваемом интервале температур и
тепловой эффект реакции при какой-либо одной темпера-
туре. Уравнение Кирхгофа в интегральной форме имеет
вид
т, -
ДЯ2 = ДЯ1+ §kCPdT. (11,11)
T1
Зависимость теплоемкости от температуры СР = ^(Г)
выражается в виде одного из двух эмпирических степей-
ных рядов: Ср == а + ЬТ + с’Т~г (11,12)
или СР = а + ЬТ + сТ2. (П,13)
Отсюда кС р = ка + кЪТ + ксТ2 + Дс'Т-2. (11,14)
После подстановки уравнения (11,14) в уравнение
(11,10) и интегрирования получим зависимость теплового
эффекта от температуры:
кН = ДЯ0 + каТ + ‘/гД&Гг + 7зДсТ3 - Дс'1/Т, (11,15)
где кН0 — постоянная интегрирования, которая определя-
ется по полученному опытному тепловому эффекту при
41
одной какой-либо температуре. Уравнение (11,15) спра-
ведливо только в том интервале температур, для которого
справедливы эмпирические уравнения (11,12) и (11,13)
для теплоемкостей веществ, участвующих в реакции.
Интегрирование уравнения (11,10) после подстановки
(11,14) можно вести в интервале температур от Л и Т%.
При этом получим
ДЯ2 = ДЯ1 + Да (Т2 - Л) + г/гА6 (Т22- Г?) +'
+ ‘Mc(7l - Л3) +Дс'(1/Л - 1/Т2). (11,16)
Пример 1. Определить зависимость теплового эффекта реакции
2Н2 (г) + СО (г) = СН3ОН (г)
от температуры при постоянном давлении, если стандартные тепло-
ты образования для СО (г) и СНзОН (г) соответственно равны
—110,5 и —201,2 кдж]моль, а зависимость мольной теплоемкости
реагентов от температуры описывается следующими уравнениями:
С%‘ = 27,28 + 3,26-10“3Т + 0,502- 105Г~2 дж/моль-град,
С%° =28,41 + 4,10-10~3Г —0,46-Ю5/-2 дж/моль-град.
Ссн,он(г) = 15(28 + 105,2-10—3Г —3,104-10-5Г2 дж/моль-град.
Вычислить тепловой эффект этой реакции при 500° К и постоян-
ном давлении.
Решение. 1. Определяем АСР по уравнению (11.14).
Да = 15,28-28,41 —2-27,28 = —67,69,
Дй = 105,2- 10-3—4,10-10-3 —2-3,26-10~3 = 94,58-10~3,
Дс = — 31,04-10-6,
Дс' =0,46-105 — 2-0,502-105 = — 0,544-105,
отсюда ДСР= — 67,69 + 94,58-Ю'3?’ —31,04-Ю-6/2 —
— 0,544 • 105Г—2.
2. Определяем тепловой эффект реакции при стандартных усло-
виях для температуры 298° К на основании первого следствия из
закона Гесса, пользуясь теплотами образования веществ, входящих
в данную реакцию
Д//298 = —201,2+ 110,5= —90,7 кдж нли —90 700 дж.
3. Выражаем тепловой эффект, как функцию температуры по
уравнению (11,15)
Д/7 = Д^ — 67,697’ + 10-37’2 —10-6Г + 0,544- id5/*—1.
2 3
42
4. Определяем ДН0 по значению ЛН при 298° К:
Д//о= — 90700 + 67,69-298 —-у— 10-3-2982 +
31,04 к « с 1
+ —~ 10-62983 — 0,544-105 — = —74 540 дж.
ЬН = — 74 540 — 67,697 + 10~372 — 10~673 +
2 3
+ 0,544-1О57’~1.
5. Определяем ДЯ при 500° К:
д//500о= -74 540 — 67,69-500 + ^~ 10-3-5002 — ^^ х
2t 3
х 10-6-5003 + 0,544-105 = —97 750 дж = —97,75 кдж'.
Значение ДЯ при 500° К можно рассчитать по формуле (11,15);
подставляя 71=298° К и 7'2=500° К, получим
Д/75(Х)О = — 90 700 — 67,69 (500 — 298) + -у- 10~3 (5002 — 2982) —
-31,04-10-6 ч , ч
----4------(5003 — 2983) — 0,544-105
= — 97 750 дж.
Пример 2. Мольная теплота метилового спирта при 25° С состав-
ляет 37,4 кдж/моль. Определить теплоту испарения метилового спир-
та при 50° С, если мольная теплоемкость жидкого и газообразного
метилового спирта соответствеиио равны 81,6 н 43,9 дж/моль-град.
Считать теплоемкость в интервале температур 25—50° практически
постоянной.
Решение. Согласно уравнению (11,11)
т,
Д/Л>Исп = А/Л,исп+ f ^pdT,
Ti
~ 323
ДЯ2 исп = 37 400 + ( (43.9 — 81 >6) dT = 36 460 дж/моль,
298
или 36,46 кдж/моль.
43
Задачи *
1. Для реакций
С (граф^Н- СО2(г) = 2С0 (г)
и С (граф) + Н20 (г) = СО (г) + Н2(г)
тепловые эффекты при постоянном давлении и 500° К со-
ответственно равны 173,6 и 133,9 кдж. Рассчитать тепло-
вой эффект реакции
СО (г) + Н2О (г) = СО2 (г) + Н2 (г)
при 1000° К, если мольные теплоемкости равны:
Ср° =28,41 + 4,10-10-3Т — 0,46 • 105?"2 дж/моль • град,
сн2о(г) = 30,00 + 10,71,10-з7-_0(зз. 1057-2 дж/моль-град,
Ср°‘ = 44,14 + 9,04-10-3Т — 8,53- Ю5?"2 дж/моль-град,
Ср2 = 27,28 + 3,26 • 10-’Т + 0,502 • 105Т-2 дж/моль - град.
2. Мольные теплоемкости окиси углерода, хлора и
фосгена равны:
Ср° = 28,41+4,10-10-3Т —0,46-105Т-2 дж/моль-град,
Ср2 = 36,69 + 1,05 • 10-3Т -2,52-105Т-2 дж/моль - град,
Ссоа2 = 6716_|_12>11. ю-зт-9,03- IO5?-2 дж/моль-град.
Стандартные теплоты образования окиси углерода и
фосгена соответственно равны —110,5 и —223,0 кдж!моль.
Вычислить тепловой эффект при постоянном объеме для
реакции
СО + С12 = СОС12
при температуре 600° К.
3. Теплота диссоциации карбоната кальция по реак-
ции
СаСОз (т) = СаО (т) + СО2
* Теплоемкость твердых и жидких веществ можно приблизи-
тельно считать не зависящей от температуры и одинаковой при по-
стоянных давлении и объеме. Численные значения тепловых эффек-
тов реакций приводятся при условии постоянства давления. Предпо-
лагается, что газообразные реагенты подчиняются законам идеаль-
ных газов.
44
при 900° С равна 178,0 кдж/моль. Мольные теплоемкости
веществ:
,,СаСОа(т)
Ср =
= 104,5 + 21,92-10~37’ —25,94-Ю5?-2 дж/моль-град,
^,саО(т)__ 49,03 4,52.1Q-3Т — 6,95- Ю5?-2 дж/моль-град,
Ср°2(г) = 44,14+ 9,04- 10-3Т-8,53- 105Т-2 дж/моль-град.
Вывести уравнение зависимости теплового эффекта
этой реакции от температуры. Определить количество
теплоты, поглощенное при разложении 1 кг карбоната
кальция при 1000° С.
4. Теплота испарения воды при 30° С равна
2427 кдж/кг, а при 20° С — 2452 кдж/кг. Оценить среднее
значение мольной теплоемкости водяного пара в интер-
вале температур от 20 до 30° С, если мольная теплоем-
кость жидкой воды 75,31 дж/моль-град. Вычислить рас-
хождение между полученным и табличным значением
33,56 дж/моль-град при постоянном давлении водяного
пара в этом интервале температур.
5. Стандартные теплоты образования FeO (т), СО (г)
и СОг (г) соответственно р'-авны —263,7; —110,5;
—393,5 кдж/моль. Определить количество теплоты, кото-
рое выделится при восстановлении 100 кг окиси железа
(II) окисью углерода при 1200° К и постоянном давлении,
если мольные теплоемкости реагентов равны:
Ср6 — 19,25 + 21,0-10-3Г дж/моль-град,
СТ2 = 44,14 + 9,04-10-3Г —8,53-1057-2 дж/моль-град,
Ср° =28,41+4,10-10-3Г —0,46-105Т-2 дж/моль-град,
СТ° = 52,80 + 6,24-10-3Т —3,19-105Т-2 дж/моль-град.
6. Вывести уравнение зависимости теплового эффекта
реакции
СН4(г) = С (т) + 2Hz (г)
от температуры, а также вычислить тепловой эффект
этой реакции при 1000° К, если его значение при стан-
дартных условиях равно 74,85 кдж, а мольные теплоемко-
сти реагентов составляют:
45
Ср = 11,19+ 10,95-IO-3? —4,89-Ю5!-2 дж/моль-град,
Ср1 = 27,28 + 3,26- Ю-3? + 0,502- Ю5?-2 дж/моль-град,
СрН<= 17,45 +60,46-10-3Г+ 1,12- 10~вГ2 дж/моль-град.
7. Вычислить теплоту образования хлорида алюминия
при 500° К, если стандартная теплота образования равна
—697,4 кдж/моль, мольные теплоемкости А1С13 (т), А1 (т)
и С12 (г) соответственно равны:
С^ = 55,44 +117,2 • 10-3Т дж/мол ь-град,
Ср1 — 20,67 + 12,39-4 0-8Т дж/моль-град,
Ср2 = 36,69 + 1,05• 10-3Т — 2,52- 105Т-2 дж/моль-град,
температура плавления А1С1з 465,6° К и теплота плавле-
ния 35,48 кдж/моль, мольная теплоемкость жидкого
А1С13 130,5 дж/моль-град.
8. Вычислить тепловой эффект реакции
СН4(г) + 2Н2О(г)= СО2(г) + 4Н2(г)
при 500° С, если он при стандартных условиях равен
165,0 кдж, а значения мольных теплоемкостей следую-
щие:
Сры‘= 17,45 + 60,46- IO-3? + 1,12- Ю+Г2 дж/моль-град,
Ср 2°= 30,00 + 10,71 • 10~3Т + 0,33- 105Т-2 дж/моль-град,
С₽°! == 44,14 +9,04-10-3Т —8,53-105Т-2 дж/моль-град,
Ср‘ = 27,28 + 3,26 • 10~3Т + 0,502 - 105Т-2 дж/моль - град.
9. Рассчитать теплоту образования AgCl (т) при
150° С, если ДЯ/айсКт)=—126,8 кдж, а значения мольных
теплоемкостей следующие:
СрА8(т)= 23,97 + 5,28 • 10~3Т — 0,25 • 105?-2 дж/моль - град,
С^(г) = 36,69 + 1,05- 10-3Т — 2,52- 105T~2 дж/моль-град,
С/8а(т= 62,26 + 4,18-10-3Т — 11,30-105Т-2 дж/моль-град.
46
10. Вычислить тепловой эффект реакции
СО (г) + 2Н2(г) = СНзОН (ж)
при 500 и 1000° К, если при 300° К тепловой эффект этой
реакции равен 90,72 кдж, а значения мольных теплоемко-
стей следующие:
Ср° = 28,41 + 4,10 • 10-3Т — 0,46 • 1О5?-2 дж/моль град,
Ср2 = 27,28 + 3,26-10~3Т + 0,502-105Т-2 дж/моль-град,
^,сн3он(ж)_ дж/моль-град.
11. Для этана, этилена и водорода зависимости тепло-
емкостей от температуры описываются следующими урав-
нениями:
СрзНв = 4,49 + 182,3-10-3Т — 74,86- Ю'6?2 дж/моль • град,
CpSi =4,20+ 154,6 • 10-3Т -81,10-10-®?2 дж/моль • град,
СРН’= 27,28 + 3,26-10-3Т + 0,502- Ю5?-2 дж/моль-град.
Вычислить тепловой эффект реакции гидрирования этиле-
на при 300 и 1000° К.
12. Мольные теплоемкости при постоянном объеме для
водорода, кислорода и водяного пара имеют следующие
значения:
Cv2 = 18,97 + 3,26- 10-3Г + 0,502- Ю5?-2 дж/моль • град,
С°’= 23,15 + 3,39-10-3T —3,77-105Т-2 дж/моль-град,
С#2° = 21,7 + 10,71 • 10~3Т + 0,33- IO5?-2 дж/моль-град.
Удельная теплота сгорания водорода (в жидкую воду)
при 0°С равна —142,2 кдж/г. Удельная теплота испаре-
ния воды при 0°С 2551 дж/г. Рассчитать мольную теплоту
образования водяного пара при 100° С.
13. Тепловой эффект реакции
СО(г) + ‘/2О2(г) = СО2(г)
при 0° С и постоянном давлении составляет
—284,5 кдж!моль, а мольные теплоемкости участвующих
в реакции веществ имеют следующие значения:
47
Cv 2 = 35,83 + 9,04-10-3Г —8,53-Ю5г-2 дж/моль • грею,
С? = 20,1 + 4,10-10-37'— 0,46- 105Т-2 дж/моль-град,
С°2 = 23,15 + 3,39- 10-3Т- 3,77- 105Т—2 дж/моль-град.
Рассчитать тепловой эффект реакции при постоянном
давлении и температурах 25 и 727° С.
14. Средняя удельная теплоемкость бензола в интер-
вале температур от 0 до 80° С 1,745 дж/г-град. Мольная
теплоемкость ацетилена в том же температурном интер-
вале 43,93 дж)моль-град. Тепловой эффект реакции
ЗС2Н2 = С6Н6
при стандартных условиях — 630,8 кдж. Рассчитать тепло-
вой эффект этой реакции при 75° С.
15. Мольные теплоемкости С12 (г), Н2(г) и HCI (г) при
постоянном объеме имеют следующие значения:
Су2 = 28,38 + 1,05- 10~~3Г — 2,52- 105Т-2 дж/моль-град,
Су2 = 18,97 + 3,26- 10-3Т + 0,502- Ю5?"2 дж/моль-град,
С^1 = 18,22+ 4,6-10-3Т+ 1,09-105?"2 дж/моль-град.
Определить температурную зависимость теплового эф-
фекта реакции
0,5Н2 + 0,5С12 = НС1
при постоянном давлении, если при 25° С он равен
— 92,3 кдж/моль. Рассчитать тепловой эффект данной
реакции при 1000° С.
16. Вычислить мольную теплоту испарения воды при
120° С. Удельная теплота испарения воды при 100° С
2255 дж/г. Удельные теплоемкости жидкой воды и пара
соответственно равны 4,184 и 1,864 дж/г-град (считать их
приближенно постоянными в этом интервале темпера-
тур) .
17. Рассчитать тепловой эффект реакции
2Н2 + О2 = 2Н2О (г)
при 1000° К, если Л//^Нг0(Г)=—241,84 кдж/моль, а значе-
ния мольных теплоемкостей следующие:
48
Ср2 = 27,28 + 3,26• ю-зт + 0,502• 105Т~2 дж/моль• град,
Ср = 31,46 + 3,39- IO-3! — 3,77- Ю5?-2 дж/моль-град,
cf2°m= 30,00 + 10,71 • 10-3Т + 0,33- 105T~2 дж/моль-град.
18. Теплота конденсации этилового спирта при 15° С
равна —27,62 кдж/моль. Средние удельные теплоемкости
жидкого спирта и его пара в пределах от 0 до 78° С соот-
ветственно равны 2,418, и 1,597 дж/г-град. Определить
количество теплоты, необходимой для испарения 500 г
спирта при 60° С.
19. Вычислить тепловой эффект реакции гидрирования
этилена
С2Н4+Н2 = С2Н6
при 1000° К, если при стандартных условиях он равен
128 кдж, а значения мольных теплоемкостей следующие:
СрН’ = 4,50 + 182- 10-3Т — 74,86- дж/моль-град,
27,28 + 3,26- 10-3Т+ 0,502 - Ю5?-2 дж/моль-град.
Ср2Н‘= 4,20+ 154,59-10-3Т —81,09-10^ дж/моль-град.
20. Вычислить теплоту образования аммиака при
700° С, если при 25° С она равна 46,19 кдж!моль, а моль-
ные теплоемкости следующие:
С₽ Нз= 29,80 + 25,48-10-3? +1,67- 105Т~2 дж/моль 'град,
Су2 = 18,97 + 3,26-10-3Т + 0,502• 105Т~2 дж/моль-град,
Су2— 19,57 +4,27-Ю-3?1 дж/моль-град.
21. Удельная теплота сгорания графита при 290° К
равна —394,5 кдж/г-атом, а удельная теплота сгорания
алмаза при той же температуре —395,4 кдж/г-атом.
Удельные теплоемкости этих веществ соответственно рав-
ны 0,710 и 0,505 дж/г-град Рассчитать тепловой эффект
аллотропного перехода графита в алмаз при 0° С.
49
22. Вычислить теплоту образования окиси цинка при
327° С, если ее A7+Zn0(T)=—349,0 кдж!моль. Мольные теп-
лоемкости ZoO(t), Zn (т) и О2(г) выражаются уравне-
ниями:
Ср == 48,99 +5,10-Ю-зТ —9,12-105Т~2 дж/моль-град,
Сра = 22,38 + 10,04- 10~3Т дж/моль-град,
Ср =31,46 + 3,39- 10-»Т — 3,77- 105Т-2 дж/моль-град.
23. Теплота затвердевания кристаллогидрата
СаС12-6Н2О при 29° С равна —170,3 дж/г, а при —160° С
равна нулю. Какова удельная теплоемкость этого соеди-
нения в жидком состоянии, если удельная теплоемкость в
твердом состоянии 1,443 дж/г-град.
24. Разница в удельной теплоте растворения 1 г моно-
клинической и ромбической серы при 0° С равна
—10,04 дж/г, а при 95,4° С —13,05 дж/г\ удельная тепло-
емкость ромбический серы в этих интервалах температур
0,706 дж/г-град. Определить удельную теплоемкость мо-
ноклинической серы. ’
25. Теплота образования СО2 при стандартных услови-
ях —393,51 кдж/моль. Мольные теплоемкости С (т),
О2 (г) и СО2 (г):
Ср = 11,19+ 10,95-10-3? — 4,89-105T-2 дж/моль-град,
Ср1 = 31,46 + 3,39- 10-3Т — 3,77- Ю5?"2 дж/моль-град,
Ср°2= 44,14 + 9,04- 10-3Т — 8,53- 105Т-2 дж/моль-град.
Составить уравнение зависимости теплоты образования
СО2 (г) от температуры и определить А/7/ <г> при
1000° С.
26. Удельная теплота конденсации бензола при 50° С
равна —414,7 дж/г и при 80° —397,1 дж!г. Удельная теп-
лоемкость жидкого бензола в этом интервале температур
1,745 дж/г-град. Вычислить удельную теплоемкость паров
бензола в этом интервале температур и рассчитать расхо-
ждение между полученным и табличным значением
1,047 дж/г-град.
50
27. .Стандартные теплоты образования газообраз-
ных СО и Н2О соответственно равны —110,5 и
—241,8 кдж!моль. Вычислить тепловой эффект реакции
С (т) + Н2О (г) = СО (г) + Н2 (г)
при 1000° К, если мольные теплоемкости участвующих в
реакции веществ выражаются уравнениями:
- Ср= 11,19+ 10,95-10-3Т — 4,89-105Т-2 дж/моль-град,
Ср° = 28,41 + 4,10- Ю-зТ — 0,46- 105Т-2 дж/моль-град,
Ср 2°= 30,00 + 10,71 • IO-3? + 0,33- 1057-2 дж/моль • град,
Ср2= 27,28 + 3,26- 10-3Т + 0,502• 1057’2 дж/моль-град.
28. Вывести температурную зависимость теплового эф-
фекта реакции
N2(r) + О2(г) — 2NO(r^
если при стандартных условиях он равен 180,74 кдж, а
зависимость мольных теплоемкостей от температуры вы-
ражается уравнениями:
Ср °= 29,58 + 3,85- IO-3? — 0,59- 105Т-2 дж/моль • град,
Ср 27,87 + 4,27- IO-3? дж/моль-град,
СР°2= 31,46 + 3,39 • 10~37 —3,77*105Т~2 дж/моль-град.
29. Стандартная теплота образования А12О3 (т)
— 1675 кдж]моль. Рассчитать теплоту образования
А12О3 (т) при 600° К, пользуясь следующими выражения-
ми для мольных теплоемкостей:
= 20,67+ 12,39-10-37 дж/моль-град,
Ср2 = 31,46 + 3,39• 10~37 — 3,77- IO5?-2 дж/моль• град,
____________________________
Ср —
= 114,56+ 12,89-10-37 — 34,31 • Ю5?-2 дж/моль-град.
51
30. Рассчитать тепловой эффект реакции
2СН4(г) + СО2(г) = СНзСОСНз (г) + Н2О (г)
при 500° К, если при 298° К он равен 84,92 кдж!моль.
Мольные теплоемкости газообразных веществ следу-
ющие:
СРСН= 17,45 + 60,46- 10-3Т + 1,117 - 10-Т2 дж/моль-град,
Ср°2— 44,14 + 9,04-10-3Т — 8,53- Ю5?-2 дж/моль-град,
-СНэСОСЩг)
Ср =
= 22,47 + 201,8- 10-3Т — 63,5- 10~«Т2 дж/моль-град,
= 30,00 + 10,71 • 10-3Т + 0,33-1О5?-2 дж/моль-град.
Глава III
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
§ 9. ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ
В РАЗЛИЧНЫХ ПРОЦЕССАХ
При переходе из состояния 1 в состояние 2 изменение
энтропии определяется соотношением
(111,1)
где знак равенства относится к обратимому процессу, а
знак неравенства — к необратимому.
В связи с тем, что энтропия является функцией состоя-
ния, ее изменение при протекании как обратимого, так и
необратимого процесса одинаково. Для определения
конечного изменения энтропии необходимо пользоваться
математическими формулами для обратимых процессов,
так как только в случае обратимых процессов в выраже-
нии (III,1) стоит знак равенства.
Изменение энтропии в сложном процессе равно сумме
изменений энтропии в отдельных стадиях процесса. Абсо-
лютное значение энтропии какого-либо вещества при лю-
бой температуре можно рассчитать, если известна абсо-
лютная величина энтропии Si при какой-либо одной тем-
пературе:
s2 = Si -f- as.
Значение Si обычно находят из справочных таблиц при
25° С и стандартном давлении 1 атм.
Изменение энтропии вычисляют по следующим урав-
нениям:
1. Изменение энтропии при нагревании п молей любо-
го вещества от температуры Ту до Tz при P = const рассчи-
тывается по формуле
7 CpdT
AS = S2-Si = nJ-—— . (Ill,2)
53
Если зависимость СР от температуры описывается выра-
жением
СР = а + ЬТ-}-сТ2,
то
Т? С 9 ,
AS = 2,303na 1g-А + nb (Т2 — Л) + п—(Т?-Т1), (II 1,3)
Л 2 -
2. Изменение энтропии при фазовом переходе рассчи-
тывается по формуле
где АН — теплота фазового перехода одного моля веще-
ства; Т — абсолютная температура фазового перехода.
3. Изменение энтропии при переходе п молей идеаль-
ного газа из одного состояния в другое вычисляется по
уравнениям:
Т2 V2
AS = 2,303/гСу lg-4 + 2,303/гЯ lg-^, (111,5)
Ji Vi
или
T2
AS = 2,303/га 1g + nb (T2 - 7\) -f-
Ti
C 9 9 V2
+ -n(T22- Л) + 2,303n/? 1g ,
2 Vi
T2 P2
AS = 2,303nCP 1g - 2,3032?« lg-£, (III,6)
Ji
или „
T2
AS = 2,303na Ig 4- nb (T2 — Ti) +
Ti
+ ~ (T2 - T2i) - 2,303/гЯ 1g ,
2 ri
PzV2
AS = 2,303nCv\Sy~~, (II 1,7)
1 1
где Vi, Pi,l\n V2, Pt, P2 — объем, давление, температура,
характеризующие начальное и конечное состояние иде-
ального газа соответственно; СР и Cv — соответственно
54
истинные мольные теплоемкости идеального газа при по-
« Ср
стоянных давлении и объеме; у = —.
Су
. 4. Изменение энтропии в процессе диффузии при сме-
шении идеальных газов (при P = const и f = const), т. е. в
изотермно-изобарном процессе, вычисляются по уравне-
нию
/ V V\
AS = 2,3032? (ntlg —+ «2lg—), (Ш,8)
' Vi Vtf
или
AS = —2,3032? (fh + n2) [WilglVi + AMglVz], (HI,9)
где nb «2 — число молей первого и второго газа; М, jV2 —
мольные доли обоих газов; Vb V2 — начальные объемы
обоих газов; V — конечный объем смеси газов (К=
= V, + V2).
5. Вычисление изменения энтропии по электрохимиче-
ским данным по уравнению
кН + zFE
(III,Ю) .
где кН — тепловой эффект химической реакции; F — чис-
ло Фарадея; Е — электродвижущая сила- (э. д. с.) элек-
трохимического элемента, в котором протекает данная
реакция; z — число электронов, участвующих в элемен-
тарном акте электродной реакции.
Пример 1. Определить изменение энтропии при превращении
2 г воды в пар при изменении температуры от 0 до 150° С и давле-
нии в 1,013-10® н/м2, если скрытая удельная теплота парообразования
воды А//=2,255 кдж/г, мольная теплоемкость пара при'постоянном
давлении
Ср = 30,13 + 11,3-10 3Г дж/моль-град.
Ср жидкой воды = 75,30 дж/моль-град.
Считать приближенно теплоемкость жидкой воды постоянной.
Решение. Данный процесс состоит из трех стадий:
1) нагревания жидкой воды от 0 до 100° С,
2) перехода жидкой воды в пар при 100° С,
3) нагревания водяного пара от 100 до 150° С.
1. Изменение энтропии в стадии 1 рассчитывается по форму-
ле (111,2), учитывая, что Ср = const,
2 373
ASj = — 75,30-2,3 1g— = 2,61 дж/град.
18 273
55
2. Изменение энтропии в стадии 2 определяется по форму-
ле (Ш,4)
„ Z-Z.ZOO-1U
AS2 =------—------= 12,09 дж/град.
о7о
3. Изменение энтропии в стадии 3 рассчитывается по форму-
ле (Ш,6)
2 423 2
AS3 = —30,1-2,3 1g—+ — 11,3-КГ3 (423-373) =
1о о/О 1о
= 0,49 дж/град.
Общий прирост энтропии составит
AS = ASj + AS2+ AS3 = 2,61 + 12,09 + 0,49 = 15,19 дж/град.
Пример 2. В одном из сосудов емкостью 0,1 м3 находится кисло-
род, в другом емкостью 0,4 м3—азот, В обоих сосудах температура
17° С я давление 1,013- 10s н/м2. Найти изменение энтропии при вза-
имной диффузии газов из одного сосуда в другой при Р и Т— const.
Считать оба газа идеальными.
Рещение. Изменение энтропии определяем по формуле (III,8).
Число молей каждого газа находим из уравнения Менделеева —
Клапейрона
71
О,
1,013-105-0,1
8,314-290
= 4,2 моль.
пЯ, —
1,013-105-0,4
8,314-290
16,8 моль,
I 0,5 0,5\
AS = 2,3-8,31414,2 Ig 16,8 Ig^J =91,46 дж/град.
Пример 3. Вычислить изменение энтропии в процессе изотермно-
го расширения 2 моль метана от Л = 101,3-105 н/м2 до Р2 = 1,013х
Х105 н/м2. Газ считать идеальным.
Решение. По формуле (111,6) при T=const находим
1,013-Ю5
AS = -2-8,314- -2,3 Ig —-------=76,4 дж/град.
101,3-105
Задачи *
1. Рассчитать мольную энтропию окиси углерода при
200° С и 50,67-Ю5 н/м?, если энтропия при 25° С и
1,013-105 я/л2 равна 197,9 дж/град-моль, а зависимость
* В условиях задач предполагается, что газы и пары подчиняют-
ся законам идеальных газов.
56
мольной теплоемкости от температуры выражается урав-
нением
СР = 28,41 + 4,10-Ю-3? — 0,46- 105Г-2 дж/моль-град.
2. Вычислить изменение энтропии при нагревании
1 кг-моль сульфида кадмия от —100 до 0°С, если зависи-
мость мольной теплоемкости от температуры в интервале
от 140 до 300° К выражается уравнением
СР = 54,0 + 3,8- 10-3Т дж/моль-град.
3. Найти изменение энтропии при нагревании 1 г-атом
кадмия от 25 до 727° С, если температура плавления
321° С и теплота плавления равна 6109 дж/г-атом:
Cpd(T)= 22,22 + 12,30-10-3Т дж/моль-град-,
Cpd(st) = 29,83 дж/моль-град.
4. Какому конечному объему отвечает изменение эн-
тропии, равное 38,28 дж]моль -град, если 1 моль идеаль-
ного газа, занимающий в данных условиях 0,02 м3, изо-
термически расширяется.
5. Насколько изменится энтропия в процессе изотер-
мического расширения 10 г криптона от объема 0,05 м3 и
давления 1,013-Ю5 н/м2-до объема 0,2 м3 и давления
0,2133-105 н/м2?.
6. Определить изменение энтропии, если 0,0112 м3 азо-
та нагреваются от 0 до 50° С. Одновременно давление
уменьшается от 1,013-105 до 1,013-103 н/м2. Теплоемкость
равна 29,29 дж/моль-град.
7. Найти изменение энтропии при изотермическом сжа-
тии 1 моль паров бензола при 80° С от 0,4053-105 до
1,013-105 н/м2 с последующей конденсацией и охлаждени-
ем жидкого бензола до 60° С. Нормальная температура
кипения бензола 80° С; мольная теплота испарения бен-
зола 30,88 кдж/моль-, удельная теплоемкость жидкого
бензола 1,799 дж/г-град.
8. Вычислить изменение энтропии при смешении
0,001 м3 водорода с 0,0005 м3 метана, если исходные газы
и образующаяся смесь газов находится при 25° С и
0,912-105 н/м2.
9. В сосуд, содержащий 0,001 м3 воды при 20° С, по-
гружена железная пластинка массой 10 г, нагретая до
57
200° С. Чему равно изменение энтропии, если
ср^— 25,52 дж/г-атом-град,
^н2О(»)__ уу gg дж/моль-град.
10. Рассчитать изменение энтропии в процессе смеше-
ния 5 кг воды при 80° С с 10 кг воды при 20° С. Удельную
теплоемкость воды считать постоянной и равной
4,184 дж/г-град.
И. Определить изменение энтропии в процессе сжиже-
ния 1 моль метана, если начальная температура равна
25° С, а конечная 111,8° К. Мольная теплота испарения
метана при 111,8° К равна 8234,0 дж!моль и мольная теп-
лоемкость Срсн<<г) = 35,79 дж/моль-град. Вычислить ра-
боту сжижения метана, приняв к. п. д. равным 10%.
12. Как изменится энтропия при нагревании 1 моль
хлорида натрия от 25° С до 1073° К, если температура его
плавления 800° С, удельная теплота плавления 516,7 дж/г.
Мольная теплоемкость
сР(т) = 45,96 + 16,32-10~3Г дж/моль-град.
13. Рассчитать'изменение энтропии 1 моль бензола при
переходе из жидкого состояния при 25° С в пар при
100° С, если теплота испарения бензола 393,3 дж/г, тем-
пература кипения бензола 80,2° С, мольная теплоемкость
жидкого бензола равна Ср (ж) = 136,1 дж/моль-град, а
мольная теплоемкость паров бензола
СР (г) = - 33,90 + 471,87 • 10~3Т -
— 298,34- 10-в7^ + 70,84- дж/моль-град.
14. Найти изменение энтропии при нагревании 1 моль
ацетона от 25 до 100° С, если удельная теплота, испарения
ацетона равна 514,6 дж/г, температура кипения равна
56° С, мольные теплоемкости жидкого ацетона
Ср(ж)= 125 дж/моль-град,
паров ацетона
Ср (г) = 22,47 + 201,8 • 10-3Т -63,5-1О”6?2 дж/моль град.
15. Рассчитать изменение энтропии при нагревании
2 моль метанола от 25 до 100° С, если удельная тепло.та
испарения СН3ОН 1100,4 дж/г, температура кипения
58
64,7° С, мольные теплоемкости жидкого метанола
СР(ж) = 81,56 дж/моль-град-,
и паров метанола
СР(г) = 15,28+ 105,2-10-зГ—31,04-10-в7^ дж/моль-град.
16. Вычислить изменение энтропии при нагревании
1 моль твердого брома от температуры плавления
—7,32 до 100° С, если удельная теплота плавления равна
67,78 дж/г, скрытая удельная теплота испарения равна
188,5 дж/г, температура кипения равна 59° С; Ср (ж) =
= 75,71 дж/моль-град; мольная теплоемкость паров
брома
Ср(г) = 37,20 + 0,71-10-37’— 1,19-1057’-2 дж/моль-град.
17. Определить изменение энтропии при нагревании
1 моль этанола от 25 до 100° С, если удельная теплота ис-
парения С2Н5ОН 863,6 дж/г, температура кипения 78,3° С,
мольные теплоемкости жидкого этанола
Ср(ж)= 111,4 дж/моль-град,
и паров этанола
Ср(г)= 19,07 + 212,7- Ю-зТ— 108,6- 10~вГ2 +
+ 21,9- IO-9?3 дж/моль-град.
18. Найти изменение энтропии при нагревании 1 моль
толуола от 25 до 150° С, если удельная теплота испарения
толуола 347,3 дж/г, температура кипения 110,6° С, моль-
ные теплоемкости жидкого толуола Ср(ж) =
= 166 дж/моль-град и паров толуола Ср (г) =—33,88 +
+ 557,0-10-37’-342,4 10-67’2+79,87-10-9Т3 дж/моль-град.
19. Как изменится энтропия при нагревании 1 моль мо-
ноклинической серы от 25 до 200° С, если удельная тепло-
та плавления моноклинической серы 45,19 дж/г, темпера-
тура плавления 119,3° С, мольные теплоемкости жидкой
серы
Ср (ж) = 35,73 +1,17- IO-3?— 3,305-1057'~2 дж/моль-град
и твердой серы
Ср(т) = 23,64 дж/моль-град.
20. Вычислить возрастание энтропии 1 моль брома
Вг2, взятого при температуре плавления —7,32° С, и пе-
, 59
реходе его из твердого состояния в пар при температуре
кипения 61,55° С; мольная теплоемкость жидкого брома
СР(ж) = 0,4477 дж/г-град-,
теплота плавления 67,72 дж/г-, теплота испарения
182,8 дж/г.
21. Рассчитать изменение энтропии этанола при пере-
ходе из жидкого состояния при 25° С и 1,013-105 «/л2 в
пар при температуре кипения 78° С и 0,0507-105 н/я2.
Мольная теплота испарения этанола 40,79 кдж/моль-,
удельная теплоемкость этанола
Ср (ж) = 2,257 + 7,104-10~3/ дж/г-град.
В каком процессе изменение энтропии максимально?
22. Вычислить изменение энтропии при смешении
0,0001 л«3 кислорода с 0,0004 л/3 азота при постоянной
температуре 17° С и давлении 1,013-105 н/м2.
23. Каково изменение энтропии в системе, если
0,002 м3 аргона при 100° С и 20 000 кг/м2 нагреваются, при-
чем объем увеличивается до 0,008 лт3, а давление — до
12,16-105 н/м2.
24. Смешаны 0,002 м3 гелия и 0,002 м3 аргона при
27° С и 1,013-105 н/м2 каждый. После изотермного смеше-
ния полученная газовая смесь нагрета до 327° С при по-
стоянном объеме. Вычислить общее возрастание энтро-
пии, учитывая, что мольная теплоемкость обоих газов
одинакова и равна
Су(г)= 12,55 дж/моль-град.
25. Определить изменение энтропии 1 моль хлорида
натрия при нагревании от 20 до 850° С, если известно,
что мольная теплоемкость твердого хлорида натрия со-
ставляет
Ср(т) — 45,94 + 16,32-10~3Т дж/моль-град
я для жидкого соединения
Ср (ж) — 66,53 дж/моль-град-,
теплота плавления 31,0 кдж/мо-ль-, температура плавле-
ния 800° С.
26. Вычислить изменение энтропии при разделении
I моль воздуха при 1,013-105 н/м2 на чистые кислород и
нзот (принять состав воздуха 21 об. % кислорода и
Г9 об. % азота).
О
27. Энтропия жидкого этанола при 25° С равна
160,7 дж/моль-град. Давление пара при этой температуре
равно 59,0 мм рт. ст., а теплота испарения равна
42,635 кдж/моль. Вычислить энтропию паров этанола при
1,013-105 н/м2 и 25° С.
28. Теплоемкость при 1,013-105 н/м2 для твердого маг-
ния в интервале температур от 0 до 560° С выражается
уравнением
СР(т) = 22,3+ 10,64-10-3Т—0,42-105Т~2 дж/г-атом-град.
Определить изменение энтропии на 1 г-атом при увеличе-
нии температуры от 300 до 800° К и при постоянном дав-
ление 1,013-105 н/м2.
29. В термически изолированный сосуд, содержащий
5 кг воды при 30° С, вносят 1 кг снега, температура кото-
рого—10° С. Как возрастает энтропия в происходящем
процессе, если теплота плавления снега 333,3 дж/г, удель-
ная теплоемкость снега 2,008 дж/г-град, а удельная теп-
лоемкость воды 4,184 дж/г-град.
30. Рассчитать изменение энтропии при превращении
0,1 кг воды, взятой при 0° С, в пар при 120° С. Удельная
теплота испарения воды при 100° С 2,255 кдж/г-, удельная
теплоемкость жидкой воды 4,184 дж/г-град, удельная теп-
лоемкость пара при постоянном давлении
19,958 дж/г-град.
§ 10. ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ РЕАКЦИИ
ПО Э. Д. С. ЭЛЕКТРОХИМИЧЕСКОГО ЭЛЕМЕНТА
Изменение энтропии служит критерием направления
процесса и установления равновесия в изолированной си-
стеме *. Условиями, определяющими изолированную си-
стему, являются 6Q = 0 и 6/1=0 или, иначе, U, V=const.
Отсюда, из основного уравнения второго начала термоди-
намики
dS 5= —,
Т
(111,11)
для изолированной системы получим следующее выра-
жение:
(dS)u,v^0, или (AS)u.v^O, (Ш,12)
* Энтропия может служить критерием направления процесса
также в адиабатных процессах.
61
где знак «>» относится к необратимым самопроизволь-
ным процессам, а знак « = » — к обратимым или р#вно*
весным процессам. Если система неизолирована, то для
использования энтропии, как критерия направления про-
цесса, в систему следует включить также тепловой ис-
точник. Изменение энтропии при этом будет складывать-
ся из изменения энтропии «рабочей части системы» (в
которой происходит процесс) и изменения энтропии теп-
лового источника (среды):
AS = ASpa6.сист 4“ А5тепл.ист 0. (111,13)
Пример 1. Определить изменение энтропии при протекании хими-
ческой реакции
Ag + 1/2С12 = AgCl
при 1,013- 10s н/л!2 и 25° С, если известно, что э. д. с. электрохимиче-
ского элемента, в котором может протекать данная реакция, равна
1,136 в. Тепловой эффект реакции—127,0 кдж/моль. Возможно ли
самопроизвольное протекание реакции в данных условиях? Рассчи-
тать теплоту при обратимом протекании процесса.
Решение. Изменение энтропии рабочей системы находим по
формуле (111,10)
Ш + zFE _ 127-103+ 1-96 500- 1,136
Д^раб.сист = = 208 =
= —58,32 дж/град.
Чтобы определить направление процесса, необходимо систему
изолировать
(AS)yy = Д5раб.сист + Д-$окр.среды-
При необратимом протекании этого процесса окружающая среда
должна поглотить +127,0 кдж, отсюда изменение энтропии окружаю-
щей среды составит
ЬН 127,0-103 , е ,
Д$окр.среды = — —— = —-----------= 425,9 дж/град, .
(Д*^)(/,у = Д^окр.среды 4- Д-^раб.сист — 425,9 58,3 = 367,6 дж/град.
Так как (AS)tr, v>0, то данный процесс протекает необратимо
самопроизвольно.
Теплота обратимого процесса определяется по уравнению
9обр = ДЯ + = — 127,0 + 109,6 = — 17,4 кдж-.
Задачи
1-30. Определить изменение энтропии при протекании
реакции при давлении 1,013-105 н/м* и 25° С, а также теп-
лоту реакции обратимого процесса и сделать вывод о воз-
можности протекания самопроизвольного процесса.
62
Номер задачи Реакция £ 2980 в Д№"°, кдж!моль
1 РЬ (т) + 2AgCl (т) = РЬС12 aq + 2Ag (т) 0,490 —105,5
2 Hg2Cl2 + 2КВг = Hg2Br2 + 2КС1 0,128 —29,54
3 Pb + Hg2Cl2 (т) = РЬС12 + 2Hg 0,394 —128,98
4 Cd + 2AgCl (t) = CdCl2 + 2Ag 0,625 —136,4
5 T1 (t) + AgCl (т) = T1C1 (t) + Ag 0,558 —78,17
6 2Ag+Hg2Cl2 (t) =2AgCl+2Hg 0,046 4-11,25
7 Hg2Cl2 (т) + 2KOH aq = Hg2O (t) + 0,1542 4-13,73
+ 2KC1 (t) + H2O
8 CuAc2 aq + Pb = PbAc2 aq + Cu 0,4764 4-69,09
9 Zn + CuSO4a<? = Cu + ZnSO4a<7 1,100 —207,1
10 Ag (т) + >/212 (t) = Agl (t) 0,688 —64,2
11 Ag + ‘/2 Br2 (ж) = AgBr 0,994 —99,16
12 2Hg + Br2 (ж) = Hg2Br2 0,925 —206,77
13 2Hg + CI2 (r) = Hg2CI2 1,092 —264,85
14 Pb (т) + I2 (т) = РЫ2 (t) 0,662 —175,1
15 PbO2 (t) + Pb (t) + 2H2SO4 aq = 1,581 —608,68
= 2PbSO4 (t) + 2H2O
16 Cd (т) + Cl2 (r) = CdCl2 (t) 1,763 —389,0
17 Cd (т) + Br2 (ж) = CdBr2 (t) 1,468 —314,5
18 Cu (т) + Cl2 (r) = CuCl2 (t) 1,023 —205,9
19 Cu (t) + ‘/212 (t) = Cui (t) 0,025 —695,3
20 Cu (t) + V2 Вг2 (ж) = CuBr (t) ' . 0,544 — 105,1
21 Cu (t) + V2CI2 (r) =CuCl (t) 0,839 — 134,7
22 Mg (т) + Cl2 (r) = MgCl2 (t) 3,723 —641,83
23 Ni (т) + Cl2 (r) = NiCl2 (t) 1,610 —315,9
24 Zn (т) + Cl2 (r) = ZnCl2 (t) 2,123 —415,9
25 Fe (t) + CI2 (r) = FeCl2 (t) 1,800 —342,7
26 Ва(т) + Cl2 (г) = BaCl2 (t) 4,259 —859,8
27 Са(т) + Cl2 (г) = CaCl2 (t) 4,226 —785,8
28 Co (т) + Cl2 (r) = CoCl2 (t) 1,637 —325,4
29 Al (т) + з/2 Cl2 (r) = A1CU (t) 3,022 -697,4
30 Sn (т) + Cl2 (r) = SnCl2 (t) 1,496 —349,6
§ 11. ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ИЗОБАРНОГО
И ИЗОХОРНОГО ПОТЕНЦИАЛОВ В РАЗНЫХ ПРОЦЕССАХ
В изобарно-изотермном процессе, т. е. протекающем
при постоянных давлении и температуре (P=const и
T=const), критерием направления процесса и равновесия
является изобарный потенциал G.
В изохорно-изотермном процессе, т. е. протекающем
при постоянных -объеме и температуре (V=const и
7' = const), критерием направления процесса и равновесия
служит изохорный потенциал F. При необратимом само-
произвольном протекании процесса изобарный и изохор-
63
ный потенциалы уменьшаются, т. е.
AG < 0 и EF < 0; (111,14)
при этом значения обоих потенциалов в конечном состоя-
нии меньше, чем в первоначальном:
G2<Gi и F2<Fi. (Ш,15)
При обратимом протекании процесса или в момент
равновесного состояния изменение изобарного и изохор-
ного потенциалов равно нулю:
AG = G2—Gi = 0 и \F — F2 — Fi = 0. (111,16)
Для изобарного и изохорного потенциала имеем соотно-
шения:
G = H-TS- F=U—TS. (111,17)
Приращение изобарного и изохорного потенциалов
при постоянной температуре может быть рассчитано по
формулам:
AG = AZ/-TAS,' AF = AG-TAS. (III,la)
Изменение изобарного и изохорного потенциалов рав-
но максимальной полезной работе, взятой с обратным
знаком, соответственно изобарно-изотермного или изо-
хорно-изотермного процесса *:
(—AG) р,т — Дтах И (—AF) у,т = Дщах- (111,19)
При изучении химической реакции в электрохимиче-
ском элементе изменение изобарного и изохорного потен-
циалов при постоянстве соответствующих параметров оп-
ределяется по уравнениям:
2
(AG)p,t = -zF£ и (AF)ViT = — zFE — §PdV
i
или
(AF) у.т — — zFE — RTA.nr,
(Ш,20)
где Anr — изменение числа молей газообразных реагентов
при протекании реакции.
* В случае изохорно-изотермного процесса максимальная полез-
ная работа равна полной работе процесса.
64
При расширении или сжатии п молей идеального газа
при постоянной температуре имеем
Р, Vi
ДО = AF = 2,3nPTIg — = 2,3nPTlg—\ (Ill,21 \
Пример 1. Рассчитать AG и ДР для химической реакции
РЬ (т) + С12(г) = РЬС12(т)
Объемом твердых веществ пренебречь. Газ считать идеальным.
Э. д. с. электрохимического элемента, в котором можно провести эту
реакцию, равна 1,192 в при 25° С и 1,013-105 н/м2.
Решение. Изменение изобарного и изохорного потенциалов
определяют по уравнениям (111,20):
ДО = — 2-96 500-1,192-10-3 = —230,0 кдж,
= —230,0+ 8,314-290-10~3 = —230,0 + 2,4= —227,6 кдж,
так как Днг= —1.
Пример 2. Вычислить изменение изобарного потенциала при изо-
термном сжатии 10 м3 кислорода от 1,013-105 до 10,13-105 н/м2
при 25° С; Газ считать идеальным.
Решение. По уравнению (111,21) рассчитываем изменение
изобарного потенциала при T=const.
и =
РУ 1,013-105-10
----=--------------— = 409 моль.
RT 8,314-298
10 13 ю5
АО = 2,3-409-8,314-298-10-3 1g-----'—:—- = 2330 кдж.
11,013-10s
Пример 3. Определить изменение изобарного потенциала при
сжатии 1 кмоль жидкого толуола от 1,013-10s до 10,13- 10s н/м2
при 18° С. Сжимаемостью жидкости в указанном интервале давле-
ний пренебречь (V=const). Плотность толуола 867 кг/м3.
Решение. Изобарный потенциал прн постоянных Г и V нахо-
дим по уравнению
дО = Г(Р2-Р1),
92 14
AG = —=—( 10,13-105— 1,013-105) 10-3 = 96,9б кдж.
867
Задачи *
1. Вычислить изменение изобарного потенциала для
процесса перехода 1 моль жидкого бензола при темпера-
туре кипения 80,1° С и давлении Pi в газообразный при
Р2 и обратно для трех случаев: I) Р\ = 1,013- 10s н!м2 и
* Во всех задачах приближенно считать, что газы подчиняются
законам идеальных газов.
3—1741
65
Р2 = 9,1Ы04 н/м2; 2) Л = 1,013 105 н/м2 и Р2 =
= 1,013-105 н/м2; 3) Л = 101,3-105 н/м2 и Р2 =
-1.114-105 н/м2.
2-7. Найти изменение изобарного потенциала при сжа-
тии 1 моль указанной жидкости от Р\ до Р2 при 0° С.
Сжимаемостью жидкости в указанном интервале давле-
ний пренебречь.
Номер задачи \ Жидкость Плотность г!см9 Давление, «/jc8«105
р, Р,
2 Четыреххлористый угле- род 1,633 1,013 10,13
3J Анилин 1,039 0,506 4,05
4^ Нитробензол 1,223 1,013 6,078
5, Хлорбензол 1,128 1,216 9,72
6 Хлороформ 1,526 1,013 8,10
7 Бензол 0,879 1,013 5,065
8. При 25° С энтропии ромбической и моноклиниче-
ской серы соответственно равны 31,88 и
32,55 дж/г-атом-град, а теплоты образования равны 0,00
и 0,30 кдж/г-атом. Рассчитать AG и AF для процесса
5ромб->5мон'при 25° С. Пренебречь приближенно различи-
ем плотностей обеих модификаций серы.
Какая из двух модификаций серы является более ус-
тойчивой при 25° С? Дайте приближенную оценку темпе-
ратуры перехода, при которой обе модификации серы на-
ходятся в равновесии, принимая для AS и АД значения
при 25° С.
9-17. Найти AG и АД химических реакций из электро-
химических данных. Изменением объемов твердых и жид-
ких веществ при реакции пренебречь.
Номер задачи Реакций Темпе- ратура, °C Э. д* c.t в
9 Ag + >/2 С12 (г) = AgCl (т) 17 1,132
10 2Hg + С12 (г) = Hg2Cl2 (т) 25 1,085
11 AgCI + V2 ^2 = Ag + НС1 ag 25 0,224
12 Zn + Cl2 (r) = ZnCl2 aq 25 2,123
13 Cu + Cl2 (r) = CuCl2 aq 25 1,023
14 Cd + Cl2 (r) = CdCI2 aq 25 1,763
15 Cu + Ч2 Cl2 (r) = CuCl (t) 25 0,839
16 Co (т) + Cl2 (r) = C0CI2 aq 25 1,637
17 Sn + CI2 (r) = SnCAtf? 25 2,496
66
18—25. Вычислить изменения изобарного потенциала
при изотермном сжатии газа от Pj до Р2; газы считать
идеальными.
Номер задачи Газ Количест- во газа Темпе- ратура, °C ^Давление, «Дм2-105
Pi Р.
18 Кислород 0,005 мз 0 0,1013 1,013
19 Азот 7 г 27 0,506 3,04
20 Хлор 0,002 м? 25 1,013 10,13
21 Водород 0,01 м3 100 0,506 5,065
22 Кислород 20 г 25 1,013 15,20
23 Фосген 0,01 м.3 20 1,013 10,13
24 Окись углерода 0,003 м3 25 0,1013 2,026
25 Сероводород 0,001 м.3 25 1,013 2,02b
26. Энтропия 1 г-атом графита равна 5,74, алмаза:
2,38 дж)град при 25° С. Теплота сгорания алмаза превы-
шает теплоту сгорания графита на 752 дж. Вычислить из-
менение изобарного потенциала при изотермном переходе
графита в алмаз. Какой вывод- можно сделать из найден-
ного результата?
27. Вычислить A, Q, AH, AU, AG, AF, AS для изотерм-
ного сжатия 1 моль идеального газа от Pi = 5,065-105 до
Р2 = 10,13-105 н/м2 при 500° С.
28. Определить изменение изохорного потенциала и
внутренней энергии при обратимом испарении 1 моль бро-
ма при давлении 1,013-105 н/м2 и температуре кипения
—7,3° С. Теплота испарения брома равна 31,0 кдж/моль.
29. Определить изменение изохорного и изобарного по-
тенциалов и изменение энтропии при испарении 1 моль
воды при 100°С и 1,013-105 н/м2, если удельный объем
жидкой воды 1,044-10-4 м2/кг, удельный объем пара
1,673 м2/кг, изменение энтальпии в процессе парообразо-
вания воды 2271,5 кдж/кг.
30. Теплота плавления льда при 0° С равна 335 дж/г.
Удельная теплоемкость воды равна 4,184 дж/г-град.
Удельная теплоемкость льда равна 2,01 дж/г-град. Найти
AG, АН и AS для процесса превращения 1 моль переох-
лажденной воды при —5° С в лед.
3*
67
§ 12. ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ИЗОБАРНОГО ПОТЕНЦИАЛА
ХИМИЧЕСКОЙ РЕАКЦИИ ПО ЗНАЧЕНИЯМ
СТАНДАРТНЫХ ЭНТАЛЬПИЙ И ЭНТРОПИЙ
Изменение изобарного потенциала химической реак-
ции можно подсчитать с использованием стандартных
таблиц по уравнениям:
ДО0 = ДЯ° - ТД5°, (111,22)
где
АН0 = ЕДЯ^од - 2Д/Уисх, (111,23)
и
Д5° = 25п°рОд - SSncx- (111,24)
Пример. Вычислить стандартное изменение изобарного потенциа-
ла при 25° С для реакции между веществами в твердом состоянии:
Cd (т) + 2AgCl (т) = 2Ag (т) + CdCl2 (т)
по стандартным значениям изменения энтальпий образования н абсо-
лютных энтропий химических соединений.
Решение. Изменение изобарного потенциала рассчитывается
по уравнениям (111,22)—(III.24):
Scd = 51,76 дж/г-атом-град;
Slgci = 96,07 дж/моль-град;
S^g = 4^,69 дж/г-атом град-,
Scdci2 = 115,3 дж/моль-град-,
ДЯи = 0; ДЯА°8а = — 126,8 кдж/моль-,
AHig = 0; ДЯсаа, = — 389,0 кдж/моль;
АН° = 2AHAg + ДЯсас12 ДТ^са 2Д//ацС1 =
= — 389,0 + 2-126,8 -- — 135,4 кдж;
Д5° = 2$Ag + 5сас12 — Sea — 2SAga —
= 2-42,69 + 115,3-51,76 — 2-96,07 =
= 85,38 + 115,3 — 51,76 — 192,14 =
= 200,68 — 243,9 = — 43,22 дж/град;
AG° = АН0 — TAS0 = — 135,4 + 298 • 10~3 • 43,22 =
_ — 135,4 + 12,88 = — 122,52 кдж.
68
Задачи
1—30. Вычислить стандартные изменения изобарного
потенциала химической реакции при 25° С по стандарт-
ным значениям энтальпий образования и абсолютных эн-
тропий, воспользовавшись таблицами стандартных вели-
чин. Все реакции проводятся между чистыми твердыми,
жидкими и газообразными веществами (ие в растворе).
Номер задачи
Реакция
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
ZnO (т) + СО (г) = Zn (т) + СО2 (г)
ZnS (т) + Н2 (г) = Zn (т) + H2S (г)
2СО2 (г) = 2СО (г) + О2 (г)
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
2HI (г) = Н2 (г) + 12 (г)
СО (г) + 2Н2 (г) = СНзОН (ж)
NH3 (г) + НС1 (г) = NH4C1 (т)
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж)
СО2 (г) + 4Н2 (г) = СН4 (г) + 2Н2О (ж)
2Н2О (ж) = 2Н2 (г) + О2 (г)
SO2 (г) + С12 (г) = SO2C12 (г)
СО (г) + С12 (г) = СОС12 (г)
4НС1 (г) + О2 (г) = 2Н2О (ж) + 2С12 (г)
СНзСООН (г) + 2Н2 (г) = 2СНзОН (г)
СО (г) + ЗН2 (г) = СН4 (г) + Н2О (г)
Н2 (г) + НСОН (г) = СНзОН (г)
4NH3 (г) + 5О2 (г) = 6Н2О (г) + 4NO (г)
Са(ОН)2 (т) = СаО (т) + Н2О (ж)
РС15 (г) = РС13 (г) + С12 (г)
С2Н4 (г) + ЗО2 (г) = 2СО2 (г) + 2Н2О (ж)
СаСОз (т) = СаО (т) + СО2 (г)
H2S (г) + COS (г) = Н2О (г) + CS2 (г)
H2S (г) + СО2 (г) = Н2О (г) + COS (г)
С6Н6 (г) + ЗН2 (г) = С6Н12 (ж)
С2Н5ОН (ж) = С2Н4 (г) + Н2О (ж)
сн; (г) + 2H2S (г) = CS2 (ж) + 4Н2 (г)
2AgNO3 (т) = 2Ag (т) + 2NO2 (г) + О2 (г)
4СО (г) + 2SO2 (г) = S2 (г) + 4СО2 (г)
2NaHCO3 (т) = Na2CO3 (т)'+ Н2О (г) + СО2 (г)
MgCO3 (т) = MgO (т) + СО2 (г)
69
Глава IV
ЗАКОН ДЕЙСТВИЯ МАСС. ИЗОТЕРМА
ХИМИЧЕСКОЙ РЕАКЦИИ
§ 13. ВЫЧИСЛЕНИЕ СТЕПЕНИ ДИССОЦИАЦИИ
ИЛИ КОНСТАНТЫ РАВНОВЕСИЯ
Константа равновесия химической реакции, протекаю-
щей в смеси идеальных газов по уравнению
аА + ЬВ =?±: gG -f- rR,
где a, b, g, г — стехиометрические коэффициенты участ-
вующих в реакции веществ А, В, G, R, имеет следующий
вид:
g Г
д- (IV,1)
/^В '
где Кр — константа химического равновесия; ра, р-&, рл,
ръ — равновесные парциальные давления.
Константа равновесия Ар не зависит от давления. Учи-
тывая соотношение между парциальным давлением
(р^ н/м2), концентрацией'(С;, моль/м3) и мольной долей
(Ni) газа i-ro сорта
Pi = CiRT ~ NiP = Р, (IV,2)
i tli
можно получить также выражения для константы равно-
весия химической реакции:
А В
NaX
70
где Р — общее давление; п,- — число молей i-ro компонен-
та; — общее число молей реагентов в равновесной га-
зовой смеси.
Константы равновесия Кр, Кс, Kn связаны соотноше-
нием
КР = Кс (RT) = K.NP&n, (IV,4).
где An=g+r—а—b — разность между стехиометрически-
ми коэффициентами конечных и начальных газообразных
веществ в соответствии с уравнением реакции. Константа
равновесия KN зависит от общего давления. Если Дп = 0,
то
Кр = Кс = Кх. (IV,5)
Это означает, что при Дп=0 численные значения кон-
станты равновесия при любом способе выражения кон-
центрации одинаковы. В этом случае для вычисления
константы равновесия достаточно знать число молей гц
всех веществ в состоянии равновесия в любом заданном
объеме.
Уравнение (IV,3) может быть использовано также для
расчета константы равновесия химической реакции в иде-
альном растворе.
Для гетерогенных реакций с участием газообразных
веществ константа равновесия Кр выражается только от-
ношением равновесных парциальных давлений газооб-
разных реагентов. Давление насыщенных паров твердых
или жидких веществ, участвующих в реакции, не зависит
от количества конденсированной фазы и при постоянной
температуре остается постоянным. Например, для реак-
ции
аА (т) + 6 В (г) gQ (г)
g
Константу равновесия химической реакции можно вы-
числить косвенным методом, пользуясь стандартными
изменениями изобарных потенциалов. Изобарный потен-
циал является функцией состояния и его изменение не
зависит от пути процесса, а лишь от начального и конеч-
ного состояния системы. В уравнение, связывающее
71
стандартные изменения изобарных потенциалов, подстав-
ляют известные константы равновесия
ДО0 = - 2.303ЯГ 1g Кр (IV,7)
и решают его относительно неизвестной константы.
Пример 1. При 200° С константа равновесия Кр реакции дегид-
рирования изопропилового спирта до ацетона (в газовой фазе)
СН3СНОНСН3 (г) СН3СОСН3 (г) + Н2 (г)
равна 6,92-104 н/м2. Вычислить степень диссоциации изопропилового
спирта при 200° С и давлении 9,7-104 н/м2, считая, что смесь газов
подчиняется законам идеальных газов.
Решение. Обозначим степень диссоциации изопропилового
спирта через а. Если до реакции число молей изопропилового спирта
было п, то в равновесной смеси остается п— па=п (1—а) молей.
В результате реакции в соответствии с уравнением, химической реак-
ции должно получиться па молей ацетона и па молей водорода.
Сумма молей газов, в равновесной смеси равна
= п — па + па + па = п (1 + а).
Парциальные давления реагирующих веществ в равновесной
газовой смеси согласно уравнению (IV.2) равны
Рт = ~т+тр’ р^=р^т^тр-
По закону действия масс [уравнение (IV,!)] для данной реакции
константа равновесия выражается
РацРн,
Лр —
Реп
Подставляя найденные парциальные давления в уравнение
для Кр, получим
или
<х2 = ---------=-----------------=0,415.
, , Р 9,7-104
1 "( д- 1 + ,
6,92-104
Отсюда а=0,645.
Пример 2. При 390° С и 1,013-10s н/м2 0,0157 моль NO2 занимают
объем 0,001 л3, причем NO2 частично диссоциирует на NO и О2. Опре-
делить Кр и Кс для реакции
2NO + О, 2NO2
считая смесь газов идеальной.
72
Решение. Для вычисления степени термической диссоциации
воспользуемся уравнением PV=inRT, где i — число, показывающее,
во сколько раз увеличивается число молей смеси прн наличии диссо-
циации по сравнению с числом первоначально взятых молей NO2.
Если при диссоциации из одной молекулы образуется т новых моле-
кул, то степень диссоциации
i— 1
а =-----.
т— 1
„ , • Pv 1,013-105-0,001
Для данной реакции i = —— = = 1,17; т = 1,5
пкТ 0,0157-8,314-оо3
1,17—1
и а = —-------= 0,34,
1,5 — 1
Отсюда число молей:
а) в исходной смеси
б) в равновесной смеси
2NO + О2 2NO2
0 0л
ла ла/2 л(1 — а)
„ па / а \ л(2 + а)
2л = ла + — + л (1 — а) = л 11 + — 1 =---------,
2(1—а) „ а 2а
отсюда pN0, = -i^P;p0, = -rjTP;pN0 = -rfTP. ’
к _ pNO, = (1—а)2 (2 +а) _•(!-0,34)2(2+ 0,34) =
₽_ Pno/’O. - “Зр 0,343-1,013-Ю5
= 25,60-f0~5 (Н/Щ2)-1.
По уравнению (IV,4) определяем Кс
КР = Кс Кс = KpRT = 25,60.10“5-8,314-663 =
= 1,41 мкмоль.
Пример 3. Рассчитать константу равновесия Кр, х при 600° К Для
реакции
2Н2 + СО^± СН3ОН (г)
если пря этой температуре для реакции
СН3ОН (г) + СО (г) СН3СООН (г) (1)
Кр Х = 2,78-10-9 (н/-И2)-1, а для реакции
2Н2 + СН3СООН (г) 2СН3ОН (г) ' (2)
КР,2 = 6,5-10-6 (н/щ2)-1.
73
Решение. При сложении уравнений (1) и (2) получим
2Н2 + СО СН3ОН (г)
Следовательно, AG^ = AGj + ДО2. Учитывая соотношение
(IV,7), получим
- 2,303/?Т 1g KPtX = -2,303 RT 1g Кр>1 -2.303ЯТ 1g /<р>2.
Отсюда lgKp,x= IgKp.i + Кр,х = КрЛКр<2 = 2,78-10“9 X
X 6,5-10—5 = 1,81-10~14 (н/л2)-2.
Примечание. Объемный процент (об %) газа в смеси равен
мольной доле газа, умноженной на 100. Понятия «объемный про-
цент» и «мольный процент» идентичны.
Задачи *
1. Взято 42,0 г N2O4 в объеме 0,01835 м3 при 50° С и
0,946-105 н/м2. N2O4 диссоциирует по уравнению
N2O4^2NO2
Вычислить степень диссоциации и константу равновесия.
2. При 2400° К для реакции
Н2О = Н2 + V2O2
lg^p= — 2,41. Насколько надо повысить давление, чтобы
степень диссоциации водяного пара уменьшилась вдвое,
если вначале давление равнялось 0,507-105 н/м2?
3. При 49,7° С и 261,4 мм рт. ст. N2O4 диссоциирует
на 63% согласно уравнению
2NO2 N2O4
Определить под каким давлением степень диссоциации
при указанной температуре будет равна 50%.
4. В объеме 0,001 м3 находится 0,99 г фосгена при
600° С. Общее давление равно 1,377-105 н/м2. Определить
степень диссоциации, константу равновесия Кс реакции
СОС12^СО + С12
и подсчитать, сколько граммов СО надо ввести в дан-
ный объем, чтобы степень диссоциации фосгена понизи-
лась до 10%-.
* Во всех задачах этой главы (кроме § 15) предполагается, что
газы подчиняются законам идеальных газов.
74
5. Если нагреть 1,518-10-3 моль иода, то пары его
займут объем 2,493-10 ~4 м3 под давлением 0,581 • 105 н/м2
и при температуре 800° К. Определить константы равно-
весия (Кс и Кр) при диссоциации 12 по уравнению 21^±Ц.
6. При 494° С и 0,99-105 н/м2 двуокись азота диссоции-
рована на 56,5% по уравнению
2NO + О2 2NO2
Определить давление, при котором степень диссоциации
равна 80%, и значения КР и Kc-
Т. При 49,7° С и 261,4 мм рт. ст. N2O4 диссоциирует
на 63% согласно уравнению 2NO24=fcN2O4. Определить
константу равновесия Кр, если а) парциальные давления
выражены в мм рт. ст., б) в ньютонах на jw2; в) рассчи-
тать значение Кс для этой реакции.
8. Константа равновесия реакции
РС13 + С12^РС15
при 500° К равна Кр=2,961 10-5 (н/м2)~1. Определить
степень диссоциации при этой температуре, если общее
давление равно 8,104 • 105 н/м2.
9. Навеска 0,99 г фосгена нагревается до 600° С в со-
суде объемом 0,001 м3. Общее давление 1,377-105 н/м2.
В результате термической диссоциации установилось
равновесие:
СО + С12^СОС12
Вычислить степень диссоциации, константу равновесия
Л'р и давление, при котором степень диссоциации пони-
зится до 10%.
10. Вычислить степень диссоциации аммиака при сле-
дующих условиях: а) 600° С и 10,13-105 н/м2-, б) 600° С и
101,3-105 н/м2, а также процентное содержание (в объ-
емных процентах) аммиака в равновесной смеси, если
константа равновесия реакции
NH3 72N2 + 3/2Н2
при 600° С равна ^ = 669,7-105 н/м2. .
11. Вычислить степень диссоциации аммиака при
а) 400° С и 10,13-105 н/м2, б) 400° С и 101,3-105 н/м2 и
процентное содержание (в объемных процентах) амми-
ака в равновесной смеси, если константа равновесия ре-
акции
N2 + ЗН2 2NH3
при 400° С Кр = 78,59-105 н/м2.
75
12. Навеска 9,2 г N2O4 частично диссоциирует при
27°С и 1,013-105 н/м2 и занимает объем 0,00295 л/3. Рас-
считать степень термической диссоциации и константу
равновесия Кс при этой температуре для системы
N2O4^2NO2. Как надо изменить объем при той же тем-
пературе и том же исходном количестве N2O4, чтобы сте-
пень диссоциации стала равной 40%?
13. Константа равновесия для реакции
РС15 = РС13 + С12
равна Кр=0,255-105 ц/м2 при 212° С. Вычислить Кс. Рас-
считать степень диссоциации и общее давление смеси,
если 9,65 г РС15 в объеме 0,00264 л/3 нагреты до 212° С.
14. При 49,7° С N2O4 диссоциирует, причем устанав-
ливается равновесие 2NO2**N2O4. Рассчитать среднее
значение константы Кр по следующим данным для об-
щего давления (н/м2): а) 0,663-105; б) 0,348-105;
в) 0,243-105; и степени диссоциации а) 0,485; б) 0,620;
в) 0,680. По среднему значению Кр найти степень диссо-
циации при общем давлении 0,125-105 н/м2, а также дав-
ление, при котором степень диссоциации равна 0,92.
15. При 49,7^0 и 261,4 мм рт. ст. N2O4 диссоциирует
на 63% согласно уравнению 2NO2^N2O4. Какова будет
степень диссоциации при той же температуре под давле-
нием 93,8 мм рт. ст.?
16. При 830° С и 1,013-105 н/м2 степень диссоциации
сероводорода согласно уравнению
2Н2 + S2 2H2S
равна 8,7%. Определить константу равновесия Кр этой
реакции.
17. При 1500° К и 0,1013-105 н/м2 степень диссоциации
СО2 по уравнению
2СО + О2 2СО2
равна 1,04-10~3. Определить константу равновесия Кр.
Рассчитать степень диссоциации СО2 под давлением
202,6-105 н/м2, пренебрегая малыми значениями а по
сравнению с единицей в (1—а) и (1 + а/2).
18. Пользуясь значением константы равновесия Кр=
= 50 реакции
Н2 + I2 2HI
76
рассчитать, сколько молей водорода надо взять на каж-
дый моль иода, чтобы 1г при 444° С превратился на 90%
в подпетый водород?
19. Для галоидов при 1000° К и 1,013-105 н/м2 полу-
чены следующие значения степени термической диссоциа-
ции на свободные атомы: для С12 си = 3,5-10-4, для Вг2 а2 =
=2,3-10-3 и для 12 аз = 2,8-10~2. Рассчитать константы
равновесия для систем: 2С1^С12, 2Вг+*Вг2, 21^12. Ка-
кие выводы можно сделать о прочности связей в моле-
кулах хлора, брома и иода?
20. При 727° С константа равновесия реакции
2SO2 + О2 2SO3
Кр=3,417-10~5 (нДм2)-1. Под каким давлением степень
диссоциации SO3 составит 20%? Какое потребуется дав-
ление для снижения степени диссоциации до 5%?
21. Константа равновесия реакции
РС1з + С12^РС15
при 500° К Кр = 2,961 • 10-5 (нЛи2)-1. Определить, под ка-
ким давлением степень диссоциации при этой температу-
ре будет равна 10%.
22. Закрытый сосуд заполняется при 17° С и 0,946 X
Х105 н!м2 фосгеном (СОС12). Прй этих условиях фосген
практически не диссоциирован. При нагревании до 500° С
давление повышается до 2,674-105 н/л/2. Рассчитать сте-
пень диссоциации фосгена и константы равновесия Кр и
Кс при 500° С для реакции
СОС12^СО + С12
23. При 444° С константа равновесия реакции
Н2 + I2 2HI
Кр = 50. Сколько молей Н2 нужно добавить к 1 моль HI,
чтобы степень диссоциации стала равной 10%?
24. Железо и СО2 реагируют по уравнению
Fe (т) + СО2(г) РеО(т) + СО (г)
При 1000° К и 1,013-105 н/м2 парциальное давление СО2
равно 0,66-105 н/л/2. Определить степень диссоциации СО2
согласно уравнению
2СО2 2СО + О2
при данной температуре и под давлением: а) 0.1013Х
77
Х105м/л2; б) 1,013-105 м/л2; в) 10,13-105 м/л2. Парциаль-
ное давление кислорода над FeO при 1000° К равно
4,131 -10-16 н/м2.
25. При 1000° К и 0,1013-Ю5 м/л2 водяной пар диссо-
циирует
2Н2 + О2 2Н2О (г)
и степень диссоциации сц = 5,56-10~7. В тех же условиях
СО2 диссоциирует
2СО +. О2 2СО2
и 02 = 5,31 • 10-7. Рассчитать по этим данным константу
равновесия реакции
СО + Н2О(г)^:СО2 + Н2
' «
и состав равновесной смеси при смешении равных объ-
емов СО и Н2О (г). Какой объемный процент Н2 и СО2
будет в равновесии с 20 об. % СО и 15 об. % Н2О?
26. Рассчитать Кр при 727° К для реакции
SO2 + NO2 =₽*= SO3 + NO
если при данной температуре для реакции
2SO2+O2^2SO3 Кр = 3,417-10-5 (м/л2)-1,
а для реакции
2NO + О2 2NO2 КР = 5,926-10-7 (м/л2)-1.
27. При 1000° К и 1,013-105 м/л2 для реакции
Fe (т) + Н2О (г) FeO (т) + Н2 (г)
парциальное давление водорода 0,652-105 н/м2. При этой
же температуре для реакции
- 2FeO(T)^t 2Fe(r) + О2(г) ро2 — 4,21 • 10~16 м/л2.
Определить константу равновесия реакции
2Н2(г) + О2^2Н2О(г)
и рассчитать степень термической диссоциации водяного
пара при общем давлении: а) 0,1013-105 м/л2; б) 1,013Х
Х105м/л2; в) 10,13 • 105 м/л/2.
28. При 900° К и 1,013-105 м/л2 для реакции
2Н2 + О2^2Н2О(г)
78
а = 3,24-10-8. При той же температуре для реакции
Н2 + С12^2НС1(г)
Кр = 2,52- 10п. Определить константу равновесия реакции
4НС1 (г) + О2 2Н2О (г) + 2С12
29. При'1000° К и 1,013 • 105 н/м2 для реакции
FeO (т) + СО (г) Fe (т) + СО2 (г)
- парциальное давление СО равно 0,353* 105 н/м2.
Константа равновесия Кр реакции
2СО + О2 2СО2
при той же температуре равна 8,443-1015 (н/м2)~*. Рас-
считать для реакции
2FeO (т) 2Fe(T) + О2 (г)"
30. При 1500° К степени диссоциации водяного пара
по реакции
H2O(r)^H2 + V2O2
и двуокиси углерода по реакции
СО2 СО + у2о2
соответственно равны 2-2Ы0-4’и 4,8-10~4. Рассчитать
константу равновесия реакции
СО + Н2О(г)^СО2 + Н2
этой температуре.
§ 14. ВЫЧИСЛЕНИЕ СОСТАВА РАВНОВЕСНОЙ СМЕСИ ГАЗОВ
Состав равновесной смеси газов вычисляют по кон-
станте равновесия и начальному нестехиометрическому
составу смеси газов, или, наоборот, рассчитывается кон-
станта равновесия по начальной нестехиометрической
смеси газов и степени превращения.
Пример 1. При 1000° К и 1,013- 10s н/я2 из исходной смесй, содер-
жащей 1 яоль SO2 и 0,6 моль О2, при достижении равновесия обра-
зовалось 0,22 моль SO3.
Определить Кр для реакции
2SO2 + O2^±2SO3
Решение. На образование 0,22 моль SO3 согласно уравнению
реакции израсходовано 0,22 моль SO2 и 0,11 моль кислорода. За-
пишем
79
число молей: 2SO24- О2 ^±2SO3
в исходной смеси 1 0,6 0
в равновесной смеси 0,78 0,49 0,22
Отсюда Ей = 0,22 4- 0,78 4- 0,49 = 1,49 моль,
T’sos = 1.013- 10s = 5,31 • 104 №.
0,49 - .
= -2—1,013-10® = 3,22-104 н/^2,
li49 '
0,22 - .
^о^МЭ1,013'10 =1,5'10 Н1М2'
Константа равновесия Кр равна
п
к, _ , = 2.4.,о-<
4о,л>, (s.ai.^.s.ffi.io*
Пример 2. Для реакции
С2Н4 (г) + НС1 (г) С2Н5С1 (г)
при 230°С Кр=0,128-10-5 (н/м2)-1. Определить состав равновесной
смеси (в объемных процентах), полученной при давлении
10,13- Ю5 н/м2 из 2 моль этилена и 1 моль НС1.
Решение. Обозначим через х число молей образовавшегося
C2H5CI. Так как на образование его должно израсходоваться соглас-
но химическому уравнению реакции по х молей С2Н4 и НС1, то в
равновесной смеси останется (2 — х) моль С2Н4 и (1 — х) моль НС1.
Запишем
число молей: С2Н4 4- НС1 7» С2Н5С1
в исходной смеси 210
в равновесной смеси 2 — х 1 — х х
- Ей = 2 — х 4-1—х + х — 3 — х.
Отсюда для парциальных давлений компонентов получаем выра-
жения
2—х 1—х х
рсгн4(г) -- 3_х Лк:- 3_х =
Подставляя эти выражения в уравнение (IV, 1) для константы
равновесия, получим
к х(3 —х)___________1_
Р (2 —х)(1—х) ю, 13-Ю5
= 0,128-Ю-5 (я/л2)-1.
80
После небольших преобразований получим
2,32x2 — 6,96x4- 2,64 = 0.
Решая квадратное уравнение, находим х^О.44 и х2=2,55.
Второй корень не имеет физического смысла, так как х может
быть только меньше единицы. Остается значение х=0,44. Следова-
тельно, в равновесной смеси содержится 2 — 0,44 = 1,56 моль С2Н4;
1 —0,44=0,56 моль НС1; 0,44 моль C2H5CI. Состав смеси в мольных
или объемных процентах определяется из соотношения
Л/
100 • У» = —1—100,
X Л/
где Хл = 1,56 4- 0,56 4- 0,44 = 2,56;
1,56
100>^c,H4 = 100 = 60>94 об- %
0,56'
100 • 7VHC1 = —100 = 21,88 об. %,
2} Оо
0,44
1°°-^сгН5с1 =2“^ Ю0= 17.18 об. %.
Пример 3. При 300° С для реакции
С (граф) 4- 2Н2 (г) = СН4 (г)
константа равновесия равна Kp=153-10r5 (w/jh2)-1. Вычислить содер-
жание метана в объемных процентах в равновесной смеси при 300° С
и 10,13-10s w/jh2.
Решение. Для рассматриваемой гетерогенной реакции
Учитывая что, pHj = Р — pciii, получим АГР = <р_ р
Решая полученное квадратное уравнение, получаем
7’сн1=(р+^) ±j/"+ ~Р '
Подставляя значения Р и К$, получим
= (10,13-105 4--------г —
/'сн, > -г 2.153-10-5/
— Г(10,13-105 4- 1 -5 Y-(10,13-Ю5)2!’^
1\ 2’ 10О’ 1U / J
= 9,88-105 я/лг2,
81
Усн==^= Wiol = Oi975,
• -Р 10,13-ю5
Следовательно, в равновесной смеси содержание метана равно
97,5 об. %.
Задачи
1. Из смеси, содержащей 1 моль азота и 3 моль во-
дорода, в состоянии равновесия при давлении 10,1 ЗХ
Х105 н/м2 образуется 0,5 моль аммиака. Вычислить Кр
для реакции
N2 + ЗН2 2NH3
Чему равен выход аммиака (в объемных процентах)?
2. При изучении реакции
Н2 + I2 2HI
при 440° С нагревалось различное число молей водорода
и иода и определялось число молей йодистого водорода
в состоянии равновесия.
Взято водо-
рода, моль
Взято кода,
моль
Получено йодисто-
го водорода, моль
2,94 8,10
5,20 7,94
14,44 8,12
5,64
9,40
14,93
По приведенным данным рассчитать константы рав-
новесия, а по среднему значению константы найти, сколь-
ко молей йодистого водорода должно образоваться при
нагревании 27,58 моль водорода и 8,02 моль иода.
3. Константа равновесия для реакции
N2 И- О2 2NO
при 2673° К равна 0,0035. Какой выход NO получится
при этой температуре: а) из воздуха; б) из смеси
40 об. % О2 и 60 об. % N2; в) из смеси 80 об. % О2 и
20 об. % N2?
4. Константа равновесия реакции
so2 -J- ci2 т* so2ci2
при 102° С Ле =13,35 (кмоль/м2)~х. Какова будет кон-
центрация SO2C12 при равновесии, если исходные кон-
центрации SO2 и С12 имеют следующие значения:
82
a) Cso2 = Cq2 - 1 кмоль/м3-,
6) Cso2 :: 6?ci2 = 2 кмоль/м3-,
в) Cso2 = 1 кмоль/м3, a Cci2 = 2 кмоль/м3?
5. Вычислить константу равновесия Лр для реакции
С(т) + СО2^2СО
по следующим данным:
Общее давление при 1000°С, я/-«2 Содержание в равновесной смеси, об. %
со, со
10,84-105 7.5 92,5
20,26-105 12,5 87,5
30,39-105 17,0 83,0
Рассчитать содержание (объемные проценты) СО2 и
СО в равновесной смеси при 47,21 • 105 н/л2 и 1000° С.
6. Твердый NH4CI при 11° С имеет давление насыщен-
ных паров, равное 0,303-105 н/м?. Пар NH4CI при 11° С
практически полностью диссоциирован на аммиак и циа-
нистый водород. Чему будет равно парциальное давле-
ние HCN, если твердый NH4CN будет возгоняться при
11° С в закрытом сосуде с аммиаком, начальное давле-
ние которого 0,430-105 н/л2? Каково будет общее давле-
ние в сосуде? Сколько граммов NH4CI возгонится, если
объем сосуда 0,001 л3?
7. При смешении 1 моль уксусной кислоты и 1 моль
этанола протекает реакция (в растворе)
СНзСООН + С2Н5ОН СН3СООС2Н5 + Н2О
При достижении равновесия в реакционной смеси нахо-
дятся по 1/3 моль кислоты и спирта и по 2/3 моль эфира
и воды. Какое количество эфира будет в реакционной
смеси при равновесии, если смешать: а) 1 моль кислоты
и 2 моль спирта; б) 1 моль кислоты, 1 моль спирта и
1 моль воды; в) 1 моль эфира и 3 моль воды; г) 1 'моль
кислоты, 1 моль спирта, 1 моль воды и 1 моль эфира?
8. Для реакции
СО + Н2О Н2 + СО2
Кр=1 при 930° К- Рассчитать процентный состав исход-
83
ной смеси СО и НгО, чтобы при той же температуре рав-
новесная смесь содержала по 20 об. % СО2 и Нг.
9. Для реакции
Н2 + I2 2HI
при 444° С Лр = 50; 1 моль HI нагревается до 444° С.
Сколько молей HI при этом разложится?. Чему будет
равна степень диссоциации?
10. Для реакции
2СО СО2 + С СО-
при 1000° К Лр = 0,587• 10~5 (н/м2)-1. Некоторое количест-
во двуокиси углерода, занимающее объем 1 л3 при 27° С и
1,013-105 н/м2, пропускается при 1000° К над углем. Ка-
кой объем будет занимать равновесная смесь газов, если
давление остается неизменным, и какой будет ее про-
центный состав?
11. Для реакции
СО + Н2О(г)^СО2 + Н2
при 930° К Лр = 1,0. Смесь, состоящая из 20 об. % СО и
80 об. % Н2О, нагревается до 930° К- Определить равно-
весный состав смеси.
12. При нагревании стехиометрической смеси метана
и водяного пара до 1100° К и при 1,013-105 н/м2 в равно-
весной смеси
сн4+н2о^со + зн2
содержится 72,43% Н2. Определить константу равнове-
сия этой реакции.
13. Смесь, начальный состав которой 4,9 моль НС1 и
5,1 моль Ог, реагирует при 480° С. Равновесное давление
равно 723 мм рт. ст., а степень превращения НС1 состав-
ляет 76%. Определить константу равновесия Кр для ре-
акции
4НС1 + О2 2Н2О + С12
14. Газовая смесь состава: 45 об. % СО, 35 об. % Нг и
20 об. % НгО нагревается до 1400° С. Рассчитать равно-
весный состав смеси газов
СО2 + Н2^СО + Н2О(г)
если константа равновесия при этой температуре рав-
на 2,21.
84
15. Для реакции
Н2 + С12 2НС1
при некоторой температуре Кр=1. Определить состав (в
объемных процентах) равновесной реакционной смеси,
полученной из 2 л Н2 и 3 л С12.
16. При получении водорода взаимодействием окиси
углерода с водяным паром
СО+Н2О(г)^СО2+Н2
при 1000° К Ар=1,37. Вычислить равновесное количество
водорода, если исходная смесь содержит 0,4 моль окиси
углерода и 0,6 моль паров воды.
17. Вычислить при 1000°К и 20,26-105 н]м2 Кр и Кс
реакции образования метана
2СО + 2Н2 СН4 + СО2
если равновесная смесь газов содержит 22,2 об. % СН4,
31,8 об. % СО2, 25,8 об. % Н2 и 20,2 об. % СО.
18. Вычислить равновесный выход СО для реакции
С (кокс) + СО2 2СО
при 800° С и 1,013-105 н/м2, если Лр=6,683-105 н/м2.
. 19. При 550° С и 1,013-105 я/ж2 из 1 моль СО и 1 моль
С12 к моменту достижения равновесия образуется
0,2 моль фосгена. Определить Лр и Кс реакции
СО + С12 СОС12
20. Для реакции
Н2 + I2 = 2HI
при 440° С Лр = 50. Сколько молей HI получится, если
нагреть до этой температуры 1,27 г иода и 0,02 г водоро-
да? Чему будут равны парциальные давления всех газов,
если объем равновесной смеси равен 0,001 л/3?
21. Газовая смесь, состоящая из равных объемов НС1
и О2, реагирует при 800° К. После наступления равновесия
в равновесной смеси содержится 18,66 об. % С12 и давле-
ние равно 1,013-105 н/ж2. Определить константу равнове-
сия реакции
4НС1 + О2^2С12 + Н2О
22. В реакционную трубку с катализатором со скоро-
стью 5 л/ч поступает смесь SO2 и О2 при 20° С и
85
1,013-105 н/м2. Смесь содержит 10 об.% SO2. В трубке
образуется SO3 по уравнению реакции
2SO2 -|- Ог 4=^ 2SO3
и устанавливается равновесие. Равновесная смесь газов,
выходящая из трубки, пропускается через раствор ВаС12,
где за 2 ч осаждается 5,58 г BaSC>4. Определить констан-
ту равновесия Лр этой реакции при данной температуре.
23. Углерод взаимодействует с СОг по уравнению
С(граф) + СО2^2СО
В состоянии равновесия при 900°К и 1,013-105 н/м2 газо-
вая фаза содержит 35,28 об. % СО. Определить Кр и со-
держание (в объемных процентах) СО в равновесной
смеси под общим давлением 10,13-105 н/м2.
24. Под давлением 1,013-105 н/м2 и при 1000° К кон-
станта равновесия Лр реакции
С(граф) + СО2=^2СО
равна 1,886-105 н/м2. Определить состав газовой фазы в
состоянии равновесия.
25. В реакционный сосуд введены 1 моль Н2 и 1 моль
Sb2S3 и нагреты до 713° К. Константа равновесия Кр
реакции
Sb2S3 (т) -j- ЗН2 2Sb (т) + 3H2S
равна 0,429. Определить, сколько молей сурьмы образу-
ется и сколько молей водорода израсходуется по этой
реакции в состоянии равновесия.
26. Для реакции
СО + Н2О(г)=^СО2 + Н2
при 800° К ЛР = 4,12. Смесь, состоящую из 20 вес. %
СО и 80%’ вес. % НгО^нагревают до 800° К. Определить
равновесный состав смеси и выход водорода, если был
взят 1 кг водяного пара.
27. Из смеси стехиометрических количеств водорода и
азота, заключенной в сосуд емкостью 0,001 м3 при 400° С,
образуется 0,0385 моль NH3. Вычислить константу равно-
весия Кс и ЛР реакции
3H2+N2^2NH3
28. Определить равновесный состав смеси для реакции
СО + Н2О (г) СО2 + Н2
86
если известно, что при 930,5° К Кр=1, а до начала реак-
ции были смешаны 3 моль СО и 4 моль НгО.
29. Рассчитать количество кислорода (в объемных
процентах), которое содержится в реакционной равновес-
ной смеси для реакции
N2 + O2^2NO
если при 2400° С Лр=0,0035, а азот и кислород были взя-
ты в эквимолекулярном соотношении.
30. Для реакции
С2Н5ОН (ж) + СНзСООН (ж) =
= СН3СООС2Н5(ж)+ Н20(ж)
при 25° С Л=4. Определить выход эфира, если взять
100 г спирта и 20 а уксусной кислоты. Считать раствор
идеальным.
§ 15. ВЫЧИСЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ
В СМЕСИ РЕАЛЬНЫХ ГАЗОВ
Для реакции, протекающей в смеси реальных газов,
константа равновесия выражается через парциальные
летучести компонентов в равновесной системе
'а' в
Летучесть можно выразить через парциальное давле-
ние по уравнению
fi == XiPii
где — равновесное парциальное давление i-ro компо-
нента; уг — коэффициент летучести (активности). Отсю-
да получаем соотношение
Kf = KyKv', (IV,9)
где
8 г
к YGYR (IV, 10)
Y“AYbB
Для вычисления коэффициентов летучести можно вос-
пользоваться приближенным методом расчета, основан-
ным на принципе соответственных состояний. Согласно
87
этому принципу ряд одинаковых свойств, в том числе и
коэффициент летучести различных реальных газов, ока-
зываются равными при одинаковых значениях приведен-
ной температуры т и приведенного давления л *.
Приведенной температурой и приведенным давлением
называются соответственно отношения абсолютной тем-
пературы и давления к их критическим значениям
Т Р
Х = Т~' и Я = 7-*
* кр ГКр
Константа равновесия для смеси реальных газов, вы-
раженная через летучесть Л/, не зависит от давления. При
малых давлениях Кл = 1 и Л/ = Лр. В неидеальном раство-
ре константа равновесия описывается уравнением
в Г
к — к к — aGflR
Ла — ~—Г >
аа аь
а в
где
8. г
„ Ygyr
Av — Г >
Y“AYbB
^i=yiCi; йг— активность i-ro компонента; у» — коэффи-
циент активности i-ro компонента.
Константы равновесия Л/ и Ля могут быть определены
также по стандартным изменениям изобарных потенциа-
лов. Стандартное изменение изобарного потенциала в
реальном газе или неидеальном растворе определяется
по уравнению
AG° = -2,303RTlgKf, (IV,11)
или
AG° = -2,303/?Tlg/(a.
При расчете Kf по уравнению (IV, 11) по значениям
AG° из стандартных таблиц Kf выражается в атм\п
(&n=g+r—b—а); умножая на (1,013-105) Дп, получают
размерность в (н/м2) Дп.
* Таблицы значений у при разных лит приведены в «Кратком
справочнике физико-химических величин», под ред. К. П. Мищенко
и А. А. Равделя. Изд-во «Химия», М. — Л., 1967.
88
Пример 1. Вычислить выход* этилового спирта по реакции
С2Н4 (г) + Н2О (г) С2Н5ОН (г)
из смеси этилена и воды стехиометрического состава при 300° С
и 10133,0 кн/м.2, если 1g К/~—4,566 [Л/ в (кн/м2)-1].
Решение. Согласно формуле (IV,9) Кf=K^Кр-
„ Тс2н5он
Кт =
7с,н47н2о
приведенные параметры для
табличные данные для кри-
Коэффициенты летучести определяем на основании принципа
соответственных состояний. Находим --------~
всех компонентов реакции, используя
тических температур и давлений:
этилен
Т
тс2н4 = т
1 кр
573 „ „
2-^Т = 2-°2;
Р Ю133 , „„
яс н = 71— = г,= 1 >98;
С,Н‘ Ркр 5117
вода
573
:н о = Z- 1 = 0,890;
н«° 647,4
1° 133 Л
п — —------— 0,46;
И’0 22 120
этанол
573
Тс»н»он ~ 516,2 ,11:
ЯС2Н5ОН- 6384
ю 133 , „
= 1,59.
Пользуясь таблицами, определяем коэффициенты летучести:
в тех случаях, когда значения приведенной температуры т меньше
единицы, значения коэффициентов летучести находят из диаграммы,
которая приводится в справочной литературе:
Тс2н4 == °'958> 1н2о = 0>73> 7с2н5он = °>642.
= 1С2Н,ОН =____________0J542_=
7 1с2н41н2о 0,958-0,78
Из условия задачи
Ig Kf = 5,4343; Kf = 2,72 -10—5 (кн№~1.
Отсюда
Kf
72-10-5 Рс2н.0Н(г) „ 1
——— = 3,16-10~5 =--------------- 2 ° ( (ЛГН/Л42)-1.
°>859 /,С2Н1(г)/’н!О(г)
* Выходом продукта называется отношение числа молей продук-
тов реакции к общему числу молей в равновесной смеси, выраженное
в процентах (объемных).
89
Парциальные давления реагентов в равновесной газовой смеси
рассчитываем по уравнению (IV,2). Находим число молей реагентов
в равновесной газовой смеси из 1 моль этилена и 1 моль водяно-
го пара
Чисто молей С2Н4 (г) 4- Н2О (г) С2Н5ОН (г)
в исходной 11 О
в равновесной смеси 1 — х 1 — х х
Общее число молей '2п = 1 — х 4- 1 — х 4- х = 2 — х.
Отсюда парциальные давления
х 1 — х
/’С.Н^ОЩг) = 2 — х’ ^С.НДг) = 7нгО(г) = 2 _ х р-
И Кр выражаем
= х^ — х) х_(2—х) = 2 2 10_5 0 133 = 0 з2о
? Р(1 — х)2’ (1 —х2)
После ряда преобразований получаем уравнение
1,32x2 - 2,64x 4- 0,32 = 0.
Решая данное уравнение, получаем следующие значения:
Х!=0,129; х2=1,87. Значение х2=1,87 (х>1) не имеет физического
смысла.
Выход этилового эфира равен
-----— 100 = 0,129 100 = 6,89% .
2 —х 2 — 0,129 ’
Пример 2. Рассчитать выход аммиака по реакции
если на синтез поступает стехиометрическая смесь при температуре
750° К и давлении 405,2-105 н/м2. Для данной реакции
ДО° = —37 949 4-72,757 1gГ — 16,64- 10~372 4- 1,40-10'673 —
— 102,727 дж.
Решение. Определяем ДО° для 7 = 750° К:
ДО° = -37 949 4- 72,75-750 lg750 — 16,64-10~3-7502 4- 1,4-10~6 X
X 7503 — 102,7-750 = 33 114 дж,
AG0 = — 2,303/?7 In Kf, отсюда
_ AG° _ —33114 _
g/</_ — 2,303/?7 “ — 2,3-8,314-750 ~ —2>31 >
где K/=4,875-10“3 атм~1. Учитывая, что давление выражено в н]м2,
a AG° рассчитано при давлении участвующих в реакциях газов, рав-
90
ном 1 атм, константу равновесия следует пересчитать в н/м2, т. е.
К/ = 4,8-:1°— = 4,810-10~8 (н/Л2)-1.
1,013-Ю5
’ Для вычисления коэффициентов летучести реагентов реакции
определяем приведенные температуры и давления (критические тем-
пературы и давления берем из справочных таблиц):
азот
Т ' 750 р 405,2- 105 , „ .
тм =------=-------=5,94; ~—=—г----------=11,95;
N’ 7кр 126,2 Ns Ркр 3^,0-105
аммиак
^750 ’ 405,2-105
тмн = = 1.85; nNH =--------— =3,58.
NH’ 405,0 113,0-105
При вычислении приведенных свойств для водорода
использовать вместо Ркр и Ткр псевдокритические
(Т’кр + 8,01-105) и (Г„р 4-8):
Водород
750
тн ~=18,16; =
н« 33,8 + 8 н’ (12,96 +8,01) 105
необходимо
параметры
405,2-105
=19,25.
Пользуясь таблицами, определяем коэффициенты летучести:
In, ~ 1>1S9; = 1.120; kNHb = 0,901,
отсюда
0,0901
=-----~Ч~~~ =0.697.
1,189/’• 1,12/>
Согласно уравнению (IV,9),
*7 _4,810-10~8
- К, ~~
число молей
*КР
0,697
= 6,8910~8 (я/л2)-1.
Найдем
N2 и 3/2 моль Н2:
реагентов
в смеси, полученной из 1/2 моль
число молей:
в исходной смеси
в равновесной смеси
Общее число молей в
о
3/2
V2N2
’/2
!/2 — V2X 3/2 — X
равновесной газовой смеси:
2л = 1/2- 1/2х + з/2 — з/2Х + х = 2- х.
Парциальные давления компонентов согласно формуле (IV,2)
равны:
*/2 —*/2Х 3/2 — 3hx D. X
Р^,= г Р' РЪ - 2-х Р’ Рт> - 2-х
2 — х
2 — х
91
Подставляя эти выражения для парциальных давлений реаген-
тов в формулу
к,- Рт
получим
2,796 =
0/2 —
х(2-х)
--------7Г = У-
х определяем методом подбора:
0,6
4,0
х = 0,5
У = 2,3
0,55
3,0
0,535
2,796
принимаем х=0,535. Следовательно,
х 0,535
выход
аммиака равен
Задачи
1-5. Вычислить выход этанола по уравнению реакции
С2Н4 (г) + Н2О (г) =₽* С2Н5ОН (г) -
из смеси этилена и воды стехиометрического состава при
температуре t и давлении Р.
Номер задачи /,°с Ig Kf. [К j, (кн/м1) '] Р, кн’м2
1 250 —4,1958 8106,40
2 300 —4,5657 12156,0
3 300 —4,5657 15199,5
4 350 —4,8758 15199,5
5 350 —4,8758 20266,0
6-10. Вычислить выход этанола (в мольных процен-
тах) по уравнению реакции
С2Н4 (г) + Н2О (г) =₽* С2Н5ОН (г)
при температуре 250° С, давлении Р и различных соотно-
шениях водяного пара и этилена в исходной смеси, если
1g Л/=—4,1958; [Л/( (кн]лР) -’].
92
Номер задачи "н,о: "с2н1 Р, кн[мг
6 0,2 : 1 10133,0
7 0,4: 1 10133,0
8 ' 0,4: 1 8106,4
9 0,6 : 1 8106,4
10 0,8: 1 8106,4
11-12. Вычислить выход пропанола, получаемого при
гидратации пропилена С3Нб
С3Н6(г) + Н2О(г)^ С3Н7ОН(г)
иод давлением 20 266 кн/м2 и температуре t из смеси сте-
хиометрического состава.
Для данной реакции
lg Ъ - 7,8856; [Л/, (кн/м^].
Номер задачи t°C
11 250
12 200
13-16. Вычислить выход бутанола, получаемого при
гидратации бутилена С4Н8 из смеси бутилена и воды сте-
хиометрического состава при температуре t и давлении Р
по уравнению реакции
С4Н8 (г) + Н2О (г) С4Н9ОН (г)
Для данной реакции
lg Kf = - 8,4006; [JQ, (кн/л<2)-1].
Н^омер задачи /,°с Р, кн!м*
13 250 15199,5
14 250 20266,0
15 200 15199.5
16 200 20266,0
93
17-19. Вычислить выход уксусноэтилового эфира из
стехиометрической смеси этилового спирта и уксусной
кислоты по уравнению реакции
С2Н5ОН (г) + СНзСООН (г) СН3СООС2Н5 (г) + Н2О (г)
при температуре t и давлении Р, если для данной реакции
\G° = — 35082,84 — 23,43047 tn Т + 195,393Т дж/моль.
Номер задачи /,°с Р, кн'м*
17 150 10133,0
18 200 10133,0
19 250 15199.5
20—23. Вычислить выход ацетонитрила CH3CN из сте-
хиометрической смеси этилена и аммиака по уравнению
реакции
С2Н4 (г) + NH3 (г) CH3CN (г) + 2Н2 (г)
при давлении 20 266 кн/м? и температуре Т.
Номер задачи г,°к Ig К; [Д'у, кн/л2]
20 700 1,5128
. 21 800 2,4288
22 900 2,9557
23 1000 3,4908
24—30. Вычислить выход аммиака из стехиометри-
ческой смеси азота и водорода по уравнению реакции
1/2N2(r) + 72H2(r)^NH3(r)
если для данной реакции
AG0 = - 37948,88 + 72,75Т lg Т - 16,64 • 10-37'2 +
+ 1,40-10-6?3 — 102,727.
Номер задачи г,° к Р, кн/мг Номер задачи г,°к Р, кн'м‘
24 600 40 532 28 800 40 532
25 700 40 532 29 800 81 064
26 700 81 064 30 800 101 330
27 700 101330
§ 16. ОПРЕДЕЛЕНИЕ НАПРАВЛЕНИЯ ПРОЦЕССА
ПО УРАВНЕНИЮ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ
Изменение изобарного потенциала при протекании
химической реакции в газовой фазе
аА + ЬВ gG + rR
*
при постоянном давлении и постоянной температуре мож-
но вычислить по уравнению изотермы’
AG° = 2,303R7’(lg-^—-lgKPj*, (IV,12)
? А?В
где р'о, p’r> Ра> р'в—любые взятые в реакцию парци-
альные давления реагирующих веществ.
Уравнение изотермы может быть записано также сле-
дующим образом (при V=const и T=const):
(с& сг \
/IV’13x
А В
где C'g, Cr, С'а Св — любые взятые концентрации реа-
гирующих веществ.
По знаку AG и АТ7 можно судить о возможности
протекания данной реакции. Если согласно расчету
(AG)p,T<0, то реакция может протекать самопроизволь-
но в прямом направлении. Если (AG)р,т>0, то данная
реакция в прямом направлении самопроизвольно проте-
кать не может. При (AG)p>T = 0 система находится в рав-
новесии. )
Приближенные данные о протекании реакции можно
также получить по стандартному изменению изобарного
потенциала реакции, которое определяется по уравнению
AGpearaj — 2 (mAG )прод 2 (mAG )исх.вещ.
Если согласно расчету АОоРеакц<0, то реакция будет
протекать; если АСореакц>0, то реакция не пойдет.
* Формула (IV,12) справедлива только для начальных условий,
когда все значения р/ постоянны. '
95
Пример 1. Степень диссоциации фосгена по реакции
СОС12^СО + С12
при 600° С и 1,38-105 н/м2 равна 0,9. Определить в каком направле-
нии будет протекать процесс при следующих заданных значениях
парциальных давлений компонентов:
Варианты ^COClj- «/•«* дсо> «/•»’ рС1, . «Ак1
1 1,013-105 1,013-105 1,013-105
2 1,048-105 2,026-105 3,039-105
3 1,048-105 3,039-105 3,039-105
Решение. 1. Определяем константу равновесия реакции
СОС12^±СО+ С12
л (1 — а) ла ла
РсоРд, . па п(1—а)
ар— „ > Рсо — /’а, — „ /1 , /’coci, — „ п ,
Pcocij п(1 + а) л(1 + а)
После подстановки и простых преобразований получаем
Pg2 1,38-105-0,92
1 —а2 1 —0,92
= 5,883-105 я/л2.
2. Направление процесса определяем по изменению изобарного
потенциала AG, которое вычисляем по уравнению изотермы химиче-
ской реакции (IV,12).
Для первого случая:
ДС?! = 2,303-8,314-873 1g
1,013-105-1,013-10s
1,013-105
1g 5,883-105
= — 12,76 кдж.
. Следовательно, в первом случае процесс в прямом направлении
возможен.
Для второго случая:
/ 2,026-105.3,039-105 Л
ДО2 = 2,303-8,314-873 11g ------------Ч--------— 1g 5,883-1051=0,
\ 1,048-105 /
Следовательно, во втором случае система находится в рав-
новесии.
Для третьего случая:
( 3,039-105-3,039-105 г
ДО3 = 2,303-8,314-87311g ------------Н-----—lg5,883-Ю5
\ 1,048-105
= 2,93 кдж.
96
Следовательно, в третьем случае процесс в прямом направлении
неосуществим, но возможен в обратном направлении.
Пример 2. Давление диссоциации NiO при 600° С равно
4-Ю-17 мм рт. ст. Определить изменение изобарного потенциала
для реакции
2N1 (т) + О2 (г) ^±2NiO (т)
при этой температуре, если кислород, взят под давлением 1,013Х
X 105 н/м2.
Решение. I. Определяем константу равновесия данной реакции
. „_17 4-10“17-1,013-105
Рог Равно 4-10 мм Рт- ст-> или Ро2 =--------------------------=
= 5,33-10“15 н/м?; отсюда /<р =-----------— (я/ж2)-1.
5,33-'10“15
2. Определяем изменение изобарного потенциала по уравне-
нию (IV,11):
ДО = 2,303 8,314 • 873 (1 g----— 1g------------
\ 1,013-105 5,33-10“15
= — 321,8 кдж.
Пример 3. Возможен ли термодинамический процесс получения
анилина из хлорбензола и аммиака по уравнению
С6Н5С1 (ж) + NH3 (г) C6H5NH2 (ж) + НС1 (г)
если известны стандартные изменения изобарного потенциала обра-
зования веществ, входящих в данную реакцию:
Л°свн5С1(ж) = 198,4 кдж/моль', = — 16,63 кдж/моль.
ДО£вн5мн2(ж) = 153,1 кдж/моль', = —95,28 кдж/моль.
Решение. Вычисляем стандартное изменение изобарного по-
тенциала реакции
д°реакЦ = 2 («дсо)прод - 2 («ДО°)исх = 153,1 - 95,28 +
+ 16,63— 198,4 = — 123,95 кдж.
Следовательно, процесс возможен.
4—1741
97
Задачи
1. Для реакции
Н2 + 12 =₽* 2HI
Лс=50 при 444° С. Определить направление процес-
са, если исходная смесь имеет следующий состав:
Сн2=2 моль/л\ Ci2=5 молъ/л-, Chi=10 молъ/л.
2. Константа диссоциации N2O4 по уравнению
N2O4^2NO2
при 50° С равна 0,797-105 н/м2. Определить направление
процесса при следующих исходных значениях парциаль-
ных давлений компонентов:
варианты pn2o4> «а*2 pno2- «/-«2
1 1,013-105 1,013-105
2 4,052-105 1,792-105
3 1,681-105 1,013-105
3. Для реакции
Н2О Н2 + V2O2
при 1500°С и 1,013-105 н/м2 а = 2,21 • 10~4. Определить, в
каком направлении пойдет процесс при следующих значе-
ниях исходных парциальных давлений компонентов:
Варианты РН2О- HlM* РН2' «/-“2 РО2«
1 1,013-105 1,013-105 1,013-105
2 1,013-104 2,026-102 1,28-Ю-з
3 1,013-104 1,013-101 1,28-Ю-з
4. Для реакции
СО2 СО + 72О2
при 1500° К и 1,013-105 н/м2 а=4,8-10~4. Определить, в
каком направлении пойдет процесс при следующих значе-
ниях исходных парциальных давлений компонентов:
98
Варианты Z'CO2- «/Л2 ’/’со- н>мг />О2- н/л2
1 1,013-105 1,013-105 1,013-105
’ 2 1,013-103 2,026-102 12,75-10-5
3 1,013-103 1,013-101 12,75-10-5
5. При 600° С константа равновесия реакции
СО + С12^ СОС12 ЛР = 1,678-10-6 (н/л/2)-1.
Вычислить максимальную работу образования 1 моль
СОС1г при этой температуре и парциальном давлении
0,507-105 h/jw2, если СО и С12 взяты при парциальных дав-
лениях соответственно 2,026-105 и 3,039-105 н/ж2.
6. Для реакции
СО + Н2О^СО2+Н2
при 1500° К Лр=0,31. Определить, в каком направлении
пойдет процесс при следующих значениях исходных пар-
циальных давлений компонентов:
Варианты лсо- н1м2 />н2о- н1мг />со2- «/«’ РН2. н;м2
1 2,026-105 6,078-105 4,052-105 3,039-105 '
2 19,25-105 2,43-105 4,052-105 3,039-105
3 20,26-105 5,065-105 6,078-105 2,026-105
7. Для реакции
SO2C12 5^ SO2 -|- С12
при 30° С Лр = 2,88-103 н/м2. Определить, в каком направ-
лении пойдет процесс при следующих значениях исходных
парциальных давлений компонентов:
Варианты /’SO2C12- «/«’ PSO2- н1м2 раг, “Iм2
1 4,052-105 2,026-105 2,026-105
2 3,565-103 1,013-103 1,013-101
3 2,026-103 1,013-103 1,013-104
8. Для реакции
2H2+S2(r)^2H2S(r)
4*
99
при 830° С /СР = 2,594-10-2 (м/лг2)1. Определить, в каком
направлении пойдет процесс при следующих значениях
исходных парциальных давлений компонентов:
Вариант />НЯ' «'-«2 PSt< «/«’ PH.S- «А«2
1 2,026-105 1,013-105 2,026-105
2 2,026-105 1,39-103 12,15-105
3 2,026-103 1,39-103 16,20-105
9. При 1000°К и 1,013-105 н/м2 для термической дис-
социации С12 по уравнению С12^2С1 а = 3,5-10~4. Опре-
делить, в каком направлении пойдет процесс при следую-
щих значениях исходных парциальных давлений компо-
нентов:
Варианты РС12- н1м2 /’С1- «/-«2
1 4,052-105 2,026-105
2 7,091-105 2,775-102
3 7,091-105 2,127-102
10. При 727° С для реакции
SO2 -|- NO2 SO3 -|- NO
/£р = 7,6. Определить, в каком направлении будет проте-
кать реакция при следующих значениях исходных парци-
альных давлений компонентов:
Варианты PSO2- н1м2 PNO2’ Р=О3- “l*2 PNO- к/-“2
1 1,013-105 6,078-105 2,026-105 3,039-105
2 0,399-105 1,013-105 1,52-105 2,026-105
3 2,026-105 3,039-105 10,13-105 6,078-105
11. Для реакции
Н2+12^2Н1
при 300° С /Ср = 80. Вычислить при этой температуре стан-
дартное изменение изобарного потенциала, если парци-
альное давление каждого из газов равно 1,013-105 н/м2.
юо
12. Для реакции
4НС1 (г) + 02 2Н2О (г) + 2С12
при 900°К Ар = 0,923-10-5 (н/м2)-1. Определить, в каком
направлении будет протекать реакция при следующих
значениях исходных парциальных давлений компо-
нентов:
Варианты /’HC1- н'-«2 Т’О2' н1м* РН20’ «/«’ PCI, • «А«2
1 2 3 13. п взаимоде водит К] 1,013-105 1,013-105 1,013-105 ри 1000°к йствие оки равновесию FeO(T)- 1,013-105 9,73-105 10,13-105 и общем си углерод ЬСО(г)^ 1,013-105 2,026-105 1,52-105 давлении 1 а и окиси жел Ре(т) + CO2(i 1,013-105 1,52-105 1,52-105 ,013-105 н/м2 еза (II) при- 0
когда парциальное давление окиси углерода равно
265 мм рт. ст. Определить, в каком- направлении пойдет
реакция при следующих значениях исходных парциаль-
ных давлений компонентов:
Варианты PCO- «/*2 /’со,- «/-«2
1 2,026-105 4,052-105
2 1,62-105 3,039-105
3 2,026-105 2,026-105
14. Для реакции
Sb2S3 (т) + ЗН2 =?* 2Sb (т) + 3H2S
при 713° К Др=0,429. Определить, в каком направлении
будет протекать реакция при следующих исходных парци-
альных давлениях компонентов:
Варианты РН2- н/л2 /’HjS- «'^2
1 0,709-105 0,507-105
2 0,674-105 0,507-105
3 0,304-105 0,507-105
101
15. Для реакции
сн4 + н2о^со + зн2
при 1100° К /Ср = 312,4• 1010 (h/к2)2. Определить, в каком
направлении будет протекать реакция при следующих
значениях исходных парциальных давлений компонентов:
Варианты />сн4> РЦ,О- >4*’ л со- *1м' Лн,' к/-«! ‘
1 0,203-105 1,013-105 10,13-105 2,026-105
2 1,013-105 2,026-105 10,13-Юь 2,026-105
3 1,013-105 1,053-105 12,15-105 3,039-105
16. Для реакции
SO2 + С12 SO2C12
при 102°С Кс= 13,35 (люль/л)-1. В каком направлении
будет протекать реакция при следующих значениях кон-
центраций реагирующих веществ в газовой смеси;
Варианты Cso2' моль1л Cq , моль/л CSO2C12- моль1л
1 1,00 0,30 5,00
2 1,00 0,45 6,00
3 2,00 3,00 5,00
17. Для реакции
2РеО(т) 2Fe (т) + О2(г)
при 1000° К Ар = 3,14-К)-3 н/л2. Определить, в каком
направлении пойдет процесс при следующих значениях
парциального давления кислорода над смесью окиси же-
леза (II) и железа:
Варианты р02, к/л2
1 2 3 4,052-Ю-з 3,14-Ю-з 2,026-Ю-з
18. Для реакции
2СО + 2Н2 СН4 + СО2
102
при 1000° К Лр=2,57-10-8 (н/л2)”1. Определить, в каком
направлении пойдет реакция при следующих исходных
парциальных давлениях компонентов:
Варианты Рсо- к'л2 рн,- «/-«2 Рен,- “Iм* /’СО,' «/•»’'
1 1,013-104 2„026-104 2,026-104 6,078-104
2 2,013-104 1,601-104 1,32-104 2,026-105
3 1,013-104 1,013-105 1,013-105 5,065-105
19. Для реакции
РС1з + С12^РС15
при 500°К Ар=2,962-10-5 (нЛи2)-1. Будет ли происходить
образование РС15 в газовой смеси, содержащей РС13,
С12 и PCI5, если парциальные давления реагирующих
веществ имеют следующие значения: ppci3= 1,013-104н/л<2,
Ppcis=5,07 • 104 н/л<2, pci2 = 2,026-105 н/м2.
20. При 111°С и 1,013-Ю5 н/м2 9,2 г N2O4 занимают
объем 0,00607 м3, причем устанавливается равновесие
N2O4^2NO2. Определить степень диссоциации N2O4,
константу равновесия Кс и направление процесса в сме-
си, содержащей в 0,001 м3 0,01 моль N2O4 и 0,5 моль NO2.
21. Для реакции
С2Н4(г) + Н2^С2Н6(г)
при 600° С Ар = 2,864-10-4 (н/м2)-1. Определить направле-
ние процесса при следующих значениях парциальных дав-
лений реагентов:
Варианты Р , HIM2 Cj л4 Рн н,лс! Рг „ , н/л2
1 4,56-104 5,07-104 5,07-103
2 5,06-103 1.52-104 8,11-104
22. Для реакции
2SO2 + О2 2SO3
при 727°С Ар = 3,417-10-8 (н/м2)-1. Определить направле-
ние процесса при следующих значениях исходных парци-
альных давлений компонентов:
103
Варианты PSOs. РО,' н,мг 'so,’
1 7,32-104 2,03-104 7,8-Юз
2 5,71-104 1,03-101 3,38-104
3 2,53-104 1,27-101 6,33-101
23. Для реакции
N2 + ЗН2 2NH3
при 350°С Ар = 7,23-10~14 (н/л2)-2. Определить направле-
ние процесса при следующих значениях исходных парци-
альных давлений компонентов:
Варианты 'и,- К/Л2 , Н,Л2 Н 2 'nH,' Н1М2
1 1,013-103 1,013-105 1,013-105
2 50,65-105 151,95-105 1,013-105
3 4,36-105 20,26-105 6,065-105
24. Для реакции
СО + Н2О СО2 + Н2
при 930° К Ар=1. В какую сторону пойдет реакция, если
смесь газов имеет при этой температуре следующий
состав (об. %): СО 50, СО2 20, Н2 25, Н2О 5?
25. При 450° С давление диссоциации NiO по урав-
нению
2NiO(T)^2Ni(T) + O2(r)
/Ср=ро2 = 5,181 • 10~26 мм рт. ст. Пойдет ли разложение NiO
на воздухе при парциальном давлении кислорода
0,203-105 н/л2? Чему будет равно AG для обратного про-
цесса
2Ni(T) + O2=f±2Ni(T)
в тех же условиях?
26. При 25° С для реакции
N2O4 2NO2 AG° = 5395 дж.
Чему равна степень диссоциации N2O4 при следующих
условиях: а) при 25° С и 1,013-105 н/л2; б) при 25° С и
10,13-105 н/м2?
104
27. Возможен ли термодинамический процесс получе-
ния анилина при 25° С по уравнению
С6Н6 (ж) + NH3 (г) C6H5NH2 (ж) + Н2 (г)
если при этой температуре AG°c6h8(®) = 124,6 кдж/моль-,
AG°nh3= —16,63 кдж)моль-, AG°c6h5nh2(®)= 153,1 кдж!моль?
28. Возможен ли при 25° С термодинамический про-
цесс
С6Н6 (ж) + С12(г) С6Н5С1 (ж) + НС1 (г)
если при этой температуре AGoc8h5ci= 198,4 кдж/моль-,
AG°Hci(r)=—95,28. к^ж/лоль; AG°c8h8(®) = 124,6 кдж/моль?
29. При 1000° К для реакции
2Fe(T) + O2^2FeO(T)
/Ср = 4,136• 1020 (н/л/2)-1. Определить направление процес-
са, если ро2 = 2,026-104 н/м2.
30. При 360° С и 1,013-105 н/м2 для реакции
2Н1^Н2+12
а=20%. Определить, в каком направлении будет проте-
кать процесс при следующих значениях парциальных
давлений реагирующих веществ:
Вариант ЛН1. н/лс2 р , Н/Л2 р. , н/м* 1я
1 3,039-101 3,039-101 5,07-101
2 3,039-101 3,039-101 4,76-102
3 3,039-101 3,039-101 1,013-103
Глава V
ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ
ХИМИЧЕСКОЙ реакции от температуры
выра-
(V.l),
(V,2)
§ 17. РАСЧЕТЫ ПО УРАВНЕНИЯМ ИЗОБАРЫ
И ИЗОХОРЫ ХИМИЧЕСКОЙ РЕАКЦИИ
Влияние температуры на константу равновесия
' жается уравнениями изобары и изохоры:
t/ln/Cp АЯ din QP
------ -- ---- ИЛИ — " -----
dT ЯР dT RT2 ’
dln/Cc AU yi dlnRc Qv
df~ ~ RT2 ИЛИ dT ~ RT2 ’
Если допустить в первом приближении, что АН = const
(это можно принять, если рассматривать изменение кон-
станты равновесия в небольшом температурном интерва-
ле), то тогда в интегральной форме уравнение (V.1) име-
ет следующий вид:
АН
Ig Яр = — -——— + const. (V,3)
2,303ЯТ v '
Интегрирование в пределах от до Т2 дает
lg*» = АН (П-7,)
ё Ярд 2.303Я T1T2 1 ’
Уравнения (V,3) и (V,4) позволяют определить достаточ-
но точно Яр,2 при Т2 в небольшом интервале температур
Ti—Т2, если известны Ярд при Ti и тепловой эффект ре-
акции; или вычислить тепловой эффект, если известны
значения констант равновесия при двух температурах.
При более точном интегрировании следует учитывать,
что AH=f(T). Эту зависимость определяют по уравне-
нию Кирхгофа (II, 11).
106
Пример 1. Рассчитать константу равновесия реакции синтеза ме-
тилового спирта
СО + 2Н2 СН3ОН (г)
при 800° К, если при 25° С <?р1298о — —90,44 кдж/моль, Кр1298==
= 4,1310—10 (н/м2)—2, и мольные теплоемкости газов
С£° = 28,41 + 4,1 • 10~3Т — 0,46 105Т“2 дж/моль-град,
С”» = 27,28 + 3,26-10“3Т + 0,502- 105Т“2 дж/моль-град,
Ссн3он = 15 28 + 105 2.10-зг _31 04.1О-6Г2 дж/моль-град.
Решение. Определяем тепловой эффект при 800° К пб уравне-
нию Кирхгофа (11,11):
800
Д^800°К = Д^298° + J >
298
ДСр = — 67,69 + 94,58-10“3Г — 0,544-105Т“2 — 31,04-10“6Т2,
800
ДЯ8(Х)О = — 90 440 + j ( — 67,69 + 94,'58- 10“3Г — 0,544 х
298
х Ю5?’-2 — 31,04-10“67’2) dT = — 90’440 — 67,69 (800 — 298) +
04 ЧЯ. 1 П“3
+ - ’ -------(8002 — 2982) + 0,544-105Х
/1 1 \ 31,04-10“6 , ч
хН-Г- -—1--------------------(8003 —2983)= — 103700 дж =
\800 298/ 3
= — 103,7 кдж.
Константу равновесия при 800° К определяем по формуле (V.4):
1й/<р,2=|84-131О~10
103700 (800 — 298)
~2,3-8,314 800-298 ’
lgKp>2 = 21,176; Кр>2 = 1,5-10“21.
Пример 2. Давление диссоциации MgCOa при 813° К равно
0,996-105 н/м2, а при 843° К — 1,786-105 н/м2. Вычислить тепловой
эффект реакции разложения магнезита
MgCO3^±MgO + CO2
и рассчитать, при какой температуре давление диссоциации будет
равно 1,013-105 н/м.2.
107
Решение. Определяем ДЯ из уравнения (V,4)
КР2
2,3037?7’1.7’2 1g-Л-
^р,1
д?/ =---------------------—
7'2-7'1
или
1 786 105
2,303.8,314-813-843 1g -----:--
0,996-105
Д7/ =-------------------------1-------= 111 300 дж.
30
Определяем Т2 при давлении диссоциации 1,013- 10s н/м2:
Яр,2
2,3037?7’1 1g—
Т2-Тг Кр,1
-------=------------------ или
Т2 ЬН
„ 1,013-Ю5
2,303-8,314-813-1g —------
__________________0,996-105
111300
813
отсюда 7’2 = 814° К.
Задачи
1. Для реакции
2СО2 2СО + О2
Кр = 4,033-1(Н6 н/м2 при 1000° К. Вычислить константу
равновесия этой реакции при 2000° К, если среднее зна-
чение теплового эффекта QP = 561,3 кдж/моль.
2. Давление диссоциации HgClNH3 равно 4693,2 н/м2
при 167° С и 8826,4 н/м2 при 185° С. Определить среднее
значение теплового эффекта реакции
HgClNH3 ч=*= HgCl + NH3
3. Тепловой эффект реакции
РС15^РС1з + С12
в температурном интервале от 475 до 575° К равен
91546,0 дж. Степень диссоциации РС15 при 475° К и
1,013-Ю5 н/м2 равна 0,428. Определить степень диссоциа-
ции РС15 при 575° К и 2,026-105 н/м2.
108
4. Давление диссоциации РЬО при 600° К равно
9,525-10—26 н/м2, а при температуре 800° К — 2,33х
ХЮ“16 н/м2. Определить температуру, при которой РЬО
будет разлагаться на воздухе.
5. Давление диссоциации СаСО3 при температуре
1150° К равно 0,669-Ю5 н/м2. Теплота диссоциации
167 360 дж/моль. Определить температуру, при которой
давление диссоциации СаСОз равно 1,013-Ю5 н/м2.
6. При нагревании СО2 под давлением 1,013-Ю5 н/м2
до 1400° К обнаруживается термическая диссоциация на
1,5-Ю_2О/о, а при температуре 1498° К и том же давле-
нии— на 4,7-Ю“2%. При этом устанавливается равно-
весие
2СО + О2 2СО2
Определить тепловой эффект реакции в этом темпе-
ратурном интервале и степень диссоциации СО2 при
1478° К и 1,013-Ю5 н/м2.
7. Йодистый водород диссоциирует при нагревании
до температуры 280° С на 17,8%, а при нагревании
до 520° С — на 24,48%. Определить степень диссоциации
при нагревании до 300° С.
8. При диссоциации N2O4 устанавливается равновесие
2NO2 N2O4
При нагревании 9,2 г N2O4 до 27° С под давлением
1,013-Ю5 н/м2 газ занимает объем 0,00295 м3, дальней-
шее нагревание до 110° С приводит к расширению объема
до 0,00607 м3. Рассчитать степень термической диссоциа-
ции при 27 и 110° С, константы равновесия Kc,i и /Сс>2
при этих температурах и среднее значение теплового эф-
фекта в указанном температурном интервале.
9. Определить тепловой эффект реакции диссоциации
магнезита
MgCO3 MgO + СО2
если упругость диссоциации при 490° С равна
59,0 мм рт. ст., а при температуре 540° С—747 мм рт. ст.
10. При нагревании пятихлористого фосфора уста-
навливается равновесие
РС13(г)+ С12(г) РС15(г)
При 200° С и 1,013-Ю5 н/м2 все компоненты находятся в
газовой фазе и степень термической диссоциации PCU
109
равна 48,5%. Под тем же давлением при 250° С пяти-
хлористый фосфор диссоциирует на 80%. Вычислить
средний тепловой эффект реакции в данном интервале
температур и степень термической диссоциации при 225°
и 5,065-105 н/л2.
11. Для реакции
СО + С12^СОС12(г)
при 1,013-105 н/м2 и 300° С а=3,9%, а при 500° С и том
же давлении а = 55%. Рассчитать средний тепловой эф-
фект реакции в указанном температурном интерва-
ле и степень термической диссоциации при 400° С
и 1,013-105 н/м2.
12. При умеренном нагревании кристаллогидрата
FeSO4-7H2O устанавливается равновесие
FeSO4• 7Н2О (т) FeSO4• 6Н2О (г) + Н2О (г)
При 45,43° С давление водяного пара над кристаллогид-
ратом равно 76,79 мм рт. ст., а при температуре 25° С—
14,55 мм рт. ст. Чему будет равно равновесное давление
пара над кристаллогидратом при 10° С?
13. При нагревании кристаллогидрата ZnSO4-7H2O
устанавливается равновесие
ZnSO4- 7Н2О (т) ZnSO4-6H2O (т) + Н2О (г)
При 283° К давление водяного пара над кристаллогид-
ратом равно 4,86 мм рт. ст., а при 348° К — 220 мм рт. ст.
Определить средний тепловой эффект реакции в данном
интервале температур и константу равновесия данной
системы при 300° К.
14. Для равновесия
Fe3O4 (т) + 4СО (г) 3Fe (т) + 4СО2 (г)
при 1091° К /СР=2,49, а при 1312° К КР=4,5. Чему равен
тепловой эффект процесса восстановления Fe3O4? При
какой температуре Кр=5,4?
15. Вычислить константу равновесия реакции
2SO2 О2 2SO3 — 188,5 кдж
при 1000° К, если при 900° К КР = 2,3-10~7 (н/м2)-1.
16. Теплоты сгорания водорода и окиси углерода со-
ответственно равны —241,8 и —283,0 кдж. Определить
состав водяного газа, образовавшегося из равных объ-
емов водяного пара и окиси углерода по уравнению ре-
ПО
акции
Н20 + СО СО2 + Н2
при 600° С, если при 1000° С /Ср = 1,39.
17. Для реакции
Н2 + I2 2HI
при 360° С Др = 61,6, а при 445° С Др=41,7. Сравнить
среднее значение теплового эффекта с нормальным срод-
ством при 445° С. Найти изменение энтропии.
18. Для реакции
N2 + 3H2=f±2NH3
при 893° К Др=7,109-10-16, а при 973° К КР=2,103Х
ХЮ-16 н/л2. Определить тепловой эффект реакции в
данном температурном интервале и вычислить констан-
ту равновесия при 933° К-
19. Определить температуру разложения известняка
при давлении 1,013-105 н/л2, если давление диссоциации
при 900° С равно 992 мм рт. ст., а тепловой эффект ре-
акции при постоянном давлении равен 165,0 кдж/моль.
20. В реакционном сосуде находится по 1 моль СО и
Н2О. Определить состав смеси в момент равновесия ре-
акции при 800° К, если при 1278°К. /Ср=1,62. Средний теп-
ловой эффект реакции
Н2О + СО СО2 + Н2
•в этом температурном интервале равен 41,84 кдж/моль.
21. Определить тепловой эффект реакции
2СО + О2 2СО2
считая его постоянным в пределах температур 2000—
2500° К, если известны константы равновесия этой реак-
ции /Ср,1 = 3,91 • 10~6 м2/н ' при 2000° К и /СР12 = 2,22Х
Х10~10 м2/н при 2100° К-
22. Теплота образования Мп3О< из элементов равна
—1407,9 кдж. Определить температуру, при которой ок-
сид разложится на элементы при нагревании на воздухе.
Давление диссоциации Мп3О4 при 450° С равно 6,655х
Х10~36 мм рт. ст.
23. Железо и водяной пар реагируют по уравнению
Fe (т) + Н2О (г) FeQ(T) + Н2 (г)
Температура реакции 1025°С, давление 1,013-105 н/м2.
111
При установлении равновесия парциальное давление во-
дорода 427 мм рт. ст., а парциальное давление паров
воды 333 мм рт. ст. При температуре реакции 900° С
Рн2=450 мм рт. ст., рн2о = 310 мм рт. ст. Рассчитать сред-
ний тепловой эффект реакции в этом интервале темпе-
ратур.
24. Для реакции сульфирования
2AgCl (т) + H2S (г) Ag2S (т) + 2HCI (г)
при 230° С /СР = 1,662-105 н/м2, а при 419°С /СР=117,8Х
ХЮ5 н/м2. Определить тепловой эффект в данном интер-
вале температур и константу равновесия при 280° С.
25. Степень диссоциации РС15 при 200°С и 1,013Х
ХЮ5 н/м2 равна 0,485, а при 250° С и том же давлении —
0,8. Рассчитать среднее значение теплового эффекта ре-
акции
РС1з + С12^РС15
при Р = const и V=const и при 200—250° С.
26. Для реакции
С(т) + 2Н2(г)^СН4(г)
при 700° С /Ср = 0,1924-10-5 и 750° С /СР = 0,1159-ЮЛ Вы-
числить средний тепловой эффект реакции в этом интер-
вале температур.
27. При 96° С давление диссоциации LiCl-NH3 (т)
равно 367 мм рт. ст., а при 109,2° — 646 мм рт. ст. Рас-
считать средний тепловой эффект реакции
LiCl -NH3(t) LiCl (т) + NH3(r)
в этом температурном интервале и при постоянном дав-
лении.
28. о-Толуидиновая кислота в бензольном растворе
ассоциирует в димер. Определить тепловой эффект реак-
ции образования димера, если при 32,6° С /СР=3,38-ЮЛ
а при 56,5° С /СР=9,27-ЮЛ Определить константу рав-
новесия реакции образования димера при 43,4° С.
29. Давление пара над системой CuSO4-5H2O-l-
+ CuSO4-3H2O при 30,2°С равно 10,9 мм рт. ст., а при
26,3° С — 8,074 мм рт. ст. Рассчитать тепловой эффект
реакции
CuSO4 - ЗН2О (т) + 2Н2О (г) =₽± CuSO4 • 5Н2О (т)
112
30. Для реакции
СгС12(т) + Н2(г) Сг (т) + 2НС1 (г)
при 677° С /<р = 6,702 н/м2 и при 772° С /Ср = 56,07 н/м2.
Определить константу равновесия при 806° С.
§ 18. ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ ХИМИЧЕСКОЙ
РЕАКЦИИ ИЛИ РАВНОВЕСНОГО СОСТАВА СМЕСИ
ПО ЗАВИСИМОСТИ КОНСТАНТЫ РАВНОВЕСИЯ ОТ ТЕМПЕРАТУРЫ
Из уравнения изохоры реакции (V,l):
кН = RT dXn^-, (V.5)
аТ
Таким образом, зная зависимость константы равнове-
сия от температуры, можно по уравнению (V.5) вычис-
лить тепловой эффект реакции для данной температуры.
Пример 1. Для процесса дегидратации спирта
2С2Н5ОН (г) СН3СООС2Н5 (г) + 2Н2 (г)
в интервале температур 181—202° С предложено следующее уравне-
ние для константы равновесия:
2100
ig кР = - +4>б6 икр) = а/и)-
Определить стандартную теплоту образования эфира, если стандарт-
ная теплота образования спирта равна —235,3 кдж/моль.
Решение. Определяем АН по уравнению (V, 1):
ягадп кР
dlnKp а 2,303-2100
dT ~ dT ~ Г2
отсюда Д/7 = 2,303-8,314-2100 = 40,4 кдж.
Полученное значение теплового эффекта реакции в интервале
температур 1814-202°С пересчитываем на температуру 25° С по зако-
ну Кирхгофа. Воспользуемся уравнением (11,11):
Тг
АН2 = Д//1 + J ACpdT.
Г,
ЛСр для данной реакции имеет следующее значение:
ДСр = 2Ср2(г) + c£HsCOOC«Hl(r) — с£’н’он(г)
113
Значения теплоемкостей следующие:
ДСр=2Ср(г) + С™гС00СаН5(р) —2С^Н’ОН(Г)
Сс,н5он(г) = 19>07 + 212,7. io~3T — 108,6-10“ 6Т2 +
+ 21,9-10~9Т3 дж/моль-град;
с£*<г) = 27,28 + 3,26-10—3Т + 0,502-105Т“2 дж/моль-град;
Сснэсоосгн5(г) _ 136 77 дж/моль-град.
Отсюда
ДСР = 2 (27,28 + 3,26- Ю-3?’ + 0,502- Ю5!-2) +
+ 136,77 — 2(19,07 + 212,7х
X10“ 3Т — 108,6- 10-6Г2 + 21,9 Ю-9Г3) = 153,19 — 418,9- 10“3Г +
+ 217,2- 10-6Т2 + 1,004- 1О5Т“2 — 43,8-10_9Т3.
Согласно уравнению (II,II)
475° 475°
ДЛГ298„ = ДЛГ475О — J LCpdT = 40 400— j (153,19 — 418,9-10-3Т +
298° 298°
+ 217,2-10“ 6Г2 + 1,004- 105Г-2 — 43,8-10“9Г3) dT = 40 400 —
418 9 10—3
— 153,19 (475 — 298) +---------(4752 — 2982) —
217,2-Ю-6 . а. , / 1 1 \
--------5-----<475 - 298 1 + 1 -°04'10’ («5 -2081 +
+ 18,8-1------(475* _ 29S1) = 36 674 дж = 36,67 кдж.
Определяем стандартную теплоту образования эфира по уравне-
нию (11,6):
Д/7эфира = 36,67 — 2-235,3== —433,93 кдж/моль.
Пример 2. Определить тепловой эффект реакции
СО + 2Н2^±СН3ОН (г) (1)
если известны зависимости констант равновесия от температур для
реакций:
2Н2 + СН3СООН 2СН3ОН (2)
te^p.i = — 3^49 +5,43 ([А7Р] =а/п-1). '
114
СН3ОН (г) + СО СН3СООН (г) (3)
, 1835 ,
te*p|2 = ——~+6,61 ’).
Решение. Выводим для реакции (1) зависимость константы
равновесия Кр, х от температуры. Для этого складываем уравнения
реакций (2) и (3). Для определения Кр, х производим аналогичное
арифметическое действие со стандартными изменениями изобарного
потенциала:
для реакции (1) AGj — —2,303/?? 1g Кр р
для реакции (2) AG2 = — 2,303/?? 1g/<?р 2;
для реакции (3) ДО° = —2,303/?? 1g Кр х.
Отсюда ДО° = AGj + ДО2 или
- 2,303/?? 1g Kp x = - 2,303/?? 1g /<р>1 -2,303/?? 1g Kp 2,
после простых преобразований получаем
4984
'gKp.^'gKp,! +1gKp,2= --^-+12,04,
d In Kp
dT
d г ( 4984
--- 2,303 — + 12,04
dT I \ ?
2,303-4980
?2
Определяем А// из уравнения (V,l):
Ш = 2,303-8,314-4984 = 95 400 дж/моль.
Задачи
1. Зависимость константы равновесия от температуры
для реакции
. СО(г) + Н2О(г)^СО2(г) + Н2(г)
выражается уравнением
1g Яс = _ 0,783 lg Т + 4,3 • 10-4T.
Рассчитать состав равновесной газовой смеси при сме-
шении равных объемов СО и Н2О и 1000° К, а также из-
менение энтальпии при этой температуре.
2. Зависимость константы равновесия от температу-
ры для реакции
С2Н4(г) + Н2(г) С2Нв(г)
115
выражается уравнением
6366
lg Кр = —------2,961 lg Т + 7,67 • 10-4Т + 5,2.
Определить Кр при 1000° К, а также изменение энталь-
пии при этой температуре.
3. Вычислить тепловой эффект при 1200° К для ре-
акции
Fe3O4 (т) + Н2(г) 3FeO (т) + Н20 (г)
если
1g =
3378
+ 3,648.
Т
4. Для реакции
СН4(г) + Н2О(г) СО(г) + ЗН2(г)
зависимость константы равновесия от температуры вы-
ражается уравнением
lgKP = --^ + 8,18 lg Т— 1,96- 10-зТ — 11,4.
Определить тепловой эффект данной реакции при
1000°к.
5. Равновесие в системе, возникающей при восстанов-
лении олова водородом
SnO2(T) + 2Н2(г) Sn (т) + 2Н2О (г)
характеризуется уравнением
lgtfp = — — 1,655 lg Т — 9,08-10^ +8,416.
Рассчитать значение и А Я для данной реакции при
1073°К.
6. Константа равновесия реакции
2НС1(г)^Н2+С12
может быть выражена уравнением
9586
IgKp ------— + 0,44 lg Т-2,16.
Определить тепловой эффект этой реакции при 1000° К.
116
7. Определить температуру, при которой FeO начнет
разлагаться на воздухе:
2FeO(T)^2Fe(T) + O2(r)
если давление диссоциации определяется уравнением
26730
—-----F 6,43.
Т
lgp =
Давление кислорода в воздухе считать приблизительно
равным 0,21 атм.
8. Давление диссоциации СаСО3 изменяется с тем-
пературой по уравнению
lgpco2 = --^+ 1,66 lg Т- 1,09-10-3Т +5,69.
Определить теплоту диссоциации СаСО3 при 1300° К.
9. Зависимость константы равновесия от температу-
ры для реакции
Fe3O4 (т) + Н2 (г) 3FeO (т) + Н2О (г) (1)
выражается уравнением
а для реакции
РеО(т)Ч-Н2(г)^Ре(т) + Н2О(г) (2)
уравнением
748
lg*p = - — +0,573.
Определить равновесный состав газовой фазы (в объем-
ных процентах) при 800° С для реакций
Fe3O4(T) + 4Н2(г) 3Fe(T) + 4Н2О (г) (3)
Вычислить тепловой эффект реакции (3) при этой тем-
пературе.
10. Константа равновесия системы 2Н^*Н2 выражает-
ся уравнением
lgKp = - 22 570 _ l 5041gr_0 767
117
Вывести уравнение зависимости AH=f(T) и вычислить
тепловой эффект реакции при 800° К.
11. Для реакции
С(т) + СО2(г)^2СО(г)
зависимость константы равновесия от температуры выра-
жена уравнением :
1g Кр = - -J- 2,475 lg Т — 1,082- 10-3Т + 2,67.
Определить тепловой эффект данной реакции при
1000° К. '
12. Для реакции
С(т)+Н2О(г)^СО4-Н2
зависимость константы равновесия от температуры выра-
жается уравнением
1g КР = - 4- 1,57 lg Т - 0,11 • 10-3Т 4- 6,565.
Определить тепловой эффект данной реакции при
1000° К и равновесный состав газовой фазы при 1000° К
под общим давлением 1,013-105 н/л12.
13. Вычислить константу равновесия и тепловой эф-
фект реакции восстановления CuCl окисью углерода
2СиС1 (т) + СО 2Си(т) 4- СОС12
при 1000° К, использовав следующие реакции:
2СиС1 2Си 4-С12 (1)
СО 4- С12 =₽* СОС12 (2)
у которых зависимость константы равновесия от темпера-
туры выражена следующими уравнениями:
13 638
1g /Срд =-— 4- 0,4534 lg Т - 0,109 • 10'4Т 4- 3,426,
1g Кр,2 = - 2,01 lg Т - 0,766.
14. Определить константу равновесия и тепловой эф-
фект при 400° К реакции
С6НцСНз + С6Н6 С6Н5СН3 + С6Н12
118
если для реакций:
С6Н6 + ЗН2^С6Н12 (1)
С6Н5СНз + ЗН2 СоНцСНз (2)
известны следующие значения констант равновесия как
функции температуры:
9590
1g Яр>1 = ----9,9194 lg Т + 0,0022857 + 8,566,
10970
lgX₽,2 = —-----20,387.
15. Зависимость константы равновесия от температу-
ры для реакции
С(т)4-СОа^2СО (1)
выражается уравнением
1g 2(р = -2^4-2,475 lg Т - 1,082 • 10-3Т + 2,67,
а для реакции-
СО2+Н2^СО + Н2О (2)
уравнением
2117
1g Яр -----— + 0,917 lg Т - 9,72- 10г47 + 0,113.
Вывести уравнение зависимости 1g Кр от Т для реакции
С(т) + Н2О^СО + Н2 (3)
и определить тепловой эффект реакции (3) при 900° К.
16. Константа равновесия реакции
2СН3ОН(г) 2Н2 (г) + НСООСН3(г)
рассчитывается по уравнению
. „ 3149 г
1g Кр — —5,43.
Определить ЛЯ реакции.
17. Рассчитать теплоту диссоциации As2S3(t), если
для реакции диссоциации
312900 -
1g Кр =-------+ 53,8.
119
18. Для реакции
С6Н6(г)+ЗН2^С6Н12(г)
константа равновесия выражается уравнением
9590
1g Кр = —_ - 9,9194 lg Т + 0,0022857 + 8,565.
Вывести уравнение и рассчитать ДД298ок.
19. Константа равновесия реакции
2Н2 + О2^2Н2О(г)
может быть выражена уравнением
24 900
1g Кс = —------- 1,335 lg Т + 9,65 • 10-5Т + 1,08,
а для реакции
Н2 + С12^2НС1(г)
1g Кс = ^- 0,44 lg Т 4- 2,16.
Из этих данных вычислить константу равновесия реакции
4НС1 + О2^2Н2О + 2С12
при 800° К, а также тепловой эффект при постоянных
объеме и давлении и той же температуре.
20. Для реакции >•
СН4(г)^С(т) + 2Н2(г)
зависимость константы равновесия от температуры выра-
жается уравнением
1g Кр = - + 3,562 lg Т - 1,5 • Ю~37 -
- 1,207-10-772 — 4,216.
Вычислить тепловой эффект реакции при 500° К.
21. Для реакции
2С(т) + 2Н2^С2Н4(г) (1)
2413
1g КР =----------5,589 lg Т + 1,025-10~37 + 13,04,
а для реакции
120
С2Н44-Н2=^СаНв
(2)
lg Кр = -----2,961 lg Т + 0,7668- Ю-’Г + 2,344.
Вывести уравнение lg Кр=f(T) для реакции
2С(т) + ЗН2^С2Н6 (3)
Вычислить константу равновесия Кр и тепловой эффект
дЛя реакции (3) при 1000° К.
22. Для реакции
2NOz 2NO + О2
зависимость константы равновесия от температуры выра-
жается уравнением
5749
1g Кр =----— + 1,75 lg Т - 5,0- 10-4Г 4- 0,407.
Определить тепловой эффект данной реакции при 1000° К.
Вычислить константу равновесия реакции при этой темпе-
ратуре и степень диссоциации ЫО2 при 1,013-105 н/л/2.
23. Определить тепловой эффект реакции
СН3СНО (г) 4- Н2(г) С2Н5ОН (г)
при 500° К, если
1g Лр = 2^ 4- 5,42 lg Т - 2,29- 10-3Т 4- 2,186.
24. Определить степень диссоциации SO3 при 700° К и
1013,3 кн]м\ если для реакции
2SO2 4- О2 2SO3
10373
igKp = -L—--H^igT-is.a.
Вычислить тепловой эффект данной реакции при 700° К.
25. Вычислить'тепловой эффект реакции
Вромб 4- 2Н2О SO2 4* 2Н2
при 1000° К, если
1g Хр = — 1381~ - 0,877 lg Т 4- 0,00267т 4- 3,88.
121
26. Вычислить тепловой эффект реакции и степень дис-
социации SO2CI2 при 400°К и 1,013-105 н/м2, если для
реакции
lgtfp=
если
SO2+C12^SO2C12'
1g Кр = -^—1,751g Г -2,2.
27. Зависимость константы равновесия от температу-
ры для реакции
2N2 + 6Н2О (г) 4NH3 + ЗО2
выражается уравнением
1,75 lg Т -5,2.
а
Определить тепловой эффект и стандартное изменение
изобарного потенциала при 2000° К.
28. Для реакции
СО + ЗН2 СН4 + Н2О (г)
зависимость константы равновесия от температуры вы-
ражается уравнением
9874
lgKp = —------7,14 lg Т + 1,88- 10-зТ -J- 8,64.
Определить константу равновесия и тепловой эффект
реакции при 1000° К.
29. Для реакции
СОС12^СО + С12
зависимость константы равновесия от температуры выра-
жается уравнением
' 1g КР = +1,75lg Т-11,58.
Вычислить тепловой эффект реакции при 400° К.
30. Вычислить константу равновесия и тепловой
эффект при 1000° К для реакции
4NO + 6Н2О 4NHs + 5О2
^2- - 1,75 lg Т — 8,7.
lgtf₽ =
122
§ 19. ВЫЧИСЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ
ПРИ ДАННОЙ ТЕМПЕРАТУРЕ
ПО ТАБЛИЦАМ СТАНДАРТНЫХ ВЕЛИЧИН
(МЕТОД ТЕМКИНА — ШВАРЦМАНА)
Стандартное изменение изобарного потенциала выра-
жается уравнением
AG° = — 2,303/?Т lg Ар, (V.6)
отсюда
При 7'=298° К
lgA₽ =
AG°
2,303/? Т ’
A G° = АЯж - ТА5ж (V,7)
или
. . А//298 , AS298
g ^Р’298 ~ 2.303А298 + 2,303/? '
(V,8)
Для расчета константы равновесия при любой темпе-
ратуре используют уравнение
I к - ^Н°т I AS?
S Лр,Г 2,303/?Т + 2,303/? ’
которое можно преобразовать к виду
А//298 , А5гй8 ,
g Ар — ~ ?,303/?Т + 2,303/? +
+ - (Да/Ио + АЬМ{ + Дс/И2 + Дс'/И_2), (V,9)
2,303а
где /Ио, /Иь /И2, /И-2 — определенные функции температу-
ры, которые вычислены и приведены в таблице, состав-
ленной М. И. Темкиным и Л. А. Шварцманом.
При отсутствии данных для Cv~f(T) иногда для при-
ближенной оценки Ар делают допущение, что АСр=0,
тогда уравнение (V,9) примет вид
1g Ар —
А/Тгэв , AS298
г.збз/?/’+ 2,зоз/? ’
(V,10)
123
Расчет константы равновесия по приближенному уравне-
нию (V,10) не всегда дает удовлетворительные резуль-
таты.
Пример. Вычислить константу равновесия по методу Темкина —
Шварцмана для реакции
СН4+ СО25±2СО + 2Н2
в газовой фазе при 1200° К Полученное значение константы равно-
весия сравнить с табличными 1g Кр —3,5407.
Решение. Вычисляем константу равновесия по уравне-
нию (V,9).
Значения ЬНр S298 а, Ь, с, с' для реагентов приведены
в табл. 1.
Таблица 1
Значения А Яу, а, Ь, с, с' для Н2, СО, СО2, СН4
1 Реагент ^ДЯ298’ кдж!моль S298’ дж!моль град а ь 10’ с 10’ с’ 10-5 d 10’
со —110,5 197,4 28,41 4,10 —0,46
н2 0,00 130,6 27,28 3,26 — 0,502 —.
сн4 —74,85 186,2 17,45 60,46 1,117 — —7,20
со2 —393,5 213,6 44,14 9,04 — -8,53 —
По данным табл. 1 вычисляем ДЯгэв. д^298,
Ас, Дс/ и Дг/ для данной реакции:
Да, Д&,
ДЯ2°9Й = 2ДЯ™ 4- 2ДЯ“2- ДЯ™4 - ДЯ;0,=
= 247,35 кдж/моль,
ASzbs — 2Sco 2Sh2 — Sch4 — Sco2 = 256,2 дж/моль • град,
Да = 2асо 4- 2аНг — асн4 — аСо2 = 49,79 дж/моль-град,
\Ь — 2&со 4- 2&нг — &сн4 — &со2 =
= -54,78-10-3 дж/моль-град,
\с — — Ссн4 = — 1,117-10'6 дж/моль-град,
\с' = 2сСо 4- 2сн2 — сСо2 = 8,614-105 дж/моль-град,
&d — — йен, = 7,20• 10“9 дж/моль-град.
124
По таблицам Темкина —Шварцмана (в справочнике)
находим:
Мо = 0,641; A4t = 0,339; М2 = 0,203;
М_2 = 0,318; М3 = 0,137.
Подставляя полученные значения в формулу (V,9),
получим
247 350 256,2
g Р~ 2,303-8,314.1200 + 2,303-8,314 +
Н-------------(31,93 - 18,57 - 0,227 + 2,739 + 0,986) =
2,303-8,314 7 7
= — 10,76 + 13,38 + 0,8806 = 3,5006;
отсюда Кр = 3,166 • 103; КРэксп = 3,473-103.
Вычисляем расхождение между рассчитанными и таблич-
ными данными:
3,473-103 —3,166-103
—------------------' 100 = 8,84%.
3,473-103
Задачи
1—30. Воспользовавшись таблицами стандартных
величин, вычислить по методу Темкина — Шварцмана
константы равновесия приведенных реакций при указан-
ных температурах. Полученные данные сравнить с таб-
личными и найти расхождение между ними в процентах.
Номер задачи Реакция 1 т, °к ig
1 НВг 7г Нг Уг Вгг 1100 —2,856
2 СО2 + 4Н2 СН4 (г) + 2Н2О (г) 675 3,037
3 НС1 >/2 С12 + ’/2 н2 1000 —5,258
4 N2 + Уг О2 3=^ N2O 1500 —6,703
5 ’/2 N2 + ’/2 О2 NO 1400 —2,821
6 4НС1 + О2 =₽* 2Н2О (г) + 2С12 703 1,611
7 СО + ЗН2 СН4 (г) + Н2О (г) 700 3,576
8 H2S Н2 + V2 s2 1000 —2,133
9 Н2 + СО2 СО + Н2О (г) 800 —0,607
10 Н2О (г) =<=* Н2 + ’/г О2 1600 —5,185
11 2СО2 ** 2СО + О2 2000 —5,764
125
Номер задачи Реакция т, °к ig к9
12 SO2 чч О2 + V2 S2 800 —19,80
13 4НС1 + О2 ч* 2Н2О (г) + 2С12 923 —0,365
14 СгНе (г) ч± С2Н4 (г) + Н2 900 —1,292
15 3/s Н2 + >/2 N2 ** NH3 800 —2,536
16 СН4 (г) + СО2 2СО + 2Н2 763 —2,67
17 СО2 ч* СО + V2 Ог 1400 —5,994
18 СО + Н2О (г) ч* со2 + н2 1200 —0,149
19 2HI Н2 + 12 1000 —1,454
20 2NO2 чч= 2NO + О2 1000 1,690
21 Н2 + СО ч* НСОН (г) 1000 —5,683
22 ЗСО + 2Н2О (г) СНзОН (г) + 2СО2 400 6,451
23 СО2 + ЗН2 ч=ь СНзОН (г) + Н2О (г) 900 —7,251
24 СО + Н2О (г) ч=* СО2 + Н2 1000 0,143
25 С2Н5ОН (г) СНзСНО (г) + Н2 523 —0,634
26 SO3 SO2 + V2 О2 1500 1,395
27 NO2 1/2 N2 + О2 900 5,164
28 НВт чк '/2 Н2 + */2 Вг2 1000 —3.182
29 2HI ч^Н2+ 12 1200 —1,338
30 С2Н6 (г) С2Н4 (г) + Н2 1000 —0,463
& 20. ВЫЧИСЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ ХИМИЧЕСКИХ
РЕАКЦИЙ ПО ПРИВЕДЕННЫМ ИЗОБАРНЫМ ПОТЕНЦИАЛАМ
Статистическая термодинамика позволяет произво-
дить расчеты абсолютных значений различных термоди-
намических функций, при помощи которых можно опре-
делить константу равновесия любой химической реакции.
Зависимость константы равновесия от термодинамиче-
ских функций описывается уравнением
Г / G° - Но \ ЛНо 1
/?1пХр = -[д(-------__2J + __2_j, (V.11)
где ДЯо — тепловой эффект реакции при 1 атм и абсо-
G°-H°o „ .
лютном нуле; ——— приведенный изобарный потенци-
ал, который определяют на основании спектроскопиче-
ских данных.
Пример. Вычислить константу равновесия для реакции, протека-
ющей в газовой фазе
СН4 + СО2 2СО + 2Н3
при 1000° С.
Решение. Определяем константу равновесия по уравнению
(V,ll). Из справочника (Краткий справочник физико-химических
126
величин. Под ред. К- П. Мищенко и А. А. Равделя. Изд-во «Химия»,
а°-н°
1967) выписываем значения --------- и Д//о для всех веществ,,
участвующих в реакции
0° - Н°о \
-------- I = —210,939 дж/моль-град',
Т /со
Д/Yq со = — 113,880 кдж/моль;
--------I =— 143,483 дж/моль-град;
Т /и,
¥
\Н°0 нг = 0 кдж/моль;
0° - Н°о \
--------- I = —211,123 дж/моль-град;
Т /сн,
Д//д CHj = — 66,965 кдж/моль;
0° - Н°о \
--------- = —235,990 дж/моль-град;
Т /со,
Д//о COj = — 393,229 кдж/моль.
G°-H°o
В таблице приводятся значения---—---для всех веществ при
Г=1000 и 1500°К. В условии задачи требуется рассчитать констан-
ту равновесия при 1000° С, т. е. 1273° К, необходимые значения мож-
но найти интерполяцией:
(G°-H°o\ / G° —//q \
— ---------I — ------------ =—2-210,939 — 2-143,483—
\ Т /сн4 \ Т /со,
; — (— 211,123) — (— 235,990) = — 421,878 — 286,966 +
+ 211,123 + 235,990 = —708,844 + 447,113 =
= —261,731 кдж/моль-г рад;
Д/Уо = 2Д7/0 с0 + 2Д//0 Hj — ДЯ0 СН1 — Д//о СОг = 2 ( 113,880) +
+ 2 0 — ( — 66,965) — ( — 393,229) = —227,760 + 460,134 =
= + 233,374 кдж/моль.
127
По уравнению (V,II) рассчитываем константу равновесия:
_ 261,731 233,374-1000 _
g р — + 19,1 19,1-1273
= 4- 13,703 - 9,598 = + 4,105;
1g Ар = 4,105; Ар = 1,274 • 104 атм2 или
Хр= 1,274-104(1,013-Ю5)2 = 1,31-1014 н/м2.
Задачи
1—30. Вычислить.константу равновесия для приведен-
ных реакций при указанных температурах и сравнить ее
с табличными значениями. .
Номер задачи Реакции г, °к ^экс«
1 НВг у2 н2 + ’/2 Вг2 1100 —2,856
2 СО2 4- 4Н2 СН4 + 2Н2О 675 3,037
3 НС1 ==*= у2 С12 + у2 н2 1000 —5,258
4 V2 ^2 + О2 NO2 1500 —4,418
5 >/2 N2 + >/2 О2 NO 1400 —2,821
6 4НС1 + О2 & 2Н2О + 2С12 700 1,611
7 СО + ЗН2 ** СН4 + н2о 700 3,576
8 H2S н2 + >/2 S2 1000 —2,133
9 н2 + со2 СО + НгО 800 —0,607
10 Н2О Н2 + V2 О2 1600 —5,185
11 2СО2 =Ft 2СО + О2 2000 —5,764
12 SO2 О2 V2 $2 800 —19,80
13 4НС1 + О2 2Н2О + 2С12 923 —0,365
14 СгНб sf* С2Н4 + Н2 900 — 1,295
15 % н2 + >/2 N2 =₽* NHs 800 —2,536
16 СН4 + СО2 5=s 2СО + 2Н2 763 —2,67
17 СО2 =₽* со' + у2 О2 1400 — 1,994
18 СО + Н2О со2 + н2 1200 —0,149
19 2HI Н2 + 12 1000 —1,454
20 2NO2 2NO + О2 1000 1,690
21 н2 + СО неон 1000 —5,683
22 ЗСО + 2Н2О з* СНзОН + 2СО2 800 —4,972
23 СО2 + ЗН2 =₽t СНзОН + Н2О 900 —7,251
24 СО + н2о ** со2 + н2 1000 0,143
25 2СО + О2 =г* 2СО2 1000 20,4608
26 SO3 ч== so2 + */2 02 1500 —2,66
27 NO2 '/2 N2 4" Ог 900 5,164
28 НВг '/2Н2 + >/2Вг2 1000 —3,182
29 2С12 + 2Н2О г* 4HCI + О2 1000 0,883
30 С2Н6 С2Н4 + н2 ЮОО —0,463
128
Глава VI
ФАЗОВОЕ РАВНОВЕСИЕ В ОДНО-
И ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ
§ 21. ТЕРМОДИНАМИКА АГРЕГАТНЫХ ПЕРЕХОДОВ
Уравнение Клапейрона — Клаузиуса описывает пере-
ход чистых веществ из одного 'агрегатного состояния в
другое, например плавление, испарение жидкости, воз-
гонка твердого тела, кипение жидкости, переход твердого
тела из одной аллотропной модификации в другую:
dP \Н
= ТДУ’
(VI,1)
где dPjdT — изменение давления пара в зависимости от
изменения температуры при равновесии сосуществующих
фаз для процессов возгонки и испарения; ДЯ — изменение
энтальпии или теплота фазового перехода; Т — абсолют-
ная температура фазового перехода; Д У= Кг—Vi — изме-
нение объема при фазовом переходе.
Для процессов плавления и аллотропных переходов
уравнение Клапейрона — Клаузиуса можно представить
в виде
dT. _ TkV
~dP~ кН ’
(VI,2)
где коэффициент dT/dP характеризует изменение темпе-
ратуры фазового перехода с изменением давления. В ин-
тегральной форме уравнение (VI,2). для процессов плав-
ления и аллотропных переходов имеет вид
дт _ тдк
ДР ~ ДЯ ‘
Пример. Рассчитать мольную теплоту плавления дифениламина,
если плавление 1 кг дифениламина сопровождается увеличением
объема на 9,58-10~5 м3,
dT 1
-^- = 2,67-10 7 град-м21н.
(VI,3)
5—1741
129
ТайцЯ^рв^вттЛёнйЯ'дифениламина 54° С, молекулярный вес 169.
- ; Р в4И.е н ие, -Применяя уравнение (VI,2) и учитывая, что AV=
=9,58-10~5-I69-1Q 3 мл/моль, находим:
,, ~ 9,58-10~5-169-10“3 „ ,
Д/7 = 327------------------= 19,84-103 дж/моль =
2,67-10~7
= 19,84 кдж/моль.
Для проверки размерности АН подставляем в формулу размер-
ности исходных величин: Т=град-, [ЬУ\=м3/моль\ &Р/&Т=н/м2-град.
Задачи
1. При нагревании ромбическая сера переходит в
моноклиническую, при этом изменение объема составля-
ет 0,0000138 м31кг. Температура перехода при давлении
1,0133 • 105 н/м2 96,7° С, а ее изменение с давлением опре-
деляется коэффициентом
dT/dP = 3,2567-10-7 град-м2/н.
Определить теплоту перехода. Результат расчета сопоста-
вить с величиной, найденной по теплотам сгорания ромби-
ческой и моноклинической серы, которые соответственно
равны —296,813 и —297,148 кдж/г-атом.
2. Зависимость температуры плавления нафталина -от
давления выражается уравнением
/пл = 80,1 + 0,0371 • 10-5Р - 186,99- 10~18Р2
(давление выражено в н/м2).
Рассчитать изменение энтальпии при плавлении, если
изменение объема 145,8 см^кг при давлении
1,0133-105 н/м2. Результат сопоставить с эксперименталь-
ным значением ДЯ= 149,8 дж/г.
3. Определить теплоту плавления метана при 90,67° К,
если зависимость температуры плавления метана от дав-
ления в интервале 101,334-20 266 кн/м2 выражается урав-
нением
Тпл = 90,667 + 2,6- 10-7Р — 6,147- 10-16Р2.
Изменение объема при плавлении составляет
2,69 см3[моль.
4. Определить приращение объема при расплавлении
10 кг олова, если теплота плавления его равна
59,413 дж/г, температура плавления 232° С, плотность
твердого олова, 7,18 г/см3, rfT/rfP = 3,2567 • 10-8 град-мУн.
130
5. Температура плавления анетола С10Н12О 21,5° С, а
изменение энтальпии при плавлении 108 дж/г. Изменение
объема при плавлении составляет 79,3 см3! кг (при
74,9842-105 н,/л*2). Рассчитать примерное давление, при
котором температура плавления будет равна 100° С, при-
нять dPfdT и АН постоянными. Опытная величина давле-
ния 410386,5 кн/м2.
6. Плотность кипящего этана и его насыщенного пара
при нормальной температуре кипения —88,6° С соответ-
ственно равны 0,546 и 0,00206 г!см3. Вычислить теплоту
парообразования при —88,6° С, если зависимость давле-
ния насыщенного пара этана от температуры выражается
уравнением
661,088
1g р(мм) = 6,81082 — —---------.
ё М( ) ’ 256,504 +t
Результаты расчета сравнить со справочной величиной
АН = 1470,26 ± 16,736 кдж/моль.
7. Определить удельный объем жидкого олова при
нормальной температуре плавления 232° С, если удельная
теплота плавления его равна 59,413 дж/г, плотность твер-
дого олова 7,18 г!см3, dTldP = 3/2tt7 10-8 град-м21н.
8. Определить расход теплоты в процессе изобарного
нагревания 1 кг гексана от 20 до 100° С. Принять, что теп-
лоемкость гексана не зависит от давления. Для расчета
воспользоваться следующими данными:
Ср= 2,0732 + 3,9171 • 10-3/ дж/г-
Ср = 1,2255 4- 4,5693-10-3/ дж/г-
1322,65
1g Р = 7,1584- Ж4(|+(л<л<рт.сг.
9. Для зависимости АНаар метанола от температуры
предложено уравнение
ЛДпар/Т1 = 1115,873— 173,636In Т дж/моль-град.
Насколько повысится температура кипения при увеличе-
нии давления на 1 мм рт. ст. при нормальной температу-
ре кипения 64,7° С.
10. Скрытая теплота плавления нафталина при нор-
мальной температуре плавления 79,9° С равна
б* ' 131
149,034 дж/г, разность удельных объемов в жидком и
твердом состоянии — 0,146-10-3 м3/кг. Вычислить измене-
ние температуры плавления при изменении давления на
1 н/м2 и сравнить с экспериментально найденной величи-
ной 0,0352-10“5 град-м2/н.
11. Плотности жидкого и твердого висмута при темпе-
ратуре плавления 271° С соответственно равны 10 005 и
9637 кг/м3. Атомная скрытая теплота плавления
10878,4 кдж/кг-атом. При какой температуре висмут пла-
вится под давлением 50,665-105 н/л/2?
12. Скрытая теплота плавления воска при 52,7° С и
1,0133-105 н/м2 147,904 кдж!кг, прирост удельного объема
при плавлении составляет 0,125-10—3 м3/кг. Определить
температуру плавления под давлением 10,133-105 н/м2.
13. Плотности жидкого и твердого висмута при темпе-
ратуре плавления 271° С соответственно равны 10 005 и
9637 кг/м3. Атомная скрытая теплота плавления равна
10878,4 кдж/кг-атом. При какой температуре висмут пла-
вится под давлением 101,33-105 н/л*2?
14. Скрытая теплота плавления воска при 52,7° С и
давлении 1,0133-105 н/м2 равна 147,904 кдж/кг. Прирост
удельного объема при плавлении составляет
0,125-10~3 м3/кг. Определить температуру плавления под
давлением 20,266-105 н/м2.
15. Плотности жидкого и твердого висмута при темпе-
ратуре плавления 271° С соответственно равны 10 005 и
9637 кг/м3. Атомная скрытая теплота плавления равна
10878,4 кдж/кг-атом. При какой температуре висмут пла-
вится под давлением 203,6733-105 н/л*2?
16. Температура превращения ромбической серы в
моноклиническую под давлением 1,0133-105 н/м2 95,6° С,
теплота превращения 13,054 кдж/кг, dP/dT =
= 0,0394-10—5 град-м2/н. Вычислить разность удельных
объемов ромбической и моноклинической серы.
17. Превращение NH4NO3 при 32° С ромбической в
ромбоэдрическую форму сопровождается поглощением
21,004 кдж/кг, плотность при этом уменьшается с
1,72-103 до 1,66-103 кг/м3. Рассчитать dT/dP (град-м2/н)
и температуру превращения при давлении 105 кг/м2.
18. Давление паров воды при 99,5° С равно
746,52 мм рт. ст. при 100,5° С — 773,69 мм рт. ст. Удель-
ный объем насыщенного пара при 100° С составляет
1,658 м3/кг. Какова теплота испарения при 100° С. Плот-
ностьжидкой воды при 100°С принять равной 1,103 кг/м3.
132
19. Температура плавления бензола 5,6° С, разность
удельных объемов в жидком и твердом состоянии соот-
ветствует 1,301 • 10-5 м3/кг. Найти изменение температуры
плавления при увеличении давления до 101,33-105 н/м2.
Скрытая теплота плавления 128,031 кдж/кг.
20. Температура плавления нафталина в зависимости
от давления (м/лг2) выражается уравнением
t = 79,8 + 0,0368- IO-5? + 1,85 • 10-16Р2,
разность удельных объемов в жидком и твердом состоя-
нии равна 0,146-10-3 м3/кг. Рассчитать скрытую теплоту
плавления при 50,665-105 н/м2.
21. Плотности жидкого и твердого висмута при тем-
пературе плавления 27ГС соответственно равны 10005 и
9637 кг/м3. Атомная скрытая теплота плавления
10878,4 кдж/кг-атом. При какой температуре висмут пла-
вится под давлением 506,65-105 н/л/2?
22. Скрытая теплота плавления воска при 52,7° С и
1,0133-105 н/м2 равна 147,904 кдж/кг, прирост удельного
объема при плавлении составляет 0,125-10-3 м3/кг. Рас-
считать температуру плавления под давлением
50,665-105 н/м2.
23. Зависимость температуры плавления олова от
давления (н/м2) описывается выражением
/пл = 231,8 + 0,3257-10~7Р,
теплота плавления олова 58,785 кдж/кг, плотность жид-
кого олова при температуре плавления под давлением
1,0133-105 н/м2 6,988-103 кг/м3. Определить плотность
твердого олова при этих условиях.
24. Плотность СбН5С1 при температуре кипения 132°.С
для жидкости 0,9814-103 кг/м3, для насыщенного пара
0,00359-103 кг/м3, dP/dT для этой температуры равна
20,5 мм рт. ст./град. Вычислить теплоту испарения при
температуре кипения.
25. Теплота испарения воды при температуре кипения
под давлением 1,0133-105 н/м2 равна 2255,176 кдж/кг.
Найти изменение давления пара при увеличении темпера-
туры на 1° вблизи температуры кипения под атмосфер-
ным давлением.
26. Плотность твердого и жидкого железа при темпе-
ратуре плавления соответственно равна 7,868-103 и
6,88 • 103 кг/м3. Изменение температуры плавления при
повышении давления на 1 н/м2 равно 1,214-10-7 граду.
133
Х.м2/н. Температура плавления железа 1535° С. Опреде-
лить теплоту плавления железа.
27. Удельный объем 1 кг жидкого СбН5С1 при темпе-
ратуре кипения 132° С равен 1,019-10-3 м3, dP/dT для
этой температуры 2,736-103 н/м2град. Теплота испарения
при этой температуре кипения 307,231 кдж/кг. Опреде-
лить плотность насыщенного пара.
28. Изменение давления пара воды при увеличении
температуры на 1° вблизи температуры кипения под ат-
мосферным давлением равно 0,0347-105 н/м2-град. Вы-
числить теплоту испарения воды при 100° С и
1,0133-105 н/м2.
29. Разность удельных объемов ромбической и моно-
клинической серы равна 0,1395-10-3 м3/кг. Температура
превращения ромбической серы в моноклиническую под
давлением 1,0133-105 н/м2 равна 368,6° К, dT/dP =
= 0,0395-10-5 град-мР/н. Определить мольную теплоту
превращения.
30. Скрытая теплота плавления нафталина при тем-
пературе плавления 352,9° К Д/7= 19079,04 кдж/кмоль.
Изменение температуры плавления при увеличении, дав-
ления на 1 н/м2 dT/dP = 0,0346-10~3 град-м2/н. Опреде-
лить разность удельных объемов в жидком и твердом со-
стоянии.
§ 22. ПРИМЕНЕНИЕ УРАВНЕНИЯ КЛАПЕЙРОНА — КЛАУЗИУСА
К ПРОЦЕССАМ ИСПАРЕНИЯ И ВОЗГОНКИ
Для процессов испарения и возгонки объемом конден-
сированной фазы можно пренебречь по сравнению с объ-
емом насыщенного пара. Считая, что пар подчиняется
законам идеальных газов, можно рассчитать его объем
по уравнению Менделеева — Клапейрона. Тогда выраже-
. ние (VI, 1) переходит в уравнение
dlnP ДЯ
dT = RT2 ’
(VI,4)
где ДЯ— мольная теплота парообразования (или воз-
гонки), которая считается постоянной в данном темпера-
турном интервале (первое приближение).
После интегрирования получаем
Рг Mi / 1
1
тг
(VI, 5),
134
Пример. Какое количество сероуглерода будет извлечено, если
|через него пропустить 0,005 м3 воздуха при давлении 720 мм рт. ст..
Ц 40° С. Теплота парообразования сероуглерода при нормальной
ртемпературе кипения 46,5° С составляет 355,8 дж/г.
Г Решение. Используя уравнение (VI,5), можем вычислить пар-
циальное давление паров сероуглерода при 40° С:
Г 1 п 355,8-76-6,5
lg Pt = 1g 760---------------------= 2,79,
ё ё 2,3-8,314-313-319,5 ’ ’
Pi =615 мм рт.'ст.
При общем давлении 720 мм рт. ст. парциальное давле-
ние воздуха равно 720—615=105 мм рт. ст. Применяя
закон Бойля—Мариотта, находим объем смеси газов,
?! Vi = ?2 У2; 0,005 • 720 = V • 105,
0,005-720 п _ ,
V = - - ----------= 0,0343 м\
105
Количество паров сероуглерода рассчитывают по
уравнению Менделеева — Клапейрона:
?1К 615-0,0343-1,0133- 10s
“ = -Rf = —= 146 мом'
g= l,16-Mcs2= 1,16-76 = 88,5 г.
Задачи
1. Нормальная температура кипения иода 185° С, теп-
лота парцобразования ДЯпар = 164,013 дж/г. До какой
примерно температуры следует нагреть иод в аппарате,
в котором поддерживается давление 100 мм рт. ст. чтобы
обеспечить его перегонку?
2. Под каким давлением будет кипеть диэтиламин
при 20° С, если нормальная температура кипения 58°С,
а теплота парообразования 27844,52 дж/моль.
3. Температура кипения жидкого метанола при
200 мм рт. ст. равна 34,7° С, а при давлении
400 мм рт. ст. — 49,9° С. Вычислить температуру кипения
под нормальным давлением.
4. Давление паров кристаллического ацетилена при
132° К равно 1,7 мм рт. ст., а при 153° К —
27,6 мм рт. ст. Рассчитать мольную теплоту плавления
ацетилена, если удельная теплота парообразования его
составляет 828,014 дж/г.
135
5. Какой объем воздуха необходимо пропустить через
сероуглерод при 720 мм рт. ст. и 40° С для извлечения
30 г его, если теплота парообразования при нормальной
температуре кипения 46,5° С равна 355,765 дж/г.
6. Давление пара теллура при 671 и 578° С соответ-
ственно равно 1,885-103 и 4,459-102 н/м2. Определить
среднее значение молекулярной теплоты испарения в
этом температурном интервале.
7. Давление пара ВС13 при 10 и 20° С соответственно
равно 562,9 и 807,5 мм рт. ст. Какова молекулярная те-
плота испарения ВС13?
8. Давление пара этанола при 70 и 80° С соответст-
венно равно 540,9 и 811,8 мм рт. ст. Рассчитать удельную
теплоту испарения.
9. Давление пара бензола при 20 и 30° С соответст-
венно равно 75 и 118 мм рт. ст. Рассчитать молекулярную
теплоту испарения.
10. Давление пара ВС13 при 10° С равно 562,9 мм. Мо-
лекулярная теплота испарения ВС13 24886,432 кдж/кмоль.
При какой температуре ВС13 закипит под атмосферным
давлением?
11. Температура кипения бутанола под давлением
1,0133-105 н/м2 117,8° С и теплота испарения
591,199 кдж/кг. Какая температура кипения бутанола
при давлении 750 мм рт. ст.?
12. Теплота испарения диэтилового эфира
360,242 кдж/кг при температуре кипения 34,66° С под
давлением 760 мм рт. ст. Вычислить температуру кипения
при 740 мм рт. ст.
13. Удельная теплота испарения диэтилового эфира
360,242 кдж/кг при температуре кипения 34,66° С под дав-
лением 760 мм рт. ст. Определить давление пара при
36,50° С.
14. Давление пара СС14 621,15 мм рт. ст. при 70 и
843,29 мм рт. ст. при 80° С. Рассчитать теплоту испарения
для 1 моль СС14.
15. Давление этиламина при температуре —22,9 и
— 13,9° С соответственно равно 111,2 и 183,0 мм рт. ст.
Определить теплоту испарения в этом температурном ин-
тервале.
16. Давление пара четыреххлористого углерода
621,15 мм рт. ст. при 70° С, теплота испарения 1 кмоль
СС14 30781,688 кдж/кмоль. Рассчитать нормальную тем-
пературу кипения.
136
17. Давление пара этиламина при —13,9 и —5,6° С
соответственно равно 183,0 и 281,8 мм рт. ст. Определить
теплоту испарения в этом температурном интервале.
18. Давление пара этиламина при —5,6 и 5,8° С соот-
ветственно равно 281,8 и 481,2 мм рт. ст. Определить те-
плоту испарения для этиламина.
19. Давление пара этиламина при 5,8 и 16,2° С соот-
ветственно равно 481,3 и 750,5 мм рт. ст. Рассчитать те-
плоту испарения этиламина в этом температурном интер-
вале.
20. Определить давление насыщенного пара четырех-
хлористого углерода при 60° С, если СС14 кипит при 75° С
и 1,0133-105 н/м2 и теплота парообразования
30833,03 кдж!моль.
21. Давление пара этилового эфира при —10° С
114,8 мм рт. ст., а при 0°С давление 184,4 мм рт. ст. Рас-
считать молярную теплоту испарения эфира.
22. Давление пара этилового эфира при 0° С
184,4 мм рт. ст., а при температуре 10° С давление
286,8 мм рт. ст. Определить молярную теплоту испарения
эфира.
23. Давление пара этилового эфира при 20° С
432,8 мм рт. ст., а при температуре 30° С давление
634,8 мм рт. ст. Определить молярную теплоту испарения
эфира.
24. Давление пара этилового эфира при 10° С
286,8 мм рт. ст., а при температуре 20° С давление
432,8 мм рт. ст. Определить молярную теплоту испарения
эфира.
25. Воздух насыщен парами воды при 25° С. При ка-
кой температуре при неизменном содержании водяных
паров относительная влажность воздуха будет равна
80%, если при 25° С давление водяного пара равно
23,76 мм рт. ст., скрытая удельная теплота испарения во-
ды— 2421,28 кдж!кг.
26. Определить нормальную температуру кипения эти-
лового эфира, если давление его паров при 30° С равно
634,8 мм рт. ст., молярная теплота испарения —
28367,52 кдж!кмоль.
27. Давление пара хлороформа при 20° С равно
161 мм рт. ст., а при 30° С — 248 мм рт. ст. Определить
теплоту испарения хлороформа.
28. Давление пара хлороформа при 50° С
535 мм рт. ст., теплота испарения хлороформа
137
30836,08 кдж!кмоль. Определить нормальную температу-
ру кипения хлороформа.
•29. Давление пара хлороформа при 30° С
248 мм рт. ст., при 40° С —369 мм рт. ст. Рассчитать теп-
лоту испарения хлороформа.
30. Давление пара хлороформа при 40° С равно
369 мм рт. ст., а при 50° С — 535 мм рт. ст. Вычислить
теплоту испарения хлороформа.
§ 23. ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНЫХ СИСТЕМ
Правило фаз Гиббса — основной закон гетерогенного
равновесия — имеет вид
С = К-Ф + 2,
где С —число степеней свободы; Ф — число фаз; К —
число независимых компонентов. При рассмотрении кон-
денсированных систем правило фаз Гиббса запишется
так: '
С = К-Ф4-1,
Фазовое равновесие изучают при помощи графика в
координатах свойство — состав, который называется диа-
граммой состояния.
Пример 1. По диаграмме состояния системы Pt—Sb (рис. 1):
1) -указать смысл всех полей, линий и характерных точек на диа-
грамме; 2) вычислить состав интерметаллических соединений, обра-
зующихся в системе, и отметить их на диаграмме; 3) рассмотреть
процесс охлаждения расплава с содержанием 45 ат. % Sb в интерва-
ле температур 300—2000° С Что происходит в точках а0, 60, do, е0,
f0, h0? Назвать и указать число равновесных фаз в этих точках. Най-
ти число степеней свободы в этих точках. Что обозначает данное чис-
ло степеней свободы? 4) начертить кривую охлаждения этого же
расплава; 5) при 1000° С для этого же расплава вычислить массы
равновесных фаз, полученных из 400 кг первоначального расплава.
Решение. 1, На исходной диаграмме (см. рис. 1) обозначаем
поля цифрами и точки — буквами I — Ж; II — Ж + кр а; III — Ж +
+ кр D; IV — Ж + кр Di; V —Ж + кр D; VI — кр а; VII — кр D] +
+ кр D; VIII — кр а+кр Di; IX — кр D + кр Sb; X — Ж + кр Sb,
где Ж — жидкость; кр — кристаллы; а—твердый раствор Sb в пла-
тине; D — конгруэнтно плавящееся соединение PtSba; Di—инконгру-
энтно плавящееся, соединение PtSb.
Каждая точка линии ACi показывает состав жидкой фазы, нахо-
дящейся в равновесии с твердыми кристаллами а при данной темпе-
ратуре*; каждая точка линии AEf.— состав твердых кристаллов а,
* В" дальнейшем слова «при данной температуре» для краткости
опускаются.
138
Находящихся в равновесии с жидкостью; каждая точка линии CjH —
состав жидкой фазы, находящейся в равновесии с кристаллами
неустойчивого химического соединения Di. Каждая точка линии HD
и DC2 (см. рис. 1, б) показывает состав жидкой фазы, находящейся
в равновесии с кристаллами химического соединения; каждая точка
линии ВС2 — состав жидкой фазы, находящейся в равновесии с кри-
сталлами Sb; E^Fi, E2F2—эвтектические линии; HG—линия пери-
тектики.
Рис. 1. Диаграмма состояния системы платина — сурьма («).
Участок диаграммы состояния около точки В в увеличенном мас-
штабе (б). Кривая охлаждения расплава Pt — Sb состава
45 ат. % Sb (в)
Точки А, В, D — температуры плавления соответственно Pt, Sb
И химического соединения D; Ci и С2 — эвтектические точки. ’
2. Определяем состав соединений. а.^, ~v
«Pt ат. % Pt 50
В точке Dx------=---------— = — = 1 ; 1,
nSb ат. % Sb 50
следовательно, состав
соединения Di будет PtSb.
о n "Sb
В точке D = --------
«Pt
ат. % Sb 67
ат. % Pt — 33
Состав соединения D будет PtSbj.
3. Чтобы рассмотреть процесс охлаждения расплава заданного
состава, выбираем ряд точек, как показано на рис. 1, а.
139
Обозна- чение точки Что происходит в дайной точке Название фаз Число Что обозначает число степеней свободы С
ф с
Мо Начинается охлажде- ние расплава ж 1 2 Можно произвольно изменять состав и температуру рас- плава
во Выпадают первые кристаллы D Ж, кр D 2 1 Каждой температуре соответствует опре- деленный состав расплава
&0 Продолжается кри- сталлизация Ж, кр D 2 1 То же
do Начинается кристал- лизация Di, кри- сталлы D растворя- ются Ж, кр D, кр Dj 3 0 Температура и соста- вы равновесных фаз имеют опреде- ленное заданное значение
«о Продолжается кри- сталлизация Di Ж, кр Dj 2 1 Каждой температу- ре соответствует определенный со- став расплава
fo Начинается и закан- чивается кристал- лизация эвтектики, исчезает последняя капля расплава Ж, кр Db Кр а 3 0 Температура и соста- вы равновесных фаз имеют опреде- ленное значение
Л0 Продолжается ох- лаждение твердых фаз и распад твер- дого раствора кр Db Кр а 2 i Каждой температуре соответствует опре- деленный состав твердого раствора \
4. Строим кривую охлаждения расплава в координатах темпера-
тура— время, основываясь на правиле фаз, и принципах соответст-
вия и непрерывности (см. рис. 1, б). Согласно этим правилам каждой
совокупности фаз в системе (C=const) соответствуют непрерывные
кривые охлаждения. Безвариантным состоянием системы (С=0) на
кривой охлаждения соответствуют температурные остановки (1 =
= const) (линии d0'dQ" и /ъ7о" на рис. 1, б).
Обозначению точек на кривой охлаждения соответствует
рис. 1, а.
5. Определяем соотношение масс твердой и жидкой фаз при
1000° С по правилу рычага:
P-ТВ = g2° — gl’
Pw. ~ g-l' — g-l
(VI, 6)
где ga', gz" и gz° — содержание сурьмы в равновесных жидкой
и твердой фазах и исходном расплаве соответственно, вес. %. Соот-
140
ветствующие этим концентрациям атомные проценты определяем по
диаграмме состояния (см. рис. 1, a): Л42/=28; Л42°=45; Л42"=50.
Переводим атомные проценты Sb в весовые
, ______100________
82 ~ Л1 /100
А2 J
где Л1 = 195 — атомный вес платины; Л2=122 — атомный вес сурьмы;
— атомный процент сурьмы.
юо
82'= 195/100 \ -1 ,6’
1 + ( — 1)
128 \ 28 )
аналогично получаем
£2 = 33,9; £2 = 38,5.
Подставляем полученные величины в уравнение (VI,6):
33,9—19,6
—--------— = 3,11, Рт + Рж = 400 кг.
38,5 — 33,9 ж.
Отсюда Ртв = 400
3,11
1 + 3,11
= 302 «г;
Рж = 98 кг.
Пример 2. По диаграмме состояния системы Sn — Sb (рис. 2)
I) указать смысл всех полей, линий на диаграмме; 2) рассмотреть
процесс охлаждения расплава с содержанием 52 вес. % Sb в интер-
вале температур 200—500° С; что происходит в точках a, b, с, d, е,
Назвать и указать число равновесных фаз в этих точках. Найти
число степеней свободы в этих точках. Что означает данное число
степеней свободы? 3) начертить кривую охлаждения этого же рас-
плава; 4) при 400° С для этого же расплава вычислить массы равно-
весных фаз, полученных из 100 кг первоначального расплава.
Решение. На исходной диаграмме (рис. 2) обозначаем поля
цифрами и точки — буквами: I—Ж; II—Ж + кр а; III — кр а;
IV — Ж + кр Р; V — Ж + кр 6; VI— кр 6; VII —кр ₽; VIII —
— кр Р + кр б; IX — Ж + кр у; X — кр у; XI — кр у + кр б; XII —
— кр а+кр у, где Ж — жидкость; кр а, кр 0, кр у, кр б — кристаллы
твердого раствора.
Данная система Sn — Sb образует ряд твердых растворов а, Р,
у, б с ограниченной растворимостью в твердом виде.
Каждая точка линии АС показывает состав жидкой фазы, нахо-
дящейся в равновесии с кристаллами твердого раствора а при дан-
ной температуре. Каждая точка линии АЕ соответствует составу
кристаллов а, находящихся в равновесии с жидкостью. Каждая
точка линии CN отвечает составу жидкой фазы, находящейся в
равновесии с кристаллами твердого раствора у; каждая точка ли-
нии PD — составу кристаллов у, находящихся в равновесии с жид-
костью; каждая точка линии GN — составу жидкой фазы, находя-
щейся в равновесии с кристаллами твердого раствора б; каждая
141
•Sn
Рис. 2. Диаграмма состояния системы олово —сурьма (а). Кривая охлажде-
ния расплава Sn — Sb состава 55 ат. % Sb (б)
точка OX — составу кристаллов твердого раствора 6, находящихся
в равновесии с жидкостью; каждая точка линии BG— составу жид-
кой фазы, находящейся в равновесии с кристаллами твердого рас-
твора р; каждая точка линии BY — составу кристаллов твердого
раствора р, находящихся в равновесии с жидкостью; каждая точка
линии VY — составу’кристаллов Р, находящихся в равновесии с кри-
сталлами твердого раствора б; каждая точка линии XZ — составу
твердого раствора б, находящегося в равновесии с кристаллами
твердого раствора Р; каждая точка линии OS — составу кристаллов
твердого раствора б, находящегося в равновесии с кристаллами твер-
дого раствора у; каждая точка линии PR — составу кристаллов у,
находящихся в равновесии с кристаллами твердого раствора б;
каждая точка линии MD — составу кристаллов твердого раствора у,
находящегося в равновесии с кристаллами твердого раствора а;
каждая точка линии EF — составу кристаллов твердого раствора а,
находящегося в равновесии с кристаллами твердого раствора у.
2. Выбираем ряд точек для рассмотрения процесса охлаждения
расплава заданного состава (см. рис. 2, а).
Обозна- чение точки Что происходит в данной точке Название фаз Число Что обозначает данное число степеней свободы С
ф с
м Начинается охлаж- дение расплава ж 1 2 Можно произвольно изменять состав и температуру рас- плава
а Выпадают первые кр р ж кр ₽ 2 1 Каждой температу- ре соответствует оп- ределенный состав расплава
ь Продолжается кри- сталлизация твер- дого раствора 0 Ж «Р ₽ 2 1 То же
с Выпадают кристал- лы твердого раство- ра 6, растворяются ранее выпавшие кристаллы твердо- го раствора р Ж кр ₽ кр 8 3 0 Температура и соста- вы равновесных фаз имеют определен- ное значение
d Продолжают выпа- дать кристаллы твердого раство- ра 6 Ж кр 8 2 1 Каждой температуре соответствует оп- ределенный состав расплава
е Исчезает последняя Капля расплава, превращаясь в кри- сталлы твердого раствора 61 Ж кр 8 2 1 Го же
f Охлаждение кристал- лов твердого рас- твора 6] кр 8 1 2 Можно произвольно менять температу- ру и состав
143
3. Кривая охлаждения имеет вид, представленный на рис. 2.
4. Определяем соотношение масс твердой и жидкой фаз при
400° С по правилу рычага:
Ртв _ S2
р • О ’
^2 —
где gi, gi" и gi —содержание сурьмы в равновесных жидкой и
твердой фазах и в исходном расплаве соответственно, вес. %.
100—х 52—38 14
-----= 77-7^ = Т = 3>5-’ Ю0-х=3,5 х;
х 56-52 4
100
х=—=22,2 «г;
4,5
Ртв= 100—22,2=77,8 кг; Рж=22,2 кг.
Задачи
I—30. 1. Указать смысл всех полей, а также линий и
точек на диаграмме.
2. Рассмотреть процесс охлаждения расплава задан-
ного состава. Для каждой точки, расположенной на пере-
сечении линии состава рассматриваемого сплава с лини-
ями диаграммы и в промежутках между ними: а) дать
наименование точки; б) определить, что происходит в
данной точке; в) назвать равновесные фазы; г) опреде-
лить число фаз и число степеней свободы; д) пояснить,
что означает данное число степеней свободы.
3. Построить кривую охлаждения этого сплава.
4. При заданной температуре для данного сплава вы-
числить по правилу рычага массы равновесных (твердой
и жидкой) фаз, полученных из 400 г первоначального
расплава.
5 Вычислить состав химических соединений.
Номер задачи Сплав Охлаждение сплава соста- ва, вес. % Темпера- тура, °C
1 (рис. 3) NasAsO4 — AS2O5 70* 650
2 (рис. 4) Na2SO4 — MgSO4 72* 700
3 (рис. 5) ЫагО • AI2O3 • 2SiO2 — 23 1360
— CaO • AI2O3 • 2SiO2
4 (рис. 6) NaF — A1F3 20 950
5 (рис. 7) BaO — S1O2 30 1500
6 (рис. 8) SrO — SiO2 45 1500
7 (рис. 9) Na2O • AI2O3 *25102 — 10 1^50
— K2O • А120з • 2SiO2
144
Номер задач Сплав Охлаждение сплава соста- ва вес, % Темпера- тура/ °C
8 (рис. 10) Li — Sn 60* 350
9 (рис. 11) Fe — Zn 15* 700
10 (рис. 12) Na —Se 80 350
11 (рис. 13) Hg-Rb 15 200
12 (рис. 14) Li — Mg 60 350
13 (рис. 15) CaO — A12O3 40 1450
14 (рис. 16) SiO2 — CaO 20 1600
15 (рис. 17) SiO2 — MgO 50 1700
16 (рис. 16) CaO — SiO2 40 1475
17 (рис. 18) Fe —P 13 1100
18 (рис. 19) Fe —Zr 40 1400
19 (рис. 20) PbO — SiO2 20* 750
20 (рис. 21) BaO —CdO 80 1400
21 (рис. 22) Fe —Si 40 1300
22 (рис. 23) MnO — SiO2 70 1500
23 (рис. 24) Hg-Cd 40 130
24 (рис. 25) Mg —Pb 40 500
25 (рис. 26) Fe —Sb 20 1200
26 (рис. 27) Mg — Zn 20 500
27 (рис. 28) Mg— Pr 70* 780
28 (рис. 29) La —TI 45 1000
29 (рис. 30) Na —TI 66 90
30 (рис. 31) Ni —Sb 50 1100
* Состав выражен в мольных процентах.
Рис. 3. Диаграмма состояния систе-
мы As2O5—Na3AsO4
145
MgSOzi
Рис. 4. Диаграмма состояния систе-
мы MgSO4 — Na2SO4
Na20-Al2O3-2Si02 CaO Al2032Si02
Рис. 5. Диаграмма состояния систе-
мы Na2O-A12O3-2SiO2— СаО*А12ОзХ
X2SiO2
146
Рис. 6. Диаграмма состояния систе-
мы NaF— A1F3
S1O2, бес. °/о
Рис. 7. Диаграмма состояния системы ВаО — SiOj
147
Рис. 8. Диаграмма состояния систе-
мы SrO — SiO2
Рис. 9. Диаграмма состояния системы
N а2О • А120з • 2S iO2 — К2О • А120з X
X2SiO2
148
Рис. 10. Диаграмма состояния системы
Li — Sn
Рис. 11. Диаграмма состояния системы
Fe — Zn
149
Рис. 12. Диаграмма состояния системы
Na — Se
Hgr . Rb
Рис. 13. Диаграмма состояния системы Hg — Rb
150
Cao AljOj
151
Рис. 16. Диаграмма состояния систе-
мы SiO2 — СаО
Рис. 17. Диаграмма состояния систе-
мы SiOa — MgO
Рис 19 Диаграмма состояния системы
Fe — Zr
BaO —CdO
РЬО
154
Рис. 22. Диаграмма состояния системы
Fe — Si
Рис. 23. Диаграмма состояния систе-
мы МпО — SiO2
165
Рис. 24. Диаграмма состояния систе-
мы Hg — Cd
Рис. 25. Диаграмма *состояния системы
Mg —РЬ
156
Рис. 26. Диаграмма состояния системы
- Fe —Sb
Рис. 27. Диаграмма состояния системы
Mg — Zn
157
г
Рис. 28 Диаграмма состояния системы
Mg — Рг
Рис. 29. Диаграмма состояния систе-
мы La — Т1
158
Рис 30 Диаграмма состояния си-
стему Na — Т1
Рис. 31. Диаграмма состояния си-
стемы Ni — Sb
Глава Vll
ТЕРМОДИНАМИКА РАСТВОРОВ
& 24. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
И ВЗАИМНЫЙ ИХ ПЕРЕСЧЕТ
Растворами называются такие системы, в которых од-
но вещество равномерно распределено в среде другого
или других веществ. Важнейшей характеристикой рас-
твора является его состав. Состав раствора можно выра-
зить через весовые, объемные, мольные и другие количе-
ства компонентов. Весовой процент — это количество
граммов растворенного вещества, приходящееся на 100 г
раствора.
Весовой долей или весовым соотношением компонен-
та в растворе называется масса компонента, приходящая-
ся на 1 г раствора. Весовая доля i-ro компонента опре-
деляется из соотношения
Ci =--------------------------------, (VII,1)
+ gz + ga + .. • + Si + • • • + gk
где gi, gz, g3, gk — весовые количества соответствую-
щих компонентов. Молярная концентрация (или моляр-
ность) равна числу молей растворенного вещества в 1 л
раствора. Моляльная концентрация (или моляльность)
равна числу молей растворенного вещества в 1000 г рас-
творителя. Мольной долей компонента называется число
молей компонента на один моль раствора. Мольная доля
i-ro компонента равна отношению числа молей i-ro ком-
понента к сумме чисел молей всех компонентов в раство-
ре и определяется соотношением
•* » г -----------------------» I v А J
Hi И2 4“ Из -J- ... 4” Пи J
Условные обозначения: g — весовой процент; С — мо-
лярность; М — нормальность; т — моляльность; —
160
мольная доля; р — плотность раствора; М2 — молекуляр-
ный вес растворенного вещества; М\ — молекулярный
вес растворителя; Э2— грамм-эквивалент растворенного
вещества.
Пример. При 15° С 20%-ный раствор серной кислоты имеет плот-
ность 1,145 г!мл. Пересчитать указанную концентрацию этого рас-
твора на молярную, нормальную, моляльную концентрации и концент-
рацию в мольных долях.
Решение. 1. Расчет молярности
2.
3.
4.
lOOOpg 1000-1,145-20
С =----------=------—— -------= 2,31 моль[л.
Л?2-100 98-100
Расчет нормальности
N _ 1000Pg _ ЮОО-1,145-20
Э2- ЮО
Расчет моляльности
1000g
49-100
= 4,62 г-экв1л.
1000-20
/я =---------=----------
М2(100 — g) 98(100 — 20)
Расчет концентрации в мольных долях
-______№__________
100-20
20/98+—-------\
1о
= 2,55 мольной г.
N‘ /М ' 100~«
е/м*+~мГ~
Задачи
1—8. Выразить концентрацию водного раствора через
молярность, моляльность, мольные доли и нормальность.
Номер задачи Растворенное вещество Заданная концен- трация, вес. % Плотность раствора, 'г/мл Температура °C
1 AgNO3 50 1,668 20
2 А1С1з 30 1,242 18
3 A12(SO4)3 20 1,226 19
4 ВаС12 10 1,092 20
5 ВеС12 14 1,095 18
6 СаВг2 25 1,250 20
7 СаС12 30 1,282 20
8 Ca(NO3)2 30 1,259 18
9—15. Выразить концентрацию водного раствора че-
рез весовые проценты, моляльность, мольные доли и
нормальность.
6—1741
161
Номер задачи Растворенное вещество Заданная концентра- ция, молъ]л Плотность раствора, г!мл Темпера- тура, СС
9 AgNO3 1,405 1,194 20
10 А1С1з 1,185 1,129 18
11 ВаС12 1,444 1,253 20
12 СаС12 1,190 1,101 20
13 Ca(NO3)2 1,100 1,128 18
14 CdSO4 1,034 1,198 18
15 FeCl3 1,900 1,234 20
16—20. Выразить концентрацию водного раствора че-
рез весовые проценты, молярность, мольные доли и нор-
мальность.
Номер задачи Растворенное вещество Заданная концентра- ция, моль11000 г Плотность раствора, г1мл Темпера- тура, °C
16 Cu(NO3)2 1,33 1,189 20
17 CuCl2 1,86 1,205 20
18 FeCl2 4,97 1,200 18
19 CuSO4 1,37 1,206 20
20 FeSO4 1,65 1,213 18
21- —25. Выразить концентрацию водного раствора че-
рез весовые проценты, молярность мальность. моляльность и нор-
Номер Растворенное Заданная концентра- Плотность Темпера-
задачи вещество дня, мол. доли раствора, г!мл тура, °C
21 НС1 0,05 1,05 20
22 НВг 0,25 1,679 20
23 А1С13 0,083 1,341 15
24 СаВг2 0,084 1,635 20
25 СаС12 0,10 1,396 20
26- -30. Выразить концентрацию водного раствора че-
рез весовые проценты, молярность, ные доли. моляльность И МОЛЬ-
Номер Растворенное .Заданная концентра- Плотность Темпера-
задачи вещество цня» г-экв(л раствора, г/жт тура, °C
26 А1С13 1,93 1,071 18
27 ВаС12 2,00 1,179 20
28 СаС12 2,38 1,101 ' 20
29 Ca(NO3)2 4,604 1,259 18
30 CdSO4 2,068 1,198 18
162
§ 25. ВЫЧИСЛЕНИЕ ПАРЦИАЛЬНЫХ МОЛЬНЫХ ВЕЛИЧИН
В общем виде парциальная мольная величина равна
отношению бесконечно малого изменения данного экстен-
сивного свойства раствора к бесконечно малому измене-
нию числа молей i-ro компонента при постоянстве темпе-
ратуры Т, давления Р и числе молей всех других компо-
нентов раствора
= . (VI 1,3)
\ дгц ' p’T’nj v '
Любое свойство раствора ХОбщ_можно выразить через
парциальные мольные величины Xi и Х2 и состав раство-
ра п\ и н2 (число молей компонентов, образующих рас-
твор) следующим образом:
Аобщ = Xitii -|- -Хг^г- (VII,4)
Уравнение (VII,4) позволяет найти парциальную
мольную долю одного компонента, если известны общее
свойство раствора, парциальная мольная величина дру-
гого компонента и состав раствора.
Изменение парциальной мольной величины i-ro ком-
понента определяется уравнением
Xxi = xi~-Xi, (VII,5)
где Axi — изменение парциальной мольной величины i-ro
компонента; х° — свойство одного моля чистого i-ro ком-
понента.
Свойство одного моля раствора X связано с парциаль-
ными мольными величинами соотношением
Х = Nixi + Nzxz, (VI 1,6)
где Vi и N2 — мольные доли.
Свойство раствора называется аддитивным, если оно
связано с составом раствора соотношением
Хад = + МгХг, (VII,7)
где %1° и х2°— свойства одного моля чистых компонентов.
Пример 1. Как изменится объем раствора, содержащего 40 вес. %
этанола (компонент 2), при добавлении 100 г этанола к большому
объему раствора, если изменение объема раствора при добавлении
1 моль воды — 0,4 см3/моль? Плотности раствора 0,936 г)см\ воды
1,000 г/см3 и этанола 0,790 г! см3,
6* 163
Решение. Изменение объема раствора при добавлении 100 г
этанола вычисляем по уравнению
100 _ 100 о.
Учитывая, что С12° = Л12/р2, получим
100- 100
ДИ = -- V2 — -
М2 р2
(а)
где М2 — молекулярный вес спирта; р2 — плотность этанола; v2—
парциальный мольный объем этанола.
Парциальный мольный объем этанола v2 рассчитываем по урав-
нению (VII,4)
Побщ = «1^1 + «2^2-
Учитывая, что Vo5ul = 100/р; пх = gGMi, п2= g2lM2; =
= V; + Ai'i; V] = Mi/р, получаем
100 = _^
р Мг
Отсюда
— 100/И2 Af2^i jW2£i —
V2 =----------—---------— —-------Avi-
РЙ Р1^2 Mi£2
(б)
Подставляя выражение (б) в (а), получим
Р&2 Plg2
Отсюда
104 100-60 100-60
~ 0,936-40 ~ 1-40 — 18-40
100^! - 100
------ Д^ —---.
М1&2 Р2
(в)
100
( — 0,4)— —- = 257— 150 +
0,87
4-3—115= —5 см3.
Пример 2. В системе таллий (2) — ртуть (1) изменения парци-
альных мольных изобарных потенциалов и энтропий таллия и ртути
npj£ 298° К для раствора с мольной долей таллия У2=0,45 равны
ДО2 =—163,3 дж/моль, AGt=—2130 дж/моль, Д52=3,48 дж/мольХ
Хград, ASj =5,4 дж/моль-град. Определить изменение парциальных
мольных-энтальпий, а также изменение энтальпии, энтропии и изо-
барного потенциала при образовании 1 кг раствора данной концент-
рации из чистых компонентов.
Решение. 1. Определяем по уравнению (VII,6) изменение изо-
барного потенциала для одного моля раствора:
ДП= + ДГ2ДП2 = 0,55( — 2130) 4- 0,45 ( — 163,3) =
= — 1245 дж/моль.
Ii64
Масса одного моля раствора равна
0,55-200,6 + 0,45-204,4 = 110,3 + 92,0 = 202,3 г.
2. Рассчитываем изменение изобарного потенциала для 1 кг рас-
твора
1000
ДО = — 1245------= —6150 дж!кг.
202,3 1
3. Вычисляем изменение энтропии для одного моля раствора
Д5 = Лг1ДбТ+ = 0,55-5,4 + 0,45-3,48 = 2,97 4- 1,57 =
= 4,54 дж/моль-град,
4. Рассчитываем изменение энтропии для 1 кг раствора
1000
AS = 4,54= 4,54-4,94 = 22,4 дж/кг-град.
5. Определяем изменение энтальпии А// для 1 кг раствора
ЬН = ДО + ГД5 = -6150 + 298-22,4 = —6150 +
+ 6684 = 534 дж/кг.
6. Находим изменение парциальных мольных энтальпий обоих
компонентов;
ЛЯ1 = ДО! + T’ASi = — 2130 + 298-5,4 -
= — 2130 + 1609 — 521 дж/моль,
кН 2 = ДО2 + TkSz = — 163,3 + 298 • 3,48 =
= — 163 + 1037 = 874 дж/моль.
Задачи
1—5. Рассчитать плотности растворов метанола.
Номер задачи Содержание мета- нола, вес. % \о’см3 V си3 сн3он’см
1 20 18,0 37,8
2 40 17,5 39,0
3 60 16,8 39,8
4 80 15,4 40,4
5 90 15,0 40,5
6. Определить парциальный мольный объем азотно-
кислого аммония в воде, если объем раствора, содержа-
щий 20 г NH4NO3 в 100 г раствора, равен 92,35 см3, а
объем растворителя в растворе — 80,14 см3.
165
7. Определить парциальный мольный объем азотно-
кислого аммония в водном растворе, если парциальный
мольный объем воды равен 17,98 сл3, объем раствора
93,87 см3, концентрация 16 г NH4NO3 в 100 г раствора.
8. Определить парциальный мольный объем азотно-
кислого аммония в водном растворе, если парциальный
мольный объем воды составляет 1*7,98 см3, объем раство-
ра 86,87 см3, концентрация 35 г NH4NO3 в 100 г раствора.
9. В смеси воды и этанола мольная доля воды равна
0,4, парциальный мольный объем равен 57,5 слг3 и плот-
ность раствора—0,8494 г/см3. Вычислить парциальный
мольный объем воды.
10. Рассчитать теплоту растворения 1 моль НС1 в
3 моль НгО, если изменения парциальных мольных эн-
тальпий НгО 36,28 кдж/моль и НС1 —5,77 кдж/моль.
11. Рассчитать теплоту растворения 1 моль НС1 в
5 моль НгО, если изменения парциальных мольных эн-
тальпий НгО 23,68 кдж/моль и НС1 —2,43 кдж/моль.
12. Рассчитать теплоту растворения 1 моль НС1 в
10 моль Н2О, .если изменения парциальных мольных эн-
тальпий НгО 11,38 кдж/моль и НС1 —4,18‘кдж/Л<оль.
13. Рассчитать теплоту растворения 1 моль НС1 в
20 моль НгО, если изменения парциальных мольных эн-
тальпий НгО 6,28 кдж/моль и НС1 —0,13 кдж/моль.
14. Рассчитать теплоту растворения 1 моль НС1 в
50 моль НгО, если парциальные мольные энтальпии НгО
3,29 кдж/моль и НС1 0,00 кдж/моль.
15. Рассчитать теплоту растворения 1 моль НС1 в
200 моль НгО, если парциальные мольные энтальпии
НгО 1,50 кдж/моль и НС1 0,00 кдж/моль.
16. Рассчитать теплоту растворения 1 моль НС1 в
1600 моль НгО, если парциальные мольные энтальпии
НгО 0,60 кдж/моль и НС1 0,00 кдж/моль.
17. Раствор, содержащий 60 вес. % метанола в воде,
имеет плотность 0,895 г/см3 при 20° С. Парциальный
мольный объем воды в растворе этого состава равен
16,8 см3. Рассчитать парциальный мольный объем спирта.
18. Плотность водного раствора, содержащего
30 вес. % NH3 при 15° С, составляет 0,8951 г/см3, а пар-
циальный мольный объем воды —18,0 см3. Рассчитать
парциальный мольный объем аммиака в этом растворе.
19—27. Определить для системы таллий (2) —-ртуть
(1) изменение парциальных мольных энтальпий и изме-
нение энтальпии, изобарного потенциала, энтропии при
166
образовании 1 кг раствора указанных концентраций при
298°К (N2—-атомная доля таллия).
Номер задач» Ns AGlf дж/моль дж/моль ASt, дж/моль град Д$8, дж/моль-град
19 0,010 — 12,97 —14 042 0,04 29,25
20 0,050 —154,8 —9 000 0,25 22,01
21 0,085 —305,4 —6 862 0,63 17,36
22 0,150 —610,9 —4 389 1,26 12,05
23 0,200 —849,4 —3163 1,67 10,17
24 0,250 -ИЗО —2 171 2,34 7,70
25 0,290 —1343 —1 619 2,97 6,07
26 . 0,360 —1711 —820,1 3,43 5,02
27 0,405 —1975 ‘ —355,6 4,14 3,85
28. Рассчитать изменение парциальной мольной эн-
тальпии уксусной кислоты, если при смешении 79,4 г ук-
сусной кислоты и 20,6 г воды выделяется 805,00 дж теп-
ла. Изменение парциальной мольной энтальпии воды в
этом растворе составляет —133,9 дж!моль.
29. Определить изменение парциальной мольной эн-
тальпии ацетона, если при смешении 83,3 г изопропило-
вого спирта (1) с 16,7 г ацетона (2) при 20° С выделяет-
ся —1443,5 дж. При добавлении 1 моль изопропилового
спирта к большому объему раствора этого состава выде-
ляется —83,68 дж. Сколько теплоты выделится при до-
бавлении 10 г ацетона к большому объему раствора этого
состава?
30. Найти изме"нение парциальной мольной энтропии
сероуглерода при 20° С в смеси сероуглерод (1) —хлоро-
'форм (2) с содержанием 0,30 мол. доли сероуглерода, ес-
ли парциальное давление паров сероуглерода над этим
раствором 113,0 мм рт. ст., а равновесное давление паров
над чистым сероуглеродом 303 мм рт. ст. Изменение
мольной энтальпии при смешении компонентов
—1046 дж/моль.
§ 26. ЗАКОНЫ БЕСКОНЕЧНО РАЗБАВЛЕННЫХ РАСТВОРОВ
Давление пара растворителя над бесконечно раз-
бавленным раствором. Из термодинамики растворов сле-
дует, что в бесконечно разбавленном растворе раствори-
тель подчиняется законам идеальных растворов, а рас-
творенное вещество им не подчиняется.
167
Для бесконечно разбавленных растворов давление
насыщенного пара растворителя над любым неидеаль-
ным раствором выражается уравнением Рауля
Pi^PiNi, (VI 1,8)
где pi—давление насыщенного пара растворителя над
раствором; р° — давление насыщенного пара над чис-
тым растворителем при той же температуре; — моль-
ная доля растворителя в растворе.
Из соотношения (VII,8), выразив Ni через 1— N2,
следует
Pl ~Pi = Нъ (VII,9)
Pi
Разность pi° — /?! называется понижением давления на-
сыщенного пара растворителя; (р°—р\) !р° — относитель-
ное понижение давления насыщенного пара растворите-
ля; N2— мольная доля растворенного вещества.
Молекулярный вес растворенного вещества рассчиты-
вают по уравнению
= (VII,10)
gi &Р
Температура замерзания бесконечно разбавленных
растворов. Понижение температуры замерзания беско-
нечно разбавленного раствора неэлектролита ДТзам пря-
мо пропорционально концентрации растворенного веще-
ства в растворе *
ДТ'зам = Азам^, (VII,11)
где ЛТзам = Т°зам—Тзам — понижение температуры замер-
зания; т — моляльная концентрация растворенного ве-
щества; Кзам — коэффициент пропорциональности, назы-
ваемый криоскопической постоянной. Численное значе-
ние криоскопической постоянной Кзам = АТзам при т = 1.
Криоскопическую постоянную рассчитывают по урав-
нению
Кзам —
/^ам)2^
1000-ДЯпл,1 ’
(VII,12)
* Раствор находится в равновесии с кристаллами чистого твер-
дого растворителя.
168
где Т°зам — температура замерзания чистого растворите-
ля, °К; Л#пл,1 —мольная теплота плавления чистого рас-
творителя, дж/моль.
Если з gl г растворителя растворено g2 г вещества,
то
«-g2J°00 • (VII,13) Afzgi
Подставляя (VII,13) в уравнение (VII,11), получим т ^зам^2’Ю00 ДТзам = Г, > (VII,14) M2gi
откуда Ma=K,„ga-l°00 Д^зам£1
Температура кипения бесконечно разбавленных рас-
творов. Повышение температуры кипения тем больше,
чем выше концентрация раствора и для бесконечно раз-
бавленных растворов неэлектролитов оно пропорциональ-
но концентрации
ДТ'кип Ккип/И, (VII,16)
где Д7КИП = ГКИП—ГКип —повышение температуры кипе-
ния; /<Кип — коэффициент пропорциональности, называе-
мый эбулиоскопической постоянной. Эбулиоскопическая
постоянная выражается уравнением
кип ЮООДЯиспд
(VII,17)
где Гкип -"-температура кипения чистого растворителя,
°К; ДЯиспд —• мольная теплота испарения чистого раство-
рителя, дж/моль.
Молекулярный вес вещества вычисляется по урав-
нению
M2 = x^woo
ДТ’кип^
Осмотическое давление бесконечно разбавленных
растворов. В бесконечно разбавленных растворах не-
электролитов осмотическое давление л рассчитывают по
уравнению
л = С/?Т, (VII,19)
где С — молярная концентрация раствора; R — универ-
169
сальная газовая постоянная; Т — абсолютная темпе-
ратура.
Если растворенное вещество в растворе диссоциирует,
то в уравнение (VII,19) нужно ввести множитель i, боль-
ший единицы:
лоп = iCRT, (VII,20)
где Поп — осмотическое давление. Множитель i называ-
ется изотоническим коэффициентом. Он равняется отно-
шению наблюдаемого осмотического давления к рассчи-
тываемому:
Лоп
I -----.
л
(VII,21)
Изотоническим коэффициент i может быть также вычис-
лен по другим равновесным свойствам бесконечно раз-
бавленных растворов:
/ ДР \
__ДРзам(оп) ДУкип(оп) \ Pl /on (VII 22)
- ДГйам “ ДГ
кип' ( ьр \
1 о 1
\ Pl J
А7зам(оп) — iKsaM^l', АТ'кип(оп) —
( ~ ) = iV2, (VII,23)
Р 1 ОП
где АТзам— понижение температуры замерзания раство-
ра, вычисленное по уравнению (VII,11) в предположении
отсутствия диссоциации растворенного вещества;
ЛТ'кип — повышение температуры кипения раствора, вы-
численное по уравнению (VII,16) в предположении отсут-
ствия диссоциации растворенного вещества; —Г —отно-
Pi
сительное понижение давления пара растворителя над
раствором в предположении отсутствия диссоциации
растворенного вещества; АТзам^п)— опытное понижение
температуры замерзания раствора, если растворенное ве-
щество в растворе диссоциирует; ДТКип(оп) — опытное по-
вышение температуры кипения, если растворенное веще-
/ Ар \
ство в растворе диссоциирует; 1 — 1 — относительное
х Р° Лоп
170
понижение давления пара растворителя над раствором,
полученное опытным путем, если растворенное вещество
в растворе диссоциирует.
Для растворов слабых электролитов i определяется
по уравнению
j=l+a(v —1), (VII,24)
где a—-степень диссоциации слабого электролита^ —
число ионов, которое образует каждая молекула при дис-
социации.
В случае сильных электролитов изотонический коэф-
фициент также больше единицы и называется осмотиче-
ским коэффициентом.
Пример 1. Вычислить давление пара 5%-го раствора сахара
С12Н220ц в воде при 100° С и процентное содержание глицерина в
водном растворе, давление пара которого равно давлению пара
5%-ного раствора сахара. Считать, что 5%-ный раствор сахара под-
чиняется законам бесконечно разбавленных растворов.
Решение. 1. Определяем мольную долю сахара в воде:
gi 5
AV =
М2
g2 _Л
М2 + 2И1
342,3'
5 95
342,3^ 18,016
= 0,0028.
2. Определяем давление водяного пара 5%-ного раствора сахара
по уравнению (VII,9):
Р1—Р1 — P1N 2 >
где рх =760 мм рт. ст.
/>HjO=760—0,0028-760=757,87 мм рт. ст.
3. Определяем процентную концентрацию глицерина в растворе.
Так как давление насыщенного пара раствора глицерина равняется
давлению насыщенного пара раствора сахара, то мольные доли саха-
ра и глицерина в растворе должны быть одинаковыми, т. е. мольная
доля глицерина также 0,0028. Концентрация глицерина в весовых
процентах составляет
ЮОЛУ/Ич 100 0,0028-92 ,09
82= N2M2+N1M1 0,0028-92,09 + 0,9978-18 = 1,42 ВеС’ %‘
Пример 2. Техническая уксусная кислота замерзает при 16,4° С.
Температура замерзания чистой уксусной кислоты 16,7° С, ее криос-
копическая константа равна 3$. Определить моляльную концентра-
цию примесей в технической уксусной кислоте.
Решение. 1. Определяем понижение температуры замерзания
уксусной кислоты в присутствии примесей
ДТ’эам = Т’зам “ ^ам = 16,7 - 16,4 = 0,3°.
171
2. Определяем по формуле (VII.11) содержание примесей в
1000 г уксусной кислоты:
А^гам
т =~к—
гхзам
0,3
— = 0,08 моль.
3,9
Пример 3. При растворении 0,6 е некоторого вещества неэлект-
ролита в 25 г воды температура кипения раствора повышается на
0,204° С. При растворении 0,3 г этого же вещества в 20 г бензола
температура кипения раствора повышается на 0,668° С. Определить
эбулиоскопическую постоянную бензола, если эбулиоскопическая по-
стоянная воды равна 0,512.
Решение. 1. Определяем по уравнению {VII,18) молекуляр-
ный вес растворенного вещества в водном растворе.
0,512-0,6-1000
—-------------= 60.
0,204-25
(VII,18) эбулиоскопическую посто-
- „ Ккип^ЮОО
М2 =------------ =
ЛТ^кип^!
2. Определяем по уравнению
янную бензола:
''кип —
0,668-60-20
— ------------= 2,67.
g21000 0,3-1000
Пример 4. Давление пара воды при 20° С 17,54 мм рт. ст., а дав-
ление пара раствора, содержащего нелетучее растворенное вещество,
17,22 мм рт. ст. Определить осмотическое давление раствора при
40° С, если его плотность при этой температуре 1,01 г} см? и молеку-
лярный вес растворенного вещества 60.
Решение. 1. Определяем по уравнению (VII,9) мольную долю
растворенного вещества в растворе
/нго— Днго, 17,54—17,22
0,0182.
мольных долях,
= 0,98 моль!л.
3.
<Phso
2. Пересчитываем концентрацию, выраженную в
на молярную концентрацию:
с _ __1000рЛЧ______________1000-1,01-0,0182
~ NiM2+~ 0,0182-60 + 0,9818-18,016
Определяем по уравнению (VII,19) осмотическое давление:
л = CRT = 0,98-8,314-103 313 = 25,73-105 н/д«2.
Задачи *
При 25° С давление паров воды равно
мм рт. ст. Чему равно давление паров воды над
1.
23,76
раствором, содержащим 6 г мочевины в 180 г воды?
* В задачах считать, что разбавленные растворы подчиняются
законам бесконечно разбавленных растворов и растворенное веще-
ство не летуче.
172
2. Давление паров ртути над амальгамой, содержа-
щей 1,14 г олова в 100 г ртути, равно 754,1 мм рт. ст. Оп-
ределить давление паров чистой ртути при той же темпе-
ратуре.
3. Какова должна быть концентрация водного рас-
твора сахара, чтобы давление пара раствора было на 1 %
ниже давления пара чистой воды?
4. Вычислить давление паров воды над 25%-ным рас-
твором глюкозы С6Н12О6 при 20° С. Давление паров воды
при’этой температуре равно 17,4 мм рт. ст.
5. Давление паров этилового эфира при 20° С равно
442 мм рт. ст. Вычислить давление паров эфира над рас-
твором, содержащим 15 г бензальдегида (мол. вес.
106,05) в 100 г эфира.
6. Давление паров воды при 25° С равно
23,75 мм рт. ст. Определить давление паров 5%-ного рас-
твора сахара С12Н220ц.
7. Определить давление паров 10%-ного раствора гли-
’ церина C3H8O3 при 25° С, если давление пара воды при
этой температуре равно 23,8 мм рт. ст.
8. Температура кипения бензола равна 80,1° С. Его
мольная теплота испарения 30,77 кдж/моль. Определить
температуру кипения раствора, содержащего 0,01 мол.
долю нелетучего вещества в бензоле.
9. Температура кипения сероуглерода 46,20° С. Его
эбулиоскопическая постоянная 2,3. В 50 а сероуглерода
растворено 0,9373 г бензойной кислоты. Полученный рас-
твор имеет температуру кипения 46,39°С. Определить
молекулярный вес бензойной кислоты в сероуглероде.
10. Эбулиоскопическая постоянная для воды 0,512.
При какой температуре кипит 5%-ный раствор тростни-
кового сахара Cl2H220ii в воде?
11. Хлороформ кипит при 60,2° С. Давление его пара
при этой температуре 781 мм рт. ст. Определить давле-
ние пара и температуру кипения раствора, содержащего
0,2 моль нелетучего растворенного вещества в 1000 г хло-
роформа. Мольная теплота испарения хлороформа
31,64 кдж/моль.
12. Раствор, содержащий 0,5 г нелетучего растворен-
ного вещества с молекулярным весом 182 в 42 а бензола,
кипит при 80,27° С. Температура кипения чистого бензо-
ла 80,1° С. Определить мольную теплоту испарения бен-
зола.
173
13. Растворение 1,2324 г нафталина в 88,26 г этилово-
го эфира повысило температуру кипения эфира на
0,234°С по сравнению с температурой кипения чистого
эфира 34,0° С. Вычислить мольную теплоту испарения
эфира.
14. Жидкая SO2 кипйт при 10° С. Теплота испарения
ее при этой температуре 25,52 кдж/моль. Вычислить
температуру кипения раствора, содержащего 1 моль SO3
на 20 моль SO2.
15. Сколько граммов глицерина необходимо добавить
к 1,0 кг воды, чтобы раствор не замерзал до —0,5°С?
Криоскопическая постоянная воды равна 1,86.
16. Водный раствор содержит 0,5 вес. % мочевины
(NH2)2CO и 1 вес. % глюкозы СеН|2О6. Какова его тем-
пература замерзания, если криоскопическая постоянная
воды равна 1,86°?
17. Какова концентрация насыщенного раствора эти-
лацетата С4НвО2 в воде, если раствор, насыщенный при
температуре 0°С, замерзает при —2,365° С, а раствор,
насыщенный при температуре 20° С, — при температуре
—1,8°. Криоскопическая постоянная воды равна 1,86°.
18. Бензол замерзает при 5,42° С. Раствор, содержа-
щий 12,8 г нафталина в 1000 г бензола, замерзает при
4,908° С. Определить удельную теплоту плавления бен-
зола.
19. Чистый кадмий затвердевает при 321°С, 10%-ный
раствор висмута в кйдмии — при 312° С. Определить атом-
ную теплоту плавления кадмия.
20. ЧеМу равна температура замерзания водного рас-
твора мочевины, в котором содержится 0,0032 мол. доли
мочевины? Теплота плавления воды 333,1 дж/г.
21. Температура плавления фенола 40° С. Раствор, со-
держащий 0,172 г ацетанилида C8HgON в 12,54 г фенола,
замерзает при 39,25° С. Вычислить теплоту плавления
фенола.
22. При 17° С осмотическое давление раствора, со-
держащего 0,125 г мочевины в 25 мл воды, равно
2,006-105 н/м2. Вычислить молекулярный вес мочевины.
23. Сколько граммов глицерина следует растворить в
0,001 м3 воды, чтобы осмотическое давление полученного
раствора при 17° С было 2,026-105 н/м2?
24. При температуре 27° С осмотическое давление
раствора сахара 800 мм рт. ст. Определить осмотическое
давление этого раствора при 0°С.
174
25. Температура заикания водного раствора саха-
ра равна —0,216° С. Выделить осмотическое давление
раствора при этой темп«|атуре, если #зам=1,86, а плот-
ность равна 1,01 г/см3.
26. При 25° С дарение паров воды равно
23,76 мм рт. ст., а давледае паров раствора глицерина —
23,68 мм рт. ст. Вычислгь осмотическое давление этого
раствора при 37° С. Плоюсть раствора 1,0017 г/см3.
27. Раствор, содержаний 1,5 г KCI в 100 а воды, за-
мерзает при —0,684° С. Определить изотонический коэф-
фициент и давление пар« воды над этим раствором при
25° С. Давление паров истой воды при 25° С равно
23,76 мм рт. ст.
28. Раствор, содержаний 0,171 г H2SO4 в 1000 г во-
ды, замерзает при —0,6'54° С. Криоскопическая посто-
янная воды равна 1,86° Определить изотонический ко-
эффициент.
29. Определить темгратуру замерзания раствора,
температуру кипения и давление паров воды над 0,08 м
раствором хлоруксусношислоты при 25° С, если он дис-
социирует на 13%. Давлвие паров воды при 25° С равно
23,756 мм рт. ст.'Криоскпическая постоянная воды 1,86,
эбулиоскопическая постойная воды 0,512.
30. Определить степеь диссоциации дихлоруксусной
кислоты, если она диссоиирует в растворе на два иона.
Температура замерзания!), 1 м водного раствора дихлор-
уксусной кислоты—0,27? С.
31. Технический димсиламин замерзает на 0,10° ни-
же,температуры плавлена (180,97° К) чистого вещества.
Вычислить мЪльный проент примесей, считая, что твер-
дых растворов не образутся. Теплота плавления чистого
диметиламина 5941,28 д^моль.
32. Теплота плавленн металлического свинца равна
5188,2 дж!моль при теюратуре плавления 327,5°С. Вы-
числить температуру закрзания раствора, содержащего
1 мол. % примесей, котфяе не растворяются в твердом
свинце.
§ 27. РАВНОВЕИЕ ЖИДКОСТЬ — ПАР
И ПЕРЕГОНКА БИТНЫХ ЛЕТУЧИХ СМЕСЕЙ
Если оба компонента(аствора в чистом состоянии ле-
тучи, то пар будет содержать оба компонента. Давление
насыщенного пара надйким раствором равно сумме
175
парциальных давлений его компонентов:
Р = pi + Pz, (VI 1,25)
где Р — общее давление насыщенного пара над раство-
ром; pi и р2— парциальные давления компонентов над
раствором.
В случае взаимно растворимых компонентов, образу-
ющих идеальный раствор, зависимость парциального
давления пара компонентов от состава раствора подчиня-
ется закону Рауля:
pi = P°Ni, Pz = Pz Ms, (VII,26)
где p° и p2°— давление насыщенного пара соответст-
вующего компонента в чистом состоянии; и N2 — моль-
ные доли компонентов в жидкой смеси.
Общее давление насыщенного пара над идеальным
раствором равно
Р = Pi + pz = Pi Nj. + pzNz, . (VII,27)
учитывая, что Я1 + Х2 = 1, получим
P = p1+V2(p2°-p1°). (VII,28)
Таким образом, зависимость Р — N2 для идеальной сме-
си летучих жидкостей имеет прямолинейный характер.
По закону Дальтона имеем
П1 = Р£; PN'. рг=р^- (VII,29)
N2 П2 P2
где ti\ и п2 — число молей компонентов в паре; N/ и
N2—мольная доля первого и второго компонента в
паре.
Если два жидких компонента образуют неидеальный
раствор, то зависимость парциального давления пара
компонентов от состава описывается уравнениями
pi = рГац рг = рга2, (VII,30)
где й] и й2 — активности компонентов в растворе.
Для расчета активности по мольной доли компонента
используют коэффициент активности, который определя-
176
ется по уравнениям:
__ Р1 __ Р% /Х7ТТ Q1\
Т1 =-----ту-, Y2 = ------(VII,31)
РпидЛц Р2,идй/2
где рь р2— парциальные давления компонентов неиде-
ального раствора; р^ид, Рг.ид— парциальные давления
компонентов в идеальном растворе согласно уравнению
(VII,26).
Давление насыщенного пара над раствором из вза-
имно не смешивающихся жидкостей равно сумме давле-
ний насыщенных паров этих компонентов в чистом сос-
тоянии
Р = pl + Р2°.
(VII,32)
При перегонке дйух взаимно нерастворимых жидкостей
их относительное количество в конденсате определяется
соотношением давлений насыщенных паров при данной
температуре:
- 21 — р°
Р°2‘
^"1 ^2
Зная, что Hi = —; пг = —, получаем
Mi М2
Pi__ giMz. gz___M2pz
P°~ gzMi ’ gi ~ Mip^ ’
(VII,33)
(VII,34)
где и п2— числа молей компонентов в конденсате; g\
и gz — весовые количества их в конденсате; М\ и М2—
молекулярные веса компонентов.
При перегонке с водяным паром
Pz = Рн2о; gz = йн2о и М2 = Л4ц2о = 18,02 и
уравнение (VII,34) примет вид
gn2o____________________ 18,02рн2о
gi MiPi
Соотношение gn2olgi дает количество водяного пара (в
весовых единицах), необходимое для перегонки одной
весовой единицы перегоняемого вещества, т. е. так назы-
ваемый расходный коэффициент пара.
177
Для идеального раствора ЛН=0; АУ=0, и изменение
энтропии выражается уравнением
AS = — R (rii In Ni + n2 In vV2 + «з lg ..). (VII,36)
Пример 1. Определить расходный коэффициент водяного пара
при перегонке нитробензола с Водяным паром, если смесь нитробен-
зола и воды при атмосферном давлении кипит при 99° С. При этой
температуре давление насыщенного пара нитробензола 27 мм рт. ст.,
а давление насыщенного пара воды 733 мм рт. ст.
Решение. В соответствии с уравнением (VII,35) находим
£н2О 18.°2Рд2о 18,02-733 ,
« —— —— ——1—1 ——— —
gi М1Р\ 123,12-27
Пример 2. Давление насыщенного пара бромбензола (1) и хлор-
бензола (2) при 132,3° С соответственно равно 400 и 762 мм рт. ст.
Эти компоненты взаимно растворимы и образуют идеальную смесь.
Определить: 1) состав смеси, кипящей при 132,3° С под давлением
760 мм рт. ст.\ 2) отношение числа молей хлорбензола к числу молей
бромбензола в парах над смесью, содержащей а) 1 мол. % С6Н5С1
и б) 1 мол. % C6HsBr; 3) направление изменения состава смеси при
изотермной перегонке.
Решение. 1. Определяем состав смеси, кипящей при 132,3°С
под давлением 760 мм рт. ст., по уравнению (VII,28):
N2 =
Р—Р1
Р2—Р\
760 — 400
762 — 400
0,994,
V2=99,4 мол. %. Отсюда Л\ = 100—99,4=0,6 мол. %.
2. Определяем отношение числа молей хлорбензола к числу молей
бромбензола для 1 мол. % CellsCl. Парциальное давление каждого
из компонентов определяем по формуле (VII,26):
/>2 = 400-0,99 = 396 мм рт. ст.',
/>2 = 762-0,01 —7,62 мм рт. ст.
По уравнению (VII,30) находим
7,62
— = 0,019.
396
«2
«1
Определяем отношение числа молей хлорбензола к числу молей
бромбензола для 1 мол. % СбН5Вг:
Р1 = 400-0,01 = 4 мм рт. ст.;
р2 = 762-0,99 = 754,38 мм рт. ст.;
п2 754,38
— =------— = 188,6.
«1 4
178
3. Определяем направление изменения состава смеси при изо-
термной перегонке. В соответствии с формулами (VII,26) и (VII,29)
находим
"2 = р2 = Р°г^2 = 762У2 j ж ДГ2
nJ ~ Pi~ p^Ni 4OO2VJ ’ 2Vi ’
т. е. соотношение Пг'М/ числа молей С6Н5С1 к числу молей CeHsBr
в парах в 1,905 раз больше, чем соотношение Nz/Ni в растворе: По-
этому в процессе перегонки состав жидкости будет обогащаться
бромбензолом.
SnCl4 ссц
Рис. 32. Зависимость общего давления и парциальных
давлений компонентов системы SnCk — CCk от со-
става (а) и зависимость температуры кипения смеси
от состава (б)
Пример 3. При температуре 100° С давления насыщенных паров
SnCl4 497 мм рт. ст. и CCk 1450 мм рт. ст. При' давлении
760 мм рт. ст. температура кипения SnCk 114° С и CCk 77° С. Смесь
SnCl4 (1) —СС14 (2) подчиняется законам идеальных газов.
Построить 1) график давление пара (Р, pi, ft) — состав смеси
при 100° С; 2) график температура кипения — состав смеси и пара
при 760 мм рт. ст. Рассчитать состав точек С и D на рис. 32, б. Опре-
делить температуру кипения смеси 20 мол. % СС14 и состав равно-
весного с ней пара; состав смеси, закипающей при 85° С, и состав
равновесного с ней пара; число молей равновесных жидкости и пара
из 10 моль исходной жидкой смеси в фигуративной точке 80 мол. %
СС14 и 85° С (рис. 32, б).
Решение. 1. Для построения графика давление пара — состав
смеси при 100° С (см. рис. 32, а) откладываем на осях ординат
Pi°=497 мм рт. ст. при 0,0 мол. % СС14=0 (точка А) и Рг =
179
= 1450 мм рт. ст. при 0,0 мол. % СС14 = 100 (точка В). Зависимость
парциальных давлений обоих компонетов и общего давления пара от
состава смеси изобразится на графике прямыми линиями р\, р2 и Р
в соответствии с уравнением (VII,26) и (VII,28).
2. Для построения графика температура кипения — состав смеси
при 760 мм рт. ст. (см. рис. 32, б) откладываем на осях ординат
^иип, i = 114°C при 0 мол. % СС14 (точка Д) и ^Кип, г— 77° С при
100 мол. % СС14 (точка В).
Состав жидкой смеси, кипящей при 100° С и 760 мм рт. ст.
(точка С), определяем по рис. 32, а. Как видно, при 100° смесь около
28 мол. % СС14 имеет общее давление пара 760 мм рт. ст. (точка R
на рис. 32, а).
Состав пара (точка D на рис. 32, б), равновесного с жидкой
смесью SnCl4— СС14, кипящей при 100° С, также находим по
рис. 32, а. Как видно, парциальное давление СС14 жидкой смеси,
содержащей 28 мол. % СС14 равно около 400 мм рт. ст. (точка S
на рис. 32, а). *
Искомый состав пара 100 N2 рассчитываем по закону Дальтона:
100ЛГ2 Р2 . inn400
— = ^; 100^=100—^53 мол. % СС14.
Откладываем точки С (100° С, 28 мол. % СС14) и £>(100° С,
53 мол. % СС14) на графике (рис. 32, б). По точкам АСВ проводим
кривую температура кипения — состав жидкой смеси; по точкам
ADB проводим кривую температура кипения — состав равновесно-
го пара.
3. Состав точки С на рис. 32, б рассчитываем по уравнению
(VII,28):
Р — р\ 760 — 497
1007/2 = 100 —-----— = 100 ——------—- = 27,6 мол. % СС14.
Р2 — Р1 1450 — 497
Парциальное давление р2 CCU при 100 N2=27,6 мол. % СС14
расчетным путем определяем по уравнению Рауля (VII,26):
р2 = р°2^2 — 1450-0,276 = 400,2 мм рт. ст.
Состав точки D на рис. 32, б рассчитываем по. закону Дальтона,
как показано выше.
4. Из графика (рис. 32, б) находим, что смесь 20 мол. % кипит
около 104° С (точка Е) и состав равновесного с ней пара — около
45 мол. % СС14 (точка £).
5. Из графика (рис. 32, б) находим, что при 85° С кипит смесь
состава около 66 мол. % СС14 (точка G) и состав равновесного с ней
пара — около 86 мол. % СС14 (точка К).
6. Определяем число молей пара и жидкости, которые находятся
в равновесии при 85° С (при условии, что состав системы в количе-
стве 10 моль характеризуется фигуративной точкой Н), по правилу
рычага по точкам G, Н и К. на рис. 32, б;
пп 80 — 66 14
__!!_ ________ __= 23
пж________________86 — 80 6
180
(nn—число молей пара; пж —число молей смеси). Учитывая, что
/?п + пж = 10 моль,
то пп = 7,0 моль', пж = 3,0 моль.
Задачи
1. Смесь СеНйСНз и СеН6 содержит 30 вес. % СеНьСНз.
При 30° С давление пара чистого СеНзСНз равно
36,7 мм рт. ст., а давление пара чистого С6Н6 —
118,2 мм рт. ст. Принимая, что эти две жидкости образу-
ют идеальные растворы, рассчитать общее давление и
парциальные давления каждого компонента над раство-
ром при этой температуре.
2. При 140° С давление пара CeHsCl равно
939,4 мм рт. ст., а давление пара C6HsBr —495,8 мм рт. ст.
Принимая, что эти две жидкости образуют идеальный
раствор, определить состав смеси, которая кипит при
140° С и 760 мм рт. ст. Какой будет состав пара при этой
температуре?
3. Толуол перегонялся с водяным паром при 83° С и
737,5 мм рт. ст.; в дистиллят перешло 53,5 г толуола и
12,75 г воды. Давление насыщенного пара воды при этой
температуре равно 400,9 мм рт. ст. Компоненты взаимно
не растворимы. Чему равна масса моля толуола? Какова
относительная ошибка опыта?
4. При 60° С давление пара этанола равно
352,7 мм рт. ст., а давлейие пара метанола —
625 мм рт. ст. Смесь этих спиртов, которую можно счи-
тать идеальной, содержит 50 вес. % каждого компонента.
Каков состав пара над раствором при этой температуре?
5. Полностью несмешивающаяся жидкая система, со-
стоящая из воды и органического соединения, кипит при
90° С и 734 мм рт. ст. Дистиллят содержит 73 вес. % ор-
ганического соединения. Каков молекулярный вес и дав-
ление пара органического соединения при этой темпера-
туре? (Давление насыщенных паров воды при 90°С рав-
но 525,76 мм рт. ст.)
6. При 30° С составлена смесь СбН5ОН и НгО, содер-
жащая 60 вес. % воды. Смесь делится на два слоя, при-
чем фенольный слой содержит 70 вес. % С6Н5ОН, а вод-
ный слой — 92 вес. % НгО. Рассчитать отношение веса
водного слоя к весу фенольного слоя.
181
7. Определить изменение энтропии при смешении
100 г метанола со 16'0 г этанола, считая, что они образу-
ют идеальный раствор.
8. Хлорид олова (IV) и четыреххлористый углерод
образуют идеальный раствор. Определить изменение изо-
барного потенциала при 20° С для 0,5 кг раствора, в ко-
тором содержится 0,5 мол. доли SnC14.
9. Раствор, состоящий из бензола и толуола, содер-
жит 30% толуола. Определить давление пара раствора
и состав пара, выразив его в мольных долях. Давление
пара бензола 120,2 мм рт. ст., а толуола 36,7 мм рт. ст.
10. Для смеси бензола и сероуглерода зависимость
между составом раствора и составом пара выражается
уравнением
где х—мольная доля бензола в растворе; у — мольная
доля- бензола в парах. Рассчитать состав пара, находя-
щегося в равновесии с раствором, содержащим
а) 90 мол. % и б) 10 мол. % бензола. Образуют ли ком-
поненты постоянно кипящую смесь?
11. Циклогексан и четыреххлористый углерод образу-
ют регулярный раствор. При смешении 2 моль CCU с
3 моль C6Hi2 при 25° С изменение энтальпии равно
704,6 дж. Определить АН при образовании 1 моль рас-
твора, в котором содержится 0,5 мол. доли С6Н12.
12. Этанол и метанол при смешении образуют рас-
твор, приближающийся к идеальному. Давление паров
этанола 44,5, а метанола 88,7 мм рт. ст. при 20° С. Рас-
считать: а) мольные доли метанола и этанола в раство-
ре, содержащем по 100 г каждого; б) парциальные дав-
ления и общее давление паров раствора; в) мольную до-
лю метанола в паре.
13. Температура кипения несмешивающейся жидкой
системы нафталин — вода 98° С при 733 мм рт. ст. Дав-
ление паров воды при этой температуре 707 мм рт. ст.
Рассчитать содержание нафталина в дистилляте в весо-
вых процентах.
14. Давление паров несмешивающейся жидкой сис-
темы диэтиланилин — вода 760 мм рт. ст. при 99,4° С.
Давление паров воды при этой температуре 740 мм рт. ст.
Какое количество пара необходимо для перегонки 0,1 кг
диэтиланилина?
182
15. Рассчитать давление и состав пара над раство-
ром, содержащим 20 вес. % о-ксилола, 30 вес. % .«-кси-
лола, 50 вес. % n-ксилола, при 80° С и если его считать
идеальным. Давления пара чистых веществ принять рав-
ным соответственно 108,9; 115,7 и 142,6 мм рт. ст.
16. Вода и уксусноэтиловый эфир ограниченно сме-
шиваются между собой. При 38° С обе фазы, находящие-
ся в равновесии, содержат одна 6,75 вес. °/о эфира, дру-
гая— 3,79 вес. % воды. Рассчитать: а) парциальное дав-
ление эфира, б) парциальное давление водяного пара,
с) общее давление паров при этой температуре (каждая
из фаз отвечает идеальному раствору). При этой темпе-
ратуре давление паров уксусноэтилового эфира 166, а
воды 48,0 мм рт. ст. •
17. Смесь SnCl4 (1)—СС14(2) подчиняется законам
идеальных растворов. При 90° С давление насыщенного
пара SnCl4(pi°) равно 362 мм рт. ст., а давление ненасы-
щенного пара СС14(р2°) — 1112 мм рт. ст. Под давлением
760 мм рт. ст. SnCl4 кипит при 114° С, а СС14 — при 77° С.
1. Построить диаграмму состав — парциальные дав-
-ления насыщенного пара компонентов и найти по диа-
грамме р\, р2 и Р для смеси 0,7 мол. доли СС14.
2. Определить состав смеси SnCl4 — CCI4, закипаю-
щей при 90° С и давлении 760 мм рт. ст.
3. Определить состав пара при той же температуре и
вычертить диаграмму состав — температура кипения.
4. Рассчитать отношение числа молей в парах и в
жидкой смеси по правилу рычага при 95° С.
18. Бензол и хлорбензол неограниченно взаимно рас-
творимы, их смесь подчиняется законам идеальных рас-
творов.
1. Построить диаграммы состав — парциальные дав-
ления и общее давление пара при 100°С и состав — тем-
пература кипения по следующим данным:
Температура кипения, °C
Давление пара С6Н5С1, р°,
мм рт. ст................
Давление пара С6Нв, р°2,
мм рт. ст. ................
132 120 100 80,4
760 543,3 292,76 —
— 2238,1 1344,3 760
183
2. Рассчитать парциальные давления и общее давле-
ние пара при 100° С и 0,8 мол. доли бензола.
3. Каков состав смеси, которая закипает при 110°С
под атмосферным давлением, и чему равна при этом
мольная доля бензола в парах?
4. Сколько молей каждого компонента будет отогна-
но при 115° С и какова общая масса дистиллята, если
3 моль бензола смешаны с 7 моль хлорбензола.
19. Ацетон (1) и сероуглерод (2) неограниченно
взаимно растворимы и не подчиняются законам идеаль-
ных растворов. Построить диаграмму состав — парци-
альные давления и общее давление пара при температу-
ре 50° С по следующим данным:
Содержание CS2, мол. % О
Давление паров ацетона
Pi, мм рт. ст....... 343,8
Давление паров сероуг-
лерода р2, мм рт. ст. . —
13,3 28,69 67,13 92,42 100
308,3 274,2 217,0 120,3 —
206,5 328,7 438,0 490 512,3
Вычислить коэффициент активности сероуглерода в
растворе, содержащем 20 мол. % CS2.
20. Построить диаграммы состав — парциальное дав-
ление и общее давление пара при 100° С и состав — тем-
пература кипения для идеальной жидкой смеси CeHgBr—
С6Н6 по следующим данным:
^КИП, °C 156 140 120 100 80,4
р\, с„Н5Вг рт. СТ. . . 760 496,7 275,3 141,2 —
/»2>с.н,> рт. СТ. . . — 3520,0 2238,0 1344,0 760
Рассчитать и определить по диаграмме парциальные
давления и общее давление пара при 100° С и 0,2 мол. до-
ли бензола. Определить, при какой температуре закипит
эта смесь под давлением 760 мм рт. ст. и какова будет
мольная дол'я бензола в парах. Каков будет состав жид-
кой смеси при 135° С.
21. Иодбензол (1) и бензол (2) неограниченно вза-
имно растворимы, их смесь подчиняется законам иде-
альных растворов. Определить состав смеси, если она за-
кипает при 100°, 760 мм рт. ст. и pi° = 50,44 и р2°=
= 1343,3 мм рт. ст. Какова при этом будет мольная доля
бензола в парах?
184
22. Какое количество по весу азеотропа НСЬНгО,
приготовленного при 740 мм рт. ст., нужно добавить к
воде, чтобы получить 2 л 0,5 М раствора НС1? Весовой
процент воды в азеотропе 79,76.
§ 28. НЕИДЕАЛЬНЫЕ РАСТВОРЫ.
АКТИВНОСТЬ И КОЭФФИЦИЕНТ АКТИВНОСТИ
РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Химический потенциал i-го компонента в идеальном
растворе связан с его мольной долей i-ro компонента
4- RT In (VII,37)
где цг°— химический потенциал чистого i-ro компонента.
Для неидеальных растворов химический потенциал
i-ro компонента в растворе рассчитывается по уравнению
= [Xi И- RT In И{,
где Цг0 — стандартный химический потенциал; «г— ак-
тивность i-ro компонента.
Зависимость активности i-ro компонента от его кон-
центрации выражается соотношениями:
Gj — Ут£И1г; Hi — Yci^'i, — YNi-Vi* (VII,38)
В разбавленных растворах эти коэффициенты приблизи-
тельно равны друг другу.
Активность i-ro компонента в растворе можно опреде-
лить по парциальному давлению пара pt компонента:
= (VII,39)
где р° — давление пара над чистым i-м компонентом.
Активность растворенного вещества можно рассчи-
тать по понижению температуры замерзания раствора:
та .
— In — = f — dm + j,
m v tn
о
где
АТ'зам
Кзам^
(VI 1,40)
(VI 1,41)
185
Л7’3ам = То—Т — понижение температуры замерзания рас-
твора; /(зам — криоскопическая постоянная.
Для очень разбавленных растворов уравнение
(VII,40) превращается в
1пу = 1п-^ = -2/. (VII,41а)
Активность и коэффициент активности одного из ком-
понентов можно определить по уравнению Гиббса—Дю-
гема, если активность другого компонента известна:
7V
lga2 — lga2'= igai) v(VII,42)
a/
или
lgY2-lgY2 = J^d(-lgYi)- (VII,43)
2
В уравнении (VII,42) значения a2 и y2' должны быть
известны.
Интегралы в уравнениях (VII,42) и (VII,43) вычисля-
ют графическим способом в координатах N\/N2—Igfli
или Ni/N2 — IgYi- Зная активности компонентов, можно
некоторые равновесные свойства неидеального раствора
выразить следующим образом:
Pi - = каг\ (VII,44)
., sac d In a2 ДЯпл,2
dT — др ’ (Vll,45)
dTSa.in RTзам
d in at АЯпл,1 (Vll,46)
dTiam RTiara
d In Я1 ДЯиспД (VII,47)
dn = — RT dlnOi. f) (VI 1,48)
_Для разбавленных' растворов, считая приближенно
ДЯплд, АЯпл,2, АЯиспд Vi постоянными величинами, рав-
186
навесные свойства раствора можно представить в интег-
ральной форме:
ш «Г = - Т} . (VII,49)
Л1о1
ЛТ 1 Д-^зам — . == 1П Gi, ДЯпл,1 (VII,50)
лт КТ°Т 1 Д^кип— ' — In Gi, Ал исп,1 (VII,51)
RT , л = — Ш О1. V1 (VII,52)
Пример 1. Чему равна активность бензола в растворе, если дав-
ление паров бензола иад раствором 600 мм рт. ст. при 80° С? Бензол
кипит при 80° С и 1,013- 10s н/м2.
Решение. По формуле (VII,39) рассчитываем активность
600
’’S'0*
Пример 2. Определить активность 0,1 м раствора глицерина, если
он замерзает при —0,2° С. Криоскопическая постоянная воды 1,86.
Решение. По уравнению (VII,41) вычисляем
Д^зам _ 0,2
Кт
= 1 — 1,075 = —0,075,
1,86-0,1
7-1
а по уравнению (VII,41)
„ 2-0,075
lg *-2//2,3=—2——-= 0,067,
2. у о
7 = 1,16, а = 1,16-0,1 =0,116,
Пример 3. Давление паров хлороформа (1) над раствором, со-
держащим ацетон (2), в зависимости от состава смеси меняется сле-
дующим образом:
ЛТ1, мол. доли 0,4 0,5 0,6 0,7 1,0
Pi, мм рт. ст. 105 147 194 242 372
Определить коэффициент активности у2 в растворе, содержащем
0,5 мол. доли ацетона, если его коэффициент активности у2' в рас-
творе, содержащем 0,34 мол. доли ацетона равен 0,49.
Решение. 1. Определяем коэффициент активности ацетона по
уравнению (VII,43). Интеграл в этой формуле вычисляем графиче-
ским способом (рис. 33). Для построения графика рассчитываем
187
значения Vi/-V2 и —lg Yi- Если Л^ = 0,4; 0,5; 0,6; 0,7, то
= 1—TV] составляет 0,6; 0,5; 0,4; 0,3;
тогда IV1/.V2 = 0,67; 1,00; 1,50; 2,33; а
«1 = Pi/Х = 0.282; 0,395; 0,522; 0,651;
откуда 7i = a-tlNt = 0,705; 0,790; 0,870; 0,930 или
— 1g71 = 0,151; 0,102; 0,060; 0,032.
Рис. 33. Графическое вычисление
интеграла в уравнении (VII,43)
По полученным данным строим график. Вычисляем площадь под кри-
вой, ограниченную значениями V2=0,34 или V|/V2=0,66/0,34= 1,94;
Л2 = 0,5 или Vi/A72 = O,5/O,5= 1; площадь в выбранном масштабе равна
2160 мм2 исходя из того, что 2 единицы 100 мм; 1 мм = 2 • Ю-2
единиц, а 0,2 единицы —1g у, 100 мм; 1 лл=2-10-3 'единицы, то
1 лл2=4-10-5 единицы.
Таким образом, согласно уравнению (VII,43) получаем
1g 72 — 1g 0,49 = 2160-4-10~5 = 0,087,
1g 72 = 0,087 — 0,308 — 0,221=1,779.
72 = 0,60 и а2 = 0,60-0,50 = 0,30.
Пример 4. При растворении 1,143 моль n-крезола в 1000 г бен-
зола температура замерзания С6Нв понижается на 3,773°. Вычислить
188
активность и коэффициент активности бензола в данном растворе.
Температура замерзания чистого бензола 5,53° С, мольная теплота
плавления 9832,4 дж/моль, теплоемкость жидкого бензола
133,05 дж/моль-град, а твердого 135,14 дж/моль-град.
Решение. Подставляя в уравнение (VI 1,46) зависимость
^л = Д< + ЛСр(7'-7'0),
получим дифференциальное уравнение
[дя^ + дСр (Г- Г»)] ат
---—--------------------- = d In /7,
Интегрируя это уравнение в пределах Т° — Т
о [ьнгп°л + ЬСр(Т-Т°)]аТ р’
I —----------------------= I d In а,',
,) . R.T2 J
т° 1
получим конечное выражение
, ЬН(Т — Т°) ЬСР , т ЬСр(Т—Т0)
1 RT°T R Го RT
Подставляя численные значения и приведя к десятичному логариф-
му, получаем
9832,4 ( — 3,773)_____ 135,14— 133,05
lgai = 2,303-8,314-278,53-274,757 + 8,314 Х
274/757 (135,14 — 133,05) ( —3,773) = _0 025343_
к 278,53 2,303-8,314-274,757
— 0,001483 + 0,001502= — 0,0253 = 1,97468 =
= Т,9747, а1 = 0,9434.
Рассчитываем мольную долю бензола в растворе данного со-
става
1000
78 12,8205 „ „ „ ,
N, =----------------------------------= 0,91814,
1000 j 143 12,8205+ 1,143
78 + ’
отсюда коэффициент активности бензола в данном растворе равен
at 0,9434
71 Mi 0,91814 ’
189
Задачи
1. Чему равна активность воды в растворе, если дав-
ление водяного пара над ним равно 700 мм рт. ст. при
100° С?
2. При 35° С давление паров ацетона 344,5 мм рт. ст.,
давление пара хлороформа 293,1 мм рт. ст. Парциальные
давления паров этих компонентов над раствором, содер-
жащим 36 мол. % хлороформа, равны соответственно
200,8 и 72,3 мм рт. ст. Определить активностй и коэффи-
циенты активностей компонентов в растворе.
3. Определить активности компонентов в смеси аце-
тона и сероуглерода, если парциальные давления паров
сероуглерода 438 мм рт. ст. и ацетона 217 мм рт. ст.,
давление паров чистых сероуглерода и ацетона при той
же температуре соответственно 512,3 и 344,5 мм рт. ст.
4. В системе этанол (2) —вода (1) с содержанием
44,6 об. % этанола при 50° С парциальное давление
С2Н5ОН 106,4 мм рт. ст. и воды 79,9 мм рт. ст. Рассчи-
тать активности и коэффициенты активности спирта и во-
ды, если давление паров чистого спирта 220,9 мм рт. ст.
и воды 92,51 мм рт. ст.
5. В системе этанол (2) —вода (1) с содержанием
88,2 об. % этанола при 50° парциальное давление
С2Н5ОН 160,8 мм рт. ст. и воды 55,2 мм рт. ст. Рассчи-
тать активности и коэффициенты активности спирта и
воды, если давление пара чистого спирта 220,9 мм рт. ст.,
а воды 92,51 мм рт. ст.
6. Чему равна активность ацетона в растворе, если
давление паров ацетона над раствором 710 мм рт. ст.
при 56° С.
7. В системе хлороформ (1)—ацетон (2), содержа-
щей 0,10 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
Р1, мм рт. ст. 18 41 69 105 147 194 242 289 333 372
8. В системе хлороформ (1)—ацетон (2), содержа-
щей 0,20 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
190
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
9. В системе, хлороформ (1)—ацетон (2), содержа-
щей 0,30 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
10. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,40 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
11. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,55 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
12. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,60 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
'13. В системе хлороформ (1)—ацетон (2), содержа-
щей 0,65 мол. доли ацетона, определить коэффициент ак-
191
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13) 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
14. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,70 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
Рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
15. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,75 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
Рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
16. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,80 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
Р1, мм рт. ст. 18 41 69 105 147 194 242 289 333 372
17. В системе хлороформ (1) —ацетон (2), содержа-
щей 0,85 мол. доли ацетона, определить коэффициент ак-
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
Рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
18. В системе хлороформ (1) — ацетон (2), содержа-
щей 0,90 мол. доли ацетона, определить коэффициент ак-
192
тивности ацетона. При содержании ацетона 0,34 мол. до-
ли его коэффициент активности 0,49. Парциальные дав-
ления паров хлороформа следующие:
СНС13, 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
мол. доли
рь мм рт. ст. 18 41 69 105 147 194 242 289 333 372
19. Вычислить осмотическое давление 0,1; 0,3 и 0,5 м
растворов сахарозы при 25° С.
20. Парциальное давление ртути над амальгамой тал-
лия, в которой содержится 0,497 мол, доли Hg, составляет
43,3% от давления над чистой ртутью. Вычислить коэф-
фициент активности ртути в этом растворе. Чему равно
изменение свободной энергии при переходе 1 моль ртути
из этой амальгамы в чистую ртуть при данных условиях.
21. При 0°С осмотическое давление раствора, содер-
жащего 141,0 г тростникового сахара в 100 г воды,
136,50-105 н/м2. Вычислить активность воды в этом рас-
творе. Парциальный удельный объем воды в этом раство-
ре равен 0,9832-10-3 мъ/кг.
22—30. Вычислить активность и коэффициент актив-
ности бензола в присутствии n-крезола в растворе, если
температура замерзания чистого бензола 5,53° С, его
мольная теплота плавления 9832,4 дж/моль, теплоем-
кость жидкого бензола 133,05 дж/моль -град, а твердого
135,14 дж/моль-град.
Номер задачи Концентрация л-крезола, моль/1000 г растворителя Понижение температуры замерзания бензола» °C Номер задачи Концентрация л-крезола, моль/1000 г растворителя Понижение температуры замерзания бензола, °C
22 23 24 25 31 если стант 32 сахар •Опре, £ 33 Фаст в Ь—174 0,0861 0,2341 0,2906 0,3867 . Определи! он замерзае а воды 1,86. . Температу а —1,6° С. целить коэф Вычислит! орах при 3< 0,420 1,100 1,305 1,663 ъ активное т при —10, ра замерзг Сриоскопич фициент ак активност! 5° С, считая 26 27 28 29 30 ть 5 58° С. шия 0 еская тивно хлор что 0,6389 0,9951 1,466 1,691 1,852 и раствора Криоскопия ,8 м водног постоянная сти сахара оформа и эн пары веду 2,539 3,483 4,405 4,780 5,002 глицерина, еская кон- о раствора воды 1,86. в растворе, ганола в их т себя как 193
идеальные газы. Давление пара чистого хлороформа
295,11 мм рт. ст.
N2 CHCI, В жид- кости, мол. доли N2 СНС1а в паре, мол. доли Общее давле- ние пара, мм рт. ст. N 2СНС13 в жид- кости, мол. доли N2 СНС1„ в паре, мол, доли Общее давле- ние пара, мм рт. ст.
0,0000 0,0000 102,78 0,2000 0,5754 190,19
0,0100 0,0414 106,23 0,3000 0,6844 228,88
0,0200 0,0832 109,83 0,4000 0,7447 257,17
0,0500 0,2000 121,58 0,5000 0,7858 276,98
0,1000 0,3588 143,23
§ 29. РАСТВОРЫ ГАЗОВ В ЖИДКОСТЯХ
И ИДЕАЛЬНАЯ РАСТВОРИМОСТЬ
Растворимость газов зависит от вида газа и раствори-
теля, температуры и давления. Зависимость растворимо-
сти газа от парциального давления в разбавленном рас-
творе описывается законом Генри
N* = kp2, (VII,53)
где — мольная доля растворенного газа в жидкости;
р2 — парциальное давление данного газа над раствором;
k — константа Генри.
Если концентрацию газа С выражать в граммах на
1 л раствора, закон Генри можно записать в следующем
виде:
С = k'p. (VII,54)
Так как давление газа р2 пропорционально его кон-
центрации V/ в газовой фазе, то уравнение (VII,53) пре-
образуется
N^=k"Nz, (VII,55)
откуда
При определении растворимости газов пользуются коэф-
RT
фициентом растворимости 1 = k'----,который показывает
М2
сколько объемов газа растворяется в одном объеме рас-
твора при данной температуре (объем газа измеряется
194
при тех же значениях Т и Р, при которых установилось
равновесие газ — раствор). Коэффициент растворимости
для идеальных и предельно разбавленных растворов иде-
альных газов не зависит от давления.
Число объемов газа, приведенных к 273° К и 1,013Х
Х105 н/м2 и поглощаемых одним объемом воды при пар-
циальном давлении газа 1,013-105 н/м2, называется коэф-
фициентом адсорбции а.
Растворимость газа в идеальном растворе может
быть рассчитана по закону Рауля
= (VII,56)
^2
где N2— мольная доля газа в растворе; р2— давление
пара чистого газообразного вещества, находящегося в
равновесии с раствором; р2° — давление насыщенного
пара сжиженного газа при той же температуре.
Растворимость газа в растворе соли вычисляется по
уравнению
S°
lg-r = AC, (VII,57)
где S°— растворимость данного газа в воде; S — раство-
римость данного газа в растворе электролита; k — эмпи-
рическая постоянная, зависящая от вида газа, электроли-
та и температуры; С — концентрация электролита.
Идеальная растворимость. Идеальная растворимость
вещества не зависит от природы растворителя. Идеаль-
ную растворимость можно определить по уравнению
Шредера:
<VII-58>
2,oUo/\2 1 пл,2
где Nz—-мольная доля растворенного вещества при об-
разовании насыщенного раствора; Гил,2 — температура
плавления одного моля чистого растворенного вещества;
АЯПл,2 — теплота плавления одного моля чистого раство-
ренного вещества; Т — температура, при которой твердое
растворимое вещество находится в равновесии с рас-
твором.
пример 1. Рассчитать растворимость ацетилена в этаноле при 0’С
и 1,013-10® н/м2, считая раствор идеальным. Давление пара жидкого
7*
195
ацетилена 26,64-10s н/м2. Растворимость выразить числом объемов
ацетилена, которые растворяются в одном объеме растворителя.
Плотность этанола 0,789 г/мл. В одном объеме этанола растворяется
8,5 объема ацетилена при 0° и 1,013- 10s н/м2.
Решение. 1. Определяем мольную долю ацетилена в идеаль-
ном растворе по уравнению (VII,56):
1,013-105
26,64-105
= 0,038.
2. Определяем объем спирта, который
97%-ного этилового спирта:
будет заключен в 100 г
Усп = 97/0,789= 123 мл.
3. Определяем объем ацетилена, который растворяется в 123 мл
спирта:
^с,н, = 123-8,5 = 1045 мл.
4. Определяем
ацетилена равно
пс,н2 =
мольную долю ацетилена в спирте. Число молей
РУ
RT
1,013-105-1045-10~6
8,314-273
= 0,0467,
число молей этанола
97
лс,н,он -46-2,11-
0,0467
н =--------------= 0,022.
CjH* 2,11 +0,0467
Такое расхождение обусловлено тем, что раствор ацетилена в спирте
нельзя считать идеальным.
Пример 2. Газовая смесь, состоящая из 78 об. % N2 и
22 об. % Ог, содержится над водой. Вычислить процентный состав
газовой смеси, растворенной в воде при 0° С, если коэффициент рас-
творимости азота /мг = 0,024, а кислорода /о 2 = 0,049.
Решение. 1. Определяем количество азота и кислорода по
объему, которые могут раствориться в 1 м3 воды. Согласно уравне-
нию (VI 1,55)
vNj = 0,024-0,78 = 0,01872
vOi = 0,049-0,22 = 0,01078 л3.
Следовательно, в 1 м3 воды всего растворится
0,01872 + 0,01078 = 0,0295 л3.
2. Определяем процентный состав газовой смеси, растворенной
в воде:
0,01872-100
N= = ~+SS----------63-46%-
196
0,01078-100
О2 =-------—~— = 36,54%.
2 0,0295 10
Пример 3. Сколько граммов СО2 растворится в 0,001 м3 воды
при 20° С, если над водой находится воздух, содержащий 0,03% СО2,
а объем растворенного газа (приведенный к 0° С и 760 мм рт. ст.)
0,878-10~3+.
Решение. 1. Определяем парциальное давление СО2
у>с02 = рдгС01! = 1,013-105-0,03 = 3,04-Ю3 h/jh2.
2. Определяем объем СО2, который растворится в 0,001 м3 воды.
При давлении 1,013-10s н/м2 растворяется 0,878-10-3 м3 СО2, отсюда
при давлении 3,04-103 н/м2 растворится
3,04-103-0,878-10—3 „ ,
vrn = — ----------5--------=2,63-10—5 лгз,
С 2 1,013-Ю5
или
г.
2,63-10“5-44 _ „ „
—--------------= 5,16 -10-2
22,4- Ю“3«
Пример 4. о-Дииитробензол (1) и jn-динитробензол (2) образуют
идеальный раствор и дают диаграмму с простой эвтектикой. Состав
эвтектической смеси 7Vj=65 (мольная доля), эвтектическая темпера-
тура 64° С. Теплоты плавления о-дннитробензола и ;и-динитробензола
соответственно равны 130,2 и 100,7 дж/г. Определить температуры
плавления чистых компонентов.
Решение. Решаем уравнение (VI 1,58) относительно темпера-
туры плавления о-динитробензола: >
А//пл,17'звт
^пл,1 — _ —
2,303/?7'э И- А//пл,г
=130Л168-337= 390.
19,1-337-1g 0,65 + 130,2-168
.м-динитробензола _
^^пл,2^эвт
Гпл’2 2,303/?r3lglV2+ Д//ПЛ)2
100,7-168-337
=------------------------------ - 363° К.
19,1-337-1g 0,35+ 100,7-168
Задачи
1. Сухой воздух содержит 21 об. % О2. Рассчитать
массу кислорода, растворенного в 0,001 ж3 воды и насы-
197
щенного воздухом при 1,013-Ю5 н/лг2 и 25° С. Константы
Генри для кислорода k= 4,02-10-4 г/м-н.
2. Рассчитать растворимость СО2 в воде при 25° С и
5,065-105 н/м2, если константа Генри &cos=
= 7,492-10-3 г/м-н.
3. Смесь Н2 и N2 перемешивается с 1 -10—4 м3 воды.
При равновесии общее давление газовой фазы равно
870 мм рт. ст. и газ после высушивания содержит
35,3 об.% Н2. Принимая, что давление водяного пара над
раствором и над чистой водой при 50° С 95,5 мм рт. ст.,
рассчитать массы растворенных Н2 и N2, если &n2 =
= 1,074-10~7 кг!м-н-, йн2= 1,587• 10~7 кг/м-н.
4. При стандартных условиях один объем воды раст-
воряет 0,757 объема и 0,539 объема окиси углерода и оки-
си азота соответственно. Растворимость окиси углерода
в 1,0 м растворе Mg,(NOa)2 0,559. Рассчитать раствори-
мость окиси азота в этом растворе.
5. При 20° С один объем воды растворяет 0,03405 объ-
ема кислорода и 0,01696 объема азота при 1,013-105н/лг2.
Рассчитать процентное содержание О2 и N2 при раство-
рении воздуха (20,9 об. % О2 и 79,1 об. % N2) в воде.
6. При 20° С и 600 мм рт. ст. 0,001 м3 воды поглоща-
ет 0,053-Ю-3 м3 NO. Вычислить коэффициент адсорбции
и коэффициент растворимости.
7. Рассчитать идеальную растворимость азота при
1,013-Ю5 н/лг2 и 20° С, если нормальная температура ки-
пения —195,8° С и (ЛЯисп)н т.к = 5577,3 дж!моль.
Определить расхождение между вычисленным и опыт-
ным значением коэффициента абсорбции азота гептаном,
который при 1,013-Ю5 н/м2 и 20° С равен 0,254. Мольный
объем гептана принять равным 146,4 см31моль. .
8. Сколько граммов этилена можно растворить в
0,001 м3 бензола при 20° С, если давление паров жидкого
этилена при /1 = 0° С равно pi =40,82-Ю5 н]м2, а при /2 =
= — 10° С — р2 = 32,42-Ю5 н/л*2; рс6н„ = 0,878 г)см3. Рас-
твор этилена в бензоле считать идеальным.
9. При 20°С и pso2= 1,013-Ю5 н/л/2 растворимость SO2
в 65%-ном растворе серной кислоты 3,55 г/100 г H2SOi.
Определить объем растворенной SO2 в 1 объеме
65%-ной кислоты |(пл. = 1,56). Рассчитать расхождение
между вычисленной и экспериментальной величиной
20,8. Сколько граммов SO2 растворится в 1 кг 65%-ной
H2SO<, если pso«“200 мм рт. ст.?
198
10. При 20°С раствор, содержащий 0,0425 мол. доли
НС1 в бензоле, находится в равновесии с газовой фазой,
причем рна = 760 мм рт. ст., давление паров чистого бен-
зола 75,1 мм рт. ст. Сколько граммов НС1 может быть
растворено в 100 г бензола при этой температуре, если
общее давление паров хлористого водорода и бензола
равно 1,013 • Ю5 н/м2?
11. Общее давление паров раствора, содержащего
3 вес. % этанола в воде, 760 мм рт. ст. при 97,1° С. Дав-
ление пара чистой воды 685 мм рт. ст. Вычислить парци-
альное давление этанола и воды над раствором, содер-
жащим 0,02 г-экв/л этанола.
12. Растворимость метана в воде характеризуется
следующими коэффициентами абсорбции при различной
температуре:
t °C. . . О 10 20 30 40
а . . . . 0,05563 0,04177 0,03308 0,02762 0,02369
Определить молярную концентрацию метана при насы-
щении воды метаном под парциальным давлением
1,013-105 н/м2 и указанных температурах и определить
\Н растворения, считая что растворимость метана в воде
подчиняется законам идеальных растворов.
13. При 15° С растворимость водорода в воде и вод-
ном растворе NaCl различной концентрации характери-
зуется следующими коэффициентами абсорбции:
Концентрация
NaCl, лоль/л 0 1,0 2,0 3,0
а в раствореNaCl 0,01833 0,01478 0,01144 0,00880
Сколько килограммов водорода растворится в 1 м3
воды и в 1 м3 раствора, содержащего 3 кг/м3 NaCl, при
15°С и парциальном давлении водорода 1,013-Ю5 н/м2?
14. Коэффициент растворимости двуокиси углерода
при 0° С /=1,713, а при 30° С /=0,665. Рассчитать объем
двуокиси углерода, который выделится из 0,001 м3 воды,
насыщенной СО2 при 0°С и 10,13-105 н/м2 и нагретой до
30° С, причем давление газа снижено до 1,013-Ю5 н/м2.
15. В закрытом сосуде при 20° С и 720 мм рт. ст. со-
держится 0,005 м3 H2S. Какое количество воды необходи-
мо добавить, чтобы парциальное давление H2S в сосуде
понизилось до 600 мм рт. ст. Коэффициент растворимос-
ти H2S равен 2,79.
16. Коэффициент растворимости СО в воде при 0°С
равен 0,0354. При атмосферном давлении ц 0° С 0,001 м3
199
СО смешали с 0,01 м3 воды. Вычислить объем СО, раст-
воренной в воде при 0° С и 1,013-105 н/м2. Определить
конечное давление нерастворившегося остатка СО.
17. Определить состав растворенных в воде газов при
0° С, если состав газовой смеси в газгольдере над водой
70 об. % О2 и 30 об. %СОг. Коэффициенты растворимо-
сти О2 и СОг соответственно равны 0,049 и 1,7.
18. Растворимость.H2S в воде при 20° С равна 0,385.
Вычислить массу H2S, растворенного в 2 л воды при
3 атм. Плотность воды принять равной 1 г/см3.
19. При 20° С и 700 мм рт. ст. 100 мл. воды поглоща-
ют 3,54 см3 СН4. Вычислить коэффициент растворимости
и коэффициент абсорбции СН4.
20. Сколько кубических метров воды надо взять, что-
бы в ней при 20° С растворился 1 кг С12, парциальное
давление которого равно 190 мм рт. ст.? Коэффициент
растворимости С12 при 20° С равен 2,3.
21. Метан плавится при 90,5° К и имеет теплоту плав-
ления 970,7 кдж/моль. Определить растворимость мета-
на в жидком азоте при 78° К, принимая, что эти вещества
образуют идеальный раствор и, пренебрегая зависимо-
стью теплоты плавления от температуры.
22. о-Дихлорбензол и л«-дихлорбензол плавятся при
17,5 и —24,5°С соответственно. Их теплоты плавления
8745 и 8535 дж/моль. Принимая, что эти два вещества
образуют идеальный раствор, вычислить температуру и
состав эвтектики.
23. Растворимость 100%-ной двуокиси серы в соляро-
вом масле при 10° С составляет 40,6 г/л, а при 20° С —
23,4 г/л. Определить молярную теплоту растворения.
24. Растворимость окиси углерода в медноаммиач-
ных растворах окиси меди (I) при нагревании от 0 до
70° С упала в одном из растворов в 69,53 раза. Опреде-
лить относительное понижение растворимости при нагре-
вании от /1 = 0° С до /=30° С.
25. Растворимость молочной кислоты в 100 г воды
составляет 2,35 г при 0° С и 6,76 г при 24,8° С. Рассчи-
тать теплоту растворения кислоты в воде.
26. Растворимость СО2 в воде при 20° С равна
0,878 см3/мл и при 30° С — 0,665 см3/мл. Вычислить \Н
растворения двуокиси углерода в воде, считая раствори-
мость идеальной. Какое количество СО2 растворится при
10° С в 1000 л/3 воды.
200
27. Метан плавится при 90,5° К и имеет теплоту плав-
ления 70,7 дж/моль. Определить растворимость метана
в жидком азоте при 50° К.
28. Растворимость окиси углерода в медноаммиач-
ных растворах окиси меди (1) при нагревании от
г'1 = О°С до /2 = 70° С упала в 69,53 раза. Определить теп-
лоту растворения окиси углерода в медноаммиачном
растворе.
29. Теплота растворения двуокиси серы в соляровом
масле ДН =—38 100 дж!моль. Определить растворимость
SO2 в соляровом масле при 0° С, если его растворимость
при 10° С составляет 40,6 г/л.
30. Температуры плавления о-динитробензола и ^-ди-
нитробензола соответственно равны 116,5 и 89,9° С. Коор-
динаты эвтектической точки: / = 64° С и jVm-c»h4(no2)2 =
= 0,65. Определить теплоты плавления обоих компонен-
тов.
§ 30. ЗАКОН РАСПРЕДЕЛЕНИЯ И ЭКСТРАКЦИЯ
Закон распределения. Вещество, добавленное к си-
стеме, состоящей из двух ограниченно растворимых жид-
костей, распределяется между обоими слоями в опреде-
ленном постоянном при данной температуре соотноше-
нии
—
К = —; . (VI 1,59)
02
где К—коэффициент распределения или константа рас-
пределения; А] и а2 — активности распределяемого веще-
ства в первом и втором слоях.
Для разбавленных растворов вместо соотношения ак-
тивностей можно приближенно пользоваться соотноше-
нием концентраций
= (VI 1,60)
Сг
Если распределяемое вещество в одном из слоев, на-
пример во втором слое, диссоциирует на ионы, то вместо
(VII,60) следует пользоваться выражением
К = % (VII,61)
201
где С/ — равновесная концентрация недиссоциирован-
ных молекул. Рассмотрим лит бинарный одно-одновалентный электро- КА К+ + А-
Подставляя С2 = (1—а) С2, в уравнение (VII,61) равенство получим А = „ , (VII,62) (1 — а)С2
диссоциации
(VII,63)
где а — степень диссоциации. Константа
выражается соотношением
_ (С& = С22^
д с; С2(1 —а)’
где С3' — равновесная концентрация ионов.
Исключая (1—а) из уравнений (VII,62) и (VII,63),
получим
*Кд = -§г- <VI1’63')
где К' = -L .
Ад
При а->1 соотношение (VII,63) принимает вид
КК^=7Ч- (VII,64)
2
Если распределяемое вещество во втором слое ча-
стично ассоциирует в димеры:
А2^2А
то вместо (VII,60) следует применять выражение
Х = (VII,65)
1 С»
2
где С2 — равновесная концентрация неассоциированных
(простых) молекул. Подставляя в уравнение (VII,61)
выражение С2 = (1—р) С2, получим
к = (VII’66)
(1 — р)С2
202
где р — степень ассоциации простых молекул в димеры.
Для константы ассоциации Кас имеем выражение
C3Z Р
С'1~ 2С2(1 —Р)2
(VII,67)
где Сз' — равновесная концентрация димеров.
Исключая (1—Р) из уравнений (VII,66) и (VII,67),
получим
<VI,W
При р->1 соотношение (VII,68) принимает вид
= (VII,69)
Константу ассоциации Касс можно вычислить из
опытных данных по концентрациям Ci и С2, когда во
втором растворителе распределенное вещество частично
образует димеры. Выражая равновесную концентра-
цию простых молекул С2 из уравнения (VI 1,61) и равно-
весную концентрацию димеров Сз' из выражения
С3' = ‘/2(С2-С2Л)
с2' =
Ci
К’
/ СЛ
С3 = */2 ( С2-— ).
' Л '
(VII,70)
Из уравнения (VII,67) с учетом (VII,70), получим:
К2 С2 К
2Касс Ci 2Касе
(VII,71)
На графике в координатах Ci — С2/С\, построенном
по опытным данным, получается прямая с угловым коэф-
фициентом А = К2/2Касс И свободным членом В = К/2Касс-
Отсюда вычисляем К И Касс:
A 9.R
К = --, Касс = ^Г. (VII,72)
D Л
203
Экстракция — извлечение вещества из раствора
подходящим растворителем (экстрагентом). Количест-
во вещества, которое извлекается экстрагентом, опреде-
ляется по уравнению
Г, A VI
ё~ Яо1 Wi+ I/J J ’
(VII,73)
где Vi — объем раствора; V2 — объем экстрагента; К,—
коэффициент распределения; g0 — начальное количест-
во вещества в растворе; п — число экстракций.
Пример 1. При 15° С водный раствор янтарной кислоты
(1,21 г в 100 см3) находится в равновесии с эфирным раствором
янтарной кислоты (0,22 г в 100 си3). Определить концентрацию ян-
тарной кислоты в эфирном слое (г/100 си3), который находится в
равновесии с водным раствором ее (0,484 г в 100 см3). Диссоциацией
янтарной кислоты в обоих растворах пренебречь.
Решение. По формуле (VII,63) определяем константу распре-
деления
К =^ = 5,5.
0,22
Зная константу распределения, находим концентрацию янтарной кис-
лоты в эфирном слое:
, 0,484
С2 = __ ' = 0,088 г.
2 55
Пример 2. При распределении уксусной кислоты между четырех-
хлористым углеродом и водой были получены следующие данные.
Концентрация, молъ!л} С, с,
в СС14, Сг в воде, Cj
0,292 4,84 0,0605
0,363 5,42 0,0671
0,725 7,98 0,0907
1,07 9,69 0,1105
1,41 10,7 0,132
В четыреххлористом углероде уксусная кислота находится ча-
стично в виде двойных молекул. Определить константу распределе-
ния и константу асоцнации уксусной кислоты в четыреххлористом
углероде.
Решение. Находим К и Касс нз уравнения (VII,71). По
опытным данным Ci и С2, вычисляем C2/Ci и по пяти опытным точ-
кам строим график в координатах С2/С[ — С[ (рис. 34).'
204
Из графика определяем отрезок А=—1,25, отсекаемый прямой
на оси ординат, н тангенс угла наклона 0=100 этой прямой с осью
абсцисс Сг/Сь Из соотношений (VII,72) вычисляем К=80; Касс —32.
Рис. 34. Графическое вычис-
ление констант К и Касс по
уравнению (VII,71)
Пример 3. Коэффициент распределения иода между водой и се-
роуглеродом равен 0,0017. Водный раствор, содержащий 1 г/л иода,
взбалтывается с сероуглеродом. Определить количество иода, остав-
шееся в водном растворе, если 1) 1 л водного раствора иода взбол-
тать с 0,05 л сероуглерода; 2) 1 л водного раствора иода взболтать
последовательно с пятью отдельными порциями сероуглерода по
0,01 л каждая?
Решение. 1. По уравнению (VII,73) прии=1 находим
_ 0,0017-1 _ 0,0017 _
* 0,0017-1 + 0,05 “0,0517“ ’° '
Экстрагировано gz=go— gi = 1,000—0,033=0,967 г.
2. По уравнению (VII,73) находим прн п=5
Г 0,0017-1 ~|5 ГО,001715
g5== 1 [ 0,0017 + 0,01 J ~[o,O117j
= [0,145]5 = 6,45-10“5
г.
Задачи
1. Вычислить, сколько фенола можно извлечь из
500 мл 0,4 М водного раствора фенола при взбалтывании
его дважды со 100 мл амилового спирта, если при 25° С
раствор, содержащий 10,53 г/л фенола в амиловом спир-
205
те, находится в равновесии с водным раствором, концен-
трация которого Ci = 0,658 г!л фенола.
2. При 15° С водный раствор янтарной кислоты
(0,7 г/100 см3) находится в равновесии с эфирным раство-
ром янтарной кислоты (0,13 г/100 см3). Определить кон-
центрацию янтарной кислрты в эфирном растворе, нахо-
дящемся в равновесии с ее 0,2 н. водным раствором.
3. При изучении распределения уксусной кислоты
между СС14(2) и водой (1) при 25° С были получены
следующие результаты:
Ci, г-экв/л . . . 0,684 1,691 9,346
С2, г-экв/л . . . 0,015 0,0525 1,0461
Определить константу распределения и константу ассо-
циации, если в слое ССЦ уксусная кислота ассоциирова-
на в димеры.
4. В двух эвакуированных сосудах, сообщающихся
между собой через парообразную фазу (пары бензола),
находится в равновесии два раствора: 21 г бензола
+ 0,24 г фенантрена, 24,28 г бензола +0,32 г бензойной
кислоты. Бензойная кислота в бензоле ассоциирована в
димеры. Рассчитать константу ассоциации бензойной
кислоты (концентрацию выразить в мольных долях).
5. Распределение фенола между водой и хлорофор-
мом при 25° С определяется следующими равновесными
концентрациями:
Распределение фенола, мг1л Распределение фенола, лсг/л
в воде в хлороформе в воде в хлороформе
73,7 163 254 761 247 436 1850 5430
Проверить предположение, что фенол в хлороформе
существует в форме (CeHsOH)» (х— целое число). Че-
му равно х?
6. Распределение иода между CCU и водой при 25° С
определяется следующими данными:
Распределение кода, мг[л Распределение кода, мг/л
в СС14 в Н„О в СС14 в Н20
0,004412 0,006966 0,0000516 0,0000818 0,01088 0,0256 0,0001276 0,0002913
206
Сколько миллилитров СС14 необходимо взять, чтобы од-
ним экстрагированием извлечь из 100 мл водного раство-
ра: а) 90%, б) 99,9% растворенного иода.
7. В водном растворе сулема HgCl2 частично образу-
ет двойные молекулы Hg2C14, а в бензоле находится в
виде простых молекул. Рассчитать константу равновесия
этой реакции по следующим данным для равновесного
распределения HgCl2 между водой и бензолом при 25° С:
Распределение HgCl„ ММОЛЬ { Л Распределение HgCh, ммоль/л
в воде в бен- золе в воде в бен- золе
232,61 157,78 111,20 17,39 12,22 8,80 64,76 7,38 1,845 5,24 0,618 0,155
8. Распределение анилина между водой и толуолом
при 25° С определяется следующими данными:
Распределение анилина,
ММОЛЬ 1л
в воде
в толуоле
23,2
48,4
102,0
181
413
1006
Рассчитать коэффициент распределения анилина между
толуолом и водой и Кд для реакции ассоциации анилина
в толуоле.
9. При распределении фенола при 25° С между водой
и бензолом концентрации фенола в водном слое состави-
ли в одном опыте 101,3 ммоль/л-, 336,0 ммоль/л-, в дру-
гом бензольном слое 279 ммоль/л-, 2978 ммоль/л. Бен-
зольная фаза содержит двойные и одинарные молекулы
фенола, а водная фаза содержит только одинарные мо-
лекулы. Рассчитать коэффициент распределения фенола
между бензолом и водой и константу ассоциации фено-
ла в бензоле.
10. При 25° С константа распределения иода между
амиловым спиртом и водой 230. Вычислить концентрацию
207
иода в воде (моль/л), если 0,500 л амилового спирта, со-
держащего 10 г/л иода, взболтать с 2 л воды?
И. При распределении фенола между водой и бензо-
лом получены следующие данные:
Распределение фенола, моль/л
в воде в бензоле
0,101 0,279
0,366 2,978
0,520 6,487
Фенол ассоциирует в бензольном слое с образованием
димеров. Рассчитать константу распределения и кон-
станту ассоциации.
12. При распределении уксусной кислоты между бен-
золом и водой получены следующие данные:
Распределение СН8СООН, моль/л Распределение СНЭСООН, моль! л
в бензоле в воде в бензоле в виде
0,043 0,245 0,094 0,375
0,071 . 0,314 0,149 0,500
Определить константу распределения уксусной кислоты,
если в бензольном слое уксусная кислота ассоциирует с
образованием димеров.
13. Определить константу распределения янтарной
кислоты в воде и в эфире по следующим данным:
Распределение янтарной
кислоты, моль/л
в воде в эфире
0,685 0,126
2,167 0,396
8,805 1,615
14. При 25° С раствор, содержащий 10,53 г/л фенола
в амиловом спирте, находится в равновесии с водным
раствором, содержащим 0,658 г/л фенола. Какое количе-
208
ство фенола будет экстрагировано из 0,500 л 0,4 М вод-
ного раствора двухкратным извлечением фенола амило-
вым спиртом? (Для каждой экстракции берется 0,1 л
амилового спирта.)
15. Коэффициент распределения иода между четырех-
хлористым углеродом и водой при 25° С равен 0,0117.
Какой объем четыреххлористого углерода необходимо
взять, чтобы однократным экстрагированием извлечь из
0,5 л водного раствора 99,9%, 99,0% и 90,0% иода?
16. Какое количество иода останется в 1 л водного
раствора, который был насыщен при 18°, после взбалты-
вания с 100 см3 CSz? Растворимость иода при 18° в воде
0,28 г/л. Коэффициент распределения иода между серо-
углеродом и водой 590.
17. Изучается распределение иода между водным
раствором, содержащим 8 г/л иодида калия, и сероугле-
родом. Водный слой содержит 2,15 г/л иода, сероуглерод
ный — 35,42 г/л иода. Коэффициент распределения иода
между сероуглеродом и йодой 410. В водном слое KI
реагирует с иодом по уравнению
К1 + 12^К1з
Вычислить константу диссоциации К1з-
§ 31. ВЫЧИСЛЕНИЕ АКТИВНОСТИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Сильные электролиты в растворах полностью диссо-
циируют на ионы по уравнению
K,+A.,_-v+Kz+ + *-Az? (VII, 74)
где v+ — число катионов; v_ — число анионов.
Средняя активность электролита определяется по урав-
нению
a± = (aV++a~yi\ (VII,75)
а средний коэффициент активности:
Y+ = (Y++Y- )1/v (VII,76)
где v - v+ + V—
209
Средний коэффициент активности электролита можно
определить по понижению температуры замерзания
раствора по уравнению
т
— lg У± = Д434/ + J jd lg tn,
о
(VII,77)
(VII,78)
где
АТ'зам
(v+ + V-) 7И/(зам
Л’зам— криоскопическая постоянная растворителя;
А7зам— понижение температуры замерзания раствора.
Средний коэффициент активности электролита можно
определить также по давлению пара легколетучего элек-
тролита над раствором по уравнению
„P1/v
Y± = ^---♦
т
(VII,79)
где К — постоянная; р — парциальное давление насы-
щенного пара растворенного вещества над раствором;
т — моляльность.
Пример 1. Вычислить коэффициент активности хлорида калия в
водном растворе для 0,05 м раствора, если ДГэам =0,175°, значение
0,05
интеграла f jd lg т = 0,0521. Криоскопическая постоянная для
о
воды 1,86°.
Решение. По уравнению (VII,78) рассчитываем
0,175
/ = 1 — ---------— = 1 — 0,940 = 0,060,
2-0,05-1,86
а затем по уравнению (VII,77)
т
— 1gТ± = 0,4343/ + j jd Igm = 0,0261 + 0,0521 =0,0782;
о
lg7± = 1,922; 7±= 0,836.
Пример 2. Парциальное давление хлористого водорода над
40%-ным водным раствором при 20°С равно 399 мм рт ст Средний
коэффициент активности соляной кислоты 1,812, парциальное давле-
ние хлористого водорода над 4 м раствором 0,02 мм рт ст. Опре-
делить коэффициент активности в 40%-ном растворе НС1.
210
Решение. Определяем моляльность 40%-ного раствора
т
40-1000
36,5-60
По уравнению (VII,79) определяем
1±т = 1,812-4 = 7,25 =
р1!'1 (0,02)|/2 0,1415
отсюда '
, ^i/2 /з99
= К------=51,3 — =51,3-1,09 = 56,0.
*± т 18,3
Задачи
1-10. Вычислить средний коэффициент активности
электролита хлорида натрия в водном растворе по кри-
оскопическим данным для растворов следующих моляль-
ных концентраций (т). Криоскопическая постоянная
воды равна 1,86.
Номер задачи m дг 1 зам m [ jd lg m 0
1 0,1 0,3473 0,0751
2' 0,2 0,6930 0,0968
3 0,3 1,0219 0,1110-
4 0,4 1,3577 0,1216
5 0,5 1,6935 0,1301
6 0,6 2,0302 0,1371
7 0,7 2,3678 0,1432
8 0,8 2,7076 0,1480
9 0,9 3,0480 0,1526
10 1,0 3,3912 0,1564
11-20. Коэффициент активности соляной кислоты для
1 м раствора НС1 0,811; парциальное давление хлористо-
го водорода над 1 м раствором 0,00035 мм рт. ст. Опре-
делить коэффициент активности для растворов соляной
211
кислоты при 25° С по парциальному давлению р хлори-
стого водорода над водным раствором НС1.
Номер задачи Концентрация НС1, вес. % РНС1’ мм рт. ст. Номер задачи Концентрация НС1, вес. % ^НСГ лслс рт. ст.
11 10 0,0067 16 28 7,05
12 14 0,0316 17 30 15,1
13 18 0,148 18 34 68,5
14 20 0,32 19 40 515
15 24 1,49 20 42 900
Значения некоторых констант
/?=8,3144 дж/моль-град=8,3144-107 эрг/моль-г рад = 1,9872 кал/моль/
Хгра<3=82,054 мл-атм/моль-град=62,36\ мм/моль-град.
f=96487 к/г-экв=23062 кал/г-экв.
0° С=273,16° К. 2,3031? = 19,1446 дж/моль-град=4,5757 кал/моль/
/град.
1 дж—0,23901 кал = 107 эрг =9,869 мл-атм.
1 кал=4,1840 дж.
1 атл1=760 мм рт. ст. = 1,0133-Ю5 н/м2.
1 л = 1000,028 см3.
Na=6,0238- Ю23 молекул/моль.
ОТВЕТЫ НА ЗАДАЧИ
Глава I
§ 1. 1. 928 дж. 2. 37,1 дж. 3. —481 дж. 4. —1,24 кдж. 5. 40,6 кдж.
6. 323,8 кн/м2 *; 1,66 кдж. 7. 179 кдж. 8. 506,5 дж. 9. 37,8 кдж.
10. 287,7 кдж. 11. 10,4 дж. 12. 374 кдж. 13. 3,52 кдж; 25,3 кн/м2.
14. 159,2 кдж. 15. 1,47 кдж. 16. 0,574 дж. 17. <2 = 1140 кдж; Л==
=326 кдж. 18. а) <2=221,1 кдж; ДУ=221,1 кдж; А =0; б) Q =
=619,1 кдж, Д[/=442,25 кдж; А = 176,9 кдж. 19. 216 кдж. 20. 68,8 дж.
21. —8650 кдж. 22. —2,44 кдж. 23. 1,63 кдж. 24. 15,9 кдж.
25. —831 дж. 26. —118° С; 752 дж. 27. 480° С; —3,83 кдж. 28. 955 дж.
29. 527° С; 3460 кн/м2. 30. 77° С; Л =—389,4 дж; Д1/=389,4 дж;
=546 дж.
§ 2. 1. 70,27 дж/моль-град. 2. 83,80 дж/моль-град. 3. 1029,2 кдж.
4. 112,4 кдж. 5. 12,9%. 6. 25259,1 дж. 7. 120,2 кдж. 8. 637,34 кдж.
9. 460,26 г. 10. 41,11 кдж. И. 36,10 кдж. 12. 24,55; 24,83;
25,88 дж/г-атом-град. 13. 94,14 кдж; Сж =30,99 дж/г-атом-град;
Ств = 25,32 дж/г-атом-град. 14. 1,45-10“4%. 15. 0,272. 16. 19,29 кдж;
78,43%. 17. 982 кдж. 18. 3239,4 кдж. 19. 50,93 дж/моль-град.
20. 23,4 дж/моль-град. 21. 27,23 кдж. 22. 845 кдж. 23. 0,1396 дж/г-град.
24. 2,54 кдж. 25. 0,39 дж/г-град; 0,127 дж/г-град; 0,388 дж:[г-град;
0,237 дж/г-град. 26. С = 123,3+72,3-10-3/ дж/моль-град. 27. 8046,4 кдж.
28. 49,7 дж/моль-град. 29. 782,668 (Т—Т°) +28,64-10-2. (Г2—Го2) +
§ 3. 1. 104,8 дж/моль-град; 105,8 дж/моль-град. 2. 71,8 дж/мольх
хград; 71,8 дж/моль-град. 3. 56,6 дж/моль-град; 55,8 дж/моль-град.
4. 54,31 дж/моль-град; 52,3 дж/моль-град. 5. 58,6 дж/моль-град;
58,0 дж/моль-град. 6. 99,8 дж/моль-град; 99,2 дж/моль-град.
7. 52,3 дж/моль-град; 52,7 дж/моль-град. 8. 51,5 дж/моль-град;
50,1 дж/моль-град. 9. 40,6 дж/моль-град; 40,7 дж/моль-град.
10. 45,5 дж/моль-град; 44,8 дж/моль-град. 11. 56,8 дж/моль-град;
55,1 дж/моль-град. 12. 54,9 дж/моль-град; 53,5 дж/моль-град.
13. 54,0 дж/моль-град; 54,5 дж/моль-град. 14. 78,8 дж/моль-град;
78,2 'дж/моль-град. 15. 58,0 дж/моль-град; 57,7 дж/моль-град.
16. 59,4 дж/моль-град; 59,6 дж/моль-град. 17. 51,2 дж/моль-град;
50,9 дж/моль-град. 18. 47,6 дж/моль-град; 47,2 дж/моль-град.
19. 53,5. дж/моль-град; 53,4 дж/моль-град. 20. 42,9 дж/моль-град;
42,9 дж/моль-град. 21. 47,8 дж/моль-град; 47,8 дж/моль-град.
22. 57,24 дж/моль-град; 55,44 дж/моль-град. 23. 55,1 дж/моль-град;
57,2 дж/моль-град. 24. 56,2 дж/моль-град; 54,4 дж/моль-град.
25. 103,4 дж/моль-град; 103,0 дж/моль-град. 26. 54,4 дж/моль-град;
54,0 дж/моль-град. 27. 36,2 дж/моль -град; 36,5 дж/моль-град.
28. 49,2 дж/моль-град, 49,9 дж/моль-град. 29. 48,8 дж/моль-град;
47,5 дж/моль-град. 30. 38,3 док/моль• град; 38,6 дж/моль-град.
Глава II
к 4 1 —74 8 кдж/моль; —72,41 кдж/моль. 2. 1) 49,11; 226,81,
—631,2 кдж/моль; 2) 56,54; 226,8; —623,8 кдж/мрль. 3. —121,4 кфЦ
87,86 кдж, 125,5 кдж, —163,2 кдж 4. —1411,0 кдж/моль
—1406,0 кдж/моль 5. 121,7 кдж/моль 6. —853,7 кдж/моль
7. —1347,1 кдж/моль 8. —645,1 кдж/моль 9. —49,7 кдж/моль
—84,85 кдж/моль 10. —215,8 кдж/моль 11. 0,49 12. 0,58 г экв
13. 4,56 кдж/моль 14. —0,17 кдж/г-экв, —1,84 кдж/г экв
15. а) —29,21 кдж/моль, б) —100,75 кдж/моль, в) —71,54 кдж/моль
16. 20,50 кдж/моль 17. 44,0 кдж/моль 18. —45,78 кдж/моль
19. —2019,1 кдж/моль, 0,12% 20. 2,6 кдж/г-атом 21. 1) —14,64 кджД
атом; 2) —13,9 кдж/г-атом, 3) 0,7 кдж/г-атом 22. —215,9 кдж/мо гь
23. —384,4 кдж/моль 24. —46,05 кдж/моль 25. 28,02 кдж/моль
26. 16,00 кдж/моль 27. —117,8 кдж/моль 28. —2611,6 кдж/мои,
29. —20219,8 кдж 30. 46,86 кдж/моль
§ 5 1. —904,8 кдж, —907,3 кдж 2. 512,28 кдж,- 499,9 кдж
3. —114,48 кдж, —112,0 кдж 4. 129,65 кдж, 124,7 кдж 5. 177,4 кдж
174,9 кдж, 6. 84,83 кдж 7. —68,13 кдж 8—269,12 кдж, —266 9 кдж
9. 1398,7 кдж, 1386,3 кдж 10. —197,6 кдж, —195,1 11. —802,34 кдж
12. 309,2 кдж, 301,75 кдж 13. 41,17 кдж 14. —77,05 кдж, —72 10
15. —206,2 кдж, —201,2 кдж 16. —409,14 кдж, —406,7 кдж
17. —85,30 кдж, —82,82 кдж 18. 34,62 кдж 19. 30,81 кдж
20. 65,42 кдж 21. 94,34 кдж, 91,86 кдж 22. 230,45 кдж, 225,5 кдж
23.—125,7 кдж, —123,2 кдж, 24. —19,33 кдж, 25. 45,05 кдж, 42,57 кдж
26. 214,2 кдж, 211,7 кдж 27. —205,3 кдж, —197,88 кдж 28. 44,06 кдж
41,60 кдж 29. 247,4 кдж, 242,4 кдж 30. —111,4 кдж, —113,9 кдж
§ 6 1. —356,31 кдж 2. —337,93 кдж 3. —1128 5 кдж
4. —162,8 кдж 5. —4,22 кдж 6. 0,46 кдж 7. —268,3 кдж
8. —1739,7 кдж. 9. 189,86 кдж 10. —94,81 кдж И. —337,93 кдж
12. 3,42 кдж 13. —27,45 кдж 14 —90,34 кдж 15. —13,25 кдж
16. —12,92 кдж 17. —1285,5 кдж 18. —136,8 кдж 19. 103,32 кдж
20. —226,5 кдж 21. —171,54 кдж 22. —759,67 кдж 23. —206,61 кдж
24. —268,3 кдж 25. —55,9 кдж 26. —111,8 кдж 27. —147,41 кдж
28. —621,31 кдж 29. —154,14 кдж 30. 64,04 кдж
§ 7 1. —660,2 кдж/моль, —609,2 кдж/моль. 2. —340,9 кдж/мо гь
—308,8 кдж/моль. 3. —279,4 кдж/моль, —278,7 кдж/моль
4. —374,0 кдж/моль, —331,5 кдж/моль 5. —554,5 кдж/моль,
—551,7 кдж/моль 6. —391,8 кдж/моль, —373,9 кдж/моль
7. —148,8 кдж/моль 8. —337,2 кдж/моль, —337,8 кдж/моль
9. —320,5 кдж/моль, —332,8 кдж/моль 10. —132,2 кдж/моль
11. —117,4 кдж/моль, —128,2 кдж/моль 12. —307,7 кдж/мо гь
—285,2 кдж/моль 13. —409,4 кдж/моль 14. —112,4 кдж/мо гь,
—109,0 кдж/моль 15. —494,8 кдж/моль, —479,43 кдж/моль
16. —282,9 кдж/моль, —257,9 кдж/моль 17. —495,6 кджг/моль
—485,1 кдж/моль 18. —369,4 кдж/моль. 19. —234,3 кдж/мо гь
—214,9 кдж/моль. 20. 121,2 кдж/моль, 152,3 кдж/моль
21. —175,7 кдж/моль, —155,5 кдж/моль 22. —208,9 кдж/моль
—189,9 кдж/моль 23. —453,6 кдж/моль, —419,6 кдж/моль
24. 186,2 кдж/моль, 202,2 кдж/моль 25. —136,0 кдж/моль,
—151,3 кдж/моль 26. —163,1 кдж/моль, —181,8 кдж/мо гь
27. —166,8 кдж/моль, —179,8 кдж/моль 28. —213,1 кдж/моль
—188,3 кдж/моль 29. 12,5 кдж/моль 30. —250,9 кдж/моль
—245,2 кдж/моль
§ 8 1. —34,86 кдж 2. —106,97 кдж 3. 1760 0 кдж
4. 30,31 кдж/моль, 9,7% 5. —329,90 кдж 6. 87,90 кдж
7. —653,8 кдж/моль 8. 184,31 кдж 9. —125,35 кдж/мо гь
10. 89,52 кдж, 84,82 кдж 11. —19,66 кдж/моль град, 3,64 кдж/мольХ
Хград 12. —239,43 кдж/моль 13. —284,7 кдж/моль,—284,7 кдж/мо гь
214
14. —630,6 кдж 15. —95,21 кдж/моль 16. 41,43 кдж/моль
17. —496,02 кдж 18. 281,3 кдж 19. 122,1 кдж 20. —55,66 кдж/моль
21. 0,942 кдж/г атом 22. —347,89 кдж/моль 23. 2,344 дж/г град
24. 0,7376 дж/г град 25. —396,06 кдж/моль. 26. 10,6% 27, 136,09 кдж.
28. 181669—0,17 Г+0,02 • 10~3 Г2—2,59 • 105 Г'1 29. —1674,3 кдж/моль
30. 85,24 кдж/моль
Глава III
§ 9 1. 179,2 дж/моль град 2. 31,18 кдж/кмоль град
3. 44,64 дж/моль град 4. 2 м3 5. 0,384 дж/моль град
6 21,76 дж/г атом град, 7. —103,43 дж/моль град 8. 100,34 дж/мольх
Хград, 448° К 9. —19,09 дж/моль град 10. 288,7 дж/град
11. —108,51 дж/град, —143,11 дж/моль 12. 99,75 дж/моль град.
13. 107,04 дж/моль град. 14. 116,1 дж/моль град 15. 238,6 дж/град
16. 137,31 дж/град 17. 141,67 дж/моль град 18. 144,1 дж/моль град
19. 20,29 дж/моль град 20. 145,0 дж/моль град 21. 226,56 дж/мольх
Хград 22 0,08744 дж/град 23. 6,485 дж/град 24. 2,347 дж/град
25. 50,41 дж/моль град 26. 4,258 дж/град 27. 282,5 дж/моль град
28. 19,32 дж>/г-атом град 29. 182,4 дж/град 30. 745 4 дж/град
§ 10 1. 317,4 дж/моль град, —10,93 кдж, 2. 82,9 дж/г-моль\
—4,84 кдж 3. 255,18 дж/моль град, —52,54 кдж 4. 404,7 дж/мольх
Хград, —15,8 кдж 5. 180,7 дж/моль град, —24,32 кдж.
6. 29,79 дж/моль град, 20,128 кдж 7. 99,87 дж/моль-град-,
43,49 кдж 8. 308,86 дж/моль град, 161,13 кдж 9. 712,4 дж/моль-град-,
5,2 кдж 10. 255,17 дж/моль град, 11,84 кдж 11. 321,88 дж/моль-град-,
3,24 кдж 12. 299,5 дж/моль град, —117,51 кдж 13. 707,23 дж/мольх
Хград, —54,094 кдж 14. 428,74 дж/моль град, —47,33 кдж.
15. 1023,9 дж/моль град, —303,55 кдж 16. 1141,8 дж/моль-град;
—48,741 кдж 17. 957,3 дж/моль град, —30,21 кдж
18. 662,5 дж/моль град, —8,461 кдж 19. 8,095 дж/моль-град-,
—692,89 кдж 20. 176,16 дж/моль град, —52,6 кдж
21, 271,7 дж/моль град, —53,74 кдж 22. 2411,2 дж/моль-град;
76,709 кдж 23. 1042 7 дж/моль град, —5,17 кдж 24. 1374,9 дж/мольх
Хград, —6,17 кдж 25. 1165,8 дж/моль град, 4,7 кдж
26. 2758,3 дж/моль град, —37,81 кдж 27. 2736,97 дж/моль-град,
29,82 кдж 28. 1060,2 дж/моль град, —9,459 кдж 29. 2935,8 дж/мольх
Хград, 177,47 кдж 30. 968,89 дж/моль град, —60,87 кдж
§ 11 1. а) —310,2 дж/моль, б) 0, в) —132,12 кдж/моль
2. 85,97 дж 3. 31,72 дж 4. 44,32 дж 5. 84,81 дж 6. 57,35 дж
7. 35,96 дж 8. 100,34 дж/г атом, 448° К 9. —109,24 кдж/моль,
—108,0 кдж/моль 10. —209,4 кдж/моль, —2069 кдж/моль
11. —21,62 кдж/моль, —20,08 кдж/моль 12. —409,74 кдж/моль,
—407,26 кдж/моль 13. —197,46 кдж/моль, —194,98 кдж/моль
14. —340,26 кдж/моль, —337,78 кдж/моль 15. —80,96 кдж/моль-,
ДГ=—79,43 кдж/моль 16. —315 94 кдж/моль, —313,5 кдж/моль
17. —481,73 кдж/моль, —479,25 кдж/моль 18. 116,495 дж
19 11142 дж 20. 466 дж 21. 1163,8 дж 22. 4187,6 дж 23. 2329,9 дж
24. 90,94 дж 25. 70,13 дж 26. 2492,8 дж/г-атом
27. —4434,4 дж/г атом, 4434 дж/г-атом, —13,38 дж/г-атом град
28. —2,21 кдж/моль, 28,79 кдж/моль 29. —3,0662 кдж/моль,
0,1096 кдж/моль 30. —70,0 дж/моль, —5,83 кдж/моль-,
—21,5 дж/моль град
§ 12 1. 61,73 кдж/моль 2. 163,24 кдж/моль 3 514,6 кдж/моль
4. 20,07 кдж/моль 5. 16,74 кдж/моль 6 —29,29 кдж/моль
7. —92,10 кдж/моль 8. 19,96 кдж/моль 9. —130,1 кдж/моль
215
10. 475,88 кдж/моль 11. —14,18 кдж/моль 12. —73,4 кдж/моль
13. —93,44 кдж/моль 14. 54,16 кдж/моль 15. —132,4 кдж/моль
16. —52,70 кдж/моль 17. —958,3 кдж/моль 18. 57,43 кдж/моль
19. 41,36 кдж/моль 20. —1330,8 кдж/моль 21. 129,6 кдж/моль
22. 33,97 кдж/моль 23. 25,71 кдж/моль 24. —92,64 кдж/моль
25. 5,66 кдж./моль 26. 180,3 кдж/моль 27. 163,3 кдж/моль
28. —348,44 кдж/моль 29. 30,88 кдж/моль 30. 49,86 кдж/моль
Глава IV
§ 13 1. 0,417, 0,797-105 н/м2 2. 4,011 10s н/м2 3. 0,688 105 н/м2
4. 0,9, 0,081; 20,38 г, 5. 7,75 103 м3/кмоль, 8,69 10~4 (н/м2)-'
6. 8,06 1 03 н/м2, 2,726 10-5 (н/м2)—', 0,1738 м3/кмоль, 7. а) 1,464 10~3,
б) 1,096 IO"5 /н/м2)-', в) 2,941 IO-2 м3/кмоль 8. 0,2 9. 0,9,
0,171 IO-5 (н/л42)-1, 579,3 io3 н/м2 10. а) 0,9903, 0,488 мол %,
б) 0,9142, 4,48 мол % И. а) 0,9255, 3,86 мол % б) 0,6116,
24,10 мол % 12. 0,20, 0,0068 кмоль/м3, 0,0157 ж3, 13. а) 6,ЗЗХ
Х10-3 кмоль/м3, б) 0,436, 1,09 105 н/м2 14. 1,188 1Q-5 (н/м2)-', 0,784,
3,75 103 н/м2 15. 0,8044 16. 2,59 10-2 (н/м2)-' 17. 1,754 10s (н/м2)-',
8,25-10-5 18. 1,548 моль 19. 20,14 (н/м2)-1, 0,466 (н/м2)-1, 316Х
ХЮ-3 (н/м2)-' 20. 51,54 10s н/м2, 4334 1 05 н/м2 21. 33,42 1 05 н/м2
22. 0,0604, 9,8-102 н/м2, 0,1525 моль/м3 23. 0,274 моль 24. а) 2 86 10“7,
б) 1,33 10-7, в) 6,16 10-8 25. 1,03, 28,2% СО, 28,2% Н2О, 21 8% СО2,
21,8% Н2, 5,3% Н2, 70,3% СО2 26. 7,6 (н/м2)-' 27. 7 33 1014 (н/м2)-',
«1=6,46 10~7, а2=3,00 10-7, а3=1,39 10"7 28. 0,923 10~5 (н/м2)-'
29. 4,12 10-16 н/м2 30. 0,31
§ 14 1. 3,44 10-13 (н/м2)-2, 14,3% 2. 50, 15,58 моль. 3 а) 2,3%,
б) 2,8%; в) 2,3% 4. а) 0,75 кмоль/м3, б) 1,65 кмоль/м3,
в) 0,935 кмоль/м3 5. 123,28-10* н/м2, 77%, 23% 6. 4,78-103 н/м2,
0,526 10s н/м2, 0,089 7. а) 0,845, б) 0,543, в) 0,463, г) 1,33
8. 72,37% Н2О и 27,63% СО, 27,63% Н2О и 72,37% СО 9. 0 22 моль,
22% 10. 5,15 Л43, 70,5% и 29,5% И- 4% СО, 64% Н2О, по 16% Н2
и СО2 12. 320,2 Ю10 (н/м2)2 13. 13,92 10~s (н/м2)-' 14. 39 об % СО,
14 об % Н2О, 41 об % Н2, 6 об % СО2 15. 23,80%, 43,8%, 32,4%
16. 0 246 моль, 17. 6,33-10-12 (н/м2)-2, 4,35 10-4 (моль/м3)-'
18. 88,3 мол % 19- 5,55 10-6 (н/м2)-', 3,796 10“2 (моль/м3)-'
20. 9,348-Ю"3 моль, 5,58 • 104 н/м2, 3,178 • 104 н/м2, 1,945 102 н/ж’
21. 2,774 IO-5 (н/Л2)-1 22. 2,034 10-s (н/м2)-' 23. 0,1947 105 н/м2,
12,94% 24. 72,16% и 27,84% 25 0 287 моль, 0,431 моль
26. 8,6 мол % Н2 27. 5 94 10"11 (моль/м3)~2, 1,89 10~18 (н/м2)-2
28. 24,5% СО2 и Н2, 18,3% СО, 32,7% Н2О 29. 48,58% 30. 28,07 г
§ 15 1. 12,45 мол % 2 8,40 мол % 3. 10,1 мол % 4. 5,0 мол %
5 6,67 мол % 6. 7,38 мол % 7. 12 35 мол % 8,. 9,98 мол %
9. 11,6 мол % 10. 12,4 мол % 11. 25,7 мол % 12. 41,84 мол %
13. 6,27 мол % 14. 7,87 мол % 15. 10,96 мол % 16, 14,35 мол %
17. 41,03 мол % 18. 38,5 мол % 19. 34,8% 20. 4,89% 21. 8,24 мол %
22. 11,1 мол % 23. 14,8% 24. 86,5% 25. 47,3% 26. 63,4% 27. 68 0%
28 23,0% 29.38,5% 30.44 5%
§ 16 1- —9,6 кдж 2. 0,643 кдж, 0, —0,715 кдж 3. 7,39 10-4,
190,8 кдж, 0, —44,53 кдж 4. 2,32 10 3, 146,8 кдж, 0, —37,7 кдж
5 5,17 кдж 6 14,59 кдж, 0, —11 82 к<3ж 7. 9,27 кдж, 0, 1,42 кдж
8. —72,00 кдж, 0, 89,50 кдж 9. 120,0 кдж, 6 5 кдж, 2,1 кдж
10. —16,8 кдж, 0, 2,28 кдж\ 11. —20 89 кдж 12. 0,5 кдж, 0, 4,57 кдж
13. 0,75 кдж, 0, —5,2 кдж 14 —0,95 кдж, 0, 14,1 кдж 15. 2,49 кдж,
—18,5 кдж, 0 16. 0,69 кдж 0, —8,6 кдж 17. 2,1 кдж, 0, —3,63 кдж
216
18 1,052 кдж, 0, 5,35 кдж, 19. —0,76 кдж 20 0,93 , 0,8, 10,98 кдж
21. —35,32 кдж, 9,45 кдж 22. —34,21 кдж, 0, 22,16 кдж 23. 37,41 кдж,
—60,75 кдж, 0 24. 5,35 кдж 25. —399,6 кдж 26. а) 0,165%,
б) 0,0529% 27. 45,13 кдж 28. —21,48 кдж 29. —475 кдж
30. 24,56 кдж, 0, —8,109 кдж
Глава V
§ 17 1. 1,91-10—* кн/м2 2. 58,93 кдж/моль 3. 0,929 4. 2976° К
5. 1178° К 6. 594,96 дж/моль, 3,76 10~2% 7. 18,35% 8. 0,20, 0,93,
147,1 м3/кмоль, 1,226 м3/кмоль, —54,48 кдж/моль 9. 261,9 кдж/моль
10. 72,13 кдж/моль-, 36,5% 11. —103,8 кдж, 0, 192% 12. 3,68 мм рт. ст.
13. 48,116 дж\ 17 мм рт ст 14. 1400° К; 31,81 кдж/моль
15. 1,848 IO-8 м?/н 16. цо 31,6% Н20 и СО по 18,4% Н2 и СО2
17. 17,33 кдж/моль, —22,39 кдж/моль, 7,0 дж/моль-град
18. —109,9 кдж/моль, 4,351 Ю"16 19. 882° С 20. СО2 и Н2 по
0,72 моль, СО и Н2О по 0,28 моль 21. —3412 кдж/моль 22. 1154° К
23. 12552 кдж/моль 24. 65,20 кдж/моль, /(=6,81 -10s н/м2
25. —14,73 кдж/моль, —10,58 кдж/моль 26. 83,73 кдж/моль
27. 50,15 кдж/моль 28. 35,291 кдж/моль, 5,43 Ю-3 29. 57,94 кдж/моль.
30. 104,4 н/м2
§ 18 1. По 27,8% Н2 и СО2, по 22,2% СО и Н2О, —38,67 кдж
2. 2820, —131,33 кдж 3. 64,59 кдж 4. 219,33 кдж 5. 3,59; 41,84 кдж.
6. 186,96 кдж 7. 77,97 кдж/моль 8. 166,05 кдж/моль 9. 107,5 кдж
51,8 и 48,2% 10. 421,6 кдж/моль 11. 167,14 кдж 12. 137,75 кдж/моль,
46,21, 46,21 и 7,58 мол % 13. 4,093-Ю11, —273,96 кдж 14. lgKp =
=0,607, 0,426 кдж 15. 136,55 кдж 16. —59,83 кдж 17. —5983,9 кдж.
18 —204,35 кдж, —206,06 кдж 19. —111,45 кдж, —118,1 кдж,
lg Кс=2,68 20. 80,18 кдж 21. —112,4 кдж 22. 114,64 кдж/моль-?
а=0,8 23. —17,573 кдж/моль 24. 0,14, —188,95 кдж 25. 257,73 кдж
26. —48,84 кдж, 0,96 27. 1228,8 кдж, 1686,6 кдж 28. —204,2 кдж
29. —90,06 кдж 30. 893,75 кдж, 3,55 Ю-62
§ 19 1. —2,8311, 5,9% 2. 3,123, 21,85% 3. —5,256, 0,45%
4. —6 671, 1,62% 5. —2,702, 31,5% 6. 1,71, 23,16% 7. 3,615, 9,4%
8. —2,11, 5,43% 9. 0,615, 1,82% 10. —5,1803, 1,1% II. —5,7364,
6,5% 12- —19,81, 2,27% 13. —0,3701, 1,2% 14. —1,314, 4,9%
15. —2,428, 4,65% 16 —3,01, 12,7% 17. —5,935, 14,5% 18. —0,143,
1,40% 19. —1,487, 7,3% 20. 1,871, 12,06% 21. -5,773, 18,87%
22. 6,565, 30,10 % 23. —7,249, 0,46% 24. 0,155, 2,8% 25. —0,683,
10,67% 26. 1,337, 12,3% 27. 5,189, 5,98 % 28. —3,16, 5,2% 29. —1,345,
1,37% 30 —0,438, 5,95%
§ 20 1. 1,175-10-’ 2. 1,61 10-13 (н/м2)—2 3. 8,591 10"’ 4. 124, н/м2
5. 1,93 н/м2 6. 5,18 10-4 (н/м2)—2 7 7,76 10~7 (н/м2)-2
8. 2,28 (н/м2)'1г 9. 0,2360 10. 1,98 10“’ (н/м2)'/ 11. 0,171 н/м2
12. 4,55 10-18 (н/м2)'/г. 13. 8,43 10“6 (н/м2)-' 14. 5400 н/м2
15 3,40 10-’ (н/м2)—' 16. 1,14 1013 (н/м2)2 17. 5,40 (н/м2) ’/«
18. 0,7464 19. 3,467-10-2 20. 7,02 10е н/м2 21: 0,131 (н/м2)-'
22. 2,36 10-15 (н/м2)—2 23. 0,0533 (н/м2)-2 24. 1,434 25. 3,41 X
ХЮ15 (н/м2)-' 26. 0,448 (н/м2) ’/« 27 4,74 107 (н/м2) ’Л 28. 6,480Х
ХЮ-4 29. 8,77 Ю5 н/м2 30. 3,60 10s н/м2
Глава VI
§ 21 1. 501,243 кдж/кг-атом 2. 138,6 дж/г, 8,08%
3. 938,053 дж моль 4. 35,6 см3/г 5. 350258,42 кн/м2 6. 15247,6 дж/г
217
7. 0,147 см3/г 8. 519,24 кдж/кг 9. 0,0347 град/мм 10. 0,0346х
ХЮ-5 град м2/н, 1,88% И- 270,8°С 12. 52,95° С 13. 270,6° С
14. 53,23° С 15. 270,13° С 16. 0,1395 10~3 м3/кг 17. 32,27° С, 0,03034 X
Х10~5 град м2/н 18. 22,394 105 кдж/кг 19. 0,284° 20. 139,9 кдж/к<
21. 268,83° С 22. 54,066° С 23. 7,178 103 кг/м3 24. 307,2 кдж/кг
326,8 кдж/кг 25. 0,356 н/м2 град 26 14991,3 кдж/моль 27. 0,00359 X
Х103 кг/м3 28. ЛЯ=40584,8 кдж/моль 29. 418,0 кдж/моль 30. 0,416 X
X 10-3 м3/кг
§ 22 1. Л = 61,1° С 2. 206 мм рт. ст. 3. 65,4° С 4 772,366 дж/моль
5. 1,821 -10—3 л«3 6. 103512 кдж/моль 7. 24886 кдж/кмоль
8. 889,9 кдж/кг 9. 33450 кдж/кмоль 10 18,4° С 11. 117,4° С 12. / =
=33,8° С 13. 808,5 мм рт. ст 14. 30781,7 кдж/кмоль 15. ДЯ=
=662,7 кдж/кг 16. 76,5° С 17. 624,6 кдж/кг 18. 646,0 кдж/кг
19 642,2 кдж/кг 20. 470 мм рт. ст. 21. 30794,2 кдж/кмоль
22. 28660,4 кдж/кмоль 23. АЯ=28262,6 кдж/кмоль
24. 30041,1 кдж/моль 25. 28,8° С 26. 34,7° С 27. 32091,28 кдж/кмоль
28. 61° С 29. 31212,6 кдж/кмоль 30. 31254 кдж/кмоль
Глава VII
§ 24 1 4,909 моль/л, 4,909 г-экв/л, 5,9 моль, 0,096 2. 2,795 моль/л
8,385 г-экв/л, 3,214 моль, V2=0,055 3. 0,716 моль/л, 2,15 г-экв/л,
0,73 моль, V2 = 0,013 4. 0,524 моль/л, 1,048 г-экв/л, 0,536 моль, 0,0095
5. 1,92 моль/л, 3,84 г-экв/л, 2,045 ладль, 0,035 6. 1,565 моль/л,
3,13 г-экв/л, 1,67 моль, 0,029 7. 3,464 моль/л, 6,928 г-экв/л,
3,861 моль, 0,065 8. 2,302 моль/л, 4,604 г-экв/л, 2,611 .ноль, 0,046
9. 20%, 1,405 г-экв/л, 1,468 моль, 0,026 10. 14%, 3,555 г-экв/л,
1,22 моль, 0,022 11.24%, 2,89 г-экв/л, 1,52 моль, 0,027 12.12%,
2,38 г-экв/л, 1,23 моль, 0,022 13. 16%, 2,2 г-экв/л, 1,161 моль, 0,021
14. 18%, 2,068 г-экв/л, 1,053 моль, 0,019 15. 25%, 5,7 г-экв/л,
2,055 Л1оль, 0,036 16. 20%, 1,27 моль/л, 2,54 г-экв/л, 0,0234 17. 20%,
1,793 моль/л, 3,59 г-экв/л, 0,0324 18. 20%, 1,891 моль/л, 3,782 г-экв/л,
0,034 19. 18%, 1,355 моль/л, 2,71 г-экв/л, 0,024 20. 20%, 1,601 моль/л,
3,202 г-экв/л, 0,029 21. 9,63%, 2,773 моль/л, 5,546 г-экв/л, 2,93 моль
22. 60%, 12,45 моль/л, 12,45 г-экв/л, 18,55 моль 23. 40%, 4,031 моль/л
12,093 г-экв/л, 5,024 моль 24. 50%, 4,125 моль/л, 8,25 г-экв/л,
5,091 моль 25. 40%, 5,11 моль/л, 10,22 г-экв/л, 6,17 .моль 26. 8%,
0,643 моль/л, 0,654 моль, 0,017 27. 17,66%, 1 моль/л, 1,03 моль, 0,018
28. 12,0%, 1,19 моль/л, 1,23 моль, 0,022 29. 30%, 2,302 моль/л,
2,613 моль, 0,045 30. 18%, 1,034 моль/л, 1,052, 0,019
§ 25 1. 0,9651 г/см3 2. 0,9338 г/см3 3. 0,9022 г/см3 4. 0,8466 г/см3
5. 0,8181 г/см3 6. 48,84 см3/моль 7. 49,82 см3 8. 50,2 см3 9. 16,2 см3
10. 103,1 кдж 11. 115,9 кдж 12. 109,6 кдж 13. 125,4 кдж 14. 164,6 кдж
15. 299,5 кдж 16. 957,3 кдж 17. 39,8 см3 18,_23,7 см3 19. AG =
= —765 дж, AS = 1,64 дж/град, КН= —275 дж, КН{ = —1,05 дж/моль,
КН2= —5350 дж/моль 20. AG = —2972 дж^_ AS=6,56 дж/град
КН——1017 дж, КН\=—80,3 дж/моль, КН2=—2444 дж/моль
21. KG= — 4313 дж, _AS=10,3 дж/град, КН= —1244 дж, KHi =
= —117,7 дж/моль, КН2= —1677 дж/моль 22. AG= —5832 дж, KS =
= 14,7 дж/град, КН*=—1451 дж, KHt=—235,4 дж/моль, КН2=
= —813 дж/моль 23. AG=—6528 дж, AS=16,7 дж/град, КН =
= —1551 дж, KHt= —351,7 дж/моль, КН2= —133 дж/моль 24. AG =
= —6894 дж, AS = 18,3 дж/град, КН=—1441 дж, КН,=
= —533 дж/моль, Д/72=123,0 дж/моль 25. KG= —7044 дж, KS =
218
= 19,3 дж/град, &Н=—1393 дж, ДЯ[=—458 дж/моль, =
= 179,8 дж/моль 26. AG=—6870 дж-, _А5= 14,85 дж/град, ЛЯ =
= —2430 дж, КНХ=—689 дж/моль, АЯ2=670 дж/моль 27. AG«=
= —6568,8 дж, Д£= 19,95 дж/град-, ЬН=—608 дж,
= —753 дж/моль, ЛЯ2=791,7 дж/моль 28. —493,71 дж/моль
29. —4570 дж/моль, —785 дж 30. 4,60 дж/град моль
§ 26 1. 23,52 мм рт ст 2. 768,6 мм рт ст 3. 16,1 %
4. 16,84 мм рт ст 5. 400,5 мм рт ст 6. 23,68 мм рт ст
7. 23,29 мм рт ст 8. 80,44° С 9. 226,9 10. 100,06° С 11. 762,8 мм рт ст,
60,9°С 12. 31,19 кдж/моль 13. 365,0 дж/г 14. 11,30°С 15. 24,75 г
16. —0,26° С 17. 10,1 вес %; 7,87 вес % >8. 125,8 дж/г
19. 19,48 кдж/г-атом 20. —0,332° С 21. 110,3 дж/г 22. 60 23. 7,73 г
24. 728 мм рт ст 25. 2,54-10® н/м2 26. 4,585 105 н/м2 27. 1,83
23,60 мм рт ст 28. 1,66 29. —0,168° С, 100,046° С, 23,72 мм рт ст
30 49,5% 31. 0,22 мол % 32. 320° С
§ 27 1. 86,7 мм рт ст, 96,5 мм рт ст 2. Я2=0,596, Я/=0,737;
Я,'=0,263 3. 90; 2,32% 4. Я/=0,281, Я/=0,719 5. 122,9 г/моль,
208,2 мм рт ст 6. 0,937 7. 29,8 дж/град моль 8. —4068,9 дж
9. 97,99 мм рт ст, 0,1, 0,9 10. а) 0,6797, б) 0,0314 11. 146,7 дж
12 а) 0,59, б) 18,25 мм рт ст, 52,33 мм рт ст, в) 0,74 13. 20,7%
14. 0,446 кг 15. 1) 127,5 мм рт ст, 2) 17,05 мол %, 27,3 мол % и
55,65 мол % 16. а) 139,2 мм рт ст, в) 47,3 мм рт ст-,
с) 186,5 мм рт ст 17. 1) 108,6 мм рт ст, 2) 778,4 мм рт ст, 3) 0,53;
4) 0,77, 5) 9/13 18. 1134 мм рт ст, 0,62, 0,27, 0,130 кг С6Н6 и 0,187 кг
С6Н5С1, 0,317 кг 19. 2,64 20. 381,8 мм рт ст, 0,66, 0,12 21. 0,548,
0,97 22. 0,180 кг.
§ 28 1. 0,921 2. 0 583, 0,911, 0,247, 0,686 3. 0,630, 0,855 4. 0,864,
0 481 5. 0,597 , 0,728 6. 0,934 7. 0,357 8. 0,400 9. 0,470 10. 0,516
11. 0 579 12. 0,603 13. 0,637 14. 0,655 15. 0,664 16. 0,673 17. 0,677
18. 0,685 19 2,47 105 н/м2, 7,42 105 н/м2, 12,36 105 н/м2 20. 0,871,
686,18 дж/моль 21.0,90 22.0,9936, 1,0065 23.0,9833, 1,0012 24.0,9802;
1 0024 25. 0,9729, 1,00224 26. 0,9614, 1,0095 27. 0,9462, 1,0196.
28 0 9391, 1,0464 29. 0,9365, 1,0599 30 0,9328, 1,0676 31. 6,60, 1,32
32 1,165 33 ai = 0,9962, а2=0,0149, «1=0,9799, а2=0,03096, «1 =
=0 9463 а2=0,0824, «1 = 0,8937, а2=0,174, «1=0,7856, а2=0,3708;
ai=0 7028, о2=0,5308, о,=0,6388, а2=0,649, а,=0,5773, а2=0,7375
§ 29 1. 0,0085 кг/м3 2. 3,795 кг/м3 3. 7.2-1Q-7 кг, 5,75-Ю-7 кг.
4 0 398 5. 35 об % О2; 65 об % Я2 6. 0,047, 0,054 7. 17,6-10-“;
0,260 (2,4%) 8. 5,11 г 9. 20,77 (0,144%); 9,34 г 10. 1,87 г
1’1 125 мм рт ст, 670 мм рт ст 12. 2,48-10-3 моль/л-, 1.865Х
Х10-3 моль/л, 1,48-10-3 моль/л, 1,23-10-3 моль/л-, 1,06 10~3 моль/л-,
—15 98 кдж/моль 13. 1,65-10~3 кг/м3, 0,79 10~3 кг/м3 14. 0,0182 м3
15 5 6 10-4 jit3 16. 0,748-105 н/м2- 2,61-Ю"4 л«3 17. 6,3% О2 и
93 7% СО2 18. 23,1 г 19. 0,0354; 0,033 20. 0,6 л«3 21. 0,817 22. 0,65;
225° К 23. —38100 дж/моль 24. 6,23 25. 28677 дж/моль
26 —20348,15 дж/моль, 1,18 106 см3 27. 0,342 28. —46870,97 дж/моль
29 73 6 г/л 30. 21882,3 дж/моль, 16928,5 дж/моль
§ 30 1. 17,7 г 2. 0,44 г/100 мл 3. 27,74, 72,12 4 1,142 103
6. 10 5 мл, 1170 мл 7. 0,3 (моль/л)-1 8 а) 1,53, б) 0,27 (моль/л)-'
9 а) 1,2, б) 17,14 (моль/л)-' 10. 3-10~4 моль/л 11. 1,398,
23,3 (моль/л)-' 12 0,72 13. 5,46 14. 17,74 г 15. 5,842 л; 0,579 л;
0,053 л 16. 4,61-10“3 г 17. 1,68-10~3.
§ 31 1. 0,787 2. 0,740. 3. 0,712. 4. 0,693 5. 0,678 6. 0,666. 7. 0,657
8. 0,650 9. 0,644. 10. 0,639 И 1,17. 12. 1,73. 13. 2,78 14. 3,58. 15. 5,92.
16. 10,8. 17. 14,3. 18. 25,4. 19. 53.7. 20. 65,7.
ОГЛАВЛЕНИЕ
Стр.
Предисловие.............................................. 3
Глава I. Первое начало термодинамики. Теплоемкость ... 6
§ 1. Применение первого начала. Процессы в иде-
альных газах..................................... 6
Задачи.....................................10
§ 2. Расчеты, основанные на соотношениях между
теплоемкостью и теплотой процесса, внутренней
энергией или энтальпией системы...........13
Задачи......................................15
§ 3. Расчет мольной теплоемкости газов по уравне-
нию Эйнштейна....................................21
Глава II. Первое начало термодинамики. Термохимия. . . 24
§ 4. Закон Гесса..............................24
Задачи *....................................26
§ 5. Расчет тепловых эффектов химических реакций
по стандартным теплотам образования или сго-
рания химических соединений......................31
Задачи......................................32
§ 6. Расчет тепловых эффектов химических реакций
в растворах по стандартным теплотам образо-
вания ионов......................................33
Задачи......................................34
§ 7. Методы приближенного расчета тепловых эф-
фектов ..........................................35
Задачи......................................39
§ 8. Зависимость теплового эффекта химической ре-
акции от температуры (закон Кирхгофа) ... 41
Задачи......................................44
Глава III. Второе начало термодинамики...................53
§ 9. Вычисление изменения энтропии в различных
процессах........................................53
Задачи......................................56
§ 10. Вычисление изменения энтропии реакции по
э. д. с. электрохимического элемента..61
Задачи......................................62
§ 11. Вычисление изменения изобарного и изохорно-
го потенциалов в разных процессах..........63
Задачи......................................65
220
Стр.
§ 12. Вычисление изменения изобарного потенциала
химической реакции по значениям стандартных
энтальпий и энтропий .................... 68
Задачи......................................69
Глава IV. Закон действия масс. Изотерма химической
реакции.................................................70
§ 13. Вычисление степени диссоциации или констан-
ты равновесия....................................70
Задачи......................................74
§ 14. Вычисление состава равновесной смеси газов . 79
Задачи......................................... 82
§ 15. Вычисление константы равновесия в смеси ре-
альных газов................................... 87
Задачи......................................92
§ 16. Определение направления процесса по уравне-
нию изотермы химической реакции.................95
Задачи......................................98
Глава V. Зависимость константы равновесия химической ре-
акции от температуры...................................106
§ 17. Расчеты по уравнениям изобары и изохоры хи-
мической реакции...............................106
Задачи.....................................108
§ 18. Вычисление изменения энтальпии химической
реакции или равновесного состава смеси по за-
висимости константы равновесия от температу-
ры ............................................113
Задачи................................... 115
§ 1- 9. Вычисление константы равновесия при данной
температуре по таблицам стандартных величин
(метод Темкина—Шварцмана)......................123
Задачи.....................................125
§ 20. Вычисление констант равновесия химических
реакций по приведенным изобарным поитенциа-
лам............................................126
Задачи.....................................128
Глава VI. Фазовое равновесие в одно- и двухкомпоиеитиых
системах...............................................129
§ 21. Термодинамика агрегатных переходов.......129
Задачи.....................................130
§ 22. Применение уравнения Клапейрона — Клаузиу-
са к процессам испарения и возгонки .... 134
Задачи...................................135
§ 23. Диаграммы состояния двухкомпонентных си-
стем ..........................................138
Задачи..................................144:
Глава VII. Термодинамика растворов.....................160
§ 24. Способы выражения концентрации и взаимный
их пересчет....................................160
Задачи...................................161
§ 25. Вычисление парциальных мольных величин . . 163
Задачи...................................165
221
Стр.
§ 26. Законы бесконечно разбавленных растворов . . 167
Задачи..........................................172
§ 27. Равновесие жидкость—пар и перегонка бинар-
ных летучих смесей.............................175
Задачи....................................181
§ 28. Неидеальные растворы. Активность и коэффи-
циент активности растворов неэлектролитов . . 185
Задачи.........................................190
§ 29. Растворы газов в жидкостях и идеальная рас-
творимость ....................................194
Задачи.........................~..........197
§ 30. Закон распределения и экстракция..........201
Задачи....................................205
§ 31. Вычисление активности сильных электролитов 209
Задачи....................................211
Ответы на задачи.........................: 213
Алла Игнатьевна Картушинская,
Хая Абрамовна Лельчук,
Армин Генрихович Стромберг
СБОРНИК ЗАДАЧ
ПО ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКЕ
Редактор Т. П. Федорова
Художественный редактор Т. М. Скворцова
Технический редактор А К. Нестерова
Художник А. Г. Батушева
Корректор С. К. Марченко
Сдано в набор 13/IX—72 г. Подп. к печати 5/IV—73 г.
Формат 84Х1087з2- Объем 7 печ. л. Усл. п. л. 11,76. Уч.-изд. л. 10.01
Изд. № Хим—371 Тираж 17 000 экз. Цена 45 коп.
План выпуска литературы для вузов и техникумов
издательства «Высшая школа» на 1973 г. Позиция № 65
Москва, К-51, Неглннная ул., д. 29/14,
Издательство «Высшая школа»
Московская типография № 8 «Союзполнграфпрома»
при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной торговли,
Хохловский пер., 7. Зак. 1741