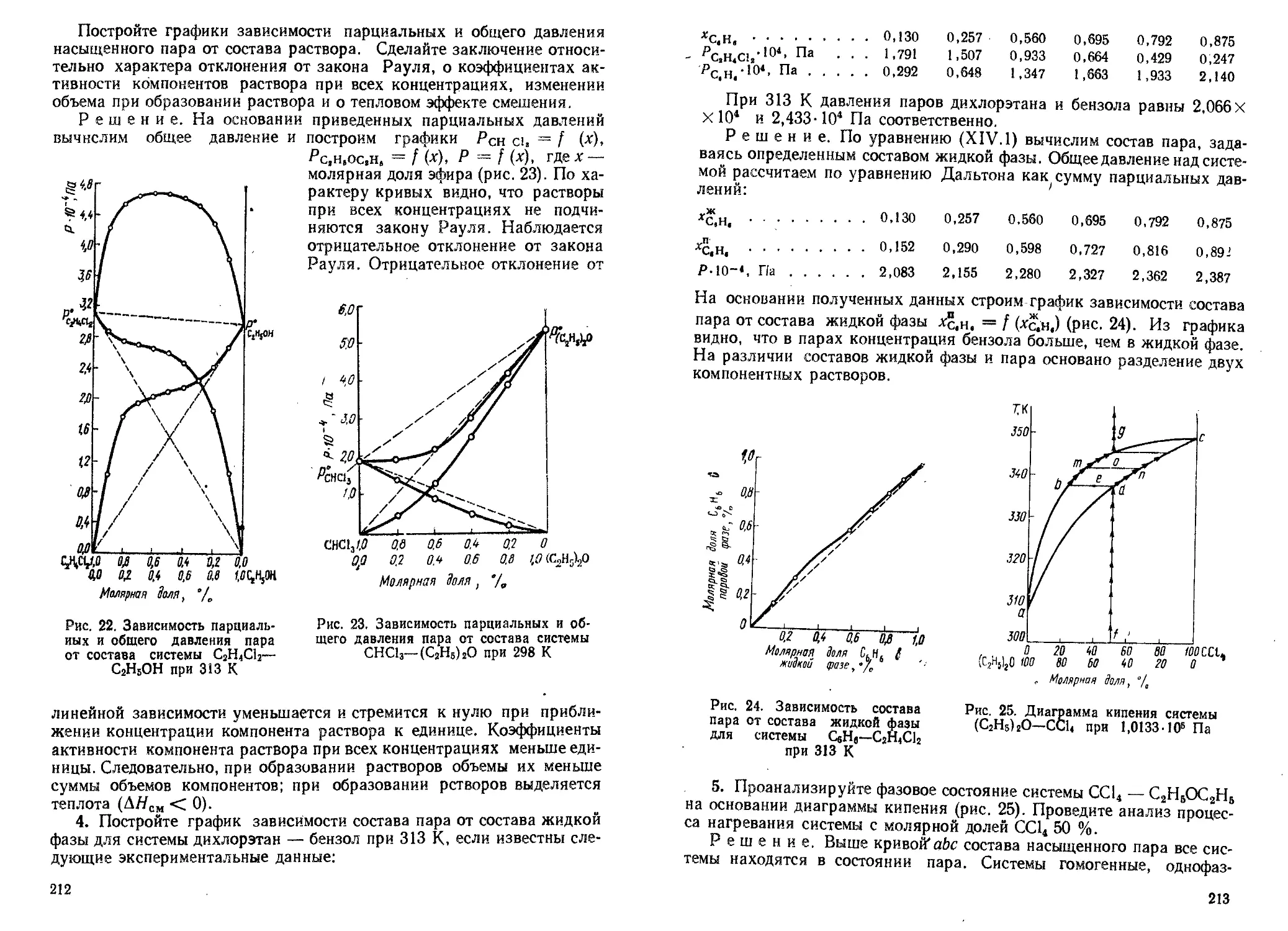
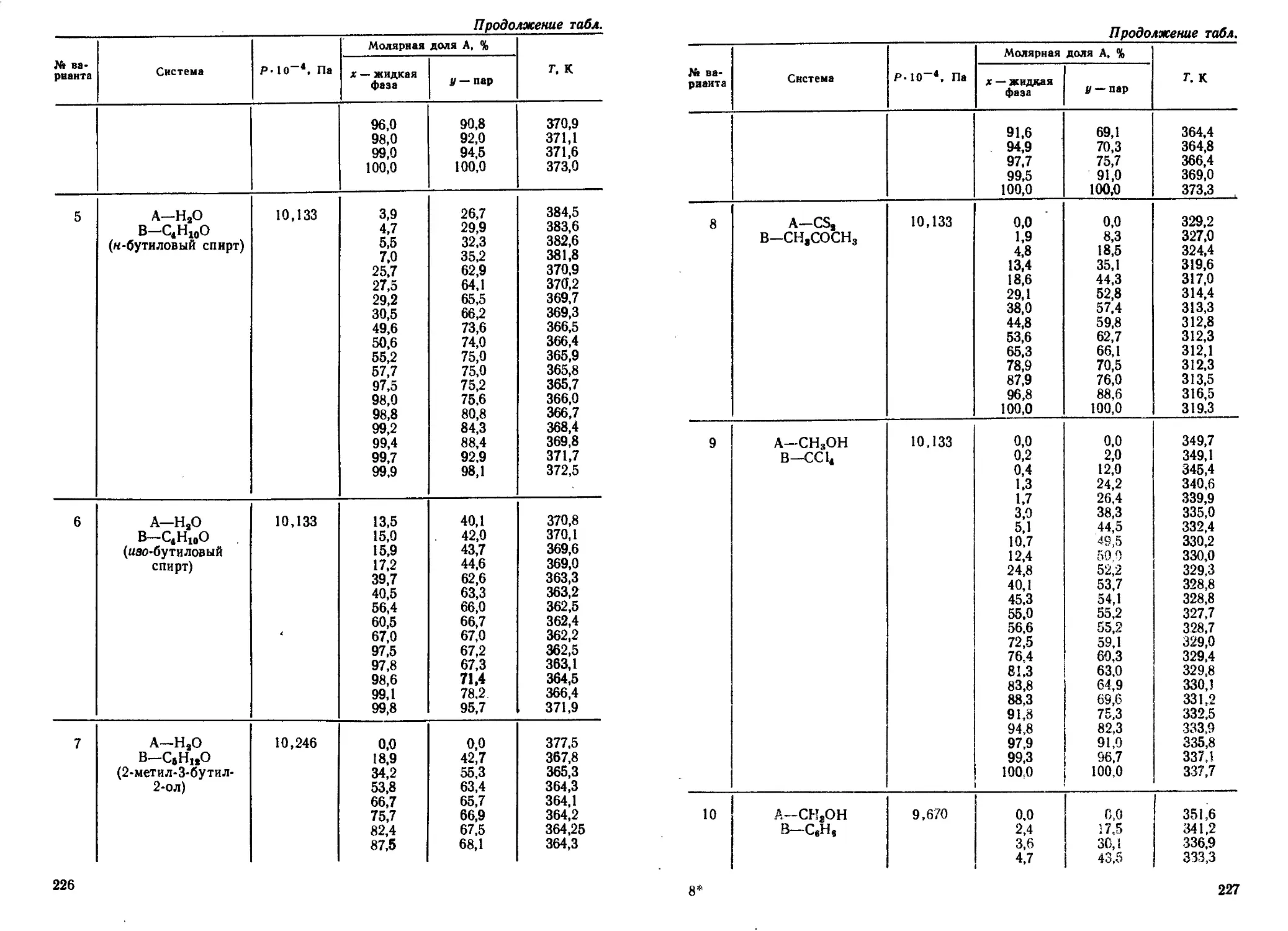
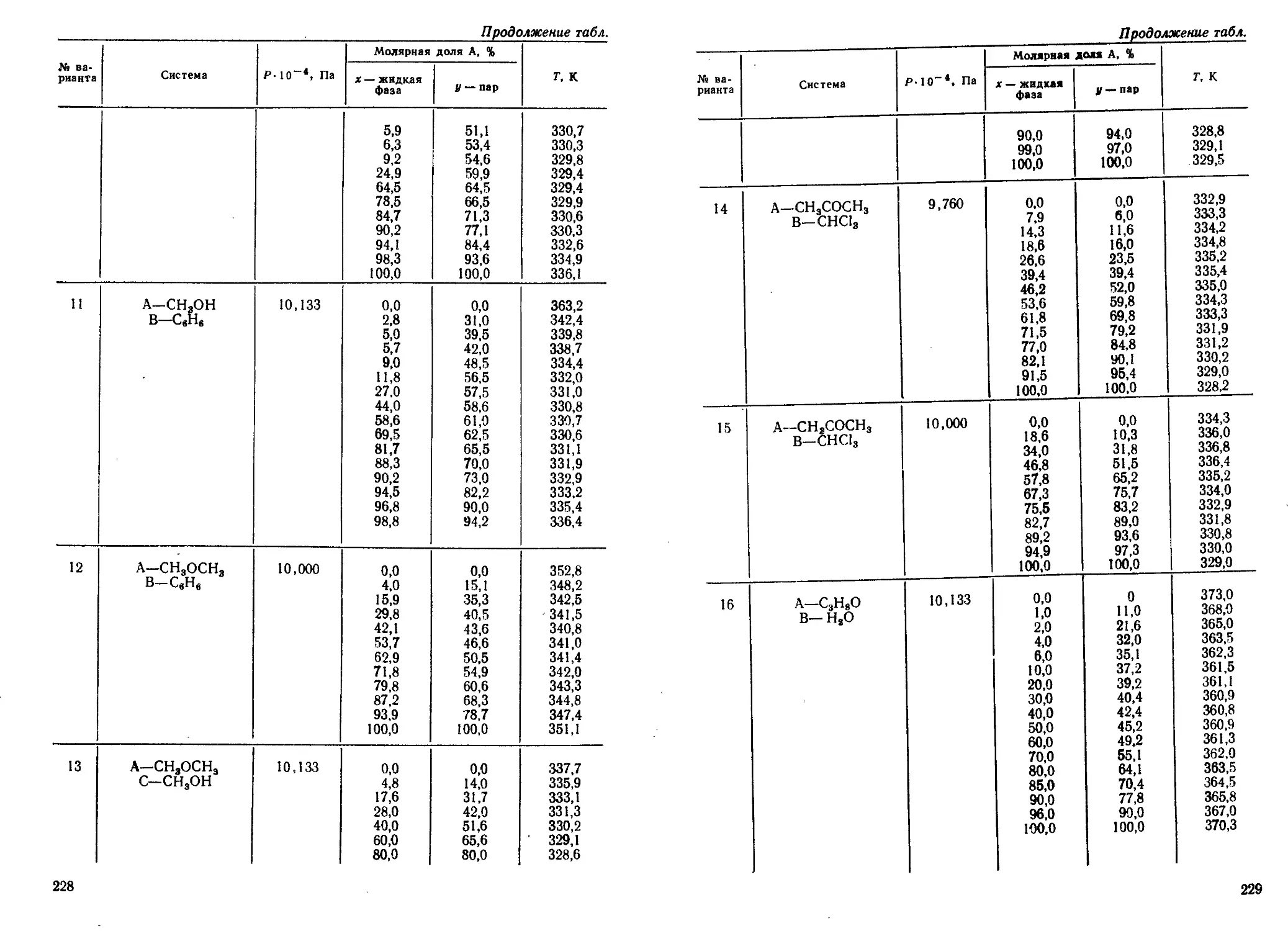
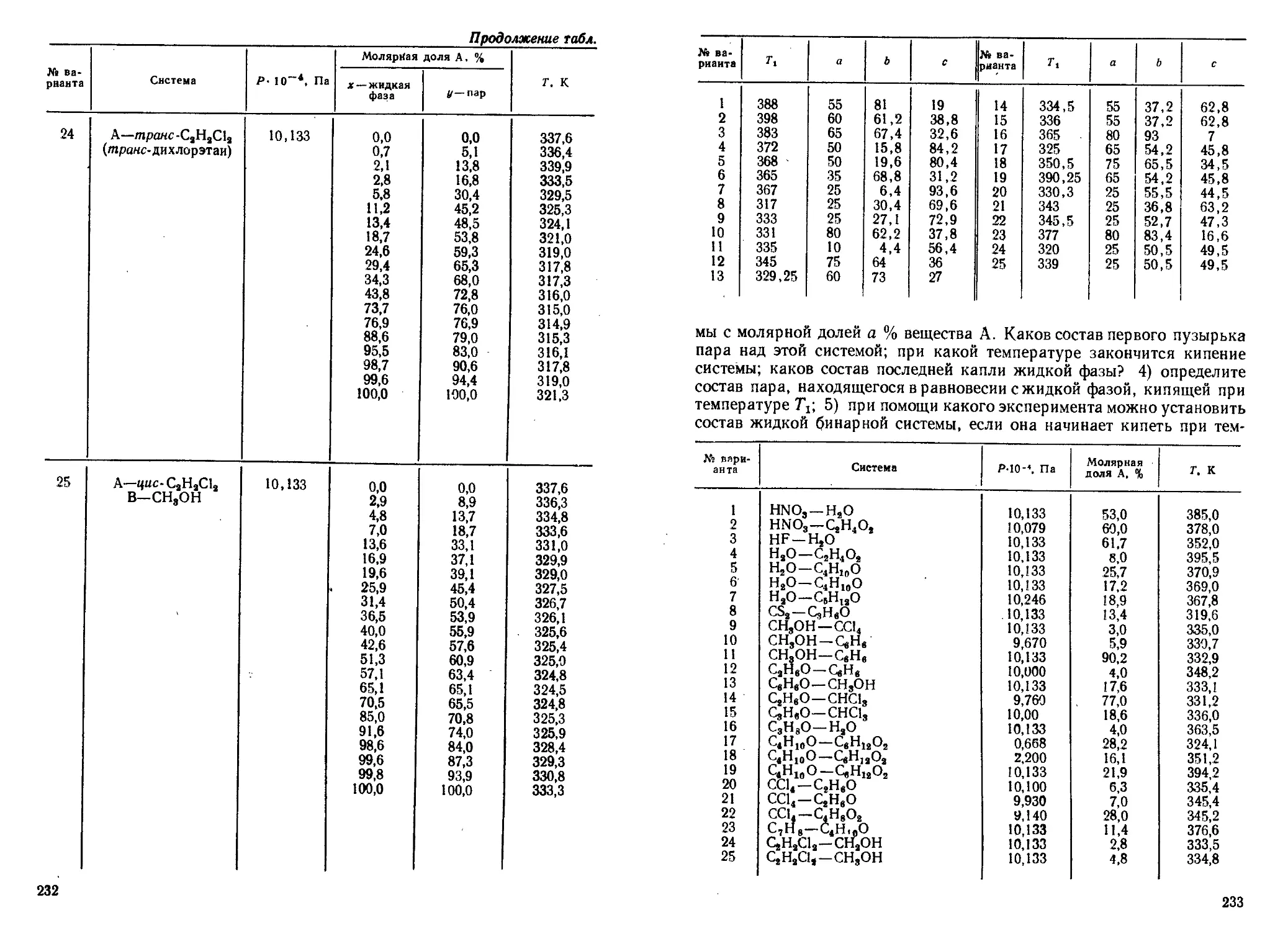
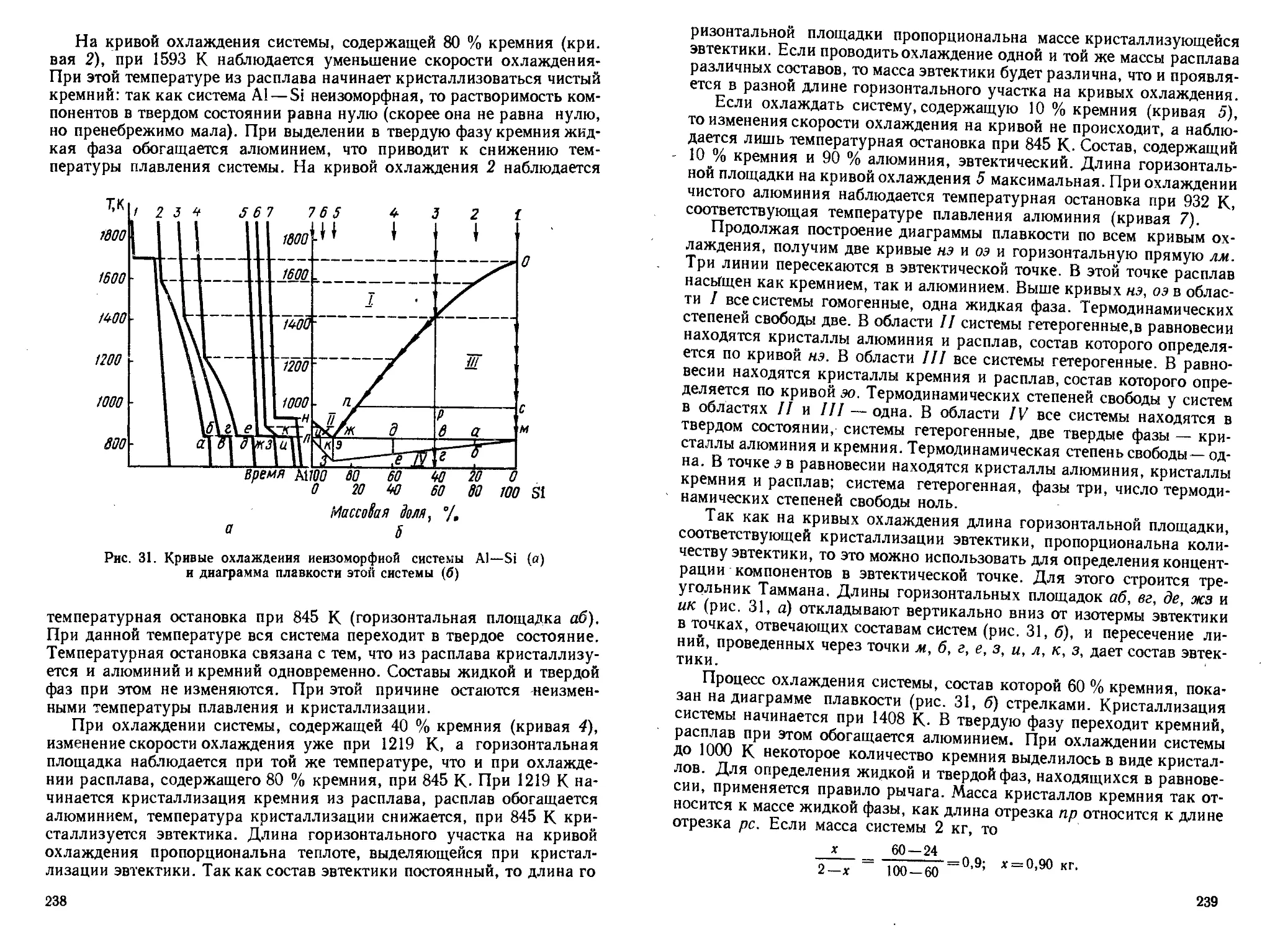
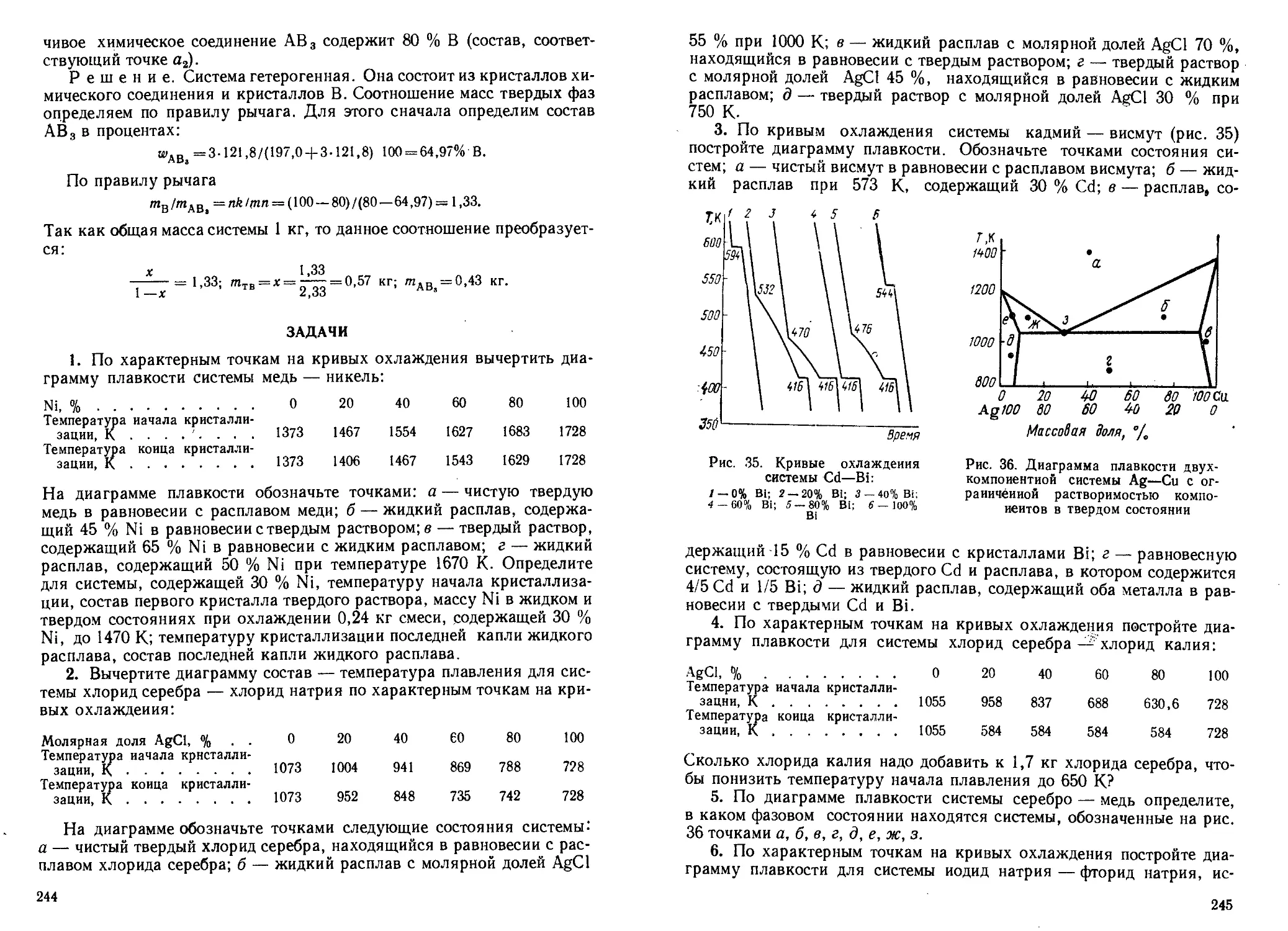
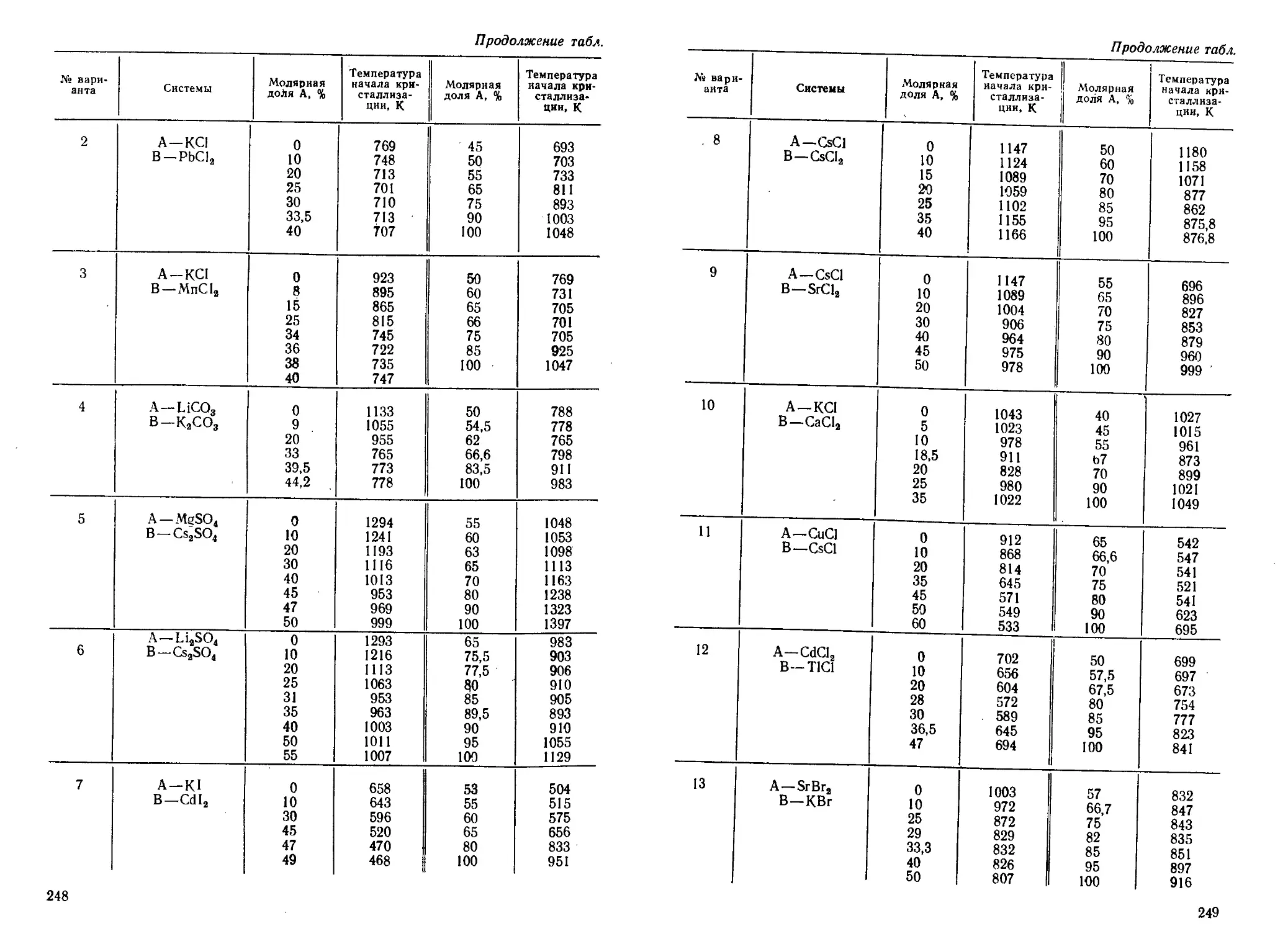
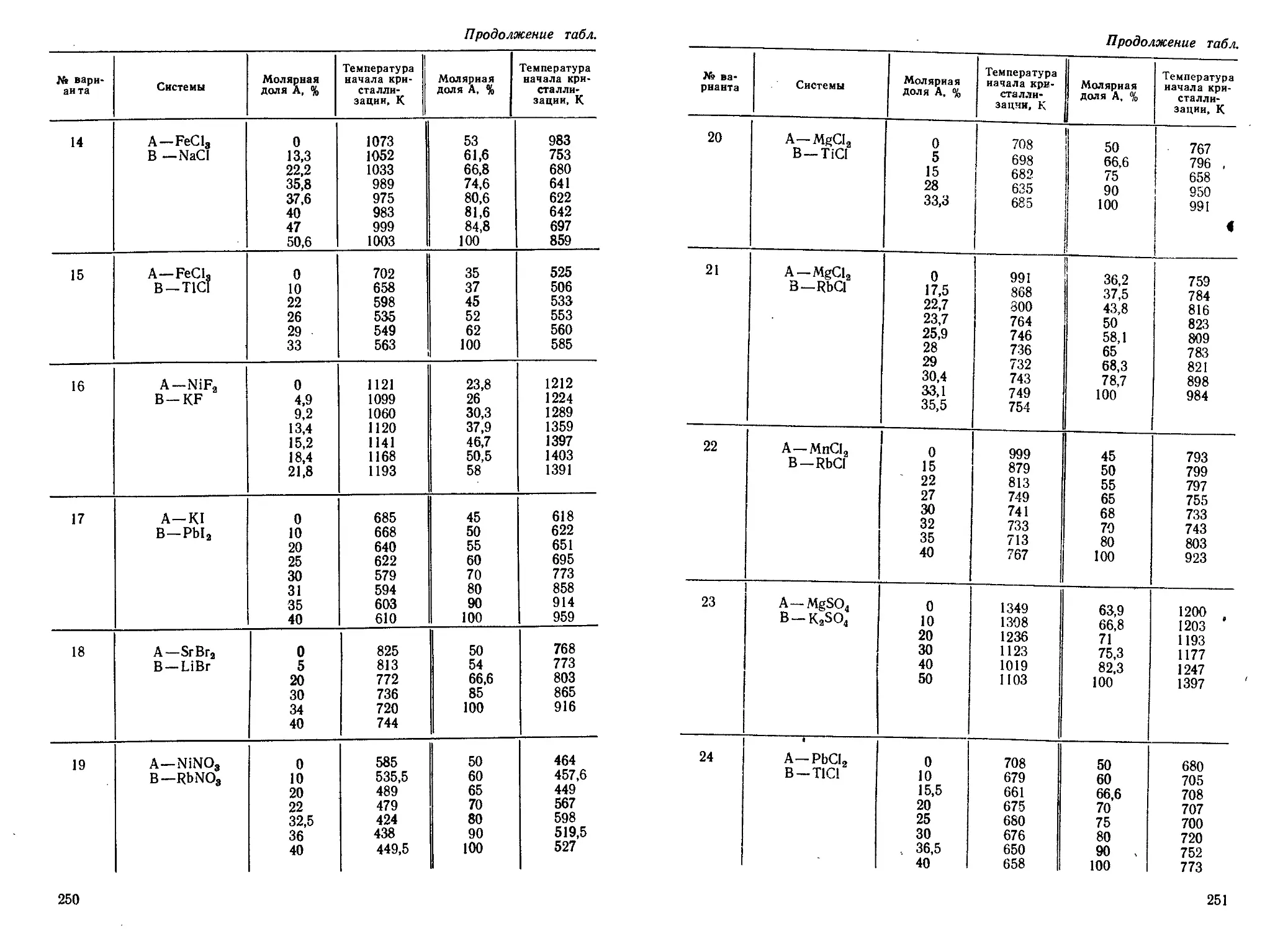
Author: Кудряшов И.В. Каретников Г.С.
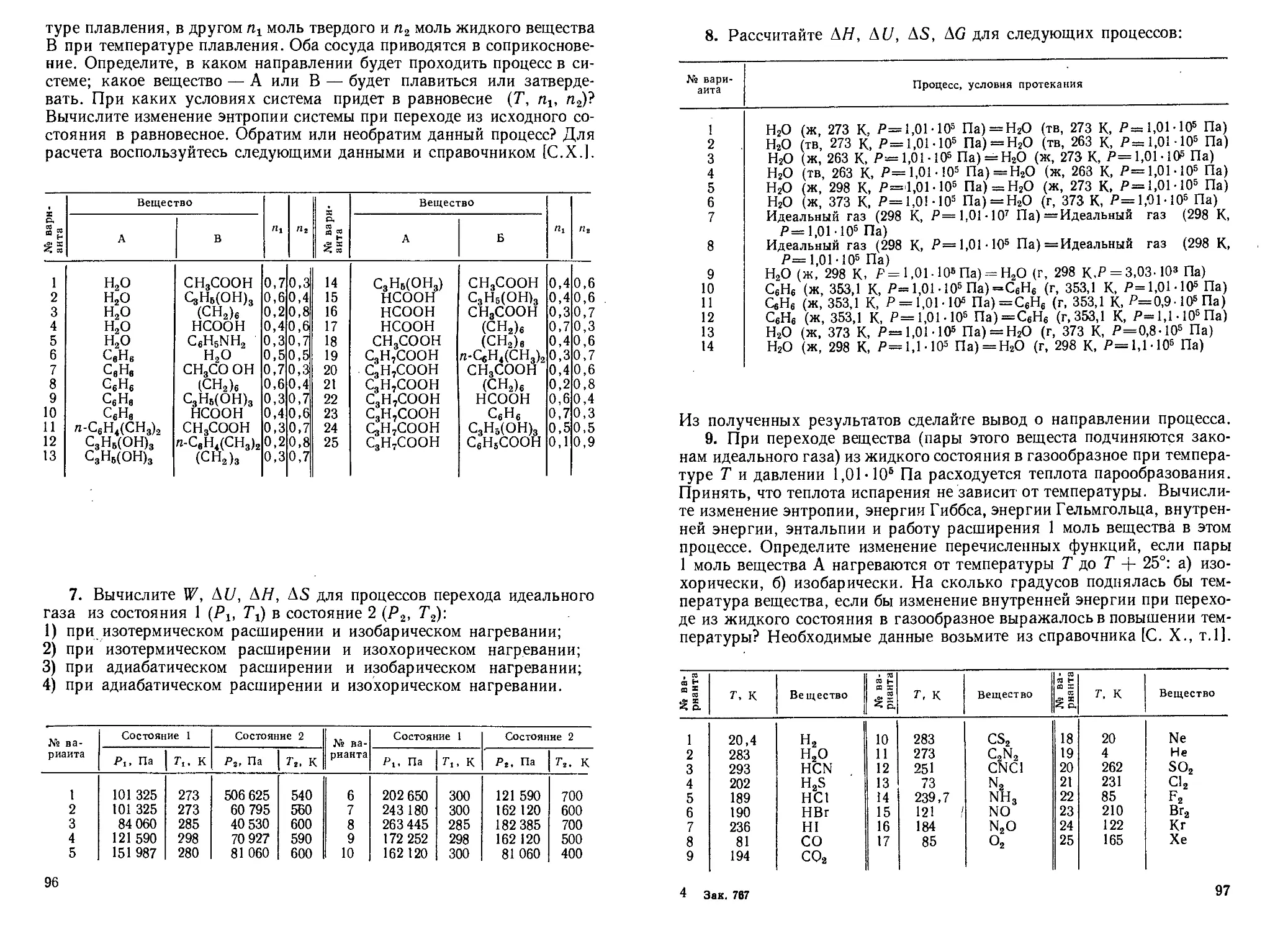
Tags: химия физическая химия химическая физика задачи по химии
ISBN: 5-06-000660-3
Year: 1991
Text
И. В. Кудряшов, Г.С.Каретников
СБОРНИК
ПРИМЕРОВ
И ЗДТДЧ
по
ФИЗИЧЕСКОЙ
ХИМИИ
Издание шестое,
переработанное и дополненное
Допущено
Государственным комитетом СССР
по народному образованию
в качестве учебного пособия
для студентов химико-технологических специальностей
высших учебных заведений
@
МОСКВА
„ВЫСШАЯ ШКОЛА*
1991
ББК 24.5
К 88
УДК 541.1
Рецензент: проф. Г. А. Добренькое (Казанский хнмнко-технологнческнй
институт им. С. М. Кирова)
Кудряшов И. В., Каретников Г. С.
К88 Сборник примеров и задач по физической химии: Учеб, по-
собие для хим.-технол. спец, вузов.— 6-е изд., перераб. и
доп. — М.: Высш, шк., 1991. — 527 с.: ил.
ISBN 5-06-000660-3
Пособие содержит задачи и примеры по всем разделам физической химии и
соответствует программе для химических вузов и отражает современное развитие
физической химии. В каждую главу включены перечень основных уравнений, реше-
ния типовых задач, задачи без решения, миоговариантиые задачи.
Настоящее издание сборника (5-е — 1983г.) дополнено задачами, требующими
применения микрокалькуляторов и ЭВМ.
1708000000(4309000000)—415
К 001(01)—91
102—91
ББК 24.5
541
ISBN 5-06-000660-3
© И. В. Кудряшов, Г. С. Каретников, 1991
ПРЕДИСЛОВИЕ
Инженер-химик и химик-технолог должны не только знать физи-
ко-химические законы, но и уметь применять их для решения конкрет-
ных задач. Решение задач помогает усвоить и глубже понять теорети-
ческие положения курса. Авторы стремились подобрать задачи, ох-
ватывающие практически все теоретические вопросы программы кур-
са физической химии и представляющие интерес для различных спе-
циальностей.
Для привития навыка работы со справочной литературой авторы
исключили из большей части задач величины, которые могут быть
найдены в доступных справочниках. Сборник задач разделен на три
части: «Теоретические основы физико-химических расчетов», «Равно-
весное состояние систем» и «Кинетика и катализ». Каяодая глава со-
держит перечень основных уравнений и символов, задачи с решениями,
задачи для самостоятельного решения, многовариантные задачи. Мно-
говариантные задачи составлены так, чтобы дать индивидуальное за-
дание каждому студенту академической группы. Эти задачи рекомен-
дуются для самостоятельной работы. Многовариантные задачи могут
быть использованы и как одновариантные, причем наличие 15—25 ва-
риантов открывает возможность подбора объекта расчета с учетом спе-
циализации студента.
При подготовке этого издания были учтены основные изменения в
программе курса физической химии и тенденции ее развития. Было
учтено также стремление усилить общую теоретическую подготовку
инженера-химика и химика-технолога. Последовательность глав соот-
ветствует более строгой логической структуре курса: изучение геомет-
рических параметров и энергетических характеристик молекул (гл.
I—V), далее изучение свойств веществ в идеальном газообразном состо-
янии, от идеального газообразного состояния сделан переход к реаль-
ному газообразному состоянию и к конденсированному состоянию
индивидуального вещества (гл. X—XII). После ознакомления со
свойствами индивидуального вещества сделан переход к системам
многокомпонентным однофазным и многокомпонентным многофаз-
ным (гл. XIII—XVII). Более сложные системы, в которых происхо-
дят химические превращения, рассмотрены и в условиях равновесия
(гл. XIX—XXI) и в динамике (гл. XXIII--XXXI). Вновь введенные
главы отражают современное развитие физической химии.
3
В связи с общей тенденцией уменьшения числа часов занятий пред-
метом в аудитории и переноса центра тяжести познания на самостоя-
тельную внеаудиторную работу студента произведено изменение ак-
центов в главе. Значительно уменьшены теоретические введения. В этом
отношении сборник не должен подменять учебник. Главное внимание
обращено на задачи с решениями, так как студент, выполняющий са-
мостоятельно практическое задание, встретив затруднения в приемах
решения, должен найти помощь в виде таких задач с решениями.
В сборник включены задачи, для решения которых необходимо
применение счетно-решающей техники. Эти задачи отмечены звездоч-
ками. В конце каждой части приведены комплексные задачи, для ре-
шения которых требуется знание нескольких разделов курса. Эти за-
дачи могут быть предложены в качестве курсовых работ.
В задачах и ответах величины даны в СИ, а также в наиболее рас-
пространенных внесистемных единицах.
При подготовке 6-го издания были учтены замечания и пожелания
преподавателей кафедры физической химии МХТИ им. Д. И. Менделе-
ева: Л. Н. Ивановской, Е. П. Старостенко, А. М. Абоймова, В. В. Бе-
лик, В. Д. Кочеткова, Н. М. Кулешовой, В. В. Федорова, Л. Б. Фе-
дяниной, И. А. Поповой, В. Д. Жигулевой, В. А. Ефремова, Т. Д. Ан-
тоновой и др. Особую благодарность выражаем доц. А. М. Мерец-
кому и Н. И. Кудряшову, принявшим активное участие в написании
ряда глав задачника, составлении и подборе вновь включенных в
сборник задач.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ
МНОГОВАРИАНТНЫХ ЗАДАЧ
Многовариантные задачи делятся на два основных типа:
1) задачи, объединяющие весь основной материал раздела,
требующие построения графиков и использования справочни-
ков. Этн задачи рекомендуется выполнять после ознакомле-
ния с теорией и решенными задачами; 2) задачи, посвящен-
ные отдельным вопросам данного раздела, решающиеся без
сложных вычислений и графиков, они могут быть использо-
ваны в качестве контрольных работ.
Многоварнантные задачи состоят нз 25 заданий. Там, где
отсутствуют экспериментальные данные, одному заданию
приписывают два-три варианта. Для решения задач рекомен-
дуется ознакомиться со следующими пособиями, которые
в тексте сокращенно обозначаются начальными буквами фа-
милий авторов: [К.] — Киреев В. А. Курс физической хи-
мии. М., 1975; [Г.] — Герасимов Я- И. и др. Курс физической
химии. Т. I—II. М„ 1971, 1972; [Д. А.] — Даниэльс Ф., Аль-
берти Р. Физическая химия. М., 1967; [М.] — Краткий спра-
вочник физико-химических величин / Под ред. А. А. Равделя
и А. М. Пономаревой. Л., 1983; [С. X.] — Справочник хими-
ка. Т. I—IV / Под ред. Б. П. Никольского. М., 1965, 1966.
Физическая химия / Под ред. К. С. Краснова. М., 1982.
Стромберг А. Г., Семчеико Д. П. Физическая химия. М., 1988.
МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ
Метрическая система единиц длины, массы, силы и других физиче-
ских величин разработана в период французской революции 1789—
1794 гг. Благодаря удобству и простоте единицы метрической системы
стали применять всюду. В научных исследованиях вместо ранее суще-
ствующих единиц измерения стали применять метрические единицы из-
мерения. Более широкая и усовершенствованная форма метрической
системы, называемая Международной системой (иногда просто СИ от
французского названия Syst^me International), была официально при-
нята Генеральной конференцией по мерам и весам в 1960 г.
За единицу массы СИ принят килограмм, определяемый как мас-
са международного эталона, изготовленного из платино-иридиевого
сплава и хранящегося в Международном бюро мер и весов в Париже.
(Обычно в метрической системе при записи дробей деятичны^доли не
разделяют на порядки.) В настоящее время в СИ есть*одна непоследо-
вательность, заключающаяся в том, что название единицы массы
имеет приставку «кило» (килограмм). Эта непоследовательность бу-
дет сохраняться до тех пор, пока не будет достигнуто соглашение о но-
вом названии и символе единицы массы. Пока следует помнить, что
1 миллиграмм, обозначаемый 1 мг, а не 1 мккг, равен одной миллион-
ной единицы массы, а не одной тысячной, как показывает приставка
милли.
Единицей длины в СИ является метр (м). Ранее метр определяли
как расстояние между двумя насечками на стандартном платино-ири-
диевом эталоне, хранящемся в Международном бюро мер и весов в Па-
риже; в 1960 г. по международному соглашению метр получил опре-
деление как расстояние, равное 1650763,73 длины волны оранжево-
красной линии спектра криптона-86.
За единицу времени в СИ принята секунда (с). Секунду определяют
как интервал времени 9 192 631 770 периодов излучения, соответству-
ющего переходу между двумя сверхтонкими уровнями основного со-
стояния атома цезия-133 при длине волны, равной приблизительно
3,26 см. Прежде секунду определяли как 1/86 400 часть средних сол-
нечных суток.
За единицу объема в СИ принят кубический метр (м3). В химии ши-
роко используют единицу объема литр (л), которая равна 1/103 м3.
6
Миллилитр, 1 • 10~3 л, равен одному кубическому сантимеру: 1 мл =
= 1 см3.
Единица силы в СИ — ньютон (Н), определяемый как сила, сообща-
ющая телу массой 1 кг ускорение 1 м-с-2 в направлении действия силы.
Ньютон равен 105 дин (дина — единица силы в системе СГС, равная
силе, придающей массе 1 г ускорение, равное 1 см-с-2).
Единица энергии в СИ — джоуль (Дж) — это работа силы 1 Н при
перемещении ею тела на расстояние 1 м в направлении действия силы:
1 Дж = 1 Н -1 м = 10’ эрг = 107 дин-см.
Ранее в химии широко использовали калорию как единицу энергии.
Термохимическая калория, определяемая как 4,184 Дж, приблизи-
тельно равна количеству энергии, необходимой для нагревания 1 г во-
ды на Г С. Большая калория (ккал) равна 103 кал. Очень полезно
запомнить следующие коэффициенты пересчета: 1 кал — 4,184 Дж,
1 ккал — 4,184 кДж.
Значения некоторых физических и химических констант
Постоянная Авогадро
Скорость света
Масса электрона
Заряд электрона
Постоянная Фарадея
Дальтон
Постоянная Планка
Квант момента количества движения
Масса протона
Масса нейтрона
Постоянная Больцмана
Молярная газовая постоянная
Газовая постоянная
Объем моля идеального газа при нор-
мальных условиях
Температура Цельсия
Атмосферное давление
Электрический момент диполя
Электрои-вольт
Аа = 0,60229-1021 моль-1
с = 2,997925-10» м/с
т = 0,91083-IO-»® кг
е = 0,106206-Ю-18 Кл
F = Na е = 96490 Кл/моль
D=l,66033-Ю—2’ кг
Л = 0,66252-10“ 33 Дж-с
й = й/2л = 0,105443-10-33 Дж-с
тр = 1,67239-Ю-27 кг
тп= 1,67470-10-27 кг
k= 13,805-Ю-24 Дж/град
R = Na й = 8,3146 Дж/(моль-К)
/?=0,08206 л-атм-град_1-моль-1
22,415-Ю-3 м3-моль-1
/°С=ТК—273,15
1 атм=101,325 кН-м-2
0,1602-Ю-28 Кл-м (4,8029 D)
1 эВ = 96,4905 кДж/моль
Использование СИ приводит к появлению непривычных единиц
лишь в двух случаях. Во-первых, в качестве единицы длины молекул
применяют пм (пикометр, 10“12 м или 0,01 А); при этом размеры моле-
кул и длины связей будут порядка 100 пм, что удобно, поскольку про-
падают десятичные дроби, или нм (нанометр, 10~9м или 10 А). Во-вто-
рых, в качестве единицы объема используют дм3 (1000 см3 или 1 л) вме-
сто см3 или м3. Замена литра на дм3 может показаться не так уж необ-
ходимой, однако это упрощает числовые расчеты.
Ниже приведены некоторые соотношения между единицами:
1 л = 1 дм3 =1000 см3=10-3 м3;
1 М=1 моль/л = 1 моль/дм3;
100 пми 1,00А = Ю-8 см = Ю-10 м;
1 атм = 760 Торр = 760 мм рт. ст. = 1,01325-Ю5 Па.
ГЛАВА I
ЭЛЕМЕНТЫ КВАНТОВОЙ ХИМИИ. ТЕОРИЯ
ХИМИЧЕСКОЙ СВЯЗИ, МЕТОД МО ЛКАО
Основные уравнения и символы
[К., с. 54—67, 720—728]
Согласно методу в приближении линейной комбинации атомных
орбиталей (МО ЛКАО) волновая функция описывается уравнением
Ф = СА фд + Фв, (Ы)
где ф — молекулярная волновая функция; СА и Св — коэффициен-
ты; фА и фв — атомные волновые функции атомов А и В. Потенци-
альная энергия системы из атомов А и В выражается уравнением
где Z — заряд ядра атома; е — заряд электрона; гАВ — межъядерное
расстояние; гА и гв — расстояния между ядром и электронов.
Уравнение Шредингера
Нф = £ф, (1.3)
где Н = — 8-^ V2 + ^пот — оператор Гамильтона; £пот — по-
тенциальная энергия электронов и ядер; V2 — оператор Лапласа,
' Для двухатомной молекулы А — В
(^АА ~ESAa) СА + (#АВ ““^Ав) СВ = °’
(^АВ~^^Ав) Са + ^ВВ-‘Е$вв) Св = 0-
-|-со
где Пав = Два = J фдНфвйи = J фвНфдбу — обменный интеграл;
— со — со >
-|-со
Даа = Двв = f фдНфд du = j фв Нфв du — кулоновский интеграл;
— ОО — СО
+“
SAB = SBa = J фдфв du — интеграл перекрывания; и — объем.
8
Для многоатомных молекул метод в приближении МО ЛКАО дает
систему из п уравнений (п — число атомов в молекуле):
2(tfl7-£So)Cy=0, (1.4)
где I — номер уравнения; j — номер члена в уравнении.
Отличные от нуля корни системы уравнений (1.4) будут при усло-
вии, если определитель равен нулю:
|Ям-£5м| = 0. (1.5)
Распространение метода ЛКАО на гомоядерные двухатомные мо-
лекулы второго периода периодической системы элементов Д. И. Мен-
делеева дает атомные орбитали (АО) 2s, 2рх, 2ру и 2pz. Условимся
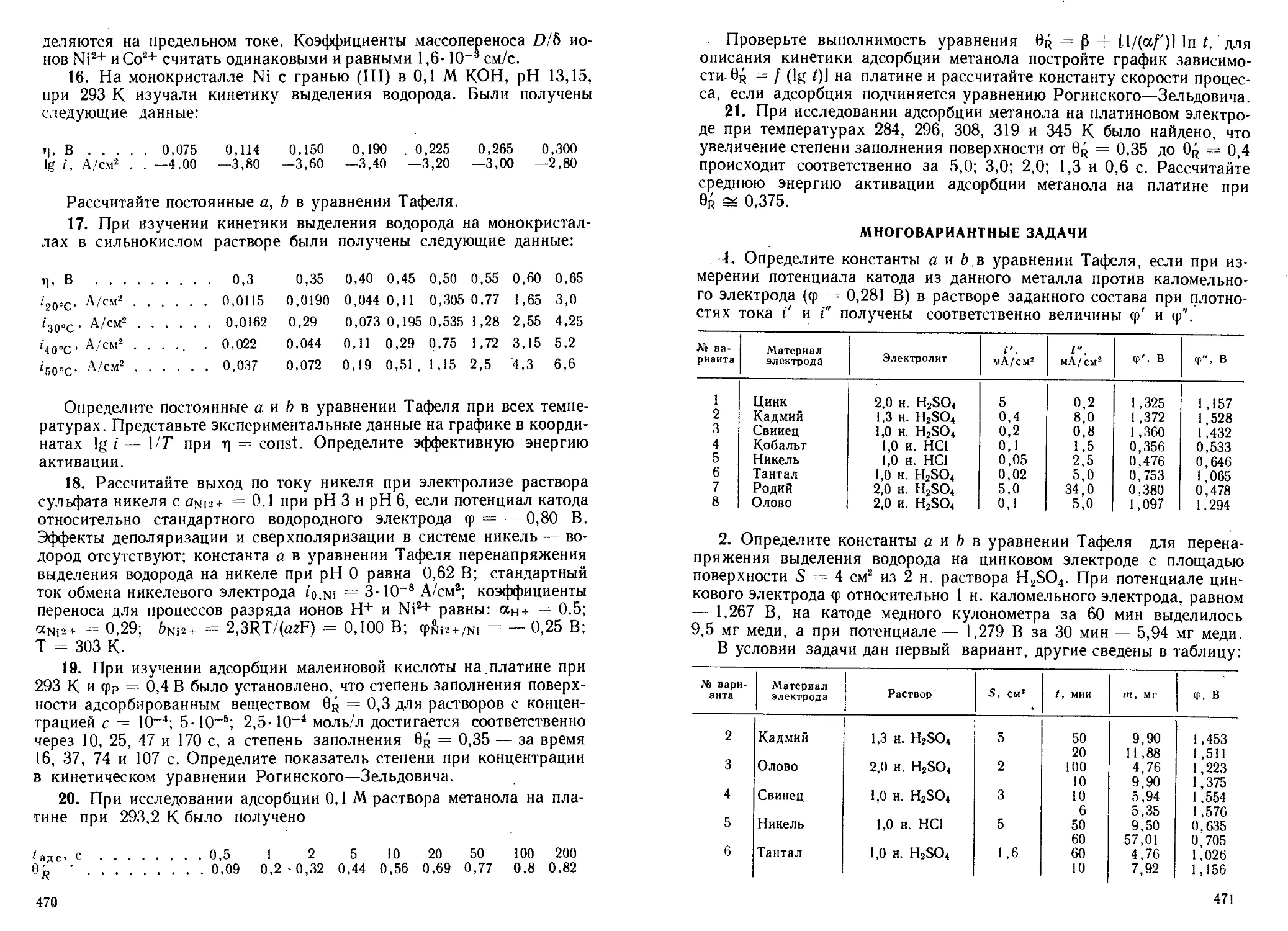
Рис. 1. Относительное расположение молекулярных орбиталей по
энергиям гомоядериых двухатомных молекул без взаимодействия
Os- и лил2-МО (а) и с взаимодействием (б)
за ось х принимать ось, совпадающую с осью молекулы. У обоих ато-
мов А — А она направлена навстречу. Атомная орбиталь 25-электрона
имеет сферическую симметрию, перекрывание 2s- и 2рх-АО симметрич-
но относительно оси молекулы. Такие МО называются ст-молекуляр-
ными орбиталями. Перекрывание 2ру- и 2р2-АО дает л-МО. л-Молеку-
лярные орбитали несимметричны относительно оси молекулы. При по-
вороте л-МО вокруг оси молекулы на 180° знак МО меняется на про-
тивоположный. Различают связывающую ст-МО и разрыхляющую ст*-
МО, связывающую л-МО и разрыхляющую л*-МО. Порядок связи
“ = 1/2 («св—«р)> (Ь6)
где псв — число электронов на связывающих МО; пр — число элект-
ронов на разрыхляющих МО.
Последовательность энергий молекулярных орбиталей ct1s < ct*s <
<^°2s °2s < (^2рх<~^ Я2ру ~ Л2рг < IliPy ~ Яр2г<С(Г2рж- МО Ст2рж’ ^2Py
и л2р. близки по энергиям, они могут меняться местами в последова-
тельности возрастания энергии. На рис. 1 представлена энергети-
9
АО МО АО
Рис. 2. Относительное располо-
жение молекулярных орбита-
лей по энергии гетероидерных
двухатомных молекул
ческая диаграмма без взаимодействия
(а) и с взаимодействием (б) 2s- и 2р-
-АО для гомоядерных двухатомных
молекул. Для гетероядерных двухатом-
ных молекул АВ при условии, что атом
В более электроотрицательный, энергии
АО и МО представлены на рис. 2.
Вклад атома В в связывающие МО боль-
ше, чем атома А, и соответственно вклад
в разрыхляющие МО меньше.
Электронные состояния молекул
классифицируют по значениям момента
количества движения и спина. Разным
типам МО соответствуют определенные
значения квантового числа/пг (табл. 1).
Терм электронного состояния запи-
сывают так:
2S+1|Ml|, (1.7)
где S — суммарное спиновое квантовое число; Ml — абсолютное
значение проекции общего орбитального момента на ось симметрии
Таблица 1. Квантовые числа, соответствующие определенным МО
Атомные орбитали Молекулярные орбитали т1
s, Рх, d* О’ 0
Ру ’ ^ху, ^xz Л ±1
dyz* dyi. — 6 ±2
молекулы. Символы суммарного момента количества движения приве-
дены ниже:
Символ состояния................... S л Д
Ml................................. О ±1 ±2
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите энергию МО иона Нг на основании метода МО в
приближении ЛКАО.
Решение. Из уравнения (1.3) определим энергию МО:
+°°
f ip Н -ip d v
F_ Чр Н Чр _ —оо
10
Подставим в это уравнениеф из (1.1):
+°°
f (Са^а-Ь ^в Фв) Н(^ад1’а+ Св Ч’б) d v
f (cA^A+cBWdv
о
После преобразования под интегралами в числителе и знаменателе и
замены символами обменного, кулоновского и интеграла перекрывания
получим
£=£а£м±!£а£в£ав + О£вв
QSaa+2Ca св sab+ Св sBB
Так как при образовании химической связи энергия должна быть ми-
нимальной, то согласно вариационному методу возьмем производную
дЕ!дСь и приравняем ее нулю. Аналогично возьмем производную
дЕ/дСв и также приравняем ее нулю:
дЕ „
дСА = 2Са^АА+ 2св ^АВ~£(2Сл 5лл+ 2Св Sab)=0,
дЕ
gr «Ав + 2СВ ^вв~Е (2Са Sab-|-2Cb Sbb)=0
или получим два уравнения:
(#ал—£SAA) сл+ (#ав—£Sab) Св = 0’
(^лв+£^ав) CA + (#BB_~£‘Sbb) СВ=0-
Для определения коэффициентов САиСвв уравнении (1.1) решим си-
стему уравнений. Решения, корни которого не будут равны нулю, по-
лучим при условии, если определитель равен нулю:
"АА-£ =()
hab~ES ”вв-Е
Решение этого определителя будет
(^АА-^г-(^АВ-£5)2 = 0>
Е^-2ЯААЕ+яхА-^в+мАвЗ£-£2^=о.
Запишем полученное уравнение в виде
£2(1_S2)_2(//aa_//abS)£+//XA-^b=°-
Квадратное уравнение имеет два корня:
F _ ("аа + "АВ3) ± /(WAA-WABS)a-(l-S2) (^А-^Гв) _
*-1,2----------------------------------------— ~
1— £2
_ (Нкк~НкВ S) ± (^ЛВ-^ЛД s)
1—£2
11
F. — #AA (1— 5)+^AB U-“S) _ ^Aa+^AB
1 1--S2 1+S
F _ Waa(1+S)-/7Ab(1+5) = tfAA-tfAB
2 1—S2 1—S
Получены две разные энергии молекулярных орбиталей.
2. Определите коэффициенты СА и Св в уравнении (1.1) для иона
Н+.
Решение. Из уравнения (1.4) с учетом того, что SAA = Sbb =
= 1, так как волновая функция нормированная, находим
("аа-«аа) с'а + (^ав — £5ав) СВ — °’ (а)
(^ав~^5ав) ^а + (^вв~"£5вв) ^В = 0-
WAB~"WAA 5
Подставим значение Elt полученное в задаче 1, в уравнение (а):
(«»-Я,^И>,)сл +(»»в-"7рЯдв s)c,°o.
Разность в первых скобках равна
[н waa+#ab )
к АА----------------i+s—J
Разность во вторых скобках равна
(„ ^аа+^ав
1+S
йАВ ~^АА 5
1+S
АВ--
Отсюда коэффициенты перед СА и Св равны между собой, но обратны
по знаку. Следовательно, СА — + Св- Подставим в уравнение
(б):
(яАВ— Яаа+#ав Д с ,(н "аа+"ав\ с о
к АВ 14-S / A-q вв f+"sту в
Разность в первых скобках равна
(н #аа+#ав с\= ^ав~'^аа5
к АВ 1 + S / 1+S
Разность во вторых скобках равна
In ^Аа + ^АВ к ^АВ“"^ВВ5
к вв 1+$ / 1+S
откуда вытекает, что СА = + Св. Подставим в уравнение (а) энергию
Е2, полученную в задаче 1. Разность в первых скобках равна
(^АА-----1TTS--) ------jTTs---
Разность во вторых скобках равна
(Н tfAA~~tfAB <Л _ АВ АА 5
к АВ 1—S ) 1—S
12
Величины в скобках равны между собой, следовательно, СА = — Св-
Подставим энергию Е2 в уравнение (б). Разность в первых скобках рав-
на
(и #АА —#АВ q'I _ HAB~~HAAS
^АВ--------------------------------
Разность во вторых скобках равна
(и #АА —#Ав'|_ #АВ~#ВВ5
вв 1—S / 1 —S
Отсюда следует Сд = — Св. Таким образом получены две волновые
функции:
’1’1= са Ч’а — а Ч’в
и
^2 = £д ’I’a + СА 1рв.
+°°
Волновая функция должна быть нормированной, т. е. [ |ф|2 dv = 1,
о
так как во всем пространстве у иона Щ должен быть всего один элект-
рон. Подставим полученные уравнения волновых функций под интег-
рал:
J |i|)|2do= J (СдДрд-Сд^в)2 du= J С^Д do—
~ 2 Па’I’B Q d” + f ЗД d«= 1 •
о о
Но коэффициент Сд не равен нулю:
•*{-00 "{-ОО -|-оо
J фД d о = J ip|do=l; 2 J do = 0,
oo о
откуда
+»
J i|)2dv=l—0+1=2.
о
В результате получили, что молекулярная волновая функция ненорми-
рованная. Чтобы молекулярная волновая функция была нормирован-
ной, ее следует разделить на В результате получим две нормиро-
ванные молекулярные волновые функции:
**=7Т*а-7Т*в
и
==V^1*’a+ УТ1|’В’
13
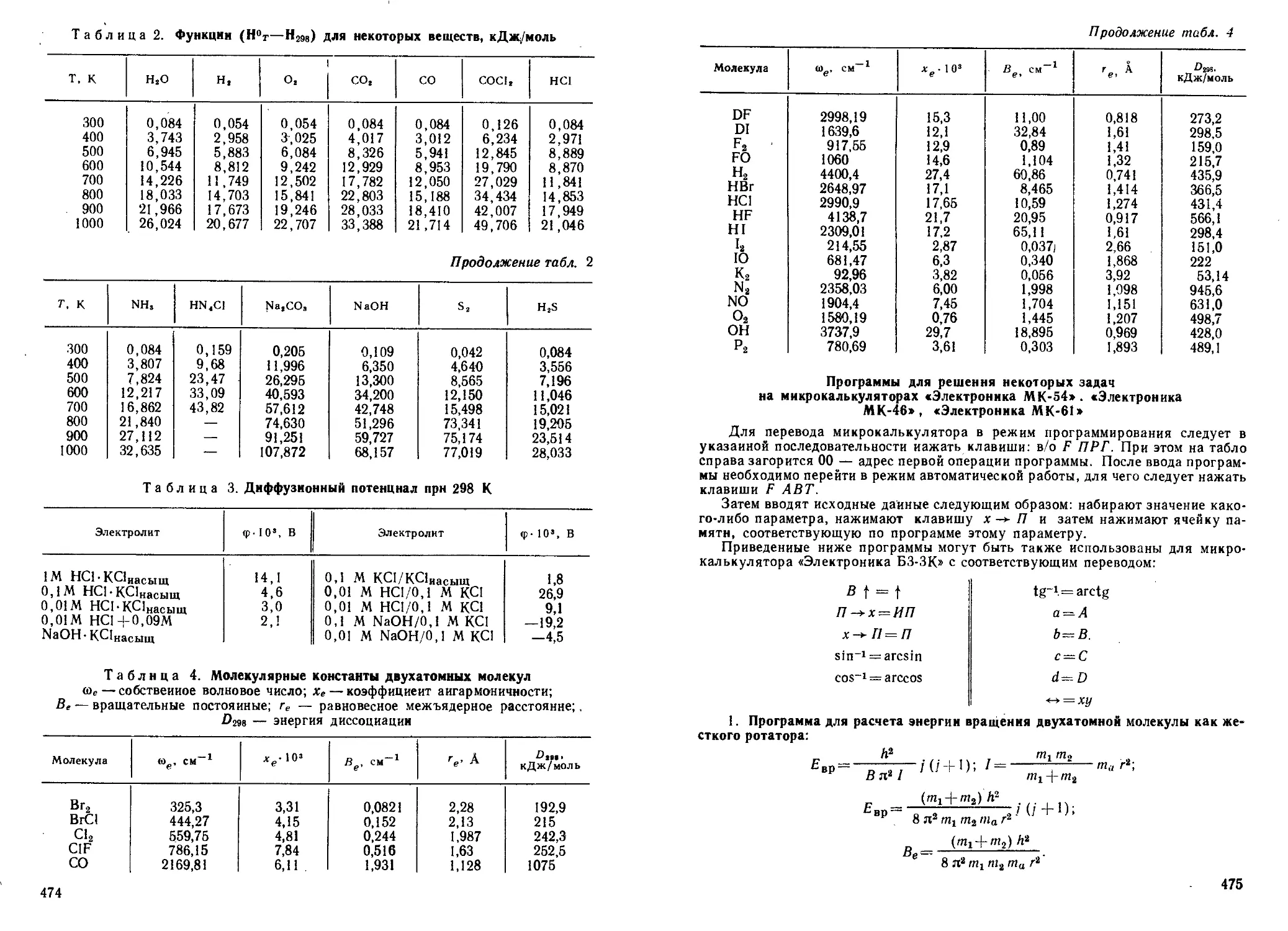
а
Рис. 3. Разрыхляющая (а) и связываю-
щая (б) иолновые функции гомоядериой
двухатомной молекулы
б
а коэффициенты СА и Св будут равны:
СА= CB=l/i/ 2 и СА=Св = 1/"|/ 2 .
3. Изобразите графически функции фх, ф2, ф2 и ф2, приняв, что
Фх = е~ГА — е~Гв и ф2 = е~ГА-[-е~Гв, где гА и гъ — расстояния от ядра А
или В до электрона. Исходя из зависимостей ф| и ф2 от г, установите,
какая из молекулярных орбита-
лей фх и ф2 более устойчива,
т. е. обладает меньшей энергией.
Решение. В молекуляр-
ной волновой функции фх знаки
У Фа и фв разные. Эти функции
располагаются по разные сторо-
ны относительно оси абсцисс
(рис. 3, а); ф] и фо — плотности
вероятности нахождения элек-
трона в пространстве. Вероят-
ность нахождения электрона в
пространстве между ядрами А
и В равна нулю (рис. 3, а), по-
этому химическая связь между
атомами А и В не образуется,
так как положительно заряжен-
ные ядра атомов отталкиваются.
Такая молекулярная орбиталь
называется разрыхляющей.
В молекулярной волновой функ-
ции ф2 знаки у фА и фв одинаковые. Эти функции располагаются по
одну сторону относительно оси абсцисс (рис. 3, 6); ф2 — плотность
вероятности нахождения электрона в пространстве между ядрами
атомов А и В не равна нулю. Отсюда положительно заряженные
ядра атомов притягиваются к отрицательно заряженному простран-
ству между ядрами. Такая молекулярная орбиталь называется свя-
зывающей. Для перевода электронов со связывающей на разрыхляю-
щую молекулярную орбиталь требуется затрата энергии. Следова-
тельно, энергия связывающей молекулярной орбитали меньше
энергии разрыхляющей молекулярной орбитали.
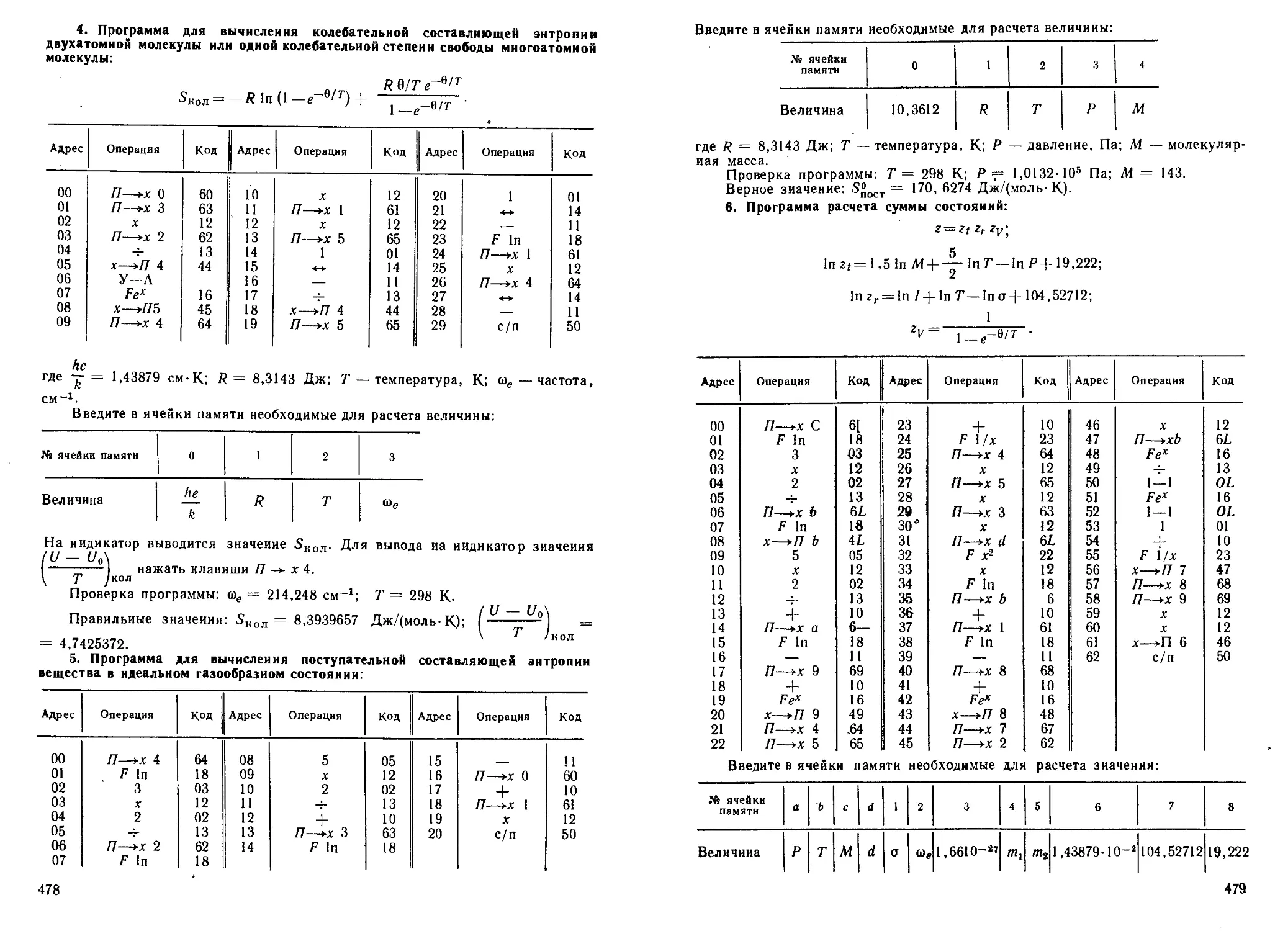
4. Постройте энергетические уровни молекулярных орбиталей моле-
кулы бора В2. Определите порядок связи. Молекула бора обладает
магнитными свойствами.
Решение. У каждого атома В атомные орбитали: Is2, 2s2, 2р\
Магнитные свойства молекулы В2 указывают на то, что у молекулы
есть неспаренные электроны. Заполнение молекулярных орбиталей
электронами подчиняется правилу Хунда. Тогда электронную конфи-
гурацию молекулы В2 можно записать так:
(a1S)2(<T|s)2 (a2s)2(a2s)2 ("») (”Д-
14
Электроны 2s воздействуют на распреде-
ление энергии между пх-, пи- и л2-элек-
тронами. Только таким расположением
электронов на энергетических уровнях
можно объяснить магнитные свойства мо-
лекулы В2. Относительное расположение
энергетических уровней показано на
рис. 1. Относительное расположение элек-
тронных уровней молекулы В2 и заполне-
ние их электронами показано на рис. 4.
Порядок связи определим по уравнению
(1.6):
и=Чг (6-4) = 1.
ЗАДАЧИ
1. Запишите молекулярные орбитали
молекулы О2 и ионов О2 иО2". Вычисли-
те порядок связи в каждой частице. Распо-
ложите энергии связей в возрастающей
последовательности.
2. Нарисуйте энергетическую диаграм-
му для молекулы Li2. Расположите элек-
троны на энергетических уровнях. Опре-
делите порядок связи. Установите, обла-
дает ли молеула Li2 магнитными свойст-
Рис. 4. Относительное рас-
положение электронных
уровней молекулы В2 и за-
полнение АО и МО -элек-
тронами
вами.
3. Чем можно объяснить, что у молекулы Н2 равновесное межъя-
дерное расстояние 0,741 • 10-8 см, а у молекулы Ы2 2,672-10-8 см?
4. Нарисуйте энергетическую диаграмму для молекулы О2. Опре-
делите порядок связи. Молекула О2 обладает магнитными свойст-
вами.
5. Запишите МО молекулы Ве2. Определите порядок связи. Сде-
лайте заключение относительно межъядерного расстояния и энергии
химической связи.
6* . Нарисуйте энергетическую диаграмму молекулы BN. Опреде-
лите порядок связи в молекуле. Молекула BN обладает магнитными
свойствами. Электроотрицательность атома N больше электроотри-
цательности атома В.
7. Запишите МО иона СО+ и молекул ВО и CN. Определите по-
рядок связи в каждой частице. Определите терм основного электрон-
ного состояния всех частиц.
8. Исходя из электронных структур молекул BN, ВО и СО, рас-
положите их по возрастанию энергии химической связи.
15
МНОГОВАРИАНТНАЯ ЗАДАЧА
Запишите МО соединения, определите терм основного электрон
ного состояния. Определите порядок связи. Установите, обладает ли
соединение магнитными свойствами?
№ варианта Соединение № варианта Соединение № варианта Соединение
1 вн 9 BrF 17 HI
2 BF 10 НВг 18 IBr
3 ВС1 11 НВг+ 19 IC1
4 ВВг 12 СО 20 HF
5 ВеН 13 C1F 21 NH
6 BeF 14 НС1 22 NO
7 BeCl 15 НС1+ 23 NO+
8 BrCl 16 HF 24 OH
25 OH+
ГЛАВА II
ЗАКОНОМЕРНОСТИ ГЕОМЕТРИЧЕСКОЙ КОНФИГУРАЦИИ
АТОМОВ В МОЛЕКУЛАХ. ЭЛЕМЕНТЫ
ТЕОРИИ СИММЕТРИИ МОЛЕКУЛ
Основные понятия и символы
[К., с. 77—86]
Геометрическая конфигурация атомов в молекуле зависит от на-
правлений химических связей каждого атома в пространстве. Направ-
ление же химических связей определяется типом АО и МО. На рис. 5
приведены ожидаемые равновесные геометрические конфигурации мо-
лекул в зависимости от числа связывающих электронных пар и числа
неподеленных электронных пар. Для определения равновесной геомет-
рической конфигурации молекулы следует установить число ст- и л-
связей, число свободных пар электронов, не участвующих в химиче-
ских связях . Пользуясь рис. 5, можно установить равновесную геомет-
рическую конфигурацию атомов в молекуле.
Под симметрией молекул понимают симметрию расположения ядер
ее атомов в равновесном состоянии. Молекула считается симметрич-
ной, если имеется линейное ортогональное преобразование координат,
которое приводит к конфигурации, не отличимой от первоначальной.
Преобразование координат, приводящее к идентичному расположе-
нию ядер атомов молекулы, называют операцией симметрии. Элемен-
ты симметрии — это вспомогательные образы (точка, прямая линия,
16
Число непо-
деленных
электрон-
ных пар
Число сВязыбаюилих электронных пар
О
2
5 Б
Линейная
Booh
Плоский
треугольник
Boh
Тетраэдр
Та
Октаэдр
Oh
Нелинейная
Ору
Тригональная
пирамида Искаженный
Сзи тетраэдр
JU_______Сгу.Сзи
Тригональная
бипирамида
Сзу
Кбадратная
пирамида
Сьу
Неправильный
октаэдр
Т-образная
Огу
Плоский
кбадрат
Вщ
J
Рис. 5. Ожидаемые равновесные геометрические конфигурации моле-
кул в зависимости от числа связывающих и иеподелениых электрон-
ных пар
плоскость), с помощью которых обнаруживается симметрия фигуры
(или пространства), табл. 2.
Главная ось симметрии — это ось вращения, имеющая наивысший
порядок п. Плоскость симметрии, содержащую ось наивысшего поряд-
ка, условились обозначать символом <yv. Плоскость симметрии, перпен-
дикулярную главной оси, условно обозначают сймволом ah.
Кроме элементов симметрии и операций симметрии, приведенных
в табл. 2, следует указать на тождественное преобразование Е. Тож-
дественное преобразование равносильно тому, что система из равно-
Таблица 2. Условные записи операций симметрии
и символы элементов симметрии
Элемент симметрии Символ элемента симметрии Операция симметрии Условная запись операций симметрии
Плоскость О Отражение в плоскости S(o)
Ось вращения Сп Поворот на угол 2л/п S(Cn)
Центр симметрии i Отражение в точке Si
Ось зеркальио-поворот- иая Sn Поворот вокруг оси и отражение в плоскости, перпендикулярной оси S(S„)
17
весной конфигурации ядер атомов вообще не подвергалась'преобра-
зованию.
Совокупность нескольких операций симметрии записывают как
«произведение»* соответствующих символов элементов симметрии, f
Символ операции симметрии, выполняемой позже, записывается сле-
ва от оператора S той операции, которая выполняется раньше.
Над каждой молекулой можно произвести ряд операций симмет-
рии, преобразующих молекулу до состояния, не различимого с тем,
которое было до преобразования. Полная совокупность таких опера-
ций симметрии представляет группу симметрии. Число операций сим-
метрии в группе называют порядком группы. Группа операций, напри-
мер а, Ь, с, ..., определяется как совокупность, удовлетворяющая ус-
ловиям: 1) произведение двух операций группы эквивалентно какой-
либо операции этой же группы (ab — с); 2) система содержит тождест-
венную операцию Е (аЕ = Еа = а); 3) для каждой операции имеется
обратная операция, которая является операцией этой же группы
(аа~1 = а-1а = Е); 4) произведение нескольких операций обладает
свойством ассоциативности a (be) = (ab) с.
Все перечисленные операции симметрии оставляют хотя бы одну
точку в пространстве без изменения. Комбинацию операций симмет-
рии, при которой по крайней мере одна точка остается без изменения,
называют точечной группой. Число возможных точечных групп ог-
раничено. Любая молекула должна относиться к какой-либо одной
из этих точечных групп. Все точечные группы делят на три основных
типа: 1) группы низшей симметрии содержат только оси второго по-
рядка и плоскости симметрии; 2) группы средней симметрии содержат
одну ось не ниже третьего порядка; 3) группы высшей симметрии со-
держат несколько осей не ниже третьего порядка. Каждая точечная
группа имеет свой вполне определенный набор элементов и операций
Таблица 3. Точечные группы симметрии
Точечная группа Операции симметрии, элементы симметрии Точечная группа Операции симметрии, элементы симметрии
Сг Е Dzh Е, ЗС2, Зар, i
с2 гч О ьэ &3h Е, С3, ЗС2 > 3<Уу, Ofy,
C1V гч о ьэ КО Q 3 Dih ЕС4, 4С2 j 4(Уу, Oh, С2, , t
Csv гч р 3 D&h Е, Cg, 5Сг> ,Сз,Se,i
Соор Е, Соо , соОр Dooh Е, Coo t со С2, oog^♦ Oh»
C‘2h гч о ьэ Q Td £, ЗС2, 4С3 бег, 3S4
Dsd Е, ЗС2, S4, 2ad Oh Е, ЗС4, 4С3, 3S4, ЗС2, 6С2,
Dsd Е, С3, ЗС2, Sg, t, Зег, 4Se
* Здесь и ниже понятие «произведение» не аналогично действию умножения •
18
симметрии. В табл. 3 приведены точечные группы, их символы и
перечень всех операций симметрии, составляющих группу.
Пользуясь табл. 3, можно установить все элементы симметрии, ко-
торыми обладает молекула в равновесном состоянии.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Запишите МО молекулы О2 и ионов Ог и О2. Расположите час-
тицы в ряд по увеличению равновесного межъядерного расстояния на
основании порядка связи.
Решение. Запишем электронные конфигурации и определим
порядок связи:
О2 (als)2(ajs)2 (a2s)2(^s)2 У^У (^Р,)2 (W (%)2,
u = i/2 (10—6)=2;
О? (<hs)2 (°is)2 (°гз)2(<^)2 (°2РХУ (ЪруУ Ы2 (^PJ,
и = 1/2 (10—5) = 2,5;
О2- (nlsp (Gfs)2 (g2s)2 (a2-s)2 (п2Рж)2 (Jt2Py)2 (л2Рг)2
u = i/2 (10—7) = 1,5.
Зная порядок связи, можно сделать вывод о том, что межъядерные
расстояния будут возрастать в ряду О2, О2, О2 •
2. Исходя из электронных структур частиц BN, ВО и СО, распо-
ложите их в порядке возрастания равновесного межъядерного рассто-
яния.
Решение. Запишем электронные конфигурации в частицах и
рассчитаем порядок связи:
BN (als)2 (a|s)2 (O3S)2 (<^s)2 (п2Р„)2 (л2Рг)2 (а2Рж),
« = */2 (8-4) = 2;
ВО (als)2 (<rjs)2 (G2S)2 (<^)2 (л2Рр)2 (л2Рг)2 (п2Рх),
u=i/2 (9-4) = 2,5;
СО (als)2 (a|s)2 (<t2S)2 (<J$S)2 (n2Pffy (я2Рг)2 (<т2Рж)2,
u = t/2(10-4)=3.
Определив порядок связи, можно сделать вывод о том, что равно-
весные межъядерные расстояния будут возрастать в ряду СО, ВО, BN.
3. Определите равновесную геометрическую конфигурацию моле-
кулы ВеН2 с точки зрения метода МО. Установите точечную группу
симметрии.
Решение. Всего в молекуле ВеН2 четыре электрона, участвую-
щих в образовании ст-связей. Связывающих электронных пар две. Не-
поделенных электронных пар нет. Из схемы, приведенной на рис. 5,
видно, что равновесная геометрическая конфигурация молекулы ВеН2
линейная. Молекула относится к точечной группе симметрии Сжв.
19
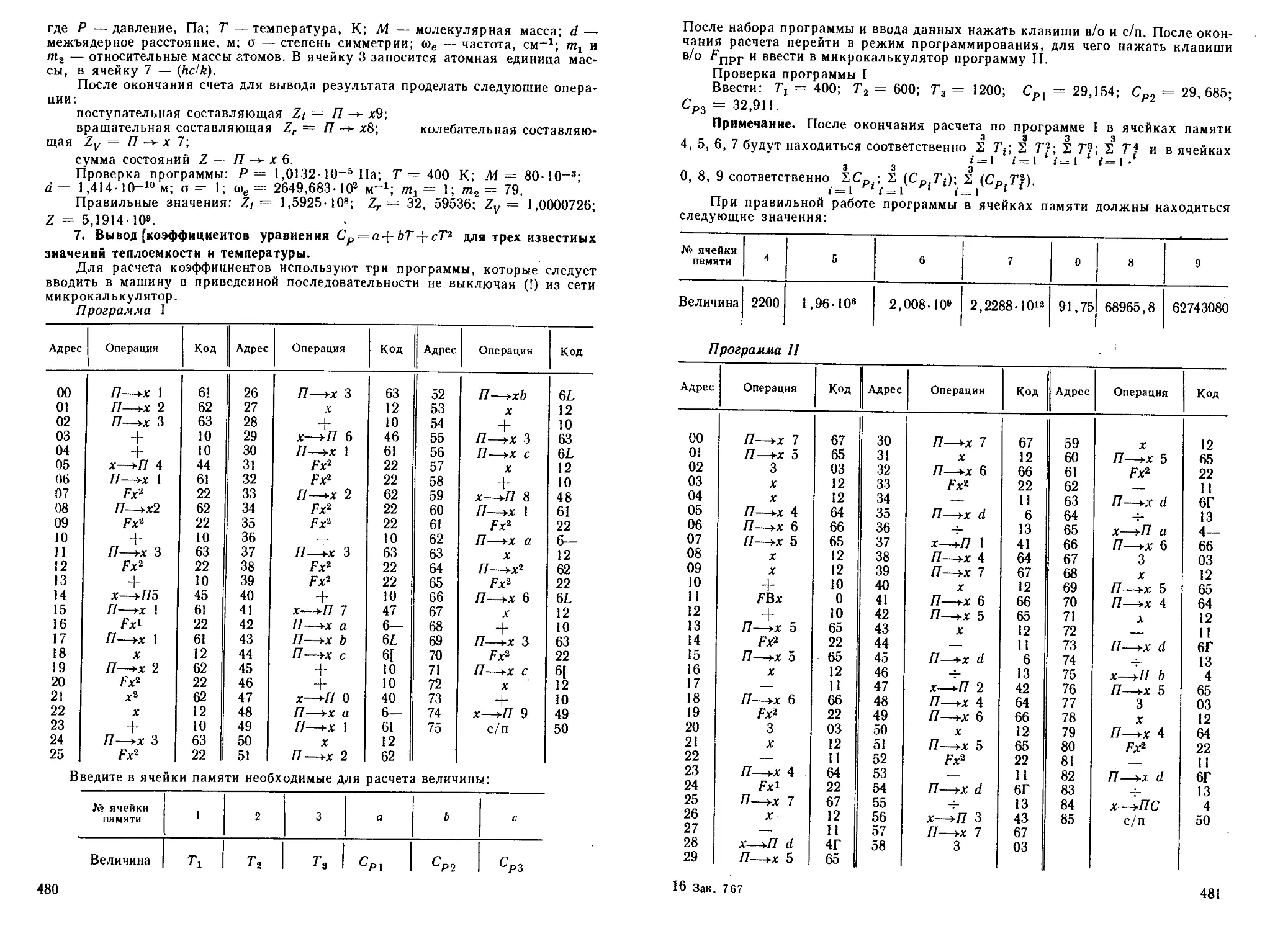
4. Некоторая точка L имеет координаты х, у, г. Запишите уравне-
ния преобразования, описывающие операцию симметрии S (о2).
Решение. Операция симметрии S (о2) есть отражение в плоскос-
ти ху. Изобразим точку до операции симметрии L и после операции
L' (рис. 6). Уравнениями преобразования будут:
S(a2)x = %; S(<T2)y = y; S(a2)z=—z.
5. Некоторая точка имеет координаты х, у и г. Напишите уравне-
ния преобразования, описывающие операцию симметрии S (ох).
Решение. Операция симметрии S (ох)
(см. табл. 2) есть отражение точки в плоско-
сти уг (рис. 6). Точка L после операции отра-
жения будет L". Отсюда уравнения преоб-
разования запишутся так:
Рис: 6.
S(a2)
Преобразование
точки ' в плоско-
сти
§(ож)х=— х\ S(ax)y = yn S(<Tx)z = z.
6. Проведите анализ элементов и опера-
ций симметрии молекулы NH3.
Решение. Молекула аммиака NH3
имеет структуру трехгранной пирамиды с яд-
ром атома азота в вершцне. Через ядро атома
азота проходит ось симметрии третьего по-
рядка С3, имеются три плоскости симметрии
ос. Отсюда, согласно табл. 3, молекулу NH3
можно отнести к точечной группе C3v.
На примере молекулы NH3 проверьте соблюдение первого ус-
группы, согласно которому произведение двух элементов сим-
7.
ловия
метрии есть элемент симметрии.
Решение. Отразим все возможные произведения операций сим-
метрии NH3 в форме таблицы произведений. Для этого в первой стро-
ке и в первом столбце запишем все символы элементов симметрии мо-
лекулы NH3.Ha пересечении строки и столбца поместим символ соот-
ветствующего произведения элемента симметрии, стоящего в первом
столбце, на элемент симметрии, стоящий в первой строке.
Элементы симметрии, стоящие во второй строке и во втором
столбце, не отличаются от элементов, стоящих соответственно в пер-
вой строке и в первом столбце, так как они представляют произведе-
ние на элемент тождественности Е. Для формирования третьего столб-
ца сначала мысленно произведем операцию, стоящую в первом столбце,
затем произведем операцию, стоящую в первой строке. Например,
С^о*,1’ = сти2)- Из таблицы видно, что все произведения двух элементов
есть элемент симметрии.
20
с3 Е с3 ci <т(,3>
Е Е Сз ci <Т<3) <T<,S)
Сз С3 С1 Е <42> (jO) а<х)
С1 ci Е Сз а(з) а’2»
а*1) Е Cl Сз
а<з) Сз Е С1
<3) <3) а») ЗАДАЧИ с% Сз Е
1. На основании метода МО определите равновесную геометриче-
скую конфигурацию молекулы СО2. Установите точечную группу сим-
метрии и перечислите элементы симметрии.
2. Определите равновесную геометрическую конфигурацию иона
NO3. Установите точечную группу симметрии и перечислите элементы
симметрии.
3. Определите равновесную геометрическую конфигурацию моле-
кулы NH3. Установите точечную группу симметрии и перечислите эле-
менты симметрии.
4. Определите равновесную геометрическую конфигурацию час-
тицы PF5. Установите точечную группу симметрии и перечислите эле-
менты симметрии.
5. Определите равновесную геометрическую конфигурацию IF5.
Установите точечную группу симметрии и перечислите элементы сим-
метрии.
6. Какой порядок имеет ось симметрии, проходящая через два ато-
ма углерода молекулы бензола, находящихся в пара-положении?
7. Какой порядок имеет ось симметрии, проходящая через центр
тяжести перпендикулярно плоскости молекулы бензола?
8. Напишите уравнения преобразования координат при операциях
симметрии S (Cn) х, S (Сп) у и S (Cn)z.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Определите точечную группу симметрии, равновесную геометричес-
кую конфигурацию и перечислите элементы симметрии у соединения
А.
21
№ варианта Соединение А* Ng варианта Соедлнение A* № варианта Соединение A*
1 нао 10 cor 19 NaO
2 PtClJ- 11 cao42- 20 o3
3 NH3 12 soa 21 PI3
4 SiHFg 13 so3 22 SO|-
5 SiCl4 14 PC1S 23 SbCL
6 HCN 15 ceHe 24 CH4
7 SiH3F 16 SbF3 25- CHC13
8 SiH4 17 NClOa
9 CH = CH 18 NF3
• Если возникает сомнение относительно структуры соединения, то обратитесь к FC. X.,
т. 1, с. 343].
ГЛАВА III
ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ И ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
Основные уравнения и символы
[К., с. 96—100; Д., с. 557—560]
Энергию вращательного движения двухатомных молекул можно
определить по уравнению
h2
£r = hcBt,/(/+l)=-—-/(/+1), (III.l)
* OJV J
где B„ — вращательная постоянная (см-1, м-1) для данного колеба-
тельного состояния V, I — момент инерции, кг-м2; h — постоянная
Планка; / — вращательное квантовое число, принимающее значения
0, 1, 2, 3, 4, ... . Если принять, что при вращении молекулы (для моде-
ли жесткого ротатора) ее параметры остаются постоянными: ге =
= const и /е = const, то уравнение (III.I) для термов вращательной
энергии можно записать так:
£,
F (/) = ~Т^ =ве/(/+1)> (III.2)
ПС
где Ве =/i/(8n2c7e)— вращательная постоянная, относящаяся к мини-
муму потенциальной энергии; с — скорость света.
По правилу отбора для спектров поглощения в микроволновой и
дальней ИК-области А/ = /' — /" = +1. Положение линий во враща-
тельном спектре может быть записано в виде
£' £"
v = F'(/')-^(/') = -r-—-г-=2В«(/”+1), (Ш.З)
ПС ПС
где v — волновое число, см-1, м-1.
22
Разность волновых чисел двух соседних линий:
Av==2Be, (Ш.4)
где Ве — вращательная постоянная, см-1, м-1; если подставить по-
стоянные величины, то получим численные значения констант:
2,79905-1О-44
Момент инерции молекулы в общем виде равен
rj.
i
Для несимметричных двухатомных молекул
/ = m1r| + mar|.
При свободном вращении молекулы mir1 = т2г2, тогда
4=Ф’е!
где р, — приведенная масса;
(Ш-5)
(III.6)
(III.7)
(III.8)
(III.9)
т1 т2
т1-\-т2
тС А А
12 Ai-^A2
1,6604-10-2’ кг,
^1^2
А + А
где At — атомная масса i-ro атома; тс — масса атома углерода, кг;
тс/12= 1,6604-10-27 кг;
h
4л3 с |i A v
(III.10)
Поглощение квантов света молекулами вещества возможно только тог-
да, когда молекула обладает постоянным электрическим моментом ди-
поля.
Вращательные энергетические уровни вырождены. Вырождение
gj определяют по уравнению
gj = 2f+l- (III.И)
ЗАДАЧИ С РЕШЕНИЯМИ
1. В дальней ИК-области спектра 1Н35С1 поглощает излучение с
волновыми числами:
№ линии ... 1 2 3 4 5 6 7
V, м-1 . . . . 8538,4 10673,0 12807,6 14942,2 17076,8 19211,4 21346,6
Определите среднее значение момента инерции и межъядерное расстоя-
ние.
Решение. На основании волновых чисел линий поглощения,
связанных с изменением энергии вращательного движения, определя-
ем Avcp. Для этого определим разность волновых чисел соседних линий
23
и найдем Avcp = 2134,6 м*1. По уравнениям (Ш.4) и (111.5) найдем мо-
мент инерции
5,5981-10~44
2134,6
= 2,6226-10-4 * * *’
кг-м2.
Равновесное межъядерное расстояние рассчитываем по уравнению
(III.10); для этого необходимо знать приведенную массу, которую оп-
ределим по уравнению (II 1.9):
1-35
1+35
1,6604-10~27 = 1,6143-10~27 кг,
ге = 1/^226~ 1Q2i = 1,2746 • 10-4» м
е Г 1,6143-Ю2’
2. Рассчитайте волновое число линии во вращательном спектре по-
глощения 19F;9Br, которая соответствует переходу молекулы с уровня
/ = 1 на вращательный квантовый уровень j = 2, если равновесное
межъядерное расстояние ге = 1,7555-10-10 м.
Решение. Волновое число линии поглощения определяем по
уравнению (III.3). Для этого по уравнению (III.9) находим приведен-
ную массу:
19-79
ц =-------- 1,6604-10~27 = 15,3-1,6604-10~27 = 25,4-10-27 кг,
г 19 + 79
а момент инерции молекулы по уравнению (III.8):
Тогда
V
3. Определите энергию вращательного движения 19F,9Br на враща-
тельном квантовом уровне j = 1, если равновесное межъядерное рас-
стояние ге — 1,7555-10-10 м.
Решение. Зная межъядерное расстояние и определив приведен-
ную массу молекулы, находим момент инерции I. Отсюда энергия вра-
щения, согласно уравнению (III. 1), будет
(6,6256-10-»4)2
е,=—--------------— 1 (1 + 1) = 0,07096-10~22-1- 2 = 0,1419-Ю'22 Дж.
1 8л2-78,355-10-47 ' т :
4. На какую величину будут отличаться волновые числа линий по-
глощения во вращательных спектрах 1НзаС1 и ДР’СЬесли линия отра-
жает переход молекулы с вращательного квантового уровня / = 6 ца
вращательный квантовый уровень / = 7. Равновесное межъядерное
расстояние у обеих молекул одинаково и равно 1,2746-1О~10 м. ~
I = 25,4-10~27 (1,7555-IO-4») =78,355-10-47 кг-м2.
6,6256-10-34 (1 + 1)
----------------А---------=0,714-103-2 = 1,428-IO2 м-‘.
4-3,142-3-108-78,355-Ю-47
24
1Н35С11е =
Решение. Определим моменты инерции молекул 1Н35С1 и ХН37С1
1-35
-----— 1,6604-Ю-2’ (1,2746-10“1#)2 = 2,6226-Ю"4’ кг-м2;
1+35 v
1-37
-------- 1,6604-Ю"2’ (1,2746-10-10)2 = 2,6265-Ю-4’ кг-м2;
1+37 v
4Н3’С11е =
- 5,5981-Ю-44
для iH35Cl v= —---------г- 7=14,9419-10® м'х,
2,6226-Ю-4’
5,5981-10~44
для iH®’Clv= ------——-------- 7= 14,9197-Ю3 М"4-
2,6265-10“4’
Линия поглощения 1Н3’С1 смещена относительно линии в сторону
меньших волновых чисел на 221,92 м-х.
ЗАДАЧИ
1. Рассчитайте момент инерции молекулы ХН127 I [M.J, если из-
вестно равновесное межъядерное расстояние этой молекулы.
2. Определите энергию вращения молекулы ХН12’ I на десяти первых
вращательных квантовых уровнях и волновые числа девяти первых
линий во вращательном спектре поглощения, если момент инерции мо-
лекулы 1е — 4,295-10-17 кг-м2. Молекула Ш127!—жесткий ротатор.
3. Во вращательном спектре поглощения некоторого вещества НХ
в дальней ИК-области спектра наблюдается несколько линий поглоще-
ния с волновыми числами (м-1): 13649,4; 15355,6 и 17061,8. Равновес-
ное межъядерное расстояние ге = 1,4146-10-10 м. Определите атомную
массу атома X.
4. Сопоставьте энергии вращения молекул HF на десяти первых
вращательных квантовых уровнях со средней кинетической энергией
поступательного движения молекул при температурах (К).'300, 500
и 1000. Значение момента инерции возьмите из справочника 1М.].
5. Определите волновые числа первых десяти линий в спектре по-
глощения 1H19F в дальней ИК-области. Момент инерции молекулы возь-
мите из справочника [M.I.
6*. Определите соотношение N}/N0 (Nj и Na -— число моле-
кул на /-м и на нулевом вращательных квантовых уровнях молекулы
XHX9F) на десяти первых вращательных квантовых уровнях при ЗООК.
; 9 Nj
7*. Определите 2 —и, пренебрегая числом молекул XHX9F, заселя-
/=о No
ющих вращательные уровни с / > 9 при 300 К, рассчитайте число
молекул на девяти первых вращательных квантовых уровнях, если взят
1 моль XH19F.
- 8*. На основании данных, полученных при решении задач 4, 5 и 7,
нарисуйте энергетические уровни, переходы молекул при поглощении
электромагнитного излучения и спектр поглощения с учетом того, что
вероятность поглощения не зависит от энергии квантового уровня, с
которого происходит переход.
25
9*. В спектре 12С1в0, снятом на приборе с высокой разрешающей
способностью, обнаружены линии:
7 V, СИ-1 7 V, СИ-' 7 V, см-1
0 3,845 10 42,263 21 84,330
1 7,690 11 46,098 22 88,138
2 11,534 12 49,939 23 91,943
3 15,379 13 53,763 24 95,744
4 19,222 14 57,593 25 99,541
5 23,065 15 61,420 26 103,334
6 26,907 16 65,245 27 107,124
7 30,748 17 69,068 28 110,909
8 34,588 18 72,888 29 114,690
9 38,426 19 76,705 30 118,467
20 80,519
Определите средний момент инерции и равновесное межъядерное
расстояние в молекуле 12С16О.
10. На основании данных, приведенных в таблице задачи 9, оп-
ределите энергию вращения (Дж) молекулы 12С16О на вращательном
квантовом уровне / = 30.
11*. На основании данных, приведенных в задаче 9, определите из-
менение межъядерного расстояния в молекуле 12С16О при переходе
ее с нулевого на 30-й вращательный квантовый уровень. Покажите,
что молекула 12С1вО не является жестким ротатором.
12. Определите разность волновых чисел линий поглощения во
вращательном спектре молекул ХН35С1 и2Н35С1 при переходе молекулы
с вращательного квантового уровня / = 6 на уровень / = 7. Равно-
весное межъядерное расстояние у обеих молекул одинаковое и равно
ге = 1,2746-10-10 м.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
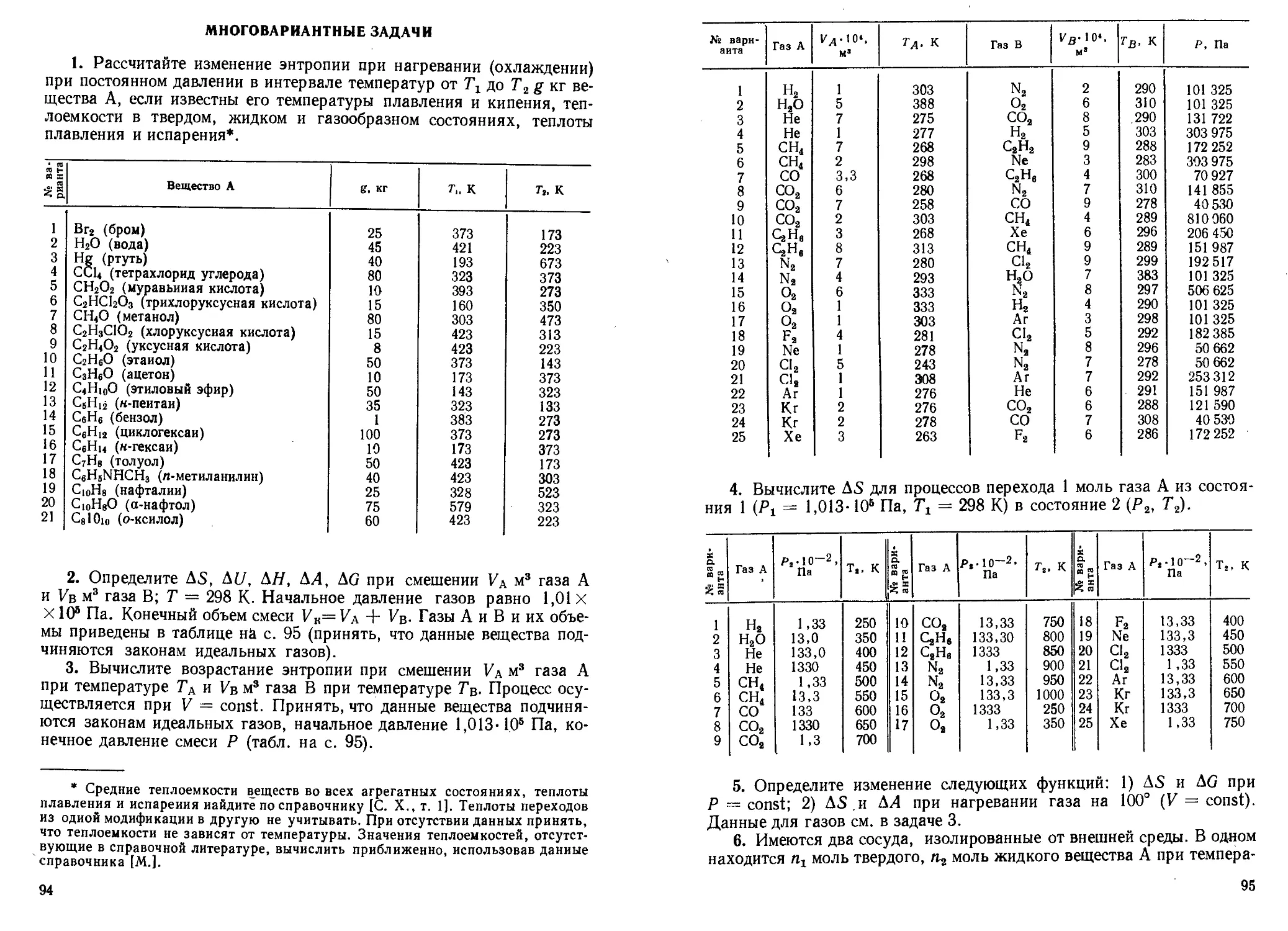
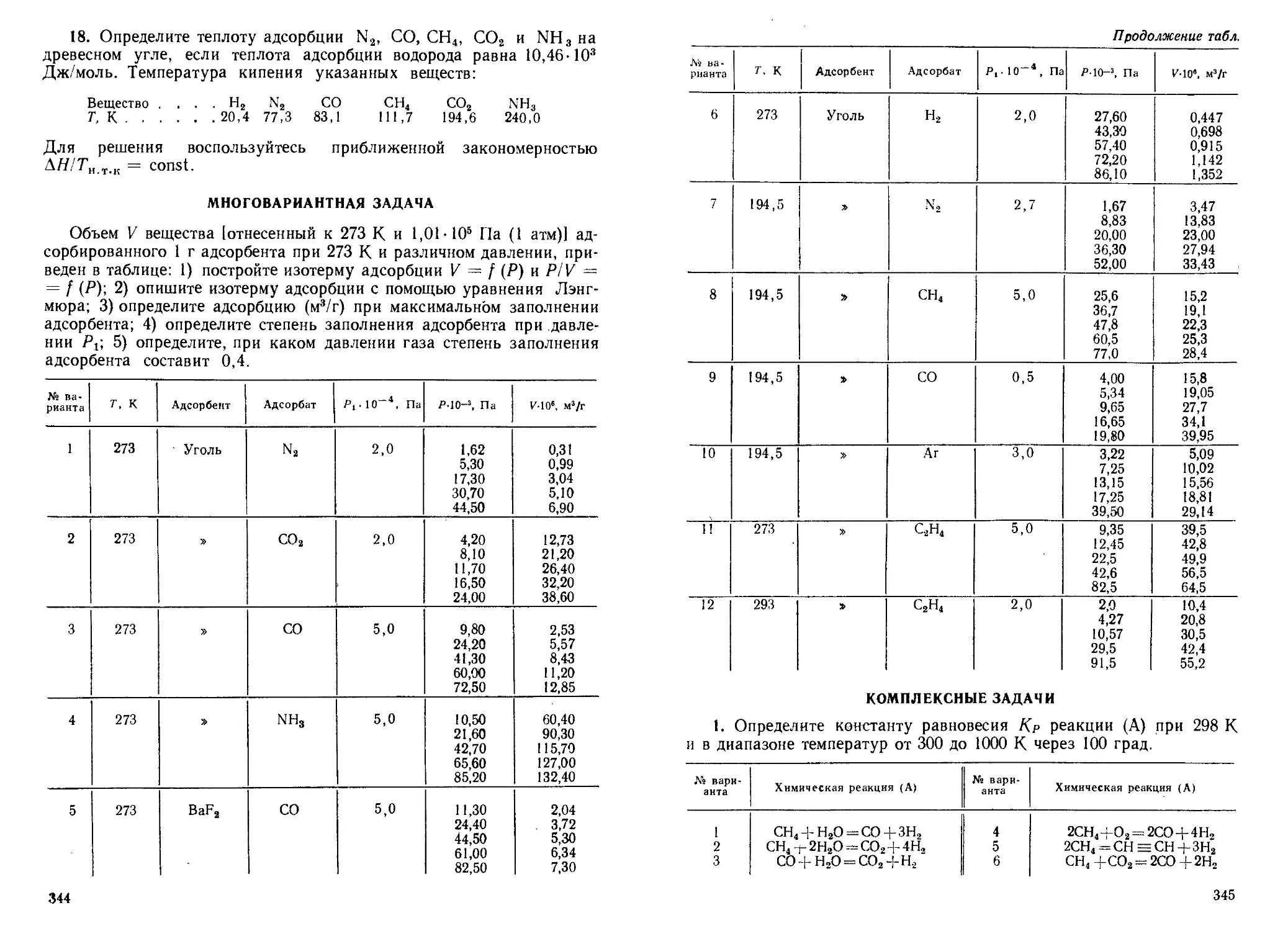
1. По разности волновых чисел соседних линий поглощения в даль-
ней ИК-области спектра рассчитайте момент инерции и равновесное
межъядерное расстояние в молекуле А.
№ варианта Молекула А Av, си-’ № варианта Молекула А Av, си*1
1 ^Н33С1 21,35 8 2Н’»Вг 8,64
2 2Н38С1 10,97 9 3Н’»Вг 5,83
3 3Н3»С1 7,51 10 1H1»F 42,22
4 W’Cl 21,32 11 2H19F 42,17 .
5 2Н3’С1 10,94 12 sHi»F . < 15,48
6 3Н3’С1 7,48 13 ‘Н31Вг 17,06
7 W’Br 17,06 14 2Н81Вг 8,64
26
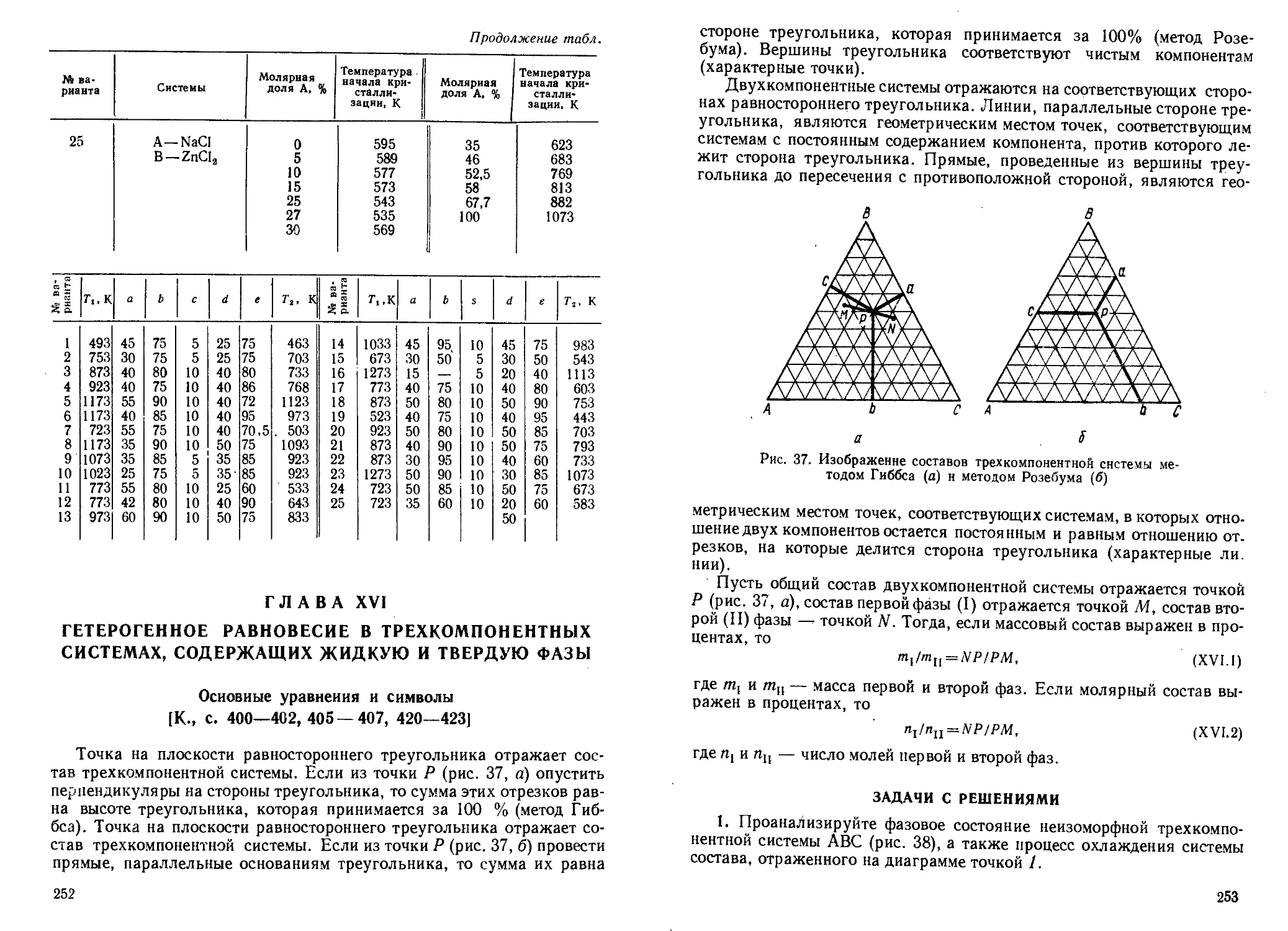
Продолжение
Ns варианта Молекула А Av, см 1 Ns варианта Молекула А см 1
15 3Н81Вг 5,83 21 3’С181Вг 0,187
16 3BC119F 1,03 22 1Н127 J 13,13
17 3’C119F 1,01 23 2J-J127 J 6,61
18 звС1”Вг 0,195 24 3Н12’1 4,44
19 35С181Вг 0,194 25 12CUN 3,80
20 3’С1,9Вг 0,188
2. На основании равновесного межъядерного расстояния в частице
А рассчитайте волновые числа десяти первых линий во вращательном
спектре поглощения, считая частицу жестким ротатором.
№ варианта Частица А Ге-10-1*, И Ns варианта Частица A Ге-10-1*, и
1 12с* н 1,120 14 32S2H 1,341
2 i«C18O 1,128 15 32S18O 1,481
3 12(219 р 1,267 16 12C2H 1,120
4 12С33С1 1,645 17 12CS7C1 1,645
5 12С31Р 1,558 18 28Si2H 1,521
6 «SPH 1,521 19 28Si3’Cl 2,058
7 28Si18O 1,509 20 14N2H 1,038
8 28Si19F 1,600 21 18O3H 0,971
9 28Si3BCl 2,058 22 32S2H 1,341
10 UN1 H 1,038 23 12C3H 1,120
11 un18O 1,151 24 28S3H 1,521
12 0,971 25 32S3H 1,341
13 18O2H 0,971
ГЛАВА IV
ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ И ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ МНОГОАТОМНЫХ МОЛЕКУЛ
Основные уравнения и символы
[К., с. 96—100; Д., с. 557—560]
Моменты инерции вращения молекулы вокруг главных осей, прохо-
дящих через центр тяжести молекулы, равны:
/х=2/пгг?х; Iy=^mtrly- Iz=^m{rlzt (IV.1)
i i i
27
где mi — массы ядер атомов; rix, riy и гiz — равновесные расстояния
ядер атомов от осей вращения. За начало координат принимают центр
тяжести молекулы, ординаты которого определяют по уравнениям:
2mirix=°; (iv.2)
i i i
Многоатомные линейные молекулы имеют две степени свободы вра-
щательного движения вокруг осей, перпендикулярных оси молекулы.
Нелинейные многоатомные молекулы имеют три степени свободы вра-
щательного движения.
Рассмотрим три типа молекул: 1) сферический волчок Iх = 1У=
= Iz. Молекулы имеют несколько осей симметрии порядка ц > 3;
2) асимметричный волчок Iх=/= Iy=£lz. Молекулы не имеют осей сим-
метрии порядка п > 3; 3) симметричный волчок. Два из трех момен-
тов инерции равны между собой: Iх = ¥= Iz или Iх =/= Iy = Iz.
Общей характеристикой вращательных энергетических уровней мно-
гоатомных молекул являются значения квантовых чисел / и тр.
+ (IV.3)
21х 21у 2IZ
где МРх, MPi/ и MPz — моменты количества движения. Одновременно
квантуется проекция момента количества движения на ось неподвиж-
ной системы координат:
= (IV’4)
где т} — квантовое число, принимающее значения целых чисел от
—/ до +/, включая ноль. Отсюда принимает 2/ + 1 значений. Для
сферического волчка Ix = Iy = Iz:
Er=-^-(M2Px + M^ + M2Pz)=^L, (IV.5)
Мр=у2Ё7Г=^-УЛ7+Т)- (iv.6)
Квантованные значения энергии будут такие же, как и у двухатомных
молекул 1см. уравнение (111.1)]. Однако многоатомные молекулы типа
сферического волчка имеют три степени свободы, отсюда для полной ха-
рактеристики движения кроме / и mj необходимо еще одно квантовое
число k, определяющее значение проекции момента количества движе-
ния на одну из подвижных осей, вращающихся вместе с молекулой:
уИРж=(й/2л)й. ’ (IV.7)
Квантовое число k принимает значения от —/ до +/, включая и ноль.
Отсюда вырождение /-уровня определяется выражением
gi = (2/+l)(2/+l) = (2/+ip. (IV.8)
28
Распределение молекул по вращательным квантовым уровням
Л8 1
Л7у= (2/Д-1)* JVoe 8"*//(/ kT . (IV-9)
Для вытянутого симметричного волчка I х < 1У = 72, соотношение
вращательных постоянных будет А > В — С. Энергию вращения оп-
ределяют из уравнения (VI.5) и значений моментов инерции для вытя-
нутого симметричного волчка:
евр=“2/Г + =
1 / 1 1 \ . 1 »
’’ (IVJ0)
I h2 h2 \ , h2
-----------^Т~Г2+ 'O'+l>- (IV-11)
\ оЯ^ *x оЛг 1 у J оЛг 1 у
После введения буквенных обозначений для вращательных по-
стоянных уравнение (IV. 11) принимает вид
£>й=(Д-В)^ + В)(; + 1). (IV.12)
Для сплющенного симметричного волчка Iх = Iу <z Iz соотноше-
ние вращательных постоянных будет А = В > С. В соответствии с
этим
Ejh=(C-B)k2 + Bj(j+V). (IV.13)
В уравнениях (IV.11) и (IV. 12) второй член зависит только от враща-
тельного квантового числа /. Первый член зависит от квадрата кван-
тового числа k, определяющего проекцию момента количества движе-
ния на главную ось симметрии, проходящую через центр тяжести мо-
лекулы. Каждый энергетический уровень 2(2; + 1) раз вырожден,
за исключением нулевого уровня, где k — 0 и вырождение 2/ + 1.
При поглощении квантов электромагнитного излучения во вращатель-
ном спектре наблюдают переходы молекул Д/ = + 1, Д/г = 0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите межъядерное расстояние гес_0 в молекуле СО2,
если момент инерции I = 71,758-10-4’ кг-м2. Молекула СО2 имеет
симметрию D^h.
Решение. Так как молекула СО2 линейна, то имеется только две
степени свободы вращательного движения вокруг оси, перпендикуляр-
ной оси молекулы. Оба момента инерции одинаковы. Вращательное же
движение молекулы вокруг собственной оси невозможно, поскольку
момент инерции такого вращения равен нулю, отсюда энергия враще-
ния, определенная по уравнению (II 1.1), будет бесконечно большой.
29
Равновесное межъядерное расстояние находим по уравнению (IV. 1):
2
/ = Vm, г? = 2-16-1,6604-10-2’ Г2
1 I е(С—О)
ге = 1/----------71.758-1Q-4’---= ] 1621 -10-1» м.
е(С-о> Г 2-16-1,6604-10-2’
2. Определите момент инерции и вращательную постоянную (м-1)
молекулы OCS, если в микроволновой области спектра в спектре по-
глощения наблюдаются максимумы поглощения (м-1): 81, 143; 121,
714; 126, 686; 202, 886. Молекула OCS линейная, тип симметрии С«,и.
Решение. Определим среднюю разность волновых чисел со-
седних линий в спектре поглощения (м-1): Avj = 40,571; Av2 = 40,572;
Av3 = 40,600; Avcp = 40,581. Так как молекула OCS линейная, то
она имеет только две степени свободы вращательного движения.
Оба момента инерции равны между собой. Момент инерции находим
по уравнению
h
4л2 с Л v ’
5,5981-Ю-44 „
I =----------------= 137,949.10-4’ кг-и2.
40,581
Вращательная постоянная будет
Ве = 8л2с / = ~2~ = 20’29 м“х-
3. Определите произведение моментов инерции 1а 1в 1с молекулы
воды на основании равновесных межъядерных расстояний гео_н =
= 0,957-10~10 ми равновесного угла НОН 104°31'. Молекула Н2О
имеет симметрию С2г.
Решение. За начало координат примем центр тяжести молеку-
лы, который определим по уравнениям (IV.2). Моменты инерции 7Х, 1У,
и Iz определяем по уравнениям (IV. 1). Произведение главных момен-
тов инерции молекулы может быть рассчитано из векового уравнения
7 а 7в 7с =
+ 7хх—7Х!/ /хг
--1ху~[-1уу---lyz
— 7ХХ — 1угА-1гг
Величины Ii} вычисляют по уравнениям:
7хх = 2 Щ (у2+а2)_-^ (2 т. yi)2 (2 mt Zi)2,
lyy = ^ ^(xf + zf) = у(2тгхг)2- (2лг(г,-)2,
/гг = 2 mt (xj +yz)— (2 mt xt)2 ~ (i/nj yi)2>
30
Ixy — 2 mi xi Уl м (S 1Щ Xj) (S ffi; yi),
I xz = 2 xi м (2 m^ xi) (S m^ Zf) ,
ly^ZmtytZi-------~ (2mtyt) (2mtzi),
где M = Sffij. Решением векового уравнения
третьего порядка будет
^А^В = I** Vvv —^Vz ^У^~
— Ixy(JxVIzz—IyzIxz) — Ixz<JxyIyz+ lyy^z)- Рис. 7. Равновесная гео-
метрическая конфнгура-
, цня молекулы воды
Полученные результаты целесообразно свести 1
в таблицу. Молекула воды, координаты ядер
атомов, равновесные межъядерные расстояния, равновесный угол и
оси координат представлены на рис. 7.
Атом т-10!в, кг х-101’, м м z*10le, м
о 2,656 0 0 0
н, 0,166 -0,586 0,757 0
н2 0,166 S т,-=2,988 • 1О~26 кг -0,586 -0,757 0
Атом О Н, Н, S
х2-102® О' - 0,343 0,343
у2-1020 0 0,573 0,573
ху-1020 0 —0,444 0,444
тх- Ю36 0 —0,097 —0,097 —0,194
ту-1036 0 0,126 —0,126 0
тху-1046 0 —0,074 0,074 0
М^+^-Ю46 0 0,152 0,152 0,304
тх2-1046 0 0,057 0,057 0,114
ту2-Ю46 0 0,095 0,095 0,190
/хх = 0,190-Ю-46,
0,038
=0,114-10-46---------- 10-46 = 0,101 • 10-46,
yv 2,988
31
/гг=0,304-10-46—0,038 —----10-4в= о,291.10-4’,
2,988
Лед = О, Лсг = О И lyz — О-
Тогда
;а7в ;с= 0.190-10-46.0,101-10-46.о,291-10-46 = 55,84.10-442 (кг-м2)3.
ЗАДАЧИ
1. Определите равновесное расстояние между ядрами атомов С и
S в молекуле CS2 по значению момента инерции / = 94,507-10-47
кг-м3. Молекула CS2 имеет симметрию D^h-
2. Средняя разность волновых чисел соседних линий во вращатель-
ном спектре поглощения HCN составляет 2,977-102 м-1. Определите
момент инерции и вращательную постоянную В' (м-1).
3. Определите произведение моментов инерции IaIbIc молекулы
SO2 на основании равновесного межъядерного расстояния ге$_о =
— 1,432-10-10 м и равновесного угла OSO 119°2Г. Молекула SO2 име-
ет симметрию С2в.
4. Определите произведение моментов инерции /д/д/с молекулы
СН35С13, если равновесные межъядерные расстояния ''е н = 1,073 х
X 10-10 и rec_ci = 1,763-10-10 м и угол С1СН 108°32'. Молекула СНС13
имеет симметрию С3в.
5. По моментам инерции молекулы воды 1а = 0,996-10-47, /д =
= 1,908-10-47 и 1С = 2,981 • 10-47 кг-см2 определите равновесное межъ-
ядерное расстояние ге^ н и угол НОН.
6. Докажите, что для нелинейных трехатомных молекул /д =/= I в^
и 1а + Iв = 1с-
7*. Определите главные моменты инерции молекулы 31Р1Н3 по рав-
новесному межъядерному расстоянию гер = 1,4206-10"10 м и углу
НРН 93°5'. Установите, является ли молекула РН3 сплющенным или
вытянутым симметричным волчком.
8*. Определите энергии десяти первых вращательных квантовых
уровней молекулы 31РХН3, если главные моменты инерции молекулы
имеют значения: /д =/в = 6, 237-10“47 кг-м2; 1с = 7,111-10-47
кг-м2. Вычертите энергетические уровни в условном масштабе
и покажите стрелками возможные переходы при поглощении квантов
света в дальней ИК-области спектра.
9. Момент инерции молекулы NH3 вокруг главной оси симметрии
/ = 1,085-10-47 кг-м2. Определите отношение числа молекул NH3,
находящихся на вращательном уровне / = 5, к числу молекул, нахо-
дящихся на нулевом вращательном квантовом уровне, при 1000 К.
10. Определите главные моменты инерции и произведение глав-
ных моментов инерции молекулы бензола, если гес_н — 1,084х
Х10"10, гес с — 1,397-10_1° м. Молекула бензола плоская и имеет
симметрию Deh.
32
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
Молекула XY4 имеет симметрию Td. На основании данных о равно-
весном межъядерном расстоянии X — Y вычислите: 1) момент инер-
ции молекулы; 2) вращательную постоянную Ве (в джоулях); 3)
энергию вращения молекулы на вращательном квантовом уровне
/ = 10; 4) отношение числа молекул на уровне /—Юк числу молекул
на нулевом вращательном квантовом уровне при 300 К; 5*) энергию
вращения молекулы XY на 20 первых вращательных квантовых уров-
нях; 6*) Nj/N0 для 20 первых вращательных квантовых уровней при
300 К; 7*) при 300 К; 8*) число молекул, находящихся на нулевом
вращательном квантовом уровне, если взять 1 моль вещества XY4,
считая, что Nj/N0 для уровней / > 20 незначительно; 9*) долю моле-
кул, находящихся при 300 К, на уровне / = 5.
№ варианта XY. rXY‘ IO10’ M № варианта XY, rx y* 10te, м
1 12С1Н. 1,093 14 28Si19F4 1,540
2 12С2Н4 1,093 15 29Si19F4 1,540
3 12С3Н4 1,093 16 30SiI9F4 1,540
4 28SiiH4 1,480 17 72Ge19F4 1,670
5 28Si2H4 1,480 18 119Sn19F4 1,840
6 28Si3H4 1,480 19 4STjl9p4 1,740
7 ^Ge1^ 1,527 20 91Zr19F4 1,850
8 72Ge2H4 1,527 21 1,8Hf19F4 1,890
9 72Ge3H4 1,527 22 207Pb19F4 2,020
10 119Sn1H1 1,701 23 29Si!H4 1,480
11 119Sn2H4 1,701 24 29Si2H4 1,480
12 119Sn3H4 1,701 25 29Si3H4 1,480
13 12C19F4 1,322
ГЛАВА V
КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ АТОМОВ В МОЛЕКУЛАХ.
КОЛЕБАТЕЛЬНЫЕ И КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ
Основные уравнения и символы
[К., с. 100—104; Д., с. 567—571]
Колебания двухатомных молекул при малых амплитудах прибли-
женно описывают уравнением
f=-ke(r-re), (V.1)
где / — сила взаимодействия между ядрами атомов, Н; ke — силовая
постоянная молекулы, Н/м; г и ге — межъядерное расстояние, м.
2 Зак. 767
33
Для модели гармонического осциллятора решение уравнения (1.3)
имеет вид:
(V.2)
где £в — энергия колебательного движения атомов; и — колебатель-
ное квантовое число, принимающее значение 0,1, 2.. цтах; Н — при-
St j/"= v<?’ где Ve—частота колебаний,
= с(ое, то уравнение (V.2) преобразуется к
веденная масса. Величина
с-1. Если принять, что ve
виду:
(V.3)
где (ое — колебательная постоянная или собственная частота, см-1,
м-1. Уравнение (V.1) не может удовлетворительно описать колебатель-
ное движение при больших амплитудах колебания. Потенциальная
энергия более или менее удовлетворительно описывается уравнением
Морзе
(7г=оД1— е~“ ('“'’е)]2, (V.4)
где Ur — потенциальная энергия; De и а — постоянные величины;
De = hc ые/4хе; (V.5)
а = "|/ 8л2 с ц<ое xe/h , (V.6)
где а>еХе — коэффициент ангармоничности колебания, см-1, м-1; хе —
коэффициент ангармоничности колебания (величина безразмерная).
Для модели ангармонического осциллятора энергия колебательного
движения выражается уравнением
„ I 1 \ / IV
=1« + — \hc4ie — It, + — I hc<oexe-, (V.7}
для термов
г Е° ( , И ( , 1 V
В колебательных спектрах наблюдается поглощение квантов
he v = Ev — Ео, v = Gv—G0 = I<Be — wexe (f-f-1)] v, (V.8)
где v — волновое число максимума полосы поглощения; £„ — энер-
гия колебательного движения на v-м колебательном квантовом уровне;
£0 — энергия колебательного движения на нулевом колебательном
квантовом уровне. С учетом того, что при комнатной температуре боль-
шинство молекул находятся на нулевом уровне, волновые числа пере-
34
ходов, согласно правилам отбора Дц = v' —vT — ±1, ±2, ±3,
могут быть определены по формулам:
v^o =ше—2соехе, (V.9)
v2_0 = 2<oe—6<вехе, (V. 10)
v3<_0 = 3<Be—12<вехе. (V.11)
В спектре наблюдаются полосы: — основная полоса (основной тон);
v2 — первый обертон; v3 — второй обертон.
Максимальное значение колебательного квантового числа
ymax—(1 хе)/^хе~~ (V. 12)
Максимальная энергия колебательного движения — энергия диссоци-
ации De, отсчитываемая от минимума потенциальной кривой;
щах~ . (V-13)
Для перевода молекулы с нулевого на максимальный колебательный
квантовый уровень цтах необходима энергия
Do = Ev,max-Ev,o = -^- (Д-хе)*, (V.14)
4хе
где Do — экспериментально определяемая энергия диссоциации.
Если вещество находится в газообразном состоянии, то вместе с воз-
буждением колебательного движения возбуждается также и враща-
тельное движение молекулы. Энергия вращательно-колебательного
движения равна
EriB = Er + Ev=hc Вв j (/+1)+£г. (V.15)
При переходе молекулы с нулевого колебательного на первый колеба-
тельный квантовый уровень изменяется вращательное состояние моле-
кулы. Тогда изменение энергии будет
Vr.v= -^=<ве(1-2хе) + Вв[/' (/' 4-1) —Г (Г-4-1)]. (V. 16)
Если Д/ = + 1, то в спектре появляется R-ветвь:
v=a>e(l-2xe)+2Bv (/4-1), (V.17)
которая расположена со стороны больших волновых чисел от vB. Если
же Д/ = -— 1, то в спектре появляется Р-ветвь с меньшими волновыми
числами:
v = we (1— 2хе)— 2Вв j.
(V.18)
35
2*
энергетические уровни, переходы мо-
лекулы при поглощении света и вра-
щательно-колебательный спектр двух-
атомных молекул
На рис. 8 показаны энергетиче-
ские уровни, переходы молекул
при поглощении квантов электро-
магнитного излучения и вид спект-
ра поглощения двухатомных моле-
кул. Уравнения (V. 17) и(V. 18) вы-
ведены с учетом того, что враща-
тельная постоянная В„ зависит от
энергии колебательного движения.
Вращательная постоянная В„
уменьшается с ростом энергии ко-
лебательного движения, что выра-
жается уравнением
В„ = Ве—а (v + 2 (V.19)
С учетом (V.19) для /?-ветви по-
лучим
V — <ое — 2а>рхе-\-2Ве (/4-1)—
-1,5а (/+1) (/ + 2); (V.20)
для Р-ветви’
v = <ве—2<ве хе — 2Ве /—1,5а (/— 1) /.
(V.21)
Разность волновых чисел двух со-
седних полос во вращательной
структуре
Av = 2Be. (V.22)
ЗАДАЧИ С РЕШЕНИЯМИ
1. В спектре поглощения 19F79Br, растворенного в неполярном раст-
ворителе, обнаружены основная полоса поглощения, более интенсив-
ная, и первый обертон, менее интенсивный. Их волновые числа соот-
ветственно равны 663,6-102 и 1318,2-102 м-1. Определите частоту ко-
лебания атомов в молекуле и коэффициент ангармоничности.
Решение. Подставим значения vx и v2 в (V.9) и .(V. 10) и решим
оба уравнения:
663,6 • 1012 = <ве—2<ве хе 3<ве—6<ве хе = 1990,8 • 102
1318,2-102 = 2<ве—6й>ехе 2<ве—6<вехе= 1318,2-Ю2
<ве =672,6-102 м-1
2<оехе=672,6-Ю2 — 663-102 = 9,0-102; <оехе = 4,50-Ю2 м"1;
хе = 4,50-102/(672,6-102) =6,69-10-®.
36
2. Определите максимальное колебательное квантовое число для
19F79Br, если <ое = 672,6-102 м-1 и хе = 6,69-10-3.
Решение. По уравнению (V.12) определяем итах:
Отах = (1— 6,69-10-®)/(2-6,69. Ю-3) =74,23.
Так как колебательное квантовое число может принимать значения
только целых чисел, то необходимо округлить полученное значение до
^гаах 74.
3. Определите энергию колебательного движения атомов в молеку-
ле 19F79Br на нулевом и на максимальном колебательных кванто-
вых уровнях. Определите энергию химической связи, если <ое =
= 672,6- 102 М-1, Хе = 6,69- 10~3 И Umax = 74.
Решение. Энергию колебательного движения вычислим по
уравнению (V.7), подставив вместо v ноль:
£кол = 0'-5-6,62.10-34.3-108-672,6.10-2—
— 0,25-6,62.10 - 34-3-108-672,6-102 = 0,66-10-2° Дж.
Энергию колебательного движения на максимальном колебательном
квантовом уровне получим по уравнению (V.13):
£'тах = 6,62-10-34-3.108.672,6-102/(4.6,69.10~3) =49,89-10-2» Дж.
Энергия химической связи есть разность энергии колебательного дви-
жения на максимальном колебательном и нулевом колебательном уров-
нях, умноженная на постоянную Авогадро:
£'х.св= (49,89-IO-20—0,66-IO-2») 6,02-1023 = 296,36.10s Дж/МОль.
4. Определите энергию колебательного движения атомов в моле-
куле 19F79Br на колебательных квантовых уровнях v = 0, 1, 2, 3, 5, 8,
12, 20, 30, и 74, если <ое = 672,6-102 м"1, хе = 6,69-10~3, итах = 74,
и оцените вклад второго члена в уравнении (V.7), характеризующего
отклонение колебания реальной молекулы от колебания гармониче-
ского осциллятора.
Решение. Зная <ов и 1 <лехе, вычислим hc<ae = 133,58-10-22
Дж, hcfUgXg = 0,89-10-22 Дж. Полученные результаты сведем в табли-
цу, отдельно записывая первый и второй члены уравнения (V.7):
V + hc№e • 1°м- Д* (»+~) Л₽<оехе-10»«, Дж Е- 10”, Дж
0 66,78 0,22 66,56
1 200,34 2,00 198,34
2 333,90 5,56 328,34
3 467,45 10,90 456,55
5 734-57 29,92 707,65
8 1135,24 64,30 1070,94
12 1669,48 139,11 1530,37
20 2737,94 374,07 2363,87
30 4073,52 827,97 3245,55
74 9950,07 4939,50 5010,57
37
Рис. 9. Энергетические уров-
ни и амплитуды колебаний
молекулы »®рт*Вг
С увеличением колебательного квантового
числа вклад ангармоничности возрастает.
На нулевом и первом колебательных кван-
товых уровнях колебания молекулы можно
считать практически гармоническими.
5. Определите минимальное и макси-
мальное расстояния между атомами 19F
и 79Вг на колебательных квантовых уров-
нях и = 0, 1, 2, 3, 5, 8, 12, 20, 30 и 74.
Постройте график Екол = f (г).
Решение. Решим совместно уравне-
ния (V.4) и (V.7):
/ 1 \ I 1 \2
I v + — jhc <ое — (v I hcG>exe =
Энергии колебательного движения на всех колебательных квантовых
уровнях приведены в задаче 4. Вычислим константы De и а по уравне-
ниям (V.5) и (V.6):
De — 133,58-10-22/(4.6,69-10~3) =0,5-IO-*8 Дж,
а = 1/ 8'3,142-25,4.10~27-672,6-10'2-3-108.6,69-10~3 = 2 017.10ю
6,62-IO’34
Уравнение (V.4) преобразуем к виду 1 — е« = ]/Екол/£>е, где у =
= —а (г— ге). Значения каждого сомножителя в преобразованном
уравнении для всех заданных колебательных уровней приведены в
таблице на с. 39. По данным строим график Екол = f (г) (рис. 9).
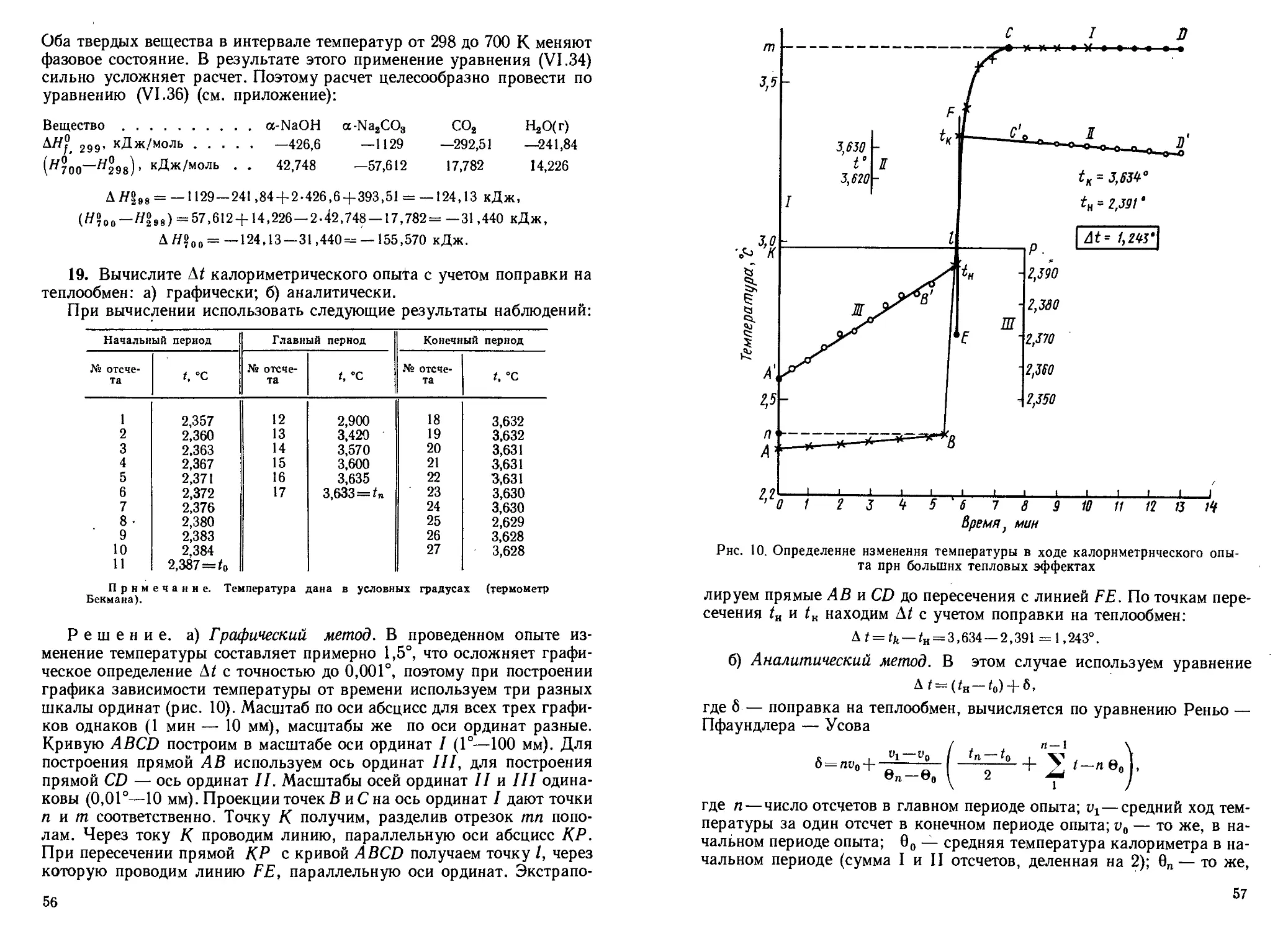
6. Определите волновые числа полос поглощения во вращательно-
колебательном спектре поглощения 19F’9Br, если сое = 672,6- 102м~1
7 /?-ветвь Р-ветвь
в'е (/4-1). 10-2, м-1 V- 1Q—2, м~1 В'е i - IO-2, м-1 17- 1о—2, м—1
0 0.714 664,31
1 1,428 665,03 0,714 662,89
2 2,142 665,74 1,428 662,17
3 2,856 666,46 2,142 661,46
4 3,570 667,17 2,856 660,74
5 4,284 667,88 3,570 660,03
6 4,998 668,60 4,284 659,32
7 5,712 669,31 4,998 658,60
8 6,426 670,03 5,712 657,89
9 7,140 670,74 6,426 657,17
ю- 7,854 671,45 7,140 656,46
38
и <яехе = 4,50-10* м-1. Значение вращательной постоянной Be =
— 0,714-10* м“\ сое — 2toexe = 663,6-10* м~х.
Решение. Волновые числа полос поглощения в Р-ветви оп-
ределим по уравнению (V.20), в Р-ветви — по уравнению (V. 21).
ЗАДАЧИ
1. Определите силовую постоянную &е(Н/м) для молекулы XH19F,
если toe = 4,141-10® м-1.
2. Определите сое для 2Н19 F, если для XH19F сое = 4,141-10® м-1.
3. По волновым числам максимумов поглощения основной полосы
и первого обертона молекулы 12С16О (2,142-108 и 4,258-108 м-1 соот-
ветственно) определите собственную частоту колебания (м-1) и коэффи-
циент ангармоничности молекулы.
4. На основании значений частоты колебаний и ангармоничности
сое и (ОеХе, взятых из справочника [M.I, для молекулы СО определите
энергию колебательного движения на нулевом и первом колебатель-
ном квантовых уровнях.
5. Определите максимальное колебательное квантовое число, энер-
гию колебаний на нулевом и максимальном колебательных квантовых
уровнях и энергию химической связи, отнесенную к молю вещества
XH19F.
6. На основании справочных данных сое и шехе [М.| для Н2 опре-
делите отношение числа молекул на первом колебательном квантовом
уровне к числу молекул на нулевом колебательном квантовом уровне
при 300 и 1000 К.
7. На основании справочных данных сое и <яехе [М.] для 12 опреде-
лите относительную заселенность молекул на первом колебательном
квантовом уровне при 300 и 1000 К.
8*. Для молекулы ХН2Н на основании значений Ге=0,7413-10-хо м,
<0е = 3817,1-Ю2 м-1 и ЫеХе — 94,96-102 м~х определите энергию ко-
лебательного движения на нулевом, пятом, десятом, двадцатом и
максимальном колебательных квантовых уровнях. Вычислите г—ге
по уравнению (V.4) и постройте кривую Морзе.
V Ео-10’, Дж D еУ* Ig —1g е»*
0 66,56 133,12 0,1153 0,8847 1,1153 Г, 9468 0,0532
1 198,34 396,68 0,1992 0,8008 1,1992 1,9035 0,0965
2 328,34 656,68 0,2562 0,7438 1,2562 1,8715 0,1285
3 456,55 913,10 9,3022 0,6978 1,3022 1,8437 0,1563
5 707,65 1415,30 0,3762 0,6238 1,3762 1,7951 0,2049
8 1076,94 2141,88 0,4628 9,5372 1,4628 1,7302 0,2698
12 1530,37 3060,74 0,5533 0,4467 1,5533 1,6500 0,3500
20 2363,87 4727,74 0,6875 0,3125 1,6875 1,4949 0,5051
30 3245,55 6491,10 0,8057 0,1943 1,8057 1,2885 0,7115
74 5010,57 10021,14 1,0000 0,0000 2,0000
39
Продолжение табл.
V —Z/1 1g У1 (П-г,) 10'» г,-101 °, м — (гг—Го) 10'» г2 • 101®, м
0 0,1225 0,0474 0,1091 0,0607 1,8162 0,5409 1,7014
1 0,2222 0,0788 0,1814 0,1102 1,8657 0,0899 1,6656
2 0,2959 0,0990 0,2280 0,1467 1,9022 0,1131 1,6424
3 0,3599 0,1146 0,2939 0,1784 1,9339 1,1309 0,6246
5 0,4718 0,1386 0,3191 0,2339 1,9894 0,1583 1,5972
8 0,6212 0,1652 0,3804 0,3080 2,0635 0,8870 1,5668
12 0,8059 0,1913 0,4405 0,3996 2,2551 0,2185 1,5370
20 1,1630 0,2272 0,5232 0,5766 2,3321 0,2595 1,4960
30 1,6383 0,2567 0,5911 0,8123 2,5678 0,2932 1,4623
74 0,3010 0,6931 0,3436 1,4119
9. Вычислите волновые числа трех первых линий в Р-ветви вра-
щательно-колебательного спектра поглощения 1H19F. Необходимые
для расчета величины найдите в справочнике [М.].
10. Определите волновые числа трех первых линий в /?-ветви вра-
щательно-колебательного спектра поглощения 1H19F. Необходимые
для расчета величины найдите в справочнике [MJ.
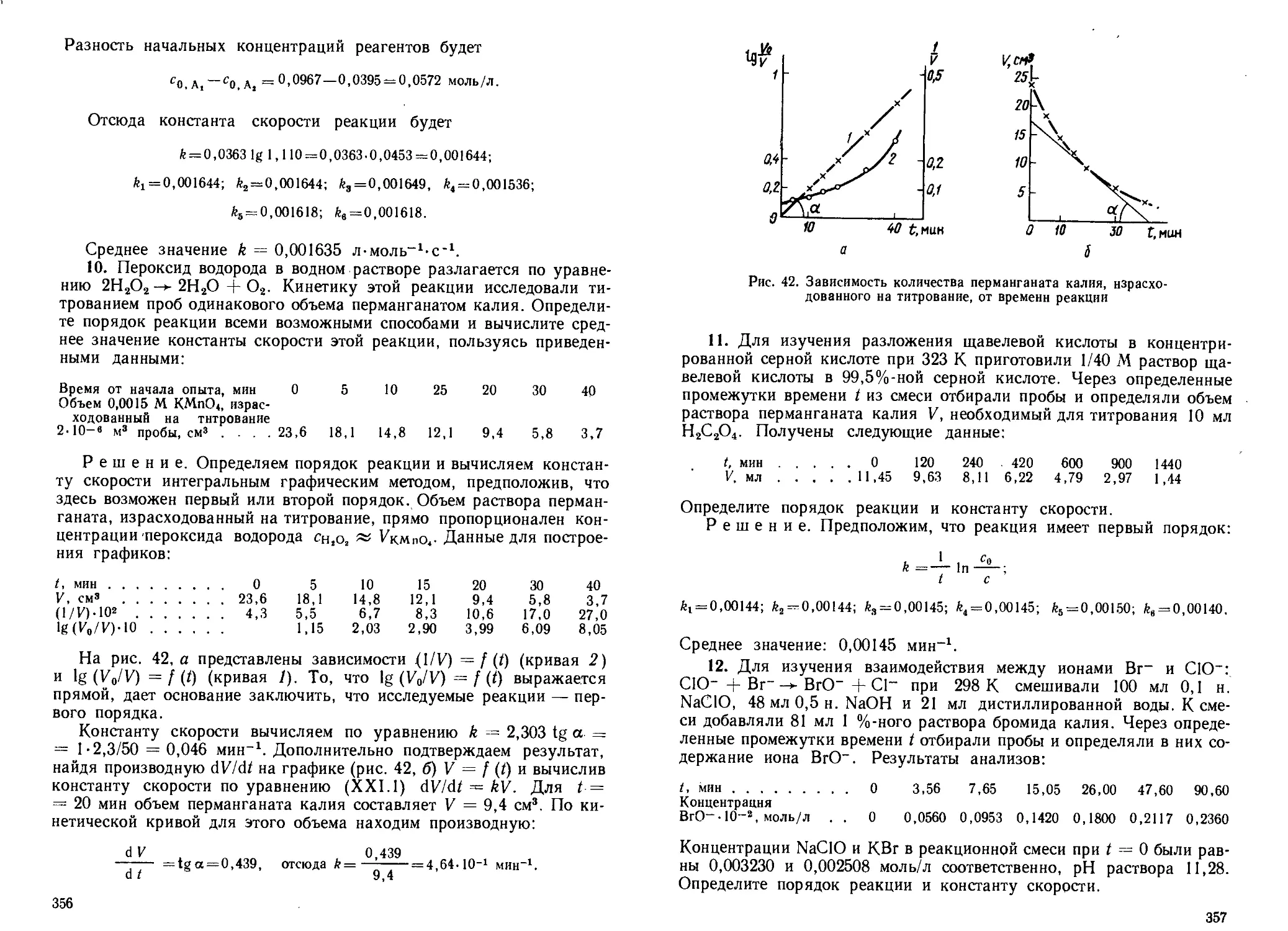
11. В спектре поглощения газообразного 1Н36С1 при 298 К и нор-
мальном давлении в 7?-ветви вращательно-колебательной полосы об-
наружены 13 заметных максимумов, волновые числа и оптические
плотности которых приведены в таблице:
/ й>е, СМ”1 D / <0е, см-1 D / см 1 D
0 2906,3 0,155 5 2997,8 0,362 9 3059,1 0,029
1 2925,8 0,418 6 3014,3 0,231 10 3072,8 0,011
2 2944,8 0,567 7 3030,9 0,129 11 3085,6 0,005
3 2963,2 0,583 8 3044,9 0,065 12 3098,4 0,001
4 2980,9 0,497
Определите долю молекул, находящихся на каждом вращательном
квантовом уровне, если коэффициент погашения молекул не зависит
от энергии вращения.
12*. Вычислите волновые числа 13 полос поглощения в /?-ветви
вращательно-колебательного спектра 1Н35С1, с учетом изменения
вращательной постоянной Вв, сое = 2990,95 см-1, соехе = 52,8185 см-1.
Определите а в уравнении (V.19) по известной v-линии /==12 (см.
данные задачи 11). Сопоставьте полученные значения волновых чисел
с экспериментальными, приведенными в задаче 11 или в справочни-
ке [M.L
13. В Р-ветви вращательно-колебательного спектра метана полу-
чены линии с волновыми числами (см-1): 3032,30; 3043,15; 3054,00;
3064,85; 3075,70. Определите момент инерции молекулы метана. Моле-
кула метана имеет симметрию Td. Определите равновесное межъядер-
ное расстояние и сопоставьте его со справочным значением [M.J.
40
14. Определите число колебательных степеней свободы линейной
молекулы CS2 (симметрия £>«,*), нелинейной молекулы SO2 (симметрия
С2г)), молекулы NH3 (симметрия С3в) и молекулы СН4 (симметрия Td).
15. В ИК-спектре поглощения MgF2 обнаружены три полосы:
240, 447 и 870 см-1. Последняя полоса имеет максимальную интенсив-
ность, средняя — минимальную. Молекула MgF2 имеет симметрию
С2в. Сделайте отнесение полос поглощения к определенным типам ко-
лебаний.
16. В ИК-спектре поглощения SnCl4 обнаружено три полосы в раз-
ными интенсивностями: 104 (сл), 129 (ср), 403 (с) см-1. (В скобках сл —
слабая, ср — средняя и с — сильная.) Сделайте отнесение колеба-
ний к определенному типу и определите вырождение каждого колеба-
ния.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. По собственным частотам колебаний атомов в молекуле А и ан-
гармоничности ше и <деХе определите: 1) волновое число v и частоту
v максимумов поглощения, соответствующих переходам молекул с уров-
ня с квантовым числом v — 0 на уровень 1 и с уровня v = 0 на
уровень v = 2 при неизменном электронном состоянии; 2) в каком
участке спектра — инфракрасном, видимом или ультрафиолетовом —
расположены полосы поглощения, соответствующие указанным пере-
ходам; 3) максимальное значение колебательного квантового числа
итах; 4) энергию колебательного движения на нулевом и на максималь-
ном колебательных квантовых уровнях (Дж); 5) энергию химической
связи в молекуле А (Дж/моль); 6) энергию колебательного движения
на 2—3 колебательных квантовых уровнях в интервале от уровня с и=0
до итах; 7) долю молекул, находящихся на нулевом и на первом коле-
бательных квантовых уровнях при 300 и 1000 К; 8) постройте график
зависимости энергии колебательного движения от колебательного
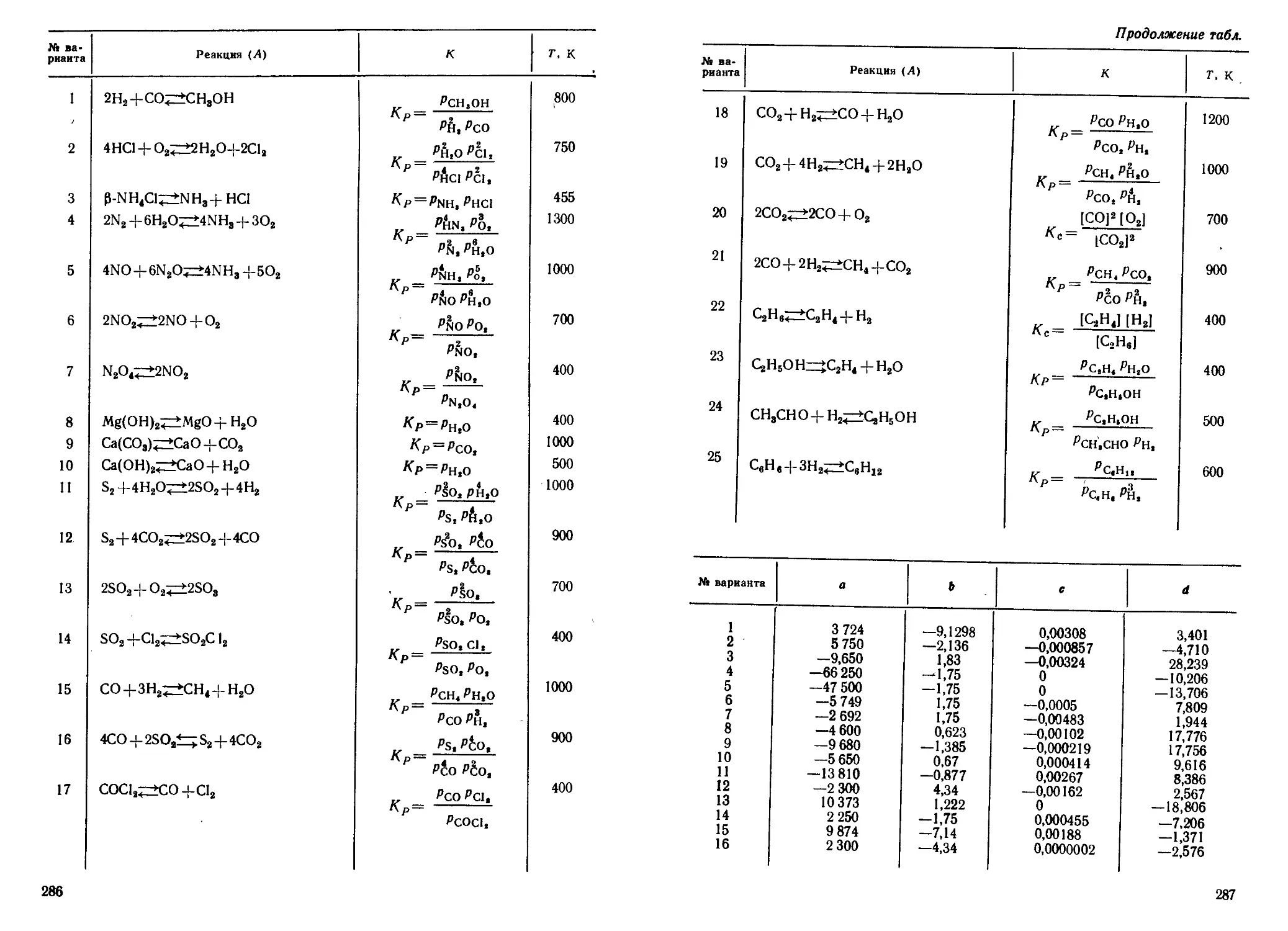
№ ва- рианта Молекула А а>е, см~1 СМ~1 Хз ва- рианта Молекула А см 1 (1) X е см“*
1 2990,95 52,82 14 2Н81Вг 1884,76 22,91
2 2Н36С1 2144,77 26,92 15 3Н81Вг 1548,14 15,45
3 3Н36С1 1775,86 18,36 16 3»C119F 787,50 7,00
4 1Н37С1 2988,70 52,74 17 s’ciihf 777,99 6,83
5 2Н37С1 2140,95 26,89 18 36С179Вг 443,10 1,80
6 3Н37С1 1770,35 18,25 19 36С181Вг 441,42 1,79
7 1Н’»Вг 2649,40 45,25 20 37С179Вг 434,72 1,77
8 2Н’9Вг 1885,33 22,73 21 з7С181Вг 433,01 1,76
9 зн’»Вг 1550,17 15,37 22 1H127J 2308,09 38,98
10 4H19F 4141,03 90,44 27 2Н12’1 1640,14 20,16
11 2H19F 3001,01 47,97 24 3H127I 1345,50 13,57
12 3H19F 2507,87 31,98 25 12C14N 2028,62 13,11
13 !H91Br 2649,03 45,25
41
квантового числа на основании рассчитанных выше энергий колеба-
тельного движения.
2. На основании данных, приведенных в задаче 1, для молекулы А
определите: 1) волновые числа трех первых линий поглощения в Р-
ветви вращательно-клебательной полосы; 2) волновые числа трех
первых линий в Р-ветви вращательно-колебательной полосы.
ГЛАВА VI
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Основные уравнения и символы
[К., с. 237—272; Г., т. 1, с. 22—33, 49—55, 72—76]
Для конечного изменения состояния системы первый закон термо-
динамики выражается уравнением
Q = A(7 + IT, (VI.1)
где Q — теплота, подведенная к системе или отведенная от системы;
А(/ — изменение внутренней энергии; W — работа. За положитель-
ную работу принята работа расширения системы. Изменение внутрен-
ней энергии равно
Д(7=(/2-(71, (VI. 2)
где Ux и {/2 — внутренняя энергия системы в начале и конце процесса;
H=U+PV, (VI.3)
где Н — энтальпия системы;
AH = AU + A(PV). (VI.4)
Для идеальных газов
АЯ = АС/ + Д\ (RT), (VI.5)
где Av — изменение числа молей газообразных веществ;
Av = S(Vj)K0H — S (vi)HCX = 2 Vj. (VI.6)
Работа изобарного процесса (Р = const)
W = P (V2—Vx), (VI.7)
где и V2 — объемы системы в начален конце процесса. Для идеаль-
ных газов
W = nR (Т2—Ti), (VI.8)
где 7\ и Т\ — температура газа в начале и конце процесса; Р —
молярная газовая постоянная.
42
Если 1 моль идеального газа нагревать при постоянном давлении
на 1°, то работа процесса будет
W = R. (VI.9)
Работа изохорного процесса (У = const)
1^ = 0. (VI.10)
Работа изотермического процесса (Т = const) расширения идеаль-
ного газа
W = Q = п RT In (V2/VJ = п RT In (PilPs),
(VI.H)
где n — число молей газа; Pt и Р2 — давление газа в начале и конце
процесса.
Работа адиабатического процесса (Q = 0)
JF=—Д{/, (VI.12)
W =-пСу (Т2—-Т1), (VI.13)
U7=(P1V1-P2V2)/(V-1), (VI. 14)
nRT / Vv—I \
W = 1 1 , у—1 I W-i / 1 \ 2 / (VI.15)
где Cv — изохорная теплоемкость газа; у = CplCv-, Рг и Р2 — на-
чальное и конечное давление; Ср — изобарная теплоемкость газа; Tt и
Т2 — начальная и конечная температура; и У2 — начальный и ко-
нечный объем. Давление и объем в начальном и конечном состояниях
системы связаны уравнением адиабаты
РХУУ=Р2И- (VI. 16)
Тепловой эффект химической реакции в изохорном процессе (И =
= const)
Qv = A£/=t/s-t/1. (VI.17)
В изобарном процессе (Р = const)
Qp=M{=Ht—H1. (VI. 18)
Первое следствие из закона Гесса описывается уравнением
Л Нт = 2 (vi Д Н1 т)кон -2 (V/ д H°f. т)исх, (V1.19)
1 I
i i
гдеу/—стехиометрический коэффициент; S(v/A//® г)к0!„ 2 (у^Щ,т)яв-
1 1
суммы стандартных тепловых эффектов образования конечных и ис-
ходных веществ реакции; АН’, т — тепловой эффект образования
вещества из простых веществ в стандартных условиях при темпера-
туре Т. За стандартные условия принято состояние вещества в чистом
виде при давлении 1 атм. Стандартное состояние вещества отмечается
верхним индексом «°».
43
Второе следствие из закона Гесса описывается уравнением
Д Н°т = 2 (vf д н°„, г)исх - 2 (v{ д//°СГ1 т)воп, (VI.20)
i i
где 2 (VjA/Zcr, т)исх. 2 (VjAZ/’r, т)кон— суммы стандартных тепловых
1 1
эффектов сгорания исходных и конечных веществ.
Зависимость теплоемкости веществ от температуры выражается
уравнениями:
для истинной теплоемкости
для идеальных газов
CP=^CV + R. (VI.22)
Уравнение для средней теплоемкости Су в интервале температур Т2 4-
— Ту имеет вид
Cl/ = (t/2-i/i)/(T3-Ti); Cp = (Hi-H1)/(T2-T1). (VI.23)
Средняя и истинная теплоемкости связаны уравнениями
1 т, т2
с„ = ~т_т~ } cvAT’ Ср- FL7 'J CPAT- (VL24>
2 1 j» 2 1 >р
Зависимость теплоемкости от температуры выражается уравнениями:
для неорганических веществ
С°р = а + ЬТ+с' Т», (VI.25)
для органических соединений
С°р =a + 6T + cT2-|-dT3, (VI.26)
для а, Ь, с, с' и d — коэффициенты, определяемые эмпирически или
на основании молекулярно-статистических расчетов. Данные коэффи-
циенты приводятся в справочниках.
Зависимость энтальпии вещества от температуры выражается урав-
нениями:
т
Нр — Нйй—^СйрАТ, (VI.27)
1
т
Я298 = J C^dT, (VI.28)
298
44
где Hq — энтальпия вещества при абсолютном нуле; 77“ — Щэа —
приращение энтальпии при нагревании вещества от 298 до Т К. Если
в интервале температур Т-т-298 происходят фазовые превращения, то
уравнение (VI. 28) имеет вид:
т Т
1 пер пл
^-«298 = У C^dT+AHnepH- У C9"dT+AZZon +
298 гпер
Гкнп т
+ J С°р" dT + AtfHcn+ У Cf'dT, (VI.29)
гпл гкнп
где Д77пер, Д77пл, А7/Нсп — теплоты перекристаллизации, плавле-
ния и испарения; Ср, С9Р , С9'Р", (?%"'— теплоемкости вещества в
низкотемпературном кристаллическом состоянии, в высокотемпера-
турном кристаллическом состояния, в жидком и газообразом состоя-
ниях. Полная энтальпия вещества (условная) при температуре Т
J°r= Afil 298 +^T~fi°29S), (VI.50)
где Jr—полная энтальпия вещества при температуре Т и при стан-
дартном давлении для того фазового состояния, которое устойчиво при
температуре Т\ Aftf, 298 — стандартная теплота образования вещества
при 298 К.
Зависимость теплового эффекта химической реакции от темпера-
туры выражается уравнением
= 2 (V/ С» )кои - 2 (v< С“)исх = А с°р, {VI.31)
1 1
i i
где 2 (v,CЯ)коИ, (vfC$) сх — суммы теплоемкостей конечных и ис-
11 м
ходных веществ; ДСр — изменение теплоемкости в ходе химической
реакции
А С°р = А а + A b Т + А с Т* + A d Т3 + А с'/Т2. (VI.32)
Уравнение (VI. 31) в интегральном виде будет
т,
AZZ^-AZZ^+j^ A C°p<i Т. (VI.33)
При фазовых превращениях некоторых веществ, участвующих в хими-
ческой реакции, уравнение (VI.33) преобразуется к виду
т т
пер пл \
AZZ9j = AZZ9i+ $ (AC9)'dT + AZ7nep+ $ (AC°)"dT +
т. т
1 пер
Гкнп Тг
+ ДЯпл+ $ (AC®,)"'dT + AZ7HCn+ $ (А С9)'”'dr. (VI.34)
т т
пл ннп
45
При расчете тепловых эффектов химических реакций при заданной
температуре можно воспользоваться приводимыми в таблицах средни-
ми значениями теплоемкостей в температурном интервале от 298 до Т
т
ДА4=ЛЯ°98+ J ДС° dT = Atf°98+AC° (Т-298). (VI.35)
298
Если в заданном температурном интервале происходит фазовое пре-
вращение одного или нескольких веществ, то удобно тепловой эффект
рассчитывать на основании таблиц полных энтальпий или таблиц
функций (Н° — Щ98):
Д = У (vf 7°)кон -2 (vf 7?)исх = Д Н*98+ Д (№-Я2°98)г, (VI.36)
1 I
Д («°-»298)г = 2 (Я»-Д°298)г, кон -2 Vi (W”-<8)r. исх. (VI.37)
1 1
При наличии фазовых превращений в интервале температур от 298 до
Т удобно воспользоваться значениями (Нт — Н^а), приведенными в
приложении для температур от 298 до 1000 К.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите работу изобарного обратимого расширения 3 моль
идеального газа при его нагревании от 298 до 400 К-
Решение. Работу изобарного расширения определяем по урав-
нению (VI. 8):
Г = 3-8,3143 (400 — 298) =2,544-103 Дж.
2. Определите работу испарения 3 моль метанола при нормальной
температуре кипения.
Решение. Нормальная температура кипения — это темпера-
тура кипения при внешнем давлении, равном 1,0133-10® Па. Нор-
мальную температуру кипения находим в справочнике [М.1. Тн.т.к =
= 337,9 К- Работу определим по уравнению (VI.7), так как испарение
происходит при постоянном давлении. Конечный объем приближенно
можно определить по закону идеального газообразного состояния
Vg = Л RTh.T.k/Р•
В первом приближении объемом жидкости можно пренебречь, так
как объем жидкости при температурах, далеких от критической, зна-
чительно меньше объема пара. Тогда
^ = Рп/?Тн.т.к/1’=Л1?7'н.т.к = 3.8,3143.337,9 = 8,428-103 Дж.
46
Для более точного решения находим [С.Х., т.1] при температуре
Т’н.т.к плотности жидкой фазы и пара: <1Ж = 0,7510-103, dn =
= 0,001222- 10s кг/м3. По плотностям находим объемы трех молей ве-
щества в жидком и газообразном состояниях:
п М
*'-77
3-33-10~3
-----------= 0,128-10-3 м3,
0,7510-Ю3
3-32-10-3 . ,
------------------= 78,560-10*3 м3.
dn 1,222
Поскольку плотность выражена в кг/м3, молекулярная масса будет
Л4-10-3. Тогда
1Г= 1,0133-105 (78,560—0,128) 1Q-3 = 7,9475-103 Дж = 7,9475 кДж.
3. Определите работу изотермического обратимого расширения 3
моль водяного пара от 0,5-106 до’0,2-106 Па при 330 К. Водяной
пар при таких параметрах подчиняется закону идеального газообраз-
ного состояния.
Р е ш е н и е. Работу определим по уравнению (VI. 11):
№ = 3-8,3143-330 In [0,5-105/(0,2-Ю5)] = 7,542-103 Дж = 7,542 кДж.
4. Определите работу адиабатического обратимого расширения 3
моль аргона от 0,05 до 0,50 м3. Начальная температура газа 298 К-
Решение. Для определения работы адиабатического расшире-
ния воспользуемся уравнением (VI-15). Величину у определим из Ср
и Су. Аргон — Одноатомный газ. Следовательно, его изохорная тепло-
емкость на основании молекулярно-кинетической теории идеальных
газов равна Cy=s/a R = 1,5-9,3143 — 12,4715 Дж/(моль К):
Cp=Cv+R= 12,4715 + 8,3143 = 20,7858 Дж/(моль-К),
7 = 20,7858/12,4715=1,667,
отсюда
8,3143-298
№ = 3 -----------
1,667 — 1
0,05«-в” \
1 ’--------| = 8,745-103 Дж = 8,745.кДж.
0,50».«»’
5. Определите тепловой эффект реакции
А12О3 корунд + 35О3= A12(SO<)3 кр + А Н°х
при 298 К и нормальном давлении.
Решение. Определим Д77® по уравнению (VI.19). Тепловые
эффекты образования исходных и конечных веществ в стандартном'со-
стоянии при 298 К находим в справочнике [MJ:
2А1 + 3/2О2 = А12Оз + Д НО
S (ромб) + 3/2О2 = SO3+ Д Я0
2A1+3S (ромб) +6O2 = A12(SO4)3 кр + Д Я0
Д Я£ = Д я£—Д Я°—ЗД я£ = -3434 + 1675+ 3-395,2= —573,4 кДж.
47
6. Определите тепловой эффект реакции
А12О3 корунд+3SO3 = A12(SO4)3 кр +д их
если реакция протекает при 298 К в автоклаве при постоянном объеме,
а тепловой эффект при Р = const равен — 573,4 кДж.
Решение. По тепловому эффекту реакции при постоянном дав-
лении определим тепловой эффект при постоянном объеме по уравне-
нию (VI.5) (изменение числа молей газообразных продуктов реакции
Av = — 3, так как А12О3 и Al2 (SO4)3 — твердые вещества):
ДС/2И = ДН®вв + 3-8,3143-298=—573,4-103 +
+ 7,433-103=-566,0-103 Дж=—566,0 кДж.
7. Определите тепловой эффект реакции образования ацетальдеги-
да из гликоля по уравнению
СН2(ОН)СН2(ОН)Ж = СН3СНОГ + Н2ОЖ + Д Н°х
при 298 К и стандартном давлении.
Решение. В данном случае удобнее рассчитать тепловой эф-
фект реакции по тепловым эффектам сгорания. В справочнике [-M.J
находим тепловые эффекты сгорания всех веществ, участвующих в ре-
акции. Следует обратить внимание на фазовое состояние продуктов ре-
акции сгорания. Так как для реакций
СН2(ОН)СН2(ОН)(ж) + 6/2О2 = 2СО2+ЗН2О(ж) + ДЯ<>
СН3СНОг+5/2О2 = 2СО2 + 2Н2О (ж) + ДЯ°
тепловой эффект сгорания воды равен нулю, то А7/“ — 0. По уравне-
нию (VI. 20) рассчитываем
Д7/° = Д7/°—Д//° — Д7/°= —1192,86+ 1192,44 = —0,42 кДж.
8. Вычислите тепловой эффект образования аммиака из простых ве-
ществ при стандартном давлении и 298 К по тепловым эффектам реак-
ций:
2Н2 + 02 = 2Н20(ж)+Д7/о (1)
4NH3+3O2 = 6H2O (ж) + 2М2 + ДЯ? (2)
Д/У® =—571,68 кДж, Д /У® =—1530,28 кДж.
Решение. Запишем уравнение реакции, тепловой эффект кото-
рой необходимо определить:
1/2N2+3/2H2=NH3 + Atf® (3)
Н2ОЖ и О2 не входят в уравнение (3), поэтому, чтобы исключить их из
уравнений (1) и (2), умножим уравнение (1) на 3 и вычтем из него урав-
нение (2):
6Н2 + ЗО2—4NH3—ЗО2 = 6Н2О (ж)+ЗДЯ®—6Н2О (ж)— 2N2 — & Н° (4)
48
После преобразования уравнения (4) и деления его на 4 получим
3/2Н2 +1 /2N2 = NH3 + (ЗД ТУ ° - Д я“) /4
ДЯ^,298 = ДЯ® = (ЗДЯ1 — ДЯ2)/4 = [3—(571,68) —
— (—1530,28)]/4=—46,19 кДж/моль.
9. Теплоты растворения 1 моль натрия и оксида натрия в воде при
стандартных условиях и 298 К' соответственно равны — 183,79 и
— 237,94 кДж/моль. Вода в обоих случаях берется в большом избытке.
Вычислите тепловой эффект АД’, 298 образования оксида натрия из
простых веществ при стандартных условиях и 298 К.
Решение. Запишем уравнение реакции, тепловой эффект кото-
рой следует определить, и уравнения вспомогательных реакций:
2Na + 1/2O2= Na2O + Д Н°х (1)
№+Н2ОЯзб = №ОН(р)+1/2Н1!+ДЯ® (2)
Na2O + H2O„36 = 2NaOH (р) + \Н°2 (3)
Чтобы исключить из уравнений (2) и (3) NaOH(p) в избытке воды, ко-
торый не участвует в реакции (1), из уравнения ракции (2), умножен-
ного на 2 , вычтем уравнение реакции (3):
2Na + 2H2O — Na2O — H2O=2NaOH (р) + Н2 +
+ 2Д/У? — 2NaOH (р)— Д (4)
После преобразования уравнения (4) получим
2Na + Н2О = Na2O + Н2 +2Д н\ — Д Н°2
Чтобы исключить из уравнения (4) Н2О и Н3 и ввести О2 сложим урав-
нение (4) с уравнением реакции образования воды из простых веществ:
Н2 + 1/2О2=Н2О + Д/У“ (5)
В справочнике [M.J находим АД’ = — 285,84 кДж/моль,
Д/У? 9ОЯ = Д7У“=2Д/У')-Д/У“+Д/У“ = 2 ( — 183,79)-
— (—237,94) + (—285,84) == —415,48 кДж/моль.
10. Определите тепловой эффект разбавления 30,8%-ного водного
раствора NaOH до концентрации 0,442 % при 298 К.
Решение. В справочнике [M.J находим интегральные теплоты
растворения. Так как в справочнике концентрации выражены в молях
Н2О на 1 моль NaOH, то пересчитаем концентрации:
30,8 69,2
----- моль NaOH растворено в ---- моль Н.,0
40,0 F F 18,0
1 » NaOH » в Xi » Н2О
69,2-40,0
х ------------= 5 моль н,0 на 1 моль NaOH.
1 18,0-30,8 2
49
Аналогично
0,442 хт 99,557
моль NaOH растворено в - моль Н2О
40,0--------------------------------------н 18,0-2
1 > NaOH » в х2 » Н2О
99 558-40 0
х, = —1-----— = 500 моль Н2О на 1 моль NaOH.
2 18,0-0,442
Интегральные теплоты растворения NaOH для начальной и конечной
концентрации растворов находим в справочнике [М.]:
Число молей Н2О на 1 моль NaOH............... 5 500
кДж....................................—37,76 —42,36
Д /7“азб = —42,36 — (—37,76) = —4,Б кДж/моль.
Разбавление раствора NaOH сопровождается выделением теплоты.
11. На основании изобарных теплоемкостей метана при нескольких
температурах
Г, К ............... 300 400 500 600 700 800 900 1000
С£, Дж/(моль-К) . . . 35,80 40,74 46,56 52,50 58,07 63,27 67,27 72,06
выразите зависимость уравнением вида Ср = f (Т).
Решение. Так как каждое опытное значение теплоемкости со-
держит ошибку измерения, то для описания зависимости уравнением
С°р=а+ЬТ±сТ*,
т.е. для определения коэффициентов а, b и с, воспользуемся методом
наименьших квадратов:
2С£ = па + &2 7'4-с2 7’2,
где п — число известных значений теплоемкости (в данной задаче оно
равно 8);
2 С°р Т = а 2 Т + Ь 2 Т“+с 2 Т3,
2 Ср 7'8=а 2 7’2-|-&2 Т’ + с 2 Т*.
Для упрощения решения задачи введем новые переменные:
х=(Т—300)/100, у=Сйр.
50
Т, к V X х‘ Xя X* ху х‘у
300 35,80 0 0 0 0 0 0
400 40,74 1 1 1 1 40,74 40,74
500 46,56 2 4 8 16 93,12 186,24
600 52,50 3' 9 27 81 157,50 472,50
700 58,07 4 16 64 256 232,28 929,12
800 63,27 5 25 125 625 316,35 1581,75
900 67,91 6 36 216 1296 407,46 2444,76
1000 72,06 7 49 343 2401 504,42 3530,94
2 436,91 28 140 784 4676 1751,87 9186,05
y=X + Y x + Zx*, d2 (у~2S (t/ —X —Ух—Zx2)=0, d X ^(y^-^^.-^^^y-X-Yx-Z^x^, 6У ™ _22 {y_x-Y x—Z x2)x2=0, d Z 2 (у—X— Y x—Zx2)=0, 2 (у— X—Y x— Z?) x = 0, 2 (y—X—Yx—Zx*) x2 = 0, 2 X = n X, 2y = ftX4-r2x + Z2x2, (a) 2 x«/ = X 2 х4-У 2.x24-Z2 x3, (6) 2 x2i/ = X 2 х2 + У 2 x3 + Z 2 x*. (в)
Подставив в уравнения (а), (б) и (в) значения 2х2у, 2х2,2х® и 2Х4, полу-
чим: 436,91 =8X+28r+140Z, (a') 1751,87 = 28X+140r + 784Z, (6') 9186,05= 140X + 784F + 4676Z, (в')
Решая совместно уравнения (а') — (в'), находим X, Y и Z:
3058,37 = 56X + 196Г + 980Z 3503,74 = 56X +280У +1568Z 445,37= 84V + 588Z 8759,35 = 140X+700У + 3920Z 9186,05 = 140X + 784У + 4676Z 426,80 84У =756Z
51
445,37 = 84Г + б882
426,80 = 84/ 4-7562
— 18,67 1682 2=—0,111
• 445,374-588-0,111 „ __
/ =-----'------1---=6,079,
84
3058,37-196-6,0794-980-0,111
X =-----------------------’--= 35,279,
56
п Т—300 / Т—300 V
<^=35,279 + 6,079 -^—0,И1(——) =
= 35,279 4-6,079-10-2T—18,237—0,lll-10-4T24-0,666-10-2T—
—0,999= 16,0434-67,45-10-3Т—11.1-IQ-’T2.
Полученная зависимость имеет вид:
С°р = 16,0434-67,45- 10-3Т— 11,1 • IO-® 7'2.
12. Вычислите среднюю теплоемкость аммиака Ср в интервале тем-
ператур от 298 до 1000 К-
Решение. Среднюю теплоемкость вычисляем по уравнению
(VI. 24). Уравнение Ср = f (Т) возьмем из справочника [M.J:
п 1,67-Ю5
С° = =29,804-25,48-10~37' — ——----.
Это уравнение справедливо в интервале температур от 298 до 1800 К:
1 ’с00 / 1,67-Ю5 х
с -------------- I (29,804-25,48-10-3Т — ——----- d Т =
р 1000—298 J \ Т*
298
= 0,001425 29,80 (1000 — 298 ) 4-12,74-10-3(10002 — 2983)4-
+ 1’67-106(-^
= 29,81 4-16,54 —0,56 = 45,79 Дж/(моль-К)-
13. Вычислите изменение энтальпии при нагревании AgCl от 298
до 1000 К при стандартном давлении (Д’ооо — Дт) и полную энталь-
пию AgCl при 1000 К. При 728 К происходит плавление AgCl, А7/пл
при температуре плавления 13,21 кДж/моль. Зависимость теплоемко-
сти AgClTB от температуры возьмите из справочника [М]. Теплоемкость
жидкого AgCl в интервале температур от 728 до 1000 К остается прак-
тически постоянной и равной 66,99 Дж/(моль-К)-
Решение. По уравнению (VI.29) определим теплоту нагрева-
ния- AgCl с учетом единственного фазового превращения в заданном
интервале температур:
728 1000
4-^98= $ с“тват+д//пл4- $ c°PjKdT,
298 728
52
Сл * * у • 1 \J
° =62,264-4,18-10-3Т— ---------,
₽тв Г2
n п Т/,. 11,30105Х
4-^298= $ (62,26 + 4,18-10-3 7-—-------— dT+
298 ' '
1000
+13,21.103 + 66,99d Г —62,26 (728—298)+2,09-10-3 (7282—2982)+
728
4-11,3010б [—------— )+13,21.103+66,99 (1000—728) =
\ 728 298 /
= 56,88-103 Дж/моль —56,88 кДж/моль.
Полную энтальпию вычисляем по уравнению (VI. 30),
находим в [M.J:
^1ооо = — 126,8+56,88= —69,92 кДж/моль.
14. Определите тепловой эффект химической реакции при 500 К
СН3ОН (г)+3/2О2 = СО2 + 2Н2О (г)
Теплоемкости всех веществ, участвующих в химической реакции, пос-
тоянные И раВНЫ С?>, 298*
Решение. Тепловой эффект находим по уравнению (VI.33), где
ДСр = AC^ 29g=const.
Необходимые величины теплового эффекта реакции при 298 К и изме-
нение теплоемкости найдем по теплотам образования всех веществ и по
теплоемкостям в справочнике [М]:
Вещество ' . . . со2 Н2ОГ о2 СН3ОНГ
Д//® 298’ кДж/моль • • • . . —393,51 —241,84 0 —201,2
Ср,298, Дж/(МОЛЬ-К) . . . . 37,13 33,56 29,36 43,9
ДД<>98 = ( — 393,51)+2 (-4241,84) —(—201,2) = —675,99 кДж,
3
ДСР, 298 = 37,13 + 2.33,56 — 43,9 —— 29,36=16,31Дж/К,
Д77gftO = -675,99-103 + 16,31 (500—298) = -672,7-103 Дж.
15. Определите тепловой эффект химической реакции
СН3ОН (г) +3/2О2 = СО2 + 2Н2О (г)
при 500 К и стандартном давлении. При расчете воспользуйтесь сред-
ними теплоемкостями веществ в интервале температур от 298 до 500 К-
Решение. Для определения А7/“оо воспользуемся уравнением
(VI.35). Тепловой эффект реакции при 298 К равен =—675,99 кДж.
Значения средних теплоемкостей Ср для интервала температур от
298 до 500 найдем в справочнике [М.]:
_Вещество..................... СО2 Н2О (г) О2 СН3ОН (г)
СР, Дж/(моль-К) ..... 42,05 34,48 30,29 52,21
53
Откуда \Ср = 13,365 Дж/(моль> К), АЯ’оо = — 675,99-103+13,365 X
X(500—298)= -673,29-103 Дж = —673,29 кДж.
16. Выразите уравнением зависимость теплового эффекта химиче-
ской реакции
СН3ОН (г) + 3/2О2=СО24-2Н2О (г)
от температуры, которое справедливо для интервала 2984-1000 К.
Решение. Для получения уравнения- Д/7?- = f (Т) воспользу-
емся выражением (VI. 33). Сначала установим зависимость изменения
теплоемкости от температуры. Эта зависимость выражается уравне-
нием (VI. 32). Коэффициенты в уравнениях (VI.25) и (VI.26) а, Ь, с и
с' найдем в справочнике [М.]:
Вещество c£ = f(T), Дж/(моль-К) Температур- ный интервал
а ft-103 с' -10“5 с-10*
со2 Н2О(г) СНзОЩгС О2 44,14 30,00 15,28 31.46 9,04 10,71 105,2 3,39 —8,54 0,33 0 —3,77 0 0 —31,04 0 298—2500 273—2500 298—1000 273—2000
2(Vf С£)кон 104,14 32,46 —7,88 0 298—2500
2(Vj Ср)исх 62,47 110,29 —5,66 —31,04 298—1000
Отсюда для данной реакции для интервала температур от 298 до
1000 К уравнение зависимости изменения теплоемкости от температу-
ры будет
Д С’=31,67 —77,83-10~3Т4-31,04-Ю"’?’3 —2,22-Ю’/Т"2;
ДС£ = 43,67; —77,83; —2,22; 31,04; 298 — 1000.
Подставляем под знак интеграла зависимость ДСр = f (Т) и проводим
интегрирование в пределах от 298 до Т, Т 1000:
г I 2,22-10» \
Д//J.= Д Т/§98 4~ \ 141,67—77,83- 10~3Т4-31,04-Ю-’Т3 ——-----I d Т ;
J \ 1 2 /
298 ......................................._
—675,99-10’4-41,67 (Т—298) —0,5-77,83-Ю~3 (7^—2983) 4-
+ — 31,04-10-в (Г3 — 2983) 4-2,22-105
3
= (675,99-9,444-3,46—0,27—0,74) 1034-41,67Т—38,91 • 10"3Т34-
2 22-105
4-10,35-10-’ Т3 4- —-----= -682,98-Ю34-41,677—38,91 -10-3 7^4-
2,22-10’
+ 10,35-10-’Т34---------.
_1______1_\
Т 298 /
54
Таким образом, получено уравнение зависимости теплового эффекта
реакции от температуры, справедливое в интервале температур от 298
до 1000 К:
ДДу.= —682,98-1034-41,677—38,91-10-3Т24-10,36-10“’Т34- 2,22-103/73.
17. Определите тепловой эффект реакции SO2 + С12 = SO2C12
при 800 К и стандартном давлении.
Решение. Воспользуемся таблицей значений (/7? — /7298)
для веществ, участвующих в химической реакции. Тепловой эффект
химической реакции при любой температуре может быть рассчитан по
закону Гесса:
ДД’ = д'д»98 + ^г(//’-//’98)(
где А/7298 —тепловой эффект реакции при 298 К; (Нт — H^s)— из-
менение энтальпии при нагревании вещества от 298 до Т К. В справоч-
нике находим значения А/7®, 29в:
Л#®9в = (— 358,74-296,9—°) 103= —61,8-103 Дж=—61,8 кДж
и значения (/7? — 77298) для веществ, участвующих в реакции:
т. к (#7—#298) 10 3> Дж/моль Г, К Я29в) Ю-3, Дж/моль
SO.CI, SO, CI, 50,01, SO, CI,
298 0,000 0,000 0,000 700 35,087 18,590 14,424
300 0,167 0,084 0,064 800 44,466 23,740 18,134
400 8,248 4,271 3,538 900 53,970 29,058 21,860
500 16,874 8,793 7,109 1000 63,559 34,459 25,604
600 25,834 13,566 10,748
дЯвоо = (—61,8-10’4-44,466 — 23,740—18,134) 103 =
= — 59,208-Ю3 Дж= —59,208 кДж.
18. Определите тепловой эффект реакции 2NaOH 4-СО2 =
= Na2CO3 4- Н2О при 700 К и стандартном давлении.
Решение. Выбор метода решения задачи по расчету теплового
эффекта химической реакции, в которой участвуют конденсированные
фазы, зависит от того, меняется ли фазовое состояние веществ в за-
данном интервале температур. Для выяснения фазового состояния
необходимо по справочнику [С. X., т. 1,2 ] определить температуры
фазовых правращений:
, Вещество Температура пере* кристаллизации а~>р, К Т. пл.. К Т. кип., К
a-NaOH 572 593 700
a-Na2CO3 629 700 —
55
Оба твердых вещества в интервале температур от 298 до 700 К меняют
фазовое состояние. В результате этого применение уравнения (VI.34)
сильно усложняет расчет. Поэтому расчет целесообразно провести по
уравнению (VI.36) (см. приложение):
Вещество.................a-NaOH
299’ кДж/моль........ —426,6
(^?00—^29в) ’ КДЖ/МОЛЬ • • 42,748
a-Na2CO3
—1129
—57,612
СО2
—292,51
17,782
Н2О(г)
—241,84
14,226
Д Я»98 = — 1129—241,84 + 2-426,6+393,51 = —124,13 кДж,
//g98) =57,612 + 14,226 —2-42,748 —17,782=—31,440 кДж,
Д//ооо = —124,13 — 31,440= —155,570 кДж.
19. Вычислите AZ калориметрического опьг4а с учетом поправки на
теплообмен: а) графически; б) аналитически.
При вычислении использовать следующие результаты наблюдений:
Начальный период Главный период Конечный период
№ отсче- та t, °C № отсче- та t, °C № отсче- та t, °C
1 2,357 12 2,900 18 3,632
2 2,360 13 3,420 19 3,632
3 2,363 14 3,570 20 3,631
4 2,367 15 3,600 21 3,631
5 2,371 16 3,635 22 3,631
6 2,372 17 3,633=6. 23 3,630
7 2,376 24 3,630
8 - 2,380 25 2,629
9 2,383 26 3,628
10 2,384 27 3,628
11 2,387=t0
Примечание. Температура дана в условных градусах (термометр
Бекмана).
Решение, а) Графический метод. В проведенном опыте из-
менение температуры составляет примерно 1,5°, что осложняет графи-
ческое определение А/ с точностью до 0,001°, поэтому при построении
графика зависимости температуры от времени используем три разных
шкалы ординат (рис. 10). Масштаб по оси абсцисс для всех трех графи-
ков однаков (1 мин — 10 мм), масштабы же по оси ординат разные.
Кривую ABCD построим в масштабе оси ординат I (1°—100 мм). Для
построения прямой АВ используем ось ординат III, для построения
прямой CD — ось ординат II. Масштабы осей ординат II и III одина-
ковы (0,01°—10 мм). Проекции точек В и С на ось ординат I дают точки
п и т соответственно. Точку К получим, разделив отрезок тп попо-
лам. Через току К проводим линию, параллельную оси абсцисс К.Р.
При пересечении прямой К.Р с кривой A BCD получаем точку I, через
которую проводим линию FE, параллельную оси ординат. Экстрапо-
56
Рнс. 10. Определение изменения температуры в ходе калориметрического опы-
та прн больших тепловых эффектах
лир уем прямые АВ и CD до пересечения с линией FE. По точкам пере-
сечения ta и tK находим At с учетом поправки на теплообмен:
Д/ = /h — /H = 3,634 — 2,391 = 1,243°.
б) Аналитический метод. В этом случае используем уравнение
Д t = (ZH— to) + 6,
где 6 — поправка на теплообмен, вычисляется по уравнению Реньо —
Пфаундлера — Усова
'о
/ / t п~!
01 v0 I tn —10 .
о = nva +------I---------Н 7
6п-6о у Т
где п—число отсчетов в главном периоде опыта; —средний ход тем-
пературы за один отсчет в конечном периоде опыта; — то же, в на-
чальном периоде опыта; 0О — средняя температура калориметра в на-
чальном периоде (сумма I и II отсчетов, деленная на 2); 0П— то же,
57
для конечного периода; tn — последний отсчет главного периода; i0—
п— 1
последний отсчет начального периода; — сумма температур всех
отсчетов главного периода, кроме последнего отсчета, т. е. + /2+
• 2 + 1*
Вычисляем
поправку на теплообмен 6:
3,633 — 3,628
у _ ------------
1 10
2,357 — 2,387
ve =-------------= —0,0030°,
° 10
Ui 4-u2= 0,0005 — (—0,0030) = 0,0035°,
3,633+3,628
е п =-----у-:-----=з,бзо0,
2,357+2,387
е0 =-------------= 2,372о >
= 0,0005°,
о
0П—0О= 3,630 — 2,372=1,258°,
отсюда
tn—te 3,633—2,387
= —-------------= 3,010°,
2 2
n —1
2 = 2,900 + 3,420 + 3,570 + 3,600 + 3,635 = 17,125°
1
n-60 = 6-2,372= 14,232,
nV0 = 6 (—0,0030) = —0,0180,
6=—0,018 + 0,00278 (3,010 + 17,125 —14,232) = —0,0016°.
Следовательно,
A i = 3,633 —2,387+ (—0,0016) = 1,246—0,002 = 1,244°.
20. Определите теплоту растворения (q) KC1 массой 2 г в 100 г во-
ды по интегральным теплотам растворения КС1 при 298 К-
Решение. Вычислим моляльную концентрацию т получен-
ного раствора КО:
2/74,5— 100 г Н2О
т —1000 » Н2О
2-10
т ———— = 0,269 моль/1000 г.
74,5
Найдем в [M.J интегральную теплоту растворения КС1 в
найдем в IM.J интегральную теплоту растворения КС1 в воде при
298 К (&Нт = 17,56 кДж/моль) и вычислим теплоту растворения 2 г
КС1:
g-\Hm 2 (17,56-103)
Ч =~м--------------—— ----------= 2830 Дж = 2,83 кДж.
2"КС1 74,5
58
21. Рассчитайте &t процесса разбавления 5 мл насыщенного раст-
вора LiCl в 200 мл воды при 298 К, если суммарная теплоемкость ка-
лориметрической системы W = 1248 Дж/град.
Решение. Моляльность раствора (т]), насыщенного при 298 К,
находим в справочнике [M.J, т1 = 19,9 моль/1000 г. Молекулярная
масса LiCl равна 42,4. Вычисляем содержание LiCl в насыщенном
растворе:
т, М-100
Р= —---------
lOOO + mjM
19,9-42,4-1000
1000+19,9-42,4
= 46 % (по массе).
В справочнике находим плотность насыщенного раствора d =
= 1,290 г/см3.
Количество молей LiCl (п), содержащихся в 5 мл насыщенного
раствора, составляет:
5dP-10-2 5-1,29-46-10-2
„ =------------ =-------------- = П. ПК07
Моляльность раствора (/п2), полученного в результате разбавления
5 мл насыщенного раствора 200 мл воды, равна
______п-1000 _________ 0,0697-1000_________
/"2= 200 dHj0 + (5dp_pa n М) ~ 200-1 +(5-1,29—0,0697-42,4) ~
= 0,341 моль/1000 г.
Находим по справочнику [M.J теплоты растворения LiCl для раст-
воров с моляльностью тг и /п2: кН™ — — 19,35 кДж/моль, А//™ =
= — 36,14 кДж/моль.
Вычисляем по закону Гесса теплоту разбавления А/7, выделяющую-
ся при разбавлении раствора от концентрации 19,9 до 0,341
моль/1000 г на 1 моль растворенного вещества:
ДЯ = ДЯ™—ДЯ? = —16,79 кДж/моль.
Теплота разбавления 0,0697 моль LiCl составляет
— <7 = ДЯп=( —16,79) 0,0697=—1169 Дж = —1,17 кДж.
Определим А/ для заданной суммарной теплоемкости калориметри-
ческой системы:
q 1169
Д t=—— =-------------= 0,936.'
W 1248
22. Вычислите теплоту образования 1 моль твердого раствора
KBr-KCl из индивидуальных веществ при 298 К- Состав твердого
раствора: 8 моль КС1 на 1 моль КВг. Теплота растворения 2 г твердого
раствора в 100 мл воды 460,0 Дж, а теплота растворения 2 г механи-
ческой смеси в 100 мл воды 466,0 Дж.
Решение. Рассчитаем теплоту растворения КВг в КС1 при об-
разовании 2 г твердого раствора заданного состава:
<7 = 466,0 — 460,0 = 6 Дж.
59
Масса 1 моль раствора составит (средняя молекулярная масса Л4)
-= 1Л4КВг +8Л4КС1 _7Q 4
9
о 2
Отсюда число молей (2пг) твердого раствора в 2 г: =
= 0,0251, Вычислим теплоту образования 1 моль твердого раствора
Q:
о 6
Q = — = ~ „ лос, = 240 Дж/моль.
п 0,0251
ЗАДАЧИ
1. Рассчитайте изменение внутренней энергии при испарении 20 X
X 10-3 кг этилового спирта при нормальной температуре кипения, если
его удельная теплота испарения 837,38-103 Дж/кг, а удельный объем
пара при этой температуре 607-10~3 м3/кг. Объемом жидкости пре-
небречь.
2. Определите изменение внутренней энергии при испарении 1 кг
воды при нормальной температуре кипения, если теплота испарения
равна 2258,7 Дж/кг. Считать пар идеальным газом и пренебречь объе-
мом жидкости.
3. При 273 К и 1,0133-105 Па нагревают 5-10~3 м3 криптона до
873 К при постоянном объеме. Определите конечное давление газа и теп-
лоту, затраченную на нагревание.
4. В резервуаре вместимостью 5-10~2 м3 при 200 К и 0,5- 10й
Па содержится азот. Определите теплоту, которую необходимо пере-
дать газу, чтобы его давление стало бы 2- 10й Па. Считать азот в ука-
занных условиях идеальным газом. Необходимые для решения данные
возьмите из справочника [М.1.
5. При 298 К 1 • 10-2 кг кислорода сжимаются адиабатически от
8-10~3 до 5-10~3 м3. Определите конечную температуру, работу про-
цесса сжатия, изменение внутренней энергии и изменение энтальпии,
если Су = 6/2 R.
6. В резервуаре при 298 К находится неизвестный газ. Предпола-
гается, что это азот или аргон. При внезапном расширении 5-10~3
м3 этого газа до объема 6-10“3 м3 его температура снизилась примерно
на 20°. Какой газ — аргон или азот — содержится в резервуаре?
7. Определите конечную температуру газов Аг, Н2 и Н2О, если при
адиабатическом сжатии давление увеличить (или объем уменьшить) в
10 раз. Начальная температура 298 К. Считать, что газы находятся в
идеальном состоянии.
8. При 298 К одноатомный газ в идеальном состоянии изотермиче-
ски и обратимо расширяется от 1,5-103 до 10-103 м3, при этом поглоща-
ется 966-103 Дж теплоты. Рассчитайте число молей газа, участвующего
в процессе.
60
9. В сосуде при 273 К и 1,01 • 10s находится 10s моль одноатомного
газа в идеальном состоянии. Рассчитайте конечную температуру, дав-
ление газа и работу процесса расширения газа до объема, в 2 раза
превышающего первоначальный: а) при медленном изотермическом рас-
ширении в цилиндре с поршнем, двигающимся без трения; б) при адиа-
батическом расширении в аналогичных условиях; в) при мгновенном
удалении перегородки между сосудом и вакуумированным пространст-
вом того же объема. Объясните различие результатов, полученных
в трех процессах.
10. Рассчитайте теплоту, необходимую для нагревания 3-103 моль
аммиака от 273 до 473 К при постоянном давлении. Необходимые дан-
ные возьмите из справочника [М.].
11. Рассчитайте изменение энтальпии при нагревании 2 кг
a-SiO2 от 298 до 800 К, если зависимость теплоемкости от температу-
ры выражается уравнением
С“ =46,94 + 34, ЗМО-3?-11,3- 10»/Т«.
12. Определите изменение энтальпии при нагревании 10 кг газооб-
разного метанола от 400 до 700 К при давлении 1,0133-105 Па. Зависи-
мость теплоемкости от температуры возьмите из справочника [М.1.
13* . По зависимости теплоемкости твердого гептана от температу-
ры найдите методом графического интегрирования изменение энталь-
пии (7/182,5 — Но) для твердого гептана. Определите изменение эн-
тальпии в процессе С7Н1втв> ок С7Н1вжЛ82,бк, если теплота плавле-
ния гептана при 182,5 К равна 14,051 -103 Дж/моль.
г, к z-»0 Ср, Дж/(моль-К) г, к Ср» Дж/(моль-К) т, к С°Р, Дж/(моль-К)
15,14 6,28 38,43 36,55 86,56 83,02
17,52 8,83 42,96 41,95 96,20 90,35
19,74 11,43 47,87 47,56 106,25 97,22
21,80 14,25 53,18 53,59 118,55 105,05
24,00 17,22 65,25 65,69 134,28 113,67
26,68 20,66 71,86 71,34 151,11 123,68
30,44 25,45 79,18 77,58 167,88 133,81
34,34 30,85
14. Вычислите в уравнении Дебая Су = АТ3 коэффициент А для
гептана, если при 15,14 Су = 6,28 Дж/(моль- К). Определите (//“5,14 —
—Но) по уравнению Дебая. В интервале температур 15,15—182,5К
определите графически изменение энтальпии, пользуясь данными зада-
чи 13. Вычислите изменение энтальпии твердого гептана в интервале
температур 0—182,5 К-
61
15. Рассчитайте разность (АЯ°— А[/°) при 1,0133—105 Па в
следующих процессах:
На + ’ЛОз^НаО (при 298 К) (а)
СНЭСООС2НВ + Н2О=СНЭСООН+С2НВОН (при 298 К) (б)
i/2N2 + 3/2H2 = NH3 (при 673 К) (в)
С + 2Н2 = СН4 (при 1073 К) (г)
16. Воду довели до температуры кипения при давлении 1 атм. Ког-
да через сопротивление, находящееся в тепловом контакте с ней, про-
пустили электрический ток в 0,5 А от 12-вольтового источника в тече-
ние 5 мин, было обнаружено, что отогналось, а затем сконденсирова-
лось 0,798 г воды.
Рассчитайте изменение молярной внутренней энергии и молярную
энтальпию испарения воды (А(7ИСП и A/7lIcn)-
17. Определите тепловой эффект реакции
CH=CH + COJ-H2O (ж) =СН2=СНСООН (ж)
при стандартном давлении и 298 К, если известны теплоты сгорания
веществ:
Вещество...........СН=СН СО Н20(ж) СН2=СНСООН(ж)
ДЯ“Г> 298- кДж/моль . —1299,63 —283,18 0 —1368,03
Определите тепловой эффект реакции при постоянном объеме.
18. Рассчитайте теплоты образования метана из простых веществ
при 298 К и стандартном давлении и при V = const на основании сле-
дующих данных: для Н2О (ж) А//', ?98 = — 285, 84 кДж/моль; для
СО2А/У^, 298 = — 393,51 кДж/моль; теплота сгорания СН4 АЯ?Г, 298 =
= — 890,31 кДж/моль.
19. Теплота образования Fe2O3 из простых веществ равна при
298 К и стандартном давлении — 821,32 кДж/моль, а А12О3 =
= 1675,60 кДж/моль. Рассчитайте тепловой эффект реакции восста-
новления 1 моль Fe2O3 металлическим алюминием.
20. Определите теплоту образования As2O3 из простых веществ
при 298 К и стандартном давлении, если известны следующие термохи-
мические уравнения:
As2O34-3H2O (изб) = 2H3AsO3 (раств)4-31,61 кДж (а)
As3/аС1а — AsCl# (г)— 270,3 кДж (б)
AsCl3 (г)4-ЗН2О (изб) =H3AsO3 (раств)4-ЗНС1 (раств)—73,60 кДж (в)
1/2Н24-1/2С12 = НС1 (г)-92,37 кДж (г)
НС1 (г)4-Н2О (изб) = НС1 (раств)—72,49 кДж (д)
Н24-1/2О2==Н2О (ж) — 285,Й4 кДж (е)
21. Вычислите тепловой эффект реакции при 298 К и стандартном
давлении:
СаС2 (тв)4-2Н2О (ж)=Са(ОН)2 (тв)4-С2Н2
Данные о теплотах образования возьмите из справочника [М.]
62
22. Определите теплоту образования из простых веществ при стан-
дартном давлении и 298 К следующих соединений: а) жидкого бензола
СвНв; б) жидкого гликоля С2НвО2; в) твердой щавелевой кислоты
(СООН)2; г) жидкого анилина CeH5 NH2. Для решения воспользуйтесь
справочными данными о теплотах сгорания 1М.1.
23. Вычислите тепловые эффекты следующих реакций при 298 К
и стандартном давлении:
(СООН)а (тв) = НСООН (ж)+СО2 (а)
СаНБОН (ж) + О2 = СН3СООН (ж)+Н2О (ж) (б)
2СН3С1 (r)+Mg (тв) =C2He (r)+MgCl2 (в)
ЗСаНа (г)=СБН, (ж) (г)
CH4+4SOaCla (ж) = СС14 (ж) +4SO2+4HC1 (д)
24. При сгорании нафталина в калориметрической бомбе при 298 К
с образованием воды и диоксида углерода тепловой эффект равен
— 5152,96 кДж/моль. Вычислите теплоту сгорания нафталина при по-
стоянном давлении, если водяной пар,, образующийся при сгорании
нафталина: а) конденсируется; б) не конденсируется.
25. Генераторный газ имеет объемный состав (%): СО — 21,85;
СО2—7,12; Н2—13,65; СН4—3,25; О2—0,90 и N2 — 53,23. Определите
теплоту, выделяющуюся при сгорании 1 м8 генераторного газа, при-
веденного к условиям Р = 1,0133-105 Па и Т — 298 К, если сгорание
газа происходит полностью. Водяной пар не конденсируется.
26. Определите тепловой эффект разбавления водой 100 кг
77,76 %-ной азотной кислоты до концентрации 25,91 %. Для расчета
воспользуйтесь справочными данными [М.].
27. Определите теплоту, которая выделится при добавлении к
0,3 кг воды 0,1 кг 50%-ной серной кислоты. Данные о теплотах раст-
ворения возьмите из справочника [M.J.
. 28. Рассчитайте тепловой эффект процесса смешения 0,5 кг 20 % -
ной серной кислоты и 1 кг 60%-ной серной кислоты. Для расчета вос-
пользуйтесь данными справочника IM.].
29. Тепловой эффект растворения безводного сульфата лития
—26,71 кДж/моль. Тепловой эффект растворения кристаллогидрата
Li2SO4-H2O —14,31 кДж/моЛь при 298 К. Вычислите тепловой эф-
фект образования Li2SO4-H2O из безводной соли и воды. Опреде-
лите процентное содержание воды в частично выветренном кристалло-
гидрате сульфата лития, если тепловой эффект растворения 1 кг этой
соли равен —0,146-10s кДж.
30. Вычислите тепловой эффект реакции нейтрализации соляной
кислоты гидроксидом натрия в бесконечно разбавленном растворе из
следующих данных:
НСЬ 46,5НаО+Na ОН • 1065,5НаО = NaCl • 1112, ОНаО—57,903 к Дж
НС1-46,5НаО+1065,5НаО = НС1-1112,0-Н2О—1,462 кДж
НС1-1112,ОНаО + огНаО = НС1-ооНаО—0,419 кДж
NaOH • 1065,5НаО -}- ооНаО = NaOH • ооНаО—0,376 кДж
NaCl • 1112,0НаО + ооНаО = NaCl • ооН20—0,292 кДж
63
31. Определите теплоту образования кристаллической аминоуксус-
ной кислоты NH2CH2COOH при 298 К и стандартном давлении на
основании ее теплоты сгорания, равной — 976,72 кДж/моль. Полу-
ченную величину сопоставьте со справочной [M.L
32. Определите теплоту сгорания кристаллического «-нитрофенола
CeH5NO3 при 298 К, если теплота образования ЛЯ®, 298 = — 191,66
кДж/моль. Полученную величину сопоставьте со справочником [М.].
33. Определите тепловой эффект реакции SO2 + С12 = 5О2С12
(ж) при 340 К, если принять, что теплоемкости всех реагирующих ве-
ществ не зависят от температуры и равны теплоемкостям при 298 К.
Значения теплоемкостей возьмите из справочника [M.J.
34. Определите тепловой эффект реакции Na (тв) + х/212 (тв) =
= Nal (тв) при 370 К. Зависимость теплоемкостей от температуры
возьмите из справочника.
35. Составьте уравнение зависимости молярной теплоты сго-
рания водорода при постоянном давлении от температуры; образу-
ющийся водяной пар не конденсируется. Установите предел темпера-
тур, для которых справедливо полученное уравнение. Вычислите теп-
ловой эффект реакции при 800 К.
36. Составьте уравнение зависимости теплового эффекта химиче-
ской реакции С (графит) + Н2О = СО + Н2 от температуры. Рассчи-
тайте ЛЯ“ооо-
37. Тепловой эффект сгорания графита при 298 К ра-
вен — 393, 795 кДж/моль, а алмаза при той же температуре — 395,
692 кДж/моль. Удельные теплоемкости для этих веществ соответ-
ственно равны 720, 83 и 505,58 Дж/(кг-К). Рассчитайте теплоту
перехода графита в алмаз при 273 К.
38. Теплота испарения метанола при 298 К равна 37,5 кДж/моль.
Определите теплоту испарения метанола при 320 К. Теплоемкости
жидкого и газообразного метанола возьмите из справочника [М.].
39. Вычислите тепловой эффект образования А1С13 из простых ве-
ществ при 423 К и стандартном давлении. Тепловой эффект при 298 К
и завимимости теплоемкостей от температуры возьмите из справочни-
ка [М.]
40. Определите тепловой эффект реакции
2a-NaOH+a-SiO2 = a-Na2SiO2+H2O (г)
при стандартном давлении и 800 К- Необходимые данные возьмите из
справочника [М.]. Теплота плавления NaOH при 595 К составляет
6,36 кДж/моль.
41*. Определите тепловой эффект реакции S + О2 = SO2 при
390 К и стандартном давлении. Необходимые данные возьмите из спра-
вочника [М.]. Сера при 390 К находится в моноклинной кристалличе-
ской модификации. Температура фазового превращения 368,6 К.
42. Вычислите тепловой эффект реакции SO2 + Cl2 = SO2C12
при 500 К. Для решения воспользуйтесь значениями (Нт — Яш),
приведенными на с. 55.
64
43* Теплоемкости «-пропана при различных температурах:
Т, К ............... 300 400 500 600 700 800 900 1000
С°, Дж/(моль-К) . . . 73,8 94,6 112,9 129,0 143,1 155,3 165,3 175,1
Выведите аналитическую зависимость Ср = f (Т) в виде степенного
ряда Ср = а + ЬТ + сТ2.
44. Платье, в котором вы вымокли, впитало 1 кг воды и холодный
ветер высушил его. Какое количество потерянной теплоты необходимо
возместить организму? Сколько глюкозы нужно потребить, чтобы вос-
полнить эту потерю? Предположим, что ваш организм не возместил по-
терю теплоты. Какова будет ваша температура после высыхания одеж-
ды (предположите, что теплоемкость вашего тела равна теплоемкости
воды).
45. Одним из факторов, учитываемых при выборе холодильных
жидкостей, является их энтальпия испарения. Небольшое количество
фтороуглерода с М = 102 помещено в сосуд с электрическим нагре-
вателем. При давлении 650 мм рт. ст. жидкость кипит при 351 К. При
пропускании через нагреватель, помещенный в кипящую жидкость,
тока в 0,232 А от 12-вольтного источника в течение 650 с получилось
Г,871 г дистиллята. Определите молярную энтальпию и внутреннюю
энергию испарения фтороуглерода.
46. Поршень, оказывающий давление 1 атм, находится на поверх-
ности воды при 100° С. При уменьшении давления на бесконечно ма-
лую величину испарилось 10 г воды. На этот процесс израсходовано
22,2 кДж теплоты. Определите Q, W, &U, \Н и' АДтдля процесса ис-
парения.
47. Определите графически с точностью 0,001° действительное из-
менение температуры при калориметрическом измерении температуры
через каждые 30 с по термометру Бекмана:
Номер отсчета Температура Номер отсчета Температура Номер отсчета Температура
0 2,299 10 2,319 20 1,683
1 2,300 11 2,050 21 1,700
2 2,303 12 1,800 22 1,708
3 2,305 13 1,658 23 1,718
4 2,307 14 1,638 24 1,727
5 2,308 15 1,639 25 1,738
6 2,311 16 1,641 26 1,747
7 2,313 17 1,653
8 2,315 18 1,662
9 2,317 19 1,671
48. Вычислите изменение температуры калориметра и раствора при
растворении 2 г NH4NO3 в 100 мл воды. Тепловая константа калори-
метра Д’ — 52,3 Дж/К.
з Зак. 767
65
49. Теплота растворения 2 г смеси кристаллогидратов сульфата
меди — различного состава равна нулю. Установите, какие формы
кристаллогидратов смешаны и в каком массовом соотношении. Рас-
считать процентное содержание воды в системе.
50. Вычислите интегральную теплоту растворения при 298 К 1 моль
КС1 в воде при образовании насыщенного раствора, если теплота
разбавления 10 мл насыщенного раствора в 100 мл воды q =
= — 87,86 Дж. Теплоту растворения для полученного раствора
взять из справочника.
51. Рассчитайте истинную теплоемкость Ср кристаллического
Ba(NO3)2 при 700 К по средним теплоемкостям в интервале темпера-
тур от 298 К до Т:
Т, К..................... 500 600 700 800
СР, Дж/(моль К).......... 174,01 183,38 192,73 200,66
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Вычислите тепловой эффект реакции А при 298 К: а) при Р =
— const ; б) прн V = const. Тепловые эффекты образования веществ
при стандартных условиях возьмите из справочника (M.J.
№ ва- рианта Реакция А № ва- рианта Реакция A
1 2На + СО = СН,ОН(ж) 14 SO2 + Cla = SO2Cla
2 4НС1 + О2 = 2НаО(ж) + 2С1а 15 CO + 3Ha = CH4 + НаО(ж)
3 NH4C1(TB) = NHS+Hai 16 2CO -|- SO2 = 5(ромб) -j- 2COa
4 2Na + 6НаО(ж) = 4NHS -J- ЗОа 17 CO-|-Cla = COCla(r)
5 4NO + 6Н2О(ж) = 4NH, + 5О2 18 COa -J- Ha = CO -J- НаО(ж)
6 2NOa = 2NO + Oa 19 COa + 4Ha = CH4 + 2НаО(ж)
7 N2O4 = 2NO2 20 2COa = 2CO -J- O2
8 Mg(OH)a = MgO + HaO(r) 21 CH4 -J- CO2 = 2CO + 2Ha
9 СаСО3 = CaO -j- COa 22 CaH,= CaH4+Ha
10 Ca(OH)2 = CaO -j- H2O(r) 23 С2Н5ОН(Ж) = СЛ + НаО(ж)
И Б(ромб) + 2НаО(ж) = SOa -J- 2Ha 24 СН8СНО(г) + Н2 = С2Н5ОН(ж)
12 Б(ромб) -J- 2COa=SO2 + 2CO 25 С.Н.(ж) + ЗНа = С«Н1а
13 2SOa + Oa = 2SOs
2. Вычислите тепловой эффект образования вещества А из простых
веществ при 298 К и стандартном давлении, если известна его теплота
сгорания при этой температуре и стандартном давлении (С. X., т. 1].
Сгорание происходит до СО2 (г) и Н2О (ж).
66
Nt ва- рианта Вещество А Формула Состояние
1 Уксусная кислота С,Н4Оа ж
2 1,1-Этнленхлорнд C3H4L12 ж
3 Этиленхлорид г
4 Этиленгликоль ж
5 Диметиламин c,h7n ж
6 Ацетон С.Н.О ж
7 Пропиламин C,HBN ж
8 Изопропиловый спирт CSH8O ж
9 Пропиловый спирт CgHgO ж
10 Глицерин CjHgO ж
11 Бутнроннтрил C4H7N ж
12 Бутиловый спирт CfHjgO ж
13 трет-Бутнловый спирт C4H10O ж
14 Днэтиловый эфир ^HiqO ж
15 Пирндни C5H5N ж
16 Амиловый спирт ж
17 Днхлорбензол C8H4Cla ж
18 Нитробензол C8HBOaN ж
19 Фенол CgHgO ТВ
20 Г ндрохинон C8H8Oa ТВ
21 Анилин CeH7N ж
22 Цнклогексанол C.HlaO ж
23 Бензойная кислота C7H8Oa ТВ
24 Бензиловый спирт C7H8O ж
25 Гептанол-1 C7H18O ж
3. Вычислите выделяющуюся или поглощающуюся теплоту при
разбавлении а кг водного &%-ного раствора вещества А в с кг воды
при 298 К. Для расчета воспользоваться справочными данными об ин-
тегральных теплотах растворения {M.J.
Nt ва- рианта Вещество А a b c Nt ва- рианта Вещество A a b c
1 НС1 1 26 2 < 14 KOH 4 45 3
2 НС1 2 38 3 15 KOH 5 40 1
3 НС1 3 30 4 16 KOH 1 35 2
4 HaSO4 4 90 1 17 HNO, 2 50 4
5 HaSO4 5 80 2 18 HNOS 3 40 5
6 H2SO4 1 70 3 19 NH. 4 30 10
7 H.SO4 2 60 3 20 LiCl 5 30 3
8 НС1 3 34 1 21 LiBr 1 45 2
9 NaOH 4 30 1 22 NaBr 2 40 6
10 NaOH 5 25 2 23 KI 3 50 6
11 NaOH 1 40 3 24 NaCl 4 26 10
12 NaOH 2 35 4 25 Nal 5 30 10
13 KOH 3 50 2
3*
67
4. Выведите аналитическую зависимость теплового эффекта (Дж)
реакции А от температуры, если известен тепловой эффект этой реак-
ции при 298 К. Уравнения зависимости С? = f (Т) возьмите из спра-
вочника (М.1. Вычислите тепловой эффект реакции при температуре Т.
Постройте графики зависимости
1(^с%)кон=НП; 2(^^)ИС1=НЛ и
1 1
в том интервале температур, для которого справедливо выведенное
уравнение зависимости ЛЯ? = f (Т). Определите графически
при температуре 7\. Рассчитайте ЛС? при этой температуре.
№ вари- анта Реакция А T, К Л. К
1 2Ha + CO = CHsOH(r) 800' 350
2 4НС1 + О2 = 2НаО(г) + 2С1 а 750 650
3 6-NH4C1 = NH, + HC1 455 450
4 2Na + 6Н2О(г) = 4NH.+ЗО2 1300 1000
5 4NO + 6Н2О(г) = 4NH,+5О2 1000 900
6 2NOa = 2NO + O2 700 500
7 N2O4 = 2NO2 Mg(OH)2 = MgO + H2O(r) 400 350
8 500 310
9 СаСО, = СаО + СО. Са(ОН)2 = СаО+Н2О(г) 1000 700
10 500 340
11 1 /2Sa(r)+2НаО(г) = SO2 + 2На 1000 900
12 VAfr) + 2СОа = SOa + 2СО 2SO2 + Оа = 2SOa SO2 + Cl2 = SOaCl2(r) 900 850
13 700 600
14 400 300
15 16 CO + 3Ha = CHt+H2O(r) 2CO+SO2 = */2§2(г) + 2C O2 1000 900 900 700
17 CO + C12 = COC12 400 . 350
18 CO2 + H2 = CO+H2O(r) 1200 1000
19 CO2 + 4H. = CH4+2H2O(r) 2CO2 = 2CO + O2 1000 900
20 700 500
21 CH44-CO2 = 2CO+2H2 CaH, = C2H4 + H2 900 320
22 400 350
23 C2HBOH(r) =C2H4+ H2O(r) 400 300
24 CH.CHO(r) + H2 = C2H5OH(r) C,H,(r) +3H2 = C«Hla(r) 500 450
25 600 500
5. Определите тепловой эффект химической реакции А при темпера-
туре Т. Для расчета воспользуйтесь таблицей функций (Я?—Я^эв)
из приложения.
68
Хе ва- рианта Реакция А т, к № ва- рианта Реакция A T, к
1 со-|-с 1^= coci2 500 14 СО-|-У2О2 = СО2 700
2 СО + У2О2 = СО2 500 15 H2+ УгО2 = Н2О 700
3 Н2+У2О2 = Н2О 500 16 NHs+HC1 = NH4C1 600
4 NH, + HC1=NH4C1 400 17 2NaOH + COa = 700
5 2NaOH-|-CO2 — = Na«CO, + H2O Н2-|-ziSa = H2S 500 18 = Na.COa + H2O H2+y2S2 = H2S 700
6 500 19 CO + Cj = COCI2 800
7 8 СО + С12 = СОС12 СО+У2О2 = СО2 600 600 20- 21 Н2+У2О2 = Н.О NH,+ HC1 = NH4C1 800 700
9 Н2+У2О2 = Н2О 600 22 2NaOH + COa = 800
10 NH,+ HCl = NH4Ci 500 rig -j- 72Og -j- rigb
11 2NaOH+CO2 = NajCO3+ 600 23 800
+н2о 24 CO + CI2 = COCl2 900
12 Н2-|- y2s2 = H2s 600 25 CO-y УгО2 = СО2 900
13 CO + C12 = COC12 700
ГЛАВА VII
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Основные уравнения и символы
[К., с. 273—281; Г., т. 1, с. 75—131]
Взаимосвязь между теплотой и работой в процессе, осуществляемом
по циклу Карио, описывается уравнением
где т| — КПД цикла; — количество теплоты, сообщенное при тем-
пературе 7\ системе, совершающей данный цикл; Q2— количество теп-
лоты, отданное системой при температуре Т2; W — работа, совершен-
ная системой.
Основные свойства энтропии: в обратимом процессе при переходе
системы из состояния 1 в состояние 2 изменение энтропии определяет-
ся по уравнению
р 6Q
AS==J“V"' (VII.2)
где 6Q — элементарное количество теплоты.
В изолированной системе (V, U = const) энтропия является кри-
терием направленности самопроизвольного процесса и состояния рав-
новесия:
AS>0.
(VII.3)
69
Изменение энтропии при нагревании (охлаждении) от Тг до Тг при
постоянном объеме или постоянном давлении определяют по уравне-
ниям:
т,
AS = Jcv-^-, (VII.4)
г,
р' dT
AS=\Cp—(VII.5)
J т
Tt
Изменение энтропии при поглощении теплоты при постоянных тем-
пературе и давлении или объеме рассчитывают по формулам:
bS = Qp{T, (VII.6)
&S — QV/T. (VII.7)
Изменение энтропии при изотермическом расширении п моль идеаль-
ного газа можно определить по формуле
Д S — n R In (V2/Vi) (VII.8)
или
AS = n/?ln(P1/P2). (VII.9)
Изменение энтропии при поглощении теплоты п моль идеального газа
выражают
при Р = const Д S = nCy In (Ts/T^ + nR In (Vj/V,), (VII.10)
при V = const ^S=nCpln(T1/TI)~nRln(Pi/P1). (VII.11)
Изменение энтропии при адиабатическом расширении идеального
газа определяют по формуле
SS^nCvln(P2Vv/P1Vv). (VII. 12)
Для химической реакции изменение энтропии ДЗреак рассчитывают
по уравнению
Д 5реак = 2 (У1 5°)кон—S (Vj S°)Ha4, (VII. 13)
где S (у{30)кон> 2 (vi‘S°)Ka4 — суммы абсолютных энтропий конечных
и исходных веществ:
Л ДС
(Д Зреак)?-, = (Д ^рвак)^-j* • (VII. 13а)
Г»
Изменение энтропии для фазовых переходов Д3ф.н будет
Ь5ф,а=ЬНф.П/Т. (VII. 14)
Абсолютную энтропию 3£ рассчитывают по уравнению
= И d Г.... + s -А -R In Ps, (VII. 15)
J -r ”
o'
70.
где первая сумма выражает изменение энтропии в процессе нагрева-
ния, вторая сумма—изменение энтропии при фазовых переходах;
7? In Ps — изменение энтропии при расширении (сжатии) насыщенного
пара от равновесного давления до 1 атм.
Основные свойства термодинамических потенциалов: энергия Гиб-
бса G и энергия Гельмгольца А:
P,T = const, —A.G = W, (VII.16)
V, T = const, —ДЛ = №', (VII.17)
где AG и АЛ — изменения энергий Гиббса и Гельмгольца в каком-
либо процессе; W —полезная работа. Энергии Гиббса и Гельмголь-
ца являются критериями направленности самопроизвольного процесса
и состояния равновесия:
при Р и T=const ДО<0, (VII.18)
при V и T = const ДЛ<0, (VII. 19)
&A = bU—T&S, (VII.20)
bG = bH—T&S, (VII.21)
где АЛ, At/, AS, AG, А// — изменение соответствующих функций в
любом физико-химическом процессе; при Т — const
ДО = ДЛ-)-Д (PV). (VII.22)
Для идеальных газов при Т = const
ДС=ДЛ-|-Д nRT, (VII.23)
где Ап — изменение числа молей газообразных веществ в ходе физи-
ко-химического процесса.
Изменения энергий Гиббса и Гельмгольца при нагревании (охлаж-
дении) от Tj до Тг при постоянном давлении или объеме выражаются
в дифференциальной форме уравнений:
=—S, \ дТ )р (VII.24)
(dbG\ ( дТ )р Л ’ , (VII.25)
(-^-1 \ дТ jv (VI 1.26)
1 ^А\ AC к д Т /д v (VI 1.27)
и в интегральной форме:
т, т, бГ1—бГ1=| —SdT; ДОГ8 —AGri=J —ASdT;
г, т, АТг— ATi =f —SdT; Д Лг> —Д Лп = f —ASdT. т, Т,
71
В небольшом интервале температур, если Ср — const, то
G2—G1 = &G = (Cp—STJ(T2—-T1)—CpT22,3\g(T2/T1)' (VII.28)
Изменения энергий Гиббса и Гельмгольца при сжатии или расшире-
нии, когда Т = const, выражаются в дифференциальной форме урав-
нениями:
\ dV = — Р, 1т (VII.29)
/ д G ) = v, )т (VII.30)
\ дР
< QS.G (VII.31)
V дР •) =ди, 1т
АГ — изменение объема в ходе физико-химического процесса;
и в интегральной форме: для 1 моль идеальных газов
А2 —Л1 = Л A = RTln (Vj/Fa), (VII.32)
Ga-G1 = /?7’ln (P2/Pi); (VII.33)
для конденсированных систем при умеренных давлениях
О2-О1 = Кк.ф(Р2-Р1), (VI 1.34)
где Гк.ф — объем конденсированной фазы; для химических реакций
(Т = const)
A Gj реак = 2 (vi О/,Окон— 2 (vi & ^/’Онач. (VI 1.35)
где 2 (v«АС/Окою 2(viAG/Онач “ СУММЫ энергий Гиббса образова-
i i
ния для конечных продуктов и исходных веществ;
A бреак = 2 (А б/,/)кон 2 Ф.Онач, (VI 1.36)
» i
&Ga = kHl) — T&Sa, (VII.37)
где ДО0, А№, AS0 — изменение соответствующих функций в стан-
дартных состояниях при температуре Т.
Изменение энергии Гиббса для фазовых переходов
Д0ф.п=0, (VII.38)
для испарения и возгонки.
ЬАф'П=-ЦТ, (VII.39)
для плавления и полиморфных превращений
А Лф.п=0. (VII.40)
72
ЗАДАЧИ С РЕШЕНИЯМИ
1. При начальной температуре 373 К 1 моль кислорода совершает
цикл в идеальной машине Карно. Сначала он расширяется изотерми-
чески до двукратного объема, затем расширяется адиабатически до
трехкратного объема (по сравнению с первоначальным), затем сжимает-
ся изотермически до такого объема, чтобы в результате последующего
адиабатического сжатия вернуться к первоначальному состоянию. При-
няв у = CpICv = 1,4, рассчитайте работу, совершенную газом в
каждой части цикла; работу, произведенную за счет теплоты в цик-
ле, и КПД цикла.
Решение. 1. Для первой стадии цикла — изотермического
процесса — работу определяем по уравнению
Г7. = п/?Т’1п (V2/V1) = Q7-,
откуда
IFj = 8,314-373.2,31g = 2146,06 Дж.
2. Для второй стадии цикла — адиабатического процесса — работу
определяем по уравнению
W2 = nR Т1~^
у —1
температуру Т2 определяем по уравнению
[ 2V, \v—1 / 2 \»-4
Ts = Л —; Т2 = 373 — =317,2К.
\ О» 1 / \ о /
Следовательно,
»/2 = 8,314 -373~317'2 =1159,8 Дж.
2 0,4
3. Для третьей стадии цикла работа будет отрицательна, так как
происходит сжатие газа W3 = — nRT In (V3/К4), где по условию V3=
= ЗКЬ а объем Vt должен быть получен согласно указанию о том, что
после адиабатического сжатия газ должен вернуться в исходное со-
стояние, следовательно, должно выполняться равенство
( Vi У~‘Т1
k V J - п ’
откуда
,1=и,'уД;
Таким образом,
№3=— 8,314-317,2-2,31g (3V1/1,5V1) = —1824,86 Дж.
73
4. Для четвертой стадии цикла работа адиабатического процесса
будет отрицательна и численно равна работе во второй стадии, так как
в результате адиабатического расширения газ возвращается к перво-
начальной температуре:
Wi=-nR
Т1—Т,
—------ = 1159,8 Дж.
У — 1
Суммарная работа за весь цикл W = + 1F2 + 1F3 + 1F4 будет
равна
№ = 2146,06—1824,86 = 321,2 Дж.
КПД цикла: ц = 1F7QX, где = Лх;
321,2
т) =-------= 14,96 %.
' 2146,06
К этому же результату придем, если определим ц из равенства (VII. 1):
Т, — Т„ 373—317,2
л = —i=------------------= 14,96 %.
1 7\ 373
2. В двух сообщающихся сосудах, разделенных перегородкой, на-
ходятся 1 моль азота и 2 моль кислорода. Перегородку вынимают, газы
смешиваются. Рассчитайте изменение энтропии ASCMein, если исход-
ные температуры и давления одинаковы, а объемы различны; Vn2 =
= 1 л; Уо2 = 2 л. Конечное давление смеси равно исходному давле-
нию газа.
Решение. Процесс смешения газов необратим, и изменение
энтропии выражается неравенством AS> J у-. Но если необратимый
и обратимый процессы проводятся в одних и тех же граничных усло-
виях, то ASo6p = ASueoCp. Всякий необратимый процесс можно мыс-
ленно провести обратимо в несколько стадий в тех же граничных ус-
ловиях и подсчитать энтропию для каждой обратимой стадии. Тогда
сумма изменений энтропии этих стадий будет равна изменению энт-
ропии необратимого процесса. В данной задаче общее изменение
энтропии можно заменить суммой изменения энтропий за счет расши-
рения каждого из газов по отдельности, т. е. принять, что ASCMeuI=
= ASn2 +ASo,.
Согласно уравнению (VII.8)
Д SNj = R In (K/VN!); Д SOi = R In (V/V02);
^=^n,+ ^02= i+2 = 3 л
и
Д5Смеш= — 2,3-8,31 (1g i/3 — 21g2/3) = 15,876 Дж/(моль-К)
(*n2 = 14, *o2 = z/3 — молярные доли азота и кислорода).
3. Смешали 1 моль аргона, взятого при 7^=293 К, с 2 моль азота,
взятого при TNs — 323 К. Исходные давления компонентов и конеч-
74
ное давление смеси одинаковы. Вычислите температурную со-
ставляющую энтропии смешения. Теплоемкость аргона Срт = 20,8
Дж/(моль-К) и азота Ср2 = 29,4 Дж/(моль-К).
Решение. Процесс смешения газов необратим, поэтому вычисля-
ем общее приращение энтропии системы как сумму изменений энтро-
пий компонентов за счет увеличения температуры и за счет уменьшения
давления, т. е.
A 5смет — (A 5n2 +А -5Аг)изм. 7-(A SNj + A SAr)„3M. Р.
Слагаемое (ДЗы, + А5аг)Изм.т является температурной составляю-
щей общего приращения энтропии в результате смешения. Соглас-
но уравнению (VI 1.5)
(A SNi + А 5Аг)изм r = nNf ф. 2,31g (T/TNj) + пАг сАг 2,31g (T/TAr), (1)
Т — конечная температура смеси, вычисляется по уравнению тепло-
вого баланса
•Ф "Аг (’’-’’Аг) = Ф "N, (ГЫ “Л. (2)
где nAr, nN2— количества молей аргона и азота. Подставляем числа в
уравнение (2):
20,8-1 (Т— 293) =29,4-2 (323—Т).
После преобразования уравнения (2) и вычислений находим Т =
= 315 К- Подставляем числа в уравнение (1):
A S = 29,4-2-2,31g (315/323) 4-20,8-2,31g (315/293) =
= —1,458+1,504 = 0,033 Дж/(моль-К) •
4. Вычислите изменение энтропии в процессе затвердевания 1 моль
переохлажденного бензола при 268 К, если при 278 К Д//Плс,н, =
= 9956 Дж/моль, (СР)£н, = 127,3 Дж/(моль-К), (СР)с.н. = 123,6
Дж/(моль-К); Р — const = 1,0Ы05Па.
Решение. Этот процесс необратим, поэтому мысленно прово-
дим его обратимо в три стадии (см. пример 2):
СвН9(ж), 268 ————. CeHe (тв), 268
t
AS, AS,
CeHg (ТВ), 278,5
♦ AS,
СвНв(ж), 278,5 ----
Тогда AS = ASj + AS2 + Д33.
Вычисляем ASX и AS3 по уравнению (VII.5); AS2 — по уравнению
(VII. 14). Тогда
AS = C« 2,31g ------——^—+ С™ 2,31g ——,
р 268 278,5 р s 278,5
278 5 9956 268
А 5= 127,3-2,31g -------— +123,6.2,31g——=35,61 Дж/(моль-К).
2оо 2/0,0 2/о,О
75
5. Рассчитайте стандартную энтропию этилена, если температуры
и теплоты фазовых превращений этилена соответственно равны:
Тпл = 103,9К; АЯПЛ = 3363 Дж/моль; Тннп = 169,4 К; АЯНСП =
= 13595,4 Дж/моль. Зависимость теплоемкости от температуры см. в
таблице:
Т, к z-»0 Ср, Дж/(моль-К) т, К ✓->0 Ср, Дж/(моль-К) т, К л* ® Ср, Дж/(моль-К) т, к Ср® Дж/(моль-К)
15 2,864 70 42,756 103,0 82,40 160 67,37
20 6,380 75 45,486 103,6 86,44 — —-
25 10,655 —- — — 179,6 36,90
30 14,948 80 48,510 105 69,47 192,8 36,99
35 19,664 85 51,87 НО 69,13 210,8 37,51
40 23,793 90 55,82 — 231,4 38,54
45 27,476 85 61,87 120 68,54 250,9 39,75
50 31,055 98,1 67,33 130 68,08 272,1 41,68
55 34.486 100 71,61 140 67,70 293,9 43,42
60 37,476 101,4 75,47 150 67,49 — —.
65 40,123 102,3 78,01 — — — —.
Решение. Определяем стандартную энтропию по уравнению
stb = Г5 d т+ '“с’9 dт+ 3363'4 ,+
S298 -J т dr+ J Т dT+ 103,9 +
0 15
298
г \ьр)сгн.
169,4 \ж , .
Г (CpJCiH. 13595,4
। ---------и / + -----------
J Т 169,4
103,9 169,4
dT.
Т
Пересчитав приведенные значения С£> на С$!Т и построив график
(рис. 11), находим энтропию для каждого интервала темпе-
ратур:
1) методом графической экстраполяции или по уравнению Дебая
С°р = 1943,5 f-y-V = а Т3,
где 9 — характеристическая температура:
Рис. 11. Зависимость С°р/Т от температуры
для этилена
S15.0“ Sq = 0,966 Дж/(моль-К);
2) графически для интер-
вала 15,0—103,9 К
о0 тв о0 тв ___
^103,9“ °15,0“
= 51,28 Дж/(моль-К);
3) для фазового перехода
д с0 _ сО Ж о0 ТВ ____
3 ° пл — ‘’юз.э- °103,9 ~
3363,4
— —-—— =32,34 Дж/(моль-К);
76
4) графически для интервала 103,9—169,4 К
s?69,4-si03,9==33>22 Дж/(моль-К);
5) для фазового перехода
А S?69.4- S?6l,4 = =80,26 ДжДмоль-К);
6) графически для интервала 169,4—298 К
$298~' ‘5169,4 = 21>60 Дж/(моль-К);
7) сумма изменений энтропий во всех интервалах температур будет
равна $298 = 219,62 Дж/(моль-К).
6. Вычислите энтропию хлорида серебра при 870 К.
Решение. Согласно уравнению (VII. 15)
S° — S° -l-V f Ср d 7* I А
+ 70, AgCl ~ Л298, AgCl + ~~ ° 7 + Z1 Т
Выписываем из справочников [M.J, [С. X., т. 2] необходимые данные
Тпл = 728 К; АЯПЛ = 12886,7 Дж/моль; C^gCI = 66,94 Дж/(моль • К)
•SXgci.298 = 96,07 Дж/(моль-К); = 62,26 + 4,18 Т — 11,30 X
X lOVT2. Подставляем числа в уравнение
„о „ Т/ 62,26 , 4,18-10-* 11,30-10+
S^gci, 870 = 96,07+ J -7—+-^------------------ dT+
298 ' '
870 . 12886,7
+ 66,94.2,31g----------—.
s 728 728
После интегрирования получаем
Sg70 = 96,07+55,55+1,80—5,309+ 17,70+ 11,92= 177,70 Дж/(моль-К).
Приращение энтропии AgCl за счет нагревания составит
(S870 —529в) =81,63 Дж/(моль-К) И S“gCl> 870 — 177,70 Дж/(моль-К).
7. Определите изменение энтальпии, внутренней энергии и энтро-
пии при переходе 2,7 кг воды, взятой при Рх = 1,0133-105 Па и 7\ —
= 298 К, в пар при Р2 = 0,50665-105 Па и Т2 = 373 К, Ср ~ С* =
= 4,187-103 Дж/(кг-К), удельная теплота испарения 2260,98-10®
Дж/кг. Считать пар идеальным газом.
Решение. Изменение свойств системы не зависит от пути про-
цесса, а определяется только начальным и конечным состояниями сис-
темы. Выбираем любой путь, состоящий из отдельных обратимых
стадий, и тогда изменение свойств в данном процессе будет равно сум-
ме изменений свойств в каждой стадии. Пусть рассматриваемый про-
цесс состоит из следующих обратимых стадий: 1) нагрев воды при Рх=
= 1,0133-10® Па от 7\ — 293 К до Т2 = 373 К; 2) превращение
воды в пар при Рх = 1,0133- 10э Па и Т2 = 373 К; 3) изотермическое
77
расширение водяного пара при Т2 = 373 К от Рг = 1,0133-105 Па
до Р2 — 0,50665-105 Па. Рассчитаем изменение энтальпии:
ДЯ = ДЯ1 + ДЯ2+ДЯ3,
373
Д#1 = т ( Ср d 7’ = 2,7-4,187-10s (373 —293) =904,392-103 Дж,
293
Д//2 = т/= 2,7-2260,98-103 = 6104,646-103 Дж,
ДЯ3 = 0.
Согласно закону Джоуля энтальпия и внутренняя энергия идеального
газа при постоянной температуре не зависят от давления или объема.
Следовательно,
Д Я = 904,392-103 + 6104,646-103 = 7009,038-103 Дж,
так как Ср ~ Су,
ДС/ = ДС/1 + ДС/2 + ДС/3,
то
Д С1 = ДЯ1 = 904,392-103 Дж,
Д С2 = ДЯ2—рД У = ДЯ-Р (Уц — Уж).
Если пренебречь объемом жидкой фазы, то
Д U2 = Д Н2 — р Уп = Л Нг — п R У2 = 6104,646 • 103—
2,7
----8,315-103-373 = 5639,419-103 Дж,
Д С3 = 0.
Изменение внутренней энергии данного процесса АС = 904,392X
X 103 +5639,419• 103 = 6543,811 • 103 Дж, а изменение энтропии:
Д S = Д Sj+Д S2+Д S3,
3? Ср d Т т
bS^m \ ----------= mC«2,3031g -2- =
293 Т Т1
= 2,7-4,187-10*-2,3031g -^-= 3,525-103 Дж/К,
« о ДЯ2
Д52 =-----
Г2
6104,646-103
-----—--------16,366-103 Дж/К,
о /о
р 2 7 1 0133 105
iS, = „Rln^ = _^8.3l5.l0..2,№lg_L___ ,C,WWJWI,
Д S = 3,525-103 +16,366-103 + 0,865-103 = 20,756-103 Дж/К.
8. Установите, осуществима ли при V = const и 298 К реакция
Ag+nCl2 = AgCl (тв) + (п — 1/2) С12, использовав свойства энтро-
пии.
Решение. Энтропия явля'ется критерием направленности про-
цесса только в том случае, если процесс протекает в изолированной сис-
78
Теме, поэтому мысленно проводим исследуемую реакцию при V =
= const и отсутствии теплообмена с окружающей средой. Чтобы рассчи-
тать AS процесса, принимаем: реакция проходит мгновенно и до кон-
ца при 298 К; выделившаяся теплота идет на нагревание избытка С12
и твердого AgCl; реакционный сосуд теплоту не поглощает; тогда об-
щее изменение энтропии складывается из энтропии реакции (ASpeaKi298)
и энтропии нагревания AgCl и Cl2 (ASHarp):
A S= A Spean+ А -^яагр-
Вычисляем ASpeaK при 298 К по уравнению (VII. 13):
S^gci = 96,07 Дж/(моль-К); S^g = 42,69 Дж/(моль-К); S&, =
= 223,0 Дж/(моль-К) ([М.], табл. 6; [С.Х. т. 1, 2]). После подстанов-
ки чисел и вычислений получаем А5реак, 298 = — 57,90 Дж/(моль-К)-
Для вычисления ASHarp сначала по уравнению теплового баланса
определяем конечную температуру AgCl (ж) и С12 (г). Составляем
уравнение теплового баланса, предположив, что конечная температу-
ра системы выше температуры плавления AgCl:
А^реак, 298 = ^AgC| (7ПЛ — 298) + А ЯПл + (7 —7ПЛ) -|-
+ пс12 Су, CI, (7—-298). .
Принимаем, что избыток С12 составляет «ci, = 5 моль. Из справочни-
ков [М.], [С.Х., т. 1, 2] имеем АЯпл а8с1 = 12886, 7 Дж/(моль-К);
CAgci = 66,94 Дж/(мольП<); А//£еак = — 127068 Дж/моль; CXgci =
= 58,99 Дж/(моль-К); Ср,с;2 = 36,36 Дж/(моль-К)- Определяем
теплоемкость при постоянном объеме:
Су. ci, = Ср, cie —/? = 36,36—8,314 Дж/(моль-К).
Вычисляем конечную температуру, а затем рассчитываем изменение
энтропии при нагревании:
A SHarp = A SAgC| + A SC| (,
A ^AgCl = (*"*81 о —$298 ) = 81 >67 Дж/(моль - К);
AS£i2 вычисляем по уравнению (VI 1.4) и соотношению Су = СР —
- R:
4° р
S —iT-
298
as® Т С^т -7 С»АТ
а ^ci, = j —— j —f—
298 298
Рассчитываем интегралы:
8 7 0 rj4
?----= (S»,o-S2«98 ) =38,28
298 7
8р° R 870 870
\ —d 7’=2,3/?lg------= 2,3-8,3141g-----= 8,895 Дж/(моль-К).
J Г 298 298 7
298
Дж/(моль-К);
79
Подставляем полученные числа в уравнение для расчета ASHarp
А 5дагр — 81.67+ 38,28+8,895 = 228,6 Дж/(моль• К) >
отсюда общая энтропия процесса
Д s= —57,91 +228,6= 170,70 Дж/(моль-К).
Таким образом, AS > 0. Реакция в принятых условиях (6Q =0;
Тнач = 298 К; const) осуществима.
9. Определите изменение энтропии для реакции
Cd + 2AgC 1 = CdCl2 + 2Ag
если проводить ее в гальваническом элементе при 1,0133-105 Па и
298,2 К, ЭДС элемента компенсируется приложенной извне и равной
0,6753 В. Стандартные теплоты образования хлоридов кадмия и сереб-
ра соответственно равны — 389,0 и —126,8 кДж/моль.
Решение. Тепловой эффект реакции в соответствии с законом
Гесса равен
А^298 =(Д^“, 298)cdCl2~2 (Д 298)AgCl =
=—38 900—2 ( — 126 800)=—135 400 Дж.
Так как реакция необратима, то ASpc > — 135400/298,2.
Для расчета ASP.C необходимо реакцию провести обратимо. Если же
осуществить эту реакцию в помещенном в термостат гальваническом
элементе, в котором поддерживаются неизменными температура и дав-
ление, и если ЭДС элемента Е компенсируется ЭДС, приложенной из-
вне, то процесс будет практически обратимым. При этом будет произ-
ведена работа IFmax — nFE, а тепловой эффект Q будет равен TAS:
A{7 = Q-B7max = Q-(PAV+ir^ax))
или
Q = bH + Wmax = bH+nFF.
Подставляя в последнее уравнение значения АДоэв (изменение энталь-
пии не зависит от пути процесса, поэтому оно будет одинаковым как
в необратимом, так и в обратимом процессах) и п = 1, Е = 0,6753 В и
F = 96 487 Кл, получаем
Q = —135 400 + 2-0,6753-96 487=—5084,7 Дж.
Следовательно, ASP.C = — 5084,7/298,2=—17,05 Дж/(моль-К). Из-
менение энтропии изолированной системы в целом (т. е. рабочая систе-
ма плюс термостат) при фактическом процессе будет равно
.о „ 235 400
А3и.с= —17,05+ — — = 437,0 Дж/(моль-К),
298,2
что подтверждает необратимость процесса.
10. Используя энергию Гиббса, решите, осуществима ли реакция
Ag + х/2 С1.2 = AgCl при Р = const = 1,013-105 Па и 298 К.
80
Решение. Для ответа на вопрос следует определить знак ДО
реакции. Согласно уравнениям (VII.13) и (VII. 37)
ДС° = ДД° —Т AS0,
= 298=—127,068 кДж/моль,
A S° = S^gC1 — Sj(g —V2 sci2= —57,97 Дж/(моль-К.) (см. пример 7),
AG°= —127 068 —298 (—57,91) = —109804,9 Дж/моль =
= —109,805 кДж/моль, AG°<0.
Следовательно, реакция осуществима.
11. Вычислите ДО298 для реакции С (графит) + 2Н2 (г) = СН4(г).
Определите Д/Угэв из следующих термохимических уравнений:
СН4 (г) -j-2О2 (г) = СО2 (г) -|-2Н2О (ж) + A /у298,
СО2 (г) =С (графит)+ О2 (г)—Д Д§98,
2НгО(ж)=2Н2(г)+О2)г)-2ДЯ«в8.
Значение ДЗ-гэв вычислите с помощью постулата Планка.
Решение. Энергию Гиббса рассчитываем по уравнению
Дб098=ДД°98 — 7’Д5°98.
Из термохимических уравнений вычисляем ДД-Ьв образования метана:
ДД°98 = ДД0сг + 2ДД°12сг-ДД0Н4сг.
Если известно Sok Для каждого компонента реакции, то при абсолют-
ном нуле Д5§к Для реакции будет равно
, д г>0 к— г>СН1 г>с (графИТ) zc>h2.
Рассчитываем изменение энтропии для каждого компонента от 0 до
298 К
т
ПЛ
СН4(ТВ, 0 К)=-СН4(ТВ, тпл) ;
(Ср)сн4
-------- d 1;
Т
СН1(ТВ- гпл) “СН1(Ж- гПл); AS^
АД™,
UM4
7пл
СН4(ж’7пл) ”СН1(Ж- Ткип);
) Т
7пл
АЯ"С"
СН4,Ж т , =СН4, т .. Д5? =-------------ДД-;
(ж,;кип) (г> 'кип) ’ т
1 кип
298 /г0\п
С (Лр7сн4 ,
I ----------а 1 ;
J Т
т
кип
С Н4< у. . —СН4(Г> 298);
I1 ’ кип)
0
81
°к 2(СО)«
2Н2(тв, г) =2Н2(тв> 0К); Д$? = Г — S- V^-dT;
\ 11 Л/ v 1
Т
ПЛ
он _2Н • AS0______2Д/Дл _
2Н2(ж- Гил)-^™’7’™)’ Таа ’
У 2(С°р)н,
2Н2(ж- 7’кип)_2Н2(ж- тпЯ)' SS°a~ J Т йТ'
Гкип
2Д ЯЯСП
2Нг, г . =2Н2,ж т A S§ = —-------------Яа_;
2(г- гкип) 2(ж- гкип) 9 т
1 кип
Г«.ип 2 (Сй)"
2Н2(г, 298) = 2Н2, у ; AS,0= I — d Т;
V кип) J Т
298
г —г л со _ С (С<^с (графит)
'-(графит, 29в) ——'-(графит,о К)! а ’ll = ) а 1 5
28 9
С(графит, 298) + 2Н2(Г, 298) = СН4(Г, 298)!
и
А^зэв^Д^ок 4-УДS0-
I
12. Для реакции Ag + Х/2С12 = AgCl вычислите теплоту обрати-
мого процесса. Сведя данные справочника и результаты вычислений
в таблицу, покажите, что ДО и АД не зависят от пути процесса, а
работа W' и количество выделяющейся теплоты Q зависят. Макси-
мальная полезная работа W = 109804,9 Дж/моль = 109,805
кДж/моль.
Решение. Согласно уравнению (VII. 6) Qo6p = TAS; исполь-
зуя справочные данные, получаем AS® =—57,91 Дж/(моль-К),
<2обр=—57,91-298= 17,263 Дж/моль.
Объединив уравнения (VII.37), (VII.6) и (VII.16), для Р и T=const
получим А 77 — Qo6p — W. Подставив числа, находим
Д И = — 17 263 —109804,9 = —127 068 Дж/моль.
Работа W необратимого процесса равна нулю. Составим таблицу:
Процесс А^реак- Дж/моль W, Дж/моль <2, Дж/моль
Необратимый 127 068 0 127 068
Обратимый 127 068 109 805 12 263
Из приведенных данных видно, что работа W и теплота Q, выделя-
ющаяся в ходе реакции, зависят от условий проведения реакции, а из-
менение энтальпии не зависит.
82
13. Благоприятствует ли протеканию реакции Ag+1/2C12 = AgCl
повышение температуры?
Решение. Температурный коэффициент энергии Гиббса реак-
ции выражается уравнением dAG^dT = — AS0. Изменение энтропии
реакции находим по энтропиям участников реакции, AS0 — — 57,91
Дж/моль. Отсюда (dAG°/dT)p = 57,91. Таким образом, энергия Гиб-
бса с ростом температуры увеличивается, т. е. повышение температуры
не благоприятствует реакции.
14. При 298 К смешали 2 моль кислорода и 1 моль азота. Исход-
ные давления газов РоД ^n2x и давление смеси Р одинаковы и равны
1,0133-106 Па. Парциальные давления газов в смеси Рог и Ры2 состав-
ляют 0,668-10® и 0,334-10s Па соответственно. Вычислите AG, AS и
АД смешения.
Решение. Так как процесс смешения газов необратим, заменя-
ем его суммой обратимых процессов, протекающих в тех же условиях
(граничных): AG = AGX + AG2, где AGX и AG2 — изменения энергии
Гиббса азота и кислорода за счет изменения давления от Рцисх до
Pt в процессе смешения. Согласно уравнению (VII. 33)
Д Gx = Д GNz -=RT In (PN2/P£x); Д G2 = Д GOj = RT In (P0t/PH0cx).
Поскольку исходные давления газов равны конечному давлению сме-
си, согласно уравнению Дальтона можно записать:
pn2 __ Л\2 рог _ роа
unv ——0,33, 11ЛЧГ ——0,Ь7.
рнсх р гЧ2 » » рИСХ р ’
N2 О2
После подстановки чисел и вычислений получаем
Д G =/?7’2,3 (lg21g XqJ =
= 8,314-2,3-298 (1g0,33-|-21g0,67) = — 4800 Дж/моль.
Вычисляем AS по уравнению (VII.26):
l д Д G \
Д S= — —- I = —R In xN —2R In x0 =16,10 Дж/(моль-К).
\ д T /p, x * 1
Для вычисления АД используем уравнения (VII.21):
Д Н = Д G -|- Т Д5 = /?7’1п xN2-j- 2RT In Xq2 — RT In xNj — 2/?Tln Xo, = 0-
15. Вычислите АД и AA для реакции
Ag+0,5Cl2 = AgCl
при 298K и 1,0133-103 Па, если = — 127,159 кДж/моль,
AG)1 = — 109,54 кДж/моль и An = — 0,5.
Решение. Подставив числовые значения АД =— 127,159
кДж/моль; Ап = — 0,5; R = 8,314 Дж/(моль-К) в уравнение (VI.5),
получим
Д и= —127,159 4-0,5-8,314-298 = — 125,92 кДж/моль.
83
Подставляя в уравнение (VII. 23) числовые значения, получаем
Д Л=-109,54-1-0,5-8,314-298-10-3= 108,27 кДж/моль.
16. Вычислите изменение AG® для 1 моль NH;, в процессе изобари-
ческого нагревания (Р = 1,013-10s Па) от Ту = 300 до Т2 = 400 К,
если Ср = const.
Решение. Для вычисления AG® используем уравнение
(VI 1.29):
д Go = (C£ —S°98) (400 — 300)-GJ} 400-2,31g (400/300).
Подставив в это уравнение данные для аммиака при 298 К. ([М.1,табл. 6;
[С.Х., т.21) S® = 192,59 Дж/(моль-К); СР = 35,65 Дж/(моль-К),
получаем
Д G°= (35,65— 192,50) (400 — 300) —35,65-400-2,31g (400/300) =
= —17,467 кДж/моль.
17. Определите А№, At/®, АХ®, AG®, AS® при стандартных усло-
виях и 298,2 К Для реакции
СаН2-[-2НаО (ж) =СН3СООН (ж) 4-На
Решение. Данные энтропий и теплот образования веществ,
участвующих в реакции, выписываем из справочника:
Вещество 298- Дж/Моль ?298’ Дж/(моль-К) (Дб§9в)°«Р=^9в- — TASOgg, Дж/моль
СаНа(г) 226,75-103 200,8 209,25-10»
На0(ж) -285,84-103 69,96 —334,46-103
СН3СООН(ж) -484,9-103 159,8 - —576,64-103
на 0 130,6 0
Теплойой эффект реакции, согласно закону Гесса, равен
ДЯ§98 = 2(Д Wf, 29з)пр.р_ 2 298)исх.в =
= (—484,9) —( — 2.285,84-1-226,75) 103= 139,97-10® Дж/моль;
Д (7»98 = Д Я»98-Р Д 7 = Д Я»98 -Дп RT.
При расчете Ап учитывают стехиометрические коэффициенты толь-
ко газообразных веществ: Ап = пн, — пс,нг = 1 — 1=0. Следова-
тельно, А[7йз = А//§98. Энергия Гиббса для реакции равна
л б298 = 2 (Д G^ 29в)пр.р— 2 (А б/, а98)исх. в =
= ( —576,64) — (—2-334,46-1-209,25) 103= — 116,97-103 Дж/моль,
ДЛ®98=ДО®а98-РД V.
Для данной реакции PAV = 0. Следовательно, AG298 == АЛгэв-
Энтропия реакции равна
А ^2 9 8 = 2 (Vf S§9e)np,p—(Vi *-*29 8)иСХ. в =
= (130,64-159,8) —(200,8+2-69,96) 10»= —50,32 Дж/(моль-К).
84
. 18. Рассчитайте AG° при 400 К для реакции V2N2 + 3/2Н2 = NH3,
если ДОг98= — 16,496 Дж/моль. Недостающие данные возьмите в
справочнике [M.L Принять AS0 = const.
Решение. Изменение энергии Гиббса реакции рассчитываем
по уравнению (VII.25):
т
A G£ —A G!l98 = —A S» J d Т.
298
Вычисляем AS0 по уравнению (VII. 13):
S?JHS= 192-5°; Sftt=191,5; S^ = 130,6 Дж/(моль-К);
тогда AS0 = —99,15 Дж/(моль-К). После подстановки чисел и вы-
числений получаем
A G400 = —16,496+99,15-100-10_® = —6,581 кДж/(моль К.).
19. Рассчитайте AG® при 400 К для реакции V2N2 + 3/2 Н2 = NH3,
учитывая зависимость AS от температуры.
Решение. Вычисляем AG® по методу Темкина — Шварцмана,
согласно которому, объединяя уравнения (VII.37), (VII.33), (VII.13а)
и (VII.32), получаем:
т т
г р л С°
AG^. = AH»ee—TAS»98 + AC5»dT— Т -------------------LdT.
298 298 Т
После подстановки степенных рядов АС?> = f (Т) уравнение преобра-
зуется; множители, зависящие только от температуры, обозначают сим-
волами /Ио, М1г М2, М_2 и находят по справочнику:
A G£ = А Я®98 —Т A SS198 — Т (A a Af0-f- А b -|-А с М2 + А с' /И_2) .
Для расчета записываем необходимые данные: А//2098 = —46,19
кДж/моль [MJ; AS§98 = — 99,15 Дж/(моль-К); /Ио = 0,0392;
Mi = 13; /И_2 = —3,65-10-7 ([M.J, табл. 6, 19).
Газ а Ь-103 С С-10-5
n2 27,87 4,27
н2 27,28 3,26 — 0,502
NH3 . 29,80 25,48 — —1,67
Ай =— 25,05; Ай = 18,46-10 новки чисел получаем -3; Ас' = — 2,42-10Б После подста-
AGJ00 = —46 190 — 400 (—99,15)—400 (—25,05 0,0392-|-
-|-18,46-10~3-13 + 0,502-106-3,65-10-’) = —6,819 кДж/моль.
85
20. Вычислите изменение AG° для 1 моль NH3 в процессе изобари-
ческого нагревания (Р = 1,013- 10в Па) от 7\ — 300 до Т2 = 400 К,
если Ср = f (Т).
Решение. В общем случае зависимость теплоемкости от тем-
пературы передается уравнением
С$ = а-\-ЬТ-}-сТг-\-с' /Т*.
Для индивидуального вещества это уравнение принимает вид
С^ — а-Ь-ЬТ -^-сТ2 или С^> —а+&Г-рс' Т~*.
Получим уравнение, выражающее зависимость S = f (Т)
т т т Т Т
с СЫТ г ad Г р р Р с'
= J — + S^=J &d7’+.) crdr+J vdr+^;
Л Л Л Ti Ti
S^a In T—a In Л + & T — b Tr + ~ T* — у Tj —
c' . c' I c c' \ .
---------------+ s« = alnT+&T+ — T2-----------H-
27-2 2TI Л \ 2 2Л /
. -HSS. - aIn л— bT\ —|.
\ r‘ 1 2 1 2Tj )
Изменение энергии Гиббса с температурой определяется соотноше-
нием
=_s.
\ дt )р ’ »
Тг i\ тг
GJ.2—G^= — aj InTAT— 6^ TAT— у J Т2АТ+
Л Л Г,
с' р* АТ / с с'
2 J Т2 \ Л 1 2 1 2Т® / J
ЬТ2, . bTf с Tl
= — а Т2 In T2-f-a Тх In Т^-\-а Т2 — аТг— - Н
с Tl с'
2 3 1Т2
с' /
----------1 S& — a In Л— bTj.
2Tl \ T1 11
2Tf )^2 T1^'
2
По справочнику [MJ находим a = 29,80; b = 25,48- IO-3; c = 0;
c'—l,67-105 Дж/(моль-К). Тогда изменение’энергии Гиббса от
температуры будет равно
G^—G^ = —29,80-2,31g 400 + 29,80-300-2,31g 300+
25,48-10-’ 25,48-10-’
+ 29,8-400—29,8.300 —-----------400’ +------------ 3002 —
86
----: н —----— (192,5 — 29,8 • 2,31g 300—25,48 • 10~3 • 300 +
2-400----------------2-300-' е
1,67.10s
+ -2"зоо2 ) (400—300) = —71341,2 + 50928,2+ И 910— 8940 —2040+ 1147—
— 209 + 279 —(192,5—169,5 — 7,44 + 0,928) 100=—19916 Дж/моль.
21. Рассчитайте давления, при которых графит и алмаз находятся
в равновесии для интервала температур 298—4000 К. При расчете ис-
пользуйте следующие данные для равновесия С (графит) С (алмаз):
Г, К дя% Дж/моль AS”, Дж/(г-К) Дб°, Дж/моль ДС£. Дж/(г-К) ДУ, см3
298 1400 18 967,3 —3,364 —4,853 2903,7 2,602 0,418 — 1,92 —1.90
Решение. Отрицательные значения AS0 и ДР показывают, что
изменение температуры не благоприятствует, а повышение давления
благоприятствует превращению графита в алмаз. Для расчета равно-
весных давлений при высоких температурах используем зависимость
AGnpeBp = f Т). Для этого представим AGpiT как сумму трех сла-
гаемых :
Дбру = Д + д б2 + д g3,
где AG?t — изменение энергии Гиббса при переходе графита в алмаз
при 1,0133-10в Па и температуре 7\‘, AG2 — изменение AG за счет
повышения температуры от Т1 до Т2 при 1,0133-105 Па; AG3 — измене-
ние AG за счет повышения давления от 1,0133- 10в Па до Р при Т =
= Т2. Приведенные данные относятся к Т < 1400 К, поэтому прини-
маем 7\±= 1400 К и вычисляем AG1400. Для этого используем уравне-
ние (VII. 21);
дб?4 00 = ДЯ§9в — 1400Д Sg98 — 1400Д аМ,
Да = ДС» 298; 44 = 0,7595
И
Д G» = 1896,6 — 1400 ( — 3,364) — 1400 • 0,7595 (— 2,602) =» 9372,16 Дж /моль.
Значение AGp вычисляем по уравнению (VII.25), допустив, что
AGp = AGp, 1400=const. Тогда
ДО2 = (ДС£—Д5{400) (Т1 —1400) —ДС«7’ 2,31g (771400).
Значение AG3 вычисляем по» уравнению (VII.31), приняв AV =
= const = А1/1400. Тогда AG3 = AV(P — 1) 0,10133-10“2 и зависи-
мость AG = f (P, T) принимает вид
ДОр, т = ДО?400+ (ДС£-Д5?400) (Т-1400) -
т
— ДС& Т 2,3 1g-----+0,10133-10-2 ДГ (Р — 1).
1400
87
После подстановки чисел получаем
Айр, г =9372,16 + 4,435 (7—1400)+ 0,962 Т 1g — 19,20-10-2 Р.
При равновесии AGp.r = 0; это условие используется для расчета рав-
новесного давления Р. Объединим результаты расчета ДО?- и Р:
т, к 298 1400 2400 3400 4000
AG?, Дж . . . 2903,7 9372,2 14346,9 19501,6 22656,4
Р-IO-8, Па . . 15,3 49,35 75,7 102,90 119,57
Таким образом, алмаз более устойчив, чем графит, в области низ
ких температур и высоких давлений.
ЗАДАЧИ
1. Идеальная машина Карно, работающая в интервале температур
от' 200 до 300 К, превращает в работу теплоту, равную 83,8 Дж. Какое
количество теплоты отдано резервуару при 200 К?
2. Какое количество теплоты будет превращено в работу идеаль-
ной машиной Карно, работающей при температуре между 200 и 100 К,
если она получит при 200 К столько же теплоты, сколько получает ма-
шина в задаче 1 при 300 К? Объясните причину различной величины
работы идеальной машины.
3. При начальной температуре 348,К 1 моль Н2 по циклу Карно сна-
чала расширяется до двойного объема изотермически, затем расширя-
ется до учетверенного первоначального объема адиабатически, затем
сжимается изотермически до такого объема, чтобы при последующем
адиабатическом сжатии вернуться в исходное положение. Вычислите
работу каждой части цикла и КПД цикла (у = 1,4).
4. Вычислите изменение энтропии при нагревании 16 кг О2 от
273 до 373 К: 1) при постоянном объеме; 2) при постоянном давлении.
Считайте кислород идеальным газом.
5. Рассчитайте изменение энтропии при нагревании 58, 82 кг В2О3
от 298 до 700 К, теплоемкость В2О3 Ср = 36,5525 + 106,345-10-3 Т
Дж/(моль-К).
6. Бромбензол кипит при 429,8 К, его теплота парообразования
при этой температуре 241,9-103 Дж/кг. Рассчитайте изменение энтро-
пии при испарении 10 кг бромбензола.
7. Под давлением 19,6-104 Па (2 кг/см2) нагревают 2-10~3м3 ар-
гона до тех пор, пока объем его не увеличится до 12-10-3м3. Каково
изменение энтропии, если начальная температура 373 К?
8. Вычислите изменение энтропии при охлаждении 12-10~3 кг
(12 г) кислорода от 290 до 233 К и одновременном повышении давления
от 1,01 • 105 до 60,6-108 Па, если ѰР= 32,9 Дж/(моль-К).
88
9. Рассчитайте изменение энтропии в процессе смешения .5 кг
воды при 7\ = 353 К с 10 кг воды при Т2 = 290К. Теплоемкость
воды считать постоянной и равной 4,2 Дж/(моль-К).
10. Рассчитайте общее возрастание энтропии при смешении 100 х
X 10-6 м3 кислорода с 400-10_6 м3 азота при 280 К и 1,01 • 10в Па, V =
= const.
11. Определите изменение энтропии при смешении 1 моль аргона,
взятого при ТАг = 293 К и Р°аг = 1,0133 • 105 Па с 2 моль азота, нахо-
дящегося при Pn2 = 1,0133-105 Па и Т^г = 323 К. Давление смеси
равно РСм = 1,0133-105 Па. Принять аргон и азот идеальными газа-
ми, а теплоемкость каждого газа — величиной, постоянной в указан-
ном интервале температур и равной для азота Су = 20,935
Дж/(моль-К), для аргона Су = 12,561 Дж/(моль-К).
12. В одном из сосудов одинаковой вместимости 3 м3 находится
28 кг азота, а в другом 32 кг кислорода при одной и той же температу-
ре. Вычислите изменение энтропии при диффузии в результате сопри-
косновения содержимого этих сосудов. Принять кислород и азот иде-
альными газами.
13. Твердый хлороводород претерпевает фазовый переход при
98, 36 К, при этом энтальпия изменяется на 1,19 кДж/моль. Рассчитай-
те молярную энтропию и внутреннюю энергию перехода. Этот обра-
зец приведен в контакт с бруском меди при термической изоляции от
окружающей среды. Каково изменение энтропии меди при фазовом
переходе и каково изменение энтропии окружающей среды?
14. Определите изменение энтропии, если 100-10-3 кг воды, взя-
той при 273 К, превращается в пар при 390 К- Удельная теплота ис-
парения воды при 373 К равна 2263,8-103 Дж/кг; удельная теплоем-
кость жидкой воды 4,2 Дж/(кг-К); удельная теплоемкость пара при
постоянном давлении 2,0-103 Дж/(кг-К).
15. Молярная теплоемкость газообразного метана выражается
уравнением СР = 17,518 + 60,69-10_3 Т Дж/(моль-К). Стандартная
энтропия метана при 298 К равна 167,73 Дж/(моль-К). Определите
энтропию 1 • 10“3 м3 метана при 800 К и 1,01 • 105 Па.
16. Рассчитайте энтропию этилового спирта в парах при 351 К и
5,05-103 Па, полагая кН = 40 950 Дж/моль. Зависимость молярной
теплоемкости от температуры выражается уравнением
Ср= 19,07 + 212,7-Ю-3 7 —108,6-10-в 72 + 21,9 73.
17. Смешаны 2-10_3 м3 гелия и 2-10-3 м3 аргона при 300 К и 1,01 х
X 10s Па; после изотермического смешения полученная газовая смесь
нагрета до 600 К при постоянном объеме. Вычислите общее возраста-
ние энтропии, учитывая, что Су — 12,6 Дж/(моль-К) и не зависит от
температуры.
18. Рассчитайте изменение энтропии в процессе Pb + 2AgCl —
=PbCl2+2Ag, если проведению этой реакции в гальваническом эле-
менте при 298,2 К отвечает Е = 0,4900 В, а теплоты образования
РЬС12 и AgCl соответственно равны — 357 732 и — 126775,2 Дж/моль.
89
Чему равна энтропия свинца при 298,2 К, если S^ci = 96,23
Дж/(моль-К); S$bci2 = 136,4 Дж/(моль-К); Здг =42,68 Дж/(моль-К).
Вычислите изменение энтропии при проведении этой реакции в
изолированной системе.
19. Найдите изменение энтропии при изотермическом (Т — 353,2
К) сжатии паров бензола от Рг = 4,0532-104 Па до Р2 = 1,0133-10в
Па с последующими конденсацией и охлаждением жидкого бензола до
Т = 333,2 К, если &Наар = 30877,92 Дж/моль и (С?.)с,н, =
= 1,80 Дж/(г-К). Пары бензола считать идеальным газом.
20. Определите стандартное изменение энтропии при 298 К для сле-
дующих реакций:
MgO+ Н2 = Н2О (ж) + Mg (1)
С + СО2 = 2СО (2)
2SO2О2 — 2S0g (3)
FeO + CO = Fe + CO2 (4)
Для решения воспользоваться данными справочника [М.1.
21. В термически изолированный сосуд, содержащий 5 кг воды при
303 К, внесли 1 кг снега при 263 К- Определите возрастание энтропии,
если теплота плавления снега 334,6-103 Дж/кг, теплоемкость снега
2,024-Ю3 Дж/(кг-К), а теплоемкость воды 4,2-103 Дж/(кг-К)-
22. Хлористоводородный метиламин существует в нескольких крис-
таллических модификациях. Вычислите теплоту фазового перехода
CH3NH2HC1, если это вещество при 220,4 К из 0-формы переходит в
у-форму; при 19,5 К Ср = 5,989 Дж/(моль-К); теплоемкость 0-формы
при 12 К Ср = 8,48 Дж/(моль-К) и
220,4
AS0= f din Т = 93,769 Дж/(моль-К),
12
220,4
ASV = | din Т— 100,3 Дж/(моль-К).
19,5 '
При расчете учесть, что теплоемкость CH3NH2HC1 в интервале тем-
ператур 0—20 К подчиняется уравнению Дебая Ср — 464,5 (Т /0)3.
23. Теплоемкость SO2 при различных температурах имеет следую-
щие значения:
т, к Ср, Дж/(моль-К). 15,20 3,612 25,67 12,028 34,87 20,248 47,16 29,106 60,85 36,653
т, к 76,98 98,30 120,37 140,92 162,03
Ср, Дж/(моль-К) 42,462 47,71 52,164 55,944 60,732
Т, К 192,03 201,74 240,09 260,86
Ср, Дж/(моль-К) 67,872 88,074 87,318 86,898
90
Для S02 Тпл = 197,64 К, теплота плавления 7,4298-103 Дж/моль,
Ткип = 263,08 К, теплота испарения 24,9336-103 Дж/моль. Вычисли-
те энтропию газообразного SO2 при 263,08 К и 1,01 • 10Б Па.
24. Вычислите графически энтропию ющим данным: серебра при 473 К по следу-
Т, к 13,5 17,0 26,9 35,0 39,1 42,9
Cv, Дж/(моль-К) 0,462 0,882 3,517 6,657 8,039 9,295
т, к 45,5 51,4 53,8 77,0 100 200 273
Cv, Дж/(моль-К) 10,174 11,756 12,435 17,04 19,62 23,446 24,158
т, к 535 589
Cv, Дж/(моль-К) 24,702 24,786
Сравните энтропию серебра при 298 К с величиной, приведенной,
в справочнике [M.L
25. Твердое тело при температуре плавления превращается в жид-
кость; при этом необратимо переносится некоторое количество теплоты
q. Правильно ли предположение, что для этого процесса AS = qlTBS^
Если это предположение правильное, то почему и на каком основа-
нии был отвергнут тот факт, что процесс необратим? Если предположе-
ние ошибочно, то как можно получить правильное выражение для AS?
26. Два одинаковых сосуда (объем каждого сосуда V) соединены
трубкой с запорным краном. Материал, из которого собрана аппарату-
ра, является совершенным термоизолятором. Сначала п моль одноатом-
ного газа Ван-дер-Ваальса были помещены в один из сосудов при тем-
пературе То, а другой сосуд оставался пустым, затем запорный кран
был открыт до установления равновесия. Теплоемкость газа принять
равной Cv = 3/2 R, как для идеального газа. Определите Q, W и At/,
АХ и AS через п, V, То, постоянные Ван-дер-Ваальса а и b и универ-
сальные постоянные.
27. Почему при использовании энтропии в качестве критерия само-
произвольности процесса необходимо предположение, что А5И.С =
= ASp.c — AS0Kp.cp, а для энергии Гиббса рассматривают только
AGp.c (но не AG = AGP.C — AG0Kp.cp)?
28. Вычислите изменение энергии Гиббса при сжатии 0,7-10~2 кг
N2 при 300 К и давлении от 5,05-104 до 3,031 • 106 Па (считать азот иде-
альным газом).
29. Рассчитайте AG, если температура кипения 351 К (пары спир-
та считать идеальным газом) для процессов:
С2НвО (ж, Р= 1,01 • 10в Па) = С2Н6О (г, P = 9,09-104 Па), (1)
С2НвО (ж, Р=1,01-10в Па) = С2Н6О (г, Р= 1,01 • 10вПа), (2)
QH.O (ж, Р=1,01-10в Па) = С2НвО (г, Р= 1,11.10вПа). . (3)
Какие выводы можно сделать о направлении процессов на основании
полученных результатов?
91
30. Вычислите ДА и ДО для 2 моль бензола при следующем изо-
термическом 'процессе испарения:
С,Hg (ж, />=1,0133.10» Па)=С,Н,(г, Ра = 0,9120 10» Па).
Нормальная температура кипения Тн.т.к = 353,3 К.
31. При 268,2 К давление насыщенного пара твердого бензола
2279,8 Па, а над переохлажденным бензолом (жидким) 2639, 7 Па. Вы-
числите изменение энергии Гиббса в процессе затвердевания 1 моль
переохлажденного бензола при указанной температуре (пары бензола
считать идеальным газом).
32. Теплота плавления льда при 273 К равна 334,7-10® Дж/кг.
Удельная теплоемкость воды 4,2-10® Дж/(кг-К), удельная теплоем-
кость льда 2,02-103 Дж/(кг-К). Определите ДО, ДЯ и AS при превра-
щении 1 моль переохлажденной воды при 268 К в лед.
33. При 298 К энтропия ромбической серы 32,04 Дж/(моль-К), а
энтропия моноклинной серы 32,68 Дж/(моль-К). Теплоты сгорания
соответственно равны — 297 948 и —298 246 Дж/моль. “Рассчитайте
ДО для реакции S(poM6) = S(MoH). Пренебречь в первом приближении
различием плотностей ромбической и моноклинной серы. Какой вывод
можно сделать из полученного результата?
34. Вычислите W, \Н, \U, AS, ДА, ДО для изотермического
сжатия 1 моль идеального одноатомного газа при 773 К и давлениях
от 5,06-103 до 1,01-10* Па.
35. В изолированной системе при 273,16 К 1 моль газа обратимо и
изотермически расширяется от 1,01 ДО7 до 1,01-10® Па. Вычислите
значения W, Q, &U, АН, Д5, ДА и Дб (считать газ идеальным): 1)
для газа и для всей изолированной системы в целом; 2) при свободном
расширении газа (расширение в вакууме необратимо), для газа и для
всей изолированной системы в целом. Результаты расчета представьт»
в виде таблицы.
36. При 298,2К и 1,01 • 10Б Па молярная энтропия алмаза равна
2,457, а графита 5,73 Дж/К. Теплота сгорания алмаза 387,9, а графита
382, кДж/моль. Плотности алмаза и графита соответственно равны
3,513• 103 и 2,26-103 кг/м3. Рассчитайте ДЯ° перехода алмаза в графит
при 298,2 К и 1,01- 10Б Па. Какая форма — графит или алмаз — явля-
ется стабильной при этих условиях? Может ли быть получена другая
стабильная форма при повышении давления? Если да, то каким долж-
но быть давление?
37. Определите стандартное изменение энергии Гиббса при 298 К
для реакции ZnO 4~ СО = Zn + СО2. Величины ДДгэв и ДД^эв
найдите по справочнику [М.1.
38. Выведите зависимость Дбт от Т для реакции
1/iHi+i/iCl = HCI
Значения ДЯ§98, Дбгэв и зависимости Ср = f (Т) найдите по справоч-
нику [М.1.
92
39. Определите А№, \U°, АЛ0, AG° и AS0 при 298,2 К для реак-
ции
С2На+2НаО (ж) + CHjCOOH (ж) + На
Необходимые данные возьмите из справочника [М.1.
40. Вычислите АОВэв для реакции С (графит) + 2Н2 (г) = СН4(г),
причем А//§98 определите из следующих термохимических уравне-
ний:
СН4 (г)+2Оа (г) = СОа (г)+2Н,0 (ж) + ДЯ§98,
СОа (г) = С (графит) + Оа (г) — ДЯ°9 7,
2НаО(ж) = 2На (г) + Оа (г) —2ДЯ§98.
Значения AS<>98 вычислите с помощью постулата Планка.
41. Вычислите AG?oo для следующих реакций:
2СОа = 2СО + Оа (1); СО + НаО = СОа + На (2);
2Н1 = На4-1а (3); СО + 2На = СН„ОН (4); 3Ha + Na = 2NHs (5)
Величины А//§98, SS>98 и Ср = f (Т) найдите по справочнику [М.1.
42. Определите изменение U, Н, S, А и G и конечные значения V и Т
при адиабатическом расширении до 1,013- 10Б Па 1-10-3 м’ кислорода,
взятого при 298,2 К и 5,065-10® Па. Молярная теплоемкость кислорода
при постоянном давлении 20,63 Дж/(моль-К), молярная энтропия при
298,2 К и 1,013-10s Па составляет 206 Дж/(моль-К).
43. Покажите, будет ли взаимодействовать этилен с водой при 298 К
и 1,013-10® Па.
44. Покажите, будет ли взаимодействовать водород с кислородом
при 180 К и 1,013-10Б Па.
45. Покажите, будет ли взаимодействовать азот с водородом при
700 К и 1,013-10Б Па.
46. Для реакции 1/а N2 + 3/2 Н2 = NH3 дано:
ДС£ = 43 540 + 29,7 lg Т+15,87-10~3 Г’.
Вычислите для этой реакции АЗ^эв и сопоставьте полученное значение
с данными справочника [М.1.
47. Для реакции 2Н2 + S2 = 2H2S дано
Д0£= 168 300 +30,35 Tig Т — 5,07-10-’ Г».
Вычислите AS298 и сопоставьте с данными справочника [M.J.
93
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Рассчитайте изменение энтропии при нагревании (охлаждении)
при постоянном давлении в интервале температур от 7\ до Т2 g кг ве-
щества А, если известны его температуры плавления и кипения, теп-
лоемкости в твердом, жидком и газообразном состояниях, теплоты
плавления и испарения*.
| № ва-1 рианта Вещество А g, КГ 7',, К Г», К
1 Вг2 (бром) 25 373 173
2 Н2О (вода) 45 421 223
3 Не (ртуть) 40 193 673
4 СС14 (тетрахлорид углерода) 80 323 373
5 СН2О2 (муравьиная кислота) 10 393 273
6 С2НС12О3 (трихлоруксусная кислота) 15 160 350
7 СН4О (метанол) 80 303 473
8 С2Н3СЮ2 (хлоруксусиая кислота) 15 423 313
9 С2Н4О2 (уксусная кислота) 8 423 223
10 С2Н6О (этанол) 50 373 143
И С3Н3О (ацетон) 10 173 373
12 С4Н10О (этиловый эфир) 50 143 323
13 С6Н12 (н-пеитаи) 35 323 133
14 С6Н6 (бензол) 1 383 273
15 C6Hi2 (циклогексан) 100 373 273
16 C6Hi4 (н-гексаи) 10 173 373
17 С7Н8 (толуол) 50 423 173
18 C6H6NHCH3 (п-метиланилин) 40 423 303
19 С10Н3 (нафталин) 25 328 523
20 С10Н8О (а-нафтол) 75 579 323
21 С8101о (о-ксилол) 60 423 223
2. Определите AS, At/, А//, АД, AG при смешении КА м3 газа А
и Vb м3 газа В; Т = 298 К. Начальное давление газов равно 1,01 X
X10® Па. Конечный объем смеси Ук= Кд + Кв- Газы А и В и их объе-
мы приведены в таблице на с. 95 (принять, что данные вещества под-
чиняются законам идеальных газов).
3. Вычислите возрастание энтропии при смешении УА м3 газа А
при температуре ТА и Кв м3 газа В при температуре Тв- Процесс осу-
ществляется при V = const. Принять, что данные вещества подчиня-
ются законам идеальных газов, начальное давление 1,013-10® Па, ко-
нечное давление смеси Р (табл, на с. 95).
* Средние теплоемкости веществ во всех агрегатных состояниях, теплоты
плавления и испарения найдите по справочнику [С. X., т. 1]. Теплоты переходов
из одной модификации в другую не учитывать. При отсутствии данных принять,
что теплоемкости не зависят от температуры. Значения теплоемкостей, отсутст-
вующие в справочной литературе, вычислить приближенно, использовав данные
справочника [М.].
94
Кг вари- анта Газ А Ул-10‘. м3 Гд, К Газ В va-io*. м3 тв, К Р, Па
1 н? 1 303 Na 2 290 101 325
2 н2о 5 388 о2 6 310 101 325
3 Не 7 275 со2 8 290 131 722
4 Не 1 277 На 5 303 303 975
5 СН4 7 268 СаНа 9 288 172 252
6 СН4 2 298 Ne 3 283 303 975
7 СО 3,3 268 С2Н„ 4 300 70 927
8 СО2 6 280 Na 7 310 141 855
9 соа 7 258 СО 9 278 40 530
10 СОа 2 303 сн4 4 289 810 060
11 сан„ 3 268 Хе 6 296 206 450
12 С,НЙ 8 313 СН4 9 289 151 987
13 n2 7 280 С12 9 299 192 517
14 N2 4 293 Нао 7 383 101 325
15 оа 6 333 N. 8 297 506 625
16 Оа 1 333 Н2 4 290 101 325
17 Оа 1 303 Аг 3 298 101 325
18 F2 4 281 С12 5 292 182 385
19 Ne 1 278 N« 8 296 50 662
20 С1а 5 243 n2 7 278 50 662
21 Cl. 1 308 Ar 7 292 253 312
22 Ar 1 276 Не 6 291 151 987
23 Кг 2 276 со2 6 288 121 590
24 Кг 2 278 СО 7 308 40 539
25 Хе 3 263 f2 6 286 172 252
4. Вычислите AS для процессов перехода 1 моль газа А из состоя-
ния 1 (Pi = 1,013- 10Б Па, 7\ = 298 К) в состояние 2 (Р2, Т2).
№ вари- I анта 1 Газ А ₽2-10~2, Па Т„ к | № вари- анта Газ А Pt-10~2- Па л. к № вари- анта Газ А ₽2-10~2, Па Т2, к
1 Н2 1,33 250 10 СОа 13,33 750 18 F, 13,33 400
2 нао 13,0 350 j 11 QH» 133,30 800 19 Ne 133,3 450
3 Не 133,0 400 ’ 12 СаН„ 1333 850 20 С12 1333 500
4 Не 1330 450 13 n2 1,33 900 21 С12 1,33 550
5 СН4 1,33 500 14 n2 13,33 950 22 Аг 13,33 600
6 СН4 13,3 550 15 оа 133,3 1000 23 Кг 133,3 650
7 СО 133 600 1 16 Оа 1333 250 24 Кг 1333 700
8 со2 1330 650 17 о2 1,33 350 25 Хе 1,33 750
9 соа 1,3 700
5. Определите изменение следующих функций: 1) AS и AG при
Р = const; 2) AS.и АА при нагревании газа на 100° (V = const).
Данные для газов см. в задаче 3.
6. Имеются два сосуда, изолированные от внешней среды. В одном
находится п.1 моль твердого, п2 моль жидкого вещества А при темпера-
95
туре плавления, в другом п1 моль твердого и п2 моль жидкого вещества
В при температуре плавления. Оба сосуда приводятся в соприкоснове-
ние. Определите, в каком направлении будет проходить процесс в си-
стеме; какое вещество — А или В — будет плавиться или затверде-
вать. При каких условиях система придет в равновесие (Т, nlt п2)?
Вычислите изменение энтропии системы при переходе из исходного со-
стояния в равновесное. Обратим или необратим данный процесс? Для
расчета воспользуйтесь следующими данными и справочником [С.Х.].
[ № варн- I аита Вещество «1 «2 № вари- анта Вещество «1 п2
А в А Б
1 Н2О СН3СООН 0,7 0,3 14 С3Н6(ОН3) СН3СООН 0,4 0,6
2 Н2О СзН6(ОН)3 0,6 0,4 15 нсоон С3Н5(ОН)3 0,4 0,6
3 Н2О (СН2)6 0,2 0,8 16 нсоон СНзСООН 0,3 0,7
4 Н2о нсоон 0,4 0,6 17 нсоон (СН2)6 0,7 0,3
5 Н2о c6h5nh2 0,3 0,7 18 сн3соон (СН2)„ 0,4 0,6
6 С„н6 н20 0,5 0,5 19 С3Н7СООН л-СвН4(СН3)2 0,3 0,7
7 Свн„ СН3СО он 0,7 0,3 20 С3Н,СООН СН3СООН 0,4 0,6
8 с6н6 (СН2)6 0,6 0,4 21 С3Н,СООН (СН2)6 0,2 0,8
9 с6н„ С3Н6(ОН)3 0,3 0,7 22 С3Н7СООН нсоон 0,6 0,4
10 с6н„ нсоон 0,4 0,6 23 С3Н7СООН С6Н6 0,7 0,3
11 п-С6Н4(СН3)2 СН3СООН 0,3 0,7 24 С,Н7СООН С3Н5(ОН)3 0,5 0,5
12 С3Н6(ОН), Д-СвН4(СН3)2 0,2 0,8 25 С3Н7СООН С6Н6СООН 0,1 0,9
13 С3Н6(ОН)3 (СН2)3 0,3 0,7
7. Вычислите W, AU, АН, AS для процессов перехода идеального
газа из состояния 1 (Рь 7\) в состояние 2 (Р2, Т2):
1) при изотермическом расширении и изобарическом нагревании;
2) при изотермическом расширении и изохорическом нагревании;
3) при адиабатическом расширении и изобарическом нагревании;
4) при адиабатическом расширении и изохорическом нагревании.
№ ва- рианта Состояние 1 Состояние 2 № ва- рианта Состояние 1 Состояние 2
Pt, Па Л. к Р2, Па Л, к Pi. Па Г,, К Рг. Па г2. к
1 101 325 273 506 625 540 6 202 650 300 121 590 700
2 101 325 273 60 795 560 7 243 180 300 162 120 600
3 84 060 285 40 530 600 8 263 445 285 182 385 700
4 121 590 298 70 927 590 9 172 252 298 162 120 500
5 151 987 280 81 060 600 10 162 120 300 81 060 400
96
8. Рассчитайте A//, At/, AS, AG для следующих процессов:
X» вари-
анта
!
2
3
4
5
6
7
8
9
10
11
12
13
14
Процесс, условия протекания
Н2О (ж, 273 К, Р=1,01-105 Па)=Н2О (тв, 273 К, Р= 1,01 • 105 Па)
Н2О (тв, 273 К, Р=1,01 • 105 Па) = Н2О (тв, 263 К, Р=1,01-106 Па)
Н2О (ж, 263 К, Р—1,01 • 105 Па) = Н2О (ж, 273 К, Р= 1,01 • 105 Па)
Н2О (тв, 263 К, Р=1,0Ы05 Па)=Н2О (ж, 263 К, Р=1,0Ы05 Па)
Н2О (ж, 298 К, Р=1,01-105 Па)=Н2О (ж, 273 К, Р=1,0Ы05 Па)
Н2О (ж, 373 К, Р=1,0Ы05 Па) = Н2О (г, 373 К, Р= 1,01- 105 Па)
Идеальный газ (298 К, Р= 1,01 -107 Па) — Идеальный газ (298 К,
Р=1,01106 Па)
Идеальный газ (298 К, Р= 1,01-10s Па) =Идеальный газ (298 К,
/>=1,0Ы05 Па)
Н2О (ж, 298 К, Р= 1,01 • 106 Па) = Н2О (г, 298 К,Р =3,03-10’ Па)
С6Н6 (ж, 353,1 К, Р=1,0Ы06Па)=С6Н6 (г, 353,1 К, Р= 1,01 • 10s Па)
СбН6 (ж, 353,1 К, Р = 1,01-105 Па)=С6Н6 (г, 353,1 К, Р=0,9106Па)
С6Н6 (ж, 353,1 К, Р=1,0Ы06 Па)=С6Н6 (г, 353,1 К, Р== 1,1 • 105 Па)
Н2О (ж, 373 К, Р= 1,01-10s Па) = Н2О (г, 373 К, Р=0,8-105 Па)
Н2О (ж, 298 К, Р—1,Г105 Па)=Н2О (г, 298 К, Р=1,1-105 Па)
Из полученных результатов сделайте вывод о направлении процесса,
9. При переходе вещества (пары этого вещеста подчиняются зако-
нам идеального газа) из жидкого состояния в газообразное при темпера-
туре Т и давлении 1,01 - 10б Па расходуется теплота парообразования.
Принять, что теплота испарения не зависит от температуры. Вычисли-
те изменение энтропии, энергии Гиббса, энергии Гельмгольца, внутрен-
ней энергии, энтальпии и работу расширения 1 моль вещества в этом
процессе. Определите изменение перечисленных функций, если пары
1 моль вещества А нагреваются от температуры Т до Т + 25°: а) изо-
хорически, б) изобарически. На сколько градусов поднялась бы тем-
пература вещества, если бы изменение внутренней энергии при перехо-
де из жидкого состояния в газообразное выражалось в повышении тем-
пературы? Необходимые данные возьмите из справочника [С. X., т.1].
| № ва- ' рнанта 7', К Ве щество № ва- рианта 7', к Вещество № ва- : рнанта 7", к Вещество
1 20,4 Н2 10 283 cs2 18 20 Ne
2 283 Н2О 11 273 c2n2 19 4 He
3 293 HCN 12 251 CNC1 20 262 so2
4 202 H2S 13 73 n2 21 231 Cl2
5 189 НС1 14 239,7 NH3 22 85 F2
6 190 НВт 15 121 / NO 23 210 Br2
7 236 HI 16 184 n2o 24 122 Kr
8 81 СО 17 85 o2 25 165 Xe
9 194 со2
4
Зак. 787
97
ГЛАВА VIII
ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ТЕРМОДИНАМИКИ
Основные уравнения и символы
[Г., с. 327—343; Д. с. 582—602]
Статистическая механика объясняет свойства веществ на основании
свойств составляющих эти вещества молекул атомов, ионов, молекул-;
комплексов и свободных радикалов. Как термодинамические свойства!
веществ, так и их реакционную способность можно рассчитать с помо^р
щью статистической механики при условии, что имеются сведения
о молекулах вещества.
Связь между энтропией и термодинамической вероятностью выра-
жается уравнением Больцмана
S = *InIF. (VIII. 1)
Термодинамическая вероятность системы W — число микросостоя-
ний, которые соответствуют данному макросостоянию при неизменном
равновесном состоянии, определяемом параметрами Р, Т и V.
Внутренняя энергия вещества складывается из энергии поступав
тельного t/n0CT, вращательного UBp, внутреннего UBa движения №
энергии молекулярного взаимодействия UB3;
(7 = (Люст + <Л.р + </вн+<Л>з. (VIII.2)
Если же система находится в идеальном газообразном состоянии, то
энергия движения каждой молекулы складывается из составляющих:
£ — ^ПОСт4~^вр4~ ^вн. вр + ^кол + ^эл + ^яд. (VII1.3)
где Епост — энергия поступательного движения молекулы; Евр —
энергия вращательного движения молекулы; Евн.вр — энергия внут-
реннего вращения (энергия вращения одной группы атомов относи-,
тельно другой внутри молекулы); Екол — энергия колебательного
движения атомов в молекуле; Еэл — энергия движения электронов*
в атомах; Енд — энёргия внутриядерного движения.
Внутренняя энергия вещества может быть записана так:
U = ^NiEt, (VII1.4)
I
где — число молекул на i-м энергетическом уровне; Ег — энергия
i-ro энергетического уровня. Число молекул, заселяющих все энерге-
тические уровни для 1 моль вещества, равно постоянной Авогадро:
£ */ = **. (VIII.5)
/
Определение внутренней энергии начинают с расчета энергии на нуле-
вом энергетическом уровне. Внутренняя энергия нулевого энергети-
ческого уровня состоит из энергии внутриядерного движения, элект-
98
ронной энергии, энергии колебательного движения на нулевом коле-
бательном квантовом уровне:
и — ио = 1/цоСт + ^вр + ^ви. вр + (^-^о)иол. (VI1I.6)
Заселенность каждого возможного энергетического уровня находят
по уравнению
Nl = Nae-Ei'kT' (VIII.7)
где No — заселенность нулевого энергетического уровня; Et — энер-
гия i-ro энергетического уровня; k — константа Больцмана. Энергети-
ческому уровню соответствует определенная энергия.
ь Некоторые энергетические уровни вырождены, т. е. энергетическо-
му уровню может соответствовать несколько различных состояний с од-
ной и той же энергией:
= —gt е -Ei'kT, (VIII.8)
So
где go — степень вырождения нулевого энергетического уровня; gt—
степень вырождения i-ro энергетического уровня. Для двухатомных
молекул поступательное движение не вырождено, каждый вращатель-
ный уровень вырожден (2/ + 1) раз, где j — вращательное квантовое
число; колебательное .движение не вырождено, каждый электронный
уровень вырожден (2S + 1) раз, где S — суммарный спин молекулы.
С учетом вырождения энергетических уровней
WA= (VI11.9)
где
<3=Sgie-£'/ft7’— (VIII. 10)
молекулярная сумма по состояниям (представляет собой сумму множи-
телей Больцмана, записанных для всех возможных энергетических со-
стояний молекулы).
В развернутом виде сумма по состояниям для отдельной молекулы
(молекулярная сумма по состояниям) записывается так:
Q = g1e-E^llT+gte-E>fkT+gae-E>fkT + ... . (VII1.1I)
Сумму по состояниям можно записать несколько иначе, если при-
нять состояние молекулы с наиболее низкой энергией за нулевое, а со-
ответствующую энергию нулевой энергии Ео и вырожденность нулевого
уровня обозначить g0:
Q — go e-E>/kr+gl e-E*'kT+gt e-E^kT + ... = 2gt ^lkT’ (™М2)
i
тогда суммирование может быть распространено на все возможные
энергетические состояния молекулы.
4*
99
Надо помнить, что для расчета термодинамических функций необ-
ходимо ввести более широкое понятие суммы по состояниям системы
(Z). Рассматривая состояние системы в целом как функцию состояния
составляющих ее частиц (молекул), необходимо различать два случая.
1. Свойства системы зависят от того, какие именно отдельные час-
тицы обладают теми или иными характеристиками, т. е. частицы счита-
ются различимы одна от другой.
2. Свойства системы зависят только от числа частиц, распределен-
ных в группы по признаку обладания упомянутыми характеристика-
ми. Сами же частицы в этом случае неразличимы.
Для различимых частиц. В системе, состоящей из N одинаковых
молекул, каждая молекула может обладать одинаковым рядом энер-
гетических состояний.
Если обозначить индексами i2, ..., iN состояния N индивидуаль-
ных частиц, то при отсутствии взаимодействия между ними энергия
системы выразится соотношением
i2, .... iN = Eit+Ei2 + ...+EiN, (VIII.13)
При этом каждое заданное значение индексов ilt i2, i3, ..., iN соответ-
ствовало бы отдельному состоянию системы в целом. Сумма по состоя-
ниям системы запищется в виде
Z = 2e(_£;.+£i2+- +EiN^kT= (2е~ Ei/kr)N = QN, (VIII.14)
где Et—энергетическое состояние молекулы; Q — молекулярная
сумма по состояниям.
При записи уравнения (VIII. 14) имеется в виду суммирование по
i отдельным уровням. В случае учета вырождения, когда несколько
уровней обладают одинаковой энергией, можно записать
Z = (2 Si e~Eif/tr\N =QN, (VIII.15)
\ i /
где gi — степень вырождения (статистический вес).
Таким образом получено выражение для суммы по состояниям си-
стемы, состоящей из N различных невзаимодействующих частиц (клас-
сическая статистика Максвелла — Больцмана).
Для неразличимых частиц. Рассмотрим систему, состояние кото-
рой определяется просто указанием числа частиц, находящихся в воз-
можных энергетических состояниях. В отличие от статистики Максвел-
ла — Больцмана здесь безразлично, какие именно частицы находятся
в том или ином состоянии. Иными словами, частицы считаются нераз-
личимыми и здесь применяется квантовая статистика (Бозе — Эйнш-
тейна и Ферми — Дирака).
Сумму по состояниям идеального газа, состоящего из N одинаковых
молекул, можно представить в виде
г- ^-(Ss, в". (VUI.16)
100
Здесь суммирование произведено по всем уровням энергии, а не по
каждому индивидуальному состоянию.
Сравнивая выражения суммы по состояниям для систем различи-
мых и неразличимых частиц, видим, что условие неразличимости час-
тиц ведет к появлению в сумме по состояниям системы дополнительного
множителя 1/ЛП. Сумму по состояниям системы называют также боль-
шой суммой по состояниям.
Для вычисления внутренней энергии системы продифференцируем
большую сумму по состояниям по температуре при постоянном объеме:
I dZ \ N n—i( dQ \
\ дТ ) = N\ Q \~дТ) ‘ (VIII.1/)
Умножаем производную на kT2 и делим на Z:
,T„/dlnZ\ (OlnQ \ gjfj
\ дТ ]v \ ОТ J Q
8гЕг -Et/kT
—_— е
Q
gjEj -E./kT
Q e
. (V1II.18)
„ Nt
Согласно уравнению —у =
и=
-EJkT
g>e 1 ,
——q------для 1 моль газа
, _ / 5 In 2 \ „ . / д In Q\ / д In Q
kT2 ----- = NkT2 --------2 = № --------
\ дТ )v \ дТ ) \ дТ
= (Е^ + f2V2 +... + EtNt + ...)= S EtNi.
(VIII.19)
Внутреннюю энергию удобнее рассчитывать по отдельным состав-
ляющим видам энергии движения:
{/пост = 1,5 RT, (VIII.20)
бг/,вр = 0,5 RT, (VIII.21)
где 1//1Вр — составляющая внутренней энергии вращательного движе-
ния для одной степени свободы вращения.
Двухатомные и линейные многоатомные молекулы имеют две степе-
ни свободы вращательного движения, нелинейные многоатомные моле-
кулы— три степени свободы вращательного движения. Колебатель-
ная составляющая внутренней энергии
Йй)| с Лео,- с
с и~и° \ = R
I Т Лол еЛ^г-1 Лт_1
где 0; — приведенная температура.
Функция / - --- ] для определенных значений Bi/T для линейного
гармонического осциллятора рассчитана и приводится в таблицах тер-
модинамических функций Эйнштейна. Для многоатомных молекул ко-
лебательную составляющую внутренней энергии рассчитывают для
R у
(VIII. 22)
101
каждой степени свободы колебательного движения отдельно и сумми-
руют по всем степеням свободы колебательного движения. Для двух-
атомных и линейных многоатомных молекул число колебательных сте-
пеней свободы
(VIII.23)
/кол — Зп—5,
для нелинейных многоатомных молекул
/кол = 3п-6, (VIII. 24)
где п — число атомов в молекуле. При наличии степей свободы внут-
реннего вращения у многоатомных молекул для одной степени свободы
Увк.вР = 0,5/?Т. (VIII.25)
Теплоемкость Су для каждого вида движения рассчитывают по уравне-
нию
(VIII.26)
(VI11.27)
I dU \ ’ „ / d*lnZ \
। I ~ = I I jma I + 2T I I
{ дТ /V v’ v L \ дТ* /V I dT !v
Nk Г / 3*lnQ \ / dlnQ \ 1
=------ T21--------- + 2T -------
R L \ dT* ]\ dT Jv\
Для газов, состоящих из двухатомных молекул, изохорную тепло-
емкость определяют по уравнению
с . d (£7—£7») = RTQ/T
v dT dT e0/T — i
Теплоемкость удобнее рассчитывать по отдельным
составляющим:
(VIII.28)
(VIII.29)
cv, пост +С«р-2,5/?.
ев!г
(VIII.30)
cv. к°л- (e0/r_0a •
В таблицах термодинамических функций Эйнштейна для линейного
гармонического осциллятора функции
се —
(VIII.31)
даются для определенных значений Q/Т. Для многоатомных молекул
колебательная составляющая теплоемкости равна сумме Се по всем
степеням свободы колебательного движения. При наличии у многоатом-
ной молекулы степеней свободы внутреннего вращения следует учиты-
вать еще Cv, вн.вр — теплоемкость, приходящуюся на внутреннее
вращение. Согласно (VIII.21) и (VIII.27) имеем
^V вн
W f on•OU
(VI11.32)
102
Термодинамическая вероятность связана с суммой по состояниям
системы следующим уравнением:
InW — lnZ-f-U/kT. (VIII.33)
Уравнение (VIII.33) содержит все основные сведения, которые термоди-
намика может дать относительно свойств системы и обеспечить логиче-
скую основу для всех термодинамических анализов. Сумма состояний
Z определяется энергетическими уравнениями, абсолютной температу-
рой и общим числом частиц, составляющих систему; величина W оп-
ределяется видом распределения энергии системы среди различных час-
тиц, т. е. числом частиц на каждом дискретном энергетическом уровне.
Из уравнения (VIII.33) следует
S = fe[InZ + T(dInZ/aT)y], (VIII.34)
Поступательная составляющая энтропии идеального газа может
быть вычислена с помощью определения Z для неразличимых частиц
и поступательной суммы по состояниям для молекулы идеального
газа. Для неразличимых частиц
Z = Qn/N\. (VIII.35)
Используя приближенное соотношение Стирлинга для 1пУ! при
больших N; In V! = N In N — N, найдем
InZ = AInQ—A’InA+A. (VIII.36)
Подставляя уравнение (VIII.36) в уравнение (VIII. 34), получаем
S = А k [In Q—InN+ 1 -l-T (d In Q/dT)y], (VIII.37}
Поступательную сумму по состоянию для молекулы можно рассчи-
тать по уравнению
<2пост = (2л/ий Т/й2)3/2 V. (VIII.38)
Зная массу частиц, давление и температуру, получаем поступательную
составляющую молярной энтропии идеального газа.
Если объем выражать через Р и Т по уравнению Менделеева — Кла-
пейрона, то поступательная составляющая суммы состояний будет
(2лй)3/2 ЯМ3/2
<2пост = --- /;3^/2--------(VIII.39)
Натуральный логарифм поступательной составляющей суммы состоя-
ний
(2л Л)3/2 Л? е 3
In Опост = 2,3026 Ig .,5/2 । о” 2,3026 Ig M -|-
n® Ад' 2
, 5.
+ у 2,3026 Ig T-2,3026 IgP. (VIII.40)
103
Выражая все постоянные величины в международной системе единиц
(СИ), уравнение (VIII.40) принимает вид
In QnocT = 3,4539 lgM + 5,7565 lg T—2,3026 1g P + 8,8612. (VIII.41)
Вращательная составляющая молярной энтропии для жесткой линей-
ной молекулы может быть получена с помощью определения Z для
различимых частиц и суммы состояний для жесткого ротатора.
Для различимых частиц Z — QN, поэтому для энтропии
S = Nk[lnQ + T (d\nQ/dT)v], (VIII.42)
Сумма по состояниям для линейного жесткого ротатора имеет вид
8n4kT kT
вр а Л2 Be а
(VIII.43)
где / — момент инерции молекулы; а — число симметрии; Ве — враща-
тельная постоянная. Гомоядерные двухатомные молекулы имеют сте-
пень симметрии о = 2, гетероядерные — о = 1. После подстановки
в уравнение (VIII.43) постоянных величин и логарифмирования полу-
чим
lnQBp = 2,3026 1g/4-2,3026 lg Т—2,3026 lg а+104,5265. (VIII.44)
Вращательная составляющая суммы состояний для многоатомных
молекул:
для сферически симметричного волчка
8л2 ! 2nlkT \3/2
Овр— I ,3 I ; (VIII.45)
о \ Л3 * J
для симметричного волчка
QbP = — ( 2Л-^-—)'72 -Л ; (VIII.46)
а \ Л2 ] Л2
для асимметричного волчка
_ 8л2 / 2л/АйТ у/2/ 2л/вЙТ V/2/ 2л/сйТ у/2
Чвр ст Л2 / \ Л2 j \ Л2 ) 1 ’
Логарифмируя уравнения (VIII.45) — (VIII.47) и подставляя постоян-
ные величины в СИ, получаем
lnQBp = 2,3026 1g
ст
3
+ 0,5-2,3026 lg(/A/B /c)+Y1Sr=0’5-2’3026 М'а'в 'с) +
+ 3,4539 1g Г—2,3026 Ig «+157,3621. (VIII.48)
Произведение главных моментов инерции /а/в/с может быть рассчи-
тано из векового уравнения (см. гл. VI)
Vc =
+ Лсх— ^ху—?xz
— Ixy-\~Iyy — lyz
— Ixz — Iyz-}~I гг
(VI11.49)
104
Для многоатомных молекул, в которых имеются группы атомов, спо-
собные свободно вращаться одна относительно другой, составляющую
суммы состояний свободного внутреннего вращения вычисляют по
уравнению
где о — число симметрии группы атомов; /прив — приведенный мо-
мент инерции внутреннего вращения;
Лфйв — ЛЛ/СЛ + Л). (VIII.51)
После подстановки в уравнение (VIII.51) постоянных величин, выра-
жаемых в СИ, и логарифмирования получим
ЗдЗ £
1g (?вн.вр = 0,5-2,3026 lg —-—4-2,3026-0,5 IgT-f-
4-0,5-2,3026 lg/прив—2,3026 Igo, (VIII.52)
In Qbh.sp= 1,1513 lg/np„n —2,2026 lg 04- 1,1513 lg T 4-52,8356. (VIII.53)
Колебательная составляющая суммы состояний для двухатомных мо-
лекул, обладающих одной степенью свободы колебательного движе-
ния, равна
QkOji = ~ ' (V111.54)
где сое — частота колебательного движения, м-1; 0 характеристи-
ческая температура,
9=(hc/k) we = 1,4387-10~2 we. (VIII.55)
Колебательная составляющая суммы состояний для многоатомных мо-
лекул, обладающих несколькими степенями свободы колебательного
движения, равна:
Зл-6(5) ' 1
<2кол= П --------777 (VIII. 56)
( = 1 1 —е 1
ИЛИ
Зп—6(5)
lnQ= V 1П-----------. (VIII.57)
1 = 1 1 — е 1
Подставляя это значение в уравнение для колебательной составляю-
щей энтропии, получаем
5«°л = Я -ln(l-g~ftv/fer)]. (VIII.58)
Электронная составляющая суммы состояний для двухатомных моле-
кул
&л=Л,эл = 2« + 1, (VIII.59)
105
где g0,9n — вырождение нулевого электронного уровня; S — суммар-
ный спин электронов в молекуле. Терм электронного состояния моле-
кулы определяется по уравнению (1.7).
Энтропия электронной составляющей равна
$Т,эл — R Soon-
Энтропия газа выражается через сумму состояний:
ST = k InZ+k Т
(VIII. 60)
(VIII.61)
д InZ \
дТ ]'
Энтропию газа, состоящего из двухатомных молекул, следует рассчи-
тывать как сумму энтропий составляющих:
Sy — Sdoct SBp -|- SK(W + ^эл
(VI11.62)
Для расчета поступательной составляющей энтропии SUOCT
варительно
Тогда
вычисляют In Q и производную
dlnQ \
dlnQ\
дТ /
пред-
1,50
Т ’
^Т, пост = 1п ^пост 4-1,5000й N.
(VIII.63)
. _ / dlnZ \
In Z—I —---
(VIII.66)
д In V /т
Объединив уравнения (VIII. 44) и (VIII.34), получаем выражение для
расчета вращательной составляющей энтропии:
SrBp= tflnQBp+tf. (VIII.64)
Колебательная составляющая энтропии находится по таблицам термо-
динамических функций Эйнштейна.
Энергия Гельмгольца равна
A—A<) = U — TS=—kT\nZ, (VIII,65)
а энергия Гиббса
G—Go= — kT
Так как энергия Гиббса равна
G=A+PV=U-TS + Py, . (VIII.67)
то для 1 моль идеального газа получим
G—H0 = A — UQ+RT=— kT\n Z±RT=—RT\n -у-. (V1I1.68)
Следует еще раз обратить внимание на то, что во всех формулах,
содержащих газовую постоянную R, расчет ведется на 1 моль, а при аб-
солютном нуле термодинамические потенциалы равны, т. е.
Ua = H0=Aa = Ge. (VIII.69)
106
Энтальпия равна
H—Ha = kT
(VI11.70)
P = feT
dlnZ \
(VIII.71)
О 1П г /Г
При расчете энтропии многоатомных молекул статистическим мето-
дом поступательную составляющую энтропии вычисляют аналогично
поступательной составляющей для двухатомных молекул. Вращатель-
ную составляющую энтропии рассчитывают в зависимости от типа мо-
лекул. Колебательную составляющую энтропии для каждой степени
свободы колебательного движения находят по таблице термодинами-
ческих функций Эйнштейна и суммируют по всем колебательным сте-
пеням свободы. При наличии внутреннего вращения составляющую
энтропии SBIt.Bp определяют по уравнению (VIII.64) для каждой сте-
пени свободы внутреннего вращения и затем составляющие суммируют.
Электронную составляющую энтропии вычисляют по уравнению
Д __ у V
—-—-) рассчитывают по уравнению
)=_felnZ.
Т 1
(VIII.72
Л / AT - U„ \
Функцию I—-y------1 рассчитывают как сумму составляющих по
А I Ат~ио\
всем видам движения. Функцию ------=---1 вычисляют по уравне-
\ * /пост
нию (VIII.41) для газов, состоящих из двухатомных и многоатомных
Л / Ат - Uo \
- молекул. Функцию I---?----I для двухатомных газов находят по
уравнению (VIII. 44), для многоатомных газов в зависимости от типа
молекул — по уравнениям (VIII.45), (VIII. 46) или (VIII.47). Функ-
цию I----т---I для двухатомных молекул находят по таблицам
термодинамических функций Эйнштейна. Для многоатомных молекул
следует сложить составляющие функции по всем степеням свободы ко-
(AT-U,\
лебательного движения. Функцию —=------1 вычисляют по уравне-
нию (VIII. 59). Для многоатомных молекул при наличии степеней сво-
f Д _____________________________________ U \
боды внутреннего вращения функцию (------— ] определяют по
\ 71 /вн.вр
/ Q ___ Н \
уравнению (VIII.53). Функцию I-------—— j вычисляют из функции
I А-и0\
\ Т Г
G-Ho
T
A — Ut
T
(VIII.73)
107
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите поступательную составляющую суммы состояний
СО при 1,0133-105 Па и 500 К.
Решение. После подстановки молекулярной массы, давления
и температуры в уравнение (VIII. 39) получим
1п(?пост = 3,4539 1g28 + 5,7565 1g 500 — 2,3026 Ig 1,0133- 10s + 8,8612 =
= 4,9983+15,5365 — 11,5262+8,8612=17,8669,
ig Qnoct ~7,7607, QnOd = 5,764-107.
2. Определите вращательную составляющую суммы состояний СО
при 500 К. Момент инерции СО равен 14,49-10~47 кг-м2.
Решение. Вращательную составляющую суммы состояний оп-
ределим по уравнению (VIII.44). Молекула СО гетероядерная, следова-
тельно, о=1:
In QBp = 2,3026 Ig 14,49-10-47+2,3026 Ig 500 — 2,3026 Ig 1 + 104,5265= —
—105,5487 — 6,2146+104,5265 = 5,1924,
Ig QBp = 2,2550, QBp = 179,9.
3. Определите колебательную суммы состояний СО при 500 К, если
частота колебательного движения составляет 2,170-105 м-1.
Решение. Определим характеристическую температуру по
уравнению (VIII. 55):
0=1,4387-1О~2-2,17О-1О* = 3123,
0 3123
— = -77Г~ = 6-245-
Т 500
Колебательную составляющую суммы состояний вычислим по уравне-
нию (VIII. 57):
^кол 1—e-«.24s 1—0,00194 1-0019-
4. Определите сумму состояний СО при 1,0133-105 Па и 500 К.
Решение. Электронная составляющая суммы состояний СО
равна единице (g0, эл = 1), так как суммарный спин электронов ра-
вен нулю. У двухатомных молекул только одна степень свободы коле-
бательного движения и отсутствует внутреннее вращение. По урав-
нению (VIII. 60) получим
Q = 5,764-107-179,9-1,0019= 1,0389- Ю7».
5. Определите долю молекул СО, находящихся на вращательном
квантовом уровне / = 5, по отношению к нулевому колебательному
уровню при 500 К, QBP = 179,9.
Решение. Из соотношения Больцмана получим
-Ве5(5+1)*Г
Л*_=2(5+1) —
ЛА
Qnp
108
Ве найдем по уравнению (II 1.5):
S (6’6256•10~31)2
8л2 14,49-10-4’
5,5593-10-»’
~14,49~Д0~47~ -°'3837-10-аа Д-'
N- .-30-0,3837 10~»2/( 1,38054 • 10~ls-500)
лГ-=11 -------------------------------------
"а 179,9
£-0,16679
6. Определите долю молекул СО, находящихся на колебательном
квантовом уровне у=1 при 500 К, если 2к0Л = 1,0019; <ое = 2,170х
X 105 м-1; <лехе = 13,37-102 м"1.
Решение. Для этого рассчитываем показатель степени экспо-
ненты:
£к.->.-1 _ 1,5Дс (og—2,25hc ti>g хе _ 64,6537• 10~21 — 0,5975• 1О-*1
kT 1,38054-10-23-500 “ 6,927-Ю-21 =9,2473.
Долю молекул СО на колебательном уровне определяем по
уравнению Больцмана
£—9,2473
^кол
0,000096
1,0019
= 0,0000958.
7. Определите поступательную составляющую внутренней энергии
СО при 500 К.
Решение. Внутреннюю энергию поступательного движения
определяем по уравнению (VIII.20):
(7пост = 1,5-8,3143-500 = 6,2357-103 Дж/моль.
8. Определите вращательную составляющую внутренней энергии
СО при 500 К-
Решение. Вращательную составляющую внутренней энергии
находим по уравнению (VIII.21). Молекула СО обладает двумя степе-
нями свободы вращательного движения:
(7Ер = 2-0,5-8,3143-500 = 4,1571-Ю3 Дж/моль.
9. Определите колебательную составляющую внутренней энергии
СО при 500 К, если Q/T — 6,245.
Решение. Величину (—~ ^-^кол найдем по таблице термо
динамических функций Эйнштейна как функцию д/Т [М.]:
6/Т..
м
6,00 6,40
0,1243 0,1050
109
Линейной интерполяцией находим
0,40—0,0193
г *=0,0118.
0,245—*
/ и—иа \
---т—М =0,1243 —0,0118 = 0,1125 Дж/(моль-К),
\ Т /кол
(f/-f/e)Kon = 0,1125-500 = 0,0562-10» Дж/моль.
10. Определите внутреннюю энергию СО при 500 К.
Решение. Электронная составляющая внутренней энергии
равна нулю, степеней свободы внутреннего вращения у молекулы СО
нет, отсюда
(U—(/о)800=6,2357-10S-H4,1571.10»+0,0562-108=10,4490-10» Дж/моль.
11. Определите поступательную составляющую теплоемкости СО
при 500 К при постоянном объеме.
Решение. Изохорную поступательную составляющую тепло-
емкости СО определим по уравнению (VIII. 20):
Су.пост^ 1,5.8,3143= 12,4715 Дж/(моль.К).
12. Определите вращательную составляющую теплоемкости СО
при 500 К.
Решение. Вращательную составляющую теплоемкости рассчи-
таем по уравнению (VIII.21). Молекула СО обладает двумя степе-
нями свободы вращательного движения, отсюда
Свр = 2.0,5-8,3143 = 8,3143 Дж/(моль-К).
13. Определите колебательную составляющую теплоемкости СО
при 500 К, если Q/T = 6,245.
Решение. Колебательную составляющую теплоемкости най-
дем по таблице термодинамических функций Эйнштейна для гар-
монического осциллятора:
д/Т ............................. 6,00
СР .............0,745
С *
Линейной интерполяцией находим
0,40—0,176
п _ * = 0,1078.
0,245—*
СЕ = 0,745—0,108 = 0,637 Дж/(моль-К)-
14. Определите теплоемкость Cp.soo СО при 1,0133-105 Па и 500 К-
Решение. Согласно уравнениям Ср = Су + R и (VI.22) най-
дем
С£ = 12,4715 + 8,3143 + 0,6374-8,3143 = 29,7371 Дж/(моль-К).
15. Установите зависимость Ср от температуры. Уравнение за-
висимости представьте в виде Ср = а+ ЬТ 4- сТ2 в диапазоне тем-
ператур от 298 до 1000 К-
6,40
0,569
110
Решение. По уравнению
С£ = 3,5/?+ Се = 29,100+Се
вычислим Ср для температур от 298 до 1000 К через 100. Методом на-
именьших квадратов рассчитаем коэффициенты а, b и с.
Т, к % II Г—300 X* хг ху х*у
100 =Л
298 29,1297 —
300 29,1295 0 0 0 0 0 0
400 29,3073 1 1 1 1 29,3073 29,3073
500 29,7369 2 4 8 16 59,4738 118,9476
600 30,3511 3 9 27 81 91,0533 273,1599
700 31,0574 4 16 64 256 124,2296 496,9184
800 31,7541 5 25 125 625 158,7705 793,8525
900 32,4170 6 36 216 1296 194,5020 1167,0120
1000 33,0056 7 49 343 2401 231,0392 1617,2744
S 246,7589 28 140 784 4676 888,3757 4497,0721
Находим коэффициенты X, Y и Z сначала в уравнении типа
у~ X х + Z х\
Из таблицы подставляем соответствующие значения в эту формулу и
получаем систему уравнений:
246,7589 = 8Х28У-|-140Z
888,3757 = 28Х-J-140У+784Z
4497,0721 =140Х-^-784Г-|-4676Z .
Решаем совместно два первых уравнения:
!727,3!23 = 56Х-]-196K-]-980Z
1776,7514 = 56X 4-2807 4-1568Z
49,4391= 8474-588Z
Решаем совместно два последних уравнения:
4441,8785 = 140X -|- 700К -)- 3920Z
4497,0721 = 140Х 4-7847-4-4676Z
55,1936 = 847-I-756Z
49,4391 = 847-|-588Z
55,1936 = 847-4- 756Z
5,7545= 168Z Z = 0,03425
„ 49,4391—588-0,03425
7 =----------------:----= 0,3488,
84
111
v 246,7589—140-0,03525 — 28-0,3488
X =---------------g--------------=29,0247,
С “ = 29,0247-/0,3488х -f-- 0,03425л2 = 29,0247+
/ Т—300 \ / Т— 300 V
+ 0,3488 —------- + 0,03425 —— = 29,0247 +
\ 100 / \ 100 / '
+ 0,0034887"—3 • 0,3488 + 0,03425Т"2 • 10~« — 600 • 10~*Т—9.
Окончательно уравнение зависимости имеет вид:
Q = 28,2866 +1,433 • 10-3?" + 2,426 1 О-в?"2.
16. Определите внутреннюю энергию метанола при 1,0133-105 Па
и 500К.
Решение. Расчет поступательной составляющей внутренней
энергии многоатомных молекул не отличается от расчета для двухатом-
ных молекул. Согласно уравнению (VIII.20)
(УпОСТ=1,5/?7’=1,5-8,3143-500 = 6,2357-103 дж/моль.
Молекула метанола имеет три степени свободы вращательного движе-
ния. Следовательно, вращательная составляющая внутренней энер-
гии будет
(Увр = 3-0,5/?7’= 1,5-8,3143-500 = 6,2357-103 Дж/моль.
Молекула метанола обладает одной степенью свободы внутреннего
вращения. Составляющую внутренней энергии внутреннего вращения
определяем по уравнению (VIII.25):
^вн.вр = 0,5-8,3143-500 = 2,0785-103 Дж/моль.
Для определения колебательной составляющей внутренней энергии не-
обходимо суммировать 11 слагаемых, которые находим по экспери-
ментальным значениям частот колебаний и вырождений колебаний в
таблицах термодинамических функций Эйнштейна для гармоническо-
го осциллятора:
а>е . 1 О-5, м~1 Вырождснне* 0/500 Дж/(моль-К) СЕ, Дж/(моль-К)
3,683 10,598 0,0025 0,025’
2,976 2 8,564 0,0145 0,118
2,845 8,187 0,0193 0,158
1,455 2 4,187 0,537 2,285
1,340 3,856 0,693 2,730
1,116 2 3,211 1,121 3,751
1,031 2,967 1,338 4,186
* В отличне от двухатомных молекул, у которых колебательное движение атомов не
вырождено, у многоатомных молекул при наличии симметрии возможно совпадение не-
скольких частот по величине. Такие колебания называются вырожденными:
(U— Уо)Кол= (------522-1 500=6,7281 -500=3,3640- 103 Дж/моль.
112
У веществ, состоящих из многоатомных молекул, в отличие от ве-
ществ, состоящих из двухатомных молекул, колебательная составля-
ющая внутренней 'энергии вносит заметный вклад в общую величину
внутренней энергии даже при невысоких температурах:
({/—{/0)800 = 6,2357-103 + 6,2357-103 + 2,0785-103 +
+ 3,3640-103 = 17,9139-103 Дж/моль.
17. Определите изобарную теплоемкость метанола при 1,0133-105
Па и 500 К-
Решение. Поступательную составляющую теплоемкости для
многоатомных молекул рассчитываем по уравнению (VIII.26):
Су>пост= 1,5-8,3143=12,4715 Дж/(моль-К)-
Молекула метанола имеет три степени свободы вращательного движе-
ния, следовательно, вращательная составляющая теплоемкости будет
Cv_ вр = 1,5-8,3143= 12,4715 Дж/(моль-К)-
Молекула метанола имеет одну степень свободы внутреннего вращения,
следовательно, составляющая теплоемкости внутреннего вращения бу-
дет
CV, вн.вр =0,5-8,3!43 = 4,1571 Дж/(моль-К)-
Колебательную составляющую теплоемкости получим суммированием
11 слагаемых, которые находим по таблице термодинамических функ-
ций Эйнштейна для каждого значения 0/Т. Величины 0/7 при-
ведены в таблице на с. 112, в которой также приведены значения Се
для всех 11 степеней свободы колебательного движения:
11
CV кол = 2 СЕ ==23,578 Дж/(моль-К)-
4=1 1
Изохорная теплоемкость будет равна сумме составляющих:
CVi 500 = 12,4715+12,4715 + 4,1571 + 23,578 = 52,678 Дж/(моль-К).
Изобарная теплоемкость
ср,5оо= 52,678 + 8,314 = 60,992 Дж/(моль-К)-
18. Определите функцию (Н° — //о)зоо для метанола, если (U —
— ^0)500 = 17,9139-103 Дж/моль.
Решение. Для идеального газа, согласно уравнению (VI.3),
(Яв-Я§) = 17,9139-103 + 8,3143-500 = 22,0711-103 Дж/моль.
19. Определите энтропию СО при 1,0133- 10s Па и 500 К.
Решение. Энтропию определяем по уравнению (VIII.61). По
уравнению (VII 1.40) находим 1п Qn0CT, отсюда находим производную —
она равна 1,5 1/7. Тогда по уравнению (VIII.61) получаем
5пост = (3,4539 1g 28+5,7565 lg 500—2,3026 lg 1,0133-103 +
+ 8,8612+1,5000) 8,3143= 161,0472 Дж/(моль-К).
113
По уравнению (VIII.43) рассчитаем In ZBP и производную —в£- j
Тогда
SBp= (2,3026 Ig 14,49-10-»’ +2,3026 1g 500+104,5265—
—2,3 Ig 2 + 1,0000) 8,3143 = 51,4854 Дж/(моль-К).
Колебательную составляющую энтропии находим на основании 0/Т
по таблице термодинамических функций Эйнштейна для гармоническо-
го осциллятора:
в/Т................. 6,00 6,40
SKon ............. 0,146 0,100
Линейной интерполяцией находим
0,40 —0,046
0,245—х
х = 0,028.
Следовательно, SKon — 0,118 Дж/(моль-К). Электронная составляю-
щая энтропии СО равна нулю, так как суммарный спин электронов ра-
вен нулю. Энтропия СО равна сумме составляющих поступательной,
вращательной и колебательной энтропий:
S®0„ = 161,0472+ 51,4854 + 0,118 = 212,6506 Дж/(моль-К).
20. Определите энтропию метанола при 1,0133-105 Па и 500 К.
Решение. Энтропию метанола определяем суммированием со-
ставляющих энтропий поступательной, вращательной, внутреннего
вращения и колебательной.
Рис. 12. Проекция и геометрические параметры молекулы
СН3ОН для вычисления произведений моментов инерции
Поступательную составляющую энтропии вычисляем по уравнению
(VIII. 34), предварительно определив In Qn0CT, и затем находим
(д In <2пост \ -т-
-----— L- Тогда
Snoct= (3,4539 1g 32+5,7565 Ig 500 — 2,3026 Ig 1,0133-10» +
+ 8,8612+1,5000) 8,3143=162,7142 Дж/(моль-К).
114
Вращательную составляющую энтропии рассчитываем по уравнению
(VIII.34). Для вычисления вращательной суммы состояний необходи-
мо знать произведение главных моментов инерции. Для определения
произведения главных моментов инерции необходимые величины све-
дем в таблицу. Выберем за начало координат ядро атома углерода.
Ось х совпадает с направлением связи С — О. На рис. 12 показаны
равновесные межъядерные расстояния и углы между направлениями
связей и представлены две проекции в плоскостях хг и уг.
Атом т • 10м, кг х-10’«, м у-10*’, м z-10’ •, м
С 1,992 0 0 0
О 2,656 1,43 0 0
н. 0,166 1,43+0,96 cos 70°= 1,76 0 0,96 sin 70°=0,90
Н, 0,166 1,11 cos 109°28'=—0,37 0 1,11 sin 70°32'= 1,05
Нз 0,166 -0,37. 1,11 cos 1,11 sin 240°=—0,56
240°=—0,96
Н4 0,166 —0,37 0,96 -0,56
6
У, т{=5,312-10~2’ кг.
М
Атом С о н, н, н, ✓ Н4 £
хМО2® 0 2,045 3,098 0,137 0,137 0,137
уЧО2» 0 0 0 0 0,922 0,922
гМО2® 0 0 0,810 1,103 0,314 0,314
ху- Ю2» 0 0 0 0 0,355 -0,355
хг - Ю20 0 0 1,584 —0,389 0,207 0,207
уг-Ю2® 0 0 0 0 0,538 —0,538
тх-10” 0 3,798 0,292 —0,061 —0,061 —0,061 3,907
ту-10” 0 0 0 0 —0,159 0,159 0
тг-10” 0 0 0,149 0,174 —0,093 —0,093 0,137
тху-10*’ 0 0 0 0 0,059 —0,059 0
тхг-10” 0 0 0,263 —0,065 0,034 0,034 0,266
myz-10” 0 0 0 0 0,089 —0,089 0
«(х’+^-Ю” 0 5,432 0,514 0,023 0,176 0,176 6,321
m(x2+z2) • 10*’ 0 5,432 0,649 0,206 0,075 0,075 6,437
m(jr2+z2)-10*e 0 0 0,134 0,183 0,205 0,205 0,727
Решение векового уравнения (см. гл. IV) дает следующие моменты
инерции:
0+0,019-10~’2
/„=0,727-ю-и——------------------ = 0,727-10-*’—0,004-10-*’= 0,723-10-*’;
* 5,312-Ю-2’
, . о, 4. 15,265-10-’2 + 0,019-Ю-’2
/„„ = 6,437-10-*’ —— ---------— --------------
™ 5,312-Ю-2»
= 6,437-10-*’—2,877-10*’=3,560-10-*’;
115
15,265-10-’24-0
IIZ = 6,321 • 10"4® — 5 312 10-2в = 6 - 321 10-4 в —2,874 10'46 = 3,447 • 1 О' 48;
О
=0—--------------= 0;
у 5,312-10-28
0,535-Ю-’2
Zxz = 0,266-10“4в — —:-------= 0,266-Ю-46—0,101 10-4б = 0,165- 10~4в;
хг « 5,312-10-2»
О
yz 5,312-Ю"’2
Произведение главных моментов инерции будет равно:
^А^В = Cwc ^УУ ^2Z— ^2 1цг\ —^ху Uxy ^zz+ lyz Л:х) —
— Ixz (Jxy lyzj- Iyy Ли)',
ZA ZB Zc = 0,723-Ю-46 (3,560- IO"46-3,447- IO-46—0-0) —
—0,165-IO-46 (0-0 + 3,560-lO-w-0,165-10-46) =
= 0,723-3,560-3,447-10-iae—0,165-3,560-0,165-10-i38 = 8,775-IO-138-
Подставляем произведение главных моментов инерции в уравнение
(VIII.43) и находим In QBP и ( ”-ln<^B-p .'i . Молекула СН3ОН несим-
\ дТ /у
метричная. Подставив полученные значения в (VIII.34), получим
SBp= (1,1513 1g 8,775-IO-1384-3,4539 lg 500 — 2,3026 lg 1 +
4- 157,36214- 1,5000) 8,3143= 10,3907-8,3143 = 86,3914 Дж/(моль-К).
Составляющую энтропии внутреннего вращения рассчитываем по урав-
нению (VIII.42). В молекуле метанола группа атомов СН 3 вращает -
ся относительно группы ОН. Можно считать, что вращение этих групп
происходит свободно, так как С — О обладает о-связью. Отсюда энер-
гия вращения превышает энергию потенциального барьера. Найдем
приведенный момент инерции:
^СН, — ®тН (ГС — Н s'n 70°31')2 —
= 3-0,166- IO"36 (1, Н . ю-io 0,943)2 = 5,454-Ю'4’ кг-м3;
/он = 1-0,166-10-28 (0,96-IO-10 sin70°)3 =
= 1 -0,166-10-28 (0,96-0,940-10—13)2= 1,351 • 10-« кг/м3;
5,454-10-4’-1,351 • 10~4’
Лтпив = —'----------------------= 1,083-Ю-4’
р 5,454-10-4’4- 1,351-Ю'4’
кг-м2.
Число симметрии равно произведению степени симметрии групп СН,
и ОН: о = 3-1 = 3 Тогда
5вн.вр=( 1,1513 lg 1,083-10-4’— 2,3026 lg 34-1,1513 lg 5004-
4-52,8356 4-0,5000) 8,3143= (0,77314-0,5000) 8,3143 =
= 1,2731-8,3143 = 10,5849 Дж/(моль-К).
116
Колебательную составляющую энтропии находим по значению 0/Т
для всех 11 степеней свободы колебательного движения. Значения ча-
стот колебаний, вырождений, 0/Т и найденные в таблице термодинами-
ческих функций Эйнштейна для гармонического осциллятора энтро-
пии приведены ниже:
(0е • 10~5, М—1 . . 3,683 2,976 2,845 1,455 1,340 1,166 1,034 1,031
Вырождение . . 0/7’ 10,598 2 8,564 8,187 2 4,187 3,856 2 3,211 2,975 2,967
$кол 0,000 0,01-5 0,021 0,663 0,872 1,465 1,767 1,779
/= и
•$кол — 2 *^1, кол —725 Дж/(моль-К)-
i=i
Суммированием составляющих энтропии получим энтропию при за-
данных условиях:
5g00 = 162,7142+86,3914 + 10,5849 + 8,725 = 268,416 Дж/(моль-К).
Электронная составляющая энтропии равна нулю, так как суммарный
спин электронов равен нулю.
/QQ ___//0\
21. Определите функцию I —°) для метанола при 500 К и
1,0133-105 Па.
Решение. Для определения функции!--------------—— I вычислим сна-
( о \ г»
чала функцию I—?--------I по уравнению (VIII.65), суммируя все со-
ставляющие по всем 18 степеням свободы движения:
(Д™.—17л \
—£-----£ I =—8,3143 (3,4539 1g32 + 5,7565 1g500 —
Т /пост
— 2,3026 lg 1,0133-105 + 8,8612)= —8,3143-18,0704= —150,2427 Дж/(моль-К);
/ Ат—Ua\
——й—-] =—8,3143(1,1513 1g 8,775-10-ise+3,4539 1g 500 —
\ А /вр
—2,3026 1g 1 + 157,3621)= —8,3143-8,8907= —73,9199 Дж/(моль-К);
( —17 л \
———- = -8,3143 (1,1513 1g 1,083-10-<’ —2,3026 1g 3 +
\ Т /вн.вр
+ 1,1513 1g500 + 52,8356) = -8,3143-0,7731 == —6,4278 Дж/(моль-К).
А- — U„
Колебательную составляющую функции -.......-у,—- находим по значе-
ниям 0/Т для всех степеней свободы колебательных движений:
(Ое-10-5, м-1 .......... 3,683 2,976 2,845 1,455 1,340 1,116 1,034 1,031
0/7’................... 10,598 8,564 8,187 4,187 3,856 3,211 2,975 2,967
Вырождение............. 2 2 2
/ Ат—Uо \
—1...... ........ 0,000 0,000 0,001 0,128 0,179 0,343 0,438 0,411
\ Т /кол
117
Тогда
fjll—t/o\ =—2,001 Дж/(моль-К);
\ T /КОЛ
^8BO~f7° —150,2427— 73,9199 —6,4278— 2,001 = —232,591 Дж/(моль-К);
(ПО ___MO \
500„--— j = — 232,591 + 8,3143 = —224,277 Дж/(моль • К) -
22. Определите функцию (Я§оо — Яме) Для метанола.
Решение. Воспользуемся табличным значением величины
(Hz98 — Я8) из справочника [М.]: (Я-гэв — Но) = 11,435 кДж/моль.
Тогда
Woo-НМ = Woo -Wg) - (W»,8 -Я«) =22,0711 10»-
— 11,435-108=10,636 10» Дж/моль.
23. Система состоит из десяти частиц, распределенных на четырех
энергетических уровнях, имеющих относительные величины энергии
1, 2, 3 и 4 и общую относительную энергию, равную 20. Определите,
какое из различных распределений может быть осуществлено наиболь-
шим числом способов.
Решение. Одно возможное распределение десяти частиц на
энергетических уровнях таково, что все десять частиц располага-
ются на энергетическом уровне 2. В этом случае общая энергия систе-
мы составит 20.
Согласно уравнению
NJ Nt\ N3\.. .Nn\
получим только один способ, которым это распределение можно осу-
ществить, т. е. обмен частиц на том же уровне не дает нового состоя-
ния системы.
Второе распределение может быть получено перемещением одной
частицы с уровня 2 на уровень 1 и другой частицы с уровня 2 на уровень
3. Общая энергия равна 20. Расчет по уравнению дает значение W,
равное 90.
Таким образом, это распределение можно осуществить 90 различ-
ными способами.
Если в первоначальном распределении две частицы перемещаются с
уровня 2 на уровень 1, а две другие частицы—с уровня 2 на уровень
3, то общая энергия составит 20. При этом W равно 1260. При пере-
мещении трех частиц с уровня 2 на уровень 1 и трех частиц с уровня 2
на уровень 3 общая энергия останется равной 20, но W возрастет до
4200.
Для этой системы значения W могут быть вычислены для всех рас-
пределений, имеющих общую энергию 20. Результаты приведены в таб-
лице.
118
Распределение частиц дли N—10, fe=4 и общей энергии £=20
В задаче отмечено 44803 способа осуществления заданных условий.
Из них около 28 % принадлежит одному конкретному распределению.
ЗАДАЧИ
1. Определите поступательную составляющую суммы состояний F2
при 298 К и 1,0133-105 Па.
2. Определите вращательную составляющую суммы состояний F2
прн 298 К. Необходимые данные возьмите нз справочника [М.].
3. Определите колебательную составляющую суммы состояний при
298 К. Необходимые данные возьмите из справочника [M.J.
4. Определите электронную составляющую суммы состояний F2.
Необходимые данные возьмите из справочника [М.].
5. Определите сумму состояний F2 при 298 К и 1,0133-105 Па. Не-
обходимые данные возьмите из справочника [М.].
6. Определите сумму состояний F2 при 298 К и 0,5-105 Па. Необхо-
димые величины возьмите из справочника [М.].
7. Определите сумму состояний F2 при 1000 К н 1,0133-10® Па.
Необходимые данные возьмите из справочника [M.J.
8. Определите сумму состояний HI при 100 К и 1,0133-10* Па. Не-
обходимые данные возьмите из справочника [М.].
9. Определите поступательную составляющую суммы состояний
метана при 1000 К н 1,0133-105 Па. Необходимые данные возьмите из
справочника [M.J.
10. Определите вращательную составляющую суммы состояний
метана при 1000 К и 1,0133-105 Па. Необходимые данные возьмите из
справочника [М.].
11. Определите колебательную составляющую суммы состояний
метана при 1000 К, если вырождения колебаний vs ~ 1, vaa ~3
119
6S = 2 и 6аз = 3. Необходимые частоты колебаний возьмите из спра-
вочника [M.L
12. Определите электронную составляющую'суммы состояний ме-
тана при 1000 К,
13. Определите сумму состояний метана при 1000 К и 1,0133 х
X 10s Па. Необходимые данные возьмите из справочника [М.].
14. Определите сумму состояний СН3Вг при 298 К и 1,0133-105 Па,
если межъядерныс расстояния С — Н 1,09; С — Вг 1,91-10-8 см; углы
между направлениями химических связей < HCN 111°, < ВгСН
107°57'. Числе симметрии равно 3. Частоты колебаний и вырождения
(указаны в скобках): 618 (1), 953 (2), 1290 (1), 1453 (2), 2965 (1) и 3082
(2). Вырождение нулевого электронного уровня равно единице.
15. Определите поступательную составляющую внутренней энер-
гии О2 при 1000 К.
16. Определите вращательную составляющую внутренней энергии
О2 при 1000 К.
17. Определите колебательную составляющую внутренней энергии
О2 при 1000 К. Необходимые данные возьмите из справочника [М.1.
18. Определите внутреннюю энергию (U — Uo) и энтальпию
(Н° — 7/о) О2 при 1006 К и 1,0133-105 Па. Необходимые данные возь-
мите из справочника [М.1.
19. Определите внутреннюю энергию и энтальпию О2 при 1000 К
и 1,0133- 10s Па. Рассчитайте (Л7° — //298)1000- Необходимые данные
возьмите из спрвочника [М.]. Результаты сопоставьте со справочной
величиной [MJ.
20. Определите теплоемкость Ср кислорода при 1,0133-105 Па и
и 298 и 1000 К. Необходимые данные возьмите из справочника [М.1.
Результаты сопоставьте со справочными данными [М.].
21. Определите внутреннюю энергию и энтальпию метана при 298 К
и 1,0133-105 Па. Необходимые данные возьмите из справочника [М.1.
Полученные величины сопоставьте со справочными данными [М.1.
22. Определите внутреннюю энергию и энтальпию СН3Вг при
298 К и 1,0133- 10s Па. Частоты колебаний (см-1) и вырождения (ука-
заны в скобках): 618 (1), 953 (2), 1290 (1), 1453 (2), 2965 (1), 3082 (2).
23. Определите поступательную составляющую изохорной теплоем-
кости метана при 1000 К..
24. Определите вращательную составляющую теплоемкости метана
при 1000 К-
25. Определите колебательную составляющую теплоемкости мета-
на при 1000 К. Значения волновых чисел колебательного движения в
молекуле метана возьмите из справочника [М.1. Вырождения колеба-
ний vs ~ 1; vOi ~ 3; 63 ~ 2; 6аз ~ 3.
26. Определите теплоемкость Ср метана при 1000, К, если вырож-
дения колебаний v3 ~1; vas ~ 3; 63 ~ 2; 6аз ~ 3. Значения волновых
чисел колебаний в молекуле метана возьмите из справочника [М.1.
27. Определите теплоемкость метана Ср при 298 К.. Необходимые
частоты колебаний возьмите из справочника [M.J. Вырождения коле-
120
баний vg ~ 1; vas ~ 3; ~ 2; 6ОЗ 3. Полученную величину сопо-
ставьте со справочной [М.].
28*. Определите теплоемкость СС14 в состоянии идеального газа
в интервале температур от 300 до 1000 К через 100 К. Необходимые
данные о частотах колебаний и вырождения возьмите из справочника
[М.1. По методу наименьших квадратов выведите зависимость теплоем-
кости СС14 от температуры в виде уравнения Ср = а + ЬТ + сТг.
29. Вычислите теплоемкость Ср водяного пара при 1000 К. Необхо-
димые данные о частотах колебаний возьмите из справочника [М.1.
30. Вычислите теплоемкость Ср диоксида углерода при 1000 К.
Необходимые данные о частотах колебаний возьмите из справочника
IM.1.
31. Определите, сколькими способам можно расположить систему
из девяти различных частиц в трех сосудах так, чтобы в первом сосу-
де было две, во втором — три и в третьем — четыре частицы.
32. Вычислите, при какой температуре атомная энтропия аргона
при 1,0133-105 Па будет равна 179,9 Дж/(моль-К), если электронная
составляющая суммы состояний аргона равна единице.
33. Вычислите, при каком давлении атомная энтропия атомарного
иода при 2000 К равна 208, 718 Дж/(моль-К), если статистический вес
нулевого электронного уровня равен четырем.
34. Оксид углерода и азот — двухатомные газы с одинаковыми мо-
лекулярными массами. При 298 К и 1,0133-105 Па они имеют теплоем-
кости 29,15 и 29,10 Дж/(моль-К) соответственно. Межъядерные рас-
стояния С— О hN — N1J28-10-10 и 1,098-10-10 м. Энтропия СО
197,4, a N2 191,5 Дж/(моль-К). Объясните столь значительное рас-
хождение значений энтропии.
35. СО2 и SO2 — трехатомные газы. Колебательная составляющая
теплоемкости СО2 при 300 К больше колебательной составляющей теп-
лоемкости SO2 при той же температуре на 1,47 Дж/(моль-К). Теплоем-
кости этих газов Ср при 300 К: СО2 37,13, SO2 39, 87 Дж/(моль-К).
Сделайте вывод о структуре молекул этих газов.
36. Вычислите атомную теплоемкость Су, внутреннюю энергию я
энтропию криптона при 298 К и 1,0133-105 Па. Электронная составля-
ющая суммы состояний криптона равна единице.
37. Рассчитайте вращательную составляющую энтропии кислоро-
да при 500 К, если межъядерное расстояние равно 1,207-10-10 м.
38. Составьте колебательную составляющую энтропий СО при 298,
1000 и 3000 К, если частота колебаний 2,170- 10s м-1.
39. Вычислите энтропию NO при стандартном давлении и 298 К,
если межъядерное расстояние 1,15-10-10м и частота колебаний
1,9165-105 м-1. Электронная составляющая суммы состояний равна
четырем.
[С<>___z/й \
40. Вычислите функцию I-----— I для С12 при 1,0133-105 Па и
298 К, если межъядерное расстояние равно 1,988-10“10 м, а часто-
121
та колебаний 0,5649-108 м-1. Электронная составляющая суммы состо-
яний С12 равна единице.
(QQ _ /у0 \
-----—2-1 хлороводорода при 298 К
и 1,0133-10® Па, если межъядерное расстояние 1,2715- 10-1п м, а часто-
та колебаний 2,9897-10® м-1. Электронная составляющая суммы состоя-
ний равна единице. Определите также (Огэв — Ягэв)-
42. Покажите, что при температуре абсолютного нуля, когда все
частицы находятся на нулевом энергетическом уровне, молярная энт-
ропия определяется уравнением So = /?1п g0, где g0 — статистический
вес нулевого электронного уровня.
43*. Определите энтропию водяного пара, находящегося в идеаль-
ном газообразом состоянии при 298 К и 1,0133-108 Па. Молекулярные
константы возьмите из справочника [М.]. ст = 2.
44*. Определите молярную энтропию этилена при 298 К и стан-
дартном давлении. Молекулярные константы возьмите из справочника
[М.]. Электронная составляющая суммы состояний равна единице.
45. Определите долю молекул NO, находящихся при 300 К на
20-м вращательном квантовом уровне. Молекулярные константы возь-
мите из справочника [М.].
46*. Определите долю молекул 1Н36С1, находящихся при 300 К на
первых 15 вращательных квантовых уровнях с точностью до 0,00001.
Определите вращательное квантовое число уровня, на котором нахо-
дится максимальное'число молекул 1Н38С1 при заданных условиях.
Вычертите вращательный спектр при 300 К.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1*. Для вещества А, находящегося в состоянии идеального газа при
температурах Tlt Т2 и Т3 и при давлении 1,0133-108 Па, определить:
1) составляющие суммы состояний: поступательную, вращательную,
колебательную; 2) сумму состояний; 3) составляющие внутренней
энергии: поступательную, вращательную и колебательную; 4) внут-
реннюю энергию U — U0', 5) составляющие теплоемкости: поступа-
тельную, вращательную и колебательную; 6) теплоемкость С$; 7) вы-
вести уравнение зависимости = f (Т) в виде ряда Ср = а + ЬТ+
+сТ2, справедливое в интервале температур от 7\ до Т3. Для решения
используйте три значения теплоемкости при трех температурах;
8) составляющие энтропии: поступательную, вращательную и колеба-
/ А р — U Л
тельную; 9) энтропию Sr; 10) составляющие функции I —— I; поступа-
/ Ар Uo \
тельную, вращательную и колебательную; 11) функцию I----?---I;
[ Q _ffO \
12) функцию I—2------ . Данные о частотах колебании и межъядер-
122
ных расстояниях, необходимые для расчета, возьмите из справочника
{С, X., т. 1]. Учтите, что основное электронное состояние
№ ва-i рианта Вещество г, т. т. № ва- рианта Вещество т, т, т.
1 ’»Вг”Вг 300 500 1000 14 300 500 1000
2 ’»Br18F 300 600 900 15 XH18F 200 400 800
3 мс“о 200 400 800 16 ХНХ271 300 600 1200
4 18С1вО 300 600 1000 17 14NUN 200 500 1000
5 86С186С1 400 800 1000 18 31psip 400 600 1200
6 збС1х»Е 300 600 1000 19 127J127{ 400 600 800
7 upiap 200 500 1200 20 127J3BC1 300 500 1000
8 2Н2Н 200 400 900 21 33К8»К 600 800 1000
9 WH 300 600 1000 22 28Na28Na 600 800 1000
10 2Н’Н 300 500 900 23 ’Li’Li 500 700 900
11 8Н8Н 400 600 1200 24 ХХВХН 600 800 1000
12 ‘Н’Н 300 500 1000 25 ХХВ2Н 500 700 900
13 W’Br 400 600 1200
2. Для вещества А определите при температуре Т и давлении
1,0133-10® Па: 1) внутреннюю энергию U — Uo; 2) энтальпию Н° —
“— ^0 \
------------------------------------------------------т—)’
, / G° - ЯМ л
функцию I----------I. Данные о геометрических параметрах молекулы
А, частотах колебаний и степенях вырождения возьмите из справочни-
ка [М.1.
№ ва- рианта Вещество А т, к № ва- рианта Вещество А т, к № ва- рианта Вещество А T, K
1 СО, 300 10 С,Н, 200 18 Н,0 1000
2 cs, 400 11 СНС1, 400 19 H4S 900
3 N.0 300 12 СН,С1 300 20 SO, 1000
4 NO, 250 13 СС14 400 21 NH, 700
5 Н,0 400 14 со, 1000 22 PCI, 1200
6 H.S 300 15 CS, 900 23 с,н. 1000
7 SO, 300 16 N,0 700 24 CHC1, 1200
8 9 NH, PCI, 400 300 17 no, 1000 25 CH,Cl 900
3. Для двухатомного гомоядерного вещества вращательная сум-
ма по состояниям Q = 50. Вычислите для i-го уровня: 1) отношение
числа молекул на t-м уровне к числу молекул на нулевом уровне; 2)
долю (от общего числа) молекул, находящихся на t-м уровне; 3) долю
молекул, находящихся на нулевом уровне.
№ варианта ... 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
t ................. 1 2 3 4 5 6 7 8 9 10 И 12 13 14 15
123
4. Установите характер всех химических связей в молекулах,
участвующих в химической реакции: 1) определите геометрическую
конфигурацию атомов в равновесном состоянии молекул, участвующих
в химической реакции; 2) установите по справочнику [М.] молекуляр-
ные константы молекул, участвующих в химической реакции; 3) опре-
делите внутреннюю энергию U — Uo всех веществ, участвующих в ре-
акции, в диапазоне температур от 300 до 1000 К через 100 К и при
298 К; 4) определите теплоемкость Ср при 298 К в диапазоне от 300 до
1000 К через 100 К для всех веществ, участвующих в реакции; 5) уста-
новите уравнение зависимости Cp = f (Т) в виде
С°р = а+ЬТ+сТ*
на основании данных, рассчитанных в п. 4 методом наименьших квадра-
тов для всех веществ, участвующих в реакции; 6) определите тепло-
вой эффект реакции при 298 К и при постоянном давлении 1,0133-108
Па; 7) выразите уравнением
Л = А + ВТ+СТ* + DT3
зависимость теплового эффекта химической реакции от температуры;
8) вычертите зависимость теплового эффекта реакции от температуры;
9) определите (№ — Но) для всех веществ, участвующих в реакции,
при 298 Кив диапазоне температур от 300 до 1000 К через 100 К; 10)
определите (№ — Нэоо) в диапазоне температур от 300 до 1000 К через
100 К; П) определите абсолютные энтропии всех веществ, участвую-
щих в реакции, при 298 К ,и в диапазоне температур от 300 до 1000 К;
/ Л J- U Q \
12) определите функции I------I для всех веществ, участвующих в
реакции, при 298 Кив диапазоне температур от 300 до 1000 К через
100 К; 13) определите функции I —— I для всех веществ, участвую-
щих в реакции,при 298 Кив диапазоне температур от 300 до 1000 К че-
рез 100 К; 14) определите функции (G°—Н292) Для всех веществ, участ-
вующих в реакции, при 298 Кив диапазоне температур от 300 до
1000 К через 100 К; 15) определите изменение энтропии в ходе химиче-
ской реакции при 298 Кив диапазоне температур от 300 до 1000 К через
100 К; 16) определите AG? в ходе химической реакции при 298 Кив
диапазоне температур от 300 до 1000 К через 100 К; 17) возможно ли
самопроизвольное протекание химической реакции при стандартных
условиях в диапазоне температур от 298 до 1000 К?
Хе вари-
анта
Химическая реакция
№ вари
анта
Химическая реакция
1
2
3
сн4+н2о^со+зн2
СН4+2Н.О^СО.+4Н.
CO+H-iO^COj + H,
2СН4+О,^2СО+4Н,
2CH4qtCH ее СН + ЗН2
СН4+СО2^2СО+2Н,
124
ГЛАВА IX
ГАЗЫ
Основные уравнения и символы
[ К., с. 125—129, 131 — 136, 149—156]
Свойства идеальных газов описываются уравнением Менделеева—
Клапейрона
PV=nRT, (IX.1)
где Р — давление; У — объем, занимаемый п молями газа; п — число
молей газа; R — молярная газовая постоянная; Т — абсолютная тем-
пература.
Свойства смеси идеальных газов описываются уравнением Дальтона
при Т = const:
I
Р = Рх + Р2 + Р3+... + Р1= 2 pt' (IX.2)
<=!
Pi = Pxh (IX.3)
где Р — общее давление газов; Pt — парциальное давление i-ro ком-
понента; х{ — молярная доля i-ro компонента; и уравнением Амага
i
И=^1+Уг + Из+...+П= S У,, (IX.4)
* = 1
Vi^VXi, (IX.5)
где V — общий объем смеси газов; Vi — парциальный объем компонен-
та; х{ — молярная доля i-ro компонента;
где nt — число молей i-ro компонента;
VtP=PiV. (IX.7)
Уравнения (IX.1) — (IX.6) применимы к реальным газам при высо-
ких температурах и низких давлениях. При расчетах свойств газов до-
пустимо применять законы идеальных газов для условий, при кото-
рых молярный объем не менее 5 л для одно- и двухатомных газов и не
менее 20 л для более высокомолекулярных газов при 298 К.
Свойства реальных газов описываются уравнением Ван-дер-Вааль-
са. Для 1 моль газа:
(а \
(y-b)=^RT; (IX.8)
И2 /
125
для п молей:
/ п2 а \
Р + -ГТ- (V-nb) = nRT-,
к У2 /
nRT пга
~ v—nb V* ’
(IX.9)
(IX. 10)
где а — постоянная, учитывающая взаимное притяжение молекул;
b — постоянная, учитывающая собственный объем молекул,
&=2/3ла’^; (IX. 12)
Ь=='Т'^' (IX.13)
в гк
где Тк — критическая температура газа; Рк— критическое давление
газа; Na — постоянная Авогадро; а — кинетический диаметр атомов
и молекул газов.
Уравнение Ван-дер-Ваальса достаточно точно описывает состояние
газа, если газ находится при температуре выше критической и 1 моль
его занимает объем не менее 0,3 л.
Другое широко применяемое уравнение, которое описывает свойст-
ва реальных газов,
z — PV/nRT, (IX.14)
где z — коэффициент сжимаемости. Для идеальных газов z = 1. Фу-
гитивность f может быть рассчитана по формуле:
1=Рг/РИд, (IX. 15)
где Р — давление реального газа; Рвд — давление, которым обладал
бы газ при данном объеме и температуре, если бы он подчинялся зако-
нам идеальных газов. Уравнение (IX. 15) применимо только для срав-
нительно небольших давлений (Р < 50 атм). Коэффициент фугитив-
ности уу выражается соотношением
V-fIP. (IX. 16)
Для идеальных газов yf — 1. Коэффициенты z и yf для заданных тем-
пературы и давления вычисляют приближенно графически (рис. 13,14).
Данные коэффициенты представляют собой функции приведенного
давления л и приведенной температуры т:
л = Р/Рк, Х — Т/Тк.
Уравнение состояния в вириальной форме:
PV В С
RT ~1+ V + у2+'”’
(IX.17)
где В и С — второй и третий вириальные коэффициенты соответствен-
но.
126
Рнс. 13. Зависимость коэффициента активности (фугитивности) реальных газов от приведенных давления
температуры
127
(IX.18)
а2 = аоо|1 -+
(IX.20)
Из молекулярно-кинетической теории газов следует зависимость
диаметра о атомов и молекул от температуры:
С
Т
о —2r, (IX.19)
где г — кинетический радиус атомов и молекул: С — константы;
средняя длина свободного пробега
Л=1/(У 2 ло2/V), Л=-------—,
2 OjU П;
где N — число молекул в единице объема;
средняя арифметическая скорость молекулы газа
й = У 8/?77(лМ) ;
коэффициент вязкости газа
ц = М и/(Зло2 Na} ;
число столкновений одной молекулы в 1 с в единице объема
Z = У 2 по2 и N ;
(IX.21)
(IX.22)
(IX.23)
число двойных соударений одноименных молекул за 1 с в единице
объема
„ Т/2
Z' = —2— ла" N2 и ’
(IX.24)
где ла2 — поперечное сечение соударений атомов и молекул; число
столкновений Z," между разноименными молекулами в единице объема
за 1 с
а1 + °2
(IX.25)
Z” = I ' I 1/ 8л RT (
\ 2 ) V \ МгМ2
где N1 и Л'2 — число молекул первого и второго газов в данном
объеме; Мг и М2 — молекулярные массы первого и второго газов; Oj
и о2 — кинетические диаметры;
общее число ударов молекул, приходящихся на единицу поверх-
ности стенки сосуда за 1 с,
Z"'=N У /?77(2лЛ1) . (IX.26)
Уравнение Клапейрона — Менделеева можно применять и для си-
стем, в которых происходит термическая диссоциация газов. Если число
молей газа до диссоциации обозначить п, степень диссоциации придан-
ных условиях а, число молекул или атомов, на которые распадается
одна молекула исходного вещества, v, то в состоянии диссоциации чис-
ло молей исходного вещества, подвергнувшихся распаду, будет равно
ап, а число нераспавшихся п — а п = п (I — а). Так как каждая мо-
лекула, претерпевшая диссоциацию, дает v новых молекул, то при рас-
128
5 Зак. 767
129
паде ап молей исходного вещества образуется avn молей продуктов рас-
пада. Следовательно, общее число молей в состоянии диссоциации рав-
но
n(l—a)4-anv = n(l — a+av) =п [1 4-a (v —1)1. (IX. 27)
Обозначив через i число, показывающее, во сколько раз возросло
число молей вследствие диссоциации, получим
Общее число молей в состоянии диссоциации
«=-----------:--------------------------------
Число молей исходного вещества до диссоциации
= ..".n+;(v-i)l =1+„(v_,;. (1X.2S)
Если каждая молекула исходного вещества расщепляется на две
новые (v = 2), то
j=l + a. (IX.29)
Из выражения (IX.28) следует, что общее число молей в состоянии
диссоциации равно первоначальному, умноженному на i. На основании
этого уравнение (IX. 1) в применении к газу, находящемуся в состоя-
нии диссоциации, преобразуется к виду:
PV — inRT. (IX. 30)
ЗАДАЧИ С РЕШЕНИЯМИ
1. При 473 К и 0,999-108 Па 0,716 г органического вещества, ис-
паряясь, занимают объем 0,246 л. Вычислите молекулярную массу со-
единения и определите его формулу, если С:Н:О = 2,25: 0,375:1.
Решение. Молекулярную массу вещества вычисляем по урав-
нению
п = РИ/(/?Т) = т/Л4,
где т — масса исследуемого вещества; М — молекулярная масса ис-
следуемого вещества;
8,314-473.0,716
М =--------------------— =116,18.
0,999-105-2,426-10-*
Записав формулу соединения в общем виде СжНуОг и используя
данные о его молекулярной массе и массовом соотношении входящих
в него элементов, составляем три уравнения:
г 16+г16.0,375 + г 16-2,25= 116,18, (1)
(/1=216-0,375, (2)
х12 = г16-2,25 (3)
<
(16, 1,12 — атомные массы О, Н и С соответственно). Решение уравне-
ний дает: z = 2, у = 12, х = 6 и СЖНУО2 = СвН12О2.
130
2. Приведите к нормальным условиям газ (вычислите объем V,
который занимает данное количество газа при 273 К и 1,0133- 10s Па),
если при 373 К и 1,333- 10s Па его объем равен 3-10-2 м3.
Решение. По уравнению (IX. 1) определяем объем газа:
1,0132-10® И
Tj - 273
1,333-108-3-10-8-273 „„ „
И=—Н:------------------=2,89-10-« м3.
373-1,0133-10»
3. Вычислите парциальные объемы водяного пара, азота и кисло-
рода и парциальные давления азота и кислорода во влажном воздухе.
Общий объем смеси 2- 10-3м3, общее давление 1,0133-10® Па, парци-
альное давление паров воды 1,233-10* Па. Объемный состав воздуха
21 % О2 и 79 % N2.
Решение. Вычисляем парциальный объем паров воды VHao по
уравнению (IX.7):
кн2о
^н2о p = vpH,o ,
2-10-8-1,233-10*
---------------=2,4-10"* м3.
1,0133.10s
Вычисляем парциальные объемы О2 и N2:
K02+kn2 =v~^н2о =0,002—0,00024 = 1,76-10-8 м3,
^,/^. = 0,21/0,79.
Отсюда
KOj= 1,76-10-8.0,21 =0,37-10-8 м3;
KN>=1,76-Ю-3.0,79=1,39-10-8 м8.
Вычисляем парциальное давление О2 по уравнениям (IX.3), (IX.5):
POt~?XO,’
xOt = ИО1/И = 0,37-10-8/2-10-3 = 0,185,
Ро, = 1,0133-10®-0,184 = 1,866-10* Па, а так как Р = Ро2 + PN,+
+ Рн,0, ТО
PNs = 1,0133-Ю5—1,866-Ю4—1,233-10« = 7,033.10* Па.
4. Вычислите объем 1 моль хлора при 473 К и 2,0267-108 Па.
Решение. Вычисляем объемС12 по уравнению (IX. 14). Для это-
го находим приведенные давление л и температуру т, используя урав-
нения (Х.15) и (Х.16): Тк = 417 К; Рк = 77,09- 10s Па [M.J; т =
= 473/417 = 1,13, л = 2,0267-108/7,709-10® = 26,3; рассчитываем
Коэффициент сжимаемости z из рис. 14 : z = 2,7;
И = 2,7-8,31-473/(2,027-10«) =5,239-IO’5 мз
5*
131
5. Вычислите давление 1 моль водорода, занимающего при 273 К
объем 0,448-10~3 м3.
Решение. Вычисляем давление по уравнению (IX.1):
Р = 8,31-273/(0,448-10~8) =50,663-105 Па.
Однако этот результат ненадежен, так как V С 5 л. Поэтому повторя-
ем расчет, используя уравнение (IX.10):
P = __________а_
V—b V*
Для водорода а = 0,244 л2-атм/моль2; b = 0,027 л/моль;
0,082-273 0,244 „ .
Р =--------------------------= 51,9 атм (52,65-105 Па).
0,448—0,027 (0,448)2
6. Вычислите объем 1 моль насыщенного водяного пара при 485 К
и Рн,о = 2,052 МПа (20,25 атм).
Решение. Расчет выполняем методом подбора с помощью
уравнения (IX. 10):
______2_
V — b И2
Для воды а = 5,464 л2-атм/моль2; b = 0,03 л/моль. Ориентировочно
принимаем
= 1,964 л.
v> _ RT = °-°82'485
~ Р ~ 20,25
Подставляем полученное значение в приведенное уравнение:
0,082-485 5,464
Р —-----------г-------~— = 19,14 атм.
1,96—0,03 1,962
Вычисленное давление ниже данного, следовательно, истинный объем
меньше, чем 1,964 л/моль.
Принимаем V" = 1,75 л/моль и повторяем расчет:
0,082-485
1,75—0,03
5,464
1,752
= 21,34 атм.
Откуда Р" > Рн2о- Так как Р" > РНго > Р', предполагаем, что
объем V" лежит в пределах 1,954-1,75 л/моль и принимаем V'" —
= 1,85 л. Тогда
0,082-485
1,85—0,03
5,464
1,852
= 20,26 атм.
Полученное значение давления отличается от заданного менее чем на
0,05 %, поэтому останавливаемся на последнем результате. Откуда
V"' — V — 1,85 л/моль (1,85-10~3 м3/моль).
7. Вычислите давление 1 моль аммиака, находящегося в сосуде
вместимостью 100 мл, при 500 К-
132
Решение. Для данных условий (V < 0,3 л) уравнения (IX. 1)
и (IX.8) неприменимы, поэтому для вычисления давления используем
уравнение (IX.17). Вириальные коэффициенты для аммиака при 500 К
находим интерполяцией из приведенных ниже данных:
e>Qoe>t»e>Qoe>Qoe>ooe>ooe>Qo*s
К . • . . . 300 400 500 600 800 1000 2000
—15,7 0,03 8,53 13,91 20,06 23,33 28,30
1115 1000 954 928 894 867 758
—4,85 9,31 17,05 21,84 27,26 29,96 33,81
1428 1332 1288 1258 1210 1167 1000
12,34 14,36 14,98 15,66 16,68 16,72 16,06
297 283 271 260 242 227 181
— —332,33 —163,47 —98,83 —47,22 —26,19 —1,47
— — — 4650 2170 1090 319
—285 —120,11 —68,30 —45,97 —29,83 -10,19 5,37
— 3317 237 1438 714 461 196
—94,03 —49,07 —25 —9,89 7,92 17,70 34,44
3116 2499 2173 2005 1852 1786 1622
11,12 10,94 10,72 10,51 10,13 9,81 8,72
98,29 89,48 82,90 77,63 69,65 63,85 48,09
В = второй вириальный коэффициент, см8/моль; С—третий вириальный коэффи
циент, см®/моль2 (В=—68,3 см8/моль; С=2397 см®/моль2).
8,31-500-IO-8
“ 0,1-10-»
68,3 , 2397 \
—-----Н-тт— =23,13 МПа.
100 (100)2 J
8. Рассчитайте кинетический радиус г и длину свободного пробега
Xдля 0,0416 моль гелия, занимающего при 293 К объем 1 л.
Решение. Кинетический радиус атомов гелия вычисляем по
уравнению (IX.18). Значения охиС для гелия берем из справочника
[М]:
аоо = 1,82-10-1® м; С=173;
I 173 \
а2=1,822 1 4------ ==5,266.Ю-2» м2;
\ 293 /
а = 2,295.10-1® м;
2,295
г =-------=1,147-10-1® м.
2
Длину свободного пробега X вычисляем по уравнению (IX.20), для это-
гоопределяем N — число молекул в 1 м3:
„ лЛ\ 0,0416-6,002-1028 „
Л --____— ------------------=2,506-102° молекул/м»
V 10-»
и
X =---7=------------------------------= 1,706-10-’ М.
у 2 - 3,14.5,266.10-2»-2,506-Ю25
9. Вычислите для гелия, находящегося в условиях,_приведенных
в задаче 8, среднюю арифметическую скорость молекул и и коэффици-
ент вязкости ц.
133
Решение. Среднюю арифметическую скорость вычисляем по
уравнению (IX.21):
- / 8-8,314-293 V/.
и — I ------------- I = 1244,86 м/с.
\3,14-4,003-ГО-3/
Коэффициент вязкости вычисляем по уравнению (IX. 22):
4,003-1244,86-102
п =--------------------------—=1,668-Ю-4 г/(см с), или 166,8 мкП.
1 3-3,14-5,266-10-1®-6,002-1023
10. Вычислите число столкновений Z одной молекулы гелия, об-
щее число соударений Z' за 1 с в 1 см3 и число ударов Z'", приходящих-
ся на 1 см2 площади стенки сосуда за 1 с, если 0,146 моль Не при 293 К
занимает объем 1 л.
Решение. Число столкновений Z одной молекулы за 1 с в 1 м:
вычисляем по уравнению (IX. 23), используя данные справочника [М.]3
4г2 = а2 = 5,266 • I О-20 м2; й = 1244,86 м/с;
М = 2,506-1025 молекул/м3;
Z = 2-5,266-10-2o-1244,86-2,506-I025-I0-e = 2,32-103.
Общее число столкновений Z' в 10-в м3 за 1 с вычисляем по уравнению
(IX.24):
Z' =(У~2~/2) 3,14-5,266-10-20 (2.506)2 Ю50-1244,86-10"® = 9,14-1028.
Число ударов Z"' в 1- Ю-4 м3 о поверхность вычисляем по уравнению
(IX.26):
Z"' = 2,506-1025 (-8,314-293-----) /г 10-4= 7,87-Ю23.
\ 2-3,14-4,003-10-3/
II. Определите число столкновений молекул азота и аргона друг
с другом в объеме 1 м3 и число ударов молекул газа о стенку сосуда
площадью 1м2 за 1 с при 373 К. и парциальных давлениях азота
1,0132-10® и аргона 2,0264-10® Па, если Сты, = 3,64 и одг = 3,5-10“10 м.
Решение. Вычисляем средний кинетический радиус сталкива-
ющихся молекул:
а = gN8 + qAr = 3,64+3,51 = 10_10
а 2 2
число молекул азота и аргона в 1 м3 вычисляем по уравнению
^i = (Pi И//?Т) /VA,
1,0132-105-1-6,022-Ю23
/VN =--------—------—----------= 1,97-102“ молекул/м3,
N* 8,314-373 J
2,0264-I-6,022-IO23
WAr =--------8 314 373------= 3,934-1025 молекул/м3.
134
Общее число соударений Z” за 1 с в 1 м3 вычисляем по уравнению
(IX. 25):
MAr+MN
2
8л RT
A1ArA1N2 /.
Z’= 1,97-1025-3,93- 102S (3,58- IO"10)2 X
39,94 4-28,01
2 = 2,70-1035.
X 8-3,14-8,314-373. „ , .
L к 39,94-28,01-10-» /J
Число ударов SZ'" молекул газа о стенку сосуда площадью 1 м2 за
1 с вычисляем по уравнению
+4;
Znj и ZAr' вычисляем по уравнению (IX. 26):
/ 8,314-373 \|
Z =l,97-1025 I-----------------— |2 = 2,61 • IO®’,
N* V 2-3,14-28-10~3 ]
I 8,314-373
Zw = 3,934 • I О25 (-------------— 2 = 4,38 • 1027,
\ 2-314-39,9-10-3 /
2 Z” = (2,61 4-4,38) 1027 = 6,99-IO27.
12. При 945° С и 1 атм 1,7 г H2S занимает объем 5,384 л. Вычислите
степень диссоциации сероводорода, если реакция протекает по урав-
нению
H2S 1 H2 + 0,5S2 (п)
Решение. Воспользовавшись уравнением (IX.30) и приняв
1 = 1+ 0,5а согласно уравнению реакции, после подстановки соот-
ветствующих числовых значений получим
PV (1+0,5а)л/?7’;
РУ 2______________1-5,384 2_о
а~ 0,5п RT ~ “ 0,5-0,05-0,082-1218 ~ ~ ’
или а= 15,6%.
ЗАДАЧИ
1. Приведите к нормальным условиям газ, занимающий при 373 К
и Р = 13,33-102 Па объем 3- 10~8 м3.
2. Определите молекулярную массу и установите формулу вещест-
ва, если плотность его пара при 373 К и 1,013-10® Па равна 2,55 г/л.
Массовое соотношение элементов в этом соединении С:Н = 12:1.
3. Какое количество диоксида углерода при 5,066-10® Па и 323 К
занимает одинаковый объем с 1 г гелия при 1,013-10* Па и 273,15 К?
Чему равны плотности этих газов?
4. Наивысшая температура в газгольдере летом 315 К, наинизшая
зимой 243 К- Рассчитайте, насколько больше (по массе) метана может
вместить газгольдер вместимостью 2000 м3 зимой, чем летом, если дав-
135
ление постоянно и равно 0,104 МПа (изменением объема газгольдера с
температурой пренебречь).
5. Барометр дает неверные показания вследствие присутствия не-
большого количества воздуха над столбиком ртути. При давлении
755 мм рт. ст. барометр показывает 748 мм рт. ст., а при 740 мм рт. ст.
истинного давления — 736 мм рт. ст. Каково действительное давление,
если барометр показывает 750 мм рт.ст. при Т = const?
6. Для газовой смеси массового состава (%): С12 — 67; Вг2 — 28;
О2 — 5, вычислите: 1) объемный состав; 2) парциальные давления
компонентов; 3) объем 1 кг смеси. Общее давление 1,013- 10s Па. Тем-
пература 373 К.
7. Из кислородного баллона вместимостью 8 л кислород при давле-
нии 120 атм вытек в резервуар вместимостью 7,5 м3, наполненный воз-
духом под давлением 740 мм рт. ст. и 298 К- Вычислите общее давление
в резервуаре и парциальные объемы азота и кислорода. (Объемный
состав воздуха (%): О2 — 21 и N2 — 79.)
8. Какое количествоСО2 может вместить стальной сосуд вместимо-
стью 0,5-10"3 м3 при 473 К, 162,1 МПа?
9. Вычислите по уравнению Ван-дер-Ваальса температуру, при
которой объем 1 кг метана станет равным 0,1 м3 при 2,026 МПа.
10. Вычислите для СО2 постоянную b в уравнении Ван-дер-Ва-
альса: 1) из критических параметров [M.J; 2) из данных о кинетиче-
ском диаметре молекулы диоксида углерода при 273 К (<* —
= 3,34-10-10 м). Сравните вычисленные величины и объясните, поче-
му они близки, но полностью не совпадают.
11. Вычислите объем 1 кг метана при. 298 К и давлении 3,039 МПа.
12. До какой температуры можно нагреть стальной сосуд вмести-
мостью 0,01 м3, содержащий 5 кг газа А(О2, N2, Н2, Н2О, NH3, СО2,
Не), если предельно допустимое давление 15,2 МПа. По какому из
уравнений состояния следует вести расчет? Оцените погрешность рас-
чета по уравнению Ван-дер-Ваальса (относительно расчета по уравне-
нию в вириальной форме). Почему величины погрешности для различ-
ных газов не совпадают?
13. При температуре Т 1 моль газа А занимает объем 0,1-10-3 м3.
Вычислите коэффициент сжимаемости по уравнению в вириальной фор-
ме и по методу соответственных состояний. Сравните результаты и
рассчитайте погрешность расчета по методу соответственных состоя-
ний. Вычислите коэффициент фугитивности газа А при Т К и
10 атм, использовав данные рис. 13.
№ варианта . 1
Газ А .... О2
Т, К......... 300
2 3 4 5 6 7
N2 Н2 Н2О NHs СО2 Не
300 300 700 500 400 300
14. Вычислите фугитивность аммиака, если его молярный объем
равен 3,109-10-4 м3/моль при 473 К и 100 атм. Для приближенного
расчета используйте уравнение (IX. 12). Результат сравните с точным
значением / = 82,2 атм. Вычислите коэффициент фугитивности у/.
136
15. Вычислите среднюю арифметическую скорость молекул кисло-
рода при 873 К. При какой температуре такую же скорость будут иметь
молекулы гелия?
16. При 293 К и 1,013- 10Б Па вязкости азота и неона равны 175 и
311 мкП соответственно. Вычислите: 1) кинетические диаметры моле-
кулы этих газов и сравните с данными справочника [М.]; 2) температу-
ру, при которой вязкость азота станет равной вязкости неона при 293 К.
17. Вычислите среднее число столкновений одной молекулы, об-
щее число столкновений и число ударов о стенку сосуда площадью 1 м2
за 1 с молекул кислорода, находящегося под давлениями 1,013-106 и
1,013 Па при 323,ПК. Объем кислорода 0,5 м3. При каких условиях
(давление) длина свободного пробега молекул О2 станет равной
1-10-2м?
18. Вычислите степень диссоциации фосгена, если 2 г фосгена, на-
гретые до 500° С, занимают при 1 атм объем 1,985 л.
19. При 1 атм и 250°С степень диссоциации РС15 равна 80 %.
Вычислите, какой объем займет 1 г РС15, если его нагреть до 250° С при
1 атм.
20. При 2500° С и 1 атм Н2О частично диссоциирует на Н2 и О2.
При этих условиях 10 л Н2О, частично распавшейся и находящейся в
.равновесии с Н2 и О2, весят 0,7757 г. Вычислите степень диссоциации
Н2О при указанных условиях.
21. При 627° С и 1 атм SO3 частично диссоциирует на SO., и О2; 1 л
равновесной смеси при этих условиях весит 0,94 г. Вычислите пар-
циальные давления газов в смеси.
22. Молекулярная масса паров иода при 1 атм и 800° С равна 241, а
при том же давлении, но при 1027° С она равна 212. Вычислите степень
диссоциации а и коэффициент i для разных давлений.
23. При 70° С и атмосферном давлении N2O4 диссоциирует на
65,6 % по уравнению N2O4 2 NO2. Вычислите кажущуюся молеку-
лярную массу N2O4 при этих условиях.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Неисправный барометр, содержащий воздух, показывает давле-
ние Pj мм рт. ст., в то время как действительное давление Р2 мм рт. ст.
Длина вакуумного пространства I мм, температура Тг. Вычислите ис-
тинное давление, если барометр показывает Р3ммрт. ст. при темпе-
ратуре Т2.
2. Для газообразного вещества А. находящегося в условиях, близ-
ких к критическим, вычислите объем и плотность при температуре Т и
внешнем давлении Р. Коэффициент сжимаемости определите с помо-
щью рис. 14.
3. В сосуде вместимостью Ум3 смешиваются gA, gB, gc кг газов А,
В и С при температуре Т. Вычислите парциальные объемы и давления
компонентов и общее давление газовой смеси.
137
№ вари- анта s г = 5 <£q. Pt, мм рт. ст. 2 2 Л. К аГо. т,. к № вари- анта 2 ь S и а. о. Р2> мм рт. ст. 2 2 & S Z s и &
1 745 750 35 283 760 293 14 750 765 30 283 760 273
2 745 765 35 293 750 283 15 740 755 40 273 750 283
3 755 770 25 288 760 298 16 735 755 45 293 740 288
4 730 750 50 298 735 288 17 735 750 45 288 745 293
5 745 760 35 291 755 273 18 735 740 45 298 755 293
6 725 740 55 273 740 291 19 740 766 40 293 745 298
7 725 745 55 283 750 291 20 730 745 50 291 740 273
8 740 745 40 291 745 283 21 725 735 55 273 730 291
9 730 735 50 288 750 291 22 750 755 30 288 755 291
10 725 730 55 291 755 288 23 730 740 50 291 745 282
11 755 760 25 293 770 298 24 745 755 35 293 755 298
12 740 750 40 298 755 283 25 750 760 30 298 765 293
13 735 745 45 283 750 273
№ ва- рианта Вещество А т, к P. МПа Xs ва- рианта Вещество A Г, к P, МПа
1 н2о 598 11,75 13 CC14 493 2,23
2 н2о 593 11,0 14 CC14 483 1,5
3 н20 588 10,3 15 CHgCOOH 593 5,6
4 н2о 583 9,6 16 CH3COOH 573 3,2
5 н2о 578 8,95 17 CH8COOH 553 2,5
6 н20 573 8,36 18 CH8COOH 503 3,8
7 NH8 345 3,2 19 CHgCOOH 483 3,0
8 NH3 335 2,5 20 CH8COOH 463 2,0
9 NHS 325 2,0 21 CeH„ 558 4,3
10 NHS 523 1,5 22 CeH„ 543 3,3
11 СС14" 513 2,9 23 CeH„ 533 2,5
12 CC14 503 2,5 24 ceHe 523 2,5
I Xs вари- । анта A в c «A* 10* , КГ • 1 °’» КГ &c •1 °* , КГ т, к V‘10е, M8
1 N2 O2 H2 1 2 3 290 2
2 n2 H2O H2 4 5 6 300 3
3 n2 co co2 7 8 9 310 4
4 n2 NH3 H2 10 1 2 320 5
5 O2 co N2 3 4 5 340 2
6 H2O N2 O2 6 7 8 290 3
7 H2O 0 H2 9 10 1 300 4
8 H2O co, co 2 3 4 310 5
9 H2O nh8 O2 5 6 7 320 2
10 H2O co o2 8 9 10 340 3
11 co2 N2 o2 9 7 5 290 4
12 co2 n2 co 3 1 9 300 5
138
Продолжение табл.
I № вари- | | аита | А в с gA’10’, кг £В* 10\ кг gc->о., КГ Т, к V-10". м3
13 со2 Н2О о2 7 5 3 310 2
14 со2 Н2О N2 1 9 7 320 3
15 со2 СО О2 5 3 1 340 4
16 СО Н2О N2 10 8 6 290 5
17 СО н2 n2 4 2 10 300 2
18 со о2 Н2 8 6 4 310 3
19 со со2 О2 2 10 8 320 4
20 со со со2 6 4 2 330 5
31 со со n2 3 6 9 290 > 2
22 со со со2 6 9 3 300 3
23 NHS NHS Н2 9 3 6 310 4
24 NHS NHS N2 4 8 1 320 5
25 NH3 NH3 n2 5 10 2 340 2
ГЛАВА X
КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Основные уравнения и символы
[К, с. 167—234]
Поляризация вещества описывается уравнением
Р = Pop + Рат + Рэл, (X. 1)
где Рор — ориентационная поляризация; Рат — атомная поляриза-
ция; Рэл — электронная поляризация;
p=pop+pA=-F7TV- <Х2>
где Рд = Р ат + Рэл — деформационная поляризация; D — диэлект-
рическая проницаемость; М — молекулярная масса; d — плотность
вещества;
Р==4/з лМд (Иор + аат + аэл) = 4/з лМда, (X.3)
где Мд — постоянная Авогадро; а — поляризуемость;
U2
аор=“зПг’ (Х-4)
где ц — электрический момент диполя; k — константа Больцмана;
D— 1 М 4 „ , 4 лМА .
D4-2 d 3 лЛ?А(аат + аэл)+ 9 (Х-5)
139
или
P = a + b/T,
(Х.6)
где
а = 4/3л Na (аат + аэл),
4 ц2
Ь= — л ^А~Т~'
9 А k
/'. 9fe6
И“|/
(Х.7)
(Х.8)
(Х.9)
В единицах СИ электрический момент диполя неполярных или слабо
полярных веществ выражается уравнением
ц=4,274-10~2’ УТ, (Х.10)
где b — коэффициент, который выражается в м®-К/моль; во внесис-
темных единицах электрический момент диполя выражают в дебаях:
ц = 0,012813 У“. (Х.11)
Молярная поляризация совершенного идеального раствора
где Р12 — молярная поляризация раствора; £>12 — диэлектрическая
проницаемость раствора; dl2 — плотность раствора; и х2 — моляр-
ные доли растворителя и растворенного вещества; М — молекулярная
масса. Для двухкомпонентного раствора получаем
Р1 2 = Р1*1+Р2*2- (Х.13)
(Х.14)
Молекулярная рефракция равна электронной поляризации вещества
n2—1 М 4
n2 + 2 d ~ 3 лЛ,а“эл-Ям,
где 7?м — молекулярная рефракция, м3/моль; d — плотность веще-
ства; кг/м3; М. — молекулярная масса; п — показатель преломления.
Удельная рефракция г равна молекулярной рефракции, деленной на
молекулярную массу:
г . n2~1 —
М л2 + 2 d
Если раствор содержит /Hj кг растворенного вещества в т2 кг раство-
рителя, то
(Х.15)
nj — 1 mi n I—1 тг
П1Г1~ л2 4-2 n2+2 ~d^
m = mi-\-m2
n2 —1 т
mr =------------,
n24-l d
(Х.16)
140
откуда
+ = 21_. (X.i7)
n*+2 di nl + 2 d2 n^+2 d
Рефракцию можно рассчитать по правилу аддитивности:
= 2 ^ат+2 (Х.18)
i j k
где Рат — рефракция атома; Рсв — рефракция связи; Рц — рефрак-
ция цикла.
Если пренебречь атомной поляризацией, то
Р = Ям+^--^у—Н2- (х-19)
Отсюда момент диполя молекулы будет
ц = 4.274-IO-®’ р— RM)T . (Х.20)
Для веществ, находящихся в жидком или твердом состоянии,
И = 4,274.10-”}/ (P-R^T. (Х.21)
В уравнениях (Х.20) и (Х.21) поляризация и рефракция выражены в
м3/моль. Плотность жидкости для неширокого интервала температур,
далеких от критической, выражается уравнением
dT =d273 [l— а (Т—273)], (Х.22)
где dr — плотность при температуре Т; d273 — плотность при 273 К;
а — коэффициент объемного термического расширения;
где V — объем жидкости. Если принять, что в узком интервале тем-
ператур а = const, то
а = ДУ/7, (Х.24)
где ДУ — изменение объема жидкости при нагревании ее на 1°. По-
верхностное натяжение жидкости о соответствует изменению энергии
Гиббса ДО при образовании единицы площади поверхности;
ст = ДО, (Х.25)
а = С {d^-dn)*, (Х.26)
где С — коэффициент пропорциональности; d® — плотность жидко-
сти; dE — плотность пара. Зависимость поверхностного натяжения
жидкости от температуры выражается уравнением
/ до \
а = ДЯ+Т —— . (Х.27)
\ о 1 /р
141
Вязкость жидкости выражается через собственный объем молекул и ее
удельный объем:
t) = C/(v— <о), (Х.28)
где т] — вязкость; С и © — постоянные величины, не зависящие от тем-
пературы; v — удельный объем жидкости. Зависимость вязкости жид-
кости от температуры выражается равенством
^keE^RT, (Х-29>
где — энергия активации вязкого течения.
Теплота испарения жидкости для температур, далеких от критиче-
ской, описывается уравнением
т
ДЯИСПгГ = ДЯИСп,гИ+ f ACdT, (Х.ЗО)
298
где Д//исп. т и Д//Исп,298 — теплота испарения при температуре Т и
298 К; ДС — разность теплоемкостей пара и жидкости.
Теплоту возгонки твердого тела рассчитывают по уравнению
т
ДЯвозг,Т=Д#возг,2в8+ f дсат, (Х.31)
299
где Д//возг. т, Д#возг,29в — теплота возгонки при температуре Т и
298 К; ДС — разность теплоемкостей пара и твердого вещества.
Энергия кристаллической решетки Е для атомных и молекулярных
кристаллов может быть определена по уравнению
£ = д7/ьозг> (Х.32)
где Д#возг — теплота возгонки.
Энергия кристаллической решетки металлов определяют из сот-
ношения:
f = Д//возг "Ь 7, (Х.ЗЗ)
где I — потенциал ионизации.
Для ионных кристаллов
£МА= Д Hf, Ма+Д ^возг, м + Д ^дисс, а+Лй+^А, (Х.34)
где Д/ff ма — теплота образования твердого вещества МА из простых
веществ; Д//ВОзг, м — теплота возгонки металла М; /м — потенциал
ионизации М; Е — сродство А к электрону. По уравнению Капустин-
ского
i
£ма= 1072,24-10-’ -/9-.. У
i (Х.35)
zi z2 / 0,345-10-1° \ »
^=1202,45-10-’—5^—1 —V—---------------- 2Пг>
Г1 "Г f2 \ Г1 "Г f2 / [
где zlt zs — заряды ионов; гъ r2 — радиусы ионов.
142
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите поляризацию молекул нитробензола при 293 К на
основании диэлектрической проницаемости и плотности.
Решение. Диэлектрическую проницаемость и плотность нит-
робензола при 293 К находим в справочнике [М.]: Di93 = 35,97; d2B3 =
= 1,2003-103 кг/м3. По уравнению (Х.2) рассчитываем
35,97—1 123-10-3
Р = ——------------ ----- = 94,143-10"’ м’/моль .
35,974-2 1,2033.10’
л 2. По значениям диэлектрической проницаемости и плотности рас-
творов нитробензола в бензоле при нескольких концентрациях при
298 К:
0,1028
4,64
0,914
поляризацию нитробензола при бесконечном разведении
zc,H,Noa • • • 0.0312
D ............ 2,98
d-Ю-’, кг/м’ 0,885
0,0704
3,86
0,901
(78.89,724-123.0,1028) 10~3
0,914-10’
х2 = 0,1028, Р12 =
определите
Роо-
Решение. Поляризацию раствора Р12 определяем по уравне-
нию (Х.12):
„ 2,98—1 (78.0,9688 4-123.0,0312) 10-’
Ха — 0 « 03 1 2 л 1 а - --
2 2 2,984-2 0,885-10’
= 35,673-10-’ м’/моль;
„ п„пл „ 3,86-1 (78-0,9294 4-123-0,0704) Ю"’
Х»> —— 0 • U704, Hi а— "
3,864-2 0,901-10’
= 39,614-10-’ м’/моль;
4,64—1
4,64 4-2
= 45,295-10-’ м’/моль.
Поляризацию нитробензола при каждой концентрации определяем по
уравнению (Х.13). Предварительно необходимо вычислить поляриза-
цию Рг чистого растворителя (бензола), которую определяем по уравне-
нию (Х.2). Диэлектрическую проницаемость бензола и его плотность
находим в справочнике [М.]: O29S = 2,27; d2w = 0,874-103 кг/м3;
78-10—’
--------= 26,544-10-’ м’/моль;
0,874-10’
л (35,673 —26,544-0,9688) 10-*
х2 = 0,0312, Р,=-----------1 ---------------- =
2 0,0312
= 319,140-10-’ м’/моль;
„ „ ~ (39,614—26,544-0,9296) 10-’
х, = 0,0704, Р, =i---------:--------------=
22 0,0704
= 212,197-10-’ м’/моль;
(45,295 -26,54-0,8972) 10—’
х2 = 0,1028, Р2 = —:----------------------= 208,947-10-’ м’/моль.
0,1028
2,27—1
р __
1 2,274-2
143
Так как каждое значение Р2 содержит некоторую ошибку, то зависи-
мость Р2 = f (х2) в виде уравнения Р2 = а + Ьх2 найдем используя ме-
тод наименьших квадратов.
Р2- 10« *1 хг Р2-10'
0,0312 0,0704 0,1028 319,140 212,197 208,947 0,000973 0,004956 0,010568 9,9572 14,9387 21,4798
Sx2 = 0,2044 SP2 = 740,284-10-» 2х?2 =0,016497 Sx2 Р2 = = 46,3757-10-«
Нормальные уравнения будут иметь вид:
За-f-0,2044 6 = 740,284-10- 8;
0,2044 а + 0,016497 6 = 46,3757-10-«.
Решение этих уравнений дает: а = 354,435-10~6 *, b = — 1580, 336х
X 10-6, а уравнение зависимости будет иметь вид
Р2 = 354,435- IO-8 — 1580,336- 10~в х2.
При х2 -+ О Р2 —> Рж = а', Р2>оо = 354,435-10~6 м3/моль.
3. Определите поляризуемость нитробензола при 298 К, если
поляризация при бесконечном разведении равна 354,435- 10-6м 3/моль.
Решение. Поляризуемость вычисляем по уравнению (Х.З):
3 Р2, оо
а»= — ------
4 +VA
3_
4
354,435-10-6
4л6,02252-1023
= 14,050-10-29
м3.
4. Определите молекулярную рефракцию нитробензола при 298 К
на основании справочных данных о его показателе преломления и плот-
ности .
Решение. Показатель преломления и плотность находим в
справочнике [M.]:nD = 1,5522, d2es = 1,1985-103 кг/м3. Молекуляр-
ную рефракцию вычисляем по уравнению (Х.14):
_ 1 .S5222 — 1
1,55222+1
123-10-3
----------=32,802.10-в №/моль.
1,1985-104 s
5. Определите электронную поляризуемость нитробензола при
298 К, если молекулярная рефракция его рана 32,803- 10-в м3/моль.
Решение. Электронную поляризуемость вычисляем по уравне-
нию
3
аэл — ~~7~
4
32,802-10-8
лб,02252-1023
= 1,3003-10-28
м3.
6. Определите электрический момент диполя молекулы нитробен-
зола, если поляризация нитробензола при бесконечном разведении рав-
на 354,435-10-6 м3/моль, молярная рефракция — 32,802-10*6 м3/моль.
144
Решение. Электрический момент диполя рассчитываем по
уравнению (Х.21), предполагая, что атомная поляризация мала по
сравнению сРж и 7?м:
ц = 4,274 • 10-2’У(354,435- 10-в —32,802- 10~6) 298 = 132,099-10-31 Кл-м,
или в единицах Дебая
р. = 0,01281 у(354,435 —32,802) 298 =3,96 Д.
7. Показатель преломления и плотность пропилового эфира хлор-
муравьиной кислоты при 298 К равны 1,4035 и 1,090-103 кг/м3. Опре-
делите молекулярную рефракцию и сопоставьте ее с рассчитанной по
правилу аддитивности.
Решение. Молекулярную рефракцию вычисляем по уравне-
Значение (п2 — 1)/(п2 + 2) можно взять из справочника [С.Х., т. 1
с. 3981. Для расчета молекулярной рефракции по правилу аддитив-
ности (Х.18) воспользуемся таблицей атомных рефракций [МД:
Ат°м ........... С1 4С 7Н Окарбонил Оэфир CICOOCH2CH2CH3
а, см3/моль . . .5,967 4-2,418 7-1,100 2,211 1,643 27,193
Величина молярной рефракции, рассчитанная по показателю прелом-
ления и плотности, хорошо совпадает с величиной, полученной по пра-
вилу аддитивности.
8. При 293 К показатели преломления и плотности равны: хлоро-
форма по = 1,4457; d~ 1488 кг/м3 и хлорбензола по = 1,5248; d =
= 1110 кг/м3. По показателю преломления раствора хлороформа в хлор-
бензоле и плотности раствора определите концентрацию хлороформа:
по == 1,4930; d = 1260 кг/см3.
Решение. Обозначим массовую концентрацию хлороформа х %.
Тогда концентрация хлорбензола будет (100 — х) %. Подставим дан-
ные в уравнение (Х.17):
1,4930е —1 100 1,44572 — 1 х 4,5248е — 1 100—х
1,49302 + 2 1260 - 1,44572 + 2 1488 + 1,52482 + 2 1110
Решая это уравнение относительно х, находим х = 46,8. Следователь-
но, концентрация хлороформа 46,8 %, а хлорбензола 53,2 %.
9. Определите молекулярную рефракцию глицерина С3Н5 (ОН)3
в воде при 293 К, если показатель преломления 10 %-ного раствора
1,34481, его плотность 1,0221-103 кг/м3. Показатель преломления воды
1,33303, плотность воды 1,0006-103 кг/м3.
Решение. Удельную рефракцию определяем по уравнению
(Х.17):
1,34481е—1 1 1,33303е— 1 0,9
1,344812 + 2 1,0221 Д,333032 + 2 1,0006-Ю3
= 0,20770-10- 3 — 0,18503- И)-3 = 0,2267-10-3.
145
Молекулярную рефракцию определяем по уравнению (X. 15):
0,02267-10-3 „ „
/?м = - —------ 92-10—3 = 20857.10-е м3/моль.
10. Зависимость объема ацетона от температуры выражается урав-
нением [С.Х., т.1, с. 586]:
Уг=Уа73 [1 + 1,3240.10-® (Т—273)+3,8090-10-в (Т—273)2 —
— 18,7983-10-» (Т — 293)3.
Молярный объем его при 273 К равен 71,3846 см3/моль. Определите
коэффициент объемного расширения и плотность ацетона при 315 К.
Решение. Определяем коэффициент объемного термического
расширения по уравнению (Х.23). Для этого вычисляем объем ацетона
при 315 К:
У315 = 71,3846 (1 + 1,3240-10-3-42 + 3,8090-10-8-422 —
— 18,7983-10-’-423) = 75,7344 см3/моль.
Плотность есть обратная величина от молярного объема, умножен-
ная на молекулярную массу:
58-Ю-3
d315 = —----=0,7658-10—3 кг/см3,
31 75,7344
/ dV \
---- = 71,3846-1,3240 • 10—3 + 2 - 71,3846 • 10—8 - 3,8090 (Г—273) —
\ дТ /р
-3-71,3846-18,7983-IO-3 (Г—273)2 = 0,2469 + 2,7418-10- 3 Т—4,0257-10“» Т2,
d3l5= 3,2481 • 10-3 +11,4038-10~3 —5,2744-10—3 = 9,3775-10~3. _
11. Плотности жидкого бензола при 273 и 304 К соответственно
равны 0,9001 -10-3 и 0,8685-10-1 кг/см3. Определите плотность жид-
кого бензола при 323 К-
Решение. Воспользуемся уравнением (Х.22):
0,8685-10-3 = 0,9001-10—3 (I — «30); а= 1,1702-10~3;
d32S = 0,9001 -10-3 (1 — 1,1702-10-3-50) = 0,8474-10-3 кг/см3.
12. Определите работу образования поверхности 1 моль бензола
при переводе его в капельно-жидкое состояние с диаметром капель
0,1 мм при 293 К-
Решение. Определяем сначала общую площадь поверхности 1
моль бензола в капельно-жидком состоянии. Плотность находим в
справочнике [М.1: d293 = 0,8790-10-3 кг/см3. Объем 1 моль 78/0,8790 =
— 88,7372 см3/моль. Объем одной капли
У=4/Зл (0.005)3 = 0,5236-10-3 см3.
Площадь одной капли s — 4л (0,005)2 = 0,314-10-3 см2. Общая
площадь поверхности 1 моль бензола в капельно-жидком состоянии
88,7372
S =------—-— 0,314-10-3 = 53,2355-10® см3/моль.
0,5234-10-«
146
Поверхностное натяжение бензола находим в справочнике [М.]: ст =
= 28,88-10"3 Н/м. Если пренебречь площадью поверхности бензола
до распыления, то работа распыления будет
Дб = 5а = 28,88-10~3-5,3236 = 153,746- 10~3 Дж/моль.
13. Определите поверхностное натяжение С6Н5Вг при 323 К.
Решение. В справочнике [М.] находим значение ст = 35,09 X
X 10-3 Н/м при 293 К. Поверхностное натяжение при заданной тем-
пературе вычисляем по уравнению (X. 26). Плотностью пара можно
пренебречь по сравнению с плотностью жидкости. Плотность СвН5 Вг
при 293 К находим в справочнике [М.]. Тогда по уравнению (Х.26)
рассчитываем коэффициент С:
С = 35,09-10“3/(1,4948-103)4 = 7,0283-10-16.
При 323 К плотность СвН5 Вг равна 1,4546-Ю3. Тогда
Пз2з = 7,0283-10-15 (1,4546-103)4 = 31,46-10-3 Н/м.
14. Поверхностное натяжение н-бутилового спирта при 273, 283
и 293 К соответственно равно 26,2-10-3, 25,4-10~3 и 24,6-10-3 Н/м.
Определите изменение энтропии при образовании 1 м2 площади поверх-
ности н-бутилового спирта и тепловой эффект в интервале температур
от 273 до 293 К-
Решение. Воспользуемся уравнением (Х.27). Для небольшого
интервала температур можно записать
/ да V Да
\дТ/р = ДТ7'
Отсюда
ЬН = а — Т----= 25.4-10-3 —283
ДТ
24,6-10-3-26,2-10-3
293-273
= 48,04.10-3 Дж/м2.
Так как ) = —AS, то AS = — 0,08 • 10_3
\ дТ ]р \ дТ /р
Дж/(м2-К).
15. Установите зависимость вязкости н-пропилового спирта от
удельного объема. Определите вязкость н-пропилового спирта при
353 К-
Решение. Воспользуемся уравнением (X. 28) в преобразо-
ванном виде:
J_____У <о
Л = С ~ С ’
В общем виде это уравнение будет у = а + Ьх, где со/С = а и 1/С —Ь.
Уравнение линейное, в координатах Уд = f (V). Вязкость при несколь-
ких температурах найдем в справочнике [М.]. Для этих же температур
находим плотности:
147
т, к......................
q-Ю3, Н-с-м-1.............
d-Ю-3, кг/м3...............
273
3,883
0,8193
293
2,234
0,8035
313
1,400
0,7875
333
0,921
0,7700
По вязкости вычислим текучести, а по плотности — удельные объемы.
Так как каждое значение вязкости и плотности содержит некоторую
ошибку, то коэффициенты а и Ь найдем по методу наименьших квадра-
тов:
о-10’ м’/кг 1/П-10-3, м’/(Н-с) V*. 10’ 1 и П
X У X* ху
1,2206 0,2575 1,4899 0,3143
1,2446 0,4476 1,5490 0,5571
1,2698 0,7143 1,6124 0,9070
1,2987 1,0858 1,6866 1,4101
2^ = 5,0337-Ю-3 £- = —2»5052’103 У х2=6,3379х х10-« 2 ху=8,1885
Нормальные уравнения будут:
4а + 5,0337-10-3 6 = 2,5052-103,
5,0337-10-3 а 4-6,3379-10-® 6 = 3,1885.
Решение системы уравнений дает а — — 12,1374-108; Ь = 10,1428х
X 10®. Отсюда С — 0,8592-IO-8; w = + 2,1967-10—3. Искомое урав-
нение будет
9,8592-10-8
П= V —1,1967-10-3 ’
При 353 К d = 0,7520-108 кг/м8, тогда v = 1,3298- 10-8м8/кг, т] =
= 0,7407- 10-8 Н-с-м-2.
16. Определите энергию активации вязкого течения хлорбензола.
Определите вязкость хлорбензола при 343 К-
Решение. Энергию активации вязкого Течения Еъ определяем
по уравнению (Х.29):
lg’1 = lgZ!+2’^^? илиг/ = а+^
где у = lgr|; а = lg& и b = Ет]/2,3026 RT. Значения вязкости при не-
скольких температурах найдем в справочнике [M.J:
Т, К......... 273 283 293 303 313 323 333
п-103, Н-с-м2 1,056 0,915 0,802 0,708 0,635 0,573 0,520
1g г)........—2,9763 —3,0386 —3,0958 - 3,1500 -3,1972 —3,2418 -3,2840
(1/Т)-103 . . . 3,663 3,534 3,4.13 3,300 3,195 3,096 3,003
148
Так как каждое значение вязкости т] содержит некоторую ошибку, то
определение энергии активации вязкого потока Еъ проведем по методу
наименьших квадратов. Решение представим в виде таблицы:
1 — . 10’ 1g п “ • юз 1 — ig n • 10я
X У Xs ху
3,663 —2,9763 13,418 —10,902
3,534 —3,0386 12,489 -10,738
3,413 3,0958 11,649 -10,566
3,300 —3,1500 10,890 -10,395
3,195 —3,1972 10,208 -10,215
3,096 —3,2418 9,585 -10,037
3,003 —3,2840 9,018 —9,862
2х= 23,204-Ю-з 21/=—21,9837 2x2=77,257-10-3 2x1/=—72,715-Ю-з
7а +23,204-IO-3 b =—21,9837;
23,204 10—3 а-|-77,254-10-» b = -72,715-Ю-3;
а + 3,315-Ю-з &= —3,1405; 5 = 485,714; а =-4,7506.
а + 3,329-Ю-з 5=-3,1337;
Уравнение зависимости вязкости от температуры для хлорбензола бу-
дет иметь вид
Ig г]= -4,75064-485,714-1/7’.
= 485,714.2,3026-8,3143 = 9,2988-103 Дж/моль.
Вязкость при 343 К будет
lgi)= -4,75064-485,714-1/343= —3,3344,
г] = 0,463-IO-3 Н-с-м-2.
17. Определите теплоту испарения 1 мольСС14 при нормальной тем-
пературе кипения на основании Д//у,298 жидкого и газообразного
СС14.
Решение. Значение находим в справочнике [М.1:
ДЯисп, аре = (—106,7 4-139,3) 103 = 32,6-103 дж/Моль.
Без большой ошибки можно принять, что \Н не зависит от давления.
Воспользуемся уравнением (Х.ЗО). Так как Тн.т.к значительно ниже
критической температуры, то можно принять, что ДС не зависит от тем-
пературы и равно ДС288:
Ль т.н
Д Н у. = Д Н 29 8 4- 1 Д С d т.
н.т.к J
208
149
Нормальную температуру кипения находим в справочнике [M.J —
Т'н-т-к = 349,7 К:
Л Нт =32,6-1034- (83,4 —131,7) (349,7—298) =30,1-103 Дж/моль.
'н.т.к
18. Теплоты образования Lil при 298 К в газообразном и твердом
состояниях составляют — 67,0 и —271,3 кДж/моль соответственно.
Зависимость теплоемкости твердого Lil от температуры выражается
уравнением
С?» = 51,50-4-10,22-10-» Т.
Теплоемкость газообразного Lil
С£ = 36,68 + 14,24 • Ю-з у'.
Определите теплоту возгонки Lil при 680 К.
Решение. Теплоту возгонки определяем по уравнению (Х.31):
680
Д Дв80= ( -67,0-103 + 271,3-103) + [(36,68—51,50) +
298
+ (14,24 — 10,22) 10-3 Г] d 7 = 204,3-Ю3— 14,82 (680—298) +
, 4,02-10~3
----!-------(6802 — 2982) = 199,39-103 Дж/моль.
19. Рассчитайте энергию ионной кристаллической решетки хлори-
да магния по термодинамическому циклу и по уравнениям Капустин-
ского. Сравните полученные величины со справочной [М.].
Решение. В справочниках [M.J и [С.Х., т. 1] находим необхо-
димые для расчета величины: A//’,29s,Mgci, = 641,83 кДж/моль;
АДвозг.мг = 1505,5 кДж/моль; Д/7/2в8, Ci = 121,3 кДж/моль,
7Mg = 2187 кДж/моль (потенциал ионизации); Е — — 363 кДж/моль
(сродство С1 к электрону).
£MgCl2 = (641,83+150,5 + 242,6 + 2187,0—726,0) 103 =
= 2495,9-103 Дж/моль.
По уравнениям (X. 35) рассчитаем энергию решетки ионного кристал-
ла. Для этого подставляем в (X. 35) заряды ионов = 2; г2 = 1 и
= 3; fMg2+ = 0,74-10~10 м; га- = 1,81 • 10-10 м. Тогда
2-1
£M?C1,= 1072,2-10~7 -2520-103 Дж/моль
или
ч Г 0,345-10-10 I _ .
X 1 ——-— -----------------— =2450-10s Дж/моль.
[ (0,74 + 1,81) 10-10 J
Справочное значение ^Mgci, = 2493-10s Дж/моль.
150
ЗАДАЧИ
1. Определите поляризацию хлороформа при 293 К по справочным
данным о диэлектрической проницаемости и плотности [М.].
2. На основании значений диэлектрической проницаемости
й плотностей растворов анилина в диоксане при 298 К определите
поляризацию анилина при бесконечном разведении:
xc.h6nh2 •108> мол- Д°ля • • •
D..............................
d, г/см3 ......................
0 9,77 35,67
2,6037 2,2508 2,3744
1,0280 1,0279 1,0276
3. По поляризации хлороформа при бесконечном его разведении в
неполярном растворителе при нескольких температурах определите
электрический момент диполя молекулы СНС13.
4*. По справочным данным [М.] о поляризации ацетона при беско-
нечном его разбавлении в неполярном растворителе при нескольких
температурах определите электрический момент диполя молекулы аце-
тона.
5. Показатель преломления и плотность пропилового эфира хлор-
муравьиной кислоты при 293 К соответственно равны 1,4053 и 1090
1090 кг/м3. Определите молярную рефракцию и сопоставьте ее с рас-
считанной по правилу аддитивности.
6. Определите молярную рефракцию пиррола C4H5N, если показа-
тель преломления 1,5034 и плотность 929 кг/м3. Сравните полученную
величину с рассчитанной по правилу аддитивности.
7. Укажите структуру соединения с эмпирической формулой
C5HSO2:
О
II
сн3—с—о-сн2—сн=сн2
или
О о
II II
сн3—с—сн2— с —сн3
если при 298 К его показатель преломления 1,4045, а плотность
928 кг/м3.
8. По диэлектрической проницаемости и плотности бензола при
температурах 283, 293, 303 и 313 К [M.J определите молярную по-
ляризацию и его электрический момент диполя.
9. Определите объем, который будет занимать 1500 кг амилово-
го спирта (1-пентанола) при 390 К. Плотность и коэффициент объемного
расширения возьмите из справочника [С.Х., т. 1 и 2].
10. Зависимость объема диэтилового эфира щавелевой кислоты от
температуры в диапазоне от 273 до 414 К выражается уравнением
У273 [1 + 1,06031 10-3 (Г—273) + 1,0983.10~e (Г—273)2 +
+ 2,6657.10-» (Г—273)3].
151
Определите плотность диэтилового эфира щавелевой кислоты при
443 К, если плотность его при 293 К равна 1,0785-103 кг/м3.
11. Зная поверхностное натяжение и плотность СС14 при темпера-
турах 273, 283, 293, 303, 313, 323 и 333 К [М.1, покажите, что вели-
чина a'l'MId не зависит от температуры. Вычислите эту величину.
12. Среди возможных структур соединения с эмпирической форму-
лой С5Н7О2 предполагаются следующие:
I I X II II
Н2С. д?н—с сн3—с—сн2—с—сн,
xoz \Н
I 1!
Установите структуру соединения, если при 298 К его поверхностное
натяжение 0,0433 Н/м, а плотность 1,1094-103 кг/м3, пользуясь табли-
цей инкриментов парахора, приведенной в приложении.
13. Эмпирическая формула соединения C4H5N. Установите струк-
турную формулу соединения, если при 293 К плотность его 969 кг/м3,
а поверхностное натяжение 37,52-10-3 Н/м.
14* . Выразите уравнением зависимость поверхностного натяжения
от температуры на основании справочных данных [М.1 о поверхност-
ном натяжении при нескольких температурах. Выведите уравнение
вида о = а 4- ЬТ методом наименьших квадратов.
15. Определите изменение энтропии при образовании 1 м2 поверхно-
сти жидкого хлорбензола по данным справочника [М.].
16. Определите изменение энтальпии при образовании 1 м2 по-
верхности жидкого хлорбензола при 293 К. Необходимые данные возь-
мите из справочника [М.].
17* . Выведите уравнение зависимости текучести 1/т) нитробензола
от удельного объема методом наименьших квадратов. Воспользуйтесь
данными справочника [М.1. Определите вязкость нитробензола при
373 К, если плотность его при этой температуре 1,1245-103 кг/м3.
18* . Определите энергию активации вязкого течения бензола на ос-
новании справочных данных [М.1 о вязкости при нескольких темпера-
турах. Выведите уравнение зависимости вязкости бензола от темпера-
туры методом наименьших квадратов.
19. Определите теплоту испарения сульфурилхлорида SO2C12 при
нормальной температуре кипения. Необходимые данные возьмите из
справочника [M.J.
20. Выведите уравнение зависимости теплового эффекта испарения
Т1С14 от температуры, справедливое в диапазоне температур от 298 до
400 К. Зависимостью АН от давления можно пренебречь. Необходимые
данные возьмите из справочника [M.J.
21. Теплота образования нафталина в твердом состоянии и в состо-
янии идеального газа при 298 К соответственно равна 78,073 и 150,959
кДж/моль. Теплоемкости Ср твердого и газообразного нафталина при
152
298 К соответтвенно равны 693,289 и 132, 549 Дж/(моль-К)- Опреде
лите теплоту возгонки нафталина при 340 К и изменение энтропии при
этой температуре.
22. На основании данных справочника [М.1 определите энергию
кристаллической решетки 12 при 298 К-
23. Определите энергию кристаллической решетки дифенила
С12Н1е при 298 К, если теплота образования его в газообразном состо-
янии 182,09 кжД/моль. Недостающие для расчета данные возьмите
из справочника [М.1.
24. Определите энергию кристаллической решетки калия при 298 К.
Необходимые данные возьмите из справочников [М.1 и [С.Х., т. 1].
25. Определите энергию кристаллической решетки КВг при 298 К,
АДвозг.к = 89, 998 кДж/моль. Необходимые данные возьмите из
справочника [М.].
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Вычислите электрический момент диполя молекул вещества А
на основании данных о поляризации при бесконечном разведении в не-
полярном растворителе при нескольких температурах [М.1. Рассчитай-
те молярную рефракцию по известной плотности и показателю прелом-
ления при одной температуре и определите приближенно электриче-
ский момент диполя по поляризации при бесконечном разведении и
молярной рефракции при одной температуре.
№ ва- рианта Вещество А № ва- рианта Вещество А Я® ва- рианта Вещество А
1 СНС13 10 СН3ОСН3 18 С2Н6ОС2Н6
9 С2Н5ОН 11 С2Н5ОС2Н5 19 СвН,Вг
3 СН3СОСН3 12 СвН5Вг 20 СвН5С1
4 с2н5ос2н5 13 С„Н5С1 21 CeH5NO2
5 СвН5Вг 14 CeH5NO2 22 СНС13
6 СвН5С1 15 СНС13 23 С2Н5ОН
7 CeH5NO2 16 С2Н5ОН 24 СН3СОСН3
8 СНС13 17 СН3СОСН3 25 С2Н5ОС2Н8
9 С2Н5ОН
2. При 293 К плотность а ?4)-ного раствора вещества А в раство-
рителе В равна d, показатель преломления раствора п. Вычислите мо-
лярную рефракцию вещества А, если при 293 К плотность растворите-
ля В равна dOl а его показатель преломления п0.
№ варианта а, % А в кг/м3 Л
1 20 НС1 СН3ОН 0,915 1,374
2 31 НС1 н2о 1,157 1,407
3 30 H2so4 н2о 1,220 1,370
153
Продолжение табл.
Хг варианта а. % А в d-10-3, кг/м" п
4 40 НС1О3 н2о 1,293 1,367
5 17 . LiBr н2о 1,129 1,362
6 35 LiCl н20 1,174 1,414
7 24,5 NaCl н2о 1,187 1,377
8 12,5 Na2SO4 н20 1,116 1,352
9 9 K2SO4 Н2О 1,075 1,345
10 50 SnCl4 CHgCOOQjHs 1,487 1,476
11 44 CO(NH2)2 н2о 1,121 1,400
12 90 С3Н7ОН 1,866 1,503
13 22 CCl3COOLi Н2О 1,128 1,365
14 29 CHgCOOH н2о 1,038 1,353
15 50 CHgCOOH свнв 0,947 1,434
16 50 CH3COCH3 свнв 0,839 1,428
17 45 CCl3COOH Н2О 1,255 1,395
18 42 CCl3COONa н2о 1,295 1,397
19 52 SCNC3H5 c5h10nh 1,075 1,580
20 25 SCNCgHs о-СвН4(СН3)2 0,968 1,551
21 40 C5H1oNH SCNCgHs 1,085 1,582
22 37 CeH5SOgH н2о 1,135 1,406
23 66 CeH5NH2 С2Н5ОН 0,959 1,516
24 3,6 CeH5COOH с3н5сн3 0,856 1,493
25 44 С12Н220ц н2о 1,191 1,406
Показатель преломления и плотность растворителя В
Растворитель В d.-10-3, кг/м3 По Растворитель В d,-10~3. кг/м1 «0
н2о 1,000 1,333 SCNCgHs 1,019 1,530
СНдОН 0,805 1,329 c5hJ0nh 0,863 1,461
с2н5он 0,808 1,364 C.He 0,885 1,504
СН3СООС2Н5 0,903 1,375 СвН5СНд 0,867 1,497
СН3СН2СН2ОН 0,807 1,386 о-СвН4(СНд)2 0,881 1,505
3. Вычислите парахор вещества А, если известны поверхностное
натяжение и плотность при температуре Т. Полученную величину со-
поставьте с рассчитанной по правилу аддитивности. См. приложение
или справочник [М.1.
* я л н св а л Вещество А a- 10s, Н/м d*10~3, кг/м3 Т, К
1 СНС13 27,28 1,489 293
2 СНдСНО 21,2 0,783 293
3 С1СН2СН2ОН 42,2 1,213 293
4 СН3СН2ОН 22,75 0,789 293
5 СН3СОСН3 23,7 0,791 293
154
Продолжение табл.
Кв ва* рнанта Вещество А а-103, Н/м d- Ю-з. кг/м3 Т, К
6 СН3СООСН3 24,6 0,924 293
7 СН3СН,СН,ОН 23.78 0,804 293
8 СН3СООС,Н5 23,9 0,901 293
9 С2Н6ОС2Н5 16.6 0,708 298
10 СН3СОС2Н5 24,6 0,810 293
И С.Н. 28.89 0,879 293
12 W-CgHj4 18,43 0,659 293
13 «-С5НцОН 21,6 0,815 293
14 С3Н3Вг 36,34 1,508 283
15 С.Н5С1 33,2 1,107 293
16 c.h5nh3 42,9 1,022 273
17 С.Н5СН3 39,8 0,885 288
18 сн3сос.н5 38,7 1,033 293
19 С3Н5СН3СН3 29,2 0,867 293
20 C»H,N 45,0 1,095 293
21 CHjOHCHjOH 46,1 1,109 293
22 СН,(СН,)4СН, 24,95 0,779 293
23 С.Н3СН(СН3)2 28,20 0,862 293
24 (СН3)3С-СН(СН3)(СН,),СН8 31,27 0,894 293
25 С3Н5СООСН3 37,3 1,088
ГЛАВА XI
ФАЗОВОЕ РАВНОВЕСИЕ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
Основные уравнения и символы
[К. с. 326—340; Г. т. 1, с. 138-151]
Условия фазового равновесия выражаются равенствами:
(XI. 1)
/?=$, (XI.2)
где р“, pl1 — химические потенциалы i-ro компонента в фазах аир,
находящихся в равновесии; /“ и $ — фугитивности.
В гетерогенной системе связь между числом степеней свободы, чис-
лом фаз и числом компонентов выражается правилом фаз Гиббса:
f = K —Ф + 2, (XI.3)
где К — число компонентов, К = R — q‘, R — число веществ; q —
число независимых реакций; Ф — число фаз; / — вариантность сис-
темы (число термодинамических степеней свободы).
Связь между основными термодинамическими параметрами одно-
компонентной двухфазной системы, находящейся в состоянии равнове-
155
сия, выражается уравнением Клапейрона — Клаузиуса. Дифферен-
циальные формы уравнения:
d P Д Яф,л . _ dP
dT TSVm ' ат
(XI.4)
где АДф.п — теплота фазового перехода в условиях равновесия фаз
(испарение, плавление, возгонка, превращение модификаций);
dP/dT— температурный коэффициент давления насыщенного пара;
AVm — разность молярных объемов фаз, находящихся в равновесии.
Для равновесий: твердое вещество пар и жидкость пар в об-
ласти температур, далеких от критической, при условии, что Упар =
= RT/P,
dlnP _ А Яф.п (XI. 5)
dT RT* ‘
После интегрирования уравнения (XI.5) при условии получаем: АДф.п = const
, . „ А Z/ф.п , , (XI.6)
г.з/гт ’г ' ’
lgP=4—В)Т, (XI.7) (XI .8)
Iff —— == .——. — — s Pi 2,3 R TtTt ’
Значение АДф.п в уравнениях (XI.6) и (XI.8) является средней вели-
чиной, справедливой для интервала температур Т\ — Т2.
Уравнение Трутона (для неполярных веществ)
Т’н.т.к
где Тн т к—нормальная температура кипения при давлении 1,0132х
X 10Б Па.
При равновесии фаз в тройной точке.
^.Ф = ^В.Ф, (XI.10)
где Рж.ф, Р’в.ф — давление насыщенного пара вещества над жидкой
и твердой фазами. В тройной точке теплоты возгонки, плавления и
испарения связаны уравнением
А Нвозг = А 7/исп-{-Д //пл- (XI.11)
Зависимость теплоты фазового прехода от температуры описывает-
ся уравнением
"(А,^Ф-п) = ДСф.п =С“-сЭ, (XI.12)
О 1
где С“ и — теплоемкости находящихся в равновесии фаз а и (J.
В небольшом интервале температур АСф.п = const, тогда
& Нт. ф. п = А Ро + А Сф.п Т (XI. 13)
156
или
ДЯ7.>гф.п«ДЯ7.1>ф.п+ДСф.п(Т8-Т1). . (XI.14)
Уравнение зависимости давления насыщенного пара от температуры
для твердых и жидких фаз) с учетом (XI.5) и (XI. 13) принимает вид
igP=—^здт + ~ ^Ф'П 1 g г+const (xi.15)
или
в
\gP=A-~+D\ST, (XI.16)
где А//о— константа интегрирования; А, В, D — константы.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Плотность твердого фенола 1072 кг/м8, жидкого 1056 кг/м8, теп-
лота его плавления 1,044- 10ь Дж/кг, температура замерзания 314,2 К.
Вычислите dP/dP и температуру плавления фенола при 5,065-10’ Па.
Р е щ е н и е. По уравнению Клапейрона — Клаузиуса (XI.4)
рассчитываем dP/dP:
dP ДРпл ..,1 1
--- = ------------- Д у —:----------
dT Т(Уж~Утв) dm dTB
dP
dT
1,044-10’
314,2-0,014-10-’
= 2,373-10’ Па/К,
—— =4,214- 10-е К/Па.
d P
Чтобы вычислить температуру плавления при заданном внешнем дав-
лении, принимаем, что dP/dP в интервале давлений 1,0132-10® —
— 5,065-10’ Па — величина постоянная, равная 4,214-10-8 К/Па.
Тогда
т, р,
f d Т = 4,214-10-е J dP
Т, Pi
И
72 = 314,2 + 4,214-10-’.5,065-10’ = 316,33 К.
2. Вычислите среднюю теплоту испарения СН4 в интервале тем-
ператур от 88,2 до 113 К, используя следующие данные:
Т, К............. 88,2 92,2 98,2 104,2 112,2
Р-10-3, Па....... 8 13,31 26,62 52,24 101,3
Решение. Расчет можно провести двумя путями:
1) по уравнению (XI.8).
112,2.88,2, 1,013-10’
ДРисп=2,3-8,314———-1g---------——----=8,62 кДж/моль.
112,2—00,2 O*1U
157
2) по уравнению (XI.7), из которого следует, что зависимость IgP
от 1/7 выражается прямой линией (рис. 15). Теплоту испарения можно
определить по тангенсу угла наклона прямой, который равен: tga =
= — Д77исп/2,3 R. Вычисляем для приведенных данных IgP и 1/7:
т, к 88,2 92,2 98,2 104,2 112,2
р.10-3, Па . . 8 13,31 26,62 53,24 93,40
(1/73 103 . . . . 11,37 10,89 10,21 9,62 8,94
lg Р 3,903 4,124 4,425 4,726 4,972
Строим график IgP = f (1/7), из которого следует
а
tga= ——
о
0,96
-----------= — 432,
2,22-10-3
А Яу = 432-2,3-8,314 = 8,27 кДж/моль.
Этот результат более точен, чем предыдущий, так как вычислен на ос-
новании пяти опытов (истинное значение теплоты испарения метана
при нормальной температуре кипения 8,19 кДж/моль).
3. Вычислите теплоту испарения диэтилового эфира по уравнениям
Клапейрона — Клаузиуса
Рис. 15. Зависимость 1g/?
насыщенного пара СН< от
обратной температуры
и Трутона, если при нормальной темпера-
туре кипения (307,9 К) dP/d7 = 3,53 X
X 10s Па/К. Полученную величину срав-
ните со справочной.
Решение. Вычисляем теплоту испа-
рения по уравнению (XI.5), приняв, что
пары подчиняются закону идеальных газов
и Д1/ « Упар:
А /7 =3,53-103 8,314-307,92---------- =
сп 1,013.10s
= 2,74-104 Дж/моль.
По уравнению (XI.9) находим ДЯИСП =
= 307,8-21,00 = 6470 кал/моль или
А Яисп = 6470.4,187 = 2,72-Ю4 Дж/моль.
По данным справочника [С.Х., т. 1, с. 9601 Д77исп = 2,67-104
Дж/моль, т. е. отклонение от истинного значения при расчете ДДИСП
по приближенным уравнениям составляет 5,5 %.
4. Зависимость давления пара (мм рт. ст.) от температуры для
жидкого металлического цинка выражается уравнением
, 6697
lgP =--------— 1,2 lg ?+ 12,247.
Вычислите теплоту испарения (Д77исп) цинка при температуре плавле-
ния (692,7 К).
158
Решение. Теплоту испарения цинка при 692,7 К рассчитаем
по уравнению (XI.5), преобразовав его к виду
/ d in Р \ _
А/Уисп= лт
\ d 7 /
Дифференцируя уравнение зависимости давления пара жидкого ме-
таллического цинка от температуры
1пР = _ ——9^2,3— — 1,21п 7’4-12,247-2,3,
получаем
dIn Р 6997-2,3 1,2
d Т — Т2 Т ’
Вычисляем Д77исп при 692,7 К:
Д /Рисп = 6997-2,3-8,314 — 1,2-8,314-692,7= 126,887 кДж/моль.
5. Зависимость давления насыщенного пара муравьиной кислоты
(мм рт. ст.) от температуры выражается уравнением:
3160
для твердой фазы lgP= 12,486 ————,
1860
для жидкой фазы 1g/’=7,884————.
Вычислите координаты тройной точки (тр.т).
Решение. Поскольку для равновесия фаз в тройной точке
справедливо условие Р» = Р?в, приравниваем друг к другу приве-
денные уравнения и вычисляем Ттр.т и Р?р.т:
3160 1860
12,486 —-------=7,884 —--------, откуда 7тр-Т = 282,6 К;
Т'тр.т Ттр. т
1860
lgPTp. т = 7,884- =1,302,
zoz,o
откуда
Ртр.т=20 мм рт. ст (2,666-103 Па).
6. Вычислите теплоту возгонки металлического цинка, если тепло-
та плавления (Д77пл) ПРИ температуре тройной точки (692,7 К) рав-
на 6,908 кДж/моль, а зависимость теплоты испарения от температуры
описывается уравнением
ДЯИСП = 133738,66 — 9,9727 (Дж/моль).
Решение. Согласно уравнению (XI.11)
Д Рвозг — Д Рисп 4~ Д //пл •
Вычисляем Д/7ИСП:
ДЯИСП= 133738,66 — 9,972-692,7 = 126,825 кДж/моль.
159
Вычисляем АДВОЗГ:
Л #возг = 126,825-|-6,908= 133,73 кДж/моль.
7. Вычислите теплоту фазового превращения для a-FeS —> 0-FeS
при 298 К. Считайте, что АС = const в интервале температур
Тпр + 298 К. Средняя теплоемкость p-FeS Cp.Fes = 53,845 Дж/моль.
Недостающие данные возьмите из справочника [М.].
Решение. Согласно уравнению (XI. 14)
А /7Пр,29в — А ^Пр, Тпр^ А С (298 Т’лр),
7’пр = 411 К, Са = 54,85 Дж/(моль-К),
ДС = Ср —Са = 53,84 — 54,85= —1,01 Дж/(моль-К),
А//Пр,мх = 4396,35 Дж/моль,
А Дпр, 298 = 4396,35-1,01 (298—411) =4510,78 Дж/моль.
8. Через метиловый спирт барботирует воздух и насыщается его па-
рами. После того как через СН3ОН пропустили 1л воздуха, масса
СН3ОН уменьшилась на 0,201 г. Общее давление в системе неизменно и
равно 1,0132-105 Па. Рассчитайте давление насыщенного пара метано-
ла при 294,5 К.
Решение. Составляем два уравнения:
VP = V'(P-P»HiQH): l.l = V'(l-P£HiOH), (1)
W = V'P£H3OH- (2)
где V — объем воздуха до пропускания его через СН3ОН; V — общий
объем воздуха и паров СН3ОН после пропускания; Р—давление воз-
духа до барботирования, Р = 1 атм; (Р — Рсн3он) — давление воз-
духа после барботирования.
Делим уравнение (1) на уравнение (2) и решаем относительно
Рсн>он:
0 (m/M) RT _ (0,201/32) 0,082-294,4 _
СНзОН= ^^т/м)ЦТ ~ 1 4-(0,201/32) 0,082-294,4 ~
= 0,1315 атм (1,146-10* Па).
9. Вычислите 3"н2о,п)298, если 5^н,о,Ж)298 = 69,96 Дж/(моль-К).
Решение. Для расчета представим себе процесс превращения
жидкой воды в пар под давлением 1,0132-105 Па, который состоит из
двух стадий: 1) равновесное испарение под давлением, равным давле-
нию насыщенного пара, А5ИСП; 2) равновесное сжатие ААСЖ насыщен-
ного пара до давления 1 атм. Тогда
A S = A £иСП4~А SCHt (1); -§н2О (п) = ^Н20(ж)“Ь
Согласно уравнениям (VII.14) и (VII.9)
Д Нцсп 1
А 5.исп — ТГ, : А 5Сж = —R In по .
Т гн2О
160
Для определения АДИСП по справочнику 1М.1 находим теплоты обра-
зования воды для разных агрегатных состояний при 298 К:
Д//Исв = A/f^o (п) —Д//ДгО(ж} = — 241,84 — (—285,84) =44,00 кДж/моль
и давление насыщенного пара Рн.о 3,167-103 Па. После подстанов-
ки чисел и вычислений получаем
44 000 760
A S =---------8,314-2,310 ——— = 118,87 Дж / (мсль • К)
298 29,76 ;
и абсолютная энтропия пара составит
SH,O (.->) == 69,964- 118,87 = 188,83 Дж/(моль-К) •
10. При 268,2 К давление насыщенного пара твердого бензола
2279,8 Па, а над переохлажденным бензолом (жидким) 2639,7 Па. Вы-
числите изменение энергии Гиббса в процессе затвердевания 1 моль
переохлажденного бензола при указанной температуре (пары бензола
считать идеальным газом) и укажите, обратимый или необратимый
процесс.
Решение. Поскольку изменение энергии Гиббса AG не зависит
от пути процесса, принимаем, что процесс затвердевания состоит из
трех стадий: 1) обратимое испарение жидкого бензола при давлении
2639,7 Па; 2) обратимое расширение паров до давления 2279,8 Па; 3)
обратимая конденсация паров в твердую фазу. Тогда
AG=AG,4-AG4-|-AG3.
Так как 1-я и 3-я стадии протекают при Р и Т = const обратимо, то
AGj == AG3 = 0, а
А04=ГГ1п(Р?в/^)
или
2279,8
ДО2 = Д 0 = 8,314-268,2-2,3 = — 326,18 Дж/моль.
2639,i
Результат указывает на необратимость данного процесса.
11. Давление насыщенного водяного пара при 428,2 К равно
54,3-104 Па, а удельный объем пара 0,3464 м3/кг. Рассчитайте фугитив-
ность воды, находящейся при 428,2 К в равновесии со своим насы-
щенным паром.
Решение. Согласно уравнению (XI.2) фугитивность жидкости
равна фугитивности ее насыщенного пара, а так как давление отно-
сительно невелико, фугитивность насыщенного пара можно вычислить
по уравнению (IX. 15):
Р2 И
----= /»-— = (54,3-10* Па)аХ
гид-КI
0,3464 (м3/кг) 18,02
X-----------1-----<—--------= 5,16-Ю3 Па.
8,315 [Дж/(моль-К)] 428,2 (К)
6
Зак. 767
161
ЗАДАЧИ
1. Может ли при температуре 386,5 К (температура превращения
фаз) находиться в равновесии ромбическая, моноклинная, жидкая и га-
зообразная сера?
2. Представьте график в координатах Р — Т для вещества, су-
ществующего в двух твердых модификациях Q и R, жидком и газооб-
разном состояниях. О фазовом состоянии системы имеются следующие
данные:
Точка t, °C Р, атм Фазы
1 10 1 Q, R, пар
2 30 10 R, жидкость, пар
3 50 100 Q, R, жидкость
3. Теплота плавления и плотности жидкой и твердой ртути
при температуре тройной точки (234, 29К) равны соответственно
11,8-103 Дж/кг, 13, 690, 14 193 кг/м3. Вычислите давление, при кото-
ром температура плавления станет равной 235,29 К.
4. Вычислите двумя способами теплоту испарения воды при 273,2
и 573,2 К, используя следующие данные:
1-й способ
Т, К................................ 273,16 573,16
vn, л/г................................... 206,3 0,0215
а», см’/г........................... 1,000 1,400
dP/dT.............................. 0,333 мм рт. ст./К 1,201 атм/К
2-й способ
Т, к................... 273,2 274,2 572,7 574,3
Р,................. 4,579 мм рт. ст. 4,924 мм рт. ст. 88,14 атм 90,17 атм
Объясните, почему при 273,2 К результаты совпадают, а при 573,2 К
расходятся.
5. Определите температуру кипения хлорбензола при 266,6 Па,
если его нормальная температура кипения 405,4 К, а при 5,332-10*
Па он кипит при 382,2 К. Вычислите теплоту испарения, изменение
энтропии, внутренней энергии, энергий Гиббса и Гельмгольца при ис-
парении 1 моль хлорбензола при нормальной температуре кипения.
6. Вычислите коэффициенты А и В в уравнении IgP = А — BIT,
выражающем зависимость давления насыщенного пара жидкого алюми-
ния от температуры. Проверьте полученные данные, вычислив темпе-
ратуру кипения при нормальных условиях (Тн.т.и = 2600 К), если из-
вестно давление паров алюминия, при следующих температурах:
Т, К......................... , 1734 1974 2093 2237
Р, Па .... ......................... 89,3 1333 3972 1,341-10*
162
7. Вычислите количество теплоты, необходимое для нагревания
1 кг TiCl4 от 298 до 423 К. Данные о теплоемкости возьмите из справоч-
ника [M.J. Зависимость давления пара (Па) над жидким TiCl4 от тем-
пературы выражается уравнением
1g 7 = 8,56—1450/7.
8. Вычислите теплоту испарения хлора при Р = 0,1013 МПа, если
уравнение зависимости давления (Па) насыщенного пара от температу-
ры над жидким хлором имеет вид
7 = 3,58-10е—3.37-10*7 + 80,1172.
9. Зависимость давления (Па) насыщенного пара от температуры
для фреона CC12F2 выражается уравнением
2406,1.
lg Р = 34,5---^———9,26 1g 7 + 0,00377.
Определите давление насыщенного пара, теплоту испарения, изменение
энтропии, энергии Гиббса и АС* п при испарении 1 моль фреона при
298 К.
10. Для 1,4-диоксана С4Н8Оа определите координаты тройной точ-
ки (Р и 7), теплоту возгонки, испарения и плавления в этой точке,
если
твердое состояние жидкое состояние
7, К............................. 260,35 272 298,16 307,0
Р, мм рт. ст....................... 4,18 10 41,55 60
11. Вычислите температуру плавления, давление насыщенного па-
ра при этой температуре и теплоту плавления серебра по данным зави-
симости давления насыщенного пара (Па) от температуры, если:
для твердого серебра
1g Р= 13,892— 1,402-10*/7,
для жидкого серебра
1g 7=13,347 —1,334-\&/Т.
12. Определите молекулярную массу уксусной кислоты в парах по
данным зависимости давления насыщенного пара от температуры и по
значению найденной колориметрически удельной теплоты испарения
АЯИСП = 406,83 Дж/г:
7, К.............. 363 383 403
Р, мм рт. ст. . . 293 583 1040
13. Вычислите разность между давлением пара воды и льда при
272 К. Теплота плавления льда равна 334 Дж/г, Рл = Рв = 610,48
Па при 273,16 К.
14* . Температура кипения бензола при 0,1013 МПа 353,3 К. Рас-
считайте давление при температуре тройной точки 278,66 К, восполь-
зовавшись уравнением Трутона со следующими допущениями: теплота
6* 163
испарения не зависит от температуры; теплота испарения зависит от
температуры, но
Д С — Сп— C)K = const, Сп = 81,67 Дж/(моль-К);
Сж = 136 Дж/(моль-К) (при 278,73 К и 4,812-103 Па).
15. Давление насыщенного пара вещества 12-102 Па при 408 К.
.При какой температуре оно будет перегоняться, если в системе под-
держивается давление 2,666-103 Па? При расчете можно использовать
уравнение Трутона и принять, что теплота испарения — величина
постоянная.
16. Вычислите А//исп хлорида таллия при температуре тройной
точки (704 К). Недостающие данные возьмите из [М.]. Теплота плавле-
ния Т1С1 при 704 К АЯПЛ равна 15,564 кДж/моль.
17. Зависимость температуры плавления калия от давления (атм),
по Бриджмену, выражается уравнением
7 = 335,65+1,56-10-2 Р—6,786-10"’ Р2 +1,55- Ю”11 Р3.
Определите температуру плавления и теплоту плавления при давлени-
ях 1,6000 и 12 000 атм, если AV = 0,0268 — 0,000174 (7 — 335, 65).
18. Вычислите фугитивность жидкого аммиака при 362 К- При рас-
чете использовать данные [M.L
19. Вычислите фугитивность жидкого аммиака при 238 К- Давле-
ние насыщенного пара аммиака Р8 = 0,95 атм. Удельный объем пара
v = 1,215 л/г.
20. При плавлении белого фосфора зависимость температуры плав-
ления и изменения объема от давления выражается следующими дан-
ными:
Р, атм . . . . 1 1000 2000 3000 4000
7ПЛ, °C ... . &V, мл/кг . . 44,2 73,8 101,0 126,8 151,3
19,3 17,9 16,6 15,4 14,2
Рассчитайте АЯПЛ путем графической обработки экспериментальных
данных при Р = 2500 атм. Можно ли считать эту величину в интерва-
ле Р = 1 + 2500 неизменной, если (АЯпл)р.] — 648,52 Дж? .
21. Определите расход теплоты в процессе изобарного нагревания
1 кг гексана от ti — 20 до t2 = 100° С. Теплоемкость гексана не зави-
сит от давления. Для расчета воспользоваться следующими данными:
(Cp)g<Hij (Дж/г) =2,07317 + 3,9170-10-3 /;
(ср)с.н„ (Дж/г) = 1,2254 + 4,5655-10-3?;
1322,65
lg Р (мм рт. ст.) =7,1584—---------
240,40 + /
22. Зависимость давления пара водорода от температуры между
1 атм и +.,г можно выразить следующим уравнением:
56,605
Р = —--------+ 3,8015—0,104587 + 0,00332177Г2 + 0,04321977s.
164
При Т = 27,47 К АЯП = 375, 3466 кДж/кг; dr = 0,00613 кг/л;
dK = 0,06050 кг/л. Согласуются ли эти данные друг с другом?
23. Зависимость давления пара никотина C10Hi4N2 от температуры
выражается данными:
t, °C........ 170 185 190 200 209 221 228
Р, мм рт. ст.. 100 160 180 240 300 400 500
Постройте график Р = f (/) и определите \НП и ASn при 200 °C.
24. На основании приведенной температурной зависимости давле-
ния пара жидкого висмута
t, °C.......... 470 515 575 580 610 630 705
Р, мм рт. ст . . . 0,003158 0,003521 0,00492 0,00502 0,01203 0,0204 0,0832
выведите линейное уравнение зависимости IgP = f (1/7’) (пользуясь
методом средних значений) и вычислите АЯП.
25. Какое количество воздуха необходимо пропустить через серо-
углерод при 730 мм рт. ст. и 313,2 К для извлечения 30 г сероуглерода,
если А//п сероуглерода при Тн.т.к — 319,7 К равно 355, 765 Дж/г?
26. Давление пара жидкого брома изменяется с температурой по
уравнению
2210
lg Р (мм рт. ст.) — ————4,08 1g 7+19,82.
Выведите уравнение зависимости теплоты испарения брома от темпера-
туры и рассчитайте изменение энтропии при испарении 1 моль брома
при температуре кипения (331,2 К).
27. Молярная теплота испарения тетрахлорида углерода изменяет-
ся с температурой по уравнению АД = 10 960—10,53 Т. Определите
давление насыщенного пара СС14 при 333,2 К, если СС14 кипит при
348,2 К под давлением 1 атм.
28. Зависимость давления насыщенного пара этилового эфира от
температуры представлена данными:
t, °C ............. —10 О 10 20 30
Р, мм рт. ст. . . 114,8 184,4 286,8 432,8 634,8
Постройте график зависимости IgP от 1/Т и определите по нему мо-
лярную теплоту испарения эфира и его нормальную температуру кипе-
ния.
29. Зависимость давления пара хлороформа от температуры пред-
ставлена данными:
Л °C ............... 20 30 40 50 60
Р, мм рт. ст......... 161 248 369 535 755
Постройте график Р = f (Т) и рассчитайте теплоту испарения хло-
роформа при 40 °C.
165
30. Зависимость давления насыщенного пара алюминия от темпе-
ратуры представлена данными:
Т, К............ 1734 1974 2093 2237
Р, мм рт. ст. . . 0,67 10,00 29,8 100,6
По графику зависимости IgP от 1/Т определите температуру кипе-
ния алюминия при 560 мм рт. ст. и выведите линейное уравнение за-
висимости IgP от 1/Т.
31. Воздух насыщен парами воды при 25 °C. При какой температуре
при неизменном содержании водяных паров относительная влажность
воздуха будет равна 80 %, если при 25 °C давление водяного пара рав-
но 23,76 мм рт. ст. и удельная теплота испарения воды — 280090,8
Дж/г?
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. По зависимости давления насыщенного пара от температуры и
плотности данного вещества А с молекулярной массой М. в твердом и
жидком состояниях (dTB и dm В кг/м3) в тройной точке (тр.т): 1) пост-
ройте график зависимости lg Р от 1/Т; 2) определите по графику коор-
динаты тройной точки; 3) рассчитайте среднюю теплоту испарения и
возгонки; 4) постройте график зависимости давления насыщенного па-
ра от температуры; 5) определите теплоту плавления вещества при тем-
пературе тройной точки; 6) вычислите dT/dP для процесса плавле-
ния при температуре тройной точки; 7) вычислите температуру плав-
ления вещества при давлении Р Па; 8) вычислите изменение энтро-
пии, энергий Гиббса и Гельмгольца, энтальпии и внутренней энергии
для процесса возгонки 1 моль вещества в тройной точке; 9) определите
число термодинамических степеней свободы при следующих значениях
температуры и давления: а) Ттр.т, Ртр.т б) Тн.т.к, Р — 1 атм; в)
Т'н.т.к! Ртр.т- Необходимые для расчета данные возьмите из таблицы
(см. с. 167).
2. Для вещества А даны: теплота испарения, теплота возгонки,
плотности твердой и жидкой фаз dTB, dm при температуре тройной точ-
ки Ттр.т. На основании этих данных: 1) вычислите температуру кипе-
ния вещества А по уравнению Трутона; 2) составьте уравнение lgP®=
= -у +& (а и b—константы) для равновесия жидкостью пар; 3) вы-
числите по полученному уравнению давление насыщенного пара А в
тройной точке; 4) составьте уравнение 1g Ртв — у- + Ь' для равновесия
твердая фаза пар; 5) вычислите dP/dT для равновесия твердая
фаза жидкость; 6) постройте график зависимости равновесного дав-
ления от температуры фазового перехода для трех фазовых состояний
в интервале давлений от 0 до 1,013-10® Па. В данном интервале давле-
ний зависимость давления от температуры для равновесия твердая
фаза жидкая фаза выражается прямой линией, т. е. dP/dT = const.
166
№ вари* анта Твердое состояние Жидкое состояние Условия
т. к Р, Па Т. К Р, Па
268,2 401,2 269,2 505 Л4 = 18
269,2 437,2 272,2 533,2 40,5-10s Па
270,2 475,9 273,2 573
1 271,2 517,2 275,2 656 rfTB === 918
272,2 533,3 278,2 760
283,2 982 </ж=1000
288,2 1600
248,0 7 998 260,0 23 327 Л4 = 27
2 254,4 13 300 265,0 27 190 Р=800 105 Па
258,0 17 995 270,0 31 860 </Тв=718
259,0 19995 278,0 40 290 d»=709
260,0 23 327 282,0 47 990
55 1333 60,0 12 663 М=28
58 3 999 64,0 17 329 Р=500-105 Па
з 59,2 11 997 66,0 22 394 dIB=1026
63 14 663 67,8 27 993 </ж = 808
64 17 329 69,0 31 992
71,0 39 990
100 4 132 105 17 329 М = 30
104 8 531 112 29 653 Р=900-108 Па
4 107 14 663 114 34 738 dIB=1272
109 19 995 115 38 657
110,5 25 367 116 46 435 </ж = 1260
112 29 653 117 53 053
229,2 133,3 273,2 4786 Л4=32
248,0 694,5 282,5 6665 Р=300 105 Па
к 257,0 1333 298,2 12 697 dTB = 837
267,2 2966 306,7 16 396
273,2 4786 312,5 18 929 </ж=825
316,5 21 328
173 7 330 190 31 192 Л4=34
178 11600 196 38 657 Р=450-105 Па
6 183 16 795 200 46 655 </тв=Ю10
184 19 995 207 55 986 </ж = 980
190 31 192 215 69 476
221 77 314
196 101 325 212 592 751 Л4 = 44.
203 190 491 220 648 480 Р=750-105 Па
7 213 402 360 223 674 824 dTB = 1542
220 648 480 239 1 005 114 б/ж = 1510
241 1 065 237
242 1 131 722
167
Продолжение табл.
№ варч- Твердое состояние Жидкое состояние
анта г. К I Р. Па Т. X | Р, Па Условия
276,6 1 1413 277,2 I 1826 34 = 46
278.2 1706 279,2 2082 Р—950-105 Па
8 279,2 1879 281,4 2372 </„ = 1240
280,2 2066 283,2 2626 1290
281,4 23/9 285,2 2932
288,7 ! 3279 1
230 1 26 260 236 63 315 34 = 52
.233 1 31 458 246 78 647 Р=350-105 Па
9 237 ' i 39 900 248 83 979 </„=зою
240 1 49 997 249 86 645 d ж = 2955
243 1 58 518 252,5 96 942
245 । 66 650 253,5 100 508
249 ; 86 645 i
1758,2 “ ' 22,65 1832 187 31 = 52,5
1788,2 63,98 1873,2 300 Р = 500-105 Па
1810,2 99,97 1905 387
10 1835,2 115,99 1938 486 йж=6750
1873,2 j. 300,00 1956 573
1991 4 800
2040 973
242,1 1333 293 26 660 Л4 = 58
252,4 2666 303 37 724 Р=700-10s Па
263,8 5332 308 46 188
11 271,2 7998 311 51 720 дж = 812
180,9 13 330 313 56 186
293,0 26 660 326 63 317 1
183,2 333,3 201 4665,6 31 = 64
188,0 586.5 203,7 5305 jООО- 10s Па
12 196,2 1850 214 7198 </„=1600
199,2 3000 216 7998 rf1K = !560
203,7 5305 230,2 13 328
244,0 21 723
131 1333 137 6665 j 34 = 68
135 1999,5 141 7331,5 Р = 300-106 Па
13 137 2666 145 8664,5 1 .'„=1/50
139,2 3999 146 9997 5 аж = 1434
141,5 5332 149 12 663
144,0 7998 151,4 1 15 996
146 9997,5
Продолжение табл.
№ вари- анта Твердое состояние ! Жидкое состояние ; Условия
г, к Р, Па Т, К 1 Р. Па |
273,2 3265,8 274.2 3730 31 = 78
274,2 3465,8 275,2 4000 Р=900-105 Па
276,2 3932,3 276.2 4160 </тв = 893
14 277,2 273,2 4305,6 4530 278,2 283,2 290,2 4530 6050 8939 а'ж=890
177,3 15996 180 26 660 Af=81
180 19 995 185,5 32 392 P = 300 10s Па
182 23 994 188 37 05’ </„=1626
ДО 184 185,5 28 659 32 992 191 194 196,8 43 456 41 987 59 985 dx = 1610
99 10 675 111 63 984 31 = 83,5
101,9 13 995 11-5,5 68 649 Р = 800 -105 Па
16 103 17 330 117 72 782 </„ = 3330
107,2 19 995 26 669 118 119 77 980 82 646 </ж = 2150
115,5 68 649 119,6 87 711
272,5 3332,5 275,7 4878,8 31 = 84
273,4 3599,1 280,2 5598,6 Р=120-105 Па
275,7 4065,6 281,7 5798,6 </„ = 796
17 277,2 279,2 281,7 4398,9 5065,4 5798,6 283,3 285,2 287,5 6198,6 6931,6 7731,4 </ж = 788
353,2 39,99 363,3 186,6 М = 122
363,2 79,98 393,2 679,8 Р=850-105 Па
18 373,2 186,6 395,2 733,1 </„=1105
383,2 393,2 393,2 679,^ 400,7 403,7 408,7 973,1 1133 1399,6 </« = 1095
19 205,2 208 209,2 213,2 216,4 220 224,2 16 796 19 195 22 662 29 859 35 99! 45 988 59 985 219,2 224,2 226,7 229,2 231.2 323,7 55319 59 985 66 650 75 981 83 979 87 975 М= 127,5 Р=500-105 Па </„ = 2970 </« = 2850
334.6 1С 248,2 1046 34=127,5
338,4 352,2 353,7 1266,3 Р=180-106 Па
343,2 533,2 358,2 1399 d„= 1145
20 348,2 733,1 363,8 1666 </« = 982
353,2 1039,1 368,8 4066
353,7 1266,3 373,8 2466
168
169
Продолжение табл.
№ вари- анта Твердое состояние Жидкое состояние Условия
Г. К | Р, Па Т. К Р. Па
423,5 23 994 446,4 47000 М = 152
433,2 31 325 448,2 47 454 Р=6ОО-1О5 Па
91 437,7 35 324 451,2 49 987 dT в =985
41 441,2 39 323 460 55 986 d1K = 977
444,2 43 322 470 63 317
448,2 47 454 480 71 345
223,2 133,3 244,2 1200 Л4=154
99 237,2 466,5 253,2 1319 Р=60,8-105 Па
246,2 799,8 270,1 2465 dIB = 1680
252,2 ’1213 282,5 3865 d«== 1650
253,2 1319 285,7 4398
418,0 133,3 490,5 5332,0 М=174
оо 446,5 667,0 504,8 8020,9 Р=220-105 Па
460,2 1333,0 523,0 13300 dIB=954
474,9 2666,0 552,0 26 600 rfiK =948
490,5 5332,0 583,2 53 320
612 101 308
377,2 7 064 373,2 10 662 М = 254
381,2 8 531 388,2 12 397 Р=200-105 Па
Ол 383,2 9 331 392,2 13 997 dIB = 3960
386,2 10 397 393,2 14 796 i/ж =3900
389,-7 11997 397,2 16929
392,2 13 997 401,2 19 462
№ вари- анта Вещество А т. К Теплота испарения ю-4, Дж/моль Теплота возгонки ю-4, Дж/моль dTB-10-3, кг/м3 </ж-10~3, кг/м3
1 12 23 Zn 692,6 12,84 12,84 6,914 6,920
2 13 24 Си 1356,1 32,09 33,39 8,41 8,37
3 14 25 Ag 1234,1 25,54 26,67 9,68 9,32
4 15 К 336,65 8,77 8,99 0,851 0,830
5 16 Bi 644,15 17,42 18,50 9,350 10,240
6 17 Hg 234,35 6,45 6,68 14,19 13,69
7 18 KF 1159,1 18,04 20,68 2,43 1,914
8 19 I* 386,7 4,53 ' 6,08 4,820 3,970
9 20 Вгг 266 3,22 4,27 3,14 2,93
10 21 nh8 199,15 2,41 3,18 0,810 0,664
11 22 CH3COOH 256,4 2,97 4,12 1,266 1,053
3. Вещество А испаряется при температуре Т. Вычислите удельную
теплоту испарения при этой температуре. Составьте уравнение зависи-
мости теплоты испарения вещества А от температуры. Теплоемкости на-
сыщенного пара и жидкости возьмите из справочника, приняв, что в
170
данном интервале температур они постоянны. Теплоты, испарения при
нормальной температуре кипения приведены в таблице.
№ вари- анта Вещество А Ги.т.и, К 4НИСП "₽’ ?н.т.н> кДж/моль г, к
1 11 Т1С14 499 35,75 309 460
2 12 HNO3 357 38,2 300 400
3 13 Вг2 331,5 29,6 270 400
4 14 Н2О 373,2 40,7 300 450
5 15 cs2 319,5 26,8 250 370
6 16 ecu 350 30,0 300 400
7 17 Hg 630 59,3 550 700
8 18 СН2О2 (муравьиная кис- лота) 373,6 22,3 320 300 400
9 19 СН4О (метаиол) 338 35,3 400
10 20 С2Н4О2 (уксусная кисло- та) 391 45,0 320 450
11 21 С2Н6О (этанол) 351,5 39,5 300 400
12 22 С3Н6О (ацетон) 329,3 98,3 280 370
13 23 С6Н6 (бензол) 353,2 30,8 300 400
14 24 С7Н8 (толуол) 384 33,2 320 450
25 «-С6Н14 (гексан) 342 28,9 290
4. Сухой воздух, занимающий при температуре 7\ и давлении Р
объем V, пропущен над веществом А при температуре Т2 и насыщен
парами этого вещества. Насколько изменится масса вещества после
пропускания воздуха? Давление паров вещества А при температуре Т2
взять из таблиц [M.J. При расчете учтите, что общее давление в систе-
ме в течение всего процесса остается неизменным и равным Р.
№ вари- анта Л, К Па S Вещество А Тг, К S о. м S Л. К 1 о . «3 0, К V, м’ Вещество А Г„ к
1 283 9,91 3 н2о 363 14 191 9,85 7 СН3ОН 293
2 285 9,97 4 н2о 353 15 293 9,91 9 СН3ОН 288
3 287 10,05 5 н2о 343 16 293 10,05 7 СН3СОСН3 323
4 289 11,12 6 н2о 333 17 295 10,12 8 СН3СОСН3 318
5 291 9,71 7 н2о 323 18 297 9,71 9 СН3СОСН3 313
6 299 9,78 8 ссц 333 19 299 9,78 10 СН3СОСН3 308
7 295 9,85 9 СС14 318 20 301 9,85 2 СНдСОСНз. 303
8 297 9,91 10 СС14 313 21 283 9,71 2 с6н6 343
9 299 9,97 2 СС14 308 22 285 9,78 3 с6н6 333
10 301 10,05 3 СС14 303 23 287 9,85 4 с6н6 323
11 285 10,12 4 СНаОН 308 24 289 9,91 5 с6н„ 313
12 287 9,71 5 СН30Н 303 25 291 9,97 6 с6н6 303
13 289 9,78 6 СН3ОН 298
5. В сухом воздухе при Т при диспергировании вещество А испари-
лось, превратилось в насыщенный пар при неизменном общем давле-
нии 1 атм и охладило воздух. На сколько градусов понизилась темпера-
171
тура воздуха? Для расчета принять, что в исследуемом интервале тем-
ператур: 1) N2, О2, пары А являются идеальными газами; 2) тепло-
емкость Ni( О2 и паров А постоянна; 3) теплоту испарения А вычис-
лите по зависимости давления насыщенного пара ot температуры [М.].
1 № вари- | анта г, к Вещество А № вари- анта г, к Вещество А № вари- анта Т. к Вещество А
1 303 н2о 3 288 СН2О2 муравьииаи кислота 5 293 С4НМО диэти- ловый эфир
2 298 СС14 4 283 СН4О метило- вый спирт 6 308 СзН6О ацетон
Задача решается графически; ответ к варианту № 1: ДТ = (—19±
± 1) К.
6. По зависимости давления насыщенного пара от температуры (см.
условие многовариантиой задачи № 1), методом наименьших квадра-
тов опишите экспериментальные данные с помощью уравнения IgP =---
= у+ составьте программу для микрокалькулятора или в случае
затруднения воспользуйтесь готовой программой, которая приведена
в конце пособия.
ГЛАВА XII
ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ
И ПРОЦЕССОВ ИХ ОБРАЗОВАНИЯ
Основные уравнения и символы
[Г., т. 1, с. 158-161, 169—178]
Способы выражения концентраций двухкомпонентных растворов:
массовое соотношение
= (XII.1)
где mi — масса t-ro компонента в растворе; т — масса раствора. Мас-
совая доля, выраженная в процентах,
a>i- 100 = mx 100/m;
молярное соотношение
(XII.2)
172
где rij — число молей растворителя; п2—число молей растворенного
рещества;
молярная доля
Xi =«{/(«! 4-п2);
(XII.3)
молярная доля соответствующего компонента, выраженная в процен-
тах,
хг-100 =
п, 100
«1 + п2
Моляльность т — число молей (п2) растворенного вещества, приходя-
щееся на 1000 г растворителя. Молярная концентрация с—число мо-
лей растворенного вещества (п2), содержащееся в 1 л раствора.
Среднюю молекулярную массу раствора М рассчитывают по урав-
нению
M=xlM1+xiM2. (XII.4)
Парциальные молярные величины Лг определяют по соотношению
£,г/'-^9бщЛ , (XII. 5)
\ дп,} ]Р<т,П]
где Лобщ = общее (среднее) экстенсивное свойство раствора; nj со-
ответствует Ль п2, п3, ..., пк.
Парциальными молярными величинами могут быть объем, энталь-
пия, энтропия, энергии Гиббса и Гельмгольца;
р / дУ \ -( дН }
' \ dniJP-r'nj’ ‘ \ dnt /Р.т,п}’
? / as \ - _/ до \
\ д nt JP.T.nj у д tit )р.т,П]
где Vi, Нг, Sir Gi — парциальный молярный объем, энтальпия, энт-
ропия, энергия Гиб0са. Парциальная молярная энергия Гиббса i-ro
компонента соответствует его химическому потенциалу:
= (XII.6)
Производная химического потенциала i-ro компонента по температу-
ре соответствует его молярной парциальной энтропии:
««=-(-9?-) - (ХП-7)
где р — химический потенциал.
Парциальные молярные функции смешения AL” (относительные
парциальные молярные величины) определяют по формуле
M^=Li—L«, (XI 1.8)
173
где Ц — экстенсивная функция L i-ro компонента в стандартном со-
стоянии. К парциальным молярным функциям смешения относятся:
= уО. — &S^ = Si—S°; Л G? = G(—G®;
АН/ — энтальпия смешения i-ro компонента, называемая дифферен-
циальной теплотой растворения. Энергию Гиббса смешения опре-
деляют по формуле
= = (XII.9)
— химический потенциал i-ro компонента в стандартном состоянии,
а энтропию смешения вычисляют по формуле
Asr=—• (XII.10)
\ О i IP
Соотношение между парциальными молярными величинами описы-
вается уравнениями Гиббса — Дюгема:
Ьобщ = Я1 ^2 ^3 ’ (XII. 11)
£=* —общ =Ъхг+Тгхг, (XII.12)
«1 + «г
Xi, (XII. 13)
\ дхг )р, т, ж,
/ dL \
£г = £+ ------ (1-ха), (XII.14)
\ дХ1 }р, т, х,
= + (XII.15)
где А£инт — интегральная функция смешения;
A Lm
----!!!!L_ = AL"l = AL'nx1 + ALmx2, (XII.16)
л1_1'яг *
/ 3 A Lm \
---------Lt =*LT‘ (XII.17)
\ дп/ JP,r,nj 7
Так, например, для энтропии смешения и теплоты смешения уравне-
ния имеют вид
5общ ______________________________— _
АЯ"Т = П1Д^+
где \Нт — интегральная энтальпия смешения (интегральная теплота
растворения, или относительная интегральная энтальпия);
АЯ!т =
д^Нт \
д п/ )р, т ’
(XII.18)
174
— интегральная теплота растворения для предельно разбавлен-
ного раствора (вычисляют экстраполяцией); Л2 — парциальная моляр-
ная теплота разбавления от данной концентрации до концентрации в
предельно разбавленном растворе.
Кажущееся молярное свойство L второго компонента <рД2 опреде-
ляют по уравнению
f.o64=ni Фд, = ... (XII.19)
Свойства идеальных растворов описываются уравнением Рауля
= (XII.20)
где Р,- — парциальное давление насыщенного пара i-ro компонента в
растворе; Р? — давление насыщенного пара чистого i-ro компонента
раствора; — молярная доля i-ro компонента в жидкой фазе.
Соответственно функции смешения идеальных растворов имеют зна-
чения:
ДУ^ = 0; ДЯ^=0; ДХ?’=-Р1пх{; (XII.21)
Д(?7 = Дщ = /?Т1пхг, (XII.22)
а химический потенциал компонента идеального (совершенного) рас-
твора будет
цг=^ + Р7Чпх£. (XII.23)
Для неидеальных растворов уравнение Рауля (XII.20) непримени-
мо, так как Рг #= Р*х* и функции смешения неидеальных растворов
не равны: AV” =#= 0; А/7” =/= 0. Для описания свойств реальных
растворов вводят понятие активности
Дб” = Д т = ЙТ1па(; (XII.24)
АН?
——Rlnat' (XII.25)
где at — активность (эффективная концентрация) i-ro компонента в
растворе. Активность at определяют по соотношению аг = Д/f" (при
Р и Р° < 1,0133-10» Па).
ai = Pt/Pni (XII.26)
или
а( = хиь (XII.27)
где ft, ft — фугитивность i-ro компонента в растворе и в стандартном
состоянии; — рациональный коэффициент активности. Химиче-
ский потенциал компонента неидеального раствора определяЩт по
уравнению
+ (XII.28)
175
Активность (коэффициент активности) зависит от температуры. Эта
зависимость выражается уравнениями:
/din at \ / dlny, \ Д И™
\ дТ \ дТ )р,т~~
(XII.29)
le J^=jg (ХИ.ЗО)
“ПЛ) 2,3/гТгГ!
Теплоты растворения, разбавления и смешения раствора рассчиты-
вают по уравнению
^А^кон- (XII.31)
где АНтон, АНнгач — интегральные теплоты растворения для конеч-
ного и исходного растворов. При расчете учитывают количества раст-
воров.
= 0,458,
= 0,018,
ЗАДАЧИ С РЕШЕНИЯМИ
1. Вычислите молярную долю метилового спирта в 60%-ном водном
растворе.
Решение. Согласно уравнению
v ___ ДСН,ОН_____ ___ mCH,OH /Мен,он_______
GH.OH ПСНзсн + пН,О /"сн3он/МСн,он + /7гн,о//"н!о
Если взято 100 г раствора, где mt — массовая доля i-ro компонента в
растворе, выраженная в процентах, то
60/32
Лсн,он = 60/32^40/18
или молярная доля CHSOH будет х100= 45,8 %.
2. Вычислите молярную долю Хна в 1 М водном растворе НО.
Решение. Согласно уравнению (XI 1.3)
__ "на_________= m
НС! "натн,о/Мн,о т+1000/18
r<HCI=m=l; mHjO=1000 r; 1000/18 = 55,55.
3. При 293,2 К плотность 60%-ного водного раствора метилового
спирта 0,8946 г/мл. Вычислите объем 1 моль раствора,
Решение. Вычисляем объем 1 г раствора:
1 1
Г=-— = -----— =1,118 мл/г.
х 0,8946
Вычисляем среднюю молекулярную массу раствора М по уравне-
нию (XII.4). Определяем молярную долю СН3ОН по уравнению
60/32
-'Л',- ли —-0,458,
сн.он 60/32-4-40/18
176
a xHso = 1—0,458 = 0,542. Тогда
M = XCH,OH ^ch,oh "Ь^н,© 44HjO = 0,458-324-0,542-18 = 24,41.
Рассчитываем объем 1 моль раствора V72zif — VM,
’/
. —-— = 1,118-24,41=27,29 мл/моль.
2 л£
4. Объем раствора как функция состава для системы Н2О — NaCl
определяется уравнением
i VoBtn = 55,K>VH>o -j- 16,4m4 2,5m2—1,2m3,
где tn — моляльная концентрация растворенного вещества. Определи-
те парциальный и кажущийся молярные объемы 0,5 М раствора NaCl.
Решение. Согласно уравнению (XI 1.5)
v . = (_£L__Y
NaCl ( <?nNaCI /р. 3". лн,о’
пн,о = 1000/18 = 55,55 --= const; пкаС; — tn. Продифференцировав
исходное уравнение, выведем уравнение для парциального молярного
объема
(= y2 = is,44-5m—3,6m2.
( dm j
Так как tn = 0,5, to V2 = 18,0 мл/моль.
Определим кажущийся молярный объем по уравнению (XII.19):
Фу» = (^общ— пн»о ^H1o)/rtNaCl-
Из уравнения условия задачи вычисляем Уо6щ = 1008, 575. Подстав -
ляя значение Уобщ в (XII.19), получаем
<Pv =-(1008,575—55,55-18)/0,5= 17,35 мл/моль.
NaCl
5. Вычислите методом пересечения парциальные молярные объемы
воды и метилового спирта для 60 %-го раствора метанола при 293,2 К-
Для расчета используйте данные о зависимости плотности растворов
метанола от концентрации:
Спирт, % ... 0 20 40 60 80 90 100
d, г/мл . . . 0,9982 0,9666 0,9345 0,8946 0,8469 0,8202 0,7917
Решение. Пересчитываем массовые доли, выраженные в про-
центах, в массовые соотношения, а плотности — в удельные объемы
и получаем
CHSOH, % . 0 20 40 60 80 90 100
№сн,он 0 0,2 0,4 0,6 0,8 0,9 1
V, мл/г , . . 1,002 1,035 1,070 1,118 1,181 1,219 1,263
177
Строим график зависимости V = f (а’сн,он) (рис. 16). Проводим
касательную к кривой в точке, соответствующей 60%-ной СН3ОН.
Отрезки на осях координат дают парциальные удельные объемы У,:
Усн.он — 1,244 мл/г; Ун,о — 0,931 мл/г. Парциальные молярные
объемы Vi находим по уравнению V,- — ViMf.
Усн.он = 1,244-32 = 29,8 мл/г;
^н,о = °>931*18=16’78 мл/г-
6. Вычислите относительный АУсн,он и кажущийся <PvCH он
парциальные молярные объемы метанола в водном 60 %-ном растворе.
Для расчета используйте зависимость удельных объемов растворов
CHgOH от концентрации:
СН,ОН, % . . 0 20 40 60 80 90 100
к’сн,он • • • • 0 0,2 0,4 0,6 - 0,8 0,9 1
V, мл/г . . . 1,002 1,035 1,070 1,118 1,181 1,219 1,263
Решение. Относительный парциальный молярный объем Усн.он
вычисляем по уравнению
А ^сн,он ~ ^сн, он- ^сн, он ^сн.он >
АУсн.он = 39,36 — 1,263-32 =— 0,786 мл/моль.
Кажущийся молярный объем фу вычисляем по уравнению
СНаОН
^-У^о
фу = >
СН,ОН *СН,ОН
V
Vm =-------=27,90 мл/моль;
2 tti
^Н,о — 18.02 мл/моль; *сн,он =0,458; хн>о=0,542.
После подстановки чисел и вычислений получаем ФгСН10Н ~
= 39, 60 мл/моль.
7. Для водных растворов метанола при 298 К получены значения
парциального молярного и кажущегося парциального объемов мета-
нола:
хсн,он • . . . 0,123 0,272 0,458 0,692 0,835
У/(я1+л»), мл/моль . . . . . . 20,4 23,3 27,3 32,7 36,3
Усн.он ’ мл/моль .... . . . 37,8 39,0 39,8 40,4 40,4
Ун,О’ мл/моль ...... . . . 18,0 17,5 16,8 15,4 15
^'сн.он • мл/моль • • • • . . . 37,25 37,4 38,3 39,2 39,9
178
Какие выводы можно сделать из приведенных значений?
Решение. Парциальные молярные объемы тем больше отлича-
ются от объемов компонентов в чистом состоянии, чем более разбавлен
раствор. Кажущиеся объемы тем меньше отличаются от парциальных
молярных, чем более разбавлен раствор.
Рис. 16. Зависимость
объема раствора СНзОН
в Н2О от молириой доли
Рис, 17. Зависимость интег-
ральной теплоты растворения
H2SO« в воде от соотношения
молей воды и кислоты
8. Вычислите дифференциальные теплоты растворения серной кис-
лоты Qh2so4 и воды QhjO для 84,5 %-ного раствора. Используйте
данные о зависимости интегральной теплоты растворения от концент-
рации при 298 К:
пн.о
/*! =—— ............. О 0,5 1 1,5 2 3 4 6
nH,SO4
—ЬНт, кДж/моль ... 0 15,73 27,8 35,90 41,45 48,92 53,89 60,23
Решение. Концентрации выражены таким образом, что число
молей растворенного вещества остается постоянным, а число молей
растворителя изменяется. Значение \Нт соответствует теплоте образо-
вания раствора, содержащего 1 моль H2SO4 и г моль воды. Поэтому
целесообразно без дополнительных пересчетов, построив график
ЬНт = f (г), найти А//н,о методом касательных, а АДнгзо4 вы-
числить по уравнению Гиббса — Дю гема. Выражаем концентрацию
84,5 %-ного раствора как молярное соотношение
пн,о 15,5-98
nH2so4 18-84,5
179
Строим график \Нт — f (г) (рис. 17). В точке кривой, соответст-
вующей г = 1, проводим касательную. Согласно уравнению ДЯн,о =
= tga
а 13,56 t
tga = — = —-—=4,52,
о о
Д ^н,о =<?н,о== —18,92 кДж/моль,
значение Qh2so4 рассчитываем по уравнению (XII. 15):
д Hm=nHiO QH!o+nH,so4 Qh,so4
или
\Нт — г <?н=о +1 QHjso4»
27,8=1 (-18,92)4-1 (QH,SOJ
Qh,so4 =46,72 кДж/моль.
9. Вычислите дифференциальные теплоты растворения серной кис-
лоты и воды для 84,5 %-ного раствора методом пересечений, если при
298 К зависимость интегральной теплоты растворения от концентра-
ции выражена значениями:
"н2о
ri — ...........
”h,so4
—\Нт, кДж/моль . . .
О 0,5 1 1,5 2 3 4 5
0 15,73 27,8 35,90 41,45 48,92 53,89 60,23
Решение. При использовании метода пересечений концентра-
ции выражают или в молярных долях х, или в процентах wt. Интег-
ральную теплоту растворения относят к 1 моль раствора, по-
этому значения г и &Нт пересчитывают на %h2so4 = l/(r + 1) и
\НтНп1 4- л2) = A//mxH2So4. Исходные данные и результаты расче-
та запишем в виде:
г ..................... 0,5
XH,SO,.................°-666
—ДЯт, кДж/моль . . . 15,73
—Иь.Нт xHjso4 ’ кДж/моль 10,47
1 1,5 2 3 4 6
0,5 0,4 0,33 0,25 0,20 0,15
27,8 35,90 41,45 48,92 53,89 60,23
13,89 13,93 13,80 12,23 10,82 9,03
Строим график в координатах -----;-----Xh.so4 (рис. 18). Мо-
лярное соотношение 84,5 % -ного раствора г = 1; молярная доля
xH,so4 — 0,5. В точке кривой, соответствующей абсциссе 0,5, проводим
касательную. Точки пересечения касательной с осями ординат дают
значения дифференциальных теплот растворения: а—воды, b — сер-
ной кислоты; ДЯн,5о4 — — 8,87 кДж/моль, Л#н2о = — 18,91
кДж/моль.
180
10. Определите парциальные молярные теплоемкости НС1 и НаО
в растворах, для которых молярные доли и теплоемкости приведены
ниже:
XHPI .............. ..... 0,000 0,091 0,130 0,200 0,259
nil
Теплоемкость раствора, содер-
жащего 1 моль Н2О, Дж/К 75,3 70,9 69,5 72,7 82,6
Решение. Сначала определим парциальные молярные теплоем-
кости второго компонента (НС1), так как приведенные теплоемкости от-
носятся к растворам, содержащим постоянное количество первого ком-
рения серной кислоты в воде от мо-
лярной доли раствора
Рис. 19. Зависимость теплоемкости
водного раствора НС1 от содержа-
ния НС1 в растворе
понента (Н2О). Таким образом, искомыми будут произодные (------)
\ дп2 )РТП1
для всех растворов. Каждая из этих производных может быть получе-
на графически (рис. 19) как тангенс угла наклона касательной к кривой,
описывающей зависимость С от пг. Рассчитаем необходимые для по-
строения графика значения пг для всех растворов, воспользовавшись
выражением, определяющим молярную долю:
fla
Х2==-------,
Я1 ~ГП2
По условию «1=1, тогда п2 = х2/хг, п2 = 0,0; п"2 = 0,091/0,909 =
= 0,1; п2' = 0,130/0,870 = 0,149; п2" = 0,200/0,800=0,250; п""‘ =
= 0,259/0,741 = 0,350.
По графику определяем производные, соответствующие парциальным
молярным теплоемкостям НС1: — — 12,9; С2 = — 8,2; С'2" =
~ — 1,5; Сз'" = 11,5; С2"" = 18,6. Парциальные молярные тепло-
емкости воды вычисляем по уравнению
C — rii Ci + «aC2 или Cj = C—л2С2,
= 18;
= 16,93 + 0,182-0,1 = 17,75;
181
С” = 16,65 + 0,149-1,5=16,87;
С”" = 17,36—0,25-11,5=14,48;
С""' = 18,75-0,35-18,6= 12,24.
11. Вычислите активность и рациональный коэффициент активности
ацетона в водном растворе, если хацетон = 0,318, Рацетон = 152 мм
рт.ст., Рацетон = 229 мм рт. ст. Дайте заключение о характере отклоне-
ния раствора от идеальности.
Решение. Активность вычисляем по формуле (XII.26):
аацетон= 152/299 = 0,664.
Коэффициент активности — по уравнению (XI 1.27):
Уацетон = 0,664/0,318 = 2,09;
Тацетон > 1 • Отклонения от закона Рауля положительные.
12. Вычислите химический потенциал и изменение химического по-
тенциала при растворении ацетона в воде, если хацетон = 0,318,
Рацетон = 152 мм рт. ст., Рацетон = 229 мм рт. ст. Остальные дан-
ные возьмите из справочника [М.].
Решение. Изменение химического потенциала при растворении
вычисляем по уравнению (XII.28):
А Рацетон = Рацетон ~~ Рацетон = Я7’ 1паацетон =
= 8,31-2,3-298 1g 0,664 = 0,013 кДж/моль.
Так как Рацетон = Абацетон, вычисляем АСацетон по уравнению
(VII. 37), необходимые данные берем из справочника [М.1. Откуда
АСацетон = — 155,50 кДж/моль, и по уравнению (XII.9) получаем
Рацетон — —155,50+ 1,01 = —154,4 кДж/моль.
13. Зависимость давления (Па) насыщенного пара чистого серебра
и серебра над твердым раствором Ag — Au с молярной долей Ag 30 %
от температуры описывается уравнениями:
, 16350
lgpo=_---------+ 12,805,
Выведите уравнения зависимости относительного химического по-
тенциала серебра для 30%-ного раствора Ag—Au от температуры.
Решение. Из уравнений (XII.9), (XII.26) и (XII.28) следует;
Ардг = pAg — pXg; Др = RT 2,3 Ig PAg — RT 2,3 Ig PAg. Подстав-
ляем в это уравнение Ig Р — f (Т) и получаем
п / 15250 16350 X
HAg-PAg = RT2,3{---------+ 11,118+—— -12,805 ,
/? = 8,314 Дж/(моль-К) и р^—р^ = 21024—32.26Г.
182
14. Вычислите относительную парциальную молярную энтропию
серебра Д5дг для раствора Ag — Au с молярной долей серебра 30 %,
если зависимость давления (Па) насыщенного пара чистого серебра и
серебра над твердым раствором от температуры выражается уравне-
ниями:
1g Р° =
1g Р~
16350
—-----+ 12,805,
15250
—------+11,118.
Т -г
Решение. Относительную парциальную молярную энтропию
серебра определяем по уравнению
ЛЯ? = I— dAflAs V
дТ / ’ *Ag
Для этого находим производную
нение ApAg = f (Т),
L г , дифференцируя урав-
’XAg
——Мр х ——32,26 Дж/моль, =32,26 Дж/моль.
д Т ) xAg **
15. Вычислите относительную парциальную молярную энтропию
воды Д5ц,о для 84,5 %-ного раствора серной кислоты при 25 °C.
Давления насыщенных паров воды над водой и над раствором равны
3,167-103 и 5,198 Па соответственно.
Решение. Относительную парциальную молярную энтропию
воды вычисляем по уравнению (XII.25). Для расчета активности во-
ды используем уравнение (XII.26). ДЯщо = — 18,912 кДж/моль.
Подставляем числа в уравнение (XI 1.25):
18 912 5 198
--------^—2,3-8,314 Ig = 10,22 Дж/(моль-К).
16. Вычислите теплоту растворения ?раств H2SO4, массой 40 г
в 160 г воды. Используйте данные о зависимости интегральных теплот
от концентрации, приведенные в справочнике [М.].
Решение. Процесс растворения можно представить схемой
щ (Н2О) +«2 (H2SO4) — раствор.
Теплоту растворения драстн вычисляем по уравнению (XII.31)
Трасте = (теплоты растворения для чистых веществ равны
нулю), где ДЯт — интегральная теплота растворения, отнесенная
к 1 моль серной кислоты. Значение \Нт находим в справочнике [М.].
Так как в справочнике концентрации выражены в молярных соот-
ношениях г, то
г=/лн,о ^h,so4/(^h,omHtsoJ — 160-98/( 18-40) = 21,77.
183
По значению г находим в справочнике IM.J интегральную теплоту
растворения, равную — 71,71 кДж/моль. Затем определяем число
молей H2SO4:
-= ~ — 0,408
и вычисляем
?раети — 0,408 (— 71,71) = —-29.25 кДж
17. Определите тепловой эффект разбавления ^разб раствора
NaOH, содержащего 30,8 % NaOH, до содержания его 0,443 %.
Решена е. Если в условии задачи количества растворов не
указаны, та расчет »-езут на 1 моль растворенного вещества по урав-
нению (ХП.31), Предел: разбавления можно описать схемой
раствор 1 (30,8%)+п (НгО) ==раствор 2 (0,443%).
Тогда
— (раствора 2)-ДЯ«> (раствора 1).
Пересчитаем массовую долю NaCl. выраженную в процентах, на мо-
лярные соотношения г. Согласно уравнению (-ХП.2) г — пн.о/ямаон:
69.2-40 99,55-40
, „ —j---------- rs. г ------------- - - goo
л 18-30,8 i 18-0,443
и по справочнику LMJ найдем интегральные теплоты растворения:
ДЯ"* = 37,76 vi &.Н™ — 42,36 кДж/моль. Вычисляем дразб:
4Дазб= —42,36— (—37,76)= —4,6 кДж/моль.
18. Определите тепловой эффект растворения 0,1 кг газообразного
хлороводорода при 298 К и 1,013-Ю5 Па в 3 кг 10 %-ного водного
раствора НО.
Решение. Процесс растворения можно представить схемой
раствор 1 Д- НС1 (г) = раствор 2.
Теплоту растворения ^раств вычисляем по уравнению (XII.31):
Трасте— (п1 + пг) А Нт— п-у Л Н™*
где «j — число молей соляной кислоты в растворе 1; п2 — число мо-
лей газообразного НО, растворенного в 10%-ном водном растворе
НС1.
Вычисляем Пн.о, п1г п2:
3000-0,9
ян,о = " ~
—150; «1= .
18 36,5
3000-0,1
= 8,219;
100
-----= 2,739.
36,5
184
Выражаем концентрации растворов как молярные соотношения гъ
г., .. . ==-----------— = 13,69.
m + n2 8,219 + 2,739
По справочнику [М.1 находим интегральные теплоты растворения, а за-
тем линейной интерполяцией (при расчетах, требующих высокой сте-
пени точности, лучше применять графическую интерполяцию) полу-
чаем
Л Н™ = 71,6; Д Н™ = — 70,6 кДж/мо;;ь.
Вычисляем +аств:
<7раотв== (8,219 + 2,739) (— 70,6)-8,219 (- 7! .6) = - 185,2 кДж.
ЗАДАЧИ
1. В 1-10~3 м3 раствора бромида натрия содержится 0,3219 кг
NaBr. Плотность раствора при 293 К равна 1238,2 кг/м8. Выразите кон-
центрацию раствора: 1) в молях соли в 1 10~3 м® раствора; 2) в мо-
лях соли на 1 кг воды; 3) в молярных долях; 4) в процентах; 5) в мо-
лях воды на 1 моль NaBr.
2. Плотность 60%-ного раствора ортофосфорной кислоты при 293 К
равна 1426 кг/м3. Определите количество молей Н3РО4: 1) в 1 л раст-
вора; 2) в 1000 г растворителя. Чему равна молярная доля кислоты
в растворе?
3. Плотность 5,18%-ного раствора фенола в воде равна 1,0042 г/см3.
Плотность воды равна 0,9991 г/см3. Выразите состав раствора в молях
фенола на 1 моль воды и в молях фенола в 1 л раствора. Чему равен
удельный объем фенола в растворе, если считать, что удельный объем
воды не изменяется при образовании раствора.
4. При 80°С плотность 12 %-ного раствора фенола в воде равна
0,9775 г/см3. Какое количество воды приходится на 1 моль фенола?
Чему равен удельный объем фенола, если удельный объем воды равен
1,029 см3/г и образование раствора происходит без изменения объема?
5. Плотность CS2 при 293 К равна 1,264 г/см3, плотность С2Н5ОН—
0,8040 г/см3. Чему равна плотность смеси, содержащей 80% CS2.
если удельный объем ее является аддитивной функцией состава?
6. Плотность 10%-ного раствора NH^Cl равна 1,029 г/см3, плот-
ность твердого NH4C1 — 1,536 г/см3, плотность воды — 0,9974 г/см3.
Определите изменение объема при образовании 100 г 10%-ного раство-
ра.
7. При 283 К плотность С2Н5ОН равна 0,7936 г/см3, плотность во-
ды — 0,9991 г/см3, плотность 50%-ного раствора спирта в воде —
0,9179 г/см3. Определите величину сжатая при смешении 50 г спир-
та с 50 г воды, если удельный объем воды при этом изменяется. Срав-
185
ните удельный объем чистого спирта с его удельным объемом в раст-
воре.
8. Определите графически парциальный молярный объем 0,4 т
раствора FeCl3, используя следующие данные:
Число молей FeCU в 100г воды 0,0000 0,0126 0,0257 0,0394 0,0536
Объем раствора, содержащего
100 г воды, см3 ........ 100,13 100,58 100,98 101,38 101,73
9. Определите графически парциальный молярный объем 0,3 т
раствора CuSO4, если известны следующие данные:
CuSO4 в растворе, % . 1,912 3,187 4,462 5,737
Плотность раствора, г/см . . 1,0190 1,0319 1,0450 1,0582
10. Зависимость удельного объема v водного раствора пероксида
водорода от массовой доли w Н2О2 выражается уравнением
V— 1,003 (1 —w) -}-0,6935w—0,036и> (1 —w).
Рассчитайте парциальные молярные объемы Н2О и Н2О2 для раствора,
в котором w = 0,4.
11. Определите парциальный молярный объем метилового спирта
(СН3ОН), если плотность 60%-ного водного раствора спирта при 293 К
равна 0,8946 г/см3, парциальный молярный объем воды в этом растворе
16,8 см3/моль.
12. Определите молярный объем раствора, если в 20 %-ном вод-
ном растворе метилового спирта парциальные молярные объемы воды и
спирта равны 18 и 37,8 см3/моль соответственно.
13. Определите массу 1 моль раствора, полученного смешением
1 моль ССЦ с 3 моль SnCl4.
14. Определите молярный объем. сплава, содержащего 62% Си,
считая объем аддитивной функцией состава. Плотность меди
8,9 г/см3, а цинка 7,1 г/см3.
15. Зависимость объема раствора хлорида натрия от количества
молей соли п2, растворенной в 1000 г воды, выражается уравнением
V= 1000-|~ 16,4л2-|-2,5п2 —1,2п|.
Определите парциальный молярный объем 0,5 т раствора NaCl (см3).
16. Определите плотность 40%-ного водного раствора метилового
спирта, если парциальные молярные объемы воды и спирта в этом
растворе соответственно равны 17,5 и 39 см3.
17. Определите парциальную молярную теплоемкость КОН в 10,
20 и 30%-ных растворах, используя следующие данные:
Число молей в 100 г Н2О Удельная теплоем- кость раствора, КОН, Дж/(г К) Число молей в 100 г Н2О Удельная теплоем- кость раствора КОН, Дж/(г-К)
0,0000 4,176 0,5951 3,235
0,0940 3,896 0,7652 3,110
0,1985 3,699 0,9636 3,001
0,3152 3,524 1,1910 2,905
0,4465 3,337
186
18. Определите парциальные
Н2О в 0,5; 1,0; 2,0 т растворах,
азотной кислота приведены ниже:
молярные теплоемкости HNO3 и
Удельные теплоемкости растворов
CHNO, ’ % ................ 0 1 2,5 5 10 15 20 25
Удельная теплоемкость,
Дж/(г-К)....................... 4,18 4,117 4,034 3,908 3,712 3,545 3,373 3,219
19. При 298 К интегральная теплота растворения некоторой кисло-
ты в воде выражается формулой
Д tf = 8,36nJ/2+ 12,54n|/2+ 16,72nf/2,
где пг — чило молей Н2О на 1 моль кислоты. Оцените [т. е.
(dAH/dn2)p/T„J раствора, молярное содержание которого составляет
10% кислоты.
Число молен на 1 кг Н2О . 0,0624 0,2001 0,4003 0,7504 1,0058
ДД, Дж/моль . 7716,3 7440,4 6897,0 6399,6 6015,0
Число молей на 1 кг Н2О 1,9457 3,1064 4,0012 4,9966 6,0004
Д Н, Дж/моль . 4961,7 3954,3 3206,1 2587,4 1897,7
20. По интегральным теплотам растворения NaCl в воде при 275 К
рассчитайте количество теплоты, которое будет поглощено при этой
температуре, если к 100 г 10%-ного раствора NaCl прибавили 126 г
Н2О.
21. Используя интегральные и дифференциальные теплоты раство-
рения 1 моль H2SO4 в воде при 298 К,
Число молей Н2О А Н, Дж ДЯн,О’ Дж/моль A#HjSO4’ Дж/моль
0 0 —28215,0 0
0,50 —15925,8 —28173,2 —1830,8
1 —28507,6 —19771,4 —8736,2
2 —41632,8 —9697,6 —22237.6
3 —49700,2 —6186,4 —22781,0
4 —54841,6 —4347,2 —37452,8
6 —61613,2 —2382,6 —47317,6
10 —67883,2 —973,9 —58143,8
определите: а) общее количество выделяющейся теплоты при прибав-
лении 4 моль Н2О к раствору, содержащему 6 моль Н2О и 1 моль H2SO4;
б) общее количество теплоты, выделяющейся при смешении 3 моль
Н2О с 6 моль H2SO4.
22. При исследовании растворимости диметилглиоксима никеля в
воде при нескольких температурах получены следующие результаты:
Т, К............. 298 303 308 313 318
Растворимое тьХ
Х105, моль/л . . 0,105±9% 0,139±4% 0,184±2% 0,240±2% 0,307±2%
187
а) оцените энтальпию растворения диметилглиоксима никеля в воде
Д/7° (кДж/моль); б) что означает индекс «°» в А//0?
23. По данным о зависимости теплоты смешения меди с серебром от
состава при 1428 К определите графическим методом теплоты раство-
рения компонентов в растворах следующего состава: = 0,10;
0,30; 0,50; 0,70; 0,90. Представьте график зависимости теплоты раст-
ворения от состава, если
xAg............ 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
А//, кДж/моль . 1,38 2,41 3,14 3,60 3,81 3,77 3,46 2,81 1,78
24. При смешении 125,4 г висмута с 9,73 г магния выделилось
16200 Дж теплоты. Определите парциальную молярную теплоту раст-
ворения висмута, если парциальная молярная теплота растворения
магния в этом растворе — 34 900 Дж/моль.
25. Парциальные молярные теплоты растворения кремния и марган-
ца в растворе Si — Мп с молярным содержанем 70% Si равны — 3800 и
— 83 500 Дж /моль соответственно. Определите количество теплоты, вы-
деляющейся при образовании 1 кг раствора этого состава.
26. Парциальная молярная энтропия растворения серебра в твер-
дых растворах Au—Ag зависит от состава и описывается уравнением
in xAg-5,03x2u дж/(моль.к).
Выведите зависимость AS"1 от состава и вычислите ASm для 75 % -
ного раствора золота.
27. Зависимость парциальной молярной теплоты и энтропии раст-
ворения y-Fe от состава раствора y-Fe — Ni описывается уравнения-
ми:
Д Ft=—2095x^1 Дж/моль; Д Fe= — R In *Y.Fe .
Определите зависимость химических потенциалов от состава раствора-
28. Вычислите активность воды в растворе, если давление водяных
паров над ним 0,9333- 10в Па и 373 К-
29. При 308 К давление пара ацетона 0,459- 10в, а давление пара
хлороформа 0,391-105 Па. Над раствором с молярным содержанием
36 % хлороформа парциальное давление паров ацетона 0,2677-108, а
хлороформа 0,0964-105 Па. Определите активность компонентов и
сравните их с молярными долями этих веществ.
30. Вычислите коэффициент активности брома в растворе тетрахло-
рида углерода, над которым парциальное давление брома соответствует
10,27 мм рт. ст. Состав раствора (мол. доли): Вг2 — 0,0250 и СС14 —
0,9750. Давление пара чистого брома при той же температуре
213 мм рт ст. За стандартное состояние брома примите чистый жидкий
бром.
31. Если 1,046 г кадмия растворить в 25,23 г ртути, то давление
пара образующейся амальгамы при 305,2 К будет составлять 0,920 от
давления насыщенного пара чистой ртути. Определите активность и
коэффициент активности (мол. доли) ртути в амальгаме.
188
32. Хлорид ртути HgaCla распределяется между бензолом и водой;
при 298 К получены следующие концентрации (моль/л):
В С6Н6 .... 0,000155 0,000310 0,000618 0,00524 0,0210
В Н2О.......... 0,001845 0,00369 0,00738 0,0648 0,2866
Рассчитайте активность соли в водном растворе при концентрации
0,2866 моль/л, если раствор его в бензоле остается идеальным до с —
= 0,03 моль/л.
33. Определите коэффициент активности сахара в растворе, если
температура замерзания 0,8 т водного раствора сахара 271,4 К. Кри-
оскопическая константа воды 1,86°.
34. Зависимость давления пара (Па) от температуры над жидким
«-бутаном в интервале температур от 272,66 до 348,16 К выражается
уравнением Антуана
203,8 / 1030,3 \
Ig Р = 0,813 - ——Ig Р = 4,11 — — - атм .
6 Г—22,2 I,6 251,0-Н /
Рассчитайте летучесть «-бутана при 289,16 К, если при этой температу-
ре плотность его насыщенного пара 4,9 кг/м3. Можно ли пренебречь раз-
личием между летучестью и давлением насыщенного naps, если пред-
полагаемая точность определения приведенного уравнения равна при-
мерно 1 %?
35. Определите летучесть NH3 в условиях, если при давлении
4,05- 10е Па и 423 К 1 моль NH3 занимает объем 0,7696 л.
36. Давление пара воды при 293 К составляет 2337,80 Па. Вычис-
лите давление пара раствора 1 • 10~а кг хлорида аммония в 1 • 10-1 кг
воды и химический потенциал воды в данном растворе, если коэффици-
ент активности воды у = 0,976, приняв, что AG° воды в интервале 293—
298 К не зависит от температуры, а р® равно AG® образования дан-
ного компонента.
37. Давление пара воды при 273 К равно 610,48 Па, а давление пара
10%-ного раствора NaNO3 589,28 Па. Определите активность и хими-
ческий потенциал воды в указанном растворе.
38. Давление пара брома над чистым бромом при 298 К составляет
28371,00 Па, а давление пара брома в 0,1m водном растворе —1,7-104
Па. Определите химический потенциал брома при 298 К. За стандарт-
ное состояние примите состояние чистого брома.
39. Хлорид ртути HgaCla распределяется между бензолом и водой.
При 298 К получены следующие концентрации (моль/л):
В С6Н6 .... 0,000155 0,000310 0,000618 0,00524 0,0210
В Н2О............... 0,001845 0,00369 0,00738 0,0648 0,2866
Рассчитайте химический потенциал р в обеих фазах как функцию кон-
центрации и представьте в виде графика.
40. При 1250 К давление насыщенного пара серебра над раствором
Ag — Au с молярным содержанием 62,0 % Ag и над чистым серебром
189
равно соответственно 2,11-10“1 и 4,83- Ю-1 Па. Определите относи-
тельный химический потенциал серебра в растворе.
41. Давления насыщенных-паров над чистым свинцом, серебром и
раствором Ag — Pb с молярным содержанием 95 % Ag при 1358 К
равны: P°Ag = 8,67-10"1 Па; = 8,40-10-1 Па; Р£ь = 5,59-102 Па,
Ррь = 9,60-10 Па.
Определите изменение энергии Гиббса для 1 моль раствора при об-
разовании раствора заданного состава, считая это изменение на 1 моль
раствора.
42. Зависимость давления (Па) насыщенного пара чистой жидкой
меди от температуры описывается уравнением
lg ро= — 16050/7’ +10,666.
Определите парциальную молярную теплоту растворения меди при
1823 К в растворе Fe — Си (концентрация меди 89,5 %), если давление
насыщенного пара меди над данным раствором 6,73-10 Па.
43. Давление (Па) насыщенного пара магния над раствором Mg—
Pb, содержащим 4,2 % магния, зависит от температуры и описыва-
ется уравнением
7810
lgP= —-----+ 9,218
£> уч * ’
и над чистым магнием
6560
-+9.723.
Определите парциальную молярную теплоту растворения и энтропию
растворения магния при 298 К.
44. Газовая фаза Н2О — Н2, равновесная при 1873 К с раствором
кислорода в железе (объемная доля кислорода 0,1200 %), содержит
72,1 % Н2. Определите изменение химического потенциала кислорода
при переходе из газовой фазы, в которой Ра. — 10® Па, в раствор ука-
занного состава. Константа равновесия реакции Н2 + v2 О2 — Н3О
при 1873 К
Кр-Т’н,о46-103.
45, . Смешали 400 г воды со 100 г 100%-ной серной кислоты. Выде-
лившаяся теплота пошла на обогрев раствора. Вычислите изменение
температуры раствора АТ, допустив, что сосуд, в котором находится
раствор, теплоту не поглощает. Теплоемкость раствора постоянная
и равна 3,427 Дж/(г-К). Недостающие данные возьмите из справочни-
ка [М.1.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Раствор веществ А и В данной концентрации; плотность этого
раствора при температуре Т равна d: 1) определите молярную концент-
рацию — число молей растворенного вещества в 1 л раствора; 2) опре-
190
делите молярную концентрацию — число молей растворенного веще-
ства на 1 кг растворителя; 3) рассчитайте молярную долю вещества А в
процентах; 4) определите число молей растворителя, приходящееся на
1 моль растворенного вещества.
№ вари* анта Массовое содержа- ние А, % Вещество T. к o'-io-5, kf/ms
А в
1 97 СВг3СНО H2o 323 2,628
2 94 СВг3СНО H2O 313 2,566
3 91 СВг3СНО H2O 313 2,485
4 87 СВг3СНО H2o 313 2,340
5 80 СВг3СНО H2O 313 2,106
6 73 СВг3СНО H2o 313 1,938
7 63 серено H2o 313 1,725
8 45 серено H2o 313 1,476
9 72 C,Hs(SO3H) H2o 298 1,281
10 66 C«H5(SO3H) H2o 298 1,256
11 61 C,Hs(SO3H) H2O 298 1,235
12 80 С«Н3(ОН)з H2o 293 1,208
13 62 (СН2)4О2 H2O 293 1,041
14 57 CioH8 CH3COCH3 293 0,992
15 50 CjpHg CH3COCH3 293 0,968
16 43 СщНз CH3COCH3 293 0,945
17 37 CjoHg CH3COCH3 293 0,921
18 30 CioHe CH3COCH3 293 0,900
19 28 CioHg CH3COCH3 293 0,875
20 17 СюЩ CH3COCH3 293 0,850
21 12 CiqHs CH3COCH3 293 0,835
22 80 CH3COCH3 293 0,765
23 60 CH3COCH3 293 0,741
24 40 C«Hj4 CH3COCH3 293 0,719
25 20 c,H14 CHgCOCHs 293 0,692
2. По зависимости интегральных теплот смешения А/7смеш от кон-
центрации в жидкой фазе xf при 298 К и 1,0133-10® Па и данных о со-
ставе пара х" и общем давлении при Т, К: 1) постройте график зависи-
мости А//сМеш = f (х*); 2) определите интегральную теплоту смеше-
ния компонентов для 1 г смеси; 3) определите всеми возможными спо-
собами парциальные теплоты смешения i-ro компонента при концент-
рации /иг и х“; 4) определите кажущуюся молярную теплоту сме-
шения i-ro компонента концентрации х“; 5) определите парциальное
давление i-ro компонецта для заданных смесей; 6) вычислите актив-
ность i-ro компонента для заданных смесей; 7) определите относитель-
ный химический потенциал i-ro компонента для заданных смесей; 8)
определите коэффициент активности i-ro компонента для заданных
смесей; 9) определите энтропию смешения при заданных концентраци-
ях, приняв, что теплота смешения не зависит от температуры.
В каждом варианте необходимо провести расчет для двух составов.
J&i
Я Молярное содер- жание Л и Молярная доля первого Давление пасы* » 1 доля омпо- меси Теплота смешения
Я га первого компо- компо- нента пара над Система А—В я “ ° g 5.0“ О на 1 моль смесн для
о. К 2 в парах R О « 4 системы
я Xi , % t? и О Q S S тп, % 1 мм рт. ст. Ч О.Н . О © Я < 04 я ем < я х Н А-В, Дж
1 3,32 0,1 7,98 146,7 СС1Д1)-С,Н16(2) 0 0
96,49 99,14 304,1 (Т=323 К; 0,1 -110,876
2 9,83 0,15 21,59 159,8 РСЛ.= 146’5 0,2 —200,832
89,92 94,68 295,4 ММ рт. ст. 0,3 -277,399
3 17,14 0,2 34,37 174,0 0,4 —327,189
81,26 90,00 282,4 ро.с14=ЗО8,5 мм рт. ст.) 0,5 —347,272
4 30,24 0,3 52,79 198,7 0,6 -326,352
73,23 85,54 271,7 0,7 —271,960
5 35,69 0,5 58,05 207,4 0,8 -194,556
64,96 80,53 256,9 0,9 — 100,416
6 43,24 0,4 64,52 220,7 0 0
57,00 75,15 244,7
7 50,12 0,6 70,00 232,3
73,23 85,54 271,1
8 9,83 0,7 21,59 159,8
64,96 80,53 256,9
9 17,14 0,8 34,37 174,0
96,49 99,14 304,1
10 3,32 0,5 7,98 140,7
57,00 75,15 244,7
11 6,84 45,56 103,6 (^НвОНО)- 0 0
71,74 Cd 58,28 119,6 С7Н1в(2) 0,1 —259,400
12 28,03 0,2 53,44 117,7 (Г = 303 К; 0.2 —401,664
51,51 54,96 119,9 рС,н,в=58,2 0,3 —595,801
13 28,03 0,3 58,28 119,6 мм рт. ст.; 0,4 -959,801
81,54 62,82 117,0 0,5 —633,876
14 6,84 0,4 45,56 103,6 ^лон = 78,2 мм рт- ст.) 0,6 —614,211
89,02 71,16 111,3 0,7 -560,656
15 5! ,51 0,5 54,96 119,9
95,45 89,68 97,1
16 6,84 0,6 45,56 103,6
71,74 58,28 119,6
17 10 0,2 16,48 156,0 С2Н6ОН(1)— 0 0
90 36,64 109,3 СвНи(2) 0,1 -255,224
18 20 0,3 20,90 158,4 (Т=298 К: 0,2 —380,744
80 27,40 138,3 ₽®тн1 ,=140,3 0,3 —460,24
19 30 0,1 22,08 157,6 мм рт. ст.; 0,4 -517,142
70 24,47 150,0 0,5 -558,146
20 40 0,7 22,46 157,2 ^Лон ^78,2 0,6 —566,00
10 36,69 109,3 мм рт. ст.) 0,7 —556,472
21 50 0,8 22,83 156,4 0,8 —510,448
90 36,69 109,3
22 60 0,9 23,21 154,7
20 20,90 158,4
23 70 1,1 24,47 150,0
30 22,08 157,6
24 80 1,2 27,40 138,3
10 16,48 156,0
25 90 1,3 36,69 109,3
20 20,90 158,4
192
ГЛАВА ХШ
РАЗБАВЛЕННЫЕ РАСТВОРЫ
Основные уравнения и символы
[К., с. 352—363, « 403—405; Г., к 1, с. 158—2481
Зависимость давления насыщенного пара над раствором твердых
веществ в летучих растворителях выражается законом Рауля (относи-
тельное понижение давления пара растворителя над раствором):
Р?-~ Р( АР п2
~"pf ~ ~рГ ~
(ХШ.1)
где Pt — давление пара над чистым растворителем; Р, — давление
пара растворителя над раствором данной концентрации; ДР/Pf — от-
носительное понижение давления пара растворителя; п2 — число мо-
лей растворенного вещества; n.j — число молей растворителя.
Уравнение Рауля, учитывающее диссоциацию (ассоциацию) раст-
.воренного вещества, имеет вид
АР
pf
in2 int
nl + ni
(XIII. 2)
где £ — коэффициент Вант-Гоффа;
Общее число молей прк диссоциации
/==-“--------------—— ---------— = 1+а (т-l); (XIII.3)
Общее число молей до диссоциации
Число распавшихся молекул
а—степень диссоциации =-------------------------;
Исходное число молекул
v — число частиц, на которые диссоциирует молекула.
Зависимость повышения температуры кипения (ДТКИЛ = Т — Т°)
разбавленного раствора от модальной концентрации m выражается
уравнением для недиссоциирующих веществ
Д Т'киц — Лэ ’Т
и уравнением для диссоциирующих веществ
Д г кип — i
(XIII.4)
(XIII.5)
где Т°, Т — температура кипения растворителя и раствора; /\3 —
эбуллиоскопическая постоянная (молярное повышение температуры
кипения);
к -
1000iHCII
(ХШ.6)
Тн.т.к — нормальная температура кипения чистого растворителя;
/исп — удельная теплота испарения растворителя.
7 Зак. 767
193
По повышению температуры кипения раствора можно определить
молекулярную массу вещества
,, 1000Хэт2
м2=---------
(XIII.7)
№1 А Твид
где М2 — молекулярная масса растворенного вещества; тг — масса
растворенного вещества; mj — масса растворителя.
Зависимость понижения температуры замерзания (АТ3 = Т® —Т)
разбавленного раствора от моляльной концентрации т выражают для
недиссоциирующих веществ уравнением
Д 7*з==/Сири, <
для диссоциирующих веществ — уравнением
4 7*3=ttfKpm, (ХШ.9)
где ККр — криоскопическая константа растворителя (молярное пони-
жение температуры замерзания);
руг
V ___ л пл
Акр —
(XIII.8)
- (ХП1.10)
1000/пл
где Тз, Т — температура замерзания чистого растворителя и раство-
ра; / — удельная теплота плавления растворителя.
По понижению температуры замерзания раствора можно опреде-
лить молекулярную массу вещества:
1 000Хкр тг
/Via —-
г т1&Тя
Зависимость осмотического давления от молярной концентрации
раствора (Вант-Гоффа) описывают уравнением:
для недиссоциирующих веществ
л=с RT
(X1II.11)
(ХШ.12)
и для диссоциирующих
n — ic RT,
(XIII.12а)
где л — осмотическое давление; с — концентрация раствора, моль/л
(моль/м8).
Интегральную теплоту растворения АЯт для разбавленных раство-
ров определяют по равенству
ДЯт = пгДНт, (XIII.13)
Химический потенциал компонентов предельно разбавленного раст-
вора определяют по уравнениям
И1=И1’ + ЯТ1пх1( (XIII.14)
р2 = р5 + ЯТ1п/п, (XIII.15)
где pl — химический потенциал второго компонента в гипотетическом
растворе с моляльностью т — 1 моль на 1000 г и свойствами предель-
но разбавленного раствора.
194
Зависимость растворимости газов в жидкостях от давления выража-
ется уравнением Генри:
(ХШ.16)
(XIII. 17)
где х* — концентрация газа в насыщенном растворе; КЬ, Кг — кон-
станты Генри, К1 = 1/Кг’, Рг — парциальное давление газа.
Зависимость растворимости газа от температуры выражают уравне-
нием в дифференциальной форме
или уравнением в интегральной форме (для интервала температур, в
котором АЯ* — const)
где АЯ™ — дифференциальная теплота растворения газа в насыщен-
ном растворе. Уравнения (ХШ.16) и (ХШ.18) применимы для иде-
альных и предельно разбавленных растворов.
Для данной температуры отношение концентраций третьего компо-
нента в двух равновесных фазах есть величина постоянная, не завися-
щая от абсолютных количеств всех веществ, участвующих в распреде-
лении:
Ci/ct=K,
(ХШ.20)
где сг — равновесная концентрация распределяющего вещества в пер-
вой фазе; — равновесная концентрация распределяющегося веще-
ства во второй фазе; К—константа (или коэффициент) распределения.
В некоторых системах распределяющееся вещество вследствие дис-
социации его молекул обладает неодинаковым средним размером час-
тиц в разных растворителях' При этом соотношение (ХШ.20) непри-
менимо, а уравнение закона распределения принимает вид
с"/с2 = К,
(XIII. 21)
где п = М"1М' (ЛГ — средняя молекулярная масса распределяющего-
ся вещества в первой фазе; М" — средняя молекулярная масса рас-
пределяющегося вещества во второй фазе). При распределении третье-
го вещества между двумя несмешивающимися жидкостями возможен
случай, когда степень диссоциации распределяющегося вещества в раз-
ных растворителях отличается. Обозначим степень диссоциации распре-
деляющегося вещества в первом растворителе а1; а во втором — а2.
Тогда закон распределения примет вид
С1(1— (1— а2)1=Х-
(ХШ.22)
195
7*
В уравнении (XIII. 20) закона распределения для концентрирован-
ных растворов концентрации следует заменить активностями
в1/а2 = К, (ХШ.23)
где di и а2 — активности распределяющегося вещества в первой и во
второй фазах. Если известна зависимость активности от концентрации
распределяющегося вещества в одном из растворителей и коэффици-
ент распределения, то можно установить ту же зависимость для сопря-
женного раствора.
Закон распределения широко используется при экстрагировании
вещества из раствора. Обозначим: т0 — начальная масса экстрагиру-
емого вещества; Vj — объем раствора, в котором находится экстра-
гируемое вещество; У2 — объем растворителя, употребляемый для
одного экстрагирования; п — общее число экстрагирований; mlt т2,
..., тп — масса вещества, остающаяся в первоначальном растворе пос-
ле 1,2, ..., n-го экстрагирований; К — коэффициент распределения
экстрагируемого вещества условились обозначать отношением концен-
трации раствора, из которого экстрагируется распределяющееся веще-
ство, к концентрации раствора, которым производится экстрагирова-
ние. Пусть после первого экстрагирования в исходном растворе оста-
лось тг кг растворенного вещества в объеме У1( а экстрагируется
тэ = т0 — кг, причем эта масса заключается в объеме Уг. По за-
кону распределения (XIII.20)
——-к.
(ХШ.24)
(m0— mi)/V.
откуда
После второго экстрагирования
----------— = /С, т.} — т,----.
^-т^!Уг lKVx+ ¥г
(ХШ.25)
(ХШ.26)
При совместном решении уравнений (ХШ.25) и (XIII.26) получим
I AVi V
(ХШ.27)
После п экстрагирований в исходном растворе останется т кг раство-
ренного вещества:
/ ЛУХ
Uvi+U
т = т9
(ХШ.28)
ЗАДАЧИ С РЕШЕНИЯМИ
1. Давление водяного пара раствора, содержащего нелетучее раст-
воренное вещество, на 2 % ниже давления пара чистой воды. Опреде-
лите моляльность раствора.
196
Решение. Используем уравнение
(P$-Pi)/P«=xt.
Приняв за 100 давление пара чистого растворителя Р? и подставив
98 вместо Р1( получим
(100— 98)/100 = 0,02 или ха=0,02.
Для определения моляльности т рассчитаем число молей растворен-
ного вещества на 1000 г воды по уравнению
x, = nt/(n,4-nl),
где rii — число молей воды; пг ~ 1000/18 — 55,55; па — т. После под-
становки значений в уравнение получаем
0,02 = /71/(55,55 -f- /«),
откуда т — 1,134.
2. Как изменится соотношение давлений пара над раствором и раст-
ворителем, если растворенное вещество диссоциировано на 80% и рас-
падается на два иона и если это вещество не диссоциировано. Давление
водяного пара раствора, содержащего нелетучее растворенное веще-
ство, на 2 % ниже давления пара чистой воды.
Решение. Вычисляем относительное понижение давления над
раствором, в котором вещество диссоциирует, и сравниваем с относи-
тельным понижением давления при отсутствии диссоциации. Соглас-
но уравнению (XIII.2)
А Р ini
Pl «1+1пл
п2 = т = 1,134 моль на 1000 г; = 55,55.
Величину i вычисляем по уравнению (ХШ.З):
1 = 1+0,8 (2—1) = 1,8.
После подстановки чисел получаем
/ ДР \ 1,8-1,134 „ ЛЧ(Г
। —1 ..... — = 0,035.
\ Р? /дисс 55,55+1,8-1,134
Находим соотношение относительных понижений давления при на-
личии и при отсутствии диссоциации растворенного вещества:
/ДР \ / ДР' \ в 0,035 _ 1 75
\ Р? /дисс \ Р® / 0,02
3. Вычислите эбуллиоскопическую постоянную К» для воды. Теп-
лота испарения ЛНИСП = 40,685 кДж/моль.
Решение. Эбуллиоскопическую константу вычисляем по урав-
нению (XIII.6):
RTI г КМ
1000Д //исп
8,314 (373,16)2-18
1000-40,685
= 5,12 град/моль.
197
4. Определите температуру кипения водного раствора, содержаще-
го 0,01 моль нелетучего вещества в 200 г воды. К9 = 0,512 град/моль.
Решение. Вычисляем моляльность раствора
т = 0,01-5 = 0,05 моль иа 1000 г воды.
По уравнению (XIII.4) вычисляем температуру кипения раствора:
ДТ = 0,512-0,05=0,0256;
Т=Т» + Д Т = 373,16 + 0,0256 = 373,186 К-
5. Вычислите молекулярную массу вещества, если температура за-
мерзания раствора, содержащего 100 г бензола и 0,2 г исследуемого
вещества, на 0,17 К ниже температуры замерзания бензола. Криоско-
пическая константа Ккр — 5,16 град/моль.
Решение. Молекулярную массу М вычисляем по уравнению
(XIII.11):
М — 1000-5,16-0,2/(100-0,17) =60,23.
6. Понижение температуры замерзания водного раствора иссле-
дуемого вещества составляет 1,395 К, а бензольного— 1,280 К. Чем
объясняется различие в АТ, если моляльности растворов одинаковы?
Какие величины, характеризующие состояние вещества в растворе,
можно получить из этих данных? Для бензола Ккр = 5,16, град/моль;
для воды Ккр = 1,86 град/моль.
Решение. Различия в температурах замерзания можно объяс-
нить тем, что вещество в водном растворе дисссоциирует, а в бензоль-
ном не диссоциирует. Используя уравнения (XIII.8) и (XIII.9), можно
вычислить коэффициент Вант-Гоффа i. Зная числовое значение I, можно
сделать, согласно уравнению (XII 1.3), предположение о числе частиц v,
на которые распадается молекула растворенного вещества, и о степени
диссоциации а. Согласно сделанным предположениям:
Д TCiH< = l,28=5,16m; Д Тн>0 = 1,395 = 11,86m;
ДТНГ) 1,395 il,86 5,16-1,395
----^=------------------; ,=----------=3,02.
Агс.н. Ь28 5,16 1,28-1,86
Если молекула, распадаясь, дает две частицы (v = 2), то даже
при а = 1 i = 2. Полученное значение i > 2 показывает, что v > 2.
Вычисляем степень диссоциации а по уравнению (XII 1.3), предполо-
жив, что v = 3; тогда 2,52 = 1 + а (3 — 1), откуда а = 0,76.
Если v = 4, а = 0,50 и т. д.
7. Раствор, содержащий 0,8718 моль/л тростникового сахара, при
291 К изоосмотичен с раствором хлорида натрия, содержащего 0,5
моль/л NaCl. Определите кажущуюся степень диссоциации и коэффи-
циент Вант-Гоффа для хлорида натрия.
Решение. Для раствора сахара осмотическое давление опреде-
ляем по уравнению л — с±КТ, где — концентрация сахара в раст-
воре. Для раствора хлорида натрия осмотическое давление рассчиты-
ваем по уравнению л = ic^RT, гдес2—концентрация NaCl в растворе.
198
Так как осмотические давления этих растворов равны, то c^RT =
= ic^RT. Откуда
4=с1/с2> или (=0,8718/0,5= 1,743.
По уравнению г = I -|- a (v — 1) определяем кажущуюся степень
диссоциации. Так как молекула хлорида натрия в растворе разлага-
ется на два иона, то v = 2 и
а= (1,743—1)/(2— 1) =0,743.
8. Вычислите константу Генри Кг для азота при 298 К и
760 мм рт. ст,- Коэффициент Бунзена а = 0,0143 (а — число объемов
азота, приведенных к нормальным условиям, поглощенных одним
объемом воды). Плотность воды 0,997 г/см3.
Решение. Вычисляем число молей азота, поглощенного 1 см8
воды, по уравнению (XI 1.3):
1.0,0143-IO-8
nN ——„ ---= 6,38-10-7 моль;
N« 0,082-273
1-0,097
nHj0 ~---—----=0,0554 моль.
Молярную долю азота %Nt вычисляем по уравнению (XII.3):
nN 6,38-ю-’
Значение Кг получаем, подставив значения давления и концентрации
в уравнение
PN. 760
К' =—- = 7г;=б,б1-10’.
г xN 1,15-io-5
9. При 295 К и 51 987 Па растворимость На в анилине составляет
10,6 кг/м8, а при 154 628 Па и той же температуре — 31,6 кг/м8. Соб-
людается ли при этих условиях закон Генри?
Решение. Если закон Генри соблюдается, то отношение давле-
ния к равновесной концентрации газа в жидкости — величина по-
стоянная, пропорциональная константе Генри Кг- Вычисляем значе-
ния отношений давления к концентрации:
51987/10,6 = 4904,4; 154628/31,6 = 4893,3.
Сравнение полученных величин позволяет ответить на поставленный
вопрос положительно.
10. Вычислите теплоту растворения азота в воде (Pn, = 760 мм
рт. ст.), использовав данные о зависимости константы Генри от темпе-
ратуры:
Г, К.......................‘ 273 283 293 303
Кг-10-’, мм рт. ст . . . . • 4,02 5,08 6,12 7,02
199
Решение. Решим уравнение (ХШ.17) относительно молярной
доли и, подставив найденную величину в уравнение (ХШ. 19), полу-
чим
! = А Я? Т’з-Т,
S (*г)л 8 («г)т, 2,3/?
ИЛИ
, (^г)г, ДЯГ Tt~Ti
--------=------------------
(К'г)Гг 2,37? T2Ti
Подставляем в уравнение значения Кг для двух температур
к 4'02 АЯТ 30
7,02 2,3-8,314 273 303
и получаем А//"* — 12,728 кДж/моль.
11. Водный 0,02 М раствор пикриновой кислоты находится в рав-
новесии с 0,07 М раствором пикриновой кислоты в бензоле. Вычислите
коэффициент распределения пикриновой кислоты между бензолом и
водой, если в бензельном растворе пикриновая кислота имеет нор-
мальную молекулярную массу, а в воде частично диссоциирована,
причем степень диссоциации равна 0,9.
Решение. Для определения коэффициента распределения пик-
риновой кислоты между бензолом и водой следует концентрацию кисло-
ты в бензоле разделить на концентрацию недиссоциированной части ее
в воде:
К = 0,77)0,02 (1—0,9)1=35.
12. При распределении салициловой кислоты между бензолом и
водой при 298 К были получены следующие данные:
Cl ... . . . . 0,0363 0,0668 0,0940 0,126 0,210
c2 . . . . . . . 0,0184 0,0504 0,0977 0,146 0,329
Cl . . . . . . . 0,283 0,558 0,756 0,912
C2 ... . . . . 0,553 0,650 2,810 4,340
где q — концентрация салициловой кислоты в водном слое, моль/л
с2 — концентрация салициловой кислоты в бензольном слое, моль/л.
Графически определите значения п и К и напишите уравнение распре-
деления.
Решение. Вычислим по уравнению (ХШ.20) значения К:К=
~ 1,97; 1,33; 0,96; 0,86; 0,64; 0,53; 0,34; 0,27; 0,21. Так как соотно-
шение Ci/Cg не остается постоянным, то наблюдается изменение молеку-
лярной массы распределяющегося вещества. Применяем закон распре-
деления в общем виде. Прологарифмировав выражение (ХШ. 21);
получим
nlgCj—lgCs = lgK ИЛИ 1g lg£i — IgK.
200
Последнее уравнение — уравнение прямой, тангенс угла наклона ко-
торой равен п, а отрезок, отсекаемый от оси ординат, есть 1g К- При-
веденные в условии данные прологарифмируем:
lg Ct ... . .• —1,4401
1g сг . ..... —1,7352
1g О ...... -0,5482
lg с, ...... -2,2738
-1,1752
—1.2976
—0,2534
+0,2175
—1,0269
—1,0101
-0,1215
+0,4487
—0,8996
-0,8356
—0,0400
4-0,6375
—0,6778
—0,4828
На основании этих данных строим график 1g с2 = / (1g (рис. 20).
По графику определяем тангенс угла наклона прямой к оси абсцисс:
tea— 0’66 — 1,66, п=1,66;
s 1,00
igX=T,34, /(=0,219.
Закон распределения для данной
системы выражается уравнением
13. Коэффициент распределения
иода между водой и сероуглеродом
равен 0,0017. Водный раствор иода,
содержащий 10“4 кг иода в 10-4 м3,
взбалтывают с сероуглеродом. Какое
количество нода останется в водном
растворе, если Кг4 м3 водного раст-
вора взболтать с 5 10~*м3 сероугле-
рода и 10~4 м® водного раствора взбол-
тать последовательно с пятью отдель-
ными порциями сероуглрода по
IQ-е мз каЖдая?
Решение. Массу, оставшуюся
определим по уравнению (ХШ.25):
Рис. 20. Зависимость логарифма
концентрации с5 бензольного рас-
твора салициловой кислоты от ло-
гарифма концентрации с, салици-
ловой кислоты в воде
после одного экстрагирования,
0,0017-10-*
0,0017-10~* + 5-10-‘
кг.
Масса экстрагированного иода равна
10-*—3,3.10-10 = 0,967-10-4 кг, или 96,7%.
Определяем массу иода, оставшуюся после пяти экстрагирований, по
уравнению (ХШ. 28)
Г2=10~«м\ m5=10-*
( KVi у
KV1+F2 ) ’
0,0017-IQ--^_
0,0017-10-*+10-®
S
I =6,5-10~’ кг.
т1^- 10-*
201
Масса экстрагированного иода после пяти экстракций равна
IO*4—6,5-10-10 = 0,999935-10-4 кг, или 100 %.
ЗАДАЧИ
1. Определите относительное понижение давления пара для раство-
ра, содержащего 0,01 моль нелетучего растворенного вещества в 0,5 кг
воды.
2. Давление пара воды при 313 К равно 7375,4 Па. Вычислите при
данной температуре давление пара раствора, содержащего 0,9206-10-2
кг глицерина в 0,360 кг воды.
3. Вычислите давление пара эфира над 3 %-ным раствором анили-
на в этиловом эфире (С2Н5)2О при 293 К. Давление пара эфира при
этой температуре равно 5,89-104 Па.
4. Давление пара серного эфира при 293 К равно 0,589-10® Па, а
давление пара раствора, содержащего 0,0061 кг бензойной кислоты в
0,05 кг эфира при той же температуре, равно 0,548-10® Па. Рассчитай-
те молекулярную массу бензойной кислоты в эфире и относительную
ошибку опыта в процентах по сравнению с величиной, приведенной
в справочных таблицах.
5. Водный 7,5%-ный раствор хлорида кальция кипит прй нормаль-
ном атмосферном давлении 1,0133-10® Па и 374 К. Вычислите коэффи-
циент i. Давление пара воды при 374 К равно 1,05-10® Па.
6. Определите процентную концентрацию водного раствора глице-
рина, если давление пара этого раствора равно давлению пара раст-
вора, содержащего 0,0089 г кг NaNO3 в 1 кг воды. Кажущаяся степень
диссоциации NaNO3 в указанном растворе воды 64,9 %.
7. Давление пара раствора, содержащего 2,21 • 10~3 кг СаС12
и 0,1 кг воды при 293 К, равно 2319,8 Па, а давление пара воды при
той же температуре 2338,5 Па. Вычислите кажущуюся молекулярную
массу и кажущуюся степень диссоциации СаС12.
8. В 0,1 кг эфира (М = 74) содержится 0,01 кг нелетучего вещест-
ва. Давление пара этого раствора равно 426 мм рт. ст. при 293 К, а дав-
ление пара чистого эфира при 293 К—442 мм рт. ст. Рассчитайте мо-
лекулярную массу растворенного вещества.
9. В 1 кг воды растворено 0,0684 кг сахара (Л4 = 342). Вычислите
давление пара этого раствора при 373 К. Рассчитайте температуру
кипения его, если теплота испарения воды при температуре кипения
равна 2256,7-Ю3 Дж/кг.
10. Температура кипения бензола 353,36 К- Его молярная теплота
испарения при температуре кипения 30 795 Дж/моль. Определите
эбулиоскопическую константу бензола.
11. Температура кипения чистогоС52 319,2 К- Раствор, содержащий
0,217-10_3 кг серы в 1,918-10-2 кг CS2, кипит при 319,304 К. Эбулио-
скопическая константа сероуглерода 2,37°. Определите число атомов,
которое содержится в молекуле серы, растворенной в сероуглероде, ес-
ли атомная масса серы 32.
202
12. В 0,0106 кг раствора содержится 0,40-10-3 кг салициловой кис-
лоты, растворенной в этиловом спирте. Этот раствор кипит при темпера-
туре на 0,337° выше чистого спирта. Молекулярное повышение тем-
пературы кипения этилового спирта 1,19°. Определите молекулярную
массу салициловой кислоты.
13. Чистая вода кипит при 373,2 К и атмосферном давлении. Опре-
делите температуру кипения раствора, содержащего 3,291 -10-8 кг
хлорида кальция в 0,1 кг воды. Кажущаяся степень диссоциации СаС12
в указанном растворе 68 %. Эбулиоскопическая константа для воды
0,516°.
14. Определите кажущуюся степень диссоциации НЮ3 в растворе,
содержащем 0,506-Ю-3 кг НЮ3 в 22,48-10—3 кг этилового спирта.
Раствор кипит при 351,624 К, чистый этиловый спирт кипит при
351,46 К. Молярное повышение температуры кипения спирта 1,19°.
15. Температура замерзания чистого бензола 278,500 К, а темпера-
тура замерзания раствора, содержащего 0,2242-10_3 кг камфоры
в 3,055-10-2 кг бензола, 278, 254 К. Молярное понижение температуры
кристаллизации бензола 5,16°. Определите молекулярную массу кам-
форы.
16. К очень слабым водным растворам для предотвращения замер-
зания в зимнее время обычно прибавляют глицерин. Допустив, что за-
кон Рауля применим к растворам такой концентрации, вычислите коли-
чество глицерина, которое должно быть прибавлено, чтобы раствор, со-
держащий 0,1 кг воды, не замерзал до 268,16 К-
17. Раствор, содержащий 1,632- 10“3кг трихлоруксусной кислоты в
0,1 кг бензола, кристаллизуется при температуре на 0,350° ниже, чем
чистый бензол. Определите, происходит ли диссоциация или ассоциация
трихлоруксусной кислоты в бензольном растворе и в какой степени.
Молярное понижение температуры кристаллизации бензола равно 5,16°.
18. Раствор, содержащий 0,001 моль хлорида цинка в 1 кг воды, за-
мерзает при 273,1545 К, а раствор, содержащий 0,0819 моль хлорида
цинка в 1 кг воды, — при 272, 7746 К. Вычислите коэффициент I. Кри-
оскопическая константа для воды 1,86°.
19. Температура плавления фенола 314 К. Раствор, содержащий
0,77-10~3 кг ацетанилида (С8Н9О) N в 1,254-10-2 кг фенола, кристал-
лизуется при 310,25 К. Вычислите криоскопическую константу для фе-
нола и теплоту плавления (Дж/кг) фенола, если молекулярная масса
ацетанилида, растворенного в бензоле, соответствует его формуле.
20. Определите концентрацию водного раствора глюкозы, если этот
раствор при 291 К изоосмотичен с раствором, содержащим 0,5 х
X 103 моль/м3 СаС12, причем кажущаяся степень диссоциации послед-
него при указанной температуре составляет 65,4 %.
21. В 1-10~3 м3 морской воды в основном содержатся соли (кг):
NaCl — 27,2-10~3; CaSO4 — 1,3- IO"3; MgCl2 — 3,4-10"3; СаС12 —
0,6-10_3; MgSO4 — 2,3-10-3. Вычислите осмотическое давление мор-
ской воды при 298 К и сравните его с величиной, рассчитанной по дан-
203
ным об осмотическом коэффициент, считая, что указанные соли пол-
ностью диссоциируют.
22. Давление пара раствора тростникового сахара в 1 кг воды сос-
тавляет 98,88 % от давления пара чистой воды при той же температуре.
Вычислите температуру кипения и осмотическое давление этого раство-
ра при 373 К; плотность раствора 1 • 10s кг/м8.
23. Вычислите температуру замерзания раствора, содержащего
7,308-10-8 кг хлорида натрия в 0,250 кг воды, если при 291 К осмоти-
ческое давление этого раствора 2,1077-10® Па, плотность 1-Ю3 кг/м3,
/пл = 333,48-10» Дж/кг.
24. Температура замерзания разбавленного, водного раствора тро-
стникового сахара 272,171 К- Давление пара чистой воды при этой же
температуре 568,6 Па, а теплота плавления льда 6029 Дж/моль. Вычис-
лите давление пара раствора.
25. Вычислите температуру замерзания водного раствора, если
давление его пара составляет 90% от давления пара чистой воды при
той же температуре. Теплота плавления льда 6029 Дж/моль.
26. Рассчитайте концентрацию водного раствора вещества в молях
на 1 кг воды и температуру кипения, если прн 373,58 К давление его
пара 1,0109-10» Па. Молярная теплота испарения воды 40 193 Дж/моль.
Рн,о = 1,0264-108 Па при 373,58 К.
27. При давлении 1,01-10» Па температура кипения эфира 308 К-
Раствор, содержащий 0,01094 кг анилина в 0,1 кг эфира, имеет давление
пара 0,444-10* Па при 288,46 К. Теплота испарения эфира 375,70 X
X 10® Дж/кг. Вычислите молекулярную массу анилина в растворе.
28. Определите процентный состав и молекулярную массу углево-
дорода на основании следующих данных: из 0,2-10-8 кг вещества об-
разуется 0,687-10-8 кг СО, и 0,1125-10~8 кг Н,О; температура замер-
зания раствора, содержащего 0,0925-10"» кг вещества в 0,01 кг бензо-
ла, ниже температуры замерзания бензола на 0,354°. Криоскопиче-
ская постоянная К для бензола 5,16°.
29. Водный раствор замерзает при 271,5 К. Определите его темпера-
туру кипения и давление при 299 К. Криоскопическая константа воды
1,86°; эбулиоскопическая константа воды 0,516°; давление пара воды
при 298 К равно 3168 Па.
30. Давление пара воды при 293 К равно 2338,5 Па, давление пара
раствора 2295,8 Па. Определите осмотическое давление при 313 К,
если плотность раствора при этой температуре 1010 кг/м3. Молекуляр-
ная масса растворенного вещества равна 60.
31. Температура замерзания раствора, содержащего 2,6152 X
X 10~3 кг эфира этиленгликоля в 0,1 воды, ниже температуры замер-
зания воды на 0,5535°. Определите молекулярную массу эфира, если
теплота плавления воды 6029 Дж/моль.
32. Через 2,5-10-8 м8 воды продувают сухой воздух при 283 К и
1,01 • 10® Па. Определите концентрации азота и кислорода в воде по до-
стижении равновесия, считая раствор идеальным. Коэффициенты Ген-
204
ри при 283 к равны для азора 677,14-10’ Па, для кислорода 331,44X
X 10’ Па.
33. Растворимость газообразного бромоводорода в бензоле при
303 К характеризуется следующими данными:
Молярная доля . .0,000612 0,005459 0,01149 0,2335 0,02913 0,04713
Р, Па......... 1016,29 8460,64 25771,00 39053,77 46832,41 75537,79
Представьте графически зависимость растворимости НВг от давления
и рассчитайте среднее значение константы в уравнении Генри.
34. Сколько сероводорода растворится в 0,004 м® воды при 283 К
под давлением 50,66-10* Па? Растворимость сероводорода в воде при
283 К равна 5,16 кг/м® при нормальном давлении.,
35. Воздух имеет объемный состав (%): О2 — 20,96; Na — 78,1;
Аг — 0,9 и СО2 — 0,04. Растворимость этих газов в воде при нормаль-
ном давлении (м®/м3): О2 — 0,0429; N2 — 0,0209; Аг — 0,057; СО2—
1,424 (газ приведен к условиям 10,132-10* Па, 278 К). Рассчитайте
процентное соотношение компонентов воздуха, растворенного в воде
при 278 К и давлении 10,132-10* Па.
36. В сосуде вместимостью 0,01 м3 при 292 К и 10® Па находится
кислород. Какой объем бензола следует добавить в сосуд, чтобы давле-
ние кислорода повысилось на 10,132-10* Па? Растворимость кислоро-
да в бензоле при 292 К и нормальном давлении 0,233 кг/м®.
37. Коэффициент Генри для кислорода в воде 273,2 и 282,2 К ра-
вен 0,04889 и 0,03802 атм"1 соответственно. Вычислите энтальпию раст-
воренного кислорода в воде.
38. Сколько граммов СО2 растворится в 1 л воды при 293 К, если
над водой находится воздух с содержанием 0,03 % СО2, а объем газа
(приведенный к 273 К и 1,01-10® Па), растворенного при данной тем-
пературе в 1 л воды и Р = 1,01-10® Па, равен V — 0,878.
39. Константы Генри для кислорода и азота при растворении их в
воде при 273,2 К равны соответственно 1,91 • 10’ и 4,09-10’ Па. Рассчи-
тайте понижение температуры замерзания воды, вызванное растворе-
нием воздуха (80 % N2 и 20 % О2) при 1,0133-10® Па.
40. При 288 К водный раствор янтарной кислоты, содержащий
12,1 г/л кислоты, находится в равновесии с эфирным раствором, содер-
жащим 2,2 г/л кислоты. Какова концентрация эфирного раствора ян-
тарной кислоты, который находится в равновесии с водным раствором,
содержащим 4,84 г/л кислоты? Янтарная кислота имеет нормальную
молекулярную массу и в воде, и в эфире.
41. При распределении уксусной кислоты между тетрахлоридом
углерода и водой были получены следующие концентрации (кг/м8):
В СС1< ..... 2,92 3,63 7,25 10,7 14,1
В Н2О........ 48,7 54,2 76,4 93,0 107,0
Уксусная кислота в водном растворе имеет нормальную молекулярную
массу. Определите молекулярную массу уксусной кислоты в растворе
СС14 и коэффициент распределения.
205
42. При распределении фенола между водой и бензолом получены
следующие данные (моль/л):
В Н2О.......... 0,0316 0,123 0,327 0,750
В С6Н6 ........ 0,077 0,159 0,253 0,390
Вычислите коэффициент распределения К и показатель степени п в
формуле, описывающей закон распределения.
43. Фенол имеет нормальную молекулярную массу и в воде, и в
амиловом спирте. При 298 К раствор, содержащий 10,53 г г/л фенола
в амиловом спирте, находится в равновесии с водным раствором, со-
держащим 0,658 г/л фенола. Определите массу фенола, полученную из
0,5 л водного раствора концентрации 37,6 г/л двукратным экстрагиро-
ванием амиловым спиртом. Для каждого экстрагирования берется по
0,1 л амилового сирта.
44. Коэффициент распределения иода между водой и тетрахлори-
дом углерода при 298 К равен 0,0117. В обоих растворителях иод име-
ет одинаковую молекулярную массу. Какой объем тетрахлорида угле-
рода следует взять, чтобы однократным экстрагированием извлечь из
0,5 л водного раствора 99,9; 99,0; 90,0 % содержащегося в нем иода?
45. Сколько иода остается в 1 л водного раствора, который был на-
сыщен при 291 К, после взбалтывания его с 0,1 л сероуглерода? Раство-
римость иода в воде при 291 К составляет 1 г на 3,616 л. Коэффициент
распределения иода между водой и сероуглеродом 0,001695. Молеку-
лярная масса иода в обоих растворителях одинакова.
46. Каково должно быть атмосферное давление, если раствор, со-
держащий 5,35 г NH4C1 на 2 л воды, кипит при 373,2 К?
47. Сколько граммов нафталина надо растворить в 120 г бензола,
чтобы давление пара бензола при 323,2 К было 0,352- 10s Па.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. При температуре Т давление пара раствора концентрации с не-
известного нелетучего вещества в жидком растворителе равно Р Па;
плотность этого рствора d. Зависимость давления насыщенного пара
от температуры над жидким и твердым чистым растворителем приведе-
на в таблице (с. 167—170): 1) вычислите молекулярную массу растворен-
ного вещества; 2) определите молярную и моляльную концентрации
раствора; 3) вычислите осмотическое давление раствора; 4) постройте
кривую Р = f (Г) для данного раствора и растворителя; 5) определите
графически температуру, при которой давление пара над чистым раство-
рителем будет равно Р Па; 6) определите графически повышение тем-
пературы кипения при давлении Р раствора данной концентрации с;
7) вычислите эбуллиоскопическую постоянную всеми возможными
способами и сравните эти величины между собой при нормальной тем-
пературе кипения (Т’н.т.л); 8) определите понижение температуры за-
мерзания раствора; 9) вычислите криоскопическую постоянную.
206
№ варианта Массовое со- держание не- летучего ве- щества, % Молекуляр- ная масса растворителя Р, Па Т, К d-10-s, кг/м*
1 0,5 18 1598 288,2 1,000
2 8 27 38 714 278 0,750
3 5 28 31 740 69 0,850
4 8,5 30 33 841 114 1,300
5 5 32 16 106 306,7 1,590
6 9 34 55 000 207 1,985
7 8 44 650 000 223 1,500
8 7 46 2375 283,2 1,210
9 5 52 91 912 252,5 2,900
10 4,5 52,5 776 1991 6,800
11 5 58 35896 303 3,560
12 6 64 7328 216 1,590
13 3 68 12 420 149 1,780
14 3- 78 5807 283,2 0,750
15 6 81 49 431 194 1,210
16 5 83,5 84 990 119,6 2,160
2. На основании данных о растворимости газов в воде при различ-
ных температурах и при общем давлении (газа и паров воды) 1,01-105
Па (см. таблицу на с. 208) рассчитайте среднюю теплоту растворения
газа в воде и сравните последнюю с теплотой конденсации растворен-
ного газа. Установите графически зависимость растворимости газа в
воде от температуры и давления. Вычислите интервал давления, в ко-
тором растворимость подчиняется закону Генри.
ГЛАВА XIV
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В БИНАРНЫХ СИСТЕМАХ,
СОДЕРЖАЩИХ ЖИДКУЮ И ПАРОВУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 363—394; Г., т. 1, с 185—204]
Для идеальных растворов концентрация i-ro компонента в паре и в
жидкой фазе связана уравнениями
4=-^-4; 4 = (xiv.i)
где Хд и хв — молярные доли компонентов А и В в паре; Хд и х* —
молярные доли компонентов А и В в жидкой фазе; РД и Р& — давле-
ния насыщенного пара над чистыми компонентами А и В; Р — общее
давление над раствором.
207
Растворимость газа в воде (г/100 г) при температуре.
Теплота испарения смеси описывается уравнением
Л//Исп = ДЙ“и£П.а4+ЛНисп,вх* (XIV.2)
где А//исп — теплота испарения 1 моль раствора; А//исп,а — теп-
лота испарения 1 моль вещества А; А//исп>в — теплота испарения
1 моль вещества В.
Для реальных растворов концентрация i-ro компонента в паре,
связана с активностью этого компонента в жидкой фазе:
ХП= П а. хп= П а (X1V3)
хА —-—аА, хв ——ав> (Alv.o)
где ад и «в — активности компонентов в растворе.
Соотношение массы пара и массы жидкости при заданных услови-
ях, если система гетерогенная, определяется по правилу рычага. Если
на диаграмме кипения на оси абсцисс отложить массовую долю, то
та/т~ ю) (w*—- wa), (XIV.4)
где тп — масса пара; т — масса системы; w — массовый состав си-
стемы, %; wn — массовая доля пара, %; ш* — массовая доля жидкости,
%. Если же на оси абсцисс отложить молярную долю в процентах, то
пп/п=(хж — х) (хж~-хп}. (XIV.5)
Давление насыщенного пара в области существования гетерогенной си-
стемы, компоненты которой ограниченно растворимы друг в друге, бу-
дет равно
Р = РА + Рв, (XIV.6)
где РА и Рв — парциальные давления; Р — общее давление пара.
В гетерогенной области Рд = const, рв const. Давление насыщен-
ного пара над гетерогенной системой, компоненты которой взаимно
нерастворимы, будет равно
Р = Р\ + РЪ, (XIV.7)
где Ра и Р& — давления насыщенного пара над чистыми компонентами
А и В. Составы пара и конденсата одинаковы;
па/пв — ха/хв~Ра/Рв, (XIV. 8)
где пд и «в — число молей компонентов А и В. Из уравнения (XIV.8)
видно, что соотношение чисел молей компонентов А и В в паре и в кон-
денсате независимо от их соотношения в исходной смеси. Массовые со-
отношения компонентов в конденсате
тА/'«в==МАР£/(Л*ь^). (XIV.9)
Если при перегонке с водяным паром одним из компонентов яляется
вода, то
тн,о=тв Р‘в), (XIV.10)
208
209
где тнго — расход водяного пара на перегонку кг вещества В.
Если в уравнении (XIV. 10) тъ ~ 1 кг, то
"4o=18Pfi,o/(MB^), (XIV. 11)
где /Пн,о — расходный коэффициент водяного пара на перегонку 1 кг
вещества В.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При 313 К давления паров дихлорэтана и бензола равны 2,066 х
X 10*и 2,433-10* Па соответственно. Какие можно сделать выводы на ос-
новании следующих экспериментальных парциальных давлений ди-
хлорэтана и бензола при нескольких значениях концентраций:
хс>н<............ 0,130 0,257
РС,Н Cl/10'*' Па 1>791 1.507
PcV-*’0-4- Па • 0,293 °.648
0,560 0,695 0,972 0,875
0,933 0,664 0,429 0,247
1,347 1,663 1,933 2,140
Определите состав смеси, которая будет кипеть при давлении 2,267 х
X 104 Па, и давление, при котором закипит смесь с молярной долей бен-
зола 40 %.
Решение. Построим диаграмму зависимости давления от со-
става системы при температуре 313 К (рис. 21). На оси абсцисс отло-
жим молярную долю дихлорэтана в %. На осях ординат отложим дав-
ления паров чистого дихлорэтана Р£,н, ci, и чистого бензола Р$,н,-
Затем соединим прямой точки Рс.н, и Р&що, и проведем прямые линии,
соединяющие начала координат с точками Рсгн4с12 и Рс«н,. Эти ли-
нии показывают зависимость
общего давления и парциаль-
ных давлений насыщенного
пара над бинарной системой
от состава при условии под-
чинения раствора закону Рау-
ля. Нанесем на этот график
точки, соответствующие экс-
периментальным значениям
парциальных давлений ком-
понентов, и суммы парциаль-
ных давлений. Из графика
видно, что в пределах оши-
бок опыта раствор можно
считать подчиняющимся за-
кону Рауля, или совершен-
ным раствором. По графику
находим, что при давлении
Р — 2,267-10* Па кипеть бу-
дет раствор с молярной долей
Рис. 21. Зависимость парциальных и обще-
го давления пара от состава системы
С6Н6—CgH^Cla при 313 К
210
дихлорэтана 62 %, а раствор с молярной долей бензола 40 % закипит
при давлении 2,200-10* Па.
2. При 323 К получены следующие парциальные давления над
системой дихлорэтан — этиловый спирт:
*С,Н,ОН Х10-*, Па /’С,Н4С1,Х Х10-*. Па *с,н,он рс,н,онх Х10~«. Па /’с,н4С1,х Х10~*. Па
0,1 1,139 2,860 0,6 2,155 2,464
0,2 1,773 2,740 0,7 2,260 2,249
0,3 1,953 2,686 0,8 2,417 1,843
0,4 2,025 2,652 0,9 2,672 1,147
0,5 2,085 2,585
Давление насыщенного пара над чистым этиловым спиртом при этой
температуре 2,960-10* Па, а над чистым дихлорэтаном 3,113-10* Па.
Вычислите общее давление над системой при всех заданных концент-
рациях. Постройте диаграмму зависимости парциальных и общего дав-
ления насыщенного пара от состава системы. Сделайте вывод относи-
тельно характера растворов, коэффициентов активности компонентов
раствора, изменения объема при смещении и тепловом эффекте смеше-
ния.
Решение. На основании парциальных давлений вычисляем об-
щее давление над системой:
xCjHj0H............. 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
Р-10-*, Па.......... 3,999 4,513 4,639 4,677 4,670 4,619 4,509 4,260 3,819
Зная парциальное и общее давление насыщенного пара при всех
заданных концентрациях, строим график Р == f (хс,н,он) (рис. 22).
Как видно из рис. 22, зависимости парциальных давлений С2Н5ОН и
С2Н4 С12 и общего давления нелинейные. Значения опытных давле-
ний для всех составов больше давления, рассчитанного по закону Ра-
уля. Отсюда можно сделать заключение, что раствор состава С2Н5ОН—
— С2Н4СЦ несовершенный, имеет положительное отклонение от зако-
на Рауля. Коэффициенты активности компонентов раствора при всех
концентрациях больше единицы. Следовательно, при образовании та-
кого раствора объем раствора больше суммы объемов его компонентов;
тепловой эффект АЯСм положительный, теплота поглощается системой
при образовании раствора.
3. При изучении равновесия системы хлороформ — диэтиловый
эфир при 298 К были получены следующие парциальные давления насы-
щенного пара:
ХС,НВОС,Н, 0 0,2 0,4 0,6 0,8 1,0
РС,Н,ОС,Н,,1°-4- Па . 0,000 0,460 1,287 2,666 4,093 5,333
Лзнс1>‘*0~4, Па . . . 1,933 1,480 0,920 0,460 0,165 0,000
211
Постройте графики зависимости парциальных и общего давления
насыщенного пара от состава раствора. Сделайте заключение относи-
тельно характера отклонения от закона Рауля, о коэффициентах ак-
тивности компонентов раствора при всех концентрациях, изменении
объема при образовании раствора и о тепловом эффекте смешения.
Решение. На основании приведенных парциальных давлений
вычислим общее давление и
Молярная Золя, %
Рис. 22. Зависимость парциаль-
ных и общего давления пара
от состава системы C2H4CI2—
С2Н5ОН при 313 К
построим графики РСн сь = f (х),
Лз.н.оод, = f (х), Р = f (х), гдех —
молярная доля эфира (рис. 23). По ха-
рактеру кривых видно, что растворы
при всех концентрациях не подчи-
няются закону Рауля. Наблюдается
отрицательное отклонение от закона
Рауля. Отрицательное отклонение от
Рис. 23. Зависимость парциальных и об-
щего давления пара от состава системы
СНС1з—(С2Н5)2О при 298 К
линейной зависимости уменьшается и стремится к нулю при прибли-
жении концентрации компонента раствора к единице. Коэффициенты
активности компонента раствора при всех концентрациях меньше еди-
ницы. Следовательно, при образовании растворов объемы их меньше
суммы объемов компонентов; при образовании рстворов выделяется
теплота (Д//См < 0).
4. Постройте график зависимости состава пара от состава жидкой
фазы для системы дихлорэтан — бензол при 313 К, если известны сле-
дующие экспериментальные данные:
212
*С,Н, . . 0,130 0,257 0,560 0,695 0,792 0,875
^н4С!/!04- Па . . 1,791 1,507 0,933 0,664 0,429 0,247
РС(Н1-1°4. Па . . . . . 0,292 0,648 1,347 1,663 1,933 2,140
При 313 К давления паров дихлорэтана и бензола равны 2,066 >
X 104 и 2,433-104 Па соответственно.
Решение. По уравнению (XIV. 1) вычислим состав пара, зада-
ваясь определенным составом жидкой фазы. Общее давление над систе-
мой рассчитаем по уравнению Дальтона как сумму парциальных дав-
лений: 1
*С,Н, • . . . 0,130 0,257 0.560 0,695 0,792 0,875
хс,н, . . . 0,152 0,290 0,598 0,727 0,816 0,893
Р-10-‘, Па . . . . . . 2,083 2,155 2,280 2,327 2,362 2,387
На основании полученных данных строим график зависимости состава
пара от состава жидкой фазы х“.н, = f (хс,н.) (рис. 24). Из графика
видно, что в парах концентрация бензола больше, чем в жидкой фазе.
На различии составов жидкой фазы и пара основано разделение двух
компонентных растворов.
Молярная Золя С.Н. {
жидкой фазе,’/„
Рис. 24. Зависимость состава
пара от состава жидкой фазы
для системы C6He—C2H4CI2
при 313 К
Рис. 25. Диаграмма кипения системы
(С2Н5)2О-СС14 при 1,0133-106 Па
5. Проанализируйте фазовое состояние системы СС14 — С2Н8ОС2Н8
на основании диаграммы кипения (рис. 25). Проведите анализ процес-
са нагревания системы с молярной долей СС14 50 %.
Решение. Выше кривой* abc состава насыщенного пара все сис-
темы находятся в состоянии пара. Системы гомогенные, однофаз-
213
ные. Ниже кривой adc состава кипящей жидкости все системы находят-
ся в жидком состоянии. Системы гомогенные, однофазные. Между
кривыми abc и adc система гетерогенная, две фазы, жидкость и пар.
Для определения состава равновесных фаз через точку заданного со-
стояния необходимо провести изотерму, так как фазы, находящиеся в
равновесии, должны иметь одинаковую температуру. Пересечение изо-
термы с кривой adc состава кипящей жидкости дает состав жидкой фа-
зы, который определяется по оси абсцисс. Пересечение изотермы с кри-
вой abc насыщенного пара дает состав пара. Так, система с молярным
содержанием СС14 40% при 338 К — гетерогенная (точка ё). Она со-
держит две фазы, находящиеся в равновесии. Одна фаза — кипящая
жидкость с молярным содержанием СС14 50%, другая — насыщенный
пар с молярным содержанием СС14 24 %. Если жидкую систему с мо-
лярным содержанием СС14 50 % (точка f) нагреть до 338 К, то начнет-
ся кипение системы. Молярный состав пара, находящегося в равнове-
сии с кипящей жидкостью, будет 24 % СС14. Состав пара беднее тетра-
хлоридом углерода, чем жидкость. Из жидкой фазы в пар преимущест-
венно уходит диэтиловый эфир. Отсюда жидкая фаза обедняется
С2Н5ОС2Н5 и ее состав меняется, как это показано стрелками на
рис. 25. Вместе с изменением состава кипящей жидкости меняется и со-
став пара, находящегося в равновесии с ней. Изменение состава пара
показано стрелками на кривой abc. При 342 К в равновесии будут на-
ходиться пар и жидкость. Молярные составы жидкой фазы СС14 65 % и
пара СС14 35 %. Изменение состава жидкости и пара и температуры
фазового равновесия будет происходить до тех пор, пока состав пара
не станет равным составу исходной жидкости /. При 345,4 К моляр-
ный состав пара будет 50% СС14, вся жидкая фаза превратится в пар.
Система станет гомогенной’ Молярный состав последней капли жидко-
сти 84 % СС14. При дальнейшем нагревании состав пара меняться не
будет.
Процесс охлаждения системы с молярной долей СС14 50 % будет
обратным разобранному. Пусть исходная система имеет молярный сос-
тав 50 % СС14. При 350 К эта система (точка g) находится в состоянии
пара. При охлаждении ее до 345,4 К система станет гетерогенной, по-
явится первая капля жидкой фазы. Ее молярный состав 84 % СС14.
Так как из пара в жидкую фазу преимущественно уходит СС14, то пар
обедняется СС14 и его состав изменяется по кривой abc. Вместе с изме-
нением состава пара меняется и состав жидкой фазы, находящейся с
паром равновесии. Изменение состава кипящей жидкости происходит
по кривой adc. Изменение составов жидкой и паровой фаз приводит к
измёнению температуры конденсации. При 338 К состав жидкой фазы
станет равным составу исходного пара. При этой температуре система
станет гомогенной, исчезнет последняя порция пара. При дальнейшем
охлаждении состав жидкой фазы не изменяется.
6. Определите массу СС14 и С2Н5ОС2Н5 в жидкой фазе и в парах
(рис. 25), если 1 кг системы с молярным содержаниемСС14 50 % нагреть
до 342 К.
214
Решение. Рассчитаем количество веществ,находящихся в жид-
кой и паровой фазах, по правилу рычага. Так как на диаграмме
(рис. 25) молярный состав выражен в процентах, то необходимо вос-
пользоваться уравнением (XIV. 5). Сначала определим количество мо-
лей вещества, которое содержится в системе массой 1 кг. Для этого
вычислим среднюю молекулярную массу:
Мср = 154-0,54-74-0,5=114.
В 1 кг системы содержится
1000/114 = 8,772 СС14'и С2Н6ОСаН5.
Молярные составы сосуществующих фаз при 342 К (%): жидкая СС14 —
61; С2Н5ОС2Н5— 39; парообразная СС14 — 35, С2Н5ОС2Н5 — 65. По
уравнению (XIV.5) находим
пп = 8,772 (0,61 —0,50)/(0,61 —0,35) =3,711 моль,
пж = 8,772 — 3,711 = 5,061 моль.
По составам фаз определим число молей компонентов в каждой фазе и
массу компонента в базе:
Фаза п ПСС1« тСС14- кг nC2HsOC,Hs тС,Н,ОС,Н,- кг
Жидкая Пар 5,061 3,711 3,087 1,299 0,475 0,200 1,974 2,412 1,146 0,179
при
CS2—СНзСОСНз
1,0133-10» Па
Рис. 26. Диаграмма кипения си-
стемы
cs2-
закона
В сумме получим: 0,475+0,200 +0,146 +0,179—1,000 кг.
7. Проанализируйте фазовое состояние системы CS2 — СН3СОСН3
на основании диаграммы кипения (рис. 26) и процесса нагревания систе-
мы с молярной долей СН3СОСН3
80 %.
Решение. Система
СН3СОСН3 характеризуется поло-
жительным отклонением от
Рауля. В этой случае коэффициенты
активности компонентов раствора
больше единицы, при образовании
раствора объем увеличивается, теп-
лота поглощается, A VCM > 0.
АНсм > 0-
Выше кривой abede состава насы-
щенного пара система гомогенна, фаза
одна — пар. Ниже кривой agefe со-
ставов кипящей жидкости система го-
могенна, фаза одна—жидкая. Между
кривыми abode и agefe система гете-
' рогенна. В равновесии находятся
215
жидкость и пар. Состав пара определяется по кривой abcde, состав
жидкой фазы определяется по кривой agcfe. Точка с — азеотропная,
смесь. Эта точка характеризуется одинаковым составом жидкой фазы
н пара.
Проследим нро.е1- нагревания системы с молярной долей
СНаСОСН;> 80 % Вплоть до 317,5 К. система жидкая, гомогенная.
При 317.5 К начинается кипение системы. Молярный состав пара 62 %
СН3СОСНЯ. Так ок пар богаче сероуглеродом, чем жидкость, то жидкая
фаза обедняете?? сероуглеродом и ее состав изменяется. Вместе с изме-
нением состава жидкой фазы меняется и температура кипения. Изме-
нение состава жидкой фазы, ведет и к изменению состава насыщенного
пара, находящегося в равновесии с жидкой фазой. На диаграмме изме-
нения составов «j».’ тсттстср'иуры показаны стрелками. При 323,7 К
состав пара стаиогштся ревдым составу исходной жидкой системы. При
этой температуре исчезает-последняя капля жидкой фазы. Ее молярный
состав 94 % СН3СОСН3. Далее система становится юмогенной и про-
исходит нагревание пара. Состав систем^ при этом меняться не будет.
Охлаждение системы на диаграмме кипения отражается изменением
фазового состоянии системы в обратной последовательности. При
323,7 К начинается конденсация системы. Молярный состав первой кап-
ли конденсата 94 % СНЯСОСН3. Из пара преимущественно з жидкую
фазу переходит ацетон. Отсюда видно, что пар обогащается сероуглеро-
дом. Состав пара и температура конденсации меняются. Вместе с изме-
нением состава пара меняется и состав жидкой фазы, находящейся в
равновесии с ларом. При 317,5 К. состав жидкой фазы становится таким
же, как и состав исходного пара. Конденсация заканчивается. Система
становится гомогенной,
8. Определите, какой компонент и в каком количестве следует до-
бавить к системеCSa — CH3COCHS с молярной долей СН3СОСН5 80%,
чтобы получить азеотропную смесь, молярный состав которой 37 %
СН3СОСН3. Масса системы 1 кг.
Решена е. Исходная смесь беднее сероуглеродом, чем азеотроп-
ная. Следовательно, необходимо добавлять к системе сероуглерод, что-
бы получить из исходной системы азеотропную. Сначала рассчитаем ко-
личество молей в 1 кг исходной системы. Для этого определим среднюю'
молекулярную массу исходного раствора:
,Мср=-76-0,2 + 58-0,8 —61,6.
В J. кг раствора содержится 1000/61,6 — 16.234 моль. В 1 кг раствора
16,234-0,8 = 12,99 моль ОН, СОСН3 и 16,234-0,2 = 3,247 мольС32.
Так как добавлять следует сероуглерод, то количество молей аце-
тона в системе останется без изменения и в азеотропном растворе
22,99 моль ацетона составят 37 %. Остальные 63 % должен составить
сероуглерод:
12,99 моль—37 %
х= 12,99-63/37 = 22,12 моль сероуглерода.
х моль — 63 %
21-S
В растворе имеется 3,247 моль сероуглерода. Следовательно, добавить
необходимо 22,12—3,247—18,873 моль, или 1.43 кг CS2.
9. Определите, какой компонент и сколько его может быть выделе-
но из I кг системы с молярной долей СНЭСОСН3 80 % (рис. 26) ректи-
фикацией в чистом виде.
Решение. Количество молей ацетона и сероуглерода в 1 кг си-
стемы, с молярным содержанием ацетона 80 % определяем по рис. 26:
^*CS — ' * *0 * T).*I‘>J 1МОЛЬ.
Так как данный состав находятся справа от азеотропной точки, то выде-
лить ректификацией в чистом виде можно только ацетон. Весь сероуг-
лерод (3,247 моль) перейдет в азеотропную сь-.гсь с молярным содержа-
нием 63 %. Остальные 37 % в азеотропном растворе составит ацетон:
3,247 моль — 63 %
, 0 ,«=3,247.37/63=1,907 моль.
.V моль — 37 %
Следовательно, в азеотроп перейдет 1,907 моль ацетона, а в чистом ви-
де можно .выделить 12,98—1,097 — 11,08 моль, или 11,08-58-10~3 =
= 0,643 кг ацетона.
10. Определите активность и коэффициент активности сероуглеро-
да и ацетона в раствореCS2 — СН3СОСН..,, в котором молярная доля
СН?,СОСН3 80 % (рис. 26) при 317,5 К.
Решение. Активность обоих компонентов определим по урав-
нению (XIV.3). Общее давление постоянно и равно 1,0133-105 Па. Дав-
ление насыщенного пара над чистыми веществами определяем по урав-
нению (ХП.8):
j ________I 1_______________I |
g P? 2,3026/? \ 7, T2 /'
По известным значениям давлений насыщенного пара при двух темпе-
ратурах рассчитаем теплоту испарения:
А /^ИСИ
2,3026/?
Давление насыщенного пара находим по справочнику [М.1. Определяем
давление насыщенного пара чистого вещества при третьей температу-
ре:
Pl
T1—Ti
UlZkzzIiL] _£L
g P'l '
1£т p»==igpo4--^H«l_ /Д----—X) = ia
3 1 2,3026/? \ Tj T2 / fe
Полученные значения сводим в таблицу:
Вещество ро - !0~5. Па Т\. к РО- 10-5. Па тг. к Т„ К Р« 1 0“-'’, Пл
сн.сосн, cs2 0,5333 0,5333 312,5 301,0 1,0132 1,0132 329,2 319,2 317,5 317,5 0,6406 0,9425
Состав пара определяем по диаграмме кипения (рис. 26):
*сн3 сосн,= 0.62;
acs> = 0,38-1,0132-106/(0,9425- 10s) = 0,409;
Vcs> = 0,409/0,200 = 2,045;
йгн гпгн =0,62-1,0132.106/(0,6406-10s)=0,981;
?сн,сосн.=0-э81/0,800= 1,226.
11. Бутиловый спирт ограниченно растворим в воде. Проанализи-
руйте фазовое состояние системы С4Н9ОН —- Н2О на основании ди-
аграммы фазового состояния (рис. 27) при постоянном давлении, пре-
вышающем давления насыщенного пара над чистыми компонентами и
над системой. Проследите изменение фазового состояния при охлажде-
нии системы с массовым содержанием
С4Н9ОН 68 %.
Решение. Так как внешнее
давление превышает давление насы-
щенного пара над системой, то не бу-
дет наблюдаться кипения системы.
Рассмотрим сначала фазовое со-
стояние систем. Выше кривой аКЬ
все системы гомогенные, одна фаза —
жидкий раствор, состоящий из воды
и бутанола. Системы внутри кривой
аКЬ гетерогенные, две жидкие фазы.
Кривая аК показывает составы раст-
воров бутанола в воде, кривая ЬК—
растворов воды в бутаноле. Для оп-
ределения составов сосуществующих
в равновесии жидких растворов через
точку, соответствующую заданному
составу при заданной температуре,
следует провести изотерму. Пересечение изотермы с кривыми аК и ЬК
дает составы растворов.
При охлаждении системы с массовым содержанием С4Н9ОН 68 %
до 370 К — система гомогенная. При 370 К появится вторая жидкая
фаза и система расслоится на два раствора. Массовый состав появив-
шейся новой фазы 10 % С4Н9ОН. При охлаждении системы раствори-
мость понижается. Составы разновесных фаз изменяются, как это по-
казано, стрелками на диаграмме. При 350 К массовые составы фаз 6%
и 74 % С4Н9ОН.
12. Проверьте применимость к системе бутанол — вода (рис. 27)
правила прямолинейного диаметра Алексеева.
Решение. Если отрезки, отсекаемые от изотерм 350 и 370 К кри-
выми аК и ЬК, разделить пополам и через центры с и f провести пря-
ГК
409-
399-
389-
379-
360-
359-
340-
339-
329-
319 _
9
HjOWO
Рис. . .
стояния системы Н2О—С4Н9ОН
ограиичеииой растворимостью ком-
понентов
|g . , , 6 I
20 40 50 80 Ж4Н,0Н
80 60 40 29 S
Массовая Имя, %
27. Диаграмма фазового со-
с
218
мую линию, то эта прямая пройдет через все аналогичные центры е, d
и т. д. и пересечет кривую фазового равновесия в критической точке К.
13. Определите массы Н2О и С4НвОН в растворах бутанола в воде
и воды в бутаноле, если 1 кг системы с массовой долей С4Н9ОН 68 %
охладить до 350 К.
Решение. Число сосуществующих фаз определяем по правилу
рычага. Так как на оси абсцисс отложена массовая доля в процентах,
то правило рычага выражается уравнением (XVI. 4). Составы сосущест-
вующих фаз при 350 К определим по рис. 27:
m1/m=(74—68)/(~4—6),
где тг — масса 1-й фазы; т — общая масса системы; т = 1 кг;
т.1 = 0,088 кг; т2 = 1 — 0,088 = 0,912 кг. Отсюда масса воды и бута-
нола в 1-й и 2-й фазах будет:
Фаза Кривые Массовая доля, %
н2о с,н,он
1-я аК 94 6
2-я ЬК 26 74
Фаза Масса, кг
С4Н9ОН Н2О
1-я 2-я 0,088-0,06=0,0053 0,912-0,74=0,6749 0,088-0,94 = 0,0827 0,912-0,26=0,2371
Общая масса системы: 0,0053+0,08274 0,6749 +0,2371 = 1,000 кг.
14. Постройте приближенно диаграмму давление насыщенного па-
ра — состав системы С4Н9ОН—Н2О при 350 К на основании диаграм-
мы фазового равновесия (см. рис. 27). Вычислите активность и коэффи-
циент активности Н2О в сосуществующих фазах при 350 К.
Решение. По уравнению Клапейрона — Клаузиуса (XI 1.8)
на основании справочных данных [М.] определяем давление насыщен-
ного пара над чистым бутанолом при 350 К-‘
Т, К ....... 343,1 357,3
/>с4н,он-10-'6’ Па °’1333 °-2666
ig р®=ig р® + ig _£1_ =
КЗ к 1Т ^(Гг-Л) К Р»
, о 357,3 (350 —343,1) 0,2666-Ю6
= 4,1248+----— ----------—L- lg — ------=4,1999;
350 (357,3 —343,1) 0,1333-Ю6
Р° = 1,5845-104 Па.
Давление насыщенного пара воды определяем по справочнику [М.1
при 350 К Р° = 1,5845-104 Па.
219
Пересчитаем массовые доли фаз гетерогенной области при 350 К
на молярные доли: для водного слоя 6 % С4НВОН соответствуют
хщн.он — 0,0153; для спиртового слоя 74,0 % С4НВОН — Хс4н,он =
— 0,4091. Отложим на оси ординат (рис. 28) Хс.н.он = 1, Т’с.н.он —
—1,8370-104 Па. Соединим эту точку с началом координат хс.н,он =
Молярная доля . %
Рис. 28. Зависимость парциальных и об-
щего давлении от состава системы
Н2О--С4Н»ОН с ограниченной раствори-
мостью при 350 К
=0 пунктирной линией. Эта прямая выражает зависимость парциаль-
ного давления бутанола от состава и подчиняется закону Рауля.
Аналогично отложим на оси ординат для хсщ.он = 0 Рн2о =
= 4,2064-104 Па. Соединим эту точку с началом координат хс.н,он =
= 1 пунктирной линией. Эта
прямая описывается законом
Рауля и выражает зависимость
парциального давления воды от
состава. Так как по первому ус-
ловию выбора стандартного со-
стояния 1 при х->1, то
приближенно можно принять,
что в гомогенных областях зави-
симости Pt — f (xi) совпадают
с зависимостями, определяемы-
ми по закону Рауля. Это соот-
ветствует на рис. 28 отрезкам
Рнго а и Рс<нлон Ь. Так как
парциальные давления компо-
нентов над гетерогенной обла-
стью не зависят от концентрации, то из точек а и b проведем горизон-
тальные прямые ас и bd. Далее зависимости парциальных давлений в
гомогенной области носят сложный характер, но они должны быть вы-
пуклыми вверх. Проведем приближенно эти кривые de и cf.
Общее давление равно сумме парциальных давлений. Проведем ли-
нию зависимости общего давления над системой от состава системы
Рй,о гпп- Рсдцон. Над гетерогенной системой общее давление будет
постоянным и равным 4,894-104 Па. Это означает, что составы от 0,0153
до 0,4091 С4НВОН при давлении 4,894-104 Па будут кипеть при 350 К.
При концентрации Н2О 1—0,0153 = 0,9847 активность воды рав-
няется концентрации, т. е. Дн,о = 0,9847 и раствор подчиняется зако-
ну Рауля. Коэффициент активности воды у' — 0,9847/0,9847 = 1. Так
как химический потенциал воды в равновесных фазах одинаков, то
8н,о ~8няо+РТ 1п Чо+*г In Тн,о~‘8н,о+Я7’ 1пхн2о + ^7'1п 7н„о-
Тогда коэффициент активности воды в растворе с концентрацией воды
(1—0,4091) - 0,5909 будет уй,о = 0,9847/0,5909 = 1,6664. Коэффи-
циент активности больше единицы, наблюдается положительное от-
клонение от закона Рауля: А Усм > 0; АДСМ > 0.
15. Для очистки толуола его перегоняют с водяным паром при внеш-
нем давлении 9,932-104 Па. При какой температуре будет происхо-
220
дить кипение системы, если толуол практически не растворим в воде?
Для расчета воспользоваться следующими данными:
т, к 333 343 353 363 . 373
?н,о-10-‘, Па . 2,058 3,219 4,893 7,244 10,469
Лз.ЩСН/10-*’ Па 1,860 2,698 2,862 5,394 7,429
Решение. Строим график зависимости давления насыщенного
пара воды (/) и толуола (2) от температуры (рис. 29). Суммируя давле-
ния Рн2о и Pc«hsch3, согласно уравнению (XIV.6), получим общее
давление насыщенного пара над гетероген-
ной системой (<3). По графику находим тем-
пературу, при которой давление насыщен-
ного пара над гетерогенной системой станет
равным внешнему давлению 9,932-104 Па.
Система закипит при 358,3 К.
16. По зависимости давления насыщен-
ного пара от температуры (рис. 29) опре-
делите расход водяного пара на перегонку
1 кг толуола при внешнем давлении
9,932-104 Па.
Решение. По графику находим дав-
ления насыщенного пара толуола и воды
при 358,3 К. Они составляют для толуола
4,800-104, а для воды 6,200-104 Па. Соглас-
но уравнению (XVI. И) на перегонку 1 кг
толуола будет израсходовано
тНгО-6,200-10*. 18/(4,800-10*-92) =0,253 кг.
Рис. 29. Зависимость давле-
ния насыщенного пара от
ЗАДАЧИ температуры для СбН5СН3
(/), Н2О (2) и системы
1. Раствор бензола в толуоле можно Н2О—СвН5СН3 (3)
считать совершенным. При 300 К давление
насыщенного пара над бензолом равно
1,603-104 Па, а над толуолом — 0,489-104 Па. Постройте график за-
висимости парциальных давлений бензола и толуола и общего давле-
ния над системой бензол—толуол от состава раствора, выраженного
в молярных долях. Определите давление пара над системой с моляр-
ной долей бензола 30 %. Чему будут равны парциальные давления
и общее давление над раствором, содержащим по 0,1 кг каждого ве-
щества? Вычислите изменение энтропии, свободной энергии в процессе
образования 1 моль раствора с молярной долей бензола 30 % при
300 К.
2. Экспериментально определены парциальные давления над систе-
мой ацетон — хлороформ при 308,2 К в зависимости от состава:
221
•*СНС1,.................
PCHCI • Па ... .
^снсоснз’10-41 Па • •
0,0 0,2 9,4 0,6 0,8 1,0
0 0,453 1,093 1,973 3,00 0 3,906
4,586 3,600 2,440 1,360 0,650 О
На основании этих данных постройте график зависимости парциаль-
ных и общего давлений над системой от состава. Сопоставьте получен-
ные зависимости с зависимостями для растворов, подчиняющихся зако-
ну Рауля. Определите, при каком общем давлении начнет кипеть сис-
тема с молярной долей хлороформа 50 % при 308, 2 К. При каком дав-
лении она кипела бы, если бы раствор был совершенным?
3. Экспериментально определены парциальные давления над сис-
темой ацетон — сероуглерод при 308,2 К при разных составах:
XCS, • 0 0,2 0,4 0,6 О',8 1,0
pcs/10-4’ Па ... . 0 3,733 5,040 5,666 6,133 6,826
^сн.сосн/10~*- Па . . 4,586 3,866 3,400 3,066 2,533 0
Постройте график зависимости парциальных и общего давления над
системой от состава, выраженного в молярных долях. Сопоставьте
зависимость с зависимостью, полученной по закону Рауля для совер-
шенных растворов. Определите, при каких составах системы общее
давление пара над ней при 308,2 К будет 8,5-104 Па. Какое давление
наблюдалось бы над этими системами, если бы раствор был совершен-
ным?
4. Вычислите общее давление паров над системой, содержащей
0,078 кг бензола и 0,076 кг сероуглерода, при каждой из температур,
если раствор считать совершенным:
Т, К.............................. 293 313 353
₽с.н.-10”4’ Па................... 1,020 2,466 10,066
pcs •10-41 Па.................... 3,960 81226 271064
Экспериментально определенные общие давления при этих темпера-
турах соответственно равны 2,746-104; 5,760-10* и 19,655-10® Па. Вы-
числите отклонения давления от давления над идеальным раствором для
каждой температуры. Когда поведение раствора ближе к идеально-
му — при более высокой или при более низкой температуре?
5. Постройте график зависимости содержания бензола в паре от со-
держания бензола в жидкой фазе. Определите содержание бензола в
паре, если в жидкой фазе его молярная доля 40 %. Бензол и толуол
образуют растворы, близкие по свойствам к идеальным. При 293 К дав-
ления паров бензола и толуола соответственно равны 1,020-10* и
0,327-10* Па.
6. Давления паров веществ А и В при 323 К соответственно равны
4,666-10* и 10,132-10* Па. Вычислите состав пара, равновесного с раст-
вором, считая, что раствор, полученный при смешении 0,5 моль А
и 0,7 моль В, идеальный.
222
7. Вычислите в молярных долях состав раствора, кипящего при
373 К и 10,133-104 Па, если СС14 и SnCl4 образуют идеальные растворы.
Давления паров СС14 и SnCl4 при 373 К соответственно равны 19,332 X
X Ю4 и 6,666-104 Па. Определите состав в молярных долях первого пу-
зырька пара. Какой состав будет иметь последняя капля жидкости, ес-
ли раствор полностью перевести в пар?
8. Рассчитайте состав пара над раствором, содержащим по 0,5 моль
бензола и толуола, по зависимости давления насыщенного пара от тем-
пературы для бензола и толуола:
Г, К.............
^с.н.‘10’4,'Па •
р0 -10-*, Па
гс,н,сн3
330 350 380 420
5,2 9,3 21,3 55,5
1,6 3,8 9,3 25,8
Дайте заключение о применимости первого закона Вревского. При
расчете раствор считать идеальным.
9*. Считая раствор «-гептана и «-октана идеальным, постройте ди-
аграмму кипения, используя справочные данные о теплотах испарения
и температурах кипения [С.Х., т. 1].
10. Определите массу пара и жидкой фазы, которые будут нахо-
диться в равновесии, если 1 кг раствора С2Н5ОС2Н5—СС14 с молярной
долей СС14 30 % нагреть до 333 К. Молярная доля жидкой фазы 37 %
СС14, пара 16 % СС14. Диаграмма кипения приведена в справочнике IM.L
11. Какой компонент и сколько его следует добавить к 1 кг системы
HNO3 — Н2О с молярной долей HNO3 60 %, чтобы получить азеот-
ропную смесь. Диаграмма кипения приведена в справочнике.
12. Парциальное давление СН3ОН над раствором СН3ОН в Н2О с
молярной долей хсн3он = 0,25 при 313,1 К составляет 12,5-10® Па,
а при 332,6 К — 30,5-10® Па. Определите парциальную молярную теп-
лоту испарения СН3ОН из раствора %сн3он = 0,25.
13. Определите парциальную молярную теплоту растворения СН3ОН
в растворе СН3ОН — Н2О с хсн3он = 0,25 при 332,6 К, если парци-
альная молярная теплота испарения СН3ОН из раствора СН3ОН в
Н2О с молярной долей Хсн,он = 0,25 при 332,6 К равна 39,6 кДж/моль,
теплоту испарения чистого метанола см. в справочнике [M.J.
14. Докажите, что в азеотропном растворе уд = Р/Рд и ув =
= Р/Рв, где Р — общее давление над системой, значения уд, ув,
Рд и Рв соответствуют температуре кипения азеотропного раствора.
15. Определите коэффициенты активности и активности СС14 и
С2Н8ОН в растворе с хСсь = 0,63 при 337 К. Общее давление 10,133 х
X 104 Па.'Необходимые данные возьмите из справочника (M.L Диаграм-
ма кипения системы СС14 — С2Н8ОН приведена в справочнике [M.J.
16. Муравьиная кислота и вода образуют азеотропный раствор при
Хн,о = 0,467 и 380,8 К. Общее давление 10,133-104 Па. Определите
Коэффициенты активности и активности муравьиной кислоты и воды в
азеотропном растворе. Теплота испарения АЯнсоон = 22,24 кДж/моль
223
при Тн.т.к = 373,9 К. Теплота испарения воды при Тн.т.к А/7н2о =
= 40,66 кДж/моль. Определите, положительное или отрицательное
отклонение от закона Рауля имеет эта система?
17. При перегонке бромбензола с водяным паром кипение начинает-
ся под давлением 10,133-10* Па при 368,3 К. Бромбензол практически
не растворим в воде, а парциальные давления воды и бромбензола при
указанной температуре соответственно равны 8,519-10* и 1,613-10* Па.
Вычислите массу бромбензола, которая переходит в дистиллят совмест-
но с 1 кг воды.
18. Давление пара над системой из двух несмешиваклцихся жидкос-
тей анилин —- вода равно 9,999- ,0’ Па при 371 К. Давление пара воды
при этой температуре равно 9.426- 10* Па. Сколько воды надо взять
для перегонки 1 кг анилина при внешнем давлении 9,999-10* Па?
19. Давление насыщенного пара над системой из двух несмешиваю-
щихся жидкостей диэтиланилин — вода равно 10,133-10* Па при
372,4 К- Сколько пара потребуется для перегонки 0,1 кг диэтиланилина,
если давление пара воды при указанной температуре 9,919-10* Па?
20. Определите массу водяного пара, необходимую для перегонки
0,1 кг нафталина с водяным паром при нормальном давлении. При ка-
кой температуре будет происходить перегонка? Для расчета воспользо-
ваться зависимостью Р — f (Т):
т, к ....... . . 368 369 370 371 372 373
£HjO-10~4, Па .. . . 8,451 8,767 9,094 9,430 9,775 10,132
^с.оН,’10-1’ Па ’ . . 0,203 0,211 0,221 0,233 0,245 0,260
Нафталин практически не растворим в воде.
21. Зависимость давления (Па) насыщенного пара фурфурола сп
температуры выражается уравнением
1g £=10.084 — 2209/7’.
Определите температуру, при которой будет происходить перегонка
фурфурола с водяным паром при нормальном давлении. Определите
количество пара, необходимого для перегонки 1 кг фурфурола. Дан-
ные о зависимости давления насыщенного пара воды от температуры
возьмите из справочника. Фурфурол очень слабо растворим в воде.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Дана зависимость составов жидкой фазы и находящегося с ней
в равновесии пара от температуры для двухкомпонентной жидкой систе-
мы А — В при постоянном давлении. Молярный состав жидкой фазы
х и насыщенного пара у выражен в процентах вещества А. По приве-
денным данным: 1) постройте график зависимости состава пара от со-
става жидкой фазы при постоянном давлении; 2) постройте диаграм-
му кипения системы А—В; 3) определите температуру кипения систе-
224
№ ва- рианта Система Р-io-4, Па Молярная доля А, % т, к
х — жидкая фаза У — пар
1 A—HNO3 В—Н2О 10,133 0,0 8,4 12,3 22,1 30,8 38,3 40,2 46,5 53,0 61,5 100,0 0,0 0,6 1,8 6,6 16,6 38,3 60,2 75,9 89,1 92,1 100,0 373 379,5 385 391,5 394,6 394,9 394,0 391,0 385 372 357
2 A—HNO3 B-CHgCOOH 10,79 0,0 10,0 20,0 33,3 40,0 50,0 60,0 100,0 0,0 3,0 8,0 34,0 47,0 82,0 96,0 100,0 391,1 395,1 399,5 401,6 400,3 393,3 378,0 358,3
3 и > 1 1 II О’” 10,133 4,95 9,2 18,9 22,8 27,9 33,8 34,4 35,8 39,7 44,4 50,3 52,2 56,0 58,2 61,7 79,8 87,9 100,0 0,8 1,8 6,4 10,6 17,8 30,5 32,1 35,8 47,5 63,3 81,0 86,2 92,2 95,8 98,9 99,2 99,5 100,0 374,6 375,8 379,8 381,4 383,3 384,7 385,0 385,4 384,4 381,7 374,7 371,9 365,9 359,6 352,0 318,1 306,5 292,4
4 А—Н2О В—СвН4О2 (фурфурол) 10,133 0,0 2,0 4,0 6,0 8,0 Ю.О 20,0 30,0 50,0 90,8 0,0 10,0 19,0 36,0 68,0 81,1 89,0 90,5 90,8 90,8 435,0 431,8 427,8 419,0 395,5 382,5 373,6 371,7 370,9 370,9
8 Зак. 767
225
Продолжение табл.
№ ва- рианта Система Р-10-4, Па Молярная х — жидкая фаза доля А, % у — пар т, к
96,0 98,0 99,0 100,0 90,8 92,0 94,5 100,0 370,9 371,1 371,6 373,0
5 А—На0 В-С4НИО (н-бутиловый спирт) 10,133 3,9 4,7 5,5 7,0 25,7 27,5 29,2 30,5 49,6 50,6 55,2 57,7 97,5 98,0 98,8 99,2 99,4 99,7 99,9 26,7 29,9 32,3 35,2 62,9 64,1 65,5 66,2 73,6 74,0 75,0 75,0 75,2 75,6 80,8 84,3 88,4 92,9 98,1 384,5 383,6 382,6 381,8 370,9 370,2 369,7 369,3 366,5 366,4 365,9 365,8 365,7 366,0 366,7 368,4 369,8 371,7 372,5
6 А—НаО В-С4Н10О (изо-бутиловый спирт) 10,133 13,5 15,0 15,9 17,2 39,7 40,5 56,4 60,5 67,0 97,5 97,8 98,6 99,1 99,8 40,1 42,0 43,7 44,6 62,6 63,3 66,0 66,7 67,0 67,2 67,3 71,4 78.2 95,7 370,8 370,1 369,6 369,0 363,3 363,2 362,5 362,4 362,2 362,5 363,1 364,5 366,4 371,9
7 А—НаО B-C4HJaO (2-метил-З-бутил- 2-ол) 10,246 0,0 18,9 34,2 53,8 66,7 75,7 82,4 87,5 0,0 42,7 55,3 63,4 65,7 66,9 67,5 68,1 377,5 367,8 365,3 364,3 364,1 364,2 364,25 364,3
Продолжение табл.
№ ва- рианта Система Р-10-4, Па Молярная х — жидкая фаза доля А, % у — пар т. к
91,6 94,9 97,7 99,5 100,0 69,1 70,3 75,7 91,0 100,0 364,4 364,8 366,4 369,0 373,3 ,
8 A—CS, В—СН,СОСН3 10,133 0,0 1,9 4,8 13,4 18,6 29,1 38,0 44,8 53,6 65,3 78,9 87,9 96,8 100,0 0,0 8,3 18,5 35,1 44,3 52,8 57,4 59,8 62,7 66,1 70,5 76,0 88,6 100,0 329,2 327,0 324,4 319,6 317,0 314,4 313,3 312,8 312,3 312,1 312,3 313,5 316,5 319,3
9 А—СН3ОН В—СС14 10,133 0,0 0,2 0,4 1,3 1,7 3,0 5,1 10,7 12,4 24,8 40,1 45,3 55,0 56,6 72,5 76,4 81,3 83,8 88,3 91,8 94,8 97,9 99,3 100,0 0,0 2,0 12,0 24,2 26,4 38,3 44,5 49,5 50,9 52,2 53,7 54,1 55,2 55,2 59,1 60,3 63,0 64,9 69,6 75,3 82,3 91,0 96,7 100,0 349,7 349,1 345,4 340,6 339,9 335,0 332,4 330,2 330,0 329,3 328,8 328,8 327,7 328,7 329,0 329,4 329,8 330,1 331.2 332,5 333,9 335,8 337.1 337,7
10 8* А—СН3ОН в-свн, 9,670 0,0 2,4 3,6 4,7 0,0 17.5 30,1 43,5 351,6 341,2 336,9 333,3 227
226
Продолжение табл.
Хе ва- рианта Система Р-10“4, Па Молярная доля А, % т, К
х — жидкая фаза У — пар
5,9 6,3 9,2 24,9 64,5 78,5 84,7 90,2 94,1 98,3 100,0 51,1 53,4 54,6 59,9 64,5 66,5 71,3 77,1 84,4 93,6 100,0 330,7 330,3 329,8 329,4 329,4 329,9 330,6 330,3 332,6 334,9 336,1
II А—СНгОН B-CeHe 10,133 0,0 2,8 5,0 5,7 9,0 11,8 27,0 44,0 58,6 69,5 81,7 88,3 90,2 94,5 96,8 98,8 0,0 31,0 39,5 42,0 48,5 56,5 57,5 58,6 61,0 62,5 65,5 70,0 73,0 82,2 90,0 94,2 363,2 342,4 339,8 338,7 334,4 332,0 331,0 330,8 330,7 330,6 331,1 331,9 332,9 333,2 335,4 336,4
12 А—СН3ОСН, в-свнв 10,000 0,0 4,0 15,9 29,8 42,1 53,7 62,9 71,8 79,8 87,2 93,9 100,0 0,0 15,1 35,3 40,5 43,6 46,6 50,5 54,9 60,6 68,3 78,7 100,0 352,8 348,2 342,5 341,5 340,8 341,0 341,4 342,0 343,3 344,8 347,4 351,1
13 А—СНяОСНа С-СН3ОН 10,133 0,0 4,8 17,6 28,0 40,0 60,0 80,0 0,0 14,0 31,7 42,0 51,6 65,6 80,0 337,7 335,9 333,1 331,3 330,2 ’ 329,1 328,6
Продолжение табл.
№ ва- рианта Система Р- 10-4, Па Молярная доля А, % г, к
х — жидкая фаза у —пар
90,0 99,0 100,0 94,0 97,0 100,0 328,8 329,1 329,5
14 А—СН3СОСН3 В-СНС1Я 9,760 0,0 7,9 14,3 18,6 26,6 39,4 46,2 53,6 61,8 71,5 77,0 82,1 91,5 100,0 0,0 6,0 И,6 16,0 23,5 39,4 52,0 59,8 69,8 79,2 84,8 90,1 95,4 100,0 332,9 333,3 334,2 334,8 335,2 335,4 335,0 334,3 333,3 331,9 331,2 330,2 329,0 328,2
15 А—СНаСОСН3 В-СНС13 10,000 0,0 18,6 34,0 46,8 57,8 67,3 75,5 82,7 89,2 94,9 100,0 0,0 10,3 31,8 51,5 65,2 75,7 83,2 89,0 93,6 97,3 100,0 334,3 336,0 336,8 336,4 335,2 334,0 332,9 331,8 330,8 330,0 329,0
16 А—С3Н8О В— НаО 10,133 0,0 1.0 2,0 4,0 6,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 85,0 90,0 96,0 100,0 0 11,0 21,6 32,0 35,1 37,2 39,2 40,4 42,4 45,2 49.2 55,1 64,1 70,4 77,8 90,0 100,0 373,0 368,0 365,0 363,5 362,3 361,5 361,1 360,9 360,8 360,9 361,3 362,0 363,5 364,5 365,8 367,0 370,3
228
229
Продолжение табл.
№ ва- рианта Система Р-10~4, Па Молярная доля А, % т, К
х — жидкая фаза у — пар
17 А-С4Н.0О (диэтиловый эфир) В—С4Н1аОа (бутилацетат) 0,668 0,0 18,0 28,2 35,5 37,0 43,5 59,1 76,5 86,8 92,1 100,0 0,0 22,5 32,2 36,3 37,0 41,6 50,4 64,5 75,2 83,3 100,0 325,6 324,5 324,1 323,8 323,7 323,8 324,2 325,3 326,5 327,7 329,1
18 А-С4Н10О (диэтиловый эфир) В- CgHlgOg (бутилацетат) 2,200 0,0 16,1 31,3 47,4 61,3 77,7 87,3 100,0 0,0 21,0 37,5 47,9 57,8 70,5 80,7 100,0 353,6 351,2 349,9 349,4 349,5 350,2 351,3 353,3
19 А—С4Н10О (диэтиловый эфир) В—С,Н1аОа (бутилацетат) 10,133 0,0 21,9 37,2 51,4 66,4 72,2 77,9 84,7 89,6 100,0 0,0 33,4 48,2 58,0 69,2 74,1 78,6 84,4 88,0 100,0 399,0 394,2 391,9 390,9 390,1 389,9 389,8 390,0 390,1 390,5
20 А—СНС13 В—СН3ОН 10,100 0,0 2,9 6,3 10,3 15,2 21,2 28,7 38,5 51,8 70,72 84,7 100,0 0,0 8,3 16,1 24,0 32,3 41,2 48,8 54,2 58,9 67,8 82,3 100,0 337,9 337,1 335,4 333,7 332,1 330,5 328,9 327,5 326,7 326,7 330,0 334,4
21 А—СС14 В—СН3СНаОН 9,930 0,0 3,2 7,0 11,4 0,0 16,6 26,5 35,4 350,9 347,8 345,4 343,3
230
Продолжение табл.
№ ва- рианта Система Р-10-4, Па Молярная доля А, % т, к
х—жидкая фаза у—пар
16,6 23,0 31,0 41,1 55,67 63,0 72,9 89,0 100,0 43,5 49,8 53,6 56,9 59,7 63,0 66,9 84,0 100,0 341,4 339,6 338,3 337,4 336,9 336,6 337,3 343,0 348,9
22 А—СС14 В—С4Н8Оа (этилацетат) 9,140 0,0 0,5 7,3 15,9 28,0 35,2 42,9 51,3 57,2 58,8 61,3 69,3 79,2 89,4 100,0 0,0 0,8 10,0 20,2 32,4 38,9 45,9 52,8 57,7 48,7 61,0 67,5 76,5 87,1 100,0 347,1 347,0 346,3 345,8 345,2 344,9 344,7 344,6 344,6 344,6 344,6 344,8 345,1 345,6 346,4
23 A—CeHsCH3 В—изо-С4Н100 (изо-бутиловый спирт) 10,133 0,0 6,6 11,4 15,0 21,1 33,3 35,5 44,1 55,0 58,8 63,8 68,2 76,2 80,3 84,4 87,0 89,7 96,5 100,0 0,0 13,1 21,8 26,7 33,4 42,1 44,2 48,0 53,6 54,4 57,0 59,8 64,1 67,4 71,2 73,6 77,3 87,0 100,0 381,0 378,2 376,6 375,8 374,9 374,2 374,1 373,8 373,5 373,6 373,4 374,4 374,9 375,5 376,3 376,8 377,7 380,2 383,4
231
Продолжение табл.
№ ва- рианта Система р. 10~4, Па Молярная доля А, % г. К
х — жидкая фаза у—пар
24 А—транс -СаНаС1а (транс- дихлорэтан) 10,133 0,0 0,7 2,1 2,8 5.8 11,2 13,4 18,7 24,6 29,4 34,3 43,8 73,7 76,9 88,6 95,5 98,7 99,6 100,0 0,0 5,1 13,8 16,8 30,4 45,2 48,5 53,8 59,3 65,3 68,0 72,8 76,0 76,9 79,0 83,0 90,6 94,4 100,0 337,6 336,4 339,9 333,5 329,5 325,3 324,1 321,0 319,0 317,8 317,3 316,0 315,0 314,9 315,3 316,1 317,8 319,0 321,3
25 А—цис-СаНаС1а В-СН8ОН 10,133 0,0 2,9 4,8 7,0 13,6 16,9 19,6 25,9 31,4 36,5 40,0 42,6 51,3 57,1 65,1 70,5 85,0 91,6 98,6 99,6 99,8 100,0 0,0 8,9 13,7 18,7 33,1 37,1 39,1 45,4 50,4 53,9 55,9 57,6 60,9 63,4 65,1 65,5 70,8 74,0 84,0 87,3 93,9 100,0 337,6 336,3 334,8 333,6 331,0 329,9 329,0 327,5 326,7 326,1 325,6 325,4 325,0 324,8 324,5 324,8 325,3 325,9 328,4 329,3 330,8 333,3
232
№ ва- рианта Г, а ь С № ва- рианта Tt а ь С
1 388 55 81 19 14 334,5 55 37,2 62,8
2 398 60 61,2 38,8 15 336 55 37,2 62,8
3 383 65 67,4 32,6 16 365 80 93 7
4 372 50 15,8 84,2 17 325 65 54,2 45,8
5 368 50 19,6 80,4 18 350,5 75 65,5 34,5
6 365 35 68,8 31,2 19 390,25 65 54,2 45,8
7 367 25 6,4 93,6 20 330,3 25 55,5 44,5
8 317 25 30,4 69,6 21 343 25 36,8 63,2
9 333 25 27,1 72,9 22 345,5 25 52,7 47,3
10 331 80 62,2 37,8 23 377 80 83,4 16,6
11 335 10 4,4 56,4 24 320 25 50,5 49,5
12 345 75 64 36 25 339 25 50,5 49,5
13 329,25 60 73 27
мы с молярной долей а % вещества А. Каков состав первого пузырька
пара над этой системой; при какой температуре закончится кипение
системы; каков состав последней капли жидкой фазы? 4) определите
состав пара, находящегося в равновесии с жидкой фазой, кипящей при
температуре 7\; 5) при помощи какого эксперимента можно установить
состав жидкой бинарной системы, если она начинает кипеть при тем-
№ вари- анта Система р-10-’. Па Молярная доля А, % т. к
1 HNO.-H.jO 10,133 53,0 385,0
2 HNO3—С2Н4О2 10,079 60,0 378,0
3 HF- Н2О 10,133 61.7 352,0
4 Н2О-С2Н4О2 10,133 8,0 395,5
5 Н2О—С4Н10О 10,133 25,7 370,9
6 Н2О-С4Н10О 10,133 17,2 369,0
7 Н2О—CsHl2O 10,246 18,9 367,8
8 CS2—CgHeO .10,133 13,4 319,6
9 CHgOH—СС14 10,133 3,0 335,0
10 CHgOH-CeHe 9,670 5,9 330,7
11 CH.OH-CeHe 10,133 90,2 332,9
12 C2HeO-CeHe 10,000 4,0 348,2
13 CeHeO—CHgOH 10,133 17,6 333,1
14 С,НЙО—СНС1. 9,760 77,0 331,2
15 CgH,O-CHClg 10,00 18,6 336,0
16 С3Н8О—нао 10,133 4,0 363,5
17 С4Н10О—CeHi8O2 0,668 28,2 324,1
18 С4Н10О—СвН1аОа 2,200 16,1 351,2
19 С4Н10О— С,Н12О2 10,133 21,9 394,2
20 СС14—С2Н4О 10,100 6,3 335,4
21 СС14—CgHeO 9,930 7,0 345,4
22 СС14-С4НвО2 9,140 28,0 345,2
23 10,133 11,4 376,6
24 CjHgClg-CHijOH 10,133 2,8 333,5
25 CgHgClj-CHgOH 10,133 4,8 334,8
233
пературе Тх при наличии диаграммы кипения системы? 6) какой ком-
понент и в каком количестве может быть выделен из системы, состоя-
щей из b кг вещества А и с кг вещества В? 7) какого компонента и
сколько надо добавить к указанной в п. 6 смеси, чтобы получилась азе-
отропная система? 8) какая масса вещества А будет в парах и в жид-
кой фазе, если 2 кг смеси с молярной долей а % вещества А нагреть до
температуры Тг? 9) определите вариантность системы в азеотропной
точке.
2. На основании общего давления и состава пара, находящегося в
равновесии с кипящей жидкостью, приведенных на с. 225, определите
активность и коэффициент активности в жидкой фазе компонента А
при заданном составе жидкой фазы и заданной температуре. Рассчи-
тайте по уравнению Клапейрона — Клаузиуса на основании справоч-
ных данных давление насыщенного пара РХ над компонентом А. Опре-
делите изменение химического потенциала при образовании раствора
при заданной концентрации и температуре.
ГЛАВА XV
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В БИНАРНЫХ СИСТЕМАХ,
СОДЕРЖАЩИХ ЖИДКУЮ И ТВЕРДУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 410—420, 423-426]
Зависимость растворимости компонента в совершенном растворе
от температуры выражается уравнением Шредера
А'Упл, i f 1
2,3026 R \ТПЛ, t
(XV. 1)
где xt — молярная доля растворенного вещества в насыщенном раст-
воре (растворимость); АЯплг — молярная теплота плавления раство-
ренного вещества; Тппл — температура плавления чистого растворен-
ного вещества; Т — температура начала кристаллизации насыщенно-
го раствора концентрации х{.
Уравнение Шредера для предельно разбавленных растворов имеет
вид
где АТ — понижение температуры кристаллизации раствора (распла-
ва) концентрации
А7’ = Тпл,1-7’;
(XV.3)
234
7'плЛ—температура плавления растворителя; — теплота плав-
ления растворителя; К2 = х™/х*; х™ — концентрация растворенного
вещества в твердом растворе; х* — концентрация растворенного ве-
щества в жидком растворе (расплаве).
Для неизоморфно кристаллизующихся систем х™ = 0 и = 0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. По кривым охлаждения системы золото — платина (рис. 30, а)
постройте диаграмму состав — свойство и определите: 1) при какой
температуре начнет отвердевать расплав с массовой долей Pt 75%;
2) при какой температуре расплав затвердевает полностью; 3) состав
первых выпавших в твердую фазу кристаллов; 4) массу золота и пла-
тины в твердом и жидком состояниях при охлаждении 3 кг системы с
массовой долей Pt 75 % до 1833 К; 5) состав последней капли расплава.
Рис. 30. Кривые охлаждения изоморфной системы Au—Pt (а) и
диаграмма плавкости этой системы (б)
Решение. На основании кривых охлаждения строим диаграм-
му плавкости (рис. 30, б). Кривая 1 соответствует охлаждению чистого
золота. При 1337 К на кривой охлаждения наблюдается температурная
остановка; она соответствует температуре плавления золота. Чистые
вещества кристаллизуются при постоянной температуре. По правилу
фаз Гиббса (XI.3) число компонентов К = 1, число фаз Ф = 2, п =1;
235
так как давление не оказывает влияния на систему, число термодина-
мических степеней свободы /усл — 0.
Кривая 2 соответствует охлаждению системы, содержащей 20 % Pt.
При 1567 К наблюдается уменьшение скорости охлаждения. Это объ-
ясняется тем, что происходит процесс, сопровождающийся выделени-
ем теплоты. Таким процессом является кристаллизация твердого раст-
вора. При кристаллизации теплота выделяется, что и снижает скорость
охлаждения системы. На этой же кривой при 1405 К наблюдается вновь
увеличение скорости охлаждения. При этой же температуре закончи-
лась кристаллизация твердого раствора, и дальнейшее охлаждение сис-
темы не сопровождается выделением теплоты. Происходит охлаждение
твердого раствора. На оси ординат, соответствующей составу 20% Pt,
откладываем температуру начала и конца кристаллизации 1567 и
1405 К. Аналогично находим точки начала и конца кристаллизации
расплавов с концентрациями 40, 60 и 80 % Pt. Соединив все точки на-
чала кристаллизации, получим кривую ликвидуса; соединив точки кон-
ца кристаллизации, получим кривую солидуса. Обе кривые сходятся
в точках кристаллизации чистых компонентов Pt и Au.
Таким образом, выше кривой NtnM все системы находятся в жид-
ком состоянии. Фаза одна, компонентов два, условных термодинамиче-
ских степеней свободы две. Можно менять и состав и температуру в ог-
раниченных пределах, и при этом не будут меняться ни число, ни вид
фаз. Ниже кривой NkM все системы находятся в состоянии твердого
раствора, состав которого может менятся непрерывно. Фаза одна —
твердая, компонентов два, условных термодинамических степеней сво-
боды две. Между кривыми NtnM и NkM все системы гетерогенные,
В равновесии находятся две фазы — твердый раствор, состав которого
определяется по кривой W/QM, и расплав, состав которого определяет1
ся по кривой NtnM. Фазы две, компонентов два, п — 1, число условных
термодинамических степеней свободы /усл — 1. Можно менять состав.
Кристаллизация системы, содержащей 75 % Pt, начинается при
1925 К, а заканчивается при 1688 К. Составы сосуществующих фаз оп-
ределим по точкам пересечения изотермы с кривыми NtnM и NkM.
Состав первого кристалла будет 92 % Pt. При 1833 К в равновесии на-
ходятся твердый раствор и расплав. Масса твердого раствора так от-
носится к массе жидкого расплава, согласно правилу рычага (XIV.4),
как плечо тп относится к плечу nk. Если общая масса 3 кг, то массу
твердого раствора обозначим х, массу жидкого расплава — 3 — х,
Измеряем длины плеч или отсчитываем составы в процентах:
х 75—57
---- == 77—77 = °-14: 7? = 1,/5 кг.
3—* 88—75
Масса твердого раствора 1,75 кг, масса жидкого расплава 1,25 кг.
Масса платины в твердом растворе будет 1,75-0,88=1,535 кг, золота—
1,75-0,12 = 0,215 кг. В расплаве находится 1,25-0,57 — 0,712 кг
236
платины и 1,25-0,43 = 0,538 кг золота. Для проверки полученных зна-
чений сложим массы Pt и Au:
масса Au 0,2154-0,538 = 0,753 кг
масса Pt 1,538 4-0,712 = 2,247 кг
Всего 3,000 кг
———=0,25, или 25%; —----= 0,75, нлн 75%.
3,000 ' 3,00
Состав последней капли расплава найдем по пересечению изотермы
конца кристаллизации с кривой NkM. Последняя капля расплава
будет содержать 34,5 % Pt. Процесс кристаллизации расплава, сос-
тав которого 75 % Pt, показан на рис. 30, б стрелками.
2. Определите теплоту плавления Pt на основании данных диаграм-
мы плавкости системы Pt — Au (рис. 30).
Решение. Для расчета воспользуемся уравнением (XV.2).
Определим молярную долю платины в расплаве, содержащем 25 %
золота:
25/197,0
х* =-----------—1--------=0 247-
pt (25/197,0)4-(75/195,1) ’ ’
хтв_________8Д9Л0________
р‘“ (8/197,0)4-(92/195,0) ’ ’
fePt = 0,085/0,247 = 0,345; ДТ = 2054 —1833 = 221 К;
, л 8,3143-2054а
АНПЛ Pt = 247---------- (1-0,345) =25,679-10« Дж/моль.
Полученная величина приближенная, так как раствор взят не предель-
но разбавленным.
3. На основании кривых охлаждения системы алюминий — крем-
ний (рис. 31, а) постройте диаграмму плавкости. По диаграмме опреде-
лите: 1) при какой температуре начнется кристаллизация системы,
содержащей 60 % кремния; 2) какое вещество будет кристаллизовать-
ся из расплава, содержащего60 % кремния; 3) какое количество твер-
дой фазы будет при 1073 К, если общая масса системы, содержащей
60 % кремния, 2 кг; 4) при какой температуре закончится кристалли-
зация системы; 5) состав последней капли жидкого расплава.
Решение. На основании кривых охлаждения (рис. 31, а) строим
диаграмму плавкости в координатах состав — температура плавления
(рис. 31, б). При охлаждении чистого кремния (кривая охлаждения 1)
наблюдается температурная остановка при 1693 К. Эта температурная
остановка связана с выделением скрытой теплоты кристаллизации
кремния при его температуре плавления. Эту температуру откладыва-
ем на оси ординат (рис. 31, б), отвечающей чистому кремнию.
237
На кривой охлаждения системы, содержащей 80 % кремния (кри.
вая 2), при 1593 К наблюдается уменьшение скорости охлаждения-
При этой температуре из расплава начинает кристаллизоваться чистый
кремний: так как система А! — Si неизоморфная, то растворимость ком-
понентов в твердом состоянии равна нулю (скорее она не равна нулю,
но пренебрежимо мала). При выделении в твердую фазу кремния жид-
кая фаза обогащается алюминием, что приводит к снижению тем-
пературы плавления системы. На кривой охлаждения 2 наблюдается
Рис. 31. Кривые охлаждения иеизоморфиой системы Al—Si (а)
и диаграмма плавкости этой системы (б)
температурная остановка при 845 К (горизонтальная площадка аб).
При данной температуре вся система переходит в твердое состояние.
Температурная остановка связана с тем, что из расплава кристаллизу-
ется и алюминий и кремний одновременно. Составы жидкой и твердой
фаз при этом не изменяются. При этой причине остаются неизмен-
ными температуры плавления и кристаллизации.
При охлаждении системы, содержащей 40 % кремния (кривая 4),
изменение скорости охлаждения уже при 1219 К, а горизонтальная
площадка наблюдается при той же температуре, что и при охлажде-
нии расплава, содержащего 80 % кремния, при 845 К. При 1219 К на-
чинается кристаллизация кремния из расплава, расплав обогащается
алюминием, температура кристаллизации снижается, при 845 К кри-
сталлизуется эвтектика. Длина горизонтального участка на кривой
охлаждения пропорциональна теплоте, выделяющейся при кристал-
лизации эвтектики. Так как состав эвтектики постоянный, то длина го
238
ризонтальной площадки пропорциональна массе кристаллизующейся
эвтектики. Если проводить охлаждение одной и той же массы расплава
различных составов, то масса эвтектики будет различна, что и проявля-
ется в разной длине горизонтального участка на кривых охлаждения.
Если охлаждать систему, содержащую 10 % кремния (кривая 5),
то изменения скорости охлаждения на кривой не происходит, а наблю-
дается лишь температурная остановка при 845 К. Состав, содержащий
- 10 % кремния и 90 % алюминия, эвтектический. Длина горизонталь-
ной площадки на кривой охлаждения 5 максимальная. При охлаждении
чистого алюминия наблюдается температурная остановка при 932 К,
соответствующая температуре плавления алюминия (кривая 7).
Продолжая построение диаграммы плавкости по всем кривым ох-
лаждения, получим две кривые нэ и оэ и горизонтальную прямую лм.
Три линии пересекаются в эвтектической точке. В этой точке расплав
насыщен как кремнием, так и алюминием. Выше кривых нэ, оэ в облас-
ти I все системы гомогенные, одна жидкая фаза. Термодинамических
степеней свободы две. В области // системы гетерогенные,в равновесии
находятся кристаллы алюминия и расплав, состав которого определя-
ется по кривой нэ. В области III все системы гетерогенные. В равно-
весии находятся кристаллы кремния и расплав, состав которого опре-
деляется по кривой эо. Термодинамических степеней свободы у систем
в областях // и III — одна. В области IV все системы находятся в
твердом состоянии, системы гетерогенные, две твердые фазы — кри-
сталлы алюминия и кремния. Термодинамическая степень свободы — од-
на. В точке э в равновесии находятся кристаллы алюминия, кристаллы
кремния и расплав; система гетерогенная, фазы три, число термоди-
намических степеней свободы ноль.
Так как на кривых охлаждения длина горизонтальной площадки,
соответствующей кристаллизации эвтектики, пропорциональна коли-
честву эвтектики, то это можно использовать для определения концент-
рации компонентов в эвтектической точке. Для этого строится тре-
угольник Таммана. Длины горизонтальных площадок аб, вг, де, жз и
ик (рис. 31, а) откладывают вертикально вниз от изотермы эвтектики
в точках, отвечающих составам систем (рис. 31, б), и пересечение ли-
ний, проведенных через точки м, б, г, е, з, и, л, к, з, дает состав эвтек-
тики.
Процесс охлаждения системы, состав которой 60 % кремния, пока-
зан на диаграмме плавкости (рис. 31, б) стрелками. Кристаллизация
системы начинается при 1408 К. В твердую фазу переходит кремний,
расплав при этом обогащается алюминием. При охлаждении системы
до 1000 К некоторое количество кремния выделилось в виде кристал-
лов. Для определения жидкой и твердой фаз, находящихся в равнове-
сии, применяется правило рычага. Масса кристаллов кремния так от-
носится к массе жидкой фазы, как длина отрезка пр относится к длине
отрезка рс. Если масса системы 2 кг, то
х 60—24
2 — х ~ 100 — 60
х = 0,90 кг.
239
системы л в уравнении
О 20 4(7 во 80 т
МассоВая Воля, °!,
Рис. 32. Диаграмма плавкости
бинарной системы с ограничен-
ной растворимостью компонен-
тов в твердом состоянии
Масса кристаллов кремния 0,90 кг, масса расплава 1,1 кг, состав ко-
торого 24 % кремния. Кристаллизация системы, содержащей 60 %
кремния, закончится при температуре эвтектики 845 К- Состав по-
следней капли расплава соответствует эвтектическому, 10% кремния.
4. Определите теплоту плавления А//пл кремния с помощью диа-
граммы плавкости алюминий — кремний (рис. 31, б).
Решение. Система А1 — Si неизоморфная. Для неизоморфной
(XV.2) равно нулю. Температура на-
чала кристаллизации системы, содержа-
щей 20 % А1, 1593 К- Температура кри-
сталлизации чистого кремния 1693 К.
Понижение температуры кристаллиза-
ции
ДТ= 1693 —1593=100 К.
Определим молярную долю А1 в системе:
20/27
„ -----------------=0,206.
А1 20/274-80/28
По уравнению (XV.2)
0,206-8,3143-16932
А«пЛ- =
= 49,091 -10s Дж/моль.
Полученная теплота плавления прибли-
женная, так как концентрация кремния
достаточно высокая.
5. Проанализируйте диаграмму плавкости системы с ограниченной
растворимостью компонентов В — Ав твердом состоянии (рис. 32).
Проследите за изменением фазового состояния при охлаждении систе-
мы, содержащей 90 % компонента А.
Решение. Рассмотрим фазовое состояние систем, характеризу-
ющихся точками в разных областях диаграммы. В области I все систе-
мы гомогенные, одна жидкая фаза. Фаза одна, компонентов два, термо-
динамических степеней свободы f с учетом того, что давление не влияет
на фазовое равновесие (п = 1), будет
/усл = К-Ф + п=2-1 + 1=2.
Можно менять как состав, так и температуру. В областях II и ///сис-
темы гетерогенные. В равновесии находятся две фазы, твердый раствор
и расплав. Состав жидкого раствора определяется по верхней кривой
ликвидуса, состав твердого раствора — по нижней кривой солидуса:
f усл = 2—2-f-1 = 1.
Можно менять только состав системы (в известных пределах). В об-
ластях IV и V системы гомогенные. Фаза одна, твердая, твердый раст-
240
вор. В области IV — раствор А и В, в области V — раствор В в А;
/усл = 2.
В области VI система гетерогенная, две твердые фазы находятся в
равновесии, /усл = 1. Однако следует учитывать, что равновесие в
твердых фазах устанавливается медленно, поэтому обычно кривые со-
ставов твердых растворов на диаграммах плавкости вычерчивают
пунктиром. В точке э в равновесии находятся две твердые фазы, два
твердых раствора и жидкий расплав. Система гетерогенная, фазы три,
^усл 0.
Проследим процесс охлаждения системы, содержащей 90 % А, и
изменение фазового состояния системы в процессе охлаждения. При
охлаждении системы до температуры 7\ фаза одна — жидкий расплав.
При температуре Т\ появляется первый кристалл твердого раствора,
состав которого определяется точкой с. Из расплава в твердую фазу
преимущественно уходит компонент А, состав твердого раствора бога-
че компонентом А, чем расплав. Отсюда состав расплава меняется по
кривой ab. Вместе с изменением состава жидкого расплава меняется и
температура кристаллизации и состав твердого раствора. Состав твер-
дого раствора меняется по кривой cd. Кристаллизация закончится,
когда состав твердого раствора будет соответствовать составу жидкого
расплава исходного состава системы при температуре Т.2. Состав по-
следней капли жидкого расплава определяется составом точки Ь. Далее
происходит охлаждение твердого раствора. При температуре Т3 по-
является вторая твердая фаза, состав которой определяется точкой е.
При дальнейшем охлаждении системы происходит изменение составов
твердых растворов, как это показано стрелками на диаграмме. Измене-
ние составов твердых растворов происходит чрезвычайно медленно.
Кривые на диаграмме плавкости соответствуют равновесным концент-
рациям.
6. Проанализируйте фазовое состояние неизоморфной системы, ком-
юненты которой образуют устойчивое химическое соединение. Диа-
'рамма плавкости приведена на рис. 33. Проведите анализ процесса
нагревания двух бинарных систем: А — АЖВУ и АХВУ — В.
Решение. Эту диаграмму плавкости можно рассматривать как
две независимые диаграммы плавкости двух бинарных систем: А —
— АхВу и АжВу — В. Закроем сначала полоской бумаги часть диаграм-
мы плавкости от АХВУ до В и мысленно сопоставим ее с диаграммой
плавкости неизоморфной системы с простой эвтектикой (см. рис. 31,6).
Повторим операцию, закрыв полоской бумаги часть диаграммы от А до
Ад-Ву.
В области I (рис. 33) все системы гомогенные. Фаза одна, жидкий
расплав; fycn = 2. В области II — системы гетерогенные. В равнове-
сии находятся две фазы: расплав и кристаллы компонента A; f = 1-
В областях III и IV системы гетерогенные, в равновесии находятся две
фазы: жидкий расплав и кристаллы химического соединения АхВа;
/усл = 1. В области V системы гетерогенные. В равновесии находят-
ся две фазы: жидкий расплав и кристаллы В; fycsl = 1. В области VI
241
системы гетерогенные. В равновесии находятся две фазы, кристаллы
А и кристаллы химического соединения fycn = 1. В области
VII системы гетерогенные. В равновесии находятся две твердые фазы,
кристаллы химического соединения АжВв и кристаллы В; /усл = 1.
Вточкахэ1иэ2 системы гетерогенные. В равновесии находятся три
фазы. Две твердые и одна жидкая; /усл = 0.
Проанализируем процесс нагревания системы состава ах. При на-
гревании системы до температуры 7\ изменения фазового состояния не
наблюдается. Нагревание кристаллов А и A^Bj, отражено на диаграм-
АЮО
О
во 60 40 20 0
20 40 60 80 100В
Массовая Золя, %
Рис. 33. Диаграмма плавкости
иеизоморфиой двухкомпоиеит-
иой системы; вещества образу-
ют устойчивое химическое сое-
динение
Массовая Золя, 7„
Рис. 34. Диаграмма плавкости
иеизоморфиой двухкомпоиент-
иой системы; вещества образу-
ют неустойчивое химическое
соединение
ме плавкости стрелками на ординатах А и АжВв. При температуре Т
начинается плавление системы. На кривой нагревания должна наблю-
даться температурная остановка, так как эвтектика плавится. Состав
твердой и жидкой фаз не меняется, температура остается постоянной,
пока не расплавится вся эвтектика. Далее происходит плавление кри-
сталлов химического соединения АжВв. При этом происходит измене-
ние состава жидкой фазы. Состав твердой фазы остается неизменным:
АжВв. В связи с изменением состава жидкой фазы меняется температу-
ра плавления. При температуре Т2 состав жидкой фазы становится
равным ах, т. е. равным составу исходной системы. При этой темпера-
туре расплавится последний кристалл АжВв. Далее будет происходить
нагревание жидкого расплава без изменения фазового состояния
системы.
По характеру максимума, отвечающего температуре плавления хи-
мического соединения, можно судить о его устойчивости при температу-
ре плавления. Смещение равновесия реакции АжВв =₽* хА + уВ впра-
во ведет к снижению температуры плавления, и максимум на диа-
грамме плавкости становится менее острым. Наоборот, при условии, ког-
242
да равновесие смещено в сторону образования химического соединения,
максимум на диаграмме плавкости получается острым.
7. Проанализируйте фазовое состояние системы, состоящей из
двух неизоморфно кристаллизующихся компонентов, образующих не-
устойчивое химическое соединение (рис. 34). Проследите изменение фа-
зового состояния системы в процессе нагревания.
Решение. Определим сначала фазовые состояния систем в раз-
личных областях диаграммы. В области / все системы гомогенные. Од-
на жидкая фаза, расплав; /усл = 2. В области II системы гетероген-
ные. В равновесии находятся кристаллы компонента А и расплав;
/усл = 1- В области III системы гетерогенные. В равновесии находят-
ся расплав и кристаллы неустойчивого химического соединения АЖВИ;
/усл = 1- В области IV системы гетерогенные. В равновесии.находят-
ся кристаллы В и расплав; /усл = 1. В области V все системы гетеро-
генные. В равновесии находятся две твердые фазы, кристаллы компо-
нента В и кристаллы химического соединения АЖВИ. При температурах
ниже 7\ химическое соединение становится устойчивым; /усл = 1.
В области VI все системы гетерогенные. В равновесии находятся кри-
сталлы А и A^Bj,; /усл = 1. В точке э сосуществуют в равновесии три
фазы. Две твердые, кристаллы А, кристаллы АЖВУ и расплав; /усл=0.
В точке р в равновесии три фазы, кристаллы В, кристаллы соедине-
ния A^Bj,, которое становится устойчивым при температуре плавления
Л, и расплав; /усл = 0.
Проследим процесс нагревания системы, состав которой ах. До
температуры Т2 система находится в кристаллическом состоянии.
В равновесии находятся кристаллы А и кристаллы химического соеди-
нения AxBj,. При температуре Тг происходит плавление эвтектики со-
става э. Составы жидкой и твердой фаз остаются неизменными, пока не
расплавится вся эвтектика. Отсюда температура на кривой охлажде-
ния не меняется. Далее начинается плавление кристаллов AJBj,. При
этом состав жидкого расплава меняется. Состав твердой фазы остается
неизменным. При температуре 7\ химическое соединение становится не-
устойчивым. Оно разлагается на кристаллы В и расплав. Так как си-
стема становится при температуре 7\ безвариантной, то на кривой на-
гревания наблюдается температурная остановка. После исчезновения
последнего кристалла химического соединения AJBj, начинается плав-
ление кристаллов компонента В. Состав расплава вновь начинает ме-
няться, меняется и температура плавления системы. При температуре
Тз состав расплава становится таким же, как и состав исходной сис-
темы di. При этой температуре исчезает последний кристалл компонента
В, система становится гомогенной и при дальнейшем нагревании ее
фазовое состояние не меняется. Процесс нагревания и связанный с ним
процесс изменения фазового состояния системы на диаграмме плавкости
показаны стрелками.
8. Определите фазовое состояние системы и соотношение масс фаз,
если 1 кг системы состава а2 (рис. 34) нагреть до температуры 7’4. Ве-
щества А и В — элементы с атомными массами 197 и 121,8. Неустой-
243
чивое химическое соединение АВ3 содержит 80 % В (состав, соответ-
ствующий точке а2)
Решение. Система гетерогенная. Она состоит из кристаллов хи-
мического соединения и кристаллов В. Соотношение масс твердых фаз
определяем по правилу рычага. Для этого сначала определим состав
АВ3 в процентах:
к>АВз =3-121,8/(197,04-3-121,8) 100 = 64,97% В.
По правилу рычага
тв^тдв, =я^/?пп = (100 — 80)/(80—64,97)= 1,33.
Так как общая масса системы 1 кг, то данное соотношение преобразует-
ся:
х 1,33
------= 1,33: ттв = х =--= 0,57 кг; т.„ =0,43 кг.
1 —X ’ - ТВ 2,33 АВ,
ЗАДАЧИ
1. По характерным точкам на кривых охлаждения вычертить диа-
грамму плавкости системы медь — никель:
Ni, % 0 20 40 60 80 100
Температура начала кристалли- зации, к . . . . ‘. 1373 1467 1554 1627 1683 1728
Температура конца кристалли- зации, к 1373 1406 1467 1543 1629 1728
На диаграмме плавкости обозначьте точками: а — чистую твердую
медь в равновесии с расплавом меди; б — жидкий расплав, содержа-
щий 45 % Ni в равновесии с твердым раствором; в — твердый раствор,
содержащий 65 % Ni в равновесии с жидким расплавом; г — жидкий
расплав, содержащий 50 % Ni при температуре 1670 К. Определите
для системы, содержащей 30 % Ni, температуру начала кристаллиза-
ции, состав первого кристалла твердого раствора, массу Ni в жидком и
твердом состояниях при охлаждении 0,24 кг смеси, содержащей 30 %
Ni, до 1470 К; температуру кристаллизации последней капли жидкого
расплава, состав последней капли жидкого расплава.
2. Вычертите диаграмму состав — температура плавления для сис-
темы хлорид серебра — хлорид натрия по характерным точкам на кри-
вых охлаждения:
Молярная доля AgCl, % • 0 20 40 60 80 100
Температура начала кристалли- зации, 1\ Температура конца кристалли- зации, К 1073 1004 941 869 788 728
1073 952 848 735 742 728
На диаграмме обозначьте точками следующие состояния системы:
а — чистый твердый хлорид серебра, находящийся в равновесии с рас-
плавом хлорида серебра; б — жидкий расплав с молярной долей AgCl
244
55 % при 1000 К; в — жидкий расплав с молярной долей AgCl 70 %,
находящийся в равновесии с твердым раствором; г — твердый раствор
с молярной долей AgCl 45 %, находящийся в равновесии с жидким
расплавом; д — твердый раствор с молярной долей AgCl 30 % при
750 К.
3. По кривым охлаждения системы кадмий — висмут (рис. 35)
постройте диаграмму плавкости. Обозначьте точками состояния си-
стем; а — чистый висмут в равновесии с расплавом висмута; б — жид-
кий расплав при 573 К, содержащий 30 % Cd; в — расплав, со-
Рис. 35. Кривые охлаждения
системы Cd—Bi:
1 — 0% Bi; 2 — 20% Bi; 3 — 40% Bi;
4-60% Bi; 5 — 80% Bi; 5 — 100%
Bi
Массовая доля, %
Рис. 36. Диаграмма плавкости двух-
компоиентиой системы Ag—Си с ог-
раниченной растворимостью компо-
нентов в твердом состоянии
держащий 15 % Cd в равновесии с кристаллами Bi; г — равновесную
систему, состоящую из твердого Cd и расплава, в котором содержится
4/5 Cd и 1/5 Bi; д — жидкий расплав, содержащий оба металла в рав-
новесии с твердыми Cd и Bi.
4. По характерным точкам на кривых охлаждения постройте диа-
грамму плавкости для системы хлорид серебра— хлорид калия:
AgCl, % 0 20 40 60 80 100
Температура начала кристалли- зации, К 1055 958 837 688 630,6 728
Температура конца кристалли- зации, к 1055 584 584 584 584 728
Сколько хлорида калия надо добавить к 1,7 кг хлорида серебра, что-
бы понизить температуру начала плавления до 650 К?
5. По диаграмме плавкости системы серебро — медь определите,
в каком фазовом состоянии находятся системы, обозначенные на рис.
36 точками а, б, в, г, д, е, ж, з.
6. По характерным точкам на кривых охлаждения постройте диа-
грамму плавкости для системы иодид натрия — фторид натрия, ис-
245
пользуя данные из справочника [M.J. Что будет происходить с твер-
дой системой, которая содержит 0,4 кг NaF и 0,6 кг Nal, если ее на-
греть до 670, 899, 950, 1033 и 1200 К?
7. Постройте диаграмму фазового состояния системы фенол — вода
по массовой доле равновесных фаз:
1) вода насыщена фенолом до концентрации сь фенол насыщен
водой до концентрации с2:
т, К . . . . . 280 300 320 335 335 338 341,8
% . . . . 7,9 8,8 11,4 15,5 18,5 22,0 35,9
С2, % . . . . 75,1 70,5 64,0 58,3 54,0 49,5 35,9
2) твердый фенол в равновесии с раствором:
Т, К................ 280 290 300 314
с, % .... 84,0 91,5 95,3 100
Первая инвариантная точка около 272,1 К: лед, фенол, раствор. Вто-
рая инвариантная точка 274,5 К: фенол, два раствора. Поясните по-
лученную диаграмму. Определите фазовое состояние систем в каждой
области диаграммы. Определите состав и число фаз в смеси, содержа-
щей 0,03 кг фенола и 0,07 кг воды при 300 К- Обозначьте точками: а—
гомогенный раствор, содержащий 80 % фенола при 320 К; б — систе-
му, содержащую 50 % фенола, разделяющуюся на два несмешивающих-
ся раствора, содержащих один 9,5, другой 69,0 % фенола; в — гомо-
генный раствор, содержащий 5 % фенола при 320 К- Что будет проис-
ходить с каждой из указанных систем, если к ним постепенно добавлять
фенол? Растворы, содержащие один 20, а другой 60 % фенола, имеют
температуру 340 К- До какой температуры надо охладить каждый из
них, чтобы вызвать расслоение системы?
8. Определите число условных термодинамических степеней свобо-
ды систем при заданных температуре и составе. Диаграммы плавкости
приведены в справочнике [M.J.
Система .... AgCl—NaCl AgCl—NaCl AgCl—NaCl
T, К............. 1073 873 —
Состав, % ... 50 50 —
Точка на диаграм-
ме ............. а
Система..................... КВг—CuBr
Т, К........................ —
Состав, %................... —
Точка на диаграмме .... е
Al—Si Al—Si
973 1373
30 50
Na—К
9. По диаграмме плавкости системы КВг — СпВг, приведенной в
справочнике [М.], определите количество твердой и жидкой фаз, если
систему с молярной долей CuBr 20 % нагреть до 773 К. Общая масса
системы 2 кг. Определите массу CuBr и КВг в жидкой и твердой фа-
зах, если 2 кг системы с молярной долей CuBr 20 % нагреть до 773 К-
246
Определите количество компонента, который следует добавить к систе-
ме, чтобы она изотермически расплавилась.
10. Представьте кривые охлаждения для системы Na — К, исполь-
зуя диаграммы плавкости в справочнике [M.J, если молярная доля
CuCl (%): 0; 21; 40; 60; 80; 100.
МНОГОВАРИАНТНАЯ ЗАДАЧА
На основании температур начала кристаллизации двухкомпонент-
ной системы: 1) постройте диаграмму фазового состояния (диаграмму
плавкости) системы А — В; 2) обозначьте точками: /—жидкий расплав,
содержащий а % вещества А при температуре 7\; II — расплав, со-
держащий а % вещества А, находящийся в равновесии с кристаллами
химического соединения; /// — систему, состоящую из твердого ве-
щества А, находящегося в равновесии с расплавом, содержащим b %
вещества А; IV — равновесие фаз одинакового состава; V — равно-
весие трех фаз; 3) определите состав устойчивого химического соеди-
нения; 4) определите качественный и количественный составы эвтек-
тик; 5) вычертите все типы кривых охлаждения, возможные для дан-
ной системы, укажите, каким составам на диаграмме плавкости эти
кривые соответствуют; 6) в каком фазовом состоянии находятся систе-
мы, содержащие с, d, е % вещества А при температуре TJ Что про-
изойдет с этими системами, если их охладить до температуры Тг?
7) определите число фаз и число условных термодинамических сте-
пеней свободы системы при эвтектической температуре и молярной до-
ле компонента А 95 и 5 %; 8) при какой температуре начнет отверде-
вать расплав, содержащий с % вещества А? При какой температуре
он отвердеет полностью? Каков состав первых кристаллов? 9) при ка-
кой температуре начнет плавиться система, содержащая d % вещества
А? При какой температуре она расплавится полностью? Каков состав
первых капель расплава? 10) вычислите теплоты плавления веществ
А и В; И) какой компонент и сколько его выкристаллизуется из сис-
темы, если 2 кг расплава, содержащего а % вещества А, охладить от
Л до Т2?
№ вари- анта Системы Молярная доля А, % Температура начала кри- сталлиза- ции, к Молярная доля А, % Температура начала кри- сталлиза- ции, К
1 A—KCI 0 512 40 460
В—SnCl2 5 507 45 481
10 496 50 497
15 479 52,5 583
20 477 55 658
25 481 70 853
30 478 80 952
35 473 100 1050
247
Продолжение табл.
Продолжение табл.
Ne вари- анта Системы Молярная доля А, % Температура начала кри- сталлиза- ции, к Молярная доля А, % Температура начала кри- сталлиза- ции, К
2 A—KCI 0 769 45 693
В—РЬС12 10 748 50 703
20 713 55 733
25 701 65 811
30 710 75 893
33,5 713 90 1003
40 707 100 1048
3 А-КС1 0 923 50 769
В—МпС1а 8 895 60 731
15 865 65 705
25 815 66 701
34 745 75 705
36 722 85 925
38 735 100 1047
40 747
4 A—LiCO3 0 1133 50 788
в-к2со3 9 1055 54,5 778
20 955 62 765
33 765 66,6 798
39,5 773 83,5 911
44,2 778 100 983
5 A—MgSO4 0 1294 55 1048
В —Cs2SO4 10 1241 60 1053
20 1193 63 1098
30 1116 65 1113
40 1013 70 1163
45 953 80 1238
47 969 90 1323
50 999 100 1397
A—Li2SO4 0 1293 65 983
6 В—Cs2SO4 10 1216 75,5 903
20 1113 77,5 906
25 1063 30 910
31 953 85 905
35 963 89,5 893
40 1003 90 910
50 1011 95 1055
55 1007 109 1129
7 A—KI 0 658 53 504
В—Cdl2 10 643 55 515
30 596 60 575
45 520 65 656
47 470 80 833
49 468 100 951
№ вари- анта Системы Молярная доля А, % Температура начала кри- сталлиза- ции, К Молярная доля А, % Температура начала кри- сталлиза- ции, к
. 8 A—CsCl 0 1147 50 1180
В—CsCl2 10 1124 60 1158
15 1089 70 1071
20 1059 80 877
25 1102 85 862
35 1155 95 875,8
40 1166 100 876,8
9 A—CsCl 0 1147 55 696
В—SrCl2 10 1089 65 896
20 1004 70 827
30 906 75 853
40 964 80 879
45 975 90 960
50 978 100 999
10 A —KCI 0 1043 40 1027
В—СаС12 5 1023 45 1015
10 978 55 961
18,5 911 ь7 873
20 828 70 899
25 980 90 1021
35 1022 100 1049
11 A—CuCl 0 912 65 542
В—CsCl 10 868 66,6 547
20 814 70 541
35 645 75 521
45 571 80 541
50 549 90 623
60 533 100 695
12 A—CdCl2 0 702 50 699
В— Т1С1 10 656 57,5 697
20 604 67,5 673
28 572 80 754
30 . 589 85 777
36,5 645 95 823
47 694 100 841
13 А—SrBr2 0 1003 57 832
В—КВг 10 972 66,7 847
25 872 75 843
29 829 82 835
33,3 832 85 851
40 826 95 897
50 807 100 916
248
249
Продолжение табл.
№ вари- анта Системы Молярная доля А, % Температура начала кри- сталли- зации» к Молярная доля А, % Температура начала кри- сталли- зации, к
14 A—FeCl3 0 1073 53 983
В —NaCl 13,3 1052 61,6 753
22,2 1033 66,8 680
35,8 989 74,6 641
37,6 975 80,6 622
40 983 81,6 642
47 999 84,8 697
50,6 1003 100 859
15 A—FeCL 0 702 35 525
B-T1CI 10 658 37 506
22 598 45 533
26 535 52 553
29 549 62 560
33 563 100 585
16 A—NiF2 0 1121 23,8 1212
В—KF 4,9 1099 26 1224
9,2 1060 30,3 1289
13,4 1120 37,9 1359
15,2 1141 46,7 1397
18,4 1168 50,5 1403
21,8 1193 58 1391
17 A-KI 0 685 45 618
В—РЫ2 10 668 50 622
20 640 55 651
25 622 60 695
30 579 70 773
31 594 80 858
35 603 90 914
40 610 100 959
18 А—SrBr2 0 825 50 768
В —LiBr 5 813 54 773
20 772 66,6 803
30 736 85 865
34 720 100 916
40 744
19 A—NiNO3 0 585 50 464
В— RbNOg 10 535,5 60 457,6
20 489 65 449
22 479 70 567
32,5 424 80 598
36 438 90 519,5
40 449,5 100 527
250
Продолжение табл.
№ ва- рианта Системы Молярная Доля А, % Температура начала кри- сталли- зации, К Молярная доля А, % Темпер атура начала кри- сталли- зации, К
20 A—MgCl2 0 708 50 767
В—TiCI 5 698 66,6 796 ,
15 682 75 658
28 635 90 950
33,3 685 100 991
<
21 A—MgCl2 0 991 36,2 759
В—RbCl 17,5 868 37,5 784
22,7 800 43,8 816
23,7 764 50 823
25,9 746 58,1 809
28 736 65 783
29 732 68,3 821
30,4 743 78,7 898
33,1 749 100 984
35,5 754
22 А—МпС12 0 999 45 793
В—RbCl 15 879 50 799
22 813 55 797
27 749 65 755
30 741 68 733
32 733 70 743
35 713 80 803
40 767 100 923
23 A—MgSO4 0 1349 63,9 1200 ,
в—k2so4 10 1308 66,8 1203
20 1236 71 1193
30 1123 75,3 1177
40 1019 82,3 1247
50 1103 100 1397
24 А—РЬС12 0 708 50 680
В —Т1С1 10 679 60 705
15,5 661 66,6 708
20 675 70 707
25 680 75 700
30 676 80 720
. 36,5 650 90 , 752
40 658 100 773
251
Продолжение табл.
№ ва- рианта Системы Молярная доля А, % Температура. начала кри- сталли- зации, к Молярная доля А. % Температура начала кри- сталли- зации, К
25 A—NaCl 0 595 35 623
В—ZnCl2 5 586 46 683
10 577 52,5 769
15 573 58 813
25 543 67,7 882
27 535 100 1073
30 569
№ ва- рианта Л. К а Ь С d е Г,. К № ва- рианта Л,К а Ь S d е г2, К
1 493 45 75 5 25 75 463 14 1033 45 95 10 45 75 983
2 753 30 75 5 25 75 703 15 673 30 50 5 30 50 543
3 873 40 80 10 40 80 733 16 1273 15 — 5 20 40 1113
4 923 40 75 10 40 86 768 17 773 40 75 10 40 80 603
5 1173 55 90 10 40 72 1123 18 873 50 80 10 50 90 753
6 1173 40 85 10 40 95 973 19 523 40 75 10 40 95 443
7 723 55 75 10 40 70,5 . 503 20 923 50 80 10 50 85 703
8 1173 35 90 10 50 75 1093 21 873 40 90 10 50 75 793
9 1073 35 85 5 35 85 923 22 873 30 95 10 40 60 733
10 1023 25 75 5 35- 85 923 23 1273 50 90 10 30 85 1073
11 773 55 80 10 25 60 533 24 723 50 85 10 50 75 673
12 773 42 80 10 40 90 643 25 723 35 60 10 20 60 583
13 973 60 90 10 50 75 833 50
ГЛАВА XVI
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В ТРЕХКОМПОНЕНТНЫХ
СИСТЕМАХ, СОДЕРЖАЩИХ ЖИДКУЮ И ТВЕРДУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 400—402, 405 — 407, 420—423]
Точка на плоскости равностороннего треугольника отражает сос-
тав трехкомпонентной системы. Если из точки Р (рис. 37, а) опустить
перпендикуляры на стороны треугольника, то сумма этих отрезков рав-
на высоте треугольника, которая принимается за 100 % (метод Гиб-
бса). Точка на плоскости равностороннего треугольника отражает со-
став трехкомпонентной системы. Если из точки Р (рис. 37, б) провести
прямые, параллельные основаниям треугольника, то сумма их равна
252
стороне треугольника, которая принимается за 100% (метод Розе-
бума). Вершины треугольника соответствуют чистым компонентам
(характерные точки).
Двухкомпонентные системы отражаются на соответствующих сторо-
нах равностороннего треугольника. Линии, параллельные стороне тре-
угольника, являются геометрическим местом точек, соответствующим
системам с постоянным содержанием компонента, против которого ле-
жит сторона треугольника. Прямые, проведенные из вершины треу-
гольника до пересечения с противоположной стороной, являются гео-
Рис. 37. Изображение составов трехкомпонентнон системы ме-
тодом Гиббса (д) и методом Розебума (б)
метрическим местом точек, соответствующих системам, в которых отно-
шение двух компонентов остается постоянным и равным отношению от.
резкое, на которые делится сторона треугольника (характерные ли.
нии).
Пусть общий состав двухкомпонентной системы отражается точкой
Р (рис. 37, а), состав первой фазы (I) отражается точкой М, состав вто-
рой (II) фазы — точкой А. Тогда, если массовый состав выражен в про-
центах, то
(XVI.1)
где т} и тп — масса первой и второй фаз. Если молярный состав вы-
ражен в процентах, то
nj/nj^VP/PAf, (XVI.2)
где nj и п1( — число молей первой и второй фаз.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Проанализируйте фазовое состояние неизоморфной трехкомпо-
нентной системы АВС (рис. 38), а также процесс охлаждения системы
состава, отраженного на диаграмме точкой 1.
253
Решение. Выше поверхностей adgf, bdge и cfge все системы го-
могенные— жидкий расплав. Поверхность adgf отражает состав расп-
лава, находящегося в равновесии с кристаллами компонента А. Поверх-
ность bdge отражает состав расплава, находящегося в равновесии с кри-
сталлами компонента В. Поверхность cfge отражает состав расплава,
находящегося в равновесии с кристаллами компонента С. Линии пере-
сечения поверхностей dg, fg и eg отражают составы расплавов, находя-
щихся в равновесии с кристаллами двух
компонентов. Линия dg — в равновесии
находятся расплав и кристаллы А и В,
линия eg — в равновесии находятся
расплав и кристаллы В и С, линия
fg — в равновесии находятся расплав и
кристаллы А и С. В точке g пересече-
ния линий dg, eg и fg в равновесии
находятся расплав и кристаллы трех
компонентов А, В и С. Точки d, е и f
эвтектики двухкомпонентных систем.
Ниже точки g — тройной эвтектики —
все системы гетерогенные, три твердые
фазы.
Проследим изменение фазового со-
стояния системы при ее охлаждении.
При охлаждении системы до температу-
ры 7\ система гомогенная, одна жидкая
фаза. При температуре Тг начинается
кристаллизация компонента А (точка 2).
Так как из расплава в твердую фазу вы-
деляется только компонент А, то соот-
ношение концентраций компонентов В
и С в жидком расплаве не меняется.
На плоском треугольнике основания
призмы такой процесс отражается ли-
нией Г—3'. Состав расплава меняется по линии 2—3. В точке 3
Расплав становится насыщенным не только компонентом А, но и компо-
нентом В. Точка 3 соответствует температуре Т3. При этой темпе-
ратуре из расплава начинает кристаллизоваться совместно с компо-
нентом А компонент В. Состав расплава меняется по линии 3—g.
На плоском треугольнике этот процесс отражается также линией
$ — g', Тройная эвтектика (точка g) находится при температуре 7’4.
При температуре Ti вся система кристаллизуется и будет гетероген-
ной, трехфазной. При дальнейшем охлаждении системы охлаждаются
кристаллы компонентов А, В и С, что отражено на диаграмме стрел-
ками на ребрах призмы. Весь процесс охлаждения системы на рис. 39
отражен стрелками.
2. Определите массу компонента А (рис. 38, точка !)_, который вы-
делится в твердую фазу из 1 кг системы, если ее состав охлажден до
в
Рис. 38. Диаграмма плавкости
иеизоморфиой трехкомпснент-
иой системы
254
NttCL
tyj е2 КС1
Рис. 39. Изотермическое сечение
диаграммы фазового состояния
системы NaCl—КС1—Н2О
температуры Т2. Проекция изотермы Т2 на основание призмы делит
отрезок Г — 3' в соотношении 13<4. Массовый состав выражен в про-
центах.
Решение. Для определения соотношения массы жидкой и твер-
дой фаз применим правило рычага:
тТв (1—ттв) =4/13 = 0,308; тГв = 0,308—0,308 mTB; ттв=0,235 кг.
Так как из системы состава, изображенного точкой /, в твердую фазу
выделяется только компонент А, то масса кристаллов компонента А при
температуре Т2 tyjsjtr 0,235 кг. Масса
оставшегося расплава будет 0,765 кг.
3. Система NaCl — КС1 — Н2О
неизоморфная. Между компонентами
не образуется химических соединений.
Исходная система состоит из 10 кг
КС1, 20 кг NaCl и 70 кг Н2О. Раство-
римости в воде при 373 К КС1 —
56,2 кг, NaCl — 39,4 кг в 100 кг раст-
вора. Совместная растворимость
27,39 кг NaCl + 35,16 кг КС1 в
100 кг раствора. 1. Постройте диа-
грамму фазового состояния системы,
считая линии растворимости прямы-
ми. 2. Определите массу испарившей-
ся воды и состав раствора до начала
кристаллизации. 3. Какая соль, NaCl
или КС1, начнет кристаллизоваться из раствора при изотермическом
испарении воды из исходной системы? 4. Какое количество воды ис-
парится до начала кристаллизации обеих солей? 5. Сколько килограм-
мов NaCl и КС1 выделится из системы в твердую фазу, если из систе-
мы испарить 95 % воды, содержащейся в исходной системе?
Решен не. На основании заданных составов исходной системы,
двойных эвтектик NaCl — Н2О и КС1 — Н2О и тройной эвтектики
NaCl — КС1 — Н2О и на треугольную плоскую диаграмму наносим со-
ответственно точки ръ е}, е2 и ея. Соединим прямыми ег и еэ, е2 и е3
(рис. 39). Так как из раствора, состав которого на диаграмме фазового
состояния отражен точкой plt испаряется только вода, то соотношение
NaCl и КС1 в системе остается при этом без изменения. Процесс испаре-
ния отражается продолжением линии, соединяющей точку рг с верши-
ной треугольника Н2О, т. е. линией рг — р2. В точке р2 раствор стано-
вится насыщенным NaCl и начинает кристаллизоваться. Определим,
сколько воды испарится в процессе, отраженном на диаграмме
линией Pi — р2. Определим состав точки р2:16,5 % КС1, 33,5 % NaCl
и 50% Н2О. Рассчитаем массу воды в системе, соответствующей
точке р2: для состава р2(10 + 20) кг соли составляют 50zo ,
а х кг воды составляют остальные 50 %. Откуда х = 30 кг.
Таким образом, в системе состава р2 после испарения во-
255
ды останется 10 кг КО, 20 кг NaCl и 30 кг Н2О. Из системы испари-
лось 40 кг воды до начала кристаллизации NaCl. Так как из системы в
твердую фазу будет выделяться NaCl по мере испарения воды, то состав
системы будет обогащаться КО. Этот процесс изобразится линией р2—
р3. В точке е3 начнется совместная кристаллизация и NaCl, и КС1.
Определим массу воды, испарившуюся из системы до начала кристал-
лизации обеих солей. Так как из раствора кристаллизуется только
NaCl (линия pj — /%), то весь КС1 остается в растворе. В точке
е3 массовая доля NaCl — 27,39 %, КС1 —35,16 % и Н2О—37,45 %.
10 кг КО в растворе состава е3 составляют 35.16 %
х * Я«О » » » е3 » 37,45 %
Отсюда .v--10,65 кг Н2О останется в растворе. Испарится воды
70—10,65 = 59,35 кг.
Чтобы определить массы NaCl и KCI, которые выкристаллизуются
из системы при испарении из нее 95 % воды, рассчитаем состав полу-
ченной системы. Общий состав будет 10 кг КС1, 20 кг NaCl и 70-0,05=
= 3,50 кг Н2О, а массовая доля будет (%): КС1 — 29,85; NaCl — 59,70;
Н2О — 10,45. На диаграмме этот состав изобразится точкой р3.
Соединим линией точку е3 с р3 и продолжим эту линию до пе-
ресечения с основанием треугольника NaCl — КО. Получим
точку г. Масса солей, выделившихся в твердую фазу, так относится
к массе всей системы, как длина отрезка р-р3 относится к длине отрез-
ка ге3, что соответствует 0,702. Общая масса системы составляет
33,5 кг. Масса твердой фазы 33,5-0,702 = 23,52 кг, масса оставшегося
раствора 33,5 —23,52 = 9,98 кг.
Состав твердой фазы определяется на диаграмме точкой г, соответ-
ствующей 73 % NaCl и 27 % КС1. В твердой фазе будет 17,17 кг NaCl
и 6,35 кг КО. Раствор имеет состав тройной эвтектики. Масса раство-
ра 9,98 кг. Он содержит 2,80 кг NaCl, 3,68 кг КС1 и 3,50 Н2О. При ис-
парении всей воды, содержащейся в исходном растворе, состав системы
будет отражаться на диаграмме точкой s.
ЗАДАЧИ
1. Система состоит из солей S, и SH с одноименным ионом и воды.
Состав системы (%): S] — 20; Sn — 25; Н2О — 55. Составы эвтектики;
S] Н2О, Sn Н2О содержат 60 % и 50 % S соответственно. Состав
тройной эвтектики (%); S, — 50; Sn — 25; Н2О — 25. Начертите
изотермическое сечение диаграммы фазового состояния при темпера-
туре выше температуры кристаллизации воды, но ниже температуры
кристаллизации двойной эвтектики соль — соль. Проследите процесс
изотермического испарения воды из системы.
2. Проследите на диаграмме фазового состояния системы, состоя-
щей из двух солей с одноименным ионом Sb Sn и Н2О, изотермическое
испарение воды из раствора, содержащего 15 % Sj, 25 % Sn и 60 %
Н2О. Растворимость соли S] в воде 45%, а соли Sn 50 %. Совместная
растворимость солей S| и Sn 40 и 25 % соответственно. Изображая ли-
256
нии растворимости прямыми, определите, какая соль начнет кристал-
лизоваться первой из системы при изотермическом испарении воды,
какое количество воды надо испарить из 1 кг указанной системы до на-
чала появления первого кристалла, какое количество воды надо ис-
парить до начала совместной кристаллизации солей SH и S2?
3. На основании изотермического сечения диаграммы фазового сос-
тояния системы Т12С12 — TI (NO3)2 — T12SO4? которая приведена в
справочнике [М.], определите массу T12SO4, выкристаллизовавшуюся
из системы, состоящей из 20 % Т12С12, 20% Tl2 (NO3)2 и 60% T12SO4,
при охлаждании ее до 400° С.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Трехкомпонентная система Н2О — А — В, где А и В — соли, не
образующие химических соединений между собой и с водой.
1. По заданным значениям концентраций эвтектик соль — вода и
сройной эвтектики вычертите диаграмму изотермического сечения
тистемы при температуре выше температуры плавления воды, но ниже
температуры эвтектики соль — вода.
2. Нанесите на диаграмму точку р, соответствующую составу ис-
ходной системы.
3. Какая соль и в каком количестве выделится из 1 кг системы при
изотермическом испарении воды в чистом виде?
4. Определите массу солей, А и В, которая будет выделена в твердую
фазу при испарении из системы 90 % воды, содержащейся в исходной
системе?
5. Рассчитайте соотношение солей А: В в твердой фазе после испа-
рения из системы 90 % воды.
[ № вари- 1 | анта j Массовая доля системы в точке р, % Массовая доля эв- тектик, % Массовая доля; тройной эвтектики, % Хе вари- I анта Массовая доля системы в точке р, % Массовая доля эв- тектик, % Массовая доля тройной эвтектики, %
А В А в А В Н,О А В А в А В ' Н2о
1 30 10 70 50 40 30 30 14 20 20 80 60 30 40 30
2 20 10 80 60 40 30 30 15 20 10 60 80 40 30 30
3 10 10 60 80 30 30 40 16 10 30 50 70 40 20 40
4 20 30 50 70 20 50 30 17 10 20 70 50 40 40 20
5 20 20 70 50 20 30 50 18 10 40 80 60 40 40 20
б 20 10 40 50 40 30 30 19 30 • 10 60 80 30 40 30
7 10 30 60 80 30 30 40 20 20 10 50 70 40 40 20
8 10 20 50 70 30 40 30 21 10 10 70 50 50 30 20
9 10 40 70 50 30 30 40 22 20 30 80 60 50 30 20
10 30 10 80 60 30 40 30 24 20 20 60 80 30 30 40
11 20 10 60 80 50 30 20 24 30 10 50 70 50 20 30
12 10 10 50 70 40 30 30 25 10 20 70 50 50 20 30
13 20 30 70 50 40 30 30
9 Зак. 767
257
ГЛАВА XVII
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Основные уравнения и символы
[К., с. 429—437, 446—451; Г., т. 1, с. 261—326]
Закон действующих масс для реакции, записанной в общем виде
VA A + VB В vDD + vE Е (а)
и протекающей в газовой фазе, при условиях, для которых применимы
законы идеального газообразного состояния:
Kc = <dc^e/cva cvb, (XVII. 1)
D Е а в
где С{ — равновесная молярная концентрация i-ro компонента;
Ci = Pi/RT,
(XVII.2)
где Pt — равновесное парциальное давление i-ro компонента:
К,
K^P^E/P^B,
Pi = *iP,
(XVII.3)
(XVII.4)
X D* E
D E
V V
*aAxbB
pvd+ve-va-vb
P E pAv
V. ’
X A-X B
A В
(XVII.5)
гдех, — равновесная молярная доля i-ro компонента в идеальном газо-
образном состоянии; Р — общее давление равновесной смеси; Av—
разность стехиометрических коэффициентов веществ;
Av=2(V;)K0H-2(vi)Ha4. (XVII.6)
i
где vt — стехиометрический коэффициент компонента химической ре-
акции;
2ni ПА + пв+пЕ~Ьпо+Пин
I
где п-i — количество молей i-ro компонента в равновесной смеси; пин—
количество молей инертного газа (газа, не участвующего в химиче-
ской реакции).
Связь между константой равновесия, выраженной через парциаль-
ные давления, и константой равновесия, выраженной через концен-
трации, описывается уравнением
КР = Кс (РТ) Av. (XVII.8)
258
Константу равновесия можно выразить через степень превращения
а. Так, например, для реакции
A4-2B = 2D (б)
КР = [а* (3—a)]/(l—a)8P, аА = ДпА/пА; ав = Апв/«&’ (XVII.9) (XVII. 10)
где ад, «в — доля исходного вещества, претерпевшего превращение
(степень превращения); Дпд, Д«в — количества молей компонентов
А и В, претерпевших превращение;
Дпд = п^—nA; AnB = ng —nB; (XVI1.11)
«X, «в — количества молей веществ А и В в исходном состоянии сис-
темы; пд, «в — количества молей вещества А и В в равновесном состо-
янии системы. Если вещества А и В взяты в стехиометрическом соотно-
шении, то
я«=2л« (XVII. 12)
И ав = 2 (ДпА)/2п^ = аА. (XV1I.13)
Мера протекания реакции (глубина реакции)
— Д т/Ув (XVII.14)
Для реакции (б) В = ДпА/1 = Д лв/2, (XVII.15)
отсюда 5 = а. (XVII.16)
Уравнение изотермы химической реакции Вант-Гоффа для реакции (а)
Pvd pVE
&GpT=RTln------5---!---RTlnKp, (XVII.17)
p A p В
A В
V V
C D с E
AAV r=RTln-----2 5—— RTlnKc, (XVII.18)
’ V
C A г В
A B
где Pa, Рц, Pd, Pe — произвольные парциальные давления исход-
ных веществ и продуктов реакции; сА, сц, св, Се — молярные концент-
рации начальных веществ и продуктов реакции;
\AVT =\Gp>T (XVI 1.19)
— \Gt = — Svjp; — химическое сродство.
Для стандартного состояния системы
\Go=—RT\nKp, (XVII.20)
д А’ = -ЯТ1пКс, (XVII.21)
ДА°У=ДО°, (XVII.22)
9* 259
где — AGr == — Svzp? — стандартное химическое сродство. В СИ
уравнение (XVII.20) принимает вид
bG° (СИ) =л<3т (атм) +Av^7’ln 1,0133.105, (XVII.23)
где ийдексы (СИ) и (атм) указывают, что равновесные давления выра-
жены в паскалях и атмосферах соответственно.
Расчет энергии Гиббса AG298 для реакций при стандартном состоя-
нии и 298 К
А^298 ~ А #<>98 ^8 A
(XVII.24)
где А//298—энтальпия реакции при стандартных условиях и при 298 К;
AS298 — энтропия химической реакции при стандартных условиях
и 298 К.
Расчет энергии Гиббса AG? для реакции квантовостатистическим ме-
тодом
ДО».
I 62—Н« \ д//°
= д | —L_°. + —«.,
\ т I т
(XVII.25)
где I—— приведенная энергия Гиббса; А 77 о— гипотетиче-
ский тепловой эффект реакции при абсолютном нуле в идеальном га-
зообразном состоянии;
Д//» = Д#«.—Д (#£—#«).
(XViI.26)
Величины (Нт — Но) вычисляются квантовостатистическим ме-
тодом.
Расчет энергии Гиббса AG£ для реакции термодинамическим мето-
дом (методом Темкина — Шварцмана):
bG} = bH29S-TbS°298+ j ЬСрйТ — Т j —- d Т. (XVII.27)
298 298 ‘
После подстановки зависимости АСр от температуры, выраженной
уравнением
Д с'
ДС£ = Да + Д6Т + Дс7^+Д(/7’3+—(XVII.28)
в уравнение (XVII. 27) получим
Д 0^. = Д #»98 — Т Д S»98 — Т (Мо Д a + Mj Дй-'г
+ М2 Дс+^зА^ + ^-гАс'). (XVII.29)
Коэффициенты М0, М2, М3 и Л1_2 вычислены и приводятся в спра-
вочниках для ряда температур.
260
Зависимость константы равновесия реакции от температуры выра-
жается уравнением изобары (изохоры) Вант-Гоффа в дифференциаль-
ном виде:
din К/, = ЬН<>
~dT ~RTr ’
d 1пКс _ At/»
dr “ RT*
(XVI 1.30)
(XVII.31)
Уравнения (XVII.30) и (XVII.31) можно проинтегрировать для сле-
дующих условий:
ДЯ°
1) Atf° = const; ДС»=0; 1g /Ср = — „ - -{-const: (XVII.32)
Z, oUZu/\ 1
Д
2) Л 7/°=^ const; ДС£ = const; ДСр = Да; lg Кр (XVII.33)
или
Д ti 2 9 О - Д ЛОО . Д Q
,g7’+const; (XVIL34)
3) AH«#=const; ДСо=Да + Д6Г,
lgKp = -y- + Blg7’+O7’ + C (XVII.35)
или
\b
Д a 298 +--2982
Ig =-------2 ^Лт~---- +4^ 'g Г +
. Д b
+ЙЙг+“'; (XVIL36>
Д c’
4) AW»#=COnst; ДСй = Да + Д67’4-ДсЛ+——;
/-2
A , В
ls Kp^ — + — + C + DigT^ET + FT^. (XVII.37)
Равновесие в газовой фазе при средних давлениях рассчитывают сле-
дующим образом.
Константа равновесия-для реакции (а) будет
Kf= V-E/?IACB = /<xKv₽Av. (XVII.38)
где
Kx = xVoxve/x4xvb. (XVII.39)
L) fc A D
KV = VdDVeE/Y?TbB; (XVI 1.40)
Yi=fi/P;
(XVI1.41)
261
fi—фугитивность i-ro компонента в равновесной смеси. Без большой
погрешности можно принять
(XVI 1.42)
где/® —фугитивность чистого i-ro компонента при давлении равновес-
ной смеси, или
fi=Pytxt-, (XVII.43)
коэффициент активности уг определяют по методу соответственных со-
стояний.
ЗАДАЧИ С РЕШЕНИЯМИ
I. Вычислите степень превращения а исходных веществ реакции
А 4- 4В = D, глубину реакции | и равновесный выход конечного про-
дукта реакции D (xD 100), если начальные количества исходных ве-
ществ: Пд = 1,000 моль, «в = 12,000 моль. При достижении равно-
весия пд = 0,025; «в = 8,100; nD = 0,975 моль.
Решение. Согласно уравнению (XVII.10) степень превращения
будет
1,000—0,025
аА =------;------= 0,97а;
12,000-8,100
-----;-------=0,325.
12
Глубину реакции вычислим по уравнению (XVII. 14):
ЛА—"а = «в—«в 1,000— 0,025 _ 12,00—8,100
1 ~ 4 ~ 1 ~ 4
Равновесный выход вещества D определим по молярной доле этого ве-
щества в равновесном состоянии системы:
пп 0,975
„ =-------Ы-------=-------------------=о Ю7.
D nA + nB + nD 0,025 + 8,100+0,975
Равновесный выход вещества D составит 0,107-100=10,7 %.
2. Рассчитайте константу равновесия Кс реакции А + 4В = D,
если объем реакционного сосуда V = 0,05 м3.
Решение. Согласно уравнению (XVII. 1)
cn nn/V 0,975-50*
Кс=-------— =------—------- --------------- = 5,66-10* (моль/л)-*.
сАс* па/г(пв/г)4 0,025-8,100*
3. Константа равновесия реакции Н2 + Ь ~ 2HI при 693 К
Кс — 50,25. Вычислите массу образующегося иодида водорода,
если в сосуд вместимостью 10-3 м3 введено 0,846-10-3. кг 12 и
0,0212-10-3 кг Н2.
262
Решение.. Определим количество молей исходных веществ:
0,0212-10~3
=------------------------------ 103 = 0,0106 моль Н2,
0,846-10'3
п? —-------------103 = 0,00333 моль 12,
254
Н2 + 1, = 2HI
10,6-10~3 3,33-10~3 0 —число молей в исходном состоянии системы
10,6-10~3—х 3,33-10-3—х 2х —число молей в равновесном состоянии си-
стемы
х = п9—пг.
По уравнению (XVII.1) находим 7<с:
(”hi/v)2 4х2/(10-3)2
КС = ~ 1(10-6-10-3-х)/10-3] [(3,33-10-3—х)/10-3]
Решение этого уравнения дает
46,25х2—0,7015л+1,7737-10~3 = 0.
Откуда
_ 0,7015 ± ~|/ 0.70152—4-1,7737-1~б~3-46,25 =
_ 0,7015 ± 0,4049
92,50
х1 = 11,961-10-3; х2 = 3,206-10'3.
Первый корень ху не имеет физического смысла, так как величина х
не может быть больше Пн2; = 3,206-10~3 моль. Масса HI, получен-
ная в результате установления состояния равновесия, составит /«hi =
=2xMhi = 2-3,206-10-3 -128-Ю"3 = 0,821-Ю"3 кг.
4. В закрытом сосуде вместимостью 0,05 м3 находится 1 моль веще-
ства А и 12 моль вещества В. В результате реакции А + 4В = D ус-
тановилось равновесие. Общее давление в равновесном состоянии сис-
темы составляет 4,51 • 105 Па. Вычислите равновесные концентрации
всех реагентов при 298 К. Система подчиняется законам идеального
газообразного состояния.
Решение. Согласно уравнению реакции приведем количество
молей в начальный момент и в состоянии равновесия:
А + 4В = D
1 12 0 —количество молей в исходном состоянии системы
1 —х 12—4х х —количество молей в равновесном состоянии системы
. 2 П[= 1 —х-р 12—4х-|-х= 13—4х.
263
По уравнению Менделеева — Клапейрона PV =
„ 4,51-105.0,05
2«г=13-4х=-->—3-298 =9,10 моль,
13 — 9-10
х —----------= 0,975 .моль.
4
Равновесные концентрации определим по уравнению
СА =
СВ =
сг> =
1 — 0,975
------------= 0,5 моль/м3,
12-4-0,975
-------------=162 моль/м3,
0,05
0,975
— = 19,5 моль/м3.
5. При 693 К водород и иод находятся в закрытом сосуде. В исход-
ном состоянии системы парциальные давления Рн2 = 0,4521 • 105 и
Pi2 = 0,1682-105 Па. Равновесное парциальное давление HI Phi =
= 0,3222-10® Па. Вычислите равновесные парциальные давления Н2
и 12 и константу равновесия.
Решение. Убыль парциальных давлений водорода и иода рав-
на между собой (ДРн2 и APi2):
рйг = рн2-АРн2;
где Рн2 и Pj'f —• равновесные парциальные давления водорода и иода.
Парциальное давление образовавшегося HI равно удвоенной убыли
пациального давления водорода:
= = Рц; ДР = 0,3222-105/2 = 0,1611-Ю6 Па.
Тогда
Р^г = 0,4221 • 105—0,1611 • 105 = 0,2910- Ю5 Па,
Pi = 0,1682-105 — 0,1611-105 = 0,0071-105 Па.
‘2
Вычислим Кр по уравнению (XVII.3):
(РЙ1)2 = (0.3222-105)2 =
PL, Р: 0,2910-105.0,0071-105
6. Процесс получения хлора окислением хлороводорода протекает
по уравнению реакции
4НС1 + О2=2Н2О -у 2С1 g
При смешении 1,000 моль НС1 с 0,480 моль О2 образуется 0,402 моль
С12. Вычислите Kj>, еслй система находится при Р = 1,0133-10® Па
и 659 К.
264
Решение. На образование 0,402 моль С12 расходуется
0,804 моль НС1 и 0,201 моль О2. В равновесном состоянии будет:
лс12 = ян2о = 0,402 моль,
пнс1 = 1,000 — 0,804 = 0,196 моль,
nOi = 0,480 —0,201=0,279 моль,
2 nt=0,196 + 0,279 + 0,402 + 0,402= 1,279 моль.
Отнесем рановесные парциальные давления к давлению 1 атм:
РНг0 = 0,402/1,279 = 0,314,
Рс1> = 0,402/1,279 = 0,314,
Рнс1 = 0,196/1,279 = 0,153,
Ро =0,279/1,279 = 0,218,
тогда
0,3142-0,3142
Ко =---------------=81,376 [атм-1].
р 0,153*.0,218 1
7. При 823 К и 1,0133'10® Па степень диссоциации фосгена на ок-
сид углерода и хлор равна 77 %. Определите Кр и К,--
Решение. Процесс диссоциации можно записать: СОС12 =
= СО + С12. Равновесное парциальное давление равно общему давле-
нию, умноженному на равновесную молярную долю:
РСО —РхСО] РС12~" РхС12; РСОС12~Р ХСОС12
СОС12 = СО + С12
1 0 0 —исходное количество молей
1 — а а а —равновесное количество молей
S П} = 1 — а+а + а= 1 + а.
Отсюда равновесные парциальные давления, отнесенные к давлению
1 атм, будут:
Ргл Ррт ~ Р --------> Prnri = Р С--------
СО С12 1+а СОС12 1-|-а
Р2а2(1 — а) „ а2 0,772
КР =-------------------= Р------------------= 1,456 атм,
р (1— а)2Р{1 — а) 1—а2 1—0,772
Кс=Кр (P7')~Av= 1,456 (8,3143-823)-i = 0,02157 моль/л,
8. В реакции, протекающей по уравнению
3Fe + 4H2O = Fe3O* + 4H2
при исходном давлении водяного пара 1,3325-10® Па после достиже-
ния равновесия при 473 Крановесное парциальное давление образую-
щегося водорода составляет 1,2717-10® Па. Определите выход водоро-
265
да, если в сосуд вместимостью 2-10-3м8, содержащий металлическое
железо, введен водяной пар под давлением 3,0399-105 Па при 473 К-
Решение. Так как концентрации металлического железа и ок-
сида железа Fe3O4 в газовой фазе практически постоянны, то константа
равновесия реакции может быть записана так:
= или Кр— ^н,/^н,о,
где К’р = Кр'2Ь. Реакция идет без изменения объема, поэтому при до-
стижении равновесия Рц,о = 1,3325-10s—1,2717-10®= 0,0608-108Па =
'=0,0600 атм.
1 2550
Ри = 1,2717-Ю5 Па= 1,2550 атм; К'р =—1----= 20,917.
н' ’ ’ Р 0,0600
Количество молей образовавшегося водорода определим по уравне-
нию Менделеева — Клапейрона
«н. = ^н, V/RT,
Рцг^Рн,о К’р = (3,0399- Ю’-Рн>) Кр,
3,0399-10’ 3,0399-1О’-20,916
РН =-----FTF----- =-------:-----------= 2,9012-10’ Па.
н’ 21,916
Количество водорода будет
°н,—2nHt—2
2,9012-Ю’-2-lO-3
8,3143-473
= 0,295 г = 0,295-10-3 кг.
9. Вычислите равновесный выход NO2 по реакции N2O4 2NO2
при 1,0133-105 Па и 298 К-
Решение. Для определения равновесного выхода необходимо
знать константу равновесия реакции. Воспользуемся данными справоч-
ника [М.] и рассчитаем энергию Гиббса по уравнению
А О§98 = А Я®98 —298Д S»98.
Вещество......................... NO2 N2O4
АЯ“ 298, кДж/моль.............. 33,89 9,37
S“98, Дж/(моль-К)............... 240,45 304,3
ДЯ®»8=58,41 кДж; A S®98 = 176,6 Дж;
Д О®98 =58,41 • 103 — 298-176,6 = 5,78-103 Дж.
По уравению (XVII.20) вычислим К?
1 К 5780
2,3026-8,3143-298
Р XNO.
------- =0,0970; xft0 = 0,0970—0,0970xNOj;
1 ~XNO, ’
-1,0131=2,9869; Л> = 0,0970;
К.
266
x|)Oj + 0,0970xNO2—0,0970 = 0.
Решение уравнения второй степени дает два корня, один из них не
имеет физического смысла. Тогда Хыог = 0,2667; молярная доля в рав-
новесии составляет хыо2 • 100 = 26,67 %.
10. Определите константу равновесия Кр при 1000 К реакции
окисления аммиака:
NH3 +%О2 = %N2-р/2Н2О
Для расчета использовать константы равновесия реакций образования
аммиака и воды из простых веществ при 1000 К:
1/2N2+3/2H2 = NH3, /<Р1=5,69-10-‘,
1/2О2+Н2 = Н2О (г) = 1,16.10™
(давление выражено в атмосферах).
Решение. Выведем уравнение, связывающее искомую величи-
ну Кр с известными значениями Kpt и Кр,'-
3
ДОо = _ДОо НгО_д0? nHj)
где AG^.t — стандартное изменение энергии Гиббса при образовании
данного вещества из простых веществ; AG0 — стандартное изменение
энергии Гиббса реакции окисления аммиака,
3
—/?7'1пКр = —— RTln КРг + RT In KPt
или
Кр,
КР,
(1,16-1010)3''2
5,69-10-*
= 2,196-Ю1».
11. Константа равновесия реакции Н2 + I2 = 2HI при 693 К
равна 50. Образуется ли иодид водорода при идеально обатимом прове-
дении процесса, если исходные концентрации (моль/л): Н2 — 2; 1,5;
1,0; 12 — 5; 0,25; 2,0; HI —10; 5; 10. Вещества в реакционный сосуд
поступают из бесконечно больших емкостей. Иодид водорода выводит-
ся из реакционного сосуда в емкость бесконечно большого объема, где
его концентрация Снг
Решение. Воспользуемся уравнением изотермы Вант-Гоффа
/ THI]2 )
ДО=Д A=RT In ‘-77, —-In Ke
\ l^2J U2J /
и вычислим AG или АЛ. Установим знак этой величины. Для этого рас-
считаем г!У7,т1 и сопоставим эти величины с Кс-
[п2](12]
1) для первых произвольных концентраций
102
------=10<50, ДС<0;
2-5
реакция будет протекать самопроизвольно в прямом направлении;
267
2) для вторых произвольных конценраций
52
—------- -=66,66>50, AG>0;
1,5-0,25
реакция в прямом направлении самопроизвольно протекать не будет;
3) для третьих произвольных концентраций
102
------= 50; ДО =0;
2-1
система находится в состоянии равновесия.
12. Выразите константу равновесия А+реакции Н2 + 1/2О2 —
— Н2О (г) через общее давление Р и степень диссоциации водяного
пара а.
Решение. Если исходить из 1 моль Н2О (г) («н2о = 1), то при
степени диссоциации а в равновесной смеси останется (1 — а) моль
Н2О (пн2о) и образуется а/2 моль О2 (пОг) и а Моль Н2 (пн2). Общее
число молей в равновесной смеси газов составит
У, пг=а+а/2 + 1 — а= (а+2)/2.
I
Равновесные парциальные давления тогда будут:
а 2а
р р----------------- р------
н’ (а+2)/2 а-4-2 ’
а/2 а
Рп -------= р-------
°2 (а + 2)/2 а-4-2
„ _ 1—а 2(1—а)
н’° (а + 2)/2 а + 2
а константа равновесия реакции
РН»О _ Р2 (1— а) (а + 2) (а-(-2)1/2 _ (1—а) (а+2) 1/2
Р рн,рс>,2 (а + 2) Р2а Р1/2 а1/2 Р1/га3/2
13. Определите стандартное сродство оксида кальция к диоксиду
углерода, находящегося под давлением 1,0133-105 Па при ИЗО К,
если давление диссоциации СаСО3 при этой температуре 0,560-105 Па.
Решение. Вычислим константу равновесия реакции СаО +
+ СО2 = СаСО3 по соотношению
ДО»13о= — RT\nKP= —8,3143.1130-2,30261g КР.
Константу равновесия рассчитаем из парциального давления СО2Рсо,,
выраженного в атмосферах, так как за стандартное состояние принято
давление 1 атм:
Кр = —J~ 1,0133-106 = 1,8095;
р РСО, 0,560-105
ДG}130 = 8,3143-1130-2,30261g 1,8095= -5,5718-103 Дж.
268
14. Определите константу равновесия реакции
AlgOj-f-SSO»—A12(SO4)3
при 298 К-
Решение. Вычислим тепловой эффект реакции изменение энт-
ропии при стандартном давлении и 298 К, используя справочные дан-
ные [М.] о тепловых эффектах образования и об абсолютных энтропиях:
Вещество............................
ДЯ® 298’ «Дж/моль ..................
S°, Дж/(моль-К).....................
A12(SO4)3 А120з SO3
-3434 -1675 —395,2
239,2 50,94 256,23
Для реакции получаем
ДЯ|98 = —573,4 кДж; Д S§98 =—580,43 Дж/К-
По уравнению (XVI 1.24) определяем стандартное сродство:
Д G!!98 = -573,4-103 — 298 (—580,43) = -400,43-10s Дж.
Константу равновесия определяем по уравнению (XVII.20):
ДОй98
2.3026Д298
400,43-103
2,3026-8,3143.298
= 70,1885;
Кр= 1,54-Ю’о.
15. Определите константу равновесйя реакции SO2 + VgOg =
— SO3 при 700 К, если при 500 К Кр = 588,9 (давление выражено в
Па), а тепловой эффект реакции в этом диапазоне температур равен
—99,48 кДж.
Решение. Воспользуемся уравнением (XVII.32) при \Нт=
= const:
дя£
1§ Кр> 500 - 2,3026-8,3143-500
ДЯ£
___________________ 4-В,
2,3026-8,3143-700 г
ДЯ£ (_1______________
2,3026-8,3143 ( 700 500 >
99,48-103 / 1 1 \ ___
= lg 588,9 4----1------------------------0,1996,
s 19,1445 ( 700 500 )
7оо =0,632.
'6 Кр, 700
1g Яр, 700 = Кр, 500
16. Выразите зависимость IgKp реакции СО+Н2О = СОа+Н2
от температуры. Установите, в каком интервале температур зависи-
мость будет справедливой. Вычислите Яр при 700 К-
Решение. Установим зависимость lg Кр = f (Т). Для этого вы-
разим зависимость &£{> от температуры. Решение удобно провести в
форме таблицы:
269
Вещество 298* кДж/моль с0 ^гэв* Дж/(моль-К) cp = f(7*), Дж/(моль К) Температур- ный интер- вал, К
° Ь- 10’ с'.10~»
СО2 —393,51 213,6 44,14 9,04 —8,53 298—2500
Нг 0 130,6 27,28 3,26 0,502 298—3000
со -110,5 197,4 28,41 4,10 -0,46 298—2500
Н2О(г) —241,84 188,74 30,00 10,71 0,33 298—2500
Для реакции получаем
ДН“98 = — 41,17-10» Дж; Д S»98 =41,94 Дж/К,
Дй=13,01; Д6=—2,51-10-3; д с'=—7,90.10s.
Температурный интервал, в котором справедливы вычисленные
значения, 298—2500 К. Рассчитаем 1g Кр при 298 К по уравнению
(XVII.20):
1g К,
—41,17-103 — 298-41,94
2,3026-8,3143.298
= 5,0257 .
Установим зависимость теплового эффекта
кону Кирхгофа (VI.31):
от температуры по за-
d Д№
——— = ДС« = 13,01 -2,51- IO-3 т
а Т г
7,90-10s
72
2 51•10-3
ДЯо = д /7О98 + 13 01 (Т—298)—--------------- (Т2—2982) +
= —41,17.103—13,01-298 +
+ 7,90- 10s (----—
\ Т 298
2,5Ы0-з 7,90-10» 7,90-10»
-----------298» —---------+13,01Т— 1,255- IO-3 Т2+ _!-----
2 298 Т
ЬН}= —47,586-103+13,017-1,255-10-3 72 + 7,90-106/Т.
Подставим полученную зависимость в уравнение изобары Вант-Гоффа
(XVII.30) и интегрируем от 298 К до Т:
. 7,90-10»
-47,586-103+ 13,017— 1,255- Ю-»72+ -L—--------
d In КР -----------------------—----------------------d 7,
р RT2
, , , . „ с / 5,723-103 , 1,565
In Kp, T —In Кр, 298 + J ( 7-2 ^*7 ~0’ 151 Ю
298 '
, 0,950-10» X / 1 1 X
Ч------™----- d 7= 11,572 + 5,723-IO» — -----— +1 ,5651п7—
7з / • -г . I т 298
270
0,950-10’/ 1 1 \
—l,5651n 298-0,151.10-3 (7-298) — ----- —-------------=
2 \ Т2 2982 /
= 11,572—19,205— 8,916 + 0,045+ 0,535+-—у—~ +
0,475-10’
+ 1,5651п Т—0,151-10-зГ----------.
' 7*2
Окончательно получим уравнение вида Ig Кр = f (Т):
5,723-103 0,47-10’
In КР< т = —15,969+—— --------+ 1,5651л 7-0,151-Ю-з 7----------
или
, 0,206-10’ , 2,485-103
1пКР 7- = ————-----------1---—-------—6,935+1,5651g 7—0,066-IO"3 7.
Это уравнение справедливо в интервале температур от 298 до 2500 К-
Для определения 1g Кр при любой температуре в интервале от 298
до 2500 К подставляем температуру в уравнение
0,206-10’ , 2,485-103
lg/<p,7oo = ™--------6,935+1,5651g 700-
/ии /ии
-0,066-10-3-700=—0,042 + 3,550 — 6,935 + 4,453 — 0,046 = 0,980;
Кр, 7оо =9,55.
17. Зависимость константы равновесия от температуры для реак-
ции Н2 + С12 = 2 НС1 выражается уравнением
9411,7 0,11-10’
1g Ка =---— 1,3121g 7 + 0,128• IO-3 7 д----д 4,9.
Уравнение приведено в справочнике [M.J. Определите тепловой эффект
реакции при 1000 К-
Решение. Преобразуем десятичный логарифм в “натуральный:
1л Ка —
21,671-Ю3
——--------—1,3121п 7+ 0.295-10-37-I-
По уравнению (XVII.26)
0,253-10’
------------+11,28.
7*2 *
din К
дя^кт2 — ,
21,671-103 1,312 ..........
----—-------------1-----1-0.295- Ю-з
/2 7
= — 180,179 -103 -10,9087 + 2,453 - IO*3 Т2
0,506-10’ \ =
73 )
4,207-10»
7
Д я;ооо = — 180,179-103 —10,908-103 + 2,453-103 — 0,421 -103= — 189,055-10» Дж.
18. Определите при 800 К константу равновесия реакции
я-С4Н10 = 1,3-С4Н8 + 2Н2
271
/ ""j ~~ A 1q j
Для решения воспользуйтесь данными I—р—у и ЛЩ, приведенны-
ми в справочнике [M.J.
Решение. Рассчитаем Gsoo по уравнению (XVI 1.25) и по СТаН-
^ДО __________________________________________р{0\
дартному сродству вычислим /<р. Величины (-----°1 и Но найдем
в справочнике [М.]:
Вещество..............................
г. о _М0\
* -9\, Дж/(моль-К)
1,3-С4Н6 н2 я-С4 Юк,
—298,07 —130,482 —333,17
125,95 0 —97,981
AZfg, кДж-моль.....................
Для реакции находим
/ G2 ____ио \
д(—---------—) = — 225,864 Дж/К, ДЯ8 = 223,931 кДж,
’ё^РОтм) 2,3026/?
О8°аа-Яо° \ '
Т J Т
--------( — 225,864 + -23’-31 ’1 °3 ) = — 2,8233; К = 0,0015.
19,1445 ( 800 / р
19. Определите равновесный выход СН3ОН при 523 К и давлении
1,0133-107 Па для реакции СО + 2Н2 = СН3ОН (г), если исходная
смесь стехиометрическая; K0i52S = 2,235-10~3 (давление выраже-
но в атмосферах).
Решение. По уравнению (XVII.38) рассчитаем Ко:
д. _ ^сн,он _ хсн, он ?сн,он р г
fco /н, ХСО ХН2 Тео Тн2
Значения у; находим по методу соответственных состояний. Зави-
симость у = / (л, т) приведена в виде графиков в справочнике [М.]:
Вещество рир-10-5’ Л ’"кр- К т V
СН.ОН 79,54 1,27 513,2 1,02 0,55
СО 34,96 2,90 132,9 3,94 1,05
н 12,96 7,82 33,3 15,71 1,06
Ка = 2,235-Ю-3 = 0,466-100~2,
ХСО ХН,
272
откуда
-сн,он = 47,96.
хсо хн2
Согласно уравнению реакции количество молей в начальный момент
и в состоянии равновесия составляет:
СО 4- 2Н2 ^±СН3ОН
1 2 0 —исходное количество молей
1—х 2—2х
х —равновесное количество молей
х (3—2х)3 х(3—2х)2
(3 —2х) (1—х)34 ~ 4(1—х)3
Для определения х необходимо решить уравнение третьей степени.
Найдем х методом подбора. Величина х не может быть больше
единицы и отрицательной: 1 > х >0. Из соотношения находим
х (з__ада
—р _-у3— ' = 191,84. Если вместо х подставить корень уравнения, то
левая часть будет равна 191,84. Если же вместо х подставить произ-
вольное значение, то левая часть будет отличаться от 191,84. Обозна-
х(3—2х)2 .
чая выражение —через А и задаваясь произвольным зна-
чением х, получим различные значения А. Так, например, если х =
= 0,900, то А = 1296; если х = 0,950, то А — 9196. Отсюда следует,
что увеличение значения х ведет к росту А. Если х = 0,800, то А =
= 196,0, а если х = 0,790, то Л = 172,0. Линейной интерполяцией
между последними близкими значениями А найдем корень уравне-
ния:
(196,0—172,0)—0,01
(196,0- 191,84) — у
Для х = 0,7983
0,7983-1,4034*
0.20173
=192,6,
что отвечает выходу метанола нз 1 моль СО и 2 моль Н2:
0,7983/(3 —2-0,7983) =0,57
20. Определите состав равновесной смеси при условии протекания
сложной реакции в газовой фазе при 600 К:
СН3С1 + Н2О = СН3ОН + НС1 (1)
2СН3ОН=СН3ОСН34-Н2О (II)
Константы равновесия реакций Кр(ц — 0,00154, Кр(п; = 10,6.
273
Решение. Метанол, образующийся в результате реакции (I),
вступает в реакцию (II) с образованием диметилового эфира и воды.
Обе реакции протекают без изменения количества молей, отсюда
кр, (1) =
*СН,ОН *НС1
*СН„С1 *н,о
= 0,00154,
Кр, (Н) =
хсн,осн, *н,о
---------------=10,6.
*сн, он
Обозначим через х количество молей НС1, если исходная смесь состо-
ит из 1 моль СН3С1 и 1 моль Н2О. Обозначим у количество молей
СН3ОСН3. Тогда в равновесном состоянии в системе будет содержаться
СН3С1 (1 — х); Н2О (1 — х + у); СН3ОН (х — 2у\, НС1 х; СН3ОСН3у.
Так как количество молей газообразных продуктов реакции не изменя-
ется, то количество молей равно молярной доле:
к х 2У>
р-(1)_ (1 —х) (1-х+у)
= 0,00154;
Кр,(11)
_У (1 —xj-y)
- (х-2у)2
10,6.
Для нахождения х и у необходимо совместно решить эти два уравнения.
Для облегчения решения выразим из второго уравнения--------— =
(1 — х + у)
У
и
~ 10 6(—И подставим в пеРвое уравнение:
0,00154=——-----------; —-------------------=0,016324.
1—х 10,6 (х—2у) 1—х х — 2у
Решение уравнений
----=0,00.54,
(1-х)(1-х + у)
ху
(1-х) (х~2у)
= 0,0016324
(б)
проведем методом подбора. Найдем сначала пределы допустимых зна
чений х и у. 0 < х <. 1; 2у <Z X’, у <Z 0,5х; у <Z 0,5. Задаваясь значе-
ниями х, получим значения у по уравнениям (а) и (б):
X У(а) р(б) Вывод
0,1 0,04346 0,02060 у (а) значительно отличается от у (б)
0,05 0,01094 0,00957 у (а) близкое к у (б)
0,04 0,00222 0,008786 у (а) значительно отличается от у (б)
Точное решение можно получить, построив графики у (а) — f (х) и
у (б) = f (х). Координаты точки пересечения линий будут решениями
уравнений х = 0,048, у — 0,009. Состав равновесной смеси тогда бу-
274
дет (моль): СН3С1—0,952; Н2О—0,961; CHSOH—0,030; CHSOCH3 —
— 0,009; НС1 — 0,048.
21. Определите константу равновесия Кр реакции диссоциации мо-
лекулярного водорода при Т = 5000 К, используя молекулярные по-
стоянные молекулы Н2: ив = 4396, 55 см-1, 1е = 0,459-10-47 кг-м2.
Энергия диссоциации при Т = 0 равна D = 431,9 кДж/моль. Основ-
ное электронное состояние молекулы Н2 и атомов Н невырожденное,
число симметрии для Н2 равно ст = 2.
Решение. Запишем уравнение реакции Н2 = 2Н. Для этой ре-
акции ДД8 = 431,9 кДж/моль.
Атомарный водород не совершает колебательного и вращательного
движений. Если не принимать в расчет возбужденные электронные
состояния, то для атомарного водорода
(2nMiikT)3^
Qh - h3NW
для молекулярного водорода
п (2л МН1 й 7”)3Z2 8л2/Н1^7’ ।
*Н, =----;—--------- -------- / ftc 0) е \
ft3№z2 а^г 1—ехр[-----1
\ kT /
Следовательно, отношение Qft к Qh2 составляет
Qh, (2лй7)3/2 / \3/2
Qh, ft3 №z2 \ мнг / 8л2/н>й7’
откуда
(2nfeT)3Z2 / Alft \з/2 ah*
P. ft3№Z2 \ I faU^kT
/ ftco)c.\1 -&Ц0 1ЦТ
X^l-exp^-—jje о/ =
(feT3/2)g / mh \3/2 Г / йСМе\1 _я8/лг
2(2л)1/2А^з/2/Н1 еХЦ kT )\e
I 1,438-4396,55 \ 431,9-10»
(1,381-10-2S-5000)3/2 2H— e 500 )e 8-314500
2 (2л)1 z2• 6,626• 10-24 (6,02-102’)3/2 - 0,459-10-4 *’
/ 1 \3/2
XI—I =12,5737-10» [Па],
или
12,5737-10»
1,01325-10»
атм.
275
22. Определите константу равновесия реакции изотопного обмена
при Т — 300 К, если известна частота колебания coHd = 3770 см-1.
Расстояние между атомами и энергию связи для молекул Н2, D2 и
HD считать одинаковыми и 1, стн, — 2, Od, — 2, Оно = 1.
Решение. В рассматриаемом случае
Sv; = 2—1 — 1=0,
тогда в соответствии с соотношением
КР =
Фн —ДНО/47"
- II — g О !
Фн. Фр,
Энергия связи представляет энергию молекул в равновесной конфигу-
рации. Минимальная энергия молекулы будет больше энергии связи на
величину энергии нулевого колебательного уровня, т. е.
,Vhc „
д^о=' 2 (2онр_'шн2~шр,).
Соотношение между частицами найдем из условия, что при заданной
силовой постоянной частоты относятся как и1/о)2 = Р1/ц2, где pj —
приведенная масса. Следовательно,
мн, _ / цНр =1/ ''2-2
“hd V Нн, V (1 + 2)1’
-^- = 1/ 2^ = 1/ =
“HD V Нр, V (1+2)2 у 3
и тогда
ДЯ« = Nhca)HD / 2___-1/ 2 \
R 27? V 3 У 3 )
6,02-1023-6,626-10-3‘-3.102.3770-10» / 2 ,о 1СЬ.
ГУТ У -g-J = 78,15K
ФЙр / У/2 'йр х
@Н, Фр, \ ^Н, ^D, / ^Н, ^D,
у ан, aDg (i e-ftc<aH,/ftr)(l-e-ftC%/ftr)
ffHP
276
т-. hc4>s , , —hca-ikT i
Поскольку > 1, можно считать 1 — e 1 ~ 1, и послед-
ний множитель приравнять единице. Так как межъядерные расстоя-
ния приняты одинаковыми, отношение моментов инерции можно заме-
нить отношением приведенных масс и тогда
Q2,n /' З2 \з/2 22-2-2 2-2
HD- = ---------------------------=4,243.
Qh,Qd, \ 2’4 / (14-2)2-1-2 1
При Т = 300 К, Кр = 4,342 ^—78,15/зоо = 3)270.
ЗАДАЧИ
1. При смешении 1 моль уксусной кислоты и 1 моль этилового
спирта реакция протекает по уравнению
СН3СООН + С2Н6ОН = СН3СООС2Н5 + Н2О
При достижении равновесия в реакционной смеси находится 1/3 моль
кислоты, 4/3 моль спирта, 2/3 моль эфира и 2/3 моль воды. Вычисли-
те количество молей эфира, которое будет в реакционной смеси при до-
стижении равновесия, при следующих условиях: 1) 1 моль кислоты и
2 моль спирта; 2) 1 моль кислоты, 1 моль спирта и 1 моль воды; 3)
1 моль эфира и 3 моль воды; 4) 1 моль кислоты, 1 моль спирта, 1 моль
эфира и 1 моль воды.
2. Константа равновесия реакции СО + Н2О = СО2 4 Н2 при
800 К равна 4,12. Смесь, содержащая 20 % СО и 80 % Н2О, нагрета до
800 К- Определите состав смеси при достижении равновесия и выход
водорода, если взят 1 кг водяного пара.
3. Константа равновесия реакции Н2 + I2 = 2HI при 717 К рав-
на 46,7. Определите количество разложившегося HI при нагревании
1 моль HI до 717 К.
4. Определите константы равновесия Кр и Кс реакции диссоциа-
ции 12 при нагревании 1,513-10“3 моль иода до 1073 К, если его пары
займут объем, равный 249,3- 10-вм3 при давлении 5,81 • 104 Па.
5. Вычислите давление и степень диссоциации N2O4, если при 323
К 1 моль N2O4 находится в сосуде вместимостью 0,075 м3. Определите
исходное давление N2O4 (N2O4 разлагается по уравнению реакции
N2O4 = 2NO2), если 1 моль N2O4 при 323 К находится в сосуде вмести-
мостью 0,125 м3. При достижении равновесия в сосуде установилось
давление 3,485-104 Па.
6. Вычислите константы равновесия Кр и Кс реакции 4/2 N2O4 =
= NO2, если а = 0,533, а давление 5,49-104 Па при Т = 323 К-
7. При 500 К константа равновесия реакции РС15 = С12 + РС13
Кр = 3,374-104 Па. Определите степень диссоциации РС15 при этой
температуре, если при достижении равновесия устанавливается давле-
ние 8,0106-104 Па. При каком общем давлении в системе степень дис-
социации РС15 будет равна 70 %?
8. При 900 К константа равновесия реакции Н2 + С12 = 2НС1
Кс = 10й-51. Степень диссоциации водяного пара при этой темпера-
туре и давлении 10,133-104 Па равна Ю-7-575. Рассчитайте для этой
277
температуры константы равновесия Кр и Ке реакции 4НС1 + О2 —
= 2Н2О + 2С12.
9. При 767 К и 9,899-104 Па диоксид азота диссоциирует на 56,5%
по уравнению 2NO2 = 2NO4-O2. Определите Кр и Кс и давление, при
котором NO2 при этой температуре диссоциирует на 80 %.
10. При 375 К константа равновесия реакции SO2 + С12 = SO2C12
Кс — 9,27. Определите концентрацию SO2C12 при равновесии, если ис-
ходные концентрации SO2 и С12 имеют следующие значения: 1) Cso2 =
— ecu = 1 кмоль/м3; 2) <?so, = Ссц = 2 кмоль/м3; 3) Cso, =
= 1 кмоль/м3; fci2 = 2 кмоль/м3.
11.. При 525 К для реакции РС1р = РС13 + С12 Кр = 1,780. Под
каким давлением нужно взять эквимолекулярную смесь С12 и РС13,
чтобы в состоянии равновесия давление РС1 было бы 5,00-104 Па,
V = const?
12. Если в сосуд вместимостью 1 м3 ввести 0,03 моль водорода и 0,01
моль азота, то при 1000 К в нем установится давление 18,127-104 Па.
Определите Кр и Кс реакции ЗН2 + N2 = 2NH3, которая будет про-
текать в реакционном сосуде.
13. Смесь 1 моль этилового спирта и 0,091 моль ацетальдегида в
равновесном состоянии при 298 К занимает объем 63-10_3м3. При
том вступает в реакцию 90,72 % ацетальдегида:
2СгН6ОН + СН3СНО = СН3СН(ОС2Н6)2 + Н2О
Рассчитайте константу равновесия Ке этой реакции.
14. Определите константу равновесия реакции 12 — 21 и степень
диссоциации при 973 К, если поместить пг кг иода в объем 10-3 м3, в
котором устанавливается равновесное давление:
m-Ю3, кг .... 0,1835 0,914 1,515 1,900
Р- Ю-s, Па ... 0,0632 0,3021 0,4963 0,6209
15. Баллон вместимостью 3,4-10-3м3, в котором находится
5-10~3 кг фосгена, нагрет до 673 К. Давление в баллоне при этом уста-
новилось 10,133-104 Па. Рассчитайте степень диссоциации фосгена по
уравнению реакции СОС12 = СО+С12 и константу равновесия Кр и
Кс при этих условиях.
16. Вычислите степень диссоциации фосгена при 673 К, если
2,5-10~3 кг его поместить в баллон вместимостью 3,4-103 м3 и добавить
1-10“3 кг хлора. Какое давление при этом будет в баллоне? Констан-
та равновесия Кр = 4,99-10-2 (атм).
17. Рассчитайте давление газа после диссоциации фосгена при
673 К, если 2,5-10-3 кг его поместить в баллон вместимостью 3,4X
X 10-3 м3 и добавить 1 10-3 азота. Константа равновесия Кр = 4,99 X
X 10~2 (атм).
18. Определите степень диссоциации диоксида углерода по уравне-
нию реакции 2СО2 = 2СО4-О2 при 2273 К и 10,133-104 Па, если
константа равновесия при таких условиях Кр = 24,93 Па.
278
19. Железо и водяной пар реагируют по уравнению
Fe + H2O = FeO4-H2
При 1000 К и 1,0133-105 Па парциальное давление водорода Рн2 =
= 6,526-104 Па. Вычислите константу равновесия.
20. Определите стандартное сродство реакции С2Н4 + Н2 — С2Н,,
если при 873 К Кр = 2,86-10~4 (Па-1).
21. При 633 К и 10,133- 104Па степень диссоциации HI равна 20 %.
Рассчитайте стандартное сродство газообразного иода к водороду.
22. Будет ли происходить разложение РС15 в газовой смеси, содер-
жащей РС13, РС15 и С12 при 298 К, при следующих парциальных дав-
лениях (Па): Ррс1, —1,0133-104; РРСц—0,5066-104; РРщ2 — 2,0266-104.
Константы равновесия вычислите из Дб’.гэв [М.].
23. Рассчитайте сродство железа к кислороду воздуха Ро2 =
= 2,0266-104 Па при 1000 К, если константа равновесия реакции
2Fe 4- О2 = 2FeO при этой температуре равна 2,450-1020 Па-1.
24. Газы СО, С12 и СОС12 находятся в резервуарах вместимостью
10 м3 каждый под давлением 2- Ю4, 3-104 и 0,5-104 Па соответственно.
По 10“5 моль СО и С12 переведено в сосуд такой же вместимости с рав-
новесной смесью и из сосуда с равновесной смесью выведено 10'5 моль
СОС12. Все процессы проведены идеально обратимо при 700 К. Констан-
та равновесия реакции при этой температуре равна 10,826. Определите
изменение энергии Гиббса при протекании реакции СО 4-С12 = СОС12.
25. Определите изменение энергии Гиббса в процессе СО4-С12 =
= СОС12, описанном в задаче 24, если из сосуда с равновесной смесью
фосген не выводится. Общее давление равновесной смеси 105 Па.
26, Константа равновесия реакций 2Н = Н2 может быть выраже-
на уравнением
22 570
1g КР (Па) = -----1,5041g Т-0,767.
Определите тепловой эффект реакции при 800 К и выведите уравнение
ДЯ = f (Т).
27. Константа равновесия реакции 2Н2 4- О2 = 2Н2О может быть
выражена уравнением
, 24 900
1g кс =-------— 1,3351gT4-9,65.10-6 Т—1,37-10~* Т» 4-1,08,
а для реакции образования хлороводорода Н2 4- С12 = 2НС1
9586
lgKc=-y—0,441gT+2,16.
Рассчитайте Кс №» реакции 4НС14-О2 = 2Н2О 4- 2С12 при 700 и
800 К, а также Д1/ при 800 К-
28. При 369 К давление диссоциации Рын, соединения LiCl-NH3
равно 4,893-104, а при 382,2 К — 8,613-104 Па. Вычислите тепловой
эффект реакции LiCl-NH3 = LiC14-NH3 при постоянном давлении в
диапазоне температур 3694-382,2 К.
279
29. Давление пара над системой CuSO4-5H2O— CuSO4-3H2O
при 303,2 К равно 1,453-102, а при 299,3 К — 1,076-103 Па. Вычисли-
те тепловой эффект реакции
CuSO4-ЗН2О + 2Н2О = CuSO4 • 5Н2О
30. Тепловой эффект реакции 2С + Н2 = С2Н4 в зависимости от
температуры меняется примерно линейно и при 700 К равен 225,20-103
Дж/моль. Температурный коэффициент теплового эффекта этой реак-
ции равен — 6.573 Дж/(моль-К). Определите константу равновесия
реакции при 1500 К, если /<>,700 ~ 1,353-10-9.
31. Степень диссоциации РС15 при 473 К и 1,0133-103 Па равна
0,485, а при 523 К и том же давлении—0,800. Рассчитайте средний теп-
ловой эффект реакции РС13 + С12 = РС15 при Р = const в интервале
температур 4734-523 К.
32. Давление диссоциации MgCO3 при 813 К равно 9,959-104, а
при 843 К— 17,865-104 Па. Вычислите тепловой эффект реакции
MgCO3 = MgO + СО2. Рассчитайте, при какой температуре давление
диссоциации MgCO3 станет равным 1,0133- 10s Па.
33. Константа равновесия реакции H2+I2 = 2HI при 633 К рав-
на 61,6, а при 718 К она равна 41,7. Сравните среднее значение тепло-
вого эффекта реакции и сродство при 718 К. Вычислите изменение
энтропии.
34*. Составьте уравнение вида 1g Кр = f (Т) для реакции окисле-
ния аммиака
4NH3 + 5О2 = 2NO+6Н2О
если при 1000 К Кр = 44,351. Вычислите констануту равновесия ре-
акции при 1400 К-
35. Определите температуру, при которой давление СО2 надСаСО3
будет 1 • 105 Па, если при 1035 К давление 13 332 Па. Тепловой эффект
реакции СаСО3 = СаО-(-СО2 при 1035 К равен 167,91-103 Дж/моль.
Считайте, что в узком температурном интервале тепловой эффект реак-
ции не зависит от температуры.
36*. Напишите уравнение зависимости константы равновесия реак-
ции СаСО3 (кальцит) = СаО + СО2 от температуры. Определите дав-
ление СО2, над СаСО3 при 1200 К, если при 1035 К давление СО2
13,332 Па. Для определения зависимости теплового эффекта реакции от
температуры воспользуйтесь данными справочника [M.J.
37. Воспользовавшись данными справочника [М.], вычислите кон-
станту равновесия реакции Н2 + С12 = 2НС1 при стандартном давле-
нии и 298 К. Рассчитайте изменение энергии Гиббса для этой реакции
при 298 К, если начальные давления (Па): Н2 — 2,026-10* 02 —
— 1,013-105; НС1 — 0,103-105. Учтите, что процесс проводится
идеально обратимо.
38. Для реакции 12 = 21 приводятся константы равновесия при не-
скольких температурах:
Т, К ... 950 1050 1150 1250
Кр-10» . .1,134 7,316 33,833 127,122
280
Постройте график IgKp — f (Т-1), определите графически тепловой
эффект реакции в изученном диапазоне температур. Составьте уравне-
ние вида 1g Кр = f (Т-1) в температурном интервале 9504-1250 К.
39. Определите константу равновесия реакции 2СвН5СН3 =
=-И-С4Н4 (СН3)2 + СвНв и состав равновесной смеси в молярных
долях при 298 К и 1,0133-10® Па. Для расчета воспользуйтесь даннны-
ми справочника [М.1.
40. По методу Темкина — Шварцмана для реакции в газовой фазе
2СвН5СН3=л-СвН4 (СН3)2+ СвНв рассчитайте Д0°, Кр и состав в мо-
лярных долях рановесной смеси при 800 К и 1,0133-105 Па.
41. Определите константу равновесия реакции А + 2В = АВ2,
если при некоторой длине волны коэффициенты погашения веществ
А и В равны нулю. Оптические плотности равновесных смесей при
этой длине волны равны:
св, моль/л.............. 0,1 0,2 0,3 0,4 0,6 0,8 1,2 2,0
D ...................... 0,165 0,385 0,533 0,608 0,682 0,712 0,750 0,750
Концентрации вещества А во всех опытах 0,01 моль/л. Длина кюветы
5-Ю-2 м.
42. Определите константу рановесия реакции А + ЗВ = АВ3>
если при некоторой длине волны коэффициенты погашения А и В рав-
ны нулю. Интенсивность света, прошедшего через кювету с раствори-
телем а; интенсивность света, прошедшего через кювету с раствором
Ь3 при этой длине волны для равновесных смесей:
св, моль/л ......... 0,1 0,2 0,3 0,4 0,6 0,77 1,2 2,0
а '..................... 21,3 21,3 21,3 21,3 21,3 21,30 21,3 21,3
b....................... 14,4 5,36 3,15 2,50 2,23 2,18 2,13 2,13
Концентрация вещества А во всех опытах 0,01 моль/л, длина кюве-
ты 1•10~2 м.
43. Некоторое количество SO3 нагрето в закрытом сосуде до 727 К.
В результате термической диссоциации образовались SO2 и О2. Вычис-
лите: 1) исходное давление SO3; 2) общее давление равновесной смеси,
если Кр реакции SO3 = SO2 -j-112О2 равна 0,539. Равновесное давле-
ние SO2 4,05-10* Па.
44. Вычислите константу диссоциации ВаО по уравнению реакции
ВаО (г) = Ва (г) + г/2 О2 при 4000 К, если константы равновесия ре-
акций:
ВаО (г)=Ва (г)+О, ^ = 0,0156;
О2 = 2О, К2 = 2,1842.
45. Вычислите константу равновесия реакции S + О2 = SO2 при
4000 К, если известны Кр для реакций
SO2 = S4-2O, Л\ = 0,63;
О2 = 2О, К2 = 2,184.
281
46. Для реакции С5Н5С2Н5 (г) + ЗН2 = СвНпС2Н5 (г) в интерва-
ле температур 485-?565 К получено уравнение
9620
1g (Па) =—у——33,058.
Рассчитайте температуру, при которой эта реакция станет осуществи-
мой, если первоначальная газовая смесь состоит из 10 моль этилбензо-
ла, 50 моль водорода и 40 моль этилциклогексана. Общее давление
первоначальной смеси газов 1,0133-10® Па.
47*. Вычислите константу равновесия реакции Ч2 Н2 + Ч2 С12=
= НС1 при 900 К и 1,0133-10® Па, используя значения моментов инер-
ции вращения молекул и частот колебаний:
Вещество .... НС1 С12 Н2
/-104’, кг-м2 . . 2,612 116,3 0,459
<ое-10—5, м-1 . . 2,9894 0,5649 4,3966
Тепловой эффект реакции в идеальном газообразном состоянии при
абсолютном нуле равен — 92,140-103 Дж/моль.
48*. Вычислите константу равновесия Кр реакции термической
диссоциации иода 12 = 21 при 1274 К и 1,0133-10® Па, если АЯо ре-
акции равен 148,766-103 Дж/моль, частота колебания молекулы 12
®е = 214,25-102 м-1, момент инерции 750, 1-10~47 кг-м2. Статисти-
ческий вес нулевого электронного уровня атома иода 4, а нулевого
электронного уровня молекулы 12 единица.
49*. Рассчитайте константу равновесия Кр реакции NO = 1/2N2-4-
-\-г/2 О2 при 1000 К и 1,0133-10® Па, если моменты инерции молекул,
частоты колебаний и статистические веса нулевых электронных уров-
ней имеют следующие значения:
Вещество .... NO N2
/-104’, кг-м2 . . 16,43 14,01
(ое-10~5, м-1 . . 1,9165 2,3564
So,эл ...... 4 1
1,5798
3
Тепловой эффект реакции, протекающей в идеальном газообразном
состоянии при абсолютном нуле, —90,761-103 Дж/моль.
50*. Рассчитайте константу равновесия Кр реакции Н2 + X/2S2=
= H2S, протекающей при 1000 К и 1,0133-10® Па, если моменты инер-
ции молекул, частоты колебаний и статистические веса нулевых элект-
ронных уровней имеют значения:
Вещество . . . .
/-104’, кг-м2
<о₽-10—5, м-1 . .
Во.эл ..............
Н2 H2S2 S2 Н2 S2
2,6674 3,1513 0,7187 0,459 94,88
2,7219 2,7394 1,2145 4,3966 0,7257
11113
Молекула H2S нелинейная, симметрия С2,в, о == 2. Для H2S АЯо =
= —82,061 кДж/моль.
282
51*. Определите константу равновесия реакции СО + Н2О =
= Н2 + СО2 при 1000 К и 1,0133- 10s Па, если.известны моменты инер-
ции молекул, частоты колебаний и теплоты образования при абсолют-
ном нуле в идеальном газообразном состоянии:
Вещество /•1047, кг-м2 <0е-10-6, м-1 ДНО, кДж-моль
со2 67,8336 1,3512 2,3964 0,6722 —393,229
н2 0,459 4,3966 0
Н2О 1,0296 3,8354
1,9674 2,9970 3,9387 1,6476 —238,906
со2 14,49 2,1700 —113,880
У молекулы СО2 колебание с частотой 0,6722-105 м-1 дважды вырож-
дено.
52. Определите Кр реакции Н2 + I2 = 2HI при 1000 К, если ста-
тистические суммы состояний Qh„ = 3,5539-107; Qi2 = 3,2346-1014;
Qhi = 3,6320-1011 и кН°0 = — 8,292 кДж.
53*. В реакторе, работающем при постоянном давлении, находят-
ся 1 мольСН2С12 и 1 моль Н2. При 600 К протекают реакции
СН2С12 + Н2 = СН3С1 + НС1 (1); СН3С1 + Н2 = СН44-НС1 (2)
Константы равновесия реакции при 600 К равны Кр, = 1,156-10®,
Кр, — 8,8716• 10*. Определите состав равновесной смеси.
54. При 3500 К и давлении 1,013-10® Па в системе протекают ре-
акции:
l/2N2+CO2=CO+NO (1)
СО2 = СО4-1/2О2 (2)
NO = i/2N2+i/2O2 (3)
Исходная смесь состоит из 0,5 моль азота и 1 моль углекислого газа.
Используя справочные данные [M.J, рассчитайте состав смеси в состо-
янии равновесия.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Газообразные вещества А и В реагируют с образованием газооб-
разного продукта С: а) выразите Кр и Кс через равновесное количество
вещества С, равное х, если исходные вещества А и В взяты в стехиомет-
рических количествах при общем давлении равновесной системы Р и
температуре Т, К; 2) рассчитайте Кр и Кс при 300 К, если Р =
= 7,5-104 Па, х = 0,45; 3) вычислите равновесное количество веще-
ства С при давлении в равновесной системе 3-104 Па и 300 К; 4) рас-
считайте степень превращения вещества А и В при 300 К-
283
№ ва- рианта Уравнение реакции | № ва- а рнанта Уравнение реакции № ва- рианта Уравнение реакции
1 а+в = 1/2с 10 »/2А-4-В = ЗС 19 А + 2В = 2С
2 %А+В=С 11 2А+УгВ = ЗС 20 А4-2В = ЗС
3 ЗАН-В = 2С 1 12 2А4-ЗВ = 2С 21 А+В=2С
4 2А4-ЗВ = ЗС 13 ЗА+ 1/2В = ЗС 22 2А4-2В=С
5 2A+’/2B = 2C 14 ЗА+ У2В = 2С 23 2А4-2В = ЗС
6 ЗА+1/2В=С 15 1/2а+1/2в=зс 24 ЗА + ЗВ = 2С
7 А+2В=С 16 У2А+У2В = С 25 1/2АЧ-В=У2С
8 А+В = ЗС 17 А+ЗВ = ЗС
9 УгА+В = 2С 18 ЗА-уВ = С
2. Гетерогенная реакция протекает при постоянной температуре Т:
1) определите стандартное сродство веществ А и В при 298 К; 2) вы-
числите константы равновесия реакции Кр и Кс', 3) определите мас-
су прореагировавшего твердого вещества А, если объем системы V м3,
а исходное давление газа В равно Plt объемом твердой фазы можно пре-
небречь; а) определите изменение энергии Гиббса, отнесенное к нача-
лу реакции, если исходные давления газообразных веществ В и С со-
ответственно равны Р2 и Ра, реакция протекает при температуре Т, К
идеально обратимо.
Хг ва- рианта Реакция т. к P,.1O-2, Па Pj-10-2, 11a Р,- 10~2, Па V- 10s Ms
1 С-{-2Н2 = СН4 600 600 186 100 8
2 С-{-2Н2 = СН4 700 700 84 50 10
3 С+2Н2 = СН4 800 700 37 25 3
4 С+2Н2 = СН4 500 600 250 200 5
5 гс+гн^СгН* 1000 68 400 480 300 7
6 2C+2H2 = G2H4 2000 68 400 2050 1000 11
7 2С-КН2=С2Н4 1800 68 400 1290 800 9
8 2С+О2 = 2СО 773 10 705 800 2
9 2С+О2 = 2СО 873 100 572 500 4
10 2С+О2 = 2СО 973 300 293 300 6
11 2CuC1 + H2=2HC14-2Cu 673 500 361 500 4
12 2CuC 1 + Н2 = 2НС1 + 2Cu 773 500 215 400 6
12 Sn+2H2O = 2H2 + SnO2 1073 50 690 800 3
14 SnO2 + 2H2 = 2H2O + Sn 1073 500 152 200 8
15 SnO2+2H3 = 2H2O+Sn 973 400 167 200 6
16 SnO2 + 2CO = 2CO2 + Sn 1173 700 580 100 2
17 SnS+H2 = H2S + Sn 783 10 745 900 5
18 SnSH-H2 = H2S + Sn 1196 50 670 700 7
19 PbS+H2= H2S + Pb 783 5 755 900 8
20 PbS + H2 = H2S + Pb 973 10 745 800 3
21 PbS-]-H2 = H2S+Pb 1273 50 654 700 5
22 PbS-rCO = COS-rPb 1081 2 758 800 7
23 PbS + CO = COS+Pb 1370 10 747 800 9
24 PbCl2+H3 = 2HC14-Pb 873 200 284 400 11
25 PbCl2+H2 = 2HCl+Pb 1073 300 350 500 2
284
3. Вещество А массой g кг помещено в закрытый сосуд вместимо-
стью V м3. При температуре Т, К, часть кристаллизационной воды вы-
делилась в газовую фазу и в сосуде установилось давление Р, Па: 1)
определите массу воды, связанную с веществом А; 2) рассчитайте аб-
солютное количество твердой фазы в равновесном состоянии системы
3) вычислите Кр, Кс, и ДС“ реакции при температуре Т, К.
№ ва- рианта £. кг А V, m‘ г, к P, Па
1 0,047 LiBr-2H2O 6 130 133,3
2 0,659 LiI-H2O 7 403 866,5
3 0,068 Na2HPO4- 12Н2О 5 273 354,6
4 0,258 Na2HPO4- 12H2O 6 288 1190,4
5 0,057 NaCOOCH3.3H2O 3 298 851,8
6 0,128 Na2CU3-10H2U 7 273 358,6
7 0,019 NaCOOCH2-3H2O 6 273 120,0
8 0,890 Na3CO3-10H2O 8 298 2399,4
9 0,500 Na2CO3-10H2O 9 288 1161,0
10 0,210 NaCOOCH3-3H2O 4 313 2492,7
11 0,612 Na2HPO4- 12H2O 7 298 2538,0
12 0,035 Na2SO4-10H2O 8 273 373,2
13 0,254 Na2SO4-10H2O 9 293 1767,6
14 0,018 Na2SO4-7H2O 4 297 2439,4
15 0,856 MgCl2-6H2O 10 343 1999,5
16 0,081 FeSO4-7H2O 4 298 1940,8
17 3,010 CoSO4-7H2O 10 298 2210,4
18 0,622 CoC12-6H2O 8 313 2826,0
19 1,495 NiCl2-6H2O 9 309 2999,3
20 0,416 CuSO4-5H2O 3 298 1037,1
21 1,174 ZnSO4-7H2O 8 303 2852,6
22 0,183 SrCl2-6H2O 5 298 1135,7
23 0,208 BaCl2-2H2O 4 288 377,2
24 0,257 BaCl2-2H2O 3 298 733,2
25 1,190 BaCl2-2H3O 5 313 2103,5
4. Зависимость константы равновесия реакции (А) от температуры
выражается уравнением
а
Ig КР +b\gT+cT+d-,
коэффициенты a, b, с nd приведены в таблице на с. 287, давление выра-
жено в Па: I) определите константу равновесия реакции (А) при Т,
К; 2) постройте график 1g К = f (Т"1) в пределах температур от
(7 — 100) до (7 + 100) К; 3) укажите, как изменяется константа рав-
новесия при повышении температуры; 4) определите тейловой эффект
реакции (А)ДЯг при 7 К; 5) сопоставьте тепловой эффект, вычислен-
ный в п. 4, с тепловым эффектом, вычисленным по закону Кирхгофа
при температуре Т, К; 6) определите стандартное сродство реагирую-
щих веществ при температуре 7, К.
285
№ ва- рианта Реакция (Д) К T, к
1 J 2H24-CO^tCH3OH v Pch,oh Ap— , Ph,Pco 800
2 4НС1 + О2^±2Н2О4-2С12 Рн,о Pci, A p— 4 2 Phci Pci, 750
3 P-nh4ci^±nh3+ HC1 ^p=Pnh, Phci 455
4 2N2 -[-6H2O^4NH3 + 3O2 PhN, Po, P Pfi. Рн,о 1300
5 4NOJ-6N2O^±4NH3 4-5O2 „ PNH, Po, Ap— . й PNO Ph,0 1000
6 2NO2^2.NO4-O2 Pno Pq, Kp~ n2 Pno, 700
7 N2O4^±2NO2 i\p — Pn,O, 400
8 Mg(OH)2^±MgO+ H2O ^P = Ph,O 400
9 Ca(CO3)^CaO-i-CO2 ^p=Pco, 1000
10 Ca(OH)2^iCaO+H2O ^P = Ph,O 500
11 S2 +4H2O^±2SO2+4H2 Pio, PH,о Др— . Ps, Ph,0 1000
12 S2+4CO2^2SO2 4- 4CO _ Ps2O, P^o p~ Ps.pfco, 900
13 2SO2-}-O2^±2SO3 > pso. P Pso, Po, 700
14 SO2 +C12^SO2C 12 Pso, Cl, i\p~ Psot 400
15 CO4-3H2^tCH44-H2O Pch,Ph,o i\p— a Pco Ph, 1000
16 4CO+2SO2jz^ S2 4- 4CO2 _ Ps,Pb, pjo P^o, 900
17 COC12^CO4-C12 Pco Pci, ^p~ Pcoci, 400
286
Продолжение табл.
№ ва* рнанта Реакция (Л) к t, к
18 СО2+Н2^СО + Н2О Pco Рн,о i\p — Pco, Ph. 1200
19 COg-]- 4Hg^=ztCH4 -j- 2Н2О Рен, Рн,о Ap— Pco, PA, 1000
20 2CO2j±2CO + O2 [CO}2 [O21 Kc~ }CO2]2 700
21 2CO4-2H2^CH4-|-CO2 _ Рен,Pco, P~ Pco Ph, 900
22 c2h8^±c2h4+h2 _ [C2HJ [H21 C [C2H„} 400
23 CjHsOfc^H. + HjO Рс,н« Рн,о Kp — Pc,h,oh 400
24 CHgCHO+H^CjHsOH „ Pc.h.oh 500
l\p — Рсн.сно Ph,
25 CeH ( 4" ЗН24_ЛСвН]2 к Pc.h„ 600
Рс,н, Ph,
№ варианта a b c a
1 3 724 —9,1298 0,00308 3,401
2 5 750 —2,136 —0,000857 —4,710
3 -9,650 1,83 —0,00324 28,239
4 —66250 -1,75 0 —10,206
5 -47 500 -1,75 0 -13,706
6 -5 749 1,75 —0,0005 7,809
7 —2 692 1,75 —0,00483 1,944
8 —4 600 0,623 —0,00102 17,776
9 -9 680 -1,385 —0,000219 17,756
10 —5 650 0,67 0,000414 9,616
11 -13810 -0,877 0,00267 8,386
12 —2 300 4,34 —0,00162 2,567
13 10 373 1,222 0 — 18,806
14 2 250 -1,75 0,000455 -7,206
15 9 874 -7,14 0,00188 —1,371
16 2 300 —4,34 0,0000002 —2,576
287
Продолжение табл.
Ns варианта а b С d
17 5 020 1,75 0 —3,748
18 —2 203 0 -0,0000516 2,3
19 7 674 —6,23 0,000906 —1,291
20 -29 500 1,75 —0,001215 —3,29
21 И 088 3,113 —0,0028524 -1,483
22 —6 365 2,961 —0,000766 —2,344
23 — 1 485 7,54 —0,00425 , 7,006
24 1 522 5,42 —0,00229 —2,810
25 9 590 —9,9194 0,002285 -6,452
5. Для данной реакции, используя справочные данные [М.], опре-
делите: 1) стандартное сродство при температуре Т, К; 2) равновес-
ный выход вещества D при общем давлении 1,0133-10® Па и Т, К, если
газообразные вещества А и В введены в реакционный сосуд в стехио-
метрических количествах; 3) изменение энергии Гиббса для начально-
го момента реакции, если исходные парциальные давления газов в ре-
акционной смеси равны Ра, Pb, Pc, Pd и реакция протекает идеально
обратимо при температуре Т, К.
г Ns ва* I I рнанта! Реакция A в c D p • 10~4, Па Г, К
A В c D
1 Н2+У2О2^±Н2О H, O2 H2O 7 6 3 1000
2 Н2+У2О2^Н2О H, o2 — H2o 2 1 — 2 700
3 H24-C12z±2HC1 H, Cl2 — HC1 4 3 — 1,5 900
4 2НС14-О2^С124-Н2О HC1 O2 Cl2 H2O 4 3 1,5 1,5 1 1000
5 2HCI ^2-<—н2о HC1 0, Cl2 H2O 1 4 2 700
6 y2N2+»/2H2;-±NHs N, H2 — NHS 10 15 — 10 600
7 y2N24-3/2H2^NH3 N2 H2 — NH3 20 20 — 10 800
8 !/2N»+ y2O2j±NO N, O2 — NO 2 1 — 0,3 1 2000
9 N2 + O2tz;2NO n2 O2 — NO 4 1 — 1000
10 NO2^±NO4-’/2O2 no2 — NO O., 6 — 2 3 460
11 NO,^±NO4-y2O2 no2 — NO o2 3 — 3 3 400
12 N2O4^±2NO2 n,o4 — — no2 5 2 2 2 340
13 N2O4^2NO2 N2O4 — — no2 2 — — 2 320‘
14 8О24" —-SU3 so2 0, — so3 3 1 — 1,5 900
15 SO24-NO2^±SO3 + NO SO, no2 so3 NO 6 3 1,5 1,2 700
16 PC134-C12^±PC15 PCI, Cl2 — PC15 3 6 — 2 500
17 CO + H.,O^±CO2+H2 co H2O co2 H2 5 2 0,7 1,6 1000
18 CO + C12^±COC12 co Cl, — COCL 2 3 — 0,5 900
19 CO4-2H2^±CH3OH co H, — CH3OH 4 3 — 1,6 570
20 co 4- y2O2^±CO2 co 0, —- CO2 4 6 — 3 1000
21 CH4 + H2O^iCO+3H2 CH4 H2o co H2 2 3 0,8 0,7 500
22 3C2H4^=±C.H.+ 3H2 C,H4 — ceH3 H2 2 — 0,7 3 700
23 C2H4 + H2J±C2H3 C2H4 H2 — C2H„ 7 8 — 3 780
24 CjH4 + H2O^C2H6OH C3H4 H2O — C2H5OH 3 2 — 1,2 480
25 (“6^6 4“ ^^24=^6^12 ceH„ H2 — C3H12 6 4 — 2 600
288
/ (jQ_\
6. На основании справочных данных I----т~] и ГМ.1 опре-
делите константу равновесия Кр реакции при температуре Т, К.
Xs ва- | рианта Реакция т, к № ва- рианта Реакция т, к
1 H24-F2 = 2HF 600 14 Н2+ !'2S2=H2S 500
2 Н24-С12 = 2НС1 800 15 РС13 + С12 = РС15 1000
3 Н2 + Вг2 = 2НВг 800 16 С(гр)+2Н2 = СН4 1500
4 Н24-12 = 2Н1 1000 17 ЦгНа 4~ Н2 ~ 500
5 н2+ у2о2=н2о 1500 18 С3Нв 4“ ^2 — С3Н8 800
6 со+у2о2=со. 1000 19 С4н8=с4нв+н2 1500
7 СО+С12 = СОС12 800 20 С4Н8 -д- Н2 = С|Н10 1000
8 Чгр) + 82 = CS2 1000 21 CgHe 4- ЗН2 — свн12 500
9 N24-O2 = 2NO 500 22 СО + 2Н2 = СН3ОН 800
10 NO2^±NO-j- !4О„ 800 23 нсно+н2=сн3он 500
11 N2J-3H2 = 2NH3 1200 24 СНС1Я+С12 = СС14+НС1 1000
12 = ^>О2 800 25 СН3С14- 2С12 = СНС13 4-2НС1 800
13 SOj 4~ ^2^2 = 1000
7. Применяя принцип Ле Шателье и уравнения (XVI 1.3) и
(XVII.30), определите, как будет меняться равновесный выход конеч-
ных продуктов реакции при: а) повышении температуры; б) пониже-
нии температуры; в) повышении давления; г) понижении давления; д)
добавлении инертного газа.
№ ва- рианта Реакция № ва- рианта Реакция
1 N2 + 3H2 = 3NH3 14 2SO2 4- О2 = 2SO3
2 с+о2=со2 15 С2Н44-Н2О = С2Н5ОН(ж)
3 2СО2 = 2СО + О2 16 СдНв = ,С.’аН4 4“ ^2
4 С4-2Н2 = СН4 17 2Н24-СО=СН3ОН(ж)
5 4Н2 4- 2SO2 = 4Н2О(ж) 4- S2(t) 18 С2Н8ОН(ж) = С2Н4 4- Н2О(г)
6 2С4-2Н2 = С2Н4 19 4НС14- О2 = 2Н2О(г) 4- 2С12
7 СОС12=СО4-С12 20 2СО 4-2Н2 =СН44~СО2
8 2Н1 = Н24-12 21 2NO4-O2 = 2NO2
9 2СО4-О2 = 2СО2 22 CsH44-H2 = C2H.
10 2Н2О(ж) = 2Н24-О2 23 2Н2О(г)4-2С12 = 4НС14-О2
11 СО4-С12 = СОС12 24 NH4C1(t) = NH34-HC1
12 N2O4 = 2NO2 25 СН3СНО(г) 4- Н2 = С2Н5ОН
13 2NO2 = 2NO4-O2
8. Вычислите константу равновесия Кр реакции при заданной тем-
пературе Т. Для расчета воспользоваться методом Темкина — Шварц-
мана [М.].
10 Зак. 767
289
№ ва-1 рнаита| Реакция X ьС ! № ва- рианта Реакция Ьй
1 2С2Н5ОН=СН3СОСН3+ЗН2+СО 400 14 С2Н„=С2Н4+Н2 800
2 СН4+2РС15=2РС13+СН2С12+2НС1 500 15 С,Н8=С,Н.+На 700
3 сн4+со2=сн3соон 400 16 СОа+4На = СН4+2Н2О 500
4 2Н2 +СО2 = НСНО-Ь Н2О 500 17 СН44-СО2 = 2СО4-2Н2 700
5 СО2+Н2 = НСООН 400 18 CeHe+3H2=CeHi2 400
6 со+н2о=нсоон 400 19 2SOa+Oa = 2SO3 500
7 СОа+зн2=сн3он + Н2О 500 20 СО4-2На = СН3ОН 600
8 С2Нв+со == сн.сосн3 400 21 Са(ОН)2 = СаО + Н2О 800
9 GjH4 + Н2О = СН3СНаОН 400 22 СаСОа=СаО+СО2 900
10 СН4+4РС15 = СС14+4РС13+4НС1 400 23 nh4ci=nh3+hci 500
11 SOa+Cl2 = SO2Cl2 500 24 Mg(OH)2 = MgO + HaO 500
12 СО+С12=СОС1а 600 25 S + 2CO2 = SOa+2CO 700
13 SiOa+4HF = SiF4+2HaO 900
9.. Определите равновесные парциальные давления всех компонен-
тов реакции и исходное давление вещества А, если известна константа
равновесия термической диссоциации вещества А при температуре
Т, К и общее равновесное Давление смеси Р. Реакция протекает в за-
крытом сосуде при температуре Т, К.
№ вари* анта Вещество Реакция KP Р-10-4, Па Т, К
1 н2о HaO = 2H+O 2,096-Ю10 1,0133 4000
2 Н2О HaO = 2H + O 0,991-1010 2,0266 3900
3 нао HaO = 2H+O 4,271-1010 3,0399 4100
4 so3 SO3 = S + 3O 0,257-Ю15 4,0532 3300
5 so3 SO3=S+3O 1,200-Ю15 5,0665 3400
6 so3 SO3 = S+3O 5,119-Ю15 6,0800 3500
7 FNO FNO = F + N 4- 0 0,720-1010 7,0931 3500
8 FNO FN0 = F + N-f-0 1,715-1010 8,1064 3600
9 FNO FNO = F + N + O 8,266-Ю10 9,1197 3800 .
10 SOFa SOFa = S4-O4-2F 1,031-IO15 10,133 3500
11 SOFa SOFa = S4-O+2F 13,632-1015 1,0133 3700
12 SOFa SOF2 = S + O+2F 3,82-Ю15 2,0266 3600
13 SOFa SOFa = S4-O+2F 0,478-Ю15 3,0399 4200
14 sof2 SOF2 = S4-O4-2F 4,235-1015 4,0532 4400
15 SOFa SOFa = S4-O4-2F 11,726-1015 5,0665 4500
16 QH, C2H2 = 2С(г) + 2H 0,477-Ю15 6,0798 4300
17 CaHa CjjHj = 2С(г) + 2H 3,808-Ю15 7,0931 4500
18 C2H2 CaHa = 2C(r) + 2H 25,596-1015 8,1064 4700
19 SiF4 SiF4 = Si(r)4-4F 2,699-10» 9,1197 4400
20 : S1F4 SlF4 = Si(r) + 4F 11,281-10» 10,133 4500
21 sif4 SiF4 = Si(r)-j~4F 44,281 -10» 1,0133 4600
22 B2O3 BaO3 = 2B-|-3O 0,542-10» 2,0266 4900
23 BaOg = 2B+3O 2,066-10» 3,0399 5000
24 B2O3 BaO3 = 2B4-3O 7,486-10» 4,0532 5100
25 B2O3 BaOg=2B + 3O 25,830 -10» 5,0665 5200
290
ГЛАВА XVIH
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ. РАВНОВЕСИЕ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Основные уравнения и символы
[К., с. 508—557; Г., т. 2, 389—517]
Электрическая проводимость — величина, обратная электрическо-
му сопротивлению I/R. Электрическая проводимость выражается че-
рез удельное сопротивление р:
где
— = %. (XV111.2)
Р
где I — длина проводника; S — сечение проводника; % — удельная
электрическая проводимость.
Эквивалентная электрическая проводимость X выражается через
удельную проводимость:
^=X‘z=X/c. (XV111.3)
где V — разведение (или разбавление) раствора; с — концентрация,
г-экв/л. Разведение — объем, в котором содержится 1 г-экв раство-
ренного электролита.
Уравнение Кольрауша (закон независимости движения ионов)
Х0=Х+4-Х_, (XV111.4)
где Хо— эквивалентная электрическая проводимость при бесконеч-
ном разведении; Х+, — электрические проводимости (электроли-
тические подвижности) катиона и аниона:
A+ = Ft>®, A_ = Ft>®.; (XVI11.5)
где и’, — абсолютные скорости движения ионов, см2/(с-В); F —
постоянная Фарадея.
Скорости движения ионов у+, о. зависят от потенциала поля:
V4-=v».^>/Z; v_=v“i|>/l, (XV1I1.6)
где i|)// — напряженнрсть поля.
Абсолютные скорости движения ионов различны. Доля количества
электричества, переносимого ионами данного знака, равна числу пере-
носа (+ или t_:
t++1- — 1;
t>+ Ад. A+ v®.
= <XV"L7)
10*
291
Число переноса иона выражается через изменение концентрации
электролита в катодном Аск или анодном Аса пространствах:
А ск t А са
Ас Ас
(XVI11.7а)
где Ас — общая убыль концентрации электролита.
Уравнение Кольрауша описывает зависимость электрической про-
водимости от концентрации:
Х = Х0—АУТ, (XV111.8)
где А — константа.
При диссоциации бинарного слабого 1 — 1-валентного электролита
АВ А+ + В- константа равновесия будет
Если степень диссоциации равна
1А+] [В] X
а =------------- — ,
с с Aq
то константа диссоциации будет
KL = a?c/(l — а).
(XVII1.9)
(XVI11.10)
(XV1I1.11)
Для Кс < 10~5 или а < 1 можно принять Кс = а2с.
Подстановка в уравнение (XVIII.11) а из уравнения (XVIII.10)
приводит к выражению
Vc .......
(XVII1 -12)
К<- =----------.
Ха (*0— X)
Зависимость константы диссоциации от температуры описывается урав-
нением
d In Кс __ А //дисс
dT ~ RT*
(XV111.13)
интегрирование которого приводит к соотношению
Кт. //дисс /1 1 \
1g ----=-------------{-------------I,
KTi 2,37? \ Т2 Л I
где А//Дисс — теплота диссоциации. Работу диссоциации W определя-
ют по уравнению изотермы Вант-Гоффа
(XVII1.14)
U7=-AGo = /?Tln Кс,
(XVII1.15)
где AG0 — изменение энергии Гиббса при диссоциации.
Для сильных электролитов вместо концентрации в термодинамиче-
ские уравнения следует подставлять активности. Активности электро-
литов выражают через моляльности и среднеионные коэффициенты ак-
тивности (табл. 4).
292
Таблица 4. Соотношение между моляльностью т,
. средней ионной моляльностью т±, активностью а
и средним иоииым коэффициентом активности у± для различных
электролитов
Тип валентности электролита Электролит Активность электролита Средняя активность v иоиа а±= у а
1—1, 2—2, 3-3 KCl, ZnSO4, LaFe(CN)e т2 -у3. тУ±
2—1, 1—2 СаС12, Na2SO4 4m3 у3. 3 / 4 тут
3-1, 1—3 А1С13, K3Fe(CN)e 27 m4 *'27ту±
3—2 Ala(SO4)3 108m5 yjj. 5 V 108m у ±
Зависимость средней ионной моляльности т± от моляльности элект-
ролита выражается уравнением
т± = т (v? vl_)1/V, (XV111.16)
где v+, v_ — число катионов и число анионов; v — общее число ио-
нов; V = v+ + v_.
Средний ионный коэффициент активности у± выражается через
ионные коэффициенты активности:
Y±=(y++Y--) • (XV111.17)
Средняя ионная активность будет
a± = ffi±Y±. (XV111.18)
Общая активность электролита со средней ионной активностью связа-
на соотношением
a=(a±)v = a^+aS (XV1I1.19)
где а+, а- — активности ионов;
Oj=y+ffi+; a_ = y_m_. (XV111.20)
Ионные моляльности связаны с моляльностью электролита соотноше-
ниями:
m+=mv+, = (XVI11.21)
Предельное уравнение Дебая и Гюккеля зависимости среднеионного
коэффициента от ионной силы I раствора имеет вид
lgV± = -0,509z+z_ У“Г, (XV111.22)
где г+, г_ — заряды катиона и аниона;
293
г?;
(XVI И.23)
mt — моляльность Z-го иона в растворе; Zi — заряд Z-ro иона.
Для 1—1-валентного электролита уравнение (XVIII.22) будет
1g у±= —0,509 т •
(XVI11.24)
Уравнение (XVIII.22) применимо при значениях / < 0,001. Если ион-
ная сила раствора не превосходит 0,1, то коэффициенты активности
отдельных ионов одинакового заряда приблизительно одинаковы (см.
табл. 5).
Таблица 5. Коэффициенты активности ионов
Ионы Коэффициенты активности ионов при ионной силе растворов I •
0,001 0,005 0,01 0,02 0,05 0,10
Одноразрядные 0,98 0,95 0,92 0,89 0,85 0,80
Двухразрядные 0,77 0,65 0,58 0,50 0,40 0,30
Трехразрядиые 0,73 0,55 0,47 0,37 0-,28 0,21
Активности веществ, растворенных в неводных растворителях
(амальгамы, сплавы), рассчитывают по уравнениям:
аг = хгуг,
at = -Д- (Pt, Р• < 1 атм),
(XVII1.25)
(XVI 11.26)
где xt — молярная доля Z-то вещества; у, — рациональный коэффи-
циент активности; Рг —давление насыщенного Z-ro вещества над раст-
вором (расплавом амальгамой); Р’ — давление насыщенного пара над
чистым Z-м веществом.
Для реакции гидролиза Ме+ + Н2О ~ МеОН + Н+ константа
равновесия
аМеОНаН +
Ла —
аМе+ аН2О
или (так как ан,о = const)
аМеОНаН +
Лг= — Аа^н.О-
“Ме +
Иначе можно записать
*г== V(l-x) ’
где х — часть распавшихся молекул соли; (1 —х) — часть молекул
негидролизованной соли; V — объем раствора в литрах.
294
Для вычисления константы гидролиза соли, образованной сла-
бым основанием и сильной кислотой используют соотношение
v Kw
Лг =----->
У ОСН
где Ки, — ионное произведение воды; /<осн — константа диссоциации,
образующегося при гидролизе основания.
Степень гидролиза, т. е. отношение числа гидролизованных молей
соли к общему числу растворенных молей соли,
число гидролизованных молей
общее число молей
100%
ЗАДАЧИ С РЕШЕНИЯМИ
1. Для 0,01 и. КС1 удельное сопротивление р — 709,22 Ом-1-см.
Вычислите удельную % и эквивалентную электрические проводимости.
Решение. Удельную электрическую проводимость вычисляем
по уравнению (XVIII.2):
X = ---= 1,41'10-’ Ом-1-см-1 = 0,141 Ом-1'М-1.
Л 709,22
Эквивалентная электрическая проводимость, согласно (XVIII.3),
выражается уравнением
„ 0,141-10-3
к -----------=0,0141 Ом-1 • г- экв-1 • м2.
0,01
2. Вычислите эквивалентную электрическую проводимость уксус-
ной кислоты, при бесконечном разведении, при 298, К, если электри-
ческие проводимости НС1, NaCOOCH3, NaCl равны 0,0426; 0,0091;
0,0126 Ом“1-г-экв-1.м2 соответственно.
Решение. Составляем систему уравнений согласно (XVIII.4):
^о, HCI = ^о, н+ + ^о, ci- — 0,0426, (1)
Ч, CH3COONa = ^0, Na+ + ^0, СН.СОО- = °,0091, (2)
^0, NaCI = 4, Na + + 4, Cl- = °,0126. (3)
Согласно (XVIII.4) складываем уравнения (1) и (2), вычитаем из них
уравнение (3) и получаем
Ч. НС1 +4. CHjCOONa NaCl = ^Н++^СН,СОО~ =
= 4, сн,соон = °,04264-°,0091 —0,0126 = 0,0391 Ом-i-г-экв-^м2.
3. Для бесконечно разбавленного раствора NH4C1 при 298,2 К чис-
ло переноса катиона t+ = 0,491. Вычислите электролитическую под-
вижность и абсолютную скорость аниона Cl~; Хо, nh4ci —
— 0,0150 Ом_1.г-экв-1-м2.
Решение. Согласно уравнению (XVIII.7)
Х_ = Х0 (1—/+)=0,015 (1—0,491) = 0,00763 Ом^-.-экв-^м2.
295
Абсолютную скорость ui рассчитываем по уравнению (XVIII.5):
0,00763
V» =-----------=7,91-10-8 м«/(с-В).
9,65- 104 м ’
4. При электролизе раствора AgNO3 на катоде выделилось
0,5831 г серебра, убыль AgNO3 в катодном пространстве составила
2,85-10-3 моль. Определите числа переноса t- и t+ для AgNO3.
Решение. Убыль серебра в катодном пространстве и об-
щая убыль AgNO3 в растворе АС, соответствующая количеству сереб-
ра, выделившегося на катоде, должны быть выражены в одних и тех
же единицах. Находим число молей серебра, выделившегося на катоде:
т 0,5831
Дс = Д/г =-- = --------= 5,4-10-3 моль.
М 107,9
Подставляем в уравнение (XVIII.7а) и получаем
2,85-Ю-з
t- =—:--------=0,528; /+ = 1— /_ = 0,472.
5,4-10-з
5. Для 0,1 М раствора Cr2 (SO4)3 вычислите среднюю ионную мо-
ляльность, активность, общую активность электролита и активности
ионов SOI- и Сг3+ при 298 К-
Решение. Среднюю ионную моляльность вычислим по уравне-
нию (XVIII.16):
т± = (22-З3) 1/5-0,1 =0,255.
Среднюю ионную активность вычисляем по уравнению (XVIII. 18):
у± = 0,0458 [М], о±=0,255-0,0458 = 0,0177.
Общую активность электролита а вычисляем по уравнению
(XVIII.19):
а=(0,0177)5 = 2,17-101».
Ионные моляльности щСгз + и рассчитаем по уравнениям
(XVIII.21): 4
тСгз+ =0,1 -3 = 0,3; mSO2- =0,1-2 = 0,2;
активности аниона и катиона определяем по уравнениям (XVIII.20):
а ,<.=0,3-0,0458 = 0,0137; а = 0,2-0,0458 = 0,0092.
Сг3+ SOJ
6. Определите ионную силу I раствора, содержащего 0,001 моль
H2SO4 и 0,002 моль MgSO4 на 1000 г воды при 298 К.
Решение. Согласно уравнению (XVIII.23)
/ = >/2 (тн'+ 4 +mso|- ^+mMg2+ z2+ +™о2- zl). х
Моляльности ионов определяем по уравнениям (XVIII.21). Тогда
ионная сила будет
/ = 1/2 (2-0,001 -12 4-0,001 -224-0,002-224-0,002-22) =0,011.
296
7. Вычислите средние ионные коэффициенты активности для
0,01 и 0,0001 М растворов NaCl, сравните полученные велиины с опыт-
ными [M.J.
Решение. Вычисляем средние ионные коэффициенты активно-
сти по уравнению (XVIII.24):
lgr±= —0,509 V 0,01 = —0,0509; у± = 0,888;
1g ?±=—0,509 У0,001 =—0,016; ?± = 0,963.
т.............. 0,01 0,001
Т±раСч ........ 0,888 0,963
?±оп .......... 0,903 0,965
Полученные данные показывают, что предельное уравнение
(XVIII.22) дает надежные результаты лишь при I < 10~3.
8. Вычислите степень диссоциации воды при 298 К, используя
удельную электрическую проводимость воды, плотность и подвиж-
ности ионов.
Решение. Удельную электрическую проводимость воды и экви-
валентные электрические проводимости ионов Н+ и ОН“ при беско-
нечном разведении находим в справочнике [М.]:
% = 6,33-10-8 Ом~1-см-1;
X ,=394,8 Ом-1-моль-1-см2; X =198 Ом-1-моль-1 см2.
Н'*’ он
Концентрацию воды определяем по плотности [M.J;
d-1000 0,997
cun=----------=-------=55,39 моль/л.
н-° м 18
Степень диссоциации воды определяем по уравнению
X 6,33-10-8
а =---Н----П5----” = 2,09- 10-е.
(^Н+ + ХОН-) 55,39-10-3 (349,84-198,3)
9. Вычислите степень диссоциации и pH 1,6-10-4 МСН3СООН при
298 К- Константа диссоциации СН3СООН Кс = 1,75-10“8.
Решение. Степень диссоциации СН3СООН рассчитаем по урав-
нению (XVIII.11):
Составляем квадратное уравнение
1,6а2 + 0,175а—0,175 = 0,
решив которое, получаем а = 0,28. Концентрацию иона водорода на-
ходим по уравнению (XVIII. 10):
[Н+]= с а= 1,6-10-4-0,28 = 4,48-10-6,
откуда
pH = —lg4,48-10-3 = 4,34.
297
10. Константа диссоциации гидроксида аммония при 298 К рав-
на 1,77-10-5. Вычислите концентрацию ионов ОН-, Н+ и pH 0,1 М
NH4OH.
Решение. Концентрацию ионов ОН- рассчитаем по уравнению
(XVIII.9). Принимаем, что концентрация NH4OH практически равна
исходной (при Кс < Ю“5). Тогда
[ОН-] = [ЬЛУ]=ас=УУГё~ = У 1,77-10-5.0,1 = 1,33-10~3 моль/л.
Концентрацию ионов водорода определяем из ионного произведе-
ния воды:
Ku> = fl„+а_н_= 1,008-10~14 [М]
Принимаем, что активности ионов Н+ и ОН" равны их концент-
рациям:
1,008-10-1*
а , = с,,, =----------= 0,76-10_11 моль/л.
н+ Н+ 1,33-IO-»
Вычисляем pH:
pH = -1g с, = -1g 7,6-10-10= 11,12.
н
11. Вычислите концентрацию ионов ОН- в 0,1 М растворе NH4OH,
содержащем 1 моль/л NH4C1. Покажите, как изменится pH раствора
NH4OH при добавлении к нему NH4C1. Соль NH4C1 полностью диссо-
циирует.
Решение. Вычисляем концентрацию ионов ОН“ по уравне-
нию (XVIII.9). Принимаем, что концентрация NH4OH практически
равна исходной [NH4OH] = 0,1 моль/л и концентрация иона МЩ
равна концентрации NH4C1, так как (Xnh4ci = 1- Отсюда [NH 4] =
= 1 моль/л. Константу диссоциации NH4OH найдем из [МЛ. Подстав-
ляем числовые значения в уравнение (XVIII.9):
[ОН-] 1
177.10- 5=—---—; [ОН'] = 1,77-10-'.
0,1 J
В результате добавления NH4C1 концентрация ионов ОН- умень-
шилась и, следовательно, значение pH раствора также уменьшилось.
12. Для 0,005 и 0,05 М водных растворов серной кислоты при 298 К
определены значения pH 2,10 и 1,2 соответственно. Вычислите водород-
ный показатель этого раствора, используя данные о средних ионных и
ионных коэффициентах активности.
Сравните расчетные величины и опытными и сделайте выводы.
Решение. Для вычисления pH необходимо определить актив-
ность иона водорода. Вычисляем ионную силу раствора по уравнению
(XVIII.23): / = V2 (2-0,005-12 + 0,005-22) = 0,015. Находим у±
в справочнике [М.]. Вычисляем активности а± иан+ по уравнениям
(XVIII. 18) и (XVIII.20). Исходные данные и результаты расчета сво-
дим в таблицу:
298
т, моль/1000 г Рноп ?+ / РНвыч
— Ig V± т± -Ig v+m +
0,005 2,1 0,639 0,015 0,905 2,19 20,04
0,05 1,2 0,34 0,1 — 1,10 —
Сопоставление вычисленных значений pH с опытными показывает,
что расчет дает лишь приближенные величины. Лучшее совпадение вы-
численной и опытной величин наблюдается для более разбавленного
раствора.
13. Вычислите произведение растворимости Са (ОН)2 при 298 К.
Растворимость гидрооксида кальция 0,155 г/100 г воды.
Решение. Активности ионов вычисляем по уравнению
(XVIII.20). Моляльность насыщенного раствора
0,155-10 1,55
т—----------= ------ =0,0209 моль/1000 г.
М 74,1
Средние ионные коэффициенты активности вычисляем по уравне-
нию (XVIII.22). Для этого по уравнению (XVIII.23) находим ионную
силу раствора:
/ = 1/2 (0,0209-224-2-0,0209-1) =6,27-10-2.
Подставляем полученную величину в уравнение (XVIII.22):
lg?±= —0,509-1-21/6,27-10-2=- —0,255 и у± = 0,556.
Вычисляем произведение растворимости:
ПР = шСа2+ у± (2тон_у±)2 = 4т2?3; = 4 (0,0209)3 0,5163 = 6,28-10-е (МОль/л)з.
14. Вычислите растворимость CuCl при 298 К в чистой воде и в
0,025 М растворе MgSO4. Используйте данные о произведении раство-
римости CuCl.
Решение. Растворимость CuCl в воде вычисляем, допустив,
что концентрация электролита очень мала, так как CuCl полностью
диссоциирована и коэффициенты активности ионов равны единице.
Отсюда
[CuCl] = [Cu+] = У~ПР~,
ПР = 3,2-10-’ (моль/л)’ [М.],
[CuCl] = 1/3,2-10-’ =5,65-10-4 моль/л.
При расчете растворимости CuCl в растворе MgSO4 нельзя принимать
коэффициенты активности равными единице, так как [MgSOJ =
= 0,025. Тогда
[СиСЦ-]/ ПР/(Тси+?С].) .
299
Коэффициенты активности вычисляем по уравнению (XVIII.22).
Ионную силу раствора вычисляем по (XVIII.23):
1 = Ч2 (0,025-224-0,02^-22) =0,1.
Коэффициенты активности для двухзарядных ионов находим в
табл. 5: YMg2+ = Tso|- = 0,3. Рассчитаем растворимость CuCl:
[CuCl] = V 3,2-10-’/0,3-0,3 = 5,96•10~4 моль/л.
15. Вычислите теплоту нейтрализации при 298 К, используя дан-
ные таблицы стандартных термодинамических величин для ионов в вод-
ных растворах электролитов [М.1.
Решение. Теплота нейтрализации равна теплоте реакции
Н (aq) + ОН (aq) = Н2О (ж), протекающей в гипотетическом пре-
дельно разбавленном растворе. Значение Л/7нейтр рассчитаем по урав-
нениям:
А ^нейтр = А HjO Д Hj н+ Д Hf он"- & Н{, Н+ = G>
Д Я® Он-= —229,94 кДж/моль; Д Я® ,н2О = —285,84 кДж/моль [М.];
Д Янейтр = —285,84— ( —229,94) = — 55,94 кДж/моль.
16. Вычислите ионное произведение воды Kw ~ ан+ «он- при
298 К, используя данные таблицы стандартных термодинамических
величин для ионов в водных растворах электролитов AGh2o —
= — 237,25 кДж/моль.
Решение. Для реакции диссоциации воды Н2О (ж) ?±Н+ т
+ ОН- константа равновесия выражется через активности
а . а„ _ г,
Ка" Н+ ОН _ Кгг
аН,О аН2О
Так как концентрация ионов Н+ и ОН" в воде исчезающе мала, то
*н2о = 1 = ан2о или Kw = Ка- Константу диссоциации находим
по уравнениям:
А Одисс = 1П Д °дисс =-- Л Gh+ + Д GOH— A GH,oI
Д0ц+=0; AGqH-= — 157,30 кДж/моль [М.],
Д 0дисс = — 157,30—(—237,25) = 79,950 кДж/моль;
1g Яо= —79,95-103/2,3-8,314-298,15= —14,023;
Ка = К» = 0,95-10-м.
17. Для реакции диссоциации муравьиной кислоты (HCOOH)aq =
— Н+ + НСОО~ дана зависимость константы диссоциации от темпера-
туры:
1342,85
Ig/Ca —---—+5,2743 —0,0152Г.
Вычислите теплоту диссоциации АЯДИСС и теплоту нейтрализации
А//Нейтр муравьиной кислоты в разбавленном водном растворе.
300
Решение. Теплота диссоциации может быть рассчитана по
уравнению
лн I dlnK« 'l
Л/'диСС— ( j, 1/?Т . I
Умножая обе части исходного уравнения на 2,3, получаем:
In Уа= -2,3-1342,85/T-J-2,3-5,2743 —2,3-0,0152Т
и возьмем производную
d In Ка
----------------------- =2,3-1342,85/Т2 —2,3-0,0152.
dT---------------------’
Умножим производную на RT'1 и получим
Л Удисс —2,3/?-1342,85—2,3/?-0,0152Г2,
Откуда
А^дисс==—133,15 Дж/моль.
Термохимическое уравнение реакции нейтрализации муравьиной кис-
лоты
НСООН4-ОН- = НСОО~ + Н2О4-ДЯ (1)
можно представить как сумму двух уравнений реакций:
реакции диссоциации НСООН = Н+4-НСОО~4-Д /7ДиСС (2)
и
реакции нейтрализации Н+ 4- ОН-= Н2О-|- Д 7/нейтр (3)
Суммирование уравнений реакций (2) и (3) дает реакцию (1) и
показывает, что А// = АДдисс + АДнейтр, поскольку АДдисс =
— —133, 15 Дж/моль, АДНейтр = — 55,94 кДж/моль. Отсюда тепло-
та нейтрализации муравьиной кислоты в разбавленном водном раство-
ре будет АД = — 56, 072 кДж/моль.
18. Вычислите энтропию реакции диссоциации ААДИСС при 298 К
и энтропию иона НСОО-, если энтропия НСООН в разбавленном вод-
ном растворе 5нсоон(аЧ) = 163, 8 Дж/моль, а засисимость констан-
ты диссоциации муравьиной .кислоты от температуры выражается урав-
нением
1342,85
lg/Cn= —--------— 0.0152Т 4-5,2743.
Решение. По уравнению (XVIH.15) вычисляем АСдисс:
Абдисс= 4-1342,85-2,3/? —5,2745-2,3/?Т4-0,0152-2,3/?Т2 =
= 2 560 492 —100,57Т 4-0,291Т2.
Затем, взяв производную по температуре, находим А5ДИСС:
/ адб \
— А5ДИСС=- —------------------- =—100,57 4-2-0,291Т
301
и при 298 К
Д Здисс = 100,57 - 2-0,291 -298= —72,87 Дж/(моль-К).
Энтропию иона НСОО- вычисляем по формуле
А Здисс = 3НСоо_ + 5н+ — 5НСООН (aq) •
Так как 5н+ = 0, то
^нсоо- = ^нсоон "Ь & 5дисс = 163,29 72,87 = 90,42 Дж/(моль - К)-
19. Определите температуру, при которой диссоциация муравьи-
ной кислоты в водном растворе максимальна. Уравнение зависимости
константы диссоциации НСООН от температуры имеет вид
1342,85
lg/Ca=------у---+ 5,2743—0,0152Г.
Решение. Находим координаты экстремума на кривой
lg/<«„cc = f (Л,
d In Ка
----~Г~ =3098,55/7’2 — 0,035.
dT
, д2 In Ка
Отсюда следует, что в точке экстремума (максимум, так как—<
<0)
Гтах = У 3098,55/0,035 = 297 К-
Диссоциация муравьиной кислоты максимальна при 297 К.
20. Вычислите произведение растворимости ПР для Ag2CO3. Для
расчета используйте значение стандартных термодинамических свойств
неорганических веществ, приведенных в справочнике [М.1.
Решение. Согласно условию гетерогенного равновесия
(XVIII. 19),
G Ag,CO, (нас. р-р) = GAg2CO, (т)" (О
Из справочника [М. 1 находим:
Д 0д£2со, (т) — —437,79 кДж/моль,
А GAg,CO, (нас. р-р) = А GAg2COa (р-р)„ 00 1" aAg,CO,; <2)
А GAg,COa (р-р), co=2AGAg+ + A GCO|-; (3)
aAg,CO, ~aAg+ аСо|~ = ПР’’
ДОде+ = 77,21 кДж/моль; AGqO2- = —528,48 кДж/моль [М.].
Подставляя числа в уравнения (1) — (3), получаем:
— 437,79 = 2.77,21—528,48 + 2,3-8,314-2981g ПР,
ПР = 6,92-Ю-i2 (моль/л)».
302
21. Вычислите парциальное давление 6М соляной кислоты при
298 К, используя данные о стандартных значениях энергии Гиббса и
среднеионных коэффициентах активности.
Решение. Согласно условию гетерогенного равновесия
МнС! (г)= МнС! (р), (О
Hhci (г)= Ннс1 (г)+ЯТ In анс1 (r)i (2)
Мне! (р) ~ Мне! (р) оо + «Г In анс) (р)> (3)
аНС1 (г) = ₽НС1/1> (4)
анс1(Р)='"2Т±. (5)
Согласно уравнениям (1) — (5)
Мне! (г) + ^Г In M-ftci (р-р), оо Inm2?2,
и
]ер МнО (р-р) оо + ЛГ1п/П»Т2-Ц»с|(г)
2,ЗДТ
Мне! (р-р), оо = Л GHC1 (р-р). оо= А GH++ А Gcr =
= 0+( —131,5) = —131,35 кДж/моль [М.[,
Mho (r)=AGHCi (г)= 95,36 кДж/моль [M.J,
у± = 3,22 [M.J.
, „ -131,35+2,3-8,314-2981g62-3,22a —95,36
к НС1 2,3-8,314.298
Рнс1 = 1,93-Ю-4 атм, или 1,93-10-4-760 = 0,147 мм рт. ст.
22. Вычислите Кт, аон-. ан+, pH и степень гидролиза в 0,1 М раст-
воре Na2CO3 при Т = 298 К. Вторая константа диссоциации уголь-
ной кислоты К2 = 5,61- IO-11, Kw = 1,27-10~14.
Решение. Определяем А"г. Гидролиз Na2CO3 практически идет
по реакции первой ступени
со2-+Н2О=нсо^-+он-
Согласно этому уравнению
G Q Cl da. „
% _ __нсОгГ он~ = нсог он н+ = Kw
°со23- асо|- ан+
где К2 — вторая константа диссоциации угольной кислоты,
НСОг==Н+ + СО2~
Таким образом,
1,27-10-1*
5,61 10-и
= 2,265-10-*.
303
Определяем аОн-- Так как Кг = 2,265-10-4, то вычислять
необходимо по уравнению
[ОН-]
[ОН] =
Так как и
v£.
1 \ _ г ж
__£_ малы по сравнению с дг с. то последнее уравне-
ние упростим:
[ОН-1 = —+ У Кг с ,
откуда
2,265-10'4 , п .-----------------------------------------
[ОН~] = ——--------------Ы/2,265 10-«-0,1 =
= --1,13-10*Щ-4,76-10~:| =4,65-10~3 г-ион/л.
Определяем
/ (12.0,2 + 22-0,1) = 0,3, у± = 0,66,
а = 0,66-4,65-10*3 = 3,07-10~3,
он- ’
откуда
pH = р Ди,—рОН-= 13,90+ Ig (3,07-Ю*3) = 11,383.
Определяем ан + :
Ки, = ан+аон-,
Kw 1,27-Ю-14
“н+ = = 3,07-10-з' = 4-14-10~12-
ОН'
Степень гидролиза
ah = 1/------------- 100 = 4,76 %.
’ Акисл ссоли
ЗАДАЧИ
1. Рассчитайте электрическую проводимость (1/r) 1М раствора
AgNO3 прн 291 К, если расстояние между электродами 5 см, площадь
каждого электрода 2 см2. Эквивалентная электрическая проводи-
мость этого раствора X = 94,3 Ом-1-см2/г-экв.
2. Молярная электрическая проводимость 0,5 М раствора K2SO4
прн 298 К равна 162,7 Ом-1-см2/моль. Определите удельную и эквива-
лентную электрическую проводимость прн этой температуре.
3. При электролизе раствора AgNO3 серебряными электродами уве-
личение массы соли в анодном пространсте составило 0,0625 г. Чему
равна убыль соли (в граммах) в катодном пространстве?
304
4. Раствор нитрата серебра, содержащий 0,18475 г AgNO3 на 25 г
воды, подвергали электролизу с серебряным анодом. После электролиза
анодное пространство содержало 0,2361 г нитрата серебра на 23 г во-
ды. За данный промежуток времени на электроде выделилось 0,0780 г
серебра. Определите числа переноса Ag+ и NOl.
5. Абсолютные скорости движения ионов Sr2+ н С1- в разбавлен-
ном растворе прн 291 К равны соответственно 5,2-10-8 н 6,8-10-8
м2/(с-В). Определите эквивалентные электрические проводимости и
числа переноса нонов в растворе SrCl2.
6. Эквнвалентня электрическая проводимость КС1О4 прн бесконеч-
ном разбавлении прн 291 К равна 122,8 0м-1 -см2-г-экв-1. Число пере-
носа нона СЮ? 0,481. Определите подвижности нонов К+ н СЮ^.
7. Рассчитайте эквивалентную электрическую проводимость
0,001 и. раствора LiCl и сравните с опытной величиной
96,6 Ом-1-см2-г-экв-1. Эквивалентные электрические проводимости
0,001 и. растворов LiNO3, NaNO3 и NaCl прн 291 К равны соот-
ветственно 92,9; 102,9; 106,5 0м-1 • см2 г-экв-1.
8. Построив график зависимости X от]/с, рассчитайте Хо для КС1 и
сравните с табличными данными [М.1. Для 291 К дана зависимость
с, моль/л......... 0,0001 0,0002 0,001 0,002 0,01 0,02 0,1 0,2 I
X, Ом-1-см2-г-экв-1 129,1 128,8 127,3 126,3 122,4 120,0 112,0 108,8 98,3
9. Установите область концентраций, для которой применимо урав-
нение Кольрауша (для растворов КО), если для 291 К дана зависи-
мость X --= f (с):
с, моль/м ........ 0,0001 0,0002 0,001 0,002 0,01 0,02 0,1 0,2 1
X, Ом-1-см2-г-экв-1 129,1 128,8 127,3 126,3 122,4 120,0 112,0 108,8 98,3
10. Определите молярность раствора соляной кислоты, если прн
кондуктометрическом титровании 100 мл раствора НС1 8 и. раствором
NaOH получены следующие результаты:
К\аОН’ мл ............ 0,32 0,60 °-92 С56 2’°° 2,34
X-fo2, Ом-1-см-1 . . . 3,20 2,56 1,86 1,64 2,38 2,96
11. Рассчитайте эквивалентную электрическую проводимость прн
298 К и бесконечном разбавлении для монохлоруксусной кислоты, ес-
ли константа диссоциации 1,55* 10~3 (моль/л), а эквивалентная
электрическая проводимость прн разбавлении V — 32 л/моль равна
77,2 Ом-1-см2-г-экв л.
12. Эквивалентная электрическая проводимость 1,59-10-4 М ук-
сусной кислоты прн 298 К равна 109, 78 Ом-1-см2-г-экв-1. Вычислите
контанту диссоциации и pH раствора, данные о подвижностях нонов
возьмите из справочника [М.].
13. Вычислите константу днссоцнацнн NH4OH, если прн данной
температуре 0,1 и. раствор имеет pH 11,27. Ионное произведение воды
прн этой температуре = 0,71 • 10-14.
305
14. Рассчитайте концентрацию ионов водорода в растворе, содер-
жащем в 1 л 0,1 моль уксусной и 0,1 моль хлоруксусной кислоты
при 298 К. Константы диссоциации этих кислот возьмите из спра-
вочника [М.].
15. При 291 К удельная электрическая проводимость % насыщен-
ного раствора хлорида серебра равна 1,374-10-4 Ом-1-м-1 (См • м-1),
удельная электрическая проводимость воды, определенная в тех же
условиях, 4-10-8 Ом~1-см~1. Вычислите молярную концентрацию AgCl
в насыщенном растворе. Значения подвижностей возьмите в справоч-
нике [М.1.
16*. Растворимость Ва (Ю3)2 при 25° С равна 8-10“4 моль/л. Оп-
ределите растворимость этой соли: 1) в 0,1 М растворе KNO3; 2) в
0,03 М раствора Ba (NO3)2. Зависимость коэффициентов активности
ионов от ионной силы раствора приведена в табл. 5.
17 *. Рассчитайте эквивалентные электрические проводимости
5-10~4 и 0,1 М растворов NaCl по уравнению Кольрауша — Онзагера
для 298 К. Сравните полученные величины с табличными. Данные о
подвижностях ионов при бесконечном разбавлении, вязкости и ди-
электрической постоянной воды возьмите из справочника [М.1.
18. Вычислите активность Na2SO4, НС1, Pb (NO3)2 в растворах с
концентрацией данного электролита пг = 1 моль/1000 г по данным о
среднем коэффициенте активности, взятом из справочника [М.1.
19. Вычислите ионную силу, коэффициенты активности отдельных
ионов и среднеионные коэффициенты для растворов смеси электроли-
тов при 298 К, если в растворе содержатся (моль на 1000 г воды)
следующие соли: Ip.p: MgSO4— (>,005; LaCl3 — 0,010; Na2SO4 —
0,006; IIP.P: MgSO4 — 0,01; LaCl3 — 0,002; Na2SO4 — 0,005.
20. Вычислите по уравнению Дебая — Гюккеля и по данным, при-
веденным в табл. 5, средний коэффициент активности ионов соли ВаС12,
если I = 0,02 при 298 К.
21. Отношение парциальных давлений хлористоводородного газа
при 298 К над растворами соляной кислоты с т1 = 4 и т2 = 8
равно 0,02253. Определите отношение среднеионных активностей а±
этих растворов. Сопоставьте результат с данными справочника [M.J.
22. По данным зависимости К,„ от температуры [М.1 вычислите
теплоту реакции Н+ + ОН” = Н2О. Сравните полученный результат
с теплотой нейтрализации, найденной калориметрически: Д/7иейтр =
~ 5,60-103 Дж/моль.
23. Теплота нейтрализации уксусной кислоты 0,005 н. раствором
NaOH при 18° С равна — 56105,8 Дж/моль, а для соляной кислоты
она составляет— 57571,25 Дж/моль. Чему равна теплота реакции
CH3COONa + НС1 = NaCl + СН3СООН
24. Для реакции
HNO3+NH3 (r)=NH4NO3 (aq)+A7/
306
протекающей при 298 К в разбавленном растворе, определена теплота
реакции АЯ =—86, 671 кДж/моль. Вычислите АЯ“ NH+, если
A//fNH,(r)=— 46,224 кДж/моль.
25. Константа диссоциации слабой кислоты НА = Н+ +
+ А- в зависимости от температуры изменяется в соответствии со сле-
дующим уравнением:
3000
’й^дисс —— j, + 21g Г-|-2.
Определите при температуре 300 К AS, А№, AG® диссоциации.
26. Определите AG®, АД®, AS® и АСр при 298 К для реакции
HSO4 = Н+ + SO?- по зависимости 1g К = 47^’14 4-5,0435—0,0182 Т
и сравните полученные результаты с данными таблиц стандартных
термодинамических величин [М.1.
27. Вычислите произведение растворимости Са (ОН)2 при 298 К,
использовав данные о термодинамических свойствах индивидуальных
веществ и ионов в водных растворах.
28. Для раствора, содержащего 0,9 моль КС1 и 0,01 моль НС1 на,
1000 г воды, вычислите водородный показатель pH. Опытное значение
pH 2,078.
29. Рассчитайте средние ионные коэффициенты активности ком-
плексной соли диаминодинитрооксалаткобальтиата тетрааминоокса-
лата кобальта (III)
[Co(NH3)4C2O4]+[Co(NH3)2(NO2)2C2OJ~
в водных — растворах хлорида натрия при 15°С:
cNaCl ’ модь/л...... о 0,0003 0,001 0,005 0,01 0,02
Растворимость соли,
моль/л ............ 0,4900 0,4935 0,500 0,5220 0,5936 0,5646
30. Вычислите растворимость иодида серебра в воде при 25° С ис-
ходя из величин стандартных энергий Гиббса для образования Agl(Kp),
Ag+ и I~ из простых веществ.
31. Вычислите стоксовый радиус иона лития в водном растворе при
бесконечном разведении при 298 К. Сравните полученное значение с
кристаллографическим радиусом Li+, по Бокию, 0,68-10-8 нм.
32. Вычислите коэффициенты активности йодата серебра в раство-
рах нитрата калия разной концентрации, если
CKNO3J02’ моль/л 0 0,1301 0,3552 0,6503 1,4100 7,0500 19,9800
Растворимость
Ag 1О3-Ю4,моль/л 1,771 1,828 1,870 1,914 1,999 2,301 2,665
Растворимость йодата серебра приведена при 25°С в чистой воде и в
присутствии различных количеств нитрата калия.
Постройте график зависимости логарифма коэффициента активно-
сти от корня квадратного из ионной силы раствора. Определите,
307
в какой мере полученные результаты согласуются с предельным за-
коном Дебая — Гюккеля.
33. Рассчитайте pH 10~8 М НВг в воде при 25° С. При расчете уч-
тите диссоциацию воды на ионы.
34. Зависимость ионного произведения воды Kw от температуры
описывается уравнением
5242,39
lg Kw=- —---Y +35,3944—0,008537—11,8261 lg Т.
Выведите уравнение зависимости теплоты диссоциации воды от тем-
пературы. При какой температуре ионное произведение воды достиг-
нет максимального значения?
35. Удельные электрические проводимости х растворов труднораст-
воримой одноосновной кислоты НА при различных концентрациях рав-
ны для 8,1 • 10~3 М НА х = 3,24-10-4 Ом_1-см-1, а для насыщенного ра-
створа х = 6,00- 10_4Ом-см_1. Эквивалентные электрические проводи-
мости Хо (Ом-1-см_2-г-экв-1) при бесконечном разведении для калие-
вой соли КА, хлорида калия и соляной кислоты соответственно рав-
ны: Хо.ка = 124; Хо,кс1 — 150; A,0,hci = 426. Вычислите константу дис-
социации и растворимость кислоты.
36. Определите растворимость бромида серебра в 0,001 М при
25°С. Произведение растворимости бромида серебра возьмите из спра-
вочника [М.1. Воспользуйтесь предельным законом теории Дебая —
Гюккеля.
37. Рассчитайте растворимость хлорида серебра в 0,01 М водном
растворе NHO3 при 25° С. Воспользуйтесь справочными значениями
ПР хлорида серебра и предельным законом Дебая — Гюккеля. Влия-
нием концентрации хлорида серебра на ионную силу раствора можно
пренебречь.
38. Сравните табличное значение среднего ионного коэффициента
активности хлорида кальция в 0,01 МСаС12 при 25°С с величинами,
рассчитанными по первому и второму приближениям теории Дебая —
Гюккеля.
39. Определите тепловой эффект реакции Н2О (ж) Н+ + ОН~
(ионы Н+ и ОН- гидратированы) при 298 К на основании теплот
образования Са (ОН)2, СаС12, НС1, теплот растворения и АЯ^ при
бесконечном разведеннн; ДД2 для Са (ОН)2 равно—7,5 кДж.
40. Определите растворимость CaSO4 при 298 К в 0,1 М водном раст-
воре Са (NO3)2. Сопоставьте с растворимостью CaSO4 в чистой воде.
41. Определите молярную электрическую проводимость водного
раствора КС1 при бесконечном разведении при 323 К. Для расчета вос-
пользуйтесь зависимостью вязкости воды от температуры [М.1.
42. Определите молярную электрическую проводимость 0,01 М
КС1 при 323 К, А,о = 244,0 Ом-1-г-экв-1- см2.
43. На основании данных об интегральной теплоте растворения
H2SO4 в Н2О при 298 К и стандартном давлении 1,0132-105 Па при не-
308
скольких концентрациях определите парциальную молярную теплоту
растворения 35 М H2SO4 (A/7h2soJ- Определите парциальную моляр-
ную теплоту растворения воды в этом растворе ДЯн.о-
44. На основании теплоты испарения воды при 298 К [М.1 н пар-
циальной молярной теплоты растворения воды в 35 М растворе H2SO4
определите парциальную молярную теплоту испарения воды из 35 М
раствора H2SO4.
45. Определите активность Н2О при 298, К, если давление насы-
щенного пара над чистой водой [М.1 и над 35М раствором H2SO4
при этой температуре равно 32,4 Па.
46. Определите изменение химического потенциала Н2О (цн2о —
—Рн2о) прн образовании раствора Н2О в 35 М H2SO4 прн 298 К, если
парциальное давление пара воды 32,4 Па, а давление паров над чистой
водой возьмите из [М.1.
47. Определите Кг> Пн + , pH н а,г 0,05 М раствора CH3COONH4
прн 298 К. Данные для расчета взять нз таблиц.
48. Определите степень гидролиза соли 0,2 н. раствора NH4CI
прн 298 к. Ли, = 1,27-10"14; ^н4он = 1,79- К)-5.
49. Вычислите степень гидролиза 0,2 н. уксуснокислого аммония
прн Т = 298 К, если Лмн.он = 1,79-10"5, Лсщсоон = 1,76-ЮЛ
Kw = 1,27-10~14. Сколько свободных уксусной кислоты и аммиака
содержится в 1 л раствора?
50. Определите концентрацию водородных ионов децинормаль-
ного раствора NH4C1, если константы диссоциации равны: Лын4он =
= 1,79 • 10-5 и Л,о = 1,27 • 10-14.
МНОГОВАРИАТНЫЕ ЗАДАЧИ
1. Используя данные о свойствах растворов вещества А в воде:
1) постройте графики зависимости удельной и эквивалентной элект-
рических проводимостей растворов вещества А от разведения V-,
2) проверьте, подчиняются ли растворы вещества А в воде закону
разведения Оствальда; 3) вычислите для вещества А по данным зави-
симостям эквивалентной электрической проводимости от концентрации
эквивалентную электрическую проводимость при бесконечном разве-
дении н сопоставьте результат со справочными данными.
№ варианта . . 1 2 3 4 5
Вещество А . . . НС1 hno2 НОС1 НСООН СН3СООН
№ варианта . . 6 7 8 9
Вещество А . . . . (CHs)2AsOOH С«Н6ОН СвН6СООН NH4OH
Зависимость сопротивления г раствора вещества А от концентра-
ции с при 298 К:
309
моль/л г, Ом-м, для вещества А
HCN HNO, HOCI нсоон сн,соон (СН,), AsOH с,н,он с.н, соон NH.OH
0.1 3,10-10» 4,32 927 6,06 19,6 131 7,46-10’ 9,75 2,55
0.05 4,37-10’ 5,7 1390 8,91 27,6 280 10,80-10’ 14,1 10,3
0,03 5,84-10’ 7,5 1810 10,3 34,8 235 14,50-10’ 18,5 14,5
0,01 10,1-10’ 13,4 3120 18,2 61,0 402 23,5-10’ 31,4 25,8
0,005 14,3-10’ 20,4 4560 25,9 87,0 582 32,7-10’ 48,8 100
0,003 18,3-10’ 26,8 5560 35,8 103 796 41,50-10’ 57,9 143
0,001 31,9-10’ 52,7 10000 68,5 185 1310 74,60-10’ 10,4 251
2. Рассчитайте молярную электрическую проводимость ве-
щества А, используя эквивалентные электрические проводимости Хо
при бесконечном разведении для следующих веществ при 298 К:
Вещество К,- 10s, Ом-1-м’Х Хг-экв—1 Вещество X,-10s, Ом— 1-M*X Хг-экв—1 Вещество Xe-1 0*» Ом— b m’x ХГ-ЭКВ—1
AgCNS 1,285 РЬС12 1,46 Mg(CNS)2 1,19
Ag2SO4 1,419 РЬС2О4 1,43 MgF2 1,08
ВаС12 1,40 Pb(CNS)2 1,36 Mgl2 1,30
СаС12 1,36 PbSO4 1,10 SrCl2 1,36
LaCl3 1,46 1,50 TINO3 ’ 1,51
La(CNS)3 1,36 MgBr2 1,31 T12SO4 1,55
La( 1OS)3 1,Ю Mg(BrO3)2 1,08
MgSO4 1,33 MgCl2 1,29
№ варианта . . . 1 2 3 4 5 6
Вещество A . , . SrC2O4 AgCl AgIO3 BaSO 4 TIBr PbSO4
№ варианта . . . 7 8 9 10 11 12
Вещество А . . СаС2О4 CaF2 BaC2O4 T1C1 PbF2 Pb(IO3)2
№ варианта . . . 13 14 15 16 17 18 19
Вещество А . . . MgC2O AgBr AgBrO3 T1CNC TlBrO3 TH T1IO3
3. Удельное сопротивление насыщенного раствора труднораство-
римой соли А (см. таблицу на с. 311) при 298 К равно р. Удельное
сопротивление воды при той же температуре рн,о = 1 • 104 Ом • м.
Вычислите: 1) растворимость соли А в чистой воде; 2) произведение
растворимости вещества А, приняв, что коэффициенты активности
ионов у± — 1 (растворы сильно разбавлены); 3) растворимость ве-
щества А в растворе, содержащем 0,01 моль вещества В; 4) раствори-
мость вещества А в растворе, содержащем 0,01 моль вещества С. Ве-
щества А, В, С полностью диссоциированы.
310
Удельное сопротивление растворов вещества А при 298 К:
№ варианта р- 10 Ом-м Beщество
А в c
1 0,0141 SrC2O4 H2C2O^ Na2SO4
2 0,333 AgCl HCI Na2SO4
3 0,0550 AglO3 HIO3 Na2SO4
4 0,330 BaSO4 Na2SO4 KBr,. „
5 0,0038 TIBr KBr Na2SO4
6 0,0248 PbSO4 Li2SO4 KBr
4. По данным о моляльности т и среднем ионном коэффициенте
активности у± электролита А вычислите среднюю ионную концентра-
цию т±, среднюю ионную активность а± и активность а.
I № ва-| рнаита Вещество A m, моль/ 1000 г V± № ва- рианта Вещество A m, моль/ 1000 г v±
1 СаС12 1 0,500 14 Th(NO3)4 4,5 0,722
2 Ca(NO3)2 2 0,347 15 Cd(C104)2 5,5 41 ,3
3 Mgl2 3 7,81 16 K3Fe(CN)e 1 0,128
4 MgBr2 4 12 17 Znl2 2 1,012
5 Sr(C104)2 5 10,09 18 Cr2(SO4)3 0,3 0,0238
6 COI2 6 1,99 19 Th(NO3)4 0,4 0,192
7 HCI 7 4,37 20 Ba(C104)2 5 2,13
8 HC1O4 8 11,83 21 AI2(SO4)3 0,6 0,014
9 LiBr 9 12,92 22 K4Fe(CN)e 0,7 0,051
10 NaOH 10 3,46 23 Na2HPO4 0,8 0,217
11 A1C13 0,5 0,331 24 K2HAsO4 0,9 0,301
12 LaCl3 1,5 0,515 25 H2SO4 10 0,559
13 SnCl2 3,5 1,504
5. Вычислите химический потенциал электролита А в водном раст-
воре при 298 К и концентрации т.
№ ва- рианта Электролит A m, моль/ 1000 г № ва- рианта Электролит А m, моль/ 1000 г № ва- рианта Электролит А m, моль/ 1000 г
1 NaOH 1 10 CH3NOOCs 1 18 А1С13 0,5
о H2SO4 1 11 Ba(NO3)2 1 19 InSO4 0,1
3 H2SO4 0,1 12 Ca(N(J3)2 0,5 20 Pb(NO3)2 0,1
4 LiF 1 13 HCI 0,5 21 H2SO4 0,5
5 Ba(OH)2 0,1 14 A12(SO4)3 0,1 22 HNO3 0,5
6 Ba(OH)2 0,05 15 A12(SO4)3 1 23 HNO3 0,1
7 NH4NO3 1 16 CsI 1 24 MgSO4 1
8 UO2(C1O4)2 0,1 17 AIC13 1 25 nh4ci 1
9 UO2(C1O4)2 1
311
6. Разбавленный водный раствор МеС12 насыщен газообразным во-
дородом при 298 К и 1 атм. Определите для реакции
Н2 (г)+МеС12 = Ме + 2Н+д + 2С1-
1) тепловой эффект при Р = const; 2) изменение энтропии; 3) стандарт-
ное изменение энергии Гиббса; 4) логарифм константы равновесия;
5) установите, будет ли протекать реакция самопроизвольно при ука-
занных условиях:
№ варианта ... 1 2 3 4 5 6
МеС12..............FeCl2 NiCI2 SrCl2 CuCl2 MgCl2 CdCl2
7. На основании справочных данных о зависимости электрической
проводимости слабого электролита А от разведения при 298 К [М.],
постройте график зависимости X, = f(c) и определите А при с = 6 X
X 10~3 моль/л. Рассчитайте степень диссоциации а электролита А
при концентрации 6 • 10~3 моль/л. Сравните найденную величину с
рассчитанной по закону разведения Оствальда (константу диссоциа-
ции электролита А возьмите из [М.1). Определите концентрацию ионов
Н+ и pH в растворе электролита А при концентрации 6 • 10~3 моль/л:
№ вари-
анта . . 1 2 3 4 5 6
Электро-
лит А ... изо-С3Н<;СООН h-C3H,COON* НСООН С2Н5СООН СН3СООН nh4oh
* ^«.н = с,н,соо- =
ГЛАВА XIX
ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ
Основные уравнения и символы
[К., с. 560—626; Г., т. 2, с. 517—561]
ЭДС гальванического элемента Е равна разности условных элект-
родных потенциалов его полуэлементов £г и £2, если величиной диф-
фузионного потенциала можно пренебречь:
Е — Е1—Е2 (XIX.1)
(индекс «2» относится к более положительному электродному потен-
циалу).
Электрохимические реакции, протекающие на электродах, и
электроды разделяют на следующие типы.
Электроды 1-го рода, обратимые по катиону, Ме"+ пе = Ме°,
где Ме"+ и Ме° — окисленная, и восстановленная формы вещества;
312
е — электрон. Потенциал электрода 1-го рода рассчитывают по урав-
нению Нернста:
RT RT
Е = Е° 1П (aOx/«Red) ИЛИ £ = £Меп + /Ме + 1П “Ме«+ ’ (Х1Х’2>
где Е — потенциал электрода; Е° — стандартный потенциал электро-
да; п — число электронов, участвующих в элементарной реакции;
F — постоянная Фарадея; aRed и аОх — активности восстановленной
и окисленной форм вещества, вступающего в реакцию. Множитель
2,3/?77F при Т = 298 К и R = 8,31 Дж/(моль • К) равен 0,059 В.
Электрод 1-го рода можно схематически представить в виде Ме"+/Ме.
К электродам 1-го рода относятся; а) серебряный электрод
Ag+|Ag; Ag+k+e = Ag°; n=l; aOx = aAg + ; aRed=aAg + = 1 - (XIX.3)
б) амальгамный электрод
Me"+|Mem, Hg; m Men+ = (Hg)
Cd2+| (Cd)Hg | Cd2+4-2e= (Cd)aM; n = 2; aOx = acd2+;
PCd
°Red = a (Cd)aM= 1
rCd
°’059 ar^+
Е = Е<> .. +-------1g cd 1-, (XIX.4)
cd2+|(Cd)Hg~ 2 acd
где E°cd2+ । (Cd)Hg — потенциал амальгамного электрода при активности
кадмия в амальгаме; аса — 1;
в) газовый электрод
H+|H2|Pt; Н+-|-е = 1/2Н2; n=l; aox = aH+J aRed = ан,= £н,',
Электроды 2-го рода обратимы по аниону. Они представляют собой
металл, покрытый труднорастворимой солью этого металла, погружен-
ный в раствор соли, содержащий анион одноименный с анионом труд-
норастворимой соли. Схематически электрод 2-го рода можно предста-
вить А"“ |МеА|Ме, а протекающую в нем реакцию МеА + пе = Me +
+ Ап~. Например:
AgCl4-е = Ag+H-Cl-; n=l; ^Ox = aAgC| = l; aRed = aci~;
£ = £»_-^-lgacr, (XIX.6)
El = £lg+ ,Ag + °’0591g ПРА&С1, (X]X-7)
313
где £дг+|Ац — стандартный потенциал серебряного электрода, обра-
тимого по катиону; nPAgci = aAg+ «с]-------произведение раствори-
мости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод
1/2Cl2-t-e = Cl-; n=l; аОх= РС1,; aRed = aCl~‘>
О пэд
£=£crici1-^r~lg(°cr/pcb); <Х1Х-8)
б) каломельный электрод Cl~ |Hg2Cl2, Hg, на котором идет электрод-
ная реакция Hg2CI2 + 2е~ = 2Hg 4- 2С1~;
°,059
£С1~ । Hg, । ci, i»Hg — £ci- । Hg, । ci„ Hg- 2 ,goci~;
в) хлоридсеребряный электрод Cl-|AgCl|Ag, на котором идет элект-
родная реакция AgCl + е = Ag + С1~:
о °’059
£С|- | AgCl | Ag=£CI~ | AgCl I Ag— ! *g°C|- •
Окислительно-восстановительные электроды (редокси-электроды)
представляют собой инертный металл, опущенный в раствор, содер-
жащий окисленную и восстановленную формы. Уравнение Нернста
для данных электродов имеет вид
р -СО , °'059 |Г °°Х /Y1Y <П
£Red, Ox ~ £Red, Ох + „ g „ ’ (XIX.9)
П °Red
где аох — активность окисленного иона; aRed — активность восста-
новленного иона.
Простой редокси-электрод записывается в виде схемы: Red, Ox|Pt
реакция Ох + ne = Red. Например:
Fes+е = Fe2+; л=1; «Red = aFe2+; «Ox = °Fe3+;
р со °’059 aFes+
£ = ££e3+, Fe2++------Ig (XIX. 10)
1 ' aFe2 +
Мп°Г4-е=МпО2-; n=l; «Red=eMnOi-; аОх=аМпоГ‘>
„ ,.о 0,059
Е — ЕмпО-, мпО2-+ Ig (ампо4_/°мпо4_)- (XIX.11)
Для сложного редокси-электрода схема записывается в виде Red, Ox, Н+ | Pt:
МпО4-+8Н++5е^Мп2++4Н2О; n=5; aRed=aMn2+; «Ох=«Мпо4-;
р рО _ । °’059 аМпО^
£ = £мп+21 МпО4 4-------1g----—. (XIX. 12)
5 °мп2+
Хингидронный электрод
СвН4О24-2Н+4-2е=СвН4(ОН)2
хинон гидрохинон
314
n=2, — агх—1; <Jqx—ax—1;
£ = £x,rx+-^^lg«H+==£L rx —0,059 pH. (XIX. 13)
Связь константы равновесия химической реакции и стандартных
электродных потенциалов выражается соотношением
lgK= (Т=298А), (XIX.14)
0,059
где Е°2
Для концентрационных цепей уравнение Нернста (при условии
отсутствия диффузионного потенциала) для электродов типа
Си | Си2+ || Си2+ | Си; Ag, Ag Cl | НС11| НС11 Ag, AgCl
Qi Q% Oj ^2
a2 > at a2 > at
имеет вид
0 059
£ = lg(02/ai)i (XIX. 15)
n
где fli и a2 — активности ионов Cu2+ и Cl~ соответственно.
Для газового элемента типа
Pt | Н21 НС11Н21 Pt
Pi Pi
уравнение (XIX. 15) преобразуется:
0,059
£ = -^-lg(P1/PJ), (XIX. 16)
где Р, и Р2 — давления водорода; Р, > Р2.
Для амальгамного элемента типа
Hg (Cd)Cd2+ | (Cd) Hg
at at
о2>Я1
уравнение Нернста будет
где а, и a2 — активности металлического кадмия в амальгаме.
Для элемента типа
Cd (жидкий, чистый)! CdCl2B расплаве I (расплав) Cd—Sn | Cd
a,= 1 | щелочных хлоридов) а2
уравнение (XIX. 17) принимает вид
0,059
£=—— 1g «2- (XIX. 18)
где а2 — активность кадмия в расплаве Cd — Sn.
315
Если диффузионным потенциалом в концентрационной цепи пре-
небречь нельзя, то ЭДС цепи
Ag I AgNO3 II AgNO31 Ag
at
рассчитывают по уравнению
2^-n. NOT а2
Е = --------------0,0591g--, (XIX. 19)
*0, Ag++*0, NOjf Щ
где Oi и a2 — активности ионов серебра; а2 > аг; N0-, Xfl Ag+ —
подвижности аниона и катиона.
Термодинамические функции AG, AS, АЯ для электрохимических
реакций рассчитывают по уравнениям:
AG = —nFE, (XIX.20)
\<iT )р (XIX.21)
t d£\ A// = — nFE nTF I Ip, \ d T ]p (XIX.22)
A*E bCp-]nFT ATi , (XIX.23)
„ AW „/ d E \ dт У (XIX.24)
,ПК“- RT ' (XIX.25)
где п — число электронов, участвующих в реакции; F — постоянная
Фарадея; Е — ЭДС.
ЗАДАЧИ С РЕШЕНИЯМИ
1. По данным о стандартных электродных потенциалах меди и цин-
ка рассчитайте ЭДС элемента, составленного из полуэлементов:
Zn | Zn2+ (aZn2+ =0,02) и Cu2+ | Си (aCu2+=0,3).
Решение. Рассчитаем ЭДС по уравнению
Е = Е2 — Ех,
-г >
nF «Red
2,3RT 2,3-8,314.298
------- = ----------------— л ЛС
316
Значения стандартных электродных потенциалов находим в спра
вочнике [M.J: fj^+lcu = 0,337 В; ^zn2+lzn = —0,763 В. Так как
медный полуэлемент более электроположителен, то
0,059 аСи2+
Е ~ £Cu2+ I Си — £Zn2+ | Zn + ~~ ~ ~~ ’
2 “zn2+
0,059 0,3
£ = 0,337 + 0,763 + -^- 1g £ = 1,135В.
2. Для реакции Zn + 2НС1(р-р) = Н2 + ZnCl2(p-p) установите
направление реакции в стандартных условиях по данным о стандарт-
ных электродных потенциалах и дайте схему соответствующего элект-
рохимического элемента.
Решение. Записываем уравнение одной из предполагаемых
электродных реакций
2Н+ + 2е=Н2 (1)
и вычитаем его из общего уравнения, записанного в ионной форме:
Zn+2H+=Zn2++H2
2Н++2е=Н2
Zn2++2e=Zn
Стандартные электродные потенциалы электродных реакций (1) и (2)
находим в справочнике [М.]: Et = 0; Е2 = —0,763 В. Так как £? >
> £2, то, согласно (XIX.1), из уравнения реакции (1) вычитаем урав-
нение реакции (2) и получаем: 2Н+ + Zn = Н2 + Zn2+. Записываем
схему элемента согласно значениям электродных потенциалов:
Pt, Zn I ZnCl21| HCI I H21 Pt
3. Дана схема гальванического элемента
Pt I H21 NaOH I PbO, Pb
Напишите уравнение соответствующей реакции.
Р е ш е н и е. Из схемы следует, что потенциалы электродов Е,
составляющих элемент, определяются следующими веществами: 1) РЬ,
РЬО, ОН~, 2) Н2, ОН~. Выписываем из [М.1 уравнения соответствую-
щих электродных реакций и стандартных потенциалов:
РЬО+НгО+2е=РЬ+2ОН—, £“=—0,758 В (электрод 2-го рода), (1)
2Н2О+2е==Н2+2ОН-; £§=—0,828 В (редокси-электрод). (2)
Так как £° >£2, из уравнения реакции (1) вычитаем уравнение
реакции (2) и получаем РЮ + Н2 = РЬ + Н2О.
4, Дана схема газового элемента
Pt|H2| HCl|Cl2|Pt
Рд =1атмт=0,1 Г’(21!=2атм
у±=0,796
317
Вычислите при 298 К потенциал хлорного электрода |С] и
ЭДС элемента в целом.
Решение. Потенциал ЕС1 ,с1_ вычисляем по уравнению
(XIX.8):
^ci, । ог=^С1“ । ci, 0,059 (1g аС1—*/2 IgPci,); ^crci, =1,358В [MJ;
£С11, С1-= 1,358—0, 059 (1g 0,1 • 0,796— */2 1g2) = 1,440В.
Рассчитаем потенциал водородного электрода по (XIX.5):
£н+ । н2=£н+ । н2+°,059 (1 g °н++ Рн.) ’
£»+,„ =0; £„+,„ =0,059 (1g 0,1-0,796)=—0,065В.
После подстановки полученных величин в (XIX. 1) вычисляем ЭДС
элемента: ч
£=1,440—(—0,065) = !,505В.
5. Вычислите ЭДС гальванического элемента
Pt | Н2 | NaOH || H2SO4|H2, Pt
m=0,l m=l
при T = 298 К, Рн2 = 1 атм.
Решение. Записываем уравнения электродных реакций и на-
ходим по справочнику соответствующие стандартные потенциалы Е°.
и средние ионные коэффициенты активности у±:
2Н2О4-2е=Н24-2ОН, £“=—0,828В; (1)
Н++е=У2Н2, £2=0 В. (2)
По среднеионным коэффициентам активности и концентрациям ионов
рассчитаем их активности:
аон_=а±=/п?±=9,1 "0,766= 0,0766, aHjO=l;
для раствора NaOH пг = 0,1; у± = 0,766; для раствора H2SO4 пг =
= 1; т± = 0,132;
ан+^а±=^Г/пу±;
а± = ^4 .1-0,32=0,21.
Вычисляем потенциалы электродов Е2 и Ег по уравнениям (XIX.5)
и (XIX.2):
0,059
£2 —£“]+। На+ ! (lgaH+—% lgPHi);
£»+|Н2==О; £2=0,059 (1g 0,21)=0,04 В;
0,059
£1= £ОН-| Н,О | Н2~£ОН'I Н2О | Н,— j 0® aOH У2 ^Н2) :
£&н-|Н2О|н2=-0,828В [М.];
318
£1=—0,828—0,059 lg 0,0766==—0,762 В.
Подставляя полученные значения £t и £2 в уравнение (XIX. 1),
получаем
Е=— о, 04+ 0,762=0,758 В.
6. Рассчитайте ЭДС и напишите схему гальванического элемента,
в котором обратимо протекает реакция по уравнению
2Fe3++HAsO2+2H2O=2Fe2++H3AsO4+2H+
при 1 атм и 298 К. Активности ионов, участвующих в реакциях:
aFe2+ = 0,005; aFes+ = 0,02; ан3Азо3 — 0,2; Ahaso, = 0,1; ан+ —
= 0,01; +1,0— 1 йн2о=1-
Решение. Определим уравнения электродных реакций. Для
этого из уравнения реакции, приведенной в условии, вычитаем урав-
нение одной из предполагаемых электродных реакций:
2Fe’++HAsO24-2H2O=2Fe2++H3AsO1+2H'-
2Fe3++2e=2Fe2+
Н3 AsO4+2Н++2е=HAsO2+2H2O
В справочнике [MJ находим соответствующие стандартные электрод-
ные потенциалы: £? = £„jAsO4 2H+HAsO2 = °’560 В; = ^Fe3+,Fe2+
= 0,771 В.
Вычисляем электродные потенциалы по уравнению (XIX.2):
„ _ , 0,059 . QH3AsO< °н+ _
£H3AsO3,2H+, HAsO,+ 1g 2 , n—2,
" “HAsO2 “h2o
0,059 0,2-0,012
£1=0,560+—— lg-----—------=0,451 B;
0,1
0,059 aFes+ 0,059 0,02
£ =£0 s+ 2++---------- fg------=0,771 +--------lg-----=0,789B.
2 Fe , Fe ‘2 К а^2+ 2 6 0,005
Подставляя значения £t и £2 в уравнение (XIX. 1), получаем £ —
= 0,789 — 0,451 = 0,338 В.
Схема элемента
Pt | н+, H3AsO4, HAsO2||Fe3+, Fe2+, H2O|Pt.
7. Дана схема гальванического элемента
Pt (Т1) Hg | Т1СЮ41| КС11 Hg2CI21 Hg | Pt
aTI=0,0628 m=0,l m=0,l
при 298 К ЭДС элемента £ = 0,610 В. Вычислите нормальный по-
тенциал амальгамного электрода £“1+ [тщнйг
Решение. Согласно уравнению (XlX.l) для каломельного элек-
трода £2 = 0,282 В [М.1. Тогда
£i=£ti + , [Ti]Hg+0,0591g_fZLL;
a[Tl]
aT1=my±=0,1-0,73=0,073.
319
Подставляем полученные значения в уравнение (XIX.1):
0,073
0,61=0,281—Ет| + . ,тп н„—0,0591g--
Ti |(TI), Hg > ё0,0628
и вычисляем
0,073
। <тп 0,61—0,0591g----=-0,333 В.
Т| Hg s0,0628
8. Нормальный потенциал амальгамного натриевого электрода
при 298 К ^Na+l(Na),Hg = —В- Нормальный потенциал натриевого
электрода -Е^а+Ыа = —2,714 В. Чем можно объяснить такое большое
различие этих величин?
Решение, Обозначим разность потенциалов
^Na+ I (Na), Hg—^Na+ I Na = ^S’ (О
Es = —0,85 В. Используем диаграмму состояния Hg — Na, из кото-
рой видно, что разбавленные амальгамы натрия (жидкие) представляют
собой раствор интерметаллического соединения Hg4Na в ртути. На
основании этого составляем уравнение электродной реакции Na+ +
+ = (Hg4Na)Hg. Заменяем эту реакцию следующими процессами:
Na+4-e=Na(e); Na-|-4Hg = Hg4Na (б);
Hg4Na+«Hg->[Hg4Na] (Hg) (В)
Так как изменение энергии Гиббса на зависит от пути процесса,
а только от начальных и конечных состояний системы, то
Абреак= А0(в) + ДО(б)-г AG(a)- (2)
Поделив уравнение (1) на nF, получим
£Na+I (Na) Hg=£Na+ | (3)
•Сопоставление уравнений (1) и (3) дает
£’ = £» + £»,
где Е° — мера химического взаимодействия металла и ртути.
9. Для электрода
ОН-, H2O/H2|Pt
Рн2=1 а™
стандартный потенциал Д' = —0,828 В. Вычислите, использовав
эту величину, ионное произведение воды Kw при 298 К, если уравне-
ние Нерста имеет вид
£4 = Е»-0,059 lgeOH-. (1)
Решение. В любом водном растворе содержатся ионы Н+ и
для водородного электрода уравнение Нерста имеет вид
, , н, + °,°59. (2)
320
Но поскольку схема приведенного электрода показывает, что ЭДС
зависит от концентрации ионов ОН-, то выразим ан+ через «он- и
ионное произведение воды К,с:
аН+ = ^w/aOH~. (3)
Тогда, после объединения уравнений (2) и (3), получим
£1 = £н+ |нг+0,059 1g/(ц, — 0,059 1g <гон-. (4)
Из сопоставления уравнений (1) и (4) следует
=£н+ |h2+°’0591S *+> = -0,825В.
Так как Дн+|Нг = 0, то
0,825
1g =77777 =14’014: =1 ’03-10”14-
и,0оУ2
10. Для электрода Cl- jCuCl, Си стандартный потенциал <pg =
= 0,137 В. Вычислите произведение растворимости ПРсио при 298 К.
Решение. Согласно уравнению
£§ = £? +0,059 1g ПР,
где Е° — нормальный потенциал медного электрода, обратимого по
катиону Cu+|Cu, £? = 0,521 В, получаем
0,137—0,521
lgnp J---= —6,486; ПР = 3,1910-’ (моль/л)2.
0,059
11. Рассчитайте константу равновесия реакции Cd2+ + Zn =
= Zn2+ + Cd, если fcd2+|cd = —0,403 В; +zn2+lzn = —0,763 B.
Решение. Константу равновесия вычислим по уравнению
(XIX.14):
Х= 1,45-10-12.
12. Рассчитайте константу равновесия для реакции Cd2+ + Zn =
= Zn2+ + Cd по стандартным термодинамическим величинам для
ионов, приведенным в справочнике [M.J.
Решение. Рассчитаем константу равновесия данной реакции
по уравнениям
1g К= -Лб»еак/2,3 RT и AGpoeaK = AGgn2+-G£d2 + .
Находим из справочника [MJ ДО0 для ионов Zn2+ и Cd2+:
AGzn2+ = —147,30 кДж/моль; AG^d2+ = —77,794 кДж/моль.
Тогда
AG» =—147,30 —(77,794) = 69,504 кДж/моль,
11 Зак. 767
321
отсюда
69 504
Ig -------------------= 12,17.
е 2,3-8,314-298
13. Вычислите ЭДС элемента
РЬ | PbSO41| РЫ21 РЬ
насыщ. р-р. насыщ. р-р
при 298 К, используя данные о произведении растворимости PbSO4
и РЫ2 (М.1.,
Решение. Вычислим ЭДС по уравнению
0,059 («рь2 + >2
Е = —“— 1g-------— -
2 (aPb2 + )i
Средние ионные активности находим из произведения активностей:
(а±)2 = Упр^7 ; (a±)i = ynpPbS0< ;
ПРРЬ1> = 8-10~» (моль/л)3; ПРРЬ50<= 1,6-10-8 (моль/л)2;
0,059
Е = —— 1g
з_______
У8-10-»
У1,6-10-8
= 0,019 В.
14. Дана схема элемента
Cd (ж)
КС1, LiCl, CdCl2
расплав
Cd—Bi (расплав)
xcd =0,423
Т = 773 К; ЭДС элемента Е — 0,0329 В. Вычислите для кадмия:
активность аса; коэффициент активности уса; парциальное давление
Ри. Давление насыщенного пара чистого кадмия Pgd = 14,84 мм
рт. ст. (LiCl — это добавка для понижения температуры плавления).
Решение. Элемент — концентрационный. Активность кадмия
в расплаве Cd — Bi находим по уравнению
2,3-8,314-773
Е~~~ 2-96487 lgaca>
lg«ca =
0,0329-2-96487
—-------------= —0,430;
2,3.8,314-773
lgaca —*’57; aCd—0,372.
Коэффициент активности кадмия в расплаве вычисляем по уравне-
нию
Yea=“ca/*ca=0,372/0,423=°,879.
322
Парциальное давление кадмия рассчитываем по уравнению
₽Cd = aCd ₽&d,
Ped = 14,84 • 0,372 = 5,22 мм рт. ст. (7,36 • 102 Па).
15. Вычислите полезную работу W реакции Ag + V2CI2 = AgCl,
используя стандартные электродные потенциалы, если Pci, = 1 атм,
Т = 298 К-
Решение. Полезная работа реакции при Р и Т = const бу-
дет W = —AG. Для электрохимической реакции в стандартных ус-
ловиях AG® = —nE°F. ЭДС элемента равна Е° = Е° — Е%, где Е% и
Е\ — стандартные потенциалы электродов, составляющих элемент.
Рассматриваемая реакция осуществляется в элементе по схеме
Ag| AgCl I Cl- I Cl2, Pt
“C|-=l /’cl2=l
= ££г I Cl, = ’.360 В; £0Г I AgCI I Ag == 0,220 В;
, £°= 1,360—0,220 = 1,14 В; и V = nEaF= 1,14-96 487 = 109,99 кДж/моль.
16. Дан а схема элемента
Pb, PbSO4 I Na2SO4 I Hg2SO4| Hg
насыщ. p-p
Уравнение общей реакции электрохимической системы
Hg2SO4+Pb = PbSO4+2Hg
(дЕ\
Вычислите ЭДС при 298 К и температурный коэффициент ис-
пользуя данные таблиц стандартных термодинамических величин.
Решение. Для расчета используем следующие уравнения:
AS —Sv Sj, кон —Sv; Sit нач!
AWo = Svf АЯ? f K0H -Sv; ДЯ? f нач.
* t, I KUH * 4» j, паЧ*
Из справочника [M.J находим значения энтропии и теплот образо-
вания для участников реакции:
Соединение . . . . - . Н§(ж) PbSO4 Hg2SO4 Pb
S0, Дж/(моль-К) . . . 76,1 148,67 100,83 64,85
кДж/моль . . . 0 —918,1 —742,0 0
Энтропия реакции
AS° = 2SHg + SPbSO< ~sftg,so4 -^b
И*
323
будет равна
AS° = 35,19 ДжДмоль.К);
температурный коэффициент ЭДС
/ дЕ \ 35,19
---- = = 1,85-10—4 В-К;
\ дТ jp 2-96487
теплота электрохимической реакции
\Цо = \Н^ Pbsot ~ Hg2so4 =
= —918,1—( — 742,0)= —176,11 кДж/моль.
Тогда ЭДС гальванического элемента будет
(-176,1-10-3)
Е=—~--------1-----г + 298-1,85-10-* = 0,968 В.
2-96487
17. По данным о зависимости ЭДС элемента Вестона от температу-
ры
Е = 1,018—0,041 • Ю-з (/ — 20) — 9,5-10~’ (/—20)24- 10» (/—20)3
для реакции
Cd + Hg2SO4 (т) + з/3Н2О = 2Hg (ж) + CdSO4- в/3Н2О (т)
вычислите ДСр при 298 К.
Решение. Вычисляем (д2Е!дТ)р, дважды дифференцируя урав-
нение Е = f(T). Для 298 К (д2Е/дТ2)Р = -16 • 10"7 В/К- По урав-
нению (XIX.23) рассчитываем
ДС»> = —16-10-в. 2-9,65-10*. 298 = 92,1 Дж/моль.
18. Температурный коэффициент элемента, работающего за счет
реакции
Pb+Hg2Cl2 = PbCl2+2Hg
(дЕ/дТ)р = 1,45 • 10-4 В/К. Определите количество теплоты, вы-
деляющейся (поглощающейся) при работе элемента, и сопоставьте
полученную величину с тепловым эффектом реакции при 298 К.
Решение. Согласно уравнению Q = nFT(dEldT)P теплота об-
ратимого процесса равна Q = 2 • 96487 • 298 • 1,45 • 10~4 =
= 8,338 кДж/моль.
Теплота необратимого процесса равна тепловому эффекту химичес-
кой реакции
= PbCl.-Д^, Hg2Cl!;
Л//“, РЬС12 = —359,1 кДж/моль; Hg2ci2 =
= 264,85 кДж/моль и ДДреак = —94,25 кДж/моль.
Сопоставление теплоты обратимого процесса с теплотой необра-
тимого процесса дает 8,338 • 100/94,25 = 8,85%.
Таким образом, теплота, выделяющаяся при работе элемента, со-
ставляет 8,85% от общей убыли энтальпии.
324
19. Дана схема концентрационного элемента
Т11 Т1С1О. । (TI) Hg | Pt
m = 0,l Xjj==0,085
ЭДС этого элемента при 298 К равна 0,071 В. Температурный коэффи-
циент элемента (дЕ!дТ)р — 1,8 • 10-4 В/К. Вычислите относительную
молярную энтальпию растворения таллия в амальгаме, если
%Ti = 0,085.
Решение. Вычисляем А//71 по уравнению
\ ! дЕ \
ДД^ = 96487 Ti —1 —Е =96 487 (298-1,8-ю-4 * *—0,071) =
= —1686 Дж/моль-
20. Вычислите парциальную молярную теплоту разбавления НС1
,Д//нс1 от концентрации тг = 0,1 до концентрации в предельно раз-
бавленном растворе /п2. Для расчета используйте данные зависимости
среднеионного коэффициента активности соляной кислоты от темпера-
туры.
Для раствора с т = 0,1: г
Т, К........... 293,16 303,16
т±............. 0,7985 0,7940
Решение. Подставляя числовые значения в уравнения
анс1 (Ti) А^нс1 (Т~2—А)
g«HCi(7’i) 2,3RTiT1 ’ “hci~Y±w2>
I / Y± (Тг) \ A^hci / Tt \
g \ (Л) / = 2,3/? \ T2T\ J ’
получаем
/0,794 \2 *_ AtfHCi / 10 \
1д0,7985/ = 2,3-8,314^ 293,15-303,15 /’
Д//НС1 = “832,62 Дж/моль.
21. Вычислите ЭДС для свинцового аккумулятора при 298 К,
массовая доля серной кислоты 21,4%; m^so* = 2,78 моль/1000 г.
Уравнение реакции, протекающей в элементе,
PbO2 + 2 H2SO4+Pb = 2PbSO4 (т) + 2Н2О
Энергии Гиббса образования веществ, участвующих в реакции, будут
\Gf (кДж/моль): Н20(ж) — 234,40; PbSO4 — 814,38; РЬО2 — 218,
H2SO4(p-p)w- 746,15.
Среднеионный коэффициент серной кислоты: у± = 0,138, давление
пара воды над раствором 21,35 мм рт. ст.
Решение. ЭДС вычисляем по уравнению Е — —&G/nF.
325
Для этого рассчитаем AG по уравнению
AG = 2 AGf< н,,о+2 PbSO4-AG", РЬО2—2ЛОЬ h2so4-
Вычисляем AGh2o и AGh2so4 по уравнениям:
Л gh2o — agh2o+1 n аНгО
^н2о 21,35
a,, n= -2^- = -------= 0,897;
H’° P<> n 23,76
rijO
AGHjO= -234,40 + 8,314-298 In 0,897= —237,67 кДж/моль.
При расчете AGh2so4(p-p) за стандартное состояние принимаем состоя-
ние предельно разбавленного раствора (т = 1). Тогда [MJ
eH2SO4 = 4(mT±)S «„^ = 4(2,78-0,138)3=0,226,
agh2so4 = agh2so4, оо + RT In 4 (my±)s =
= —746,15 + 8,314-298 In 4 (0,138-3,78)3= —749,84 кДж/моль.
Находим AG = 2( — 237,67) + 2 (—814,38) + 218 + 2 • 749,84 =
= —386,42 кДж/моль. Вычисляем Е:
— 386 420
£• = —---------=2,002 В.
2-96 487
22. Вычислите температурный коэффициент (дЕ1дТ)Р для свинцо-
вого аккумулятора, если массовая доля H2SO4 21,4%; mH2so4 =
= 2,78 моль/1000 г.
Уравнение реакции, протекающей в элементе,
PbO2 + 2 H2SO4+ Pb = 2 PbSO4 (т) + 2 Н2О
Энтропии участников реакции равны S0 [Дж/(моль • К): Н20(ж) —
69,96; PbSO4 — 148,67; РЬО2 — 71,92; Pb — 64,80; H2SO4(p)M—
18±1.
Парциальная молярная теплота растворения воды А/7н2о =
— 196,65 Дж/моль. Парциальная молярная теплота разбавления сер-
ной кислоты A//h2so4 = —2824,5 Дж/моль. Среднеионный коэффи-
циент активности H2SO4 у± =0,138, давление пара воды над раст-
вором Рн2о = 21,35 мм рт. ст.
Решение. Рассчитываем (дЕ!дТ)х по уравнению
I дЕ \ AS
---- —-------, где п = 2.
\дТ)р л 96 487
Вычисляем AS по уравнению
&S = 2SJ>bsO4 4-2SHjO — SpbOj spb—2Sh2so4 •
326
Согласно уравнению
Л/7т
SH o = S& о + -^--/?1пян о
rljU HjU 1 у» НгО»
Q -СО anH,SO4
—^HjSO. (р-р) — 298 — К lnaH2SO.’
195,65
sh o = 69,96+~onQ -8,314-2,3 lg 0,897 = 72,27 Дж/(моль-К),
2 298
2824,5
SH!SOt=18+-^----------8,314-2,3 lg 4 (0,138-2,78)3 =80,87 Дж/((моль-К)
H тогда
AS = 2-148,69 + 2-72,27 — 71,92 — 64,80 — 2-80,87 =
= 143,42Дж/(моль-К),
дЕ \ 143,42
дТ/р~~ 2,96487
= 7,4-10-« в/К-
23. Определите при Т = 298 К Е° цепи
Pt|, Н2(г) HBr I Ag Вг (т) I Ag
Р =* 1 атм
для которой получены следующие значения потенциалов:
m.................. 0,0056125 0,010021 0,015158 0,02533 0,03006
Е.................. 0,34594 0,31265 0,29225 0,26718 0,25901
Решение. В гальваническом элементе протекает реакция
%H2(r)+Ag Br(T)=Ag (т)+Н++Вг-
Уравненне Нернста для приведенной цепи
RT RT 2RT 2RT
Е = Е°——— In (а~а+) =Е° ——— In (у±/п)2 = Е9----— 1пу±——— Inm,
2.RT
так как пг -> 0, а у± -> 1, то -р— 1пу± ->• 0 и
Д» = lim £-|-
/т-»0
2/?Г
—1пт .
Пересчитаем приведенные данные в условии задачи и запишем в виде:
m ....... . 0,0056125 0,10021 0,015158 0,02533 0,03006
V m . 0,07159 0,1001 0,12312 0,15915 0,17338
£+(2/?TF) In m . . 0,0749 0,0762 0,0771 0,0782 0,0790
327
Построим график зависимости Е + (2RT/F) In т от У т и, экстраполи-
руя к Ит = 0, получаем для данной цепи £° = 0,0722 В. Можно по-
строить также график зависимости
2RT 2RT
Е°-=ЕЕ ----lnm+ ------Inyl,
F F *
где у± вычисляют из предельного уравнения Дебая — Гюккеля. В
данном варианте £° — Е" =£ 0, поэтому наблюдается отклонение от
предельного закона. В этом случае строят график зависимости от т, а
не от Ут, так как 1пу' (и, следовательно, £° — £') приблизительно
линейно зависит от иг.
ЗАДАЧИ
1. Напишите уравнения реакций, протекающих в следующих эле-
ментах :
Си, Zn|ZnSO4;:CuSO41 Си (1)
Си|СиС12-:-:А1С1|А1С1(т)| Ag, Си (2)
Pt | Cd | CdSO4:: Hg2SO41 HgSO4(T) | Hg | Pt (3)
Pt I H21 H2SO4->: Hg2SO4 [ Hg2SO4(T) | Hg I Pt
Си, Си (ОН)2(т) | NaOH(p-p) | H2 | Pt (4)
H8O
2. Как должны быть составлены элементы и полуэлементы, чтобы
в них протекали реакции:
Cd-|-CuSO4=CdSO4-|-Cu (1)
2Ag++H2=2Ag-]-2H+ (2)
Ag+ + I~—Agl(-r) (3)
Ag(T) + I(T)=AgI(p-p) (4)
H2+C12=2HCI (5)
Zn+2Fe8+=Zn2+4- Fe2+ (6)
h++oh-=h2o (7)
Li-F’/a F2=Li+4-F“ (8)
H2+’/2o2=H2O (9)
3. Рассчитайте ЭДС элемента
Zn|Zn2+-:;Cd2+ | Cd
а=5-10~4 а —0,2
4. Напишите уравнение реакции для элемента
Pb!Pb(NO3)2i;AgNO3/ Ag
apb2+=l “Ag+=I
Вычислите ЭДС. Необходимые данные возьмите из справочника [М.].
328
5. По данным стандартных электродных потенциалов установите,
осуществима ли практически в стандартных условиях при 298 К в
водном растворе реакция
Ag(T)+Fe3+=Fe2+4-Ag+
Рассчитайте константу равновесия реакции.
6. Вычислите ЭДС элемента
Pt|Ti4+, Ti3+ :;Sn4+, Sn2+1 Pt
aTji+^l = l д$п4ч-:=:1 aSn2^=l
Напишите уравнение реакции элемента; установите, самопро-
извольна или нет данная реакция, если £“,4+ Т|з+ = 0,04 В, а
£.sr^,sn2+ = 0-15B.
7. Элемент составлен из нормального каломельного и ферроферрит-
ного электродов:
Pt, Hg, Hg2CI3| KC|::.FeCI2, FeCI3, HCI | Pt
",KC1=0-1 mFeCl2="2FeCI3=0’01
mHCI=0’1
ЭДС этого элемента при 298 К равна 0,446 В. (Соляная кислота до-
бавлена для предотвращения гидролиза.) Принимая коэффициенты
активности ионов Fe2+ и Fe3+ равными соответственно 0,75 и 0,87, рас-
считайте £° для ферроферритного электрода, содержащего 0,1 М НО.
8. Определите потенциал электрода
Pt, Н2| Н+-
Рн2=| а™ аН +=0-1
9. По данным о стандартных электродных потенциалах [М.] для
элемента
Mn|MnCI2|CI2, Pt
₽ci2=I а™
вычислите ЭДС элемента в стандартных условиях: установите, какой
из нолуэлементов электроотрицателен; определите, можно ли за счет
изменения концентраций ионов или давления газа изменить знак ЭДС
полуэлементов; определите, чем характеризуются полуэлементы, на-
правление ЭДС которых зависит от концентрации раствора и давления
газа, насыщающего электрод.
10. Определите ЭДС при 298 К:
для элемента
Pt | Н2 | Н+ :: хингидрон, Н+ | Pt
Рцг=2 атм aj-i+=o»1 (насыщ. р-р) а^+=2
для элемента
Pt I хингидрон, СН3СООН KCI I Hg2CI2(T), Hg I Pt
(насыщ. р-р) ГСН3СООН=°.1 аСГ=1
Стандартный электродный потенциал хингидронного полуэлемента
равен 0,6994 В. Константа диссоциации уксусной кислоты К = 1,75 X
X 10~8.
329
Определите pH соляной кислоты, если для элемента
Pt | Hg, Hg2Cl21 KCI хингидрон | Pt
m=0,1 (насыщ. p-p)
HC1 c=0,l моль/л
E = 0,301 В; T = 298 K.
11. Рассчитайте стандартный электродный потенциал полуэлемента
Ag | Ag (т) | KI
“r=i
по данным о произведении растворимости Agl [MJ и стандартном элект-
родном потенциале Ag, Ag+.
12. По ЭДС элемента
Cd | Cdl21 Ag | (т) | Ag
при 298 К определите активность иодида кадмия в растворе (Е =
= 0,286 В).
13. Стандартная ЭДС элемента
Pt, Н2| HCI | Hg2CI2 (т) | Hg| Pt
рн2 т- v±
при 298 К равна 0,2680 В. Вычислите ЭДС при следующих услови-
ях:Рн, (атм) — 0,01; 0,1; иг—1 • 10*3 (моль/1000 г); у± — 0,809;
0,966 соответственно.
14. По стандартным электродным потенциалам рассчитайте при
298 К константы равновесия реакций:
Pu3++3Li+~Pti»+3Li+; Fe2++S2-=Fe»+S»
15. Вычислите при 298 К стандартные электродные потенциалы
полуэлементов
Fe3+|Fe, T13+|TI, Cu+|Cu
если известны [MJ стандартные электродные потенциалы для электро-
дов Fe2+ |Fe; Fe3+ |Fe2+; T13+|T1+; T1+ |T1; Cu2+|Cu и константа равно-
весия реакции Си + Си2+ = 2Си+
^а=аси+/аСи2+=6’31 ’ 10~’-
16. ЭДС элемента
Zn | Znso4 Znso4 । Zn
^,=0,01 моль/1000 г m2=0,l моль/ 1000 г
при 298 К равна 0,0235 В. Можно ли в данном случае пренебречь диф-
фузионным потенциалом? (Сравните вычисленную ЭДС с приведенной
и сделайте соответствующий вывод.)
17. Для элемента
Zn / ZnSO4 ;; Znso4 |Zn
rHt==0,05 m2=0,005
при 298 К E — 0,0185 В. Вычислите у± в концентрированном раст-
воре, если в разбавленном растворе у± = 0,477.
330
18. Рассчитайте для 298 К ЭДС элемента
Pt I Н2 I CHgCOOH I NH4OH, Н2О | Н2 I Pt
= 1 атм с = 0,1 моль/л с— 0,01 моль/л ^н2 = 1 а™
Данные о константах диссоциации уксусной кислоты и гидроксида
аммония возьмите из справочника [М.].
19. Определите коэффициент активности для 1 М H2SO4, если
для 0,05 М H2SO4 средний коэффициент активности ионов равен 0,34,
плотность 1 М раствора равна 1,060 г/см3 и ЭДС элемента
Pt | Н2 | H2SO4, Hg2Pt | Hg2SO4(T),
Рщ — 1 атм с = 0,05 моль/л
имеет следующие значения: для 0,05 М H2SO4 Е = 0,7546 В; для 1 М
H2SO4 Е = 0,6744 В.
20. Элемент составлен из амальгам цинка разных концентраций.
Вычислите ЭДС, приняв, что azn = Czn- Укажите направление пере-
мещения ионов Zn2+ в растворе, если при 298 К (\ = 0,00337 моль/л и
с2 = 0,00011 ммоль/л.
21. Для элемента
Pt | Hg (Pb), PbSO41 H2SO41 H2 | Pt
xpb = 0,0192 m = 0,02 Рщ = 1 атм
при 298 К ЭДС равна 0,1238 В. Стандартный потенциал амальгамного
электрода ^so4-lPbso.,(Pb)Hg ~ —0,353 В. Вычислите активность и ко-
эффициент активности свинца в амальгаме.
22. Для элемента
Pt (TI)Hg | Т1С1О4 :: КС1 | Hg2Cl2, Hg, Pt
xyj = 0,085 m — 0,1 m — 0,1
при 298 К ЭДС равна 0,61 В. Активность таллия в амальгаме аТ) =
= 0,0628. Вычислите стандартный потенциал амальгамного электрода.
23. Для элемента
Ag | Zn | ZnCl | AgCl (t), Ag
m = 0,555 моль/1000 г H2O
используя стандартные электродные потенциалы, напишите уравнение
реакции и вычислите при 273 К изменение энтальпии АТ/, количество
теплоты Q, выделяющееся при обратимом протекании реакции в галь-
ваническом элементе, и Е° элемента, если при 273 К Е = 1,125 В,
(дЕ/дТ)Р = —0,0004 В/К.
24. Для гальванического элемента
Ag (т) | AgCl (т) | НС1 | Cl2, Pt
а = 1 Pqi — 1 атм
ЭДС как функция температуры определяется уравнением
£ = 0,977 + 5,7-10-* (350—/) —1,48-10-’ (350— /)2.
Вычислите АСр, сравните полученную величину с найденной в спра-
вочнике [M.J.
331
25. Напишите уравнение реакции, протекающей в гальваническом
элементе
Ag I Ag Вг (т) | KBr I Hg2 Вг2 | Hg I Pt
насыщ.р-р
По данным
Г, К........... 293 298 303
Е, В........... 0,0663 0,0684 0,0705
и стандартным термодинамическим величинам [М.1 вычислите теплоту
при обратимом и необратимом протекании электрохимической реакции.
26. Для элемента, в котором протекает реакция по уравнению
V2 H2(r) + AgCI (T) = Ag (т)+НС1 (р-р)
существует следующая зависимость ЭДС от температуры:
Т к............ 273 283 293 298 303 313 323 333
Е, В........... 0,236 0,231 0,225 0,222 0,219 0,212 0,204 0,196
Представьте схему элемента; вычислите графическим дифферен-
цированием при 298 К (дЕ/дТ)р; AG°; A//0, AS0; АД, AG°, W и Q
обратимой реакции; сведите полученные данные в таблицу; проверьте
полученный результат с помощью уравнения
Е = 0,2224 — 645-10-« (Т — 298)— 3,284-10-» (Т— 298)2.
27. Дана схема концентрационного элемента
Т1 I Т1С1О, / (Tl) Hg
m = 0,l = 0,085
ЭДС этого элемента при 298 К равна 0,071 В. Температурный коэффи-
циент элемента (дЕ!дТ)р = 1,8 • 10-4 В/К- Вычислите для таллия,
растворенного в ртути, а<т1), T(td, AGti, AS™ и дайте заключение о
типе отклонения раствора Т1 — Hg от закона Рауля.
28. Дана схема концентрационного элемента
Pt | Hg (Tl) I T12SO4 i (Tl) Hg | Pt
молярная доля Tl 10,02% раствор молярная доля Tl 4,93%
При 7\ = 298 К £1 = 0,02948 В, при 7\ = 303 К Е-> = 0,02997 В.
Вычислите дифференциальную теплоту разбавления А//т1 таллия при
293 К.
29. В гальваническом элементе
Cd (т) | CdCl2 (расплав), КС!, NaCl.LiCl ((расплав) Cd—Sn | Cd
^Cd=-°-258
при 756 К ЭДС равна 0,0324 В, Ped = 9,2 мм рт. ст. Вычислите:
а) активность кадмия в расплаве; б) давление пара кадмия над рас-
плавом; в) установите характер отклонений от закона Рауля.
30. Собран электрохимический элемент, в котором одним из элект-
родов служит жидкий таллий, другим — сплав таллия и свинца. Элект-
ролитом является смесь расплавленных солей LiCl — КО — Т1С1.
332
При 711 К, когда молярная доля таллия в сплаве достигнет 0,20,
ЭДС элемента станет равной 0,115 В. Вычислите активность, коэффи-
циент активности и давление пара для сплава. Давление насыщенного
пара чистого таллия Pti = 5 • 10~5 мм рт. ст.
31. Для элемента
РЬ (ж) | PbCl2 (LiCl, КС1) I (жидкий расплав) РЬ—Bi / Pb
расплав
при 700 К получено Хрь = 0,23; Е = 59,76 • 10~3 В; dEldT = 64,4 X
X 10~в В/К; Ррь = 5,1 • 10~5 атм. Вычислите активность, коэффициент
активности, давление пара над расплавом для свинца, а также АСрь,
А//рь, ASpb.
32. Вычислите ЭДС элемента
Pt | Н2 | НС1 :: КС1 | Hg2Cl21 Hg | Pt
а™ 1П—\ насыщ. р-р
для 298 К с учетом диффузионного потенциала. Необходимые данные
возьмите из справочника [М.] и таблицы в Приложении.
33. Рассчитайте константы равновесия следующих реакций:
Sn + CuSO4 = Си + SnSO,
2Н2О2 = 2Н2О (ж)
Си2+ + Си = 2Си+
при 298 К на основании стандартных электродных потенциалов.
34. ЭДС гальванического элемента при 298 К
Pt I Н2 I НС1 I Cl2 I Pt
1 атм т — 0,01
зависит от давления С12
Р, атм......... 1 50 100
Е, В........... 1,5962 1,6419 1,6451
Определите фугитивность С12 и коэффициент фугитивности при
50 и 100 атм.
35. В топливном элементе протекает химическая реакция Н2 +
+ ’Ю2 = Н20(ж). Какое максимальное значение электрической энер-
гии будет получено на 1 моль Н2 и каково значение максимальной
ЭДС?
36. При Т = 298 К для цепи
Zn (т) / Zn SO4 PbSO4 (т) / Pb
р-р н,о
были получены следующие данные:
R.T
т 1/~т — Inm, В Е, В
г г
0,001000 0,03162 —0,17745 0,59714
0,005000 0,07071 —0,13611 0,56598
333
1) напишите химические уравнения реакций, протекающих в цепи;
2) напишите уравнение Нерста для цепи, включающее т и средний
коэффициент активности ZnSO4 ,у± (примите, что PbSO4 нерастворим);
3) линейной экстраполяцией, графически или численно, определите
Е° цепи; 4) определите у± в 0,005 м растворе по известной ЭДС.
37. Укажите условия, при которых справедливо каждое из следую-
щих уравнений: 1) Е = 0; 2) Е° = 0; 3) X = Хо + const 4) 1g =
= —0,509]/7; 5) t+ = U+/(U+ + {/_); 6) as± = 4m3yV> 7) с =
= 1000 (x/X0); 8) \H = —nF[E — 1; 9) /_ = EJE.
38. При потенциометрическом титровании 10 мл раствора урана
(III) 0,09064 н. К2Сг2О7 получены следующие данные:
^КгСг^От’ мл Е, мВ ^К1Сг2О7, мл Е, мВ ИК,Сг,О,- мл Е, мВ
0,0 —570 0,50 65 10,5 170
0,05 —565 2,5 90 10,6 350
0,15 —560 4,4 НО 10,8 370
0,25 —490 6,5 120 10,9 390
0,30 —440 8,7 130 11,1 420
0,35 -70 10,3 140 11,55 440
0,40 50 10,4 150
Постройте графики зависимости Е от V и от V (среднее между по-
следующими объемами) и определите общий объем К2Сг2О7, прибав-
ленного в точках эквивалентности U (IV) и U (VI).
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Для концентрационного элемента, составленного из металла А
в растворах электролита В с концентрациями mi и т2 моль/1000 г,
рассчитайте ЭДС при 298 К. Активность вычислите по среднему ко-
эффициенту активности, взятому из справочника [М.], или (для раз-
бавленных растворов) по ионной силе. Для элемента, составленного
из водородного электрода в растворе электролита С с концентрацией
т3 моль/1000 v и каломельного полуэлемента с концентрацией КС1
т4 моль/1000 г, вычислите ЭДС и pH раствора, содержащего электро-
лит С. Диффузионную ЭДС не учитывайте. При 298 К стандартный
потенциал каломельного электрода (aCI- = 1) равен 0,2812 В, а
ионное произведение воды 1,008 • 10~14. Константы диссоциации сла-
бых электролитов найдите в справочнике [М.].
334
• W Q Ь 0 X Я ££ Вещество C m4 атм
А в
1 Со CO(NO3)2 0,1 0,7 NH4OH 0,5 0,35 0,50
2 Со CO(NO3)2 0,02 0,7 nh4oh 1,0 0,4 1,00
3 Ni niso4 0,1 0,7 HCOOH 0,3 0,03 0,50
4 Ni niso4 1,5 0,2 nh4oh 1 0,3 0,50
5 Си CuCl 2 1 2 HCI 0,01 0,1 0,20
6 Си CuCl2 0,2 0,05 HCI 3 0,5 2,00
7 Си CuCl2 2 0,06 NaOH 2 1 2,00
8 Си CuCl 2 0,02 0,6 NaOH 8 1,5 2,00
9 Си CuSO4 0,1 0,5 HBr 0,95 4 0,20
10 Си CuSO4 0,01 1 HBr 1 0,45 0,20
11 Zn ZnCl2 0,005 1 CeH6OH 0,9 0,2 0,50
12 Zn ZnCl2 0,5 0,01 CeH6OH 0,1 0,25 1,00
13 Zn ZnCl2 0,5 0,02 H2O — 3 1,00
14 Zn ZnCl2 1 3 H2O — 3,5 1,00
15 Zn ZnSO4 0,01 0,1 CeH5OH 0,3 1 0,50
16 Zn ZnSO4 3 0,002 CeH5OH 0,7 1,5 0,50
17 Ag AgNO3 0,1 1 CH3COOH 0,1 4 0,10
18 Ag AgNO3 0,2 2 CH3COOH 1 0,2 0,10
19 Ag AgNO3 0,1 3 CH3COOH 0,3 0,3 2,00
20 Ag AgNO3 1 0,5 HCOOH 0,1 0,7 2,00
21 Cd Cd(NO3)2 0,2 0,6 NaOH 1,4 2 3,00
22 Cd Cd(NO8)2 2 0,7 NaOH 0,1 2,5 3,00
23 Cd CdSO4 0,005 2 H2SO4 0,5 3 3,00
24 Cd CdSO4 1 0,2 H2SO4 17 3,5 0,10
25 Pb Pb(NO3)2 0,002 0,02 HCOOH 1 2,5 2,00
2. Для окислительно-восстановительного элемента типа
Pt | А, В || С, D | Pt
по стандартным электродным потенциалам полуэлементов [М,] напи-
шите уравнение и вычислите константы равновесия реакции окис-
ления — восстановления. Вычислите ЭДС элемента при 298 К. Ука-
жите, можно ли практически изменить направление реакции за счет из-
менения концентраций компонентов. Считайте, что ан2о = 1, ян2 =
= 0,2.
Ms ва- рианта A в c D “A "B aC “D
1* MnO4 Mn2+ Cr8+ Cr2+ 0,10 0,02 0,01 0,01
2* MnO4- Mn2+ H3AsO4 HAsO2 0,005 0,015 0,001 0,03
3* MnOf Mn2+ MnO2 Mn2+ 0,009 0,014 0,001 0,07
4* MnO4- Mn2+ Sn‘+ Sn2+ 0,02 0,01 0,08. 0,15
5 MnO^ Mn2+ уз+ \?2 + 0,018 0,005 0,1 0,15
6 Fe8+ Fe2+ Cr8+ Cr2+ 0,005 0,15 0,1 0,001
7 Fe(CN)8- Fe(CN)J~ Co3+ Co2+ 0,06 0,06 0,04 0,005
8 Cr3+ Cr2O7 T|s+ Ti+ 0,006 0,1 0,08 0,002
9 Co8+ Co2+ Fe(CN)j“ Fe(CN)*" 0,04 0,009 0,06 0,001
335
Продолжение табл.
№ ва- рианта А в c D °A aB °C “D
10* Со3+ Co2+ MnO4 Mn2+ 0,1 0,006 0,01 0,007
и* Со3 + Co2+ Cr3+ Cr2+ 0,012 0,01 0,005 0,06
12 Си2+ Cu + uor LJ4+ 0,007 0,016 0,002 0,05
13* Си2+ Cu* Sn4 + Sn2 + 0,14 0,009 0.002 0,08
14 H3AsO4 HAsO2 MnO2 Mn’+ 0,08 0,04 0,02 0,007
15* H3AsO4 HAsO2 V3+ V2+ 0,15 0,005 0,005 0 01
16 V3+ V2+ Tl3+ T1 + 0,016 0,007 0,001 0,1
17* Sn4+ Sn2+ H3AsO4 HAsO2 0,06 0,008 0,04 0,003
18 Sn4* Sn2+ Pu4+ Pu3+ 0,08 0,06 0,007 0,005
19 Sn4+ Sn2+ Tl3+ T1 + 0,1 0,05 0,02 0,01
20 Ce4+ Ce3‘ Co3+ Co2+ 0,08 0,007 0,02 0 005
21 Ce4+ Ce3+ Co3+ Co2+ 0,01 0,02 0,01 0,04
22 Tl3+ T1+ Ce4 + Ce3+ 0,009 0,04 0,02 0,02
23* UO2+ U4+ Fe3 + Fe2+ 0,012 0,1 0,01 0,1
24* UO|- u«+ Fe3+ Fe2+ 0,04 0,08 0,06 0,003
25* Pu«+ pU3 + UOi + U4+ 0,02 0,10 0,08 0,001
* В реакции участвуют Н+ и Н20.
3. Для реакции, протекающей обратимо в гальваническом элемен-
те, дано уравнение зависимости ЭДС от температуры. При заданной
температуре Т вычислите ЭДС Е, изменение энергии Гиббса AG, из-
менение энтальпии \Н, изменение энтропии AS, изменение энергии
Гельмгольца АД и теплоту Q, выделяющуюся или поглощающуюся
в этом процессе. Расчет производите для 1 моль реагирующего ве-
щества.
Реакция
Уравнение Е—К'П
1 273 2 323 CeH4O2 + 2H+ = CeH4(OH)2 + 2e
3 343 4 363 Zn-p 2 AgCl = ZnCl2 -|- 2Ag
5 278 6 313 Zn + Hg2SO4 = ZnSO4 + 2Hg
7 273 8 298 Ag + Cl- = AgCl -(- e
9 273 10 363 Cd + Hg2SO4 = CdSO4 + 2Hg
11 303 13 273 Cd+2AgCl=CdCl2+2Ag
13 293 14 323 Cd + PbCl2 = CdCl2 + Pb
15 273 16 363 2Hg -|-ZnCl2 = Hg2Cl2 -|- Zn
17 273 18 353 2Hg-FSOi" =Hg2SO4 + 2e
19 333 20 353 Pb-)-2Ag[ = PbI2 + 2Ag
21 273 22 298 ,2Hg+2Cl-=Hg2Cl2 + 2e
23 363 2Ag + Hg2Cl2 = 2 AgCl + 2Hg
24 353 Hg2CI 2+2KOH=Hg2O+2KCl + i u о
25 298 "Тп2и Pb4-Hg2Cl2 = PbCl2-F2Hg
Е = 0,6990—7,4 • 10~4(Г—298)
£=1,125—4,02-10-«Г
£ = 1 ,4328—1,19-10—з(Г—228)
Е = 0,2224—6,4-10- «(Г—298)
£ = 1,0183—4,06-10-5(Т—293)
£ = 0,869—5,5-10-«Т
£ = 0,331—4,8-10-«Г
£=1+9,4-10-5(Г—288)
£ = 0,6151—8,02-10~4(Т—298)
£ = 0,259—1,38-10~4Г
£ = 0,2438—6,5-10- «(Т—298)
£ = 0,556-1-3,388-10-Т
£ = —0,0947-1-8,37-10-«Г
£ = 0,5353-1-1 ,45-10-Т
336
4. Для элемента
Cd (т) | CdCl2, ZnCl2 | (жидкий) Cd—Sb | (Cd)
расплав
при 753 К получены значения ЭДС для различных концентраций Cd
в сплаве. Вычислите активность, коэффициент активности Cd и давле-
ние его паров над расплавом. Давление пара чистого кадмия Р° ~
= 9,01 мм рт. ст.
№ варианта A’Cd Е-1 О’, В № варианта *Cd Е- 10s, в
1 11 21 0,796 3,31 6 16 0,559 33,85
о 12 22 1,818 7,20 7 17 0,434 52,00
3 13 23 0,750 11,56 8 18 0,401 56,51
4 14 24 0,676 18,96 9 19 0,375 59,90
5 15 25 0,588 29,69 10 20 0,344 63,95
5. Для гальванической цепи
Me | МеС1п | Cl2, Pt
Вычислите ЭДС при температуре Т. При расчете используйте дан-
ные таблиц стандартных термохимических величин [M.J
№ ва- рианта Me MeCln т, к № ва- рианта Me MeCln т, к
1 Ag AgCl 700 9 Mg MgCl2 900
2 Cd CdCl2 800 10 Na NaCl 1000
3 Са CaCl2 1000 И Pb PbCl2 700
4 Со CoCl2 1000 12 Sn SnCl2 500
5 Cs CsCl 900 13 Cr CrCl3 1300
8 Ba BaCl2 1200 14 TI T1C1 700
7 К KCI 1000 15 La LaCl3 1100
8 Li LiCl 800
ГЛАВА XX
АДСОРБЦИЯ
Основные уравнения и символы
[К., с. 504—508; Г„ т. I, с. 443—446, 4841
Адсорбция газа при Т = const описывается уравнением изотер-
мы адсорбции Лэнгмюра
ЬР
а=а-ЦТр’ (XXJ)
337
где а — количество газа, адсорбированного 1 г адсорбента или 1 см2
его поверхности; ах — максимальное количество газа, которое может
адсорбировать 1 г адсорбента (или 1 см2 его поверхности) при данной
температуре; b — константа адсорбционного равновесия; Р — равно-
весное давление газа. Уравнение (XX. 1), выраженное через степень
заполнения 9, имеет вид
0 = ftP/(l-|-W). (XX.2)
Степень заполнения определяют по соотношению
0 = а/а-. (ХХ.З)
Изотерма адсорбции Лэнгмюра может быть выражена через объем по-
глощенного газа:
V = VmbP(l + bP). (XX.4)
Константы в уравнении Лэнгмюра вычисляют по соотношениям
Р 1 1
— А -Ь — р (ХХ.5)
или а Clboo Qoo
1 V 1 “ Vm + ь VmP ’ (ХХ.6)
где V — объем адсорбированного газа; Vm — объем адсорбированного
газа, полностью покрывающего поверхность 1 г адсорбента; объемы
V, Vm приведены к нормальным условиям (Т = 273 К, Р = 1 атм).
Площадь поверхности S 1 г адсорбента
где s — площадь, которую на поверхности адсорбента занимает одна
молекула адсорбата.
Адсорбция из раствора описывается уравнением Лэнгмюра вида
а = а-6с/(1+6с), (ХХ.8)
где с — равновесная концентрация адсорбированного вещества в раст-
воре.
Более строгим уравнением адсорбции служит уравнение
где b — константа, учитывающая силы притяжения между молекула-
ми адсорбата.
Для средних заполнений поверхности адсорбента используют урав-
нение изотермы Фрейндлиха
x/m=bc" (XX.10)
или
lg x//n = lg b = n lg с, (XX.11)
338
где х — количество адсорбированного вещества; т — масса адсорбен-
та; b и п — константы.
Предполагая многослойную адсорбцию, Брунауэр, Эммет и Теллер
вывели уравнение изотермы адсорбции (БЭТ):
Р 1 (С— 1) Р
V(Ps-P) ~ vmc + vmcp8 ’ ( ,12)
где V — общий объем адсорбированного газа; Vm — объем адсорби-
рованного газа, если вся поверхность адсорбента покрыта сплошным
мономолекулярным слоем; Р — равновесное давление адсорбирован-
ного газа; Ps — давление насыщенного пара; С — константа при
данной температуре. Согласно уравнению (XX. 12) зависимость
Р Р
—„г от р- на графике дает прямую линию с тангенсом угла накло-
С—1
на vmc-
Дифференциальную теплоту адсорбции Qa вычислите по уравнению
(?а = ЯТ2р-^Ц , (XX. 13)
\ еТ /е
Qa^R (ХХ.14)
где Plt Р2 — равновесные давления для двух состояний при двух тем-
пературах 7\ и Т2 при одном и том же количестве адсорбированного -
вещества а или при одной и той же степени заполнения.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При адсорбции аргона коксовым углем при 194,7 К получены
следующие результаты:
Р, Па............................. 31,9-103 1 30,5-103 290-103
Р, мм рт. ст........................... 24 98,4 218
а, мг/г................................. 5 15,4 24
Рассчитайте постоянные в уравнении Лэнгмюра.
Решение. Согласно уравнению Лэнгмюра а/ах является уг-
ловым коэффициентом прямой зависимости между P/а и Р, а \/Ьах —
отрезком, отсекаемым этой прямой на оси ординат. Вычисляем величи-
ны Р/а:
Л Па....................... 31,9-103 130,5-Ю3 290-103
Р!а........................ 6,4-103 8,7-Ю3 12,1-103
По полученным данным строим график, отложив на оси абсцисс Р,
а на оси ординат — PJa. Как видно из графика (рис. 40),
1/в = (П —7)/(240 — 60) = 0,0222.
Отсюда а = 45,1/Ьа^ = 5,7 • 10s. Следовательно, b — 1/5,7 • 45 =
= 0,004.
339
Рис. 41. Зависимость P/[V(P,—Р)|
от Р/Р,
2. Объем газообразного азота Vm при 1,04 • 10s Па (750 мм рт. ст)
и 273 К, необходимый для покрытия образца силикагеля мономоле-
кулярным слоем, 129 мл/г. Вычислите площадь поверхности 1 г
силикагеля, если молекула азота занимает площадь 16,2 • 10-20 м2.
Решение. Площадь вычисляем по уравнению
о (0,129 л-г-1) (б.Ог-Ю2® моль-п (16,2.10-20 м2) ее„ , ,
22,4 л-моль-*
3. При 77,5 К на серебряном катализаторе была снята изотерма ад-
сорбции криптона, которая характеризуется следующими данными:
Р, мм рт. ст............. 0,0992 0,1800 0,3686 0,5680 0,6843
Объем адсорбированного газа
1 кг катализатора, см’/г . . 0,0127 0,0150 0,0176 0,0190 0,198
Рассчитайте постоянные в уравнении БЭТ, удельную поверхность
катализатора, приняв площадь одной молекулы криптона £кг =
== 19,5 • 10-20 м2, плотность криптона do°c — 3,739 г/л, давление
насыщенного пара криптона Ps = 2,57 мм. рт. ст.
Решение. Экспериментальные данные сведем в таблицу:
Р, мм рт. ст. V, см’/г PIP, Ps~P
0,0992 0,0127 0,0385 0,4708
0,1800 0,0150 0,0700 2,3900
0,3686 0,0176 0,143 2,2014
0,5680 0,0190 0,220 2,0020
0,6843 0,0198 0,2660 1,8857
На основании полученных данных строим график в координатах
р р
i/7p—рт — Б- (рис. 41). Из графика находим tga:
У V S г) Гs
tga = —— =68;
vm-c
(а)
340
отрезок, отсекаемый на оси ординат, равен
Г3 = о’5-
¥ т'-’
(б)
Решая совместно уравнения (а) и (б), получаем С = 136; Vm =
— 0,0146 см3/г. Чтобы вычислить удельную поверхность, отнесем
Ут к 1 моль:
Vm = 0,0146 см3/г =
0,0147-3,739-Ю-3
83,6
= 6,5-10-’ моль/г;
тогда удельная поверхность будет равна
= 6,5-10-’-6,02-Ю33-19,5-Ю”1’= 763,05 см2/г.
ЗАДАЧИ
1. Количество V азота (отнесенное 273 К и 1,01 • 10s Па), адсор-
бированное 1 г активированного угля при 273 К и различном давлении,
следующее:
Р, Па ............. 51,8-102 1 6,0-103 33,0-103 45,3-103 74,2-103
Г, см3-!—1 . . . 0,987 3,04 5,08 7,04 10,31
По приведенным данным постройте изотерму Лэнгмюра и вычислите
константы.
2. Какой объем (л) аммиака при 298 К и 1,01 • 105 Па может ад-
сорбироваться на поверхности 45 г активного угля, если вся поверх-
ность полностью покрыта NH3? Поверхность 1г активированного
древесного угля 1000 м2. Диаметр молекулы NH3 равен 3 • 10-8 см.
Молекулы касаются друг друга в плоскости так, что центры четырех
соседних сфер расположены в углах квадрата.
3. Вычислите площадь поверхности катализатора, 1 г которого при
образовании монослоя адсорбирует 103 см3 азота (при 1,01 • 105 Па
и 273 К). Адсорбция измеряется при 78 К, эффективная площадь, за-
нятая молекулой азота на поверхности, 16,2 • 10-20 м2.
4. Вычислите константы в уравнении Лэнгмюра и xltn при 23,8 X
X 104 Па (опытное значение xltn = 30,8 мм3), если зависимость адсорб-
ции азота на слюде от давления следующая:
Р, Па.........2,8-10-' 6,1-10-' 17,3-10-'
х/т ...... 12,0 19,0 28,2
соотношение xltn выражено в мм3 газа при 293 К и 1,01 • 10s Па;
газ адсорбирован 24,3 г слюды, площадь поверхности которой
5750 см2).
5. Удельная поверхность активированного угля 400 м2/г. Плот-
ность метанола при 288 К 0,7958 г/см3. Определите максимальное ко-
личество метанола, адсорбированное 1 г угля при 288 К, если спирт
адсорбируется с образованием мономолекулярного слоя.
341
6. Определите постоянные в уравнении Лэнгмюра, если известны
значения Р и а при 273 К:
Р, Па...........................
а, моль/г.......................
Р, Па...........................
а, моль/г.......................
1,35-10* 2,63-10*
0,150 0,275
6,63-10* 7,94-10*
0,550 0,620
3,98-10* 5,30-10*
0,380 0,470
9,25-10* 1,06-105
0,685 0,745
7. Определите постоянные в уравнении Лэнгмюра и адсорбциюСО2
на слюде при 7 Па, если при 155 К Р и а имеют значения:
Р, Па .............4,8-10-1
а-1010, моль/см3 , 1,22
11,9-Ю-1 20,6-10 1 41,0-10-1 98,0-10-'
1,95 2,55 3,24 3,62
8. Оксид углерода СО адсорбируется на слюде при 90 К, Давление
и объем адсорбированного газа при нормальных условиях имеют зна-
чения:
Р, Па..................... 75 139 600 727 1050 1400
а-103, см3 .............. 10,^2 13,39 17,17 17,60 18,89 19,60
Площадь поверхности слюды равна 6,24 • 103 см2. Определите пло-
щадь, приходящуюся на одну молекулу СО.
9. Оксид магния адсорбирует кремнезем из воды. Постройте гра-
фик в логарифмических координатах по данным:
MgO, ч. на 1 млн................ 0
SiO2 остаток, ч. на 1 млн. . . 26,2
SiO2 (удельный), ч. на 1 мли. 0
75 100 200
9,2 6,2 1,0
17,0 20,0 25,2
Вычислите константы в уравнении Фрейндлиха. Определите коли-
чество оксида магния (части на 1 млн.), которое необходимо, чтобы
уменьшить остаток кремнезема до 2,9 ч. на 1 млн.
10. Вычислите количество водорода (измеренного при стандартных
условиях), которое адсорбируется 100 мл адсорбента, если его пло-
щадь поверхности 850 м2, причем 95% поверхности является актив-
ной. Диаметр молекулы водорода 27 нм. Адсорбированные молекулы
касаются друг друга в плоскости так, что центры четырех соседних
сфер расположены в углах квадрата.
11. Газы А и В стремятся занять места на поверхности адсорбен-
та. Покажите, что для поверхности, занятой молекулами газа, степень
заполнения равна
^4PA^+kAPA+kBPB).
12, Рассчитайте удельную поверхность катализатора, если адсорб-
ция криптона при 77,5 К характеризуется следующими данными:
Р, мм рт. ст............... 0,447 0,645 0,159 0,450
Объем адсорбированного газа
1 г катализатора, см3/г . . 0,4185 0,4619 0,5234 0,6313
342
Масса катализатора 13,03 г. Площадь, занимаемая одной молеку-
лой криптона, Skt = 19,2-10~20 м2, плотность криптона d0°c =
— 3,739 г/л, давление насыщенного пара криптона Ps = 2,57 мм
. рт. ст. = 342,65 Па.
13. При температуре 298 К на активированном угле была снята
изотерма адсорбции бензола. Получены данные:
P/Ps................ 0,1 0,2 0,3 0,4 0,5 0,6
Р
—-----— . .......... 0,19 0,23 0,35 0,42 0,5 0,6
Плотность бензола d2o°c = 0,878 г/л, площадь, занимаемая одной
молекулой бензола в монослое, «с,н4 = 30,3-10-20 см2. Рассчитайте
удельную поверхность активированного угля.
14. При 77,5 К на платиновом катализаторе была снята изотер-
ма адсорбции криптона. Получены данные:
Р, мм рт. ст.............. 0,149 0,200 0.308 0,491
Объем адсорбироваииого газа
1 г катализатора, см’/г . . 0,2763 0,3040 0,3524 0,4098
Рассчитайте постоянные в уравнении БЭТ и удельную поверхность
катализатора, если площадь, занимаемая одной молекулой криптона,
sKr = 19,2-10“20 м2, плотность криптона do°c = 3,739 г/л, давление
насыщенного пара криптона Ps = 2,57 мм рт. ст. = 342,65 Па.
15. Давление при адсорбции некоторого количества NH3 одним
граммом угля составляет 1,4- 104Па при 303 К и 7,44-104 Па при 353 К.
Вычислите теплоту адсорбции при данной степени заполнения.
16. При нормальных условиях 40 см3 СО2 адсорбируются 1 г уг-
ля при 303 К под давлением 8-104 Па и при 273 К под давлением
2,27-104 Па. Определите теплоту адсорбции.
17. Определите теплоту адсорбции оксида азота на фториде бария
по следующим данным:
233 К 273 К
Р, Па | а, см3 Р, Па а, см9
3,53-103 3,17 7,51-10’ 1,81
4,65-103 3,70 11,15-10’ 2,40
6,70-103 4,40 17,3-10’ 3,01
8,55-10’ 5,09 23,9-103 3,73
12,5-10’ 6,14 33,9-10’ 4,24
17,3-103 6,70 44,0-10’ 5,30
18,6-103 7,35 53,0-10’ 5,86
30,3-10’ 8,48 59,0-103 6,16
35,3-1 О’ 9,07 60,7-10’ 6,34
47,3-1 О’ 9,92 82,0-103 7,30
343
18. Определите теплоту адсорбции N2, СО, СН4, СО2 и NH3 на
древесном угле, если теплота адсорбции водорода равна 10,46-10®
Дж/моль. Температура кипения указанных веществ:
Вещество . . . . Н2 N2 СО СН4 СО2 NH3
Т, К............ 20,4 77,3 83,1 111,7 194,6 240,0
Для решения воспользуйтесь приближенной закономерностью
\Н!Т„ ,т.к = const.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Объем V вещества [отнесенный к 273 К и 1,01 • 105 Па (1 атм)] ад-
сорбированного 1 г адсорбента при 273 К и различном давлении, при-
веден в таблице: 1) постройте изотерму адсорбции И = f (Р) и P/V =
= f (Р); 2) опишите изотерму адсорбции с помощью уравнения Лэнг-
мюра; 3) определите адсорбцию (м3/г) при максимальном заполнении
адсорбента; 4) определите степень заполнения адсорбента при давле-
нии Р4; 5) определите, при каком давлении газа степень заполнения
адсорбента составит 0,4.
№ ва- рианта Т, к Адсорбент Адсорбат Р,. 10~4, Па р-10-3, Па V-Ю6, м3/г
1 273 ‘ Уголь N2 2,0 1,62 5,30 17,30 30,70 44,50 0,31 0,99 3,04 5,10 6,90
2 273 » со2 2,0 4,20 8,10 11,70 16,50 24,00 12,73 21,20 26,40 32,20 38,60
3 273 » со 5,0 9,80 24,20 41,30 60,00 72,50 2,53 5,57 8,43 11,20 12,85
4 273 NH3 5,0 10,50 21,60 42,70 65,60 85,20 60,40 90,30 115,70 127,00 132,40
5 273 BaF2 СО 5,0 11,30 24,40 44,50 61,00 82,50 2,04 3,72 5,30 6,34 7,30
344
Продолжение табл.
As ва- рианта т, к Адсорбент Адсорбат Pt. 10"4, Па ZM0-3, Па V40*, м3/г
6 273 Уголь Н2 2,0 27,60 43,30 57,40 72,20 86,10 0,447 0,698 0,915 1,142 1,352
7 194,5 N. 2,7 1,67 8,83 20,00 36,30 52,00 3,47 13,83 23,00 27,94 33,43
8 194,5 сн4 5,0 25,6 36,7 47,8 60,5 77,0 15,2 19,1 22,3 25,3 28,4
9 194,5 со 0,5 4,00 5,34 9,65 16,65 19,80 15,8 19,05 27,7 34,1 39,95
10 194,5 » Аг 3,0 3,22 7,25 13,15 17,25 39,50 5,09 10,02 15,56 18,81 29,14
1'1 273 » С2Н4 5,0 9,35 12,45 22,5 42,6 82,5 39,5 42,8 49,9 56,5 64,5
12 293 с2н4 2,0 2,0 4,27 10,57 29,5 91,5 10,4 20,8 30,5 42,4 55,2
КОМПЛЕКСНЫЕ ЗАДАЧИ
1. Определите константу равновесия Ар реакции (А) при 298 К
и в диапазоне температур от 300 до 1000 К через 100 град.
№ вари- анта Химическая реакция (А) № вари- анта Химическая реакция (А)
1 сн4+н2о=со+зн2 CH4-f-2H2O = CO2+4H2 4 2СН4+О2= 2СО + 4Н2
2 5 2СН4 = СН = СН + ЗН2
3 СО+Н2О = СО2+Н2 6 СН4 +СО2 = 2СО +2Н2
345
2. Начертите график Кр = f (Т) в диапазоне от 198 до 1000 К.
3. Начертите график в координатах 1g Кр — (1/Т) для диапазона
температур от 298 до 1000 К.
4. Для заданной реакции начертите график зависимости выхода
конечного продукта х.от константы равновесия при условии, что ис-
ходная смесь стехиометрическая.
5. Определите выход продукта реакции в диапазоне температур от
298 до 1000 К, если давление равновесной смеси 1,0133-105 Па, и по-
стройте график зависимости выхода продукта реакции от температуры
при указанном давлении.
6. Сделайте заключение о смещении равновесия, если к исходной
смеси добавлен азот, который не участвует в химической реакции.
7. Определите коэффициенты активности всех веществ, участвую-
щих в реакции, при давлении 2,0-10’ Па и температуре максимально-
го выхода продуктов реакции, если равновесное давление 1,0133- 10s Па.
8. Вычислите Ку при температуре максимального выхода продук-
тов реакции и давлении 2,0-10’ Па.
9. Вычислите равновесный выход продуктов реакции при давлении
2,0-10’ Па.
10. Определите тепловой эффект процесса перехода из исходного
в равновесное состояние при температуре в диапазоне от 300 до 1000 К
и постройте график Qp = f (Т).
11. Определите парциальные давления газов в равновесном со-
стоянии системы при условиях максимального выхода продуктов ре-
акции при равновесном давлении 2,0-10s Па.
12. Определите температуру, до которой необходимо охладить рав-
новесную систему, с тем чтобы из нее начало конденсироваться одно
из реагирующих веществ.
ГЛАВА XXI
ФОРМАЛЬНАЯ КИНЕТИКА
Основные уравнения и символы
[К., с. 626—637; Г., т. 2, с. 13—25, 38—41]
Химическая кинетика рассматривает скорости химических реак-
ций и параметры, от которых эти скорости зависят. Наиболее важны-
ми параметрами являются концентрация, температура и давление. При
кинетическом исследовании прямым или косвенным способом изме-
ряют изменение концентрации веществ во времени. Порядок реакции —
строго экспериментальная величина, показывающая характер зависи-
мости скорости реакции от концентрации.
346
Для реакций, описываемых стехиометрическим уравнением
va1ai + va2a2 + vAjA3 + ••• vb1Bi+vb2b2 + vBjB3>
истинная скорость w выражается соотношением
1 dcA, 1 dcA,
а, —---- --- — —----- —— — ... —
VA, dZ VA2 dZ
где vA., vB. — стехиометрические коэффициенты; A — исходные ве-
щества; В — продукты реакции.
Зависимость скорости реакции от концентрации исходных веществ
(кинетическое уравнение в дифференциальной форме) выражается за-
коном действующих масс
w = k(^c’£, (XXI. 2)
где k — константа скорости реакции: и1( п2, ... — числа, указываю-
щие частный порядок реакции по компоненту Аь А2, соответственно.
Полный порядок реакции п равен
л = П1-]-л2. (XXI.3)
Средняя скорость реакции w
U> = C2 —^/(/г —/1), (XXI.4)
где — интервал времени, за которое в течение реакции кон-
центрация реагента изменяется от с2 до с2- Для различного типа ре-
акций закон действующих масс будет выражаться различным образом.
Для реакции нулевого порядка дифференциальная форма кинетиче-
ского уравнения имеет вид
dcA-
-—7- =й, (XXI.5)
at
dx
=k, (XXI.6)
а интегральные формы кинетического' уравнения будут:
* = (co,A.-cA.)/z> (XXI.7)
k=x/t, (XXI.8)
сА.=со, А~(XXI.9)
/1/2 =0,5с01 А./йг', (XXI.10)
где со,а. — исходная концентрация реагента А;; сд. — концентра,
ция реагента А, в момент времени t; х — число молей вещества А, про-
реагировавшее к моменту времени t, х — с о, а. — с&:, t\/2 — время
347
полураспада (время, в течение которого исходная концентрация веще-
ства уменьшается вдвое).
Для реакций первого порядка (А-> продукты) дифференциальная
форма кинетического уравнения имеет вид
dcA щ — kch< (XXI.11)
dx -^•=*Hco.A -*). (XXI. 12)
а интегральные формы кинетического уравнения:
2,3 C0, A (XXI. 13)
t CA
2,3 c0, A
(ЛЛ1. 14)
t c0, A--v
—kt (XXI.15)
A e ,
=0,693/*. (XXI. 16)
Для реакций второго порядка (At + А2 продукты), если началь-
ные концентрации реагентов одинаковы Со.д, — Со,д2. дифференциаль-
ные формы кинетического уравнения принимают вид
d c, A =*c'l, d t A d x — k (c0, A~~%) ’ (XXI. 17) (XXI. 18)
а интегральные формы кинетического уравнения:
1 /_1_ 1\
t \ СА с0, А /
1 X
I С0, А (С0, А- х)’
_ С°- А
С0, A + 1
1
-= т--------.
/г ЙС0> Д
(XXI. 19)
(XXI. 20)
(XXI.21)
(XXI.22)
348
Для реакций второго порядка (Аг + А2-> продукты), если началь-
ные концентрации реагентов неодинаковы: Со.а, ¥= со,а, то дифферен-
циальные формы кинетического уравнения принимают вид
----TT = kc^’ (XXL23)
d/ = k(co, At~x) (co, a2~'x)< (XXI.24)
а интегральные формы кинетического уравнения будут:
2,3 k — t 1 , . СА, С0, А, (XXI.25)
^ё с0, А, ~С0, А. % С0, А,
2,3 1 , . (С0, А,-Л')с0, А2 (XXI.26)
rv —— t i ё , . • со,а1~со,а2 (со, а2 —х) со, а.
Для реакций третьего порядка (Ах + А2 + А3->- продукты), если
начальные концентрации реагентов одинаковы: с0,д, = с0,д2 = с0,д3, то
дифференциальные формы кинетического уравнения принимают вид
___^А_=йс», (XXI.27)
-Ау-=й(Со, А-*)3> (XXI.28)
а интегральные формы кинетического уравнения будут:
k— - 2t ( СА, С0,А, )’ (XX 1.29)
1 k = — 2/ 1 . (С0, А,-Х)2' 1 г2 со, At J , (XXI.30)
3 2йс§>А1 (XXI.31)
Определение порядка реакции методом Оствальда—Нойеса (инте-
гральный метод):
щ= 1ёу^У- + 1, (XX 1.32)
1g (Со, 2/с0,1)
где /{/г — период полураспада, соответствующий начальной концен-
трации сод, (1/2 — период полураспада, соответствующий начальной
концентрации с0,2 (вместо времени, за которое реагирует половине ве-
щества, брать время, за которое реагирует 1/3 (Л/з), 1/5 (/«/.) исход-
ного вещества й т. д).
* Иногда начальные концентрации с0 д обозначают буквой а, а с0 А
буквой Ь.
349
Определение порядка реакции методом Вант-Гоффа (дифференци-
альный метод):
nI- = (lgui1 — lgK>2)/(lgc0, i— Ig с0,2)- (XXI.33)
где «>!, w2 — истинные скорости реакции, соответствующие начальным
концентрациям соД и с0,2; п, — частный порядок по компоненту, на-
чальная концентрация которого с0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Превращение пероксида бензоила в диэтиловый эфир (реакция
первого порядка) при 333 К прошло за 10 мин на 75,2 %. Вычислите
константу скорости реакции.
Решение. Напишем уравнение первого порядка и подставим
в него соответствующие значения:
, 2,303 / а \ 2,303 100
fe =---- 1g----- =—’ Ig------- =0,^303 Ig 4,03 = 0,2303 - 0,606 =
t \ a —x ) 10 24,8
= 0,140 мин-1.
2. Тростниковый сахар (биоза) в присутствии ионов Н+ гидроли-
зуется водой, распадаясь на две монозы (глюкозу и фруктозу) по
уравнению
С12Н22ОП+Н2О=С6Н12О6+СЙН12О6
Раствор тростникового сахара вращает плоскость поляризации
света вправо, а смесь глюкозы и фруктозы — влево. Угол вращения
в обоих случаях пропорционален концентрации растворенных веществ.
При 298 К в 0,5 н. растворе НС1 при большом избытке воды изменение
угла вращения а плоскости поляризации раствора тростникового
сахара во времени t было следующее:
/, мин.........0 176 сю
а, град........ 25,6 5,46 —8,38
Рассчитайте константу скорости реакции и количество сахара (%,)
которое инвертируется в течение 236 мин. Определите угол вращения
к моменту времени t = 236 мин.
Решение. Обозначим угол вращения в начальный момент а0,
после окончания инверсии и наблюдаемый в данный момент av
Так-как от начального до конечного момента угол вращения изменит-
ся на а0 — а„, то эта величина пропорциональна начальной концен-
трации сахара с0,а. концентрация же сахара в данный момент со,а — х
пропорциональна изменению угла вращения от данного момента at до
конца инверси аи, т. е. пропорциональна at — ах. Реакция инверсии
сахара в присутствии большого избытка воды идет по первому поряд-
ку. Рассчитываем константу скорости реакции по уравнению (XXI.14),
заменив со.а и с0,а — х пропорциональными величинами а0 —
и at —
2,3 а0—««,
350
Подставив в это уравнение заданные значения t, а0, ах и at, по-
лучим
2,3 25,16—(—8,38) 2,3 33,54 „
й,=---— 1g--------*---—— =--------1g — =0,005028.
1 176 5,46—(—8,38) 176 13,84
Определяем количество сахара, которое инвертируется в течение
236 мин. Для этого, подставив в уравнение (XXI.14) вместо kt и t со-
ответственно 0,005028 и 236 мин, получим
с о д 0,005028-236
1g----=-- =-------—------=0,5152.
с0, А х 2,3
Откуда получаем количество гидролизованного сахара
Сл Д
-------=3,275 и х=0,6948 с0 А или х=0,6948-100=69,48 %.
со, х~х
Определяем угол вращения, соответствующий t = 236 мин.
Когда все начальное количество сахара проинвертирует, изменение
угла вращения составит 25,16° — (—8,38°) = 33,54°. Так как при
t = 236 мин остается 30,52 % сахара, не подвергшегося гидролизу,
то изменение угла вращения, вызванное превращением этого количе-
ства,
О, А
Так
будет соответственно меньше. Обозначим его через г, тогда
z 30,52 33,54-30,52
----- =------ 2= —= ю 23°.
33,54 100 100
как z = at — (8,38°), то at = г — 8,38° = 10,23° — 8,38° =
1,85°, т. е. реагирующая смесь спустя 236 мин после начала ре-
акции будет иметь правое вращение, равное 1,85°.
3. Для реакции А = В 4- С + D, протекающей в газовой фазе
при V = const, определено общее давление в начальный момент
t = 0 Р = Ро и по прошествии времени t — t' Р = Р’. Выразите кон-
станту скорости через общее давление, приняв, что реакция первого
порядка.
Решение. По уравнению идеальных газов с\ = P^IRT, тогда
fe=(2,3//) 1g (Ро_ д/Рд).
Выражаем парциальные давления РА вещества А через общее
давление Р. Для этого записываем, согласно уравнению Дальтона,
Р = Рк Рц + Pc + Pd', вводим величину х (убыль давления ве-
щества А в ходе реакции),- тогда Рд = Ро.а — х. Начальное давление
в системе равно давлению вещества А: Ро.а — Ро- Обозначим Рв =
= Pc = Pd = х. Тогда общее давление в момент времени t будет
Р = Ро — х + Зх = Ро + 2х. Выражаем х через Р и Ро: х =
= (Р — Ро)/2. Подставляем значение х в уравнение РА = Ро — хи
выражаем парциальное давление реагента А через общее давление:
0,3 2Р0
_J_ lg ----»---
t ЗР0—Р
, ЗР0~р
А- 2
и k=
351
4. В течение реакции СН3СООСН(г) -► С2Н4 + Н2 + СО общее
давление изменяется следующим образом:
I, мин............... О 6,5 13,0 19,9
Р, Па................ 41589,6 54386,4 65050,4 74914,6
Покажите, что реакция является реакцией первого порядка, и вычисли-
те среднее значение константы скорости при температуре опыта
298 К (V = const).
Решение. Если реакция относится к реакциям первого поряд-
ка, то константа скорости, вычисленная по уравнению k = 1 //In (с0—с)
для любого момента времени, должна оставаться постоянной. В мате-
матическом уравнении концентрации исходного вещества в начальный
и данный моменты можно заменить парциальными давлениями этого
вещества в те же моменты времени, так как давление газа пропорцио-
нально его концентрации (при Т = const). Приведенные давления (за
исключением первого) — это суммарное давление всех четырех газов,
а для вычисления константы скорости необходимо знать только дав-
ление ацетона.
Пусть в момент t РСгн. = х, тогда Рн2 = Рсо - •« и Р(сн3)2соо -=
= Ро — х, где Ро — начальное давление ацетона. Общее давление в
любой момент Р = Ро — х /- Зх = Ро — 2х, откуда
Р-Ро „ ЗР0-р
X =-------; рл — X =------.
2 ° 2
Заменяем соотношение концентраций соотношением давлений:
С0 Р»2Р о
с Р0 — х ЗР0~Р
тогда
Подставляем значения давления в системе для данного времени и рас-
считываем константу скорости:
, 2,3 2-41589,6
k 1g------------------— ;-= 0,025986;
6,5 & 3-41589,6 — 54386,4
2,3 2-41589,6
k =—-— lg -----------------:------=0,02569;
13,0 s 3-41589,6 — 65050,4
2,3 2-41598,6
k =------lg ----------------------= 0,02590;
19,9 6 3-41589,6—74914,6
fecp = 0,02586.
Константа скорости постоянна в пределах неизбежных ошибок опыта
Следовательно, эта реакция является реакцией первого порядка.
352
5. Скорость реакции (C2H5)3N + CH3I-► [(C2H5)3CH3N1 I в нит-
робензоле определялась при 298 К, причем получены следующие дан-
ные:
t, с ....................... 1200 1800 2400 3600 4500 5400
х, моль/л ............... 0,00876 0,01065 0,01208 0,01392 0,01476 0,01538
где t — время; х — количество триэтиламина и метилиодида, проре-
агировавших за время t. Начальные концентрации амина и йодистого
алкила равны 0,0198 моль/л. Рассматриваемая реакция — второго по-
рядка. Определите константу скорости.
Решение. Для реакции второго порядка, в которой реагируют
два вещества с одинаковыми концентрациями,
х 0,00876
k =-----------; k =--------------------=0,0334;
tc0(c„—х) 1200.0,0198-0,01104
k = 0,0334; 0,0327; 0,0329; 0,0332; 0,0328; 0,0325. Среднее значение
k = 0,0329 л-моль-1-с-1.
6. Константа скорости реакции омыления этилацетата едким на-
тром при 283 К равна 2,38, если концентрацию выражать в моль/л,
а время — в минутах. Вычислите время, необходимое для омыления
50 % этилацетата, если смешать при 289 К: 1 м3 0,05 н. раствора эти-
лового эфира уксусной кислоты с 1) 1 м3 0,05 н. NaOH; 2) с 1 м3
0,1 н. NaOH; 3) с 1 м3 0,04 н. NaOH. Реакция — второго порядка.
Решение. Концентрации эфира и щелочи равны, поэтому ис-
пользуем уравнение (XXI.20):
1 X
kc0A.! (со, а,~л)
Так как объем смеси равен 2 м3, то сд, = 0,025 г-экв/л, а х = 0,0125
г-экв/л. Подставив эти величины и k в выражение для t, получим
1 0,0125 1 0,0125
/. =----------------------------------- -----------=16,8 мин.
1 2,38 0,025 (0,025 — 0,0125 ) 2,38 0,025-0,0125
Концентрация эфира не равна концентрации щелочи, т. е. реаги-
рующие вещества взяты не в эквивалентных количествах, поэтому
воспользуемся соотношением (XXI.26):
*2 с0,А1—с0, А, (с0, Аг — Х) с0, At
Обозначив через со.а, начальную концентрацию эфира, а через
Со,д2 — начальную концентрацию щелочи, получим со.а, = 0,025
г-экв/л, со,а2 = 0,05 г-экв/л, х = 0,0125 г-экв/л. Подставив эти дан-
ные в выражение, полученное для t, находим
2,38 0,025 — 0,05 Б (0,05—0,0125) 0,025
12 Зак. 767
353
Концентрация эфира со,а, = 0,025 г-экв/л, х = 0,0125 г-экв/л,
а концентрация щелочи со.а, — 0,02 г-экв/л, тогда
2,3 1 , (0,025 — 0,0125) 0,02
/ ——---------------lg —1—I-----l----i—.----= 24 2 мин
• 2,38 0,025 — 0,02 6 (0,02 - 0,0125) 0,025
7. Для химической реакции А -► В константа скорости k ~ 0,5,
исходная концентрация со.а — 1 моль/л. Вычислите степень превра-
щения вещества А за время t = 1 ч, если реакция идет по нулевому,
первому, второму порядку. Как зависит степень превращения от по-
рядка реакции?
Решение. Для реакции, протекающей по нулевому порядку,
согласно уравнению (XXI.7)
1а
1,5=-----; а = 0,5.
Для реакции, протекающей по первому порядку, согласно уравнению
(XXI.14)
2,3 1 0.5
0,5=——1g-——; ——= — lg (1— а); а=0,39.
1 1 а z, <5
Для реакции, протекающей по второму порядку, согласно урав-
нению (XXI. 20)
Чем выше порядок, тем меньше степень превращения, тем медленнее
идет реакция.
8. Раствор уксусноэтилового эфира при cOii= 0,01 г-экв/л 293 К
омыляется 0,002 г-экв/л (с0,2) раствором едкого натра за tx — 23 мин
на 10 %. За какое время (tlt t2 и т. д.) тот же раствор эфира омыляет-
ся на 10 % растворами NaOH концентрации с0,3 = 0,004, с0 4 = 0,006,
св>5 = 0,008 и сОв — ОД г-экв/л?
Решение. Обозначив а = сод, b = с0 2, х = 0,1сод и восполь-
зовавшись уравнением (XXI.26), получим
2,3
1 2,3 , (свд—0,1с011)с012
— |g ,
t (co,i—со.а) (Со,а—0>1со,1)со,1
(0,01-0,1-0,001) 0,002
---1 а 2—!----!---!----—-----= 3 10
Подставляя в уравнение для k его значение, а вместо с0,а значения
с0,3. £о,4. с0,5, и сол, вычисляем t2, ts, и ts:
_______2,3_______ (0,01—0,1-0,01) 0,004
t3 (0,01 —0,04) lg (0,004- 0,1-0,01)0,01 ’
(a = 9,5 мин и t. д.
354
9. Кинетику реакции взаимодействия тиосульфита с м-пропил-
бромидом 52Оз~ + RBr->- RSSOT + Вг- изучали при 310,5 К. Кон-
центрацию иона 52Оз~ определяли через различные интервалы вре-
мени t титрованием. Для титрования использовали V мл 0,02572 н.
раствора 12 на одну порцию (10,02 мл) реакционной смеси. Начальная
концентрация тиосульфата, присутствующего в избытке, составляла
0,100 моль/л. Получены следующие данные:
/, с ..........1110 2010 3192 5052 7380 11232 78840
И, мл .........35,20 33,63 31,00 29,86 28,04 26,01 22,24
Вычислите константу скорости реакции второго порядка.
Решение. Для реакции второго порядка
2’3 , С0.А, (с0,А,-Л)
1g '
1 (с0. А,-с0, А,)----с0, А, (с0, Аг— х)
где со,а, — концентрация при t = 0;
И0,02572 37,62-0,02572 п „
сп л =-------------------------------= 0,0967 моль/л.
0>А> V 10,02
Ssoi
К моменту времени t = 0 некоторое количество S2O3_ уже было из-
расходовано, так что концентрация 52Оз- станет меньше исходной
концентрации (0,100 моль/л). Рассчитаем начальную концентрацию
м-С3Н7Вг, приняв, что при t = 78 840 с достигнуто равновесие:
Общее количество S2O|_, израсходованное на н-С3Н7Вг
с0.А,= K,rHRr ’ “
W * П j Х5Г
(37,63—22,24) 0,02572
=------------------------= 0,0395 моль/л.
10,02
Рассчитаем концентрацию реагентов в момент времени t= 1110 с:
Количество S2O3~, израсходованное на н-С3Н7Вг
(со. As~x) = ~ V г н Вг
(35,20 — 22,24) 0,02572 12,96-0,02572
~ моль/л;
, , Количество иода, израсходованное на S2O^_
(со,А,-Л)= у
S,o£"
35,20-0,02572
-------io^-------моль/л>
(со.а, — х) — концентрация м-С3Н7Вг в момент времени (; (со.а,— х) —
концентрация 520з“ в момент времени t. Тогда
с0. А, (с0, At~X) _
А, (с0.А,~а)
0,0395 (35,20-0,02572)/10,02 __ 0,0395-35,20
0,0967 (12,96-0,02572)/10,02 ~ 0,0967-10,96
12*
355
Разность начальных концентраций реагентов будет
со.А,—со,Аг =0,0967—0,0395 = 0,0572 моль/л.
Отсюда константа скорости реакции будет
fe = 0,0363 1g 1,110 = 0,0363-0,0453 = 0,001644;
^ = 0,001644; 62 = 0,001644; 63 = 0,001649, 64 = 0,001536;
65 = 0,001618; fee = 0,001618.
Среднее значение k = 0,001635 л-моль-1-с'1.
10. Пероксид водорода в водном растворе разлагается по уравне-
нию 2Н2О2 2Н2О + О2. Кинетику этой реакции исследовали ти-
трованием проб одинакового объема перманганатом калия. Определи-
те порядок реакции всеми возможными способами и вычислите сред-
нее значение константы скорости этой реакции, пользуясь приведен-
ными данными:
Время от начала опыта, мин 0 5 10 25 20 30 40
Объем 0,0015 М КМпСЦ, израс-
ходованный на титрование
2-10-в м3 пробы, см3 . . . .23,6 18,1 14,8 12,1 9,4 5,8 3,7
Решение. Определяем порядок реакции и вычисляем констан-
ту скорости интегральным графическим методом, предположив, что
здесь возможен первый или второй порядок. Объем раствора перман-
ганата, израсходованный на титрование, прямо пропорционален кон-
центрации-пероксида водорода снго2 ~ Ккмпо4- Данные для построе-
ния графиков:
t, мин ... 0 5 10 15 20 30 40
V, см3 . . . 23,6 18,1 14,8 12,1 9,4 5,8 3,7
(1/Ю-Ю2 . . . . . . . 4,3 5,5 6,7 8,3 10,6 17,0 27,0
ig(Fo/F)-10 . . . 1,15 2,03 2,90 3,99 6,09 8,05
На рис. 42, а представлены зависимости (1/V) — f (0 (кривая 2)
и 1g (Уо/У) = f (0 (кривая /). То, что lg (Vo/V) — f (Ь выражается
прямой, дает основание заключить, что исследуемые реакции — пер-
вого порядка.
Константу скорости вычисляем по уравнению k = 2,303 tg а =
= 1-2,3/50 = 0,046 мин-1. Дополнительно подтверждаем результат,
найдя производную dVl&t на графике (рис. 42, б) V = f (t) и вычислив
константу скорости по уравнению (XXI. 1) dV/d/ — kV. Для t =
— 20 мин объем перманганата калия составляет V = 9,4 см3. По ки-
нетической кривой для этого объема находим производную:
dV 0,439
----- =tga = 0,439, отсюда k=-------= 4,64-10-! мин-1.
d/ 9,4
356
Рис. 42. Зависимость количества перманганата калия, израсхо-
дованного на титрование, от времени реакции
11. Для изучения разложения щавелевой кислоты в концентри-
рованной серной кислоте при 323 К приготовили 1/40 М раствор ща-
велевой кислоты в 99,5%-ной серной кислоте. Через определенные
промежутки времени t из смеси отбирали пробы и определяли объем
раствора перманганата калия V, необходимый для титрования 10 мл
Н2С2О4. Получены следующие данные:
t, мин.......... 0 120 240 420 600 900 1440
К мл............11,45 9,63 8,11 6,22 4,79 2,97 1,44
Определите порядок реакции и константу скорости.
Решение. Предположим, что реакция имеет первый порядок:
. 1 , с<>
k =— In----;
t с
kt = O,00144; =-0,00144; % = 0,00145; fe4 = 0,00145; % = 0,00150; ^ = 0,00140.
Среднее значение: 0,00145 мин-1.
12. Для изучения взаимодействия между ионами Вг- и СЮ-:
СЮ- + Вг~ВгО-+ С1~ при 298 К смешивали 100 мл 0,1 н.
NaClO, 48 мл 0,5 н. NaOH и 21 мл дистиллированной воды. К сме-
си добавляли 81 мл 1 %-ного раствора бромида калия. Через опреде-
ленные промежутки времени t отбирали пробы и определяли в них со-
держание иона ВгО-. Результаты анализов:
t, мин............... 0 3,56 7,65 15,05 26,00 47,60 90,60
Концентрация
ВгО--10~в, моль/л . . 0 0,0560 0,0953 0,1420 0,1800 0,2117 0,2360
Концентрации NaClO и КВг в реакционной смеси при t ~ 0 были рав-
ны 0,003230 и 0,002508 моль/л соответственно, pH раствора 11,28.
Определите порядок реакции и константу скорости.
357
Решение. Предположим, что реакция имеет второй порядок:
, 2,3 . со,д, (со. А,~~х)
Л =------------------1g---------------—;
Z (с0,А,— с0, Аг) с0, А, (С0,А,~
с0 Д1 = [NaClO]0= 0,003230; cQ = [КВг]о = О,003230;
с0. А! со. А, —0,000722;
3,56-7,22-Ю"4
2,508-10~3 (0,003230 — 0,000560)
3,230- Ю-з (0,002508 — 0,000560)
= 23,42 л-моль-1-мин-1;
fex = 23,42; fe2=23,30; fe3 = 23,52; *„ = 23,90; fe5 = 23,80; fee = 23,80.
Среднее значение 23,62 л-моль-1-мин-1. Как показывает вычисление
констант k, реакция имеет второй порядок.
13. Для изучения кинетики реакции
Н2с—CHj
+ н2о
н2с—сн2
НО он
готовили раствор с исходными концентрациями 0,007574 моль/г хлор-
ной кислоты и 0,12 моль/л окиси этилена. Ход реакции контролиро-
вали дилатометрически (измерение объема раствора как функция вре-
мени). При 293 К получены следующие данные:
t, мии......... 0 30 60 135 300 сю
Показания дилато-
метра .... 18,48 18,05 17,62 16,71 15,22 12,29
Определите порядок реакции по этилену и константу скорости реакции.
Решение. Предположим, что реакция имеет первый порядок:
с0 >А1 = 18,48—12,29 = 6,19;
сп . —х= 18,05—12,29 = 5,76;
и, А1 ’ ’
2,3 с0 А 2,3 6,19
—1g-------—----= —— Ig _ — = 2,40- Ю-з мин-1.
t Сд А —х 30 5,76
fe1 = 2,40; fea = 2,46; fe3 = 2,49; fe4 = 2,49.
Среднее значение 2,46-10-3 мин-1. Отсюда следует, что реакция имеет
первый порядок.
14. При взаимодействии брома и этилового спирта были получены
следующие данные:
t, мии.........................0 4
Ci, моль/л..................... 0,00814 0,00610
с2, моль/л..................... 0,00424 0,00314
Определите порядок реакции.
358
Решение. Определяем порядок реакции согласно уравнению
п _ Ig (A ct/A/) — 1g (Д са/А г)
~ IgCl—lgc8
Подставляем необходимые данные. Так как Ас/\t = w — средняя ско-
рость реакции, то и концентрации сг и сг также необходимо взять
средние:
0,00814 + 0,00610
с, = —----’--------=0,00712;
0,00424+0,00314
= —2-----1—2-------= 0 00369;
2 2
0,00814 — 0,00610 0,00424— 0,00314
Ig -------------_|g------------------
п = Ig0,00712-lg0,00369 = 0,964 « 1.
Следовательно, изучаемая реакция первого порядка.
15. Вычислите порядок реакции для стадии, определяющей ско-
рость пиролиза диборана В2Нв (г) при 373 К из следующих данных по
скорости увеличения давления в системе как функции концентрации
диборана:
св,н,-1ог> моль-л........ 2,153 0,433
Скорость увеличения давле-
ния- 104, моль/(л-ч) .... 7,4 0,73
Решение. Запишем для реакции n-го порядка
de / d с \
----—=kcn\ 1g---------—- =lgfe + nlgc.
dr \ d t /
Откуда
n Ig ( —d c/d/)x —Ig ( —dc/dZ)2
Igci —lgc2
Скорость увеличения давления пропорциональна dc/df Тогда
lg7,4-lg0,73 , .. 3
п =----------------— 1,44 aj--.
Ig2,153 — lg0,433 2
16. При 298 К взаимодействуют эквивалентные количества иода и
натриевой соли фенилпропиловой кислоты CeH5C ва CCOONa по урав-
нению
C,HsC = COONa + Ia —+ C,HeIC = ClCOONa
За ходом реакции следили по убыванию концентрации иода, оттитро-
вывая его периодически раствором гипосульфита натрия.
359
Были проведены два опыта и получены следующие результаты:
Опыт 1
Время, с..................... О 29
Объем Na2S2O3, израсходован-
ный на титрование 250 см3
пробы, см3 ................ 24,96 8,32
Опыт 2
0 34,5
21,00 7,00
Определите порядок реакции и константу скорости реакции.
Решение. Поскольку реакция протекала между эквивалент-
ными количествами исходных веществ и к концу обоих опытов концен-
трация иода уменьшилась ровно в 3 раза, порядок этой реакции можно
определить по методу Оствальда—Нойеса:
_ 1g (г2^1) । .
п~ ‘g + •
Подставляя в это уравнение числовые значения, получаем
1g (34,5/29) 0,0754
" “lg(24,96/21,00)+1= 0,0751
Таким образом, реакция между иодом и натриевой солью фенил-
пропиловой кислоты — реакция второго порядка. Рассчитываем кон-
станту скорости этой реакции по уравнению (XXI.20). Для первого
опыта
2.
V-—
29
Для второго опыта
16,64
-----:-----= 2,756 • 10-3.
24,96-8,32
k2 —------
2 34,5
14
------------= 2,761.10'».
21-00-7,00
подтверждают порядок реакции, так как
Полученные результаты
совпадение значений констант полное.
ЗАДАЧИ
1. Концентрация атомов трития в воздухе приблизительно
5-10-15 моль/л. Период полураспада трития около 12 лет. Через сколь-
ко лет распадается 90 % трития, содержащегося в воздухе? Пополне-
ние содержания трития в воздухе за счет реакций синтеза не учитывать.
2. Раствор (20 %-ный) тростникового сахара, имевший правое вра-
щение 34,50°, инвертируется в 0,5 н. молочной кислоте при 298 К-
Вращение раствора по истечении 1435 мин достигает +31,10°, после
11 360 мин оно составляет +13,98° и, наконец, после полной инвер-
сии равно —10,77°. Раствор тростникового сахара вращает плоскость
поляризации вправо, а смесь продуктов инверсии влево. Угол враще-
ния в обоих случаях пропорционален концентрации растворенных
веществ. Реакция протекает по уравнению первого порядка, вычисли-
360
те константу скорости инверсии и определите, сколько времени по-
требуется, чтобы инверсии подвергалось 90 % сахара.
3. Пероксид водорода в водном растворе разлагается по уравне-
нию 2Н2О2 2Н2О + О2. Кинетику этой реакции исследовали ти-
трованием проб одинакового объема перманганатом калия. Определи-
те порядок реакции всеми возможными способами и вычислите сред-
нее значение константы скорости этой реакции, пользуясь приведен-
ными данными:
Время от начала опыта, мни 0 5 10 15 20 30 40
Объем 0,0015 М КМпО4, из-
расходованный на титрова-
ние 2 см3 пробы, см3 . . . 23,6 18,1 14,8 12,1 9,4 5,8 3,7
4. При нагревании раствор дибромянтарной кислоты распадается
на броммалеиновую кислоту и НВг по уравнению
СООН —СНВг—СНВг—СООН —> СООНСН—СВгСООН + НВг
При титровании раствора стандартным раствором щелочи через t
мин титр ее в объеме раствора изменялся следующим образом:
t, мии........ О 214 380
Нц, см3 ... . 12,11 12,44 12,68
Вычислите константу скорости реакции. Через сколько времени раз-
ложится 1/3 дибромянтарной кислоты?
5. Определите порядок реакции А (г) -> В (г) -j- С (г) + D (г) по
изменению давления в ходе реакции. Вычислите среднее значение
константы скорости реакции (V = const, 298 К), если
t, мии........ 0 6,5 13,0 19,9
Р Ю"3, Па . . . 41,6 54,5 63,7 74,2
6. Бимолекулярная реакция, для которой сА = Св. протекает за
10 мин на 25 %. Сколько потребуется времени, чтобы реакция прошла
на 50 % при той же температуре
7. Константа скорости рекомбинации ионов Н+ и ФГ~ (фенил-
гликси пат) в молекуле НФГ при 298,2 К равная = 1011,68 с-1-моль-1-л.
Рассчитайте время, в течение которого реакция прошла на 99,999 %,
если концентрации ионов Н+ = ФГ~ = 0,001 моль/л.
8. Скорость окисления бутилового спирта хлорноватистой кисло-
той не зависит от концентрации окисляемого вещества и пропорцио-
нальна концентрации НС1О во второй степени. Вычислите время, в те-
чение которого реакция окисления бутилового спирта хлорноватистой
кислотой пройдет на 90 % в растворе, содержащем 0,1 моль/л НС1О
и 1 моль/л спирта при 298,2 К. Константа скорости реакции при 298,2 К
равна 24 мин-1-моль-л-1.
9. Константа скорости реакции
CH8COOC2H5 + NaOH —> CH3COONa 4- С2Н5ОН
361
равна 5,4 мин_1-моль-1-л. Вычислите количество (%) эфира, которое
прореагирует за 10 мин: 1) если исходные концентрации щелочи и
эфира 0,02 моль/л; 2) если концентрация щелочи 0,02 моль/л, а эфира
0,01 моль/л.
10. При определенной температуре 0,01 н. раствор уксусно-этило-
вого эфира омыляется 0,002 н. раствором NaOH за 23 мин на 10 %. Че-
рез сколько минут он будет омылен до такой же степени 0,005 н. раст-
вором NaOH, если реакция омыления эфира — реакция второго по-
рядка, а щелочи диссоциированы полностью?
11. Рассчитайте константу скорости 1см®/(моль-с); л/(моль-с) и
л/(моль-мин)], если скорость реакции второго порядка 4,5-10~7
моль/(см’-с) при концентрации одного реагента 1,5-10~2 моль/л и
другого 2,5-10~3 моль/л.
12. Скорость реакции распада (А-► продукт) подчиняется урав-
нению второго порядка —d [A] dt = k [А]2. При изучении изменения
концентрации во времени получены следующие результаты:
t (±1 с), с . . . 0 200 400 600 800
А (±1%), мг/см» 16,4 15,0 13,4 12,8 11,5
Для каждой пары точек рассчитайте константу скорости реакции вто-
рого порядка и оцените точность каждого определения. Какие из ве-
личин определены с наименьшей и какие с наибольшей точностью?
13. В результате реакции формальдегида с пероксидом водорода
образуется муравьиная кислота (реакция второго порядка): ЯСНО 4~
+ Н2О2 = HCOOH + Н2О. Если смешать равные объемы молярных
растворов Н2О2 и НСНО, то через 2 ч при 333,2 К концентрация му-
равьиной кислоты становится равной 0,215 моль/л. Вычислите констан-
ту скорости реакции и определите, через сколько времени прореаги-
рует 90 % исходных веществ. Сколько времени потребуется, чтобы
реакция дошла до той же глубины, если исходные растворы Н2О2 и
НСНО разбавить в 10 раз, а затем смешать.
14. Реакция димеризации бутадиена в газовой фазе — реакция вто-
рого порядка по бутадиену. Кинетика этого процесса может быть изу-
чена при помощи измерения в определенные моменты времени давления
реагирующей системы при постоянном объеме. При 599,2 К для реак-
ции димеризации бутадиена по уравнению
СН2—СН.-СН.
I I
I СН2
2НгС= НС—СН = СН2 —> CHS = C
сн2—сн8
были получены следующие данные:
t, мин........................... 0 3,25 6,12 10,08 14,30 20,78
Р Ю-3, Па................... 84,2 82,4 80,9 78,9 76,8 74,2
t, мии....................... 29,18 36,38 49,50 60,87 68,05
Р Ю-3, Па...................... 71,4 69,5 66,4 64,4 63,3
t, мии....................... 77,57 90,05 103,58 119,00 135,72
Р10-’, Па . . ‘........... 62,0 60,4 59,0 57,7 56,4
362
Графически и аналитически вычислите константу скорости.
15. Окисление FeCl2 при помощи КС1О3 в присутствии НС1 — ре-
акция третьего порядка. Если время выражать в минутах, а концентра-
ции — в моль/л, то константа скорости этой реакции равна приблизи-
тельно единице. Вычислите концентрацию FeCl2 через 1,5 ч после на-
чала реакции, если начальные концентрации всех реагирующих ве-
ществ равны 0,2 моль/л.
16. Вещество А смешано в равных количествах с веществами В
и С, с0 = 1 моль/л. По истечении 1000 с половина вещества А про-
реагировала. Определите количество вещества А, которое остается по
истечении 2000 с, если соответствующая реакция: 1) первого порядка;
2) второго порядка; 3) третьего порядка; 4) нулевого порядка. Ка-
кое количество вещества прореагирует за 1000 с во всех случаях, если
константа скорости реакции k — 1?
17. Фенилдиазохлорид разлагается по уравнению
C,HsNaGI=C,HsCI+Ng
При 323 К и начальной концентрации 10 г/л были получены следую-
щие результаты:
Время, мии ... 6 9 12 14 18 22 24 26 30 оо
Выделено N2, см’ 19,3 26,0 32,6 36,0 41,3 45,0 46,5 48,3 50,4 58,3
Обработайте приведенные данные дифференциальным и интеграль-
ным методами и определите порядок и константу скорости реакции.
18. Реакция разложения аммиака на горячей вольфрамовой прово-
локе протекает по стехиометрическому уравнению 2NH3 = N3 4 ЗНа.
Во время реакции в различные моменты времени давление повышалось
следующим образом:
Время, с................ 100 200 400 600 800 1000
Повышение давления, Па . . 1466,3 2945,9 5865,2 8837,8 11717,0 14663,0
Выразите эти результаты графически и определите по графику по-
рядок реакции. Если начальное давление равнялось 200 мм рт. ст.,
рассчитайте константу скорости (концентрации выразите через дав-
ление в Па) и укажите размерность константы скорости.
19. Исследовали кинетику каталитического распада аммиака на
простые вещества при 1373 К. Время, необходимое для разложения
половины всего количества аммиака (причем вначале азот и водород
отсутствуют), зависит от начального давления аммиака следующим об-
разом:
Ро, мм рт. ст. ...... 265 130 58
tt/t, мин............. 7,6 3,7 1,7
Определите порядок и константу скорости реакции.
363
20. Определите порядок реакции 2СО = СО2 + С при 583,2 К,
если давление за 30 мин уменьшилось с 1,049-16® до 0,924-106 Па, а
затем за тот же промежуток времени с 0,714-105 до 0,624-105 Па (V =
— const).
21. При взаимодействии эквивалентных количеств оксида углеро-
да (II) и хлора согласно уравнению СО + С12->-СОС12 при 300 К в
присутствии катализатора наблюдалось следующее уменьшение обще-
го давления системы:
t, мии......... 0 5 10 15 21
Р-10-5, Па . . . 0,965 0,900 0,829 0,779 0,735
Определите порядок реакции (V = const).
22. Определите порядок для реакции конверсии пара-водорода
в орто-водород при 923 К, пользуясь зависимостью между временем
полупревращения и давлением. Давление Р и время полупревращения
пара-водорода в орто-водород при 923 К следующие:
Р-10-5, Па . . . 0,067 0,133 0,267 0,533
6/г. с......... 648 450 318 222
23. Определите порядок реакции разложения окиси этилена
СТ г-СН2 (г) = СН4 (г) + СО (г)
Х)/
и вычислите константу скорости (V = const), если при 687,7 К общее
давление реакционной смеси изменяется со временем следующим
образом:
t, мни......... 0 4 7 9 12 18
Р-10-6, Па . . . 0,155 0,163 0,168 0,172 0,178 0,188
24. Скорость инверсии тростникового сахара в присутствии соля-
ной кислоты изменялась следующим образом:
Времи, с . . . . 0 1035 3113 4857 9231 12834 18520 26320
а, град .... 11,20 10,35 8,87 7,64 5,19 3,61 1,60 —0,16
Время, с . . . . 32640 76969
а, град .... —1,10 —3,26 —3,37
Определите порядок реакции и константу скорости.
25. При 583,2 К AsH3 (г) разлагается с образованием твердого
мышьяка и газообразного водорода. Во время реакции давление из-
менялось следующим образом (давление паров мышьяка во внимание
не принимается):
Г, ч........... 0 5,5 6,5 8
P-Ю"5, Па . . . 0,978 1,074 1,091 1,114
364
Определите порядок реакции разложения AsH3 (г) и вычислите
константу скорости (V = const).
26. Монохлоруксусная кислота при 298 К взаимодействует с во-
дой (вода в большом избытке):
CHgClCOOH + Н2О = СН2(ОН)СООН + НС1
За ходом реакции следили посредством отбора проб, которые оттит-
ровывали щелочью. Результаты титрования проб одинакового объема
раствором щелочи:
t, мин......... О 600 780 2070
У, см3 ........ 12,9 15,8 16,4 20,5
Определите порядок реакции, вычислите константу скорости и рас-
считайте, сколько времени после начала реакции необходимо, чтобы
все три кислоты присутствовали в эквивалентных количествах.
27. Реакция гидролиза метилуксусного эфира протекает по урав-
нению
СН3СООСН3 + Н2О = СЩСООН + СН3ОН
Кинетику этой реакции исследовали титрованием проб смеси одинако-
вого объема щелочью. Определите порядок реакции всеми возможными
способами и вычислите среднее значение константы скорости этой
реакции на основании следующих данных:
Время от начала опыта, мнн 0 30 60 90 120 150
Объем 0,05 и. щелочи, израс-
ходованный на титрование
2 см3 пробы, см»......... 12,70 13,81 16,73 15,52 16,80 20,22
28. Восстановление оксида азота (II) водородом протекает при
298 К по стехиометрическому уравнению
2NO + 2H3 —► N24-2H2O
Если исходные газы взяты в эквивалентных количествах при
0,454-106 Па, то давление их уменьшилось вдвое в течение 102 с, если
же начальное давление было 0,384-106 Па, то оно уменьшилось вдвое
по истечении 140 с. Определите порядок реакции (К = const), поль-
зуясь зависимостью между временем расхода половины исходного ве-
щества и начальной концентрацией.
29. Реакция омыления метилуксусного эфира щелочью при 298 К
протекает по уравнению
СН3СООСН3 + NaOH = CH3COONa + СН3ОН
Для этой реакции при 298 К получены следующие результаты:
t, мин .................................
CNaOH- Г-ЭКВ/Л..........................
t , МИИ.................................
cNaOH- Г-ЭКВ/Л..........................
3 5 7
0,00740 0,00634 0,00550
10 15 25
0,00464 0,00363 0,00254
365
Исходные концентрации щелочи и эфира одинаковы и равны
0,01 г-экв/л. Определите порядок реакции омыления эфира и усред-
ненную константу скорости.
30. Реакция омыления этилуксусного эфира щелочью при 298 К
протекает по уравнению
CH3COOC2Hs + NaOH = CH3COONa + C2HsOH
Кинетику этой реакции исследовали титрованием проб смеси одинако-
вого объема кислотой. Определите порядок реакции всеми возможны-
ми способами и вычислите среднее значение константы скорости этой
реакции на основании следующих данных:
t, мии........................ 0 4,9 10,4 28,2 оо
Объем 0,01 и. НС1, израсходо-
ванный на титрование 0,1 см3
смеси, см3 ................ 61,95 50,59 42,40 29,35 14,9
31. В некоторой реакции при изменении начальной концентрации
от 0,502 до 1,007 моль/л период полураспада уменьшается от 51 до
26 с. Вычислите порядок этой реакции и константу скорости.
32. Реакция разложения пентаоксида азота протекает по уравнению
N2O5 -> 0,5О2 + N2O4. Кинетику этого процесса изучали при помощи
измерения в определенные моменты времени давления реагирующей
системы при постоянном объеме. При 328,1 К для этой реакции были
получены следующие данные:
t, мии......................3 4 5 6 7 8 9 10
Увеличение давления-1 О*3, Па 8,7 12,7 15,5 18,1 20,1 22,4 24,4 26,3
t, мии.................... 12 14 16 18 22 26 30 38
Увеличение давления-10-3, Па 29,1 31,4 33,6 35,5 38,5 39,9 41,2 42,6
Вычислите порядок этой реакции, среднее значение константы ско
рости реакции и период полураспада.
33. Константа скорости реакции, имеющей порядок 3/2 при 303 К,
равна 3,0-10~5 л'/г-моль~,/! -с-т. Определите константу скорости:
а) в (см3)’/*• моль’/' • мин-1 и б) в (см3)'/' • молекула'/' • с-1. Рассчитай-
те начальную скорость расходования и время полураспада в се-
кундах для начальной концентрации вещества с0 = 0,042 моль/л.
Определите время, за которое концентрация реагирующего вещества
достигает 0,002 моль/л.
34. Реакция разложения некоторого газа подчиняется уравнению
порядка 3/2; в начале опыта концентрация реагента была 5,2-10-4
моль/л. Если 55 % его прореагирует за 50 мин, то какова будет раз-
мерность константы скорости?
МНОГОВАРИАНТНАЯ ЗАДАЧА
Определите порядок и константу скорости реакции, протекающей
при заданной температуре Т, К, пользуясь данными о ходе процесса
во времени t (с начала реакции).
366
№ вари» вита Реакция Время, мин Результат контроля за ходом реакции т, к
1 2NCI3(»)—»-N24-ЗС12 а—объем N2-10~e, м8; С12 поглощается 4 6 32 00 а 10 13 26 28,5 298,2
2 2HgCl2 + HCOONa—->Hg2CI2 4- NaCl + HCl -f- CO2 a — концентрация HgjClj, моль/л; b — концентрация HCOONa, моль/л 0 3 0 3 0 1 0 2,2 а b 0,1034 0,1734 0,0679 — 0,0503 0,1734 0,0316 0,1028 1,0227 0 9579 0,1028 О’,3790 — 0,3279 298,2
3 C,H6C == CCOONa + 12 —> —+C5H»lC = ClCOONa Исходные концентрации эквивалент- ны: а—объем 0,1 я. Na2S2Os, израсходо- ванный на титрование 25-10~7 м3 пробы, см3 0 29 0 34,5 24,29 8,32 21,00 7 298,2
4 Ru—>RaA а — объем газа Ra • 10“’, м3 0 70 НО 140 165 200 250 360 450 600 750 0,102 0,062 0,044 0,033 0,025 0,019 0,016 0,007 0,003 0,002 0,000 293,2
5 2С2Н6ОНЦ- 2Вг2—-> —>СНВСООС2Н5 + 4НВг Спирт в большом избытке а — концентрация брома-10s, моль/л 0 4 6 10 15 0 4 10 15 4,24 3,14 2,49 2,24 1,78 8.14 6,10 4,45 3,73 298,2
6 2 Н2О2 О2-f-2 НгО В водном растворе; а — объем КМпО«, израсходованный на титрование пробы-Ю-8, м8 0 11,5 27,1 42,6 23,89 19,30 14,50 10,95 303,2,
7 КДО.+2К1—>2K,SO4+I2 а — объем 0,01 н. Na2S20s, израсходованный на титро- вание 25-10-8 м3 пробы, см8 9 16 52 оо а .4,52 7,80 14,19 20,05 298,2
367
Продолжение табл.
Хе вари * анта Реакция Время, мин Результат контроля за ходом реакции Т, к
8 9 10 11 12 13 Раствор N2OS в СС1< разлагается с выделением Ог; а — объем Од, см3 Н2Ог в присутствии коллоидальной платины разлагается с выделением О2; а — объем Ог, см3 СН8СООСгН5+ NaOH = = CH3COONa +С2Н5ОН а и b — начальные концентрации СН3СООС2Н5 и NaOH моль/л; х — убыль исходных веществ, моль/л CjgHggOgg4“ НдО — = С6Н1дО6+ С6Н12О6 с — концентрация сахара в данный момент, моль/л; с0 — начальная концентрация — 0,65 моль/л CH3COOC2HS+ NaOH = = CH3COONa-T-C2H5OH a = b начальные концентрации СН3СООС2Н5 и NaOH, моль/л; х — убыль исходных веществ, моль/л NgOs—>NgO1+1/2Og а — концентрация NgO5, моль/л 20 40 60 80 100 ос 10 30 00 0 178 273 531 866 1510 1918 2401 0 1435 4315 7070 1! 360 14 170 16 935 19815 29 925 0 300 900 1380 2100 3300 7200 0 184 319 526 867 1198 1877 2315 3144 11,4 19,9 23,9 27,2 29,5 34,75 3,3 8,1 15,6 а—х Ь—х 0,00980 0,00486 0,00892 0,00398 0,00864 0,00370 0,00792 0,00297 0,00724 0,00230 0,00646 0,00151 0,00603 0,00109 0,00574 0,00080 с0/с 1 1,081 1,266 1,464 1,830 2,117 2,466 2,857 4,962 а—х 0,0200 0,0128 0,00766 0,00540 0,00422 0,00289 0,00138 а 2,33 2,08 1,91 1,67 1,36 1,11 0,72 0,55 0,34 313,2 303,2 291,2 298,2 293,7 298,2
368
ГЛАВА XXII
СЛОЖНЫЕ РЕАКЦИИ
Основные уравнения и символы
[К., с. 637—643; Г., т. 2, с. 27—38]
В гл. XXI были рассмотрены только простые кинетические реак-
ции, в которых реагенты переходили непосредственно в продукты.
Однако чаще встречаются реакции, протекающие более чем в одну ста-
дию.
fe-i
Для мономолекулярных обратимых реакций типа В диффе-
fei
ренциальные формы кинетического уравнения:
-77- =*i (IAJ0—х) —*_! (IB]„+x), (XXII. 1)
• d t
d А
——- = — *i [A]-h*_i [В]. (XXII.2)
При равновесии = 0, и если при t = О [В] = 0, то
[В]равн ^1 д.
[А]равн ^-1
[В]равп= I А]о [А]рЯвн,
А равн—
fel + fe-1
IAJO>
(XXII.3)
(XXII.4)
(XXII.5)
где [А], [В] — текущие концентрации веществ А и В; [А]о — кон-
центрация А при t = 0; и ki k-y—константы скорости прямой и обрат-
ной реакций; [А]равн и [В]равн — концентрации А и В при равновесии;
К — константа равновесия.
Интегральные формы кинетического уравнения:
2,3 [ *i[AJ0-й-JBIq
t ^i([A]o х)—k _ j ([BJo + )
__ 2,3 j fellA]o fe_1 [B]o
t fe^A]- fe-JB] '
При условии, что в момент времени t = 0 [В]о = 0,
, . , 2,3 [А]о [А]равн
fel + fe-1 = — lg —7 •
Z [А] — [A]pSBH
Для мономолекулярных параллельных реакций типа
kt
АС
В(1)
С(2)
(XXII.6)
(XXII.6a)
(XXII.7)
369
дифференциальные формы кинетического уравнения
= + ([А]о—х), (XXII.8)
d t
--~'==^ + ^‘НА]. (ХХ11.9)
d t
Интегральные формы кинетического уравнения:
, (XX1I.10)
t [Ajo—x
(XX11.11)
где kt, k2 — константы скорости первой и второй реакций. Констан-
ты скоростей отдельных стадий для реакций данного типа определяют
по соотношению
Xi/x2 = *i/*2, (XXII. 12)
где xt и х2 — количества молей веществ В и С, образовавшихся к мо-
менту времени t, или приращение концентраций веществ В и С. Теку-
щая концентрация исходного вещества выражается формулой
[А] = [А]0—х.
Для мономолекулярных последовательных реакций типа
дифференциальные формы кинетического уравнения имеют вид
d л = й1([А]0-х), d t (XXII.13)
d (х ) ,, x)-Ag(x—у), d t (XXII. 14)
(XXII.15)
(XXII.16)
(XXII. 17)
Интегральные формы кинетического уравнения:
fA„l — z=[A]oe~ftl (XXII. 1.8)
•4* 1 •«Г 1 •«* 1 «AS о < II а. 1 X (XXII.19)
370
y = lA]of — 1 . \ e ~ky e (XXII.20)
\ «2—*1 K2—1
[A] =[A]0 e~kl *, (XXII.21)
rR1 / -&U o~k^\ /vvii
[Dj = —-----— e —e I, (XXI 1.22)
*2 — aj \ /
[C] = [A]O-[AJ-[BJ, (XXII.23)
где [А], [В], [C] — текущие концентрации веществ А, В, С; [А]о —
концентрация вещества А при t = 0; и k2 — константы скорости
первой и второй реакций: [А] = ([А]о — х); [В] = х — у, [С] = у.
Рис. 43. Зависимость концентра-
ции исходного вещества А, проме-
жуточного вещества В и конечно-
го вещества С от времени для по-
следовательной реакции первого
поридка
Точка максимум на кривой [В] = / (t) характеризуется уравнения-
ми (рис. 43): ('USL'j = о, (ХХ11.24) \ d f / max (XXII.25) I^lmax ^2 2,3 (Igfej—Ig fe2) Gnax= b b ’ (XX11.26) «1 — «2
где tmax — время, соответствующее максимальной концентрации ве-
щества В.
ЗАДАЧИ С РЕШЕНИЯМИ
1. у-Оксимасляная кислота при 293 К в водном растворе в при-
сутствии кислот (например, НС1) распадается с образованием лакто-
на и воды по уравнению
CH2 (OH)CH2CH2COOH^ztCH2CH2CH2CO+H2O
I----------------------О---1
Приготовлен 0,176 н. раствор у-оксимасляной кислоты. В начале опы-
та на 10 см3 кислоты при титровании с фенолфталеином израсходова-
но 18,23 см3 0,1 н. раствора Ва (ОН)2: через 21 мин после начала опы-
371
та на то же количество кислоты израсходовано 15,84 см3, а через
45 ч — 4,95 см3 "барита. Последняя величина остается постоянной и
при дальнейшем титровании. Через какое время после начала опы-
та на титрование кислоты будет израсходовано 6,67 см3 барита?
Решение. Обозначим через а начальную концентрацию кисло-
ты, а через а' — начальную концентрацию лактона и через х — ко-
личество лактона, образовавшегося за время t. Тогда
d X
.., =*i (a—x) — fe2 (а —х),
d t
где kx и k2 — константы скорости реакции;
(fejO—k2a')— (ki-[-k2) х
-------In [(feja—k2a')~- (fei + fe2) x] = /-]-const.
!l + «2
Для начального момента реакции t = 0 и х = 0, откуда
1
1 км—км'
(*1 + *2> =— И У. . (1)
Умножая числитель и знаменатель уравнения (1) на k2, переводя
натуральный логарифм в десятичный и заменяя кг/к2 константой рав-
новесия Лс, получим
^17^2 1 , Кса—
2,303 t lg (Кса—а') — {\+Ке.)х '
Величина + £2)/2,303 должна быть постоянной при данной темпе-
ратуре в течение реакции. Так как а' = 0, то -
+ = — 1g-----------------. (2)
2,303 t Ксо—(1 —Кс)х ' ’
Выразим начальную концентрацию кислоты а в см3 раствора барита.
Тогда а = 18,23 см3; количество образовавшегося лактона х за время
t = 21 мин, также выраженное в см3 раствора барита, составит
х = 18,23 — 15,84 = 2,39 см3.
Чтобы рассчитать , необходимо определить константу рав-
новесия Ке =----------лактона----. Концентрацию лактона опреде-
Су-оксимасляиой кислоты
ляем по разности между объемами раствора барита, израсходованны-
ми на титрование у-оксимасляной кислоты в начале реакции и по-
сле достижения равновесия. Концентрацию у-оксимасляной кислоты
372
определяем по объему раствора барита, израсходованному на титро-
вание того же количества раствора при достижении равновесия. Отсю-
да
(18,23—4,95) 13,38
.. 4,?5 -=-^ = 2’68'
Подставляя в уравнение (2) значения Кс, t, а и х, получаем
ki + k, 1 (2,68-18,23)
—=--------------]g--------1'----------------=0,0041.
2,303 21 2,68-18,23—(1+2,68) 2,39
Значения и Q в ходе реакции не меняются; величина х изме-
нится: х = 18,23 — 6,67 = 11,56, отсюда
1 , 2,68-18,23
/ =------— 1g--------------------------— = 217 мин.
0,0041 к 2,68-18,23—(1 4-2,68) 11,56
2. Реакция разложения изопропилового спирта протекает в при-
сутствии катализатора триоксида ванадия при 588 К по схеме
—%Н6О + Н2
С3Н7ОН---->с3нв + н2о
—►CgHg + О2
Концентрации веществ реакции, измеренные через 4,3 с после нача-
ла опыта, следующие (ммоль): сс,н,он = 27,4; сс3н,о = 7,5; сс,н, =
= 8,1; сс.н, = 1,7. Определите константу скорости каждой реакции,
если в начальный момент в системе присутствовал только С3Н7ОН.
Решение. Определим начальное количество С3Н7ОН:
[Ао] = с1 + с2 + с3 + с4 = 27,4 + 7,5 + 8,1 + 1,7 = 44,7 ммоль/л.
Вычислим сумму констант скоростей реакций:
d х _ d xt . d x2 । d xs
d / d / At At'
да— —k, ([A]o—х)+&3([А]0—x) — (й1 + &2 + &з) ([A]o—x),
1 IA1
(*1+*2 + йз) = ~~ *n “77^ 5 -
t [AJo—x
44,7
—— =0,115 c-1.
27,4
2,3
S £ = —— Ig
4,3 6
Определим константу скорости (с-1) каждой реакции:
d х. Xi ki
a t x2
-П7- = М[А10-х);
d i
d х, х,
—- =й2 ([А]о—х), —
d t х3
= S k—(й2 + й3);
Z:2
373
Xi = S *-(*2 + *8) 7,5 = 0,115—(*2-|~*8)
x2 *2 ’8,1 *2
0,935—8 1 k..
7,5*2 = 0,935—8,1*,—8,1*3; 15,6 *2 = 0,935—8,1 *8; *2 =—1: 2
15,6
Так как x2lx3 = k2lk3, то
8,1 _ 0,935—8,1*3
1,7 ~ 15,6*8
74,3*3 = 0,935—8,1*8; 82,4*8 = 0,935; *8= 1,135-10-2;
0,935-0,01135-8,1 0,935—0,092 0,843
* = :— = --------------=--------= 5,42- IO-2 c-1;
2 15,6 15,6 15,6
*i = 0,115 — 1,135-10-2—5,42-10-2 = 4,95-10-2 c-i.
3. Последовательная реакция первого порядка протекает по
схеме:
А Р -А- В
При 298 КЛ =0,1 ч-1; k2 — 0,05 ч-1; начальная концентрация исход-
ного вещества [А]о = 1 моль/л. Вычислите: 1) координаты максиму-
ма кривой [Р] = f (/); 2) время достижения концентрации [А]
0,001 моль/л, продолжительность /а реакции А->- Р; 3) концентра-
ции [Р] и [В] в момент окончания реакции А Р; 4) время, за которое
концентрация В станет 0,01 моль/л, продолжительность индукцион-
ного периода /инд; 5) координаты точки перегиба кривой [В] = f (/); 6)
точку пересечения кривых [А] = f (/) и [Р] = f (t).
На основании полученных данных постройте график [В] = f (/).
Решение. Рассчитаем время, которому будет соответствовать
максимальная концентрация промежуточного продукта:
In *2 —In *1 2,303—2,997
/тах =----2-----5- = —------!--= 13,6 ч.
та *2-*! -0,05
Обозначим концентрацию А при /тах через [А]тах. Тогда
|А]тах= [А]о е~k>‘ = е~°'1'13,6 = 0,259 моль/л,
максимальная концентрация промежуточного продукта будет
[Plmax = (*1/*2) Атах= (0,1 /0,05) 0,249 = 0,498 моль/л.
Примем [А]с = 0,001 моль/л; тогда 0,001 = [А]ое~*1<А;
0,001 = е“°’ИА; /А=69 ч.
Рассчитаем концентрацию Р при t = 69 ч:
[Р] =----—------- е-О,О5-69) = о 061 МОЛЬ/Л.
0,1—0,005 v
374
[В] = [А]0 1 +
Рассчитаем концентрацию продукта [В] через 69 ч:
(В] = [А]о — [Р] — [А] = 1 —0,061 —0,001 = 0,938 моль/л.
Вычислим время /инд, за которое устанавливается концентрация В,
равная 0,01 моль/л, по уравнению
—Ц— (й2 е~МиВД- е-Минд)1;
— ^2
[В]=1 — —----(о,О5е—°’1<иид — 0,1е"0’05'иид);
1 0,05
0,990-0,05 = 0,05е_0’ПчВД—0,1 е“°’05'иид. (1)
Уравнение (1) решаем относительно /инд методом подбора:
/иид- ч........... 1 2 2,5 3 4
[В], моль/л .... в,000 0,008 0,014 0,018 0,032
Принимаем /инд = 2 ч. Точку перегиба кривой [В] = f (t) находим,
используя условие — q. После дифференцирования и преобра-
зований уравнения
получим
[В]о = [А]о [ 1 + —-Ц— (й2 е^к' '- k, е~к‘ ')
для точки перегиба
. — ^‘п ь ~Ьг‘п „ „ -0,1/„ -0,05/п .
kr е п—k2e п = 0 или 2е п—е п = 0,
координата точки перегиба, которую находим методом под-
значений индукционных периодов /иид 5, 15, 10, 20 ч. Строим
(2)
где tB —
бора для
график зависимости % = /(/):
х = 2е-0,1 * —е~°’05*, откуда х = 0,00 при /=13,6 ч.
Концентрацию [В] в точке перегиба находим по уравнению (2):
[В] = 0,243 моль/л.
4. Установлено,
хлорбензальдегида:
что скорость реакции деформилирования 2,6-ди-
Н2О
+ НСОО"
не соответствует ожидаемому на основании стехиометрии уравнению
— = 1НРО~], но при меньшей концентрации ионов гидро-
ксила (по сравнению с [А]) выражается уравнением
d [А]
----7?- = * [Л] [НО-]».
d t
375
Несоответствие стехиометрического уравнения экспериментально оп-
ределенному порядку реакции свидетельствует о многоступенчатом
протекании реакции:
1) Ar—СНО4-НО-
(А)
о-
2) Ar—С—ОН + НО
I
н
(В)
о-
kx быстро |
: .. Аг—С —ОН
I
н
(В)
о-
кг медленно I
------------. Аг~ + НС-4-Н2О
О
(С)
3) Аг- + Н2О ка быстР\ АгН+НО-
Докажите, что скорость реакции определяет стадия 2. Выведите урав-
нения скорости реакции для случаев, когда самой медленной стадией
является стадия 1, 2 или 3.
Решение. 1) Если скорость реакции определяется стадией 2, то
оу = *2[В] [ОН-]
На основании условия равновесия находим [В]:
k, [А] [ОН-]
К [A] [OH-]==^-i [В]; ]В]=—-- Ч
тогда
МНАННО-р .ГД1ГНП_12
w =-----;-------= 6 [А] [НО р.
R-1
2) Если скорость реакции определяется стадией 1, то
w=ki [А] [ОН-]-*-! [В], но и w = k± [А] [ОН-].
3) Если скорость реакции определяется стадией 3, то
ш = £3[Аг-] [Н2О] и £з<&1<£2.
Из условий равновесия kx [А] [НО~] = k_x [В]. Методом стационар-
ной концентрации определяем [С]:
= [А][ОН-]-Л-1[В]-*2[В][ОН-] = 0; (а)
d [С]
d/
= [В] [ОН-]-k3 [С] 1Н2О] = 0.
(б)
376
Сложив уравнения (а) и (б), получаем:
k. [А]-[В]-k2 [В] [OH-J + MBJ [ОН-]—*з[С| [Н,О] = 0,
h [С] [Н2О1 = к [А] [ОН-] -fe-! [В],
fei [А] [ОН-] —[В]
МВД
(в)
МСПНО1 MMAHOH-l-^nBimO]
№ = ^[С] [Н2О]= -------
= *1 [А] [ОН-]—[В].
Заменив в уравнении (а) вещество В на А, получим
k, [А] [Он-] = ^ [В] + k2 [В] [он-];
«i-т «2 [ОН-]
k. [А] [ОН-] / k_i \
ш=МА1 [OH~] — fe_t—у- =fei [А] [ОН-1 1 - .
«14-«2[ОН ] \ ^4-^ [ОН-] /
5. Метанолизация диэтилацеталя является двухстадийным процес-
сом, в котором две этоксигруппы замещаются метоксигруппами со-
гласно уравнениям:
CH8CH(OEt)2 + MeOH CHsCH(OMe) (OEt)4-EtOH (I)
СН3СН(ОМе) (OEt)4-MeOH CH3CH(OMe)24-EtOH (II)
где Me и Et — метил- и этилгруппы.
Введем обозначения: СН3СН (Me) (OEt) — метилэтилацеталь
(Me—Et—Ac); CH 3CH(OEt)2 — диэтилацеталь; CH3CH(OMe)2 — ди-
метилацеталь.
Метилэтилацеталь в этой реакции является промежуточным продук-
том, соляная кислота служит катализатором. Хроматографическим
анализом установлено, что прямая и обратная реакции каждой стадии
имеют первый порядок по ацеталю и по кислоте и не зависят от концен-
трации спирта. Результаты анализа стадии 1 при Т = 298 К и кон-
центрации НС1 = 17,3-10-5 моль/л приведены ниже:
/, мин................ О 10 20 30 40 50 60 оо
h, см ............. 17,7 9,74 6,3 4,77 4,16 3,86 3,72 3,65
h — высота хроматографического пика, пропорциональная концен-
трации Du—Et—Ac.
Определите эффективную константу скорости этой реакции (ktЭф =
= К + k_r).
Эффективная константа скорости стадии 2 (&2.Эф) при тех же ус-
ловиях равна 1,07-10-2 мин-1. На основании этих данных рассчитай-
те максимальную концентрацию Me—Et—Ас и время ее достижения.
Исходное содержание вещества Du—Et—Ас в пробе 0,03 г.
377
Решение:
2,3 Хао
*1, эф — = ~~~ 1g ~~ ~
I Лоо —л *
2,3 t h#—hoo 2,3 , h0—Лоо
, lg < « « । « , lg i « »
t Лд-------Лоо---I rlf — Лоо
2,3 17,7—3,65 2,3 14,05 л
lg = 0,0835 мин-1;
9,74—3,65 10 6,09
2,3 17,7 — 3,65 2,3 14,05
1g lg = 0,0834 мин-1;
2’ эф 20 ё 6,3—3,65 20 2,65
2,3 14,05 2,3 14,05
1g Ig = 0,0843 мин-1;
з, эф 3(| 6 4,77 — 3,65 30 1,12
2,3 14,05 2,3 14,05 л _
1g 1 lg = 0,0829 мин-1;
«. »Ф 40 4,16—3,65 40 0,51
2,3 14,05 2,3 . 14,05 л
lg lg = 0,084 мии-1;
5, Эф зд 3,86-3,65 50 0,21
2,3 14,05 2,3 14,05 л
lg 1 ~ —1 1g =0,0824 мин-1;
••эф 60 3,75—3,65 60 0,16
0,08354-0,0834 + 0,0843 + 0,08294-0,084 + 0,0824 л Ллп
Л1, Эф. ср=----------------------£-----------------------= 0,0834 мин-1;
1П (Ъ/Ь) __ In0,128 = -2,0534
Ттах~ (1,07—8,34) 10-2 7,27-10-2 ’ МИН
(г 1 п г In г \
(__г е ' е /
7 0,1281П 0,128 In 0,128 \
= 0,03----!-----L 0-128-1 , е O.128-1J =
1—0,128 ' г
/ 0,2631328 2,0557251 \
= 0,03 —— (е -0.872 _е 0.872 ) =
0,872
= 0>03—L—(е-о.зо17б_е-2,3575) = о 03_£^L = 0 0222 г.
0,872 v 0,872
378
6. Гидролиз метилгалогенидов в водных щелочных растворах проте-
кает одновременно с водой по Мономолекул яр ному, а с ионами — по
бимолекулярному механизмам в соответствии со схемой:
СН8С1 + Н2О-^>СН8ОН + Н++С1-
(О— X)
СН8С1 + он- Д.снзон + С1"
(а —х) (Ь—X)
Напишите дифференциальное уравнение гидролиза метилхлорида.
Рассчитайте степень превращения СН8С1 через 65 мин от начала
реакции, а также количество СН3С1 (в % мольн. от исходного количе-
ства), претерпевшее превращение за счет взаимодействия с ОН". Для
решения используйте следующие экспериментальные данные:
Топ = 333,05 К; fei =2,16-10-»с-1; й2 = 4,88-10"* с'1 (моль/л)-1.
/, мии 0 2 30 65 109 214 1160 СЮ
(а—х)-Ю3, моль/л 35,3 35,1 32,0 29,4 25,5 18,9 2,1 0
(Ь—х)Ю3, моль/л 102,5 102,3 99,2 96,6 92,7 86,1 69,3 67,2
Решение:
d х
1) Ti =fti (“ —х)+*2 (а— х) (Ь—х);
d I
2) а = 35,3’-10-8 моль/л; а—х = 29,4-10~3;
35,3.10-3 — х=29,4-10-*; х = 35,3-10-»—29,4-10-8 = 5,9-10-3 моль/л.
Степень превращения СН3С1
х 5,9-10-з
— = —7----------=0,166, т. е. 16,6%.
а 35,3-Ю-з /0
3) Если бы имела место только первая реакция, то k2 = 0,
I 1 о
— -г In-----; а — х = ае~м;
t а—х’
35.3.10-8—х = 35,3-10-8е~2'16- 10 *-3900;
35,3-10-8—х = 35,3-10-8 е-8’424’10’3;
35,3-10-8—х = 35,3-10-8-0,9916;
Xi = 35,3-10-8— 3,5-10-8 = 0,3-10-8 = 3-IO-4 моль/л;
а—х = 35,3- IO-3 —0,3- 10~з = 35-10~3 моль/л.
Столько молей осталось бы непрореагировавшими через 65 мин, если
бы шла только первая реакция.
379
Из экспериментальных данных видно, что во второй реакции про-
реагировало х2 = 35-10“3 — 29,4-10-3 = 5,6-10-3 моль/л, или
5,6-10-»
---:------ 100 = 0,159,
35,3-Ю-3
т. е. во второй реакции реагирует 15,9 % от исходного количества,
а всего через 65 мин прореагирует 16,6 % вещества.
7. Равновесие реакции Н2О Н+ + ОН" релаксирует за 37 мкс
при 298 К. Найдите константы скорости прямой и обратной реакций.
Решение. Находим выражение для времени релаксации* т,
зная (прямая реакция первого порядка) и k_T (обратная реакция
второго порядка):
H2OjZ^ Н+ + ОН-
fe-l
Скорость изменения концентрации Н2О
- d [ВДе+Л!! [Н+]е[ОН-]е,
a t
где [Н2О]е, <Н+]е и ЮН-]е — концентрации Н2О, Н+ и ОН" при
равновесии. Если система находится в равновесии, то
d [Н,О]
- =0 И k{ [Н2О]е = ^11 [ННе [ОН-]е. (1)
d t
При изменении состояния системы (например, повышение температуры)
константы скоростей изменяются. Новые равновесные условия опреде-
ляются следующим образом:
МНгО^-ИН+ИОН-Ь. (2)
Обозначим отклонение [Н2О] от нового положения равновесия через
х, тогда
1Н2О]* = ^ + [Н2О]в.
При t = 0 (сразу же после изменения условий) [Н2О]0 = [Н2О]е,
следовательно, концентрация Н2О изменяется следующим образом:
d [H2O]/d / = dx/d t= —k-x (x< + [H2O]e)(—xt + [B]e) (— -|-[C]e).
Считая отклонение от равновесия очень малым, пренебрегаем xt и,
учитывая уравнение (2), получаем
d х
d i
* Время релаксации (т) — это время возвращения системы к состоянию рав-
новесия после смещения равновесия под действием некоторого внешнего воздей-
ствия (например, изменение температуры). Это время, в течение которого кон-
центрация изменяется в е раз.
380
Xf— х0 ехр
или после разделения переменных и интегрирования имеем:
__________t__________
й1 + ^1([Н+]е+[ОН-]е
или
Xi=xoexp( — -7), где —= + ([Н+]е+ [ОН~]е).
\ I / т
Константа равновесия реакции равна
К = [Н+1 1 = 1,0-10-1«/55,5= 1,8-10-1’.
HgO
При равновесии kr [Н2О1е = k_r [Н+]е [ОН"]е, и поэтому kr — k_xK.
(моль/дм3). Отсюда
1/т = й_1 (К + [Н+]е + [ОН-]е) = к_г (к+ V7^. + /GD = 2-10-’ fe_x.
Поэтому
*-!= 1/(37-10-’) 2-10-’= 1,4-Юн моль-i-дм3-с-1.
Из этого следует, что
Лх= 1,4-ЮН-1,8-10-1’ = 2,4-10-® с-i,
ЗАДАЧИ
1. Превращение роданида аммония NH«CNS в тиомочевину
(NH2)2CS — обратимая мономолекулярная реакция. Рассчитайте кон-
станту скорости прямой и обратной реакций при 425 К, используя сле-
дующие данные:
Г, мин . . 0 5 12 19 28 38 48 60 78 80 оо
(NH4) NCS,
%......... 2,0 3,8 6,2 6,1 8,2 10,4 12,3 13,5 14,5 21,2 21,2
При достижении состояния равновесия 21,2 % роданида аммония
превращается в тиомочевину.
2. При смешении раствор содержал 73,2 % этилового спирта,
0,677 моль НСООН и 0,0261 % НС1 (вода не учитывается). Для иссле-
дования кинетики реакции образования этилформиата прн 298 К от-
бирали в различное время пробы объемом 5 мл и оттитровывали
Ва(ОН)2. Результаты титрования:
t, мни ... 0 50 100 160 290 1 оо
V, мл . . . 43,52 40,40 37,75 35,10 31,09 24,28
Вычислите константы образования kx и разложения k_r этилфор-
миата в этом растворе и константу равновесия обратимой реакции К,
если концентрации воды, этанола и НС1 постоянны.
381
3. Образование этилового эфира муравьиной кислоты при 303 К
протекает по уравнению реакции первого порядка
О О
II II
НС + C2HeO^z*H2O + НС
I I
он о—С2Н5
Были получены следующие результаты:
t, МИН......... О 1700 10000 14000 20000 40000 .
Объем кислоты в
данный момент,
см3 .......... 29,44 28,59 24,77 23,05 21,28 16,80
Концентрацию кислоты определяли титрованием. Константа об-
ратной реакции k_r = 1,15-10-5 мин-1. Концентрация продукта пря-
мой реакции в начальный момент равна 0. Определите константу
прямой реакции.
4. При 300 К протекает реакция по уравнению
СН,—С=СН-СООС2Н5->СН3-С—СН2-СООС2Н5
I . II
ОН о
Получены следующие результаты:
t, мин Коэффициент пре- 0 4,25 6,50 9,17 12,0 14,17
ломления систе- мы 1,4450 1,4440 1,4430 1,4420 1,4410 1,4400
Еиольиая форма, % 88 84 80 76,3 72,5 69
t, мии 17,5 20,83 24,25 27,5 31,5 оо
Коэффициент пре- ломления систе- мы 1,4390 1,4380 1,4370 1,4370 1,4360 1,4230
Енольная форма, % 65 61 57 53 49 2
Покажите, что превращение енольной формы в кетонную представ-
ляет собой обратимую мономолекулярную реакцию. Вычислите кон-
станты скоростей прямой и обратной реакций.
н4с6н3с снэ
СНзСвЩ^СНзЬ + СН31 —— N—СНз
I сн3
5. Для реакции между метилиодидом и раствором диметилпарато-
луидина в интробензоле получены следующие данные:
t, мии , . . , , 10,2 26,5 36,0 78,0
х/с0 • 0,175 0,343 0,402 0,523
382
Константа равновесия реакции равна 69,8. Начальные концентрации
обоих реагентов равны 0,05 моль/л, продукт в процессе реакции отво-
дится. Определите кинетическое уравнение, описывающее кинетиче-
скую кривую, и рассчитайте константу скорости реакции.
6. Реакции
C,H4+HC1+HC1O-J
-ЛС1С,Н4ОН+НС1
->С,Н4С18+Н2о
й8
(1)
(2)
при температуре Т протекают параллельно. Этилен взят в избытке.
Вычислите константу скорости каждой реакции. Концентрации
(моль/л) исходных веществ в одном из опытов изменялись следующим
образом:
[НСЮ]М03, моль/л.........
[HClplO3, моль/л.........
начало опыта
8,675
0,612
конец опыта
3,695
0,532
7. Реакция термического крекинга нефти относится к консеку-
тивной реакции, причем бензин является промежуточным продуктом,
распадающимся на газообразные вещества. Определите максимальную
концентрацию бензина и время ее достижения при крекинге 1 т не-
фт'и, если при 673 К константа образования бензина — 0,283 ч-1,
а константа распада бензина k2 — 0,102 ч"1.
8. Покажите, что для реакций
А—*В; А—*С
время, за которое образуется половина количества В (по сравнению
с его количеством при t — оо), и время, за которое образуется полови-
на количества С, одинаковы, хотя константы и k2 имеют разные зна-
чения.
9. Алкилирование изопропилбензола н-бутилецом осуществляет-
ся в присутствии HF по уравнению
или
А-1-вЛ.В С+вЛ-D
383
где А — изопропилбензол; В — к-бутилен; С — изопропил-втор-бу-
тилен; D — конечный продукт. Соотношение скоростей образования
промежуточных конечных продуктов равно 1,665. Массовый состав
смеси к данному моменту (%): А 11,7; В 68,6. Определите отношение
fej и k2.
10. Определите периоды полураспада RaB(Pb*) и RaC(Bi*), свя-
занные генетическим рядом
(T'/2)i (т%)2
RaB-----*-RaC-----►RaC
если существует зависимость изменения концентрации радиоактивных
ядер RaB от времени:
Число ядер /VRaB 100 70 50 34 17 5 4 2,5
т, мии ........ 0 10 20 40 50 80 90 100
и время, при котором концентрации накопленных RaC, RaC' будут
максимальны, ттах = 35 мин. (Опыт проводили с чистыми ядрами
RaB).
11. Для последовательных реакций первого порядка
Ai=0,I5c-1 42=0'IcI
А---------В--------С
вычертите кривые зависимости концентраций А, В и С от времени.
12. Реакция 2А + В -> 2D протекает через образование промежу-
точного вещества С по механизму
А-ьвД; С+аЛ.20
Обе реакции смешанного второго порядка. Напишите уравнение для
вещества С как функции вещества В (выразите концентрацию веще-
ства С через концентрацию В), используя граничные условия с — 0
при t = 0 и уравнение для d[B]/d/, в которое должны войти концен-
трации [А]о, [В], [В]о и константы kr и k2.
13. Для реакции 2А + В -> D, протекающей по схемам 2А + В ->
-►С; С + A->D, рассчитайте стационарную концентрацию вещест-
ва С. Совпадает ли эта концентрация с максимальной концентрацией
вещества С? Рассчитайте массу вещества В, расходуемого в момент,
когда концентрация вещества С достигнет 95 % от стационарной, если
[А]о = [В]о, t = 0 и k2 = 25fev Сколько вещества D образуется к это-
му времени? Определите время, за которое будет получено 95 % ве-
щества С от стационарного, если [А]о = 0,02 моль/л и = 3,0 х
X 10-4 моль/с.
14. Составьте кинетические уравнения, если реакция протекает по
следующему механизму:
hi k,
А^±В; B+C—*D
кг
384
Покажите, что при высоких давлениях реакция может протекать
по первому порядку, а при низких давлениях — по второму порядку.
15. В герметический сосуд вместимостью 1 см3 заключен 1 г ра-
дия. Каково будет давление радона при О °C при наступлении веково-
го равновесия, если kx = 1,37-10-11 с-1, й2 = 2,Ы0'6 с-1.
16. Радон, распадаясь, превращается в RaA, который испыты-
вает а-распад. Рассчитайте время /тах, по истечении которого накопит-
ся максимальное количество RaA, если вначале был чистый радон.
Рассчитайте максимальное количество RaA (в граммах), если началь-
ное количество радона занимает при нормальных условиях объем
0,65 см3 и Tj/2 = 3,82 дня и т1/2 = 3,05 мин. Определите число атомов
радона и RaA через 5 ч.
17. Радиоизотоп 118Cd испытывает превращения по схеме
Ху =30 мин xt/=4,5 мин
118Cd-------1418 In--------118 Sn (стабилен)
Считая, что в начальный момент препарат содержал 0,1 г только пер-
вого радиоизотопа, определите: а) массу стабильного изотопа через
1 ч; б) во сколько раз уменьшится активность данного препарата че-
рез 1 ч.
18. Изотоп 134Sb испытывает ^-радиоактивные превращения по
схеме
tv—50 с ty—44 мин ty =54 мин
134 Sb----"1зз те------->134 j-------134 Хе (стабилен)
Определите относительное число ядер 134Те и 1341 через 1 ч, полагая,
что в начальный момент препарат содержал только первый изотоп.
19. Определите константы скоростей прямой и обратной реакций
/пранс-СНС1=СНС1^чис-СНС1=СНС1
при 573 К на основании данных о концентрации транс-СНС\ — СНС1
к моменту времени t:
t, с.............. 0 600 1080 оо
с, % ............ 95 82,88 75,24 41,89
20. Реакция изомеризации кислоты в транс-форму протекает через
образование промежуточного продукта С. За кинетикой реакции сле-
дили по изменению оптической плотности D раствора:
/•10-2, с.................. 0 5,88 11,58 20,88 38,88 91,50
D ........................ 0,126 0,128 0,133 0,142 0,172 0,230
/•IO-2, с................ 132,50 177,60 266,80 оо
D ........................ 0,263 0,300 0,340 0,421
Л1
21. Для обратимой реакции А 7-* В начальные концентрации
k-1
веществ А и В: [А]о — 1,33-104 Па и [В]о = 0. Через 10 мин после на-
чала реакции [А] = 5,3-103 Па и [В] = 8,0-103 Па. Определите [А]
через 20 и 40 мин после начала реакции, если = 3.
13 Зак, 767
385
22. В системе идут две параллельные реакции по уравнениям:
А+вЛс; вЛ-D
Исходные концентрации веществ А и В равны IА]о = [В]о =
= 1,33-104 Па. Ниже приведена зависимость давления от времени:
Время, с .... О 20 40 60 90 120
ДР, Па......... 0 213 427 640 960 1226
В момент времени, когда ДР = 5,2-103 Па, реакция была приостанов-
лена. При этом [В] = 3,7-103 Па. Определите kr и k2.
23. Гидрат лактозы в присутствии воды превращается в лактон со-
гласно уравнению
С12Н24О12=С12Н22Ои+Н2О
Зная зависимость угла вращения от времени
t, мин......... 0 15 60 120 180 240 300 оо
а, град . . . .8,98 8,77 8,23 7,67 7,18 6,63 6,58 5,65
покажите, что превращение гидрата лактозы в лактон в присутствии
избытка воды представляет собой обратимую мономолекулярную ре-
акцию.
24. Гидролиз метилгалогенидов в водных щелочных растворах
протекает одновременно с водой по мономолекулярному, а с ионами —
по бимолекулярному механизмам в соответствии со схемой:
ch3iC+h2oAch3oh+h++ci-
(«—х)
СН3 +ОН- Дсн3ОН+С1
(о—х) <*—х) . ..
Напишите кинетическое уравнение относительно t и рассчитайте вре-
мя полупревращения СН3С1 (в мин).
25. Получите уравнение для расчета степени превращения СН3Вг
и определите по нему долю молекул СН3Вг, прореагировавших по
истечении 900 мин от начала реакции. Полученный результат сравните
с экспериментальными данными.
При расчете используйте экспериментальные данные, полученные
при 297,62 К (^ = 3,21-10-’ с"1, k2 = 1,373-10~4 (моль/л)-4):
t, мин .............. 0 290 500 900 1400 2000 3000 о?
(а—х)-10-3, моль/л....... 57,2 48,4 38,5 29,0 21,1 15,2 8,9 0
(&—х)-10-з, моль/л....... 105,0 96,2 86,3 76,8 68,9 63,0 56,7 47,8
При расчете кинетики щелочного гидролиза СН3Вг используйте
выражение
1 — к1—кг (Ь—а) a ^2 1 п I, Л — 2 k\ —р ® J
386
где fex — константа скорости реакции взаимодействия с Н2О (реак-
ция 1-го порядка); k2 — константа скорости реакции взаимодействия
СН3Вг с 0Н~; b — исходная концентрация ОН”; а — исходная
концентрация СН3Вг.
26. Дифенилхлорметан взаимодействует с этиловым спиртом с об-
разованием хлороводородной кислоты и эфира по схеме:
Н Н
I I
(СвН4)2 С+С2Н6ОН^:НС1+(СвН6)2 C-O-C2HS
А
A+B^C+D
[А]о = 0,09966 моль; [В]о = 21 моль.
Проверьте предполагаемую схему реакции и определите константы
скоростей прямой и обратной реакций, используя следующие экспери-
ментальные данные:
t, мин.............. 13 119 142 162 182 212
НС1, моль......... 0,00346 0,02680 0,0309 0,0343 0,0375 0,0418
МНОГОВАРИАНТНАЯ ЗАДАЧА
Последовательная реакция первого порядка протекает по схеме
< k\ —. k'
А—Д-Р —
При 298 К удельная скорость реакции А -> Р равна а реакции
Р В — fe2 начальная концентрация исходного вещества [А]о. Вы-
числите: 1) коэффициенты максимума кривой [Pl == f (t) (максималь-
ную концентрацию промежуточного продукта Р и время ее достиже-
ния); 2) время достижения концентрации исходного вещества [А]х;
3) концентрации [Р] и [В] в момент времени 4) время, за которое
концентрация промежуточного вещества станет равной [Р]х; 5) коор-
динаты точки перегиба кривой [В] = / (/); 6) точку пересечения кри-
вых [А[ — f (t) и [Pl — f (0; 7) на основании полученных данных по-
стройте график [Р] =/(/).
№ ва- рианта [А]., моль/л [А]., моль/л [Р] Ь МОЛЬ/Л kl, мни-1 мии 1 Хе ва- рианта [А]е, моль/л [A]i. моль/л [PL. моль/л klt мин-"1 kt, мии-1
1 1 0,001 0,01 0,1 0,05 13 1 0,001 0,01 0,12 0,07
2 1 0,02 0,01 0,1 0,05 14 1 0,001 0,02 0,12 0,07
3 1 0,0015 0,01 0,1 0,05 15 1 0,001 0,015 0,12 0,07
4 1 0,002 0,01 0,1 0,05 16 1 0,001 0,10 0,1 0,07
5 1,5 -0,001 0,01 0,1 0,05 17 2 0,002 0,02 0,12 0,05
6 2 0,001 0,02 0,1 0,05 18 2 0,002 0,02 0,12 0,05
7 2 0,001 0,015 0,1 0,05 19 2 0,002 0,01 0,12 0,05
8 2 0,001 0,012 0,1 0,05 20 2 0,002 0,01 0,1 0,07
9 1,5 0,015 0,02 0,1 0,05 21 1 ,2 0,015 0,01 0,1 0,08
10 1,5 0,015 0,01 0,1 0,05 22 1,2 0,015 0,01 0,1 0,08
11 1,5 0,015 0,015 0,1 0,05 23 1,2 0,015 0,01 0,1 0,08
12 1,5 0,015 0,012 0,1 0,05 24 1,3 0,015 0,01 0,1 0,08
13*
387
ГЛАВА XXIII
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
Основные уравнения и символы
[К., с. 644—654; Г., т. 2, с. 41—45]
Изучение зависимости скоростей реакции от температуры особен-
но важно потому, что температурная зависимость лежит в основе тео-
ретического обоснования вывода для вычисления скорости химиче-
ского процесса, поскольку температура является молекулярным свой-
ством реагирующей системы. Именно по этой причине такой подход
к изучению скорости реакции называют молекулярной кинетикой.
Зависимость скорости реакции от температуры приближенно выра-
жается правилом Вант-Гоффа
kT Т2-Т,
—- = у 'О , (XXIII.1)
k 'J'
где kTl и krt — константы скорости при температурах Т\ и Т2; у —
температурный коэффициент скорости реакции (коэффициент Вант-
Гоффа); у = 2-4-4.
Если температура реакции изменяется в арифметической прогрес-
сии Т2 — 7\= 10п, то скорость реакции будет изменяться в геометри-
ческой прогрессии kT1 = krtyn, например при у = 2 kr, = krfin.
Зависимость скорости реакции от температуры выражается урав-
нением Аррениуса, которое в дифференциальной форме имеет вид
(XXIII.2)
(XXIII.3)
(XXIII.4)
(XXIII.5)
d 1 п k Еон
d Г ~ RT2 ’
а в интегральной форме
] £оп / Ту — Tj \
g fei = 2, ЗЯ \ Т2ТГ )
Ig k = — ——cons t,
’ 2,ЗЯГ
£оп
k = kne ,
k0 — постоянная (предэкспоненциальный множитель); Еоп — энергия
активации (экспериментальная энергия активации). Энергия актива-
ции и температурный коэффициент связаны уравнением
£ = 2,ЗЯ7' (Г+10) IsVy/lO, (XXIII.6)
где ут — коэффициент Вант-Гоффа при температуре Т.
388
Рис. 44. Зависимость Ig k от 1/Т для
реакции окисления меди
Зависимость Ig k -= f (1/7") может
быть представлена прямой (рис. 44),
тогда
£=—2,3/?tga, (XXIII.7)
где а — угол наклона прямой.
ЗАДАЧИ С РЕШЕНИЯМИ
1. В присутствии ионов CN~ бензальдегид превращается в бензо-
ил. Определите энергию активации этого превращения, если извест-
ны следующие данные:
Т, к............ 313,2 323,1 333,2
k, мин-1 .... 0,026 0,048 0,089
Решение. Находим энергию активации по уравнению
fe2 _ Еа Т*~Т1
" kr ~ 2,303-8,314 Тг 7\ ’
откуда
Еа =
2,303-8,314 7", 7\ k2
--------------2_J_
Я,
Г2-Г1
Для
313,2
Еа
и 323,1 К
2,303-8,314-313,2-323,1
---------------------- 1g
Для
9,9
333,2 и 323,1 К
2,303-8,314-333,2.323,1 ,
£a== 10,1 g
0,048
-----= 58785,2 Дж/моль.
0,026
0,089
----- =54643,04 Дж/моль.
0,048
Для 313,2 и 333,2 К
2,303-8,’314-313,2-333,2 0,089 спплп л ,
Е,,=----------------------- 2-------=60040,4 Дж/моль,
20 0,029
58785,2 + 54643,04 + 60040,1 оо „ ,
£ср =-----'—!!------------------ =57822,88 Дж/моль.
3
2. Определите энергию активации реакции
Cu + (NH4)2 S2O8->CuSO4+(NH4)2 so4
Значения констант скоростей реакции для различных температур:
Т, К......................... 293,2 313,2 333,2
k-103, л/(моль-мии) .... 9,6 18,16 39,96
389
Решение. Определяем энергию активации Еа графическим ме-
тодом, используя уравнение
Еа
1г fe=lg k0—-------—-— .
’ ь 0 2,303-8,3147’
Представим экспериментальные данные в следующем виде:
1
— 103 ............. 3,41 3,19$ 3,005
lg k.............. —2,018 —1,741 —1,475
и на их основании строим график (рис. 44). Откуда
Определяем энергию активации по уравнению (XXIII.7):
/—2,02—1,50\
Еа=—2,303-8,314 tga=—2,303-8,3141 I-103 = 25522,4 Дж/моль.
3. Раствор уксусно-этилового эфира при сг = 0,01 г-экв/л и
293 К рмыляется 0,002 н. раствором NaOH (с2) в течение 23 мин на
10 %. Реакция — второго порядка. Как изменится это время, если
уменьшить концентрации реагирующих веществ л 10 раз; увеличить
температуру на 15°?
Решение. Воспользуемся кинетическим уравнением
1 1 (а—х) Ь
k*=-------1п~------—
t (а—Ь) (Ь—х) а
и, подставив t = 23 мин, а = сг = 0,01 г-экв/л, b = сг — 0,002 г-экв/л,
х = 10 % от сь т. е. х = 0,001 г-экв/л, получим
1 1 (0,01-0,001) 0,002
23 0,01—0,002 6 (0,002—0,001) 0,01
При уменьшении всех концентраций в 10 раз будем иметь сг —
= 0,001 г-экв/л, с.г = 0,0002 г-экв/л, х = 0,0001 г-экв/л. Подставляя
эти значения в кинетическое уравнение для k = 3,19, получаем
1 1 (0,001—0,0001) 0,002
t 0,001—0,0002 8 (0,0002—0,0001) 0,001
Отсюда t = 230 мин. Полагаем, что при повышении температуры на
10° скорость реакции увеличивается вдвое: fer+i0 = 2йг. Следователь-
но, йг+15 = kT 21’5 = 3,19 = 3,19-2,83 = 9,04. В случае омы-
ления 10 % эфира при Т и Т + 15 kt = k^. Отсюда время будет
3 19
—1 23 = 8,1 мин =486 с.
390
ЗАДАЧИ
1. Для реакции термического разложения этана получены следую*
щие константы скорости реакции первого порядка:
Т, К........... 823 833 843 853 863 873 883 893 903
10-5, с—1 . . . 2,5 4,7 8,2 12,3 23,1 35,3 57,6 92,4 141,5
Постройте график зависимости k от Т и lg k от 1/Т. Рассчитайте энер-
гию активации и предэкспоненциальный множитель.
2. Константы скорости реакции разложения органической кисло-
ты в водном растворе следующие:
Т, к........... 273,2 293,2 313,2 333,2
k 105, мин-1 . . 2,46 47,5 576 5480
Постройте график зависимости lg k от 1/Т и определите энергию ак-
тивации. Вычислите константу k0 в уравнении k = кое~Еа1ЕТпериод
полураспада для этой реакции при 373,2 К, если эта реакция первого
порядка.
3. Две реакции одинакового порядка имеют равные предэкспонен-
циальные множители, но их энергии активации различаются на
41,9 кДж/моль. Рассчитайте соотношения констант скоростей этих
реакций при 600 К-
4. Щелочное омыление этилового эфира уксусной кислоты характе-
ризуется следующими константами скоростей при различных темпера-
турах:
Т, к....................... 273 293 298
k, мин-1-л-моль-1........ 1,17 5t,08 6,56
Вычислите энергию активации и время протекания половины реакции
при 298 К, если: 1) взаимодействуют 0,025 моль/л, 2) 0,0125 моль/л '
раствора эфира и щелочи.
5. В спиртовом растворе для реакции
c2hsx+oh-==c2h6oh+h+
где X —С1, Вг или I, константы скорости могут быть рассчитаны по
уравнениям:
для хлорида:
^ = 0,793-10*» т-'/г-эбгзб/ят;
для бромида
k2= 1,28-1010 ТУг е-878®8/777";
для иодида
fe3 = 2,70-1010 т'/г е-878®8/7?7’.
Рассчитайте константы скорости и соотношение констант скоростей
при 298 К, характеризующее зависимость подвижности галогена от
его природы.
391
6. Разложение некоторого вещества является реакцией первого
порядка с энергией активации 231 кДж/моль. При 300 К разложение
этого вещества проходит со скоростью 95% в 1 ч. Вычислите температу-
ру, при которой это вещество разлагается со скоростью 0,1 % в
1 мин.
7. Соль диазония разлагается по уравнению
CH3CeH4N2Cl+H2O=CH3CeH4OH+\2+HCl
Процесс разложения представляет реакцию первого порядка. Кон-
станты скорости реакции при 297,9 и 303,2 К соответственно равны
9-Ю-3 и 13-10-3 мин-1. Вычислите константу скорости при 308,2 К
и время, в течение которого распадается 99 % соли диазония при этой
температуре.
8. Константа скорости разложения ацетондикарбоновой кис-
лоты
СО (СН2СООН)2->СО (CH3)2-i-2CO2
(реакция первого порядка) при 7\ = 273,2 К равна k2 = 2,46-10-5
мин-1, при Т2 — 313,2 К k.2 = 5,76-10-3 мин-1. Вычислите время,
в течение которого реакция пройдет на 70 % при Т = 323,2 К.
9. Период полупревращения вещества в реакции первого порядка
при 323,2 К составляет 100 мин, а при 353,2 К — 15 мин. Вычис-
лите температурный коэффициент константы скорости этой реак-
ции.
10. Константа скорости омыления уксусно-этилового эфира едким
натром при 282,6 К равна 2,37, а при 287,6 К — 3,204. При какой тем-
пературе константа скорости будет равна 4?
11. В растворе содержится 0,1 моль этилацетата и 0,1 моль NaOH.
При 283,2 К в течение 15 мин омыляется 10 % эфира, а при 298,2 К
за тот же промежуток времени — 20 %. Вычислите количество эфира,
которое омылится в течение 5 мин при 313,2 К.
12. Разложение пербората натрия
МаВО34-НгО-*№Н2ВО3-|-УгО2
реакция первого порядка. Константы скорости реакции при Тг —
= 303,2 К и Т2 = 308,2 К соответственно равны 2,2-10-3 и 4,Ь 10-3
мин-1. Вычислите энергию активации реакции и время, в тече-
ние которого при Ts = 313,2 К разложится 99,99 % пербората
натрия.
13. Изопропиловый эфир в парообразном состоянии изомеризуется
в аллилацетон, и скорость реакции подчиняется уравнению первого по-
рядка. Зависимость константы скорости (с-1) оттемпературы описыва-
ется уравнением k = 5,4-1011 е~122597/^т . За какое время при
423 К парциальное давление аллилацетона достигает 300 мм рт. ст.,
если начальное давление изопропилового эфира 760 мм рт. ст.?
14. Константы скоростей реакции второго порядка при 328,2 и
392
298,2 К соответственно равны 10-2 и 10-3 мин-^моль-1-л. Вычисли-
те скорость этой реакции при 343,2 К в начальный момент реакции,
если начальные концентрации обоих веществ одинаковы и равны
0,01 моль/л.
15. Реакция второго порядка (At + А2 -> продукты) протекает на
90 % при [AJo = [А2]о = 0,1 моль/л и 300,2 К за 200 мин, а при
320,2 К — за 40 мин. Вычислите время, когда реакция пройдет на
99 % при 330 К и [AJ0 = [А2]о = 0,01 моль/л.
16. Обратимая реакция протекает по стехиометрическому урав-
нению
2Ai + A2 2С — 84 кДж/моль (экзотермическая реакция)
При 473 К прямая реакция подчиняется закону скорости
— d [AJ/d/ -= [Аг|2, а зависимость скорости от температуры вы-
ражается так:
1g ^=10,42—19 700/7
[kT имеет размерность л/(моль-с)]. Выведите закон, которому подчи-
няется скорость обратной реакции. Определите энергию активации
обратной реакции. Вычислите изменение энтропии реакции и k2 при
температурах 473 и 573 К, если константы равновесия при 473 К Кр =
- 6,2-103 атм-1. Скорость реакции нулевого порядка зависит от кон-
центрации вещества At. Для всех ли концентраций веществ Аг и А2
будет соблюдаться такая зависимость?
17. Скорость расходования индивидуального вещества А подчиня-
ется уравнению — d [A]/d/ k [А]3. При 7\ = 333 К k = 4,20-10-6
(концентрация вещества А выражена в мм рт. ст.), а при Т2 = 473 К
k — 1,4-10-4 (концентрация выражена в мм рт. ст.). Рассчитайте
энергию активации и фактор Аррениуса (предэкспоненциальный мно-
житель), константы k при 333 и 473 К, если концентрация вещества
А выражена в моль/л. Вычислите энергию активации и предэкспонен-
циальный множитель, если скорость реакции выражена в моль/(л-с).
Объясните, будет ли данная энергия активации истинной энергией ак-
тивации реакции.
18. Реакция изомеризации А+± В проходит до конца при 338 К.
Для двух начальных концентраций вещества А с011 и с0>2 = 2с011 был
измерен период полупревращения для реакции и найдено, что реакция
имеет порядок 4/3 по компоненту А. Точность определения концентра-
ции А составляет ±2 %, ошибка в определении времени пренебрежи-
мо мала, температура поддерживается с точностью ±0,1°, энергия
активации 840 кДж/моль. Какова точность определения времени полу-
превращения? Достаточна ли точность измерений, чтобы отличить ре-
акцию порядка 3/2 от реакции порядка 4/3?
393
19. Для димеризации бутадиена lg k = 7,673 — 5680/Т, где k име-
ет размерность л-моль-1-с-1. Какая доля молекул бутадиена, присутст-
вующих в системе, имеет энергию, достаточную для взаимодействия
при 573 и 723 К?
20. Для разложения фосфина, протекающего по уравнению реак-
ции 4РН3Р4 + 6Н2, имеется следующая зависимость константы
скорости от температуры: lg k —-----+ 2 lg Т + 12,130.
По этим данным определите зависимость энергии активации от тем-
пературы и энергию активации при 800 К.
21. Кинетику пиролиза этилбромида исследовали в газовой фазе
при использовании толуола как газоносителя при различных темпе-
ратурах. Было установлено, что пироли протекает как реакция пер-
вого порядка. Для констант скорости были найдены следующие зна-
чения:
Т, К .................... 800 833 877
*1, с-1 ................ 0,0361 0,141 0,662
Т, К..................... 794 806 855
й-i, с-1 .... 0,110 0,192 1,126
900
1,410
881
2,708
где fej — константа прямой реакции; — константа обратной ре-
акции. Из приведенных данных определите графически: а) энергию
активации и предэкспоненциальный множитель обеих реакций;
б) выведите зависимость константы скорости от температуры в анали-
тической форме.
22. Для реакции 2HI ^2 12 + Н2 константы скорости имеют
k~ 1
следующие значения: при 666,8 К = 0,259; при 698,6 К ki'= 1,242;
при 666,8 К fe_i = 15,59; при 698,6 К = 67,0 см3-моль-1-с-1. На
основании этих данных определите: а) температурную зависимость
константы скорости прямой и обратной реакций; б) температурную
зависимость константы равновесия диссоциации HI; в) константу рав-
новесия при 553 и 763 К, а результаты сравните с эксперимен-
тальными: /<с = 1,173-10-2 при 553 К, Кс = 2,182-10-2 при
763 К.
МНОГОВАРИАНТНАЯ ЗАДАЧА
По Значениям констант скоростей реакции при двух температурах
определите энергию активации, константу скорости при температуре
Т3, температурный коэффициент скорости и количество вещества, из-
расходованное за время t, если начальные концентрации равны с0.
Учтите, что порядок реакции и молекулярность совпадают.
394
I ь/л ф со со х Г- X ъ© со г- г- o-xooxxoosc>xi©£ l© Г— с© ф L© Ф X 00 X О 1© О <© c© l© ФГ- Ф L© L© X c© s
S OOW-W-C4-OOW- CO Ф Ф Ф Ф Ф -M СЧХОХСЧ
НИН ФОХС^-Г-ХХХСМФХХ О —-СМ СМ - -’f « X X X © I© Ф Tt« ф X c© 1© 1© XO--W-W О Г- l© Ф 0 Xt© ф Ф I©
смсмсмсмсмсмсмсмсмсмсмсм СЧ СЧ СЧ СЧ СЧ СЧ СЧ СЧ СЧ СЧ X СЧ CM
ххарххс©хххоооох х^ЗХ’осмс-'-смххаоооао ’’а«1©с©с©ффт^ФХС>с©Х co X X 'CO 'CO 'CO 'CO OtfoOOOW- co <© СЧ co Tt« co co X 06 00 l© 00 сч©хсо~ ©MXWX 313,
*-1. Мин-'Х X моль-1-л со сч (© О 11 Хс©Х — ф__-.0X0 о см с© t© х t© £? Ч-* со OOtONOOts ’О -V© £5 О Ct со ф — ь-i© с^см о* о* о* о* о* о" ” o' 2 **•* Ф o' t©7 t- ” co £m 8 vg 2 о м n 0 7 0 -O —. СЧ 0 — rt o^c4ioo=4'g «Э _,- CO Щ <0 1 1 I 222^ _ • " " Ф 0 °Ч©> -ф N- О Ф x — oq 35,5
СМФФФФ^чГФСМСЧСМСМ C4OWXC4-C4 сч сч СЧ СЧ СЧ CM
ьГ -«i© х ао х i© ©счГ'- —ox©£30 —©О •«Г1©С©С^-С^-С^-СМ-мСМС>1©Х co t© CO c© co X 00 -Tj-Q-O-O co C^- X co rf CO co X X 00 <30 QQ О L© ф X X X X CM X 328,
1Гч_Ч1гоя х Xi-ИИЯ ч «о С© 1 1 __ 1 (©ф^фффф ДглО toio^ioXXt© ££?— SSSScj^KjsgS Ф о ф о 8 * со о О ф "* © °* о «* co w 1 I cOOco 2^-2 0 — X x .от Qt^^cn^co 4F2 ф 0 сч сч t© оЧ СЧ c© 0 o” 0* CO in 1 I CO 22i>o Ф • сэ-'*- O »© 1© ф — c©“ 4 I©’ -M CM 0,765
1©Ь.фффч^СМФСМСМСМСМ СЧ Ф CO C^- СЧ С© СЧ CM CM CM CM CM CM
^ОфХУЭХЛ^ХХС^Х с-'-хФххсмсмхфххх 1©1©1©С©’фС©1©ФСМФ1©СМ о x t© co c^- co сч ad X L© C" 0 1© x Ф СЧ <© СЧ СЧ X СЧ w X X X X X Ф C4- CM Г* Ф CM CM X CM C4 298,
Q X
4“ 0 9 +x®x и X 4-
Реакция Е4-оЧ + « 9.x +х X zxog9 <_> 4-0 О ~*‘ « “_Х и О I t ®о*Чо- I, Ух 9.x 8 г? О и X У <г> х ।и 15 г* « г? 1 1' । 9 ” iOl ^Т' X Т xES-.- я «04.+" "to+84-®+++?. <n ® х х 7 7 4--о+о $ о о □ _Т+ mttz"St&o’A§ +x"0^x 14 T 1 xx?t fM+^оЛ «8044 till f_? «.«г® LqXXoo 4-H-++1 looo bW-fe +ух°»и»°«ия x'xxx'Sg§§z£8^+88j,5555 (в водном р-ре катализатор—0,1 н. CH3CO2CH. + H2O -ч-СН3СО2Н+СН3С СН3СО2С2Н6+ Н2О—>сн3со2н+ С2Н 2СН2О + NaOH—>HCO2Na 4- СН3ОН (CH3)2SO4 4- Nal—.CH314-Na(CH3)SO4 C6H6CH2Br+ C2H5OH—>C6H6CH2OC2H 4-HBr С12Н22Оц 4- H2O >C6Hi2O64- C„H12O6
вхив -н<1ве atf X Tt« L© С© Г- x 0 «И WM wM WM О —CM 'X CM CM CM CM CM I© CM
Реакция подчиняется уравнению реакции первого порядка.
395
ГЛАВА XXIV
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАСЧЕТА КОНСТАНТЫ
СКОРОСТИ РЕАКЦИИ
Основные уравнения и символы
[К., 654—658; Г., т. 2, с. 119—130, 139—1551
Скорость взаимодействия w одинаковых газообразных молекул рас-
считывают по уравнению
ui = Zaa е~£°п/ет ’ (XXIV. 1)
если £оП — энергия активации; ZAA — число столкновений между
молекулами газа А в 1 см3 за 1 с;
== 4" V2Wn2u; (XXIV.2)
ZAA e~E°n!RT — число активных столкновений в 1 см3 за 1 с;
п — число молекул в 1 см3; и — среднеарифметическая скорость дви-
жения молекул.
Для реакции типа
А + В —» Продукты
скорость взаимодействия w неодинаковых молекул А и В будет
и = 2две~£оп/;?Г- (XXIV.3)
где Zab e~Eoa/RT — число активных столкновений А и В в 1 см3
за 1 с;
7" ( °а+(Тв V j / 8RT ! MA+MB \
2ав-^ 2 J |/ — (^й^7“)па"в, (XX1V-4)
где стА. ств — газокинетические диаметры молекул А и В; М&, Mr —
молекулярные массы веществ А и В; Zab — число столкновений мо-
лекул А и В в 1 см3 за 1 с. Величину л I—%— I [сечение соударений
в (XXIV.4)] для газов определяют по вязкости вещества. Для индиви-
дуального газа сечение соударений будет равно:
Ми
па2=—------- . (XXIV.5)
Злт]пА
Отсюда диаметр молекул будет
М и
<т=—-------. (XXIV. 6)
Злт]пА
3%
Для бинарной смеси газов сечение соударений будет:
/ИЛЫА
ЗЛТ]А«А
Mb«b
ЗлПв^В
(XXIV.7)
Для химической кинетики достаточно точно можно оценить величину
сечения соударений, считая, что в жидкости или в твердом теле про-
исходит плотная упаковка молекул. Объем, занимаемый 1 моль (мо-
лярный объем), равен M/d, где d — плотность вещества, г/см3. При
плотной упаковке шарик радиусом г занимает объем 8г3/у2. Следо-
вательно,
1 3/ М /Л1\1/3
г=— 1/ 1,41 • 1,66 • Ю-24 — = 0,665 • 10-8 —
2 Г d \а
л (огА Н-<тв)2= 1 ,ЭЭ-Ю—16
Л1А X i/з /'Мв\1/312
dA / ' dB /
(XXIV.8)
Для взаимодействия одинаковых и неодинаковых молекул константа
скорости выражается уравнениями:
(Xxiv-9>
где k имеет размерность см3/(молекула-с);
k=Zt-\0»nAe E°n/RT' (XXIV.10)
где Zo — фактор соударений; k в (XXIV. 10) имеет размерность
л/(моль-с). Фактор соударений при столкновении одноименных моле-
кул рассчитывают по уравнению
4== 4" У2ло2 , (XXIV.11)
2 г лиг
где Zo имеет размерность см3/(молекула-с). ,
Фактор соударений при столкновении разноименных молекул опре-
деляют по уравнению
„ ( V /ярг М,-|-Л4в
4 = л .....А ,г _? \/ —------AZL- В , (XXIV.12)
\ 2 / у я '^а'^В
где Zo имеет размерность см3/(молекула-с).
Уточненное уравнение для расчета константы скорости
k=pZ'fi~E°nIRT, (XXIV. 13)
где р — стерический фактор.
Предэкспонеициальный множитель в уравнении (XXIII.5), соглас-
но теории бинарных столкновений, выражается так:
&0 = pZ0- (XXIV.14)
397
Согласно теории активированного комплекса (переходного состояния)
константу скорости реакции определяют по уравнению Эйринга (для
бимолекулярных реакций)
(XXIV.15)
h vaVb
где Ео — энергия активации при абсолютном нуле; QaK, QA, Qb —
молекулярные статистические суммы (молекулярные суммы по состоя-
ниям) для активированного комплекса и исходных веществ А и В.
Квази-термодинамическая форма уравнения Эйринга
fe = xex —еЛ5*/ке“£°п/ЛГ, (XXIV.16)
h
где х — трансмиссионный коэффициент; для мономолекулярных ре-
акций х = 1; для бимолекурных реакций х = 2; А5^ — энтропия ак-
тивации; £оП — экспериментальная энергия активации;
Eon = RT+bH*, (XXIV.17)
где А//* — энтальпия активации. Размерности констант: для моно-
молекулярных реакций — время"1, для бимолекулярных реакций —
объем-масса-1-время"1. Предэкспоненциальный множитель в уравне-
нии (XXIII.5), согласно теории переходного состояния, выражается
уравнением
k0 = 7.ex e&s*'R, (XXIV. 18)
h
где k имеет размерность объем-масса-1-время-1.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Разложение иодида водорода является бимолекулярной реакци-
ей, энергия активации которой Е = 1848-102 Дж/моль. Реакция
протекает при 566,2 К. диаметр молекулы HI, вычисленный по вяз-
кости, равен 3,5-10-10 м, концентрация иодида водорода 1 моль/л.
Определите константу скорости при 566,2 К.
Решение. Константу скорости при 566,2 К вычисляем через
число соударений. Определяем среднюю скорость иа по уравнению
йа= T/8-8,314_1№-566,r=4 33.iQ1 4з3 2
Г лМ* У 3,14-128/2
Рассчитаем число молекул HI в 1 см3. Так как концентрация иоди-
да водорода 1 моль/л, то число молекул п в 1 см3 составит
6,02-1023 „ ,
п —---—— =6,02-I020 молекул.
398
Число сталкивающихся молекул pZ0 в 2 раза больше числа столкно-
вений Z, поэтому
pZ0 = 4,25- Ю31-2 = 8,5- 103i молекул/см3.
Чтобы выразить число столкновений молекул через число молей в
1 см3 за 1 с, разделим полученную величину на постоянную Авогадро:
pZ0 = 8,5-10з1/(6.02-1023) = 1,4Ы0’.
Подставляя рассчитанную величину в уравнение k — pZoe~EiRT,
получаем
k= 1,41 • 1О’-8,42- 10-is = ц,9. Ю-n см3/(моль-с).
2. При исследовании кинетики реакции взаимодействия метилио-
дида с пиридином в тетрахлорэтане
CeH5N +CH3I - ICeHsNCH3]+l-
бы.1и получены следующие данные:
Т, К....................... 293,3 303,1 313,1 323,2
Jfe-103, л-моль-1-мин-1 . . . 0,713 1,50 3,5 5,89
Реакция необратима, относится к реакциям второго порядка. Вы-
числите энергию активации и стерический фактор, если плотность пи-
ридина dn = 0,98 и метилиодида dM = 2,28 г/см3.
Решение. Выразим графичёски зависимость k от температуры
Т в аррениусовских координатах (рис. 45). По тангенсу угла наклона
полученной прямой определим энергию активации:
E — 2,3R tga = 2,3-8,314-1,43-2000 = 54689 Дж,
где tg а — соотношение приращений по оси абсцисс и оси ординат с
учетом масштабов. Запишем уравнение прямой линии:
1 gk = 1 g<PZ0)—I tga 1 $ i/Г-10»= Ig (pZ0)—2,86/7’- IO3.
399
Отсюда по координатам любой точки, взятой на прямой, например
lg k -= 3,88 при 1/Т-103 = 3,40, рассчитываем
lg (pZ0) =3,88 + 2,86-8,40 = 388 + 9,73 = 7.61,
4,1-107
pZe = 4,1 IO’ л-моль-1-мии-1 = —-----—— См8/с = 1,10. 10-is см’/с.
и 9 60-6,02-1023
По уравнению
(гА + г
/ ZkT М/2
в)2 TZT
вычисляем Zo. Рассчитав из опытных данных значения pZ0, определим
стерический фактор реакции. Так, молекулярная масса пиридина
Мп - 79, плотность da = 0,98 r/см3; молекулярная масса иодида
пиридина Ми = 142, плотность dH == 2,28 r/см3. Приведенная масса
М* будет
Ии.Мп _ 79-142
и + '^п 211
С достаточной точностью можно оценить величину сечения соударения
в жидкости или в твердом теле, если существует плотная упаковка мо-
лекул. Объем, занимаемый 1 моль (молярный объем), равен Mid.
На один шарик радиусом г при плотной упаковке приходится объем
8r3/V2, следовательно,
1 з _____________________
г = — V1,41 -1,66-10-2* Mid = 0,665-10—8 (Af/d)I/3
и сечение соударения равно
I Пи + <Тп \ ГЛМИ\1/3 /Мп\1/3 12
л — п 1 = 1,39 -10—16 — + — .
\ 2 / [ \ da ) \^п/1
Отсюда получаем
/ <ти+<тп \2 Г/ 79 \1/3 /142X1/312
л и п =1,39-10—1« ----------- + -------- =9,5-10-16 см2.
\ 2 ) [ДО,98/ \2,28/ J
Средняя относительная скорость молекул для температуры 308 К
будет
8.104
Г 3,14-50,7
Тогда
Z0 = n вн'з -п у й = 3,58-104-9,5-10-15 = 3,4-ю-1" см3/с.
Следовательно, стерический фактор
р= 1,13-10-16/(3,4-10-1») =3,3-10-8.
400
3. На основании теории соударения и теории переходного состоя-
ния покажите, что kB = Zo. Используя справочные данные, рассчи-
тайте по указанным теориям предэкспоненциальный множитель для
реакции Н + С1НС1 при 298 К.
Решение. Для реакции двух атомов у исходных частиц враща-
тельная составляющая статистической суммы отсутствует, а активи-
рованный комплекс представляет собой двухатомную частицу. Момент
инерции / активированного комплекса относительно центра тяжести
равен
; = "'н-«н+"гс1хсь
где Хн и Xci — расстояние от центра атомов Н и С1 до центра тяжести
молекулы (рис. 46). Согласно определению центра тяжести тнхн —
= Маха. Учитывая, что хн + хС1 = /н+ + Гсь
после преобразования получаем:
Я С1
Рис. 46. ©пределе-
ние координат
центра тяжести
молекулы HCI
тн
”h+"ci <Гн+'С,)'
/Ли
/= ~"т —(Гн+ГС1)2='п* ('h+'ci)2-
тн + тс1
Для двухатомной частицы, имеющей две вращательные степени сво-
боды,
* 8я2 kT 8?t2 kT
г вр_ Л2 - Л2
8л kT
т* (гн -fc.i)2 = —т* я (ГН + гш)2.
Отсюда по теории переходного состояния при условии, что для этой
реакции колебательная статистическая сумма равна единице,
(2л)’^! k'^ Т'^ (^н)вр (^ш)вр
(2л)’/‘Л,/2 {т*)‘1гТ^ вр
Л2 8л kT
(2п)’^^(т*)г^Т^ h* 'П*Я(гн + гС1) -
Если р — 1, то
/ 86Т V/,
*о-я(гн+гс1) пт, j
401
Таким образом, для реакции между двумя атомами предэкспоненци-
альный множитель, вычисленный по методу активированного комплек-
са, совпадает с фактором соударений. Из справочника находим, что
гн— 2,08-10-8 см и fci = 1,81-Ю-8 см и, следовательно,
Zo = 3,14 (1.81 +2.,08)а-10-» ]/ 8-8,31'107~2?? = 1,36-10-» ,см»/с.
F 3,14
4. Рассчитайте предэкспоненциальный множитель и стернческий
фактор для реакции С2Н4 + С1 -+ С2Н4С1, протекающей при 298 К,
используя модель активированного комплекса н исходных частиц,
приведенных на рис. 47 и 48.
Решение. Для расчета предэкспонеициального множителя и
сферического фактора необходимо определить молекулярные статисти-
ческие суммы поступательного, вращательного и колебательного дви-
жений для реагирующих веществ и активированного комплекса. Опре-
деление вращательных статистических сумм требует знания моментов
инерции, для чего необходимо иметь Представление о конфигурации
исходных частиц и активированного комплекса. Вращательные стати-
стические суммы для активированного комплекса можно вычислить
лишь при определенных предположениях о его строении. Это можно
сделать с достаточной точ-
z ностью, поскольку активиро-
f Y
Рис. 47. Определение координат центра
тяжести молекулы СН2=СН2
Рис. 48. Предполагаемая структура ак-
тивированного комплекса
ванный комплекс является про-
межуточным состоянием между
исходными частицами и части-
цами продуктов реакции.
При построении модели ак-
тивированного комплекса допу-
скаем следующие предположе-
ния: 1) связь С—С имеет длину,
среднюю между длиной связи
С—С в этилене н в образующем-
ся свободном радикале С2Н4С1;
2) углы ^Н1С1С2, Н2С4С2, HiQH2
(рис. 48) равны и составляют
115° (среднее между 120° в эти-
лене и 109° в С2Н4С1); 3) атом
С1 подходит к молекуле этилена
в направлении, перпендикуляр-
ном плоскости молекулы, и в
активированном комплексе угол
ClCjC2 (рис. 48) равен 100° (сред-
ний между прямым углом и 109°
в образующемся свободном ра-
дикале). Расстояние от атома
С1 до Ci принято равным
2-Ю-8 нм (несколько больше,
402
чем в С2Н4С1). Предполагаемая конфигурация активированного ком-
плекса приведена на рис. 48.
Для вычисления моментов инерции этилена и активированного ком-
плекса удобно выбирать систему координат с осью Ох, направленной
по связи С—С; осью Оу, лежащей в плоскости молекулы этилена и пер-
пендикулярной связи С—С; осью Oz, перпендикулярной плоскости
молекулы этилена и началу координат, проходящему через середину
связи С—С. Для этилена начало координат находится в центре тяже-
сти молекулы, а оси координат направлены по осям симметрии моле-
кулы. Так как этилен имеет три взаимно перпендикулярные оси сим-
метрии, то они же являются главными осями инерции и, таким образом,
задача сводится к вычислению моментов инерции относительно трех
координатных осей:
/<А> = 2М^.==2МЦх?-Н?).
Координаты атомов равны:
C, c, Hi H, H, H,
Xi • - • . . 0,67 —0,67 — 1,20 — 1,40 1,20 1,20
Ui • - . . 0 0 0,93 —0,93 —0,93 0,93
z, . . . . . 0 0 0 0 0 0
/Ин = 1, /Ис — 12. Отсюда
1{хк} = 4-1 -0,93s = 3,46;
7^) = 4-1-1,20’4-2-12-0,67’ = 16,56;
/£А) = 4-1 (1,20’4-0,93s) 4-2-12-0,672 = 20,0;
/А/В/С ly lz-
При вычислении произведения моментов инерции относительно глав-
ных осей инерции для активированного комплекса воспользуемся
формулой
Ix — 1 xu IXX
^b Iq-' — IxU h — lyx
— 1XX —lyx ~h
где 1Х, 1У, 1г — моменты инерции относительно любых трех взаим-
но перпендикулярных осей, проходящих через центр тяжести моле-
кулы; 1ХУ, 1хг и 1Уг— так называемые произведения инерции;
Ixy = S М[Х1У(‘, 1хг = £ Iyz=^ MiyiH.
403
Координаты атомов Cl, Н3, Н4, Ci н С2 вычисляем по принятым
Длинам связей и углам. Координаты Hi (х, у, г) и Н2 (х, — у, z) рас-
считываем следующим путем. Длина I отрезка между точками с коор-
динатами х0, у0, z0 и х4, yi, Zi равна
ll = V (*1~*o)2 + (Vi —Уо)2+(*1—?о)2,
а угол <р между двумя отрезками с общим началом в точке (х0, у0, z0)
и концами в точках (хь ylf z4) и (х2, у2, z2) может быть определен по
формуле
(Х1—*о) (х2—х0) + (У1— Уо) (у2 —'/о) + (г1—zo) (Z2 —z0) = /i/2cos<p.
Применяя это выражение к отрезкам C4Hi, С4Н2 и С4О, получаем
для искомых координат х, у, z атомов Н4 и Н2
(х—0,72)2 + '/2 + z2= 1,072;
(х—0,7 )2 — г/ + ?2= 1,07-0,72cos 115°;
— (х—0,72) 0,72= 1,07-0,72cos 115°.
Решение этих уравнений дает координаты Н4 и Н2. Таким образом
координаты атомов равны:
Xi .. . Уг - - - Z; . . н, . . . 1,17 . . . —0,86 . . . 0,45 н, 1,17 0,86 0,45 н, — 1,25 0,93 0 н* —1,25 —0,93 0 С, С, CI 0,72 —0,72 1,07 0 0 0 0 0 -1,97
Координаты центра тяжести находят при помощи соотношений
Z*= - 2 MjXj 2 Mi = 0,6; У* _ 2 Мщ Q 2 Mt
Z* =- ZMjZi, 2 Mt = — 1,09.
Отсюда в системе координат связанной с центром тяжести,
Xi Vi н, 0,57 -0,86 -1,55 Н, , 0,57 - 0-86 1,54 н, н« с, CI -1,85 —1,85 —1,32 0,47 0,93 —0,03 0 0 1,09 1,09 10,9 —0,88
Отсюда К = - получаем = - 32,7; = 66,3; = 99,4; If - 39,5; If, = If = 0;
66,3 0 32,7
0 99,4 0 = 1,54-106.
32,7 0 39,5
Подставив значение для вращательных статистических сумм в урав-
нения
____________ft2________ Z*
(гл)3'2*1'2^*)3/2?1'2 <2а)вр (Zb)bp ’
404
после сокращения получим
hi (;а /р?)1/2
(2л)3/2 'kA,'kA)'LA)
отсюда k0 = 4,8-10-12 см3/с.
Чтобы определить стерический фактор, нужно знать фактор со-
ударений. Для вычисления сечения соударений можно воспользовать-
ся данными вязкости С12 и С2Н4: т]С1, = 1,33-10-3 Па-с, т|Сзн4 -
= 1,01-!0-3 Па-с. По формуле (XXIV.6) рассчитаем радиус:
1/ -—— , vcb = 2,63-10 ; гСгН<-2,4-10 см.
2 у Злг),У0
Если предположить, что объем, приходящийся на один атом С1. ра-
вен объему молекулы С12, то линейные размеры атома С1 должны быть
3
в 1^2 раза меньше, чем молекулы С12:
э_
ГС1 =2,63-10-81/2 =2,08-10-8 СМ,
и, следовательно,
Zo = 3,14 (2,434-2,08)2-10~ц|/8'8.’31' ‘О7'298 = 4,45-10~i« см3/с.
г 3,14-15,6
Отсюда стерический фактор равен р =- k0!Z0 == 1,08-10-2.
5. Для реакции разложения оксида азота 2NO ч=ь N2 + О2 кон-
станты скорости kr = 0,0108 моль/(л-с-атм) при 1620 К и k2 —
= 0,030 моль/(л-с-атм) при 1572 К- Рассчитайте Кн* и AS* при тем-
пературе 1572 К.
Решение. Энтропию и теплоту активации вычисляем по урав-
нению теории абсолютных скоростей реакции, выраженному в лога-
рифмической форме:
lg* = lg hR 4-2>3/?(AS — R j;
1,3805-10-23 1
lg fe = lg 6,6238 10“34• 0,08206 + 2ТзХ314 \AS* /’
1,3805-Ю-23
Ig ---—— ----------=1 g(2,5398- IO») = 11,4048.
6,6238-10- 34-0,08206 ’
Записываем уравнение для Ig k при T = 1620 К:
AS* AW*
Ig 0,0108= 1,96658= 11,40484-147 19.147-1620 ’ (0
для T = 1525 К
AS* A/7*
lg 0,0030=-2,52288=11,4048+^- - • <2)
405
Для определения AS* и АН*, решая совместно уравнения (1) и (2),
A//* AS*
31018,4 ”i9,i47” 13,37138:
A//* AS* „ „„ „
29199,17” 19,147 ~ 13-92768-
Откуда АН* = 276993,62 Дж/моль; AS* = — 85,038 Дж/(моль-К).
Полагаем, что значения AS* и АН* для средней температуры реакции
(1572 К) остаются теми же, что и для 1620 и 1525 К-
ЗАДАЧИ
1. Азот находится в сосуде при 1,01-10s Па и 298 К- Рассчитайте:
1) число ударов о стенки сосуда в 1 с/см2; 2) число соударений между
молекулами за 1 с в 1 см8; 3) средний свободный пробег молекул.
2. Термическое разложение газообразного ацетальдегида — би-
молекулярная реакция. Энергия активации Е равна 1911 • 108 Дж/моль,
а молекулярный диаметр молекулы ацетальдегида 5-10-8 см. Рассчи-
тайте число молекул, реагирующих в ЫО"6 м} за 1 с при 800 К и
1,01 • 106 Па, и сравните с экспериментальной величиной 7,3-10й,
а также период полураспада для этой реакции.
3. Термическое разложение диоксида азота 2NO2 -► 2NO + О2
является гомогенной бимолекулярной реакцией. При 627 К констан-
та скорости реакции равна 1,81•108 см8-моль_1-с-1. Стерический
множитель равен 0,019. Вычислите энергию активации Е, приняв ди-
аметр молекулы NO2 равным 3,55-10~8 см. Определите долю молекул,
обладающих при 627 К энергией, большей Е.
4. Константа скорости мономолекулярной реакции разложения
азоизопропана C3H7N = NC3H7 -> N2 + CeHu выражается следую-
щим уравнением: kY = 5,71 • 1013г-40 90°/«7'. Подсчитайте макси-
мально возможное с точки зрения теории столкновений значение пред-
экспоненциального множителя, приняв Осан,ы=мс,н, = 5-10-8 см,
ccsh,n=nc1h, ” 1 моль на 22,4 л. Температура опыта 563 К. Срав-
ните полученное значение с опытными.
5. Энергия активации для реакции разложения ацетона
СН3СОСН3 = С2Н4 4- СО + Н2 равна 286,6 кДж/моль. Приняв ди-
аметр молекулы ацетона равным 5,0-10-8 см, вычислите константу
скорости этой реакции при 835 К. и 760 мм рт. ст. Вычисленное значе-
ние сравните с опытной величиной kr = 1,5-10~3 с-1.
6. Опытное значение константы скорости реакции между метил-
иодидом и этилатом натрия CH3I + C2H5ONa -> СН3ОС2Н5 + Nal,
протекающей в растворе этилового спирта при 291,К 4,96-10“*
л-моль_1-с-1. Приняв радиусы молекул равными соответствен-
но 2,64-10~8 и 2,74-10-8 см, вычислите с помощью уравнения теории
столкновений энергию активации этой реакции (р — 0,8).
406
7. Для реакции Н2 + 12—>-2Н1 получено значение в уравнении
Аррениуса:
k = \,6-\011e~EIRT.
Вычислите стерический фактор р и энергию активации Е, сравните
с табличными данными (р = 0,14; Е = 162,758 кДж/моль), если при
700 К средняя константа скорости равна 6,4-10-2 л/(моль-с) и вяз-
кость г|н2 = 1,83-10-3 Па-с, T|i2 = 3,6-10-3 Па-с.
8. При исследовании кинетики взаимодействия триэтиламина с
этилбромидом в бензоле (C2H5)3N4-C2H5Br-> были получены следую-
щие данные:
Т, К ..................’ 273,12 283,2 293,2 303,2
*•103, см3 • моль-1 -с-1 .... 0,28 0,558 1,17 2,22
Реакция необратимая и относится к реакциям второго порядка. . Вы-
числите энергию активации и стерический фактор, если плотности
d(C,H,)aN = 0,723 и dc,H,Br = 1,456 г/см3.
9. При исследовании кинетики взаимодействия диметилбензилами-
на с метилиодидом в нитробензоле CeH5(CH3)2N + СН31 были получе-
ны следующие данные:
Т, К...................... 273,2 283,2 293,3 303
*-108, см3-моль~1-с-1 .... 0,922 1,64 4,615 9,65
Реакция необратима и относится к реакциям второго порядка. Вычис-
лите энергию активации и стерический фактор, если плотности 4Д =
= 0,956 и dM = 2,28 г/см3.
10. При исследовании кинетики взаимодействия этилиодида с ди-
метилбензиламином в ацетоне CeH5N(CH3)2 + С2Н51 были получены
следующие данные:
Т, К..................... 273,2 283,2 293,2 303,2
*-108, см8,моль~ 1 • с—1. 0,27 0,677 1,518 3,398
Реакция необратима и относится к реакциям второго порядка. Вычис-
лите энергию активации и стерический фактор, если d„ — 0,956;
d9 = 1,933 г/см3.
11. Рассчитайте сумму состояний для линейного активированного
комплекса Н---Н---Вг, если: а) расстояние Н---Н равно 1,50-10"8
см, расстояние Н---Вг • 1,42-10—8 см; б) молекула имеет три коле-
бательные частоты: 2340, 460 и 460 см-1 (четвертая частота соответст-
вует колебанию вдоль барьера и не требуется для расчета).
12. На основе теории абсолютных скоростей реакции определите
температурную зависимость предэкспоненциального множителя для
следующих типов превращений: а) бимолекулярная реакция между
атомом и двухатомной молекулой, приводящая к образованию линей-
ного активированного комплекса; б) тримолекулярная реакция между
двумя атомами и двухатомной молекулой, приводящая к образованию
407
нелинейного активированного комплекса, лишенного степеней свободы.
Колебательная сумма состояний не зависит от температуры.
13. Для элементарной реакции H -j O2 ОН + О известны сле-
дующие данные: а) разность нулевых энергий в активированном и ис-
ходном состояниях равна 62,76 Дж; б) го-о = 0,12 нм; активиро-
ванный комплекс Н—О—О имеет линейное строение с параметрами
гн-о = 0,1 нм и го-о — 0,14 нм; в) частоты колебаний для
О2 v = 1580 см-1, для Н—О—О валентные колебания отсутствуют,
кроме дважды вырожденного деформационного колебания с v =
= 300 см-1; г) трансмиссионный коэффициент х = 1. Электронные
суммы по состояниям не учитываются. Рассчитайте константу скоро-
сти реакции при 800 К.
14. Для реакции Н + НС1 = Н2 + С1 известны следующие дан-
ные: а) разность нулевых уровней энергии в исходном и активирован-
ном состояниях 18,828 кДж; б) конфигурации молекул гн-н —
= 0,13 нм; в) все частоты колебаний достаточно велики и QK0JI = 1;
г) трансмиссионный коэффициент х —1. Электронные суммы по со-
стояниям не рассматриваются. Рассчитайте константу скорости реак-
ции при 600 К.
15. Для реакции О + СО -> О • • • С • • • О СО2 известны сле-
дующие данные: а) разность нулевых уровней энергий в исходном
и активированном состояниях 83,68 кДж, б) гС-о = 0,112 нм; ак-
тивированный комплекс го-с-о = 0,12 нм имеет линейное строение
с указанными размерами; в) все частоты колебаний достаточно велики
(Qko.i кроме дважды вырожденного деформационного колеба-
ния активированного комплекса с v = 200 см-1; г) трансмиссионный
коэффициент х = 1. Электронные суммы по состояниям не рассматри-
ваются. Вычислите константу скорости этой реакции при 500 К-
16. Вычислите константу скорости при 600 К для реакции
Н . . . Н
Н2 4- 12 = . . = 2HI, если: а) активированный комплекс име-
I ... I
ет плоское строение, его три главных момента инерции соответственно
равны: /А = 920-10-40 г-см2, /в = 7-Ю"40 г-см2, /с = 930-10~40
г-см2; б) для молекул исходных веществ гн—н = 0,07 нм, rj_ i —
= 0,25 нм; в) для всех колебательных степеней свободы (?кол = 1,
кроме одного колебания в активированном комплексе v = 100 см-1;
г) трансмиссионный коэффициент х = 1. Электронные суммы по со-
стояниям не рассматриваются; д) энергия активации Ерп =
= 167,36 кДж/моль.
17. Две реакции одинакового порядка имеют равные энергии ак-
тивации, но их энтропии активации различаются на 42 Дж/(моль-К).
Рассчитайте соотношения их констант скоростей при 300 К-
408
18. Вычислите константу скорости димеризации этилена 2С2Н4->
-+ С4Н8 при 673 К, если для 1-бутена \Н = 147 466 Дж/моль; AS* =
— — 147 Дж/(моль-К).
19. Для реакции пиридина с этилиодидом
CgHsN-f- C2H5I C7Hi0NI
при 303 К k = 1,72-10-6 л/(моль-с), AS* — — 118,5 Дж/(моль-К).
Рассчитайте теплоту активации АД* и энергию активации Е.
20. Для реакции бромирования бутен-2-дисульфоната-1,4
CH—CHj—SOjNa
CH—CH j—SOj Na
+ Br;
H;O
Вг—СЯ—CHj—SOjNa
H3C О
so3
+ NaBr
на основании следующих данных:
Т, К................ 293
fe-10-3, мин-1 . . 8,9
298 303
11,0 13,7
рассчитайте теплоту и энергию активации при 298 К, если коэффи-
циент трансформации равен единице и AS* и АД* не зависят от тем-
пературы.
21. Константа скорости k для реакции 2NO тО2^± 2NO2 при
600 К равна 6,63-105, а при 645 К — 6,52- 10а моль,л. Для обратной
реакции k при этих же температурах равна соответственно 83,9 и 407.
Вычислите: 1) константы равновесия для этих температур; 2) энергию
активации Е прямой и обратной реакций; 3) теплоту активации
АД* прямой и обратной реакций.
22. Для реакции разложения оксида азота 2NO N., О2 кон-
станты скорости: при 7\ — 1620 К К — 0,0108 моль/(л-с-атм2); Т.г =-
-= 1525 К k = 0,0030 моль/(л-с-атм2). Рассчитайте АД* и AS* при
температуре 1527 К, используя уравнение теории абсолютных скоро-
стей реакций.
23. Для гомогенных газовых реакций первого порядка энтропия
активации часто бывает незначительной и ею можно пренебречь. По-
лагая, что AS*=0, определите константу скорости и время полупре-
вращения исходного вещества при комнатной температуре (300 К), если
для реакции теплота активации: а) 63-Ю3 Дж'моль; б) 84-Ю3
Дж/моль; в) 105- 10s Дж/моль.
24. Изучалась скорость реакции
SO2 lo,5 О2 SO3
^2
Получены константы скоростей прямой и обратной реакций при раз-
личных температурах:
Г, К . . . . . . 873 879 898 933 938 947
A’j, мин-1 . . . . 82,5 92,0 132,0 196,0 209,0 279
k2, МИН-1 . . . . 9,95 11.8 23,8 52,3 58,25 85,60
409
Вычислите теплоту активации и энтропию активации для прямой и
обратной реакций. Проверьте применимость теории переходного со-
стояния в этих температурных пределах.
25. Определите константу скорости димеризации этилена 2С2Н4 ->
->-СН2 = СН — СН2 —СН3 при 300 К, если стандартные энтропии
этилена и активированного комплекса (при Р = 1 атм), определяе-
мые поступательным, вращательным и колебательным движениями
молекул, даны в таблице:
Вещество Энтропия, ДжЦмоль-К) Дж/(моль*К)
^ПОСТ е0 '•’вращ сО ° КОЛ P=const V=const
2С2Н4 С4Н8 302,63 160,094 132,92 136,69 5,52 18,39 —125,82 -41,80
Опытная энергия активации равна Еоп = 146,30 кДж.
26. Частотный фактор для диссоциаций димера циклопентадиена
в газовой фазе равен 1,3-1013 с-1, энергия активации 146,30 кДж. Вы-
числите: а) константу скорости при 373 К; б) энтропию активации.
27. Для гидролиза сульфамидной кислоты константа скорости ре-
акции k = 1,16-10“3 л/(моль-с) при 363 К, энергия активации
Е = 127,49 кДж/моль. Рассчитайте АЛ*, АД* и AS* реакции.
28. Соединение двух молекул бутадиена приводит к образованию
3-винилциклогексана:
Z"2
СН
сн
сн—сн=сн2
СН2
сн сн,-сн=сн2
сн ^сн
сн2
Предполагается, что активированный комплекс имеет структуру би-
радикала СН2—СН = СН—СН2—СН2—СН—СН = СН2, который за-
мыкается в кольцо соединением двух свободных валентностей. Вычис-
лите константу скорости димеризации бутадиена 1см3/(моль-с)] при
600 К, если опытное значение энергии активации равно fon = 99,024
кДж/моль. Стандартные энтропии даны в таблице:
Вещество Энтропия, Дж/(моль’К) AS*, Дж/(моль-К)
$пост $вращ е0 ° кол P=const V=const
2С4Н6 с8н12 339,42 182,67 270,86 214,85 132,09 183,92 -119,13 —71,06
410
29. Покажите, что при расчете скорости димеризации этилена
2С2Н4 -+ C4HS энтропийный член близок к значению стерического мно-
жителя в теории столкновений. Опытное значение энергии активации
равно Еоа = 146,30 кДж/моль, эффективный диаметр молекулы эти-
лена при 300 К о = 4,9-10-8 см, а опытное значение константы ско-
рости димеризации k = 1,08-10-u см3/(моль-с). Стандартная энтропия
этилена и активированного комплекса при давлениях, равных единице,
приведена в таблице:
Вещество Энтропия, Дж/(моль-К) AStC Дж/(моль-К)
^ПОСТ е0 °вращ 5КОЛ P==const V=const
2С2Н4 С4Нв 302,63 139,20 132,92 136,69 5,52 18,39 —125,82 -41,80
30. Рассчитайте константу скорости для реакции рекомбинации
метильных радикалов при 473 К (реакция второго порядка), если
энергия активации равна нулю, диаметр столкновения — 2,03-10-8 см
по теории столкновений неупругих шаров, энтропия активации —
8,4 Дж/(моль-К) по теории абсолютных скоростей реакций. За стан-
дартное состояние принять 1 моль/см3.
31. Реакция А + В + С->- D протекает по механизму
АДВ^АВ (В AB+Cj±D (II)
Стадия (I) представляет собой обратимую реакцию. Покажите, что за-
висимость константы скорости от температуры выражается уравнением
k = koe-^^^/Rr ,
где АД — изменение энтальпии в стадии (I).
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Химическая реакция протекает в условиях, указанных в таб-
лице (см. с. 412). Определите с помощью теории столкновения ту ки-
нетическую характеристику реакции, которая отсутствует в соответст-
вующем варианте.
2. Определите энергию активации Еа реакции, для которой по
опытным данным при Т, К и парциальном давлении 1,01-10® Па из-
вестна константа скорости реакции fe. Стерический фактор принять
равным 1. Полученную энергию активации и диаметр молекул сравни-
те со значениями, приведенными в справочниках. (Считайте диаметр
атомов равным диаметру молекулы, диаметр молекул считайте исходя
из критических или кинетических данных.)
411
Ответ 3,12-IO-8 см 70,24 см3/(моль- 80,75 кДж 5,21-10-9 с-> 255,96 кДж 177,6 кДж & см 7 256,75 кДж 7,84-10-8 см 3,47-10-7 л/(моль-с) 127,63 кДж 93,43 см3/(моль- 2,50-10-3 л/(моль-с) 5-IO-8 см
Диаметр реагирующих частиц а,>Гь. vp см Г». я—01-о‘г 2,0-10-8 2,6410-8 2,74-10-8 Об О © эд" Об О ЭД 5-Ю-8 5-Ю-8 Об Об Об 1 1 1 О О О © © ЭД • «CD сч сч * эд X © ео О1 —о2 3,5-10-8 3,55-10-8 X X 1 1 С с эд эд хг ЭД 3,8-10-8 2,72-10-8 А.
Стерический фактор р CD © С эд ©*© КЗ 1 © эд" кЗ 1 О сч Об 1 О cd эд с с А. —' КЗ 1 ЭД СЧ © © © — — 1 4,47-10-‘ 1 С эд эд"
Энергия активации Е, кДж/моль сч s'^'i эд эд сч А. сч эд с эд А. © © СгГ сч А. 629,93 100,32 А. 91,86 186,43 А. А. эд эд сч
Константа скорости <ь оо Л ч о 'S W S 7 © эд © л/(моль-с) А. © эд © А. СЧ 1 о л/(моль-с) 2,96 10-3 мнн-f 5,7-10-“ с-1 2,75-10-3 л/(моль-с) & 00 сма/(моль-с) -он-нэ ,1-01-61‘г i-инн е-01 ’SfrZ'S LL к- 5 эд ч -Г
т, к § S Ь*СЧ эд эд эд © эд О эд эд эд эд 8 ЭД эд с 3,33 1440,2 § ЭД ь- ЭД эд сч"< эд г- эд сч эд об
Реакция 04 О + о Z см 04 О Z см H2+I2—+2HI CH3I + C2H5ONa—>СНЭОС2Н5+ CQ Z (в этиловом спирте) СН3СОСН3 = с2н4 + СО 4- Н2 /’ = 760 мм рт. ст. СН3ОСН3—>сн4 + Н 2 + СО /’ = 550 мм рт. ст. C2H5Br+(C2H5)3N—> —>(C5HK)4NBr(B ацетоне) ее X 04 и t 04 X + X 04 0 CH3NNCH3—>с2н8+ n2 /’ = 487 мм рт. ст. N2O—>N2+ l/2O2 /’ = 810 мм рт. ст. С3Н71 + (СНз)21ЧН- > —>(CH3)2C3H7NHI (в этиловом спирте) 2N2O—»2N24-О2 04 О + о Z см t 04 О Z см 04 о + « 04 — И о | 04^2. их сч сч SO2Cl2-^-SO2+ С12 С2Н2 + Н—>СзН3 СН3СО—СН3—>С2Н4+ СО + н2 />=760 мм рг. ст.
В1НВ -Hdes сч эд эд © г- ЭД © С —• СЧ ЭД чф эд © Г-
412
№ ва- рианта Реакция T, К k
1 H + HD—>HD+H 1000,2 0,68-IO-9 л/(с-моль)
2 H + HD—>H2+D 1000,2 0,95- IO-9 л (/с-моль)
3 H+D2—>HD 4-D 1000,2 1,2-10-12 л/(с-моль)
4 H2+ I2-^2HI 647,2 0,0140 л/(мии-моль)
5 H2 + I2—>2HI 629,2 0,00676 л/(мии-моль)
6 H2 + Br2—>2HBr 847,7 8,56-1012 л/(мии-моль)
7 H2+Br2—->2HBr 771,2 3,6-10~4 л/(мии-моль)
8 2HI—>H2+I2 829,2 2,11 • I0-5 л/(мии-моль)
9 2HI—>H2+I2 556,2 0,942- 10~в л/(мии-моль)
10 2HI—>H2+ I2 666,2 0,588-10-3 л/(мии-моль)
11 2H.~>H2 + I2 683,2 0,00137 л/(мии-моль)
12 d+h2—>dh+d 1000,2 1,0-10~9 л/(с-моль)
13 d+h2—>-dh+h 1000,2 2,5-10-9 л/(с-моль)
14 D + DH—>D2 + H 1000,2 0,79-10~9 л/(с-моль)
15 T4-H.—>HT4-H 1000,2 2,2-10~9 л/(с-моль)
16 t+d2—>dtd 1000,2 1,2-10-9 л/(с-моль) . ।
17 2NO—>N2+O2 1893,2 19,18-10-1 л/(с-моль)
18 2NO—>-N2+O» 1628,2 38,43-10‘ л/(с-моль)
19 2NO—>N2 + O2 1473,2 62,46-103 л/(с-моль)
20 2NO—>N2 + O2 1235,2 39,82-103 л/(с-моль)
21 2NO—>N2 + O2 1259,2 6,72-103 л/(с-моль)
22 N2O6—>2NO2+ %O2 571,2 2,03-10-3 л/(мии-моль)
23 ^2^5 *^2^44“ ^2^2 611,4 286-10~3 л/(мии-моль)
24 n2o5—>n2o4+ ho2 581,4 7,9 л/(мии-моль)
25 2N2O—>2N2 + O2 1351,2 110,9-Ю3 л/(мии-моль)
26 2N2O—>2N., J- O2 1441,2 977,0 л/(мии-моль)
3. Для реакции (А), протекающей по n-му порядку, известны кон-
станты скорости при различных температурах. [Для реакции п — 1
k имеет размерность с“\ адляп = 2 размерность k будет см3/(с-моль).]
Рассчитайте: а) энергию активации; б) предэкспоненциальный мно-
житель; в) теплоту активации; г) энтропию активации; д) температур-
ный коэффициент скорости реакции.
Хе ва- рианта Реакция (4) Т, к k
1 CI
Гидролиз (СН2)вС в 80%-ном этаноле 273 1,06-10-5
1 298 3,19-10~4
С1 308 9,86-IO"4
л=1 318 2,92-10-3
2 N2O—>N2O4+ ‘/2Оа 273,1 7,87-10-7
п = 1 288,1 1,05-10-5
283,1 1,76-10-5
298,1 3,38-10-5
308,1 1,35- Ю-4
313,1 2,47-10-4
318,1 4,98-10-4
413
Продолжение табл.
№ ва- рнанта Реакция (4) т. к k
323,1 7,59-10-4
328,1 1,50-10-«
338,1 4,87-10-’
3 Разложение ацетодикарбокснльной кис- 273,2 2,46-10-’
лоты в водном растворе, п = 1 293,2 47,5- 10"’
333,2 5480-10"в
273,2 7,67 -10-7
4 С2Н6Вг—>С2Н4 + НВг 298,2 3,46-10~6
л = 1 308,2 1,46-10-4
318,2 4,98-10-<
328,2 1,50-10-3
338,2 4,87-10-’
5 CjH6Br—fCjH4 4-HBr 750 4,539-10-8
п= 1 760 7,194-IO"8
770 1,125- 10"’
780 1,741-10“’
790 2,667-10-2
800 4,140-10-2
6 NjO4—>2NO2 300 3,288-10’
п — 1 310 6,652-10’
320 1,259-107
330 2,398-107
340 4,295-107
350 7,447-107
7 i0«Mo-(CHsCHO)8—>ЗСН8СНО 500 5,175-10-’
п — 1 510 1,238-10-4
520 2,345-10-4
530 6,455-10~4
540 1,404-10-’
550 2,994-10-8
8 СН,СН = СНСН8 + НВг—> 300 7,638-10'7
—>СН8СН2СНВгСН, 310 2,055-10-’
п = 2 320 6,309-10-’
330 1,888-10-’
340 5,188-10-’
350 5,902-10-*
360 3,020-10-4
9 Н2 4~ С8Нд—►СаНб 600 7,413-10-’
п = 2 610 1,343-10-’
620 2,38-10-’
630 4,149-10-’
640 7,145-10-’
650 7,586-10-1
660 1,995-10-'
500 7,834-10'4
10 Н2 + 12—>2Н1 510 1,714-10-’
п = 2 520 0,243-10-3
530 7,48-10-3
540 1,503-10-’
550 2,930-10-’
560 5,610-Ю-2
414
Продолжение табл.
№ ва- рианта Реакция (Л) т, К k
и Н1 + СН31—>СН4 + 12 400 9,954-10-8
п = 2 410 2,780-10-*
420 7,396-10-*
430 1,884-Ю-9
440 , 4,592-Ю"8
450 5,370-10-9
460 2,427-Ю-2
12 2Н1—>Н2+12 500 2,938-10-6
л = 2 510 7,096-10-6
520 1,652-10-5
530 3,732-Ю-6
540 8,185-ю-6
550 1,742-1 О’-*
560 3,606-10-4
13 2NO2—>2N0+O2 359 1,119-ю-4
л = 2 360 4,130-Ю-4
370 1,119-10-’
380 2,999-10~9
390 7,499-10-»
400 1,786-10-»
410 4,083-10-»
14 СН8СООС2Н5+ NaOH—► 280 24,378
—*CH3COONa 4- C2HSOH 290 48,865
n = 2 300 93,540
(растворитель H2O) ЗЮ 122,460
320 216,272
15 CH3Br + Nal—>CH3I + NaBr 330 216,272
280 8,395-10-’
л = 2 (растворитель H2O) 290 ' 300 2,075-10-1 7,55-10-'
310 2,032
320 5,152
16 330 1,233
2H2C = НС-НС = CH2—> СН2—СН2—СН3 503 513 0,531 0,751
। —>сн2=с 523 527 1,19 1,40
сн2—сн=сн2 Я г- 9 530 540 1,70 2,43
П — л. 555 4,18
578 9,85
606 25,4
622 44,5
17 СН4+Н2О = СО + ЗН2 642 973 84,4 0,14-10-4
л~2 1023 0,28-Ю-4
1073 < 0,14-Ю-9
1221 0,012
1273 0,018
1323 0,024
415
ГЛАВА XXV
КИНЕТИКА ФОТОХИМИЧЕСКИХ И ЦЕПНЫХ РЕАКЦИЙ
Основные уравнения и символы
[К., с. 658-680; Г., т. 2, с. 183—254]
Изменение интенсивности светового потока, прошедшего через
слой раствора толщиной I, выражается законом Ламберта—Бугера-
Бера
(XXV.1)
где / — интенсивность светового потока после поглощения в слое раст-
вора толщиной I см; /0 — интенсивность светового потока до прохож-
дения поглощающего слоя; k — молекулярный коэффициент поглоще-
ния; п — число поглощающих молекул в 1 см3.
Энергия, поглощенная средой, выражается законом Вант-Гоффа
£ = /0(l-t-toZ), (XXV.2)
где Е — количество энергии, поглощенной за единицу времени.
Количественной характеристикой фотохимических реакций явля-
ется квантовый выход у реакции, т. е. число прореагировавших моле-
кул на один поглощенный квант светового потока (закон Штарка—
Эйнштейна). Этот закон постулирует, что на один поглощенный квант
света приходится одна претерпевшая превращение молекула, т. е.
с точки зрения этого закона у = 1. Однако у учитывает число превра-
щенных частиц, полученных и во вторичных, чисто химических актах
превращения:
y = npMai (XXV.3)
где у — квантовый выход; пр — число молекул в единице объема,
которые прореагировали в результате поглощения кванта светового
потока за единицу времени; па — число квантов светового потока, по-
глощенных в единицу времени тем же единичным объемом раствора,
na = Elhv.
Кинетическое уравнение (для первичного фотохимического акта
или для нецепного фотохимического процесса)
(XXV-4)
dz hv
Скорость цепной реакции по какому-либо компоненту равна ско-
рости той стадии продолжения цепи, в которой образуется или расходу-
ется рассматриваемый компонент. Так, если звено цепи состоит из
двух элементарных реакций, в каждой из которых расходуются исход-
ные вещества и образуются продукты реакции
Rj-f-Aj—* By-(-R2; R^-j-Aa—* B2-4~Ri’
416
где /?i — свободные радикалы, то скорость цепной неразветвленной
реакции описывается уравнением
”^ = *1 tR'l [А]’ (XXV.5)
dr аг
При написании дифференциальных уравнений для концентраций сво-
бодных радикалов следует учитывать скорости процессов зарождения
и обрыва цепей. Как правило, в результате зарождения образуется
какой-либо один из свободных радикалов, участвующих в цепном про-
цессе, например R j. Обозначив скорость зарождения через щ0, ско-
рости гибели свободных радикалов — через wri и wrt, можно напи-
сать
=«<□—*! [RJ] [АИ+Й2 JR'] [А2]~wrt, (XXV.6)
d [R2]
[Ad —^2 [R2] [A2] = , (XXV.7)
dr 1
где w0 представляет собой функцию концентрации исходных веществ
или каких-либо инициирующих добавок и не зависит от концентра-
ции свободных радикалов; wrt и иоГг — функции концентраций сво-
бодных радикалов. Поскольку свободные радикалы являются высоко-
активными промежуточными частицами, их концентрацию практиче-
ски на всем протяжении процесса можно считать стационарной, т. е.
w0 = wrt-j-wr2. (XXV.8)
В стационарном режиме скорость зарождения цепи равна скорости
гибели цепи. Если принять, что обрыв цепи идет только на одном из
свободных радикалов при достаточно длинных кинетических цепях,
т. е. v > 10, то соотношение (XXV.8) преобразуется:
w0 = wr; (XXV.9)
для линейного обрыва цепи
«-0=MRd. (XXV. Ю)
Скорость цепной неразветвленной реакции для линейного обрыва
цепи будет
w = ki (wjks) [Aj],
а для квадратичного обрыва цепи
ау0 = 2Л3 [RfP (XXV. 11
И
w = kt l/w„/2k3 [AJ,
где k3 — константа скорости реакции обрыва цепи.
14 Зак. 767
417
Стадия продолжения цепи, протекающая с участием свободного
радикала, на котором происходит основной обрыв цепи, является ли-
митирующей стадией звена цепи и индекс i относится к лимитирующей
стадии продолжения цепи. Длина цепи v цепной неразветвленной ре-
акции равняется скорости цепной реакции, деленной на скорость об-
рыва цепи (или на скорость зарождения цепи). Поэтому для линейно-
го обрыва цепи
v = (ki/k3)[At], (XXV.12)
а для квадратичного обрыва цепи
v = —=г[А;]. (XXV.13)
"|/2^о
Порядок цепных реакций по отдельным компонентам и эффектив-
ную константу скорости можно определить по данным кинетики на-
копления продуктов или по расходованию исходных веществ. Эффектив-
ная константа представляет собой комбинацию константы скоростей
зарождения, продолжения и обрыва цепей. Зависимость эффективной
константы скорости от температуры описывается уравнением Арре-
ниуса. При этом для линейного обрыва цепей измеряемая эффектив-
ная энергия активации определяется по уравнению
Еафф = Е 0-!rE1—Е3, (XXV.14)
где Ео — энергия активации зарождения цепи; Ег — энергия акти-
вации реакции продолжения цепи, протекающей с участием менее ак-
тивного свободного радикала; Е3 — энергия активации обрыва цепи.
Аналогично для квадратичного обрыва цепей будет
£эфф= 1/2 £o+£i-1/2 Е3. (XXV.15)
Скорость разветвленной цепной реакции может быть описана урав-
нением
—— = tfiip-f-qpn, (XXV.16
d t
п — суммарная концентрация свободных валентностей; —
скорость зарождения цепи; <р — разность скоростей разветвления и об-
рыва цепи. Если оба эти процесса первого порядка по концентрации
свободных радикалов, то скорости их могут быть записаны в виде
fn и qn, тогда
d п
= №„-(?-/) п. (XXV.17)
dr
В таком виде уравнение (XXV. 17) описывает разветвленные реакции.
Если q> f, то в системе устанавливается стационарная концентрация
свободных радикалов:
n-—wa/(q—f). (XXV.18)
418
Наличие реакции разветвления приводит лишь к увеличению стацио-
нарной концентрации, что эквивалентно уменьшению скорости обры-
ва при f = 0. Тогда в системе протекает стационарная цепная реак-
ция, по своим кинетическим закономерностям не отличающаяся от
цепных неразветвленных реакций. Если f>q, f — q = Ф > 0, то
интегрирование уравнения (XXV. 16) дает
(XXV.19)
ф ' '
ИЛИ При (pt > 1
л = ^- (XXV.20)
Из уравнения (XXV.20) видно прогрессивное нарастание концентра-
ции свободных радикалов, а следовательно, и скорости цепной реак-
ции. Через каждые 1/<р с концентрация свободных радикалов, а следо-
вательно, и скорость цепной реакции возрастают в е раз и за время не-
скольких интервалов 1/<р практически полное отсутствие реакции сме-
няется взрывным протеканием процессов. Для разветвленных цепных
реакций характерно наличие двух резко различающихся режимов
протекания процесса. Если скорость обрыва больше скорости развет-
вления цепей, то обеспечивается стационарный режим процесса, при-
чем скорость процесса неизмеримо мала. Если скорость обрыва мень-
ше скорости разветвления, то развивается нестационарный автоуско-
ряющийся процесс, заканчивающийся цепным воспламенением смеси.
Переход от условия > f к условию f>q может произойти при не-
значительном изменении одного из параметров, определяющих ско-
рости обрыва или разветвления цепи: давления, температуры, состава
смеси, размера реакционного сосуда, состояния стенок сосуда. Таким
образом, незначительное изменение одного из параметров может вы-
звать переход от неизмеримо медленной стационарной реакции к бы-
строму взрывному процессу или наоборот. Такие явления в химиче-
ской кинетике называют предельными или критическими. Параметр,
при котором происходит переход от одного режима к другому, назы-
вают пределом воспламенения.
ЗАДАЧИ С РЕШЕНИЯМИ
1. На основе следующих данных оцените квантовый выход разло-
жения уранилоксалата для каждой длины волны:
Длина волны, нм Доля разложив- шегося оксалата Число разло- жившихся моле- кул-10-18 Число погло- щенных фото- нов«10“’8
365,5 0,0592 6,18 10,58
365,5 0,0498 4,32 8,93
435,8 0,0242 2,10 3,64
435,8 0,0208 1,79 3,10
14!
419
Решение. Рассчитаем квантовый выход по уравнению (XXV.3)
при 365,3 нм:
Число разложившихся молекул 6,18-Ю18
V Число поглощенных фотонов 10,58-10й
Для остальных измерений у равен 0,483; 0,576; 0,577 соответствен-
но.
2. Фотохимическое бромирование толуола протекает по следую-
щему брутто уравнению:
Вг, + СвН5СН3^СвН5СН2СН2СвН5 + НВг + С2Н5СН2Вг
Реакция протекает по цепному механизму, на что указывает вы-
сокий квантовый выход. Напишите схему механизма цепной реакции,
если обрыв цепи происходит на свободном радикале бензила, а сво-
бодные радикалы образуются при фотохимическом распаде Вг2. На-
пишите стехиометрическое уравнение цепной реакции, если длина
цепи V. Определите, сколько молекул Вг2, СвН5СН3 расходуется и
сколько молекул СвН5СНаСН2СвН5, НВг и СвН5СНаВг образуется в
одной цепи, если ее длина v — 50.
Решение. Цепные реакции являются сложными реакциями и,
строго говоря, не могут быть описаны одним стехиометрическим урав-
нением. Это объясняется тем, что часто обрыв цепей приводит к по-
явлению некоторых побочных веществ. Реакция бромирования толу-
ола протекает по следующему механизму;
Br2 + hv —»- 2Вг" ( реакция зарождения )
Согласно условию обрыв цепи происходит на радикале бензила
(обрыв цепи)
Так как длина цепи v, то (v + 1)-е звено окажется неполным. В ре-
зультате этого на последнем звене израсходуется молекула толуола,
образуется молекула НВг, но не образуется бензил бромида и не
израсходуется молекула Вга. Если еще учесть, что половина молекулы
420
Вг2 была израсходована в процессе зарождения цепи, то полное урав-
нение процесса можно записать в вйде
(v + V2) Вг2 + (?+1) с,н8сн3 -»»/2 свн5сн2сн2свн5+
+ (v + l) НВг- vC,H5CH2Br
Это уравнение можно рассматривать как стехиометрическое уравнение
цепной реакции. В отличие от обычных стехиометрических уравнений
величина v зависит от условий протекания реакции.
Определяем число молекул, образовавшихся и израсходованных
при v = 50:
51 НВг; 50C6HsCHBr
3. Кинетика фотохимического хлорирования муравьиной кислоты
в газовой фазе описывается дифференциальным уравнением
_ d =fe[Cl2] [НСООН].
а/
Реакция цепная, на что указывает высокий квантовый выход. Со-
ставьте дифференциальное уравнение, если реакция идет по следую-
щей схеме:
C12 + Av-^- 20• (зарождение цепи),
Л. \
С1 • + НСООН -Д НС1 + -СООН (продолжение цепи)
С12+ .СООН Д- НС1+СО2 + СГ ’
СР + стенка О (обрыв цепи).
Решение. Скорость данной цепной реакции определяем по
формуле
ау = *г [А,].
Так как цепь обрывается на атоме С1, то можно считать, что kt — klt
lAJ = [НСООН]. Так как w0 = k0 [С1а1, то
и» = |С12] (НСООН].
Отсюда
k = kvk1/ka.
421
4. Фотохимическое окисление 5 М дибензилового эфира (СвН5СН2)2О
в жидкой фазе молекулярным кислородом развивается по следующей
схеме:
k
RH • R- (зарождение цепи),
R‘-l-0 —S )
2 | (продолжение цепи),
RO-2+RH Л- ROOH+R- I
R0'2 + R0'2 (обрыв цепи).
Реакция идет с энергией активации Е = 28,5 кДж при интенсивно-
сти светового потока 10-’ £-л-1-с~1 и со скоростью ыу = 9,5-10~в
моль-л-1-с-1. Скорость зарождения цепи, измеренная методом ин-
гибиторов, = 9-10-8 моль-л-1-с-1. Реакция окисления дибензи-
лового эфира при инициировании азо-«зо-бутиронитрилом имеет
энергию активации Е = 93,6 кДж, энергия активации распада азо-
ызо-бутиронитрила 128,9 кДж. Рассчитайте длину цепи и энергию акти-
вации каждой стадии.
Решение. Кинетика цепной неразветвленной реакции описы-
вается уравнением
w = kt Vffi>0/2*3 [А;].
Так как [А;] = [RH], kt = k2, то w = ——— ’jAy0 IRH], Отсюда
V2fe3
k. 1/Г-9,510-«
--— — ----- -------- =8,9-10-3 МОЛЬ - '/г • л'/г С~ '/г.
1/9-10-8-5
Длина цепи реакции будет v = w/w0 = 105. Энергия активации
Е = 1/2 Ео + Ё2 — Ё2Е3. Так как фотохимическое инициирование
является элементарной фотохимической реакцией, то ее энергия акти-
вации равна нулю. Следовательно,
Е2—*/2 £3 + 28,5 кДж.
Так как
Е2—0,5 Е3 = Е—0,5 Ео = 9$,6—0,5-128 ,9 = 28,9 кДж.
Поскольку энергия активации процессов рекомбинации и диспропор-
ционирования свободных радикалов близка к нулю, то полученная
величина Е2 — 0,5£3 « Е2.
5. В цилиндрическом кварцевом сосуде диаметром 4 см, заполнен-
ном стехиометрической смесью 2Н2 + О2, под давлением 10 мм рт. ст.
и при температуре 788 К протекает цепная реакция. Рассчитайте кон-
станту скорости гибели атомов Н, если эффективность захвата атомов
Н кварцем составлет <&н - 1,3-10-3. Диаметр атомов водорода
стн + 1,90-10~8 см, молекул водорода он, = 2,40-10~8 см, молекул
кислорода По, + 2,98-10~8 см.
422
Решение. Для цилиндрического сосуда константа скорости
обрыва цепей равна
__________1_______
г== (r*/8D) + (2r/gu) ’
где г — радиус сосуда; D — коэффициент диффузии; S — эффектив-
ность захвата; и — относительная скорость движения атомов.
Коэффициент диффузии рассчитываем по формуле молекулярно-
кинетической теории газов
О = !/3 и 1,
где и — скорость движения частиц; X — длина свободного пробега;
Х = и/2 стг- иг П{,
где <тг — сечение соударений свободного радикала с i-й частицей из
числа всех частиц, присутствующих в реакционном сосуде; пг — число
i-частиц в 1 см3; и — относительная скорость движения свободных ра-
дикалов и i-х частиц. Для данной системы
Gi П\ —|- Gg Wg Zig
относительные скорости движения Н и Н2
i = = V S-S-31-107'78» =5,05-103 см/с,
У яМ* V 3,14-0,66
относительная
скорость движения Н и О2
й2 = 1Л8Л31-107-788 = 4,2-103 ем/с.
У 3,14-0,97
Число молекул Н2 и О2 в 1 см3 будет:
2
”'=РТ
1
п,= Р —-
2 3
0,97-101»
= 8,2.101з/>;
Т
0,97-101»
---------= 5,1- 1О‘з Р.
Т
Относительная скорость одной молекулы
u = l/'±8^kZ88 = 4,15.103 см/с.
Сечения соударений атомов Н с Н2 и О2 равны:
л .j = n (0,95+1,20)2 10-!»= 1,45-10-13 С!д
л f = n (0,95+1,49)2 10-i«= 1,89.10-13 см2.
423
Следовательно,
1 (4,15-Ю6)2
D =------------------------------2--------------------------------
3 1,45-10~15-5,05-IO5 -8,2 • I О'15 Z3- 1,89-10’16-4,1 -10l5-4,9-10ь Л
1 17,22-106 6,2-103
—------------------------------- см3/с;
3 60P + 61,51P P
тогда
г2
8D
---------= 8- 105P c = 8. IO'4 c,
8-6,2-103
2r _____________4_________
£u ~ 1,3-IO-3-4,15-105
Отсюда
8-10-4—f-7,4-10-3 8,2-10-3T
ЗАДАЧИ
1. Кварцевый реактор, содержащий бензол, насыщенный 10 %
хлора, облучали световым потоком (А, = 313 нм). Продолжительность
облучения 35 мин. В результате реакции был получен гексахлорцикло-
гексан. Определите квантовый выход реакции, если энергия, прошед-
шая через кварцевый реактор с чистым бензолом, 46,81 Дж, а энергия,
прошедшая через реактор во время реакции, 4,25 Дж. Выход С6Н6С1
составил 1,8 г.
2. При прохождении светового потока с X = 400 нм через реактор,
в котором протекала реакция по уравнению СО + С12 = СОС12, было
получено 100 г фосгена; количество поглощенной газом энергии элек-
тромагнитного излучения £абс = 3-102 Дж. Рассчитайте квантовый
выход.
3. Определите для образования 1 моль озона при квантовом вы-
ходе у = 2 количество энергии электромагнитного излучения X —
= 207 нм, которое поглотит кислород, превращаясь в озон; ЗО2 = 2О3.
4. Термическое разложение ацетона происходит при 578 К на
25 % за 90,9 с, при 601 К — за 31 с. Фотохимическое разложение
осуществляется при длине волны 313 нм с квантовым выходом у = 2.
Рассчитайте константу скорости мономолекулярного термического
разложения ацетона, энергию активации этого процесса и расход
энергии электромагнитного излучения (Дж/моль) в фотохимическом
процессе. Будет ли общий расход энергии электромагнитного излуче-
ния соответствовать вычисленному?
5. Вычислите энергию активации для реакции, протекающей по
уравнению
СН2С1СООН + Н2О = СН2( ОН)СООН + НС1
424
по &з5зк — 2,22-10“5 и &4озк = 2,37-10-3 мин-1 и сравните с энер-
гией, которую получает система при фотохимическом активировании
от освещения с длиной волны 253,7 нм, при квантовом выходе у = 1.
Как изменяется валентность хлора в этой реакции? Как и почему будет
изменяться электрическая проводимость во времени?
6. Составьте систему уравнений зарождения и развития цепи в га-
зовой смеси Н2 + С12 при фотохимическом процессе. Достаточно ли
светового потока от источника с длиной волны X = 0 475,8 нм для
инициирования цепи? Каковы тепловые эффекты в элементарных актах?
Рассчитайте количество поглощенной лучистой энергии при образова-
нии 1 моль НС1 и квантовом выходе у = 105. Свободные радикалы от-
метьте точкой.
7. Кинетика фотохимического хлорирования тетрахлорэтилена в
растворе СС14 описывается уравнением
Реакция цепная, на что указывает высокий квантовый выход, а так-
же дробный порядок реакции. Получите приведенное дифференциаль-
ное уравнение, если реакция идет по следующей схеме:
С124-Л v —2СР (зарождение цепи),
ft,
Cl’+CgClj------>• 'C^Clj (продолжение цепи),
•С2С16+С12 С1-+.С2С1в
•С2С16-|-'С2С15 —С2С1в + С2С14 (обрыв цепи).
8. Кинетика термического распада дихлорэтана в газовой фазе
описывается уравнением первого порядка
d[C2H4Cl2]j
— к [С2п4С12j .
a t
Получите приведенное дифференциальное уравнение, если реакция
протекает по следующему механизму:
С2Н4С12 —'С2Н4С1 +СР (зарождение цепи),
£
С2Н4С124-С1------► • С2Н3С12-рНС1 (продолжение цепи),
•С2Н3С12 С2Н3С1-рС1-
ь
С2Н3С124-стенка-----► (обрыв цепи).
425
9. Для термического разложения окиси этилена был предложен
следующий механизм:
+ Н (зарождение цепи)
СН,—СН —СН, +
\о/
СН2—сн2 + сн2 —
V . *4
СН2 — СН + СН, ---2-»-
со
сн2—сн + сн4
\z
> (продолжение цепи)
(устойчивые продукты)
Предполагая, что концентрации радикалов стационарны, покажите
что реакция разложения имеет первый порядок по окиси этилена.
10. При 300 К распад циклопропана (С) с образованием пропиле-
на (Р) идет через промежуточное образование триметиленового бира-
дикала (Т):
С ~—- Т +226,8 кДж; Д S» « 42,0 Дж/(моль-К);
k,
Т Р —258,2 кДж; Д S» = 8,4 Дж/(моль-К);
С —► Р — 31,4 кДж/моль; ДХ° = 33,6 Дж/(моль-К).
Выразите скорость изомеризации через константы klt k3, k3 (изме
пением давления пренебречь). Вычислите общую энергию активации
изомеризации, если для k3 энергия активации равна 46,2 кДж/моль,
а Е2 = 16,8 кДж/моль. Рассчитайте среднее время жизни частицы
Т в системе, если k03 = 1-1014 с-1. Вычислите константу скорости для
суммарного распада, если предэкспоненциальный множитель k03 =
= 2-1013 с'1.
11. Реакцию окисления СН4 кислородом
СН4 + О2 —> СО2+Н2О
проводили при помощи фотосенсибилизации:
h v
Hg -----------------------------Hg*
CH4 + Hg* —► Hg*+-CH3+-H
Радикалы ’CHg реагируют с О2 с образованием смеси продуктов
О
II
СО2, СО, НС' Основной продукт реакции диоксид углерода СО2. Ко-
426
личество прореагировавшего СН4 6,1-104 молекул/с. Энергия электро-
магнитного излучения 8,7-10~14 Дж/с, температура опыта 298 К,
1 = 253,7 нм. Определите квантовый выход реакции.
12. Фотосенсибилизированная реакция брома с водородом в из-
бытке Н2 при 423 К представляет собой цепной процесс, протекающий
по схеме:
Br24-Av —> 2Вг (зарождение цепи),
1
Вг-|-Н2 НВг + Н (реакция смешанного второго порядка),
2
Н-|-Вг2 HBr^-Br (реакция смешанного второго порядка),
4
Вг + Вг-|-Н2 у Вг24-Н2 (реакция смешанного третьего порядка)-
Пользуясь методом стационарных концентраций, выразите стацио-
нарные концентрации атомов Н и Вг через концентрации других про-
дуктов, константы скоростей и скорость реакции инициирования. На-
пишите дифференциальное уравнение для стационарной скорости об-
разования НВг. Вычислите квантовый выход образования НВг. При
каких условиях квантовый выход будет наибольшим? Каков физиче-
ский смысл этого явления?
13. Цепная реакция распада О3 в газовой фазе, катализируемая
N2O5, протекает по механизму
NA 7Д2 no2+no3 *!,2«1 (1,2)
NO2 + O3 NO3 + O2 (3)
2NO3 —- 2NO2 + O2 (4)
Предполагая, что реакция (1) первого порядка, а все остальные
реакции — реакции второго порядка, напишите уравнения для ско-
рости расходования исходных веществ и накопления конечных и про-
межуточных продуктов. Примените метод стационарных концентраций
к частицам NO2 и NO3 и подсчитайте их стационарную концентрацию.
Выразите скорость расходования О3 через концентрации О3 и N2O5
(N2O5 в реакции не расходуется). Напишите уравнение для скорости
расходования О3, если в схему вместо реакции (4) ввести реакцию
^3
О3 + NO3-<- 2О2 + NO2. Можно ли экспериментально установить
различие между полученными уравнениями скоростей?
14. Реакция термического разложения озона протекает по меха-
низму
О34-М ;—- О24-О + М
к,
О + О3 — - 2О2
427
где М — валентнонасыщенная молекула. Используя метод стационар-
ных концентраций, получаем уравнение для скорости разложения
озона:
d [О3] _ k3 [О3р [М]
dZ kt [Оа] (Ml + k3 [O3] ’
По этому уравнению и энергиям активации Et = 103,0 кДж/моль;
Е3 = 0 кДж/моль; Е3 = 12,6 кДж/моль вычислите эффективную
энергию активации для реакции разложения озона: а) при полном от-
сутствии кислорода; б) в избытке кислорода.
15. При помощи метода стационарных концентраций выведите вы-
ражение для скорости реакций хлора с водородом по схеме
С12ДМ -A- 2С14-М
С1 + Н2 —- HCl-j-H
НЧ-С12 — - НС1ДС1-
Н+О2 но2
ci+o2 -А- сю2
С1 + Х -±._ Cl X
где М — некоторое вещество (которым может быть и поверхность ре-
акционного сосуда), влияющее на диссоциацию молекул хлора; X —
некоторое вещество, связывающее атомы хлора. Скорость образования
хлороводорода можно принять равной ka [ННС1а1; так как k2 < k3, то
Можно пренебречь членами с [Н] [Оа]2.
Получите выражение для скорости: а) при полном отсутствии кис-
лорода; б) в присутствии кислорода. Используя значения Ег =
~ 117,4 кДж/моль; Ег = 25,2 кДж/моль; Е3 = 8,4 кДж/моль; Е4 =
-- 0 кДж/моль; Е5 — 0 кДж/моль, вычислите эффективную энергию
активации в обоих случаях.
16. Механизм реакции На + Вг2 = 2НВг:
Вг2 —2Вг
Вг4-Н2 —HBr-J-H
Н4-Вг2 —НВг + Вг
Н + НВГ Н24-Вг
2Вг —Вг2
Переносчиками цепей служат атомы водорода и брома. Скорость
образования бромоводорода выражается уравнением
d [НВг]
— =МВг] [На]-|-/г3 [Н] [Вг2] —/г4[Н] [НВг].
428
После некоторых преобразований и замен получаем уравнение
d [HBrJ _ 2M*i/fr)17‘
dz - 1+(^з)/([НВг]/[Вг2]) •
Используя это уравнение и следующие значения энергии активации:
£\ = 189,5 кДж/моль, Е2 = 740 кДж/моль, Е3 = 5,04 кДж/моль,
Et = 5,04 кДж/моль, Е5=--0 кДж/моль, рассчитайте эффективную
энергию активации реакции брома с водородом: а) в начале процесса
и б) в присутствии большого избытка бромида водорода.
17. Вычислите энергию активации для реакции зарождения цепи
при окислении бутана, если по истечении 100 с от начала реакции по-
лучены следующие данные:
Т, К....................... . .
<р, с~1 .........................
п, см3-с-1 ..................
540 543 553
2,5 -10-2 2,3 10-2 2,0-10"2
2,16-10* 1,98-10* 1,86-10»
Реакция окисления бутана—цепная, разветвленная.
18. При изучении цепной реакции окисления изопропилбензола
+ RH
были получены следующие данные:
t, Ч (О, моль/(л •ч) <о., моль/(л-ч) (D [RH], моль/л
V [ROOH]
1,00 0,20 0,106 0,630 10
2,00 0,417 — т —«
2,83 0,556 — — —
3,67 0,750 — — У
Определите длину цепи и выведите выражение скорости разветвления
цепи.
19. На рис. 49 приведена область воспламенения для системы
СО 4- О2. Опишите зависимость интервала воспламенения от темпе-
ратуры и состава газовой смеси и объясните нижний и верхний пределы
воспламенения. Какие радикалы могут снизить температуру воспла-
менения при наличии влаги в этой газовой смеси?
429
е- 60
Е 40
Ч
S 20
о?
560 ‘ 600 620 640 ' 660 Т,К
Рнс. 49. Область воспламенения прн
различном содержании О2:
I - 90%; 2 — 33%
20. Сферический кварцевый со-
суд диаметром 10 см заполнен сте-
хиометрической смесью 2Н2 + О2
под давлением 20 мм рт. ст. и
515 К, где протекает цепная реак-
ция. Рассчитайте константу скоро-
сти гибели атомов Н, если эффек-
тивность захвата атомов Н кварцем
составляет <^н=1,3-10"3. Диаметр
атомов (см): Н— 1,90-10-8,
Н2 — 2,40 • 10"8, О2 — 298-10"8.
21. Определите энергию поглощенного света 1 кДж/моль при
протекании фотохимической реакции Вг2 + С6Н12 —> СвНцВг + НВг,
если за время освещения прореагировал 1 моль Вг2. Длина волны мо-
нохроматического света 470 нм. Квантовый выход у = 1.
22. Определите энергию поглощенного света 1 кДж/моль при
Av
протекании фотохимической реакции СН3СООН —> СН4 + СО2, если
за время освещения прореагировал 1 моль уксусной кислоты. Длина
волны монохроматического света 230 нм. Квантовый выход у = 0,5.
23. Определите, пользуясь справочными данными [М.], энергию
поглощенного монохроматического света при разложении 1 моль
СН3СОСН3 по уравнению реакции СН3СОСН3—> С2Н6 + СО, про-
текающей в газовой фазе при 333 К.
24. Какой коэффициент поглощения имеет 0,25 М раствор с по-
глощающим слоем 10 см и пропусканием 90 %?
25. Сколько лучистой энергии необходимо, чтобы Na молекул
ацетона возбудить светом с длиной волны 253,7 нм? Сравнимо ли это
количество с энергией связи С = С?
26. При облучении паров HI УФ-светом с длиной волны 207 нм
образуются Н2 и 12. При энергии излучения 1 Дж распадается 0,00044г
HI. Определите квантовый выход.
27. В реакционном сосуде вместимостью 1 л находятся водород Н2
(парциальное давление V2 атм) и С12 (парциальное давление */2 атм).
Эта газовая смесь облучается при комнатной температуре светом с
длиной волны 400 нм. При этом поглощается 6,28 Дж энергии и дав-
ление увеличивается на 9013 атм. Каков квантовый выход?
28. Натриевая лампа (1000 Вт) излучает большую часть энергии
при длине волны 589 нм (£>-линия). Как долго следует облучать пробу
из Na/ 1000 молекул этой лампой, с тем чтобы по крайней мере полови-
на молекул прореагировала ?
МНОГОВАРИАНТНАЯ ЗАДАЧА
Реакция Ах + А2 = Вх Ц- В2 протекает по цепному не развет-
вленному механизму. Зарождение цепи происходит в результате вза-
имодействия кванта света с одним из реагирующих компонентов или
430
Молекула, которая образуется НС1 «0 боб JXX НС1 НС1 НВг я б о о СОС12 С0 Я jX НВг 1 । НВг 61 X о
Молекула, которая распада- ется § о о X Я я ДО оХХ я я оо я б я X « X о ю X я б о XX Я га Я X о 1 С5 X о О я о
1 Свободный радикал, на котором происходит гибель цепи о •С2Н6 •С2Н3С12 •С2Н3С12 и X я X о Л X «0 О б 'и и СО X 6 1 я X •о
я >
S Е я Ю о СО ю о о о 8S О <5 ° я О
5 S ю СО
Вещество, с которым взаимодей- ствует квант света или происходит термический распад 64 б я б -х я б я б я га я б я б XX оо я га я га о 1 X о о п X о
Л X
б t
Реакция С12+HCOOH-^НС1 + со2 СаНвЧ- С12 ►CgClg Термический распад С2Н4С12 б X я X + я б о X СЧ Я X + я б СвН6—СН3+Вг2-^НВг+ + СвН5СН2Вг+свн6сн2 = сн2— я б р ft я б + о о я о о я б о о Пиролиз метана СН4 Пиролиз метана СН4 И X СЧ 4 Я га я X га X О) « 1 я га X 2О3-ХзО2 Термический распад СН2СОСН3- -^СН4 + с2н6—>сосн8 Термический распад СН3ОСН3— —+СН4+СО4-Н2
вхнвийва «X сч Л М" ю* о 00 о> о СЧ СО rf ю
431
посредством термического воздействия. Предполагая, что реакция про-
должения цепи идет через две элементарные стадии, а гибель цепи
происходит на одном из участвующих в процессе свободном радикале,
запишите:
1) схему предполагаемого механизма цепной реакции; 2) стехио-
метрическое уравнение цепной реакции с использованием значения
длины цепи v; 3) кинетическое уравнение для изучаемой реакции на
основании предложенного механизма. Покажите, что в зависимости от
природы свободного радикала, на котором происходит гибель цепи,
реакция описывается различными кинетическими уравнениями; 4) ка-
кое количество молекул Ах расходуется и какое количество молекул
Bj образуется в цепи, если длина цепи v (см. табл, на с. 431).
ГЛАВА XXVI
ДИФФУЗИЯ. КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Основные уравнения и символы
[К., с. 681—684; Г., т. 2, с. 295, 296]
Процесс диффузии описывается уравнениями Фика. Дифференци-
альные формы 1-го уравнения
dn de
—— D—S, (XXVI. 1]
dZ dx J
2-го уравнения
/ de \
dz \dx2)t
(XXVI.2)
где dn — количество вещества, проходящее за время At через площадь
поверхности S, моль: (dc/dx) (grad с) — градиент концентрации. Гра-
диент концентрации зависит от концентрации [dc/dx = f (с)]. При ста-
ционарном потоке
de , Сц0Н Сисх
— = const =-------------- ,
dx Дх
(dddt)x — изменение концентрации диффундирующего вещества в
данной точке системы от времени; D — коэффициент диффузии;
D = D(le-£»^7', (XXVI.3)
где Do — константа; Ео — энергия активации диффузии. Уравнения
Фика в интегральных формах имеют вид:
1-е уравнение для стационарного потока
JiM = T=~D^S; (XXVI.4)
432
2-е уравнение для нестационарного потока, если диффузия в бесконеч-
но-протяженном теле (х изменяется от — оо до + оо), имеет решение
(1-erfZ). (XXVI,5)
Тогда
Со Г D п
• J, (х=0) = I/ — = ~ • (XXVI.6)
/л V t t
Если диффузия в полубесконечном (полуограниченном) теле (х изме-
няется от 0 до + оо), то решение приобретает вид:
с = с0 ()—erfZ), (XXVI,7)
2с0 Г D п
Ji (х=0) = — 1/ — = — (XXVI.8)
Ул V 1 1
где erf Z — гауссовский интеграл ошибок. Значение erf Z приводит-
ся в справочниках как функция значения Z:
Z = —. (XXVI.9)
2 y'Dt
Некоторые предельные значения Z и соответствующие им значения
erf Z:
Z........ О >2,8 <0,7
erf Z ... 0 1 2
Уравнения (XXVI .5)—(XXVI.8) применимы при условии
I > 5,бУ57, f (XXVI. 10)
где I = хтах — толщина слоя вещества, в котором происходит диф-
фузия;
5,6/07=1, (XXVI. 10а)
L — расстояние, на которое за время t продвигается фронт диффузии
Коэффициент диффузии можно выразить через коэффициент тре-
ния по уравнению Стокса—Эйнштейна
где т] — коэффициент вязкости; г — радиус диффундирующих ча-
стиц, имеющих сферическую форму.
Скорость растворения при постоянном перемешивании описывает-
ся уравнением Фика, дифференциальная форма которого имеет вид
dn DS
— =-£Т (с0—с), (XXVI.12)
Си Ио
433
где D — коэффициент диффузии растворяющегося вещества; S —
площадь поверхности растворяющегося вещества; V — объем раство-
рителя; 6 — толщина приповерхностного слоя; с0 — концентрация
насыщенного раствора, моль/л; с — концентрация раствора;
DS/V6 = *раств. (XXVI.13)
Если с = const, то процесс растворения становится стационарным,
приэтом(с0— с)/6 = const и интегральная форма уравнения (XXVI. 12)
принимает вид
bn = DS/V6 (с0—с) t, (XXVI.14)
где Ап —• количество вещества, растворившееся за время t.
Если при растворении концентрации с меняется, то
браств = 1 е (XXVI.15)
*2 — *1 ^0 ^2
Для скорости гетерогенной мономолекулярной реакции типа
т ^(гг.з или жидкость) —* раствор
(скорость перемешивания постоянна) эффективная константа скорости
k* = f>k/(k+f>), (XXVI.16)
где k — константа скорости собственно химической реакции первого
порядка; р — константа скорости диффузии (скорость переноса веще-
ства в зону реакции на единицу площади поверхности),
р = О/6,
6 — расстояние, на которое переносится реагент.
Для реакции, протекающей в диффузионной области
кинетические уравнения принимают вид:
дифференциальная форма
dn „
- —=PS(C-Co),
dr
где с, с0 — концентрации реагента В в объеме раствора и
ности реагента А соответственно. При — 0
(XXVI. 17)
(** - р),
(XXVI.18)
у поверх-
(XXVI 19)
(XXVI.20)
интегральная форма
DS 2,3 Cj
6V Z2 — Zi 'g c,2
Для реакций типа А(тВ) + В(Г) — АВ(тв) , когда слой продук-
та реакции АВ пористый и не затрудняет контакта исходных веществ
А и В и реакция протекает в кинетической области, порядок может
434
быть нулевым, первым, вторым и дробным. Для реакций нулевого по-
рядка кинетическое уравнение в интегральной форме имеет вид
кт
----= k't,
S
(XXVI.21)
где Am — приращение массы исходного реагента А за счет образова-
ния на нем слоя АВ; S — реакционная площадь поверхности,
S = const; k — константа скорости.
Если контакт реагентов А и В осуществляется через плотный слой
АВ, реакция, как правило, лимитируется диффузией, тогда кинетиче-
ское уравнение в интегральной форме является уравнением параболы:
кт \2
— = k"t, (XXVI.22)
где k" — константа скорости, которая пропорциональна коэффициен-
ту диффузии D реагента А или В через слой конечного продукта АВ.
Скорость испарения описывается уравнением
Углм/гт
(XXVI.23)
где /исп — число молей жидкости, испарившихся в единицу времени
с единицы площади поверхности (скорость испарения); Ps —давление
насыщенного пара.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Образец сплава металла А и В длиной 0,5 см и образец метал-
ла В длиной 0,5 см спаяны друг с другом. Определите время, за кото-
рое в результате диффузии А из сплава в чистый слиток В на расстоя-
нии от спая 0,01 и 0,2 см установится относительная концентрация
А (сл/с0), равная 0,2, и D — const = 2-Ю-9 см2/с.
Решение. Для определения времени диффузии используем
уравнения Фика (XXVI.5) и (XXVI.9). Вначале вычисляем t для
х = 0,01 см, предварительно определив Z по уравнению
= 1/2(1 —erf Z); 0,2= I/2(l—erf Z); erf Z = 0,6~ Z.
Затем вычисляем время по уравнению
„ х х 0,01
Z =-----_. = -----_ =. / = 9,6 4.
2 VDt Z2VD 0,6.21/2-10-’
Проверяем надежность полученных результатов и применимость урав
нения (XXVI.5). Для этого подставляем найденные величины в урав-
нение (XXVI. 10):
0,5 > 5,6 1/2-10-’-9,6-3600 > 0,046.
435
Условия применимости уравнения (XXVI.5) выполняются, так как
I /шах) > 5,6/01
Повторяем расчет и вычисляем t для х ~ 0,2 см:
0,2
Z = 0,6 =--- : / = 3875 ч.
2 /2.10—»
Проверяем применимость уравнения (XXVI.5) для х = 0,2 см:
0,5 > 5,6 /2-10-’-3875.3600 > 0,93.
Условие применимости уравнения не выполняется: / (хтах) < 5,6/ОЛ
Последний результат не надежен.
2. Рассчитайте время, за которое ширина диффузионной размы-
той зоны между сплавом АВ и металлом В станет равной 0,1 см и
О = const = 2-10~9 сма/с.
Решение. Ширина диффузионной размытой полосы 6 при диф-
фузии в бесконечно протяженном теле (расстояние между фронтами диф-
фузии) равна 2L или
6 = 2L=2-5,6 V Di; 2,56 /2-10-’/ =0,1; t = 11 ч.
3. На дно цилиндрического сосуда, залитого водой, помещен слой
сахара. Сахар, растворяясь, диффундирует в объем раствора. Над
сахаром раствор насыщен и концентрация его с0 постоянна. Высота
столба жидкости 20 см. Вычислите, на каком растоянии х от границы
раздела сахар—раствор относительная концентрация с/с0 станет рав-
ной 0,8 через 16 сут; D = 0,25 см2/сут. Учтите, что для данных условий
(t, D), согласно уравнению (XXVI. 10), /= 11,2 см при 298 К.
Решение. Поскольку происходит нестационарная диффузия
в полубесконечном пространстве, то для расчета используем уравнения
(XXVI.7) и (XXVI-9):
0,8 = (1—erf Z); erfZ = 0,2 Z = 0,2;
0,2 =х/2 1/0,25-16; л = 0,8см.
Уравнение (XXVI.7) применимо для данных условий, так как I > х
(11,2 >0,8).
4. На дно цилиндрического сосуда, залитого водой, помещен слой
сахара. Сахар, растворяясь, диффундирует в объем раствора. Над
сахаром раствор насыщен и концентрация его с0 постоянна. Высота
столба жидкости 20 см и D = 0,25 см2/сут. Рассчитайте количество са-
хара, которое перейдет в раствор с 1 см2 поверхности за 16 сут, если
с о = 2,565 моль/л.
Решение. Число молей сахара, растворившегося за 16 сут,
рассчитываем по уравнению (XXVI.8):
1/»35 = 2.в..1О-- »оль/(еуг.е«=).
/л V t 1000 Г 16
Дп = Jt = 2,61 • 10~4-16 = 5,776-10"3 моль-см2,
«сахара =5,776-IO-3-342,3=1,977 г/см2.
436
5. Рассчитайте радиус молекулы белка, если его коэффициент диф-
фузии в растворе сахара D = 6,39-10~’ см2/с, Т = 298 К. Считайте,
что молекулы белка имеют сферическую форму.
Решение. Радиус молекулы белка рассчитываем по формуле
RT
r ~ DNА блг] ’
где ц = 1,227-10~3 Па-с [M.I;
г =_______________(8,314 Дж/(моль-К)) (298 К)_________
(6,39 • 10—11 м2/с) (6,02 • 1023 моль-1) 6-3,14 (1,227-10-3 Па-с)" ’ ' М’
6. Таблетка бензойной кислоты с площадью поверхности S =
= 2 см2 помещена в раствор бензойной кислоты. Объем раствора 20 л,
концентрация 0,003 моль/л. Раствор размешивали, в результате чего
за 5 мин растворилось 0,001 моль СвН5СООН. Можно принять, что
практически концентрация раствора при этом не изменилась. Кон-
центрация кислоты в насыщенном растворе cs = 0,024 моль/л (298 К)-
Коэффициент диффузии бензойной кислоты D = 0,75 ем2/сут. Вычис-
лите константу скорости растворения k, скорость диффузии (J, толщи-
ну приповерхностного слоя 6.
Решение. На границе приповерхностного слоя и поверхности
таблетки концентрация постоянна и равна с&. Концентрация в массе
раствора в течение рассматриваемого времени тоже постоянна, поэто-
му поток вещества через приповерхностный слой можно считать стацио-
нарным и
de Де cs—с
dx Дх 6
Для стационарного потока уравнение (XXVI. 12) принимает вид
dn Дл DS
Константы скорости рассчитываем по уравнению (XXVI. 13), для чего
находим DS/8:
DS Дл 0,061-60-24
. ------------ ------------ _ ig 714 смз/СуТ
6 t (cs —с) 5(0-,024—0,003) 3
Подставляем числа в (XXVI. 13):
13714 „ D
k=—----- =0,6857 сут-1; ₽ = —
20-Ю3 3 6
. DS 0,75-2
6 =-------------= 1,09-10-4 см.
13714 13714
7. Концентрация кислоты в насыщенном растворе cs = 0,024 моль/л
(298 К). Коэффициент диффузии CeH5COOH D = 0,75 см2/сут. Концен-
трация раствора в ходе растворения изменялась. Таблетка бензойной
кислоты с площадью поверхности S = 2 см2 помещена в раствор бен-
13714
------= 6857 см/сут;
2
437
зойной кислоты. Объем раствора 20 л, концентрация
Раствор размешивали, в результате чего за 5 мин
0,001 моль С„Н5СООН. Определите время, за которое
раствора станет равной 0,012 моль/л.
Решение. Поскольку концентрация раствора в
мом отрезке меняется, меняется и градиент концентраций в припо-
верхностном слое, т. е. процесс диффузии не стационарен. Используем
уравнение (XXVI. 15). Так как
0,003 моль/л.
растворилось
концентрация
рассматривае-
/1 = 0; Ci =0,003. то k=—— lg —-1- .
^2 CS О
Подставляем числа и решаем относительно t:
2,3 0,024 — 0,003
----- ig = 0,815 сут, или 19,55 ч.
0,6857 0,024 — 0,012-J
8. Металлический цинк площадью 20 см2 при 298 К растворяли
в 700 см3 серной кислоты по уравнению
Zn + H2SO4 = ZnSO4+ Н2
Вычислите скорость диффузии (5 и соотношение толщины диффузион-
ных слоев (6г/62) в опытах 1 и 3, используя следующие данные:
Скорость перемешивания
Опыт ...........
t, ч...........
cHsso4 ’ г-экв/л .
мо об/мин.
О
0,153
1
0,5
0,118
2
1
0,090
Скорость перемешивания
Опыт . .
t, Ч . . .
cHtSO4> г-экв/л
216 об/мин.
о
0,080
3
0,5
0,069
скорости растворения по
Решение. Определяем константу
уравнению (XXVI.20). При t = 0
2,3 0=0
= — 1g——
О ''f
Определяем скорость диффузии р для опыта 1:
2,3 0,153
kr = — 1g--- =0,519 ч-1;
0,5 s0,118
Vk 700-0,519
В, = — =--------= 18,27 см/ч;
P1 S 20
для опыта 3:
2,3 0,080
/г, = — 1g ---= 0,296 ч-1;
0,5 * 0,069
„ 700-0,296
В, =----1----- =10,32.
нз 20
438
По полученным значениям Р рассчитаем толщину диффузионного
слоя 6:
D D
61 = -^- И 63 = — ;
Р1 Рз
61
6з
10,32
18,27
= 0,56.
Толщина диффузионного слоя при изменении числа оборотов умень-
шилась почти двое.
9. Над углем пропускают воздух под постоянным давлением, в ре-
зультате чего происходит реакция С + О2 = СО2. Данные измерений
позволили определить эффективную константу k* при различных тем-
пературах. Результаты измерений и вычислений:
Г, К............... 777 873 973
(1/Т)103 .... 1,290 1,145 1,026
k*, см/с......... 0,073 0,447 2,15
lg k* ............—1,137 —0,35 0,332
1073 1173 1273 1373 1573
0,930 0,85 0,785 0,728 0,636
6,81 13,72 19,49 23,40 26,90
0,832 1,137 1,29 1,369 1,429
Установите, в какой области протекает реакция, и вычислите
энергию активации.
Решение. Строим график в координатах lg k* — l/Т (рис. 50).
Отрезок de соответствует кинетической области, т. е. скорость реакции
лимитируется собственно кинетикой при
Тс 1100 К, k « р, k = k*. При Т > 1100 К
отрезок cb — переходная область, т. е. кон-
станты скорости диффузии р и собственно
кинетики k соизмеримы. Связь между k*,
k и р описывается уравнением (XXVI. 16).
Энергию активации Еа находим по уравне-
нию
tgk*
of
X
,У______
Еа = —2,3 R 1g а,
где tg а определяется по рис. 50,
tg а = 5,573-103.
Вычисляем энергию активации
Еа = 5,573-103 2,3.8,314 = 106,97 кДж/моль.
10. Над углем пропускают воздух при
Р = const. В результате протекает реакция
Эффективную константу k*
различных температурах. Результаты измерений и
Рис. 50.
lg k от 1/Г
окисления угля кислоро-
дом воздуха
Зависимость
для реакции
С -4’ О2 — СО2.
определили при
вычислений:
Т, К ........... 777 873 973 1073 1173 1273 1373 1673
(1/Т).Ю3 .... 1,290 1,145 1,026 0,930 0,85 0,785 0,728 0,636
k*, см/с ...... 0,073 0,447 2,15 6,8! 13,72 19,49 24,40 26,90
lg k*.......... —1,137 —0,35 0,332 0.832 1,137 1,29 1,369 1,429
Составьте уравнение типа
1g& = Я/7’-|-const.
а \ к
X
о
439
Решение. Сопоставив
нением (XXIII.4), получим
уравнение Ig k = AIT + const с урав-
—25,4 7 -103
= —1,33-10».
2,3-8,31
2,3 R
Для вычисления const подставляем в исследуемое уравнение значения
Ig k и МТ, относящиеся к кинетической области протекания реакции
для 973 К:
0,332 =—1,33-10»/973+const,
откуда const = 0,244. После подстановки чисел получим
1g 6 = 0,244 — 5573/7’.
11. Над углем пропускают воздух под постоянным давлением.
В результате протекает реакция С + О2 = СО2. Эффективная кон-
станта k* определена при различных температурах:
Т, К........... 777 873 973 1073 1173 1273 1373 1573
k*, см/с....... 0,073 0,447 2,45 6,81 13,73 19,49 23,40 26,90
Зависимость константы скорости химической реакции выражается
уравнением
1g 6 = 6,06 — 5573/Т.
Вычислить константу скорости диффузии 0 при 1373 К.
Решение. Константу 0 вычисляем по уравнению (XXVI.16).
Для этого используем k* = 23,40 см/с при 1373 К. Кинетическую кон-
станту вычисляем по уравнению
1g 6 = 6,06 —(5573/1373) =2,00; 6=100 см/с.
После подстановки чисел в уравнение (XXVI. 16) и вычислений
получаем
23,40==ф-100/(100+ Р); Р = 30,8 см/с,
12. При исследовании кинетики реакции бромирования серебра
Ag + 1/2Вг2 — AgBr получены следующие данные (500 К, Рвг2 =
= 170 мм рт. ст.):
t, с . . . 1000 2000 3000 4000 6000
102, г/см2 . . . . ... 1 1,34 1,61 1,84 2,24
(Am/Sj2-104, г2/см4 . . . . ... 1 1,8 2,6 3,4 5
Какие выводы о типе реакции можно сделать на основании результатов
опыта? Вычислите константу скорости реакции.
Решение. Поскольку на металлическом серебре в ходе реакции
образуется бромид серебра, можно предположить, что скорость ре-
акции лимитируется скоростью диффузии Ag или Вг через слой AgBr.
Для проверки предположения строим графики зависимостей \m!S =
440
_ „ Azn /Дт'|2
Рис. 51. Зависимость —7т- и
от t для реакции окисления тория
= /(/)(!) и (Azn/S)2 =/(/) (2).
Прямая в координатах (Azn/S)2— t
подтверждает предположение о
том, что реакция протекает в диф-
фузионной области. Константу ско-
рости k* находим из графика как
тангенс угла наклона прямой:
tg а = /г = 8,0-10“8 г2/(см4 с).
+ О2 = ThO2 получены сле-
13. Для реакции окисления тория Th
дующие данные при 598 К:
/, мин.............................. 1
(Azn-S)-lO6, г/см2 ................. 3
(Azn/S)2-1012, г2/см4............... 9
4 9 16 25 36 64
5,5 9 12 15,5 19 25
18,28 81 144 240,25 361 625
Какие сведения о механизме реакции можно получить из этих данных?
Вычислите константы скорости.
Решение. Поскольку на частицах тория в ходе реакции обра-
зуется слой оксида, можно предположить, что реакция будет опреде-
гяться скоростью диффузии. Для проверки предположения строим
лрафики в координатах Azn^S — / и (Azn/S)2 — t (рис. 51). Зависимость
(Azn/S)2 = f (t) выражается прямой, т. е. реакция лимитируется диф-
фузией. Отсюда константа скорости будет
625—9
fe=tga= g4_j 10~12 г2/(см4-мин).
ЗАДАЧИ
1. При исследовании скорости растворения алебастра CaSO4 в во-
де при 298 К были получены следующие данные:
№ опыта Время раст- ворения, ч Концентра- ция Са$Оч в 50 см3 раствора, г № опыта Время раст- ворения, ч Концентра- ция CaSO4 в 50 см3 раствора, г
0 0,004 0, 0,0270
0,083 0,0274 п 0,083 0,0480
I 0,167 0,0492 11 0,167 0,0632
0,200 0,0566 0,250 0,0736
Скорость перемешивания 2235 об/мин. Объем жидкой фазы равен 1 л;
в 50 см3 насыщенного раствора при 298 К содержится 0,1047 г CaSO4;
площадь поверхности куска CaSO4 31,55 см2. Толщина поверхностно-
го слоя, окружающего 'твердый кусок, 5-10-6 м имеет концентрацию
441
равную концентрации насыщенного раствора. Определите константу
растворения и коэффициент массопереноса.
2. В кювете, заполненной водой, находится таблетка бензойной
кислоты. В верхней части сосуда вода все время течет и концентрация
CgH5COOH в потоке равна 0. Концентрация в насыщенном растворе
cs = 0,024 моль/л. С6Н5СООН растворяется и диффундирует к проте-
кающей воде. Температура опыта 298 К, площадь 5кюветы = 2 см2, рас-
стояние от таблетки до потока 5 см и масса таблетки т = 1 г, коэффи-
циент D =--= 0,75 см2/сут. Объясните, является ли этот процесс стацио-
нарным? Какое количество бензойной кислоты в указанных условиях
растворяется за сутки?
3. Кусок мрамора с постоянной площадью поверхности растворя-
ется в 1 л 1 н. НС1, причем в течение первой минуты скорость раство-
рения равна 5 г/мин. Раствор перемешивают с постоянной скоростью.
Определите объем СО2 (измеренный при н.у.), выделяющийся в те-
чение 20 мин, а также время, необходимое на выделение такого же объе-
ма газа при погружении идентичного куска мрамора в 2 л той же кис-
лоты.
4. Скорость растворения куска мрамора с постоянной площадью
поверхности в 1 н. НС1 равна 0,091 мг-экв/с в тот момент, когда титр
кислоты понизился на х/4 его первоначального значения. Сколько вре-
мени потребовалось, чтобы произошло такое падение концентрации?
5. Гипс CaSO4-2H2O растворяется в воде при 298 К. Скорость
перемешивания постоянная. Объем жидкой фазы 1 л. Площадь по-
верхности S неизменна и равна 31,55 см2. Коэффициент диффузии
D = 1,45 см2/сут. Результаты опытов:
t, мин......................0 5 10
Концентрация раствора
в 50 см3, г................. 0,027 0,048 0,063
Установите тип потока. Вычислите концентрацию насыщенного раство-
ра (г) в 50 см3; k = DS/&V.
6. Медный шар вращают в азотной кислоте и время от времени
взвешивают. В течение первой секунды масса уменьшилась от 4,3465
до 4,0463 г, в течение второй — от 4,0463 до 3,7673 г. Средняя площадь
поверхности за эти интервалы времени была соответственно равна
289,93 и 276,40 см2. Полагая, что объем кислоты очень велик и концен-
трация ее остается практически постоянной, рассчитайте, сколько меди
растворится в течение шестой секунды, если средняя площадь поверх-
ности за это время будет равна 225,15 см2.
7. Сплавленная бензойная кислота, имеющая площадь поверхно*
сти 18 см2, погружена в воду, перемешиваемую с постоянной скоро*
стью. Через известные промежутки времени из раствора отбирали
20 см3 пробы и титрованием определяли концентрацию бензойной кис-
лоты. Толщина поверхностной пленки 6 оставалась постоянной. Кон-
центрация насыщенного раствора бензойной кислоты равна
442
24,3 ммоль/л. Коэффициент диффузии D = 0,5-10~3 см2/мин. Резуль-
тат титрования приведен ниже:
Время между отбором проб,
мии.....................
Концентрация раствора до и
после отбора пробы, ммоль/л 0,75
Объем жидкой фазы, см3 . .
12 15 13,3
2,05 3,05 5,05
1020 1000 980
Определите среднюю константу скорости процесса растворения и
толщину поверхностного слоя.
8. Пробирка с водой внесена в помещение с идеально сухим возду-
хом, температура которого 293 К. Вода испаряется, но уровень ее
поддерживается постоянным. В пробирке отсутствует конвективное
перемешивание. Сечение пробирки S = 0,05 см2. Давление насыщенно-
го пара Рщо = 0,023 атм. Вычислите коэффициент диффузии водяных
паров в воздух, если расстояние до края пробирки 1,85 см, за 87,5 ч
испарилось 1,94-10~3 моль воды. Проверьте полученную величину
D, используя соответствующее уравнение молекулярно-кинетической
теории.
9. В пробирку с водой, уровень которой поддерживается постоян-
ным, на расстоянии 20 см от поверхности воды помещают на сетке
прокаленный сульфат меди. Сечение пробирки 0,05 см2. Пары воды
диффундируют от воды к сульфату. Температура системы 293 К- Дав-
ление насыщенных паров воды Рц2о = 0,023 атм. Коэффициент диф-
фузии воды в воздух £>н2о = 0,24] см2/с. При давлении паров воды у
поверхности сульфата 6-Ю-2 мм рт. ст. начинается реакция
CuSO4-J-H2O = CuSO4-H2O (Р = const)
Вычислите: а) время, в течение которого концентрация паров воды
на расстоянии 10 см от поверхности станет равной концентрации над
поверхностью сульфата; б) массу воды, которую поглотит сульфат за
10 мин.
10. Реакционный сосуд разделен диафрагмой-катализатором на
две части. По обе стороны диафрагмы-катализатора поступал при од-
ном и том же давлении газ разного состава. Так как давление в обеих
частях сосуда постоянно, то обмен веществ между частицами совер-
шался только путем диффузии через диафрагму. С одной стороны диа-
фрагмы подавали газ, содержащий в 1 см3 0,008 см3 ацетилена, с дру-
гой стороны — чистый воздух. Диффундирующий сквозь диафрагму
ацетилен вымывался чистым воздухом и его определяли аналитически.
Определите эффективный коэффициент диффузии D*, если толщина
диафрагмы 6 — 1,34 см, сечение ее S = 4,52 см2, скорость потока чис-
того воздуха v = 10 см3/с, скорость диффузии 2,6-10~3 см3/с.
11. Определите аналитически и графически зависимость коэффи-
циента диффузии водорода в азот от температуры, используя следую-
щие данные:
Т, К........ 2 73 288 289,2 293 373 435 483
D, см2/с . . . 0,647 0,743 0,737 0,80 1,05 1,61 1,92
443
12. Этиловый спирт испаряется в воздух, коэффициент диффузии
при 303 К равен 0,4673 см3/с, а при 323 К—0,5465 см2/с. Определите
коэффициент диффузии этилового спирта в воздух при 313 К.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Растворимость вещества А в Н2О при 7\ = 298,2 К равна csl,
а при Т2 = 333,2 К — cs2. В течение времени при постоянной скоро-
сти перемещения (400 об/мин) и постоянной площади поверхности
(горизонтальная поверхность) в постоянном объеме V растворяли
моль вещества А за время /1( а за время /2 в тех же самых условиях —
п2 моль. При температуре 7\ определите среднюю константу скорости
растворения соли А; время, необходимое, чтобы насыщение раствора
веществом А достигло 35, 70 и 90 %. Вычислите приближенно теплоту
растворения по данным растворимости при двух температурах, при-
няв <р = 1.
I № вари- | аита Вещество А Растворимость X X 2 nt, моль ник пг, моль ч
при 298,2 К csl. г/100 г НгО при 333,2 К cs2. моль/ /1000 г Н,0
1 NaCl 35,92 6,33 20 5,39 65 6,15 1
2 NaCl 35,82 6,33 20 26,9 65 30,3 5
3 MgSO4-7H2O 38,3 4,50 15 5,94 35 10,1 10
4 КС1 36,32 6,15 15 17,3 55 19,5 4
5 КВг 67,75 7,24 10 9,3 40 11,4 2
6 KI 146,45 10,35 5 15,6 15 25 3
7 k2so4 12,04 1,04 20 3 40 3,4 5
8 K4Fe(CN),-3H2O 32,0 1,498 15 1,6 35 2,5 4
9 CaSO4-2H2O 0,210 — 45 0,015 75 0,0193 20
10 CaSO4-2H2O 0,21 — 45 0,0746 75 0,0965 100
11 FeBr2 0,257 0,0072 9 0,0084 15 0,0114 6
12 FeBr2 0,257 0,0072 9 0,0224 15 0,0302 16
13 ,FeCl2 0,385 0,0436 30 0,080 12 0,065 5
14 FeSO4-7H2O 29,7 3,69 4 0,38 10 0,9 2
15 CoSO4-7H2O 37,8 3,32 15 10,8 45 20,2 15
16 NiSO4-7H2O 39,6 3,65 10 1,2 40 3,0 3
17 CuSO4-5H2O 22,29 2,38 9 4,96 27 10,4 12
18 ZnSO4-7H2O 57,9 5,27 12 7,35 48 17,0 И
19 ZnSO4-7H2O 57,9 5,27 12 4,5 24 8,08 8
20 CdSO4-«/3H2O 77,0 3,92 17 11,60 51 24,6 14
21 BaCl2-2H2O 36,9 1,94 25 14,5 50 15,7 19
22 PbBr2 0,947 0,0642 35 0,247 70 0,264 10
23 PoBr2 0,974 0,0642 35 0,0247 70 0,0264 1
24 PbBr2 0,974 0,0642 35 0,173 70 0,185 7
25 PbBr2 1,08 0,0697 35 0,25 70 0,268 7
444
ГЛАВА XXVII
КИНЕТИКА РЕАКЦИИ В РАСТВОРАХ. ГОМОГЕННЫЙ
И ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Основные уравнения и символы
(К., с. 671—699; Г., т. 1, с. 170—183, 255—346, т. 2, с. 276—346]
где
Зависимость константы скорости реакции в разбавленном растворе
от ионной силы раствора выражается уравнением
lg* = lg*o+2AzAzBy7, (XXVII.1)
Л = 1/е,/17’,/.; (XXVII.2)
при 298 К для водного раствора А = 0,509; ?д и ?в — числа зарядов
реагирующих ионов; k0 — константа скорости при бесконечном разве-
дении (у = 1); 1 — ионная сила раствора; е — диэлектрическая по-
стоянная.
Зависимость константы скорости реакции от электростатической
составляющей энергии Гиббса активизированного комплекса выража-
ется уравнением
гАегъе
in й=1п AZ—---------,
0 edABkT
zAzBe2V
lnft = lnft0——
(XXViI.3)
где k0 — константа скорости в
среде, в которой е =
zAezBe
оо;
(XXVII.4)
8<гдв
AG*C. — электростатическая составляющая энергии Гиббса активи-
рованного комплекса; tZAB — расстояние между центрами ионов сфе-
рической формы, составляющих активированный комплекс; zAe,
?вв — заряды ионов.
Электростатическую составляющую энтропии активированного ком-
плекса определяют по уравнению
гАгвй2 / In е \
эс~ 2dABe дТ )v'
Скорость бимолекулярных гомогенно-каталитических реакций вы-
ражается уравнением
(XXVII.5)
М-1 [А] [В]
w =--------[К]»
л^+МВ]1
где ki и k-i — константы скорости прямой и обратной реакций образо-
вания промежуточного комплекса между исходным веществом А и ка-
тализатором; k2— константа скорости распада промежуточного ком-
445
плекса до продуктов реакции; [А], [В], [К] — концентрации исходных
веществ А, В и катализатора.
Для h— случай Аррениуса
kt k,
w = [А] [В] [К] = КСК2 [А] [В] [К]. (XXVI1.6)
Для < /г! — случай Вант-Гоффа
ш = МА][К]. (XXVII.7)
В сильнокислых растворах некоторые реакции катализируются
только ионами гидроксония, и выражение для скорости может быть
записано в следующей форме:
ш = йн+ [H3OT][S], (XXVI1.8)
где &н+—константа скорости кислотного катализа; [Н3О+]— кон-
центрация катализатора; [S] — концентрация субстрата. Каталитиче-
скую константу £н+ для этих ионов определяют изменением скоро-
стей реакций в кислых растворах при различных концентрациях Н3О
и S.
В сильнощелочных растворах
w = *он- [ОН-] [SI- (XXV1I.9)
Каталитическую константу &он- определяют измерением скоростей
реакций в щелочных растворах при различных концентрациях ОН-
и S. Если катализ может осуществляться обоими ионами Н+ и ОН~
и если реакция одновременно идет по двум направлениям, скорость
реакции может быть записана так:
™ = k0 [S] + йн+ [Н3О+] [S] + /еон_ [ОН-] [S], (XXVII. 10)
где k0 — константа скорости некатализируемой реакции. Поэтому
константу скорости первого порядка можно выразить в виде
k = k0 + kH+ [Н3О+] + *он_ [ОН-]. (XXVII.il)
Кислотная каталитическая константа скорости реакции k связана
с константой диссоциации Ка уравнением Бренстеда
£ = GaK“, (XXV11.12)
где Ga и а — константы, значения которых обычно меньше единицы.
Для основного катализа уравнение Бренстеда записывается в виде
fe = GbKf=GbK₽, (XXVII. 13)
где G6, G'b, ₽ — константы.
Любая реакция между газообразными веществами, которая проте-
кает на поверхности катализатора, может быть расчленена на пять
последовательных стадий: 1) подвод вещества к поверхности катализа-
тора; 2) адсорбция вещества; 3) реакция на поверхности катализато-
ра; 4) десорбция продукта реакции с поверхности катализатора;
446
5) отвод продуктов реакции от поверхности в объем газовой фазы.
Общая скорость процесса определяется наиболее медленной его
стадией.
Для гетерогенно-каталитических реакций промежуточное соеди-
нение реагирующего вещества с катализатором образуется на поверх-
ности твердого катализатора вследствие хемосорбции. Если реакция
не имеет транспортных ограничений и адсорбция протекает быстро,
то механизм реакции объясняет теория Лэнгмюра—Хиншельвуда и
скорость реакции может быть представлена уравнением
W = -^T К>- (XXV1L14)
dt-ds
где w — скорость реакции прореагировавшего вещества на поверх-
ности за время t, моль; ks — константа скорости поверхностной реак-
ции; К; — константа адсорбционного равновесия t-ro компонента;
Pt — парциальное давление реагирующего компонента.
Для поверхностной реакции первого порядка скорость определя-
ется уравнением
kJ>A
w=ksC^=.ksaM * — . (XXV11.15)
1 + ftA ГА
При KaPa « 1
w-k,axKApA, (XXV1I.16)
&эФФ = ^saoo^A, где — максимальное количество адсорбирован-
ного реагента; К а — константа адсорбционного равновесия этого ком-
понента; РА — его парциальное давление; /гэфф — константа скорости
катализируемой реакции.
Для реакции первого порядка зависимость /гЭфф от температуры вы-
ражается уравнением
*.эфФ = А«_Е”-к-р//?Г«_ЛНадс-//?Г- (XXVII.17)
где £н.к.р — энергия активации некатализируемой реакции; А//адс —
теплота адсорбции реагирующего вещества; А —постоянная, А =/=
Ф f (ту,
рк. р — £н.к-р + АНадС. (XXVII.18)
Согласно принципу энергетического соответствия А. А. Баландина
гетерогенная каталитическая реакция может быть представлена схемой
Аисх + К —► АК —> Р 4-К,
катализатор мультиплетный
комплекс
pf, АК = <?~"2£А’
Ярасп.АК^Р-?’ (XXVII.19)
447
где Ef. лк — энергия образования мультиплетного комплекса; fpacn.AK—
энергия его распада; q — адсорбционный потенциал, равный сумме
энергий взаимодействующих атомов, составляющих молекулы реаги-
рующих веществ с катализатором.
Энергия активации процесса равна
E=-Y£f,AK- (XXVII.20)
Изменяя адсорбционный потенциал (т. е. применяя различные катали-
заторы), можно достигнуть равенства
1 Е = г
£расп. АК*
Катализатор, на котором достигнуто это равенство, будет самым эф-
фективным.
Согласно Н.И. Кобозеву носителем каталитической активности ад-
сорбционного катализатора является атомная (докристаллическая)
фаза катализатора. Для каждого процесса активным центром являет-
ся ансамбль из определенного числа атомов (п)
Л,м
п =----IS—
м м
где У£, Ум — число молекул катализатора, при котором достигает-
ся максимальная общая и удельная активности. Соответственно число
областей миграций равно
7.r.=-N^ —Na
^0 VM VM'
(XXVII.21)
(XXV П.22)
Абсолютная активность r0 одного n-атомного ансамбля определяется
по уравнению прямой
Рис. 52. Зависимость йп от vy
дли реакции каталитической дегидра-
тации этилового спирта
(XXVII.23)
или
А / 1 \ А
lg ,yn =ls[rn Z1 п nl J — 2 3Z
(XXVII.24)
Для мономолекулярных реак-
ций в потоке при постоянном дав-
лении уравнение (XXVII. 14)
имеет вид
Г1п —— = а + р7у, (XXVII.25)
1-g
где v — скорость подачи исходно-
го вещества в молях на единицу
времени, отнесенная к единице
448
объема катализатора; у — степень превращения; а — постоянная,
прямо пропорциональная общей площади поверхности катализатора
и константе скорости поверхностной реакции; Р — постоянная, ха-
рактеризующая адсорбционные коэффициенты вещества. Коэффициен-
ты а и р являются кинетическими характеристиками реакции.
Уравнение Фроста-—Баландина (XXVI 1.25) _можно представить
графически (рис. 52). Откладывая на оси абсцисс vy, а на оси ординат
Г1п (1/1 — у), получим прямую линию. Тангенс угла наклона прямой
коси абсцисс определяет значение р, а отрезок на оси ординат, отсекае-
мый прямой при значении у = 0, — величину а.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При изучении кинетики реакции
Со (NH3)S NO^-J-OH-^Co (NH3)S ОН2++NOy
получена следующая зависимость константы скорости k от ионной си-
лы раствора 7:
I . . . .... 2,34 5,61 8,10 11,22 11,73 16,90
(5-f-lg k) .....................1,7640 1,7130 1,6800 1,6467 1,6418 1,5990
Вычислите константу скорости k0 при ионной силе, равной нулю.
Решение. Построим график зависимости lg k от УI и прове-
дем экстраполяцию к У/ = 0 (рис. 53):
(5+lg k) .................1,7640 1,7130 1,6800 1,6467 1,6418 1,5990
У~Г....................... 1,53 2,37 2,85 3,35 3,42 4,11
Рис. 53. Зависимость lg k от У1
для реакции Co(MH3)5NO? + +
+ОН- —>Co(NH,UOH2++NOr
Значение, полученное экстраполяцией: (5 + 1g 7?0) = 1,858; k„ =
= 7,21-10-4.
2. Используя метод стационарной концентрации, выведите урав-
нение, определяющее скорость гомогенно-каталитической реакции
А + В + КС + К. Гомогенно-каталитическая реакция протекает
по следующему механизму: 1) образо-
вание промежуточного продукта АК
в результате обратимого взаимодей-
ствия между катализатором и одним
из исходных веществ:
А + К АК,
k-t
2) образование активированного
комплекса в результате взаимодей-
ствия образовавшегося промежуточ-
ного продукта со вторым компонен-
тов реакции:
АК4-В Д. (АВ*) к,
15 Зак. 767
449
3) образование конечных продуктов и регенерация катализатора:
(АВ*) К Л. С + К.
Решение. Согласно теории активированного комплекса ско-
рость реакции определяется скоростью его распада на конечные про-
дукты:
4^- = k3 [(АВ*) К]. (1)
а I
Определяем методом стационарной концентрации содержание акти-
вированного комплекса (АВ*)К. Через некоторое время после начала
процесса скорость накопления активированного комплекса будет
d [(АВ*) К
' = [АК] [В]—[(АВ*) К] =0, (2)
d t
откуда
[(АВ*) К] = -Л[АК] [В]. (3)
кз
Концентрацию промежуточного продукта выражаем через концентра-
цию исходных веществ. Согласно рассматриваемой схеме реакция на-
копления промежуточного продукта АК обратима, тогда
d ^Kl =fei [А] [К] - k, [AK]~fes [АК] [В]=0. (4)
a t
Откуда находим
Подставляя (5) в (3) и полученное выражение в (1), получаем
d [С] = ft, k.t [А] [В]
dz A_j+*s[B] lK|’
Из полученного уравнения видно, что скорость реакции прямо пропор-
циональна концентрации катализатора.
3. Разложение СаН5ОН на этилен и воду происходит при 653 К
на 10 см3 катализатора А1аО3. Расход 64 %-ного раствора спирта
п и объем Уоп газа, образовавшегося за 3 мин, в результате реакции
будут следующими:
я, см3 .......... 0,144 0,65 0,937 1,15 2,37
Коп> см3 ... 30,3 85,7 119 131,5 217
Барометрическое давление 100121,63 Па, комнатная температура
300 К. Вычислите коэффициенты а и 0 в уравнении (XXVII.25) и на-
пишите эмпирическое уравнение.
Решение. Коэффициенты а и 0 в уравнении Фроста
v In [1/(1 — //)] = 0и/ + а получим графически. Для этого вычислим
450
значения v, у, vy, In 1/(1 — у) и построим график в координатах
v In — vy (см. рис. 52). Для одного опыта рассчитаем
-= тсгн,он
tV кат
где /«с2н,он = ndfe/AHOO — масса спирта; b — содержание спир-
та, %; dc2H,oH = 0,9 г/см3 — плотность спирта; t — время подачи;
^кат — объем катализатора. Тогда
0,144-0,9-64
т, = -----------= 0,0018 моль;
46-100
- 0,0018
v =------
310
= 0,006 ммоль/(см3-мии).
Приведем объем выделившегося газа к н. у.:
УрД (^бар ^нго) Тр
Pp (То + -Комн)
(Рн2о = 3212,63 Па — давление насыщенного пара воды при данной
температуре.)
Для данного опыта получим объем С2Н2 при н.у.
V =
30,3-10012-273
---------------= 27,7 см3.
760-296-133,3
Откуда число молей этилена будет
/П1,С2Н5 m С, Н4 = 2 4 22,4 27,7-10-3 = = 0,0012 моль 22,4
Тогда
— т,, С,Н4 0,0012
</ =---— = ------- =0,667; и V </ = 0,060-66,7-10-2 = 0,040;
mj,C2H5OH 0,0018 ’
- 1 2 1
vln------= 0,0060 In --------= 0,0060 In------ =
\—y 1—0,663 0,33
= 0,0060 In 3 = 0,0060-1,0986 = 0,0066.
Для всех опытов скорость подачи и степень превращения будут:
V . . 0,0060 0,0272 0,0392 0,0482 0,0995
</-10-2 . . . . . 66,7 41,7 40,2 36,5 26,6
. . 0,0040 0,0114 0,0157 0,0176 0,0264
— 1 V In . . 0,0066 0,0146 0,0200 0,0218 0,0306
1-1/
Построив график, находим а = 0,012, Р 1. Уравнение будет
иметь вид v In 1/(1 — у) = vy + 0,012.
15*
451
ЗАДАЧИ
1. Определите константу скорости реакции СН3Вг + KI =
= СН31 + КВг в воде при 298 К, если предэкспоненциальный множи-
тель 1,7-1013 см3/(моль-с) и энергия активации 76,6 кДж/моль.
2. Определите константу скорости реакции СН3Вг + KI = СН31
в СН3ОН при 298 К, если предэкспоненциальный множитель 2,3-1013
см3/(моль-с) и энергия активации 76,2 кДж/моль. Сопоставьте скорость
реакции, протекающей в воде, если предэкспоненциальный множи-
тель 1,7-1013 см3/(моль-с) и энергия активации 76,6 кДж/моль, и в
метаноле.
3. Определите константу скорости реакции, протекающей по
уравнению
Св Н6 (СНЭ)2 N+CH3 I [Ce Н5 (СН3)3 NJ++1-
в нитробензоле, дихлорэтане и бензиловом спирте при 353 К, исполь-
зуя значения предэкспоненциальных множителей и энергий, активации
из справочника [М.]. В каком из растворителей реакция протекает с
наибольшей скоростью?
4. На основании данных о скоростях омыления эфиров в водных
растворах [М.] сделайте вывод, омыление какого из эфиров при
323 К СН3СООС2Н5 или СН3СООС3Н7, или СН3СООС4Н(), про-
исходит быстрее. В каком соотношении находятся константы скоро-
сти омыления этих эфиров?
5. Определите время полупревращения при омылении 0,05 М этил-
ацетата при 298 К 0,05 М водным раствором LiOH на основании
данных о константе скорости омыления [М.].
6. Определите время полупревращения при омылении этил-
ацетата при 298 К водным раствором NaOH, содержащим NaOH
0,0500; 0,0250 и 0,0125 моль/л и одинаковые концентрации этил-
ацетата. Константы скорости возьмите из справочника [М.].
7. Сопоставьте начальные скорости реакции омыления 0,05 М
этилацетата при 298 К 0,05 М водными растворами LiOH, NaOH и
КОН.
8. Определите, во сколько раз изменится константа скорости
реакции
С2 Н6 Вг COO-J-S2O23- C2H4S2O3COO2-4-Br-
если ионную силу раствора изменить от 0,01 до 0,04.
9. Константа скорости реакции между персульфатом натрия и
иодом зависит от ионной силы следующим образом:
/, моль/л .............. 0,00245 0,00365 0,00445 0,00645 0,00845 0,01124
/г, л/(моль-с).......... 1,05 1,12 1,16 1,18 1,26 1,39
Представьте эти данные графически, используя уравнение
(XXVII. 1), и рассчитайте za?b. Какой заряд имеет ион персульфата,
если стадией, контролирующей скорость реакции, является реакция
452
между ионами персульфата и иода? Объясните, почему произведение
зарядов 2д?в не равно целому числу.
10. При изучении кинетики реакции
Со (NH3)6 NO^+OH- —> Со (NH3)6 OH2++NO2-
получено, что при ионной силе раствора 5,61 константа скорости этой
реакции равна 5,164>10~4. Определите константу скорости этой ре-
акции при ионной силе, равной нулю.
11. Какое влияние на скорость реакций
S20h+2I- —► I2+2SOr
Со (NH3)6Br2++NO2- —► Со (NH3)6NO|++Br~
СН3 Вг+2 Н2О —► СН3ОН+Н3О++Вг-
СН3Вг+ОН- —> СН3ОН+Вг-
окажет повышение: а) диэлектрической проницаемости; б) ионной си-
лы раствора; в) гидростатического давления. Определите знак эн-
тропии для каждой реакции.
12. Рассчитайте электростатический вклад в AG*, АД* и TAS*
(кДж/моль), если ZaZb = — 2; е = 80; (din г/дТ)Р = — 0,0046;
t/дв = 25 нм, при Т = 298 К.
13. Константа скорости реакции гидролиза диазоуксусного эфира
n2ch соос2н5-рн2о НОСН2 COOC2H5+N2
изменяется с концентрацией ионов Н+ следующим образом:
Н3О+, моль/л . . 0,00046 0,00087 0,00158 0,00323
k, л/(моль-с) . . 0,0168 0,0320 0,0578 0,1218
Представьте эти данные графически и определите константу катализа
реакции ионами водорода /гн + -
14. Реакция мутаротации глюкозы имеет первый порядок по кон-
центрации глюкозы и катализуется кислотами (А) и основаниями (В).
Константу скорости первого порядка можно выразить с помощью
уравнения такого же типа, какие встречаются для реакций, протекаю-
щих по параллельным путям:
й=Л0+^н+ [Н+]+&д [В],
где k0 — константа скорости первого порядка в отсутствие каких-
либо кислот и оснований (кроме воды). Для этой реакции при 291 К
в среде, содержащей 0,02 моль/л ацетата натрия и различные концен-
трации уксусной кислоты, получены следующие данные:
СН3ООН, моль/л............. 0,020 0,105 0,199
А-10«, мин-1 .............. 1,36 1,40 1,46
Рассчитайте k0 и /г.д. Член, содержащий кц + , при этих условиях пре-
небрежимо мал.
453
15. Константа скорости реакции гидролиза диазоуксусного эфира
изменяется с концентрацией ионов Н+ следующим образом:
СН+, моль/л........................ 0,00046 0,00087 0,00158 0,00323
k, л/(моль-с)
0,0168 0,0320 0,0578 0,1218
(реакция по эфиру имеет первый порядок). Определите среднюю кон-
станту скорости катализа ионами Н+.
16. Мутаротация глюкозы катализируется кислотами и основа-
ниями и имеет первый порядок по концентрации глюкозы. Если в ка-
честве катализатора используется хлорная кислота, то концентрацию
ионов Н+ можно считать равной концентрации хлорной кислоты, а
влияние перхлорат-иона можно не учитывать, так как он является
очень слабым основанием. Были получены следующие значения кон-
стант скорости первого порядка:
[HCIOJ, моль/л . . . 0,0010 0,048 0,0099 0,0192 0,0300 0,040
*•10-*, мин-1 ...... 1,25 1,38 1,53 1,90 2,15 2,59
Определите константы k0 и /гн+.
17. Приготовлен раствор, содержащий 0,5 моль/л уксусной ки-
слоты и 0,3 моль л ацетата натрия. Константа диссоциации уксусной
кислоты 1,8-10~5, а показатель степени а в уравнении Бренстеда для
реакции кислотного катализа равен 0,9. Рассчитайте глубину реакции
в процентах по ионам водорода, уксусной кислоте и воде.
18. Ниже приведены значения констант диссоциации кислот и
каталитических констант для реакции разложения нитроамида неко-
торыми основными ионами.
Ион Ка k Ион Ка k
Г идроксил 1,1 • ю-’в 1 • 10« Бензоат 6,5-10-5 0.189
Три метилацетат 9,4-10-в 0,822 Формиат 2,1-10-* 0,082
Пропионат 1,4-10-® 0,649 Монохлорацетат 1.4-10“» 0,016
Ацетат 1,0-10-5 0,504 о-Нитробензоат 7,3-Ю-з 0,0042
Фенилацетат 5,3- IO-5 0.232 Дихлорацетат 5,0-10-2 0,0007
Представьте эти данные графически таким образом, чтобы показать
применимость соотношения Бренстеда, и определите константы урав-
нения.
19. Реакция между ацетоном и иодом протекает согласно урав-
нению
СН3СОСН3+12 —> СН3СОСН21+Н1
Реакция может рассматриваться как идущая через предварительную
енолизацию ацетона
ОН
СН3СОСН3 —> сн3—с=сн2
454
с последующим присоединением иода и отцеплением молекулы иодида.
водорода:
ОН ОН
I I
СН3-С=СН2-Н2 СН3—С—СН2 I —> СН3СОСН2 I-f-HI
I
Подтверждением этого механизма служит то, что скорость реакции
не зависит от концентрации иода и не изменяется при замене иода на
бром. Поэтому енолизация является стадией, определяющей скорость
реакции, а последующее присоединение галогена происходит в быстрой
стадии. Используя константы скорости иодирования ацетона, приве-
денные в таблице
Катализатор ft.10’, л/(моль«с) Катализатор Ка k-10". л/(моль- с)
Дихлоруксусная 5,7-Ю-2 220 а-Хлорпропионо- 1,01-10-* 5,9
кислота а, р-Дибромпропи- 6,7-10-’ 63 вая кислота Уксусная кислота 1,75.10-3 2,4
оновая кислота Монохлоруксус- ная кислота Гликолевая кисло- та 1,41'Ю-» 1,54-10-* 34 8,4 Пропионовая кис- лота Триметилуксусиаи кислота 1,34-10-5 9,1-Ю-з 1,7 1,9
рассчитайте усредненные коэффициенты в уравнении Бренстеда и ка-
талитические константы всех кислот.
20. Для реакции иодирования ацетона в присутствии кислот, у ко-
торых р = q = 1 (<7 — число положений в катализирующем основа-
нии, способном присоединять протон, ар — число протонов, способ-
ных отцепляться в сопряженной основанию кислоте), уравнение Брен-
стеда имеет вид: k = 7,90- 10-4/(2,в2. Рассчитайте каталитическую
константу скорости k в присутствии монохлоруксусной кислоты и срав-
ните ее с опытной k0ll = 34 л/(моль-с). Константа диссоциации моно-
хлоруксусной кислоты Ка = 1,41 • 10~3.
21. Во сколько раз увеличится скорость (воображаемой) газовой
реакции при 400 К, если в кинетическую систему ввести твердый ката-
лизатор. Энергия активации реакции без катализатора Ег равна
29 824 Дж/моль, а с катализатором (Ег-к) — 26 000 Дж/моль. Пред-
экспоненциальные множители уравнения Аррениуса в обоих случаях
одинаковы: /гог = /гог-к.
22. Каталитический обмен между дейтерием и аммиаком идет по
уравнению реакции
’/г Dj-|-NH3—е —>
455
Ниже приведены значения энергии активации реакции на разных ка-
тализаторах и работы выхода электрона из металла-катализатора:
Металл........................ Pt
Энергия активации Еа,
кДж/моль....................21,6
Работа выхода электрона из
металла <р, кДж/моль ... 518
Ni Pd Fe Ag Си
39,0 38,0 51,0 60,0 58,0
483 481 456 438 437
Выведите уравнение, связывающее энергию активации приведенной
реакции с работой выхода электрона из металла, и покажите, во сколь-
ко раз изменяется скорость реакции на приведенных металлах по
сравнению с платиной. Предэкспоненциальный множитель уравнения
Аррениуса для всех металлов одинаков.
23. Реакция разложения аммиака 2NH3—>- N2 Нт ЗН2 без катали-
затора протекает с энергией активации Еа = 326 кДж/моль, а при
той же температуре на катализаторах W, Mo, Fe, Os с энергиями ак-
тивации Ew = 163 кДж/моль, £мо = 121,3 кДж/моль, Ере =
= 125,5 кДж/моль и £qs = 197 кДж/моль. Покажите, как связана
«истинная» энергия активации гетерогенной реакции с теплотой ад-
сорбции исходных веществ и чему равна теплота адсорбции активиро-
ванного комплекса на катализаторе.
24. Разложение этилового спирта на катализаторе А12О3 проте-
кает по уравнению С2Н5ОН —>-С2Н4 + Н2О. При 650 К эффективная
константа скорости равна 0,234 с-1. Зависимость константы скорости
поверхностной реакции от температуры цыражается уравнением
lg k = 6,06 — 4230/Т. Определите энергию активации поверхностной
реакции и константу скорости диффузии.
25. Кинетика разложения муравьиной кислоты НСООН —> Н2О ~Ь
+ СО на различных катализаторах при 473 К характеризуется сле-
дующими данными:
Катализатор...................Стекло Au Ag Pt Rh
Энергия активации, кДж/моль 103 98 130 92 146
Относительная скорость ... 1 40 40 2000 10000
Скорости процесса отнесены к равным площадям поверхности катали-
затора. Объясните различие в скоростях.
26. Олеиновая кислота, растворенная в уксусной кислоте в при-
сутствии платинового катализатора при 320 К, гидрируется. Скорбеть
гидрирования в зависимости от массы катализатора изменяется сле-
дующим образом:
w. мг/мин........................3,7
Масса катализатора, г . . . . 0,025
7,4 11,3 14,9
0,05 0,0625 0,10
Интенсивность встряхивания 600 качаний/мин. Определите, к какой
области гидрирования относится протекающая реакция.
27. Зависимость скорости реакции гидрирования спирта в при-
сутствии платинового катализатора в ледяной уксусной кислоте при
456
интенсивном встряхивании (500—600 качаний/мин) при 290 К от мас-
сы катализатора имеет линейный характер, что свойственно кинетиче-
ской области. На основании данных
Масса катализатора, г . 0,03 0,06 0,06 0,09 0,15 0,23 0,30 0,40 0,50
w, см3/с..............1,56 3,83 3,75 6,04 9,75 13,5 18,2 22,7 37,6
выразите графически зависимость константы скорости реакции от мас-
сы катализатора (в расчете на металлическую платину в граммах).
Содержание Pt в катализаторе 6 %.
28. Реакция С2Н5Вг -> С2Н4 + HBi* при 693 К протекает на А12О3.
Степень заполнения катализатора исходным веществом в зависимости
от давления приведена ниже:
Степень заполне-
НИЯ Давление, 0,0715 0,1334 0,1876 0,235 0,278
мм рт. ст. . . . Степень заполне- 0,1 0,2 0,3 0,4 0,5
ния Давление, 0,316 0,350 0,381 0,409 0,435
мм рт. ст. . . . 0,6 0,7 0,8 0,9 1,0
Рассчитайте эффективную и истинную константы скорости реакции,
если продукты реакции не тормозят процесс.
29. В результате исследования кинетики гомомолекулярного обме-
на кислорода на оксиде гадолиния в интервале температур 78—
500 °C были определены константы скорости реакции при различных
температурах:
Т, К................. 223 273 300 473 673
/МО3, с-1 .......... 0,177 0,0224 0,9055 4,48 27,16
Постройте график зависимости 1g й = /(1/Т), определите энергию
активации в области температур 573 — 300 и 300—223 К- Объясни-
те смысл отрицательной энергии активации.
30. Выведите уравнение для дегидратации этилового спирта (в по-
токе) над оксидом алюминия, которая протекает при 653,2 К, если
V . . . . . . . 0,060 0,152 0,272 0,331 0,392
у-Ю1 . . . . . . 66,7 55,0 41,7 42,8 40,2
V . . . 0,423 0,482 0,542 0,995 1,464
у-102 . . . . . . 40,1 36,5 37,1 26,6 22,1
31. При дегидратации этилового спирта С2Н5ОН С2Н4 + Н2О
на катализаторе А12О3 при 653 К через каждые 3 мин измеряли рас-
ход 75 %-ного водно-спиртового раствора п и объем образовавшегося
газа Уоп в газовой бюретке:
л-10е, м3 . . . . 0,2 0,31 0,41 0,62 0,82
Уоп-Юв, м3 . . . 61 84,2 107,5 143 177
л-IO3, м3 . . . 10,6 1,37 1,66 1,95
von-10«, м3 „ . . 218 263 283 302
457
Вычислите а и в уравнении Фроста для данной реакции в указанных
условиях, если объем катализатора 15 см3, температура опыта 293,2 К,
барометрическое давление 99641,7 Па (747,5 мм рт. ст.).
32. Реакция окисления тиосульфата пероксидом водорода катали-
зируется ионом 1_ и протекает по следующему механизму:
I-+HSOS Л- ю-+нао
2 S2O1" + IO-+2H+ Л S4O§~+H2O+I-
Выведите кинетическое уравнение для этой реакции. Определите,
во сколько раз изменится скорость реакции, если концентрацию уве-
личить в 3 раза.
33. Гомогенно-каталитическая реакция протекает по схеме
E-i-K ЕК —► К+Р.
. k—i
В качестве катализатора используется вещество [RhCl(PRh3)3l. Оп-
ределите эффективную константу скорости и энергию активации про-
цесса, если Се = 1,5 моль/л, а концентрации катализатора и скоро-
сти реакций приведены в таблице:
Ск-Ю-’, моль/л u>-10-s, моль/(л-с) т. К
22 288
1 ’ 37 298
44 303
25,5 288
2 42 298
, 48 303
30 288
3 47 298
52 303
34. Реакция дегидратации изопропилового спирта протекает на
алюмосиликатном катализаторе по схеме:
А-Г(+) А^дс,
Аадс+(—) —* —Аадс,
-Аа+дс Л ( + ) + (-)4-Р.
Здесь А — изопропиловый спирт; (+), (—) — положительные и от-
рицателные адсорбционные центры иа поверхности катализатора. Оп-
ределите скорость реакции, если /г1 = 2,7-10~4 молекул/активного
центра, с-Па; Рспирта = 0,01 Па.
458
, 35. Реакция каталитического превращения бутилового эфира про
текает по схеме:
СН3 ОС (СН3)3 аде —► СН3 ОНадс'Н'Са Н8 адо
сн осн 4.,- ci f-c5Hlo+CH3OH
СН3 ОСНз адс+.-С* Н8 адс Q QH
Определите селективность катализатора относительно i-C5H10, если
скорость образования t-C5 Н1о в 2 раза больше скорости образования
1-С5Н8.
36. При изучении реакции алкилирования бензола этиленом на би-
функциональных катализаторах на основе цеолитов было показано:
С8 Н8+С2 Н4
--► Св Н5—С4 Hg
--► Сд Нд-Сд Нд-(-Сд Нд-Сд Нд
--► Сд Нд-Сд Нд + С4 Н8
Определите селективность катализатора относительно С4Н8, если в
результате конверсии С2Н4 через 0,6 ч получено С4Н8 — 8,7 % этил-
бензола — 1,6 %, eznop-бутилбензола — 48,7 %.
37. При изучении каталитического окисления водорода на оксид-
ных катализаторах были получены теплоты сорбции кислорода в за-
По полученным данным: построить: 1) график зависимости
АНадс = f (0), где 0 — степень заполнения; 2) график зависимости
энергии активации каталитической реакции от степени заполнения,
если £к-р — 11 кДж/моль при монослойном заполнении поверхности
на Со3О4.
38. Используя теорию мультиплетов А. А. Баландина, определите
энергию образования и распада мультиплетного комплекса, адсорбци-
онного потенциала, энергию активации для реакции гидрирования
связи С—С, С—N над Ni-катализатором, если энергия связи ^н-n =
= 229,4 кДж; ?c-Ni = 58,4 кДж; —ni = 112,6 кДж; qc_c =
= 344,4 кДж. Сравните эти энергии связи с приведенными в справоч-
нике [М.1.
459
39. При исследовании кинетики реакции синтеза аммиака на же-
лезе, нанесенном на алюмогель, получено, что максимальная удельная
каталитическая активность имеет место при Nmax — 6,1-Ю18, а мак-
симальная общая активность при 7Vmax = 8,8-1018. Определите число
атомов, входящих в активный ансамбль, и число областей миграции
МНОГОВАРИАНТНАЯ ЗАДАЧА
При исследовании кинетики конверсии оксида углерода статически
циркуляционным методом было получено кинетическое уравнение для
скорости прямого процесса:
v а0,5 (t] — а)0, s
*1= а*-,
(1-а) (т]-а)-—
где v — скорость входа в циркуляционный контур парогазовой сме-
си, см3/(г-с); а — степень превращейия; т] — соотношение пар/газ
в искомой смеси; kf — константа равновесия. Определите удельную
каталитическую активность катализатора, энергию активации катали-
тической реакции. Постройте зависимость удельная каталитическая
активность — порядковый номер металла оксида, если известно, что
С С £ Оксид г. к v, сма/(г-с) Л а Масса 1 катализа- тора q, г vm, см’ (количество адсорбированного Кг на монослой)
1 2 3 4 5 6 7 _ 8
1 тю2 713 773 798 0,08 0,08 0,08 4,0 4,0 4,0 0,0005 0,0016 0,0024 2 0,73
2 тю2 823 848 798 0,08 0,08 0,08 4,0 4,0 4,0 0,0042 0,0061 0,0024 2 0,73
3 V2O3 713 748 773 0,37 4,8 0,021 0,066 0,141 3 1,33
4 v203 798 823 848 0,37 0,35 4,8 4,8 4,4 0,294 0,456 0,597 3 1,33
5 Cr2O3 623 648 673 0,26 4,7 0,1 0,164 0,250 3 17
6 Сг2О3 673 713 748 0,26 0,27 0,27 4,7 4,8 4,8 0,250 0,504 0,695 3 17
460
Продолжение
№ п/п Оксид T, к V, см3/(г.с) ц а Масса катализа- тора q, г см’ т (количество адсорбированного Кт на монослой)
7 МпО 773 748 773 0,37 5,0 0,161 0,107 0,173 2 2,61
8 МпО 798 823 848 0,34 5,0 0,259 0,360 0,458 2 2,61
9 Fe3O4 623 648 673 1,39 1,39 1,37 5,0 5,0 4,9» 0,140 0,275 0,396 4 10,4
10 Fe3O4 673 713 748 1,37 1,39 1,43 4,9 5,0 5,2 0,396 0,613 0,748 4 10,4
11 ZnO 713 748 773 0,29 0,29 0,28 5,0 5,0 4,8 0,037 0,075 0,111 3 0,98
12 ZnO 798 823 773 0,28 0,30 0,28 4,9 5,2 4,8 0,195 0,372 0,111 3 0,98
ГЛАВА XXVIII
КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКИХ РЕАКЦИЙ
Основные уравнения и символы
[К., с. 602—625, Г., т. 2, с. 572—6191
Количество электричества, необходимое для разложения I г-экв
электролита, равное 96 450 Кл, называют постоянной Фарадея. Мас-
су вещества т, подвергшегося разложению, выделившегося на элек-
тродах или образовавшегося в растворе в результате электролиза,
вычисляют по уравнению
z 11
т =-------, (XXVIII.1)
где г — эквивалентная масса, г; / — сила тока, A; t — время, с;
F — постоянная Фарадея.
461
При проведении электролиза часть тока уходит на побочные про-
цессы и поэтому степень полноты электролиза всегда меньше теорети-
ческой. Обычно вычисляют величину выхода по току:
„ Масса выделившегося при электролизе вещества
В<у—- — ,
Рассчитанная масса вещества, которая должна выделиться при электролизе
Многие реакции электролиза не являются обратимыми. Наблю-
даемый потенциал разложения превышал величину, вычисляемую из
термодинамических данных. Этот избыточный потенциал, называемый
потенциалом перенапряжения, зависит от площади электродов и со-
стояния их поверхности, наличия примесей в растворе и плотности
тока, протекающего через раствор.
Для многих электрохимических процессов плотность тока i и пере-
напряжение т] связаны между собой уравнением Тафеля
T) = a + Z>lgi, (XXVIII.2)
где а и b — некоторые параметры, характеризующие данную систему.
Большинство электрохимических реакций с участием органи-
ческих веществ протекает через стадию предварительной адсорбции
их на поверхности электрода. Скорость адсорбции органических ве-
ществ описывается уравнением Рогинского—Зельдовича
щ=*сехр(-а/'0р)( (XXVIII.3)
где k — константа скорости адсорбции; с — концентрация органиче-
ского вещества; a — константа; f — коэффициент неоднородности по-
верхности электрода.
Зависимость адсорбции от времени подчиняется уравнению
0£ = Р+—~~ Int, (XXVIII.4)
a [
где 0r — степень заполнения поверхности электрода органическим
веществом.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Через раствор CuSO4 пропущено 5 А-ч электричества. При
этом на электроде (катоде) выделилось 5,6 г меди (/п,1р = 5,6). Опре-
делите выход по току.
Решение. Эквивалентная масса меди 63,57/2 = 31,785; израс-
ходовано 5/26,8 = 0,1865 F (96 540-0,1865 = 18000 Кл). Следователь-
но, теоретически, согласно закону Фарадея, должно выделиться меди:
Итеор=31,785-0,1865= 5,92 гСи.
Отсюда выход меди по току составит
WflD
Вт =---22— 100 = 5,6/5,92-100 = 94,7 %.
ттеор
462
2. При пропускании электрического тока через слаборазбавленную
серную кислоту выделяется на катоде в течение 5 мин 40 см8 водорода,
измеренных при 288 К и 748 мм рт. ст. Определите силу тока, проходя-
щего через электролит.
Решение. Определяем массу выделившегося водорода (на ка-
тоде) по уравнению т = MPV/RT. Имеем: М = 2,016; Р = 748/760
атм; V = 0,04 л (40 см3); R — 0,082 л/атм/(моль-К); Т = 288 К.
Отсюда
2,016.748-0,04
т =----------------= 0,00336 г Н,.
760-0,082-288 2
Силу тока определяем по уравнению (т — 0,00336 г, z = 1,008»
t = 5-60 = 300 с)
т-96 540 0,00336-96 540
~ zt = 1,008-300 ~ ’
3. Железный лист, общая площадь поверхности которого 1000 см8,
используют в качестве катода при электролизе соли цинка. Какой
толщины достигает слой цинка, выделившегося на катоде, за 25 мин, ес-
ли средняя плотность тока равна 2,5 А/дм8. Плотность цинка 7,15 г/см3.
Решение. Определяем массу выделившегося на Fe-электроде
цинка по уравнению
m = z 1 t/F.
Для этого рассчитаем эквивалентную массу цинка
Определяем силу тока по уравнению I = iS:
/ = 2,5-10 = 2,5 А
и продолжительность электролиза
/ = 25-60= 1500 с.
Масса выделившегося цинка составит
32,69-25-1500 .
т =--------------=12,7 г.
96 500
Зная массу и плотность выделившегося цинка, находим его объем:
12,7
V =---— =1,776 см3.
7,15
463
Рассчитаем толщину слоя цинка, выделившегося на электроде:
„ 1,776
6 =--------— 1,776-103 см3.
1000
4. При исследовании кинетики адсорбции малеиновой кислоты на
гладком родиевом электроде при 293 К и потенциале фр = 0,2 В с
помощью электрохимических импульсных методов были получены сле-
дующие данные:
Время, c 0^ при концентрации, моль/л
ю-2 [ 5-10-3 2-10-3 10-3
5 0,06 0,03 0,01 0,01
10 0,13 0,06 0,02 0,01
20 0,19 0,12 0,03 0,02
30 0,23 0,17 0,07 0,02
50 0,27 0,21 0,14 0,04
100 0,34 0,28 0,20 0,11
200 0,42 0,34 0,26 0,18
300 0,43 0,37 0,30 0,23
500 0,44 0,39 0,33 0,28
1000 0,4b 0,39 0,32 0,30
Постройте кинетические кривые адсорбции (Or—lg t), проверьте
применимость уравнения w = kc exp (— ос/'Or) для описания кинети-
Рис. 54. Зависимость степени
заполиеиия поверхности малеи-
новой кислотой различной кон-
центрации от времени адсорб-
ции, моль/л:
1 — с=10-2; 2 — с---5-1 о-3; 3 —с=
= 2-10-3; 4 — с=10~3
ки адсорбции и определите константу
скорости адсорбции.
Решение. На рис. 54 представ-
лена зависимость степени заполнения
(Or) поверхности хемосорбированными
органическими частицами малеиновой
кислоты от логарифма времени адсорб-
ции lg t. Для растворов всех концен-
траций наблюдается хорошо выражен-
ный линейный участок, т. е. зависи-
мость адсорбции от времени может быть
описана уравнением
0R = P +—77- 1и *,
а/'
где постоянная af есть функция концентрации. Величину а/' опреде-
ляем как тангенс угла наклона прямой, который равен 1/а/'. Для
концентрации малеиновой кислоты с = 5-10~3 получаем
2,3 (lgTg— lgTi) 2,3-1
1 0R(2)—0R(i) 0,275—0,06
464
Аналогично рассчитаем af для всех концентраций малеиновой кисло
ты. Величина а/' практически не зависит от концентрации и является
характеристикой процесса адсорбции данного вещества на родии:
10,2+10,7+10,4-J-9,6
ос [ с р =f -10, 2.
Рассчитываем скорость адсорбции малеиновой кислоты на родии для растворов различной концентрации (например, для с = 10“2 моль/л и 9r = 0.09): а-, - . a°r 9r (2)—9r (1) - 0,13—0,06 4J0_2(,_1 A t t2 — t, 5
и сводим полученные данные: для с - ю-2 моль/л
0R W . -1g 0,09 0,16 1,4-10—2 6-10-3 w 1,84 2,22 0,21 4-IO-3 2,4 2- 0,25 0,30 Ю-з 1,4-Ю-з 2,7 2,86 0,38 8-Ю-f 3,1
для c = 5-10-3 моль/л
0R -lg 0,09 0,15 7-10-3 5-10-3 w 2,15 2,3 0,19 2-10-3 2,7 0,25 0,32 l,4-10-3 6-10-1 2,86 3,2 0,35 З-10-i 3,5
Для c = 2-10-3 моль/л
9r w . -lg 0,05 0,11 ' 4-10~3 3,5-10—3 а> 2,4 2,45 0,17 1,2-10- 2,92 -3 0,23 6-io-« 3,2 0,28 4-10-1 3,4
Для с = IO-3 моль/л
7Q . 0,03 0,07 IO-» 1,4-10—3 w 3 2,86 0,14 7-10- 3,15 4 0,20 5-10-1 2 3,3 0,26 ,5-10-i 3,6
На основании рассчитанных величин строим зависимости lg ш =--
= / (9r) для растворов указанных концентраций (рис. 55). Из полу-
ченных зависимостей рассчитываем а/':
„ 2,3 (igm>2 — lg а>,)
ОС f — д д ,
°R(1) °(R2)
ОС/'p= 10,4.
На основании полученных зависимостей lg w = f (9r) строим гра-
фик в координатах lg w — lg с при 6r = const (рис. 55, а). Логариф-
мируя уравнение w = kc" exp (— oc/rOr), получаем
In и> = 1п k-\-n In c—a f' Од,
465
Рис. 55. Зависимость скорости адсорбции малеиновой кислоты
на родии от концентрации (а) н степени заполнения поверх-
ности (б)
откуда при 0r = const
л = (1g и>2 — 1g иМ / (Ig c2~lg Ci);
nl = 94; л2=1,01; n3 = 0,99; nt— 1 ,05; л5 = 0,97;
лСр ==0,99 /0,05.
Таким образом, показатель степени при концентрации в кинетическом
уравнении скорости адсорбции примерно равен 1. Рассчитаем кон-
станты скорости адсорбции
w
k —-----прн 0р = 0 и п = 1.
Определяем скорость адсорбции экстраполяцией зависимостей
Ig w от Or (рис. 55, б) до Or = 0. Сведем полученные экстраполяцией
значения скорости адсорбции, константы скоростей адсорбции при
различных концентрациях малеиновой кислоты:
с, моль/л.................... 1-10—2 5-10’3 2-10-3
w............................3,16-10—2 1,7-10—3 6,3-10-3
eR=o
k, 1/(моль-с)................ 3,16 3,40 3,15
ю-3
3,6-10-3
3,16
&ср = 3,25±0,15.
Таким образом, общее кинетическое уравнение процесса адсорб-
ции малеиновой кислоты на родии имеет вид
tt> = 3,25 сехр(— 1О,20р).
5. При исследовании адсорбции малеиновой кислоты на родиевом
электроде при различных температурах были получены следующие
данные:
466
Время, с б^при температуре, °C
60 | 50 40 30 20
10 0,07 0,06 0,04 0,03 0,02
20 0,17 0,12 0,09 0,06 0,03
30 0,20 0,16 0,14 0,12 0,07
50 0,27 0,25 0,19 0,17 0,14
100 0,27 0,25 0,19 0,17 0,20
200 0,42 0,39 0,35 0,33 0,27
300 0,42 0,39 0,38 0,34 0,31
590 0,44 0,41 0,38 0,36 0,32
Определите энергию активации процесса адсорбции малеиновой ки-
слоты на родии при различном заполнении поверхности адсорбиро-
ванным водородом и установите зави-
симость энергии активации адсорбции 8Я
от степени заполнения поверхности.
Решение. Строим зависимость
0r = f (Ig t) при различных темпера-
турах (рис. 56). Затем определяем ско-
рость адсорбции:
Рис. 56. Кинетические кривые
адсорбции малеиновой кисло-
ты при различных температу-
рах; °C;
I — 60; 2 — 50; 3 — 40; 4 — 30;
5—20
01 = 0,2; / = 6О°С,
К
0,23—0,17 „ ,
w =------------= 4,68 • 10-3,
34,7—21,9
lgo> = 3,67= -2,33.
Результаты расчета сводим в таблицу:
Темпера* тура, °C Ig W при 0R
0,10 0,15 0,20 0,25 0,30
60 — 1,98 —2,17 —2,33 —2,49 —2,65
50 —2,14 -2,30 —2,47 -2,65 —2,79
40 -2,25 -2,43 -2,62 —2,80 —2,99
30 —2,41 -2,60 —2,78 —2,98 -3,21
20 -2,55 —2,76 —3,00 —3,18 —3,40
Строим зависимость Ig w от МТ при 0r = const (рис. 57), исполь-
зуя полученные результаты, из которых определяем энергию актива-
ции процесса адсорбции:
A Ig w
£a = 2,37?tga, где tga = ~ ,
467
Рис. 57. Зависимость скорости ад-
сорбции от обратной температуры
при различных степенях заполне-
ния
Еа.
к/Дк/имь
32
2В
2Ь
V fe ОД
Рис. 58. Изменение энергии акти-
вации от степени заполнения по-
верхности
Построить зависимость энергии активации от степени заполнения
поверхности 0р (рис. 58). Эта зависимость носит линейный характер
и описывается уравнением Еа = Ео + af'RTQ^, где Ео = 23,9 кДж.
ЗАДАЧИ
1. Через раствор сульфата меди проходит ток силой 1,5 А. Опре-
делите теоретический выход меди в течение 1 ч.
2. При помощи электролиза воды требуется получить 0,6 л грему-
чего газа при 293 К и 740 мм рт. ст. Сколько для этого потребуется
времени, если сила тока 2 А?
3. Металлический предмет требуется покрыть слоем никеля тол-
щиной 0,3 мм. Площадь поверхности покрываемого предмета равна
100 см2. Плотность никеля 9,0 г/см3. Сколько времени требуется про-
пускать ток силой 3 А, если выход по току составляет 90 %?
4. Определите расход электроэнергии на получение 1 т меди при
выходе по току 96 %.
5. При электролизе 20 %-ного раствора ацетата калия при 290 К
наряду с другими продуктами на аноде получается этан по уравнению
реакции
2 СН3 СОО-=С2Н,+2 СО2Ц-2 е.
Отношение числа молекул этана, полученного на аноде, к числу моле-
кул водорода, полученного на катоде, равно 0,8. Определите выход
этана по току.
6. Для восстановления нитробензола до анилина в катодное про-
странство поместили 20 г CeH5NO2 30 см3 спирта, 250 см3 воды, 11 г
НС1 и 1 г SnCl2-2H2O. После пропускания 26,5 А-ч через электроли-
зер со свинцовым катодом было получено 12,76 г анилина. Определи-
те выход по току.
468
7. Ток последовательно проходит через сосуды с водными раство-
рами AgNO3, CuSO4, KI и НС1О4. Какие вещества и в каких количе-
ствах выделяются на платиновых электродах в растворах CuSO4,
KI и НС1О4, если в сосуде с раствором AgNO3 на катоде осадилось
0,1079 г серебра?
8. При прохождении тока через раствор сульфата никеля на като-
де выделяются никель и водород. Определите выход по току никеля,
если после пропускания 0,5 А-ч выделилось 17,4 см3Н2(при н. у.).
9. Если при электролизе раствора поваренной соли отделить ка-
тодное пространство от анодного, то в катодном пространстве получают
едкий натр, а на анод. — хлор. Напишите уравнения реакций, проте-
кающих на электродах, и определите выход по току щелочи, если в
70,5 л катодного раствора после электролиза в течение 6 ч при силе то-
ка 1000 А содержалось 118 г едкого натра на каждый литр раствора.
10. При электролизе концентрированного кислого раствора суль-
фата аммония на аноде при низкой температуре образуется персуль-
фат аммония. Напишите уравнение протекающей на аноде реакции и
определите количество электричества, израсходованное на полу-
чение 1 кг персульфата аммония, если выход продукта по току состав-
ляет 75 %. Какой побочный продукт и в каком количестве выделится
на аноде?
11. Постройте график зависимости сдвига потенциала от плотно-
сти поляризующего тока при электролизе раствора, содержащего
0,01 моль/л CuSO4 и 1 моль/л H2SO4. Коэффициент диффузии ионов
Си2+ равен 1 • 10-5 м2/с, толщина диффузионного слоя 6 = 10 мкм,
298 К.
12. При выбранных условиях перемешивания раствора плотность
предельного тока осаждения меди /пр из 0,02 М CuSO4 составляет
20 мА/см2. Рассчитайте потенциал медного электрода (относительно
н. в. э.) при катодных плотностях тока 5, 10, 15, 18 и 19 мА/см2, если
наблюдается чисто концентрационная поляризация (y±cuso4 = 0,317
при 298 К).
13. Потенциал кадмиевого катода (<рк = —0,535 В) измерен в
0,01 М растворе CdSO4 (у± =0,399). Определите, какую долю от
предельного тока составляет ток при данном потенциале, если поляри-
зация при осаждении кадмия чисто концентрационная. Найдите от-
ношение тока к предельному току для потенциалов фК = —0,505;
— 0,490; —0,485; —0,480 В (298 К).
14. Сплав серебро—медь осаждают на цианистых электролитах,
содержащихся в виде ионов Си (CN)7 и Ag (CN)7 8 г/л меди и 2 г/л
серебра (в пересчете на металлы). Определите массовый состав сплава
(%), если осаждение обоих металлов ведется при предельных токах и
константы диффузии ионов одинаковы.
15. Электролит содержит 10 г/л никеля и 5 г/л кобальта в виде
сульфатов. Определите выход по току сплава, массу осадка и его со-
став, если электролиз ведется при плотности тока 20 А/дм2 в течение
20 мин на электроде с площадью поверхности 10 см2 и оба металла вы-
469
деляются на предельном токе. Коэффициенты массопереноса D/6 ио-
нов Ni2+ иСо2+ считать одинаковыми и равными 1,6-10-3 см/с.
16. На монокристалле Ni с гранью (III) в 0,1 М КОН, pH 13,15,
при 293 К изучали кинетику выделения водорода. Были получены
следующие данные:
г], В........ 0,075 0,114 0,150 0,190 . 0,225 0,265 0,300
Ig i, А/см2 . . —4,00 —3,80 —3,60 —3,40 —3,20 —3,00 —2,80
Рассчитайте постоянные а, b в уравнении Тафеля.
17. При изучении кинетики выделения водорода на монокристал-
лах в сильнокислом растворе были получены следующие данные:
г). В . 0,3 0,35 0,40 0,45 0,50 0,55 0,60 0,65
г'20оС. А/см2 0,0115 0,0190 0,0440,11 0,3050,77 1,65 3,0
г30°С ’ А/см2 . 0,0162 0,29 0,073 0,195 0,535 1,28 2,55 4,25
Чо°С ’ А/см2 • • • • • 0,022 0,044 0,11 0,29 0,75 1,72 3,15 5,2
^50°С* А/см^ 0,037 0,072 0,19 0,51 . 1,15 2,5 4,3 6,6
Определите постоянные а и b в уравнении Тафеля при всех темпе-
ратурах. Представьте экспериментальные данные на графике в коорди-
натах Ig i - \!Т при т] = const. Определите эффективную энергию
активации.
18. Рассчитайте выход по току никеля при электролизе раствора
сульфата никеля с <zni2 + = 0.1 при pH 3 и pH 6, если потенциал катода
относительно стандартного водородного электрода ф = — 0,80 В.
Эффекты деполяризации и сверхполяризации в системе никель — во-
дород отсутствуют; константа а в уравнении Тафеля перенапряжения
выделения водорода на никеле при pH 0 равна 0,62 В; стандартный
ток обмена никелевого электрода t'o.Ni = 3-10-8 А/см2; коэффициенты
переноса для процессов разряда ионов Н+ и Ni24- равны: ан+ = 0,5;
aNi2+ - 0,29; ftNi2+ = 2,3RT/(azF) = 0,100 В; фЬ+/щ = — 0,25 В;
Т = 303 К.
19. При изучении адсорбции малеиновой кислоты на. платине при
293 К и фР = 0,4 В было установлено, что степень заполнения поверх-
ности адсорбированным веществом Or = 0,3 для растворов с концен-
трацией с 10“*; 5-10~5; 2,5-10~4 моль/л достигается соответственно
через 10, 25, 47 и 170 с, а степень заполнения Or = 0,35 — за время
16, 37, 74 и 107 с. Определите показатель степени при концентрации
в кинетическом уравнении Рогинского—Зельдовича.
20. При исследовании адсорбции 0,1 М раствора метанола на пла-
тине при 293,2 К было получено
/адс, с.................. 0,5 1 2 5 10 20 50 100 200
О’ '..................... 0,09 0,2-0,32 0,44 0,56 0,69 0,77 0,8 0,82
1\
470
Проверьте выполнимость уравнения 0r = р + ll/(af')] In t, для
описания кинетики адсорбции метанола постройте график зависимо-
сти 6r = f (1g 0] на платине и рассчитайте константу скорости процес-
са, если адсорбция подчиняется уравнению Рогинского—Зельдовича.
21. При исследовании адсорбции метанола на платиновом электро-
де при температурах 284, 296, 308, 319 и 345 К было найдено, что
увеличение степени заполнения поверхности от 0r = 0,35 до Or = 0,4
происходит соответственно за 5,0; 3,0; 2,0; 1,3 и 0,6 с. Рассчитайте
среднюю энергию активации адсорбции метанола на платине при
Or эй 0,375.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
4. Определите константы а и Ь.в уравнении Тафеля, если при из-
мерении потенциала катода из данного металла против каломельно-
го электрода (<р = 0,281 В) в растворе заданного состава при плотно-
стях тока i' и I” получены соответственно величины <р' и <р’.
№ ва- рианта Материал электрод^ Электролит мА/см2 мА/см2 ф', в Ф", в
1 Цинк 2,0 н. H2SO4 5 0,2 1,325 1,157
2 Кадмий 1,3 н. H2SO4 0,4 8,0 1,372 1,528
3 Свинец 1,0 н. H2SO4 0,2 0,8 1,360 1,432
4 Кобальт 1,0 и. НС1 0,1 1,5 0,356 0,533
5 Никель 1,0 н. НС1 0,05 2,5 0,476 0,646
6 Тантал 1,0 н. H2SO4 0,02 5,0 0,753 1,065
7 Родий 2,0 н. H2SO4 5,0 34,0 0,380 0,478
8 Олово 2,0 и. H2SO4 0,1 5,0 1,097 1.294
2. Определите константы а и b в уравнении Тафеля для перена-
пряжения выделения водорода на цинковом электроде с площадью
поверхности S = 4 см2 из 2 н. раствора H2SO4. При потенциале цин-
кового электрода <р относительно 1 н. каломельного электрода, равном
— 1,267 В, на катоде медного кулонометра за 60 мин выделилось
9,5 мг меди, а при потенциале — 1,279 В за 30 мин — 5,94 мг меди.
В условии задачи дан первый вариант, другие сведены в таблицу;
№ вари- анта Материал электрода Раствор S, см2 t, мии т, мг ф, в
2 Кадмий 1,3 н. H2SO4 5 50 9,90 1,453
20 11,88 1,511
3 Олово 2,0 н. H2SO4 2 100 4,76 1,223
10 9,90 1,375
4 Свинец 1,0 н. H2SO4 3 10 5,94 1,554
6 5,35 1,576
5 Никель 1,0 н. НС1 5 50 9,50 0,635
60 57,01 0,705
6 Тантал 1,0 н. H2SO4 1,6 60 4,76 1,026
10 7,92 1,156
471
КОМПЛЕКСНЫЕ ЗАДАЧИ
1. Превращение С2Н4 по уравнению реакции С2Н4 = С2Н2 + Н2
происходит со скоростью 50 % за 10 ч при 1073,2 К. Рассчитайте энер-
гию активации прямой реакции (конечные продукты удаляются из
сферы реакции).
2. Для реакции С2Н4 = С2Н2 + Н2 энергия активации Еа —
= 252-103 Дж. Вычислите температуру, при которой выходС2Н2 за 1 ч
равен половине теоретически возможного при достижении равнове-
сия. Рассчитайте время, за которое указанная концентрация будет
достигнута при 1573 К-
3. Рассчитайте равновесный выход в реакции С2Н4 + Н2 = С2Нв
при 1,01-105 Па, 673,2 К и время, за которое может быть достигнут
выход С2Нв, равный 90 % от равновесного. Энергия активации Еа =
= 182,7-10s Дж, концентрации С2Н4 и Н2 1 моль/л.
4. Водород и иод взаимодействуют между собой согласно урав-
нению Н2 + 1.2 = 2HI. Поступающий на синтез газ имеет массовую
долю (%): Н2 — 32; 12 — 48, инертный газ — 20. Определите, при ка-
кой температуре в равновесной смеси будет содержаться 30 % Н2
при давлении 1,01- 10s Па, если известна зависимость AG° = 246,0 —
— 2,30 lg Т + 10,7 Т. Вычислите время после смешения, если степень
превращения Н2 при рассчитанной температуре будет равна 30 и 18 %,
реакция второго порядка, константа скорости прямой реакции k при
Tj = 556,2 К равна 0,000119, а при Т2 = 781,2 К k = 3,58. Покажи-
те графически, как меняются равновесный выход и скорость этой реак-
ции от температуры.
ПРИЛОЖЕНИЕ
Таблица 1. Парахоры атомов, связей и циклов
Атомы Р. 10’ дж‘Л-м'/гх Хмоль-1 Инкременты связей, циклов р. 19’ Дж'/<.м‘/«х Хмоль-1
Углерод 16,36 Связь:
Водород при: простая 0
углероде 27,39 двойная гомеополяр' 33,78
кислороде 17,79 ная
азоте 22,23 тройная 67,56
семиполярная 0
Цикл:
Кислород 35,56 трехчленный 22,23
> перекисный 37,87 четырехчленный 10,67
Азот 31,11 пятичленный 5,33
Фосфор 72,01 шестичленный 1,42
Мышьяк 96,01 семичленный -7,11
Сурьма 120,90
Сера 88,01
Селей 112,01
Фтор 45,34
Хлор 97,79
Бром 122,68
Иод 160,02
Бор 38,23
Кремний 55,12
Олово 114,68
Ртуть 122,68
Примечание. Присоединение двух или более отрицательных групп X (Cl, CN,
COOR, OR н т. п.) к одному н тому же атому С, N, S уменьшает парахор в среднем для
СХ2 на 5,33-Ю-7; для CXS на 10,67,10~7 и для СХ, на
16.0010-7 единиц.
473
Таблица 2. Функции (Н°т—Н298) для некоторых веществ, кДж/моль
т, к Н2О Н, О, СО, со COCI, НС1
300 0,084 0,054 0,054 0,084 0,084 0,126 0,084
400 3,743 2,958 3,025 4,017 3,012 6,234 2,971
500 6,945 5,883 6,084 8,326 5,941 12,845 8,889
600 10,544 8,812 9,242 12,929 8,953 19,790 8,870
700 14,226 11,749 12,502 17,782 12,050 27,029 11,841
800 18,033 14,703 15,841 22,803 15,188 34,434 14,853
900 21,966 17,673 19,246 28,033 18,410 42,007 17,949
1000 26,024 20,677 22,707 33,388 21,714 49,706 21,046
Продолжение табл. 2
Т, к NHj hn4ci NajCO, NaOH s2 H2S
300 0,084 0,159 0,205 0,109 0,042 0,084
400 3,807 9,68 11,996 6,350 4,640 3,556
500 7,824 23,47 26,295 13,300 8,565 7,196
600 12,217 33,09 40,593 34,200 12,150 11,046
700 16,862 43,82 57,612 42,748 15,498 15,021
800 21,840 — 74,630 51,296 73,341 19,205
900 27,112 — 91,251 59,727 75,174 23,514
1000 32,635 — 107,872 68,157 77,019 28,033
Таблица 3. Диффузионный потенциал при 298 К
Электролит q>- 10s, в Электролит <₽• 10s, в
IM НС1-КС1иасыщ 0,1М НС1*КС1Насыщ 0,01 M НСЬКС1Насыщ 0,01M HC14-0.09M NaOH • КС1насЫщ 14,1 4,6 3,0 2,1 0,1 М КС1/КС1иасыщ 0,01 М HCl/0,1 М КС1 0,01 М HCl/0,1 М КС1 0,1 М NaOH/0,1 М КС1 0,01 М NaOH/0,1 М КС1 1,8 26,9 9,1 —19,2 -4,5
Таблица 4. Молекулярные константы двухатомных молекул
—собственное волновое число; хе — коэффициент ангармоничности;
Ве — вращательные постоянные; ге — равновесное межъядерное расстояние;.
^29в — энергия диссоциации
Молекула <0е, см 1 хе- 10s ве, см-1 ге’ А кДж/моль
Вг2 325,3 3,31 0,0821 2,28 192,9
ВгС1 444,27 4,15 0,152 2,13 215
С12 559,75 4,81 0,244 1,987 242,3
C1F 786,15 7,84 0,516 1,63 252,5
СО 2169,81 6,11 1,931 1,128 1075
474
Продолжение табл. 4
Молекула и>е, см 1 хе - ю» Ве. с“-1 'е, А £>298. кДж/моль
DF 2998,19 15,3 11,00 0,818 273,2
DI 1639,6 12,1 32,84 1,61 298,5
f2 917,55 12,9 0,89 1,41 159,0
FO 1060 14,6 1,104 1,32 215,7
н2 4400,4 27,4 60,86 0,741 435,9
НВг 2648,97 17,1 8,465 1,414 366,5
НС1 2990,9 17,65 10,59 1,274 431,4
HF 4138,7 21,7 20,95 0,917 566,1
HI 2309,01 17,2 65,11 1,61 298,4
h 214,55 2,87 0,037) 2,66 151,0
10 681,47 6,3 0,340 1,868 222
к2 92,96 3,82 0,056 3,92 53,14
n2 2358,03 6,00 1,998 1,098 945,6
NO 1904,4 7,45 1,704 1,151 631,0
о2 1580,19 0,76 1,445 1,207 498,7
ОН 3737,9 29,7 18,895 0,969 428,0
р2 780,69 3,61 0,303 1,893 489,1
Программы для решения некоторых задач
на микрокалькуляторах <Электроника МК-54». «Электроника
МК-46» , «Электроника М К-61»
Для перевода микрокалькулятора в режим программирования следует в
указанной последовательности нажать клавиши: в/о F ПРГ. При этом на табло
справа загорится 00 — адрес первой операции программы. После ввода програм-
мы необходимо перейти в режим автоматической работы, для чего следует нажать
клавиши F АВТ.
Затем вводят исходные данные следующим образом: набирают значение како-
го-либо параметра, нажимают клавишу х П и затем нажимают ячейку па-
мяти, соответствующую по программе этому параметру.
Приведенные ниже программы могут быть также использованы для микро-
калькулятора «Электроника БЗ-ЗК» с соответствующим переводом:
В f = f
П-^х = ИП
х-+П=П
sin-1 = arcsin
cos-1 = arccos
tg~i = arctg
a — A
b=B.
c = C
d=.D
^ = xy
1. Программа для расчета энергии вращения двухатомной молекулы как же-
сткого ротатора:
Л2
£вр“ Вл21
тг щ2
mi + m2
~та г2;
Евр —
„ , , 1 (1 + 1 )
8 л2 тг т2 та г2
8 л2 mt т2 та г2
475
Введите в ячейки памяти необходимые для работы величины:
Адрес Операция Код Адрес Опернцня Код Адрес Операция Код
00 77—«г1 61 10 • 13 19 13
01 П—>х2 62 11 77—►Х1 61 20 х—>776 41
02 + 10 12 -Д- 13 21 77—>х5 65
03 П—>х3 63 13 П—^х2 62 22 1 01
04 Fx2 22 14 — 13 23 + 10
05 X 12 15 П— 60 24 X 12
06 8 08 16 — 13 25 П—>х5 65
07 — 13 17 П—*х* 64 26 X 12
08 £л 20 18 Fx2 22 27 с/п 50
09 Fx2
№ ячейки памяти 0 1 2 3 4 5
Величины та т1 т2 h Г /
где / — квантовое число; г — межъядерное расстояние [М.]; h — постоянная
Планка, 6,62-10-34 Дж-с; т1 и т2— атомные массы в у.е.; та — атомная
единица массы, 1,66* 10-27 кг.
Пуск программы иа счет реализуется клавишами: в/о с/п. На индикаторе —
значение £вр; для получения Ве нажать клавиши П -*• xb.
Проверка программы: / = 10; г = Ю-10 м; т1 — 5; т2 = 10.
Правильное значение: £вр = 1,10339-10-20Дж, Ве = 1,003-Ю-22 Дж
2. Программа дли определения доли молекул N;-/No иа j-м вращательном
квантовом уровне:
^- = (2/+1)е-^;
/¥0
Л2
Е'у= я7в J ~/(/+!)•
у о л* I
Адрес Операция Код Адрес Операция Код ! Адрес Операция Код
00 77— 61 09 77—«з 65 18 1 — 1 OL
01 Fx2 22 10 1 01 19 Fex 16
02 П—*х3 63 11 + 10 20 П—>х5 65
03 — 13 12 X 12 21 2 02
04 8 08 13 П—>х5 65 22 X 12
05 -Д- 13 14 X 12 23 1 01
06 Fit 20 15 П—>х2 62 24 +' 10
07 Fx2 22 16 -Д- 13 25 X 12
08 — 13 17 П—+х* -? 26 с/п 50
476
Введите в ячейки памити необходимые дли расчета величины:
№ ячейки 1 2 3 4 5
Величина Л k I т /
где / — квантовое число; Т — температура, К; I — момент инерции, кг-м?
k — постоянная Больцмана, 1,38-10-?3 Дж/К; Л — постоянная Планка,
6,6262-Ю-34 Дж-с.
Проверка программы: /= 0,459-10-47 кг-м2; j = 5; Т — 300 К.
Правильное значение: Nj/N0 = 1,69-Ю-3.
3. Программа для вычисления колебательной составляющей теплоемкости н
изобарной теплоемкости двухатомного вещества в идеальном газообразном со-
стоянии:
7
-
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П~»х° 60 09 х—>Д5 45 18 X—е/74 44
01 П~*х3 63 10 X 12 19 П—>Х7 61
02 X 12 11 П—+Х1 61 20 7 07
03 П~^х2 62 12 X 12 21 X 12
04 13 13 П—>х5 65 22 2 02
05 х-н-7/4 44 14 1 01 23 13
06 Fx2 22 15 — 11 24 4- 10
07 П~*х* 64 16 Fx2 22 25 с/п 50
08 Fex 16 17 -г 13
Введите в ячейки памяти необходимые для расчета величины:
Хе ячейки памяти 0 1 2 3
Величина he R т ше
где -g = 1,43879 см-К; R = 8,3143 Дж; Т — температура, К; ше — частица
см-1. На индикатор выводится зиачеиие С®. Для вывода иа ииднкатор зиачеиня
СЕ нажать клавиши П -> х 4.
Проверка программы: <ае = 214,248 см-1; Т = 298 К.
Правильные ответы: СЕ = 7,61096; С° = 36,71101.
477
4. Программа для вычисления колебательной составляющей энтропии
двухатомной молекулы или одной колебательной степени свободы многоатомной
молекулы:
о, Re/Te-e/T
«кол = -Л1п(1-с-е/7')+ ~1__е-е/т
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П—0 60 10 X 12 20 1 01
01 П—ух 3 63 11 П—ух 1 61 21 14
02 X 12 12 X 12 22 — 11
03 П—ух 2 62 13 П-—ух 5 65 23 F In 18
04 — 13 14 1 01 24 П—ух 1 61
05 х—уП 4 44 15 14 25 X 12
06 У-Л 16 — 11 26 П—ух 4 64
07 Fex 16 17 — 13 27 14
08 х—уП5 45 18 х—уП 4 44 28 — 11
09 П—ух 4 64 19 П—ух 5 65 29 с/п 50
где = 1,43879 см-К; R = 8,3143 Дж; Т — температура, К; ше — частота,
см-1.
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки памяти 0 1 2 3
Величина he R т ше
k
На индикатор выводится значение 5К0Л. Для вывода на индикатор значения
IU — и0\
-------- нажать клавиши П -► х 4.
у 7* /кол
Проверка программы: ше = 214,248 см-1; Т = 298 К.
Правильные значения: SK0JI = 8,3939657 Дж/(моль-К); (----------—
\ Т /кол
= 4,7425372.
5. Программа для вычисления поступательной составляющей энтропии
вещества в идеальном газообразном состоянии:
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П—УХ 4 64 08 5 05 15 11
01 F 1п 18 09 X 12 16 П—ух 0 60
02 3 03 10 2 02 17 + 10
03 X 12 11 — 13 18 П—УХ 1 61
04 2 02 12 10 19 X 12
05 — 13 13 П—УХ 3 63 20 с/п 50
06 П—УХ 2 62 14 F In 18
07 F 1п 18
478
Введите в ячейки памяти необходимые для расчета величины:
Ns ячейки памяти 0 1 2 3 4
Величина 10,3612 R т Р м
где R = 8,3143 Дж; Т — температура, К; Р — давление, Па; М — молекуляр-
ная масса.
Проверка программы: Т = 298 К; Р = 1,0132-10® Па; М = 143.
Верное значение: S“0CT = 170, 6274 Дж/(моль-К).
6. Программа расчета суммы состояний:
г = г( гг гу;
5
In Zt= 1,5 In М + — In Г —In Р+ 19,222;
1пгг = 1п /-]-1п7’— 1па+104,52712;
1
2К = \_е-Ч/т
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П—+х С 6[ 23 + 10 46 X 12
01 F In 18 24 F 1/х 23 47 П-^xb 6L
02 3 03 25 П—4 64 48 Fex 16
03 X 12 26 X 12 49 — 13
04 2 02 27 П—*х 5 65 50 1-1 OL
05 — 13 28 X 12 51 Fex 16
06 П—>х b 6L 29 П—>х 3 63 52 1—1 OL
07 F In 18 30* X 12 53 1 01
08 х—>П Ь 4L 31 П—»х d 6L 54 _L F 1/x 10
09 5 05 32 F х- 22 55 23
10 X 12 33 X 12 56 x—>П 7 47
11 2 02 34 F In 18 57 П—>x 8 68
12 — 13 35 П—*х b 6 58 П—>x 9 69
13 + 10 36 d- 10 59 X 12
14 П—>х a 6— 37 П—*x 1 61 60 X 12
15 F In 18 38 F In 18 61 x—>П 6 46
16 17 18 19 20 21 22 П—>х 9 + Fex х—->П 9 П—>х 4 П—>х 5 11 69 10 16 49 .64 65 39 40 41 42 43 44 45 П—>x 8 + Fex x—>/7 8 FI—*x 7 П—>х 2 11 68 10 16 48 67 62 62 c/n 50
Введите в ячейки памяти необходимые для расчета значения:
Ns ячейки памяти a b c d 1 2 3 4 5 6 7 8
Величина p T M d a We 1.6610-2’ тг m2 1,43879-10-2 104,52712 19,222
479
где р — давление, Па; Т — температура, К; М — молекулярная масса; d —
межъядерное расстояние, м; а — степень симметрии; <ое — частота, см-1; ш1 и
т2 — относительные массы атомов. В ячейку 3 заносится атомная единица мас-
сы, в ячейку 7 — (hc/k).
После окончания счета для вывода результата проделать следующие опера-
ции:
поступательная составляющая Zt — П -*• х9;
вращательная составляющая ZT = П ->• х8; колебательная составляю-
щая Zv = П -»• х 7;
сумма состояний Z = П -*• х 6.
Проверка программы: Р — 1,0132-10-5 Па; Т — 400 К; М = 80-10-3;
а = 1,414-10-10 м; а= 1; <ое = 2649,683-102 м-1; иц = 1; тг = 79.
Правильные значения: Zt = 1,5925-108; ZT = 32, 59536; Zv = 1,0000726;
Z = 5,1914-10».
7. Вывод (коэффициентов уравнения Ср = а-'-- ЬТ4- сТ2 для трех известных
значений теплоемкости и температуры.
Для расчета коэффициентов используют три программы, которые следует
вводить в машину в приведенной последовательности не выключая (!) из сети
микрокалькулятор.
Программа I
После набора программы и ввода данных нажать клавиши в/о и с/п. После окон-
чания расчета перейти в режим программирования, для чего нажать клавиши
в/о Fnpr и ввести в микрокалькулятор программу II.
Проверка программы I
Ввести: 7\ = 400; Тг = 600; Г3 = 1200; Ср1 = 29,154; Ср2 = 29,685;
Срз = 32,911.
Примечание. После окончания расчета по программе I в ячейках памяти
зззз
4, 5, 6, 7 будут находиться соответственно 2 Тр, S ТЪ; S 7?; 2 Tf и в ячейках
i = i i = i i=i t=i •
0, 8, 9 соответственно 2С„ ; 2 (Cp.Tj); 2 (СР.Т,).
z=i 4=1 1 f=i 1
При правильной работе программы в ячейках памяти должны находиться
следующие значения:
№ ячейки памяти 4 5 6 7 0 8 9
Величина 2200 1,96-10е 2,008-10» 2,2288-1012 91,75 68965,8 62743080
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П—>х 1 6! 26 /7—+х 3 63 52 П—ухЬ 6L
01 77—>х 2 62 27 X 12 53 X 12
02 П—ух 3 63 28 + 10 54 “Т- 10
03 + 10 29 х—->-/7 6 46 55 П—ух 3 63
04 + 10 30 П—УХ 1 61 56 П—ух с 6L
05 х—уП 4 44 31 Fx2 22 57 X 12
06 П—ух 1 61 32 Fx2 22 58 + 10
07 Fx2 22 33 П—ух 2 62 59 х—уП 8 48
08 П—ух2 62 34 Fx2 22 60 П—ух 1 61
09 Fx2 22 35 Fx2 22 61 Fx2 22
10 + 10 36 + 10 62 П—ух а 6—
11 П—ух 3 63 37 П—ух 3 63 63 X 12
12 Fx2 22 38 Fx2 22 64 П—ух2 62
13 + 10 39 Fx2 22 65 Fx2 22
14 х—>-/75 45 40 + 10 66 П—ух 6 6L
15 /7—>х 1 61 41 х—уП 7 47 67 X 12
16 Fx1 22 42 П—ух а 6— 68 + 10
17 /7—>х 1 61 43 П—ух b 6L 69 П—ух 3 63
18 X 12 44 П—ух с 6| 70 Fx2 22
19 П—ух 2 62 45 + 10 71 П—ух с 6|
20 Fx2 22 46 + 10 72 X 12
21 X2 62 47 х—>// 0 40 73 + 10
22 X 12 48 П—ух а 6— 74 х—уП 9 49
23 10 49 П—ух 1 61 75 с/п 50
24 П—ух 3 63 50 X 12
25 Fx2 22 51 П—ух 2 62
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки памяти 1 2 3 а ь с
Величина Л Т2 Т3 сР1 СР2 СРЗ
Программа II
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П—ух 7 67 30 П—УХ 7 67 59 X 12
01 П—ух 5 65 31 X 12 60 П-ух 5 65
02 3 03 32 П—ух 6 66 61 Fx2 22
03 X 12 33 Fx2 22 62 — 11
04 X 12 34 — 11 63 П—ух d 6Г
05 П-ух 4 64 35 П—ух d 6 64 — 13
06 П—ух 6 66 36 -L- 13 65 х—уП а 4—
07 П-ух 5 65 37 x-уП 1 41 66 П—ух 6 66
08 X 12 38 П-ух 4 64 67 3 03
09 X 12 39 П—ух 7 67 68 X 12
10 + 10 40 X 12 69 П—ух 5 65
11 FBx 0 41 П—ух 6 66 70 П—ух 4 64
12 10 42 П—ух 5 65 71 Л 12
13 П-ух 5 65 43 X 12 72 — 11
14 Fx2 22 44 — 11 73 П—ух d 6Г
15 П-ух 5 65 45 П—ух d 6 74 -2_ 13
16 X 12 46 — 13 75 х—уП Ь 4
17 — 11 47 х—уП 2 42 76 П—ух 5 65
18 П-ух 6 66 48 П—ух 4 64 77 3 03
19 Fx2 22 49 П—УХ 6 66 78 X 12
20 3 03 50 X 12 79 П—ух 4 64
21 X 12 51 П—ух 5 65 80 Fx2 22
22 — 11 52 Fx2 22 81 —' 11
23 П—ух 4 64 53 — 11 82 П—ух d 6Г
24 Fx1 22 54 П—ух d 6Г 83 13
25 П—ух 7 67 55 — 13 84 х—уПС 4
26 X 12 56 x-уП 3 43 85 с/п 50
27 —— 11 57 П—ух 7 67
28 х—уП d 4Г 58 3 03
29 П-ух 5 65
16 Зак. 767
481
480
Для проверки правильности программы использовать данные программы I.
После окончания расчета в ячейках 1, 2, 3, a, b, с, d должны быть следующие
значения:
№ ячейки памяти i 2 3 а ь С d
Величина 36,5 0,105 6,25-Ю-з 3,087-10-® 1,857-10-’ 1,128-10-ю 9,216-101»
Программа III
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П+х 1 61 14 Г-Л 0 28 Л—х 0 60
01 П-+х 0 60 15 Л—X 0 60 29 X 12
02 X 12 16 X 12 30 П-^х 8 68
03 П-+х 2 62 17 П->-х а 6- 31 П-+х b 6L
04 Г-Л 0 18 П—х 8 68 32 Г—Л 0L
05 П-+х 8 68 19 X 12 33 X 12
06 X 12 20 + 10 34 + 10
07 10 21 П-^х 9 69 35 П-*х с 6L
08 П-+Х 3 63 22 П-*-х b 6 36 П-+х 9 69
09 П-+х 9 69 23 Г-Л 0 37 X 12
10 X 12 24 X 12 38 + 10
И + 10 25 + 10 39 х-+П 6 46
12 х-»-П 4 44 26 Л—X 5 45 40 с/п 50
13 П-+х 2 62 27 П-+х 3 63
Коэффициенты уравнения Ср=а+5Г+сГ2, а, Ь и хранятся соответствен-
но в 4, 5,6, ячейках памяти.
Для извлечения из памяти нажать клавишу П -* х и номер нужной ячейки.
Проверка программы III.
Правильные значения коэффициентов: а= 28,9085; Ь— 4,602-10-8; с =
= 4,8454-10-®.
8. Программа вычисления факториала nl = 1. Если принять заранее, что
п ф 0, то п! можно вычислить по следующей программе:
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 1 01 02 X 12 04 01 01
01 Л-*х О 60 | 03 FLO 5Г 05 с/п 50
Значение п вводите в ячейку 0. Для любого л > 0 вычисляют л! по про-
грамме:
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 вп °[ 04 X 12
01 Х-+П0 40 05 FLO 5Г
02 1 01 1 06 03 03
03 Л-»л' О 60 07 с/п 50
482
Проверка программы: п = 6; л!= 720; п = 0; п! = 1.
9. Программа для вычисления корней квадратных уравнений вида ах2-)-
+ Ьх + с = 0.
В ячейку «а» вводится а, в «Ь» — значение Ь, в «с» — значение с.
Если корни уравнения действительные, то по окончании расчета на индикато-
ре высвечивается значение х2 и в ячейках памяти 1 и 2 хранятся соответственно
Xi и х2. Если корни уравнения мнимые, то по окончании расчета на индикаторе
высвечивается [0]. В ячейках памяти 0 н 9 хранятся соответственно действитель-
ная и мнимая части корней.
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 /7->Х b 6L 11 11 22 Х-*/7 2 42
01 П-^х а 6 12 Ех>0 59 23 БП 51
02 — 13 13 25 25 24 29 29
03 2 02 14 F У~ 21 25 1 — 1 0
04 13 15 х-*П d 4Г 26 F V— 21
05 1—1 01 16 П-*-х 0 60 27 х-+П 9 49
06 х-+ПО 40 17 10 28 С х ОГ
07 Fx2 22 18 Х-+П 1 41 29 с/п 50
08 . П-+х С 6[ 19 П-+х 0 60
09 П->-х а 6— 20 /7-»х d 6Г
10 -h 13 21 — 11
Проверка программы: 1) 5х2 + 2х—3=0; хг = 0,6; х2 = — 1; 2) х2 —
— 2х + 10= 0; Xj = 1 4- /3; х2 = 1 — /3.
Статистическая обработка непосредственных измерений
После ввода программы и перехода в режим автоматической работы ввести в
ячейки памяти 1, 2 и 3 соответственно nlt п2 н п3. В ячейку а вводится критерий
Стьюдента ta (я), где а — доверительная вероятность, п — число измерений.
В ячейку d вводится точность прибора.
Принцип работы программы. Сначала вычисляют среднее значение п, за-
тем (л — я). Если (л — n)<_d, то (л — л) отбрасывают и в дальнейшем рас-
считывают доверительный интервал d. Если (п — п) d, то в расчет доверитель-
ного интервала идет это значение.
По окончании расчета п хранится в ячейке 0, Дл — в ячейке с.
Все вышеуказанное относится ко всем программам статистической обработки
непосредственных измерений, с той лишь разницей, что для 4, 5, 6, 7, 8 и 9-го из-
мерений соответственно л4 -► 4, л5 -> 5, лв -> 6, л7 -> 7, лч -► 8, л9 -► 9 ячейки.
Значения критерия Стьюдента для доверительной вероятности при а =
= 0,96:
п 3 4 5 6 7 8 9
4,303 3,182 2,776 2,571 2,447 2,365 2,306
16*
483
Программа для 1=3
Программа для 1=5
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 77->х 1 61 16 25 25 31 — 11 00 П^х 1 61 19 ПП 53 38 Fx2 22
01 77-*х 2 62 17 6 06 32 Fx<.0 01 П~+х 2 62 20 36 36 39 F V~ 21
02 Л->х 3 63 18 — 13 33 36 36 02 П-+х 3 63 21 /7-*х 4 64 40 х-+ПЬ 4L
03 10 19 F V~ 21 34 /7->х d 6Г 03 П->-х 4 64 22 ПП 53 41 П-+х d 6F
04 10 20 П-+х 6— 35 х->-П Ь 6L 04 10 23 36 36 42 11
05 3 03 21 X 12 36 П-+х b 6L 05 10 24 /7->х 5 65 43 Fx<0 51
06 — 13 22 x-t-ПС 4( 37 Fx2 22 06 10 25 ПП 53 44 47 47
07 х—/70 40 23 ьп 51 38 /7—С 61 07 /7-*х 5 64 26 36 36 45 П->-х d 6Г
08 /7->х 1 61 24 42 42 39 + 10 08 + 10 , 27 2 02 46 х-ь-П b 4L
09 ПП 53 25 П-+х 0 60 40 X-+IIC 4[ 09 5 05 28 0 00 47 П-*-х b 6L
10 25 25 26 — 11 41 в/о 52 10 — 13 29 — 13 48 Fx2 22
11 /7->х 2 62 27 Fx2 22 42 с/п 50 11 х-ь-ПО 40 30 F 21 49 П->-х C 6
12 ПП 53 28 F V~ 21 12 П-+Х 1 61 31 П-+х а 6— 50 + 10
13 25 25 29 х-^ПЬ 4L 13 ПП 53 32 X 12 51 Х-+ПС 41
14 /7-*х 3 63 30 П-+х d 6Г 14 36 36 33 х-*ПС 4[ 52 b/o 52
15 ПП 53 15 П-+х 2 62 34 ЬП 51 53 c/n 50
16 ПП 53 35 53 53
17 36 36 36 П-~х 0 60
Проверка программы: = 6,3; п2 = 6,7; п3 = 5,9. 18 /7-*х 3 63 37 — 11
Точность прибора d = 0,25.
Правильный ответ: п±Дп; п— 6,3; Дл 1,08645. Проверка программы: nt = 3,3; пг = 3,8; п3 = 3,5; л4 = 3,15; л6 = 3,35.
Точность прибора d = 0,25.
Правильный ответ: п ±Дл; п= 3,42; Дл = 0,39493.
Программа для i=4 „ '
................................................................. Программа для »=6
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 /7->х 1 61 17 ПП 53 33 F х 22 —
01 /7->х 2 62 18 31 31 34 F V 21 00 П->-х 1 61 21 ПП 53 41 60
02 /7->х 3 63 19 /7->х 4 64 35 х->/7 b 4L 01 П-+х 2 62 22 41 41 42 11
03 /7->х 4 64 20 ПП 53 1 36 П-+Х d 6F 02 /7-*х 3 63 23 /7-*х 4 64 43 Fx2 22
04 + 10 21 31 31 37 — 11 03 П^-х 4 64 24 ПП 53 44 F V~ 21
05 10 22 1 01 38 Fx<& 5[ 04 + 10 25 41 41 45 х-+П b 4[
06 10 23 2 02 39 42 42 05 + 10 26 /7->х 5 65 46 П-*х d 6Г
07 4 04 24 — 13 40 /7->х d 6F 06 10 27 ПП 53 47 11
08 — 13 25 F V~ 21 41 х-+П b 4L 07 П-+х 5 65 28 41 41 48 Fx<Q 5[
09 Х-+П0 40 26 П-+х а 6— 42 П-+х b 6L 08 /7->х 6 66 29 /7-*х 6 66 49 52 52
10 П-+х 1 61 27 X 12 43 Fx2 22 09 + 10 30 ПП 53 50 /7-*х d 6Г
H ПП 53 28 х-*ПС 4[ 44 ll—^x C 6( 10 + 10 31 41 41 51 х-+П b 4L
12 31 31 29 ЬП 51 45 + 10 И 6 06 32 3 03 52 П—*х b 6L
13 П-+х 2 62 30 48 48 46 X~i-llC 4( 12 -L, 13 33 0 00 53 Fx2 22
14 ПП 53 31 П-+х 0 60 47 b/o 52 13 х-+ПО 40 34 13 54 П-*-х C 61
15 31 31 32 — 11 48 c/n 50 14 П-+х 1 61 35 F V~ 21 55 + 10
16 /7->х 3 63 15 ПП 53 36 П-+х а 6— 56 х-^ПС 4
16 41 41 37 X 12 57 b/o 52
Проверка программы: nj = 5,2; пг = 5,3; Точность прибора d = 0,25. Правильный ответ: л±Дл; л=.5,45; Дл = л3 = 5,4; л4 0,57364. = 5,9. 17 18 19 20 /7-»х 2 ПП 41 /7-*х 3 62 53 41 63 38 39 40 х-^ПС ЬП 58 4[ 51 58 58 c/n 50
484
485
Проверка программы: лх = 2,1; л2 — 2,2; п3 — 2,3; л4 — 2,8; л5 — 3,0;
лв — 2,35.
Точность прибора d = 0,25.
Правильный ответ: п ± Дл; п ~ 2,45833; Дл = 0,40113.
Программа для i=7
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 П-+х 1 61 22 /7->Х 3 63 43 Х-+ПС 4[
01 П-*х 2 62 23 ПП 53 44 ьп 51
02 П-+х 3 63 24 46 46 45 63 63
03 /7-*х 4 64 25 П-+х 4 64 46 П-+х 0 60
04 + 10 26 ПП 53 47 — 11
05 4- 10 27 46 46 '48 Fx2 22
06 -j- 10 28 П-+х 5 65 49 F V 21
07 П—х 5 65 29 ПП 53 50 х-^ПЬ 4L
08 /7->х 6 66 30 46 46 51 П-+х d 6Г
09 П-+х 7 67 31 П-+х 6 66 52 — 11
10 + 10 32 ПП 53 53 Fx<0 5[
11 10 33 46 46 54 57 57
12 10 34 П-+х 7 67 55 П-t-x d 6F
13 07 35 ПП 53 56 х-*-ПЬ 4L
14 • 13 36 46 46 57 П-+х Ь 6L
15 Х-+П0 40 37 4 04 58 Fx2 22
16 П-гХ 1 61 38 2 02 59 П-+хС 6[
17 ПП 53 39 — 13 60 -1- 10
18 46 46 40 F V- 21 61 х—ПС 4[
19 П-+х 2 62 41 П-*х а 6— 62 в/о 52
20 ПП 53 42 X 12 63 с/п 50
21 46 46
Проверка программы: п3 — 1,3; л2 — 1,7; л3 — 1,5; л4 — 1,4; л6 1,7;
лв = 1,5; л, = 1,6.
Точность прибора d =_0,25. _
Правильное решение: л ± Дя; л = 1,52857; Дл = 0,24974.
Программа для i=8
Адрес Операция Код Адрес Операция Код Адрес Операция Код
00 П-*х 1 61 24 П-+х 3 63 48 Х-+ПС 4[
01 П-+х 2 62 25 ПП 53 49 ЬП 51
02 П-+х 3 63 26 ' 51 51 50 68 68
03 П-+х 4 64 27 П-+х 4 64 51 П—х 0 60
04 4- 10 28 ПП 53 52 — 11
05 4- 10 29 51 51 53 Fx2 22
06 -j- 10 30 П-+х 5 65 54 F V 21
07 П-*х 5 65 31 ПП 53 55 х-*-ПЬ 4L
08 П-*х 6 66 32 51 51 56 П-+х d 6F
09 /7->х 7 67 33 П-^х 6 66 57 — 11
10 + 10 34 ПП 53 58 F х<0 5[
486
Продолжение программы
Адрес Операция Код Адрес Операция Код Адрес Операция Код
11 + 10 35 51 51 59 62 62
12 + 10 36 П^х 7 67 60 П-<-х d 6Г
13 П-*х 8 68 37 ПП 53 61 х-»-П b 4L
14 + 10 38 51 51 62 П-+х Ь 61
15 8 08 39 П-*х 8 68 63 Fx* 22
16 — 13 40 ПП 53 64 П-+х С 6[
17 х-*-ПО 40 41 51 51 65 + 10
18 П-+х 1 61 42 5 05 66 х-+ПС 4
19 ПП 53 43 6 06 67 в/о 52
20 51 51 44 — 13 68 с/п 50
21 П-+х 2 62 45 F V- 21
22 ПП 53 46 П-t-x а 6—
23 51 51 47 X 12
Проверка программы: «1=1; п2 = 2; п3 = 3; я4 = 5; п6 = 2,5; пв =
3,1; «1 == 4.
Точность прибора d = 0,25.
Правильный ответ: п±Дп; я" = 2,575; Дп = 1,3360484.
Программа для 1=^9
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 П-+х 1 61 25 56 56 50 F Г” 21
01 П-+х 2 62 26 /7->х 3 63 51 П-<-ха 6—
02 П-+х 3 63 27 ПП 53 52 X 12
03 П-*х 4 64 28 56 56 53 Х-+ПС 4[
04 + 10 29 П-+х 4 64 54 ЬП 51
05 + 10 30 ПП 53 55 73 73
06 “Ь 10 31 56 56 56 /7->х0 60
07 П-*-х 5 65 32 П-*х 5 65 57 11
08 П-*х 6 66 33 ПП 53 58 Fx* 22
09 П-+х 7 67 34 56 56 59 F V~ 21
10 “Ь 10 35 П-+х 6 66 60 х-+ПЬ 4L
11 + 10 36 ПП 53 61 n~+xd 6F
12 “Ь 10 37 56 56 62 11
13 П-+х 8 68 38 П-*х 7 67 63 Fx<0 5[
14 П-*х 9 69 39 ПП 53 64 67 67
15 + 10 40 56 56 65 П-t-xd 6F
16 + 10 41 П-+х 8 68 66 х-*ПЬ 4L
17 9 09 42 ПП 53 67 П—^xb 6L
18 — 13 43 56 56 68 Fx* 22
19 х-*ПО 40 44 П-+х 9 69 69 П-*хС 6[
20 П-+х 1 61 45 ПП 53 70 + 10
21 ПП 53 46 56 56 71 х-+ПС 4[
22 56 56 47 7 07 72 в/о 52
23 П-+х 2 62 48 2 02 73 с/н 50
24 ПП 53 49 V 13
487
Проверка программы: пг = 1,2; п2 = 1,3; п3 = 1,4; nt~ 1,3; л6 = 1,2;
лв = 1,4; л7 = 1,0; л8 = 1,35; nt = 1,6.
Точность прибора d — 0,25.
Правильный ответ: п±Дп; п = 1,30555; Ап = 0,213566.
Для статистической обработки непосредственных измерений для любого I
можно использовать программу, состоящую из двух частей.
Коэффициент распределения Стьюдеита для различных уровней значимости
(доверительных вероятностей) можно взять из книги В.Е. Гмурман «Руководство
к решению задач по теории вероятностей и математической статистике», прило-
жение 6, с..393. Следует учесть, что число степеней свободы k = i — 2.
После ввода программы в ячейку 0 — число измерений, в ячейку 9 — /ц(п),
в ячейку d — точность прибора. По окончании расчета в ячейке а — п в ячейке
с — Ал.
Правила работы с программой. После ввода всех зна-
чений нажать на клавиши в/о, с/п. На индикаторе загорится 1. Это значит, что
необходимо ввести первую точку. Набрать на клавиатуре значение первой точки и
нажать клавишу с/п. Через несколько секунд загорится цифра 2, следовательно,
необходимо ввести вторую точку и т. д. После ввода последней точки на индика-
торе вновь загорится цифра 1. Это значит, что среднее значение рассчитано и
для вычисления доверительного интервала необходимо вновь ввести все точки,
нажимая после ввода каждой точки клавишу с/п.
Когда все точки введены — на индикаторе и в ячейке с — значение Ал,
в ячейке а — значение п.
Программа для любого i
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 1 01 21 П —ь-Х а 6— 42 1 01
01 х->-/76 46 22 — 11 43 — 11
02 П-f-x 6 66 23 Fx2 22 44 П->-х5 65
03 с/.п 50 24 FV~ 21 45 X 12
04 П-+ха 6— 25 х-+П b 4£ 46 — 13
05 Я- 10 26 n-*-xd 6f 47 FV~ 21
06 x-t-Па 4— 27 — 11 48 П-+х§ 69
07 КП-+х6 Гб 28 Fx<0 5 49 X 12
08 КП-+хЬ Г5 29 32 32 50 x-tllC 4[
09 FLO 5Г 30 LJ-f-xd 6f 51 с/п 50
10 02 02 31 x-*-A b 41 52 Cx OF
11 П-*-ха 6— 32 П-+хЬ 61 53 x-t-Па 4—
12 П-*-х5 65 33 Fx2 22 54 Х-+П5 45
13 — 13 34 П-+хС 6[ 55 Х-+ПС 41
14 х-*-Па 4- 35 10 56 ЬП 51
15 П-+х 5 65 36 Х-+ПС 4[ 57 00 00
16 Х-+П0 60 37 КП-+Х6 Г6
17 1 01 38 FLO oF
18 х->/76 46 39 19 19
19 /7->х6 66 40 !7-+xC 6[
20 с/п 50 41 LI-+xt> 65
Проверка программы по любым предыдущим значениям.
Программа линейной интерполяции. Часто случается так,что необходимо
определить табличный параметр, находящийся между известными точками. На-
пример, пусть дана зависимость давления от температуры:
488
Р, МПа 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
Г, К 271,5 280 289 298,5 308,5 319 330 341,5 353,5
Нам необходимо определить температуру прн давлении 0,417 МПа. Для
этого, учитывая, что зависимость P=f (7) нелинейная, предполагаем, что ин-
тересующий нас участок осн — линейный. Вводим программу:
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 х->/74 44 08 х->/75 45 16 /7->х5 65
01 FO 25 09 /7->х2 62 17 П-гхЗ 63
02 х^ПЗ 43 10 /7->х1 61 18 — 11
03 FQ 25 11 — 11 19 X 12
04 х-*-П2 42 12 /7->х4 64 20 П-+х\ 61
05 FO 25 13 /7->хЗ 63 21 + 10
06 х-+П\ 41 14 — 11 22 с/п 40
07 с/п 50 15 13
Предположим, что есть некая общая зависимость I = / (F). В этом случае, если
необходимо определить Yx, лежащее между Fj и К2, которому соответствует из-
вестный параметр ввод производится в следующем порядке:
Гх; B2f;/2; В f ; Л; Bf ; /2.
Нажимают клавиши в/о и с/п. После остановки программы /" вводятся в ре-
гистр X (т. е. просто набирают значение) и нажимают клавишу с/п. По оконча-
нии расчета на индикаторе горит значение Yx
Г
/х........./2
Ух . . . . Y2
Ух
В общем случае расчет производится по формуле
/’—Л
.......
В нашем примере при правильном
вводе программы и исходных данных дав-
лению 0,417 МПа соответствует температу-
ра Т = 300,2 К.
Программа вычисления интеграла (пло-
щади подынтегральной кривой) с исполь-
зованием сумм Дарбу. Пусть есть некото-
рая кривая f (х) (рис. 59), необходимо оп-
ределить / (х) dx, т. е. рассчитать площадь
подынтегральной кривой отточки а до точ-
ки Ь. Отрезок ab разбиваем пол равных ча-
стей. Величину h — шаг разбиения и i —
число разбиений введем в ячейки памяти
соответственно h d, i ->• 0. После ввода
программы нажимаем клавиши в/о и с/п. На
489
индикаторе загорается цифра 1, следова-
тельно, необходимо ввести значения f'(x)
«по недостатку» и «по избытку» для первой
точки (а). Ввод производится следующим
образом: f (х) недостаток В | f (х) избыток
с/п. Далее загорается цифра 2 и т. д., При-
чем для каждого элемента разбиения не-
обходимо вводить сначала недостаток, по-
том избыток. Это следует помнить, если
функция имеет экстремум на исследуемом
отрезке, если функция монотонная — за-
дача упрощается'
Перед началом работы в ячейку 6 вве-
сти число 1. После окончания расчета в
п п
ячейке А -> 2 5f ; в — 2 51изП;
ь ~~
с-И f(x).
i = 1
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 77->х6 66 12 X [О 24 П-+ха 6—
01 с/п 50 13 П-*-хЬ 67. 25 10
02 х-»772 42 14 4" 10 26 Х-+ПС 4|
03 FO 25 15 х-+ПЬ 4L 27 с/п 50
04 х-+П\ 41 16 КП-+х6 F6 28 Сх OF
05 П-+хс1 6Г 17 FLO 5F 29 х-*-Па 4—
06 X 12 18 00 00 30 х-+ПЬ 4L
07 П-+ха 6— 19 П-i-xb 67. 31 ВП О[
08 10 20 П-*-ха 6— 32 х-+Пв 46
09 х-тПа 4— 21 — 11 33 ЬП 51
10 П-^хЪ 6F 22 2 02 34 00 00
11 П->-х2 62 23 -Т- 13
Площадь вычисляют по формуле (рис. 60)
п п
b п 2^гизб 2 ^неДост
Р w = S Чедост +—-----------------,
а « = 1 2
где Sf — площадь одного прямоугольника.
Проверка программы:
юз з
j- /(х) = 39,45; 2 Чедост = 28-5= 2 Чз« = 50-4'
1 «=1 «=1
Программа метода наименьших квадратов. Предлагаемые программы МН К
позволяют определить все характеристические параметры линейной регрессион-
ной зависимости у — а + Ьх.
После ввода программы и перехода в режим автоматических вычислений
ввести число экспериментальных точек (/) в ячейку 0, нажать клавиши в/о;
490
Программа 1
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 I 01 33 Л-*хЗ 63 65 + 10
01 х->Л6 46 34 X 12 66 Л->х2 62
02 Л—хб 66 35 — 11 67 — 11
03 с/п 50 36 П-+х8 68 68 Fx2 22
04 х-»-Л I 41 37 П-т-ХО 65 69 П-+х7 67
05 FQ 25 38 X 12 70 + 10
06 Х-+П2 42 39 П-тхЗ 63 71 х->Л7 47
07 П-^-хА 64 40 Fx2 22 72 КП-гхЬ F6
08 + 10 41 — 11 73 FLO 5F
09 х-»Л4 44 42 — 13 74 56 56
10 Л->х1 61 43 х-+ПЬ 4 75 Л->х7 67
11 Л—хЗ 63 44 П-+хЗ 63 76 Л-*х5 65
12 + 10 45 X 12 77 2 02
13 х—>Л 3 43 46 П-1-х^ 64 78 — 11
14 Л-»х1 61 47 «-► 14 79 -г- 13
15 Fx2 22 48 — 11 80 х->Л</ 4F
16 П->-х8 68 49 Л—х5 65 81 Л->х5 65
17 + 10 50 — 13 82 X 12
18 х->Л8 48 51 х^-Па 4— 83 П-+х8 68
19 Л->х 1 61 52 П--+ХЭ 65 84 П-+хо 65
20 Л->х2 62 53 х-+П0 40 85 X 12
21 X 12 54 1 01 86 П->~хЗ 63
22 П-*-х§ 69 55 х->Л6 46 87 Fx2 22
23 10 56 Л—хб 66 88 — 11
24 х-*-П§ 49 57 с/п 50 89 — 13
25 КП-+хв 6 58 х-»Л 1 41 90 х-+П\ 41
26 КП-+хо 5 59 FO 25 91 П~+х8 68
27 FLO 5 60 х-+П2 42 92 X 12
28 02 02 61 П-+х1 61 93 П-+хЗ 65
29 Л-*х9 69 62 П-+хЬ 6L 94 13
30 Л->-х5 65 63 X 12 95 х->Л 2 42
31 X 12 64 П->-ха 6— 96 с/п 50
32 П-*-х4 64
с/п. На индикаторе загорится цифра 1. Ввести у^х^ с/п, на индикаторе загорится
2. Ввести вторую точку и т. д. После того как все точки введены, иа индикаторе
вновь загорится цифра 1. Повторить ввод всех точек. По окончании расчета в
ячейках памяти будут содержаться следующие значения:
ячейка А значение а d — 5а2Д
В — b 1 Sb
4 Zyi
3 2хг 2
8 — Ъх2
9 — ^Xt у2
7 — (квадратич-
ный крите-
рий рассо-
гласований)
Выписать все значения, так как оии пригодятся в дальнейшей обработке, и очи-
стить все ячейки памяти и регистры стека. Перейти к программе 2, чтобы оце-
нить статистическую значимэсть.
491
Программа 2
Адрес Оператор Код Адрес Оператор Код Адрес Оператор Код
00 П^-xi 64 08 1 01 16 Ех>0 59
01 П-*-хС 6[ 09 с/п 50 17 20 20
02 X 12 10 /7->х4 64 18 2 02
03 х-^ПС 4» 11 П-^xd 6Е 19 с/п 50
04 П-^хЬ 6L 12 X 12 20 /7-*х9 69
05 11 13 х-+П d 4Е 21 с/п 50
06 Fx^O 59 14 П-^ха 6—
07 10 10 15 — 11
Ввести в ячейки памяти следующие значения:
значение
С2
ь
10ВП99ВП6В
ячейка
С
D
А
В
9
td (m) 4, где td (т) — критерий Стьюдента; d — доверительная вероятность
(уровень значимости) для односторонней критической области; т— число экспе-
риментальных точек (т = 0.
Нажать клавиши в/о, с/п. Если на индикаторе загорается 1, то Ь < До, сле-
довательно, его необходимо отбросить. Если загорится 2, то а < Да. Если за-
горится Е 000000, то оба коэффициента имеют статистическую значимость; Д&
находится в ячейке С, а — в ячейке D.
Для проведения дальнейших расчетов вновь очищают регистры памяти и
стека.
Программу 3 используют для регрессионного анализа.
Программа 3
Адрес Оператор Код 1 Адрес Оператор Код Адрес Оператор Код
00 1 01 20 FLI 5L 40 — 13
01 X-+J76 46 21 11 11 41 Х-+П2 42
02 П—*~х$ 66 22 /7->х5 65 42 1 01
03 с/п 50 23 1 01 43 — 11
04 П^-хЬ 6L 24 — 11 44 Ех<0 51
05 X 12 25 х-+П\ 41 45 51 51
06 П-+х а 6— 26 КП-+х6 Е6 46 П-*х2 62
07 + 10 27 FLO 5F 47 F\/х 23
08 х->/79 49 28 02 02 48 Х-+П2 42
09 1 01 29 П-+х8 68 49 П-^хС 6[
10 Х-+-П 5 45 30 П-+хЪ 66 50 х-+П d IF
11 /7->х5 65 31 1 01 51 П-^xd 6F
12 с/п 50 32 — 11 52 П^х2 62
13 /7->-х9 69 33 — 13 53 — 11
14 11 34 П-±х 1 61 54 Ех>0 59
15 Ех2 22 35 1 01 55 58 58
16 /7->-х8 68 36 — 11 56 /7-*х4 64
17 + 10 37 13 57 с/п Я)
18 х-* /78 48 38 х^т 48 58 /7—х7 67
19 КП х5 F5 39 П х2 62 59 • с/п 50
492
Ввести в регистры памяти следующие значения:
ячейка — значение
А — а
В — Ь
О — т
1 — п
7 — 10ВП99ВП1
4 — 10ВП99ВП6
2 С А S2 ад - F(₽. /1. М - F (₽, f2, ft,
где F — критерий Фишера — Сиедекора; 0 — доверительная вероятность; Д=
= п — 2; [2 = т — 2; т — число точек в эксперименте; п — число параллель-
ных ОТКЛИКОВ ytj ОТ Xj.
После ввода программы и всех значений нажать клавиши в/о, с/п. На инди-
каторе загорится 1, ввести Xj, нажать клавишу с/п, на индикаторе загорится 2,
нвести у12, с/п и так далее доу1П; после ввода у1П, с/п, иа индикаторе загорит-
ся 2, ввести х2, с/п, загорится 1, ввести у21, с/п, 2—y2tи, с/п и так далее повеем
циклам.
После ввода последнего значения программа выдает ответ. Если на индика-
торе загорится Е 00 — значит уравнение неадекватно, если Е 000000 — адек-
ватно. В регистре 8 хранятся значения 8у\ В регистре 2 — Еэкс. 1.
Таблица значений критерий Фишера — Снедекора есть в учебнике
В. Е. Гмурман «Руководство к решению задач по теории вероятностей и мате-
матической статистике» (с. 394, приложение 7).
Для дальнейших расчетов вновь проводится очистка регистров памяти и
стека.
Программа расчета «коридора ошибок»
Адрес Оператор | Код j Адрес | Оператор | Код Адрес | Оператор Код
00 х->/75 45 10 /7->-х2 62 19 /7-*-х2 62
01 FO 25 11 X 12 20 Е1/х 23
02 х-^-П 6 46 12 П--+хЗ 63 21 10
03 П-+ха 6— 1 13 П-*х2 62 22 FV~ 21
04 — 11 , 14 X 12 23 П-+х1 61
05 П-^хЬ 6L 15 П-+х4 64 24 X 12
06 — 13 16 Fx2 22 25 П^-хО 60
07 Д-»-х5 65 17 11 26 X 12
08 — 11 18 13 27 с/п 50
09 Ех2 22
После ввода программы ввести следующие значения:
ячейка значение
А а
В — b
0 —
1 — Яад = К51д
2 т
3 — 2xf
4 — 2х.
493
Рис. 61. Зависимость y=b(x)
т
а =
Ввести 1/зксп> хэксп> в/о, с/п. На ин-
дикаторе появится значение Ду. Расчет
повторить по всем экспериментальным
точкам. По полученным результатам ст-
роятся две гиперболы, образующие «ко-
ридор ошибок», т. е. у ± Ду.
Пояснение к программе МН К. Про-
стейшее уравнение линейной зависимо-
сти у от фактора х:
у = а-\-Ьх.
Коэффициенты регрессии можно вычис-
лить по формулам:
т т т
^2 х1У1~ У xi 2 yi
ь=______'
т / т \г ’
т xi — [ xi I
<=! \f=l /
т
В этих выражениях коэффициенты регрессии определяют на основании измере-
ний, проведенных в т экспериментальных точках (т > 2), т. е: по т уравнени-
ям.
Дисперсия адекватности модели характеризует меру отклонения дан-
ных yi (рис. 61), рассчитанных по уравнению регрессии, от экспериментальных
результатов yi для i-аст точки, в которой проведено измерение:
т
2 (</г-;г)2
J2 = -L-!---------
ал щ-2
при числе степеней свободы f = т — 2
т / т
т 2 2 Х1
i = i \i=i
S2a
st 2 xi
i= I
tn
Доверительные интервалы Да и Д&:
Коэффициенты уравнения значимы, если выполняется условие а > Да и
Г> ЛЬ.
494
Выборочная дисперсия S* определяется по формуле
т п
2( ,2 (уи — У{)*
т (л—1)
где 1= 1,2,3, .... т — число точек на линии регрессии; /= I, 2, 3.п — чис-
ло параллельных измерений в каждой точке.
«Коридоры ошибок» строят на основании вычислений по формуле
Л«/к= ±ta(f}ys^
______т (xh — х)2
т_____. т 2
mt 2 xi—I 2
f=l \i=I '
Расчет свойств электролитов на микро-ЭВМ ДВК-ЗМ2
(диалого-вычислительном комплексе)
В настоящее время для увеличения эффективности учебного процесса все ча-
ще используют компьютерную технику. В частности, широкое применение на-
шли микроЭВМ, с помощью которых можно осуществить диалог учащийся —
компьютер: иа дисплей выдаются вопросы, а клавиатура используется учащим-
ся для ввода ответов. В зависимости от полученного ответа программа, которую
выполняет компьютер, переключается иа одну из нескольких возможных аль-
тернатив, обеспечивая подходящее реагирование на данный ответ и дальней-
шее продолжение диалога.
Диалог учащегося с компьютером получается предельно простым и лаконич-
ным. На проведение диалога учащийся затрачивает минимум времени.
Учебный материал организован в виде последовательности пронумерован-
ных разделов (секций). Как правило, секции посвящена отработке определен-
ного вопроса и начинается его сжатым изложением (текст), после чего следует
ряд упражнений и, если это необходимо, справочио-иллюстративиый материал.
Учащийся в ходе диалога может использовать информацию с дисплея или полу-
чать распечатку данных и результатов иа печатающем устройстве. Следователь-
но, с помощью компьютера можно управлять учебной деятельностью учащихся
и протоколировать процесс обучения.
Рассмотрим пример применения компьютера в учебном процессе для выпол-
нения расчетов по теме «Растворы электролитов» в диалоговом режиме.
Программа иаписаиа на языке QHASIC, предназначенном для миии- и микро-
ЭВМ в малых конфигурациях. Язык QUAS1C применяется иа ЭВМ, программно
совместимых с микроЭВМ «Электроиика-60», имеющих память 8—28К слов и
необязательно имеющих магнитные диски или ленты. Такие ЭВМ получили ши-
рокое распространение, а средства программирования для них недостаточно раз-
виты. QUAS1C совмещает в себе преимущества языка низкого уровня —Ас-
семблера (большое быстродействие) и языка высокого уровня — БЭЙСИКА
(удобство программирования и диалоговый режим работы).
Все этапы разработки программы: редактирование текста, трансляция, вы-
полнение и отладка осуществляются без обращений к внешним носителям ии-
амации. Система может использоваться автономно (иа машине без операциои-
системы) или в рамках стандартной операционной системы (RT-11/SF)-
РАФОС или RSX -НМ (ОСРВ).
Программа, приведеииаи ниже, составлена для микроЭВМ ДВК-ЗМ2 для
выполнения задания по теме «Растворы электролитов» в диалоговом режиме.
1, Постановка задачи. В работе рассматривают круг задач, которые отно-
сятся к разделу курса «Физическая химия» с названием «Растворы электролитов».
Выделено три типа задач: сильные электролиты; слабые электролиты; гидро-
лиз солей.
495
Задачи сформулированы следующим образом: а) раствор содержит КОН с
концентрацией с-1 моль/л и Na3SO4 с концентрацией с-2 моль/л. Вычислите pH и
рОН раствора, коэффициент активности f, солесодержание этого раствора и оп-
ределите влияние изменения концентрации электролитов на эти параметры;
б) раствор содержит NH4OH с концентрацией с-3 моль/л. Вычислите pH,
рОН и степень диссоциации раствора а, если константа диссоциации =
= 1,75-10—6;
в) раствор содержит соль CH3COONa с концентрацией с=4 моль/л. Вычис-
лите pH, рОН и степень гидролиза, если константа диссоциации СН3СООН рав-
на 4,5-10~7.
2. Формализация задачи, а) Растворы сильных электролитов диссоцииру-
ют иа ионы:
КОН-Ч-К++ОН-
NajSO4—>2Na++SO2“
Для определения активности иона ОН- необходимо рассчитать ионную силу
раствора:
/ = 4-Scfz2.
Л 1 I •
Ионная сила раствора связана с коэффициентом активности следующим соотно-
шением:
А г, г., 1/ 1
G=lgfa= ----1 2-L_—+о,1 /,
где гх, гг —заряды ионов; А — коэффициент, равный 0,514; fa = 10е.
Определим активность ионов ОН-:
аон_ •—/« сон~.
Определим рОН и pH раствора:
рОН=—lgaOH-,
рН=—lg (10-i‘)—рОН=14— рОН.
Содержание солн раствора равно
т=Л1КОН скон+^а2 SO4 cNa2 SO4,
где А1КОН = 39 + 16 + 1 = 56 — молекулярная масса гидроксида калия;
MNaSO = 2-23+32 + 4-16 = 142 — молекулярная масса сульфата натрия,
б) Для раствора слабого электролита
Степень диссоциации равна
а=|/ Wcnh4OH >
концентрация ионов ОН~ в растворе составляет
+н4он ; coh-=cnh.oh«-
496
Так как для слабых электролитов /а ж 1, то аон_ ~ сон- = cnh он а-
тогда
рОН =—1gаон-; рН = 14 — рОН.
в) При гидролизе соли
CH3COONa+HOH^±CH3 COOH+Na+H-OH-
степень гидролиза определяется по уравнению
₽ = ^г/сСНз COONa =- 1/' —— .
I- сСН3 COONa
Концентрация ионов ОН- в растворе равна
СОН~ == Р сСН3 COONa*
Так как степень гидролиза — малая величина, коэффициент активно-
сти ~ 1 и
аОН“ ~ СОН“ = ₽ сСН3 COONa,
pH = — lgaH + ; рОН = — lgaOH_; pH = 14 — рОН.
3. Текст диалога. После запуска программы на выполнение на экране
дисплея появляется текст:
Начало работы программы «Растворы электролитов». Вы работаете с про-
граммой вычисления pH и F в растворах сильных электролитов^ степени гидро-
лиза и pH в растворах солей.
А. Сильные электролиты.
Задание получить у преподавателя. Электролит 1 — щелочь или кислота,
электролит 2 — соль.
Введите фамилию и иомер группы. Введите исходные данные:
Молекулярная масса 1-го электролита, начальная концентрация 1-го элект-
ролита. Заряд катиона для 1-го электролита, заряд аниона для 1-го электролита,
число изменений концентрации для 1-го электролита.
Молекулярная масса 2-го электролита, начальная концентрация 2-го элект-
ролита, изменение концентрации 2-го электролита, заряд катиона 2-го элек-
тролита, заряд аниона для 2-го электролита, число изменений концентрации
для 2-го электролита.
Пользователь последовательно вводит требуемые данные через клавиа-
туру.
Затем система запрашивает пользователя:
Желаете ли повторить или исправить ввод?
Ответ пользователя ДА или НЕТ.
Если ответ ДА, то система возвращается к началу задания, если ответ НЕТ,
то производится расчет и печатающее устройство выдает следующую таблицу
результатов:
497
Таблица используемых данных н вычисленных результатов
Математическая величина Имя Струк- тура Физически# смысл Начальное Примечание
^КОН /MNa.SO4 Л1 X и с2 С3 Л Cj Дса Лс3 Дг4 *Д1 Кдг N М рОН сильного электролита pH сильного электролита La СС а pH слабой кис- лоты рОН слабой кислоты рОН соли pH соли MCI МС2 zKl гА1 zK2 zA2 cl c2 c3 c4 ДС1 ДС2 ДСЗ ДС4 Д1 Д2 /V M Pl P2 F cc sm РД1 РД2 STG PG1 PG 2 Пере- менная To же > » » Молекуляриаяя масса КОН Молекулярная масса NajSO4 Заряд катиона +К Заряд аниона ОН- Заряд катиона Na+ Заряд аниона SOJ- Концентрация КОН Концентрация Na2SO« Концентрация NH4OH Концентрация NaHCO» Изменение концентрации кон Изменение концентрации NajSO« Изменение концентрации NH«OH Изменение концентрации NaHCO3 Константа диссоциации NH4OH Константа диссоциации CH,COONa Количество молей С1 Количество молей С2 Характеристика среды в растворе То же Коэффициент активности иоиа Солесодержаиие в раст- воре Степень диссоциации кислоты Характеристика среды в растворе То же Степень гидролиза Характеристика среды в растворе То же 56 142 1 1 1 2 СЮ С20 СЗО С40 1,75- 10-s 4,5-10-7 Исходные данные начальных значений задаются путем ввода
Петров И. И. Н-22
Молекулярная масса i-ro электролита 56.000
Начальная концентрация 1-го Электролита 0.005
Изменение концентрации для 1-го электролита 0.005
Заряд катиона для 1-го электролита 1
Заряд аниона для 1-го электролита 1
Число изменений концентрации для 1-го электролита 5
Молекулярная масса 2-го электролита 142.000
498
Начальная конецнтрация 2-го электролита 0.000
Изменение концентрации для 2-го электролита 0.050
Заряд катиона для 2-го электролита 1
Заряд аниона для 2-го электролита 2
Число изменений концентрации для 2-го электролита 4
Концентра- ция 1-го электроли- та. моль/л Концентра- ция 2-го электроли- та, моль/л рОН сильно- го электро- лита pH сильного электролита Коэффици- ент активно- сти иоиа Солесодер- жание в растворе, г/л
0,005 0,000 2,334 11,666 0,926 0,280
0,005 0,050 2,424 11,576 0,753 7,380
0,005 0,100 2,448 11,552 0,713 14,480
0,005 0,150 2,459 11,541 0,695 21,580
0,010 0,009 2,046 11,954 0,900 0,560
0,010 0,050 2,125 11,875 0,751 7,660
0,010 0,100 2,148 11,852 0,712 14,760
0,010 0,150 2,158 11,842 0,695 21,860
0,015 0,009 1,878 12,122 0,882 0,840
0,015 0,050 1,950 12,050 0,748 7,940
0,015 0,100 1,972 12,028 0,711 15,040
0,015 0,150 1,983 12,017 0,694 22,140
0,020 0,000 1,761 12,239 0,868 1,120
0,020 0,050 1,826 12,174 0,746 8,220
0,020 0,100 1,848 12,152 0,710 15,320
0,020 0,150 1,858 12,142 0,694 22,420
0,025 0,009 1,670 12,330 0,856 1,400
0,025 0,050 1,731 12,269 0,744 8,500
0,025 0,100 1,751 12,249 0,709 15,600
0,025 0,150 1,761 12,239 0,693 22,700
Далее на экране дисплея появляется текст:
Переходим к разделу слабые электролиты. Имеем раствор электролита 3.
Задание получить у преподавателя. Введите исходные даииые: Начальная кон-
центрация 3-го электролита, изменение концентрации для 3-го электролита,
константа диссоциации для 3-го электролита.
После введения требуемых данных система запрашивает пользователя:
Желаете ли повторить или исправить ввод?
Если пользователь отвечает ДА, система возвращается к началу задания по
разделу «Слабые электролиты». Если ответ НЕТ, то ЭВМ переходит в режим сче-
та и по окончании счета печатающее устройство выдает следующую таблицу резу-
льтатов:
Начальная концентрация 3-го электролита 0,050
Изменение концентрации для 3-го электролита 0,010
Константа диссоциации для 3-го электролита 0,18Е-04
Концентрация сла- бого электролита Степень диссоциации pH слабой кислоты рОН слабой кислоты
0,0500 0,0190 3,0229 10,9771
0,0600 0,0173 2,9833 11,0167
0,0700 0,0160 2,9498 11,0502
0,0800 0,0150 2,9208 11,0792
0,0900 0,0141 2,8952 11,1048
499
Затем на экране появляется текст:
Переходим к разделу «Гидролиз солей». Имеем раствор электролита 4. Зада-
ние получить у преподавателя. Введите исходные данные. Начальная концент-
рация 4-го электролита, изменение концентрации для 4-го электролита, кон-
станта, диссоциации для 4-го электролита, число изменений концентрации
для 4-го электролита.
После ввода исходных данных система запрашивает пользователя:
Желаете ли повторить или исправить ввод?
Если пользователь отвечает ДА, то система возвращается к началу раздела
«Гидролиз солей», если ответ НЕТ, то производится счет и. по его Окончании
печатающее устройство выдает следующую таблицу:
Начальная концентрация 4-го электролита 0.050
Изменение концентрации для 4-го электролита 0.0500
Константа диссоциации для 4-го электролита 0.45Е-06
Число изменений концентрации для 4-го электролита 10
Концентрация соли Степень гидролиза раствора рОН pH раствора
0,050 0,000667 4,477 9,523
0,100 0,000471 4,327 9,673
0,150 0,000385 4,239 9,761
0,200 0,000333 4,176 9,824
0,250 0,000298 4,128 9,872
0,300 0,000272 4,088 9,912
0,350 0,000252 4,055 9,945
0,400 0,000236 4,026 9,974
0,450 0,000222 4,000 10,009
0,500 0,000211 3,977 10,023
После этого система возвращается к началу первого раздела «Сильные
электролиты» и готова к работе со следующим пользователем.
4. Структурная схема алгоритма расчета к заданию по теме
«Растворы электролитов»
1.
3.
4.
5.
6.
7.
8.
9.
Ввод: МС1.МС2, ZK1, ZA1.ZK2, ZA2, М, N, С10,
С20.С30.С40, ДС1.ДС2.ДСЗ.ДС4, Д1, Д2
10.
L= 1
СЗ = С30
501
11.
12.
13.
14.
15.
502
10 BYT! ИЗО:177566\RGD=ieB\INT XXX(6),NAHE(20)\OPKN 5 "LP“
20 RIAL MC1,MC2.C10,C20.C30,C4,D10.DC1,DC2,DC3,DC4
30 RIAL Cl,C2,C3,e,H,G,F,CU,P1,P2,CC,X1.X2,D1,D2,03
40 RIAL STD,CD.PD1 ,PD2,C40,STG,CG,PG1 ,FG2
100 PUT ////, "РАСЧЕТ RH РАСТВОРОВ ЭЛЕКТРОЛИТОВ " , //.'
110 PUT" А СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
120 PUT" ЗАДАНИЕ ПОЛУЧИТЬ У ПРЕПОДОВАТЕЛЯ
130 PUT" ЭЛЕКТРОЛИТ 1 ИВЛСЧЬ ИЛИ КИСЛОТА
140 PUT" ЭЛЕКТРОЛИТ 2 СОЛЬ
150 PUT -L " ИСХОДНЫЕ ДАННЫЕ: МОЛЕКУЛЯРНАЯ МАССА ЭЛЕКТРОЛИТА,"
180 PUT" НАЧАЛЬНАЯ КОНЦЕНТРАЦИЯ,"
170 PUT" ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ, ЗАРЯД КАТИОНА, ЗАРЯД АНИОНА."
180 PUT" ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИЙ ЭЛЕКТРОЛИТА 1 И 2 ,///
190 PUT" ВВЕДИТЕ ФАМИЛИЮ И НОМЕР ГРУППЫ "\ GET NAME • А: SU
200 I=1\WWODM\GET MCI
210 WWODC\GET C10
220 WWODD\GET DC1
230 WWODK\GET ZK1
240 WWODA\GET ZA1
250 WWODN\GET N
320 PUT\I=2\WM0DM\GET MC2
330 WWODCMJET C20
340 WWOBDMJET DC2
350 WWODK\GET ZK2
380 WWODAXGET ZA2
370 WWODH\GKT M
400 PUT -L" ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ ИЛИ ИСПРАВИТЬ ВВОД-
410 DANET\IF PR=1 THEN GOTO 200\ENDI
500 PUT 5/,HAME:A:SU
510 I=1\WYWI\PUT 5 MC1:F7.3
520 WYNCXPUT 5'C10:F6.3
530 WYTOXPUT 5 DC1:F6.3
540 WYWK\PUT 5 ZK1:12
550 WYWA\PUT 5 ZA1.I2
560 WYNNXPUT 5 N:I2,//
570 I=2\WYWf\PUT 5 MC2:F7.3
580 WYWCXPUT 5 C20-.F6.3
590 WYWD\PUT 5 DC2-.F6.3
800 WYWKXPUT 5 ZK2-.I2
610 WYWA\PUT 5 ZA2:I2
620 WYWNXPUT 5 M:I2
390 PUT 5 //
900 IL=73\LIHE
930 PUT -L 5 КОНЦЕНТРА- КОНЦЕНТРА-: РОИ СИЛЬНО-: РН СИЛЬНОГО:*
940 PUT 5 " КОЭФФИЦИЕНТ: СОЛЕСОДЕР-:"
950 PUT -L 5 ":ЦИЯ 1 ЭЛ-ТА:ЦИЯ 2 ЭЛ-ТА: ГО ЭЛ-ТА: ЭЛ-ТА :э
503
960 PUT 5 " АКТИВНОСТИ; ХАН. В P-PE
970 PUT -L 5 ":МОЛЬ/Л МОЛЬ/Л :
980 PUT 5 " ИОНА Г/Л :
990 LINE
1000 C1=C10
1010 FOR J-l TO N
1020 C2=C20
1030 FOR 1=1 TO M
1040 Q=0.5*(C1*ZK1*ZK1+C1*ZA1*ZA1+C2*ZK2*ZK2+C2*ZA2*ZA2)
1060 H=SQRT(Q)
1070 G=-0.514*ZKl*ZAl*H/(1+HJ+0.1*Q
1030 F-EXP (G*LOG (10.0))
1090 CU=C1*F
1100 Pl=-(LOG(CU))/LOG(10-0)
1110 P2=14-P1
1120 CC=MC1*C1+MC2*C2
1130 PUT -L 5":",Cl:Fl 1.3," : ” , C2:Fl1.3,":", Pl:Fll.3,":“,P2:Fl1.3,":”
1140 PUT 5 F : Fl 1.3 , " : “ , CC: F11.3 ,,
1150 C2=C2+DC2
1160 ENDF\LINE\C1=C1+DC1
1170 ENDF
1200 PUT 5 ///
1210 VEL
1230 IF PR-0 THEN GOTO 100\ENDI
1240 PUT /," ПЕРЕХОДИМ К РАЗДЕЛУ СЛАБЫЕ ЭЛЕКТРОЛИТЫ "
1250 PUT -L" ИМЕЕМ РАСТВОР ЭЛЕКТРОЛИТА 3. ЗАДАНИЕ ПОЛУЧИТЬ У '*
1260 PUT " ПРЕПОДАВАТЕЛЯ."
1270 PUT -L" ИСХОДНЫЕ ДАННЫЕ: КОНЦЕНТРАЦИЯ ЭЛЕКТРОЛИТА, ИЗМЕНЕНИЕ “
1260 PUT" КОНЦЕНТРАЦИИ."
1290 PUT'KOHCTAHTA ДИССОЦИАЦИИ, ЧИСЛО ИЗМЕНЕНИЙ КОНЦЕНТРАЦИИ/
1300 PUT /,“ ЗАПИШИТЕ УРАВНЕНИЕ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА",/
1310 I=3\WWODC\GET С30
1320 WWODD\GET DC3
1330 PUT -Ь' ВВЕДИТЕ КОНСТАНТУ ДИССОЦИАЦИИ ЛвЕТ D1
1340 PUT -Ь"ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ ИЛИ ИСПРАВИТЬ ВВОД" \ DANET
1350 IF PR=1 THEN GOTO 1310\KNDI
1360 WYWC\PUT 5 C30:F6.3
1370 . WYWD\PUT 5 DC3:F6.3
1360 WYWKD\PUT 5 D1:E6.2
1390 PUT 5\IL=60\LINE
1400 PUT -L 5:КОНЦЕНТРАЦИЯ : СТЕПЕНЬ POH СЛАБОЙ :
1410 PUT 5" PH СЛАБОЙ:"
1420 PUT -L 5СЛАБОГО : ДИССОЦИАЦИЯ : КИСЛОТЫ
1430 PUT 5" КИСЛОТЫ
1440 PUT -L 5":ЭЛЕКТРОЛИТА:
1450 PUT 5"
1460 LINE
504
1500
1510
1520
1530
1540
1550
1580
1570
1580
1800
1810
1820
1630
1840
1850
I860
1870
I860
1630
1700
1702
1704
1710
1720
1730
1740
1750
1760
1770
1760
1730
1800
1810
1820
1630
1840
1850
I860
1870
I860
1830
1300
ЭЭЭЭ
10000
10010
10020
10030
10040
C3=C30XFOR L=1 TO N
STD=SQRT(D1/C3)
CD=STD*C3
PDl=-(LOG(CD))/LOG(10.0))
PD2=14-PD1
PUT 5" : " , C3:F13.4, " : " , STD:F14.4 , " : " ,PD1: F14.4, " : " ,PD2 :F14.4,": **
C3=C3+DC3
ENDF
LIMEXPUT 5
VEL\IF PR=0 THEN GOTO 100XENDI
PUT" ПЕРЕХОДИМ К РАЗДЕЛУ ГИДРОЛИЗ СОЛЕЯ-
PUT ИМЕЕМ РАСТВОР ЭЛЕКТРОЛИТА 4. ИСХОДНЫЕ ДАННЫЕ:'
PUT" КОНЦЕНТРАЦИЯ СОЛИ,ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ СОЛИ,"
PUT" СТЕПЕНЬ ДИССОЦИАЦИИ,
PUT" ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИЯ."
РОТ/."ЗАПИШИТЕ УРАВНЕНИЕ ГИДРОЛИЗА ПО 1-Я СТУПЕНИ ",/
I=4\WWODC\GET С40
WWODDXGET DC4
WWODKDXGET D2
WWODNXGET N
PUT -L "ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ ИЛИ ИСПРАВИТЬ ВВоД'ХОАНГГ
IF PR=1 THEN GOTO 1670XENDI
WYWCXPUT 5 C40:F6.3
WYTOXPUT 5 DC4:F6.4
MYWKPXPUT 5 D2:E6.2
WYWNXPUT 5 N:12
IL=60\LINE
PUT -L 5“ :КОНЦЕНТРАЦИЯ : СТЕПЕНЬ РОИ РАСТВОРА
PUT 5" PH РАСТВОРА:"
PUT -L 5" : СОЛН : ГИДРОЛИЗА
PUT 5“ : ALINE
C4=C40\FOR L-l TO N
STG=SQRT(1E-14/(D2*C4))
CG=STG*C4
PG1--(LOG(CG))/(LOG(10.0))
PG2=14-PG1
PUT 5":",C4:F13.3,":",STG:F14.6.PG1:F14.3 ,": ',PG2:F14.3,":"
C4=C4+DC4
ENDF
LINE
PUT 5 ////
PUT ////\GOTO 100
STOP
PROG DANET
PUT -Ь"(ДА ИЛИ HETJ XGET XXX:A:NN\XXX(0)=XXX(0).BIC.177600b
IF XXX(0)=144B THEN PR=1\RETURN\ENDI
IF XXX(0)-156B THEN PR=0\RETURNXENDI
PUT'OHHBKA'XGOTO 10010XENDP
505
нем PROC WWODM
11010 PUT -Ь'ВВЕДИТЕ МОЛЕКУЛЯРНУЮ МАССУ",I:Il,"-ГО ЭЛЕКТРОЛИТА-
11020 ENDP
11100 PROG WWODC
11110 PUT -Ь'ВВЕДИТЕ НАЧАЛЬНУЮ КОНЦЕНТРАЦИЮ" , I: Il, "-ГО ЭЛЕКТРОЛИТА
11120 ENDP
11200 PROG WWODD
11210 PUT -Ь'ВВЕДИТЕ ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ДЛЯ ,I. Il,"
11220 PUT -L''-ГО ЭЛЕКТРОЛИТА" \ENDP
11300 PRQG WWODK
11310 PUT -Ь'ВВЕДИТЕ ЗАРЯД КАТИОНА ДЛЯ", I:Il,"-ГО ЭЛЕКТРОЛИТА-
11320 ENDP
11400 PROG WWODA
11410 PUT -Ь'ВВЕДИТЕ ЗАРЯД АНИОНА ДЛЯ",I:Il, "-ГО ЭЛЕКТРОЛИТА-
11420 ENDP
11500 PROG WYWM
11510 PUT -L 5"МОЛЕКУЛЯРНАЯ МАССА" , I: Il, "-ГО ЭЛЕКТРОЛИТА"\ENDF
11800 PROG WYWC
11610 PUT -L.5"НАЧАЛЬНАЯ КОНЦЕНТРАЦИЯ,I:I1."-ГО ЭЛЕКТРОЛИТА"\ENDP
11700 PROG WYWK
11710 PUT -L 5 "ЗАРЯД КАТИОНА ДЛЯ" , I: Il,''-ГО ЭЛЕКТРОЛИТА"\ENDP
11800 PROG WYWA
11810 PUT -L 5 "ЗАРЯД АНИОНА ДЛЯ",I:Il,"-ГО ЭЛЕКТРОЛИТА"\ENDP
11800 PROG WYWD
11810 PUT -L 5" ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ДЛЯ",I:Il,"-ГО ЭЛЕКТРОЛИТА"
11820 ENDP
12000 PROG WWODN
12010 PUT -L " ВВЕДИТЕ ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ ДЛЯ",I:12
12020 PUT -L'-ГО ЭЛЕКТРОЛИТА"\ENDP
12100 PROG WYNN
12110 PUT -L " ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ ДЛЯ" , 1:12
12120 PUT -Ь"-ГО ЭЛЕКТРОЛИТА'ЛЕНВР
12200 PROG LINE
12210 РОИ TI=1 ТО IL\PUT -L 5 \ ENDF\PUT 5KENDP
12300 PROC VEL
12310 PUT" ЖЕЛАЕТЕ ЛИ ПРОДОЛЖИТЬ РАВОТУ С РАЗДЕЛОМ ДЛЯ ПОЛУЧЕНИЯ"
12320 PUT tL" НОВЫХ ДАННЫХ 7"\DANET\ENDP
12400 PROG WWODKD
12410 PUT -L" ВВЕДИТЕ КОНСТАНТУ ДИССОЦИАЦИИ ДЛЯ",1:12
12420 PUT -L’’-ГО ЭЛЕКТРОЛИТА"\ENDP
12500 PROG WYWKD
12510 PUT -L б "КОНСТАНТА ДИССОЦИАЦИИ ДЛЯ",I:12."-ГО ЭЛЕКТРОЛИТА"
12520 ENDP
506
ОТВЕТЫ НА ЗАДАЧИ
Гллва I
1- О2 (als)2 (afx)2 (a2s)2 (ajs)2 (а2РЯ)2 (л2Р!/)2 (л2рг)2 (л£ру)1 (л2рг)»; и = 2;
<>2+ (<hs)a ts)2 (®2з)2 (O^s)2 (®2Рх)2 (Л2рр)2 (n2Pz)2 (Л^ру)1: « = 2’5; 02~ (<*1S)2
(ffu)2 (°а*)2 (a*s) (°2Рх)2 (л2рИ)2 (л2Рг)2 (я+ру) (л|рг)2; и = 1,5. 2. 1, не обладает.
4. 2. 5. (Ci,)2 (ajs)2 (a2s)2 (a*s)2; u=0; re=oo, e = 0. 6. 2. 7. C0+, ВО и CN;
(°is)2(<*;s)2 (a28)2 (a2s)2 (л2РИ)2 (ларг)2 (л2Ра)ь, «=2,5;2 S. 8. BN, ВО, CO.
Глава II
1. Линейная (Е, Са, aCr, aov, an, i). 2. Плоский треугольник,
Dth (Е, Ct, ЗС2, Зст0, On)- 3- Тригональная пирамида, C3(J (Е, С,, За0)'
4. Тригональная бипирамида, Ctv (Е, С2, ЗОц). 5. Квадратная пирамида, CiB
(Ct, С2, а0, ad). 6. 2. 7. 6. 8. S (Cn) х = х cos_?5— -[-у sin 5(СП) у =
п п
= —xsin—?^-+ycos-J^-; S(C„)z = z.
п п
Глава III
1. 4,265-10~«7 кг-м2.
/ е-10*’, Дж •V, м-1 / е-10“, Дж V, м-1 / е-10!г, Дж V, м 1
0 0 1312,1 4 26,072 6562,8 8 93,858 11813,1
1 2,607 2625,1 5 39,108 7875,4 9 117,323 13125,7
2 7,822 3937,7 5 39,108 7875,4 10 143,395 14438,3
3 15 643 5250,3 6 54,751 9188,0
3. 79.
507
4.
/ е8р10”' Дж / «вр'»"’ Дж / евр'°". Дж
0 0 4 83,870 7 234,836
1 8,387 5 125,805 8 301,932
2 25,161 6 176,127 9 377,415
3 50,322
Т. К 300 500 1000
вцОСТ'Ю22, Дж 62,12 108,54 207,10
5.
! 7, м-1 / 7, м-1 / 7, м-1
0 4222,4 4 21112,2 7 33779,5
1 8444,9 5 25334,6 8 38001,9
2 12667,3 6 29557,0 9 42224,0
3 16889,7
в.
i Nj/N. । i V» / Nj/N.
0 1 4 1,1877 7 0,0517
1 2,4384 5 0,5275 8 0,0116
2 2,7240 6 0,1849 9 0,0021
3 2,0768
7.
/ 7 Nj-10“»» / Nj-IO-*»
0 0,5902 1 4 0,7010 7 0,0305
1 1,4391 5 0,3113 8 0,0068
2 1,6077 5 0,1091 9 0,0012
3 1,2257
508
9. 14,652-Ю-4’ кг-м2; 1,1344-10-« м. 10. 352,96-10-” Дж. 11. 0,2787х
X 10-м м. 12. 43,580-10* м~».
Глава IV
1. 1,540-10—10 м. 2. 18,80-10~« кг-м2; 297,7 м'1. 3. 107, 155- 10-1** (кг-м2)*.
4. 3,093-Ю-134 (кг-м3)3. 5. 0,9433-Ю-1® м; 106°29'. 7. /А=/в=6,237-10-4’ кг-м2;
/с = 7,111 • 10~4’. Симметричный волчок сплющенный.
8.
/ к е-10“, Дж / k е-Ю“, Дж | k в-10“. Дж
0 0 С 2 1 5,235 3 1 10,581
1 0 1,782 2 2 4,902 3 2 10,248
1 1 1,671 3 0 10,692 3 3 9,694
2 0 5,346
9. 39,16. 10. 1 = 1 = 147,317-10—47 кг-м2; 1С = 294,634-10~4’ кг-м»;
7 A D 7 ' V ’
6,394-10~13* (кг-м2)*.
Глава V
1. 9,597-Ю-14 Н/м. 2. 3,0004-106 м~». 3. 0,0060. 4. е0 = 2,148-10-“ Дж;
ег = 6,406-1022 Дж. 5. 22; 4,0677-10-“ Дж; = 94, 154-10~22 Дж. £х.св =
= 542,54-10* Дж/моль. в. 5,9-10-*; 5,334-10-». 7. 0,359; 0,736.
8.
ь е-10“. Еж (г ге) ’ 10“, м
0 3,744 0,6368 0,8706
5 35,995 0,4714 1,3411
10 58,796 0,4160 1,8288
20 76,098 0,3839 4,5689
9. 3915,93; 3837,71; 3831,49 см-1. 10. 4000,37,4042,59,4084,81 см-1.
11.
/ N1/NK / / Ni/NK
0 0,051 5 0,119 9 0,009
1 0,137 6 0,076 10 0,004
2 0,186 7 0,042 11 0,002
3 0,191 8 0,021 12 0,0003
4 0,163
509
12.
/ v", см 1 / V, см 1 / V, СМ 1
0 2906,01 5 2998,76 9 3060,00
1 2926,00 6 3015,15 10 3075,51
2 2945,27 7 3030,82 11 3086,30
3 2963,82 8 3045,77 12 3098,37
4 2981,65
13. 5,1595-10~47 кг-м2; 1,079-1010м. 14. 4; 6; 9. 15. vas = 870; vs = 447;
fi = 240 см-1. 16.\.s = 403 (3); 6as = 129 (3); fis = 104 cm-1 (2).
Глава VI
1. 15,52-103 Дж. 2. 2085,4 кДж/кг. 3 . 3,24-105 Па; 1670,2 Дж. 4. 18,7498
кДж; 5. 359, 637 К; — 400,37 Дж; 400,34 Дж; 1,335 кДж. 6. N2. 7. Аг; 1389,19
К; Н2—748,42 К; Н2О — 637,11 К. 8.205,51.9. а) 273 К; 0,505-105 Па; 1573,3
кДж; б) 172 К; 0,636-105 Па; 1259,9 кДж; а) 273 К; 0,505-105 Па; 0. 10. 98Х
X 10е Дж. 11. 1,0212-10“ Дж. 12. 5,9547-10’ Дж. 13. (Д?82,5 — Н0^в =
= 14,375 кДж/моль; (Д?8->,3—Д®)нк = 28,426 кДж/моль. 14. А = 0,0018095
Дж/(моль-К4), (H?S1U - Д») = 23,8 Дж/моль; (Д?82 s- Д») = 14,356 кДж/
/моль. 15. а) — 3,716 кДж; б) 0; в) — 5,596 кДж;’ г) — 8,921 кДж. 16.
ДЯ®208 = —214,78 кДж At/M8 =— 209,82 кДж. 17. ДД»88 =214,87 кДж;
ДД2,8 = — 209, 82 кДж. 18. ДД% 2>8 = — 74,88 кДж; &Uf 288= —72,40 кДж.
19. — 854,28 кДж. 20. — 1070,07 кДж. 21. — 125,07 кДж.’ 22. а) 83,01 кДж;
б)— 451,68 кДж, в) — 826,84 кДж; г)х34,70 кДж. 23. а) 10,49 кДж; б)
— 493,14 кДж; в) — 562,50 кДж; г)—631, 21 кДж; д)— 64,85кДж; 24.
а) —5156,78 кДж/моль; б) —5149,14 кДж/моль. 25. —5061,06 кДж. 26.— 231,18
кДж. 27. —6.98 кДж. 29. — 12,40 кДж/моль; 14,70%. 30. —55,938 кДж/моль.
31. — 524,90 кДж/моль. 32. — 2884,0 кДж/моль. 33. — 89,76 кДж. 34.
—643,06 кДж. 35. Д/7“~ —237,644-103—13,01 Т+2,883-10-37^—(1,713-105)/5;
— 246, 421 кДж; от 298 до 2500 К. 36. ДД| = 131,99-103 + 8,547 — 3.81Х
10~3Т2 — (8,502 10Б)/Т; 135,87 кДж. 37. 1,962 кДж/моль. 38. 36,70 кДж/моль.
39 — 694,91 кДж//моль. 40. —78,87 кДж. 41. —298,26 кДж. 42. — 60,826 кДж.
43. 0° = 2,08+269,27-10-3 Т — 36,61 • 10-“Т2. 47. ДТ = — 0,732°. 48. ДТ =
= — 1,348. 49. 32 % Н2О. 50. Q = — 15447.3 Дж/моль. 51, 226,65 Дж/моль.
Миоговариаитиая задача № 1
Кг ва- рианта кДж/моль кДж/моль № ва- рианта ДЯ“»8, кДж/ моль ДС/®288, кДж/моль № ва- рианта ДЯ2»8, кДж/моль Д</®»8. кДж/моль
1 — 128,04 —120,01 7 57,27 54,79 13 — 197,9 —195,42
2 —202,42 — 194,99 8 81,36 78,88 14 —66,27 -63,79
3 175,97 171,01 9 178,23 175,75 15 —260,15 —242,72
4 1531,22 1518,87 10 108,22 105,74 16 —269,06 —266,58
5 1166,18 1153,79 11 274,76 267,33 17 —108,97 —106,49
6 114,14 111,66 12 260,06 266,58 18 —2,85 —0,37
510
Главе VII
1. — 167,6 Дж. 2. — 125,7 Дж. 3. 2005,5; 1752,0; 1519,8; —1752,0 Дж
4. 3242,46; 4539, 40 Дж/К. 5. 62369,9 Дж/К. 6. 5628 Дж/К. 7. 2,44 Дж/(мольХ
X К). 8.-15,16 Дж/(моль-К). 9, Г5.340. 10. 9,0-Ю-2 Дж/(моль-К). Ц.
15,341 Дж/моль. 12. 11525,65 Дж/моль. 13. 12,1 Дж/кмоль; — 12,1 Дж/кмоль;
0. 14. 142 Дж/(моль-К). 15. 3,52 Дж/(моль-К). 18. 302 Дж/(моль К). 17. 1,2
Дж/(моль-К). 18. 1) AS=—32,56 Дж/(моль-К); 2) S—61,55 Дж/(моль-К);
3) AS = 317,10 Дж/(моль-К). 19. AS = —103,182. 20. 1) -54,96 Дж/
(моль-К); 2) 175, 7 Дж/(моль-К); 3)— 187, 8 Дж/(моль-К); 4)—17, 49 Дж/
/(моль-К). 21. 103,8 Дж/(моль-К). 22. AS& = 93,769 Дж/моль; ASV =
= 100, 3 Дж/моль. 23. 246,6 Дж/(моль-К). 24. 56,87 Дж/(моль-К). 26. Изо-
2V — nb
термическое расширение ASi = nR in ——---------—;
V — по .
изохорическое охлаждение
2V — nb 3 / па
AS=AS1+ASa+«/?ln= —- + — in 11 - —
. 28. 1116,7 Дж/моль. 29.
1) 307, 46 Дж/моль; 2) 0; 3) 275,5. 30. — 619,72 Дж; 5875,38 Дж; 6495,1 Дж.
31. AG] - 0; AGa — — 328,02 Дж/моль. 32. AG = = — 108 Дж/моль; АД=
= — 5840 Дж/моль; AS = —21,3 Дж/(моль-К). 33. 107,28 Дж/(моль К).
34. W =— 4454,66 Дж; MJ = 0; АД = 0; AS = = — 5,76 Дж/(моль-К);
AG = 4454,66 Дж/моль; АД = 4454,66 Дж/моль. 35. W = 5229, 29 Дж;
MJ = 0; АД = 0; AG = — 5229,29 Дж/моль; AS = = 19,14 Дж/(моль К);
ДА = —5229,29 Дж/моль. 36. a) AS = 3,27 Дж/моль; АД = 5700 Дж/моль;
AG = 4724 Дж/моль; б) графит; в) да, при давлении не менее чем 2500 атм.
37. AG® = — 535,3 кДж/моль; ДД®=631 кДж/моль; AS® — 14,23 Дж/(моль• К).
38. Д^ == — 21 755 + 0,74 In Т — 7,57" — 7-10“® Г2. 39. АД® = —
— 139,18 кДж/моль; АД = Al/; AS = — 50,37 Дж/моль; Д6“ = ДА® =
= — 124,1 кДж/моль; АСр = 42,27 Дж. 40. 1) 890,31 кДж/моль; 2)
393,51 кДж/моль; 3) 571,66 кДж/моль; 4) 105, 358; 5) 55, 168 кДж/моль.
41. 1) Д6»= 443,899 кДж/моль; 2) Д6® =— 24,366 кДж/моль; 3) Д6®=
= 57 650 Дж/моль. 42. АД — — 469 Дж/моль. 43. Да; —5,06 кДж/моль; — 7,49
кДж/моль. 44. Да. — 521,064 кДж. 45. AG^00 = — 60,7 кДж/моль; да, будет.
46. ASg98 = 96,588 Дж/(моль-К). 47. AS§98 = 80,2 Дж//(моль-К).
Глава VIII
1. 2,4993-10’. 2. 1,1733-10*. 3. 1,0117. 4. 2.5. 5,9335-10®. 6. 1,2025-101®.
7. 5,5216-Ю11. 8. 6,5424-10®. 9. 1,4086-10®. 10. 220,4288. 11. 2,1926. 12. 1. 13.
680,7935-10®. 14. 2,5857-10u. 15. 12,4715 кДж/моль. 16. 8,3143 кДж/моль. 17.
2,173 кДж/моль. 18. (Дюоо - До) = 22,959 кДж/моль; (Д?»#» — ДЯ) = 31,273
кДж/моль; (Д®ооо — Д»»») = 22,591 кДж/моль. 20. С® 298 = 29,3368 Дж/(мольХ
X К); юоо = 34,6000 Дж/(моль-К). 21. 7,5534 кДж/моль; 10,0311 кДж/
моль. 22. 8,1233 кДж/моль; 10,6010 кДж/моль. 23. 12,4715 Дж/(моль-К).
24. 12,4715 Дж/(моль-К). 25. 38, 819 Дж/(моль-К). 26. 72,076 Дж/(моль-К)
27.35,639 Дж/(моль-К). 28. = 60,356+ 97,754-10~» Т — 54,09-10“ Т*.
29. 40,524 Дж/(моль-К). 30. 53,909 Дж/(моль-К). 31. 1260. 32 . 999,6.
33. 1,0135-10® Па. 35. СОа молекула линейная, SOa молекула нелинейная.
36. Cv— 12,4715 Дж/(моль-К); (Даа8— До) = 3,7166 кДж/моль; 3!|ав —
= 163,962 Дж/(моль-К). 37. 48,1261 Дж/(моль-К).
38. Г, К............. 298 1000 3000
Зкол • • . ’ . . 0,0014 1,572 8,363
39. 210,884 Дж/(моль-К). 40. — 192,1023 Дж/(моль-К). 41. — 157,1403 Дж/
/(моль-К); — 4,683 кДж/моль. 43. 188, 721 Дж/(моль-К). 44. 219,4. 45. 0,0108.
511
46.
/ Ni/NA i Ni/NA j / n(/na
0 0,05119 6 0,07752 11 0,00137
1 0,13862 7 0,04369 12 0,00044
2 0,18826 8 0,02183 13 0,00012
3 0,19386 9 0,00971 14 0,00003
4 0,16550 10 0,00385 15 0,00000
5 0,12124
4 7. 1260.
Глава IX
I. 0,288 л. 2. 78, СвНл. 3.0,465 кг; 8,3 кг/м3; 0,0179 кг/м3. 4. На 376,7 кг
5. 757 мм рт. ст. 6. С12 74, 1 %; Вг2 13,7 %, О2, 12,2 %, РВ].2 = 0,137 атм
РС| = 0,74, РОг = 0,123 атм, V = 0,39 м3. 7. 0,987 атм; VOi = 16,56 м3;
yN> = 58,44 м3. 8.4,53 кг. 9.396 К- 10. Ь = 469,7-10~7 2м3/моль; Ь=
= 427,7-10-’ м3/моль. 11. У= 47,8 л. 14. у, = 0,801. 15. 7,6-102м/с. 16. <гм> =
= 3,64-10-1» м; 750 К- 17. Z = 8,05-1011; Z'=9,l- 1032; Z" = 1,18-Ю26; 0,261'атм.
18. 55 %. 19. 0,37 л. 20. 4.4 %. 21. 0,4986; 0,2676; 0,1338 атм. 22. 5,4 %;
19,8%; 1,054; 1,198. 23. 55, 55.
Глава X
1. 18,22-10-» м3/моль. 2. 96,3576-10-» м3/моль. 3. 1,17 D. 4.2,77 D; 0.92Х
X 10—22 К-М. 5.27,453-ю-» м3/моль; 27,193-10~» м3/моль. 6.21,334-10-»;
21,140-10-» м3/моль. 7. СН3СООСН2—СН=СН2. 8. 0. 9. 2.0183. 10. 0,8995 х
СН=СН.
Х10~3 кг/см3. 11. 0,0390 кг|/,4-м3-с—*/2 кмоль-1. 12. 1. 13. I /NH
СН=С1Г
(пиррои). 14. оу = 0,6988 — 0,12377-10~3 Т; -0,12377-10"3 Дж/(м2-К). 15.—
—12377-10“3 Дж/(м2-К). 16. 69,76-10-3 Дж/м2. 17. — = 16,5-10»/d—13,226 X
Л
ХЮ3; Т]= 0,1877-10-3. 18. Ец = 10,4895 кДж/моль; г] = 9,8145-10~»х
xei0489,5/«7- 19 28,074 кДж/моль. 20. Я исп= 51,87-103—50,4 Т-|-0,5-10~3Х
ХЛ + (9,87• 21. ДЯ340 = 49,335 кДж/моль; AS340 = 145 Дж/(моль-К.).
22. 62, 24 кДж/моль. 23. 85, 44 кДж/моль. 24. 508,690 кДж/моль. 25.
440,718 кДж/моль.
Глава XI
1. Нет. 3.1,947-10’ Па. 4. ДЯ2,312 = 44,991 кДж/моль; ДЯИЗ>2 =
= 94,326 кДж/моль; ДЯ273г2 = 46,312 кДж/моль; ДЯ672 7 = 36,727 кДж/моль.
5. ДДИСП = 35,82 кДж/моль; AS = 88,36 Дж/(моль-К); АЛ = —3,369 кДж/
моль; AG = 0; А1/ = 32,452 кДж/моль; Т= 260,2 К. 6. А = 11,628; В =
512
= 16,78-104; Т = 2537 К. 7. ДЯ = 239,119 кДж/кг. 8. ЛЯнспС| =21,706
кДж/моль. 9. Р2К = 4,159- 104Па; ЛЯИСП = 29,337 кДж/моль; 2 AGHcn =
= 0; ЛСфп = - 34 Дж/(моль-К); AS = 98,446 Дж/моль. 10. 7’т“°” =
= 276, 46 К; Рт.тр = иЗ-КРПа; ДЯВОЗГ = 45,250 кДж/моль; Дя1п =
= 33,894 кДж/моль; ДЯПЛ = 11,356 кДж/моль. 11. 7'пл = 1247,7 К; Рт тр =
= 452,9 Па; ДЯИСП = 12,997 кДж/моль. 12. 95 — истинная молекулярная
масса СН3СООН 100, 24. Полученная величина указывает, что в парах
СН3СООН частично ассоциирована. 13. 5,998. 14. 1) Р = 7,13-103 Па; 2)
Р= 33, 56-Ю3 Па. 15. Т = 430,65 К. 16. ДЯ7М,ИСП = ИЗ,303 кДж/моль.
17. 7’пл.!,, = 335,67; 7'пл 1200 = 451,9 К; ДЯПЛ = 476, 67 Дж/моль; ДЯПЛ =
= 497, 2’Дж/моль. 19. = 9,76-107. 21. \Н = 519,068 кДж/кг. 22. Не со-
гласуются. 23. ДЯИСП = 43,367 кДж/моль; Д5ИСП= 91,68 Дж/(моль-К).
24. 1пР = 17,55—1,484-10VT; ДЯпар = 120,873 кДж/моль. 25. V = 0,88 л;
(1,79-10~2 л). 26. ДЯИСП = 42240—39,9 Т Дж/моль; А5зз1,2,исп = 93,64 Дж/
/моль. 27. Р=606,5 мм рт. ст. 28. ДЯИСП = 28,67 кДж/моль; Тп т к = 307,6 К.
f = 34,6°С. 29. ДЯИСП = 33,02 кДж/моль. 30. 7'кип 5eo мм пт ст = 2475 К;
Р = 10,86 — 1685/Т. 31. t = 28,8° С. '
Глава XII
1. 3,128 моль/л; 3,414 моль/кг; 0,058; 26 %. 2. 8,732 моль кг; 15,31 моль/кг,
0,216. 3. 0,0105 моль/моль Н2О; 0,5534 моль/л; 0,9016 см3/г. 4. 789,3 г;'0,98 см3/г.
5. 1,134 г/см3. 6. 0,44 см3. 7. 4,16 см3; 1,17 см3/г; 1,260 см3/г. 8. 27,3 см3/моль.
9. 8,75 м3/моль. 10. 19, 93; 23,14 см3/моль. 11. 39,72 см2/моль, 12. 20, 44 см3/
/моль. 13. 234 г. 14. 7,918 см3/моль. 15. 18 см3/моль. 17. — 0,421; — 0,231; —
— 0,148; — 1,730; —0,986;—0,619. 18. — 0,0765; —0,052; — 0,047; —0,3198;
—0,217;—0,196. 19. 4430, 86 Дж; ЬНГ = 1188, 26 Дж/моль; ДЯ2 = 6263,45
Дж/моль. 20. 6351,31 Дж/моль; ДЯ = 230,96 Дж. 21. ДЯ7 = — 28200, 16 Дж/
/моль; ДЯ2 = — 1832,59 Дж/моль; ДЯ = — 95596,03 Дж. 22.ДЯ = 41798,16
Дж/моль. 24 . 3740 Дж/моль. 25.— 718 кДж. 26. AS,„ = R (xAg+xAulnxAu) —
— 5,03 -vAgXAu; 4,34 Дж/(моль-К). 27. pFe = Ние + RTxFe ~ 2093 х>
HN1 = HNi + 1п *Ni = 2095 *Ni- 28- °’903- 29- 0,583; °’246- 30- 1-93- 31. а =
= 0,920; у = 0,989. 32. 0,2499. 33. 1,52. 34. 161. 35. 35,41. 36. 16,89 Дж/моль.
38.. 1903,72 Дж. 40.—8600 Дж/моль. 41. — 1330 Дж/моль. 42. 660 Дж/моль.
43. 9,68 Дж/(моль-К). 44. Др = — 157500 Дж/моль 45. ДТ = 42°С.
Глава Х111
1. 0,00036. 2. 7330 Па. 3 . 5,75-104 Па. 4. 123; 6,82 %. 5. 1,87. 6. 0,6 %.
7.61 % . 8. 198. 9. 1,0096-105 Па. 10.2, 637. 11. 8 атомов. 12. 138,8. 13.373,56.
14. 0,08. 15. 153, 8. 16. 24,0 17. i = 0,324; ассоциация. 18. i = 2,52. 19. К~
= 8,245; 99,37 кДж/моль. 20. 1,154-103 моль/м3. 21. 27, 25-105 Па. 22. 373,
295 К; 1, 94-10“ Па. 23. 271, 39. 24. 564 Па. 25. 271,963 К. 26. 0,936 моль/л.
27. 62, 9. 28. 6,25 %; М = 128; 93,7. 29. 3122,4 Па. 30. 2,56-10“ Па. 31. 72,3.
32. = 1,49-10-4; ХО2= 3,0-10~4; no* = 0,0165 моль/л. 33. 15,8-105 Па.
34 . 0,1032 кг. 35. O2=22,7%, N2 = 1,35” %, Аг = 3, 69%, СО2 = 92,2 %.
36. 0,00233 кг. 37. 16192,08 Дж/моль. 38. 5,16-103 г; 4,81 Ю3 г. 39. ДТ3 =
= 0,48. 40. 0,88 г/л. 41. 117; 0,03558. 42. К = с? 515/с2=2,192; 0,515. 43. 17,27.
44. 5,85 л. 44. 5,85; 0,579; 0,0527 л. 45. 4,61 Ю-3 г. 46. 1,008-105 Па. 47. 2,973 г.
17 Зак. 767
513
Многовариаитная задача № 1
1 № ’ варианта Р, Па Т, К Р°. Па М. /и, моль/1000 г С, моль/л Я-10~5 * 7, Па
1 1 598 288,2 1 600 72,27 0,07 0,07 1,677
2 38 714 278 40 290 57,67 1,5 1,04 23,344
3 31 740 69 31 992 185,6 0,28 0,23 1,319
4 33 841 114 34 738 105,14 0,88 1,05 9,95
5 16108 306,7 16396 94,2 0,558 0,84 21,419
6 55 000 207 55 986 187,57 0,527 0,952 16,384
7 650 000 223 674 824 100,18 0,86 1,197 22,192
8 2 375 283,2 2 626 32,76 2,29 2,58 60,747
9 91 912 252,5 96 942 50 1,05 2,9 60,879
10 776 1991 800 80 0,589 4,82 632,331
11 35 896 303 37 724 60 0,877 2,96 74,566
12 7 328 216 7 998 44,38 1,428 2,13 38,251
13 12 420 149 12 663 107,5 0,287 0,496 6 144
14 5 807 283,2 6 050 57,65 0,536 0,39 9,183
15 49431 194 51 987 100 0,638 0 726 11,710
16 84 990 119,6 87 711 137,27 0,38 0,786 7,815
Глава XIV
1. 0,823-104; 0,867-104; 0,224-104; 1,092-104 Па; AS = 12,88 Дж/моль;
Др = 408,9 Дж/моль. 2. 3,38-104; 4,24-104 Па. 3. 0,43 н 0,85 % CS2; 5,5-104 н
6,5-104 Па.
4. Т, К...........' 293 313 353
(ДР/Р) 100,% . -9,32 7,19 —5,59
5. 67,6 % 6. 0,248. 7. х" , = 0,521; х* = 0,143.
4 '-A-. 14 х_А.Д4
Т, К............. 330 350 380 420
.......... 0,765 0,710 0,696 0,682
10. Пар 0,295 кг; жидкость 0,05 кг. 11. Н2О 0,223 кг. 12. 39,6 кДж/моль.
13. —3,4 кДж/моль. 15. ?сс|4 = 1,555; асС14 = 0,9799; YCjh5oh ~ 1.876;
ас1н8он== °.6940. 16. ?НгО— 0,6920; аН2О= 0,3204; Тсан5он=0’8777; ансоон =
= 0,4716; отрицательное отклонение. 17. 0,84 кг. 18. 3,18 кг. 19. 0,567 кг. 20.
0,555 кг. 21. 1,29 кг
Глава XV
1. 1515 К; 53 % N1; тж = 0,024 кг; ттв= 0,048; 1435 К. 4. 0,348 кг.
7. 8,8 %; 70,5; 0,066 кг; 0,034 кг; 336,5 К; 327,6 К. 9- птв=6,92 моль; пж =
= 9,22 моль; убылей 3,72 моль.
Глава XVII
1. 0,845; 0,543; 0,465; 1,333. 2. СО—1,447% Н2О—59,858 %; СО2—37,013% ;
Н2—1,68%. 3. 0,2264 моль. 4. 0,01113; 0,1264. 5. 5,496-Ю4 Па; 0,535. 6.
514
0,932; 0,0352. 7. 0,542; 3,516-Ю4 Па. 8. 1,014; 1,871-Ю-2. 9. 0,363; 5,768 моль/м3,
0,632-10* Па. 10. 0,721; 1,586; 0,910. 11. 28, 99-Ю4 Па. 12. 2527,5; 17,02. 13.
72,35-10'3. 14. 0,00164. 15. 0,219; 0,0504; 0,912. 16. 0,148; 7,0866-104Па. 17.
1,1255-Ю3 Па. 18. 0,083 19. 1,809. 20. —24,436 кДж. 21. — 21,888 кДж. 22.
Не будет. 23.-472,77 кДж. 24. — 148,48 Дж. 25. — 27,02 Дж. 26. —442,095
кДж; АЯГ = — 432,092—12,505-10~3 Т (кДж). 27.4454,08 м3/моль; 387,81
м3/моль; —114,19 кДж. 28. 50,232 кДж. 29. —116,226 кДж. 30. 1,0402. 31.
— 71,170 кДж. 32. 110, 997 кДж; 813,9 К. 33. — 17,345 кДж; — 22,270 кДж;
, 0,6568-Ю3 47,2576-103
0,859 Дж/К. 34. 1g Кр = — 52,3444- Г2 - — —?-----------------Н 2,6244 lg Т —
—1,0241-Ю-3 Т; 7,614-Ю9. 35. 1154,25 К. 36. 1g КР = (0,273-Ю5)/?2 —
-(9,6356- 103)/7" — 1,2905 lg Т + 12,5205 — 0,2183 Ю~3 7"; 1,879. 37.
177,455 кДж; 2,463-Ю33 . 38 . 73,63 3 кДж; lgKp = — (3,846-103)/7"- 0,3904.
39. ~ — 200 кДж; хс,н. = хс,н4(сн3>2 ~ °>086; хс,н8сн3 = °’828- 40.
5,2518; хс>н>=хс'н<(сн , = 0,8217; Хс,н3сн3 =0,1783. 41. 29,97. 42. 247,5.
43. 3,36-Ю4 Па; 9,44-10* Па. 44. 1,059-Ю-2. 45. 3,293. 46. 492,2 К 47. 8,357-X
ХЮ3. 48.0,173. 49. 2,532-Ю5. 50. 4,116-Ю4 51. 1,2787. 52. 31,109. 53. СН,С12—
—0,090; С12—0,001; СНС13—0,320; НС1 — 0,499; CCL — 0,090. 54. Выход NO~
— 3,5 %.
Миоговариаитиая задача № 1
№ ва-
рианта
_ х1^2 (2—Зх)3^2
Кр (1—2х)2Р3/2
-у (3—х)1/2
Р~~ (1-Х)3/2р!/2 ’
16х2 (4—х)2
Кр~ 27(2—х4)Р2 ’
К 81 х3
р 4 (3-х)3 (15—2х)2Р2
х2(Ю-х)1/2
Р~ (2—х)5/2Р'/2
к __ х(7—5х)5/2
Р 108(1 —х)7/5 Р5/2
к х(3—2х)2
р~ 4(1 —х)8Р2 ’
9х3Р
Кр= (3-х)2 (64-х) ’
Kc=Kp(RT) 3/2;
Kc=Kp(RT)1'2-,
Kr=Kp(RT)\
Ke^Kp(RT)^
Kc=Kp(RT)l/2;
Ke^Kp(RT)5!2\
Kc = KP(RT)*-,
Ke=Kp(RTK1\
17*
515
9 д- 8х2 Р|/2 р"(2-Х)3/2(6+х)’ А'<-=Кр(Р7’)^1/2;
10 6i/2-3-23/2.P3/2-v3
Р (3—х)3/2 (З+х)3/2 ~ Кс=Кр (RT) 3/2;
20,78 л-з рЗ/2
(9—х2)3/2
11 27%зр'/2
Р 2(3—х)ъ'2 (15-J-x),/2 Лс = КР (RT) 1/2;
12 х2(10—Зх)»
р‘ (2—х)59Р3 ’ Кс = КР (RT)3;
13 К %3 (21—х)1/2 Р (3—х)7'2 Р1/2’ Kc = Kp(RT)1/2;
14 К _ 2х2 ((4—Зх)372 Р~ 27 (2—х)7/2 рЗ/2 ’ Kc = KP(RT)3/2;
15 54 х3 Р2 Р~ (3—х) (3+2х)2’ Ke = Kp(RT)~3-y
16 к 2х Кр~ 1-х ’ Ке~Кр\
17 х3(12—х)
Р (3—х)4Р ’ Кс = КР RT-
18 х(4-3х)з
Р~ 27(1—х)4Рз ’ Kc=KP(RT)3-,
19 х2 (6-х) р (2—X)3 Р ’ K,.= KpRT-
20 к 27^3 Р' 4(3—х)3 ’ Kc^Kp-
21 г 4x2 Р - (2-х)2 ’ Ke=Kp,
22 v х(4—Зх)3
Р 16(1—л)4 Р ’ Kc = Kp(RT)3.
516
Многоварнантная задача № 6
Ns ва- рианта Кр № ва- рианта Кр Ns ва- рианта Кр № ва- рианта Кр
1 1,928 -Ю48 6 1,656-1010 11 3,726-10-7 17 1,654-Ю12
2 9,757-1012 7 0,912 12 4,196-Ю39 18 3,152- 1О-4
3 5,557-107 8 7,896 13 2,217 19 1,268-Ю-2
4 42.127 9 2,24-10-18 14 5,65-106 20 2,028
5 1,157-1010 10 1.43 16 9,74-10-2
Миоговариаитиая задача № 7
Ne ва- рианта Повышение Р Понижение Р Давление инертного газа Ne ва- рианта Повышение Р Понижение Р Давление инертного газа
1 увелич. уменьш. уменьш. 11 увелич. уменьш. уменьш.
2 умеиьш. увелич. увелич. 12 уменьш. увелич. увелич.
3 » » » 13 » »
4 увелич. уменьш. уменьш. 14 увелич. уменьш. уменьш.
5 » » 15 » » »
6 2> 2> » 16 уменьш. увелич. увелич.
7 уменьш. увелич. увелич. 17 увелич. уменьш. уменьш.
8 не изм. ие нзм. не изм. 18 уменьш. ’ увелич. увелич.
9 увелич. уменьш. уменьш. 19 увелич. уменьш. уменьш.
10 уменьш. увелнч. увелич. 20 ' » »
Глава XVIII
1. l/R= 0,0377 См. 2. х= 8,135 См^м-1. 3. 2,28-Ю~2 г. 4. t+ = 0,418;
t_ = 0,582. 5. Х+= 5,02-10~3 См-м2/моль; = 6,56-10-3 См-м2/моль; t+=
= 0,185; /_ = 0,815. 6.1С|О_=59,07 См-м2. 7. 1=96,5 (совпадает с опытным
значением 96,6). 8.1КС] = 129,5 См.см2. 9. 0,22. 10. 0,101 моль/л. 11. 10 =
= 390 См-!-см2; а=0,198. 12. 4,35; Ка = 0,173-10~4. 13. 1,74-10~5. 14. [Н+]=
= 1,175-Ю-2, [Н+] = 1,324-Ю-3. 15. 9,939-10-4. 16. £,=0,87-10-3; £2=7,81 X
Х10-4 моль/л. 17.11=112,9; 12 =— 65,26. 18. 3,25-Ю2; 0,654; 5,32-10~3.
19.
Соль с, моль/1000 1 Y± Соль моль/1000 с, I v±
1 Mgso, LaCl3 Na2SO4 0,005 0,010 0,006 0,098 0,230 0,333 0,4№ 11 MgSO, LaCl3 Na2SO4 0,01 0,002 0,005 0,059 0,320 0,426 0,565
517
20. v± = 0,718. 21. <z±1/a±2 =0,15. 22. ДЯ = — 574 92 Дж/моль. 23. 1465,45
Дж/моль. 24. A^onh + =:—132,9 кДж/моль. 25. AG!}00= —97, 382 кДж; ДЯ^Оо=
= — 52, 453 кДж;4 AS = 149,76 Дж. 26. bG° = 11, 227 кДж; Д5“ =
— ПО, 8 Дж. 27. ПР = 5,07-10-“. 28. pH = 2,16. 29. 0,980; 0,964; 0,920;
0,889; 0,847. 30. ПР = 7,33. 31. 238-10~10 М. 32. 0,865; 0,845; 0,826; 0,791;
0,687; 0,593. 33. pH = 6,9. 34. Т 353,3 К. 35. Кд = 0,072 • 10~3; С =
= 27,0-10-3. 36. а= 7,33-10-7. 37. I. = 1,48-10~5. 38. у± = 0J07. 39.
55,94 кДж. 40. С=7,9-10-2. 41. 250,7. 42.211(136,3). 43 ДЯНг§О4 =
= 18,57 кДж/моль; ДЯНгО= 14,7. 44. 56, 5 кДж/моль. 45. 0,01023. 46. Др= 11321
Дж/моль. 47. ah = 5,16-10-3. 48. 6-Ю-5. 49. ah = 0,00633; ah= 0,00122. 50.
0,74-10—5.
Глава XIX
1. Zn + CuSO4 = Си + ZnSO4; Си2+ + 2Ag+2Cl- =2 AgCl+Cu; Cd+
4- Hg2SO4 = 2Hg+SOr +Cd2+; H2+Hg2SO4= Hg+2H+ + SOI-; Си (OH)2 +
+ H2 = Cu+2 H2O. 2. Cd|Cd2+:: Cu2+|Cu; Pt|H2|H+ Ag+ | Ag; Ag |Ag I| Agl |
Ag; Pt|H2| HCI |C12| Pt; Zn |Zn2+:.i Fe3+|Fe2+|Pt ; Pt|H2|OH- !! H+ |H2J Pt; Pt
|H2| OH-|O2|Pt. 3. 0,43648 B. 4. 0,925 B. 5. 2,65. 6. 0,11 В'. 7. 0,7763 B. 8.
—0,059 B. 9. 2,54 B. 10. £,=0,7846; £2= —0,2479 B; pH=l,083. 11.-0,15 B.
12.0,065.13. £4=0,337 B; £2=0,594 B. 14./f4 = 6,8-1085;/<2= 1,313. 15. £J =
= — 0,0363 B; £» = 0,721 B; £» = 0,519 B. 16. 0,01735 B. 17. Y± = 0,202.
18. 0,459 B. 19. 0,1317.20. 0,0438 B. 21. apb = 5,7-IO-3; yPb =0,297. 22. —О,33б
В. 23. ДЯ = — 238,175 кДж/моль; q = 21,07 кДж/моль; £!J98 = 0,985 В.
24. ДС}, 298== 12,59 Дж/(моль-К). 25. ?= 24,153 кДж. 26. 6,45-10-“. 27.
а(Т1) Hg = 0,0626; 7= 0,736; ДОт = — 6,865 Дж/моль; \S'n = 17,36 Дж/
/(моль-К). 28. ДЯТ] = —1,459 кДж/моль. 29. a^Cd, Sn =0,0797; P^Cd)Sn =2,37 мм
рт. ст. 30. ат1 =0,0112; у=0,0562. 31. аТ|—0,00432; у = 0,0Г88; ДОт=—13,489
кДж/моль; \Нт = — 2,832 кДж/моль; Д5"!= 12,43 Дж/(моль-К). 32. £=
= 0,261 В. 33. Ki = 1,98-Ю14; К2 = 1,645 10м; /G = 2,78-10~“. 34./С1г =
= 35,41 атм; у = 0,708; /с14 ~ 45,45 атм; у= 0,4545. 35. 237 кДж/моль;
1,229 В. 36. £° = 0,41146 В; у± = 0,488. 37. 1) Равновесие; 2) КР~ 1 или
Кс — 1 в зависимости от того, как определялось £°. Другой ответ: концентра-
ционная цепь; 3) очень разбавленный раствор сильного электролита; 4) очень
разбавленный раствор; 5) без ограничений; 6) только для соли 1:2 или 2:1; 7)
очень разбавленный раствор; 8) обратимая реакция в цепи; 9) £г = ЭДС той
же цепи без переноса. Число переноса зависит от концентрации.
Глава XX
1. а= 7,1-10-3 мм рт. ст.; К = 36 мл-г-1. 2. а = 18,6. 3. S = 449 м2.
5. а = 0,129 г. 6. Оао = 1,706, К = 9,56-10-“. 7. ах = 4,33-10—10; /<=0,07:
а=3-1О-10 моль/см2. 8.5=12,22 А2. 12. Svn = 0,21 м2/г. 13. Sva =-
= 199,5 ма/г. 16. ДЯ = 28,5-103 Дж/моль. 17. ДЯ -= 22,2-103 Дж/моль.
Глава XXI
1. 43,2 года. 2. 5,3-10—5; 4,35-10“ мин. 3. 0,0515 мин-1. 4.2,65-10-“;
1530 мин. 5. Первый 2,7-10~3 мин-1. 6. 30 мин, 7. 2,55-10-8 с. 8. 3,75 мин. 9.
52 % 10. 7,36 мин. 13. 0,7544; 23,8 ч; 238,5 ч. 14. 0,86 моль-1-мин~1-л. 15.
518
0,07 моль/л. 16. 25 %; 33,3%; 38%; 100%. 20. Первый. 21. Первый 22. Полу-
торный. 23. Первый; 0,0123 мин-1. 25. Первый; 0,040 ч-1. 26. Первый;
4,19-10—4 мин-1. 27. 5,31 -10—3 мин-1-г-экв-1-л. 28. Третий. 29. Второй;
11,6 мин-1-г-экв-1-л. 30. Второй; 2,35 мин-1-г-экв-1-л. 31. Второй;
0,0383—1с~г-экв-л. 32. Первый; 1,5-10—2 с-1; 460 с.
Глава XXII
1. = 0,00314 мин-1; Л>_1=0,0104; Кс = 0,302. 2. Кравн = 0,79242; kt=
= 0,0017045; k^= 0,002151. 3. kt = 1,495-Ю-5 (1,84-10—6) мин-1. 4. kt =
= 0,01637 мин-1; #_, = 0,000334 мин-1; Кравк
X мин-1-л. 6. kt = 0,035 мин-1; #2 =
= 5,67 ч; [В]тах = 595 кг. 8. ri/2 = -—~
kt т k2
но kt/k2 = хг/х2. 9. kt/k2 = 6,94. 10. Kcd
1 a
CRaC' - CRaBHCX)- "• *1 ~ t
= a —— (e~klt — e~klt );
&2 —
X e~klt 1. 12. [C] = 1 -
In
= 49. 5. п = 2; /<=0,412 моль
= 5,72-10-6 ’ ’
а
In — — In
2
= 0,0346995
; 1) а — х = ае
а — х
3)
Г [В]
[Cl = а 1 —
мин 7. ттах —
I a_ Xt kt+ k2 \
1,2”~ 2 kt )’
мин-1 (через 35 мин
2) [B[ =
---e-ktt + h------x
^2 — ^2 —
~ = ([B)-[B0] [2 ^([Bol-
ar
K-l \[B0]/
[А]ГВ1
- (Bl) - kt (BJ). 13. [С]стац = 1
= _1 = oo _J при t 0. (A] = [Ao]. [B] = [Bo]. [CJ _ о
D **
. [Ao] - [B0J - [BJ . #5 [A] [C]
следовательные; A— --------------------. 14. W = k3-~--------—— ; 1)
3 «—1 «з [C]
больших P k-t > k3 [CJ; W — Кдф [A] [C]; 2) При малых P k-t < #3[C].
= #i[A]; n=l. 15. P = 66,73 Па. 16. #2 = 3,79-10-3 c-1; -
к^г.ЬЮ-'с-1; [“ '___________________ ' 7 /________ ~ " ' '
X Ю11 атм. 17. Sn118 = 0,07 г. 18. WT|/ASb = 0,396;’ Aj/ASb = 0,6. 19. #, =
= 2,41-10—4c—i; #_j=l,9-10-4c-1. 20. *1=4,74.10-5c-1; #2=5,70- 10-5c-1. 22. ky=
=3,6-10-8 Па-1; &2 = 3,2-IO-4 c-1. 23. #i + #2 = 0,00187 . 24. t =
a ky -J- #2 (5 — ___ . 1
.<z—x kt~\~k2b
№ *) .
#1“Ь^2 b
26. #_1 = 9,47.10-3;
X In
25
Tmax — 7,45 мин; [С]стац — [Cimaxi
#2о
по-
При
№ =
15. Р = 66,73 На. 16. #2 = 3,79-10—3 с—ттах = 1979,51 с;
[RaA]max = 7,22-10-11 г; [RnlT=54 = 3,41-1014; [RaA) = l,93x
= 0,396:
#i 4- #2(#—о)
а
In ---- X
а—х
; 236,9 мин. 25. t —
eat — \
------; a = 3,5-10-5c-1; 0 = 0,33; x/a = 0,459.
#1 “Ь ^2 —л)
а
=2,659-10-3.
Глава XXIII
1. 311,8 кДж/моль (308,8 кДж/моль), ka = 1,029-1025. 2. 97,25 кДж/моль
(96,9 кДж/моль), #O = 8,21-IO13; т|/2 = 0,308 мин. 3. #j/#2 = 4444,78 (0,0002).
4. 46,65 кДж/моль; т[^2 = 6,1 мии; т"^2 = 12,2 мин. 5. #j: #2 : #= 1:47,3:99,7.
6. 291,3 К- 7. 18,2-10-3 мин-1; t— 253 мин. 8. 65 мин. 9. у = 1,882.
10. Т3= 291,4 К- Н. К28з, 2 — 7,05-10-:|, К313,2 = 29-10-3; К2»3, 2 =
= 14,9-10-3; х = 12,477 % = 0,01248 моль эфира. 12.96,747 кДж/моль;
519
й3=7,49-10~3 мин-1; t= 1230 мин. 13. 122,597 кДж/моль; / = 1274 с. 14
^343,2 = 2,72-10-6; Х343,2 = 0,02 72 мин-1-моль-1-л. 15. /=2147,5 мин;
й3=4,61 мин-1-моль"1-л. 17. 32,805 кДж/моль; ^о=О,587 с-1-мм рт. ст.-2; Кс,ззз=
= 1811,32 с-1-моль-2-л2; А7С,473= 12 1 871 с-1-моль-2-л2; 39,37 кДж/моль; й0=
= 2,71-109 с-1 моль-2-л2. 18. Точность определения времени полупревращения
зависит от точности термостатирования. Точности измерений недостаточно, что-
бы отличить реакции порядка 3/2 от реакции порядка 4/3; (Д/Аг^)-100= ±8,46%.
19. 573 К—1,22-10-10; 723 K=l,39-10-8. 20. Еа = 362895,78+16,628 Т Дж/
/моль; Е = 376, 198 кДж/моль. 21. 217, 73 кДж/моль; k0 1=6,08-1012 с-1; 213,
223 кДж/м-оль; й0>2= 1,18-1013 с-1; lg£j=12, 784—(1137*1,4/Т); lg*2= 13,073—
(11136/Т) 22. 18*!= 14,37—(9973/Т); lg k2= 15,104 — (9276/7’); W8, в =
= 0,018573; Кс, ввв, в к = 0,01661132; АН = 13348, 846 Дж/моль; Кс' 553 к =
= 1,013-10-2; кг ЛЗК= 2,25-IO-2.
Многовариантная задача № 1
1. 16,8 кДж/моль; k3 = •!, 108-105 мин-1-моль-1-л; у = 2,029; сЖ13 =
= 0,537-10-4 моль/л.
2. 166,672 кДж/моль; k3 = 0,0488 мин-1- моль-1-л; у = 2,001; сх^ —
= 0,00465 моль/л.
3. 167,87 кДж/моль; &3=0,0188 мин-1-моль-1-л; у= 1,65; = 1,695
моль/л.
4. 214,267 кДж/моль; &3=0,1148 мин-1-моль-1-л; у = 1,69; = 1,556
моль/л.
5. 88,213 кДж/моль; k3 = 0,1209 мин-1-моль-1-л; у= 1,39; cKj = 1,976
моль/л.
6. 192,549 кДж/моль; й3=40,699 мин-1-моль-1.л; у= 1,603; =
= 1,868 моль/л.
7. 219,168 кДж/моль; А3=13638,6 мин-1-моль-1-л; у= 1,148; сх> =
= 2,83 моль/л.
8. 265,714 кДж/моль; А3=53,138 мин-1-моль-1-л; у= 1,32; cXj = 1,7497
моль/л.
9. 103,8 кДж/моль; &3=0,287 мин-1-моль-1-л; у=4,274; сЖз=0,832 моль/л.
10. 326, 864 кДж/моль; &3=0,0788 мин-1-моль_1-л; у= 1,567; =
= 0,7359 моль/л.
11. Е = 204,366 кДж/моль; &3=0,402 мин-1-моль-1-л; у= 2,117; сЖз =
= 2,431 моль/л.
12. 64,265 кДж/моль; k3 = 1238,09 мин-1-л; у= 2,445; сх = с0 =
= 1,67 моль/л.
13. 98,153 кДж/моль; k3 = 0,00235 мии-1-моль-1-л; у = 3,697; сх,=
= 1,718 моль/л.
14. 218,6 кДж/моль; k3 ~ 0,0635 мии-1-моль—1-л; у = 1,714; =
= 0,673 моль/л.
15. 95,570 кДж/моль; k:t = 0,295 мин-1-моль-1-л; у = 4,003; сх* =
= 0,626 моль/л.
16. 83,765 кДж/моль; k3= 1,256 мии-1 • моль-1 - л; у = 2,910; сх> =
— 0,918 моль/л.
17. 110,618 кДж/моль; k3 = 0,011 мин-1-моль-1-л; у= 2,545; сх =
= 0,064 моль/л.
520
18. 47,148 кДж/моль; k3 = 79,724 мии-1-моль-1• л; 7=1,88; сх* = 0,949
моль/л.
19. 71,441 кДж/моль; k3 = 0,00259 мин-1-моль-1-л; у= 2,547; -
= 0,150 моль/л.
20. 65,355 кДж/моль; 63=0,123 мин“1моль_1-л; у= 2,352; сх* =
= 2,862 моль/л.
21. 70,694 кДж/моль; k:t = 0,000289 мин-1•моль-1-л; 7 = 2,701; сх* =
= 0,221 моль/л.
22. 109,439 кДж/моль: k:. = 0,0335 мин-1-моль-1-л; 7= 3,117; сх =
— 0,0386 .моль/л. =
23. 97,002 кДж/моль; k3 = 0,190 мин-1 -моль-1 • л; 7= 4,186; сх =
= 3,838 моль/л.
24. 6,992 кДж/моль; k:l = 1,719 мин-1-моль-1-л; 7= 1,087; сх =
= 2,66 моль/л.
25. 104,1 кДж/моль; ks = 5,713 мин-1-моль~х-л; 7= 3,593. сх = 1,838
моль/л.
Глава XXIV
1. Zo=29,4-1022; Zo=9,581O28; 7 = 61,4-10~7 см. 2. ZaKT = 184-Ю16; /,, =
= 0,00104 мин. 3. £„ = 128030,4 Дж/моль. 4. Z„=4,78-109. 5. k = 7,8-109 с-1.
7. р = 0,205; £„=165953,9 Дж/моль. 8. р = 5,3-10~10; Еа = 46818,96
Дж/моль 9. р = 5,3-10—8; Ев = 54475,68 Дж/моль. 10. 'р= 63-10—8; Еа =
= 57237,12 Дж/моль. 13. k = 9,3-10~9 см3-молекула-1-с-1. 14. £=1,25-10—12
см3 • молекула-^-1. 15. k = 4,12 • 10-21 см3 • молекула-1-с-1. 16. k =
= 0,298 см3 • моль-1 • с-1. 17. 152,9. 18. 7-10-3ч-1. 19. Д/7* = 72174
Дж/моль; Еа = 74709,5 Дж/моль. 20. ДН^ = 36149,76 Дж/моль; ДЗ^ =
68,032 Дж/(моль-К). 21. ; 7,76-10-3; Еп= 1112,9 Дж/моль; Кр =
= 1,63-103; Д/7* = —10794,7 Дж/моль. 22. ДЯ^ = 10 836 Дж/моль; ДЗ* =
•— 84,010 Дж/моль; = — 280196,3 Дж/моль. 23. a) k = 74 с-1; tt/~
-- 9,4-103с; б) k= 1,7- 10-2с-1; = 41 с; в) k = 3,8-10-6с-1; = 50 ч. 24
ДЯ- 121 336 Дж/моль; £„=233467,2 Дж/моль. 25. 6= 1,28-10-14 см3-моль-1.
26. k = 4,0- 10-8с-1; ДЗ* = — 3,347 Дж/(моль-К). 27. 1105457, 6 Дж/моль;
124683,2 Дж/моль; 39,33 Дж/(моль-К)- 28. 6=45,3 см3-моль-1-с-1. 29.
р = 0,5-IO-3.
521
Многовариантная задача № 3
№ варианта Еа. кДж/моль A Hj , кДж/моль » м’/(с«моль) ’ А Доу1 , Дж/моль '’ср
1 88,875 Т-298; 86,399 1,27- 10s Т-298; -155,26 3,09
2 103,000 298,1; 100,523 4,25-107 298,1; —107,01 3,22
3 98,195 293,2; 95,759 1,512-10» 293,2; —96,341 4,39
4 103,592 298,2; 101,114 5,19-107 298,2; —105,36 3,47
5 228,343 750; 222,111 3,855 1О7 750; —115,481 1,55
6 54,95 300; 52,457 1,259-1010 300; —59,826 1,87
7 187,556 500; 183,401 8,03-108 500; —86,913 2,27
8 89,621 300 К; 84,635 3,258-103 300 К; —194,04 2,88
9 172,985 600 К; 163,013 8,99-10* 600 К; —172,254 1,86
10 175,464 500 К; 167,154 1,799-10’ 500 К; —88,53 2,02
1! 133,791 400 К; 127,143 3,147-107 400; —120,263 2,61
12 191,13 500 К; 182,82 2,938-10» 500 К; -103,57 2,23
13 113,168 350 К; 107,351 9,243-10» 350; —129,32 2,71
14 42,373 280 К; 37,719 2,014-103 280 К; —197,458 1,74
15 77,541 280 К; 72,887 2,588-107 280 К; —118,925 2,84
16 98,461 503 К; 90, 101 9,27-103 503 К; -189,649 1,47
17 242,496 973 К; 226,325 2,534-102 973 К; —229,167
Глава XXV
1. 55,35. 2.103. 3. 281,9 кДж/моль. 4.Еа = 287,7 кДж. 5. 105,6 кДж.Х
X моль-1; 1 Эйнштейн = 112,5 ккал/моль. 6. Достаточно; в одном звене — 46,2;
во втором -‘186,06 кДж; на моль НС1 поглощается при фотоимпульсе 2,5 Дж/
/моль. 7. а1 = k2 (&о/2&3) С13'2. 8. w = k2(k0/k3) CjH^Clg. 11. у=0,55. 17. 24,6
кДж/моль. 18. у— 7,5; k — 6,3-lO-’c-1. 21. 254,7 кДж/моль. 22. 1041 кДж/моль.
23. 1912 кДж/моль.
Глава XXVI
1. £ср 3,86, D = 6-Ю-2 см2/ч. 2. 7,2-10—6 моль или 8,8-10—4 г. 3. V = =
9,84 л; t = 10,98 мии. 4. t — 39 мин 38 с. 5. cs — 0,1031 г/50 см3: k =
--- 6.45-10-^ мин-1; 6= 4,95-10-4 см. 6. 0,23 г. 7. йср = 5,0-10—3 мин-1; 6 =
- 19-10—в м. 8. D = 0,24 см2/с. 9. r=24; т=6,2-10-3 г. 10. D = 0,10 см2/с.
12. D — 0,545 см2/с.
Глава XXVII
1. 0,636 см3/(моль с). 2. 1,012 см3/(моль-с). 3. й1=2,32-10-4 см3/(моль-с)1
k2= 1,18- 10-3см3/(моль-с); k3= 8,65-10-3 см3/(моль-с). 4. 1:1,17:1,11. 5. 3130 с.
6. 3145; 6329; 12882 с. 7 1,60-10~5; 1,59-10—6; 1,66-10-5 моль/(л-с). 8. 1,585.
14. 1,34-Ю-4 мин-1;/гА=5-10-5 моль_1-мин—'. 19. Ga — 7,90-10— *; а=0,62.
522
20. 32 л-мо.тъ'1-с“1. 21. 2,72 раза. 22. £'а=161—0,284 ф. 23. Д/Zjj/= 163 кДж;
Д/7^о = 205 кДж; ДДре = 200,9 кДж; ДЯ^ = 129 кДж. 24.. kD = 3,1 с-1;
Дя=35,2 кДж/моль. 28. Аэфф = 0,0025 с-1; йвст = 0,0032 с-1. 29. Ех = 41,8
кДж/моль; Eif= 20,9 кДж/моль. 30. v0 In 1/(1 —у) = v0 у + 0,012. 31. 0=1;
а = 0,048.
Глава XXVI11
1. 1,779 г. 2. t = 1560 с (26 мин). 3. t = 32906 с (9 ч 8 мин 25 с). 4. 6,34 X
Х109 Дж. 5. 80%. 6. 83, 25 %. 7. 5,6 см3 О2; 31,77 мг Си; 126,9 мг 12; 11,2 см3
Н2. 8. 92,7%. 9. 92,9%. 10. 313 А-ч; 21,8 л О2.
11. i, А/см2 . . Дф, В . . . . . . 0,01 . . . 0,0092 0,015 0,0189 0,018 0,0340 0,019 0,0524 0,0193
12. i, А/см2 . . . . . 5 10 15 18 19
Дф, В . . . , . . . 0,269 0,264 0,255 0,244 0,235
13. в . . —0,535 —0,505 - -0,490 —0,485 —0,480
;/!пр . . 0,99 0,92 0,74 0,62 0,42
14. 70,2 % Си; 29,8 А. 15. 66,6 % Ni; 33,4 % Со. 16. а = 0,840 В; Ь ==
0,190 В; а = 0,305. 19. п = 1,0. 20. а/' = 6,4; А = 0,2; k = 2 л/(моль-с). 21.
Еа = 42 кДж.
ОГЛАВЛЕНИЕ
Предисловие.................................................... 3
Методические указания к решению многовариантных задач.......... 5
Международная система единиц................................... 6
Г л а в а I. Элементы квантовой химии. Теория химической связи, метод
МО ЛКАО..................................................... • 8
Задачи с решениями........................................ Ю
Задачи.................................................... 15
Многовариантная задача.....................................16
Глава II. Закономерности геометрической конфигурации атомов в мо-
лекулах. Элементы теории симметрии молекул ................ 16
Задачи с решениями.........................................19
Задачи.....................................................21
Многовариантная задача................................... 21
Г л а в a III. Вращательное движение и вращательные спектры двухатом-
ных молекул.................................................22
Задачи с решениями.........................................23
Задачи.....................................................25
Многовариантные задачи.....................................26
Глава IV. Вращательное движение и вращательные спектры много-
атомных молекул. ...........................................27
Задачи с решениями.........................................27
Задачи.....................................................32
Многовариантные задачи.....................................33
Глава V. Колебательное движение атомов в молекулах. Колебатель-
ные и. колебательно-вращательные спектры....................33
Задачи с решениями.........................................36
Задачи.....................................................39
Многовариантные задачи.....................................41
Глава VI. Первый закон термодинамики...........................42
Задачи с решениями.........................................4b
Задачи.....................................................60
Многовариантные задачи.....................................66
524
j л а в a VII. Второй закон термодинамики.......................69
Задачи с решениями........................................ 73
Задачи.................................................... 88
Многовариантные задачи......................................94
Глава VIII. Элементы статистической термодинамики...............98
Задачи с решениями.........................................108
Задачи......................................................119
Многовариантные задачи......................................122
Глава IX. Газы..................................................125
Задачи с решениями..........................................130
Задачи......................................................135
Многовариантные задачи......................................137
Глава X. Конденсированное состояние вещества...................139
Задачи с решениями..........................................143
Задачи......................................................151
Многовариантные задачи......................................153
Глава XI. Фазовое равновесие однокомпонентных систем............155
Задачи с решениями..........................................157
Задачи......................................................162
Многовариантные задачи......................................166
Глава XII. Термодинамические характеристики растворов и процес-
сов их образования..........................................172
Задачи с решениями.........................................176
Задачи.....................................................185
Многовариантные задачи.....................................190
Глава XIII. Разбавленные растворы..............................193
Задачи с решениями.........................................196
Задачи.....................................................202
Многовариантные задачи.....................................206
Глава XIV. Гетерогенное равновесие в бинарных системах, содержа-
щих жидкую и паровую фазы...................................207
Задачи с решениями.........................................210
Задачи.....................................................221
Многовариантные задачи.................................... 224
Глава XV. Гетерогенное равновесие в бинарных системах, содержа-
щих жидкую и твердую фазы...................................234
Задачи с решениями.........................................235
Задачи.................................................... 244
Многовариантная задача.....................................247
Глава XVI. Гетерогенное равновесие в трехкомпонентных системах,
содержащих жидкую и твердую фазы............................252
525
Задачи с решениями..........................................253
Задачи......................................................256
Многовариантная задача......................................257
Глава XVII. Химическое равновесие...............................258
Задачи с решениями..........................................262
Задачи......................................................277
Многовариантные задачи......................................283
Глава XVIII. Электрическая проводимость. Равновесие в растворах
электролитов ............................................. 291
Задачи с решениями..........................................295
Задачи......................................................304
Многовариантные задачи......................................309
Глава XIX. Электродвижущие силы. Электродные потенциалы . . . 312
Задачи с решениями..........................................316
Задачи......................................................328
Многовариантные задачи......................................334
Глава XX. Адсорбция.............................................337
Задачи с решениями..........................................339
Задачи......................................................341
Многовариантная задача......................................344
Комплексные задачи..........................................345
Глава XXI. Формальная кинетика..................................346
Задачи с решениями..........................................350
Задачи......................................................360
Многовариантная задача......................................366
Глава XXII. Сложные реакции.....................................369
Задачи с решениями..........................................371
Задачи.................................................... 381
Многовариантная задача......................................387
Глава XXIII. Зависимость скорости реакции от температуры . . . . 388
Задачи с решениями..........................................389
Задачи......................................................391
Многовариантные задачи......................................394
Глава XXIV. Теоретические основы расчета константы скорости ре-
акции .....................................................396
Задачи с решениями..........................................398
Задачи..............„.......................................406
Многовариантные задачи......................................411
Глава XXVu Кинетика фотохимических и цепных реакций.............416
Задачи с решениями..........................................419
Задачи......................................................424
Многовариантная задача......................................430
526
Глава XXVI. Диффузия. Кинетика гетерогенных процессов .... 432
Задачи с решениями..........................................435
Задачи......................................................441
Многовариантная задача......................................444
Глава XXVII. Кинетика реакций в растворах. Гомогенный и гетеро-
генный катализ...............................................445
Задачи с решениями..........................................449
Задачи ................................................ ..... 452
Многовариантная задача......................................460
Глава XXVIII. Кинетика электрохимических реакций................461
Задачи с решениями........................................ 462
Задачи......................................................468
Многовариантные задачи......................................471
Комплексные задачи..........................................472
Приложение......................................................473
Ответы на задачи .............................................. 507
Учебное издание
Кудряшов Игорь Владимирович
Каретников Герман Сергеевич
Сборник примеров и задач
по физической химии
Зав. редакцией С. Ф. Кондрашкова. Редактор Т. С. Костян. Мл. редакторы Л. С. Макар-
кина, В. Н. Бораненкова, Е. Н. Xopoiueea. Художник Л. И. Шавард. Художественный ре-
дактор Т. А. Коненкова. Технический редактор Т. Д. Гарина. Корректор Р. К. Косинова
ИБ № 8195
Изд. № Хим-872. Сдано в набор 09.01.91. Подп. в печать 18.09.91. Формат 60X88'/i6 Бум.
газетная. Гарнитура литературная. Печать офсетная. Объем 32,34 усл. печ. л. -J-0.t2 усл.
печ. л. форз. 32,46 усл. кр.-отт. 31,49 уч.-изд. л. +0,14 уч.-изд. л. ’форз. Тираж 25 000 экз.
Зак. № 767. Цена 2 р. 20 к.
Издательство «Высшая школа», 101430, Москва, ГСП-4, Неглинная ул., д. 29/14.
Московская типография № 4 Государственной ассоциации предприятий, организаций н объ
единений полиграфической промышленности «АСПОЛ».
129041, Москва, Б. Переяславская ул., 46