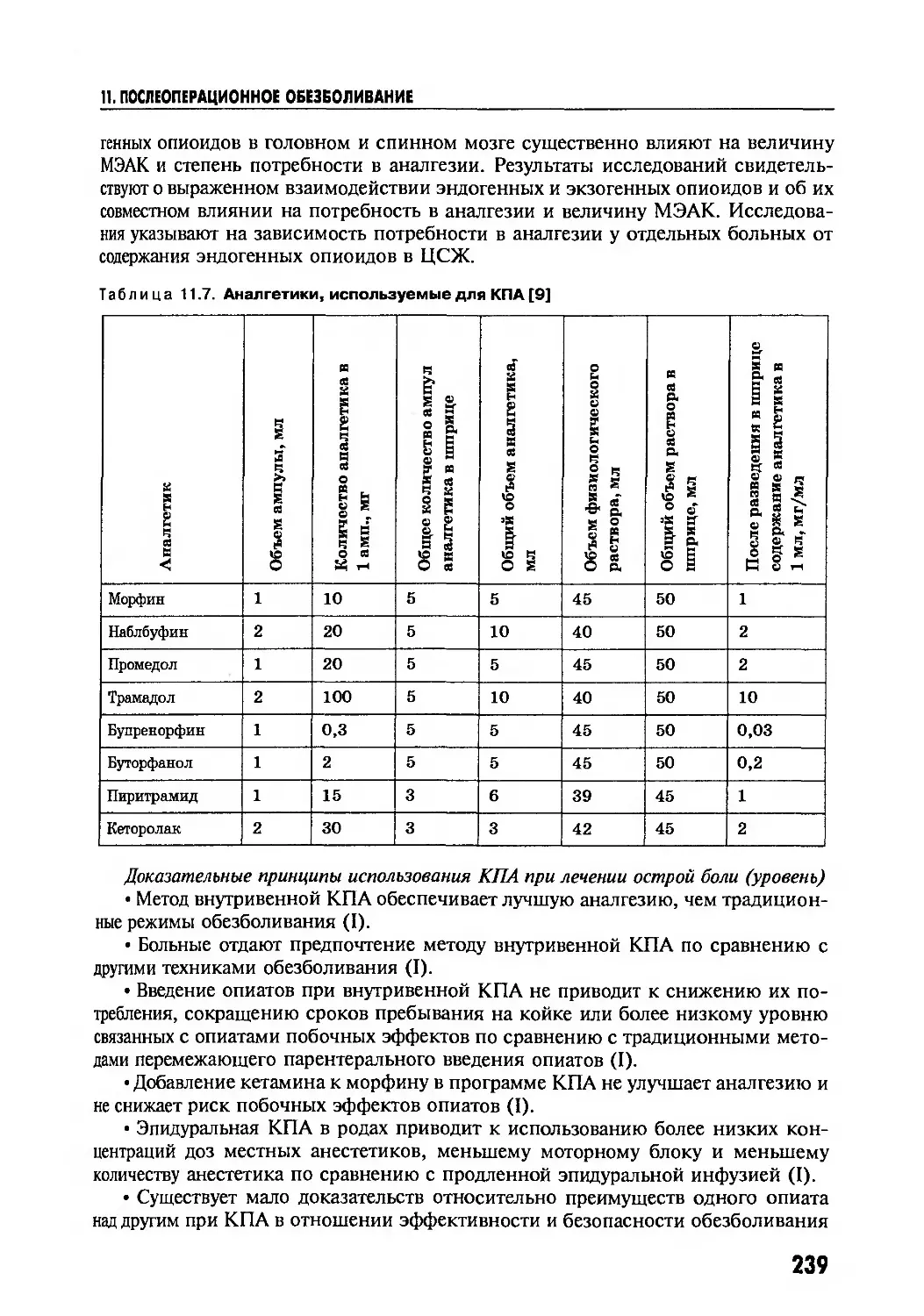
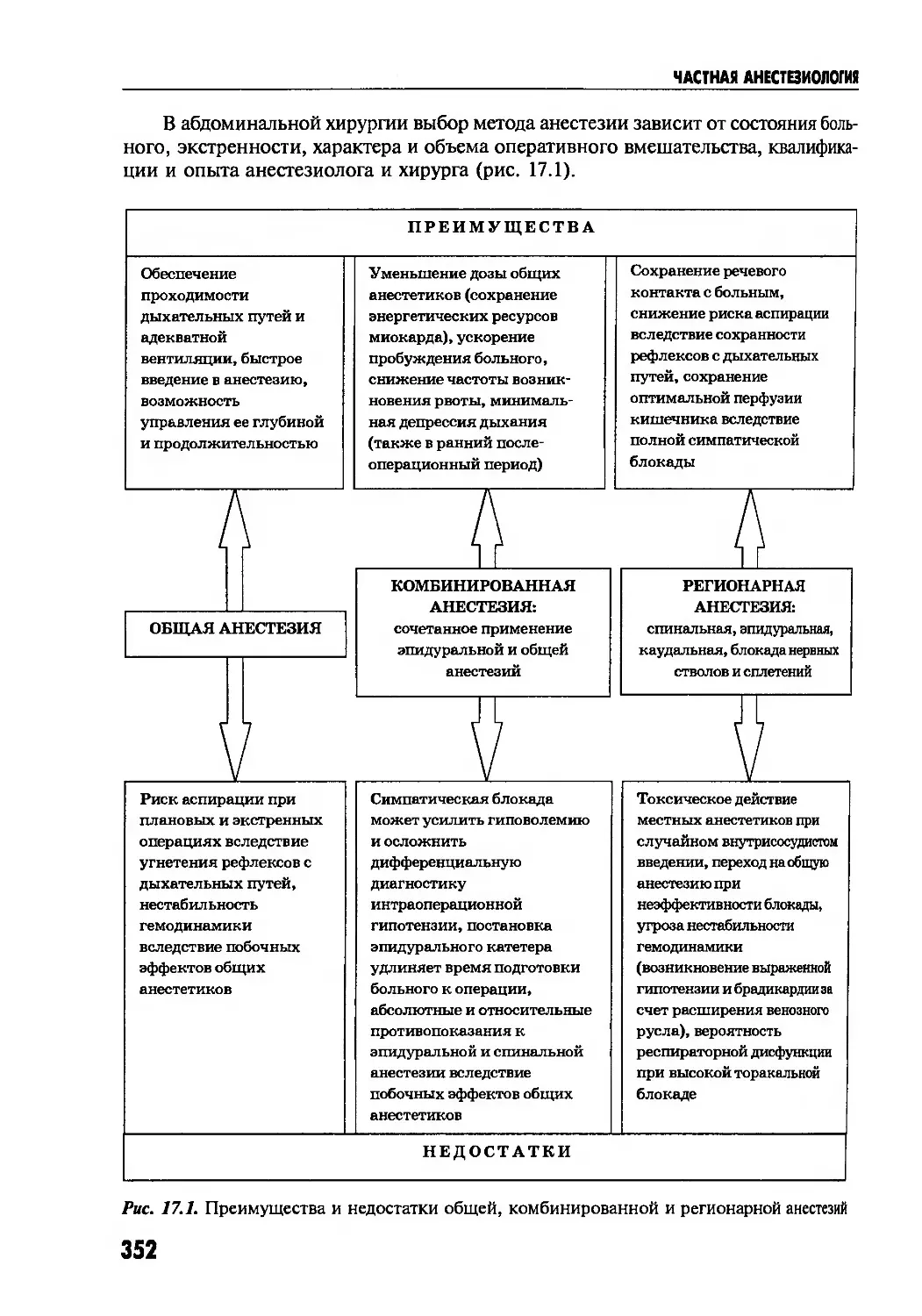
Author: Глумчер Ф.С. Трещинский А.И.
Tags: нервная система невропатология неврология хирургия медицина руководство для врачей анестезия издательство медицина руководство по анестезиологии
ISBN: 978-966-8144-86-8
Year: 2008
РУКОВОДСТВО
ЛИИ
Под редакцией профессора Ф.С. Глумчера,
профессора А.И. Трещинского
Данный файл представлен исключительно
в ознакомительных целях.
Все авторские права на данный файл
сохраняются за правообладателем.
Любое коммерческое и иное использование
кроме предварительного ознакомления запрещено.
Публикация данного документа не преследует
никакой коммерческой выгоды. Но такие документы
способствуют быстрейшему профессиональному и
духовному росту читателей и являются рекламой
бумажных изданий таких документов.
Все авторские права сохраняются за правообладателем.
РУКОВОДСТВО
ei
Под редакцией профессора Ф.С. Глумчера,
профессора А.И. Трещинского
Рекомендовано
Министерством здравоохранения Украины
как учебное пособие для студентов, врачей-интернов
высших медицинских учебных заведений Ш — IV уровней
аккредитации, а также врачей-анестезиологов, курсантов
высших медицинских учебных заведений (факультетов)
последипломного образования
Кшв
“Медицина”
2008
ББК 54.5я73
Р85
УДК 616.8-009.614
Авторы:
Ф.С. Глумчер, А.И. Трещинский, М.М. Багиров, М.В. Бондарь, А.Ф. Бубало,
В.П. Вьюницкий, С.Н. Гриценко, А. М. Дубов, В.Л. Иванюшко, Т.П. Кабанько,
Е.Н. Клигуненко, Ю.Ю. Кобеляцкий, А.Н. Колесников, А.П. Мазур, Л.А. Маль-
цева, В.Ф. Москаленко, П.И. Никульников, Н.Н. Смирнова, В. В. Суслов,
О.А. Тарабрин, Р.А. Ткаченко, Л.В. Усенко, А.В. Царев, В.И. Черний
Рецензенты:
И.И. Титов, д-р мед. наук, проф., зав. кафедрой анестезиологии Ивано-
Франковского государственного медицинского университета;
А.А. Хижняк, д-р мед. наук, проф., зав. кафедрой неотложных состояний и
анестезиологии Харьковского государственного медицинского университета
Руководство по анестезиологии: Учеб, пособие / М.М. Багиров,
Р85 М.В. Бондарь, А.Ф. Бубало, С.Н. Гриценко и др.; Под ред. Ф.С. Глум-
чера, А.И. Трещинского — К.: Медицина, 2008. — 608 с. + кол. вкл. 12 с.
ISBN 978-966-8144-86-8
В работе над учебным пособием приняли участие ведущие украинские специа-
листы по анестезиологии. В издании отражены современные мировые тенденции
анестезиологического обеспечения, основанные на принципах доказательной меди-
цины. В учебном пособии лаконично представлена история развития анестезиоло-
гии, большое внимание уделено предоперационному осмотру, оценке анестезиоло-
гического риска, премедикации, фармакологии анестетиков, интубационному нар-
козу, регионарной анестезии, проблемам профилактики осложнений и ведению
послеоперационного периода. Дана характеристика технического оснащения, необ-
ходимого для проведения анестезии и контроля состояния больного во время опера-
ции. Раздел “Частная анестезиология” посвящен анестезиологическому обеспече-
нию при различных видах операций — нейрохирургических, торакальных, абдоминаль-
ных, операциях на сердце, при пересадке органов и др.; сделан акцент на выборе
анестезии в зависимости от сопутствующих заболеваний, а также с учетом тяжести
состояния и возраста больного.
Издание проиллюстрировано таблицами, схемами, рисунками.
Для студентов и врачей-интернов высших медицинских учебных заведений
III — IV уровней аккредитации, а также врачей-анестезиологов, курсантов высших
медицинских учебных заведений (факультетов) последипломного образования.
ББК 54.5я73
УДК 616.8-009.614
© Ф.С. Глумчер, A.I. Трещинський, М.М. Бапров,
М.В. Бондар, О.Ф. Бубало, В.П. В’юницький,
С.М. Гриценко, О.М. Дубов, В.Л. 1ванюшко,
Т.П. Кабанько, О.М. Юпгуненко, Ю.Ю. Кобеляць-
кий, А.М. Колесников, А.П. Мазур, Л.О. Мальцева,
В.Ф. Москаленко, П.1. Нжульников, Н.М. Смир-
нова, В. В. Суслов, О.О. Тарабрш, P.O. Ткаченко,
Л.В. Усенко, О.В. Царьов, B.I. Чершй, 2008
ISBN 978-966-8144-86-8 © Видавництво «Медицина», 2008
ПРЕДИСЛОВИЕ
Анестезиология стала одним из самых высокоразвитых и высокотех-
нологических разделов медицины. Термин “анестезиология” произошел от греческих:
ап — отсутствие + aistesis — чувствительность + logos — слово, наука). Таким образом,
анестезиология — это наука, которая изучает методы обезболивания, выключения чув-
ствительности. Однако постепенно анестезиология стала включать в себя и методы под-
держания функции жизненно важных органов — сначала во время операции, а затем и
в течение всего послеоперационного периода, — методы защиты организма от операци-
онного стресса. Эти методы в настоящее время включают как общую анестезию, когда
гипнотический эффект выражен во время операции, так и различные методы нейро-
аксиальной анестезии, которая эффективно обеспечивает аналгезию, но при этом боль-
ной “присутствует” на собственной операции. Каждая из этих методик имеет свои пре-
имущества и недостатки. Одним из главных компонентов общей анестезии стала мышеч-
ная релаксация с протезированием функции вентиляции легких, что обеспечивает хирургу
лучшие условия для операции и большую степень безопасности при полостных операциях.
Все последние достижения хирургии и многих других разделов медицины стали
возможны благодаря прогрессу анестезиологической науки. В настоящее время невоз-
можно представить выполнение практически всех крупных операций во всех разделах
хирургии, акушерстве и гинекологии, травматологии и ортопедии без анестезиологи-
ческого обеспечения. Родившись в недрах хирургии, анестезиология быстро стала са-
мостоятельной наукой и заняла вместе с интенсивной терапией одно из ведущих мест
в медицине. Анестезиолог во время периоперационного периода должен контролиро-
вать большинство жизненно важных функций организма, поэтому его знания должны
охватывать все основные разделы медицины — хирургию, акушерство, кардиологию,
Пульмонологию, эндокринологию и др. Врач-анестезиолог становится одним из наи-
более эрудированных специалистов в медицине. Но кроме того, что анестезиолог дол-
жен много знать, он еще должен многое уметь. Такие манипуляции, как интубация
трахеи, катетеризация центральных и периферических вен, применение различных ме-
тодов регионарной анестезии могут сопровождаться тяжелыми осложнениями, иногда
угрожающими жизни больного. Врач-анестезиолог должен в совершенстве владеть этими
навыками, уметь предупреждать возможные осложнения, своевременно диагностиро-
вать и устранять их. К врачу-анестезиологу предъявляются также значительные харак-
терологические требования, так как жизнеобеспечение во время операции больного,
ПРЕДИСЛОВИЕ
находящегося между жизнью и смертью, а также огромное напряжение, которое испы-
тывает анестезиолог, работая с наиболее тяжелыми больными в отделении интенсив-
ной терапии, делают эту специальность одной из наиболее стресс-индуцирующих. Не
зря для анестезиологов, которые длительно проработали по специальности, предложен
термин “профессиональное выгорание”. Особенно быстро это “выгорание” происхо-
дит в условиях отсутствия или недостатка необходимого оборудования и лекарствен-
ных средств.
Несмотря на недостаточную техническую оснащенность, дефицит многих анесте-
тиков и лекарственных средств, которые применяются во время анестезии, около 7000
анестезиологов и 10 000 среднего медицинского персонала отделений анестезиологии
и интенсивной терапии Украины с честью выполняют свои обязанности. За год в
нашей стране проводится более полутора миллиона анестезий со средней интраопера-
ционной летальностью, не превышающей 0,03%, что соответствует средним общеми-
ровым показателям, в отделениях интенсивной терапии в течение года лечится до по-
лумиллиона очень тяжелых больных. Анестезиологи Украины в своей практике при-
меняют все важнейшие современные методы общей и регионарной анестезии и
обеспечивают выполнение всех оперативных вмешательств, требующих анестезиоло-
гического обеспечения. Кроме этого, анестезиологи консультируют больных в других
отделениях, их вызывают для проведения мероприятий по сердечно-легочной реани-
мации, анестезиологи играют главную роль в проведении экстракорпоральной деток-
сикации организма, и роль их в здравоохранении все время растет.
В 2004 году в “Руководстве по интенсивной терапии” украинские ученые-анесте-
зиологи изложили современные методы интенсивной терапии критических состоя-
ний, а также способы их предупреждения. Работа над “Руководством по анестезиоло-
гии” стала логическим продолжением обобщения опыта практической деятельности в
области анестезиологии отечественных и зарубежных специалистов. Это первое изда-
ние подобного рода в Украине, в работе над которым приняли участие ведущие укра-
инские специалисты-анестезиологи. Авторы в первую очередь ставили перед собой
цель расширить практические клинические возможности врачей-анестезиологов, от-
разить современные мировые тенденции анестезиологического обеспечения, основан-
ные на принципах доказательной медицины.
В “Руководстве по анестезиологии” систематизированы необходимые знания для
врачебной анестезиологической практики. Издание проиллюстрировано таблицами,
схемами, рисунками.
В разделе “Общая анестезиология” лаконично представлена история развития анесте-
зиологии, уделено достаточно внимания предоперационному осмотру, оценке анестезиоло-
гического риска, премедикации, фармакологии анестетиков, интубационному наркозу, ре-
гиональной анестезии, проблемам профилактики осложнений и ведению послеоперацион-
ного периода; дана характеристика технического оснащения, необходимого для проведения
анестезии и контроля состояния больного во время операции.
Раздел “Частная анестезиология” посвящен вопросам особенностей анестезиоло-
гического обеспечения при различных видах операций — нейрохирургических, тора-
кальных, операциях на сердце, абдоминальных, при пересадке органов и др.; сделан
акцент на выборе анестезии в зависимости от сопутствующих заболеваний больного, с
учетом его возраста и тяжести состояния.
По разным причинам в руководстве отсутствуют главы об анестезиологическом
обеспечении в нейрохирургии, в эндокринологии, в амбулаторной практике. Надеемся
устранить этот недостаток в последующих изданиях.
Материалы руководства большей частью основаны на современных данных, прин-
ципах доказательной медицины, в них вошли все новейшие достижения в анестезио-
4
ПРЕДИСЛОВИЕ
логической науке за последние десятилетия, самые современные подходы к анестези-
ологическому обеспечению и периоперационному ведению больных.
“Руководство по анестезиологии” предназначено прежде всего для врачей-анестези-
ологов, однако оно может заинтересовать также врачей смежных специальностей — хи-
рургов, акушеров-гинекологов и др. Авторы надеются, что предлагаемая книга, рекомен-
дованная М3 Украины в качестве учебного пособия для врачей-анестезиологов, будет
часто использоваться в практической деятельности врача-анестезиолога и служить осно-
ванием для выбора стратегии и тактики анестезиологического обеспечения.
Профессор Ф.С. Глумчер,
профессор А. И. Трещинский
5
ОБЩАЯ
АНЕСТЕЗИОЛОГИЯ
• Триумф над болью: очерк по истории анестезиологии
• Теории и механизмы действия общих анестетиков
• Предоперационный период
• Премедикация
• Неингаляционные методы общей анестезии.
Внутривенная общая анестезия
• Клиническая фармакология мышечных релаксантов
• Клиническая фармакология ингаляционных анестетиков
• Интубационный наркоз
• Обеспечение общей анестезии во время операции
• Ранний послеоперационный период
• Послеоперационное обезболивание
• Клиническая фармакология местных анестетиков
• Регионарная анестезия
• Лекарственная интеракция
и полипрагмазия в анестезиологии
1. ТРИУМФ НАД БОЛЬЮ:
ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Благодеяние наркоза не поддается никакому реальному измере-
нию или исчислению. Каждый культурный человек не может не
почувствовать душевной полноты от сознания этой блистатель-
ной победы над физической болью и благодарных чувств по адре-
су тех, кто своими трудами и мыслью дал человечеству этот
бесценный клад, это ни с чем не сравнимое сокровище.
С.С. ЮДИН, 1946 г.
“Ничто так не ослабляет жизненные силы и дух человека, как
боль”, — писал Амбруаз Паре (1510— 1590), французский хирург.
История человеческой цивилизации хранит множество докумен-
тов, свидетельствующих о постоянном поиске эффективных мето-
дов борьбы с болью. Первые сведения об обезболивании при раз-
резах и выжиганиях обнаружены в знаменитой медицинской рукопи-
си, найденной в 1874 году и датированной XV веком до н. э., —
папирусе Эберса (документ назван в честь египтолога Эберса Геор-
га Морица). Согласно папирусу, во времена египетских фараонов с
целью обезболивания использовали дурман, белладонну, мак, ман-
драгору. Из Египта сведения о применении этих растений попали
в Грецию (герои поэм Гомера “Илиада” и “Одиссея” употребляли
обезболивающие и снотворные снадобья), а затем распространи-
лись в Римской империи. Китайцы одни из первых открыли одур-
манивающие свойства конопли и использовали ее для лечения боль-
ных. На территории Малой Азии и Ближнего Востока в библейс-
кие времена в качестве снотворного средства употребляли алкоголь.
За столетия до открытия наркоза люди использовали и пере-
давали из поколения в поколение рецепты средств, вызывавших
глубокий, практически наркотический сон. Не таким ли таин-
ственным зельем была усыплена Джульетта? Не о глубоком ли
наркозе говорит отец Лоренцо?
Когда ты выпьешь весь раствор до дна,
Тебя скует внезапный холод. В жилах
Должна остановиться будет кровь.
Ты обомрешь. В тебе не выдаст жизни
Ничто: ни слабый вздох, ни след тепла.
Со щек сойдет румянец. Точно ставни,
Сомкнутся на ночь наглухо глаза.
Конечности, лишившись управленья,
Закоченеют, как у мертвецов.
В таком, на смерть похожем, состоянье
1
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Останешься ты сорок два часа,
И после них очнешься освеженной.
В. Шекспир, “Ромео и Джульетта”, акт IV, сцена I
Японский врач Сейшу Ханаока (1760— 1835) в 1805 году использовал энте-
ральный наркоз тсусенсаном, который представлял собой авторскую смесь алка-
лоидов различных трав — гиосциамина, атропина, сапонина, аконитина и др.
Ханаока выполнял под наркозом операции на конечностях, брюшной полости,
черепе и молочной железе длительностью до 4 часов. К сожалению, рецепт тсу-
сенсана остался тайной.
Кроме лекарственных средств с целью обезболивания применяли сдавлива-
ние сонных артерий и нервных стволов, а также воздействие холодом. В качестве
метода хирургического обезболивания в Европе во второй половине XVIII века и
позже, на протяжении столетия, был широко распространен месмеризм — пред-
шественник современного гипноза. Основоположником месмеризма был австрий-
ский врач Франц Антон Месмер (1734— 1815).
Разнообразные методы обезболивания, найденные в результате хаотического
поиска, были не столь эффективны, как большей частью небезопасны из-за непред-
сказуемости эффекта применяемых средств, поэтому риск хирургического вмеша-
тельства стремились снизить за счет увеличения скорости выполнения операций.
Точкой отсчета начала победного шествия эпохи обезболивания стали откры-
тия в области химии. По всей видимости, первым удалось получить эфир в каче-
стве побочного продукта во время алхимических исследований в 1275 году испан-
скому монаху, миссионеру, поэту и философу Раймонду Луллиусу (1235— 1315). В
средние века эфир называли сладким купоросным маслом (Oleum vitriole dulce).
Это название вместе с фармакологическим описанием эфира впервые сделал не-
мецкий ботаник и аптекарь Валериус Кордус (1515— 1544) в 1540 году. В это же
время эксперименты по изучению фармакологических свойств эфира проводил
Парацельс (1493— 1541) и рекомендовал применять эфир в качестве успокоитель-
ного, снотворного и противосудорожного средства. В сравнении с препаратами
опия и мандрагоры главным преимуществом эфира Парацельс считал быстрое
восстановление сознания. В 1680 году эфир повторно синтезировал Роберт Бойль
(1627— 1691), знаменитый физик, химик, теолог и один из основателей Лондонс-
кого Королевского общества (1662). После Роберта Бойля эфир удалось получить
Исааку Ньютону (1642— 1727). В начале XVIII века немецкий врач Фридрих Гоф-
ман (1660— 1742) предложил смесь эфира со спиртом в качестве успокаивающих
капель, названных его именем; их применяли более ста лет. В 1730 году Фробени-
ус продолжил исследования, и именно он ввел в практику термин “эфир”. Чистый
эфир получил в 1796 году Товий Ловиц (1757— 1804), химик и фармацевт, акаде-
мик Петербуржской Академии Наук (1793). Наркотизирующее действие эфира
открыл в 1818 году английский физик Майкл Фарадей (1791— 1867).
В 1772 году английский ученый Джозеф Пристли (1733— 1804), богослов,
философ и химик, синтезировал закись азота.
Гэмфри Дэви (1778— 1829) — президент Лондонского Королевского обще-
ства, кавалер ордена Почетного легиона, получивший награду от самого Наполе-
она, известный физик и химик, один из основателей электрохимии (рис. 1.1),
первые химические эксперименты проводил, будучи учеником аптекаря. В по-
следствии, став ассистентом местного хирурга, Дэви использовал технологию по-
лучения закиси азота, разработанную Пристли. Действие закиси азота Дэви испы-
8
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Рис. 1.1. Гэмфри Дэви
тывал на себе: вдыхание газа производило чарующее
впечатление, вызывало опьяняющий эффект и весе-
лое настроение. Увлекательные опыты поставили под
удар врачебную практику шефа Дэви, поскольку па-
циенты, встретившись в приемной с возбужденным
и невменяемым, по их мнению, помощником врача,
уезжали недовольные. Дэви перенес исследования в
другое место и даже прекратил их на непродолжи-
тельное время из-за взрыва во время одного из экс-
периментов. Благодаря прозорливому участию док-
тора Гидди, будущего президента Королевского об-
щества, талантливому Дэви предоставили место
работы в Пневматическом институте в Бристоле. Это
позволило продолжить исследования закиси азота,
которую Дэви назвал веселящим газом. В возрасте
двадцати одного года (1800) он публикует книгу “Ис-
следования химические и философские, касающие-
ся главным образом закиси азота, или дефлогисти-
рованного воздуха, и его вдыхания”, где впервые описывает обезболивающий эф-
фект газа. В 1799 году Дэви удалось наладить производство химически чистой
закиси азота и начать эксперименты с ингаляциями больших доз газа. Сохрани-
лись записи Дэви об ощущениях от вдыхания закиси азота:
Почти немедленно началось дрожание, идущее от груди к конечностям. Я испы-
тывал ощущение осязательного напряжения, в высшей степени приятного в каждом
члене. Мои зрительные впечатления были ослепительны и казались великолепными. Я
отчетливо слышал звук в комнате и был прекрасно ориентирован в происходившем.
Постепенно, по мере того как приятные ощущения нарастали, я потерял связь с
внешним миром. Потоки зрительных образов быстро пробегали в моем сознании и так
сочетались со словами, что производили совершенно новые образы. Я пребывал в мире
идей, заново измененных и причудливо сочетавшихся. Я строил теории и делал откры-
тия. Когда я был разбужен из этого полубредового транса доктором Кинглэком, ко-
торый отнял мешок от моего рта, то негодование и гордость были первыми чувства-
ми от присутствия около меня другого человека. Мои эмоции были возвышены, и я
испытывал энтузиазм. Я ходил по комнате около минуты, совершенно не считаясь с
тем, что говорили вокруг меня. Когда я вернулся к прежнему состоянию рассудка, я
испытывал потребность сообщить об открытии, которое я сделал во время экспери-
мента. Я старался вернуть свои видения, но они были слабы и неотчетливы. Однако
сумма данных представлялась сама собой, и я заявил о ней доктору Кинглэку с самой
полной уверенностью и пророческим образом: в мире нет ничего, кроме понятий; все-
ленная состоит из впечатлений, идей, удовольствий и страданий...
По книге С.С. Юдина “Избранные произведения.
Вопросы обезболивания в хирургии”
Результаты опытов над собой и многочисленными пациентами позволили Дэви
сделать крупнейшее открытие, которое автор сформулировал в книге Medical Vapours:
...так как закись при интенсивном действии способна уничтожать физическую
боль, она может быть с успехом использована при хирургических операциях, в кото-
рых не имеет места большая потеря крови.
По книге С.С. Юдина “Избранные произведения.
Вопросы обезболивания в хирургии”
9
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Идею Дэви попытался воплотить в практику
английский хирург Генри Хилл Хикмен (1800— 1839),
идеолог будущей анестезиологии (рис. 1.2). После
многочисленных экспериментов с закисью азота на
животных, он активно пропагандировал идею анес-
тезии в течение целого ряда лет. Хикмен обратился
в Королевское хирургическое общество в Лондоне,
действительным членом которого состоял, но его
предложение об операциях в состоянии “полуасфик-
сии” было принято с большим скептицизмом. Тогда
он отправил письмо президенту Лондонского Коро-
левского общества сэру Гемфри Дэви с изложением
своих основных идей и просьбой о содействии в
получении разрешения на дальнейшие эксперимен-
ты. Письмо должно было сыграть решающую роль,
ведь именно Гемфри Дэви первым описал аналгети-
Рис. 1.2. Генри Хилл Хикмен ческое действие закиси азота. Хикмен написал на
титульном листе только должность Дэви, а один из
вице-президентов общества не смог должным образом оценить значение обраще-
ния, и письмо не попало в руки адресата. Хикмен был разочарован отсутствием
ответа. Более того, его самолюбие было ущемлено критической статьей, опубли-
кованной в 1826 году в “Ланцете” и размещенной под заголовком “Хирургичес-
кий вздор”.
Не получив поддержки среди английских хирургов, Хикмен решил попытать
счастье в Париже, который в то время был общепризнанным центром научной
медицинской мысли. Он обратился к королю Франции Карлу X со стремлением
доказать, что речь идет о важнейшем открытии для человечества. Хикмен просил
разрешения испытать свой наркоз на человеке. В августе 1828 года в Парижской
медицинской академии был создан комитет из пяти человек для обсуждения про-
блемы Хикмена. Парижские хирурги проявили любознательность не более лон-
донских и отвергли предложение Хикмена, как иллюзорное. Генри Хилл Хикмен
скончался 5 апреля 1830 года в возрасте двадцати девяти лет от туберкулеза, пре-
бывая в состоянии полного разочарования и подавленности.
В Великобритании и США в первой половине XIX-го века общественные
демонстрации действия закиси азота не были редкостью. 10 декабря 1844 года в
небольшом американском городке Хартфорде (штат Коннектикут) 27-летний дан-
тист Хорас Уэллс (1815— 1848) пришел на публичную демонстрацию действия
“веселящего газа” приезжего доктора-химика Кольтона. Уэллс наблюдал, как его
знакомый во время сеанса вдыхания газа получил значительную травму голени,
но не ощутил боли. Уэллс увлекся идеей обезболивания закисью азота при экст-
ракции зубов.
...11 декабря 1844 года коллега-дантист удалил здоровый зуб Хорасу, который
находился под действием паров закиси азота. Очнувшись после наркоза, Уэллс вос-
кликнул: “Наступила новая эра в экстракции зубов!” Приступив к широкому при-
менению закиси азота, Хорас получал обезболивающий эффект только в половине
случаев. Не вникая в причины проблемы, в 1845 году он настоял на публичной
демонстрации экстракции зуба в Массачусетском общем госпитале, которая закон-
чилась провалом (рис. 1.3). Присутствующие кричали: "Обман, мошенничество!”
Позже, отойдя от дел, Хорас получил известие о том, что его бывший партнер
10
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Рис. 1.3. Массачусетский
общий госпиталь, гравюра
(XIX век)
Уильям Томас Грин Мортон с успехом продемонстрировал наркоз эфиром в том же
госпитале, где Хорас потерпел неудачу. Хорас настойчиво боролся за приоритет
открытия, но эта борьба пошатнула его психическое здоровье. Однажды, он плес-
нул раствор кислоты в лицо проходившей по улице незнакомой женщине. В тюрем-
ной камере Хорас покончил с собой.
Уильям Томас Грин Мортон (1814—1868) апробировал самые разнообразные
средства для достижения аналгетического эффекта — алкоголь, большие дозы опия,
месмеризм (рис. 1.4). Начав эксперименты с эфиром на домашней собаке, вскоре
он провел эксперимент на себе, вдыхая смоченный эфиром платок. Впервые Мортон
применил эфир для обезболивания при экстракции зуба у больного Фроста
30 сентября 1846 года. После этого Мортон сделал запись:
К вечеру мужчина, живущий в Бостоне, пришел, испытывая большие боли и же-
лая удалить зуб. Он боялся операции и просил его месмеризироватъ. Я сказал ему, что
имею кое-что получше, и, смочив носовой платок эфи-
ром, дал ему для ингаляции. Он сделался бессознатель-
ным почти немедленно. Было темно, а доктор Хейден
держал лампу, пока я вырвал крепко сидевший малый
коренной зуб. Больших изменений пульса и релаксации
мускулов не было. Он очнулся через минуту и не знал
ничего, что было ему сделано. Он остался на некото-
рое время, разговаривая по поводу эксперимента.
По книге С.С. Юдина “Избранные произведения.
Вопросы обезболивания в хирургии”
16 октября 1846 года состоялась публичная де-
монстрация эфирного наркоза: 20-летнему Джиль-
берту Эбботту хирург Джон Коллинз Уоррен (1778—
1856) удалил врожденную подчелюстную сосудистую
опухоль (рис. 1.5). Чтобы увеличить шансы на ус-
пех, Мортон усовершенствовал ингалятор — тот при-
Рис. 1.4. Уильям Томас Грин
Мортон
11
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 1.5. “Первая демонстрация анестезии эфиром”, художник Роберт Хинкли (1846)
обрел форму стеклянного шара с двумя отверстиями: в одно из них наливали
эфир, а второе соединяли с мундштуком, который вставляли в рот пациента
(рис. 1.6).
Мортон налил в стеклянный шар эфир и приложил ко рту больного “маску”,
которая закрыла рот. Большим и указательным пальцем он сдавил ноздри больного,
который через 4— 5 минут заснул. Уоррен начал оперировать. В аудитории установи-
лась мертвая тишина. Глубокое внимание в ожидании результатов обезболивания
овладело всеми присутствующими. Обезболивание оказалось эффективным, и опера-
ция была произведена при полной тишине. На окружающих, привыкших к душеразди-
рающим крикам во время операции, это произвело ошеломляющее впечатление.
По книге И.С. Жорова “Общее обезболивание”
После операции Уоррен заявил: “Джентльмены, это не обман!” Несмотря на
последующие судебные тяжбы, именно 16 октября 1846 года во всем мире считают
днем открытия эфирного наркоза и профессиональным праздником анестезиоло-
гов. Известный хирург Генри Бигелоу на могиле Мортона в Бостоне установил
Рис. 1.6. Ингалятор для эфира
Мортона (1846)
эпитафию: “Уильям Т.Г. Мортон, изобретатель и
создатель анестезирующих ингаляций, кем боль
в хирургии была предупреждена и уничтожена,
до которого во все времена хирургия была ужа-
сом, после которого — наука получила управле-
ние над болью”.
Известие об открытии эфирного наркоза стре-
мительно облетело весь мир. В Англии одним из
первых применил эфирный наркоз Джон Сноу
(1813—1858), первый профессиональный анесте-
зиолог. В 1847 году он описал пять стадий нарко-
за и разработал показания и противопоказания к
его применению.
12
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Иноземцев Ф.И. (1802— 1869) 7 февраля 1847
года провел первый эфирный наркоз в Российской
империи в Москве, итальянский хирург Т.Л. Ван-
цетти (1809— 1888) в Харькове — второй. Большой
вклад в распространение идей хирургического обез-
боливания привнес Н.И. Пирогов (1810—1881); 14
февраля 1847 года он провел четвертую операцию в
России под эфирным наркозом, которая была опи-
сана в газете “Друг здравия”:
Четырнадцатого сего февраля во Втором военно-
сухопутном госпитале произведена без боли операция
отнятия правой женской груди при помощи вдыхания
воздуха, насыщенного парами серного эфира. Опера-
цию совершил великий знаток своего дела профессор
Пирогов.
По книге И.С. Жорова “Развитие хирургического
обезболивания в России и СССР”
Рис. 1.7. Николай Иванович
Пирогов
Н.И. Пирогов (рис. 1.7) экспериментально разработал методы наркоза и обоб-
щил результаты в одной из первых в мире монографий по анестезиологии “Практи-
ка и физиология этеризации” (1847), изданной на французском языке (рис. 1.8). Он
RECHERC1IES
PRATIQUES ЕТ PHYSIOLOG1QUES
l’£th£risatk)N
N. PIROCGFF
«а Mcdtrlnr; Arnd/mlrlia; РгаГсмсчг I FAeaddmM N«d>c«>
СМшг|1с«1г da ft.-pdtrrtbrurf: Oirurgira ea «и rr<<>n4 M4p>Ui
•uHMlf»: d«> Vntui Chirur^lrn <«ntun«»r aui
htydtatM 4 Oboukbnw. da St. M«r>«~Ma<h)rlBt «I do ft. Pirrrr at At
Paul! Caatrilltr 4'Et«l , Membra du Cantril Mrdirtl «« Membra СаГГГ»-
fandaal dr 'Arad*ml«
ST. РЙШВОШ.
iMratMzili nufaiu. Taoitikv ftMoi'LC*. T.
1847.
Рис. 1.8. Обложка монографии
Н.И. Пирогова “Практика и физиология
этеризации” (1847)
первым использовал наркоз в военно-поле-
вых условиях и является родоначальником
ректального, эндотрахеального и внутривен-
ного видов наркоза. С февраля 1847 года по
февраль 1848 года в России было проведено
690 оперативных вмешательств с примене-
нием эфирного наркоза.
20 сентября 1847 года шотландский
хирург и акушер Джеймс Янг Симпсон
(1811—1870) впервые провел успешный нар-
коз хлороформом роженице при выполне-
нии поворота плода на ножку. Немногим
позже Сноу применил хлороформ короле-
ве Англии Виктории во время родов восьмо-
го ребенка. По мере введения в практику
хлороформного наркоза начали появляться
сведения о его токсическом влиянии на
миокард и печень: первая описанная нар-
козная смерть 15-летней пациентки на опе-
рационном столе в 1848 году в Англии про-
изошла именно от применения хлорофор-
ма. На международных конференциях 1864
и 1879 годов было сделано заключение, что
хлороформ является одним из наиболее
опасных анестетиков, однако это не при-
вело к ограничению его использования
вплоть до первой половины XX века. За-
13
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 1.9. Наркозный аппарат
для закиси азота Спрейга (1863)
ключение об опасности использования хло-
роформа положило начало длительным дис-
куссиям, противопоставлявшим преимуще-
ства местной анестезии общему обезболи-
ванию. Особенно “горячими” были споры
в Советском Союзе в 1920— 1960 гг.
Эдмунд Эндрюс, профессор хирургии
из Чикаго, в 1868 году предложил рецепт
наркозной газовой смеси, состоящей из 85 %
закиси азота и 15 % кислорода, а в 1881 году
русский военный хирург Станислав Сигиз-
мунд Кликович (1853— 1910) предложил бо-
лее оптимальное соотношение газов — 4:1.
В наркозном аппарате, изобретенном
Спрейгом в 1863 году, закись азота готови-
ли перед операцией ex temporae, поскольку
промышленного производства газа не су-
ществовало (рис. 1.9). Закись азота получа-
ли при нагревании нитрата аммония в стек-
лянной реторте с последующим удалением
более грубых примесей путем промывки
газа в различных реагентах. Затем газ соби-
рали под легким положительным давлени-
ем в большом газгольдере, из которого его
вдыхал больной. В 1868 году английские
предприниматели Коксетер и Барт стали из-
готавливать сжиженную закись азота и продавать ее в баллонах, что резко повыси-
ло популярность этого анестетика. Несколькими годами позже Коксетер создал
один из первых дозиметров поплавкового типа для газов.
Впервые эндотрахеальный наркоз с
помошью металлической трубки провел
Сноу в 1852 году 4-летнему мальчику. До
этого испытания подобного рода на живот-
ных проводил Пирогов. Немецкий хирург
Фридрих Тренделенбург (1844—1924) в
1869—1871 гг. при операциях в полости рта
и носа впервые применил резиновые труб-
ки с раздувными манжетами, которые вво-
дил через трахеостому. В 1895 году Кирш-
тейн изобрел аутоскоп, который считают
прообразом современного ларингоскопа
(рис. 1.10).
В 1853 году Александр Вуд (1817—1884),
секретарь Королевского колледжа врачей в
Эдинбурге, сообщил об изобретении полой
иглы и шприца для инъекций, что создало
реальные условия для внедрения в практи-
ку неингаляционной анестезии. В 1904 году
Рис. 1.10. Аутоскоп Кирштейна (1895)
русские ученые С.П. Федоров и Н.П. Кравков
14
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
описали методику внутривенного гедоналового нар-
коза, положив начало развитию внутривенной анес-
тезии.
Несмотря на успехи, важнейшей проблемой ос-
тавался уровень наркозной смертности при прове-
дении общего обезболивания. Методики анестезио-
логических пособий того времени позволяли отклю-
чить сознание, вызывать развитие миорелаксации (в
большей или меньшей степени) и подавить реакцию
организма на операционный стресс, но только при
относительно глубоком наркозе. В этой связи осо-
бенно актуальными стали работы Анрепа В.К. (1852—
1927), российского профессора судебной медицины
(рис. 1.11). Введя себе под кожу 0,003 г кокаина, он
отметил временную потерю кожной чувствительно-
сти к покалыванию в месте инъекции. Это открытие
было описано дважды в немецком Физиологичес-
ком журнале в 1879 и 1880 годах, но осталось неза-
меченным. 15 ноября 1884 года Анреп опубликовал
в российском еженедельнике “Врач” статью “Кокаин как местноанестезируюшее
средство”, которая стала первым в мире отчетом о клиническом использовании
кокаина.
15 сентября 1884 года венский врач К. Коллер (1857— 1944) сообщил об ус-
пешной анестезии глаза кокаином при операциях. В 1905 году Айнгорн синтези-
ровал новокаин. В 1890—1892 гг. К. Шлейх разработал технологию инфильтраци-
онной анестезии, которая в последующем была блестяще развита А.В. Вишневс-
ким (1874—1948).
16-го августа 1897 года немецкий хирург Август Бир (1861—1949) провел без-
болезненную резекцию голеностопного сустава с предварительным введением в
субарахноидальное пространство 3 мл 0,5 % раствора кокаина путем инъекции в
поясничную область способом Квинке (рис. 1.12). Проведя эксперименты на себе
и своем коллеге, Бир обнаружил наиболее частое ос-
ложнение при использовании спинномозговой ане-
стезии — постпункционную головную боль.
...Нужен был гений Бира, чтобы сочетать вместе
средства проводниковой кокаинизации с проколом Квин-
ке и получить полный, блестящий эффект сознатель-
но продуманных мероприятий.
С.С. Юдин, 1925 г.
В России, а затем и в Советском Союзе, основ-
ными пропагандистами регионарных методов обез-
боливания стали Валентин Феликсович Войно-Ясе-
нецкий и Сергей Сергеевич Юдин. В.Ф. Войно-Ясе-
нецкий (1877—1961) в 1915 году защитил докторскую
диссертацию на тему “Регионарная анестезия”, ко-
торая несколько позже была издана в виде моногра-
фии. С.С. Юдин (1891— 1954) после демобилизации
Рис. 1.11. Василий Константи-
нович Анреп
Рис. 1.12. Август Бир
15
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 1.13. “Портрет хирурга
Юдина С.С.”, художник
М.В. Нестеров (1935)
в 1919 году начал работать над диссертацией по спинномозговой анестезии (рис.
1.13). В 1922 году его командировали в Германию в клинику Бира, а в 1926 году
Юдин опубликовал монографию “Спинномозговое обезболивание”.
Достижения в области химии и фармакологии обеспечили прогресс в разви-
тии неингаляционного наркоза. Первый анестетик из группы барбитуратов — пер-
ноктон — был применен А. Бумом в 1927 году в Германии. В последующем был
синтезирован целый ряд барбитуратов для наркоза: веронал (1906), амактал (1929),
нембутал (1931). Синтез барбитуратов ультракороткого действия в Германии в
1930-х годах позволил приблизить неингаляционный наркоз к современному уров-
ню. Эвипан (гексенал), примененный для наркоза Веезе и Шарпфом в 1932 году,
Рис. 1.14. Сэр Роберт
Рейнольдс Макинтош
сразу завоевал симпатии хирургов и анестезиологов.
Модификация его структурной формулы привела к
появлению “дедушки неингаляционных анестетиков”
пентотала (тиопентал-натрия) — препарата, кото-
рый продолжают широко использовать более 70 лет,
начиная с момента его первого применения в кли-
нике Ланди в 1934 году.
Первые общества анестезиологов были органи-
зованы в Великобритании и США, а с 1920 года в
США начали публиковать старейший специализи-
рованный журнал Anaesthesia & Analgesia. В 1955 году
была организована Всемирная федерация обществ
анестезиологов — WFSA.
Одним из основоположников развития мировой
анестезиологии является сэр Роберт Рейнольдс Ма-
кинтош (1897— 1989). Макинтош (рис. 1.14) совмест-
но с Эпштейном и Уильямом Машиным изобрели
принципиально новую конструкцию испарителей
эфира. Испаритель ЭМО (Эпштейн—Макинтош-
16
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Оксфорд) стал первым испарителем с определением вдыхаемой концентрации пара
в объемных процентах. Это изобретение нашло широкое применение в анестези-
ологических клиниках всего мира. В 1937 году Макинтош создал первую в мире
кафедру анестезиологии при Оксфордском университете и стал первым профессо-
ром анестезиологии. В ЗО-е годы XX века он изобрел изогнутый клинок для ла-
рингоскопа и впервые применил эндотрахеальный наркоз.
Революционным событием в истории анестезиологии явился синтез миорелак-
сантов. В 1935 году Г. Кинг выделил из очищенного кураре d-тубокурарин-хлорид.
В 1938 году А. Мак-Интайр и Г. Датчер создали очищенный препарат кураре —
интокострин. В 1942 году канадские анестезиологи Гарольд Гриффитс и Дж. Джонсон
провели 25 наркозов при операциях на легких с их искусственной вентиляцией
ручным способом на фоне тотальной миорелаксации интокострином.
В 1951 году англичанин Дж. Саклинг синтезировал галотан, который клини-
чески был апробирован М. Джонстоном и Р. Макинтошем в 1956 году. Несколько
позже в США были синтезированы другие жидкие летучие галогенсодержащие
анестетики — энфлюран, изофлюран (1965) и севофлюран.
В 1965 году Д. Мак Карлайл синтезировал кетамин, а клинические исследова-
ния его действия были проведены Дж. Корссеном и Э. Домино в 1966 году. Эти же
авторы ввели определение “диссоциативной анестезии”.
Анри Лабори и Пьер Гюгенар в 50-е годы XX века выдвинули концепцию
искусственной фармакологической гибернации — состояния, имитирующего зим-
нюю спячку у животных. Состояние и методика получили название “нейропле-
гия”, которой достигали путем введения так называемых литических коктейлей на
основе нейролептика аминазина (с целью подавления симпатического отдела ве-
гетативной нервной системы через блокирование проведения возбуждения в си-
напсах ретикулярной формации). Однако полная неуправляемость нейроплегией,
большое количество осложнений и летальных исходов поставили точку в ее ис-
пользовании в анестезиологии.
В 1960 году А. Лабори синтезировал и исследовал оксибутират натрия (ГОМК),
обнаружив хороший гипнотический, практически не выраженный аналгетический
и ничтожный токсический эффекты его применения. Последний эффект был под-
твержден случаем, когда служитель лаборатории с суицидальной целью принял
внутрь 8 г ГОМК, в результате чего потенциальный самоубийца: “...проспал трое
суток и проснулся в хорошем настроении” (по книге А.Д. Беляевского, Г.Д. Монченко
“Очерки по истории анестезиологии”).
В 1959 году французские анестезиологи Ж. де Кастро и П. Манделира высту-
пили с сообщением на тему: “Нейролептаналгезия: анестезия без барбитуратов”.
В основу предложенной методики было положено использование нейролептика
галоперидола и анестетика феноперидина, близкого к опиатам. В целом методика
нейролепаналгезии (НЛА) повторяла направленность предложенных ранее иссле-
дований по нейроплегии, но отличалась от нее большей управляемостью и мень-
шей глубиной влияния на вегетативные функции. Негативные эффекты галопери-
дола привели к поиску новых препаратов для НЛА. В 1962 году П. Янссен синте-
зировал нейролептик дроперидол и аналгетик фентанил, которые стали
оптимальными составляющими НЛА.
Хайуорд-Батт из Новой Зеландии в 1957 году ввел определение атаралгезии —
варианта анестезии, заключающегося в сочетанном использовании транквилиза-
тора и аналгетика. В 1983 году в США Фраген и Кей впервые применили пропо-
17
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 1.15. Исаак Соломонович
Жоров
фол, ставший наиболее популярным анестетиком в
мире, что позволило сформулировать концепцию
тотальной внутривенной анестезии.
В развитии отечественной анестезиологии зна-
ковой фигурой является Исаак Соломонович Жоров
(1888—1974), великолепный практикующий хирург,
который основным направлением научной работы
избрал анестезиологию (рис. 1.15). В 1920-х годах
он широко применял ректальный наркоз авертином,
в 30-х годах его внимание привлекли барбитураты
ультракороткого действия — гексенал и тиопентал-
натрий. И.С. Жорову принадлежит заслуга в изуче-
нии и внедрении в клиническую практику барбиту-
рового наркоза в нашей стране. В 1936 году он издал
монографию “Неингаляционный наркоз в хирургии”
и защитил диссертацию на эту тему, в 1959 году —
опубликовал первое в СССР руководство по анесте-
зиологии “Общее обезболивание в хирургии”, кото-
рое дополнил и повторно издал в 1964 году под на-
званием “Общее обезболивание”. Эта книга стала
настольной для всех советских анестезиологов. Иса-
ак Соломонович выступил организатором и руководителем первого в СССР сим-
позиума по анестезиологии, посвященного проблеме нейроплегии (1960).
В хирургической клинике Ленинградской Военно-медицинской академии, ру-
ководимой Петром Андреевичем Куприяновым (1893—1963), в 1946 году М.С. Гри-
горьев и М.Н. Аничков провели первый эндотрахеальный наркоз, в 1947 году —
стали использовать при эндотрахеальном наркозе d-тубокурарина-хлорид иност-
ранного производства. В 1947—1948 годах А.Л. Мнджоян синтезировал отечествен-
ный препарат сукцинилдихолинйодид (дитилин), после чего в отечественных кли-
никах начали широко применять миорелаксанты. В 1957 году М.С. Григорьев и
М.Н. Аничков опубликовали первое руководство по применению миорелаксантов
“Кураре и курареподобные препараты в хирургии”.
В 1962 году В.Н. Смольников впервые в СССР использовал наркоз ксеноном
при пробной лапаротомии по поводу неоперабельного рака желудка. Идею иссле-
довать эффекты этого инертного газа Смольникову подсказал Нобелевский лауре-
ат, американский физик и химик Полинг Лайнус Карл (1901—1994). Эти исследо-
вания были возрождены в 1990-х в России Н.Е. Буровым и позволили клиничес-
кое применение ксенона в анестезиологии.
В 1961 году журнал “Экспериментальная хирургия”, организованный Алек-
сандром Александровичем Вишневским (1906—1975), получил новое название “Эк-
спериментальная хирургия и анестезиология”, а в 1977 году — “Анестезиология и
реаниматология”. Тигран Мовсесович Дарбинян, первый профессор анестезиоло-
гии в СССР, защитивший первую докторскую диссертацию по специальности,
стал первым главным редактором журнала. Первым членом-корреспондентом АМН
СССР по специальности “Анестезиология и реаниматология” был Геннадий Алек-
сеевич Рябов, классик советской анестезиологии и реаниматологии, автор ряда
фундаментальных работ по анестезиологии и медицине критических состояний.
В 1958 году П.А. Куприянов в Ленинградской Военно-медицинской академии
создал первую кафедру анестезиологии. Затем были орагнизованы кафедры усо-
1. ТРИУМФ НАД БОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
Рис. 1.17. Анатолий Иванович
Трещинский
вершенствования врачей в Московском Централь-
ном институте (заведующий кафедрой — профессор
Е.А. Дамир) и Киевском ГИДУВе (заведующий ка-
федрой — профессор А.И. Трещинский).
В 1966 году М3 СССР был издан приказ об орга-
низации анестезиологической службы в Советском
Союзе. Приказ регламентировал организацию в ста-
ционарах отделений анестезиологии в качестве са-
мостоятельных структур, подчиненных не ведущему
хирургу, а специализированному руководителю. С
1969 года в составе отделений анестезиологии орга-
низуют палаты реанимации и интенсивной терапии.
Главный анестезиолог М3 СССР Армен Артаваздо-
вич Бунятян совместно с Г.А. Рябовым и А.З. Мане-
вичем издали первый
учебник “Анестезио-
логия и реаниматоло-
гия” (1977, 1984) для
студентов медицин-
ских вузов.
В истории развития украинской анестезиологии
выделяют четыре периода:
I. До 1964 года — период становления и вне-
дрения эндотрахеального наркоза. Первый эндо-
трахеальный наркоз в Киеве проведен в 1949 году
В.К. Бойко в Украинском институте клинической
медицины. На базе Киевского института усовершен-
ствования врачей в 1957 году Николай Михайлович
Амосов (1913—2002) организовал первую в Украи-
не кафедру торакаль-
ной хирургии и анес-
тезиологии (рис. 1.16).
В этом же году кафед-
ра подготовила одиннадцать врачей-анестезиологов.
В 1958 году на кафедре был организован курс ане-
стезиологии длительностью четыре месяца, кото-
рый возглавил Анатолий Иванович Трещинский,
первый главный анестезиолог М3 УССР (рис. 1.17).
Первая кафедра анестезиологии создана на базе
Киевского института усовершенствования врачей;
немногим позже аналогичные кафедры были орга-
низованы в Харькове и Львове. В 1967 году кафедру
анестезиологии при Киевском государственном уни-
верситете возглавил Леонард Петрович Чепкий (рис.
1.18), который начал профессиональную деятельность
в кардиохирургической клинике Н.М. Амосова. В
Украине в 1964 году было организовано первое в
Рис. 1.16. Николай
Михайлович Амосов
Рис. 1.18. Леонард Петрович
Чепкий
19
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Советском Союзе общество анестезиологов, председателем которого стал профес-
сор А.И. Трещинский К 1964 году в Украине работали около 300 врачей-анесте-
зиологов.
II. 1964—1969 гг. — период освоения и изучения новых анестетиков, выбора
различных методов анестезии при оперативных вмешательствах. В этот период
открыто первое в Украине отделение реанимации и интенсивной терапии на шесть
коек на базе Киевской городской больницы им. Октябрьской революции. В Ук-
раине работали 1076 врачей-анестезиологов. В 1969 году во Львове состоялся I
съезд анестезиологов Украины.
III. 1969—1991 гг. — период становления и развития современной организа-
ционной структуры службы анестезиологии и интенсивной терапии. Это был ка-
чественно новый этап в развитии анестезиологии на территории Украины. В 1973
году соответствующий приказ М3 СССР позволил организовывать кафедры анес-
тезиологии и реаниматологии при медицинских вузах. На кафедрах специальность
преподавали студентам и подготавливали врачей-специалистов.
В 1983 году в Украине изданы первые учебники для студентов медицинских
вузов: “Анестезиология и реаниматология”, авторы — Л.П. Чепкий, В.Ф. Жалко-
Титаренко; “Анестезиология и реаниматология: практические занятия” под ре-
дакцией Л. В. Усенко.
IV. С 1991 года — по настоящее время. В 1991 году создана Ассоциация анес-
тезиологов Украины (ААУ), первым президентом которой избран профессор
А.И. Трещинский В 2004 году Ассоциацию возглавил профессор Ф.С. Глумчер.
Печатным органом ассоциации является журнал “Быь, знеболювання i штенсив-
на терап!я”. В 1992 году в Запорожье проведен I Национальный конгресс анесте-
зиологов Украины. На данный момент в АМН Украины по специальности “Ане-
стезиология и интенсивная терапия” представлено два член-корреспондента —
профессор Л.В. Усенко и профессор В.И. Черний, в НАН Украины по специаль-
ности “Клиническая физиология” — член-корреспондент Л.В. Усенко.
Вклад в развитие анестезиологии и интенсивной терапии Украины внесли
талантливые ученые и организаторы службы: В.А Аркатов, Л.Н. Аряев, Г.И. Белебе-
зьев, В.Д. Бесараба, Ю.П. Бутылин, А.С. Владыка, Ф.С. Глумчер, В.Т. Дубик,
В.Д. Жабо, В.И. Зубков, Е.Н. Клигуненко, Е.П. Курапов, В.А. Лисецкий,
А.Я. Маловичко, Л.А. Мальцева, И.И. Мищук, Г.И. Можаев, Р.И. Новикова,
Н.И. Оболенцев, А.Ю. Пащук, Ю.П. Свиргуненко, О.Н. Спицын, В.П. Стадниц-
кий, В.Ф. Стащук, В.М. Струменский, В.В. Суслов, И.Д. Тимчук, З.А. Тка-
чук, В.А Тропевич, И.В. Халатурник, А.А. Хижняк, А.А. Цыганий, В.И. Черний,
Л.П. Чепкий, В.П. Шано, Г.А. Шифрин, И.П. Шлапак, И.С. Юрчук, И.П. Ям-
ковой.
Научные достижения ученых в области анестезиологии и интенсивной тера-
пии отмечены Государственными премиями Украины в области науки и техники,
премией правительства Российской Федерации.
Не иссякнет источник уважения и благодарности к первопроходцам и настав-
никам столь важной и увлекательной отрасли медицины, как анестезиология, суть
которой точно выразил Роберт Макинтош: “Анестезия — более искусство, чем
наука”.
20
1. ТРИУМФ НАД ВОЛЬЮ: ОЧЕРК ПО ИСТОРИИ АНЕСТЕЗИОЛОГИИ
ЛИТЕРАТУРА
1. Беляевский А.Д., Манченко ГД. Очерки по истории анестезиологии. — Р.-на-Д.:
РГМУ, 2000. - 168 с.
2. Жоров И.С. Развитие хирургического обезболивания в России и СССР. — М.:
АМН СССР, 1951. - 173 с.
3. Жоров И.С. Общее обезболивание. — М.: Медицина, 1964. — 15—49 с.
4. Зильбер А.П. 150 лет эры анестезиологии. — Календарь, 1846. — 16 октября —
1996. — Петрозаводск, 1996. — 25 с.
5. Макинтош Р., Машин У., Эпштейн X. Физика для анестезиологов. — М.: Мед-
гиз, 1962. — 395 с.
6. Мейер-Мей Ж. Современное обезболивание в хирургии. — М.: Медгиз, 1948. —
232 с.
7. Трещинский А.И, Заманский Я.Л., Тверской М.Н. Из истории отечественной ане-
стезиологии. — К.: Здоров’я, 1973. — 162 с.
8. ТрещинськийА.Г, Шлапак 1.П., Грандо О.А., Тверський М.Н. Основы етапи розвит-
ку анестезюлоги в Украпй. Матер1али 2-го Конгресу анестезюлопв Укршни, 24—27 верес-
ня 1996 р. — Харюв, 1996. — 3—5 с.
9. Юдин С.С. Избранные произведения. Вопросы обезболивания в хирургии. —
М.: Медгиз, 1960. — 574 с.
10. Askitopoulos Н. Pain & Pain killing medicines in the Homeric times. In: Abstracts of
13 th World Congress of Anesthesiologists// WFSA, April 18—23, 2004, Paris. CD-ROOM,
C 025a.
11. Caton P. Early theories of narcosis. In: Abstracts of 13 th World Congress of
Anesthesiologists// WFSA, April 18—23, 2004, Paris. CD-ROOM, C 025b.
12. Cousin M.T. Missed opportunities in inhalational anesthesia. In: Abstracts of 13 th
World Congress of Anesthesiologists// WFSA, April 18—23, 2004, Paris. CD-ROOM, C 025c.
13. Desbarax P. Motton’s design of the early ether vaporizers// Anaesthesia, 57, 2002;
463-469.
14. Sprigge J.S. Sir Humphry Davy: his researches in respiratory physiology and his debt
to Antoine Lavoiser// Anaesthesia, 57, 2002; 375—364.
21
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ
ОБЩИХ АНЕСТЕТИКОВ
Общая анестезия — это искусственно вызванное физиологи-
ческое состояние, характеризующееся обратимой утратой созна-
ния, аналгезией, амнезией и некоторой степенью миорелаксации.
С момента открытия общей анестезии ученые, теоретики и
клиницисты всего мира стремятся выяснить причины возникно-
вения этого удивительного процесса, Пирогов Н.И. одним из пер-
вых попытался объяснить феномен анестезии; он утверждал, что
наркотический эффект эфира проявляется, когда насыщенная его
парами кровь “...приходит в соприкосновение с органами нервной
системы” (1848). К сожалению, многие вопросы сущности явле-
ния общей анестезии до сих пор остаются без убедительных отве-
тов, но прогресс научной мысли ищет пути их решения.
В настоящее время молекулярные механизмы общей анесте-
зии полностью не выяснены. Не существует единой общеприня-
той теории действия анестетиков, которая объясняет, каким об-
разом достаточно схожее состояние ЦНС и других систем орга-
низма вызывают разнообразные по химической структуре
соединения, например инертные газы (ксенон), простые неорга-
нические соединения (закись азота), галогенизированные углево-
дороды (фторотан), сложные органические соединения (барбиту-
раты) и др.
2.1. ТЕОРИИ НАРКОЗА
Исследователями предложен ряд теорий, объяс-
няющих своеобразный эффект общих анестетиков. По сути, эти
концепции являются гипотезами, а термин “теория” употребля-
ют, отдавая должное истории проблемы.
Предпосылкой для создания одной из первых теорий — коа-
гуляционной теории (Кюн, 1864; Клод Бернар, 1875) — явилось
свойство диэтилового эфира и хлороформа вызывать своеобраз-
ное свертывание внутриклеточного белка с образованием зернис-
22
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩИХ АНЕСТЕТИКОВ
тости в протоплазме. Эти изменения рассматривали в качестве основной причины
нарушения функции клетки. Позже исследователи выяснили, что отмеченные из-
менения возникают при условии, если концентрация анестетиков в тканях значи-
тельно превышает уровень, достигаемый в клинических условиях.
Известно, что клеточные мембраны и нервные клетки содержат большое ко-
личество липоидов, а анестетики обладают высокой степенью тропности к липо-
идам. На этих фактах базировалось возникновение липоидной теории (Герман, 1866;
Мейер, Овертон, 1899—1901), согласно которой, насыщение клеточных мембран
анестетиками создает барьер для нормального обмена веществ в клетке. Опреде-
ленным подтверждением справедливости данной гипотезы считали зависимость
степени выраженности наркотического эффекта (силы действия) анестетиков от
степени их тропности к липоидам (закон Мейера—Овертона). В дальнейшем уче-
ные выяснили, что такая закономерность характерна лишь для большинства инга-
ляционных анестетиков. Были обнаружены исключения, поэтому липоидная тео-
рия оказалась не универсальной.
Теория поверхностного натяжения (Траубе, 1913) основывалась на данных о
том, что липотропные анестетики обладают свойством снижать поверхностное
натяжение на границе между липоидной оболочкой клетки и окружающей ее жид-
костью, вызывая повышение проницаемости мембраны.
Сторонники адсорбционной теории (Лове, 1912) утверждали, что анестетики
оказывают наркотическое действие благодаря высокой сорбционной способности
в отношении внутриклеточных липоидов в коллоидном состоянии и свойству по-
вышать проницаемость клеточных мембран. Предполагали, что специфическая
функция нервных клеток блокируется вследствие высокого насыщения анестети-
ком их липопротеиновых структур.
Теория критического объема (Варбург, 1911) объясняла интересный феномен
устранения анестезии под действием повышенного давления. Известно, что бимо-
лекулярный слой фосфолипидов в клеточных мембранах нейронов имеет в соста-
ве множество гидрофобных структур. Согласно теории критического объема, ане-
стетики, связываясь с гидрофобными структурами мембраны нейронов, расширя-
ют фосфолипидный бимолекулярный слой до критического объема, после чего
функция мембраны претерпевает изменения, и, возможно, повышенное давление
вытесняет часть молекул анестетика из мембраны, увеличивая потребность в нем.
Данные об ингибирующем влиянии анестетиков на ферментные комплексы,
которые занимают ключевое положение в обеспечении окислительно-восстанови-
тельных процессов в клетках, привели к формированию гипоксической теории (Фер-
ворн, 1912) общей анестезии. Приверженцы этой теории утверждали, что тормо-
жение функции ЦНС при насыщении анестетиками возникает в результате нару-
шения энергетики клеток. Позже исследователи выяснили, что в условиях обшей
анестезии клеточный метаболизм нарушается не всегда, а характерные для гипок-
сии метаболические изменения в клетке обычно возникают лишь при концентра-
ции некоторых анестетиков в тканях, значительно превышающей используемую
концентрацию в клинических условиях. Также не было получено убедительных
данных о снижении потребления клетками кислорода, не объяснено быстрое вос-
становление функций нейронов после удаления из них анестетика; с теорией во
многом не согласовались показатели КОС тканей и оттекающей от ЦНС крови.
В 1961 году Полинг предложил теорию водных микрокристаллов, согласно кото-
рой наркотическое состояние развивается благодаря свойству общих анестетиков
образовывать в жидкостной фазе тканей своеобразные кристаллы, создающие пре-
23
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
пятствие для перемещения катионов через мембрану клетки, тем самым, блокируя
процессы деполяризации и формирование потенциала действия. Дальнейшие ис-
следования показали, что свойством кристаллообразования обладают не все общие
анестетики; те же из них, для которых характерен этот феномен, образуют кристал-
лы при концентрациях, превышающих используемые в клинической практике.
Наибольшее признание и развитие получила мембранная теория общей анестезии
(Хобер, 1907; Бернштейн, 1912; Винтерштейн, 1916; Ходжкин, Кац, 1949). Она бази-
ровалась на данных о влиянии анестетиков на проницаемость мембран нервных кле-
ток. Основой теории явились результаты исследований по формированию потенциа-
ла действия и распространению возбуждения в пределах одного нейрона и в межней-
ронных контактах. Было установлено, что перемещение через мембрану ионов калия
(К+) и натрия (Na+) при раздражении клетки происходит неравномерно: выходу К+ из
клетки предшествует интенсивный ток Na+ в клетку. При этом в зоне раздражения на
мембране клетки возникает обратное обычному распределение зарядов: снаружи элек-
трический заряд становится отрицательным, а с внутренней поверхности — положи-
тельным. Возникающий на границе возбуждения потенциал значительно превышает
потенциал покоя, что и обусловливает его способность распространять возбуждение.
Следующая фаза сопровождается затратой АТФ: ионы калия возвращаются в клетку,
ионы натрия — извлекаются из нее (катионный насос). В механизме перехода клетки
из состояния покоя в состояние возбуждения с последующим восстановлением транс-
мембранного потенциала покоя важную роль играют ионы кальция (Са++): под их
влиянием изменяется интенсивность тока К+ и Na+ через мембрану во время ее депо-
ляризации и восстановления потенциала покоя.
В дальнейшем было установлено, что общие анестетики оказывают выражен-
ное тормозящее действие на синаптическую передачу в дозах, которые существен-
но не влияют на распространение возбуждения по мембране нейрона. Для тормо-
жения распространения потенциала действия по мембране необходимы более зна-
чительные концентрации анестетика, хотя сам механизм торможения в том и другом
случае аналогичен.
Синапсы являются одним из наиболее сложных звеньев рефлекторной цепи и
подвержены влиянию различного рода эндогенных и экзогенных факторов, по-
этому тормозящее влияние анестетиков на передачу импульсов в синапсах выра-
жено более, чем на мембранах нейронов. Механизм угнетения возбудимости ней-
ронов и торможения синаптической передачи возбуждения под влиянием анесте-
тиков полностью не раскрыт. Известно, что различные анестетики неодинаково
влияют на основные функциональные звенья синапсов, например, они могут на-
рушать образование и высвобождение медиатора через пресинаптическую мемб-
рану в синаптическую щель, или угнетать обратный захват медиатора, или сни-
жать чувствительность рецепторов пресинаптической и постсинаптической мемб-
ран к медиатору, или приводить к угасанию постсинаптического потенциала
действия, вызывая изменения тока ионов через мембрану. При всей ценности
сведений о тонких механизмах действия анестетиков на клеточном и молекуляр-
ном уровнях, мембранная теория не раскрывает сущности общей анестезии как
своеобразного функционального состояния нервной системы организма, поскольку
в клинических условиях используемая концентрация анестетиков не вызывает
полной ареактивности нейронов и блокады синаптической передачи, а лишь ока-
зывает тормозящее влияние на их функцию.
Эффект многих общих анестетиков объясняют их действием на специфичес-
кие рецепторы медиаторов ЦНС — ацетилхолина, катехоламинов, серотонина,
24
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩИХ АНЕСТЕТИКОВ
гамма-аминомасляной кислоты (ГАМК), аденозина, аспартата, глютамата, эндо-
генных опиатов, цАМФ и др. Многие анестетики усиливают опосредованную гам-
ма-аминомасляной кислотой депрессию ЦНС. Более того, агонисты ГАМК-ре-
цепторов углубляют анестезию, в то время как антагонисты устраняют многие
эффекты анестетиков. Возможно, влияние на функцию ГАМК является одним из
главных механизмов действия многих анестетиков.
Особого внимания заслуживает теории парабиоза (1901). Ее автор, Введенский Н.Е.,
пришел к заключению, что анестетики действуют на нервную систему как силь-
ные раздражители и вызывают соответствующие фазы парабиоза, которые харак-
теризуются последовательным снижением физиологической лабильности отдель-
ных нейронов и нервной системы в целом. Согласно теории парабиоза, при опре-
деленном уровне насыщения мозга анестетиком снижение лабильности механизмов,
лежащих в основе формирования и распространения нервных импульсов, дости-
гает степени торможения функций ЦНС и клинически проявляется состоянием
общей анестезии. В дальнейшем теория парабиоза получила развитие в трудах
Ухтомского А.А. и его последователей в 1950—1960-е годы.
Концепция изменений физиологической лабильности нейронов и, особенно,
синапсов под влиянием наркотических веществ позволила приблизиться к пони-
манию, что в каждое мгновение процесса общей анестезии степень торможения
функции различных отделов мозга оказывается неодинаковой, так как неодинако-
ва исходная функциональная лабильность отделов мозга. Такая версия нашла убе-
дительное подтверждение в следующем факте: наиболее подверженными тормо-
зящему влиянию анестетиков оказались функции коры больших полушарий и ре-
тикулярной формации. Это явилось предпосылкой для разработки ретикулярной
теории общей анестезии. Известно, что ретикулярная формация играет активиру-
ющую роль в отношении вышележащих отделов ЦНС. Разрушение определенных
зон ретикулярной формации вызывает состояние, близкое к медикаментозному
сну или наркозу. Эти факты дали возможность сделать заключение о вероятной
связи специфического действия наркотических веществ на функцию ретикуляр-
ной формации. Таким образом, сформировалось представление, что эффект об-
щих анестетиков является результатом торможения рефлекторных процессов на
уровне ретикулярной формации (устраняется ее восходящее активизирующее вли-
яние, что приводит к деафферентации вышележащих отделов ЦНС). Несмотря на
убедительные данные ретикулярной теории общей анестезии, результаты некото-
рых исследований свидетельствуют, что она во многом упрощена и не может быть
признана универсальной, тем более что влияние анестетиков на активность ней-
ронов ретикулярной формации разнообразно и может повышать, уменьшать или
не изменять ее функции (в зависимости от действующего вещества). Вероятно,
что изменение активности ретикулярной формации при анестезии связано со спе-
цифическим взаимодействием общих анестетиков с определенными структурами
в каждом отделе ЦНС. Кроме того, состояние уровня сознания не определяется
одной лишь активностью ретикулярной формации.
Клинические концентрации анестетиков угнетают спонтанную и вызванную
активность в различных отделах ЦНС: коре головного мозга, гиппокампе, спин-
ном мозге и др. Анестетики оказывают одновременное действие на многие облас-
ти ЦНС, и анестезия не возникает от воздействия анестетиков на отдельные спе-
цифические отделы ЦНС. Нервная система человека состоит из биллионов ней-
ронов, каждый из них имеет тысячи синапсов, поэтому не удивительно, что действие
анестетиков имеет такую сложную и разнообразную природу.
25
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
2.2. СТАДИИ НАРКОЗА
При введении в организм общих анестетиков установлена зако-
номерная стадийность в клинической картине общей анестезии, которую наибо-
лее четко прослеживают при использовании эфира. Проявления наркотизации
другими анестетиками развиваются аналогично, но разделение проявлений по ста-
диям менее выражено. Знание клинической картины каждой из стадий помогает
анестезиологу при проведении общей анестезии. Наиболее широкое распростра-
нение получила классификация стадий наркоза Гведела А., модифицированная
Жоровым И.С. (рис. 2.1).
Классификация стадий наркоза (по Гведелу А.):
I. Стадия аналгезии начинается с момента вдыхания паров эфира. Через не-
сколько минут наступает потеря сознания: речь становится бессвязной, появля-
ется сонливость. Кожа лица гиперемирована. Зрачки исходной величины или
расширены, реагируют на свет. Дыхание учащено, неритмичное. ЧСС увеличе-
на, АД несколько повышено. Тактильная и температурная чувствительности со-
хранены, болевая — ослаблена, что позволяет проводить кратковременные ма-
нипуляции.
II. Стадия возбуждения начинается сразу после потери сознания и характери-
зуется речевым и двигательным возбуждением. Кожа гиперемирована. Веки сомк-
нуты, зрачки расширены, фотореакция сохранена, ресничный рефлекс отсутству-
ет; появляются слезотечение и плавательные движения глазных яблок. Дыхание
частое, аритмичное. ЧСС и АД повышены. Кашлевой и рвотный рефлексы усиле-
ны. Мышцы напряжены, тризм. При стимуляции гортани и глотки возможен ла-
рингоспазм. Во время этой стадии может развиться фибрилляция желудочков сер-
дца, редко — непроизвольное мочеиспускание, рвота.
III. Хирургическая стадия
III, . На фоне спокойного сна еще сохранены мышечный тонус и гортанно-
глоточные рефлексы. Зрачки сужены, реагируют на свет; роговичный рефлекс
сохранен; медленные движения глазных яблок. Дыхание ровное, несколько уча-
щенное. ЧСС повышена, АД на исходном уровне.
Ш2. Кожа розовая, слизистые влажные. Зрачки сужены, фотореакция сохра-
нена; роговичный рефлекс отсутствует; глазные яблоки фиксированы. Дыхание
ровное. ЧСС и АД на исходном уровне. Гортанный и глоточный рефлексы отсут-
ствуют. Мышечный тонус снижен.
Ш3. Появление признаков токсического действия анестетика. Кожа бледно-ро-
зовая. Зрачки расширены, фотореакция ослаблена; сухость роговицы. Дыхание
диафрагмальное, учащенное. ЧСС увеличена, АД понижено. Мышечный тонус
снижен.
Ш4. Появление признаков передозировки анестетика. Кожа бледно-цианотичная.
Зрачки резко расширены, фотореакция отсутствует. Сохранено только диафрагмаль-
ное дыхание — поверхностное, аритмичное. ЧСС резко повышена, пульс частый,
нитевидный; АД резко понижено. В случае продолжения поступления анестетика
происходит дальнейшее угнетение дыхания и кровообращения и развивается тер-
минальное состояние. Этот уровень недопустим в клинической практике.
IV. Стадия пробуждения наступает после прекращения поступления анестети-
ка и характеризуется постепенным восстановлением рефлексов, мышечного тону-
са, чувствительности и сознания в обратном порядке.
26
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩИХ АНЕСТЕТИКОВ
1 стадия II стадия возбуждения III толерантная стадия IV стадия пробуждения Передози- ровка
1 Анал- гезия 1 2 3 4
Сознание
1 Диафрагма
Реберное
Пульс Л<***^ч_ — L —
Кровяное давление - —
—
Окраска кожи Нормаль ная Ярко-красная Красная Розовая Розовая Бледная Розовая бледная Бледно- цианотическая
| Миотонус | Скелетная
Абдоми- нальная
Движение глазного яблока \ л .—
XJ V
Величина зрачка СМ ( • )
без М V)
Веки Закрыты Крепко сжаты Закрыты Полу- ОТКрЫТЫ Открыты Широко открыты Попеременно полуоткрыты или закрыты Широко открыты
Рефлекс с век
Рефлекс с конъюнктивы
Роговичный рефлекс
Реакция зрачка на свет
Глотательный рефлекс
рвотный рефлекс — —
Секреция
Концентрация эфира в веноз- ной крови, мг% 18- 30 70-90 90-110 110-120 140-180
Рис. 2.1. Классификация стадий наркоза (по Гведелу А.)
2.3. КОНЦЕПЦИИ АНЕСТЕЗИОЛОГИЧЕСКОГО
ОБЕСПЕЧЕНИЯ ОПЕРАЦИЙ
Любое оперативное вмешательство, выполняемое по жизненным
показаниям с самыми благими намерениями, тем не менее, является определен-
ной формой агрессии, на которую организм реагирует комплексом сложных гоме-
остатических процессов. Общий адаптационный синдром, как итоговое проявле-
ние стресс-реакции, развивается при любых операциях и проявляется в различной
степени.
27
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
До определенного исторического периода главной задачей анестезии считали
лишь устранение болевых ощущений. Долгое время этого было вполне достаточ-
но, так как хорошее обезболивание позволяло хирургам в значительной степени
расширить спектр выполняемых операций. В последующем, когда оперативные
доступы к большинству органов человеческого тела были разработаны, возникла
необходимость решать проблемы не только анатомические, но и анатомо-функ-
циональные. При этом уже стало возможным рассчитывать не только на силы
больного, но и искусственно помогать организму преодолевать опасные функци-
ональные расстройства, возникающие во время операции и в ближайший после-
операционный период. Анестезия стала включать в себя элементы функциональ-
ной терапии, которые приобрели решающее значение при большинстве обшир-
ных операций, а у тяжело больных — при любых вмешательствах. Именно эти
факты позволили наркотизаторам (эфиродателям) трансформироваться в специа-
листов широкого профиля.
Многочисленными исследованиями установлено, что нейрофизиологические
механизмы боли достаточно сложны. Оказалось, что устранение лишь перцепту-
ального компонента болевой реакции (психоэмоционального ощущения боли)
далеко не исчерпывает всей полноты последствий, которые развиваются в ответ
на повреждение; невозможно предупредить развитие нейрогуморальных реакций
в ответ на тяжелую травму (операцию) за счет локальной активации той или иной
структуры нервной системы, так как воздействие на корковые и подкорковые
образования, ответственные за формирование ноцицептивной импульсации (суп-
расегментарный уровень), не исключает реализации сегментарного ответа через
мотонейроны задних рогов спинного мозга. Периферическая (первичная) гипер-
алгезия снижает эффективность узких сегментарных (спинальных) воздействий и
блокирует проведение импульсации по первичным афферентам (регионарные ме-
тоды анестезии). Все это привело к пониманию необходимости придания анесте-
зии многоуровнего характера, предусматривающего воздействие на различные уча-
стки нервной системы: рецепторного поля, первичных афферентов, сегментарно-
го и супрасегментарного уровней.
Полное подавление ноцицепции с помощью медикаментозных средств у жи-
вого человека, в принципе, недостижимо. Анестезиологу подвластны лишь моду-
ляция ноцицептивного потока, а также снижение информационного паттерна других
факторов агрессии (кровопотери, гипоксемии, ацидоза и пр.) с целью уменьше-
ния выраженности ответной реакции организма на травму. Следовательно, при
сильном возбуждающем начале ответная реакция неизбежна и она обратно про-
порциональна эффективности защиты. Примером крайнего варианта плохой за-
щиты может служить развитие шока при ранениях и травмах. В то же время вы-
полнение плановых хирургических вмешательств в больничных условиях, кото-
рые по тяжести агрессии можно приравнять к ранениям и травмам, на фоне
адекватной анестезии не сопровождаются критическими расстройствами систем
жизнеобеспечения, хотя и проявляются общим адаптационным синдромом. Соот-
ветственно, ухудшение качества анестезии смещает вектор стресс-реакции в сто-
рону крайне негативных проявлений.
При определении полноценности анестезии было бы ошибкой ограничивать
ее только адекватностью аналгетического компонента. Необходимо учитывать, что
общий поток возмущающей импульсации, идущей в ЦНС при повреждении, со-
стоит из мультимодальной афферентации от ноцицепторов, баро-, хемо- и прочих
рецепторов, реагирующих на изменение внутренней среды организма при травме
28
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩИХ АНЕСТЕТИКОВ
(разрезе) тканей, кровотечении, изменении кровотока, кислотно-основного со-
стояния и т. д. Это диктует необходимость комплексного подхода к защите, кото-
рый ориентирован на поддержание различных гомеостатических процессов во время
операции, тем более в случаях, когда в результате патологического процесса на-
ступило истощение адаптационных возможностей организма. Поэтому в процессе
анестезии важно не только уменьшать или устранять гемодинамические расстрой-
ства и обеспечивать антиноцицептивную защиту, но и осуществлять реализацию
плана интенсивной терапии, если ее проводили в предоперационный период.
Известно, что проявления стресс-реакции реализуются в виде нейрогенного и
гуморального ответов. Модуляция обоих без устранения причины малоэффективна.
Накоплены данные в отношении первичной периферической сенситизации и вто-
ричной центральной гипералгезии (по терминологии академика Крыжановс-
кого Г.Н. — патологической алгической системы), предусматривающие возмож-
ность повторной стимуляции ноцицептивных рецепторов. Эти факторы являются
базисными для упреждающего подхода в анестезиологической практике, направлен-
ного на предотвращение чрезмерной активации нейрогуморальных механизмов.
Таким образом, современные представления о патофизиологии боли и форми-
ровании стресс-реакции в ответ на травму (операцию) обусловливают ряд положе-
ний, имеющих принципиальное значение для обоснования тактики анестезии:
• основные усилия анестезиолога должны быть направлены на афферентное
звено рефлекторной дуги, а также на уменьшение ятрогенной активации механиз-
мов, ответственных за эфферентную импульсацию;
• устранение психоэмоционального ощущения боли необходимо сочетать с
блокадой вегетативного нейронального и двигательного компонентов ноцицеп-
тивной афферентации и с активацией антиноцицептивной системы путем соче-
танного использования общих и местных анестетиков с аналгетиками;
• в процессе анестезии необходимо минимализировать угнетение физиоло-
гических механизмов антиноцицепции и реактивности основных регуляторных
систем;
• рассматривая действия хирурга в операционной ране как дополнительное
повреждение, и учитывая способность ноцицептивной системы к самоактивации,
следует добиваться деафферентации и включения антиноцицептивной системы до
нанесения травматического воздействия;
• анестезию у тяжело больных необходимо объединять единой тактикой и
стратегией с интенсивной терапией, проводимой анестезиологом в пред- и после-
операционном периодах.
Цели современной анестезиологической помощи: обеспечить психическое (эмо-
циональное) спокойствие больного, исключить “присутствие пациента на соб-
ственной операции”, предотвратить сопутствующие боли эмоциональные реак-
ции; устранить перцептуальный компонент боли, снизить до безопасного (не-
стрессового) уровня интенсивности ноцицептивный поток из операционной раны
по всему пути его следования (от периферических рецепторов до центральных
структур мозга); предупредить нежелательные патологические рефлексы и чрез-
мерное напряжение деятельности функциональных систем; поддержать и, при
необходимости, откорректировать деятельность систем жизнеобеспечения; создать
удобные условия хирургу для работы (положение больного на операционном сто-
ле, мышечное расслабление, коллабирование легкого и т. п.).
Для решения этих целей используют наркоз (“обездушивание”), аналгезию,
нейровегетативную защиту, выключение двигательной активности, различные
29
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
методы интенсивной терапии (ИВЛ, инфузионно-трансфузионную, кардиотроп-
ную, сосудистую терапии и др., в том числе специфические, применяемые в спе-
циализированных областях хирургии). Полнота использования этих приемов и
способы достижения конечного результата зависят от конкретной ситуации (забо-
левания, индивидуальных особенностей пациента и его состояния, характера опе-
ративного вмешательства и т. п.). В совокупности эти факторы определяют прин-
цип избирательной регуляции функций в процессе анестезии, который составляет
основу концепции многокомпонентности анестезии (за рубежом употребляют тер-
мин “концепция мультимодальности”). Согласно этой концепции, анестезиоло-
гическое обеспечение состоит из отдельных компонентов, каждый из которых
может быть применен (или не применен) анестезиологом в зависимости от возни-
кающих проблем перед предстоящей операцией. Такой подход обеспечивает гиб-
кость тактики, позволяет легче и качественнее решать конкретные задачи путем
применения нескольких средств, оказывающих более или менее направленное и
избирательное действие.
Концепция многокомпонентности пришла на смену доминировавшей в тече-
ние многих лет концепции глубины анестезии. Она предусматривала решение не-
скольких задач (выключения сознания, обезболивания, расслабления мышц) за счет
последовательного углубления анестезии одним анестетиком и была во многом обус-
ловлена превалированием в арсенале анестезиологов препаратов ингаляционного
действия. Реализация ее на практике всегда сопровождалась опасностью передози-
ровки анестетика с распространением торможения на жизненно важные регулятор-
ные центры. В настоящее время концепция глубины анестезии устарела, но это не
означает, что устарела и сама ингаляционная анестезия. Ориентация на многоком-
понентность позволяет использовать ингаляционную анестезию в качестве компо-
нента общей анестезии и применить другие средства и приемы в качестве компо-
нентов для повышения ее эффективности и безопасности.
Новые знания в областях нейрофизиологии боли и формирования общего
адаптационного синдрома позволяют детализировать действия анестезиолога в пред-,
интра- и ближайший послеоперационный период.
Предоперационный период. Неустраненный предоперационный эмоциональ-
ный стресс может привести к значительному снижению болевого порога, выбросу
стресс-гормонов с последующей активацией гемодинамических и эндокринных
реакций, повышению толерантности к действию анестезирующих средств (Оси-
пова Н.А. и др., 1994, 1998). Одним из важнейших моментов в тактике анестезио-
лога является создание психологического покоя для пациента путем нахождения с
ним взаимопонимания, разъяснения сути предстоящей анестезии, адекватной пре-
медикации с использованием седативных препаратов (особенно бензодиазепинов).
Исключают возникновение боли при выполнении предоперационных инвазивных
исследований и манипуляций, особенно непосредственно перед анестезией (в том
числе при катетеризации периферических и центральных вен, эпидурального про-
странства). Травматичные операции предваряют использованием средств, способ-
ных уменьшить эффект периферической и центральной сенситизации, — несте-
роидными противовоспалительными аналгетиками, тормозящими выделение про-
стагландина Е2, по показаниям — наркотиками.
Интраоперационный период. Применяют максимально интенсивные воздей-
ствия для предотвращения выхода потока ноцицептивной импульсации за разум-
ные пределы. Анестезиолог наделен широкими полномочиями по коррекции стрес-
совых гемодинамических и других реакций. Это позволяет использовать наиболее
30
2. ТЕОРИИ И МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩИХ АНЕСТЕТИКОВ
эффективные дозы атарактиков, нейролептиков, центральных аналгетиков (опиа-
тов и опиоидов) и других средств, не опасаясь их побочного действия (депрессии
дыхания, снижения АД и пр.). При этом, согласно упреждающему подходу, дости-
гают должной глубины анестезии до нанесения травмирующего воздействия (вклю-
чая интубацию трахеи), а не по мере появления гемодинамических признаков
неадекватности анестезии.
Современный арсенал средств позволяет анестезиологу достигать уменьше-
ния ноцицепции путем использования ингибиторов простагландине- и кининоге-
неза (апротинин), блокаторов NMDA-рецепторов (малые дозы кетамина), а также
за счет блокады первичных афферентов (местная инфильтрационная и регионар-
ная анестезии). Уделяют внимание коррекции повышенной активности стресс-
лимитирующих систем путем введения естественных метаболитов медиаторов, их
синтетических аналогов, антиоксидантов, адренопозитивных средств. Многоуров-
невый характер анестезии позволяет реализовать сочетанная анестезия.
Послеоперационный период. Используют методы, позволяющие обеспечить
деафферентацию, например, продленную эпидуральную и другие виды блокад,
медикаментозную противоболевую терапию. По возможности избегают примене-
ния средств, обладающих супрасегментарным действием (синтетических аналогов
эндогенных опиатов), чтобы не мешать центральным механизмам регуляции обес-
печивать координирующую роль над гомеостатическими функциями. Природа
послеоперационного болевого синдрома во многом обусловлена избыточным про-
стагландине- и кининогенезом в подвергшихся травматизации тканях. Эти про-
цессы могут стать причиной патологического течения раневого процесса (чрез-
мерный отек, асептическое воспаление оперированных тканей) с развитием ос-
ложнений (анастомозиты, несостоятельность швов анастомозов, некрозы), поэтому
препаратами первого ряда при выборе медикаментозного обезболивания являют-
ся нестероидные противовоспалительные средства, применение которых в подоб-
ных ситуациях патогенетически оправдано.
Высокая квалификация анестезиолога помогает разобраться в широком спек-
тре возможностей воздействия на организм пациента и не допустить превращения
многокомпонентное™ в полиинградиентность и полипрагмазию.
ЛИТЕРАТУРА
1. Бараш П., Куллен Б., Стэлтинг Р. Клиническая анестезиология. Перевод с англ.,
Под ред. Родионова В.Я. — М.: Медицинская литература, 2004. — С. 27—31.
2. Белоярцев Ф.Ф. Компоненты общей анестезии. — М.: Медицина, 1977. — 261с.
3. Бунятян А.А. Актуальные вопросы тотальной внутривенной анестезии. — Вест-
ник интенсивной терапии. Актуальные вопросы общей анестезии и седации: приложе-
ние к журналу, 1998. — С. 1—6.
4. Бунятян А.А. Руководство по анестезиологии. — М.: Медицина, 1997. — С. 68—83.
5. Ваневский В.Л., Носырев С.П., Азаров В.И., Ершова Т.Г. Антиноцицептивный
компонент анестезиологического пособия: смена концепции в анестезиологии. V респуб-
ликанский съезд анестезиологов-реаниматологов. — Ворошиловград, 1988. С. 42—43.
6. Ейткенхед А.В., Смитт Г. Руководство по анестезиологии. Пер. с англ. Дуд-
никова С.Ф., Митрохина А.А., под ред. проф. Дамир Е.А. — М.: Мединина, 1999. —
С. 137-153.
7. Клиническая анестезиология. Пер. с англ., под ред чл.-корр. РАМН Гологорско-
го В.А., проф. Яснецова В.В. — М.: Гэотар-мед, 2001. С. 181—203.
31
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
8. Костючеко АЛ., Дьяченко ПК. Внутривенный наркоз и антинаркотики. — СПб.,
1998. - С. 33-50.
9. Крыжановский Т.Н. Центральные патофизиологические механизмы патологи-
ческой боли. — Боль и ее лечение, № 12, 2000. — С. 2—4.
10. Лихванцев В.В. Практическое руководство по анестезиологии. — М.: Мед. ин-
формационное агентство, 1998. — С. 145—148, 263—283.
11. Морган Дж. Эдвард, Мэгид С. Михаил. Клиническая анестезиология. Пер. с
англ., под ред. акад. РАМН Бунятяна А.А., Издание 2-е, кн.1. — Бином, Невский
Диалект, М./СПб., 2001. - С. 174-198.
12. Осипова Н.А. Антиноцицептивные компоненты общей анестезии и послеопе-
рационной аналгезии. — Анестезиология и реаниматология, № 5, 1998. — С. 11—15.
13. Осипова Н.А., Петрова В.В., Береснев В.А., Долгополова Т.В., Железкина Н.В.
Профилактическая аналгезия — новое направление в анестезиологии. — Анестезиоло-
гия и реаниматологи, № 6, 1999. — С. 13—18.
14. Усенко Л.В., Шифрин Г.А. Концепция антиноцицептивного обезболивания. —
К.: Здоров’я, 1993. — 192 с.
15. Чепкий Л.П., Новицкая-Усенко Л.В., Ткаченко Р. О. Анестезюлопя та 1нтенсивна
тератя. — К.: Вища школа, 2003. — С. 99—116.
32
3. ПРЕДОПЕРАЦИОННЫМ ПЕРИОД
3.1. ПРЕДОПЕРАЦИОННЫЙ ОСМОТР
Пациентов, которым запланировали проведение
оперативного вмешательства, анестезиолог осматривает до опера-
ции для оценки состояния здоровья. Во время предоперационно-
го осмотра, как правило, анестезиолог и пациент знакомятся, и
от качества первого контакта во многом зависят дальнейшее со-
трудничество и результаты лечения.
В случаях плановых оперативных вмешательств первичный
предоперационный осмотр чаще всего проводят в день накануне
операции, в некоторых случаях — утром в день операции. Осмотр
пациентов с высоким риском развития осложнений и летального
исхода желательно проводить ранее, чем за сутки до операции,
так как примерно в 20 % случаев таким больным необходима
коррекция плана подготовки и проведения анестезии [1]. В слу-
чаях неотложных оперативных вмешательств предоперационный
осмотр проводят непосредственно перед операцией.
Kindler С.Н. и соавторы [2] исследовали некоторые количе-
ственные показатели предоперационного осмотра: средняя про-
должительность предоперационного общения анестезиолога с па-
циентом составила 16,1 ± 7,8 мин (диапазон от 3,7 до 42,7 мин);
анестезиологи произносили приблизительно 170 фраз за визит,
пациенты — 150; пол врача и пациента не влияли на распределе-
ние фраз и длительность визита; разговор концентрировался, в
основном, на биомедицинских темах с малой долей психосоци-
альной дискуссии (< 0,1 % всех высказываний анестезиологов);
анестезиологи довольно часто использовали эмоциональные ком-
ментарии по отношению к пациентам (7 %) и тем самым вовле-
кали их в разговор; применение анестезиологами упрощений,
открытых вопросов и эмоциональных утверждений коррелиро-
вало со значительным вовлечением пациентов в общение; анес-
тезиологи предоставляли пациентам больше возможностей для
2 7-685
33
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
обсуждения альтернативных способов лечения в сравнении с врачами общей
практики.
Предоперационный осмотр включает: изучение истории болезни, сбор анамне-
за, физикальный осмотр, интерпретацию результатов имеющихся обследований и
анализов, оценку анестезиологического риска, назначение дополнительных мето-
дов обследования и консультаций других специалистов (при необходимости), вы-
работку плана проведения анестезиологического обеспечения, в том числе оценку
возможных трудностей и путей их преодоления.
Пациента и историю болезни к предоперационному осмотру анестезиологом
готовит лечащий врач (чаще — хирург), который с должной степенью понимания
должен отнестись к этому этапу оперативного лечения, в частности — к своевре-
менности и точности проведения предоперационных тестов и анализов. Исследо-
вания проводят, в первую очередь, для повышения безопасности наркоза и улуч-
шения результатов лечения, а не “для анестезиолога”. Зачастую от результатов
предоперационного осмотра анестезиологом тяжелых больных зависит вопрос
функциональной операбельности, то есть способности больного пережить пла-
нируемый вид оперативного вмешательства. Соответственно, решают вопросы:
показано ли больному оперативное лечение? Какую максимальную по объему
операцию больной может перенести? Ответы на эти вопросы во многом зависят от
уровня организации работы в медицинском учреждении, слаженности работы хи-
рургической и анестезиологической бригад и доверительного отношения между
ними, которые возможны только при условии высокой квалификации медицинс-
кого персонала.
Внушение больному мысли о благоприятном результате операции является
одной из важных задач предоперационного осмотра анестезиолога. Случается, что
этого трудно достичь, особенно, когда функциональная операбельность пациента
сомнительна, или в случаях, когда больному предоставлено право выбора: прово-
дить операцию или нет. Если вопрос о проведении операции решен положитель-
но, то анестезиолог должен всячески усилить веру больного в благоприятный ис-
ход операции, так как эмоциональное состояние пациента во многом определяет
результат общения с анестезиологом во время предоперационного осмотра. Иног-
да хорошая психотерапевтическая подготовка больного, проведенная накануне
операции высокопрофессиональным специалистом, имеет лучший успокоитель-
ный эффект, чем назначение снотворных и седативных средств.
Швейцарские исследователи [3] провели анкетный опрос среди больных и
специалистов-анестезиологов по проблемам предоперационного периода. Соглас-
но исследованию, анестезиологи склонны неправильно интерпретировать многие
ожидания и точки зрения пациентов.
Влияние индивидуальной удовлетворенности пациента дооперационным осмот-
ром на послеоперационные осложнения (тошноту/рвоту, скорость восстановления
после анестезии, выраженность послеоперационной боли, физический дискомфорт)
авторы исследования проанализировали посредством метода структурного модели-
рования [4]. Показатели пола, возраста и продолжительности операции использова-
ли в качестве переменных данных. Модель продемонстрировала, что дооперацион-
ное интервью анестезиолога в комбинации со связанными с ним побочными эф-
фектами объясняет до 45 % случаев развития чувства физического дискомфорта и
в 18 % случаев — удовлетворение лечением. Таким образом, результаты исследова-
ний показали, что улучшение качества предоперационных посещений анестезиоло-
га (совершенствование осмотра и сбора анамнеза, увеличение потенциала положи-
34
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
тельного влияния врача на пациента) приведут к снижению числа побочных эф-
фектов анестезии и ускорению восстановления после операции.
Анестезиолог совместно с лечащим врачом (оперирующим хирургом) опреде-
ляют течение преднаркозного периода. Известно, что наркоз и операция усугуб-
ляют течение острых процессов и способствуют их генерализации, поэтому важ-
нейшей задачей предоперационного осмотра является диагностика состояний, при
которых плановое оперативное вмешательство не показано: острая артериальная
гипертензия, острые нарушения ритма сердца, острая ишемия миокарда, острые
инфекционные заболевания (особенно верхних дыхательных путей).
3.1.1. Сбор анамнеза
Перечень вопросов, которые задает анестезиолог во время пред-
операционного осмотра, определяют индивидуально, но существуют обязатель-
ные вопросы, ответы на которые позволяют анестезиологу наилучшим образом
обеспечить проведение наркоза и минимизировать возможные осложнения.
Анестезиологи с большим опытом работы, как правило, не задают весь комп-
лекс вопросов во время предоперационного осмотра, но и не пропускают ни од-
ной важной детали. Учитывая интеллектуальные способности пациента и клини-
ческую картину заболевания, вполне вероятно появление дополнительных вопро-
сов. Необходимо помнить, что не все пациенты, исходя из уровня интеллекта,
культуры и воспитания, могут дать внятные ответы на задаваемые вопросы. На-
пример, чтобы выяснить реакцию на использование местных анестетиков, эффек-
тивнее сформулировать опосредованный вопрос: “Была ли экстракция зубов в
анамнезе? Как ее перенес больной?” Необходимо расположить к себе пациента,
завоевать его доверие, чтобы он перед операцией рассказал врачу все о своем
здоровье. Анестезиолог должен обладать необходимой степенью психотерапевти-
ческих навыков, а это качество — особый дар врача.
Вопросы анестезиолога во время предоперационного осмотра
Анамнез жизни. Проводили больному ранее операции под общей анестезией?
Если “да”, то какими осложнениями сопровождались — трудной интубацией, дли-
тельным пробуждением, длительным отсутствием спонтанного дыхания, тошно-
той/рвотой после операции и др.? Сколько времени больной после операции на-
ходился в ОИТ (реанимации)?
Семейный анамнез. Какие операции под общей анестезией проводили кров-
ным родственникам, и какими осложнениями они сопровождались?
Аллергологический анамнез. Отмечали ранее аллергические реакции? Если “да”,
то на какие аллергены — антибиотики, местные анестетики, др.? Как проявлялась
аллергическая реакция — анафилактическим шоком, бронхиолоспазмом, кожны-
ми высыпаниями, др.?
Система крови. Проводили в прошлом переливания крови? Если “да”, то как
пациент реагировал? Отмечали ранее обильные кровотечения (из носа, десен и
др.) или массивные гематомы? Страдает ли пациент какой-либо формой врожден-
ных коагулопатий (гемофилией, др.)?
Нервная система. Какие нарушения функции ЦНС отмечали в прошлом (ин-
сульты, судороги, др.)? Страдает ли пациент наркоманией, токсикоманией, ал-
коголизмом? Принимал/принимает снотворные препараты, антидепрессанты, нар-
котики, амфетамины и средства подобного действия?
35
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Сердечно-сосудистая система. Страдает ли пациент артериальной гипер-, ги-
потензией? Если “да”, то какой уровень “рабочего” АД?
Страдает ли пациент ИБС (стабильной, нестабильной формой)? Были в анам-
незе: инфаркт миокарда (когда перенесен, какой характер, лечился ли в ОИТ и
как долго); ревматизм, пороки сердца, нарушения ритма сердца? Для каждого
заболевания уточняют, какое лечение проводили, какие препараты пациент при-
нимает в данный момент.
Система дыхания. Бывали/бывают у пациента состояния диспноэ, ортопноэ?
Как пациент переносит физическую нагрузку? Страдает кашлем, выделением мок-
роты (ее характер), кровохарканьем, бронхоспазмом, бронхиальной астмой, аст-
матическим бронхитом? Были в анамнезе пневмонии?
Если пациент курит, то на протяжении какого времени и сколько сигарет в день?
Система пищеварения. Были в анамнезе гепатиты, желтухи? Предъявляет па-
циент жалобы на диспепсические явления и нарушения питания? Страдал/страда-
ет гастритом, язвой желудка или 12-перстной кишки? Они сопровождались кро-
вотечениями или перфорацией?
Злоупотребляет пациент алкоголем?
Мочеполовая система. Страдал/страдает нефритом, пиелонефритом, почечно-
каменной болезнью?
Страдает пациент-женщина нарушениями менструального цикла? При необ-
ходимости проводят тест на беременность.
Скелетно-мышечная система. Страдал/страдает артритами, артрозами, осте-
порозом, миастенией?
Эндокринная система. Страдает пациент сахарным диабетом (наличие чувства
жажды, частота мочеиспусканий, уровень глюкозы в крови и моче, характер тера-
пии), заболеваниями щитовидной и паращитовидной желез, надпочечников (ха-
рактер терапии)?
Иммунная система. Какие инфекционные заболевания были в анамнезе? Стра-
дает аутоиммунным заболеванием? С каким диагнозом состоял/состоит на дис-
пансерном учете у дерматовенеролога или врача-инфекциониста?
3.1.2. Физикальный осмотр
Определяют цвет кожных покровов и видимых слизистых: диффуз-
ный цианоз свидетельствует о респираторном характере гипоксии (дифференци-
альный признак — отсутствие изменения цвета ногтевых фаланг пальца руки пос-
ле массирования); акроцианоз свидетельствует о циркуляторном характере гипок-
сии (более розовый цвет ногтевой фаланги после массирования); выраженная
бледность кожных покровов свидетельствует об анемии или нарушении перифе-
рического кровообращения, желтушность — о гипербилирубинемии.
Определяют наличие периферических отеков с целью дифференцирования сер-
дечной и почечной недостаточностей.
Оценивают волемический статус: состояние слизистой языка, наполнение
шейных вен, диурез, наличие ортостатической гипотензии (см. раздел 3.1.5).
Оценивают неврологический статус: уровень сознания, наличие сенсорных и
моторных периферических расстройств.
Обследуют верхние дыхательные пути при помощи тестов, прогнозирующих
трудную интубацию (см. раздел 9.3.4).
36
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Оценивают систему дыхания: характер дыхания (определяют стридорозное
дыхание и ортопноэ); тип одышки — инспираторный или экспираторный; прово-
дят аускультацию легких с целью исключения острой патологии легких — пнев-
монии, бронхита, ателектаза, пневмоторакса и др.
Оценивают сердечно-сосудистую систему: качественные и количественные по-
казатели периферического пульса, учитывая эмоциональное состояние пациента
перед операцией; показатели АД (при необходимости — на обеих руках); проводят
аускультацию тонов сердца, с целью определения ритма, шумов, наличия третьего
или четвертого тонов сердца.
Проводят пальпацию живота: определяют нижнюю границу печени и т. д.
Оценивают подвижность суставного аппарата: наличие деформаций, тугопод-
вижности суставов, ограничения амплитуды движений (от этого зависит выбор
положения пациента на операционном столе).
3.1.3. Лабораторные и инструментальные
методы исследования
Объем предоперационных лабораторных анализов и инструмен-
тальных исследований определяют характером предстоящей операции и индиви-
дуальными особенностями пациента.
Перечень стандартных предоперационных исследований:
общий анализ крови — количество эритроцитов, гемоглобин и/или гематокрит,
количество лейкоцитов, лейкоцитарная формула, тромбоциты (табл. 3.1);
биохимические показатели — глюкоза крови, мочевина и/или креатинин, элек-
тролиты (чаще достаточно определения уровня К+ и Na+), общий белок и альбу-
мин, билирубин, печеночные ферменты (табл. 3.2, 3.3; раздел 3.2.4);
коагулограмма — акцентируют внимание на показателях протромбинового вре-
мени и АЧТВ (табл. 3.4);
общий анализ мочи — акцентируют внимание на показателях относительной
плотности, степени прозрачности, наличии осадка (см. раздел 3.2.3);
электрокардиография-,
рентгенография грудной клетки-,
легочные функциональные тесты — жизненная емкость легких (ЖЕЛ), форси-
рованный объем выдоха за 1 с (ФОБ/, соотношение ФО В/ЖЕЛ, газовый состав
крови и pH (см. раздел 3.2.2).
В литературе нет четких стандартов и рекомендаций по комплексу необходи-
мых лабораторных исследований у всех больных перед операцией. На современ-
ном этапе утверждается тенденция к уменьшению количества анализов и обследо-
ваний перед операцией. По-видимому, нет необходимости проводить предопера-
ционное обследование всем больным в вышеуказанном объеме.
Cole и Schlunt [5] предложили уточнения в перечне предоперационных тестов:
• гемоглобин/гематокрит определять у детей, пожилых, перед операциями на
сердце и сосудах, у пациентов с онкологическими заболеваниями и в процессе
проведения химиотерапии, у пациентов с кровотечениями в анамнезе;
• лейкоцитарную формулу определять у больных с гематологическими заболе-
ваниями, после проведенных химиотерапии или операций на сосудах;
• ЭКГ проводить только больным старше 50 лет, а также пациентам, страдаю-
щим заболеваниями сердца, артериальной гипертензией, заболеваниями сосудов;
37
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
• глюкозу крови определять у пациентов, страдающих сахарным диабетом и/
или ожирением, у больных старше 60 лет, принимающих глюкокортикоиды;
• электролиты определять у больных с нарушениями функции почек и систе-
мы пищеварения, с диабетом и другими эндокринными расстройствами, у боль-
ных, принимающих диуретики, препараты дигиталиса (в настоящий момент или в
анамнезе), с нарушениями ритма сердца, при алкоголизме;
• коагулограмму определять у больных с коагулопатиями, повышенной крово-
точивостью, болезнями печени, принимающих антикоагулянты, аспирин, несте-
роидные противовоспалительные средства, при операциях на сосудах и т. п.
Об определении количества эритроцитов Cole и Schlunt не упоминают вообще.
Можно соглашаться или оспаривать тенденцию к уменьшению количества
анализов и исследований перед операцией, но анестезиологу при назначении ме-
тодов обследования необходимо помнить, что увеличение их количества повы-
шает стоимость лечения, поэтому каждое назначение должно быть обоснованным.
Анестезиолог и лечащий врач несут ответственность за качество предоперацион-
ного обследования. Назначение перечня методов обследования перед операцией,
в том числе консультаций специалистов, является прерогативой анестезиолога.
3.1.4. Интерпретация результатов
анализов и исследований
Гемоглобин. В литературе не указан четкий порог анемии, при
котором больному противопоказано оперативное лечение. Несомненно, что кон-
центрация гемоглобина (Нв) более 100 г/л при отсутствии гиповолемии является
достаточной для проведения операции у большинства пациентов (см. табл. 3.1).
Исключение составляют пациенты с хронической сердечно-легочной недостаточ-
ностью и компенсаторной исходной полицитемией (пороки сердца, хроническая
дыхательная недостаточность и др.).
В некоторых клинических ситуациях при показателях гемоглобина 70—90 г/л
анестезиолог решает вопрос о необходимости проведения гемотрансфузии. В та-
ких случаях учитывают факторы: как пациент переносит анемию, каков характер
анемии — хронический или острый (при хронической анемии организм адаптиро-
ван к снижению гемоглобина), каковы характер планируемой операции и объем
предполагаемой кровопотери, возраст пациента и наличие у него сопутствующих
заболеваний сердца, сосудов, легких.
По рекомендации Duke J. [1] при операциях с планируемой небольшой интрао-
перационной кровопотерей у больных класса I—II по ASA (табл. 3.5) при отсутствии
гиповолемии допустимо снижение гематокрита до 0,18 л/л, у больных класса III по
ASA гематокрит должен быть не ниже 0,24 л/л, у больных ИБС — более 30 л/л.
Хотя состояние выраженной анемии увеличивает риск операции, в предопе-
рационный период гемотрансфузии проводят по строгим показаниям, учитывая
возможные отрицательные эффекты. Авторы не обнаружили в литературе реко-
мендаций по показаниям к гемотрансфузиям у больных с полицитемией, у кото-
рых понижен показатель НЬ.
Глюкоза крови. Определение показателя глюкозы крови должно стать рутин-
ным методом исследования, так как частота нарушений обмена глюкозы и инсу-
лина достаточно высока (см. табл. 3.2). Стабильная нормогликемия является важ-
ным условием благоприятного результата операции у многих хирургических боль-
38
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
ных. Коррекция гликемии проблематична у больных сахарным диабетом, при не-
которых онкологических заболеваниях, тяжелом шоке. У пациентов, которые при-
нимают p-блокаторы, определение глюкозы крови — обязательный метод иссле-
дования [7].
Мочевина и креатинин. Определение мочевины крови, как правило, является
рутинным исследованием, хотя нет необходимости исследовать этот параметр у
всех пациентов (см. табл. 3.2). Прежде всего его определяют у больных с наруше-
ниями функций почек и печени, у пожилых пациентов, у пациентов, страдающих
сахарным диабетом, выраженным атеросклерозом сосудов и артериальной гипер-
тензией.
Для выяснения причин повышенного уровня мочевины исследуют креатинин
крови. Оба этих показателя определяют у больных, которым вводили нефроток-
сичные рентгенконтрастные вещества, у больных, длительно получающих диуре-
тики, ингибиторы ангиотензин-превращающего фермента, аминогликозиды, дру-
гие потенциально нефротоксичные препараты, или при высоком риске ишемии
почек во время планируемой операции (например, из-за пережатия аорты).
Для определения возможных причин повышения показателей мочевины и
креатинина крови исследуют клиренс креатинина. Снижение клиренса креатини-
на является показанием для коррекции доз многих применяемых в перинаркоз-
ном периоде лекарственных препаратов.
Незначительное повышение уровня мочевины при нормальном уровне креа-
тинина не является абсолютным противопоказанием к плановой операции.
Электролиты. Показаниями к определению электролитов плазмы (К+, Na+,
CI", при необходимости — Са**; см. табл. 3.3) являются анамнестические данные
и результаты физикального осмотра: нарушения функций сердца, печени, почек,
пищеварительного тракта, наличие в анамнезе сахарного и несахарного диабетов,
других эндокринных расстройств, нарушения водного баланса.
Коррекция гипокалиемии, особенно хронической, в достаточной степени слож-
ный процесс, тем более что после быстрой коррекции риск осложнений со сторо-
ны сердца может сохраняться. Противопоказанием к плановой операции является
гиперкалиемия (свыше 6 ммоль/л), которая, прежде всего, свидетельствует о не-
достаточности функции почек и грозит серьезными осложнениями в периопера-
ционный период.
Нарушения концентрации Na* связаны с состоянием водного баланса
(см. раздел 3.1.5). Особенно обращают внимание на уровень Na* у нейрохирурги-
ческих больных. При тяжелых расстройствах КОС, особенно хронических, а так-
же у больных с некоторыми эндокринными расстройствами серьезной проблемой
является нарушение обмена Са**.
Общий белок и альбумин крови. Этот вид исследования не является обязатель-
ным для всех больных, но показан при отеках, асците, заболеваниях печени, нару-
шениях питания (см. табл. 3.2). Известно, что гипоальбуминемия коррелирует с
неблагоприятными результатами лечения пациентов с острыми заболеваниями.
Результаты работ, исследующих терапию альбумином для коррекции гипоальбу-
минемии, оказались неубедительными.
Vincent J.L. и соавторы [8] провели метаанализное исследование с использо-
ванием мультивариантного анализа, включавшее 291 433 пациента, у которых
гипоальбуминемию оценивали в качестве предиктора исхода лечения, а также,
отдельно, в девяти проспективных контролируемых исследованиях, включавших
535 пациентов, у которых гипоальбуминемия была скоррегирована. Оказалось,
39
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
что гипоальбуминемия является мощным независимым предиктором неблагопри-
ятного результата. Снижение на каждые 10 г/л концентрации альбумина суще-
ственно повышало летальность — на 137 %, заболеваемость — на 89 %, длитель-
ность пребывания в ОИТ и в стационаре соответственно на 28 и 71 %, увеличива-
ло ресурсные затраты — на 66 %. Взаимосвязь между гипоальбуминемией и
неблагоприятным результатом лечения не зависела от питания пациентов и степе-
ни воспаления. Согласно исследованию, терапия альбумином снижала риск пос-
леоперационных осложнений в случаях, когда удавалось повысить концентрацию
альбумина в сыворотке крови выше 30 г/л. Таким образом, пока не существует
доказательств для отказа от терапии альбумином при наличии гипоальбуминемии
перед операцией.
Билирубин, печеночные пробы. Во многих учебниках и руководствах по анесте-
зиологии исследование уровня билирубина не входит в перечень обязательных
преднаркозных анализов. Вероятно, это вызвано доступностью определения жел-
тухи визуальным способом, хотя известно, что в острой стадии гепатита желтуш-
ность кожных покровов и слизистых оболочек выражена не резко. Так как визу-
альный способ определения цвета кожи является субъективным и весьма сомни-
тельным методом, то исследование уровня билирубина крови проводят перед
операцией у большинства больных (см. табл. 3.2).
Показаниями к определению печеночных ферментов (АЛТ, ACT) являются:
повышенный уровень билирубина, желтуха в анамнезе, хронический гепатит, ал-
коголизм, операции на печени и желчных протоках, патологическое ожирение,
злокачественные опухоли, прием гепатотоксичных препаратов (метатрексата, ри-
фампицина и др.).
Уровень билирубина до 50—55 мкмоль/л при отсутствии клинической симп-
томатики и нормальных показателях печеночных ферментов не должен быть при-
чиной отмены операции.
Коагулограмма. Многие специалисты не считают коагулограмму обязатель-
ным дооперационным исследованием. Однако, учитывая значение функции гемо-
стаза во время операции, определение показателей протромбинового времени,
фибриногена, АЧТВ, INR (Международного нормализованного отношения) про-
водят у большинства пациентов (см. табл. 3.4). Согласно современным представ-
лениям [5], показатели свертываемости крови и время кровотечения не являются
информативными тестами для оценки функции системы гемостаза во время опе-
рации.
Коагулограмма — обязательное исследование у больных, принимающих анти-
когулянты или антиагреганты, у больных с коагулопатией в анамнезе и при пла-
нируемой большой интраоперационной кровопотере. При наличии показаний
определение АЧТВ, как одного из наиболее информативных тестов, должно быть
обязательным.
Общий анализ мочи. Исследование проводят для определения концентрацион-
ной функции почек, диагностики заболеваний почек и мочевыводящих путей (см.
раздел 3.2.3).
Электрокардиография. Назначение ЭКГ больным молодого возраста без тяже-
лых сопутствующих заболеваний, которым планируют нетравматичное кратковре-
менное оперативное вмешательство, нецелесообразно.
В большинстве случаев ЭКГ является рутинным исследованием предопераци-
онного периода, который незаменим при острой ишемии миокарда, остром ин-
фаркте миокарда, нарушениях ритма сердца. Тяжелые нарушения, обнаруженные
40
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
на электрокардиограмме, могут стать основанием для отмены и/или переноса пла-
нового оперативного вмешательства. Изменения электрокардиограммы учитыва-
ют при выборе метода анестезии. Некоторые показатели ЭКГ, например незначи-
тельное снижение метаболизма или незначительные нарушения проводимости
миокарда, обнаруживают у многих пациентов. Такого рода нарушения не повы-
шают риск периоперационных осложнений со стороны сердца.
У больных перед операцией при проведении ЭКГ возможны диагностические
находки [6] в виде фибрилляции предсердий, атриовентрикулярной блокады, ише-
мии миокарда, предсердных или желудочковых экстрасистол, гипертрофии желу-
дочков сердца. У больных старше 40 лет ЭКГ — обязательный метод исследования.
Рентгенография грудной клетки. Нет необходимости проводить РГК всем пред-
операционным больным. Показаниями к выполнению РГК являются: заболева-
ния легких и сердца в анамнезе (частые пневмонии, бронхиальная астма, обструк-
тивный бронхит, длительное курение, легочная гипертензия, ИБС, болезни кла-
панного аппарата сердца, застойная сердечная недостаточность); жалобы на
кровохарканье и откашливание большого количества мокроты; данные осмотра
(диспноэ) и аускультации (наличие хрипов и участков ослабленного дыхания в
легких); торакотомия, часто — лапаротомия; онкологические заболевания.
При подозрении на ателектаз легкого, пневмо- или гидроторакс проведение
РГК является обязательным. Особенно часто осложнения развиваются при спон-
танном пневмотораксе, когда больного ошибочно берут на операцию по поводу
другого заболевания (часто на лапаротомию), и после интубации состояние боль-
ного резко ухудшается. В таком случае, если своевременно не выполнить декомп-
рессию плевральной полости, больной может умереть от напряженного пневмото-
ракса. Спонтанный пневмоторакс может симулировать клинику острого инфаркта
миокарда.
Исследование функции внешнего дыхания проводят, практически, по тем же по-
казаниям, что и РГК: тяжелые легочная и/или сердечная недостаточности, опера-
ции на легких (показатели дыхательных тестов — один из прогностических факто-
ров результатов операции), бронхиальная астма, хронические неспецифические
заболевания легких у пациентов пожилого возраста (см. раздел 3.2.2).
Определение группы крови и Rh-фактора — обязательное исследование перед
операцией повышенной сложности, в процессе которой существует даже незначи-
тельная вероятность большой кровопотери.
В клинической практике часто возникает дилемма: какие результаты исследо-
вания группы крови и Rh-фактора принимать к сведению — из отметки в паспор-
те, полученные ранее в каком-либо лечебном учреждении или проведенные нака-
нуне операции? Авторами не найдено четкого ответа на этот вопрос в специализи-
рованной литературе. По-видимому, многое зависит от качества документа, который
подтверждает группу крови и Rh-фактор, а также от внутренних правил, которые
существуют в конкретной больнице.
Дополнительные методы обследования. В процессе предоперационной оценки
состояния больного для определения риска предстоящего оперативного вмеша-
тельства могут понадобиться дополнительные методы обследования, которые про-
водят по необходимости, например, компьютерную томографию, гастро-, брон-
хоскопию и т. д.
Повторное проведение обследований. В клинической практике иногда возни-
кают ситуации, когда давнишние сроки предоперационных анализов и иссле-
дований становятся причиной серьезных разногласий между хирургом и анесте-
41
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
зиологом. По рекомендациям Cole и Schlunt [5] нет необходимости проводить
повторные исследования, если они были выполнены в течение предыдущих
6 месяцев, не выявили патологии, и при этом не возникли какие-либо дополни-
тельные показания к их повторному проведению (изменение клинической кар-
тины, появление у больного новых жалоб). Если же в результатах исследований
были обнаружены отклонения от нормы, то обследования повторяют накануне
операции.
Таблица 3.1. Показатели периферической крови взрослого человека [10]
Показатель Нормальное значение
Количество эритроцитов, х1012/л Муж. 4,0-5,1 Жен. 3,7-4,7
Гемоглобин, г/л Муж. 130-160 Жен. 120-140
Количество тромбоцитов, х 109/л 150-300
Количество лейкоцитов, х 109/л 4,0-8,8
Лейкоцитарная формула: • миелоциты • метамиелоциты • нейтрофилы, х 109/л или %: палочкоядерные сегментоядерные • эозинофилы, х 109/л или % • базофилы, х 109/л или % • лимфоциты, х 109/л или % • моноциты, х109/л или % отсутствуют отсутствуют 0,040—0,300 или 1—6 2,0-5,5 или 45-70 0,02-0,30 или 0-5 0-0,065 или 0-1 1,2-3,0 или 18-40 0,09-0,60 или 2-9
Скорость оседания эритроцитов, мм/ч Муж. 1-10 Жен. 2-15
Гематокрит, л/л Муж. 0,40-0,48 Жен. 0,36-0,42
Таблица 3.2. Биохимические показатели крови взрослого человека [10]
Показатель Нормальное значение
Глюкоза, ммоль/л: • плазмы • цельной капиллярной крови 4,22-6,11 3,88-5,55
Общий белок, г/л 64-83
Альбумин, г/л 31-65
42
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Продолжение табл. 3.2
Показатель Нормальное значение
Общий билирубин по Йендрашеку, мкмоль/л • прямой билирубин, мкмоль/л • непрямой билирубин, мкмоль/л 8,5-20,5 0-5,1 до 16,5
Мочевина: • крови, ммоль/л • мочи, ммоль/сут 2,5-8,3 330-580
Креатинин: • крови, ммоль/л Муж. 0,053-0,166 Жен. 0,044-0,097
• мочи, ммоль/сут Муж. 8,8-17,7 Жен. 7,1-15,9
Клиренс креатинина, мл/(с-м2) Муж. 0,93-1,32 Жен. 0,85-1,23
Осмолярность плазмы, мОсм/кгН2О 280-290
Таблица 3.3. Показатели водно-электролитного обмена взрослого человека [10]
Показатель Нормальное значение
Натрий, ммоль/л: • плазмы • мочи 135-152 до 340
Калий, ммоль/л: • плазмы • мочи 3,6-6,3 39-91
Кальций, ммоль/л: • плазмы • мочи 2,2-2,75 0,25-4,99
Кальций ионизированный, ммоль/л 1,0-1,15
Магний: • плазмы, ммоль/л • мочи, ммоль/сут 0,7-1,2 до 0,41
Хлориды: • плазмы, ммоль/л • мочи, ммоль/сут 95-110 99,1-297,3
Неорганический фосфор: • плазмы, ммоль/л • мочи, ммоль/сут 0,81-1,55 19,37-31,29
43
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 3.4. Показатели системы свертывания крови и фибринолиза
взрослого человека [10]
Показатель Нормальное значение
Время свертывания крови, мин: - капиллярная кровь • венозная кровь 5-10 начало: 0,5-2; конец: 3-5
Время кровотечения, мин не более 4
Протромбиновое время (по Квику), с 11-15
Активированное частичное тромбопластиновое время (АЧТВ), с 30-40
Активирование время рекальцификации (АВР), с 80-120
Протромбиновый индекс 0,93-1,07 или 80-105 %
Тромбиновое время, с 12-17
Продукты деградации фибрина (ПДФ), мкг/л 5-10
Растворимые фибрин-мономерные комплексы (РФМК), ед. 0,35-0,47
Фибриноген, г/л 2-4
Эуглобулиновый лизис (время растворения фибринового сгустка), ч 3-5
XII-А зависимый фибринолиз, мин 6-12
Антитромбин-Ш, г/л или % 0,21-0,30 или 85-110
Толерантность плазмы к гепарину, мин 6-9
Международное нормализованное отношение (INR) 1-2
3.1.5. Оценка жидкостного баланса организма
Одной из основных функций мочевыделительной системы явля-
ется регуляция жидкостного баланса организма. Оценку жидкостного баланса орга-
низма основывают на данных анамнеза (объеме принимаемой жидкости в послед-
ние несколько суток; наличии рвоты, поноса; объеме диуреза), состояния созна-
ния, тургора кожи, наполнения вен шеи, величины АД в горизонтальном и
вертикальном положениях, ЧСС, наполнения вен, показателей гематокрита и ЦВД,
концентрации электролитов.
Для оценки волемии используют ортостатическую пробу: если систолическое
АД снижается при переходе в вертикальное положение более чем на 20 % и при
этом увеличивается ЧСС, то дефицит жидкости составляет 6—8 % массы тела.
Если же пульс не ускоряется, то причиной ортостатической гипотензии могут
быть нарушения регуляции автономной нервной системы или применение анти-
гипертензивных средств. Ортостатические изменения АД наблюдают у 20—30 %
пожилых пациентов при отсутствии гиповолемии [11].
44
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Коррекция гиповолемии является важным условием гемодинамической ста-
бильности пациента во время операции. Гиповолемию диагностируют по показа-
телям лабораторных анализов, которые свидетельствуют о гемоконцентрации, азо-
темии, низкой концентрации Na+ в моче. При гиповолемии и нормальной функ-
ции почек повышается реабсорбция Na+ и воды в почечных канальцах: содержание
Na+ в моче — менее 20 ммоль/л, осмолярность мочи — более 400 мосмоль/л,
соотношение креатинина мочи/плазмы — более 40:1. Эти показатели обладают
хорошей чувствительностью, но низкой специфичностью.
Олигурия при отсутствии нарушений функции почек свидетельствует о зна-
чительном дефиците жидкости в организме.
3.2. ОЦЕНКА ОПЕРАЦИОННОГО РИСКА
Идентификация пациентов хирургического профиля с высоким
риском развития осложнений и смертности, а также оптимизация у них периопе-
рационной терапии являются важными составляющими клинической анестезио-
логической практики.
Определение степени операционного риска является принципиальным про-
гностическим фактором, который влияет на многие последующие звенья лечения:
принятие решения о функциональной операбельности больного (перенесет ли
больной операцию, и если перенесет, то какую), выбор анестезиолога и хирурга,
выбор метода анестезии, возможность развития осложнений и методов их предот-
вращения, план ведения раннего послеоперационного периода. Недооценка фак-
торов операционного риска может привести к тяжелым интраоперционным ос-
ложнениям.
Для оценки операционного риска используют классификацию объективного
статуса больного, предложенную Американской ассоциацией анестезиологов —
ASA (см. табл. 3.5). Эффективность этой классификации доказана ее многолетним
применением в клинической практике специалистами всего мира. Тем не менее, в
ней есть определенные недостатки, а именно: классификация позволяет опреде-
лять лишь статус здоровья пациента и не учитывает множество других рисков,
например степень технической сложности операции и т. п. Разработаны класси-
фикации, в которых учтено детальное соотношение разносторонних факторов риска,
и все же классификацию ASA наиболее часто применяют в мировой практике и
считают универсальной.
Таблица 3.5. Классификация объективного статуса больного по ASA
Класс Объективный статус
I Системные расстройства отсутствуют (условно здоровый пациент)
II Легкие системные расстройства без функциональных нарушений, то есть заболевания в стадии компенсации (например, гипертоническая болезнь, сахарный диабет, хронический бронхит)
III Тяжелое системное заболевание с функциональными нарушениями (например, тяжело контролируемая артериальная гипертензия, сахарный диабет с осложнениями, ИБС, инфаркт миокарда в анамнезе, заболевания дыхательной системы с недостаточностью дыхания)
45
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 3.5
Класс Объективный статус
IV Тяжелое системное заболевание с функциональными нарушениями, которые представляют угрозу для жизни (например, нестабильная форма ИБС, тяжелая сердечная, дыхательная, почечная, печеночная недостаточности)
V Крайне тяжелое состояние пациента, при котором он не выживет без операции (например, разрыв сосудистой аневризмы, ТЭЛА, требующая эмболэктомии, ЧМТ с дислокацией головного мозга)
VI Смерть головного мозга, возможно донорство органов для трансплантации
Е К классу объективного статуса добавляют букву «Е», если хирургическое вмешательство производят по экстренным показаниям
Рейтинг факторов риска неблагоприятного исхода при некардиальных опера-
циях (табл. 3.6) возглавляют следующие причины: застойная сердечная недоста-
точность, инфаркт миокарда (менее 1 года), почечная недостаточность, возраст
старше 80 лет, хронические обструктивные заболевания легких. Данные таблицы 3.6
расширяют и дополняют классификацию ASA, но и эти показатели имеют недо-
статки: в них не учтена степень тяжести заболеваний, которая является усугубля-
ющим фактором риска. Поэтому, только полный учет всесторонних факторов
позволит анестезиологу максимально объективно оценить операционный риск.
Таблица 3.6. Факторы риска и госпитальная летальность при некардиальных
операциях [12]
Фактор риска Госпитальная летальность, %
Возраст старше 80 лет 5,8
Ишемическая болезнь сердца 2,9
Инфаркт миокарда, давность: • более 1 года • менее 1 года 4,0 7,7
Застойная сердечная недостаточность 9,0
Хронические обструктивные заболевания легких 5,0
Почечная недостаточность 5,9
Сахарный диабет 2,1
Операции по экстренным показаниям 2,8
Продолжительность операции более 300 мин 4,9
Обширность операции 3,1
46
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
По данным литературы, количество пациентов с высоким риском летального
исхода и серьезных осложнений после обширной операции составляет более 20 %
от общего количества. Основными факторами операционного риска, главным об-
разом, являются дооперационное состояние пациента, а также уровни функцио-
нальных резервов сердечно-сосудистой и дыхательной систем [9]. По данным Kerwat
и соавторов [13], периоперационный риск определяется состоянием сердечно-
сосудистой системы и степенью сложности хирургического вмешательства.
3.2.1. Оценка состояния сердечно-сосудистой системы
Принципиально важно еще на этапе назначения премедикации
идентифицировать пациентов с кардиальными факторами риска. Кардиальный и
легочной риски операции во многом определяются способностью пациента вы-
полнить физическую нагрузку. Часто тесты с физической нагрузкой более инфор-
мативны, чем выполняемые в покое. Ответ пациента на вопрос о способности
выполнить физическую нагрузку в течение 20 с или подняться на 2-й этаж без
отдыха позволяет выяснить приблизительную степень анестезиологического рис-
ка без особых усилий. При самом низком уровне риска дальнейшую оценку ре-
зервов сердечно-сосудистой и дыхательной систем можно не проводить. Целью
такой схемы является минимизация частоты периоперационных осложнений и
уменьшение времени предоперационного обследования.
Важными факторами периоперационного кардиального риска являются сте-
пень ишемии миокарда и инфаркты миокарда в анамнезе. Older и соавторы [14]
считают, что на послеоперационный результат, главным образом, оказывает вли-
яние состояние функциональных резервов желудочков сердца. Тесты, разработан-
ные для идентификации только ишемии миокарда, недостаточны для обнаруже-
ния сердечной недостаточности и, следовательно, неадекватны для выявления
скрытой формы заболевания и идентификации кардиального риска у экстракар-
диальных хирургических пациентов. Эти авторы считают, что степень сердечной
недостаточности — самый важный предиктор заболеваемости и смертности. В
исследовании авторы использовали кардиопульмональный тест с физической на-
грузкой. Пациенты с анаэробным порогом менее 11 мл/мин/кг имеют повышен-
ный операционный риск при обширной операции. Ишемия миокарда, осложнен-
ная умеренной и тяжелой сердечной недостаточностью (анаэробный порог менее
11 мл/мин/кг), прогнозирует самую высокую заболеваемость и смертность.
Cohen S.P. и Kent С. [15] сообщили о высоком риске интраоперационных
кардиальных осложнений у больных с выраженной дооперационной тахикардией
(ЧСС более 120 в 1 мин) без установленной причины.
Согласно последним научным данным, степень кардиального риска находит-
ся в прямой зависимости от уровня кардиального тропонина в крови. По данным
Landesberg и соавторов [16], у хирургических пациентов с высоким кардиальным
риском во время предоперационного исследования регистрировали “немую” ише-
мию миокарда, которая сопровождалась повышением уровня тропонина без ка-
ких-либо специфических изменений со стороны ЭКГ. Таким образом, повыше-
ние уровня тропонина дает возможность более точно прогнозировать раннюю и
позднюю смертность, чем ишемические изменения в миокарде при ЭКГ.
Одной из наиболее распространенных систем опенки кардиального риска при
некардиальных операциях является шкала Гольдмана (табл. 3.7).
47
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 3.7. Шкала оценки кардиального риска (по Гольдману) [17]
Клинический признак Оценка риска, баллы
Возраст старше 70 лет 5
ОИМ (менее 6 мес) 10
Ритм галопа или давление в яремной вене > 12 см вод. ст. 11
Стеноз аорты с явными клиническими проявлениями 3
Изменения на ЭКГ (предсердная эктопия, желудочковая экстрасистолия более 5 в 1 мин) 7
Нарушения функции других органов: гипоксемия (рО2 < 60 мм рт. ст.), гиперкапния (рСО2 > 50 мм рт. ст.); калий плазмы <3,0 или гидрокарбонат плазмы < 20 ммоль/л; азот мочевины > 50 мг/дл или креатинин >3,0 мг/дл 7
Хроническое заболевание печени 3
Нарушения интеллекта некардиальной причины 3
Хирургические операции (торакальные, абдоминальные, на аорте, ургентные) 4
Максимальное количество баллов 53
Гольдман и соавторы (1977) провели многовариантный анализ кардиального
периоперационного риска у 1001 хирургического больного старше 40 лет, которым
были выполнены некардиальные операции. На основании этого анализа, авторы
определили количественную значимость каждого фактора риска. В зависимости от
суммы набранных баллов кардиальный риск по этой шкале распределен по трем
классам (в последствии шкалу модифицировал Detsky и соавторы, табл. 3.8):
• класс 1 — 0—15 баллов, кардиальный риск менее 3 %;
• класс II — 20—30 баллов, кардиальный риск 3—15 %;
• класс III — более 30 баллов, кардиальный риск более 15 %.
Таблица 3.8. Модифицированная шкала кардиального риска Detsky [18]
Фактор риска Баллы
Ишемическая болезнь сердца: • инфаркт миокарда (менее 6 мес) 10
• инфаркт миокарда (более 6 мес) 5
Ишемия миокарда по классификации Канадской сердечно-сосудистой Ассоциации: • класс 0 — отсутствие симптоматики со стороны сердца; 0
• класс I — признаки ишемии возникают при тяжелой физической нагрузке; 0
- класс II — симптомы ишемии миокарда возникают при средней физической нагрузке; 0
48
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Продолжение табл. 3.8
Фактор риска Баллы
• класс III — симптомы ишемии миокарда возникают при незначительной физической нагрузке, например при небыстрой ходьбе по горизонтальной поверхности; • класс IV — малая физическая нагрузка приводит к дискомфорту 10 20
Альвеолярный отек легких: • в течение последнего года • ранее 10 5
Болезни клапанов сердца: критический стеноз аорты 20
Нарушения ритма сердца: • несинусовый ритм более 5 экстрасистол в 1 мин на ЭКГ перед операцией 5 5
Нарушения общего статуса 5
Возраст старше 70 лет 5
Ургентная операция 10
Общая оценка 0-120
Авторам издания наиболее простыми и в достаточной степени информатив-
ными представляются критерии периоперационного кардиологического риска по
Vanzetto и соавторам [19]: возраст старше 70 лет, ишемия миокарда в анамнезе,
сахарный диабет, q-волна на ЭКГ, инфаркт миокарда в анамнезе, ишемические
изменения сегмента S- Т на ЭКГ, гипертензия с выраженной гипертрофией левого
желудочка, застойная сердечная недостаточность в анамнезе. Кардиальный риск
составляет 2 %, если сумма баллов равна 0 (нет ни одного симптома); кардиаль-
ный риск составляет 4 %, если сумма баллов равна от 1 до 4 (1—4 симптома);
кардиальный риск составляет 16 %, если сумма баллов более 5.
Таблица 3.9. Стратификация кардиального риска при некардиальных хирургических
вмешательствах
Кардиальный риск Вид операции Частота осложнений, %
Высокий Операции на аорте и крупных сосудах, обширные операции на органах груди и живота, сопровождающиеся большой кровопотерей и высокой степенью травматичности >5
Промежуточный Операции без осложнений на голове, шее, костях (таз, бедро); урологические операции (радикальная простатэктомия); некоторые торакальные операции 1-5
Незначительный Все остальные операции; эндоскопические вмешательства <1
49
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Периоперационный кардиальнай риск также увеличивают следующие факто-
ры: нарушения функции дыхания, гипокалиемия, ацидоз, тяжелые заболевания
печени, заболевания, уменьшающие функциональные резервы сердечно-сосудис-
той системы.
3.2.2. Оценка состояния дыхательной системы
Осложнения со стороны легких и послеоперационная недоста-
точность дыхания являются частыми причинами послеоперационной летальности
и увеличения продолжительности лечения. Идентификация факторов риска во
время периоперационной оценки состояния дыхательной системы позволяет их
предотвращать и значительно минимизировать [20].
Факторы риска развития послеоперационных осложнений со стороны легких: воз-
раст старше 60 лет; пол (у мужчин чаше, чем у женщин); хронические обструктив-
ные заболевания легких; хронические заболевания других органов и систем (ИБС,
артериальная гипертензия, диабет, болезни печени и почек, онкологические забо-
левания, инсульт); курение; нарушения дыхания без установленной причины; ос-
трые заболевания верхних и нижних дыхательных путей на протяжении предыду-
щих 2 недель; нарушения когнитивной функции; нарушение двигательного режи-
ма (полная или частичная иммобилизация); ожирение (ИМТ > 27 кг/м2);
продолжительный предоперационный период в стационаре; класс по ASA > II;
продолжительность анестезии более 3 ч; характер операции (верхняя лапарото-
мия); отсутствие предоперационного обучения правильному дыханию; онкологи-
ческое заболевание в анамнезе.
Спирометрия является информативным исследованием для оценки функцио-
нального резерва легких, но по данным одной лишь спирометрии (табл. 3.10,
см. раздел 16.1.1), без комплексного обследования, оценить операционный риск
невозможно. Уменьшение ЖЕЛ свидетельствует о рестриктивном характере сни-
жения дыхательных резервов, снижение ФОВ( и ФОВуЖЕЛ — об обструктивно-
констриктивном. Показатели форсированного выдоха являются наиболее инфор-
мативными критериями для оценки риска осложнений со стороны легких после
операции. Периоперационный риск возрастает при проведении верхней лапаро-
томии и торакотомии. После абдоминальных операций ФОВ) снижается почти на
50 % [5].
Таблица 3.10. Нормальные величины основных показателей спирометрии у взрослого
(т = 70 кг) в положении сидя
Показатель Нормальное значение
ЖЕЛ, л 4,71
ФОВ^ л 3,9
ФОВ^ЖЕЛ, % 83
ФОЕ, л 2,71
Определение газового состава артериальной крови. Артериальные гипоксемия и
гиперкапния являются факторами, которые значительно увеличивают риск рес-
пираторных нарушений в послеоперационный период.
50
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
3.2.3. Оценка функции почек
Приблизительно у 5 % хирургических пациентов диагностируют
нарушения функции почек. Развитие острой почечной недостаточности (ОПН),
является серьезным и частым осложнением послеоперационного периода, поэто-
му предоперационная идентификация пациентов с риском почечных осложнений
и профилактика этих состояний являются важными условиями успешного лече-
ния хирургических больных.
Определяющим фактором периоперационного риска со стороны почек явля-
ется уровень их функционального резерва до операции. Необходимо выяснить
наличие заболеваний почек в анамнезе. У больных с хронической почечной недо-
статочностью частыми симптомами являются анемия и артериальная гипертен-
зия. Значительное влияние на функциональный резерв почек оказывают: возраст
(к 70 годам сохраняют работоспособность лишь 50 % нефронов), атеросклероз,
гипертоническая болезнь, сахарный диабет, заболевания периферических сосу-
дов, заболевания печени.
Характер операций является независимым фактором риска развития ОПН в
послеоперационный период. Наибольший риск представляют операции, сопро-
вождающиеся ишемией почек, например, на брюшном отделе аорты (особенно
при супраренальном пережатии аорты), с использованием искусственного крово-
обращения, операции трансплантации почек и печени, операции с большой кро-
вопотерей и последующей артериальной гипотензией, операции, сопровождаю-
щиеся массивными гемотрансфузиями.
Применение нефротоксичных препаратов — аминогликозидов и рентгенокон-
трастных веществ — увеличивает риск развития ОПН. В отличие от галотана и
севофлюрана, ингаляционные анестетики, в процессе метаболизма которых обра-
зуются свободные ионы фтора (энфлюран), тоже значительно повышают риск
развития ОПН. ОПН в послеоперационный период может развиться из-за приме-
нения нестероидных противовоспалительных средств (например, кеторолака), ко-
торые ингибируют простагландины и вызывают дилатацию почечных сосудов.
У больных с повышенным риском ОПН во время операции и в ранний после-
операционный период обязательным является мониторинг диуреза (с помощью
катетера Фолея). Пристальное внимание анестезиолога обязаны привлечь состоя-
ния олигурии (диурез менее 0,5 мл/кг/ч) и анурии. Необходимо как можно быст-
рее обнаружить их причину и, по возможности, устранить. Следует помнить, что
величина диуреза не всегда коррелирует со степенью повреждения почечной па-
ренхимы.
В данных анализа мочи оценивают степень ее прозрачности, наличие протеи-
нурии, пиурии, цилиндров.
При признаках инфекции мочевыводящих путей — бактериурии и лейкоцшпу-
рии — проводят предоперационную санацию.
О концентрационной функции почек судят по показателю относительной плот-
ности мочи (ОПМ), которую определяют путем сравнения массы 1 мл мочи и 1 мл
дистиллированной воды. При низкой ОПМ (менее 1010) проводят пробы Зим-
ницкого и с сухоедением. Снижение ОПМ, даже при проведении пробы Зимниц-
кого, не всегда свидетельствует о потере почками способности концентрировать
мочу. Для этого дополняют исследование проведением пробы с адиурекрином
(вазопрессином). Применение рентгеноконтрастных веществ, осмодиуретиков,
глюкозы и некоторых других лекарственных средств влияет на показатель ОПМ.
51
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Определение осмолярности мочи помогает дифференцировать различные фор-
мы ОПН.
Гиперкалемия свидетельствует о серьезном нарушении функции почек
(см. табл. 3.3).
Повышение концентрации креатинина в крови (см. табл. 3.2) свидетельствует
о снижении клубочковой фильтрации: если этот показатель увеличен в 2 раза, то,
соответственно, клубочковая фильтрация снижена в 2 раза. Показатель уровня
креатинина зависит от функциональной способности почек, а также от мышечной
массы и физической активности пациента. Уровень креатинина повышается при
заболеваниях печени, диабетическом кетоацидозе, рассасывании гематом, крово-
течениях из пищеварительного канала. В принципе, повышение показателя креа-
тинина крови является поздним симптомом ОПН, поэтому его диагностическая
ценность ограничена.
Клиренс креатинина весьма точно отражает функциональное состояние почек
и почечный резерв. Наиболее точную оценку дает определение клиренса креати-
нина при сборе мочи в течение суток.
ОПН (табл. 3.11) может быть преренальной (нарушение перфузии почек),
собственно почечной, или ренальной, и постренальной (нарушение функции мо-
чевыводящих путей).
Таблица 3.11. Лабораторные дифференциально-диагностические признаки ОПН
Показатель Преренальная ОПН Ренальная ОПН Постренальная ОПН
Азот мочевины, Кр >20 10-20 10-20
Осмолярность мочи, мосмоль/кг >350 <300 >400 <300
Na+ мочи, ммоль/л <20 >40 < 20 (ранняя) > 40 (поздняя)
Относительная плотность мочи >1020 <1010 > 1010 (ранняя) < 1010 (поздняя)
Осадок Норма, гиалиновые цилиндры Патологический Норма, гиалиновые цилиндры
3.2.4. Оценка функции печени
Нарушения функций печени в периоперационный период разви-
ваются намного реже, чем нарушения функций сердца, легких или почек, но, если
острая печеночная недостаточность (ОпечН) развивается, то это серьезное ослож-
нение угрожает жизни больного. Оценка риска развития ОпечН является одной из
целей дооперационного осмотра. Необходимость проведения лабораторных ис-
следований, определяющих нарушения функций печени, может быть продиктова-
на: желтухой, анорексией, рвотой и поносом, болями в правом подреберье, алко-
голизмом и гепатитом в анамнезе, кровотечениями из вен пищевода, гепатомега-
лией, асцитом, телеангиоэктазиями на коже.
52
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Лабораторные показатели, характерные для заболеваний печени
Билирубинемия. При нарушении проходимости желчных путей повышаются
показатели прямого билирубина, связанного с глюкуроновой кислотой. Повыше-
ние непрямого билирубина характерно для нарушений обмена билирубина и свя-
зано с гемолизом эритроцитов или другими причинами.
Повышение уровня печеночных ферментов. Ферменты аланинаминотрансфера-
за (АЛТ) и аспартатаминотрансфераза (ACT) попадают в кровоток в результате
повреждения мембран при некрозе гепатоцитов. Повышение уровня АЛТ наибо-
лее специфично для повреждений печени. Уровень ACT может повышаться при
повреждении миокарда, мышц, почек, эритроцитов, поджелудочной железы.
Снижение уровня факторов свертывания крови. Практически все факторы свер-
тываемости синтезируются печенью (за исключением фактора VIII). Наиболее
чувствительным при поражениях печени является показатель протромбинового
времени, хотя этот тест тоже не является специфичным. Уровень протромбиново-
го времени повышается при дефиците витамина К и приеме непрямых антикоагу-
лянтов.
Гипоальбуминемия является показателем хронического процесса в печени, хотя
во многом уровень альбумина в крови зависит от питания и характера метаболи-
ческих процессов.
Повышение щелочной фосфатазы. Повышение щелочной фосфатазы — чув-
ствительный, но неспецифичный тест при нарушениях функции желчевыводящих
путей, так как он также может повышаться при заболеваниях костей и во время
беременности.
Таблица 3.12. Анестезиологический риск, основанный на предоперационной оценке
функции печени [21]
Показатель Операционный риск
Минимальный Средний Значительный
Билирубин, мг/дл <2 2-3 >3
Альбумин, г/л >3-5 3-3,5 <3
Пролонгация протромбинового времени, с 1—4 4-6 >6
Энцефалопатия — Средней степени тяжести Тяжелая
Питание Не нарушено Незначительно нарушено Серьезно нарушено
Асцит — Средней степени Выраженный
Наиболее частые осложнения, возникающие вследствие ОпечН [22]: тяжелая
коагулопатия, энцефалопатия, острый респираторный дистресс-синдром, острая
почечная недостаточность, сепсис.
Пациенты с болезнями печени в терминальной стадии имеют высокий риск
тяжелых осложнений и летального исхода. Необходим контроль за степенью на-
53
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
рушения питания, асцитом, уровнем энцефалопатии, протромбиновым временем,
концентрациями сывороточного альбумина и билирубина. От значений этих по-
казателей зависит риск развития осложнений и смерти после операции. Другие
детерминанты, которые влияют на неблагоприятный результат: ургентность опе-
рации, пожилой возраст и болезни сердечно-сосудистой системы.
Портальная гипертензия предрасполагает к кровотечению из варикозных вен,
гепаторенальному синдрому, гепатопульмональному синдрому и неконтролируе-
мому асциту. Портальная гипертензия может быть уменьшена чрескожным или
хирургическим портасистемным шунтированием. При отсутствии явных противо-
показаний у пациентов с запущенной тяжелой болезнью печени необходимо рас-
сматривать вопрос об ортотопической трансплантации печени. Подготовка долж-
на включать коррекцию коагулопатии, энцефалопатии, профилактику сепсиса и
оптимизацию функции почек.
Во время предоперационного осмотра исключают острый гепатит (табл. 3.13),
как правило, вирусного генеза, который значительно повышает риск периопера-
ционной печеночной недостаточности.
Таблица 3.13. Характеристики различных видов гепатитов
Тип гепатита Тип вируса Симптомы Пути передачи Диагностический тест*
Гепатит А ssPHK Общие симптомы, желтуха, 50 % Алиментарный IgM, anti-HAV (острый) IgG, anti-HAV (хронический)
Гепатит В ДНК- пикорна- вирус Общие симптомы, желтуха, 50 % Парентераль- ный, половой HBsAg, HBcAg, anti-HBV, anti-HBAg, ДНК-полимераза
Гепатит С ssPHK Общие симптомы, желтуха, 25 % Парентераль- ный, половой Anti-HCV, PCR, HCV- PHK
Гепатит D Неполная РНК Общие симптомы Требует нали- чия HBV для клинических проявлений IgM, anti-HD (острый) IgG, anti-HG (хронический)
Гепатит Е ssPHK Общие симптомы Фекально- оральный IgM, anti-HE (острый) IgG, anti-HE (хронический)
* HAV — вирус гепатита А, НВс — вирус гепатита В cor, HbsAg — поверхност-
ный антиген вируса гепатита В, HBV — вирус гепатита В. HCV — вирус гепатита
С, HD — вирус гепатита D, НЕ — вирус гепатита Е, PCR — полимеразно-цепная
реакция.
Часто гепатиты протекают в безжелтушной форме, поэтому их трудно ди-
агностировать. Необходимо обращать внимание на симптомы: боли в правом
подреберье, повышение уровня печеночных ферментов, изменение цвета мочи,
анорексию, рвоту. Уровень трансаминаз может повыситься за 7—14 дней до
начала клинических проявлений гепатита. Достоверно определить тип гепатита
54
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
возможно только на основании серологических проб и полимеразно-цепной
реакции.
Острый гепатит является противопоказанием к проведению плановой опера-
ции, летальность достигает 10 % [5]. Рекомендуют выполнять плановую операцию
только через 4 недели и позже после нормализации состояния и лабораторных
показателей. В литературе нет данных, которые бы подтверждали увеличение опе-
рационного риска при хронических гепатитах В и С в стадии компенсации. Cheung
и соавторы [23] не обнаружили увеличение смертности и количества осложнений
у больных, инфицированных вирусом гепатита С.
Заражение гепатитом А от больного во время операции возможно через мокро-
ту или отделяемое слизистых оболочек, если операция совпала по времени с инку-
бационным периодом (3~6 недель). В этом случае инфицированному необходимо
ввести 1 дозу у-глобулина (не позднее 1 недели после инфицирования).
Гепатит В протекает более тяжело, чем гепатит А. Заражение происходит че-
рез инфицированную кровь и другие жидкости организма при попадании на по-
врежденную поверхность кожи, слизистые оболочки или непосредственно в кровь,
например, при гемотрансфузиях от инфицированного донора. Риск заражения
анестезиолога от инфицированного больного высокий. В случае заражения эф-
фективной является вакцинация.
Гепатиты С, D, Е схожи по течению и путям заражения с гепатитом В.
При проведении ургентной операции поддерживают адекватную интраопера-
ционную перфузию печени, избегают назначения гепатотоксичных анестетиков,
прежде всего галотана. Наркоз галотаном сопровождается нарушениями функций
печени средней степени тяжести с транзиторным повышением АЛТ и ACT у 30 %
пациентов. После наркоза галотаном у одного пациента на 30 000 больных разви-
вается тяжелая печеночная недостаточность [1]. У больных с заболеваниями пече-
ни избегают применения ингаляционных анестетиков, за исключением закиси
азота и ксенона.
3.3. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА
Предоперационная подготовка у больных, которым будут прово-
дить плановую операцию, заключается в коррекции состояний, развившихся по
причине сердечно-сосудистых, легочных или эндокринологических заболеваний,
которые не являются причиной проведения операции. Количество и тип доопера-
ционной лекарственной терапии коррелируют с возрастом, полом и сопутствую-
щей патологией пациентов [24]. Пациенты с высоким классом риска по ASA обычно
нувдаются в большем количестве лекарственных средств перед операцией.
Для адекватной предоперационной подготовки необходимо тесное сотрудни-
чество всех специалистов, особенно в случаях, когда пациенты с кардиологичес-
кой и сосудистой патологией получают антикоагулянты. Предоперационная под-
готовка показана больным, которые не получали накануне лечение или тем, кому
проводили неадекватную терапию. Если же больной систематически лечился по
поводу сопутствующего хронического заболевания, то показания к проведению
предоперационной подготовки значительно уменьшаются.
Проблематично проведение предоперационной подготовки больным, кото-
рым необходима операция по экстренным показаниям. Часто у таких пациентов
развиваются острые нарушения (например, гиповолемия, дисэлектролитемия и
55
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
др.), требующие коррекции состояний. В таких ситуациях находят разумный ком-
промисс между подготовкой больного к операции и срочностью ее проведения,
тем более что современные методы анестезии позволяют снизить риск оператив-
ного вмешательства у тяжелых больных.
Многие пациенты нуждаются в дополнительных консультациях врачей раз-
личных специальностей [9]: во-первых, с целью диагностики какого-либо заболе-
вания, которое может повлиять на прогноз лечения; во-вторых, для оказания спе-
циализированной помощи в выборе методов предоперационной коррекции сопут-
ствующего заболевания (например, вызов эндокринолога к больному с
декомпенсированным сахарным диабетом, вызов кардиолога для лечения острого
нарушения ритма сердца и т. п.).
3.4. ВЫБОР МЕТОДА АНЕСТЕЗИИ
Итогом предоперационного осмотра является выбор метода анес-
тезии: общей анестезии с интубацией трахеи, общей анестезии с сохраненным
спонтанным дыханием (внутривенной, масочной), аксиальной (спинальной, эпи-
дуральной, блокады периферических нервов), комбинации методов. Выбор мето-
да анестезии зависит от вида и объема предполагаемой операции (например, при
торако- или лапаротомии необходим интубационный наркоз с мышечными ре-
лаксантами), положения пациента на операционном столе, наличия сопутствую-
щих заболеваний, пожеланий хирурга, пожеланий пациента, от экстренности опе-
рации и возраста пациента.
ЛИТЕРАТУРА
1. Duke J. Anesthesia secrets. 2th ED// Denver, Hanley&Belfus, inc., 2002; 560 p.
2. Kindler C.H., Szirt L., Sommer D. et al. A quantitative analysis of anaesthetist-patient
communication during the pre-operative visit// Anaesthesia, 2005 Jan; 60 (1): 53—9.
3. Hofer C.K., Ganter M.T., Furrer L. et al. Patients’ needs and expectations regarding
anaesthesia. A survey on the pre-anaesthetic visit of patients and anaesthesiologists//
Anaesthesist, 2004 Nov; 53 (11): 1061—8.
4. Reurer M., Hueppe M., Klotz K.F. et al. Detection of causal relationships between
factors influencing adverse side-effects from anaesthesia and convalescence following surgery:
a path analytical approach// Eur. J. Anaesthesiol., 2004 Jun; 21 (6): 434—42.
5. Cole D.J., Schlunt M. Adult Perioperative Anesthesia// Philadelphia, ELSEVIER
MOSBY, 2004; 542 p.
6. Stoe Iting R.K., Miller RD. Basics of Anesthesia. 3th ED// New-York, Churchill
Livingstone, 524 p.
7. Brown D.R., Brown M.J. Hypoglycemia associated with preoperative metoprolol
administration// Anesth. Analg., 2004 Nov; 99 (5): 1427—8.
8. Vincent J.L., Dubois M.J., Navickis R.J., Wilkes M.M. Hypoalbuminemia in acute
illness: is there a rationale for intervention? A meta-analysis of cohort studies and controlled
trials// Ann. Surg., 2003 Mar; 237 (3): 319-34.
9. Pearse R.M., Rhodes A., Grounds RM. Clinical review: how to optimize management
of high-risk surgical patients// Crit Care, 2004 Dec; 8 (6): 503—7.
10. Гомес A.C., Парк Г.Р. Ключевые факты в анестезиологии и интенсивной тера-
пии. Пер. с англ. 3-е изд. — М.: Медэкспертпресс, 2004. — С. 96.
11. Llpsitz L.A. Orthostatic hypotension in the elderly// N. Engl. J. Med., 1989;
321: 952-957.
56
3. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
12. Layiug E.L., Wallace A., Tateo I. Effect of atenolol on mortality and cardiovascular
morbidity after noncardiac surgery// N. Engl. J. Med., 1996; 335: 1713—1720.
13. Kemal K.M., Kratz C.D., Olt C, Christ M., Zirlng M., WulfH., Geldner G. Marburg
model for optimization of stratification of the anaesthesiological risk// Anaesthesist, 2004
Sep; 53 (9): 856-61.
14. Older P., Hall A. Clinical review: how to identify high-risk surgical patients// Crit.
Care, 2004 Oct; 8 (5): 369-72.
15. Cohen S.P., Kent C. Pronounced unexplained preoperative tachycardia heralding
serious cardiac events: a series of three cases// Can. J. Anaesth., 2005 Oct; 52 (8): 858—63.
16. Landesberg G., Vesselov Y., Einav S. et al. Myocardial ischemia, cardiac troponin,
and long-term survival of high-cardiac risk critically ill intensive care unit patients// Crit.
Care Med., 2005 Jun; 33 (6): 1281-7.
17. Goldman I., Caldera D.L., Nussbaum S.R. etal. Multifactorial index of cardiac risk in
noncardiac surgical procedures// N. Ingl. J. Med., 1977; 297: 845—850.
18. Detsky A.S., Abrams H.B., McLaughlin J.R. etal. Predicting cardiac complications in
patients undergoing non-cardiac surgery// J. Gen. Intern. Med., 1986; 1: 211—219.
19. Vanzetto G., Machecourt J., Blendea D. etal. Additive value of thallium single-photon
emission computed tomography myocardial imaging for prediction of perioperative events in
clinically selected high cardiac risk patients having abdominal aortic surgery// Am. J. Cardiol.,
77, 1996; 143-148.
20. Berger M.M., Gust R. Perioperative evaluation of lung function// Anaesthesist, 2005
Mar; 54 (3): 273-86.
21. Strunin L. Preoperative assessment of the patient with liver dysfunction// Br. J.
Anaesth., 1978; 50: 25-34.
22. Wiklund R.A. Preoperative preparation of patients with advanced liver disease// Crit.
Care Med., 2004 Apr; 32 (4 Suppl): S. 106—15.
23. Cheung R.C., Hsieh F., Wang Y., Pollard J.B. The impact of hepatitis C status on
postoperative outcome// Anesth. Analg., 2003 Aug; 97(2): 550—4.
24. Buhre K., de Rossi L., Buhre W. Preoperative long-term therapy// Anaesthesist, 2005
Sep; 54 (9): 902-13.
57
4. ПРЕМЕДИКАЦИЯ
Премедикация — специальная фармакологическая подготовка
пациента к хирургическому вмешательству с целью обеспечения
психоэмоционального комфорта, потенцирования действия общих
анестетиков, снижения рефлекторной возбудимости, болевой чув-
ствительности, секреции слюнных и бронхиальных желез.
Ожидание операции, сознание ее прямой опасности для жиз-
ни, риск летального исхода или последующей инвалидизации
вызывают у пациента тревогу, страх, чувства тоски и отчаяния,
порой — нежелание жить. Предоперационное состояние пациен-
та является классическим примером негативного эмоционально-
го стресса, вызывающего в организме каскад адаптационно-за-
щитных реакций. Отрицательное влияние беспокойства и нервоз-
ности пациента на течение обезболивания столь велико, что
грамотный анестезиолог не рискнет проводить анестезиологичес-
кое пособие без соответствующей подготовки психоэмоциональ-
ной сферы больного.
Современный уровень развития анестезиологии отводит вопро-
су преднаркозной медикаментозной подготовки одно из ведущих
мест в комплексе мероприятий по проведению обезболивания.
4.1. ИСТОРИЧЕСКИЕ ДАННЫЕ
Некоторые из современных наркотических средств
применяли задолго до синтеза общих анестетиков и наркотичес-
ких газов для снижения болевых ощущений. Несомненно, что
наиболее древним веществом с седативными свойствами является
опиум — высушенный млечный сок снотворного мака (Papaver
somniferum). Историкам известен факт, что опиум вместе с манд-
рагорой и другими ингредиентами входил в состав так называе-
мых сонных губок. Упоминание об опиуме обнаружили в древнем
египетском папирусе, датированном примерно 155 годом до н. э.
Свойства опиума знал Диоскорид, врач времен Нерона, автор зна-
менитой классификации лекарственных веществ.
58
4. ПРЕМЕДИКАЦИЯ
В более поздние времена, несмотря на разработку примитивных способов
парентерального введения лекарственных средств, применение опиума не стало
популярным вследствие непостоянства его состава и непредсказуемости эффекта.
В 1805 году Сертюрнер Ф. открыл морфин. Это первое в истории выделение ак-
тивного вещества из сырого продукта стало точкой отсчета развития химии алка-
лоидов. В 1833 году Mein, Gieger и Hesse выделили атропин из растения Atropa
belladonna. Возможность точного дозирования лекарственных веществ при парен-
теральном введении, благодаря изобретению шприца и полой иглы, послужили
предпосылкой будущих интенсивных фармакологических и физиологических ис-
следований.
Основоположником премедикации является Клод Бернар (1813—1878), фран-
цузский физиолог и патолог, один из основоположников экспериментальной меди-
цины. Именно его исследования, обобщенные в серии лекций в Colledge de France,
привлекли внимание хирургов к премедикации. Dastre предложил комбинацию
морфина и атропина, так как одновременное применение этих препаратов умень-
шает их отрицательные эффекты. В дальнейшем метод Dastre модифицировал Albert,
который предложил более приемлемую и близкую к современной схему премедика-
ции: 10 мг морфина и 0,5 мг атропина за 30 мин до операции. В 1864 году Von Baer
синтезировал барбитуровую кислоту, предшественницу барбитуратов.
В 1931 году Rowbotham писал: “Под премедикацией подразумевается новая
концепция преднаркозной медикаментозной подготовки, при помощи которой
достигается утрата сознания больным в постели до введения анестетика”. В 1936 году
Гведел утверждал, что основным показателем, определяющим гладкое течение
обезболивания, является уровень метаболизма. Его идеи послужили основой для
расширения задач премедикации, которые теперь не ограничивали рамками эмо-
ционального успокоения и блокады саливации. Следующий этап развития преме-
дикации характеризуют стремлением предотвратить метаболические и нейроэн-
докринные сдвиги.
В 1940-е годы в практику вошла “стандартная премедикация” — 10 мг морфи-
на и 0,6 мг атропина. Революционные открытия синтеза сукцинилхолина и дити-
лина в 1947—1949 годах затронули и премедикацию: стали очевидными преимуще-
ства раннего восстановления функций организма после операции. В 50-е годы
прошлого века в клинической практике стали использовать вводный наркоз бар-
битуратами, поэтому исчезла необходимость в применении седативных средств с
целью сделать течение наркоза более гладким. Вновь были пересмотрены подхо-
ды к премедикации, результатом чего стали сомнения в ценности использования
опиатов для премедикации и предложения заменить их барбитуратами.
Влияние на развитие премедикации оказали работы, посвященные производ-
ным фенотиазина. Концепция Laborit о необходимости полной блокады вегета-
тивной нервной системы, по возможности на всех уровнях, не получила распрос-
транения, так как глубокая нейровегетативная блокада подавляет не только пато-
логические, но и приспособительные реакции на операционную агрессию. Поэтому
“наркоз без наркотиков” в духе Laborit не доказал своей состоятельности.
В 1960 году Stemdach и Reeder синтезировали и применили диазепам, Janssen
в 1962 году синтезировал фентанил, фирма Hoffmann-La Roche в 1963 году начала
производить в инъекционной форме валиум. Основным объектом премедикации
был, несомненно, вводный наркоз: улучшение его течения, борьба с возбуждени-
ем были важнейшими требованиями к премедикации. Воздействие на психичес-
кую сферу больного было подчинено этой основной задаче и служило скорее не
59
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
целью, а средством ее реализации. Поэтому и отношение к глубине седативного
эффекта премедикации меняли в зависимости от фармакологических свойств но-
вых средств для вводного наркоза. От премедикации требовали “уменьшения по-
требности в наркотическом веществе”, противодействия отрицательным эффек-
там анестетиков на сердце, обеспечения “спокойного” послеоперационного пери-
ода и т. д.
В 1966 году на 1-й Всесоюзной учредительной конференции анестезиологов и
реаниматологов Дарбинян Т.М. в программном докладе “Премедикация в анесте-
зиологии” поднял вопрос о связи премедикации и предоперационной медикамен-
тозной подготовке. В итоге, к премедикации отнесли не только медикаментозное
воздействие, имеющее целью успокоение, но и всю предоперационную подготов-
ку, направленную на обеспечение безопасности во время наркоза и операции, и
разделили ее на лечебную и профилактическую. Лечебная премедикация — это
все лечебные мероприятия, направленные на компенсацию функциональных на-
рушений в дооперационном периоде: интенсивная терапия недостаточности ды-
хания и кровообращения, коррекция сдвигов водного, электролитного и кислот-
но-основного балансов, нормализация свертывающей и антисвертывающей сис-
тем крови, компенсация нарушенных функций систем и органов и др.
Профилактическая премедикация — это комплекс мероприятий, направленный
на предупреждение чувств страха и беспокойства перед операцией, профилактику
рвоты и т. п., то есть собственно премедикация в первоначальном смысле этого
слова. Новое видение термина “премедикация” (лечебная и профилактическая)
обосновывалось необходимостью объединить в руках одного специалиста всю под-
готовку к наркозу и операции. Рациональность такого объединения в настоящее
время стала более очевидной, чем когда-либо прежде.
В настоящее время наиболее существенное влияние премедикация оказывает
на течение предоперационного периода. Господствует принцип, по которому каж-
дый из компонентов наркоза необходимо достигать при помощи веществ с разны-
ми механизмами действия, поэтому естественно, что современная анестезиология
ставит перед премедикацией более ограниченные, чем ранее, задачи и сводит их к
адекватной подготовке к обезболиванию.
Цели профилактической премедикации: создание обстановки комфорта для
больных (устранение чувства страха перед операцией, успокоение, достижение
амнезии и аналгезии); профилактика тошноты и рвоты; облегчение вводного
наркоза; уменьшение количества анестетика для поддержания основного нарко-
за; уменьшение количества и активности нежелательных рефлексов; уменьше-
ние секреции.
4.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
ДЛЯ ПРОФИЛАКТИЧЕСКОЙ ПРЕМЕДИКАЦИИ
Перечень лекарственных средств, используемых для премедика-
ции, достаточно велик. Выбор препаратов или их комбинаций осуществляют для
каждого пациента индивидуально. Время осуществления премедикации и ее дли-
тельность также определяют индивидуально в зависимости от объективного стату-
са больного и степени эмоционального напряжения.
60
4. ПРЕМЕДИКАЦИЯ
4.2.1. Антихолинергические препараты
Основным свойством, обусловливающим применение антихоли-
нэргических препаратов для премедикации, является их способность блокировать
эффекты ацетилхолина, не нарушая при этом распространение импульсов по нер-
ву и освобождение ацетилхолина в области синапсов. Блокада действия ацетилхо-
лина происходит на всех уровнях нервной системы, вплоть до ганглиев симпати-
ческой нервной системы и нервно-мышечных синапсов. Для премедикации ис-
пользуют периферические М-холинолитики. Их антагонизм с ацетилхолином
наиболее выражен на уровне постганглионарных мускариночувствительных окон-
чаний блуждающего нерва.
Антихолинергические препараты используют для достижения антисаливаци-
онного, седативного и противорвотного эффектов, предотвращения рефлектор-
ной брадикардии. Наиболее часто с вышеуказанной целью применяют атропин,
гиосцин и гликопирониум. Первые два препарата являются третичными аминами и
способны проникать через гематоэнцефалический барьер. Гликопирониум — это
четвертичный амин; он не проникает через гематоэнцефалический барьер и не
абсорбируется в ЖКТ. Абсорбция атропина непредсказуема и зависит от pH и
объема желудочного содержимого, а также от активности моторики. Атропин, сти-
мулируя ЦНС, вызывает развитие центрального холинергического синдрома (бес-
покойство, возбуждение и сонливость), а при использовании больших доз воз-
можно развитие комы.
В стандартных дозах гиосцин отличается от атропина более выраженными
антисаливационным, седативным и противорвотным эффектами. Гиосцин не сти-
мулирует высшие нервные центры, слабо влияет на сердечные вагусные рецепто-
ры, но вызывает дисфагию и беспокойство, в связи с чем препарат не назначают
пациентам старше 60 лет. Гиосцин в сочетании с морфином оказывает хорошее
седативное и противорвотное действие. При применении гиосцина может раз-
виться продолжительная бессонница. Гиосцин и гликопирониум блокируют сек-
рецию при использовании раздражающих ингаляционных анестетиков, снижают
чрезмерную секрецию и брадикардию при применении повторных доз инфузион-
ного введения мышечных деполяризирующих релаксантов.
Снижение тонуса нижнего пищеводного сфинктера при использовании анти-
холинергических препаратов повышает риск гастроэзофагального рефлюкса и может
способствовать аспирации. Атропин и гиосцин увеличивают физиологическое
мертвое пространство легких на 25 %, но этот эффект можно компенсировать за
счет повышения вентиляции.
Побочные эффекты антихолинергических препаратов: тахикардия, мидриаз,
циклоплегия, пирексия, сухость во рту.
4.2.2. Бензодиазепины
Фармакодинамика и фармакокинетика (см. раздел 6.3.2).
Диазепам с целью премедикации применяют в дозе 10—15 мг per os, эффекти-
вен через 30—45 мин, длительность действия 4—6 ч. После внутривенной болюс-
ной дозы вызывает седацию через 1—2 мин. Период полувыведения составляет
20-90 ч, что обусловлено фармакологической активностью и более длительным
периодом выведения метаболита N-десметил-диазетама. Применение стандарт-
61
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ной дозы диазепама 5—10 мг перорально с метоклопрамидом (регланом, церука-
лом) вызывает максимальный седативный эффект через 15—20 мин.
Мидазолам с целью премедикации вводят внутримышечно 0,07—0,1 мг/кг за
20—30 мин до начала анестезии или внутривенно 2,5—5 мг за 5—10 мин до начала
операции. Мидазолам в клинической практике в качестве внутривенного седатив-
ного средства практически вытеснил диазепам, так как при внутривенном введе-
нии начинает действовать быстрее последнего. Соотношение силы мидазолам/
диазепам находится в пределах 2/1. Период полувыведения мидазолама составля-
ет 1,5—2,5 ч; его метаболиты неактивны.
Темазепам — бензодиазепин короткого действия. В дозе 30 мг per os эффекти-
вен для седации и анксиолизиса у пациентов, подвергшихся зубоврачебным про-
цедурам. Крайне низкая растворимость не позволяет разработать препарат для
внутривенного введения.
Лоразепам обладает длительным действием, период полувыведения составляет
10—20 часов. Для премедикации используют дозу 2-5 мг. Применение сопровож-
дается амнезией, продолжающейся несколько часов.
Агонисты. Для уменьшения и прекращения действия бензодиазепинов исполь-
зуют антагонисты их центральных эффектов, в частности — флюмазенил, кото-
рый конкурентно связывает бензодиазепиновые рецепторы. Флюмазенил метабо-
лизируется в печени, период полувыведения — менее 1 ч. Препарат восстанавли-
вает сознание, но требуются повторные дозы до тех пор, пока не снизится
концентрация агониста в плазме.
4.2.3. Нейролептики
Фармакодинамика и фармакокинетика (см. раздел 6.3.4).
Дроперидол используют для премедикации внутримышечно в дозе
1,25—2,5 мг совместно с препаратом группы бензодиазепинов или опиоидов. По
данным некоторых авторов, дозы дроперидола свыше 2,5 мг не усиливают проти-
ворвотный эффект. Не следует применять дозы, превышающие 5 мг, так как эф-
фекты препарата пролонгируются без улучшения седации.
Действие препарата начинается через 2—3 мин после внутривенного введения,
достигает максимума через 10—12 мин, сохраняется на таком уровне 30—40 мин,
ослабевает к концу 3—4 часа и полностью прекращается через 6—12 ч после введе-
ния. Вторую фазу продолжительного, но менее интенсивного действия препарата
связывают с продуктом его гидролиза — бензперидолом. Дроперидол нецелесооб-
разнее использовать на фоне гиповолемии.
4.2.4. Опиоидные аналгетики
Фармакодинамика и фармакокинетика (см. раздел 6.3.5).
Морфин применяют для премедикации в дозе 0,05—0,2 мг/кг внут-
римышечно (пик через 60—90 мин) или 0,03—0,15 мг/кг внутривенно (пик через
10—20 мин). Длительность действия препарата, как при внутримышечном, так и
при внутривенном введении, составляет 3—4 ч. Частое введение дробных доз мо-
жет привести к передозировке.
Промедол для премедикации вводят подкожно или внутримышечно в дозе
0,02—0,03 г вместе с 0,5 мг атропина за 30—45 мин до операции. Для экстренной
премедикации препараты вводят в вену.
62
4. ПРЕМЕДИКАЦИЯ
Фентанил используют для премедикации в качестве седативно-аналгетического
препарата. Его вводят внутривенно незадолго до вводного наркоза в дозе 25—50 мкг.
Поскольку существует риск угнетения дыхания, то необходим контроль за паци-
ентом, получающим фентанил для премедикации.
4.3. КРИТЕРИИ ЭФФЕКТИВНОСТИ
ПРОФИЛАКТИЧЕСКОЙ ПРЕМЕДИКАЦИИ
Методики оценки эффективности премедикации:
• субъективная оценка по Дарбиняну Т.М. и соавторам;
• субъективно-объективная оценка Добкина—Гологорского в модификации
Фрида И.А. и Беляева Д.Г., дополненная сенсографией по Сангайло А.К.;
• субъективная оценка по шкале Гологорского В.А. в сочетании с анализом
динамики внешнего дыхания, центральной и периферической гемодинамики, ко-
личества расходуемого для вводного наркоза анестетика, с оценкой болевой чув-
ствительности (с помощью аппарата ПДС-I по методике Сангайло А. К.) и учетом
количества содержания адреналина и норадреналина в крови;
• оценка по модифицированной корректурной таблице с кольцами Ландольта,
по методике определения критической частоты слияния световых мельканий и по
двигательной пробе Небылицына В.Д.;
• определение уровня электроотрицательности ядер клеток буккального эпи-
телия и его отношение к возрастной норме;
• модифицированная система баллов по Barker R.A. и соавторам.
При использовании модифицированной системы баллов по Barker R.A. кли-
нико-физиологические данные дополнены количественной оценкой седативного
эффекта медикаментозной подготовки по биохимическим показателям, характе-
ризующим функционирование симпатоадреналовой, калликреин-кининовой, ги-
стаминреактивной и серотонинергической систем. Это позволяет сравнивать раз-
личные схемы премедикации с учетом особенностей развивающихся нейрогумо-
ральных реакций. Клинико-физиологическую характеристику проводят на
основании общепринятых тестов: АД, ЧСС, ЧД, психоэмоциональной реакции
на окружающую обстановку. Полученные данные пересчитывают в баллы. Пре-
имуществом этого метода является возможность представить реакцию больного
на “ожидание боли” и “собственно боль” — субъективное ощущение, которое
играет важную роль в генезе любого эмоционального напряжения. Учет клинико-
физиологических данных в предоперационной палате и операционной позволяет
определить реакцию на обстановочную травму.
Дополненная биохимическим разделом и более точными методами исследо-
вания сердечно-сосудистой системы, указанная схема представлена в табл. 4.1.
Таблица 4.1. Схема оценки эффективности премедикации по Barker R.A. в модифика-
ции усенко Л.В. и соавторов
Критерии Оценка в баллах
О 1 2
I. Предоперационная комната
Бодрствование Отсутствие сна Дремота
63
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 4.1
Критерии Оценка в баллах
0 1 2
П. Операционная комната
Субъективно Крик, возбуждение Страх; ухудшение дремоты, переход в бодрствование Отсутствие перехода в дремоту
Объективно а) нейрогуморальные сдвиги, развивающиеся в организме
Симпатоадре- наловая система Выходят за пределы физиологических колебаний Находятся в пределах допустимых физиологи- ческих колебаний Соответствуют уровню возрастной нормы или исходных показателей
Гистамин- реактивная система Выходят за пределы физиологических колебаний Находятся в пределах допустимых физиологи- ческих колебаний Соответствуют уровню возрастной нормы или исходных показателей
Серотониерги- ческая система Выходят за пределы физиологических колебаний Находятся в пределах допустимых физиологи- ческих колебаний Соответствуют уровню возрастной нормы или исходных показателей
Калликренин- кининовая система Выходят за пределы физиологических колебаний Находятся в пределах допустимых физиологи- ческих колебаний Соответствуют уровню возрастной нормы или исходных показателей
б) патофизиологические и метаболические проявления нейрогуморальных сдвигов
АД Повышается на 2,66 кПа Повышается на 1,35 кПа Сохраняется неизменной
чсс У величивается на 30 в мин"1 Увеличивается на 15 в мин"1 Сохраняется неизменной
Ударный объем сердца Снижается на 10 % и более от исходных данных Снижается на 5-10 % от исходных данных Остается на уровне исходных данных или возрастной нормы
Общее перифе- рическое сопро- тивление сосудов Повышается на 10- 15 % и более от исходных данных Остается в пределах возрастной нормы для исходных данных Снижается на 10-15 % от исходных данных
Дыхательная система Грубое нарушение дыхания Учащение дыхания на 4 дыхательных движения в 1 мин Без изменений
Тканевой метаболизм Нарастание явлений метаболического ацидоза, повышение лактата более чем на 25 %, появление «избытка» лактата Отсутствие метаболичес- кого ацидоза, снижение BE на 2,5 ммоль/л, повы- шение лактата не более чем на 25 %, отсутствие в «избытке» лактата Данные в пределах возрастной нормы или исходных величин
в) реакция на укол Крик или борьба Вздрагивание или изменение голоса Отсутствие реакции
64
4. ПРЕМЕДИКАЦИЯ
Интерпретация результатов тестирования: 0—12 баллов — слабый эффект пре-
медикации; 13—18 баллов — удовлетворительный эффект премедикации; 18—26 бал-
лов — хороший эффект премедикации.
В повседневной практической деятельности наиболее часто применяют схему
оценки эффективности премедикации по Гологорскому В.А. (табл. 4.2)
Таблица 4.2. Схема оценки эффективности премедикации Гологорскому В.А.
I Увеличение ЧСС на 10-15 уд. в мин 1 балл
Увеличение АД на 10-15 мм рт. ст. 1 балл
Увеличение ЧДД на 3-5 в мин 1 балл
II Возбуждение больного 5 баллов
Увеличение ЧДД на 5 в мин 5 баллов
Увеличение ЧСС на 20 в мин 5 баллов
Увеличение АД на 20 мм рт. ст. 5 баллов
ш АД, пульс, ЧДД не изменяются 0 баллов
Интерпретация результатов тестирования: 3—5 баллов — эффект премедика-
ции плохой; более 5 баллов — эффект премедикации неудовлетворительный;
О баллов — эффект премедикации удовлетворительный.
ЛИТЕРАТУРА
1. Бунятян А.А., Мещеряков А.В., Цибуляк В.Н. Атаралгезия. — М.: Медицина,
1983. - 170 с.
2. Дарбинян Т.М., Тверской А.Л., Натансон М.Г. Премедикация, наркоз и дыхание. —
М.: Медицина, 1973. — 375 с.
3. Foldes F.F., Swerdlow М., Siker E.S. Narcotics and narcotic antagonists-spriengfield,
1964. - 284 p.
4. Guedel A.E. Inhqlation anesthesia. — New-York, 1933. — 283 p.
5. Shearer W.M. The evolution of premedication// Brit. J.Anaesth., 1960. — № 32. —
P. 554.
6. Shearer W.M. The evolution of premedication// Brit.J.Anaesth., 1960. — № 33, T. 4. —
P. 219.
7. Beecher H.K. Preanesthetic medication// J.A.M.A., 1955. — № 157. — 242 p.
8. Beecher H.K., Ford C. Anesthesia: fifty years of progress// Surg. Gynec. Obstet, 1955. —
№ 101, T. 2. - P. 105.
9. Cohen E.N., Beecher H.K. Narcotics in preanasthetic medication controlled study;
report to council on pharmacy and chemistry// JAMA, 1951. — № 147, T. 17. — 1664 p.
10. Laborit H. Comment concevoir le role de 1 hypometabolisme dans la protection
organique?// Anesth. Analg. Reanim, 1957. — № 14, T. 2. — 243 p.
11. Riding J.E. Premedication. In: F.T. Evans, T.C. Gray. General anestesia. — London,
1965. - P. 75.
12. Rowbotham S. Premedication// Brit. med. J., 1931. — № 1. — P. 693.
13. Дарбинян T.M. Премедикация, ее место и значение в анестезиологии. В сб.:
Труды Всесоюзной учредительной конференции анестезиологов и реаниматологов. —
М.: Медицина, 1967. — с. 4.
14. Руководство по анестезиологии: в 2 т. Т. I: пер. с англ./ Под ред. А.Р. Эйткен-
хед, Смит Г. — Я.: Медицина, 1999. — 488 с.
3 7-585
65
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
15. Закусав В.В. Новые психофармакологические средства// Фармакология и ток-
сикология, 1964. — № 1. — С. 107.
16. Eger E.J. Atropine, scopolamine and compounds// Anesthesiology, 1962. — № 23,
T. 3. - P. 365.
17. Alper M.H., Fleisch J.H., Flacke W. The effects of hqlothqne on the responses of
cardiac sympathetic ganglia to various stimulants// Anesthesiology, 1969. — № 31, T. 5. —
P. 429.
18. Шандурский K.C., Искарев H.A. Алкалоиды группы морфина и синтетические
их наполнители. В кн.: Н.В. Лазарев. Руководство по фармакологии. — Л.: 1961. — Т. I. —
С. 343.
19. Woods L.A., Drill V.A. Pharmacology in medicine, 1958. — P. 215.
20. Woolmer R. Analgesic drugs// Brit. J. Anaesth., 1955. — № 27, T. 6. — P. 278.
21. Gross E.C., Holland H., Carter H.R., Christensen E.M. Role of epinephrine in analgesia//
Anesthesiology, 1948. — № 9, T. 4. — P. 459.
22. Ведерников Ю.П., Африканов И.И. Значение катехоламинов для аналгетическо-
го действия морфина// Фармакол., токсикол., 1970. — № 2. — С. 154.
23. Helller В.,Saavedra J.M., Fischer Е. Influence of adrenergic blocking agent upon
morphine and canecholamine analgesic effect// Experientia, 1968. — № 24, T. 8. — P. 804.
24. Gardoska G. Khnischer Erlahrungsbericht bber spleno-renale Anastomosen bei
Patienten mit intra-und pmhepatischem Block und Pfortader hochdruck in NLA// Anaesthesist,
1971. - Bd. 20. - P. 451.
25. Janssen P. The pharmacology of neuroleptanalgesie. Symposium “Dehydrobenzperidol-
Fentanyl”. — Moscow, 1967. — P. 7—14.
26. Кузин М.И., Ефимова H.B., Осипова H.A. Нейролептаналгезия в хирургии. —
М.: Медицина, 1976. — 314 с.
27. Мещеряков А.Б. Нейролептаналгезия (клинико-экспериментальное исследова-
ние). Автореф. дис. докт. мед. н. — М., 1971. — 34 с.
28. Орлов И.В. О нейрохимических механизмах ретикулярной формации, участву-
ющих в формировании болевой интеграции. В кн.: Нейрональные механизмы боли. —
Л., 1973. - С. 70-72.
29. Goodman-Gilman A., Rail Т. W., Nies A.S., Taylor Р. The pharmocological basis of
therapeutics, 8th edn. Macmillan, New-York, 1990.
30. Vickers M.D., Morgan M., Spencer P.S.J. Drungs in anaesthetic practice, 7th edn.
Butterworths, London, 1991.
31. Wood M., WoodA.JJ. Drungs and anesthesia, 2nd edn. Williams and Wilkins, Baltimore,
1990.
32. Науменко B.A. Электроотрицательный заряд клеточных ядер как критерий на-
пряженности стрессорных реакций в амбулаторной анестезиологии// Быь, знеболю-
вання, жтенсивна тератя, 2003. - № 4. - С. 64—69.
33. Усенко Л.В., Мальцева Л.А. Нейрогуморальный гомеокинезис как критерий
оценки эффективности премедикации у детей с патологией опорно-двигательного ап-
парата // Быь, знеболювання, штенсивна тератя, 1999. — № 1(6). — С. 35—42.
34. Barker R.A., Nisbet J.A. The objective measurement of sedation in children: a
modisurement of sedation in children: a modified scoring system// Canad. Anqesthes. Soc.,
1973. - V. 20, № 5. - P. 599-606.
66
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ
ОБЩЕЙ АНЕСТЕЗИИ.
ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Неингаляционные методы общей анестезии, или неингаля-
ционный наркоз, — это методы общей анестезии, основанные на
введении в организм пациента средств не через дыхательные пути,
а другими способами.
На современном этапе развития анестезиологии необходимо
признать условность термина “неингаляционная анестезия”, ко-
торый появился в эпоху господства ингаляционного наркоза. Тра-
диционно под “другими способами” введения общего анестетика
подразумевают внутривенный (наиболее распространенный), внут-
римышечный, ректальный и пероральный. Немедикаментозные
электростимуляционные методы анестезии также относят к неин-
галяционным методам общей анестезии; это — центральная элек-
тростимуляционная анестезия и электроиглоаналгезия (регионар-
ная). Способы внутрикостного, внутриплеврального, внутрибрю-
шинного введения наркотических препаратов и средств для наркоза
представляют исторический интерес и в клинических условиях не
используют.
Для неингаляционной анестезии применяют препараты раз-
личных фармакологических групп: барбитураты, наркотические и
нейролептические средства, бензодиазепины и др. Неингаляци-
онные средства для наркоза используют для премедикации (см.
раздел 4.2), вводного наркоза (см. раздел 8.1) и послеоперацион-
ного обезболивания (см. раздел 11.4.1).
Наиболее распространенным среди неингаляционных мето-
дов общей анестезии остается внутривенный метод, благодаря про-
стоте, удобству дозирования и управления анестезией. Внутри-
венной общей анестезии достигают путем введения общего анес-
тетика в венозное кровяное русло, откуда происходит его
проникновение в ЦНС и распределение по органам и тканям с
последующим развитием характерных для каждого фармакологи-
ческого агента центральных и периферических проявлений об-
щей анестезии. Используемые для внутривенной анестезии сред-
ства многочисленны и принадлежат к различным фармакологи-
ческим группам.
67
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Преимущества внутривенной анестезии: незаметное для больного, но достаточ-
но быстрое введение в анестезию с максимальным устранением психоэмоциональ-
ной травмы; отсутствие раздражения слизистой оболочки дыхательных путей; как
правило, минимальное влияние на паренхиматозные органы; низкая частота возник-
новения тошноты и рвоты; амнезия периода введения в анестезию; техническая про-
стота оснащения (шприц, система для внутривенных вливаний, реже — инфузор).
Недостатки внутривенной анестезии: низкая степень управляемости; большая
вероятность последействия препаратов; отсутствие способности блокировать не-
благоприятные рефлекторные реакции на хирургическую травму; склонность многих
препаратов к кумуляции за счет длительно циркулирующих продуктов метаболиз-
ма; отчетливая судорожная активность некоторых препаратов.
В современной анестезиологии практически не используют какое-либо сред-
ство общей анестезии, в том числе внутривенной, в виде моноанестезии. В боль-
шинстве случаев для достижения полноценной внутривенной анестезии применяют
комбинации общих анестетиков — чаще всего наркотического и аналгетического
средств. Даже в ситуациях, когда для достижения общей анестезии при кратковре-
менных хирургических или эндоскопических манипуляциях применяют единствен-
ный агент, вряд ли правомочно говорить о моноанестезии, так как общей анестезии
обязательно предшествует премедикация, при которой, как минимум, используют
аналгетики и ваголитики, а нередко — психотропные и антигистаминные препара-
ты. Использование нейротропных средств для премедикации оказывает существен-
ное влияние на основной и побочные эффекты общего анестетика.
5.1. ИСТОРИЧЕСКИЕ ДАННЫЕ
Началом эпохи внутривенной анестезии считают 1857 год, когда
Пирогов Н.И. впервые внутривенно ввел человеку эфир с целью достижения нар-
коза. В последующие десятилетия этот способ анестезии не был должным образом
развит из-за отсутствия безопасных и эффективных фармакологических средств.
Внедрение внутривенной анестезии в клиническую практику в начале 1900-х годов
связано с именем Кравкова Н.П., использовавшего для этой цели гедонал. В 1932 году
Weese Н. и Scharpff W. синтезировали и применили для внутривенной анестезии барби-
туровый препарат короткого действия эвипан-натрий. С тех пор внутривенный наркоз
получил широкое распространение в анестезиологии. В 1934 году Lundy и Waters при-
менили тиопентал-натрий. Примерно в течение последующих двух десятилетий барби-
тураты считали единственным средством внутривенной анестезии.
В 1954—1955 годах Laubach G.D., P’an S.Y., Rudel Н. в исследовательской лабора-
тории фирмы Pfizer синтезировали и передали для клинических испытаний новый
внутривенный анестетик виадрил. В клинике Мирфи (США) в 1955 году впервые
применили предион — новый стероидный препарат для внутривенной анестезии.
Исследовательской лабораторией бельгийской фирмы Janssen Pharmaceutica в 1958
году в г. Берсе были синтезированы и запатентованы сильнодействующий морфино-
подобный аналгетик фентанил и нейролептик дегидробензперидол (дроперидол). В
1960 году в лаборатории Laborit Н. и Huguenard Р. были открыты наркотические
эффекты и впервые применен в клинике натрия оксибутират (ГОМК). Данди клини-
чески изучил и испытал в 1964 году пропанидид — ультракороткий анестетик для
внутривенного введения. В 1965 году синтезировали этомцдат (гипномидат), попол-
нив арсенал средств для кратковременной и безопасной анестезии; в анестезиологии
68
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
этомидат начали применять с начала 1970-х годов. В 1965 году синтезировали кета-
мин, и через год Corssen G. и Domino E.F. впервые применили его на практике.
Для обеспечения необходимых компонентов общей анестезии предложены и
внедряют новые средства неингаляционной анестезии, пришедшие на смену более
токсичным “поливалентным” ингаляционным анестетикам. Многие из некогда по-
пулярных внутривенных общих анестетиков, пройдя этап интенсивного клиническо-
го изучения, в настоящее время утратили практическое значение (например, геми-
неврин и виадрил) или имеют ограниченные показания к применению (пропанидид).
Ряд препаратов последнего поколения (альтезин, кетамин, этомидат) нахо-
дятся в стадии широкого клинического применения с параллельным клинико-
экспериментальным изучением. Поиск новых препаратов этого типа продолжает-
ся, но не столь интенсивно, как прежде, поскольку за последние 20 лет усилия
химиков, фармакологов и клиницистов в значительной степени направлены на
создание и внедрение в практику внутривенных анестетиков с селективными свой-
ствами (аналгетиков, транквилизаторов, нейролептиков).
5.2. ТРЕБОВАНИЯ К "ИДЕАЛЬНОМУ"
ВНУТРИВЕННОМУ АНЕСТЕТИКУ
Рациональное (селективное) применение средств для внутривен-
ной анестезии базируется на знаниях о концепции компонентности анестезии и
основах фармакокинетики и фармакодинамики лекарственных средств. Требова-
ния к средствам внутривенной анестезии не отличаются от таковых в ингаляцион-
ной анестезии: главным и непременным условием их действия является выключе-
ние сознания и подавление реакции на внешние раздражители.
Перед проведением анестезии анестезиологу необходимо остановить свой выбор
на препарате (или их комбинации), который бы в наибольшей степени отвечал крите-
риям, разработанным для так называемого идеального внутривенного анестетика.
Требования к “идеальному” внутривенному анестетику: стабильность в раство-
ре; отсутствие боли, раздражения, повреждения тканей в месте введения; низкая
способность к высвобождению гистамина; быстрое начало действия; быстрый
метаболизм до неактивных метаболитов; эффективные показатели клиренса/пе-
рераспределения; отсутствие депрессивного действия на сердечно-сосудистую и
дыхательную системы; снижение мозгового метаболизма, возможность церебро-
протекции; быстрое и полное восстановление сознания; отсутствие в послеопера-
ционном периоде тошноты, рвоты, нарушения сознания, головной боли и т. п.
5.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
ДЛЯ ВНУТРИВЕННОЙ ОБЩЕЙ АНЕСТЕЗИИ
5.3.1. Барбитураты
Для обшей внутривенной анестезии часто используют барбитура-
ты короткого и ультракороткого действия, в частности тиопентал-натрий. По хи-
мическому строению барбитураты являются производными барбитуровой кисло-
ты. Натриевые соли барбитуратов растворимы в воде, обладают выраженной ще-
69
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
лочной реакцией (pH 2,5 % раствора тиопентал-натрия >10) и относительной не-
стабильностью (срок хранения 2,5 % раствора тиопентал-натрия — 2 недели).
Преимущества барбитуровой анестезии: быстрая и спокойная индукция, просто-
та и доступность метода в любых условиях, быстрое пробуждение при правильной
дозировке, отсутствие тошноты и рвоты, амнезия периода введения в анестезию.
Недостатки барбитуровой анестезии: относительно трудная управляемость;
сохранение тонуса скелетных мышц, глоточных и гортанных рефлексов при уме-
ренной глубине анестезии; опасность значительного угнетения жизненно важных
функций; широкие колебания индивидуальной чувствительности; кумуляционный
эффект.
5.3.1.1. Тиопентал-натрий
Метаболизм. Действие тиопентал-натрия делят на фазы: фазу рас-
пределения в водных средах и фазу элиминации.
Фаза распределения в водных средах. Время наступления наркотического сна
при внутривенном способе введения тиопентал-натрия во многом зависит не столько
от общей дозы, как от скорости введения препарата в сосудистое русло. Известно,
что около 20 % сердечного выброса крови составляет мозговой кровоток, и в
тканях мозга при высокой скорости введения тиопентал-натрия быстро создается
концентрация, вызывающая наркотический эффект. Кроме этого, скорость на-
ступления наркотического сна и его длительность зависят от свойства тиопентал-
натрия хорошо растворяться в жирах (при физиологическом pH среды 61 % тио-
пентал-натрия находится в неионизированном состоянии). После прекращения
введения анестетика происходит его быстрое распределение по всей массе крови,
после чего концентрация тиопентал-натрия в тканях мозга начинает снижаться,
что может привести к пробуждению больного или к значительному ослаблению
наркотического эффекта.
Значительная часть барбитурата (85-75 %) вступает в комплексную связь с
альбуминами плазмы, образуя белковые фракции, поэтому лишь четверть введен-
ной дозы тиопентал-натрия производит фармакологический эффект. Процесс свя-
зывания с белками не одномоментный и длится несколько минут, таким образом,
непосредственно после введения анестетика его свободная фракция достаточно
высока. При пониженном содержании протеинов в крови (истощении, почечных
и печеночных заболеваниях, на фоне лечения сульфамидными препаратами) ко-
личество связанного с белками тиопентал-натрия уменьшено и, соответственно,
увеличена доля свободной активной фракции.
Интенсивность связывания барбитуратов с белками крови находится в пря-
мой зависимости от pH крови. Максимальную интенсивность этого процесса на-
блюдают при pH 7,8. Всякое снижение pH (гипоксия, интоксикация, шоковое
состояние, диабет, алкогольное опьянение) резко уменьшает количество связан-
ного анестетика и, следовательно, способствует увеличению концентрации актив-
ной фракции, что при неосторожном введении анестетика может привести к быс-
трой передозировке.
Фаза элиминации. Тиопентал-натрий метаболизируется в печени, продукты его
распада выводятся почками. Сначала гидролизу подвергается свободная фракция,
которая пополняется за счет связанной, при этом наркотический эффект продол-
жается до тех пор, пока эффективная концентрация свободной фракции поддер-
живается пополнением из белковой. В неизмененном виде с мочой выделяется
70
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
около 1 % анестетика. Процесс распада происходит медленно — около 10—15 %
препарата в час, период полураспада составляет 5—12 ч, таким образом, через
сутки в организме может оставаться до 30 % первоначальной дозы. Последующее
введение тиопентал-натрия в течение 1—2 дней может привести к кумуляции эф-
фекта. При неполноценной функции печени, у больных преклонного возраста, а
также после многократного введения анестетика метаболизм происходит еще мед-
леннее. Тучным пациентам дозировку препарата не увеличивают ввиду его замед-
ленного распределения и задержки в жировой клетчатке, что увеличивает период
элиминации.
Механизм действия. В мозге барбитураты взаимодействуют с одноименными
рецепторами макромолекулярного ГАМК-бензодиазепин-рецепторного комплек-
са, в составе которого входят: ГАМК-рецепторы, бензодиазепиновые рецепторы,
хлор-ионофоры, барбитуровые рецепторы и рецепторы других физиологически
активных веществ, например стероидов. Названные субъединицы функциониру-
ют как единый ГАМК-бензодиазепин-рецепторный комплекс. Стимуляция бар-
битуровых рецепторов, расположенных внутри или вблизи ионного канала, при-
водит к увеличению продолжительности активированного состояния ГАМК-ре-
цепторов и времени открытого состояния хлорных каналов, при этом тормозной
эффект ГАМК усиливается и барбитураты оказывают ГАМК-миметическое дей-
ствие. Барбитураты изменяют физико-химические свойства мембраны нейронов,
что сопровождается нарушением функционирования катионных каналов (натрие-
вых, калиевых, кальциевых).
Действие на ЦНС. Барбитураты быстро преодолевают гематоэнцефалический
барьер и подавляют функции ЦНС. Степень угнетения зависит от дозы препарата,
способа его применения, состояния рефлекторной активности организма. Основ-
ной областью действия барбитуратов является ретикулярная формация ствола мозга.
В зависимости от дозы анестетика и, соответственно, от степени торможения ре-
тикулярной формации и уменьшения потока неспецифических импульсов полу-
чают различные эффекты — седативный, снотворный или наркотический.
Механизм наркотизации барбитуратами не объясняют одним лишь угнетени-
ем ретикулярной формации, так как для поддержания анестезии даже на умерен-
ном уровне требуются значительные дозы барбитуратов, чем те, которые блокиру-
ют передачу импульсов в ретикулярной формации (20—45 мг/кг). Следовательно,
барбитураты наряду с ретикулярной формацией в какой-то степени угнетают дру-
гие отделы ЦНС, в частности — кору головного мозга, ядра таламуса, другие под-
корковые структуры. Значительному угнетению подвергается стволовой отдел, что
объясняет высокую чувствительность к барбитуратам дыхательного и сосудодви-
гательного центров.
Барбитураты оказывают прямое угнетающее действие на вегетативную нервную
систему (симпатический отдел более подвержен влиянию); при использовании
барбитуратов развивается относительное преобладание парасимпатической иннер-
вации, в частности — более выражены вагусные рефлексы.
На фоне барбитуровой анестезии уменьшается объем крови в мозге, снижа-
ются внутричерепное давление и метаболизм в мозговой ткани.
Действие на дыхание. Тиопентал-натрий вызывает дозозависимую депрессию
дыхания в результате угнетения дыхательного центра: снижаются частота и сила
дыхательных экскурсий, минутный объем дыхания, с последующими гиперкапни-
ей и ацидозом, которые, в свою очередь, обуславливают увеличение концентра-
ции свободной фракции барбитурата в крови. Формируется порочный круг, кото-
71
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
рый может привести к остановке дыхания. Часто при введении тиопентал-натрия
наблюдают короткий период апноэ, обычно предваряемый несколькими глубоки-
ми вдохами. Необходимо помнить, что на угнетение дыхания могут влиять сред-
ства премедикации, например опиоиды; в таких случаях может потребоваться вспо-
могательная или контролируемая вентиляция легких. При восстановлении спон-
танного дыхания после использования барбитуратов частота и дыхательный объем
обычно ниже нормы и остаются такими во время пробуждения.
Барбитураты незначительно повышают тонус бронхиальных мышц, хотя яв-
ный бронхоспазм возникает редко. Возникновению бронхо- или ларингоспазма
способствуют хирургические манипуляции на дыхательных путях, их раздражение
инородным телом (секретом, кровью, воздуховодом) в области гортани или глот-
ки в условиях недостаточной анестезии.
Действие на сердечно-сосудистую систему. Под действием барбитуратов форми-
руется гипотензия за счет сосудистого и сердечного компонентов: угнетается тонус
сосудодвигательного центра и уменьшается его вазоконстрикторное влияние на пе-
риферические сосуды, следствием чего является их расширение и увеличение емкос-
ти. Кровь относительно депонируется на периферии, уменьшается венозный возврат,
снижается сердечный выброс и уменьшается сопротивление току крови. Одновре-
менно уменьшается коронарный кровоток, ухудшается питание миокарда и снижает-
ся его сократительная способность. Отрицательное влияние на деятельность сердца
оказывает повышенный тонус блуждающего нерва при использовании барбитуратов.
Степень снижения АД находится в прямой зависимости от глубины анестезии.
Сравнительно медленное введение анестетика (50 мг/мин у взрослых) позво-
ляет избежать развития гипотензии за счет компенсаторных реакций сердечно-
сосудистой системы — учащения ЧСС и повышения периферического сопротив-
ления сосудов. При этом учащение пульса при отсутствии сердечной патологии не
приводит к гипоксии миокарда, поскольку увеличение потребности его в кисло-
роде компенсируется улучшением коронарного кровотока.
Действие на печень. Рекомендованные концентрации барбитуратов не оказы-
вают существенного влияния на печень. Редкие нарушения функции печени свя-
заны не с прямым действием анестетика на гепатоциты, а с гипоксией, которая
возникает при неправильном использовании барбитуратов. Известно, что в обыч-
ных условиях циркулирующая в печени кровь содержит мало кислорода, посколь-
ку 80 % притекающей к печени крови составляет венозная кровь, поступающая от
непарных органов живота, и только 20 % кровотока составляет поступление по
печеночной артерии. Возможная при барбитуровой анестезии респираторная и
циркуляторная гипоксии еще более снижают доставку кислорода и предраспола-
гают к повреждению патологически спровоцированной печени.
Действие на почки. Барбитураты не оказывают прямого влияния на почки, но
функция почек после введения тиопентал-натрия временно ухудшается. Наблю-
дающееся при глубокой анестезии уменьшение диуреза объясняют влиянием вы-
раженных гемодинамических нарушений, интраренальной вазоконстрикцией и
увеличением секреции антидиуретического гормона.
Действие на другие системы и органы. Барбитураты оказывают некоторое вли-
яние на тонус матки в покое, но при высоких дозах препарата сокращения матки
угнетаются. Тиопентал-натрий легко проникает через плаценту и при искусствен-
ном родоразрешении может тормозить восстановление дыхания новорожденного.
Если доза тиопентал-натрия не превышает 7 мг/кг, то такие побочные эффекты
развиваются крайне редко.
72
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Внутриглазное давление при использовании барбитуратов снижается пример-
но на 40 %. Зрачки в начале использования расширяются, а затем сужаются; кор-
неальный и коньюнктивальный рефлексы последовательно исчезают; рефлекс на
свет сохраняется до достижения хирургической анестезии.
При использовании тиопентал-натрия в качестве единственного анестетичес-
кого агента релаксация скелетных мышц незначительна. Тонус скелетных мышц
снижается при высокой концентрации тиопентал-натрия в результате частичного
угнетения спинномозговых рефлексов, а не за счет прямого влияния на нервно-
мышечное соединение.
Клинические проявления анестезии. Тиопентал-натрий используют в виде 1—2 %
растворов, так как более концентрированные растворы вызывают раздражение
вены и их труднее дозировать. Раствор готовят ex tempore, вводят внутривенно со
скоростью 1 мл/с. Используют, в основном, в качестве средства для вводного
наркоза. Для поддержания анестезии тиопентал-натрий малоприемлем в связи с
недостаточным аналгетическим эффектом и вышеуказанными побочными эффек-
тами, в частности, сравнительно медленной биотрансформацией (продолжитель-
ные сонливость и адинамия в ближайший послеоперационный период).
Разовая наркотическая доза тиопентал-натрия у взрослых весьма вариабель-
на, колеблется в пределах от 200 до 800 мг (3—5 мг/кг) и зависит от объективного
статуса больного, состояния функции печени, белкового состава и pH крови, ха-
рактера премедикации; максимальная доза составляет — 8 мг/кг, длительность
действия — 15—20 мин.
Перед началом анестезии готовят необходимое для ингаляции кислорода и
осуществления ИВЛ через маску и эндотрахеальную трубку. Первые 5—8 мл ра-
створа взрослым вводят быстро, а затем замедляют темп введения. Так, дозу, не-
обходимую для индукции в наркоз (250—350 мг), вводят в течение 2—3 мин. После
потери сознания обычно происходит глубокий вдох, а затем начинает проявляться
более или менее выраженное угнетение дыхания. Чтобы депрессия не достигла
опасного уровня, временно прекращают введение анестетика используют вспомо-
гательную вентиляцию легких.
Сужение зрачков, значительное снижение их реакции на свет, фиксация глаз-
ных яблок в срединном положении, расслабление мышц лица и шеи — признаки
допустимого уровня анестезии, необходимого для осуществления ларингоскопии,
интубации трахеи и выполнения кратковременных операций. Анестезию тиопен-
тал-натрием используют как базисную при последующем углублении ее закисью
азота (1:1, 1:2), аналгетиками, фторотаном и другими средствами. При этом после
индукции в анестезию барбитураты вводят фракционно или капельно. Такую так-
тику при непродолжительных и нетравматичных вмешательствах используют без
интубации трахеи и ИВЛ, если удается избежать угнетения дыхания.
Осложнения при анестезии барбитуратами (депрессия дыхания и гипотензия)
возникают, в основном, при использовании нерациональных дозировок. Ларинго-
спазм является, в некоторой степени, специфичным для барбитуратов осложнением,
так как развивается по причине повышенного тонуса блуждающего нерва. Для про-
филактики ларингоспазма в премедикацию включают парасимпатолитики.
Противопоказания. Абсолютным противопоказанием к применению анесте-
тиков барбитурового ряда является ремиттирующая порфирия. С осторожностью
используют барбитураты при некомпенсированной кровопотере, шоке, у исто-
щенных больных, при сопутствующей сердечно-сосудистой патологии.
73
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
5.3.2. Бензодиазепины
Бензодиазепины — психотропные средства (класс транквилизато-
ров), обладающие анксиолитическим действием за счет специфического влияния
на одноименные рецепторы макромолекулярного ГАМК-бензодиазепин-рецептор-
ного комплекса. Бензодиазепины используют для премедикации, в качестве основ-
ного компонента анестезии или в качестве моноанестетика. По фармакологическо-
му действию бензодиазепины относят к группе малых транквилизаторов.
Клинические эффекты применения бензодиазепинов: выраженное анксиолити-
ческое и седативное действие; дозозависимая антероградная амнезия вследствие
влияния на раннюю фазу консолидации процесса запоминания (при применении
диазепама); противосудорожное действие за счет предотвращения подкоркового
распространения судорожной активности, без влияния на судорожный фокус; ре-
лаксация гладких мышц за счет угнетения полисинаптической передачи в спин-
ном и головном мозге, а также путем легкого угнетения моторных нервов и мы-
шечной функции; угнетение рефлексов с верхних дыхательных путей, депрессия
дыхания через прямое угнетение дыхательного центра в ответ на гипоксемию и
гиперкапнию, а также за счет некоторого снижения активности дыхательных мышц;
уменьшение минутного объема и АД, рефлекторная тахикардия (при использова-
нии больших доз).
Побочные эффекты применения бензодиазепинов: остаточная сонливость, мен-
тальные нарушения, дизартрия и атаксия, вентиляционная депрессия после внут-
ривенного применения препаратов, мышечная слабость, головная боль, тошнота
и рвота, головокружение, суставные и грудные боли.
5.3.2.1. Диазепам
Дериват бензодиазепина, препараты которого выпускают под раз-
ными названиями: валиум, реланиум, седуксен, сибазон, фаустан. Это кристалли-
ческое, почти бесцветное вещество, нерастворимое в воде. Растворителем препара-
тов диазепама является пропиленгликоль в сочетании с этанолом, бензоатом на-
трия и бензойной кислотой. Проявляют осторожность при разведении препаратов
диазепама в водных растворах и при смешивании с различными лекарственными
веществами, чтобы не вызвать образования эмульсии. Валиум и седуксен выпуска-
ют в ампулах из желтого стекла по 2 мл (10 мг), что является средней разовой дозой.
Метаболизм. После введения минимальной седативной дозы (0,1 мг/кг) диа-
зепам связывается с белками плазмы, после чего быстро снижается его плазмен-
ная концентрация. При использовании дозы до 0,3 мг/кг снижение концентрации
диазепама в крови происходит более медленно. Через 6—8 ч плазменный уровень
диазепама и его основного метаболита диметиддиазепама вновь возрастает, так
как препарат способен депонироваться в жировой ткани. Гепарин конкурирует с
диазепамом, вытесняя его из белков и увеличивая свободную фракцию препарата:
после введения 1000 ЕД гепарина свободная фракция диазепама повышается на
200 %. При повторном введении препаратов диазепама возможен кумуляционный
эффект. При внутривенном введении в дозе 20 мг диазепам и его метаболиты
обнаруживают в крови у взрослых в течение более 50 ч.
Токсичность диазепама невелика. Описаны благоприятные исходы интенсивной
детоксикационной терапии после перорального приема 1200—1500 мг препарата.
74
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Механизм действия. Нейромедиаторные особенности диазепамового сна сво-
еобразны. Диазепам, гематогенным путем попадая в головной мозг, умеренно уг-
нетает образование и действие дофамина и норадреналина в мозговых структурах
и усиливает нарушение проводимости в образованиях, где основным нейромеди-
атором является ГАМК. Считают, что молекулярный механизм центрального дей-
ствия диазепама определяется взаимодействием его молекул со специфическими
бензодиазепиновыми рецепторами (БД-рецепторами). Бензадиазепиновый рецеп-
тор и ГАМК-БД-рецептор — различные, но функционально связанные образова-
ния, которые формируют комплекс “ГАМК-рецептор-хлоридный канал” в субси-
наптической мембране нейронов, играющий существенное значение в передаче
возбуждения. В значительных дозах диазепам оказывает центральный миорелак-
сирующий эффект за счет усиления ГАМК-эргического торможения в мотоней-
ронах спинного мозга.
Действие на ЦНС и нервно-мышечную передачу. Диазепам оказывает угнетаю-
щее действие на кору больших полушарий, снижая возбудимость таламуса, лим-
бической системы и ретикулярной формации ствола мозга. Корковые влияния
являются вторичным эффектом диазепама, опосредованным через подкорковые
структуры головного мозга. Подавляя активность гиппокампа, диазепам облегчает
наступление медикаментозного сна, особенностью которого является антероград-
ная и ретроградная амнезии, распространяющиеся на весь период глубокой тран-
квилизации больного.
Как и другие бензодиазепины, диазепам угнетает возбудимость афферентных
и эфферентных систем головного мозга с обеспечением направленной защиты
организма от болевого стресса. Установлено, что бензодиазепины обладают свой-
ством повышения устойчивости к боли за счет угнетения ее эмоционального ком-
понента, то есть являются в какой-то мере неспецифическими аналгетиками. Об-
легчение ГАМК-эргической передачи сопровождается снижением болевой чув-
ствительности вследствие связи между системами ГАМК и опиоидных пептидов.
Диазепам обладает противосудорожным эффектом, действуя на гиппокамп и
височную долю мозга. Отчетливое клиническое противосудорожное действие ди-
азепама при эпилепсии и центральных мышечных гипертензиях, например, при
токсических реакциях на местные анестетики, определяется повышением порога
возбудимости таламуса и лимбических структур и прерыванием патологической
импульсации на уровне этих образований. Этот эффект диазепама связан с разви-
тием миорелаксации, имеющей и спинальный механизм.
Диазепам приводит к вазодилятации артерий и вен головного мозга. Как и
другие бензодиазепины, диазепам обладает вегетотропным действием, с его помо-
щью купируют предоперационную тахикардию эмоционального генеза, аритмию,
артериальную гипертензию.
Действие на дыхание. При внутривенном введении седативные дозы диазепа-
ма не оказывают клинически значимое влияние на дыхание. Апноэ в ответ на
быстрое введение препарата объясняют высокой индивидуальной чувствительнос-
тью и наблюдают достаточно редко. В начале диазепамового сна наступает мы-
шечное расслабление с частичным западением языка, но введение такому больно-
му воздуховода вызывает кашлевую реакцию и пробуждение. Когда диазепам в
полной мере проявляет гипнотический (потерю сознания) и центральный релак-
сирующий эффекты, развивается гиповентиляция со снижением МОД у некото-
рых больных на 20—38 % от уровня бодрствования: рО2 отчетливо снижается с
повышением рСО,. При этом чувствительность дыхательного центра к СО, под
75
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
влиянием диазепама не меняется. Такая особенность требует применять вспомо-
гательную ИВЛ при индукции в наркоз с помощью препаратов диазепама и вы-
полнять интубацию трахеи для проведения контролируемой ИВЛ. Синергизм ди-
азепама с миорелаксантами во время анестезии не сопровождается длительной
депрессией дыхания в посленаркозный период.
Действие на сердечно-сосудистую систему. При введении седативных доз диа-
зепама кровоснабжение миокарда у пациентов с ИБС возрастает более чем на 70 %,
у здоровых людей — на 22,5 %. Увеличение коронарного кровотока связано с
непосредственным коронарорасширяющим действием препарата.
Диазепам предупреждает прямой коронаросуживающий эффект вазопресси-
на. Установлено центральное антиаритмическое действие седуксена: препарат по-
вышает порог возбудимости миокарда и усиливает антиаритмический эффект ли-
докаина.
Диазепам незначительно повышает общее легочное сосудистое сопротивле-
ние и давление в легочной артерии.
При использовании значительной дозы диазепама развивается умеренная ар-
териальная гипотензия. У пациентов с глубокими расстройствами сердечной дея-
тельности может развиться значительная артериальная гипотензия, особенно на
фоне выраженной гиповолемии. Имеются единичные сообщения о коллапсе кро-
вообращения после вводного наркоза седуксеном.
Действие на печень. Препараты диазепама не влияют на печеночный кровоток,
портальное давление и функции печени в дозах, используемых в анестезиологии.
Действие на почки. Изменения функции почек на фоне действия диазепама
носят обратимый характер, хотя под его влиянием происходит некоторое увеличе-
ние клубочковой фильтрации и снижение почечного сосудистого сопротивления,
что приводит к некоторому уменьшению экскреции осмотически активных суб-
станций с мочой. Это снижение одинаково для пациентов с практически здоровы-
ми почками и на фоне хронической почечной недостаточности, что позволяет
применять препараты диазепама для премедикации и вводного наркоза у больных
с существенно нарушенным функциональным состоянием почек.
Действие на другие системы и органы. На сократительную способность матки
диазепам не влияет, что вместе с отсутствием нефротоксичности позволяет при-
менять сибазон в дозе 0,1—0,5 мг/кг при патологическом течении беременности. В
дозе более 0,5 мг/кг сибазон незначительно снижает системное АД, что сказыва-
ется на маточно-плацентарном кровообращении. Диазепам легко проникает через
плацентарный барьер: концентрация в крови матери и плода после введения быс-
тро становится одинаковой.
Диазепам не вызывает существенных изменений активности эндокринной
системы, наоборот, он уменьшает ее ответ на травму при сохранении чувствитель-
ности периферических структур к адреналину, уменьшая одновременно эффекты
гистамина и ацетилхолина на жизненно важные функции, хотя и не является пря-
мым антагонистом этих биологически активных веществ. Установлено, что седук-
сен в дозе 0,2 мг/кг снижает концентрацию свободного кортизола в крови на фоне
предоперационного напряжения.
Клинические проявления анестезии. В анестезиологии применяют 0,5 % ра-
створ диазепама с почти нейтральным значением pH (6,4—6,9).
Закономерная клиническая стадийность сна при применении диазепама от-
сутствует; глазные рефлексы сохранены. При внутривенном введении 10-20 мгу
взрослого человека чувство страха снижается через 30—90 с, а продолжительность
76
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
седативного эффекта составляет 15—20 мин и более. Снотворный эффект после
внутривенного введения седуксена развивается через 1—2 мин, хотя для достиже-
ния уровня подавления сознания, напоминающего физиологический сон, исполь-
зуют дозировки 0,25—1,5 мг/кг. Седуксеновый сон при средней дозе транквилиза-
тора 0,3 мг/кг внутривенно обычно продолжается не более 10 мин, после чего
начинает восстанавливаться сознание. Ориентация пациента в окружающей об-
становке в течение последующих 10 мин резко нарушена. В отличие от нейролеп-
тиков диазепам не обладает выраженными антипсихотическими свойствами с дли-
тельным угнетением сознания. Применение его в небольших дозах характеризуют
быстрым восстановлением адекватных реакций на окружающую обстановку.
Иногда начальный эффект диазепама поддерживают последующим введением
натрия оксибутирата, что ускоряет наступление оксибутиратового сна и предуп-
реждает судорожные реакции. При такой индукции не возникает ларинго- и брон-
хоспазм, хорошо расслабляются шейные и жевательные мышцы, сокращается по-
требность в миорелаксантах по сравнению с другими методами общей анестезии,
если применяют контролируемую ИВЛ.
В качестве одного из основных компонентов анестезиологического пособия
диазепам нашел применение в программе сбалансированной анестезии под назва-
нием “атаралгезии”, которая введена в практику Бунятяном А.А. и его сотрудни-
ками в 1968 году. Аналгетический компонент атаралгезии обеспечивают опиоида-
ми (фентанилом, реже — дипидолором и др.). Особенно благоприятное течение
такой анестезии наблюдают при внутривенном введении диазепама (седуксена,
сибазона) в дозе 0,3 мг/кг. Полноценная атаралгезии отличается стабильностью
показателей кровообращения, умеренной блокадой симпатоадреналовой системы,
сохранением функциональной активности печени и почек, устойчивостью кис-
лотно-основного состояния крови, а также спокойным пробуждением больного
без существенной постнаркотической депрессии сознания. Заслуживает внимания
отчетливое снижение болевой чувствительности на протяжении первых 5—6 часов
после завершения анестезии.
Преимущества диазепиновой анестезии. Диазепам потенцирует действие сно-
творных, общих анестетиков, наркотических аналгетиков и нейролептиков (гало-
первдила, дроперидола). Обладая свойствами центрального миорелаксанта, диа-
зепам позволяет уменьшить дозы периферических миорелаксантов, при этом по-
вышая длительность нервно-мышечного блока, вызываемого недеполяризующими
миорелаксантами, и укорачивая длительность миопаралитического действия де-
поляризующих миорелаксантов. В клинических условиях доказано отчетливое
антигипоксическое действие диазепама в терапевтических дозах; считают, что по
выраженности защитного эффекта при гипоксии, диазепам близок к натрию ок-
сибутирату, но превосходит его по длительности действия, которое сохраняется до
4-5 ч после введения.
Недостатки диазепиновой анестезии. Диазепам не повышает тонус блуждаю-
щего нерва, но и не блокирует вагусные реакции, что вынуждает всегда сочетать
его применение с парасимпатолитиками (атропином, скополамином). Основным
недостатком, который не позволяет отнести сибазон к “настоящим” внутривен-
ным наркотикам, считают отсутствие точного дозозависимого действия и, в ре-
зультате этого, непостоянство наркотического эффекта, что заставляет индивиду-
ально подбирать “анестетическую дозу” препарата. Отсутствие закономерной ста-
дийности сна усложняет контроль за течением анестезии при применении
диазепама, при этом наиболее информативными признаками, по которым ори-
77
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ентируются, являются уровень системного АД, качественные характеристики по-
казателей кровообращения (ЧСС, ритмичность, наполнение пульса), состояние
периферического кровотока (цвет, влажность кожи, симптом белого пятна, темп
почасового мочеотделения), показатели пульсоксиметрии. При болюсном внутри-
венном использовании диазепама повышается риск развития постинфузионных
тромбофлебитов.
Взаимодействие с лекарственными средствами. Диазепам обладает синергети-
ческим действием с миорелаксантами, поэтому ограничивают введение последних
во второй половине анестезиологического пособия во избежание задержки вос-
становления мышечного тонуса и адекватного самостоятельного дыхания.
5.3.2.2. Мидазолам
Бензодиазепин, препараты которого выпускают под разными на-
званиями: сульсед, дормикум, версед и др. Каждый миллилитр препарата содер-
жит 1 или 5 мг мидазолама с добавлением 1 % бензилового алкоголя как консер-
ванта; активная реакция препарата доведена соляной кислотой до pH 3. Именно
растворимость мидазолама в воде, его совместимость с солевыми инфузионными
растворами, безболезненность внутривенного введения и кратковременность дей-
ствия составляют значительные преимущества перед диазепамом.
Метаболизм. Приблизительно 94—97 % препарата находится в организме в
связанном с белками состоянии. Период полувыведения мидазолама в среднем
составляет 60—80 мин и колеблется 1,5—12 ч. Менее 0,03 % выводится из организ-
ма в неметаболизированном виде, остальная часть активной субстанции быстро
метаболизируется в 1-гидроксиметилмидазолам, который конъюгируется и выво-
дится с мочой. После одноразового внутривенного введения количество мидазо-
лама в крови в 10—30 раз больше, чем гидроксиметилмидазолама. Концентрация
мидазолама на фоне гиповолемии снижается примерно в 1,5 раза медленнее, чем
при нормоволемии. Замедление выведения мидазолама из организма наблюдают
при застойной сердечной и хронической почечной недостаточностях. У пациен-
тов с расстройствами функций печени очевидных изменений фармакокинетики
мидазолама не наблюдают. Эритромицин подавляет метаболизм мидазолама, что
пролонгирует и усиливает его действие.
Действие на ЦНС зависит от дозы, пути введения и премедикации опиоида-
ми. Мидазолам обладает выраженным гипнотическим действием, но развивается
оно медленнее, чем при введении барбитуратов или этомидата. Оказывает седа-
тивное, центральное миорелаксирующее и противосудорожное действие. Мидазо-
лам в сравнении с другими препаратами группы бензодиазепинов обладает более
сильным транквилизирующим и амнестическим действием. Как и седуксен, он
снижает внутричерепное давление и метаболизм мозга.
Действие на дыхание. Внутримышечное введение мидазолама существенно не
угнетает вентиляционный ответ на СО,. При медленной внутривенной инъекции в
15 % случаев применения мидазолама возникает апноэ, а вентиляционный ответ на
СО, остается нарушенным на протяжении 15 мин и более. Этот эффект подобен
угнетению дыхания под действием тиопентал-натрия. Нарушение ответа на СО,
особенно значительно у пациентов с хроническими обструктивными легочными
заболеваниями. Использование мидазолама одновременно с барбитуратами, други-
ми депрессантами ЦНС или на фоне действия этанола может увеличить риск легоч-
ной гиповентиляции и углубить или удлинить действие этих депрессантов.
78
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Действие на сердечно-сосудистую систему. Мидазолам у пациентов без исход-
ных расстройств кровообращения приводит к некоторому снижению сердечного
выброса, системного сосудистого сопротивления и, следовательно, показателя САД.
Это наблюдают на фоне замедления ЧСС при исходной умеренной тахикардии.
Гипотензивный эффект мидазолама усиливается при дефиците ОЦК.
У кардиохирургических больных гемодинамические эффекты мидазолама за-
висят от состояния сократимости левого желудочка: при сохраненной функции на-
блюдают отчетливое снижение сердечного выброса без изменения давления напол-
нения желудочков сердца и системного сосудистого сопротивления. У пациентов с
поражением клапанного аппарата и умеренной недостаточностью кровообращения
использование мидазолама в качестве вводного наркотика не вызывает изменений
ударной производительности сердца, а МОК проявляет тенденцию к возрастанию.
У пациентов с ИБС мидазолам вызывает отчетливое снижение кровотока через
коронарный синус и снижение потребления кислорода миокардом, но признаков
нарастания ишемии миокарда, отражающейся на ЭКГ, не отмечают.
Клинические проявления анестезии. Как и у диазепама, седативный и снотвор-
ный эффекты мидазолама вариабельны: дозы для выключения сознания колеб-
лются от 0,015 до 0,05 мг/кг (в среднем для взрослого человека — 7,5—15 мг). Доза
2 мг мидазолама по наркотическому эффекту в среднем эквивалентна 400 мг тио-
пентал-натрия.
Для введения в анестезию вводят внутривенно 0,15—0,2 мг/кг мидазолама в
комбинации с аналгетиками, средняя доза — 15 мг. Пациентам, не получавшим
премедикацию, вводят 0,3—0,35 мг/кг медленно дробно: 5 мг в течение 20—30 с,
интервал — 2 мин.
Начальная внутривенная доза мидазолама должна быть не менее чем 1 мг, но
и не превышать 2,5 мг, при этом ее вводят в течение 1—2 мин. После 2-минутной
паузы вводят следующую дозу. Иногда на фоне введения мидазолама наблюдают
непроизвольные движения, включая тоникоклонические подергивания и мышеч-
ный тремор, непроизвольное сопротивление, но появление таких реакций зависит
от индивидуальных особенностей пациента. Эффект засыпания достигают при дозах
0,015-0,35 мг/кг через 2—2,5 мин. При включении в премедикацию опиоидов вве-
дение в анестезию укорачивается до 1,5 мин. Снотворный эффект достигает мак-
симума в течение 3—5 мин и продолжается 6—20 мин. Выход из наркотического
сна отчетливо замедлен, что исключает применение мидазолама при кратковре-
менных вмешательствах. Полное восстановление координации движений у паци-
ентов наступает в среднем через 75—100 мин после пробуждения. Характерна вы-
раженная амнезия и более полное восстановление психической активности в срав-
нении с диазепамом.
При внутривенном капельном введении в дозе 0,03—0,1 мг/кг/ч препарат под-
держивает достаточный уровень анестезии, но обязательно в комбинации с
наркотическими аналгетиками, закисью азота или одним из методов местной ане-
стезии. Использованию больших доз мидазолама следует предпочесть дополнение
его действия малыми дозами гипнотиков, например, 30—50 мг пропофола или
100 мг тиопентал-натрия.
Пожилым и ослабленным пациентам назначают половину обычной дозы ми-
дазолама; начальная доза не должна превышать 1 мг. У больных с гиповолемией и
гипотермией используют инфузионное введение препарата.
Перед тем как приступить к внутривенному введению мидазолама, убеждают-
ся в доступности подачи кислорода и исправности соответствующего оборудова-
79
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ния для дыхательной поддержки и поддержания проходимости дыхательных пу-
тей. Тщательно наблюдают за больным для выявления ранних проявлений апноэ.
Необходима повышенная готовность к проведению ИВЛ.
Побочные действия. Редко — аллергические реакции в виде кожной сыпи или
крапивницы. У больных, которых разбудили в первые часы после приема препа-
рата, возможно развитие амнезии.
Противопоказания. Миастения, беременность.
Антагонисты. Наличие специфического антагониста анексата делает анесте-
зию мидазоламом управляемой.
5.3.3. Общие неингаляционные анестетики
5.3.3.1. Этомидат (гипномидат)
Содержит карбоксилированный имидазол, структурно отличается
от остальных анестетиков и может быть отнесен к группе гипнотиков. Наличие
имидазольного кольца обепечивает водорастворимость в кислой среде и жирора-
створимость при физиологическом значении pH. Этомидат выпускают в ампулах
по 10 мл (2 мг препарата в 1 мл раствора).
Метаболизм. Несмотря на высокую степень связи с белками крови, этомидат
обладает быстрым началом действия вследствие высокой растворимости в жирах и
наличия большой неионизированной фракции при физиологическом значении pH.
Биотрансформация этомидата протекает в 5 раз быстрее, чем тиопентал-на-
трия. Ферменты микросом печени и эстеразы плазмы быстро гидролизуют этоми-
дат до неактивных метаболитов, которые в течение суток выводятся почками и
частично кишечником.
Механизм действия. Этомидат угнетает ретикулярную формацию и имитирует
ингибирующие эффекты гамма-аминомасляной кислоты.
Действие на ЦНС. Этомидат обладает сильным гипнотическим действием, он
выключает сознание, практически не влияя на болевую чувствительность. Этоми-
дат снижает метаболические потребности головного мозга, мозговой кровоток и
внутричерепное давление аналогично тиопентал-натрию. Церебральное перфузи-
онное давление не снижается благодаря отсутствию депрессии кровообращения.
Этомидат вызывает изменения ЭЭГ, аналогичные при применении барбитуратов.
В отличие от барбитуратов этомидат может устранять ингибирующее влияние
центров, регулирующих экстрапирамидную двигательную активность. Миоклони-
ческая активность в 30—60 % случаев обусловлена именно этим растормаживанием.
Действие на дыхание. Этомидат влияет на вентиляцию в меньшей степени,
чем барбитураты и бензодиазепины. В средних клинических дозах он незначи-
тельно снижает МОД и увеличивает ЧДД. Индукционные дозы обычно не вызы-
вают апноэ, если одновременно не используют опиоиды.
Действие на сердечно-сосудистую систему. Этомидат незначительно влияет на
кровообращение: умеренно снижает АД, не изменяет сократимость миокарда и
сердечный выброс. Препарат не провоцирует освобождение гистамина.
Действие на другие системы и органы. Послеоперационные тошнота и рвота
возникают чаще, чем после введения барбитуратов. Риск появления тошноты и
рвоты значительно снижается при включении в премедикацию противорвотных
препаратов. Индукционные дозы этомидата вызывают преходящее угнетение
80
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
ферментов, участвующих в синтезе кортизола и альдостерона. При длительной
инфузии этомидата возникает недостаточность коры надпочечников, что увели-
чивает смертность у больных в критическом состоянии. В литературе сообщают о
нефротоксическом эффекте пропиленгликоля, входящего в состав препарата.
Клинические проявления анестезии. Этомидат применяют только внутривенно.
Максимальную концентрацию в крови достигают через 1 мин после введения. В
связи с чрезвычайной кратковременностью действия и отсутствием аналгезии и
арефлексии этомидат применяют после полноценной премедикации, включаю-
щей психотропный, аналгетический и холинолитический компоненты, а в перио-
де индукции сочетают с препаратами для нейролептаналгезии. Доза для индукции
составляет в среднем 0,2 мг/кг, ее вводят в течение 60 с. Введение раствора этоми-
дата часто вызывает боль по ходу вены, которую уменьшают предварительной
инъекцией лидокаина.
Методика индукции этомидатом в сочетании с препаратами для нейролепт-
аналгезии заключается в предварительном введении дроперидола и фентанила, а
затем этомидата (0,2 мг/кг) и миорелаксанта, что обеспечивает общую анестезию
достаточной эффективности и длительности для выполнения интубации трахеи
без существенной реакции кровообращения. Целесообразнее введение фентанила
перед этомидатом из соображений чрезвычайно кратковременного гипнотическо-
го действия этомидата и для профилактики вызываемых им болей при введении и
миоклоний. Во избежание сочетанного действия этомидата и дроперидола, после-
дний вводят после индукции.
Действие этомидата развивается быстро: выключение сознания происходит в
течение минуты от начала введения препарата. Наступление сна сопровождается
кратковременным расширением зрачков и нередко судорожным подергиванием
мышц. В редких случаях возможны кратковременные (не более 30 с) угнетение
или остановка дыхания с последующим самопроизвольным восстановлением.
Болевая чувствительность и рефлекторная деятельность при моноанестезии
этомидатом сохраняются, поэтому в таких случаях выполнение интубации трахеи
и каких-либо болезненных манипуляций недопустимо. Длительность сна при дозе
этомидата 0,2 мг/кг составляет 2—3 мин, при дозе 0,3 мг/кг — 4—5 мин (при
гипопротеинемии может увеличиваться). Восстановление функции ЦНС проис-
ходит быстро, но после пробуждения возможно развитие астенического синдрома.
Благодаря минимальному влиянию на кровообращение этомидат особенно по-
казан больным в критических состояниях и с сердечной недостаточностью, в том
числе у кардиохирургических бальных для вводной анестезии и последующей дли-
тельной инфузии во время операции в сочетании с фракционным введением фента-
нила. При таком варианте возможно исключение из схемы анестезии закиси азота.
Взаимодействие с лекарственными средствами. Фентанил повышает концент-
рацию этомидата в плазме и увеличивает его период полувыведения в фазе элими-
нации. Опиоиды снижают частоту миоклонуса при индукции этомидатом.
Противопоказания. Предоперационная недостаточность функции коры над-
почечников.
5.3.3.2. Пропофол
По химическому строению является дериватом фенола: состоит
из фенольного кольца, к которому присоединены две изопропильные группы.
Торговые названия — диприван, профал, рекофол. Промышленное изготовление
81
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
препарата началось с 1986 года. Пропофол — более дорогостоящий препарат, чем
тиопентал-натрий, но он приобрел огромную популярность благодаря противо-
рвотному действию и благоприятным восстановительным характеристикам.
Механизм действия. Предполагают, что механизм действия пропофола обус-
ловлен способностью облегчать передачу ингибиторного нервного импульса, опос-
редованного гамма-аминомасляной кислотой.
Метаболизм. Высокая растворимость в жирах обеспечивает быстрое начало
действия, аналогичное таковому у тиопентал-натрия. Пробуждение после одно-
кратного струйного введения также происходит очень быстро вследствие чрезвы-
чайно короткого периода полусуществования пропофола в фазе быстрого распре-
деления (2—8 мин). Большинство исследователей считают, что пробуждение после
анестезии пропофолом происходит быстрее и влечет за собой меньше остаточных
явлений, чем после анестезии тиопентал-натрием или этомидатом.
Исключительно высокий клиренс (в 10 раз выше, чем у тиопентал-натрия),
вероятно, и обеспечивает относительно быстрое пробуждение после длительной
инфузии пропофола. Конъюгация в печени приводит к появлению неактивных
метаболитов. Умеренный цирроз не влияет на фармакокинетику пропофола. Хро-
ническая почечная недостаточность не влияет на клиренс пропофола, хотя его
метаболиты выделяются с мочой.
Действие на ЦНС и нервно-мышечную передачу. Из крови препарат поступает
в головной мозг более медленно, чем тиопентал-натрий. Пропофол снижает моз-
говой кровоток и внутричерепное давление. При внутричерепной гипертензии без
прессорной поддержки пропофол может вызвать недопустимое снижение цереб-
рального перфузионного давления ниже критического уровня (менее 50 мм рт. ст.).
Степень защиты головного мозга от очаговой ишемии приблизительно одинакова
для пропофола и тиопентал-натрия. Пропофол устраняет рвоту и зуд, что является
уникальным свойством для анестетиков; снижает внутриглазное давление; может
вызвать субъективные ощущения благополучия и эйфории (риск развития при-
страстия).
Препарат снижает тонус мышц, но в ответ на хирургическое воздействие то-
нус и движения могут возобновиться. Вводный наркоз пропофолом иногда сопро-
вождается моторным возбуждением —- неэпилептической миоклонией. Пропофол
эффективно прекращает или сокращает продолжительность судорог, вызываемых
электроконвульсивной терапией. Тем не менее, в литературе сообщают о возник-
новении судорог при применения пропофола, в связи с чем, рекомендуют прояв-
лять осторожность при его использовании у пациентов с эпилепсией.
Действие на дыхание. Пропофол вызывает дозозависимую депрессию дыха-
ния. Вероятность возникновения апноэ во время вводного наркоза — 25-35 %. Во
время инфузии пропофола увеличивается дыхательный объем, а ЧДД уменьшает-
ся. Отмечают снижение дыхательного ответа на двуокись углерода. Угнетение
дыхания более выражено в случае введения опиоидов.
Пропофол не оказывает влияния на тонус бронхиальных мышц, хотя у пациен-
тов с хроническими обструктивными заболеваниями легких может развиться бронхо-
дилатация. При применении пропофола возникновение ларингоспазма маловероят-
но; при использовании гортанного воздуховода с маской подавление ларингеальных
рефлексов обусловливает низкую частоту возникновения кашля и ларингоспазма.
Пропофол не подавляет гипоксическую легочную вазоконстрикцию.
Действие на сердечно-сосудистую систему. Пропофол оказывает депрессивное
действие на сердечно-сосудистую систему за счет прямой депрессии миокарда и
82
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
гладкомышечных образований сосудов. Это проявляется снижением основных
показателей гемодинамики после введение болюсной дозы пропофола. Степень
гипотензии уменьшается при снижении скорости введения препарата. Стимуля-
ция симпатической нервной системы, обусловленная ларингоскопией и интуба-
цией трахеи, обычно быстро возвращает АД к норме.
Степень угнетения гемодинамики более выражена, чем при введении болюс-
ной дозы барбитуратов. У пациентов с гиповолемией или предшествующей гипер-
тензией, а также у пациентов с заболеванием сердца вероятность возникновения
глубокой гипотензии выше. Артериальную гипотонию усугубляет использование
больших доз пропофола, чрезмерно быстрое введение и преклонный возраст па-
циента. Дисфункция желудочков увеличивает риск значительного снижения сер-
дечного выброса в результате уменьшения давления наполнения желудочков сер-
дца и сократимости миокарда. Хотя потребление кислорода миокардом и коро-
нарный кровоток снижаются в равной степени, концентрация лактата в коронарном
синусе в ряде случаев увеличивается. Это свидетельствует о регионарном несоот-
ветствии между доставкой кислорода к миокарду и потребностями в нем.
Действие на другие системы и органы. Пропофол не изменяет печеночные фун-
кциональные пробы в течение 24 ч, но возможно уменьшение печеночного крово-
тока за счет снижения АД.
При использовании пропофола не развивается рвота, напротив — его приме-
няют в субанестетических дозах (10—20 мг) для лечения послеоперационной тош-
ноты и рвоты.
О влиянии пропофола на маточный тонус и о проникновении препарата через
плаценту известно немного. После введения пропофола плазменная концентра-
ция кортизона снижается.
Пропофол не запускает механизм злокачественной гипертермии, поэтому его
рассматривают в качестве препарата выбора для вводного наркоза у пациентов,
предрасположенных к ее развитию. Полагают, что пропофол безопасен у пациен-
тов с порфирией.
Клинические проявления анестезии. Используют 1 % водный эмульсионный
раствор пропофола (10 мг/мл), содержащий соевое масло, глицерол и яичный
лецитин. Пишевая аллергия на яйца не является абсолютным противопоказанием
к использованию пропофола, потому что в большинстве случаев она обусловлена
реакцией на яичный альбумин, который содержится в белковой части яйца, а
лецитин выделяют из желтка.
Раствор пропофола не содержит консервантов, поэтому соблюдают строгую
стерильность при использовании препарата, включая обработку горлышка ампу-
лы (флакона) тампоном, пропитанным спиртом. По истечении 6 ч после откры-
тия ампулы пропофол непригоден для применения: при использовании контами-
нированного раствора высок риск развития сепсиса.
При введении пропофола у 40 % пациентов может возникнуть боль по ходу
вены; ее уменьшают предварительной инъекцией 10 мг 1 % раствора лидокаина.
Возможно смешивание лидокаина с пропофолом в шприце (1 мл 0,5—1 % раство-
ра лидокаина на 20 мл пропофола).
У практически здоровых молодых людей анестезия индуцируется через 20—40 с
после внутривенного введения пропофола с возможным возбуждением (чаще, чем
при использовании тиопентал-натрия). Отмечают задержку исчезновения реснич-
ного рефлекса, обычно используемого в качестве признака потери сознания при
введении барбитуровых анестетиков. Использование этого клинического призна-
83
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ка в случае применения пропофола чревато передозировкой препарата и, соответ-
ственно, увеличением его побочных эффектов; лучшим показателем бессознатель-
ного состояния пациента считают потерю вербального контакта с ним.
Для индукции здоровым взрослым без премедикации внутривенно применя-
ют дозу пропофола 2—2,5 мг/кг. Пожилым пациентам дозу снижают; наиболее
приемлема началь-ная доза 1,25 мг/кг с последующим введением добавочных доз
по 10 мг вплоть до отключения сознания. У детей используют дозировку 3-3,5 мг/
кг. Седацию при регионарной аналгезии или эндоскопии достигают с помощью
доз 50—150 мкг/кг/ч. Темп внутривенной инфузии для поддержания гипнотичес-
кого состояния составляет 100—200 мкг/кг/мин и 25—75 мкг/кг/мин — для седа-
ции. У пациентов после премедикации используют меньшие дозы пропофола. При
комбинировании с закисью азота используют дозы до 250 мкг/кг/ч; при введении
опиоидов — примерно до 50 мкг/кг/ч в сочетании с медленным введением мор-
фина (2 мг/ч) для пациентов в ОИТ.
Учитывая быстроту и эффективность действия, пропофол применяют для ввод-
ного наркоза у пациентов с нормальными показателями гемодинамики и без забо-
леваний сердечно-сосудистой системы. Особенно его применение показано при
непродолжительных операциях, когда необходимо раннее и быстрое восстановле-
ние сознания. Через 2 ч после анестезии отсутствуют различия в психомоторной
функции у пациентов, получавших пропофол, и у пациентов, получавших тиопен-
тал-натрий (пациенты первой группы предъявляют меньше жалоб на сонливостъв
течение 12 ч после операции). Характерного быстрого восстановления сознания
не происходит, если за индукцией следует поддерживающая анестезия ингаляци-
онными анестетиками в течение более 10—15 мин или другими неингаляционны-
ми препаратами. Быстрое восстановление сознания при применении пропофола
может повысить риск осведомленности пациента во время кратковременной ин-
тубации трахеи (при диагностических и санационных процедурах), если в период
между индукцией в наркоз и интубацией введение препарата прекращают.
Пропофол успешно применяют для под держания наркоза во время операции у
пациентов со стабильной гемодинамикий или для седации при сочетании общего
и регионарного обезболиваний. Необходимо помнить, что в любой момент воз-
можна потеря контроля над проходимостью дыхательных путей.
Среди препаратов повседневного использования пропофол является наиболее
подходящим для обеспечения общей однокомпонентной внутривенной анестезии,
так как характеризуется коротким периодом пробуждения и отсутствием кумуля-
ционного эффекта. Даже после инфузионного использования пропофола увеличе-
ние времени пробуждения и кумуляция значительно меньше по сравнению с та-
ковым при аналогичном введении барбитуратов. Пропофол в большей степени,
чем тиопентал-натрий, пригоден для поликлинической анестезии, однако его при-
менение не избавляет от необходимости наблюдения за пациентом в течение со-
ответствующего периода перед выпиской.
Учитывая легкий и эффективный контроль уровня седатации, пропофол ус-
пешно применяют для седатации пациентов в ОИТ.
Противопоказания. Единственным абсолютным противопоказанием к при-
менению пропофола является наличие подтвержденной повышенной чувстви-
тельности к препарату. Относительными противопоказаниями являются обструк-
ция дыхательных путей, наличие сопутствующей патологии сердечно-сосудис-
той системы с нестабильной гемодинамикой. В настоящее время пропофол не
рекомендуют назначать детям с целью долговременной седации в ОИТ, поскольку
84
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
имеется ряд сообщений о неблагоприятных последствиях такого применения
препарата.
Аллергические реакции. Редко — кожные высыпания. Анафилактические реак-
ции возникают не чаще, чем при использовании тиопентал-натрия.
5.3.3.3. Натрия оксибутират
По химическому строению натрия оксибутират является натрие-
вой солью гамма-оксимасляной кислоты (ГОМК). Выпускают препарат в виде 20 %
водного раствора по 10 мл в ампуле.
Механизм действия. Сходство в химическом строении натрия оксибутирата с
естественным метаболитом мозга — гамма-аминомасляной кислотой (ГАМК) —
обуславливает механизм наркотического эффекта, так как ГАМК является одним
из медиаторов торможения.
Метаболизм. Около 80 % анестетика метаболизируется с образованием воды
и СО2, остальная часть выделяется с мочой.
Действие на ЦНС. Оксибутират натрия обладает сильным гипнотическим, но
слабым аналгетическим действием.
Действие на дыхание. В хирургической стадии наркоза объем альвеолярной
вентиляции не нарушается. Даже при использовании доз, увеличенных в 2—3 раза,
дыхательный центр остается чувствительным к увеличению концентрации СО2 во
вдыхаемом воздухе, что свидетельствует о сохранении его активности. Выявляют
отчетливое уменьшение МОД даже под влиянием средних доз (150—200 мг/кг),
поэтому применение высоких доз требует использования ИВЛ.
В комбинации с небольшими дозами аналгетиков умеренные дозы оксибути-
рата натрия (до 150 мг/кг) используют при неполосных операциях с сохранением
спонтанного дыхания, так как в средних дозах препарат обладает специфически-
ми свойствами стимулировать дыхание за счет повышения тонуса холинэргичес-
кой системы, ответственной наравне с серотонинэргической системой за цент-
ральную регуляцию дыхания.
Действие на сердечно-сосудистую систему. На фоне хирургической стадии нар-
коза при использовании натрия оксибутирата ЧСС и сердечный выброс уменьша-
ются, особенно у пациентов с исходной тахикардией. Причиной является тормо-
жение центральных механизмов стимуляции сердечной деятельности. Введение
атропина устраняет или уменьшает брадикардию. В ответ на введение малых доз
анестетика закономерно повышается диастолическое давление на 20—30 мм рт. ст.
Более высокие дозы (120—150 мг/кг) вызывают повышение систолического и диа-
столического давления. Это связано не только с увеличением ОЦК на 8—10 %, а
также с возрастанием МОК за счет улучшения сократительной способности мио-
карда.
Установлено отчетливое антиаритмическое действие оксибутирата натрия и
повышение устойчивости миокарда к раздражению, как из центральных, так и из
периферических зон.
Действие на печень и почки. При анестезии оксибутиратом натрия почти в
2 раза возрастает печеночный кровоток, что объясняют прямым воздействием на
сосуды гепатопортальной зоны. Оказывает прямое воздействие на печеночный
метаболизм. Способствует восстановлению функции почек при олигурии за счет
антигипоксической защиты и улучшения кровообращения в бассейне почечных
артерий.
85
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Действие на другие системы и органы. Установлено, что оксибутират натрия
предупреждает функциональные изменения, вызванные кислородным голодани-
ем, задерживает развитие тяжелых органных дисфункций. В условиях тяжелой
циркуляторной гипоксии (шока) оксибутират натрия в предельно короткие сроки
успевает включить не только приспособительные механизмы на разных уровнях
обменной интеграции, но и подкрепить их перестройкой энергетического обмена
в клетках органов жизнеобеспечения.
При использовании оксибутирата натрия происходит повышение плазменно-
го уровня АКТГ на 80 %, что позволяет его применять в качестве компонента
анестезии у больных со сниженной функцией коры надпочечников. Влияя на элек-
тролитный обмен, оксибутират натрия вызывает гипокалиемию.
Клинические проявления анестезии. Начало сна после внутривенного введения
препарата начинается через 5—7 мин, глубина и длительность которого находятся
в прямой зависимости от дозы: неглубокий сон длительностью до 60 мин возника-
ет при введении оксибутирата натрия в дозе приблизительно 60-80 мг/кг; при
использовании дозы 100—120 мг/кг сон более глубокий и длится до 2 ч. Наркоти-
ческого эффекта достигают внутривенным и пероральным введениями.
В качестве единственного и основного анестетика использовать оксибутират
натрия нельзя, так как он обладает сильным гипнотическим, но слабым аналгети-
ческим действием. Его применяют в качестве средства для вводного наркоза и для
поддержания анестезии в сочетании с другими средствами, обладающими доста-
точно сильным обезболивающим действием. Для индукции в анестезию препарат
вводят в вену однократно в дозе 50—60 мг/кг, причем во избежание двигательной
реакции раствор вводят медленно, приблизительно 1—2 мл/мин. Наступающее нар-
котическое состояние напоминает естественный сон, который при указанной дозе
продолжается 10—15 мин. Глазные и глоточные рефлексы сохраняются полнос-
тью. Аналгезия при этой дозе почти не проявляется.
Если предусматривают поддерживать эффект оксибутирата натрия в течение
всей операции, то его вводят дополнительно в дозе 100—120 мг/кг.
Взаимодействие с лекарственными средствами. Оксибутират натрия потенци-
рует действие аналгетиков и других анестетиков.
5.3.3.4. Кетамин
Является структурным аналогом фенциклидина. Кетамин в 10 раз
слабее фенциклидина и вызывает многие из его психомиметических эффектов.
Увеличение силы действия изомера свидетельствует о существовании стереоспе-
цифического рецептора.
Препарат выпускают в водных растворах с кислой реакцией в ампулах по 100 мг
и во флаконах из темного стекла в концентрациях, эквивалентных 50 и 10 мг
кетамина в 1 мл раствора. В качестве консерванта используют фелорид в концен-
трации 1:10 000, что обеспечивает сохранение стерильности раствора при по-
вторных заборах препарата из флакона.
Механизм действия. Кетамин — самый “полноценный” из неингаляционных
анестетиков, потому что вызывает аналгезию, амнезию и утрату сознания. Меха-
низм своеобразного наркотического эффекта кетамина во многом не раскрыт,
Электроэнцефалографически установлено, что при введении обычных доз кета-
мина в соматосенсорных зонах коры, зрительном бугре и хвостатом ядре появля-
ются дельта-волны, которые характерны для естественного сна. В то же время в
86
5. КЕИНГАЛЯЦИОКНЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
ядрах гиппокампа возникает тетта-активность, что свойственно пробуждению. Такая
диссоциация в биоэлектрической активности головного мозга удерживается на
протяжении 2—3 ч после операции и анестезии. Таким образом, считают, что
анестетик вызывает не столько депрессию ЦНС, сколько дезорганизацию ее фун-
кции: диссоциативно возбуждается лимбическая система и угнетается таламокор-
тикальная, при этом проявляется активация структур ретикулярной формации и,
как следствие, возникают спинальная гиперрефлексия и гипертония.
Существует и другая теория, в соответствии с которой кетамин активирует
структуры промежуточного мозга. Возникающая судорожная активность ирради-
ирует в различные отделы коры больших полушарий и подкорковых образований,
с чем и связывают проявление специфического эффекта анестетика. Аналгетичес-
кое действие кетамина предположительно развивается в результате его взаимо-
действия с системой биогенных аминов и опиоидным механизмом, а основное
действие кетамина на ЦНС обусловлено его антагонизмом к Ы-метил-О-аспар-
татным рецепторам. Кетамин увеличивает в мозге содержание адреналина и дофа-
мина. Ему также свойственен центральный антихолинергический эффект.
Метаболизм. Кетамин лучше растворяется в жирах и в меньшей степени свя-
зывается с белками, чем тиопентал-натрий; при физиологическом pH степень их
ионизации одинакова. Эти свойства кетамина, наряду с увеличением мозгового
кровотока и сердечного выброса, приводят к быстрому поглощению его мозгом и
последующему перераспределению (период полусуществования в фазе распреде-
ления составляет 10—15 мин).
Кетамин подвергается биотрансформации в печени с образованием несколь-
ких метаболитов, некоторые из них сохраняют 1/5—1/3 анестетической активнос-
ти кетамина. При многократных анестезиях кетамином может возникнуть толе-
рантность к препарату, что частично объясняют индукцией печеночных фермен-
тов. Короткий период полусуществования кетамина в фазе элиминации обусловлен
значительным поглощением в печени. Конечные продукты биотрансформации
выделяются через почки.
Действие на ЦНС. Кетамин увеличивает потребление кислорода головным
мозгом, мозговой кровоток и внутричерепное давление, поэтому внутричерепные
объемные образования являются противопоказанием к применению кетамина.
Кетамин может вызывать миоклонические движения, обусловленные подкор-
ковой электрической активностью, не выявляемой на ЭЭГ. Нежелательные пси-
хомиметические эффекты, например галлюцинации, устрашающие сновидения,
делирий, на этапе пробуждения реже возникают при использовании бензодиазе-
пинов в премедикации и у детей.
Действие на дыхание. Стандартные индукционные дозы кетамина влияют на
дыхание незначительно. При быстром струйном введении или при сочетании с
опиоидами возможно развитие апноэ. Кетамин — мощный бронходилататор, что
при бронхиальной астме делает его идеальным анестетиком для индукции. Хотя
рефлексы с верхних дыхательных путей обычно не угнетаются, при повышенном
риске аспирации показана интубация трахеи.
Действие на сердечно-сосудистую систему. Для кетаминовой анестезии весьма
характерны изменения гемодинамики, проявляющиеся выраженным подъемом АД
и ЧСС. Одновременно с этим отмечают и увеличение производительности сердца.
Это обусловлено стимуляцией симпатоадреналовой и адренокортикальной сис-
тем. Именно поэтому не оправдались надежды на “противошоковое” влияние ке-
тамина. Установлено, что у пострадавших с тяжелыми механическими повреж-
87
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
дениями, особенно при дефиците О ЦК более 20 %, введение кетамина сопровож-
дается резким снижением АД. Такой парадоксальный эффект не выражен при
субтерапевтических дозах кетамина.
Кетамин незначительно улучшает атриовентрикулярную проводимость серд-
ца, усиливает функцию синусового узла и оказывает прямое угнетающее влияние
на миокард.
Действие на другие системы и органы. В обычных клинических дозах токси-
ческого влияния на паренхиматозные органы кетамин не оказывает и поэтому
сопутствующие заболевания этих органов не служат противопоказанием для его
применения. Однако, по данным ряда авторов, кетамин снижает печеночный кро-
воток на 20 %. Кетамин усиливает слюноотделение, что можно предотвратить
предварительным введением холинолитика.
Клинические проявления анестезии. Кетамин вводят внутривенно в дозе 1,5-4 мг/кг
(2—5 мг/кг) и внутримышечно в дозе 5—8 мг/кг. В первом случае хирургическая
стадия анестезии наступает через 15—30 с и длится 15—20 мин, во втором - через
4—5 мин и продолжается до 20—25 мин. При необходимости продления анестезии
вводят несколько меньшие дозы: повторные дозы анестетика составляют не более
половины первичной. При длительных оперативных вмешательствах возможны
различные комбинации с другими анестетиками — барбитуратами, пропофолом,
закисью азота, фентанилом и др.
Непосредственно после введения кетамин сосредотачивается в хорошо кро-
воснабжаемых тканях, в первую очередь, в мозге (концентрация в 4—5 раз превы-
шает концентрацию в плазме). Вскоре после введения происходит перераспреде-
ление анестетика в менее перфузируемые ткани.
Клиническая картина кетаминовой анестезии довольно характерна. На фоне
выраженной аналгезии и торможения реакции организма на травму происходит вык-
лючение сознания. Глаза остаются открытыми или полузакрыты, довольно часто от-
мечают нистагм или беспорядочное движение глазных яблок, умеренное слезотече-
ние. Мышечный тонус, особенно у физически крепких мужчин, сохранен. Иногда
отмечают непроизвольные движения конечностей, речевую и двигательную актив-
ность. У женщин и детей такого возбуждения, как правило, не бывает. Характерна
усиленная саливация, уменьшение которой достигают включением в премедикацию
атропина. Глоточный и гортанный рефлексы сохранены. При быстром внутривенном
введении кетамина может наступить кратковременное апноэ в течение 15-30 с.
Дозы кетамина снижают за счет назначения сильной премедикации, а также
комбинируя его капельное введение с пропофолом, закисью азота, фторотаном.
Анестезию кетамином используют при длительных операциях, в том числе поло-
стных, с интубацией трахеи и ИВЛ.
Особенностью послеоперационного периода при кетаминовой анестезии яв-
ляются непродолжительная депрессия и спутанность сознания, дезориентирован-
ность, сновидения и галлюцинации. Вероятность и выраженность этих проявле-
ний зависят от возраста, пути введения анестетика, его дозы и некоторых других
факторов. Характер ощущений зависит от типа нервной системы и степени пси-
хического напряжения в предоперационный период. С целью профилактики пси-
хопатологических проявлений наиболее эффективными являются препараты бен-
зодиазепинового ряда. Внутривенное введение сибазона в дозе 0,15-0,3 мг/кг за
5—7 мин до начала кетаминовой анестезии существенно уменьшает выраженность
переживаний и иллюзорных проявлений во время сна: они превращаются из чер-
но-белых в цветные, из кошмарных — в добрые. Частота галлюцинаций в таких
88
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
случаях снижается с 30 до 2,9 %, а общих психосоматических нарушений — с 36,6
до 11,8 %. Есть подтверждающие данные, что дополнительное введение седуксена
в конце анестезии в дозе 0,1—0,15 мг/кг значительно повышает эффективность
профилактики, особенно делирия, двигательного беспокойства, тошноты и рвоты.
Считают, что частота психических расстройств в послеоперационный период умень-
шается, если сразу после завершения хирургического вмешательства ввести боль-
ному внутривенно пирацетам в дозе 75 мг/кг. С целью купирования двигательного
беспокойства или его профилактики используют барбитураты (100—200 мг тиопен-
тал-натрия внутривенно).
Возможность выполнения операций при самостоятельном дыхании постра-
давших и стимулирование сердечно-сосудистой системы позволяет успешно ис-
пользовать кетаминовую анестезию в медицине катастроф.
Отличительной чертой действия препарата является выраженный аналгети-
ческий эффект при сохраненной активности защитных гортанных и глазных реф-
лексов, проявляющийся даже при введении небольших доз (менее 1 мг/кг), поэто-
му некоторые авторы используют его для обезболивания нормальных родов. Ма-
лые дозы (приблизительно 0,7 мг/кг) дают хорошую аналгезию, не угнетают родовой
деятельности и не проникают через плацентарный барьер.
Взаимодействие с лекарственными средствами. Кетамин потенцирует действие
недеполяризующих миорелаксантов. Сочетанное применение теофиллина и кета-
мина повышает риск развития судорог. Диазепам ослабляет обусловленную кета-
мином стимуляцию кровообращения и удлиняет период его полусуществования в
фазе элиминации. Кетамин вызывает депрессию миокарда при введении на фоне
галотана или, в меньшей степени, других ингаляционных анестетиков. Препараты
лития могут пролонгировать действие кетамина.
Противопоказания. Относительными противопоказаниями для кетаминовой
анестезии являются: гипертермия, диабет, повышенное внутричерепное давление,
злоупотребление алкоголем. Вследствие стимуляции кровообращения кетамин не-
целесообразно использовать при ИБС, нелеченной или неправильно леченной ар-
териальной гипертонии, сердечной недостаточности и артериальных аневризмах.
5.3.4. Нейролептики
Механизм центрального нейрохимического действия нейролеп-
тиков обусловлен способностью снижать поверхностную активность биологичес-
ких мембран, преимущественно в ЦНС, за счет образования монослоя, действую-
щего как водно-липидная интерфаза, а также структурной близостью к гамма-
аминомасляной кислоте — одному из естественных регуляторов мембранной
проницаемости в ЦНС. Нейролептики уменьшают проницаемость постсинапти-
ческих мембран за счет конкурентного замещения ГАМК-рецепторов. Это ведет к
блоку медиатора (дофамина или норадреналина) в постсинаптической щели и, в
конечном счете, к нарушению синаптической передачи.
5.3.4.1. Дроперидол
Наиболее широко применяемый в анестезиологической практике
нейролептик. Дроперидол является бутирофеноном, структурно похож на галопе-
ридол.
89
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Механизм действия. Дроперидол — антагонист дофаминовых рецепторов; он
оказывает влияние на хеморецепторы триггерной зоны продолговатого мозга и
хвостатого ядра, а также воздействует на передачу нервного импульса, опосредо-
ванную серотонином, норадреналином и гамма-аминомасляной кислотой. Этими
эффектами обусловлено противорвотное и седативное действие дроперидола. Также
дроперидол вызывает блокаду периферических а-адренорецепторов.
Метаболизм. Несмотря на быстрое распределение (период полусуществова-
ния 10 мин) и начало действия через 3—10 мин после внутривенной инъекции,
седативное действие дроперидола длится долго в результате замедленного про-
никновения через гематоэнцефалический барьер, что в свою очередь обусловлено
относительно высокой молекулярной массой и высокой степенью связи с белка-
ми. Продолжительность действия (3—24 ч) объясняют стойкой связью препарата с
рецепторами.
Большая часть введенной дозы дроперидола метаболизируется в печени, по-
этому у пациентов с заболеваниями печени используют сниженные дозы. Почки
выделяют конечные продукты метаболизма и приблизительно 10 % препарата в
неизмененном виде.
Действие на ЦНС. Дроперидол снижает психическую и двигательную актив-
ность, что проявляется угнетением активного поведения и развитием эмоциональ-
ной индифферентности к внешним раздражителям, с резким торможением мо-
торной деятельности вплоть до каталепсии (“минерализации”). Дроперидол ока-
зывает антипсихотическое действие, прежде всего — антигаллюцинаторное.
Структурные отличия объясняют нейролептический эффект дроперидола и
антипсихотическую активность галоперидола. При однократном введении дропе-
ридол вызывает транквилизацию, при этом пациент выглядит умиротворенным,
но в последующем могут возникать жалобы на неприятные ощущения ментальной
неуспокоенности и ажитации. Этого эффекта избегают путем совместного введе-
ния дроперидола с опиоидами или бензодиазепинами.
Дроперидол суживает сосуды головного мозга, что вызывает уменьшение моз-
гового кровотока и внутричерепного давления. В отличие от барбитуратов, бензо-
диазепинов и этомидата дроперидол не снижает потребности мозга в кислороде и
ЭЭГ не претерпевает значительных изменений. Дроперидол — мощное противо-
рвотное средство, хотя риск замедленного пробуждения ограничивает его интра-
операционное использование в низких дозах (0,05 мг/кг). В редких случаях анти-
дофаминэргический эффект препарата провоцирует экстрапирамидные реакции
(кривошею, возбуждение), что устраняют с помощью дифенгидрамина. При бо-
лезни Паркинсона дроперидол применять нецелесообразно.
Дроперидол снижает давление спинномозговой жидкости.
Действие на дыхание. Стандартные дозы дроперидола (без сочетания с други-
ми препаратами) не вызывают депрессии дыхания: наоборот, препарат стимули-
рует реакцию системы дыхания на гипоксию.
Действие на сердечно-сосудистую систему. Дроперидол вызывает умеренную
блокаду а-адренорецепторов, что приводит к периферической вазодилатации и
снижению АД. При гиповолемии высок риск развития тяжелой артериальной ги-
потонии. Блокада а-адренорецепторов объясняет антиаритмический эффект дро-
перидола.
Действие на другие системы и органы. Дроперидол уменьшает общее потреб-
ление организмом кислорода, обладает слабой антигистаминной активностью, не-
значительное влияет на тепловой баланс.
90
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Клинические проявления аналгезии. Дроперидол в стандартных дозах не вызы-
вает аналгезии, амнезии и утраты сознания. Его используют с целью премедика-
ции, нейролептаналгезии и анестезии.
Сочетанное внутривенное использование фентанила и дроперидола (смесь
50 мкг/мл фентанила и 2,5 мг/мл дроперидола) вызывает состояние нейролепта-
налгезии. Добавление закиси азота к этому сочетанию приводит к утрате сознания —
наступает общая анестезия (нейролептанестезия), которая по характеристикам
напоминает обусловленную кетамином диссоциативную анестезию.
Взаимодействие с лекарственными средствами. Дроперидол является антаго-
нистом леводопы и может провоцировать симптомы паркинсонизма. Дроперидол
нивелирует влияние дофамина на почки и потенцирует аналгетическое действие
аналгетиков.
Теоретически дроперидол может устранять действие клонидина на централь-
ные а-адренорецепторы и потенцировать реактивную артериальную гипертонию.
Дроперидол ослабляет влияние кетамина на кровообращение.
Побочные эффекты: нейролептдислептический синдром (страх, галлюцина-
ции); экстрапирамидные нарушения, проявляющиеся гипокинетически-гипер-
кинетическим синдромом по типу паркинсонизма или гиперкинетически-дис-
кинетическими реакциями (турбулентность, акатизия и др.); продолжительное
действие способствует замедлению восстановления после анестезии, особенно у
пожилых людей.
Противопоказания. Применение дроперидола противопоказано при феохро-
моцитоме, так как он вызывает выброс катехоламинов из мозгового вещества над-
почечников, что обусловливает тяжелую артериальную гипертонию.
5.3.5. Опиоидные онолгетики
Опиоиды — это обобщающий термин для обозначения препара-
тов (природных и синтетических) и эндогенных пептидов, которые связываются с
опиоидными рецепторами как агонисты, агонисты-антагонисты и антагонисты.
Термины “опиаты” и “опиоиды” тождественны, но исторически опиатами назы-
вают препараты, полученные из опия (морфин, кодеин). Основными препаратами
группы опиоидных аналгетиков являются морфин, промедол, фентанил, суфента-
нил, альфентанил и ремифентанил (табл. 5.1).
Таблица 5.1. Классификация наиболее распространенных опиоидов
Агонисты опиоидных рецепторов Натуральные алкалоиды опия: морфин, кодеин Полусинтетические алкалоиды опия: диаморфин Синтетические опиоиды: петидин, промедол, фентанил, альфентанил, суфентанил, ремифентанил
Частичные агонисты опиоидных рецепторов Бупренорфин
Агонисты/антагонисты опиоидных рецепторов Пентазоцин, налбуфин
Антагонисты опиоидных рецепторов Налоксон, налтрексон
91
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Механизм действия. Опиоидные аналгетики стимулируют специфические опи-
оидные рецепторы, что сопровождается разнообразными фармакологическими
эффектами. Опиоидные рецепторы (табл. 5.2) разбросаны по центральной и пери-
ферической нервной системе и являются точками приложения действия всех опи-
оидов. Опиоидные рецепторы делят на классы: ц (мю), к (каппа) и 5 (дельта). Все
опиоидные рецепторы соединяются с G-протеинами, которые регулируют актив-
ность аденилатциклазы и последующее изменение характеристик проводимости
ионных каналов.
“Преимущественно морфинные”, или ц-рецепторы, делят на два типа: ц-1 —
с высоким аффинитетом (опосредование аналгезии), ц-2 — с более низким аффи-
нитетом (опосредование депрессии дыхания). Действие этих рецепторов связано с
проводимостью калия, который подавляет высвобождение нейротрансмиттеров и
гиперполяризацию клеточных мембран. Экзогенные опиоиды (морфин, проме-
дол, фентанил) высокоселективны в отношении ц-опиоидных рецепторов.
Действие рецепторов о (сигма) связано с дисфорией. Они не являются истин-
ными опиоидными рецепторами, так как их эффект не реверсируется даже боль-
шими концентрациями налоксона. К препаратам, взаимодействующим с о-рецеп-
торами, относят пентазоцин, налбуфин и кетамин.
Таблица 5.2. Классификация опиоидных рецепторов
Рецептор Клинический эффект Агонист
Мю(ц) Супраспинальная аналгезия (ц-1) Депрессия дыхания (ц-2) Физическая зависимость Морфин Мет-энкефалин (эндогенный опиоид) Ц-эндорфин (эндогенный опиоид)
Каппа (к) Мышечная ригидность Седация Спинальная аналгезия Морфин Нальбуфин, буторфанол, динорфин
Дельта (5) Аналгезия Изменение поведения Эпилептогенный Лей-энкефалин (эндогенный опиоид) Р -эндорфин (эндогенный опиоид)
Сигма (с) Дисфория Галлюцинации Стимуляция дыхания Пентазоцин Налорфин Кетамин
В головном мозге группы опиоидных рецепторов максимально сосредото-
чены в трех областях (табл. 5.3): в гипоталамусе и таламусе — ц-рецепторы; в
стволе, гиппокампе, лимбической системе ц-рецепторы преобладают над 5-ре-
цепторами; в коре мозга и полосатом теле — одинаковое число ц- и 5-рецепто-
ров. Подобно ц-рецепторам распределены к-рецепторы, но их абсолютное чис-
ло в 2—3 раза меньше. Опиоидные рецепторы за пределами ЦНС обнаружены в
дистальных окончаниях некоторых С-волокон (возможность нового подхода к
устранению боли).
92
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Таблица 5.3. Локализация и функция опиоидных рецепторов в ЦНС
Локализация Функция, эффект
Спинной мозг Спинальная аналгезия
Околоводопроводное вещество Супраспинальная аналгезия
N.n. solitarius, commissuralis, ambiguus Регуляция висцеральных рефлексов (депрессия дыхания, ортостатическая гипотония)
Медиальное и латеральное оптические ядра Миоз
Лимбическая система Эйфория
Базальное ядро Регуляция двигательного поведения
Locus cerulius Эйфория
Megial eminence Регуляция нейроэндокринных функций
Эндогенные опиоидные полипептиды — эндорфины и энкефалины — облада-
ют аналгетическими свойствами, подобными свойствам экзогенных опиоидов. Они
синтезируются из прогормонов, каждый из которых закодирован отдельным геном.
Энкефалины присутствуют в большом количестве в центральном сером веще-
стве ствола мозга и substantia gelatinosa спинного мозга, то есть их распределение
соответствует зонам высокой плотности опиоидных рецепторов. Энкефалины мо-
дулируют восприятие боли как в высших центрах, так и в спинном мозге, в послед-
нем — при помощи механизма, опосредованного через субстанцию Р. Централь-
ным действием обладают энкефалины и p-эндорфин, но на спинальном уровне
действуют только энкефалины.
Синтез большей части эндорфинов из прогормонов осуществляется в перед-
нем гипофизе, p-эндорфин присутствует в больших концентрациях в гипоталамо-
питуитарной системе и регулирует эндокринную функцию. Структурно молекулы
p-эндорфина значительно крупнее и оказывают более длительное действие, но по
сравнению с энкефалинами их количество в 10 раз меньше.
Энкефалины обладают слабой аналгетической активностью, так как они быс-
тро инактивируются пептидазами; они являются ингибирующими нейротрансмит-
терами. Напротив, крупные молекулы p-эндорфина противостоят инактивации и
обладают мощной генерализованной аналгетической активностью.
Теоретически, опиоиды с частично агонистическими эффектами в р-рецепто-
рах или со смешанным агонистически-антагонистическим действием могут про-
дуцировать аналгезию, эквивалентную морфиновой, но с меньшим угнетением
вентиляции (см. табл. 5.4). Ни один из разработанных до настоящего времени
препаратов не оказывает такого действия.
Опиоидные аналгетики различаются между собой, главным образом, по выра-
женности основного и побочного действия и фармакокинетике. Основным для
наркотических аналгетиков является обезболивающий эффект, поэтому их исполь-
зуют преимущественно в комбинации с другими средствами для вводного наркоза
или поддержания общей анестезии, в больших дозах иногда применяют в качестве
единственных средств для наркоза, например, в кардиохирургии (так называемая
центральная аналгезия).
93
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 5.4. Фармакологические эффекты агонистов р.-, к-, о-опиоидных
рецепторов
Эффект Опиоидные рецепторы
Ц К СТ
Зрачок Миоз Миоз Мидриаз
чдд Стимуляция, затем депрессия Нет изменений Стимуляция
чсс Брадикардия Нет изменений Тахикардия
Температура тела Гипотермия Нет Нет
Аффект Безразличие к различным стимулам Седация Делирий
Кожная чувствительность (супраспинальные рефлексы) Снижение Нет Нет
Ноцицептивные рефлексы (спинальные) Снижение Повышение Некоторое снижение
Метаболизм. Процессы, происходящие с опиоидами после попадания в организм,
однотипны и проходят по одинаковым схемам. Основные различия состоят в скорости
и длительности действия и выведения. Факторами, которые определяют кинетику и
динамику, являются физико-химические свойства опиоидных аналгетиков: размер
молекулы, степень ионизации, жирорастворимость и связывание с белками.
После попадания в организм происходит первичное распределение опиоидов
в организме, которое зависит от степеней жирорастворимости, ионизации препа-
рата и связывания с белками плазмы крови.
Жирорастворимость препарата определяет его начальное распределение и ско-
рость появления эффекта за счет достижения рецепторов на клеточных мембранах
нейронов ЦНС. Препараты с меньшей жирорастворимостью медленнее поступа-
ют в ЦНС и другие ткани и характеризуются более медленным развитием положи-
тельных и отрицательных эффектов. Жирорастворимость определяют степенью
ионизации (рК) опиоида и pH тканей. Растворимость неионизированных форм
препаратов в 1000—10 000 раз превышает растворимость их ионизированных форм.
Значение pH, в свою очередь, влияет на степень ионизации препарата. Указанные
факторы определяют перераспределение препаратов после достижения равновес-
ных концентраций в органах, тканях и крови и, соответственно, длительность и
выраженность действия (силу препарата).
Препараты с высокой жирорастворимостью, например фентанил, быстрее
достигают ЦНС, вымываются из нее и перераспределяются в депонирующие тка-
ни. Такие препараты имеют короткий период действия; их эффектами легче уп-
равлять, но у них “слабая” сила действия.
Препараты с низкой жирорастворимостью, например морфин, достигают ре-
цепторов более медленно и, соответственно, медленнее перераспределяются меж-
ду ЦНС и другими органами и тканями; их пролонгированный эффект развивает-
ся позже. Концентрация этих препаратов в ЦНС снижается медленно — по мере
метаболизма в других органах и тканях и скорости выведения из организма.
94
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Существенным фактором, влияющим на клиническое действие препарата,
является образование его активных метаболитов. Например, продукт метаболизма
морфина — морфин-6-глюкуронид — более мощный и длительнодействующий
опиоид, чем сам морфин. Конечные продукты метаболизма фентанила, суфента-
нила и алфентанила неактивны.
Биотрансформация современных опиоидов происходит, главным образом, в
печени. Их клиренс зависит от печеночного кровотока и активности метаболизи-
рующих опиоиды ферментов. У большинства наркотических аналгетиков образу-
ются неактивные метаболиты, которые выводятся из организма преимущественно
почками.
Действие на ЦНС. Опиоидные аналгетики в зависимости от дозы оказывают
болеутоляющее и седативное действие; они часто вызывают эйфорию, особенно
при повторном применении. В больших дозах препараты способны вызвать амне-
зию и утрату сознания. Опиоиды снижают потребление кислорода головным моз-
гом, мозговой кровоток и внутричерепное давление, но в меньшей степени, чем
барбитураты или бензодиазепины. Эти эффекты наблюдают при поддержании
нормокапнии с помощью ИВЛ.
В литературе существуют данные, что при опухолях мозга и черепно-мозго-
вой травме внутривенное струйное введение опиоидов может вызывать незначи-
тельное и преходящее увеличение линейной скорости мозгового кровотока и по-
вышение внутричерепного давления.
При применении наркотических аналгетиков иногда развиваются тошнота и
рвота вследствие возбуждения хеморецептивной триггерной зоны рвотного цент-
ра. На сам рвотный центр морфин и другие агонисты опиоидных ц-репепторов
действуют угнетающе.
Действие на дыхание. Наркотические аналгетики дозозависимо угнетают ды-
хание за счет прямого угнетающего влияния на нейроны бульбопонтинного дыха-
тельного центра. Первым этапом угнетения является снижение ЧДД; при более
высоких дозах (второй этап) — уменьшается дыхательный объем. Снижается чув-
ствительность дыхательного центра к углекислоте и рефлекторным воздействиям.
Апноэ вследствие депрессии дыхания наблюдают не только при применении боль-
ших доз препаратов, но и при их быстром внутривенном введении. В эквианалге-
тических дозах опиоиды вызывают депрессию дыхания на фоне применения дру-
гих препаратов, угнетающих дыхание, а также на фоне сопутствующих заболева-
ний легких. Наркотические аналгетики в зависимости от дозы угнетают центральные
звенья кашлевого рефлекса.
Действие на сердечно-сосудистую систему. Наркотические аналгетики в обыч-
ных дозах слабо изменяют сократительную способность миокарда и в определен-
ной степени депрессируют симпатическую нервную систему. Опиоиды способны
существенно усилить угнетающее влияние на сердце других наркотических ве-
ществ (бензодиазепинов, ингаляционных анестетиков и др.). Опиоидные аналге-
тики, кроме меперидина, в зависимости от дозы вызывают брадикардию в резуль-
тате возбуждения центра блуждающего нерва; брадикардия значительно выражена
на фоне действия р-адреноблокаторов.
Действие на эндокринную систему. Стресс от хирургической операции увели-
чивает секрецию ряда гормонов, включая катехоламины, кортизол и антидиурети-
ческий гормон. Опиоиды блокируют выброс этих гормонов в большей степени,
чем ингаляционные анестетики.
95
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Действие на зрительный анализатор. Опиоидные аналгетики дозозависимо
вызывают сужение зрачков (миоз) в результате возбуждения ядер Якубовича—Эдин-
гера—Вестфаля (по-видимому, вследствие уменьшения нисходящих тормозных вли-
яний на эти ядра с вышележащих отделов ЦНС).
Действие на нервно-мышечную передачу. При применении опиоидов возможно
развитие мышечной ригидности; ее частота увеличивается с возрастанием дозы и
скорости введения препарата, а также на фоне ингаляции азота закиси. Особенно
выражена ригидность грудных, межреберных и мышц брюшного пресса, след-
ствием которой является невозможность осуществления адекватной вентиляции
легких. Такой нежелательный эффект может быть устранен с помощью малых доз
недеполяризующих мышечных релаксантов или специфических антагонистов нар-
котических аналгетиков.
Действие на ЖКТ. Под влиянием наркотических аналгетиков происходит по-
вышение тонуса сфинктеров ЖКТ, снижение перистальтики кишечника и отделе-
ния желудочного и панкреатического соков и желчи; все это резко замедляет про-
движение химуса по кишечнику. Спазм желчных протоков и сфинктера Одди ста-
новится причиной печеночной колики (эффект почти не выражен при применении
меперидина).
Действие на мочевыделительную систему. Возможно развитие спазма сфинк-
тера мочевого пузыря, а также центральное седативное действие, уменьшающее
реакцию больного на афферентные импульсы, поступающие из переполненного
мочевого пузыря.
Дозы и пути введения. Вводят опиоиды обычно внутривенно болюсно или ин-
фузионно. Дозу для каждого пациента подбирают индивидуально в зависимости от
состояния больного и его реакции на наркотический аналгетик (табл. 5.5, 5.6).
Клиническое применение опиоидов: премедикация, вводный наркоз (в качестве
моно- или вспомогательного препарата), сглаживание гемодинамического ответа
на болевую стимуляцию, аналгезия во время операции, послеоперационное обез-
боливание (контролируемая пациентом аналгезия, спинномозговое и парентераль-
ное введение), облегчение механической вентиляции и подавление реакции на
эндотрахеальную трубку (в качестве вспомогательного препарата).
Таблица 5.5. Средние дозы и эффекты опиоидных аналгетиков
Показатели Морфин Промедол Фентанил
Эквианалгезирующие дозы (под кожу), мг 10 30-40 0,03-0,1
Удовлетворительно переносимые дозы 10 20-40 0,05-0,15
Длительность действия, ч 4-5 3-4 0,5-0,45
Активность при пероральном приеме Низкая Низкая Не применяют
Эйфория, противотревожное действие + + + + + +
Угнетение дыхания (эквианалгезирующие дозы) + + + + + + + +
Спазмогенное действие + + + + + +
Тошнота, рвота, % 35-46 20-35 Редко
Явления абстиненции (выраженность) + + + + + + + +
96
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Таблица 5.6. Средние значения физических и фармакокинетических показателей
опиоидов для взрослого человека (т = 70 кг)
Препарат Объем распределения в устойчивом состоянии, л Период полураспре- деления, мин Период полувы- ведения, ч Клиренс, л/мин Растворимость в жирах, коэффи- циент соотношения октанол/вода
Морфин 200 25 3,5 1,2 1,4
Метадон 420 10 36 0,15 116
Петидин 250 8 3,5 0,8 40
Фентанил 375 3 4 1,0 810
Альфафентанил 36 2 1,5 0,3 130
Суфентанил 98 1 2,5 0,75 1800
Взаимодействие с лекарственными средствами. Опиоидные аналгетики могут
заметно усиливать влияние общих анестетиков на ЦНС, сердечно-сосудистую и
дыхательную системы; снижают МАК средств для ингаляционного наркоза. Соче-
танное применение опиоидов с другими анестетиками (закисью азота, бензодиа-
зепинами, барбитуратами, ингаляционными анестетиками) может вызывать де-
прессию миокарда.
Производные фенотиазина, ингибиторы МАО и трициклические антидепрес-
санты потенцируют центральное угнетающее действие наркотических аналгетиков.
Седативные препараты могут усиливать действие опиоидов.
Побочные эффекты', угнетение дыхания и задержка возобновления спонтан-
ной вентиляции, тошнота и рвота, спазм сфинктера Одди, стимуляция выброса
гистамина (противопоказание к применению при бронхиальной астме). У пожи-
лых людей, при гипотиреозе, болезни Аддисона, циррозе печени, инфекционном
гепатите, у ослабленных пациентов и у лиц с хроническими инфекционными про-
цессами отмечают повышенную чувствительность к опиоидам. У пациентов с по-
здними стадиями злокачественных заболеваний возможно развитие толерантнос-
ти к опиоидам.
5.3.5.1. Морфин
Способ синтеза морфина известен, и все же технически его про-
изводят из натурального сырья — высушенного сока семенной коробочки мака
Papaver somniferum. Морфин является третичным амином и слабым основанием.
Он легче растворяется в воде, чем большинство опиоидов, применяемых в анесте-
зиологической практике. Морфин имеет ряд нежелательных побочных эффектов,
тем не менее, его считают отличным аналгетиком, и он принят в качестве золото-
го стандарта для сравнения остальных опиоидов. Выпускают в виде сульфата мор-
фина; 10 мг сульфата морфина содержат 8,5 мг обезвоженного морфина.
Метаболизм. После внутривенного введения 35 % морфина связывается бел-
ками крови; период полураспределения составляет 20—25 мин. Большой объем
относительно липофильного морфина поступает в гидрофильные ткани, особенно —
в скелетные мышцы. Менее 10 % неионизированного препарата находится в плаз-
4 7-585
97
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ме, проникает через ГЭБ и оказывает непосредственное наркотическое действие.
Плазменная концентрация морфина зависит от метаболизма, обратного перерасп-
ределения в сосудистый компартмент, экскреции и, возможно, внутрипеченочной
рециркуляции. Период полувыведения морфина составляет 2—4 ч.
Метаболизм осуществляется главным образом в печени: препарат инактиви-
руется при дезалкилировании, оксидации и конъюгации с глюкуронидом. Значе-
ние внепеченочного глюкуронирования (почки, легкие, желудочно-кишечный
тракт) у человека неизвестно, тем не менее, оно имеет место. Один из основных
метаболитов морфина — морфин-6-глюкуронид — активен и присутствует в крови
в больших концентрациях. Продукты метаболизма и около 10 % неизменного мор-
фина выделяются почками. Следовательно, длительность клинического эффекта
морфина может превосходить ожидаемую на основании времени его полувыведе-
ния, особенно у пациентов с нарушениями функции почек.
Пика концентрация в плазме после внутримышечного введения морфина до-
стигает через 20 мин.
Действие на ЦНС. Действие морфина посредством имитации эффекта эндо-
генных опиоидов, как агониста ц-1 и ц-2 опиоидных рецепторов, классифициру-
ют как центральное и периферическое. В центральном действии на ЦНС выделя-
ют депрессивное и стимулирующее.
Центральное депрессивное действие: аналгезия, седация, угнетение респира-
торного центра, кашлевого рефлекса, угнетение вазомоторного центра, снижение
уровня метаболизма (гипотермия).
Центральное стимулирующее действие: галлюцинации, эйфория, судороги (при
очень высоких дозах), миоз, тошнота, рвота, брадикардия, высвобождение АДГ и
других гормонов гипофиза.
В центральном действии выделяют две составляющие: супраспинальную опи-
оидную аналгезию (начинается в сером веществе вокруг водопровода, голубова-
том месте и ядрах продолговатого мозга, затрагивая, в основном, ц-1 опиоидные
рецепторы) и спинальную аналгезию (опосредуется через ц-2 рецепторы). Мор-
фин оказывает первичное действие на пресинаптические афферентные ноцицеп-
торы на уровне спинного мозга, угнетая выброс вещества Р и вызывая гиперполя-
ризацию интернейронов Роландова вещества (желатинозной субстанции) дорсаль-
ного отдела спинного мозга, а также снижая афферентную передачу ноцицептивных
импульсов.
Периферическое действие морфина — антиноцицептивное: повышается то-
нус гладкомышечной мускулатуры, высвобождается гистамин (эритема, ощуще-
ние жара, прилив крови к лицу, гипотензия). Периферическое действие, вероят-
нее всего, обусловлено активацией опиоидных рецепторов главных афферентных
нейронов, наблюдаемой только при воспалении.
Аналгезия морфином развивается за счет комплексного воздействия на раз-
личные участки в головном и спинном мозге и, при определенных условиях, на
периферические нервные образования. Морфин устраняет боли соматического и
висцерального происхождения, но при тупой и длительной боли он более эффек-
тивен, чем при острой и перемежающейся. Болевой порог повышается, а психо-
логический и эмоциональный компоненты боли уменьшаются. Эти эффекты уси-
ливаются эйфорией и сонливостью, которые при увеличении дозы могут прогрес-
сировать до уровня сна или даже наркоза, с выраженным угнетением рефлекторной
возбудимости и глубокой депрессией дыхания.
98
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Морфин относительно медленно проникает через ГЭБ вследствие гидрофиль-
ности. Поскольку начало действия морфина отсрочено, его труднее титровать для
поддержания анестезии. Морфин не оказывает непосредственного действия на
мозговой кровоток, если депрессию дыхания и последующее накопление углекис-
лого газа, вызывающего расширение сосудов мозга, компенсируют ИВЛ.
Действие на дыхание. Депрессия дыхания обусловлена прямым угнетением
медуллярного респираторного центра. Снижение частоты дыхания и уменьшение
дыхательного объема при внутривенном введении морфина наблюдают через 2—5 мин,
а при внутримышечном введении — несколько позже. После введения морфина
или его дериватов отмечают угнетение кашлевого рефлекса.
Действие на сердечно-сосудистую систему. Морфин не подавляет сократитель-
ную способность миокарда, но оказывает центральное депрессивное действие на
вазомоторный центр. Он может вызвать периферическую артериолярную и веноз-
ную дилатацию в результате снижения вазоконстрикторного тонуса с развитием
гипотензии.
Морфин проявляет центральную симпатолитическую активность, особенно в
больших дозах и у пациентов с высоким тонусом симпатической части вегетатив-
ной нервной системы (при недостаточности кровообращения, тяжелой травме).
Это также сопровождается периферической вазодилатацией. Наконец, характер-
ный для морфина выброс гистамина также способствует изменению показателей
гемодинамики. При применении в обычных дозах эти эффекты оказываются ми-
нимальными и не сопровождаются изменениями показателей гемодинамики у
пациентов с нормоволемией в положении на спине. У пациентов с гиповолемией
или получавших препараты с сосудорасширяющими свойствами (например, фе-
нотиазины), а также при превышении терапевтических доз возможно изменение
АД, ЧСС и сердечного ритма вплоть до критических. Морфин иногда вызывает
брадикардию вследствие симпатолитического и параллельного парасимпатомиме-
тического действия.
Действие на ЖКТ. Морфин стимулирует хеморецепторы триггерной зоны дна
четвертого желудочка, что может вызывать тошноту и рвоту (или только тошноту)
в течение 6—8 ч после введения. Этот побочный эффект производит впечатление
допаминоподобного, так как препараты с допаминблокирующим действием, на-
пример бутирофеноны и фенотиазины, являются эффективными противорвотны-
ми средствами при рвоте, спровоцированной опиоидами. Однако в вызванной
морфином рвоте присутствует и вестибулярный компонент, поэтому вероятность
проявления этого побочного эффекта у амбулаторных пациентов выше.
В гастроинтестинальной системе морфин ослабляет перистальтику, но усили-
вает неперистальтическую сократимость. Эвакуация желудочного содержимого
замедляется, что может способствовать возникновению рвоты. Повышение непе-
ристальтической сократимости кишечника может привести к несостоятельности
анастомозов толстого кишечника.
Морфин усиливает сокращение гладких мышц сфинктера Одди, мочеточни-
ков и сфинктера мочевого пузыря. Морфин не применяют при печеночных и
почечных коликах.
Действие на зрительный анализатор. Миоз является результатом стимуляции
ядер Якубовича—Эдингера—Вестфаля окуломоторного центра и может затруднять
оценку глубины анестезии. Возникает при передозирвке, применении больших
доз, длительном регулярном употреблении.
99
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Действие на другие системы и органы. Морфин проникает через плаценту и
может вызвать глубокую респираторную депрессию плода.
Клиническое применение. Морфин применяют для премедикации и послеопе-
рационного обезболивания в дозе 0,05—0,2 мг/кг внутримышечно (пик через 60-
90 мин) или 0,03—0,15 мг/кг внутривенно (пик через 10—20 мин). Длительность
действия препарата при внутримышечном и внутривенном введении составляет
3—4 ч. Частое введение дробных доз может привести к передозировке.
Для интраоперационного применения выбор дозы морфина (0,1—1 мг/кг) за-
висит от типа премедикации, предполагаемой длительности операции и общего
состояния пациента. Сочетание морфина с закисью азота, летучими анестетиками
или другими препаратами позволяет получить эффективную сбалансированную
анестезию со снижением общих доз препаратов.
Морфин широко применяют для проведения центральной аналгезии, но при-
менение центральных аналгетиков в больших дозах, как правило, приводит к глу-
бокому угнетению дыхания. Поэтому одним из обязательных условий является
проведение ИВЛ во время операции и в ближайший послеоперационный период.
Ориентировочная методика центральной аналгезии морфином состоит в сле-
дующем. Индукцию начинают с внутривенного введения диазепама в дозе
0,1—0,15 мг/кг на фоне ингаляции смеси закиси азота с кислородом (1:1). После
выключения сознания дробно внутривенно вводят морфин по 5—7 мг. Возможно
также капельное введение морфина после диазепама. При этом морфин (3 мг/кг)
разводят в 500 мл 5 % раствора глюкозы и инфузируют со скоростью 5—10 капель
в минуту. Обычно до интубации вводят 100—150 мл раствора. Затем вводят дити-
лин и осуществляют интубацию. До кожного разреза вводят 1,5—2 мг/кг морфина.
Оставшуюся часть раствора вводят во время операции медленно в течение 1—2 ч
для поддержания аналгезии.
Методика центральной аналгезии с помощью морфина получила распростра-
нение, главным образом, при операциях на сердце, у больных с тяжелыми форма-
ми сердечной недостаточности, низким сердечным выбросом, тяжелыми форма-
ми ИБС.
Противопоказанием к применению морфина в качестве основного аналгетика
являются кратковременные оперативные вмешательства и отсутствие возможнос-
ти проведения длительной ИВЛ.
5.3.5.2. Промедол
Синтетическое производное фенилпиперидина. По химическому
строению является аналогом фенил-М-метилпиперидиновой части молекулы морфи-
на. Белый кристаллический порошок, легко растворим в воде, растворим в спирте.
Действие. Промедол по силе аналгетического действия в 3—4 раза слабее мор-
фина. Близок к морфину по действию на ЦНС: уменьшает восприятие болевых
импульсов, угнетает условные рефлексы, понижает суммационную способность
ЦНС, усиливает анестезирующее действие местных анестетиков, оказывает сно-
творное действие. По сравнению с морфином меньше угнетает дыхательный центр,
меньше возбуждает центр блуждающего нерва и рвотный центр. Оказывает уме-
ренное спазмолитическое действие на гладкую мускулатуру внутренних органов,
но повышает тонус и усиливает сокращения мускулатуры матки.
Клиническое применение. В анестезиологии промедол является одним из ком-
понентов премедикации.
100
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Промедол применяют в качестве основного компонента для проведения цен-
тральной аналгезии. Насыщающая доза до разреза кожи составляет 2—3 мг/кг, ее
вводят болюсно. Общая доза препарата на 3—4 ч операции составляет около 4—5 мг/кг.
Самостоятельное адекватное дыхание при этом восстанавливается через 1,5—3 ч
после окончания операции, а аналгезия сохраняется в течение 6—8 ч.
В качестве аналгетика промедол применяют в сочетании с атарактиками и
нейролептиками для потенцирования их действия.
Для обезболивания родов промедол вводят под кожу по 10—20 мг при удовлетво-
рительном состоянии плода; при необходимости инъекцию повторяют через 2—3 ч.
В послеоперационном периоде промедол применяют при отсутствии наруше-
ний дыхания для снятия болей. Отсутствие спазмогенного влияния на гладкую
мускулатуру и сфинктеры, и даже наличие спазмолитического действия, умень-
шает возможность задержки мочеиспускания и газов в кишечнике в послеопера-
ционный период.
Побочные эффекты. В редких случаях появляются легкая тошнота, головокру-
жение, слабость, ощущение легкого опьянения. Эти явления проходят самостоя-
тельно. Если побочные явления отмечают при повторном применении препарата,
то дозу уменьшают. При применении промедола возможно развитие привыкания
и болезненного пристрастия.
5.3.5.3. Фентанил
Синтетический опиоид, структурно близкий к петидину. Его анал-
гетический эффект примерно в 50—100 раз выше, чем у морфина.
Метаболизм. Препарат обладает высокой жирорастворимостью; начинает дей-
ствовать через 1—2 мин после внутривенного введения. Фентанил быстро перерасп-
ределяется в неактивные ткани (скелетную мускулатуру и подкожно-жировую клет-
чатку), что определяет непродолжительность действия. Выраженность аналгезии
зависит от концентрации препарата в плазме. После однократной дозы длитель-
ность действия фентанила ограничена 20—30 мин. Высокие дозы или длительное
введение фентанила могут насытить ткани перераспределения, превращая этот пре-
парат в длительно действующий опиоид, при этом действие продолжается в течение
2-5 ч (у пожилых — 9 ч) и заканчивается по мере элиминации препарата.
Фентанил метаболизируется в печени (N-деалкилирование до норфентанила
и гидроксилирование фентанила и норфентанила).
Действие на ЦНС. Фентанил производит относительно слабый седативный
эффект по сравнению с морфином или петидином. Данные о влиянии фентанила
на внутричерепное давление противоречивы.
Действие на дыхание. Дозы, превышающие 50 мкг, в сочетании с анестетика-
ми могут привести к угнетению дыхания в течение нескольких минут. Пик угнете-
ния наступает через 5 мин и параллелен концентрации в плазме и глубине анесте-
зии. Большие дозы или инфузию фентанила используют только в случае, если
планируют проведение ИВЛ. Может развиться отсроченное угнетение дыхания
после большой суммарной внутривенной дозы, что связано с секвестрацией в
желудочном соке и последующей абсорбцией из тонкого кишечника. Данный фе-
номен возможен у большинства опиоидов.
Действие на сердечно-сосудистую систему. Вследствие вагусной стимуляции
развивается незначительное снижение АД и ЧСС. Гистаминозависимая гипотен-
зия нехарактерна.
101
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Действие на другие системы и органы. После больших доз фентанила при быст-
ром внутривенном введении может развиться ригидность скелетной мускулатуры,
в том числе и грудной клетки, что затрудняет ИВЛ. При быстром введении воз-
можны непроизвольные подергивания мышц, похожие на миоклонус, но на ЭЭГ
судорожной активности не отмечают.
Вызываемый фентанилом выброс гистамина незначителен.
Фентанил, подобно морфину, даже в умеренных дозах вызывает спазм сфин-
ктера Одди и увеличивает давление в общем желчном протоке, имитируя наличие
камней в желчном пузыре. Фентанил может замедлить моторику и опорожнение
желудка, вызвать тошноту и рвоту, особенно у амбулаторных пациентов с такой
же частотой, как и при использовании других опиоидов.
Клиническое применение. Фентанил используют для премедикации, а также в
качестве вспомогательного препарата при вводном наркозе для сглаживания ге-
модинамического ответа на ларингоскопию и интубацию трахеи. Поскольку пик
эффекта фентанила отстает от пика концентрации на 3—5 мин, то его вводят за 3
мин до начала интубации.
Наиболее широко фентанил используют в качестве основного компонента анал-
гезии при сбалансированной общей анестезии. Дозы 50—100 мкг вводят внутривен-
но пациентам при операциях с сохранением спонтанного дыхания. Большие дозы
(0,5—2,5 мкг/кг внутривенно или 2—10 мкг/кг/ч инфузионно) используют в сочета-
нии с ИВЛ; выбор дозы определяют предполагаемой длительностью операции.
При любом способе введения фентанила наблюдают снижение МАК летучих
анестетиков, степень которого зависит от времени после введения опиоида. По-
стоянная инфузия обеспечивает устойчивую концентрацию в плазме и соответ-
ствующее снижение потребности в анестетиках. При обширных операциях, на-
пример, в кардиохирургии фентанил применяют в дозах 50—150 мкг/кг внутри-
венно в качестве моноанестетика. Такие высокие дозы могут полностью подавить
метаболические эффекты анестезии и операции, обеспечить стабильность гемо-
динамики у пациентов с заболеваниями сердца. Необходимо помнить, что дей-
ствие препарата пролонгировано, и пациенты могут нуждаться в ИВЛ в течение
нескольких часов после операции; даже если спонтанная вентиляция выглядит
адекватной, необходимо тщательное наблюдение за пациентом в ОИТ в течение
суток после операции.
Фентанил не обеспечивает амнезии у здоровых пациентов, поэтому его необ-
ходимо использовать совместно с гипнотиками при необходимости неучастия боль-
ного в процессе операции.
С некоторым успехом фентанил применяют в качестве аналгетика для после-
операционного обезболивания у онкологических пациентов в виде постоянной
внутривенной инфузии 50—100 мкг/ч. Возможно послеоперационное трансдер-
мальное введение с начальной нагрузочной дозой.
5.3.5.4. Суфентанил
Высокоселективный мощный агонист-опиоидных рецепторов
(в 10—15 раз сильнее фентанила и в 600—700 раз сильнее морфина).
Метаболизм. Кинетика суфентанила подобна фентанилу, но еще более уско-
рена вследствии высокой жирорастворимости. При внутривенном введении быст-
ро достигается равновесие между концентрациями препарата в крови и мозге.
102
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
Быстрое начало и малая длительность действия обусловлены высокой степенью
связывания с белками и ионизацией при физиологическом значении pH.
Ожирение может увеличить объем распределения и продлить время полувыве-
дения суфентанила. Клиренс суфентанила, как и фентанила, быстрый и происходит
за счет печеночного метаболизма (N-деалкилирование и О-деметилирование).
Фармакологические эффекты подобны фентанилу.
Клиническое применение. Суфентанил является неплохой альтернативой фен-
танилу при интраоперационном применении в дозе 5—10 мкг у пациентов со спон-
танным дыханием. При внутривенном введении 0,3—1,0 мкг/кг в течение 1—3 мин
до ларингоскопии суфентанил сглаживает гемодинамический ответ на интубацию
трахеи.
Чаще всего суфентанил применяют в качестве компонента сбалансированной
анестезии в дозе 25—30 мкг с параллельным проведением ИВЛ; в высоких дозах
(до 50 мкг/кг внутривенно) — в кардиохирургии. Дозы 10—30 мкг/кг используют
во время операции для достижения гипнотического и аналгетического эффектов.
Суфентанил вводят фракционно (0,1—0,5 мкг/кг внутривенно) или в виде посто-
янной внутривенной инфузии (0,3—1,0 мкг/кг/ч).
5.3.5.5. Альфентанил
Синтетический дериват фентанила, агонист ц-опиоидных рецеп-
торов (в 10 раз сильнее морфина и в 4—10 раз слабее фентанила).
Метаболизм. При pH плазмы 7,4 90 % несвязанного с белками альфентанила
не ионизировано, что одновременно с умеренной жирорастворимостью позволяет
альфентанилу быстро проникать через ГЭБ и обусловливать быстрое начало дей-
ствия.
Концентрация альфентанила в плазме быстро снижается из-за быстрого рас-
пределения в тканях, 90 % введенной дозы покидает плазму в течение 30 мин. При
однократном введении распределение альфентанила служит главным механизмом,
определяющим пробуждение.
Короткий период полусуществования альфентанила в фазе элиминации (1,5 ч)
обусловлен низким объемом распределения. Клиренс альфентанила в 2 раза ниже,
чем у фентанила, но так как объем его распределения в 4 раза меньше, то большее
количество альфентанила доступно метаболизму в печени (N-деалкилированию и
О-деметилированию).
Действие на дыхание. В первые несколько минут после введения альфентани-
ла может развиться угнетение дыхания, поэтому препарат применяют лишь при
наличии необходимого оборудования для ИВЛ. В сравнении с фентанилом аль-
фентанил обеспечивает наименьшую вероятность послеоперационного угнетения
дыхания.
Действие на сердечно-сосудистую систему. Альфентанил в большей степени,
чем фентанил, угнетает сердечно-сосудистую систему, особенно у пожилых и у
пациентов III и IV класса по ASA.
Действие на почки. В меньшей степени, чем морфин, накапливается в тканях
при использовании в виде длительной инфузии у пациентов с острой почечной
недостаточностью.
Клинические проявления анестезии. Альфентанил применяют для вводного нар-
коза из-за быстрого начала действия (доза 120 мкг/кг в/в приводит к потере созна-
ния в течение 2—2,5 мин). Быстрое выравнивание концентрации кровь/мозг по-
103
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
зволяет вводить альфентанил внутривенно в дозе 30 мкг/кг за 60—90 с до прямой
ларингоскопии для сглаживания гемодинамических реакций на интубацию трахеи.
Альфентанил применяют в виде постоянной внутривенной инфузии в дозе
25—100 мкг/кг/ч вместе с закисью азота или инфузией пропофола. Дозы, прибли-
жающиеся к 500 мкг, вводят пациентам со спонтанным дыханием; продолжитель-
ность действия составляет 5—10 мин. Начальная болюсная доза альфентанила с
последующей длительной инфузией в дозе 30—60 мкг/мин подходит для пациен-
тов, находящихся на ИВЛ.
В отличие от фентанила и суфентанила, альфентанил даже в высоких дозах
обладает коротким действием и, следовательно, для устойчивого эффекта прово-
дят постоянную инфузию.
5.3.5.6. Ремифентанил
Агонист ц-рецепторов ультракороткого действия. Аналгезия ре-
мифентанилом по силе, длительности и времени наступления идентична альфен-
таниловой, но ее достигают значительно меньшими дозировками.
Метаболизм. Уникальные свойства ремифентанила обусловлены метилэфир-
ной боковой цепью, которая гидролизуется неспецифическими эстеразами крови
и тканей, что обеспечивает время полувыведения 10—20 мин. Таким образом, уль-
тракороткое действие ремифентанила обусловлено в большей степени метаболиз-
мом, чем перераспределением. Эта же особенность определяет низкую вероят-
ность накопления ремифентанила при повторном введении или инфузии.
Внепеченочный гидролиз ремифентанила делает безопасным его применение
при болезнях печени и почек.
Клиническое применение. Быстрое начало и короткая длительность действия пред-
полагают применение ремифентанила для вводного наркоза. В литературе описаны
высокая частота развития ригидности скелетной мускулатуры и непроизвольных
беспорядочных движений. При внутривенном введении в дозе свыше 1 мкг/кг
происходит кратковременное увеличение АД и ЧСС без выброса гистамина.
Пробуждение после введения ремифентанила быстрое, с восстановлением
спонтанного дыхания через 2—5 минут. Отрицательным свойством ремифентани-
ла является необходимость использования аналгетиков вскоре после прекраще-
ния его введения.
Ремифентанил вводят в виде постоянной инфузии в дозе 0,3—1,0 мкг/кг/мин
в качестве компонента сбалансированной анестезии с 66 % закиси азота. Такое
сочетание предотвращает гемодинамический ответ на хирургическую стимуляцию.
Аналгетический эффект ремифентанила при внутривенном введении в дозе
1,5 мкг/кг соответствует введению альфентанила в дозе 32 мкг/кг и вызывает анал-
гезию длительностью до 10 мин.
ЛИТЕРАТУРА
1. Бараш П., Куллен Б., Стэлтинг Р. / Пер. с англ.; Под ред. Родионова В.Я. — М.:
Медицинская литература, 2004. — С. 82—104.
2. Бунятян А.А. Руководство по анестезиологии. — М.: Медицина, 1997. —
С. 83-103.
3. Ваневский В. Л., Посырее С. П., Азаров В. И., Ершова Т. Г. Антиноцицептивный
компонент анестезиологического пособия: смена концепции в анестезиологии // Ма-
104
5. НЕИНГАЛЯЦИОННЫЕ МЕТОДЫ ОБЩЕЙ АНЕСТЕЗИИ. ВНУТРИВЕННАЯ ОБЩАЯ АНЕСТЕЗИЯ
териалы V Республиканского съезда анестезиологов-реаниматологов. — Ворошилов-
град, 1988. — С. 42—43.
4. Ейткенхед А.В., Смитт Г. Руководство по анестезиологии / Пер. с англ.
С.Ф. Дудникова, А.А. Митрохина; Под ред. проф. Е.А. Дамир. — М.: Медицина, 1999. —
С. 179-233.
5. Клиническая анестезиология / Пер. с англ.; Под ред. чл.-кор. РАМН В.А. Голо-
горского, проф. В.В. Яснецова. — М., Геотар-мед, 2001. — С. 181—203.
6. Костючеко А.Л., Дьяченко П.К. Внутривенный наркоз и антинаркотики. — СПб.:
1998. - С. 51-133.
7. Лихванцев В.В. Практическое руководство по анестезиологии. — Мед. инф. аген-
тство, 1998. — С. 150—174.
8. Морган Дж. Эдвард, Мэгид С. Михаил. Клиническая анестезиология / Пер. с
англ.; Под ред. акад. РАМН А.А. Бунятяна, 2-е изд., кн.1. — М., СПб.: Бином, Нев-
ский Диалект, 2001. — С. 174—198.
9. Усенко Л.В., Шифрин Г.А. Концепция антиноцицептивного обезболивания. —
К.: Здоров’я, 1993. — 192 с.
10. Фрейе Е. Показания к применению опиоидов в анестезиологии и интенсивной
терапии // 10 Европейский конгресс анестезиологов. Франфуркт на Майне. Германия.
30 июня — 4 июля 1998 г. Освежающий курс лекций “Актуальные проблемы анестези-
ологии и реаниматологии”, 6-й выпуск. — Архангельск, 2000. — С. 150—161.
11. Чепкий Л.П., Новицкая—Усенко Л.В., Ткаченко P.O. Анестезиология и интен-
сивная терапия. — К.: Вища школа, 2003. — С. 99—116.
105
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
МЫШЕЧНЫХ РЕЛАКСАНТОВ
Мышечные релаксанты (миорелаксанты) — это вещества, вы-
зывающие обратимое расслабление скелетных мышц. Введение
мышечных релаксантов в клиническую практику дало возмож-
ность отказаться от глубокого опасного для жизни уровня нарко-
за, обеспечить идеальное расслабление скелетных мышц, приме-
нять эндотрахеальный метод обезболивания, эффективно осуще-
ствлять ИВЛ при проведении анестезиологического пособия.
Мышечные релаксанты выборочно блокируют рефлекторную
дугу в нервно-мышечном синапсе поперечнополосатых мышц. При
применении лишь одних миорелаксантов у человека полностью
сохраняются сознание, память, слух, зрение, ощущение запахов,
болевая и другие виды тактильной чувствительности. Миорелак-
сация при условии использования рациональных дозировок мы-
шечных релаксантов обратима и не приводит к нежелательным
последствиям.
6.1. ИСТОРИЧЕСКИЕ ДАННЫЕ
В 1516 году появилось первое достоверное сооб-
щение испанского монаха-миссионера о существовании сильно-
действующего яда, которым индейцы Южной Америки смазыва-
ли кончики стрел для поражения животных. Последующие сооб-
щения об этом яде были, как правило, фантастического характера,
и лишь в 1857 году известный французский ученый Клод Бернар
описал механизм действия яда кураре на организм животного.
Ученики Бернара установили, что кураре действует на окончания
двигательных нервов скелетной мускулатуры.
Впервые с лечебной целью кураре стали применять во второй
половине XIX века для снятия судорог при различных заболевани-
ях, но непредсказуемость действия кураре, трудности и неудачи
при его использовании были следствием отсутствия чистого стан-
дартного препарата. В 1935 году из растения кураре выделили чис-
тый алкалоид, названый тубокурарином, а в 1938 году был получен
106
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
очищенный стандартный миорелаксант интокострин, что послужило началом бо-
лее успешного использования миорелаксантов в клинической практике.
23 января 1942 года в Монреальском Гомеопатическом госпитале Griffith H.R.
и Johnson G.E. впервые использовали тубокурарин при выполнении аппендэкто-
ми. С этого момента началось широкое применение миорелаксантов в хирургии и
анестезиологии. Не все свойства естественного кураре удовлетворяли клиницис-
тов. Интенсивные поиски синтеза препаратов, имеющих курареподобное действие,
увенчались успехом, когда в 1947 году синтезировали флакседил, в 1949 — сукци-
нилхолин.
Уровень развития современной науки дает возможность более глубоко изучать
фармакодинамику этих препаратов, расширять представление о структуре и функ-
ции нервно-мышечного соединения в норме и под воздействием мышечных релак-
сантов. Это позволяет более взвешенно подходить к показаниям и выбору методики
применения мышечных релаксантов в анестезиологической практике и, соответ-
ственно, значительно уменьшить количество осложнений при их применении.
6.2. СТРОЕНИЕ И ФУНКЦИИ
НЕРВНО-МЫШЕЧНОГО СИНАПСА
Основной структурной единицей нервной системы является ней-
рон, специализированными функциями которого являются прием, первичная об-
работка и передача информации. Типичные двигательные нейроны имеют 5—7
отростков, или дендритов, и длинный волокнистый отросток — аксон, который
покрыт миелином (оболочкой белково-липидного комплекса).
Моторный аксон, подходя к мышце, теряет миелиновую оболочку и делится
на терминальные веточки, каж-
дая из которых подходит к от-
дельному мышечному веретену.
Нервная клетка вместе с сар-
колеммой мышечного волокна
образует структуру, которую
называют нервно-мышечным
синапсом (рис. 6.1). Оголен-
ная часть нерва, обращенная
к поверхности мышечного во-
локна, — это пресинаптическая
мембрана; оголенная часть мы-
шечного волокна — это пост-
синаптическая мембрана; мик-
ропространство между этими
мембранами — это синаптичес-
кая щель. Поверхность мышеч-
ного волокна образует множе-
ственные контактные складки,
на которых расположены N-
холинорепепторы.
В пресинаптических струк-
турах синтезируется основная
Рис. 6.1. Схема строения и функции нервно-мышеч-
ного синапса (Barash Р., Cullen В., Stoelting R., 1989)
107
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
часть ацетилхолина (АХ). Синтез происходит путем переноса ацетильной группы
с коэнзима А на холин при участии фермента холинацетилазы. Ацетилхолин де-
понируется в виде так называемых синаптических везикул, которые представляют
собой заготовленные кванты этого медиатора. С помощью ацетилхолина происхо-
дит переход возбуждения с нерва на скелетную мышцу.
Химический механизм проведения возбуждения содержит элементы электро-
физиологических явлений. В покое постсинаптическая мембрана находится в со-
стоянии статической поляризации: ее внутренняя поверхность электроотрицатель-
ная по отношению к внешней. Электростатическая разница между ними состав-
ляет около 90 мВ. При возникновении импульса развивается потенциал действия
в нервном окончании: высвобождаются ионы Са++, которые соединяясь с протеи-
нами способствуют высвобождению ацетилхолина из везикул. В каждом термина-
ле аксона имеется до 200 таких везикул, которые содержат около 10 000 молекул
ацетилхолина.
В синаптической щели ацетилхолин вступает в связь со специализированны-
ми участками постсинаптической мембраны — холинергическими рецепторами
[8 (рис. 6.2)]. Большинство этих рецепторов расположены на внутренней поверх-
ности контактных складок. Постсинаптическая мембрана содержит никотиновые
АХ-рецепторы, мембрана которых состоит из протеинов с молекулярным весом
250 000 Дт. Протеины состоят из 5 субъединиц — а (2 субъединицы), Р, е. При
соединении а-субъединицы (40 000 Дт) с ацетилхолином открывается централь-
ный ионный канал. Соединение первой а-субъединицы с ацетилхолином увели-
чивает сродство последнего со второй а-субъединицей. Этот механизм обеспечи-
вает положительную обратную связь для высвобождения трансмиттера во время
высокой активности нервно-мышечного синапса.
Мембранные каналы АХ-репепторов неспецифичны и проходимы для ионов
Na+, К+, Са++, что позволяет генерировать конечно-платовый (end-plate) потенци-
ал. Этот потенциал способствует открытию 1Ма+-каналов, что вызывает по концен-
трационному градиенту вход в клетку внеклеточных ионов, снижение трансмемб-
ранного потенциала, быструю деполяризацию и проведение импульса к мышце.
Как только разность потенциалов достигает 45 мВ, возбуждение переходит на
Аксон
Рис. 6.2. Постсинаптический никотиновый
холинергический рецептор и ионный канал [19]
мышцу и происходит ее сокраще-
ние. При достижении импульса Т-
тубулярных систем в саркоплазма-
тический ретикулум высвобожда-
ются ионы Са++, что инициирует
мышечное сокращение. Липидная
среда вокруг холинергических ре-
цепторов может повреждаться, на-
пример, ингаляционными анесте-
тиками, которые оказывают влия-
ние на свойства ионных каналов.
Содержащийся в синаптичес-
кой зоне фермент ацетилхолинэс-
тераза быстро прекращает дей-
ствие ацетилхолина. Он гидроли-
зируется на холин и уксусную
кислоту. Ионы К+и Na+диффун-
дируют на свои предшествующие
108
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
места, потенциал конечной пластины возвращается к исходному уровню (90 мВ),
постсинаптическая мембрана реполяризуется и вновь способна проводить после-
дующие импульсы. Холин и уксусная кислота здесь же ресинтезируются холина-
цетилазой в ацетилхолин, который депонируется в везикулы. Нарушение одного
из звеньев вышеописанного процесса приводит к нарушению передачи возбужде-
ния с нерва на мышцу.
6.3. МЕХАНИЗМ ДЕЙСТВИЯ И КЛАССИФИКАЦИЯ
МЫШЕЧНЫХ РЕЛАКСАНТОВ
Точка приложения действия миорелаксантов — нервно-мышеч-
ный синапс скелетных мышц.
Классификация мышечных релаксантов по механизму действия:
• деполяризующие (двухфазного действия), которые вызывают десенситивный
блок и действуют как агонисты холинорецепторов (сукцинилхолин);
• недеполяризующие (однофазного действия), которые вызывают конкурент-
ный блок и действуют как конкурентные антагонисты холинорецепторов (тубоку-
рарин и др.).
Факторы, влияющие на продолжительность и глубину нервно-мышечного блока
Снижение температуры тела пациента на несколько градусов ниже нормы
значительно удлиняет время нервно-мышечного блока, вызванного деполяризую-
щим релаксантом. Это имеет особое значение при обезболивании в детском воз-
расте, так как у новорожденных и детей первого года жизни очень быстро пони-
жается температура тела во время наркоза по причине снижения теплопродукции
вследствие отсутствия мышечной активности. Согревание таких пациентов помо-
гает быстро ликвидировать нервно-мышечный блок.
Метаболический ацидоз при действии недеполяризующих миорелаксантов усу-
губляет и удлиняет нервно-мышечный блок. Возможно, определенную роль игра-
ют нарушения тканевого кровообращения.
Нарушение экскреторной функции почек может привести к пролонгированному
действию недеполяризующих релаксантов.
Гипотония, гиповолемия, замедление периферического кровотока, печеночная не-
достаточность, гипоксия, гиперкапния, гипокалиемия, состояние глубокого наркоза,
пожилой возраст пролонгируют действие миорелаксантов.
6.4. ДЕПОЛЯРИЗУЮЩИЕ МЫШЕЧНЫЕ РЕЛАКСАНТЫ
Химическая структура деполяризующих миорелаксантов сходна с
ацетилхолином (см. рис. 6.3). Деполяризующие миорелаксанты действуют на пост-
синаптическую мембрану подобно ацетилхолину, вызывая ее стойкую деполяри-
зацию и стимуляцию мышечного волокна (I фаза), что клинически проявляется
генерализованными мышечными фасцикуляциями. Во II фазе действия холино-
рецепторы конечной пластины на определенное время становятся нечувствитель-
ными к квантам ацетилхолина. Канальцы остаются продолжительное время от-
крытыми, сохраняя деполяризацию мембран концевой пластины и препятствуя
прохождению следующего импульса, что приводит к миорелаксации. Продолжи-
109
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
СН, О О СН-
I II II I
H,CNCH2CH2OCCH?CH2COCH,CH,NCH,
О | £. £. С. С. С. С. J J
сн3 сн3
Сукцинилхолин
СН- О О
I II II
h3cnch2ch2occh2ch2coh
сн3
Сукцинилмонохолин
О о
II II
НОССН2СН2СОН +
Уксусная кислота
Холинэстераза
плазмы
СН3
+ hoch2ch2nch3
сн3
Холин
Холинэстераза
плазмы
сн3
hoch2ch2nch3
сн3
Холин
тельное открытие канальцев способ-
ствует выходу ионов К+ из клетки, что
может значительно повысить их кон-
центрацию в плазме.
В отличие от ацетилхолина, де-
поляризующие миорелаксанты не
гидролизуются ацетилхолинэстера-
зой. Их гидролиз происходит в плаз-
ме и печени под действием фермента
псевдохолинэстеразы (синонимы —
неспецифическая холинэстераза, хо-
линэстераза плазмы). При низкой
концентрации псевдохолинэстеразы
вследствие заболеваний печени, бе-
ременности, воздействия некоторых
медикаментов (антибиотиков, про-
тивоопухолевых средств, ингаляци-
онных и местных анестетиков, др.),
а также при наследственном дефек-
те псевдохолинэстеразы метаболизм
деполяризующих релаксантов нару-
шается, действие релаксанта удли-
Рис. 6.3. Метаболизм сукцинилхолина
няется. Так, при дефекте гена
псевдохолинэстеразы действие сук-
цинилхолина удлиняется до 30 мин, иногда — до 6—8 ч, и их концентрация в
синаптической щели достаточно долго не снижается, что вызывает длительную
деполяризацию концевой пластины.
6.4.1. Сукцинилхолин (дитилин)
Основной деполяризующий миорелаксант, который в настоящее
время используют в клинической практике (суксаметоний хлорид, суксаметоний
йодид, листенон, миорелаксин). Сукцинилхолин состоит из двух молекул ацетил-
холина, связанных метиловой группой. Гидролиз сукцинилхолина на неактивные
метаболиты происходит под действием псевдохолинэстеразы на сукцинилмонохо-
лин и холин. Структурное сходство с ацетилхолином объясняет механизм дей-
ствия, побочные эффекты и метаболизм сукцинилхолина.
Сукцинилхолин вызывает быстрый — в течение 30—60 с — мышечный пара-
лич, длительность эффекта — 5—10 мин. Доза сукцинилхолина составляет 0,5—1,5
мг/кг внутривенно. Перед релаксацией мышц возникают генерализованные не-
синхронные сокращения миофибрилл — фибрилляции, или фасцикулляции, мышц.
Для их предотвращения за 2—4 мин перед введением сукцинилхолина вводят не-
деполяризующие миорелаксанты.
Если доза сукцинилхолина превышает 3—5 мг/кг, то может наступить II фаза
блока — десентизационная мышечная блокада, механизм которой неизвестен и
напоминает недеполяризующую нейромышечную блокаду.
Сукцинилхолиновую нейромышечную блокаду можно значительно продлить
дибукаином — амидным местным анестетиком, который ингибирует активность
110
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
псевдохолинэстеразы примерно на 80 %. При гетерозиготном варианте этого эн-
зима (частота ~ 1:500) продолжительность нейромышечной блокады может возра-
стать до 20 мин, при гомозиготном варианте (частота ~ 1:3200) — до 120—180 мин.
Препарат выпускают в ампулах по 5 мл 2 % раствора, хранят в защищенном
от света месте при температуре не выше +5 °C (замораживание не допускается).
Дитилин применяют в качестве миорелаксанта короткого действия в условиях нар-
коза и ИВЛ для интубации трахеи, поддержания миоплегии при оперативных вмеша-
тельствах, выполнения бронхоскопии и других эндоскопических процедур, репози-
ции костных обломков и вправления вывихов, устранения судорог при столбняке.
Несмотря на широкое применение в клинической практике, сукцинилхолин
обладает рядом побочных действий, которые в последнее время с появлением
новых миорелаксантов с быстрым эффектом ограничили его применение.
Побочные эффекты сукцинилхолина: нарушения ритма сердца, фасцикуляции,
гиперкалиемия, миалгия, миоглобинурия, повышение внутричерепного, внутри-
желудочного и внутриглазного давлений, тризм, аллергические реакции. Кроме
зтого, сукцинилхолин является триггером злокачественной гипертермии.
Нарушения ритма сердца. Сукцинилхолин может вызвать синусовую бради-
кардию, желудочковый ритм и блокаду синусового узла. Эти осложнения являют-
ся следствием воздействия сукцинилхолина на кардиальные постсинаптические
М-холинорепепторы. Чаше нарушения ритма сердца возникают при повторном
введении сукцинилхолина через 5 мин после первой дозы. Внутривенное введение
атропина и субпаралитических доз недеполяризующих миорелаксантов за 1—3 мин
перед введением сукцинилхолина уменьшает риск этих осложнений. Внутримы-
шечно введенный в премедикации атропин может оказаться неэффективным для
предотвращения нарушений ритма сердца. За счет миметического эффекта на ав-
тономные ганглии ацетилхолин может вызывать повышение АД и ЧСС.
Гиперкалиемия. Резкий выход внутриклеточного калия в межклеточную жид-
кость и кровь после введения сукцинилхолина может вызвать остановку сердца.
Такое осложнение характерно для больных с денервацией (повреждение спинного
мозга, которое повлекло развитие мышечной атрофии), для больных с массивны-
ми мышечными повреждениями (тяжелые ожоги) и политравмой. Наибольший
риск развития гиперкалиемии у этих пациентов возникает через 7—10 дней после
повреждения и снижается через 3—6 месяцев.
У пациентов с почечной недостаточностью не возникает повышенный риск
гиперкалиемии после введения сукцинилхолина, поэтому его можно с успехом
применять у этих больных. Есть данные, что предварительное введение недеполя-
ризующих миорелаксантов не всегда предотвращает гиперкалиемию после введе-
ния сукцинилхолина у больных с высоким риском.
Миалгия. После введения сукцинилхолина в послеоперационном периоде боль-
ные часто жалуются на мышечные боли в области шеи (иногда относят к послед-
ствиям интубации трахеи), спины, живота. Чаще миалгия выражена у молодых
пациентов после сравнительно кратковременных операций. Причиной возникно-
вения миалгии после применения ацетилхолина считают генерализованные асин-
хронные сокращения мышц (фасцикуляции), при которых происходит поврежде-
ние мышц с развитием миоглобулинурии. Предотвращение фасцикуляций путем
предварительного введения недеполяризующих миорелаксантов уменьшает выра-
женность и частоту миалгий, вызванных сукцинилхолином.
Повышение внутрижелудочного давления. Сукцинилхолин вызывает непредска-
зуемое увеличение внутрижелудочного давления, что также связывают с фасцику-
111
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ляциями. Этот эффект сукцинилхолина опасен увеличением риска регургитации
и аспирации желудочного содержимого.
Повышение внутричерепного давления. Введение сукцинилхолина сопровожда-
ется транзиторным повышением внутричерепного давления. Клиническое значе-
ние этого феномена не определено. Его предотвращают предварительным введе-
нием недеполяризующих миорелаксантов.
Повышение внутриглазного давления. Через 2—4 мин после инъекции сукци-
нилхолина транзиторно увеличивается внутриглазное давление. Механизм этого
эффекта полностью не известен, хотя предполагают, что он может быть связан с
контракцией миофибрилл и дилатацией хороидальных сосудов. Исходя из этого,
сукцинилхолин не показан для применения в офтальмологии и у больных с глау-
комой, хотя этот факт не подтвержден клиническими исследованиями.
Тризм — достаточно редкое осложнение после введения сукцинилхолина по
сравнению с приведенными выше и возникает чаще в педиатрической практике.
Развитие выраженного тризма может значительно затруднить прямую ларинго-
скопию и интубацию трахеи, вследствие спазма жевательных и мимических мышц.
У таких пациентов существует высокий риск развития злокачественной гипертер-
мии (см. раздел 9.4.6.1).
6.5. НЕДЕПОЛЯРИЗУЮЩИЕ МЫШЕЧНЫЕ РЕЛАКСАНТЫ
Механизм действия недеполяризующих миорелаксантов основан на
их конкуренции с ацетилхолином за специфические рецепторы. По химическому стро-
ению недеполяризующие миорелаксанты представляют собой большие-ригидные мо-
лекулы, содержащие фрагменты, подобные ацетилхолину. В результате действия кон-
курентных миорелаксантов постсинаптическая мембрана нервно-мышечного синапса,
находящаяся в состоянии поляризации, теряет способность переходить в состояние
деполяризации и, соответственно, мышечное волокно теряет способность к сокраще-
нию. Именно поэтому эти препараты называют недеполяризующими.
Восстановление нервно-мышечной проводимости при недеполяризующем бло-
ке обусловлено перераспределением, частичным метаболизмом и экскрецией релак-
санта в неизмененном виде или может быть вызвано действием специфических анти-
дотов — ингибиторов ацетилхолинэстеразы. Поскольку эти ингибиторы способству-
ют возрастанию уровня ацетилхолина в нервно-мышечных синапсах, они не способны
ликвидировать деполяризующий блок и увеличивают его продолжительность.
Общее название недеполяризующих миорелаксантов имеет несколько сино-
нимов: антидеполяризующие, конкурентного, курареподобного или однофазного
действия. В эту группу входят тубокурарин, пипекурониум (ардуан), атракуриум
(тракриум), павулон, векурониум (норкурон), рокурониум (эсмерон), алкурониум
(аллоферин), мивакурий.
6.5.1. Тубокурарин
Классический миорелаксант недеполяризующего действия, по
химическому строению — моночетвертичное аммониевое соединение. Выпускают
в ампулах по 1,5 мл 1 % раствора. Препарат блокирует N-холинореактивные сис-
темы скелетных мышц, то есть зону действия ацетилхолина.
112
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
Препарат вводят внутривенно. Действие развивается постепенно: релаксация
начинается через 1—2 мин, максимум действия — через 3—4 мин. Расслабление
мышц проходит в определенной последовательности: сначала релаксируются мыш-
цы глаз и век, затем — мимические и жевательные, мышцы шеи, верхних и ниж-
них конечностей, брюшные, межреберные и, наконец, мышцы диафрагмы. На
фоне вводного наркоза (как правило, барбитурового) доза тубокурарина 0,3—0,5 мг/кг
(у грудных детей — 0,1—0,2 мг/кг) вызывает полное мышечное расслабление на
протяжении 25—30 мин. При необходимости повторного введения последующие
дозы должны быть в 1,5—2 раза меньше начальной из-за способности препарата к
кумуляции. На фоне действия общих анестетиков (эфира, фторотана и др.) усили-
ваются глубина и продолжительность релаксации. Ликвидация нервно-мышечно-
го блока происходит в обратном порядке.
Клиническими признаками восстановления мышечного тонуса и возможнос-
ти экстубации являются способность больного по требованию пожать руку, высу-
нуть язык, немного приподнять голову и, главное, эффективно кашлять и само-
стоятельно адекватно дышать на протяжении 10—15 минут и более без признаков
нарастающей гипоксии. Постоянным симптомом, указывающим на неполную
ликвидацию нервно-мышечного блока, являются нистагмоподобные движения
глазных яблок при попытке фиксировать взгляд. Исчезновение этого симптома с
ранее упомянутыми является надежным клиническим тестом нормализации пере-
дачи возбуждения в синапсах скелетных мышц.
В клинических дозах тубокурарин не оказывает какого-либо заметного по-
бочного действия на сердце, но вследствие ганглиоблокирующего действия про-
являет умеренный гипотензивный эффект. При тяжелом состоянии больного (шоке,
декомпенсации сердечной деятельности) даже небольшие дозы тубокурарина мо-
гут значительно снизить АД.
Тубокурарин вызывает снижение уровня калия в плазме крови. Предвари-
тельное введение деполяризующего релаксанта (для проведения интубации тра-
хеи) нивелирует этот эффект.
Введение тубокурарина приводит к освобождению гистамина, что может выз-
вать у некоторых больных аллергические реакции в виде уртикарной сыпи, гипе-
ремии по ходу вены, в которую релаксант вводили, и даже бронхиолоспазм. Жела-
тельно избегать применения тубокурарина у лиц с аллергическими реакциями в
анамнезе. Следует осторожно применять его при нарушении функции почек.
6.5.2. Ардуан
Действующее вещество — пипекурония бромид. Выпускают во
флаконах по 4 мг порошка лиофилизированного пипекурония бромида. Раствор
для внутривенного введения готовят ex temporae, добавляя во флакон 2 мл прила-
гаемого растворителя (0,9 % раствора натрия хлорида).
Полная миорелаксация после внутривенного введения необходимой дозы ар-
дуана наступает через 4—5 мин. При применении ардуана после сукцинилхолина
недеполяризующая блокада развивается через 2—3 мин. Продолжительность дей-
ствия препарата составляет 40—60 мин в зависимости от применяемой дозы и
индивидуальной чувствительности пациента.
Ардуан выводится в неизменном виде преимущественно почками, в незначи-
тельном количестве — с желчью. После введения повторных доз препарата воз-
113
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
можна умеренная кумуляция. Ардуан применяют при хирургических вмешатель-
ствах, когда необходимо обеспечить миорелаксацию продолжительностью более
30 мин.
С целью проведения эндотрахеальной интубации для полной миорелаксации
вводят ардуан в дозе 0,06—0,08 мг/кг. Если интубацию проводили с помощью
дитилина, то начальная доза ардуана составляет 0,04 мг/кг. Повторные дозы пре-
парата составляют 1/4—1/3 от начальной. Более высокие дозы могут вызвать про-
лонгацию действия. В некоторых случаях ардуан может вызвать умеренную бради-
кардию, особенно во время наркоза с применением галотана или фентанила.
Ардуан противопоказан при миастении, миастеническом синдроме, а также у
больных с гиперчувствительностью к ингредиентам препарата — пипекуронию и брому.
6.5.3. Тракриум
Действующее вещество — атракуриума бесилат. Недеполяризую-
щий миорелаксант средней продолжительности действия, в состав которого вхо-
дит четвертичная аммониевая группа. Выпускают в ампулах в виде прозрачного
бледно-желтого раствора: по 2,5 мл раствора с 25 мг атракурия или по 5,0 мл с
50 мг атракурия. Хранят при температуре 2—8 °C в защищенном от света месте.
Доза для взрослого пациента 0,3—0,6 мг/кг обеспечивает адекватную релакса-
цию на протяжении 15—30 мин. Интубацию трахеи выполняют через 60—90 с пос-
ле внутривенного введения 0,5—0,6 мг/кг препарата. Нейромышечную блокаду
пролонгируют введением дополнительных доз тракриума — 0,1—0,2 мг/кг и пре-
кращают, как у всех недеполяризующих миорелаксантов, антихолинэстеразными
препаратами. Дозы тракриума для детей старшее 1 года, как правило, такие же,
как у взрослых. У пациентов преклонного возраста тракриум применяют в стан-
дартных дозах, но начальную дозу уменьшают.
Метаболизм основного количества тракриума обеспечивается двумя незави-
симыми процессами: гидролизом эфирной связи, который катализируется неспе-
цифическими эстеразами, и спонтанным неферментативным химическим разру-
шением. Небольшое количество препарата выделяется через почки и печень в
неизмененном виде, поэтому тракриум применяют у пациентов с разными степе-
нями нарушений функций печени, а при почечной недостаточности тракриум яв-
ляется препаратом выбора.
Тракриум оказывает умеренное гистаминогенное действие, поэтому его не
применяют при бронхиальной астме и других заболеваниях аллергического гене-
за. Гипотермия и ацидоз пролонгируют действие тракриума. Считают, что тракри-
ум в стандартных дозах не проникает через плаценту при использовании рацио-
нальных дозировок, поэтому его применяют при кесаревом сечении.
6.5.4. Павулон
Действующее вещество — панкурония бромид. Выпускают в ам-
пулах по 4 мг, хранят при температуре 2—8 °C в защищенном от света месте.
Применяют павулон у пациентов всех возрастных групп. В течение 90—120 с
после внутривенного введения в дозе 0,08 мг/кг павулон самостоятельно обеспечива-
ет все условия для проведения интубации трахеи и надлежащий уровень релаксации
продолжительностью до 45 мин. Поддерживающая доза составляет 0,02—0,03 мг/кг.
114
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
Препарат частично метаболизируется в печени. Основной путь выведения
препарата и его метаболитов — почечная экскреция.
Павулон производит незначительный кардиоваскулярний эффект, который
проявляется умеренным повышением АД, ЧСС, сердечного выброса. Павулон
вызывает незначительное кардиоселективное ваголитическое действие, которое
корригирует брадикардию, вызванную некоторыми сильными анестетиками или
аналгетиками во время операции.
У больных с циррозом печени использование павулона может привести к уг-
нетению дыхания в послеоперационный период. При истинной миастении, у боль-
ных с миастеническим синдромом, а также при нейромышечных заболеваниях
павулон может вызывать продолжительное апноэ, поэтому при этих патологиях
применяют индивидуально подобранные дозы препарата.
Павулон рекомендуют к применению в офтальмохирургии, поскольку он вы-
зывает заметное снижение повышенного, а также нормального внутриглазного
давления. Павулон проникает через плацентарный барьер.
Действие павулона пролонгируют: гипокалиемия (интенсивная рвота, по-
нос, мочегонная терапия), гипокальциемия, гипермагниемия, гипопротеине-
мия, дегидратация, метаболический ацидоз, гиперкапния, кахексия, гипо-
термия.
Возможны аллергические реакции на панкуроний и ионы брома, что является
противопоказанием к применению павулона.
6.5.5. Норкурон
Действующее вещество — векурония бромид. Выпускают в виде
лиофилизированного порошка в дозе 4 мг в одном флаконе. Хранят в течение
3 лет при комнатной температуре.
Норкурон применяют у пациентов всех возрастных групп. После внутривен-
ного введения норкурона в дозе 0,08-0,10 мг/кг через 90—120 с возникают надле-
жащие условия для проведения интубации трахеи. Полный паралич скелетной
мускулатуры, необходимый для любого хирургического вмешательства, наступа-
ет через 3—4 мин. Начальная доза норкурона обеспечивает достаточную глубину
миорелаксации на протяжении 20—30 мин у взрослых, 15—20 мин — у детей,
30-40 мин — у грудных детей. Поддерживающая доза норкурона составляет 0,02—
0,03 мг/кг. Норкурон не обладает кумулятивным свойством, не вызывает выброса
гистамина, не оказывает ганглиоблокирующего и вазолитического действия. При-
чины углубления и удлинения миорелаксации норкуроном такие же, как и паву-
лоном.
Особенностью норкурона является элиминация его основной части в неиз-
мененном виде с желчью, а незначительной части — через почки, поэтому у
больных с заболеваниями печени и желчевыводящих путей необходимо умень-
шать дозы норкурона. Норкурон применяют с большой осторожностью при ней-
ромышечных заболеваниях, миастении, миастеническом синдроме, выраженном
ожирении.
Противопоказанием к применению норкурона является наличие в анамнезе
аллергических реакций на векуроний и ионы брома.
115
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
6.5.6. Эсмерон
Действующее вещество — рокурония бромид. В клинической прак-
тике с 1995 года. Деполяризующий миорелаксант короткого действия. Выпускают
в виде раствора для инъекций, который содержит 10 мг/мл рокурония бромида.
Хранят при температуре 2—8 °C в течение 3 лет.
После внутривенного введения эсмерона в дозе 0,6 мг/кг через 60—90 с созда-
ются оптимальные условия для интубации трахеи. Рекомендованная поддержива-
ющая доза — 0,15 мг/кг, при многократном введении во время продолжительного
наркоза — 0,075—0,1 мг/кг.
Элиминируется препарат в неизмененном виде, в основном, с желчью, в незна-
чительном количестве — почками. Нарушения функций печени пролонгируют эф-
фект эсмерона. В стандартных дозах эсмерон практически не проникает через пла-
центарный барьер и является безопасным препаратом при кесаревом сечении.
Необходима осторожность при использовании эсмерона у больных миастени-
ей или с миастеническим синдромом. В таких случаях предварительно подбирают
эффективную дозу методом титрования. На фоне действия эсмерона по возмож-
ности избегают введения препаратов амоксициллина, цефазолина, эритромицина,
дексаметазона, преднизолона, гидрокортизона, фуросемида, фамотидина, интра-
липида и др.
Препарат противопоказан при наличии в анамнезе аллергических реакций на
рокуроний или ионы брома.
6.5.7. Мивакуриум (мивакрон)
В клинической практике с 1995—1996 гг. Недеполяризующий мио-
релаксант короткого действия. Выпускают в виде ампул по 5 мл (10 мг мивакури-
ума) и по 10 мл (20 мг мивакуриума).
При введении препарата в дозе 0,2 мг/кг через 2—2,5 мин возможно проведе-
ние интубации трахеи; длительность действия — 15—20 мин. Увеличение дозы до
0,75 мг/кг вызывает продление нейромышечной блокады на 10—20 мин.
При быстром введении препарата возможно покраснение кожи лица и тулови-
ща вследствие высвобождения гистамина, а также повышение АД на 15—20 % от
исходного уровня. При медленном введении (30—60 с) эти явления не наблюдают.
Почечная недостаточность и цирроз печени пролонгируют действие препарата.
Мивакуриум с осторожностью применяют, когда известно или есть предполо-
жение, что пациент гомозиготен по атипичному гену плазменной холинэстеразы.
Чувствительность к мивакуриуму повышается у пациентов с миастенией и други-
ми заболеваниями, нарушающими нейромышечную функцию, а также при кахек-
сии, нарушениях кислотно-щелочного равновесия и электролитных расстройствах.
6.5.8. Алкурониум (аллоферин)
Действующее вещество — алкурония хлорид — синтетическое про-
изводное алкалоида кураре токсиферина. Выпускают в ампулах по 2 мл (5 мг/мл).
Доза для интубации трахеи после индукции в наркоз составляет 0,25 мг/кг
внутривенно, поддерживающая доза — 0,15 мг/кг, длительность действия 15—20 мин.
116
6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
При введении 40 % препарата связывается с белками плазмы. Действие препарата
характеризуют предсказуемостью нервно-мышечной блокады, а отсутствие куму-
ляции дает возможность быстрой декураризации без применения антихолинэсте-
разных препаратов.
В настоящее время распространено использование алкурониума исключительно
для поддержания нервно-мышечной блокады, а интубацию трахеи предпочитают
осуществлять после введения сукцинилхолина или мивакуриума. В этих условиях
при современных методиках тотальной внутривенной или комбинированной (га-
зовыми анестетиками) анестезии после введения аллоферина в дозе 0,10 мг/кг
нейромышечный блок длится 17 ± 4 мин. Контроль газового состава крови под-
тверждает полное восстановление функции внешнего дыхания. Алкурониум с ус-
пехом применяют у больных в ОИТ при длительной ИВЛ, так как препарат не
нарушает электролитный баланс клетки.
Алкурониум выводится почками (85 %) практически в неизмененном виде.
6.6. ДЕКУРАРИЗАЦИЯ
При использовании рекомендуемых доз процесс нервно-мышеч-
ной блокады и расслабления скелетных мышц после внутривенного введения мио-
релаксантов является временным и обратимым. Каждый миорелаксант через оп-
ределенный период времени выводится из организма в виде метаболитов или в
неизмененном виде, вследствие чего восстанавливается тонус скелетных мышц.
Этот процесс называют декураризацией.
Клинические признаки адекватной декураризации: наличие самостоятельного
полноценного дыхания через интубационную трубку; живая реакция на интубаци-
онную трубку, на санацию трахеобронхиального дерева; способность по требова-
нию открыть и закрыть глаза, высунуть язык, пожать 2 пальца руки; способность
напрячь жевательные мышцы, приподнять голову.
При выполнении всех вышеописанных условий возможна экстубация больного.
Для ускорения процесса декураризации используют в качестве антидота анти-
холинэстеразные препараты, которые эффективны лишь при недеполяризующей
нервно-мышечной блокаде. Эти препараты блокируют ацетилхолинэстеразу и спо-
собствуют накоплению в нервно-мышечных синапсах необходимого количества
ацетилхолина, который восстанавливает нервно-мышечную передачу, и ацетилхо-
лин становится способным конкурировать с недеполяризующим миорелаксантом.
Это явление носит временный характер. Продолжительность эффекта декурариза-
ции зависит от уровня и скорости снижения концентрации ингибитора ацетилхо-
линэстеразы в плазме.
6.6.1. Антихолинэстеразные препараты
Наиболее часто в анестезиологии применяют антихолинэстераз-
ный препарат прозерин (миастигмин, неостигмин, простигмин). Для декурариза-
ции его вводят внутривенно в дозе 0,03—0,05 мг/кг. Для уменьшения нежелатель-
ных побочных эффектов прозерина (брадикардии, гиперсаливации, бронхореи,
бронхоспазма и др.) за 2-3 мин до его применения внутривенно вводят 0,5 мл 0,1 %
раствора атропина сульфата.
117
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Декураризацию проводят только в случае, если восстановилась определенная
степень самостоятельной нервно-мышечной проводимости. Глубокий нервно-
мышечный блок является абсолютным противопоказанием к введению антидота,
в особенности при состояниях, которые пролонгируют и углубляют миорелакса-
цию — метаболический ацидоз, нарушение электролитного баланса, почечная не-
достаточность, гипотермия и др.
Необходимо помнить, что больному после декураризации требуется тщатель-
ное наблюдение в послеоперационный период, поскольку после прекращения дей-
ствия прозерина наличие в организме недеполяризующего миорелаксанта может
опять привести к развитию нервно-мышечного блока. Это явление называют ре-
кураризацией. В случае возникновения такого осложнения больному проводят ИВЛ
до выхода из состояния миорелаксации.
6.6.2. Мониторинг нервно-мышечной блокады
При применении миорелаксантов в клинической практике про-
водят объективную оценку их блокирующего эффекта. Субъективная оценка мы-
шечной силы (открывание глаз, поднимание головы, способность самостоятельно
и адекватно дышать и т. п.) несовершенна.
В настоящее время существует четыре основных метода объективной оценки
степени нервно-мышечной передачи: механомиография, стимуляционная электро-
миография, акцеломиография, периферическая нейростимуляция. Первые два ме-
тода непригодны для применения в клинике, а акцеломиографию и периферичес-
кую нейростимуляцию применяют в повседневной клинической практике.
Акцеломиография — это метод количественного анализа нервно-мышечной
передачи путем регистрации вызванных мышечных сокращений. На принципе
этого метода базируется работа приборов TOF-CUARD и TOF-WATCH.
Периферическая нейростимуляция является более простым методом монито-
ринга нервно-мышечной блокады. Нервно-мышечную передачу оценивают по силе
ответа мышцы на супрамаксимальную электростимуляцию периферического дви-
гательного нерва, чаще всего — локтевого. Интенсивность ответа определяют по
движениям пальцев руки. Оценку проводят визуально и тактильно на протяжении
всего периода блокады. Для оценки нервно-мышечной блокады применяют сле-
дующие виды электростимуляции: единичный электроимпульс, четыре импульса
подряд (ТОЕ), единичные импульсы после тетанического разряда, два коротких
тетанических разряда подряд.
Мониторинг методом контролируемой электростимуляции позволяет достоверно
оценить степень нервно-мышечной блокады, необходимость введения поддержива-
ющих релаксацию доз, избегать передозировки, контролировать степень восстанов-
ления нервно-мышечной передачи при выходе из наркоза и миорелаксации.
6.8. ИСПОЛЬЗОВАНИЕ МЫШЕЧНЫХ РЕЛАКСАНТОВ
ПРИ НЕЙРОМИОПАТИЯХ
Существуют определенные предостережения относительно при-
менения миорелаксантов при некоторых нервно-мышечных заболеваниях.
Истинная миастения (miastenia gravis) проявляется слабостью и быстрой утом-
ляемостью скелетных мышц, что связывают с патологией вилочковой железы.
118
t. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЫШЕЧНЫХ РЕЛАКСАНТОВ
Непосредственной причиной мышечной слабости на современном этапе считают
аугоимунную деструкцию, или инактивацию, постсинаптических холинорецепто-
ров нервно-мышечных синапсов, которая приводит к снижению числа этих ре-
цепторов и потере складчатости постсинаптической мембраны. Заболевание про-
текает с обострениями и ремиссиями. При тяжелой форме поражаются даже ды-
хательные мышцы. Состояние больного улучшает введение антихолинэстеразных
препаратов.
У больных миастенией развита чрезмерная чувствительность к миорелаксан-
там недеполяризующего действия: даже тест-доза, которую вводят для предупреж-
дения фасцикуляций, может привести к глубокой и продолжительной миорелак-
сации. Реакция на введение деполяризующего миорелаксанта при миастении не-
прогнозирована. Возможны варианты относительной резистентности, но на фоне
действия антихолинэстеразных препаратов может развиться резкое возрастание
продолжительности действия деполяризующих релаксантов.
При миастении оптимально избегать использования миорелаксантов. Если
это невозможно, то рекомендуют очень малые дозы относительно коротко дей-
ствующих недеполяризующих миорелаксантов — тракриума, эсмерона.
При некоторых злокачественных новообразованиях (карциноме бронха, мел-
коклеточном раке легкого, саркоидозе) появляется слабость проксимальных групп
мышц, особенно — нижних конечностей. Так проявляется миастенический синд-
ром, который в отличие от истинной миастении характеризуется уменьшением
мышечной слабости при физической нагрузке и неэффективностью применения
антихолинэстеразных препаратов. При этой патологии отмечают чрезвычайно
высокую чувствительность к деполяризующим и недеполяризующим миорелак-
сантам, поэтому следует избегать их применения или применять в минимальных
дозах.
При миопатиях Дюшена, Беккера, которые являются наследственными забо-
леваниями и характеризуются прогрессирующей мышечной слабостью и атрофи-
ей скелетных мышц, также отмечают повышенную чувствительность к недеполя-
ризующим миорелаксантам. Сукцинилхолин при данной патологии оказывает
непрогнозируемое действие, а также может спровоцировать выраженную гиперка-
лиемию и злокачественную гипертермию.
Для миотонии характерно замедленное и неполное расслабление мышц после
сокращения или механической стимуляции, которое не всегда удается снять
даже с помощью недеполяризующих миорелаксантов. Деполяризующие ре-
лаксанты в данной клинической ситуации противопоказаны, поскольку могут
спровоцировать тотальное миотоническое сокращение мышц. Такого типа со-
кращения дыхательных и гортанных мышц могут сделать невозможным проведе-
ние ИВЛ, а тризм — вызвать затруднение при открытии рта для интубации
трахеи.
Семейные периодические параличи проявляются внезапными приступами про-
ходящей мышечной слабости или полного паралича. При этом концентрация ка-
лия в плазме или резко снижается или возрастает. Реакция на миорелаксанты у
этих больных непрогнозируема. При гипокалиемии можно ожидать повышенную
чувствительность к недеполяризуюшим миорелаксантам. Сукцинилхолин сам вы-
зывает гиперкалиемию, поэтому противопоказан при гиперкалиемическом вари-
анте периодического паралича.
119
ОБЩАЯ АНЕСТЕЗИОЛОГИИ
ЛИТЕРАТУРА
1. Бунятян А.А. Руководство по анестезиологии. — М.: Медицина, 1997. 565с.
2. Ганонг В.Ф. Ф1зюлопя людини: Пщручник, пер. з англ. Наук. ред. — М.: Гже-
гоцький. — Льв1в: БаК, 2002. — 784 с.
3. Ковалев В.А., Хмелевский Я.М., Белоярцев Ф.Ф. Мышечные релаксанты в анесте-
зиологии. — М.: Медицина, 1970. — 228 с.
4. Лихванцев В.В. Практическое руководство по анестезиологии. — М.: 1998___288 с.
5. Морган Дж., Михаил М. Клиническая анестезиология. Пер. с англ. — М., СПб.:
Бином, III кн., 2003. — 298 с.
6. Панасенко Р.Н. Мониторинг нейромышечного блока в анестезиологической
Практике // Материалы II съезда анестезиологов-реаниматологов Украины. — Харьков,
1996. - С. 100.
7. Панасенко Р.Н., Суслов В.В. Нейромышечная блокада рокурониумом при уроло-
гических операциях // Материалы II съезда анестезиологов-реаниматологов Украины. —
Харьков, 1996. — С. 73.
<£ Суслов В.В., Панасенко Р.Н, Викторов ГА. Клиническая фармакология совре-
менных миорелаксантов. — Бить, знеболювання i штенсивна терашя, 1998, № 3. -
С. 29-38.
9. Barash Р. Cullen В., Stoelting R. Clinical Anesthesia. — London, 1989. — 1575 s.
10. Bernard C. Lecons sur les effects des substances toxiques et medicamenteuses. -
Paris, Bailiere, 1857.
11. Fox M.H., Hunt P.C.W. Prolonged neuromuscular block associated with mivacurium//
Br. J. Anesth., 1995. - 74: 237-238.
12. Griffith H.R., Jonson G.E. The use of curare in general anesthesia// Anesthesiology,
Ne 3, 1942.
13. Libonati M.M., Leahy J.J., Ellison N. The use of succinilcholine in open eye surgery//
Anesthesiology, 1985. — 62: 637—40.
14. Naguib M. Histamine release haemodynamic changes producted by rocuronium,
niivacuronium, atracurium and tubocurarine// Br. J. Anesth. 1995. — 75: 588—592.
15. Pace N.I. Prevention of succinilcholine myalgias: A meta—analysis// Anest. Analg.,
1990. - 70: 477-83.
16. RiggJ.D., Wilson A.S., PollardB.J. Mivacurium or recuronium for muscular relaxation
ip day—case surgery// Eur. J. Anesth., 1997. — 8: 40—45.
17. Sparr H.J. Pharmacodynamics and pharmacokinetics of rocuronium following
continuous infusion in patients during intravenous anesthesia// Eur. J. Anesth., 1994. — 11
(9): 63-65.
18. StirtJ.A., Grosslight R.R., Bedford Ц.Е, Vollmer D. “Defasciculation” with metocurine
prevents succinilcholine—induced increases in intracranial pressure// Anesthesiology, 1987. -
67: 50-3.
19. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3,h ed. Churchill Livingstone,
1994. - 524 p.
120
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ
АНЕСТЕТИКОВ
7.1. ТРЕБОВАНИЯ К "ИДЕАЛЬНОМУ"
ИНГАЛЯЦИОННОМУ АНЕСТЕТИКУ
Идеального ингаляционного анестетика (ИА) не
существует, но существует комплекс требований к физическим и
биологическим свойствам, которому должны соответствовать
современные ингаляционные анестетики (Крафт Т.М., Аптон П.М.,
1997).
Физические свойства “идеального” ингаляционного анестетика:
• химическая стабильность — должен иметь длительный срок
хранения, быть стабильным в широком диапазоне температур, не
реагировать с металлами, резиной, пластмассами, сохранять ста-
бильность при ультрафиолетовом облучении и не требовать доба-
вок стабилизаторов;
• невоспламеняемость/невзрывоопасность: должен не поддер-
живать горение и не воспламеняться при клинически используе-
мых концентрациях и смешивании с другими газами, например
кислородом;
• должен испаряться при комнатной температуре и нормаль-
ном атмосферном давлении с определенной закономерностью;
• адсорбент не должен вступать в реакцию с ингаляционным
анестетиком, сопровождающуюся выделением токсичных про-
дуктов;
• должен быть безопасным для окружающей среды (не разру-
шать озон) даже в минимальных концентрациях;
• низкая стоимость.
Биологические свойства “идеального” ингаляционного анес-
тетика:
• должен быть приятным при вдыхании, не раздражать дыха-
тельные пути и не вызывать усиление секреции;
• аналгетическое действие;
• высокий коэффициент растворимости масло/газ, низкий
коэффициент кровь/газ, низкая минимальная альвеолярная кон-
121
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
центрация (эти свойства обеспечивают быструю индукцию в анестезию и быстрое
восстановление после нее);
• высокая наркотическая активность (возможность использования низких кон-
центраций препарата в сочетании с высокими концентрациями кислорода);
• минимальное побочное действие на другие органы и системы (ЦНС, печень,
почки, дыхательную и сердечно-сосудистую системы); отсутствие эпилептоген-
ной активности;
• должен не подвергаться биотрансформации и экскретироваться в неизме-
ненном виде, не вступать в реакцию с другими препаратами;
• нетоксичность даже при хроническом воздействии малыми дозами, что весьма
важно для медицинского персонала, работающего в операционной.
Ни один из существующих ингаляционных анестетиков не отвечает полнос-
тью вышеуказанным требованиям, хотя современные препараты по многим пара-
метрам стали более соответствовать критериям, предъявляемым к “идеальному”
анестетику.
7.2. ХИМИЧЕСКАЯ СТРУКТУРА ИНГАЛЯЦИОННЫХ
АНЕСТЕТИКОВ
n2o N= N+ — N- = n+ = o
Cl F
I I
Галотан H — C — C — F
I I
Br F
F F H
I I I
Энфлюран H — С — О — С — C — F
F HF
I I I
Изофлюран н — С — О — C — C — F
F HF
I I I
Десфлюран н — С — О — С — C — F
F CF3
I I
Севофлюран н — С — О — С — Н
I I
Н CF3
Рис. 7.J. Химическая структура
ингаляционных анестетиков [1]
В настоящее время в качестве ингаляци-
онных анестетиков используют летучие жид-
кости (галотан, изофлюран, энфлюран, десф-
люран, севофлюран) и газы (закись азота, ксе-
нон). По разным причинам в клинической
практике уже не используют хлороформ, диэ-
тиловый эфир, трилен, циклопропан и меток-
сифлюран. Эти ингаляционные анестетики
представляют интерес в историческом аспекте.
Химическая структура применяемых ин-
галяционных анестетиков представлена на
рис. 7.1.
7.3. МИНИМАЛЬНАЯ АЛЬВЕОЛЯРНАЯ
КОНЦЕНТРАЦИЯ
Для количественной оценки наркотичес-
кой активности ингаляционных анестетиков
используют показатель минимальной альвео-
лярной концентрации (МАК). МАК — это та-
кая альвеолярная концентрация анестетика,
которая обеспечивает отсутствие реакции на
стандартный хирургический стимул (разрез
кожи) у 50 % больных при давлении, равном
1 атмосфере, т. е. на уровне моря. На МАК
анестетика влияет большое количество физи-
ологических и фармакологических факторов
122
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ.АНЕСТЕТИКОВ
(см. табл. 7.1). В практической деятельности у 95 % пациентов для полного обез-
движивания требуется концентрация анестетика, в 1,2—1,3 раза превышающая МАК.
Комбинация ингаляционных анестетиков оказывает суммарное действие на МАК.
Как правило, 1 % закиси азота снижает МАК летучего анестетика на 1 %.
Таблица 7.1. Факторы, влияющие на МАК ингаляционного анестетика
Факторы, увеличивающие МАК Факторы, уменьшающие МАК
Детский возраст Гипертермия Гипертиреоидизм Катехоламины и симпатомиметики Длительное применение опиоидов Хронический алкоголизм Острое отравление амфетамином Гипернатриемия Период новорожденности Беременность Гипотензия Гипотермия Гипотиреоидизм аг-агонисты Седативные препараты Острый прием опиоидов Острый прием алкоголя Хронический прием амфетамина Литий
По теории Meyer-Overton, предложенной более столетия назад, существует
прямая линейная зависимость между коэффициентом растворимости масло/газ и
МАК ингаляционного анестетика [1] (рис. 7.2), т. е. коэффициент растворимости
зависит от количества растворенного анестетика в липидной мембране нейронов.
Согласно современным представлениям, ингаляционный анестетик взаимодей-
ствует со специфическими мембранными белками, влияя на активность мембран-
ных ионных каналов и рецепторов. Например, изомеры изофлюрана с идентич-
ными физико-химическими свойствами обладают специфическим стереоселек-
тивным сродством с рецепторами
гамма-аминомасляной кислоты А
(GABAa). Franks и Lieb обнаружи-
ли, что растворимость в октаноле
более коррелирует с мощностью
ингаляционного анестетика, чем
его липофильность.
Величина МАК зависит от
возраста пациента и является наи-
высшей у детей в возрасте 6 меся-
цев. При снижении температуры
тела на 1 °C величина МАК сни-
жается на 2—5 %. Опиаты и алко-
голь потенцируют действие ИА и
снижают МАК, но у больных, ко-
торые длительно употребляли опи-
аты и алкоголь, т. е. при развив-
шемся привыкании к этим сред-
ствам, МАК может значительно
возрастать. Именно по этой при-
чине у лиц, злоупотребляющих
Рис. 7.2. Соотношение между логарифмом МАК
анестетиков и коэффициентом растворимости в
жирах [1]
123
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
наркотическими средствами и алкоголем, индукция в наркоз может быть суще-
ственно затруднена.
МАК различных ингаляционных анестетиков усиливают друг друга. Напри-
мер, по причине нерастворимости в крови быстрая абсорбция закиси азота из
альвеол вызывает повышение МАК другого ингаляционного анестетика. Этот эф-
фект в клинической практике большого значения не имеет.
7.4. СВОЙСТВА ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Поскольку парциальное давление анестетика в мозге (Рв) зависит
от парциального давления анестетика в альвеолах (РА), то определение РА позво-
ляет непрямым методом вычислить Рв.
Факторы, влияющие на анестетическую активность ингаляционного анестетика
Альвеолярная вентиляция. Увеличение альвеолярной вентиляции увеличивает Рд
и, соответственно, увеличивается Рв, то есть индукция в наркоз происходит быст-
рее. Однако увеличение функциональной остаточной емкости (ФОЕ) способствует
распределению ИА в большем объеме газа, что замедляет индукцию в наркоз.
Концентрация ИА во вдыхаемом газе. Более высокая концентрация ингаляци-
онного анестетика во вдыхаемом газе (F,) вызывает более быстрое увеличение Рд
и, соответственно, более быструю индукцию в наркоз. У различных анестетиков
соотношения PA/F, разнятся [1] (рис. 7.3).
Сердечный выброс. Высокий показатель сердечного выброса способствует под-
держанию концентрационного градиента между альвеолами и кровью в легочных
капиллярах, поэтому РА повышается медленнее; при более низком показателе сер-
дечного выброса анестезия наступает быстрее.
Коэффициент распределения кровь/газ. Этот коэффициент отражает отношение
распределения ИА в крови и газе при температуре 37 °C и при одинаковых объеме
и давлении. При низком значении коэффициента, то есть при малой растворимо-
сти ингаляционного анестетика в крови, быстрее достигается МАК и быстрее на-
ступает анестезия, так как быстрее возрастает РА; при высоком значении коэффи-
Рис. 7.3. Соотношение PA/F, у различных анестетиков [1J
124
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
циента кровь/газ, то есть при высокой растворимости ингаляционного анестетика
в крови, наступление анестезии замедляется.
Показатели коэффициентов распределения, или растворимости, характеризу-
ют распределение попавшего в организм ингаляционного анестетика между двумя
средами при одинаковых условиях (температуре, давлении и объеме). Коэффици-
енты распределения мозг/кровь, жир/кровь, жир/газ также играют роль для пере-
распределения ингаляционного анестетика в тканях организма (табл. 7.2).
Таблица 7.2. Свойства ингаляционных анестетиков (Fiedler S.O., 2002)
Ингаля- ционный анестетик Моле- куляр- ная масса Точка кипе- ния, •с Давление паров (или газа) при 20 ‘С, мм рт. ст. Коэффициенты растворимости (распределения) в различных средах при 37 °C МАК, об% к 1 атм. (толь- ко с О2)
кровь/ газ мозг/ кровь жир/ кровь жир/ газ
Закись азота 44 -88 39 000 0,47 1,7 2,3 1,44 104
Галотан 197,5 50,2 241 2,3 2,9 60 224 0,77
Энфлюран 184,5 56,5 175 1,91 1,4 36 98,5 1,7
Изофлюран 184,5 48,5 238 1,4 2,6 45 90,8 1,15
Десфлюран 168 23,5 664 0,42 1,2 27 18,7 6,0
Севофлюран 200 58,5 160 0,69 1,7 48 7,2 1,7
7.5. МЕТАБОЛИЗМ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Печеночный цитохром Р450 способствует метаболизму С—(гало-
ген)-связи с освобождением ионов галогенов (F", СГ, Вг“), которые могут выз-
вать повреждение печени или почек. С—F—связь является стабильной и метаболи-
зируется слабо.
Таблица 7.3. Характер метаболизма ингаляционных анестетиков [1]
Ингаляционный анестетик Метаболизм, % Метаболиты
Закись азота <0,01 N2
Галотан 20 Трифторуксусная кислота, СГ, Вт"
Севофлюран 3,5 Неорганические и органические фториды
Энфлюран 2 Неорганические и органические фториды
Изофлюран 0,2 Трифторуксусная кислота и F'
Десфлюран 0,02 Трифторуксусная кислота
125
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 7.4. Кардиоваскулярные эффекты ингаляционных анестетиков [1]
Показатель n2o Галотан Изо- флюран Эн- флюран Дес- флюран Сево- флюран
Сократимость миокарда Ф ффф* ф* фф* Фо Ф
Сердечный выброс Т ф* 0 ф* 0 0
ЧСС Т ф ТТ* т т 0
Системное сосудистое сопротивление 0 ф ФФ* ф ф Ф
АД 0 4Д<* фф* фф* ФФ* Ф
Коронарный кровоток 0 0 То 0 То То
Мозговой кровоток 0 То Т т Т
Спланхнический кровоток Фо ф 0 Ф 0 0
Сенситизация к катехоламинам 0 ТТТ 0 Т 0 0
* Действие зависит от дозы ингаляционного анестетика
Таблица 7.5. Респираторные эффекты ингаляционных анестетиков [1]
Показатель Галотан Изофлюран Энфлюран Десфлюран Севофлюран
чдд т ТТ ТТ ТТ ТТ
Дыхательный объем ф ФФ ффф ФФ ф
рСО2 0 ТТ ттт ТТ т
Существуют данные, что ингаляционные анестетики (кроме закиси азота, га-
лотана и, возможно, энфлюрана) обладают протекторным эффектом при ишеми-
чески-реперфузионном повреждении миокарда посредством активации АТФ-за-
висимых калиевых каналов [2].
Kevin L.G. и соавторы [3] обнаружили, что некоторые ингаляционные анесте-
тики способствуют продукции свободных кислородных радикалов (ROS) в сердце,
что, вероятнее всего, происходит по причине ингибиторного эффекта на карди-
альные митохондрии. ROS также вовлекаются в сигнальный каскад кардиопро-
тективных процессов, вызванных коротким применением ингаляционных анесте-
тиков (anesthetic preconditioning).
По результатам современных исследований, ингаляционные анестетики, в
частности десфлюран и севофлюран (возможно — изофлюран) обладают протек-
торным эффектом на миокард, мозг и другие органы при повреждениях, вызван-
ных ишемией/реперфузией. Этот эффект, по-видимому, связан с ингибированием
экспрессии внутриклеточных и сосудистых адгезивных молекул ICAM-1 и VCAM-1,
126
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Е-селектина, а также снижением продукции фактора некроза опухоли альфа
(ФНОа) [4].
Поданным Fischer и соавторов [5], все протестированные внутривенные (это-
мидат, кетамин, фентанил, пропофол, мидазолам, натрия оксибутират) и ингаля-
ционные (галотан, энфлюран, изофлюран, десфлюран, севофлюран) анестетики
не влияли на проницаемость гематоэнцефалического барьера.
7.6. ИНГАЛЯЦИОННЫЕ АНЕСТЕТИКИ-ЖИДКОСТИ
7.6.1. Галотан (фторотан)
Галогенизированный углеводород, который имеет наиболее длитель-
ную историю применения в сравнении со всеми современными жидкими ингаляци-
онными анестетиками. В последнее время галотан реже используют в анестезиологи-
ческой практике. Одним из его преимуществ является относительная дешевизна.
Галотан — это бесцветная, прозрачная, подвижная, легко летучая жидкость с
запахом, напоминающим запах хлороформа, сладким и жгучим вкусом. Галотан
вызывает коррозию некоторых металлов и медленно разлагается под действием
света, поэтому его хранят в темных флаконах; стабилизатором является 0,01 %
тимол для предотвращения образования свободных бромидов. Галотан растворя-
ется в резине, поэтому незначительные концентрации могут оставаться во вдыха-
емом газе после прекращения его подачи. Из всех галогенсодержащих анестети-
ков галотан имеет самый высокий коэффициент распределения кровь/газ. Не об-
ладает раздражающим эффектом на дыхательные пути, поэтому его часто
используют для масочной индукции в наркоз, особенно у детей.
Действие на ЦНС. Галотан расширяет сосуды мозга более, чем другие ИА, и
повышает внутричерепное давление даже в дозе 0,6 МАК, поэтому его нежела-
тельно применять у больных с внутричерепной гипертензией.
Действие на дыхание. На функцию дыхания галотан оказывает наименее выражен-
ный среди всех галогенсодержащих анестетиков депрессивный эффект (см. табл. 7.5):
снижает тонус гладких мышц бронхов и не стимулирует бронхиальную секрецию, по-
этому его используют у больных с бронхиальной астмой. Учитывая бронходилатирую-
щий эффект, галотан пробуют использовать для купирования астматического статуса,
но убедительных данных о его эффективности в этих случаях пока не получили.
Действие на сердечно-сосудистую систему. В зависимости от дозы галотан вы-
зывает наиболее выраженный среди всех ИА кардиодепрессивный эффект (см.
табл. 7.4): снижает сократимость миокарда и сердечный выброс, депрессирует
проводимость, ингибирует атрио-вентрикулярную активность. Именно поэтому
галотан не применяют у больных с шоком и сердечной недостаточностью.
Галотан оказывает выраженный сенсибилизирующий эффект к катехоламинам,
следовательно, при артериальной гипотензии, возникшей во время наркоза галотаном,
категорически противопоказано применение симпатомиметиков. В таких случаях преж-
де всего уменьшают концентрацию галотана во вдыхаемой смеси. Если этого оказа-
лось недостаточно, то вообще прекращают подачу анестетика, а далее лечат по об-
щим принципам. При инфузии катехоламинов на фоне галотанового наркоза могут
возникнуть опасные для жизни нарушения ритма сердца, вплоть до фибрилляции
желудочков. Галотан снижает ОПСС в основном за счет расширения кожных сосу-
дов, при этом может снижаться перфузия внутренних органов, например почек.
127
06ЩАЯ АНЕСТЕЗИОЛОГИЯ
Клинические проявления анестезии. Для индукции в наркоз концентрацию га-
лотана увеличивают постепенно: при мононаркозе, как правило, увеличивают кон-
центрацию до 2,5—3 об%; в комбинации с закисью азота для достижения хирурги-
ческой стадии наркоза необходима значительно меньшая концентрация галотана.
Во время индукции в наркоз возможна кратковременная фаза возбуждения, кото-
рая также менее выражена при комбинации с закисью азота. Галотан обладает
незначительным аналгезирующим эффектом, поэтому проводить травматичные
вмешательства при галотановом мононаркозе нецелесообразно.
Метаболизм. До 25 % ингалируемого галотана подвергается оксидативному
метаболизму печеночным цитохромом Р450 с образованием трифторуксусной кис-
лоты, ионов Вг" и СГ.
Токсическое действие. Галотан оказывает токсическое действие на печень, ко-
торое усиливается при печеночной гипоксии.
Обратимая форма токсического действия галотана на печень может протекать
субклинически и проявляться только повышением показателей трансаминаз.
Более тяжелое токсическое действие галотана на печень проявляется в виде
фульминантного печеночного некроза, или галотанового гепатита. Трифторуксус-
ная кислота является гаптеном, который ковалентно соединяясь с печеночными
протеинами, индуцирует образование антител к гепатоцитам. Диагноз галотаново-
го гепатита базируется на исключении всех остальных причин острого гепатита
после ингаляции галотана. Инцидентность этого осложнения у детей составляет
1 на 80—200 тысяч анестезий, у взрослых — 1 на 2,5—35 тысяч. Факторами риска
развития галотанового гепатита являются: длительная экспозиция, ожирение, сред-
ний возраст, женский пол. Летальность достигает 50—75 %.
Необходимо помнить, что галотан неблагоприятно влияет на здоровье меди-
цинского персонала, работающего в операционной.
7.6.2. Энфлюран
МАК энфлюрана примерно в 2 раза больше, чем у галотана, по-
этому его наркотическая активность вдвое ниже.
Действие на ЦНС. По свойству увеличивать церебральный кровоток и ВЧД
энфлюран занимает срединное положение между галотаном и изофлюраном. Он
вызывает эпилептиформную активность на ЭЭГ при концентрации более 3 % и
хотя нет абсолютных доказательств, что энфлюран увеличивает риск эпилепти-
ческих припадков, у больных с эпилепсией его предпочитают не использовать.
Действие на дыхание. Энфлюран в большей степени, чем другие ИА, вызывает
депрессию дыхания, снижает МОД и повышает рСО2.
Действие на сердечно-сосудистую систему. Энфлюран увеличивает ЧСС, сни-
жает сердечный выброс, сократимость миокарда, АД и ОПСС, редко вызывает
аритмии.
Метаболизм и токсическое действие. Только 2 % энфлюрана метаболизирует-
ся печеночным цитохромом Р450, что способствует образованию F", однако кри-
тические клинически значимые концентрации ионов фтора (свыше 40 мкмоль/л)
возникают редко. В результате наличия в энфлюране CHF,-группы при взаимо-
действии с натрием образуется монооксид углерода. Иногда при применении эн-
флюрана развивается нефропатия, которая носит клинически обратимый харак-
тер. Поражения печени по сравнению с галотаном регистрируют реже.
128
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
7.6.3. Изофлюран
Структурный изомер энфлюрана. На современном этапе доста-
точно широко применяют во всем мире для поддержания обшей анестезии.
Действие на ЦНС. Из всех ИА изофлюран наиболее благоприятно воздей-
ствует на мозг: в минимальной степени увеличивает мозговой кровоток и снижает
его потребность в кислороде. При концентрации изофлюрана, не превышающей
1 МАК, сохраняется ауторегуляция сосудов мозга.
Действие на дыхание. Изофлюран оказывает депрессивный эффект на венти-
ляцию легких в большей степени чем галотан, но в меньшей, чем энфлюран.
Обладает раздражающим действием на дыхательные пути, вызывая кашель, по-
этому его редко используют для индукции в наркоз. В незначительной степени
изофлюран обладает бронхолитическим эффектом.
Действие на сердечно-сосудистую систему. В зависимости от дозы изофлюран
снижает сосудистое сопротивление, поэтому, возможно, тахикардия является реф-
лекторным ответом. Изофлюран в незначительной степени снижает сократимость
миокарда и сердечный выброс, может вызвать синдром обкрадывания при ИБС,
однако ишемию миокарда наблюдают не чаще, чем при наркозе другими ИА.
Предполагают, что изофлюран оказывает кардиопротективный эффект при учас-
тии АТФ-зависимых калиевых каналов.
Метаболизм. Практически весь препарат выводится из организма в неизме-
ненном виде и лишь 0,2 % изофлюрана метаболизируется.
Токсическое действие. Также как и энфлюран, изофлюран содержит CHF2-rpyn-
пу и при взаимодействии с натрием образует монооксид углерода.
7.6.4. Десфлюран
Метиловый галогенизированный эфир, по структуре похож на
изофлюран, но не содержит ионов хлора. Вследствие высокого давления насыще-
ния пара десфлюран не применяют через обычные испарители. Низкий коэффи-
циент распределения кровь/газ обеспечивает быструю индукцию в наркоз.
Действие на дыхание. Депрессивное действие десфлюрана на дыхание зависит
от дозы и более выражено, чем у галотана, но менее, чем у изофрюрана и энфлю-
рана. Десфлюран производит выраженный раздражающий эффект на дыхатель-
ные пути, что ограничивает его применение для вводного наркоза.
Действие на сердечно-сосудистую систему. Эффект десфлюрана на сердечно-сосу-
дистую систему сходен с изофлюраном: снижает сосудистое сопротивление, в том чис-
ле мозговых и коронарных сосудов, не сенсибилизирует миокард к катехоламинам.
Клинические проявления анестезии. Десфлюран наряду с севофлюраном широ-
ко используют в “хирургии одного дня”, при этом применение десфлюрана связа-
но с более быстрым пробуждением без разницы в протекании послеоперационного
периода, кроме более высокой инцидентности раздражения дыхательных путей [12].
Время восстановления у детей после десфлюрановой анестезии короче, чем после
применения изофлюрана; продолжительность анестезии влияет на время восста-
новления при применении изофлюрана, но не десфлюрана [13].
По данным lannuzzi и соавторов [11], при анестезии десфлюраном у пожилых
больных наблюдали более раннее восстановление в сравнении с анестезией се-
вофлюраном, что определяли по способности отвечать на простые вопросы после
5 7-585
129
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
прекращения подачи анестетика, тем не менее, оценка боли по визуально-анало-
говой шкале и потребность в послеоперационной аналгезии были более высокими
в группе десфлюрана.
Метаболизм. Незначительное количество десфлюрана (0,02 %) метаболизирует-
ся, поэтому потенциальный токсический эффект при его применении минимальный.
Токсическое действие. В литературе представлено всего три случая гепатоток-
сического действия десфлюрана, но, по мнению канадских авторов [10], все фто-
рированные анестетики могут вызвать острое повреждение печени.
7.6.5. Севофлюран
Метилизопропиловый эфир, галогенизированный ионами фтора.
Севофлюран успешно используют для вводного наркоза, так как он обладает оп-
ределенными свойствами: относительно низким коэффициентом распределения
кровь/газ (0,7), отсутствием раздражающего эффекта на дыхательные пути, отно-
сительно низкой МАК (1,8).
Действие на ЦНС. Эффект сходен с галотаном. Описаны случаи посленаркоз-
ного нарушения сознания, галлюцинаций у детей, замедления пробуждения.
Действие на дыхание. Так же как и другие ИА, севофлюран оказывает депрессив-
ное, но не выраженное действие на дыхание со снижением МОД и повышением РСО2.
Действие на сердечно-сосудистую систему. Не влияет на сократимость миокра-
да и ЧСС, снижает АД и сосудистое сопротивление, в том числе мозговых и коро-
нарных артерий. Не вызывает сенситизации к катехоламинам.
Метаболизм и токсическое действие. Севофлюран метаболизируется печеноч-
ным цитохромом Р450 в большей степени (3,5 %), чем другие ИА, за исключением
галотана. В процессе метаболизма образуются гексафторизопропанол и неоргани-
ческий F', но клинически, несмотря на повышение концентрации этого нефро-
токсичного иона, осложнений со стороны почек не наблюдали [14].
При применении ингаляционных анестетиков, в частности севофлюрана, об-
наружена редукция экспрессии в почечной коре внутриклеточных адгезивных
молекул-1 и мессенджеров РНК, а также провоспалительных цито- и хемокинов.
Ингаляционные анестетики уменьшают в почечной коре активность миелоперок-
сидазы и транслокацию провоспалительного ядерного фактора каппа В. Таким
образом, некоторые ингаляционные анестетики обеспечивают более выраженную
протекцию почек при ишемии/реперфузии в сравнении с пентобарбиталом и ке-
тамином, уменьшая воспаление. Для анестезиологов эти результаты клинически
значимы при выборе анестезии у пациентов, которые подвержены риску развития
интраоперационной почечной ишемии [15].
Одним из основных недостатков севофлюрана является нестабильность при кон-
такте с натронной известью, что приводит к образованию некоторых нефротоксич-
ных продуктов.
7.7. ИНГАЛЯЦИОННЫЕ АНЕСТЕТИКИ-ГАЗЫ
7.7.1. Закись азота
Широко используемый в комбинации с кислородом ингаляцион-
ный анестетик. Для потенцирования общей анестезии и короткой седации закись
азота применяют в течение более 150 лет.
130
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
Закись азота — бесцветный газ с характерным запахом, тяжелее воздуха и
растворим в воде. Хранят в баллонах серого цвета. Обладает хорошими физичес-
кими свойствами, предъявляемыми к “идеальному” анестетику, за исключением
высокой МАК.
Закись азота получают путем нагревания аммония нитрата до 250 °C:
NH4NO -э N2O + 2Н2О.
Несмотря на тщательный контроль технологии изготовления, промышленная
закись азота содержит примеси NH3, N2, NO, NO2, HNO3. Эти весьма активные
примеси хорошо диффундируют в резину, воду, каустическую соду и могут оказы-
вать токсическое действие.
В течение десятилетий закись азота считали практически идеальным аналге-
тиком вследствие ее благоприятных физических свойств и незначительных побоч-
ных эффектов на сердечно-сосудистую систему. Закись азота часто используют
для индукции в наркоз маской, прежде всего в педиатрической и гинекологичес-
кой анестезиологии. Однако обнаруженные в последние годы побочные эффекты
закиси азота, а также внедрение в практику новых анестетиков и короткодейству-
ющих наркотических аналгетиков ограничили применение этого газа. Осторож-
ный анализ противопоказаний и побочных эффектов показывает, что закись азота
все еще занимает определенное место в современной общей анестезии [8], тем не
менее, по данным Enlund М. и соавторов [9], большинство опрошенных анестези-
ологов, учитывая последние сведения о токсичности закиси азота, предпочитают
в клинической практике заменять ее другим анестетиком.
Действие на ЦНС. Анестетик обладает выраженной аналгетической активно-
стью. При концентрации свыше 60 % может вызвать амнезию. Закись азота рас-
ширяет церебральные сосуды в меньшей степени, чем другие ингаляционные ане-
стетики, и незначительно повышает ВЧД. Категорически не утверждают, что за-
кись азота противопоказана при нейрохирургических операциях, тем не менее, у
больных с высоким ВЧД избегают ее применения.
Действие на дыхание. На функцию дыхания закись азота практически не ока-
зывает действия; незначительно увеличивает сопротивление легочных сосудов,
поэтому ее применение нецелесообразно у больных с легочной гипертензией.
Действие на сердечно-сосудистую систему. Закись азота оказывает прямой деп-
рессивный эффект на миокард, который клинически выражен слабо: незначи-
тельно увеличиваются ЧСС, АД и сердечный выброс в результате стимуляции
симпатической нервной системы.
Клинические проявления анестезии. Анестетическое действие начинается быст-
ро, благодаря низкому коэффициенту распределения кровь/газ. Закись азота ра-
створяется в крови в 20 раз более, чем кислород и азот. При быстром уменьшении
концентрации N,0 во вдыхаемом газе ее концентрация в альвеолах может значи-
тельно возрасти в результате быстрой диффузии из крови. Кроме этого, может
уменьшиться объем альвеол, поэтому снижают концентрацию закиси азота посте-
пенно, увеличивая при этом подачу кислорода, который ингалируют в течение
3 мин после прекращения подачи N,O, иначе может развиться так называемая
диффузионная гипоксия.
Поскольку закись азота проникает в закрытые полости в 20 раз быстрее, чем
удаляется из них, то применение закиси азота может значительно увеличить объем
газа в закрытых пространствах (пневмотораксе, пневмомедиастинуме, полостях
мозга и среднего уха), поэтому ее применение при вышеуказанных состояниях
131
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
опасно. Важное клиническое значение имеет свойство закиси азота быстро запол-
нять газовые кишечные пространства. По данным Акса и соавторов [6], отказ от
использования закиси азота во время длительных операций на кишечнике мини-
мизирует растяжение кишечника и уменьшает выраженность связанной с ним
послеоперационной боли.
Закись азота при сохраненном сознании пациента используют с целью дости-
жения лишь аналгетического эффекта.
Взаимодействие с лекарственными средствами. Осуществлять индукцию в нар-
коз одной закисью азота сложно и небезопасно, так как часто возникает воз-
буждение. Чтобы достичь достаточного гипнотического эффекта, необходимы ги-
поксические концентрации закиси азота, поэтому ее, как правило, применяют в
комбинации с другими ингаляционными и внутривенными анестетиками.
Подача закиси азота в высокой концентрации увеличивает скорость поглоще-
ния сопутствующих ингалируемых газов, например изофлюрана и кислорода. Та-
кое явление называют эффектом второго газа.
Закись азота применяют в комбинации с кислородом в концентрации 50—60 %.
При концентрации закиси азота свыше 70 % может развиться гипоксия. Необходи-
мо помнить о высоком риске развития отека легких во время масочного наркоза,
когда возможно прекращение подачи N2O и оставшегося объема кислорода будет
недостаточно для вентиляции легких. Избежать возможных проблем позволяет при-
менение энтонокса (entonox), который является смесью закиси азота и кислорода в
соотношении 1:1 (смесь невзрывоопасна, но может поддерживать горение).
Согласно недавним научным исследованиям, закись азота обладает анти-N-
метил-В-аспартатовыми свойствами, таким образом, периоперационное исполь-
зование закиси азота уменьшает гипералгезию, вызванную опиатами, и, соответ-
ственно, интраоперационный расход морфина [7].
Метаболизм. Закись азота практически не подвергается биотрансформации в
организме, выделяется преимущественно через легкие в неизмененном виде.
Токсическое действие. Ранее считали, что закись азота практически не оказы-
вает токсического действия, но последние научные данные позволили усомниться
в этом утверждении.
Закись азота взаимодействует с кобальтом, который входит в состав витамина
В12. В результате ингибируется синтез метионина, тимидина, тетрагидрофолата и
ДНК. Закись азота напрямую ингибирует метионинсинтетазу, стимулирует обра-
зование мегалобластов в костном мозге, а при длительном воздействии может
привести к угнетению функции костного мозга с развитием агранулоцитоза. Дли-
тельная ингаляция N2O может вызвать хроническую инактивацию цианкобаломи-
на и метионинсинтетазы, что может вызвать анемию. Особенно опасно примене-
ние N2O у больных с гиповитаминозом В12. В этих случаях необходимо примене-
ние цианкобаломина и фолиевой кислоты.
В результате длительной ингаляции N,O может развиться миелонейропатия,
которую характеризуют прогрессирующей демиелинизацией задних рогов спин-
ного мозга с характерной симптоматикой.
Экспериментально обнаружен тератогенный эффект закиси азота, и хотя он
не доказан у людей, тем не менее, закись азота не следует использовать в первом
триместре беременности.
Побочные действия. Применение N2O увеличивает риск возникновения тош-
ноты и рвоты, поэтому нежелательно применять закись азота у пациентов с пол-
ным желудком.
132
1. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
7.7.2. Ксенон
Сравнительно новый ингаляционный анестетик в современном
арсенале анестезирующих средств. Ксенон — это инертный газ без запаха, содер-
жится в атмосфере в 0,0000087 %. Технология производства ксенона достаточно
дорогостоящая — в 2000 раз дороже производства закиси азота.
МАК ксенона — 71 %. Низкий коэффициент распределения кровь/газ (0,14)
позволяет достигать быстрого эффекта при применении. Обладает выраженным
аналгетическим действием. Наиболее важными положительными свойствами ксе-
нона являются стабильность в деятельности сердечно-сосудистой системы, протек-
ция мозга и благоприятная фармакокинетика; недостатками — высокая стоимость
и ограниченное количество респираторов, снабженных дозиметрами для ксенона.
В рандомизированном контролированном исследовании у 30 пациентов при
больших ортопедических операциях [16] наркоз 70 % ксеноном обеспечивал по-
требность в опиоидах, эквивалентную по МАК комбинации закиси азота (70 %) и
десфлюрана (2 %).
Действие на ЦНС. По предварительным данным ксенон вызывает вариабель-
ное увеличение мозгового кровотока, поэтому его не рекомендуют применять в
нейрохирургии. В литературе описаны церебропротекторные свойства ксенона [20].
Действие на дыхание. В отличие от других ингаляционных анестетиков ксе-
нон уменьшает ЧДД и увеличивает дыхательный объем, поэтому МОД не изменя-
ется. По сравнению с закисью азота ксенон обладает большей плотностью (в 3
раза) и вязкостью (в 1,5 раза), но это не вызывает клинически значимого увеличе-
ния сопротивления дыхательных путей. Низкая растворимость ксенона в крови
может вызвать диффузионную гипоксию, если во время завершения анестезии его
не заменить чистым кислородом.
Действие на сердечно-сосудистую систему. Ксенон оказывает минимальные
гемодинамические эффекты, не влияя на сократимость миокарда и незначительно
снижая ЧСС. По данным Goto и соавторов [17], ксенон обеспечивает лучшую
гемодинамическую стабильность в сравнении с закисью азота, сохраняя систоли-
ческую функцию левого желудочка. Таким образом, ксенон можно использовать у
больных с гиповолемией и шоком. Было показано, что в сравнении с другими
анестетиками при ксеноновой анестезии сохраняется самый высокий региональ-
ный кровоток в мозге, печени, почках и кишках [18]. По предварительным дан-
ным анестезия ксеноном обеспечивает гемодинамическую стабильность, тем не
менее, не обнаружено абсолютных доказательств преимущества ксеноновой анес-
тезии в сравнении с тотальной внутривенной анестезией у хирургических пациен-
тов с высоким риском [19].
Метаболизм. Ксенон не метаболизируется в организме и полностью выводит-
ся через легкие.
Токсическое действие. Обладает низкой токсичностью и нетератогенен.
7.8. ГАЗЫ, ИСПОЛЬЗУЕМЫЕ В АНЕСТЕЗИОЛОГИИ
В анестезиологии используют кислород, углекислый газ, оксид
азота и гелий. Особенно широко используют кислород, значение, транспорт и
потребление тканями которого подробно изложены в “Руководстве по интенсив-
ной терапии” [21].
133
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
7.8.1. Диоксид углерода, или углекислый газ
Использование углекислого газа (СО2) в анестезиологии значительно возрос-
ло после широкого внедрения в практику эндоскопических методик оперативных
вмешательств, например лапароскопического метода, который выполняют под кар-
боперитонеумом.
Диоксид углерода — газ без цвета, запаха и вкуса. Хранят в баллонах под
давлением 51 атм при 20 °C. Кроме лапароскопических операций углекислый газ
используют для криотерапии и лабораторных исследований (в газоанализаторах).
Действие на ЦНС. При повышении в крови рСО2 выше 10 кПа (75 мм рт. ст.)
функция ЦНС угнетается вплоть до наркоза и комы. Углекислый газ расширяет
церебральные сосуды; гиперкапния увеличивает ВЧД и отек мозга.
Действие на дыхание. Активируя дыхательный центр через хеморецепторы, угле-
кислый газ увеличивает МОД, ЧДД и глубину дыхания, обладает бронхолитическим
эффектом. При увеличении рСО2 выше 10 кПа (75 мм рт. ст.) дыхание угнетается.
Действие на сердечно-сосудистую систему. Углекислый газ стимулирует симпати-
ческую нервную систему, увеличивая ЧСС, АД, сердечный выброс, коронарную пер-
фузию. При дальнейшем повышении рСО2 могут возникать нарушения ритма сердца.
7.8.2. Оксид азота
Оксид азота (NO) является эндогенным вазодилататором. Исполь-
зуют в периоперационном периоде в интенсивной терапии. Потенциально может
находиться в баллонах с закисью азота. Дозировка оксида азота составляет от 1-5
до 40 ppm (ppm — 1 на 1 000 000 объема газа); ингаляцию осуществляют через
специальные дозаторы.
Оксид азота синтезируется [1] из гуанидиннитрогенной группы L-аргинина в
процессе катализа NO-синтазой (NOS) (рис. 7.4). NOS существует в двух формах:
конституциональной, которая в норме присутствует в эндотелии, нейронах, ске-
летных мускулах, миокарде и тромбоцитах, ее действие является Са++/кальмоду-
лин-зависимым и стимулируется цГМФ; индусибелъной, которая активируется оп-
ределенными эндотоксинами в эндотелии, гладких мышцах сосудов, миоцитах,
макрофагах и нейтрофилах. Длительная индукция NO может обладать цитотокси-
ческим эффектом, способствовать образованию активных радикалов (пероксинит-
рита), повреждению клеток и увеличению проницаемости капилляров.
Оксид азота синтезируется в макрофагах и нейтрофилах, являясь компонен-
том их противомикробной защиты.
Действие на дыхание. Значительно снижая сопротивление легочных и бронхи-
альных сосудов, оксид азота может уменьшать внутрилегочное шунтирование вслед-
ствие увеличения перфузии альвеол. Эти эффекты используют у детей с тяжелой
легочной гипертензией в предоперационном периоде при правожелудочковой не-
достаточности и ОРДС. Оксид азота не обладает бронхолитическим эффектом.
L-цитруллин
L-аргинин
Действие на сердечно-сосудистую
систему. Оксид азота снижает тонус
сосудов, в частности, мелких артерий
и артериол, ингибирует агрегацию
тромбоцитов. Его сродство к гемогло-
Рис. 7.4. Синтез эндогенного оксида азота [1] бину в 1500 раз выше, чем СО. Про-
134
7. ФАРМАКОЛОГИЯ ИНГАЛЯЦИОННЫХ АНЕСТЕТИКОВ
тивопоказанием к применению оксида азота является метгемоглобинемия. При септи-
ческом шоке оксид азота может быть одной из причин вазодилатационного шока [22].
При ингаляции оксид азота не обладает системным действием на АД, так как
быстро инактивируется. Нитропруссид натрия и другие нитраты реализуют свой эф-
фект посредством освобождения NO или его метаболитов в гладких мышцах сосудов.
ЛИТЕРАТУРА
1. Peck Т.Е., Hill S.A., Williams М. Pharmacology for Anaesthesia and Intensive Care.
2 th Ed. GMM, 2003, 376 p.
2. Lee H.T., Ota-Setlik A., Fu Y. Differential protective effects of volatile anesthetics
against renal ischemia-reperfusion injury in vivo. Anesthesiology, 2004 Dec; 101 (6): 1313—24.
3. Kevin L.G., Novalija E., Stowe D.F. Reactive oxygen species as mediators of cardiac
injury and protection: the relevance to anesthesia practice. Anesth. Analg., 2005 Nov; 101 (5):
1275-87.
4. Biao Z., Zhanggang X., Hao J., et al. The in vitro effect of desflurane preconditioning
on endothelial adhesion molecules and mRNA expression. Anesth. Analg., 2005 Apr; 100 (4):
1007-13.
5. Fischer S., Renz D., Kleinstuck J. et al. In vitro effects of anaesthetic agents on the
blood-brain barrier. Anaesthesist., 2004 Dec; 53 (12): 1177—84.
6. Акса O., Lenhardt R., Fleischmann E. et al. Nitrous oxide increases the incidence of
bowel distension in patients undergoing elective colon resection. Acta Anaesthesiol. Scand.,
2004 Aug; 48 (7): 894-8.
7. Richebe P., Rival C., Creton C. et al. Nitrous oxide revisited: evidence for potent
antihyperalgesic properties. Anesthesiology, 2005 Oct; 103 (4): 845—54.
8. Schonherr M.E., Hollmann M. W., Graf B. Nitrous oxide. Sense or nonsense for todays
anaesthesia. Anaesthesist, 2004 Sep; 53 (9): 796—812.
9. Enlund M., Edmark L., Revenas B. Ceasing routine use of nitrous oxide-a follow up
Br. J. Anaesth., 2003 May; 90 (5): 686-8.
10. Tung D., Yoshida E.M., Wang C.S., Steinbrecher LLP. Severe desflurane hepatotoxicity
after colon surgery in an elderly patient. Can. J. Anaesth., 2005 Feb; 52 (2): 133—6.
11. lannuzzi E., lannuzzi M., Viola G. etal. Desflurane and sevoflurane in elderly patients
during general anesthesia: a double blind comparison. Minerva Anestesiol., 2005 Apr; 71 (4):
147-55.
12. Saros G.B., DoolkeA., Anderson R.E., Jakobsson J.G. Desflurane vs. sevoflurane as the
main inhaled anaesthetic for spontaneous breathing via a laryngeal mask for varicose vein day
surgery: a prospective randomized study. Acta Anaesthesiol. Scand., 2006 May; 50 (5): 549—52.
13. Nordmann G.R., Read J.A., Sale S.M. et al. Emergence and recovery in children after
desflurane and isoflurane anaesthesia: effect of anaesthetic duration. Br. J. Anaesth., 2006
Jun; 96 (6): 779-85.
14. Luginbuhl M., Petersen-Felix S. et al. Xenon does not reduce opioid requirement for
orthopedic surgery. Can. J. Anaesth., 2005 Jan; 52 (1): 38—44.
15. Goto T., Hanne P., Ishiguro Y. et al. Cardiovascular effects of xenon and nitrous oxide
in patients during fentanyl-midazolam anaesthesia. Anaesthesia, 2004 Dec; 59 (12): 1178—83.
16. Hecker K., Baumert J.H., Hom N., Rossaint R. Xenon, a modern anaesthesia gas.
Minerva Anestesiol., 2004 May; 70(5): 255—60.
17. Bein B., Turowski P., Renner J. et al. Comparison of xenon-based anaesthesia compa-
red with total intravenous anaesthesia in high risk surgical patients. Anaesthesia, 2005 Oct;
60 (10): 960-7.
18. Руководство по интенсивной терапии. Под ред. Трещинского А.И., Глумчера
Ф.С. К.: Вища школа, 2004. — 583 с.
19. Глумчер Ф.С. Септический шок: новые концепции патогенеза и лечения. Ми-
стецтво л!кування, 2004, № 8/014, с. 4—8.
135
8. ИНТУБАЦИОННЫМ НАРКОЗ
8.1. ВВОДНЫЙ НАРКОЗ
Вводный наркоз перед интубацией трахеи, как
правило, осуществляют внутривенными анестетиками. Выбор ане-
стетиков или их комбинаций зависит от состояния пациента, на-
личия тяжелых сопутствующих заболеваний, в основном, со сторо-
ны сердечно-сосудистой системы (ИБС, гипертонической болезни
и др.), а также от фармакодинамических и фармакокинетических
свойств препаратов.
Применение комбинаций анестетиков позволяет значитель-
но уменьшить дозу каждого. Наиболее часто для индукции в
наркоз перед интубацией трахеи применяют комбинации про-
пофола, тиопентал-натрия, производных бензодиазепинов (си-
базона, мидазолама), натрия оксибутирата, этомидата, опиои-
дов. Необходимо помнить, что в некоторых клинических си-
туациях выбор сочетания анестетиков имеет ограничения
(табл. 8.1, 8.2).
Таблица 8.1. Стандартные дозы внутривенных анестетиков
для индукции в наркоз перед интубацией трахеи
Внутривенный анестетик Стандартная доза, мг/кг Клиренс, мл/мин/кг Период полу- выведения, ч
Тиопентал-натрий 3-5 3,4 11,6
Пропофол 1,5-2,5 59,4 4-7
Этомидат 0,2-0,3 10-20 2-5
Мидазолам 0,1-0,2 7,5 1-4
Кетамин 1-2 16-18 1-2
136
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Таблица 8.2. Эффекты внутривенных анестетиков на показатели
гемодинамики
Внутривенный анестетик АД ЧСС Сократимость миокарда Церебральны й кровоток Потребление кислорода вчд
Тиопентал- натрий г Т г г г г
Пропофол г - г г г г
Этомидат - - г г
Мидазолам -г - - 4. г 4.
Кетамин -t т t т т
Натрия оксибутират -т - -т -4- г 4-
Учитывают фармакодинамику анестетиков при различных тяжелых состояни-
ях или сопутствующих заболеваниях. Например, при гиповолемии нецелесообраз-
но использовать препараты, обладающие кардиодепрессивным или вазодилатиру-
ющим эффектом (тиопентал-натрия, пропофол); осторожно использовать в ввод-
ном наркозе опиоиды; у больных с шоком предпочтительнее использовать натрия
оксибутират и кетамин; у больных с гипертонической болезнью целесообразно
применять пропофол, бензодиазепины, опиоиды.
8.1.1. Профилактика гемодинамических реакций
перед интубацией трахеи
Важным элементом индукции в наркоз является уменьшение вы-
раженности стрессовой реакции на прямую ларингоскопию и интубацию трахеи.
Стрессовая реакция часто проявляется тахикардией, артериальной гипертензией,
подъемом внутричерепного и внутриглазного давлений, увеличением потребления
кислорода миокардом и мозгом. Это особенно важно у больных с инфарктами
миокарда в анамнезе, ИБС, тяжелой артериальной гипертензией, внутримозговой
гипертензией, некоторыми видами эндокринной патологии, глаукомой.
Для предотвращения стрессовой реакции на ларингоскопию и интубацию
применяют комбинированный внутривенный наркоз с использованием пропофо-
ла и фентанила. С этой целью применяют и адъювантные препараты, прежде все-
го лидокаин (внутривенно 1,0—1,5 мг/кг, местно (эффект не доказан) на голосо-
вые связки перед интубацией) и клонидин (клофелин). В последнее время чаще
используют блокаторы 0-адренергических рецепторов. Опубликованы данные об
эффективном применении антагонистов 0-адренергических рецепторов — эсмо-
лола и ландиолола. По данным Menigaux С. и соавторов [1], введение эсмолола
перед интубацией трахеи в дозе 1 мг/кг с последующим его введением со скорос-
тью 250 мкг/кг/мин не только уменьшает гемодинамические и двигательные отве-
ты на ларингоскопию и оротрахеальную интубацию, но также предотвращает по-
веденческие и электроэнцефалографические реакции активации у пациентов при
индукции пропофолом. Применение нового антагониста p-адренергических ре-
137
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
цепторов ландиолола (0,1 и 0,3 мг/кг) может служить методом профилактики та-
хикардии без влияния на АД в течение вводного наркоза и интубации трахеи [2].
Недостаточно изучена роль ингаляционных анестетиков для профилактики
стрессовой реакции на интубацию трахеи. Обнаружено, что закись азота, которую
ингалировали в течение 3 мин перед интубацией трахеи, уменьшала вазопрессор-
ную реакцию, но увеличивала выброс норадреналина в ответ на ларингоскопию и
эндотрахеальную интубацию [3]. Поэтому возможность применения закиси азота
с этой целью сомнительна, суммарно учитывая факт, что при применении закиси
азота уменьшается содержание кислорода в дыхательной смеси газов.
У больных высокой группы риска с целью профилактики тяжелой реакции на
интубацию со стороны сердечно-сосудистой системы ларингоскопию и интубацию
выполняют после хорошей преоксигенации. Оптимальная концентрация кислорода
во время индукции в наркоз точно не установлена. С одной стороны, желательна
максимальная оксигенация крови (лучше всего использовать вентиляцию чистым
кислородом), с другой — эта методика приводит к увеличению риска возникнове-
ния ателектазов легких [4]. Эти же авторы отмечают, что вдыхание 80 % кислорода
корригирует с минимальным ателектазированием, но сокращает время насыщения
кислородом до 90 % в сравнении с вдыханием 100 % кислорода.
Наиболее частыми причинами артериальной гипотензии, развивающейся после
индукции в наркоз и интубации трахеи, являются гиповолемия со снижением
венозного возврата и сердечного выброса и использование анестетиков для ин-
дукции в наркоз с кардиодепрессивным или сосудорасширяющим действием. Ос-
новным методом профилактики и лечения артериальной гипотензии является кор-
рекция гиповолемии.
8.2. ПРИМЕНЕНИЕ МЫШЕЧНЫХ РЕЛАКСАНТОВ
ДЛЯ ИНТУБАЦИИ ТРАХЕИ
Наиболее часто современные анестезиологи используют для ин-
тубации трахеи миорелаксант сукцинилхолин (дитилин). Являясь деполяризую-
щим миорелаксантом, сукцинилхолин в дозе 1,0 мг/кг оказывает быстрое дей-
ствие и через 60—90 с после введения создает благоприятные условия для интуба-
ции трахеи. Появились сообщения о возможности применения более низкой дозы
(до 0,5—0,6 мг/кг) без ухудшения условий для интубации, но с сокращением дли-
тельности эффекта [6—8].
Naguib М. и соавторы [6] провели проспективное, рандомизированное, двой-
ное слепое, плацебо-контролируемое исследование, в котором авторы попыта-
лись определить оптимальную дозу сукцинилхолина, обеспечивающую превос-
ходные условия для интубации в пределах 60 с после быстрого вводного наркоза.
Анестезию проводили фентанилом (2 мкг/кг) и пропофолом (2 мг/кг). На основа-
нии результатов исследования был сделан вывод, что оптимальная доза сукцинил-
холина составляет 1,5 мг/кг.
У большинства пациентов введение сукцинилхолина вызывает подъем кон-
центрации калия на 0,5—1,0 ммоль/л. Опасно применять сукцинилхолин у боль-
ных после тяжелой травмы, обширных ожогов, повреждений спинного мозга, ин-
сультов с нарушением моторной функции, при тетании, мышечной дистрофии
Дюшена, так как при перечисленных состояниях сохраняется высокий риск раз-
138
8. ИНТУБАЦИОННЫЙ НАРКОЗ
вития тяжелой гиперкалиемии с последующей остановкой сердца. Применение
сукцинилхолина в качестве единственного миорелаксанта необходимо избегать у
больных с высоким риском нарушений ритма сердца и внутричерепной гипертен-
зии, у больных с глаукомой, в случаях злокачественной гипертермии и дефицита
псевдохолинэстеразы.
Отрицательное действие сукцинилхолина уменьшают, используя его после
введения недеполяризующих миорелаксантов. Например, вводят панкурониум в
достаточной дозе за 2-3 мин до введения сукцинилхолина. Подобный метод явля-
ется методом выбора при интубации у больных с тяжелыми сопутствующими за-
болеваниями, у которых побочные эффекты сукцинилхолина могут вызывать тя-
желые осложнения.
В литературе с каждым годом увеличивается количество сообщений об ис-
пользовании для интубации трахеи быстродействующего недеполяризующего мио-
релаксанта рокурониума (эсмерона). Рокурониум обладает более быстрым дей-
ствием, чем другие недеполяризующие мышечные релаксанты, и обеспечивает
хорошие условия для интубации трахеи, сравнимые с действием сукцинилхолина
через 60—90 с после введения. По нашему опыту у большинства больных через 60 с
и, особенно, 90 с после введения рокурониума создавались хорошие условия для
прямой ларингоскопии и интубации трахеи.
Действие комбинации лидокаина (1,5 мг/кг) и рокурониума в низкой дозе
(0,6 мг/кг) при вводном наркозе пропофолом клинически эквивалентно действию
сукцинилхолина и создает условия для интубации через 60 с после введения, а
также эффективно блокирует увеличение ЧСС после интубации [10].
Поданным Sluga М. и соавторов [9], при быстрой индукции в наркоз во время
экстренных операций сукцинилхолин в сравнении с рокурониумом обеспечивает
более быструю релаксацию и создает более подходящие условия для интубации.
Таблица 8.3. Мышечные релаксанты, используемые для интубации трахеи [5]
Мышечный релаксант Доза для интубации трахеи, мг/кг Пути эли- минации Начало действия, мин Освобож- дение гис- тамина Комментарий
Деполяризующие
Сукцинил- холин 0,5-1,0 Псевдо- холинэсте- раза 1 0 Хорошие условия для интубации трахеи, но есть побочные эффекты
Недеполяризующие (длительного действия)
Панку- рониум 0,1 Почки > печень 3 0 Редко используют для интубации трахеи, так как действие наступает через 3 мин
Недеполяризующие (средней длительности)
Векурониум (норкурон) 0,1 Печень > почки 2,5-3,0 0 В более высокой дозе (0,2) более быстрое начало
139
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 8.3
Мышечный релаксант Доза для интубации трахеи, мг/кг Пути эли- минации Начало действия, мин Освобож- дение гис- тамина Комментарий
Рокурониум (эсмерон) 0,6-1,2 Печень > почки 0,7-1,2 0 Препарат выбора для интубации трахеи у тяжелых больных
Атракуриум (тракриум) 0,4-0,5 Эфирный гидролиз 4- спонтан- ная дегра- дация 3,0 + Предпочтителен при печеночной и почечной недостаточностях
Цисатра- куриум 0,1-0,15 Спонтан- ная дегра- дация 3,0 0 Не освобождает гистамин
Недеполяризующие (быстрого действия)
Мива- куриум (мивакрон) 0,15-0,2 Плазмен- ная холин- эстераза 1,0 + Способствует освобождению гистамина
Рапа- курониум 1,5-2,0 Печень > почки 1,0-1,5 + Способствует освобождению гистамина
8.3. ИНТУБАЦИЯ ТРАХЕИ
Интубация трахеи — это наиболее надежный метод обеспечения про-
ходимости верхних дыхательных путей во время общей анестезии. На современном
этапе интубацию трахеи считают золотым стандартом поддержания проходимости
верхних дыхательных путей и проведения ИВЛ. До определенной степени альтерна-
тивными методами обеспечения вентиляции считают использование ларингеальной
маски и, в крайнем случае, лицевой маски и воздуховода. Интубация трахеи в наи-
большей степени позволяет избежать аспирации желудочного содержимого в нижние
дыхательные пути и поддерживать их проходимость во время наркоза.
Интубация трахеи является одним из ответственейших этапов общей анесте-
зии. Релаксация мышц после применения миорелаксантов и отсутствие дыхания у
пациента во время интубации являются основными факторами, которые делают
выполнение этого метода опасным для пациента и оказывающим определенное
стрессовое воздействие на анестезиолога (особенно недостаточно опытного). Опыт-
ный специалист выполняет интубацию не более 15—20 с. Строгий лимит времени,
в течение которого необходимо выполнить прямую ларингоскопию и интубацию
трахеи, требует от анестезиолога определенных характерологических особеннос-
тей — самообладания, невозмутимости, умения принимать решения в экстренных
ситуациях. Необходимо сохранить хладнокровие и не поддаться панике при воз-
можных нескольких неудачных попытках интубации.
140
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Неспособность осуществления удачной интубации и, следовательно, невоз-
можность обеспечения проходимости верхних дыхательных путей с последующим
развитием тяжелой гипоксии и асфиксии являются наиболее частой причиной
тяжелых анестезиологических осложнений и летальных исходов. Совершенное
владение анестезиолога этим навыком включает тщательную подготовку рабочего
места, оценку вероятности трудной интубации, знание и использование алгорит-
ма действий при трудной интубации.
8.3.1. Необходимый набор инструментов
и аппаратуры для интубации трахеи:
• лицевые маски разных размеров;
• набор интубационных трубок (для взрослых достаточно № 6,5—9,5);
• мешок Амбу;
• наркозно-дыхательный аппарат;
• адекватная подача кислорода (до 10 л/мин);
• ларингоскоп с набором клинков разных размеров и видов (прямой, изогну-
тый и др.);
• фибробронхоскоп (фиброларингоскоп);
• щипцы Маджилла;
• проводник;
• катетеры для аспирации содержимого ротоглотки и трахеи;
• электрический или механический отсос;
• набор необходимых анестетиков и миорелаксантов;
• набор для ретроградной интубации;
• набор для экстренной коникотомии;
• пульсоксиметр с капнографом.
Частыми ошибками анестезиологов и причинами возникающих осложнений
являются недостаточно тщательная проверка исправности ларингоскопа, отсоса,
респиратора, а иногда — отсутствие необходимого оборудования. Неисправность
ларингоскопа или отсоса в случае возникшей регургитации значительно увеличива-
ют риск асфиксии и смерти больного. В настоящее время обеспечение фиброброн-
хоскопами или фиброларингоскопами всех анестезиологических отделений Украи-
ны проблематично, но крайне необходимо планировать оснащение ими в будущем.
8.3.2. Методика интубации трахеи
под общей анестезией
Пациент находится в горизонтальном положении на спине с не-
значительно приподнятой (примерно на 10 см) головой. После проверки наличия
и исправности всей необходимой аппаратуры проводят ингаляцию кислорода че-
рез лицевую маску, индукцию в наркоз и введение миорелаксантов.
После этого выполняют вспомогательную, а затем и управляемую вентиля-
цию легких с помощью лицевой маски: специальным приемом выводят нижнюю
челюсть (прием описан в руководствах по сердечно-легочной реанимации) и
герметизируют маску с дыхательными путями пациента. Вентиляцию осуществля-
ют обогащенной кислородом дыхательной смесью или чистым кислородом в тече-
141
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 8.1. Образцы используемых клинков
ларингоскопа для прямой ларингоскопии:
прямой клинок (А), прямой клинок с изогнутым
концом (Б), изогнутый клинок (В) [41]
ние не менее 3 мин в режиме уме-
ренной гипервентиляции. О на-
личии адекватной вентиляции
свидетельствуют экскурсии груд-
ной клетки на вдохе и выдохе (в
случае ригидной грудной клетки —
адекватные движения надчревной
области живота), а также данные
пульсоксиметрии и капнографии.
Одной из частых ошибок этого
этапа, на наш взгляд, является
вентиляция большим дыхатель-
ным объемом. В этом случае даже
при адекватном выведении ниж-
ней челюсти часть газа попадает
в пищевод и желудок и увеличи-
вает внутрижелудочное и внутри-
брюшное давления, что в свою
очередь повышает риск регургитации желудочного содержимого, а также поджи-
мает диафрагму, препятствуя дальнейшей вентиляции. Особенно это важно при
нескольких попытках интубации, в промежутках между которыми осуществляют
вентиляцию с помощью маски. Мы рекомендуем при проведении масочной вен-
тиляции дыхательный объем, не превышающий 7—8 мл/кг.
После масочной вентиляции при условии тотальной миорелаксации выпол-
няют прямую ларингоскопию. Для этого правой рукой открывают рот пациента.
Левой рукой вводят в полость рта по центру, оставляя язык несколько левее, кли-
нок ларингоскопа до визуализации надгортанника. Руки можно менять в зависи-
мости от привычки, но прямую ларингоскопию выполняют только левой рукой.
Используют прямые клинки Миллера (размер 2 или 3) и изогнутый клинок
Макинтоша (размер 3 или 4), а также прямые клинки с изогнутым концом Джек-
сона—Висконсина (рис. 8.1, 8.2).
У каждого типа клинка есть свои преимущества и недостатки. Прямым
клинком подхватывают надгортанник, а изогнутый клинок подводят под над-
гортанник и затем приподнимают его. У пациентов с короткой и толстой шеей
Рис. 8.2. Прямая ларингоскопия изогнутым (А) и прямым (Б) клинком [41]
142
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Рис. 8.3. Ларингоскоп с клинком МакКоя
(McCoy): наличие специального рычага по-
зволяет после введения клинка в полость
ротоглотки приподнять концом клинка об-
ласть над надгортанником.
для прямой ларингоскопии удобнее применять изогнутый клинок, при длин-
ной шее и надгортаннике, при наличии патологии гортани (опухоли, отек) пред-
почтительнее использовать прямой клинок. Предпочтение в применении пря-
мого или изогнутого клинка является прерогативой опытного анестезиолога,
но начинать обучение специалистов прямой ларингоскопии следует с приме-
нения прямого клинка, так как часто при обратном варианте врачи так и не
могут освоить ларингоскопию прямым клинком. Клинок Джексона—Вискон-
сина обладает преимуществами перед прямым и изогнутым клинками, но, к
сожалению, его пока широко не применяют в Украине. Вводят любой клинок
осторожно, не повреждая ткани гортани и глотки (осложнения см. ниже). Для
прямой ларингоскопии сравнительно недавно предложили новый тип клинка —
клинок МакКоя (McCoy) (рис. 8.3, 8.4), с помощью которого область под над-
гортанником приподнимают непосредственно концом клинка.
Рис. 8.4. Прямая ларингоскопия
клинком МакКоя
Надгортанник
Открытая
голосовая
щель
_ Голосовые
связки
Рис. 8.5. Вид голосовой шели при прямой
ларингоскопии (изогнутым клинком)
143
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
После визуализации голосовых связок (рис. 8.5) в голосовую щель между го-
лосовыми связками вводят интубационную трубку (табл. 8.4).
Таблица 8.4. Размеры и длина интубационной трубки в зависимости
от возрастных размеров дыхательных путей
Возраст пациента Внутренний диаметр трубки, мм Длина трубки, см Длина трахеи, см Расстояние от губ до карины, см
Недоношенный новорожденный 2,5 10
Доношенный новорожденный 3,0 • 11
1-6 месяцев 3,5 11 6 13
6-12 месяцев 4,0 12
2 года 4,5 13
4 года 5,0 14
6 лет 5,5 15-16
8 лет 6,5 16-17 8 18
10 лет 7,0 17-18
12 лет 7,5 18-22
14 лет и старше: • женщины • мужчины 7,0 8,0 20-24 20-24 12 14 24 28
Обычно применяют однопросветные эндотрахеальные трубки (у женщин раз-
мер № 7—8, у мужчин — № 8—8,5). Изготавливают их чаще из поливинилхлорида.
Конец трубки имеет скос, который облегчает ее введение в гортань. Наличие рен-
тгенконтрастной метки на трубке позволяет контролировать ее местоположение
рентгенологически. Применение других типов трубок (двухпросветных) имеет бо-
лее узкие показания.
Интубационная трубка для взрослых имеет раздувную манжету, нагнетание
которой специальной грушей позволяет герметизировать дыхательный контур,
прекратить сброс газа через рот и предотвратить в значительной степени попада-
ние содержимого ротоглотки в трахею. Трубку вводят (желательно под контролем
зрения) до верхнего края манжеты с целью профилактики ее чрезмерно глубокого
введения, что иногда присуще неопытным врачам, для которых факт удачной ин-
тубации трахеи является доминирующей задачей.
8.3.3. Методика интубации трахеи под местной анестезией
Фиброоптическую интубацию при сохраненном сознании пациента
считают золотым стандартом для пациентов с трудными для интубации дыхательными
путями, тем не менее, в литературе сообщают о неудачах этой методики в 13 % случаев.
144
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Показанием для проведения интубации трахеи под местной анестезией явля-
ется высокий риск асфиксии вследствие тяжелой неудавшейся интубации (см.
ниже). Для выполнения этой процедуры, прежде всего, необходим тесный психо-
логический контакт анестезиолога с пациентом, то есть пациенту необходимо объяс-
нить причины такого решения и процесс выполнения процедуры. Необходимо
помнить, что не у каждого пациента интубация под местной анестезией возможна.
Мы владеем опытом интубации трахеи с применением местной анестезии у 12
пациентов после введения субанестетических доз пропофола.
Вначале выполняют местную анестезию лидокаином носовых ходов (если
предполагают назотрахеальную интубацию), задней стенки глотки, корня языка,
гортани (аналогично проведению местной анестезии при выполнении фиброб-
ронхоскопии). Затем, после возможной седации пациента, фибробронхоскоп про-
водят через рот или нос, и по нему, как по проводнику, вводят в трахею эндотра-
хеальную трубку. Ее местоположение контролируют трахеоскопией. Затем брон-
хоскоп удаляют. Еще раз контролируют адекватность вентиляции легких и после
этого начинают общую анестезию.
Голландские авторы [11] сообщают об удачной трахеальной интубации с по-
мощью фибробронхоскопа под контролем капнографии у всех пациентов, без кро-
вотечений или других осложнений, при этом среднее время (диапазон) интубации
составило 3 (2—15) мин.
Ранее, до применения фибробронхоскопов, существовала методика слепой инту-
бации трахеи под местной анестезией через нос: выполняли местную анестезию и
вводили интубационную трубку в область гортаноглотки через носовой ход; пациента
просили сделать глубокий вдох и в это время пытались провести трубку в трахею.
Вероятность удачной интубации была малой, и часто требовались повторные попытки.
8.3.4. Трудная интубация
Интубацию трахеи считают трудной, если опытный анестезиолог
не может выполнить ее с первой попытки. Трудная интубация и ее осложнения
остаются одними из важнейших проблем современного анестезиологического обес-
печения, несмотря на успехи, достигнутые анестезиологией в последние годы [12].
Частота неудачной интубации составляет 1—3 случая на 1000 попыток интуба-
ции, а неэффективная вентиляция маской — 1—3 случая на 10 000 попыток [13].
Поданным клиники Мейо [14], интубация посредством прямой ларингоскопии
не была выполнена в 0,43 % случаев. В каждом случае неудачной интубации воз-
никают обстоятельства, значительно увеличивающие риск осложнений и даже
летальных исходов.
8.3.4.1. Прогностические тесты трудной интубации трахеи
Степени визуализации гортани (см. рис. 8.6) [12]:
• степень I — полностью видна голосовая щель, отсутствуют какие-либо труд-
ности при интубации;
• степень II — видна задняя часть голосовой щели; методика усложняется
незначительными неудобствами; опытному специалисту удается интубировать тра-
хею, как правило, с первой попытки (вспомогательный прием — надавливание на
перстневидный хрящ);
145
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
по Cormack по Williams,
и Lehane Carli и Cormack
Рис. 8.6. Степени трудности интубации трахеи
при прямой ларингоскопии
• степень III— виден только над-
гортанник, голосовая щель не видна;
даже опытному анестезиологу в 4 %
случаев необходимо несколько попы-
ток для удачной интубации;
• степень IV— не виден даже над-
гортанник; часто интубация невоз-
можна без применения специальных
методов; как правило, эта степень
встречается при явной патологии у
0,35 % пациентов.
Ключевым моментом для умень-
шения риска неблагоприятных послед-
ствий трудной интубации является
преднаркозная оценка дыхательных
путей пациента и определение степе-
ни риска трудной интубации, которые
в настоящий момент позволяют в 92 %
случаев прогнозировать трудную ин-
тубацию и, соответственно, принимать
предварительные меры [15].
В преднаркозную оценку дыхатель-
ных путей входит: сбор анамнеза, фи-
зикальное исследование, при необхо-
димости — специальные методы
(фиброларинготрахеоскопия). Сбор
анамнеза анестезиологом включает
вопросы о предшествующих случаях
общей анестезии, возможных ослож-
нениях, наличии операций, травм и
ожогов в области лица, глотки, гортани, шеи, наличие эпизодов нарушения дыха-
ния. Физикальное обследование включает: оценку дыхательных резервов у боль-
ного, наличие рубцов на шее, степень ожирения, размеры шеи, состояние и мор- :
фологию зубов, размеры языка, способность открывать рот, объем движений го-
ловы и шеи.
Прогностические критерии трудной интубации (Rose D.K., Cohen М.М., 1994 с
дополнениями): мужской пол, возраст 40—59 лет, наличие отеков, избыточный вес
(индекс массы тела более 25 кг/м2), маленькое расстояние между зубами при макси-
мальном открытии рта (менее 4 см), щитоподбородочное расстояние менее 6 см,
стернально-подбородочное расстояние менее 12,5 см, гнойные процессы в области
гортаноротоглотки (особенно флегмона шеи), наличие гематом или опухолей в об- :
ласти шеи и гортани, плохое разгибание шеи или толстая короткая шея, микрогна-
ция (маленькая верхняя челюсть), выступающие резцы, длинный узкий рот.
Важную информацию о риске трудной интубации анестезиолог может полу-
чить, используя тест визуализации области ротоглотки Маллампати. Автор мето-
дики предложил первые 3 класса, Sansoon и Young добавили 4-й класс. Тест про-
водят в положении больного сидя напротив врача. Больного просят максимально
открыть рот и высунуть язык. Объем видимых анатомических структур является
основанием для прогноза.
146
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Классификация визуализации гортани,
или тест Маллампати (рис 8.7):
• класс / (легкая степень) — визуали-
зируются мягкое небо, глоточные дужки
и язычок;
• класс //(средняя степень) — визуали-
зируются мягкое небо и глоточные дужки;
• класс III (трудная степень) — визу-
ализируется мягкое небо;
• класс IV(крайне трудная степень) —
визуализируется только твердое небо.
Высокую прогностическую ценность
теста Маллампати подтверждают Cattano D.
и соавторы [ 16] в проспективном иссле-
довании 1956 пациентов, которым про-
водили общую анестезию с эндотрахеаль-
ной интубацией. Обнаружены высокие
индексы линейной корреляции класси-
фикации по Маллампати и степени визуализации гортани по Cormack и Lechane.
При этом авторы указывают, что одного теста Маллампати недостаточно для про-
гнозирования трудной интубации трахеи. Многовариантный регрессионный ана-
лиз обнаружил, что патологическое ожирение, пожилой возраст, мужской пол,
нарушение подвижности в височно-мандибулярном суставе, более высокий класс
по Маллампати, наличие расстройств дыхания во сне, ненормальная протрузия
верхних зубов были независимыми предикторами трудной интубации. Оценка по
шкале Маллампати III—IV оказалась единственным независимым фактором риска
трудной интубации у тучных пациентов по данным Juvin Р. и соавторов [17]. На
увеличение риска трудной интубации при тугоподвижности краниоцервикального
соединения, а также при внутренней или наружной фиксации обращают внима-
ние Calder I. и соавторы [18].
Krobbuaban В. и соавторы [19] считают одним из наиболее важных прогности-
ческих тестов трудной ларингоскопии соотношение роста к тиреоподбородочному
расстоянию (RHTMD), которое имеет, очевидно, лучшее прогностическое значе-
ние, чем тиреоподбородочное расстояние (TMD). При многофакторном анализе
этими авторами были найдены 3 независимых критерия для трудной ларингоско-
пии: движения шеи < 80°, класс III—IV по Маллампати, RHTMD < 23,5.
По данным Ludwig, особенно значительные трудности при интубации трахеи воз-
никают у пациентов с тяжелой инфекцией шеи, особенно флегмоной и ангиной [20].
Bouaggad А. и соавторы [21] определили, что у больных с патологией щито-
видной железы (новообразованиями) различные степени трудности при интуба-
ции возникали в 57,8 % случаев. Мужской пол, значительный индекс массы тела,
класс III—IV по Маллампати, малое тиреоподбородочное расстояние, снижение
подвижности шеи, злокачественное новообразование шитовидной железы, откло-
нение или компрессия трахеи были идентифицированы при одновариантном ана-
лизе как потенциальные факторы риска трудной интубации.
В настоящее время доступные методики для выявления скрытой формы труд-
ной интубации трахеи обладают незначительной прогностической ценностью, тем
более, если их используют по отдельности. Комбинации тестов увеличивают диаг-
ностическую ценность. Наиболее информативным прикроватным тестом для про-
147
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
гнозирования трудной интубации является комбинация теста Маллампати и опре-
деление тиреоподбородочного расстояния [42].
На сегодняшний день практически отсутствуют достоверные тесты, прогнозиру-
ющие трудности вентиляцией маской или даже невозможность ее проведения. Венти-
ляция маской — существенный элемент интубации трахеи, которую редко изучали в
качестве первичного результата. В частности, тест Маллампати, по данным Lee А. и
соавторов [40], не является результативным для прогнозирования этой ситуации.
Kheterpal S. и соавторы в 2006 году [43] для градации трудности вентиляции
маской предложили 4 уровневую шкалу. Индекс массы тела 30 кг/м2 и более,
борода, тест по Маллампати III—IV, возраст старше 57 лет, резкое ограничение
подвижности челюстей и храп были идентифицированы как независимые пре-
дикторы градации 3 уровня. Храп и тиреоподобородочное расстояние менее 6 см
были независимыми предикторами для градации 4 уровня. Ограниченная или
резко ограниченная подвижность челюстей, патологическая анатомия шеи, сон-
ное апноэ, храп, индекс массы тела 30 кг/м2 и более были независимыми пре-
дикторами градации 3—4 уровней трудной вентиляции маской и трудной интуба-
ции. В течение 24-месячного периода авторы изучили 22 660 попыток вентиля-
ции маской: 313 случаев (1,4 %) были отнесены к градации 3 уровня, 37 случаев
(0,16 %) — к градации 4 уровня, в 84 из этих случаев (0,37 %) определяли трудную
интубацию.
8.3.4.2. Алгоритм действий при трудной интубации трахеи
Наилучшим выходом из экстремальной ситуации трудной инту-
бации трахеи является следование рекомендуемым алгоритмам действий, которые
предложены Американской и Канадской ассоциациями анестезиологов [13, 22].
Незначительно измененный алгоритм действий анестезиолога при трудной инту-
бации изображен на рис. 8.8.
Алгоритм действий при выборе решения проведения интубации
с сохраненным сознанием и дыханием пациента
Рис. 8.8. Алгоритм действий при трудной интубации трахеи
148
8. ИНТУБАЦИОННЫЙ НАРКОЗ
Продолжение рис. 8.8
Алгоритм действий при выборе решения проведения интубвции
с сохраненным сознанием и дыханием пациента
Примечание: — неудача; + удачная попытка; * рекомендуют не более 3 попыток инту-
бации.
При повторных попытках интубации целесообразно: изменить положение головы па-
циента, сменить размер или тип клинка, использовать наружное давление на гортань, инту-
бировать на эластическом буже, применить интубационную трубку меньшего диаметра.
Сначала оценивают риск:
• трудной интубации;
• нарушений вентиляции;
• затрудненного контакта с больным.
Затем принимают решение:
• выбирают технику проведения — нехирургическую или хирургическую (тра-
хеостомию);
• выбирают проведение интубации при сохраненном сознании или под наркозом;
• выбирают проведение интубации на фоне спонтанного дыхания или под
действием миорелаксантов.
149
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Combes X. и соавторы [23] выполнили проспективную оценку практического
использования алгоритма действий при Непредвиденном трудном обеспечении про-
ходимости дыхательных путей. По данным исследования, случаев невозможности
вентиляции не зарегистрировали в течение 18-месячного периода изучения; зарегис-
трировали 100 случаев неожиданно трудного контроля за проходимостью дыхатель-
ных путей (0,9 %) из 11 257 интубаций; у 2 пациентов, которых вентилировали с
помощью ларингеальной маски, так и не удалось выполнить интубацию трахеи.
Правильность нахождения интубационной трубки в трахее определяют по
показателям мониторинга вентиляции (см. раздел 9.2.2).
Важным элементом алгоритма трудной интубации является своевременное
проведение коникотомии или трахеостомии. О последнем методе обеспечения
профилактики асфиксии анестезиолог должен всегда помнить и своевременно
использовать этот метод.
8.3.4.3. Альтернативные методы интубации трахеи
Из приведенного на рис. 8.8 алгоритма видно, что в случаях не-
удачных попыток интубации трахеи традиционными способами методом выбора
является интубация по фибробронхоскопу или фиброларингоскопу. вначале в трахею
вводят фибробронхоскоп (фиброларингоскоп), на который уже надета интубаци-
онная трубка, а затем по нему, как по Проводнику, проводят интубацию трахеи.
Beilin и соавторы [24] в клинических условиях сравнили эффективность двух
ларингоскопов для интубации трахеи — ларингоскопа Макинтоша и гибкого ла-
рингоскопа (levering). Согласно данным исследования, у больных с плохим обзо-
ром гортани при начальной ларингоскопии гибкий фиброоптический ларинго-
скоп облегчил интубацию трахеи и сократил ее продолжительность.
Heidegger Т. и соавторы [25] проанализировали 2дичные данные назотрахе-
альных фиброоптических интубаций (ФОН) у пациентов в сознании и оротрахе-
альных ФОН у пациентов под наркозом. Согласно исследованию, почти все ка-
надские анестезиологи выполняли около 15 назотрахеальных и 10 оротрахеальных
ФОН: в 85,2 % интубация удавалась с первой попытки, 93,9 % всех ФОН были
успешно проведены за 3 мин, в 24 случаях ФОН оказалась неудачной, в 1,3 %
развивалось тяжелое носовое кровотечение, которое было наиболее частым ос-
ложнением назотрахеальных интубаций.
По данным Tong и соавторов [31], при интубации трахеи по фибробронхоско-
пу с применением ларингоскопии (клинком Макинтоша) артериальная гипертен-
зия более выражена, чем без использования ларингоскопии.
Мы обладаем опытом успешной интубаций трахеи по фибробронхоскопу у
29 пациентов, у которых не удавалась интубация трахеи традиционным мето-
дом. Не подлежит сомнению утверждение, что для уменьшения количества не-
удачных интубаций трахеи и связанных с ними осложнений каждое отделение
анестезиологии и интесивной терапии должно быть оснащено современной фиб-
рооптической аппаратурой для интубации трахеи и в каждом отделении должны
быть специалисты, в совершенстве владеющие этим методом. Успешность инту-
бации трахеи по фибробронхоскопу во многом зависит от опыта бронхолога-эн-
доскописта, но бывают клинические случаи, когда даже опытный специалист не
может ввести фибробронхоскоп в трахею. Таким образом, ФБС не решает всех
проблем трудной интубации. Разработан метод интубации по фибробронхоскопу,
который вводят через ларингеальную маску (см. раздел 8.4.9).
150
В. ИНТУБАЦИОННЫЙ НАРКОЗ
Рис. 8.9. Применение оптического стилета для интубации трахеи. Для введения стилета в
голосовую щель иногда предварительно выводят нижнюю челюсть (А). Наличие светящего-
ся элемента на конце стилета позволяет контролировать его местоположение во время ин-
тубации трахеи (Б)
При невозможности интубации традиционными методами альтернативным
методом считают ретроградную интубацию. Ретроградная интубация — это мини-
мально инвазивная методика с несложным обучением и высоким уровнем сохра-
нения усвоенного навыка: иглой широкого диаметра прокалывают в направлении
глотки щитоперстневидную мембрану; иглу направляют проксимально и по ней
ретроградно вводят проводник; в области ротоглотки проводник подхватывают и
по нему проводят интубационную трубку. За рубежом оснащение рабочего места
анестезиолога включает специальные наборы для ретроградной интубации. По
данным Weksler N. и соавторов [26], ретроградная интубация трахеи успешно про-
ведена у всех 24 пациентов, которым ее выполняли: наиболее частым осложнени-
ем ретроградной интубации были воспалительные изменения в области гортани
(почти у 60 % пациентов); у 2 пациентов возникла умеренная подкожная эмфизе-
ма; у одного — минимальное кровотечение в участке пункции.
Альтернативным методом, обеспечивающим вентиляцию пациента во время
трудной интубации, является чрезтрахеальная струйная вентиляция (ЧСВ, jet) че-
рез катетер размером 12 или 14 G, который вводят по проводнику в трахею через
щитовидноперстневидную мембрану. Дыхательную смесь подают, регулируя соот-
ношение вдоха к выдоху приблизительно 1:4—1:3. Gerig и соавторы [27] сообщили
об удачном использовании этой методики у 11 пациентов с чрезвычайно трудной
интубацией. По данным литературы, этот метод сопровождается частой баротрав-
мой с массивной подкожной эмфиземой, что ограничивает возможности его ис-
пользования. ЧСВ можно считать временной мерой для обеспечения вентиляции
либо во время интубации, либо при неадекватной вентиляции маской.
151
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Еще одним альтернативным методом интубации трахеи является использование
специального оптического стилета (рис. 8.9). По данным Evans А. и соавторов [28],
методика интубации трахеи с использованием видеооптического стилета по мно-
гим показателям превосходит обычную методику при трудной трахеальной инту-
бации. Результаты проведенного исследования на манекене достаточно убедительны,
чтобы перейти к клиническому испытанию у больных.
Следование алгоритму действий при трудной интубации позволяет существенно
снизить риск неудачных интубаций и осложнений. Например, в Юго-Западной
Темзе, области Великобритании, с 1999 по 2003 год зафиксировано 20 неудавших-
ся интубаций трахеи при проведении 4768 общих анестезий в акушерстве (инци-
дентность 1:238). В половине из проанализированных 16 случаев анестезиологи не
следовали общепринятому протоколу при неудавшейся интубации трахеи [29], что
привело к осложнениям различной степени тяжести.
Кроме следования алгоритму, у больных с высоким риском трудной интуба-
ции для уменьшения риска тяжелой гипоксии во время интубации многие авторы
[30] предлагают применять вентиляцию с сопротивлением на выдохе во время
индукции в наркоз и ПДКВ перед интубацией у взрослых пациентов. Этот метод
позволяет увеличивать продолжительность негипоксической остановки дыхания
более чем на 2 мин (SpO2 > 90 %).
8.3.5. Профилактика и лечение
осложнений интубации трахеи
Наиболее тяжелыми осложнениями неудачной интубации являет-
ся асфиксия и смерть больного, а также последствия тяжелой гипоксии, возник-
шей во время интубации, прежде всего — повреждения мозга.
Осложнения во время интубации трахеи: повреждения зубов, губ, языка, мяг-
ких тканей глотки, сосудистых сплетений задней стенки глотки с кровотечением,
аспирация желудочного содержимого, перфорация трахеи или пищевода, эндопи-
щеводная интубация с асфиксией, эндобронхиальная интубация с асфиксией, по-
вышение внутричерепного и внутриглазного давлений, тахикардия, брадикардия,
артериальная гипертензия.
Осложнения во время проведения ИВЛ и наркоза: непроизвольная экстубация,
обструкция или перегиб интубационной трубки, бронхоспазм, напряженный пнев-
моторакс, разгерметизация дыхательного контура, нарушение работы респирато-
ра, прекращение подачи кислорода, ишемия стенки гортани или трахеи.
Осложнения после экстубации трахеи: аспирация рвотных масс или инород-
ных тел, дисфония, афония, отек надгортанника или гортани, паралич (одно- или
двусторонний) голосовых связок, синуситы, стеноз гортани и трахеи, гранулемы
гортани (поздние осложнения).
8.3.5.1. Осложнения во время интубации
8.3.5.1.1. Повреждение зубов
Наиболее частое осложнение прямой ларингоскопии, с которым
сталкивался практически каждый анестезиолог. Для профилактики этого ослож-
нения оценивают состояние зубов до интубации, обязательно извлекают протезы,
во время ларингоскопии оказывают минимальное давление на зубы. Если экст-
152
8. ИНТУБАЦИОННЫЙ НАРКОЗ
ракния зуба(ов) или мостового протеза произошла, то их обязательно находят и
извлекают из полости рта; если найти сломанный зуб не удалось, то выполняют
диагностические мероприятия для определения его местонахождения (рентгено-
графию грудной клетки и живота); если определили нахождение зуба(ов) в ниж-
них дыхательных путях, обязательно извлекают его (их) с помощью трахеоброн-
хоскопии или даже оперативного вмешательства. Категорически запрещено воз-
вращать сломанную коронку зуба или мостовой зубной протез на их место во рту,
когда пациент находится в бессознательном состоянии, что делают некоторые
анестезиологи, стремясь скрыть осложнение.
8.3.5.1.2. Регургитация и аспирация желудочного содержимого
К сожалению, регургитация желудочного содержимого остается не-
редким осложнением интубации трахеи. Это осложнение опасно, во-первых, по при-
чине значительного затруднения проведения интубации и риска развития асфиксии;
во-вторых, если удалось избежать асфиксии, то регургитация чревата развитием ас-
пирационного пневмонита (синдрома Мендельсона) или аспирационной пневмонии.
Наиболее часто регургитация и аспирация желудочного содержимого возникают в
акушерской практике, медицине катастроф и при абдоминальных вмешательствах.
Факторы риска развития регургитации и аспирации: экстренные показания к опера-
тивному вмешательству (полный желудок), повышенное внутрибрюшное и внутриже-
лудочное давления (беременность свыше 12 недель, стеноз привратника желудка, не-
проходимость кишок, перитонит, асцит), кровотечения из верхнего отдела пишевари-
тельного канала, диафрагмальная грыжа, отеки, кома (по оценке ШКГ менее 8 баллов),
судороги, отравление алкоголем или лекарственными средствами, склеродермия.
Для профилактики регургитации существует много методик, но ни одна из
них не гарантирует абсолютного успеха, то есть риск возникновения этого ослож-
нения всегда присутствует.
Основным методом профилактики регургитации является “пустой желудок”.
Голодание в течение 6—8 ч перед операцией, то есть отказ от приема пищи после
полуночи перед операцией, стало стандартом в хирургии. О сроках голодания
единого мнения нет, например, анестезиологические ассоциации нескольких стран
мира рекомендуют 2-часовой период отказа от приема жидкости до операции и
6-часовой период отказа от приема твердой пищи у некоторых пациентов. Эти
рекомендации безопасны — их внедрение улучшает состояние больного перед опе-
рацией, главным образом, уменьшая чувство жажды. Выпитый перед анестезией и
операцией напиток, богатый углеводами, изменяет метаболизм от ночного голо-
дания к питаемому статусу, уменьшает послеоперационную резистентность к ин-
сулину, что имеет значение для более быстрого послеоперационного восстановле-
ния. Большинству пациентов (без патологии пищеварительного канала) можно
позволить свободное потребление жидкости за 2 ч перед анестезией [39], в част-
ности, кому запланировано проведение оперативного вмешательства во 2 очередь.
Конечно, эти современные рекомендации нуждаются в проверке практикой.
Применение в премедикации средств, снижающих кислотность желудочного со-
держимого (блокаторов Н2-гистаминовых рецепторов, блокаторов протонной пом-
пы), весьма эффективно для предотвращения аспирационного пневмонита и рес-
пираторного дистресс-синдрома, но не гарантирует абсолютной профилактики
регургитации или аспирационной пневмонии. Для уменьшения желудочной сек-
реции применяют блокаторы М-холинорецепторов (атропин, гликопирролат).
153
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Методика введения зонда в желудок перед индукцией в наркоз и интубацией не
доказала свою эффективность и оспорена многими авторами. В случае тяжелого
состояния больного (на фоне продолжающегося кровотечения, тяжелого шока)
такая тактика может оказаться опасной: асфиксия развивается вследствие рвоты и
аспирации желудочного содержимого. Кроме этого, не всегда удается ввести зонд
в желудок перед введением в наркоз, например, при стриктуре пишевода или
диафрагмальной грыже с ущемлением желудка в грыжевом мешке.
Быстрое введение в наркоз, или краш-индукцию, часто используют у больных с
полным желудком. Сначала проводят преоксигенацию (дыхание чистым кислоро-
дом в течение 15—20 мин) для денитрификации и более длительного поддержания
оксигенации крови в условиях апноэ. Затем осуществляют быструю индукцию в
наркоз внутривенными анестетиками и вводят быстродействующие миорелаксан-
ты (на наш взгляд лучше всего с этой целью использовать комбинацию рокурони-
ума и сукцинилхолина). После миорелаксации, без этапа вентиляции маской, ис-
пользуя прием Селлика, выполняют интубацию трахеи: ассистент надавливает на
перстневидный хрящ, тем самым прижимая стенку пищевода и препятствуя попа-
данию содержимого желудка в полость ротоглотки. Отсутствие вентиляции мас-
кой исключает раздувание желудка и повышение внутрижелудочного давления, а
также сокращает прединтубационный период.
Некоторые авторы рекомендуют во время индукции в наркоз использовать по-
ложение пациента с незначительно приподнятым головным концом, однако приме-
нение этого метода ограничивается риском развития артериальной гипотензии.
Прием Селлика необходимо использовать у всех больных с риском регургита-
ции, независимо — применяют краш-индукцию или нет.
Одним из профилактических мероприятий регургитации мы считаем венти-
ляцию маской перед интубацией с использованием небольших величин дыхатель-
ного объема (см. раздел 8.3.2).
8.3.5.1.3. Кровотечение из задней стенки глотки
В задней стенке глотки расположены множественные сосудистые
сплетения, поэтому неаккуратные движения клинком ларингоскопа могут вызвать
тяжелое кровотечение с последующими затруднением интубации и возможной
асфиксией.
8.3.5.1.4. Перегиб интубационной трубки
Это осложнение может развиться во время интубации трахеи или
во время проведения ИВЛ. Проявляется затруднением или полным отсутствием
прохождения газа по интубационной трубке. Чаще всего перегиб трубки происхо-
дит в области глотки. Диагностируют это осложнение и определяют уровень об-
струкции с помощью проведения через интубационную трубку трахеального кате-
тера. Если не удалось распрямить трубку и наладить адекватную вентиляцию, то
проводят экстренную экстубацию и повторную интубацию.
8.3.5.1.5. Введение интубационной трубки в пищевод
Наиболее частое и серьезное осложнение трудной интубации -
это введение интубационной трубки в пищевод. При своевременном обнаружении
этого осложнения, проводят экстубацию, выполняют вентиляцию маской и про-
154
8. ИНТУБАЦИОННЫЙ НАРКОЗ
водят повторную интубацию. Даже опытному анестезиологу только на основании
клинических данных (экскурсий грудной клетки, объема выдоха, аускультации)
иногда трудно определить положение интубационной трубки. Клинические при-
знаки развития гипоксии (цианоз кожных покровов, нарушения гемодинамики) и
показания пульсоксиметра (снижение SpO2 < 90 %) являются поздними признака-
ми интубации пищевода. Наиболее информативным современным методом, опре-
деляющим местонахождение интубационной трубки, является капнография, по-
этому капнограф сейчас считают обязательной частью необходимого оборудова-
ния для интубации трахеи. РЕТСО2 в конце выдоха более 30 мм рт. ст. в течение
3-5 последующих выдохов свидетельствует о расположении трубки в трахее [32].
8.3.5.1.6. Чрезмерно глубокое введение
интубационной трубки в трахею
Факт введения интубационной трубки в трахею еще не гаранти-
рует адекватной вентиляции легких. Наиболее частой ошибкой, особенно нео-
пытных анестезиологов, является чрезмерно глубокое введение интубационной
трубки в трахею. Чаще в таких случаях трубка проходит в правый главный бронх.
Поскольку он очень короткий (до 1—1,5 см), то часто трубка попадает в промежу-
точный бронх с последующим выключением из вентиляции левого легкого и вер-
хней доли правого легкого. Через 5—10 мин развивается тяжелая гипоксия и ас-
фиксия, так как длительный адекватный газообмен при вентиляции только ниж-
ней и средней доли правого легкого невозможен. Диагностируют эндобронхиальное
введение интубационной трубки по визуальному определению отсутствия дыха-
тельных экскурсий грудной клетки слева, по отсутствию дыхания при аускульта-
ции слева и по смещению верхушечного толчка сердца влево (ненадежный при-
знак). При подозрении на эндобронхиальную интубацию осторожно при неразду-
той манжете подтягивают трубку на 1—1,5 см и вновь оценивают вентиляцию. При
подтягивании трубки следует опасаться высокого расположения манжеты с по-
вреждением гортани.
8.3.5.1.7. Повреждения трахеи и пищевода
Трахею во время интубации можно повредить непосредственно
интубационной трубкой (чаще с проводником) и из-за высокого давления чрез-
мерно раздутой манжетой интубационной трубки. Повреждение пишевода может
возникнуть из-за перфорации интубационной трубкой (чаще проводником).
Симптомами повреждения трахеи и пищевода являются появление выражен-
ной подкожной эмфиземы (чаще при повреждении трахеи) или крепитации на шее
(чаще при перфорации пищевода). Диагноз подтверждают трахеобронхоскопией.
Разрыв трахеи угрожает нарушением вентиляции и асфиксией. Если перфора-
ция произошла в верхнем отделе трахеи, то интубационную трубку проводят ниже
перфорации; при более низкой локализации разрыва немедленно дренируют сре-
достение или плевральную полость. При несвоевременном лечении перфорация
пищевода угрожает развитием флегмоны шеи или медиастинита, поэтому анесте-
зиолог должен проявлять высокую настороженность в ранней диагностике этого
осложнения, симптомы которого часто неспецифичны и могут быть отсрочены по
времени [33]. Консультация торакального хирурга является обязательной при пер-
форации пищевода или трахеи.
155
ОБЩАЯ АНЕСТЕЗИОЛОГИ»
8.3.5.2. Осложнения интубации
во время проведения ИВЛ и наркоза
Во время обшей анестезии из-за смещения или перегиба может
нарушиться проходимость интубационной трубки, которая проявляется, прежде
всего, нарушениями вентиляции, а затем гипоксией и гиперкапнией. При обтура-
ции интубационной трубки любой этиологии (мокротой, кровью, из-за смешения
к бифуркации трахеи или эндобронхиально) внезапно увеличивается давление в
дыхательном контуре.
Напряженный пневмоторакс во время общей анестезии является более частым
осложнением, чем это принято считать, и развивается вследствие баротравмы лег-
ких и разрыва легочной паренхимы. Кроме обычных для напряженного пневмото-
ракса симптомов [34], при его развитии во время интубационного наркоза резко
повышается давление в дыхательном контуре, развивается гиперкапния, а затем и
гипоксия. В таких случаях немедленно проводят декомпрессию плевральной по-
лости на стороне пневмоторакса.
Разгерметизация дыхательного контура является нередкой причиной тяжелых.
осложнений во время наркоза, особенно при невнимательности анестезиологи-
ческой бригады. Анестезиологу необходимо на протяжении всего периода интуба-
ционного наркоза внимательно следить за вентиляцией и давлением в дыхатель-
ном контуре по манометру респиратора.
Бронхиолоспазм довольно редкое осложнение во время интубационного нар-
коза, особенно у больных, не страдающих бронхиальной астмой. Чаще обтурация
мокротой дыхательных путей или интубационной трубки, нарушение проходимо-
сти трубки вследствие других причин симулируют клинику бронхиолоспазма. Если
анестезиолог вовремя не определил истинную причину нарушения вентиляции, то
могут возникнуть тяжелые осложнения. У пациентов с повышенной реактивнос-
тью бронхов дооперационная подготовка комбинацией внутривенных и ингаляци-
онных кортикостероидов и ₽2-адреномиметиков минимизирует вызванную инту-
бацией бронхоконстрикцию более эффективно, чем только ингаляция одним Р2-
адреномиметиком [35].
Ишемия стенки гортани и трахеи развивается при неадекватно большом диа-
метре интубационной трубки или высоком давлении в манжете. Особенно выра-
жена ишемия слизистой гортани и трахеи у больных с артериальной гипотензией
и снижением перфузии тканей. Чрезмерное раздувание манжеты может привести
не только к ишемии слизистой трахеи, но и к-обтурации просвета интубационной
трубки. Поэтому манжету раздувают только до возникновения герметичности ды-
хательного контура.
Внезапная экстубация при условии неподготовленности анестезиолога может
стать причиной асфиксии. Чаще всего она происходит во время перекладывания
больного, но нельзя исключить случайное перемещение интубационной трубки из
трахеи в любой момент операции, поэтому во время интубационного наркоза ане-
стезиолог всегда должен быть готов к реинтубации.
8.3.5.3. Осложнения после экстубации трахеи
Ранние осложнения после экстубации трахеи: ларингоспазм, рвота,
аспирация, асфиксия, эпиглотит, фарингит, ларинготрахеит.
Поздние осложнения после экстубации трахеи: стенозирование гортани или трахеи.
156
1. ИНТУБАЦИОННЫЙ НАРКОЗ
Ларингоспазм, возникающий сразу после экстубации, является одним из час-
тых осложнений интубации трахеи и, как правило, протекает благоприятно, без
терапии. Если же после тяжелой интубации (после многократных попыток) воз-
никает упорное стридорозное дыхание, то следует предположить повреждение го-
лосовых связок, развитие отека и воспаление гортани. Повреждение голосовых
связок и послеоперационная хрипота после общей анестезии — одно из наиболее
частых осложнений, связанных с деятельностью анестезиолога. Риск их развития
во многом зависит от условий для интубации трахеи [36].
Wason R. и соавторы [37] описали редкое осложнение эндотрахеальной инту-
бации — рецидивирующий паралич гортанного нерва. Авторы сообщили о случае
двустороннего паралича голосовых связок после эндотрахеальной интубации под
общей анестезией. Клинически это проявлялось охриплостью голоса и затруднен-
ным вдохом. Вероятным механизмом этого осложнения была компрессия пере-
дней ветви возвратного гортанного нерва между манжетой интубационной трубки
и задней частью хряща щитовидной железы. Для профилактики такого осложне-
ния необходимо располагать манжету интубационной трубки дистальнее перстне-
видного хряща; давление в манжете должно быть минимальным для обеспечения
герметизации дыхательных путей
Обнаружено существенное увеличение риска осложнений со стороны дыха-
тельных путей и гемодинамики с увеличением попыток интубации: при количе-
стве попыток > 3, в сравнении с одной или двумя, развивались гипоксемия (70
против 11,8 %), регургитация желудочного содержимого (22 против 1,9 %), аспи-
рация желудочного содержимого (13 против 0,8 %), брадикардия (21 против 1,6 %)
и остановка сердца (11 против 0,7 %; р < 0,001). Результаты этого анализа поддер-
живают рекомендации ASA “Task Force on the Management of the Difficult Airway”
по ограничению количества попыток интубаций до трех [38].
По данным клиники Мейо [12], частота неожиданных неудач интубации тра-
хеи посредством прямой ларингоскопии остается неизменной по сравнению с
более ранними исследованиями, однако риск осложнений трудной интубации в
последние годы уменьшился, что связано с более хорошей подготовкой анестези-
ологов и ранним использованием альтернативных методик. В перспективе это
может еще более ограничить риск осложнений, связанных с трудной интубацией.
ЛИТЕРАТУРА
1. Menigaux С., Guignard В., Adam F. et al. Esmolol prevents movement and attenuates
the BIS response to orotracheal intubation. Br. J. Anaesth., 2002 Dec; 89 (6): 857—62.
2. Yamazaki A., Kinoshita H., Shimogai M. et al. Landiolol attenuates tachycardia in
response to endotracheal intubation without affecting blood pressure. Can. J. Anaesth., 2005
Mar; 52 (3): 254-7.
3. Yoo K.Y., Jeong S.T., Ha I.H., Lee J. Nitrous oxide attenuates pressor but augments
norepinephrine response to laryngoscopy and endotracheal intubation. Anesth. Analg., 2003
May; 96 (5): 1516-21.
4. Edmark L., Kostova-Aherdan K. et al. Optimal oxygen concentration during induction
of general anesthesia. Anesthesiology, 2003 Jan; 98 (1): 28—33.
5. Cole D.J., Schlunt M. Adult Perioperative anesthesia. Philadelphia: Elsevier Mosby,
2004, 541 p.
6. Naguib M., Samarkand! A., Riad W., Alharby S. Ж Optimal dose of succinylcholine
revisited. Anesthesiology, 2003 Nov; 99 (5): 1045—9.
157
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
7. Koptnan A.F., Zhaku В., Lai K.S. The “intubating dose” of succinylcholine: the effect
of decreasing doses on recovery time. Anesthesiology, 2003 Nov; 99 (5): 1050—4.
8. El-Orbany М.1., Joseph N.J., Salem M.R., Klowden A.J. The neuromuscular effects and
tracheal intubation conditions after small doses of succinylcholine. Anesth. Analg., 2004 Jun;
98 (6): 1680-5.
9. Sluga M., Ummenhofer W., Studer W. Rocuronium versus succinylcholine for rapid
sequence induction of anesthesia and endotracheal intubation: a prospective, randomized trial
in emergent cases. Anesth. Analg., 2005 Nov; 101 (5): 1356—61.
10. Yorukoglu D., Asik Y., Okten F. Rocuronium combined with i.v. lidocaine for rapid
tracheal intubation. Acta Anaesthesiol. Scand., 2003 May; 47 (5): 583—7.
11. Huitink J.M., Buitelaar D.R., Schutte P.F. Awake fibrecapnic intubation: a novel
technique for intubation in head and neck cancer patients with a difficult airway. Anaesthesia,
2006 May; 61 (5): 449-52.
12. BenumofJ.L. Management of the difficult airway. Anesthesiology, 1991, 75: 1087-1110.
13. Crosby E.T., Cooper R.M., Douglas M.J. etal. The unanticipated difficult airway with
recommendations for manegment. Can. J. Anaesth., 1998, 45: 757—776.
14. Burkle C.M., Walsh M.T., Harrison B.A. et al. Airway management after failure to
intubate by direct laryngoscopy: outcomes in a large teaching hospital. Can. J. Anaesth., 2005
Jun-Jul; 52 (6): 634-40.
15. Wilson M.E., Spiegelhalter D., Robertson J.A. et al. Predicting difficult intubation. Br.
J. Anaesth., 1988, 61: 211-216.
16. Cattano D., Panicucci E., Paolicchi A. et al. Risk factors assessment of the difficult
airway: an italian survey of 1956 patients. Anesth. Analg., 2004 Dec; 99 (6): 1774—9.
17. Juvin P., Lavaut E., Dupont H., Lefevre P. et al. Difficult tracheal intubation is more
common in obese than in lean patients. Anesth. Analg., 2003 Aug; 97 (2): 595—600.
18. Calder L, Picard J., Chapman M. et al. Mouth opening: a new angle. Anesthesiology,
2003 Oct; 99 (4): 799-801.
19. Krobbuaban B., Diregpoke S., Kumkeaw S., Tanomsat M. The predictive value of the
height ratio and thyromental distance: four predictive tests for difficult laryngoscopy. Anesth.
Analg., 2005 Nov; 101 (5): 1542-5.
20. Ovassapian A., Tuncbilek M., Weitzel E.K., Joshi C. W. Airway management in adult
patients with deep neck infections: a case series and review of the literature. Anesth Analg.,
2005 Feb; 100 (2): 585-9.
21. Bouaggad A., Nejmi S.E., Bouderka M.A., Abbassi O. Prediction of difficult tracheal
intubation in thyroid surgery. Anesth. Analg., 2004 Aug; 99 (2): 603—6.
22. American Society of Anesthesiologists Task Foce on Management of the Difficult
Airway. Practice guidelines of management of the difficult airway. Anesthesiology, 1993, 78:
597-602.
23. Combes X., Le Roux B., Suen P. et al. Unanticipated difficult airway in anesthetized
patients: prospective validation of a management algorithm. Anesthesiology, 2004 May; 100
(5): 1146-50.
24. Beilin B., Yardeni I.Z., Smolyarenko V. et al. Comparison of the Flexiblade levering
laryngoscope with the English Macintosh laryngoscope in patients with a poor laryngoscopic
view. Anaesthesia, 2005 Apr; 60 (4): 400—5.
25. Heidegger T, Gerig H.J., Ulrich B., Schnider T. W. Structure and process quality illustrated
by fibreoptic intubation: analysis of 1612 cases. Anaesthesia, 2003 Aug; 58 (8): 734—9.
26. Weksler N., Klein M., Weksler D. et al. Retrograde tracheal intubation: beyond fibreoptic
endotracheal intubation. Acta Anaesthesiol. Scand., 2004 Apr; 48 (4): 412—6.
27. Gerig H.J., Schnider T., Heidegger T. Prophylactic percutaneous transtracheal
catheterisation in the management of patients with anticipated difficult airways: a case series.
Anaesthesia, 2005 Aug; 60 (8): 801—5.
28. Evans A., Morris S., Petterson J., Hall J.E. A comparison of the Seeing Optical Stylet
and the gum elastic bougie in simulated difficult tracheal intubation: a manikin study.
Anaesthesia, 2006 May; 61 (5): 478—81.
158
8. ИНТУБАЦИОННЫЙ НАРКОЗ
29. Rahman К., Jenkins J. G. Failed tracheal intubation in obstetrics: no more frequent
but still managed badly. Anaesthesia, 2005 Feb; 60 (2): 168—71.
30. Herriger A., Frascarolo P., Spahn D.R., Magnusson L. The effect of positive airway
pressure during pre-oxygenation and induction of anaesthesia upon duration of non-hypoxic
apnoea. Anaesthesia, 2004 Mar; 59 (3): 243—7.
31. Tong J.L., Ashworth D.R., Smith J.E. Cardiovascular responses following laryngoscope
assisted, fibreoptic orotracheal intubation. Anaesthesia, 2005 Aug; 60 (8): 754—8.
32. Owen R.L., Cheney F.W. Endobronchial intubation: A preventable complication.
Anesthesiology, 1987, 67: 255—7.
33. Hilmi LA., Sullivan E., Quinlan J., Shekar S. Esophageal tear: an unusual complication
after difficult endotracheal intubation. Anesth. Analg., 2003 Sep; 97 (3): 911—4.
34. Глумчер Ф. С. Дыхательная недостаточность. В кн. Руководство по интесивной
терапии. Под ред. Трещинского А.И., Глумчера Ф.С. К.: Вища школа, с. 99—147.
35. Silvanus М. Т, Groeben Н., Peters J. Corticosteroids and inhaled salbutamol in patients
with reversible airway obstruction markedly decrease the incidence of bronchospasm after
tracheal intubation. Anesthesiology, 2004 May; 100 (5): 1052—7.
36. Mencke T, Echtemach M., Kleinschmidt S. et al. Laryngeal morbidity and quality of
tracheal intubation: a randomized controlled trial. Anesthesiology, 2003 May; 98 (5): 1049—56.
37. Wdson R., Gupta P., Gogia A.R. Bilateral adductor vocal cord paresis following
endotracheal intubation for general anaesthesia. Anaesth. Intensive Care, 2004 Jun; 32 (3):
417-8.
38. Mort T.C. Emergency tracheal intubation: complications associated with repeated
laryngoscopic attempts. Anesth. Analg., 2004 Aug; 99 (2): 607—13.
39. Ljungqvist O., Soreide E. Preoperative fasting. Br. J. Sutg., 2003 Apr; 90 (4): 400—6.
40. Lee A., Fan L. T, Gin T. et al. A systematic review (meta-analysis) of the accuracy of
the mallampati tests to predict the difficult airway. Anesth. Analg., 2006 Jun; 102 (6): 1867—78.
41. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3th ed. Churchill Livingstone, 1994,
524 p.
42. Shiga T, Wajima Z., Inoue T, Sakamoto A. Predicting difficult intubation in apparently
normal patients: a meta-analysis of bedside screening test performance. Anesthesiology, 2005
Aug; 103 (2): 429-37.
43. Kheterpal S., Han R., Tremper K.K. et al. Incidence and predictors of difficult and
impossible mask ventilation. Anesthesiology. 2006 Nov; 105 (5): 885—91.
8.4. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ
ЛАРИНГЕАЛЬНОЙ МАСКИ
Ларингеальный масочный воздуховод, или ларингеальная маска
(Laryngeal Mask Airway), изобретен английским анестезиологом Брейном A. (Brain А.)
в 1981 году на основании биоинженерных исследований слепков гортани умер-
ших. Ларингеальную маску используют в клинической практике с 1988 года. Ее
конструкция обеспечивает свободное поступление дыхательной смеси из дыха-
тельного контура к пациенту за счет создания герметичного контакта с мягкими
тканями гортаноглотки над входом в гортань больного.
Ларингеальная маска состоит из трех основных частей: тубуса воздуховода,
маски и трубки с контрольным баллоном и клапаном для заполнения воздухом
обтуратора маски (см. рис. 8.10). Тубус изготовлен из полупрозрачного поливи-
нилхлорида. Проксимальный конец тубуса соединен с дыхательным контуром при
помощи стандартного коннектора диаметром 15 мм. Продолжением дистального
159
ОБЩАЯ АНЕСТЕЗИОЛОГИИ
Обтуратор
Рис. 8.10. Ларингеальная маска (внешний вид)
конца тубуса является манжета обту-
ратора маски эллипсовидной формы,
имеющая отдельную трубочку с кон-
трольным баллоном и клапаном для
наполнения ее воздухом.
При корректной установке ларин-
геальной маски манжета обтуратора
при раздувании ее воздухом прилега-
ет вверху к корню языка, отодвигая
его вперед и кверху, и к верхнему краю
надгортанника, приподнимая его над
входом в гортань; латерально манже-
та маски прилегает к грушевидным
синусам. Конический конец манжеты
обтуратора упирается в верхний пи-
щеводный сфинктер, препятствуя поступлению газовой смеси в пищевод и попада-
нию в гортань ротоглоточного секрета (рис. 8.11). Нежное, но достаточно плотное
прилегание обтуратора маски к тканям ротоглотки (давление не более 60 см вод. ст.)
обеспечивает герметизацию сообщения воздуховода с гортанью, не вызывая при
этом возникновения защитных рефлексов со стороны глотки и гортани.
Размер и форма ларингеальной маски имеют определенные преимущества
перед эндотрахеальной трубкой: проникновение маски в пищевод или трахею, тем
более — эндобронхиально, невозможно; отсутствует перенос микрофлоры из вер-
хних дыхательных путей в трахею; не возникает препятствий для инспираторной
дилатации и экспираторной констрикции голосовой щели, что благоприятно для
осмотра верхних дыхательных путей, в том числе голосовых связок. Таким обра-
Голосовая
щель
Щитовидная
железа
Пищевод
Вход в
гортань
Мягкое небо
Задняя треть
языка
Надгор- S
Слизистая \
щитовидного
хряща
Верхний
Г руше-
видная
ямка
сфинктер
пищевода
Черпало-
надгортанная
складка
Рис. 8.11. Соотношение анатомических структур гортаноглотки и обтуратора при идеаль-
ной позиции ларингеальной маски ([4] с изменениями)
160
8. ИНТУБАЦИОННЫЙ НАРКОЗ
зом, при использовании ларингеальной маски значительно снижается травматизм
в сравнении с эндотрахеальной трубкой.
Идеальную позицию ларингеальной маски, когда надгортанник и вход в пище-
вод размещены снаружи и гортань полностью видна в просвете ларингеальной мас-
ки, достигают в 50—60 % случаев. Надгортанник должен находиться в пределах
проксимального обода ларингеальной маски: в 50—90 % случаев его кончик завора-
чивается в направлении гортани, в 50 % случаев складки окологлоточного про-
странства свисают в направлении гортани. Анатомические особенности надгортан-
ника некоторых пациентов могут вызвать частичную обструкцию ларингеальной
маски и гортани. Дистальный обод ларингеальной маски обычно вклинивается в
гипофаринкс, но в 10—15 % случаев вход в пищевод отчетливо виден внутри ларин-
геальной маски. Иногда дистальный обод ларингеальной маски находится прямо
напротив голосовой щели.
8.4.1. Показания к применению
Ларингеальную маску в анестезиологии используют как альтерна-
тиву лицевой маске и обычным воздуховодам для контроля дыхательных путей в
течение непродолжительных плановых и неотложных малотравматичных хирурги-
ческих вмешательств под общей анестезией как с сохраненным самостоятельным
дыханием, так и с применением миорелаксантов и ИВЛ у подготовленных паци-
ентов без риска аспирации. Ларингеальная маска обеспечивает высокий процент
успеха адекватной вентиляции легких, облегчает интубацию трахеи эндотрахеаль-
ной трубкой в случаях предсказуемой и неожиданно сложной интубации, позво-
ляет проводить фибробронхоскопию и фиброларингоскопию.
В отличие от эндотрахеальной интубации установка ларингеальной маски не
травматична, не требует проведения ларингоскопии и дополнительной помощи
среднего медперсонала, не сопровождается выраженными гемодинамическими
изменениями и осложнениями во время ее установки и по окончании хирургичес-
кого вмешательства. Накопление опыта по использованию ларингеальной маски
во многих клиниках привело к расширению показаний к ее применению (частота
использования в некоторых лечебных учреждениях достигает 75 % от всех плано-
вых анестезий, в среднем — 40—50 % плановых анестезий).
При проведении сердечно-легочной реанимации ларингеальную маску исполь-
зуют для экстренного обеспечения проходимости дыхательных путей и проведе-
ния ИВЛ в случаях невозможной интубации по причинам отсутствия необходимо-
го оборудования или неудачных попыток интубации трахеи.
В практике неотложной медицины ларингеальную маску применяют в каче-
стве временной меры для восстановления проходимости дыхательных путей и ИВЛ
средним медицинским персоналом при оказании помощи больным и пострадав-
шим с черепно-мозговой травмой, инсультом, отравлениями и т. п. на месте про-
исшествия и при транспортировке.
При потенциальном риске возникновения регургитации и аспирации, анесте-
зиологу необходимо оценить соотношение польза/риск использования ларинге-
альной маски: взвесить аргументы пользы контроля дыхательных путей и вреда
осложнений, которые могут развиться при вероятно “полном желудке”. Как пра-
вило, аргументы за использование ларингеальной маски перевешивают аргументы
“против” при необходимости проведения сердечно-легочной реанимации, а так-
же в ситуациях невозможной интубации.
6 7-S85
161
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
8.4.2. Противопоказания к применению
Ларингеальная маска не защищает дыхательные пути от регурги-
тации и аспирации желудочного содержимого, поэтому во всех случаях, когда
существуют клинические данные или подозрение “полного желудка”, примене-
ние ларингеальной маски для проведения общей анестезии противопоказано.
Противопоказания к применению ларингеальной маски: диафрагмальная грыжа,
стеноз привратника желудка, кишечная непроходимость, ожирение, беременность
(II—III триместр), множественные или массивные травмы, повреждение органов
брюшной или грудной полости, операции на верхнем этаже брюшной полости (преж-
де всего — на желудке и 12-перстной кишке), операции со вскрытием плевральной
полости, замедленная эвакуация желудочного содержимого (при длительной тера-
пии опиоидами, опийной наркомании, алкогольной интоксикации, остром панкре-
атите, родах), диагностированная пониженная легочная растяжимость/эластичность
(например, легочной фиброз; ларингеальная маска не обеспечивает изоляцию вок-
руг гортани при высоком (более 20—25 см вод. ст.) сопротивлении вдоху).
8.4.3. Технические особенности использования
Классическую ларингеальную маску, как изделие многоразового
использования, перед применением предварительно очищают, тщательно промы-
вают и стерилизуют.
Методы стерилизации ларингеальной маски: а) автоклавирование в стандарт-
ном режиме при температуре 120—134 °C; б) химическая стерилизация в 6 % ра-
створе перекиси водорода при температуре 20 °C в течение 4 часов. Применение
других химических стерилизующих агентов может повредить материал манжеты, а
также требует полоскания ларингеальной маски после стерилизации в стерильной
дистиллированной воде.
Ларингеальная маска стандартно рассчитана на 40 циклов стерилизации, пос-
ле чего ее использование не рекомендуют по причине снижения качественных
характеристик — гибкости и прозрачности тубуса, герметичности и эластичности
манжеты, надежности клапана. При неисправности клапана его заменяют без риска
каких-либо осложнений.
Негерметичные ларингеальные маски не подвергают восстановлению, так как
эта процедура ненадежна и может привести к травме дыхательных путей.
8.4.4. Побочные эффекты
Боль в горле при использовании ларингеальной маски регистриру-
ют в среднем у 10—70 % больных. Ее причины — избыточное давление манжеты
обтуратора на окружающие ткани с нарушением локального кровообращения или
повреждением нервных окончаний. Как правило, это осложнение развивается при
травматичной установке ларингеальной маски или неправильно подобранном раз-
мере с вынужденным перераздуванием манжеты (чаще при меньшем размере, чем
необходимо). Необходимо использовать максимально удобный размер ларинге-
альной маски и контролировать давление в манжете (оптимально — не более
60 см вод. ст.). Для уменьшения раздражения поддерживают достаточную глубину
162
8. ИНТУБАЦИОННЫЙ НАРКОЗ
анестезии — отсутствие глотательных движений, кашля, задержки дыхания, спаз-
ма гортани. Реже причиной болей и воспалительных изменений является инфи-
цирование глотки при нарушении правил асептики.
Аспирация желудочного содержимого при соблюдении противопоказаний к ис-
пользованию ларингеальной маски возникает крайне редко (2:10 000 случаев, что
сопоставимо с частотой аспирации при масочном или интубационном наркозе в
амбулаторной практике) [1, 2].
В литературе не зарегистрировано ни одного летального исхода непосред-
ственно по причине использования ларингеальной маски, при более чем 100 мил-
лионах использований устройства во всем мире [3].
8.4.5. Методика введения
Правильно и корректно установленная ларингеальная маска обес-
печивает достаточную герметизацию дыхательных путей и свободное дыхание.
Опытный врач успешно устанавливает ларингеальную маску не менее чем в 98 %
случаев, используя для этого не более 3 попыток.
Размер ларингеальной маски должен соответствовать анатомо-физиологичес-
ким особенностям пациента, для чего необходимо наличие для каждого пациента,
по крайней мере, 3 размеров маски (табл. 8.5).
Таблица 8.5. Размеры ларингеальных масок
Размер ЛМ Возрастная категория Масса пациента, кг Объем манжеты, мл
1 Грудной ребенок ДО 6,5 2-4
2 Ребенок 6,5-20 10
2,5 Подросток 20-30 15
3 Взрослый 30-50 20
4 Взрослый 50-70 30
5 Взрослый 70-100 40
6 Взрослый Более 100 50
Методика введения ларингеальной маски. Голову пациента разгибают в атланто-
затылочном сочленении и легко сгибают шею вперед, для чего используют плоскую
подушку высотой 7—10 см (рис. 8.12). Из обтуратора маски удаляют воздух и при-
дают ему плоскую форму с отвернутым назад передним краем. Тыльную поверх-
ность маски и обтуратор смазывают нейтральным гелем; не используют гель, содер-
жащий лидокаин или другие местные анестетики. Проводят преоксигенацию. Про-
водят индукцию в наркоз и достигают адекватной стадии наркоза. Для индукции
идеальным является применение пропофола (2—3 мг/кг) в сочетании с фентанилом
(2-5 мкг/кг) или кетамином (0,3—0,5 мг/кг). Альтернативным методом индукции
является введение мидазолама 2—5 мг за 3 мин перед введением тиопентал-натрия
(3-6 мг/кг). У пациентов с мышечным типом конституции иногда применяют ми-
орелаксанты. Расслабление жевательной мускулатуры является хорошим индикато-
ром перед попыткой введения ларингеальной маски. Далее см. рис. 8.12.
163
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. S.12. Стандартная тех-
ника введения ларингеаль-
ной маски ([4] с измене-
ниями):
А — позиция руки для стан-
дартного введения маски
Б — движение головой паци-
ента напоминает движение
при чихании — вначале голо-
ву разгибают назад, затем не-
значительно сгибают вперед;
В — средним пальцем ниж-
нюю челюсть отодвигают кни-
зу, удерживая открытым рот;
Г, Д — указательным пальцем
правой руки направляют ман-
жету, прижимая тубус к твер-
дому небу, и скользящим
движением опускают маску в
гипофаринкс до ощущения
сопротивления. В это время
голову пациента наклоняют
не того вперед;
Е — удерживая маску за ту-
бус, извлекают указательный
палец изо рта пациента;
Ж — раздувают манжету об-
туратора. Для оптимального
расположения маски ее не
удерживают при раздувании
манжеты, при этом тубус выд-
вигают вперед на 0,5-2 см.
Объем заполнения манжеты
не должен превышать реко-
мендуемый для данного раз-
мера (см. табл. 8.5). Для на-
дежной изоляции гортани дав-
ление в манжете должно быть
не более 60 см вод.ст.;
3 — фиксируют маску. Для
предупреждения закусывания
тубуса используют распорку из
марлевого валика толщиной
3 см.
164
8. ИНТУБАЦИОННЫЙ НАРКОЗ
8.4.6. Трудности при введении
Недостаточная подготовка ларингеальной маски может привести
к ее неправильной позиции даже при точном соблюдении методики установки.
Ларингеальная маска со спавшейся манжетой должна иметь правильную фор-
му и складываться так, чтобы ее кончик оставался гладким и был немного согнут
в направлении, противоположном вогнутой стороне. Поверхности манжеты маски
тщательно прижимают друг к другу с обеих сторон; это помогает придать маске
необходимую степень ригидности и облегчает ее установку.
Методика введения ларингеальной маски должна соответствовать нормально-
му акту глотания, то есть процесс введения маски аналогичен механизму протал-
кивания языком пищевого комка. Указательный палец анестезиолога служит точ-
кой опоры для продвижения ларингеальной маски в правильную позицию.
Проблемы во время установки ларингеальной маски связаны, главным обра-
зом, с недостаточной подготовкой врача, выполняющего манипуляцию, а также с
неадекватной глубиной анестезии (табл. 8.6).
Таблица 8.6. Проблемы, возникающие при введении ларингеальной маски
Проблема Возможная причина Предупреждение или устранение
Кашель, спазм голосовых связок, задержка дыхания Недостаточная глубина анестезии Используют пропофол, изофлюран
Недостаточное открывание рта, невозможность введения ларингеальной маски в рот Неадекватная релаксация Углубляют анестезию, применяют миорелаксанты, ассистент отводит нижнюю челюсть вниз
Невозможность преодоления угла между корнем языка и задней частью глотки, загибание манжеты ларингеальной маски или ее винтообразная деформация Разгибание головы в шейно-затылочном сочленении, гипертрофия миндалин, отек языка, удержание ларингеальной маски за тубус при раздувании манжеты воздухом Проводят повторную установку ларингеальной маски; легким движением сгибают голову пациента вперед во время введения ларингеальной маски; прижимают тыльную поверхность маски и тубуса к твердому небу при введении; вводят маску с полу заполнен- ной воздухом манжетой и открытым клапаном; используют ларингоскоп для оттеснения языка
Растяжение верхнего пищеводного сфинктера, попадание дыхательной смеси в пищевод и желудок Удержание ларингеаль- ной маски за тубус при раздувании манжеты воздухом, ее смещение даже при первоначаль- но правильной позиции При раздувании манжеты не удерживают ларингеальную маску
165
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Определенные трудности могут возникнуть при введении ларингеальной мас-
ки за язык. Существует несколько вариантов стандартной методики, с помощью
которых преодолевают эту проблему, например, вводят маску с частично раздутой
манжетой. Альтернативно, ларингеальную маску продвигают слегка в сторону или
вводят после изменения положения головы.
Модификация стандартной методики введения ларингеальной маски (по Garcia-
Pedrajas [5]). После достижения глубокой анестезии маску вставляют в рот паци-
ента, левый указательный палец размещают на верхней поверхности маски — между
маской и твердым небом. Продвигают маску до контакта с задней стенкой глотки.
Скользящими движениями правой руки продвигают маску. Указательный палец
левой руки, поднятый вперед, облегчает продвижение маски и предупреждает воз-
можность изгиба и заворота кончика маски. Маску продвигают до появления ха-
рактерного ощущения сопротивления при вклинивании кончика маски в верхний
пищеводный сфинктер, после чего раздувают манжету.
Этот вариант стандартной методики введения ларингеальной маски позволяет
правильно ее устанавливать с первой попытки в 95 % случаев. По мнению автора,
у новой модификации оригинальной методики есть определенные преимущества,
и она особенно показана при использовании маски у детей, когда введение ларин-
геальной маски затруднено из-за увеличенных миндалин и небольшого размера
голосовой щели.
8.4.7. Обеспечение безопасности пациента
во время анестезии
Использование пульсоксиметрии и капнографии является стандар-
тным мероприятием при ведении анестезии с применением ларингеальной маски.
Самостоятельное дыхание через ларингеальную маску эффективно у пациен-
тов с использованием внутривенной инфузии пропофола, при ингаляционном
наркозе изофлюраном и галотаном при адекватной глубине наркоза, соответству-
ющей уровню хирургических стимулов. После установки маски даже без исполь-
зования миорелаксантов может потребоваться кратковременная ИВЛ с постоян-
ным положительным давлением до восстановления адекватного самостоятельного
дыхания. Поскольку маска не обеспечивает изоляцию дыхательных путей при дав-
лении вдоха более 25 см вод. ст., ИВЛ проводят с объемом вдоха не более 8 мл/кг,
ЧДД не более 20 в минуту и пиковым давлением вдоха не более 25 см вод. ст.
Внезапное повышение пикового давления вдоха во время ИВЛ свидетельствует об
уменьшении глубины анестезии и ослаблении нервно-мышечного блока.
Реже причиной повышения пикового давления или неадекватной вентиляции
является смещение ларингеальной маски или регургитация и аспирация желудоч-
ного содержимого. Аускультация переднебоковой поверхности шеи и легочных
полей помогает дифференцировать причину нарушений проходимости воздухово-
да или дыхательных путей.
При возникновении подозрения на регургитацию желудочного содержимого
немедленно отсоединяют ларингеальную маску от дыхательного контура, накло-
няют головной конец операционного стола вниз и аспирируют через тубус ларин-
геальной маски содержимое гортани. После углубления анестезии и оксигенации
для надежной изоляции дыхательных путей через просвет маски вводят эндотра-
хеальную трубку с помощью эластичного проводника или фибробронхоскопа. При
166
8. ИНТУБАЦИОННЫЙ НАРКОЗ
неудаче трех попыток введения эндотрахеальной трубки через просвет маски ее
извлекают и интубируют больного с помощью стандартной техники.
Раздувание манжеты маски дополнительным объемом воздуха очень редко
устраняет негерметичность. Чаще это еще более нарушает контакт обтуратора маски
с тканями. Поэтому наиболее целесообразно уменьшить раздутие манжеты или
переустановить ларингеальную маску. При использовании закиси азота следят за
давлением в манжете и своевременно выпускают избыточный газ из обтуратора,
так как закись азота легко диффундирует в полость обтуратора, увеличивая его
объем и давление в манжете. При отсутствии датчика давления контролируют
форму и напряжение контрольного баллона.
Некоторые авторы считают, что ИВЛ через ларингеальную маску создает такой
же риск, как анестезия со спонтанным дыханием, но такое утверждение все еще
остается предметом дискуссий. В США Американской администрацией продоволь-
ствия и лекарств (FDA) принято постановление, согласно которому ларингеальная
маска не должна заменять эндотрахеальную трубку. Этот документ был принят в
целях защиты потребителей от необоснованного применения ларингеальных масок
и привел к ограничению их производства в США и, соответственно, сократил пока-
зания к ее использованию. В странах, где отсутствуют подобного рода ограничения,
ларингеальную маску применяют более часто, в том числе для операций, сопровож-
дающихся ИВЛ: в ортопедии, травматологии, урологии, гинекологии, сосудистой и
абдоминальной хирургии, в частности — при лапароскопической холецистэктомии.
Таким образом, была искусственно создана ситуация, когда специалисты, не владе-
ющие методикой использования ларингеальной маски, по-прежнему предпочитают
использовать эндотрахеальную трубку, и все же, возрастающую популярность ла-
рингеальной маски во многих областях анестезиологии обеспечивают простота ее
установки, минимальное количество осложнений, герметичность и изоляция дыха-
тельных путей, достаточные для безопасного проведения ИВЛ.
8.4.8. Методика извлечения
При раннем пробуждении до полного восстановления нервно-
мышечной проводимости возможно развитие спазма голосовой щели, кашля, из-
быточной секреции слизи, рвоты, закусывания тубуса маски. Чтобы избежать по-
добных осложнений, контролируют уровень седации пациента, который должен
быть достаточным для подавления рефлекторных реакций на ларингеальную мас-
ку до восстановления адекватной самостоятельной вентиляции легких. Маску уда-
ляют при восстановившихся способностях пациента глотать, открывать рот, высо-
вывать язык. Слизь аспирируют перед извлечением ларингеальной маски только
из надманжетного пространства. Удаляют воздух из манжеты и извлекают маску
одновременно при открывании рта по команде.
8.4.9. Особенности применения
в специализированных областях анестезиологии
Урологические операции, которые выполняют в положении боль-
ного на спине, успешно проводят с применением ларингеальной маски. Исполь-
зование маски имеет ряд преимуществ перед интубационной техникой особенно у
167
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
пожилых больных, у которых чаще возникают трудности при интубации трахеи
из-за ригидности шейного отдела позвоночника. В случаях противопоказаний к
спинальной или эпидуральной анестезии во время операций на органах малого
таза использование ларингеальной маски можно рассматривать в качестве опти-
мального варианта обеспечения ИВЛ при общей анестезии. В боковом почечном
положении больного на операционном столе (при операции на почках, надпочеч-
никах, верхнем отделе мочеточников) также используют маску, но учитывают, что
степень ее фиксации в горле менее надежна, чем при положении на спине. Ис-
пользование ларингеальной маски в таких ситуациях является альтернативным
при предполагаемой трудной интубации трахеи.
Урологические операции с применением ларингеальной маски: резекция стенки
мочевого пузыря по поводу опухоли, экстирпация мочевого пузыря, уретеролито-
томия в нижней трети мочеточника, иссечение оболочек яичка (гидроцеле), пла-
стика уретры, ушивание везиковагинальных свищей, трансуретральная резекция
простаты или опухоли мочевого пузыря.
Поскольку при трансуретральной резекции (ТУР) степень травматизации зна-
чительно ниже, чем при открытых операциях, и нет необходимости в мышечной
релаксации, то ИВЛ через ларингеальную маску обеспечивают за счет внутривен-
ного введения пропофола (1,5—2,0 мл/мин) и фентанила (0,003—0,005 мг/кг/ч).
Такая техника ИВЛ через ларингеальную маску без применения миорелаксантов
обеспечивает быстрый и легкий выход из анестезии.
Использовать ларингеальную маску в педиатрической анестезиологии может
только врач, который имеет достаточный опыт ее применения у взрослых. Иногда
размер маски, подобранной по возрасту и весу ребенка, не соответствует индиви-
дуальным особенностям гортани, что требует замены маски другого размера.
Методика введения ларингеальной маски у детей не отличается от таковой у
взрослых. В связи с более высоким потреблением кислорода у детей десатурацию
регистрируют чаще при длительной установке маски. Наиболее часто применяют
ларингеальную маску при коротких амбулаторных вмешательствах и диагности-
ческих процедурах, особенно когда доступ к голове и шее ребенка ограничен для
поддержания проходимости дыхательных путей и оксигенации с помощью лице-
вой маски.
Особенностью использования ларингеальной маски в педиатрической анесте-
зиологии является ее извлечение, так как при пробуждении ребенка часто возни-
кают ларингоспазм, рвота, закусывание тубуса маски. Поэтому у детей извлекают
маску до полного пробуждения на фоне поверхностного наркоза при восстановле-
нии адекватного спонтанного дыхания. Чтобы обеспечить гладкое пробуждение
пациента, ограничивают манипуляции с ларингеальной маской и не допускают
излишней стимуляции дыхательных путей больного до того, как он проснется и
сможет координированно отвечать на команды. Несоблюдение этих правил может
привести к различным нежелательным реакциям и снижению сатурации. Катего-
рически запрещается двигать ларингеальную маску вперед и назад, чтобы уско-
рить пробуждение.
Если вентиляция дыхательным мешком и лицевой маской неадекватна, а ин-
тубация трахеи невозможна (например, в экстренных случаях трудной интубации,
исключая локальную патологию гортани и глотки), то используют ларингеальную
маску. В клинических ситуациях при вышеуказанных ситуациях, описанных в
литературе как “невозможная интубация/невозможная вентиляция”, отсутствие
адекватной вентиляции является показанием к высокочастотной вентиляции или
168
8. ИНТУБАЦИОННЫЙ НАРКОЗ
другому экстренному способу обеспечения проходимости дыхательных путей —
коникотомии, чрескожной дилатационной трахеостомии.
После успешной установки ларингеальной маски и достижения адекватного
газообмена как можно скорее стабилизируют ситуацию (переходят на спонтанную
вентиляцию, используют интубацию трахеи, осуществляют трахеостомию), так как
риск возникновения регургитации в экстренной ситуации всегда остается высо-
ким. Ларингеальная маска позволяет осуществлять интубацию трахеи “вслепую”
(по стилету) или с помощью фибробронхоскопа в случаях трудной интубации.
Очевидно, что возможность проведения интубации “вслепую” увеличивается при
центральном положении ларингеальной маски: тубус маски облегчает бронхоско-
пическую визуализацию голосовой щели. При непредвиденных осложнениях, в
виде “невозможной вентиляции/невозможной интубации”, применение ларинге-
альной маски с последующей успешной интубацией “вслепую” обеспечивает эф-
фективную вентиляцию и оксигенацию у 94 % пациентов.
Ларингеальная маска облегчает диагностические процедуры с использованием
фиброоптических инструментов при обследовании гортани, голосовой щели и тра-
хеобронхиального дерева у детей и взрослых, особенно во время и после хирурги-
ческих вмешательств на шее, которые имеют высокий риск повреждения гортан-
ной ветви возвратного нерва. При этом помимо технического облегчения прове-
дения процедуры возможно одновременное проведение ИВЛ. Проведение процедур
возможно у пациентов в сознании на фоне блокирования глоточных рефлексов
местными анестетиками.
В литературе описан клинический опыт применения ларингеальной маски
для поддержания проходимости дыхательных путей при общей анестезии во вре-
мя фиброоптической дуоденохоледохоскопии. При этом эндоскоп вводили через
рот мимо приспущенной манжеты маски, с последующим ее раздуванием до пре-
жнего объема [6].
Необходимость введения назогастрального зонда при установленной ларинге-
альной маске возникает чаще всего при лапароскопических вмешательствах, ког-
да раздутый желудок мешает визуализации операционного поля и хирургическим
манипуляциям [7]. Вводят назогастральный зонд для эвакуации желудочного со-
держимого или для удаления газа при установленной ларингеальной маске после
небольшой дефляции манжеты. После установки зонда давление воздуха в манже-
те восстанавливают. Для облегчения проталкивания зонда через манжету исполь-
зуют щипцы Мэгилла. Введенный зонд не гарантирует полной эвакуации желу-
дочного содержимого, поэтому после уменьшения объема желудка зонд постепен-
но извлекают, при этом не прекращают аспирацию и удерживают тубус для
предупреждения дислокации маски.
Ravalia А. [8] опубликовал результаты экспериментального использования ар-
мированных ларингеальных масок при отоларингологических вмешательствах (опе-
рациях в области носа, тонзилэктомиях, фарингопластике). Ларингеальную маску
устанавливали под контролем зрения, перед раздуванием манжеты устанавливали
санационный катетер. В идеале, катетер должен был размещаться по средней ли-
нии вдоль тубуса, но не далее дистального конца маски. Вакуум-аспирацию во
время манипуляций проводили непрерывно. Несмотря на отсутствие осложнений,
автор указывает на необходимость постоянной готовности анестезиолога и хирур-
гов к интубации трахеи при подобных операциях [8].
На догоспитальном этапе или при транспортировке пациента в ОИТ стандарт-
ной рекомендацией является проведение масочной вентиляции с помощью мешка
169
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
для ИВЛ до момента, пока пациента не доставят в клинику, где опытный анестези-
олог проведет интубацию трахеи. Масочная вентиляция зачастую не обеспечивает
адекватной вентиляции легких, приводя к раздуванию желудка с последующей ре-
гургитацией и легочной аспирацией. В неотложных ситуациях ларингеальная маска
более надежно обеспечивает проходимость дыхательных путей, снижает риск разду-
вания желудка и позволяет проводить вспомогательную ИВЛ дыхательным объе-
мом до 750 мл (Европейский совет реаниматологов рекомендует для вентиляции
ручным мешком с лицевой маской у неинтубированных пациентов дыхательный
объем 500 мл) [9]. В экстренных ситуациях, например, при политравме или череп-
но-мозговой травме, успешное введение ларингеальной маски на месте происше-
ствия в позиции пациента сидя или на боку может спасти жизнь пострадавшему,
так как интубация трахеи в этих ситуациях чаще всего невозможна [10, 11].
8.4.10. Модификации ларингеальной маски
Ларингеальная маска с армированным гибким тубусом отличается
от классической ларингеальной маски меньшим диаметром тубуса. Эта модифи-
кация предназначена для применения при операциях в области головы и шеи, в
глазной хирургии, а также при отоларингологических вмешательствах. Сложность
ее установки обусловлена гибкостью тубуса: вместо указательного пальца в каче-
стве рычага для продвижения маски используют саму трубку. Хотя для облегчения
введения используют различные типы интродюсеров, в большинстве случаев при
установке армированной ларингеальной маски соблюдают методику, описанную в
руководстве по ее введению.
При установке маски для проведения тонзилэктомии за счет установки языч-
ного ретрактора возможно ее продвижение глубже, чем обычно. Мягкость матери-
ала, из которого изготовлен армированный тубус, создает опасность повреждения
маски в зоне между резцами и язычным ретрактором, поэтому маску защищают от
избыточного давления в этой точке. Для успеха анестезии с применением армиро-
ванной ларингеальной маски анестезиолог и хирург всегда заранее согласовывают
действия. Необходимо помнить, что через армированный тубус проведение эвдо-
трахеальной трубки и фибробронхоскопа диаметром более 4 мм невозможно.
Интубационная ларингеальная маска. Через стандартную ларингеальную мас-
ку возможно установить лишь эндотрахеальные трубки диаметром 6 и 7—7,5 мм
(размеры №3, № 4, № 5). Из-за большой длины трубки маски невозможно устано-
вить эндотрахеальную трубку без риска компрессии манжетой голосовых связок.
Тубус интубационной ларингеальной маски изготовлен из нержавеющей ста-
ли, его внутренний диаметр составляет 13 мм. Интубационная маска обладает
характерной анатомической кривизной и меньшей длиной, чем стандартная, а
наружный конец интубационной ларингеальной маски снабжен специальной ру-
кояткой. Техническое усовершенствование обеспечивает ряд специфических от-
личий интубационной маски: во-первых, это позволяют осуществить установку
без введения пальца в ротовую полость пациента; во-вторых, дает возможность
контролировать положение маски относительно голосовой шели; в-третьих, га-
рантирует устойчивое положение маски при продвижении через нее эндотрахе-
альной трубки.
Преимуществами интубационной ларингеальной маски являются возможность
вентиляции перед попытками интубации и во время этих попыток, предотвраще-
но
8. ИНТУБАЦИОННЫЙ НАРКОЗ
ние риска контаминации анестезиолога и травматизации его пальцев, возмож-
ность установки эндотрахеальной трубки соответствующего размера. Кроме этого,
при использовании интубационной маски перед интубацией трахеи эндотрахеаль-
ной трубкой не нужно производить удаление маски, как это обычно принято при
стандартной методике. Это повышает защиту дыхательных путей от травматиза-
ции, в частности, при сердечно-легочной реанимации, которая может сопровож-
даться рефлюксом желудочного содержимого. Помимо указанных преимуществ
интубационная ларингеальная маска позволяет избежать манипуляций с головой
и шеей пациента, так как ее введение можно провести из различных позиций и с
помощью всего одной руки, что представляет несомненную пользу в экстренных
ситуациях.
Как и стандартные маски, интубационную маску также подвергают автокла-
вированию и повторному использованию, а при отсутствии эндотрахеальной трубки
она может независимо от интубации обеспечить проходимость дыхательных путей
и адекватную вентиляцию, так как наружный конец маски снабжен стандартным
коннектором диаметром 15 мм для дыхательного мешка или контура.
Недостатками интубационной ларингеальной маски являются: невозможность
введения ригидной металлической трубы в ротовую полость, если расстояние между
зубами составляет менее 16 мм; отсутствие гарантий от возникновения аспира-
ции; вероятность безуспешной интубации при высоком стоянии голосовой щели
и грубых анатомических дефектах (последний из недостатков объясняют фикси-
рованной кривизной трубы маски и проведением интубации “вслепую”). Приме-
нение интубационной ларингельной маски при трудной интубации выглядит дос-
таточно сомнительным решением проблемы адекватной вентиляции.
Изолирующая ларингеальная маска (с дренажем желудочного содержимого),
LMA-ProSeal™. Данная модификация ларингеальной маски имеет канал и от-
верстие в обтураторе, которые соединены с отдельным тубусом и сообщаются с
пищеводом, за счет чего можно создавать более высокое давление в манжете и
беспрепятственно вводить желудочный зонд. Считают, что установка маски с
дренажем желудка более сложная, но степень изоляции дыхательных путей выше,
чем при использовании классической ларингеальной маски. Поэтому изолирую-
щую маску в последнее время чаще применяют при операциях на органах брюш-
ной полости, в частности — при лапароскопической холецистэктомии, так как
она обеспечивает возможность ИВЛ с более высоким уровнем пикового давления
(до 30 см вод. ст.) [12].
Ларингеальную маску однократного применения изготавливают из прозрачно-
го медицинского поливинилхлорида (LMA-Unique) и поставляют в стерильной
упаковке. Такие маски сразу готовы к применению. Размеры соответствуют раз-
мерам классических ларингеальных масок. Методика введения одноразовой ла-
рингеальной маски аналогична описанной выше. Единственным отличием при
подготовке к введению одноразовой маски является отсутствие необходимости
придавать плоский вид манжете путем полного удаления из нее воздуха. При
введении одноразовой ларингеальной маски создают сообщение полости манже-
ты с атмосферой путем вставки специального устройства для деблокирования
клапана. Применение одноразовых масок предпочтительнее при догоспиталь-
ной и внутрибольничной кардиопульмональной реанимации, у пациентов с вы-
соким риском инфицирования.
171
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ЛИТЕРАТУРА
1. Bapat Р.Р., Verghese С. Laryngeal Mask Airway and the incidence of regurgitation
during gynecologic laparoscopies. Anesth. Analg. 1997; 85: 139—43.
2. Brimacombe J.R., Berry A. The incidence of aspiration associated with the laryngeal
mask airway: a meta-analysis of published literature. J. Clin. Anesth. 1995; 7: 297—305.
3. Sidaras G., Hunter J.M. Is it safe to artificially ventilate a paralysed patient through
the laryngeal mask? The jury is still out (Editorial). Br. J. Anaesth. 2001; 86: 749—53.
4. LMA-classic. Instruction Manual. The Laryngeal Mask Company Limited, PO Box
23620, Nicosia.
5. Garcia-Pedrajas F., Monedero P., Carrascosa F. Modification of Brain’s technique for
insertion of laryngeal mask airway. Anesth Analg. 1994; 79 (5): 1024—5.
6. Osborn I.P., Cohen J., Soper RJ., Roth L.A. Laryngeal mask airway — a novel method
of airway protection during ERCP: Comparison with endotracheal intubation. Gastrointest.
Endosc. 2001; 53: AB80.
7. Ford S., Cook T.M., Myles P. The use of the laryngeal mask in gynaecological
laparoscopy/Limited evidence. Anaesth. Intensive Care. 2005; 33 (1): 145.
8. RavaliaA., Steele A. Reinforced laryngeal mask and nasal surgery. Anaesthesia. 1996;
51 (3): 286.
9. Doerges V., Sauer C, Ocker H. et al. Airway management during cardiopulmonary
resuscitation. A comparison of bag-valve-mask, laryngeal mask and combitube. Resuscitation.
1999; 41: 63-69.
10. Rosenblatt W.H. The Use of the LMA-ProSealTM in Airway Resuscitation. Anesth.
Analg. 2003; 97 (6): 1773-1775.
11. Barbieri S., Michieletto E., Di Giulio M. et al. Prehospital airway management with the
laryngeal mask airway in polytraumatized patients. Prehosp. Emerg. Care. 2001; 5: 300—303.
12. Maltby J.R., Beriault M.T., Watson N.C. et al. The LMA-ProSeal™ is an effective
alternative to tracheal intubation for laparoscopic cholecystectomy. Can. J. Anesth. 2002; 49:
857-862.
172
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ
ВО ВРЕМЯ ОПЕРАЦИИ
9.1. ПОЛОЖЕНИЕ НА ОПЕРАЦИОННОМ СТОЛЕ
В зависимости от вида и характера оперативного вмешательства
определяют положение пациента на операционном столе. Анесте-
зиологу необходимо учитывать изменения патофизиологических
процессов, которые происходят при смене положения на опера-
ционном столе, особенно — изменения в дыхательной и сердечно-
сосудистой системах. Во многом эти эффекты зависят от воздей-
ствия гравитации: увеличивается наполнение кровью нижележа-
щих областей, уменьшается перфузия вышележащих, значительно
изменяются вентиляционно-перфузионные соотношения в легких,
что влияет на оксигенацию крови. Поворот на живот или на бок
больного под наркозом, особенно с предшествующей гиповолемией,
может сопровождаться артериальной гипотензией, которую обыч-
но купируют инфузией жидкости, поэтому обязателен мониторинг
АД при смене положения больного на операционном столе.
— На патофизиологические изменения, связанные с положени-
ем тела, влияют некоторые сопутствующие заболевания. Напри-
мер, больные с тяжелой степенью ожирения или застойной сер-
дечной недостаточностью плохо переносят горизонтальное поло-
жение на спине.
Некоторые положения, особенно при длительных операциях,
увеличивают риск развития неврологических осложнений — по-
вреждений периферических нервов и сплетений, что связано с их
длительной ишемией во время операции из-за сдавливания выс-
тупающими костными образованиями и внутрисуставными голов-
ками костей. Необходимо помнить, что пациенты во время об-
щей анестезии не испытывают боли и неприятных ощущений от
неадекватного положения частей тела. Поражения локтевого не-
рва составляют около 30 % от всех случаев повреждений перифе-
рических нервов; второе место по частоте повреждений занимает
аксиллярное сплетение. Наложение жгута на конечность увели-
чивает риск неврологических повреждений у пациентов с гипо-
термией, артериальной гипотензией и гипоперфузией, сахарным
173
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 9.1. Положение
на спине, или гори-
зонтальная позиция
диабетом, хронической алкогольной интоксикацией. Эти повреждения характери-
зуются послеоперационной болью в области поврежденных нервных стволов, на-
рушением функций конечностей, длительным (до 3—12 месяцев) и, иногда, не-
полным восстановлением.
Положение на спине, или горизонтальная позиция, — наиболее часто использу-
емое положение во время операций (рис. 9.1) на органах брюшной и грудной
полостей, на лице, шее, конечностях. В этой позиции изменения гемодинамики
наименьшие, но ухудшена вентиляция задних отделов легких. Подкладывание ва-
лика под колени способствует расслаблению брюшных мышц. Значительное отве-
дение верхних конечностей способствует повреждению нервных стволов, поэтому
длительную выраженную экстензию в плечевых суставах не рекомендуют. Более
функциональным считают положение с пронацией кисти (рис. 9.2). После дли-
тельных операций больные могут испытывать боль в области позвоночника.
В некоторых случаях используют модификации положения на спине, например
положение Тренделенбурга — с опущенным головным концом. В этом положении
значительно страдает функция легких, увеличивается внутричерепное давление, по-
вышается (не всегда) АД. Для увеличения перфузии мозга при выраженной гиповоле-
мии и гипотензии используют положение с приподнятым ножным концом.
Положение для литотомии (рис. 9.3) чаше используют при гинекологических,
акушерских и урологических операциях. В этом положении увеличен риск по-
вреждения перонеального, подкожного, бедренного и запирательного нервов, риск
развития компартмент-синдрома нижних конечностей (по причине ишемии) и
тромбоза вен нижних конечностей.
Положение на животе (рис. 9.4) используют при операциях на позвоночнике,
органах грудной полости, задней части головы, конечностях. В этом положении
повышаются внутричерепное и внутриглазное давления, что учитывают у больных
с внутричерепной патологией и глаукомой. Больным, особенно с большим живо-
том, подкладывают валики под грудь и ноги (а также — под плечи и голеностоп-
ные суставы), что значительно уменьшает внутрибрюшное и внутригрудное давле-
ния и улучшает вентиляцию легких.
Рис. 9.2. Положение
руки с пронацией
кисти (А); положе-
ние кисти с высоким
риском повреждения
локтевого нерва (Б)
174
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
Рис. 9.3. Положение
для литотомии
Положение на боку (см. рис. 9.5) используют чаще при торакальных операциях
и вмешательствах на органах забрюшинного пространства. В этом положении зна-
чительно нарушаются вентиляционно-перфузионные соотношения в легких и по-
вышается риск попадания секрета из верхнележащего легкого в нижележащее,
если не используют раздельную вентиляцию легких. В положении на боку воз-
можна компрессия полых вен, увеличен риск повреждения подмышечного не-
рвного сплетения. Голову укладывают в нейтральное положение, чтобы избежать
нарушений кровообращения и повреждений нервных стволов.
В некоторых областях хирургии используют специальные позиции, например
положение сидя при определенных нейрохирургических операциях.
9.2. ПЕРИОПЕРАЦИОННЫЙ МОНИТОРИНГ
Адекватный мониторинг во время общей анестезии и в послеопе-
рационный период является одним из ключевых условий успеха операции и нар-
коза. Наиболее простыми методами мониторинга являются визуальная оценка цвета
кожных покровов, пальпация пульса, неинвазивное измерение АД. Для опытных
анестезиологов этих простейших методов мониторинга достаточно для успешного
проведения анестезии, но у тяжелых больных (при обширных длительных опера-
циях с большой кровопотерей, с тяжелыми сопутствующими заболеваниями и др.)
для адекватной своевременной оценки состояния больного используют более со-
вершенные методы интра- и послеоперационного мониторинга.
175
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Методы мониторинга во время анестезии: контроль АД, измерение температу-
ры тела, определение газов крови и КОС, ЭКГ, ЭхоКГ, контроль давления в ле-
гочной артерии, пульсоксиметрия, масспектрометрия, электроэнцефалография,
эзофагальная стетоскопия, спектроскопия Raman, измерение диуреза.
Количество методов для интра- и послеоперационного мониторинга постоян-
но увеличивается благодаря внедрению в клиническую практику современных на-
учных технологий. Перед каждым оперативным вмешательством анестезиолог
планирует использование комплекса методов мониторинга. Несмотря на индиви-
дуализацию, существуют стандарты интра- и послеоперационного мониторинга.
Первый стандарт интраоперационного мониторинга был предложен в Гарвар-
дском госпитале и в 1986 году принят Американской ассоциацией анестезиологов.
В качестве объективной оценки респираторной функции стали использовать пуль-
соксиметрию и капнографию. Эти методы существенно повысили качество мони-
торинга и увеличили безопасность тяжелых больных во время операции.
Стандарт интраоперационного мониторинга Американской Ассоциации анестези-
ологов (1993):
а) Квалифицированный анестезиологический персонал присутствует в опера-
ционной во время проведения общей и региональной анестезии; необходимо на-
личие соответствующей аппаратуры для мониторинга.
б) У всех больных во время операции контролируют оксигенацию, вентиля-
цию, циркуляцию крови (кровообращение) и температуру тела.
Мониторинг оксигенации: определяют концентрацию кислорода во вдыхаемом
газе, проводят постоянную пульсоксиметрию для контроля насыщения кислоро-
дом крови; оценивают цвет кожных покровов.
Мониторинг вентиляции легких: по клиническим признакам постоянно оцени-
вают экскурсии грудной стенки, давление в дыхательном контуре, проводят аус-
культацию легких, контролируют рСО, в конце выдоха (капнография).
Мониторинг кровообращения: проводят ЭКГ (постоянно), измеряют АД и ЧСС
(каждые 5 мин); альтернативные методы контроля — анестезиолог во время нар-
коза обязательно пальпирует периферический и при необходимости — централь-
ный пульс, выслушивает тоны сердца, для контроля пульса использует пульсокси-
метрию и плетизмографию.
Температурный мониторинг: используют поверхностную и инвазивную ме-
тодики.
176
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
9.2.1. Мониторинг оксигенации
Современные наркозно-дыхательные аппараты оснащены анали-
затором концентрации кислорода во вдыхаемом газе (FiO2). Этот показатель мо-
жет снижаться в результате уменьшения подачи кислорода или увеличения пода-
чи другого газа, чаще всего закиси азота. Система тревоги сообщает о снижении
FiO2 ниже определенного уровня (например, 0,4), что дает возможность своевре-
менно исключить эту причину гипоксической гипоксии. Ранее с этой целью ис-
пользовали паларографический электрод Кларка и гальванический электрод. В
современных аппаратах анализирующий электрод расположен между пациентом и
респиратором. В последние годы широко используют парамагнетический и элек-
тромеханический электроды.
Пульсоксиметрия — один из распространенных методов определения оксиге-
нации крови во время и после операции, который позволяет своевременно диаг-
ностировать снижение насыщения крови кислородом. По эффективности пульс-
оксиметрия значительно превосходит определение оксигенации по визуальным
признакам, например, по цвету кожных покровов. Конечно, наиболее точным
является определение рО2 и SO, крови с помощью газоанализатора, однако этот
метод требует инвазивных вмешательств (пункции сосуда, как правило, артерии)
и обеспечивает только дискретную информацию.
Метод пульсоксиметрии основан на принципе фотоспектрометрии и законе
Ламберта-Бэра (Lambert—Beer). В 1939—1942 годах физиолог Glen Millikan разра-
ботал первый пульсоксиметр для практической врачебной деятельности. В 1948
году пульсоксиметр впервые применили в операционной для мониторирования
гипоксемии. С тех пор пульсоксиметры значительно усовершенствовали, они ста-
ли более надежными в практическом применении. В 1990 году ASA приняла
пульсоксиметрию в качестве стандарта интраоперационного мониторинга, в 1992
году — послеоперационного мониторинга.
Современная пульсоксиметрия основана на спектрофотометрии и плетизмо-
графии. С помощью спектрофотометрии определяют количество абсорбируемого
света. Источник света генерирует красный (длина волны 660 нм) и инфракрасный
(длина волны 940 нм) световые потоки. Оксигемоглобин в большей степени аб-
сорбирует инфракрасный свет, а восстановленный гемоглобин — красный свет.
Эту разницу регистрирует фотодетектор и затем конвертирует в процент насыще-
ния крови оксигемоглобином.
С помощью плетизмографии регистрируют артериальную пульсацию, что по-
зволяет провести коррекцию с непульсирующей венозной кровью. Артерии изме-
няют объем в период систолы и диастолы, в то время как объем капилляров и вен
практически остается неизменным. Определение абсорбции света в разные фазы
пульсовой волны также играет роль в разработке алгоритма для определения SpO2.
Алгоритм работы большинства пульсоксиметров предполагает значительную
корреляцию между SpO2 и SaO2, которая составляет 98 % (ошибка ±2 %). Эта
корреляция существенна только при SpO2 свыше 70 %, а при более низком насы-
щении кислородом процент ошибки увеличивается. Поскольку такие низкие цифры
насыщения кислородом в клинической практике имеют небольшое значение, этот
недостаток пульсоксиметрии несущественно влияет на клиническое применение.
Точность пульсоксиметрии во многом зависит от пульсации крови, в частно-
сти, на конечностях, поэтому гипотензия, гиповолемия, выраженная вазоконст-
177
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
рикция, гипотермия, тяжелая сердечная недостаточность значительно ограничи-
вают использование пульсоксиметрии в практике.
Методика пульсоксиметрии несовершенна. Анестезиологу следует учитывать
некоторые недостатки в ее работе, чтобы допускать меньше ошибок при интер-
претации показателей. Недостатком пульсоксиметрии является запаздывание из-
менения насыщения крови кислородом до 30 с. Двигательная активность пациен-
та также может искажать показания пульсоксиметра. К ошибочной интерпрета-
ции показателей пульсоксиметрии может привести увеличение концентрации
карбоксигемоглобина, метгемоглобина и сульфогемоглобина, так как карбоксиге-
моглобин и метгемоглобин обладают такой же, как нормальный гемоглобин, аб-
сорбционной способностью по отношению к красному свету. Естественная кож-
ная пигментация и применение красителей, например метиленового синего, мо-
гут искажать показатель SpO2 в сторону снижения.
9.2.2. Мониторинг вентиляции легких
Об адекватной вентиляции легких свидетельствуют полноценные
экскурсии грудной клетки при дыхании, а также данные аускультации и перкуссии
легких, но в некоторых случаях даже опытному анестезиологу сложно диагностиро-
вать определенные состояния, например адекватность местонахождения интубаци-
онной трубки. В таких случаях незаменимую помощь оказывает капнография.
Капнография (от греч. kapnos — дым). Метод основан на принципе закона
Ламберта—Бэра и заключается в спектрофотометрическом определении абсорб-
ции углекислым газом проходящего света. Забор газа для анализа производят у
наружного конца эндотрахеальной трубки. С помощью капнографии измеряют
парциальное давление углекислого газа в выдыхаемом газе в конце выдоха (РЕСО,).
Зависимость между РЕСО2, рСО, и РАСО, зависит от нескольких факторов. В иде-
альной ситуации РЕСО2 = рСО, = РАСО2, но в норме градиент между РЕСО,и
РаСО, равен 5—10 мм рт. ст. При нарушении вентиляционно-перфузионных соот-
ношений во время общей анестезии этот показатель изменяется (табл. 9.1): при
состояниях, сопровождающихся увеличением мертвого пространства и гипопер-
фузией легких, градиент снижается, при эмболии легочной артерии — увеличи-
вается.
Таблица 9.1. Факторы, влияющие на РЕСО2 во время анестезии
Факторы, увеличивающие РЕСО2 Факторы, уменьшающие РЕСО2
Гипертермия Злокачественная гипертермия Гипертиреоидизм Сепсис Дрожь Применение натрия гидрокарбоната Инсуфляпия СО2 в брюшную полость Нарушение элиминации СО2 Гиповентиляция Нарушение рециркуляции газа в дыхательном контуре Гипотермия Гипотереоидизм Низкий сердечный выброс и остановка сердца
Гипоперфузия Гипервентиляция Эмболия легочной артерии Спонтанная экстубация
178
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
С помощью капнографии опре-
деляют нарушения элиминации угле-
кислого газа, связанные с респира-
торными, метаболическими и цирку-
ляторными причинами. Капнография
является золотым стандартом при
определении местонахождения инту-
бационной трубки (см. раздел 8.3.4.2),
а также при определении эффектив-
ности массажа сердца. Следует отме-
тить, что с помощью капнографии не-
возможно определить эндобронхиаль-
ное расположение интубационной
трубки.
Нормальная капнографическая
кривая представлена на рис. 9.6.
Масспектрометрия обеспечивает
постоянный или периодический кон-
троль за составом вдыхаемой и вы-
Рис. 9.6. Нормальная капнографическая кривая [1].
Фаза A-В отражает вдох. Фаза В-С соответствует на-
чалу выдоха с быстрым увеличением концентрации
СО,. Более медленный подъем кривой часто наблю-
дают при ХОЗЛ или острой обструкции дыхательных
путей, включая бронхоспазм, а также при обтурации
интубационной трубки. Фаза С-D соответствует эли-
минации СО, из альвеол. Точка D соответствует РЕСО,.
Фаза D-Е отражает начало вдоха. Раннее снижение
РЕСО, часто свидетельствует об утечке газа мимо ман-
жеты интубационной трубки. Форма кривой наруша-
ется при неполной релаксации и появлении спонтан-
ного дыхания
дыхаемой газовой смеси, включая ингаляционные анестетики. Разница между вды-
хаемой и выдыхаемой концентрациями анестетика отражает степень растворимо-
сти препарата в крови, а его концентрация в выдыхаемом газе коррелирует со
степенью анестезии.
Спектрометрия Raman позволяет проводить независимый анализ каждого вдыха-
емого газа, не повреждая его молекул, которые возвращаются в дыхательный контур.
Вентилометр, или респирометр, располагается в дыхательном контуре и определя-
ет дыхательный объем на выдохе, что является важным показателем при утечке газа.
Определение давления в дыхательных путях — необходимый метод во время
проведения наркоза с применением ИВЛ; позволяет определить разгерметизацию
дыхательного контура при резком снижении давления и обнаружить частичную
или полную обструкцию дыхательных путей или интубационной трубки при по-
вышении давления в дыхательных путях при неизмененном дыхательном объеме.
Давление в дыхательном контуре внезапно повышается при напряженном пнев-
мотораксе и эндобронхиальном смещении эндотрахеальной трубки.
9.2.3. Мониторинг кровообращения
Контроль за кровообращением во время анестезии является ос-
новным компонентом адекватного мониторинга за состоянием больного.
Таблица 9.2. Основные гемодинамические показатели
Показатель Нормальный показатель Диапазон колебаний в норме
Системное АД, мм рт. ст. 120/80 90-140/70-90
Среднее АД (САД), мм рт. ст. 93 77-97
ЧСС, в 1 мин 70 60-80
179
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 9.2
Показатель Нормальный : показатель Диапазон колебаний в норме
ЦВД, ммрт. ст. 5 0-10
Давление в правом желудочке, мм рт. ст. 25/5 15-30/0-10
Давление в легочной артерии, мм рт. ст. 23/10 15-30/5-15
ДЗЛА, мм рт. ст. 10 5-15
Среднее давление в левом предсердии, мм рт. ст. 8 4-12
Сердечный выброс, лхмин-1 5 4-6
Сердечный индекс, лхмин-1хм'! 3 2,2-4,2
Ударный объем, мл 70 60-90
Системное периферическое сопротивление, динхсхсм"6 1200 900-1500
Сопротивление легочных сосудов, динхсхсм"6 100 50-150
Мониторинг кровообращения осуществляют путем пальпации пульса, опре-
деляя ЧСС и пульсовые характеристики чаще на лучевой артерии, и измерения
АД методом Короткова, или неинвазивным аускультативным методом. Показатели
АД являются ведущими в гемодинамическом контроле над пациентом во время
общей анестезии. От уровня АД во многом зависит перфузия тканей, в том числе
мозга и миокарда, а большинство осложнений со стороны сердца возникают на
фоне артериальной гипо- или гипертензии.
Кроме метода Короткова достаточно широко распространен метод неинвазив-
ного автоматического определения АД, который основан на осциллометрии пульсо-
вой волны: микропроцессор определяет показатели САД, систолического и диасто-
лического АД. Для максимальной достоверности определения АД соблюдают ряд
условий: ширина манжеты должна быть на 40—50 % больше, чем диаметр конечно-
сти (при узкой манжете показатели завышены, при широкой — занижены); газ из
манжеты должен дефлироваться небыстро (при быстром выпускании газа показате-
ли занижены); при частом автоматическом определении АД может развиться ише-
мия конечности и даже компартмент-сицдром. Ограничением для автоматического
неинвазивного определения АД является состояние тяжелой гипоперфузии с рез-
ким снижением пульсового давления. Ошибки измерений возникают при непра-
вильной эксплуатации кардиомонитора, например, при попытке измерить следую-
щее значение АД, когда не произошла полная дефляция газа из манжеты. Необхо-
димо помнить о возможной разнице величин АД на правой и левой руках и о
влиянии на результаты измерения АД выраженного атеросклероза артерий.
Инвазивное определение АД позволяет получить более точные данные. Для
этого канюлируют лучевую (наиболее часто), плечевую, бедренную артерии или
артерию стопы. Обычно у взрослых используют канюлю 20 G, у детей — 22 G.
Катетер присоединяют посредством преобразователя к специальному порту кар-
диомонитора.
Показания к инвазивному определению АД: тяжелый шок, рефрактерный к объем-
ной нагрузке, операции на сердце и крупных сосудах, необходимость в частых
180
9, ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
заборах артериальной крови для анализа. Для максимальной достоверности пока-
зателей электрически сбалансированный преобразователь устанавливают на уров-
не правого предсердия по средней подмышечной линии; учитывают комплайенс,
помехи, резонанс, калибровку системы.
Осложнения инвазивного метода определения АД: кровотечение, гематома, тром-
боз артерии, ишемия конечности дистальнее катетеризации, инфицирование, га-
зовая эмболия. Риск развития одного из наиболее грозных осложнений — тромбо-
за артерии — возрастает с увеличением продолжительности нахождения катетера
в артерии, а также зависит от диаметра катетера, наличия заболеваний перифери-
ческих артерий, сахарного диабета, тяжелой гипотензии.
Для определения адекватности компенсации кровотока в дистальной части
руки перед катетеризацией лучевой артерии выполняют тест Аллена: больной
сжимает кисть в кулак, врач пережимает локтевую и лучевую артерии, затем кисть
расслабляют и восстанавливают кровоток в локтевой артерии. Адекватность кро-
вообращения определяют по времени восстановления цвета кожных покровов кисти:
если этот период не превышает 10 с, то коллатеральный кровоток кисти адеква-
тен. Не все специалисты признают прогностическую ценность этого теста [3].
После интубации трахеи за рубежом анестезиологи часто применяют эзофа-
галъный стетоскоп, с помощью которого своевременно определяют изменение
ритма сердца и ЧСС, нарушения вентиляции легких, обтурацию дыхательных путей.
ЭКГ-мониторинг, при котором ЭКГ-кривая постоянно фиксируется на дисп-
лее монитора, является золотым стандартом интраоперационного мониторинга.
ЭКГ-мониторинг дает возможность быстро определять нарушения ритма сердца,
ишемию миокарда (депрессию сегмента S—T), острые электролитные расстрой-
ства (прежде всего, концентрацию К'1'). Второе стандартное отведение используют
для определения нарушений ритма сердца, отведение V5 — для идентификации
ишемии. Чувствительность метода в идентификации составляет 75 %, а в сочета-
нии с данными II отведения возрастает до 80 % [2]. До 89 % диагностируемой на
ЭКГ ишемии миокарда определяют в отведении V5 [3]. В некоторых кардиомони-
торах возможен компьютерный анализ ЭКГ, в частности сегмента S—T, что позво-
ляет на ранних стадиях обнаруживать ишемию миокарда.
С помощью траисззофагальной эхокардиографии определяют региональное
нарушение моторики стенки желудочка (ишемию), фракцию выброса желудочка,
наличие воздуха в полостях сердца, эффекты анестетиков и действий хирурга на
функцию миокарда.
Катетеризацию центральных вен и измерение ЦВД используют для оценки воле-
мии, адекватности инфузионной терапии, необходимости применения кардиотони-
ческих и вазопрессорных препаратов. ЦВД — это гидростатическое давление крови
на уровне правого предсердия или близлежащих участков полых вен; показатель
отражает объем венозного возврата крови к правому предсердию, или преднагрузку
правого предсердия. Величина ЦВД зависит от ОЦК, ОПСС и сократительной спо-
собности правого желудочка. Низкое ЦВД (ниже 1 мм рт. ст.) свидетельствует о
выраженной абсолютной или относительной гиповолемии. Высокое ЦВД (свыше
Юммрт. ст., или 120 мм вод. ст.) свидетельствует о перегрузке жидкостью, недоста-
точности правого желудочка, повышении ОПСС или комбинации этих факторов.
Показатель ЦВД изменяется в зависимости от сердечного цикла.
Характер кривой, отражающей изменение величины ЦВД, и связь с сердечным
циклом представлены на рис. 9.7. Нормальная ЦВД-кривая состоит из 3 подъемов и
181
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 9.7. Кривая изменений величины ЦВД
и ее связь с сердечным циклом [1]
2 спусков. Форма кривой облегча-
ет анестезиологу оценить функцию
правого желудочка.
Показания к катетеризации
центральных вен и ЦВД-монито-
рингу: риск большой кровопотери
с необходимостью массивного вос-
полнения жидкостью, выраженная
гиповолемия, применение кардио-
и вазоактивных препаратов, уста-
новка катетера в легочной артерии,
установка трансвенозного водите-
ля ритма, введение больших ко-
личеств жидкости (парентеральное
питание, длительная внутривенная антибиотикотерапия), внутривенное введение
препаратов с раздражающим эффектом (гипертонические растворы и др.).
Для ЦВД-мониторинга катетеризируют, как правило, верхнюю полую вену
через подключичную и внутреннюю яремную вены, реже — через наружную ярем-
ную и локтевую базиллярную вены (табл. 9.3).
Таблица 9.3. Преимущества и недостатки венозного доступа при катетеризации
центральных вен
Методика катетеризации Преимущества Недостатки
Правая внутренняя яремная вена Сравнительная простота и надежность Пункция сонной артерии, травма плечевого сплетения, неудобства для пациента в сознании
Левая внутренняя яремная вена Сравнительная простота и надежность Пункция сонной артерии, травма плечевого сплетения, неудобства для пациента в сознании, повреждение грудного протока
Подключичная вена Вена сохраняет просвет даже при тяжелой гиповолемии Пневмоторакс, гемоторакс
Наружная яремная вена Пациенты лучше переносят процедуру в сознании Трудно провести катетер в центральную вену
Бедренная вена Поверхностное расположение, безопасность Тромбозы и инфекционные осложнения
Кубитальные вены Безопасность Иногда трудно провести катетер в центральную вену, флебиты
Несмотря на широкое распространение этой методики для проведения интра-
и послеоперационной внутривенной медикации, катетеризация центральных вен
сопровождается большим количеством осложнений, среди которых одним из наи-
более опасных и нередких остается катетер-ассоциированный сепсис.
182
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
Осложнения катетеризации центральных вен во время катетеризации: гемато-
мы, гематоракс, гемомедиастинум (часто при пункции артерии), повреждение лег-
кого с последующим пневмотораксом, подкожная и медиастинальная эмфиземы,
повреждения плечевого нервного сплетения, звездчатого узла, гортани и трахеи,
при пункции слева — повреждение грудного протока, хилоторакс, повреждение
полой вены.
Осложнения катетеризации центральных вен, связанные с нахождением кате-
тера в вене: газовая эмболия, нарушения ритма сердца, венозный тромбоз и тром-
бофлебит, повреждение катетера с эмболизацией его фрагментом, повреждение
вены с развитием гцдромедиастинума и гидроторакса.
Поздние осложнения катетеризации центральных вен: флебиты, бактериемия,
сепсис, псевдоаневризмы сосудов.
Lefrant J.Y. и соавторы [4] проанализировали факторы риска осложнений при
707 катетеризациях подключичной вены: 562 случая (79,5 %) выполнены успешно
без осложнений, в 67 случаях (9,5 %) попытки катетеризации оказались неудачны-
ми, 55 случаев (7,8 %) осложнились пункцией артерии, 22 случая (3,1 %) осложни-
лись пневмотораксом, 30 случаев (4,2 %) осложнились дистопией конца катетера.
Согласно исследованию, прогностическими факторами развития непосредствен-
ных осложнений оказались возраст пациента старше 77 лет и количество попыток
венопункции более одной.
С целью изучения осложнений катетеризаций центральных вен и легочной
артерии, Domino и соавторы [5] проанализировали закрытую базу данных ASA:
исследовали НО случаев (1,7 %) осложнений катетеризации центральных вен из
6449 случаев катетеризации центральных сосудов. Согласно исследованию, наи-
более частыми осложнениями оказались: эмболизация обрывком катетера (20 случа-
ев), тампонада сердца (16 случаев), пункция/катетеризация сонной артерии
(16 случаев), гемоторакс (15 случаев), пневмоторакс (14 случаев). Тампонада сер-
дца, гемоторакс и повреждение легочной артерии сопровождались более высокой
смертностью (р < 0,05) в сравнении с остальными осложнениями. Количество
осложнений в 1978—1983 годы составило 53 %, в 1994—1999 годы — 16 %.
Осложнения катетеризаций центральных вен привели к значительному огра-
ничению показаний к применению этого метода и замене его катетеризацией пе-
риферических вен, хотя и этот метод не лишен недостатков в виде частых и быстро
развивающихся флебитов и невозможности измерения ЦВД.
Kagel и соавторы [6] изучили осложнения катетеризаций периферических вен.
Согласно исследованию, наиболее часто осложнения катетеризации перифери-
ческих вен локализуются в области верхних конечностей, а женщины и пациенты
старшего возраста более восприимчивы к этим осложнениям. Осложнения катете-
ризации периферических вен довольно распространенное явление, которое при-
водит к увеличению затрат на лечение в результате длительной госпитализации,
дополнительной антибиотикотерапии и увеличения количества хирургических
вмешательств. Таким образом, обеспечение венозного доступа во время операции
и в послеоперационный период является серьезной и не полностью решенной
проблемой анестезиологии.
В 1970 году кардиологи Swan и Ganz совместно с коллегами предложили ме-
тод катетеризации легочной артерии специальным катетером для измерения пара-
метров центральной гемодинамики; впоследствии метод получил название Сван—
Ганза. Суть метода заключается во введении катетера с баллончиком на конце
через яремную или подключичную вены. Форму волны и давление мониторируют
183
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
по траектории движения катетера и через правое предсердие и правый желудочек
катетер вводят в легочную артерию. Используя метод Сван-Ганза, определяют
давление в легочной артерии и полостях сердца, давление заклинивания в легоч-
ных капиллярах, а также вычисляют сердечный выброс термодилюционным мето-
дом, сердечный индекс и ударный объем. ДЗЛА отражает конечнодиастолическое
давление в левом желудочке и его конечнодиастолический объем, то есть опреде-
ляет преднагрузку левого желудочка.
Показания к катетеризации легочной артерии: острая ишемия миокарда, по-
вреждение клапанов сердца, кардиогенный шок, обширные операции у пациентов
с тяжелыми сопутствующими заболеваниями, острый инфаркт миокарда (в тече-
ние предыдущих 6 месяцев перед операцией), острые нарушения моторики стен-
ки левого желудочка (аневризма), легочная гипертензия с недостаточностью пра-
вого желудочка, тяжелый сепсис, септический шок, тяжелые ожоги, акушерские
операции с высоким риском (тяжелый токсикоз, отслойка плаценты), тяжелая
травма, травматический шок, все операции на сердце и крупных сосудах, транс-
плантации легких и печени.
При нарушениях функции желудочков, особенно левого, и легочной эмболии
показатели ЦВД могут не коррелировать с показателем ДЗЛА (табл. 9.4). ДЗЛА
является более точным показателем, отражающим волемию, поэтому измерение
ДЗЛА предпочтительнее у больных с сердечной недостаточностью и тяжелой ги-
поволемией. Этот показатель информирует о возможности повышения уровня
конечнодиастолического давления в левом желудочке. При повреждении миокар-
да (ишемии, инфаркте, контузии, констриктивном перикардите) снижается растя-
жимость миокарда левого желудочка, поэтому показатель конечнодиастолическо-
го давления более чутко реагирует на повышение объема.
Таблица 9.4. Разница в показаниях ЦВД и ДЗЛА
Вид патологии ЦВД ДЗЛА
Гиповолемия г
Недостаточность левого желудочка г
Недостаточность правого желудочка г —
Эмболия легочной артерии —
Тампонада сердца г г
Осложнения катетеризации легочной артерии: суправентрикулярные аритмии,
фибрилляция предсердий, желудочковые аритмии, фибрилляция желудочков, по-
вреждение межжелудочковой перегородки, газовая эмболия, венозный тромбоз,
тромбоэмболии, перфорация легочной артерии с развитием гемомедиастинума,
повреждение трикуспидального клапана, смещение или отрыв катетера.
Относительные противопоказания к катетеризации легочной артерии: каогуло-
патии, острая тромбоцитопения, наличие эндокардиального водителя ритма, по-
вреждение трикуспидального клапана.
Chittock и соавторы [7] исследовали данные за 1988—1998 годы по положитель-
ным эффектам и осложнениям катетеризации легочной артерии у 7310 пациентов,
которые находились в критическом состоянии, и обнаружили, что катетеризация
184
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
легочной артерии уменьшает смертность в группе наиболее тяжелых больных на
фоне увеличении смертности в группе больных с более низкой степенью тяжести
болезни. Эти результаты подчеркивают необходимость учета тяжести болезни при
определении показаний к катетеризации легочной артерии.
9.2.4. Температурный мониторинг
Стабильное поддержание температуры тела осуществляется за счет
продукции тепла в результате метаболических процессов и теплоотдачи в окружа-
ющую среду. Гипоталамус выполняет терморегуляиионную функцию, которая зак-
лючается в контроле над метаболизмом, тонусом сосудов, гормональной и мы-
шечной активностями. При повышении температуры тела расширяются сосуды и
активируется потоотделение, при понижении — спазмируются сосуды и появляет-
ся дрожь (спонтанные асинхронные сокращения скелетных мышц), за счет чего
повышается метаболизм и, соответственно, теплопродукция.
Температурный мониторинг является обязательным компонентом интраопе-
рационного обеспечения, так как во время общей и регионарной анестезии всегда
высок риск избыточной потери тепла: состояние обездвиживания, особенно при
длительных полостных операциях, в значительной степени ограничивает способ-
ность организма самостоятельно регулировать температуру тела, тем более, при
прохладной температуре в операционной. У некоторых пациентов во время общей
анестезии, наоборот — появляется риск развития злокачественной гипертермии.
Рутинный интраоперационный температурный мониторинг осуществляют с
помощью электронных термометров (термистора и термопары). Термисторы со-
стоят из полупроводников, электрическая проводимость которых меняется в зави-
симости от температуры окружающей среды. Жидкостную кристаллоидную тех-
нологию используют в основном для определения поверхностной температуры
тела. Место расположения температурных датчиков зависит от вида операции,
анестезии и др. Противопоказаний к температурному мониторингу во время опе-
рации не существует, но не всем пациентам его проведение необходимо.
Данные температурных датчиков интерпретируют в зависимости от их места
расположения: кожная температура примерно на 3—4 °C меньше внутренней тем-
пературы, температура в аксилярной ямке на 1 °C меньше внутренней температу-
ры, ректальная температура медленно реагирует на изменения температуры внут-
ренних органов. Наиболее точно температуру крови отражает измеряемая в ниж-
ней трети пищевода. Из инвазивных методик наиболее точной является температура
в легочной артерии.
9.2.5. Мониторинг диуреза
Периоперационный мониторинг диуреза позволяет получать важ-
ную информацию о функции почек и почечном кровотоке. На функцию почек во
время операции и наркоза оказывают влияние артериальное давление, лекарствен-
ные средства (в том числе анестетики), манипуляции хирурга и др. Оценка диуре-
за. как единственного истинного показателя функции почек во время операции,
имеет важное значение для своевременной диагностики и коррекции нарушений.
Для определения диуреза используют трансуретральный катетер Фолея. Вели-
чину диуреза измеряют почасово путем прямого измерения объема мочи и, ис-
185
ОБЩАЯ АНЕСТЕЗИОЛОГИ»
пользуя компьютерный контроль, когда автоматически происходит измерение
объема диуреза через каждые 10 мин. Адекватный диурез составляет 0,5—1,0 мл/кг/ч.
Во время наркоза контролируют не только темп диуреза, но и характер мочи,
особенно при массивных гемотрансфузиях.
Интраоперационный мониторинг диуреза показан больным с тяжелыми заболе-
ваниями почек, сердца, при массивных гемотрансфузиях, операциях на сердце и круп-
ных сосудах, трансплантации органов, при операциях длительностью более 5 ч.
Катетеризация мочевого пузыря может осложниться травмой уретры и инфи-
цированием. Нозокомиальная (от лат. nosocomium — больница, от греч. nosokomeo -
ухаживать за больным) инфекция мочевыводящих путей вследствие катетериза-
ции является наиболее частым видом подобных инфекции в США, причем часто-
та возникновения бактериурии зависит от сроков катетеризации.
Следует помнить, что олигурия не всегда свидетельствует о нарушении функ-
ции почек, а нормальный диурез — не всегда о нормальной функции почек во
время операции.
9.2.6. Мониторинг состояния нервной системы
Основным параметром, определяющим адекватность мозговой
перфузии, является мозговое перфузионное давление (МПД), которое равно раз-
нице САД и ВЧД (норма ВЧД — 10—13 мм рт. ст.):
МПД = САД - ВЧД.
Снижение перфузии может привести к тяжелым последствиям функциониро-
вания головного мозга. Поскольку полость черепа является ограниченным про-
странством, то увеличение объема мозга приводит к увеличению давления, что
наблюдают при отеке, внутричерепных гематомах, выраженной церебральной ва-
зодилатации и др. Своевременный контроль изменений ВЧД часто является осно-
вой для лечения нейрохирургических больных.
Электроэнцефалография регистрирует электрическую активность коры голов-
ного мозга. Электроэнцефалограмма — кривая, полученная при регистрации ко-
лебаний электрического потенциала головного мозга через покровы головы. Кар-
тина ЭЭГ существенно изменяется под влиянием патологических процессов, при-
чем ее изменения зависят от тяжести и характера поражения мозга. По картине
изменений ритмов биопотенциалов коры выявляют очаговые нарушения, вызван-
ные локальным патологическим процессом. ЭЭГ помогает оценить состояние мозга,
что особенно важно у тяжелых больных, пострадавших от черепно-мозговой трав-
мы, в ранние сроки после внутричерепных кровоизлияний, в остром периоде пос-
ле нейрохирургических вмешательств. Данные ЭЭГ достаточно сложно интерпре-
тировать, поэтому в последнее время становится популярным компьютерный ана-
лиз ЭЭГ.
Сигналы нормальной электроэнцефалограммы симметричны в обеих геми-
сферах. В зависимости от частоты колебаний различают альфа-ритм (8-13 Гц),
бета-ритм (более 13 Гц), тета-ритм (4—7 Гц), дельта-ритм (менее 4 Гц). В условиях
бодрствования доминирующим является бета-ритм, который характеризуется вы-
сокой частотой и низкой амплитудой волн. При глубокой анестезии превалируют
низкочастотные ритмы.
Типичными состояниями, определяемыми на ЭЭГ, являются: наличие со-
знания, отсутствие сознания, сон, кома. Информативность ЭЭГ ограничена, тем
186
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
не менее, ее данные позволяют анестезиологу судить о глубине анестезии, кор-
ректировать дозу анестетиков, прогнозировать и определять развитие ишемии (на-
пример, при каротидной эндартериоэктомии или экстракорпоральном кровооб-
ращении).
Влияние на характер кривых ЭЭГ ингаляционных анестетиков изофлюрана,
десфлюрана и севофлюрана очень сходно. С увеличением их дозы наступает то-
тальная супрессия на ЭЭГ. Такие же эффекты наблюдают при увеличении доз
барбитуратов, пропофола и этомидата. Опиоиды, бензодиазепины и другие инга-
ляционные анестетики оказывают различный эффект на ЭЭГ-сигнал.
Ряд показателей ЭЭГ, получаемых с электродов на лобной и височной облас-
тях, подвергают биспектральному анализу и получают показатель биспектралыюго
индекса (БИ). Мониторинг биспектрального индекса (табл. 9.5) — это алгоритм
перевода данных ЭЭГ в цифровое выражение каждые 30 с. Биспектральный ин-
декс позволяет ранжировать изменения на ЭЭГ от 0 до 100 баллов. Его величина
обратно коррелирует со степенью седации и гипнотического эффекта: чем ниже
индекс, тем больше степень седации пациента.
Таблица 9.5. Мониторинг биспектрального индекса [8]
Величина БИ Клинический статус
100 Бодрствование
70-90 Легкая гипнотическая стадия
60-70 Легкая/средняя седация
45-60 Средняя гипнотическая стадия
менее 40 Глубокая гипнотическая стадия
1 Изоэлектрическая ЭЭГ
Мониторинг БИ помогает анестезиологу оценивать степень гипнотического
эффекта и подбирать дозу анестетика, тем не менее, по показателю БИ невозмож-
но определить, например, гемодинамическую реакцию больного на хирургичес-
кую манипуляцию. При использовании только ингаляционной анестезии, напри-
мер изофлюраном, информативная ценность БИ выше, чем при использовании
внутривенной анестезии, включающей опиоиды.
Данные исследования [9] продемонстрировали, что применение капнографии
и биспектрального индекса в качестве дополнения к стандартному мониторингу у
детей в амбулаторных условиях облегчают эффективную безопасную седацию во
время проведения процедур: позволяют рано диагностировать гиповентиляцию и
снижают риск чрезмерной седации. По-видимому, эти исследования справедливы
и для взрослых.
Метод вызванных потенциалов (ВП) — это метод регистрации биоэлектричес-
кой активности мозга, изменения которой обусловлены внешним воздействием и
фиксируются в относительной временной близости с этим воздействием. На ос-
новании данных метода ВП строят гипотезы относительно восприятия, внимания,
интеллекта, функциональной асимметрии мозга и индивидуальной психофизио-
логической дифференциации. В анестезиологии метод ВП позволяет оценить фун-
кциональную активность нервных путей во время анестезии.
187
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Вызванные потенциалы классифицируют на сенсорные и двигательные. Сен-
сорные ВП применяют для мониторинга во время операций: стимулируют чув-
ствительный нерв частотой 1—2 Гц и определяют изменения электрической актив-
ности, которую регистрируют поверхностным кожным или подкожным игольча-
тым электродом. Наиболее часто используют медиальный, локтевой,
промежностный или задний большеберцовый нервы. Ингаляционные анестетики,
опиоиды и гипотермия изменяют латентный период и амплитуду ВП. Этот метод
востребован в нейрохирургии, особенно при операциях на спинном мозге.
Carter B.G. и Butt W. [11] при проведении систематического обзора установи-
ли, что соматосенсорные ВП являются лучшим отдельным предиктором результа-
та после тяжелой травмы мозга. В литературе достаточно данных, чтобы использо-
вать этот метод для прогнозирования результатов при внутричерепной патологии
в клинической практике.
Контроль метаболизма мозга проводят путем определения парциального дав-
ления кислорода в ткани мозга, сатурации крови из яремной вены, транскрани-
альной церебральной оксиметрии.
9.3. ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ
ВО ВРЕМЯ ОПЕРАЦИИ
В оценку предоперационного состояния обязательно входит кон-
троль над состоянием жидкостного баланса пациента и, если необходимо, его
коррекция (раздел 3.1.5). Инфузионно-трансфузионная терапия во время опера-
ции поддерживает нормальный внутрисосудистый объем крови, от которого за-
висит качество перфузии тканей. Объем восполнения жидкости зависит от объе-
ма интраоперационной кровопотери и потери жидкости вследствие перспира-
ции, потоотделения, диуреза (табл. 9.6). Все потери жидкости должны быть
возмещены, потому что гиповолемия во время операции связана с большим рис-
ком развития тяжелых осложнений — артериальной гипотензии, ишемии мозга
и миокарда, вплоть до остановки кровообращения. Интраоперационная гипово-
лемия является частой потенциальной причиной дисфункции органов, увеличи-
вает риск послеоперационных осложнений, продолжительность госпитализации
и летальность [11].
Таблица 9.6. Объем периоперационной внутривенной инфузионной терапии
в зависимости от степени травматизации [1]
Характер оперативных вмешательств Объем инфузий, мл/кг/ч
Нетравматичные операции без кровопотери 2
Малотравматичные операции 3-4
Операции средней травматичности 5-6
Операции высокой травматичности (полостные, большой продолжительности) 7-8
Для инфузионной терапии во время операций используют кристаллоидные
растворы, прежде всего изотонический раствор натрия хлорида и Рингер-лактат.
188
9, ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
В случае повышения температуры тела объем потери жидкости возрастает, что
учитывают при определении объема инфузии. Поскольку дети более чувствитель-
ны к дефициту калорий, в состав инфузионных сред включают глюкозу.
9.3.1. Оценка адекватности
периоперационной инфузионной терапии
Считают, что ОЦК приблизительно равен 7 % массы тела у муж-
чин и 6,5 % — у женщин. Адекватность периоперационной жидкостной ресусци-
тации оценивают по многим клиническим и лабораторным показателям, включая
ЧСС, АД, диурез, pH крови и показатель количества оснований.
Тахикардия и артериальная гипотензия являются чувствительными, но неспе-
цифичными симптомами гиповолемии, так как во время операции большое коли-
чество причин могут вызывать эти состояния. Необходимо отметить, что отсут-
ствие тахикардии и гипотензии во время операции и наркоза свидетельствуют о
маловероятном выраженном недовосполнении жидкостью.
Если диурез нормальный, отсутствуют метаболические расстройства КОС и не
повышен уровень лактата в крови, то считают, что серьезного дефицита жидкости в
организме нет и перфузия тканей адекватная. При отсутствии глюкозурии темп
мочеотделения 0,5—1,0 мл/кг/ч свидетельствует об адекватной перфузии почек.
Дебаты относительно количества и разновидности растворов, применяемых
для восстановления объема жидкости во время обширных операций, продолжают-
ся [12]. Знания об эффектах переливания различных растворов увеличились за
последние годы. При выборе типа раствора в разнообразных клинических ситуа-
циях анестезиолог может руководствоваться пониманием физико-химических и
биологических свойств различных кристаллоидных и коллоидных растворов. Су-
ществует незначительное количество полезных клинических данных о результатах
принятия решения относительно состава инфузионной терапии. На современном
этапе бесспорным остается лишь утверждение о возможности переливания взрос-
лым во время операции только кристаллоидных и коллоидных растворов, а не
растворов глюкозы. По данным Sicardi S.Z. и соавторов [52], толерантность к глю-
козе прогрессивно снижается с увеличением продолжительности и травматичнос-
ти операции.
Объем переливаемой жидкости также является спорным вопросом. Результа-
ты многих клинических исследований поддерживают подход, основанный на дос-
тижении максимального ударного объема левого желудочка и недопустимости
переливания избыточного объема жидкости и чрезмерного увеличения работы
левого желудочка [32]. Важным подспорьем в определении адекватности воспол-
нения жидкостью при выраженной гиповолемии являются показатели ДЗЛК и
ЦВД, которыми руководствуются при выборе темпа инфузии.
Magner и соавторы [13] отмечают, что внутривенное введение натрия лактата
в дозе 30 мл/кг здоровым женщинам при гинекологической лапароскопии умень-
шило инцидентность рвоты, тошноты и необходимости применения противорвот-
ных средств по сравнению с введением жидкости в дозе 10 мл/кг. По данным Gan
и соавторов [11], контролируемое интраоперационное введение жидкости приво-
дит к более раннему восстановлению функции кишечника, снижению частоты
послеоперационной тошноты и рвоты и уменьшению продолжительности после-
операционного пребывания в стационаре.
189
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Возросло количество сообщений об увеличении послеоперационной заболе-
ваемости и летальности по причине чрезмерной внутрисосудистой инфузии во
время операции [12]. Brandstrup и соавторы [14] считают важным фактором умень-
шения риска осложнений, в частности при колоректальной резекции, режим ог-
раниченного периоперационного внутривенного введения жидкости, нацеленного
на сохранение стабильного веса тела (массивная инфузионная терапия в случаях
большой операции приводит к увеличению веса тела на 3-6 кг). Обнаружена связь
между послеоперационным увеличением веса и плохой выживаемостью, а также
перегрузкой жидкостью и осложнениями. Авторы приводят данные, что ограни-
ченный внутривенный режим введения жидкости достоверно уменьшает риск после-
операционных осложнений (33 против 51 %, р = 0,013). Согласно исследованию,
количество осложнений со стороны сердца и легких (7 против 24 %, р = 0,007), а
также количество осложнений заживления ран (16 против 31 %, р = 0,04) значи-
тельно меньше в группе рестриктивного инфузионного режима.
Fraind и соавторы [15] считают, что пересмотр подходов к внутривенному
применению лекарственных средств и жидкостей улучшает результаты анестезии.
Избыточное введение лекарственных средств и жидкости они определили в 50 и
75 % случаев анестезии при экстракардиальных и кардиальных вмешательствах,
соответственно. По мнению авторов, адекватное внутривенное введение лекар-
ственных средств и жидкостей составляет значительную часть лечения во время
анестезии, особенно в сложных случаях. Применяемые методы часто неэффек-
тивны и приводят к медицинским ошибкам. Авторы считают, что существует ре-
альная возможность улучшить качество и снизить стоимость лечения, пересмот-
рев методы внутривенной медикации во время анестезии. Опубликованные дан-
ные дают основания предположить, что разумная периоперационная инфузионная
терапия улучшает результаты после обширных операций на желудке и кишечнике.
Наблюдаемые преимущества не могут быть отнесены исключительно к ограниче-
нию переливания кристаллоидов, а имеют отношение и к использованию коллои-
дов. Сбалансированный подход в инфузионной терапии предполагает применение
коллоидов с целью обеспечения гемодинамической стабильности и кристалло-
идов — с целью поддержания водно-электролитного баланса и диуреза (0,5 мл/кг/ч).
Потерю крови восполняют коллоидами по принципу “один к одному”.
Ранее разработанные алгоритмы, предполагающие восполнение потерь жид-
кости с диурезом в третье пространство, оказались ненужными [12]. Авторы сде-
лали заключение, что уменьшение объема переливаемых кристаллоидов можно
использовать у больных с интраоперационной стабильностью гемодинамики, при
этом избегая восполнения потерь в третье пространство.
Несомненно, необходимы дальнейшие исследования для выбора критериев
определения оптимального объема инфузии жидкости во время операции, однако
уже сейчас можно рекомендовать стратегию разумной достаточности объема ин-
фузионной терапии, основываясь на современном мониторинге.
9.3.2. Оценка объема кровопотери
У здорового пациента возникают клинические признаки крово-
потери и гиповолемии при потере около 20 % ОЦК. Восполнение необходимо
начинать ранее, так как уже при 10 % потери ОЦК возникают признаки гипопер-
фузии тканей, требующие коррекции.
190
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИВО1ВРЕМЯ ОПЕРАЦИИ
Определить точный объем кровопотери во время операции достаточно слож-
но. В таблице 9.7 приведены общепринятые методы определения объема кровопо-
тери и их недостатки [20].
Таблица 9.7. Методы оценки кровопотери
Метод Недостатки
Оценка наружной кровопотери Не учитывает кровопотерю вследствие гемолиза и образования гематом
Зрительный контроль Субъективный метод
Взвешивание сгустков крови и салфеток с кровью Не учитывает изменение содержания гемоглобина в истекающей крови и сгустках; ошибка за счет испарения
Балансовый метод Не учитывает эритропоэз
Измерение содержания гемоглобина в крови до и после кровопотери Подразумевает постоянный ОЦК и гомогенное распределение эритроцитов
9.3.3. Гемотрансфузии
Независимо от методов оценки кровопотери, необходимость ге-
мотрансфузий зависит от определяемых уровней гемоглобина и гематокрита, а не
от объема потерянных эритроцитов.
Принципы восполнения гиповолемии путем гемотрансфузий остаются такими
же, как приведено выше, но с тщательным определением показаний к ним. Отри-
цательное воздействие гемотрансфузий на результаты лечения больных, механизмы
компенсации доставки кислорода при нормоволемической гемодилюции, показа-
ния к гемотрансфузиям рассмотрены в “Руководстве по интенсивной терапии” [16].
После коррекции гиповолемии, как правило, развивается нормоволемичес-
кая анемия. Клиническое значение уменьшения концентрации гемоглобина со-
стоит в снижении общей или региональной доставки кислорода с развитием ги-
поксии тканей. Этот индивидуальный порог для каждого пациента зависит от спо-
собности компенсировать пониженное содержание кислорода в крови. Поэтому
физиологические показания к гемотрансфузии основывают на показателях кон-
центрации гемоглобина, но необходимо помнить, что этот показатель не учитыва-
ет индивидуальный резерв каждого пациента [17].
Показанием к интраоперационным гемотрансфузиям остается показатель концен-
трации гемоглобина менее 70—80 г/л. Уровень менее 60—70 г/л сопровождается увели-
чением осложнений и смертности, особенно у больных пожилого возраста, с высокой
оценкой по APACHE II, сопутствующими заболеваниями сердца и сосудов. Снижение
гемоглобина на 10 г/л ниже уровня 80 г/л сопровождается увеличением летальности в
2,5 раза [18]. Увеличение риска ишемии миокарда во время операции у больных с ИБС
при снижении гематокрита ниже 0,28 отмечают Nelson и соавторы [19].
Периоперационное переливание крови является фактором риска неблагопри-
ятного результата после операции, поэтому необходимо чаще использовать мето-
ды сохранения крови, особенно у пациентов, которым требуются незначительные
по объему гемотрансфузии [21].
191
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
9.3.4. Методы ограничения
интраоперационной кровопотери [22]
Методы ограничения интраоперационной кровопотери в предопера-
ционный период: назначение рекомбинантного эритропоэтина человека, назначе-
ние лекарственных средств — препаратов железа, фолиевой кислоты и др., плани-
рование хирургического вмешательства по стадиям, артериальная эмболизация,
предоперационная заготовка крови больного, своевременная диагностика и лече-
ние коагулопатий.
Методы ограничения интраоперационной кровопотери в интраоперационный пе-
риод: нормо-, изо- или гиперволемическая гемодилюция, оценка устойчивости к
анемии, реинфузия крови (с отмыванием эритроцитов и без), управляемая гипо-
тензия, гипотермия, антифибринолитические средства и факторы свертывания.
Методы ограничения интраоперационной кровопотери в послеоперационный пе-
риод: реинфузия крови, назначение рекомбинантного эритропоэтина человека, сво-
евременная повторная операция в случае продолжающегося кровотечения.
Усиление кровеобразующей функции. Дооперационное назначение рекомби-
нантного человеческого эритропоэтина (ЭПО) в качестве монотерапии или в ком-
бинации с дооперапионным забором аутогенной крови стимулирует эритропоэз,
помогает избегать или уменьшает потребность в переливаниях аллогенной крови.
В литературе описаны клинические свидетельства эффективности дооперацион-
ного использования ЭПО при ортопедических, кардиальных, онкологических и
других видах операций [23]. Авторы сообщают о высокой эффективности ЭПО в
дозах 150-300 ЕД/кг в предоперационной подготовке больных с исходной анемией
и предполагаемой большой кровопотерей. Четкие рекомендации по дозировке
препарата пока отсутствуют.
Karkouti и соавторы [24] предложили схему введения ЭПО при ортопедических
операциях. У пациентов с исходным уровнем гемоглобина менее 130 г/л применяли
1—3 подкожных введения ЭПО каждые 3—7 дней перед операцией (20 000 ЕД у боль-
ных массой 70 кг, 40 000 ЕД у больных массой более 70 кг). После такого лечения
частота гемотрансфузий во время операций уменьшилась с 56,1 % у больных, не
получавших ЭПО, до 16,4 % (р < 0,0001) у пациентов, которые получали ЭПО по
схеме. Назначение ЭПО рекомендуют при нормоволемической гемодилюции.
К сожалению, ограничением к применению ЭПО является высокая стоимость
препарата. В 15—30 % случаев без препаратов железа, фолиевой кислоты и вита-
минов применение ЭПО является неэффективным [25], поэтому для максималь-
ного эффекта используют комбинации этих препаратов.
Своевременная диагностика и лечение коагулопатий. Сбор анамнеза перед опера-
цией о кровотечениях во время предыдущих операций, нарушениях свертываемос-
ти крови, патологическом образовании гематом, носовых и желудочных кровотече-
ниях наряду с проведением лабораторных тестов является эффективным средством
пооперационной диагностики риска кровотечений во время операции с необходи-
мой последующей коррекцией в случаях нарушений гемостаза у пациента.
Переливание ранее заготовленной аутогенной крови во время операции по-
зволяет избежать осложнений при гемотрансфузиях с использованием аллогенной
крови. Существует несколько методов заготовки крови.
Метод предоперационной нормоволемической гемодилюции (НГ). При исполь-
зовании этого метода показатель исходного гемоглобина должен быть не менее
192
^ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
ПО г/л, предельный уровень гематокрита — не менее 0,25 л/л. Производят забор
крови по 200—250 мл 2—3 раза перед операцией с восполнением ОЦК кровезаме-
нителями, при этом больным назначают препараты, способствующие кроветворе-
нию (липоевую кислоту, препараты железа, эритропоэтин).
Метод предоперационной острой нормоволемической гемодилюции (ПОНГ). За-
бор крови производят сразу после индукции в наркоз из артериальной или веноз-
ной канюли в стерильный контейнер с антикоагулянтом. Поддерживают нормо-
волемию с помощью инфузии коллоидных и кристаллоидных растворов. Объем
забранной крови зависит от исходных показателей гемоглобина и гематокрита:
как правило, нижней границей являются уровень гемоглобина 100 г/л и гематок-
рита — 0,30 л/л. После выполнения основного этапа операции (или по показани-
ям) и остановки кровотечения забранную кровь возвращают больному.
Эффективность ПОНГ остается невыясненной из-за недостатка правильно
организованных проспективных рандомизированных контролированных исследо-
ваний, поэтому пока его невозможно рекомендовать в качестве рутинного для
уменьшения гемотрансфузий. По результатам обширного прагматического иссле-
дования ПОНГ не влияла на частоту аллогенных гемотрансфузий при больших
операциях на желудочно-кишечном тракте. Предоперационный уровень гемогло-
бина, кровопотеря и протокол трансфузии были ключевыми факторами, влияю-
щими на частоту аллогенных гемотрансфузий [26].
Методы реинфузии крови. Широкое распространение для реинфузии крови
получают специальные аппараты селл-сейверы, но их применение ограничено вы-
сокой стоимостью самого аппарата и фильтров. Противопоказаниями для реин-
фузии крови считают инфекционный и онкологический процессы.
Интраоперационная аутогемотрансфузия. Кровь собирают из раны, отмывают
эритроциты и возвращают больному. Этот метод позволяет возвращать лишь 50 %
собранных эритроцитов, остальные подвергаются гемолизу или теряются по дру-
гим причинам [20].
Послеоперационная аутогемотрансфузия. Профильтрованную кровь, излившу-
юся из раны, возвращают пациенту. Затрудняет методику малая скорость транс-
фузии фильтрационных систем, а при большой кровопотере это недопустимо.
Перспективным считают использование новых фильтров фирмы Pall с более вы-
сокой скоростью фильтрации [22].
Управляемая гипотензия. Метод внедрен в практику в 1948 году Griffits Gillie.
Цель управляемой гипотензии (УГ) — создание “сухого” операционного поля, УГ
чаше используют при некоторых нейрохирургических вмешательствах, микрохи-
рургии среднего уха, пластических и ортопедических операциях, при редкой груп-
пе крови пациента. УГ используют для уменьшения давления в области сосудис-
того анастомоза либо в месте клипирования аневризмы.
При методе управляемой гипотензии САД поддерживают в пределах 50—
60 мм рт. ст. у больных без тяжелых сопутствующих заболеваний со стороны
сердечно-сосудистой и нервной систем и 60-70 мм рт. ст. у тщательно отобранных
пожилых больных. Безопасный уровень АД до сих пор остается нерешенным воп-
росом. Теоретически, управляемое снижение АД не должно приводить к ишемии
органов и тканей, так как параллельно со снижением АД снижается и сосудистое
сопротивление. Применение УГ требует очень качественного мониторинга функ-
ций сердечно-сосудистой системы, почек, оксигенации. При обнаружении ише-
мии мозга или миокарда немедленно повышают уровень АД до нормальных вели-
чин. Обязательное условие проведения УГ — это своевременное восполнение ОЦК,
7 7-585
193
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
так как если возникнет гиповолемия, то ишемии органов избежать не удастся. Для
достижения эффекта УГ область операции располагают выше, чем остальные уча-
стки тела.
Лекарственные средства для проведения управляемой гипотензии
Нитроглицерин —- нитрат с хорошо управляемым эффектом при внутривенной
инфузии. Имеет короткий период полураспада, не токсичен, снижает преднагруз-
ку, увеличивает церебральный кровоток. При низкой эффективности повышают
дозу препарата.
Натрия нитропруссид — высокоэффективный периферический вазодилататор.
Обладает быстрым началом действия и высокой управляемостью вследствие ко-
роткого периода полураспада. Снижает постнагрузку, обладает артериодилатаци-
онным эффектом. Недостатком является образование токсических метаболитов,
быстрая тахифилаксия, синдром отмены. Примерная дозировка: 3—8 мкг/кг/мин.
Эсмолол — селективный p-адреноблокатор с коротким периодом полураспада.
Не расширяет сосуды мозга, не образует токсические метаболиты, отсутствует
синдром отмены. Используют при нейрохирургических вмешательствах. Пример-
ная дозировка: 1 мг/кг — начальная болюсная доза с последующей скоростью
инфузии 0,5 мг/кг/мин.
АТФ и гидралазин. Для достижения целевого САД дополнительно болюсно
вводят 50—100 мг лабеталола.
Ингаляционные анестетики. В больших дозах применяют для создания УГ при
глубоком ингаляционном наркозе. Эту методику применяют кратковременно и
только на определенных этапах операции.
Ганглиоблокаторы, в частности — арфонад. Популярность этого препарата на
современном этапе уменьшается, впрочем, как и блокаторов а,-адренорецепторов
(фентоламина).
Осложнения управляемой гипотензии: ишемия миокарда, инфаркт миокарда,
ишемия головного мозга, отек мозга, тромбоз сосудов, ОПН, массивное кровоте-
чение после восстановления АД. Осложнения развиваются редко, но описаны ле-
тальные исходы.
Противопоказания к проведению управляемой гипотензии: выраженный атеро-
склероз сосудов, ИБС, заболевания клапанов сердца, нарушения церебрального
кровообращения, инсульты в анамнезе, выраженная гипертензия, беременность,
анемия и гиповолемия, заболевания печени и почек, глаукома с приемом ганглио-
блокаторов.
Поданным исследования [27], восполнение коллоидным раствором HES 130/0,4
для гемодилюции сохраняет почечную функцию в большей степени, чем воспол-
нение физиологическим раствором в условиях управляемой гипотензии.
Применение лекарственных средств с целью уменьшения кровопотери. Применя-
ют антифибринолитические средства: эпсилон-аминокапроновую кислоту, тра-
нэксамовую кислоту, апротинин [31], а также десмопрессин — синтетический аналог
антидиуретического гормона, который стимулирует высвобождение фактора фон
Виллебранда и фактора VIII.
При развившейся или исходной коагулопатии для нормализации гемостаза и
уменьшения кровопотери с успехом применяют рекомбинантный активирован-
ный фактор VII (НовоСевен). В литературе появились сообщения об эффективно-
сти этого препарата для остановки кровотечения у больных без коагулопатии.
Создаются новые методы, уменьшающие объем кровопотери во время опера-
ции, в частности — сварочная технология выполнения операций, которую разраба-
194
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
тывают украинские хирурги совместно со специалистами Института электросвар-
ки им. Б. Патона. Кроме этого, применяют новые гемостатические местные пре-
параты, основанные на фибриновом клее, коллагене, желатине-тромбине [28, 29].
В последние годы в литературе появились сообщения о высокой эффективности
местного применения заплаты из N-ацетил-глюкозамина для остановки кровоте-
чения из селезенки [30]. Используют методы эмболизации артерий селезенки,
печени, сосудов таза.
9.4. ОСЛОЖНЕНИЯ ВО ВРЕМЯ ОПЕРАЦИИ
9.4.1. Остановка сердца и интраоперационная смерть
Наиболее тяжелыми осложнениями во время операции являются
остановка кровообращения и интраоперационная смерть. Причины этих ослож-
нений преимущественно анестезиологические и/или хирургические. Часто иден-
тифицировать основную причину, а следовательно, и “вину” анестезиолога или
хирурга достаточно трудно, поэтому нести ответственность за интраоперацион-
ную смерть должна вся оперирующая бригада. Каждый случай нуждается в тща-
тельном анализе и выработке мероприятий, которые в дальнейшей работе сокра-
тят риск возникновения подобных осложнений. К сожалению, часто патологоана-
томы или судмедэксперты не дают однозначный ответ о причине смерти во время
операции в случае, когда это неясно по клиническому анализу, и, таким образом,
этиология осложнения остается гипотетической.
В зарубежной литературе периоперационная смертность включает случаи ин-
траоперационных остановок сердца и летальные исходы в течение операции и
операционных суток.
Периоперационную смертность в хирургии, акушерстве и гинекологии регис-
трируют крайне редко [33], в основном — при ургентных вмешательствах.
Частота периоперационных остановок сердца составляет по данным Newland
М.С. и соавторов 19,7 на 10 000 анестезий [34] (табл. 9.8). Согласно исследованию,
чаще остановку сердца фиксировали у пожилых людей (р = 0,0002), пациентов
мужского пола (р = 0,07), с высоким статусом по ASA (68 % при ASA IV—V,
р = 0,0001), при экстренных операциях (р = 0,0001), торакальных (включая кар-
диальные) и верхних брюшных операциях (р = 0,0001), длительных операциях
(р = 0,0002), операциях, выполняемых во второй половине дня (р = 0,0001). Ста-
тус по ASA и экстренность операции были самыми значимыми предикторами
риска остановки кровообращения во время операции. Исследование подтвердило,
что статистически риск остановки сердца не зависит от вида анестезии, хотя недо-
стоверно он выше при общей анестезии.
Т а б лица 9.8. Интраоперационные остановки сердца и летальные исходы
в зависимости от вида хирургического вмешательства [34]
Причина остановки сердца Остановки сердца, % Летальность, %
Травма (ДТП, огнестрельные ранения, падения с высоты) 21,7 75
Трансплантация печени 19,4 100
195
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Продолжениение табл. 9.S
Причина остановки сердца Остановки сердца, % Летальность, %
Невозможность восстановить сердечную деятельность после АИК 16,3 76
Операции на сердце 7,0 100
Ушивание аневризмы аорты 7,0 100
В независимом обзоре Комиссии по изучению анестезиологических остано-
вок сердца описаны 144 остановки сердца при 72 959 анестезиях в одном академи-
ческом медицинском центре в течение 10 лет (15.08.1989-14.08.1999) [34]. Комис-
сия обнаружила, что 15 случаев остановок сердца были связаны с анестезией, из
которых по причинам интраоперационной медикации — 40 %, из-за осложнений,
связанных с центральным венозным доступом — 20 %, из-за нарушения вентиля-
ции — 20 %, по неизвестным причинам или возможной вагусной реакции — 13 %,
из-за периоперационного инфаркта миокарда — в единственном случае.
Остановки сердца, связанные с анестезией, были изучены в 1985 году Keenan R.L.
и Boyan С.Р. [35]. Авторы проанализировали все случаи остановок сердца в уни-
верситетском госпитале за 15-летний период и выяснили, что риск у пациентов,
которых оперировали по неотложным показаниям, в 6 раз выше, чем при плано-
вых операциях; 60 % случаев связанных с анестезией остановок сердца происхо-
дили в течение фазы индукции в наркоз.
В 1988 году датские авторы Olsson G.L. и Hallen В. [36] сообщили об анализе
случаев остановок сердца во время анестезии, используя компьютерный анализ
250 543 анестезий. Согласно исследованию, из 170 интраоперационных остано-
вок сердца 115 были связаны с анестезией, таким образом, инцидентность соста-
вила 6,8 остановок сердца на 10 000 анестезий. Было зарегистрировано 9 смер-
тельных исходов, связанных с анестезией, с инцидентностью 0,3 на 10 000 анесте-
зий. Самыми частыми причинами были нарушения вентиляции, асистолия после
введения сукцинилхолина и гипотензия после индукции.
Французские авторы [37] проанализировали 101 769 анестезий (за 2001 год) и
обнаружили 11 интраоперационных остановок сердца; инцидентность составила
1,1 на 10 000 анестезий, смертность — 0,6 на 10 000. При этом 3 случая были
полностью связаны с анестезией, а 8 — частично; 13,7 % случаев интраоперацион-
ных остановок сердца произошли у пациентов со статусом ASA I.
Британские авторы White S.M. и Akerele О. [38] зарегистрировали 15 случаев
остановок сердца, связанных с анестезией, при изучении 72 959 анестезий за 10 лег
в университетском госпитале высокоспециализированной медицинской помощи
(табл. 9.9). Причины, связанные с медикацией, вентиляцией и осложнениями цен-
трального венозного доступа, составили 80 % всех остановок сердца. Инцидент-
ность остановок сердца, относящихся к анестезии, составила 0,69 на 10 000 анес-
тезий, а летальных исходов, связанных с анестезией, — 0,55 на 10 000 анестезий.
При этом 20 % смертей происходили при плановых операциях, 78 % — при экст-
ренных вмешательствах. Согласно исследованию, 16 % смертей были идентифи-
цированы как предотвратимые, 55 % — как непредотвратимые; 35 % британских
анестезиологов заявили о своей персональной ответственности за смерть пациен-
та, 63 % — отрицали такую ответственность.
196
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
Таблица 9.9. Интраоперационные летальные исходы в зависимости от вида
экстренного хирургического вмешательства [38]
Вид хирургического вмешательства Интраоперационные летальные исходы, %
На крупных сосудах 41
Травма 15
Общая хирургия 14
Кардиальные 8
На печени 3
Урология 2
Педиатрия 2
Акушерство и гинекология 2
Нейрохирургия 2
ЛОР 2
Западный австралийский Анестезиологический Комитет Смертности проана-
лизировал данные периоперационной смертности с 1980 по 2002 год [39], согласно
которым в середине 1980-х годов уменьшился показатель смертности, связанной с
анестезией; с того момента этот показатель не претерпел существенных изменений.
Согласно исследованию, современные показатели анестезиологической смертности
чрезвычайно низкие (менее 1:50 000 хирургических операций в год) и подобны
показателям, о которых сообщают из других австралийских регионов.
Бразильские авторы [40] изучили инцидентность и причины периоперацион-
ных остановок кровообращения и смертей в одной из районных больниц за
9-летний период. Из 53 718 анестезий авторы зарегистрировали 186 остановок сер-
дца (34,6 на 10 000) и 118 смертельных случаев (21,97 на 10 000). Исследование
позволило определить основные факторы риска остановки сердца: младенческий
(новорожденные, дети до 1 года) и пожилой возраст (р < 0,05), мужской пол с ASA
III или выше (р < 0,05), операции по неотложным показаниям (р < 0,05), опера-
ции под общей анестезией (р < 0,05). Статус пациента был основной причиной
остановки сердца или смерти (р < 0,05). Авторы обнаружили 18 связанных с ане-
стезией остановок сердца (3,35 на 10 000), из них 10 случаев были полностью
связаны с анестезией (1,86 на 10 000), 8 случаев — частично (1,49 на 10 000).
Было определено 6 связанных с анестезией смертельных случаев (1,12 на 10 000),
из них 3 случая были полностью связаны с анестезией, 3 случая — частично (0,56
на 10 000 в обоих случаях). Главными причинами связанных с анестезией остано-
вок сердца были расстройства дыхания (55,5 %) и проблемы медикации (44,5 %).
Анализ вышеприведенных данных свидетельствует, что периоперационные
остановки сердца и летальные исходы регистрируют редко. Увеличен риск этих
осложнений у новорожденных, младенцев, пожилых и у пациентов мужского пола
с тяжелой степенью течения основного заболевания, а также при неотложных
операциях. Большинство связанных с анестезией остановок сердца связаны с на-
рушением обеспечения проходимости дыхательных путей, медикацией, осложне-
ниями катетеризации центральных вен.
197
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
White S.M. и Akerele О. [38] считают, что большинство анестезиологов, вероят-
но, в практике встретятся с интраоперационной смертью, последствия которой вы-
зывают чрезвычайный стресс у медицинского персонала. По данным авторов, 71 %
опрошенных анестезиологов согласились с мнением, что бригада медперсонала,
испытавшая интраоперационную смерть, обоснованно не должна принимать учас-
тие в операциях минимум 24 ч после этого события. Администрация больниц дол-
жна учитывать этот фактор, а все отделения — отсрочить плановые операции.
9.4.2. Нарушения вентиляции
Причины нарушений вентиляции и оксигенации во время опера-
ции более подробно рассмотрены в разделах 8.1, 8.3.5 и 9.2. Основными симпто-
мами нарушений вентиляции являются нарушения экскурсий грудной стенки при
дыхании и гиперкапния. Для профилактики этих осложнений необходима тща-
тельная проверка анестезиологом рабочего места и аппаратуры до операции, по-
стоянный мониторинг вентиляции во время наркоза и своевременное реагирова-
ние на нарушения вентиляции легких.
Нарушение проходимости интубационной трубки — наиболее частая причина
нарушений вентиляции во время общей анестезии. Возникает из-за обтурации
мокротой, кровью, манжетой интубационной трубки, по причине перегиба или
чрезмерно глубокого расположения интубационной трубки (на бифуркации тра-
хеи, эндобронхиально).
Симптомы: нарушение экскурсий грудной клетки, ослабление дыхания при
аускультации, повышение инспираторного давления в дыхательном контуре, по-
вышение РЕСО2, гипоксемия и гиперкапния (поздние признаки).
Методы диагностики и коррекции. Проводят катетер через интубационную труб-
ку, определяют уровень обструкции, аспирируют содержимое. При необходимости
подтягивают интубационную трубку на 1—2 см (возможен риск экстубации); выпол-
няют фибробронхоскопию и рентгенографию грудной клетки, в крайнем случае -
экстубацию, вентиляцию маской, возможно ларингеальной, и реинтубацию.
Разгерметизация дыхательного контура
Симптомы: отсутствие экскурсий грудной клетки, отсутствие давления в ды-
хательном контуре.
Методы диагностики и коррекции. Переходят на вентиляцию другим респира-
тором или, в крайнем случае, мешком Амбу. Проверяют целостность шлангов,
герметичность манжеты интубационной трубки, все соединения наркозно-дыха-
тельного аппарата. Неисправность наркозно-дыхательного аппарата проявляется
невозможностью обеспечения достаточного давления на вдохе или значительным
спонтанным повышением давления на выдохе. Если не удалось сразу устранить
неисправность, то переходят на вентиляцию другим наркозно-дыхательным аппа-
ратом или временно — на вентиляцию мешком Амбу.
9.4.3. Нарушения оксигенации
Как правило, нарушения вентиляции являются первопричиной
нарушений оксигенации, чем и обусловлена более низкая частота возникнове-
ния последних. Кроме этого, причинами нарушений оксигенации являются:
198
9, ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
тяжелые нарушения газообмена, связанные с повреждением или отеком легких
(передозировка жидкости, ОРДС), снижение концентрации кислорода во вды-
хаемой газовой смеси, “эффект второго газа” и диффузионная гипоксия
(см. раздел 7.7.1).
9.4.4. Нарушения гемодинамики
9.4.4.1. Артериальная гипотензия
Причины возникновения артериальной гипотензии во время опера-
ции: гиповолемия, кровопотеря, ортостатическая гипотензия, снижение сократи-
тельной способности миокарда, острая ишемия миокарда, тяжелые нарушения
ритма сердца, нарушение симпатической регуляции сосудистого тонуса, септи-
ческий шок, нейрогенный шок, передозировка анестетиков и других лекарствен-
ных препаратов, обладающих кардиодепрессивным и вазодилатирующим эффек-
том, анафилактический шок, недостаточность надпочечников и другие эндокрин-
ные нарушения, гипотензия во время беременности (сдавление маткой полой вены),
травматические действия хирурга (особенно — механическое сдавление крупных
сосудов и сердца, редко — рефлекторное).
Во всех случаях внутриоперационной артериальной гипотензии, исключая
случаи исходной сердечной недостаточности, до применения кардиотонических и
вазопрессорных препаратов проводят объемную интервенцию жидкостью.
Гиповолемия является наиболее частой причиной артериальной гипотензии во
время операции и чаще связана с кровопотерей. Стратегия и тактика инфузионно-
трансфузионной терапии при гиповолемии подробно представлена в разделе 9.3.
Ортостатическая гипотензия проявляется при смене операционного положения.
Ее основной причиной является абсолютная или относительная гиповолемия.
Снижение сократительной способности миокарда часто возникает вследствие
нарушения коронарной перфузии, ишемии миокарда, тяжелого нарушения сер-
дечного ритма, ацидоза, тяжелой гипоксемии. Для предотвращения ишемии мио-
карда поддерживают коронарную перфузию, которая зависит от САД и ЧСС, по-
этому во время травматических моментов операции не допускают артериальной
гипотензии и значительной тахикардии. В противном случае развивается пороч-
ный круг кардиогенного шока, когда в результате снижения сократительной спо-
собности миокарда, вызванной ишемией, снижается АД, а вследствие гипотензии
прогрессирует ишемия миокарда. Значительным протекторным эффектом на ми-
окард обладают 0-блокаторы. С целью профилактики у больных с повышенным
риском нарушений ритма сердца в интраоперационном периоде используют ами-
одарон (кордарон), лидокаин (местно и внутривенно).
Передозировка анестетиков, чаще ингаляционных, вызывает артериальную ги-
потензию. При передозировке галотана гипотензия особенно неблагоприятна
из-за его депрессивного влияния на миокард со снижением сократительной спо-
собности. В этом случае снижение АД сопровождается более выраженными нару-
шениями микроциркуляции и ишемией тканей. Галотан сенсибилизирует мио-
кард к катехоламинам, поэтому их не применяют при галотановой анестезии. Изоф-
люран снижает АД за счет вазодилатации. При гипотензии, вызванной
ингаляционными анестетиками, сразу прекращают их подачу или значительно
уменьшают дозу и проводят массивную инфузионную терапию.
199
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Из внутривенных анестетиков депрессивным влиянием на миокард обладают
барбитураты, особенно в больших дозах. Возникновению артериальной гипотензии
способствуют пропофол, бензодиазепины, морфин, дроперидол; риск гипотензии
увеличивают атракуриум и мивакуриум вследствие освобождения гистамина. При
гипотензии, вызванной внутривенными анестетиками и адъювантами, проводят
внутривенное введение жидкости и применяют вазопрессорные средства.
Нитраты, а2-адреноагонисты (клофелин), 0-блокаторы, блокаторы кальцие-
вых каналов содействуют развитию гипотонии.
Нормальные показатели АД не всегда гарантируют нормальную перфузию
тканей и доставку кислорода. Meregalli и соавторы [41] доказали, что скрытая
гипоперфузия связана с увеличением смертности у гемодинамически стабильных
хирургических пациентов с высоким риском. Критерием нарушений микроцирку-
ляции служит уровень лактата смешанной венозной крови. Согласно исследова-
нию, повышенный уровень лактата крови ассоциировался с более высокой смер-
тностью и большим риском послеоперационных осложнений у гемодинамически
стабильных хирургических пациентов. Поэтому при повышенном уровне лактата
(более 3 ммоль/л) увеличивают сердечный выброс и уменьшают периферическое
сопротивление сосудов. Например, этого достигают, используя инодилататоры
(добутамин, допексамин) или комбинацию нитроглицерина с добутамином.
9.4.4.2. Артериальная гипертензия
Умеренное повышение АД не так опасно, как его понижение, тем
не менее, это состояние обязательно корректируют, так как оно чревато тяжелы-
ми осложнениями.
Причины возникновения артериальной гипертензии во время операции: гиперто-
ническая болезнь до операции, недостаточное обезболивание и гиперкатехолами-
немия, гипоксия и гиперкапния, гиперволемия, гипогликемия, злокачественная
гипертермия, острая внутричерепная гипертензия, мышечная дрожь, перерастя-
жение мочевого пузыря.
Недостаточное обезболивание — частая причина артериальной гипертензии,
поэтому при повышении АД во время операции, особенно в сочетании с тахикар-
дией, дополнительно вводят опиаты или углубляют анестезию ингаляционными
анестетиками.
Периоперационная медикация у больных с гипертонической болезнью опи-
сана в разделе “Частная анестезиология”.
9.4.5. Анафилактические реакции
Арсенал лекарственных средств анестезиолога достаточно велик,
поэтому всегда существует риск развития аллергических реакций на препараты.
Анафилаксия — наиболее тяжелая иммунная реакция в ответ на лекарственное
средство, которая развивается при повторном контакте организма со специфичес-
ким антигеном и приводит к освобождению провоспалительных медиаторов. Боль-
шинство реакций иммунологически обусловлены (IgE-зависимые, анафилактичес-
кие) или связаны с прямой стимуляцией освобождения гистамина при действии
фракции комплемента СЗ и С5 — анафилотоксина (анафилактоидные реакции).
Анафилактоидные реакции приводят к прямому IgE-независимому освобождению
медиаторов из тучных клеток или в результате активации комплемента.
200
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
В литературе за последние годы возросло количество сообщений об увеличе-
нии частоты в экономически развитых странах реакций гиперчувствительности
немедленного типа на анестетики и другие средства, которые используют в тече-
ние периоперационного периода [42]. Инцидентность анафилаксии составляет
1:10 000-1:20 000, при этом любое лекарственное средство может вызывать реак-
ции повышенной чувствительности [43]. Анафилактические и анафилактоидные
реакции диагностированы в 66 и 34 % случаев, соответственно.
Этиология. Самую низкую частоту возникновения аллергических реакций ре-
гистрируют при применении бензодизепинов и кетамина, наиболее высокую —
при применении миорелаксантов (58,2-"69,2 %), латекса (12,1—6,7 %) и антибио-
тиков (15,1 %). Из миорелаксантов рокурониум (43,1 %) и сукцинилхолин (22,6 %)
наиболее часто вызывают аллергию. Необходимо помнить, что при применении
миорелаксантов возможно развитие перекрестной иммунизации. К барбитуратам
повышенную чувствительность отмечают редко (1:30 000) и в основном у аллерги-
зированных пациентов. Несколько чаще и, в основном, у аллергизированных па-
циентов наблюдают реакцию на пропофол, которая выражается в сильном брон-
хиолоспазме. Из опиатов наиболее часто анафилактоидные реакции регистрируют
на морфин.
Аллергическая реакция на галотан является наиболее известной и изученной
реакцией на ингаляционные анестетики, которая клинически проявляется эози-
нофилией и лихорадкой, а затем — фторотановым гепатитом (см. раздел 7.6.1).
Минимальный риск развития аллергических реакций зафиксирован при примене-
нии десфлюрана и севофлюрана.
Частота возникновения истинных аллергических реакций на местные анесте-
тики значительно меньше, чем принято думать, так как часто токсические реак-
ции при попадании препарата в кровеносный сосуд принимают за аллергические
(см. раздел 12.8). Наиболее часто из местных анестетиков аллергические реакции
возникают на новокаин, значительно реже — на лидокаин.
При применении антибиотиков чаще всего возникают аллергические реакции
на пенициллины и цефалоспорины. Угрожающие жизни анафилактические реак-
ции наблюдали при использовании ванкомицина. Возможны анафилактические и
анафилактоидные реакции на введение растворов искусственных коллоидов, чаще
всего — на декстраны. Нередки аллергические реакции во время анестезии при
использовании йодистых рентгеноконтрастных препаратов.
В последнее время значительную проблему представляет аллергия на латекс, из
которого изготавливают многие медицинские изделия, в частности, используемые в
анестезиологии — различные катетеры, интубационные трубки и др. Основную группу
риска составляют дети с неврологическими заболеваниями (менингомиелоцеле, spina
bifida, миелодисплазией) и атопией (аллергией на бананы, каштаны, авокадо). У
последних наблюдают перекрестную белковую реактивность с латексом.
Клинические проявления. Освобождающиеся из тучных клеток и базофилов
медиаторы вызывают целый комплекс симптомов, которые могут включать нару-
шения всех систем и органов, но наиболее опасными являются бронхоспазм и
сердечно-сосудистый коллапс (анафилактический шок). Согласно исследованию
[43], наиболее тяжелые клинические проявления при анафилаксии. Редко необъяс-
нимая артериальная гипотензия является единственным объективным симптомом
анафилактической реакции во время общей анестезии.
Лабораторная диагностика. При анафилактической реакции в плазму выделя-
ется триптаза. Положительное прогнозирующее значение триптазного теста для
201
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
диагноза анафилаксии составило 92,6 %, отрицательное прогнозирующее значе-
ние — 54,3 % [43]. Определение концентрации триптазы в сыворотке подтвержда-
ет диагноз анафилактической реакции, однако этот метод пока мало доступен в
клинической практике, тем более в условиях операционной. Лекарственное сред-
ство, которое вызывает анафилаксию, идентифицируют путем внутрикожных и
серологических тестов.
Лечение. Прекращают введение предполагаемого лекарственного средства (или
контакта с латексом), которое спровоцировало аллергическую реакцию. Проводят
мощную инфузионную терапию. Большинство практических руководств для лече-
ния анафилаксии рекомендуют в качестве вазопрессора использовать адреналин.
В последнее время в литературе появилось много сообщений о применении дру-
гих симпатомиметиков, например альфа-агониста метараминола [44], норадрена-
лина (подробное лечение анафилаксии см. в специальных руководствах).
Профилактика. Важен сбор полноценного аллергоанамнеза. Тщательно избе-
гают применения препаратов с известными аллергическими реакциями. При вы-
раженной аллергизации пациента рекомендуют с профилактической целью при-
менять комбинации антагонистов гистаминовых рецепторов Н^блокаторов (за
рубежом используют дифенгидрамин в дозе 0,5—1,0 мг/кг внутрь) и Н,-блокато-
ров (циметидина в дозе 4—6 мг/кг внутрь). В тяжелых случаях рекомендуют про-
филактический прием глюкокортикоидов (по 50 мг преднизолона внутрь за сутки
и за 6 ч до операции).
Необходимо помнить, что возможен ложный предположительный диагноз
аллергии у некоторых пациентов, и тогда бесполезные профилактические мероп-
риятия создадут значительные затруднения в лечении основного заболевания.
Поэтому всех пациентов с подозрением на аллергические реакции до оперативно-
го вмешательства обследуют в специализированных центрах. Любую предполагае-
мую анафилактическую реакцию экстенсивно исследуют, используя до- и после-
операционное тестирование для определения характера реакции, идентификации
аллергена и выработки точных рекомендаций для возможных будущих анестезио-
логических процедур. Эти исследования включают определение уровня гистами-
на, триптазы и специфических IgE на введение агента, а также проведение кож-
ных и серологических тестов.
9.4.6. Нарушения терморегуляции
9.4.6.1. Злокачественная гипертермия
Злокачественная гипертермия (ЗГ) является угрожающим для
жизни осложнением, генетически опосредованным гиперчувствительностью ске-
летных мышц к ингаляционным анестетикам и деполяризующим мышечным ре-
лаксантам; развивается во время или после анестезии. Инцидентность составляет
1:12 000 анестезий у детей и 1:40 000 у взрослых [45]; 50 % случаев злокачествен-
ной гипертермии обусловлены генетическими мутациями.
Патофизиология. В процессе нормального мышечного сокращения ионизиро-
ванный кальций освобождается в сарколему из саркоплазматического ретикулума
и при расслаблении мышцы АТФ-энергозависимым образом возвращается назад.
Ген ЗГ влияет на освобождение кальция саркоплазматическим ретикулумом попе-
речно-полосатых мышц через рианодиновые рецепторы на хромосомах. Эти ре-
202
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
цепторы являются важным компонентом открытия кальциевых каналов. Действие
триггерного фактора приводит к накоплению ионов Са++ в миоплазме, повыше-
нию концентрации ионов Са++ в саркоплазме совместно с тропонином, что вызы-
вает длительную контрактуру мышц. Длительное мышечное сокращение вызывает
значительное повышение метаболизма, тахикардию, гипоксемию, повышение про-
дукции СО2, ацидоз и значительное повышение температуры тела. Триггерные
агенты — это вещества, которые “запускают” ЗГ. К ним относят ингаляционные
анестетики и сукцинилхолин.
Клинические проявления. Вариабельность проявления реакции колеблется от
невыраженной (кратковременный подъем температуры тела, мышечная ригидность,
ацидоз) до тяжелой, трудно купируемой гипертермии (выраженная мышечная ри-
гидность, гиперкапния, ацидоз, сопровождаемые нарушениями ритма сердца, раб-
домиолизом и шоком). Злокачественная гипертермия развивается через 10—15 мин
после введения триггерного агента. Необъяснимая тахикардия во время наркоза,
повышение РЕСО2 и мышечная ригидность являются ранними признаками ЗГ.
Гипертермия, изменение цвета мочи и повышение уровня креатинкиназы могут
возникнуть позже. После введения сукцинилхолина у пациента при проведении
прямой ларингоскопии трудно открыть рот в результате спазма жевательной и
мимической мускулатуры [46]. ЗГ часто осложняется рабдомиолизом с массивной
потерей мышцами калия, кальция, миоглобина и креатинфосфокиназы. Гиперка-
лиемия — наиболее частая причина летального исхода в ранней стадии ЗГ; она
является одной из причин нарушений ритма сердца. Аритмиям способствует ги-
пертермия и повышенная потребность миокарда в кислороде. Последствиями раб-
домиолиза может быть ДВС-синдром и ОПН. В более поздние стадии ЗГ больные
умирают от отека легких, ОПН, полиорганной недостаточности. Степень гипер-
термии не коррелирует с исходом.
Дифференциальный диагноз. Злокачественную гипертермию дифференцируют
с сепсисом, патологией ЦНС, гипертиреоидным приступом, феохромоцитомой.
При этих состояниях возможно возникновение гипертермии, но она не сопровож-
дается мышечной ригидностью и резким повышением РЕСО2.
Оценка риска развития. Идентификация пациентов с высоким риском являет-
ся важной частью профилактики ЗГ; тщательно собирают семейный анамнез.
Примерно у 70 % пациентов с высоким риском ЗГ в покое увеличен уровень
креатинкиназы. Проводят биопсию мышц с последующим тестированием мышеч-
ной сократимости in vitro. В течение более 30 лет тесты in vitro на контрактуру
мышц (IVCT) были единственным диагностическим методом для определения риска
злокачественной гипертермии. Сейчас разработаны рекомендации для примене-
ния молекулярной генетической диагностики восприимчивости к ЗГ. В семьях с
известными случаями злокачественной гипертермии возможен 50 % успех под-
тверждения восприимчивости при неинвазивном тестировании. Girard и соавторы
[47] рекомендуют выполнение IVCT в случае отрицательных результатов генети-
ческой экспертизы.
Лечение. После постановки диагноза злокачественной гипертермии немедлен-
но прекращают подачу ингаляционных анестетиков и начинают агрессивную те-
рапию. Вводят внутривенно дантролен 2—3 мг/кг через каждые 10—15 мин до ку-
пирования симптоматики, затем — внутрь по 1 мг/кг каждые 4—8 ч в течение 48 ч.
Проводят гипервентиляцию чистым кислородом и используют физические мето-
ды охлаждения — внутривенную инфузию холодного изотонического раствора
натрия хлорида (15 мл/кг каждые 10 мин), промывание желудка холодной водой,
203
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
наружное охлаждение до температуры тела 38 °C. Лекарственная терапия включа-
ет: натрия гидрокарбонат 1—2 мл/кг внутривенно под контролем pH, диуретики
(манитол, фуросемид) после гидратации, инфузию глюкозо-инсулиновой смеси
(для коррекции гиперкалиемии).
Специфический миорелаксант дантролен является единственным в настоя-
щее время доступным лекарственным средством для специфической и эффектив-
ной терапии этого синдрома у человека. После его применения смертность от
злокачественной гипертермии уменьшилась с 80 % в 1960-х годах до 10 % в насто-
ящее время [48]. Дантролен блокирует освобождение ионов кальция из саркоп-
лазматического ретикулума, вызывает депрессию внутренних механизмов связи
возбуждения-сокращения в скелетной мышце. Более точный молекулярный меха-
низм его действия полностью не известен. В недавних исследованиях идентифи-
цированы рианодиновые (ryanodine) рецепторы, с которыми связывается дантро-
лен. Прямое или непрямое ингибирование рианодиновых рецепторов, как полага-
ют, является фундаментальным механизмом действия дантролена на молекулярном
уровне. Дантролен также используют для лечения нейролептического злокаче-
ственного синдрома, мышечной спастики и при интоксикации “экстэзи”. Основ-
ной недостаток дантролена — плохая растворимость в воде и, следовательно, труд-
ности при экстренном приготовлении внутривенных растворов в критической си-
туации. По экономическим соображениям другие подобные средства пока не
внедрены в обычную клиническую практику.
Хороший результат прогнозируют, если показатели гомеостаза удалось нор-
мализовать в течение 45 мин после начала клинических проявлений ЗГ. В осталь-
ных случаях продолжают дополнительную интенсивную терапию, которая заклю-
чается в коррекции гемостаза, восполнении жидкостью, контроле диуреза, элект-
ролитного состава и КОС крови, вазопрессорной поддержки (при шоке). Для
стимуляции диуреза продолжают введение манитола до 3 г дробно, фуросемида -
0,5—1,0 мг/кг.
Несмотря на явные успехи в разработке интенсивной терапии злокачественной
гипертермии, в литературе сообщают о летальных исходах при этой патологии [49].
Авторы описали случай вторичного тяжелого компартмент-синдрома с летальным
исходом по причине гиперкалиемии на фоне непрерывного гемодиализа.
Профилактика. Если идентифицировали пациентов с высоким риском ЗГ, то
им профилактически назначают дантролен в дозе 5 мг/кг внутрь 3—4 раза через
6 ч с приемом последней дозы за 4 ч перед операцией. При экстренной необходи-
мости дантролен вводят внутривенно в дозе 2,4 мг/кг за 10—30 мин до индукции в
наркоз. При отсутствии признаков ЗГ во время операции дальнейшее профилак-
тическое введение дантролена прекращают в связи с его побочными эффектами
(мышечной слабостью, тошнотой, рвотой), но при условии неприменения сукци-
нилхолина [50].
У пациентов с высоким риском ЗГ в анестезиологическое пособие включают
барбитураты, этомидат, пропофол, опиаты, бензодиазепины, недеполяризующие
миорелаксанты. При проведении общей анестезии исключают применение инга-
ляционных анестетиков (кроме закиси азота и, возможно, ксенона) и сукцинил-
холина. Приемлемой альтернативой общей анестезии является регионарная анес-
тезия.
Для тщательного мониторинга за больными, в семьях которых были случаи
злокачественной гипертермии, в США и некоторых странах Европейского Союза
их регистрируют в специальных картотеках с открытым доступом.
204
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
9.4. Ф.2. Гипертермия
Гипертермия возникает при общей анестезии нечасто и характе-
ризуется подъемом температуры тела на 2 °C выше нормы в течение 2 ч.
Причины возникновения гипертермии: острая бактериальная или вирусная ин-
фекция, сепсис, нарушение терморегулирующей функции гипоталамуса при трав-
ме и гипоперфузии, новообразования гипоталамуса, некоторые расстройства эн-
докринной функции (гипертиреоз, феохромоцитома), применение симпатомиме-
тиков, ингибиторов моноаминоксидазы, амфетаминов, антидепрессантов,
антихолинэстеразных и антигистаминовых препаратов.
Клинические проявления: головная боль, тошнота, тахикардия, потливость, ва-
зодилатация, повышение РЕСО2, возможно — дегидратация. При длительной ги-
пертермии возможны тяжелые поражения ЦНС и судороги.
Печение. Определяют причину гипертермии и устраняют ее. Применяют методы
физического охлаждения — внутривенное введение охлажденных растворов, клизмы
и промывания желудка охлажденными растворами; используют антипиретики.
9.4. 6.3. Гипотермия
Гипотермия характеризуется снижением функции теплообразова-
ния или повышением теплоотделения или первого и второго одновременно. Ги-
потермией считают снижение температуры тела ниже 36 °C. При температуре ядра
тела менее 35 °C автономные и эндокринные защитные механизмы организма
самостоятельно не способны восстановить нормальную температуру тела без внеш-
него согревания. Это состояние часто осложняет проведение общей анестезии.
Кроме действия анестетиков и миорелаксантов, способствующих повышенной теп-
лопродукции, и низкой температуры в операционной развитию гипотермии во
время полостных операций способствуют отдача тепла из поверхности брюшины
или плевры, а также инфузия относительно холодных растворов.
Факторы, которые увеличивают риск гипотермии: пожилой и детский воз-
раст, обширные ожоги, повреждения гипоталамуса и спинного мозга, некоторые
эндокринные расстройства (например, гипотиреоидизм). Необходимо отметить,
что базальный метаболизм уменьшается на 1 % за каждый прожитый год после
30 лет жизни, соответственно, снижается способность регулировать теплопродукцию.
Ингаляционные и многие внутривенные анестетики расширяют сосуды и уг-
нетают терморегуляционную функцию гипоталамуса, что способствует повышен-
ной теплоотдаче. Изофлюран, например, провоцирует дозозависимое снижение
вазоконстрикторного холодового барьера (1 % изофлюрана на 3 °C), миорелаксан-
ты предотвращают дрожательный компенсаторный термогенез, спинальная и эпи-
дуральная анестезии вызывают симпатическую блокаду, вазодилатацию, мышеч-
ную релаксацию и сенсорный блок терморецепторов.
Дооперационный уровень АД влияет на выраженность интраоперационной
гипотермии во время общей анестезии. Результаты исследований свидетельству-
ют, что высокие уровни дооперационной секреции катехоламинов вызывают мень-
шую степень интраоперационной гипотермии [51]. Периоперационная гипотер-
мия сопровождается тяжелыми осложнениями.
Физиологические эффекты гипотермии: вазоконстрикция и снижение тканевой
перфузии, метаболический ацидоз, увеличение ОПСС и ЦВД, депрессия миокар-
да и нарушения ритма сердца, увеличение сопротивления легочных сосудов, на-
205
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
рушение вентиляционно-перфузионных соотношений в легких с развитием ги-
поксемии, нарушение почечного кровотока и клубочковой фильтрации, увеличе-
ние диуреза и катаболизма белков, снижение реабсорбции натрия в почечных
канальцах и развитие гиповолемии, смещение кривой диссоциации гемоглобина
влево, снижение мозгового кровотока, нарушение функции тромбоцитов, их сек-
вестрация, тромбоцитопения, снижение активности остальных факторов гемоста-
за, активация фибринолиза, ухудшение заживления ран.
Клинические проявления. Нарушения зависят от степени выраженности гипо-
термии. При невыраженной гипотермии (32—35 °C) снижается метаболизм, воз-
никает дрожь, тахикардия, нарушаются функции ЦНС в виде амнезии, атаксии и
апатии. При средней степени гипотермии (27—32 °C) вплоть до комы нарушается
сознание, возникают нарушения функций жизненно-важных органов, нарушения
ритма сердца, холодовой диурез. Для глубокой гипотермии (менее 27 °C) харак-
терны кома, арефлексия, глубокое угнетение функций жизненно важных органов.
Продукция СО2 снижается на 50 % при снижении температуры на каждые 8 °C;
pH артериальной крови повышается на 0,015 единиц при снижении температуры
на каждый 1 °C; метаболическая потребность в кислороде тканями мозга снижает-
ся на 7 % при снижении температуры на каждый 1 °C. Гипотермия влияет на
фармакодинамику и фармакокинетику анестетиков, например, снижает МАК ин-
галяционных анестетиков на 5—7 % на каждый 1 °C, однако скорость индукции в
наркоз при этом не меняется. Вследствие снижения печеночного и почечного
кровотоков снижаются метаболизм и клиренс лекарственных препаратов. Напри-
мер, при гипотермии удлиняется действие мышечных релаксантов.
При гипотермии меняется характер ЭКГ. Пролонгируется интервал Q—T, воз-
можна элевация сегмента S—T. Узловой ритм характерен для снижения темпера-
туры тела до 32 °C; фибрилляция желудочков и асистолия, рефрактерные к дефиб-
рилляции и водителю ритма, возникают при температуре менее 28 °C. При гипер-
термии нарушается вентиляция легких, поэтому наблюдают гиперкапнию, несмотря
на снижение продукции СО,.
Особенно быстро развивается гипотермия у детей, поэтому температуру в операци-
онной, особенно при длительных операциях, поддерживают на оптимальном уровне.
Гипотермия производит протективный эффект на ткани мозга при гипопер-
фузии, что учитывают при проведении нейрохирургических операций.
Лечение. Коррекцию гипотермии проводят путем пассивного и активного со-
гревания. Пассивное согревание предполагает уменьшение теплоотдачи путем из-
лучения и конвекции при сохраненной функции гипоталамуса, возникновении
дрожательного термогенеза, наличии достаточных запасов гликогена для увеличе-
ния термопродукции. Активное согревание предполагает применение теплых внут-
ривенных растворов и различных средств наружного согревания. Поддерживают
адекватную температуру в помещении и следят за достаточным увлажнением вды-
хаемой газовой смеси по закрытому или полузакрытому контуру для уменьшения
теплопотери с дыханием. В тяжелых случаях используют перитонеальный лаваж
согретыми растворами и экстракорпоральное согревание больного.
9.4.7. Восстановление сознания во время общей анестезии
У некоторых больных в той или иной мере восстанавливается со-
знание во время операции, несмотря на якобы адекватный уровень общей анесте-
зии. Пациенты могут помнить некоторые моменты оперативного вмешательства,
206
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
что в последствии является тяжелой психологической травмой, особенно если во
время операции возникали осложнения и по этому поводу были устные коммен-
тарии хирургов и анестезиолога. Особенно неприятны случаи восстановления со-
знания, которые сопровождаются болевыми ощущениями у больного. По данным
Ottevaere J.A. (2002), инцидентность эпизодов восстановления сознания с болевы-
ми ощущениями составляет приблизительно 1 случай на 3000, а без боли — 3 случая
на 1000 общих анестезий.
Проблему усугубляет факт, что ни один из видов мониторинга с абсолютной
точностью не позволяет определить наличие сознания у пациента, особенно, если
ему ввели миорелаксанты и гемодинамические показатели сохраняют стабиль-
ность. В какой-то степени в оценке уровня сознания во время операции помогает
определение биспектрального индекса (см. раздел 9.2.6).
Восстановление сознания у пациента чаще происходит при поверхностной ане-
стезии, которую требует клиническая ситуация, например, при кесаревом сечении,
у больных с сердечной недостаточностью, шоком, при кардиохирургических вме-
шательствах, так как гемодинамическая нестабильность этих состояний требует
уменьшения дозы анестетиков. Исключением является оксибутират натрия. Необ-
ходимо помнить, что закись азота и опиоиды не предотвращают этого осложнения
во время наркоза и при этом подавляют реакцию автономной нервной системы на
поверхностную анестезию. При тотальной внутривенной анестезии наркотически-
ми аналгетиками риск восстановления сознания выше, чем при ингаляционной или
комбинированной ингаляционно-внутривенной анестезии. Как правило, концент-
рация ингаляционных анестетиков, достигающая 0,8 МАК, достаточна для подавле-
ния сознания во время хирургического вмешательства.
Часто восстановление сознания наблюдают при трудной интубации, когда
уровень седации недостаточен. Если процесс интубации сопровождается эпизода-
ми гипоксии, то состояние пациента особенно страдает.
Нарушения состояния больного, связанные с восстановлением сознания во
время операции, могут выражаться в развитии так называемого синдрома пост-
травматического стрессового расстройства. Этот синдром включает неприятные
воспоминания об операционном периоде, ночные кошмары, повышенную эмоци-
ональную чувствительность и возбудимость, а иногда даже суицидальные попыт-
ки, поэтому сохранение даже элементов сознания во время операции нельзя счи-
тать несущественным осложнением. Такие пациенты нуждаются в психиатричес-
кой помощи. Учитывая вышесказанное, анестезиологу необходимо анализировать
случаи восстановления сознания у пациентов во время операции и по возможно-
сти предотвращать их.
ЛИТЕРАТУРА
1. Крафт Т.М., Аптон П.М. Ключевые вопросы в анестезиологии. Пер. с англ. М.:
Медицина, 1997; С. 203—205.
2. Глумчер Ф.С. Шок. В руководстве по интенсивной терапии. Под ред. Трещин-
ского А.И., Глумчера Ф.С. — К.: Вища школа, 2004. — С. 417—455.
3. Лисандер Б. Сравнительная оценка различных методов сбережения крови в хи-
рургии. В кн.: Альтернативы переливанию крови в хирургии. Материалы симпозиума.
Анестезиология и реаниматология (приложение), 1999. С. 81—93.
4. Шандер А. Анестезиологическая тактика и фармакологические средства для ог-
раничения периоперационной кровопотери. В кн.: Альтернативы переливанию крови
207
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
в хирургии. Материалы симпозиума. Анестезиология и реаниматология (приложение),
1999. С. 68-71.
5. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3th ed. Churchill Livingstone, 1994;
524 p.
6. Malangoni M.A. Critical Issues in Operating Room Management. Lippincton-Raven.
Philadelphia, New-York, 1997; 287 p.
7. Lefrant J. K, Muller L., De La Coussaye J.E. et al. Risk factors of failure and immediate
complication of subclavian vein catheterization in critically ill patients. Intensive Care Med.,
2002 Aug; 28 (8): 1036-41.
8. Domino K.B., Bowdle T.A., Posner K.L. et al. Injuries and liability related to central
vascular catheters: a closed claims analysis. Anesthesiology, 2004 Jun; 100 (6): 1411—8.
9. Kagel E.M., Rayan G.M. Intravenous catheter complications in the hand and forearm.
J. Trauma, 2004 Jan; 56 (1): 123-7.
10. Chittock D.R., Dhingra V.K., Ronco J.J. et al. Severity of illness and risk of death
associated with pulmonary artery catheter use. Crit. Care Med., 2004 Apr; 32 (4): 911—5.
11. Cole D.J., Schlunt M. Adult Perioperative Anesthesia. Philadelphia, ELSEVIER
MOSBY, 2004, 542 p.
12. Levine D.A., Platt S.L. Novel monitoring techniques for use with procedural sedation.
Curr. Opin. Pediatr., 2005 Jun; 17 (3): 351-4.
13. Carter B.G., Butt W. Are somatosensory evoked potentials the best predictor of
outcome after severe brain injury? A systematic review. Intensive Care Med., 2005 Jun; 31
(6): 765-775.
14. Gan T.J., SoppittA., MaroofM. etal. Goal-directed intraoperative fluid administration
reduces length of hospital stay after major surgery. Anesthesiology, 2002 Oct; 97 (4): 820-6.
15. Joshi G.P. Intraoperative fluid restriction improves outcome after major elective
gastrointestinal surgery. Anesth. Analg., 2005 Aug; 101 (2): 601—5.
16. Magner J. J., McCaul C, Carton E. et al. Effect of intraoperative intravenous crystalloid
infusion on postoperative nausea and vomiting after gynaecological laparoscopy: comparison
of 30 and 10 ml kg(-l). Br. J. Anaesth., 2004 Sep; 93 (3): 381—5.
17. Brandstrup B., Tonnesen H., Beier-Holgersen R. et al. Effects of intravenous fluid
restriction on postoperative complications: comparison of two perioperative fluid regimens: a
randomized assessor-blinded multicenter trial. Ann Surg., 2003 Nov; 238 (5): 641—8.
18. Fraind D.B., Slagle J.M., Tubbesing V.A. et al. Reengineering intravenous drug and
fluid administration processes in the operating room: step one: task analysis of existing processes,
Anesthesiology, 2002 Jul; 97 (1): 139—47.
19. Madjdpour C, Marcucci C, Tissot J.D., Spahn D.R. Perioperative blood transfusions,
Value, risks and guidelines. Anaesthesist, 2005 Jan; 54 (1): 67—80.
20. Carson J.L., Noveck H., berlin J.A., Gould S.J. Mortality and morbidity in patients
with very low postoperative hemoglobins who decline blood transfusion. Transfusion, 2002;
42: 812-818.
21. Nelson A.H., Fleisher L.A., Rosenbaum S.H. Relationship between postoperative anemia
and cardiac morbidity in high risk vascular patients in the intensive care unit. Crit. Care med.,
1993; 21: 860-866.
22. Kooby D.A., Stockman J., Ben-Porat L. et al. Influence of transfusions on perioperative
and long-term outcome in patients following hepatic resection for colorectal metastases. Ann
Surg., 2003 Jun; 237 (6): 860-9.
23. Monk T.G. Preoperative recombinant human erythropoietin in anemic surgical patients.
Crit. Care, 2004; 8 Suppl 2: S45-8.
24. Karkouti K., McCluskey S. A., Evans L. et al. Erythropoietin is an effective clinical
modality for reducing RBC transfusion in joint surgery. Canadian Journal of Anesthesia,
2005; 52: 362-368.
25. Sunder-Plassmsn G., Horl W.H. Erythropoietin and iron. Clin Nephr., 1997; 47:141-57.
26. Sanders G., Mellor N., Rickards K. et al. Prospective randomized controlled trial of
acute normovolaemic haemodilution in major gastrointestinal surgery. Br. J. Anaesth., 2004
Dec; 93 (6): 775-81.
208
9. ОБЕСПЕЧЕНИЕ ОБЩЕЙ АНЕСТЕЗИИ ВО ВРЕМЯ ОПЕРАЦИИ
27. Fenger-Eriksen С., Hartig Rasmussen С., Kappel Jensen Т etal. Renal effects of hypotensive
anaesthesia in combination with acute normovolaemic haemodilution with hydroxyethyl starch
130/0.4 or isotonic saline. Acta Anaesthesiol. Scand., 2005 Aug; 49 (7): 969—74.
28. Cohn S.M., Cross J.H., Ivy M.E. et al. Fibringlue terminates massive bleeding after
complex hepatic injury. J. Trauma, 1998; 45(4): 666-72.
29. Bochicchio G. V, Scalea T.M. Acute caval perforation by an inferior vena
cava filter in a multitrauma patient. J. Trauma, 2001; 51 (5): 991—3.
30. Schwaitzberg S.D., Chan M. W., Cole D.J. et al. Comparison of poly-N-acetyl
glucosamine with commercially available topical hemostats for achieving hemostasis in
coagulopathic models of splenic hemorrhage. J. Trauma, 2004 Jul; 57 (1 Suppl): S29-32.
31. Fremers S., Wong B., Lee E. et al. Metaanalysis of prophylactic drug treatment in the
prevention of postoperative bleeding. Ann. Thorac. Suig., 1994, 58: 1580—1588.
32. Grocott M.P., Mythen M. G., Gan T.J. Perioperative fluid management and clinical
outcomes in adults. Anesth. Analg., 2005 Apr; 100 (4): 1093—106.
33. Lunn J.N., Hunter A.R., Scott D.B. Anaesthesia-related surgical mortality. Anaesthesia,
1983, 38: 1090-1094.
34. Newland M.C., Ellis S.J., Lydiatt C.A. Anesthestic-related Cardiac Arrest and Its
Mortality: A Report Covering 72,959 Anesthetics over 10 Years from a US Teaching Hospital
Anesthesiology, 2002; 97: 10—15.
35. Keenan R.L., Boyan C.P. Cardiac arrest due to anesthesia. JAMA 1985; 253: 2373—7.
36. Olsson G.L., Hallen B. Cardiac arrest during anaesthesia: A computer-aided study in
250, 543 anaesthetics. Acta Anaesthesiol. Scand., 1988; 32: 653—64.
37. Biboulet P., Aubas P., Dubourdieu J., Rubenovitch J., Capdevila X., d’Athis F. Fatal
and non fatal cardiac arrests related to anesthesia. Can. J. Anesth., 2001; 48: 326—32.
38. White S.M., Akerele O. Anaesthetists’ attitudes to intraoperative death. Eur. J. Anaesth,
2005, 22: 938-941.
39. Gibbs N., Rodoreda P. Anaesthetic mortality rates in Western Australia 1980-2002.
Anaesth. Intensive Care., 2005 Oct; 33 (5): 616—22.
40. Braz L. G., Modolo N.S., do Nascimento P.J.R. et al. Perioperative cardiac arrest: a
study of 53,718 anaesthetics over 9 yr from a Brazilian teaching hospital. : Br. J. Anaesth.,
2006 May; 96 (5): 569-75.
41. Meregalli A., Oliveira R.P., Friedman G. Occult hypoperfusion is associated with
increased mortality in hemodynamically stable, high-risk, surgical patients. Crit Care, 2004
Apr; 8 (2): 60—5.
42. Hepner D.L., Castells M.C. Anaphylaxis during the perioperative period. Anesth.
Analg., 2003 Nov; 97 (5): 1381-950.
43. Mertes P.M., Laxenaire M.C. Allergy and anaphylaxis in anaesthesia. Minerva
Anestesiol., 2004 May; 70 (5): 285—91.
44. Heytman M., Rainbird A. Use of alpha-agonists for management of anaphylaxis occurring
under anaesthesia: case studies and review. Anaesthesia, 2004 Dec; 59 (12): 1210—5.
45. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3th ed. Churchill Livingstone, 1994,
524 p.
46. Littleford J.A., Patel L.R., Bose D. et al. Masseter spasm in children: Implication of
continuing the triggering anesthetic. Anesth. Analg., 1991, 72: 151—160.
47. Girard T., Treves S., Voronkov E. et al. Molecular genetic testing for malignant
hyperthermia susceptibility. Anesthesiology, 2004 May; 100 (5): 1076—80.
48. Krause T, Gerbershagen M. U, Fiege M. et al. Dantrolene — A review of its phar-
macology, therapeutic use and new developments. Anaesthesia, 2004 Apr; 59 (4): 364—73.
49. Green G. A fatal case of malignant hyperthermia complicated by generalized compartment
syndrome and rhabdomyolysis. Acta Anaesth. Scand., 2003 May; 47 (5): 619—21.
50. Hacki W., Mauritiz W., Winkler M. et al. Anaesthesia in malignant hypertermia
susceptible patients without dantrolen prophylaxis. Acta Anaesth. Scand., 1990, 34: 534—537.
51. Kasai T, Hirose M., Matsukawa T. et al. Preoperative blood pressure and catecholamines
related to hypothermia during general anesthesia. Acta Anaesth. Scand., 2003 Feb; 47 (2): 208—12.
52. Sicardi S. Z., Rodhe P., Hahn R.G. Progressive decrease in glucose clearance during
surgery. Acta Anaesth. Scand., 2006 Aug; 50 (7): 848-54.
209
10. РАННИМ ПОСЛЕОПЕРАЦИОННЫМ
ПЕРИОД
10.1. ПЕРЕВОД ПАЦИЕНТА В ПАЛАТУ, ЭКСТУБАЦИЯ
В тесном сотрудничестве с хирургическим персоналом анес-
тезиологи принимают участие в обеспечении раннего восстанов-
ления пациента после операции [1].
Во многих странах мира для больных после операции предус-
мотрены специальные “палаты пробуждения” после анестезии -
recovery room, или палаты послеоперационного восстановления.
Такие палаты оснащены интенсивными методами наблюдения,
позволяющими обеспечивать контроль и коррекцию жизненно
важных функций, в первую очередь — дыхания и кровообраще-
ния. Как правило, эти палаты расположены непосредственно воз-
ле операционной, что минимизирует возможную травматизацию
и время транспортировки больного. Исторически сложилось, что
в Украине функцию “палат пробуждения” выполняют палаты от-
деления интенсивной терапии (ОИТ) либо больные до пробужде-
ния и экстубации пребывают в операционной. Нахождение паци-
ента в операционной целесообразно только в случае, если удается
быстрое, в течение нескольких десятков минут пробуждение и
экстубация больного, иначе задерживается работа анестезиологи-
ческой и операционной бригад при необходимости проведения
следующего оперативного вмешательства.
В палатах ОИТ создают условия для тщательного мониторин-
га в ранний послеоперационный период и обеспечивают конт-
роль и поддержание жизненно важных функций. Больные высо-
кой группы риска после тяжелых продолжительных операций в
ранний послеоперационный период нуждаются в наблюдении и
коррекции состояния, которые почти не отличаются от операци-
онного периода.
Скорость восстановления функций ЦНС, мышечного тонуса,
систем дыхания и кровообращения во многом зависит от времени
после прекращения подачи ингаляционного или последнего вве-
дения внутривенного анестетиков и миорелаксантов, их фарма-
кодинамики и фармакокинетики, интеракции, вида и продолжи-
тельности оперативного вмешательства, температуры тела, вод-
но-электролитного баланса, КОС крови и др.
210
10. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
Ранее доминировала концепция о необходимости плановой продленной ИВЛ
в ранний послеоперационный период у больных высокой группы риска. Сейчас
популярна тенденция более быстрого пробуждения больных и раннего перевода
на спонтанное дыхание после экстубации. Это стало возможным благодаря при-
менению современных более управляемых анестетиков (прежде всего ингаляци-
онных) и миорелаксантов. Продленная ИВЛ в послеоперационном периоде пока-
зана больным с тяжелой дыхательной недостаточностью, некоторыми расстрой-
ствами функций сердечно-сосудистой системы, тяжелым сепсисом, полиорганной
недостаточностью.
Проблема полного пробуждения и восстановления спонтанного дыхания являет-
ся одной из центральных в ранний послеоперационный период. Только после вос-
становления ясного сознания, мышечного тонуса и адекватного самостоятельного
дыхания проводят экстубацию; в некоторых случаях больных экстубируют во сне.
По данным анестезиологов Великобритании и Ирландии [2], осложнения не-
своевременной экстубации остаются важным фактором риска анестезии. Соглас-
но исследованию, использование короткодействующих препаратов поощряет ане-
стезиологов экстубировать больного ранее положенного срока, проводить эксту-
бацию в положении больного с приподнятым головным концом или в позиции
сидя. Относительно часто возникают осложнения экстубации, связанные с нару-
шением проходимости дыхательных путей, но обычно их ликвидируют простыми
основными мероприятиями. Авторы утверждают, что роль препаратов по типу
пропофола в уменьшении инцидентности осложнений экстубации нуждается в
дальнейшей оценке. Авторы исследования настоятельно подчеркивают важность
применения постоянной оксигенации до полного восстановления пациента.
Основным субъективным симптомом декураризации (см. раздел 6.6) является
восстановление тонуса мышц шеи (способность больного поднять голову на 5 см)
и сократительной способности мышц предплечья (способность пожать руку, для
чего анестезиолог, как правило, подает пациенту для пожатия два пальца — указа-
тельный и средний). Мониторинг нервно-мышечной блокады подробно описан в
разделе 6.6.2 [3].
Оксигенацию определяют методом пульсоксиметрии (см. раздел 9.9.2); адек-
ватность вентиляции при отсутствии постоянного мониторинга газового состава
крови оценить сложнее. Субъективным тестом адекватности вентиляции является
ритмичное дыхание, способность пациента некоторое время дышать глубоко с
хорошими экскурсиями грудной клетки, отсутствие парадоксального дыхания.
Парадоксальное дыхание, когда функция диафрагмы восстановлена, а функция
межреберных мышц — не полностью, является противопоказанием к переводу на
спонтанное. Восстановление сознания и мышечного тонуса не гарантируют адек-
ватность спонтанного дыхания, например, у ослабленных и больных с дыхатель-
ной недостаточностью.
Экстубация трахеи в условиях остаточного пареза дыхательных и фарингеаль-
ных мышц может способствовать развитию неблагоприятных осложнений со сто-
роны дыхания. Murphy и соавторы [4] исследовали инцидентность и тяжесть оста-
точного блока нервно-мышечной передачи во время экстубации трахеи. Получен-
ные результаты свидетельствуют, что анестезиологи не всегда проводят экстубацию
трахеи при полном восстановлении после нервно-мышечной блокады.
Выбор времени экстубации — ответственная и иногда трудная задача анесте-
зиологического обеспечения послеоперационного периода: преждевременная эк-
стубация грозит тяжелыми расстройствами вентиляции, а длительное нахождение
211
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
интубационной трубки в трахее является источником симпатической стимуляции,
беспокойства больного и гемодинамической нестабильности.
Критерии для проведения экстубации трахеи: ясное сознание, ЖЕЛ более 15 мл/кг,
сила вдоха не менее —20 см вод. ст., нормальное насыщение крови по данным
пульсоксиметрии. Ни один из критериев самостоятельно не обеспечивает безо-
пасную экстубацию больного, необходима комплексная оценка состояния перед
экстубацией. Экстубация у больных высокой группы риска сопряжена с тяжелы-
ми осложнениями, так как может вызывать сильную стрессовую гемодинамичес-
кую реакцию, равную реакции на интубацию трахеи. Kulkarni и соавторы [5] на-
звали этот феномен “трудной экстубацией” по аналогии с интубацией. Они опи-
сали пациента с инфарктом миокарда, у которого были неоднократные неудачные
попытки экстубации трахеи: после каждой попытки развивался острый отек лег-
ких, вследствие повышенной активности симпатической нервной системы, и лишь
применение пропофола и длительная инфузия дексмедетомидина позволили ус-
пешно выполнить экстубацию.
С целью профилактики артериальной гипертензии экстубацию выполняют на
фоне инфузии нитроглицерина, введения 0-блокаторов и др. Оптимальным вари-
антом для некоторых больных является экстубация на фоне ингаляции субнарко-
тических доз быстродействующих ингаляционных анестетиков, например, дес-
флюрана. Таким образом, для обеспечения безопасной экстубации необходимо
строгое мониторирование функций дыхания и кровообращения, и если для стаби-
лизации последнего необходимо применение седативных средств, то необходимо
помнить, что на дыхание эти препараты оказывают депрессивное действие.
Всегда существует риск возникновения в раннем послеоперационном перио-
де непроизвольной экстубации или самоэкстубации (см. раздел 8.3.5.3). Для этого
необходима постоянная готовность для экстренной реинтубации больного.
Восстановление адекватной вентиляции полностью не гарантирует ее сохра-
нение в течение раннего послеоперационного периода вследствие рекураризации.
Особенно часто возникает это осложнение, если для восстановления мышечного
тонуса использовали ингибиторы холинэстеразы (см. раздел 6.6.1). В период, пред-
шествующий экстубации, или в ближайшее время после нее осторожно применя-
ют наркотические аналгетики с целью обезболивания. Хорошей альтернативой им
являются нестероидные противовоспалительные средства, особенно перспектив-
ны селективные ингибиторы циклооксигеназы-2 (парекоксиб), которые не дей-
ствуют на дыхание и гемостаз, что важно в раннем послеоперационном периоде
[6, 7]. Применение парекоксиба для обезболивания в послеоперационном перио-
де разрешено в странах Евросоюза [8].
Хорошо изучен эффект потенцирования действия мышечных релаксантов
препаратами магния. Fawcett и Stone [9] описали случай рекураризации у пациен-
та после применения магния сульфата, хотя примененная доза была недостаточ-
ной для снижения мышечного тонуса. Авторы рекомендуют избегать использова-
ния препаратов магния, по крайней мере, в течение 30 мин после восстановления
нервно-мышечной передачи. Нарушение нервно-мышечной проводимости могут
усилить аминогликозиды, стрептомицин, фуросемид.
Одним из условий неосложненного течения раннего послеоперационного пе-
риода является регламентированная передача пациента анестезиологом, который
обеспечивал анестезию, врачу, который будет обеспечивать ранний послеопера-
ционный период.
Регламент информации, которую должен предоставить анестезиолог лечащему
врачу [10]: фамилия и имя пациента, оперативное вмешательство и вид анестезии,
212
10. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
включая примененные анестетики и другие препараты (антибиотики, вазо- и кар-
диоактивные, диуретики, антиаритмические, антикоагулянты и др.), предопера-
ционное состояние жизненно-важных органов и систем, сопутствующие заболе-
вания, объем предмедикации, аллергологический анамнез, объем интраопераци-
онной кровопотери, инфузионно-трансфузионная терапия, осложнения
(хирургические и анестезиологические) во время операции, состояние больного
на данный момент.
Лечащий врач проводит физикальное обследование больного, акцентирует вни-
мание на состоянии сознания, ЧДД и характере дыхания, ЧСС, характеристиках
пульса, АД, показаниях пульсоксиметра, при необходимости выполняет анализ га-
зов крови, КОС, ЭКГ и др. Иногда эти принципы нарушают, что недопустимо,
когда больного после операции переводят не в палату ОИТ, а в общую хирургичес-
кую палату.
10.2. ОСЛОЖНЕНИЯ РАННЕГО ПОСЛЕОПЕРАЦИОННОГО
ПЕРИОДА
Осложнения раннего послеоперационного периода: обструкция верх-
них дыхательных путей, артериальная гипоксемия, гиповентиляция, артериальная
гипотензия, артериальная гипертензия, нарушения ритма сердца, олигурия, кро-
вотечение, гипотермия, нарушения сознания, тошнота и рвота, боль, поврежде-
ние периферических нервов и нервных сплетений.
Обструкция верхних дыхательных путей наиболее часто развивается по причи-
не нарушения тонуса мимической и жевательной мускулатуры и смещения (запа-
дения) нижней челюсти, реже — из-за ларингоспазма после травматичной интуба-
ции, отека гортани и надгортанника. При выраженных расстройствах проходимо-
сти дыхательных путей иногда проводят повторную интубацию.
Инцидентность артериальной гипоксемии достигает 50 % в течение первых
3 послеоперационных часов. После торакальных операций и верхней лапарото-
мии рО2, как правило, снижается на 20 % от дооперационного уровня [11].
Причины возникновения артериальной гипоксемии в раннем послеопераци-
онный период: снижение функциональной остаточной емкости легких, боль, уве-
личение шунтирования в легких и потребности тканей в кислороде (послеопера-
ционная дрожь).
Диагностируют гипоксемию с помощью анализа газов крови, метода пульс-
оксиметрии, по цвету кожных покровов. Оксигенотерапия часто корректирует ги-
поксемию, однако, если выражено шунтирование или оксигенотерапия стимули-
рует гиповентиляцию и гиперкапнию, то проводят повторную интубацию и пере-
вод на ИВЛ с ПДКВ. В раннем послеоперационном периоде насыщение кислородом
крови поддерживают на уровне не менее 95 %.
Гиповентиляция является более частым осложнением, чем гипоксемия, так
как ее нельзя корректировать оксигенотерапией.
Причины развития гиповентиляции в ранний послеоперационный период:
угнетение дыхательного центра анестетиками, снижение функции дыхательной
мускулатуры в результате остаточной кураризации, боль, сопутствующие ожире-
ние и ХОЗЛ.
Диагностируют гиповентиляцию по анализам газов крови (рСО2 > 45 мм рт. ст.)
и клиническим признакам (теплым влажным кожным покровам, возбуждению,
213
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
тахикардии, артериальной гипертензии). Лечат гиповентиляцию продленной ИВЛ
до стабилизации тонуса дыхательного центра. При остаточном действии опиоидов
применяют налоксон (40—80 мкг внутривенно болюсно), но его введение может
сопровождаться большим количеством осложнений — артериальной гипертензи-
ей, отеком легких, тяжелыми нарушениями ритма сердца. Кроме этого, действие
налоксона длится не более 45 мин, а действие опиоидов — значительно больше. В
какой-то степени вышеуказанное справедливо при декураризации с помощью ан-
тихолинэстеразных препаратов. При применении больших доз бензодиазепинов
во время операции используют их антагонист — флумазенил (внутривенно болюс-
но по 0,2 мг титруют до 1 мг в течение 5 мин, максимальная доза 5 мг). После
окончания действия флумазенила седация может возобновиться.
По причине высокой частоты развития артериальной гипотензии после опера-
ции систематическое измерение АД является обязательным компонентом мони-
торинга в ранний послеоперационный период.
Причины возникновения артериальной гипотензии в раннем послеопераци-
онном периоде: абсолютная или относительная гиповолемия, вызванная кровоте-
чением или снижением периферического сосудистого сопротивления, снижение
сократительной способности миокарда (ишемия миокарда, депрессивный эффект
некоторых анестетиков), нарушения ритма сердца, напряженный пневмоторакс и
легочная эмболия (редко).
Ортостатическая гипотензия часто возникает после общей анестезии даже при
небольших операциях и является основной причиной потери ортостатической то-
лерантности в послеоперационный период [12].
Своевременно проводят дифференциальную диагностику артериальной гипо-
тензии и выбирают тактику — терапевтическую или хирургическую. В дифферен-
циальной диагностике гиповолемии и миокардиальной недостаточности важное
значение имеют уровни ЦВД, ДЗЛА, а также реакция на объемную нагрузку -
переливание внутривенно 3—6 мл/кг кристаллоидного изотонического раствора.
Увеличение АД и диуреза в ответ на инфузию с большой вероятностью свидетель-
ствует о гиповолемии, а не о снижении сократимости миокарда, при котором
повышаются ЦВД и ДЗЛА (свыше 15 мм рт. ст.). Для исключения напряженного
пневмоторакса проводят рентгенологическое обследование грудной клетки. Уро-
вень АД нормализуют в кратчайшие сроки, так как чем продолжительнее артери-
альная гипотензия, тем больше осложнений может развиться в последующем, осо-
бенно у пожилых больных с тяжелыми сопутствующими'заболеваниями.
Артериальная гипертензия. Причины развития в ранний послеоперационный
период: артериальная гипоксемия, гиперкапния, активация симпатической не-
рвной системы в ответ на боль, предоперационная гипертензия, гиперволемия
(редко).
Артериальная гипертензия может значительно увеличить нагрузку на левый
желудочек с развитием его недостаточности и последующим отеком легких. Осо-
бенно опасно это осложнение после обширных резекций легких и у больных с
исходной недостаточностью миокарда. Применение адекватного обезболивания и
антигипертензивных препаратов позволяет избежать развития артериальной ги-
пертензии при условии исключения гипоксемии и гиперкапнии.
Нарушения ритма сердца. Причины развития в ранний послеоперационный
период: артериальная гипоксемия, гиперкапния, гиповолемия, боль, гипотермия,
нарушения электролитного баланса (особенно часто — гипокалиемия), интокси-
кация гликозидами.
214
10. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
Лечение начинают с коррекции этиологических факторов аритмий. Прежде все-
го, исключают нарушения газообмена, нормализуют водно-электролитный баланс и
показатели КОС. При рефрактерное™ аритмии к этим методам проводят консульта-
цию кардиолога и совместно с ним назначают антиаритмические средства.
Послеоперационное кровотечение — одно из наиболее частых и грозных ос-
ложнений раннего послеоперационного периода. Перед анестезиологом стоит за-
дача исключить и, если необходимо, откорректировать расстройства коагуляции.
Наиболее информативными диагностическими критериями послеоперационного
кровотечения является мониторинг отделяемого из раны, его объемная скорость и
содержание в нем гемоглобина. Опыт показывает, что ранний хирургический ге-
мостаз является наиболее эффективной и безопасной стратегией, чем длительное
наблюдение с продолжающейся кровопотерей, массивным восполнением, в том
числе и препаратами крови, прогрессированием коагулопатии и другими расстрой-
ствами гомеостаза.
В случае клинически значимой коагулопатии со снижением количества тром-
боцитов, замедлением протромбинового времени, АЧТВ проводят коррекцию ге-
мостаза путем переливания свежезамороженной плазмы. В последнее время при
неэффективности хирургического гемостаза и обычной гемостатической терапии
эффективным средством остановки кровотечения является применение активиро-
ванного рекомбинантного фактора VII (НовоСевена), терапия которым часто бы-
вает жизнеспасительной, несмотря на высокую стоимость препарата.
Замедленное пробуждение. Причины развития: остаточное действие анестети-
ков, особенно опиоидов и бензодиазепинов, гипотермия, гипогликемия, наруше-
ния электролитного баланса, тяжелая гипоксия и ишемия мозга, внутричерепные
кровоизлияния во время операции, внутричерепная гипертензия, отек мозга, воз-
душная эмболия церебральных сосудов.
Остаточный эффект препаратов, которые применяли для поддержания общей
анестезии во время операции, является наиболее частой и наименее опасной при-
чиной замедленного пробуждения после операции. Управляемость действия ха-
рактерна практически для всех современных ингаляционных анестетиков. Доста-
точно быстрое пробуждение наступает после применения пропофола, этомидата,
мидазолама. Значительно более длительный гипнотический эффект характерен
для оксибутирата натрия, бензодиазепинов (кроме мидазолама) (см. раздел 5),
поэтому их не вводят в конце операции, если предполагают экстубацию больного.
Если замедление восстановления сознания в послеоперационный период вы-
звано интраоперационными осложнениями, наиболее часто — интраоперацион-
ной ишемией головного мозга, особенно у больных пожилого возраста, то прово-
дят консультацию невропатолога, нейрохирурга и компьютерную томографию го-
ловы.
Замедление пробуждения больного после операции или восстановление со-
знания с последующим развитием комы иногда связаны с продолжающейся ги-
поксией и ишемией головного мозга из-за нарушений оксигенации, вентиляции,
перфузии (артериальной гипотензии, внутричерепной гипертензии) или отека го-
ловного мозга, вызванного гипергидратацией, гипонатриемией, гипернатриеми-
ей, гипогликемией. Необходимо помнить о возможности повторного глубокого
сна пациента с нарушением функции дыхания после экстубации.
Larijani и соавторы [13] оценили эффект однократного введения 200 мг мода-
финила (средства, способствующего более быстрому пробуждению после наркоза)
и плацебо у пациентов после общей анестезии и сделали заключение, что прием
215
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
модафинила существенно уменьшает усталость и улучшает эмоциональный статус
после операции. Окончательные рекомендации по применению модафинила бу-
дут сделаны после дополнительных рандомизированных исследований.
Гипотермия (см. раздел 9.4.6.3).
Послеоперационная дрожь — частое осложнение послеоперационного перио-
да. Это реакция организма на нарушение теплового баланса во время операции.
Послеоперационная дрожь модулируется центром терморегуляции гипоталамуса
и выражается в спонтанных асинхронных сокращениях скелетной мускулатуры,
После прекращения действия миорелаксантов и общих анестетиков в ответ на
повышенную потерю тепла во время операции стимулируется дрожательный тер-
могенез. Посленаркозная дрожь сопровождается энергозатратами, значительным
увеличением метаболизма, потребностью тканей в кислороде, увеличением про-
дукции углекислого газа, неприятными субъективными ощущениями больного [14].
У молодых физически развитых людей продукция тепла может увеличиться на 300 %;
у больных с легочно-сердечной недостаточностью дрожь может привести к тяже-
лым осложнениям.
Относительная эффективность средств, используемых для лечения послеопе-
рационной дрожи, изучена не полностью. Kranke и соавторы [15] провели мета-
анализ рандомизированных исследований фармакологических средств против дрожи
с плацебо-контролем в послеоперационном периоде. Были проанализированы
данные 20 исследований, в которых 944 взрослых получили активное вмешатель-
ство и 413 взрослых составили контрольную группу. Антидрожательная актив-
ность зависела от режима и продолжительности применения средств. Эффектив-
ность мепередина (25 мг), клонидина (150 мкг), кетанеста (10 мг) и доксапрама
(100 мг) изучали в трех исследованиях. Все препараты были достоверно более
эффективными по сравнению с плацебо. Данные об эффективности альфентани-
ла, фентанила, морфина, налбуфина, лидокаина, магнезии, метамизола, метилфе-
нидата, нефопама, пентазоцина и трамадола были недостаточно надежными.
По данным Piper и соавторов [16, 17], у больных после урологических опера-
ций применение клонидина до операции было эффективным в предотвращении
дрожи, а доласетрона — нет; введение нефопама в дозе 0,2 мг/кг превосходило
действие клонидина в дозе 1,5 мкг/кг для профилактики посленаркозной дрожи и
не сопровождалось седативными или гемодинамическими побочными эффекта-
ми. По данным Rohm и соавторов [18], нефопам достоверно (р < 0,01) уменьшает
частоту послеоперационной тошноты и рвоты; физостигмин является безопасной
альтернативой нефопаму, достоверно уменьшая инцидентность и тяжесть поста-
нестетической дрожи без влияния на постнаркозное восстановление. Таким обра-
зом, большинство исследований подтверждает эффективность клонидина и нефо-
памома для предотвращения посленаркозной дрожи.
Разные анестетики неодинаково влияют на терморегуляцию и, соответствен-
но, на частоту возникновения послеоперационной дрожи. В сравнении с изофлю-
раном анестезия пропофолом в комбинации с инфузией растворов аминокислот
обладает хорошим теплопродуцирующим эффектом [19]. Dal D. и соавторы [20]
сообщили об эффективности профилактического применения кетамина в дозе
0,5 мг/кг. Для профилактики послеоперационной дрожи авторы предложили инт-
раоперационно использовать инфузии белков и аминокислот, которые стимули-
руют теплопродукцию.
Частота возникновения тошноты и рвоты в ранний послеоперационный пе-
риод достигает 20 % [21]. Хотя эти осложнения, как правило, не вызывают серьез-
216
10. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
ных последствий, они значительно отягощают самочувствие больного, усугубляют
его страдания.
Причины высокого риска возникновения посленаркозных тошноты и рвоты:
посленаркозные тошнота и рвота в анамнезе, женский пол, ожирение, послеопе-
рационная боль, некоторые виды оперативного вмешательства (в офтальмологии,
на среднем ухе, лапароскопические операции), некоторые средства для анестезии
(опиоиды, закись азота), повышение внутрибрюшного давления.
Stadler и соавторы [22] утверждают, что патогенез тошноты и рвоты разнится
в зависимости от вида операции, что наличие мигрени в анамнезе является факто-
ром риска возникновения тошноты, но не рвоты. Из анестетиков наиболее часто
вызывают тошноту и рвоту закись азота и опиоиды [23].
По нашему опыту одним из лучших методов профилактики и лечения после-
наркозных тошноты и рвоты является эффективная декомпрессия и промывание
желудка через назогастральный зонд. В литературе много работ посвящено этому
вопросу. Предложен ряд профилактических средств: дроперидол (1,25 мг), декса-
метазон (8 мг), ондасетрон (4 мг) в различных комбинациях [24], дименгидринат
[25], диксиразин (dixyrazine) [26].
Gan T.J. и соавторы [27] по результатам рандомизированного двойного слепо-
го исследования предложили приемлемую методику профилактики рвоты в ран-
нем послеоперационном периоде: введение 8 мг дексаметазона во время вводного
наркоза с последующим введением за 15 мин перед экстубацией малой дозы гра-
нисетрона (0,1 мг) либо ондасетрона (4 мг). Эти комбинации эффективны у боль-
ных после внутрибрюшной гистерэктомии.
По результатам исследования IMPACT, метоклопрамид для профилактики
тошноты и рвоты малоэффективен [23], хотя в литературе представлены данные,
опровергающие данное исследование. Спинномозговая и эпидуральная анестезии
с применением морфина при кесаревом сечении также часто сопровождаются
посленаркозными тошнотой и рвотой [28]. С целью профилактики авторы пред-
лагают внутривенное введение 50 мг циклизина, который уменьшает частоту этих
осложнений в сравнении с дексаметазоном (8 мг) или плацебо.
Hausel и соавторы [29] обнаружили, что прием углеводного напитка (50 ккал/100 мл,
290 мосм/кг) за 2 ч перед операцией уменьшает риск возникновения посленаркоз-
ных тошноты и рвоты в течение 12—24 ч после лапароскопической холецистэкто-
мии в сравнении с больными, которые 8 ч голодали до операции.
Maharaj и соавторы [30] утверждают, что пооперационное восстановление внут-
рисосудистого дефицита объема жидкости эффективно уменьшает частоту тошно-
ты и рвоты и послеоперационную боль у пациентов с высоким риском при амбу-
латорных операциях. Авторы рекомендуют применять инфузию натрия лактата в
дозе 2 мл/кг/ч во время амбулаторной операции у пациентов с увеличенным рис-
ком тошноты и рвоты после перации.
Apfel и соавторы [31] считают профилактической мерой тошноты и рвоты
применение тотальной внутривенной анестезии пропофолом, но у пациентов с
высоким риском этот метод уменьшает возникновение подобных осложнений толь-
ко на 30 %. Этот результат сопоставим с уменьшением риска при применении
противорвотных средств по типу антагонистов серотонина, дексаметазона и дро-
перидола. Эти авторы считают, что для лечения тошноты и рвоты необходимо
выбрать противорвотное средство, которое не использовали профилактически, и
назначить его в дозировке, превышающей в 4 раза дозировку профилактического
препарата.
217
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рутинную профилактику послеоперационных тошноты и рвоты считают не-
рентабельной. Идентификация пациентов с высокой степенью риска позволяет
планировать профилактику индивидуально. Не требуется никаких профилакти-
ческих мероприятий у пациентов с низким риском тошноты и рвоты. Для пациен-
тов с умеренным риском развития для профилактики используют одно противо-
рвотное средство или комбинацию двух. Двойные и тройные комбинации реко-
мендованы пациентам с высоким риском [32].
Повреждение периферических нервов и нервных сплетений связано с ишемией
нервных стволов, возникшей в результате длительного сдавливания при нефизио-
логическом положении конечностей во время операции.
Факторы риска послеоперационного повреждения периферических нервов:
продолжительность операции более 4 ч, небольшая масса тела, курение.
Наиболее часто возникают повреждения малоберцового нерва с развитием “кон-
ской стопы” (осложнение характерно для литотомического положения), поврежде-
ния локтевого и срединного нервов, плечевого сплетения. Для успешного лечения
проводят своевременную диагностику и наблюдение врача-невропатолога.
В литературе описана возможная связь между различными видами анестезии
и появлением звона в ушах. После обшей анестезии это осложнение не должно
возникать, но очень редко наблюдают специфическую форму низкочастотного
звона в ушах в сочетании с сенсорной потерей слуха в низкочастотном диапазоне
звучания после спинномозговой анестезии. Обратимый звон в ушах и нарушение
слуха после местной анестезии обычно появляются в случаях токсического эф-
фекта анестетика на ЦНС.
ЛИТЕРАТУРА
1. Kehlet Н, Dahl J.B. Anaesthesia, surgery and challenges in postoperative recovery.
Lancet, 2003 Dec 6; 362 (9399): 1921-8.
2 Rassam S., Sandbythomas M., Vaughan R.S., Hall J.E. Airway management before,
during and after extubation: a survey of practice in the United Kingdom and Ireland. Anaesthesia,
2005 Oct; 60 (10): 995-1001.
3. Murphy G.S, SzokolJ.W, Marymont JH. etal. Residual paralysis at the time of tracheal
extubation. Anesth. Analg., 2005 Jun; 100 (6): 1840—5.
4. Kulkarni A., Price G., Saxena M., Skowronski G. Difficult extubation: calming the
sympathetic storm. Anaesth. Intensive Care, 2004 Jun; 32 (3): 413—6.
5. Tang J., Li S., White P.F., Chen X- et al. Effect of parecoxib, a novel intravenous
cyclooxygenase type-2 inhibitor, on the postoperative opioid requirement and quality of pain
control. Anesthesiology, 2002 Jun; 96 (6): 1305—9.
6. Gajraj N.M., Joshi G.P. Role of cyclooxygenase-2 inhibitors in postoperative pain
management. Anesthesiol. Clin. North. America, 2005 Mar; 23 (1): 49—72.
7. Mehlisch D.R., Desjardins P.J., Daniels S., Hubbard R.C. The analgesic efficacy of
intramuscular parecoxib sodium in postoperative dental pain. J. Am. Dent. Assoc., 2004 Nov;
135 (11): 1578-1590.
8. Fawcett W.J., Stone J.P. Recurarization in the recovery room following the use of
magnesium sulphate. Br. J. Anaesth., 2003 Sep; 91 (3): 435—8.
9. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3th Ed. Churchill Livingstone, 1994,
524 p.
10. Daley M.D., Norman P.H, Colmenares M.E., Sandler A.N. Hypoxaemia in adults in
the post-anesthetic unit. Can. J. Anaesth., 1991, 38: 740—746.
11. Cowie D.A., Shoemaker J.K., Gelb A- W. Orthostatic hypotension occurs frequently in
the first hour after anesthesia. Anesth Analg., 2004 Jan; 98 (1): 40—5.
218
10. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
12. Larijani G.E., Goldberg М.Е., Hojat М. et al. Modafinil improves recovery after
general anesthesia. Anesth. Analg., 2004 Apr; 98 (4): 976—81.
13. Perez-de-Sa V., Cunha-Goncalves D., Schou H. etal. The hemodynamic and metabolic
effects of shivering during acute normovolemic hemodilution. Anesth. Analg., 2003 Oct; 97
(4): 972-8.
14. Kranke P., Eberhart L., Roewer N., Tramer M.R. Pharmacological treatment of
postoperative shivering: a quantitative systematic review of randomized controlled trials. Anesth.
Analg., 2002 Feb; 94 (2): 453-60.
15. Piper S.N., Rohm D., Maleck W.H. et al. Dolasetron for preventing postanesthetic
shivering. Anesth. Analg., 2002 Jan; 94 (1): 106—11.
16. Piper S.N., Rohm K.D., Suttner S. W. et al. A comparison of nefopam and clonidine
for the prevention of postanaesthetic shivering: a comparative, double-blind and placebo-
controlled dose-ranging study. Anaesthesia, 2004 Jun; 59 (6): 559—64.
17. Rohm K.D., Riechmann J., Boldt J. et al. Physostigmine for the prevention of
postanaesthetic shivering following general anaesthesia — a placebo-controlled comparison
with nefopam. Anaesthesia, 2005 May; 60 (5): 433—8.
18. Sahin A., Aypar U. Effect of amino acid solutions on intraoperative hypothermia and
postoperative shivering. Comparison of two anesthetic regimens. Acta Anaesthesiol. Scand.,
2002 Jan; 46 (1): 64-7.
19. Dal D., Kose A., Honea M. et al. Efficacy of prophylactic ketamine in preventing
postoperative shivering. Br. J. Anaesth., 2005 Aug; 95 (2): 189—92.
20. Watcha M.F., White P.F. Postoperative nausea and vomiting. Anesthesiology, 1992;
77: 162-84.
21. Stadler M., Bardiau F, Seidel L. et al. Difference in risk factors for postoperative
nausea and vomiting. Anesthesiology, 2003 Jan; 98 (1): 46—52.
22. Apfel C.C., Roewer N. Postoperative nausea and vomiting. Anaesthesist, 2004 Apr; 53 (4):
377-89; quiz 390-1.
23. Sanchez-Ledesma M.J., Lopez-Olaondo L. et al. A comparison of three antiemetic
combinations for the prevention of postoperative nausea and vomiting. Anesth. Analg., 2002
Dec; 95 (6): 1590-5.
24. Kranke P., Morin A.M., Roewer N., Eberhart L.H. Dimenhydrinate for prophylaxis of
postoperative nausea and vomiting: a meta-analysis of randomized controlled trials. Acta
Anaesthesiol. Scand., 2002 Mar; 46 (3): 238—44.
25. Glaser C, Sitzwohl C, Wallner T. etal. Dixyrazine for the prevention of postoperative
nausea and vomiting after laparoscopic cholecystectomy. Acta Anaesthesiol. Scand., 2004
Nov; 48 (10): 1287-91.
26. Gan T.J., Coop A., Philip B.K. A randomized, double-blind study of granisetron plus
dexamethasone versus ondansetron plus dexamethasone to prevent postoperative nausea and
vomiting in patients undergoing abdominal hysterectomy. Anesth. Analg., 2005 Nov; 101 (5):
1323-9.
27. Nortcliffe S.A., Shah J., Buggy D.J. Prevention of postoperative nausea and vomiting
after spinal morphine for Caesarean section: comparison of cyclizine, dexamethasone and
placebo. Br. J. Anaesth., 2003 May; 90 (5): 665—70.
28. Hausel J., Nygren J., Thorell A. et al. Randomized clinical trial of the effects of oral
preoperative carbohydrates on postoperative nausea and vomiting after laparoscopic
cholecystectomy. Br. J. Surg., 2005 Apr; 92 (4): 415—21.
29. Maharaj C.H., Kallam S.R., Malik A. et al. Preoperative intravenous fluid therapy
decreases postoperative nausea and pain in high risk patients. Anesth. Analg., 2005 Mar; 100 (3):
675-82.
30. Apfel C.C., Roewer N. Postoperative nausea and vomiting. Anaesthesist, 2004 Apr; 53
(4): 377-89; quiz 390-1.
31. Habib A.S., Gan T.J. Evidence-based management of postoperative nausea and
vomiting: a review. Can. J. Anaesth., 2004 Apr; 51 (4): 326—41.
219
11. ПОСЛЕОПЕРАЦИОННОЕ
ОБЕЗБОЛИВАНИЕ
11.1. АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема боли остается одной из глобальных и нерешенных на
современном этапе развития медицины. Острая боль, в частно-
сти, послеоперационная, является одним из наиболее распрост-
раненных видов боли. Рост количества оперативных вмешательств,
повышение удельного веса среди оперируемых больных лиц по-
жилого и старческого возраста, которые в большей степени под-
вержены риску побочных эффектов неустраненной послеопера-
ционной боли, делает актуальным разработку дифференцирован-
ных схем послеоперационного обезболивания в различных областях
хирургии на принципах доказательной медицины. В 2006 году
опубликовано 10 метаанализов, которые посвящены различным
аспектам послеоперационного обезболивания [18—21, 26, 27, 29,
42, 45, 47].
Каждое оперативное вмешательство сопровождается предна-
меренной операционной травмой, устранение последствий кото-
рой является основной задачей послеоперационного периода.
Анестезиологи в течение длительного времени уделяли основное
внимание интраоперационному обезболиванию, рассматривая пос-
леоперационную аналгезию, как нечто второстепенное. Зачастую
этот этап лечения, к сожалению, иногда полностью является обя-
занностью среднего медицинского персонала хирургических от-
делений, что нередко порождает недостаточное устранение боли
и, соответственно, неудовлетворенность больных результатами
лечения. В настоящее время неудачи в послеоперационном обез-
боливании составляют 20-75 %.
На современном этапе устранение послеоперационной боли
рассматривают в качестве части общей реабилитационной страте-
гии каждого конкретного больного, которая включает раннюю
активизацию на фоне полноценного обезболивания и раннее эн-
теральное питание.
Неустраненная боль в раннем послеоперационном периоде,
кроме выраженного субъективного дискомфорта, чревата целым
220
II. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
рядом серьезных осложнений, которые могут стать серьезным препятствием на
пути выздоровления больного. Контроль над послеоперационной болью позволя-
ет снизить риск развития серьезных послеоперационных осложнений: ишемии и
инфаркта миокарда, тахикардии, аритмии, ателектазов, тромбоэмболических ос-
ложнений, периферической вазоконстрикции, метаболического ацидоза и нару-
шений процесса заживления послеоперационной раны.
Адекватное устранение послеоперационной боли обеспечивает лучший уро-
вень восстановления, повышенный комфорт пациента (уменьшение психологи-
ческого стресса, повышение мотивации к выздоровлению и ранней активизации),
уменьшение влияния стресса на сердечно-сосудистую систему, снижение количе-
ства легочных, тромбоэмболических осложнений, нарушений моторики желудоч-
но-кишечного тракта, задержек мочи, иммунологических нарушений, септичес-
ких осложнений, летальности у пациентов высокого риска, хронической нейропа-
тической боли, а также уменьшение стоимости медицинской помощи. По данным
Shea R.A. и соавторов [43], послеоперационная боль у возрастных больных с абдо-
минальными операциями способствовала увеличению времени их пребывания в
стационаре (17,9 койко-дней у больных с легочными осложнениями против 8,5 у
больных без таковых).
Несмотря на значительные успехи в области послеоперационного обезболи-
вания, остается актуальным вопрос неудовлетворительной аналгезии после боль-
ших операций [33]. Одной из причин неудовлетворительной аналгезии является
ложное представление, что боль в послеоперационном периоде является симпто-
мом основного заболевания и в качестве моносимптома — не представляет опас-
ности. Также ошибочным является мнение, что аналгезия затрудняет и даже дела-
ет невозможной постановку истинного диагноза. Боязнь перед потенциальным
привыканием к опиатам и развитием их побочных эффектов (депрессии дыхания,
тошноты, рвоты и др.), отсутствие понимания фармакокинетики обезболивающих
препаратов и различий их аналгетического эффекта (назначение в несоответству-
ющей дозировке, с неправильно выбранным интервалом введения, неправильной
трактовкой назначений дозировок опиатов средним медицинским персоналом)
также являются причинами неудовлетворительной послеоперационной аналгезии
(табл. 11.1).
Таблица 11.1. Популярные представления и истинные факты
о послеоперационной боли [28]
Представление Факт
Больной убежден, что персонал знает о его болях В 50 % случаев персонал не осведомлен о болях у пациента
Боль, как правило, хорошо устраняется в стационаре Около 58 % больных, находящихся в стацио- наре, испытывают сильную боль (в том числе 7 % больных испытывают ее во время опроса)
Больные получают избыточное коли- чество обезболивающих препаратов Средняя суточная доза морфина у одного про- оперированного пациента составляет 12,4 мг
Применение ненаркотических средств эффективно только при слабых болях Ненаркотические средства эффективны у30-50 % больных, преимущественно при слабой и умеренной болях, но не при сильной боли
221
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Окончание табл. 11.1
Представление Факт
Больные во время сна не испытывают боли У некоторых пациентов сон прерывистый даже из-за слабой боли; по причине выраженных и сильных болей многие пациенты страдают от бессонницы; 61 % больных просыпается от боли
В современной литературе представлено много публикаций, основанных на
принципах доказательной медицины, по лечению острой боли различного генеза,
в том числе послеоперационной.
Специалисты Колледжа анестезиологов и специалистов по медицине боли
Австралии и Новой Зеландии предлагают градацию уровней доказательств лечения
послеоперационной боли [16]:
• I уровень — данные системных обзоров всех имеющихся на сегодняшний
день рандомизированных исследований по проблеме;
• II уровень — данные, по крайней мере, одного рандомизированного клини-
ческого исследования;
• III-1 уровень — данные псевдорандомизированных исследований хорошего
качества (альтернативное распределение и другие методы);
• Ш-2 уровень — данные сравнительных исследований с конкурентным кон-
тролем, нерандомизированных (групповых) и случай-контролированных исследо-
ваний, прерванных временных серий с контрольной группой;
• Ш-З уровень — данные сравнительных исследований с хронологическим
контролем, системных обзоров всех имеющихся рандомизированных исследова-
ний по проблеме, прерванных временных серий без контрольной группы;
• IV уровень — данные серии клинических случаев;
• V уровень — мнения экспертов по данной проблеме.
11.2. ПАТОФИЗИОЛОГИЯ
ПОСЛЕОПЕРАЦИОННОЙ БОЛИ
Одна из наиболее полных схем поведенческих и физиологичес-
ких последствий послеоперационной боли представлена на рис. 11.1.
Острую послеоперационную боль в настоящее время рассматривают с пози-
ций изменений в нервной системе [23]. Первичная и втори.чная гипералгезии
(рис. 11.2) являются следствием возникновения в ЦНС феномена wind-up (англ.
wind-up — взвинчивание), который развивается в результате стимуляции NMDA-
рецепторов. Известно, что неизбирательным антагонистом этих рецепторов явля-
ется кетамин в субнаркотических дозировках. Его применение предотвращает и
устраняет развитие феномена wind-up. При неадекватной защите больного от опе-
рационного стресса расширяются рецептивные поля спинальных нейронов и воз-
буждаются больвоспринимающие нейрональные структуры спинного мозга. Так
развивается сенситизапия нервной системы. Повреждение тканей вызывает также
повышение возбудимости и реактивности ноцицептивных нейронов в вышележа-
щих центрах головного мозга, включая ядра таламуса и соматосенсорную кору
222
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Ю Рис. 11.1. Последствия тканевого повреждения, приводящего к острой боли у пациентов после оперативных вмешательств
Ь? и травм [24]
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 11.2. Механизмы периферической и центральной сенситизации [46]
больших полушарий [12]. В результате формируется патологическая алгическая си-
стема, являющаяся патодинамической основой хронических болевых синдромов
[8]. Ранее полагали, что при развившейся сенситизации нервной системы для ее
поддержания не требуется периферических ноцицептивных раздражений. В насто-
ящее время это утверждение пересмотрено и, соответственно, считают, что исполь-
зование продленной регионарной аналгезии позволяет надежно устранять боль.
Категорически неверно рассматривать послеоперационную боль в качестве
кратковременного эпизода и неизбежного следствия оперативного вмешательства,
которое исчезает бесследно по мере восстановления больного. Неадекватно устра-
ненная послеоперационная боль может иметь последствия, сохраняющиеся до
8 (!) лет [24].
Реакция организма (каскад последствий) на острую боль [24]:
• освобождение нейротрансмиттеров (Glu, Asp, SP, En, CK, NY, VIP, Gal);
время — до 5 мин;
• электрофизиологические ответы (ВПСП, сенситизация, “wind-up”); время -
до 4 часов;
• внутриклеточный стрессовый ответ (Са++, NOS, РКС); время — до 6 дней;
• структурный ответ (прорастание, синаптическое ремоделирование, апоптоз/
клеточная смерть); время — до 8 лет;
• нейрофизиологические ответы (перцепция, аверсия, избегание, СИА, алло-
диния, хроническая боль, инвалидность, качество жизни); время — до 8 лет.
Традиционно считают, что механизм развития острой послеоперационной боли
связан с хирургической агрессией и стрессовым ответом на операционную травму
(табл. 11.2).
224
II.ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Процесс ответа на хирургическую травму [25]:
• шоковая фаза — скоротечна. Уровень метаболизма и других физиологичес-
ки процессов снижен;
• основная фаза — длится дни, и даже недели, в зависимости от объема опера-
тивного вмешательства и наличия или отсутствия осложнений. Уровень метабо-
лизма повышен, в частности — повышена плазменная концентрация катаболичес-
ких гормонов (адренокортикотропного, кортизола, катехоламинов, антидиурети-
ческого, ренина, ангиотензина, альдостерона, гормона роста) и снижен уровень
анаболических гормонов (инсулина, тестостерона).
Табл и ца 11.2. Эндокринные, метаболические и водно-электролитные реакции
на хирургическое вмешательство [16]
Эндокринные реакции Т катаболические гормоны; Ф анаболические гормоны Т: АКТГ, кортизол, гормон роста, катехоламины, ангиотензин П, альдостерон, глюкагон, IL-I, TNF, IL-6. Ф: инсулин, тестостерон
Метаболические реакции
Углеводный обмен Гипергликемия, снижение толерантности к глюкозе, инсулинорезистентность Т гликогенолиз, глюконеогенез; Т: кортизол, глюкагон, гормон роста, адреналин, свободные жирные кислоты; Ф секреция/активация инсулина
Белковый обмен Катаболизм мышечных белков, Т синтез острофазовых белков Т: кортизол, адреналин, глюкагон, IL-I, IL-6, TNF
Липидный обмен Т липолиз и оксидация Т: катехоламины, кортизол, глюкагон, гормон роста
Водно- электро- литные изменения Задержка воды и Na+, Т экскреция К+, 4- функциональная внеклеточ- ная жидкость со сдвигом во внутриклеточный сектор Т: катехоламины, альдостерон, АДГ, кортизол, ангиотензин II, простагландины и др.
Многие авторы подчеркивают, что наиболее важным фактором, вызывающим в
послеоперационном периоде дисфункцию сердечно-сосудистой и дыхательной сис-
тем, пищеварительного тракта и мочевыделительной системы является активация сим-
патической нервной системы на фоне болевого синдрома. Гиперсимпатикотония —
наиболее значимая причина развития гиперкоагуляционного синдрома и реологичес-
ких нарушений в послеоперационном периоде. Повышенный тонус симпатической
нервной системы может спровоцировать ишемию миокарда за счет увеличения по-
требности миокарда в кислороде и/или снижения доставки кислорода, которое являет-
ся результатом коронарной вазоконстрикции, особенно у больных со сниженными
функциональными резервами кардиоваскулярной системы. При этом ишемия миокар-
да чаще всего возникает на фоне несущественных гемодинамических нарушений —
незначительного увеличения ЧСС. Активация симпатических нервов сердца может
сыграть роль триггера вышеуказанных механизмов за счет стимуляции а-адренорецеп-
торов и последующего спазма крупных эпикардиальных коронарных артерий.
8 7-585
225
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Послеоперационная легочная дисфункция является одной из основных при-
чин послеоперационной летальности, особенно в торакальной хирургии и при
операциях в верхнем отделе брюшной полости. Дисфункция легких обусловлена
болевым синдромом, нарушением функции диафрагмы, повышением тонуса ниж-
них межреберных мышц и мышц брюшной стенки при выдохе. Затруднение при
откашливании вызывает нарушение эвакуации бронхиального секрета, что спо-
собствует ателектазированию с последующим развитием легочной инфекции. Че-
рез 14—16 ч после операции снижается функциональная остаточная емкость лег-
ких, достигает пика в течение 24-48 ч и может сохраняться до 2 недель. При этом
снижаются показатели вентиляционно-перфузионных соотношений, возрастает
сопротивление (эластическое и неэластическое) дыханию.
Интенсивная послеоперационная боль является одной из основных причин
послеоперационного пареза кишечника: она активирует спинальную рефлектор-
ную дугу, угнетая моторику кишечника. Симпатическая гиперстимуляция, инду-
цированная стрессом, угнетает пропульсивную способность кишечника.
11.3. Объективизация боли
Факторы, оказывающие влияние на потребность в аналгетиках: воз-
раст (пожилым пациентам требуются меньшие дозы), пол, сопутствующая патоло-
гия (наркомания или абстиненция, гипертиреоидизм, тревожные и аффективные
расстройства, нарушения функции печени и почек, др.), локализация оператив-
ного вмешательства (пациенты после торакальных и абдоминальных операций на
верхнем отделе брюшной полости чувствуют боль интенсивнее), культурные и
личностные особенности (реакция от полного нетерпения боли до максимального
самоконтроля, интеллектуальный и дооперационный образовательный уровень
больного), индивидуальные болевые пороги, субъективно-негативное отношение
медицинского персонала.
Несмотря на большое количество факторов, влияющих на потребность в анал-
гетиках, каждый пациент имеет собственный болевой профиль в послеоперацион-
ном периоде, который исследуют в динамике для оценки эффективности прово-
димой аналгезии.
Оценку интенсивности боли в ранний послеоперационный период следует
осуществлять не реже, чем регистрацию ЧСС, АД, ЧДД. Являясь субъективным
ощущением, боль всегда представляла трудность для количественной оценки.
Многие авторы предлагали разнообразные методы — от простейших до самых
сложных (электрофизиологические методы с изучением соматосенсорных выз-
ванных потенциалов, ЭЭГ, позитронно-эмиссионную томографию, функциональ-
ный ядерно-магнитный резонанс, исследование протоонкогенов c-fos и c-jun и
т. д.). Большинство из вышеуказанных методов оценки болевых ощущений слож-
ны, требуют дорогостоящей аппаратуры и поэтому мало применимы в клиничес-
кой практике.
Доступным и простым базовым методом остается оценка интенсивности боли
по визуально-аналоговой шкале (ВАШ). ВАШ представляет собой 100 мм отрезок,
в котором 0 — это отсутствие боли, а 100 мм — максимально переносимая боль.
При использовании метода ВАШ применяют производные величины: среднюю
ВАШ за все время наблюдения; время, в течение которого ВАШ превышает 30 мм
(превышение этого порога требует медикаментозной коррекции); площадь под
226
11. ПОСЛЕОПЕРАЦИОННОЕОБЕЗБОЛИВАНИЕ
кривой ВАШ; время, в течение которого удерживается максимальная боль по ВАШ.
Помимо метода ВАШ для объективизации послеоперационной боли используют
показатель суммарного потребления морфина и других опиатов при контролируе-
мой пациентом аналгезии, оценку тактильного и болевого порогов, а также порога
переносимости боли при неинвазивном определении кожных электрических по-
рогов. Последний метод позволяет оценить уровень чувствительности к боли и
функцию ноцицептивной и антиноцицептивной систем, провести дифференциро-
ванный учет ответов разных типов ноцицепторов на операционную травму.
11.4. ЛЕЧЕНИЕ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ
Существует большое количество техник послеоперационного обез-
боливания. В зависимости от способа объективизации боли все методы послеопе-
рационного обезболивания делят на две группы: а) методы устранения боли на
основании субъективных ощущений больного; б) методы устранения боли на ос-
новании постоянного контроля и мониторинга боли вне зависимости от жалоб
больного, с учетом изменений нервной системы и на основании разработанных
индивидуальных схем обезболивания в зависимости от вида хирургического вме-
шательства.
11.4.1. Лекарственные средства
для лечения послеоперационной боли
Традиционно для лечения послеоперационной боли используют
3 группы препаратов: опиоидные аналгетики (см. раздел 5.3.5), местные анестети-
ки (см. раздел 12) и нестероидные противовоспалительные средства (НПВС). Каж-
дая группа препаратов влияет на различные звенья ноцицептивного процесса в
зависимости от режима и пути введения. Также для лечения послеоперационной
боли используют адъювантные препараты.
При рутинном назначении препаратов “по требованию”, без учета индивиду-
альных потребностей больного, без знания особенностей происхождения и разви-
тия боли в зависимости от оперативного вмешательства возможности каждой из
этих групп препаратов ранее использовали далеко не полностью.
11.4.1.1. Опиоидные аналгетики
Наиболее часто используют морфин и его синтетические про-
изводные — промедол и омнопон, а также смешанные агонисты-антагонисты
опиоидных рецепторов (стадол, или буторфанола тартрат, пентазоцин, налбу-
фин) и частичные агонисты опиоидных рецепторов (бупренорфин). Новше-
ством в применении опиоидных аналгетиков является создание периферичес-
кого агониста ц-опиоидных рецепторов для клинического использования —
фракефамида.
Опиоидные аналгетики вводят перорально, внутримышечно, внутривенно,
подкожно (см. табл. 11.3). Новыми путями введения опиоидных аналгетиков яв-
ляются трансдермальный, трансмукозный и ингаляционный.
227
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 11.3. Опиоидные аналгетики для лечения острой боли [37]
Препарат Путь введения Начальная доза, мг/кг Поддержание, мг/кг Частота, ч
Агонисты опиоидных рецепторов
Кодеин П/о 1,5 0,75 3-4
П/к,в/м 1,0 0,5 3-4
Морфин П/о 0,5-1,0 0,5-1,0 4
П/к, в/м 0,15 0,1-0,2 3-4
В/в 0,15 0,01-0,04/4 Постоянно
Омнопон П/к,в/м 0,3 0,1-0,2 4
Фентанил В/в 0,0008-0,0016 0,0003-0,0016/4 Постоянно
Агонисты-антагонисты опиоидных рецепторов
Буторфанол П/к, в/м 0,03 0,02-0,04 3
В/в 0,03 0,02-0,04 3
Частичные агонисты опиоидных рецепторов
Бупре- норфин Сублингвально 0,006 0,004 6-8
П/к, в/м 0,004 0,002 6
В/в 0,004 0,002/ч 6
Доказательные принципы при применении опиоидных аналгетиков для лечения
острой боли (уровень)
• Трамадол эффективен для лечения нейропатической боли (I).
• Дроперидол, дексаметазон и ондансетрон равно эффективны для профилак-
тики послеоперационной тошноты и рвоты (I).
• Налоксон, налтрексон, налбуфин и дроперидол эффективны для устранения
зуда, вызванного введением опиатов (II).
• В лечении острой боли опиоидные аналгетики не имеют преимуществ друг
перед другом, но некоторые из них более эффективны у отдельных пациентов
(II).
• Клинически значимые побочные эффекты опиоидных аналгетиков зависят
от их дозы (II).
• Трамадол обладает малым риском развития респираторной депрессии и на-
рушений моторной функции ЖКТ в эквианалгетических концентрациях с дру-
гими опиатами (II).
• Дополнительная оксигенация в послеоперационный период улучшает сату-
рацию и снижает риск тахикардии и миокардиальной ишемии (II).
• У взрослых возраст в большей степени, чем вес, является прогностическим
признаком потребности в опиоидных аналгетиках; возможны существенные ин-
дивидуальные различия между больными (IV).
• Нарушения функции почек приводит к более высокой концентрации мета-
болитов морфина (IV).
228
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
• Оценка уровня седации — более надежный путь определения ранней рес-
пираторной депрессии, вызванной опиоидными аналгетиками, чем снижение
ЧДД (V).
Для послеоперационной аналгезии применяют нейроаксиальный (эпидураль-
ный, субарахноидальный) путь введения опиоидных аналгетиков: фентанил опти-
мизирует регионарную анестезию, морфин обеспечивает многочасовое адекват-
ное обезболивание (табл. 11.4, раздел 13).
Таблица 11.4. Опиоидныеаналгетики для нейроаксиальноговведения
при лечении острой боли [37]
Препарат Однократно, мг Инфузня, мг/ч Время развития эффекта, мин Длительность действия однократной дозы, ч
Эпидуральное введение
Морфин 1-6 0,1-1,0 30 6-24
Февтанил 0,025-0,1 0,025-0,1 5 2-4
Субарахноидальное введение
Морфин 0,1-0,3 30 8-24
Февтанил 0,005-0,025 5 3-6
Доказательные принципы при нейроаксиальном введении опиоидных аналгетиков
для лечения острой боли (уровень)
• Субарахноидальное введение морфина вызывает лучшую послеоперацион-
ную аналгезию после кесарева сечения в сравнении с фентанилом (I).
• Комбинация опиоидных аналгетиков с местными анестетиками при эпиду-
ральном введении повышает качество аналгезии и снижает дозировки обоих пре-
паратов (I).
• Однократная доза морфина при введении во внутрисуставное пространство
вызывает аналгезию, длящуюся до 24 часов (I).
• Доказательства клинической эффективности действия опиоидных аналгети-
ков во внесуставных местах, включая периневральный путь введения, являются
неокончательными (II).
• Эпидуральное введение петидина обеспечивает лучшую аналгезию и мень-
шую седацию в сравнении с его внутривенным использованием после кесарева
сечения (II).
• Не отмечен нейротоксический эффект при применении обычных субарах-
ноидальных дозировок морфина, фентанила и суфентанила (V).
• Нейроаксиальное введение болюсов гидрофильных опиоидных аналгетиков
повышает риск отстроченной седации и респираторной депрессии в сравнении с
применением липофильных опиоидных аналгетиков (V).
Причины неудач при применении опиоидных аналгетиков для послеоперационной
аналгезии: стандартное назначение, боязнь развития привыкания, пристрастия и
побочных явлений, недостаточная дозировка, введение без учета вида и объема
оперативного вмешательства, характера боли, неправильная оценка интенсивнос-
ти боли персоналом, недоучет психологических факторов, отсутствие специфи-
ческих антагонистов и возможность развития острой толерантности.
229
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
J 1.4.1.2. Нестероидные противовоспалительные средства
В течение длительного времени эта группа препаратов находи-
лась вне поля зрения анестезиологов, за исключением аналгина (метамизола). Фар-
макологическое лечение болей малой и средней интенсивности начинают с НПВС
при отсутствии противопоказаний к ним (табл. 11.5). НПВС уменьшают уровень
продуцируемых воспалительных медиаторов в месте операционной травмы, бло-
кируют синтез простагландинов, предотвращая компенсаторный ответ на опера-
ционную травму, подавляют агрегацию тромбоцитов (отрицательный эффект -
увеличивают потенциальный риск кровотечений). При использовании НПВС не
развиваются гемодинамические эффекты и депрессия дыхания, не нарушается
опорожнение желудка и время пассажа пищи по тонкому кишечнику. Профилак-
тическое использование НПВС в значительной степени устраняет эффекты, свя-
занные с активацией NMDA-рецепторов.
В литературе много работ, в том числе за последние годы [30, 31], посвящен-
ных послеоперационному обезболиванию специфическими ингибиторами ЦОГ-2
(циклооксигеназы 2 типа) — целекоксибом, парекоксибом, валдекоксибом, это-
рикоксибом и др. Парентеральные формы селективных и специфических ин-
гибиторов ЦОГ-2 (парекоксиб натрия, мелоксикам) расширяют возможности пос-
леоперационного обезболивания.
Таблица 11.5. Аналгетическая эффективность обезболивающих средств
(данные Оксфордской лиги, сокращенно) [48]
Аналгетик Количество пациентов Не менее 50 % обезболивания, % NNT Доверительные интервалы NNT
Валдекоксиб-40 473 73 1,6 1,4-1,8
Валдекоксиб-20 204 68 1,7 1,4-2,0
Диклофенак-100 411 67 1,9 1,6-2,2
Парацетамол 1000 + кодеин 60 197 57 2,2 1,7-2,9
Парекоксиб-40 (в/в) 349 63 2,2 1,8-2,7
Диклофенак-50 738 63 2,3 2,0-2,7
Ибупрофен-600 203 79 2,4 2,0-4,2
Ибупрофен-400 4703 56 2,4 2,3-2,6
Кеторолак-10 790 50 2,6 2,3-3,1
Ибупрофен-200 1414 54 2,7 2,5-3,1
Диклофенак-25 204 54 2,8 2,1-4,3
Морфин-10 (в/м) 946 50 2,9 2,6-3,6
Кеторолак-30 (в/м) 359 53 3,4 2,5-4,9
Парацетамол-500 561 61 3,5 2,2-13,3
Парацетамол-1000 2759 46 3,8 3,4-4,4
230
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Продолжение табл. 11.5
Аналгетик Количество пациентов Не менее 50 % обезболивания, % NNT Доверительные интервалы NNT
Парацетамол- 600/650 + кодеин 60 1123 42 4,2 3,4-5,3
Аспирин-600/650 5061 38 4,4 4,0-4,9
Парацетамол- 600/650 1886 38 4,4 4,0-4,9
Трамадол-100 882 30 4,8 3,8-6,1
Трамадол-75 563 32 5,3 3,9-8,2
Аспирин-650 + кодеин-60 598 25 5,3 4,1-7,4
Парацетамол 300 + кодеин 30 379 26 5,3 4,0-9,8
Трамадол-50 770 19 8,3 6,0-13,0
Кодеин-60 1305 15 11,0 11,0-48,0
Особое место среди НПВС занимает парацетамол (ацетаминофен). Многие
авторы не относят его к группе НПВС из-за отсутствия периферического про-
тивовоспалительного эффекта. Новый всплеск интереса к этому препарату был
обусловлен двумя обстоятельствами: во-первых, появлением его парентераль-
ной формы — пропацетамола, во-вторых, объяснением механизма действия
за счет блокады циклооксигеназы-3. Специалисты клиники анестезиологии и
интенсивной терапии Днепропетровской государственной медицинской ака-
демии были среди первых, кто обратил внимание на широкие терапевтичес-
кие возможности парацетамола и комбинированных препаратов на его основе
при послеоперационной аналгезии [13]. По мнению Breivik Н. [22], парацета-
мол является удачным дополнением практически к любому методу послеопе-
рационного обезболивания, в том числе в комбинации с другими НПВС при
КПА.
Среди традиционных негативных эффектов НПВС следует отметить наруше-
ние функции ЖКТ, повышенную кровоточивость, а также нарушения функций
почек, особенно у больных с высоким риском или сниженным ОЦК.
Доказательные принципы при применении НПВС для лечения острой боли
(уровень)
• Парацетамол — эффективный аналгетик при острой боли (I).
• НПВС и ингибиторы ЦОГ-2 равно эффективны при острой боли (I).
• Применение НПВС и парацетамола в комбинациях с другими препаратами
повышает эффективность обезболивания (I).
• Тщательный отбор пациентов и регулярный мониторинг при применении НПВС
делает вероятность развития побочных эффектов со стороны почек низкой (I).
• Аспирин и некоторые НПВС повышают риск повторной операции вслед-
ствие кровотечения после тонзилэктомии (I).
231
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
• Ингибиторы ЦОГ-2 и НПВС имеют сходный профиль побочных эффектов в
отношении функции почек (I).
• Ингибиторы ЦОГ-2 не вызывают бронхоспазма у пациентов с известной
аспиринзависимой астмой (I).
• Парацетамол, НПВС и ингибиторы ЦОГ-2 — важный компонент сбаланси-
рованной аналгезии (II).
• Ингибиторы ЦОГ-2 не нарушают функцию тромбоцитов (II).
• Риск развития гастроинтестинальных язв при кратковременном использова-
нии ингибиторов ЦОГ-2 не отличается от плацебо (II).
• Побочные эффекты НПВС являются клинически важными и ограничивают
их использование (V).
• Риск побочных эффектов НПВС и ингибиторов ЦОГ-2 повышается при
диагностированных ранее почечных нарушениях, гипокалиемии, гипотензии, ис-
пользовании нефротоксических препаратов и ингибиторов АПФ (V).
• Отмечены серьезные сердечно-сосудистые осложнения при использовании
ингибиторов ЦОГ-2 в некоторых исследованиях. В настоящее время невозможно
дать четкие рекомендации по их применению; необходимы дополнительные ис-
следования (V).
11.4.1.3. Местные анестетики
Использование местных анестетиков для нейроаксиального вве-
дения — это эффективный метод интра- и послеоперационной аналгезии (см.
раздел 12). В настоящее время вновь возрос интерес к различным техникам пери-
ферической аналгезии, например подкожной инфильтрация места разреза, оро-
шению брюшной полости и т. д. Новый местный анестетик наропин (ропивакаина
гидрохлорид), левовращающий изомер бупивакаина, отличается от бупивакаина
меньшим кардиотоксическим действием, большей дифференциацией между сен-
сорным и моторным блоком. Использование наропина открывает новые возмож-
ности в регионарной анестезии, послеоперационной и акушерской аналгезии.
Доказательные принципы при применении местных анестетиков для лечения ос-
трой боли (уровень)
• Длительная периневральная инфузия лидокаина приводит к менее эффек-
тивной аналгезии и более выраженному моторному блоку в сравнении с местны-
ми анестетиками длительного действия (II).
• Нет существенных различий в качестве аналгезии и выраженности моторной
блокады между ропивакаином, левобупивакаином и бупивакаином при использо-
вании их в низких дозах для регионарной аналгезии (II).
• Токсическое действие ропивакаина и левобупивакаина на сердечно-сосуди-
стую и нервную системы меньше, чем рацемического бупивакаина (II).
11.4.2. Методы контроля послеоперационной боли
Современная концепция обезболивания базируется на примене-
нии антиноцицептивных методик до начала хирургического вмешательства [15],
что позволяет в значительной степени устранять последствия операционной трав-
мы и не просто ликвидировать послеоперационную боль, а контролировать ее.
Наиболее важными методами контроля являются: опережающее обезболивание,
232
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
сбалансированная аналгезия, контролируемая пациентом аналгезия. Создание служб
лечения острой боли позволит более рационально использовать потенциал анес-
тезиологической помощи.
11.4.2.1. Опережающее обезболивание
Концепция опережающего, или предупреждающего, обезболива-
ния (preemptive analgesia) основана на экспериментальных исследованиях цент-
ральной сенситизации, то есть повышенной возбудимости спинальных нейронов.
Согласно концепции, проведенная до операции афферентная блокада на уровне
спинного мозга уменьшает выраженность и длительность послеоперационной боли.
Основой предупреждающей аналгезии является предотвращение изменений ней-
рональной активности больвоспринимающих структур ЦНС за счет полной бло-
кады или максимального ограничения интенсивности периоперационного ноци-
цептивного входа. Клиническим результатом является предотвращение развития
послеоперационного болевого синдрома или максимальное снижение его интен-
сивности.
Обзор этих методов проведен ранее в работах Woolf C.J., Chong M.S. [46],
McQuay H.J. [38], Ong C.K. [40]. Более 30 контролируемых исследований по сопо-
ставлению до- и послеоперационного введения идентичных дозировок различных
групп препаратов (НПВС, местных анестетиков, опиоидных аналгетиков и их ком-
бинаций) в большинстве не показали эффективность опережающего обезболива-
ния. С 1995 года было проведено около 10 контролируемых клинических исследо-
ваний на эту же тему, к сожалению, с тем же эффектом. Лишь высокие дозировки
местных анестетиков при условии их использования до и после операции блоки-
ровали нейроэндокринный метаболический ответ при операциях на нижней по-
ловине тела [32, 34].
Moiniche S. и соавторы [39] провели исследование, посвященное опережающе-
му обезболиванию, что позволило обобщенно оценить данную проблематику на
современном этапе. Согласно данным авторов, неэффективность использования
методики обусловлена узким пониманием самого термина “опережающее обезбо-
ливание”, то есть использования обезболивающих препаратов до начала оператив-
ного вмешательства. Kissin I. [36] настаивает на трактовке этого метода, как таково-
го, который применяют до, во время и после оперативного вмешательства.
Для достижения успеха при использовании метода опережающего обезболива-
ния соблюдают определенные условия, а именно: аналгезия должна быть достаточ-
но глубокой, чтобы блокировать все виды ноцицепции; аналгезия должна быть до-
статочно широкой, чтобы покрыть все хирургическое поле; аналгезия должна быть
достаточно продолжительной, чтобы действовать во время и после операции [17].
Таблица 11.6. Дозировка аналгетиков при эпидуральном и внутривенном введении
для опережающей аналгезии [17]
Препарат Путь введения Начальная доза Поддерживающая доза
Морфин Эпидуральный 3 мг 1-2 мг/ч
Бупренорфин Эпидуральный 0,1 мг 0,02-0,03 мг/ч
Эптазоцин Эпидуральный 15 мг 2,5-5,0 мг/ч
Кетамин Внутривенный 1 мг/кг 0,5 мг/кг/ч
233
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Доказательные принципы эпидуральной аналгезии при лечении острой боли
(уровень)
• Эпидуральная анестезия при всех видах оперативных вмешательств обеспе-
чивает лучшее послеоперационное обезболивание по сравнению с парентераль-
ным введением аналгетиков (I).
• Эпидуральное введение местных анестетиков улучшает оксигенацию и умень-
шает риск развития легочных инфекций и других легочных осложнений по срав-
нению с парентеральными опиатами (I).
• Торакальная эпидуральная аналгезия в комбинации с местными анестетика-
ми улучшает функцию кишечника после абдоминальных операций (I).
• Торакальная эпидуральная аналгезия продолжительностью более 24 ч сни-
жает риск послеоперационного инфаркта миокарда (I).
• Эпидуральная аналгезия не связана с повышением риска несостоятельности
анастомоза в хирургии кишечника (I).
• Торакальная эпидуральная аналгезия снижает риск развития пневмонии и
необходимость вентиляции пациентов с множественными переломами ребер (II).
• Комбинация торакальной эпидуральной аналгезии и местных анестетиков
при нутритивной поддержке приводит к сохранению уровня общего белка при
операциях в верхнем отделе брюшной полости (II).
• Поясничная эпидуральная аналгезия уменьшает риск окклюзии шунта после
операций на периферических сосудах (II).
• Комбинация низких концентраций местных анестетиков и опиатов обеспе-
чивает лучшую аналгезию по сравнению с изолированным использованием этих
компонентов (II).
• Риск стойкого неврологического повреждения при проведении эпидураль-
ной аналгезии достаточно низкий и повышается при поздней диагностике эпиду-
ральной гематомы или абсцесса (IV).
• Немедленная декомпрессия спинного мозга (в течение 8 ч с момента появ-
ления неврологических знаков) повышает вероятность частичного или полного
неврологического восстановления (IV).
• Проведение эпидуральной аналгезии путем длительной инфузии или КПА
смесями местных анестетиков и опиатов является безопасной в общих хирурги-
ческих палатах при 24-часовом контроле службы острой боли под руководством
анестезиолога и мониторировании хорошо подготовленным средним медицинс-
ким персоналом (V).
11.4.2.2. Сбалансированная аналгезия
Концепция сбалансированной, или мультимодальной, аналгезии
(balanced analgesia) базируется на принципе использования комбинаций препара-
тов с различными точками приложения в механизме действия и учетом их синер-
гического или суммированного эффектов. В 1910 году глазной хирург Crile пред-
ложил термин anociassociation — обеспечение комфортного состояния больного
во время операции, который стал основой интегрированного подхода к операции,
анестезии и быстрому восстановлению больных. Crile предложил рекомендации
по достижению полной антиноцицепции при помощи подбора и комбинации анал-
гетических агентов. Он высказал предположение, что интенсивность послеопера-
ционной боли зависит от адекватности защиты структур ЦНС от операционной
травмы. В 1924 году Джон Ланди, первый руководитель отдела анестезиологии
234
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Трамадол
Диклофенак +
трамадол
Диклофенак +
лидокаин +
трамадол
Диклофенак +
лидокаин+в/в смесь
(трамадол +
аналгин+дроперидол)
а) абодоминальная хирургия
Инфильтрация +
трамадол
Солпафлекс +
нфильтрация +
трамадол
Солпафлекс +
нфильтрация +
ЭПА + трамадол
Трамадол
б) гинекология
СМА (фентанил) +
КПА (морфин)
СМА (фентанил) +
КПА
(морфин + кетамин)
Морфин
в) ортопедия
Морфин
СМА (морфин) +
трамадол
Кетолонг +
кетамин +
СМА (фентанил)
СМА (фентанил) +
продеин
Кетамин +
СМА (фентанил) +
продеин
ЭПА (фентанил) +
наропин
(эпидуральная
инфузия)
г) спинальная нейрохирургия
ЭПА (фентанил) +
бупивакаин
ЭПА (фентанил) +
бупивакаин
Морфин
д) акушерство
Рис. 11.3. Дифференцированные “аналгетические лестницы”
после оперативных вмешательств в различных областях хирургии
235
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
клиники Мэйо и автор термина “сбалансированная аналгезия”, подчеркнул зна-
чение выбора периоперационной анестезиологической тактики для последующе-
го развития послеоперационного болевого синдрома.
В конце 1990-х годов H.Kehlet Н. [35] удалось значительно сократить длитель-
ность пребывания больных в стационаре после хирургических вмешательств, ис-
пользуя полимодальный подход к периоперационной реабилитации одновремен-
но с инструктированием пациента до операции, минимизацией интраоперацион-
ного стресса, ранней мобилизацией, ранним энтеральным питанием.
В серии наших исследований [2—7] выработаны многокомпонентные схемы
послеоперационной аналгезии в зависимости от вида оперативного вмешатель-
ства с учетом понимания гетерогенности ноцицептивных механизмов боли [1].
На рис. 11.3 представлены дифференцированные “аналгетические лестницы”
после оперативных вмешательств в различных областях хирургии.
При экстирпации матки с придатками хорошие результаты по обезболиванию
получены при сочетанном использовании солпафлекса (медленно освобождающе-
гося ибупрофена) по 400 мг в сутки, начиная с вечера перед операцией и в течение,
по крайней мере, 2 суток; инфильтрации области разреза 0,25 % раствором бупи-
вакаина гидрохлорида (10 мл); эпидуральной анестезии 0,5 % бупивакаином (20-25 мл,
сенсорный блок Th4—S5) и фентанилом (100 мкг), с дополнительным внутримышеч-
ным введением трамадола (100 мг в/м) в послеоперационном периоде.
При открытой холецистэктомии оптимальное сочетание при использовании в
премедикации диклофенака натрия 75 мг в/м, болюсного внутривенного введения
до операции 2 % раствора лидокаина 1,5 мг/кг, интраоперационной инфузии 1,5—
2 мг/кг/час этого раствора и послеоперационной внутривенной инфузии смеси тра-
мадола 200-400 мг, анальгина 4-5 г и 1 мл 0,25 % дроперидола (по потребности).
При поясничной дискектомии хорошие результаты получены при сочетании
внутривенных субнаркотических дозировок кетамина (0,5 мг/кг непосредственно
перед операцией с последующей инфузией 1 мг/кг/ч во время операции), спи-
нальной анестезии (3 мл 0,5 % раствора бупивакаина с 25 мкг фентанила) и внут-
римышечного введения пролонгированной формы кеторолака — трометами-
на — в дозе 30 мг.
При обширных ортопедических операциях использованы комбинации спи-
нальной аналгезии морфином (0,1 мг) или субарахноидального введения фента-
нила (25 мкг); в последующем — внутривенная КПА морфином или одновремен-
ное введение морфина и кетамина (режим КПА: нагрузочная доза — 5 мг, концен-
трация морфина — 0,8 мг/мл, болюс — 2 мг, локаут-интервал — 15 мин; лимиты
по введению морфина: 4-часовый — 20 мг, 8-часовый — 30 мг, 16-часовый — 40 мг;
кетамин — 0,4 мг/мл), внутримышечное введение кетанова (первое — 60 мг, пос-
ледующие — 30 мг).
При кесаревом сечении оптимальной стала комбинация интраоперационного
эпидурального введения 100 мкг фентанила и 50 мкг клофелина с 0,5 % раствором
бупивакаина и продленная эпидуральная инфузия наропина (0,2 % ропивакаина
гидрохлорида, 6—8 мл/ч).
11.4.2.3. Контролируемая пациентом аналгезия
Метод контролируемой пациентом аналгезии (КПА, patient-
controlled analgesia) имеет существенные преимущества по сравнению с традици-
онными подходами: позволяет обеспечить адекватное обезболивание, поддержи-
236
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
вать стабильную концентрацию аналгетика в плазме крови, экономить время ме-
дицинского персонала, снижать частоту развития побочных эффектов. Метод КПА
в настоящее время широко применяют во многих странах мира и рассматривают в
качестве альтернативы традиционному назначению аналгетиков “при болях” или
их плановому введению. По мнению некоторых авторов, КПА становится стан-
дартом для послеоперационного обезболивания. За прошедшие 30 лет многочис-
ленными исследованиями продемонстрированы безопасность и эффективность
метода КПА. При использовании метода КПА, больной получает препараты “по
требованию”, что позволяет наиболее гибко варьировать дозировкой препаратов в
зависимости от реальных индивидуальных потребностей больного.
Большое значение в эффективности метода играет психологический фактор,
поскольку пациент уверен, что в любой момент самостоятельно может справиться
с болью. Неотъемлемым требованием для проведения данной методики является
ясное сознание больного. Также необходимо психологическое тестирование при
решении вопроса о способности пациента эффективно пользоваться КПА.
Для метода КПА используют специальные устройства — перфузоры с моду-
лем для КПА. При выполнении процедуры назначают нагрузочную дозу, болюс
препарата, локаут-интервал (lockout) — минимальное время между последователь-
ными дозами, лимит — максимальное количество аналгетика за определенное
время независимо от требований больного, скорость введения болюса. Наиболее
часто используют внутривенное, эпидуральное и подкожное введение аналгетика.
Наиболее часто в послеоперационный период для проведения КПА применя-
ют внутривенное введение опиоидных аналгетиков. Обезболивания достигают [11],
когда в крови создают определенную и для каждого больного индивидуальную
концентрацию опиоида (максимальная концентрация, ассоциирующаяся с силь-
ной болью — МКСБ) (рис. 11.4). Полная ликвидация болевых ощущений проис-
ходит при так называемой минимальной эффективной аналгезирующей концент-
рации (МЭАК). При увеличении содержания опиоидов в крови выше МЭАК обез-
боливающий эффект не усиливается. Небольшое снижение уровня препарата в
237
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
крови ниже МЭАК приводит к быстрому появлению сильных болей. Величины
МЭАК значительно варьируют у отдельных пациентов, что объясняет столь боль-
шие колебания потребностей во введении опиоидов у разных больных. Мини-
мальное повышение уровня опиоида в крови над максимальной его концентрацией,
соответствующей сильной боли (МКСБ), приводит к быстрому снижению боле-
вых ощущений.
Участок между МКСБ и МЭАК (заштрихован, см. рис. 11.4) называют тера-
певтическим окном. Наклон кривой между МКСБ и МЭАК достаточно крутой.
Всего лишь 0,05 мкг/мл меперидина может определить развитие либо сильной
боли, либо аналгезии. Таким образом, опиоиды имеют узкое терапевтическое окно.
Терапевтическую эффективность каждого метода обезболивания опиоидами
определяют соотношением создающейся в крови концентрации препарата, степе-
нью аналгезии и интервалами между отдельными инъекциями (рис. 11.5). Пред-
сказать, какова будет концентрация опиоида в крови после внутримышечного вве-
дения, достаточно трудно. Пик концентрации препарата (Смах) при повторных
внутримышечных инъекциях может индивидуально разниться у больных (даже в
2 раза). Время наступления пика концентрации (Тмах) может разниться в 3 раза. У
некоторых больных отмечают 5-кратные колебания Смах и 7-кратные Тмах. Колеба-
ния уровня опиоидов в крови происходят и в промежутках между повторными
инъекциями. Подсчитано, что только на протяжении 35 % интервала 4-часового
промежутка времени между повторными инъекциями опиоида его уровень в кро-
ви превышает МЭАК. При повторных введениях препаратов “по требованию” эти
колебания сглаживаются, поскольку пациент сразу ощущает падение уровня пре-
парата ниже МЭАК.
Объем распределения, константы скоростей распределения и выведения ме-
перидина, кетобемидона и морфина исследованы у больных, подвергшихся лапа-
ротомии. Работы Tamsen показывают, что предоперационное содержание эндо-
Пациент А Пациент Б Пациент В
Рис. 11.5. Соотношение между концентрацией опиоида в плазме и качеством аналгезии [И]
238
11. ПОСЛЕОПЕРАЦИОННОЕОБЕЗБОЛИВАНИЕ
генных опиоидов в головном и спинном мозге существенно влияют на величину
МЭАК и степень потребности в аналгезии. Результаты исследований свидетель-
ствуют о выраженном взаимодействии эндогенных и экзогенных опиоидов и об их
совместном влиянии на потребность в аналгезии и величину МЭАК. Исследова-
ния указывают на зависимость потребности в аналгезии у отдельных больных от
содержания эндогенных опиоидов в ЦСЖ.
Таблица 11.7. Аналгетики, используемые для КПА [9]
Аналгетик Объем ампулы, мл Количество аналгетика в 1 амп., мг Общее количество ампул аналгетика в шприце Общий объем аналгетика, мл Объем физиологического раствора, мл Общий объем раствора в шприце, мл После разведения в шприце содержание аналгетика в 1 мл, мг/мл
Морфин 1 10 5 5 45 50 1
Наблбуфин 2 20 5 10 40 50 2
Промедол 1 20 5 5 45 50 2
Трамадол 2 100 5 10 40 50 10
Бупренорфин 1 0,3 5 5 45 50 0,03
Буторфанол 1 2 5 5 45 50 0,2
Пиритрамид 1 15 3 6 39 45 1
Кеторолак 2 30 3 3 42 45 2
Доказательные принципы использования КПА при лечении острой боли (уровень)
• Метод внутривенной КПА обеспечивает лучшую аналгезию, чем традицион-
ные режимы обезболивания (I).
• Больные отдают предпочтение методу внутривенной КПА по сравнению с
другими техниками обезболивания (I).
• Введение опиатов при внутривенной КПА не приводит к снижению их по-
требления, сокращению сроков пребывания на койке или более низкому уровню
связанных с опиатами побочных эффектов по сравнению с традиционными мето-
дами перемежающего парентерального введения опиатов (I).
• Добавление кетамина к морфину в программе КПА не улучшает аналгезию и
не снижает риск побочных эффектов опиатов (I).
• Эпидуральная КПА в родах приводит к использованию более низких кон-
центраций доз местных анестетиков, меньшему моторному блоку и меньшему
количеству анестетика по сравнению с продленной эпидуральной инфузией (I).
• Существует мало доказательств относительно преимуществ одного опиата
над другим при КПА в отношении эффективности и безопасности обезболивания
239
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
в целом. Отдельный больной по-разному воспринимает эффект различных опиа-
тов (II).
• Не существует доказательств пользы добавления налоксона к КПА морфи-
ном, но частота возникновения тошноты и зуда уменьшается (II).
• Добавление базовой инфузии при внутривенной КПА не повышает качества
обезболивания и сна, а также не снижает потребности в КПА (II).
• Метод подкожного введения при КПА так же эффективен, как и при внут-
ривенном способе введения (II).
• Интраназальная КПА так же эффективна, как и внутривенная (II).
• Эпидуральная КПА приводит к меньшей суммарной дозе препаратов по
сравнению с длительной эпидуральной инфузией без различий в аналгезии и ко-
личестве побочных эффектов (II).
• Риск респираторной депрессии при КПА повышается при использовании
базовой инфузии (IV).
• Необходимо добиться адекватной аналгезии до начала КПА. При расчете
начального болюса необходимо принять во внимание индивидуальные показатели
больного: предыдущее использование опиатов и возраст. Возможно, потребуются
индивидуальные расчеты режимов КПА (V).
• Рутинное использование протиьорвотных не показано, так как не имеет
преимуществ над их селективным применением (V).
• Системы для КПА должны включать антисифонные и антирефлюксные кла-
паны (V).
• Концентрация препарата должна быть стандартизирована лечебным учреж-
дением для снижения вероятности программных ошибок (V).
11.4.2.4. Службы лечения острой боли
Наиболее совершенным методом управления послеоперационной
болью является создание специализированных организационных структур, кото-
рые на основе динамического мониторинга боли обеспечивают наиболее адекват-
ное ее лечение. Начало 1990-х годов ознаменовалось самым пристальным внима-
нием к проблемам острой боли и поиску путей ее устранения.
В 1990 году в Великобритании были предложены рекомендации по улучше-
нию лечения острой боли после хирургических вмешательств. Рабочая группа по
проблемам острой боли Международной ассоциации по лечению боли (IASP Task
Force on Acute Pain) и Агентство по политике в области охраны здоровья и соци-
альных служб США (AHCPR) опубликовали два клинических исследования по
лечению острой боли, включая и послеоперационную, в которых впервые была
поставлена проблема систематической оценки интенсивности боли у пациентов и
создание служб острой боли. После этого во многих клиниках США подобные
службы были созданы для внедрения в лечебный процесс новых, более совершен-
ных лечебных комплексов, при которых обеспечивают круглосуточное наблюде-
ние за пациентами, ощущающими боль. Эту практику успешно реализуют в ряде
европейских стран, особенно в скандинавских странах и Великобритании.
Несмотря на некоторые различия в организации, работа служб острой боли в
различных странах построена на одинаковых принципах: оценку планируемого ме-
тода обезболивания проводят с каждым пациентом до операции, обеспечивая паци-
ентов инструкциями по использованию простых познавательно-поведенческих тех-
ник; рутинную оценку интенсивности боли наряду с другими витальными функци-
240
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
ями проводят до того, пока их изменения не стали угрожающими; раннее начало
лечения боли; одновременно используют медикаментозные и немедикаментозные
методы обезболивания; метод обезболивания выбирают в зависимости от клини-
ческой ситуации, его изменение — в зависимости от реакции больного; обеспечива-
ют преемственность лечения боли после выписки больного из стационара.
Доказательные принципы функционирования служб лечения острой боли (уровень)
• Предоперационные подготовка и обучение пациентов, знание базовых прин-
ципов обезболивания персоналом являются положительными моментами для обез-
боливания (II).
• Организация и функционирование служб лечения острой боли улучшает
качество обезболивания и снижает риск развития побочных эффектов (Ш-З).
• Образование персонала и использование рекомендаций повышает эффек-
тивность оценки боли, обезболивания и выбора технологий аналгезии (Ш-З).
• Даже простые методы обезболивания эффективны, если уделяют достаточное
внимание обучению персонала, правильности заполнения документации, оценке рис-
ков больного, соблюдению рекомендаций и установок лечебного учреждения (Ш-З).
• Успешное управление острой болью подразумевает тесное сотрудничество
всего персонала, который имеет к этому отношение (V).
По инициативе и под непосредственным руководством клиники анестезиоло-
гии и интенсивной терапии ДГМА (руководитель клиники — чл.-корр. НАН и
АМН Украины, профессор Новицкая—Усенко Л.В.) в областной клинической боль-
нице им. И.И. Мечникова г. Днепропетровска (главный врач — профессор Павлов В.А.)
организована первая в Украине служба лечения острой послеоперационной боли
у хирургических больных (приказ № 109 от 17.04.2000 г.). Структура этой службы,
ее цели и задачи представлены на рис. 11.6. Ежегодно в клинике проводят более
10 000 оперативных вмешательств. В первый год службой лечения острой боли
были охвачены лишь 11,5 % наиболее крупных оперативных вмешательств в орто-
педии, гинекологии, абдоминальной хирургии и спинальной нейрохирургии. Ито-
ги первого года работы службы превзошел ожидания и доказал свою эффектив-
ность [14]: средняя интенсивность боли снизилась практически в 2 раза; длитель-
ность периода, когда интенсивность боли превышала 30 мм по ВАШ, сократился
на 8 ч, время максимальной боли — на 10 ч; значительно расширилось использо-
вание НПВС и регионарных техник аналгезии; повысилась удовлетворенность
больных.
11.5. ПРОФИЛАКТИКА ХРОНИЗАЦИИ ОСТРОЙ
ПОСЛЕОПЕРАЦИОННОЙ БОЛИ
Известно, что острая послеоперационная боль может стать хрони-
ческой после определенных оперативных вмешательств, например ампутации конеч-
ностей, удалении паховых грыж, хирургии молочной железы, желчного пузыря, лег-
ких и др. [41].
Для профилактики хронизации острой послеоперационной боли необходимо
выполнение условий: а) интра- и послеоперационная нейрональная блокада, под
которой понимают полное прекращение прохождения импульсов в сегментарные
и супрасегментарные структуры ЦНС, должна быть адекватной; б) в ранний пос-
леоперационный период, характеризующийся интенсивной ноцицептивной сти-
муляцией, необходимо пролонгировать антинопицептивные эффекты.
241
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 11.6. Структура, цели и задачи службы лечения острой боли
242
11. ПОСЛЕОПЕРАЦИОННОЕОБЕЗБОЛИВАНИЕ
Факторы риска развития хронической послеоперационной боли [10, 44]:
• предоперационные — предоперационная боль (в том числе хроническая), кон-
ституциональные особенности, психоэмоциональная лабильность, пол, возраст,
повторные операции, генетическая предрасположенность, предоперационный ди-
стресс, ожидание хронизации, боязнь боли, низкие уровень дохода и самооценка
состояния здоровья, низкий образовательный уровень;
• интраоперационные — травматичность операции, избранный метод анесте-
зии, область и объем операции, положение на операционном столе;
• послеоперационные — послеоперационная острая боль, интенсивная боль, хи-
мио- и лучевая терапия, психоэмоциональная лабильность, инфекция, кровотечения,
разрывы органов, компартмент-синдром, длительное использование аналгетиков.
Для устранения факторов риска хронизации острой послеоперационной боли
[44] учитывают ожидания и интересы больного, выбирают наименее болезненный
хирургический доступ, регулярно оценивают боль, используют полимодальную
фармакологическую аналгезию, обеспечивают обучение больного, индивидуали-
зируют рекомендации по приему аналгетиков, обеспечивают преемственность обез-
боливающей терапии после выписки больного из стационара.
11.6. ОПТИМИЗАЦИЯ ПЕРИОПЕРАЦИОННОГО
ОБЕЗБОЛИВАНИЯ НА ОСНОВЕ ПРИНЦИПОВ
ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
В большинстве развитых стран периоперационное обезболивание
осуществляют в соответствии с принятыми национальными и международными
стандартами. По ряду причин в Украине пока не приняты подобные стандарты.
Тем не менее, в определенной степени необходимо руководствоваться междуна-
родными рекомендациями. В частности, многонациональная группа анестезиоло-
гов и хирургов PROSPECT (PROCEDURE-SPECIFIC PAIN MANAGEMENT,
www.postoppain.org) разработала итоговые рекомендации по интраоперационному
ведению больных в различных областях хирургии. Рекомендации определяют до-,
интра- и послеоперационную тактику анестезиолога и хирурга с позиций адекват-
ного послеоперационного обезболивания. На современном этапе — это первые
рекомендации, основанные на принципах доказательной медицины в соответствии с
градацией классов Оксфордского центра доказательной медицины:
• класс А — результаты метаанализов рандомизированных клинических ис-
следований;
• класс В — результаты рандомизированных клинических исследований;
• класс С — результаты ретроспективных исследований и серий клинических
случаев;
• класс D — данные клинической практики.
11.6.1. Периоперационное обезболивание
абдоминальной гистерэктомии
Перед операцией
Рекомендуют: однократное спинальное введение местных анестетиков и силь-
ных опиатов для анестезии (D) и послеоперационного обезболивания (А) (необхо-
243
ОБЩАЯ АНЕСТЕЗИОЛОГИИ
димо взвесить соотношение польза/риск с учетом инвазивности процедуры); со-
здание психологического контакта с пациентом (А).
Не рекомендуют: системное введение аналгетиков — внутривенное введе-
ние ингибиторов ЦОГ-2, традиционных НПВС, сильных опиатов, за исключе-
нием обеспечения достаточной аналгезии при просыпании больного (А); ис-
пользование клонидина, антагонистов NMDA-рецепторов и бензодиазепинов
(А); однократные эпидуральные введения препаратов для послеоперационного
обезболивания (А); инфильтрацию местными анестетиками предполагаемого
места разреза до операции (А), но не интраоперационную инфильтрацию раны
(см. ниже); использование гомеопатической арники и саморелаксационных
техник (А).
Во время операции
Рекомендуют: общую анестезию иди однократную спинальную анестезию с
или без поверхностной общей анестезии у пациентов низкого риска (D); эпиду-
ральную анестезию с поверхностной седацией или комбинированную спиналыю-
эпидуралъную анестезию у пациентов высокого риска (А); сильные опиаты да
обеспечения достаточной аналгезии на момент просыпания больной (А); инфиль-
трацию раны перед ее ушиванием (А); влагалищная гистерэктомия или эта же
операция, выполненная лапароскопически, имеют преимущества над абдоминаль-
ной гистерэктомией только в случаях, когда это удовлетворяет хирургическим тре-
бованиям (технические возможности, Показания со стороны пациентки и факто-
ры риска) (А); предпочтительнее использовать разрез по Пфанненштилю (техни-
ческие возможности, показания со стороны пациентки и факторы риска) (В);
использование диатермии при разрезе (В); активное согревание пациенток высо-
кого риска (А); музыкотерапию (А).
Не рекомендуют: однократные эпидуральные введения препаратов для после-
операционной аналгезии (А); аденозин, блокаторы NMDA-рецепторов, бензодиа-
зепины или триптофан (А); интраперитонеальную инфильтрацию (А); неушитую
брюшину, влажные повязки (А) или хирургические дренажи (D); терапевтические
вмешательства или акупунктуру (А).
После операции
Рекомендуют: селективные ингибиторы ЦОГ-2 или традиционные НПВС, в ком-
бинации с сильными опиатами при боли высокой интенсивности (ВАШ > 50 мм);
слабые опиаты при боли средней интенсивности (ВАШ < 50 мм > 30 мм) или при
боли низкой интенсивности (ВАШ < 30 мм) (А); сильные опиаты внутривенно
с использованием КПА или фиксированные внутривенные дозы, которые титру-
ют в зависимости от интенсивности боли (А); парацетамол при боли средней
(ВАШ > 30 мм < 50 мм) или низкой (ВАШ < 30 мм) интенсивности, в комбинации
с ингибиторами ЦОГ-2 или традиционными НПВС (А); эпидуральную аналгезию
у пациенток высокого риска (A, D).
Не рекомендуют: эпидуральную аналгезию для рутинного использования у
пациентов низкого риска (D); повторные спинальные болюсы аналгетиков (D);
одновременное использование селективных ингибиторов ЦОГ-2 или традицион-
ных НПВС с эпидуральной аналгезией (В); длительную инфузию сильных от-
ток при болюсном режиме КПА (D); внутримышечное введение сильных опиати
(D); интраназальные, медленно-освобождающиеся и трансдермальные формы силь-
ных опиатов (D); парацетамол при интенсивной боли (ВАШ > 50 мм) (В); антаго-
нисты NMDA-рецепторов и бензодиазепины (А); клонидин, пентазоцин, кломипра-
244
II. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
мин, дельта-9-тетрагидроканнабинол и налоксон (А); длительную инфильтрацию
раны местными анестетиками после ушивания раны (А); инфильтрацию раны до
ушивания рекомендуют (см. выше); музыкотерапию в ОИТ, гомеопатическую ар-
нику или саморелаксационные техники (В).
11.6.2. Периоперационное обезболивание
тотальной артропластики бедра
До операции
Рекомендуют начать аналгетическую медикацию заблаговременно, чтобы обес-
печить адекватный аналгетический эффект в ранний послеоперационный период.
Во время операции
Рекомендуют: выбор вида анестезии основывать с учетом сопутствующей па-
тологии; кроме адекватной анестезии возможна аналгезия препаратом, которому
требуется время для развития эффекта до просыпания больного; цементное про-
тезирование имеет преимущество над бесцементным.
Не рекомендуют хирургические дренажи.
После операции
Рекомендуют системную аналгезию: вместо традиционных НПВС — селектив-
ные ингибиторы ЦОГ-2 в комбинации с сильными или слабыми опиатами с уче-
том интенсивности боли; сильные опиаты в комбинации с НПВС или селектив-
ными ингибиторами ЦОГ-2 при интенсивной боли, предпочтительно внутривен-
ную КПА или инъекции через фиксированные интервалы времени; слабые опиаты
в комбинации с селективными ингибиторами ЦОГ-2 или НПВС при боли низкой
интенсивности; парацетамол только в комбинации с НПВС и селективными ин-
гибиторами ЦОГ-2 (с или без слабых опиатов) при боли низкой интенсивности.
Рекомендуют регионарную аналгезию: длительные периферические нервные
блоки после операции и/или контролируемую пациентом регионарную аналгезию
(КПРА) в комбинации с системной аналгезий (см. выше) при интенсивной боли
сразу после операции; длительную спинальную аналгезию после операции, если
позволяет состояние пациента, затем системную аналгезию боли высокой интен-
сивности (см. выше) по мере регресса блока; длительную эпидуральную аналге-
зию с и без спинальной анестезии с местным анестетиком после операции, если
позволяет состояние пациента, при интенсивной боли сразу после операции; по-
степенный переход к режимам устранения боли низкой интенсивности (см. выше).
11.6.3. Периоперационное обезболивание
эндоскопической холецистэктомии
Перед операцией
Рекомендуют: аналгетическую медикацию, которая должна обеспечивать бе-
зопасную и достаточную аналгезию на момент активизации больного после про-
цедуры; клонидин, если дальнейшие исследования подтвердят полезность; декса-
метазон (в том числе, как средство против тошноты).
Рекомендуют техники анестезии: ингаляционные, внутривенные или сбалан-
сированные виды анестезии. Внутривенная анестезия связана с меньшей частотой
возникновения послеоперационной тошноты и рвоты.
245
ОБЩАЯ АНЕСТЕЗИОЛОГИ»
Не рекомендуют: проведение опережающей аналгезии, комбинации эпидураль-
ной и общей анестезии, кроме пациентов с высоким легочным риском.
Во время операции
Рекомендуют: опиаты короткого действия; внутрибрюшинное введение мест-
ных анестетиков в конце операции; инфильтрацию места разреза местным анесте-
тиком в конце операции (необходима осторожность в отношении суммарной дозы
местного анестетика, если его используют и для инраперитонеального введения);
клонидин, если дальнейшие исследования подтвердят полезность.
Не рекомендуют: интерплевральную аналгезию местными анестетиками, силь-
ные опиаты длительного действия, слабые опиаты.
Рекомендуют техники операции: пневмоперитонеум с низким давлением С02;
пневмоперитонеум СО, с перитонеальным лаважем, несмотря на относительно
слабый уровень доказательств; пневмоперитонеум СО2 с отсасыванием, несмотря
на относительно слабый уровень доказательств.
Не рекомендуют техники операции: пневмоперитонеум согретым СО,, техники
без использования газа, пневмоперитонеум гелием, пневмоперитонеум согретой
окисью азота, радиально расширяющиеся или режущие троакары, микролапаро-
скопические техники.
После операции
Рекомендуют: НПВС, ингибиторы ЦОГ-2, парацетамол, слабые опиаты, эпи-
дуральное введение местных анестетиков и опиатов у пациентов высокого риска,
если лапароскопическую холецистэктомию трансформируют в открытую; кета-
мин в комбинированной аналгезии, если аналгезия недостаточна.
Рекомендуют в течение 6 часов после операции, включая пребывание в ОИТ, и
через б ч после операции пошаговый подход (для пациентов с интенсивной болью мож-
но начинать с шага б и в): а) неопиатную аналгезию НПВС/ингибиторами ЦОГ-2
в комбинации с парацетамолом; б) добавить слабые опиаты к НПВС/ингибитора-
ми ЦОГ-2 в комбинации с парацетамолом, если боль продолжается; в) добавить
сильные опиаты короткого действия, если боль продолжается (в течение бч
после операции); добавить малые дозы сильных опиатов, если боль продолжается
(через 6 ч после операции).
Не рекомендуют: альфа-тринозитол, монотерапию кетамином, сильные опиа-
ты длительного действия, аналгин.
11.6.4. Периоперационное обезболивание
резекции кишечника
До операции
Рекомендуют: однократно высокую дозу метилпреднизолона у пациентов вы-
сокого легочного риска (А); предоперационную лапароскопию (А).
Не рекомендуют: системные аналгетики, например внутривенно селективные
ингибиторы ЦОГ-2, традиционные НПВС, сильные и слабые опиаты, габапен-
тин/прегабалин и кетамин, магнезию или другие антагонисты NMDA-рецепторов
(если их предоперационное введение не требуется для обеспечения установления
аналгезии в период, непосредственно следующий за операцией, например перо-
ральные селективные ингибиторы ЦОГ-2) (В); однократно высокие дозы метил-
преднизолона для рутинного использования (А);
246
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
Во время операции
Рекомендуют: при отсутствии противопоказаний для рутинного использова-
ния эпидуральную анестезию/аналгезию с или без общей анестезии (А); комбина-
ция местного анестетика и сильного опиата для эпидуральной аналгезии предпоч-
тительнее по сравнению с изолированным использованием вышеназванных пре-
паратов (А); при невозможности выполнения пациенту эпидуральной анестезии,
для обеспечения раннего послеоперационного обезболивания — общую анесте-
зию с системной аналгезией сильными опиатами (D) (сильные опиаты вводят
заблаговременно для обеспечения достаточной аналгезии при пробуждении паци-
ента); нормотермию, хотя это не влияет на качество аналгезии (А).
Рекомендуют оперативные техники: для снижения интенсивности послеопе-
рационной боли лапароскопическая резекция кишечника предпочтительнее от-
крытой (А), практическое выполнение этой операции зависит, прежде всего, от
других факторов, например злокачественности заболевания, риска инфицирова-
ния раны и опыта хирурга; при открытой технике операции, горизонтальный или
кривой разрез имеет преимущество над вертикальным для снижения интенсивно-
сти послеоперационной боли (В), но выбор разреза диктуется техническими воз-
можностями, показаниями к резекции кишечника и факторами риска (D); диа-
термический разрез имеет преимущества над разрезом скальпелем (В).
Не рекомендуют: спинальную аналгезию в комбинации с эпидуральной анал-
гезией (А); однократную инфильтрацию раны местными анестетиками или тради-
ционными НПВС (В); длительное орошение раны местными анестетиками (D);
антагонисты кальциевых каналов (А); клофелин (D); габапентин/прегабалин (D);
антагонисты NMDA-рецепторов (А); слабые опиаты (В).
После операции
Рекомендуют: при боли высокой интенсивности (ВАШ > 50 мм) проведение
торакальной эпидуральной аналгезии местными анестетиками и сильными опиата-
ми в качестве базового метода (А); после удаления эпидурального катетера, селек-
тивные ингибиторы ЦОГ-2 (В) или традиционные НПВС (А) в комбинации с силь-
ными опиатами (В) для контроля боли высокой интенсивности (ВАШ > 50 мм) в
ранний послеоперационный период или комбинации со слабыми опиатами при
боли средней (ВАШ > 30 мм < 50 мм) или низкой (ВАШ < 30 мм) интенсивности в
отсроченный послеоперационный период (D); после удаления эпидурального кате-
тера при боли средней (ВАШ > 30 мм < 50 мм) или низкой интенсивности параце-
тамол в комбинации с селективными ингибиторами ЦОГ-2 или традиционными
НПВС (В); при невозможности выполнения эпидуральной аналгезии, например, у
пациентов которые получили только общую анестезию, сильные опиаты внутри-
венной КПА (В); при невозможности выполнения эпидуральной аналгезии, селек-
тивные ингибиторы ЦОГ-2 (В) или традиционные НПВС (А) рекомендованы с силь-
ными опиатами (В) для контроля интенсивной боли (ВАШ > 50 мм) в раннем после-
операционном периоде или в комбинации со слабыми опиатами для контроля боли
средней (ВАШ > 30 мм < 50 мм) или низкой (ВАШ < 30 мм) интенсивности позже в
послеоперационный период (D); полимодальные реабилитационные мероприятия (А).
Не рекомендуют: сочетанное использование селективных ингибиторов ЦОГ-2
или традиционных НПВС с эпидуральной аналгезией (В); клонидин (D); габапен-
тин/прегабалин (D); антагонисты NMDA-рецепторов (А); внутримышечное вве-
дение сильных опиатов (D); парацетамол при боли высокой интенсивности (ВАШ
> 50 мм) (В); длительное орошение раны местными анестетиками (D); механичес-
кий массаж с аспирацией брюшной стенки (D); назогастральные трубки (А).
247
ОБЩАЯ АНЕСТЕЗИОЛОГИ!
11.6.5. Периоперационное обезболивание грыжесечения
До операции
Рекомендуют: системно — традиционные НПВС (А) или селективные инги-
биторы ЦОГ-2 (А); местно-анестезирующие техники — до- и/или интраопераци-
онную блокаду подвздошного нерва/зоны иннервации (А); длительные местные
анестетики (D).
Не рекомендуют: системно — клонидин, кортикостероиды, габапентин/прега-
балин, кетамин (D); местно-анестезирующие техники — адреналин (А), декстра-
ны (D) или кортикостероиды (D) в составе растворов местных анестетиков, бло-
каду паравертебральных нервов (D), инфильтрацию раны клонидином (D), ин-
фильтрацию раны традиционными НПВС (А), топическое применение
традиционных НСПВП (D).
Во время операции
Рекомендуют: местно-анестезирующие техники — до и/или интраоперацион-
ная блокада подвздошного нерва/зоны иннервации/инфильтрации (А), длитель-
ные местные анестетики (D); техники интраоперационной анестезии — местные
анестетики с седацией или общую анестезию в комбинации с местно анестезиру-
ющими техниками (блокаду подвздошного нерва/зоны иннервации/инфильтра-
ции) (А), длительные местные анестетики (D).
Не рекомендуют: системно — клонидин, габапентин/прегабалин, кетамин (D);
местно-анестезирующие техники — адреналин (А), декстраны (класс D) или кор-
тикостероиды (класс D) в составе растворов местных анестетиков; орошение мес-
тными анестетиками при ушивании раны (без игл) (D); экстраперитонеальные
орошения местными анестетиками во время лапароскопической операции (А);
блокаду паравертебральных нервов (класс D); инфильтрацию раны клонидином
(D), традиционными НПВС (А), сильными опиатами (А).
Рекомендуют оперативные техники: открытую или лапароскопическую опера-
цию (D), техники с использованием сетки (А).
Не рекомендуют оперативные техники: эпидуральную анестезию (D), спиналь-
ную анестезию (D), открытую операцию без использования сетки (А); хирурги-
ческое выделение подвздошного нерва (А), криоаналгезию (А).
После операции
Рекомендуют: системно — традиционные НПВС (А) или селективные ин-
гибиторы ЦОГ-2 (А), парацетамол для рутинного обезболивания в комбинациис
традиционными НПВС и ингибиторами ЦОГ-2 (В), слабые опиаты при боли
средне-низкой интенсивности, когда традиционные НПВС/селективные инги-
биторы ЦОГ-2 с парацетамолом недостаточны или противопоказаны (В), силь-
ные опиаты при интенсивной боли только как добавление к неопиатной аналге-
зии (В).
Не рекомендуют: системно — габапентин/прегабалин (D), кетамин (D); мест-
но-анестезирующие техники — длительную инфузию местных анестетиков через
катетер в ране (D), однократные/повторные дозы местных анестетиков через ка-
тетер в ране (А), послеоперационную подкожную инфильтрацию местными анес-
тетиками (D); нефармакологические техники — транскутанную электронейрости-
муляцию (А).
248
II. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
ЛИТЕРАТУРА
]. Калюжный Л.В. Гетерогенность ноцицептивных и антиноцицептивных пептид-
ных механизмов и их коррекция с генезом боли// Успехи физиологических наук, 1990,
Т. 21, № 4. - С. 68-83.
2. Кобеляцкий Ю.Ю. Варианты опережающего обезболивания у больных при пояс-
ничной дискэктомии// Харювська х!рурпчна школа, 2002, Т. 3, № 4. — С. 99—106.
3. Кобеляцкий Ю.Ю. Совместное использование морфина и кетамина для контро-
лируемой пациентом аналгезии после ортопедических операций// Бить, знеболювання
i штенсивна тератя, 2002. — № 2 (д). Матер1али науково-практично! конференцп 26—
27 вересня 2002 р. — Ужгород. — С. 80—83.
4. Кобеляцкий Ю.Ю. Солпафлекс как компонент послеоперационного обезболива-
ния при абдоминальной гистерэктомии// УкраУнський медичний часопис, 2002, Ne 6
(32). - С. 134-138.
5. Кобеляцький Ю.Ю. Вар1анти збалансованоТ аналгезп при абдомшальшй пстер-
ектомн// УкраУнський журнал екстремальноУ медицини im. Г.О.Можаева, 2002, № 1. —
С. 49-54.
6. Кобеляцький Ю.Ю. Вплив кетанову на соматичний та в!сцеральний компоненти
больового синдрому теля абдомшальноУ пстеректомй’// УкраУнський журнал екстре-
мальноУ медицини 1м. Г.О.Можаева, 2001, № 1. — С. 51—56.
7. Кобеляцький Ю.Ю. Епщуральна анестез!я та аналгез!я при абдомшальшй псте-
ректомй'// Медичи! перспективи, 2001, Т. VI, № 2. — С. 61—66.
8. Крыжановский Г.Н. Общая патофизиология нервной системы. — М.: Медицина,
1997. - 380 с.
9. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. — М.: Издательство
“Аир-Арт”, 1998. - 184 с.
10. Овечкин А.М., Гагарина Ю.В., Морозов Д.В., Жарков И.П. Хроническая боль как
результат хирургического вмешательства: состояние проблемы, способы ее решения
(аналитический обзор)// Анест. и реаниматол., 2002, № 4. — С. 34—37.
11. Послеоперационная боль. Руководство. Пер. с англ./ Под ред. Ф. Майкла Фер-
ранте, Тимоти Р. Вейд Бонкора. — М.: Медицина, 1998. — 640 с.
12. Решетняк В. К, Кукушкин М.Л. Боль: физиологические и патофизиологические
аспекты// Актуальные проблемы патофизиологии (избранные лекции)// Под ред.
Б.Б. Мороза. — М.: Медицина, 2001. — С. 354—387.
13. Усенко Л.В., Кобеляцкий Ю.Ю., Волкова И.Н., Тютюнник А.Г., Кравченко А.М.
Новые подходы к послеоперационному обезболиванию в хирургической клинике//
УкраУнський медичний часопис, 1997, Т.1, № 1. — С. 62—67.
14. Усенко Л.В., Кобеляцкий.Ю.Ю., Павлов В.А., ГавураА.Я. Первый опыт создания
службы лечения послеоперационной боли в Украине// Б!ль, знеболювання i штенсив-
на тератя, 2000, № 2 (д). Матер!али Пленуму АсощашУ анестезюлопв УкраУни, Ялта,
26-28 вересня 2001. - С. 111-115.
15. Усенко Л.В., Шифрин Г.А. Концепция антиноцицептивного обезболивания. —
К.: Здоров’я, 1993. - 192 с.
16. Acute Pain Management. Scientific Evidence, Second Edition, 2005. Australian and
New Zealand College of Anaesthetists and Faculty of Pain Medicine. Australian Government.
National Health and Medical Research Council. — Sydney. — 310 p.
17. Aida S. Preemptive analgesia. — 1ASP Press. Newsletter. — 2005. — P. 1—4.
18. Bainbridge D., Cheng D.C., Martin J.E., Novick R. Evidence—Based Perioperative
Clinical Outcomes Research (EPiCOR) Group. NSAID—analgesia, pain control and morbidity
in cardiothoracic surgery// Can. J. Anaesth., 2006. — V. 53, № 1. — P. 46—59.
19. Bell R.F., Dahl J.B., Moore R.A., Kalso E. Perioperative ketamine for acute post-
operative pain: a quantitative and qualitative systematic review (Cochrane review)// Acta
Anaesthesiol. Scand., 2005. — V. 49, № 10. — P. 1405—1428.
249
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
20. Bell R.F., Dahl J.B., Moore R.A., Kalso E. Perioperative ketamine for acute postoperative
pain// Cochrane Database Syst Rev. — 2006, Jan 25; (1): CD 004603.
21. Bong C.L., Samuel M., Ng J.M., Ip-Yam C. Effects of preemptive epidural anal-
gesia on postthoracotomy pain// J. Cardiothorac. Vase. Anesth., 2005. — V. 19, № 6,-
P. 786-793.
22. Breivik H. How to implement an acute pain service// Best. Pract. Res. Clin.
Anaesthesiol., 2002. — V. 16, № 4. — P. 527—547.
23. Caderre T.J., Katz J-, Vaccarino A.L., Melzack R. Contribution of the central
neuroplasticity to pathological pain: review of clinical and experimental evidence// Pain,
1993,- V. 52, № 3. - P. 259-285.
24. Carr D.B., Goudas L.C. Acute pain// Lancet. The Pain Series, 1999. — V. 353. — P.
2051-2058.
25. Charlton J.E. Two for the price of one — is it worth it?// Anaesthesia, 2002. — V. 57,
№ 1. - P. 1-3.
26. Davies R.G., Myles P.S., Graham J.M. A comparison of the analgesic efficacy and
side-effects of paravertebral vs epidural blockade for thoracotomy — a systematic review and
meta-analysis of randomized trials// Br. J. Anaesth., 2006. — V. 96, № 4. — P. 418-426.
27. Dhiwakar M., Eng C. Y., Selvaraj S., McKerrow IV.S. Antibiotics to improve recovery
following tonsillectomy: a systematic review// Otolaryngol. Head Neck Surg., 2006. — V.
134, № 3. - P. 357-64.
28. Donovan M., Dillon P., McGuire L. Incidence and characteristics of pain in a sample
of medical-surgical inpatients// Pain, 1987. — V. 30. № 1. — P. 69—78.
29. Duedahl Т.Н., Romsing J., Moiniche S., Dahl J.B. A qualitative systematic review of
periperative dextromethorphan in post-operative pain// Acta Anaesthesiol. Scand., 2006. -
V. 50, № 1. - P. 1-13.
30. Engstrom M., Naesh O. NSAID demonstrate convincing effect on postoperative pain//
Lakartidningen, 2002. — V. 8; № 99 (19). — P. 2164—2169.
31. Katz W.A. Cyclooxygenase-2-selective inhibitors in the management of acute and
perioperative pain// Cleve Clin. J. Med., 2002. —V. 69, Suppl 1. — P. 165—175.
32. Kaufman E., Epstein J.B., Gorsky M., Jackson D.L, Kadari A. Preemptive analgesia
and local anesthesia as a supplement to general anesthesia: a review// Anesth. Prog., 2005,-
V. 52, № 1. - P. 29-38.
33. Kehlet H,. Holte K. Effect of postoperative analgesia on surgical outcome// Br. J.
Anaesth., 2001. - V. 87, № 1. - P. 62-72.
34. Kehlet H., Nielsen H.J. Impact of laparoscopic surgery on stress responses,
immunofunction, and risk of infectious complications// New Horiz., 1998. — V. 6, 2 Suppl-
Р. 80-88.
35. Kehlet H. Multimodal approach to control postoperative pathophysiology and
rehabilitation// Br. J. Anaesth., 1997. — V. 78, № 5. — P. 606—617.
36. Kissin I. Preemptive analgesia. Why its effect is not always obvious//
Anesthesiology, 1996. — V. 84, № 5. — P.1015—1019.
37. Management of acute pain: a practice guide. Task Force on Acute Pain. Eds L. Brian
Ready, W. Thomas Edwards. — IASP Press, 1992. — 73 p.
38. McQuay H.J. Pre-emptive analgesia: a systematic review of clinical studies//Ann
Med., 1995. - V. 27, № 2. - P. 249-256.
39. Moiniche S., Kehlet H., Dahl J.B. A qualitative and quantitative systematic review of
preemptive analgesia for postoperative pain relief: the role of timing of analgesia//
Anesthesiology, 2002. — V. 96, № 3. — P. 725—741.
40. Ong C.K., Lirk P., Seymour R.A., Jenkins B.J. The efficacy of preemptive analgesia
for acute postoperative pain management: a meta-analysis // Anesth. Analg., 2005. —V. 100,
№ 3.- P. 757-773.
41. Perkins F.M., Kehlet H. Chronic pain as an outcome of surgery. A Review of predictive
factors// Anesthesiology. — 2000. — V. 93, № 4. — P. 1123—1133.
250
11. ПОСЛЕОПЕРАЦИОННОЕ ОБЕЗБОЛИВАНИЕ
42. Richman J.M., Liu S.S., Courpas G., Wong R., Rowlingson A.J., McGready J., Cohen
S.R., Wu C.L. Does continuous peripheral nerve block provide superior pain control to opioids?
A meta-analysis// Anesth. Analg., 2006. — V. 102, № 1. — P. 248—257.
43. Shea R.A., Brooks J.A., Dayhoff N.E., Keck J. Pain intensity and postoperative
pulmonary complications among the elderly after abdominal surgery// Heart Lung., 2002. —
V. 31, № 6. - P. 440-449.
44. Shipton E.A., Tait B. Flagging the pain: preventing the burden of chronic pain by
identifying and treating risk factors in acute pain I I European Journal of Anaesthesiology,
2005. - V. 22, № 6 - P. 405-412.
45. Verspyck E., Sentilhes L., Roman H., Sergent E, Marpeau L. Episiotomy techniques
[Article in French]// J. Gynecol. Obstet. Biol. Reprod. (Paris), 2006. — V. 35. 1 Suppl. — P.
1S40-1S51.
46. Woolf C.J., Chong M.S. Preemptive analgesia — treating postoperative pain by
preventing the establishment of central sensitization// Anesth. Analg,. 1993, — V. 77, № 2. —
P. 362-379.
47. Wu C.L., Cohen S.R., Richman J.M., Rowlingson A.J., Courpas G.E., Cheung K, Lin
E.E., Liu S.S. Efficacy of postoperative patient-controlled and continuous infusion epidural
analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis//
Anesthesiology, 2005. - V. 103, № 5. - P. 1079-1088.
48. www.jr2.ox.ac.uk/bandolier.
251
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
МЕСТНЫХ АНЕСТЕТИКОВ
Местные анестетики (МА) — это лекарственные средства, ко-
торые в определенных концентрациях, контактируя с нервным
стволом, вызывают обратимый моторный и сенсорный паралич в
иннервируемых областях.
Факторы, влияющие на выбор местного анестетика: длитель-
ность оперативного вмешательства, метод анестезии, хирургичес-
кие требования, особенности метаболизма препарата, степень
местной и системной токсичности препарата и др.
12.1. ХИМИЧЕСКАЯ СТРУКТУРА МЕСТНЫХ
АНЕСТЕТИКОВ
По химическому строению местные анестетики являются произ-
водными ароматического ряда с частичным замещением амино-
групп эфирными (прокаин, кокаин, хлорпрокаин, тетракаин, или
дикаин) или амидными (лидокаин, мепивакаин, бупивакаин, эти-
докаин, ропивакаин) связями. Значение pH растворов местных
анестетиков приближено к физиологичному. В организме челове-
ка местные анестетики могут существовать в виде ионизирован-
ных и не ионизированных соединений. Степень ионизации моле-
кул местных анестетиков имеет большое значение, так как неио-
низированные формы лучше растворяются в липидах, что облегчает
их доступ к нервным окончаниям. Местные анестетики эфирного
и амидного рядов клинически отличаются механизмами метабо-
лизма и побочными эффектами.
При фармакологическом произврдстве местных анестетиков
для повышения их химической стабильности pH растворов за-
кисляют (pH < 7). Обычно растворы местных анестетиков имеют
pH 6, а с содержанием сосудосуживающих препаратов — pH 4.
При снижении pH раствора местного анестетика снижается кон-
центрация его неионизированных молекул, что предопределяет
медленное начало развития анестезии. Иногда во флаконы с ра-
252
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ
Таблица 12.1. Клинические характеристики местных анестетиков
Анестезия Анестетик Концентрация, % Длительность действия, ч Длительность действия с адреналином, ч Доза, мл (ш = 70 кг)
Блокада перифери- ческого нерва Лидокаин 1-2 1,5-3,0 2-4 40-50
Мепивакаин 1-2 3-5 3-5 40-50
Бупивакаин 0,25-0,5 6-12 6-12 40-50
Этидокаин 1,0-1,5 6-12 6-12 40-50
Эпидуральная и каудальная анестезии Хлоропрокаин 2-3 0,25-0,5 0,5-1,0 20-30
Лидокаин 1-2 0,5-1,0 0,75-1,5 20-30
Мепивакаин 1-2 0,75-1,0 1-2 20-30
Бупивакаин 0,25-0,75 1,5-3,0 2-4 20-30
Омникаин 0,5 1,5-3,0 2-4 5-30
Этидокаин 0,5-1,5 1,5-3,0 2-4 20-30
Местная инфильт- рационная анестезия Новокаин 0,5-1,0 0,25-0,5 0,5-1,5 1-60
Лидокаин 0,5-1,0 0,5-2,0 1-3 1-50
Мепивакаин 0,5-1,0 0,5-2,0 1-3 1-50
Бупивакаин 0,25-0,5 2-4 4-8 1-45
Омникаин 0,5 2-4 4-8 4-50
Спинальная анестезия Лидокаин (гипер- барический) 5 0,75-1,5 0,75-1,5 60 мг (1,2 мл)
Лидокаин (изобарный) 2 1-2 1-2 60 мг (3 мл)
Бупивакаин (гипер- барический) 0,75 2-4 2-4 9 мг (1,2 мл)
Бупивакаин (изобарный) 0,5 2-4 2-4 15 мг (3 мл)
Омникаин 0,5 2-4 2-4 15 мг (3 мл)
Дикаин (гипер- барический) 0,5 2-3 3-5 12 мг (2,4 мл)
Дикаин (изобарный) 0,5 3-5 5-8 15 мг (3 мл)
Дикаин (гипо- барический) 0,1 3-5 5-8 10 мг (10 мл)
253
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
створами местных анестетиков добавляют антимикробные добавки, поэтому для
предупреждения потенциально нейротоксического действия при спинальной, эпи-
дуральной и каудальной анестезии используют растворы местных анестетиков, не
содержащие антимикробных добавок.
12.2. МЕХАНИЗМ ДЕЙСТВИЯ МЕСТНЫХ
АНЕСТЕТИКОВ
Основная точка приложения действия местных анестетиков -
мембрана нейрона. Механизм действия местных анестетиков заключается в бло-
кировании нервного импульса путем вмешательства в процессы генерации потен-
циала действия. Они уменьшают проницаемость клеточной мембраны для ионов
натрия, что сопровождается деполяризацией мембраны. Одним из важнейших путей
блокирования натриевых каналов является вытеснение местными анестетиками
ионов кальция из рецепторов, расположенных на внутренней поверхности мемб-
раны. Изменяя потенциал действия в мембранах нервных клеток, местные анесте-
тики не приводят к выраженному изменению потенциала покоя.
Физико-химические свойства местных анестетиков, предопределяющие разви-
тие нейроблокады: растворимость в жирах обеспечивает легкое проникновение через
клеточную мембрану и, соответственно, силу действия; высокая степень связыва-
ния с белками обеспечивает более длительный анестетический эффект; константа
диссоциации определяет скорость диффузии через клеточные мембраны нейро-
нов и зависит от pH (при физиологичных значениях pH 50 % МА находится в
организме в ионизированной форме и 50% — в неионизированной), то есть пре-
параты с низкой константой диссоциации оказывают более быстрое местноанес-
тетическое действие.
Действие местных анестетиков на различные типы нервных волокон (табл. 12.2)
неодинаково. Как правило, мелкие нервные волокна более чувствительны к дей-
ствию анестетиков, чем крупные; миелинизированные волокна блокируются лег-
че, чем немиелинизированные, потому что для этого необходима блокада лишь в
местах перехватов Ранвье.
Таблица 12.2. Классификация нервных волокон
Тип нервного волокна Миелини- зация Диаметр, микроны Функция
А-альфа 4-+ 6-22 Двигательная функция, проприоцептивная чувствительность
А-бета ++ 6-22 Двигательная функция, проприоцептивная чувствительность
А-гамма ++ 3-6 Двигательная активность мышечного веретена
А-дельта ++ 1-4 Болевая, температурная, тактильная чувствительность
В + <3 Преганглионарные волокна вегетативной нервной системы
254
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ
Путем тщательного подбора местного анестетика и концентрации его раство-
ра селективно блокируют болевую и температурную чувствительности (волокна
А-дельта и С) без существенной двигательной блокады (волокна А-альфа). Селек-
тивность блокады зависит от разновидности нервных волокон, из которых состо-
ит периферический нерв. Блокада протекает от периферии нерва к центру.
Последовательность блокады периферических нервов: блок симпатических во-
локон нервных корешков, потеря болевой и температурной, проприоцептивной,
тактильной чувствительности и ощущения давления, паралич двигательной ак-
тивности.
12.3. МЕТАБОЛИЗМ МЕСТНЫХ АНЕСТЕТИКОВ
Эфирные связи легче разрываются плазменной холинэстеразой.
Период полужизни эфиров в плазме очень короткий и составляет около минуты.
Продуктом распада эфиров является парааминобензойная кислота.
Амидные связи разрываются путем деалкилирования с последующим гидроли-
зом преимущественно в печени, поэтому пациенты с тяжелой патологией печени
более склонны к возникновению побочных реакций в случае использования амид-
ных местных анестетиков. Период полувыведения амидных местных анестетиков
составляет приблизительно 2—3 ч.
Влияние патофизиологических факторов на действие местных анестетиков: сни-
жение сердечного выброса уменьшает объем распределения и плазматический
клиренс местных анестетиков, повышает их концентрацию в плазме и потенци-
альную токсичность; патология печени способствует увеличению токсичности амид-
ных местных анестетиков по причине замедления их метаболизма; почечная пато-
логия минимально влияет на метаболизм местных анестетиков; пациенты со сни-
женной активностью псевдохолинэстеразы (беременные, новорожденные) склонны
к токсическому действию местных анестетиков, особенно с эфирными связями в
химическом строении.
12.4. МЕСТНЫЕ АНЕСТЕТИКИ ЭФИРНОГО РЯДА
12.4.1. Прокаин (новокаин)
Обладает быстрым началом действия, короткой длительностью,
незначительной силой и низкой токсичностью.
Используют для местной инфильтрационной и спинальной анестезии при
кратковременных хирургических вмешательствах.
12.4.2. Хлоропрокаин (несакаин)
Обладает быстрым началом действия, короткой длительностью,
незначительной силой и низкой токсичностью. Быстрый гидролиз плазменной
холинэстеразой определяет низкую токсичность и кратковременность действия.
Используют для местной инфильтрационной анестезии, блокад периферичес-
ких нервов, эпидуральной анестезии.
255
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
12.4.3. Тетракаин (дикаин)
Обладает медленным началом действия, длительной активностью,
большой силой анестетического действия и средней токсичностью. Двигательная
и чувствительная блокады приблизительно одинаковы по длительности.
Выпускают в виде 1 % изобарного раствора (10 % раствор декстрозы) или в
виде кристаллов по 20 мг в ампуле.
Используют преимущественно для спинальной анестезии. При точном ис-
пользовании тетракаина, согласно рекомендациям, его токсичность для ЦНС и
сердечно-сосудистой системы маловероятна. Применяют изобарный раствор, ко-
торый готовят путем разведения 20 мг кристаллического порошка в 4 мл ЦСЖ.
Гипобарический раствор готовят путем растворения 20 мг кристаллического тетра-
каина в 20 мл стерильной воды для инъекций, свободной от стабилизаторов.
12.5. МЕСТНЫЕ АНЕСТЕТИКИ АМИДНОГО РЯДА
12.5.1. Лидокаин (ксилокаин)
Обладает быстрым началом действия, средними длительностью,
силой и уровнем токсичности.
Используют для всех типов регионарной анестезии.
12.5.2. Бупивакаин (марками, сенсоркаин, омникаин)
Обладает медленным действием, длительной активностью, боль-
шой силой и достаточно заметной токсичностью.
Используют для всех разновидностей местной и регионарной анестезии, ког-
да необходимо длительное обезболивание. Степень и длительность чувствитель-
ной блокады значительно превышает двигательную. Случайное внутрисосудистое
введение препарата может вызвать остановку сердца, резистентную к интенсив-
ной кардиотропной терапии, особенно у беременных.
12.5.3. Омникаин (бупивакаин)
Величина системной абсорбции омникаина зависит от дозы, кон-
центрации и объема раствора, пути введения и васкуляризации места инъекции.
Связывание с белками плазмы вариабельное и зависит от попавшего в систем-
ный кровоток количества препарата: чем меньше концентрация, тем больше сте-
пень связывания с белками. Имеет большое сродство с протеинами крови (око-
ло 95 %), слабо проходит через маточно-плацентарный барьер (соотношение
плод/мать составляет 0,2—0,4). В зависимости от способов введения омникаин
обнаруживают в значительном количестве в головном мозге, миокарде, печени,
почках и легких.
Омникаин подвергается биотрансформации в печени путем конъюгации с глю-
куроновой кислотой. Экскретируется в основном почками, при этом 6 % - в
неизмененном виде.
256
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ
Используют для местной инфильтрационной и регионарной анестезии. При
проведении каудальной, эпидуральной и проводниковой анестезий максимальной
концентрации в плазме крови достигают через 30—45 мин; период полувыведения
у взрослых составляет 2,7 ч, у новорожденных — 8,1 ч. Местная анестезия разви-
вается через 5—10 мин и длится при межреберной блокаде 7—14 ч, эпидуральной
блокаде — 3—4 ч, блокаде мышц живота — 45—60 мин. При любом типе анестезии
начальная доза не должна превышать 150 мг (30 мл 0,5 % раствора), за исключе-
нием спинальной анестезии (начальная доза не должна превышать 20 мг, или 4
мл). Повторные инъекции препарата приводят к заметному росту концентрации
препарата в плазме крови за счет кумуляции.
Правила применения омникаина (табл. 12.3): повторную инъекцию выполняют не
ранее, чем через 45 мин; повторная доза не должна превышать 1/3 максимальной
начальной дозы, если интервал между ними составляет 45 мин, и 1/2 максимальной
начальной дозы, если интервал составляет 90 мин; начиная с 3-й инъекции, доза не
должна превышать 1/3 максимальной начальной дозы при условии интервала меж-
ду инъекциями 75 мин и 1/2 части максимальной начальной дозы, если интервал
составляет 150 мин; пациентам преклонных лет вводят уменьшенные дозы препара-
та, особенно при необходимости повторных введений.
Таблица 12.3. Дозирование омникаина у взрослых и детей старше 12 лет
Анестезия Доза, мг Объем 0,5 % раствора, МЛ
начальная максимальная
Межреберная блокада 10-15 на один нерв 150 на один нерв 2-3
Блокада сплетения 62,5 150 12,5-30
Блокада нервных стволов туловища 12,5—25 в зависимости от нерва 50-100 в зависимости от нерва 2,5-20
Эпидуральная на грудном уровне 20-30 50 4-6
Эпидуральная на нижнегрудном уровне 50 150 10-30
Эпидуральная на поясничном уровне 40 150 8-30
Спинальная 15 20 3-4
Долговременную эпидуральную анестезию для обезболивания органов грудной
клетки и верхнего этажа брюшной полости достигают путем длительной инфузии
0,125 % раствора омникаина в эпидуральное пространство со скоростью 5—10 мл/ч,
для обезболивания органов нижнего этажа брюшной полости — со скоростью 15 мл/ч,
для обезболивания нижних конечностей — со скоростью 10 мл/ч [1, 2].
Побочные эффекты при клиническом применении омникаина наблюдают
редко. Вероятность их возникновения увеличивается, если применяют неадекват-
ные дозы и нарушают методику введения препарата. Существует риск развития
9 7-585
257
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
аллергических реакций (в тяжелых случаях — анафилактического шока), поэтому
перед применением проводят кожные тесты на переносимость. При спинальной
анестезии возможны артериальная гипотензия и брадикардия в результате блока-
ды симпатического отдела вегетативной нервной системы. Описаны единичные
случаи остановки сердца. При высокой спинальной анестезии возможен паралич
дыхательных мышц и остановка дыхания.
Омникаин противопоказан: для проведения внутривенной регионарной анес-
тезии, при повышенной индивидуальной чувствительности к любому из компо-
нентов препарата или к любому местному анестетику амидного ряда, лицам с
противопоказаниями к проведению местной и регионарной анестезии.
Случайное внутривенное введение омникаина приводит к развитию токсических
эффектов: со стороны ЦНС — к появлению обеспокоенности, тревожности, воз-
буждения, парестезий, состояния опьянения, тремора, ощущению страха, зевоты,
нистагма, головной боли, тошноты, звона в ушах, в тяжелых случаях возможны
потеря сознания и клонико-тонические судороги; со стороны сердечно-сосудис-
той системы — к ухудшению сократительной способности миокарда, артериаль-
ной гипотензии, брадикардии, нарушению атриовентрикулярной проводимости,
высокие концентрации в плазме могут вызвать вентрикулярную аритмию, фиб-
рилляцию желудочков и асистолию.
Омникаин применяют с осторожностью для местной анестезии у пациентов,
которые получают антиаритмические средства или другие местные анестетики по
причине возможной суммации токсичных эффектов. Ингибиторы местных анес-
тетиков и трициклические антидепрессанты потенцируют риск развития долго-
временной гипотензии. При одновременном применении с барбитуратами воз-
можно уменьшение концентрации омникаина в крови.
12,5.4. Мепивакаин (карбокаин)
Обладает средней скоростью развития анестетического эффекта,
умеренными длительностью, силой действия и токсичностью.
Используют для местной инфильтрационной анестезии, блокад нервов и для
эпидуральной анестезии.
12.5.5. Этидокаин (дуранест)
Обладает быстрым началом действия, длительной активностью,
высокой силой действия и средней токсичностью. Глубокая моторная блокада
более выражена, чем сенсорная.
Используют для блокад нервов и эпидуральной анестезии. Для обеспечения
брюшнополостных операций с помощью эпидуральной анестезии используют 1,5 %
раствор местного анестетика.
12.5.6. Ропивакаин
Обладает медленным началом действия, длительной активностью,
высокой анестетической силой и средней токсичностью. Вызывает более выра-
женную сенсорную блокаду, чем моторную.
Показания к применению сходны с таковыми бупивакаина, но с меньшим
риском токсического воздействия на сердце.
258
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ
12.6. КОМБИНИРОВАНИЕ МЕСТНЫХ АНЕСТЕТИКОВ
Смеси местных анестетиков потенциально имеют лучшие характери-
стики, чем каждый отдельно, например, комбинации хлорпрокаин-бупивакаин или
лидокаин-бупивакаин вызывают быстрый и длительный анестетический эффект, но
анестетическая сила других комбинаций местных анестетиков непредсказуема и явля-
ется предметом дискуссий среди клиницистов. Системная токсичность комбинаций
местных анестетиков состоит из суммы токсических эффектов каждого отдельно.
12.7. АДЪЮВАНТНЫЕ ПРЕПАРАТЫ
Для снижения системного действия, токсического эффекта и про-
лонгирования эффекта местных анестетиков их часто используют в комбинации с
вазоконстрикторами (адъювант — любое вещество, используемое в соединении с
другим для повышения активности последнего).
Адреналин, или эпинефрин. Добавляют к местным анестетикам с целью увеличе-
ния длительности анестезии, которая зависит от разновидности регионарного блока
и концентрации местного анестетика, а также для снижения системной токсичнос-
ти, увеличения проявления блока и снижения кровотечения из хирургической раны.
В клинике используют обычные растворы местных анестетиков с добавлением
адреналина до концентрации 1:200 000, что соответствует 0,1 мл или 2 каплям 0,1 %
раствора адреналина в 20 мл местного анестетика. Максимальная доза адреналина не
должна превышать 10 мкг/кг для детей и 200—250 мкг для взрослых. Адреналин не
используют для блокад периферических нервов в местах со слабым коллатеральным
кровообращением (пальцы рук, ног, пенис), а также при проведении внутривенной
регионарной блокады. С осторожностью добавляют адреналин к местным анестетикам
в случаях использования этой смеси для регионарной анестезии у больных с тяжелыми
заболеваниями венечных артерий, аритмиями, тяжело контролируемой артериальной
гипертензией, тиреотоксикозом и маточно-плацентарной недостаточностью.
Фенилэфрин, или мезатон. Обладает такими же эффектами, как адреналин.
Для пролонгации анестетического эффекта спинальной анестезии к раствору ме-
стных анестетиков добавляют 5 мг фенилэфрина.
Натрия бикарбонат. Добавление к растворам местных анестетиков повышает pH
и концентрацию неионизированной свободной фракции анестетика. Повышение со-
держания неионизированной фракции увеличивает скорость диффузии и развития
нейроблокады. Обычно 1 мэкв натрия бикарбоната (приблизительно 1 мл 4 % раство-
ра натрия бикарбоната) добавляют к каждым 10 мл лидокаина или мепивакаина.
12.8. ТОКСИЧЕСКОЕ ДЕЙСТВИЕ МЕСТНЫХ АНЕСТЕТИКОВ
12.8.1. Аллергические реакции
Истинные аллергические реакции на местные анестетики регис-
трируют редко (см. табл. 12.4). Необходимо дифференцировать их с общетокси-
ческими реакциями.
Местные анестетики эфирного ряда могут вызвать аллергические реакции за счет
продукта их метаболизма — парааминобензойной кислоты. Кроме этого, аллергичес-
кие реакции на местные анестетики этой группы могут возникать у больных с повы-
шенной чувствительностью к сульфаниламидам или тиазидным диуретикам.
259
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Местные анестетики амидного ряда, в сущности, не обладают аллергической
активностью. Растворы анестетиков, которые содержат метилпарабен в качестве
стабилизатора, могут вызвать аллергические реакции у части пациентов, имею-
щих повышенную чувствительность к парааминобензойной кислоте.
Таблица 12.4. Относительная токсичность местных анестетикоа
Местный анестетик Анестетическая сила при спинальном применении Токсичность для ЦНС Максимальная доза (рекомендуют для блокад периферических нервов у взрослых пациентов, m = 70 кг), мг
без адреналина с адреналином
Прокаин 1 1 400 600
Хлоропрокаин 1 1 800 1000
Лидокаин 2 3 300 500
Мепивакаин - 2 300 500
Етидокаин - 6 300 400
Бупивакаин 14 12 175 225
Тетракаин 10 8 100 200
Местные реакции гиперчувствительности на местные анестетики могут про-
являться местной эритемой, уртикарной сыпью, отеком или дерматитом.
Системные реакции гиперчувствительности при использовании местных ане-
стетиков возникают редко и могут проявляться генерализованой эритемой, кож-
ной сыпью в виде волдырей и отеков, а также бронхоспазмом, гипотензией и
сердечно-сосудистым коллапсом.
При развитии сосудистого коллапса немедленно прекращают введение анес-
тетика, проводят оксигенацию 100 % кислородом, при необходимости интубиру-
ют больного и проводят ИВЛ. Артериальную гипотензию лечат инфузиями сба-
лансированных растворов кристаллоидов или коллоидов с применением внутривен-
но 0,05—0,1 мл 0,1 % раствора адреналина гидрохлорида (норадреналина, изопротеренапа).
Внутривенно вводят стероидные гормоны — гидрокортизон (0,250—1 г) или
метилпреднизолон (1—2 г). Антигистаминные препараты, например, пипольфен
(0,5—1 мг/кг внутривенно) используют в качестве препаратов второго ряда.
Профилактику аллергических реакций на местные анестетики осуществляют
путем предварительного тестирования на переносимость препарата и комплекса
предупредительных мероприятий: вечером перед операцией и утром в день опера-
ции назначают дифенгидрамин (пипольфен) в дозе 0,5—1,0 мг/кг и циметидин
(150—300 мг) или ранитидин (1—2 мг/кг); за сутки до операции назначают предни-
золон в дозе 1 мг/кг или 50 мг для взрослых через каждые 6 ч, до 4 доз.
12.8.2. Системное токсическое действие
Системная токсичность обычно является результатом ошибочного внут-
рисосудистого введения местных анестетиков или вследствие его передозировки. Внут-
рисосудистое введение местных анестетиков чаще происходит при проведении блокад
периферических нервов в зонах непосредственной близости к большим кровеносным
сосудам (аксиллярным и вертебральным артериям, венам эпидурального пространства).
260
12. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МЕСТНЫХ АНЕСТЕТИКОВ
Для снижения риска развития системного токсического действия местных
анестетиков проводят аспирационную пробу перед введением, для тест-дозы ис-
пользуют растворы с адреналином, а также применяют рациональные малые объемы
местных анестетиков для получения нервного блока.
Тканевая токсичность при использовании местных анестетиков развивается редко.
12.8.3. Токсическое действие на ЦНС
Местные анестетики оказывают нейротоксическое действие при оши-
бочном введении в субарахноидальное пространство больших объемов или концентри-
рованных растворов. Развиваются симптомы головокружения, скандируемой речи, звона
в ушах, металлического привкуса во рту, нарушения зрения, онемения языка и губ,
судорожных подергиваний мышц, потери сознания, судорог и комы. Токсичность
местных анестетиков на ЦНС усиливают гиперкапния, гипоксия, ацидоз.
При первых признаках токсического эффекта проводят ингаляцию кислородом. Если
возникли судороги с нарушением или затруднением дыхания, то применяют противо-
судорожные препараты: бензодиазепины, например мидозолам в дозе 1 —2 мг внутривенно
или барбитураты, например тиопентал-натрий в дозе 50—200 мг. Для облегчения инту-
бации трахеи используют сукцинилхолин (дитилин), который ликвидирует повышен-
ную мышечную активность и понижает риск развития метаболического ацидоза.
12.8.4. Токсическое действие на сердечно-сосудистую
систему
Сердечно-сосудистая система является более стойкой к токсическому
действию местных анестетиков, чем ЦНС. Клинические проявления токсического дей-
ствия проявляются снижением сократительной способности миокарда, проводимости
и периферического сосудистого тонуса. Например, внутрисосудистая инъекция бупи-
вакаина или этидокаина может привести к развитию сердечно-сосудистого коллапса,
который зачастую рефрактерен к терапии по причине высокой степени связывания
местных анестетиков с белками миокарда и гладкой мускулатуры сосудов.
Лечение проводят с помощью оксигенотерапии и мероприятий, направлен-
ных на возобновление кровообращения и микроциркуляции: восполняют ОЦК,
применяют вазопрессоры, включая препараты для инотропной поддержки сердца.
Желудочковую тахикардию лечат с помощью кардиоверсии. Аритмии, возникно-
вение которых было предопределено токсическим действием местных анестети-
ков на миокард, тяжело поддаются лечению, но со временем их излечивают, если
осуществляют адекватную поддержку гемодинамики. При лечении желудочковой
тахикардии, которая возникла в результате внутрисосудистого введения бупивака-
ина, бретилиум эффективнее, чем лидокаин. Проведение сердечно-легочной реа-
нимации продолжают до тех пор, пока симптомы кардиотоксического эффекта
пойдут на убыль за счет перераспределения местных анестетиков [1, 2].
ЛИТЕРАТУРА
1. Bobbie Jean Sweitzer Local Anesthetics, in: J.K. Davison, W.F. Eckhardt III, D. A.
Perese Clinical Anesthesia Procedures of the Massachusetts General Hospital, 4-th Ed., Little,
Brown and Company, Boston/Toronto/London, 1993. — P. 197—205.
2. Jaffe R.A., Samuels S.I. Anesthesiologist Manual of Surgical Procedures, 2-th ed.,
Lippincott Williams Wilkins, 1999. — 1084 p.
261
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
По многочисленным статистическим данным регионарная анес-
тезия составляет 15—45 % в общем объеме анестезиологических
пособий. Регионарная анестезия является экономичным решени-
ем в амбулаторной хирургии, которая удовлетворяет интересы
анестезиолога, хирурга и пациента. Вид регионарной анестезии и
ее технику выбирают исходя из характера оперативного вмеша-
тельства (длительности, положения больного на операционном
столе, ожидаемой кровопотери, уровня мышечной релаксации),
требований анестезиолога, хирурга, интересов пациента, сложно-
сти данной методики.
Предоперационную оценку состояния больного перед прове-
дением регионарной анестезии осуществляют так же, как и перед
проведением общей анестезии. Во время предоперационного ос-
мотра особое внимание уделяют оценке неврологического статуса,
а также осмотру места пункции и зоне предполагаемого блока для
своевременной диагностики потенциальных сложностей манипу-
ляции или другой патологии. При сборе анамнеза делают акцент
на состоянии системы свертывания крови и при необходимости
проводят дополнительные лабораторные исследования.
Пациента знакомят со всеми деталями будущей процедуры по
анестезиологическому обеспечению: успокаивают, заверяют, что он
не будет чувствовать боли и при необходимости проведут общую
анестезию, если регионарная будет недостаточной или оператив-
ное вмешательство продлится более предполагаемого времени.
Во время проведения всех разновидностей регионарной ане-
стезии проводят стандартный мониторинг ЭКГ, АД, ЧСС, ЧДД и
показателя сатурации кислорода. Обеспечивают адекватный ве-
нозный доступ, подачу кислорода, проверяют аппаратуру для про-
ведения ИВЛ, интубации трахеи и готовят лечебные препараты
для поддержки показателей гемодинамики.
Для анестезиолога всегда актуально совершенствование про-
фессиональных навыков проведения регионарной анестезии. Чтобы
успешно оперировать в условиях регионарной анестезии, хирург
должен ощущать себя комфортно в присутствии бодрствующего
пациента, работать аккуратно и быстро. Пациент должен быть
контактен, спокоен и готов к сотрудничеству.
262
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
13.1. ОПРЕДЕЛЕНИЕ УРОВНЯ СЕГМЕНТАРНОГО БЛОКА
ДЛЯ ПРОВЕДЕНИЯ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА
Знание расположения чувствительных, двигательных и вегетатив-
ных волокон спинальных нервов является необходимым для определения анесте-
зиологом верного сегментарного уровня блокады, необходимого для осуществле-
ния определенных оперативных вмешательств. Известно, что афферентные веге-
тативные волокна, которые осуществляют иннервацию внутренних органов и
отвечают за реализацию висцеросоматических рефлексов на спинальном уровне,
в большинстве случаев расположены выше, чем соответствующие дерматомы
(см. табл. 13.1, рис. 13.1).
Таблица 13.1. Минимальные уровни блока кожной чувствительности при проведении
спинальной анестезии для обычных оперативных вмешательств
Место оперативного вмешательства Уровень блока
Нижние конечности Th12
Бедро Th10
Влагалище/матка Th10
Мочевой пузырь/предстательная железа Th10
Нижние конечности с использованием турникета ThB
Яички/яичники The
Нижний отдел брюшной полости The
Верхний отдел брюшной полости Th4
13.2. СПИНАЛЬНАЯ АНЕСТЕЗИЯ
Спинальная анестезия (синонимы: люмбальная, субдуральная, суб-
арахноидальная) основана на введении раствора местного анестетика (см. раздел 12)
в субарахноидальное пространство спинного мозга. При этом наступает блокада
задних (чувствительных) корешков спинного мозга, что приводит к утрате боле-
вой, тактильной, температурной чувствительности, и передних (двигательных)
корешков, что вызывает миорелаксацию.
Противопоказания к проведению спинальной анестезии
Абсолютные противопоказания: отсутствие согласия больного, наличие инфек-
ции кожных покровов в месте предполагаемой пункции, сепсис (септицемия, бак-
териемия), коагулопатия, аллергия на местные анестетики, повышенное внутри-
черепное давление.
Относительные противопоказания: наличие инфекционного процесса рядом с
местом пункции, гиповолемия, заболевания ЦНС, хроническая боль в спине, прием
препаратов, которые подавляют функции тромбоцитов (аспирина, дипиридамола,
нестероидных противовоспалительных препаратов).
263
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 13.1. Дерматомы спинальных нервов: С6—С8 — спина; С6— С8 — локоть; С6—С7 — запя-
стье руки и предплечье; С,—С8, Th, — рука и пальцы; Th,—Thn — межреберные мышцы;
С3—С5 — диафрагма; Th,—Th12 — живот; L,—Ц — тазобедренный сустав (сгибание); Ls-S, —
тазобедренный сустав (разгибание); L3—S. — колено (сгибание); Ц—L, — колено (разгибание);
L4— Ls — голеностопный сустав (сгибание); S — S2 — голеностопный сустав (разгибание)
264
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
13.2.1. Прикладная анатомия
Спинномозговой канал (рис. 13.2) расположен на протяжении от
большого отверстия черепа до сакральной щели. Границами костного канала яв-
ляются передняя стенка тела позвонков, латеральные дужки, остистые отростки
и задняя пластинка. Остистые отростки соединяют три связки: супраспинальная,
межспинальная и желтая. Желтая связка содержит эластические волокна; ее легко
идентифицируют по повышенному сопротивлению во время прохождения иглы.
Анатомия позвоночного канала у детей раннего возраста и взрослых неодина-
кова. Спинной мозг у новорожденного может заканчиваться на уровне Тр—Ц, то
есть ниже, чем у взрослых. По мере роста ребенка спинной мозг перемешается в
краниальном направлении и в возрасте 2 года заканчивается на уровне Ц. Conus
medullaris, поясничные, крестцовые, копчиковые корешки направляются дисталь-
но и формируют конский хвост. Именно на этом уровне — ниже L, — пунктируют
субарахноидальное пространство, чтобы предотвратить травмирование спинного
мозга иглой.
Спинной мозг имеет три оболочки: мягкую, твердую (заканчивается на уров-
не S,) и арахноидальную, которая расположена между мягкой и твердой оболочка-
ми. Субарахноидальное пространство находится между мягкой мозговой оболоч-
кой и арахноидальной оболочкой на уровне от S, внизу до желудочков мозга ввер-
ху. В субарахноидальном пространстве находится спинной мозг, нервные корешки,
цереброспинальная жидкость и сосуды, которые осуществляют кровоснабжение
спинного мозга. ЦСЖ представляет собой прозрачную бесцветную жидкость, ко-
торая наполняет субарахноидальное пространство. Общий объем ЦСЖ составляет
100-150 мл, на уровне спинного мозга циркулирует 25-35 мл ЦСЖ. ЦСЖ проду-
цируется хориоидальным артериальным сплетением третьего и четвертого желу-
дочков со скоростью 450 мл/сут. ЦСЖ реабсорбируется в кровоток через арахно-
идальные ворсинки и грануляции, которые выступают в просвет церебральных
венозных синусов и контактируют с эндотелием этих образований. Удельный вес
ЦСЖ при температуре 37 °C колеблется в пределах 1,003—1,009.
13.2.2. Эффекты спинальной анестезии
Блокада нервных корешков. Тонкие С-волокна проводят импульсы
вегетативной нервной системы и блокируются легче, чем толстые чувствительные
и двигательные волокна. Уровень вегетативной блокады находится на 2—3 сегмен-
та выше, чем уровень блокады чувствительности (сенсорный блок на уровне Th3
отвечает полной блокаде структур автономной нервной системы). В свою очередь,
волокна, которые проводят чувствительные импульсы, легче блокируются, чем
толстые двигательные волокна, потому уровень сенсорной блокады расположен
выше уровня моторной блокады.
Действие на дыхание. Низкая спинальная анестезия не влияет на дыхание.
При спинальной анестезии в грудном отделе прогрессивно нарастает паралич меж-
реберной дыхательной мускулатуры. Это не влияет значительно на уровень венти-
ляции у больных, которые находятся в положении на спине, то есть при сохранен-
ном диафрагмальном компоненте дыхания, но у больных с низкими дыхательны-
ми резервами, например, при патологическом ожирении, вентиляция нарушается
более существенно. Паралич межреберной мускулатуры и мышц брюшного прес-
265
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 13.2. Поперечный срез позвоночника и спинномозгового канала: 1) паутинная оболоч-
ка, 2) субдуральное пространство, 3) внутренний слой твердой мозговой оболочки, 4) на-
ружный слой твердой мозговой оболочки, 5) желтая связка, 6) мягкая мозговая оболочка,
7) субарахноидальное пространство, 8) эпидуральное пространство, 9) заднекорешковые
ганглии, 10) надкостница
са снижает эффективность кашлевого толчка, что важно для лечения больных с
хроническими обструктивными заболеваниями легких.
Действие на сердечно-сосудистую систему. Артериальная гипотензия развива-
ется прямо пропорционально степени симпатической блокады. Блокада симпати-
ческих волокон проявляется расширением артерий и увеличением емкости веноз-
ных сосудов, что приводит к снижению системного сосудистого сопротивления и
снижению венозного возврата. Если блокаду проводят ниже Th4, то повышается
барорецепторная активность, что приводит к повышению активности симпати-
ческих волокон, которые иннервируют сердце, сужению сосудов верхних конеч-
266
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
ностей. Блокада выше уровня Th4 нарушает симпатическую иннервацию сердца,
что проявляется брадикардией, снижением сердечного выброса и, как следствие,
снижением АД. Подобные явления чаще наблюдают у больных с гиповолемией, у
людей пожилого возраста и у больных с нарушением венозного возврата крови к
сердцу, например у беременных.
Действие на внутренние органы. Сакральная блокада вызывает атонию мочево-
го пузыря, что может сопровождаться задержкой мочи. Блокада симпатических
волокон на уровне Th,-!^ вызывает повышение тонуса сфинктера мочевого пузы-
ря и задержку мочи, таким образом, если анестезию или аналгезию проводят дли-
тельное время, то катетеризируют мочевой пузырь.
Висцеральная блокада симпатических волокон на уровне Th5—L, сопровожда-
ется повышением сократительной активности тонкого и толстого кишечников за
счет превалирования парасимпатической иннервации.
Спинальная анестезия вызывает снижение скорости гломерулярной фильтра-
ции на 5—10 % и снижение эффективного почечного кровотока, что не имеет
существенного клинического значения.
Нейроэндокринный (стрессорный) ответ на хирургическое вмешательство
представляет комплекс гормонального и метаболического каскадов, которые про-
являются повышением скорости метаболических реакций, уменьшением энерге-
тических запасов, задержкой в организме воды и электролитов. Этот ответ может
негативно влиять на ход послеоперационного периода, особенно у тяжелых боль-
ных. Спинальная анестезия до уровня Th5 подавляет часть неврального компонен-
та стрессорного ответа за счет блокады симпатических и соматических путей, ко-
торые обычно активируются под воздействием болевой импульсации. Волокна
блуждающего нерва, которые иннервируют органы верхнего этажа брюшной по-
лости, не блокируются, и их стимуляция может сопровождаться освобождением
гормонов гипоталамической зоны и гипофиза — антидиуретического и адрено-
кортикотропного гормонов.
Кровопотеря и инфекция также могут быть причиной центрального освобож-
дения стрессорных гуморальных факторов. Спинальная блокада предупреждает
повышение уровня глюкозы плазмы, что наблюдают во время проведения общей
анестезии. Также сохраняется нормальная толерантность к глюкозе и нормальная
чувствительность к инсулину.
Вазодилатация в зоне блокады и ниже предрасполагает к гипотермии.
13.2.3. Методика проведения спинальной анестезии
13.2.3.1. Спинальные иглы
Спинальную анестезию чаще всего выполняют, используя спи-
нальные иглы диаметром 22—25 G, хотя возможно использование более тонких
игл, например, 27 G. Игла диаметром 22 G более упругая, ее легче продвигать в
необходимом направлении, но, статистически, большинство случаев послепунк-
ционной головной боли связано с использованием иглы именно этого диаметра.
Игла диаметром 25 G более гибкая, поэтому при ее использовании часто требует-
ся проводник диаметром 19 G и длиной 1,5 дюйма. Этим фактом объясняют дос-
таточно редкие случаи (менее 1 %) возникновения послепункционной головной
боли при использовании.
267
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
В анестезиологическом техническом обеспечении появились новые иглы, на-
пример, Sprotte и Whitacre, которые имеют заточку кончика в виде карандаша.
Использование этих игл снижает частоту случаев послепункционной головной боли
за счет того, что они раздвигают волокна твердой мозговой оболочки, а не режут
их, как традиционные иглы.
13.2.3.2. Положение пациента
Во время выполнения спинальной анестезии обычно используют
следующие позиции пациента: положение на боку, положение сидя, положение
на животе, реже — положение “сложенного ножа”.
Положение на боку используют с целью предупреждения распространения вверх по
субарахноидальному пространству гипобарического раствора анестетика и с целью пре-
дупреждения распространения вниз по субарахноидальному пространству гипербари-
ческого раствора анестетика. Позвоночник располагают горизонтально и параллельно
поверхности стола, колени согнуты и приведены к грудной клетке, подбородок приве-
ден к грудной клетке для обеспечения максимального сгибания позвоночника.
Положение сидя используют для обеспечения низкого спинального блока, глав-
ным образом, в гинекологической и урологической практике и, обычно, исполь-
зуют у пациентов с ожирением для облегчения определения средней линии. Как
правило, положение сидя используют при введении в субарахноидальное про-
странство гипербарических растворов анестетиков. Голова, плечи, позвоночник
пациента согнуты, руки согнуты, локти приведены к втянутому животу, ноги сто-
ят на стуле. Помощник поддерживает больного в этом положении.
Положение на животе используют при применении гипобарических растворов
анестетиков для обеспечения операций на прямой кишке и в области промежности.
13.2.3.3. Доступы к пункции субарахноидального пространства
Линия, которая соединяет гребни подвздошных костей, соответ-
ствует остистому отростку Ц или мсждпозвонковому промежутку L3—L4. Межпоз-
вонковые промежутки Ц—L3, Ц—Ц, L4~Ls чаще всего используют для пункции
субарахноидального пространства с целью проведения спинальной анестезии.
Кожу в месте пункции широко обрабатывают раствором антисептика, высу-
шивают сухими стерильными салфетками для предупреждения контакта спиналь-
ной иглы с раствором используемого антисептика, который является потенциаль-
но нейротоксичным.
Проверяют соответствие стилета спинальной иглы ее диаметру. С помощью
иглы диаметром 25 G проводят местную инфильтрационную анестезию кожи в
области места спинальной пункции 1 % раствором лидокаина.
Срединный доступ. Спинальную иглу или проводник вкалывают в кожу и про-
ходят межостистую связку. Во время прохождения межсвязочного пространства
направление иглы должно соответствовать расположению остистого отростка с
небольшим наклоном в краниальном направлении.
Парамедианный доступ. Кончик спинальной иглы располагают на 1,5 см лате-
ральнее центра межпозвонкового пространства. Иглу направляют медиально и
слегка в краниальном направлении и продвигают латеральнее супраспинальной
связки. Этот доступ используют у больных, которые не могут достаточно согнуть-
ся, или в случаях оссификапии связок.
268
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
13.2.3.4» Постановка иглы
Для профилактики возникновения послепункционной головной
боли срез иглы располагают параллельно вдоль размещенным волокнам твердой
мозговой оболочки. Иглу продвигают до момента исчезновения повышенного
сопротивления, что свидетельствует о прохождении иглой желтой связки. При
дальнейшем продвижении иглы внезапное исчезновение сопротивления ее про-
движению с характерным звуковым оформлением свидетельствует, что игла про-
шла внутренний листок твердой мозговой оболочки. После этого вынимают сти-
лет иглы и ожидают вытекания ЦСЖ из павильона иглы. Если ЦСЖ вытекает
медленно, то павильон иглы вращают по оси на 90° до улучшения вытекания
ЦСЖ. Если используют спинальную иглу диаметром 25 G, то есть достаточно
тонкую, или у больного изначально низкое ликворное давление, то осторожно
аспирируют ЦСЖ с помощью шприца. Во время пункции стилет должен быть
вставлен в иглу максимально. Если во время пункции субарахноидального про-
странства у больного появились парестезии, то иглу немедленно извлекают и
корректируют ее направление.
13.2.3.5. Введение раствора местного анестетика
в субарахноидальное пространство
Шприц с тест-дозой местного анестетика подсоединяют к спи-
нальной игле. Аспирация ЦСЖ в шприц свидетельствует о нахождении конца
иглы в субарахноидальном пространстве. Медленно вводят местный анестетик (см.
табл. 13.2). Повторная аспирация ЦСЖ в конце инъекции местного анестетика
свидетельствует, что конец иглы находится в субарахноидальном пространстве.
Иглу извлекают и осторожно переводят больного в необходимое положение на
операционном столе.
Показатели АД, ЧСС и сатурации кислорода мониторируют каждые 60—90 с в
течение первых 10—15 мин. Уровень анестезии контролируют нанесением болево-
го раздражения с помощью иглы и фиксируют окончательно приблизительно на
20-й минуте. Распространенность спинальной анестезии определяют по уровню
блокады болевой чувствительности.
При пункции субарахноидального пространства на поясничном уровне введе-
нием разных доз местных анестетиков (для достижения высшего блока по восхо-
дящей) избегают высокого блока симпатических волокон, особенно у больных в
тяжелом состоянии.
Длительность анестезии может быть продлена путем повторного введения
местного анестетика в эпидуральное пространство. С этой целью используют на-
бор для эпидуральной анестезии с эпидуральной иглой диаметром 17 G и катете-
ром диаметром 20 G. После пункции эпидурального пространства эпидуральный
катетер вводят через иглу на 2—4 см дистальнее кончика иглы. Более глубокое
введение катетера сопровождается сильной болью. Повторные введения гиперба-
рических растворов местного анестетика в субарахноидальное пространство через
специальные спинальные катетеры диаметром 26—32 G могут сопровождаться ней-
ротоксическим эффектом, поэтому данную методику не рекомендуют для про-
лонгации спинальной анестезии.
269
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 13.2. Дозы местных анестетиков, необходимые для получения гипербари-
ческой спинальной анестезии
Местный авестетик Доза в зависимости от уровня анестезии*, мг Длительность анестезии, мин
Тйю The The
Тетракаин 10 12 14 90-120
Бупивакаин/омникаин 7,5 9 10,5 90-120
Лидокаин 50 60 70 30-90
* Дозы местных анестетиков рассчитаны для больного ростом 165 см. С увеличением или
уменьшением роста на 15 см дозы местных анестетиков для спинальной анестезии увеличивают
или уменьшают: тетракаина — на 2 мг, лидокаина — на 10 мг, бупивакаина — на 1,5 мг.
13.2.3.6. Факторы, влияющие на уровень
спинальной блокады
Уровень спинального блока напрямую зависит от дозы местного
анестетика, которую вводят в субарахноидальное пространство. Введение местного
анестетика в субарахноидальное пространство в большем объеме способствует более
широкому его распространению с ЦСЖ. Это особенно характерно для гипербаричес-
ких растворов местных анестетиков. Возникновение турбулентного движения ЦСЖ
во время или после введения местного анестетика в субарахноидальное пространство
способствует повышению распространения анестетика в субарахноидальном простран-
стве и повышению уровня сенсорного блока. Турбулентность движения ЦСЖ увели-
чивается при быстром введении препарата в субарахноидальное пространство, при
применении методики барботажа ЦСЖ, при кашле и резких движениях пациента.
Растворы МА могут быть гипербарическими, гипобарическими или изобари-
ческими по отношению к удельному весу ЦСЖ. Гипербарические растворы (с
удельным весом больше, чем удельный вес ЦСЖ) обычно готовят путем добавле-
ния к раствору местного анестетика декстрозы. Эти растворы распространяются
по субарахноидальному пространству вследствие повышенного удельного веса. Ги-
побарические растворы имеют удельный вес меньше удельного веса ЦСЖ и рас-
пространяются вверх по субарахноидальному пространству. Изобарические ра-
створы имеют удельный вес, равный удельному весу ЦСЖ, и их распространение
в субарахноидальном пространстве зависит от положения больного. Повышение
дозы изобарного раствора анестетика более влияет на длительность анестезии,
чем на его распространение в субарахноидальном пространстве, таким образом,
изменение положения больного на операционном столе можно использовать для
ограничения или распространения изобарного раствора местного анестетика по
субарахноидальному пространству. Беременность, ожирение, асцит или опухоль
брюшной полости ухудшают кровоток в нижней полой вене, что, в свою очередь,
повышает кровообращение в венозном сплетении эпидурального пространства,
снижает объем ЦСЖ на уровне спинного мозга и способствует более широкому
распространению введенного анестетика в субарахноидальном пространстве. Лор-
доз в поясничном и кифоз в грудном отделах позвоночника затрудняют распрос-
транение гипербарических растворов по субарахноидальному пространству. Мест-
270
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
ные анестетики, которые вводят в субарахноидальное пространство выше уровня L3
в положении на боку, распространяются в краниальном направлении до уровня
Th4, где их распространение ограничивает грудной изгиб.
13.2.3.7. Факторы, влияющие на длительность
спинальной анестезии
На длительность спинального блока влияет разновидность мест-
ного анестетика и его доза (табл. 13.3).
Таблица 13.3. Местные анестетики для спинальной анестезии
Местный анестетик Концентрация, % Длительность действия, ч Длительность действия с адреналином, ч Доза для взрослого пациента (т = 70 кг), мг (мл)
Лидокаин (гипербарич.) 5 0,75-1,5 0,75-1,5 60(1,2)
Лидокаин (изобарич.) 2 1-2 1-2 60 (3)
Бупивакаин (гипербарич.) 0,75 2-4 2-4 9(1,2)
Омникаин (гипербарич.) 0,5 2-4 2-4 15(3)
Бупивакаин (изобарич.) 0,5 2-4 2-4 15(3)
Тетракаин (гипербарич.) 0,5 2-3 3-5 12 (2,4)
Тетракаин (изобарич.) 0,5 3-5 5-8 15(3)
Тетракаин (гипобарич.) 0,1 3-5 5-8 10(10)
Добавление 0,2 мг адреналина (0,2 мл 0,1 % раствора ) или 2—5 мг мезатона к
растворам тетракаина (дикаина) продлевают на 50 % длительность спинальной
анестезии. Адреналин добавляют к растворам местных анестетиков непосредственно
перед введением в субарахноидальное пространство. Добавление адреналина к
растворам местных анестетиков замедляет развитие спинальной анестезии, за ис-
ключением растворов бупивакаина (см. раздел 12.7).
13.2.4. Осложнения спинальной анестезии
13.2.4.1. Осложнения во время проведения
спинальной анестезии
Артериальная гипотензия является самым частым осложнением спи-
нальной анестезии особенно существенным у больных с гиповолемией. Внутривенное
введение 500—1000 мл раствора Рингера-лактата перед проведением спинальной ане-
271
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
стезии снижает риск развития артериальной гипотензии. Во время проведения спи-
нальной анестезии больному осуществляют подачу кислорода через кислородную маску.
В случае развития артериальной гипотензии больному приподнимают ноги, внутри-
венно вводят 5—10 мг эфедрина или проводят внутривенную инфузию мезатона.
В результате блокады симпатических волокон, которые иннервируют сердце,
может развиться брадикардия, которую лечат внутривенным введением атропина в
дозе 0,4-1,2 мг (0,4-1,2 мл 0,1 % раствора атропина сульфата). Больные со сни-
женными сердечными резервами требуют осторожного переливания больших объе-
мов внутривенных растворов, так как во время восстановления сосудистого тону-
са происходит перераспределение жидкости из периферических сосудистых от-
резков в центральные с увеличением преднагрузки и возможным развитием отека
легких.
Парестезии могут возникать во время пункции или введения местного анесте-
тика по причине прямой травмы спинальных нервов или интраневрального введе-
ния препарата.
Во время спинальной пункции иглой могут быть повреждены вены эпиду-
рального пространства с развитием изолированной гематомы эпидурального про-
странства или гематомы с примесью ЦСЖ. Если вытекающая из пункционной
иглы ЦСЖ быстро не очищается от крови, то иглу необходимо вынуть и осуще-
ствить повторную пункцию.
Диспноэ обычно является осложнением высокой спинальной анестезии и воз-
никает в результате блокады двигательных волокон, которые иннервируют мыш-
цы грудной клетки и брюшной полости, принимающие участие в обеспечении
дыхательных движений. В таких случаях больного успокаивают и контролируют
адекватность вентиляции.
Апноэ может стать следствием снижения мозгового кровообращения в резуль-
тате выраженной гипотензии или прямой блокады сегментов С3—С5 (“тотальная
спинальная блокада”) с нарушением функции диафрагмального нерва. В этих слу-
чаях немедленно проводят ИВЛ через маску, ларингеальную маску или интубаци-
онную трубку.
Тошнота и рвота во время спинальной анестезии возникает в результате арте-
риальной гипотензии и чрезмерной стимуляции блуждающего нерва. Лечение вклю-
чает нормализацию АД, ингаляцию кислорода и внутривенное введение атропина.
Возможно осторожное внутривенное введение дроперидола, если позволяют по-
казатели АД.
13.2.4.2. Послеоперационные осложнения спинальной анестезии
Послепункционная головная боль усиливается в сидячем и верти-
кальном положениях и уменьшается в положении лежа. Боль локализуется в обла-
сти затылка, отдает в заднюю часть шеи и может сопровождаться звоном в ушах,
нарушением зрения в виде расплывчатости предметов и двоения. Головная боль
возникает через 24—48 часов после операции и является результатом вытекания
ЦСЖ через пункционное отверстие твердой мозговой оболочки в эпидуральное
пространство и, соответственно, снижения давления ЦСЖ, что вызывает смеще-
ние сосудов и нервов менингеальных оболочек. Средняя частота возникновения
послепункционной головной боли составляет приблизительно 5—10 %; частота
возникновения повышается у молодых пациентов, при использовании толстых
игл и после многократных попыток пункции субарахноидального пространства.
272
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
При своевременной диагностике послепункционную головную боль сначала
лечат консервативно постельным режимом, внутривенными инфузиями изотони-
ческих растворов и применением аналгетиков. Назначают 300 мг кофеина внутрь
или внутривенно капельно в течение двух часов вводят 500 мг кофеина бензоата,
растворенного в 500 мл изотонического раствора хлорида натрия. Если головная
боль интенсивная и длится более суток, то используют эпидуральную кровяную
заглушку. Для этого в стерильных условиях из периферической вены предплечья
делают забор 10—15 мл крови и вводят в эпидуральное пространство. В 95 % слу-
чаев первичное лечение бывает успешным.
Менингиты и арахноидиты возникают редко, но риск их развития необходимо
учитывать при проведении дифференциальной диагностики причин возникнове-
ния головной боли.
Частота случаев болей в спине после проведения спинальной анестезии не
отличается от частоты возникновения боли после проведения общей анестезии.
Считают, что причиной возникновения этого осложнения является выравнивание
физиологичного поясничного лордоза после мышечной релаксации в результате
растяжения капсул суставов, связок и мышц. Лечение консервативное: покой и
использование аналгетиков.
Причиной задержки мочи могут явиться сенсорная или моторная блокады.
Анестезиолог должен помнить о риске развития такого осложнения, особенно у
больных с сопутствующими симптомами нарушения проходимости мочевыводя-
щих путей или в случаях, когда пациенту провели объемную инфузионную тера-
пию в процессе оперативного вмешательства.
Неврологические повреждения наблюдают исключительно редко. Они являют-
ся результатом прямой травмы пункционной иглой, токсического действия хими-
ческих соединений, вирусов или бактерий, результатом ишемии, которая разви-
лась по причине экстрадуральной гематомы. Возможна прямая травма нерва в
результате хирургического вмешательства или неудобного положения на операци-
онном столе. Неврологические повреждения диагностирует невропатолог в ран-
ний послеоперационный период; ранняя диагностика имеет определяющее значе-
ние для результатов лечения.
Инфицирование в процессе проведения спинальной анестезии наблюдают край-
не редко, но возможно развитие менингита, арахноидита или абсцесса эпидураль-
ного пространства. Своевременно назначают консультацию невропатолога для
диагностики и начала специфического лечения [3].
13.3. Эпидуральная анестезия
Эпидуральная анестезия — разновидность региональной анесте-
зии, которую обеспечивают введением в эпидуральное пространство местноанес-
тезируюших средств. Анестезия при этом обусловлена блокадой спинномозговых
корешков на уровне эпидурального пространства, блокадой спинальных нервов в
паравертебральном пространстве и непосредственным действием местноанестези-
рующих средств (см. раздел 12) на спинной мозг.
Противопоказания к проведению эпидуральной анестезии
Абсолютные противопоказания: отсутствие согласия больного, наличие инфек-
ции кожных покровов в месте предполагаемой пункции, сепсис (септицемия, бак-
териемия), коагулопатия, аллергия на местные анестетики, повышенное внутри-
черепное давление.
273
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
Относительные противопоказания: наличие инфекционного процесса рядом с
местом пункции, гиповолемия, заболевания ЦНС, хроническая боль в спине, прием
препаратов, которые подавляют функции тромбоцитов (аспирина, дипиридамола,
нестероидных противовоспалительных препаратов).
13.3.1. Прикладная анатомия
Эпидуральное пространство располагается на протяжении от ос-
новы черепа до крестцово-копчиковой мембраны. Задней стенкой эпидурального
пространства является желтая связка, передней — внешний листок твердой мозго-
вой оболочки и суставные отростки позвонков. Кпереди располагается задняя про-
дольная связка, которая покрывает задние поверхности тел позвонков и межпоз-
вонковые диски. Сбоку эпидуральное пространство ограничено межпозвоночны-
ми отверстиями и нервными корешками. Эпидуральное пространство напрямую
соединяется с паравертебральным пространством и содержит жировую и лимфо-
идную ткани. Вены эпидурального пространства не содержат клапанов и напря-
мую соединяются с интракраниальными венами, с венами грудной и брюшной
полости через межпозвоночные отверстия и с венами таза через вены крестцового
венозного сплетения. Эпидуральное пространство более широкое по средней ли-
нии, в латеральном направлении — сужается. На поясничном уровне по средней
линии ширина эпидурального пространства составляет 5—6 мм, на среднегрудном
уровне — 3—5 мм.
13.3.2. Эффекты эпидуральной анестезии
Блокада нервных корешков. Местные анестетики, которые вводят в
эпидуральное пространство, прямо влияют на спинальные нервные корешки,
расположенные в латеральных отделах и покрытые твердой мозговой оболочкой.
Местные анестетики проникают в ЦСЖ, проходя через твердую мозговую оболоч-
ку. Развитие блока нервных волокон и степень сенсорной и двигательной блокад
при эпидуральной анестезии протекают медленнее и менее выражено, чем при
спинальной анестезии. Анестезия распространяется сегментарно, благодаря чему
достигают селективной блокады.
Действие на сердечно-сосудистую систему. Артериальная гипотензия развива-
ется в результате симпатической блокады, подобно спинальной анестезии. Кроме
этого, большие дозы анестетиков могут абсорбироваться в системный кровоток и
вызывать кардиодепрессивный эффект. В системный кровоток может абсорбиро-
ваться и адреналин, который добавляется к местным анестетикам при проведении
эпидуральной анестезии, что способствует возникновению тахикардии и артери-
альной гипертензии.
Другие физиологические изменения при эпидуральной анестезии подобны
эффектам спинальной анестезии (см. раздел 13.2.2).
Эпидуральная анестезия способствует снижению венозных тромбозов и коли-
честву тромбоэмболий легочной артерии в ортопедии, вероятнее всего из-за по-
вышения перфузии нижних отделов тела. При эпидуральной анестезии наблюда-
ют снижение коагуляционного потенциала, снижение агрегационной способнос-
ти тромбоцитов и повышение фибринолитической активности плазмы.
274
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
13.3.3. Методика проведения эпидуральной анестезии
13.3.3.1. Иглы для пункции и катетеризации эпидурального
пространства
Чаще всего для пункции и идентификации эпидурального про-
странства используют иглы Tuohy или Weiss диаметром 17 G. Эти иглы имеют
проводники, тупые концы с боковыми отверстиями и просвет, достаточный для
проведения катетера диаметром 20 G. Иглы диаметром 22 G часто используют для
разового введения местного анестетика в эпидуральное пространство.
13.3.3.2. Положение пациента
Для проведения эпидуральной анестезии используют положение
больного сидя или на боку. Эпидуральное пространство пунктируют по срединно-
му или парамедианному доступу (см. раздел 13.2.3.3). Преимущества срединного
доступа включают: максимальную ширину эпидурального пространства и низкий
риск пункции вен, спинальных артерий и корешков спинальных нервов, которые
расположены в его латеральных отделах.
Определяют место пункции, обрабатывают его и обезболивают кожу анало-
гично, как при выполнении спинальной анестезии (см. раздел 13.2.3.3).
13.3.3.3. Пункция и катетеризация на поясничном уровне
Для обезболивания кожи и подкожной клетчатки, а также для
введения местного анестетика в надостистую и межостистую связки используют
длинную иглу диаметром 25 G. Эта игла создает тоннель, в который вставляют
эпидуральную иглу. Для пункции кожи используют иглу диаметром 15 G, что
облегчает введение через кожу эпидуральной иглы. Эпидуральную иглу проводят
через надостистую и межостистую связки с небольшим наклоном к голове до
момента ощущения провала сопротивления, что соответствует моменту прохожде-
ния иглы через желтую связку.
Методы идентификации прохождения иглы через желтую связку
Метод “потери сопротивления”. Из эпидуральной иглы вынимают стилет и
присоединяют специальный шприц с легким ходом поршня на 1/3 заполненный
воздухом или физраствором. Медленно продвигая иглу в направлении эпидураль-
ного пространства, поршнем постоянно создают повышенное давление в шприце.
Когда конец иглы попадает в эпидуральное пространство, это проявляется ощу-
щением потери сопротивления, и поршень шприца как бы проваливается.
Метод “висящей капли ”. На павильон эпидуральной иглы до пункции желтой
связки вешают каплю жидкости, которая во время входа иглы в эпидуральное
пространство втягивается в просвет иглы. Отрицательное давление возникает в
результате того, что игла натягивает листок твердой мозговой оболочки, которая
после пункции сразу расправляется. Эта методика не информативна у больных с
ожирением и беременных. Втягивание капли наблюдают приблизительно в 80 %
случаев, что вызвано разной податливостью желтой связки во время ее пункции.
При неудачном использовании метода “висящей капли” рекомендуют метод “по-
тери сопротивления”.
275
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
13.3.3.4. Пункция и катетеризация эпидурального
пространства на грудном уровне
Этот метод проводят для обезболивания верхнего отдела брюш-
ной и грудной полостей с использованием меньших доз местных анестетиков.
Послеоперационную аналгезию на этом уровне достигают без блокады нижних
конечностей. Методика пункции эпидурального пространства на грудном уровне
такая же, как и на поясничном, только иглу направляют более краниально. Во
время пункции эпидурального пространства на грудном уровне существует риск
травмирования спинного мозга.
13.3.3.5. Постановка эпидурального катетера
Эпидуральный катетер используют для повторных введений мест-
ных анестетиков во время длительных оперативных вмешательств с целью про-
лонгации анестезии, а также для проведения послеоперационного обезболивания.
Используют рентгеноконтрастный катетер с градуированием в 1 см. Катетер вво-
дят в эпидуральное пространство через эпидуральную иглу, срез которой направ-
ляют в краниальном направлении. Если катетер содержит металлический провод-
ник, то его извлекают на 1—2 см для уменьшения риска перфорации твердой
мозговой оболочки или вен. Катетер вводят в эпидуральное пространство на рас-
стояние 2—5 см. Пациента предупреждают о возможности возникновения парес-
тезий, которые, как правило, имеют транзиторный характер. Если парестезии со-
храняются, то катетер переустанавливают. Катетер не следует извлекать через иглу,
так как он может быть срезан краем наружного отверстия иглы. Если возникает
необходимость извлечения катетера, то катетер и иглу извлекают вместе.
Для послеоперационного обезболивания выполняют подкожное тоннелирование
с целью лучшей фиксации, уменьшения риска инфицирования катетера и эпидураль-
ного пространства. Выполняют контрольную аспирацию с целью исключения нахож-
дения конца катетера в сосуде или субарахноидальном пространстве. Затем в эпиду-
ральное пространство вводят тест-дозу местного анестетика через эпидуральную иглу
при использовании методики одноразового введения или через эпидуральный кате-
тер. Тест-доза состоит из 3 мл анестетика с добавлением адреналина 1:200 000. После
введения тест-дозы проявляется минимальный эффект анестетика. Если тест-дозу
вводят субарахноидально, то быстро развивается неврологическая симптоматика
и спинальный блок. Если раствор местного анестетика вводят в вену эпидураль-
ного пространства, то на 20—30 % повышается ЧСС. Введение базисной расчет-
ной дозы анестетика осуществляют дробно — по 3—5 мл каждые 3—5 мин. Перед
введением очередной порции препарата каждый раз проводят аспирационную пробу
для идентификации нахождения катетера или иглы в эпидуральном пространстве.
13.3.3.6. Факторы, влияющие на уровень
эпидурального блока
Объем раствора анестетика, который вводят в эпидуральное про-
странство, составляет 1,6 мл на один спинальный сегмент. Объем раствора уменьша-
ют в 2 раза у новорожденных и больных пожилого возраста, так как сужение межпоз-
вонковых отверстий у больных пожилого возраста уменьшает распространение ане-
276
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
стетика в паравертебральном пространстве и предрасполагает его распространение в
краниальном направлении. У беременных дозу анестетика для эпидуральной анесте-
зии уменьшают на 1/3, так как во время беременности чувствительность нейронов к
местным анестетикам повышается. Кроме этого, сдавление нижней полой вены бере-
менной маткой повышает кровоток в венозном сплетении эпидурального простран-
ства и за счет этого уменьшается объем эпидурального пространства.
Быстрая инъекция анестетика в эпидуральное пространство вызывает менее
надежный блок, чем медленное введение. Установлено, что оптимально вводить
анестетик со скоростью приблизительно 0,5 мл/с. Быстрое введение является по-
тенциально опасным по причине резкого повышения давления в эпидуральном
пространстве и может привести к повышению внутричерепного и артериального
давлений, ишемии спинного мозга в результате снижения кровообращения в нем.
В положении больного сидя эпидуральная блокада распространяется в каудаль-
ном направлении, в положении на боку — в ту сторону, на которой лежит пациент.
Развитие блокады начинается на уровне инъекции местного анестетика и за-
тем распространяется в краниальном направлении, а потом — в каудальном. Это
объясняют различием толщины корешков спинальных нервов: на поясничном и
крестцовом уровнях они толще, чем на грудном.
Чаще анестетик вводят на уровне L5~SI по причине широкого межостистого
промежутка и медленной пенетрации препарата из этой зоны. Местный анестетик
полностью всасывается из эпидурального пространства через 20—30 мин.
13.3.3.7. Факторы, влияющие на длительность
эпидурального блока
На длительность эпидурального блока влияет разновидность мест-
ного анестетика. Добавление адреналина к раствору анестетика до концентрации
1:200 000 уменьшает его системную резорбцию и плазматическую концентрацию,
что пролонгирует анестетическую активность препарата. Этот эффект более оче-
виден при использовании местных анестетиков короткого действия. Например,
добавление адреналина к лидокаину увеличивает длительность его анестетическо-
го действия на 50 %. Этого не наблюдают при эпидуральном применении длитель-
но действующих местных анестетиков, например бупивакаина.
Добавление к раствору анестетика фентанила в дозе 50—100 мкг ускоряет на-
чало его действия, повышает глубину и увеличивает длительность эпидуральной
блокады. Фентанил осуществляет свой аналгетический эффект через взаимодей-
ствие с опиоидными рецепторами желатинозной субстанции задних рогов спин-
ного мозга. Фентанил и местные анестетики действуют синергично.
Добавление на каждые 10 мл раствора лидокаина 1 мл 8,4 % раствора бикарбо-
ната натрия (0,1 мл на каждые 10 мл раствора бупивакаина) сокращает время начала
блокады.
13.3.4. Осложнения эпидуральной анестезии
13.3.4.1. Осложнения во время проведения
эпидуральной анестезии
Перфорацию внутреннего листка твердой мозговой оболочки регис-
трируют в 1 % случаев. Если это грозное осложнение произошло, то анестезиолог
277
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
имеет несколько вариантов решения проблемы: перейти на проведение спиналь-
ной анестезии путем инъекции соответствующей дозы местного анестетика в су-
барахноидальное пространство или ввести эпидуральный катетер в субарахнои-
дальное пространство для продленной спинальной анестезии. Если эпидуральная
анестезия является крайне необходимой, например, для послеоперационного обез-
боливания, то иглу извлекают и осуществляют пункцию эпидурального простран-
ства на 1—2 сегмента выше с последующей катетеризацией. Возможность разви-
тия спинальной анестезии после введения анестетика в эпидуральный катетер не-
обходимо предусмотреть, чтобы не получить высокий спинальный блок по причине
применения большой дозы анестетика. Если возникла перфорация внутреннего
листка твердой мозговой оболочки, то от эпидурального введения наркотических
аналгетиков необходимо воздержаться по причине возможности развития отсро-
ченного угнетения дыхания.
Осложнения введения эпидурального катетера. Причиной невозможности про-
ведения эпидурального катетера через иглу в эпидуральное пространство обычно
является нахождение конца иглы в латеральной части эпидурального простран-
ства или острый угол между иглой и эпидуральным пространством. Еще одной
причиной может быть неполное прохождение иглы через желтую связку. В этом
случае иглу продвигают в направлении эпидурального пространства на 1 мм. Если
постановка катетера не удалась, то иглу и катетер извлекают одновременно.
Признаками попадания катетера в вену эпидурального пространства являют-
ся аспирация крови из катетера и появление тахикардии после введения тест-дозы
анестетика. В таких случаях катетер подтягивают до момента, когда аспирация
крови прекращается, со следующим тестированием верности положения катетера.
Эпидуральный катетер может оборваться и завязаться в узел в эпидуральном
пространстве. При отсутствии инфицирования катетер оставляют, а пациента ин-
формируют об этом осложнении.
Ошибочная субарахноидальная инъекция местного анестетика. Инъекция боль-
шого объема анестетика в субарахноидальное пространство может вызывать то-
тальную спинальную анестезию (см. раздел 13.2.4.1.).
Инъекция местного анестетика в вену эпидурального пространства проявляется
развитием токсического действия на структуры ЦНС и сердечно-сосудистую сис-
тему в виде судорог и остановки кровообращения. Описана резистентная к лече-
нию фибрилляция желудочков после внутривенного введения 0,75 % раствора бу-
пивакаина.
При превышении рекомендуемой дозы местного анестетика развиваются токси-
ческие эффекты (см. раздел 12.8).
Непосредственное повреждение спинного мозга возможно при пункции эпиду-
рального пространства выше L2. Появление односторонних парестезий во время
пункции эпидурального пространства свидетельствует о латеральном расположе-
нии иглы, в таких случаях при постановке катетера могут травмироваться нервные
корешки. Возможно травмирование небольших ветвей передней спинальной арте-
рии, которые проходят в межпозвонковых отверстиях. Травма этих артерий может
вызвать ишемию передних рогов спинного мозга или формирование эпидураль-
ной гематомы.
Кровяная пробка. Повреждение иглой вены эпидурального пространства вы-
зывает появление крови в павильоне иглы. Иглу необходимо извлечь и переуста-
новить. Наличие гематомы в эпидуральном пространстве затрудняет идентифика-
цию правильности нахождения иглы.
278
13. РЕГИОНАРНАЯ АНЕСТЕЗИЯ
13.3.4.2. Послеоперационные осложнения
эпидуральной анестезии
При пунктировании внутреннего листка твердой мозговой обо-
лочки эпидуральной иглой диаметром 17 G у 75 % больных развивается послепунк-
ционная головная боль.
Инфицирование эпвдурального пространства. Абсцесс эпидурального простран-
ства является крайне редким осложнением эпидуральной анестезии и происходит,
в основном, по причине гематогенного заноса инфекции из других отделов тела,
например с поверхности кожи при длительном использовании катетера для пос-
леоперационного обезболивания. Развиваются лихорадка, боль в спине, локаль-
ное напряжение мышц спины, прогрессирование корешковых болей и появление
параличей. Начальное обследование включает определение лейкоцитоза и прове-
дение люмбальной пункции для исключения параменингеальных инфекций. Ди-
агноз ставят на основании результатов миелографии или ЯМР. Лечение заключа-
ется в проведении срочной декомпрессионной ляминэктомии и рациональной ан-
тибиотикотерапии. Определяющими моментами являются ранняя диагностика и
своевременное патогенетическое лечение.
Гематома эпидурального пространства также является достаточно редким ос-
ложнением эпидуральной анестезии. Наиболее частая причина возникновения —
это повреждение вен эпвдурального пространства на фоне сопутствующих коагу-
лопатий. Развиваются сильная боль в спине и персистирующий неврологический
дефицит. Для диагностики используют компьютерную томографию или ЯМР.
Лечение — ургентная декомпрессионная ламинэктомия.
ЛИТЕРАТУРА
1. Bobbie Jean Sweitzer Local Anesthetics, in: J.K. Davison, W.F. Eckhardt III, D. A Perese
Clinical Anesthesia Procedures of the Massachusetts General Hospital, 4-th Ed., Little, Brown
and Company, Boston/Toronto/London, 1993. — P. 197—205.
2. Jaffe R.A., Samuels S.I. Anesthesiologist Manual of Surgical Procedures, 2-th ed.,
Lippincott Williams Wilkins, 1999. — 1084 p.
3. Rawan Molnar Spinal, Epidural and Caudal Anesthesia, in: Davison J.K., Eckhardt III
W.F., Perese D.A. Clinical Anesthesia Procedures of the Massachusetts General Hospital,
4-th Ed., Little, Brown and Company, Boston/Toronto/London, 1993. — C. 206—225.
279
14. ЛЕКАРСТВЕННАЯ ИНТЕРАКЦИЯ И
ПОЛИПРАГМАЗИЯ В АНЕСТЕЗИОЛОГИИ
Огромный выбор лекарственных средств, принадлежащих к
различным фармакологическим группам, с одной стороны, по-
зволил врачам обеспечивать индивидуальный подход в лечении
каждого пациента, с другой — столкнул их с проблемой полипраг-
мазии, или полифармации, — одновременного назначения боль-
ному нескольких лекарственных средств. Анестезиологи не стали
исключением. Сама по себе полипрагмазия не является осложне-
нием, но ее использование значительно повышает риск некото-
рых осложнений. Например, интраоперационная медикация яв-
ляется одной из наиболее частых причин периоперационных ос-
тановок кровообращения и летальных исходов, при этом
отрицательная интеракция (от англ, interaction — взаимодействие)
играет не последнюю роль [1].
Фармакологический ответ может разниться, когда одновремен-
но применяются два и более лекарственных средства (табл. 14.1).
Таблица 14.1. Терминологические дефиниции лекарственной
интеракции
Тип интеракции Математическая дискрипция
Аддитивная интеракция 1 + 1 = 2
Супер-аддитивная интеракция (синергизм) 1 + 1>2
Инфра-аддитивная интеракция (антагонизм) 1 + К2
Пример аддитивной интеракции — потенцирование эффекта
миорелаксантов ингаляционными анестетиками; пример синер-
гической интеракции — взаимодействие бензодиазепинов и опи-
оидов; пример антагонистической интеракции — между ингиби-
торами холинэстеразы и недеполяризующими миолрелаксантами.
Конкурентная интеракция, характерная для недеполяризующих
миорелаксантов, основана на конкурентном воздействии на одни
и те же рецепторы.
280
14. ЛЕКАРСТВЕННАЯ ИНТЕРАКЦИЯ И ПОЛИПРАГМАЗИЯ В АНЕСТЕЗИОЛОГИИ
Таким образом, интеракция бывает как потенциально выгодной, так и опас-
ной. В зависимости от предполагаемого механизма интеракцию лекарственных
средств классифицируют на фармацевтическую, фармакодинамическую и фарма-
кокинетическую [2].
Механизмы лекарственной интеракции:
I. Фармацевтическая интеракция (интеракция in vitro) — химическая или фи-
зическая несовместимость. Развивается до применения пациентом лекарственных
препаратов вследствие окислительно-восстановительных реакций, изменения pH
раствора, образования солей, гидролиза или реакций полимеризации (химическая
интеракция). Пример фармацевтической интеракции — реакция преципитации при
смешивании растворов тиопентал-натрия и векурония. Иногда химическая интер-
акция происходит без визуальных изменений характера раствора, что делает ее еще
более опасной. Химическая отрицательная интеракция может произойти между
ингаляционным анестетиком (галотаном, севофлюраном) и абсорбентом.
Для предотвращения случаев фармакологической интеракции не следует сме-
шивать препараты, если отсутствует уверенность в их химической и физической
совместимости. Пример отсутствия отрицательной интеракции — сочетанное при-
менение в растворе дроперидола и фентанила, натрия оксибутирата и тиопентал-
натрия.
2. Фармакокинетическая интеракция — нарушение абсорбции вследствие из-
менений pH в ЖКТ, моторики кишечника, связывания и хелации лекарственных
препаратов, токсического эффекта на пищеварительный канал, изменения регио-
нального кровотока и др. Некоторые лекарственные средства могут влиять на ки-
шечную абсорбцию, изменяя время начала действия и силу эффекта других лекар-
ственных препаратов. Например, опиоиды замедляют начало действия лекарствен-
ных средств, принятых per os.
До момента попадания в системный кровоток лекарственное средство может
пройти несколько фаз биотрансформации: в фазе 1 могут произойти процессы
оксидации, восстановления и гидролиза; в фазе 2 лекарственный препарат может
метаболизироваться с образованием водорастворимых молекул, глюкуроновой
кислоты, глютатиона или сульфатных групп. Оксидация — наиболее важный про-
цесс фазы 1. Он катализируется цитохромом Р450 (СУР450). СУР450 подразделя-
ется на классы, подклассы и специфические изозимы: СУР1, СУР2, СУРЗ уча-
ствуют в метаболизме лекарств и других ксенобиотиков; СУР4, СУР5 и СУР7
выполняют эндогенную функцию [7]. Многие субстраты или ингибируются или
индуцируются СУР энзимами. Например, совместное применение с мидозаламом
ингибиторов или индуцеров СУР-энзимов может изменять концентрационно-вре-
менную кривую в 400 раз [8].
3. Дистрибуция — распределение лекарственного средства (соединение с бел-
ками плазмы с последующим перераспределением) зависит от многих факторов. В
частности сердечный выброс и различия в региональной перфузии влияют на аль-
веолярную концентрацию газов и концентрацию в крови внутривенных анестети-
ков. Существенным моментом является связывание лекарственного препарата с
клетками крови и белками. Поскольку лишь несвязанная фракция препарата яв-
ляется фармакологически активной, то увеличение концентрации этой фракции
может значительно усиливать его фармакологический эффект.
4. Элиминация лекарственного препарата. Интеракция лекарственных препа-
ратов может увеличивать или уменьшать скорость метаболизма лекарственных
281
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
средств. Энзимная индукция может значительно снижать концентрацию препара-
та. Некоторые препараты стимулируют метаболизм лекарств (рифампицин, бар-
битураты, фенитоин, карбамазепин). Курение и значительные дозы алкоголя мо-
гут усилить индукцию печеночных микросомальных энзимов (иногда в течение
нескольких дней или недель).
Недавние исследования показали, что многие пищевые продукты и пищевые
добавки могут оказывать влияние на фармакокинетику лекарственных средств.
Например, грейпфрутовый сок является ингибитором СУРЗА4 и значительно уве-
личивает концентрацию зависимых СУРЗА4 субстратов — триазолама, амиодаро-
на, нисолдипина, фелодипина.
Практически невозможно оценить интеракцию всех лекарственных препара-
тов, которые одновременно применяются у одного больного во время анестезии и
после операции. В литературе подобных сообщений немного. Как правило, незна-
чительные изменения в фармакодинамике или фармакокинетике лекарственного
средства по причине интеракции чаще клинически незначимы. Интеракцию мож-
но считать существенной, если эффект применения препарата(ов) значительно
меньше ожидаемого или развился токсический эффект.
Для анестезиолога важно знание и понимание принципиальных механизмов
интеракции, что позволит спрогнозировать и, если необходимо, предотвратить
нежелательную интеракцию. Помимо понимания общих факторов риска, фунда-
ментальные знания базовой и клинической фармакологии и их клиническое воп-
лощение предотвращают серьезные или фатальные осложнения, вызываемые вза-
имодействием лекарственных средств.
®Риск неблагоприятной интеракции возрастает по экспоненте с количеством
назначаемых препаратов [6]
Полипрагмазия, как катализатор цепной реакции, лавинообразно провоцирует
комплекс последующих проблем, в частности — увеличивает количество ошибок при
введении лекарственных препаратов в интра- и послеоперационной медикации, а эти
осложнения, как известно, являются классическими медицинскими ошибками.
Пакистанские исследователи Khan и Hoda [3] сделали обзор критических слу-
чаев, связанных с ошибочным применением лекарств во время операции, сооб-
щения о которых поступили из основного операционного отделения клиническо-
го госпиталя в одной из развивающихся стран с января 1997 по декабрь 2002 года.
В течение этого периода было осуществлено 44 874 назначения препаратов, зарегис-
трировано 768 критических случаев, из которых 165 (21 %) были связаны с оши-
бочным применением медикаментов. Наиболее частыми ошибками в применении
лекарственных средств были неправильные дозировки препаратов и последующие
побочные эффекты и негативные реакции, а также неумышленная подмена шпри-
цов. В целом 76 % ошибок были классифицированы как таковые, которые можно
было предупредить, 56 % ошибок произошло по вине конкретного человека, 19 % -
вследствие системной оплошности, 10 % ошибок привели к ситуациям высокого
риска и большинство из них были связаны с применением миорелаксантов. Чаще
анестезиологи вводят ненужные препараты, чем не вводят необходимые.
Систематически используя обзор литературы, Jensen и соавторы [4] разрабо-
тали рекомендации для минимизации ошибок при внутривенном применении ле-
карственных средств во время анестезии, основанные на принципах доказатель-
282
14. ЛЕКАРСТВЕННАЯ ИНТЕРАКЦИЯ И ПОЛИПРАГМАЗИЯ В АНЕСТЕЗИОЛОГИИ
ной медицины. На первый взгляд азбучные и доступные рекомендации являются
результатом систематизации наиболее распространенных ошибок врачей и сред-
него медицинского персонала. Элементарные превентивные меры позволяют зна-
чительно уменьшить количество досадных оплошностей:
• необходимо систематически принимать контрмеры с целью уменьшения ко-
личества ошибок при применении лекарственных средств во время анестезии;
• прежде чем вводить лекарственное средство, необходимо детально и старательно
прочитать обозначение лекарственного средства на каждой ампуле или шприце;
• четкость обозначений на ампулах и шприцах должны быть оптимизированы
согласно утвержденным стандартам, шприцы необходимо всегда маркировать;
• обозначения должны быть проверены вторым человеком или устройством
прежде, чем лекарственное средство приготовят и введут.
Таблица 14.1. Потенциальная интеракция препаратов, часто используемых
в периоперационный период
Препарат Побочный эффект
Хронический прием алкоголя Толерантность к анестетикам
Антибиотики (аминогликозиды, стрептомицин) Пролонгация эффекта миорелаксантов
Антигипертензивные препараты Снижение активности симпатической нервной системы
Аспирин и другие НПВС Коагулопатии
Хронический прием бензодиазепинов Толерантность к анестетикам
Антагонисты p-адренорецепторов Брадикардия, бронхоспазм, снижение активности симпатической нервной системы, депрессия миокарда
Блокаторы кальциевых каналов Артериальная гипотензия
Дигиталис Нарушения ритма сердца
Диуретики Гиповолемия
Ингибиторы моноаминоксидазы Гипокалиемия
Трициклические антидепрессанты Усиленный ответ на симпатомиметики
Таким образом, знание фармакологических свойств применяемых для меди-
кации лекарственных средств и возможностей их отрицательной интеракции с
тяжелыми осложнениями позволяет уменьшить инцидентность таких ситуаций.
Необходимо рационально минимизировать медикацию во время операции и в
послеоперационном периоде и использовать только препараты, действительно
необходимые больному; гипотетическая польза профилактических лекарственных
средств должна быть максимально оправдана.
С каждым годом увеличивается, в том числе и в Украине, количество жалоб и
судебных исков к анестезиологам по финансовой компенсации осложнений, свя-
занных с анестезией. Например, в Дании законность требования на финансовую
компенсацию основывается на определенных критериях, разработанных незави-
симой Страховой Ассоциацией Пациентов (PIA). Hove L.D. и соавторы [5] изучи-
283
ОБЩАЯ АНЕСТЕЗИОЛОГИЯ
ли документацию пациентов, которым выдали финансовую компенсацию вслед-
ствие ущерба, вызванного анестезиологической процедурой. Согласно исследова-
нию, с 1996 по 2002 год было предъявлено 18 917 финансовых исков к медицинс-
ким работникам: 916 случаев были связаны с обезболиванием, из них 374 иска
были удовлетворены. В этот же период в Дании общее количество обезболиваю-
щих процедур составило около 400 000 ежегодно. Наиболее частыми первичными
причинами финансовой компенсации были повреждения нерва во время (эпиду-
ральной, спинальной, блокаде периферического нерва) региональной анестезии
(132 случая), II место в рейтинге причин финансовой компенсации заняли по-
вреждения, связанные с положением тела во время анестезии (100 случаев),
III место — осложнения внутрисосудистых катетеризаций или инъекций (39 слу-
чаев), IV место — повреждение зубов во время ларингоскопии и поддержания
проходимости дыхательных путей (31 случай). После анестезии функция мозга у
12 пациентов ухудшилась, вероятно, в результате перенесенной длительной пери-
операционной гипотензии и гипоксемии. Зафиксирован 21 случай смертельного
исхода. Средняя сумма финансовой компенсации составила 21 500 евро (0,3 %
обшей суммы от всех случаев). В 13 случаях осложнения анестезии вызвали тя-
желую инвалидность, поэтому компенсация достигла 150 000 евро. По данным
авторов, приблизительно у 2 из 10 000 пациентов, получающих анестезию, могут
развиться осложнения, которые дают им право получения финансовой компенсации.
284
14. ЛЕКАРСТВЕННАЯ ИНТЕРАКЦИЯ И ПОЛИПРАГМАЗИЯ В АНЕСТЕЗИОЛОГИИ
ЛИТЕРАТУРА
1. Marcucci С., Sandson N.B., Thorn Е.М., Bourke D.L. Unrecognized drug-drug
interactions: a cause of intraoperative cardiac arrest? Anesth. Analg., 2006 May; 102 (5):
1569-72.
2. Milde A.S., Motsch J. Drug interactions and the anesthesiologist. Anaesthesist, 2003
Sep; 52 (9): 839-59.
3. Khan F.A., Hoda M.Q. Drug related critical incidents. Anaesthesia, 2005 Jan; 60 (1):
48-52.
4. Jensen L.S., Merry A.F., Webster C.S. et al. Evidence-based strategies for preventing
drug administration errors during anaesthesia. Anaesthesia, 2004 May; 59 (5): 493—504.
5. Hove L.D., Nielsen H.B., Christoffersen J.K. Patient injuries in response to anaesthetic
procedures: cases evaluated by the Danish Patient Insurance Association. Acta Anaesthesiol.
Scand., 2006 May; 50 (5): 530—5.
6. Qinn D.L, van RiJ A.M., Spears G.F. et al. Clinically important drug interactions. In:
Speight TM, Holford NHG, eds. Avery’s drug treatment. Auckland: Adis, 1997. — P. 301—338.
7. Levy R.H., Thummel K.E., Trager E.F. et al. Metabolic drug interaction. 1-st ed.
Philadelphia: Lippincott Williams and Wilkins, 2000. — P. 1—793.
8. Backman J., Kivisto KT., Olkkola K.T., Neuvonen P.J. The area under the plasma
concentration-time curve for oral midazolam is 400-fold larger during treatment with intra-
conazole than with rifampicin. Eur. J. Clin. Pharmacol., 1998; 54: 53—58.
285
ЧАСТНАЯ
АНЕСТЕЗИОЛОГИЯ
• Анестезиологическое обеспечение
кардиохирургических вмешательств
• Анестезиологическое обеспечение торакальных операций
• Анестезиологическое обеспечение абдоминальных операций
• Анестезиологическое обеспечение урологических операций
• Обезболивание в акушерстве и гинекологии
• Обезболивание в отоларингологии
• Обезболивание в офтальмохирургии
• Анестезиологическое обеспечение
лапароскопических операций
• Обезболивание и интенсивная терапия
при трансплантации органов
• Принципы обезболивания у пожилых пациентов
• Анестезиологическое обеспечение операций на сосудах
• Принципы обезболивания у пациентов
с сопутствующими заболеваниями
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Требования к анестезиологическому обеспечению кардио-
хирургических вмешательств не отличаются от таковых в других
областях хирургии. Для выполнения большинства операций (про-
цедур) необходимы сон, аналгезия, нейровегетативная зашита и
комфортные условия для хирурга (мышечная релаксация). Анес-
тезиологу необходимы знания нормальной и патологической фи-
зиологии кровообращения, влияния анестетиков на функцию сер-
дечно-сосудистой системы, фармакологии кардиотонических и ва-
зоактивных препаратов; к специализированным требованиям
относят знания методики искусственного кровообращения и тех-
ник выполнения некоторых хирургических операций.
В Украине развитие кардиохирургии и, соответственно, кар-
диоанестезиологии связано с именами выдающихся ученых: Амо-
сова Н.М., Трещинского А.И., Чепкого Л.П., которые выполнили
и обеспечили первые операции на сердце в конце 50-х начале 60-х
годов прошлого столетия. В настоящее время украинские специ-
алисты владеют практически всеми видами кардиохирургических
вмешательств и успешно выполняют их, но, к сожалению, не каж-
дый областной центр Украины может рапортовать о высоком уров-
не службы хирургии сердца. Причин тому множество. Например,
до сих пор остается нерешенным вопрос об упорядочении схемы
кардиохирургической службы Украины, о необходимости содер-
жания и функционирования областных центров.
В Украине пока не существует систематизированного обуче-
ния специальности “Кардиоанестезиология”. Теоретически это-
му могла бы соответствовать 2-годичная клиническая ординатура
по анестезиологии в специализированных академических инсти-
тутах — Институте сердечно-сосудистой хирургии АМН Украи-
ны или Институте хирургии и трансплантологии АМН Украины.
Реально специалистами-кардиоанестезиологами становятся те,
кто проходил обучение “на рабочем месте” в вышеназванных
институтах или, в лучшем случае, в крупных кардиохирургичес-
ких центрах Европы или Северной Америки. В идеале необходи-
мо, чтобы обучение врачей-интернов по специализации “Анесте-
287
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
зиология” в течение последнего полугодия проходило на базе кардиохирургичес-
ких центров Украины. Такой подход в обучении кардиоанестезиологии позволит
решить в будущем немало вопросов, в частности, качественное анестезиологичес-
кое обеспечение больных с высоким сердечным риском в общехирургической
практике. Унификация последипломного образования поможет решить многие
проблемы.
15.1. ИСТОРИЧЕСКИЕ ДАННЫЕ
Долгие столетия сердце считали органом, не подвластным хирур-
гическому лечению. Например, Аристотель (384—322 до н. э.) полагал, что именно
физическое сердце, а не мозг, является органом мышления и что сердце — един-
ственный орган, который не может перенести повреждение. Фабриций (1533-1619)
писал о бесполезности попыток оперировать травму или ранение сердца. Теодор
Билльрот (1829—1894), основоположник современной хирургии, писал: “Хирург,
который пытается зашить рану сердца, заслуживает потери уважения своих кол-
лег”. Лишь в XIX веке появились работы, посвященные хирургическому лечению
ранений сердца. Так, в 1868 году Георг Фишер опубликовал данные о 10 % выздо-
ровлении после операций у 452 пациентов с ранениями сердца. В 1882 году была
издана экспериментальная работа Блока, в которой автор сообщил об успешном
ушивании резаных ран сердца кроликов и сделал резонный вывод о возможности
таких операций у людей. Немецкий хирург Людвиг Рен 9 сентября 1896 года при
выполнении ревизии плевральной и перикардиальной полостей ушил рану право-
го желудочка сердца 22-летнему мужчине. Через 10 лет после первого доклада Рен
сообщил о 40 % выживаемости при операциях по поводу ранений сердца и пери-
карда у 124 пациентов.
Расцвет кардиохирургии начался в 1940—1950 гг. (табл. 15.1). “Эпидемия трав-
матизма” периода мировых войн способствовала накоплению опыта лечения боль-
ных с повреждениями органов грудной клетки, опыт искусственной вентиляции
легких у больных с полиомиелитом оказался востребованным для проведения опе-
раций на легких и сердце, а применение препаратов кураре расширило границы
безопасного проведения общей анестезии.
Таблица 15.1. Основные события XX века в развитии кардиохирургии
Год Автор Событие
1905 Alexis Carrel, Charles Guthrie Гетеротопическая трансплантация сердца в эксперименте
1908 Frederic Trendelenburg Эмболэктомия из легочной артерии
1912 Theodore Tuffier Аортальная вальвулотомия
1918 Howell W.H., Holt E. Исследование роли гепарина
1923 Eliott Cutler Митральная комиссуротомия
1926 Брюхоненко С., Чечулин C. Аппарат искусственного кровообращения (автожектор)
1929 Warner Forssmann Катетеризация полостей сердца
288
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Продолжение табл. 15.1
Год Автор Событие
1937 Gibbon J.H. Работы с искусственным кровообращением
1938 Robert Gross Успешное закрытие артериального протока
1944 Clarence Crafoord Устранение коарктации аорты
1945 Alfred Blalock, Helen Taussig Системно-легочный анастомоз при «синих» пороках
1947 Thomas Holmes Sellers Легочная вальвулотомия
1950 Bigelow и соавторы Работы по искусственной гипотермии
1951 Dennis C. Закрытие межпредсердного дефекта в условиях искусственного кровообращения
1952 Lewis F. J., Taufic M. Закрытие межпредсердного дефекта в условиях гипотермии
1954 Lillehei C.W. Операции в условиях перекрестного кровообращения
1955 Melrose и соавторы Экспериментальные работы по кардиопротекции с использованием калиевой кардиоплегии
1960 Dwight Harken Протезирование аортального клапана в условиях искусственного кровообращения
1960 Starr A., Edwards M. Протезирование митрального клапана в условиях искусственного кровообращения
1967 Колесов В.И. Аортокоронарное (маммарокоронарное) шунтирование
1967 Christian Barnard Ортотопическая пересадка сердца
За последние 10—15 лет в кардиохирургии увеличилось количество малоинва-
зивных процедур (ангиопластики и стентирования коронарных артерий), различ-
ных видов вальвулопластики (митрального, аортального и клапана легочной арте-
рии), закрытий артериального протока и дефектов перегородок окклюдерами раз-
личных типов. В мировой литературе появились сообщения о выполнении операций
на сердце при помощи робототехники.
15.2. ПРИКЛАДНАЯ ФИЗИОЛОГИЯ
СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Основной функцией сердечно-сосудистой системы является
транспортирование (доставка) кислорода и питательных веществ к клеткам, гор-
монов — к органам-мишеням, продуктов жизнедеятельности — к органам-“дез-
интоксикаторам” и т. д.
10 7-585
289
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Наиболее информативными показателями работы сердечно-сосудистой сис-
темы являются минутный объем кровообращения (МОК) и сердечный индекс (СИ):
МОК = УО х ЧСС,
СИ = МОК / площадь поверхности тела,
где УО — это ударный объем сердца (синонимы: систолический объем крови,
систолический объем сердца, ударный объем крови; объем крови, выбрасываемый
сердцем за один сердечный цикл).
Для условий физического покоя и горизонтального положения тела нормаль-
ная величина МОК соответствует диапазону 4—6 л/мин, величина СИ — 2-4 л/
(мин хм2). В период тяжелой работы МОК у здорового человека может увели-
читься до 25—30 л/мин, а у спортсменов — до 35—40 л/мин.
Факторы, влияющие на ударный объем сердца:
• сократительная способность миокарда;
• преднагрузка — нагрузка, которую испытывает желудочек до начала сокраще-
ния, то есть это объем крови, поступивший в желудочек из предсердия (правого или
левого) до начала сокращения желудочка; условно соответствует давлению в пред-
сердии или конечному диастолическому давлению в соответствующем желудочке;
• постнагрузка — нагрузка, которую испытывает желудочек после начала сокраще-
ния (условно называют “сопротивлением выбросу”), соответствует системному сопро-
тивлению для левого желудочка и легочному сопротивлению для правого желудочка.
Факторы, влияющие на потребность миокарда в кислороде: сократимость мио-
карда, напряжение стенки желудочка, радиус желудочка, развиваемое желудочком
давление, ЧСС.
Факторы, влияющие на коронарный кровоток: диастолическое давление, ко-
нечнодиастолическое давление в желудочке (особенно для субэндокардиальных
слоев) и продолжительность диастолы.
Факторы, влияющие на доставку кислорода к миокарду: насыщение артериаль-
ной крови кислородом, способность клеток миокарда усваивать кислород.
Ограничение коронарного кровотока при ишемической болезни сердца (стенозе
венечных артерий) является важным фактором, влияющим на доставку кислорода
миокарду. При резком стенозе артерий доставка кислорода значительно уменьшает-
ся, таким образом, при повышении потребности миокарда в кислороде (например,
при повышенном выбросе эндогенных катехоламинов) страдают “зависимые” участ-
ки миокарда. Снижению транспортировке кислорода способствуют снижение диас-
толического давления, повышение конечного диастолического давления левого же-
лудочка, сокращение времени диастолы, уменьшение кислородной емкости крови.
Стеноз митрального клапана характеризуется нарушением диастолического за-
полнения левого желудочка, увеличением давления в левом предсердии. Если хро-
нически давление в левом предсердии превышает 25 мм рт. ст., то развивается
легочная гипертензия. Растяжение левого предсердия предрасполагает к наруше-
ниям ритма сердца — фибрилляции предсердий, тромбообразованию в левом пред-
сердии с риском системной тромбоэмболии. При отсутствии склероза легочных
сосудов повышается давление в легочной артерии, что приводит к гипертрофии
правого желудочка, возможно развитие отека легких. Стеноз митрального клапана
часто является следствием ревматического поражения соединительной ткани.
Недостаточность митрального клапана характеризуется регургитацией крови в
систолу из левого желудочка в левое предсердие, поэтому давление в левом пред-
сердии повышается, снижается ударный выброс левого желудочка, вследствие чего
290
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
развиваются гипертрофия левого желудочка и левого предсердия. Недостаточность
митрального клапана часто развивается при ревматическом поражении и комби-
нируется с митральным стенозом.
Стеноз клапана аорты характеризуется увеличением систолического давления в левом
желудочке для поддержания ударного объема через суженное аортальное отверстие.
Увеличение систолического давления в левом желудочке сопровождается гипертрофи-
ей левого желудочка, повышением потребности в кислороде, при этом может снижать-
ся доставка кислорода за счет сдавления коронарных артерий, особенно в субэндокар-
диальном слое. Препятствие выбросу крови из левого желудочка способствует разви-
тию его гипертрофии концентрической формы, при которой общая площадь сечения
коронарных сосудов не соответствует мышечной массе. Наполнение левого желудочка
и, следовательно, сердечный выброс по причине так называемой “жесткости левого
желудочка” крайне зависят от силы сокращения предсердий. Изолированный аорталь-
ный стеноз чаще развивается в результате аортосклероза, при ревматической этиоло-
гии порока чаще поражаются и аортальное, и митральное отверстия.
При недостаточности клапана аорты постоянная перегрузка объемом приводит
к развитию гипертрофии левого желудочка, которая, как правило, неконцентри-
ческая и менее выражена, чем при стенозе клапана аорты.
15.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ЛЕКАРСТВЕННЫХ
СРЕДСТВ, ЧАСТО ПРИМЕНЯЕМЫХ В КАРДИОХИРУРГИИ
Термин “сбалансированная анестезия”, предложенный в 1926 году,
полностью соответствует современной концепции анестезии в кардиохирургии. В
настоящее время практически не применяют моноанестезию, а используют не-
сколько препаратов для обеспечения адекватной защиты пациента во время опе-
рации и создания комфортных условий хирургам для выполнения операции.
15.3.1. Препараты для вводного наркоза
Для вводного наркоза при кардиохирургических вмешательствах
применяют тиопентал-натрий, кетамин, диазепам и пропофол, которые оказыва-
ют различное влияние на сердечно-сосудистую систему (табл. 15.2). Использова-
ние так называемой cardiac grid (в переводе с англ. — сердечная сетка) позволяет
анестезиологу выбрать препарат с наиболее подходящими свойствами, учитывая
индивидуальные особенности пациента.
Таблица 15.2. Гемодинамические эффекты анестетических
и вспомогательных препаратов
Препарат Гемодинамический эффект
СИ АД опсс КДДлж ЧСС Сократи- мость миокарда
Тиопентал-натрий <-> ? <-> ? г “1
Диазепам г 4 4 г <-> < >
291
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 15.2
Препарат Гемодинамический эффект
СИ АД ОПСС КДДлж ЧСС Сократи- мость миокарда
Кетамин т ? ? ? ? ?
Пропофол <-Х-> <-> ? <-> ? X
Сукцинилхолин <- X —> X X X ?
Пипекурониум <> <-> <-> <-> о
Векурониум <-> <-> <-> <> о
Рокурониум <-> <> <-> <> <->
Изофлюран <> X X <-> т X
Фентанил <-> X X <-> <-> <>
Морфин <-Х-> X X <->
Закись азота <-Х-> <-Х-> X
Примечание: Т — повышает, X — уменьшает, «-> — не производит эффекта, <-Т-> — эффект
зависит от других факторов.
Самым распространенным v “старым” средством для анестезии является ти-
опентал-натрий. Препарат, как средство для индукции, в чистом виде в настоящее
время используют редко, учитывая его прямое кардиодепрессивное действие в
рекомендованных для вводного наркоза дозах (5—7 мг/кг), поэтому у пациентов с
низким сердечным выбросом препарат применяют крайне осторожно.
Кетамин обладает уникальными для анестетиков свойствами: вызывает сти-
муляцию сердечно-сосудистой системы и повышает тонус симпатической нервной
системы (повышает ЧСС, АД, венозный тонус, сократимость миокарда, систем-
ное и легочное сосудистые сопротивления). Побочные эффекты действия кетами-
на в виде гипертензии, тахикардии и делирия нивелируют, комбинируя его с бен-
зодиазепинами, например диазепамом. Рутинное использование кетамина для
плановой анестезии нежелательно.
Диазепам используют для премедикации в дозе 0,05—0,1 мг/кг, для дости-
жения гипнотического эффекта — 0,5—0,6 мг/кг. Препарат практически не ока-
зывает выраженного влияния на системную гемодинамику. Недостатки дей-
ствия диазепама: относительно медленное начало действия по сравнению с
тиопентал-натрием, транзиторная боль по ходу вены при введении в перифе-
рический внутривенный катетер, значительная продолжительность полужизни
препарата (21—37 ч).
Использование пропофола для индукции и поддержания анестезии позволяет
применять принципы fast track (в переводе с англ. — быстрый след). Дозы пропо-
фола, рекомендуемые для индукции, у пациентов с низким сердечным выбросом
снижают, комбинируя, например, с кетамином.
292
IS. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
15.3.2. Препараты для поддержания анестезии
В настоящее время наиболее часто для поддержания анестезии во
время кардиохирургических вмешательств используют закись азота, изофлюран и
севофлюран.
Закись азота не так широко используют для поддержания анестезии, как ра-
нее (см. раздел 7.7.1), особенно в кардиоанестезиологии. В норме она оказывает
стимулирующее действие на симпатическую нервную систему, у пациентов со
сниженными миокардиальными резервами уменьшает сердечный выброс в соче-
тании с некоторыми препаратами.
Галогенсодержащие анестетики (галотан, энфлюран, изофлюран, севофлю-
ран) традиционно используют в кардиохирургии. Эти препараты оказывают пря-
мой миокардиодепрессивный эффект (см. разделы 7.6.1—7.6.5), особенно — га-
лотан. Изофлюран почти не оказывает влияния на сократимость миокарда, но
возможно его опосредованное действие на коронарные сосуды, когда развивает-
ся так называемый эффект обкрадывания: при резком стенозе одной из коро-
нарных артерий (более 90 %) и наличии обходного кровотока через коллатерали
к месту ниже стеноза изменяется интервал S—T на ЭКГ, снижается системный
выброс и возможно развитие нарушений ритма. У около 12 % пациентов с ИБС
имеются анатомические особенности, предрасполагающие к развитию “эффекта
обкрадывания”, но применение изофлюрана необязательно приводит к небла-
гоприятным гемодинамическим изменениям, возможно, из-за его негативного
инотропного эффекта, приводящего к снижению потребления кислорода мио-
кардом.
Наркотические аналгетики традиционно используют в кардиохирургии для
индукции, в период поддержания анестезии и послеоперационного обезболива-
ния. В настоящее время чаше всего используют фентанил в различных дозировках
(до 100 мкг/кг). Хорошо зарекомендовала комбинация фентанила (5—10 мкг/кг/ч)
и пропофола (2—5—7 мг/кг/ч) у пациентов со сниженными резервами (низкой
фракцией выброса, высокой легочной гипертензией) и при прогнозируемой или
плановой длительной ИВЛ. Иногда действие вышеуказанной комбинации требует
использования дополнительных препаратов для коррекции часто возникающей
артериальной гипертензии.
Морфин (см. раздел 5.3.5.1) для проведения анестезии в кардиохирургии в
настоящее время почти не применяют по причине выраженного вазодилатацион-
ного эффекта, что требует значительных объемов инфузии. Кроме этого, продол-
жительное действие морфина не позволяет быстро активизировать больного. В
основном препарат используют для послеоперационного обезболивания в виде
внутривенных инфузий (10—20 мкг/кг/ч) с возможностью самостоятельной бо-
люсной подачи при усилении болевых ощущений.
15.3.3. Мышечные релаксанты
Гемодинамические эффекты сукцинилхолина, пипекурониума,
векурониума и рокурониума представлены в табл. 15.2. Сукцинилхолин, особенно
при повторном введении, вызывает выраженную брадикардию, поэтому в кардио-
хирургии препарат практически не используют (только при прогнозируемой труд-
293
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ной интубации). Пипекурониум и векурониум практически не оказывают влияния
на системную гемодинамику и их наиболее часто применяют для проведения кар-
диохирургических операций. Эсмерон получил распространение благодаря исполь-
зованию принципов fast track.
15.3.4. Инотропные препараты
Показанием к применению инотропных препаратов (табл. 15.3) в
кардиохирургии является низкий сердечный выброс — менее 2 л/(мин х м2). Не-
обходимость их применения может возникнуть в любой момент периоперацион-
ного периода, чаще всего — во время завершения искусственного кровообраще-
ния. Гиповолемия, нарушения ритма сердца и истинная миокардиальная слабость
(из-за недостатков коррекции, неадекватной васкуляризации при АК.Ш, неадек-
ватной защиты миокарда) являются причинами низкого сердечного выброса. Как
правило, инотропные препараты назначают в комбинации с традиционными ме-
роприятиями по коррекции ОЦК, электролитного и газового составов крови. Пре-
параты назначают в сочетании с вазодилататорами.
Терапию начинают с дофамина в дозе 5—7 мкг/кг/мин, при необходимости
увеличивают до 10—12 мкг/кг/мин или добавляют второй симпатомиметик, на-
пример адреналин в дозе 0,1—0,2 мкг/кг/мин. Кальция хлорид (глюконат) назна-
чают при подтвержденной гипокальциемии, а применение сердечных гликозидов
в ранний послеоперационный период проблематично, особенно на фоне больших
доз симпатомиметиков.
При выраженной вазодилатации с целью восстановления перфузионного дав-
ления применяют сосудосуживающие препараты (фенилэфрин, или мезатон). К
сожалению, на украинском фармацевтическом рынке не представлены препараты
изопротеренол и амринон, которые оказывают хорошее инотропное действие.
Таблица 15.3. Инотропные препараты, применяемые
в периоперационный период в кардиохирургии
Препарат Влияние на адрено рецепторы Дозировка, комментарий
а Р1 Р2
Адреналин +++ ++ + 0,05—0,2 мкг/кг/мин При использовании больших доз преиму- щественно влияет на а-рецепторы, иногда используют болюсное введение
Норадреналин ++++ ++ + 0,05-0,4 мкг/кг/мин Возможно применение увеличенных доз при выраженной вазодилатации, напри- мер, после использования феноксибенза- мина или нитропруссида натрия; также применяют в сочетании с добутамином
Допамин ++ ++ + 3—12 мкг/кг/мин Оказывает дозозависимое действие на стимуляцию а-рецепторов
294
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Продолжение табл. 15.3
Препарат Влияние на адренорецепторы Дозировка, комментарий
а ₽1 ₽2
Добутамин + +++ + 3-15 мкг/кг/мин Преимущественно оказывает действие на а-рецепторы; вазодилатационный эффект увеличивается в зависимости от длительности применения препарата
Изопротеренол (не зарегистри- рован в Украине) 0 ++++ ++++ 0,05-0,2 мкг/кг/мин
Фенилэфрин ++++ 0 0 Болюс 0,1-0,5 мг
Кальция хлорид 0 0 0 Болюсное введение
Амринон (не зарегистрирован в Украине) 0 0 0 Болюс 2,5-5 мг/кг, затем инфузия 5-10 мкг/кг/мин Ингибитор фосфодиэстеразы. Возможна вазодилатация и тромбоцитопения при длительном применении; применяют в комбинации с допамином, особенно при правожелудочковой недостаточности
Дигоксин 0 0 0 Не применяют на фоне значительных доз симпатомиметиков
15.3.5. Вазодилататоры
Наиболее часто в кардиохирургии применяют нитропруссид на-
трия, нитроглицерин, нифвдипин (табл. 15.4). В мировой практике хорошие реко-
мендации получили а-адреноблокаторы фентоламин и феноксибензамин (не за-
регистрированы в Украине).
Основные показания к применению вазодилататоров: снижение высокого со-
судистого сопротивления (например, при выраженной симпатической стимуля-
ции) и коррекция сердечного выброса при миокардиальной недостаточности с
целью уменьшения постнагрузки на левый желудочек (обычно в сочетании с сим-
патомиметиками).
Вазодилататоры не применяют при гиповолемии, так как расширение сосудов
вызывает рефлекторное увеличение ЧСС.
Таблица 15.4. Вазодилататоры, применяемые в кардиохирургии
Препарат Механизм действия Дозировка Комментарий
Нитро- пруссид натрия Оказывает прямое действие преимущественно на артериолы 0,2-8 мкг/кг/мин Быстрое начало, короткая продолжи- тельность; не рекомендуют использовать в течение продолжительного времени в дозе более 4 мкг/кг/мин, так как возможна интоксикация цианидами
295
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 15.4
Препарат Механизм действия Дозировка Комментарий
Нитро- глицерин Оказывает прямое действие преимущественно на вены 0,5-5 мкг/кг/мин Оказывает действие на артериолы в дозе 4 мкг/кг/мин и более, что соответствует действию нитропруссида натрия в дозе 2 мкг/кг/мин; является препаратом выбора у пациентов с венозной легочной гипертензией, ишемией миокарда, высоким левопредсердным давлением
Нифиди- пин Антагонист кальция До ю мкг/кг/ч Применяют при АКШ (маммарокоронарном) с целью профилактики спазма внутренней грудной артерии
15.3.6. Антиаритмические препараты
Механические манипуляции на сердце и магистральных сосудах
часто провоцируют развитие нарушений ритма сердца — от предсердных экстра-
систол до трепетания (мерцания) предсердий, от единичных желудочковых экст-
расистол до фибрилляции желудочков, от синусовой тахикардии при гиповоле-
мии до резкой брадикардии (особенно при вывихивании сердца — изменении
конфигурации и положения работающего сердца во время АКШ). В некоторых
случаях для восстановления нормального сердечного ритма достаточно в течение
короткого времени прекратить манипуляции хирурга, если позволяет ситуация.
В кардиохирургии используют весь арсенал антиаритмических препаратов
(табл. 15.5), но, в первую очередь, исключают или устраняют наиболее вероятные
причины нарушений ритма: гипоксию, гиперкапнию, электролитные нарушения
(гипо- или гиперкалиемию), нарушения КОС, гипо- или гиперволемию.
Таблица 15.5. Антиаритмические препараты, часто применяемые в кардиохирургии
Препарат Механизм действия Дозировка Комментарий
Ново- каинамид Блокатор натриевых каналов (мембраностабилизатор), увеличивает эффективный рефрактерный период Болюс — 100 мг, максимальная доза — 1000 мг Возможно значительное снижение АД
Метопролол (беталок) p-Блокатор, уменьшает симпатическое влияние на миокард Болюс — 1 мг, мак- симальная доза — 5 мг Снижает сердечный выброс
Лидокаин Блокатор натриевых кана- лов (мембраностабилиза- тор), сокращает эффектив- ный рефрактерный период Болюс —1-2 мг/кг, максимальная доза— 5 мг/кг, инфузия — 20-50 мкг/кг/мин Повышенная судорожная готовность при использовании больших доз
Верапамил Блокатор кальциевых каналов Болюс — 0,15-10 мг/кг в те- чение 1-2 мин Возможно снижение АД
296
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Продолжение табл. 15.5
Препарат Механизм действия Дозировка Комментарий
Амиодарон (кордарон) Блокатор калиевых каналов, увеличивает все фазы реполяризации и потенциал действия Болюс — 3-5 мг/кг, до 1200 мг/сут Используют в до- и послеоперационной профилактике наруше- ний ритма, особенно для коррекции аорталь- ных пороков, после резекции аневризм левого желудочка
Дигоксин Уменьшает атриовентрику- лярную проводимость и ЧСС, увеличивает желудочковый автоматизм Болюс — 125-250 мкг Обязателен контроль электролитов (К+ и Са++)
Атропина сульфат Блокирует парасимпати- ческую стимуляцию синусового узла Болюс — 0,6-1 мг Брадикардия при использовании малых Доз
15.4. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Традиционно анестезиолог наносит визит пациенту за день до
операции. При хорошо налаженной системе дооперапионного обследования в кар-
диохирургическом стационаре практически нет необходимости проводить допол-
нительные обследования и медикаментозные назначения: вся необходимая ин-
формация содержится в истории болезни (табл. 15.6).
Обращают внимание на возможность трудной интубации, особенно у пациен-
тов с поражением клапанов сердца при системных поражениях соединительной
ткани — ревматизме, ревматоидном полиартрите и т. д. Учитывая системное пора-
жение артерий при атеросклерозе, выбирают наиболее удобные сосуды для арте-
рио- и венепункций.
Во время визита анестезиолог рассказывает пациенту в доступной форме об эта-
пах операции и особенностях послеоперационного периода, объясняет необходимость
инвазивного или неинвазивного мониторинга и возможного переливания препаратов
крови. Желательно, чтобы в отделении пациенты имели возможность самостоятель-
но ознакомиться с краткой информацией в виде буклетов и листовок (в электронном
виде — на интернет-сайтах кардиохирургической клиники) о заболеваниях сердца,
возможных методах лечения и обследования, периоперационном периоде.
Таблица 15.6. Интерпретация показателей инструментальных
и лабораторных методов исследования
Исследование Комментарий
Общий анализ крови Выясняют причину низкого уровня гемоглобина (например, анемия в резуль- тате инфекционного эндокардита, кровотечения из язвы желудка или 12-перст- ной кишки); обращают внимание на количество тромбоцитов, особенно при повторных вмешательствах на сердце и операциях на грудной аорте
297
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 15.6
Исследование Комментарий
Коагуло- грамма При приеме гепарина (по поводу нестабильной стенокардии) возможны изменения АЧТВ, при приеме непрямых антикоагулянтов — изменения протромбинового времени и индекса; изменения этих показателей возможны по причине нарушений функции печени при ЗСН
Электролиты При плановом приеме мочегонных средств возможно снижение показателей К+, Mg++, Са++, коррекцию которых проводят интраоперационно
Мочевина, креатинин Уровень креатинина повышен при сахарном диабете, длительно протекающей артериальной гипертензии, стенозе артерий почек; избегают назначения нефротоксичных препаратов, предусматривают необходимость проведения гемодиализа после операции
Глюкоза крови Регулярно контролируют уровень глюкозы у пациентов с сахарным диабетом
Группа крови и резус- фактор Индивидуально подбирают и готовят препараты крови до операции: при плановых операциях с ИК, например протезировании клапана или АКШ, необходимо 2 U эритроцитарной массы (желательно обедненной лейкоци- тами) и 2 U свежезамороженной плазмы; при повторных вмешательствах на сердце или операциях на грудной аорте — 4 U эритроцитарной массы, 4 U свежезамороженной плазмы, 3-5 U тромбоцитарной массы. Рассматривают возможность до- и интраоперационного аутодонорства.
Функциональ- ные пробы печени При недостаточности митрального и трикуспидального клапанов, инфекционном эндокардите возможно повышение уровня билирубина; уровень трансаминаз повышен при ЗСН. Исключают вирусные гепатиты
Рентгенограм- ма органов грудной клетки Проводят для сравнительного мониторинга со снимками в послеоперационном периоде
ЭКГ (12 отве- дений) Проводят в течение 24-48 ч до операции (!) для сравнительного мониторинга в послеоперационный период
ЭхоКГ Обращают внимание на объем и фракцию выброса левого желудочка, нарушение сократимости желудочков, градиенты на клапанах сердца, недостаточность клапанов сердца, наличие отложений кальция в структурах сердца, вегетаций на клапанах, тромбов в полостях сердца, аневризм левого желудочка
Ангиографи- ческие иссле- дования (ко- ронарогра- фия, вентри- кулография ит. д.) Обращают внимание на наличие значимых стенозов коронарных артерий и показатели давления в полостях сердца
298
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕКАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Как правило, кардиохирургические больные перед операцией продолжают
получать плановую кардиальную терапию — нитраты, 0-блокаторы, антагонисты
кальциевых каналов и т. д., что обеспечивает стабильное состояние во время опе-
рации, тем не менее, анестезиолог вправе внести некоторые изменения в плано-
вую терапию (табл. 15.7).
Таблица 15.7. Препараты для плановой кардиальной терапии
в дооперационный период
Препарат или группа Комментарий
f-блокаторы Уменьшают риск периоперационной ишемии миокарда и артериальной гипертензии. Не подлежат отмене перед операцией
Нитраты Не подлежат отмене перед операцией
Ингибиторы АПФ Отменяют или уменьшают дозу за 24-48 ч перед операцией
Блокаторы кальциевых каналов Не подлежат отмене перед операцией
Аспирин Отменяют за 7—8 дней перед плановой операцией. При неотлож- ных вмешательствах проводят тщательный хирургический гемостаз, применяют аминокапроновую кислоту или апротинин. Назначают в послеоперационный период при АКШ
Непрямые антикоагулянты Проводят тщательный биохимический мониторинг системы гемостаза, планово назначают после протезирования клапанов сердца, при нарушениях гемостаза применяют свежезамороженную плазму
Гепарин Назначают при тромбоэмболии и нестабильной стенокардии, при продолжительном использовании возможна тромбоцитопения
Клопидогрель, тиклопидин Предотвращают АДФ-индуцированную агрегацию тромбоцитов. Антитромботическая активность длится 7—10 дней. Отменяют за 10-14 дней перед операцией
Продолжение плановой терапии позволяет избежать назначения значитель-
ных доз седативных средств для премедикации. В ИХТ АМН Украины в течение
предыдущих 5 лет и на современном этапе успешно используют следующую схему
премедикации: диазепам 5—10 мг перорально или 10 мг внутримышечно вечером
накануне операции; за 30 мин до начала общей анестезии — диазепам 10 мг и
омнопон 20 мг (морфин 10 мг) внутримышечно; у больных с “язвенным анамне-
зом” назначают Н,-блокаторы (фамотидин 20 мг вечером накануне операции и за
30-60 мин до начала общей анестезии).
Кардиохирургическим больным проводят антибиотикопрофилактику с целью
предупреждения развития инфекции по общепринятым в хирургии правилам: эф-
фективной концентрации антибиотика в операционной ране достигают к началу
операции и сохраняют в течение операции, при этом внутривенное введение ан-
тибиотика осуществляют за 30—40 мин до начала операции.
При операциях на сердце антибиотикопрофилактику прекращают после уда-
ления внутригрудных дренажей
299
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Схема антибиотикопрофилактики практически не изменилась в течение пре-
дыдущих 2—3 лет (табл. 15.8). Пациентам после кардиохирургических операций
показана профилактика бактериального эндокардита [8].
Таблица 15.8. Антибиотикопрофилактика при кардиохирургических вмешательствах
Операция Рекомендуемый препарат Предоперационная доза для взрослого, г
АКШ, имплантация искусственного кла- пана, искусственный водитель ритма, ангиопластика и стентирование коронарных артерий Цефазолин 2,0 внутривенно
Цефуроксим 1,5 внутривенно
Ванкомицин (при подозрении на наличие метициллин-резистентного стафилококка) 1,0 внутривенно
Пересадка сердца Ампициллин/сульб актам 3,0 внутривенно 3 раза в день, прекращают после удаления внутригрудных дренажей
15.5. ИНТРАОПЕРАЦИОННЫЙ МОНИТОРИНГ
При проведении кардиохирургических операций проводят стан-
дартный мониторинг ЧСС, АД, ЭКГ, ЭхоКГ, ЦВД, ДЗЛА, пульсоксиметрии, кап-
нографии, диуреза, температуры тела, биохимических показателей, операционной
раны (см. раздел 9.2).
ЭКГ. Проводят непрерывный мониторинг II и V5 отведений (наиболее ин-
формативен для раннего выявления ЭКГ-признаков ишемии миокарда левого
желудочка).
АД. Используют инвазивный мониторинг АД, при этом катетер чаще устанав-
ливают в левую лучевую артерию (у правшей); возможна катетеризация локтевой
и бедренной артерий. Некоторые авторы рекомендуют проведение теста Аллена
для определения коллатерального кровотока.
ЦВД. Измерение осуществляют через катетер, введенный в какую-либо цент-
ральную вену, например внутреннюю яремную, бедренную, подключичную.
ДЗЛА. Измерение проводят через катетер, введенный в легочную артерию. По
данным различных авторов измерение ДЗЛА показано при фракции выброса ле-
вого желудочка менее 40 %. Решение о необходимости постановки катетера анес-
тезиолог принимает совместно с кардиохирургом.
Данные измерений позволяют составить представление о гемодинамическом
профиле пациента в реальном режиме времени: мониторинг ДЛА и ДЗЛА позволяет
судить о преднагрузке на левый желудочек и немедленно реагировать на изменения
параметров системной гемодинамики; также с помощью катетера измеряют сердеч-
ный выброс методом термодилюции. К сожалению, метод не лишен недостатков. В
литературе описаны случаи травмирования легочной артерии и легочные кровоте-
чения. Катетер во время ИК подтягивают на 2—3 см; необходимо помнить, что при
гипотермии катетер становится жестким, поэтому возможна травма легочной арте-
рии. Появились новые мало- и неинвазивные методы определения СИ.
300
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Диурез. Кроме количественной оценки диуреза, обращают внимание на цвет
мочи. Появление “розовой” мочи свидетельствует о внутрисосудистом гемолизе
(в результате трансфузионных осложнений) или механической травме эритроци-
тов при ИК.
Температура тела. Измеряют температуру в пищеводе и носоглотке, при этом
температурный датчик находится в оксигенаторе, что позволяет измерять темпе-
ратуру крови. Этого же достигают, располагая катетер в легочной артерии. Изме-
рение температуры в нескольких местах позволяет при необходимости равномер-
но охлаждать/согревать больного без выраженных температурных градиентов. Тем-
пература в носоглотке соответствует температуре головного мозга и служит
ориентиром при глубокой гипотермии (до 18 °C). Во время проведения кардио-
плегической защиты миокарда измеряют его температуру.
Биохимические показатели. Проводят мониторинг газов крови (артериальной
и смешанной венозной), электролитов (особенно К* и Са+*), уровня гемоглобина,
гематокрита, глюкозы, общего белка. Особое внимание уделяют показателям ге-
мостаза, в частности — активированному времени свертывания.
ЭхоКГ. Чреспищеводный или эпикардиальный методы ЭхоКГ позволяет выя-
вить структурные изменения в сердце, например недостаточность клапанов, и
провести дополнительную коррекцию в течение операции.
Визуальный мониторинг операционной раны. Для опытного анестезиолога этот
метод наиболее информативен, так как вскрытая полость перикарда позволяет
получить исчерпывающую информацию о больном: экскурсии легких и цвет опе-
рационной раны свидетельствуют об адекватности вентиляции, работа сердца дает
информацию о сократимости, ритме, волемии и т. д.
15.6. ИСКУССТВЕННОЕ КРОВООБРАЩЕНИЕ
Искусственное кровообращение (ИК) — метод, с помощью кото-
рого главные функции сердца и легких временно заменяют механической систе-
мой для поддержания жизни больного во время оперативного вмешательства на
сердце или легких. Самый простой аппарат искусственного кровообращения (АИК)
состоит из насосного устройства, при помощи которого кровь поступает в орга-
низм больного, и оксигенатора, в котором происходит газообмен. Все современ-
ные системы снабжены теплообменником — устройством, с помощью которого
изменяют температуру крови в оксигенаторе, что позволяет регулировать темпе-
ратуру тела больного.
Цель ИК — транспортирование крови (доставка кислорода и удаление углекис-
лого газа) к органам и тканям организма для поддержания жизнедеятельности во
время операции. Дополнительно контролируют показатели pH крови, температуру
крови, гематокрита, онкотического давления, электролитного состава, глюкозы крови.
Использование АИК при операциях на сердце в начале 1950-х годов приводило
к тяжелым осложнениям и высокой смертности. По мере усовершенствования ма-
териалов и методов ИК операции на открытом сердце стали более безопасными
(рис. 15.1).
Перед началом ИК хирург вводит катетеры в аорту (иногда — бедренную
артерию), верхнюю и нижнюю полые вены, иногда правое предсердие. В боль-
шинстве случаев артериальный катетер вводят в восходящую часть аорты (для
доступа к артериальной системе используют любую артерию среднего или боль-
301
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 15.1. Главные компоненты контура АИК: насос (чаще роликовый), оксигенатор (для
обеспечения газообмена), венозный резервуар (для временного сохранения крови, собран-
ной из полостей сердца и магистральных вен), система трубок и катетеров для транспорти-
ровки крови от больного к оксигенатору и от оксигенатора к больному, теплообменник,
фильтры крови
шого диаметра). Артериальную кровь возвращают к больному из оксигенатора
через артериальный катетер, венозную кровь (под действием силы тяжести) — от
больного в оксигенатор — через венозные катетеры в венозный резервуар. Веноз-
ные катетеры должны быть большого диаметра, чтобы сопротивление кровотоку
было минимальным. Для дренирования крови от больного в оксигенатор исполь-
зуют активную аспирацию, но она способствует лизису эритроцитов и белка.
Из венозного резервуара кровь поступает в оксигенатор, где происходит газо-
обмен. Кровь, аспирируемая из операционной раны кардиотомическими аспирато-
рами, также поступает в венозный резервуар. Кардиотомические аспираторы (отсо-
сы) — это система трубок, через которые кровь активно отсасывают в венозный
резервуар с помощью роликовых насосов. Ток крови, насыщенной кислородом в
оксигенаторе и возвращаемой к больному через артериальный катетер, чаще всего
обеспечивают роликовым насосом, головка которого во время вращательного дви-
жения сжимает содержащую кровь трубку и проталкивает ее по направлению к
аорте. В некоторых системах ИК насос располагают проксимальнее оксигенатора.
15.6.1. Методика проведения
После введения в наркоз и обработки операционного поля прово-
дят срединную стернотомию, потом перикардиотомию. Накладывают кисетные
швы в местах планируемой катетеризации артерии и системных вен. С целью
предотвращения тромбоза катетеров, систем трубок и оксигенатора вводят гепа-
302
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
рин в дозе 3 мг/кг, или 300 ЕД/кг. После подтверждения результатов гепариниза-
ции по показателю активированного времени свертывания (АВС, в норме 80—120 с,
при проведении ИК достаточно более 480 с) вводят артериальный и венозные
катетеры. Катетеры заполняют кровью больного, освобождают от воздуха и соеди-
няют с системами трубок, которые идут к оксигенатору.
ИК начинают со снятия зажимов на венозных магистралях и включения арте-
риального насоса, нагнетающего кровь от оксигенатора к больному. В течение
первой минуты к организму больного поступает раствор первичного заполнения —
жидкости, содержащейся в артериальной магистрали и оксигенаторе. Если не воз-
никли проблемы с забором венозной крови от больного, работой оксигенатора и
возвращением артериальной крови к больному, начинают охлаждение больного,
при этом обращают внимание на уровень ЦВД с целью предупреждения наруше-
ния венозного оттока по верхней полой вене. В большинстве случаев применяют
умеренную (иногда глубокую) гипотермию. После выхода на полную производи-
тельность АЙК турникетами обжимают полые вены вокруг катетеров, что препят-
ствует попаданию воздуха в венозную магистраль АИК. Обжимание полых вен
необходимо также для того, чтобы вся венозная кровь (за исключением крови из
коронарного синуса) поступала в оксигенатор (полное ИК). После этого прекра-
щают ИВЛ, так как легкие не принимают участие в газообмене.
В большинстве случаев во время внутрисердечных манипуляций хирурги ис-
пользуют временную ишемию миокарда: накладывают зажим на аорту между ме-
стом введения артериального катетера и корнем аорты, где венечные артерии вы-
ходят из синусов аорты. Для защиты миокарда в течение индуцируемой ишемии и
создания комфортных условий для работы хирурга, применяют холодовую хими-
ческую остановку сердца. Таким способом прекращают его механическую дея-
тельность. Для остановки сердца вводят кардиоплегический раствор через катетер
малого диаметра, введенный между аортальным клапаном и зажимом на аорте.
Внутрисердечную коррекцию выполняют на охлажденном остановленном сер-
дце. В большинстве кардиохирургических центров для кардиоплегии используют
официнальные растворы, например St. Thomas Hospital или “Консол” российского
производства, которые охлаждают до 6—8 °C. Сердце охлаждают за счет введения
этих растворов в корень аорты и далее по коронарным сосудам. При планируемой
длительной ишемии миокарда используют растворы, которые применяют в транс-
плантологии, например Custadiol или UW solution (раствор университета штата Вис-
консин), а также так называемый раствор “кровяной кардиоплегии”. Использова-
ние “домашних” рецептур кардиоплегических растворов в настоящее время нео-
правдано. Кардиоплегический раствор вводят антеградно (в корень аорты или устья
коронарных сосудов) или в коронарный синус (под значительно меньшим давлени-
ем по сравнению с давлением при антероградной кардиоплегии).
Во время полного ИК определенное количество крови поступает в полости
левого предсердия. Это кровь, которая поступает в легкие через бронхиальные
артерии, а из легких — через бронхиальнолегочные шунты и легочные вены в
левое предсердие. Чтобы не допустить попадания этой крови в операционное поле
и предотвратить перерастяжение сердца, дренируют левые отделы сердца. Катетер
для дренажа вводят в левое предсердие и проводят в левый желудочек через мит-
ральный клапан. В некоторых случаях применяют полную остановку кровообра-
щения. Глубокая гипотермия (менее 18 °C) повышает безопасность периода об-
щей ишемии тела — это методика глубокой гипотермии с полной остановкой
кровообращения.
303
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Во время манипуляций на левых отделах сердца или дренирования левого
желудочка катетером в полость левого желудочка или предсердия каждый раз по-
падает воздух. После завершения операции и возобновления сокращений сердца
воздух может попасть в большой круг кровообращения и привести к фатальным
последствиям, поэтому его удаляют из левых отделов сердца до возобновления
сердечных сокращений. Воздух удаляют заполнением сердца изотоническим ра-
створом натрия хлорида, перфузатом через катетер (дренаж) левых отделов сердца
или кровью из бронхиальных артерий. Воздух, который содержится в левых каме-
рах сердца, после возобновления сокращений выводят также через отверстие в
восходящей части аорты, проксимально от аортального зажима (в месте введения
катетера для кардиоплегии). После снятия турникетов вокруг катетеров полых вен
заполняют правые отделы сердца и герметизируют сердечные полости, венозные
катетеры подтягивают в правое предсердие.
Как только внутрисердечный этап операции закончен, воздух удален и поло-
сти сердца герметизированы, снимают зажим с аорты и возобновляют коронар-
ный кровоток. Кровь вымывает кардиоплегический раствор из венечного русла.
Чаще всего сердце начинает сокращаться спонтанно. Если вместо сокращений
сердца наблюдают фибрилляцию желудочков, то проводят дефибрилляцию. Пос-
ле восстановления полноценного сердечного выброса сердце и АИК работают
параллельно. Кровь, проходящую через оксигенатор во время параллельного ИК,
нагревают и таким способом температуру тела больного повышают до нормально-
го уровня.
После возобновления сокращений сердца начинают проведение ИВЛ. ИК
прекращают при температуре тела 35—36 °C, визуально хорошей сократимости
миокарда с обеспечением надлежащего уровня АД. Процесс выхода из ИК заклю-
чается в уменьшении объемной скорости перфузии с одновременным уменьшени-
ем венозного возврата в оксигенатор. Это вызывает увеличение объемной нагруз-
ки на миокард. Функцию сердца во время заполнения необходимым объемом крови
оценивают визуально, определяют АД и давление в предсердиях. При нормализа-
ции всех показателей АИК выключают. На этом этапе системное и легочное кро-
вообращения обеспечиваются сердцем больного, а оксигенация зависит от функ-
циональной способности системы дыхания. После подтверждения стабильности
адекватной гемодинамики и оксигенации катетеры из магистральных сосудов уда-
ляют, места катетеризации герметизируют. Гепарин нейтрализуют внутривенным
введением протамина сульфата. Соотношение гепарин/протамин сульфат состав-
ляет 1:1 или 1:1,5, например, для нейтрализации 21 000 ЕД гепарина (210 мг)
вводят 210—315 мг протамина сульфата. Качество нейтрализации контролируют,
определяя показатель АВС.
15.6.2. Физиологические эффекты,
профилактика осложнений
Кровообращение. Перекачивание крови роликовыми насосами из
оксигенатора в русло крови больного существенно отличается от физиологичес-
кого кровообращения. Форма волны АД при ИК не имеет больших колебаний;
разница между максимальным и минимальным давлением составляет 5—10 мм рт. ст.,
то есть кровоток при ИК практически непульсирующий. Известно, что пульсиру-
ющий кровоток лучше обеспечивает перфузию тканей, способствует снижению
304
15, АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
ОПСС и меньшему накоплению внеклеточной жидкости, особенно в период сни-
женной объемной скорости перфузии.
В начале процесса ИК из-за исходной гемодилюции ОПСС снижается, а за-
тем прогрессивно повышается выше начального уровня. Почки на непульсирую-
щий кровоток отвечают увеличением продукции ренина, что также вызывает по-
вышение ОПСС. У взрослых больных во время ИК увеличивается симпатический
тонус в связи с выбросом надпочечниками адреналина. Объемная скорость пер-
фузии почти всегда равняется МОК анестезированного больного, но производи-
тельность артериального насоса не должна превышать венозный возврат, иначе
это приводит к опорожнению оксигенатора и попаданию воздуха в сосудистое
русло больного.
Регулируют объемную скорость перфузии за счет поддержания достаточного
уровня крови в венозном резервуаре. Для точной регуляции системы необходим
постоянный контакт между перфузиологом и хирургом. Незначительное измене-
ние положения венозного катетера может привести к значительному уменьшению
венозного возврата и вызвать снижение уровня крови в оксигенаторе. Для ком-
пенсации потерь жидкости в течение ИК (в том числе из-за диуреза и задержки
воды в тканях) и поддержки адекватного уровня перфузата в оксигенаторе перфу-
зиолог добавляет в контур ИК кристаллоидные растворы или кровь. В большин-
стве систем ИК кровь из операционной раны также возвращается в контур ИК
через систему кардиотомических аспираторов.
Основным параметром регуляции ИК является объемная скорость перфузии,
а не перфузионное давление. Для повышения АД лекарственные средства исполь-
зуют редко. Чтоб улучшить перфузию тканей и обеспечить равномерность охлаж-
дения перед полной остановкой кровообращения, применяют а-адренергическую
блокаду фентоламином (0,1 мг/кг) или используют вазодилататоры, например
нитропруссид натрия.
Дыхание. Поступление в кровь кислорода и удаление углекислого газа проис-
ходит через оксигенатор. Обмен происходит между газовой смесью, которую по-
дают в оксигенатор, и газами крови, которая поступает в оксигенатор. В старых
моделях оксигенаторов (например, пузырьковых или дисковых) контакт между
кровью и газовой смесью был прямым. Количество кислорода, поступавшего в
кровь, и количество изъятого углекислого газа зависели как от состава газовой
смеси, подаваемой в оксигенатор, так и от производительности АЙК. Большие
потоки газовой смеси для адекватной оксигенации приводили к удалению боль-
шого количества СО,, поэтому в смесь добавляли углекислый газ для регуляции
его уровня в крови. В современных оксигенаторах тонкостенные мембраны рас-
положены между газом и кровью (мембранные оксигенаторы). Этим достигают
уменьшение вредного прямого влияния газовой смеси на белки плазмы и клетки
крови. Характеристики газообмена зависят от типа оксигенатора и приведены в
сопроводительной документации к АИК.
Дыхание на клеточном уровне во время ИК зависит от нескольких парамет-
ров. При ИК в условиях нормотермии обшее потребление кислорода организмом
связано со скоростью перфузии. Для обеспечения потребления кислорода на уровне
110-130 мл/(мин х м2), производительность АИК (перфузионный индекс) должна
быть, по крайней мере, 2 л/(мин х м2). Если перфузионный индекс меньше, то к
тканям поступает недостаточное количество кислорода, что приводит к развитию
метаболического ацидоза. Потребление кислорода уменьшается при снижении
температуры тела. Для оптимизации проведения операций большинство хирургов
305
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
используют умеренную гипотермию. При достижении температуры тела 25 °C про-
изводительность АИК уменьшают. Глубокую гипотермию (менее 20 °C) с полной
остановкой кровообращения применяют в случаях коррекции некоторых видов
пороков у новорожденных и детей первого года жизни, а также при операциях на
дуге аорты.
Проблема регуляции газообмена крови и показателей pH и рСО, в условиях
гипотермии остается нерешенной. Используют две стратегии — pH-stat и альфа-stat.
При стратегии pH-stat показатели рСО2 и pH крови в течение гипотермии
(20 °C) поддерживают на уровне 40 мм рт. ст. и 7,4 соответственно, независимо от
снижения температуры тела.
Используя стратегию альфа-stat, охлажденная кровь должна иметь значения
рСО2 = 40 мм рт. ст. и pH = 7,4 при восстановлении ее стандартных характеристик
при температуре 37 °C и нормальном атмосферном давлении. Например, при за-
боре крови при температуре 25 °C и помещении ее в стандартные условия газоана-
лизатора при температуре 37 °C актуальное значение рСО2 с поправкой на темпе-
ратуру тела будет составлять 23 мм рт. ст., а значение pH, которое при стандарт-
ных условиях составляет 7,4, для больного при 20 °C будет составлять 7,6. При
альфа-stat такие значения при температуре 25 °C считают нормальными.
В литературе результаты сравнения потребления кислорода у взрослых при
стратегиях альфа-stat и pH-stat противоречивы. Вопрос о том, какая из стратегий
является оптимальной, остается открытым, но большинство авторов предпочита-
ют стратегию альфа-stat.
Температура тела. Защитное действие гипотермии на ткани в условиях умень-
шенного или остановленного кровотока впервые в условиях экспериментальной
хирургии сердца исследовали в 1950-х годах. При низкой температуре уменьша-
ются метаболические потребности тканей, чем и обусловлен механизм гипотер-
мической защиты тканей в условиях ишемии.
Полная остановка кровообращения обеспечивает идеальные условия для внут-
рисердечной коррекции у новорожденных и детей первого года жизни. При этом
для ИК используют один аортальный и один венозный катетер, который вводят в
правое предсердие; перфузат охлаждают до 25 °C.
Охлаждение больного проводят во время ИК, хотя некоторое снижение тем-
пературы происходит до начала ИК, после индукции в наркоз. Дополнительное
охлаждение проводят с помощью водяного матраса. Охлаждение во время ИК
продолжают в течение 10—15 мин, при этом температуру в носоглотке и прямой
кишке снижают до 20 °C и менее. Внешнее охлаждение продолжают и при полной
остановке кровообращения.
Одним из негативных последствий гипотермии является секвестрация жидко-
сти в тканях. Этот феномен наблюдают даже в случаях, когда ИК не применяют, а
проводят только внешнее охлаждение. В таких ситуациях возникают проблемы при
отлучении больного от ИВЛ из-за значительного отека тканей грудной клетки и
всего тела. Назначение мочегонных средств способствует исчезновению отеков че-
рез 1—3 суток и дает возможность перевести больного на самостоятельное дыхание.
Прекращение кровообращения. После пережатия аорты и введения кардиопле-
гического раствора АИК выключают, всю кровь больного дренируют из оксигена-
тора через венозную магистраль. При необходимости удаляют артериальный кате-
тер. Перед вскрытием полостей сердца для предотвращения попадания воздуха в
эту область пережимают венозную магистраль и удаляют венозный катетер. Про-
водят коррекцию порока. После завершения основной коррекции сердце герме-
306
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
тизируют, в полость правого предсердия вводят венозный катетер, катетеризиру-
ют аорту, если произошла декатетеризация.
Длительность полного прекращения кровообращения можно сократить. Для
этого ИК начинают с малой объемной скоростью (50 мл/кг/мин), используя кровь,
которую аспирировали кардиотомическими аспираторами. При использовании спе-
циальных венозных катетеров с металлическими наконечниками, согнутыми под
прямым углом и введенными непосредственно в верхнюю и нижнюю полые вены,
возможна визуализация внутрисердечных структур без полной остановки кровооб-
ращения. По необходимости снижают до минимума объемную скорость перфузии
или на некоторое время прекращают ее с возобновлением ИК в любой момент.
Полная остановка кровообращения, безусловно, необходима в случаях рекон-
струкции дуги аорты. Все другие виды операций выполняют без остановки крово-
обращения. Некоторые хирурги применяют методику полного прекращения кро-
вообращения только в случаях, когда это крайне необходимо, другие — применя-
ют этот метод достаточно широко и работают в “идеальных” условиях — бескровном
операционном поле и неподвижном сердце.
После герметизации полостей сердца кровообращение возобновляют и согре-
вают пациента с соблюдением адекватного температурного градиента: температу-
ра воды в теплообменнике не должна превышать температуру крови больного
более чем на 10 °C. Такой режим согревания предотвращает десатурацию раство-
ренных в крови газов.
Длительность безопасного периода полного прекращения кровообращения при
температуре 18—20 °C составляет 40—45 мин. Исследования при операциях с при-
менением полного прекращения кровообращения показали, что от длительности
полной остановки кровообращения зависит возникновение послеоперационных
судорог. Раннее возникновение судорог также коррелирует с ухудшением показа-
телей интеллекта через некоторое время после операции. В литературе сообщают
о невысокой частоте неврологических осложнений (5—15 %) после полной оста-
новки кровообращения, но мозговой кровоток после операций с полной останов-
кой кровообращения возобновляется значительно хуже по сравнению с больны-
ми, у которых этот метод не применяли.
Гемодилюция. В процессе ИК широко используют гемодилюцию: во-первых,
при гипотермии увеличивается вязкость крови, что способствует повышению со-
противления кровотока, особенно в микроциркуляторном русле. Когда этот фак-
тор сочетается с непульсирующим кровотоком во время ИК, возникают суще-
ственные нарушения микроциркуляции, что приводит к ишемии тканей. Гемоди-
люция прерывает эту патофизиологическую последовательность. Во-вторых, при
гемодилюции уменьшается травмирование клеток крови, приводящей к гемолизу
и выходу физиологически активных веществ. В-третьих, снижается потребность в
использовании донорской крови и ее препаратов для первичного заполнения АИК.
Оптимального значения гематокрита в процессе ИК — 20—25 % — достигают пу-
тем применения сбалансированных кристаллоидных растворов (pH = 7,4) и до-
бавления крови или эритроцитарной массы к перфузату.
Электролитный состав и уровень глюкозы в крови поддерживают в пределах
нормы за исключением нескольких случаев: а) при ишемии повышенный уровень
глюкозы негативно влияет на ткани головного мозга, поэтому используют перфу-
зат без глюкозы, особенно когда планируют полную остановку кровообращения;
б) аккумуляция внутриклеточного кальция повышает метаболические потребнос-
307
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ти во время ишемии, поэтому уровень кальция уменьшают до или после возник-
новения ишемии (создают гипокальциемию в течение охлаждения, особенно у
новорожденных, путем введения раствора первичного заполнения, свободного от
кальция), при этом уровень кальция корректируют в течение согревания после
возобновления венечного кровотока незадолго до окончания ИК.
Медикаментозное обеспечение. Поскольку ИК не является физиологичным со-
стоянием, для коррекции его неблагоприятных воздействий применяют различ-
ные лекарственные средства. Самый неблагоприятный эффект ИК — это наруше-
ние баланса свертывающей и противосвертывающей систем крови. Для предотв-
ращения тромбообразования до начала ИК вводят гепарин, который активирует
антитромбин III. Начинают ИК только после удовлетворительных результатов
коагуляционных тестов (АВС).
ИК влияет на функции тромбоцитов и их количество. Некоторые авторы пред-
лагают введение ингибиторов функции тромбоцитов во время ИК — дипиридамо-
ла, простациклина и т. д., но эти средства производят выраженный сосудорасши-
ряющий эффект, что способствует снижению перфузионного давления. По завер-
шении ИК эффект гепарина нейтрализуют введением протамина сульфата, тем не
менее проблемы с гемостазом остаются. ИК активизирует общую воспалительную
реакцию организма, обусловленную контактом крови с поверхностью контура АИК,
активизируются каликреин-кининовая система и активированный комплемент.
Во время ИК также разрушаются гранулоциты, что сопровождается выбросом
продуктов перекисного окисления. Чтобы избежать подобных реакций, в перфу-
зат добавляют кортикостероиды, которые оказывают благоприятное действие у
больных с низким показателем МОК после операций с использованием ИК.
Маннитол, который используют для осмодиуреза, нейтрализует продукты пе-
рекисного окисления, поэтому его вводят перед периодом ишемии и после возоб-
новления кровотока. Для уменьшения ОПСС применяют периферические вазоди-
лататоры, например фентоламин или натрия нитропруссид.
Обеспечение анестезии. Поддержание анестезии в процессе ИК проводят ин-
галяционными и внутривенными анестетиками. Для проведения ингаляционной
анестезии предусмотрено легкое монтирование испарителя в контур АИК. В тече-
ние ИК обязательно применяют наркотические аналгетики и миорелаксанты.
Фармакокинетика изофлюрана, пропофола и фентанила во время ИК несколько
отличается от обычной по причине значительной чужеродной поверхности окси-
генаторов, фильтров, магистралей и за счет перераспределения препаратов в орга-
низме (см. раздел 15.3).
15.7. ТИПИЧНЫЕ ПРОТОКОЛЫ ПРОВЕДЕНИЯ
АНЕСТЕЗИОЛОГИЧЕСКИХ ПОСОБИЙ ПРИ
КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВАХ У ВЗРОСЛЫХ
Основные этапы кардиохирургического вмешательства: подготов-
ка к анестезии и сосудистым доступам, индукция в анестезию, предперфузион-
ный период (стернотомия, перикардиотомия, манипуляции на сердце и магист-
ральных сосудах, канюляция), перфузионный период, выход из перфузии, окон-
чание операции, транспортирование из операционной в ОИТ, ранний
послеоперационный период.
308
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
15.7.1. Операция аортокоронарного шунтирования
В настоящее время операции аортокоронарного шунтирования
(АКШ, реваскуляризация миокарда) в Украине выполняют с приемлемым миро-
вым уровнем ранней послеоперационной летальности: у пациентов с низким рис-
ком послеоперационных осложнений летальность составляет менее 1 %, у паци-
ентов со сниженной сократительной функцией левого желудочка (фракция выб-
роса менее 30 %) и выраженной сопутствующей патологией летальность несколько
больше.
Дооперационное обследование при АКШ не отличается от стандартного в
кардиохирургии. Основная задача анестезиолога в периоперационном периоде —
обеспечить наиболее оптимальную работу миокарда с максимальной возможнос-
тью увеличения доставки кислорода и минимальной возможностью увеличения
потребления миокардом кислорода. Предоперационная кардиальная терапия
ф-блокаторы и нитропрепараты) и седативные препараты во время премедикации
обеспечивают стабильное, без выраженных гемодинамических нарушений, состо-
яние пациента в операционной.
В операционной обеспечивают мониторинг ЧСС, АД (неинвазивным мето-
дом), ЭКГ, пульсоксиметрии. Проводят венепункцию катетером 16—18 G и арте-
риопункцию под местной анестезией катетером 20 G (левой лучевой артерии у
правшей). После преоксигенации начинают индукцию в наркоз, при этом подбор
препаратов проводят индивидуально в зависимости от состояния и сопутствую-
щих заболеваний пациента. Например, возможна комбинация диазепама (10 мг) с
последующим введением тиопентал-натрия (200 мг), пропофола (3—5 мг/кг), ком-
бинация диазепама (10 мг) с кетамином (1—2 мг/кг) у больных со сниженной,
фракцией левого желудочка. Затем вводят 100—200 мкг фентанила (для предотвра-
щения выраженных гемодинамических нарушений во время интубации) и мы-
шечные релаксанты (рокурониум, векурониум или пипекурониум). Сукцинилхо-
лин для миорелаксации практически не используют.
Проводят интубацию трахеи, после чего анестезию продолжают изофлюра-
ном или пропофолом (5—7 мг/кг/мин) с введением дополнительных доз фентани-
ла перед разрезом кожи. По необходимости используют нитроглицерин внутри-
венно (0,5-1—2 мкг/кг/мин). Гипотензию, которая может развиться на любом этапе
до введения в ИК, купируют переливанием коллоидов при низких показателях
ЦВД и хорошей сократимости миокарда. При необходимости применяют фени-
лэфрин (мезатон) с целью увеличения диастолического давления.
При наложении периферических сосудистых анастомозов проводят кардио-
плегическую остановку сердца (особенно при сочетании АКШ с протезированием
какого-либо клапана) либо фибрилляцию желудочков с кратковременной ишеми-
ей миокарда. Фибрилляция предпочтительнее по сравнению с кардиоплегичес-
ким методом защиты: она позволяет сохранить миокардиальные запасы АТФ.
По окончании ИК анестезиолог и оперирующий хирург оптимизируют сердеч-
ный выброс с учетом показателей давления в левом предсердии. Оптимальные по-
казатели давления в левом предсердии при нормальной функции левого желудоч-
ка составляют 10—12 мм рт. ст., при сниженной фракции выброса — 15—20 мм рт. ст.,
оптимальный показатель ЧСС в течение первых 2—3 ч после ИК — около 90 уд./мин.
При необходимости подбирают дозы симпатомиметиков и вазодилататоров. При
использовании артериальных анастомозов для шунтирования, в частности внут-
ренней грудной артерии, обязательно применяют вазодилататоры — желательно
309
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
нифидипин (“Адалат”) или нитроглицерин (1,5—2 мкг/кг/мин). Без длительного
использования вазодилататоров возможно развитие выраженного спазма шунта,
что может привести к ишемии миокарда и серьезным нарушениям системной
гемодинамики — выраженной гипотензии, стойким нарушениям ритма.
АКШ без использования ИК. В настоящее время операции АКШ без ИК заво-
евали определенную популярность среди хирургов-кардиологов, так как при по-
добных операциях значительно снижается время проведения ИВЛ и пребывание
больного в ОИТ и стационаре. Частота послеоперационных инфарктов миокарда
и мерцательных аритмий у больных после стандартного АКШ и АКШ без ИК
существенно не отличаются. Отдаленные результаты проведения АКШ без ИК
(проходимость шунтов в течение длительного времени) пока отсутствуют.
Противопоказаниями к проведению АКШ без ИК являются: наличие тромбов
в полостях сердца, злокачественные желудочковые нарушения ритма, глубокое
расположение интрамуральных сосудов в миокарде, сочетанная патология (на-
пример, АКШ, протезирование клапана, резекции аневризмы левого желудочка).
Во время выполнения АКШ без ИК повышается риск развития острой ише-
мии миокарда и значительных нарушений системной гемодинамики в результате
нарушения насосной функции сердца. Эти драматические изменения обусловле-
ны техникой проведения подобных операций, созданием удобных для хирурга ус-
ловий наложения сосудистых анастомозов: при изменении положения верхушки
сердца предсердия располагаются ниже желудочков, что приводит к увеличению
давлений в предсердиях и требует поддержания большего, чем обычно ЦВД (ДЗЛА);
при подъеме верхушки сердца изменяется геометрия митрального и трикуспи-
дального клапанов, в результате механической компрессии боковой и передней
стенок сердца снижается сердечный выброс.
Показаниями к конверсии, то есть выполнению АКШ с ИК, являются изменения,
которые фиксируют в течение более 15 мин: снижение СИ менее 1,5 л/(мин х м2),
насыщение смешанной венозной крови менее 60 %, САД менее 50 мм рт. ст., подъем
сегмента S—T, злокачественные нарушения ритма, значительные участки наруше-
ния сократимости желудочков, плохой доступ к коронарной артерии.
15.7.2. Операции на клапанах сердца
Особенности гемодинамики при поражении клапанов сердца тре-
буют неукоснительного выполнения определенных условий во время операции,
особенно в предперфузионный период (табл. 15.9).
Обеспечение анестезии при протезировании клапанов сердца не отличается
от таковой при АКШ (учитывают индивидуальные особенности гемодинамики в
зависимости от порока). Перед выполнением внутрисердечных манипуляций на
клапане проводят кардиоплегию с целью защиты миокарда от ишемии.
Таблица 15.9. Гемодинамические параметры при операциях на клапанах сердца
Порок сердца ЧСС, уд./мин Преднагрузка Постнагрузка
Стеноз митрального клапана 60-80, желателен синусовый ритм Верхняя граница нормы Норма, избегают повышения легочного сосудистого сопротивления
310
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Продолжение табл. 15.9
Порок сердца ЧСС, уд./мин Преднагрузка Постнагрузка
Недостаточность митрального клапана 80-100 Норма Используют вазодилататоры (небольшие дозы) с целью уменьшения объема регургитации
Стеноз клапана аорты 60-80, жела- телен синусо- вый ритм Верхняя граница нормы Избегают снижения по причине резкого падения коронарного кровотока
Недостаточ- ность клапана аорты 80-100 Норма Используют вазодилататоры (небольшие дозы) с целью уменьшения объема регургитации
15.7.3. Повторные операции на сердце
Улучшение качества выполнения кардиохирургических вмеша-
тельств и преемственность наблюдения после операции создали условия для
увеличения количества пациентов, которые нуждаются в повторных операциях
на сердце — репротезировании клапанов, АКШ и т. д. Как правило, эти опера-
ции сопровождаются высоким риском по причине тяжелого исходного состоя-
ния пациентов из-за сочетанной кардиальной патологии. Вероятность значи-
тельной кровопотери в интра- и послеоперационном периодах обуславливает
применение кровосберегающих технологий и плановую заготовку препаратов
крови перед операцией (4 U эритроцитарной массы, 4 U свежезамороженной
плазмы, 3—5 U тромбоцитарной массы). У этих больных часто затруднена кате-
теризация вен и артерий (часто артериальный доступ обеспечивают через бед-
ренные сосуды, поэтому накануне операции обрабатывают места возможных
доступов. Перед началом операции предусматривают возможную необходимость
проведения ИК.
Наиболее опасные моменты операции — стернотомия и этап выделения сер-
дца от спаек. При возникновении массивного кровотечения вводят канюлю в бед-
ренную артерию и проводят И К. Рекомендуют применение апротинина.
15.7.4. Операции на аорте
Традиционно хирургическое лечение заболеваний восходящей и
грудной частей аорты проводят кардиохирурги. Основные патологические изме-
нения аорты, требующие хирургического (подчас неотложного) вмешательства:
расслоение, формирование аневризмы, разрыв, врожденные аномалии (коаркта-
ция, двойная дуга и т. д.).
Особенности проведения анестезиологического обеспечения при заболевани-
ях аорты зависят от индивидуальных анатомических характеристик — локализа-
ции и объема поражения, степени вовлечения в патологический процесс магист-
ральных сосудов и др.
Операции на восходящем отделе грудной аорты выполняют с целью протезиро-
вания аорты и аортального клапана с имплантацией коронарных артерий в протез.
311
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Современные сосудистые протезы позволяют проводить подобные операции с
минимальной кровопотерей. При выполнении операции возможно пережатие бра-
хиоцефального ствола, поэтому для мониторинга используют инвазивный метод
измерения АД с канюляцией левой лучевой артерии.
Операции на дуге аорты. Для проведения ИК чаще используют доступ через
бедренные артерии. С целью протекции головного мозга проводят глубокую ги-
потермию, во время проведения которой повышается риск развития коагулопа-
тических кровотечений. Использование ретроградной (через венозные сосуды)
перфузии головного мозга уменьшает, но не исключает риск возникновения пос-
леоперационной энцефалопатии с неврологическим дефицитом различной сте-
пени.
Операции на нисходящем отделе грудной аорты проводят с использованием ИК
и без него; хирургический доступ — левосторонняя торакотомия. Во время анес-
тезиологического обеспечения реконструкций нисходящей аорты сводят к мини-
муму нарушения функций дыхательной и сердечно-сосудистой систем, возникаю-
щих в результате нефизиологического положения пациента на операционном сто-
ле и пережатия проксимального отдела аорты. Для уменьшения травмирования
левого легкого проводят интубацию двухпросветной трубкой, так как возможны
эпизоды однолегочной вентиляции. Возможны трудности при интубации из-за
смещения трахеобронхиального дерева увеличенной аортой. Для прямого монито-
ринга АД проводят канюляцию правой лучевой артерии, так как во время опера-
ции возможно пережатие левой подключичной артерии. Операции на нисходящей
аорте связаны с высоким риском развития массивной кровопотери, послеопера-
ционной параплегии (в результате нарушения кровоснабжения спинного мозга),
ОПН (в результате нарушения перфузии почек или неадекватной инфузионной
терапии).
Пережатие проксимального отдела нисходящей аорты приводит к наруше-
нию дистального кровотока и повышению преднагрузки на левый желудочек.
Для поддержания дистального кровотока и декомпрессии левого желудочка при-
меняют: а) вазодилататоры во время пережатия аорты (метод прост и позволяет
контролировать артериальную гипертензию в проксимальных отделах аорты),
но избыточное применение вазодилататоров может привести к снижению кол-
латерального кровотока по дистальному отделу аорты; б) частичное ИК с ис-
пользованием оксигенации или частичное ИК без оксигенации, что обеспечи-
вает адекватную перфузию проксимального и дистального отделов аорты, воз-
можность реинфузии крови при массивной кровопотере и гипотермическую
защиту внутренних органов, особенно спинного мозга; в) временный силико-
новый шунт (метод позволяет сохранить кровоток в дистальной части аорты и
проводить декомпрессию проксимальных отделов без использования вазодила-
таторов).
Классификации расслоений аорты представлены в таблицах 15.10 и 15.11.
Неотложная хирургия показана при расслоениях аорты I и II типов, консер-
вативное лечение — при расслоении III типа. При проксимальных поражениях
аорты (I и II типы по DeBakey, тип А по Daily) возможно вовлечение в патологи-
ческий процесс кольца аортального клапана с последующим пролабированием
некоронарной створки аортального клапана в левый желудочек, что приводит к
выраженной аортальной недостаточности.
312
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Таблица 15.10. Классификация расслоений аорты по DeBakey
Тип Описание
I Разрыв интимы аорты расположен в восходящем отделе, расслоение распространяется на восходящий отдел, дугу и нисходящий отдел грудной аорты (проксимальное поражение)
П Разрыв интимы аорты расположен в восходящем отделе, расслоение ограничено восходящим отделом аорты (проксимальное поражение)
ш Разрыв интимы аорты расположен в нисходящем отделе (дистальное поражение)
Ш-А Расслоение распространяется проксимально с вовлечением восходящей аорты
Ш-В Расслоение ограничено нисходящим отделом аорты
Таблица 15.11. Классификация расслоений аорты по Daily
Тип Описание
А Расслоение с вовлечением восходящей аорты независимо от места разрыва (проксимальное поражение)
В Расслоение ограничено нисходящей аортой (дистальное поражение)
15.8. ТРАНСПОРТИРОВАНИЕ В ОИТ
ПОСЛЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
После завершения операции пациента переводят в ОИТ. Во вре-
мя транспортирования возрастает риск развития осложнений по причине необос-
нованного уменьшения объема мониторинга и субъективных факторов (усталости
персонала после продолжительной операции). Перед транспортированием прове-
ряют исправность автоматических устройств, обеспечивающих введение лекар-
ственных препаратов, наличие кислорода в баллоне, работу наружного электро-
кардиостимулятора, наличие медикаментов в шприцах (наркотических аналгети-
ков, гипнотиков, миорелаксантов, симпатомиметиков), обеспечивают необходимый
объем мониторинга ЭКГ, пульсоксиметрии и АД. Особое внимание уделяют кон-
тролю дренажей перикардиальной и грудной полостей.
'№!
При подозрении на массивное кровотечение после кардиохирургических
вмешательств все виды терапии, вплоть до ревизии полости перикарда,
лучше проводить в операционной
В ОИТ пациента подключают к аппарату ИВЛ и возобновляют полный гемо-
динамический мониторинг. Анестезиолог несет ответственность за обеспечение
ИВЛ и устанавливает параметры вентиляции, делает подробный доклад дежурно-
му врачу и медсестре ОИТ об особенностях операции и анестезиологического
обеспечения. Обсуждают вероятный план течения ближайшего послеоперацион-
ного периода (необходимость длительной гемодинамической поддержки, длитель-
313
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ной ИВЛ и т. п.). Желательно, чтобы пациента в течение первых послеоперацион-
ных суток обслуживала одна медсестра, а с высоким риском гемодинамических
расстройств — две.
15.9. РАННИЙ ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
Объем мониторинга у стабильных больных после кардиохирурги-
ческих вмешательств включает: ЭКГ, АД (инвазивным методом в течение первых
18—24 ч после операции), пульсоксиметрию, контроль ЦВД, температуры тела
(центральной и периферической), диуреза, количества экссудата из операцион-
ной раны; при необходимости — ДЗЛА, ДЛП, МОК и другие показатели. Регуляр-
но контролируют показатели газов в артериальной и венозной крови, электролит-
ный состав крови (К+, Na+, Са++, Mg++, СГ), глюкозу крови, содержание гемогло-
бина в крови и экссудате из грудной полости, показатели коагулограммы (АЧТВ,
протромбинового времени, протромбинового индекса, фибриногена, АВС, осо-
бенно в течение первых 3—6 ч после операции), количество тромбоцитов. Уровень
белка, мочевины и креатинина в крови определяют не реже 2 раз в сутки.
Инфузионно-трансфузионная терапия. После операции с использованием ИК
в течение первых 3—6 ч пациенты пребывают в состоянии относительной гипово-
лемии из-за действия вазодилататоров, продолжающегося согревания пациента,
послеоперационной аналгезии и седации, потери жидкости с экссудатом из пос-
леоперационной раны, выхода жидкости из сосудистого русла в результате синд-
рома “капиллярной утечки”. Дежурный врач оценивает жидкостный баланс паци-
ента и принимает решение о необходимости его коррекции. Признаки адекватного
сердечного выброса (“теплый, розовый” больной): удовлетворительная перифери-
ческая пульсация (проверяют на артериях стоп), диурез 1—2 мл/кг/ч без стимуля-
ции, отсутствие изменений показателей pH крови и BE ±2, САД > 80 мм рт. ст.,
отсутствие тахи- или брадикардии.
При снижении сердечного выброса в первую очередь исключают внесердеч-
ные причины; при снижении показателей ЦВД, ДЗЛА, ДЛП больному проводят
инфузионную терапию. Гемотрансфузию проводят, ориентируясь на показатели
гемоглобина и гематокрита. Уровень гемоглобина поддерживают не менее 80 г/л,
у больных с ИБС и миокардиальной недостаточностью — 100—110 г/л. По дости-
жении необходимых уровней гемоглобина и гематокрита продолжают введение
растворов коллоидов (препаратов желатина, гидроксиэтилкрахмалов), свежезамо-
роженной плазмы и тромбоконцентрата (при нарушениях гемостаза, ориентиру-
ясь на данные лабораторных исследований).
После стабилизации состояния через 3—4 ч после операции начинают плано-
вую инфузионную терапию. Учитывая значительный дрейф жидкости в “третье
пространство”, внутривенно вводят кристаллоидные растворы в зависимости от
времени после операции: 0—24 ч после операции — 750 мл/м2, 24—48 ч — 1000 мл/м2,
48—72 ч — 1000 мл/м2, через 72 ч — 1500 мл/м2. Не применяют значительное
количество физиологического раствора из-за задержки натрия в организме.
В результате осмодиуреза (после применения салуретиков) часто развивается
гипокалиемия. Поддержание оптимального уровня К+ в послеоперационный пе-
риод (4,5—5,0 ммоль/л) позволяет осуществлять профилактику аритмий. При раз-
витии аритмий обязательно контролируют уровень Mg++.
314
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
В течение первых часов после операций с использованием ИК часто развивается
метаболический ацидоз по причине низкого сердечного выброса в результате гипово-
лемии или миокардиальной недостаточности. Для коррекции КОС в таких случаях
стабилизируют сердечный выброс, используя при необходимости симпатомиметики
и вазодилататоры. Буферные растворы (4—5 % раствор натрия гидрокарбоната) при-
меняют редко. Метаболический алкалоз, как правило, развивается по причине ги-
покалиемии и метаболизма цитрата в результате переливания значительных доз
препаратов крови через 12—24 ч после операции. Нарушения дыхания — дыхатель-
ный ацидоз или алкалоз — возникают при неадекватных параметрах ИВЛ.
Контроль гемостаза, тактика при кровотечениях. Дренажи из полости пери-
карда и плевральных полостей присоединяют к источникам вакуума (до 5 кПа);
возможно применение 3-ампульной системы. Контролируют общий объем и темп
экссудации, содержание гемоглобина в экссудате, наличие сгустков и цвет экссу-
дата. Оценивают объем экссудации: умеренный — до 3 мл/кг/ч (не более 200 мл/ч),
выраженный — 3—5 мл/кг/ч (200—400 мл/ч), массивный — более 5 мл/кг/ч (более
400 мл/ч).
При выраженной экссудации проверяют наличие свободного гепарина в кро-
ви (по уровню АВС). У тучных больных может возникнуть необходимость повтор-
ного введения протамина сульфата даже при полной интраоперационной нейтра-
лизации гепарина по причине выхода ранее введенного гепарина из жировых депо.
При низких показателях гемостаза (АЧТВ, РТ, фибриногена) назначают свежеза-
мороженную плазму и тромбоконцентрат (при снижении уровня тромбоцитов).
Во многих хирургических клиниках в подобных случаях вводят апротинин, осо-
бенно при повторных операциях с ИК (начальная доза 2 000 000—4 000 000 ЕД
болюсно, затем — 500 000 ЕД/ч).
Показанием к повторному вмешательству (реторакотомии, реэксплорации)
является продолжающееся кровотечение (при нормальных показателях гемостаза)
с признаками тампонады перикарда (высокими показателями давлений наполне-
ния желудочков, левого и правого предсердий, ЦВД, системной гипотензии) или
нестабильной системной гемодинамикой.
Нарушения системной гемодинамики. Контролируют показатели МОК и СИ
(см. раздел 15.2) в течение первых двух суток после операции (см. табл. 15.12).
Приемлемы такие методы определения МОК: термодилюционный (также дает воз-
можность определить косвенные показатели преднагрузки на левый желудочек —
ДЗЛА), допплерографический, метод разведения индикаторов и т. д.
Таблица 15.12. Примерный алгоритм коррекции гемодинамических нарушений
у пациентов после операций на сердце
Гемодинамическая ситуация Примерная схема лечения Комментарий
САД| цвд! ДЛП(ДЗЛА)! чсс! Восполняют ОЦК коллоидами, эритроцитарной массой (при низком гемоглобине) или перфузатом Причина — гиповолемия
САДТ цвдТ ДЛП(ДЗЛА)Т ЧСС норма или 1 Назначают или увеличивают дозы вазодилататоров, диуретиков Причина — « перевосполнение » сосудистого объема
315
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 15.12
Гемодинамическая ситуация Примерная схема лечения Комментарий
САДТ ЦВД норма или 1 ДЛП (ДЗЛА) норма или 1 чссТ Исключают дыхательную гипоксию, проводят адекватное обезболивание
САД| цвдТ ДЛП (ДЗЛА) t чссТ Исключают тампонаду перикарда, пневмоторакс; корректируют дозы симпатомиметиков и вазодилататоров
САД| цвдТ ДЛП (ДЗЛА) Т чсс! Навязывают сердечный ритм По возможности сти- мулируют предсердия и желудочки (использу- ют режим DDD)
САДф цвдл ДЛП (ДЗЛА) Т чссТ Назначают антиаритмические препараты; при выраженных гемодинамических нарушениях проводят кардиоверсию
Как правило, при нарушениях системной гемодинамики в первую очередь
исключают “несердечные” причины снижения СИ: пневмоторакс, тампонаду пе-
рикарда, нарушения легочной вентиляции, кровотечение, электролитные наруше-
ния (например, гипокальциемию или гипомагниемию). Причины “истинной”
миокардиальной недостаточности: исходные нарушения функции желудочков,
неадекватная защита миокарда (в результате отклонений от протокола защиты
миокарда и длительной ишемии миокарда), неадекватная (неполная) хирургичес-
кая коррекция (например, протезирование одного клапана при двухклапанном
поражении, неполная реваскуляризация миокарда).
Нарушения сердечного ритма. После диагностики нарушений сердечного рит-
ма устраняют причину ее возникновения: гипоксию и гиперкарбию (неадекват-
ную вентиляцию легких, пневмоторакс), гипо- или гиперволемию, электролитные
нарушения (гипокалиемию или гипомагниемию), неблагоприятное сочетание ле-
карственных препаратов (например, использование сердечных гликозидов на фоне
значительных доз симпатомиметиков, введение препаратов кальция после насы-
щающей дозы сердечных гликозидов), ишемию миокарда (в результате неполной
реваскуляризации, спазма внутренней грудной артерии при маммарокоронарном
шунтировании), хирургическое повреждение проводящих путей (при протезиро-
вании и значительном кальцинозе аортального клапана), неадекватную работу
электрокардиостимулятора.
Из антиаритмических препаратов часто используют амиодарон. В институте
хирургии и трансплантологии АМН Украины амиодарон используют в плановом
порядке у больных с ИБС после операции по поводу резекции аневризмы левого
желудочка, операций на клапане аорты и протезировании восходящей аорты, вос-
становления синусового ритма при предшествующей мерцательной аритмии, при
316
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
наджелудочковых тахикардиях, частых политопных желудочковых экстрасисто-
лах, пароксизмальной желудочковой тахикардии. Амиодарон применяют внутри-
венно в течение первых суток после операции в дозе до 1000—1200 мг с последую-
щим пероральным приемом. При выраженных нарушениях системной гемодина-
мики и над- и желудочковых тахикардиях проводят кардиоверсию.
Лечение брадикардии начинают с навязывания ритма при помощи электро-
кардиостимулятора (по возможности стимулируют предсердия и желудочки режи-
мом DDD). Стимуляция ритма атропина сульфатом, изопротеренолом (не зареги-
стрирован в Украине), адреналином или эуфиллином нежелательна, особенно у
больных с ИБС.
Экстубация. Большинству кардиохирургических больных в ОПТ проводят ИВЛ,
длительность которой зависит, прежде всего, от состояния больного, объема опе-
рации, наличия осложнений. Использование изофлюрана, пропофола, векурони-
ума и рокурониума позволяет выполнять перевод на самостоятельное дыхание в
течение 1—4-х ч после окончания операции при полной хирургической коррекции
и отсутствии у больного системных нарушений.
Условия проведения экстубации: больной в сознании, адекватен, достаточно
обезболен, нет признаков остаточного действия миорелаксантов (проводят мони-
торинг нервно-мышечной блокады), показатели системной гемодинамики — ста-
бильные, экссудация по дренажам — незначительная (не более 75 мл/ч), темпера-
тура тела — не более 36 °C (разница между центральной и периферической темпе-
ратурами — не более 3 °C), показатели pH, уровня бикарбоната крови, рО2 и рСО2 —
стабильные, ЧДД и ДО — в пределах нормы.
После экстубации проводят оксигенацию лицевой маской. Показатели газов
артериальной крови проверяют через 15—30 мин после экстубации.
Пролонгированную ИВЛ проводят согласно общепринятым правилам.
Нарушения функции почек. Причины нарушения функции почек в периопераци-
онном периоде у кардиохирургических больных: дооперационная почечная недо-
статочность (стеноз артерий почек, ЗСН, сахарный диабет, ГБ), низкий сердечный
выброс до и после ИК (преренальные причины нарушения функции почек), дли-
тельное время ИК и ишемии миокарда, выраженный внутрисосудистый гемолиз.
Ренопротекгивную терапию традиционно проводят в периоперационный пе-
риод: маннитол — до 1 г/кг (обычно добавляют в перфузат во время ИК с целью
стимуляции диуреза при адекватном СИ, отсутствии ацидоза и периферического
спазма), допамин — не более 3—4 мкг/кг (многие авторы оспаривают эту тера-
пию), фуросемид — 20 мг 3—4 раза в сутки (планово в течение 24—72 ч после
операции, при диурезе более 2 мл/кг/ч не применяют), эуфиллин (не применяют
у больных с нарушениями коронарного кровообращения).
У некоторых больных с исходно сохранной функцией левого желудочка и
недлительной продолжительности болезни плановое назначение мочегонных
средств проводят осторожно по причине возможного выраженного диуреза со зна-
чительными электролитными расстройствами.
В некоторых клинических ситуациях (при длительном ИК, исходных наруше-
ниях водного баланса, выраженной гемодилюции при ИК, повторных операциях с
ИК и т. д.) во время ИК выполняют ультрафильтрацию, которая обладает рядом
преимуществ: корректирует водно-электролитный баланс, уменьшает проявления
системного воспалительного ответа и вероятность нарушений легочной вентиля-
ции в послеоперационный период и др.
317
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
При развитии почечной недостаточности в послеоперационном периоде и
отсутствии эффекта после консервативной терапии (оптимизации сердечного выб-
роса, применения осмо- и салуретиков) в течение 24—36 ч после операции прини-
мают решение о проведении гемодиализа.
Показания для проведения гемодиализа кардиохирургическим больным в ран-
нем послеоперационном периоде: олигурия — менее 400—500 мл/сут, гиперкалие-
мия — более 6,5 ммоль/л, метаболический ацидоз (pH менее 7,1), креатинин —
более 300 мкмоль/л, значительный положительный водный баланс.
Принципы обезболивания у кардиохирургических больных. Наркотические анал-
гетики (традиционно — морфин) назначают в течение первых трех суток после
операции в виде болюсов (5—10 мг) или постоянной инфузии (10—20 мкг/кг/ч).
После удаления внутригрудных дренажей чаще всего исчезает необходимость в
применении аналгетиков.
В литературе появились сообщения о применении эпидуральной анестезии в
послеоперационный период у кардиохирургических больных. Препятствием для
широкого использования этого метода аналгезии является системная антикоагу-
ляционная терапия. Постановку эпидурального катетера проводят в плановом по-
рядке за сутки до операции.
Температурный режим. Использование гипотермии при операциях с ИК и
последующее активное согревание больного часто приводит к развитию гипертер-
мии в послеоперационном периоде. Послеоперационная гипертермия может раз-
виться как проявление системного воспалительного ответа или инфицирования
бактериальной, грибковой или вирусной инфекциями. Повышение температуры
тела вызывает увеличение потребления кислорода, что неблагоприятно отражает-
ся на метаболизме, особенно, миокарда.
Для коррекции гипертермии традиционно используют антипиретики, физи-
ческие методы охлаждения, кортикостероиды (преднизолон 1—2 мг/кг, многие
авторы оспаривают подобную терапию), увеличивают дозы вазодилататоров (при
выраженном периферическом спазме).
Если повышение температуры тела произошло через 72 ч после операции, то
исключают инфекционный процесс: проводят диагностические исследования крови,
мокроты, мочи, отделяемого из дренажей, ЭхоКГ, рентгенографию органов груд-
ной клетки и т. д., проводят замену внутривенных катетеров. Гипертермия с со-
путствующими лейкоцитозом (преобладанием юных форм гранулоцитов) и повы-
шением уровня С-реактивного белка свидетельствует о начале инфекционного
процесса. При подозрении на наличие бактериальной инфекции проводят замену
антибиотиков (по принципу деэскалации).
ЛИТЕРАТУРА
1. American Society of Anesthesiologists and Society: Practice guidelines for perioperative
transesophageal echocardiography. Anesthesiology, 1996; 84:986.
2. Barnard C.N. A human cardiac transplant: An interim report of a successful operation
performed at Groote Schuur Hospital, Cape Town. S. Afr. Med. J., 1967; 41:1271.
3. Bedford R.F., Shah N.K. Blood pressure monitoring: Invasive and noninvasive in Blitt
CD, Hines RL (eds): Monitoring in Anesthesia and Critical Care Medicine, 3d ed. New
York, Churchill-Livingstone, 1995, p. 95.
4. Bigelow W.G., Callaghan J.C., Hopps J.A. General hypothermia for experimental
intracardiac surgery. Am. Surg., 1950; 132:531.
318
15. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ КАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
5. Blalock A., Taussig Н.В. The surgical treatment of malformations of the heart in which
there is pulmonary stenosis or pulmonary atresia. JAMA, 1945; 128:189.
6. Bovill J. G., Boer F. Opioids in cardiac anesthesia in Kaplan J. (ed): Cardiac Anesthesia,
3d ed. Philadelphia, Saunders, 1993, p. 467.
7. Brukhonenko S.S., Tchetchuline S. Experience avec la tete isole du chien: I. Techniques
et conditions des experiences. J. Physiol. Pathol. Genet., 1929; 27:31.
8. Carrel A., Guthrie C.C. The transplantation of vein and organs. Am. Med., 1905;
10:101.
9. Chassot P.G., Van Der Linden, Zaugg M., Mueller X.M., Spahn D.R. Off-pump coronary
artery bypass surgery: physiology and anaesthetic management. Br. J. Anaesth., 2004; 92:400—13.
10. Cheung A., Chernov/ B. Perioperative electrolyte disorders in Benumof J.L. Saidman L.J.
(eds) Anesthesia and Perioperative Complications. St. Louis, Mosby-Year Book, 1991, p. 466.
11. Cheung A. T, Levin S.K., Weiss S.J. et al. Intracardiac thrombus: A risk of incomplete
anticoagulation for cardiac operations. Ann. Thorac. Surg., 1994; 58:541.
12. Cheung A. T, Marshall B.E. The inhaled anesthetics in Longnecker DE, Murphy FL
(eds): Dripps: Introduction to Anesthesia, 9th ed. Philadelphia, Saunders, 1996.
13. Crafoord C, Nylin G. Congenital coarctation of the aorta and its surgical treatment.
J. Thorac. Cardiovasc. Surg., 1945; 14:347.
14. Cutler E.C., Levine S.A. Cardiotomy and valvulotomy for mitral stenosis. Boston
Med. Surg. J., 1923; 188:1023.
15. Dajani A.S., Bisno A.L., Ching J.K. et al. Prevention of bacterial endocarditis:
Recommendation by American Heart Association. JAMA, 1990; 264:2919.
16. Dennis C, Spreng D.S., Nelson G.E. et al. Development of a pump oxygenator to
replace the heart and lungs: An apparatus applicable to human patients, and application to
one case. Ann. Surg., 1951; 134:709.
17. Drop L.J. Ionized calcium the heart and hemodynamic function. Anesth. Analg.,
1985; 64: 432.
18. England M.R., Gordon G., Salem M., Chernow B. Magnesium administration and
dysrhythmias after cardiac surgery: A placebo-controlled, double-blind, randomized trail. JAMA,
1992; 268:2395.
19. Forssmann W. Catheterization of the right heart. Klin. Wochenschr., 1929; 8:2085.
20. Gibbon J.H. Jr. Artificial maintenance of circulation during experimental occlusion
of the pulmonary artery. Arch. Surg., 1937; 34:1105.
21. Gross R.E., Hubbard J.H. Surgical ligation of a patent ductus arteriosus: Report of
first successful case. JAMA, 1939; 112:729.
22. Harken D.E., Soroff H.S., Taylor W.J. et al. Partial and complete prostheses in aortic
insufficiency. J. Thorac. Cardiovasc. Surg., 1960; 40:744.
23. Hill J.D., O’Brien T.G., Murray J.J. et al. Prolonged extracorporeal oxygenation for
acute post-traumatic respiratory failure (shock-lung syndrome): Use of the Bramson membrane
lung. N. Engl. J. Med., 1972; 286:629.
24. Hov/ell W.H., Holt E. Two new factors in blood coagulation: Heparin and pro-
antithrombin. Am. J. Physiol., 1918; 47:328.
25. Kolessov VI. Mammary artery-coronary artery anastomosis as a method of treatment
for angina pectoris. J. Thorac. Cardiovasc. Surg., 1967; 54: 535.
26. Lewis F.J., Tauflc M. Closure of atrial septal defects with the aid of hypothermia:
Experimental accomplishments and the report of one successful case. Surgery., 1953; 33:52.
27. Lillehei C. W., Cohen M., Warden HE. et al. The results of direct vision closure of
ventricular septal defects in eight patients by means of controlled cross circulation. Surg.
Gynecol. Obstet., 1955; 101:446.
28. London M., Hollenberg M., Wong M. et al. Intraoperative myocardial ischemia:
Localization by continuous 12-lead electrocardiography. Anesthesiology, 1988; 69:232.
29. Longnecker D.E., Cheung A. T. Pharmacology of inhalational anesthetics in Longnecker
D.E., Tinker J.H., Morgan G.E. (eds): Principles and Practice of Anesthesiology, 2d ed. St.
Louis, Mosby-Year Book, 1996.
319
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
30. Mangano D.T., Browner W.S., Hollenberg M. et al. Association of perioperative
myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac
surgery. N. Engl. J. Med., 1990; 323:1781.
31. Melrose D.G., Dreyer B., Bentall M.B., Baker J.B.E. Elective cardiac arrest. Lancet,
1955; 2:21.
32. Mora C.T., Dudek C., Torjman M.C., White P.F. The effects of anesthetic technique
on the hemodynamic response and recovery profile in coronary revascularization patients.
Anesth. Analg., 1995; 81:900.
33. Philip J.H., Feinstein D.M., Raemer D.B. Monitoring anesthetic and respiratory gases
in Blitt CD Hines RL (eds): Monitoring in Anesthesia and Critical Care Medicine, 3d ed.
New York, Churchill-Livingstone, 1995, p. 363.
34. Practice guidelines for pulmonary artery catheter: A report by the American Society
of Anesthesiologists Task Force on Pulmonary Artery Catheterization. Anesthesiology, 1993;
78:380.
35. Ramsay J.G., DeLima L.G.R., Wynands J.E. et al. Pure opioid vs opioid-volatile
anesthesia for coronary artery bypass graft surgery: A prospective randomized double-blinded
study. Anesth. Analg., 1994; 78:867.
36. Reich D.L., Kaplan J.A. Hemodynamic monitoring in Kaplan J.A. (ed): Cardiac
Anesthesia. Philadelphia, Saunders, 1993, p. 261.
37. Sellers Т.Н. Surgery of pulmonary stenosis: A case in which the pulmonary valve was
successfully divided. Lancet, 1948; 1:988.
38. Slogoff S., Keats A.S. Randomized trial of primary anesthetic agents on outcome of
coronary artery bypass operations. Anesthesiology, 1989; 70 (2): 179.
39. Starr A., Edwards M.L. Mitral replacement: Clinical experience with a ball-valve
prosthesis. Ann. Surg., 1961; 154.
40. Stowe D.F., Bosnjak Z.J., Kampine J.P. Comparison of etomidate, ketamine, midazolam,
propofol, and thiopental on function and metabolism of isolated hearts. Anesth. Analg., 1992;
74:547.
41. Swenson J.D., Hollander R.M., Wingler K, Leivers D. Early extubation after cardiac
surgery using combined intrathecal sufentanil and morphine. J. Cardiothorac. Vase. Anesth.,
1994; 8:509.
42. Trendelenburg F. Operative management of pulmonary embolie. Verh. Dtsch. Ges.
Chir., 1908; 89.
43. Tuffier T. Etat actuel de la chirurgie intrathoracique. Trans Int. Congr. Med., 1913
(London 1914), 7; Surgery, 1914; 2:249.
44. Tuman KJ., McCarthy R.J., Spiess B.D. et al. Does choice of anesthetic agent
significantly affect outcome after coronary artery surgery? Anesthesiology, 1989; 70 (2):189.
45. Tuman KJ., McCarthy R.J., Spiess B.D., Ivankovich A.D. Comparison of anesthetic
techniques in patients undergoing heart valve replacement. J. Cardiothorac. Anesth., 1990; 4
(2):159.
46. Wray Roth D.L., Rothstein P., Thomas S.J. Anesthesia for cardiac surgery. In Barash
P.G., Cullen B.F., Stoelting R.K. [eds]: Clinical Anesthesia, pp. 835—869. Philadelphia,
Lippincott-Raven, 1997.
320
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
Операции на органах грудной клетки травматичны, связаны с
прямым повреждающим воздействием на жизненно важные функции —
дыхание и кровообращение, нередко сопряжены с большой крово-
потерей и необходимостью многообразной интенсивной терапии.
Для повышения качества анестезиологической защиты в торакаль-
ной хирургии необходимо прогнозировать осложнения.
Торакальные оперативные вмешательства включают опера-
ции: на легких, нижних дыхательных путях (трахее и бронхах),
пищеводе, органах средостения, диафрагме.
16.1. ОПЕРАЦИИ НА ЛЕГКИХ
Показанием к проведению большинства операций на легких
является онкологический процесс. Кроме этого, выполняют опе-
рации по поводу гипоплазии легких, бронхоэктатической и бул-
лезной болезней, хронической эмпиемы плевры, туберкулезных
поражений.
Операции на легких (по принципу возрастания объема операции):
ушивание паренхимы легкого, атипичная резекция части легоч-
ной паренхимы, сегментэктомия, лобэктомия, лобэктомия с ре-
зекцией части бронха (пластическая лобэктомия), правосторон-
няя билобэктомия, пневмонэктомия, лобэктомия по типу пнев-
монэктомии (повторная операция по удалению оставшейся доли
легкого, двусторонняя резекция легких.
Операционные доступы для выполнения операций на легких
во многом зависят от предпочтений хирурга. Выполняют торако-
томии: боковую, заднебоковую и переднебоковую (редко, в ос-
новном для выполнения резекции средней доли правого легкого).
При операциях на культе главных бронхов используют трансстер-
нальный и контрлатеральный доступы.
Как правило, операции на легких выполняют планово, но при
легочном кровотечении или травме грудной клетки операции про-
водят по экстренным показаниям.
11 7-585
321
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Средний возраст пациентов в торакальной хирургии превышает таковой сре-
ди всех хирургических больных из-за преобладающего характера онкологической
патологии легких. При запущенной стадии процесса развивается раковая инток-
сикация. Если патология связана с ХОЗЛ, то больные часто ослаблены, у них
диагностируют нарушения функции иммунной системы вследствие хронической
интоксикации, гипоксии и гиперкапнии.
16.1.1. Предоперационный период
Предоперационный осмотр
Во время предоперационного осмотра и сбора анамнеза обращают внимание
на наличие и степень дыхательной недостаточности, характер одышки и мокроты,
наличие кровохарканья и легочных кровотечений. Выясняют пристрастие к куре-
нию и его интенсивность, перенесенные пневмонии, лечение антибиотиками (уточ-
няют группу препаратов). Больному задают вопросы о наличии неспецифических
симптомов некоторых заболеваний легких — потере в весе, подъемах температуры
тела, анорексии.
Выясняют способность больного выполнять физическую нагрузку: наличие
симптомов сердечной и дыхательной недостаточностей (одышки, тахикардии, др.)
в покое и при ходьбе по горизонтальной поверхности, способность без отдыха
подняться на 2—3-й этаж.
При физикальном осмотре оценивают цвет кожных покровов и видимых сли-
зистых оболочек, показатели ЧСС, АД и ЧДД. Обращают внимание на наличие
цианоза и наполнение шейных вен. При перкуссии и аускультации легких диагно-
стируют участки ослабленного дыхания, хрипы в легких и их характер (постоян-
ный или транзиторный после откашливания).
Предоперационное обследование и оценка операционного риска
У больных, которым планируют проведение операции на легких, прово-
дят необходимый комплекс лабораторных и инструментальных исследований
(см. раздел 3.1). Часто обнаруживают анемию и лейкоцитоз, иногда — признаки
гиперкоагуляции, редко — расстройства биохимических показателей.
Для оценки анестезиологического риска (см. раздел 3.2.2) и функциональной
операбельности (то есть переносимости операции) имеет значение исследование
функции внешнего дыхания. У пациентов с признаками низких функциональных
резервов и/или при планировании обширных резекций легочной паренхимы оп-
ределяют газовый состав артериальной крови: если рО2 менее 60 мм рт. ст. и рСО,
более 45 мм рт. ст., то риск резекции легких значительно увеличивается. Важное
прогностическое значение имеют показатели спирометрии (табл. 16.1).
Таблица 16.1. Основные показатели спирометрии у взрослых
Показатель Способ определения Нормальный показатель, мл
Дыхательный объем (ДО), Vt Объем вдоха и выдоха при обычном дыхании 500
Объем форсированного выдоха (ОФВ) Максимальный объем, который может выдохнуть человек после обычного выдоха 1100
322
И. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
Продолжение табл. 16.1
Показатель Способ определения Нормальный показатель, мл
Остаточный объем (ОО) Объем газа, который остается в легких после форсированного выдоха 1200
Функциональная оста- точная емкость (ФОЕ) Объем газа, который остается в легких после обычного выдоха (ФОЕ = ОФВ + ОО) 2300
Жизненная емкость легких (ЖЕЛ) Максимальный объем, который может вы- дохнуть человек после максимального вдоха 4000-5000
Общая емкость легких (ОЕЛ) Объем газа, который содержится в легких на высоте максимального вдоха (сумма всех объемов) 5800
Снижение ЖЕЛ свидетельствует о рестриктивных нарушениях функции лег-
ких, снижение форсированных объемов — о констриктивно-обструктивных рас-
стройствах дыхания. Показатель форсированной ЖЕЛ (ФЖЕЛ) в норме равен
60 мл/кг; если ФЖЕЛ менее 15 мл/кг, то больной теряет способность эффективно
откашливать содержимое дыхательных путей. Если показатель ОФВ за одну се-
кунду (ОФВ]) менее 0,8 л, то считают, что резекция легкого невыполнима.
Максимальную вентиляцию легких (МВЛ) определяют по формуле:
МВЛ = V, х ЧДДмах15с х 4,
где ЧДДмах 15с — это максимальная ЧДД в течение 15 с.
В норме показатель МВЛ составляет более 60 л/мин, МВЛ = 25—50 л/мин
свидетельствует о тяжелой степени дыхательной недостаточности, МВЛ менее 25
л/мин считают противопоказанием к резекции легкого.
Определенное прогностическое значение имеет показатель диффузионной
способности легких DLCO, который определяют по диффузии СО в легких. Умень-
шение этого показателя свидетельствует о снижении диффузионной поверхности
легких и/или нарушении диффузионной способности альвеолокапиллярных мем-
бран.
Важное прогностическое значение имеет определение предполагаемой (рас-
четной) послеоперационной величины ОФВ] п/о в зависимости от объема резек-
ции. Считают, что одна доля легкого обеспечивает 20 % вентиляционной способ-
ности. Показатель вычисляют, исходя из процента удаляемой паренхимы, напри-
мер, при пневмонэктомии справа (удалении трех долей легкого) расчетный ОФВ] п/0
вычисляют по формуле:
°ФВ1П/о = офв1д/оХ(1-°>6),
где ОФВ] ыо — дооперационный объем форсированного выдоха.
Необходимо помнить об относительной прогностической значимости спи-
рографических тестов, так как больные не всегда добросовестно выполняют их.
Brunelli и соавторы [1] определили, что у пациентов с ОФВ] менее 70 % от
должного показатель ОФВ] не был информативным прогностическим факто-
ром риска развития послеоперационных осложнений. Таким образом, прогнози-
руемый ОФВ] п/о не используют в качестве единственного критерия выбора для
определения показаний и противопоказаний к операции у больных с высоким
риском.
323
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Поданным Song S.W. и соавторов [17], высокий дооперационный сывороточ-
ный уровень фибриногена, длительность хирургического вмешательства и мужс-
кой пол являются прогнозирующими факторами летальности после хирургичес-
ких операций на легких.
По данным Licker M.J. и соавторов [18], прогнозируемый ОФВ, п/0 менее 60 %
является точным предиктором развития дыхательных осложнений и 30-дневной
летальности. Риск летального исхода также связан с возрастом старше 70 лет,
наличием не менее трех сердечно-сосудистых факторов риска и пульмонэкгоми-
ей. К независимым факторам риска осложнений после операций на легких отно-
сят продолжительность операции более 300 мин, нарушения питания, ожирение.
Согласно исследованию, после поправки на все переменные величины продолжи-
тельность операции оказывает наиболее значимое действие на развитие послеопе-
рационных осложнений [19].
Benumof J.L. и Alfery D.D. [2] разработали таблицу зависимости показателей
предоперационных тестов и риска пневмонэктомии (см. табл. 16.2).
Таблица 16.2. Зависимость предоперационных функциональных тестов
и риска пневмонэктомии
Фаза тестирования Тест Высокий риск операции
Исходное состояние Газы артериальной крови Гиперкапния при дыхании комнатным воздухом
Спирометрия ОФВ^ФЖЕЛ ОФВ! < 2 л МВЛ < 50 % расчетной ОО/ОЕЛ > 50 %
Тест с однолегочной вентиляцией В зависимости от стороны пневмонэктомии ОФВ1П/о < 0,85 л или > 70 % кровотока в удаляемом легком
Имитация послеоперационно- го состояния Временная окклюзия баллоном легочной артерии удаляемого легкого (при ингаляции кислорода) СДЛА > 40 мм рт. ст., рСО2 > 60 мм рт. ст., рО2 < 45 мм рт. ст.
Важным прогностическим тестом является моделирование состояния, кото-
рое возникнет после удаления легкого. Способность больного перенести обшир-
ную резекцию легочной паренхимы во многом зависит от адаптационной способ-
ности сосудов малого круга и сократительной способности миокарда, поэтому
важен тест на определение давления в общем стволе легочной артерии после обту-
рации ветви легочной артерии со стороны удаляемого легкого. Для проведения
этого теста необходимо использование инвазивных методов катетеризации легоч-
ной артерии (раздувания баллончика в ней на стороне удаляемого легкого), что
часто сопряжено у больных со сниженными дыхательными и сердечно-сосудис-
тыми резервами развитием тяжелых осложнений — нарушением ритма сердца и
даже остановки кровообращения.
Ценными прогностическими данными обладает показатель максимального
потребления кислорода (VO2Max): если VO,Max более 20 мл/кг/мин, то прогноз опе-
рации благоприятный; УО2мах менее 10 мл/кг/мин считают противопоказанием к
324
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
обширной резекции легких (пневмонэктомии, билобэктомии, резекции с проти-
воположной стороны) [2]. Показатель процента от предсказанного VO2, по мне-
нию Win Т. и соавторов [3], является лучшим индикатором результата хирургичес-
кого лечения. Порог пикового VO2 для хирургического вмешательства устанавли-
вают в пределах 50—60 % от расчетных величин без избыточной хирургической
смертности.
Datta D. и Lahiri В. [4] предложили схему оценки анестезиологического риска
у онкологических больных, которым планируют резекцию легких. Первоначально
определяют ОФВ( и диффузионную способность легкого для окиси углерода DLCO.
Если эти показатели более 60 % от должных, то у пациентов с низким риском
осложнений возможно выполнение резекции легкого, включая пульмонэкгомию,
без дальнейшего тестирования. Если ОФВ! и DLCO менее 60 % от должных вели-
чин, то проводят дальнейшую оценку посредством количественного сканирова-
ния легких. Если при сканировании легких обнаруживают предсказанные после-
операционные значения ОФВ! и DLCO более 40 %, то пациенту выполняют резек-
цию легкого, менее 40 % — проводят тест с физической нагрузкой. Если тест выявляет
V02jiax более 15 мл/кг, то проведение операции возможно, менее 15 мл/кг — счи-
тают, что пациент не перенесет операцию. Хотя эти рекомендации обладают вы-
сокой прогностической ценностью, необходимо отметить трудности при их прак-
тическом выполнении.
По нашему опыту, важнейшим прогностическим тестом является способность
к выполнению физической нагрузки: если больной в состоянии без остановок
подняться на 2-й, а тем более 3-й этаж, то риск пневмонэктомии оправдан. При
определении риска функциональной операбельности обязательно учитывают со-
стояние удаляемого легкого, величины предоперационного шунтирования через
удаляемое легкое. Если удаляемое легкое находится в состоянии ателектаза (на-
пример, вследствие обтурации опухолью главного бронха), риск пневмонэктомии
намного меньше, чем в случае предполагаемого удаления дышащего легкого с
небольшой величиной внутрилегочного шунта. Кроме шунтирования через легкое
на стороне операции, шунтирование справа налево может происходить и через
саму опухоль, особенно если она больших размеров, что также учитывают при
оценке функционального риска операции.
В качестве примера приведем клинический случай.
Больной К., 62 года, поступил с диагнозом: “Сг правого легкого с обтурацией
правого главного бронха и ателектазом правого легкого”. Вес 66 кг, рост 170 см.
Трудовая деятельность в течение жизни была связана с физическими нагрузками;
злостный курильщик — выкуривал в день не менее двух пачек сигарет. Одышка и
тахикардия возникали при незначительной физической нагрузке. ЖЕЛ = 38 %, ОФВ] =
36 %, рО2 = 52 мм рт. ст., рСО2 = 46мм рт. ст., шунтирование (Q^QJ = 20 %.
Учитывая значительно сниженные дыхательные резервы и высокое внутрилегоч-
ное шунтирование, при обоюдном решении больного и близких родственников о необхо-
димости операции была выполнена радикальная пневмонэктомия справа. Экстубация
проведена через 50 мин после окончания операции. Послеоперационный период проте-
кал без осложнений. Через неделю после операции больной ходил и был переведен из
ОПТ, еще через неделю — выписан из стационара.
Как правило, риск правосторонней пневмонэктомии более высок, чем при
удалении левого легкого, а резекция доли представляет гораздо меньший риск
осложнений и летального исхода, чем удаление целого легкого. При планирова-
325
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
нии пневмонэктомии по онкологическим показаниям у пациентов с высоким опе-
рационным риском учитывают их желание к проведению операции, что сопряже-
но с возможными последующими морально-этическими деонтологическими про-
блемами. В западных странах больному сообщают о степени риска операции и
вероятности неблагоприятного исхода. У нас при решении таких вопросов сохра-
нен более осторожный подход, так как считают, что сам факт осознания больным
высокого риска операции может негативно повлиять на пред- и послеоперацион-
ное состояние и, тем самым, еще больше увеличить риск операции, поэтому учи-
тывают позицию близких родственников пациента.
В последнее время получены определенные успешные результаты в понима-
нии функции дыхания у пациентов с нарушениями функций легких. Эти резуль-
таты определили возможность хирургического лечения рака легких у пациентов,
ранее считавшихся функционально неоперабельными [5].
Во время предоперационного обследования проводят рентгенологическое ис-
следование органов грудной клетки (переднезадней и боковой проекции), а так-
же КТ грудной клетки. Оценивают функциональную способность легкого, кото-
рое не нуждается в оперативном лечении, и состояние сердца. По результатам
КТ определяют изменения легочной паренхимы, которые не диагностируются
на обычной рентгенограмме, что также помогает оценить риск предстоящей опе-
рации.
Значение для оценки функциональной операбельности имеют данные ультра-
звукового исследования сердца с определением функции желудочков сердца и
степени легочной гипертензии.
Предоперационная подготовка
У больных со злокачественными новообразованиями легких без тяжелой со-
путствующей патологии предоперационную подготовку не проводят, экономя
жизненную энергию пациента. У больных с неспецифическими заболеваниями
легких предоперационная подготовка включает: санацию дыхательных путей (ФБС),
ингаляции Р2-адреномиметиков, использование бронхолитиков, физиотерапевти-
ческих методов, дыхательной гимнастики, массажа.
При тяжелом трахеобронхите для успешного санирования дыхательных пу-
тей иногда требуется проведение 10—12 процедур ФБС. Мы рекомендуем широ-
кое использование ФБС для санации дыхательных путей перед операцией на
легких, в частности, у онкологических больных. По мнению Chhajed P.N. и со-
авторов [16], лечебную ФБС можно использовать дополнительно в комбиниро-
ванном бронхоскопическом и хирургическом лечении злокачественной обструк-
ции дыхательных путей; лечебная ФБС уменьшает объем операции у онколегоч-
ных больных.
В тяжелых случаях — при выраженном рефрактерном трахеобронхите — для
купирования процесса проводят антибиотикотерапию. Выбор антибиотика(ов)
основывают на данных бактериологического исследования мокроты и чувстви-
тельности высеваемой микрофлоры к антибиотикам, с учетом предшествующей
антибиотикотерапии. Иногда у больных с длительным анамнезом патологическо-
го процесса в легких, которые неоднократно лечились антибиотиками, выбор пре-
парата представляет большие трудности.
Если до операции диагностируют пневмонию участков легкого, расположен-
ных за опухолью, которая частично или полностью обтурирует бронх, наличие
пневмонии не считают противопоказанием к оперативному лечению.
326
It. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
16.1.2. Интраоперационный период
При торакотомии проводят интубационный наркоз с управляе-
мой ИВЛ. Методы региональной анестезии при торакальных операциях в каче-
стве моноанестезии не приемлемы, их используют в комплексе с интубационным
наркозом.
Особенностью анестезиологического обеспечения резекции легких являются
возможные сложности при обеспечении вентиляции, связанные со значительным
количеством мокроты, попаданием крови в дыхательные пути, необходимостью в
однолегочной вентиляции во время наркоза, смещением эндотрахеальной трубки.
Кроме этого, могут возникнуть трудности с обеспечением стабильности гемоди-
намики при манипуляциях хирурга на корне легкого, крупных сосудах средосте-
ния, перикарде, предсердиях, при значительной интраоперационной кровопоте-
ре. По нашему мнению, основой профилактики серьезных осложнений со сторо-
ны сердечно-сосудистой системы во время таких манипуляций является
поддержание адекватной коронарной перфузии, которая зависит от САД и ЧСС.
Отсутствие артериальной гипотензии и тахикардии во время травматичных мани-
пуляций в средостении является наиболее значимым методом профилактики тя-
желых нарушений ритма сердца и остановки кровообращения. При расширенных
резекциях легких, особенно в случаях прорастания опухолью перикарда и широ-
кой распространенности злокачественного процесса, важно своевременное вос-
полнение кровопотери, адекватное обезболивание, применение анестетиков, не
обладающих кардиодепрессивным эффектом (галотана, тиопентал-натрия). Прак-
тически все анестетики обладают незначительным кардиодепрессивным действи-
ем, за исключением кетамина (в умеренных дозах) и натрия оксибутирата. Кета-
мин увеличивает ДЛА, тогда как другие анестетики оказывают незначимый эф-
фект на тонус легочных сосудов [6]. В некоторых случаях для восстановления
гемодинамических показателей делают перерыв во время операции, что оправда-
но для предотвращения тяжелых осложнений.
В комплексе обезболивания при операциях на легких хирурги часто применя-
ют интраоперационную блокаду раствором местного анестетика (чаще 0,25 % ра-
створом новокаина) симпатического ствола, блуждающего и диафрагмального не-
рвов. Мы широко используем эту методику, но контролируемых исследований по
ее эффективности и безопасности в литературе не обнаружили, поэтому не можем
рекомендовать для рутинного применения. Отметим, что при использовании дан-
ной методики мы не наблюдали выраженных осложнений, кроме редких случаев
гипотензии.
В зависимости от морфологии опухоли во время операции могут возникнуть
различные нюансы по обеспечению безопасности больного, например сдавление
верхней полой вены или других крупных сосудов, перикарда, блуждающего или
диафрагмального нервов, возвратного нерва гортани.
Анестезиологическое обеспечение операций на легких при неонкологической
патологии также обладает особенностями. При буллезной болезни во время опе-
рации поддерживают невысокое давление в дыхательных путях до вскрытия груд-
ной клетки для профилактики разрыва буллы или кисты с развитием напряженно-
го пневмоторакса. Мы практикуем очень низкий дыхательный объем (до 5 мл/кг)
при проведении ИВЛ до торакотомии у больных с буллезной болезнью или нали-
чием кист легкого. В таких ситуациях всегда необходима готовность к быстрой
декомпрессии плевральной полости.
327
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
При бронхоэктазах и гипоплазии паренхимы легкого трудности могут возник-
нуть при недостаточной предоперационной санации или невозможности таковой:
большое количество гнойной мокроты затрудняет обеспечение проходимости ды-
хательных путей во время операции.
При эмпиеме плевры, особенно при выполнении мышечной торакопластики,
плеврэктомии и декортикации легкого возможна большая кровопотеря и необхо-
димость ее своевременного восполнения. Для таких больных предусматривают
дооперационную заготовку препаратов крови.
16.1.2.1. Обеспечение вентиляции при операциях на нижних
дыхательных путях, виды однолегочной вентиляции
При необходимости вскрытия просвета трахеи или бронхов, на-
личии свищей главных бронхов (после пневмонэктомии) возникает опасность
нарушения герметичности дыхательного контура во время проведения ИВЛ и не-
достаточной вентиляции легких. Для предупреждения подобных состояний разра-
ботан комплекс методик по обеспечению вентиляции.
Наиболее распространенным методом является однолегочная вентиляция с
блокированием проходимости главного бронха противоположного легкого.
Абсолютные показания к проведению однолегочной вентиляции [2]: инфекция,
массивное легочное кровотечение, бронхоплевральная фистула, хирургическое
вскрытие крупного бронха, гигантская киста или булла легкого на стороне опера-
ции, повреждение трахеобронхиального дерева.
Относительные показания к проведению однолегочной вентиляции [2]: аневризма
грудной аорты, пневмонэктомия, верхняя лобэктомия, резекция пищевода, тора-
коскопия, вмешательства на грудном отделе позвоночника.
Мы считаем необходимым выключать из вентиляции легкое на стороне опе-
рации только в случае невозможности обеспечения вентиляции противоположно-
го легкого вследствие негерметичности дыхательных путей, а также при легочном
кровотечении. Наиболее часто необходимость в однолегочной вентиляции возни-
кает при операциях на бронхах: резекции бронха при доброкачественной опухоли,
пластической резекции легких (с резекцией бронха), вскрытии главного бронха
для ревизии распространенности злокачественного процесса, ушивании крупного
свища культи главного бронха (после пневмонэктомии).
Патофизиология однолегочной вентиляции. Сердечный выброс и легочная пер-
фузия могут изменяться под воздействием анестезии и ИВЛ. Эти изменения спо-
собствуют нарушению оксигенации крови. Главной детерминантой распределе-
ния перфузии в легком является отношение между альвеолярным и легочным
капиллярным давлениями. Перфузия увеличивается в нижних отделах легких вслед-
ствие гидростатических сил. Так как ателектазы локализованы в зависимых обла-
стях легкого, то перфузия невентилируемой паренхимы легкого является причи-
ной около 8—10 % шунтирования сердечного выброса [6].
При выключении из вентиляции одного легкого происходят изменения, прежде
всего, вентиляционно/перфузионных соотношений. При отсутствии вентиляции в
невентилируемом легком сохраняется перфузия. Если бы перфузия невентилиру-
емого легкого сохранялась в полном объеме, то шунтирование венозной крови в
артериальное русло (QS/QD) составило бы 45—55 %, однако этого не происходит
вследствие редуцирования кровотока в невентилируемом легком. Важное значение
328
И. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
в снижении кровотока в невентилируемом легком, а следовательно, и шунтирова-
нии оказывают рефлекс гипоксической вазоконстрикции, манипуляции хирурга
на легком (сдавление), наличии патологического процесса в оперируемом легком
и гравитационный компонент (при положении больного на боку). В результате
Qs/Qd снижается, по данным разных авторов, на 22,5—27,5 % сердечного выброса,
что позволяет в большинстве случаев обеспечить приемлемую оксигенацию крови
в момент однолегочной вентиляции, а также элиминацию углекислоты.
Применение вазодилататоров, например нитроглицерина или добутамина,
оказывает влияние на гипоксическую вазоконстрикцию во время наркоза. Эти
препараты уменьшают сопротивление сосудов невентилируемого легкого и увели-
чивают в нем кровоток.
Поданным Abe и соавторов (1998), внутривенная анестезия пропофолом име-
ет преимущества при однолегочной вентиляции по сравнению с ингаляционной
анестезией, которая ингибирует гипоксическую вазоконстрикцию и увеличивает
QS/QD- Beck и соавторы (1999), напротив, не обнаружили существенной разницы
между анестезией пропофолом и севофлюраном.
Во время однолегочной анестезии возникает шунтирование кровотока не только
в невентилируемом, но и в вентилируемом легком, и шунт в нем бывает намного
значительнее, чем это принято считать [6]. Поэтому логичны данные о положи-
тельном эффекте на оксигенацию умеренного уровня ПДКВ в вентилируемом
легком (+5—10 см вод. ст.) [7].
Для уменьшения шунтирования и гипоксемии при однолегочной вентиляции
применяют некоторые вазоконстрикторы, например внутривенно вводят алмит-
рин, который улучшает оксигенацию во время однолегочной вентиляции без из-
менений гемодинамики. Алмитрин (4 мк/кг/мин) в комбинации с ингаляцией NO
значительно улучшает оксигенацию во время однолегочной вентиляции при то-
ракотомии, не изменяя легочную гемодинамику. Увеличение дозы алмитрина до
16 мкг/кг/мин с ингаляцией NO еще более улучшает артериальную оксигенацию,
но также и увеличивает СДЛА [8]. Этот метод лечения используют в случаях,
когда обычная вентиляторная стратегия не в состоянии исключить гипоксемию
или существуют препятствия для ее применения [9]. В качестве вазоконстриктора
используют незначительные дозы фенилэфрина (мезатона). Ингаляцию оксида
азота используют для лечения легочной гипертензии и гипоксемии, которые воз-
никают во время торакальной операции при однолегочной вентиляции, постпуль-
монэктомического отека легких и трансплантации легкого. Ингаляционный ок-
сид азота полезен у больных с низким отношением pO,/FiO, во время однолегоч-
ной вентиляции [10]. К сожалению, в Украине этот метод до настоящего времени
не применяют вследствие отсутствия на рынке и дороговизны.
При однолегочной вентиляции имеет значение выбор адекватного дыхатель-
ного объема: ИВЛ со значительным ДО (10 мл/кг) может вызвать эпителиальное
повреждение и провоспалительную реакцию в вентилируемом легком; уменьше-
ние ДО во время однолегочной вентиляции до 5 мл/кг уменьшает альвеолярные
концентрации цитокинов (TNF-альфа) и адгезивных молекул [11].
®При однолегочной вентиляции во время торакотомии легкое необходимо
вентилировать чистым кислородом, ДО должен быть невысоким — 5-6 мл/кг,
ЧДД — адекватной для поддержания нормального значения рСО2. Для про-
филактики гипоксемии или при ее развитии используют ПДКВ вентилируе-
мого легкого 5-10 см вод. ст.
329
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
А Положение на карине
Б Положение на карине
Рис. 16.1. Двухпросветные труб-
ки Robertshaw для вентиляции
правого (А) и левого (Б) лег-
кого [12]
Техника проведения однолегочной вентиляции. Большинство авторов рекомен-
дуют для проведения однолегочной вентиляции использовать двухпросветные труб-
ки (ДПТ). Наиболее распространены ДПТ для вентиляции правого и левого лег-
кого (рис. 16.1). Несмотря на широкое распространение этого метода обеспечения
однолегочной вентиляции, он не лишен многих недостатков. Во-первых, ДВП не
позволяют хирургу манипулировать на бифуркации трахеи, во-вторых, примене-
ние ДВП часто сопровождается рядом осложнений. По данным Seymour и соавто-
ров [14], при однолегочной вентиляции с использованием ДПТ могут возникнуть
осложнения: десатурация кислородом (< 88 %), обструкция верхней доли легкого,
обструкции карины, недостаточная изоляция легкого, чрезмерная секреция, др.
Согласно исследованию, опыт анестезиолога и использование волоконно-опти-
ческого бронхоскопа не влияли на частоту этих осложнений. Кроме этого, необ-
ходимо отметить затруднение аспирации содержимого дыхательных путей через
канал ДВП при большом количестве мокроты и, особенно, при легочном крово-
течении.
Для изоляции легкого и проведения однолегочной вентиляции также исполь-
зуют бронхиальные блокаторы. На рис. 16.2 представлена интубационная трубка с
бронхиальным блокатором, который с помощью фибробронхоскопа проводят в
главный бронх легкого, выключаемого из вентиляции (рис. 16.3) [15].
Существует еще один метод проведения однолегочной вентиляции — с помо-
щью обычной однопросветной интубационной трубки. Мы с успехом использова-
ли этот метод у более тысячи больных. Введение трубки в правый главный бронх
не представляет сложности, но трудность заключается в том, чтобы не выключить
из вентиляции верхнюю долю правого легкого, так как правый главный бронх
обычно короткий (длина не превышает 1,5 см). Для облегчения этой задачи мы
применяли интубационную трубку с тупым концом: срезали его и затем оплавля-
ли на огне для восстановления герметичности манжеты.
Более трудной задачей является проведение интубации левого главного брон-
ха. С этой целью мы применяем следующую методику: интубационную трубку
перемещают в левый угол рта, голову поворачивают влево, при продвижении
интубационной трубки смещают трахею вправо. В большинстве случаев эта
методика позволяет проведение успешной интубации левого главного бронха.
Еще проще выполнить эндобронхиальную интубацию с помощью фиброброн-
хоскопа (см. рис. 16.4).
330
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
Рис. 16.2. Интубационная
трубка Univent с бронхи-
альным блокатором
Рис. 16.3. Введение брон-
хоблокатора в левый глав-
ный бронх с помощью
фибробронхоскопа
Рис. 16.4. Интубация левого
главного бронха однопросвет-
ной интубационной трубкой с
помощью фибробронхоскопа
16.1.3. Послеоперационный период
16.1.3.1. Экстубация
Ранее полагали, что после операций на легких, особенно при об-
ширных резекциях, в ранний послеоперационный период необходимо проведение
продленной ИВЛ. Согласно большинству современных рекомендаций, показано про-
ведение ранней экстубации после торакальной операции. Прогностической цен-
ностью возможности ранней экстубации обладает тест предполагаемого OOBj п/о
(см. раздел 16.1.1): при OOBj п/о более 40 % возможно проведение немедленной
экстубации после операции; при ОФВ[ п.о менее 30 % время проведения экстубации
определяют по состоянию пациента [20]. По-видимому, нет необходимости в про-
дленной ИВЛ в послеоперационный период даже после обширных резекций лег-
ких, если у больного восстановилось адекватное спонтанное дыхание, что подтвер-
ждают клинические данные, показатели газов крови, пульсоксиметрии, капногра-
фии. ИВЛ способствует развитию ряда осложнений в послеоперационны период:
повышается риск присоединения инфекции, несостоятельности швов на бронхах с
развитием бронхиальных свищей (особенно бронхиальных и трахеобронхиальных
анастомозов, поддержания негерметичности легочной паренхимы).
По нашему опыту, риск осложнений со стороны кровообращения и дыхания
у больных после обширных резекций легких наиболее высокий не в течение пер-
331
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
вых часов и суток после операции, а в течение вторых, третьих и четвертых после-
операционных суток, когда возрастает риск отека легких и декомпенсации дыха-
ния и кровообращения.
Кроме увеличения риска характерных осложнений, по нашим данным, ИВЛ
после пневмонэктомии может отрицательно влиять на гемодинамику, способствуя
смещению средостения в пораженную сторону при открытом дренаже по Бюллау,
поэтому мы предпочитаем накладывать на дренаж в плевральной полости зажим
до экстубации. Отрицательным моментом подобной тактики является риск несво-
евременной диагностики кровотечения в плевральную полость; с этой целью дре-
наж периодически раскрывают, особенно, при возникновении гемодинамической
нестабильности.
После экстубации при торакотомии показана оксигенотерапия.
16.1.3.2. Уход за дренажами после торакотомии
Как правило, торакотомия заканчивается дренированием плев-
ральной полости. Адекватный уход за дренажами является важным условием тече-
ния послеоперационного периода без осложнений. Несомненно, что приоритет в
этом вопросе остается за хирургом. Средний медицинский персонал ОПТ должен
хорошо владеть методикой ухода за дренажами.
Наиболее частой ошибкой ухода за дренажами является их обструкция при
пассивном дренировании плевральной полости по Бюллау с возможным развити-
ем пневмогемоторакса. Центральный и периферический отделы дренажа система-
тически промывают антисептическим или физиологическим растворами.
Постоянно следят за разрежением в плевральной полости. При активной ас-
пирации по дренажу наиболее простой и доступной является 3-ампульная систе-
ма. При отсутствии герметичности легочной паренхимы остается возможным только
пассивное дренирование по Бюллау. В некоторых случаях при отсутствии герме-
тичности легочной паренхимы устанавливают активную аспирацию из плевраль-
ной полости с помощью водоструйного отсоса или специальных аппаратов, кото-
рую проводят с целью попытки расправить легкое, но при такой методике увели-
чивается риск образования свища.
16.1.3.3. Послеоперационное обезболивание
Оптимальный метод послеоперационного обезболивания в тора-
кальной хирургии является предметом дискуссий среди многих авторов. При опе-
рациях на легких во многих исследованиях показано, что боль, связанная с недо-
статочной аналгезией, может вызвать уменьшение легочных объемов и снижение
кашлевого рефлекса с последующим увеличением инцидентности послеопераци-
онной смертности и осложнений.
Традиционно используют системное введение наркотических и ненаркотичес-
ких аналгетиков, но в качестве моноаналгезии этот метод не обеспечивает адекват-
ного обезболивания после торакальных операций. Завоевывает популярность метод
КПА путем эпидуральной или паравертебральной инфузии растворов местного ане-
стетика с опиоидом либо путем системного внутривенного введения аналгетиков.
Наиболее эффективной по обезболивающему действию является эпидураль-
ная анестезия, хорошие результаты получены при использовании постоянной па-
равертебральной анестезии [21]. По данным Michelet Р. и соавторов [7], эпиду-
332
И. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
ральная аналгезия уменьшает даже риск недостаточности анастомоза после резек-
ции пищевода.
При использовании торакальной эпидуральной аналгезии, которую начинали
перед операцией, получены наилучшие результаты по снижению острой и хрони-
ческой боли после торакотомии. Этот режим аналгезии ассоциируется со сниже-
нием частоты и интенсивности случаев хронической боли по сравнению с после-
операционной эпидуральной и внутривенной аналгезией [22]. Согласно исследо-
ванию [18], грудная эпидуральная аналгезия связана со снижением смертности и
дыхательных осложнений.
Хорошие результаты получены при применении интраплевральной аналге-
зии, которую проводят путем интраплеврального введения местного анестетика. С
этой целью мы используем лидокаин в дозе 2 мг/кг, растворенный в 20—40 мл
изотонического раствора натрия хлорида. Раствор вводят через дренаж, находя-
щийся в плевральной полости, либо через катетер, специально поставленный во
время операции (чаще — подключичный). По-видимому, еще более эффективным
является метод внутриплевральной инфузии местного анестетика. Систематичес-
кий обзор рандомизированных исследований свидетельствует, что метод интра-
плевральной аналгезии не менее эффективен, чем эпидуральная аналгезия, и зна-
чительно эффективнее, чем только системное введение наркотиков [23].
Паравертебральная блокада в комбинации с внутривенной аналгезией явля-
ется альтернативой эпидуральному обезболиванию после торакотомии. Непрерыв-
ное паравертебральное введение 0,5 % раствора ропивакаина улучшает качество
обезболивания после торакальной операции при использовании многомодального
аналгетического подхода [24]. Об удовлетворительном обезболивании после тора-
котомии при использовании эпидуральной и межреберной аналгезии в сочетании
с методом КПА сообщают Luketich J.D. и соавторы [25]. Согласно исследованию,
не было обнаружено разницы в эффективности этих методов обезболивания после
торакотомии, но при эпидуральной аналгезии отмечено несколько большее коли-
чество осложнений.
Преимуществом паравертебральной и интраплевральной бдркад является
меньший риск осложнений, в частности — депрессии дыхания и артериальной
гипотензии, а также отсутствие риска образования эпидуральной гематомы на фоне
применения антикоагулянтов по сравнению с эпидуральной блокадой.
16.1.3.4. Профилактика и лечение
послеоперационных осложнений
Несмотря на успехи, достигнутые в периоперационной терапии, торакальные
операции сопровождаются высоким риском осложнений для многих пациентов. Во
многом этот риск предопределен объемом перенесенной операции и тяжестью со-
путствующих заболеваний. Наибольший риск развития осложнений представляют
пневмонэктомии, особенно правосторонние, и двусторонние резекции легких.
По данным Hollaus и соавторов [26], факторами риска развития осложнений
со стороны сердечно-сосудистой системы являются: неоадъювантная химиоте-
рапия, алкоголизм, болезни легкого, сонное апноэ, пневмококковый сепсис в
анамнезе и повторные торакотомии; факторами риска со стороны дыхания явля-
ются нарушения функции легких и газового состава крови. Комбинация дыха-
тельных и сердечно-сосудистых факторов является основным предиктором для
развития осложнений. Комбинация ИБС и двух дыхательных факторов риска
333
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
оказалась прогнозирующим показателем для увеличения риска инфекционных
осложнений; болезни периферических артерий, тяжелые ХОЗЛ и расширенные
резекции легких являются прогнозирующими факторами для неинфекционных
осложнений.
По данным Miller и соавторов [27], факторами, увеличивающими смертность
при одновариантном и многовариантном анализах, являются: пожилой возраст,
дооперационное использование кортикостероидов, сниженная дооперационная
диффузионная способность легкого по окиси углерода, интраоперационное пере-
ливание крови, низкий уровень гемоглобина до операции, чрезмерные инфузии
кристаллоидных растворов в течение первых 12—24 ч после операции (р = 0,02).
По данным Fukuse и соавторов (2005) [19], послеоперационные осложнения при
операциях на легких развивались у 16,7 % гериатрических пациентов.
После операции на легких наиболее частыми и серьезными являются карди-
альные осложнения: отек легких, трепетание и фибрилляция предсердий, ишемия
миокарда, легочная эмболия [28]. Наиболее высок риск развития отека легких и
пневмонии после пульмонэктомии. Cerfolio и соавторы [29] считают эти осложне-
ния неизбежными.
Одним из серьезных послеоперационных осложнений является выраженная
легочно-сердечная или сердечно-легочная недостаточность с необходимостью про-
ведения длительной ИВЛ. Острое повреждение легких (ОПЛ) является главным
фактором послеоперационной смертности. Согласно исследованию Licker и соав-
торов [18], независимыми факторами риска ОПЛ являются: чрезмерные инфузии
жидкости, пульмонэктомия и дооперационное злоупотребление алкоголем. Для
уменьшения риска ОПЛ после операции необходимо применять комплекс мероп-
риятий, включающий дооперационное воздержание от приема алкоголя, протек-
тивные методы вентиляции, ограничение инфузии жидкости, частую (желательно
через 2 ч) активную или пассивную смену положения больного.
Существует группа осложнений, которые непосредственно связаны с опера-
цией и могут считаться хирургическими, например недостаточность культи брон-
ха с развитием бронхиальных свищей, длительное отсутствие герметичности ле-
гочной паренхимы. Одним из наиболее значительных факторов риска этих ослож-
нений является нарушенное питание больного до операции [19].
Лоб- и билобэктомии, даже у больных с тяжелой сопутствующей патологией,
сопровождаются невысоким риском, ненамного превышающим таковой при об-
шехирургических операциях. Более высокий риск осложнений и летальности на-
блюдают при пневмонэктомиях, особенно правосторонних. Одним из главных
факторов риска является снижение резервов дыхательной и сердечно-сосудистой
систем и избыточный вес. Наиболее частыми осложнениями в послеоперацион-
ный период у этой группы больных является отек легкого и фибрилляция пред-
сердий.
Методами профилактики развития отека легких являются адекватное обезбо-
ливание, осторожная мобилизация больного, снижение давления в малом круге
кровообращения, профилактика тромбоэмболических осложнений. У таких боль-
ных выбирают “правильное” время мобилизации, которое, прежде всего, зависит
от состояния больного после операции. Необходим определенный период для адап-
тации сердечно-сосудистой и дыхательной систем к значительно изменившимся
условиям у больных после пневмонэктомии. Неоправданно ранняя мобилизация
может в последующем осложниться отеком легких и длительной иммобилизацией
больного в кровати. При левосторонней пневмонэктомии и неосложненном тече-
334
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
нии послеоперационного периода чаще всего мы разрешаем больному садиться с
помощью персонала на 2-е—3-и сутки после операции, после правосторонней пнев-
монэктомии — не ранее 3-х, а чаще на 4-е сутки после операции.
Для профилактики перегрузки малого круга после пневмонэктомий мы при-
меняем нитраты (чаще продленного действия), морфин, постоянную ингаляцию
кислорода. Ограничениями для применения нитратов являются низкие показате-
ли АД и выраженная тахикардия. Кроме нитратов, с целью профилактики артери-
альной гипертензии в послеоперационном периоде применяют магнезию и инги-
биторы АПФ. Рекомендуют ограничительный режим внутривенных инфузий в
послеоперационный период. Мы наблюдали случаи отека легких у больных после
обширных резекций легких даже при низких показателях ЦВД, поэтому, начиная
со 2-х послеоперационных суток, мы переводим больных на энтеральное питание
с минимальным объемом переливаемой жидкости.
Cerfolio и соавторы [29] для профилактики отека легких и ОРДС после пуль-
монэктомии предложили интраоперационное внутривенное введение 250 мг ме-
тилпреднизолона натрия сукцината непосредственно перед лигированием легоч-
ной артерии во время пульмонэктомии. Такая терапия, по данным авторов, не
увеличивает риск бронхоплевральных фистул после операции. Необходимы даль-
нейшие рандомизированные исследования по этому предложению.
Фибрилляция предсердий после резекций легкого увеличивает продолжи-
тельность и стоимость лечения. Достоверно уменьшает риск фибрилляции пред-
сердий после резекции легкого применение амиодарона, или кордарона (200 мг
перорально каждые 8 ч) [30]. При возникшей фибрилляции предсердий также
наиболее эффективным средством является внутривенное, а затем пероральное
введение амиодарона. Согласно данным [31], для профилактики фибрилляции
предсердий при некардиальных торакальных операциях эффективно предопера-
ционное использование статинов.
ГВ!
У больных с высоким риском развития фибрилляции предсердий после пнев-
монэктомии в послеоперационном периоде не применяют эуфиллин, учи-
тывая его аритмогенноое действие
Спорным является профилактическое применение у больных после обшир-
ных резекций легких сердечных гликозидов (дигоксина). Некоторые авторы реко-
мендуют применение дигоксина в до- и послеоперационном периодах у пожилых
больных при обширной резекции легких [32]. При назначении дигоксина в после-
операционный период учитывают возможное нарушение функции почек, гипока-
лиемию, увеличение активности симпатической нервной системы, что может уве-
личить токсический эффект циркулирующего дигоксина [33]. Мы назначаем ди-
гоксин таким больным профилактически внутривенно или перорально в случае
предрасположенности к тахикардии, несмотря на коррекцию волемии и адекват-
ное обезболивание. Применение других сердечных гликозидов, в частности стро-
фантина, согласно нашему опыту, неоправданно, так как часто сопровождается
нарушениями ритма сердца.
Важным фактором, увеличивающим риск фибрилляции предсердий и отека
легких после пневмонэктомий является смещение средостения, особенно в здоро-
вую сторону, чему может способствовать накопление крови, экссудата или возду-
ха после извлечения дренажа из плевральной полости. Для предупреждения по-
добного проводят систематический рентгенологический и клинический (измере-
335
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ние давления в плевральной полости торакальным хирургом) контроль положе-
ния органов средостения.
Вследствие длительной иммобилизации больного в кровати высок риск раз-
вития пневмоний, особенно у больных после пневмонэктомий. С этой целью сво-
евременно применяют ФБС и рациональную антибиотикопрофилактику, исполь-
зуют раннюю адекватную двигательную активность (самостоятельную или пассив-
ную), проводят дыхательную гимнастику (дыхание с сопротивлением на выдохе,
периодические глубокие вдохи).
Несмотря на явный прогресс, темнее менее, заболеваемость и смертность
после резекций легких остается высокой. Так, по данным Miller и соавторов (2002)
[27], осложнения со стороны сердца и легких после пульмонэктомий, которые
выполняли по поводу незлокачественных заболеваний, возникли у 63,7 % пациен-
тов, а смертность после пневмонэктомий, выполненных по поводу незлокаче-
ственных заболеваний и рака легких, составила, соответственно, 26,3 и 17,6 %.
По данным Licker M.J. и соавторов (2006) [18], в течение предыдущего деся-
тилетия зарегистрировано снижение периоперационной смертности при резекции
легких с 3,7 до 2,4 %, инцидентности дыхательных осложнений — с 18,7 до 15,2 %,
что в основном связывают с уменьшением объема резекции легочной паренхимы
с 17 до 11 % (р < 0,05).
В отделении торакальной хирургии Киевской городской клинической боль-
ницы № 17 в течение 2005—2006 гг. проведено 88 пневмонэктомий у взрослых (4
летальных исхода), 251 лоб- и билобэктомия (2 летальных исхода).
16.2. ОПЕРАЦИИ НА ТРАХЕЕ И ГЛАВНЫХ БРОНХАХ
Наиболее частыми показаниями к операции на трахее и главных
бронхах являются злокачественные и доброкачественные опухоли, стенозы трахеи
после длительной интубации или трахеотомии.
Часто состояние больных в дооперационном периоде тяжелое, что обусловле-
но дыхательной недостаточностью по причине нарушения проходимости трахеи и
главных бронхов. Обычные прогностические критерии функциональной опера-
бельности в подобных случаях не применяют, напротив, срочность выполнения
операции зависит от степени выраженности дыхательной недостаточности: чем
значительнее степень, тем короче сроки. Основным лимитирующим фактором у
этих больных является хирургическая операбельность при значительном распрос-
транении патологического процесса.
В предоперационном периоде по возможности и необходимости проводят са-
нацию нижних дыхательных путей, что часто трудно осуществимо по причине
значительного сужения просвета трахеи и гортани. Санацию осуществляют с по-
мощью ФБС.
В премедикации у таких больных с осторожностью применяют наркотические
аналгетики и снотворные средства в связи с высоким риском депрессии дыхания.
Наиболее трудным компонентом анестезиологического обеспечения операций
на трахее и главных бронхах является поддержание адекватной вентиляции с макси-
мально комфортными условиями для хирурга при наложении анастомозов. Основная
трудность во время подобных операций — это отсутствие герметичности дыхатель-
ных путей во время хирургических манипуляций на трахее и главных бронхах. Двух-
просветные трубки не используют, так как их трудно перемещать, и они мешают
336
И. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
хирургу. Методика обеспечения вентиляции во многом зависит от уровня и харак-
тера операции на трахее.
Обеспечение вентиляции при локализации стриктуры (опухоли) на уровне горта-
ни или верхней части трахеи
Основные трудности возникают в начале операции, так как интубационную
трубку обычно небольшого диаметра (№ 6—7 у взрослых) необходимо провести
ниже стриктуры (рис. 16.5). При необходимости проводят бужирование гортани
или трахеи.
Если причиной сужения верхнего отдела трахеи является доброкачественная
опухоль “на ножке”, то во время интубации высок риск обрывания опухоли, кото-
рая может обтурировать интубационную трубку. При неудачной попытке ее аспи-
рации проводят переинтубацию. Кроме этого, у хирурга возникают трудности при
определении локализации основания опухоли. Более безопасно провести трубку
за опухолью с помощью ФБС, хотя и эта методика не гарантирует отсутствие
осложнений.
После пересечения трахеи ниже опухоли переходят на вентиляцию с помо-
щью так называемого “шунта дыхания”, когда интубационную трубку хирург вво-
дит в дистальный отдел трахеи через операционную рану (рис. 16.6).
В случаях, когда обычная интубационная трубка создает сложности для хи-
рургических манипуляций, используют высокочастотную ИВЛ (ВЧИВЛ), кото-
рую обеспечивают с помощью отечественных аппаратов “Фаза—8” и “Бриз”
(рис. 16.7). Преимуществом ВЧИВЛ при операциях на нижних дыхательных путях
является возможность вентиляции легких при отсутствии герметичности дыха-
тельных путей. Кроме этого, узкий катетер в меньшей степени затрудняет работу
Рис. 16.7. Высокочастотная
ИВЛ через катетер (внутрен-
ний диаметр > 3 мм), введен-
ный в дистальную часть тра-
хеи
Рис. 16.5. Проведение ин-
тубационной трубки ниже
стриктуры гортани или
верхней части трахеи
Рис. 16.6. ИВЛ через “шунт
дыхания”; интубационную
трубку вводят в дистальный
отдел трахеи через операци-
онную рану
337
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 16.S. Ушивание задней
стенки трахеального анасто-
моза на “шунте дыхания”
Рис. 16.9. Ушивание передней
стенки трахеального анастомо-
за на назотрахеальной трубке
Рис. 16.10. Вентиляция лег-
ких на начальном этапе
операций на средне-ниж-
ней части трахеи
хирургу. После резекции поврежденного участка трахеи ушивают заднюю стенку
анастомоза (см. рис. 16.8). Переднюю стенку анастомоза ушивают на назо- или
оротрахеальной трубке (рис. 16.9).
При трахеогортанных резекциях для обеспечения проходимости дыхательных
путей в послеоперационном периоде мы используем длительную назотрахеальную
интубацию (до 3 недель). Больные в течение этого времени дышат самостоятельно
через назотрахеальную трубку, находятся в полном сознании, как правило, не тре-
буют дополнительной седации, питаются через назогастральный зонд. Для поддер-
жания проходимости интубационной трубки регулярно проводят заливки теплого
физиологического раствора с аспирацией трахеобронхиального содержимого.
Обеспечение вентиляции при локализации стриктуры (опухоли) на уровне сред-
ненижней части трахеи
При расположении опухоли или стеноза другой этиологии в средненижнем сег-
менте трахеи операцию начинают с обычной оротрахеальной интубации, располагая
интубационную трубку над местом сужения (рис. 16.10). В момент мобилизации тра-
хеи возможны трудности с вентиляцией. После рассечения трахеи применяют раз-
личные методики вентиляции: чаще всего используют однолегочную вентиляцию с
введением через рану интубационной трубки в левый главный бронх (рис. 16.11).
Обеспечение вентиляции при локализации стриктуры (опухоли) на уровне бифур-
кации трахеи
Особые трудности возникают при обеспечении вентиляции при резекции би-
фуркации трахеи. Часто сочетание традиционных методов вентиляции отдельных
отделов легких с ВЧИВЛ позволяет избежать серьезных нарушений вентиляции и
в то же время не создавать трудностей для хирургических манипуляций. Из общих
положений применения ВЧИВЛ необходимо отметить необходимость отсутствия
338
It. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
Рис. 16.11. Однолегочная
вентиляция левого легкого
после рассечения трахеи
Рис. 16.13. ИВЛ на началь-
ном этапе резекции бифур-
кации трахеи с пневмонэк-
томией слева
Рис. 16.12. ИВЛ на началь-
ном этапе резекции бифур-
кации трахеи с пневмонэк-
томией справа
герметичности дыхательного контура, то есть диаметр катетера должен быть мень-
ше диаметра бронха, через который производится вентиляция, так как выдох, в
основном, происходит мимо катетера. Если для ВЧИВЛ используют интубацион-
ную трубку, то нельзя раздувать манжету.
Наиболее простой вариант обеспечения вентиляции представлен на рис. 16.12,
когда опухоль исходит из правого главного или верхнедолевого бронха с распрос-
транением на бифуркацию трахеи. В этом случае выполняют правостороннюю
пневмонэктомию с резекцией бифуркации трахеи. Вентиляцию после отсечения
трахеи осуществляют через левый главный бронх.
Проблематично обеспечение вентиляции при расположении опухоли в левом
главном бронхе с распространением на бифуркацию трахеи (рис. 16.13). С односто-
роннего торакотомного доступа нельзя удалить левое легкое и резецировать бифурка-
цию, поэтому в таких случаях проводят одномоментную двустороннюю торакотомию
и резекцию бифуркации трахеи через правосторонний доступ. На рисунках 16.14,
16.15, 16.16 показаны варианты обеспечения вентиляции легких при резекции би-
фуркации трахеи. Таким образом, используя различные комбинации традиционной
ИВЛ и ВЧИВЛ, обеспечивают вентиляцию во время сложных реконструктивных опе-
раций на бифуркации трахеи. Как правило, после резекций трахеи проводят ФБС.
16.3. ОПЕРАЦИИ НА ПИЩЕВОДЕ
Операции на пищеводе чаще выполняют по поводу злокачествен-
ных новообразований, дивертикулов, ахолазии, стриктур пищевода Баррета.
Операционными доступами являются цервикотомия, торакотомия или верх-
няя срединная лапаротомия.
339
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 16.14. ВЧИВЛ левого
легкого (наиболее сложный
вариант вентиляции); макси-
мальное время вентиляции
в нашей практике — 15 мин
Рис. 16.15. ВЧИВЛ левого
легкого, нижней и средней
доли правого легкого
Рис. 16.16. ВЧИВЛ нижней
и средней доли правого лег-
кого с ИВЛ левого легкого
Часто больные перед операциями на пищеводе требуют предоперационной
подготовки, включающей, прежде всего, коррекцию гиповолемии и гипопротеи-
немии. Пациентам с раком пищевода перед хирургическим вмешательством часто
проводят химио- и лучевую терапию, что увеличивает риск осложнений в после-
операционном периоде.
При индукции в наркоз у этой группы пациентов повышен риск регургита-
ции и аспирации желудочного содержимого, особенно у пациентов с большими
“карманами” пищевода, которые сложно очистить во время предоперационной
подготовки.
Операции на пищеводе отличаются значительной продолжительностью (час-
то — при кишечной пластике пищевода), что увеличивает риск периоперацион-
ных осложнений, в частности гипотермии и гиповолемии. Иногда обширные ре-
зекции пищевода сопровождаются повышенной кровопотерей.
Предпочтительной методики анестезии при операциях на пищеводе не суще-
ствует. Некоторые авторы рекомендуют для обеспечения вентиляции во время опера-
ции использовать раздельную вентиляцию легких, а в конце вентиляции переинтуби-
ровать больного на однопросветную трубку. На наш взгляд, такой подход только
создает дополнительные трудности для анестезиолога, увеличивает риск осложне-
ний, практически не улучшая условий для операции хирургу. Обычная адекватная
вентиляция легких является оптимальным методом во время операций на пищеводе.
При перфорациях пищевода часто повышен риск развития медиастинита.
Необходима готовность к проведению адекватной противошоковой терапии при
развитии септического шока во время операции.
В последнее время удалось значительно улучшить результаты лечения у боль-
ных после операций на пищеводе. Law и соавторы [34] использовали проспектив-
340
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
но собранные данные с целью анализа результатов лечения 421 пациента с внут-
ригрудным плоскоклеточным раком пищевода, которым выполнили резекцию.
Логистический регрессионный анализ идентифицировал возраст, продолжитель-
ность операции и непосредственное местоположение опухоли, как факторы риска
для легочных осложнений, принимая во внимание, что пожилой возраст и более
высокая потеря крови были прогнозирующими факторами смертности. При Сох-
пропорциональном регрессионном анализе, проведенном независимыми экспер-
тами, неблагоприятными факторами риска поздней летальности (после исключе-
ния операционной летальности), по данным Langley S.M. и соавторов [35], были:
вовлечение лимфатических узлов в злокачественный процесс (р = 0,001), неради-
кальная резекция (р = 0,0001), низкодифференцированная опухоль (р = 0,04) и
переливание больше 3 U крови (р = 0,04).
Госпитальная смертность, по данным этих авторов, уменьшилась с 7,8 % в
1980-х годах до 1,1 % (р = 0,001) в начале XXI века, соответственно уменьшилась
средняя кровопотеря во время операции с 700 мл (диапазон: 200—2700 мл) до 450 мл
(диапазон: 100—7000 мл). Согласно данным других американских авторов (2004) [36],
операционная смертность после операций на пищеводе остается на уровне 5,8 %, а по
данным английских авторов [35] — 5,6 %, то есть является весьма высокой. О 30-днев-
ной смертности, достигающей 9,8 %, сообщают Bailey S.H. и соавторы [37], а часто-
та осложнений, по данным этих авторов, достигает 49,5 %. Наиболее частыми пос-
леоперационными осложнениями были: пневмония (21 %), дыхательная недоста-
точность (16 %) с вентиляторной поддержкой длительностью более 48 ч (22 %).
Тяжелые легочные осложнения остаются наиболее частыми после операций
на пищеводе и составляют 15,9 % всех случаев осложнений, они же являются
основной причиной стационарных смертных случаев (55 %) [34]. По данным Atkins B.Z.
и соавторов [36], у 64 % пациентов после операций на пищеводе возникли ослож-
нения, включая расстройства дыхания (28,5 %), анатомические стриктуры (25 %)
и негерметичность анастомоза (14 %). Пожилой возраст, недостаточность анасто-
моза и пневмония были связаны с увеличенным риском смертности. У пациентов
с пневмонией летальность достигала 20 %; в этой же группе пациентов чаще на-
блюдали нарушения глотания и чаще возникала недостаточность анастомоза при
эзофагографии барием по сравнению с пациентами без пневмонии (р < 0,001).
Авторы констатируют, что наиболее тяжелым осложнением после резекций пи-
щевода является пневмония. Стратегия уменьшения послеоперационной леталь-
ности должна включать осторожную оценку нарушений глотания и предрасполо-
женность к аспирации с помощью рентгенокинематографии или волокнисто-оп-
тической эндоскопии. После резекций пищевода перед возобновлением
энтерального питания должны быть восстановлены приемлемая фарингеальная
функция и защита дыхательных путей. Серьезные усилия должны быть направле-
ны на разработку методов, ограничивающих количество переливаемой крови.
По данным Bailey S.H. и соавторов [37], дооперационными предикторами
смертности, основанными на мультивариантном анализе, являются: неоадъюван-
тная терапия, высокий уровень азота мочевины и щелочной фосфатазы, сахарный
диабет, злоупотребление алкоголем, снижение функциональных резервов, асцит и
пожилой возраст; дооперационные факторы увеличения риска осложнений: по-
жилой возраст, одышка, сахарный диабет, ХОЗЛ, уровень щелочной фосфатазы
более 125 ЕД/л, низкая концентрация альбумина в сыворотке крови, снижение
функционального статуса; интраоперационные факторы риска смертности: необ-
ходимость в переливании препаратов крови; интраоперационные факторы риска
341
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
осложнений: необходимость в переливании препаратов крови, значительная про-
должительность операции.
В отделении торакальной хирургии Киевской городской клинической боль-
ницы № 17 в течение 2005—2006 гг. проведено 69 операций по поводу резекций
пищевода, при этом умер один пациент.
Основными методами профилактики осложнений со стороны органов дыха-
ния являются: обеспечение проходимости дыхательных путей после операции (как
правило, с помощью ФБС), ранние активизация и энтеральное питание (через
назогастральный, назоинтестинальный либо через зонд, проведенный в 12-перст-
ную или тощую кишку через гастростому). Важным средством профилактики ос-
ложнений является адекватная интраоперационная коррекция волемии.
Кардиальные осложнения вероятны у больных с внутригрудной пластикой
пищевода желудком, если в ранний послеоперационный период не обеспечена
адекватная декомпрессия желудочного трансплантата.
При медиастинитах, вызванных перфорацией пищевода, основным методом
лечения, наряду с адекватной антибиотике- и противошоковой терапией, является
адекватное дренирование и санация инфекционного очага с применением лаважа
средостения.
16.4. ОПЕРАЦИИ НА ОРГАНАХ СРЕДОСТЕНИЯ
Операции на органах средостения чаще всего выполняют по по-
воду новообразований. Особенностями этого вида операций являются возмож-
ность ранения крупного сосуда с массивным кровотечением, а также гемодинами-
ческая нестабильность на начальном этапе наркоза вследствие сдавления крупных
сосудов опухолью. При этом виде операций увеличен риск повреждения крупных
дыхательных путей во время операции (трахеи и главных бронхов), поэтому необ-
ходима готовность к продвижению интубационной трубки ниже повреждения или
к проведению однолегочной вентиляции.
У больных с патологией вилочковой железы (тимомой, гиперплазией) увели-
чен риск миастеноподобного синдрома в послеоперационный период с необходи-
мостью длительной ИВЛ.
По данным Bechard Р. и соавторов [38], частота интраоперационных сердеч-
но-легочных и послеоперационных дыхательных осложнений при операциях на
средостении составляет, соответственно, 3,8 и 10,5 %. Высокий риск ранней пос-
леоперационной угрозы развития опасных для жизни дыхательных осложнений
наблюдали у 6,7 % больных. Высок риск периоперационных осложнений при на-
личии сердечно-легочных симптомов в дооперационном периоде, сочетании об-
структивного и констриктивного компонентов (при исследовании функции лег-
ких), компрессии трахеи (> 50 %), выпоте в полость перикарда или сочетании
обоих признаков (на основании результатов КТ).
16.5. ОПЕРАЦИИ НА ДИАФРАГМЕ
Чаще всего операции на диафрагме выполняют по поводу ее релаксации или
наличия диафрагмальных грыж. При кажущейся простоте обеспечения этих опе-
раций необходимо знать некоторые особенности. Когда органы брюшной полости
(желудок, кишки, селезенка) перемещаются в плевральную полость (в случае гры-
342
16. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ТОРАКАЛЬНЫХ ОПЕРАЦИЙ
жи) или располагаются в грудной полости ниже релаксированного отдела диаф-
рагмы, то быстрое восстановление анатомических структур (перемещение в брюш-
ную полость) вызывает значительное увеличение в ранний послеоперационный
период внутрибрюшного давления с затруднением функции противоположного
(как правило, правого купола диафрагмы). Для восстановления функции легкого
на больной стороне, которое было длительно коллабировано, необходимо какое-
то время, поэтому возможно развитие тяжелой дыхательной недостаточности, тре-
бующей проведения длительной ИВЛ (иногда в течение 2—3 недель).
Для профилактики дыхательной недостаточности проводят декомпрессию
желудка с помощью назогастрального зонда, используют эпидуральную аналге-
зию в послеоперационный период, которая быстрее нормализует моторику ки-
шечника, применяют другие методы борьбы с метеоризмом для понижения внут-
рибрюшного давления.
У бальных с ущемлением диафрагмальной грыжи высок риск регургитации при
вводном наркозе и аспирации желудочного содержимого, если ущемленным орга-
ном является желудок. Часто в подобных случаях во время предоперационной под-
готовки не удается ввести зонд в ущемленный желудок, а после введения миорелак-
сантов ущемленный участок раскрывается и возникает массивная регургитация.
ЛИТЕРАТУРА
1. Brunetti A., Al Refai М., Monteverde М. et al. Predictors of early morbidity after major
lung resection in patients with and without airflow limitation. Ann Thorac. Surg., 2002 Oct;
74 (4):999-1003.
2. Benumof J.L., Alfery D.D. Anesthesia for Thoracic Surgery. In: Miller R.D. Anesthesia.
4th Ed., Churchill Livingstone, 1994, V.2, p. 1663—1755.
3. Win T., Jackson A., Sharpies L. et al. Cardiopulmonary exercise tests and lung cancer
surgical outcome. Chest. 2005 Apr; 127 (4): 1159—65.
4. Datta D., Lahiri B. Preoperative evaluation of patients undergoing lung resection
surgery. Chest., 2003 Jun; 123 (6):2096—103.
5. Burke J.R., Duarte LG., Thourani V.H., Miller J.LJr. Preoperative risk assessment for
marginal patients requiring pulmonary resection. Ann Thorac. Surg., 2003 Nov; 76 (5): 1767—73.
6. Hedenstiema G. Pulmonary perfusion during anesthesia and mechanical ventilation.
Minerva Anestesiol., 2005 Jun; 71 (6):319—24.
7. Michelet P., Roch A., Brousse D. et al. Effects of PEEP on oxygenation and respiratory
mechanics during one-lung ventilation. Br. J. Anaesth., 2005 Aug; 95 (2):267—73.
8. Silva-Costa-Gomes T., Gallart L. et al. Low- vs high-dose almitrine combined with
nitric oxide to prevent hypoxia during open-chest one-lung ventilation. Br. J. Anaesth., 2005
Sep; 95 (3):410—6.
9. Dalibon N., Moutafis M. Liu N. et al. Treatment of hypoxemia during one-lung ventilation
using intravenous almitrine. Anesth. Analg., 2004 Mar; 98 (3):590—4.
10. Della Rocca G., Coccia C. Nitric oxide in thoracic surgery. Minerva Anestesiol., 2005
Jun; 71 (6):313-8.
11. Schilling T., Kozian A., Huth C. The pulmonary immune effects of mechanical ven-
tilation in patients undergoing thoracic surgery. Anesth. Analg., 2005 Oct; 101 (4):957—65.
12. Benumof J.L. Anesthesia for Thoracic Surgery. Philadelphia:W.B. Saunders, 1997.
13. Core A.F., Fortier J.D., Perreault M.-A., PharandA. Anesthesia for Thoracic Surgery.
In: J.D. Cole, M. Schlunt. Adult Perioperative Anesthesiology. Elseivier Mosby, 2004.
14. Seymour A.H., Prasad B., McKenzie R.J. Audit of double-lumen endobronchial
intubation. Br. J. Anaesth., 2004 Oct; 93 (4):525—7.
15. Benumof J.L., Alfery D.D. Anesthesia for Thoracic Surgery. In: Miller R.D., Anesthesia,
5th ed. New York: Churchill Livingstone, 2000.
343
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
16. Chhajed P.N., Eberhardt R., Dienemann H. et al. Therapeutic bronchoscopy interventions
before surgical resection of lung cancer. Ann Thorac. Surg., 2006 May; 81 (5):1839—43.
17. Song S. W., Lee H.S., Kim M.S. et al. Preoperative serum fibrinogen level predicts
postoperative pulmonary complications after lung cancer resection. Ann Thorac. Surg., 2006
Jun; 81 (6): 1974-81.
18. Licker M.J., Widikker L, Robert J. et al. Operative mortality and respiratory
complications after lung resection for cancerimpact of chronic obstructive pulmonary disease
and time trends. Ann Thorac. Surg., 2006 May; 81 (5):1830—7.
19. Fukuse T, Satoda N., Hijiya K, Fujinaga T. Importance of a comprehensive geriatric
assessment in prediction of complications following thoracic surgery in elderly patients. Chest.,
2005 Mar; 127 (3):886—91.
20. CoreA.V, Fortier J.D., Perreault M.-A., PharandA. Anesthesia for Thoracic Surgery. In:
J.D., Cole M. Schlunt. Adult Perioperative Anesthesiology. Elseivier Mosby, 2004, pp. 227—246.
21. Palermo S., Gastaldo P., Malerbi P. et al. Perioperative analgesia in pulmonary surgery.
Minerva Anestesiol.? 2005 Apr; 71 (4):137—46.
22. Senturk M., Ozcan P.E., Talu G.K et al. The effects of three different analgesia
techniques on long-term postthoracotomy pain. Anesth. Analg., 2002 Jan; 94 (1):11—5.
23. Detterbeck F. C. Efficacy of methods of intercostal nerve blockade for pain relief after
thoracotomy. Ann Thorac. Surg., 2005 Oct; 80 (4): 1550—9.
24. Marret E., Bazelly B., Taylor G. et al. Paravertebral block with ropivacaine 0.5% versus
systemic analgesia for pain relief after thoracotomy. Ann Thorac. Surg., 2005 Jun; 79 (6):2109—13.
25. Luketich J.D., Land S.R., Sullivan E.A. et al. Thoracic epidural versus intercostal
nerve catheter plus patient-controlled analgesia:a randomized study. Ann Thorac. Surg., 2005
Jun; 79 (6): 1845-9.
26. Hollaus P.H., Wilfing G., Wumig P.N., Pridun N.S. Risk factors for the development
of postoperative complications after bronchial sleeve resection for malignancy:a univariate
and multivariate analysis. Ann Thorac. Surg., 2003 Mar; 75 (3):966—72.
27. Miller D.L., Deschamps C., Jenkins G.D. et al. Completion pneumonectomyifactors
affecting operative mortality and cardiopulmonary morbidity. Ann Thorac. Surg., 2002 Sep;
74 (3):876—83.
28. De Decker K, Jorens P.G., Van SchilP. Cardiac complications after noncardiac thoracic
surgery:an evidence-based current review. Ann Thorac. Surg., 2003 Apr; 75 (4): 1340—8.
29. Cetfolio R.J., Bryant A. S., Thurber J.S. etal. Intraoperative solumedrol helps prevent
postpneumonectomy pulmonary edema. Ann Thorac. Surg., 2003 Oct; 76 (4): 1029—35.
30. Lanza LA., Visbal A.L., De Valeria PA. et al. Low-dose oral amiodarone prophylaxis
reduces atrial fibrillation after pulmonary resection. Ann Thorac. Surg., 2003 Jan; 75 (1):223—30.
31. Amar D., Zhang H., Heerdt P.M. et al. Statin use is associated with a reduction in
atrial fibrillation after noncardiac thoracic surgery independent of C-reactive protein. Chest.,
2005 Nov; 128 (5):3421—7.
32. Chee T.P., Prakash N.S., Desser K.B., Benchimol A. Postoperative supraventricular
arrhythmias and the role of prophylactic digoxin in cardiac surgery. Ann Heart J., 1982,
104:974-7.
33. Chung D.C. Anaesthetic problems associated with the treatment of cardiovascular
disease: Digitalis toxicity. Can. Anaesth. Soc. J., 1981, 28:6—16.
34. Law S., Wong K.H., Kwok KF. et al. Predictive factors for postoperative pulmonary com-
plications and mortality after esophagectomy for cancer. Ann Surg., 2004 Nov; 240 (5):791—800.
35. Langley S.M., Alexiou C, Bailey D.H., Weeden D.F. The influence of perioperative
blood transfusion on survival after esophageal resection for carcinoma. Ann Thorac. Surg.,
2002 Jun; 73 (6): 1704-9.
36. Atkins B.Z., Shah A.S., Hutcheson KA. et al. Reducing hospital morbidity and mortality
following esophagectomy. Ann Thorac. Surg., 2004 Oct; 78 (4):1170—6.
37. Bailey S.H., Bull DA., Harpole D.H. et al. Outcomes after esophagectomy:a ten-year
prospective cohort. Ann Thorac. Surg., 2003 Jan; 75 (1):217—22.
38. Bechard P., Letourneau L., Lacasse Y. et al. Perioperative cardiorespiratory
complications in adults with mediastinal mass:incidence and risk factors. Anesthesiology, 2004
Apr; 100 (4):826—34.
344
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
Операции по поводу заболеваний и травм органов брюшной
полости составляют около 60 % от всех оперативных вмешательств,
выполняемых в хирургических стационарах (Суховецкий А.В., 2004;
Трещинский А.И., Шлапак И.П., 1997); из них более 70 % —
экстренные оперативные вмешательства, сопровождающиеся слож-
ным патофизиологическим фоном, способным изменить течение
и исход традиционной анестезии.
17.1. ПРИКЛАДНАЯ ФИЗИОЛОГИЯ
ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ
С учетом принятой жидкости в норме за сутки через пищева-
рительный тракт проходит 8—10 л жидкости (табл. 17.1).
Таблица 17.1. Объем секрета и концентрация электролитов
в пищеварительном тракте (Henderson J.M., 1997)
Секрет Объем, л/сут Na+, ммоль/л Ка+, ммоль/л er, ммоль/л НСО3-, ммоль/л
Слюна 1,5 14 21 24 8
Желудочный сок 2,5 125 25 300 0
Содержимое желу- дочного пузыря 0,7 105 4 70 25
Секрет поджелу- дочной железы 1,5 125 5 70 70
Секрет тонкой кишки 1,0 435 15 300 90
Всего 7,2 804 70 764 193
В тонкой кишке происходит всасывание воды около 8,5 л/сут,
в толстой кишке — 1,0—1,5 л/сут; с калом выделяется около 100 мл
345
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
воды. Перемещение воды в просвет и из просвета пищеварительного тракта про-
исходит пассивно по осмотическому градиенту, который создается активным транс-
портом электролитов. Именно ионный транспорт обеспечивает абсорбцию и сек-
рецию воды. После попадания химуса из желудка в 12-перстную кишку вода из
плазмы крови через слизистую оболочку поступает в просвет кишки, обеспечивая
изотоничность содержимого. В просвете 12-перстной кишки концентрации Na+
(145 ммоль/л) и СГ (105 ммоль/л) соответствуют плазменной.
В тонкой кишке содержание Na+ прогрессивно снижается, достигая в под-
вздошной кишке значения около 130 ммоль/л. В толстой кишке за счет снижения
проницаемости слизистой оболочки, препятствующей обратной диффузии Na* и
воды в просвет кишки, концентрация Na+ составляет всего 30 ммоль/л.
Концентрация К+ в содержимом тонкой кишки не превышает 5—10 ммоль/л.
Благодаря активной и пассивной секреции, концентрация ионов калия в толстой
кишке повышается до 80 ммоль/л.
Из-за активного всасывания концентрация СГ прогрессивно уменьшается в
дистальном направлении, достигая 60—70 ммоль/л в илеоцекальном клапане и
20 ммоль/л — в толстой кишке.
Ионообмен хлора и бикарбонатов обеспечивает повышение концентрации
НСО" по мере продвижения химуса к дистальным отделам тонкой кишки.
Таким образом, нормальное функционирование пищеварительного тракта обес-
печивает стабильность водно-электролитного обмена в организме, а патологичес-
кие состояния сопровождаются расстройствами, представляющими в ряде случаев
серьезную угрозу для жизни больного (табл. 17.2).
Таблица 17.2. Суточная потеря секрета и содержащихся в нем электролитов
при патологических расстройствах (Хлябич Г.Н., 1992)
Секрет или состояние Потеря при патологии, мл Na*, ммоль/л К*, ммоль/л СГ, ммоль/л
Пот до 2000 58 10 45
Желудочный сок до 5000 59 9 85
Желчь до 1000 145 5 100
Секрет поджелудочной железы до 1500 141 5 77
Секрет тонкой кишки до 500 105 5 99
Диарея до 5000 80-105 20 и более 50-100
Динамика функциональных и метаболических нарушений при заболеваниях
и повреждениях органов брюшной полости зависит от вида нозологии, длительно-
сти патологического процесса, исходных компенсаторных возможностей организ-
ма, сопутствующей соматической и возрастной патологий.
В плановой хирургии анестезиолог имеет достаточный запас времени для ка-
чественной подготовки больного к операции и анестезии. При экстренных опе-
ративных вмешательствах подготовка к операции длится не более 2—3 ч, при этом
выбор правильного алгоритма дооперационной интенсивной терапии зависит от
точности оценки тяжести состояния больного, основанной на знании патофизио-
логических особенностей различных заболеваний.
346
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
Признаки непроходимости тонкой кишки: рвота, кишечник проксимальнее об-
струкции расширен газом и жидкостью, ишемия кишечной стенки вследствие отека
(угроза некроза и перфорации), гиповолемия, гипокалиемия.
Признаки непроходимости толстой кишки при нормальном функционировании
илеоцекального клапана: расширение кишечника (особенно восходящей и попереч-
ной ободочных, слепой кишок), угроза ишемии и перфорации кишечной стенки,
дегидратация, расстройства обмена электролитов.
Признаки непроходимости толстой кишки при недостаточности илеоцекального
клапана: рвота кишечным содержимым, дегидратация, расстройства обмена элек-
тролитов.
17.2. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Оценка операционного риска и предоперационная подготовка
Программа подготовки к любому экстренному хирургическому вме-
шательству основана на оценке тяжести расстройств водно-электролитного обме-
на, выраженности метаболических расстройств, анемии, степени функциональ-
ных или органических поражений почек, печени, сердечно-сосудистой и дыха-
тельной систем. При сборе анамнеза уточняют данные о потере жидкости.
Причины дегидратации у больных с желудочно-кишечными расстройствами: сни-
жение потребления жидкости, рвота, понос, паралитический илеус, воспаление и
отек кишечника.
При язвах и новообразованиях желудочно-кишечного тракта, варикозном рас-
ширении вен пищевода, дивертикулитах, ангиодисплазиях или геморрое возмож-
но снижение ОЦК вследствие кровотечения. При непроходимости кишечника зна-
чительная потеря объема жидкости происходит за счет рвоты и секвестрации жид-
кости в просвете кишечника. При перитоните и сепсисе значительные объемы
жидкости задерживаются в интерстиции. При лихорадке резко возрастает потеря
жидкости за счет потоотделения. Сопутствующая диарея может обусловить поте-
рю до 2 л экстракционной (внеклеточной) жидкости.
Дефицит ОЦК при легкой и умеренной гиповолемии определяют по качеству
наполнения пульса, изменениям ЧСС и АД. При тяжелой гиповолемии выражена
сухость слизистых оболочек, снижены тургор и температура кожи, в положении боль-
ного на спине появляются тахикардия и артериальная гипотензия (табл. 17.3).
Таблица 17.3. Изменения АД и ЧСС при гиповолемии (Березницкий Я.С.
и соавторы, 2003)
Дефицит ОЦК Положение больного
МЛ % на спине сидя
АД ЧСС АД чсс
500 5 N N N N или?
1000 10-15 N N или Т N или Т т
1500 20 N или г т г г t
2000 30 т гг тт
347
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Для оценки тяжести водно-электролитных расстройств используют данные
лабораторной диагностики. Исследуют показатели: гематокрит, общий гемогло-
бин, эритроциты, общий белок, соотношение азота мочевины крови к креатинину
сыворотки крови, средний объем эритроцитов и средняя концентрация гемогло-
бина в них, концентрации электролитов, осмолярность сыворотки крови. Анализ
динамики отклонений этих показателей от нормы дает представление о виде воз-
никших расстройств (табл. 17.4).
Таблица 17.4. Динамика лабораторных показателей
при различных видах дегидратации
Показатель Норма Вид дегидратации
гипер- тоническая изотоническая гипо- тоническая
Количество эритроцитов 4,5-4,9 х 1012/л т т ?
Общий гемоглобин 150 г/л т т т
Гематокрит муж. 45 % жен. 42 % N или Т т п
Средний объем эритро- цита (СОЭр или MCV) 80-95 фентолитров г N т
Среднее содержание гемоглобина в эритроците (СГЭилиМСН) 27-37 пг т N г
Общий белок, г/л 60-80 т т т
Na+ плазмы, ммоль/л 135-146 более 147 135-146 менее 135
В зависимости от клинических проявлений дегидратация бывает 3 степеней
тяжести. Для определения степени тяжести дегидратации и объема растворов для
инфузионной терапии используют пробу на гидрофильность тканей по Шелестю-
ку П.И.: после обработки кожи антисептиком в переднюю поверхность предпле-
чья внутрикожно вводят 0,25 мл 0,9 % раствора хлорида натрия и отмечают время
до полного рассасывания образовавшейся “лимонной корки”, которое соответ-
ствует определенной степени дегидратации (табл. 17.5).
Таблица 17.5. Степень тяжести дегидратации и соответствующий объем инфузионной
терапии по Шелестюку П.И.
Степень дегидратации Время рассасывания «лимонной корки», мин Количество жидкости, мл/кг/сут Суточное количество растворов для инфузии (маса пациента 70 кг), мл
1 40-30 50-80 3550-5660
2 29-15 81-120 5640-8400
3 14-5 121-160 8440-11200
Восполнение дефицита ОЦК при дегидратации обычно проводят физиологи-
ческим раствором, 5 % раствором глюкозы и сбалансированными солевыми ра-
348
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
створами (Рингера, Хартмана, Дарроу) в равных частях. После восполнения не
менее 1/3 расчетного объема, как правило, начинают проведение оперативного
пособия.
Приступая к наркозу, анестезиолог должен помнить об угрозе развития кис-
лотно-аспирационного синдрома или синдрома Мендельсона. Последний возникает
вследствие аспирации желудочного содержимого и последующего кислотного ожога
слизистой оболочки дыхательных путей. Это обуславливает нарушение функции
эпителия трахеи, бронхов, стенок альвеол и эндотелия капиллярной сети с после-
дующей экстравазацией плазменной части крови в интерстиций легочной ткани и
полость альвеол, что приводит к быстрому развитию ОРДС. Несмотря на много-
компонентную интенсивную терапию и ИВЛ, более 80 % больных, у которых
развился синдром Мендельсона, погибает при явлениях полиорганной недоста-
точности (Буров Н.Е., 1995).
Периоды анестезиологического пособия с высоким риском возникновения рвоты и
регургитации: период индукции; период поддержания анестезии с применением
обычной лицевой или ларингеальной маски при сохранении спонтанного дыха-
ния на фоне угнетения ларингеального рефлекса; период поддержания анестезии
на фоне ИВЛ в случаях нарушения герметичности надувной манжеты эндотрахе-
альной трубки, когда создают эффект присасывания во время фазы выдоха (скры-
тая регургитация); период экстубации на фоне неполного восстановления рефлек-
сов, угнетения сознания, дыхания и мышечного тонуса.
Основным барьером для желудочно-пищеводного рефлюкса является нижний
сфинктер пищевода. Развитие рефлюкса зависит от тонуса сфинктера и градиента
давления между желудком и пищеводом.
Причины снижения тонуса нижнего сфинктера пищевода: ожирение, бере-
менность (в III триместре эвакуация пищи может задерживаться на 10—12 ч, со
2-3-й недели беременности в связи со снижением продукции гастрина и повыше-
нием секреции прогестерона возникают снижение моторики желудка и гипотония
кардиального сфинктера пищевода), сахарный диабет, ОПН (высокий уровень га-
стрина), грыжи пищеводного отверстия диафрагмы, желудочно-пищеводный реф-
люкс (изжога при эзофагите, дивертикулите, язвенной болезни желудка и 12-перст-
ной кишки, гастрите, энтероколите), асцит.
Предшествующий прием лекарственных средств может существенно повли-
ять на тонус нижнего пищеводного сфинктера. На скорость эвакуации содержи-
мого желудка оказывают влияние многие факторы (табл. 17.6).
©Увеличивают тонус нижнего сфинктера пищевода: метоклопрамид, неостиг-
мин, сукцинилхолин, панкурониум, гистамины, антациды.
Понижают тонус нижнего сфинктера пищевода: атропин, опиоидные анал-
гетики, ингаляционные анестетики (галотан, энфлюран), тиопентал-натрий,
допамин, ганглиоблокаторы.
Повышенное внутрибрюшное давление является значимым фактором риска воз-
никновения кислотно-аспирационного синдрома. Внутрибрюшное давление по-
вышено при: беременности (особенно в III триместре), ожирении, давлении на
область живота извне, попадании газонаркотической смеси в желудок (дыхании
через плотно прилегающую маску), фибрилляции мышц передней брюшной стен-
349
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ки (после быстрого введения деполяризующих миорелаксантов), вздутии живота,
парезе кишечника.
Таблица 17.6. Факторы, влияющие на скорость эвакуации желудочного содержимого
Факторы Влияние на эвакуацию
Ускорение Замедление
Физиологические Растяжение желудка, невроз Пища, кислота, беременность
Патологические Тиреотоксикоз Чувство тревоги, страха, шок, сахарный диабет, стенокардия
Фармако- логические Метоклопрамид, прозерин, никотин (курение) Опиоиды, алкоголь, антихолинергические препараты, трициклические антидепрессанты
Система профилактики развития аспирационного пневмонита состоит из обя-
зательного выполнения определенных организационно-технических приемов во
время анестезии, а также проведения специальной медикаментозной и антацид-
ной предоперационной подготовки (Буров Н.И., 1995). Так, перед плановыми
операциями ограничивают прием твердой пищи за 10 ч и жидкости за 2-3 ч до
операции. Перед экстренными операциями опорожняют желудок с помощью зон-
да. Противопоказаниями к данной манипуляции служат желудочное или пище-
водное кровотечение, прободная язва желудка или 12-перстной кишки, экламп-
сия, угроза разрыва матки, отслоение плаценты. Если больной отказывается от
введения зонда, то анестезиолог обязан сделать соответствующую запись в исто-
рии болезни во время предоперационного осмотра больного.
Премедикация
При плановых операциях антацидную подготовку начинают не позже, чем за
2 ч до наркоза. Для снижения секреции желудка и усиления моторики кишечника
назначают антагонисты гистаминовых рецепторов: циметидин (200—400 мг внутрь,
в/м или в/в) или ранитидин (150—300 мг внутрь или 50—150 мг в/в, в/м). За 30 мин
до наркоза больному назначают 2 чайные ложки альмагеля, который, соединяясь
с соляной кислотой желудка, образует нерастворимый хлористый алюминий. После
приема альмагеля pH желудочного содержимого составляет около 3,0, после Н,-
блокаторов гистаминовых рецепторов и альмагеля — около 6,0. Альмагель можно
заменить “жженой магнезией” (смесь 25 г карбоната магния и 25 г бикарбоната
натрия) за 15—20 мин до наркоза (1—2 чайные ложки смеси в 1/4 стакана воды
внутрь). При наличии противопоказаний к введению желудочного зонда дозу “жже-
ной магнезии” увеличивают в 2 раза. Кроме этого, используют растворимый анта-
цид — раствор бицитрата (смесь цитрата натрия и лимонной кислоты), 30-60 мл
за 30 мин до вводного наркоза).
За 60 мин до вводного наркоза вводят метоклопрамид — антагонист дофами-
новых рецепторов. В дозе 10 мг внутрь он ускоряет опорожнение желудка вслед-
ствие повышения тонуса нижнего сфинктера пищевода и одновременного рас-
слабления привратника. Также препарат вводят внутривенно непосредственно в
операционной, но его быстрое введение может спровоцировать абдоминальную
колику. Противопоказанием к назначению метоклопрамида является механичес-
350
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
кая кишечная непроходимость, так как препарат в этом случае способен усилить
обратную перистальтику.
Применяют следующие схемы премедикации:
• “легкая” — диазепам (5—10 мг внутрь за 1 ч до анестезии);
• “средняя” — мидазолам (1—2 мг в/в) в сочетании с фентанилом (25-100 мкг в/в)
на операционном столе;
• “тяжелая” — диазепам (10 мг внутрь за 1—2 ч до операции) в сочетании
с морфином (0,1 мг/кг) и скополамином (0,2—0,4 мг) в/м за 30—60 мин до
операции.
17.3. ИНТРАОПЕРАЦИОННЫЙ ПЕРИОД
Вводный наркоз. Всех больных, которым проводят абдоминаль-
ные операции по экстренным показаниям, рассматривают, как потенциально
имеющих полный желудок. Им проводят быструю последовательную индукцию
в наркоз.
Показания к быстрой последовательной индукции: ожирение, асцит, грыжи
пищеводного отверстия диафрагмы с клиническими проявлениями, кишечная
непроходимость, беременность (II—III триместр), травмы с возможностью за-
держки опорожнения желудка, период после последнего приема пищи до трав-
мы менее 8 ч.
Быстрая последовательная индукция требует специального технического ос-
нащения: электроотсос с широким тонзиллярным наконечником, ларингоскоп с
прямыми и изогнутыми клинками разных размеров, эндотрахеальные трубки раз-
ных размеров с проводниками.
До наркоза больному на операционном столе придают положение Фовлера
(Fowler): полусидя, когда головной конец операционного стола поднят на 50 см
(уровень щитовидного хряща по горизонтали выше уровня эпигастральной об-
ласти).
Проводят прекураризацию субапнойными дозами недеполяризующих миоре-
лаксантов, например ардуаном 1 мг, затем — преоксигенацию высоким потоком
кислорода в течение 3—5 мин. Для преоксигенации не используют плотную ма-
сочную вентиляцию, так как она создает угрозу попадания газовой смеси в желу-
док, его перерастяжения, рвоты и аспирации. Шею больного разгибают, что обес-
печивает расположение трахеи непосредственно кпереди от пищевода.
Вводный наркоз осуществляют внутривенным введением анестетиков. Одно-
временно ассистент выполняет прием Селлика — выраженное нажатие пальцами
на перстневидный хрящ, что позволяет сдавить и пережать пищевод без наруше-
ния проходимости гортани. Прием Селлика осуществляют до полного подтверж-
дения успешной интубации трахеи.
Вводят деполяризующие миорелаксанты. После расслабления шейных и же-
вательных мышц производят быструю интубацию трахеи, раздувают манжету эн-
дотрахеальной трубки до полной герметизации и начинают ИВЛ.
©Если в момент ларингоскопии началась регургитация, то эндотрахеальную
трубку вводят в пищевод и раздувают манжету. Не извлекая ларингоскопа,
санируют полость рта и проводят интубацию трахеи второй, заранее приго-
товленной трубкой
351
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
В абдоминальной хирургии выбор метода анестезии зависит от состояния боль-
ного, экстренности, характера и объема оперативного вмешательства, квалифика-
ции и опыта анестезиолога и хирурга (рис. 17.1).
ПРЕИМУЩЕСТВА
Обеспечение
проходимости
дыхательных путей и
адекватной
вентиляции, быстрое
введение в анестезию,
возможность
управления ее глубиной
и продолжительностью
Уменьшение дозы общих
анестетиков (сохранение
энергетических ресурсов
миокарда), ускорение
пробуждения больного,
снижение частоты возник-
новения рвоты, минималь-
ная депрессия дыхания
(также в ранний после-
операционный период)
Сохранение речевого
контакта с больным,
снижение риска аспирации
вследствие сохранности
рефлексов с дыхательных
путей,сохранение
оптимальной перфузии
кишечника вследствие
полной симпатической
блокады
КОМБИНИРОВАННАЯ
АНЕСТЕЗИЯ:
РЕГИОНАРНАЯ
АНЕСТЕЗИЯ:
ОБЩАЯ АНЕСТЕЗИЯ
сочетанное применение
эпидуральной и общей
анестезий
спинальная, эпидуральная,
каудальная, блокада нервных
стволов и сплетений
Риск аспирации при
плановых и экстренных
операциях вследствие
угнетения рефлексов с
дыхательных путей,
нестабильность
гемодинамики
вследствие побочных
эффектов общих
анестетиков
Симпатическая блокада
может усилить гиповолемию
и осложнить
дифференциальную
диагностику
интраоперационной
гипотензии, постановка
эпидурального катетера
удлиняет время подготовки
больного к операции,
абсолютные и относительные
противопоказания к
эпидуральной и спинальной
анестезии вследствие
побочных эффектов общих
анестетиков
Токсическое действие
местных анестетиков при
случайном внутрисосудистом
введении, переход на общую
анестезию при
неэффективности блокады,
угроза нестабильности
гемодинамики
(возникновение выраженной
гипотензии и брадикардии за
счет расширения венозного
русла), вероятность
респираторной дисфункции
при высокой торакальной
блокаде
НЕДОСТАТКИ
Рис. 17.1. Преимущества и недостатки общей, комбинированной и регионарной анестезий
352
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
Эпидуральная и спинальная анестезии имеют общие противопоказания
(см. разделы 13.2, 13.3). Хирургические вмешательства в области нижней части
живота выполняют на фоне регионарной анестезии, выключающей чувствитель-
ность на уровне Th4—Th6. Однократное введение анестетика в эпидуральное про-
странство возможно только при операциях длительностью не более 2—3 ч. Катете-
ризация эпидурального пространства и длительное капельное или фракционное
введение местного анестетика позволяют достичь адекватного обезболивания во
время оперативного вмешательства и в послеоперационный период. Спинальную
анестезию также выполняют однократным введением местного анестетика или
путем длительного капельного введения через катетер.
Адекватность анестезии в абдоминальной хирургии усиливают блокадой нерв-
ных стволов и сплетений. Так, двусторонняя блокада VIII—XI межреберных нервов
приводит к потере соматической чувствительности, а блокада чревного сплетения
обеспечивает висцеральную анестезию (эту методику используют при холецистэк-
томиях). Блокады подвздошно-пахового, подвздошно-подчревного и бедренно-по-
лового нервов обеспечивают анестезию, достаточную для выполнения операций
при паховых грыжах. Вместе с тем, блокада чревного сплетения не обеспечивает
полной анестезии при тракциях органов верхней части живота. Доказано, что при
операциях выше пупка одной регионарной анестезии недостаточно. Для эффектив-
ности спинальной или эпидуральной анестезии необходимо обеспечить выключе-
ние чувствительности на уровне Th2—Th6, но эти манипуляции вызывают паралич
межреберных мышц, что затрудняет глубокое дыхание больного.
17.4. ОПЕРАЦИИ НА ЖЕЛУДКЕ
Наиболее часто выполняют операции резекции желудка, ушива-
ния перфорации желудка или 12-перстной кишки, операции при пептических яз-
вах, дуоденотомии.
Предоперационный период
Тактику проведения оперативного вмешательства определяют в зависимости
от экстренности проведения операции. Пациенты, которым проводят ургентную
операцию (наиболее часто по поводу желудочно-кишечного кровотечения или
перфорации), как правило, гемодинамически нестабильны и требуют быстрой
предоперационной подготовки и соответствующей водной нагрузки. Необходимо
помнить о вероятности “полного желудка” и у пациентов, которым проводят пла-
новую операцию. У пациентов с желудочно-кишечными кровотечениями высока
вероятность развития аспирации крови и желудочного содержимого с последую-
щей дыхательной недостаточностью.
Проводят коррекцию волемии перед индукцией в анестезию. При рвоте, диа-
рее или желудочно-кишечных кровотечениях, как правило, диагностируют гипо-
волемию, снижение тургора кожи, АД и диуреза. Потеря жидкости через кишеч-
ник приводит к нарушениям выделительной функции почек и электролитным
нарушениям, коррекцию которых начинают до операции. Вследствие потери жид-
кости через кишечник, вероятны дегидратация и полицитемия.
Проводят премедикацию (см. раздел 17.2). Назначают Н2-блокаторы гистами-
новых рецепторов, метоклопрамид (10 мг в/в за 1 ч до операции), натрия цитрат
(30 мл за 15—30 мин до индукции).
12 7-585
353
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Интраоперационный период
Анестезиологическое обеспечение: общая анестезия с миорелаксацией и ИВЛ в
комбинации с эпидуральной послеоперационной аналгезией или без нее. Если пла-
нируют проведение послеоперационной эпидуральной аналгезии, то введение эпи-
дурального катетера осуществляют до индукции в анестезию. С целью верифика-
ции положения катетера в эпидуральном пространстве вводят 5—7 мл 1 % раствора
лидокаина через эпидуральный катетер с достижением сегментарного блока.
Обеспечивают стандартный мониторинг: ЧСС, АД, капнометрия, ЭКГ в 5 отве-
дениях, пульсоксиметрии, внешнее наблюдение за больным, темп диуреза, уро-
вень ЦВД (при необходимости).
Индукция в наркоз. Пациенты с заболеваниями желудка или желудочно-кишечны-
ми кровотечениями подвержены риску легочной аспирации, поэтому их интубируют в
сознании или используют быструю последовательную ивдукцию с выполнением при-
ема Селлика. Титруют индукционную дозу гипнотика: тиопентал-натрий (3—5 мг/кг),
пропофол (1,5—2,5 мг/кг, возможно увеличение дозы), этомидат (0,2—0,4 мг/кг).
Поддержание анестезии
Сбалансированная анестезия: на фоне оксигенации 100 %
увлажненным кислородом вводят промедол (0,5—1,5 мг/кг в течение 3—4 ч) или
фентанил (1—10 мкг/кг/ч) в сочетании с изофлюраном (0,5 %) или пропофолом
(50—200 мкг/кг/мин).
Тотальная внутривенная анестезия: на фоне оксигенации 100 %
увлажненным кислородом проводят инфузию кетамина (час — 1 мг/мин/кг, сле-
дующие 1—4 ч — 0,6 мг/мин/кг, 4-й час и более — 0,4 мг/мин/кг, инфузию пре-
кращают за 15—30 мин до конца операции) и пропофола (первые 10 мин — 140-
200 мкг/кг/мин, следующие 2 часа — 100—140 мкг/кг/мин, после 2 часов — 80-
120 мкг/кг/мин, инфузию прекращают за 5—10 мин до конца операции).
Дозы препаратов на различных этапах анестезии приведены в табл. 17.7.
Таблица 17.7. Дозы препаратов для анестезии, вводимые в режиме инфузии
(Гласс П., 1995)
Цель введения Название препарата Индукционная доза, мкг/кг Нагрузочная доза, мкг/кг Поддерживающая доза, мкг/мин
Гипнотик пропофол 1,0-2,0 — 80-160
мидазолам 1,0-2,0 — 0,5-1,5
Аналгетик кетамин — 250-750 10-30
фентанил — 3-6 0,02-0,04
Комбинированная анестезия: 12—15 мл 1,5—2 % раствора
лидокаина каждые 60 мин вводят в эпидуральный катетер; общую анестезию при-
меняют в качестве приложения к регионарной, для обеспечения амнезии. При
эпидуральном введении опиоидных аналгетиков дозы системных седативных пре-
паратов (дроперидола, опиатов, бензодиазепинов и т. д.) уменьшают. Если опиаты
назначают для послеоперационной аналгезии, то нагрузочную дозу опиатов вво-
дят не менее чем за 1 ч до завершения операции.
Решение об экстубации в конце оперативного вмешательства принимают на ос-
новании оценки сердечно-сосудистой и легочной систем и длительности операции.
К моменту экстубации пациент должен быть гемодинамически стабилен, согрет, с
354
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
восстановленным мышечным тонусом и сознанием. Продленную ИВЛ проводят, когда
пациент неспособен самостоятельно поддерживать проходимость дыхательных путей
или функция дыхания восстановлена не полностью (ЖЕЛ менее 15 мл/кг, макси-
мальное инспираторное усилие до 25 см вод. ст., ЧДД менее 25 в мин).
Инфузионно-трансфузионная терапия. При прогнозируемых больших потерях
ОЦК для венозного доступа используют катетер диаметром 14—16 G. Инфузион-
ные растворы согревают. Предусматривают заготовку до 1 л эритроцитарной массы.
Тромбоцитарную массу, криопреципитат и свежезамороженную плазму назнача-
ют при необходимости.
Осложнения: кровотечение, гипоксемия, снижение ФОЕ.
Послеоперационный период
Осложнения: ателектазы, кровотечение, паралитическая кишечная непрохо-
димость (илеус), гипотермия.
Обезболивание: эпидуральная аналгезия или метод КПА (табл. 17.8, 17.9, а
также раздел 11.4.2.3).
Таблица 17.8. Дозировка морфина для эпидуральной аналгезии
при послеоперационном обезболивании
Уровень аналгезии Нагрузочная доза морфина, мг Инфузионная доза морфина (0,15 мг в 1 мл раствора), мл/ч
Нижние конечности 2-3 2-3
Таз 3-4 2-4
Живот 5-7 3-5
Грудная клетка 7-10 5-8
Таблица 17.9. КПА после абдоминальных операций
КПА Препарат Титруют до достижения эффекта
Пациент-контролируемая доза, мг/кг Морфин 0,015
Промедол 0,15
Интервал 10-20 минут
Основная доза, мг/ч/кг Морфин 1
Промедол 10
4-часовый лимит, мг/кг Морфин 0,3
Промедол 3
17.5. ОПЕРАЦИИ НА ЖЕЛЧНЫХ ПУТЯХ
Наиболее часто выполняют открытую и лапароскопическую холе-
цистэктомии, резекцию опухолей желчных путей, холедохоцистоанастомоз, дренаж
билиарного тракта, трансдуоденальную сфинктеротомию и сфинктеропластику.
Премедикация-, “легкая” или “средняя”.
355
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Интраоперационный период
Анестезиологическое обеспечение: общая анестезия с миорелаксацией и ИВЛ.
Инсуфляция СО2 при проведении лапароскопических операций может привести к
повышению внутрибрюшного давления и спровоцировать пассивную регургита-
цию желудочного содержимого. ИВЛ сводит возможность возникновения гипер-
карбии к минимуму.
Обеспечивают стандартный мониторинг: ЧСС, АД, капнометрия, ЭКГ в 5 отве-
дениях, пульсоксиметрия, внешнее наблюдение за больным, темп диуреза, уро-
вень ЦВД (при необходимости).
Индукция в наркоз: стандартная. У пациентов с риском аспирации осуществ-
ляют быструю последовательную индукцию с выполнением приема Селлика. Ис-
пользуют: тиопентал-натрий (3—5 мг/кг), пропофол (1,5—2,5 мг/кг, возможно уве-
личение дозы), этомидат (0,2—0,4 мг/кг).
Поддержание анестезии
Сбалансированная анестезия: на фоне оксигенации 100 %
увлажненным кислородом; вводят промедол (0,5—1,5 мг/кг в течение 3—4 ч) или
фентанил (1—10 мкг/кг/ч) в сочетании с изофлюраном (0,5 %) или пропофолом
(50—200 мкг/кг/мин).
Тотальная внутривенная анестезия: на фоне оксигенации
100 % увлажненным кислородом вводят кетамин (час — 1 мг/мин/кг, следующие
4 часа — 0,6 мг/мин/кг, через 4 ч и далее — 0,4 мг/мин/кг, инфузию прекращают
за 15—30 мин до конца операции) и пропофол (первые 10 мин — 140—200 мкг/кг/мин,
следующие 2 часа — 100—140 мкг/кг/мин, после 2 часов — 80—120 мкг/кг/мин,
инфузию прекращают за 5—10 мин до конца операции).
При наличии риска аспирации желудочного содержимого пациента экстубируют
в сознании после полного восстановления защитных рефлексов с дыхательных путей.
Инфузионно-трансфузионная терапия. Как правило, подобные операции со-
провождаются минимальной кровопотерей. Венозный доступ осуществляют кате-
тером 16—18 G. Используют кристаллоидные растворы (5—8 мл/кг/ч). При необ-
ходимости регидратацию проводят до индукции в наркоз.
Осложнения: эмболия СО2, подкожная эмфизема.
Послеоперационный период
Осложнения: дыхательная недостаточность, пневмоторакс, ателектазы вслед-
ствие хирургической ретракции и шунтирования.
Обезболивание: метод КПА (промедол: нагрузочная доза — 20—100 мг, добавочная
доза — 10 мг, минимальные периоды между введениями — 10 мин). Возможно приме-
нение межреберной или интраплевральной блокад, а также эпидуральной аналгезии.
17.6. ОПЕРАЦИИ НА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЕ
Наиболее часто выполняют оперативные вмешательства по пово-
ду острого панкреатита, дренирования кист поджелудочной железы, панкреато-
еюностомию, панкреатэкгомию, панкреатодуоденальную резекцию.
Премедикация-, “средняя” или “тяжелая”.
Интраоперационный период
Анестезиологическое обеспечение: общая анестезия с миорелаксацией и ИВЛ.
Если планируют проведение послеоперационной эпидуральной аналгезии, то вве-
356
17. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ АБДОМИНАЛЬНЫХ ОПЕРАЦИЙ
дение эпидурального катетера осуществляют до индукции в анестезию. С целью
верификации положения катетера в эпидуральном пространстве вводят 5—7 мл
1 % раствора лидокаина через эпидуральный катетер с достижением сегментар-
ного блока.
Обеспечивают стандартный мониторинг: ЧСС, АД, капнометрия, ЭКГ в 5 отве-
дениях, пульсоксиметрия, внешнее наблюдение за больным, темп диуреза, уро-
вень ЦВД (при необходимости).
Индукция в наркоз. Пациенты с кишечной непроходимостью и илеусом под-
вержены высокому риску легочной аспирации. Проводят интубацию в сознании
или с использованием быстрой последовательной индукции и выполнением при-
ема Селлика. При клинических признаках гиповолемии восстанавливают ОЦК
путем инфузии растворов коллоидов, кристаллоидов или компонентов крови до
индукции в анестезию. Индукционную дозу препаратов для наркоза титруют. Воз-
можны незначительные изменения гемодинамики во время индукции в наркоз
этомидатом (0,2—0,4 мг/кг) или кетамином (1—3 мг/кг).
Поддержание анестезии
Сбалансированная анестезия: на фоне оксигенации 100 %
увлажненным кислородом, вводят промедол (0,5—1,5 мг/кг в течение 3—4 ч) или
фентанил (1—10 мкг/кг/ч) в сочетании с изофлюраном (0,5 %) или пропофолом
(50-200 мкг/кг/мин).
Тотальная внутривенная анестезия: на фоне оксигенации
100 % увлажненным кислородом вводят кетамин (час — 1 мг/мин/кг, следующие
4 часа — 0,6 мг/мин/кг, через 4 часа и далее — 0,4 мг/мин/кг, инфузию прекращают
за 15—30 мин до конца операции) и пропофол (первые 10 мин — 140—200 мкг/кг/мин,
следующие 2 часа — 100—140 мкг/кг/мин, после 2 часов — 80—120 мкг/кг/мин,
инфузию прекращают за 5—10 мин до конца операции).
Комбинированная анестезия: 12—15 мл 1,5—2 % лидокаина
каждые 60 мин вводят в эпидуральный катетер; общая анестезия выступает как
приложение к регионарной и для обеспечения амнезии. При эпидуральном введе-
нии опиоидных аналгетиков дозы системных седативных препаратов (дроперидо-
ла, опиатов, бензодиазепинов и т. д.) уменьшают, что значительно уменьшает
риск послеоперационной депрессии дыхания. Если опиаты назначают для после-
операционной аналгезии, то их нагрузочную дозу вводят не менее чем за 1 ч до
завершения операции.
Решение об экстубации в конце оперативного вмешательства принимают на
основании оценки сердечно-сосудистой и легочной систем и длительности опера-
ции. К моменту экстубации пациент должен быть гемодинамически стабилен,
согрет, с восстановленным мышечным тонусом и сознанием.
Инфузионно-трансфузионная терапия. При прогнозируемых больших потерях
ОЦК для венозного доступа используют 2 катетера диаметром 14—16 G. Инфузи-
онные растворы согревают. Возмещение дефицита ОЦК производят кристаллоид-
ными растворами (10-20 мл/кг/ч). Предусматривают заготовку препаратов крови.
Аутогрансфузию проводят при исключении новообразований и инфекционного
процесса.
Осложнения: гипокалиемия, гиповолемия, кровотечения. Развитие гиповоле-
мии связано с потерей жидкости в третье пространство и испарением через дыха-
тельные пути. При иссечении поджелудочной железы может возникнуть кровоте-
чение из мезентериальных и портальных сосудов.
357
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Послеоперационный период
Осложнения: электролитный дисбаланс, гиповолемия, гипотермия, гипокаль-
циемия, гипергликемия.
Обезболивание: см. табл. 17.8, 17.9.
ЛИТЕРАТУРА
1. Anesthsiologist2s Manual of Surgical Procedures (под ред. R. Jaffe, S. Samuels),
Philadephia, 1994. — 948 c.
2. Актуальные проблемы анестезиологии и реаниматологии/ Освежающий курс
лекций. — Архангельск, 1995. — С. 86—88.
3. Буров Н.Е. Кислотно-аспирационный синдром/ Вестник интенсивной терапии. —
1995, № 3 - С. 1-5.
4. Руководство по анестезиологии/ Под ред. АА Бунятина/ М.: “Медицина”, 1997. — 656 с.
5. Manual of Surgical Therapeutisc/ Под ред. R. Condon, G. Nyhus/ Boston, 1996. —
716 C.
6. Клиническая анестезиология/ Под ред. В.А. Гологорского, В.В. Яснецова/
М.: “ТЭОТАР-МЕД”, 2001 - 816 с.
7. Clinical Anesthesia/ под ред. Р. Barash, В. Cullen, R. Stoelting/ Philadephia, 2004. —
592 С.
8. Руководство по анестезиологии и реаниматологии/ под ред. Ю.С. Полушина/
СПб.: “ЭЛБИ-СПб”, 2004. - 720 с.
358
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
По данным мировой статистики, около 10—20 % всех анесте-
зий проводят по поводу обеспечения урологических операций.
Большинство урохирургических пациентов — это пожилые люди
с сопутствующими заболеваниями, прежде всего, с нарушениями
функций почек.
18.1. ПРИКЛАДНАЯ ФИЗИОЛОГИЯ
МОЧЕВЫДЕЛИТЕЛЬНОЙ СИСТЕМЫ
Почки — парный орган, располагающийся ретроперитонеаль-
но у задней стенки брюшной полости на уровне Тп—Ц. Суммар-
ный вес почек составляет 300 г, или около 0,5 % от общей массы
тела. Почки получают 20—25 % общего сердечного выброса. Кро-
воснабжение почек обеспечивают почечные артерии, отходящие
от брюшной аорты ниже верхней брыжеечной артерии и разделя-
ющиеся в воротах каждой почки на две ветви — переднюю и зад-
нюю. Между мезентериальными и супраренальными сосудами су-
ществуют многочисленные анастомозы. Отток крови от каждой
почки происходит по почечной вене, впадающей в нижнюю по-
лую вену.
Почки имеют обильную иннервацию: сокращающие симпа-
тические нервные волокна выходят из ТЬ4-Ц сегментов спинного
мозга и распределяются через чревное и почечное сплетения; рас-
слабляющая симпатическая и парасимпатическая иннервация
отсутствует. Болевые волокна, в основном от почечных лоханок и
верхних отделов мочеточников, входят в спинной мозг в составе
висцеральных нервов.
На поперечном срезе почки выделяют три зоны: кору, внеш-
ний мозговой и внутренний мозговой слои. Около 80 % почеч-
ного кровотока приходится на кортикальные структуры. Основ-
ной структурно-функциональной единицей почки является не-
359
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 18.1. Строение нефрона: 1 — клубочек, 2 — про-
ксимальный отдел канальца, 3 — дистальный отдел
канальца, 4 — тонкий отдел петли Генле
фрон (рис. 18.1). В обеих поч-
ках взрослого человека в нор-
ме насчитывают 2,5—4,0 млн.
нефронов. В зависимости от
расположения и длины ка-
нальцев нефроны делят на по-
верхностные (около 85 %) и
юкстамедуллярные. Каждый
нефрон состоит из почечно-
го, или мальпигиева, тельца
и канальца. Почечное тельце
(рис. 18.2) является начальной
частью нефрона и состоит из
клубочка и покрывающей его
капсулы, или капсулы Шум-
лянского-Боумена. Клубочек,
или гломерула, — это сосуди-
стое образование, которое со-
держит около 50 капиллярных
петель, начинающихся от при-
носящей клубочковой арте-
риолы (arteriola glomerularis
afferens seu vas afferens) и со-
бирающихся в выносящую
клубочковую артериолу
(arteriola glomerularis efferens
seu vas efferens).
Капсула Шумлянского-
Боумена на разрезе имеет
форму чаши, внутри которой расположен клубочек. Она состоит из двух лист-
ков (слоев) — внутреннего и наружного. Внутренний (висцеральный) листок
клубочковой капсулы плотно прилегает к стенкам клубочковых капилляров и
является одновременно наружным (эпителиальным) слоем стенки капилляра.
Наружный (париетальный) листок капсулы несколько отстоит от внутреннего,
в результате между ними образуется микроскопическая полость — полость кап-
сулы Шумлянского-Боумена, в которую после фильтрации поступает жидкая
часть плазмы крови и образуется ультрафильтрат, или первичная (превентив-
ная) моча. Полость клубочковой капсулы непосредственно переходит в про-
свет, а наружный листок капсулы — в стенку канальца. Приносящая и вынося-
щая артериолы клубочка образуют его полюс, располагаются рядом и не по-
крыты капсулой Шумлянского-Боумена. Клубочковые капилляры как бы
подвешены к этому полюсу. Общая длина клубочковых капилляров обеих по-
чек составляет около 25 км, а площадь их фильтрующей (рабочей) поверхности —
около 1,5 м2 (площадь поверхности человеческого тела в среднем составляет
1,73 м2). Каждая капсула Шумлянского-Боумена соединяется с проксималь-
ным канальцем, который имеет изогнутую форму в кортикальной части, но
становится прямым внутри внешнего слоя коры. С этого уровня каналец изве-
стен, как петля Генле.
360
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Функции почек:
• регуляция водно-электролитно-
го баланса — поддержание постоян-
ной концентрации ионов натрия, ка-
лия, кальция, магния, водорода, хло-
ра, фосфатов и бикарбонат-ионов;
• поддержание кислотно-основ-
ного равновесия посредством экск-
реции ионов водорода и регенерации
бикарбонатов: в обмен на каждый ион
водорода, выделенный в просвет по-
чечных канальцев, образуется бикар-
бонат-ион, который возвращается во
внеклеточную жидкость;
• экскреция продуктов жизнеде-
ятельности, например мочевины, мо-
чевой кислоты, креатинина;
• экскреция чужеродных для
организма соединений, например ле-
карственных препаратов, ядов, пище-
вых добавок;
Рис. 18.2. Строение мальпигиева тельца:
1 — приносящая клубочковая артериола, 2 — вынося-
щая клубочковая артериола, 3 — капиллярные петли
клубочка, 4 — капсула, 5 — каналец
• синтез и выведение в кровоток физиологически-активных веществ:
— ренина, который участвует в регуляции ОЦК и кровяного давления, влияя
на обмен воды и натрия;
— эритропоэтина, который стимулирует образование эритроцитов в красном кост-
ном мозге и высвобождается в ответ на дефицит кислорода в ткани почек;
— активной формы витамина D, который способствует поддержанию концен-
трации кальция, фосфора и магния в пределах нормы, стимулирует процессы ре-
зорбции костной ткани и повышает реабсорбцию кальция и фосфора в почках;
— простагландинов, которые оказывают преимущественно сосудорасширяю-
щее действие, влияют на почечный кровоток, увеличивают чувствительность по-
чечной ткани к действию АДГ и альдостерона.
При АД от 80 до 180 мм рт. ст. поддерживается почечный кровоток на уровне
1200 мл/мин. Особенностью почечного кровотока является его постоянство при
изменениях САД в широких пределах (от 60 до 150 мм рт. ст.), обусловленное
ауторегуляцией кровоснабжения почек. Метаболизм в почках протекает более ин-
тенсивно, чем в других органах (головном мозге, печени, сердце и др.), при этом
его скорость определяется величиной почечного кровотока. Первоначальным от-
ветом на снижение почечного кровотока является сохранение ультрафильтрации
вследствие перераспределения кровотока внутри почек: происходят селективная
вазодилатация афферентных артериол и вазоспазм эфферентных артериол. Гипо-
перфузия почки приводит к активной абсорбции натрия и пассивной абсорбции
воды в восходящем отделе петли Генле (70—80 % энергии, расходуемой в почке,
предназначено для активного транспорта ионов натрия). Компенсаторные симпа-
тоадреналовые механизмы перераспределяют почечный кровоток от внешнего кор-
кового слоя к внутреннему мозговому. Если почечная гипоперфузия усугубляется,
это приводит к вазоспазму почечных артериол и снижению гломерулярной филь-
трации, в результате чего меньшее количество растворимых соединений посту-
пает в восходящий отдел петли и, соответственно, меньшее количество всасывает-
361
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ся (энергоемкий процесс). Конечным эффектом вазоспазма афферентных артери-
ол является уменьшение потребления кислорода. Результатом вышеописанного
процесса является олигурия.
ГВ!
Олигурия — это симптом снижения почечного кровотока в результате вклю-
чения компенсаторных механизмов, предназначенных для предотвращения
ишемического повреждения почки
18.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
АНЕСТЕЗИОЛОГИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
ПРИ ДИСФУНКЦИЯХ ПОЧЕК
Элиминация большинства лекарственных препаратов, применя-
емых во время анестезии, полностью или частично зависит от почечной экскре-
ции. Нарушения функции почек требуют корректировки дозы во избежание ку-
муляции препарата или его активных метаболитов. Кроме этого, азотемия по-
тенцирует действие многих лекарственных препаратов за счет снижения
связывания препаратов с белками плазмы, повышенной проницаемости гемато-
энцефалического барьера, синергизма токсинов, накапливающихся при почеч-
ной недостаточности. Время полувыведения препаратов, экскретируемых почка-
ми, медленно увеличивается по мере ухудшения работоспособности почек, пока
не наступает тяжелое поражение нефронов, когда время полувыведения увели-
чивается резко. Диализ способен заменить лишь малую часть экскреторной спо-
собности здоровых почек.
Препараты для вводного наркоза
При почечной недостаточности вводный наркоз рекомендуют начинать с низ-
ких доз барбитуратов, этомидата или пропофола. Их действие прекращается при
перераспределении. У больных с гипоальбуминемией гораздо большее количество
анестетика достигает тканей. При ацидозе облегчается проникновение барбитура-
тов в мозг за счет увеличения их ионизированной фракции.
Заболевания почек незначительно влияют на фармакокинетику кетамина, хотя
повышение АД, обусловленное его применением, является нежелательным при
заболеваниях почек, которые сопровождаются артериальной гипертензией.
Мышечные релаксанты
Не рекомендуют использовать суксаметониум из-за возможной гиперкалиемии,
тем не менее, его использование при почечной недостаточности безопасно, если к
моменту индукции концентрация калия сыворотки не превышает 5 ммоль/л.
Атракуриум и мивакурий являются препаратами выбора. Атрактиум при тем-
пературе тела инактивируется путем Хоффмановской деградации. Продолжитель-
ность действия мивакурия практически не зависит от почечной экскреции.
Векурониум и рокурониум достаточно безопасны при почечной недостаточ-
ности, так как выводятся с мочой в минимальном количестве. Векурониум в зна-
чительных дозах (> 0,1 мг/кг) умеренно пролонгирует длительность нервно-мы-
шечной блокады.
Панкурониум, алкурониум, пипекурониум и доксакуриум у больных с почеч-
ными дисфункциями используют с осторожностью, так как 60—90 % элиминации
362
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
этих препаратов осуществляют почки; при использовании этих препаратов прово-
дят постоянный мониторинг нервно-мышечной проводимости.
Пролонгации нервно-мышечной блокады способствуют метаболический аци-
доз, гипокалиемия, гипермагнемия, гипокальциемия, аминогликозиды.
Препараты для поддержания анестезии
Опиоидные аналгетики. Морфин метаболизируется в печени до морфин-6-глю-
куронида, который обладает половиной седативного эффекта морфина и более
продолжительным периодом полувыведения. Петидин метаболизируется до нор-
петидина, который обладает более слабым аналгетическим и выраженным про-
конвульсивным действием. Оба этих метаболита (морфин-6-глюкуронид, норпе-
тидин) могут кумулироваться у больных с почечной недостаточностью при по-
вторном введении или инфузии препаратов и пролонгировать отрицательные
эффекты. Стандартное интраоперационное использование обычно не приводит
к каким-либо проблемам, но применение морфина предпочтительнее, чем пе-
тидина.
Фентанил и альфентанил используют в стандартных клинических дозировках.
Фармакокинетика наиболее распространенных агонистов-антагонистов опиатных
рецепторов — буторфанола, налбурфина, бупренорфина — при почечной недоста-
точности не изменена.
Большинство бензодиазепинов в значительной степени связывается с белками,
поэтому у больных с почечной недостаточностью при гипоальбуминемии чувстви-
тельность к ним повышена.
Все ингаляционные анестетики способны снижать сократительную способность
миокарда и показатели АД, увеличивать сопротивление почечных сосудов (в не-
значительной или умеренной степени), что приводит к уменьшению почечного
кровотока и скорости клубочковой фильтрации. Закись азота, изофлюран, севоф-
люран не элиминируются почками и позволяют легко управлять АД. По этим
причинам их считают идеальными препаратами для поддержания анестезии при
почечных дисфункциях. Легкая и среднетяжелая дисфункции почек не влияют на
поглощение и распределение анестетика, но при глубокой анемии у больных с
ХПН могут ускориться индукция и пробуждение, что объясняют изменением ко-
эффициента распределения кровь/газ, а также снижением МАК.
Основными метаболитами метоксифлюрана являются ионы фтора, которые
оказывают токсическое действие на почки, поэтому его не применяют у больных
с дисфункциями почек.
От использования НПВС необходимо отказаться, так как они уменьшают по-
чечный кровоток и могут способствовать усугублению почечной недостаточности.
18.3. ОСОБЕННОСТИ
АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ
ПРИ НАРУШЕНИЯХ ВОДНО-ЭЛЕКТРОЛИТНОГО ОБМЕНА
Вода составляет около 60 % веса тела, из которых 1/3 объема
находится во внутриклеточном пространстве, 2/3 — во внеклеточном (около 2/3
объема внеклеточной воды находится в интрацеллюлярном пространстве, 1/3 —
во внутрисосудистом).
363
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Ежедневная потребность взрослого человека в воде составляет около 2600 мл,
из них 1400 мл человек получает с выпиваемой жидкостью, 800 мл — с пищей,
400 мл — эндогенная вода, образующаяся в результате метаболизма. В норме еже-
суточные поступления воды количественно равны ее потере: 1500 мл выделяется с
мочой, 200 мл — с калом, 400 мл — через легкие при дыхании, 500 мл испаряется
с поверхности кожи. Потери жидкости увеличиваются при лихорадке (около
500 мл на 1 °C в сутки), усилении потоотделения, низкой влажности воздуха,
повышении диуреза при гипергликемии, введение рентгеноконтрастных средств,
медикаментозной терапии, расстройствах деятельности кишечника и заболевани-
ях надпочечников.
18.3.1. Гипокалиемия
Гипокалиемия — это содержание ионов калия в плазме крови
менее 3,5 ммоль/л.
Общий баланс ионов калия в организме определяется приемом калия внутрь
и почечной экскрецией, при этом 90 % введенного в организм калия секретируют
почки (значительную часть — дистальные части нефронов). Процесс усиливается
при действии альдостерона, высоком содержании ионов калия в клетках, алкалозе
(ацидоз изгоняет калий из клеток).
Этиология: недостаточное поступление К+ в организм, чрезмерные потери К+
из ЖКТ (при рвоте, назогастральной интубации, ворсинчатой аденоме, передози-
ровке слабительных), сопутствующий алкалоз любого генеза, первичный и вто-
ричный гиперальдостеронизм, гидрокарбонатурия, применение диуретиков (кро-
ме калийсберегаюших), осмотический диурез (как при гипергликемии), пораже-
ние канальцев почек некоторыми лекарствами (амфотерицином, гентамицином,
карбенициллином), дефицит Mg++, избыточный переход К+ внутрь клеток из вне-
клеточной жидкости (как при алкалозе, лечении инсулином или периодическом
параличе).
Клинические проявления. Симптоматика обусловлена нарушениями нервно-
мышечной передачи и включает: мышечную слабость, снижение тонуса и мо-
торики желудка, кишечника (паралитический илеус), мочевого пузыря, поли-
урию, изменения ЭКГ (уплощение и даже инверсия зубца Т, удлинение интер-
вала Q—T, снижение сегмента S—T и нарушения ритма сокращений предсердий
и желудочков). Выраженная гипокалиемия приводит к вялому параличу и оста-
новке сердца.
Лечение. Выясняют причины дефицита и восполняют уровень К+ (0,2 мэкв/кг/ч)
внутривенно). При хронической гипокалиемии (К+ < 2,5 ммоль/л) нет необходи-
мости в ее коррекции перед индукцией в наркоз, так как быстрое восполнение
дефицита может спровоцировать более серьезные нарушения, чем сама гипокали-
емия. В нетяжелых случаях иногда достаточно назначения хлорида калия внутрь.
У больных с отеками, получающих диуретики, также назначают калийсберегаю-
щие препараты (альдактон). Потери через ЖКТ возмещают путем внутривен-
ного введения хлорида калия (< 20 ммоль/ч). При выраженной симптоматике
гипокалиемии вводят значительные дозы хлорида калия (20—40 ммоль/ч) под кон-
тролем деятельности сердца и частом определении содержания калия в плазме
крови. Гипокалиемия в сочетании с интоксикацией сердечными гликозидами тре-
бует экстренной коррекции состояния.
364
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Особенности анестезиологического обеспечения. Считают, что плановую опера-
цию можно проводить, если концентрация К+ в плазме составляет более 3—
3,5 ммоль/л. Вместе с тем, учитывают скорость развития гипокалиемии, а также
наличие или отсутствие сопутствующей дисфункции органов. Умеренно выражен-
ная хроническая гипокалиемия (=3 ммоль/л), при которой нет ЭКГ-изменений,
существенно не повышает риск возникновения осложнений при анестезии. У боль-
ных, принимающих дигоксин, гипокалиемия существенно повышает риск дигок-
синовой интоксикации, поэтому концентрацию К+ в плазме поддерживают свыше
4 ммоль/л. Показанием к интраоперационной инфузии растворов калия является
возникновение предсердных или желудочковых аритмий. Для предотвращения
дальнейшего снижения концентрации калия в плазме не переливают глюкозосо-
держащие растворы.
Избегают гипервентиляции во время операции. Возникшие на фоне гипока-
лиемии нарушения внутрисердечной проводимости или снижение сократитель-
ной способности миокарда устраняют внутривенным введением препаратов калия
(0,5-1 ммоль через 3—5 мин до получения желаемого эффекта).
18.3.2. Гиперкалиемия
Гиперкалиемия — это содержание ионов калия в плазме крови
более 5,5 ммоль/л.
Этиология: неадекватная экскреция при почечной недостаточности (ОПН,
выраженная ХПН (СКФ < 10 мл/мин), поражение канальцев), недостаточность
надпочечников (гипоальдестеронизм, болезнь Аддисона), применение калийс-
берегающих мочегонных (спиронолактона, триамтерена, амилорида), повреж-
дение тканей (внутреннее кровотечение, миолиз, гемолиз), применение арги-
нина, сукцинилхолина, а-адренергических блокаторов, интоксикация сердеч-
ными гликозидами, ацидоз при повышении осмотического давления и
гиперкалиемическом периодическом параличе, чрезмерное поступление К+ в
организм.
Этиология псевдогиперкалиемии: тромбоцитоз, лейкоцитоз, подкожная гемато-
ма после венепункции, гемолиз in vitro.
Клинические проявления. Острая гиперкалиемия клинически является более
значимой, чем хроническая, и проявляется преимущественным влиянием на ске-
летные мышцы и миокард. Развиваются генерализованная мышечная слабость,
парестезии, нарушения проводимости и ритма сердца.
При концентрации К+ 6—7 ммоль/л появляются изменения на ЭКГ: увеличе-
ние зубца Т в прекардиальных отведениях в сочетании со снижением зубца R,
исчезновение зубца Р, расширение комплекса Q—R—S, удлинение интервала P—R.
При повышении К+ более 7 ммоль/л требуется проведение экстренной терапии.
При концентрации К+ более 10 ммоль/л возникает фибрилляция желудочков и
остановка сердца.
Лечение. Интенсивность лечения определяют выраженностью ЭКГ-измене-
ний и концентрацией калия в крови, причем последнему показателю отдают пред-
почтение (см. табл. 18.1).
365
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 18.1. Методы неотложной коррекции гиперкалиемии
Препа- рат Показания Доза Начало дейст- вия, МИН Длитель- ность действия, ч Механизм действия, комментарий
Глюко- нат каль- ция К+ свыше 6,5 ммоль/л при выра- женных ЭКГ- изменениях Внутривенно 10 мл 10 % раствора в течение 2-3 мин 1-5 0,5 Снижает пороговый потенциал, препятствует токсическому действию К+ на сердце и нейромышечные мембраны. Очень быстрый эффект. Обязателен ЭКГ-контроль. При необходимости повторяют введение через 5 мин. Опасно одновременное назначение с сердечными гликозидами. Корректируют гипонатриемию
Инсу- лин + глю- коза Гиперкалие- мия средней степени, толь- ко повышен- ный зубец Г на ЭКГ Внутривенно 10 ЕД обычно- го инсулина + 50 мл 50 % раствора глюкозы 15-45 4-6 Переход К+ в клетки. Раствор глюкозы вводить не обязательно, если ее концентра- ция в крови повышена. При необ- ходимости повторно вводят инсу- лин с глюкозой через 15 мин
Гидро- карбо- нат натрия Гиперкалие- мия средней степени Внутривенно 90 ммоль (2 ампулы) в течение 5 мин Немед- ленно Кратко- времен- но Переход К+ в клетки. Наибольший эффект при аци- дозе. Высокий риск примене- ния при ЗСН или гипернатрие- мии. Опасность возникновения гипокалиемических судорог
Кати- оно- обмен- ная смола + сорби- тол Гиперка- лиемия средней степени Внутрь: 30,0 г в 50 мл 20 % раствора сорбитола; per rectum: 50,0 г в 200 мл 20 % раствора сорбитола 60 4-6 Выделение К+ из организма. Один грамм ионообменной смолы извлекает около 1 ммоль К+ (при приеме внутрь) и около 0,5 ммоль К+ (при введении per rectum). Повторя- ют каждые 4 ч. Применяют с осторожностью при ЗСН
Фуро- семид Гиперкалие- мия средней степени, кре- атинин сыво- ротки < 265 мкмоль/л Внутривенно 20-40 мг 15 4 Выведение К+ с мочой. Максимальный эффект, если гиперкалиемия возникла из-за неадекватной экскреции К+
Диализ Гиперкалие- мия на фоне почечной недоста- точности Немед- ленно Варьи- рует Извлечение К+ из организма. Наиболее эффективен. Также ликвидируется ацидоз
366
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Особенности анестезиологического обеспечения. Плановые операции при гипер-
калиемии отсрочивают, пока концентрация калия не достигнет нормы. Не допус-
кают ее повторного развития, проводят тщательный ЭКГ-мониторинг. Противо-
показано введение сукцинилхолина и любых калийсодержащих инфузионных ра-
створов. Во время операции предупреждают возникновение метаболического и
дыхательного ацидозов. ИВЛ проводят в режиме умеренной гипервентиляции.
18.3.3. Гипонатриемия
Гипонатриемия — это содержание ионов натрия в плазме крови
менее 135 ммоль/л.
Этиология. Гипонатриемия возникает при избытке в организме воды по отно-
шению к содержанию в нем натрия, при этом общее количество натрия во вне-
клеточной жидкости может быть нормальным, сниженным или повышенным.
Гипоосмолярность возникает, если в организме находятся объемы растворов с
низким содержанием натрия, как при сахарном диабете, выраженной гиперлипи-
демии, гиперпротеинемии (например, миеломной болезни). В норме осмоляр-
ность крови не превышает 320 мосм/л. При повышении содержания в плазме
осмотически активных веществ (глюкозы, мочевины, маннита, метанола и др.)
величина осмолярности плазмы повышается, несмотря на низкую концентрацию
натрия в крови.
Клинические проявления. Симптоматика проявляется при снижении уровня
натрия в крови менее 125 ммоль/л или быстром уменьшении концентрации электро-
лита. Преобладают неврологические нарушения, что обусловлено гипергидрата-
цией клеток мозга. Тяжесть состояния зависит от скорости развития гипоосмо-
лярности внеклеточной жидкости. Ранние клинические симптомы обычно неспе-
цифичны и проявляются прогрессирующей головной болью, анорексией, слабостью,
сонливостью, переходящей в летаргическое состояние, а затем, без лечения — в
кому. Гипонатриемия вызывает ухудшение сердечной деятельности, появление
аритмий.
Лечение. Восстанавливают нормальную концентрацию натрия в плазме и про-
водят коррекцию основного патологического состояния, то есть волемического
статуса больного.
Гиповолемическую гипонатриемию, возникающую при использовании диурети-
ков, рвоте, диарее, недостаточности надпочечников и др., устраняют внутривен-
ным введением изотонических растворов кристаллоидов (чаще изотонического
раствора натрия хлорида). При тяжелой гиповолемической гипонатриемии повы-
шают уровень натрия в крови до 125 ммоль/л путем инфузии 3 % раствора натрия
хлорида. Введение гипертонических солевых растворов опасно у пациентов с ги-
перволемией, например, при ЗСН.
При нормоволемической гипонатриемии, возникающей при синдроме неадек-
ватной секреции вазопрессина, гипотиреозе, применении лекарственных средств,
которые угнетают экскрецию воды почками, водной интоксикации, ограничивают
прием жидкости. Внутривенное введение гипотонического 0,3 % раствора натрия
хлорида или маннита является неотложным мероприятием при симптоматике,
свидетельствующей о выраженном поражении мозга или сердца. Оба препарата
применяют с осторожностью по причине возможной перегрузки кровообращения
с резким увеличением ОЦК. Вообще, интенсивное проведение нормализации со-
367
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
держания натрия в крови чревато высоким риском возникновения центрального
понтинного миелинолиза. Большинство симптомов исчезает при повышении кон-
центрации натрия в крови до 125 ммоль/л.
При гиперволемической гипонатриемии, сопровождающей почечную недоста-
точность, ЗСН, цирроз печени и др., ограничивают потребление воды и натрия,
нормализуют ОЦК с помощью диуретиков.
Особенности анестезиологического обеспечения. Считают безопасным проведе-
ние общей анестезии при концентрации натрия в плазме более 130 ммоль/л. Пе-
ред плановой операцией концентрацию натрия в плазме увеличивают более
130 ммоль/л даже при отсутствии клинических проявлений. При более низкой
концентрации натрия повышается риск возникновения тяжелого отека мозга, что
проявляется в послеоперационный период психомоторным возбуждением, спу-
танностью сознания и сонливостью. При ТУРП во время промывания мочево-
го пузыря может абсорбироваться значительное количество воды (до 20 мл/мин),
что сопряжено с опасностью тяжелого острого водного отравления.
18.3.4. Гипернатриемия
Гипернатриемия — это содержание ионов натрия в плазме крови
более 150 ммоль/л.
Этиология. Гипернатриемия возникает при дефиците воды в организме по
отношению к содержанию натрия, при этом общее количество воды может соот-
ветствовать норме, быть увеличенным или уменьшенным. Выраженная потеря воды
возможна через кожу, легкие, почки. Потеря воды, превышающая потерю натрия,
возникает при лихорадке, ожогах, высокой температуре окружающей среды, ос-
мотическом диурезе. Избыток натрия регистрируют у больных, употреблявших
пищевую соль в избытке, или которым вводили гипертонический раствор NaHCO3,
например, во время реанимационных мероприятий.
Клинические проявления. Симптоматика в большей степени зависит от скоро-
сти дегидратации клеток мозга, чем от абсолютного уровня гипернатриемии.
Прогрессирующая дегидратация нейронов проявляется беспокойством, сонли-
востью, гиперрефлексией, раздражительностью, лихорадкой, тахикардией, по-
вышением АД, судорогами, комой. Быстрое уменьшение объема мозга чревато
разрывом церебральных вен, что может привести к внутричерепному кровоизли-
янию.
Лечение. Определяют реальное содержание воды в организме, восстанавли-
вают нормальную осмолярность плазмы, проводят коррекцию основного пато-
логического состояния. Быстрая коррекция гипернатриемии сопряжена с рис-
ком возникновения судорог, отека мозга, стойкого повреждения мозга и даже
летального исхода. Рекомендуют концентрацию натрия в плазме снижать не
быстрее, чем на 0,5 ммоль/л/ч, при этом обязательно неоднократно измерять
осмолярность плазмы.
Гиповолемическая гипернатриемия возникает при потере воды и натрия с пре-
обладанием утраты первой (при диарее, рвоте, осмотическом диурезе, профузном
потоотделении и др.) или недостаточном потреблении воды (при повреждении
центрального механизма жажды, изменении психического статуса и др.). Для быс-
трого увеличения объема внутрисосудистой жидкости вводят коллоидные растворы —
5 % раствор альбумина или 6 % раствор гидроэтилированных крахмалов. Если
368
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
объем восстанавливают с помощью растворов кристаллоидов, то до применения
гипотонического раствора восполняют ОЦК инфузией изотонического раствора.
Нормоволемическая гипернатриемия возникает, как правило, при несахарном
диабете. Лечение включает этиотропную терапию, возмещение дефицита свобод-
ной воды инфузией 5 % раствора глюкозы, а также назначение вазопрессина при
центральной форме несахарного диабета.
Гиперволемическая гипернатриемия возникает вторично вследствие избыточ-
ной активности минералокортикоидов, проведения диализа с использованием ги-
пертонических солевых растворов, внутривенного введения гипертонических ра-
створов натрия хлорида или натрия гидрокарбоната с лечебной целью. В таких
случаях назначают петлевые диуретики и инфузию 5 % раствора глюкозы, по по-
казаниям проводят гемодиализ.
Особенности анестезиологического обеспечения. В клинической практике боль-
шое значение имеет сопряженный с гипернатриемией дефицит жидкости в орга-
низме. Гиповолемия усугубляет депрессию кровообращения, вызываемую анесте-
тиками, и способствует гипотонии и гипоперфузии тканей; уменьшение сердеч-
ного выброса повышает поглощение ингаляционных анестетиков в легких, поэтому
дозу большинства анестетиков снижают.
Необходимо выявить клиническую симптоматику нарушений обмена натрия, а
также патологическое состояние, ставшее их причиной. Нарушения обмена (гипо-
волемия при дефиците натрия или гиперволемия при его избытке) необходимо ус-
транить до операции. При избытке натрия, обычно проявляющемся отеками, прово-
дят тщательное исследование функций сердца, печени, почек. Гиповолемия потен-
цирует вазодилатацию и отрицательное инотропное действие ингаляционных
анестетиков, барбитуратов, препаратов, вызывающих освобождение гистамина (мор-
фина, меперидина, тубокурарина, атракурия), симпатолитические эффекты спи-
нальной и эпидуральной анестезии. Препаратом выбора для индукции в наркоз при
гиповолемии является кетамин, приемлемой альтернативой — этомидат.
Гиперволемию устраняют путем применения диуретиков до начала операции.
По возможности нормализуют функцию сердца, почек и печени. Увеличение объема
внеклеточной жидкости сопряжено с высоким риском нарушения газообмена вслед-
ствие интерстициального или альвеолярного отека легких, а также выраженного
плеврального выпота или асцита.
18.4. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ, ДИАГНОСТИКА
И ЛЕЧЕНИЕ ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ
Острая почечная недостаточность (ОПН) — острое, потенциаль-
но обратимое нарушение выделительной функции почек, проявляющееся быстро-
нарастающей азотемией и тяжелыми водно-электролитными нарушениями.
Формы ОПН: преренальная (гемодинамическая), обусловленная острым нару-
шением почечного кровообращения; ренальная (паренхиматозная), вызванная по-
ражением почечной паренхимы; постренальная (обструктивная), развивающаяся в
результате острого нарушения оттока мочи.
Этиология. Пусковые механизмы преренальной ОПН — это снижение сердеч-
ного выброса, острая сосудистая недостаточность, гиповолемия и резкое сниже-
ние ОЦК. Нарушения общей гемодинамики и циркуляции, резкое обеднение почеч-
369
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ного кровообращения индуцируют почечную афферентную вазоконстрикцию с
перераспределением (шунтированием) почечного кровотока, ишемией коркового
слоя почки и снижением СК.Ф. При усугублении почечной ишемии преренальная
ОПН может перейти в ренальную за счет ишемического некроза эпителия почеч-
ных извитых канальцев.
Ренальная ОПН в 75 % случаев вызвана острым канальцевым некрозом (ОКН),
чаще — ишемическим ОКН, осложняющим шок (кардиогенный, гиповолемичес-
кий, анафилактический, септический), коматозные состояния, дегидратацию. Кроме
этого, повредить эпителий извитых почечных канальцев могут некоторые лекар-
ственные препараты и химические соединения, вызывающие нефротоксический
ОКН, который диагностируют у каждого 10-го больного ОПН, поступившего в
центр острого гемодиализа.
©Первое место в рейтинге известной сотни нефротоксинов занимают ами-
ногликозидные антибиотики, применение которых в 10-15 % случаев при-
водит к умеренной, а в 1 -2 % — к тяжелой ОПН. Из промышленных нефро-
токсинов наиболее опасны соли тяжелых металлов (ртути, меди, золота,
свинца, бария, мышьяка) и органические растворители (гликоли, дихлор-
этан, четыреххлористый углерод)
В 25 % случаев ренальная ОПН обусловлена воспалением в почечной парен-
химе и интерстиции (острым или быстропрогрессирующим гломерулонефритом,
интерстициальным нефритом), поражением почечных сосудов (тромбозом почеч-
ных артерий, вен, расслаивающейся аневризмой аорты, васкулитами, склеродер-
мической почкой, гемолитико-уремическим синдромом, злокачественной ГБ) и
др. Среди воспалительных заболеваний почечной паренхимы в последнее десяти-
летие существенно увеличился удельный вес лекарственного (аллергического) ос-
трого интерстициального нефрита (ОИЦ) в рамках геморрагической лихорадки с
почечным синдромом (ГЛПС), а также интерстициального нефрита при лепто-
спирозе. Увеличение заболеваемости ОИН объясняют растущей аллергизацией
населения и полипрагмазией.
Одна из частых причин ренальной ОПН — миоренальный синдром, или пиг-
ментный миоглобинурийный нефроз, вызванный массивным рабдомиолизом. Раб-
домиолиз бывает травматическим (при краш-синдроме, судорогах, чрезмерных
физических нагрузках) и нетравматическим (при электротравме, отморожениях,
отравлении СО, соединениями цинка, меди, ртути, героином, при вирусных мио-
зитах, хроническом алкоголизме, коматозных состояниях, тяжелой гипокалиемии,
гипофосфатемии, длительной лихрадке, эклампсии, пролонгированном астмати-
ческом статусе и пароксизмальной миоглобинурии).
Постренальная ОПН вызвана острой обструкцией (окклюзией) мочевых пу-
тей: двусторонней обструкцией мочеточников, обструкцией шейки мочевого пу-
зыря аденомой или раком предстательной железы, опухолью, шистосомозом мо-
чевого пузыря, стриктурой уретры. Среди других причин — некротический папил-
лит, ретроперитонеальный фиброз и забрюшинные опухоли, заболевания и травмы
спинного мозга. Для развития постренальной ОПН у больного с хроническим
заболеванием почек нередко достаточно односторонней обструкции мочеточника.
Механизм развития постренальной ОПН связан с афферентной почечной вазо-
констрикцией, развивающейся в ответ на резкое повышение внутриканальцевого
давления с выбросом ангиотензина II и тромбоксана А,.
370
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Особо выделяют ОПН, развивающуюся в рамках полиорганной недостаточ-
ности, ввиду крайней тяжести состояния и сложности лечения. Синдром полиор-
ганной недостаточности проявляется сочетанием ОПН с дыхательной, сердечной,
печеночной, эндокринной (надпочечниковой) недостаточностью и осложняет тер-
минальные состояния у кардиологических, пульмонологических, гастроэнтероло-
гических, геронтологических больных, при остром сепсисе и множественной травме.
Патогенез. Основной патогенетический механизм развития ОПН — ишемия
почек. Шоковая перестройка почечного кровотока — внутрипочечное шунтирова-
ние крови через юкстагломерулярную систему со снижением давления в гломеру-
лярных афферентных артериолах менее 60—70 мм рт. ст. — является причиной
ишемии коркового слоя, индуцирует выброс катехоламинов, активирует ренин-
альдостероновую систему к выработке ренина, антидиуретического гормона и тем
самым вызывает почечную афферентную вазоконстрикцию с дальнейшим сниже-
нием СКФ, ишемическим повреждением эпителия извитых канальцев, повыше-
нием концентрации кальция и свободных радикалов в клетках канальцевого эпи-
телия. Ишемическое поражение почечных канальцев при ОПН часто усугубляется
их одновременным прямым токсическим повреждением эндотоксинами. Вслед за
некрозом (ишемическим, токсическим) эпителия извитых канальцев развивается
утечка гломерулярного фильтрата в интерстиций через поврежденные канальцы,
которые блокируются клеточным детритом, а также в результате интерстициаль-
ного отека почечной ткани. Интерстициальный отек усиливает ишемию почки и
способствует дальнейшему снижению клубочковой фильтрации. Степень увели-
чения интерстициального объема почки, а также степень снижения высоты ще-
точной каймы и площади базальной мембраны эпителия извитых канальцев кор-
релируют с тяжестью ОПН.
В настоящее время накапливается все больше экспериментальных и клини-
ческих данных, свидетельствующих о том, что влияние констриктивных стимулов
на сосуды при ОПН реализуется через изменения внутриклеточной концентрации
кальция. Кальций первоначально поступает в цитоплазму, а затем, с помощью
специального переносчика, в митохондрии. Энергия, используемая переносчи-
ком, необходима и для начального синтеза АТФ. Дефицит энергии приводит к
некрозу клеток, а образовавшийся клеточный детрит обтурирует канальцы, усу-
губляя анурию. Введение блокатора кальциевых каналов веропамила одновремен-
но с ишемией или непосредственно после нее препятствует поступлению кальция
в клетки, что предупреждает ОПН или облегчает ее течение.
Помимо универсальных существуют и частные механизмы патогенеза отдель-
ных форм ренальной ОПН. Так, ДВС-синдром с билатеральным кортикальным
некрозом характерен для акушерской ОПН, острого сепсиса, геморрагического и
анафилактического шока, БПГН при системной красной волчанке. Внутриканаль-
цевая блокада за счет связывания канальцевого белка Tamm-Horsfall с белком
Бенс-Джонса, свободным гемоглобином, миоглобином определяет патогенез ОПН
при миеломной болезни, рабдомиолизе, гемолизе.
Отложение кристаллов в просвете почечных канальцев обнаруживают при
мочекислой блокаде (первичной и вторичной подагре), отравлении этиленглико-
лем, передозировке сульфаниламидами и метотрексатом.
При некротическом папиллите (некрозе почечных сосочков) возможно раз-
витие постренальной и ренальной ОПН. Чаще регистрируют постренальную ОПН,
вызванную обструкцией мочеточников некротизированными сосочками и сгуст-
ками крови при хроническом некротическом папиллите (при диабете, аналгети-
371
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ческой нефропатии, алкогольной нефропатии, серповидно-клеточной анемии).
Ренальная ОПН за счет тотального некротического папиллита развивается при
гнойном пиелонефрите и часто приводит к необратимой уремии. Ренальная ОПН
может развиться при остром пиелонефрите в результате выраженного интерсти-
циального отека стромы, инфильтрированной нейтрофилами, особенно при при-
соединении апостематоза и бактериемического шока.
Выраженные воспалительные изменения в виде диффузной инфильтрации
интерстициальной ткани почек эозинофилами и лимфоцитами — причина ОПН
при лекарственном остром интерстициальном нефрите.
ОПН при геморрагической лихорадке с почечным синдромом может развить-
ся по причине острого вирусного интерстициального нефрита и других осложне-
ний ГЛПС: гиповолемического шока, геморрагического шока и коллапса за счет
подкапсульного разрыва почки, острой надпочечниковой недостаточности.
Тяжелые воспалительные изменения в почечных клубочках с диффузной эк-
стракапиллярной пролиферацией, микротромбозами и фибриноидным некрозом
сосудистых петель клубочков ведут к ОПН при БПГН (первичном, волчаночном,
синдроме Гудпасчера) и реже — при остром постстрептококковом нефрите.
Причиной ренальной ОПН могут стать тяжелые воспалительные изменения
почечных артерий: некротический артериит со множественными аневризмами ду-
гообразных и интерлобулярных артерий (узелковый периартериит), тромботичес-
кая окклюзирующая микроангиопатия сосудов почек, фибриноидный артериоло-
некроз (злокачественная ГБ, склеродермическая почка, гемолитико-уремический
синдром и тромботическая тромбоцитопеническая пурпура).
Клинические проявления. Для ОПН характерно циклическое, потенциально об-
ратимое течение. Выделяют начальную (кратковременную) стадию, олигуричес-
кую, или анурическую (2—3 недели), и восстановительную, или полиурическую
(5—10 дней). О необратимом течении ОПН следует думать, когда длительность
анурии превысила 4 недели. Этот редкий вариант течения тяжелой ОПН наблюда-
ют при билатеральном кортикальном некрозе, БПГН, тяжелых воспалительных
поражениях почечных сосудов (системных васкулитах, злокачественной ГБ).
Ранние клинические признаки (предвестники) ОПН часто минимальны и
непродолжительны — почечная колика при постренальной ОПН, эпизод острой
сердечной недостаточности, циркуляторный коллапс при преренальной ОПН.
Нередко клинический дебют ОПН замаскирован экстраренальными симптомами,
например, острым гастроэнтеритом при отравлении солями тяжелых металлов,
местными и инфекционными проявлениями при множественной травме, систем-
ными проявлениями при лекарственном ОИН. Многие ранние симптомы ОПН
(слабость, анорексия, тошнота, сонливость) неспецифичны, поэтому наибольшую
ценность для ранней диагностики имеют лабораторные методы — определение
уровней креатинина, мочевины и калия в крови.
Признаки клинически развернутой ОПН — это симптомы выпадения гомео-
статической функции почек: острые нарушения водно-электролитного обмена и
КОС, нарастающая азотемия, поражения ЦНС (уремическая интоксикация), лег-
ких, ЖКТ, острые бактериальные и грибковые инфекции.
Олигурию (диурез менее 500 мл) обнаруживают у большинства больных ОПН.
У 3—10 % больных развивается анурическая ОПН (диурез менее 50 мл/сут). К
олигурии и, особенно, анурии, могут быстро присоединиться симптомы сначала
внеклеточной гипергидратации (периферические и полостные отеки), а затем —
внутриклеточной (отек легких, острая левожелудочковая недостаточность, отек
372
18.АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХОПЕРАЦИЙ
мозга). У 30 % больных развивается неолигурическая ОПН при отсутствии при-
знаков гипергидратации.
Азотемия — важный признак ОПН. Выраженность азотемии, как правило, отра-
жает тяжесть ОПН. Для ОПН, в отличие от ХПН, характерны быстрые темпы нарас-
тания азотемии. Ежесуточный прирост уровня мочевины крови на 1,6—3,33 ммоль/л и
креатинина на 44,2—88,4 мкмоль/л свидетельствует о некатаболической форме
ОПН. Гиперкатаболическая форма ОПН при остром сепсисе, ожоговой болезни,
множественной травме с краш-синдромом, хирургических операциях на сердце и
крупных сосудах отличается значительно более высокими темпами ежесуточного
прироста мочевины и креатинина крови, а также более выраженными нарушени-
ями обмена калия и КОС. При неолигурической ОПН высокая азотемия, как
правило, появляется при присоединении гиперкатаболизма.
Гиперкалиемию (см. раздел 18.3.2) чаще выявляют при олигурической и ану-
рической ОПН, особенно при гиперкатаболических формах, когда накопление
калия в организме происходит не только за счет снижения его почечной экскре-
ции, но и вследствие его поступления из некротизированных мышц и гемолизи-
рованных эритроцитов. При этом критическая, опасная для жизни гиперкалиемия
(более 7 ммоль/л) может развиться в течение первых суток болезни и определить
темп нарастания уремии. Ведущая роль в выявлении гиперкалиемии и контроле
уровня калия принадлежит биохимическому мониторингу и ЭКГ.
Метаболический ацидоз со снижением уровня бикарбонатов в сыворотке до
13 ммоль/л обнаруживают у большинства больных ОПН. При более выраженных
нарушениях КОС со значительным дефицитом бикарбонатов и снижением pH
крови, что характерно для гиперкатаболических форм ОПН, в клинической кар-
тине появляется симптоматика большого шумного дыхания Куссмауля и другие
признаки поражения ЦНС, усугубляются нарушения сердечного ритма, вызван-
ные гиперкалиемией.
Тяжелое угнетение функции иммунной системы характерно для ОПН: угнетают-
ся фагоцитарная функция и хемотаксис лейкоцитов, подавляется синтез антител,
нарушается клеточный иммунитет (лимфопения). Острые бактериальные (чаще
вызванные условно-патогенной грамположительной и грамотрицательной флорой)
и грибковые инфекции (вплоть до кандидасепсиса) развиваются у 30—70 % боль-
ных ОПН и часто определяют прогноз. Типичны острая пневмония, стоматиты,
паротиты, инфекция мочевых путей и др. Одно из наиболее тяжелых легочных
поражений при ОПН — абсцедирующая пневмония.
Часто развиваются другие формы поражения легких, которые дифференциру-
ют с пневмонией. Развивающийся при тяжелой гипергидратации уремический отек
легких проявляется ОДН, рентгенологически — множественными облаковидны-
ми инфильтратами в обоих легких. Респираторный дистресс-синдром, часто ассо-
циирующийся с тяжелой ОПН, также проявляется ОДН с прогрессирующим ухуд-
шением легочного газообмена и диффузными изменениями в легких (интерсти-
циальным отеком, множественными ателектазами) с признаками острой легочной
гипертензии и последующим присоединением бактериальной пневмонии. Леталь-
ность от дистресс-синдрома очень высока.
Дифференциальная диагностика. На первом этапе диагностики ОПН диффе-
ренцируют анурию от острой задержки мочи: убеждаются в отсутствии мочи в
мочевом пузыре (перкуторно, с помощью УЗИ или катетеризации) и немедленно
проводят лабораторные исследования уровня мочевины, креатинина и калия сы-
воротки крови. Следующий этап диагностики заключается в установлении формы
373
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ОПН — преренальной, ренальной или постренальной. В первую очередь, исклю-
чают обструкцию мочевых путей с помощью УЗИ, радионуклидных, рентгеноло-
гических и эндоскопических методов. Исследуют лабораторные показатели мочи.
При преренальной ОПН содержание в моче натрия и хлора снижено, а соотноше-
ние креатинина мочи к креатинину плазмы повышено, что свидетельствует об
относительно сохраненной концентрационной способности почек. Обратное со-
отношение наблюдают при ренальной ОПН. Показатель экскретируемой фрак-
ции натрия при преренальной ОПН составляет менее 1, а при ренальной ОПН —
равен 2.
После исключения преренальной ОПН устанавливают форму ренальной ОПН.
Присутствие в осадке эритроцитарных и белковых цилиндров свидетельствует о
поражении клубочков (например, при ОГН или БПГН), обильный клеточный детрит
и тубулярные цилиндры указывают на ОКН, наличие полиморфно-ядерных лей-
коцитов и эозинофилов характерно для острого тубулоинтерстициального нефри-
та, обнаружение патологических цилиндров (миоглобиновых, гемоглобиновых,
миеломных), а также кристаллурии типично для внутриканальцевой блокады.
Исследование состава мочи в некоторых случаях не имеет решающего диаг-
ностического значения. Например, при использовании диуретиков содержание
натрия в моче при преренальной ОПН может повыситься, а при хронических
нефропатиях преренальный компонент (снижение натрийуреза) может не выя-
виться, поскольку даже в начальной стадии ХПН в значительной мере теряется
способность почек к консервации натрия и воды. В дебюте острого нефрита элек-
тролитный состав мочи может быть аналогичным таковому при преренальной ОПН,
а в дальнейшем — сходен с таковым при ренальной ОПН. Острая обструкция
мочевых путей приводит к изменениям состава мочи, характерным для прере-
нальной ОПН, а хроническая — вызывает изменения, характерные для ренальной
ОПН. Низкую экскретируемую фракцию натрия фиксируют у больных с гемогло-
бин- и миоглобинурической ОПН. На заключительных этапах диагностики ис-
пользуют биопсию почки. Она показана при затянувшемся течении анурического
периода ОПН, ОПН неясной этиологии, подозрении на лекарственный острый
тубулоинстициальный нефрит, ОПН, ассоциированной с гломерулонефритом или
системным васкулитом.
Лечение. Главная задача лечения постренальной ОПН заключается в устране-
нии обструкции и восстановлении нормального пассажа мочи, после чего симп-
томы постренальной ОПН в большинстве случаев быстро ликвидируются. Диа-
лизные методы применяют при постренальной ОПН в тех случаях, если, несмотря
на восстановление проходимости мочеточников, анурия сохраняется. Это наблю-
дают при присоединении апостематозного нефрита или уросепсиса.
Если диагностировали преренальную ОПН, то, в первую очередь, устраняют
факторы, вызвавшие острую сосудистую недостаточность или гиповолемию, отме-
няют лекарства, индуцирующие преренальную ОПН (НПВС, ингибиторы АПФ,
сандиммун). Для выведения из шока и восполнения ОЦК внутривенно вводят зна-
чительные дозы стероидов, крупномолекулярных декстранов (полиглюкина, реопо-
лиглюкина), плазмы, раствора альбумина. При кровопотере переливают эритро-
цитарную массу. При гипонатриемии и дегидратации внутривенно вводят солевые
растворы. Все виды трансфузионной терапии проводят под контролем диуреза и
уровня ЦВД. Только после стабилизации АД и восполнения внутрисосудистого русла
рекомендуют перейти на внутривенное длительное (6—24 ч) введение фуросемида с
допамином, что позволяет уменьшить почечную афферентную вазоконстрикцию.
374
IS. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
При олигурии у больных с ренальной ОПН (при миеломной болезни, уратном
кризисе, рабдомиолизе, гемолизе) рекомендуют непрерывную (до 60 ч) инфузи-
онную ощелачивающую терапию, включающую введение маннитола вместе с изо-
тоническим раствором хлорида натрия, бикарбонатом натрия, глюкозой (в сред-
нем 400—600 мл/ч) и фуросемидом. Благодаря этой терапии, диурез поддерживают
на уровне 200—300 мл/ч, сохраняют щелочную реакцию мочи (pH > 6,5), что пре-
дотвращает внутриканальцевую преципитацию цилиндров и обеспечивает выведе-
ние свободного миоглобина, гемоглобина, мочевой кислоты.
На ранней стадии ренальной ОПН, в течение первых 2—3 суток развития ОКН,
при отсутствии полной анурии и гиперкатаболизма оправдана попытка проведения
консервативной терапии с применением фуросемида, маннитола, инфузии жидко-
сти. Об эффективности консервативной терапии свидетельствует увеличение диу-
реза с ежедневным снижением массы тела на 0,25—0,5 кг. Потеря массы тела более
0,8 кг/сут часто сочетается с нарастанием уровня калия в крови — это тревожный
признак гипергидратации, требующей ужесточения водного режима.
При некоторых вариантах ренальной ОПН (БПГН, лекарственном ОИН, ос-
тром пиелонефрите) базисную консервативную терапию дополняют иммунодеп-
рессантами, антибиотиками, плазмаферезом, который также рекомендуют боль-
ным с краш-синдромом для удаления миоглобина и купирования ДВС-синдрома.
При ОПН в результате сепсиса или отравлений используют гемосорбцию. При
отсутствии эффекта от консервативной терапии в течение 2—3 суток ее продолже-
ние бесперспективно и опасно ввиду увеличения риска осложнений от примене-
ния больших доз фуросемида (поражения слуха) и маннитола (острой сердечной
недостаточности, гиперосмолярности, гиперкалиемии).
Диализное лечение начинают немедленно, не прибегая к консервативной тера-
пии, при выраженном гиперкатаболизме (приросте уровня мочевины в крови бо-
лее 15-20 мг/сут с нарастающими гиперкалиемией и метаболическим ацидозом),
тяжелой внутриклеточной гипергидратации (угрозе отека легких или мозга), пол-
ной ренальной анурии, ОПН с необратимым течением (билатеральном корти-
кальном некрозе, гемолитико-уремическом синдроме, злокачественной ГБ).
Выбор диализного лечения определяют особенностями ОПН. При некатабо-
лической ОПН с отсутствием тяжелой гипергидратации (с остаточной функцией
почек) используют острый гемодиализ. В то же время при некатаболической ОПН
у детей и геронтологических пациентов, при тяжелом атеросклерозе, лекарствен-
ной ОПН (аминогликозидном ОКН) эффективен острый перитонеальный диализ.
Для лечения больных с критической гипергидратацией и метаболическими
нарушениями с успехом используют гемофильтрацию (ГФ). У больных с ОПН без
остаточной функции почек гемофильтрацию проводят непрерывно в течение все-
го периода анурии (постоянная ГФ). При наличии минимальной остаточной функ-
ции почек проведение процедуры возможно в интермиттирующем режиме (интер-
миттирующая ГФ). В зависимости от вида сосудистого доступа постоянная ГФ
бывает артериовенозной и веновенозной. Непременное условие для проведения
артериовенозной ГФ — стабильность гемодинамики. У больных с критической
гипергидратацией и нестабильной гемодинамикой (гипотонией, падением сердеч-
ного выброса) проводят веновенозную ГФ. Перфузию крови через гемодиализа-
тор осуществляют с помощью насоса, который гарантирует адекватный поток крови
для поддержания требуемой скорости ультрафильтрации.
Прогноз и исходы. Несмотря на совершенствование методов лечения, леталь-
ность при ОПН остается высокой, достигая 20 % при акушерско-гинекологических
375
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
формах, 50 % — при лекарственных поражениях, 70 % — после травм и хирургичес-
ких вмешательств, 80—100 % — при полиорганной недостаточности. Ухудшают прог-
ноз при ОПН присоединение инфекции (сепсис) и пожилой возраст больных.
ЬВ!
.„„-т-тли IIIII-. ,
Прогноз преренальной и постренальной ОПН более благоприятный, чем ре-
нальной ОПН. Прогностически неблагоприятны олигурическая и особенно ану-
рическая ренальная ОПН, а также ОПН с выраженным гиперкатаболизмом
Среди исходов ОПН наиболее частым является выздоровление: полное — в
35—40 % случаев, частичное — в 10—15 %. Летальный исход констатируют в 40-45
% случаев. Хронизацию с переводом больного на хронический гемодиализ регис-
трируют редко (1—3 %) при билатеральном кортикальном некрозе, синдроме зло-
качественной гипертонии, гемолитико-уремическом синдроме, некротических вас-
кулитах. В последние годы наблюдают необычно высокий процент хронизации
(15—18 %) после ОПН, вызванной рентгенконтрастными веществами. Нередким
осложнением перенесенной ОПН являются инфекция мочевых путей и пиело-
нефрит, который в последующем может привести к ХПН.
ХПН возникает при первичном поражении почек и вследствие системных
заболеваний, влияющих на почки. Биохимические признаки ХПН определяют
только при функционировании менее 40 % всех нефронов. Пока функционируют
хотя бы 10 % нефронов, диализ (перитонеальный или гемодиализ) обычно не
требуется. У больных с ХПН высока вероятность развития ассоциированных ате-
ром и гипертензии.
18.5. ОСОБЕННОСТИ АНЕСТЕЗИОЛОГИЧЕСКОГО
ОБЕСПЕЧЕНИЯ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Ведущую роль в многообразии патологических процессов при уро-
логических заболеваниях играют острые и хронические воспалительные процессы в
почках и мочевыводящих путях, уролитиаз, новообразования, аномалии развития
мочевой системы. Тяжелым осложнением урологических заболеваний является уро-
сепсис (в том числе ятрогенный). Ряд заболеваний почек или их сосудов осложня-
ется нефрогенной гипертензией, трудно поддающейся медикаментозному лечению.
В урологических операциях нуждаются пациенты разных возрастных групп: в
детском возрасте превалируют аномалии развития мочевой системы и воспали-
тельные процессы в почках; в пожилом возрасте чаще диагностируют уролитиаз,
новообразования почек, мочевого пузыря, предстательной железы, ХПН. Для ге-
ронтологических пациентов характерны сопутствующие заболевания сердечно-со-
судистой и дыхательной систем, обменные нарушения. Литотомическое положе-
ние на операционном столе и трансуретральный доступ осложняют проведение
анестезии.
18.5.1. Предоперационный период
Часто больные с дисфункциями почек принимают системное ле-
чение кортикостероидными гормонами или другими иммунодепрессантами, при-
ем которых не прерывают накануне плановой или экстренной операции.
376
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Пациентам с последней стадией почечной недостаточности проводят плано-
вый перитонеальный диализ вплоть до поступления в операционную. Гемодиализ
осуществляют с минимальной гепаринизацией за 12 ч до операции.
Предоперационные осмотр, оценка анестезиологического риска,
обследование и подготовка
У больных с ХПН проводят своевременную диагностику и коррекцию состо-
яний, которые оказывают влияние на течение периоперационного периода (ги-
пер- и гипокалиемии, гипер- и гипонатриемии, гиперфосфатемии, гипокальцие-
мии, метаболического ацидоза, нормохромной анемии).
Оценка водно-электролитного баланса. Степень гидратации оценивают по обыч-
ным признакам (см. раздел 3.1.5) — тургору кожи, состоянию слизистых, давле-
нию в яремной вене, наличии отеков, аускультативных признаков отека легких.
При необходимости проводят измерение ЦВД. Большинству пациентов, находя-
щихся на гемодиализе, известны нормальный вес и ежедневные потребности в
жидкости.
Перед операцией максимально добиваются состояния нормоволемии. Ин-
тенсивную инфузионную терапию проводят физиологическим раствором, в случа-
ях кровопотери проводят гемотрансфузию.
Наиболее значимыми биохимическими проблемами, связанными с тяжелым
некорригированным поражением почек, являются гиперкалиемия (см. раздел 18.3.2)
и ацидоз, который наилучшим образом корректируют с помощью диализа. Введение
раствора бикарбоната натрия используют только в случае снижения pH менее 7,2
(побочные эффекты — гипернатриемия и водная перегрузка).
Оценка состояния сердечно-сосудистой системы. Показатели АД корректируют
до операции. Проводят дифференциальную диагностику первичной и вторичной
артериальной гипертензии, ИБС. Отек легких может являться следствием водной
перегрузки или левожелудочковой недостаточности, перикардит — возникнуть при
уремическом состоянии.
Оценка функции дыхания. Отек легких и экссудативный плеврит ухудшают ра-
стяжимость легких и показатель ФОЕ, усиливают несоответствие вентиляции и
перфузии, что увеличивает вероятность развития гипоксии. Лучшим методом ле-
чения является выведение жидкости путем использования диуретиков или с по-
мощью диализа.
Оценка функции кроветворения. У больных с ХПН, не получавших эритропоэ-
тин, достаточно часто регистрируют хроническую анемию. Если пациент не страдает
ИБС, то допустимый уровень гемоглобина перед операцией составляет 70—80 г/л.
Необходимо помнить, что больные с уремическим синдромом склонны к крово-
точивости в связи со снижением адгезивной способности тромбоцитов и хрупко-
стью сосудистой стенки.
Оценка функции пищеварительной системы. На фоне ХПН часто развиваются
анорексия, тошнота, рвота, кровотечение из стрессовых язв, диарея, икота, кото-
рые усиливают дегидратацию. У таких больных часто нарушено питание, что пре-
пятствует нормальному процессу заживления ран.
Оценка функции ЦНС. Уремические больные предъявляют жалобы на раздра-
жительность и слабость. У них часто диагностируют снижение интеллектуальных
способностей и угнетение сознания, которое может прогрессировать вплоть до
комы. Тяжелая уремия, нарушения водно-электролитного баланса могут вызвать
судорожные приступы.
377
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Оценка состояния эндокринной системы. Гиперпаратиреоидизм приводит к де-
минерализации костей, что повышает склонность к переломам. Снижение чувстви-
тельности к инсулину затрудняет поддерживающую терапию сахарного диабета.
Премедикация•
Используют пероральные седативные препараты (диазепам, темазепам). Если
высока вероятность развития пищеводного рефлюкса, то обязательно назначают
Н2-антагонисты или антациды (например, цитрат натрия).
18.5.2. Интраоперационный период
Влияние анестезии на функцию почек. Трудно отдифференцировать
прямое действие анестетиков на почки от опосредованного; необходимо учиты-
вать характер операции, тип инфузионных растворов, исходную сердечную и по-
чечную функции и др.
Существуют определенные закономерности влияния анестезии на функцию
почек: общая и регионарная анестезии вызывают обратимое снижение почечного
кровотока, диуреза и экскреции натрия; вышеперечисленные изменения менее
выражены при регионарной анестезии. Большинство изменений опосредовано
вегетативными и гормональными влияниями. Эти изменения можно частично
нивелировать поддержанием адекватных показателей ОЦК и АД. Специфическое
нефротоксическое действие оказывают лишь некоторые анестетики в высоких дозах,
например, фторотан и метоксифлюран.
Большинство ингаляционных и неингаляционных анестетиков вызывают де-
прессию миокарда и снижение показателей АД. Приводя к симпатической блока-
де, спинальная и эпидуральная анестезии способствуют развитию артериальной и
венозной дилатации, что сопряжено с риском возникновения артериальной гипо-
тонии. Падение уровня АД ниже пределов ауторегуляции может вызвать уменьше-
ние почечного кровотока, диуреза и экскреции натрия. Инфузия жидкости устра-
няет артериальную гипотонию, что приводит к нормализации почечной функции.
Поверхностная анестезия, интенсивная хирургическая стимуляция, травма тка-
ней и депрессия кровообращения являются причинами симпатической активации в
периоперационный период, что увеличивает почечное сосудистое сопротивление и
активирует различные гормональные системы, что, в свою очередь, способствует
снижению почечного кровотока, СК.Ф и диуреза. Эндокринная стрессорная реак-
ция проявляется повышением в крови концентрации катехоламинов, ренина, анги-
отензина II, альдостерона, АДГ, АКТГ и кортизола. Вызывая почечную артериаль-
ную вазоконстрикцию, катехоламины, АДГ и ангиотензин II уменьшают почечный
кровоток. Альдостерон повышает реабсорбцию натрия в дистальных канальцах и
собирательных трубочках, что приводит к задержке натрия и увеличению объема
внеклеточной жидкости. Неосмотическая секреция АДГ также способствует задержке
воды, а в некоторых случаях может вызвать гипонатриемию. Преходящая задержка
жидкости, наблюдаемая в послеоперационный период, у многих больных отчасти
объясняется реакцией эндокринной системы на операцию и анестезию. Таким об-
разом, прямое действие анестетиков на почечную функцию выражено гораздо сла-
бее по сравнению с вышеописанными опосредованными эффектами.
Наиболее сложные патофизиологические изменения в организме развивают-
ся при ОПН и ХПН, когда значительно или полностью утрачиваются выделитель-
ная и гомеостатическая функции почек.
378
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕУРОЛОГИЧЕСКИХОПЕРАЦИЙ
Обеспечение анестезии. Если в будущем планируют проведение гемодиализа,
то вены предплечья и области локтевой ямки у таких пациентов не пунктируют с
целью сохранения потенциальных мест установки артериовенозных фистул.
У больных с ХПН обеспечивают комплексный мониторинг до начала индук-
ции в наркоз; особенно важна ЭКГ-диагностика гиперкалиемии. Поддерживают
адекватную оксигенацию и гемодинамическую стабильность. Гиповолемия и ги-
потония ухудшают работу почек, поэтому тщательно компенсируют потери крови
и жидкости. По возможности используют короткодействующие препараты. Во время
спинальной и эпидуральной анестезии волемическую преднагрузку проводят в
минимальном объеме, а стабильность гемодинамики обеспечивают вазоконстрик-
торными препаратами. Перегрузка жидкостью в послеоперационный период мо-
жет потребовать проведения гемодиализа. Наиболее благоприятный вид обезбо-
ливания — сбалансированная анестезия.
Характерные особенности у больных с сопутствующей почечной недостаточ-
ностью (уремией), которые учитывают при выборе метода и проведения анесте-
зии: нормохромная анемия, сниженная кислородная емкость крови, компенса-
торное увеличение МОС, шунтирование крови, гипертензия, левожелудочковая
гипертензия, склероз сосудов, относительная коронарная недостаточность, кар-
диомиопатия, мочевинный перикардит, возможный застой жидкости (гипергид-
ратационная гипертензия), нарушения электролитного обмена (гиперкалиемия),
ЭКГ-замедление ритма, метаболический ацидоз, риск инфекций, опасность сеп-
сиса, нарушения заживления ран, гепатита и печеночной недостаточности, гемор-
рагический диатез (нарушение функции тромбоцитов), повышенный риск аспи-
рации, периферическая нейропатия.
Во время операции соблюдают строгую асептику, ограничивают инфузии (осо-
бенно растворов калия). Применяют ардуан, панкурониум, векурониум, рокуро-
ниум; использование сукцинилхолина опасно, так как высок риск развития ги-
перкалиемии.
Общую анестезию с интубацией трахеи и миорелаксацией применяют при опе-
рациях на почках, верхней и средней трети мочеточника.
Регионарную (эпидуральную или спинальную) анестезию применяют преиму-
щественно при оперативных вмешательствах на нижней трети мочеточника, мо-
чевом пузыре, предстательной железе, уретре. Широкое применение находит ме-
тод продленной эпидуральной анестезии, как с использованием местных анесте-
тиков, так и с введением морфина (2—4 мг) в эпидуральное пространство для
обеспечения длительной послеоперационной аналгезии.
Некоторые операции выполняют под местной анестезией в сочетании с седа-
тивной терапией: блокаду подвздошно-пахового и полового нервов применяют при
операциях на мошонке и яичках, часто сочетая с дополнительной блокадой поло-
вой ветви бедренно-полового нерва; при циркумцизио используют инфильтрацион-
ную анестезию полового члена и/или блокаду дорсального нерва полового члена.
18.5.3. Послеоперационный период
Проводят тщательный контроль послеоперационного баланса
жидкости, профилактику развития рвоты, компенсацию всех потерь жидкости,
при необходимости — гемодиализ (при развитии осложнений гепаринизации его
проведение отсрочивают).
379
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
У некоторых пациентов может возникнуть сонливость при введении относи-
тельно небольших доз аналгетиков.
Профилактика ОПН. Даже у здоровых пациентов высок риск развития ОКБ в
случаях массивного кровотечения, множественной травмы, сепсиса, обширных
ожогов, и, тем более, если были исходные нарушения почечной функции. Почеч-
ную недостаточность диагностируют, когда продукция мочи составляет меньше
0,5 мл/кг/час или растет уровень креатинина плазмы.
Главными факторами предотвращения развития ОПН являются поддержа-
ние нормоволемии и адекватного перфузионного почечного давления. У пациен-
тов с высоким риском инфузионную терапию проводят под контролем ЦВД и
ежечасного диуреза (не менее 1 мл/кг/ч).
При невозможности поддержания нормального уровня САД путем интенсив-
ной инфузионной терапии применяют вазоактивные препараты. При олигурии на
фоне адекватной инфузии и показателях АД внутривенно вводят фуросемид до
240 мг в течение 60 мин; если диурез не увеличивается, то дальнейшее введение
фуросемида не имеет смысла. Диурез увеличивают допамин и маннитол, но они, в
свою очередь, увеличивают потребность почек в кислороде, поэтому применение
фуросемида более предпочтительно.
Не применяют нефротоксичные препараты — НПВС и ингибиторы АПФ. При
использовании аминогликозидов контролируют их плазменную концентрацию.
Лабораторное исследование показателей электролитов в течение перио-
перационного периода проводят ежедневно (потребность в натрии составляет
0—40 ммоль/сут). Как можно раньше в послеоперационный период обеспечивают
адекватное введение энергетических субстратов.
18.5.4. Диагностические и лечебные
урологические манипуляции
Эндоскопические исследования и цистоскопию выполняют с целью
диагностики и лечения гематурии, пиурии, уролитиаза, травм, обструкций и опу-
холей. Эти манипуляции проводят в литотомическом положении (см. раздел 9.1),
что иногда сопровождается повреждениями нервов (общего малоберцового, седа-
лищного, запирательного, бедренного), изменением сосудистой емкости и пере-
распределением крови (при поднятии и опускании ног).
Основные требования к “малой анестезии ” в урологии: адекватная аналгезия,
транквилизация, снятие спазма гладкой мускулатуры мочевыводящих путей.
Выбор метода анестезии зависит от возраста и пола больного, характера хирур-
гического вмешательства. Детям, как правило, проводят общую анестезию. У жен-
щин уретра короткая, поэтому при диагностической цистоскопии осуществляют
местную анестезию лидокаиновым гелем, иногда в сочетании с седацией. При
оперативной цистоскопии с целью биопсии, прижигания, манипуляций с моче-
точниковыми катетерами проводят регионарную или общую анестезии.
Доминирующим методом обезболивания урологических манипуляций явля-
ется потенцированная местная анестезия: 10—20 мл 3—5 % раствора лидокаина вво-
дят в уретру, внутривенно взрослым вводят 5—10 мг диазепама, 10 мг промедола
или 100 мкг фентанила (в амбулаторных условиях — 5 мг диазепама). При такой
анестезии выполняют цистоскопию, катетеризацию мочеточников, электрокоа-
гуляцию мелких папиллом мочевого пузыря, бужирование уретры. При экстрак-
380
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
ции петлей камней мочеточников осуществляют внутривенную инъекцию 5—10 мл
баралгина. У некоторых больных (при выраженном цистите, сморщенном мочевом
пузыре, стриктурах уретры) для обеспечения адекватного обезболивания подобных
манипуляций используют любую методику общей анестезии, подходящую для ам-
булаторной практики, в частности, внутривенный наркоз пропофолом.
В стационарных условиях при длительных манипуляциях альтернативой об-
щей анестезии является регионарная анестезия (эпидуральная и спинальная блока-
ды). Поднятие ног сразу после интратекальной инъекции местного анестетика не
повышает уровень блокады и не увеличивает риск возникновения тяжелой арте-
риальной гипотонии. Сенсорная блокада на уровне Ц—L3 обеспечивает хорошую
анестезию для проведения практически всех цистоскопических вмешательств.
18.5.4.1. Тронсуретрольная резекция предстательной железы
Доброкачественная гиперплазия предстательной железы нередко
приводит к клинически выраженной обструкции мочевого пузыря; нередко, в свя-
зи с неэффективностью консервативной терапии, проводят оперативное лечение.
Трансуретральную резекцию предстательной железы (ТУРП) обычно выпол-
няют больным старше 60 лет, у которых масса гиперплазированной простаты не
превышает 60 г, а объем — 60—80 см3. Ткань предстательной железы удаляют с
помощью петли, через которую пропускают электрический ток. Петлю проводят
через специальный цистоскоп (резектоскоп). Через него же осуществляют посто-
янное орошение и прямой визуальный контроль. Предстательная железа содер-
жит большое количество венозных синусов, вскрытие которых сопровождается
обильной абсорбцией жидкостью, омывающей операционное поле. Если гидро-
статическое давление омывающих растворов выше давления крови в венозных
синусах, то растворы проникают в последние, а затем — в общую циркуляцию.
Количество абсорбированной жидкости зависит от размеров и количества вскры-
тых синусов, продолжительности контакта с омывающей жидкостью и гидроста-
тического давления последней. Используют прозрачные растворы высокого каче-
ства, которые не проводят электрический ток и не вызывают гемолиза эритроци-
тов (идеальный омывающий раствор — глицин).
hB!
При ТУРП в среднем за одну минуту абсорбируется около 20 мл омывающе-
го раствора, чаще — значительно больше
ТУРП проводят при регионарной или общей анестезии. Регионарная анесте-
зия (спинальная или эпидуральная на уровне Ц—L4) предпочтительнее, так как
позволяет оптимально контролировать начальные симптомы тяжелой гипонатри-
емии. Общая анестезия показана больным, которые категорически отказываются
от проведения регионарной, а также неконтактным больным.
Абсорбция значительного количества омывающего раствора вызывает пере-
полнение ОЦК, ЗСН, отек легких и мозга, гипонатриемию и, как следствие, оста-
новку сердца. Развивается комплекс клинических проявлений, получивший на-
звание ТУРП-синдрома.
Клинические проявления ТУРП-синдрома. У бодрствующего больного (при ре-
гионарной анестезии) появляются ранние признаки: головная боль, головокруже-
ние, страх, дезориентация, поверхностное дыхание, тошнота, нарушения зрения и
381
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
др. Эти явления прогрессируют до развития сопора, комы, судорог и/или коллап-
са (иногда сначала регистрируют гипертензию).
Во время общей анестезии симптомы менее специфичны и включают необъяс-
нимое повышение или падение АД, рефрактерную брадикардию и ЭКГ-измене-
ния: расширение комплекса Q—R—S, подъем сегмента S—T, желудочковую тахи-
кардию или фибрилляцию. Фаза гипертензии перед остановкой сердца, обуслов-
ленной гипонатриемией, может отсутствовать у больных с умеренной гиповолемией
перед операцией, со значительным кровотечением во время операции, а также у
больных с исходно пониженными резервами миокарда.
ТУРП-синдром может развиться во время операции в результате прямой внут-
рисосудистой абсорбции или в течение нескольких часов после операции вслед-
ствие всасывания из интерстициального пространства при перипростатическом
скоплении жидкости. Симптомы со стороны ЦНС могут выражаться проявления-
ми интоксикации глицином или аммиаком даже без гипонатриемии, которая раз-
вивается в результате разведения крови глицином.
Лечение. При тяжелой гипонатриемии во время операции проводят гемостаз и
по возможности немедленно прекращают операцию. Точная диагностика основа-
на на определении уровня натрия в сыворотке крови. Ограничение подачи жидко-
сти и стимуляция диуреза фуросемидом в большинстве случаев позволяют купи-
ровать это состояние.
Смертность при резком снижении уровня натрия в плазме крови менее
120 ммоль/л составляет 50 %. По мнению многих невропатологов, при снижении
уровня натрия в крови, сопровождающемся нарушениями функции ЦНС, больно-
му необходимо ввести 3 % раствор поваренной соли и диуретики. Скорость повы-
шения уровня натрия должна составлять примерно 2 ммоль/л/ч. Лечение продол-
жают до достижения уровня натрия 120—130 ммоль/л. В дальнейшем ограничива-
ют прием жидкости. Нормализации уровня натрия в крови в течение нескольких
дней способствует выделение мочи и пота.
Быстрая коррекция уровня натрия может послужить причиной развития серь-
езных осложнений: обезвоживания клеток мозга и демиелинизации в области цен-
трального моста, которая проявляется квадриплегией, дисфагией или псевдолобу-
лярными симптомами. Диагностику проводят с помощью КТ. Факторами, предрас-
полагающими к демиелинизации, служат повышение уровня натрия в сыворотке в
течение 48 ч на 25 ммоль/л или более или его полная нормализация в течение 48 ч.
Такое же действие оказывает сочетание гипонатриемии с гипоксией и печеночной
энцефалопатией. Признаки отека легких служат показанием для интубации трахеи
и проведения ИВЛ вплоть до стабилизации водно-электролитного равновесия.
Из других осложнений ТУРП наиболее часто регистрируют гипотермию, пер-
форацию мочевого пузыря, септицемию, коагулопатии. При необходимости (за-
купорке, неправильном положении) катетер Фолея переустанавливают.
18.5.4.2. Экстракорпоральная ударно-волновая литотрипсия
Экстракорпоральную ударно-волновую литотрипсию используют
для разрушения камней в почках и верхних двух третях мочеточников. Ударные
волны, чаще всего, генерируются за счет разрядки помещенного в воду накопите-
ля, расположенного под больным в первом фокусе эллиптического отражателя. В
усовершенствованных установках ударные волны формируют с помощью элект-
ромагнита или пьезоэлектрического кристалла. Ткани имеют такую же акустичес-
382
18. АНЕСТЕЗИОЛОГИЧЕСКОЕОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
кую плотность, что и вода, поэтому волны проходят через тело, не повреждая
ткани. Изменение акустического импеданса на границе ткань/камень приводит к
появлению сил, режущих и разрывающих камень. Опасность повреждения тканей
появляется, когда волны ошибочно фокусируются на границе воздух/ткань (на-
пример, в легких или кишечнике).
Противопоказания к проведению литотрипсии: невозможность укладки боль-
ного, чтобы легкие и кишечник находились вне фокуса волн, обструкция мочевы-
водящих путей дистальнее камня, нелеченная инфекция, геморрагический диатез,
брюшное расположение искусственного водителя ритма сердца, беременность. В
некоторых клиниках относительными противопоказаниями считают расположен-
ную в непосредственной близости аневризму аорты, ортопедический протез и тяже-
лое ожирение.
Аритмия в анамнезе и установленный электрокардиостимулятор — это факто-
ры риска возникновения аритмий, индуцируемых ударными волнами. Синхрони-
зация ударной волны с зубцом R на ЭКГ снижает риск возникновения аритмии.
Боль при литотрипсии обусловлена рассеиванием малого количества энергии
ударных волн при прохождении через кожу, поэтому она локализована в коже и ее
выраженность пропорциональна интенсивности ударных волн. При использова-
нии новых видов литотрипторов, которые прижимают непосредственно к коже,
достаточно нанести 2000—3000 относительно низкоинтенсивных (10—18 кВ) удар-
ных волн, что требует лишь легкой седации, иногда в сочетании с местной анесте-
зией. Используют различные методики местной анестезии: инфильтрацию участ-
ка кожи размером 10 х 10 см местным анестетиком или смазывание специальным
кремом, содержащим местно-анестезирующие вещества. Для внутривенной седа-
ции у взрослых и детей с успехом применяют инфузию пропофола, кетамина,
мидазолама, гексенала, альфентанила и др. Адекватная внутривенная инфузия в
сочетании с периодическим введением диуретиков облегчает отхождение фраг-
ментов конкремента.
18.5.5. Открытые операции на предстательной железе
Открытые хирургические вмешательства на предстательной желе-
зе выполняют при массе гиперплазированной простаты более 60 г или ее опухо-
лях. Используют чреспузырный, промежностный и позадилобковый оперативные
доступы. Для чреспузырного (надлобкового) и позадилобкового доступов иногда
применяют положение Тренделенбурга, для промежностного — крайнее литото-
мическое положение. Частота осложнений и летальность приблизительно одина-
ковы при всех видах доступов, за исключением надлобковой простатэктомии.
Осложнения, как правило, связаны с кровопотерей и включают гипотермию,
анемию и коагулопатию. Серьезную проблему при хирургическом лечении добро-
качественной гиперплазии предстательной железы (ДГПЖ) представляет тромбоз
глубоких вен и связанная с ним ТЭЛА. Одним из важных факторов влияния на
гемостаз во время операции является кровопотеря. Изменения в свертывающей
системе крови прямо пропорциональны размерам кровопотери. Кровопотеря
5-12 мл/кг при исходных нормальных показателях не вызывает серьезных нару-
шений гемостаза.
Предстательная железа относится к группе органов, которые содержат факто-
ры, активирующие фибринолиз. Во время операции на предстательной железе эти
383
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
факторы могут попасть в кровеносное русло, нарушить динамическое равновесие
между свертываемостью и фибринолизом. При исследовании ткани предстатель-
ной железы было установлено, что простата и ее аденома содержат комплекс ге-
мокоагулирующих и фибринолитических соединений. Тромбопластическая актив-
ность аденомы предстательной железы сохраняется до разведения экстрактов в
50 000 раз, а предстательной железы — в 10 000 раз. Фибринолитические суб-
станции не устойчивы к разведению и проявляют свое действие при разведении в
10—100 раз. Таким образом, выделившись из ткани предстательной железы в из-
бытке, фибринолизин (плазмин) разрушает образующийся фибрин, оказывает дей-'
ствие на I, II, IV, VIII факторы свертывания крови, компоненты комплемента и
увеличивает проницаемость кровеносных сосудов.
На частоту и интенсивность кровотечения влияют естественная фибринолити-
ческая активности мочи, наличие в ней урокиназы, способной растворить имею-
щиеся тромбы в ложе простаты, лизосомальные и протеолитические ферменты лей-
коцитов способны активизировать местный фибринолиз и сами лизировать эритро-
цитарные агрегаты. Выраженность интра- и послеоперационной кровопотери
коррелирует с изменениями гемостатического потенциала, в связи с чем предопе-
рационные исследования показателей гемостаза обязательны для всех больных.
Во время операции на свертывающую, антикоагулянтную и фибринолитичес-
кую системы крови влияет, прежде всего, операционная травма, которая изменяет
гемостаз в результате освобождения тромбопластина и активаторов плазминогена,
нарушения сосудистой стенки и реакции симпатоадреналовой системы. Естествен-
ной защитной реакцией организма в этих условиях является компенсаторная ги-
перкоагуляция. При операции возрастают количество и функциональная актив-
ность тромбоцитов, повышается активность плазменных факторов свертывания,
увеличивается уровень фибриногена и протромбиновый индекс. Гиперкоагуляция
усиливается также в связи со снижением антитромбиновой активности и угнете-
нием фибринолиза. По данным Bergquist D. (1983), более 50 % тромбозов глубо-
ких вен возникает во время операции или в течение первых послеоперационных
суток, свыше 90 % — в течение первых 3 суток.
Осложнения оперативного вмешательства, нарушающие ауторегуляцию функ-
ций, приводят к такой стимуляции или истощению свертывающей, антикоагулянт-
ной и фибринолитической систем крови, когда наступает ДВС с тромбозом и ише-
мией важных органов или, наоборот, угнетение тромбообразования с растворением
образовавшихся ранее тромбов и коагулопатическим кровотечением. Особенно опас-
ны при оперативных вмешательствах коагулопатические кровотечения, возникшие
в результате предшествующих операции дефектов гемостаза и коагулопатий, раз-
вившихся в связи с операцией. Коагулопатическое кровотечение первого типа мо-
жет возникнуть у больных с врожденной или приобретенной патологией крови, при
которой наблюдают недостаток различных факторов свертывающей системы. Так-
же причиной коагулопатического кровотечения может явиться предшествующая
антикоагулянтная терапия, но если ее внезапно прерывают, то могут возникать не
менее опасные тромбоэмболии. Если больной получал антикоагулянты до опера-
ции, то необходимо вводить их и в раннем послеоперационном периоде, так как на
7—10 день после операции велика опасность развития тромбозов. Коагулопатичес-
кие кровотечения второго типа, то есть возникающие вследствие операции, — это
ДВС-синдром и так называемые трансфузионные коагулопатии, которые развива-
ются после гемотрансфузий, особенно массивных, когда переливание крови не-
скольких доноров ведет к гемолизу в результате междонорской несовместимости.
384
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
Оперативное лечение у пациентов с ДГПЖ имеет две особенности: первая —
повышение операционного и анестезиологического риска из-за резко сниженных
адаптационно-приспособительных механизмов стареющего организма; вторая —
неблагоприятный фон, на котором возникают и развиваются урологические забо-
левания, так как у больных пожилого и старческого возраста в 75—80 % случаев
имеются четыре и более сопутствующих заболевания, сопровождающиеся нару-
шением функций жизненно важных органов и систем. У 55—75 % этих больных
имеются выраженные изменения со стороны сердечно-сосудистой системы.
Функциональная проба с двукратной локальной гипоксией верхней конечно-
сти вызывает кратковременное состояние претромбоза, а выявляемые изменения
в системе гемостаза позволяют оценить резервную компенсаторную реакцию орга-
низма на моделируемое экстремальное состояние. Характер реакции системы ге-
мостаза на функциональную пробу у тромбоопасных больных в определенной сте-
пени можно использовать в качестве критериев оценки состояния тромбоопасно-
сти и, соответственно, выбора лечебных мероприятий.
Одной из мер предупреждения послеоперационных осложнений является адек-
ватное послеоперационное обезболивание, поэтому применение пролонгирован-
ной эпидуральной анестезии в послеоперационный период способствует эффек-
тивному обезболиванию и снятию “ощущения раны”, что приводит к ранней ак-
тивации больных уже на 1—2 сутки после операции. Сокращение длительности
постельного режима после различных хирургических вмешательств — один из дей-
ственных способов предотвращения венозного застоя.
Сочетание эпидуральной или спинальной анестезии с другими профилакти-
ческими мерами является одним из весьма эффективных способов предотвраще-
ния послеоперационных коагулопатий. Некоторые авторы считают, что примене-
ние прямых антикоагулянтов у больных с ДГПЖ нередко приводит к развитию
кровотечений, иногда заканчивающихся летальным исходом. Обобщив литератур-
ные сведения о применении прямых антикоагулянтов в хирургии, Kakkar (1988)
сделал вывод, что они приводят к кровотечениям в 2 из 76 случаев, при этом
летальность составляет 0,08—1,0 %, что сопоставимо с показателями летальности
от ТЭЛА. Необходимо отметить, что существуют предостережения относительно
применения низкомолекулярных гепаринов в сочетании со спинальной или эпи-
дуральной анестезией. Хотя число спинальных гематом на фоне применения низ-
комолекулярных гепаринов (в частности, клексана) довольно низкое (около 40
случаев в мировой практике), катастрофичность подобных осложнений способ-
ствовала появлению таких предостережений. Зачастую причиной геморрагичес-
ких осложнений являются травматическое введение эпидурального катетера, со-
четание низкомолекулярных гепаринов с другими препаратами, воздействующи-
ми на гемостаз, передозировка препаратов.
Риск геморрагических осложнений можно сократить при соблюдении следу-
ющих правил: следует отсрочить применение антикоагулянтов при травматичной
спинальной или эпидуральной пункции; необходимо удалить, если возможно,
эпидуральный катетер перед введением антикоагулянтов; спинальная пункция
возможна только через 10—12 ч после начальной профилактической дозы низко-
молекулярного гепарина; если катетер остается на месте, то его удаляют через
10-12 ч после последней дозы низкомолекулярного гепарина и за 2 ч до следую-
щей; следует соблюдать осторожность при применении НПВС на фоне использо-
вания низкомолекулярных гепаринов и регионарной анестезии.
13 7-585
385
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
18.5.6. Нефрэктомия
Показания к нефрэктомии: хронический инфекционный процесс,
травматические повреждения почки, поликистоз, нефролитиаз, новообразования
и трансплантация почки.
При радикальной нефрэктомии перевязывают почечную артерию и вену, пос-
ле чего почку, надпочечник и паранефральную клетчатку удаляют одним блоком
вместе с окружающей фасцией.
В зависимости от показаний к операции применяют торакоабдоминальный,
трансабдоминальный или боковой доступы. При боковом доступе пациент нахо-
дится в положении на боку, под который подкладывают валик или переразгибают
операционный стол соответствующим образом. При боковом доступе существует
риск повреждения плевры и развития пневмоторакса, поэтому после операции
это осложнение исключают, выполняя рентгенографию грудной клетки. Плев-
ральный дренаж в обязательном порядке устанавливают только при торакоабдо-
минальном доступе.
Применяют общую и комбинированную анестезии.
18.5.7. Онкоурологические операции
Согласно статистическим данным, выполнение радикальных ре-
зекций при онкозаболеваниях предстательной железы, мочевого пузыря, яичка и
почек значительно улучшило показатели выживаемости. Операции по радикаль-
ному удалению этих опухолей длятся около 3—4 ч и более, часто возникает необ-
ходимость в гемотрансфузиях. Управляемая гипотония снижает интраоперацион-
ную кровопотерю и потребность в препаратах крови. Сочетание общей анестезии
со спинальной или продленной эпидуральной (комбинированной) облегчает про-
ведение управляемой гипотонии и снижает потребность в общих анестетиках. Ком-
бинированная анестезия показана при длительных и травматичных урологических
операциях: экстирпации мочевого пузыря с отведением мочи различными спосо-
бами, энтеропластике мочеточников, повторных реконструктивных операциях на
мочевых путях, операциях на почечных сосудах, аутотрансплантации почки.
Во время операции стандартный мониторинг обычно дополняют установкой
катетера для измерения ЦВД, поскольку во время длительных операций возникают
значительные изменения водного баланса и при оценке адекватности заместитель-
ной инфузионной терапии могут возникнуть большие сложности. При необходимо-
сти для стимуляции мочеотделения применяют диуретики. Для визуализации усть-
ев мочеточников может потребоваться введение красителей, например индигокар-
мина или метиленового синего. Основные осложнения: гипотермия, неадекватное
восполнение дефицита жидкости. При необходимости проводят продленную ИВЛ.
ЛИТЕРАТУРА
1. Интенсивная терапия: пер. с англ., доп.// Гл. ред. А.И. Мартынов — М.: ГЭО-
ТАР МЕДИЦИНА, 1998. - 639 с.
2. Клиническая анестезиология: Справочник: Пер. с англ., доп.// Под ред. чл.-корр.
РАМН В.А. Гологорского, проф. В.В. Яснецова. — М.: ГЭОТАР-МЕД, 2001. — 816 с.
3. Местная анестезия: Практическое руководство/ М. Малрой; Пер. с англ. С.А. Пан-
филова; под ред. проф. Емельянова. — М.: БИНОМ. Лаборатория знаний, 2003. — 301 с.
386
18. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ УРОЛОГИЧЕСКИХ ОПЕРАЦИЙ
4. Николаев А. Ю., Милованов И.С. Лечение почечной недостаточности. Руковод-
ство для врачей, 1999. — Москва. — 393 с.
5. Рай У.Ф. Диализный пациент и трансплантация почки. Сборник материалов
нефрологического симпозиума. — Москва, 1998.
6. Секреты анестезии/ Джеймс Дюк, пер. с англ.; под общ. ред. А.П. Зильбера,
В.В. Мальцева. — М.: МЕДпресс-информ, 2005. — 552 с.
7. Суслов В.В. Интенсивная терапия и обезболивание в урологии. — Киев: Здоро-
в’я, 1981. - 191 с.
8. Суслов В.В., Тарабрин О.А., Симовских А.В. Современные методы профилактики
тромбоэмболических осложнений на этапах хирургического лечения доброкачествен-
ной гиперплазии предстательной железы. Метод, рекомендации — Киев, 2003. — 43 с.
9. Суслов В.В., Тарабрт О.О., Омовських А.В. Диссмшоване внутр!шньосудинне
мжрозгортання кров! в патогенез! розвитку пгсляоперащйних тромбогеморапчних ус-
кладнень у хворих на доброяюсну пперплазпо передм!хурово1 залози// В!сник невщклад-
нб! i вщновлювально!' медицини. — 2004. — Т. 5. — №2. — С. 268—272.
10. Суслов В.В., Тарабрин О.А., Мазур В.Н., Кирпичникова Е.П., Суханов А.А., Код-
руль Е.О. Диагностика и профилактика венозных тромбоэмболических осложнений на
этапах хирургического лечения у больных с доброкачественной гиперплазией предста-
тельной железы// Б!ль, знеболювання i штенсивна тератя, 2005. — № 5. — С. 57—61.
11. Суслов В.В., Тарабрин О.А., Мазур В.Н., Суханов А.А., Костенко М.О. Система
гемостаза и претромботическое состояние у больных с доброкачественной гиперпла-
зией предстательной железы// Патолопя, 2005. — Т. 2. — № 2. — С. 17—19.
12. Солодовников В.А., Суслов В.В. Анестезиологические аспекты радикальной
простатэктомии// Б!ль, знеболювання i штенсивна терап!я, 2000. — № I (додаток) —
С. 471-472.
13. Тарабрин О.А. Диагностика и коррекция состояния тромбоопасности у боль-
ных с аденомой предстательной железы на этапах хирургического лечения. — Одесса,
1998. - 166 с.
14. Шумаков В. И. Трансплантология. Руководство. — 1995. — Москва. — С. 152—
154, 183-191.
15. Azar Y. Transurethral prostatectomy syndrome and other complications of urological
procedures. En: McLeskey C.H. editor. Geriatric Anesthesiology. Baltimore. Williams & Wilkins,
1997:595-607.
16. Calatrava M.P., Villalonga A. Recurarizaciyn postoperatoria en un paciente con
insuficiencia renal. En: Gomar C., Villalonga A. edit. Casos ClHnicos AnestesiologHa I.
Barcelona, Masson, 1999:107—112.
17. Lebowitz P- W. Anesthesia fir urological surgery in international anaesthesiology clinics.
Vol. 31: № 1. Little, Brown, 1993.
18. Monsalve C., Calatrava M.P., Gomar C. Edema pulmonar у midriasis despuiis de una
resecciyn transuretral de prystata. En: Gomar C., Villalonga A. edit. Casos ClHnicos
AnestesiologHa I. Barcelona. Masson, 1999:199—205.
19. Wong K, Liw W. Anesthesia for Urologic Surgery. In: Advances in Anesthesia. Stoelting
R. Barash P. Gallargher T. Year Book Medical Publisher. Vol 3: p. 349, 1986.
20. Pertek J.P., Haberer J.P. Extracorporeal shock wave lithotripsy in a patient with
complete atrioventricular heart block. Eur. J. Anaesth., 1997; 14:458—460.
21. Sprung J., Kapural L., Bourke D.L., O,Hara J.F. Jr. Anesthesia for kidney transplant
surgery. Anesthesiol. Clin. North America, 2000 Dec; 18 (4): 919—51.
22. Tarabrin O.A., Simovskykh A.V., Codrul E.O., Simovskykh A.A., Kuzmenko V.I.
Haemoviscoelastography as a perioperative measure of Clexane anticoagulation therapy//
European Jornal of Anesthesiology, 2003. — Vol. 20, Suppl. 30, P. 52—53.
387
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И
ГИНЕКОЛОГИИ
Анестезиологическое обеспечение различных акушерских и
гинекологических операций требует от анестезиолога строго ин-
дивидуального и дифференцированного подхода к его выбору и
проведению. Выбор анестезии осуществляют с учетом патологии,
тяжести состояния беременной, роженицы, родильницы, нали-
чия сопутствующей патологии.
19.1. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ
Обезболивание родов является одной из важнейших задач ане-
стезиологов и акушеров-гинекологов. Следует помнить, что это
не только мера гуманности, избавляющая беременную от страда-
ний, но и важнейшее лечебное мероприятие, предупреждающее
различные нарушения жизненно важных функций у матери и пло-
да, обусловленные болевой реакцией. Обезболивание родов бази-
руется на современных представлениях о физиологии родовой
боли, принципах компонентности обезболивания. Его рассмат-
ривают как принцип анте- и перинатальной охраны плода.
19.1.1. Прикладная физиология родовой боли
Причины возникновения родовой боли: 1) сокращение матки, как
полого органа, при наличии препятствия для его опорожнения;
2) натяжение связок матки; 3) повышение внутрибрюшного дав-
ления при схватках и потугах, раздражение париетальной и вис-
церальной брюшины; 4) раскрытие шейки матки; 5) растяжение
мышц тазового дна; 6) растяжение и сжатие сосудов матки, влага-
лища, тазовых органов; 7) раздражение периоста внутренней по-
верхности крестца и лонного сочленения при прохождении пло-
да; 8) давление головки плода на пояснично-крестцовое сплете-
ние; 9) сдавление органов малого таза (мочевого пузыря,
кишечника) при родовой деятельности.
388
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
При раздражении указанных образований активируются механоноцицепторы,
при растяжении и механическом сдавлении из тканей выделяются альгогенные
субстанции (простагландины, гистамин, кинины, вещество Р и др.), которые ак-
тивируют хеморецепторы.
Различают висцеральную и соматическую родовую боль. Также используют
термины “маточный и промежностный компоненты родовой боли”, “боль I и II
периодов родов” [4], которые являются условными, так как ноцицептивная (боле-
вая) импульсация от указанных анатомических структур поступает в ЦНС в тече-
ние всех периодов родов, а импульсация от определенных образований преобла-
дает в различные периоды родов.
В I периоде родов ноцицептивная импульсация преимущественно поступает
от тела и шейки матки. В родах сокращения матки носят изометрический харак-
тер, поскольку ее опорожнению препятствует наличие плода, при этом возрастает
внутриматочное давление. Считают, что боль возникает при повышении внутри-
маточного давления до 25—30 мм рт. ст. При продвижении плода шейка матки
подвергается растяжению. Ноцицептивная импульсация от тела и шейки матки
идет преимущественно по симпатическим безмиелиновым С-волокнам и тонким
миелиновым А-дельта волокнам, проходит через маточно-влагалищное и нижнее
подчревное сплетения и поступает в сегменты T10-Lj задних рогов спинного мозга.
Кроме матки, болевая импульсация идет от ее связочного аппарата, париетальной
и висцеральной брюшин и мочевого пузыря. В конце I периода родов (при опус-
кании головки) сдавлению подвергаются крестец и пояснично-крестцовое сплете-
ние. Спланхно-, мио- и дерматомы имеют нервные связи не с одним, а с 2—3
сегментами спинного мозга, что существенно расширяет рецепторное поле боли.
В восприятие боли вовлекаются нижнегрудные сегменты (ориентировочно Т9~Т12),
все люмбальные и первый сакральный сегменты спинного мозга. Наиболее ин-
тенсивная импульсация поступает от шейки матки. Боль в I периоде родов, осо-
бенно в начале периода, диффузная, трудно локализуемая.
Во II периоде родов ноцицептивная импульсация поступает из шейки матки,
влагалища, промежности и крестца. Импульсы идут, в основном, по срамному
нерву (n. pudendus — ветвь срамного сплетения) и достигают S,—S4 сегментов спин-
ного мозга. Одновременно ноцицептивная импульсация может поступать по под-
вздошно-паховому (n. ilioinguinalis — ветвь поясничного сплетения, сегмент Lj),
бедренно-половому (n. genitofemoralis — ветвь поясничного сплетения, сегменты
L-L,) и заднему кожному нерву бедра (n. cutaneus femoris posterior — ветвь крес-
тцового сплетения, сегменты S,—S3). Боль во II периоде родов обычно более ин-
тенсивная по сравнению с 1 периодом и имеет определенную локализацию.
Поскольку родовая боль в значительной степени связана с растяжением тка-
ней родовых путей, существует определенная, но не прямая связь ее интенсивнос-
ти с состоянием указанных образований, поэтому боль обычно более интенсивная
у первородящих женщин, при ригидной шейке матки, стремительных родах и
крупном плоде.
Восприятие боли зависит от психоэмоционального состояния роженицы.
Субъективную оценку боли, как более интенсивной (снижение болевого порога)
наблюдают при страхе, тревоге, боязни боли. Напротив, спокойное отношение к
родам и уверенность в их благополучном исходе повышают болевой порог, хотя и
не исключают родовую боль полностью. Интенсивность боли зависит от состоя-
ния эндогенных антиноцицептивных систем, поэтому болевые пороги индивиду-
альны.
389
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
При болевом синдроме развивается состояние гипералгезии, которая обус-
ловлена сенситизацией (перевозбуждением) ноцииепторов, а также спинальных и
супраспинальных ноцицептивных структур ЦНС. Выделяют периферическую и
центральную сенситизацию. Периферическая сенситизация связана с накоплени-
ем в травмированных тканях медиаторов боли и воспаления (простагландинов,
вещества Р, кининов, интерлейкинов) и снижением под их влиянием порога воз-
будимости ноцицепторов, при этом раздражители низкой интенсивности начина-
ют возбуждать ноцицепторы, чего не происходит в нормальных условиях. Цент-
ральная сенситизация обусловлена тем, что нейроны центров ноцицептивной си-
стемы длительное время находятся в состоянии определенного возбуждения.
Поступление к ним субпороговых (неноцицептивных) сигналов приводит к гене-
рированию потенциала действия и, таким образом, неболевой раздражитель вос-
принимается, как болевой. Возбуждение нейронов формируется под действием
глутамата, вещества Р, нейрокинина А и, возможно, других медиаторов боли, вы-
деляющихся из терминалей С- и А-дельта волокон. Роль гипералгезии в родовой
боли изучена недостаточно, но априорно полагают, что механизмы центральной и
периферической сенситизации имеют такое же значение для развития этой боле-
вой реакции, как и для другого болевого синдрома.
В ответ на родовую боль у матери возникают многочисленные ответные реак-
ции, опосредованные разными структурами ЦНС. При возбуждении нейронов
задних рогов спинного мозга формируется поток восходящей ноцицептивной им-
пульсации и импульсы передаются к мотонейронам передних рогов, что приводит
к развитию простейших защитных двигательных реакций. Ретикулярная форма-
ция посылает поток активирующих импульсов к вышележащим структурам ЦНС,
в результате чего активизируются анализаторные системы. На уровне гипоталаму-
са формируются отрицательные эмоции и вегетативные ответы на боль. В реали-
зации последних важную роль играют связи гипоталамуса с гипофизом, в резуль-
тате чего активизируется гипоталамо-гицофизарно-надпочечниковая система. На
уровне коры головного мозга формируется ощущение боли (перцептуальный ком-
понент болевой реакции), альгогнозия (знание о нанесенном болевом раздраже-
нии), мотивация устранения боли, а также память о нанесенном болевом раздра-
жении. Кора осуществляет определенный контроль над уровнем вегетативных и
моторных ответов на боль.
Стрессорный ответ на родовую боль характеризуют повышением секреции
гормонов гипофиза и активацией симпатического отдела нервной системы [11].
Изменения секреции гормонов гипофиза опосредованно влияют на секрецию гор-
монов другими эндокринными органами (АКТГ, кортизола, вазопрессина). Ко-
нечным метаболическим эффектом гормональных изменений является увеличе-
ние катаболизма для энергетического обеспечения механизмов сохранения гомео-
стаза. В реакции стресса, необходимой для существования организма, с самого
начала заложены элементы декомпенсации, которые в зависимости от выражен-
ности рано или поздно приводят к истощению, срыву адаптации, развитию пато-
логических состояний [12].
Гипоталамическая активация симпатического отдела вегетативной нервной
системы приводит к увеличению секреции катехоламинов мозговым веществом
надпочечников, в первую очередь, норадреналина [13].
Эндогенный опиоид полипептидной природы — p-эндорфин, состоящий из
31-й аминокислоты, синтезируется из молекулы предшественника — пропиоме-
ланокортина. Повышение концентрации p-эндорфина в крови при стрессе рас-
390
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ценивают, как результат увеличения его секреции гипофизом. Метаболическая
активность этого гормона не доказана. Известно, что между интенсивностью боли
во время родов и концентрацией p-эндорфина в плазме крови рожениц существу-
ет позитивная корреляционная взаимосвязь [14]. Концентрация Р-эндорфина в
плазме крови в конце нормальной беременности составляет 10—40 пг/мл, перед
началом родов его концентрация возрастает до 110,8 ± 30,3 пг/мл [15]. Наивыс-
шую концентрацию p-эндорфина определяют за 1 ч до родов, затем она постепен-
но снижается к началу родов до 57,0 ± 7,3 пг/мл и по мере возрастания интенсив-
ности родовой боли вновь повышается до 118,2 ± 68,4 пг/мл. Уровень р-эндорфи-
на нормализуется (33,7 ± 16,5 пг/мл) к 5-му дню после родов [16, 17]. Измерение
концентрации p-эндорфина до и после субарахноидального введения 1,0 мг мор-
фина в родах продемонстрировало значительное ее уменьшение с 176,0 ± 9,7 до
92,0 + 9,1 пг/мл в результате снижения секреции p-эндорфина гипофизом в ответ
на уменьшение интенсивности боли [18]. В сравнительном исследовании [19]
эффектов акушерской аналгезии на материнские концентрации p-эндорфина в
3 группах рожениц авторы наблюдали последующий значительный прирост кон-
центрации p-эндорфина и при отсутствии аналгезии, и при применении петиди-
на; при эпидуральной аналгезии авторы исследования зарегистрировали стабиль-
ную концентрацию p-эндорфина вплоть до окончания родов.
Под воздействием родовой боли увеличивается секреция кортизола и может
достигать значений более 1500 нмоль/мл в зависимости от выраженности стрессо-
генного фактора. Секреция кортизола уменьшается под воздействием анестезии [20].
Клинические проявления реакции на родовую боль. У роженицы появляются не-
гативные эмоции, часто возникают страх, возбуждение, двигательное беспокой-
ство. Дыхание учащается и углубляется. У рожениц без исходной патологии сер-
дечно-сосудистой системы увеличиваются ЧСС и сила сердечных сокращений,
развивается спазм сосудов, повышается АД. Данные изменения характеризуют,
как гиперкинетический тип реакции. Развивается централизация кровообраще-
ния; диурез снижается, что обусловлено ухудшением почечного кровотока, увели-
чением синтеза АДГ и альдостерона. Свертываемость крови повышается. В крови
увеличиваются уровни катехоламинов, глюкозы, кортизола. Значительно повыша-
ются энергозатраты и потребность миокарда в кислороде. Родовая деятельность
является мышечной работой, и для удовлетворения возросших энергозатрат тре-
буется увеличение объема минутной вентиляции легких и сердечного выброса.
Болевая реакция оказывает неблагоприятное влияние на родовую деятель-
ность и состояние плода. Гиперкатехоламинемия может вызвать дискоординацию
родовой деятельности и ухудшить маточно-плацентарное кровообращение вслед-
ствие вазоконстрикции, которой способствует гипокапния, развивающаяся при
гипервентиляции. В результате этого возникает (или прогрессирует) внутриутроб-
ная гипоксия плода и увеличивается длительность родов.
При тяжелых акушерской и экстрагенитальной патологиях болевая реакция
может представлять угрозу для жизни матери и плода. Гиперкинетическое крово-
обращение и артериальная гипертензия могут привести к инсульту, отеку легких,
ишемии и ИМ, ОСН у больных с преэклампсией, эклампсией, ГБ, ИБС, порока-
ми сердца и другими сопутствующими заболеваниями. Даже незначительное ухуд-
шение маточно-плацентарного кровообращения способствует прогрессу внутри-
утробной гипоксии плода.
Родовая боль является закономерным компонентом родового акта. Несмотря
на эволюционно обусловленный характер, она оказывает существенное и небла-
391
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
гоприятное влияние на психоэмоциональную сферу и состояние жизненно важ-
ных функций роженицы, а также может привести к нарушениям родовой деятель-
ности и внутриутробной гипоксии плода. Интенсивная и длительная родовая боль
при тяжелых акушерской и экстрагенитальной патологиях может явиться причи-
ной смерти матери и плода.
19.1.2. Общая характеристика методов
обезболивания родов
Требования к методам обезболивания родов: обеспечение блокады
или значительное ослабление ноцицептивной афферентации; предупреждение или
устранение неблагоприятных психоэмоциональных и вегетативных нарушений, выз-
ванных болевой реакцией; отсутствие нарушений жизненно важных функций ма-
тери и плода, ослабления сократительной способности мышц матки, угнетения
родовой деятельности, нарушений маточно-плацентарного кровотока, провоци-
рования внутриутробной гипоксии плода, наркотического воздействия на ново-
рожденного; низкая токсичность и отсутствие проникновения лекарственного сред-
ства через маточно-плацентарный барьер; управляемость и, желательно, простота
исполнения.
Несмотря на немалый арсенал методов обезболивания родов, идеального ва-
рианта до сих пор не существует, поэтому метод обезболивания выбирают инди-
видуально в зависимости от состояния роженицы и плода, степени болевой реак-
ции и способа родоразрешения.
Методы обезболивания родов классифицируют на медикаментозные и неме-
дикаментозные.
Медикаментозные методы обезболивания родов
1. Общее обезболивание:
• ингаляционная анестезия;
• неингаляционная анестезия;
• сочетание ингаляционной и неингаляционной анестезий.
2. Регионарное обезболивание:
• эпидуральная анестезия;
• спинальная анестезия;
• спинально-эпидуральная анестезия;
• парацервикальная блокада;
• пудендальная анестезия.
3. Комбинированное обезболивание.
Немедикаментозные методы обезболивания родов
1. Электроаналгезия: центральная, периферическая;
2. Аку-, электроакупунктура;
3. Гипносуггестивные методы.
Медикаментозные методы обезболивания родов получили наибольшее распро-
странение, так как их основными преимуществами являются эффективность и
результативность при массовом применении. Основные недостатки: нарушения
дыхания и гемодинамики у матери, снижение тонуса матки, угнетение родовой
деятельности и гипотония матки в послеродовой период, нарушение маточно-
392
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
плацентарного кровотока, развитие внутриутробной гипоксии плода, переход ане-
стетиков и аналгетиков через маточно-плацентарный барьер и, как следствие, раз-
витие наркотической депрессии у новорожденного. Неблагоприятные эффекты
проявляются при применении высоких доз анестетиков и не соблюдении фарма-
кокинетических свойств применяемых препаратов.
Ингаляционная анестезия является наиболее управляемым методом обезболива-
ния родов. Чтобы уменьшить влияние ингаляционных анестетиков на жизненно
важные функции роженицы и тонус матки, ингаляционный наркоз в родах приме-
няют в стадии аналгезии. Именно это требование и ограничивает количество инга-
ляционных анестетиков, пригодных для обезболивания родов. Используют закись
азота и, значительно реже, метоксифлюран (пентран). Галотан для обезболивания
родов не используют, так как он снижает тонус матки и вызывает кардиодепрессию
у матери и плода. Наркоз современными анестетиками — энфлюраном, изофлюра-
ном, десфлюраном и севофлюраном — проводят по полузакрытому и закрытому
контурам, что резко ограничивает их применение в акушерской практике.
Ингаляционные анестетики обычно подают через маску, причем это может
делать как анестезиолог, так и сама роженица. Возможна подача анестетиков с
помощью стандартного наркозного аппарата по типу “Полинаркона” или специ-
альных распылителей (Dure, Lyprane, Pentran Analgiser). Эти аппараты осуществ-
ляют подачу препаратов в определенных дозировках, не зависящих от минутной
вентиляции и колебаний температуры в помещении, так как во время схваток
уровень минутной вентиляции может сильно варьировать. Концентрацию анесте-
тика регулируют в зависимости от реакции роженицы. Если появляются сонли-
вость, спутанность сознания или возбуждение, то немедленно снижают концент-
рацию препарата. Анестезиолог должен постоянно словесно контактировать с па-
циенткой. Основной риск ингаляционной аналгезии — передозировка анестетика,
с последующей рвотой или регургитацией и развитием аспирационного пневмо-
нита (синдрома Мендельсона).
Иеингаляционная анестезия наиболее проста в исполнении, но наименее управ-
ляема, так как ее длительность зависит от скорости метаболизма введенных препа-
ратов. Использование препаратов короткого действия (мидазолама, альфентанила)
не может полностью решить проблему управляемости, поскольку роды — это мно-
гочасовой процесс, а суммарные дозы препаратов могут быть весьма высокими. Ни
один из неингаляционных препаратов не может обеспечить адекватной аналгезии
без нарушения функций дыхания и кровообращения у матери, кроме этого, все
неингаляционные препараты проходят через маточно-плацентарный барьер и по-
ступают к плоду, вызывая нарушения становления спонтанного дыхания у ново-
рожденного, поэтому используют многокомпонентную неингаляционную анестезию.
Регионарная анестезия обеспечивает наиболее полную блокаду ноцицептив-
ной афферентации и оказывает меньшие влияния на жизненно важные функции
матери и плода. Хотя метод отличается технической сложностью, его все чаще
рассматривают как метод выбора при обезболивании родов или применяют в ка-
честве важнейшего компонента комбинированной анестезии.
Немедикаментозные методы минимально воздействуют на жизненно важные
функции матери, не угнетают родовую деятельность, не нарушают маточно-пла-
центарное кровообращение и не вызывают наркотическую депрессию у новорож-
денного.
Психопрофилактическая подготовка является наиболее простой и распростра-
ненной формой обезболивания родов. Сущность метода заключается в обучении
393
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
пациентки управлять процессом деторождения. Формируют положительную пси-
хологическую доминанту в связи с предстоящими родами. Данный метод базиру-
ется на утверждении, что во время схваток родовую боль можно подавить реорга-
низацией цереброкортикальной активности. Роженица должна сконцентрировать
внимание на каком-либо предмете, шуме (музыке), беседе с медицинским персо-
налом или близким человеком, что не даст ей возможности сосредоточиться на
родовой боли. Психопрофилактическую подготовку начинают за 6—8 недель до
родов с объяснения нормальной анатомии и физиологии беременности и родов.
Это позволяет уменьшить страх и волнение, часто возникающие перед неизвест-
ностью. Роженицу обучают правильно реагировать на начало родовой деятельно-
сти, формируя положительные эмоции, связанные с рождением ребенка. Бере-
менных обучают правильно дышать во время схваток, делая глубокий вдох при
схватке, а затем плавный и мягкий выдох. Согласно данным Melzac R. и соавторов
(1981), у женщин, получавших психопрофилактическую подготовку, более низкая
интенсивность родовой боли по сравнению с неподготовленными.
Гипноз для обезболивания родов используют редко по причине необходимости
длительной предварительной подготовки беременной: курс обычно состоит из ежед-
невных занятий в течение 5—6 недель, в процессе которых женщину обучают раз-
личным способам достижения гипнотического состояния. Определенное значение
имеет отбор пациенток, так как существует риск возникновения психотических
реакций у рожениц, начиная от легкого беспокойства до выраженного психоза.
Применение акупунктуры с целью обезболивания родов весьма перспектив-
но, но отсутствие точных доказательств эффективности метода и недостаток ква-
лифицированных специалистов ограничивают его применение.
Использование транскутанной стимуляции электрическим током различной
силы, также как и акупунктуры, не позволяет достичь эффективного обезболива-
ния родов. Этот метод используют в качестве дополнения к другим. На спину
роженицы помещают две пары электродов: верхнюю пару — с двух сторон от
средней линии в области проекции дерматомов задних ветвей TI0~Lp нижнюю —
на обе половины крестца. Обычно в течение I периода родов используют низко-
амплитудную стимуляцию и увеличивают ее во время схваток, при этом роженица
может самостоятельно регулировать силу воздействия в зависимости от болевых
ощущений. Уровень амплитуды стимуляции в среднем составляет 1 —40 МА, уро-
вень частоты — 40—150 Гц.
Немедикаментозные методы, как правило, мало эффективны, что в значитель-
ной степени обусловлено недостаточной разработкой их теоретических основ. При
массовом использовании они уступают другим методам обезболивания родов.
19.1.3. Клиническая фармакология
лекарственных средств,
используемых для обезболивания родов
При выборе анестетических средств, используемых для обезболи-
вания родов, учитывают их влияние на жизненно важные функции матери, маточ-
но-плацентарный кровоток, тонус матки, плод и новорожденного.
Во время беременности фармакокинетика лекарственных препаратов значи-
тельно изменена, что обусловлено изменениями в почках и печени, нарушениями
394
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
скоростей кровотока, метаболизма, эвакуации из желудка, а также функциониро-
ванием маточно-плацентарной системы кровообращения.
Воздействие лекарственных веществ на плод подчиняется множеству законов
и зависит, в первую очередь, от функционирования так называемого плацентар-
ного барьера. Плацентарный барьер — это совокупность морфологических и фун-
кциональных свойств плаценты, определяющих ее способность регулировать про-
никновение различных веществ из крови беременной в организм плода.
Метаболизм лекарственных препаратов изменяется не только за счет их пре-
образований в печени матери, но также за счет метаболизма в печени плода и
плаценте. Вводимые матери медикаменты попадают в кровоток плода преимуще-
ственно за счет пассивной диффузии. Скорость транспорта веществ через плацен-
ту описывают формулой Фика:
Q A(C„,-Cf)
— ~ Л----------
t D
где Q/t — скорость диффузии,
К — коэффициент диффузии препарата,
А — площадь поверхности плацентарной мембраны,
Ст — концентрация препарата в крови матери,
С. — концентрация препарата в крови плода,
D — толщина плацентарной мембраны.
Коэффициент диффузии препарата (К) зависит от интенсивности маточно-
плацентарного кровотока, степени ионизации лекарственных веществ, степени их
растворимости в липидах, молекулярной массы вещества, степени сродства и свя-
зи с белками крови (табл. 19.1).
Обменная площадь поверхности плаценты (А) постоянно возрастает и к 40-й
неделе беременности составляет 12—14 м2. Параллельно этому процессу толщина
плацентарной мембраны (D) постепенно истончается с 33—38 мкм в начале бере-
менности до 3—6 мкм в конце, поэтому проницаемость плаценты прогрессивно
увеличивается до 35-й недели беременности, а затем снижается из-за процессов
физиологического старения плаценты. Для проницаемости лекарственных веществ
имеет значение интенсивность маточно-плацентарного кровотока. При осложне-
ниях течения беременности скорость маточно-плацентарного кровотока умень-
шается. Величина маточного кровотока в родах достигает 700 мл/мин и обуслов-
лена следующим соотношением:
., „ Давление маточных артерий - Давление маточных вен
Маточный кровоток =-------------------—-----=-------------------.
Сопротивление маточных сосудов
Анестезиологические воздействия могут изменить перфузионное давление и
сосудистое сопротивление матки. Например, гипотензия, иногда возникающая при
проведении регионарной анестезии вследствие развития симпатической блокады,
требует введения а-адренергических препаратов, которые повышая АД, значитель-
но увеличивают сосудистое сопротивление, что уменьшает маточный кровоток.
Проницаемость лекарственного вещества через плацентарный барьер зависит
от его молекулярной массы: чем она меньше, тем легче вещество преодолевает
плацентарный барьер. Через плацентарный барьер легко проникают вещества с
молекулярной массой до 500 дальтон; вещества с молекулярной массой более
1000 дальтон почти не проникают через плаценту, например, инсулин (12 000
дальтон), гепарин (16 000 дальтон).
395
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Проникновение препаратов через плаценту также зависит от степени их ра-
створимости в липидах: хорошо растворимые в липидах вещества (эфир, фторотан
и др.) быстро проникают к плоду, и наоборот.
Таблица 19.1. Факторы, влияющие на проницаемость веществ через плаценту
Свойство вещества Фактор организма матери Фактор организма плода
Градиент концентрации Характер элиминации веществ из системы кровообращения матери Состояние печени плода
Молекулярная масса Общий объем крови и содержание белковых фракций Степень разведения веществ в крови плода на пути к головному мозгу
Растворимость в жирах Характер сократительной деятельности матки Интенсивность шунтирования крови
Степень ионизации Интенсивность маточного кровотока Степень зрелости плода и активность ферментной системы
Способность связывать- ся с белками крови Метод и скорость введения препарата Специфические свойства крови (объем, гематокрит, pH), степень сжатия пупочного канатика
Для оценки проникающей способности лекарственного вещества введено по-
нятие индекса проницаемости плаценты (ИПП), который отражает в процентах
концентрацию вещества в крови плода к концентрации этого вещества в крови
матери:
Эффект воздействия лекарственных препаратов на плод ослабляется за счет
быстрого распределения, метаболизма и элиминации препаратов в его организме.
Это обусловлено уникальностью циркуляции у плода, так как пупочная венозная
кровь, возвращаясь из плаценты, попадает через ductus venosus непосредственно в
печень, где происходит преобразование лекарственных средств. Кроме этого, пе-
ченочные микросомы плода содержат повышенные уровни цитохрома Р—450 и
НАДФ-цитохром-С-редуктазы по сравнению со взрослыми, что объясняет более
быструю метоболизацию препаратов в крови плода.
Анестетические средства оказывают прямое и непрямое влияние на плод.
Прямое влияние обусловлено переходом анестетических средств через маточно-
плацентарный барьер и их последующим воздействием на организм плода, непря-
мое — обусловлено влиянием анестезии на жизненно важные функции матери,
прежде всего, на дыхание и гемодинамику, и маточно-плацентарное кровообра-
щение. При нарушении этих функций снижается доставка кислорода к плоду и
развивается его внутриутробная гипоксия.
Прямое влияние препаратов на плод, прежде всего, проявляется изменения-
ми гемодинамики. Как правило, эти изменения невелики и не имеют существен-
ного клинического значения. Лишь при значительном превышении доз анестети-
ческих средств или нарушении техники выполнения анестезии гемодинамические
396
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
изменения у плода могут стать опасными. Анестетические средства, поступившие
к плоду, тормозят деятельность ЦНС. Некоторые из них уменьшают активность
дыхательного центра и снижают мышечный тонус, в результате чего задерживает-
ся становление спонтанного дыхания. Это явление называют наркотической деп-
рессией новорожденного, которая существенной опасности не представляет и в
большинстве случаев требует только кратковременного проведения ИВЛ. Таким
образом, желательно применять такие препараты и их дозы, чтобы свести нарко-
тическую депрессию плода к минимуму.
Количество поступившего к плоду анестетического средства зависит от транс-
плацентарного переноса [3], который, в свою очередь, зависит от величины общей
введенной дозы, концентрационного градиента препарата между кровью матери и
плода, молекулярной массы препарата, его липофильности, тропности к белкам,
pH крови матери и плода. Через маточно-плацентарный барьер проникает сво-
бодная фракция препарата (не связанная с белком) и его неионизированная фор-
ма. При прочих равных условиях быстрее осуществляется трансплацентарный пе-
ренос препаратов, которые имеют низкую молекулярную массу и обладают высо-
кой липофильностью. При первом поступлении анестетического препарата в кровь
матери начинается его трансплацентарный переход, и концентрация анестетика в
крови плода возрастает. Максимально высокая концентрация препарата у плода
обычно меньше, чем у матери, и достигается позже. Это происходит потому, что
переход осуществляют только свободная и неионизированная фракции препарата.
Максимальная концентрация внутривенных анестетиков в крови плода достигает-
ся через 3—10 мин, ингаляционных анестетиков — около 20 мин. Если повторно
препарат не вводят, то его концентрации у матери и плода начинают снижаться.
Неингаляционные препараты, в основном, подвергаются метаболизму в печени, а
их метаболиты выводятся почками. Поскольку детоксикационные функции этих
органов лучше развиты у взрослых, то у матери концентрация препарата может
снижаться быстрее, и на определенных этапах концентрация в крови плода может
превышать таковую у матери, при этом возможен механизм обратной диффузии —-
перехода препарата от плода к матери. Более высокая концентрация препарата у
плода обусловлена и тем, что pH его крови меньше, чем у матери, поэтому кон-
центрации местных анестетиков в крови плода превышают материнские. Совре-
менные ингаляционные анестетики практически не подвергаются метаболизму и
выделяются при дыхании. По мере того, как они элиминируются из организма
матери, снижается и их концентрация в крови плода. При повторных введениях
препаратов устанавливается динамическое равновесие концентраций в крови ма-
тери и плода.
Непрямое влияние анестетических препаратов на плод более существенно,
чем прямое. Внутриутробную гипоксию, прежде всего, вызывают гипоксия и ги-
потензия у матери. Нарушения маточно-плацентарного кровотока наблюдают при
гипокапнии и вазоконстрикции, обусловленной болью или введением вазопрес-
соров. Тяжелая внутриутробная гипоксия вызывает нарушения гемодинамики плода
и может стать причиной его гибели. Кроме этого, она нарушает деятельность ЦНС,
и у новорожденного задерживается становление спонтанного дыхания из-за паде-
ния чувствительности дыхательного центра к рСО, и снижения мышечного тону-
са. Следует особо подчеркнуть, что если отсутствие спонтанного дыхания у ново-
рожденного вызвано внутриутробной гипоксией, то это является признаком глу-
бокого нарушения функций ЦНС. Это состояние значительно опаснее, чем
397
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
наркотическая депрессия, и требует проведения полного комплекса реанимаци-
онных мероприятий. В силу указанных причин, поддержание стабильности жиз-
ненно важных функций у матери следует рассматривать, как первоочередную за-
дачу анестезиологического пособия в родах.
19.1.3.1. Опиоидные аналгетики
Наиболее часто в акушерстве используют агонисты ц-опиоидных
рецепторов: промедол, фентанил, альфентанил, суфентанил, морфин, пиритрамид
(дипидолор) и др. Одновременно с m-рецепторами они активируют и другие классы
опиоидных рецепторов, поэтому их называют “полными агонистами” (см. раздел
5.3.5). Препараты этой группы обладают выраженным аналгетическим действием,
могут вызывать угнетение спонтанного дыхания у матери за счет снижения чувстви-
тельности дыхательного центра к СО, и ригидности дыхательных мышц, незначи-
тельно снижают сократимость миокарда и сосудистый тонус, урежают ЧСС, наруша-
ют моторику кишечника, вызывают тошноту и рвоту. Родовая деятельность под вли-
янием агонистов ц-опиоидных рецепторов несколько угнетается, но гипотонические
кровотечения в послеродовый период возникают редко. Данные препараты быстро
переходят через плацентарный барьер, и концентрации в крови матери и плода прак-
тически уравниваются через 2 мин. У новорожденного эти препараты замедляют ста-
новление спонтанного дыхания в результате торможения дыхательного центра. При
длительном приеме матерью таких препаратов у новорожденного может развиться
синдром абстиненции. Эффекты опиоидных аналгетиков носят дозозависимый ха-
рактер. Для уменьшения негативного влияния этих препаратов на мать и плод их
используют в небольших дозах, но при этом не достигают полной блокады ноцицеп-
тивной афферентации, из-за чего и применяют, как один из компонентов обезболи-
вания родов. В качестве моноанестетиков р-агонисты не эффективны.
Частичные агонисты слабее активируют опиоидные рецепторы, а агонист-
антагонисты активируют один класс (как полные или частичные агонисты) и бло-
кируют другие классы рецепторов. Для обезболивания родов чаще применяют:
бупренорфин, буторфанол (стадол), налбуфин, пентазоцин и трамадол. Для дан-
ных препаратов характерен “эффект плато”, при котором с увеличением дозы
аналгезия и угнетение дыхания возрастают только до определенного предела и
далее не прогрессируют. Используют небольшие дозы полных агонистов, постольку
использование частичных агонистов и агонист-антагонистов существенных пре-
имуществ не дает. Ранее для уменьшения респираторной депрессии у матери и
новорожденного применяли сочетание полных агонистов с агонист-антагониста-
ми, но полученные результаты ослабления аналгетического эффекта и даже раз-
вития синдрома отмены заставили отказаться от их использования.
19.1.3,2. Бензодиазепины
Для обезболивания родов применяют бензодиазепины: хлозепид
(элениум), диазепам (валиум, седуксен, сибазон), флюнитрозепам (рогипнол),
лоразепам, мидазолам (дормикум, флормидал). Эти препараты активируют бензо-
диазапиновые рецепторы и, соответственно, ГАМК-ергические структуры ЦНС.
Бензодиазепины обладают выраженными анксиолитическим и противосудорож-
ным эффектами, слабыми аналгетическим и миорелаксирующим эффектами. У
беременных в высоких дозах они могут вызывать угнетение дыхания (за счет дей-
398
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ствия на дыхательный центр), снижение тонуса дыхательных мышц, сосудистого
сопротивления, кардиодепрессию, угнетение родовой деятельности.
Транквилизаторы быстро переходят через плацентарный барьер. У новорож-
денных метаболизм бензодиазепинов осуществляется значительно медленнее, чем
у взрослых, а у недоношенных период полувыведения в 3—4 раза больше, чем у
детей, рожденных в срок. У новорожденных под действием бензодиазепинов су-
щественно замедляется становление спонтанного дыхания, в дальнейшем может
развиться синдром вялого младенца, который проявляется сонливостью, мышеч-
ной гипотонией, гипотермией, приступами апноэ, отказом от кормления, а также
синдром отмены, проявляющийся дрожью, гипертонусом мышц, повышенной
рефлекторной возбудимостью, тахипноэ, поносом, рвотой. Эти явления могут со-
храняться длительное время (до нескольких месяцев).
Ранее не столь широко применяли бензодиазепины при обезболивании родов.
Появление мидазолама — первого водорастворимого бензодиазепина с малой дли-
тельностью действия (период полувыведения — 1,5—3 ч) — расширило показания к
использованию бензодиазепинов в акушерстве для устранения тревоги, страха, судо-
рожной активности ЦНС. Эти препараты повышают порог переносимости боли, по-
тенцируют действие аналгетиков, уменьшают уровень вегетативных ответов на боль.
19.1.3.3. Нейролептики
Для обезболивания родов применяют дроперидол, очень редко —
галоперидол и нейролептики фенотиазинового ряда (хлорпромазин, или амина-
зин, и прометазин, или дипразин). Основной механизм их действия обусловлен
блокадой дофаминергических рецепторов. Они устраняют чувство страха, трево-
ги, вызывают состояние психического и двигательного покоя, уменьшают тошно-
ту и оказывают противорвотное действие. Не обладая аналгетическим действием,
они повышают порог переносимости боли и уменьшают уровень вегетативных
ответов на боль. Нейролептики практически не влияют на функцию дыхания у
матери и новорожденного, снижают сосудистый тонус. Они не действуют на тонус
матки, быстро переходят через плацентарный барьер, но на становление спонтан-
ного дыхания у новорожденного влияют мало.
Отрицательные действия нейролептиков заключаются в развитии гипотензии
у матери, сопутствующих ей нарушений маточно-плацентарного кровотока, дис-
лептического синдрома и экстрапирамидных нарушений. Дислептический синд-
ром проявляется чувством страха, тревоги, двигательным возбуждением. Чаще его
наблюдают у эмоционально неустойчивых рожениц, испытывающих страх перед
родами. Экстрапирамидные расстройства возникают по причине блокады тормоз-
ных дофаминергических нейронов базальных ядер и черной субстанции. Чаше
они проявляются ригидностью мышц, тремором, акинезией (скованностью дви-
жений), но иногда — акатизией (бесконтрольным моторным беспокойством) и
тардивной (поздней) дискинезией. Очевидно, действием на дофаминергические
рецепторы обусловлен и синдром Куленкампфа-Тарнова, проявляющийся при-
ступообразными судорогами жевательных мышц, отеком языка, тоническими су-
дорогами мышц шеи, гиперрефлексией, спазмами мышц туловища, психомотор-
ным возбуждением при сохраненном сознании. Наличие описанных отрицатель-
ных эффектов ограничивает применение нейролептиков для обезболивания родов.
Их постепенно вытесняют транквилизаторы. Важнейшим показанием к использо-
ванию нейролептиков является выраженная гипертензивная реакция на боль.
399
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.1.3.4. Барбитураты
Воздействие барбитуратов на роженицу, новорожденного и родо-
вую деятельность существенно зависит от дозы: в низких дозах они мало влияют
на жизненно важные функции роженицы и новорожденного и не угнетают родо-
вой деятельности. Через плацентарный барьер препараты проникают быстро: че-
рез 2—3 мин концентрация у плода достигает максимума. В высоких дозах барби-
тураты угнетают дыхание, снижают сердечный выброс, вызывают гипотензию у
матери, угнетают родовую деятельность, могут уменьшить маточно-плацентарный
кровоток, у новорожденного при этом развивается наркотическая депрессия. При
систематическом приеме препаратов развивается синдром отмены, симптоматика
которого аналогична таковой при отмене бензодиазепинов.
19.1.3.5. Неингаляционные анестетики
Препараты данной группы применяют, как часть многокомпо-
нентной анестезии, и лишь кетамин обладает определенным аналгетическим эф-
фектом. Остальные препараты являются гипнотиками, их используют для усиле-
ния седативного действия других анестетических средств, выключения сознания
роженицы или купирования судорожной активности ЦНС.
Возврат в акушерскую практику кетамина обусловлен открытием его воздей-
ствия на NMDA-рецепторы. Считают, что кетамин может уменьшить уровень про-
воспалительных цитокинов. Для достижения этих эффектов используют субнар-
котические дозы кетамина (0,15—0,4 мг/кг внутривенно), при которых препарат
незначительно влияет на жизненно важные функции роженицы и плода и не угне-
тает родовой деятельности. При более высоких дозах кетамин может вызвать гал-
люцинации, повышение сердечного выброса, ЧСС и АД у роженицы. У новорож-
денного отмечают торможение дыхательного центра, мышечный гипертонус и
нарушение проходимости дыхательных путей в результате гиперсаливации. Нега-
тивное влияние на новорожденного является основным фактором, сдерживаю-
щим применение кетамина для обезболивания родов.
В настоящее время натрия оксибутират применяют редко из-за значительной
длительности действия (концентрация в крови матери снижается на 50 % в тече-
ние 2 ч) и плохой управляемости. В низких дозах (30—40 мг/кг) препарат обладает
седативным, гипнотическим, противосудорожным и антигипоксическим эффек-
тами, при этом незначительно влияет на жизненно важные функции роженицы и
новорожденного. Это определяет его сферу применения — создание седативного
фона и медикаментозный отдых. Натрия оксибутират удлиняет фазу быстрого сна,
хорошо восстанавливает физическую работоспособность, способствует развитию
полноценной родовой деятельности. Аналгетическим действием препарат не об-
ладает. В высоких дозах (80—120 мг/кг), особенно при отсутствии блокады ноци-
цептивной афферентации, может вызвать судороги, психомоторное возбуждение,
артериальную гипертензию у роженицы и наркотическую депрессию у новорож-
денного.
Этомидат и пропофол являются гипнотиками, не обладают аналгетическим
эффектом, отличаются кратковременностью действия. Они не получили широко-
го распространения при обезболивании родов, хотя иногда их применяют для
выключения сознания у матери. На начальных этапах действия препараты вызы-
вают слабую судорожную активность ЦНС. Они могут кратковременно нарушать
400
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
дыхание у матери. Этомидат мало влияет на гемодинамические показатели, но
существенно снижает уровень глюкокортикоидов в крови. Пропофол вызывает
преходящие брадикардию и кардиодепрессию. Указанные свойства делают неце-
лесообразным применение этих препаратов у больных с малым сердечным выбро-
сом и гипотензией. Ввиду быстрого метаболизма препараты вызывают минималь-
ную наркотическую депрессию новорожденных.
19.1.3.6. Ингаляционные анестетики
Ингаляционные анестетики используют в качестве самостоятель-
ного агента при обезболивании родов.
Закись азота в используемых объемных концентрациях мало влияет на жиз-
ненно важные функции матери, не нарушает родовой деятельности, не вызывает
гипотонии матки, быстро переходит через плацентарный барьер (максимальная
концентрация у плода меньше, чем у матери, достигается через 15—20 мин после
начала применения), незначительно тормозит становление спонтанного дыха-
ния у новорожденного. Закись азота элиминируется при дыхании. При ее исполь-
зовании теоретически возможна диффузионная гипоксия у новорожденного,
поэтому ему производят подачу кислородовоздушной смеси в течение 10—15 мин
с FiO2 = 0,5—0,75. При неадекватном спонтанном дыхании проводят ИВЛ, при
этом концентрация закиси азота в крови быстро снижается.
Основным недостатком закиси азота является низкая аналгетическая актив-
ность, поэтому для достижения эффекта ее необходимо подавать в высоких объем-
ных концентрациях — не менее 50 %. Закись азота в соотношении с кислородом
1:1 или 2:1 может усилить гипоксию у рожениц с тяжелой патологией сердечно-
сосудистой и дыхательной систем.
Достаточно широко в настоящее время в акушерской практике использу-
ют метоксифлуран (пентран). Обычно используют концентрацию препарата
0,25 — 0,35 об.%, при этом не подавляется сократительная способность матки и не
нарушается дыхание у роженицы и новорожденного. Обезболивание развивается
через 5 мин после начала ингаляции. Используют прерывистый метод подачи ме-
токсифлюрана (перед схватками), так как препарат обладает кумулятивным эф-
фектом и медленно выводится из организма.
Трихлорэтилен — устаревший анестетик. Ранее в акушерстве его применяли
только для аутоаналгезии. Концентрации 0,3—1,0 об.% не вызывают существенно-
го угнетения дыхания у роженицы, обладают умеренным кардиодепрессивным и
аритмогенным действиями. При кратковременной ингаляции родовая деятельность
существенно не нарушается. Препарат быстро переходит через плацентарный ба-
рьер и может вызвать наркотическую депрессию новорожденного.
19.1.3.7. Местные анестетики
При любом виде регионарной анестезии часть введенного препа-
рата попадает в кровоток и оказывает влияние на ЦНС и внутренние органы. Эти
резорбтивные эффекты зависят от общего количества попавшего в кровь анесте-
тика и скорости его перехода в кровь, последнее определяет пиковую концентра-
цию. При прочих равных условиях более высокий уровень анестетика в крови
создают при повышении концентрации вводимого препарата. Резорбтивные эф-
фекты могут проявляться в виде седации, угнетения сознания (вплоть до его утра-
401
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ты), судорог, снижения сосудистого тонуса, брадикардии и гипотензии. При вы-
раженной гипотензии нарушается маточно-плацентарный кровоток. Местные ане-
стетики быстро переходят через плацентарный барьер и, в силу фармакодинами-
ческих характеристик, описанных выше, могут находиться в крови плода в кон-
центрациях, превышающих таковые у роженицы. Они могут вызвать судорожную
активность и брадикардию у плода и новорожденного.
Препараты эфирной группы быстро метаболизируются эстеразами крови роже-
ницы и поэтому в меньшей степени переходят к плоду. Из анестетиков амидной
группы к плоду в меньшей степени поступают препараты, которые более тропны к
белкам крови. Наибольшей связью с бедками обладает бупивакаин. Метаболизм
амидных анестетиков у новорожденного может замедлиться ввиду несовершенства
функций печени. Выраженные резорбтивные эффекты у роженицы и новорожден-
ного возникают только при использовании больших доз препаратов.
19.1.3.8. Нестероидные противовоспалительные средства
Основой действия НПВС является блокирование циклооксигена-
зы и уменьшение синтеза простагландинов, ряд из которых являются альгогенны-
ми субстанциями. НПВС особенно эффективны при боли воспалительного и ише-
мического генеза и хорошо дополняют опиоиды. Они не вызывают угнетения
дыхания у роженицы и новорожденного и почти не влияют на гемодинамические
показатели. Препараты быстро переходят через плацентарный барьер и у плода их
определяют в концентрациях, превышающих таковые у роженицы.
НПВС обладают рядом существенных недостатков, связанных с основным меха-
низмом их действия: простагландины усиливают сокращение матки и выполняют
роль вазодилататоров в почках, поэтому применение НПВС может ослабить родовую
деятельность и ухудшить почечный кровоток у роженицы и плода. При системати-
ческом приеме они снижают количество околоплодных вод (олигогидрамнион), вы-
зывают нарушения свертываемости крови и поражают ЖКТ. У новорожденных воз-
можны явления почечной недостаточности, развитие некротизирующего энтероко-
лита и раннее закрытие артериального протока, что ведет к стойкой легочной
гипертензии и дыхательной недостаточности. В силу указанных причин длительное
назначение НПВС нежелательно, в родах их применяют в ограниченных дозах.
19.1.3.9. Гипотензивные средства
Клофелин — центральный а-адреноблокатор — обладает рядом
эффектов, которые позволяют использовать его, как компонент при обезболива-
нии. Препарат оказывает аналгетическое действие, нарушая ноцицептивную аф-
ферентацию на уровне спинного и головного мозга, обладает седативным эффек-
том (в высоких дозах способен вызвать амнезию), уменьшает вегетативные ответы
на боль, прежде всего, предупреждая сосудистый спазм и артериальную гипертен-
зию. Клофелин быстро переходит плацентарный барьер. Он не угнетает дыхатель-
ный центр, чем выгодно отличается от опиатов. При высоких дозах может вызвать
гипотензию у роженицы. На новорожденного препарат оказывает слабое седатив-
ное действие, вызывает отек слизистой оболочки и затрудняет носовое дыхание.
Клофелин для обезболивания родов применяют в небольших дозах (0,018 мг/кг
внутримышечно, внутривенно, эпидурально или интратекально) для усиления
аналгезии и нейровегетативного торможения.
402
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
19.1.4. Обезболивание нормальных родов
При нормально протекающих родах обезболивание обычно начи-
нают при появлении боли у роженицы, установившейся родовой деятельности и
открытии шейки матки на 3—4 см [1]. Обезболивание не начинают раньше, по-
скольку полагают, что существующие методы могут ослабить родовую деятель-
ность. Такие взгляды находятся в определенном противоречии с принципами пре-
вентивной аналгезии (см. раздел 11.4.2.1), согласно которой обезболивание надо
начинать до нанесения болевого раздражения, причем необходимо предотвратить
развитие периферической и центральной сенситизации. В целях профилактики
периферической сенситизации используют регионарную анестезию, введение НПВС
и контрикала, как ингибитора синтеза кининов. Для профилактики центральной
сенситизации до нанесения болевого воздействия вводят опиоиды и субнаркоти-
ческие дозы кетамина (0,15—0,5 мг/кг). Имеются сообщения, что эпидуральная
аналгезия, начатая до появления родовой боли, более эффективна, чем начатая
после появления болей. Возможно, что тактика обезболивания нормальных родов
в будущем будет строиться на принципах превентивной аналгезии. Для контроля
над эффективностью обезболивания родов рекомендуют использовать шкалу Рас-
стригина Н.Н. и Шнайдера Б.Н. (табл. 19.2).
Таблица 19.2. Оценка эффективности обезболивания родов
(по Расстригину Н.Н., Шнайдеру Б.Н.)
Клинические признаки (регистрируют в момент схваток) Эффективность обезболивания родов, балл
2 1 0
Боль Отсутствует или легко переносится Кратковременная, слабо выражена на высоте схватки В течение всей схватки
Двигательное возбуждение Отсутствует или мало выражено Контролируемые движения Некоординируемые движения, беспокойство
Психо- эмоциональное напряжение Отсутствует или мало выражено Временный страх, угнетение психики Страх, плаксивость, резкое возбуждение, сменяющееся угнетением
ЧДД и ритм дыхания ЧДД — в пределах нормы, ритм правильный Кратковременное учащение не более чем на 10 дыхательных циклов в 1 мин, ритм правильный Учащение более чем на 10 дыхательных циклов в 1 мин, нарушения ритма дыхания
Повышение АД, изменение ЧСС Повышение АД не бо- лее чем на 10 мм рт. ст., увеличение ЧСС не более чем на 10-15 уд./мин Повышение АД более чем на 20 мм рт. ст., увеличение ЧСС на 20-25 уд./мин Повышение АД более чем на 20 мм рт. ст., увеличение ЧСС на 30 уд./мин и более
403
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Интерпретация результатов: 8—10 баллов — эффект полный, 4—7 балла —
эффект удовлетворительный, 3 балла и менее — эффект отсутствует.
Обезболивание родов ингаляционными анестетиками
Основным принципом данного метода является проведение наркоза в стадии
аналгезии. В качестве анестетика используют закись азота, которую подают с кис-
лородом в соотношении 1:1 или 2:1. Более высокие концентрации закиси азота
(FiN2O более 70 %) являются гипоксическими, их не используют в акушерской
практике.
Закись азота подают непрерывно, с паузами через 30—40 мин в течение 10—15 мин
или прерывисто. В последнем случае применяют два варианта: 1) роженица начи-
нает дышать газонаркотической смесью в момент развития схватки, при оконча-
нии схватки подачу закиси азота прекращают; 2) роженица вдыхает закись азота в
паузах между схватками. Поскольку аналгезия начинается не ранее чем через 3—5 мин
после начала ингаляции, то при первом варианте начало схваток обезболивается
плохо. При непрерывной подаче закиси азота качество аналгезии выше, но увели-
чивается расход анестетика, и создаются более высокие концентрации препарата
в организме плода. Эта методика требует тщательного контроля со стороны анес-
тезиолога, так как у роженицы может наступить потеря сознания из-за угне-
тения дыхания и гипоксии. Прерывистая подача закиси азота менее опасна с точ-
ки зрения развития гипоксии, но менее эффективна. Употребление закиси азота
без кислорода в сочетании с атмосферным воздухом крайне опасно, так как при
этом легко возникает гипоксия у матери и плода. Аналгезию закисью азота следу-
ет проводить с помощью наркозных аппаратов, в которых предусмотрена блоки-
ровка подачи закиси азота при отключении кислорода и имеется возможность
устанавливать фиксированные соотношения закиси азота к кислороду.
Обезболивание триленом проводят методом аутоаналгезии с использованием
аутоаналгезеров — “Автонаркона-С”, “Трилана”, “Трингала”. Аналгетическая кон-
центрация препарата варьирует в пределах 0,3—1 об.%, но чаще используют кон-
центрацию 0,4—0,6 об.%. Анестетик обладает кумулятивным эффектом и при дли-
тельной ингаляции угнетает родовую деятельность, поэтому используют прерыви-
стую подачу. Наиболее распространенной является следующая методика: роженица
самостоятельно держит аутоаналгезер и вдыхает трилен, при угнетении сознания
и снижении мышечного тонуса рука опускается, вдыхание трилена прекращается,
сознание восстанавливается. Эта техника использования трилена ни в коем случае
не исключает постоянного контроля анестезиолога над состоянием роженицы.
Обезболивание родов неингаляционными анестетиками
Ни один из известных неингаляционных анестетических препаратов не спо-
собен обеспечить адекватную аналгезию в родах, поэтому используют сочетание
нескольких средств, подобранных, согласно принципам многокомпонентной ане-
стезии. В соответствии с этим, обезболивание родов требует применения аналге-
тика, транквилизатора и/или нейролептика и спазмолитика: аналгетик обеспечи-
вает неполную блокаду ноцицептивной афферентации (полной блокады не дости-
гают ввиду негативных воздействий препаратов на роженицу и плод);
транквилизатор и нейролептик обеспечивают седативный и анксиолитический
эффекты, снижают уровень вегетативных ответов на боль, повышают порог пере-
носимости боли; спазмолитики способствуют раскрытию шейки матки, тем са-
мым уменьшая болевую импульсацию с максимально рефлексогенной зоны. В
случаях, когда необходимо усилить седативный эффект, выключить сознание роже-
404
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ницы или уменьшить судорожную активность ЦНС, вводят общие анестетики.
При нормальных родах необходимость использования этого класса препаратов
возникает редко. Усиление аналгетического эффекта классической триады средств
достигают за счет использования адъювантных препаратов — ненаркотических
аналгетиков и центральных а-адреномиметиков. Первоначальная доза всех ука-
занных классов препаратов должна быть минимальной; если желаемого эффекта
не достигают, то вводят их дополнительно. По окончанию действия препаратов
вводят повторные дозы. Поскольку большинство используемых препаратов обла-
дают кумулятивным эффектом, то выбирают те из них, длительность действия
которых близка к предполагаемой длительности родов у данной роженицы.
Промедол — ц-агонист. При внутривенном введении эффект развивается через
2-3 мин, длительность аналгетического эффекта — 1—1,5 ч, первоначальная доза —
10 мг (в среднем). При 2—3-х кратном введении побочные эффекты выражены
мало. Промедол — один из наиболее часто используемых препаратов.
Морфина гидрохлорид — ц-агонист. При внутривенном введении эффект раз-
вивается через 2—3 мин, длительность аналгетического эффекта — 3—4 ч, при
внутримышечном введении — до 4—5 ч, первоначальная доза — 10 мг (в среднем).
Обладает выраженными побочными эффектами, способен кумулироваться, по-
этому нежелательно многократное введение.
Пиритрамид (дипидолор) — по характеристикам близок к морфину гидрохло-
риду. Первоначальная доза при внутримышечном введении — 15 мг.
Морфина гидрохлорид и пиритрамид применяют у рожениц с высокой интен-
сивной болью, а рождение ребенка ожидают через 3—4 ч.
Налбуфин является антагонистом ц-рецепторов и агонистом к-рецепторов. При
внутримышечном введении начало действия — через 5 мин, длительность дей-
ствия — до 4—6 ч, первоначальная доза — 20 мг. Мало влияет на гемодинамику, но
при неоднократных введениях может вызвать угнетение дыхания (меньшее, чем
при использовании морфина гидрохлорида и пиритрамида).
Буторфанол (морадол, стадол) — агонист к-рецепторов. По данным разных
авторов, на ц-рецепторы действует либо как частичный агонист, либо как антаго-
нист. При внутримышечном введении начало действия — через 5 мин, длитель-
ность действия — до 4—6 ч, первоначальная доза — 2 мг. При неоднократных
введениях может вызвать угнетение дыхания, оказывает умеренное депримирую-
щее влияние на гемодинамику.
Пентазоцин (фортрал, лексир) — антагонист ц-рецепторов, частичный агонист
к-рецепторов и агонист о-рецепторов. При внутримышечном введении начало дей-
ствия — через 5 мин, длительность действия — до 3—4 ч, первоначальная доза —
30 мг. При неоднократных введениях может вызвать угнетение дыхания. У неко-
торых рожениц вызывает незначительное повышение силы и частоты сердечных
сокращений, что, возможно, связанно со стимуляцией p-рецепторов. Эта особен-
ность делает его препаратом выбора у больных с гипотензией.
Налбуфин, буторфанол и пентазоцин применяют в родах по тем же показаниям,
что и ц-агонисты. Не имеют существенных преимуществ перед ц-агонистами, вы-
зывают меньшее угнетение дыхания и менее выраженную ригидность мышц. При
небольших дозах эти отличия не имеют существенного клинического значения.
Бупренорфин — частичный агонист ц~рецепторов. При внутримышечном вве-
дении начало действия — через 20 мин, длительность действия — до 4—6 ч, перво-
начальная доза — 0,3 мг. При неоднократных введениях может вызвать угнетение
дыхания, оказывает умеренное депримирующее влияние на гемодинамику. У зна-
405
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
чительной части рожениц вызывает тошноту и рвоту. Последнее, наряду с боль-
шим латентным периодом, делает этот препарат мало пригодным для обезболива-
ния родов.
Трамадол (трамал) — частичный агонист ц-, о- и к-рецепторов, аналгетичес-
кий эффект также связан с воздействием на серотониновые рецепторы. Препарат
выгодно отличается от всех описанных аналгетиков тем, что редко вызывает тош-
ноту и рвоту, мало влияет на дыхание и гемодинамику. Чувствительность к трама-
долу значительно отличается у различных индивидуумов. При внутримышечном
введении начало действия — через 15—30 мин, длительность действия — до 3-5 ч,
первоначальная доза — 100 мг.
Из бензодиазепинов в родах преимущественно применяют диазепам и мидазо-
лам. Первоначальная доза диазепама — 10 мг, мидазолама — 10—15 мг. Повторно
вводят по 5—10 мг при наличии показаний. Многократные введения диазепама
нежелательны ввиду отрицательных эффектов (см. раздел 19.1.3.2).
Из группы нейролептиков преимущественно применяют дроперидол, показа-
нием к введению которого является значительное увеличение АД в ответ на боль.
В остальных случаях нормальных родов вместо дроперидола используют транкви-
лизаторы. При внутривенном введении выраженный эффект наступает через 7-10
мин, длительность действия — 40—60 мин (при однократном введении), перво-
начальная доза — 5 мг, повторные дозы — 2,5—5 мг.
Из спазмолитиков применяют но-шпу в дозе 2 мл, галидор — 2 мл 2,5 %
раствора; из холинолитиков — метацин в дозе 1 мл 0,1 % раствора. Повторно эти
препараты вводят в тех же дозах через 2—2,5 ч.
Наиболее эффективными из ненаркотических аналгетиков являются кетанов и
баралгин. Кетанов вводят 30 мг внутримышечно не более 1—2 раз в течение родов.
Кетанов не угнетает сокращения матки, поэтому, в соответствии с принципами
превентивной аналгезии, его вводят при первых признаках родовой деятельности.
Эффект баралгина обусловлен комбинированным аналгетическим и спазмолити-
ческим действием; вводят по 5 мл не более 2 раз в течение родов.
Клофелин применяют у рожениц с повышенным уровнем АД. Как компонент
аналгезии, его вводят в дозе 100 мкг внутривенно или внутримышечно. Аналгети-
ческий и седативный эффекты развиваются через 15—25 мин и длятся 3—4 ч. Он
выгодно отличается от опиатов тем, что не вызывает угнетения дыхания у рожени-
цы и плода. Наиболее целесообразными являются его сочетания с промедолом,
трамадолом и кетановом. Препарат не следует сочетать с нейролептиками, так как
это может привести к развитию значительной гипотензии.
Введение адъювантных препаратов позволяет сократить дозы опиоидов.
Обезболивание родов методами регионарной анестезии
Причиной болевых ощущений у роженицы в I периоде родов является сокра-
щение матки, сглаживание и растяжение ее шейки, натяжение прикрепляющих
связок. Зоны отраженной боли распространяются от пупочной области (Т10), па-
ховой и верхней трети бедра (L,) до боковых и нижних частей спины. Во II пери-
оде родов боль возникает в результате растяжения, натягивания, а иногда — раз-
рывов тазовых структур и промежности, возникающих при прохождении плода по
родовым путям. Эти болевые ощущения передаются крестцовыми и копчиковыми
нервами, поэтому для адекватного обезболивания родовой деятельности во второй
стадии в дополнение к блокаде сегментов Т10—L, обязательно блокируют крестцо-
вые и копчиковые проводники. Для этих целей наиболее широко используют эпиду-
406
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ральную и субдуральную аналгезии, парацервикальную блокаду, реже — каудаль-
ную анестезию и местную инфильтрацию промежности. Эти методы обезболива-
ния позволяют роженице активно участвовать в процессе родов и вызывают зна-
чительно меньшее количество осложнений по сравнению с центральной аналге-
зией наркотическими аналгетиками или ингаляционной анестезией.
Перед проведением регионарных методов обезболивания в обязательном по-
рядке выполняют следующие действия: 1) объясняют беременной суть предстоя-
щей манипуляции и ее преимущества перед другими методами обезболивания,
получают согласие на проведение; 2) обеспечивают надежный венозный доступ
путем катетеризации периферической или центральной (при необходимости) вены;
3) проводят предварительную внутривенную инфузию 800—1000 мл кристаллоид-
ных растворов для уменьшения риска гипотензии, развивающийся вследствие сим-
патической блокады; 4) подготавливают необходимое оборудование для обеспече-
ния надежного наблюдения за состоянием роженицы и новорожденного; 5) под-
готавливают аппаратуру, инструментарий и медикаменты (наркозный аппарат,
ларингоскоп, воздуховоды, интубационную трубку, отсос, тиопентал-натрий, диа-
зепам, эфедрин и т. д.) для ликвидации возможных осложнений
Эпидуральная анестезия завоевывает популярность в акушерской практике.
Сущность этого метода заключается во введении в эпидуральное пространство
растворов местных анестетиков либо их сочетания с наркотическими аналгетика-
ми (см. раздел 13.3).
Показания к проведению эпидуральной анестезии: обезболивание родов при от-
сутствии эффективности других методов обезболивания, дискординированная ро-
довая деятельность, роды в ягодичном предлежании, гестоз и выраженная артери-
альная гипертензия, сопутствующая эктрагенитальная патология, многоплодная
беременность, кесарево сечение.
Абсолютные противопоказания к проведению эпидуральной анестезии:
• отсутствие квалифицированного анестезиологического персонала и необхо-
димого оборудования для постоянного мониторинга за состоянием пациентки.
Несвоевременно выявленные осложнения регионарной анестезии и их неадекват-
ная коррекция могут привести к гибели роженицы и плода;
• гнойничковые поражения кожи в области пункции. Прохождение иглы че-
рез инфицированную зону может привести к распространению инфекции и раз-
витию внутривертебрального абсцесса, вплоть до менингита;
• наличие септического очага и генерализованной инфекции у роженицы.
Хориамнионит не рассматривают в качестве противопоказания к регионарной
анестезии (Goodman E.J. и соавторы, 1996). Необходимо помнить о возможной
дегидратации у пациентки с гипертермическим состоянием;
• нарушения свертывающей системы и лечение антикоагулянтами из-за веро-
ятности формирования гематомы вследствие повреждения сосуда. Это может со-
провождаться сдавлением cauda equinae либо спинного мозга с последующими
серьезными неврологическими нарушениями (Haljamae Н., 1996). Терапия стан-
дартными дозами аспирина и применение профилактических доз гепарина не яв-
ляются противопоказаниями для эпидуральной анестезии при условии, что у па-
циентки нормальные показатели протромбинового времени и АЧТВ, а последнее
введение гепарина осуществляли более чем за 6 ч до момента выполнения мани-
пуляции. При содержании тромбоцитов более 100 х 109/л возможно проведение
эпидуральной аналгезии даже без исследования коагуляционных тестов, при 50—
100 х 109/л — необходим контроль коагуляционных тестов для исключения ДВС-
407
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
синдрома. При выраженной тромбоцитопении (менее 50 х 109/л) выполнение эпи-
дуральной анестезии абсолютно противопоказано (Beilin Y. и соавторы, 1997);
• гиповолемический шок. Проведение эпидуральной анестезии при выра-
женной гиповолемии может привести к срыву компенсации вследствие симпа-
тической блокады и развитию тяжелой гипотензии, вплоть до остановки крово-
обращения.
• выраженные анатомические аномалии позвоночного столба.
Относительные противопоказания к проведению эпидуральной анестезии: неже-
лание пациентки к проведению данного метода анестезии; заболевания сердца
при отсутствии полноценного мониторинга за состоянием гемодинамики; анато-
мические особенности (выраженное ожирение, кифосколиоз, обширные хирурги-
ческие вмешательства на спине), затрудняющие идентификацию топографичес-
ких ориентиров; неврологические заболевания (рассеянный склероз, боковой ами-
отрофический склероз и др.).
Эпидуральная анестезия в родах должна отвечать двум основным требовани-
ям: во-первых, обеспечивать блокаду ноцицептивной афферентации от всех ана-
томических образований, участвующих в формировании родовой боли (анестезия
должна распространяться от нижнегрудных до сакральных сегментов включитель-
но); во-вторых, должна быть достигнута только 1-я степень нервного блока -
аналгезия без миоплегии, так как более высокий уровень блока может вызвать
гемодинамические расстройства и релаксацию мышц брюшной стенки и тазового
дна, что ослабляет или делает невозможными потуги и нарушает биомеханику
родов. У рожениц с миорелаксацией чаще наблюдают рождение ребенка в заднем
виде затылочного предлежания, при этом увеличивается количество случаев нало-
жения акушерских щипцов. Эти требования находятся в определенном противо-
речии между собой, поскольку обширный эпидуральный блок требует введения
значительной дозы местного анестетика, что, в свою очередь, увеличивает вероят-
ность развития гипотензии и миорелаксации.
Чтобы уменьшить объем анестетика, область его введения выбирают диффе-
ренцировано, в зависимости от периода родов: в I периоде, когда преобладает
маточный компонент боли, анестетик вводят на уровне нижнегрудных или верх-
них люмбальных сегментов; во II периоде родов, когда преобладает промежност-
ный компонент боли, анестетик вводят на уровне нижних люмбальных сегментов.
Чтобы обеспечить введение анестетика на разных уровнях, пунктируют эпиду-
ральное пространство на уровне L,—Ц иглой, имеющей два просвета, и проводят
эпидуральные катетеры на 3—4 см в краниальном и каудальном направлениях.
Можно осуществить пункцию и катетеризацию эпидурального пространства на
двух уровнях (Th12—L1 и L3—L4) с проведением катетеров, соответственно, в крани-
альном и каудальном направлениях. Учитывая, что соматическая родовая боль
более интенсивная, чем висцеральная, используют следующую методику: пунк-
цию эпидурального пространства проводят на уровне Th12—L, или Ц—L2, вводят
начальную дозу местного анестетика, а затем в каудальном направлении проводят
катетер, через который осуществляют введение последующих доз, при этом опус-
кают ножной конец кровати.
При правильно выбранной точке введения объем первоначальной дозы мест-
ного анестетика составляет 8—10 мл (не менее 0,7—1,0 мл/сегмент). Малый объем
анестетика не обеспечивает блокаду должного числа сегментов. Используют ми-
нимальную концентрацию местного анестетика из диапазона рекомендуемых кон-
центраций. Следует подчеркнуть, что глубина блока в большей степени зависит от
408
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
концентрации местного анестетика, чем от его объема и суммарной дозы. Для
достижения блока 1-й степени используют следующие концентрации анестети-
ков: 0,75—1 % растворы ксилокаина (лидокаина), 0,125—0,25 % растворы бупива-
каина. При возобновлении боли введение анестетиков повторяют, объем при по-
вторных введениях выбирают эмпирически, но, как правило, он практически иден-
тичен первоначальному. Средняя длительность аналгезии при введении лидокаина
составляет 40—60 мин, бупивакаина — 100—120 мин.
Для пролонгации времени эффективного действия местных анестетиков
Casins M.J. (1994) рекомендует их ощелачивание 8,4 % раствором NaHCO3: на
каждые 10 мл раствора бупивакаина добавляют 0,05 мл гидрокарбоната натрия,
лидокаина — 0,25 мл, хлорпрокаина — 0,5 мл.
Эффективность повторных введений может уменьшиться из-за феномена та-
хифилаксии, присущего местным анестетикам. Чтобы избежать тахифилаксии и
уменьшить суммарную дозу препарата, используют длительно действующие анес-
тетики, в частности — бупивакаин, или сочетают их с адъювантами. При строгом
соблюдении вышеописанной методики суммарные дозы местных анестетиков не-
велики и не оказывают неблагоприятного воздействия на роженицу и плод.
Кроме фракционного введения повторных доз местных анестетиков, реко-
мендуют вводить их в эпидуральное пространство в виде постоянной инфузии.
Метод показан при обезболивании схваток в течение длительного времени (2 ч и
более) и обеспечивает ряд преимуществ, которые недостижимы при фракционном
режиме введения (потребность в местном анестетике уменьшается почти на 1/3).
Введение анестетиков в эпидуральное пространство осуществляют с помощью
перфузоров (табл. 19.3).
Таблица 19.3. Рекомендуемая скорость введения местных внестетиков
при проведении постоянной эпидуральной инфузии
Местный анестетик, % Рекомендуемая скорость введения, мл/ч
Бупивакаин, 0,125 % 8-10
Лидокаин, 0,5-0,75 % 15-20
Хлорпрокаин, 0,5-0,75 % 30-40
Мепивакаин, 0,5-0,75 % 15-20
Начинают введение анестетика с растворов меньшей концентрации. Это обус-
ловлено тем, что объемы растворов с низкой концентрацией распространяются на
большее количество сегментов, чем малые объемы концентрированных растворов.
Если глубина анестезии недостаточна, то увеличивают концентрацию анестетика.
В периоде изгнания продолжают инфузию препаратов, так как ее прекраще-
ние может вызвать резкое усиление болевой чувствительности. Проверяют уро-
вень блокады и, в случае недостаточной анестезии промежности, дополнительно
вводят 8—12 мл 1,5 % лидокаина или 2 % хлорпрокаина.
Для пролонгации эффективной аналгезии получило широкое распростране-
ние сочетанное эпидуральное введение местных анестетиков и наркотических анал-
гетиков. Такое сочетание позволяет уменьшить дозу местного анестетика, снизить
риск его токсического влияния и препятствовать развитию нежелательной мы-
шечной слабости. Добавление 100 мкг фентанила или 3 мг морфина значительно
409
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
улучшает качество эпидурального обезболивания по сравнению с использованием
местного анестетика в качестве монопрепарата.
Наряду с комбинированным эпидуральным введением наркотических аналге-
тиков и местных анестетиков, достаточно широко применяют моноаналгезию опиа-
тами. Эпидуральное введение 200 мкг фентанила вызывает быстрое (через 5—10 мин)
наступление аналгезии, эффект которой продолжается в течение 1,5—2 ч. Исполь-
зование 5 мг морфина вызывает длительную (12—24 ч) аналгезию, но начало дей-
ствия наступает через 1—1,5 ч и может сопровождаться рядом побочных эффектов:
кожным зудом, тошнотой, рвотой, задержкой мочеиспускания. Также не исклю-
чено депрессивное влияние морфина на новорожденного. Быстрого и продолжи-
тельного обезболивания с минимальными побочными эффектами морфина дос-
тигают сочетанным применением морфина (2,5 мг) и фентанила (25—50 мкг), при
этом аналгезия наступает через несколько минут и продолжается до 4—5 ч, чего,
как правило, достаточно для обезболивания I периода родов. Широко применяют
постоянную эпидуральную инфузию фентанила (2,5 мкг/ч).
Помимо эпидурального введения местных анестетиков и опиатов, эффектив-
ного обезболивания достигают путем эпидуральной инъекции 50—100 мкг клофели-
на, при этом обезболивание наступает через 15—20 мин, продолжается в течение
3—5 ч и сопровождается снижением системного АД. Данный метод наиболее целе-
сообразно использовать у рожениц с артериальной гипертензией и преэклампсией.
Кроме фракционного введения клофелина, разработана методика его посто-
янной эпидуральной инфузии со скоростью 20 мкг/ч после однократного введе-
ния болюсной дозы. Также используют сочетанное введение 75 мкг клофелина с
раствором какого-либо местного анестетика.
Спинальная анестезия обладает рядом преимуществ: малым латентным перио-
дом (3—5 мин) и минимальной дозой местного анестетика. Вместе с тем, спиналь-
ная анестезия имеет и ряд существенных недостатков: во-первых, длительность
действия местного анестетика при интратекальном введении существенно короче,
чем при эпидуральном; во-вторых, практически невозможно управлять глубиной
блока; в-третьих, легко возникает релаксация мышц брюшной стенки и тазового
дна; в-четвертых, возможно чрезмерное распространение блока в краниальном
направлении, что чревато возникновением гипотензии и нарушений дыхания (при
схватках и потугах резко повышается внутрибрюшное давление и нарушается дви-
жение ЦСЖ).
Обычно спинальную анестезию используют для обезболивания II периода
родов. Спинальную пункцию осуществляют на уровнях L3~L4 или Ц—Ц, после
чего вводят 1,5 мл гипербарического раствора местного анестетика. Введение изо-
барических и гипобарических растворов нежелательно, так как уровень их рас-
пространения при родовой деятельности трудно предсказуем.
Для уменьшения побочных эффектов субдурального введения местных анес-
тетиков широко применяют субдуральную аналгезию опиатами, при этом роже-
ница сохраняет двигательную активность. Рекомендуют субдуральное введение 40-
50 мкг фентанила, разведенного в 1,5 мл изотонического раствора хлорида натрия.
Эффект наступает через 4—5 мин и продолжается в течение 1,5—2 ч, чего не всегда
достаточно. Введение 0,5 мг морфина, разведенного в 1 мл физраствора, вызывает
начало обезболивания через 20 мин, которое продолжается в течение 4—6 ч. Как и
в случае эпидурального введения морфина, качество обезболивания не всегда до-
статочное, и часто развиваются побочные эффекты. Рекомендуют сочетанное вве-
дение 25 мкг фентанила и 0,25 мг морфина в 1,5 мл физраствора.
410
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
На современном этапе для увеличения длительности спинальной аналгезии
используют тонкие спинальные катетеры. Существуют данные, что катетериза-
ция субдурального пространства при спинальной анестезии может вызвать раз-
витие синдрома конского хвоста — длительную дисфункцию мочевого пузыря и
кишок.
Спинально-эпидуральная анестезия. Иглой 18 G (желательно типа Кроуфорда)
пунктируют эпидуральное пространство. После прокола желтой связки через про-
свет иглы-интродьюсера вводят иглу для спинальной анестезии — 25 или 27 G.
Осуществляют спинальную пункцию и вводят раствор анестетика. Тонкую иглу
извлекают, а через иглу-интродьюсер вводят эпидуральный катетер. После завер-
шения действия спинальной анестезии обезболивание проводят путем эпидураль-
ного введения препаратов. Преимущества данного метода обезболивания — ма-
лый латентный период и уменьшение суммарной дозы анестетика.
Парацервикальная блокада эффективна для устранения маточного компонента
родовой боли. Местный анестетик вводят в боковой свод влагалища с обеих сто-
рон матки — на 3—4 ч и 8—9 ч по отношению к шейке матки. Чтобы ограничить
глубину введения иглы, используют направитель, не позволяющий кончику иглы
выходить из него более чем на 4 мм. С каждой стороны матки вводят по 5 мл
анестетика. Используют 0,5—1 % растворы ксилокаина или ксикаина (средняя
длительность анестезии — 1,5 ч), 0,25 % раствор бупивакаина (средняя длитель-
ность анестезии — 2,5 ч). Специфическим осложнением анестезии является бра-
дикардия у плода, развивающаяся вследствие быстрого поступления к нему анес-
тетика. Созданию высокой концентрации анестетика в крови плода способствуют
проникновение препарата в маточные артерии и межворсинчатое пространство
плаценты без предварительного разведения его в крови матери, прохождение пре-
парата через стенку матки (особенно при низко расположенной плаценте), введе-
ние анестетика в предлежащую часть плода (грубая техническая ошибка при про-
ведении анестезии). При развитии брадикардии у плода роженицу укладывают на
левый бок, начинают инсуфляцию кислорода, внутривенно вводят холинолитики
(атропин) и/или p-адреномиметики (с учетом гемодинамического профиля роже-
ницы). В настоящее время парацервикальную блокаду используют редко.
Блокаду полового нерва (пудендальную анестезию) применяют для устранения
промежностного компонента родовой боли. Используют промежностный и транс-
вагинальный методы выполнения блокады. При промежностном способе иглу вво-
дят в точку, находящуюся на середине расстояния между дорсальной спайкой
влагалища и седалищным бугром. Далее иглу направляют к седалищному бугру,
пальпируемому через влагалище или прямую кишку. Анестетик в объеме 5—10 мл
вводят медиальнее седалищного бугра в седалищно-прямокишечную ямку. После
этого иглу подтягивают и, проколов крестцовую связку, направляют к седалищ-
ной ости, одновременно осуществляя введение 5 мл анестетика. При трансваги-
нальном способе через влагалище пальпируют седалищную кость и крестцово-
остистую связку. Иглу вводят через боковую стенку влагалища, подводят ее не-
посредственно к связке и вводят 10 мл анестетика. Для блокады используют 1 %
растворы ксилокаина и ксикаина, 0,5 % раствор бупивакаина.
Осложнения регионарной анестезии: тяжелая гипотензия, судороги, тотальная
спинальная анестезия с остановкой дыхания, гипертензия, вызванная вазопрес-
сорными добавками, травматические повреждения корешков нервов, постпунк-
ционная головная боль, инфицирование эпи- и субдурального пространства и др.
411
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Гипотензия является наиболее частым осложнением регионарной анестезии.
Ее частота и выраженность зависят от уровня распространения анестетика, поло-
жения и физического состояния роженицы, др.
Для профилактики гипотензии, кроме предварительной гидратации солевыми
растворами, за 15—20 мин до ее проведения внутримышечно вводят 10—15 мг эфед-
рина. Учитывая возможность развития тяжелой гипотонии, проведение регионар-
ных методов обезболивания родов требует тщательного наблюдения за состояни-
ем роженицы и постоянного присутствия анестезиолога. При снижении систоли-
ческого АД менее 100 мм рт. ст. пациентку укладывают в положение Тренделенбурга
с приподнятым ножным концом на 20—30° и немедленно начинают введение кри-
сталлоидов, параллельно осуществляя ингаляцию 100 % кислорода. Если в тече-
ние 5 мин уровень АД не восстанавливается, то вводят эфедрин (5—15 мг).
При интраваскулярном расположении катетера в результате случайного внут-
рисосудистого введения местного анестетика могут развиться судороги клонико-
тонического характера. Обеспечивают ингаляцию 100 % кислорода через носоли-
цевую маску и проводят противосудорожную терапию: тиопентал-натрий (100 мг
внутривенно) в сочетании с диазепамом (5 мг). При необходимости внутривенные
введения повторяют. При продолжающихся судорогах для обеспечения адекват-
ной вентиляции и газообмена проводят интубацию трахеи с последующей ИВЛ в
режиме умеренной гипервентиляции, что препятствует развитию тяжелого ацидо-
за и внутриутробной гипоксии плода.
Перфорация твердой мозговой оболочки иглой или катетером может привес-
ти к развитию тотальной спинальной анестезии, что обусловлено попаданием в
субдуральное пространство значительного количества местного анестетика и его
распространением вплоть до продолговатого мозга. Развиваются тяжелейшая ги-
потония и тотальная мышечная релаксация, которые сопровождаются нарушени-
ями вентиляции и могут привести к остановке сердца. В этих случаях немедленно
осуществляют интубацию трахеи и ИВЛ, при необходимости проводят сердечно-
легочную реанимацию.
Добавление к раствору местных анестетиков адреналина и других вазоактив-
ных средств может привести к развитию артериальной гипертензии, что сопровож-
дается рядом цереброваскулярных нарушений: головными болями распирающего
характера, тошнотой, рвотой, нарушениями зрения и др. В этих случаях вводят
гипотензивные средства: нитропруссид натрия (50 мг в 500 мл физраствора), ар-
фонад (500 мг в 500 мл физраствора) и др.
Не исключены травматические повреждения корешков и образование гематоме
последующим абсцедированием и развитием менингита.
После субдуральной пункции или при случайной перфорации твердой мозговой
оболочки во время эпидуральной пункции возможно развитие постпункционных голов-
ных болей. Механизм развития цефалгий связан, прежде всего, с образованием пост-
пункционного канала в dura mater и последующим истечением ликвора, приводящим к
нарушению внутричерепной ликвородинамики. Постпункционную головную боль в 3
раза чаще диагностируют у больных, страдающих головным болями в анамнезе. Часто-
та цефалгий заметно возрастает у женщин в возрасте 18—30 лет, особенно имеющих
низкий ИМТ и эндокринные заболевания в анамнезе. При перпендикулярном направ-
лении среза иглы относительно продольных волокон твердой мозговой оболочки ча-
стота постпункционной головной боли достигает 16,1 %, при продольном направлении -
0,24 %, при использовании игл 22 G и более — 10—15 %. Развитие цефалгии зависит
свойств используемого анестетика (лидокаин > бупивакаин > тетракаин).
412
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Консервативная терапия постпункционной головной боли: кофеина бензоат
(300-500 мг перорально), ненаркотические аналгетики, внутривенное введение
18-20 мл стерильной дистиллированной воды, гидратация (солевые растворы —
2,0-2,5 л/сут, обильное питье), ношение бандажа на животе (повышает давление в
венах эпидурального пространства и препятствует истечению ликвора). Если в те-
чение 4—5 дней отсутствует положительный эффект от проводимой консервативной
терапии, то выполняют “пломбировку” эпидурального пространства аутокровью:
при соблюдении правил асептики и антисептики 15 мл венозной аутокрови вводят
в эпидуральное пространство в области предыдущей пункции (1 мл/с), после чего
родильница должна находиться в горизонтальном положении не менее 1 ч. Данный
метод в 95—96 % случаев успешно устраняет постпункционную головную боль.
Краниальное распространение опиоидов, вводимых интратекально, при до-
стижении 4-го желудочка может вызвать депрессию дыхательного центра. Прово-
дят вспомогательную ИВЛ и вводят налоксон (0,4 мг).
Возникновение тошноты и рвоты связано со стимуляцией опиоидом триггер-
ной зоны 4-го желудочка. Для лечения подобного осложнения используют: пи-
польфен (25 мг), дроперидол (12,5 мг) или метоклопрамид (10 мг). Если введение
указанных препаратов не устраняет тошноту и рвоту, то дополнительно вводят
налоксон (0,1 мг).
Кожный зуд устраняют введением налоксона (0,1 мг), пипольфена (25 мг) или
димедрола (25 мг).
При задержке мочи и послеродовой атонии мочевого пузыря катетеризируют
мочевой пузырь, проводят электростимуляцию низкоамплитудными токами в со-
четании с введением прозерина и платифиллина.
Комбинированное обезболивание родов
Оптимальными вариантами комбинированного обезболивания родов являют-
ся сочетание ингаляционной аналгезии закисью азота с неингаляционными пре-
паратами и сочетание регионарной анестезии, преимущественно эпидуральной
или спинальной, с неингаляционными препаратами.
Уровень аналгезии, обеспечиваемый закисью азота, невысок, поэтому совме-
стно с этим анестетиком применяют наркотические аналгетики, транквилизаторы
и/или нейролептики. При подобных сочетаниях возможны утрата сознания роже-
ницей и угнетение спонтанного дыхания. Во избежание этого концентрацию за-
киси азота во вдыхаемой смеси обычно устанавливают на уровне 50 %, а дозы
аналгетиков и транквилизаторов снижают. Данный метод обезболивания отлича-
ется хорошей управляемостью и достаточно высокой эффективностью.
С помощью эпидуральной и спинальной анестезий, особенно в случаях, когда
используют сочетание местных анестетиков с опиатами или клофелином, достига-
ют полноценной аналгезии, но эти методы не обладают должными седативным и
анксиолитическим эффектами. Роженицы, испытывающие чувство страха и трево-
ги, при этих видах анестезии могут воспринимать тактильные ощущения, как боле-
вые, поэтому регионарную анестезию дополняют введением транквилизаторов, ко-
торые обеспечивают и противосудорожный эффект (местные анестетики могут выз-
вать судорожную активность ЦНС). Если используемая методика регионарной
анестезии не блокирует ноцицептивную афферентацию на уровне ряда сегментов,
то дополнительно вводят аналгетики. Используемые дозы транквилизаторов и анал-
гетиков снижают на 30—50 % по сравнению с внутривенной анестезией. Комбина-
ция нейролептиков с эпидуральной или спинальной анестезией может вызвать су-
щественную гипотензию и, в большинстве случаев, является неоправданной.
413
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.1.5. Обезболивание родов при тяжелых
акушерской и экстрагенитальной патологиях
У рожениц с тяжелыми акушерской и экстрагенитальной патоло-
гиями родовая боль представляет существенную опасность для жизни, поэтому
тактика обезболивания родов в таких случаях имеет определенные особенности:
обезболивание осуществляют с начала родовой деятельности, не дожидаясь необ-
ходимой степени раскрытия шейки матки; обеспечивают глубину анестезии с адек-
ватной стабильностью гемодинамики и дыхания, отсутствием жалоб роженицы на
боль (в случае сохранности сознания); если достижение адекватной глубины ане-
стезии невозможно без применения сочетаний и доз анестетических средств, ко-
торые могут вызвать наркотическую депрессию у новорожденного, то эти сочета-
ния и дозы используют.
Адекватную глубину анестезии достигают за счет сочетания анестетических
средств, а не за счет увеличения их доз, поэтому ведущими при обезболивании
родов у рожениц высокого риска являются методы комбинированного обезболи-
вания. Если при обезболивании нормальных родов эти методы в большинстве
случаев рассматривают, как альтернативные, то у данного контингента рожениц
их применяют в зависимости от акушерской и сопутствующей патологий.
Обезболивание с помощью закиси азота, аналгетиков, транквилизаторов и
нейролептиков не применяют у рожениц с дыхательной недостаточностью, ане-
мией, низким сердечным выбросом, “синими” пороками сердца и легочной ги-
пертензией. У рожениц с тяжелой преэклампсией и эклампсией для купирования
судорожной активности иногда используют значительные дозы транквилизаторов,
аналгетиков, а также общие неингаляционные анестетики. Закись азота у таких
рожениц может вызвать гипоксию.
Эпидуральную и спинальную анестезии не применяют у рожениц с наруше-
ниями свертываемости крови и в состоянии шока. Относительными противопока-
заниями являются: анемия, гиповолемия, низкий сердечный выброс, заболевания
ЦНС. Спорным остается вопрос применения этих методов обезболивания у роже-
ниц с сепсисом. У рожениц с судорожной готовностью (тяжелой преэклампсией и
эклампсией) их используют только после устранения судорожной активности ЦНС
с помощью общих анестетиков и транквилизаторов, а также после опиоидной
аналгезии. Следует отметить, что указанные регионарные методы могут привести
к существенной гипотензии.
Сужение показаний к применению ингаляционной и регионарной анестезий
расширяет показания к обезболиванию неингаляционными препаратами. У роже-
ниц высокого риска этот метод обезболивания имеет определенные особенности:
дозы аналгетиков, транквилизаторов и нейролептиков увеличивают, применяют
общие неингаляционные анестетики, расширяют показания к использованию адъ-
ювантных препаратов.
Общие неингаляционные анестетики в родах обеспечивают усиление седативно-
го и противосудорожного эффектов; их применяют при необходимости для выключе-
ния сознания. Выбор анестетика проводят в соответствии с патологией роженицы.
Для длительного обеспечения противосудорожного эффекта используют
0,25—0,5 % раствор барбитуратов (начальная доза — 2—5 мг/кг, в дальнейшем
индивидуально подбирают темп введения, суточная доза — не более 1 г, особенно
для тиопентал-натрия).
414
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Роженицам с невысоким уровнем АД и сниженным сердечным выбросом вво-
дят субнаркотические дозы кетамина, который усиливает аналгезию. Перед его
введением назначают транквилизаторы и аналгетики. Первоначальная доза кета-
мина составляет 0,15—0,25 мг/кг, дальнейший темп введения подбирают индиви-
дуально. Ранее кетамин не применяли у больных с повышенным ВЧД и судорож-
ной активностью ЦНС. В настоящее время существуют данные о том, что субнар-
котические дозы препарата обеспечивают протекторный эффект у таких больных
вследствие блокады NMDA-рецепторов. Вопрос о применении кетамина для обез-
боливания родов у рожениц с тяжелой преэклампсией и эклампсией подлежит
дальнейшему изучению.
Натрия оксибутират применяют в субнаркотических дозах для усиления седа-
тивного эффекта у рожениц с низким сердечным выбросом и сниженным АД.
Препарат используют также для обеспечения медикаментозного отдыха.
Пропофол и этомидат используют исключительно для кратковременного вык-
лючения сознания при наложении акушерских щипцов, вакуум-экстрактора, при
проведении болезненных манипуляций. Оба препарата являются чистыми гип-
нотиками, их используют только в сочетании с аналгетиками, транквилизатора-
ми и/или нейролептиками.
Выбранная методика обезболивания родов у рожениц высокого риска должна
предусматривать возможность перехода к оперативному родоразрешению.
19.1.6. Анестезиологическое обеспечение
малых акушерских и гинекологических операций
Традиционное утверждение, что небольшая операция не означает
небольшой анестезии, и на современном этапе не потеряло актуальности, ведь
вероятность развития осложнений при “малой” анестезии такая же и даже выше,
чем при продолжительных операциях, а оказание помощи при развитии осложне-
ний иногда затруднено по причине отсутствия достаточного технического осна-
щения (наркозно-дыхательной аппаратуры, электроотсоса, мониторинговой ап-
паратуры и др.), чем, как правило, пренебрегают в малых операционных.
Мононаркоз даже самым безопасным анестетиком в акушерской практике не
оправдан, так как для его проведения требуется достаточно высокая доза или кон-
центрация анестетика, что увеличивает вероятность проявлений его побочных или
нежелательных эффектов. На современном этапе отдают предпочтение методу
многокомпонентной анестезии, позволяющему не только уменьшить дозу всех
используемых препаратов, но и рационально их комбинировать и нивелировать
отрицательные эффекты.
Методы выбора анестезиологического обеспечения малых акушерских операций:
внутривенная комбинированная анестезия (сочетание внутривенного и ингаляци-
онного введения анестетиков) и масочный комбинированный наркоз (использова-
ние 2 ингаляционных анестетиков при сохраненном спонтанном дыхании).
Выбор анестезии при малых акушерских и гинекологических операциях, про-
должительность которых в среднем составляет 5—15 мин, имеет особенности, так
как дополнительное болевое раздражение после родов может стать причиной раз-
вития нарушений гемодинамики. Специфика анестезиологических пособий за-
ключается в том, что практически в 100 % случаев их проводят по неотложным
показаниям в условиях “полного желудка”, без какой-либо предварительной под-
415
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
готовки. Метод анестезии, препараты и способы введения выбирают индивиду-
ально в зависимости от наличия и тяжести сопутствующих экстрагенитальной и
акушерской патологий, аллергологического анамнеза, длительности, болезненно-
сти и травматичности операции, данных объективного и лабораторного обследо-
ваний. Кратковременный .наркоз, тем более в акушерстве, требует внимательного
отношения анестезиолога к его проведению. Поспешность, связанная со срочно-
стью малых операций, создает ситуацию, когда анестезиолог может не учесть все
вышеперечисленное факторы.
Требования к обезболиванию малых акушерских и гинекологических операций (Рас-
стригин Н.Н., 1978): широкая доступность метода и простота его исполнения,
безукоризненная эффективность общей анестезии с ретроградной амнезией, лег-
кая управляемость состоянием наркоза, кратковременность наркотического эф-
фекта, отсутствие у анестезирующего средства отрицательного влияния на жиз-
ненно важные функции и органы организма матери и плода (дыхание, кровообра-
щение, паренхиматозные органы), быстрое пробуждение — без явлений длительной
постнаркозной депрессии, отсутствие у анестезирующего средства отрицательно-
го влияния на сократительную функцию матки и свертывающую систему крови.
©Опасность наркоза всегда должна быть
меньше риска предполагаемой операции
Минимальной аллергенной активностью обладают препараты короткого и
ультракороткого действия (калипсол, пропофол, этомидат), тем не менее, из-за
своеобразного влияния, прежде всего, на гемодинамику, эти препараты не явля-
ются идеальными анестетиками в акушерской практике.
Кетамин обеспечивает высокую степень безопасности и управляемости анал-
гезии и анестезии, обладает сильным аналгетическим действием. Отрицательные
эффекты, присущие кетамину, например, устрашающие сновидения, устраняют и
предотвращают премедикацией (транквилизаторами и нейролептиками). После
внутривенного введения кетамина наркотический эффект наступает через 30 с и
длится 5—10 мин, после внутримышечного — через 3—5 мин и длится 12-15 мин.
Препарат стимулирует симпатоадреналовую систему, приводит к гипердинами-
ческому типу кровообращения (повышает АД на 20—30 % от исходного, вызывая
тахикардию), в связи с чем его использование нежелательно и даже опасно у бере-
менных с преэклампсией различной степени тяжести. Кетамин не оказывает от-
рицательного влияния на газообмен, снижает потребление кислорода мозгом при
массивной кровопотере, повышает тонус матки, что может стать причиной за-
труднений при извлечении плода, например, за тазовый конец. Препарат прони-
кает через плаценту; в дозе, превышающей 1,2 мг/кг, оказывает угнетающее вли-
яние на жизненные функции плода, увеличивает вероятность развития наркодеп-
рессии и асфиксии новорожденного.
Пропофол (диприван, рекофол) через 30—40 с после введения вызывает сон,
продолжительность которого при мононаркозе не превышает 3—5 мин. У пропо-
фола отсутствует кумулятивный эффект, поэтому возможно многократное повторное
введение без риска развития посленаркозной депрессии ЦНС. Пропофол вводят
путем постоянной инфузии или фракционно. После прекращения введения со-
знание восстанавливается полностью через 5—7 мин, при этом выход из наркоза
ускорен. Пропофоловой анестезией легко управлять и контролировать ее глубину.
416
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Препарат сочетают с наркотическими аналгетиками, нейролептиками, транк-
вилизаторами. Пропофол обладает миорелаксирующим эффектом, угнетает гор-
танно-глоточные рефлексы, практически не вызывает аллергических реакций,
способствует развитию тахипноэ, при быстром введении может вызвать апноэ,
требующее вспомогательной вентиляции легких. Обладая мощным вазодилатиру-
ющим эффектом, пропофол снижает показатели АД на 20—30 % от исходных,
особенно при быстром внутривенном введении и в сочетании с наркотическими
аналгетиками. Использование этого препарата у рожениц с гиповолемией и про-
должающимся кровотечением опасно (даже в сочетании с кетамином).
Этомидат — внутривенный гипнотик короткого действия — не обладает анал-
гетическим эффектом. При болюсном введении выключение сознания происходит
через 30—60 с, продолжительность сна — 4—7 мин. Сон поддерживают фракцион-
ным введением в половинной дозе. Пробуждение наступает через 8—10 мин после
прекращения введения препарата. После пробуждения при мононаркозе этомида-
том сознание восстанавливается полностью через 30—60 мин. При быстром введе-
нии наблюдают мышечные подергивания — миоклонии. Этомидат снижает показа-
тели АД на 15-20 % от исходных в результате снижения ОПСС и работы левого
желудочка без существенных изменений ЧСС. При введении значительных доз от-
мечают снижение УО и МОК в течение первых 10 мин после применения.
В результате использования этомидата при кратковременном и длительном
наркозе в крови уменьшается концентрация гормонов адренокортикальной систе-
мы, поэтому его не применяют у родильниц с осложненным течением родов, преж-
де всего — кровотечением. Этомидат, угнетая кору головного мозга, оказывает раз-
дражающее влияние на подкорковые образования, что проявляется развитием судо-
рог, поэтому его не применяют у беременных, рожениц и родильниц с преэклампсией.
До недавнего времени самыми распространенными анестетиками были бар-
битураты, внутривенное использование которых обеспечивает гипнотический
эффект до 20—30 мин. Выход из анестезии, особенно в комбинации с другими
анестезирующими средствами, иногда пролонгируется до 50—60 мин и требует
длительного наблюдения. Существенным недостатком барбитуратов является воз-
можность стойкого угнетения дыхания во время анестезии и после; не исключена
возможность развития стойкой артериальной гипотонии, обусловленной токси-
ческим влиянием на миокард, особенно на фоне гиповолемии.
Барбитураты быстро проникают через маточно-плацентарный барьер: через
2-3 мин после введения концентрация в крови матери и плода выравнивается, а
затем довольно быстро снижается. В дозе, не превышающей 4 мг/кг, барбитураты
существенно не влияют на сократительную деятельность матки, в более высоких
дозах — оказывают депрессивное действие. Применение барбитуратов оправдано
у пациенток с артериальной гипертензией, судорожным синдромом, тахикардией.
Натрия оксибутират по безопасности и сумме положительных эффектов со-
поставим с закисью азота, но по причине позднего начала и значительной про-
должительности действия его использование нецелесообразно в схеме обезболи-
вания малых акушерских и гинекологических операций. Так, гипнотический эф-
фект ГОМКа проявляется через 15—20 мин после введения и продолжается
40—60 мин и более. Во время анестезии и при пробуждении может развиться
артериальная гипертензия, что делает его непригодным у беременных с гестозом
различной степени тяжести.
Сибазон — атарактик, обладающий успокаивающим и противосудорожным
эффектами. Продолжительность действия у беременных несколько удлиняется в
14 7-585
417
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
связи с увеличением периода элиминации. В крови плода наивысшая концентра-
ция достигается через 5 мин после внутривенного введения; в крови новорож-
денного концентрация сибазона равна таковой в крови матери при введении в
дозе 10 мг и более, при этом у новорожденного нередко развиваются апноэ, арте-
риальная гипотензия, гипертермия, неврологические нарушения. Сибазон спосо-
бен ускорять раскрытие шейки матки.
Промедол — наркотический аналгетик, обладающий аналгетическим, седатив-
ным и спазмолитическим эффектами. Максимальный аналгетический эффект
проявляется через 10 мин после внутривенного введения. Препарат ускоряет рас-
крытие шейки матки, легко проникает через плаценту и в некоторых случаях мо-
жет вызвать угнетение дыхания у новорожденного. Промедол не оказывает суще-
ственного влияния на сердечно-сосудистую систему матери, поэтому является
препаратом выбора при анестезии у беременных и рожениц с тяжелой кардиаль-
ной патологией.
Фентанил — мощный аналгетик, превосходящий морфин в 200—400 раз, обла-
дает кратковременным действием, проникает через плацентарный барьер, может
вызвать наркодепрессию у плода.
В акушерской практике большое распространение получила закись азота из-
за малой токсичности, легкой управляемости, минимального влияния на мать и
плод. В связи с преобладанием тормозных процессов у беременных и рожениц,
чрезмерно чувствительных к воздействию анестетиков, мононаркоз закисью азота
позволяет добиться достаточной глубины анестезии. При подаче закиси азота бо-
лее 50 % по объему обеспечивают выключение сознания и адекватную анестезию
при сочетании с умеренными дозами других анестетиков. Насыщение тканей анес-
тетиком достигает максимума через 5—10 мин после начала ингаляции; через
5—6 мин после прекращения подачи препарат полностью выводится из крови.
Фторотан имеет ограниченное применение в акушерстве в связи с возможно-
стью угнетения сократительной способности матки, наркотической депрессией и
асфиксией новорожденного, но он незаменим в экстренных ситуациях — преэк-
лампсии, эклампсии, гипертензии в родах и др. Чаще препарат применяют (в
концентрации 0,5—0,7 об.%) в качестве составляющего элемента в многокомпо-
нентной анестезии. Через 5 мин после прекращения ингаляции тоническая актив-
ность миометрия полностью восстанавливается.
19.1.6.1. Ручное обследование полости матки
Ручное обследование полости матки проводят с целью контроля
целостности ее стенок, удаления сгустков крови, ручного отделения и выделения
последа, наружно-внутреннего массажа полости матки при гипотоническом кро-
вотечении.
При выборе анестезии, кроме общих вышеперечисленных факторов, учиты-
вают наличие и степень кровопотери, гемодинамические изменения, состояние
тонуса матки и ее сократимость, наличие заболеваний крови и коагулопатических
нарушений.
Методом анестезии является комбинированный внутривенный или ингаляци-
онный наркоз. Оба варианта анестезии предполагают сохранение самостоятельно-
го дыхания. Местную анестезию не используют.
Препараты выбора: калипсол, пропофол, этомидат, закись азота с кислоро-
дом в комбинации с наркотическими аналгетиками (например, фентанилом) и
418
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
препаратами диазепинового ряда (седуксеном, сибазоном), а также сочетание ке-
тамина, этомидата с ингаляцией закиси азота и кислорода.
При стабильных показателях гемодинамики премедикацию ограничивают вве-
дением метацина (0,1 мг/кг) и сибазона (5—10 мг). При нестабильных показателях
гемодинамики, связанных с уменьшением ОЦК в результате кровопотери, из пре-
медикации исключают сибазон или уменьшают его дозу до 2,5—5 мг, добавляют
кортикостероиды 30—90 мг (по преднизолону). При дефиците ОЦК, не превыша-
ющем 10—15 % и не сопровождающимся изменением систолического АД, в каче-
стве основного анестетика используют пропофол (1,5—2 мг/кг, не более 2,4 мг/кг)
либо этомидат (0,15—0,2 мг/кг). При необходимости продления анестезии после-
дующую дозу этомидата уменьшают на 1/2, пропофола — на 1/3.
Аналгетический эффект обеспечивают внутривенным введением наркотичес-
ких аналгетиков — фентанила (0,05—0,1 мг), промедола (10—20 мг) или кетамина
(0,5 мг/кг) и ингаляцией закиси азота с кислородом (2:1). Вариантом анестезии
является масочный наркоз закисью азота с кислородом (2:1) со спонтанным дыха-
нием после внутривенной премедикации сибазоном (5—10 мг).
При геморрагическом шоке I—II степени анестезию обеспечивают кетамином
(0,5-0,7—1,0 мг/кг, внутривенно фракционно) на фоне ингаляции закиси азота с
кислородом (не более 2:1), III степени и выше — ограничиваются использованием
ингаляции закиси азота с кислородом (1:1 или 2:1). При относительной стойкой
компенсации кровообращения анестезию углубляют дробным введением малых
доз наркотических аналгетиков — фентанила (0,05 мг) или промедола (10 мг).
Угнетение дыхания компенсируют вспомогательной вентиляцией (ручной или че-
рез маску). Обязательно выполняют прием Селика. Если дыхание не восстанавли-
вается в течение 5—10 мин, то проводят срочную интубацию трахеи и последую-
щую ИВЛ.
При ревизии полости матки у рожениц с преэклампсией из схемы анестезии
исключают этомидат и кетамин.
19.1.6.2. Операция извлечения плода за газовый конец
Оптимальное обезболивание при извлечении плода за тазовый
конец обеспечивает более бережное родоразрешение — снижает опасность трав-
матического повреждение мягких тканей родовых путей.
Проводят пудендальную или общую анестезию. Возможна комбинация
этих видов обезболивания, при этом используют ингаляционную анестезию
(N2O:O,= 2:1).
При проведении общей анестезии премедикацию расширяют внутривенным
введением спазмолитиков, например но-шпы (2 мл 2 % раствора) в сочетании с
метацином или атропина сульфатом (1 мл 0,1 % раствора). Оправдано внутривен-
ное применение комбинированных аналгетиков, например баралгина (5 мл), спаз-
молгона (5 мл) и др. Для проведения общей анестезии используют кетамин (0,5—
0,7-1,0 мг/кг), этомид (0,15—0,3 мг/кг), пропофол (до 2 мг/кг). Как правило, эти
анестетики применяют в сочетании с сибазоном (5—10 мг). Возможны варианты
комбинированной внутривенной анестезии: кетамин (0,5 мг/кг) в сочетании с
пропофолом (1,5—2,0 мг/кг) или кетамин (0,8—1,0 мг/кг) в сочетании с ингаляци-
ей закиси азота с кислородом (2:1).
419
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.1.6.3. Вакуум-экстракция плода
Выполнение вакуум-экстракции плода требует активного участия
роженицы в момент извлечения плода, поэтому выключение сознания не допус-
тимо. Выраженный болевой синдром затрудняет участие роженицы в изгнании
плода, могут развиться рефлекторный спазм мышц тазового дна и судорожное
сокращение маточного зева. Адекватная аналгезия позволят выполнить операцию
с минимальной травмой родовых путей роженицы.
Проводят пудендальную или ингаляционную (N2O:O, = 3:1 или 2:1) анесте-
зию. Ингаляционную смесь подают в промежутках между тракциями. Общую ане-
стезию закисью азота проводят после внутривенной премедикации метацином или
атропина сульфатом (0,5—1 мл). Целесообразно расширение премедикации путем
внутривенного введения спазмолитиков, например но-шпы (2 мл 2 % раствора).
Для усиления аналгезии внутривенно вводят анальгин (2—4 мл 50 % раствора) или
баралгин (5 мл).
19.1.6.4. Операция наложения акушерских щипцов
Для успешного выполнения операции наложения акушерских
щипцов необходимо адекватно обезболить роженицу и добиться релаксации мышц
тазового дна (релаксация миометрия может вызвать гипотензию или атонию мат-
ки и последующее кровотечение). При слабости родовой деятельности и/или внут-
риутробной гипоксии плода особенностью данной операции является активное
участие роженицы, что допускают только у соматически здоровых женщин и при
отсутствии патологии беременности.
Используют проводниковую (перидуральную или пудендальную) анестезию,
общую анестезию закисью азота с кислородом (3:1 или 2:1) в стадии аналгезии. В
качестве местного анестетика для перидуральной анестезии используют анекаин
(0,5 % раствор, суммарная доза — 10—15 мл).
Роженицам, которым акушерские щипцы накладывают с целью выключения
II периода родов (с тяжелыми заболеваниями сердца, компенсированными врож-
денными и приобретенными пороками сердца, аритмиями, ГБ, преэклампсией
легкой степени, миопией и др.), операцию выполняют под общим обезболивани-
ем. У рожениц с пороками сердца и аритмиями в качестве альтернативного метода
используют кетаминовую (1—1,2 мг/кг) или сибазоновую (5—10 мг) анестезию после
внутривенной премедикации метацином (0,5 мл). В ряде случаев усиливают анал-
гетический компонент кетамина промедолом (10—20 мг) или фентанилом (0,05 мг).
У рожениц с патологией легких фентанил для усиления аналгезии не используют.
При сопутствующей патологии сердца в качестве варианта анестезии применяют
сибазон (5—10 мг), ингаляционную анестезию (N2O:O2= 2:1), причем аналгетичес-
кий эффект усиливают внутримышечным введением промедола (10—20 мг за 40-
60 мин перед началом анестезии) или внутривенным введением ненаркотических
аналгетиков (2,0 мл 50 % раствора анальгина непосредственно перед началом ане-
стезии). У рожениц с высокой миопией наиболее оправдана анестезия этомида-
том (0,3 мг/кг) в сочетании с сибазоном (5—10 мг) и фентанилом (0,05-0,1 мг).
Если причиной выключения II периода родов является преэклампсия, то исполь-
зуют комбинированную анестезию: внутривенное введение сибазона (5-10 мг) и
ингаляцию закиси азота с кислородом через маску (2:1). При высоких показателях
420
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
АД вышеописанный вариант анестезии дополняют ингаляцией фторотана (не бо-
лее 10 мин и 0,7—0,9 об.%). Внутривенное введение сибазона и ингаляцию через
маску закисно-фторотаново-кислородной смеси применяют также у рожениц с
высокой миопией и ГБ. Роженицам, страдающим ГБ, проводят внутривенный
комбинированный наркоз пропофолом (2—2,4.мг/кг) или этомидатом (0,15—
0,3 мг/кг) б сочетании с сибазоном (5—10 мг) и фентанилом (0,05—0,1 мг), либо
внутривенную анестезию пропофолом (2,4—2,5 мг/кг) или этомидатом (0,3 мг/кг)
в комбинации с ингаляцией закиси азота с кислородом (2:1).
19.1.6.5. Эпизио- и перинеотомия, восстановление
целостности промежности, влагалища и шейки матки
Эпизио- или перинеотомию выполняют под местной инфильтра-
ционной или пудендальной анестезией. У рожениц с преэклампсией любой степе-
ни, сопутствующей патолргией сердечно-сосудистой системы (пороками сердца,
ГБ без признаков недостаточности кровообращения) используют варианты общей
анестезии: 1) пропофол (2—2,4 мг/кг) в сочетании с промедолом (10—20 мг) или
фентанилом (0,05 мг), или пропофол в вышеуказанной дозе в сочетании с ингаля-
цией закиси азота с кислородом (2:1), промедолом (10 мг) или ненаркотическими
аналгетиками (2—4 мл 50 % раствора анальгина); 2) сибазон (0,15—0,2 мг/кг) в
сочетании с ингаляцией закиси азота с кислородом (2:1) и фентанил (0,05 мг) или
промедол (10 мг) для усиления аналгетического эффекта; 3) масочный наркоз
закисью азота с кислородом (2:1) с кратковременной подачей субнаркотических
доз фторотана (0,7—1 об.%); 4) калипсол (0,5—0,7—1 мг/кг) в сочетании с сибазо-
ном (5-10 мг), или пропофолом (2—2,4 мг/кг), или этомидатом (0,2—0,3 мг/кг).
Обезболивание при восстановлении целостности промежности, шейки матки
и стенок влагалища обычно не представляет трудностей, если повреждение тканей
не сопровождается кровотечением. При кровотечении в премедикацию включают
глюкокортикоиды и используют общую многокомпонентную анестезию: калип-
сол (0,7—1 мг/кг) в сочетании с сибазоном (5 мг) или ингаляцией закиси азота с
кислородом (2:1) и малыми дозами наркотических аналгетиков — промедола (10 мг),
фентанила (0,05 мг). При продолжающемся кровотечении фторотан, пропофол и
этомидат не используют.
19.1.6.6. Плодоразрушающие операции
Плодоразрушающие операции проводят при невозможности ро-
доразрешения каким-либо другим способом; им всегда предшествует длительная
безуспешная родовая деятельность. Роженица к моменту принятия решения о не-
обходимости выполнения этой операции истощена физически и морально, испы-
тывает страх не только перед предстоящей операцией, но и перед будущим. Эмо-
циональное перенапряжение может стать причиной неадекватного поведения и
нарушений гемодинамики, поэтому в премедикацию включают седативные пре-
параты, например сибазон (10 мг).
Нередко к моменту выполнения плодоразрушающей операции значительно
снижается моторная функция матки, на фоне чего применение родостимулирую-
щих средств или акушерских пособий еще больше ослабляет ее сократительную
функцию и является наиболее частой причиной развития гипотонии матки.
421
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Длительный безводный период, повторяющиеся акушерские пособия, в некото-
рых случаях погибший плод являются причинами инфицирования матки. При оказа-
нии помощи этой группе рожениц необходимо помнить о риске развития во время и
после операции инфекционных осложнений, вплоть до инфекционно-токсического
шока. Профилактическую антибактериальную терапию проводят в до-, интра- и пос-
леоперационном периодах. Применяют цефалоспорины 3-го поколения.
Задачей анестезиолога является не только адекватная анестезиологическая
защита роженицы во время плодоразрушающей операции, но и создание опти-
мальных условий для работы акушеров за счет релаксации матки и мышц тазового
дна, а также достаточного открытия канала шейки матки.
Оптимальным вариантом при плодоразрушающих операциях считают общую
многокомпонентную анестезию с использованием мышечных релаксантов, прове-
дением интубации трахеи и ИВЛ. Допустимой глубиной анестезии является III,
стадия по Гведелу. Непосредственно перед началом общего обезболивания опери-
рующий хирург выполняет пудендальную анестезию для прерывания мощной бо-
левой импульсации, исходящей из влагалища и шейки матки.
В схему премедикации, кроме сибазона, включают промедол (10—20 мг), атропи-
на сульфат (0,5—1 мг), антигистаминные препараты, например, димедрол (10—20 мг).
Для вводного наркоза применяют барбитураты (0,5—1 %) или кетамин (1,5—2 мг/кг).
В качестве основного наркоза используют вариант атаралгезии (сибазон 0,15—0,2 мг/
кг, фентанил 0,05—0,2 мг дробно) с ингаляцией закиси азота с кислородом (2:1) или
капельное введение калипсола (1,5 мг/кг/ч). Миоплегию поддерживают недеполяри-
зующими мышечными релаксантами, например ардуаном (0,04—0,06 мг/кг).
Возможны альтернативные варианты аналгезии: кетамин (1,5 мг/кг) или ма-
сочный наркоз (N2O:O, = 2:1 или 3:1 со следами фторотана 0,2—0,3 об.%, но не
более 0,5 об.%) с сохраненным спонтанным дыханием при перфорации головы
плода и эксцеребрации. Предлагаемым вариантам анестезии должна предшество-
вать премедикация: атропина сульфат (до 1 мг), сибазон (до 10 мг), промедол (до
20 мг), антигистаминные средства, например димедрол (10 мг).
Также используют регионарные виды анестезии, но их обязательно сочетают
с достаточной степенью седации.
Местная анестезия при обезболивании плодоразрушающих операций не до-
пустима.
19.1.6.7. Операции искусственного прерывания беременности
Выбор варианта анестезии при операциях искусственного преры-
вания беременности зависит от ряда факторов: срока беременности, наличия родов
в анамнезе, осложнений в течение беременности (например, неукротимой рвоты и
др.), сопутствующей экстрагенитальной патологии. Риск развития кровотечения, в
том числе коагулопатического, повышен при сроке беременности более 12 недель
по причине увеличения продолжительности операции и ее травматичности.
Как правило, эти операции выполняют в плановом порядке при неукосни-
тельном соблюдении принципа “пустого желудка”. Перерыв между приемом пищи
и выполнением операции должен быть не менее 4—6 ч. Риск развития регургита-
ции возрастает у женщин с осложненным течением беременности (рвотой) и при
прерывании беременности в сроке более 10—12 недель. Необходима готовность к
проведению мероприятий по предупреждению аспирации рвотных масс.
Обеспечивают надежный венозный доступ (для срочной заместительной тера-
пии при развитии кровотечения), достаточный запас инфузионных сред, в том
422
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
числе искусственных коллоидов, и препаратов для профилактики и интенсивной
терапии коагулопатии. Обычно после окончания операции используют средства,
стимулирующие сокращение матки, — окситоцин или эргометрин. Введение ок-
ситоцина может стать причиной короткого эпизода гипотензии, а эргометрина —
артериальной гипертензии, причем значительной, поэтому эргометрин противо-
показан беременным с сопутствующими заболеваниями сердечно-сосудистой си-
стемы (ГБ, врожденными и приобретенными пороками сердца). У беременных без
сопутствующей экстрагенитальной патологии эргометрин применяют только по
абсолютным показаниям, так как он оказывает рвотное действие, особенно при
поверхностной анестезии.
Как правило, расширение канала шейки матки у женщин с первой беремен-
ностью затруднено, поэтому в премедикацию включают спазмолитики: но-шпу
(2 мл), папаверина гидрохлорид (2 мл), баралгин (5 мл).
Глубина анестезии на этапах захвата передней губы пулевыми щипцами и
расширения канала шейки матки должна быть достаточной, так как это наиболее
болезненные моменты операции. При недостаточной аналгезии могут появиться
рефлекторные двигательные реакции и/или ларингоспазм. Болюсно вводят анал-
гетики, например, фентанил (0,05—0,1 мг), либо включают в премедикацию про-
медол (10—20 мг) или фентанил (0,05—0,1 мг).
В качестве варианта анестезии при искусственном прерывании беременности в
настоящее время наибольшее распространение получил комбинированный внутри-
венный наркоз на основе препаратов ультракороткого (пропофол в дозе 2,4—2,5 мг/
кг, этомидат — 0,3 мг/кг) или короткого (кетамин — 1—1,5 мг/кг) действия в сочета-
нии с препаратами деазепинового ряда (сибазоном — 2,5—10 мг) или нейролептика-
ми (дроперидолом — 2,5—5 мг) и наркотическими (фентанилом — 0,05—0,1 мг, про-
медолом — 10—20 мг) или ненаркотическими аналгетиками (баралгин — 5,0 мл).
Премедикацию ограничивают введением атропина сульфата (0,5—1 мл). У беремен-
ных с отягощенным аллергоанамнезом в премедикацию включают антигистаминные
препараты (1 % димедрол — 1—2 мл) и глюкокортикоиды (преднизолон — 30—60 мг).
Мы предлагаем следующую схему проведения анестезии: премедикацию осу-
ществляют на операционном столе непосредственно перед началом анестезии (внут-
ривенно вводят атропина сульфат, диазепам, аналгетик, затем — один из вышепри-
веденных гипнотиков); при необходимости анестезию продлевают пропофолом (по
10 мг каждые 10—15 с), этомидатом (0,15 мг/кг) или кетамином (0,5—0,7 мг/кг).
Возможен вариант одновременного внутривенного введения средств для премеди-
кации и основного наркоза в одном шприце, кроме использования пропофола.
Используют комбинированную анестезию на основе сочетания внутривенных
и ингаляционных анестетиков. После внутривенной премедикации метацином и
сибазоном (до 5 мг, при чрезмерном возбуждении пациентки) в качестве основно-
го ингаляционного анестетика используют закись азота в сочетании с кислородом
(2:1 или 1:1). Через 3—5 мин внутривенно водят кетамин, пропофол, этомидат (в
вышеуказанных дозах). Преимуществом этого вида анестезия является его доста-
точная глубина, стабильность, минимальная токсичность, возможность отказа от
наркотических аналгетиков.
Ранее при искусственном прерывании беременности был широко распрост-
ранен мононаркоз закисью азота с кислородом: после стандартной внутривенной
премедикации атропина сульфатом (0,5—1 мл) начинали ингаляцию закиси азота
с кислородом (2:1). Через 7—10 мин после начала ингаляции выполняли опера-
цию. На современном этапе этот метод используют крайне редко.
423
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.1.6.8. Диагностическое выскабливание полости матки
Наиболее травматичным моментом диагностического выскаблива-
ния полости матки является захват пулевыми щипцами передней губы шейки мат-
ки. Канал шейки матки при выполнении этой операции, как правило, не расширя-
ют. Удаление слизистой оболочки со стенок матки менее болезненно, чем разруше-
ние и удаление плодного яйца, но всегда сопровождается неприятными ощущениями.
Выбор варианта анестезии зависит от вида и тяжести экстрагенитальной пато-
логии. В премедикации часто применяют только атропина сульфат (0,5 мл). Воз-
бужденным пациенткам, а также больным с сопутствующей патологией сердца (ГБ,
ИБС, аритмиями) в премедикацию обязательно включают сибазон (5—10 мг). Нарко-
тические аналгетики при этой операции используют редко, в основном применяют
неингаляционные анестетики в качестве мононаркоза — кетамин (0,5—0,7 мг/кг),
пропофол (до 2—2,4 мг/кг), этомидат (0,3 мг/кг). Возможно применение ингаля-
ции закиси азота с кислородом в сочетании с сибазоном, кетамином или другими
неингаляционными анестетиками, причем дозы препаратов можно уменьшить на
1/3—1/2 от вышеприведенных. Барбитураты (0,5—2 %) используют редко по при-
чине значительной продолжительности действия, длительной фазы пробуждения,
плохой управляемости.
19.1.7. Особенности анестезиологического обеспечения
общехирургических операций
в различные триместры беременности
Общехирургические операции у беременных выполняют только по
абсолютным или жизненным показаниям. Во всех остальных случаях проведение опе-
раций отсрочивают после родоразрешения. Выбор метода анестезии зависит, в первую
очередь, от особенностей формирования плода в различные сроки беременности.
В I триместре увеличен риск преждевременного прерывания беременности,
причиной чему является не только действие препаратов, но и операционный стресс,
сопровождающийся гиперкатехоламинемией и психоэмоциональной реакцией.
Объем операции, место вмешательства, характер основного заболевания также
влияют на частоту самопроизвольного прерывания беременности. В I триместре
происходит органогенез, поэтому чувствительность плода к тератогенному дей-
ствию лекарственных препаратов максимальная. Не используют калипсол, сомб-
ревин, диазепам. Дозы анестезиологических препаратов зависят от характера вме-
шательства, индивидуальных особенностей пациенток и не отличаются от обще-
принятых норм. Отдают предпочтение регионарной или местной анестезии, а также
вариантам анестезии на основе электроаналгезии.
Во II триместре беременности уменьшается риск тератогенного действия ане-
стезии по сравнению с ранними сроками беременности; также не столь высока
возбудимость матки, что уменьшает риск самопроизвольных абортов. Именно в
эти сроки целесообразно проводить плановые хирургические вмешательства, если
нет возможности отсрочить их до конца беременности. Используют разнообраз-
ные препараты и методы, кроме повышающих тонус матки.
В III триместре оптимальным является анестезиологическое пособие, кото-
рое удовлетворяет всем принципам акушерской анестезиологии.
424
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ЛИТЕРАТУРА
1. Анестезиология и реаниматология: Учебное пособие/ Под ред. О.А. Долиной. —
М.: Медицина, 1998. — С. 342—371.
2. Зильбер А.П., Шифман Е.М. Акушерство глазами анестезиолога. “Этюды крити-
ческой медицины”, Т. 3. — Петрозаводск.: Изд—во ПГУ, 1997. — 397 с.
3. Клиническая фармакология при беременности/ Под ред. Х.П. Кьюмерле, К. Брен-
дела: Пер. с англ., в 2 т. — М.: Медицина, 1987. — Т. 1 — 328 с., Т. 2 — 349 с.
4. Кулаков В.И., Серов В.Н., Абубакирова А.М., Федорова ТА. Баранов И.И. Обезбо-
ливание родов. — М.: Триада-Х, 1998. — 152 с.
5. Ланцев Е.А., Абрамченко В.В., Бабаев В.А. Эпидуральная анестезия и аналгезия в
акушерстве. — Свердловск: Изд-во УрГУ, 1990. — 240 с.
6. Митькин В.В., Сухих Г.Т. Эндогенные опиоиды при беременности и родах//
Акуш. и гинекол. — 1993. —№ 6. — С. 6—10.
7. Мойр Д.Д. Обезболивание родов: Пер. с англ. — М.: Медицина, 1985. — 184 с.
8. Неотложные состояния в акушерстве и гинекологии. Под ред. Г.К. Степанков-
ской, Б.М. Венцковского. — К.: Здоровье, 2000. — 672 с.
9. Расстригин Н.Н. Анестезия и реанимация в акушерстве и гинекологии. — М.:
Медицина. — 1978. — 336 с.
10. Руководство по акушерской аналгезии и анестезии/ Под ред. Г.Х. Морланда,
Г.Ф. Маркс: Пер. с англ. — М.: Медицина, 1998. — 208 с.
11. Руководство по анестезиологии/ Под ред. А.А. Бунятяна. — М.: Медицина,
1994. - 656 с.
12. Руководство по анестезиологии/ Под ред. А.Р. Эйткенхеда, Г. Смита: в 2 т.:
Пер. с англ., Т. 2. — М.: Медицина, 1999. — 552. с.
13. Ткаченко РА. Анестезиологическое обеспечение в родах/ZDoctor, 2003. — № 6. —
С. 58-62.
14. Черний В.И., Кабанько Т.П., Смирнова Н.Н., Костенко В.С. Анестезия и интен-
сивная терапия в акушерстве и гинекологии. — К.: Здоров’я, 2.001. — 456 с.
15. Desborough J.P., Hall G.M. Endocrine response to surgery// Kaufman L. Anaesthesia
Review. — Edinburgh: Churchill Livingstone, 1993. — Vol. 10. — P. 131—148.
16. Dissociation of plasma and cerebrospinal fluid beta—endorphin—like immunoactivity
levels during pregnancy and parturition / R.A. Steinbrook, D.B. Carr S. Datta et al.// Anesth.
Analg. - 1982. - № 61. - P. 893-897.
17. Effect of intrathecal morphine during labor on maternal plasma beta—endorphin levels/
T.K. Abboud, U. Goebelsmann, J. Raya et al.//Am. J. Obstet. Gynecol. — 1984. — № 149. —
P. 709-710.
18. Norepinephrine, adrenocorticotropin, cortisol and beta—endorphin in women suffering
from fear of labor: responses to the cold pressor test during and after pregnancy/ T. Saisto, R.
Kaaja, S. Helske et al.//Acta Obstet. Gynecol. Scand., 2004, Jan, Vol. 83, № 1. — P. 19—26.
19. Opioid plasma levels during labour / F. Facchinetti, G. Centini, D. Parrini et al.//
Gynecol. Obstet. Invest. — 1982. — № 13. — P. 155—163.
20. Pain and plasma beta—endorphin level during labor /I. Raisanen, H. Paatero, K.
Salminen, T. Laatikainen// Obstet. Gynecol. — 1984. — № 64. — P. 783—786.
21. Riss P.A., Bieglmayer C. Obstetric analgesia and immunoreactive endorphin peptides
in maternal plasma during labor// Gynecol. Obstet Invest. — 1984. — № 17. — P. 127—130.
22. Rout C.C. Anaesthesia and analgesia for the critically ill parturient// Best Prac. Res.
Clin. Obstet. Gynaecol. — 2001. — № 15. — P. 507—52.2.
23. Third Trimester POMC Disregulation Predicts Use of Anesthesia at Vaginal Delivery /
C.A. Sandman, P.D. Wadhwa, A. Chicz—DeMet et al.// Peptides. — 1995. — Vol. 16, № 2. —
P. 187-190.
425
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.2. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ОПЕРАЦИИ КЕСАРЕВА СЕЧЕНИЯ
После внедрения в клиническую практику антибиотиков и по-
явления банков донорской крови частота выполнения кесарева сечения (лат. —
sectio caesarea) в мире в среднем составляла 4—6 %, но в настоящее время в
Европе этот показатель достиг 16,6 % от общего количества родов, США — 22,3
% (в 2004 г. показатель превысил 27 %), Украине — 14,3 %. В увеличении часто-
ты кесарева сечения немаловажную роль играет появление так называемых “но-
вых” показаний: гипоксии плода, преждевременных родов с малой массой пло-
да, родоразрешение беременности после экстракорпорального оплодотворения,
др. Параллельно с ростом количества операций кесарева сечения увеличиваются
показатели материнской заболеваемости и смертности. Так, по данным многих
авторов [4, 6, 7], риск материнской смертности в разных странах при самостоя-
тельных родах составляет 1:10 000, при кесаревом сечении — 1:25 000. К сожа-
лению, в настоящее время не существует идеального анестетика, удовлетворяю-
щего всем принципам акушерской анестезиологии, а перспектива появления
такового в ближайшем будущем — маловероятна. Таким образом, анестезиоло-
гическое обеспечение операции кесарева сечения по-прежнему остается акту-
альной задачей анестезиологии.
Исход операции кесарева сечения для роженицы и плода во многом зависит
от функционального состояния различных систем роженицы в сочетании со ско-
ростью хирургического гемостаза, выбора анестезиологического пособия, величи-
ны кровопотери и степени ее возмещения. Анестезиологическое пособие при ке-
саревом сечении должно быть тщательно продумано и обосновано, удовлетворять
всем принципам акушерской анестезиологии.
Принципы анестезиологического обеспечения при оперативных родах входят в
состав основных принципов анестезии в акушерстве (см. раздел 20.1): степень
риска анестезии не должна превышать степени риска оперативного вмешатель-
ства; анестезия должна обеспечивать адекватную защиту организма матери и пло-
да во время оперативного вмешательства; анестезия не должна: оказывать выра-
женное влияние на тонус матки, приводить к существенным расстройствам в си-
стеме гемостаза, оказывать депрессивное влияние на плод, (не провоцировать
развитие наркозной депрессии у новорожденного).
19.2.1. Показания и противопоказания
к операции кесарева сечения
Показания к операции кесарева сечения прошли сложный “эво-
люционный путь”: длительное время использовали только абсолютные показания
к проведению этой операции, затем появилась группа относительных показаний.
Авторы работы [4] считают целесообразным заменить термины “абсолютные” и
“относительные” показания на “показания к кесареву сечению во время беремен-
ности и в родах”.
Показания к операции кесарева сечения во время беременности: полное предле-
жание плаценты, неполное предлежание плаценты с выраженным кровотечени-
ем, преждевременная отслойка нормально расположенной плаценты с выражен-
426
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ным кровотечением или наличием внутриутробного страдания плода, несостоя-
тельность рубца на матке после кесарева сечения или других операций на матке,
два рубца на матке и более после кесаревых сечений, анатомически узкий таз
2-3 степени сужения (истинная конъюгата 9 см и менее), опухоли или деформа-
ции костей таза, состояние после операции на тазобедренных суставах и тазе,
пороки развития матки и влагалища, опухоль шейки матки, яичников и других
органов полости малого таза, которые блокируют родовые пути, множественная
миома матки больших размеров, дегенерация миоматозных узлов, низкое (шееч-
ное) расположение узла, тяжелые формы преэклампсии при отсутствии эффекта
от терапии и неподготовленных родовых путях, тяжелые экстрагенитальные за-
болевания (заболевания сердечно-сосудистой системы с явлениями декомпенса-
ции, заболевания нервной системы, миопия высокой степени, особенно ослож-
ненная и др.), рубцовые сужения шейки матки и влагалища (после пластических
операций на этих органах и ушивания мочеполовых и кишечно-половых сви-
щей), рубец на промежности после зашивания разрыва III степени в предше-
ствующих родах, выраженное варикозное расширение вен в области влагалища и
вульвы, поперечное положение плода, сросшаяся двойня, тазовое предлежание
плода в сочетании с разогнутой головой при массе плода более 3600 г и менее
1500 г с анатомическими изменениями таза, тазовое предлежание или попереч-
ное положение 1-го плода при многоплодной беременности, три и более плода
при многоплодии, экстракорпоральное оплодотворение и перенос эмбриона,
искусственная инсеминация при осложненном акушерско-гинекологическом
анамнезе, хроническая гипоксия плода, гипотрофия плода, неподдающиеся ме-
дикаментозной терапии, возраст первородящей старше 30 лет в сочетании с аку-
шерской и экстрагенитальной патологией, длительное бесплодие в анамнезе в
сочетании с другими отягощающими факторами, гемолитическая болезнь плода
при неподготовленности родовых путей, переношенная беременность в сочета-
нии с отягощенным гинекологическим или акушерским анамнезом, неподготов-
ленностью родовых путей и отсутствием эффекта от родовозбуждения, экстраге-
нитальный рак и рак шейки матки, обострение герпесвирусной инфекции поло-
вых путей.
Показания к операции кесарева сечения в родах: клинически узкий таз, преж-
девременное излитие околоплодных вод и отсутствие эффекта от родовозбужде-
ния, аномалии родовой деятельности, неподдающиеся медикаментозной терапии,
острая гипоксия плода, отслойка нормально или низко расположенной плаценты,
угрожающий или начинающийся разрыв матки, предлежание и выпадение петель
пуповины при неподготовленных родовых путях, неправильное вставление и пред-
лежание головки (лобное, передний вид лицевого, задний вид высокого прямого
стояния стреловидного шва), состояние агонии или внезапная смерть роженицы
при живом плоде.
Противопоказания к операции кесарева сечения', неблагоприятное состояние плода
(глубокая недоношенность, уродство и др.), наличие потенциальной или клини-
чески выраженной инфекции. Противопоказания имеют значение только в слу-
чае, когда операцию проводят в интересах плода; при наличии витальных показа-
ний со стороны матери их не принимают во внимание.
Решение о необходимости абдоминального родоразрешения принимает аку-
шер-гинеколог и согласовывает его с анестезиологом и неонатологом.
427
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.2.2. Предоперационный период
Оценка операционного риска
Перед выбором метода анестезиологического пособия анестезио-
лог проводит оценку операционного риска в зависимости от физического состоя-
ния пациентки и тяжести оперативного вмешательства.
Помимо выяснения общего состояния женщины, оценивают риск разви-
тия: гипотензивного синдрома вследствие аортокавальной компрессии, желу-
дочно-пищеводного рефлюкса, возможных трудностей при проведении инту-
бации трахеи (частота трудных интубаций в акушерской практике составляет
1:300, в общехирургической — 1:2500). Результаты прогностических тестов труд-
ной интубации (см. раздел 8.3.4) позволяют принять решение о выборе метода
анестезии. Риск неудач при интубации трахеи прямо пропорционален классу
шкалы трудной интубации по Малампатти: у рожениц I класса он составляет
0,42 %, IV класса — 23,1 % (Farcon E.L., Marx G., 1994). При высоком риске
трудной интубации или невозможности проведения регионарной анестезии
проводят интубацию трахеи в сознании с помощью ФБС или используют ла-
рингеальную маску.
Предоперационная подготовка
Профилактика и терапия осложнений беременности и родов. У беременных с
преэклампсией объем инфузионной терапии ограничен: чем больше степень тя-
жести преэклампсии, тем меньше объем инфузий. У беременных с тяжелой пре-
эклампсией объем инфузий не должен превышать 1200 мл/сут.
Объем и состав интраоперационной инфузионно-трансфузионной терапии
зависят от объема кровопотери во время кесарева сечения. В настоящее время
широкое распространение получил метод искусственной гемодилюции. Кровопо-
терю в объеме 800—850 мл при абдоминальном родоразрешении считают “физио-
логической” и не требующей проведения гемотрансфузий.
Профилактика и терапия внутриутробной гипоксии плода. Анестезиолог может
и должен воздействовать на состояние плода, находящегося в неблагоприятных
условиях внутриутробного развития. Нормализация психоэмоционального состо-
яния матери, стабилизация гемодинамических показателей на оптимальных уров-
нях и преоксигенация способствуют улучшению внутриутробного состояния пло-
да. Профилактика и терапия внутриутробной гипоксии плода повышают его толе-
рантность к неблагоприятным эффектам анестезиологических препаратов при
акушерской и экстрагенитальной патологиях матери.
Одним из самых простых и доступных методов профилактики и терапии внут-
риутробной гипоксии плода является предоперационная ингаляция кислорода,
которую начинают сразу после укладывания роженицы на операционный стол.
Следует отметить, что ингаляция кислорода должна быть непрерывной, так как
прекращение подачи кислорода вызывает снижение его содержания в крови ниже
нормы (проба Штемберга).
С целью повышения энергетических ресурсов организма матери и плода мож-
но ввести внутривенно 15—20 мл 20—40 % раствора глюкозы, 500—1000 мг аскор-
биновой кислоты, 100—150 мг кокарбоксилазы.
Особо актуальна медикаментозная подготовка при операции кесарева сече-
ния у рожениц с недоношенной беременностью, так как опасность операции и
428
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
наркоза оказывает значительное влияние на адаптацию недоношенного ребенка к
условиям внеутробного существования.
Премедикация
При кесаревом сечении некоторые авторы [2, 3, 5J рекомендуют применять
сложные многокомпонентные медикаментозные схемы, заимствованные из об-
щей анестезиологии. Практика показывает, что использование “тяжелой” пре-
медикации приводит к серьезным нарушениям “стартовой” адаптации новорож-
денных.
Задачи премедикации при кесаревом сечении: достижение психического покоя и
устранения страха у рожениц, предупреждение побочных влияний наркотических
и анестезирующих средств, защита от неблагоприятных нейровегетативных реак-
ций, профилактика и терапия осложнений беременности, родов, внутриутробной
гипоксии плода (преэклампсии, эклампсии, кровотечения, др.).
Воздействие на психоэмоциональную сферу перед кесаревым сечением игра-
ет значительно меньшую роль по сравнению с больными общехирургического
профиля. Часто беременные самостоятельно отказываются от применения каких-
либо препаратов из-за боязни их отрицательного воздействия на состояние плода
и новорожденного. Беременным, которым предстоит плановое родоразрешение,
накануне на ночь назначают снотворные препараты: фенобарбитал (0,1 г), барбо-
вал (10-15 капель с водой).
Практика показывает, что включение в премедикацию производных фено-
тиазина (дипразина) или бутирофенонов (дроперидола) у беременных нередко
вызывает экстрапирамидные расстройства в виде бессонницы, акатизии, тахи-
кинезии (синдрома Куленкампфа—Тарнова). Исходя из этого, более целесооб-
разно применять сочетание барбитуратов с бензодиазепинами в обычных тера-
певтических дозах. У беременных с повышенной эмоциональной лабильностью
и сопутствующей акушерской патологией премедикацию накануне операции
дополняют нейротропными и седативными препаратами. Следует помнить, что у
недоношенных новорожденных значительно повышена тропность бензодиазе-
пинов к белкам крови (длительная циркуляция препаратов в крови новорожден-
ных). В день операции роженицам с высокой степенью эмоциональной лабиль-
ности, испытывающих страх, целесообразно внутримышечное введение диазепа-
ма (10 мг) за 2 ч до операции.
Для предупреждения побочных влияний наркотических и анестезирующих
средств при обшей и регионарной анестезиях вводят периферические М-холино-
литики, в частности — атропин (при сопутствующей сердечно-сосудистой патоло-
гии и исходной тахикардии — метацин). При плановых операциях М-холинолити-
ки вводят внутримышечно за 20—30 мин до начала наркоза либо внутривенно на
операционном столе в дозе 0,5—0,8 мг.
В премедикацию включают антигистаминные препараты, из которых наибо-
лее приемлем димедрол (0,14 мг/кг внутривенно на операционном столе).
Наркотические аналгетики (промедол, фентанил, дипидолор и др.), широко
используемые для премедикации в общей анестезиологии, при оперативных ро-
дах не применяют из-за их угнетающего действия на дыхательный центр ново-
рожденных.
Таким образом, стандартная профилактическая премедикация у беременных
при кесаревом сечении состоит из препаратов двух групп — М-холинолитиков и
антигистаминных препаратов. Расширенную профилактическую премедикацию
429
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
используют у беременных с сопутствующими акушерской и экстрагенитальной
патологиями.
Одной из физиологических особенностей беременности является угнетение
моторики желудочно-кишечного тракта, что обусловливает высокий риск развития
аспирационного синдрома (синдрома Мендельсона) при проведении общей анесте-
зии. Перед началом экстренной анестезии уточняют время последнего приема пищи,
ее состав и количество. При употреблении значительного количества жирной пищи,
мяса, кислых или острых продуктов пищевые массы из желудка у беременных Moiyr
эвакуироваться более чем через 8—12 ч, поэтому в случае экстренного оперативного
родоразрешения и указаний в анамнезе на прием пищи менее чем за 6 ч до опера-
ции проводят промывание желудка с помощью зонда с широким просветом, после
чего через зонд вводят 20—30 мл антацидного средства. Перед ургентной операцией
кесарева сечения рекомендуют внутривенное введение блокаторов Н2-рецепторов —
ранитидина (150 мг) или циметидина (300 мг), перед плановой операцией — перо-
ральный прием ранититидина (150 мг) или натрия цитрата (табл. 19.4).
Таблица 19.4. Схема назначения антацидов при кесаревом сечении
Антацид Плановая операция Экстренная операция
Ранитидин 150 мг per os на ночь и за 90 мин до операции 50 мг в/в сразу после принятия решения о проведении операции
Натрия цитрат 30 мл per os за 30 мин до операции 30 мл per os непосредственно перед операцией
Циметидин уменьшает печеночный кровоток и тем самым изменяет метабо-
лизм лекарственных средств, а также увеличивает токсичность лидокаина, поэто-
му, если планируют проведение регионарной анестезии, то используют ранити-
дин. Необходимо помнить, что назначение цитрата натрия значительно снижает
pH желудочного содержимого, но в меньшей степени снижает его объем, поэтому
риск регургитации сохраняется, несмотря на промывание желудка. Для ускорения
эвакуации желудочного содержимого назначают метоклопрамид (10 мг за 1,5-2 ч
до операции).
Для уменьшения риска регургитации следует, по возможности чаще, рассмат-
ривать вопрос о проведении регионарной анестезии. При выраженной седации,
токсических реакциях на местные анестетики, высоком уровне спинальной или
эпидуральной анестезии опасность аспирации сохраняется.
19.2.3. Интра- и послеоперационный периоды
Выбор метода анестезии (обшей, регионарной или местной ин-
фильтрационной) при операции кесарева сечения зависит от многих факторов:
опыта и квалификации анестезиологической бригады, степени срочности опера-
ции, состояния матери и плода, возможностей лечебного учреждения, пожела-
ний пациентки и др. При равных условиях регионарная анестезия более безо-
пасна, чем общая.
Каждый метод анестезии имеет преимущества и недостатки, показания и про-
тивопоказания (табл. 19.5, 19.6).
430
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Таблица 19.5. Сравнительная оценка преимуществ и недостатков
различных методов анестезии при кесаревом сечении
Общая анестезия Регионарная анестезия
Преимущества Недостатки Преимущества Недостатки
Возможность быстрого расширения объема операции при необходимости, защита и контроль функций дыхания, контроль и коррекция функций сердечно- сосудистой системы, профилактика и устранение судорожного синдрома Неудачи при интубации, осложнения при трудной интубации, риск неожи- данного пробуждения, непредвиденного расслабления мускулатуры матки, угнетения ЦНС у плода / новорожденного, возникновения аномальной реакции на лекарственные средства Отсутствие ослож- нений интубации, уменьшения тонуса матки, риска непредусмо- тренного выхода из состояния анестезии, ранние контакт матери с ребенком и грудного в скарм ли вания Случаи полного отсутствия эффекта, недостаточ- ность и неадекватность анестезии, осложнения спинномозго- вой пункции
Таблица 19.6. Показания и противопоказания к применению
различных видов анестезии при кесаревом сечении
Общая анестезия Регионарная анестезия
Показания Противопоказания Показания Противопоказания
Желание роженицы, противопоказания к выполнению регионарной анестезии, значительная кровопотеря / гиповоле- мия, эклампсические судороги либо нарушение сознания роженицы, необходимость экстренного выполнения хирургической операции, если невозможно проведение регионарной анестезии Обстоятельства, затрудняющие либо делающие невозможной интубацию трахеи, аллергия на применяемые анестетики в анамнезе, наличие серповидно- клеточной анемии, миастении, дистрофической МИОТОНИИ, злокачественной гипертермии, диабета Желание роженицы, преждевремен- ные роды, тромбоз глубоких вен в анамнезе, см. разделы 13.2, 13.3, 19.1.4 См. разделы 13.2, 13.3, 19.1.4
19.2.3.1. Общая анестезия
При проведении общей анестезии обеспечивают стандартный мо-
ниторинг-. ЧСС, АД (прямым или непрямым методом при необходимости), ЭКГ,
пульсоксиметрия, капнография, ЦВД или ДЗЛА (при необходимости), контроль
температуры тела и диуреза, визуальный контроль.
У беременных повышена чувствительность к гипоксии, поэтому тщательно
контролируют цвет кожных покровов, экскурсии грудной клетки, деятельность
431
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
аппарата ИВЛ и давление на вдохе. Контролируют уровень напряжения СО2 в
конечной пробе выдыхаемого воздуха: до извлечения плода его поддерживают на
уровне 28—30 мм рт. ст. Внезапное, но очень непродолжительное повышение
РЕТСО2 может возникнуть при быстрой ликвидации синдрома аортокавальной ком-
прессии после извлечения плода.
Анестезиолого-операционные этапы кесарева сечения при общей анестезии:
1) премедикация на операционном столе (профилактическая), 2) индукция в
наркоз, 3) интубация трахеи, 4) период до извлечения плода, 5) период после
извлечения плода (базисная анестезия), 5) экстубация и перевод в послеопера-
ционную палату.
Каждый компонент общей анестезии (гипнотический, аналгетический, мио-
релаксацию, ИВЛ, нейровегетативную защиту) обеспечивают группой лекарствен-
ных препаратов, которые по-разному воздействуют на роженицу и плод.
Гипнотический компонент сбалансированной многокомпонентной анестезии
с ИВЛ при кесаревом сечении достигают использованием анестетиков (табл. 19.7).
Применяют внутривенные анестетики: тиопентал-натрий, кетамин, натрия окси-
бутират. Оптимальная доза тиопентал-натрия для индукции в наркоз и поддержа-
ния гипнотического компонента составляет 4—7 мг/кг, кетамина — 1—1,2 мг/кг.
Натрия оксибутират в качестве индукционного анестетика в чистом виде при ке-
саревом сечении практически не применяют, а используют в сочетании с 1 %
раствором тиопентал-натрия в дозе 40—50 мг/кг.
Таблица 19.7. Действие анестетических препаратов на роженицу и плод
Анестетик Минутный объем сердца Маточно- плацентарный кровоток Сокра- тимость матки Депрессия плода Тератогенное действие на плод
Закись азота < > < > т
Фторотан <-> J.U т г- Т
Тиопентал-натрий г о г < >
Пропанидид (сомбревин) г о? ft ?
Калипсол т г тт г ?
Диазепам и другие атарактики г Г? г ?
Местные анестетики < > г < > <>
Наркотические анальгетики о J.J, 4' 4' 4' <>
Примечание: Т — увеличение действия, J- — уменьшение действия, — отсутствие
действия, ? — достоверные данные отсутствуют.
При интубации трахеи используют мышечные релаксанты деполяризующего
(короткого) действия — дитилин, листенон, миорелаксин. Расчетная доза дитили-
на при интубации трахеи составляет 100—120 мг (не более 2 мг/кг). Мышечную
432
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
релаксацию до извлечения плода поддерживают за счет фракционного введения
деполяризующих миорелаксантов, после извлечения плода используют недеполя-
ризующие мышечные релаксанты в стандартных расчетных дозах, например, ар-
дуан (0,04 мг/кг).
©Суммарная доза сукцинилхолина до извлечения плода
при кесаревом сечении не должна превышать 300 мг
В акушерской практике чаще регистрируют случаи трудной интубации, чем у
общехирургических больных, что требует от анестезиолога безупречного владения
техникой и знаний алгоритма действий при трудной интубации (см. раздел 8.3.4).
При проведении интубации трахеи у рожениц в обязательном порядке применяют
прием Селлика и местную анестезию ротовой полости и глотки 10 % раствором
лидокаина. Решение о невозможности интубации должно быть принято как мож-
но раньше. При 3 неудачных попытках интубации переходят к выполнению алго-
ритма неудавшейся интубации (рис. 19.1).
ЪВ!
Во время кесарева сечения повторная доза сукцинилхолина
при трудной интубации недопустима, равно как и повторная доза
внутривенного анестетика
При безуспешных попытках восстановления проходимости дыхательных пу-
тей и невозможности вентиляции легких через маску с помощью внутривенной
канюли большого диаметра экстренно пунктируют перстнещитовидную мембрану
и проводят транстрахеальную оксигенацию, желательно в режиме ВЧИВЛ, а затем
выполняют трахеостомию по традиционной методике или ожидают пробуждения
больной.
Хорошей альтернативой интубации трахеи является использование ларинге-
альной маски (см. раздел 8.4).
Период до извлечения плода — один из самых напряженных этапов при кеса-
ревом сечении, в течение которого роженицам не требуется такого компонента
анестезии, как нейровегетативная защита, так как хирургическая агрессия не со-
провождается воздействием на рефлексогенные зоны и тем самым не вызывает
нейровегетативной “бури”. Следовательно, этап до извлечения плода обеспечива-
ют за счет 4 компонентов общей анестезии: гипнотического, аналгетического, ИВЛ
и миорелаксации.
Аналгетический компонент обеспечивают путем ингаляции закиси азота с
кислородом (2:1). В настоящее время не существует альтернативы закиси азота,
так как использование других аналгетиков в этот период опасно из-за возможно-
сти развития наркотической депрессии новорожденного.
На данном этапе анестезии актуальным является условное понятие “наркоз-
ного индекса” (НИ) — интервала от начала наркоза до извлечения плода, выража-
ющегося в минутах. Для каждого препарата при кесаревом сечении эта величина
разнится в силу факторов, влияющих на проницаемость веществ через плаценту
(см. раздел 19.1.3). Для барбитуратов оптимальный НИ составляет 12—15 мин,
кетамина — 8—10 мин, диазепама и его аналогов — 2—8 мин.
Закись азота имеет низкую молекулярную массу и быстро проникает через
плацентарный барьер. Увеличение процентного содержания закиси азота в крови
433
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Невозможность интубации
Рис. 19.1. Алгоритм действий анестезиолога при неудачно проведенной интубации
плода находится в прямой зависимости от времени ингаляции закиси азота у ма-
тери, но возможность развития диффузионной гипоксии у новорожденных прак-
тически полностью исключена, что подтверждено исследованиями многих авто-
ров [2]. Согласно нашим данным, в течение первых 3 мин самостоятельного дыха-
ния у новорожденных примесь закиси азота в выдыхаемом воздухе не превышает
2-4 %.
После извлечения плода в течение первой минуты анестезиолог оцени-
вает состояние доношенного новорожденного по шкале Апгар (табл. 19.8),
недоношенного — по шкале Сильвермана-Андерсена (основана на признаках
респираторной ретракции, табл. 19.9). Результаты фиксируют в наркозной
карте.
434
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Таблица 19.8. Шкала Апгар
Признак Оценка, балл
0 1 2
Сердцебиение Отсутствует ЧСС менее 100 уд./мин ЧСС более 100 уд./мин
Дыхание Отсутствует Слабый крик Громкий крик
Мышечный тонус Вялый Некоторая степень сгибания Акутивные движения
Рефлекторная возбудимость Отсутствует Слабо выражена (гримаса) Хорошо выражена (крик)
Окраска кожи Синюшная или бледная Розовая окраска туловища и синюшная конечностей Розовая окраска
Таблица 19.9. Шкала Сильвермана-Андерсена
Оценка, балл Признак
1 Втяжение межреберных промежутков с абдоминальной респирацией во время вдоха
2 Втяжение нижних межреберных мышц
3 Втяжение ксифоидного отростка
4 Движение крыльев носа во время вдоха
5 Вдох с шумом (ворчанием)
6 Здоровый ребенок
Период после извлечения плода (базисную, или постнатальную, анестезию)
обеспечивают редуцированными дозами анестетиков, аналгетиков, нейролепти-
ков, атарактиков из-за опасности нарушения контрактильной активности матки
после пережатия пупочного канатика. Рациональной глубиной базисной анесте-
зии при кесаревом сечении считают IIIj стадию по классификации Гведела.
Традиционные виды базисной анестезии при кесаревом сечении [1, 2]:
• Комбинированная нейролептаналгезия. Сразу после извлечения и пережа-
тия пупочного канатика вводят 2 мл фентанила (0,0014 мг/кг) каждые 15—20 мин,
1-2 мл дроперидола (0,03—0,06 мг/кг) под контролем АД.
• Комбинированная атаралгезия. Методика схожа с комбинированной нейро-
лептаналгезией, но фентанил вводят в дозе 0,0016 мг/кг и сочетают с 1—2 мл
сибазона (0,07 мг/кг).
• Комбинированный эндотрахеальный наркоз. Дробно вводят 25—50 мг кета-
мина каждые 15—20 мин (0,7 мг/кг) в сочетании с сибазоном (5—10 мг) для пре-
дотвращения побочного действия кетамина (галлюцинаций, возбуждения, гипер-
тензии).
ИВЛ, как компонент современной сбалансированной многокомпонентной
анестезии при кесаревом сечении, имеет свои особенности. Существующие для
расчета параметров ИВЛ номограммы (Ретфорда, Энгстрема—Герцога) не учиты-
вают изменений, происходящих в организме беременных и, следовательно, не
435
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
пригодны для расчета параметров ИВЛ при кесаревом сечении. Согласно данным
работ [4, 5, 8], существуют формулы для расчета параметров ИВЛ при кесаревом
сечении, а также средние абсолютные величины ДО и МОД. Так, во II периоде
физиологических родов МОД у рожениц в среднем составляет 14,4 ± 0,4 л/мин,
ДО — 750 ± 70 мл. Расчет параметров ИВЛ с использованием формул позволяет
индивидуализировать подбор режима ИВЛ. Наиболее приемлемой для расчета ДО
и МОД у рожениц при кесаревом сечении является формула, предложенная Пав-
ловой Н.Н., основу которой составляет формула Дарбиняна Т.М.:
МОД =
Масса тела , . ,
----------1,4 +1,
10
ДО =
МОД
ЧДД’
где ЧДД у беременных составляет 18—20 движений в минуту.
Данную формулу применяют у рожениц без сопутствующих акушерской и
экстрагенитальной патологий; у рожениц с сопутствующей сердечно-сосудистой
патологией автор предлагает учитывать коэффициент 1,6.
При кесаревом сечении наибольшее распространение получил режим ИВЛ с
перемежающимся положительным давлением вдоха 15—20 мм вод. ст. при пассив-
ном выдохе. Такой режим ИВЛ создает благоприятные условия для остановки
кровотечения после извлечения плода, предупреждает возникновение воздушной
эмболии через зияющие сосуды матки, препятствует повышению ЦВД, тем са-
мым, предупреждает перегрузку правых отделов сердца.
Вопрос экстубации трахеи и перевода рожениц на спонтанное дыхание по-
прежнему остается актуальным и дискуссионным. Однозначных критериев для
перевода на спонтанное дыхание не существует. Мы рекомендуем экстубиро-
вать рожениц при адекватном спонтанном дыхании через интубационную трубку
(ЧДД = 16—20 в 1 мин, сатурации кислорода — не менее 96 %), стабильной гемо-
динамике, восстановившемся мышечном тонусе.
У беременных с сопутствующей экстрагенитальной патологией,
а также находящихся в критическом состоянии, проводят продленную ИВЛ
Протоколы проведения общей анестезии у беременных без сопутствующих
акушерской и экстрагенитальной патологий при кесаревом сечении
Индукционно-базисный анестетик: кетамин. Операционный стол наклоняют
влево на 15—20°. Проводят ингаляцию кислорода. Премедикацию осуществляют
на операционном: метацин (0,014 мг/кг), димедрол (0,14 мг/кг). Орошают рото-
вую полость и глотку 10 % раствором лидокаина. Для вводного наркоза исполь-
зуют кетамин (1,5—2 мг/кг) и седуксен (0,1 мг/кг), миорелаксант — дитилин
(100—120 мг, не более 2 мг/кг).
Интубацию трахеи проводят с использованием приема Селлика интубацион-
ной трубкой с раздувной манжетой. После интубации трахеи и до извлечения
плода режим подачи N2O:O2 = 2:1. Параметры ИВЛ вычисляют по формулам МОД
и ДО. Оптимальный НИ составляет 8—10 мин.
После извлечения плода обеспечивают базисную анестезию (вариант атарал-
гезии): кетамин (1,5 мг/кг), седуксен (0,1 мг/кг), фентанил (фракционно через
20 мин, 0,0014 мг/кг).
436
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
После окончания операции на фоне адекватно восстановленного сознания, ста-
бильных параметров гемодинамики и спонтанного дыхания проводят экстубацию.
В наркозной карте фиксируют: течение всех анестезиолого-операционных
этапов абдоминального родоразрешения, НИ, оценку новорожденного (доношен-
ного — по шкале Апгар, недоношенного — по шкале Сильвермана—Андерсена),
при переводе родильницы в послеоперационную палату — время, ЧДД, ЧСС, АД,
объем кровопотери, количество и цвет мочи, Ф.И.О. врача акушера-гинеколога,
которому передают родильницу для наблюдения.
Индукционно-базисный анестетик: тиопентал-натрий. Операционный стол
наклоняют влево на 20°. Проводят ингаляцию кислорода. Премедикацию осуще-
ствляют на операционном столе: метацин (0,014 мг/кг), димедрол (0,14 мг/кг).
Орошают ротовую полость и глотку 10 % раствором лидокаина. Для вводного
наркоза используют 1 % тиопентал-натрий (4—7 мг/кг).
Интубацию трахеи проводят с использованием приема Селлика интубацион-
ной трубкой с раздувной манжетой. После интубации трахеи и до извлечения
плода проводят ИВЛ в режиме умеренной гипервентиляции с ингаляцией закиси
азота и кислорода (2:1). Оптимальный НИ составляет 12—14 мин.
После извлечения плода обеспечивают базисную анестезию (вариант атарал-
гезии или нейролептаналгезии). Достигают глубины анестезии, соответствующей
IIIj стадии наркоза по классификации Гведела.
После окончания операции на фоне адекватно восстановленного сознания, ста-
бильных параметров гемодинамики и спонтанного дыхания проводят экстубацию.
В наркозной карте фиксируют: течение всех анестезиолого-операционных
этапов абдоминального родоразрешения, НИ, оценку новорожденного (доношен-
ного — по шкале Апгар, недоношенного — по шкале Сильвермана-Андерсена),
при переводе родильницы в послеоперационную палату — время, ЧДД, ЧСС, АД,
объем кровопотери, количество и цвет мочи, Ф.И.О. врача акушера-гинеколога,
которому передают родильницу для наблюдения.
19.2.3.2. Регионарная анестезия
При кесаревом сечении возможно проведение эпидуральной, спи-
нальной, комбинированной спинально-эпидуральной или продленной спиналь-
ной анестезий.
Наряду с классическими методами интраоперационного мониторинга исполь-
зуют методы оценки развития сенсорного блока: потерю температурной чувстви-
тельности, ощущения укола, тактильной чувствительности. Первой исчезает тем-
пературная чувствительность, последней — тактильная. До начала операции про-
веряют чувствительность на задней поверхности нижних конечностей (дерматомы
S,-S3) для подтверждения сакрального блока. Согласно экспериментальным дан-
ным, наиболее надежный признак блока — это потеря тактильной чувствительно-
сти (легкого прикосновения иглы к коже) на уровне Т5 (ниже сосков). Блок дол-
жен распространяться на уровне Th4-S4. Самая частая причина неадекватного обез-
боливания — нарушение распространения блока в крестцовых дерматомах (чаще
при эпидуральной анестезии, реже — при спинальной).
Избыточные эпидуральный и спинальный блоки вызывают временное состо-
яние симпатэктомии, способствующей развитию артериальной гипотонии. У бе-
ременных вследствие аортокавальной окклюзии гипотония может развиться быст-
ро, поэтому АД измеряют каждые 2 мин от начала регионарного блока. Тошнота,
437
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
возникающая после начала регионарной анестезии, обычно является признаком
гипотензии. Блок выше Т4 прерывает симпатическую иннервацию сердца, что
проявляется брадикардией.
Обеспечивают венозный доступ путем пункции периферической вены.
При регионарной анестезии ослаблен тонус мышц передней брюшной стенки
и межреберных мышц, что еще больше уменьшает изначально пониженные пока-
затели ФОБ у беременных, поэтому в качестве мониторинга обязательно исполь-
зуют пульсоксиметрию. При блоке грудных дерматомов пациентки часто жалуют-
ся на странное ощущение при дыхании, невозможность произвольно откашлять-
ся, что является нормальным и обратимым ощущением. Затруднение речи является
признаком развивающегося паралича диафрагмального нерва и необходимости
минимизировать дальнейшее распространение анестетика. Если используют ги-
пербарический анестетик, то головной конец операционного стола поднимают.
Необходима готовность к проведению интубации и ИВЛ.
При эпидуральной анестезии возможно случайное внутривенное введение
местного анестетика и последующее возникновение судорог (1:500—9000). После
каждой введенной дозы оценивают появление симптомов внутрисосудистого вве-
дения анестетика (табл. 19.10), даже если предыдущие инъекции не сопровожда-
лись осложнениями (см. раздел 13.3.4).
Таблица 19.10. Симптомы аллергических и токсических реакций
при внутрисосудистом введении местного анестетика
Аллергическая реакция Слабая интоксикация Сильная интоксикация Опасная для жизни интоксикация (крайне редко)
Шок, покраснение кожи, высыпания на коже, бронхоспазм, рвота, сывороточная болезнь Онемение губ и языка, металлический привкус во рту, головокружение, вспышки в глазах, звон в ушах, затруднение фокусирования зрения Сонливость, дезориентация, мышечные подергивания и дрожь, спутанная речь Тонико-клонические судороги, угнетение дыхания или его остановка, угнетение сердечной деятельности или остановка сердца
Эпидуральная анестезия при кесаревом сечении
Преимущества эпидуральной анестезии при кесаревом сечении: хорошая анестезия и
аналгезия, снижение риска аспирационных осложнений, более ранняя активность в
послеоперационном периоде, возможность роженицы “присутствовать” без боли при
рождении ребенка, хорошая релаксация мышц в зоне анестезии, отсутствие наруше-
ний дыхания и метаболических расстройств, длительность обезболивания практичес-
ки не ограничена (пункционная катетеризация эпидурального пространства).
Показания, противопоказания, техника проведения, осложнения — см. раздел 13.3.
Эпидуральную анестезию при кесаревом сечении выполняют срединным или
боковым доступом, уровень пункции — L,—L3. Для адекватной анестезии опера-
тивного родоразрешения достаточной является блокада на уровне Th10~Thn.
У беременных используют на 30—40 % меньше анестетика для достижения тех
же сегментарных границ блокады, что у небеременных за счет уменьшения емко-
сти эпидурального пространства.
Вариант расчета дозы местного анестетика для эпидуральной анестезии при
кесаревом сечении:
438
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Общая доза = Количество сегментов - Сегментарная доза,
где сегментарная возрастная доза составляет 1,3—1,5 мл/сегмент (при введе-
нии анестетика на уровне Ц—L3).
Препараты вводят в эпидуральное пространство медленно (табл. 19.11).
Основное назначение тест-дозы, которая не должна превышать 5 мл анестезирую-
щего раствора, — предупреждение случайного субарахноидального или внутри-
венного попадания значительной дозы анестетика.
Таблица 19.11. Клиническая характеристика местных анестетиков для эпидуральной
анестезии в акушерстае
Препарат Концентрация раствора, % Минимальная разовая доза, мг Аналгезия Продолжитель- ность эффекта Токсич- ность
Ксилокаин, лидокаин 2 500 + + + + + + + +
Тримекаин 2 700 + + + + + 4- 4-
Мепивакаин 2 750 + + + + 4-4- + + +
Бупивакаин 0,5 150 + + + + + + + + + + + +
Блокада, выполненная ниже сенсорного уровня Т4, приводит к появлению боли,
тошноты, рвоты и ощущения дискомфорта. Повторные дозы местного анестетика,
составляющие 50—60 % от первоначальной, вводят с учетом времени действия кон-
кретного препарата до того, как произойдет регрессия анатомического уровня бло-
кады. Если перед выполнением повторной инъекции местного анестетика происхо-
дит регрессия уровня блокады более чем на 2 дерматома, то для восстановления
первоначального уровня анестезии необходимо введение увеличенных доз местного
анестетика, что чревато развитием тахифилаксии. Восстановить первоначальный
уровень блокады при ее регрессии более чем на 2 дерматома обычно удается при
введении дозы местного анестетика, соответствующей первоначальной.
Для улучшения качества и продолжительности эпидуральной анестезии реко-
мендуют сочетанное введение местного анестетика с опиатами или клофелином
(25-50 мкг), особенно у пациенток с гипертензивными состояниями или преэк-
ламсией. Такое сочетание позволяет уменьшить дозу местного анестетика и сни-
зить риск его токсического действия. Добавление 100 мкг фентанила или 5 мг
морфина значительно улучшает качество эпидурального обезболивания по срав-
нению с использованием лишь одного местного анестетика (табл. 19.12). Кроме
этого, дополнительное эпидуральное введение опиатов обеспечивает более дли-
тельное послеоперационное обезболивание и уменьшает потребность в нем.
Таблица 19.12. Использование наркотических аналгетиков при эпидуральной
анестезии в акушерстве
Препарат Доза Продолжительность обезболивания, ч
Морфин 3-5 мг 4-12
Стадол 1-2 мг 6-8
Фентанил 50-100 мкг 1-4
439
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Спинальная анестезия при кесаревом сечении
Спинальная анестезия имеет ряд преимуществ по сравнению с эпидуральной:
относительная техническая простота выполнения пункции, более быстрый и на-
дежный сенсорный и моторный блоки, экономичность и др. Спинальная анесте-
зия является достойной альтернативой эпидуральной блокаде для обеспечения
анестезиологической защиты пациентки при кесаревом сечении.
Показания, противопоказания, техника выполнения, осложнения — см. раздел 13.2.
Пункцию осуществляют на уровне Ц—Ц в положении на боку (при необходи-
мости — сидя), предварительно приподняв головной конец операционного стола
на 30°. После введения анестетика в субдуральное пространство женщину остав-
ляют в таком положении в течение 40—50 с, а затем укладывают на спину и при-
поднимают головной конец операционного стола на 30° для препятствия кра-
ниальному распространению гипербарического раствора анестетика. В течение
последующих 10 мин ежеминутно контролируют АД и продолжают внутривенную
инфузию кристаллоидных растворов. В случае снижения показателей АД более
20 % от исходных дробно внутривенно вводят эфедрин (5—10 мг) или мезатон
(10—50 мкг). Уровень чувствительности контролируют на 2, 5 и 10-й минутах.
Развитие слабости в руках свидетельствует о распространении блока до уровня Тр
что требует особого внимания, так как возможна блокада диафрагмальных нервов
и развитие дыхательной недостаточности.
Чем меньше удельный вес и относительная плотность местного анестетика и
чем больше его объем и концентрация, тем выше уровень распространения блока-
ды. Для спинальной анестезии при кесаревом сечении используют гипербаричес-
кие (к раствору местного анестетика добавляют 1—1,5 мл 10 % глюкозы или декст-
розы) и изобарические растворы местных анестетиков.
Для обеспечения адекватной анестезии при кесаревом сечении чаще всего
используют лидокаин (4 мл 2 % раствора или 1,6—1,8 мл 5 % раствора, длитель-
ность анестезии 45—80 мин) или бупивакаин (2—2,5 мл 0,5 % раствора или 1,2-1,6 мл
0,75 % раствора, длительность анестезии 90—120 мин). Для увеличения продолжи-
тельности анестезии в раствор местного анестетика добавляют фентанил (25-50 мкг)
или морфин (0,25—0,3 мг).
Для обеспечения достаточной продолжительности субдуральной анестезии
иногда применяют постоянную спинальную анестезию: через тонкую спинальную
иглу диаметром 0,5—0,6 мм в субдуральное пространство вводят катетер диамет-
ром 0,3 мм, по которому осуществляют дальнейшее введение местного анестетика
в послеоперационном периоде.
Техника выполнения комбинированной спинально-эпидуральной анестезии зави-
сит от набора для ее проведения. При использовании специальных наборов пунк-
цию эпидурального пространства выполняют иглой Туохи (16—17 G), через до-
полнительный канал которой вводят спинальную иглу Whitacre или Sprotte (27 G).
Вводят раствор местного анестетика в субдуральное пространство, иглу удаляют и
осуществляют введение катетера в эпидуральное пространство через иглу Туохи
краниально на 3 см. После введения катетера иглу аккуратно удаляют. Таким
образом, операцию начинают в условиях спинальной анестезии, а затем, по окон-
чанию ее действия, переходят на эпидуральную анестезию. Длительное послеопе-
рационное обезболивание обеспечивают методом эпидуральной аналгезии.
Для комбинированной спинально-эпидуральной анестезии можно использо-
вать обычную эпидуральную иглу Крауфорда с концом, срезанным под углом 30':
через нее проводят и спинальную иглу, и эпидуральный катетер.
440
1». ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Перспективы широкого применения комбинированной спинально-эпидураль-
ной анестезии в качестве стандартного предварительно планируемого метода ане-
стезии при кесаревом сечении сомнительны: послеоперационное обезболивание
можно обеспечить более простыми способами. При тяжелой преэклампсии выбор
этого метода анестезии оправдан.
19.2.3.3. Местная анестезия
При невозможности проведения общей или регионарной анесте-
зии при кесаревом сечении используют местную инфильтрационную анестезию,
что случается довольно редко. Этот метод является альтернативой общепринятым
методам обезболивания при условиях высокой квалификации хирурга и отсут-
ствия полноценного анестезиологического обеспечения.
Преимущества местной анестезии при кесаревом сечении: безопасность (осо-
бенно при исходной гипотензии), снижение кровопотери (благодаря добавлению
адреналина в раствор местного анестетика), осуществление анестезии оперирую-
щим хирургом без участия анестезиолога, дешевизна.
Недостатки местной анестезии при кесаревом сечении: дискомфортные ощу-
щения у пациентки, длительное время для развития и проведения анестезии, на-
личие богатого хирургического опыта.
Инфильтрационную местную анестезию выполняет, как правило, хирург, при
этом доза местного анестетика не должна превышать максимально допустимую.
На каждый 1 мл местного анестетика вводят 5 мкг адреналина, что соответствует
его концентрации 1:200 000 (0,1 мл 0,1 % раствора адреналина на каждые 20 мл
местного анестетика, как правило, 0,5 % лидокаина). По возможности, женщина
должна получать ингаляцию кислорода.
Техника проведения. Иглой, длина которой 100 мм, инфильтрируют полоску
кожи и подкожной клетчатки шириной 3—4 см в месте предполагаемого разреза
по средней линии (от симфиза до точки, расположенной на 5 см выше пупка).
Иглу направляют параллельно коже, так как у беременных тонкая стенка живота.
Выполняют разрез кожи на 4 см больше, чем при общей или регионарной анесте-
зии. Разрез по Пфанненштилю, как правило, не используют, так как это требует
значительных затрат времени и количества местного анестетика, а также создает
затруднения при разведении краев раны.
Перед каждым введением анестетика проводят аспирационную пробу для ис-
ключения внутрисосудистого введения. Через 2 мин после завершения введения
анестетика проводят щипковую пробу. После кожного разреза инфильтрируют вла-
галище прямой мышцы живота. Для осуществления анестезии париетального лист-
ка брюшины под белую линию живота дополнительно вводят 10 мл раствора мест-
ного анестетика, после чего в висцеральный листок брюшины, покрывающий мат-
ку, в точке ее разреза в области нижнего сегмента вводят 5 мл местного анестетика
и 30 мл — под маточно-пузырную складку, проводя инфильтрацию латерально до
круглой маточной связки. Необходимости в дополнительной инфильтрации мио-
метрия нет. Перед извлечением ребенка предупреждают женщину о появлении чув-
ства дискомфорта, который обычно не больше, чем при влагалищных родах.
Длительность местной анестезии при использовании лидокаина, как правило,
составляет около 60 мин, чего вполне достаточно для проведения операции. До-
полнительная местная анестезия может понадобиться при ушивании брюшной
стенки.
441
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
19.2.4. Особенности анестезиологического обеспечения
операции кесарева сечения при тяжелых акушерской
и экстрагенитальной патологиях
При выборе метода обезболивания у беременных с тяжелыми аку-
шерской и экстрагенитальной патологиями учитывают, что приоритетом является
сохранение жизни матери, поэтому у пациенток даже до извлечения плода под-
держивают более глубокий уровень анестезии, чем у беременных без сопутствую-
щей патологии. Глубина анестезии должна соответствовать III, стадии по класси-
фикации Гведела. У беременных с преэклампсией легкой и средней тяжести, ГБ,
гипертензивным синдромом проводят комбинированную эпидуральную анесте-
зию или вариант общей анестезии.
®Чем выше тяжесть сопутствующей патологии, тем предпочтительнее
проведение общей анестезии при кесаревом сечении
Общую анестезию иногда проводят без соблюдения принципов акушерской
анестезиологии, так как первоочередной задачей является сохранение жизни ма-
тери. Осуществляют расширенную профилактическую премедикацию М-холино-
литиками, антигистаминными препаратами, нейролептиками или атарактиками,
наркотическими аналгетиками. В качестве индукционного и базисного анестетика
используют барбитураты в дозе 4—5 мг/кг. Целесообразно применение закисно-
кислородной смеси в соотношении 2:1 на фоне фракционного болюсного введе-
ния наркотических аналгетиков и анестетиков. При родоразрешении таких бере-
менных в плановом порядке соблюдают принцип преемственности в ОИТ, то есть
интенсивную терапию (лечебную премедикацию), которую проводили в предопе-
рационном периоде (гипотензивную, детоксикационную, рео- и энергокорриги-
рующую и др.) продолжают в интра- и послеоперационном периодах с коррекци-
ей доз и интервалов введения препаратов. Всем родильницам после операции по-
казана продленная ИВЛ, длительность которой определяют индивидуально.
Применение кетамина и натрия оксибутирата у данной категории родильниц про-
тивопоказано.
Эпидуральную анестезию проводят после расширенной премедикации (М-хо-
линолитики, антигистаминные препараты, атарактики или нейролептики, барби-
тураты). Эпидуральная анестезия является методом выбора у беременных с брон-
хиальной астмой, легочной гипертензией, сахарным диабетом, деформациями
лицевого скелета. У беременных с тяжелыми пороками сердца целесообразно ис-
пользовать комбинированную эпидуральную анестезию или общую анестезию (атар-
алгезию) с включением в премедикацию нитратов (аппликация нитромази дли-
ною 3 см или 0,5 мг нитроглицерина под язык) и салуретиков (40 мг лазикса).
Натрия оксибутират используют у беременных с предполагаемым массивным
кровотечением: на фоне струйной инфузии глюкокортикоидов (5—7 мг/кг) или
при низких показателях АД (систолическом АД — 50 мм рт. ст. и менее) на фоне
инфузии адреномиметиков осуществляют вводный наркоз натрия оксибутиратом
(40—50 мг/кг) в сочетании с барбитуратами (2—3 мг/кг). Иногда при массивных
кровотечениях эффективно применение кетамина (1,5—2 мг/кг через 15-20 мин,
при повторных введениях — 1 мг/кг). Кетамин сочетают с диазепамом (5 мг) и
фентанилом (0,0014 мг/кг через 20 мин). Необходимо помнить, что у больных с
442
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
истощением симпатоадреналовой системы (при шоковых состояниях) сердечный
выброс за счет симпатомиметического действия кетамина не увеличивается. Дан-
ный вид общей анестезии эффективен также при обезболивании у больных с ин-
фекционно-токсическим шоком.
ЛИТЕРАТУРА
1. Зильбер А.П., Шифман Е.М. Акушерство глазами анестезиолога. — Петрозаводск:
Б. и., 1997. - 396 с.
2. Ланцев Е.А., Смирнов А.А. Анестезия и аналгезия при кесаревом сечении. —
Л.: Б. и., 1991. - 128 с.
3. Новикова Р.И., Черний В.И., Кабанько Т.П., Штутин С.А. Анестезия, интенсив-
ная терапия и реанимация при критических состояниях в акушерстве. — Донецк: ДМИ,
1993. - 148 с.
4. Кулаков В.И., Серов В.Н., Абубакирова А.М., Чернуха ЕЛ., Баранов И.И., Федорова
Т.А. Анестезия и реанимация в акушерстве и гинекологии — М.: медицина, 2000. — 382 с.
5. Расстригин Н.Н. Анестезия и реанимация в акушерстве — М.: Медицина, 1978. —
336 с.
6. Старостина Т.А., Фролова О.Г. Летальность после операции кесарева сечения//
Акушерство и гинекология, 1989. — № 3. — С. 22—24.
7. Черний В.И., Кабанько Т.П., Смирнова Н.Н., Костенко В.С. Анестезия и интен-
сивная терапия в акушерстве и гинекологии — К.: Здоров’я, 2003. — 456 с.
8. Шурыгин И.А. Спинальная анестезия при кесаревом сечении — СПб.: “Изда-
тельство “Диалект”, 2004. — 192 с.
9. Энкин М., Кейрс М., Нейлсон Дж., Краутер К., Дьюли Л., Ходнет Э., Хофмейстер
Дж. Руководство по эффективной помощи при беременности и рождении ребенка. Пер.
с англ. Под ред. А.В. Михайлова. — СПб.: Издательство “Петрополис”, 2003. — 480 с.
10. Evans L.C., Combs С.А. Increase maternal morbidity after caesarean section delivery
before 28 weeks of gestation// Int. J. Obstet. Gynecol. — 1993. — Vol. — 40. — P. 227—233.
11. Graham H., McMorland, M.B. Obstetric analgesia and anesthesia. — WFSA, 1992. —
156 p.
12. Farcon E.L., Marx G. Changing Mallampati score during labour// Canad. J. Anaesth.,
1994, Vol. 41, P. 50-51.
13. Khor L.J., Jeskins G., Cooper G.M., Paterson-Brown S. National obstetric anaesthetic
practice in the UK 1997/1998// Anaesthesia - 2000. — Vol. 55. - P. 1168-1172.
14. Kuczkowski, K.M., Benumof, J.L. Decrease in the incidence of post-dural puncture//
Acta Anaesthesiologica Scandinavica — 2003. — Vol. 47. — Issue 1. — P. 98—101.
15. Husaini S. W., Russel I.F. Volume preload: lack of effect in the prevention of spinal-
induced hypotension at cesarean section// International Journal of Obstetric Anesthesia. —
1998. - Vol.7. - p. 76-81.
19.3. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ГИНЕКОЛОГИЧЕСКИХ ОПЕРАЦИЙ
При выборе анестезии в оперативной гинекологии учитывают: па-
тофизиологические изменения в организме, вызванные патологическим процес-
сом и его осложнениями, топографоанатомические особенности расположения
внутренних органов в зоне операции, травматичность, длительность и срочность
операции, необходимость специальной укладки для обеспечения оптимального
доступа к пораженному органу, величину предполагаемой кровопотери, возмож-
ные осложнения в интра- и раннем послеоперационном периодах.
443
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
В гинекологии оперативное лечение проводят по поводу доброкачественных
и злокачественных новообразований, воспалительных заболеваний матки, при-
датков, выполняют реконструктивные и корригирующие операции по причине
бесплодия и аномалий развития половых органов, пластические операции при
выпадении матки и стенок влагалища.
Операции, как правило, выполняют в плановом порядке; экстренно опериру-
ют пациенток с прервавшейся эктопической беременностью, перитонитом, кро-
воточащими опухолями матки, перфорацией матки при искусственном прерыва-
нии беременности, а также в случае невозможности осуществить гемостаз каким-
либо другим путем.
Для большинства операций считают достаточным поддержание глубины ане-
стезии в стадии III, по классификации Гведела, при экстирпации матки углубляют
анестезию до Ш2 стадии, при расширенной экстирпации — до Ш3 стадии.
Анестезиологическое обеспечение малых гинекологических операций -
см. раздел 20.1.6.
19.3.1. Предоперационный период
Предоперационные обследование и подготовка
Хирургическая патология женской половой системы приводит не
только к локальным изменениям в пораженном органе, но и к патологическим
изменениям в органах и системах, не связанных с ним анатомически, изменениям
гомеостаза в целом. Выраженность подобных нарушений различна, поэтому во
время предоперационного обследования пациенток с хирургической гинекологи-
ческой патологией уделяют должное внимание ЭКГ, клиническим и биохимичес-
ким анализам крови, др. При выявлении патологических изменений проводят со-
ответствующую подготовку пациенток к операции, при планировании анестезии
подбирают препараты для наркоза и средства для инфузионной и интенсивной
терапии с учетом выявленных изменений и степени их компенсации.
Так, доброкачественные опухоли матки (миомы) являются причиной разви-
тия кардиомиопатий, формирования дистрофических изменений в миокарде (ми-
омного сердца) и печени (особенно при длительном существовании миомы), на-
рушений в свертываюшей системе крови — гиперкоагуляции и гиперагрегации
тромбоцитов на фоне сниженной функции антитромбинового звена [7]. Эти изме-
нения в свертывающей системе крови у пациенток с новообразованиями матки
расценивают как предтромботическое состояние с высоким риском развития ве-
нозных тромбозов в интра- и послеоперационный период.
Для больных гинекологического профиля специфичны нейроэндокринные
нарушения. Опухоли матки и придатков чаще развиваются в возрасте 45-60 лет в
период гормональной нестабильности, какими являются климакс и предшествую-
щий ему предклимактерический период. Этот этЪп в жизни женщины характери-
зуется дисрегуляцией вегетативных центров, повышенной возбудимостью симпа-
тических центров и лабильностью вазомоторной системы. Достаточно часто кли-
мактерический период сопровождается гиперфункцией щитовидной железы, что
проявляется психоэмоциональной лабильностью и нарушениями сна. В подобных
случаях ожидание предстоящей операции усугубляет тревожное состояние, поэто-
му назначают седативные и снотворные средства с момента поступления пациент-
ки в хирургический стационар.
444
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
У женщин со склерокистозными изменениями в яичниках также диагности-
руют различные нейроэндокринные нарушения, возникающие по причине недо-
статочной выработки гормонов яичников (эстрогенов и прогестерона): изменяют-
ся соотношения 11- и 17-кетостероидов, повышается выработка альдостерона и
АДГ, в связи с чем усиливается экскреция калия с мочой, снижается его содержа-
ние в плазме крови и повышается концентрация натрия. Увеличение концентра-
ции натрия в плазме приводит к задержке жидкости, ее перераспределению и
накоплению в интерстициальном пространстве с формированием характерных
отеков. Нарушения водно-электролитного обмена учитывают при выборе мышеч-
ных релаксантов и проведении инфузионной терапии.
Повреждения (например, патологические изменения или удаление яичников)
в единой гормональной системе “яичники — надпочечники — гипофиз” часто
сопровождаются нарушениями терморегуляции, что учитывают при диагностике
субфебрилитета до операции или гипертермии в послеоперационный период. Для
больных с гипофункцией яичников характерны изменения обменный процесс,
проявляющиеся тучностью, ожирением, склонностью к сахарному диабету.
У женщин с новообразованиями матки значительно чаще, чем у пациенток с
другой патологией, выявляют медикаментозную аллергию.
У пациенток со злокачественными новообразованиями и сопутствующей хро-
нической постгеморрагической анемией отмечают угнетение иммунной системы,
что, несомненно, увеличивает вероятность развития послеоперационных гнойно-
септических осложнений.
Опухоли матки, осложненные кровотечением, сопровождаются развитием ос-
трой или хронической постгеморрагической анемии. При хронической анемии
происходят изменения в кровообращении: увеличиваются минутный объем, ско-
рость кровотока, ЧСС, уменьшаются ОПСС и вязкость крови. У таких пациенток
часто диагностируют систолические шумы, при тяжелой форме хронической ане-
мии — изменения на ЭКГ: снижение интервала S—T, появление зубца U, измене-
ния зубца Т, иногда — удлинение систолы и нарушения атриовентрикулярной
проводимости. Как правило, при неизмененном ОЦК диагностируют изменения в
соотношении его компонентов. Неврологические нарушения при хронической
анемии обычно проявляются головной болью, головокружениями, шумом в ушах,
эмоциональной неустойчивостью, раздражительностью, плаксивостью, беспокой-
ством, снижением памяти, быстрой утомляемостью, вялостью, обмороками. При
хронической анемии могут возникнуть воспалительные процессы в полости рта,
глотки, желудка, что проявляется расстройствами глотания, болью в желудке, рво-
той, поносом, др.
Коррекцию постгеморрагической анемии начинают с момента поступления
в стационар. Рекомендуют полноценное питание с достаточным количеством
белка, кальция, витаминов, причем повышенную потребность в последних обес-
печивают за счет сбалансированных поливитаминов. Используют препараты же-
леза, при гемоглобине менее 70—80 г/л проводят гемотрансфузии эритромассы
или отмытых эритроцитов. Повышение концентрации гемоглобина до 100 г/л и
более свидетельствует о готовности больных к оперативному лечению. У боль-
ных с хронической анемией (особенно при угрозе повторного кровотечения)
отсутствие положительной динамики в терапии либо низкая эффективность прово-
димого лечения не являются противопоказаниями для проведения плановой опе-
рации.
445
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Эндогенной интоксикацией различной степени выраженности сопровожда-
ются гнойно-воспалительные образования внутренних половых органов, а также
злокачественные новообразования при их диссеминации.
Обширные вмешательства (экстирпация матки, надвлагалищная ампутация
матки с придатками, удаление гнойных тубоовариальных опухолей и др.) часто
сопровождаются значительной кровопотерей, что учитывают при подготовке к
операции (проводят коррекцию волемии и сопутствующей анемии), обеспечении
венозного доступа и составлении программы интраоперационной инфузионно-
трансфузионной терапии. При необходимости заранее заготавливают препараты
крови (см. раздел 9.3).
Проводят соответствующие обследования при сопутствующей экстрагениталь-
ной патологии, прежде всего, сердечно-сосудистой системы (ИБС, ГБ, постин-
фарктного кардиосклероза, аритмий и др.), органов дыхания (хронического брон-
хита, бронхиальной астмы, пневмосклероза), хронических заболеваний паренхи-
матозных органов (хронического нефрита, пиелонефрита, ХПН, холецистита,
гепатита, ХПечН), эндокринной системы (сахарного диабета, гипер- и гипотире-
оза, патологии надпочечников). Недооценка этих факторов и, соответственно, их
неадекватная коррекция часто являются причинами осложнений в интраопераци-
онном периоде.
Следует учитывать факт, что в настоящее время многие пациентки детород-
ного возраста постоянно принимают гормональные контрацептивные средства.
Высокое содержание эстрогена способствует нарушению коагуляции и может явить-
ся причиной тромбоэмболических осложнений в послеоперационном периоде.
Рекомендуют прекращение приема эстрогенсодержащих контрацептивов не ме-
нее чем за 6 недель до предстоящей операции на органах малого таза или нижних
конечностях. Исключение составляют “малые” вмешательства по типу выскабли-
вания полости матки.
Премедикация
С момента поступления в стационар больным назначают лечебную премедика-
цию, характер которой определяют сопутствующей патологией и обеспечением пси-
хоэмоционального покоя. Состав лечебной премедикации варьирует (гипотензив-
ные средства, коронаролитики, сердечные гликозиды, противоаритмические сред-
ства, антикоагулянты и др.), но неизменным остается назначение транквилизаторов
и седативных средств. Используют: сибазон (седуксен), феназепам, нозепам, меза-
пам (средняя доза — 2,5—5 мг 2—3 раза в сутки), препараты корня валерианы, пус-
тырника, ландыша, боярышника, масло мяты перечной, комбинированные сред-
ства. При нарушениях сна дополнительно применяют снотворные средства, напри-
мер, фенобарбитал (0,1—0,2 г за 30—60 мин до сна) и др. Вышеуказанные препараты
назначают индивидуально в зависимости от психоэмоционального состояния паци-
ентки. Эффективность седативной терапии контролируют лечаший акушер-гинеко-
лог и анестезиолог, при необходимости — проводят коррекцию терапии.
Полноценная профилактическая премедикация позволяет уменьшить дозы пре-
паратов, используемые для вводного наркоза и поддержания анестезии. У боль-
ных без сопутствующей экстрагенитальной патологии используют седативные или
нейролептические препараты в сочетании с наркотическими аналгетиками и хо-
линолитиками; препараты вводят внутримышечно за 30—40 мин до предстоящей
операции, при экстренных операциях — внутривенно на операционном столе за
5—10 мин до начала анестезии (табл. 19.13).
446
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Таблица 19.13. Варианты премедикации в оперативной гинекологии
Холинолитик Атарактик/нейро- лептик, дозировка Наркотический аналгетик, дозировка Антигистаминное средство, дозировка
Атропина сульфат 0,5 мг — Промедол, 0,3 мг/кг Димедрол, 0,15 мг/кг
Атропина сульфат или метацин 0,5-1 мг Дроперидол, 0,07-0,15 мг/кг Фентанил, 1-2 мкг/кг —
Атропина сульфат или метацин 0,5-1 мг Диазепам (сибазон), 0,15-0,2 мг/кг Фентанил, 1-2 мкг/кг —
Атропина сульфат или метацин 0,5-1 мг Диазепам (сибазон), 0,15 мг/кг Промедол, 0,3 мг/кг Димедрол, 0,15 мг/кг
Пациенткам с сопутствующей патологией сердечно-сосудистой системы, эмо-
ционально лабильным, с психическими отклонениями и заболеваниями премеди-
кацию усиливают дополнительным парентеральным введением препаратов диазе-
пинового ряда накануне операции (как правило, в 21:00—22:00) и в день операции
(6:00-7:00). Дополнительное введение 5—10 мг сибазона необходимо для достиже-
ния максимального седативного эффекта, обеспечивающего, в том числе и мень-
шие колебания гемодинамики при непосредственном приближении срока начала
операции и анестезии.
19.3.2. Интра- и послеоперационный периоды
В оперативной гинекологии применяют несколько доступов, сре-
ди которых основными являются нижнесрединная лапаротомия и влагалищный
доступ. При лапароскопических операциях доступами являются небольшие разре-
зы передней брюшной стенки.
Мониторинг зависит от вида и сложности операции, метода анестезии, состо-
яния пациентки.
Обеспечивают надежный венозный доступ путем катетеризации перифери-
ческой вены; при рассыпном типе периферических вен катетеризируют централь-
ную вену.
Положение на операционном столе. Положение Тренделенбурга предполагает
наклон головного конца операционного стола под определенным углом. Угол на-
клона в пределах 15—20° относительно хорошо переносят молодые пациентки без
сопутствующей экстрагенитальной патологии; у пациенток старшего возраста с
сопутствующими заболеваниями органов дыхания и сердечно-сосудистой систе-
мы даже при небольшом наклоне операционного стола могут развиться выражен-
ные гемодинамические реакции, так как при положении Тренделенбурга диаф-
рагма смещается краниально (на 30 % снижается растяжимость грудной клетки).
Изменение объема грудной полости влечет нарушения вентиляции, особенно при
сохраненном спонтанном дыхании. Вследствие нарушений вентиляции и газооб-
мена изменяется газовый состав крови, происходит увеличение кровенаполнения
легких, при этом вентиляция легких снижается, коэффициент вентиляция/крово-
ток уменьшается и развивается гипоксемия. Таким образом, положение Тренде-
447
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ленбурга может спровоцировать развитие отека легких. В результате механическо-
го сжатия нижних долей легких увеличивается риск развития краевых ателектазов.
Для данного положения характерно увеличение венозного возврата, потребности
миокарда в кислороде, ЦВД, среднего легочного давления, ДЗЛА, ВЧД (риск раз-
вития отека головного мозга), внутрибрюшного, внутригрудного, внутриглазного
давлений.
В связи с вышеуказанными изменениями у пациенток, длительно находя-
щихся в положении Тренделенбурга, при выведении из анестезии могут возник-
нуть выраженные реакции в виде дезориентации, двигательного беспокойства,
стонов, криков и др. Если этот момент сопровождается гипоксией, связанной с
неадекватным дыханием в результате остаточного действия релаксантов и цент-
рального угнетения дыхания, то существующие отек и ишемия головного мозга
усилятся и поддержат вышеописанные реакции при пробуждении, а, возможно,
и спровоцируют нарушения мозгового кровообращения. В подобных случаях
вводят седативные препараты, проводят коррекцию гиповолемии и АД, прину-
дительно не восстанавливают дыхание и сознание, цри необходимости проводят
продленную ИВЛ.
Таким образом, положение Тренделенбурга с осторожностью применяют у
больных с заболеваниями сердечно-сосудистой системы, ХОЗЛ, ожирением, гла-
укомой, склеротическими изменениями сосудов головного мозга.
Во время проведения анестезии у больных в положении Тренделенбурга при
сохраненном спонтанном дыхании увеличивается опасность развития регургита-
ции желудочного содержимого. В подобных ситуациях противопоказано исполь-
зование ларингеальной маски.
При проведении ИВЛ (особенно с положительным давлением) в положении
Тренделенбурга увеличивается опасность развития баротравмы и спонтанного на-
пряженного пневмоторакса.
Придание горизонтального положения после длительного пребывания паци-
ентки в положении Тренделенбурга (особенно при длительных эндоскопических
операциях) может сопровождаться снижением АД (до критических показателей) и
тахикардией, что связано с декомпенсацией механизмов поддержания сосудисто-
го тонуса, депонированием крови в системе мозговых артерий, скрытой гиповоле-
мией. Перевод больных в положение Тренделенбурга и обратно необходимо про-
водить медленно, а объем инфузий жидкости во время операции должен быть
минимальным. Если гипотензию не удается откорректировать увеличением объе-
ма инфузий, то используют вазопрессоры.
При использовании литотомического положения (см. рис. 9.3) во время предо-
перационного осмотра выясняют наличие ограничений подвижности в тазобед-
ренных и коленных суставах, травм позвоночника в анамнезе, особенно в пояс-
нично-крестцовой области, хронического радикулита. Поясничная боль при дли-
тельном пребывании в литотомическом положении может усугубиться, поэтому
для поддержания физиологического поясничного лордоза используют небольшие
валики.
Нижние конечности располагают в удобном для пациентки положении. Для
профилактики ятрогенного повреждения общего малоберцового нерва (невоз-
можности тыльного сгибания стопы с ее провисанием) нижние конечности не
разводят слишком широко. Если голень опирается на стойку медиальной поверх-
ностью, то не исключено повреждение подкожного нерва (онемение медиаль-
448
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
ной поверхности голени). Чрезмерное сгибание ног в тазобедренных суставах
может привести к повреждению запирательного и, реже, бедренного нервов.
Нижние конечности поднимают (или опускают) одновременно во избежание
повреждения спинальных связок. Укладывая пациентку в необходимое поло-
жение, следует осторожно перемещать ее по операционному столу, поддержи-
вая голову.
Перед изменением положения убеждаются в достаточной длине шлангов ды-
хательного аппарата для исключения возможности случайной экстубации или рас-
соединения отдельных частей дыхательного контура. Не допускают свисания верх-
них конечностей со стола при перемещении больной.
Литотомическое положение вызывает значительные функциональные изме-
нения и предрасполагает к развитию ателектазов и гипоксии в результате умень-
шения функционального остаточного объема легких.
Если литотомическое или положение Тренделенбурга используют у больных
пожилого возраста, с ожирением, сниженными дыхательными резервами, сопут-
ствующей артериальной гипертензией или аритмией, то независимо от характера
дыхания (спонтанного или аппаратного) высока вероятность развития гипоксии.
Подъем нижних конечностей резко увеличивает венозный возврат, что может при-
вести к декомпенсации ЗСН.
Поднятие нижних конечностей сразу после инъекции местного анестетика
при выполнении регионарной анестезии не повышает уровень блока и не уве-
личивает риск возникновения тяжелой артериальной гипотензии, опускание
нижних конечностей иногда приводит к артериальная гипотензии. Кроме это-
го, гипотензию потенцируют общие и, особенно, местные анестетики. Следо-
вательно, сразу же после опускания или поднятия нижних конечностей изме-
ряют АД.
Выбор метода анестезии. В зависимости от вида операции, состояния боль-
ной, наличия сопутствующей экстрагенитальной патологии, квалификации анес-
тезиолога и др. используют общую, регионарную или местную анестезию. Полост-
ные операции чаще выполняют под эндотрахеальным наркозом или эпидуральной
анестезией. Методом выбора у больных со сложной экстрагенитальной патологией
является комбинированный вариант обезболивания, сочетающий продленную эпи-
дуральную и эндотрахеальную анестезии. В последнее время при выборе варианта
анестезии отдают предпочтение общей многокомпонентной сбалансированной
анестезии.
Индукция в наркоз. Оптимальной глубиной вводного наркоза является III, ста-
дия по Гведелу. Популярным препаратом для вводного наркоза в оперативной
гинекологии по-прежнему остается тиопентал-натрий. У больных без сопутствую-
щей экстрагенитальной патологии применяют 1-2 % тиопентал-натрий в дозе
4-6 мг/кг. Препаратами выбора являются кетамин (1,5—2 мг/кг), пропофол (2 мг/кг),
этомидат (0,3 мг/кг), фторотан (до 1,5—2 об.%), сочетание фторотана и закиси
азота с кислородом (2:1).
У пациенток с заболеваниями сердечно-сосудистой и эндокринной сис-
тем, патологией почек предпочтение отдают барбитуратам, у больных с со-
путствующей патологией органов дыхания и медикаментозной аллергией —
кетамину, сочетанию ингаляционных и неингаляционных анестетиков (см.
табл. 19.14).
15 7-585
449
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Таблица 19.14. Варианты вводного наркоза на основе сочетания ингаляционных
и неингаляционных анестетиков при гинекологических операциях
Ингаляционный анестетик Неингаляционный анестетик, мг/кг Наркотический аналгетик, мкг/кг
N2O:O2 = 2:1 0,5-1 % барбитураты, 3-4 —
Кетамин, 1-1,5 —
Диазепам, 0,3 Фентанил, 1,43
Пропофол, 1,5-2 Фентанил, 1,43
Этомидат, 0,15-0,2 Фентанил, 1,43
Кетамин, 0,5-1, + диазепам, 0,15-0,2
Интубацию трахеи выполняют, согласно классическим предписаниям
(см. раздел 8.3). Используют деполяризующие мышечные релаксанты: дитилин
(1,5—2 мг/кг) после прекураризации ардуаном (0,01 мг/кг или 0,1 мг). Также воз-
можно проведение интубации трахеи с использованием только недеполяризую-
щих мышечных релаксантов, например, норкурона (0,08—0,1 мг/кг).
У больных с сопутствующей патологией легких и сердечно-сосудистой систе-
мы перед интубацией трахеи проводят преоксигенацию в течение не менее 5 мин.
ИВЛ проводят в режиме умеренной гипервентиляции с пассивным выдохом.
Чаще всего применяют полуоткрытый контур. В случае проведения тотальной
внутривенной анестезии при общем эндотрахеальном наркозе ИВЛ проводят кис-
лородно-воздушной смесью, причем количество кислорода в ней не должно пре-
вышать 40—60 %.
Поддержание анестезии. Используют неингаляционные (кетамин, пропофол,
этомидат, натрия оксибутират) и ингаляционные (фторотан, закись азота) анесте-
тики, нейролептики, атарактики, наркотические аналгетики. Приведенные в таб-
лице 19.15 варианты не исчерпывают все многообразие возможных схем поддер-
жания анестезии у больных при общей анестезии в оперативной гинекологии.
Таблица 19.15. Варианты сбалансированной анестезии
при гинекологических операциях
Торможение психического восприятия Торможение вегетативных реакций Торможение болевой афферентации Миорелаксация
N2O:O2 = 2:1 Дроперидол 2,5-5 мг через 15-30 мин (при повышении АД) Фентанил 0,2-0,3 мг до разреза кожи; затем 0,05-0,1 мг при повышении АД и ЧСС Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении —1/2 от первоначальной дозы
N2O:O2 = 2:1+ фторотан 0,5- 0,7 об.% Дроперидол 2,5-5 мг перед операцией и травматичными этапами операции; при повышении АД — 2,5 мг Фентанил 0,05-0,1 мг перед разрезом кожи и травматичным этапом операции; при повышении АД и ЧСС — 0,05 мг Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1 /2 от первоначальной дозы
450
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Продолжение табл. 19.15
Торможение психического восприятия Торможение вегетативных реакций Торможение болевой афферентации Миорелаксация
N2O:O2 = 2:1 Диазепам 0,2-0,3 мг/кг/ч; через 1,5 ч — 0,04- 0,08 мг/кг (2,5-5 мг) Дипидолор 15 мг перед разрезом кожи, затем 5—7,5 мг через 30-50 мин Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1 /2 от первоначальной дозы
N20:02 = 2:l Диазепам 0,2-0,3 мг/кг/ч; через 50-60 мин — 0,15-0,2 мг/кг Фентанил 0,15-0,2 мг перед разрезом кожи; при повышении АД и ЧСС — 0,05-0,1 мг Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1/2 от первоначальной дозы
Кетамин 2-2,5 мг/кг/ч (капельно) Диазепам 0,2-0,3 мг/кг/ч; через 50-60 мин — 0,1-0,15 мг/кг/ч Фентанил 0,1—0,2 мг перед разрезом кожи; при повышении АД и увеличении ЧСС — 0,05-0,1 мг Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1/2 от первоначальной дозы
ГОМК 70- 100 мг/кг/ч; через 40-60 мин — 35-50 мг/кг/ч Дроперидол 5-7,5 мг до разреза кожи; при повышении АД — 2,5-5 мг Фентанил 0,1—0,3 мг до разреза кожи; при увеличении ЧСС и АД — 0,05—0,1 мг Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1/2 от первоначальной дозы
Пропофол 5-6 мг/кг/ч Диазепам 0,1-0,15 мг/кг Фентанил 0,1—0,3 мг, через 20-30 мин — 0,05-0,1 мг; кетамин 0,5-0,7 мг/кг/ч Ардуан 0,04-0,06 мг/кг или норкурон 0,06 мг/кг; при повторном введении — 1/2 от первоначальной дозы
Инфузионная терапия в интраоперационный период должна компенсировать
физиологические потребности организма, потерю жидкости через операционную
рану и во время проведения ИВЛ, кровопотерю, а также сопутствующий дефицит
жидкости (потери при подготовке к операции, связанные с невозможностью энте-
рального приема жидкости и пищи) и др. По возможности коррекцию волемии
проводят до операции. В качестве инфузионных сред применяют изотонический
раствор натрия хлорида и 5 % раствор глюкозы в равных количествах.
Интраоперационные потери возмещают путем введения кристаллоидов
(6-8 мл/кг/ч). Кровопотерю до 10 % ОЦК возмещают кристаллоидами, превышая
объем кровопотери в 3—4 раза, сочетанием полиионных растворов с коллоидными
или растворами ГЭК в соотношении 1:1. При нормальном исходном гематокрите
переливание крови и ее компонентов проводят только при кровопотере, превы-
шающей 15—20 % ОЦК. При снижении величины гемоглобина до 70—80 г/л или
гематокрита до 0,2—0,3 переливают эритроцитарную массу. У пациенток пожило-
го возраста и с тяжелой сопутствующей патологией сердца или легких показанием
к переливанию крови и ее препаратов является снижение ОЦК на 10 %, гемогло-
бина — менее 90 г/л.
Эпидуральную анестезию используют при полостных и влагалищных операци-
ях. Пункцию с последующей катетеризацией эпидурального пространства выполня-
451
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ют на уровне Th12—Ц или Ц—Ц (см. раздел 13.3). Лидокаин вводят из расчета
1,4—1,5 мл/сегмент, бупивакаин — в суммарной дозе до 15 мл.
Для предупреждения “присутствия пациентки на собственной операции” ис-
пользуют кетамин (1—1,5 мг/кг) или его сочетание (0,25—0,5 мг/кг) с сибазоном
(0,14 мг/кг).
При тяжелой эндогенной интоксикации и тяжелой сопутствующей экстраге-
нитальной патологии вариантом выбора является комбинированная анестезия -
продленная эпидуральная с эндотрахеальной общей анестезией. После премеди-
кации выполняют пункцию и катетеризацию эпидурального пространства, вводят
местный анестетик, затем приступают к проведению общей анестезии. Осуществ-
ляют вводный наркоз кетамином (1,5—2 мг/кг) или 0,5—1 % тиопентал-натрием
(3—4 мг/кг) в сочетании с натрия оксибутиратом (первоначальная доза — 60—70 мг/кг).
После интубации трахеи поддерживают анестезию закисью азота с кислородом
(2:1) или ГОМКом (0,72 мг/кг/мин).
При эпидуральной анестезии увеличивают объем интраоперационных инфу-
зий до 10—15 мл/кг.
Особенности анестезиологического обеспечения гинекологических операций
У пациенток с хронической посттеморрагической железодефицитной анемией ее
коррекция в дооперационный период часто невозможна из-за циклического по-
вторения кровотечений. У этой категории больных наиболее рациональным вари-
антом анестезии является общий многокомпонентный наркоз с интубацией тра-
хеи, использованием мышечных релаксантов и проведением ИВЛ. Профилакти-
ческую премедикацию дополняют преднизолоном (30—60 мг). Для вводного наркоза
используют барбитураты (0,5 % концентрация, 4—5 мг/кг) или кетамин (1,5—2 мг/кг).
Анестезию на этом этапе целесообразно углубить диазепамом (0,14 мг/кг) и фен-
танилом (0,1 мг). Для поддержания анестезии наиболее приемлем оксибутират
натрия (70—100 мг/кг). При сопутствующей ГБ в качестве варианта анестезии ис-
пользуют атаралгезию. Кетамин, в качестве основного средства для наркоза,
фторотан и значительные дозы дроперидола не применяют.
Интраоперационную инфузионно-трансфузионную терапию проводят в ре-
жиме умеренной гемодилюции кристаллоидами, препаратами желатина и гидро-
ксиэтилкрахмала. Объем инфузионной терапии определяют из расчета 20 мл/кг.
Независимо от величины интраоперационной кровопотери при исходных показа-
телях гемоглобина менее 80 г/л и гематокрита менее 0,28—0,3 осуществляют ге-
мотрансфузию эритроцитарной массы, отмытых эритроцитов. Гемотрансфузию це-
лесообразно начинать после выполнения основного (наиболее “кровавого”) этапа
операции и удаления кровоточащего органа.
В течение анестезии и ближайшем послеоперационном периоде регулярно про-
водят мониторинг показателей гемоглобина, гематокрита, эритроцитов: каждые 4-6 ч
в течение первых послеоперационных суток и через 12 ч в течение 2-х и 3-х суток.
У больных с постгеморрагической анемией возможен пролонгированный вы-
ход из наркоза. В таких случаях не допустимы попытки медикаментозной стиму-
ляции восстановления дыхания и сознания. Проводят интенсивную терапию, ИВЛ,
коррекцию гиповолемии, контролируют адекватность послеоперационного обез-
боливания.
Если величина интраоперационной кровопотери составляет 25—30 % ОИК, то
показано проведение продленной ИВЛ до восполнения ОЦК в количественном и
качественном отношениях, нормализации гемостаза, гемодинамических показа-
телей и диуреза.
452
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
В послеоперационный период всем больным с хронической анемией прово-
дят профилактику гнойно-септических и тромбоэмболических осложнений.
У больных с гнойными тубоовариальными образованиями придатков матки опе-
рационный риск крайне высок, что связано с выраженной интоксикацией, нару-
шениями гомеостаза, значительной вероятностью развития инфекционно-токси-
ческого шока во время операции (вследствие повреждения отграничивающей кап-
сулы и прорыва инфекта), массивной кровопотерей и опасностью повреждения
близлежащих органов (кишок, мочевого пузыря).
Перечисленные неблагоприятные факторы указывают на необходимость всесто-
роннего предоперационного обследования и тщательной подготовки пациенток с
гнойными опухолями к оперативному вмешательству. Во время предоперационной
подготовки проводят антибактериальную (за 2—3 дня до предполагаемой операции,
очередную дозу антибиотика вводят за 1—2 ч до начала операции) и дезинтоксикаци-
онную терапии, корригируют нарушения гомеостаза (токсическую анемию, наруше-
ния свертывающей системы крови, токсический миокардит и др.). После операции
антибактериальную терапию расширяют внутривенным введением метронидазола,
введение которого начинают на операционном столе после окончания основного
этапа операции при стабильных гемодинамических показателях или после перевода
больной в ОИТ. Метронидазол назначают в стандартных дозах в течение 5—7 дней.
При выборе анестезии у этой категории больных отдают предпочтение обще-
му многокомпонентному наркозу с использованием релаксантов, интубации тра-
хеи и проведением ИВЛ. Премедикацию дополняют дексаметазоном (8 мг). Для
вводного наркоза применяют 0,5 % тиопентал-натрий (3—4 мг/кг) в сочетании с
сибазоном (0,2 мг/кг) и фентанилом (1,43 мкг/кг) на фоне ингаляции закиси азота
скислородом в (1:1 или 2:1), а также кетамин (1—2 мг/кг). Миоплегию обеспечивают
недеполяризующими мышечными релаксантами, например, ардуаном (0,06 мг/кг)
или сочетанием их с деполяризующими мышечными релаксантами — дитилином
(2 мг/кг), который вводят в момент интубации трахеи. Для поддержания анесте-
зии используют натрия оксибутират (первоначальная доза — 60—100 мг/кг, под-
держивающая — 30—50 мг/кг/ч) в сочетании с сибазоном (0,14 мг/кг), фентани-
лом (3,5—4 мгк/кг/ч) и закисью азота с кислородом (2:1).
В интраоперационный период инфузионную терапию проводят в режиме ге-
модилюции кристаллоидами (20~25 мл/кг) с форсированием диуреза салуретика-
ми после окончания операции. Инфузионную дезинтоксикационную терапию
продолжают в ранний послеоперационный период. Характер и темп введения ин-
фузионно-трансфузионных сред определяют индивидуально в зависимости от де-
фицита ОЦК и водно-электролитных нарушений.
Наиболее частой причиной экстренных операций в гинекологической практи-
ке является прервавшаяся внематочная беременность. Течение ее вариабельно: от
незначительного ухудшения состояния пациентки (легкого недомогания) с умерен-
ной болью внизу живота до крайне тяжелого с развернутой клиникой геморрагичес-
кого шока (резкой бледностью кожи и слизистых оболочек, заторможенностью,
отсутствием пульса на периферических сосудах, снижением АД до критического
уровня). Эктопическая беременность может прерваться в любой момент, и внешне
стабильное состояние пациентки внезапно ухудшается, вплоть до крайне тяжелого.
Единственным средством остановки кровотечения является оперативное вмеша-
тельство. Задержка операции для обследования и подготовки недопустима.
Операцию проводят при постоянном мониторинге ЧСС, АД, ЦВД, пульсо-
ксиметрии, почасового диуреза, цвета кожи и температуры тела. Результаты ла-
453
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
бораторных исследований (показатели гемоглобина, гематокрита, эритроцитов,
коагулограммы) являются вспомогательными методами оценки тяжести состоя-
ния и эффективности проводимой терапии. Не следует забывать о возможности
развития ДВС-синдрома у пациенток с гинекологическими кровотечениями, по-
этому экспресс-методы исследования свертывающей системы крови проводят с
момента поступления пациентки в стационар до момента остановки кровотече-
ния, достижения надежного гемостаза и компенсации кровопотери.
При проведении анестезии у больных с внематочной беременностью, ослож-
нившейся развитием геморрагического шока, методом выбора является много-
компонентный эндотрахеальный наркоз. В операционной помощь больной ока-
зывают, соблюдая “правило 3-х катетеров”: пунктируют 2—3 периферические вены,
катетеризируют мочевой пузырь и обеспечивают адекватную оксигенацию (до
интубации трахеи проводят преоксигенацию 100 % кислородом).
Премедикацию и вводный наркоз осуществляют на фоне быстрого темпа за-
местительной инфузионной терапии. Восполнение ОЦК проводят кристаллоида-
ми и искусственными коллоидами, а также компонентами крови (эритроцитарной
массой, отмытыми эритроцитами), при этом не допуская снижения показателей
АД менее 70 мм рт. ст. и почасового диуреза менее 15 мл.
Премедикацию выполняют на операционном столе и ограничивают, как правило,
внутривенным введением метацина (0,01 мг/кг) и глюкокортикоидов (0,7—1,5 мг/кг).
Во время вводного наркоза может развиться выраженная артериальная гипотензия,
как результат скрытой гиповолемии. В качестве основного средства для вводного
наркоза применяют кетамин (1,5—2 мг/кг) в сочетании с малыми дозами фентанила
(не более 0,05—0,1 мг) во избежание чрезмерной депрессии миокарда. У больных с
компенсированной гемодинамикой допускают использование барбитуратов (2-4 мг/кг)
в сочетании с ингаляцией закиси азота с кислородом (2:1) и малыми дозами фента-
нила (0,05 мг). При выраженной артериальной гипотензии на фоне декомпенсиро-
ванной кровопотери возможно осуществление вводного наркоза комбинацией ке-
тамина (1—1,5 мг/кг) с оксибутиратом натрия (60—80 мг/кг).
Интубацию трахеи проводят, выполняя прием Селика. Анестезию поддержи-
вают ингаляцией закиси азота с кислородом (1:1) в сочетании с инфузией натрия
оксибутирата (40—50 мг/кг/ч). После стабилизации гемодинамики анестезию уг-
лубляют сибазоном (0,14 мг/кг) и фентанилом (3—3,57 мкг/кг).
Перевод больных на самостоятельное дыхание возможен только после ком-
пенсации кровопотери, стабилизации гемодинамики, нормализации функции свер-
тывающей системы крови и, естественно, восстановления сознания и адекватного
самостоятельного дыхания. Длительность ИВЛ зависит от исходных тяжести со-
стояния и величины кровопотери.
Венозные тромбоэмболические осложнения являются одними из самых серьез-
ных, нередко приводящих к гибели, осложнений. В оперативной гинекологии ве-
нозные тромбозы могут развиться при опухолях, в послеоперационном периоде, а
также при септических осложнениях. До недавнего времени при отсутствии соот-
ветствующей профилактики венозные тромбозы были причиной гибели 10-20 %
пациенток после гинекологических операций. Чаще всего тромбоэмболические
осложнения развиваются после удаления матки и ее придатков (при злокачествен-
ных и доброкачественных опухолях).
Факторы высокого риска тромбообразования: варикозная болезнь нижних ко-
нечностей, опухоли матки и придатков больших размеров, возраст старше 45 лет,
постельный режим более 72 ч, тромбоэмболия и тромбоз вен в анамнезе, ожире-
ние, инфаркт и инсульт в анамнезе, ГБ II степени, аритмии, сепсис, ХОЗЛ, хирур-
454
19. ОБЕЗБОЛИВАНИЕ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
гические вмешательства в анамнезе, хроническая анемия, предполагаемая про-
должительность операции более 2 ч, гормональная терапия препаратами половых
стероидов перед операцией, острая кровопотеря и др.
Для оценки степени тромбоопасности до исследования свертывающей системы
крови обращают внимание на наличие клинических факторов риска. Основным про-
воцирующим фактором этого осложнения является компрессия нижней полой вены
опухолью больших размеров, что ограничивает венозный возврат из нижних конеч-
ностей. Венозные тромбозы у гинекологических больных наиболее часто возникают
при миоме матке и раке эндометрия. У больных с миомой матки увеличивается кон-
центрация фибриногена; при обследовании обнаруживают снижение времени ре-
кальцификации, толерантности крови к гепарину, что косвенно свидетельствует об
уменьшении концентрации эндогенного гепарина и, следовательно, о недостаточной
функции антитромбиновой системы гемостаза. Кроме этого, увеличивается количе-
ство тромбоцитов и активируется их агрегационная функция. Таким образом, у боль-
ных с миомами при имеющейся гиперкоагуляции и гиперагрегации тромбоцитов
снижено антитромбиновое звено гемостаза. Предтромботическое состояние системы
гемостаза также обусловлено циркуляцией антител к фосфолипидам.
Для профилактики тромбоэмболических осложнений в предоперационном пе-
риоде проводят специфические и неспецифические профилактические мероприятия.
Специфические мероприятия: за 3—5 дней до предстоящей операции назначают аце-
тилсалициловую кислоту (100 мг), за 10—12 ч до операции — фраксипарин (0,3 мл)
или другие низкомолекулярные гепарины. Неспецифические мероприятия: отсрочи-
вают проведение плановой операции до стихания клинических проявлений обостре-
ния флебита, используют эластичные бинты, гольфы, чулки для компрессии ног.
В интраоперационном периоде также проводят неспецифическую профилакти-
ку тромбоэмболических осложнений, которая заключается в гиперволемической
гемодилюции. С этой целью назначают инфузионную терапию кристаллоидами
(15-20 мл/кг) с обязательным включением низкомолекулярных коллоидных ра-
створов (реополиглюкина или высокомолекулярных гидроксиэтилированных крах-
малов) с добавлением дезагрегантов, например трентала (5 мл). Такой инфузион-
ный режим целесообразно продолжать (при отсутствии противопоказаний) в тече-
ние ближайших 2—3 послеоперационных суток. Больным с варикозным расширением
вен назначают оральные формы дезагрегантов в течение 7—10 суток послеопераци-
онного периода: трентал (100 мг 3 раза в сутки) или ксантинола никотинат (150 мг
3 раза в сутки). Целесообразен прием троксевазина (0,6 мг/сут).
В послеоперационном периоде с целью специфической профилактики тромбо-
эмболических осложнений применяют антикоагулянты: гепарин (2500 ЕД 6 раз в
сутки каждые 4 ч в течение первых 3 суток, с последующим переходом на 4-кратное
введение в течение 5—7 суток), фраксипарин (0,3 мл/сут) или клексан (40 мг 1 раз в
сутки) в течение 7—10 дней). У больных с варикозным расширением вен и сопут-
ствующей кардиальной патологией оправдано сочетание гепарина с ацетилсалици-
ловой кислотой (100 мг, начиная с 3-го послеоперационного дня). Аспирин приме-
няют в течение 3—4 недель после операции. Пациенткам, у которых профилактику
проводили низкомолекулярными гепаринами, при неосложненном течении после-
операционного периода ацетилсалициловую кислоту назначают после окончания
введения гепаринов, начиная с 5—7 послеоперационных суток.
При лапароскопических операциях (см. раздел 22.5) учитывают особенности их
проведения и, соответственно, прогнозируют возможные осложнения. Длительное
пребывание больной в положении Тренделенбурга и повышение внутрибрюшного
давления при создании пневмоперитонеума в течение операции создают условия
455
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
высокого риска развития регургитации и кислотно-аспирационного синдрома. Пнев-
моперитонеум может сопровождаться нарушениями гемодинамики (гипотензией)
вследствие компрессии крупных венозных сосудов забрюшинного пространства,
что провоцирует повышенное тромбообразование в сосудах нижних конечностей и
снижает органный артериальный кровоток. Сдавление диафрагмы чревато развити-
ем гипоксии. Увеличивается вероятность развития пневмоторакса, пневмомедиас-
тинума, газовой эмболии. Повышение ВЧД требует использования препаратов, ис-
ключающих этот эффект. При длительном пневмоперитонеуме снижается почеч-
ный кровоток, клубочковая фильтрация, что приводит к усилению синтеза
катехоламинов и др. и, соответственно, к развитию вазоконстрикции.
Давление пневмоперитонеума поддерживают в пределах 12—14 мм рт. ст. По-
вышение внутрибрюшного давления более 20 мм рт. ст. может привести к наруше-
нию венозного возврата, падению сердечного выброса, что сопровождается сни-
жением АД и особенно опасно при исходной гиповолемии.
При создании пневмоперитонеума углекислый газ быстро всасывается через
брюшину и поступает в кровоток. Образующаяся при этом угольная кислота ока-
зывает депрессивное влияние на дыхательный центр и хеморецепторы синокаро-
тидной зоны, нарушает нервно-мышечную проводимость, что при использовании
мышечных релаксантов может стать причиной их пролонгированного действия.
При неадекватной вентиляции возможно развитие гиперкапнии. Высокая кон-
центрация СО, снижает сократительную способность миокарда, ухудшает пред-
сердно-желудочковую проводимость, снижает АД, повышает тонус блуждающего
нерва, поэтому возможны случаи развития бронхоспазма и спазма сосудов почек с
нарушением их функции (водно-электролитных нарушений и патологических из-
менений в КОС). При появлении признаков гиперкапнии срочно удаляют газ из
брюшной полости и увеличивают параметры ИВЛ до состояния гипервентиляции.
При лапароскопических операциях возможна перфорация троакаром кишок,
мочевого пузыря, крупных сосудов. При развитии подобных осложнений срочно
проводят лапаротомию. Инсуффляция газа в поврежденный сосуд вызывает зна-
чительные нарушения гемодинамики (гипотензию, тахикардию) и вентиляцион-
но-перфузионные изменения, которые проявляются гипоксией.
ЛИТЕРАТУРА
1. Расстригин Н.Н. Анестезия и реанимация в акушерстве и гинекологии. -
М.: Медицина, 1978. — 336 с.
2. Рябов Г.А., Семенов В.Н., Терентьева Л.М. Экстренная анестезиология. -
М.: Медицина, 1983. — 304 с.
3. Руководство по анестезиологии/ Под ред. А.А. Бунятяна. — М.: Медицина,
1994. - 656 с.
4. Руководство по анестезиологии. В 2 томах. Том 2: Пер. с англ./ Под ред. АР.Эйткен-
хеда, Г.Смита. — М.: Медицина, 1999. — С. 152—159.
5. Кулаков В.И., Серов В.Н., Абубакиров А.М., Чернуха ЕЛ., Баранов И.И. Федорова ТА
Анестезия и реанимация в акушерстве и гинекологии. — М.: Триада-Х, 2000. — 384 с.
б. Тихомирова Н.И., Тиербаев В.Х., Боровкова Т. Ф. Оказание экстренной помощи боль-
ным пожилого и старческого возраста при острой гинекологической патологии, требую-
щей оперативного лечения// Вест, интенсивной терапии, 2000. — № 4. — С. 82-84.
7. Озолиня ЛА. Эффективность применения клексана для профилактики венозных
тромбозов в оперативной гинекологии// Акушерство и гинекология, 2000, №5. — С. 43-46.
8. Черний В.И., Кабанько Т.П., Смирнова Н.Н., Костенко В.С. Анестезия и интен-
сивная терапия в акушерстве и гинекологии. — К.: Здоров’я, 2003. — 456 с.
456
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
Анестезиологическое обеспечение большинства отоларинго-
логических операций сопровождается высоким риском развития
обструкции верхних дыхательных путей вследствие кровотечений,
аллергических и рефлекторных реакций. Анестезиологический риск
также повышен по причине высокой рефлексогенности зон опе-
раций (наличие крупных нервно-сосудистых сплетений и корот-
кого пути проведения ноцицептивной информации в ЦНС увели-
чивает опасность рефлекторного нарушения сердечной деятель-
ности), повышенной кровоточивости тканей в связи с богатым
кровоснабжением головы и шеи, что может сопровождаться цир-
куляторными и дыхательными расстройствами. Риск развития ос-
ложнений повышен при онкологических отоларингологических
операциях из-за их травматичности и обширности; обширная трав-
матизация тканей может способствовать значительному отеку в
послеоперационный период и развитию ОДН. При анестезиоло-
гическом обеспечении ЛОР-операций затруднен контроль над со-
стоянием больного и глубиной анестезии.
Исходя из вышеперечисленного, метод обезболивания при
ЛОР-операциях должен быть максимально безопасным для жиз-
ни больного, обеспечивать бескровность операционного поля и
быстрое восстановление рефлексов после окончания операции.
При хирургических вмешательствах на ЛОР-органах приме-
няют три вида анестезии: местную, комбинированную местную (в
сочетании с аналгетиками, транквилизаторами и другими препа-
ратами) и общую анестезии. Местную анестезию применяют лишь
при ограниченных оперативных вмешательствах у взрослых с ус-
тойчивой психикой.
Метод комбинированной местной анестезии прост, широко
доступен и обеспечивает удовлетворительное обезболивание при
большинстве отоларингологических операций.
Эндотрахеальный наркоз показан при онкологических опе-
рациях, по поводу ото- и риногенных внутричерепных осложне-
ний и таких, когда необходим надежный контроль функции внеш-
457
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
него дыхания и изоляция нижележащих дыхательных путей от изливающихся во
время операции крови, гноя и другого содержимого. Используют оро-, назотрахе-
альную и черезтрахеостомную интубации. Перед индукцией в наркоз проверяют
носовое дыхание, отсутствие которого является препятствием для проведения ма-
сочной ИВЛ.
В последние годы в качестве альтернативы эндотрахеальной трубке и лицевой
маске при большинстве плановых ЛОР-операций используют ларингеальную мас-
ку (см. раздел 8.4). Способ установки ее прост, малотравматичен, не требует про-
ведения прямой ларингоскопии и применения мышечных релаксантов, обеспечи-
вает надежную проходимость дыхательных путей и адекватный газообмен. Приме-
нение ларингеальной маски эффективно при различных методиках общей анестезии
со спонтанным дыханием и проведением ИВЛ у взрослых и детей. Используют
ларингеальные маски с обычными и армированными трубками, интубационные
— в качестве проводника для эндотрахеальной трубки у взрослых, фиброоптичес-
кие интубационные, в которых объединены преимущества интубационной ларин-
геальной маски и фиброоптическая визуализация голосовой щели.
Прямым показанием для интубации трахеи с помощью ФБС или фиброопти-
ческой ларингеальной маски являются прогнозируемые или выявленные анато-
мические признаки трудной интубации, которую проводят при сохраненном со-
знании и общей анестезии.
С каждым годом увеличивается тенденция широкого применения седации и
общей анестезии в детской отоларингологии. Выбор вида анестезии проводят со-
гласно оценочной шкале Пивоварова С.А. (табл. 20.1).
Таблица 20.1. Шкала оценки выбора вида анестезии (по Пивоварову С. А., 2002)
Признак 3 балла 2 балла 1 балл
Возраст, годы 1-4 4-8 8-15
Состояние Тяжелое Средней тяжести Удовлетворительное
Сопутствующие заболевания Диагностированы с клинико- лаборатор ними проявлениями Имеются, без лабораторных проявлений Отсутствуют
Травматичность операции Большая Умеренная Малая
Кровопотеря, мл Более 100 50-100 До 50
Вероятность аспирации Высокая Умеренная Низкая
Время операции, мин Более 60 20-60 До 20
Интерпретация результатов: 7—10 баллов — возможно проведение местной анестезии с се-
дацией, ингаляционного или неингаляционного наркоза при спонтанном дыхании; более 10 бал-
лов — возможно проведение комбинированной эндотрахеальной анестезии.
После наркоза при операциях по поводу заболеваний носа и придаточных
пазух, верхней челюсти, глотки и гортани проводят тщательный туалет полости
458
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
рта и глотки, контроль восстановления гортанного и глоточного рефлексов. В
случае замедленного пробуждения и восстановления адекватного спонтанного
дыхания целесообразно проведение продленной ИВЛ и ВЧИВЛ до полного про-
буждения и возобновления дыхания и рефлексов.
После некоторых операций в подчелюстной области могут развиться наруше-
ния иннервации мышц языка, мягкого неба, глотки в результате сдавления соот-
ветствующих нервов отечными тканями, после экстубации — нарушения прохо-
димости дыхательных путей при сохраненном сознании. В большинстве случаев
поддержание удовлетворительной проходимости дыхательных путей в течение не-
скольких суток достигают, применяя носоглоточный воздуховод (не интубацию
или трахеостомию), на фоне противоотечной терапии, введения антигистаминных
препаратов и стероидных гормонов в небольших дозах.
20.1. ОПЕРАЦИИ НА ПРИДАТОЧНЫХ ПОЛОСТЯХ НОСА,
В ПОЛОСТИ НОСА, КОСО- И РОТОГЛОТКИ
Наиболее распространенными операциями при заболеваниях носа,
околоносовых пазух и ротоглотки являются: полипэктомия, эндоскопические опе-
рации на околоносовых пазухах (лобной, передних, средних и задних пазухах ре-
шетчатой кости, клиновидной, верхнечелюстной), ринопластика, септопластика,
тонзилэктомия, аденоидэктомия. Эти операции по причине кратковременности
чаще проводят под местной анестезией, хотя они сопровождаются неприятными
ощущениями и болями, особенно при удалении шпор, пункциях и вскрытиях кост-
ных образований; возможно выполнение внутривенной анестезии. Главной зада-
чей анестезиолога является тщательное удаление попавшего в ротоглотку содер-
жимого, при аспирации крови в дыхательные пути — проведение бронхоскопи-
ческого туалета трахеобронхиального дерева.
При полипотомии и подслизистой резекции перегородки носа предпочтение от-
дают эндотрахеальному наркозу или внутривенной тотальной анестезии с ИВЛ,
учитывая возможную обильную кровоточивость тканей. У взрослых с уравнове-
шенной психикой возможно проведение местной анестезии с седацией. Включе-
ние в премедикацию дормикума (0,05 мг/кг) или других препаратов мидазолама
позволяет получить хороший анксиолитический эффект и значительно уменьшить
дозу основного анестетика.
Операции на околоносовых пазухах выполняют под местной анестезией с пре-
паратами НЛА или атаралгезией при спонтанном дыхании. При радикальных опе-
рациях на верхнечелюстной пазухе проводят трепанацию костей лицевого черепа,
вскрытие ячеек решетчатого лабиринта и другие болезненные манипуляции, по-
этому применяют эндотрахеальный наркоз. При фронтотомии методом выбора
является эндотрахеальный наркоз или тотальная внутривенная анестезия с ис-
пользованием пропофола и кетамина.
Обширны и травматичны операции по поводу опухолей носа, придаточных
пазух и верхней челюсти. В ряде случаев для профилактики кровотечения прово-
дят предварительную перевязку наружной сонной артерии на соответствующей
стороне. При этих операциях рекомендуют эндотрахеальный наркоз с миорелак-
сантами и ИВЛ через оротрахеальную трубку или внутривенную анестезию кета-
мином при спонтанном дыхании. При внутривенной анестезии используют орофа-
459
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
рингеальный воздуховод в связи с нарушением или полным отсутствием носово-
го дыхания.
Операции по поводу атрезии хоан проводят под эндотрахеальным наркозом
с ИВЛ.
При анестезиологическом обеспечении микроскопических эндоназальных опе-
раций необходимо помнить, что оперативные вмешательства проводят в зоне с
богатой иннервацией, возможна аспирация кровью и операционным материалом,
затруднен контроль над состоянием больного и глубиной наркоза по привычным
для анестезиолога признакам. Рекомендуют препараты быстрого действия, обес-
печивающие адекватный контроль над глубиной и управляемостью анестезии, ус-
коренный выход из наркоза.
При ринопластике, септопластике, вскрытии передних и задних пазух решетча-
того лабиринта, резекции средних и нижних носовых раковин, микрогайморотомии
методом выбора является эндотрахеальный наркоз с миорелаксантами и ИВЛ.
Целесообразно сочетание пропофола с фентанилом или фентанила с закисью азо-
та и кислородом у больных без наличия сопутствующих заболеваний, калипсола с
фентанилом — при сопутствующих сердечно-сосудистых заболеваниях. Исполь-
зование пропофола при этих операциях позволяет отказаться от проведения мето-
да управляемой гипотонии (табл. 20.2).
Таблица 20.2. Методика инфузии пропофола “шаг за шагом” с учетом аозраста
больного (Литвиненко С.Н., Тимошенко А.А., 1998)
Доза Возраст Индукция, мг/кг Поддержание, мг/кг/ч
Первые 15 мин Следующие 25 мин Далее
До 60 лет 2-2,5 12,5 9,0 6,0
Более 60 лет 1,5-1,75 10,0 6,0 5,0-6,0
Более 80 лет 1,0 8,0-9,0 6,0 5,0
Ослабленные больные 1,0-1,5 9,0 6,0-7,0 5,0-6,0
При ангиофиброме носоглотки опухоль значительно распространяется на смеж-
ные анатомические области — носоглотку, полость носа, верхнюю челюстную и
основную пазухи, глазницу. Оперативные вмешательства по поводу ангиофибро-
мы отличаются длительностью и травматичностью, сопровождаются значитель-
ной кровопотерей, что требует практически у всех больных предварительной пе-
ревязки одной или двух наружных сонных артерий. Операции проводят под эн-
дотрахеальным наркозом. Способ интубации трахеи при фибромах носоглотки
зависит от величины и распространения опухоли в ротоглотке: если обтурирована
лишь носоглотка, то проводят оротрахеальную интубацию, если опухоль распрос-
траняется в ротоглотку — проводят трахеостомию.
Следует помнить, что при ангиофиброме носоглотки нарушено носовое дыха-
ние, поэтому используют армированные эндотрахеальные трубки. Для уменьше-
ния интраоперационной кровопотери используют местные анестетики, содержа-
щие адреналин, придают головному концу операционного стола слегка возвы-
шенное положение, проводят умеренную управляемую гипотонию.
Перед операцией катетеризируют крупную вену. Для создания умеренной ги-
перволемической гемодилюции до удаления опухоли вводят внутривенно не ме-
460
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
нее 400 мл коллоидных плазмозаменителей (препаратов ГЭК) и кристаллоидов,
по показаниям — проводят гемотрансфузии.
Некоторые авторы не отмечают существенного влияния на величину крово-
потери при управляемой гипотонии. Долина О.А. (2002) рекомендует проводить
ее путем инфузии раствора арфонада или имехина в другую вену, чтобы не преры-
вать инфузионно-трансфузионную терапию. К моменту удаления опухоли систо-
лическое АД снижают до 70—80 мм рт. ст. и поддерживают на этом уровне в
течение удаления опухоли, после чего введение ганглиоблокатора прекращают.
При этой методике у 20—30 % больных показатели гемодинамики нестабильные, в
связи с чем рекомендуют во время анестезии введение клофелина и трансамина
(15-20 мг/кг) в течение всей операции. При повреждении магистральных сосудов
во время радикального удаления опухоли возможна значительная кровопотеря,
что требует от анестезиолога адекватной компенсации кровопотери.
Вариант эндотрахеального наркоза по Долиной О.А.\ премедикация — диазепам
(5 мг), в операционной — внутривенно болюсно трансамин (10—15 мг) и клофе-
лин (1,5 мкг/кг), вводный наркоз — пропофол (1,5 мг/кг) или гексенал (Змг/кг),
после введения сукцинилхолина — интубация трахеи, перед разрезом кожи —
фентанил (1,5—2,5 мкг/кг, для поддержания анестезии — 1,0—1,2 мг/кг).
Через 2—3 мин после введения клофелина и трансамина развивается выра-
женный седативный эффект: безразличие к окружающему, легкая эйфория, тен-
денция к урежению ЧСС, у некоторых больных — легкий сон. Анестезия эндотра-
хеальным методом с применением клофелина и трансамина позволяет достичь
стабильного течения наркоза при уменьшенных дозах фентанила (45 %), транкви-
лизаторов, миорелаксантов, что способствует благоприятному течению послеопе-
рационного периода с быстрым восстановлением мышечного тонуса, уменьшени-
ем случаев замедленного пробуждения (в 3 раза), снижением кровопотери в про-
цессе операции на 50—65 %, уменьшением воспаления и оптимизацией процессов
заживления по сравнению с НЛА. При выведении из наркоза необходимо по-
мнить об отсутствии носового дыхания.
Наиболее частыми оперативными вмешательствами в отоларингологии, особен-
но детской, являются тонзилэктомии и аденотомии, вариант анестезии при которых
выбирают в зависимости от возраста и пожеланий больного, привычек хирурга.
Тонзилэктомия. У взрослых, как правило, тонзилэктомию проводят под мест-
ной анестезией, которая позволяет выполнить эту операцию, но оставляя воспо-
минаний о неприятных ощущениях. С целью оптимизации анестезиологического
пособия при этих операциях рекомендуют введение мидазолама (0,35—0,4 мг/кг
внутримышечно, за 10 мин до операции), дополняют местную анестезию лидока-
ином и субанестетическими дозами кетамина (0,2—0,3 мг/кг внутримышечно). При
выраженных седативном, амнестическом и аналгетическом эффектах сохраняется
возможность контакта с больным. Мидазолам с успехом заменяет в премедикации
дроперидол и диазепам: его мощный седативный эффект позволяет проводить
травматичные операции под потенцированной анестезией, достаточно быстрое
окончание действия дает возможность использовать мидазолам в стационарной
хирургии “одного дня”.
Зарубежные специалисты методом выбора у взрослых и детей при тонзилэк-
томии считают эндотрахеальный наркоз. Проведение общей анестезии в таких
случаях затруднено, так как операционное поле расположено в непосредственной
близости от дыхательных путей, их защиту в подобных случаях обеспечивают про-
ведением интубации трахеи.
461
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
В отечественной литературе выделены показания к проведению эндотрахе-
ального наркоза при тонзилэктомии: у детей, пациентов с повышенной возбуди-
мостью и отказывающихся от местной анестезии, при непереносимости местных
анестетиков (аллергических реакциях), Наличии выраженного фиброзного пере-
рождения миндалин или обширного спаечного процесса, у больных с тиреотокси-
козом, эпилепсией, сердечно-сосудистой и бронхолегочной патологиями.
При эндотрахеальном наркозе чаще используют назофарингеальную интуба-
цию после предварительного орошения раствором лидокаина, что уменьшает отеч-
ность и облегчает проведение интубационной трубки. При аденоидах у детей при-
меняют орофарингеальную интубацию во избежание их повреждения.
Для профилактики аспирации крови головной конец операционного стола
опускают или запрокидывают голову пациента под углом 45°.
Используют комбинированную анестезию с применением внутривенных или
ингаляционных анестетиков при спонтацном дыхании или с миорелаксантами и
ИВЛ. При проведении ингаляционной анестезии в последние годы стало возмож-
ным применение режима низкого потока, позволяющего избежать отрицательных
эффектов традиционной ингаляционной анестезии (охлаждение температуры ды-
хательной смеси, плохое увлажнение, загрязнение атмосферы). Препаратом выбо-
ра является изофлюран. Применяют быстродействующий недеполяризующий ми-
орелаксант эсмерон (1 мг/кг) на фоне индукции пропофола или фентанила/тио-
пентал-натрия, что создает условия для интубации трахеи в течение 60 с.
При тонзилэктомии, как и при других операциях на ротоглотке, применяют
специальный роторасширитель со шпателем для отодвигания языка, чтобы инту-
бационная трубка не мешала хирургу. Необходимо помнить о высоком риске раз-
вития аспирации. Для этого применяют армированные, изогнутые под прямым
углом или эндотрахеальные трубки с раздувной манжетой.
Экстубацию проводят только после восстановления рефлекторной возбуди-
мости, тщательной аспирации слизи и крови из глотки и гортани, извлечения
тампонов.
Наиболее грозное осложнение тонзилэктомии — кровотечение. Его опасность
заключается в трудности определения величины кровопотери, так как больные
заглатывают кровь.
Аденотомия. По данным Мишулина Ю.В. и соавторов (2002), в течение пре-
дыдущих 50 лет аденоидные вегетации у детей диагностируют в 6 раз чаще, так как
с учетом малоэффективное™ консервативного лечения и развития осложнений в
виде отитов, полисинуситов, нарушений развития лицевого скелета и прикуса ре-
комендуют проведение оперативного лечения аденоидных вегетаций у детей.
Проблема обезболивания при аденотомиях остается актуальной. Чаше исполь-
зуют местную анестезию 10 % лидокаиновым спреем в сочетании с диазепамом,
который также применяют трансбуккальцо в виде жевательной резинки.
Хороший психоэмоциональный эффект достигают внутримышечным введе-
нием в палате в возрастных дозировках диазепама, димедрола или других антиги-
стаминных препаратов, атропина или метацина, скопаламина с аналгетиками или
без них в сочетании с субнаркотическими дозами кетамина.
Учитывая кратковременность операции, ее выполняют под внутривенной или
ингаляционной анестезией (масочным методом или с помощью ларингеальной мас-
ки). Если проводят эндотрахеальный наркоз, то применяют оротрахеальную инту-
бацию. Задачей анестезиолога является контроль чистоты дыхательных путей; при
малейшем подозрении на аспирацию проводят туалет бронхиального дерева.
462
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
20.2. ОПЕРАЦИИ НА УХЕ
И СОСЦЕВИДНОМ ОТРОСТКЕ
Наименьшие трудности для анестезиолога представляют опера-
ции на наружном ухе, так как при этом не затрагиваются дыхательные пути и
рефлексогенные зоны. Ввиду кратковременной, но выраженной болезненности
при подобных операциях методом выбора является внутривенная анестезия бар-
битуратами, пропанидидом, кетамином, пропофолом в сочетании с фентанилом
или местной анестезией операционного поля лидокаином. Возможен масочный
наркоз (или ларингеальномасочный) фторотаном с закисью азота, изофлюраном.
При пластических операциях на ушной раковине со значительной продолжитель-
ностью проводят эндотрахеальный наркоз с применением ингаляционных и неин-
галяционных анестетиков при спонтанном дыхании или с миорелаксантами и ИВЛ,
как и при операциях по поводу хемодектом и сосудистых опухолей уха. В послед-
нем случае для уменьшения кровотечения применяют умеренную искусственную
гипотонию арфонадом или имехином со снижением систолического АД к моменту
выделения опухоли до 70—80 мм рт. ст. (при нормальном исходном уровне АД).
Стапедопластика. Как и при других микрохирургических вмешательствах на внут-
реннем ухе, при стапедопластике главными задачами анестезиолога являются обес-
печение неподвижности операционного поля, предотвращение кровотечения, умень-
шение истечения перилимфы для создания “сухого” операционного поля, уменьше-
ние раздражения лабиринта с целью профилактики развития вестибулярных
расстройств (головокружения, тошноты, рвоты). Даже незначительное кровотечение
не только затрудняет выполнение операции, но и резко ухудшает ее результат.
Спонтанные дыхательные движения передаются на операционное поле более,
чем дыхательные циклы при ИВЛ, особенно высокочастотной, с помощью кото-
рой создают абсолютно неподвижное операционное поле.
Профилактику кровоточивости достигают за счет придания головному концу
операционного стола возвышенного положения, применения управляемой гипо-
тонии, с помощью инфильтрационной местной анестезии растворами местных
анестетиков с вазопрессорами.
Применение пропофола для анестезиологического обеспечения этих опера-
ций позволяет достичь необходимого гемодинамического профиля и избежать
включения в медикацию препаратов для управляемой гипотонии.
При стапедопластике, корригирующих тимпанотомиях и других операциях по
улучшению слуха периодически в течение операции необходим продуктивный
контакт с больным для оценки слышимости разговорной и шепотной речи, высо-
ких и низких частот. В связи с этим методом выбора является комбинированная
местная анестезия на этапах премедикации и в ходе анестезии препаратами НЛА в
небольших дозах или наркоз пропофолом. Для вводного наркоза используют бо-
люсные введения пропофола (2,5 мг/кг), поддержание анестезии обеспечивают
медленной внутривенной капельной инфузией (4 мг/кг/ч). При необходимости
введение препаратов прерывают; при неудовлетворительных результатах аудиаль-
ного тестирования больного вновь вводят в анестезию и продолжают операцию.
При операциях на среднем ухе не применяют закись азота из-за ее способности
активно проникать в полости, что повышает давление в среднем ухе и даже может
привести к перфорации барабанной перепонки, особенно у больных с нарушени-
ями проходимости слуховой трубы.
463
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
После операций на внутреннем ухе часто возникают вестибулярные расстрой-
ства. Хотя применение вышеуказанных видов анестезии уменьшает их частоту,
тем не менее, ведение послеоперационного периода у таких больных представляет
особую проблему — даже простой подъем головы вызывает резкое головокруже-
ние и тошноту. Частота послеоперационной тошноты и рвоты составляет 20—80 %
в зависимости от характера оперативного вмешательства и индивидуальных осо-
бенностей больного. Кроме дискомфорта, этот синдром может стать причиной
серьезных и даже фатальных осложнений: нарушений проходимости верхних ды-
хательных путей, аспирации, нарушений гемодинамики, повышения внутриче-
репного, внутрибрюшного и внутригрудного давлений, кровотечения, увеличения
продолжительности постельного режима и др. Длительная рвота может вызвать
дегидратацию и дисбаланс электролитов.
Для уменьшения этих явлений, согласно рекомендациям согласительной комис-
сии по лечению послеоперационной тошноты и рвоты, при высоком риске их разви-
тия назначают комбинацию антагонистов 5НТ3-рецепторов — ондансетрона (4—8 мл)
с дексаметазоном (5—10 мг внутривенно) и/или дроперидолом (0,625—1,25 мг внут-
ривенно). В последние годы часто используют новый антиэметик — трописетрон
(новобан), который вводят в дозе 5 мг внутривенно один раз в сутки. Антиэметики
вводят в конце операции, или лучше, как и дексаметазон, до начала индукции в
анестезию, что предотвращает развитие послеоперационных тошноты и рвоты.
При операциях по поводу внутричерепных гнойных осложнений и гнойного мас-
тоидита применяют эндотрахеальный наркоз с миорелаксантами и ИВЛ, что обус-
ловлено трудностью определения степени распространенности и локализации па-
тологического очага (местная потенцированная анестезия не обеспечивает удов-
летворительного обезболивания). Дополнение общей анестезии введением даларгина
(1мг внутривенно) на этапе премедикации и его повторное введение при длитель-
ности операции более 90 мин в той же дозе позволяет стабилизировать гемодина-
мику во время операции и в послеоперационный период, значительно уменьшить
расход наркотических аналгетиков и нейролептиков.
20.3. ОПЕРАЦИИ НА ГОРТАНИ
Наиболее частой причиной оперативных вмешательств на горта-
ни является рак гортани, реже — доброкачественные новообразования, кисты и
паралич голосовых связок.
Операции на гортани по поводу рака с метастазами в шейные лимфатические
узлы отличаются значительными объемом и продолжительностью. Эти больные
(как правило, пожилого возраста) нуждаются в значительной предоперационной
подготовке, так как ослаблены длительным прогрессирующим течением заболева-
ния, расстройствами питания, нередко предшествующим лучевым или химиоте-
рапевтическим лечением.
При расширенной ларингоэктомии по поводу рака вместе с гортанью удаляют
части пораженных соседних органов — языка, подъязычной кости, подчелюстных
слюнных желез, регионарные лимфатические узлы шеи с внутренней яремной
веной, грудинно-ключично-сосцевидную мышцу по Крайлу, иногда с резекцией
блуждающего нерва и общей сонной артерии. Эти операции часто сопровождают-
ся тяжелыми рефлекторными реакциями и значительной кровопотерей по причи-
не близкого расположения жизненно важных сосудов и крупных нервных стволов.
464
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
Метод обезболивания не должен нарушать абластику и асептику, должен уст-
ранять эмоциональное напряжение (“калечащая” операция), обеспечивать адек-
ватный газообмен, полную релаксацию, своевременное и адекватное возмещение
кровопотери, быстрое восстановление кашлевого рефлекса для предотвращения
аспирации крови и слизи в дыхательные пути.
Методом выбора является общая анестезия с эндотрахеальной интубацией
и ИВЛ.
Проведение премедикации у больных со стенозом гортани связано с опасно-
стью развития грубых нарушений дыхания, вплоть до апноэ, которые иногда не
проявляются клинически при вертикальном положении тела. Горизонтальное по-
ложение больного после премедикации способствует декомпенсации стеноза. На-
рушения дыхания могут возникнуть под действием опиоидных аналгетиков или
препаратов с выраженным снотворным эффектом. В случаях, когда возникает
подозрение на возможное развитие стеноза гортани, премедикацию ограничивают
назначением М-холинолитиков и дроперидола в небольших дозах и обеспечивают
тщательное постоянное наблюдение за больным после премедикации.
Часть авторов рекомендуют использование оротрахеальной интубации, но
проведение эндотрахеальной трубки через голосовую щель может привести к об-
семенению окружающих тканей. Кроме этого, проведение интубации часто зат-
руднено по причине изменения конфигурации гортани, нарушения ее подвижно-
сти, сужения просвета дыхательных путей, легкой ранимости слизистой. При пря-
мой ларингоскопии возможен разрыв пораженного надгортанника, травмирование
опухоли с последующими кровотечением, аспирацией и асфиксией. Таким обра-
зом, даже если интубация трахеи через рот технически осуществима, ее не реко-
мендуют проводить по соображениям абластики.
В случаях, когда опухоль вызывает значительное затруднение дыхания за счет
сужения дыхательных путей, предварительно осуществляют наложение трахеосто-
мы за 5—7 дней до операции, которую проводят лишь после исчезновения альве-
олярного отека, повышенной бронхиальной секреции и респираторного ацидоза.
При опухолях гортани с обтурацией без значительных расстройств дыхания чаще
проводят ларингоэктомию под эндотрахеальным наркозом через трахеостому од-
номоментно. Премедикацию проводят с учетом вышеуказанных особенностей.
Обнажают трахею под местной анестезией, индукцию в наркоз проводят с помо-
щью пропофола в сочетании с фентанилом, при этом используют деполяризую-
щие миорелаксанты. Вскрывают трахею и вводят в ее просвет канюлю с раздувной
манжетой армированной эндотрахеальной трубки, к которой присоединяют сте-
рильный переходник. У больных с лабильной психикой при отсутствии явлений
стеноза трахеостомию выполняют под масочным наркозом фторотаном с закисью
азота и кислородом. Для поддержания анестезии используют пропофол, натрия
оксибутират, тиопентал-натрий, НЛА.
При подобных операциях высок риск воздушной эмболии при повреждении
шейных вен, для уменьшения которой рекомендуют применять ИВЛ с перемежа-
ющимся положительным давлением. Также повышается опасность рефлекторных
нарушений гемодинамики и ритма сердца в результате хирургических манипуля-
ций в областях блуждающего и возвратного нервов, синокаротидной зоны. Для их
профилактики в премедикацию включают атропин в полной дозе, применяют ней-
роплегические средства. Избегают применения фторотана для поддержания анес-
тезии, обеспечивают достаточную глубину наркоза, используют местную инфиль-
трационную анестезию областей, близких к рефлексогенным зонам.
465
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Должное внимание уделяют фиксации тройника, эндотрахеальной трубки, гоф-
рированных шлангов; предусматривают проведение экстренных мероприятий при
выскальзывании эндотрахеальной трубки, аспирации крови в трахею, рефлекторных
нарушениях ритма сердца, возмещения довольно значительной кровопотери. Высок
риск развития эмфиземы средостения, одно- или двустороннего пневмоторакса.
Особого внимания анестезиолога в ближайший послеоперационный период
требует пробуждение больного, так как часто во время подобных операций пере-
вязывают яремную вену, в результате чего нарушается отток крови из головного
мозга. В раннем послеоперационном периоде проводят профилактику отека моз-
га, устраняют возможную гиперкоагуляцию крови.
В послеоперационный период у таких больных частично или полностью на-
рушено питание, поэтому максимально рано обеспечивают адекватное поступле-
ние энергетических и биопластических материалов — назначают смешанное пита-
ние (через зонд и парентерально).
После удаления гортани иногда возникают фарингостомы, которые закрыва-
ют при последующих пластических операциях. Эти операции проводят под эндо-
трахеальным наркозом, так как необходима тотальная мышечная релаксация, а
инфильтрация кожно-мышечного лоскута местным анестетиком изменяет его кон-
фигурацию и размеры, создавая дополнительные трудности для хирурга. Интуба-
цию проводят через длительно функционирующую трахеостому. Применение
мышечных релаксантов исключает глотательный рефлекс и создает неподвижное
операционное поле, что очень важно при пластических оперативных вмешатель-
ствах. Общую анестезию проводят, согласно классическим требованиям. В конце
операции обеспечивают полное восстановление рефлексов, проводят туалет тра-
хеобронхиального дерева с вызыванием кашля.
Длительные пластические восстановительные операции на гортаноглотке и го-
лосовых связках нередко проводят с помощью микрохирургической техники, что
требует надежной блокады гортанно-глоточных рефлексов при умеренном уровне
аналгезии с хорошим гипнотическим эффектом и стабильным поддержанием кис-
лородного гомеостаза. Этим требованиям отвечает комбинированная анестезия
пропофолом в условиях инжекционной ИВЛ (желательно высокочастотной) при
тотальной миоплегии деполяризующими или быстродействующими недеполяри-
зующими миорелаксантами. Инжекционную нормочастотную или высокочастот-
ную ИВЛ у больных с рубцовыми деформациями гортани после тяжелых травм
или онкологических операций используют только при хорошей проходимости
дыхательных путей и отсутствии препятствий вдыхаемым газам. В противном слу-
чае в кратчайшие сроки может развиться острая эмфизема легких, пневмоторакс,
нарушения гемодинамики вследствие резкого повышения давления в дыхатель-
ных путях. В случаях применения обычного эндотрахеального наркоза с назотра-
хеальной или оротрахеальной интубацией армированной трубкой малого размера
для уменьшения неблагоприятного действия ИВЛ через заведомо узкую трубку
используют режимы с отрицательным давлением на выдохе при обязательном кон-
троле газового состава крови. Подвижная, небольшого диаметра армированная
трубка позволяет хирургу свободно манипулировать даже в области голосовых свя-
зок, при этом необходимо иметь наготове набор для экстренной трахеостомии в
случае невозможности обеспечения адекватного газообмена.
Схема комбинированной анестезии. Премедикацию осуществляют фентанилом
(0,1—0,2 мг), дроперидолом (2,5—5 мг), диазепамом (2,5—5 мг). На фоне премеди-
кации обязательно проводят местную анестезию гортаноглотки 10 % раствором
466
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
лидокаина. Индукцию в наркоз осуществляют пропофолом (1,5—2 мг/кг). На фоне
миоплегии деполяризующими миорелаксантами проводят интубацию трахеи эн-
дотрахеальной трубкой малого размера (4,0—6,0 мм), обеспечивающей хорошую
визуализацию голосовых связок. Поддерживают анестезию болюсным введением
пропофола (20—40 мг) каждые 6—8 мин. Аналгезию осуществляют внутривенным
введением фентанила в течение всей операции (0,1—0,2 мг), при этом обеспечива-
ют стабильные показатели гемодинамики, пробуждение через 3—4 мин после окон-
чания операции с полным восстановлением сознания.
При других эндоларингеальных операциях анестезиологическое обеспечение
требует специального технического оснащения. При его отсутствии общую анес-
тезию осуществляют при самостоятельном дыхании больного внутривенным или
ингаляционным способом в комбинации с поверхностной местной анестезией
гортани. Из внутривенных препаратов рекомендуют препараты НЛА и атаралге-
зии. В премедикацию обязательно включают атропин, учитывая высокую рефлек-
согенность. Нежелательно применение барбитуратов и пропанидида из-за воз-
можности угнетения дыхания, хотя однократное использование для вводного нар-
коза допустимо. После индукции в наркоз препараты вводят капельно или
фракционно, обязательно контролируют показатели дыхания. После введения
операционного ларингоскопа (манипуляцию осуществляет хирург) анестезию под-
держивают, согласно инсуффляционной методике по специальному каналу ла-
рингоскопа или катетеру, введенному в трахею.
Способы, позволяющие длительное время проводить ИВЛ при открытых ды-
хательных путях — инжекционная и высокочастотная инжекционная вентиляция
легких — вытесняют ингаляционную инсуффляционную анестезию при спонтан-
ном дыхании, так как обеспечивают условия применения безопасных для больно-
го и медицинского персонала видов общей комбинированной анестезии.
20.4. ОПЕРАЦИИ НА ШЕЕ
Чаще всего операции на шее проводят по поводу нагноительных
процессов (флегмон, абсцессов, медиастинитов), метастазов опухолей ЛОР-орга-
нов в шейные лимфатические узлы (операция Крайла), кист шеи (срединной и
боковой), ранений шеи, ранней лимфонодулэктомии и др.
Методика и техника анестезии при вскрытии заглоточного абсцесса схожа с
таковыми при флегмоне полости рта и шеи и связана с высоким риском. При
тяжелом общем состоянии больного, отеке окружающих тканей, нарушениях ды-
хания (одышке, стридорозном дыхании, цианозе) проводят трахеостомию. По-
пытки интубации трахеи даже с использованием ФБС опасны, тем более вслепую,
так как могут привести к аспирации крови и гноя.
Местную анестезию (обычно смазыванием и опрыскиванием) задней стенки
глотки сочетают с введением диазепама, препаратов НЛА и атаралгезии в дозах,
не нарушающих дыхание, или в сочетании с поверхностной ингаляционной анес-
тезией. Опасно введение быстродействующих внутривенных анестетиков (барби-
туратов, пропанидида и др.), миорелаксантов, применение глубокой ингаляцион-
ной анестезии. В премедикацию включают атропин.
Ввиду неизбежного излития гноя в полость глотки некоторые хирурги опери-
руют больных в положении с “висящей головой”. Во время анестезии и операции
в полость ротоглотки помешают наконечник работающего отсоса.
467
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Одним из сложных оперативных вмешательств на шее является операция Крайла,
особенностью которой является высокая травматичность, необходимость манипу-
ляций на нервных стволах, прежде всего — на блуждающем нерве. Перевязка и
иссечение внутренней яремной вены нарушает отток крови от головного мозга,
вызывает отек мягких тканей лица и может замедлить пробуждение после нарко-
за. Методом выбора у этих больных является комбинированная общая анестезия
эндотрахеальным методом с добавлением клофелина.
Удаление срединной или боковой кисты шеи проводят под комбинированной
местной анестезией или общей с применением ларингеальной маски по причине
чрезвычайно обильной иннервации и васкуляризации, сложной топографической
анатомии шеи, близости дыхательных путей.
При ранениях шеи могут быть повреждены крупные артериальные и венозные
сосуды, гортань, трахея, что часто сопровождается массивной кровопотерей. Боль-
ные обескровлены, цианотичны, часто возбуждены. Прежде всего, проводят ин-
фузионно-трансфузионную терапию с целью выведения больного из шокового
состояния; отграничивают трахею от раны и проводят туалет трахеобронхиального
дерева. При полном пересечении трахеи интубацию осуществляют через рану.
Сразу же останавливают кровотечение, проводят туалет трахеобронхиального де-
рева. При частичном ранении гортани или трахеи оротрахеальную интубацию про-
водят до появления эндотрахеальной трубки в ране, а затем под контролем зрения
направляют ее в дистальный конец трахеи так, чтобы манжета интубационной
трубки располагалась глубже уровня раны.
®В случае госпитализации пострадавшего с ранящим предметом в области
шеи, не извлеченным из раны, проводят срочную трахеостомию под мест-
ной анестезией, так как даже небольшое смещение головы и шеи может
привести к дополнительному повреждению окружающих сосудов и нервов
острым предметом
20.5. ЭНДОСКОПИЧЕСКИЕ ВМЕШАТЕЛЬСТВА
Анестезиологическое обеспечение эндоскопических операций,
проводимых с диагностической или лечебной целью, является неотъемлемой час-
тью успешного лечения больных с инородными телами гортани, трахеи, бронхов у
детей и взрослых.
При эндоскопических вмешательствах (эзофагоскопии, диагностической и
лечебной прямой ларингоскопии, микроларингоскопии, трахеобронхоскопии,
фибробронхоскопии) необходимы глубокая миорелаксация жевательных мышц,
способствующая беспрепятственному проведению бронхоскопа в трахею и обес-
печивающая неподвижное операционное поле, адекватная оксигенация и венти-
ляция, стабильная гемодинамика.
Адекватной миорелаксации достигают путем длительной инфузии деполяри-
зующих мышечных релаксантов или недеполяризующих миорелаксантов средней
продолжительности действия (рокурониума, верокурониума, атракуриума). При
этом важно помнить о возможном риске развития II фазы блока при применении
деполяризующих мышечных релаксантов и возможной задержке восстановления
защитных рефлексов и экстубации при использовании недеполяризующих миоре-
468
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
лаксантов. Методом выбора является применение короткодействующих недепо-
ляризующих миорелаксантов, например, мивакурия.
Адекватную оксигенацию и вентиляцию при эндоскопических вмешательствах
обеспечивают несколькими способами: а) проведением интубации узкими эндо-
трахеальными трубками, лучше микроларингеальными (диаметром 4,0—6,0 мм);
б) инсуффляцией большого потока кислорода через тонкий катетер, введенный в
трахею (используют чаще при кратковременных процедурах с сохраненной функ-
цией легких); в) использованием методики периодического апноэ, при которой
периоды вентиляции, проводимой через маску или эндотрахеальную трубку, чере-
дуются с периодами апноэ, в течение которого выполняют хирургические манипу-
ляции (продолжительность каждого периода апноэ не должна превышать 2—3 мин,
определяют по показателям пульсоксиметра); г) проведением инжекционного ме-
тода ИВЛ интубационным или неинтубационным способом путем подсоединения
ручного инжектора к боковому порту ларингоскопа (при вдохе в течение 1—2 с
струя кислорода под большим давлением поступает в дыхательные пути, захваты-
вая воздух (эффект Вентури), выдох происходит пассивно). Обязателен тщатель-
ный контроль экскурсий грудной клетки для определения оптимального дыха-
тельного объема и продолжительности выдоха, чтобы избежать избыточного рас-
тяжения легких и баротравмы. Разновидностью этого метода является ВЧИВЛ,
проводимая через введенную в трахею тонкую канюлю или трубочку, инжекцией
струи дыхательной смеси с частотой 80—300 л/мин.
Минимальные интраоперационные колебания показателей гемодинамики обес-
печивают поддержанием поверхностного уровня анестезии с ее углублением ко-
роткодействующими анестетиками (пропофолом), а также проведением блокады
языкоглоточного и гортанного нерва.
Эзофагоскопия — мучительная и травматичная манипуляция, иногда довольно
продолжительная. При использовании жестких эзофагоскопов всех конструкций
проводят общую анестезию эндотрахеальным методом с миорелаксантами и ИВЛ.
Используют ингаляционные и неингаляционные анестетики; главное условие —
быстрое введение в наркоз и быстрое пробуждение. Введение миорелаксантов
позволяет произвести тщательный осмотр и извлечь инородное тело. Используют
эндотрахеальную трубку с раздувной манжетой, лучше — армированную. Перед
экстубацией проводят тщательный туалет рото- и гортаноглотки.
Прямую ларингоскопию часто сочетают с осмотром гортаноглотки для получе-
ния хирургического доступа при эндоларингеальных вмешательствах. Эти опера-
ции выполняют под общей многокомпонентной анестезией с ИВЛ. Интубация
трахеи трубками небольшого диаметра (4—5 мм) с раздувными манжетами сужает
операционное поле и приводит к развитию гиперкапнии; эту проблему решают
путем применения инжекционной ИВЛ (интубационным или неинтубационным
способом). Для эффективности неинтубационной инжекционной ИВЛ совмеща-
ют продольные оси клинка ларингоскопа и трахеи, обеспечивают проходимость
клинка ларингоскопа при использовании хирургических инструментов, препят-
ствующих формированию струи дыхательной смеси, четко согласовывают дей-
ствия хирурга и анестезиолога для прерывания ИВЛ на время, необходимое для
удаления из гортани инородных тел, мелких опухолей, крови. Необходим ларин-
госкоп с замкнутым трубчатым клинком, способным служить диффузором.
Трахеобронхоскопию проводят под общей анестезией: используют анестетики,
оказывающие минимальное повреждающее действие на газообмен и гемодинами-
ку, поддерживают эффективный газообмен при исходно сниженных дыхательных
469
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
резервах, обеспечивают эффективную блокаду стресс-реакции организма при ма-
нипуляциях тубусом бронхоскопа и инструментами.
В совершенствовании проведения поднаркозных ригидных бронхоскопий зна-
чительную роль сыграл предложенный Sanders (1967) инжекционный метод ИВЛ,
позволяющий проводить довольно длительные манипуляции в трахеобронхиаль-
ной системе в условиях негерметичного дыхательного контура у больных с выра-
женной обструкцией бронхов, при инородных телах дыхательных путей и др.
Оптимальным методом ИВЛ при бронхоскопиях является высокочастотная
струйная ИВЛ.
Фибробронхоскопия имеет ряд преимуществ и, по сути, является альтернати-
вой ригидной бронхоскопии. Ее проводят при полностью сохраненном сознании
или под общей анестезией (при сохраненном спонтанном дыхании или с помо-
щью ларингеальной маски). При фибробронхоскопии с сохраненным сознанием
проводят премедикацию атропином, димедролом, реланиумом в стандартных до-
зировках. После последовательного опрыскивания лидокаиновым спреем корня
языка, задней стенки глотки, надгортанника и голосовых связок в положении
больного сидя проводят фиброскоп, при этом больной глубоко дышит. Бифурка-
цию трахеи и бронхи опрыскивают через тубус бронхоскопа. Затем по бронхоско-
пу проводят интубацию.
Доминирующим методом общей анестезии является тотальная внутривенная
анестезия в условиях ИВЛ, оптимально — на основе пропофола.
20.6. НЕОТЛОЖНЫЕ СОСТОЯНИЯ В ОТОЛАРИНГОЛОГИИ
Острый стеноз гортани, тяжелый ларингоспазм, сильные и про-
должительные носовые кровотечения требуют проведения экстренных мероприя-
тий по обеспечению жизнедеятельности.
Острый стеноз гортани или начальной части трахеи приводит к острым рас-
стройствам дыхания. Клинические степени стенозирования дыхательных путей
имеют характерную клиническую картину: стридорозное дыхание, участие вспо-
могательной мускулатуры, вынужденное сидящее положение, цианоз, последова-
тельное нарушение сознания (возбуждение, апатия, прекоматозное состояние).
Интубацию трахеи в подобных случаях не рекомендуют, так как нет уверенности
в успешном проведении эндотрахеальной трубки за область стеноза. Методом
выбора является выполнение трахеостомии под местной анестезией. После введе-
ния через трахеостому эндотрахеальной или трахеостомической.трубки при необ-
ходимости продолжения операции показана внутривенная анестезия пропофолом
в сочетании с натрия оксибутиратом (30—40 мг/кг) или седуксеном (5—10 мг/кг) в
условиях миоплегии и ИВЛ. Обязательным является включение в премедикацию
атропина.
При возбуждении больного проведение трахеостомии под местной анестезией
представляет большие трудности, поэтому осуществляют общую анестезию, но
лишь по абсолютным показаниям. Порядок действий и особенности сходны с
таковыми при флегмонах полости рта и шеи: обязательно в премедикацию вклю-
чают атропин, не вводят внутривенно препараты и миорелаксанты до надежной
проходимости дыхательных путей, дыхательная смесь должна содержать не менее
50 % кислорода при применении ингаляционных анестетиков, глубина анестезии
не должна превышать уровень Как только удалось выключить сознание боль-
470
20. ОБЕЗБОЛИВАНИЕ В ОТОЛАРИНГОЛОГИИ
ного и снять двигательное возбуждение, максимально быстро выполняют трахео-
стомию и вводят эндотрахеальную трубку ниже места сужения. После интубации
трахеи применяют миорелаксанты и разнообразные способы обшей анестезии.
Можно попытаться улучшить проходимость дыхательных путей с помощью
введения ФБС под контролем зрения, используя местную анестезию или ингаля-
ционный наркоз. Иногда удается без насилия пройти тубусом место сужения и
даже ввести интубационную трубку достаточного диаметра. Такая техника поддер-
жания проходимости дыхательных путей создает оптимальные условия для даль-
нейшего проведения анестезии и операции.
При обструкции верхних дыхательных путей инструментом выбора для сроч-
ного осмотра гортани и глотки является инжекционный ларингоскоп, который
позволяет начать ИВЛ сразу же после устранения причины обструкции. В случае
сужения гортани применяют инжекционный бронхоскоп с тубусом малого диа-
метра. Если тубус не проходит за область стеноза, то ИВЛ осуществляют создани-
ем мощной струи дыхательной смеси при подведении бронхоскопа к области су-
жения.
При облитерирующем папилломатозе гортани для удаления папиллом прово-
дят неинтубационную инжекционную прямую ларингоскопию, при этом ИВЛ осу-
ществляют под усиленной струей кислорода, постепенно уменьшая ее давление.
№
..л
При тяжелом ларингоспазме абсолютно надежным и рациональным сред-
ством экстренного восстановления проходимости дыхательных путей явля-
ется введение миорелаксантов с последующей ИВЛ, лучше с использова-
нием неинтубационной инжекционной прямой ларингоскопии
В ряде случаев возникает необходимость в проведении операции при обиль-
ном и продолжительном носовом кровотечении, которое не поддается обычному
способу остановки (с помощью тампонады) и требует перевязки наружной сонной
артерии или эмболизации кровоточащего сосуда. В этих случаях опорожняют же-
лудок от проглоченной крови и сгустков, интубируют больного и проводят комби-
нированную анестезию с миорелаксантами и ИВЛ, возмещают кровопотерю.
ЛИТЕРАТУРА
I. Анестезиология и реаниматология под ред. Долиной О.А. — М.: ТЭОТАР-МЕД,
2002. - 551 с.
2. Короткоручко А.А. Пропофол. Современный внутривенный анестетик. — К.:
Книга плюс, 2000. — 190 с.
3. Морган мл. Дж. Э., Михаил М.С. Клиническая анестезиология Пер. с англ. —
Бином, 2003. — 298 с.
4. Пивоваров С.А. Выбор метода анестезии на основе бальной оценки в детской
отоларингологии, тез. докл. VII Всерос. съезда анестез. и реаним. — Омск, 2002. — 81 с.
5. Руководство по анестезиологии под ред. проф. Бунятяна А.А. изд. 2-е. — М.:
Медицина, 1997. — 655 с.
6. Усенко Л.В., Панченко Г.В., Слива В.И., Дудукина С.А. Рекофол в современной
анестезиологии и интенсивной терапии. — К.: Пирамида, 2004. — 75 с.
7. Чепкий Л.Т., Жалко-Титаренко В.Ф. Анестезиология и реаниматология. — К.:
Вища школа, 1983. — 350 с.
471
21. ОБЕЗБОЛИВАНИЕ В
ОФТАЛЬМОХИРУРГИИ
21.1. ПРИКЛАДНАЯ ФИЗИОЛОГИЯ
ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ
И ГЛАЗОСЕРДЕЧНОГО РЕФЛЕКСА
Показатель внутриглазного давления (В ГД) обусловлен вза-
имозависимыми показателями скорости продукции внутриглаз-
ной жидкости и скорости ее выведения. В норме ВГД составля-
ет 10—22 мм рт. ст.; ВГД считают повышенным, если оно равно
или превышает 25 мм рт. ст. Мигательные движения повышают
ВГД на 10—15 мм рт. ст., насильственное закрывание глаза — бо-
лее чем на 70 мм рт. ст.
Факторы, предрасполагающие к повышению ВГД: двигательная
активность, кашель, напряжение, рвота, нарушение венозного
оттока, гиперкарбия, повышение мышечного тонуса, артериаль-
ная гипертензия.
Факторы, предрасполагающие к понижению ВГД: применение
ганглиоблокаторов, маннитола, ацетазоламида, лекарственных
препаратов, угнетающих ЦНС, гипервентиляция, гипотермия.
Глаукома — заболевание, приводящее к повреждению зри-
тельного нерва и потере зрения; основной симптом — повыше-
ние ВГД. В США в рейтинге причин потерь зрения глаукома за-
нимает второе место. Различают две разновидности глаукомы -
открытоугольную и закрытоугольную. Открытоугольная глаукома
обычно развивается в результате хронической обструкции ликво-
ропроводящих путей и характеризуется незаметным коварным
течением без болевого синдрома. При закрытоугольной глаукоме
отток внутриглазной жидкости заблокирован сужением передней
камеры глаза; заболевание проявляется острой болью в глазу при
расширении зрачка.
При надавливании на глазное яблоко или тракции наруж-
ных мышц глазного яблока развивается глазосердечный рефлекс
(ГСР, рефлекс Даньини-Ашнера), который проявляется развитием
брадикардии. При надавливании на переднебоковые поверхности
глазных яблок в течение 20—30 с в норме ЧСС уменьшается на
472
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
8-10 уд./мин. Ретробульбарная блокада также может сопровождаться развитием
брадикардии в результате активации ГСР.
Рефлекторная дуга ГСР: n. ophthalmicus (ветвь n. trigemini, V пара ЧМН) -»
тройничный узел -» двигательное вегетативное ядро nucl. dorsalis n. vagi -» n. vagus,
X пара ЧМН.
ГСР купируют путем устранения патологической стимуляции, внутривенным
введением атропина (0,007 мг/кг) или местной инфильтрацией раствором лидокаи-
на наружных мыши глазного яблока. При повторной стимуляции рефлекс быстро
истощается.
21.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ОФТАЛЬМОЛОГИЧЕСКИХ
ЛЕКАРСТВЕННЫХ СРЕДСТВ
Местные лекарственные средства
Большинство местных офтальмологических препаратов (глазных
капель) являются концентрированными растворами, которые проявляют систем-
ный лечебный эффект после всасывания (абсорбции).
Мидриатики — это лекарстенные средства, вызывающие мидриаз (расшире-
ние зрачка): фенилэфрин, циклопентолат, атропин.
Фенилэфрин — агонист а-адренергических рецепторов — вызывает мидриаз
и вазоспазм. Если используют 10 % раствор глазных капель, то препарат суще-
ственно повышает АД и приводит к развитию аритмий. Обычно применяют 2,5 %
раствор глазных капель.
Циклопентолат может оказывать токсическое действие на ЦНС, что проявля-
ется нарушением сознания и судорогами.
Атропин — холинолитический препарат, обусловливающий развитие мидриа-
за; используют в виде глазных капель при исследовании глазного дна. Внутривен-
ное введение 0,1 % раствора атропина сульфата используют инграоперационно для
лечения брадикардии, возникшей в результате активации ГСР. Атропин может выз-
вать развитие центрального антихолинергического синдрома, который проявляется
сухостью во рту, тахикардией, возбуждением, делирием, галлюцинациями, вплоть
до потери сознания. Физостигмин (0,01—0,03 мг/кг) повышает уровень ацетилхоли-
на в структурах ЦНС и ликвидирует вышеперечисленные симптомы. При необхо-
димости повторяют введение такой же дозы физостигмина через 15—30 мин.
Миотики — это лекарстенные средства, вызывающие миоз (сужение зрачка).
Ацетилхолин — нейромедиатор, который освобождается в окончаниях всех пре-
ганглионарных вегетативных волокон и большинства постганглионарных пара-
симпатических нейронов. Ацетилхолин вызывает миоз, а также возникновение
брадикардии, гиперсаливации, бронхореи, повышенной потливости.
Препараты, понижающие ВГД: тимолол, бетаксолол, фосфалин, кокаин.
Тимолол — неселективный антагонист Р-адренергических рецепторов — сни-
жает продукцию внутриглазной жидкости и, соответственно, снижает ВГД. Из-
редка на фоне применения этого препарата развиваются атропин-резистентная
брадикардия, бронхоспазм, симптомы ЗСН, артериальная гипотензия.
Бетаксолол — селективный антагонист Р-адренергических рецепторов; при
его применении существует меньшая вероятность возникновения бронхоспазма у
больных, страдающих бронхиальной астмой.
473
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Фосфалин — антихолинэстеразный препарат — в виде глазных капель ис-
пользуют при глаукоме для получения миоза и снижения ВГД. Абсорбируясь в
системный кровоток, этот препарат необратимо связывается с плазменной холи-
нэстеразой (псевдохолинэстеразой) и угнетает ее активность в течение 2—4 не-
дель, что может стать причиной пролонгации эффекта сукцинилхолина (обычно
не более, чем на 20—30 мин).
Кокаин может потенцировать действие симпатомиметических препаратов.
Системные лекарственные средства
Диакарб — ингибитор карбоангидразы — используют для снижения ВГД. Сти-
мулируя диурез, может вызывать развитие гипокалиемии, гипонатриемии, мета-
болического ацидоза.
Маннитол — осмодиуретик — используют для снижения ВГД в течение до- и
интраоперационного периодов. Сумарную дозу препарата, не превышающую
1,5—2,0 г/кг, вводят внутривенно в течение 30—60 мин. Быстрая инфузия значитель-
ной дозы маннитола может усугубить симптомы ЗСН, вызывать отек легких, электро-
литные нарушения, артериальную гипертензию и, возможно, ишемию миокарда.
21.3. ОСОБЕННОСТИ
АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ
ОФТАЛЬМОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
21.3.1. Предоперационный период
Большинство пациентов, нуждающихся в офтальмологических
операциях, — это люди пожилого возраста с множеством сопутствующих заболе-
ваний, прежде всего — сердечно-сосудистой системы (ИБС, ГБ, ЗСН, ИМ в
анамнезе, аритмиями и др.). Осложнения со стороны сердечно-сосудистой сис-
темы являются наиболее частой причиной ухудшения состояния и повышения
летальности у офтальмохирургических больных в послеоперационный период.
У пациентов, страдающих сахарным диабетом, чаще развиваются безсимптом-
ная ишемия и инфаркт миокарда. Необходимо учитывать наличие у офтальмо-
хирургического пациента заболеваний клапанного аппарата сердца, искусствен-
ного водителя ритма сердца, внутреннего автоматического кардиовертера-дефиб-
риллятора.
При сборе анамнеза выясняют диагностированные ранее заболевания сердца
и сосудов, объем получаемой терапии, проводят ЭКГ и ЭхоКГ, при необходимос-
ти назначают консультацию кардиолога.
Осложнения со стороны органов дыхания, возникающие в послеоперацион-
ном периоде, занимают второе место среди причин послеоперационной летально-
сти в офтальмохирургии. К возникновению подобных осложнений предраспола-
гают сопутствующие заболевания органов дыхания: ХОЗЛ (эмфизема, хроничес-
кий бронхит, бронхиальная астма, пневмофиброз), рестриктивные заболевания
легких (респираторный дистресс-синдром у взрослых, аспирационный пневмо-
нит, отек легких, саркоидоз, хронический гиперсенситивный пневмонит, радиа-
ционный фиброз). Кроме этого, осложнения со стороны органов дыхания, возни-
кающие в послеоперационный период, у офтальмохирургических больных могут
474
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
быть вызваны нелегочными причинами: заболеваниями плевры с развитием фиб-
роза и образованием эксудата, деформациями грудной клетки, компрессией на
органы грудной полости со стороны диафрагмы за счет ожирения, асцита, бере-
менности, других причин повышения внутрибрюшного давления.
Перед офтальмохирургическим вмешательством выясняют наличие сопутству-
ющих заболеваний почек, печени, эндокринной системы и объем соответствую-
щей терапии.
У пациентов, страдающих сахарным диабетом, повышен риск развития скры-
той ишемии миокарда, регургитации и аспирации желудочного содержимого. Уро-
вень гликемии контролируют в течение периоперационного периода. Утром в день
операции эти пациенты получают 1/2 или 1/3 суточной дозы пролонгированного
инсулина: если уровень глюкозы менее 5 ммоль/л, то внутривенно инфузируют 5 %
раствор глюкозы; если уровень глюкозы более 11,1 ммоль/л, то гипергликемию
корректируют дробным введением простого инсулина.
У пациентов с патологическими изменениями суставов предусматривают на-
личие приспособлений для укладки на операционном столе. Если пациент прини-
мал аспирин или НПВС, то проводят предоперационное исследование показате-
лей свертывающей системы крови и функции тромбоцитов, особенно, при пред-
стоящих операциях на веке или орбите. У пациентов старше 64 лет обязательно
определяют концентрацию креатинина в плазме.
Во время предоперационного общения пациента ознакамливают с особенно-
стями оперативного вмешательства: по возможности детально объясняют этапы
предстоящей операции, включая постановку внутривенной канюли, подсоедине-
ние монитора, выполнение местной блокады, подготовку операционного поля,
накрывание лица стерильной простыней, обеспечение ингаляции кислорода; пре-
дупреждают о возможных колебаниях ВГД и развитии осложнений в послеопера-
ционный период.
Премедикация
Идеальная премедикация должна обеспечивать отсутствие тревоги у больно-
го, предупреждать возникновение тошноты и колебаний ВГД, сохранять возмож-
ность словесного контакта с больным.
©Внутримышечное введение атропина не вызывает повышения ВГД
даже у пациентов с глаукомой
С целью премедикации используют мидазолам (2—4 мг внутримышечно за
30 мин до операции или 1—2 мг внутривенно непосредственно перед выполнени-
ем ретробульбарной блокады). Альтернативой является пероральный прием диа-
зепама (5—10 мг за 1 ч до операции). В высоких дозах мидазолам и диазепам могут
провоцировать развитие мидриаза, что крайне нежелательно у больных с острой
узкоугольной глаукомой.
Если для премедикации используют наркотические аналгетики, то их комби-
нируют с одним из противорвотных препаратов, например прометазином (фенег-
раном), гидроксизином (вистарилом), дроперидолом.
Барбитураты вызывают седацию различной степени и длительности, но не
обеспечивают аналгезии, амнезии и контроля уровня тревоги.
Пациентам с повышенным риском аспирации желудочного содержимого вво-
дят метоклопрамид (10 мг внутривенно).
475
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
21.3.2. Интраоперационный период
Офтальмологические оперативные вмешательства проводят под
местной и общей анестезией. Выбор метода анестезии зависит от необходимости
контакта с пациентом, сложности и длительности оперативного вмешательства,
общего состояния и сопутствующих заболеваний, др.
Неожиданные движения тела или глаз во время микроскопических внутри-
глазных манипуляций могут вызвать повышение ВГД, кровоизлияние в сосудис-
тую оболочку глаза, выход содержимого стекловидного тела, поэтому принципи-
ально важна профилактика появления кашля, внезапных движений или мышеч-
ного напряжения.
В настоящее время считают, что проводниковая (ретробульбарная, перибуль-
барная и транскорункулярная) анестезия является оптимальным методом анесте-
зиологического обеспечения в офтальмохирургии. Из местных анестетиков в на-
стоящее время за рубежом наиболее часто используют 2 % раствор мепивакаина
(при длительности операции до 90 мин) и 0,75—1 % раствор ропивакаина (при
длительности операции до 3 ч). При проведении регионарной анестезии в офталь-
мохирургии редко используют растворы местных анестетиков с адреналином по
причине развития спазма артерий сетчатки. Ранее для облегчения диффузии мест-
ного анестетика использовали раствор гиалуронидазы, но в настоящее время эту
методику не используют из-за риска развития болезни Крейтуфельдта-Якоба.
Противопоказания к применению местных анестетиков в офтальмохирургии:
аллергические реакции, нарушения в системе свертывания крови, открытые по-
вреждения глаза, хронический кашель, клаустрофобия, неспособность длительно
находиться в горизонтальном положении, сознательный отказ пациента от мест-
ной анестезии.
21.3.2.1. Ретробульбарная анестезия
Ретробульбарную анестезию с поверхностной внутривенной седаци-
ей применяют при экстракции катаракты, пересадке роговицы, ирригации передней
камеры глаза. Этот метод используют в стационарной и амбулаторной практике, при
послеоперационном обезболивании. Обеспечивают стандартный мониторинг.
Методика проведения. Чувствительная иннервация глаза осуществляется се-
мью ветвями тройничного нерва. Ретробульбарного блока достигают путем инъек-
ции 5—7 мл раствора, состоящего из равных объемов 2 % раствора лидокаина и
0,5—0,75 % раствора бупивакаина (с добавлением адреналина 1:200 000) в мышеч-
ный конус позади глазного яблока возле цилиарного нерва. Используют иглу дли-
ной 3—5 см и диаметром 25—27 G.
Ретробульбарного пространства достигают через нижневисочный квадрант
орбиты, вводя иглу в область нижнелатерального угла глазницы. Взгляд пациента
должен быть направлен вверх и медиально, то есть положение глаза должно нахо-
диться в нейтральной или нижнемедиальной позиции, что позволяет легче прово-
дить иглу под нижней косой мышцей к ganglion ciliaris. При продвижении иглы
вводят слабый раствор анестетика для оттеснения сосудов и достигают кости ниж-
нелатерального отдела глазницы. Затем, направление иглы изменяют к верхушке
глазницы, то есть кзади, кверху и медиально. После пункции нижневисочного
квадранта орбиты проводят пробную аспирацию; если не получают крови или
ЦСЖ, то медленно вводят анестезирующий раствор. Двигательную ветвь лицевого
476
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
нерва, иннервирующую musculus orbicularis oculi, блокируют инъекцией 4—8 мл
раствора местного анестетика выше и ниже латеральной поверхности стенки ор-
биты для предупреждения мигательных движений век.
Контакт с пациентом и неподвижность головы являются важными компонен-
тами для успешного проведения блокады. Сложности при проведении ретробуль-
барной анестезии возникают у больных старческого возраста, с нарушениями слу-
ха, психозами, хроническим кашлем, непроизвольным тремором, артритами, при
наличии языкового барьера.
Во время оперативного вмешательства через лицевую маску подают свежий
воздух (10—15 л/мин). Кислородную смесь подают больным с заболеваниями ко-
ронарных артерий. Подачу кислорода прекращают при использовании диатермии.
При необходимости внутривенную седацию осуществляют до ретробульбарной
инъекии местных анестетиков. Внутривенно титрованно вводят мидазолам (0,015 мг/кг),
диазепам (0,03 мг/кг) или пропофол (0,3 мг/кг). Во время седации больные не
доступны контакту.
Проводят стандартный мониторинг с контролем вентиляции.
Осложнения ретробульбарной анестезии: непосредственная травма зрительного
нерва, ретробульбарная гематома, повышение ВГД, стимуляция ГСР, внутрисосу-
дистая инъекция местных анестетиков (судороги и депрессия миокарда), кратко-
временное апноэ (редко) без нарушений гемодинамика.
Ретробульбарную анестезию в настоящее время практически не используют
во многих странах Европы по причине высокой вероятности осложнений, глав-
ным из которых является травма зрительного нерва.
21.3.2.2. Перибульбарная анестезия
Перибульбарный блок обеспечивает диффузную анестезию глаз-
ного яблока, которая позволяет выполнять оперативные вмешательства в области
переднего (при лечении катаракты, трабекулотомии, хирургии роговицы, включая
ее трансплантацию) и заднего (при отслойке сетчатки, отслойке и пролиферации
стекловидного тела) сегментов глаза. Перибульбарная анестезия гарантирует бо-
лее длительный анестетический эффект, чем ретробульбарная, но чаще является
причиной отека конъюнктивы, что затрудняет проведение оперативного вмеша-
тельства.
Необходимы осознанное согласие больного и его способность длительное время
находиться в горизонтальном положении. Зона оперативного вмешательства должна
быть свободной от инфекции. Показатели свертывающей системы крови должны
быть в пределах нормы: содержание тромбоцитов — 150—300 х 109/л, протромби-
новое время — 11—15 с, парциальное тромбопластиновое время — менее 1,5 по
отношению к норме. Непрямые антикоагулянты подлежат отмене за 4 дня до
операции, антиагреганты (плавике, тиклид) — за 8—10 дней до операции, или эти
группы препаратов заменяют низкомолекулярными гепаринами в профилакти-
ческой дозировке (также подлежат отмене, но за 12—24 ч до операции). Прием
аспирина не отменяют.
Монофтальмия не является противопоказанием для перибульбарной анесте-
зии. Миопия с увеличением диаметра глазного яблока более 30 мм повышает риск
перфорации глаза; в таких случаях более показано проведение обшей анестезии,
но использование регионарной также возможно. Кашель и дыхательная недоста-
точность являются относительными противопоказаниями для проведения пери-
477
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
бульбарной анестезии. При ИБС, ГБ, бронхиальной астме, сахарном диабете же-
лательно проведение регионарной анестезии.
Обеспечивают стандартный мониторинг и венозный доступ. Необходима го-
товность к проведению обшей анестезии и ИВЛ.
Методика проведения. До начала хирургической обработки операционного поля
в оба глаза закапывают раствор местного анестетика для предупреждения раздра-
жающего действия на роговицу водорастворимого бетадина.
Используют иглу с тупым срезом длиной 25 мм и толщиной 25 G, шприц
объемом 10—20 мл.
Больной находится в комфортном горизонтальном положении, голову незна-
чительно приподнимают с помощью подголовника. Пациентам, которые сильно
волнуются, внутривенно вводят пропофол (10—30 мг) или фентанил (25—50 мкг).
Взгляд пациента направлен прямо. Указательным пальцем отодвигают глазное
яблоко вверх, пункцию проводят снизу от глазного яблока на границе наружной и
средней трети в перпендикулярном направлении на глубину 20—25 мм или после
продвижения на 10 мм иглу поворачивают на 45° краниально и медиально, затем
продвигают еще на 10 мм. После выполнения обязательного аспирационного тес-
та, пациента просят посмотреть вправо и влево, при этом игла не должна двигать-
ся синхронно с движениями глаза. В противном случае иглу немедленно изыма-
ют, так как это является признаком перфорации одной из глазодвигательных мыщц
или глазного яблока (1:16 000). Если двигательный тест негативный, то медленно
вводят тест-дозу анестетика (0,5—1 мл), после чего в течение последующих 2-3
мин вводят полную дозу препарата (4—12 мл). При симптомах напряженного гла-
за, птозе верхнего века и акинезии глазного яблока введение местного анестетика
прекращают.
Для полноценной анестезии часто выполняют вторую пункцию сверху: точка
инъекции — граница медиальной и средней трети. Указательным пальцем отодви-
гают глазное яблоко книзу, затем пунктируют в перпендикулярном направлении
на глубину 20—25 мм. Методика введения 4—8 мл местного анестетика такая же,
как при нижней пункции.
Осложнения: перфорация глазного яблока, кровотечение, повреждение зри-
тельного нерва и субдуральная инъекция местного анестетика (очень редко).
21.3.2.3. Транскорункулярная анестезия
Транскорункулярную анестезию используют в качестве основной
методики или при недостаточности перибульбарного блока.
Методика проведения. Открывают глаз указательным и большим пальцами ле-
вой руки, удерживают верхнее и нижнее веко. Место инъекции — carunculla. Пун-
кцию проводят в строго перпендикулярном направлении на глубину 20 мм, при
этом характерно ощущение прохождения препятствия при использовании иглы с
тупым срезом.
После проведения вышеописаных методик глаз закрывают, заклеивают пласты-
рем для предупреждения высыхания роговицы, покрывают марлевым компрессом
и осуществляют компрессию при помощи баллона Гонана с давлением 30 мм рт. ст.,
который ускоряет диффузию местного анестетика, снижает ВГД, предупреждает
развитие ишемии сетчатки. Экспозиция компрессии — 10—15 мин. Затем про-
веряют эффективность анестезии: просят пациента открыть глаз, при поднятии
пальцем верхнего века — посмотреть вправо и влево. Признаком идеальной эф-
478
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
фективности является полная неподвижность глазного яблока. Также для провер-
ки качества анестезии касаются роговицы стерильным компрессом или закапыва-
ют несколько капель физиологического раствора; при хорошем качестве анесте-
зии пациент ничего не чувствует.
21.3.2.4. Общая анестезия
Глаз является очень чувствительным и высокоиннервируемым
органом, поэтому для предупреждения движений глазного яблока, кашля, мышеч-
ного напряжения и артериальной гипертензии при необходимости проводят об-
щий эндотрахеальный наркоз. Перед интубацией используют недеполяризующие
мышечные релаксанты короткой длительности действия, а также вводят лидокаин
(1,0-1,5 мг/кг, 2 % раствор внутривенно) или орошают слизистую трахеи 4 %
лидокаиновым спреем.
Для вводного наркоза и поддержания анестезии используют ингаляционные и
неингаляционные анестетики. Кетамин редко используют для обезболивания оф-
тальмологических операций, так как он провоцирует возникновение блефароспазма,
нистагма, повышения АД и ВГД, тошноты.
В офтальмохирургии принципиально важна осторожная и быстрая экстуба-
ция: аспирируют слизь и слюну из ротоглотки, пока больной находится в глубо-
кой анестезии, за 5 мин до запланированной экстубации внутривенно вводят ли-
докаин (1,0—1,5 мг/кг) и наркотические аналгетики для угнетения кашлевого реф-
лекса. Больные должны просыпаться экстубированными и с восстановленными
защитными рефлексами дыхательных путей.
21.3.2.5. Интра- и послеоперационные осложнения
Нарушения ритма сердца. Чаще регистрируют брадикардию (ос-
новная причина — ГСР), реже — узловой ритм, желудочковые экстрасистолы,
AV-блокаду, желудочковую тахикардию, асистолию. Лечение брадикардии: пре-
кращают патологическую стимуляцию ГСР, углубляют анестезию, в случаях реф-
рактерной брадикардии внутривенно вводят атропин (7 мкг/кг), инфильтрируют
раствором лидокаина область вокруг глазных мышц.
Артериальная гипертензия. Вероятные причины: обеспокоенность, боль. Лече-
ние: лабеталол (5 мг внутривенно) и дополнительно, согласно показаний, гидро-
лазин (4 мг внутривенно).
Ретробульбарное кровотечение. Лечение: давящая повязка, отмена операции.
Если перфорировали глазное яблоко иглой для проводниковой анестезии, то не
проводят никаких мероприятий.
Судороги. Вероятная причина: ошибочное внутрисосудистое введение местно-
го анестетика. Лечение: внутривенное введение тиопентал-натрия или сибазона,
проведение ИВЛ.
Остановка дыхания. Вероятная причина: ошибочное субарахноидальное вве-
дение местного анестетика. Лечение: сердечно-легочная реанимация.
Ишемия миокарда. Лечение: ингаляция кислорода, контроль АД и ЭКГ, нит-
роглицерин под язык, консультация кардиолога.
Тошнота/рвота. Лечение: метоклопрамид (10 мг внутривенно), дроперидол
(0,625 мг внутривенно) или ондасетрон (4 мг внутривенно).
479
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
21.4. ЭКСТРАКЦИЯ КАТАРАКТЫ, ПЕРЕСАДКА РОГОВИЦЫ,
ТРАБЕКУЛОЭКТОМИЯ, ВОССТАНОВИТЕЛЬНЫЕ ОПЕРАЦИИ
НА ВЕКЕ И ГЛАЗНОМ ЯБЛОКЕ, ОПЕРАЦИИ ПО ПОВОДУ
ПТОЗА ВЕКА, РЕКОНСТРУКТИВНЫЕ ОПЕРАЦИИ НА ВЕКЕ,
УДАЛЕНИЕ КРЫЛОВИДНОЙ ПЛЕВЫ РОГОВИЦЫ
Предоперационный период
Предоперационные осмотр, оценка анестезиологического риска,
обследование, подготовка — см. раздел 21.3.1. Чаще всего для премедикации ис-
пользуют мидазолам (0,5—1,0 мг внутривенно). При повышенном риске аспира-
ции желудочного содержимого вводят метоклопрамид (10 мг внутривенно).
Интраоперационный период
Вышеуказанные операции непродолжительные, сопровождаются минималь-
ной кровопотерей.
Мониторинг: ЧСС, АД (неинвазивным методом), ЭКГ (5 отведений), пульсоксимет-
рия, капнография, визуальный контроль размеров зрачка, постоянный речевой контакт.
Положение на операционном столе: горизонтальное на спине.
Подачу кислорода осуществляют через носовой катетер. Обеспечивают готов-
ность к проведению общей анестезии и ИВЛ.
Выбор метода анестезии. С целью минимизации болезненных ощущений при
проведении ретробульбарной или перибульбарной анестезии внутривенно вводят ане-
стетики короткого действия, например ремифентанил (0,5—1 мкг/кг), альфентанил
(5—7 мкг/кг) или пропофол (30—50 мг). Дозу препарата подбирают индивидуально в
зависимости от состояния и сопутствующих заболеваний. Обычно нет необходимос-
ти в пролонгации седации, так как это создает препятствия для речевого контакта.
Проводят ретробульбарную или перибульбарную анестезию. Традиционно,
раствор анестетика состоит из равных объемов 0,5—0,75 % раствора бупивакаина и
2 % раствора лидокаина с добавлением гиалуронидазы.
Если длительность ретробульбарной анестезии недостаточна, то вводят:
1) мидазолам (0,5—2 мг) в сочетании с кетамином (10—20 мг), альфентанилом
(3—7 мкг/кг) или ремифентанилом (0,5 мкг/кг); 2) тиопентал-натрий (1-3 мг/кг) в
сочетании с фентанилом (25—50 мкг).
Возможно использование этих же комбинаций за 3—5 мин перед проведением
ретробульбарной и перибульбарной блокад.
При необходимости углубляют уровень седации и аналгезии постоянной внут-
ривенной инфузией пропофола (25—100 мкг/кг/мин), или периодическими бо-
люсными введениями мидазолама (0,25—1 мг) в сочетании с фентанилом (10-25
мкг), или инфузией ремифентанила (0,025—0,05 мг/кг/мин, титруют до получения
необходимого аналгетического эффекта). Проводят тщательный мониторинг для
своевременной диагностики угнетения дыхания.
Интраоперационную волемическую поддержку осуществляют через веноз-
ную канюлю (18 G) изотоническим раствором натрия хлорида или натрия лактата
(1,5—3 мл/кг/ч). Избыточная внутривенная инфузия приводит к растяжению мо-
чевого пузыря и провоцирует повышение АД.
Послеоперационный период
С целью обезболивания применяют ацетаминофен (парацетамол, перорально
325-1000 мг).
480
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
21.5. ПРОНИКАЮЩИЕ (ОТКРЫТЫЕ) ТРАВМЫ ГЛАЗА
Проникающие травмы глаза — это ургентные состояния, кото-
рые, как правило, происходят у соматически здоровых пациентов. Подобные травмы
сопровождаются высоким риском потери зрения по причине внезапного повыше-
ния ВГД (до 40 мм рт. ст. и более), выпадения содержимого глазного яблока в
результате кашля, плача, крика или мышечного напряжения во время индукции в
наркоз. Также у этих пациентов высок риск аспирации желудочного содержимого
вдыхательные пути.
Предоперационный период
Считают, что пациент с “условно полным желудком”, если травма глаза про-
изошла в течение 8 ч после последнего приема пищи. Для минимизации риска
развития аспирационного пневмонита уменьшают объем содержимого желудка и
снижают кислотность желудочного сока. Премедикация должна включать: мето-
клопрамид (10—20 мг внутривенно), натрия цитрат (15—30 мл внутрь непосредственно
перед индукцией в наркоз), ранитидин (50 мг внутривенно). При необходимости
устанавливают желудочный зонд перед началом операции. У детей используют ми-
дазолам (0,5—0,75 мг/кг внутрь с колой или яблочным соком в объеме 15—30 мл).
Если пациент курит или страдает бронхиальной астмой, то перед операцией
рекомендуют проведение ингаляции альбутерола (2—4 дозы).
Объем лабораторного обследования зависит от анамнеза и состояния.
Интраоперационный период
Пациентам с проникающей травмой глаза противопоказана регионарная ане-
стезия по причине повышения ВГД, поэтому проводят эндотрахеальный интуба-
ционный наркоз.
Положение на операционном столе: горизонтальное на спине.
Мониторинг: стандартный (см. раздел 21.4).
Индукция в наркоз. Для защиты дыхательных путей и предупреждения повы-
шения ВГД используют методику краш-индукции с использованием приема Сел-
лика. Применяют пропофол (1—2 мг/кг) или тиопентал-натрий (3—5 мг/кг).
Вопрос о выборе мышечного релаксанта для достижения оптимальных условий
интубации остается спорным. Сукцинилхолин (дитилин), который используют в ме-
тодике краш-индукции, кратковременно повышает ВГД, что не всегда предупрежда-
ется прекураризацией недеполяризующими миорелаксантами. В литературе нет со-
общений об усилении симптоматики травмы глаза, если дитилин вводили после пре-
дыдущего введения прекураризируюших доз недеполяризующих миорелаксантов.
Альтернативой сукцинилхолина при краш-индукции считают использование
высоких доз векурониума (0,2—0,3 мг/кг) или рокурониума (1 мг/кг).
Преждевременная попытка интубации может значительно повысить ВГД в
результате возникновения кашля и мышечного напряжения. При проведении пре-
оксигенации исключают возможность давления на глаз лицевой маской. Для умень-
шения реакции со стороны сердечно-сосудистой системы на ларингоскопию и
интубацию используют прекураризацию недеполяризующими миорелаксантами с
внутривенным введением лидокаина (1 мг/кг) и фентанила (2—3 мкг/кг). Счита-
ют, что лабеталол (5—10 мг) также ослабляет гипертензивную реакцию, но его
применяют у пациентов без острых воспалительных заболеваний дыхательных путей.
Через 4 мин после выше перечисленных действий внутривенно вводят пропофол
(1,5-2,5 мг/кг), потом — дитилин (1,5 мг/кг) и проводят интубацию.
16 7-586
481
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
У детей индукцию в наркоз осуществляют ингаляционными анестетиками
(например, севофлюраном) с использованием приема Селлика, потом обеспе-
чивают венозный доступ и проводят интубацию на фоне глубокой ингаляцион-
ной анестезии. Такая методика предупреждает плач, крик и мышечное напря-
жение.
Поддержание анестезии осуществляют ингаляционными анестетиками, прове-
дением сбалансированной или тотальной внутривенной анестезии.
Методику ингаляционной анестезии чаще применяют у детей и осуществля-
ют путем ингаляции через интубационную трубку дыхательной смеси, состоящей
из 30 % кислорода, 70 % закиси азота и изофлюрана, концентрацию которого
подбирают соответственно клинике наркоза. Альтернативно, в случаях непродол-
жительных операций или в течение последнего часа при длительных операциях
вместо изофлюрана используют севофлюран или десфлюран.
Сбалансированная анестезия включает: ингаляцию через интубационную трубку
дыхательной смеси (30 % кислорода, 70 % закиси азота, 0,5 % изофлюрана) и
внутривенное введение меперидина (0,5—1,5 мг/кг каждые 3—4 ч), либо фентани-
ла (1—10 мкг/кг дробно до исчезновения ответа на хирургические манипуляции),
либо ремифентанила (0,05—2 мкг/кг/мин). Вместо изофлюрана используют внут-
ривенную инфузию пропофола (50—200 мкг/кг/мин). В качестве альтернативы ис-
пользуют севофлюран или десфлюран.
Методика тотальной внутривенной анестезии предусматривает подачу в ды-
хательный контур 30—100 % кислорода, иногда с закисью азота, и одновремен-
ные внутривенные инфузии ремифентанила (0,25 мкг/кг/мин, за 5 мин до оконча-
ния операции инфузию прекращают) и пропофола (при длительности анестезии
менее 30 мин — 100 мкг/кг/мин, при длительности анестезии более 30 мин -
80—100 мкг/кг/мин, за 5 мин до окончания операции инфузию прекращают).
Для определения уровня нейромышечной блокады рекомендуют исполь-
зовать метод стимуляции периферического нерва. Для поддержания миорелак-
сации используют: внутривенное введение мивакуриума (в болюсной дозе -
0,1 мг/кг на 10—20 мин, в виде инфузии — 1—15 мкг/кг/мин), болюсное внут-
ривенное введение векурониума (0,025 мг/кг), рокурониума (0,6 мг/кг), цисат-
ракуриума (0,2 мг/кг), панкурониума (0,02 мг/кг), пипекурониума (0,015 мг/
кг). Миорелаксанты вводят вплоть до хирургического восстановления целост-
ности глазного яблока.
Во время поддержки анестезии избегают гиперкапнии, которая способствует
повышению ВГД.
Осложнения: повышение ВГД с выпадением содержимого глазного яблока,
аспирация желудочного содержимого.
Послеоперационный период
Экстубацию осуществляют после пробуждения и возобновления защитных
рефлексов с дыхательных путей. Аспирируют ротоглотку. Для подавления кашле-
вого рефлекса за 5 мин перед экстубацией внутривенно вводят лидокаин (1,5 мг/кг)
и наркотический аналгетик ультракороткого действия, например ремифентанил
(1—2 мкг/кг).
Осложнения: тошнота, рвота (лечение: метоклопрамид в дозе 10 мг внутривен-
но, дроперидол — 0,625 мг внутривенно, ондасетрон — 4 мг внутривенно), ссади-
на роговицы, аспирационный пневмонит (лечение: ингаляция кислорода через
лицевую маску, если больной не интубован, контроль рО,, рентгенография орга-
482
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
нов грудной клетки, антибиотики широкого спектра действия, глюкокортикоиды,
санационные ФБС).
Послеоперационное обезболивание: ацетаминофен (325—1000 мг per os), реже —
морфин (от 1—2 мг/10 мин до 10 мг внутривенно), меперидин (от 10 мг/10 мин до
50-70 мг внутривенно), гидроморфон (от 0,5—1 мг/10 мин до 6 мг внутривенно),
фентанил (от 12,5—25 мкг/5 мин до 100 мкг внутривенно), кеторолак (30 мг внут-
ривенно медленно, затем 15 мг каждые 6 ч, но не более 3 дней).
21.6. ОПЕРАЦИИ ПО КОРРЕКЦИИ КОСОГЛАЗИЯ
Предоперационный период
В офтальмохирургии косоглазие у детей является самой частой
причиной плановых оперативных вмешательств. Хотя большинство больных с этой
патологией соматически здоровы, тем не менее, чаще косоглазие диагностируют у
детей с церебральным параличом и гидроцефалией. У всех больных с патологией
скелетной мускулатуры (косоглазием, птозом) повышен риск возникновения зло-
качественной гипертермии (ЗГ), что обязательно фиксируют в истории болезни
(см. раздел 9.4.6.1). Тщательно собирают анамнез с целью выявления семейной
предрасположенности к ЗГ.
Операцию отсрочивают, если обнаруживают признаки инфекции верхних
дыхательных путей или лихорадку.
Объем лабораторного обследования зависит от анамнеза и состояния. Обяза-
тельно проводят ЭКГ и ЭхоКГ, так как у пациентов с миопатиями часто регистри-
руют функциональные нарушения сердечной деятельности.
С целью премедикации у детей используют мидазолам (0,5—0,7 мг/кг перо-
рально в 15—30 мл яблочного сока или колы). Детей предупреждают, что один или
оба глаза после операции будут закрыты повязками и в течение раннего послеопе-
рационного периода возможны нарушения зрения. Перед индукцией в наркоз внут-
ривенно вводят атропин (0,02 мг/кг) или гликопирролат (0,01 мг/кг) для ослабле-
ния ГСР.
Интраоперационный период
Проводят общий эндотрахеальный наркоз, при этом используют “чистые”
наркозные аппараты без испарителей или один из аппаратов, который в течение
ночи перед операцией очищался потоком кислорода. В аппараты ставят свежий
абсорбер углекислого газа. Готовят дантролен и запасаются льдом.
Положение на операционном столе: горизонтальное на спине.
Мониторинг: стандартный (см. раздел 21.4, тщательно контролируют темпера-
туру и ЭКГ).
Индукция в наркоз. В течение 3 мин через лицевую маску ингалируют 100 %
кислород. Иногда используют дополнительную внутривенную седацию фентани-
лом (1—3 мкг/кг) и мидазоламом (0,03—1 мг/кг). Препаратами выбора являются
тиопентал-натрий (3—5 мг/кг) или пропофол (1,5—2,5 мг/кг).
После индукции хирург проводит тест на определение тонуса внешних мышц
глаза. Внутривенно вводят недеполяризующий миорелаксант (оптимально для
профилактики возникновения ЗГ — панкурониум в дозе 0,1 мг/кг) и проводят
интубацию трахеи через рот. Также можно использовать мивакуриум, цисатраку-
риум, рокурониум в возрастных дозировках.
483
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
®При операциях по коррекции косоглазия исключают применение сукцинил-
холина, так как он может вызвать тоническую контрактуру внешних мышц
глаза и помешать хирургу в выборе верного плана оперативного вмешатель-
ства. Не используют ингаляционные анестетики и закись азота (она являет-
ся слабым триггерным агентом ЗГ)
Поддержание анестезии (см. раздел 21.5). За 30 мин до окончания операции
внутривенно вводят метоклопрамид (0,1 мг/кг), проводят санацию ротоглотки.
Осуществляют адекватную инфузионно-трансфузионную терапию изотоническим
раствором натрия хлорида или Рингер-лактата (5—10 мл/кг/ч).
Осложнения: ГСР (лечение: анестезия адекватной глубины, в случаях рефрак-
терной брадикардии внутривенно вводят атропин в дозе 0,007 мг/кг или проводят
местную инфильтрацию раствором лидокаина внешних мышц глазного яблока), ЗГ.
При возникновении внезапной немотивированной тахикардии, увеличении
рСО2 в выдыхаемом воздухе, снижении рО2, ригидности мышц, спазме musculus
masseter, повышении температуры тела (поздний симптом), повышении концент-
рации калия в плазме подозревают начало развития ЗГ. Немедленно прекращают
введение анестетиков, заменяют шланги наркозного аппарата и абсорбер СО2, по
возможности приостанавливают проведение операции, проводят гипервентиля-
цию 100 % кислородом, внутривенно вводят раствор натрия бикарбоната, 15 ЕД
простого инсулина на 500 мл 10 % раствора глюкозы, дантролен (2,5 мг/кг, при
необходимости вводят повторно в суммарной дозе 10 мг/кг), проводят наружное
охлаждение пациента льдом, катетеризируют мочевой пузырь.
Послеоперационный период
Осложнения: тошнота и рвота (лечение: метоклопрамид 10 мг внутривенно,
дроперидол 0,625 мг внутривенно, ондасетрон 4 мг внутривенно).
Обезболивание: ацетаминофен (в свечах или 15—20 мг/кг каждые 4-6 ч).
21.7. ДАКРИОЦИСТОРИНОСТОМИЯ, ЭНУКЛЕАЦИЯ,
ПЕРЕДНЯЯ И ЛАТЕРАЛЬНАЯ ОРБИТОТОМИИ
Предоперационный период
Подобные оперативные вмешательства выполняют у больных раз-
ных возрастных групп. Эти пациенты, как правило, соматически здоровы, за ис-
ключением инфекции, опухоли или травмы, которые обусловили глазную или
окологлазную патологию. Перед оперативным вмешательством учитывают преды-
дущее терапевтическое лечение, например, химиотерапию или препараты для ле-
чения глаукомы.
Объем лабораторного обследования зависит от анамнеза и состояния.
Легкая премедикация: диазепам (5-10 мг перорально за 1 ч до операции), лоразе-
пам (1—2 мг), гидроксизин (25—100 мг); средняя премедикация: мидазолам (1-2 мг
внутривенно), фентанил (25—100 мкг внутривенно); сильная премедикация: диазепам
(10 мг перорально за 1—2 часа до операции) в сочетании с морфином (0,1 мг/кг внутри-
мышечно) и скополамином (0,2—0,4 мг внутримышечно за 30—60 мин до операции).
Интраоперационный период
Проводят общий эндотрахеальный наркоз.
484
21. ОБЕЗБОЛИВАНИЕ В ОФТАЛЬМОХИРУРГИИ
Положение на операционном столе: горизонтальное на спине.
Мониторинг: стандартный (см. раздел 21.4).
Индукция в наркоз. По показаниям проводят дополнительную седацию фента-
нилом (1-3 мкг/кг) и мидазоламом (0,03—0,1 мг/кг). Используют; тиопентал-на-
трий (3-5 мг/кг), или пропофол (1,5—2,5 мг/кг), или этомидат (0,2—0,4 мг/кг).
После применения мышечных релаксантов проводят интубацию трахеи.
Поддержку анестезии осуществляют стандартно; миорелаксанты можго не ис-
пользовать. Осуществляют инфузионно-трансфузионную терапию (4—6 мл/кг/ч).
Возможно интраоперационное введение метоклопрамида (10 мг внутривенно), дро-
перидола (0,625 мг внутривенно), ондасетрона (4 мг внутривенно) за 30 мин до
окончания операции.
Послеоперационный период
Осложнения: в основном — тошнота и рвота.
Обезболивание: ацетаминофен перорально, иногда — опиоидные аналгетики
(см. раздел 21.5).
21.8. ОПЕРАЦИИ НА СЕТЧАТКЕ
Предоперационный период
Отслойку сетчатки диагностируют у пациентов разных возраст-
ных групп. Риск отслойки сетчатки повышен у детей с врожденными ретинопати-
ями и у недоношенных детей; у взрослых причинами отслойки сетчатки являются:
сахарный диабет, миопия, травмы, предыдущие оперативные вмешательства по
поводу катаракты.
У больных с сахарным диабетом (см. раздел 26.3) проводят тщательный кон-
троль и коррекцию гликемии (интраоперационная концентрация глюкозы должна
составлять 6,6—11,1 ммоль/л). Оперативное вмешательство таким больным прово-
дят утром в первую очередь.
В премедикацию включают маннитол или ацетазоламид для снижения ВГД.
Маннитол применяют в течение до- или интраоперационного периодов: общая
доза не должна превышать 1,5—2 г/кг внутривенно, вводят в течение 30—60 мин;
быстрая инфузия значительной дозы может увеличить выраженность ЗСН, отека
легких, электролитных нарушений, артериальной гипертензии и, возможно, ише-
мии миокарда. Применяют мидазолам (0,5 мг перорально у детей, 1—2 мг — у
взрослых.
Лабораторные обследования проводят в общепринятом объеме.
Интраоперационный период
Как правило, используют регионарную анестезию, но если длительность опера-
тивного вмешательства превышает 2 ч, то проводят общий эндотрахеальный наркоз.
Мониторинг: стандартный (см. раздел 21.4).
Индукция в наркоз. Применяют стандартные методики с предупреждением дав-
ления лицевой маской на поврежденный глаз.
Поддержание анестезии. Используют стандартные методики. Во время опера-
ции для внутренней тампонады поврежденной сетчатки хирурги могут использо-
вать внутриглазные инъекции определенных газов, например, сульфургексофлюо-
рида (SF6) или перфлюоропропана (C3F8). Если для анестезии используют закись
азота, то за счет ее высокой диффузионной способности внутриглазной газовый
485
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
пузырь из вышеуказанных газов может резко расшириться с нежелательным по-
вышением ВГД, что, соответственно, может нарушить кровообращение в сетчат-
ке. Для предотвращения подобных эффектов подачу закиси азота в дыхательный
контур прекращают за 15 мин до инъекции газового пузыря. При необходимости
в проведении повторной операции под общим обезболиванием закись азота не
используют в течение последующих 5 дней, если в глазное яблоко первый раз
вводили воздух; в течение 10 дней — если вводили SF6; в течение 15—30 дней —
если для внутренней тампонады использовали C3Fg.
Неожиданные движения пациента во время операции на сетчатке (иногда -
внутриглазные манипуляции) могут привести к потере зрения, поэтому обеспечи-
вают глубокую ингаляционную анестезию с использованием миорелаксантов сред-
ней длительности действия во время внутриглазного этапа операции.
Послеоперационный период
Для спокойного пробуждения и экстубации рекомендуют использовать нар-
котические аналгетики и введение лидокаина (1,0—1,5 мг/кг внутривенно за 5 мин
до экстубации). Проводят профилактику кашля, мышечного напряжения и рвоты.
Осложнения: тошнота, рвота (лечение см. в предыдущих разделах), ссадина
роговицы, кровотечение в стекловидное тело, глаукома, птоз, диплопия, потеря
зрения, инфицирование.
Обезболивание: меперидин (0,5—1 мг/кг/ч внутривенно), ретробульбарная ане-
стезия.
ЛИТЕРАТУРА
1. Martin Acquadro Anesthesia for Head and Neck Surgery; in “Clinical Anesthesia
Procedures of the Massachusetts General Hospital”, Fourth Edition, edited by J.Kenneth
Davison, William F. Eckhardt 111, Deniz A. Perese, 1993, Little, Brown and Company Boston/
Toronto/London. — P. 390—395.
2. Richard A. Jaffe, Stanley I. Samuels Anesthesiologist’s Manual of Surgical Procedures,
second edition, 1999, Lippincott Williams and Wilkins. — P. 91—112.
486
22. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЙ
Предыдущие два десятилетия в развитии хирургии ознамено-
ваны стремительным ростом количества лапароскопических опе-
раций. Это направление постепенно оттесняет “открытые” мето-
ды хирургического традиционного лечения. Малоинвазивные ме-
тоды в хирургии привлекают не только врачей, но и больных в
силу значительных преимуществ — это операции без традицион-
ных разрезов, с максимальным косметическим эффектом, значи-
тельным сокращением послеоперационного периода. Максимально
щадящие и наименее травматичные лапароскопические методы тре-
буют определенных затрат и подготовки специалистов.
22.1. ОСОБЕННОСТИ АНЕСТЕЗИОЛОГИЧЕСКОГО
ОБЕСПЕЧЕНИЯ И ПРОВЕДЕНИЯ
ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЙ
При проведении обезболивания во время лапароскопических
оперативных вмешательств необходимо учитывать метаболизм вве-
денного в брюшную полость углекислого газа, повышение внутри-
брюшного давления, положение больного на операционном столе.
Для визуализации операционного поля в брюшную полость
нагнетают углекислый газ, выбор которого был определен его
физико-химическими свойствами: он не воспламеняется, обеспе-
чивая безопасность электрокоагуляции, хорошо растворяется в
крови и тканях, создавая минимальную опасность развития газо-
вой эмболии.
Введенный в брюшную полость углекислый газ частично диф-
фундирует в кровь, таким образом, при его нагнетании в брюш-
ную полость всегда развивается определенная степень выражен-
ности гиперкапнии: в положении Тренделенбурга на фоне ИВЛ и
внутрибрюшном давлении 15 мм рт. ст. рСО2 в артериальной кро-
ви повышается в среднем на 10 мм рт. ст., рСО2 в альвеолярном
487
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
воздухе — на 4 мм рт. ст., общая растяжимость легких понижается в среднем на 25 %.
Повышенное содержание углекислого газа в крови в вышеуказанных пределах
клинически имеет незначительные проявления, подобные нарушения легко уст-
раняют небольшим увеличением минутной вентиляции легких.
ГВ!
Несмотря на малую инвазивность, все лапароскопические операции сопро-
вождаются риском возникновения потенциально опасных осложнений по
причине гиперкарбии и повышения внутрибрюшного давления
Поглощение углекислого газа организмом может привести к развитию мета-
болического ацидоза, а утечка газа под давлением в ткани и межтканевое про-
странство может обусловить возникновение подкожной эмфиземы, пневмоторак-
са, пневмомедиастиума и пневмоперикарда, вплоть до тампонады сердца.
Осложнения со стороны сердечно-сосудистой системы во время лапароскопичес-
ких операций: нарушения сердечного ритма, острая ишемия и инфаркт миокарда,
отек легких, газовая эмболия правых отделов сердца и сосудов малого круга кро-
вообращения, тромбоз глубоких вен в системе нижней полой вены, тромбоэмбо-
лия легочной артерии. Некоторые из осложнений довольно редки, но чрезвычай-
но опасны.
Причиной возникновения аритмий является респираторный ацидоз, на фоне
которого повышается тонус симпатического отдела вегетативной нервной систе-
мы. Использование галогенсодержащих анестетиков (особенно галотана) усугуб-
ляет это состояние.
Существенное повышение рСО, в артериальной крови (до 70 мм рт. ст. и
более) может развиться при проведении общей анестезии с сохранением спонтан-
ного дыхания и при развитии эмболии легочной артерии углекислым газом в тече-
ние интра- и послеоперационного периодов. Небольшие количества углекислого
газа при попадании в сосуды не представляют опасности, так как он быстро ра-
створяется в плазме и выделяется через легкие, но значительная болюсная доза
СО, при попадании в сосудистое русло представляет угрозу для жизни пациента
Важным этиологическим фактором в развитии венозной эмболии углекислым га-
зом является высокое внутрибрюшное давление (более 15 мм рт. ст.). Установле-
но, что углекислый газ под давлением может попадать в зияющие венозные сосу-
ды, целостность которых нарушается в результате хирургических манипуляций.
Кроме этого, эмболия углекислым газом может развиться при ошибочной внутри-
сосудистой постановке иглы, через которую СО, нагнетают в брюшную полость.
Немедленное устранение пневмоперитонеума может приостановить дальнейшее
прогрессирование эмболии. Необходим строгий контроль внутрибрюшного дав-
ления и поддержание его показателей на уровне не более 15 мм рт. ст.
Признаки массивной эмболии углекислым газом легочной артерии: снижение си-
столического АД, появление грубого шума над легочной артерией, цианоз кожных
покровов и слизистых оболочек, резкое снижение насыщения гемоглобина кисло-
родом.
Повышение внутрибрюшного давления в зависимости от величины может
оказывать два противоположных эффекта на гемодинамику: при показателе до
30 мм рт. ст. происходит вытеснение крови из органов брюшной полости, в ре-
зультате чего увеличиваются венозный возврат крови к сердцу и сердечный выб-
рос; при показателе более 30 мм рт. ст. венозный отток от нижних конечностей и
таза затрудняется, в результате чего снижаются венозный возврат крови к сердцу
488
22. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛАПАРОСКОПИЧЕСКИХОПЕРАЦИЙ
и сердечный выброс. У относительно здоровых пациентов с пневмоперитонеумом
15 мм рт. ст. сердечный выброс практически не изменяется или слегка повышает-
ся (в горизонтальном положении ЦВД повышается на 8 мм рт. ст., в положении
Тренделенбурга — на 6 мм рт. ст.).
При лапароскопических операциях фундопликации и кардиомиотомии ис-
пользуют стандартное положение Фовлера с приподнятым головным концом —
положение, при котором нарушения венозного кровотока более выражены и чаще
сопровождаются значительным снижением сердечного выброса и АД (особенно у
пациентов с сопутствующей патологией сердечно-сосудистой системы). Систем-
ное сосудистое сопротивление при карбоксиперитонеуме может значительно уве-
личиваться, вызывая повышение систолического и диастолического показателей
АД, а сердечные выброс и индекс при этом могут снижаться. Эти изменения не-
редко сохраняются в течение первых часов после завершения операции.
Повышение внутрибрюшного давления приводит к высокому стоянию диаф-
рагмы, что является причиной сдавления легких (уменьшается ФОБ, повышаются
эластическое сопротивление легких, мертвое легочное пространство, риск разви-
тия ателектазирования, нарушаются вентиляционно-перфузионные соотношения)
с последующим возможным развитием рестриктивного легочного синдрома. Эти
нарушения способствуют развитию гиперкапнии, возникают в течение первых минут
наложения карбоперитонеума и регрессируют сразу после окончания операции.
Все параметры дыхания компенсируют ИВЛ с мониторинговым контролем рСО2 в
выдыхаемом воздухе. Режим вентиляции устанавливают с учетом поддержания
нормокапнии, которая снижает риск развития аритмий.
Оптимальным вариантом анестезии при лапароскопических оперативных вме-
шательствах является эндотрахеальный интубационный наркоз с применением
миорелаксантов и ИВЛ. Обязательно устанавливают желудочный зонд с целью
декомпрессии и опорожнения желудка, что также снижает риск перфорации же-
лудка операционными троакарами.
Миорелаксанты позволяют получить адекватный пневмоперитонеум при низ-
ком внутрибрюшном давлении и избежать неблагоприятных эффектов и осложне-
ний, связанных с высоким внутрибрюшным давлением. Оптимальным является
использование недеполяризующих миорелаксантов короткого действия — векуро-
ниума, атракуриума, рокурониума.
Учитывая нежелательные эффекты (см. раздел 7.7.1), большинство специа-
листов рекомендует исключать закись азота из вдыхаемой смеси при проведении
обшей анестезии во время лапароскопических оперативных вмешательств. Реко-
мендуют заменять закись азота пропофолом.
22.2. ЛАПАРОСКОПИЧЕСКИЕ ОПЕРАЦИИ
НА ЖЕЛЧЕВЫВОДЯЩИХ ПУТЯХ
Лапароскопическая холецистэктомия является золотым стандар-
том хирургического лечения желчнокаменной болезни во всем мире. При сравне-
нии результатов открытой и лапароскопической холецистэктомий оказалось, что
жизненно важные функции организма меньше страдают и быстрее восстанавлива-
ются у больных после лапароскопических вмешательств. С возрастанием попу-
лярности лапароскопической хирургии большинство открытых холецистэктомий
489
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
теперь производят только крайне тяжелым больным или в случае, когда нет воз-
можности проведения лапароскопической операции.
Лапароскопические операции на желчевыводящих путях проводят при удале-
нии камней из желчных протоков, полипозе желчного пузыря, опухолях желчных
протоков и др.
Предоперационный период
Боль, возникающая в результате острого воспалительного процесса в брюш-
ной полости, вызывает неподвижность и вынужденное положение, которые нару-
шают дыхательную функцию легких. Тахипноэ, гиперпноэ и остро развившийся
респираторный алкалоз являются клиническими признаками сепсиса или резуль-
татом болевого синдрома при воспалении желчного пузыря.
Как правило, у больных диагностируют гиповолемию при лихорадке, рвоте и
ограничении приема жидкости. Гемодинамический статус определяют путем изме-
рения АД и ЧСС в горизонтальном и вертикальном положениях: если диагностиру-
ют ортостатическую гипотензию, то проводят регидратацию до улучшения гемоди-
наммческмх показателей. Боли в эпигастральной области, связанные с патологией
желчевыводящих путей, могут маскировать симптомы ишемии миокарда.
У больных с обструктивной (механической) желтухой могут развиться явле-
ния гепаторенального синдрома, который проявляется элементами почечной не-
достаточности и артериальной гипертензии. Причиной развития этого осложне-
ния является снижение почечной перфузии, связанное с избыточной продукцией
эндотелина.
У пациентов с желчным перитонитом регистрируют напряжение брюшной
стенки и паралитическую кишечную непроходимость с повышением внутрибрюш-
ного давления, поэтому проведение лапароскопических вмешательств у таких па-
циентов не рекомендуют.
Цирроз печени (даже средней степени) существенно повышает риск возник-
новения кровотечений. Наличие портальной гипертензии повышает сложность и
длительность оперативного вмешательства, интраоперационную кровопотерю.
Проводят общий анализ крови с определением лейкоцитарной формулы и
количества тромбоцитов; определяют концентрацию мочевины, креатинина, би-
лирубина, АЛТ и ACT, щелочной фосфатазы, альбумина; исследуют коагулограм-
му и общий анализ мочи. Обычно обнаруживают лейкоцитоз со сдвигом лейкоци-
тарной формулы влево; возможны нарушения синтеза факторов свертываемости
крови. В зависимости от анамнеза и результатов физикального осмотра проводят
рентгенографию грудной клетки, ЭКГ, др.
С целью премедикации применяют меперидин (0,5—0,6 мг/кг внутривенно),
поскольку он, по сравнению с другими опиатами, в наименьшей степени вызыва-
ет спазм сфинктера Одди, который препятствует интраоперационному проведе-
нию холангиографии и является причиной боли. Введение налоксона (0,4 мг внут-
ривенно) устраняет этот побочный эффект опиатов.
Вместе с опиатами вводят атропин (0,4—0,6 мг внутримышечно или внутри-
венно) или гликопирролат (0,2—0,3 мг внутримышечно или внутривенно), кото-
рые также снижают спазм сфинктера Одди.
Витамин К (10 мг/сут внутримышечно в течение 3 дней) применяют при уве-
личении показателя протромбинового времени.
У пациентов с повышенным риском аспирации желудочного содержимого ис-
пользуют ранитидин (50 мг внутривенно) или метоклопрамид (10 мг внутривенно).
490
22. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЙ
Интраоперационный период
Проводят общий эндотрахеальный наркоз.
Положение на операционном столе. Положение Тренделенбурга используют во
время постановки в брюшную полость троакаров. Это положение предрасполагает
к повышению венозного возврата крови к сердцу, уменьшению емкости легких и
потенциально усложняет интубацию. После постановки троакаров больного укла-
дывают в горизонтальное положение на спине.
Венозный доступ осуществляют венозной канюлей (16—18 G), инфузионно-
трансфузионную терапию — переливанием теплого изотонического раствора на-
трия хлорида или Рингер-лактата (8—12 мл/кг/ч). Катетеризируют мочевой пу-
зырь и устанавливают назогастральный зонд.
Мониторинг: ЧСС, АД (неинвазивным методом), ЭКГ (5 отведений), пульсок-
симетрия, капнография, пищеводная или прекардиальная стетоскопия, стимуля-
ция периферического нерва, контроль температуры, визуальное наблюдение за
больным.
Вводный наркоз. Если операцию проводят по ургентным показаниям, то счи-
тают, что у больного условно полный желудок. У пациентов с повышенным рис-
ком аспирации желудочного содержимого применяют методику краш-индукции.
Для снижения кислотности и объема желудочного содержимого используют ра-
нитидин (50 мг внутривенно за 30—60 мин до индукции в наркоз), метоклопра-
мид (5-10 мг внутривенно за 30—60 мин до индукции), раствор натрия цитрата
(30 мл внутрь непосредственно перед индукцией в наркоз).
Проводят преоксигенацию около 3 мин, затем — прекураризацию тубокурари-
ном (3 мг за 3—5 мин до введения сукцинилхолина). При использовании приема
Селлика вводят: этомидат (0,1—0,4 мг/кг), тиопентал-натрий (3—5 мг/кг), кетамин
(1 мг/кг) или пропофол (1,5—2,5 мг/кг). Если сукцинилхолин (1,5 мг/кг) противо-
показан, то используют рокурониум (1,2 мг/кг). Осуществляют интубацию трахеи
при полной релаксации больного. Проводят контроль вентиляции по данным визу-
ального обследования, аускультации легких и данных аппаратного мониторинга.
Фиксируют эндотрахеальную трубку, ставят назогастральный зонд и эвакуируют
содержимое желудка. При неудачной попытке интубации — см. раздел 8.3.4.2.
У больных без риска аспирации желудочного содержимого проводят оксиге-
нацию в течение 1—3 мин 100 % кислородом, затем применяют предоперацион-
ную аналгоседацию: фентанил (1—3 мкг/кг) в сочетании с мидазоламом (0,03—0,1
мг/кг). Вводный наркоз: тиопентал-натрий (3-5 мг/кг), пропофол (1,5—2,5 мг/кг
дробно) или этомидат (0,2—0,4 мг/кг). Необходимо помнить, что применение про-
пофола и этомидата не дает пролонгированной аналгезии. Для обеспечения мио-
релаксации во время интубации используют недеполяризующие миорелаксанты.
Поддержание анестезии осуществляют, согласно стандартным методикам, за ис-
ключением использования закиси азота, которая способствует растяжению кишеч-
ника. Используют ингаляционную анестезию из 100 % кислорода и изофлюрана; при
коротких оперативных вмешательствах или в течение последнего часа при длитель-
ных операциях в качестве альтернативы вместо изофлюрана используют севофлю-
ран или десфлюран.
Методика сбалансированной анестезии: О2 + изофлюран (0,5 %), или пропо-
фол (50-200 мкг/кг/мин) в сочетании с меперидином (0,5—1,5 мг/кг каждые 3—4 ч),
фентанилом (1—10 мкг/кг до исчезновения ответа организма на хирургическую
стимуляцию) или ремифентанилом (0,05—2 мкг/кг/мин до исчезновения ответа
организма на хирургическую стимуляцию).
491
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Методика тотальной внутривенной анестезии: 30—100 % О2 + ремифентанил (для
индукции в наркоз — 1 мкг/кг/мин, для поддержания анестезии — 0,25 мкг/кг/мин) +
пропофол (для индукции в наркоз — болюсно 1 мг/кг, для поддержания анестезии
менее 30 мин — в виде инфузии 100 мкг/кг/мин, для поддержания анестезии
более 30 мин — в виде инфузии 80—100 мкг/кг/мин).
Если необходима длительная мышечная релаксация, то используют несколь-
ко разновидностей мышечных релаксантов при обязательном проведении методи-
ки стимуляции периферического нерва: миорелаксанты короткой продолжитель-
ности действия — мивакуриум (0,1 мг/кг через каждые 10—20 мин или в виде
непрерывной инфузии 1—15 мкг/кг/мин); миорелаксанты средней продолжитель-
ности действия — векурониум (0,025 мг/кг каждые 30 мин), рокурониум (0,6 мг/кг
каждые 30 мин) или цисатракуриум (0,2 мг/кг каждые 40 мин); миорелаксанты
длительного действия — панкурониум (0,02 мг/кг каждые 60—90 мин) или пипер-
курониум (0,015 мг/кг каждые 60—90 мин).
Внутрибрюшное нагнетание СО2 сопровождается повышением внутрибрюш-
ного давления и гиперкапнией (повышением давления в дыхательном контуре на
вдохе, снижением напряжения О2 и повышением напряжения СО, в крови), что
корректируют ИВЛ.
Осложнения: пневмоторакс (снижение рО2, повышение давления в дыхатель-
ном контуре на вдохе, повышение ЧСС, снижение АД, возможно появление под-
кожной эмфиземы), смещение эндотрахеальной трубки, гипотензия (за счет умень-
шения венозного возврата крови к сердцу, особенно, при повышении внутри-
брюшного давления более 15 мм рт. ст.), кровотечение, эмболия углекислым газом
(см. выше), повреждение внутренних органов (возможен переход на открытую
методику), гипотермия (по причине инсуффляции в брюшную полость сухого хо-
лодного углекислого газа), подкожная эмфизема (повышение рСО, в выдыхаемом
воздухе, подкожная крепитация брюшной и грудной стенок), тошнота и рвота (в
50 % случаев, для профилактики за 30—60 мин до окончания операции рекоменду-
ют внутривенное введение метоклопрамида в дозе 10 мг).
При появлении подкожной эмфиземы прекращают инсуффляцию СО2 в брюш-
ную полость и подачу анестетика в дыхательный контур, увеличивают минутную
вентиляцию легких. Профилактической мерой возникновения подкожной эмфи-
земы является поддержание давления инсуффляции СО, менее 12 мм рт. ст.
Послеоперационный период
Обезболивание: используют методику КПА (см. разделы 11.4.2.3 и 11.6.3).
В ранний послеоперационный период возникновение болей в области плеча
и лопатки свидетельствуют о пневмоперитонеуме. Возникновение тошноты и рво-
ты предупреждают внутривенным введением метоклопрамида (10 мг) или онда-
сетрона (4 мг).
22.3. ЛАПАРОСКОПИЧЕСКАЯ СПЛЕНЭКТОМИЯ
Показания к проведению лапароскопической спленэктомии: идиопа-
тическая тромбоцитопеническая пурпура, лимфоматозная болезнь, аутоиммунная
гемолитическая анемия, тромботическая тромбоцитопеническая пурпура, наслед-
ственный сфероцитоз, синдром Эванса, волосистоклеточная лейкемия, гиперсп-
ленизм в результате портальной гипертензии, саркаидоз, истинная полицитемия,
миелофиброз.
492
22. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЙ
Открытую спленэктомию обычно проводят при травматическом разрыве се-
лезенки. Предыдущие операции на органах брюшной полости не являются абсо-
лютными противопоказаниями к лапароскопическим процедурам.
Лапароскопическая спленэктомия длится дольше, чем открытая.
Предоперационный период
Пациенты, которые получали химиотерапевтические препараты, требуют тща-
тельного предоперационного обследования и подготовки. По крайней мере, за
одну неделю до операции проводят вакцинацию против пневмококковой, менин-
гококковой инфекций и Haemophilus influenzae.
Лапароскопические процедуры противопоказаны больным с тяжелыми рас-
стройствами функции внешнего дыхания. У пациентов со спленомегалией часто
обнаруживают различной степени выраженности ателектаз нижней доли левого
легкого, поэтому необходима своевременная диагностика этого состояния — про-
ведение рентгенографии органов грудной клетки в боковой проекции, легочных
функциональных проб, определение газового состава крови).
У пациентов, которым показана спленэктомия, часто регистрируют цитопению.
Проводят стандартную премедикацию (см. раздел 22.2).
Интраоперационный период
Проводят общую эндотрахеальную анестезию — стандартные индукцию в нар-
коз и поддержание анестезии без использования закиси азота (см. раздел 22.2).
Возможно возникновение таких же осложнений, как и при проведении лапа-
роскопической холецистэктомии. Кровопотеря обычно составляет меньше I еди-
ницы. Если кровопотеря превышает 750—1000 мл, то переходят на открытую спле-
нэктомию и переливают тромбоцитарную массу (после лигирования селезеноч-
ных сосудов, что уменьшает их секвестрацию в удаляемой селезенке).
Послеоперационный период (см. 22.2).
Обращают внимание на лечение ателектаза нижней доли левого легкого.
22.4. ЛАПАРОСКОПИЧЕСКАЯ АДРЕНАЛЭКТОМИЯ
Различные клиники определяют показания к лапароскопической
адреналэктомии с некоторыми отличиями, но, в общем, эти показания сходны.
Показания для лапароскопической адреналэктомии (по Барреси и Принцу): синд-
ром Кушинга, обусловленный наличием доброкачественной кортизол-продуциру-
ющей аденомы, болезнь Кушинга при неэффективности любых других методов
терапии, альдостерон-продуцируюшая аденома надпочечника (синдром Конна),
доброкачественная феохромоцитома надпочечника, нефункциональные аденомы
надпочечников или другие опухоли, при которых показана адреналэктомия (раз-
мер более 4 см или постоянный рост), доброкачественные патологические образо-
вания, проявляющиеся определенными симптомами.
Синдром Кушинга характеризуется избыточной продукцией стероидных гор-
монов в результате гиперплазии надпочечников, гипофизарной гиперсекреции
(болезнь Кушинга), гиперсекреции вненадпочечниковой опухолью или примене-
нием экзогенных стероидов. Адреналэктомия является традиционным лечением
гиперадренокортицизма, развившегося в результате карциномы надпочечников.
493
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Заболевание проявляется типичным ожирением, “лунообразным лицом”, артери-
альной гипертензией, аритмиями, гиперволемией, гипокалиемией, гиперглике-
мией, повышенной ломкостью сосудов, наличием камней в почках, остеопоро-
зом, миопатией, психическими отклонениями.
Феохромацитома — сосудистая опухоль мозгового вещества надпочечника или
любой части тела, содержащей хромафинную ткань (мочевой пузырь, truncus
sympaticus). Опухоль является источником избыточной продукции катехоламинов
(норадреналина более чем адреналина), что обусловливает клиническую симпто-
матику пароксизмальной артериальной гипертензии, нарушений сердечного рит-
ма, ортостатической гипотензии, гиповолемии, миокардиальной дисфункции, ги-
пергликемии.
Проводят предоперационное лечение с применением а-адреноблокаторов (фе-
ноксибензамина 40—100 мг/сут) и препаратов, увеличивающих ОЦК, в течение
1—2 недель. Пациентам с нарушениями сердечного ритма назначают консульта-
цию кардиолога. Неадекватная предоперационная подготовка сопровождается
повышением послеоперационной летальности. Адекватность медикаментозной
подготовки оценивают по отсутствию клинических симптомов избытка катехола-
минов: показатели АД должны быть меньше или равны 160/90 мм рт. ст. за 36 ч до
операции, систолическое АД должно быть снижено не менее чем на 15 % от исход-
ного уровня, на ЭКГ не должно быть изменений интервала S—T в течение 2 недель
до операции.
Феохромацитома может сопровождать другие заболевания, например, муль-
тиэндокринную неоплазию II, нейрофиброматоз, синдром Стерджа—Вебера и др.
Синдром Конна — сочетание мышечной слабости, полидипсии, полиурии, ги-
пертензии, гипокалиемии, алкалоза, возникающее в результате избыточной сек-
реции гормона альдостерона корой надпочечников. Гиперальдостеронизм бывает
первичным (в результате аденомы или гиперплазии клубочковой зоны коркового
вещества надпочечников) или вторичным (в результате избыточной продукции
ренина как компенсаторно-приспособительная реакция на фоне сердечно-сосу-
дистой, почечной или печеночной патологий, либо как осложнение ренин-секре-
тирующей опухоли юкстагломерулярного аппарата почек, при этом в результате
хронической стимуляции ренин-ангиотензин-альдостероновой системы развива-
ются гиперплазия коркового вещества надпочечников).
У больных с синдромом Конна перед операций проводят коррекцию гипока-
лиемии (см. раздел 18.3.1).
Предоперационный период
В зависимости от вышеуказанных симптомов проводят соответствующие об-
следование и подготовку. Если планируют двустороннюю адреналэктомию, то перед
операцией проводят заместительную терапию стероидами.
С целью премедикации назначают мидазолам (0,025—0,05 мг/кг внутривенно).
Интраопрационный период
При лапароскопической адреналэктомии используют общую эндотрахеаль-
ную анестезию. Если в течение операции высока вероятность перехода на откры-
тую адреналэктомию, то предварительно ставят катетер в эпидуральное простран-
ство для послеоперационного обезболивания.
Волемическую поддержку осуществляют через венозную канюлю (14-16 G)
теплым изотоническим раствором натрия хлорида или раствором Рингера-лактата
494
22. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛАПАРОСКОПИЧЕСКИХ ОПЕРАЦИЙ
(10-15 мл/кг/ч). При проведении открытой адреналэктомии необходимо предви-
деть большую кровопотерю, поэтому обеспечивают два венозных доступа канюля-
ми диаметром 14—16 G. Заблаговременно заготавливают препараты крови. Если
патология надпочечника не онкологической этиологии, то возможно использова-
ние селл-сейверов для реинфузии крови. Адекватность волемической поддержки
оценивают по мочеотделению, стабильности АД, величине сердечного выброса.
Мониторинг: стандартный (см. раздел 22.2) с катетеризацией лучевой (для ин-
вазивного определения АД) и легочной (у пациентов с феохромацитомой) арте-
рий. Для наблюдения за сердечной деятельностью используют чреспищеводную
ЭхоКГ.
Вводный наркоз осуществляют титрованым введением тиопентал-натрия или
этомидата. Из миорелаксантов используют векурониум.
Поддержание анестезии. Используют ингаляционные анестетики (изофлюран),
наркотические аналгетики, мышечные релаксанты.
Возможно введение в эпидуральное пространство 5—10 мл 2 % раствора лидо-
каина (1 раз в течение часа) без добавления адреналина, что способствует углубле-
нию анестезии, релаксации и перистальтике кишечника. Если для послеопераци-
онной аналгезии используют эпидуральное введение опиатов, то нагрузочную дозу
(например, гидроморфон 1,0 мг) вводят эпидурально за 1 ч до окончания опера-
ции. Седативные препараты (дроперидол, опиаты, бензодиазепины) используют в
минимальных дозах для предупреждения послеоперационной дыхательной деп-
рессии.
Течение анестезии зависит от хирургических особенностей операции и гемо-
динамической стабильности. Если в течение операции регистрировали нестабиль-
ную гемодинамику, гипотермию или большую секвестрацию жидкости в третье
водное пространство, то проводят продленную послеоперационную ИВЛ.
Осложнения подобны, как при при лапароскопической холецистэктомии
(см. раздел 22.2). Для профилактики интраоперационных осложнений важна со-
дружественная работа анестезиолога с командой хирургов, особенно в период мо-
билизации надпочечника, так как манипуляции на нем могут спровоцировать су-
щественное повышение АД и возникновение аритмии.
При интраоперационной артериальной гипертензии осуществляют инфузию
нитропруссида натрия или болюсное внутривенное введение фентоламина (2,5—5 мг
каждые 5 мин), при тахикардии используют эсмолол, при артериальной гипотен-
зии — мезатон или допамин.
Послеоперационный период
Бальных наблюдают в ОИТ для своевременного лечения побочных эффектов
применяемых опиатов и осуществления адекватного мониторинга (ЭКГ, уровней
электролитов и глюкозы плазмы, др.).
Обезболивание: используют методику КПА (см. раздел 11.4.2.3).
У больных с синдромом Кушинга после адреналэктомии могут возникнуть
острая адреналовая недостаточность, для купирования которой проводят замести-
тельную терапию стероидными гормонами (гидрокортизон по 100 мг каждые 8 ч),
и гиповентиляция, проявляющаяся гипоксемией и гиперкапнией.
У больных с феохромацитомой в послеоперационный период может развить-
ся лабильность АД и дисфункция миокарда.
При возникновении тошноты и рвоты внутривенно применяют метоклопрамид
(10 мг) или ондасетрон (4 мг), при боли в лопатке и плече — кеторолак (30 мг).
495
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
22.5. ЛАПАРОСКОПИЧЕСКИЕ
ГИНЕКОЛОГИЧЕСКИЕ ОПЕРАЦИИ
Лапароскопическую методику проведения операций используют
при внематочной беременности, миомэктомии, гистерэктомии, хирургическом
лечении эндометриоза.
Предоперационный период
В связи с длительным предоперационным приемом анксиолитических препа-
ратов по причине хронической боли внизу живота высока вероятность использо-
вания в премедикации значительных доз седативных препаратов для преодоления
толерантности: диазепам (10 мг перорально за 1—2 ч до операции), дополнительно
— мидазолам (внутривенно титровано до получения седативного эффекта непос-
редственно перед операцией, иногда до 10 мг).
При высоком риске развития регургитации желудочного содержимого (у жен-
щин с ожирением, сахарным диабетом, грыжей пищеводного отверстия диафраг-
мы) непосредственно перед операцией назначают препараты, уменьшающие объем
и кислотность желудочного сока.
Интраоперационный период
Выбор анестезиологического обеспечения зависит от срочности проведения
операции. Используют общий эндотрахеальный наркоз (см. раздел 22.2). Избега-
ют использования антихолинэстеразных препаратов с целью декураризации, так
как эти препараты вызывают тошноту и рвоту.
Как правило, при лапароскопических гинекологических вмешательствах, кроме
внематочной беременности, кровопотеря минимальна. Волемическую поддержку
осуществляют теплым изотоническим раствором натрия хлорида или раствором
Рингера-лактата (2—4 мл/кг/ч), интраабдоминально вводят жидкость с целью ир-
ригации и гидродиссекции. Перегрузка жидкостью может стать причиной разви-
тия отеков.
При длительных оперативных вмешательствах в литотомическом положении
могут развиться нейропатии верхних конечностей в результате позиционного по-
вреждения плечевого сплетения.
Послеоперационный период
Используют традиционные методики послеоперационного обезболивания.
ЛИТЕРАТУРА
1. Riley Е.Т., Orris В.Я,, Nezhat C.R. Laparoscopic Procedures for gynecologic surgery,
in: R.A. Jaffe, S.I.Samuels Anesthesiologist”s Manual of Surgical Procedures, 1999, Second
edition, Lippincott Williams and Wilkins. — P. 413—432.
2. Timothy E. Black Anaesthesia for Laparoscopic-Assisted Surgery., in: Thomas E.J.Healy,
Peter J.Cohen A Practice of Anaesthesia., 6-th edition, 1995., vol. III., chapter 69, Wyley and
Churchill-Davidsons.— P. 1391—1396.
3. Vierra M.A., Howard S.K. Laparoscopic general surgery in: R.A. Jaffe, S.I.Samuels
Anesthesiologist’^ Manual of Surgical Procedures, 1999, Second edition, Lippincott Williams
and Wilkins. — P. 413—432.
496
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ
ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
Ни одно из достижений современной медицины не является
столь эффективным, как трансплантация органов человеку, благо-
даря которой в течение предыдущих четырех десятилетий врачи
спасли жизнь и повысили ее качество тысячам пациентов. В транс-
плантационной хирургии принципы и методы общей анестезии и
интраоперационной интенсивной терапии по поддержанию функ-
ций организма в течение оперативного вмешательства и раннего
послеоперационного периода, сохраняя традиционное содержание,
приобретают специфические особенности: анестезиологическое
пособие должно обеспечить реципиенту эффективную защиту орга-
низма от хирургической травмы, не нарушая напряженных меха-
низмов поддержания жизненно важных функций; во время и после
трансплантации необходимо проводить комплексное лечение, на-
правленное на восстановление функциональной активности транс-
плантированного органа, так как состояние реципиента может быть
обусловлено реакцией отторжения трансплантата, побочными эф-
фектами и осложнениями иммуносупрессивной терапии.
С расширением показаний к различным видам пересадок еще
более увеличился дефицит донорских органов, который на совре-
менном этапе развития трансплантационной медицины рассмат-
ривают как основной фактор, сдерживающий дальнейший рост
числа операций. Проблему получения жизнеспособного донорс-
кого материала в достаточном количестве необходимо решать пу-
тем интенсификации донорства — изъятия максимального коли-
чества органов от одного донора, или мультиорганного забора,
совершенствования координационных механизмов донорской
службы, а также экстенсивным путем — за счет расширения кри-
териев пригодности донорских органов, ранее считавшихся суб-
оптимальными. Принципиальными вопросами, определяющими
возможность получения органов для трансплантации, остаются:
установление момента истинной смерти донора и сохранение функ-
циональной полноценности изымаемых органов.
Смерть, то есть состояние необратимой гибели организма,
как единого целого, с тотальной гибелью головного мозга может
497
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
быть констатирована, во-первых, на основании традиционных критериев прекра-
щения сердечной деятельности и дыхания, во-вторых, на основании смерти моз-
га, то есть необратимого прекращения функционирования головного мозга, вклю-
чая и функции его стволовых отделов. В обоих случаях решающим критерием для
констатации смерти является прекращение функций головного мозга с доказа-
тельствами необратимости этого прекращения. В Украине правовые аспекты уста-
новления смерти человека регулируются законом Украины “Про трансплантацпо
оргашв та шших анатомгчних матер!ал!в людиш” от 16.07.99 г. № 1007-XIV (1007-14),
а также подзаконными актами — приказами МОЗ Украины № 226 от 25.09.2000 г.
“Про затвердження нормативно-правових документа з питань трансплантацп” и
№ 184 (v 0184282—99) от 26.07.99 г. “Про затвердження форм облжово! статистич-
Hoi документацп, що використовуеться в стацюнарах л1кувально-профыактичних
заклад!в”. Принятие нормативных документов, допускающих заготовку органов
от доноров с мозговой смертью, открыло реальные перспективы для транспланта-
ции жизненно важных органов в клинике. В странах, где изъятие органов от доно-
ров с мозговой смертью не разрешено, развитие трансплантологии продвигается
замедленными темпами.
Показания для трансплантации органов: конечные стадии их недостаточности
с целью спасения и улучшения качества жизни реципиентов.
Абсолютные противопоказания для трансплантации органов: инкурабельные
злокачественные-и системные заболевания, старческий возраст, сепсис, выражен-
ное ожирение, алкогольная, лекарственная или никотиновая зависимость, эмоци-
ональная нестабильность, асоциальный образ жизни.
Для органов, у которых время холодовой ишемии ограничено часами (сердце,
легкие, печень), процедуру трансплантации проводят по ургентным показаниям.
Обследование, подготовка, премедикация и анестезиологическое пособие специ-
фичны для каждого донорского органа и реципиента.
23.1. СМЕРТЬ МОЗГА
Поскольку смерть мозга означает смерть индивидуума, то своев-
ременное установление такого диагноза является гуманным актом. После конста-
тации смерти мозга операцию изъятия органов следует рассматривать как обыч-
ное медицинское мероприятие. Таким образом, наиболее важными аспектами труп-
ного донорства являются: установление факта смерти индивидуума и определение
момента изъятия трансплантата.
Патофизиологический процесс, вызывающий кому, может диффузно пора-
жать мозг или локально его глубокие центральные структуры.
Повреждения мозга и/или образования классифицируют следующим образом:
• супратенториальные нарушения — субдуральная, субарахноидальная, интра-
церебральная гематомы, инфаркт, опухоль, абсцесс мозга;
• инфратенториальные нарушения, непосредственно поражающие стволовую
часть мозга, — стволовые и мозжечковые кровоизлияния, абсцесс, инфаркт, опу-
холь ствола;
• нарушения метаболизма, угнетающие и прерывающие функции ствола мозга, -
ишемия, аноксия, инфекции, экзогенные токсины.
Повреждения и патологические процессы, которые наиболее часто предрасполагают
к развитию неврологических осложнений с исходами в кому или смерть мозга: череп-
498
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
но-мозговые травмы, эмболии и тромбозы сосудов головного мозга, субарахноидаль-
ные и внутримозговые кровоизлияния, энцефалиты, опухоли, инфаркты миокарда.
В головном мозге (независимо от характера и механизмов действия исходных
патологических процессов) на финальных стадиях формирования смерти мозга раз-
вивается прогрессирующий отек (или острое набухание) с повышением ВЧД до уров-
ня системного АД, что, в свою очередь, снижает ПДМ, вызывает ишемию и вклине-
ние мозга, повреждение его ствола. Как следствие этих осложнений, наступает пол-
ное прекращение кровообращения, тотальный инфаркт мозга и его смерть. При
первичном прекращении кровообращения и дыхания ведущим механизмом является
аноксическое повреждение мозга с последующими отеком и вклинением, или пер-
вичный ишемический некроз мозговой ткани; функциональная дезинтеграция при-
водит к остановке дыхания и, в конечном счете, — к гипоксической остановке серд-
ца. При искусственной поддержке кровообращения и газообмена в течение опреде-
ленного времени сердце, почки и печень могут продолжать функционировать.
К постановке диагноза смерти мозга необходимо приступать при оценке комы
по ШКГ в 3 балла, руководствуясь при этом подзаконными актами на основании
комплекса из 9 клинических критериев диагностики: критерии 1—3 характеризуют
утрату функции коры головного мозга, 4—9 — ствола головного мозга.
Обязательные критерии диагностики смерти мозга:
1) полное и устойчивое отсутствие сознания (кома);
2) атония всех мышц;
3) отсутствие реакции на сильные болевые раздражения в области тригеми-
нальных точек и отсутствие любых других рефлексов, замыкающихся выше шей-
ного отдела спинного мозга;
4) отсутствие реакции зрачков на свет при неподвижных глазных яблоках;
5) отсутствие корнеальных рефлексов;
6) отсутствие окулоцефалических рефлексов;
7) отсутствие окуловестибулярных рефлексов;
8) отсутствие фарингеальных и трахеальных рефлексов;
9) отсутствие самостоятельного дыхания (апноэтический тест).
Дополнительными критериями диагностики смерти мозга являются: панангио-
графия сосудов головного мозга, транскраниальная допплерсонография, прекраще-
ние потребления мозговой тканью кислорода по данным артериовенозной разницы
р02 в артериальной крови и крови во внутренней яремной вене. При отсутствии
мозгового кровотока по данным ангиографии или транскраниальной допплерсо-
нографии либо при прекращении потребления мозговой тканью кислорода по дан-
ным артериовенозной разницы рО, в артериальной крови и крови во внутренней
яремной вене смерть мозга констатируют без дальнейшего наблюдения.
23.2. ДОНОРСКАЯ ОПЕРАЦИЯ
Коррекция нарушений гомеостаза у доноров в состоянии смерти
головного мозга является сложной проблемой. Анестезиологическую помощь при
мультиорганном заборе донорских органов следует сфокусировать на поддержа-
нии органной перфузии и оксигенации. При смерти головного мозга функции
коры и ствола мозга утрачены, и общая анестезия не показана в такой ситуации.
Для подавления сохраненных рефлексов, замыкающихся на уровне спинного моз-
га, вводят мышечные релаксанты.
499
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Мультиорганными донорами являются пациенты в состоянии смерти мозга с
сохраненной сердечной деятельностью. При отсутствии у донора высших центров
регуляции потенциальные трансплантаты становятся основными объектами пато-
генетически обоснованных мер интенсивной терапии, от эффективности которых
во многом зависит исход предстоящей трансплантации. У мультиорганных доно-
ров выявляют следующие патологические симптомы и синдромы: артериальную
гипотензию (85 %), различные варианты нейроэндокринной дисфункции (100 %),
гиповолемию (50 %), анемию (28 %), гипотермию (80 %), полиурию (54 %), арте-
риальную гипоксемию (24 %), метаболический ацидоз (81 %), респираторный ал-
калоз (70 %), гипокалиемию (33 %), гипернатриемию (43 %) [1]. Отмечают при-
знаки нарушения аэробных процессов со снижением артериовенозной разницы
по кислороду и уменьшением продукции углекислого газа. Кроме этого, у мульти-
органных доноров обнаруживают: коагулопатии (28—42 %), отек легких (30-52 %),
тяжелые нарушения сердечного ритма (27 %). В 25 % наблюдений, несмотря на
проводимую интенсивную терапию, может возникнуть остановка сердца. Крат-
ковременные эпизоды выраженной артериальной гипотензии или фибрилляция
желудочков не исключают возможности мультиорганного изъятия и последующей
трансплантации не только почек, но и других органов [1].
Основной задачей анестезиологического пособия у донора является поддер-
жание показателей гомеостаза на определенных уровнях (с помощью инфузион-
ной и симпатомиметической терапии): систолического АД — 100 мм рт. ст., ЧСС-
70—90 уд./мин, ЦВД — 5—12 мм рт. ст., рО2 в артериальной крови — 70—100 мм рт. ст.,
насыщения гемоглобина в артериальной крови — не менее 95 %, рСО2 — не менее
25 мм рт. ст., концентрации гемоглобина в крови — более 90 г/л, температуры
тела — 34—36 °C, диуреза — не менее 1 мл/кг/ч (при необходимости используют
фуросемид 1,0 мг/кг). Коррекцию уровня калиемии проводят при концентрации
калия в плазме менее 3,5 ммоль/л, коррекцию метаболического ацидоза — при BE
менее 5,0 ммоль/л). Важнейшим корригирующим мероприятием является актив-
ная инфузионная терапия.
На начальном этапе пособия темп инфузии согретых плазмозамещающих ра-
створов составляет 10—50 мл/кг до достижения ЦВД 10 мм рт. ст., в дальнейшем
— снижают до 5—6 мл/кг/ч. Более 85 % доноров на начальном этапе пособия
нуждаются в кардиотонической терапии дофамином или добутамином, реже -
адреналином. При коррекции гемодинамических показателей у доноров сердца не
проводят интенсивную инотропную или вазопрессорную поддержку, так как зна-
чительные дозы препаратов истощают миокардиальные запасы норадреналина,
что ухудшает результаты пересадок сердца [1, 3].
После обработки операционного поля производят рассечение от яремной вырезки
до лобка с последующей стернотомией. Печень освобождают от связок и отделяют от
диафрагмы. Чтобы свести к минимуму время теплой ишемии, приводящей к повреж-
дению внутренних органов, выполняют специальную методику регионального охлаж-
дения и консервации органов in situ, проводя при этом тотальную гепаринизацию.
23.3. КОНСЕРВАЦИЯ ОРГАНОВ,
КОНСЕРВИРУЮЩИЕ РАСТВОРЫ
Успех органной трансплантации зависит от техники забора орга-
нов, их защиты ex vivo от ишемии и сохранения в течение длительного промежут-
ка времени (для каждого органа определен соответствующий лимит времени).
500
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
Стратегия сохранения органов включает: гипотермию (для снижения активности
метаболизма) и использование консервирующих растворов (для предотвращения
клеточного повреждения). Консервирующие растворы содержат химические инг-
редиенты, которые, являясь источником энергии, обладают криопротективными
свойствами и способностью защищать клетки от отека, действия токсических про-
дуктов метаболизма. Стратегия консервации основана на управлении клеточным
метаболизмом, целью которого является уменьшение выраженности ишемичес-
ких и реперфузионных реакций в пересаживаемых органах, поэтому в состав кон-
сервирующих растворов включены так называемые мусорщики (scavengers) сво-
бодных радикалов кислорода (маннитол, супероксиддисмутаза) и синтетические
блокаторы (аллопуринол).
Collins и соавторы [12] первыми применили изотонические растворы для кон-
сервации почек. Состав этих растворов был близок к составу внутриклеточной
жидкости (низкая концентрация натрия и высокая концентрация калия), что вы-
зывало минимальные повреждения коркового слоя почечных трансплантатов. Для
защиты трупной почки от агонального вазоспазма и тромбоза сосудов использова-
ли гепарин, феноксибензамин и прокаин. В настоящее время в США и Европе
широко используют для консервации почек модифицированный гиперосмоляр-
ный, не содержащий добавок раствор Euro-Collins, позволяющий сохранять почки
exvivo в течение 24—48 ч (табл. 23.1).
Из-за высокой метаболической активности печени ее ишемические поврежде-
ния развиваются достаточно быстро, поэтому для консервации печени наиболее
подходит раствор UW, содержащий лактобионат и раффинозу, которые препятству-
ют отеку гепатоцитов, индуцированному гипотермией. Дополнительные компонен-
ты раствора UW: глютатион (3 ммоль), аденозин (5 ммоль), гидроксиэтилкрахмал
(50 г/л), инсулин (40 ЕД/л), пенициллин (200 000 ЕД/л), дексаметазон (16 мг/л).
Сердце еще более чувствительно к ишемии, чем печень: у человека лимит
времени до возникновения ишемии составляет всего 4—6 ч. Консервация сердца
основана на охлаждении и кардиоплегии, что защищает миокард при реперфузии
от действия цитотоксических свободных радикалов. Для кардиоплегии использу-
ют растворы UW или НТК (Custodiol). Дополнительные компоненты раствора НТК:
триптофан (2 ммоль) и К^-а-кетоглютарат (1 ммоль).
Таблица 23.1. Состав консервирующих растворов
Состав Collins Euro-Collins UW НТК
К+, ммоль 115 115 125 10
Na+, ммоль 10 10 30 15
Mg++, ммоль 30 - 5 4
НР04"'/НР04", ммоль 58 58 25 25
Са++, ммоль - - 0,5 -
СГ, ммоль 15 15 - 50
НСО3~, ммоль 10 10 - -
S04*~, ммоль 30 - 5 -
Лактобионат, ммоль - - 100 -
501
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Продолжение табл. 23.1
Состав Collins Euro-Collins uw НТК
Гистидин, ммоль - - - 197
Глюкоза, ммоль 126 194 - -
Раффиноза, ммоль - - 30 -
Маннитол, ммоль - - - 30
Осмолярность, мосм/л 320 355 320 310
pH (8 °C) 7,3 7,3 7,4 7,3
23.4. ТРАНСПЛАНТАЦИОННАЯ ИММУНОЛОГИЯ
Ткани донора одного биологического вида (не близнеца) называ-
ют аллотканью, или аллотрансплантатом. Попадание аллоткани в организм имму-
нокомпетентного реципиента вызывает иммунный ответ, направленный против
антигенов, расположенных на поверхности клеточных мембран аллоткани. Гены,
кодирующие эти белки, называют генами тканевой совместимости, и их локали-
зация в хромосомах зависит от биологического вида. Благодаря генам тканевой
совместимости, трансплантат будет распознан, как подобный тканям реципиента
или как чужеродный. В иммунном ответе участвуют все компоненты иммунной
системы реципиента: гуморальные (секретируемые В-лимфоцитами иммуногло-
булины и комплемент) и клеточные (Т-клетки, другие лимфоциты, макрофаги).
Т-лимфоциты играют важнейшую роль в иммунном ответе, они выполняют пер-
вичное распознавание чужеродного антигена, а затем производят окончательную
деструкцию аллоткани. В зависимости от специфических реакций на определен-
ные антигены и наличия специфических антигенов на поверхности, Т-лимфоци-
ты делят на 4 подкласса: хелперы, супрессоры, цитотоксические Т-клетки и
Т-клетки замедленной гиперчуствительности. Все они — важные участники реак-
ции на чужеродные ткани.
Поверхностные гликопротеины, которые определяют иммунологическую иден-
тичность ткани, называют антигенами главного комплекса гистосовместимости
(major histocompatibility complex, МНС). У человека он локализован на коротком
плече 6-й хромосомы. Несоответствие донора и реципиента по антигенам МНС
приводит к отторжению трансплантата. Гены МНС кодируют полиморфные мо-
лекулы клеточной мембраны — аллоантигены, известные как антигены лейкоци-
тов человека (human leukocyte antigens, HLA). H LA-система включает не менее
6 отдельных генов. Фенотипически каждый из них представлен двумя кодоминант-
ными аллелями (по одной из отцовской и материнской гамет). В зависимости от
представительства в тканях, химической и кристаллографической структур и им-
мунологической функции HLA делят на два основных класса — I и II. Антигены!
класса МНС (HLA-A, -В, -С) обнаружены на поверхности практически всех кле-
ток, имеющих ядро. Они являются классическими трансплантационными антиге-
нами и первичной мишенью цитотоксических клеток. Антигены II класса МНС
(HLA-DR, -DQ, -DP) представлены на гораздо меньшем количестве клеток, по-
скольку эти антигены обычно экспрессируют антигенпрезентирующие клетки, а
502
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
именно: В-лимфоциты, моноциты, макрофаги, дендритные клетки лимфоидных
органов, мезенгиальные клетки почек, купферовские и клетки выстилающего аль-
веолярного эпителия типа 2. Активированные Т-лимфоциты тоже способны эксп-
рессировать молекулы класса II и являться первичной мишенью для Т-хелперов.
В инициации иммунного ответа на трансплантационные антигены главную роль
играют молекулы класса II. После распознавания чужеродных молекул класса II
активируются хелперные СО4+-Т-лимфоциты, в результате чего начинается про-
цесс клональной экспансии. Кроме этого, посредством стимуляции выработки
цитокинов СО4+-Т-лимфоцитами инициируется клональная экспансия цитоток-
сических Т-клеток. Антигены МНС обоих классов играют существенную роль в
распознавании иммунной системой всех антигенов. Рецепторы клеток, ответствен-
ных за первичное распознавание антигенов, распознают не только какой-либо
участок молекулярной структуры антигена, но и поверхностные белки, являющи-
еся молекулами идентификации “своего”. Именно в распознавании “своего”, в
самоидентификации, заключена суть иммунорегуляторной функции МНС. При
отторжении аллогенные молекулы I и II классов становятся мишенями для эффе-
рентных реакций иммунной системы. Огромное разнообразие аллелей в локусах
хромосом, кодирующих HLA, объясняет различные степени HLA-совместимости.
Антигены групповой совместимости крови АВО-системы являются одними из
самых мощных трансплантационных антигенов, поэтому у реципиента при пере-
садке донорского органа, несовместимого по АВО-системе, разовьется наиболее
сильный иммунный ответ.
23.4.1 . Механизмы отторжения аллотрансплантата
При отсутствии иммуносупрессии иммунный ответ на трансплан-
тируемые ткани начинается с распознавания донорских антигенов как “чужих”,
продолжается как пролиферация иммунокомпетентных клеток и завершается эф-
фекторной фазой. Процесс распознавания — это реакция связывания рецепторов
Т-хелперов или Т-цитотоксических клеткок и антигенов, расположенных на повер-
хности донорских клеток. Макрофаги также участвуют в реакции, они секретируют
“цитокины” (наиболее значимым является IL—1), которые усиливают активацию
Т-клеток. IL—2 и другие лимфокины, секретируемые Т-хелперами, способствуют
пролиферации и дифференциации лимфоцитов. Дифференцирующиеся лимфоциты,
в свою очередь, секретируют эффекторные молекулы, включая у-интерферон, кото-
рые активируют и вовлекают макрофаги, лейкоциты и тромбоциты в процесс оттор-
жения трансплантата, усугубляют повреждение клетки и усиливают воспаление.
Сверхострая реакция отторжения почечного аллотранплантата характеризует-
ся микрососудистым тромбозом с последующим некрозом донорского органа и
развивается при несовместимости по групповым антигенам АВО-системы. При
этом, как и при гемотрансфузии, возможна трансплантация почки донора 0-груп-
пы совместимому, но не идентичному по АВО-системе реципиенту, то есть реци-
пиенту А-, В- или АВ-группы. В некоторых центрах выполняют подобную транс-
плантацию почек доноров с хорошими результатами, но только по специальным
протоколам иммуносупрессии, которые включают спленэктомию, плазмаферез,
донорспецифическую инфузию тромбоцитов и назначение циклоспорина.
Важность HLA-совместимости при трансплантации почки является дискус-
сионной, так как хотя и зарегистрированы хорошие результаты при пересадке от
503
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
HLA-несовместимых родственных доноров, но результаты трансплантации от HLA-
совместимых трупных доноров все же лучше. Наличие предсуществующих цито-
токсических антител к Т-лимфоцитам донора (антилимфоцитарных антител) уве-
личивает риск сверхострой реакции отторжения и обычно делает транспланта-
цию невозможной. Кроме этого, существуют другие иммунологические параметры,
которые влияют на выживаемость почечного трансплантата, — это панельно реа-
гирующие антитела (ПРА) и перекрестная реакция (crossmatch reaction): про-
изводят смешивание сыворотки пациента и клеток донора (лимфоцитов) для оп-
ределения наличия или отсутствия предсуществующих антител. Отмечено, что
пациенты, у которых имеются лимфоцитотоксические антитела, реагирующие более
чем в 50 % тестов панели, имеют худшие шансы выживаемости трансплантата.
Донорспецифические АВО-изоагглютинины также могут вызвать сверхострую
реакцию отторжения донорского сердца, то есть совместимость по АВО-системе счи-
тают обязательной при трансплантации сердца. Роль HLA-совместимости при транс-
плантации сердца является более дискутабельной. Некоторые исследования указыва-
ют, что HLA-несовместимость не сочетается со значительной частотой отторжения
или выживаемостью, в то же время другие исследователи находят важное клиничес-
кое значение HLA-несовместимости. В связи с тем что время переносимой холодо-
вой ишемии донорским сердцем не превышает 4—6 ч, выполнить полное исследова-
ние гистосовместимости и скрининг на наличие предсуществующих лимфоцитоток-
сических антител, в частности ПРА, практически не представляется возможным.
В отличие от ситуации с трансплантацией сердца и почек, не существует со-
общений о сверхострой реакции отторжения печеночного трансплантата, что под-
тверждает предположение о том, что печень резистентна к повреждению антите-
лами. Следовательно, трансплантацию печени можно выполнять при несовмести-
мости пары донор—реципиент по АВО-системе, но когда совместимость по
АВО-системе все же соблюдают, то краткосрочная выживаемость лучше у АВО-иден-
тичных пар, чем у АВО-неидентичных, при этом долговременные результаты вы-
живаемости остаются одинаковыми. Похоже, что нет никакой связи между HLA-cob-
местимостью и выживаемостью печеночного трансплантата.
Таким образом, трансплантация почек в основном зависит от AB0-, HLA-
совместимости, перекрестной реакции и количества лимфоцитотоксических ан-
тител. В противоположность этому, трансплантация сердца и печени, за исключе-
нием АВО-совместимости, более зависит от совместимости по размеру органа и
клинической ситуации.
23.4.2 . Лекарственные средства,
обладающие иммуносупрессивным действием
Для предотвращения отторжения донорского органа необходимо
подавить иммунный ответ реципиента. С этой целью разработаны иммуносупрес-
сивные препараты, использование которых, несмотря на продолжающееся совер-
шенствование, все же сопровождается значительными осложнениями. Из-за по-
бочных эффектов и токсичности иммуносупрессия оправдана только при жизне-
спасающей пересадке органов и тканей (например, трансплантация щитовидной
железы нецелесообразна по причине возможного адекватного медикаментозного
замещения). В идеале, иммуносупрессивные препараты должны ингибировать толь-
ко популяции Т-лимфоцитов, реагирующие с донорспецифическими антигенами,
504
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
но современные препараты являются иммунологически неспецифическими. Им-
муносупрессивные протоколы обычно включают комбинацию низких доз несколь-
ких агентов для обеспечения достаточной иммуносупрессии при минимальных
побочных эффектах.
Кортикостероиды
Кортикостероиды являются мощными противовоспалительными агентами, по-
этому их включают практически во все иммуносупрессивные протоколы. Они реа-
лизуют свой наиболее важный иммуносупрессивный эффект через блокирование
цитокинов, продуцируемых Т-клетками и антигенпрезентирующими клетками, и
экспрессию цитокиновых рецепторов. Кортикостероиды ингибируют функцию ден-
дритных клеток, которые являются наиболее важными среди антигенпрезентирую-
щих клеток. Кортикостероиды гидрофобны и могут диффундировать внутрь клет-
ки, где связываются с цитоплазматическими рецепторами, в частности с 90-kd-
теплошоковым протеином, который и образует комплекс стероид—рецептор. Этот
комплекс, перемещаясь в ядро и контактируя с ДНК, ингибирует транскрипцию
генов цитокинов. Кортикостероиды ингибируют экспрессию IL-1, IL-2, IL-3, IL-6,
TNF-a- и у-интерферонов. В результате ингибируются все стадии процесса актива-
ции и клональной экспансии цитотоксических клеток и Т-хелперов. Высвобожде-
ние цитокинов провоцирует развитие лихорадки, часто сопровождающую отторже-
ние и быстро купирующуюся высокими дозами кортикостероидов.
Глюкокортикоиды вызывают лимфопению, которая является следствием пе-
рераспределения лимфоцитов из сосудистого русла в лимфоидную ткань, блоки-
руют миграцию моноцитов в область воспаления. Общее количество лейкоцитов
может повышаться в несколько раз при приеме высоких доз стероидов. Наиболее
важными осложнениями стероидной терапии являются: косметические измене-
ния, замедление роста, остеонекроз, плохое заживление ран, слабое сопротивле-
ние инфекциям, катаракта, гиперлипидемия, уменьшение толерантности к глю-
козе, психопатологические эффекты.
Азатиоприн
Азатиоприн (Имуран) является антиметаболитом, имидазольным производ-
ным 6-меркаптопурина. Метаболит азатиоприна — тиоинозиновая кислота — кон-
курирует с инозиновой кислотой за превращение в ксантиновую кислоту, которая
является необходимым субстратом для синтеза de novo пуринов, требующихся для
ДНК- и РНК-синтеза. Азатиоприн является мощным супрессором миелоцитов.
Он ингибирует пролиферацию промиелонитов в костном мозге, что приводит к
снижению количества циркулирующих моноцитов, способных дифференцироваться
в макрофаги. Азатиоприн — мощный ингибитор первичного иммунного ответа и
полноценный агент для предупреждения возникновения острого отторжения, но
он неэффективен для лечения эпизодов острого отторжения. Азатиоприн иногда
является причиной гепатита или холестаза, которые обычно проявляются обрати-
мым повышением сывороточных аминотрансфераз и уровня билирубина. Дозу
азатиоприна в таких случаях, как правило, снижают или отменяют его прием на
время эпизода печеночной дисфункции. Панкреатит при применении азатиопри-
на является редким осложнением.
Ингибиторы кальциневрина
Термин “ингибиторы кальциневрина” является весьма подходящим, чтобы
подчеркнуть близкое сходство в механизме действия двух препаратов — цикло-
505
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
спорина и такролимуса, которые в настоящее время являются основой иммуно-
супрессии при трансплантации крупных органов. Несмотря на биохимические от-
личия, они сходны не только по механизму действия, но и по клиническим и
побочным эффектам. Ингибиторы кальциневрина отличаются в селективности ин-
гибирования иммунного ответа. Они не подавляют фагоцитарную активность ней-
трофилов, как это делают кортикостероиды, и не являются миелосупрессорами,
как азатиоприн. Их иммуносупрессивные эффекты зависят от формирования ком-
плекса с цитоплазматическими рецепторными протеинами: циклофилином — для
циклоспорина, такролимуссвязывающим белком — для такролимуса. Ингибиро-
вание кальциневрина уменьшает в некоторых генах экспрессию воспалительных
цитокинов, которые способствуют активации Т-клеток.
Циклоспорин является липофильным антибиотиком, выделенным из почвен-
ных грибков. Препарат революционизировал органную трансплантацию, позво-
лил достичь результатов, сравнимых с результатами при трансплантации от одно-
яйцевых близнецов. Основной мишенью циклоспорина являются Т-лимфоциты, а
именно — ключевой лимфокин IL—2, синтез которого циклоспорин ингибирует.
Циклоспорин также предотвращает активацию Т-хелперов чужеродными антиге-
нами и ингибирует продукцию IL—1 макрофагами.
Пациенты, получающие эффективную дозу ингибиторов кальциневрина в ка-
честве поддерживающей иммуносупрессии, сохраняют уровень иммунного ответа,
который достаточен для обеспечения защиты хозяина. Эта относительная имму-
носупрессия является отражением факта, что в терапевтических дозах ингибиторы
кальциневрина снижают кальциневриновую активность только на 50 %, позволяя
мощным сигналам инициировать экспрессию цитокинов и генерировать эффек-
тивный иммунный ответ. У пациентов, принимающих циклоспорин, СО4+-Т-клетки
снижают продукцию IL-2 тем больше, чем выше концентрация препарата в крови.
Степень ингибирования кальциневриновой активности и продукции IL-2 являет-
ся золотой серединой хрупкого равновесия, которое устанавливается между чрез-
мерной и недостаточной иммуносупрессиями.
Такролимус (програф) — новый макролидный иммунодепрессантный анти-
биотик, который достаточно широко применяют в современной трансплантоло-
гии. Он является мощным иммунодепрессантом, но менее токсичен, чем цикло-
спорин. Такролимус относительно стабильно всасывается из ЖКТ (в основном из
тонкой кишки, биодоступность составляет около 25 %), поэтому возможно его
введение через назогастральный зонд. Циклоспорин более тормозит моторику
кишечника, чем такролимус.
Мофетила микофенолат
Антиметаболическая селективность у мофетила микофенолата (ММФ, селлсепт)
более выражена, чем у азатиоприна. Препарат введен в клиническую транспланта-
цию в 1995 году после клинических испытаний, показавших, что для предупрежде-
ния острых кризов отторжения у реципиентов трупных почечных трансплантатов
при использовании в комплексе с циклоспорином и преднизолоном он более эф-
фективен, чем азатиоприн. Активным веществом является микофеноловая кислота
(МФК) — ферментативный продукт различных видов Penicillinum. МФК является
обратимым ингибитором темпопределяющего фермента инозинмонофосфатдегид-
рогеназы в так называемом синтезе de novo пуринов, который катализирует образо-
вание гуанозиновых нуклеотидов из инозина. Истощение гуанозиновых нуклеоти-
дов посредством МФК имеет относительно выборочное антипролиферативноедей-
506
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИОРГАНОВ
ствие на лимфоциты, которые зависят от de novo пуринового синтеза больше, чем
другие типы клеток (имеют “запасной” путь образования гуанозиновых нуклеоти-
дов из гуанина). ММФ отличается принципиально от ингибиторов кальциневрина
и сиролимуса тем, что не нарушает продукцию цитокинов. Несмотря на относи-
тельную специфичность действия ММФ на лимфоциты, лейкопения, анемия и тром-
боцитопения развиваются с той же частотой, которую наблюдают при приеме аза-
тиоприна, что может потребовать коррекции дозы. Модификацией мофетила мико-
фенолата является Мифортик — энтеральная форма ММФ, покрытая специальной
оболочкой для уменьшения осложнений со стороны ЖКТ.
Сиролимус
Сиролимус (рапамун, рапамицин) — макролидный антибиотик, который струк-
турно родственен такролимусу. При использовании сиролимуса в комбинации с
преднизолоном и циклоспорином значительно снижается количество эпизодов
острого отторжения в раннем послеоперационном периоде по сравнению с азати-
оприном или плацебо. Сиролимус является более сильным, но и более токсичным
иммуносупрессантом по сравнению с ММФ. Подобно кальциневриновым инги-
биторам, он объединяется с цитоплазматическим связывающим протеином, кото-
рый является его мишенью, и редуцирует ингибирование цитокинзависимой кле-
точной пролиферации в цикле деления гемопоэтических клеток.
Моноклональные и поликлональные антитела
Поликлональные антитела получают путем иммунизации лошадей или кро-
ликов человеческой лимфоидной тканью, а затем из иммунной сыворотки выде-
ляют у-глобулиновые фракции. Поликлональные антитела (АЛГ, АТГ, антилим-
фобластную сыворотку) применяют в клинической трансплантации с 1970-х го-
дов. В настоящее время широко используют антитимоцитарные глобулины Атгам
и Тимоглобулин.
Моноклональное мышиное антитело анти-СБЗ (Ортоклон, ОКТЗ) использу-
ют в клинической практике с 1987 года, а препараты гуманизированного анти-Тас
моноклонального антитела Даклизумаб и Базиликсимаб — с 1998 года. Биологи-
ческие иммуносупрессивные агенты используют для индукционной иммуносуп-
рессии и/или лечения острого отторжения, но их не применяют для базовой им-
муносупрессии.
ОКТЗ является IgG, который получают путем гибридизации мышиных анти-
телосекретирующих В-лимфоцитов с несекретирующим миеломным клеточным
рядом, чей неопластический потенциал позволяет секретировать антитела беспре-
рывно. ОКТЗ реагирует с человеческими Т-клетками посредством связывания с
одной из 20-kd подгрупп комплекса CD3 — внутренней части Т-клеточного ре-
цептора. Последующая инактивация комплекса CD3 приводит к тому, что рецеп-
торы Т-клеток подвергаются эндоцитозу и исчезают с клеточной поверхности.
Т-клетки становятся неэффективны в распознавании чужеродных антигенов и в
течение оного часа они опсонизируются, перемещаясь из крови в РЭС. ОКТЗ
также блокирует функцию Т-киллеров, которые играют важную роль в генериро-
вании острого отторжения. Стандартная доза ОКТЗ, вводимая внутривенно через
фильтр, составляет 5 мг; курс лечения острого отторжения — 10 дней.
Атгам и Тимоглобулин являются поликлональными антителами, которые вы-
рабатываются иммунной системой животных, иммунизированных человеческими
лимфоидными клетками. Их применение быстро приводит к истощению лимфоци-
тов в периферической крови. Т-лимфоциты или лизируются, или поглощаются РЭС,
507
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
а их поверхностные антигены могут быть замаскированы антителами. Применение
тимоглобулина обеспечивает длительную лимфопению в течение нескольких лет.
Длительный иммуносупрессивный эффект этих препаратов гарантирует относитель-
ную редкость повторных эпизодов отторжения по сравнению с ОКТЗ. Атгам вводят
в дозе 10—15 мг/кг, Тимоглобулин — 1,5 мг/кг; курс лечения составляет 7-14 дней.
Гуманизированные моноклональные антитела
Гуманизированные моноклональные антитела — базиликсимаб (Симулект) и
даклизумаб (Зенапакс) — схожие соединения, которые используются в клиничес-
кой трансплантологии в силу способности уменьшать количество случаев острого
отторжения при использовании в комбинации с циклоспорином и кортикостеро-
идами. Оба препарата представляют собой мышиные моноклональные антитела,
генетически реконструированные таким образом, что значительную часть молеку-
лы занимает человеческий IgG. Эффект действия гуманизированных монокло-
нальных антител направлен против альфа-цепей, представляемых как CD25-pe-
цепторов IL-2. Рецептор присутствует только на активированных Т-клетках. В
результате его связывания с антителами IL-2-опосредованный ответ блокируется.
Гуманизированные моноклональные антитела предупреждают, но не лечат эпизо-
ды острого отторжения.
Симулект вводят внутривенно: первую дозу (20 мг) — перед операцией, вто-
рую (20 мг) — на 4-й день после операции. Такой режим приводит к насыщению
альфа-участков IL-2-рецепторов в течение 30—45 дней. Зенапакс вводят внутри-
венно (5 доз по 1 мг/кг): первую дозу — перед операцией, последующие — с
двухнедельным интервалом, что приводит к насыщению альфа-участков IL-2-ре-
цепторов в течение более чем 12 недель.
23.5. ТРАНСПЛАНТАЦИЯ ПОЧЕК
Каждый год в мире проводят более 30 000 трансплантаций почек
пациентам, из которых более половины получали заместительную терапию диа-
лизными методами. Диализ успешно устраняет многие опасные нарушения мета-
болизма, в частности, гипергидратацию, электролитные нарушения, неврологи-
ческие симптомы, удлиняет продолжительность жизни эритроцитов, улучшает
функциональную способность тромбоцитов. У больных в терминальной стадии
ХПН не удается диализными методами контролировать и корректировать артери-
альную гипертензию, синтез эритропоэтина, гиперпигментацию и кожный зуд [3,
4, 27, 31, 43, 44, 47, 48].
Диализ высокоэффективен в устранении симптомов хронической уремии, но
годичная и пятилетняя выживаемость больных, находящихся на диализе, в 2 раза
меньше, чем у реципиентов после успешно выполненной трансплантации почки.
Качество жизни после пересадки почки значительно лучше, чем на диализе, поэто-
му больные диализным методам лечения предпочитают трансплантацию почки [48].
23.5.1. Предоперационный период
Потенциальными реципиентами для трансплантации почки явля-
ются больные с терминальной стадией ХПН, которая независимо от этиологии
характеризуется уремической интоксикацией [4, 7, 8, 66]. Такие больные нуждают-
508
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
ся в проведении программного диализа. В Украине структура этиологии ХПН пред-
ставлена следующим образом: хронический гломерулонефрит — 32,1 %, хроничес-
кий пиелонефрит — 29,7 %, диабетическая гломерулонефропатия — 22,4 %, поли-
кистоз почек — 6,9 %, гипертензивные нефропатии — 3,7 %, неизвестные причины —
5,2 % [2]. При уремии и хронической анемии развиваются гиперволемия и гиперди-
намия кровообращения, увеличивается периферическое артериовенозное шунтиро-
вание и снижается вязкость крови. Уменьшение кислородной емкости крови ком-
пенсируется повышением тканевого кровотока и облегчением поступления кисло-
рода в ткани (сдвиг кривой диссоциации оксигемоглобина вправо).
Патофизиологические изменения при ХПН [12, 15, 26]: артериальная гипертен-
зия, дисритмии, сердечная недостаточность, перикардит, ломкость капилляров,
гидроторакс, отек легких, тошнота, рвота, кишечная непроходимость, пептичес-
кие и острые язвы, панкреатиты; повреждение механизмов клеточного иммуните-
та, анемия, укорочение жизни эритроцитов, дисфункция тромбоцитов.
Метаболические нарушения при терминальной стадии ХПН: ацидемия, гиперка-
лиемия, гипермагниемия, гиперфосфатемия и гипокальциемия.
Предоперационные обследование и подготовка
До операции реципиентам часто назначают блокаторы кальциевых каналов,
ингибиторы АПФ, (З-блокаторы, вазодилататоры и агонисты ^-адренорецепто-
ров. Антигипертензивные препараты уменьшают ОПСС, антагонисты р-адреноре-
цепторов снижают сократимость миокарда, что необходимо учитывать при выбо-
ре препаратов для вводного наркоза из-за возможного синергизма и развития стой-
кой артериальной гипотензии [69].
Обязательным является проведение ЭКГ и ЭхоКГ [63, 79].
В связи с тем, что время холодовой ишемии для донорских почек составляет
24-48 ч (в зависимости от консервирующего раствора), трансплантация трупной
почки является ургентной процедурой; трансплантация почки от живого родствен-
ного донора — плановая операция, так как времени для проверки АВО- и HLA-
совместимости, постановки перекрестной реакции и определения титра предсу-
ществующих антител достаточно.
Гемодиализ для коррекции гиперволемии, гиперкалиемии (К+ > 5,5 ммоль/л),
метаболического ацидоза и артериальной гипертензии проводят реципиентам, у
которых время после последнего диализа до трансплантации превышает 48 ч. В
идеале период между последним гемодиализом и трансплантацией должен состав-
лять 24 ч (остаточный эффект гепарина). После диализа оценивают волемию, ка-
лиемию, показатели гематокрита, гемоглобина, КОС, газов крови.
23.5.2. ИНТРАОПЕРАЦИОННЫЙ ПЕРИОД
Выбор метода анестезии при трансплантации почки основывают
на надежности защиты реципиента от операционного стресса, степени легкости
управления анестезией, низкой токсичности препаратов, “комфортабельности”
для больного и хирурга [9, 10, 11, 14].
Регионарные методы анестезии, в частности эпидуральную анестезию, благодаря
низкой токсичности и мощному аналгетическому эффекту, успешно применяли в
эпоху освоения трансплантации почки [75]. Продленная эпидуральная анестезия обес-
печивала достаточную сенсорную блокаду, мышечную релаксацию и предотвращала
509
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
гипертензивную сосудистую реакцию [13], но при этом методе анестезии больные
хуже переносили кровопотерю, чем при НЛА (трудно спрогнозировать объем крово-
потери и длительность операции) [14, 17]. Эпидуральную анестезию при трансплан-
тации почек в настоящее время применяют достаточно редко (1 %) [17, 22].
В большинстве центров трансплантации, в том числе и в Украине, при пере-
садке почки применяют эндотрахеальный наркоз с ИВЛ, так как этот метод га-
рантирует хорошую управляемость глубиной анестезии и безопасность восполне-
ния кровопотери и инфузионной терапии [1, 16, 18, 67].
Объем мониторинга'. ЧСС, АД (неинвазивным методом), ЦВД, пульсоксимет-
рия, капнография, ЭКГ (непрерывно).
Премедикация. Внутривенно вводят: фамотидин, метоклопрамид, атропин
(0,01 мг/кг), димедрол (0,2 мг/кг), сибазон (0,15 мг/кг), антибиотик; перорально-
30 мл цитрата натрия (время эвакуации пищи из желудка при уремии — 10-12 ч).
При низких показателях ЦВД проводят инфузию 0,9 % раствора натрия хло-
рида до достижения нормального значения — 5—6 мм рт. ст.
Индукцию в наркоз осуществляют методом краш-индукции с преоксигенацией,
прекураризацией и приемом Селлика. Используют: тиопентал-натрий (5-6 мг/кг),
пропофол (2—3 мг/кг) или кетамин (2 мг/кг, у гипо- и нормотензивных реципиен-
тов), в сочетании с лидокаином (1,5 мг/кг) и фентанилом (2—3 мкг/кг). При САД
менее 95 мм рт. ст. вводят 2000 мг натрия оксибутирата.
Сукцинилхолин повышает концентрацию ионов калия на 0,5 ммоль/л,
что ограничивает его применение при калиемии более 5 ммоль/л
Вводят сукцинилхолин (1—1,5 мг/кг); при калиемии 5,0—5,5 ммоль/л — атра-
куриум (1 мг/кг), векурониум (0,2 мг/кг) или, что менее предпочтительно, панку-
рониум или пипекурониум (0,08—0,1 мг/кг). Интубируют трахею. ИВЛ проводят в
режиме нормокапнии. Аналгезию достигают фентанилом (10,0—5,0—3,0 мкг/кг/ч).
Для поддержания анестезии применяют ингаляционные или внутривенные
анестетики. Препараты выбора — изофлюран или пропофол, так как они не ока-
зывают нефротоксического действия. Возможно использование тиопентал-натрия
(3—4 мг/мин).
Поддерживают уровень систолического АД 140—150 мм рт. ст., диастоличес-
кого — 80—90 мм рт. ст.
За 30 мин до включения трансплантата в кровоток вводят маннитол (1,0 г/кг),
фуросемид (1,0 мг/кг) и метилпреднизолон (1000 мг). Наряду с оптимизацией
гемодинамики и кислородотранспортной функции крови используют фармаколо-
гические методы защиты трансплантата, направленные на профилактику вазокон-
стрикции. С этой целью за 10—15 мин до реперфузии трансплантата вводят вера-
памил (0,15 мг/кг). Пуск кровотока через трансплантат сопровождается снижени-
ем внутрисосудистого объема и вымыванием ионов калия, молочной кислоты и
вазодилатирующих веществ из трансплантата и нижних конечностей, в которых
частично, а иногда и полностью нарушен кровоток. Инфузируя 0,9 % раствор
натрия хлорида, достигают уровня ЦВД 10—12 мм рт. ст. и поддерживают его на
таком уровне до окончания операции. После включения трансплантата в крово-
ток вводят допамин (2,0 мкг/кг/мин), а при достижении герметичности неоурете-
роцистоанастомоза — повторно фуросемид (1,0 мг/кг).
Тщательно контролируют гемостаз, проходимость катетера Фолея.
Транспортируют реципиента в специализированное ОИТ.
510
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
23.5.3. Послеоперационный период
Спектр мониторируемых показателей в специализированном ОИТ
такой же, как во время операции: ЧСС, АД, насыщение гемоглобина кислородом
(каждые 15 мин в течение 6 ч), диурез (ежечасно), ЭКГ (непрерывно в течение
первых суток, после стабилизации гемодинамики — ежечасно в течение 24 ч, за-
тем — каждые 3 ч), ЦВД (ежечасно в течение первых суток, обычно регистрируют
низкое ЦВД — менее 5 мм рт. ст.). Поддерживают показатели гомеостаза на опре-
деленных уровнях: систолического АД — 130—140 мм рт. ст., диастолического АД —
70-90 мм рт. ст., САД — 90—106 мм рт. ст., ЧСС — 60—80 уд./мин, рО2 — 95-98 %,
ЦВД — 5—7 мм рт. ст.
Увлажненный кислород подают через носовые катетеры.
Вводят: фамотидин (20 мг/сут), неорал (10 мг/кг/сут в 2 приема, перорально),
метилпреднизолон (в течение первых суток — 1000 мг, вторых — 500 мг, третьих —
250 мг, затем перорально — 0,5—0,8 мг/кг), азатиоприн (2,0 мг/кг в 2 приема).
При диурезе более 300 мл/ч возмещают 0,45 % раствором натрия хлорида в 5 %
растворе глюкозы 4/5 части объема мочи за предшествующий час, при диурезе менее
300 мл/ч — полностью компенсируют объем выделенной мочи за предшествующий
час. Для улучшения почечного кровотока вводят допамин (1,0—2,0 мкг/кг/мин),
при снижении диуреза менее 50—100 мл/ч — фуросемид (1,0 мг/кг).
Внутривенно назначают антибиотики цефалоспоринового ряда 3—4-го поко-
ления в течение 5—7 суток, прекращают их введение после извлечения мочевого и
центрального венозного катетеров. Применяют: флуконазол (50—100 мг), бисеп-
тол (480 мг 2 раза в сутки после восстановления перистальтики), ацикловир (200 мг
4-6 раз в сутки).
Каждые 12 ч в течение первых послеоперационных суток исследуют: концен-
трацию креатинина в крови и моче, СКФ, коагулограмму, калий и натрий в крови
и моче, общий анализ крови с тромбоцитами, гемоглобин и гематокрит, КОС и
газовый состав крови. В последующем вышеперечисленные лабораторные тесты
повторяют ежесуточно.
Причиной отсутствия функции трансплантата является ОКН, возникающий в
результате длительной ишемии, нестабильной гемодинамики, реперфузионных
повреждений, а также острой реакции отторжения. При клинических признаках
острого отторжения (снижении диуреза, повышении температуры тела, артери-
альной гипертензии, увеличении размеров и плотности трансплантата по данным
пальпации и УЗИ) проводят тонкоигольную аспирационную биопсию.
23.6. ОРТОТОПИЧЕСКАЯ ТРАНСПЛАНТАЦИЯ ПЕЧЕНИ
Ортотопическая трансплантация печени (ОТП) — одно из наибо-
лее сложных хирургических вмешательств, что обусловлено исходной тяжестью
состояния реципиента (конечной стадией хронической или фульминантной пече-
ночной недостаточности), многоэтапностью, объемом и травматичностью опера-
ции, необходимостью применения различных вариантов вспомогательного крово-
обращения, массивной кровопотерей, стремительными изменениями во время
операции показателей гемодинамики и гомеостаза, дисфункцией донорской пече-
ни в послеоперационном периоде, вплоть до развития синдрома полиорганной
недостаточности [6, 19, 20, 23, 45].
511
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Успех ОТП во многом определен адекватностью анестезии и интраопераци-
онной интенсивной терапии, гемодинамическим и метаболическим мониторин-
гом в периоперационном периоде.
23.6.1. Предоперационный период
23.6.1.1. Патофизиология терминальной стадии
печеночной недостаточности
Проявления терминальной печеночной недостаточности разно-
образны, но большинство потенциальных реципиентов объединяет максимальная
тяжесть общего состояния. Исключение составляют больные с первичными зло-
качественными новообразованиями печени, у которых еще не развился в полном
мере комплекс гомеостатических нарушений. Контингент с высокой степенью
операционного риска — это больные с циррозом печени, осложненным порталь-
ной гипертензией, кровотечениями, асцитом и энцефалопатией.
Сердечно-сосудистая система. Для больных с циррозом печени и портальной
гипертензией характерны: высокие показатели СИ и насыщения кислородом ге-
моглобина смешанной венозной крови, умеренная тахикардия, артериальная гипо-
тензия, низкий уровень ОПСС [67]. Снижение тонуса сосудов и гипердинамичес-
кое состояние кровообращения обусловлены нарушением печеночного метаболиз-
ма вазоактивных и кардиотропных веществ. Ведущим фактором, способствующим
развитию вазодилатации сосудов спланхнической зоны [59], является высокая кон-
центрация в портальной крови циркулирующих вазоактивных веществ — оксида
азота, глюкагона, вазоактивного интестинального полипептида, ферритина. Эти ме-
диаторы снижают чувствительность а-адренорецепторов к норадреналину, умень-
шают ОПСС, увеличивают мезентериальное артериовенозное шунтирование [50,72].
Повышение сатурации смешанной венозной крови и снижение артериовенозной
разницы по содержанию кислорода обусловлено артериовенозным шунтированием
в кишечнике и селезенке [28]. Несмотря на высокий СИ, печеночный кровотоку
больных с циррозом печени снижен в результате выраженного уменьшения пор-
тального кровотока при нормальном или даже увеличенном кровотоке по печеноч-
ной артерии [29]. Значительные по объему асциты приводят к увеличению внутри-
брюшного и внутригрудного давлений, снижению венозного возврата и производи-
тельности сердца. Ранним признаком наступления сердечной декомпенсации у
больных с циррозом печени является увеличение ЧСС.
Дыхательная система. Нарушениям дыхания и газообмена при терминальной
стадии печеночной недостаточности способствуют: изменения вентиляционно-
перфузионных соотношений на фоне внутрилегочного шунтирования крови, спе-
цифическое поражение легочной паренхимы, выпотной плеврит. У большинства
больных с циррозом печени и портальной гипертензией диагностируют артери-
альную гипоксемию [36]. Из-за снижения диффузионной способности легких умень-
шается содержание кислорода в артериальной крови. Внутрилегочный шунт у боль-
ных портальной гипертензией может достигать 8—20 % и обусловлен наличием
артериовенозных анастомозов [58]. Кроме этого, у больных с циррозом печени
появляется внелегочное шунтирование крови между системой воротной вены и
легочными венами через непарную вену, вены средостения и параэзофагеальные
вены [62]. Наличие легочного и внелегочного шунтов увеличивает риск развития
512
ДЗ. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
воздушной эмболии. Несмотря на наличие артериальной гипоксемии, у 98 % боль-
ных с циррозом печени не развивается гипоксическая венозная вазоконстрикция,
а формируется внутрилегочная вазодилатация, обусловленная увеличением кон-
центрации глюкагона и вазоактивного интестинального полипептида [74]. Лишь у
2 % больных с алкогольным циррозом печени, портальной гипертензией и карди-
омиопатией, имеющих низкий СИ, развивается легочная гипертензия [53].
Причинами артериальной гипоксемии является: несоответствие вентиляции и
кровотока вследствие наличия внутри- и внелегочного шунтирования, альвеоляр-
ная гиповентиляция, вызываемая повышением внутрибрюшного давления (из-за
асцита) и уменьшением ФОЕ. Снижение коллоидно-онкотического давления плаз-
мы и отсутствие детоксикационной функции печени предрасполагают к повыше-
нию проницаемости альвеолярно-капиллярных мембран и отеку легких. Диффу-
зия кислорода может нарушаться в результате интерстициального отека легких и
наличия жидкости в плевральной полости. При острой печеночной патологии
возможно развитие ОРДС у взрослых [50, 54, 55, 71].
Водно-электролитный обмен. Функцию почек нарушают шунтирование крови
и уменьшение перфузии коркового слоя из-за повышения содержания в плазме
крови ренина, альдостерона и норадреналина. Развивается олигурия с низким со-
держанием в моче натрия (менее 5 ммоль/л), нарушается азотвыделительная фун-
кция. Почки дополнительно повреждаются при нарушении биотрансформации
нефротоксических лекарственных веществ, в частности антибиотиков, накопле-
нии в крови эндо- и экзотоксинов [56]. Одним из наиболее важных звеньев нару-
шения функции почек у больных с заболеваниями печени, в частности при цир-
розе, является первичная (обусловленная возрастанием уровня альдостерона) и
вторичная (обусловленная снижением эффективного объема плазмы) задержка и
реабсорбция натрия почечными канальцами. Снижение плазматического объема
наступает вследствие перемещения воды из внутрисосудистого сектора в интер-
стициальное пространство и свободную брюшную полость, что быстро вызывает
активацию волюмрецепторов с последующей активацией симпатической нервной
системы. Темп разрушения печенью альдостерона первично связан с печеночным
кровотоком, который снижен у подавляющего числа больных с циррозом печени.
Диурез снижается в связи с усилением активности АДГ, что приводит к увеличе-
нию реабсорбции свободной воды в нефроне. Наиболее вероятно, что возрастание
концентрации АДГ у больных с печеночной недостаточностью вызывается по-
средством неосмотической стимуляции, включающей механизмы снижения ОПСС
и АД. Нарушения метаболизма АДГ в печени также способствуют возрастанию
его активности [21]. Терапия мочегонными средствами вызывает дальнейшие на-
рушения водного баланса, усугубляет гипонатриемию и гипокалиемию. Развива-
ется метаболический алкалоз [64].
В результате почечной дисфункции может развиться гиперкалиемия, которую
необходимо ликвидировать до операции, в том числе используя гемодиализ. Уме-
ренную гипокалиемию не корригируют, поскольку пуск кровотока через транс-
плантат сопровождается вымыванием больших количеств калия, содержащегося в
консервирующем растворе. Желудочно-кишечные кровотечения, гипотензия, де-
гидратация и всасывание из кишечника большого количества азотистых веществ
также способствуют развитию дисфункции почек, которые чаще обратимы, но иногда
столь серьезны, что развивается ОКН. Уровень креатинина плазмы является наи-
лучшим маркером для определения степени повреждения почек, так как при пече-
ночной недостаточности снижается темп синтеза мочевины печенью [29, 30].
17 7-585
513
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Нарушения внутрипочечной гемодинамики, в частности, снижение кортикаль-
ной перфузии и возникновение внутрипочечных шунтов играют решающую роль
в развитии гепаторенального синдрома. Другими факторами его патогенеза явля-
ются: активация ренин-ангиотензиновой системы, снижение синтеза простаглан-
динов, изменения в калликреин-кининовой системе, увеличение уровней вазоак-
тивного интестинального полипептида и других вазоактивных компонентов. У
больных с циррозом печени без почечных нарушений в 2—5 раз возрастают кон-
центрации ренина, альдостерона и норадреналина по сравнению со здоровыми
людьми. При развитии гепаторенального синдрома концентрация вышеперечис-
ленных гормонов и медиаторов возрастает еще в 2—3 раза. У больных с циррозом
печени и гепаторенальным синдромом по сравнению с больными без почечной
недостаточности снижена экскреция с мочой простагландина Е2 на 50 %, каллик-
реина — на 25 %. Простагландин Е2 и калликреин играют защитную роль при
ухудшении почечной функции у больных с циррозом печени. Почечная деком-
пенсация развивается, когда эти защитные механизмы исчерпываются [25, 39].
Возможна предоперационная гипокальциемия, которая опасна при значитель-
ных гемотрансфузиях из-за быстрого развития цитратной интоксикации. Гипо-
магниемию выявляют редко [64].
ЦНС. Специфическим проявлением печеночной недостаточности является
энцефалопатия, которая развивается по причине нарушения обменных процессов
в цикле мочевины и накопления в крови аммиака. Повышение креатинина и азо-
тистых шлаков в крови усугубляют интоксикацию и энцефалопатию. Клиничес-
кими проявлениями энцефалопатии являются: апатия, нарушение ориентации в
окружающем пространстве, немотивированные поступки, эпизоды амнезии. Вы-
раженные расстройства психики, вплоть до делирия, могут развиться в результате
нарушения биотрансформации психотропных лекарственных средств [55].
Системы крови и гемостаза. Анемия — результат угнетения процессов крове-
творения, гиперспленизма, кровотечений из варикозно расширенных вен пище-
вода. Снижение активности тромбоцитарного ростка и гиперспленизм приводят к
тромбоцитопении [54]. В печени синтезируются компоненты фибринолитической
системы (плазминоген), физиологические антикоагулянты (антитромбин III, про-
теин С, протеин S, альфа-антитрипсин, альфа-2-макроглобулин) и факторы свер-
тывания (I — фибриноген, II — протромбин, V, VII, IX, X, XI, XII, фактор Фитц-
джеральда). При печеночной недостаточности снижается синтез вышеперечис-
ленных факторов, что приводит к удлинению протромбинового времени и АЧТВ.
Факторы II, IX, X зависят от содержания витамина К, факторы I и V — не зависят.
Концентрация фактора VIII, который не синтезируется в печени, может возрасти
при печеночной недостаточности в результате его выброса из эндотелия сосудов.
Наиболее чувствительным маркером нарушений белкового синтеза в печени явля-
ется VII фактор, имеющий наиболее короткий период полувыведения. Ряд иссле-
дователей указывают на возможность развития при печеночной недостаточности
ДВС-синдрома с вторичным фибринолизом [35, 64].
23.6.1.2. Клиническая фармакология
анестезиологических лекарственных средств
при хронической печеночной недостаточности
При хронических болезнях печени по мере развития гипоальбуми-
немии уменьшается возможность связывания лекарственных препаратов с белками
крови и, следовательно, повышается концентрация свободной фракции препара-
514
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
тов, приводя к усиленному распределению и повышению концентрации в рецепто-
рах. В синусоидах печени лекарства диффундируют в гепатоциты. Клиренс препа-
ратов в гепатоцитах зависит от количества имеющихся энзимных систем и их ак-
тивности. При развитии портосистемного шунтирования снижается печеночный
кровоток. Метаболизм лекарств уменьшается по мере снижения эффективного пе-
ченочного кровотока и активности микросомальных ферментов [41, 53]. Существу-
ет тесная взаимосвязь между печеночным кровотоком и метаболизмом препаратов,
которые имеют высокие экстракцию и клиренс в гепатоцитах (пропофол, лидока-
ин, фентанил). Метаболизм препаратов с низкой экстракцией и клиренсом в гепа-
тоцитах (диазепам, фенобарбитал) не зависит от печеночного кровотока [70].
Наибольшую роль в метаболизме препаратов играет энзимный комплекс ци-
тохрома Р450. В результате индукции цитохрома Р450 клиренс препаратов повыша-
ется [65], в результате уменьшения печеночного кровотока и массы гепатоцитов,
нарушенного печеночного метаболизма и уменьшения в плазме холинэстеразы —
понижается. Эффектом снижения портальной экстракции является уменьшение
“эффекта первого прохода” препаратов, что приводит к их повышенной биодоступ-
ности. Каждая болезнь представляет собой различную совокупность этих наруше-
ний, а каждый пациент — их уникальную индивидуальную комбинацию.
Эффект препаратов необходимо тщательно мониторировать [77]. Клиренс
морфина у больных с циррозом печени не нарушен, вероятно, из-за внепеченоч-
ной глюкуронизации морфина, так что его метаболизм сохранен при всех степе-
нях печеночной недостаточности. Изменения в клиренсе и связывания с белками
фентанила и суфентанила при циррозе печени отсутствуют вообще [33, 38, 42, 57].
Эффект печеночной дисфункции на мышечные релаксанты неоднозначен:
действие сукцинилхолина удлиняется в связи с уменьшением уровня холинэсте-
разы; объем распределения панкурониума возрастает на 50 %, что приводит к
снижению его концентрации в плазме, уменьшению клиренса и удлинению пери-
ода полувыведения до 3—5 ч [37]; клиренс векурониума снижается при болезнях
печени [24]; метаболизм атракуриума не нарушается при печеночной недостаточ-
ности, но печеночный клиренс лауданозина, его главного метаболита и стимуля-
тора ЦНС, удлиняется [61, 81].
Кардиоваскулярные препараты необходимо назначать в уменьшенных дози-
ровках. Лидокаин и новокаинамид имеют сниженный клиренс у больных с цирро-
зом печени, следовательно, может развиться токсический эффект, если дозировку
не снизить на 50 %. Дозировки p-блокаторов и блокаторов кальциевых каналов
уменьшают на 50 % при внутривенном и на 80 % при оральном путях введения.
Клиренс метоклопрамида при алкогольном циррозе уменьшен, что требует 50 %
снижения дозировки [82].
23.6.2. Интраоперационный период
Для успешного анестезиологического обеспечения ОТП требует-
ся наличие современной медицинской техники и достаточного запаса необходи-
мых лекарственных средств, соблюдение разработанных алгоритмов (протоколов)
в различных ситуациях.
Необходимое оснащение в операционной для ОТП: наркозно-дыхательный аппа-
рат с бактериальным фильтром, капнограф, масс-спектрометр, система быстрой
инфузии (можно использовать АИК и оксигенатор с набором магистралей), селл-
515
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
сейвер, монитор с термодилюционной приставкой для инвазивного контроля ге-
модинамики, микроанализатор, биохимическая лаборатория, полуавтоматические
перфузоры (4 шт.), гравитационные дозаторы (3 шт.), дефибриллятор, согреваю-
щий матрац (38 °C), набор сосудистых катетеров.
Необходимые лекарственные средства для ОТП: кислород, тиопентал-натрий,
натрия оксибутират, дитилин, ардуан, фентанил, допамин, добутамин, мезатон
(фенилэфрин), нитроглицерин, норадреналин, маннитол, фуросемид, тиенам, ап-
ротинин, аминокапроновая кислота, метилпреднизолон, адреналин, инсулин, ге-
парин (для лабораторных исследований и селл-сейвера), 5 и 40 % раствор глюко-
зы, 0,9 % раствор хлорида натрия (25 л для селл-сейвера), 5 % раствор альбумина
(1 л для отмывания донорской печени перед реперфузией, 4 °C).
Необходимые инфузионно-трансфузионные препараты для ОТП: эритроцитарная
масса (не менее 5 л), свежезамороженная плазма (не менее 3 л), 10 % раствор аль-
бумина (не менее 3 л), криопреципитат (не менее 20 доз), 7,5 % раствор хлорида калия.
При необходимости проведения сердечно-легочной реанимации заранее го-
товят шприцы с атропином, лидокаином, адреналином, хлоридом или глюкона-
том кальция, натрия гидрокарбонатом.
Под пятки, крестец, затылок подкладывают мягкие прокладки.
Необходимость быстрой инфузии больших объемов крови и ее компонентов в
случае острой массивной кровопотери может возникнуть на любом этапе опера-
ции. Система быстрой инфузии включает: 3-литровый резервуар (заполняют пе-
ред операцией эритроцитарной массой, плазмой и кристаллоидами), роликовый
насос, систему магистралей, кровяные фильтры, воздушную ловушку и инфузи-
онный монитор. С этой же целью используют некоторые узлы АИК, что позволя-
ет проводить инфузию крови со скоростью 1500 мл/мин и более. Применяя систе-
му быстрой инфузии, следует особенно тщательно контролировать ДЛА из-за опас-
ности объемной перегрузки малого круга кровообращения.
Консервированная кровь содержит большое количество калия, поэтому его
массивное поступление в сосудистое русло может вызвать внезапную остановку
сердца. Перед началом гемотрансфузии убеждаются, что кровь, содержащаяся в
резервуаре системы быстрой инфузии, не содержит угрожающих концентраций
ионов калия, а если содержит, то проводят отмывание донорской крови селл-
сейвером. Селл-сейвер обычно напрямую соединяют с системой быстрой инфу-
зии. Использование крови из селл-сейвера не повышает риск развития коагулопа-
тии и инфекционных осложнений. Этот метод применяют у пациентов с повы-
шенным уровнем аммиака, лактата и калия, так как в процессе обработки аутокрови
содержание подобных веществ в ней резко снижается [32]. Метод не применяют у
пациентов со злокачественными заболеваниями печени.
Обеспечение термостабильности в течение всей операции является первосте-
пенной задачей [1]. Температура тела начинает снижаться еще во время индукции
в наркоз, затем гипотермия прогрессирует во время беспеченочного этапа опера-
ции, при функционировании экстракорпорального вено-венозного обхода, а так-
же после реперфузии, когда охлажденный консервированный орган включен в
систему циркуляции. При гипотермии развивается дисфункция тромбоцитов, ко-
агулопатии, ухудшается функция проводящей системы сердца, может развиться
брадикардия, желудочковые эктопические экстрасистолы, коронарный ангиоспазм.
В профилактических целях поддерживают необходимую температуру воздуха в опе-
рационной, используют согревающий матрац и подогретые растворы для инфузи-
онной терапии.
516
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
Стандартная премедикация включает: мидазолам, димедрол, фамотидин и ат-
ропин.
Предпочтительна техника краш-индукции. Для вводного наркоза чаще исполь-
зуют тиопентал-натрий (4—6 мг/кг), кетамин (2 мг/кг), этомидат (300—500 мкг/кг)
в сочетании с сукцинилхолином (1—2 мг/кг). Все последующие действия (сосуди-
стые доступы, введение в мочевой пузырь катетера Фолея, в желудок — мягкого
назогастрального зонда) выполняют после интубации трахеи.
Для поддержания анестезии применяют ингаляционные или внутривенные анес-
тетики в сочетании с наркотическими аналгетиками [5]. В настоящее время наиболее
предпочтительным ингаляционным анестетиком является изофлюран (0,6—1,5 об. %),
который обеспечивает оптимальные соотношения между доставкой и потреблени-
ем кислорода в печени [30]. Следует избегать применения закиси азота, поскольку
это может привести к транслокации газа из перерастянутого кишечника и повысить
риск газовой эмболии. При использовании мышечных релаксантов, метаболизиру-
емых в печени (панкурониума, векурониума), мониторируют нервно-мышечную
проводимость с помощью теста стимуляции лицевого нерва [6, 67].
После интубации трахеи возможно поддержание наркоза натрия оксибутира-
том (0,6 мг/кг/мин). Дозировка фентанила в течение первого часа операции —
20,0 мкг/кг, затем — 0,06—0,08 мкг/кг/мин.
ИВЛ проводят высоким объемом и с низкой частотой. Небольшое конечное
положительное давление на выдохе позволяет осуществлять адекватную альвео-
лярную вентиляцию, особенно в нижних долях, а также предотвращает риск воз-
душной эмболии легочной артерии из печеночного трансплантата после его ре-
перфузии.
Длительное нефизиологичное положение больного на операционном столе,
использование ранорасширителей и ретракторов по типу Rochard может привести
к позиционному синдрому сдавления плечевого сплетения. Компрессия плечево-
го нерва может усилиться также вследствие наличия магистралей в подмышечной
вене при циркуляции экстракорпорального обхода, что учитывают при проведе-
нии анестезии [67].
Обеспечивают всесторонний мониторинг: катетеризируют правую лучевую ар-
терию артериальной канюлей 16 G (для прямого измерения АД и забора крови);
катетер Swan-Ganz вводят в правую внутреннюю яремную вену (для измерения
ДЛА и ДЗЛА через интродюсер 8,5 F; в 2 порта этого катетера вводят апротинин и
добутамин); трехпросветный катетер 7 F устанавливают в правую подключичную
вену и соединяют с дозаторами норадреналина, фентанила и допамина; катетер
8,5 F устанавливают открытым способом в левой подкрыльцовой вене и соединя-
ют с системой быстрой инфузии; катетер 16 или 14 G устанавливают в правой
локтевой вене. Если во время операции применяют экстракорпоральный венове-
нозный обход, то дополнительно катетеризируют левую подкрыльцовую и левую
бедренную вены.
Для непрерывного инвазивного измерения систолического и диастолического
АД, САД, СДЛА, ЦВД, ЭКГ и температуры тела используют мониторы с термоди-
люционной приставкой для регистрации параметров центральной гемодинамики.
Систему быстрой инфузии соединяют с катетером (внутренний диаметр 3 мм),
находящимся в левой локтевой подкожной или внутренней яремной венах. Дози-
рованное введение лекарственных средств осуществляют с помощью полуавтома-
тических перфузоров (допамина, оксибутирата натрия, норадреналина, апротини-
на) и гравитационных дозаторов (добутамина, нитроглицерина, фентанила). С
517
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
помощью общепринятых методов в течение операции оценивают показатели КОС,
газового состава артериальной и смешанной венозной крови, электролитов плаз-
мы (К+, Na+, Са++), содержания белка и глюкозы крови, параметры гемостаза
(время свертываемости, фибриноген, протромбиновый индекс) [5, 6, 36].
Операция состоит из трех этапов: добеспеченочного (выделение над- и подпе-
ченочных отделов нижней полой вены, сосудистых структур ворот печени и свя-
зок печени), беспеченочного (от пережатия всех печеночных сосудов и удаления
печени до реперфузии трансплантата), послебеспеченочного (от реперфузии транс-
плантата до окончания операции).
Соответственно этапам хирургического вмешательства, проведение общей
анестезии тоже делят на 3 основные стадии.
23.6.2.1. Добеспеченочная стадия
Стадия начинается с кожного разреза, заканчивается — полным
выключением печени из кровотока.
Цель: поддержание адекватной преднагрузки (ЦВД > 5 мм рт. ст., СДЛА -
10—18 мм рт. ст., ДЗЛК — 6—12 мм рт. ст.), СИ и САД — в физиологических значениях.
Проблемы: кровопотеря при мобилизации печени и магистральных сосудов,
нестабильность гемодинамики в связи с манипуляциями хирурга на нижней по-
лой вене, ротация печени и снижение при этом венозного возврата.
Задачи: управление ОЦК, руководствуясь уровнями ЦВД, СДЛА, ДЗЛК, гема-
токрита, гемоглобина, общего белка плазмы крови и диуреза.
Гемотрансфузию (эритроцитарной массы, свежезамороженной плазмы, аль-
бумина, крови из селл-сейвера) начинают у больных с циррозом печени в начале
операции и продолжают в объеме, соответствующему объему кровопотери. Пере-
ливание тромбоконцентрата начинают при снижении тромбоцитов менее 50 х 1 O’/л,
так как резко повышается риск внутримозговых кровоизлияний. Гематокрит под-
держивают в пределах 25—30 л/л, общий белок — 55,0 г/л.
Гипотензия в этой стадии чаще всего обусловлена гиповолемией, кровопоте-
рей, хирургическими манипуляциями (сдавлением крупных сосудов при их выде-
лении) [56]. Непрерывно инфузируют допамин (2,0—3,0 мкг/кг/мин). Для профи-
лактики активации плазминогена и фибринолиза применяют апротинин, который
вводят вначале болюсно 200 000 ЕИК, затем — непрерывно до конца операции
50 000 -100 000 ЕИК/ч.
23.6.2.2. Беспеченочная стадия
Стадия начинается с пережатия надпеченочного отдела нижней
полой вены, заканчивается — включением печени в кровоток.
Цель: поддержание перфузионного давления АД на уровне 60—70 мм рт. ст.,
ЦВД — 5—10 мм рт. ст., СДЛА — не более 20 мм рт. ст., ДЗЛК — не более 12 мм рт. ст.,
коррекция метаболического ацидоза и гипокальциемии.
Проблемы: гиподинамия кровообращения, снижение венозного возврата при
пережатии нижней полой вены, венозная почечная гипертензия, отек кишечной
стенки, кровотечение, коагулопатия, синдром системного воспалительного ответа.
Задачи: стимулирование сократительной способности миокарда (добутамином),
поддержание перфузионного АД на уровне не более 60—70 мм рт. ст. (норадрена-
лином и фенилэфрином).
518
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
ИВЛ проводят с FiO2 = 1,0. Избегают избыточного введения кристаллоидов
из-за опасности развития отека легких. При повышении СДЛА более 16 мм рт. ст.
используют нитраты.
Пережатие нижней полой вены оказывает большее влияние на гемодинамику,
чем воротной. После удаления печени внутривенно вводят 1,0 г метилпреднизоло-
на. Стероиды блокируют освобождение IL— 1, IL-2, IL—6 из макрофагов. На этой
же стадии проводят пассивную иммунизацию реципиента с целью профилактики
реинфекции гепатита В из трансплантата посредством введения гипериммунного
глобулина [67].
Беспеченочная стадия сопровождается тяжелыми гемодинамическими и ме-
таболическими нарушениями, степень которых зависит от наличия или отсут-
ствия экстракорпорального веновенозного обхода. При отсутствии последнего
развивается глубокая гипотония вследствие снижения венозного возврата, что тре-
бует применения вазопрессоров (адреналина, норадреналина, допамина, добута-
мина) [40]. Снижение сердечного выброса в сочетании с пережатием нижней по-
лой вены приводит к нарушению перфузии почек и, как следствие, — к олигурии.
Использование веновенозного обхода уменьшает негативные проявления в беспе-
ченочной стадии [5, 6, 60].
В некоторых центрах веновенозный обходной шунт не используют из-за опас-
ности потенциальных осложнений, например, воздушной эмболии, тромбоэмбо-
лии, а также из-за увеличения длительности операции [76]. В то же время, много-
численные физиологические преимущества экстракорпорального шунтирования
кавальной и портальной венозных систем являются очевидными, особенно у па-
циентов с тяжелой портальной гипертензией. При удлинении времени работы шунта
может повыситься гематокрит, коллоидно-онкотическое давление и осмолярность
плазмы, а также может прогрессировать метаболический ацидоз. Следует доби-
ваться ровного адекватного кровотока по экстракорпоральному контуру. Обычно
производительность шунта составляет 1000 мл/мин, но ее можно менять в зависи-
мости от параметров центральной гемодинамики, но не более чем на 40 % МОК.
Снижение конечного диастолического объема правого желудочка свидетельствует
о неэффективности шунтирования; показателем адекватной производительности
служит удовлетворительный диурез в течение всего беспеченочного этапа опера-
ции [37].
Метаболический ацидоз (при BE > 5,0 ммоль/л и НСО3~ <15 ммоль/л ) кор-
ригируют натрия гидрокарбонатом и повышением рСО, до 50 мм рт. ст. путем
изменения параметров ИВЛ. Коррекцию коагулопатии осуществляют свежезамо-
роженной плазмой.
За 15—30 мин до реперфузии печеночного трансплантата внутривенно вводят
препараты фармакологической противоишемической защиты: метилпреднизолон
(I г), верапамил (0,15 мг/кг), вазапростан (0,7 мкг/кг), маннитол (0,5 г/кг). Внутри-
венное введение вазапростана повторяют после включения печеночной артерии.
Перед реперфузией донорскую печень промывают через воротную вену хо-
лодным 5 % раствором альбумина или Рингер-лактата (1000 мл, не менее 45 % от
веса донорской печени) от консервирующего раствора, содержащего калий и про-
дукты метаболизма, образующиеся в процессе консервации. Выход перфузата про-
исходит через неполностью сформированный подпеченочный анастомоз нижней
полой вены. За 1 мин до реперфузии вводят 50—100 ммоль бикарбоната натрия и
1,0 г хлористого кальция.
519
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
23.6.2.3. Послебеспеченочная стадия
Стадия начинается с последовательного снятия зажимов с ниж-
ней полой и воротной вен и завершается с окончанием операции.
Цель: коррекция коагулопатии, согревание больного, опенка функции пече-
ночного трансплантата.
Проблемы: коагулопатии, тромбоцитопения, фибринолиз, гипотермия, ОПН,
метаболический ацидоз, гемодинамическая нестабильность, дисфункция печеноч-
ного трансплантата, синдром первично нефункционирующего трансплантата, ги-
погликемия, гипернатриемия, гиперосмолярность.
Тщательно проводят гемостаз в течение 1,5—2 ч и только затем ушивают брюш-
ную полость и операционную рану. Диагностику нарушений гемостаза проводят с
помощью коагулограммы, подсчета числа тромбоцитов и данных ТЭГ. Дефицит
факторов свертывания восполняют свежезамороженной плазмой и тромбоцитар-
ной массой. Для лечения фибринолиза используют апротинин и аминокапроно-
вую кислоту. Согревание больного и коррекция метаболического ацидоза также
являются методами лечения коагулопатии.
Интраоперационное восполнение потерь жидкости осуществляют на основа-
нии гемодинамического мониторинга и учета диуреза. При отсутствии поврежде-
ния почек диурез без использования диуретиков должен составлять 0,5—1,0 мл/кг/ч
и более. Этот показатель является индикатором адекватного восполнения внутри-
сосудистого объема и хорошей функции сердечно-сосудистой системы. Если при
адекватном восполнении жидкости и нормальном уровне ЦВД у больного сохра-
няется олигурия, то оптимизируют сердечный выброс фармакологически, после
чего ожидают восстановления диуреза в ответ на введение фуросемида или ман-
нитола. Допамин (2—3 мг/кг/мин) в сочетании с диуретиками также позволяет
добиться высокого темпа мочеотделения.
Острое интраоперационное повреждение почек, сопровождающееся олигоа-
нурией при отсутствии ответа на введение диуретиков, является серьезной про-
блемой, так как резко ограничивает объем инфузионной терапии и создает угрозу
перегрузки малого круга кровообращения и развития отека легких. В такой ситу-
ации ограничивают введение воды и натрия и рассматривают вопрос о проведе-
нии ультрафильтрации или гемодиализа. Интраоперационная ультрафильтрация,
с одной стороны, повышает опасность кровотечения, но, с другой стороны, уда-
ляя избытки воды из сосудистого сектора, способствует повышению концентра-
ции в крови синтезируемых факторов свертывания. Ее можно рассматривать, как
шаг в коррекции коагулопатии.
Фаза характеризуется особенно выраженными гемодинамическими и метабо-
лическими сдвигами, а также потенциальной угрозой воздушной эмболии. В на-
чале послебеспеченочного этапа операции выполняют наложение артериального
анастомоза. В случаях неадекватного кровотока (менее 200 мл/мин) возникает
необходимость в сосудистой реконструкции и анастомозировании кондуита пече-
ночной артерии с инфраренальным отделом аорты. Это требует временного боко-
вого или полного пережатия аорты, что может отразиться на показателях гемоди-
намики [67]. Во время включения артериального анастомоза необходимо поддер-
живать систолическое АД на уровне не менее 100 мм рт. ст., в противном случае
возникает опасность гипоперфузии печени. После окончания реваскуляризации
печени измеряют градиент давлений выше и ниже анастомозов нижней полой
вены, что позволяет исключить наличие возможной деформации в области верх-
520
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
него анастомоза, которая проявится в будущем внутрипеченочной венозной ги-
пертензией.
Во время наложения желчеотводящего анастомоза задачами анестезиологи-
ческой бригады являются согревание больного и коррекция коагулопатии. Если
сохраняется гипотермия, то проводят активные мероприятия по повышению тем-
пературы в операционной, ирригации брюшной полости подогретыми раствора-
ми, осуществляют прямое согревание операционного поля осветительными лам-
пами. Эффект гепарина, используемого для обработки канюль магистралей вено-
венозного обхода в дозировке 1000—2000 ЕД, нейтрализуют введением
протамин-сульфата.
Начальный период послебеспеченочного этапа операции может осложниться
развитием реперфузионного синдрома [21], который характеризуется гипотензией,
брадикардией, аритмией, циркуляторным коллапсом и желудочковой фибрилля-
цией. Повышается давление в легочной артерии, развивается дисфункция желу-
дочков [78], нарушается сократимость межжелудочковой перегородки, поданным
ЭхоКС наблюдают пролабирование межжелудочковой перегородки в полость ле-
вого желудочка. Развитие реперфузионного синдрома объясняют внезапным по-
ступлением в кровоток из печеночного трансплантата холодного раствора с низ-
ким pH и высоким содержанием калия. Это может произойти даже при проведе-
нии превентивных мероприятий вследствие отека эндотелия и неадекватного
предварительного промывания раствором мелких внутрипеченочных сосудов.
Максимальную концентрацию калия в легочной артерии регистрируют в течение
первых 5 мин реперфузионной стадии [37]. Это состояние требует срочного внут-
ривенного болюсного введения раствора глюкозы (декстрозы) с инсулином.
Дополнительной причиной развития реперфузионного синдрома является
эвдотоксинемия. Эндотоксины направленно воздействуют на макрофаги, моно-
циты, лимфоциты и эндотелиальные клетки, активируют систему комплемента и
цитокины. Медиаторы, освобождаясь в сосудистое русло, оказывают не только
местное разрушительное действие, но также могут вызывать шок, лихорадку, ва-
зодилатацию, нарушение свертывания крови, судороги, тканевые некрозы, по-
вреждение эндотелия. В зависимости от степени эндотоксинемии могут развить-
ся: кровоточивость, коллапс, первичная недостаточность печеночного трансплан-
тата, ОПН, полиорганная недостаточность. Лечение эндотоксинемии
специфическими моноклональными антителами не привело к снижению леталь-
ности. Профилактика заключается в превентивном контроле грамотрицательной
инфекции тиенамом.
Цель: профилактика осложнений реперфузионного синдрома (гиперкалиемии,
гипотермии, воздушной эмболии, эндотоксемии).
Проблемы: артериальная гипотензия вплоть до асистолии, брадикардия, арит-
мии, воздушная эмболия, гипертензия в легочной артерии, метаболический аци-
доз, гипотермия.
Задачи. Для лечения артериальной гипотензии используют болюсное внутри-
венное введение адреналина (5—10 мкг), продолжают инфузию норадреналина. При
брадикардии вводят атропин и/или адреналин. Гиперкалиемию (К+ > 5,5 ммоль/л)
корригируют натрия гидрокарбонатом, хлористым кальцием, 40 % раствором глю-
козы с инсулином. Продолжают коррекцию метаболического ацидоза. Профилак-
тику воздушной эмболии осуществляют ИВЛ в режиме ПДКВ (5—10 см вод. ст.) с
положительным ЦВД. При асистолии проводят сердечно-легочную реанимацию.
Нарушения свертываемости крови контролируют по данным коагулограммы или
521
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ТЭГ. Через 30—90 мин функционирования трансплантата коагулопатия обычно
уменьшается. Фибринолиз корригируют апротинином и аминокапроновой кис-
лотой.
Чрезвычайно опасным осложнением реперфузионного синдрома является воз-
душная эмболия полостей сердца, которую диагностируют при помощи трансэзо-
фагальной Эхо КС [78]. Воздушная эмболия полостей сердца проявляется дисфун-
кцией правых полостей сердца, хотя фракция выброса из правого желудочка при
этом может не снижаться.
Реперфузионное повреждение печени объясняют действием высвобождающихся
свободных кислородных радикалов, а также активацией ксантиноксидазы и супер-
оксиддисмутазы. Инфузия маннитола во время реперфузии позволяет удалить зна-
чительную часть этих соединений из кровотока, а использование препаратов про-
стагландина Ер обладающих протективным действием на сосудистый эндоте-
лий, уменьшает тяжелое ишемическое повреждение печени даже при наличии
нереперфузируемых участков.
Первые 5 минут реперфузии. Восстановление кровотока через трансплантат
сопровождается кратковременной артериальной гипотензией, урежением ЧСС,
повышением ЦВД, СДЛА и ДЗЛК. Постреперфузионный синдром обусловлен
влиянием кардиодепрессивных и вазоактивных веществ, вымываемых из “новой”
печени, кишечника и нижних конечностей (простагландинов, калликреинов, лей-
котриенов, факторов, активизирующих тромбоциты и др.), а также снижением
температуры тела. Инфузионная терапия в этой стадии обычно включает приме-
нение препаратов кальция, бикарбонат натрия, глюкозу, инсулин (10-12 ЕД), ат-
ропин, адреналин. Преднагрузку оптимизируют ограничением введения инфузи-
онно-трансфузионных сред и снижением производительности системы быстрой
инфузии, ориентируясь на величину ЦВД. Высокое ЦВД может стать причиной
затруднения оттока из трансплантата. В данном случае показано применение нит-
роглицерина (10-20 мкг/мин) и фуросемида (1 мг/кг). На этом этапе ЦВД не
должно превышать 10—12 мм рт. ст. Через несколько минут после реперфузии
развивается гипердинамическое состояние кровообращения, обусловленное воз-
растанием венозного возврата с высоким насыщением гемоглобина кислородом
смешанной венозной крови. Инфузию добутамина прекращают.
Наиболее серьезные изменения гемодинамики и утилизации тканями кисло-
рода наблюдают в течение первых 30 мин реперфузионной фазы. Потребление
тканями кислорода восстанавливается спустя 1 ч после включения трансплантата
в кровоток.
Признаками дисфункции трансплантата являются: гемодинамическая неста-
бильность, отсутствие выделения желчи из донорской печени, коагулопатия, ги-
погликемия, неэффективность мероприятий по коррекции гипотермии и ацидоза.
При развитии синдрома первично нефункционирующего трансплантата ре-
ципиент нуждается в экстракорпоральной коррекции (гемофильтрации).
23.6.2.4. Метаболические и электролитные изменения
В течение добеспеченочной стадии выраженных изменений pH
не отмечают. К концу беспеченочного этапа операции наблюдают постепенное
снижение pH и увеличение показателя BE. Если показатель pH достоверно возра-
стает, то это свидетельствует о сдвиге кривой диссоциации оксигемоглобина вправо.
522
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
В течение бес- и послебеспеченочной стадий развивается декомпенсирован-
ный метаболический ацидоз. Причинами ацидоза являются: снижение системно-
го транспорта кислорода, отсутствие печеночного метаболизма неэстерифициро-
ванных жирных кислот и других кислых промежуточных продуктов обмена ве-
ществ, инфузия цитратной крови.
Тактика коррекции BE является дискутабельной. Основными отрицательны-
ми эффектами чрезмерно активного использования гидрокарбоната натрия явля-
ются гипернатриемия и гиперосмолярность. Коррекцию метаболического ацидоза
гидрокарбонатом натрия начинают при снижении BE менее 5 ммоль/л.
В бес- и послебеспеченочной стадиях, как правило, не отмечают достоверных
изменений концентрации калия в плазме крови. Вероятно, это объясняется доста-
точным отмыванием печеночного трансплантата 5 % раствором альбумина (1 л),
гипокалиемическим эффектом натрия оксибутирата и низким содержанием калия
в Кустадиоле (10 ммоль/л).
Снижение концентрации ионизированного кальция в плазме крови в течение
до- и беспеченочной стадий — типичное электролитное нарушение при ОТП,
требуюшее инфузии значительных количеств препаратов кальция, поскольку при
снижении уровня ионизированного кальция в плазме крови менее 0,56 ммоль/л
угнетается инотропная функция миокарда. Одной из причин снижения концент-
рации ионизированного кальция в плазме крови является массивная трансфузия
консервированной крови, содержащей цитрат натрия, который активно связывает
ионизированный кальций. В послебеспеченочной стадии содержание ионизиро-
ванного кальция достигает дооперационного уровня.
В течение бес- и начале послебеспеченочных стадий возможна умеренная ги-
пергликемия, причинами развития которой являются: использование значительных
доз метилпреднизолона, выброс глюкозы из гепатоцитов трансплантата, нарушение
оттока крови от поджелудочной железы. К концу операции уровень гликемии сни-
жается, что является важным начальным признаком восстановления метаболичес-
ких функций. Рост протромбинового индекса к концу операции свидетельствует о
начале восстановления белково-синтетической функции трансплантата.
23.6.2.5. Гемостаз
У большинства реципиентов, ожидающих трансплантации печени,
имеются нарушения коагуляции: снижен синтез факторов свертывания крови, син-
тезируются дисфункциональные коагулирующие факторы, развивается первичная
или вторичная активация фибринолиза, нарушены функции и количество тромбо-
цитов [67]. Во время ОТП эти нарушения усугубляются гемодилюцией с прогресси-
рующей тромбоцитопенией и потреблением факторов свертывания, преобладанием
процессов фибринолиза, снижением содержания ионизированного кальция и гипо-
термией [67]. В послеоперационном периоде фактором, негативно влияющим на
систему гемостаза, является консервационное и реперфузионное повреждение транс-
плантата, а в педиатрической группе больных — невозможность использования ру-
тинных медикаментозных гемостатических средств из-за риска тромбоза печеноч-
ной артерии. Результатом этого является высокий процент интра- и послеопераци-
онных кровотечений, нередко требующих, кроме фармакологической коррекции,
выполнения дополнительного хирургического гемостаза [67].
Полный мониторинг каскадной системы гемостаза включает исследования: про-
тромбинового времени, АЧТВ, тромбинового времени, уровня фибриногена, содер-
523
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
жания тромбоцитов, антитромбина III, определение лизиса эуглобулинов (как инди-
катора фибринолиза). Золотым стандартом является определение протромбинового
времени, АЧТВ, уровня тромбоцитов и фибриногена. Чрезвычайно важным является
возможность мониторирования системы коагуляции с помощью ТЭГ [28, 55].
Трансфузионная коррекция коагулопатии имеет особенности в течение каждой
из 3 стадий трансплантации печени. Дефицит факторов свертывания интраопера-
ционно восполняют переливанием свежезамороженной плазмы. При снижении в
сыворотке фибриногена менее 1 г/л, а также при ускоренном фибринолизе (что
регистрируют по данным ТЭГ и времени свертывания по Lee-White) показано пере-
ливание криопреципитата. Трансфузию тромбоцитарной массы проводят при не-
адекватном гемостазе и снижении концентрации тромбоцитов менее 50 000/мл. У
высокоиммунизированных пациентов переливание тромбоконцентрата может быть
малоэффективным из-за повышенного их разрушения в периферической крови. В
таких ситуациях осуществляют инфузию с учетом HLA-совместимости.
Фармакологическую коррекцию коагулопатии при трансплантации печени
осуществляют с помощью а-аминокапроновой кислоты, протамин-сульфата и
апротинина. Обычно при тяжелом фибринолизе вводят I г/ч аминокапроновой
кислоты в течение 5 ч, тем самым воздействуя на процессы активации тканевого
плазминогена. Гемодинамических нарушений и других осложнений при этом не
наблюдают [55].
После реперфузии трансплантата у некоторых пациентов возникают нежела-
тельные коагулопатические эффекты, обусловленные действием свободного гепа-
рина. В ряде ситуаций возникает необходимость обеспечить инактивацию гепари-
на протамин-сульфатом, который вводят в дозе, зависящей от АЧТВ. В отличие от
аминокапроновой кислоты, применение протамин-сульфата ассоциируется с ана-
филактическими и анафилактоидными реакциями, особенно у пациентов с инсу-
линозависимым сахарным диабетом, получающих протамин-инсулин. Учитывая
подобные побочные эффекты, использование протамин-сульфата проводят по стро-
гим показаниям.
Апротинин является неспецифическим ингибитором сывороточных протеаз и
одновременно демонстрирует подобную активность при гиперфибринолизе. Он также
снижает уровень тканевого плазминогена после реперфузии печени. Использова-
ние апротинина уменьшает потребность в интраоперационных гемотрансфузиях
почти на 50 % [45]. Вначале препарат вводят болюсно в дозе 200 000 ЕИК, а затем -
в виде медленной постоянной инфузии в дозе 50 000—100 000 ЕИК/ч.
Наряду с трансфузионной и фармакологической коррекцией коагулопатии
определенную положительную роль играют методы местного гемостаза. Описаны
различные способы, позволяющие улучшить гемостаз в операционной ране: при-
менение оксидной целлюлозы, аппликации фибринового геля, содержащего фиб-
риноген, фибронектин, фактор VIII и плазминоген [60]. Лучшим способом обес-
печения местного гемостаза при трансплантации печени в последнее время при-
знан аргоновый коагулятор [67].
23.6.2.6. Восполнение кровопотери
Интраоперационная потребность эритроцитарной массы при ОТП
может превышать 50,0 л, свежезамороженной плазмы — 20—30 л, альбумина -
10—15 л [67]. В отдельном наблюдении положительный результат был достигнут
после переливания 106 л крови (Gyness Book, 1991). В последние годы, благодаря
524
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
совершенствованию хирургической техники, улучшению фармакологической кор-
рекции коагулопатий, применению современных медицинских технологий, по-
зволяющих выполнять аутогемотрансфузии из операционной раны с помощью
селл-сейверов, потребность в донорской крови существенно уменьшилась и со-
ставляет в среднем 3—5 л эритроцитарной массы и препаратов крови [32].
Несмотря на явный прогресс, проблемы восполнения интраоперационной
кровопотери остаются достаточно актуальными. Первая группа проблем касается
непосредственно замещения кровопотери с помощью донорской крови и селл-
сейвера. Реципиенты печеночных трансплантатов сохраняют относительную то-
лерантность к кровопотере до снижения гематокрита не менее 21 л/л [67]. Вос-
полнение осуществляют донорскими отмытыми эритроцитами через отдельную
венозную магистраль с темпом, пропорциональным операционной кровопотере.
Как правило, для этого используют систему быстрой инфузии, снабженную инфу-
зионным монитором и гемофильтром. Использование последнего позволяет избе-
жать многочисленных негативных последствий массивных гемотрансфузий. Реин-
фузия аутокрови через селл-сейвер уменьшает потребность в донорской крови. В
среднем соотношение объемов реинфузии и консервированной крови в течение
всей операции составляет 1:3 [55].
23.6.3. Послеоперационный период
Операция ОТП у взрослых пациентов длится обычно 8—12 ч, но
после ушивания брюшной полости требуется дополнительно около 3 ч для подго-
товки больного к переводу в ОИТ. Все последующие диагностические и лечебные
мероприятия выполняют только у постели больного. Транспортировка пациента в
течение нескольких суток категорически запрещена.
Реципиента переводят в ОИТ с катетером Swan-Ganz, центральным венозным
катетером, несколькими периферическими венозными катетерами на верхней ко-
нечности, артериальным катетером и катетером в бедренной вене. Обязательными
являются постоянный назогастральный зонд для декомпрессии желудка и катетер
Фолея в мочевом пузыре. Маркированные дренажи брюшной полости Джексона-
Пратта подключают к закрытой (стерильной) системе отсоса и поддерживают в
рабочем состоянии. Желчный дренаж удлиняют и герметизируют. Сразу после
операции контролируют функциональную способность Т-образного дренажа. Оце-
нивают не только количество, но и цвет желчи. Дренажная трубка должна быть
полностью заполнена желчью и не содержать пузырьков воздуха. Наличие воздуха
в дренаже может свидетельствовать о его негерметичности, дислокации из просве-
та протока, либо о дефекте самого анастомоза. Обязательно выясняют причину
появления воздуха в желчном дренаже.
Мониторинг печеночных функций. Оценку функции донорской печени начина-
ют сразу после реперфузии на основании цвета и консистенции паренхимы орга-
на, но только желчеобразование служит главным признаком ее жизнеспособности
и коррелирует с выживанием пациента. Отсутствие желчеобразования чаше всего
свидетельствует об угрозе развития синдрома “первично нефункционирующего
трансплантата”. Нормальная желчь имеет темно-золотистый или светло-коричне-
вый цвет. Темная мутная желчь является признаком тяжелой ишемии и некроза
эпителия желчевыводящих протоков, ярко-зеленая желчь — признаком холестаза
(трансформация билирубина в биливердин в дренажной трубке) или присутствия
525
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
некоторых бактерий. Подобные находки не свидетельствуют о патологии у паци-
ентов с функционирующим гепатоеюноанастомозом.
После нормального желчеобразования вторым благоприятным фактором, сви-
детельствующим о восстановлении печеночных функций, является нормализация
свертывающего потенциала крови. Адекватная синтетическая функция новой пе-
чени проявляется улучшением показателей протромбинового времени, АЧТВ, уров-
ня фибриногена сыворотки и отсутствием кровотечения из операционной раны.
Лактацидоз является плохим прогностическим признаком, напротив, метабо-
лический алкалоз свидетельствует о положительной динамике. Метаболический
алкалоз развивается благодаря интенсивному печеночному метаболизму цитрата,
который присутствовал в препаратах крови, применяемых интраоперационно.
Кроме лактацидоза, отсутствия желчеобразования и сохраняющейся коагуло-
патии, об отсутствии (или плохой) функции трансплантата свидетельствуют: низ-
кий уровень сознания (кома), персистирующие уровни азота сыворотки или уро-
вень трансаминаз, гипогликемия, гемодинамическая нестабильность, почечная
недостаточность, гипотермия. Эти симптомы вызывают необходимость проведе-
ния быстрых и тщательно продуманных действий по дифференциальной диагнос-
тике синдрома “первично нефункционируюшего трансплантата” (ишемическое и
консервационное повреждение, тромбоз печеночной артерии, сверхострое оттор-
жение, сепсис), а также быстрой оценки перспектив выздоровления пациента или
решения вопроса об ургентной ретрансплантации [67].
Лабораторный мониторинг функции трансплантата в течение первых 48 ч после
операции включает контроль: печеночного повреждения (аминотрансфераз), ме-
таболических функций (клиренса лактата, синтеза глюкозы, белковосинтетичес-
ких функций, в том числе синтеза факторов свертывания крови), экскреторной
функции печени (продукции желчи). Мониторинг начинают в операционной сра-
зу после реперфузии печени. При удовлетворительной начальной функции на-
блюдают высокий клиренс лактата, глюконеогенез и, как результат, — гипергли-
кемию. Способность новой печени синтезировать факторы свертывания оценива-
ют по протромбиновому времени и ТЭГ. В течение первых часов после операции
содержание в крови ACT и АЛТ может быть сниженным или нормальным, что
объясняют значительными объемами интраоперационной инфузионной терапии
и гемодилюцией. В последующие 48—72 ч отмечают умеренный рост, а затем сни-
жение аминотрансфераз, что является закономерным процессом. При гемолизе
уровень ACT превышает уровень АЛТ. Стойкое повышение ферментов наблюдают
при жировой инфильтрации печени и сегментарных инфарктах.
На вторые сутки после операции рутинно выполняют допплерографию пече-
ночных сосудов. Селективную ангиографию и биопсию трансплантата применяют
при его прогрессирующей дисфункции [67].
Мониторинг общего состояния. Даже при удовлетворительной функции пече-
ночного трансплантата пациенты нуждаются в обеспечении тщательного монито-
ринга с целью предупреждения развития возможных специфических печеночных
и внепеченочных осложнений. Стандартный мониторинг включает: ЧСС, АД, ДЛА,
ЭКГ, пульсоксиметрию, капнографию, контроль температуры тела.
Неврологический статус пациента контролируют на основании оценки уров-
ня сознания, рефлексов ЧМН, моторных и сенсорных рефлексов. У некоторых
больных дополнительно изучают ВЧД и ПДМ.
Уровень сознания после операции ОТП может быстро восстанавливаться, но
в течение минимум 12 ч следует воздержаться от экстубации. В условиях мета-
526
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
болического алкалоза, обусловленного печеночным метаболизмом цитрата, может
наступить депрессия дыхательного центра. Явления глубокого алкалоза обычно
регрессируют через 48—72 ч, хотя повышенное содержание бикарбоната в крови
может сохраняться еще некоторое время. Это требует коррекции КОС путем внут-
ривенной инфузии через центральный доступ раствора НО*. Конечная точка тит-
рования pH сыворотки — менее 7,5.
Во время проведения ИВЛ осуществляют респираторный мониторинг. Рент-
генографию органов грудной клетки выполняют сразу же после транспортировки
больного из операционной и затем повторяют ежедневно до перевода пациента из
ОИТ. Спонтанная вентиляция возможна при устойчивой функции печеночного
трансплантата. Ее начинают при полном восстановлении сознания и отсутствии
признаков нарушения мозговых функций.
Параметры центральной гемодинамики при нормальной функции трансплан-
тата могут указывать на некоторое увеличение сердечного выброса. У таких паци-
ентов наблюдают брадикардию, причина которой полностью не выяснена. При
адекватной перфузии тканей это состояние не требует специфического лечения.
При выраженной брадикардии применяют атропин, используя ЭКГ-контроль. У
некоторых пациентов иногда регистрируют желудочковые эктопические экстра-
систолы, наиболее частыми причинами которых являются: ирритация эндокарда
пульмональным катетером (при удалении симптоматика исчезает), гипоксия, аци-
доз и электролитные нарушения.
Повышение ЦВД крайне нежелательно, так как приводит к ретроградному
повышению давления в печеночных венах и синусоидах, следствием чего является
отек паренхимы печени и ухудшение ее перфузии. Катетер Swan-Ganz, артериаль-
ный катетер и катетер из бедренной вены удаляют через 24 ч после транспланта-
ции или экстубации при условии удовлетворительных данных коагулограммы.
При неосложненном течении послеоперационного периода олигурия, про-
должающаяся обычно в течение 48—72 ч, не требует применения гемодиализа.
Как правило, достаточно внутривенного введения 40—60 мг фуросемида при усло-
вии обеспечения адекватного сердечного выброса и отсутствия водно-электролит-
ных нарушений. Малые дозы допамина, блокаторов кальциевых каналов, пенток-
сифиллина способствуют увеличению диуреза.
У пациентов с предшествующим рефрактерным асцитом и периферическими
отеками при нормальной функции печеночного трансплантата и восстановленном
диурезе в течение 48—72 ч из третьего пространства начинается мобилизация ин-
терстициальной жидкости. Обычные потери составляют около 5—25 кг воды, не
считая количества асцитической жидкости, удаленной во время операции. Это
требует адекватного восполнения интраваскулярного объема, но в послеопераци-
онном периоде применение кристаллоидных растворов сводят к минимуму. Вос-
полнение ОЦК проводят свежезамороженной плазмой (если протромбиновое вре-
мя > 15 с) или 5 % раствором альбумина (если уровень протромбинового времени
нормальный).
Ежедневно исследуют содержание электролитов — К+, Na+, Са++, Cl“, Mg++.
У некоторых пациентов иногда развивается гипонатриемия, которая ассоциирует-
ся с синдромом центрального понтийного миелинолиза или является следствием
интраоперационного применения гипотонических растворов. Если регистрируют
гипернатриемию, то применяют концентрированный 25 % раствор альбумина, а
при резком повышении осмолярности и угрозе отека мозга — гемодиафильтра-
цию. Потери больших объемов желудочного содержимого через назогастральный
527
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
зонд приводят к гипохлоремическому или гипокалиемическому алкалозу, первым
шагом лечения которого является восполнение дефицита калия (инфузия раство-
ра хлорида калия 0,5 ммоль/кг в течение 2 ч). Коррекцию гипокальциемии прово-
дят после стабилизации печеночных функций внутривенной инфузией раствора
хлорида кальция (20 мг/кг/ч). Гипофосфатемию корректируют внутривенной ин-
фузией Na2PO4 в дозе 0,33 ммоль/кг в течение 6 ч.
Особенности коррекции водных и электролитных нарушений в течение пер-
вых 48 ч после операции зависят от того, с каким состоянием волемии больной
переведен в ОИТ из операционной. Если диагностируют секвестрацию жидкости
в третьем пространстве, то объем инфузионной терапии увеличивают. При гипер-
натриемии и гипергликемии восполнение осуществляют 0,45 % раствором натрия
хлорида в 5 % растворе глюкозы. При выделении из брюшной полости по дренаж-
ным трубкам асцитической жидкости, восполнение (особенно у детей) осуществ-
ляют 5 % раствором альбумина по принципу “миллилитр за миллилитр”. В случае
гиповолемии агрессивную инфузионно-трансфузионную терапию продолжают в
течение 3—4 ч до достижения адекватных гемодинамических показателей и доста-
точного диуреза (> 1,0 мл/кг/ч).
Если после окончания операции уровень Mg++ в сыворотке крови нормаль-
ный, то сразу начинают терапию циклоспоринами; гипомагниемия может ослож-
ниться развитием судорожного синдрома (коррекцию проводят внутривенным
введением сернокислой магнезии в дозе 50 мг/кг в течение 6 ч). При назначении
магнийсодержащих антацидов вероятность развития гипомагниемии снижается.
Практически у всех реципиентов диагностируют тромбоцитопению (в сред-
нем, 30—60 х 109/л). Снижение уровня тромбоцитов менее 20 х 109/л опасно разви-
тием спонтанного внутримозгового кровоизлияния. Устанавливают причину тром-
боцитопении (внутрибрюшное или желудочно-кишечное кровотечения), прово-
дят ее коррекцию путем переливания тромбоцитарной массы.
Все биологические жидкости из дренажей (асцитическую жидкость, кровь,
желчь) подвергают обязательному цитологическому, биохимическому и бактерио-
логическому исследованиям. При отсутствии отделяемого из поддиафрагмальных
пространств, соответствующие дренажи удаляют на 2-е сутки. Дренаж из подпече-
ночного пространства удаляют к концу 2-й недели после выполнения фистулохо-
лангиографии и при отсутствии желчных осложнений. Катетер Фолея удаляют
после восстановления адекватного уровня сознания. Назогастральный зонд остав-
ляют в течение 3—4 суток до восстановления кишечной перистальтики; в течение
этого срока осуществляют мониторирование внутрижелудочного pH для адекват-
ной профилактики стрессовых язв желудочно-кишечного тракта.
Осложнения. Ранняя дисфункция трансплантата, обусловленная ишемичес-
ким и консервационным повреждениями или предшествующими заболеваниями
донора, может привести к почечной недостаточности, нарушениям сознания, па-
ралитической кишечной непроходимости и множеству других осложнений, по-
следствия которых могут быть чрезвычайно тяжелыми и потребовать длительной
интенсивной терапии.
В случае отсутствия функции трансплантата единственным вариантом спасе-
ния жизни больного до развития отека и ущемления ствола мозга является урген-
тная ретрансплантация. Частота синдрома “первично нефункционирующего транс-
плантата”, требующего ретрансплантации печени, в течение последних лет снизи-
лась с 18 до 10 %, но первичную дисфункцию донорской печени до сих пор
регистрируют в 15 % случаев [67].
528
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
Обезболивание. После ОТП осторожно назначают аналгетики, так как их пере-
дозировка может затруднить своевременную диагностику печеночной энцефало-
патии, обусловленную первично нефункционирующим трансплантатом. Абсолютно
противопоказано использование бензодиазепинов и НПВС. Рекомендуют приме-
нять фентанил.
23.7. ТРАНСПЛАНТАЦИЯ СЕРДЦА
Трансплантация донорского сердца является методом выбора в
лечении конечных стадий некоторых кардиальных заболеваний, при этом в ряде
наблюдений интенсивная медикаментозная терапия обеспечивает относительную
стабилизацию функции сердца, но этот эффект непродолжителен.
23.7.1. Предоперационный период
Патофизиология неизлечимых заболеваний сердца
Состояние потенциальных реципиентов перед операцией может
быть от крайне тяжелого до удовлетворительного и соответствовать II-III функци-
ональному классу по номенклатуре Нью-йоркской ассоциации кардиологов. Про-
гноз продолжительности жизни без операции не превышает нескольких месяцев.
Многие больные имеют в анамнезе эпизоды клинической смерти. До эры цикло-
спорина годичная выживаемость составляла 40 %. Биопсия миокарда (монито-
ринг острого отторжения) и агрессивная терапия острого отторжения лимфоцит-
специфическими моноклональными антителами увеличили общую выживаемость
реципиентов после трансплантации сердца до 80 % в течение первого года и более
70 % — в течение 5 лет. В некоторых центрах трансплантации 4-летняя выживае-
мость пациентов составляет 90 % [34, 45].
Неизлечимые болезни сердца являются результатом врожденных или приоб-
ретенных заболеваний сердечно-сосудистой системы; в большинстве случаев это —
ИБС, патология клапанов сердца, первичная кардиомиопатия. В зависимости от
нозологии фиксируют различные по длительности периоды компенсации, но в
конечном итоге наступает декомпенсация. При врожденных заболеваниях сердца
5-летняя выживаемость составляет менее 50 %, а у пациентов со стремительно
нарастающей симптоматикой декомпенсации — выживаемость еще меньше. На-
личие дисритмий и пониженная сократительная функции- сердца (низкая фракция
выброса) существенно ухудшают прогноз [45].
У реципиентов с дилатационной кардиомиопатией на ЭКГ часто регистриру-
ют мерцательную аритмию, дистрофические изменения миокарда, признаки пе-
регрузки левого и правого предсердий, нарушения внутрисердечной проводимос-
ти, экстрасистолию.
При ИБС выявляют рубцовые изменения миокарда, нарушения внутрижелу-
дочковой и предсердно-желудочковой проводимостей, желудочковую экстрасис-
толию (как правило, синусовый ритм сохранен). Для значительной части больных
характерна недостаточность митрального клапана, реже — трехстворчатого. Не-
редки тромбозы полостей сердца и тромбоэмболические осложнения [73].
При левожелудочковой недостаточности основным компенсаторным механиз-
мом является увеличение размера и конечного диастолического объема левого
529
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
желудочка, что делает более эффективным сокращение мышечных волокон мио-
карда и увеличивает УО, но при этом возрастает давление в левом предсердии и
начинает формироваться венозный застой в малом круге кровообращения. Другие
компенсаторные механизмы заключаются в увеличении выработки катехолами-
нов и ренина, что приводит к задержке натрия и воды.
Центральная гемодинамика характеризуется значительным повышением
КДДлж (до 20—30 мм рт. ст.), снижением его фракции изгнания (в большинстве
наблюдений — менее 20 %) и СИ (менее 2,5 л х мин-1 х м 2), увеличением конеч-
но-диастолического и конечно-систолического объемов левого желудочка (табл. 23.2).
У большинства больных повышено ДЛА (систолическое более 30 мм рт. ст.). Про-
грессирующее ухудшение гемодинамических показателей требует назначения инот-
ропной терапии (дигоксина, амринона, добутамина), вазодилататоров (каптопри-
ла, амринона) и диуретиков.
Таблица 23.2. Патофизиологические нарушения при дилатационной кардиомиопатии
Органы и системы Нарушения
Дыхательная система Легочная гипертензия, интерстициальный отек легких
Почки Преренальная азотемия
Печень Застойная ХпечН, гепатомегалия, асцит
ЦНС Нарушения сознания (низкий сердечный выброс)
Эндокринная система Гиперкатехоламинемия, увеличение концентрации ренина
Дыхательная система. Функция внешнего дыхания и условия газообмена су-
щественно нарушаются за счет интерстициального отека легких и уменьшения
легочных объемов при кардиомегалии и выпоте в плевральных полостях. Повы-
шение сопротивления дыхательных путей и уменьшение податливости легких при-
водят к увеличению ЧДД. На фоне нормализации гемодинамики после операции
эти нарушения подвергаются регрессу и не оказывают заметного влияния на ис-
ход операции [73].
Функции печени и почек. Грубые нарушения функций печени и почек для по-
тенциальных реципиентов не характерны, поскольку таких больных исключают
из “листа ожидания” трансплантации. Умеренная дисфункция печени и/или по-
чек является следствием ЗСН. Нарушение синтеза факторов свертываемости пред-
располагает к коагулопатии. Гипопротеинемия и снижение активности печеноч-
ного метаболизма лекарственных средств могут изменять их фармакодинамику и
фармакокинетику [52, 73]. Активность печеночных ферментов, как правило, не
повышена. Возможно появление умеренной протеинурии при нормальных пока-
зателях азотовыделительной функции почек. Преренальная азотемия на фоне низ-
кого сердечного выброса и интенсивной диуретической терапии является факто-
ром риска в развитии послеоперационной почечной недостаточности. В результа-
те активного назначения мочегонных препаратов могут развиться гипонатриемия,
гипокалиемия, метаболический алкалоз и гипомагнемия [73].
Психоэмоциональное состояние. Ожидание трансплантации сердца у 80 % боль-
ных вызывает умеренные психоэмоциональные расстройства — тревогу, страх,
возбуждение, эмоциональную несдержанность. Активное назначение седативных
препаратов чревато усугублением дыхательной недостаточности и дестабилизаци-
530
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
ей гемодинамики [52, 73]. Доверительная беседа с больными является альтернати-
вой фармакологическим воздействиям.
Показания и противопоказания к трансплантации сердца
Кандидатами на трансплантацию сердца являются пациенты в возрасте 40—60
лет с ишемической кардиомиопатией и сниженной фракцией выброса левого желу-
дочка сердца менее 20 %, пациенты с идиопатической и врожденной кардиомиопати-
ей, приобретенными пороками сердца, которые осложнились вторичной кардиомио-
патией и сопровождаются выраженным цианозом и/или гипертрофией миокарда.
Выраженная легочная гипертензия является абсолютным противопоказаниям
для трансплантации сердца, так как правый желудочек нормального донорского
сердца неспособен в кратчайшие сроки справиться с нагрузкой, вызванной высо-
кой резистентностью сосудов малого круга кровообращения. Точный уровень ле-
гочной гипертензии до сих пор не уточнен и является предметом дискуссии, но
большинство кардиохирургов придерживаются величины индекса периферичес-
кой сосудистой резистентности в легочной артерии в пределах 6—8 единиц Вуда
(480-640 дин х с х см-5 х м'2) и транспульмонального градиента между СДЛА и
ДЗЛК в пределах 10—15 мм рт. ст. При инкурабельной легочной гипертензии пред-
почтительна сердечно-легочная трансплантация.
Физиологический возраст при решении вопроса трансплантации сердца явля-
ется более весомым фактором, чем хронологический возраст.
Предоперационная подготовка
Как правило, пациенты с вышеуказанными заболеваниями получают ино-
тропные (дигоксин, амринон) и вазодилататируюшие (каптоприл, амринон) пре-
параты, диуретики и антиаритмические средства. Пациенты с увеличенным дила-
тированным сердцем и низким сердечным выбросом склонны к формированию
внутрисердечных тромбов. Прием антикоагулянтов и антиагрегантов способствует
повышенной кровоточивости. Длительное использование варфарина или гепари-
на осложняется тромбоцитопенией и снижением агрегационной способности тром-
боцитов. Аналогичные эффекты вызывают антагонисты кальция [52, 73]. Поэтому
перед операцией заблаговременно проводят заготовку препаратов крови, которые
подвергают тщательной проверке на наличие инфекции (одна из вероятных при-
чин летальности после трансплантации сердца — ЦМВ-сепсис при наличии цито-
мегаловирусной инфекции в донорской крови).
При сборе анамнеза устанавливают эффективность системной лекарственной
терапии (амиодарон, обладающий кумулятивными свойствами, снижает ЧСС транс-
плантата и обусловливает длительную элекгрокардиостимуляцию), тщательно изу-
чают аллергоанамнез, поскольку даже малейшая дестабилизация кровообращения
вследствие непродуманных медикаментозных воздействий может привести к опас-
ным осложнениям.
Донорская операция
Забор сердца производят одновременно с забором внутренних органов. Это
приводит к восстановлению регионарной перфузии консервирующим раствором
после пересечения брюшного и грудного отделов аорты, предотвращая непредви-
денную остановку сердца перед кардиоэктомией и повреждение трансплантата
сердца. Кардиоэктомию у донора начинают с перикардиотомии, затем тщательно
пальпируют эпикардиальные коронарные артерии для исключения бляшек. Мо-
билизуют аорту и обе полые вены. После системной гепаринизации перевязывают
531
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
верхнюю и нижнюю полые вены, а легочные вены берут на держалки. Кардиопле-
гическим раствором отмывают сердце через аорту. После остановки сердца аорту
пережимают, а легочные вены пересекают. Лимит ишемии для донорского сердца
составляет 4—6 ч (время от пережатия сосудов до наложения анастомозов при
трансплантации). Исходя из этого, минимальное исследование, которое успевают
осуществить, — это иммунологическая совместимость по АВО-системе.
Травма и остановка сердца во время его забора, гипоксемия и эндогенные
катехоламины могут вызвать серьезные повреждения органа, делающие его не-
пригодным для трансплантации. Практически во всех центрах нет ограничения в
возрасте для донорства, но если донор старше 40 лет, то необходимо тщательное
физикальное обследование во время забора для предотвращения внезапной коро-
нарной окклюзии.
23.7.2. Интраоперационный период
Премедикация. Эмоциональные переживания, сопровождающие-
ся активацией симпатоадреналовой системы, могут привести к декомпенсации
сердечной деятельности реципиента в результате повышения ОПСС и увеличения
постнагрузки на левый желудочек [73], но для премедикации не используют ней-
ролептики и сильнодействующие наркотические аналгетики. Избегают внутри-
венного введения препаратов. Атропин не назначают.
Если больной сильно взволнован, допустимо внутримышечное введение за 30
мин до операции небольших доз бензодиазепинов или их комбинации с промедо-
лом (0,1—0,15 мг/кг диазепама и 0,3 мг/кг промедола) [49, 68, 80]. При резко
сниженном сердечном выбросе даже 2,5 мг диазепама или 50 мкг фентанила могут
вызвать апноэ вследствие изменений фармакокинетики препаратов, нарушения
их поступления в ткани за счет низкого периферического кровотока или плохого
связывания с белками [52].
Удовлетворительное состояние пациентов, отсутствие одышки и ортопноэ не
должны снижать настороженности анестезиолога. Минимальная физическая на-
грузка при перекладывании пациента с каталки на операционный стол может при-
вести к появлению признаков недостаточности кровообращения (одышки, жалоб
на нехватку воздуха, болей в сердце). В этой ситуации больному на операционном
столе придают положение с приподнятым головным концом и начинают ингаля-
цию кислорода, затем катетеризируют периферическую вену и осуществляют пуль-
соксиметрический контроль.
Легкая внутривенная дооперационная седация атаракгиками необходима для
профилактики выброса эндогенных катехоламинов и повышения АД. Такое уси-
ление премедикации проводят за 20—30 мин до начала индукции в общую анесте-
зию под контролем ЭКГ и пульсоксиметрии.
Мониторинг. Инвазивный мониторинг АД проводят через канюлю или кате-
тер, которые вводят под местной анестезией в лучевую артерию. ЦВД регистриру-
ют через катетер в одной из подключичных вен или левой внутренней яремной
вене, поскольку правые подключичную или внутреннюю яремную вены после транс-
плантации используют для выполнения эндомиокардиальных биопсий.
Катетеризация легочной артерии в предперфузионный период не обязатель-
на. Современные методы обшей анестезии позволяют обеспечить достаточную
стабильность кровообращения, поэтому значимость мониторинга сердечного выбро-
532
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
са и гемодинамики малого круга до начала ИК невысока (более значима в после-
операционный период). Установка катетера Swan-Ganz показана у больных с вы-
сокой легочной гипертензией или получавших длительную инотропную терапию.
Перед пережатием турникетов вокруг полых вен дистальный конец катетера пере-
мещают в верхнюю полую вену, а после восстановления функции донорского сер-
дца вновь вводят в легочную артерию. Перемещения катетера повышают риск
инфицирования больных [52], поэтому используют изолирующие чехлы. Контро-
лируют центральную и периферическую температуру тела. Уретральный катетер
устанавливают в строго асептических условиях [52, 80].
Полезными методами мониторинга являются чреспищеводная ЭхоКГ и по-
стоянное измерение насыщения гемоглобина кислородом смешанной венозной
крови с помощью катетера, введенного в легочную артерию [73].
Вводный наркоз. Задача начального этапа анестезиологического пособия — дос-
тижение достаточной глубины общей анестезии без депрессии кровообращения.
Гипнотический эффект усиливают малыми дозами кетамина (25 мг до общей дозы
0,5-0,7 мг/кг) [3, 11, 52, 68]. Используют суфентанил (10—15 мкг/кг) [73]. Для ин-
дукции в анестезию приемлема внутривенная комбинация этомидата (0,3 мг/кг),
фентанила (10 мкг/кг) и сукцинилхолина (1,5 мг/кг). Необходимость дробного
введения препаратов с интервалами около 30 с обусловлена замедлением кровото-
ка при низком сердечном выбросе, что удлиняет время, необходимое для развития
клинического эффекта [46].
Поддержание анестезии. Используют методику общей аналгезии фентанилом,
которая наиболее подходит реципиентам с низкой сократительной способностью
желудочков (общая дозировка фентанила — 35—75 мкг/кг) .
Пациенты с тяжелой патологией сердца чувствительны к изменениям пред- и
постнагрузки, артериальная гипотензия может возникнуть при малейшей гипово-
лемии или снижении ОПСС, поэтому чреспищеводная ЭхоКС во время транс-
плантации сердца важна для оценки функции сердечно-сосудистой системы.
Предперфузионный период. До начала перфузии при ортотопической операции
на сердце манипуляции сводят к минимуму для предупреждения отрыва внутри-
сердечных тромбов. После раздельной канюляции полых вен и аорты начинают
ИК. Реципиента охлаждают, как при обычной кардиохирургической операции
(25-30 °C). В течение охлаждения сердце реципиента иссекают с оставлением
только участков предсердий с впадающими в них легочными и полыми венами, а
также как можно более длинными участками легочной артерии и аорты. Заднюю
часть донорского сердца (предсердия) иссекают и анастомозируют с соответству-
ющим остатком предсердий реципиента. С особым вниманием относятся к под-
держанию гипотермии передней стенки донорского сердца даже во время наложе-
ния анастомозов задней стенки, так как ее преждевременное согревание будет
способствовать в последующем правожелудочковой сердечной недостаточности.
Затем сердце заполняют холодным раствором с целью вытеснения воздуха и после
повторной деаэрации снимают зажим с аорты, что знаменует время окончания
ишемии. Электрическая активность сердца чаше восстанавливается спонтанно.
Последним накладывают анастомоз легочной артерии.
Во многих центрах перед снятием зажимов с аорты проводят профилактику
“гиперострого” иммунного ответа — за 30 мин внутривенно вводят 1000 мг метил-
преднизолона. Около 5 % реципиентов имплантируют электрокардиостимулятор.
Даже у пациентов с нормальным давлением в легочной артерии до операции
запускается механизм вазоконстрикции в сосудах малого круга кровообращения с
533
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
развитием правожелудочковой недостаточности, которая сохраняется часами и сут-
ками. Для ее лечения внутривенно постоянно вводят вазапростан (0,02 мкг/кг/мин),
который уменьшает постнагрузку на правый желудочек сердца.
23.7.3. Послеоперационный период
Начиная с первых послеоперационных суток, проводят комплек-
сную антибактериальную, противогрибковую и антивирусную профилактику.
При неосложненном течении посттрансплантационного периода и клинико-
лабораторных признаках адекватного сердечного выброса, нормальных показате-
лях АД, темпа диуреза более 0,5 мл/кг/ч без стимуляции, отсутствии перифери-
ческой вазоконстрикции, рО2 около 70 % ограничиваются мониторингом ЭКГ,
инвазивной регистрацией АД, ЦВД и пульсоксиметрией. При малейших призна-
ках дестабилизации кровообращения показан мониторинг сердечного выброса и
гемодинамики малого круга.
Поддерживают ЧСС на уровне 90—100 уд./мин, систолическое АД — 100-
110 мм рт. ст., ЦВД — 5—10 мм рт. ст., ДЛА — 25—30 (систолическое) и 10-15 (диа-
столическое) мм рт. ст., ДЗЛК — 8—12 мм рт. ст., СИ — не менее 2,5 л х мин-1 х м2,
рО, - 60-70 %.
Общепризнана рекомендация поддерживать умеренную тахикардию в тече-
ние нескольких первых суток после операции: повышение ЧСС не только увели-
чивает сердечный выброс и стабилизирует гемодинамику, но и способствует про-
филактике атрофических процессов в денервированном миокарде [73]. Для дости-
жения необходимой ЧСС назначают симпатомиметические кардиотоники с
отчетливым положительным хронотропным действием (изадрин, добутамин) или
применяют временную элекгрокардиостимуляцию. Методом выбора является пред-
сердная стимуляция (при сохраненной атриовентрикулярной проводимости), но
можно использовать предсердно-желудочковую и желудочковую. Длительность
искусственного навязывания ритма редко превышает 3—4 суток, у отдельных ре-
ципиентов может удлиниться до нескольких недель.
Восстановление нормальной насосной функции сердца происходит, как пра-
вило, в течение 3—4 суток. В это время показана кардиотоническая терапия. За-
медление адаптации трансплантата требует продолжения инотропной поддерж-
ки до 7—8 суток и не является негативным прогностическим признаком.
Осложнения. Типичное осложнение трансплантации сердца — синдром дис-
функции синусового узла, который клинически проявляется брадиаритмией. Ре-
гистрируют медленный узловой ритм, миграцию водителя ритма по предсердиям,
реже — выраженную синусовую брадикардию. Причины синдрома: травматичес-
кое повреждение и нарушение кровоснабжения зоны синусового узла, послед-
ствия перенесенной аноксии миокарда, перерастяжение правого предсердия и
денервация сердца [73]. Циклоспорин А обладает прямым отрицательным хроно-
тропным действием.
Прогрессирующую недостаточность насосной функции трансплантата наблю-
дают редко (0—8 %). Причины возникновения: повреждение сердца в организме
донора, длительность ишемии миокарда более 4 ч, дефекты техники изъятия орга-
на, его неэффективная защита во время аноксии, воздушная или материальная
эмболия коронарных сосудов, сверхострая реакция отторжения.
534
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
ЛИТЕРАТУРА
1. Козлов И.А., Алферова А.В., Пиляева И.Е., Матвеев Ю.Г. Анестезиологическое и
реанимационное пособие при трансплантации жизненно важных органов// Транспланто-
логия. Руководство. Под ред. В.И. Шумакова. — М.: Медицина; Тула: Репоникс Ltd. —
1995. - С. 121-159.
2. Колесник М.О., Сайдакова Н.О. Зам1сна ниркова тератя в Украш!: стан, пробле-
ми та шляхи !Т вирппення// Трансплантолопя, 2004. — том 7. — № 3. — С. 33—36.
3. Константинов Б.А., Дземешкевич С.Л., Бунятян А.А. Введение в клиническую
трансплантологию. — М.: Медицина. — 1993. — 391 с.
4. Корнеева С.П. Адекватный хронический гемодиализ// Матер1али Всеукрашсько!’
конференц!!' з м!жнародною участю “Актуальн! проблеми вщновлювально! хирурги”. —
Запор1жжя: Видавництво ЗДМУ. — 2001. — С. 146—147.
5. Мещеряков А.В., Готье С.В., Кожевников В.А. Анестезиологическое обеспечение
трансплантации печени//Анестезиология и реаниматология. — 1999. — С. 15—19.
6, -Мещеряков А.В., Кожевников В.А., Прокофьев А.А. Анестезия при транспланта-
ции печени// Анналы РНЦХ РАМН. — 1999. — № 8. — С. 39—45.
7. Новикова Р.И., Штутин С.А. Проблема выбора метода обезболивания в совре-
менной анестезиологии// Бёль, знеболювання i штенсивна тератя. — 2000. — № 3
(12). - С. 18-23.
8. Новикова Р.И., Штутин С.А. Факторы, определяющие безопасность оператив-
ных вмешательств// Бгпь, знеболювання i штенсивна тератя. — 2000. — № 1 (Д). — С.
388-389.
9. Новикова P.I., Штутш С.А. Анестезюлопчне забеспечення оперативних втру-
чань у хворих з хрошчною нирковою недостатшстю (методичн! рекомендацп). —До-
нецьк: Тов. Лебщь. — 2001. — 40 с.
10. Новикова Р.1., Штутш С.А. Оптим!зац!я обсягу периоперацшно! штенсивно!’
терапп// Медичи! перспективи. — 2000. — Том V. — № 4. — С. 76—79.
11. Руководство по анестезиологии/ Под ред. А.А. Бунятяна. — М.: Медицина.-
1997.- 656 с.
12. Руководство по трансплантации почки// Под ред. Габриэля Дановича/ Пер. с
англ., под ред. Я.Г. Мойсюка. — Третье изд. — Тверь: ООО Издательство Триада. —
2004. - 472 с.
13. Солонинко I.I., Сольман Д.Б. Тривала епщуральна анестез!я при операщях пере-
садки нирки// Матер!али конгресу анестезюлопв-реашматолопв Укра’ши “Актуальн!
проблеми анестезюлоп! та реашматологп”. — Запор!жжя: Комунар. —1992. — С. 56.
14. Суслов В.В. Интенсивная терапия и обезболивание в урологии. — К.: Здоров‘я. —
1981. - 192 с.
15. Суслов В.В. Клиническая физиология почек/ Руководство по интенсивной те-
рапии. Под ред. А.И. Трещинского, Ф.С. Глумчера. — К.: Вища шк., 2004. — С. 154—189.
16. Суслов В.В., Байда В.Г. Комбинированная многокомпонентная анестезия при
аллотрансплантации почки// Материалы 10-й Всесоюзной научной конференции
“Трансплантация органов”. — К.: Здоров'я. — 1985. — С. 88—89.
17. Чуев П.Н., Басенко И.Л., Каташинский О.Ю., Марухняк Л.И., Шкварок К.М.
Комбинированная анестезия в обеспечении операций аллотрансплантации трупной
почки// Б!ль, знеболювання i штенсивна тератя. — 2000. — № 1 (Д), — С. 472—473.
18. Штутин С.А., Родин И.Н. Анестезиологическое обеспечение операции аллот-
рансплантации почки// Матер!али конгресу анестезюлопв-реашматолопв Укра’ши
“Актуальн! проблеми анестезюлоп! та реашматологи”. — Запор!жжя: Комунар. — 1992. —
С. 253.
19. Шумаков В.И., Мойсюк Я.Г. Трансплантация печени в России// Транспланто-
логия и искусственные органы. — 1994. — Презентационный выпуск. — С. 25—28.
20. Шумаков В.И., Козлов И.А., Пиляева И.Е. Анестезиологическое обеспечение
ортотопической трансплантации печени// Анестезиология и реаниматология. — 1991. —
№ 4. - С. 3-10.
535
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
21. Aggrawal S., Kang Y., Freeman J.A., Fortunato F.L., Pinsky M.L. Postreperfusion
syndrome: cardiovascular collapse following hepatic reperfusion during hepatic transplantation//
Transplant Proc. — 1987. — 19. — P. 54—55.
22. Akpek E., Kayhan Z., Kaya H, Candan S., Haberal M. Epidural anesthesia for renal
transplantation: a preliminary report// Transplant Proc. — 1999. — Vol. 31. № 8. — P. 3149-
3150.
23. Anesthetic priciples for organ transplantation/ (eds.) D.R. Cook, P. J. Davis. New
York: Raven Press Ltd. — 1994. — 384 pgs.
24. Arden Y.R., Lynam D.P., Castognoli K.P. Vecuronium and alcoholic cirrhosis.
Pharmacokinetic and pharmacodynamic analysis// Anesthesiology, 1999. P. 771—778.
25. Bernardi M., Wilkinson S.P., Poston L. The renin-angiotensin-aldosterone system in
fulminant hepatic failure// Scand. J. Gastroenterol., 1993. — 18 (3). — P. 369—375.
26. Briggs J.D. The recipient of renal transplant//In: Kidney transplantation: principles
and practice. P.J. Morris (ed.). Philadelphia: W.B. Saunders. — 1988. — P. 71—90.
27. Belani K. G., Palahnik P.J. Kidney Transplantation// International Anesthesiology
Clinics. - 1991. - Vol. 29. - № 3. - P. 17-39.
28. Benoit J.N., Barrowman J.A., Harper S.L. Role of humoral factors in the intestinal
hyperemia associetied with chronic portal hypertension//Am. J. Physiol. — 1994. — 2. -
P. 486-493.
29. Bosch J., Arroyo V., Betrin A. Hepatic hemodynamics and renin-angiotensin-aldocterone
system in cirrhosis. Pathophysiology and management// In: Zakim D., Boyer T.D. (eds).
Hepatology: A textbook of liver disease. Philadelphia: W.B. Saunders. — 1999. — 746 pgs.
30. Boyer T.D. Portal hypertension and bleeding esophgeal varices// In: Zakim D., Boyer
T.D. (eds). Hepatology: A textbook of liver disease. Philadelphia: W.B. Saunders. — 1999. —
P. 572-615.
31. Briggs J.D. The recipient of renal transplant// In: Kidney transplantation: principles
and practice. P.J. Morris (ed.). — Philadelphia: Saunders, 1988. — P. 71—90.
32. Brown M.R., Ramsay M.A., Swigert T.N. Exchange autotransfusion using the cell
saver during liver transplantation (letter)// Anesthesiology, 1989. — 7. — P. 168—169.
33. Chauvin M., Ferrier C., Haberer I.P. Sufentanyl pharmacokinetic in patients with
cirrhosis// Anesth. Analg. — 1989. — 68.- P. 1—4.
34. Clark N.J., Martin R.D. Anesthetic considerations for undergoing cardiac
transplantation// J. Cardiothorac. Anesth. — 1998. — 2. — P. 519—522.
35. Coffam S., Hunt B., Segal H. Aprotinin inhibits tissue plasminogen activator-mediated
fibrinolysis during orthotopic liver transplantation// Transplant. Proc. — 1991. — 23. —
P. 19-33.
36. Devis P.J, Belany K.G. Liver transplantation// In: Cook D.R., Devis P.J. (eds).
Anesthetic principles for organ transplantation. NY: Reven Press Ltd. — 1994. — P. 159-181.
37. DeWolf A.M., Begliomini B., Gasior T.A., Kang Y., Pinsky M.R. Right ventricular
function during orthotopic liver transplantation// Anesth. Analg. — 1993. — 76. — P. 562-568.
38. Duvaldestin P., Algoston S., Heazel D. Pancuronium pharmacokinetic in patients with
cirrhosis// Br. J. Anaesth. — 1998. — 50. — P. 1131—1136.
39. Epstein M. Functional renal abnormalities in cirrhosis. Pathophsiology and
management// In: Zakim D., Boyer T.D. (eds). Hepatology: A textbook of liver disease.
Philadelphia: W.B.Saunders. — 1999. — P. 493—512.
40. Estrin J.A., Bucklej J.J. Complications of organ transplation// In: L. Toledo Perejra
(ed.). Anesthetic principles for organ transplantation. NY: Marcel Dekker.- 1987. — P. 26-36.
41. Farrell G.C., Cooksley W.G.E., Powel L. W. Drug metabolism in liver diseases. Activity
of hepatic microsomal metabolizing enzymes// Clin. Pharmacol. Ther. — 1999. — 26. —
P. 483-492.
42. Ferrier C., Marty J., Bouffard Y. Alfentanyl pharmacokinetic in patients with cirrhosis//
Anesthesiology. — 2003. — 62. — P. 480—485.
43. Fine R.N., Ettenger R.B. Renal transplantation in chidren// In: P.J. Morris (ed.).
Kidney transplantation: principles and practice. Philadelphia: W.B. Saunders. — 1988. —
P. 635-691.
536
23. ОБЕЗБОЛИВАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ОРГАНОВ
44. Flechner S.M. Current status of renal transplantation. Patient selection, results and
immunosuppression// Urol. Clin. North. Am. — 1994. — Vol. 22. — № 2. — P. 265—282.
45. Freeman J.A., Weis J.A. Anesthetic principles for organ transplantation// In: L.Makowka
(ed.). The Handbook of transplantation management. Austin-Georgtown: R.G. Lansted Co. —
1991. - P. 149-158.
46. Gallo J.A., Cork R.C. Anestesia and transplantation surgeri// In: B.Brown (ed.)
Organ transplantation. Philadelphia: Davis Co.- 1987. — P. 91—107.
47. Graybar G.B., Erdimir H. Anesthesia for vascular access and other proceedings// In:
G.B. Graybar, L.L. Bready (eds.). Anesthesia for renal transplantation. Boston: Martinus
Nijhoff. - 1987. - P. 213-246.
48. Groopman J.E., Molina J.M., Scadden D.T. Hematopoetic growth factor and clinical
applications// N. Engl. J. Med. — 1989. — № 321. — P. 1449—1459.
49. Hosenpud J.D., Norvick R.J., Breen T.J., Daily O.P. The registry of the international
society for heart and lung transplantation: eleventh official report 1994//J. Heart Lung.
Transplant. — 1994. — 2. — P. 561—564.
50. Howard T.K. The handbook of transplantation management. — 1991. — P. 401—447.
51. Hull C.J. Variations in drug disposition: Pregnancy, diseases, drugs and anesthesia//
In: Hull C.J.(ed). Pharmacokinetic for anesthesia. Oxford, England: Butterworth-Heinemann. —
1991. - P. 128-130.
52. Humphrey L.S., Blanck T. J. Z// In: W.A. Baumgarther, B.A. Reitz, S.C. Achuft
(eds.). Heart and heartlung transplantation. Philadelphia: W. B. Saunders Co. — 1990. —
P. 103-112.
53. Julik T.J., Johnson D.E., Eide R.P., Lock J.E. Pulmonary vascular effects of
vasoactive intestinal peptide in conscious newborn lambs// Am. J. Physiol. — 1994. —
246. - P. 716-722.
54. Kang Y. G., Aggarwal S. Anesthetic principles in liver transplantation// In: L. Makowka
(ed.). The handbook in the transplantion management. Austin Georgtown: R. G. Landes Co.-
1999. - P. 126-154.
55. Kang Y., Aggarwal S. Intraoperative changes in blood coagulation and
thromboelastographic monitoring in liver transplantation// Anesthesiology. — 1991. — 64. —
P. 126-144.
56. Kang Y, Freeman J.A., Aggarwal S., de Wolf A.M. Hemodynamic instability during
liver transplantation// Transplant. Proc. — 1989. — 21. — P. 348—359.
57. Kang Y.G., Uram M., Shin G.K. The pharmacokinetics of fentanyl and the end-stage
liver disease// Anesthesiology. — 1984. — 61. — P. 380—392.
58. Keren Y., Boichis H., Zwas T.S., Frand M. Pulmonary arterio-venous fistulae in
hepatic cirrhosis// Arch. Dis. Child. — 1998. —58. — P. 302—305.
59. Kiel J. W., Pitts V., Benoit J.N. Reduced vascular sensitivity to norepinephrin in portal
hypertensive rats// Am. J. Physiol. — 1985. — P. 192—196.
60. Krom R.A., Weisner R.H., Retire S.R. The first 100 liver transplantation at the Mayo
clinic// Mayo Clin. Proc. — 1989. — 64. — P. 84—94.
61. Lawhead R.G., Matsumi M., Peters K.D. Plasma laudanosine level in patients given
atracurium during liver transplantation// Anesth. Analg. — 1993. — 76. — P. 519—573.
62. MacCloskey J.J., Schleien C, Schwarz K. Severe hypoxemia and intrapulmonary
shunting resulting from cirrhosis reversed by liver transplantation in pediatric patient //
J. pediatr. - 1991. - 118. - P. 902-904.
63. MacGregor E., Gardine A.G., Murray L.S. Pre-operative echocardiographic abnormalities
and adverse outcome foilwowing renal transplantation// Nephrol. Dial. Transplant. — 1998. —
№ 13. - P. 1499-1505.
64. Marques J.M., Martin D. Anesthesia for liver transplantation// In: P.M. Winter, Y.G.
Kang (eds.). Hepatic transplantation. Anesthetic and perioperative management. NY: Prager. —
1996. - P. 44-57.
65. Pandele G., Chaus E, Salvador! C. Thiopental pharmacokinetics in the patients with
cirrhosis//Anesthesiology. — 1993. — 59. — P. 123—132.
537
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
66. Pitts R.F. Phisiology of kidney and body fluids: an introductory textbook. Yearbook. —
1994. - P. 286-300.
67. Ramsay M.A., Swygert Т.Н. Anesthesia for liver transplantation// In: R.W. Busuttil,
G.B. Klintmalm (eds.). Transplantation of the liver. Philadelphia: W.B. Saunders. — 1996. —
p. 419-434.
68. Ream A.K., Howies R.E., Jamson S./f In: J. Kaplan (ed.). Cardiac anesthesia.
Philadelphia: W.B Saunders Co. - 1987,- Vol. 2. - №5. - P. 881-891.
69. ScriabineA., Taylor D.G. Antihypertensive drugs// In: M.J. Antonaccio (ed.). Problems
of vascular pharmacology. NY: Raven Press. — 1984. — P. 257—294.
70. Secor J. W., Schenker S. Drug metabolism in patients with liver disease// Adv. Intern.
Med. — 1997. - 32. - P. 379-406.
71. Shapiro M.J., Wood R.P., Shaw B.W., Grenvik A. Hepatic transplantation//In: P.M.
Winter, Y.G. Kang (eds.). Anesthetic and perioperative management organ transplantation.
NY: Prager. - 1986. - P. 177-202.
72. Sherwin R., Joshi P., HendlerR. Hyperglucagonemia in patients with Laennec‘s cirrhosis:
The role of porta-systemic shunting// N. Engl. J. Med. — 1994. — 12. — P. 121—134.
73. Schertz C.W., Gasior T.A. Anesthetic and perioperative management in organ
transplantation// In: L. Makowka (ed.). The Handbook of the transplantation management.
Austrin- Georgtown: R.G. Landes Co. — 1991. — P. 110—125.
74. Stoller J.K., Moodie D., Shiquone W.A. Redaction ofintrapulmonary shunt and resolution
of digital clubbin associated with primary biliary cirrhosis after liver transplantation// Hepatology.
- 1990. - 11. - P. 54-58.
75. Vandam L.D., Harrison J.H., Murray J.E. Anesthetics aspects of renal
homotransplantation in man// Anesthesiology. — 1962. — № 23. — P. 783—792.
76. Verli P., Elhage C. Does adult liver transplantation without veno-venous bypass result
in renal failure?// Anesth. Analg. — 1992. — 75. — P. 489—494.
77. Watkins P.B. Role of cytochrome 450 in drug metabolisms and hepatotoxity// Semin
Liver Dis. - 2000. - 10. - P. 235-250.
78. Webster N.R., Bellamy M.C., Lodge J. P., SadekS.A. Haemodynamics of liver reperfusion:
comparison of two anaesthetic techniques// British Journal of Anaesthesia.—1994. — 72. —
P. 418-421.
79. Weigert A., Andreade M.J., Branco P., Gaspar A., Silva M., Dickson J., Messias H.,
Pais M.J., Horta E., Gouveia R., Gomes R.S., Oliveira A., Machado S. Dramatic clinical and
echocardiographic improvement of uremic dilated cardiomyopathy in five patients after cadaveric
renal transplantation// 10th Congress of ESOT. Book of abstracts. Lisboa, Portugal. — 2001. —
P. 215-216.
80. Wolf A., Gasior T. L. Rigth ventricular function during orthotopic liver transplantation//
Anesthesiology. — 1990. — №73. — P. 97—102.
81. Word S., Neill A.M. Pharmacokinetic of atracurium in hepatic failure// Br. J. Anaesth. —
1983. — 55. — P. 11-16.
82. Woolsey R., Roden D.M. Pharmacologic causes of arrhythmogenic actions of
antiarrhythmic drug// Am. J. Cardiol. — 1987. — 59. — P. 19—25.
538
24. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У
ПОЖИЛЫХ ПАЦИЕНТОВ
В докладе ООН за 2007 год на Комиссии по народонаселе-
нию и развитию указывается, что на современном этапе населе-
ние планеты столкнулось с беспрецедентными демографически-
ми изменениями: почти все страны мира вступили в переходный
демографический процесс, а Япония и Европа уже достигли его
последнего этапа. На европейском континенте население наибо-
лее старое, и оно будет оставаться таким в недалеком будущем.
Согласно докладу, в 2007 году из 6,6 млрд, людей, которые живут
на Земле, 28 % составляют дети, 18 % — молодежь, 44 % — лица
основного трудоспособного возраста и 10 % — пожилые люди. В
будущих десятилетиях население планеты будет стареть: в разви-
тых странах количество детей останется стабильным, на уровне
16 %, а количество пожилых людей возрастет и достигнет к 2030
году 20 %, 2050 году — 32 %. Таким образом, в 2050 году в разви-
тых странах в среднем на одного ребенка будет приходиться два
пожилых человека.
Приблизительно половина людей старше 65 лет в течение
дальнейшей жизни нуждается в оперативных вмешательствах
и, согласно прогнозам, с 2030 года до 1/3 всех операций будут
выполняться у пожилых больных. В Украине пока не увеличи-
вается средний показатель продолжительности жизни, все же
количество пожилых пациентов, которые нуждаются в опера-
тивном лечении, в будущем возрастет, о чем свидетельствуют
демографические статистические данные. Поэтому знание осо-
бенностей анестезиологического обеспечения больных пожи-
лого и старческого возраста является актуальной проблемой.
Риск периоперационных осложнений с возрастом увеличивает-
ся вследствие нарушений функционирования органов и систем
организма и увеличения количества и тяжести сопутствующих
заболеваний [1].
539
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
24.1. ВОЗРАСТНЫЕ ФИЗИОЛОГИЧЕСКИЕ
ИЗМЕНЕНИЯ
Нормальный процесс старения сопровождается физиологически-
ми изменениями, предрасполагающими человека к заболеваниям. Физиологичес-
кие изменения у людей старше 65 лет имеют универсальный характер с индивиду-
альными особенностями. Функция большинства жизненно важных органов и си-
стем снижается ежегодно с 30 лет на 1—1,5 % [2].
ЦНС. Снижение активности ЦНС в пожилом возрасте исследователи связыва-
ют с потерей количества нейронов коры головного мозга (преимущественно), но
корреляции между морфологическими изменениями коры головного мозга и поте-
рей когнитивной функции не обнаруживают. Снижение количества функциониру-
ющих нейронов приводит к снижению потребности головного мозга в кислороде и
мозгового кровотока. Уменьшается скорость проведения импульсов по проводя-
щим путям спинного мозга и периферическим нервным волокнам, снижается уро-
вень нейротрансмиттеров и количество специфических рецепторов в нервной тка-
ни, в частности — количество серотониновых рецепторов в коре головного мозга,
уровень дофамина и количество дофаминовых рецепторов в базальных ганглиях,
количество ацетилхолиновых и холинергических рецепторов. Эти изменения, как
правило, требуют снижения доз анестетиков во время операции.
Сердечно-сосудистая система. Даже при отсутствии хронических заболеваний у
пожилых людей уменьшены резервы сердечно-сосудистой системы (рис. 24.1): сни-
жена контрактильная способность миокарда, пролонгирован период кардиальной ре-
лаксации (диастолическая недостаточность миокарда является энергетически зависи-
мым процессом и характерна для ГБ, ИБС, кардиомиопатий, болезней клапанной
системы сердца). С возрастом уменьшается тонус p-адренергических рецепторов, их
чувствительность к эндо- и экзогенным катехоламинам; увеличивается конечно-диа-
столический объем (более характерно для пациентов мужского пола, способствует
увеличению УО и урежению ЧСС); снижается контроль автономной нервной систе-
Рис. 24.1. Изменения функции сердечно-сосудистой системы у пожилых людей
540
24. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПОЖИЛЫХ ПАЦИЕНТОВ
мы над функцией сердечно-сосудистой системы (в покое уменьшается тонус пара-
симпатической нервной системы и увеличивается тонус симпатической); снижается
регуляторная роль барорецепторов (частично объясняет склонность к ортостатичес-
кой гипотензии у пожилых); понижается функция синусового узла и проводящей
системы сердца (способствует урежению ЧСС и развитию блокад); увеличивается АД
и скорость пульсовой волны из-за атеросклеротических изменений стенок сосудов.
Все вышеуказанные изменения приводят к снижению толерантности у пожи-
лых людей к физическим нагрузкам и операционному стрессу, в частности —
снижение способности компенсировать гиповолемию проявляется гемодинами-
ческой нестабильностью во время операции (рис. 24.2). Возрастные изменения
менее выражены у пациентов, которые систематически испытывают дозирован-
ные физические нагрузки.
Система внешнего дыхания. После 20 лет с каждым годом повышается альвео-
ло-артериальная разница по кислороду и на 0,5 мм рт. ст. снижается рО2. Возраст-
Рис. 24.2. Возможные осложнения со стороны сердечно-сосудистой системы
во время анестезии
541
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ные изменения сопровождаются нарушениями биомеханики дыхания и газообме-
на в легких и отражают прогрессирующие расстройства по причине пневмоскле-
роза и эмфиземы легких (рис. 24.3). Респираторный ответ на гипоксемию и гипер-
капнию снижен у пожилых в 2 раза по сравнению с молодыми людьми, что учи-
тывают при назначении общих анестетиков, особенно опиоидов.
Возрастные изменения сопровождаются нарушениями вентиляционно-пер-
фузионных соотношений в легких, проявляются легочной гипертензией, сниже-
нием активности рефлекса гипоксической вазоконстрикции: уменьшается диффу-
зионная способность легких, что особенно сказывается на переносимости одноле-
гочной вентиляции.
Биомеханика дыхания нарушается вследствие снижения эластичности легких и
грудной клетки, а также нарушения реактивности дыхательных путей по причине
бронхитов. МВЛ у пожилых снижается на 50 %. Каждые 10 лет жизни на 5-10 %
уменьшается ОФВ. С возрастом снижается ЖЕЛ, хотя ФОБ меняется незначительно.
У пожилых пациентов увеличивается риск развития пневмоний вследствие
снижения функции иммунной системы, угнетения защитных рефлексов гортани и
трахеи, снижения бактериального клиренса эпителия дыхательных путей и под-
вижности ресничек.
Пищеварительная система. Снижены моторика пищевода и желудка, тонус
кардиального сфинктера, что увеличивает риск ршургитации и аспирации во вре-
мя наркоза.
Печень. С возрастом снижается масса печеночной паренхимы (в 80 лет — на
40 %), печеночный и спланхнический кровоток, активность печеночных энзимов,
продукция альбумина. Эти изменения уменьшают печеночный клиренс и фарма-
кокинетику многих лекарственных препаратов, применяемых в анестезиологии.
Мочевыделительная система. Возрастные изменения в почках проявляются
снижением почечного кровотока, клубочковой фильтрации, концентрационной
способности почек. Наряду со снижением функций сердца, эти изменения снижа-
ют толерантность пожилых пациентов к объемной нагрузке жидкостью. Посте-
пенно почки теряют способность удерживать жидкость при дегидратации орга-
низма, то есть у пожилых повышается склонность к развитию гиповолемии. Не-
Рис. 24.3. Изменения функции системы внешнего дыхания у пожилых людей
542
24. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПОЖИЛЫХ ПАЦИЕНТОВ
смотря на эти изменения, уровень креатинина в плазме крови изменяется незна-
чительно, так как параллельно со снижением почечного клиренса креатинина сни-
жается его продукция вследствие мышечной дистрофии. В результате нарушений
функций почек у пожилых снижается почечный клиренс некоторых лекарствен-
ных средств, например сердечных гликозидов и антибиотиков.
Терморегуляция. Основной обмен снижается после 30 лет на 1 % в год, таким
образом, снижается теплопродукция и увеличивается чувствительность у пожилых
людей к гипотермии, что проявляется посленаркозной дрожью с резким увеличе-
нием риска осложнений со стороны сердечно-сосудистой системы и свертываю-
щей системы крови. Гипотермия способствует пролонгации действия анестетиков
и миорелаксантов.
24.2. СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ
Наиболее часто у пожилых пациентов регистрируют следующие со-
путствующие заболевания (см. раздел 26): артериальную гипертензию, ИБС, сер-
дечную недостаточность, болезни периферических сосудов, ХОЗЛ, анемию, болез-
ни почек, сахарный диабет, субклинический гипотиреоидизм, артриты, деменцию.
У пожилых пациентов высок риск полипрагмазии и отрицательной интерак-
ции лекарственных препаратов, в том числе анестетиков. Согласно исследованию
[3], обширная периоперационная медикация у пожилых больных увеличивает риск
нарушений сознания в послеоперационный период.
Пожилые люди, как правило, принимают лекарственные препараты для ле-
чения хронических заболеваний, поэтому при сборе анамнеза выясняют объем
медикаментозного лечения накануне операции для предупреждения возможного
отрицательного влияния некоторых препаратов на течение анестезии. Например,
хронический прием диуретиков приводит к гипокалиемии и гиволемии, антиги-
пертензивных препаратов — к снижению активности симпатической нервной си-
стемы и потенцированию эффекта общих анестетиков, антагонистов Р-адреноре-
цепторов — к снижению активности симпатической нервной системы, брадикар-
дии, бронхоспазму, препаратов дигиталиса — к нарушениям ритма сердца,
трициклических антидепрессантов — к антихолинергическим эффектам, антиарит-
мических препаратов и некоторых антибиотиков — к потенцированию действия
миорелаксантов, гипогликемических средств — к гипогликемии.
Анестезиологическое обеспечение у пожилых пациентов усложняется вслед-
ствие частых нарушений зрения и слуха, что затрудняет контакт анестезиолога с
пациентом; наличие артритов затрудняет выбор адекватного положения больного
во время операции.
24.3. ОСОБЕННОСТИ КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ
АНЕСТЕТИКОВ И МЫШЕЧНЫХ РЕЛАКСАНТОВ
У ПОЖИЛЫХ ПАЦИЕНТОВ
Пожилые пациенты более чувствительны к действию анестетиков
и некоторых лекарственных препаратов, используемых в периоперационной ме-
дикации, что требует снижения доз по сравнению с пациентами среднего возрас-
543
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
та. Снижение общего количества воды в организме и ОЦК, увеличение процент-
ного содержания жировой ткани у пожилых способствуют повышенной концент-
рации анестетиков и миорелаксантов при болюсном введении и пролонгации их
эффекта.
Для вводного наркоза у пожилых пациентов дозу тиопентал-натрия снижают
на 15 %, так как выражено его влияние на гемодинамику в виде артериальной
гипотензии. У пожилых восстановление сознания после использования тиопен-
тал-натрия незначительно пролонгировано.
С возрастом повышается чувствительность мозга к пропофолу и снижается его
печеночный клиренс, поэтому дозу пропофола у пожилых снижают на 30-50 % по
сравнению с пациентами среднего возраста. После применения пропофола у по-
жилых пациентов замедлено пробуждение.
Дозу мидазолама у пожилых уменьшают примерно на 70 % по причине сниже-
ния связанной с белками фракции препарата.
Дозу этомидата для индукции в наркоз у пожилых снижают на 20 %, хотя не
существует свидетельств возрастного повышения чувствительности мозга к препа-
рату у пожилых. Этомидат в меньшей степени, чем тиопентал-натрий, вызывает
депрессию миокарда у пожилых.
Дозу фентанила у 85-летних пациентов уменьшают на 50 %.
У пожилых пациентов повышена чувствительность мозга к ингаляционным
анестетикам, что обусловливает снижение МАК, но индукция в наркоз с их помо-
щью может замедлиться вследствие нарушения вентиляционно-перфузионных
соотношений в легких.
Клиренс большинства применяемых в Украине миорелаксантов у пожилых
снижен, поэтому продолжительность эффекта панкурониума, векурониума, року-
рониума при обычной дозировке увеличивается.
24.4. ОСОБЕННОСТИ АНЕСТЕЗИОЛОГИЧЕСКОГО
ОБЕСПЕЧЕНИЯ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
У ПОЖИЛЫХ ПАЦИЕНТОВ
Биологический возраст не является единственным критерием рис-
ка анестезии и операции у пожилых пациентов. Важную роль играет объективный
физиологический статус конкретного пациента с диагностикой сопутствующих за-
болеваний. Уменьшенные функциональные резервы органов и систем в пожилом
возрасте требуют проведения тщательного дооперационного обследования, основной
задачей которого является диагностика резервов сердечно-сосудистой и дыхатель-
ной систем, в частности — физиологических и патологических изменений, пред-
располагающих к гипоксемии и развитию послеоперационных инфекционных ос-
ложнений. Кроме этого, особенности фармакокинетики и фармакодинамики ле-
карственных средств у пожилых людей требуют индивидуализированного
дозирования. Должное внимание уделяют предотвращению послеоперационных ког-
нитивных нарушений, которые увеличивают риск осложнений и негативно влияют
на послеоперационное восстановление функций организма.
Исследователи из Великобритании после 20-летнего анализа анестезиологи-
ческих обеспечений операций у пожилых пациентов [4] выделили 10 факторов —
достоверных предикторов смертности: возраст, количество лейкоцитов, концент-
544
М. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПОЖИЛЫХ ПАЦИЕНТОВ
рация мочевины в сыворотке, ЧСС, САЦ, тип операционного доступа, срочность
операции, сложность операции, консервативное лечение и диагностические ста-
дии болезни сосудов. Используя анализ множественной логистической регрессии,
авторы исследования разработали индекс смертности, достоверность которого
подтверждена в отдельном исследовании лечения сравнимых пациентов в 1999—
2001 годах. Этот показатель можно использовать в случаях, когда пациенты или их
родственники консультируются по поводу рисков и результатов лечения.
Существенный риск послеоперационной заболеваемости и смертности у по-
жилых пациентов представляют сердечно-сосудистые, ортопедические, торакаль-
ные и абдоминальные вмешательства [5]; менее травматичные вмешательства со-
провождаются, соответственно, меньшим риском, несмотря на снижение функ-
циональных резервов в пожилом возрасте.
ТВ!
Даже высокий риск оперативного вмешательства, если его проводят
по онкологическим или жизненным показаниям, не является причиной
для отказа от операции у пожилого пациента
Совершенствование методов анестезиологического обеспечения и интенсивной
терапии сделало возможным проведение у пожилых пациентов самых сложных опе-
ративных вмешательств с хорошим результатом, которые ранее, как правило, пред-
ставляли чрезмерный риск и сопровождались неблагоприятными результатами.
Недавние исследования [6] продемонстрировали, что изменения некоторых
показателей (гемоглобина, глюкозы крови, креатинина, количества тромбоцитов
и электролитов) при стандартном дооперационном скрининге у пожилых пациен-
тов не всегда является причиной для отказа от операции, хотя необходим более
тщательный мониторинг этих переменных гомеостаза. У пожилых пациентов чаще
необходимо проведение предоперационной коррекции системы внешнего дыха-
ния и водно-электролитного баланса, чаще необходимы консультации специали-
стов по поводу сопутствующих заболеваний — кардиологов, эндокринологов, не-
вропатологов и др.
Выбор метода анестезии. Несмотря на противоречивые результаты, авторы
многих исследований склоняются к мнению о преимуществах регионарной анес-
тезии у пожилых пациентов, которая сопровождается снижением на 1/3 30-днев-
ной летальности, уменьшением частоты развития легочной эмболии, осложнений
со стороны сердца и легких, инсультов. Не все исследователи подтверждают пре-
имущества регионарной анестезии перед обшей при длительных и обширных опе-
рациях у пожилых пациентов.
Качественный и количественный состав премедикации у пожилых пациентов
подбирают индивидуально: с одной стороны, показана достаточная седация для
предупреждения отрицательного влияния предоперационного стресса, с другой
стороны — глубокая седация может вызвать серьезные расстройства вентиляции и
артериальную гипотензию.
Индукция в наркоз. Учитывая склонность пожилых людей к артериальной ги-
потензии при использовании внутривенных анестетиков, а также пониженную
толерантность к массивной внутривенной инфузии жидкостью с целью восста-
новления гемодинамических показателей, тщательно продумывают методику ин-
дукции в наркоз у пожилых пациентов. Риск трудной интубации увеличивается
вследствие возможного снижения подвижности суставов и, как правило, снижает-
18 7-585
545
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ся по причине отсутствия зубов у пожилых пациентов. Увеличивается риск регур-
гитации и аспирации желудочного содержимого.
Во время операции у пожилых пациентов осуществляют тщательный монито-
ринг. Необходимо помнить об увеличении риска при использовании инвазивных
методов (например, катетеризации легочной артерии) по причине атеросклероти-
ческих морфологических изменений в артериях.
Поддержание анестезии у пожилых существенно не отличается от общеприня-
тых правил, но более тщательно проводят контроль над нарушениями газообмена
и гемодинамической нестабильностью, которые грозят развитием тяжелых ослож-
нений. Учитывая ограничение способности организма компенсировать гемичес-
кую гипоксию, показания к гемотрансфузиям у пожилых пациентов более либе-
ральные, чем у пациентов средней возрастной группы.
Регионарную анестезию, как правило, используют у пожилых больных прк
операциях на нижних конечностях, в нижнем отделе живота, урологических и
гинекологических хирургических вмешательствах. Дозу анестетиков для регио-
нарной анестезии у пожилых пациентов снижают, но унифицированных рекомен-
даций по ее уменьшению не существует.
Согласно исследованию [7], при региональной анестезии по сравнению с об-
щей уменьшаются объем кровопотери и риск тромбоэмболических осложнений,
реже наблюдают расстройства сознания в послеоперационный период. Несмотря
на адекватную аналгезию при использовании регионарных методов анестезии, у
пожилых пациентов часто требуется дополнительная внутривенная седация мида-
золамом или пропофолом.
У пожилых больных уменьшен кровоток в субарахноидальном пространстве
и объем ЦСЖ, поэтому они более чувствительны к спинальной анестезии, при
которой увеличивается риск артериальной гипотензии и замедляется восстановле-
ние двигательной активности. Вследствие физиологических поясничного лордоза
и грудного кифоза чаще наблюдают распространение анестетика в краниальном
направлении с развитием блокад на уровне грудных сегментов спинного мозга.
Пожилые пациенты лучше переносят эпидуральную анестезию.
У пожилых пациентов в течение послеоперационного периода тщательно конт-
ролируют кровоснабжение миокарда, поддерживают стабильность показателей АД
и ЧСС. Наиболее частыми и опасными осложнениями со стороны органов дыха-
ния являются пневмонии и ОРДС. Сопутствующие ХОЗЛ, курение, избыточная
масса тела способствуют развитию этих осложнений. Проводят агрессивную про-
филактику легочных осложнений, включающую раннюю мобилизацию, широкое
использование санационных ФБС и дыхание с сопротивлением на выдохе.
У пациентов гериатрической возрастной группы часто развиваются осложне-
ния со стороны нервной системы в виде послеоперационного делирия (чаще —
при обшей анестезии, реже — при регионарных методах анестезии), увеличению
частоты которого способствуют предшествующая деменция, органические заболе-
вания ЦНС, полипрагмазия. С профилактической целью в периоперационный
период по возможности отказываются от использования антихолинергических пре-
паратов.
Одной из проблем послеоперационного периода является когнитивная дис-
функция, которую регистрируют у 25,8 и 9,9 % пожилых больных в течение 1-й
недели и 3 месяцев после операции, соответственно. Факторами риска этого ос-
ложнения считают продолжительность оперативного вмешательства, возраст, низ-
546
34. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПОЖИЛЫХ ПАЦИЕНТОВ
кий уровень образования, повторность оперативного вмешательства, инфекцион-
ные и респираторные осложнения. Считают, что периоперационная церебральная
гипоперфузия является одним из основных факторов риска когнитивной дисфун-
кции.
ЛИТЕРАТУРА
1. CraigD.B., McLeskey С.Н., Mitenko Р.А. etal. Geriatric anaesthesia. Can. J. Anaesth.,
1987, 34:156-67.
2. Evans T.I. The physiological basis of geriatric anaesthesia. Anaesth. Intansive Care,
1973, 1:319-28.
3. Pauldine R.W. Geriatrics. In: Cole D.J., Schlunt M. Adult perioperative anesthesia.
Elsevier Mosby, 2004, p. 465—475.
4. Lloyd H., Ahmed L, Taylor S., Blake J.R. Index for predicting mortality in elderly
surgical patients. Br. J. Surg., 2005 Apr; 92 (4):487—92.
5. Proietti R., Aceto P., De Cosmo G. Anesthesia and concomitant pathologies: anesthesia
in the elderly patient. Minerva Anestesiol., 2004 May; 70 (5):273—8.
6. Pauldine R. W. Geriatrics. In: Cole D.J., Schlunt M. Adult perioperative anesthesia.
Elsevier Mosby, 2004, p. 465—475.
7. Covert C.R, Fox G.S. Anaesthesia for hip surgery in the elderly. Can. J. Anaesth., 1989,
36:311-319.
547
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
ОПЕРАЦИЙ НА СОСУДАХ
25.1. ПРЕДОПЕРАЦИОННЫЙ ПЕРИОД
Предоперационный осмотр
У “сосудистых” пациентов, как правило, диагностируют ком-
плекс сопутствующих заболеваний, среди которых особо следует
выделить заболевания сердечно-сосудистой, респираторной и
мочевыделительной систем, часто развивающихся как осложне-
ния сахарного диабета.
Сердечно-сосудистая система. Особенностью пациентов, ко-
торым предстоит операция на сосудах, является высокий риск
кардиальных осложнений (до 50—65 %). У большинства больных
диагностируют сочетанное поражение сосудов, например коро-
нарных и периферических, коронарных и сонных артерий.
При сборе анамнеза уточняют объем и режим приема медика-
ментов, выясняют функциональные возможности сердечно-сосу-
дистой системы в покое и при выполнении физической нагрузки
(см. раздел 3.2.1). Поражение периферических артерий нижних
конечностей затрудняет оценку функциональных возможностей
сердечно-сосудистой системы. Хорошо собранный анамнез в боль-
шинстве случаев позволяет анестезиологу определить функциональ-
ный класс по классификации New York Heart Association (табл. 25.1)
и функциональный класс стенокардии по классификации Canadian
Heart Association (табл. 25.2).
Дыхательная система. Определение показателей функции
внешнего дыхания и газов крови (для определения степени ис-
ходной дыхательной недостаточности и последующего контроля)
проводят при обнаружении признаков дыхательных расстройств
(см. раздел 3.2.2). Исходная гиперкапния (рСО2 более 45 мм рт. ст.)
указывает на высокий риск послеоперационных осложнений.
Желателен отказ от курения и проведение дыхательной гимнасти-
ки до операции.
Мочевыделительная система. Заболевания аорты и хирурги-
ческие манипуляции на ней, особенно в зоне почечных сосудов,
548
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
Таблица 25.1. Классификация функционального статуса New York Heart Association
Функциональный класс Описание
I Обычная физическая нагрузка не вызывает усталости, одышки или сердцебиения
II Незначительное ограничение физической активности: в покое — состояние комфорта, при незначительной физической нагрузке — усталость, одышка, сердцебиение или стенокардия
III Значительное ограничение физической активности: несмотря на состояние комфорта в покое, незначительная физическая активность провоцирует одышку, сердцебиение или стенокардию
IV Дискомфорт при выполнении любой физической активности, симптомы ЗСН даже в покое
Таблица 25.2. Классификация стенокардии Canadian Cardiovascular Society
Функциональный класс Описание
I Обычная физическая активность (например, ходьба и подъем по лестнице) не сопровождаются симптомами стенокардии; при сильном, быстром или продолжительном напряжении во время работы или активного отдыха возникают симптомы стенокардии
II Небольшое ограничение обычной активности: симптомы стенокардии возникают при ходьбе и быстром подъеме по лестнице после еды, эмоционального стресса, в условиях морозной или ветреной погоды, через несколько часов после пробуждения
ш Значительные ограничения обычной физической активности: симптомы стенокардии возникают при ходьбе на расстояние 1-2 кварталов или подъеме на один лестничный пролет в нормальном темпе и нормальных условиях
IV Симптомы стенокардии возникают при любой физической нагрузке и в состоянии покоя
вызывают нарушения почечного кровотока, поэтому обязательно проводят доопе-
рационную оценку функции почек (см. раздел 3.2.3).
Предоперационное обследование
Перечень обязательных лабораторных и инструментальных исследований, а
также интерпретация их результатов представлены в таблице 15.6 (см. раздел 15.4).
Оценка операционного риска
Eagle К.А. предложил 5 факторов риска кардиальных осложнений [12], на
которые ссылается большинство авторов: ИМ в анамнезе, возраст старше 70 лет,
ЗСН, сахарный диабет, стенокардия. Считают, что риск кардиальных осложнений
высокий у пациентов с тремя и более факторами. Диабетическая автономная ней-
549
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
ропатия — виновник “немых” нарушений коронарного кровообращения (“безбо-
левых” ИМ) в периоперационный период.
Определенный интерес представляют индексы кардиального риска Goldman L.
[15] (см. раздел 3.2.1, табл. 3.7) и Detsky A.S. [11] (см. раздел 3.2.1, табл. 3.8). В
настоящее время в Интернете представлено достаточное количество тестов-каль-
куляторов для подсчета этих индексов.
Американский колледж кардиологов (АСС) и Американская сердечная ассо-
циация (АНА) предложили рекомендации, четко определяющие показания к вы-
полнению инвазивных и неинвазивных тестов больным с кардиальной патологи-
ей, которым предстоят операции не на сердце, а также рекомендации по медика-
ментозной терапии и проведению реваскуляризации с целью профилактики
возможных кардиальных осложнений [13]. Основой принятия решения о дальней-
ших обследованиях и действиях служат данные истории болезни, переносимости
физической нагрузки и вид планируемого вмешательства на сосудах. Доопераци-
онные предвестники кардиальных осложнений представлены в таблице 25.3.
Таблица 25.3. Дооперационные факторы периоперационных кардиальных
осложнений на основании рекомендаций АСС/АНА
Факторы риска Степень риска
ОИМ (до 30 дней), нестабильная стенокардия, декомпенсированная сердечная недостаточность, выраженные нарушения ритма (проводят интенсивную терапию, плановую операцию отсрочивают кроме неотложных случаев) Высокая
Стенокардия, ИМ в анамнезе, возраст старше 70 лет, ЗСН, значительные ограничения физической активности, ХПН, нарушения мозгового кровообращения в анамнезе, сахарный диабет (инсулинотерапия до операции) При наличии 1 фактора — низкая, 2 — умеренная, 3 и более — высокая
©Операции на аорте или периферических сосудах нижних конечностей со-
провождаются высоким риском кардиальных осложнений (предполагаемый
риск ОИМ — более 5 %), ЭСА — умеренным риском (1 -5 %)
Рекомендации АСС/АНА, получив широкое распространение, позволили уве-
личить количество специфических исследований сердечно-сосудистой системы у
больных с кардиальной патологией, которым необходима операция несердечного
профиля. Многие авторы отмечают, что функциональные тесты разработаны, в
основном, для выявления критических стенозов коронарных артерий, хотя обще-
известно, что периоперационные ИМ чаще развиваются при некритических сте-
нозах. Инвазивные вмешательства по рекомендациям АСС/АНА (ангиопластика и
стентирование коронарных артерий), уменьшая риск последующих операций, сами
чреваты тяжелыми осложнениями и высоким риском летального исхода. Кроме
этого, до 15 % “сосудистых” пациентов имеют поражения коронарных сосудов,
которые не подлежат коррекции. Многие центры разработали собственные алго-
ритмы на основе рекомендаций АСС/АНА (рис. 25.1).
Lustik S.J. и соавторы [18] предложили уменьшить количество специфических
тестов в рекомендациях АСС/АНА, взяв за основу определение функционального
статуса и использование ₽-блокаторов. Рекомендации АСС/АНА с предложения-
550
И. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
Рис. 25.1. Алгоритм дооперационной оценки (Ellis J.E. и соавторы, 2005)
ми Lustik S.J. были внедрены в работу отдела анестезиологии и интенсивной тера-
пии ИХТ АМН Украины в 2002 году, в результате чего был принят протокол
профилактики кардиальных осложнений в сосудистой хирургии [1] (рис. 25.2).
Алгоритм (рис. 25.2) позволяет дифференцировать пациентов с высоким опе-
рационным риском, дает рекомендации возможного дополнительного обсле-
дования и инвазивного вмешательства, а также периоперационной терапии, в ос-
новном, p-блокаторами (атенололом, бисопрололом или метопрололом). Поло-
жительный эффект Р-блокаторов в периоперационной терапии неоспорим [14,
551
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Рис. 25.2. Алгоритм дооперационной оценки (Lustik S.J. и соавторы, 2002)
20]. Некоторые авторы предпочитают проводить терапию, используя а2-агонисты
(клонидин). При выраженном поражении периферических артерий, когда исполь-
зование p-блокаторов нежелательно, рационально применять ингибиторы АПФ.
Для оптимизации гипотензивной, антиангинальной и гиполипидемической
терапии и оценки степени риска кардиальных осложнений назначают консульта-
цию кардиолога, тем не менее, прерогатива в выборе метода анестезии принадле-
жит анестезиологу.
Предоперационная подготовка
Некоторые препараты плановой кардиальной терапии отменяют или коррек-
тируют их дозу накануне операции (табл. 25.4).
552
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
Таблица 25.4. Препараты для плановой терапии в дооперационный период
Препарат или группа Комментарий
р-блокаторы Уменьшают риск периоперационной ишемии миокарда и арте- риальной гипертензии. Не подлежат отмене перед операцией
Диуретики Отменяют в день операции
Нитраты Не подлежат отмене перед операцией
Ингибиторы АПФ Отменяют или уменьшают дозу за 24-48 ч перед операцией
Блокаторы кальциевых каналов Не подлежат отмене перед операцией
Аспирин Отменяют за 7-8 дней перед плановой операцией. При неотлож- ных вмешательствах проводят тщательный хирургический гемостаз, применяют аминокапроновую кислоту или апротинин
Непрямые антикоагулянты Проводят тщательный биохимический мониторинг системы гемостаза, планово назначают после протезирования клапанов сердца, при нарушениях гемостаза применяют свежезамороженную плазму
Гепарин Назначают при тромбоэмболии и нестабильной стенокардии, при продолжительном использовании возможна тромбоцитопения
Клопидогрель, тиклопидин Предотвращают АДФ-индуцированную агрегацию тромбоцитов. Антитромботическая активность длится 7-10 дней. Отменяют за 10-14 дней перед операцией
Статины Препараты для плановой гиполипидемической терапии. Не подлежат отмене перед операцией. Возможны изменения в функциональных пробах печени и рабдомиодиз (контроль уровня креатинфосфокиназы при миалгии после операции)
Пероральные гипогликемические препараты Заменяют инсулином, проводят тщательный контроль уровня глюкозы крови
25.2. ИНТРАОПЕРАЦИОННЫЙ ПЕРИОД
В ИХТ АМН Украины в течение предыдущих пяти лет и на со-
временном этапе успешно используют следующую схему премедикации; диазепам
(5—10 мг перорально или 10 мг внутримышечно вечером накануне операции); за
30 мин до начала общей анестезии — диазепам (10 мг) и омнопон (20 мг, или
морфин — 10 мг, внутримышечно); больным с язвенным анамнезом — фамотидин
(20 мг вечером накануне операции и за 30—60 мин до начала общей анестезии).
Схема премедикации аналогична таковой у кардиохирургических больных.
Антибиотикопрофилактику у “сосудистых” пациентов проводят по общепри-
нятым в хирургии правилам: эффективную концентрацию антибиотика в опера-
ционной ране достигают к началу операции и сохраняют до ее окончания, при
553
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
этом внутривенное введение антибиотика осуществляют за 30—40 мин до начала
операции (табл. 25.5).
Таблица 25.5. Антибиотикопрофилактика при операциях на сосудах
Операции на брюшной аорте и сосудах нижних конечностей, протезирование сосудов Рекомендуемый препарат Предоперационная доза для взрослого, г
Цефуроксим 1,5 внутривенно
Амоксициллин/клавуланат 1,2 внутривенно
Ампициллин/сульбактам 1,5 внутривенно
Обеспечивают мониторинг. ЧСС, АД, ЭКГ, ЭхоКГ, ЦВД, ДЗЛА, пульсокси-
метрия, капнография, ЭЭГ (при операциях на сонных артериях), давление ЦСЖ
(при операциях на торакоабдоминальном отделе аорты), диурез, температура тела,
биохимические показатели, визуальный контроль операционной раны.
ЭКГ. Во время операции проводят непрерывный мониторинг II и V5 отведений
(наиболее информативен для раннего выявления ЭКГ-признаков ишемии миокар-
да левого желудочка), через 12—18 ч после операции — мониторинг 12 отведений.
АД. Используют инвазивный мониторинг АД при операциях на аорте (торако-
абдоминальном и абдоминальном отделах) и сонных артериях. Катетер чаще уста-
навливают в левую лучевую артерию (у правшей). При разнице АД на руках кате-
теризируют артерию на руке с увеличенными показателями. Возможна катетери-
зация локтевой и бедренной артерий при операциях на торакоабдоминальном отделе
аорты. Некоторые авторы рекомендуют проведение теста Аллена для определения
коллатерального кровотока.
ЦВД. Измерение осуществляют при операциях на аорте (торакоабдоминаль-
ном и абдоминальном отделах) через катетер, введенный в какую-либо централь-
ную вену, например внутреннюю яремную, бедренную, подключичную.
ДЗЛА. Измерение проводят через катетер, введенный в легочную артерию. По
данным различных авторов измерение ДЗЛА показано при фракции выброса ле-
вого желудочка менее 40 %.
Диурез. Кроме количественной оценки диуреза, обращают внимание на цвет
мочи. Появление “розовой” мочи свидетельствует о внутрисосудистом гемолизе в
результате трансфузионных осложнений или механической травмы эритроцитов
при ИК, повреждении мочевых путей (гематурия) при операциях на абдоминаль-
ной аорте и ее ветвях.
Температура тела. Измеряют температуру в пищеводе, при использовании
ИК — в пищеводе, носоглотке и крови.
Биохимические показатели. Проводят мониторинг газов крови (артериальной
и смешанной венозной), электролитов (особенно К+ и Са++), уровня гемоглобина,
гематокрита, глюкозы, общего белка. Особое внимание уделяют показателям ге-
мостаза, в частности активированному времени свертывания.
Выбор метода анестезии. Для анестезиологического обеспечения большинства
“сосудистых” операций обычно планируют проведение регионарных методов ане-
стезии (или в сочетании с общей анестезией, как например, при операциях по
поводу аневризм абдоминального отдела аорты). О достоинствах регионарных
методов анестезии у “сосудистых” больных (уменьшении частоты тромбозов глу-
боких вен бедра, сохранении самостоятельного дыхания, улучшении кровотока по
554
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
оперируемым сосудам) говорится во многих руководствах [3, 6, 8, 9], тем не ме-
нее, использование регионарных методов анестезии не влияет на частоту карди-
альных осложнений [3, 8].
Проведение регионарных методов анестезии затруднено при применении ан-
тикоагулянтов и антитромбоцитарных препаратов, особенно при неотложных по-
казаниях к “сосудистой” операции на фоне острого коронарного синдрома. В
данных ситуациях высока вероятность образования спинальной гематомы после
эпидуральной или спинальной анестезии, поэтому проводят общую анестезию.
Во многих странах используют рекомендации по применению антикоагулянтов
в сочетании с регионарными методами анестезии (табл. 25.6). Спинальную и эпиду-
ральную анестезии проводят при условии использования гепарина не ранее 60 мин
после пункции. При травматичной пункции (например, появлении крови в катете-
ре) операцию отсрочивают на 24 ч и более и проводят общую анестезию.
Таблица 25.6. Регионарная анестезия при применении тромболитиков,
антикоагулянтов и антитромбоцитарных препаратов
(American Society of Regional Anesthesia and Pain Medicine, 2003)
НПВС, антитромбо- цитарные препараты Нефракционированные гепарины Низкомолеку- лярные гепарины (НМГ) Непрямые антикоагулянты Тромболи- тические препараты
Подкожное введение Внутривенное введение
Нет противо- показаний для НПВС; отменяют тиклопидин за 14 дней перед опера- цией, клопидо- грель —- за 7 дней Нет проти- вопоказа- ний, при техничес- ких трудностях назначают после прекраще- ния блока (удаления катетера) Вводят через 1ч после проведения блокады, удаляют катетер через 2-4 ч после последней дозы гепарина НМГ через 24 ч после травма- тичного блока Введение НМГ 2 раза в сутки: НМК через 24 ч после операции, независимо от техники блока; удаление катетера за 2 ч до введения первой дозы НМГ Перед постановкой катетера убеждаются в нормальных показателях INR после отмены антикоагулян- тов, удаляют катетер при INR < 1,5 (возобновление приема препаратов) Нет данных о безопас- ном времен- ном интер- вале для постановки (удаления) катетера для регио- нарной анестезии. Контроль уровня фиб- риногена
25.3. ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
Пациенты после сложных и длительных реконструктивных опе-
раций на торакоабдоминальном и абдоминальном отделах аорты и ее магистраль-
ных ветвях поступают в ОИТ для дальнейшего наблюдения и лечения. Рекоменду-
ют через 12—18 ч после операции проведение 12-канальной ЭКГ, так как именно
в этот период высок риск кардиальных осложнений.
Для объективизации боли используют ВАШ (см. раздел 11.3), для послеопе-
рационного обезболивания — эпидуральное введение местных анестетиков (ли-
555
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
докаина, бупивакаина) и внутривенное введение наркотических аналгетиков (мор-
фина или омнопона в виде болюсов или постоянной инфузии). На фоне примене-
ния антикоагулянтов нежелательно использование НПВС. Возможно применение
новых препаратов — ЦОГ-2 ингибиторов (парекоксиба натрия).
Адекватное обезболивание в течение первых 2—3 ч после операции и активное
согревание уменьшают вероятность артериальной гипертензии. Если больной дос-
тавлен в ОИТ на управляемом дыхании, то рационально в период согревания соли-
ровать пациента и использовать мышечные релаксанты (для профилактики мышеч-
ной дрожи, которая неблагоприятно действует на ишемизированный миокард).
После стабилизации состояния возможно развитие артериальной гипотензии
по причине снижения ОПСС, что приводит к относительной гиповолемии. Прово-
дят тщательный контроль ЦВД, восполняют ОЦК, исключают кровотечение. Раз-
витие гипотензии в поздние сроки после операции может свидетельствовать о раз-
витии септических осложнений (пневмонии, катетер-ассоциированной внутрисо-
судистой инфекции, инфекции мочевых путей или интраабдоминальной инфекции).
Возобновляют прием плановой кардиальной терапии с началом перорального
приема жидкости. Исключают развитие гипоксии любой этиологии (дыхательной,
гемической и циркуляторной), которая может способствовать появлению тахи-
кардии. При появлении признаков ишемии миокарда внутривенно вводят нитро-
глицерин.
Оптимизация сердечного выброса — лучший метод профилактики почечной
недостаточности. Снижение диуреза менее 0,25 мл/кг/ч в течение 2 ч требует по-
вторной переоценки волемического статуса; при подозрении на тромбоз почеч-
ных сосудов проводят УЗИ (допплерографию) почечного кровотока. При необхо-
димости проводят гемодиализ или ультрафильтрацию, для чего предусматривают
дооперационную постановку катетера.
Олигурия, сочетающаяся с нормальными показателями ОЦК, свидетельству-
ет о синдроме абдоминального компартмента (синдроме брюшной полости), осо-
бенно после операций по поводу разрыва аневризмы абдоминального отдела аор-
ты. При развитии этого синдрома прогрессируют нарушения легочной вентиля-
ции и системной гемодинамики (уменьшение сердечного выброса). Давление в
брюшной полости (соответствует давлению в мочевом пузыре) более 15 см вод. ст.
свидетельствует о развитии синдрома брюшной полости. Критическим считают
давление более 30 см вод. ст. После лапаротомии и снижения внутрибрюшного
давления возможны нарушения системной гемодинамики из-за реперфузионных
повреждений органов брюшной полости (синдрома возобновления кровотока).
Большинство “сосудистых” пациентов переводят на самостоятельное дыха-
ние и экстубируют в условиях операционной. В некоторых случаях возникает по-
требность в пролонгированной ИВЛ (после операций на торакоабдоминальном
отделе аорты, массивной кровопотере, при нарушениях коронарного кровообра-
щения, развитии почечной недостаточности, острого повреждения легких). При
пролонгированной ИВЛ возникает потребность в адекватной седации с целью
предупреждения адренергической стимуляции и ишемии миокарда. При лечении
острого повреждения легких используют рекомендации ARDS Network protocol,
позволяющие уменьшить баротравму, волютравму (травму объемом) и ателекто-
травму (нарушения в результате развития ателектазов легких). У больных, находя-
щихся на ИВЛ, применяют меры профилактики развития пневмонии.
Возможны нарушения мозгового кровообращения ишемической природы,
нарушения сознания по типу делирия.
556
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
При необходимости проводят коррекцию гипокалиемии, гипокальциемии и
гипомагнемии, гипер- или гипогликемии.
Нарушения системы гемостаза возможны после массивных интраоперацион-
ных потерь крови (например, при операциях по поводу разрыва или острого рас-
слоения аневризмы аорты) или гемодилюции.
25.4. КАРОТИДНАЯ ЭНДАРТЕРЭКТОМИЯ
Операция каротидной эндартерэктомии, или эндартерэктомии из
сонных артерий (ЭСА), показана пациентам с определенной неврологической сим-
птоматикой и стенозом сонных артерий более 70 %. Эффект от оперативного ле-
чения значительно превышает результат консервативной терапии.
Целью анестезиологического пособия при ЭСА является обеспечение стабиль-
ной системной гемодинамики на всех этапах операции. Манипуляции на сонных
артериях могут провоцировать гипо- или гиперперфузию головного мозга с после-
дующим неврологическим дефицитом; изменения центральной гемодинамики могут
способствовать нарушениям коронарного кровотока, с последующими кардиаль-
ными осложнениями.
Для обеспечения быстрого просыпания и восстановления жизненно важных
функций в премедикации не используют значительные дозы седативных препара-
тов и наркотических аналгетиков.
При ЭСА возможно использование регионарных методов обезболивания и
общей анестезии [22].
Регионарная анестезия. В течение предыдущих 10—15 лет опубликованы иссле-
дования, в которых при проведении ЭСА авторы отдают предпочтение методам
местной анестезии. Условия для проведения операции обеспечивают блокадой на
уровне Cj—С4 и поверхностного шейного сплетения. Необходимости в аппаратном
мониторинге функций ЦНС нет. Возможно использование легкой седации.
Во время пробной окклюзии сонной артерии выявляют наличие неврологи-
ческого дефицита. Если обнаруживают новые симптомы, свидетельствующие о
гипоперфузии головного мозга, то возобновляют кровоток по сонной артерии.
Дальнейшие события могут развиваться по следующим сценариям: отмена опера-
ции, повышение артериального давления с помошью вазопрессоров и повторная
окклюзия сонной артерии, наложение обходного шунта.
В Институте хирургии и трансплантологии АМН Украины при выполнении
ЭСА регионарные методы анестезии в качестве монометодов не применяют.
Общая анестезия. Для индукции в наркоз используют сочетание тиопентал-на-
трия (5—7 мг/кг) или пропофола (5—7 мг/кг) с фентанилом (до 10 мкг/кг). Ис-
пользование тиопентал-натрия и пропофола оправдано определенным нейропро-
текторным эффектом обоих препаратов.
Препаратами выбора для миорелаксации являются векурониум и рокурониум.
Использование рокурониума, особенно в сочетании с мониторингом нервно-мы-
шечной блокады (TOF-watch), приводит к быстрому восстановлению нейромы-
шечной проводимости и возможности оценивать функции ЦНС через 10—15 мин
после окончания операции.
Для поддержания анестезии используют сочетание пропофола (5—7 мг/кг/ч) с
ингаляцией закиси азота (60 %) и фентанилом (5—10 мкг/кг/ч). Возможно сочета-
ние закиси азота (60 %) с изофлюраном (МАК не более 1).
557
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Резкие колебания гемодинамических показателей (брадикардия и гипотен-
зия, тахикардия и гипертензия) происходят в результате манипуляций в области
каротидного синуса, перед которыми проводят инфильтрацию местными анесте-
тиками этой области.
Режим ИВЛ поддерживают на уровне нормокапнии. В момент окклюзии сон-
ной артерии системное АД поддерживают на уровне, превосходящем исходный на
20 %. Использование вазопрессоров (фенилэфрина) для поддержания высоких цифр
системного АД нежелательно, учитывая высокий риск кардиальных осложнений.
В некоторых центрах стандартным мониторингом во время ЭСА является ЭЭГ,
которая в 10—20 % случаев выявляет ишемию головного мозга. С целью профи-
лактики ишемии мозга во время ЭСА показано применение обходного шунта или
повышение системного АД.
McFarland в исследовании показал, что возможность предвидения инсульта в
периоперационном периоде с помощью ЭЭГ составляет всего 11 %, а также не
существует определенной взаимосвязи между показателями давления в дисталь-
ном “пеньке” сонной артерии, ЭЭГ-признаками ишемии мозга и неврологичес-
кими нарушениями.
Специалисты Института хирургии и трансплантологии АМН Украины пред-
почитают поддерживать высокие показатели АД в период окклюзии сонных арте-
рий и применять обходной шунта при невысоких показателях в дистальном “пеньке”
сонной артерии.
С целью профилактики повреждения мозга не используют Рингер-лактат и
растворы, содержащие глюкозу.
Необходимость быстрой оценки функций ЦНС требует быстрого пробужде-
ния и восстановления нейромышечной проводимости, при этом необходимо по-
мнить, что артериальная гипертензия в период пробуждения опасна развитием
осложнений (кровотечений, вплоть до разрыва анастомозов, или напряженных
гематом). Для уменьшения стресса при экстубации возможно применение мест-
ных анестетиков путем орошения через интубационую трубку или внутривенного
введения (около 100 мг). Для контроля АД применяют нитропруссид натрия или
нитроглицерин. В Институте хирургии и трансплантологии АМН Украины при-
меняют внутривенное введение нимодипина.
Осложнения: нарушения мозгового кровообращения (инсульт), ИМ, наруше-
ния функции внешнего дыхания.
Причиной неврологического дефицита являются нарушения перфузии (гипо-
или гипер-) головного мозга. Причинами гипоперфузии являются диссекция сон-
ных артерий и их тромбоз (из-за нарушений хирургической техники, артериаль-
ной гипотензии, некорректного использование протамин-сульфата для нейтрали-
зации гепарина).
Из-за выраженного стеноза внутренней сонной артерии возможно развитие
синдрома гиперперфузии после восстановления кровотока по артерии. Развитие
симптоматики (жалобы на головную боль, судороги, др.) возможно через несколь-
ко дней после операции. Причиной развития геморрагического инсульта также
считают артериальную гипертензию.
Единого мнения о преимуществах различных методов анестезии при ЭСА для
профилактики артериальной гипертензии пока не существует. Оптимальной так-
тикой считают периоперационное проведение гипотензивной терапии и сочета-
ние легкой общей анестезии с регионарным введением местных анестетиков.
558
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
Нарушения дыхания после ЭСА могут развиться в результате массивной шей-
ной гематомы или после двусторонней ЭСА (из-за потери каротидных телец
не развивается рефлекторная гипервентиляции в ответ на гипоксию), наруше-
ния функции мышц гортани — из-за поражения ларингеальных нервов и пнев-
моторакса.
25.5. ОПЕРАЦИИ ПО ПОВОДУ АНЕВРИЗМ
АБДОМИНАЛЬНОГО ОТДЕЛА АОРТЫ
При аневризме абдоминального отдела аорты часто диагности-
руют сопутствующие заболевания: ХОЗЛ, сахарный диабет (до 10 %), ГБ и ИБС
(20-73 %) [4, 7]. Согласно данным большинства сосудистых центров, летальность
при плановой хирургии аневризм абдоминального отдела аорты составляет 1,8—6
% [4], кардиальные осложнения в общей структуре осложнений — 2,5—13 %, в
структуре причин смертности — 2—15 %. Считают, что аневризма абдоминального
отдела аорты является маркером ИБС [7, 17, 21].
Показания к операции: аневризма диаметром более 6 см с бессимптомным
течением, быстрое увеличение размеров аневризмы, симптоматическая аневризма
любых размеров.
Особенностями выполнения операции на аорте являются: ишемический пе-
риод, во время которого устраняют повреждение аорты и ее протезирование (ди-
стальный кровоток по аорте минимальный) и период восстановления кровотока
(реперфузии). Пережатие аорты и восстановление кровотока по ней иногда со-
провождаются значительными изменениями системной гемодинамики.
Возможно прекращение кровотока по аорте на разных уровнях: выше чревно-
го ствола, выше отхождения почечных артерий и ниже почечных артерий. Чем
выше уровень пережатия аорты, тем значительнее преднагрузка на левый желудо-
чек. Пережатие аорты выше почечных артерий может сопровождаться ишемией
внутренних органов (кишечника, почек), выраженным метаболическим ацидозом
и большой кровопотерей.
Предоперационную подготовку проводят с учетом сопутствующих заболева-
ний и согласно рекомендациям АСС/АНА с дополнениями Lustik S.J. и соавторов
(см. раздел 25.1). Практически всем пациентам с аневризмой абдоминального от-
дела аорты показано профилактическое применение p-блокаторов или ингибито-
ров АПФ при сахарном диабете в течение 5—7 дней до операции и в течение всего
послеоперационного периода. Некоторые авторы отдают предпочтение а-агонис-
там (клофелину).
Интраоперационный мониторинг — см. раздел 25.2.
При плановой хирургии аневризмы абдоминального отдела аорты комбини-
руют общую и эпидуральную (на среднегрудном уровне) анестезии. Согласно дан-
ным рандомизированного исследования 173 пациентов с аневризмой абдоминаль-
ного отдела аорты [3], нет различий в частоте сердечных осложнений у пациентов,
оперированных при комбинированной (регионарной в сочетании с легкой общей)
и общей анестезиях.
После постановки эпидурального катетера определяют сенсорный уровень
анестезии путем введения 2 % раствора лидокаина, дальнейшее введение анесте-
тиков в эпидуральное пространство выполняют после манипуляций на аорте, вос-
становления кровопотери и стабилизации системной гемодинамики.
559
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Для вводного наркоза используют тиопентал-натрий (5—7 мг/кг), пропофол
(5—7 мг/кг), диазепам (0,3—0,5 мг/кг) в сочетании с фентанилом (5—10 мкг/кг).
В случаях неотложных вмешательств (разрыва или расслоения, сопровождаю-
щихся артериальной гипотензией) возможно применение кетамина (1—2 мг/кг)
или натрия оксибутирата (50—100 мг/кг). У таких больных осуществляют краш-
индукцию. Используют недеполяризующие мышечные релаксанты (векурониум или
рокурониум). Для поддержания анестезии применяют пропофол (3—5—7 мг/кг/ч) в
сочетании с фентанилом (5—10 мкг/кг/ч). Возможно дополнение закиси азота в
дыхательную смесь (2:1).
ИВЛ проводят в режиме, обеспечивающем нормокапнию (рСО2 = 35-40 мм рт. ст.,
ПДКВ = 4—5 мм вод. ст.). Концентрацию кислорода в дыхательной смеси уста-
навливают на уровне, позволяющем поддерживать рО2 более 100 мм рт. ст.
Восполнение ОЦК проводят под контролем показателей ЦВД (9—10 мм рт. ст.)
и гемоглобина (110—130 г/л). При кровопотере более 2000 мл обязательно контро-
лируют-показатели коагулограммы: при низком уровне протромбинового времени
и высоком уровне АЧТВ показано переливание свежезамороженной плазмы.
После наложения зажима на аорту возможны резкие изменения показателей
системной гемодинамики из-за повышения ОПСС и снижения МОК. При резком
повышении АД показано применение вазодилататоров (например, нифидипина).
Возможно применение болюсных доз пропофола. При снижении АД (у больных с
низкой сократительной функцией левого желудочка) и отсутствии признаков гипо-
волемии показано использование симпатомиметиков — дофамина (5—7 мкг/кг/мин).
С целью предупреждения резкого падения АД после возобновления кровотока по
аорте поддерживают нормоволемию или умеренную гиперволемию перед снятием
зажима с аорты.
При снижении диуреза на фоне адекватной гидратации вводят маннит. Со-
гласно нашему опыту, предварительное введение маннита (0,5 г/кг) предупрежда-
ет функциональные нарушения деятельности почек во время пережатия аорты и
возобновления кровотока по ней [2].
После выполнения основных хирургических манипуляций, восполнения кро-
вопотери, восстановления биохимических показателей возможен переход на эпи-
дуральную анестезию, что позволяет проведение ранней экстубации.
Показания к продленной ИВЛ: нестабильная системная гемодинамика, не-
откорректированные коагулопатии, продолжающееся кровотечение, гипотермия
(менее 33-34 °C).
25.6. ОПЕРАЦИИ НА ПЕРИФЕРИЧЕСКИХ АРТЕРИЯХ
Плановые операции на периферических артериях проводят в основ-
ном на нижних конечностях. Наибольшее количество осложнений у этой катего-
рии пациентов — кардиальные (6—10 %) [10].
Предоперацинные осмотр, обследование, оценка операционного риска, под-
готовка, интраоперационный мониторинг — см. разделы 25.1 и 25.2.
Применяют регионарную и общую анестезии. Корреляции между видом ане-
стезии и вероятностью значимых осложнений нет.
Неотложные операции на периферических артериях проводят при остром ар-
териальном тромбозе. Как правило, при подобных ситуациях не используют допол-
нительные исследования и вмешательства. Операцию проводят параллельно с
560
25. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ОПЕРАЦИЙ НА СОСУДАХ
назначением специфической терапии p-блокаторов, ингибиторов АПФ, клони-
дина).
Тромбоз периферических сосудов часто является признаком значительных
кардиальных проблем (аритмий, ОИМ, аневризмы левого желудочка, распростра-
ненного атеросклероза).
Вид оперативного вмешательства (эмболэктомия, аортобедренное или бед-
ренно-подколенное шунтирование и т. д.) зависит от индивидуальных особеннос-
тей клинических проявлений заболевания. Выбор метода анестезии зависит от
применения антикоагулянтов (см. раздел 25.2). При длительном периоде окклю-
зии артерии возможны эпизоды гиперкалиемии, миоглобинемии, выраженного
метаболического ацидоза. Возможно развитие ОПечН после восстановления кро-
вотока по артерии.
ЛИТЕРАТУРА
1. Мазур А.П., Шевченко В.М., Силантьев В.В., Смирнова Л.М., Шубин М.К., Зай-
ченко П.А. Периоперационная профилактика кардиальных осложнений в хирургии
аневризмы абдоминальной аорты// Бить, знеболювання i штенсивна терашя. — 2004. —
№3. - С. 15-19.
2. Шарапов О. В., Влайков Г. Г. Використання машту при х!рурпчному л1куванш
аневризм черевно! частини аорти// Юпшчна xipypria. — 2002. — №10. — С. 24—26.
3. Baron J.F., Bertrand М., Barre Е. et al. Combined epidural and general anesthesia
versus general anesthesia for abdominal aortic surgery. Anesthesiology, 75:611, 1991.
4. Bayly P.J., Matthews J.N., Dobson P.M., Price M.L., Thomas D.G. In-hospital mortality
from abdominal aortic surgery in Great Britain and Ireland: Vascular Anaesthesia Society
Audit. Br. J. Surg., 2001; 88:687—692.
5. Bender J.S., Smith-Meek M.A., Jones C.E. Routine pulmonary artery catheterisation
does not reduce morbidity and mortality of elective vascular surgery: results of a prospective
randomised trial. Ann. Surg., 1997; 226:229—236.
6. Bew S., Bryant A., Desborough J., Hall G. Epidural analgesia and arterial reconstructive
surgery to the leg: effects on fibrinolysis and platelet degranulation. Br. J. Anaesth., 2000;
86:230-235.
7. Blomberry P.A., Ferguson I.A., Rosengarten D.S. et al. The role of coronary artery
disease in complications of abdominal aortic aneurysm surgery. Surgery, №2, 150—155.
8. Bode R., Lewis K., Zarich S., Pierce E. T., Roberts M., Kowalchuk G.J., Satwicz P.R.,
Gibbons G.W., Hunter J. A., Espanola C.C. Cardiac outcome after peripheral vascular surgery:
comparison of general and regional anaesthesia. Anesthesiology, 1996; 84:3—13.
9. Caldicott L., Lumb A., McCoy D. Vascular anaesthesia: a practical hand book. Oxford:
Butterworth Heinemann; 2000.
10. Cooperman M., Pflug B., Martin E.W., Evans W.E. Cardiovascular risk factors in
patients with peripheral vascular disease. Surgery, 1978; 84:505—509.
11. Detsky A.S., Abrams H.B., Mclaughlin J.R., Drucker J.D., Sasson Z., Johnston N.,
Scott J.G., Forbath N., Hilliard J.R. Predicting cardiac complications in patients undergoing
non-cardiac surgery. J. Gen. Intern. Med., 1986; 1:211—219.
12. EagleK.A., Coley C.M., Newel J.B., BrewsterD.C., DarlingR.C., Strawss H.W., Guiney
T.E., Boucher CA. Combining clinical and thallium data optimises pre-operative assessment of
cardiac risk before major vascular surgery. Ann. Intern. Med., 1989; 110:859—866.
13. Eagle K.A., Berger P.B., Calkins H., Chaitman B.R., Ewy G.A., Fleischmann K.E.,
Fleisher L.A., Froehlich J.B., Gusberg R.J., LeppoJ.A., Ryan T., Schlant R.C., Winters W.L.Jr.
ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery:
executive summary: a report of the American College of Cardiology/American Heart Association
Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative
Cardiovascular Evaluation for Noncardiac Surgery). Circulation, Vol. 105:1257—1267.
561
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
14. Fleisher L., Eagle К. Lowering risk in non-cardiac surgery. N. Engl. J. Med., 2001;
345:1677-1682.
15. Goldmann L., Caldera D.L., Nussbaum S.R., Southwick F.S., Krogstad D., Murray B.,
Burke D.S., O’Malley T.A., Gorrol A.H., Caplan C.H., Nolan J., Carabello B., Slater E.E.
Multifactorial index of cardiac risk in non-cardiac surgical pro-cedures. New Engl. J. Med.,
1977; 297:845-850.
16. Howell S.J., Sear Y., Yeates D., Goldacre M., Sear J., Foex P. Risk factors for
cardiovascular death after elective surgery under general anaesthesia. Br. J. Anaesth., 1998;
80:14-19.
17. Langanay T., Valla J., Le Du J. et al. Coronary artery disease in patients with aortic
abdominal aneurysm. Apropos of a consecutive series of 172 cases. Arch. Mai. Coeur. Vaiss.,
№ 2, 211-218.
18. LustikS.J., Eichelberger J.P., Chhibber A.K. Preoperative stress testing: new guidelines.
J. Clin. Anesth., Vol. 14:375-380.
19. Mangano D. T. Assessment of the patient with cardiac disease: an anesthesiologist’s
paradigm. Anesthesiology, Vol. 91:1521—6.
20. Mangano D. T., Layung E.L., Wallace A., Tateo I. For the Multicenter Study of
Perioperative Ischemia Research Group. Effect of atenolol on mortality and cardiovascular
morbidity after non-cardiac surgery. N. Engl. J. Med., 1996; 335:1713—1720.
21. Suggs W.D., Smith F.B., Weintraub W.S. etal. Selective screening for coronary artery
disease in patients undergoing elective repair of abdominal aortic aneurysms. Journal of Vascular
Surgery, № 3, 349—355.
22. Tangkanakul C., Counsell C., Warlow C. Local versus general anaesthesia for carotid
endarterectomy. Cochrane Database System Rev, 2000; 2:CD000126.
562
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ
У ПАЦИЕНТОВ
С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
26.1. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С СОПУТСТВУЮЩЕЙ ПАТОЛОГИЕЙ
СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
26.1.1. Анестезиологическое обеспечение у пациентов
с ишемической болезнью сердца
Ишемическая болезнь сердца и гипертоническая болезнь явля-
ются наиболее частыми сопутствующими заболеваниями у хирурги-
ческих больных, особенно у пациентов старшей и гериатрической
возрастных групп. По данным американских исследователей, около
5—10 % всех хирургических больных имеют какую-либо степень ИБС.
26.1.1.1. Предоперационный период
Предоперационный осмотр и оценка анестезиологического риска
При сборе анамнеза выясняют наличие симптомов ишемии
миокарда (давящих болей за грудиной, отдающих в левую руку),
частоту и характер боли, препараты, которые использовали для
купирования боли. Выясняют наличие ОИМ в анамнезе, длитель-
ность пребывания в ОИТ. Определяют характер стенокардии (не-
стабильный или стабильный) по состоянию в течение предыдущих
двух месяцев: увеличению/уменьшению частоты и интенсивности
характерной боли, дозе антиангинальных препаратов, причинам
возникновения болей (при физической нагрузке или в покое).
Определяют способность пациента выполнять физическую
нагрузку и по результатам предварительно судят о резервах мио-
карда. У 50-70 % больных со стенозом коронарных артерий кли-
нических симптомов ишемии миокарда не наблюдают, хотя пе-
риоперационная ишемия миокарда возникает у 20—40 % пациен-
тов с риском заболеваний сердца и сопровождается 9-кратным
увеличением риска развития осложнений со стороны сердца [1].
563
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Согласно исследованию [2], факторами, способствующими развитию послеопера-
ционных кардиальных осложнений, являются сердечная недостаточность и коро-
нарные интервенции в анамнезе.
Тяжелым осложнением у больных с ИБС является интра- или послеопераци-
онный ОИМ, который сопровождается высокой летальностью. Особенно высок
риск этого осложнения у больных с ИБС, которые в прошлом перенесли ОИМ.
Риск зависит от времени, прошедшего после предыдущего ОИМ (табл. 26.1): чем
короче период, тем более высок риск. Даже спустя 6 месяцев после перенесенного
ОИМ, риск периоперационного развития повторного ИМ примерно в 50 раз больше
по сравнению с пациентами, у которых не было ОИМ в анамнезе. Наиболее часто
повторные ОИМ возникают в течение 48—72 ч после операции.
Таблица 26.1. Инцидентность повторного ИМ у хирургических больных [3, 4]
Время после предыдущего ОИМ, мес Инцидентность повторного ИМ у хирургических больных, %
Tarhan и соавторы Steen и соавторы Rao и соавторы
0-3 37 27 5,7
4-6 16 11 2,3
более 6 5 6 -
Предоперационное обследование
Во время предоперационного обследования у больных с ИБС обязательно
проводят ЭКГ для исключения острой ишемии миокарда, а также для идентифи-
кации остаточных изменений, произошедших после перенесенных ранее эпизо-
дов острой ишемии. Рекомендуют проведение 12-канальной ЭКГ. Следует по-
мнить, что ранний период ИМ, особенно субэндокардиального, может не прояв-
ляться изменениями на ЭКГ [5]. Для оценки функции левого желудочка проводят
трансторакальную ЭхоКГ или радионуклидное исследование у больных с ОИМ в
анамнезе, кардиомегалией, ЗСН, наличием шумов в сердце при аускультации,
одышкой неясной этиологии, выраженной гипертрофией левого желудочка. В не-
которых случаях для оценки состояния коронарных сосудов проводят коронарную
ангиографию и ЭКГ во время физической нагрузки или после введения добутами-
на. После выполнения тестов решают вопрос о возможности проведения некарди-
альной операции у больного с ИБС, необходимости (объеме) предоперационной
подготовки и коронарной реваскуляризации.
Важное диагностическое значение имеет определение тропонина и креатин-
киназы. Higham и соавторы [6] продемонстрировали, что периоперационное уве-
личение сывороточной концентрации кардиальных тропонинов I и Т и креатин-
киназы-МВ является предиктором развития тяжелых осложнений со стороны сер-
дечно-сосудистой системы, включая кардиальную смерть, в течение трех месяцев
после операции.
Предоперационная подготовка
Если больные с ИБС ранее получали антиангинальную терапию (Р-адрено-
блокаторы, блокаторы кальциевых каналов, нитраты), то ее продолжают накануне
операции.
564
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ Y ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
Stevens и соавторы [7] провели количественный систематический обзор для
сравнения результатов 21 клинического исследования (3646 пациентов) лекарствен-
ных препаратов, применяемых с целью уменьшения кардиальных осложнений у
пациентов с ИБС при некардиальных хирургических вмешательствах: в 11 иссле-
дованиях использовали р-блокаторы (6 препаратов, 866 пациентов), в 6 — клони-
дин (клофелин) или мивазерол (614 пациентов), в 3 — дилтиазем или верапамил
(121 пациент), в 1 — нитроглицерин (45 пациентов). Уменьшили частоту эпизодов
ишемии миокарда p-блокаторы во время операций (7,6 против 20,2 % по сравне-
нию с плацебо) и после операций (15,2 против 27,9 % по сравнению с плацебо);
а2-агонисты уменьшили ишемию только во время операций (19,4 против 32,8 %
по сравнению с плацебо); p-блокаторы уменьшили риск ИМ (0,9 против 5,2 % по
сравнению с плацебо). Эффект а2-агонистов на риск развития ИМ не был досто-
верным (6,1 против 7,3 % по сравнению с плацебо). Существенно уменьшили
риск кардиальной смерти Р-блокаторы (с 3,9 до 0,8 %); а2-агонисты достоверно
уменьшили риск кардиальной смерти (с 2,3 до 1,1 %). Авторы исследования не
обнаружили достоверных доказательств эффективности блокаторов кальциевых
каналов и нитроглицерина. Наиболее частым неблагоприятным эффектом приме-
нения p-адреноблокаторов была брадикардия, которая возникла у 24,5 % пациен-
тов, в контрольной группе — у 9,1 %.
Накануне некардиальных операций назначают p-адреноблокаторы больным с
ИМ в анамнезе, стенокардией, сердечной недостаточностью, сопутствующим са-
харным диабетом, в периоперационном периоде — пациентам старше 65—70 лет, с
высоким уровнем холестерина в крови, злостным курильщикам [8]. У больных с
ИБС симпатическая нервная система усиливает функцию сердечной мышцы, ак-
тивируя p-адренергические рецепторы. Недавние исследования [9] свидетельству-
ют, что хроническое возбуждение p-адренорецепторов ухудшает состояние паци-
ентов с ЗСН. По данным этих же авторов, блокада p-адренорецепторов обладает
антиапоптическим эффектом и способствует защите миокарда.
Согласно недавнему исследованию [10], у пациентов с ИБС применение
Р-блокаторов снижает сердечный выброс в меньшей степени, чем предполагали
ранее, возможно поэтому целесообразно использование периоперационной бло-
кады Р-адренорецепторов для гемодинамической оптимизации.
Начинают терапию p-адреноблокаторами в течение нескольких дней или не-
дели накануне операции после совместной консультации кардиолога и анестезио-
лога. Противопоказания к применению p-адреноблокаторов: снижение ЧСС менее
60 уд./мин, артериальная гипотензия с систолическим АД менее 100 мм рт. ст.,
блокада проводящей системы сердца, бронхиолоспазм. Наиболее часто рекомен-
дуют прием атенолола, дозу которого подбирает кардиолог, с последним приемом
за 30 мин до операции и продолжением внутривенной терапии (при необходимо-
сти) в течение послеоперационных суток и 7 дней после операции. В экстренных
ситуациях при развитии острой ишемии миокарда p-адреноблокаторы вводят внут-
ривенно.
Периоперационная терапия p-адреноблокаторами снижает риск госпиталь-
ной смерти у пациентов с высоким, но не низким риском, которым выполняют
некардиальные операции [11].
ЬВ!
Несмотря на кардиопротективный эффект p-адреноблокаторов, у больных,
которые длительное время их применяют, риск периоперационных карди-
альных осложнений повышен
565
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Giles и соавторы [12] провели обзор литературы с целью идентификации ис-
следований, в которых изучали связь между хронической терапией р-адренобло-
каторами и периоперационными результатами. После изучения 18 исследований
авторы обнаружили, что ни в одном из них не продемонстрирован кардиопротек-
тивный эффект хронической блокады Р-рецепторов. Оказалось, что у пациентов,
хронически получающих терапию p-адреноблокаторами, со значительной долей
вероятности повышается риск возникновения ИМ (р < 0,05). Эти результаты, как
было отмечено выше, отличаются от результатов острого непродолжительного
применения Р-адреноблокаторов.
Перспективным считают периоперационное применение а2-агонистов, посколь-
ку, кроме возможного протективного эффекта на миокард, препараты этой группы
обладают полезными в периоперационном периоде эффектами — седативным и
потенцирующим действие анестетиков. Протекторный эффект клонидина у боль-
ных с ИБС изучали Wallace и соавторы [13]. Согласно исследованию, инцидент-
ность периоперационной ишемии миокарда существенно уменьшается после при-
ема клонидина, профилактическое назначение клонидина оказывает минимальное
воздействие на гемодинамику, его прием в течение 4 периоперационных дней умень-
шает послеоперационную смертность в течение 2-летнего периода (р = 0,035). Для
точных рекомендаций по применению а2-агонистов с целью протекции миокарда в
периоперационный период необходимы дополнительные исследования.
Значение применения блокаторов кальциевых каналов и нитратов для про-
текции миокарда у больных с ИБС в периоперационный период, по-видимому,
ограничено, хотя если больные принимали их до операции, то терапию не прекра-
щают.
В последнее время появились сообщения [14] об уменьшении частоты пери-
операционных кардиальных осложнений при периоперационной терапии стати-
нами, в частности аторвастатином.
26.1.1.2. Интраоперационный период
У больных с ИБС премедикация должна обеспечивать глубокую
седацию (без гипоксемии и гиперкапнии) и гемодинамическую стабильность. К
сожалению, идеальных схем для премедикации у больных с ИБС пока не суще-
ствует. Выбор лекарственных средств зависит от других сопутствующих заболева-
ний и гемодинамических показателей в преднаркозном периоде.
Чаще с целью премедикации используют морфин; рекомендуют скополамин,
который предпочтительнее атропина, так как в меньшей степени вызывает тахи-
кардию; бензодиазепины вводят по необходимости.
Мы обладаем положительным опытом клинического применения субгипно-
тических доз пропофола перед доставкой больного в операционную. При неадек-
ватном контроле артериальной гипертензии, так же как у больных с ГБ, возможна
внутривенная инфузия нитратов под контролем АД и ЧСС во время доставки в
операционную.
У больных с ИБС при выборе анестезиологической тактики учитывают, прежде
всего, функциональные резервы левого желудочка, доставку и потребление кис-
лорода миокардом. Потребность миокарда в кислороде зависит от показателей
ЧСС, системного АД, сократимости миокарда, желудочкового объема, а доставка —
от коронарной перфузии и содержания кислорода в артериальной крови. Макси-
мально избегают тахикардии, снижения САД, гипоксемии, систолической гипертен-
566
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ Y ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
зии, так как эти состояния сопровождаются повышением потребности миокарда в
кислороде и снижением коронарной перфузии.
По данным Sander и соавторов [15], инцидентность тяжелых кардиальных ос-
ложнений у критически больных пациентов с высоким кардиальным риском значи-
тельно увеличивалась при ЧСС более 95 уд./мин в течение более 12 ч. Стабильность
гемодинамических показателей не является абсолютной гарантией профилактики
ишемии миокарда, так как в 50 % случаев тахикардия или резкие колебания АД не
предшествовали ЭКГ-фиксируемой интраоперационной ишемии миокарда [16].
Учитывая вышеуказанные обстоятельства, индивидуально выбирают тактику
индукции в наркоз, интубации трахеи и поддержания анестезии. У пациентов с
нормальными показателями АД используют для индукции в наркоз внутривенные
анестетики в сочетании с опиоидами, с предрасположенностью к гипотензии —
натрия оксибутират и кетамин в сочетании с фентанилом, с ИБС и гипертензией —
пропофол и бензодизепины с быстрым подключением ингаляционных анестети-
ков — изофлюрана, десфлюрана (интубацию трахеи проводят на фоне инфузии
нитратов). Становится популярной методика внутривенной инфузии короткодей-
ствующего p-адреноблокатора эсмолола в дозе 200 мкг/кг/мин, применение кото-
рого позволяет эффективно контролировать АД и ЧСС.
Для поддержания анестезии у больных с ИБС используют ингаляционные ане-
стетики (изофлюран, десфлюран, севофлюран) в сочетании с опиоидными анал-
гетиками — фентанилом или ремифентанилом (препарат не зарегистрирован в
Украине). Кардиопротективное действие ингаляционных анестетиков (см. раздел 7)
позволяет эффективно управлять гемодинамикой и быстро восстанавливать со-
знание больного после операции. Исключением является галотан, который вызы-
вает депрессию миокарда. При невозможности обеспечения ингаляционной анес-
тезии, например, отсутствии специального наркозно-дыхательного оборудования
или препаратов, альтернативой поддержания анестезии у больных с ИБС является
внутривенная анестезия с использованием опиоидов (в качестве аналгетиков),
пропофола, натрия оксибутирата, бензодиазепинов (лучше мидазолама), этомида-
та, в некоторых случаях — кетамина (в качестве гипнотиков).
Для интубации трахеи у больных с ИБС целесообразно использование неде-
поляризующих миорелаксантов быстрого действия (например, эсмерона) или сук-
цинилхолина на фоне недеполяризующих миорелаксантов (эсмерона, норкурона,
ардуана). Избегают монотерапии сукцинилхолином по причине его отрицатель-
ного влияния на миокард; для поддержания миорелаксации во время операции
применяют недеполяризующие миорелаксанты.
Licker и соавторы [17], используя многоканальную трансэзофагальную ЭхоКГ,
исследовали механизмы сердечно-сосудистой адаптации в течение острой нормово-
лемической гемодилюции у больных с тяжелой ИБС. Согласно исследованию, у
анестезированных пациентов с ИБС умеренная острая нормоволемическая гемоди-
люция (гематокрит 28-30 %) не влияла на систолическую и диастолическую функ-
цию желудочков, желудочковую постнагрузку и сократительную способность мио-
карда; понижение вязкости крови привело к увеличению УО, что было связано с
увеличенным венозным притоком и более значительной кардиальной преднагруз-
кой (конечнодиастолическим давлением). По-видимому, уровень гематокрита
28-30 % является пороговым у нормоволемических пациентов с ИБС для проведе-
ния гемотрансфузий и предоперационной нормоволемической гемодилюции.
При развитии острой ишемии миокарда по данным ЭКГ во время операции
экстренно начинают агрессивную терапию — нормализуют показатели ЧСС и АД,
567
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
вводят p-адреноблокаторы (пропранолол или эсмолол в дозе 0,2—0,5 мг/кг внут-
ривенно капельно). При повышенном АД без выраженной тахикардии проводят
внутривенную инфузию нитроглицерина. Если ишемия миокарда развилась на
фоне снижения АД, то проводят адекватное восполнение жидкостью и внутривен-
ную инфузию вазоконстрикторов (фенилэфрина, мезатона). При развитии ише-
мии миокарда контролируют достаточный уровень аналгезии, чтобы ноцицептив-
ная стимуляция не повышала потребность миокарда в кислороде.
Рекомендации АСС/АНА по дооперационной оценке кардиального риска с пред-
ложениями Lustik S.J. были внедрены в работу отдела анестезиологии и интенсивной
терапии ИХТ АМН Украины в 2002 году, в результате чего был принят протокол
профилактики кардиальных осложнений в сосудистой хирургии (см. рис. 25.2).
Существует ли “идеальная анестезия ’’для обеспечения операций у больных с ИБС?
Увы, однозначного ответа на этот вопрос пока не существует. При выборе метода
анестезии анестезиологу следует руководствоваться, прежде всего, здравым смыс-
лом и клиническими представлениями доказательной медицины.
Не существует корреляции между видом анестезии (общей и регионарной) и
вероятностью развития серьезных осложнений. В литературе достаточно данных о
сомнительном преимуществе при экстренных операциях регионарной анестезии
перед общей.
©Кардиолог не может настаивать на выборе определенного метода анесте-
зии, так как анестезиолог несет ответственность за проведение пособия кон-
кретному больному, поэтому выбор метода анестезии является прерогати-
вой анестезиолога, который должен учитывать мнение кардиолога, а не сле-
по следовать его инструкциям
На результат анестезиологического обеспечения влияет вид оперативного вме-
шательства и клинический опыт анестезиолога (скорость реагирования на изме-
нения параметров гемодинамики и умение немедленно откорректировать их).
Тщательный мониторинг интраоперационной гемодинамики и деятельности
сердца позволяет избежать, вовремя диагностировать и исправить последствия
артериальной гипо- и гипертензии, тахи- и брадикардии, др.
26.1.1.3. Послеоперационный период
Ранняя мобилизация у пациентов с ИБС в послеоперационном пе-
риоде важна для профилактики дыхательных и тромбоэмболических осложнений.
Для профилактики ТЭЛА, как правило, применяют антикоагулянтную терапию (не-
фракционированный или низкомолекулярный гепарины), при этом тщательно под-
бирают адекватную дозу антикоагулянта, время начала и окончания терапии.
26.1.2. Анестезиологическое обеспечение у пациентов
с гипертонической болезнью
Гипертоническая болезнь — одно из наиболее часто встречающихся сопут-
ствующих заболеваний у больных хирургического профиля. По данным амери-
канских исследователей [18], около 25 % взрослой популяции страдает ГБ, таким
образом, эти данные можно экстраполировать на популяцию хирургических боль-
568
26, ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
ных. По данным Seki М. и соавторов [19], артериальная гипертензия является
главным фактором риска интраоперационных кардиальных осложнений.
Диагноз ГБ ставят, когда в течение 1—2 недель наблюдения показатели АД
превышают значения 140/90 мм рт. ст. Стадии ГБ определяют, основываясь на
уровне АД и степени повреждения органов (табл. 26.2).
Таблица 26.2. Стадии гипертонической болезни
Стадия (степень тяжести) Систолическое АД, мм рт. ст. Диастолическое АД, мм рт. ст.
1(легкая) 140-159 90-99
2 (средняя) 160-179 100-109
3 (тяжелая) 180-209 110-119
4 (очень тяжелая) >210 >120
В 90 % случаев артериальная гипертензия носит эссенциальный характер, в 10 %
случаев причинами возникновения артериальной гипертензии являются: наруше-
ния функции почек, эндокринных желез (феохромоцитома, тиреотоксикоз, акро-
мегалия), неврологические расстройства, атеросклероз крупных артерий (систо-
лическая форма артериальной гипертензии), токсикоз беременных, коарктация
аорты и др.
26.1.2.1. Предоперационный период
Предоперационные осмотр,
оценка анестезиологического риска, обследование
Предоперационную оценку состояния больного с ГБ основывают на трех ба-
зовых положениях: выборе метода премедикации и медикации, оценке функции
органов, которые могут повреждаться (сердце, головной мозг, почки), тщательной
оценке жидкостного баланса организма.
При сборе анамнеза во время предоперационного осмотра у пациента выяс-
няют уровень контроля и коррекции показателей АД. Если больной регулярно
принимает гипотензивные препараты и поддерживает оптимальный индивидуаль-
ный уровень АД, то риск развития осложнений в определенной степени снижает-
ся. В случаях плохо контролируемой артериальной гипертензии, при нерегуляр-
ном лечении или его отсутствии иногда трудно определиться со стратегией и так-
тикой ведения периоперационного периода.
Прежде всего, обращают внимание на уровень диастолического АД, так как
именно этот показатель отражает тонус сосудов. Существуют рекомендации от-
срочивать оперативное вмешательство, если его проводят не по ургентным пока-
заниям, при уровне диастолического АД > ПО мм рт. ст. [18], либо > 120 мм рт. ст.,
хотя не существует доказательств увеличения риска периоперационных осложне-
ний со стороны сердца и сосудов при этих показателях [5]. В 2004 году британские
исследователи [20] провели систематический обзор и мета-анализ 30 наблюда-
тельных исследований у хирургических больных с ГБ. Авторы обнаружили, что
существует небольшое количество фактов, подтверждающих ассоциацию меж-
ду систолическим АД при госпитализации <180 мм рт. ст. и диастолическим
АД < ПО мм рт. ст. и периоперационными осложнениями; пациенты с уровнем
569
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
АД при госпитализации, превышающим вышеуказанные цифры, более склонны к
периоперационной ишемии, аритмиям и неустойчивости гемодинамики, но ис-
следователи не обнаружили четких свидетельств того, что задержка анестезии и
операции у таких пациентов уменьшает периоперационный риск. Авторы реко-
мендуют не отсрочивать проведение анестезии и операции на основании повы-
шенного дооперационного уровня АД.
В литературе много исследований, проведенных в 1980-х годах и посвящен-
ных вопросу снижения риска интраоперационных осложнений, в частности -
артериальной гипертензии и ишемии миокарда у больных с откоррегированным
уровнем диастолического АД (< 110 мм рт. ст.) до операции [21]. По-видимому,
отмену операции и продолжение предоперационной подготовки гипотензивными
средствами следует проводить при уровне диастолического АД > 120 мм рт. ст., в
остальных случаях отмена операции вряд ли целесообразна, хотя следует учиты-
вать опыт и квалификацию анестезиолога, оснащенность отделения анестезиоло-
гии, в частности, наркозно-дыхательной аппаратурой и ингаляционными анесте-
тиками.
Для оценки предоперационного риска у больных с ГБ учитывают функцио-
нальное состояние сердца, почек, головного мозга и других жизненно важных
органов, функция которых страдает в первую очередь при артериальной гипертен-
зии (ОИМ, внутричерепное кровоизлияние, сердечная недостаточность). Степень
гипертрофии и повреждения миокарда левого желудочка является наиболее важ-
ным фактором риска кардиальных осложнений во время операции у больных с ГБ
[20]. Часто у больных с ГБ следствием гипертрофии левого желудочка является
его дисфункция, при этом для поддержания нормального сердечного выброса тре-
буется адекватная пред нагрузка, поэтому особенно неблагоприятно протекает дис-
функция левого желудочка у больных с гиповолемией. При выраженной дисфун-
кции левого желудочка у больных с ГБ показан инвазивный мониторинг АД и
катетеризация легочной артерии [19].
У больных с ГБ более высокий риск развития артериальной гипотензии во
время анестезии: в ответ на постоянно повышенный тонус артерий снижается
объем сосудистого русла и, соответственно, ОЦК, то есть больные с некомпенси-
рованной ГБ изначально находятся в состоянии гиповолемии. Принципиально
важно адекватно оценить состояние больного и выбрать оптимальную тактику
предоперационной подготовки и метода анестезии.
Во время предоперационного осмотра анестезиолог должен помнить о “ги-
пертензии белого халата” и знать потенциальные ошибки при измерении АД. Для
определения истинного значения дооперационного АД рекомендуют проведение
серии измерений компетентным персоналом [20].
Назначают консультацию кардиолога и совместно определяют сроки предо-
перационной подготовки и методы гипотензивной терапии.
Предоперационная подготовка
Для лечения ГБ используют: диуретики, [З-адреноблокаторы, о^-адреноблока-
торы, ингибиторы АПФ, антагонисты рецепторов ангиотензина II, блокаторы каль-
циевых каналов, прямые вазодилататоры, препараты смешанного действия.
В случаях компенсированной ГБ больной перед операцией не должен пре-
кращать проводимую ранее гипотензивную терапию. В литературе практически
не существует рекомендаций, основанных на принципах доказательной медици-
ны, по предоперационной подготовке у больных с ГБ, которые не лечились или
570
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
лечились неэффективно. Cole D.J. и Schlunt М. [18] рекомендуют применение
гипотензивных препаратов в зависимости от сопутствующей патологии и возра-
ста (табл. 26.3).
Таблица 26.3. Рекомендации по применению гипотензивных средств в зависимости
от сопутствующих заболеваний и возраста
Группа пациентов, заболевание или состояние Рекомендованные гипотензивные препараты Гипотензивные препараты, которые рекомендуют не назначать
Пожилые Диуретики или блокаторы кальциевых каналов р-адреноблокаторы
ЗСН Ингибиторы АПФ, диуретики р-адреноблокаторы, верапамил, дилтиазем
ИБС р-адреноблокаторы, ингибиторы АПФ (особенно после ОИМ и при низкой фракции инжекции)
Гипертрофия левого желудочка Ингибиторы АПФ, блокаторы кальциевых каналов, а [-адреноблокаторы, Диуретики, прямые вазодилататоры
Сахарный диабет или гиперлипидемия Ингибиторы АПФ, блокаторы кальциевых каналов, а j-адреноблокаторы p-адреноблокаторы, диуретики
ХОЗЛ или болезни периферических сосудов — р-адреноблокаторы
Во многих исследованиях, поддерживающих правило продолжения гипотен-
зивного лечения в течение всего периоперационного периода, продемонстрирова-
на периоперационная гемодинамическая стабильность при адекватной общей ане-
стезии у пациентов с леченой гипертензией по сравнению с пациентами, которые
не принимали гипотензивные средства [21].
26.1.2.2. Интраоперационный период
Целью премедикации у больных с ГБ является седация и стаби-
лизация АД во время доставки в операционную. В течение нескольких лет мы
успешно используем методику введения субгипнотических доз пропофола в па-
лате (0,5—0,6 мг/кг) [22], при этом даже в случаях, когда пациент не засыпает,
АД остается стабильным во время доставки в операционную. Такая тактика со-
провождается незначительным количеством осложнений и вызывает у пациента
амнезию о пребывании в операционной. Применение этого метода представляет
определенный риск у пациентов старше 65 лет и ослабленных больных, так как
введение даже небольших доз пропофола может вызвать у них развитие артери-
альной гипотензии и нарушения вентиляции. Альтернативой в таких случаях
является строго дозированная внутривенная инфузия нитроглицерина во время
571
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
доставки в операционную или применение в премедикации а2-агониста — кло-
нидина (клофелина).
Важен вопрос времени отмены гипотензивных препаратов у больных с ГБ пе-
ред операцией, так как, с одной стороны, их внезапная отмена может привести к
резкому подъему АД и острой ишемии миокарда, с другой стороны, при продолже-
нии приема во время наркоза может развиться нестабильность гемодинамики. В
большинстве случаев антигипертензивную терапию продолжают до дня операции.
Comfere и соавторы [23] изучили зависимость между выбором времени пре-
кращения хронического приема ингибиторов АПФ и антагонистов подтипа ангио-
тензиновых рецепторов—1 (ARA) и развитием артериальной гипотензии после
индукции в общехирургической популяции пациентов. Авторы ретроспективно
изучили 267 пациентов с гипертензией, хронически получающих АПФ/АИА-тера-
пию и перенесших экстракардиальную операцию под общей анестезией. Пациен-
ты принимали дозу АПФ/АКА-терапии утром в день операции или за 24 ч перед
операцией; время приема последней дозы регистрировали во время дооперацион-
ного интервью. Авторы исследовали медицинский и анестезиологический элект-
ронные отчеты по сопутствующим заболеваниям, виду и дозе используемых анес-
тетиков, интраоперационной гемодинамике, объему внутривенных инфузий, пе-
риоперационной вазопрессорной под держке и частоте тяжелых послеоперационных
осложнений. Согласно исследованию, прекращение АПФ/АКА-терапии, по край-
ней мере, за 10 ч перед анестезией связано с уменьшением риска непосредствен-
ной постиндукционной гипотензии.
Сосудистый отек лица и шеи является редким, но потенциально опасным для
жизни осложнением, вызванным приемом ингибиторов АПФ. Это состояние тре-
бует особого внимания анестезиолога, поскольку может быстро прогрессировать с
острой обструкцией верхних дыхательных путей. В литературе описаны 5 случаев
сосудистого отека лица и шеи после применения ингибиторов АПФ; все случаи
сопровождались тяжелой обструкцией верхних дыхательных путей [24]. Не отме-
няют, если нет противопоказаний, 0-адреноблокаторы перед операцией. Внима-
тельно оценивают целесообразность приема диуретиков, особенно у бальных с
гиповолемией и гипокалиемией.
Тщательно контролируют показатели АД во время индукции в наркоз и инту-
бации трахеи; проводят профилактические мероприятия по гипертензивной реак-
ции на прямую ларингоскопию и интубацию трахеи (см. раздел 8.3). Индукцию в
наркоз у больных с ГБ осуществляют введением пропофола, бензодиазепинов (ми-
дазолама), опиоидных аналгетиков (фентанила); не используют кетамин и натрия
оксибутират, которые могут способствовать повышению АД.
У больных с нестабильной ГБ на фоне гиповолемии нередко артериальная ги-
пертензия до и во время интубации может перейти в артериальную гипотензию после
интубации, чему также способствует проведение ИВЛ в режиме гипервентиляции.
При смене положения на операционном столе у таких больных возможно развитие
ортостатической гипотензии, поэтому сразу после интубации трахеи больного не по-
ворачивают на живот или бок, а проводят это после контрольного изменения АД-
Основная задача анестезиологического обеспечения у больных с ГБ — макси-
мальное сохранение стабильности оптимальных показателей АД. Наиболее уп-
равляемыми гипотензивными препаратами являются внутривенно вводимые нитра-
ты — нитропруссид натрия и нитроглицерин; под их контролем осуществляют
индукцию в наркоз у больных с ГБ. Для профилактики выраженной реакции симпа-
тической нервной системы на интубацию трахеи, кроме рекомендованных выше
572
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
мер, избегают гипоксии и гиперкапнии при интубации, то есть выполняют эту
манипуляцию максимально быстро — в течение 15 с.
Для поддержания анестезии у больных с ГБ используют ингаляционные анес-
тетики, которые позволяют наиболее управляемо поддерживать АД при условии
отсутствия гиповолемии; в частности применяют десфлюран, поскольку у него
низкая растворимость в крови. Альтернативой ингаляционным анестетикам при
проведении тотальной внутривенной анестезии у больных с ГБ является постоян-
ная инфузия нитроглицерина или нитропруссида натрия.
У больных с ГБ возможно проведение нейроаксиальной блокады, но следует
помнить о выраженном влиянии этого вида анестезии на симпатическую регуляцию
сосудистого тонуса, что может привести к выраженной, плохо купируемой артери-
альной гипотензии, поэтому спинномозговую и эпидуральную анестезии проводят у
пациентов с компенсированной артериальной гипертензией и нормоволемией [19].
Интраоперационные показатели АД поддерживают в пределах менее 20 % от
дооперационного уровня, особенно у пациентов с высокими показателями доопе-
рационного АД [20].
Исторически сложилось, что при ГБ контроль фокусировали на показателях
диастолического АД. Недавно полученные клинические результаты и данные боль-
ших наблюдательных исследований [21] обнаружили более тесную ассоциацию между
систолической гипертензией, ИБС и риском инсультов по сравнению с диастоли-
ческой гипертензией. Разработаны рекомендации агрессивного лечения изолиро-
ванной систолической гипертензии, особенно у пациентов старше 65 лет. Авторы
обнаружили четкую связь между уменьшением эластичности центральных систем-
ных артерий и изолированной систолической гипертензией; у пациентов с изоли-
рованной систолической гипертензией снижение диастолического АД связано с
ухудшением течения болезней артерий, и именно разница между показателями си-
столического и диастолического АД является ценным диагностическим показате-
лем. Выбор метода обезболивания у таких больных продолжают изучать.
Поддерживают адекватный уровень аналгезии у больных с ГБ, особенно в
момент травматических хирургических вмешательств, для предотвращения сим-
патической стимуляции артериальной гипертензии.
26.1.2.3. Послеоперационный период
Во время экстубации у больных с ГБ также увеличен риск гемоди-
намической нестабильности, поэтому в некоторых случаях экстубацию проводят
на фоне инфузии нитратов.
Некоторые больные с ГБ в ранний послеоперационный период склонны к
артериальной гипотензии, поэтому осторожно назначают гипотензивные препара-
ты, особенно если у больного продолжается даже незначительное кровотечение.
26.1.3. Анестезиологическое обеспечение
у пациентов с болезнями клапанов сердца
Болезни клапанов сердца (митральная и аортальная недостаточ-
ности, митральный и аортальный стенозы, см. раздел 15.2) диагностируют по
данным аускультации, рентгенологических исследований, ЭхоКГ (наиболее эф-
фективный метод).
573
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
Митральный стеноз. Особенности анестезиологического обеспечения при мит-
ральном стенозе заключаются в недопущении синусовой тахикардии, в случаях
фибрилляции предсердий — желудочковой тахикардии, увеличения ЦВД за счет
перегрузки жидкостью, вазоконстрикторами, опущенного головного конца, гипо-
вентиляции. Частота сокращений желудочков не должна превышать 80 уд./мин.
Пациенты, принимающие препараты дигиталиса, продолжают терапию в пе-
риоперационный период. В премедикации у больных со стенозом митрального
клапана не применяют атропин, предпочтительнее применение скополамина или
гликопирролата.
При выборе анестетиков не применяют галотан и тиопентал-натрий по при-
чине их кардиодепрессивного эффекта, кетамин — из-за увеличения сердечного
ритма, закись азота (особенно у больных с легочной гипертензией) — из-за увели-
чения ДЛА. Для миорелаксации используют недеполяризующие миорелаксанты.
Во время операции строго учитывают баланс жидкости для недопущения передо-
зировки и последующего отека легких. Больные с митральным стенозом плохо
переносят положение Тренделенбурга.
Недостаточность митрального клапана. Во время операции избегают резкой
брадикардии, так как значительно снижается сердечный выброс, острого повыше-
ния сосудистого сопротивления, применения препаратов, снижающих инотроп-
ную функцию; поддерживают нормальный водный баланс.
Стеноз аортального клапана. Основные требования анестезиологического обес-
печения при аортальном стенозе: поддержание синусового ритма, избегание бра-
дикардии и резкого снижения ОПСС, оптимизация внутрисосудистого объема. У
пациентов с аортальным стенозом одинаково опасны тахикардия (ЧСС > 100 уд./мин)
и брадикардия (ЧСС < 60 уд./мин). Снижение ОПСС сопровождается выражен-
ной гипотензией и снижением коронарной перфузии, поэтому ингаляционные
анестетики применяют только в низких концентрациях. Восполнение внутрисосу-
дистого объема проводят более либерально, чем при митральном стенозе, но ста-
рательно предупреждают развитие гиповолемии. У пациентов с аортальным сте-
нозом во время операции высок риск развития нарушений ритма сердца.
Недостаточность аортального клапана. Во время операции состояние может
усугубиться нарушением коронарной перфузии, что связано со снижением пока-
зателя диастолического АД и характерно для данного порока. Особенности анес-
тезии такие же, как и при митральной недостаточности.
Основные правила проведения анестезии у больных с болезнями клапанов сердца
У пациентов с умеренными клапанными поражениями проводят терапию по
компенсации сердечной недостаточности до операции. Любое оперативное вме-
шательство у больных с поражениями клапанного аппарата или протезированны-
ми клапанами является показанием для профилактики инфекционного эндокар-
дита (см. раздел 15.4).
У пациентов с критическим стенозом или выраженной недостаточностью про-
водят коррекцию порока до плановой операции. В экстренных ситуациях интра-
операционно проводят тщательный мониторинг системной гемодинамики и спе-
цифическую терапию. У больных с имплантированными клапанами сердца в пе-
риоперационном периоде проводят антикоагулянтную терапию прямыми
антикоагулянтами и осуществляют профилактику инфекционного эндокардита.
Абсолютные противопоказания к плановым операциям у больных с заболеваниями
сердца: инфаркт миокарда (до 4 недель), декомпенсированная сердечная недоста-
точность, критический митральный или аортальный стенозы.
574
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
Относительные противопоказания к плановым операциям у больных с заболевани-
ями сердца: инфаркт миокарда (1—6 месяцев), стенокардия, умеренная сердечная
недостаточность, ВПС с цианозом и полицитемией, нарушения гемокоагуляции.
26.1.4. Анестезиологическое обеспечение
у пациентов с застойной сердечной недостаточностью
Каждое полостное травматичное оперативное вмешательство у
бальных с ЗСН, которая является одним из факторов послеоперационной леталь-
ности, представляет угрозу для жизни, поэтому тщательно взвешивают показания
к операции и определяют способность больного ее перенести. Анестезию у таких
больных проводят только опытные анестезиологи, только отсутствие ошибок яв-
ляется одним из основных условий успешного результата.
Главной особенностью анестезиологического обеспечения у больных с ЗСН
является применение анестетиков, минимально влияющих на сердечный выброс
и сократимость миокарда. Не применяют анестетики, вызывающие депрессию
миокарда (галотан, барбитураты). Дозу ингаляционных анестетиков уменьшают.
Перспективным является применение ксенона у таких больных. Несмотря на не-
которые отрицательные свойства, в клинической практике часто применяют за-
кись азота. Из внутривенных анестетиков отдают предпочтение натрия оксибути-
рату и кетамину в сочетании с большими дозами опиоидов (фентанила). По воз-
можности применяют регионарные методы анестезии на фоне незначительной
седации, что часто является наиболее предпочтительным вариантом.
ЛИТЕРАТУРА
1. Wallace A.W., Galindez D., Salahieh A. et al. Effect of clonidine on cardiovascular
morbidity and mortality after noncardiac surgery. Anesthesiology, 2004 Aug; 101 (2):284—93.
2. Seki M., Kashimoto S., Nagata O. et al. Are the incidences of cardiac events during
noncardiac surgery in Japan the same as in the United States and Europe? Anesth. Analg.,
2005 May; 100 (5): 1236-40.
3. Tarhan S., Moffitt E.A., Taylor W.F., Guilliani E.R. Myocardial infarction after general
anesthesia. JAMA, 1972, 220:1451—1454.
4. Steen P.A., TincerJ.H., Tarhan S. Myocardial reinfarction after anesthesia and surgery.
JAMA, 1978, 239:2566-70.
5. Stoelting R.K., Miller R.D. Basics of Anesthesia. 3th ED. New-York, Churchill
Livingstone, 524 p.
6. Higham H., Sear J. W., Sear Y.M. et al. Peri-operative troponin I concentration as a
marker of long-term postoperative adverse cardiac outcomes — A study in high-risk surgical
patients. Anaesthesia, 2004 Apr; 59 (4):318—23.
7. Stevens R.D., Burri H., Tramer M.R. Pharmacologic myocardial protection in patients
undergoing noncardiac surgery: a quantitative systematic review. Anesth. Analg., 2003 Sep; 97
(3):623—33.
' 8. Mangano D.T., Layug E.L., Wallace A., Tateo I. Effect of atenolol on mortality and
cardivascular morbidity after noncatdialc surgery. N. Engl. J. Med., 1996, 335:1713—1720.
9. Patterson A.J., Zhu W., Chow A. et al. Protecting the myocardium: a role for the beta2
adrenergic receptor in the heart. Crit. Care Med., 2004 Apr; 32 (4): 1041—8.
10. Biccard B.M. Perioperative beta-blockade and haemodynamic optimisation in patients
with coronary artery disease and decreasing exercise capacity presenting for major noncardiac
surgery. Anaesthesia, 2004 Jan; 59 (l):60—8.
575
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
11. Lindenauer Р.К., Рекою Р., Wang %. et al. Perioperative beta-blocker therapy and
mortality after major noncardiac surgery. N. Engl. J. Med., 2005 Jul 28; 353 (4):349-61.
12. Giles J.W., Sear J.W., Foex P. Effect of chronic beta-blockade on peri-operative
outcome in patients undergoing non-cardiac surgery: an analysis of observational and case
control studies. Anaesthesia, 2004 Jun; 59 (6):574—83.
13. Wallace A. W., Galindez D., Salahieh A. et al. Effect of clonidine on cardicascular
morbidity and mortality after noncardiac surgery. Anesthesiology, 2004 Aug; 101 (2):284-93.
14. Biccard B.M., Sear J.W., Foex P. The pharmaco-economics of peri-operative statin
therapy. Anaesthesia, 2005 Nov; 60 (11): 1059—63.
15. Sander O., Welters I.D., Foex P., Sear J. W. Impact of prolonged elevated heart rate
on incidence of major cardiac events in critically ill patients with a high risk of cardiac ’
complications. Crit. Care Med., 2005 Jan; 33 (1):81—8.
16. Stogoff S., Keats A.S. Further observations on perioperative myocardial ischemia.
Anesthesiology, 1986, 65:539—42.
17. Licker M., Ellenberger C., Sierra J. Cardiovascular response to acute normovolemic
hemodilution in patients with coronary artery diseases: Assessment with transesophageal
echocardiography. Crit. Care Med., 2005 Mar; 33 (3):591—7.
18. Cole D.J., Schlunt M. Adult Perioperative Anesthesia. Philadelphia, ELSEVIER
MOSBY, 2004, 542 p.
19. Seki M., Kashimoto S., Nagata O. et al. Are the incidences of cardiac events during
noncardiac surgery in Japan the same as in the United States and Europe? Anesth. Analg.,
2005 May; 100 (5): 1236-40.
20. Howell S.J., Sear J.W., Foex P. Hypertension, hypertensive heart disease and
perioperative cardiac risk. Br. J. Anaesth., 2004 Apr; 92 (4):570—83.
21. Wongprasartsuk P., Sear J.W. Anaesthesia and isolated systolic hypertension-
pathophysiology and anaesthesia risk. Anaesth. Intensive Care, 2003 Dec; 31 (6):619-28.
22. Глумчер Ф.С., Суслов Г.Г. Внутривенная премедикация диприваном у больных
с высокой степенью риска при торакальных операциях. Бить, знеболювання i штенсив-
на тератя, 2002, № 2Д, с. 62—63.
23. Comfere Т., Sprung J., Kumar М.М. et al. Angiotensin system inhibitors in a general
surgical population. Anesth. Analg., 2005 Mar; 100 (3):636—44.
24. Rai M.R., Amen F., Idrees F. Angiotensin-converting enzyme inhibitor related
angioedema and the anaesthetist. Anaesthesia, 2004 Mar; 59 (3):283—9.
25. Fleisher L.A. Strategies to Reduce Cardiac Risk in Noncardiac Surger. Where Are We
in 2005? Editorial views. Anesthesiology, 2005, 102:881—882.
26.2. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ОРГАНОВ ДЫХАНИЯ
Болезни органов дыхания являются одной из главных причин пе-
риоперационных заболеваемости и смертности. Тяжелые легочные осложнения
обычно возникают после операции; одним из наиболее существенных факторов
риска их развития являются ХОЗЛ (бронхиальная астма, эмфизема, пневмоскле-
роз, бронхиты, гипоплазия и др.) [1]. Региональная разница в сопротивлении ды-
хательных путей, снижение легочного комплайенса, нарушения вентиляционно-
перфузионных соотношений в легких являются причиной нарушения функции и
снижения легочных резервов. Клинически ХОЗЛ проявляются диспноэ, откашли-
ванием мокроты (иногда гнойного характера), наличием хрипов в легких, экспи-
раторной (в тяжелых случаях — смешанной) одышкой.
576
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
На рентгенограммах легких при ХОЗЛ часто определяют участки гиперинф-
ляции, чередующиеся с участками гиповентиляции, поднятие купола диафрагмы.
На КТ легких часто обнаруживают большое количество мелких полостей, кист,
булл. Одним из отрицательных качеств ХОЗЛ является прогрессирование заболе-
вания, несмотря на лечение. Курение и загрязнение окружающей среды являются
факторами, способствующими развитию и прогрессированию ХОЗЛ. В послеопе-
рационный период у больных с ХОЗЛ высок риск присоединения инфекции (пнев-
монии являются одним из наиболее частых послеоперационных осложнений и
значительно ухудшают результаты лечения).
26 .2.1. Анестезиологическое обеспечение
у пациентов с бронхиальной астмой
Основными патофизиологическими механизмами бронхиальной
астмы — классического примера ХОЗЛ — является гиперреактивность нижних ды-
хательных путей и их хроническое воспаление (подробно в “Руководстве по интен-
сивной терапии” [10]). В клинической картине заболевания во время обострения
преобладают: экспираторная одышка, непродуктивный кашель, специфические хрипы
в легких при аускультации. Дыхательная недостаточность при бронхиальной астме
сначала вентиляционного характера, но за непродолжительное время становится
смешанного характера с присоединением легочного компонента.
Предоперационные осмотр и обследование, оценка анестезиологического риска
Специфическим инструментальным тестом при бронхиальной астме является
определение объема форсированного выдоха за 1 с (ОФВ^; как правило, этот
показатель менее 80 % от нормального значения и его уменьшение коррелирует с
тяжестью заболевания (табл. 26.4). С целью определения тяжести бронхиальной
астмы и риска послеоперационных осложнений проводят определение газового
состава крови.
Таблица 26.4. Степени тяжести бронхиальной астмы [2]
Степень тяжести ОФВ,, % рО2, мм рт. ст. (при дыхании воздухом) рС02, мм рт. ст.
Легкая (бессимптомная) 65-80 >60 <40
Средняя 50-64 >60 <45
Тяжелая 35-49 <60 >50
Крайне тяжелая <35 <60 >50
Предоперационная подготовка
Плановую операцию у больных с бронхиальной астмой целесообразно выпол-
нять в период между приступами. Накануне операции не прекращают системати-
ческого лечения (иногда даже увеличивают дозы препаратов) ингаляционными
Р,-адреномиметиками (сальбутамолом, тербуталином, альмотеролом), ипратропи-
ума бромидом, ингаляционными кортикостероидами. Если больной ранее полу-
чал системные кортикостероиды, то их прием накануне операции возобновляют
19 7-585
577
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
за 24—48 ч перед операцией и продолжают в течение 5—7 послеоперационных
дней. Такой подход уменьшает риск послеоперационных осложнений у больных с
бронхиальной астмой.
В предоперационном периоде, как и у всех больных с ХОЗЛ, важным компо-
нентом подготовки является санация дыхательных путей, особенно если присут-
ствует инфекционный компонент. При наличии гнойной мокроты после бактери-
ологического исследования с определением чувствительности микрофлоры про-
водят антибиотикотерапию, а также санационные ФБС с промыванием нижних
дыхательных путей теплым изотоническим раствором натрия хлорида. Боязнь раз-
вития бронхиолоспазма при применении лидокаина во время проведении ФБС
часто преувеличена. Освобождение дыхательных путей от мокроты с восстановле-
нием их проходимости является важным условием профилактики послеопераци-
онных пневмоний.
Интраоперационный период
Используют анестетики, которые снижают реактивность дыхательных путей и
риск бронхиолоспазма в ответ на механическое раздражение при интубации тра-
хеи, прямой ларингоскопии, введении катетера в трахею для аспирации мокроты.
Для вводного наркоза используют натрия оксибутират и кетамин, которые комби-
нируют с бензодиазепинами; фентанил предпочтительнее морфина, который мо-
жет увеличить риск бронхиолоспазма. Существуют данные [3] о положительном
эффекте введения перед интубацией трахеи лидокаина в дозе 1—2 мг/кг.
Для поддержания анестезии используют галотан и изофлюран. Необходимо
помнить о кардиодепрессивном и сенсибилизирующем к катехоламинам влиянии
галотана на миокард. Исключают миорелаксанты, обладающие свойством осво-
бождать гистамин. В литературе сообщают о случаях бронхоспазма у пациентов с
астмой в ответ на введение атракуриума [4].
Хорошей альтернативой общей анестезии у больных с бронхиальной астмой
является региональная анестезия, при которой уменьшается риск осложнений,
связанный с этим заболеванием.
Острый бронхиолоспазм во время операции является редким, но грозным и опас-
ным осложнением. Часто анестезиологи ошибочно ставят этот диагноз. Бронхо-
спазм во время общей анестезии следует дифференцировать с механической об-
струкцией (перегибом, обтурацией, смещением, перекрытием манжетой просвета
интубационной трубки), неадекватной миорелаксацией, пневмотораксом. Для ис-
ключения всех вышеуказанных причин иногда необходимо проведение рентгено-
графии легких во время операции. В случае истинного бронхиолоспазма увеличи-
вают глубину анестезии, если это возможно, особенно галотана, и подачу кисло-
рода, вводят кортикостероиды, эуфиллин, магнезию, р,-адреномиметики
(ингаляционно, подкожно, тербуталин — внутривенно, но не на фоне ингаляции
галотана). У больных с бронхиальной астмой систематически, в зависимости от
количества мокроты, аспирируют содержимое дыхательных путей.
Послеоперационный период
Интубационная трубка в трахее у больных с бронхиальной астмой провоциру-
ет бронхиолоспазм, который может возникнуть во время экстубации или при про-
буждении пациента. Поэтому некоторые авторы рекомендуют проводить экстуба-
цию на фоне сохраняющейся анестезии, исключение — больные с трудной инту-
бацией, избыточной массой тела, дыхательной недостаточностью. После экстубации
проводят мероприятия по профилактике бронхиолоспазма.
578
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
26 .2.2. Анестезиологическое обеспечение
у пациентов с хроническим бронхитом и эмфиземой легких
Хронический бронхит характеризуется постоянными или перио-
дически возникающими кашлем с выделением мокроты, иногда гнойного харак-
тера, хрипами в легких; довольно быстро у некоторых больных развиваются арте-
риальная гипоксемия и даже гиперкапния, хроническое легочное сердце. Важным
предрасполагающим фактором хронического бронхита является курение.
Эмфизема легких характеризуется потерей эластичности паренхимы легких,
повышением сопротивления дыхательных путей, гиперинфляцией альвеол.
Предоперационное обследование
Обязательно проводят спирометрию, рентгенографию легких, ЭКГ.
Риск послеоперационной дыхательной недостаточности возрастает, если со-
отношение ОФВуЖЕЛ < 50 %. Важными предикторами послеоперационной ОДН
являются показатели газового состава артериальной крови, степень гипоксемии и
гиперкапнии.
Предоперационная подготовка
Для уменьшения риска послеоперационной ОДН и трудностей с вентиляцией
проводят тщательную предоперационную подготовку, которая заключается в пре-
кращении курения, санации дыхательных путей (ФБС, антибиотикотерапии при
гнойном бронхите с учетом чувствительности к антибиотикам, приеме муколити-
ков), аэрозолетерапии (ингаляции 0,-адреномиметиков, ипратропия бромида).
Иногда для достижения эффекта проводят серию ФБС в течение 1—2 недель.
©Программа прекращения курения за 6-8 недель до операции эффективно
снижает частоту послеоперационных осложнений; такого рода рекоменда-
ции должны широко внедряться в практику
Курильщики подвержены высокому риску развития сердечно-легочных ос-
ложнений и осложнений заживления послеоперационной раны. К сожалению,
некоторые врачи придерживаются ложного мнения о том, что курящему пациенту
не стоит расставаться с этой пагубной привычкой перед операцией. По данным
Moller А.М. [5], максимальный эффект от прекращения курения выражается в
снижении количества осложнений, связанных с заживлением послеоперационных
ран (5 против 31 %, р = 0,001), осложнений со стороны сердечно-сосудистой
системы (0 против 10 %, р = 0,08) и снижением частоты повторных операций
(4 против 15 %, р = 0,07). Согласно исследованию [6], у курящих пациентов повы-
шена частота развития раневой инфекции по сравнению с некурящими и пациен-
тами, которые прекратили курить за 4 недели до операции.
По данным Warner D.O. и соавторов [7], большинство врачей считают своим
долгом советовать пациентам отказаться от курения, но только 30 % анестезиоло-
гов и 58 % хирургов это делают регулярно. Основной причиной является скепти-
ческое отношение к эффективности антиникотиновой пропаганды, которая зави-
сит от качества применяемых методов, и неверие врачей, что их рекомендации
повлияют на поведение пациента.
Ошибочным является мнение о развитии абстинентного синдромом с осложнени-
ями в послеоперационный период после прекращение курения за некоторое время до
579
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
операции. Warner и соавторы [7] отмечают, что курильщики отмечают повышенный
исходный стресс после прекращения курения, но это не влияет на течение периопера-
ционного периода, то есть абстинентный синдром не является существенной клини-
ческой проблемой в периоперационном периоде для большинства курильщиков.
Интраоперационный период
Принципиальных особенностей анестезиологического обеспечения у больных
с ХОЗЛ не существует, кроме систематического акцентирования внимания на под-
держании проходимости дыхательных путей в виде аспирации, особенно у больных
с большим количеством мокроты. Наиболее подходящими анестетиками у больных
с ХОЗЛ являются ингаляционные, возможно, за исключением закиси азота, если у
больного диагностировали буллезную болезнь или полости в легком другой этиоло-
гии. Volta С.А. и соавторы [8] продемонстрировали, что изофлюран и севофлюран
вызывают бронходилатацию у больных с ХОЗЛ. У больных с дисфункцией миокар-
да с осторожностью применяют галотан; с осторожностью используют морфин,
который может спровоцировать бронхиолоспазм у больных с ХОЗЛ.
При адекватной предоперационной подготовке возможно выполнение регио-
нарной анестезии, которая является методом выбора для интра- и послеопераци-
онного анестезиологического обеспечения у пациентов с ХОЗЛ [9].
Послеоперационный период
У больных с ХДН, которая часто осложняет ХОЗЛ, могут возникнуть трудности
во время экстубации. При переводе на спонтанное дыхание, особенно после приме-
нения больших доз опиоидов во время операции, у таких больных может развиться
гиперкапния по причине снижения чувствительности дыхательного центра к СО,.
Кроме этого, у больных с хронической дыхательной недостаточностью обычные тес-
ты, которые используют для определения восстановления мышечного тонуса, могут
оказаться неинформативными (при адекватной реакции на императивные команды
поднять голову или пожать руку адекватное спонтанное дыхание остается неэффек-
тивным). У таких больных увеличивают период времени после операции для перево-
да на самостоятельное дыхание. Перед экстубацией у больных с ХОЗЛ проводят тща-
тельную санацию дыхательных путей теплым изотоническим солевым раствором.
Вследствие вышеуказанных причин часто проводят продленную ИВЛ после
операции, что по нашему опыту и данным литературы неоправдано, так как уве-
личиваются количество осложнений и нагрузка на персонал. Современный мони-
торинг и клинический опыт анестезиолога позволяют своевременно определить
адекватность самостоятельного дыхания у пациента с ХДН; при отсутствии гипер-
капнии и гипоксемии и обеспечении проходимости дыхательных путей проводят
экстубацию. Быстрее адекватное спонтанное дыхание восстанавливается после
применения ингаляционных анестетиков (десфлюрана, изофлюрана) и современ-
ных миорелаксантов (рокурониума). Неинвазивные методы ИВЛ могут стать воз-
можной альтернативой более быстрого перевода на спонтанное дыхание [9].
В послеоперационный период у больных с ХОЗЛ по возможности проводят
раннюю активизацию; поддерживают проходимость дыхательных путей. При не-
обходимости проводят неоднократные ФБС, адекватную антибиотикотерапию,
дыхательную гимнастику с периодическими глубокими вдохами и дыханием с со-
противлением на выдохе, аэрозолетерапию 02-адреномиметиками, прием муколи-
тиков (амбраксола, N-ацетилцистеина).
Мы разделяем мнение Henzler D. и соавторов [9], что в большинстве случаев
нет существенных причин для отказа в операции у пациентов с ХОЗЛ.
580
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
ЛИТЕРАТУРА
1. Berger М.М., Gust R. Perioperative evaluation of lung function. Anaesthesist, 2005
Mar; 54 (3):273-86.
2. Kingston H. G. G., Hirshman C.A. Perioperative management of the patient with asthma.
Anesth. Analg., 1984, 63:844—55.
3. Downes H., Gerber N., Hirshman C.A. I.V. lignocaine in reflex and allergic
bronchoconstriction. Br. J. Anaesth., 1980, 52:873—8.
4. Oh T.E., Horton J.M. Adverse reactions to atracurium. Br. J. Anaesth., 1989, 62:467—70.
5. Moller A.M., Villebro N., Pedersen T., Tonnesen H. Effect of preoperative smoking
intervention on postoperative complications: a randomised clinical trial. Lancet, 2002 Jan 12;
359 (9301):l 14—7.
6. Sorensen L.T., Karlsmark T, Gottrup F. Abstinence from smoking reduces incisional
wound infection: a randomized controlled trial. Ann. Surg., 2003 Jul; 238 (1):1—5.
7. Warner D.O., Sarr M.G., Offord K.P., Dale L.C. Anesthesiologists, general surgeons,
and tobacco interventions in the perioperative period. Anesth. Analg. 2004 ec; 99 (6): 1766—73.
8. Volta C.A., Alvisi V, Petrini S. et al. The effect of volatile anesthetics on respiratory
system resistance in patients with chronic obstructive pulmonary disease. Anesth. Analg., 2005
Feb; 100 (2):348-53.
9. Henzler D., Dembinski R., Kuhlen R., Rossaint R. Anesthetic considerations in patients
with chronic pulmonary diseases. Minerva Anestesiol., 2004 May; 70 (5):279—84.
10. Руководство по интенсивной терапии. Под ред. Трещинского А.И. и Глумчера
Ф.С., К.: Вища школа, 2004, с. 107—110.
26.3. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
Сахарный диабет — эндокринопатия с неуклонно увеличиваю-
щейся частотой встречаемости у хирургических больных, которая значительно
увеличивает риск периоперационных осложнений и летальности; это заболевание
занимает 6-е место в рейтинге причин смертности в США и оказывает существен-
ное влияние на течение других заболеваний, приводящих к смерти, особенно сер-
дечно-сосудистых [1]. По данным Coursin D.B. и соавторов [1], примерно у 25 %
пациентов ОИТ диагностируют сахарный диабет.
Заболевание проявляется, прежде всего, гипергликемией и тяжелыми нару-
шениями метаболизма, вызванными недостаточным усвоением глюкозы; хрони-
зация при недостаточной компенсации приводит к повреждению многих систем и
органов — почек, сосудов, сетчатки, нервной системы и др.
Инсулинозависимый сахарный диабет (I типа) обусловлен аутоиммунным или
воспалительным процессом, поражающим р-клетки поджелудочной железы с пос-
ледующей недостаточной продукцией инсулина; основной метод терапии — при-
менение экзогенного инсулина.
Инсулинонезависимым сахарным диабетом (II типа) чаще болеют пожилые
люди. Этот вид диабета возникает вследствие нарушений метаболизма; кроме на-
рушений продукции инсулина, причиной гипергликемии является нарушение чув-
ствительности к инсулину (количества инсулина, особенно на ранних стадиях бо-
лезни, вполне достаточно, но организм его не усваивает по причине повреждения
581
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
специфических рецепторов клеток). Ожирение является основным фактором рис-
ка сахарного диабета II типа. Более комплексное лечение, чем при диабете I типа,
включает: диетотерапию, физическую активность, лекарственные средства, сти-
мулирующие продукцию инсулина (производные сульфонилмочевины) и повы-
шающие чувствительность к инсулину (метформин и др.), инсулинотерапию (при
необходимости). Производные сульфонилмочевины увеличивают высвобождение
инсулина из Р-клеток поджелудочной железы, метформин — производное бигуа-
нида — тормозит глюконеогенез в печени, увеличивает чувствительность рецепто-
ров к инсулину.
Предоперационные осмотр и обследование, оценка анестезиологического риска
Определяют степень компенсации диабета, адекватность контроля над уров-
нем глюкозы, риск развития кетоацидоза, состояние органов (почек) и систем
(сердечно-сосудистой и нервной), которые чаще поражаются при диабете.
Обязательно проводят ЭКГ-исследование для исключения ишемии миокарда,
так как ИБС — наиболее серьезное периоперационное осложнение у больных с
сахарным диабетом. Нарушение состояния сосудов грозит нестабильностью гемо-
динамики в периоперационном периоде.
Протеинурия является ранним признаком диабетической нефропатии.
Предоперационная подготовка
У больных с нестабильным уровнем глюкозы в крови проводят консультацию
эндокринолога. Прием p-адреноблокаторов перед операцией может способство-
вать гипогликемии.
Премедикация
Осуществляют полноценный объем премедикации для максимального умень-
шения стрессовой реакции. У больных с сахарным диабетом нарушена моторная
функция желудка и увеличен риск регургитации во время вводного наркоза, поэто-
му для снижения риска этого осложнения в премедикацию у больных с плохо кон-
тролируемым диабетом предлагают включать метоклопрамид (10 мг внутривенно за
20 мин перед вводным наркозом) [2]; авторы этого исследования утверждают, что у
больных с компенсированным сахарным диабетом объем желудочного содержимо-
го не отличается от пациентов, которые не страдают этим заболеванием.
Препараты сульфонилмочевины потенцируют действие барбитуратов.
Часто у больных с тяжелым сахарным диабетом предпочтительными являются
регионарные методы анестезии, в таких ситуациях осторожно применяют адрена-
лин в составе анестезирующего раствора.
Периоперационный контроль гликемии
Поддержание нормального уровня глюкозы в крови и регулярный контроль
над ним в периоперационный период являются важными условиями профилакти-
ки осложнений, так как гипергликемия — главный фактор риска неблагоприятно-
го результата после серьезной операции у пациентов с диабетом II типа [3]. При
выборе метода контроля над гликемией учитывают вид, травматичность и продол-
жительность оперативного вмешательства; при коротком и нетравматичном вме-
шательстве возможен обычный контроль уровня глюкозы, при обширных и дли-
тельных операциях — контроль усиливают. Cole D.J. и Schlunt М. предложили
схемы контроля уровня глюкозы в периоперационный период [4].
Схема контроля уровня глюкозы в периоперационный период при диабете I типа
[4]: утром за час перед операцией начинают инфузию 5 % раствора глюкозы со
582
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
скоростью 80—100 мл/ч (5—10 г/ч), 0,32 ЕД инсулина на 1,0 г глюкозы (36 ЕД
инсулина на 1 л 5 % раствора глюкозы); проводят контроль каждые 1—2 ч и под-
держивают уровень глюкозы крови 8—10 ммоль/л; при повышении уровня более
11 ммоль/л, начинают внутривенную инфузию инсулина (0,025 ЕД/кг/ч).
Схема контроля уровня глюкозы в периоперационный период при диабете II типа [4]:
утром в день операции пациент принимает утреннюю дозу сахароснижающего
препарата (у пациентов с компенсированным диабетом приемлема тактика отме-
ны глюкозы и инсулина в день операции или прекращения приема препаратов
сульфонилмочевины за сутки до операции); если пациент принимал препараты
сульфонилмочевины, то проводят профилактику гипогликемии с последующим
голоданием больного; измеряют уровень глюкозы крови до поступления в опе-
рационную; до операции начинают инфузию 5 % раствора глюкозы 80—100 мл/ч
(ш = 70 кг); осуществляют контроль через 2—4 ч, если уровень глюкозы повы-
шен — то чаще; при гипергликемии (> 11 ммоль/л) проводят инфузию инсулина
(0,025 ЕД/кг/ч); прием сахароснижающих препаратов возобновляют после опера-
ции, как только становится возможным энтеральное питание.
Во время операции используют только инсулин короткого действия (начало —
через 3—5 мин, продолжительность — около 20—30 мин).
Трудности в коррекции гликемии возникают, если больному с плохо контроли-
руемым сахарным диабетом необходима экстренная операция. В таких ситуациях в
течение предоперационного периода проводят коррекцию водно-электролитного
состояния, содержания сахара в крови и возможного метаболического ацидоза.
Интенсивная инсулинотерапия до достижения нормогликемии заметно улучшает
выживаемость пациентов в критическом состоянии, но широкое клиническое при-
менение этого метода ограничено трудностью применения и риском гипогликемии.
Meier J.J. и соавторы [5] исследовали эффект глюкагонподобного пептида-1
(GLP-1, или гормона, понижающего глюкозу) после обширной операции у паци-
ентов с диабетом II типа. Согласно исследованию, инфузия GLP-1 достоверно
увеличивала секрецию инсулина и подавляла секрецию глюкагона (р = 0,041); в
течение экспериментов не зарегистрировали случаев острой гипогликемии. Авто-
ры утверждают, что инфузию GLP-1 можно использовать для уменьшения кон-
центрации глюкозы крови у пациентов с диабетом II типа после обширного хи-
рургического вмешательства.
В послеоперационный период проводят строгий контроль гликемии, не реже
чем через 6 ч; поддерживают оптимальный уровень глюкозы крови — 5—12 ммоль/л.
При переходе больного на нормальный режим питания возобновляют обычную схе-
му контроля гликемии, при необходимости назначают консультацию эндокринолога.
Контроль гликемии в периоперационный период затруднен по причине акти-
визации контринсулярных гормонов — адреналина, кортизола, гормона роста,
которые активируют гликогенолиз, глюконеогенез, протеолиз и липолиз, в ре-
зультате чего могут развиться тяжелая гипергликемия и кетоацидоз. Также конт-
роль гликемии затруднен из-за нарушения обычного режима питания (диеты, го-
лодания, дегидратации) и приема лекарственных препаратов. Белковый катабо-
лизм увеличен у больных с сахарным диабетом II типа, что подтвердили Schricker Т.
и соавторы [6].
Прогноз и осложнения
Мнения исследователей о влиянии сахарного диабета на исход оперативного
вмешательства противоречивы: одни авторы утверждают, что на современном эта-
583
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
пе частота летальных исходов и осложнений почти идентичны у диабетических и
недиабетических пациентов в течение 30-и послеоперационных дней; другие ис-
следователи считают, что сахарный диабет продолжает оставаться одним из глав-
ных факторов риска кратко- (< 30 дней) и долгосрочной (> 30 дней) летальности,
особенно после тяжелых кардиальных операций. Juul А.В. и соавторы [7] зарегис-
трировали более высокую смертность у пациентов с сахарным диабетом после
экстракардиальных операций по сравнению с больными, не страдающими этим
заболеванием.
Высокая смертность обусловлена, прежде всего, заболеваниями сердечно-со-
судистой системы, поэтому будущие терапевтические стратегии должны сосредо-
точиться на осуществлении кардиопротективного лечения в течение периопера-
ционного периода у больных с сахарным диабетом. У таких больных увеличен
риск инфекционных осложнений, нарушены репаративные процессы заживления
ран, у декомпенсированных пациентов затруднен контроль АД и водно-электро-
литного баланса.
Гипергликемия
Как правило, в ОИТ гипергликемия возникает у пациентов с сахарным диабе-
том, находящихся в критическом состоянии, но часто ее диагностируют у боль-
ных во время периоперационного периода без эпизодов повышения уровня глю-
козы крови в анамнезе [1]. Причиной развития гипергликемии в критическом
состоянии является чрезмерная концентрация стрессовых гормонов и воспали-
тельных цитокинов в тканях и крови. Активное поддержание нормогликемии улуч-
шает результаты лечения у диабетических пациентов с ОИМ и после кардиальных
операций. Согласно результатам недавних исследований, “напряженный” конт-
роль гликемии у диабетических и недиабетических пациентов с гипергликемией в
ОИТ привел к увеличению выживаемости хирургических пациентов без чрезмер-
ного риска развития гипогликемии. Механизмы выгоды эугликемии являются
многофакторными. Необходимы дальнейшие исследования по показателям опти-
мальной концентрации глюкозы крови, механизмам положительного воздействия
эугликемии и инсулинотерапии.
Гипогликемия
Одним из серьезнейших осложнений инсулинотерапии и приема препаратов
сульфонилмочевины является гипогликемия, которая также является следствием
аденомы или карциномы поджелудочной железы.
Клинические признаки гипогликемии: нарушения сознания (вплоть до комы),
усиленное потоотделение, тахикардия, артериальная гипертензия, боли за груди-
ной. Гипогликемия достаточно трудно поддается диагностике во время операции
и наркоза, поэтому у пациентов с повышенным риском проводят постоянный
мониторинг уровня глюкозы крови; при диагностике оказывают неотложную по-
мощь: вводят гипертонический раствор глюкозы и глюкагон.
ЛИТЕРАТУРА
1. Coursin D.B., Connery L.E., Ketzler J.T. Perioperative diabetic and hyperglycemic
management issues. Crit. Care Med., 2004 Apr; 32 (4 Suppl): S. 116—25.
2. Jellish W.S., Kartha V., Fluder E., Slogoff S. Effect of metoclopramide on gastric fluid
volumes in diabetic patients who have fasted before elective surgery. Anesthesiology, 2005
May; 102 (5):904-9.
584
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
3. Meier J.J., Wieyhe D., Michaely M. et at. Intravenous glucagon-like peptide 1 normalizes
blood glucose after major surgery in patients with type 2 diabetes. Crit. Care Med. 2004 Mar;
32 (3):848—51.
4. Cote D.J., Schlunt M. Adult Perioperative Anesthesia. Philadelphia, ELSEVIER MOSBY,
2004, 542 p.
5. Meier J .J., Weyhe D., Michaely M. etal. Intravenous glucagon-like peptide 1 normalizes
blood glucose after major surgery in patients with type 2 diabetes. Crit. Care Med., 2004 Mar;
32 (3):848—51.
6. Schricker T., Gougeon R., Eberhart L. et al. Type 2 diabetes mellitus and the catabolic
response to surgery. Anesthesiology, 2005 Feb; 102 (2):320—6.
7. Juul A.B., Wetterslev J., Kofoed-Enevoldsen A. Long-term postoperative mortality in
diabetic patients undergoing major non-cardiac surgery. Eur. J. Anaesthesiol., 2004 Jul; 21
(7):523—9.
26.4. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С МИАСТЕНИЕЙ
(MYASTHENIA GRAVIS)
Myasthenia gravis (код G70.0 по МКБ-10), или миастения тяжелая
псевдопаралитическая, характеризуется мышечной слабостью, обусловленной ауто-
иммунным процессом, нарушающим передачу импульса через нервно-мышечный
синапс. Частота в обшей популяции составляет 1:20 000.
Этиология. Причиной нарушения проведения нервно-мышечного импульса
считают образование аутоантител к ацетилхолиновым рецепторам постсинапти-
ческой мембраны, уменьшение количества функционирующих рецепторов, их де-
струкция или блокада.
Клинические проявления. Болезнь часто начинается с симптомов слабости мышц
глотки и глазного дна, что клинически проявляется дисфагией, диплопией, пто-
зом; в дальнейшем развивается слабость всех поперечнополосатых мышц (в том
числе, дыхательных), возможно развитие кардиомиопатии и гипотиреоидизм. Осо-
бенностью заболевания является быстрая истощаемость поперечнополосатых мышц
и их относительное восстановление после отдыха. Причиной обострения заболе-
вания и развития миастенического криза может явиться любой стрессогенный
фактор — инфекция, эмоциональный стресс, обострение другого заболевания,
менструация.
Диагностика. /Антитела к АХ-рецепторам постсинаптической мембраны обна-
руживают у 90 % больных с myasthenia gravis, этот метод является наиболее специ-
фическим признаком заболевания. У 10 % больных обнаруживают гиперплазию
или опухоли вилочковой железы. Для подтверждения диагноза, кроме определе-
ния титра антител к АХ-рецепторам, используют электромиографические иссле-
дования, провокационные тесты, тест с внутривенным введением эдрофониума
хлорида (короткодействующего антихолинэстеразного препарата) в дозе 2—10 мг.
Лечение. Для восстановления мышечной силы в течение предыдущих 50 лет и
на современном этапе применяют ингибиторы холинэстеразы. Снижение актив-
ности холинэстеразы способствует накоплению и повышению активности ацетил-
холина. Применяют ингибиторы холинэстеразы, не обладающие выраженным
585
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
холинергическим эффектом: местинон, пиридостигмин, калимин; в острой ста-
дии миастенического криза используют прозерин.
Для подавления образования антител применяют кортикостероиды и имму-
нодепрессанты (азатиоприн, циклоспорин).
Тимэктомия может приостановить прогрессирование заболевания и вызвать
длительную ремиссию; особенно эффективен этот вид лечения на ранних стадиях
болезни и при гиперплазии или опухоли вилочковой железы.
Для уменьшения титра антител применяют экстракорпоральные методы очи-
щения крови (плазмаферез).
Особенности анестезиологического обеспечения. В послеоперационный период
больные с myasthenia gravis подвержены высокому риску расстройств вентиляции;
более высокий риск продленной ИВЛ у больных с длительностью диагноза более
5 лет. За 6 ч перед операцией принимают рекомендованную дозу ингибитора хо-
линэстеразы без отмены систематического лечения. Для миорелаксации ре-
комендуют использовать сукцинилхолин (см. раздел 6.8). Мы обладаем опытом
успешного применения у больных с миастенией норкурона (векурониума) и эсме-
рона (рокурониума) в сниженных дозах.
N3!
У больных с myasthenia gravis повышена чувствительность к недеполяризу-
ющим миорелаксантам, но на современном этапе считают, что их можно при-
менять, но в меньших дозах
Для поддержания анестезии оптимальным является использование ингаляци-
онных анестетиков, которые не вызывают длительного угнетения дыхания. Продол-
жительной ИВЛ в послеоперационный период способствует применение опиатов и
других внутривенных анестетиков, так как эти препараты, а также аминогликозиды,
препараты магния, лития, блокаторы кальциевых каналов и антиаритмические сред-
ства в той или иной степени вызывают депрессию дыхания.
Перед экстубацией проводят тестирование восстановления мышечного тону-
са с помощью миографии и обычных тестов — способности приподнять голову и
удерживать ее в течение 5 с, определении силы вдоха, то есть создания макси-
мального отрицательного давления на вдохе не менее 25 см вод. ст. (при недоста-
точной силе вдоха маловероятно адекватное самостоятельное дыхание).
У больных с myasthenia gravis, которые принимают ингибиторы холинэстера-
зы, особенно в больших дозах, существует риск развития холинэргического криза,
который проявляется симптомами активации парасимпатической нервной систе-
мы: усиленной саливацией, миозом, слезотечением, бронхореей, возможно — не-
держанием мочи, диареей, и даже отеком легких.
В литературе сообщают [1] об успешном выполнении расширенной тимэкто-
мии у трех пациентов с myasthenia gravis под изолированной высокой грудной
эпидуральной анестезией со спонтанным дыханием. Эта методика обезболивания
обладает существенными преимуществами, так как не требует применения мы-
шечных релаксантов и ингаляционных анестетиков; необходимы дальнейшие ис-
следования для определения показаний.
ЛИТЕРАТУРА
1. Tsunezuka Y., Oda М., Matsumoto I. et al. Extended thymectomy in patients with
myasthenia gravis with high thoracic epidural anesthesia alone. World J. Surg., 2004 Oct; 28
(10):962-5.
586
36. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
26.5. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С АЛКОГОЛИЗМОМ И НАРКОМАНИЕЙ
У пациентов, страдающих алкоголизмом, часто диагностируют
цирроз печени, кардиомиопатии, генерализованные миопатии, расстройства пи-
тания, синдром Корсакова—Вернике, полинейропатии, ХОЗЛ (большинство этих
пациентов являются злостными курильщиками).
Тщательная оценка функций всех внутренних органов необходима в пре-
доперационный период. У алкоголиков часто изменена чувствительность к об-
щим анестетикам, в том числе ингаляционным, что требует увеличения их дозы [1];
в терминальных стадиях заболевания чувствительность к анестетикам может зна-
чительно возрасти. Ускорение метаболизма препаратов обусловлено алкоголь-
индуцированной микросомальной энзимной стимуляцией, что приводит к за-
медлению накопления в мозге анестетических субстанций. Swerdlow B.N. и со-
авторы [2] утверждают, что у алкоголиков чувствительность к тиопентал-натрию
не снижена.
Servin F.S. и соавторы [3] установили, что у пациентов-алкоголиков требуют-
ся более высокие дозы пропофола для вводного наркоза, и что хронический алко-
голизм сопровождается умеренными изменениями в фармакокинетике пропофо-
ла (увеличением быстрого клиренса и большей индивидуальной вариабельностью
в центральном объеме распределения).
У пациентов-алкоголиков с кардиомиопатиями осторожно применяют инга-
ляционные анестетики, обладающие кардиодепрессивным эффектом; кроме это-
го, у них снижена толерантность к кровопотере, возможна сниженная чувстви-
тельность к кардиотоническим и вазопрессорным препаратам. У больных хрони-
ческим алкоголизмом часто выражена портальная гипертензия, поэтому
значительная доля перфузии и оксигенации гепатоцитов приходится на печеноч-
ную артерию. В связи с этим ограничивают дозы ингаляционных анестетиков (в
частности, изофлюрана), комбинируя их с закисью азота и опиоидами [4].
В зависимости от степени нарушения функций печени и почек может замед-
ляться восстановление мышечного тонуса после применения недеполяризующих
миорелаксантов, хотя их начальная доза может увеличиться вследствие повышен-
ного распределения [5].
У пациентов, страдающих алкоголизмом, повышен риск развития ишемичес-
ких невритов и нозокомиальной инфекции после обширных и длительных хирур-
гических операций [6].
При острой интоксикации алкоголем потребность в анестетиках может зна-
чительно снизиться, вследствие аддитивного эффекта алкоголя и анестетиков. У
этих пациентов увеличен риск регургитации и кровотечений, особенно из пище-
варительного канала.
Алкогольный делирий (delirium tremens) — одно из наиболее частых после-
операционных осложнений у пациентов-алкоголиков — чаще развивается че-
рез 48—72 ч после операции и сопровождается высокой летальностью (до 15 %);
проявляется возбуждением и бредом с галлюцинациями, при этом происходит
активация симпатической нервной системы и выброс эндогенных катехолами-
нов с последующими гиперпирексией, тахикардией, артериальной гипертензи-
ей, гипогликемией, возможными маленькими судорожными припадками. При-
меняют агрессивную тактику лечения алкогольного делирия: внутривенно вво-
587
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
дят диазепам (5—10 мг), повторяют под контролем вентиляции до достижения
седации. Для седации также используют пропофол, галоперидол. Для стабили-
зации гемодинамики применяют p-адреноблокаторы, в частности пропранолол
или эсмолол; проводят коррекцию водно-электролитного баланса и КОС, в
частности — терапию препаратами магния; используют метаболиты (тиамин).
В тяжелых случаях осуществляют перевод на ИВЛ с постоянной седацией па-
циента. Несмотря на агрессивную терапию, больной может умереть на фоне
некупируемой артериальной гипотензии, нарушений ритма сердца, судорог.
В случаях нарушения сознания в послеоперационный период, прежде всего,
исключают гипоксемию, гиперкапнию, нарушения перфузии головного мозга,
гипогликемию, тяжелый ацидоз. Только убедившись в нормальной вентиляции,
оксигенации и перфузии дифференцируют другие причины нарушения сознания,
в том числе алкогольный делирий. Особенно часто ошибочный диагноз алкоголь-
ного делирия ставят у больных мужского пола среднего возраста, когда у них
развиваются опасные для жизни осложнения со стороны внешнего дыхания, сер-
дца и других органов. Ошибка часто приводит к летальному исходу, так как несво-
евременно начинают терапию вышеуказанных осложнений или вводят значитель-
ные дозы седативных препаратов, которые еще больше нарушают функции дыха-
ния и кровообращения.
©Диагноз алкогольного делирия у послеоперационных больных можно ста-
вить, лишь исключив все другие осложнения
К сожалению, существует небольшое количество публикаций по анестезиоло-
гическому обеспечению у пациентов, злоупотребляющих наркотическими сред-
ствами. Хорошее знание анестезиологом этой проблемы облегчает профилактику
неблагоприятной интеракции между принимаемыми пациентом препаратами и
анестетиками и позволяет избегать интра- и послеоперационных осложнений [7].
Важно завоевать доверие пациента, чтобы выяснить виды используемых препара-
тов и их дозы для успешного лечения возможных случаев абстиненции или пере-
дозировки, которые являются двумя самыми значительными опасностями для па-
циента-наркомана в течение перинаркозного периода.
ЛИТЕРАТУРА
1. Johnstone R.E., Kulp R.A., Smith Т.С. Effects of acute and chronic ethanol administration
on isoflurane requirement in mice. Anesth. Analg., 1975, 54:177—181.
2. Swerdlow B.N., Holley F.O., Maitre P. O., Stanski D.R. Chronic alcohol intake does not
change thiopenthal anesthetic requirement, pharmacokinetics, or pharmacodinamics.
Anesthesiology, 1990, 72:455—461.
3. Servin F.S., Bougeois B., Gomeni R. et al. Pharmacokinetics of propofol administered
by target-controlled infusion to alcoholic patients. Anesthesiology, 2003 Sep; 99 (3):576-85.
4. Gelman S., Fowler K.C., Smith L.R. Liver circulation and function during isofluran and
halothane anesthesia. Anesthesiology, 1984, 61:726—730.
5. Duvaldestin P., Agoston S., Henzel D. et al. Pancuronium pharmacokinetics in patients
with liver cirrhosis. Br. J. Anaesth., 1978, 50:1131—1136.
6. Delgado-Rodriguez M., Mariscal-Ortiz M., Gomez-Ortega A. et al. Alcohol consumption
and the risk of nosocomial infection in general surgery. Br. J. Surg., 2003 Oct; 90 (10): 1287—93.
7. Cavaliere F, lacobone E., Gorgoglione M. et al. Anesthesiologic preoperative evaluation
of drug addicted patient. Minerva Anestesiol., 2005 Jun; 71 (6):367—71.
588
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
26.6. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С ВИЧ/СПИДом
Пандемия ВИЧ/СПИДа находится на пороге третьего десятиле-
тия. По статистике ВОЗ и ООН состояние проблемы катастрофически ухудшает-
ся. Женщины репродуктивного возраста — самая быстрая группа роста инфици-
рования ВИЧ. Общие симптомы заболевания стали менее выраженными до уме-
ренных или субклинических, появились новые клинические признаки.
Очевидно, что ВИЧ-инфицирование воздействует на многие системы и орга-
ны человека. За предыдущие годы сделаны успешные шаги в понимании патоге-
неза заболевания; молекулярная методика определения вируса и определение
СО+4Т-лимфоцитов позволяют осуществлять диагностику, прогноз и возможный
ответ на терапию.
Объем информации об анестезиологических рисках и операциях у ВИЧ/СПИД
пациентов в литературе ограничен. По современным представлениям, ВИЧ-ин-
фицирование не увеличивает риск послеоперационных осложнений или смерти,
поэтому таким больным нельзя отказывать в операции по этой причине [1]. Об-
щую анестезию рассматривают, как безопасный метод анестезиологического обес-
печения в этой группе больных, но лекарственную интеракцию и воздействие на
различные системы и органы необходимо анализировать до операции. Регионар-
ная анестезия является методом выбора. Учитывают наличие нейропатий, локаль-
ной инфекции и нарушений свертывания крови. Необходима выработка опти-
мальной тактики для этой группы пациентов и оснащение профилактическими
средствами.
ЛИТЕРАТУРА
1. Evron S., Glezerman М., Harow Е. et al. Human immunodeficiency virus: anesthetic
and obstetric considerations. Anesth. Analg., 2004 Feb; 98 (2):503—11.
26.7. АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
У ПАЦИЕНТОВ С ОЖИРЕНИЕМ
Согласно статистическим данным, в развитых странах мира око-
ло 20—50 % населения имеют избыточную массу тела. Наиболее частой формой
ожирения является алиментарно-конституционное, или первичное, в основе
которого лежат переедание и гиподинамия, что предопределяет избыточное
образование энергии в организме человека. В странах СНГ ожирение разной
степени диагностируют почти у 26 % взрослого населения, крайние степени
ожирения — у 6 %.
Ожирение — это превышение идеальной массы тела более чем на 20 %. Сте-
пень ожирения определяют с помощью показателя индекса массы тела (ИМТ):
.масса тела, кг
ИМТ =--------—
рост, м
589
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
При ожирении легкой степени ИМТ равен 25—30 кг/м2, ожирении средней
степени — 30—35 кг/м2, ожирении тяжелой степени — более 35 кг/м2.
По данным Госкомстата Украины, в 2001 году ИМТ превышает 30 кг/м2 у 12 %
населения страны. Больные ожирением крайней степени лишены возможности
осуществлять элементарный гигиенический уход за собой, огромные размеры тела
усложняют пользование обычной мебелью, одеждой, общественным и личным
транспортом. Все это предопределяет как медицинскую, так и социальную значи-
мость проблемы ожирения.
Для анестезиологов и врачей других специальностей значительную сложность
представляет лечение больных с ожирением крайней степени, когда ИМТ превы-
шает 40 кг/м2. Такое ожирение называют морбидным, поскольку болезнь ассоци-
ируется с прогрессированием тяжелых сопутствующих заболеваний. Морбидное
ожирение и сопутствующие заболевания предопределяют увеличение частоты опе-
рационных и послеоперационных осложнений, которые труднее поддаются лече-
нию, чем аналогичные осложнения у больных с нормальной массой тела. Частота
осложнений и последствия хирургического вмешательства в значительной мере
зависят от адекватности анестезиологического обеспечения.
Предоперационный период
Ожирение сопровождают тяжелые сопутствующие заболевания: атеросклероз,
артериальная гипертензия, сахарный диабет, дыхательная недостаточность, синд-
ром сонного апноэ (ССА), хроническая лимфовенозная недостаточность, заболе-
вания паренхиматозных органов, полиартрит и другие, вызывающие потерю рабо-
тоспособности и инвалидность. Сопутствующие заболевания при морбидном ожи-
рении определяют тяжелое течение периоперационного периода и высокую
летальность — 1,2—25 %. Учитывая многогранность и сложность сопутствующих
заболеваний, больных с морбидным ожирением в предоперационный период об-
следуют более тщательно с привлечением смежных специалистов (кардиологов,
пульмонологов, эндокринологов и др.) для выявления степени компенсации со-
путствующих заболеваний и их коррекции при необходимости.
У 70 % больных с морбидным ожирением диагностируют нарушения функций
сердечно-сосудистой системы, то есть каждый человек с избыточной массой тела
является потенциальным кардиальным больным, и именно в 70 % случаев у таких
больных смерть наступает в результате заболеваний системы кровообращения.
Вредное влияние ожирения на работу сердечно-сосудистой системы происходит
за счет жировой инфильтрации миокарда, накопления жира в средостении, между
волокнами и в миоцитах (ранняя дистрофия), а также в результате увеличения
сосудистого русла за счет жировой ткани.
С увеличением массы тела повышается частота и тяжесть артериальной ги-
пертензии, причем у женщин ее регистрируют в 1,5 раза чаще, чем у мужчин.
Основными причинами артериальной гипертензии считают: увеличение сердеч-
ного выброса при повышенном ОПСС, повышение вязкости крови, уменьшение
синтеза гипотензивных веществ и накопление недоокисленных метаболитов с ги-
пертензивным действием. В последнее время увеличение АД связывают с дей-
ствием избыточного количества гормона жировой клетчатки — лептина [11].
Одновременно с артериальной гипертензией при ожирении прогрессирует
атеросклероз сосудов, в первую очередь коронарных, что приводит к раннему
развитию ИБС. Увеличение МОК происходит, главным образом, за счет увеличе-
ния ЧСС; сердце больного выполняет работу в среднем на 50 % превышающую у
590
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
людей с нормальной массой тела, при этом нагрузка на левый желудочек значи-
тельно больше, чем на правый.
При анализе результатов исследования сердечно-сосудистой системы, угле-
водного и липидного обменов у 60 % больных с морбидным ожирением и 83 % с
суперожирением диагностируют метаболический синдром, который представляет
комплекс метаболических и гемодинамических расстройств: абдоминальное ожи-
рение, нарушение толерантности к глюкозе, или сахарный диабет II типа, дисли-
попротеинемию и артериальную гипертензию [4].
Наряду с нарушениями гемодинамики у больных с ожирением регистрируют
изменения легочной вентиляции — уменьшение ЖЕЛ и резервного объема выдоха
(РО ). По мере увеличения массы тела и возраста выраженность этих расстройств
увеличивается: у больных с ИМТ = 51—82 кг/м2 ЖЕЛ уменьшается на 20 %, а
РОвьш — на 17 % по сравнению с больными с ИМТ = 40—50 кг/м2. Уменьшение
легочной вентиляции организм пытается компенсировать путем увеличения ЧДД,
которая в среднем составляет 19—20 в мин, что на 5—6 дыхательных движений
больше, чем у пациентов с нормальной массой тела.
Уменьшение легочной вентиляции сопровождается возникновением кисло-
родной недостаточности. Парциальное давление кислорода в артериальной крови
прогрессивно снижается по мере увеличения массы тела и длительности ожире-
ния, достигая критических величин (60,1 ±1,6 мм рт. ст.). У больных с морбид-
ным ожирением одышка обеспечивает выведение углекислого газа, но показатели
приближаются к верхней границе нормы и отвечают таковым при умеренном ды-
хательном ацидозе. У больных с морбидным суперожирением одышка не обеспе-
чивает достаточного выведения углекислого газа из крови, что сопровождается
появлением смешанного дыхательного и метаболического ацидоза, умеренной тя-
желой вентиляционной недостаточности.
Особенно важны результаты исследования показателя SatO2 у больных с мор-
бидным ожирением, как маркера их состояния при смене положения тела, поэто-
му этот показатель имеет принципиальное значение при выборе положения тела
пациента во время операции и в ранний послеоперационный период. Более поло-
вины больных с ИМТ = 51—82 кг/м2 в положении лежа на спине чувствуют дис-
комфорт, предъявляют жалобы на сердцебиение, нехватку воздуха, чувство страха.
Поскольку пункцию внутренней яремной или подключичной вены и подго-
товку больного к индукции в наркоз осуществляют в положении лежа на спине,
актуальным является проведение курса дыхательной гимнастики в течение 7—10
суток перед операцией. После проведения дыхательной гимнастики показатели
легочной вентиляции (ЖЕЛ, РОвд, РОвьщ) и SatO, в большинстве наблюдений улуч-
шаются.
У многих больных с морбидным ожирением диагностируют синдром сонного
апноэ и у половины из них — самую неблагоприятную для анестезиолога форму —
Пиквикский синдром (ожирение, непреодолимый дневной сон, ночной храп с
частыми периодами апноэ/гипопноэ, артериальная гипертензия, нарушение ме-
ханики дыхания, полицитемия, гипоксемия и гиперкапния) [5, 10]. Обычно у та-
ких больных часто констатируют смерть в ночные часы, особенно после приема
обычных доз снотворных препаратов или алкоголя.
Интраоперационный период
Учитывая характер нарушений функций жизненно важных органов и систем,
анестезиологическое обеспечение у больных с ожирением должно обеспечивать
591
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
адекватную оксигенацию и выведение углекислого газа, уменьшать до минимума на-
грузку на сердечно-сосудистую систему, обеспечивать оптимальные условия для вы-
полнения операции, способствовать раннему возобновлению двигательной активно-
сти больных для профилактики легочных и тромбоэмболических осложнений.
Катетеризация центральных вен (подключичной, внутренней яремной) у боль-
ных с ожирением часто проблематична: после длительных и безуспешных попы-
ток высок риск ошибочной пункции артерии или легкого. Специалисты Институ-
та хирургии и трансплантологии АМН Украины предпочитают проводить катете-
ризацию подключичной вены через периферический доступ (кубитальную вену),
так как это менее травматичная и рискованная манипуляция, которую можно
выполнять в положении больного сидя.
Часто индукция в наркоз, масочная вспомогательная вентиляции легких и
интубация трахеи сопровождаются возникновением гипоксемии, гиперкапнии,
нарушением сердечной деятельности. Почти 80 % больных с морбидным ожире-
нием относятся к группе высокого риска тяжелой интубации (II-III степень по
Маллампати). Избыточное отложение жира на передней брюшной стенке, груд-
ной стенке, шее, лице, ротовой полости приводит к снижению податливости и
эластичности легких, мешает проведению эффективной масочной вентиляции,
осложняет интубацию трахеи [1, 2, 6]. Для облегчения осуществления этих мани-
пуляций используют ларингеальные маски, ларингоскопы разной модификации и
размеров. При подозрении на недостаточно эффективную масочную вентиляцию
и сложную интубацию трахеи у больных с морбидным суперожирением использу-
ют фибробронхоскоп в качестве оптического проводника для интубационной труб-
ки. Эту манипуляцию выполняют под местной анестезией в положении больного
сидя, что снижает риск возникновения регургитации, гипоксемии, гиперкапнии.
При выборе параметров ИВЛ ориентируются на исходные показатели функ-
ции внешнего дыхания, пиковое давление в дыхательных путях, КОС, SatO2, дан-
ные аускультации легких, состояние кожи и видимых слизистых оболочек. Прове-
дение ИВЛ с использованием малого ДО усиливает гипоксемию. Использование
увеличенного ДО (1 л и более) также нецелесообразно, поскольку при этом увели-
чивается пиковое давление в дыхательных путях, что в дальнейшем предопределя-
ет нарушение венозного оттока и артериального притока, баротравму легких, ухуд-
шение газообмена. Таким образом, повышение пикового давления в дыхательных
путях способствует усилению гипоксемии.
У больных с морбидным ожирением многокомпонентная сбалансированная
анестезия на основе сочетания наркотических аналгетиков и бензодиазепинов —
не совсем приемлемый метод по причине возникновения в ранний послеопераци-
онный период сонливости, мышечной слабости и необходимости проведения про-
дленной ИВЛ. Объяснением этому является фармакокинетика вышеупомянутых
препаратов у больных с ожирением, так как эффект и длительность их действия
не всегда предсказуемы.
Расчет доз лекарственных препаратов, которые используют для общего
обезболивания у больных с морбидным ожирением, проводят не от общей
массы тела, а от должной массы тела с учетом клинических признаков адек-
ватности анестезии
Применение многокомпонентной сбалансированной анестезии с эпидураль-
ным блоком обладает определенными трудностями из-за сложности постановки
592
26. ПРИНЦИПЫ ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ЗАБОЛЕВАНИЯМИ
эпидурального катетера через избыточное отложение жира в области позвоночни-
ка, удаленности эпидурального пространства от кожи, отсутствия надежных ори-
ентиров и выраженного остеохондроза. Для облегчения пункции эпидурального
пространства возможно применение ультразвукового аппарата для выбора наибо-
лее удобного межостистого промежутка и приблизительного угла наклона для вве-
дения иглы, измерения расстояния между кожей и эпидуральным пространством.
Пункцию эпидурального пространства осуществляют с использованием средин-
ного или бокового доступов в зависимости от данных УЗИ позвоночника.
Многокомпонентная сбалансированная анестезия с эпидуральным блоком
обеспечивает выполнение современных бариатрических вмешательств (шунтиро-
вания желудка, билеопанкреатического шунтирования) у пациентов с морбидным
суперожирением и выраженными сопутствующими заболеваниями [8, 9]. Для под-
держания основной анестезии используют эпидуральную анестезию с лидокаином
и фентанилом, а также внутривенное введение фентанила, тиопентал-натрия, суб-
наркотических доз кетамина и миорелаксантов, на фоне ИВЛ закись-кислород-
ной смеси (FiO2 = 0,5).
Для профилактики гипотензии основную дозу лидокаина (1,5 мл препарата на
сегмент) вводят в эпидуральное пространство фракционно, с перерывами 5—7 мин,
его концентрацию в растворе доводят до 1 %, в сочетании с фентанилом и адрена-
лином (в разведении 1:200 000), заблаговременно проводят прегидратацию крис-
таллоидными и коллоидными растворами.
В некоторых случаях через 15—20 мин после введения основной дозы лидо-
каина в эпидуральное пространство может возникнуть гипотензия, брадикардия,
увеличиться ЦВД. Эти симптомы свидетельствуют о распространении эпиду-
ральной блокады выше уровня Т4 с нарушением симпатической иннервации сер-
дца. Для устранения этого осложнения используют атропин, у некоторых боль-
ных — адреналин, в дальнейшем уменьшают объем раствора лидокаина при вве-
дении в эпидуральное пространство. Таким образом, лидокаин используют для
эпидуральной блокады у больных с избыточной массой тела как препарат корот-
кого действия.
Хирургические манипуляции на пищеводе и желудке сопровождаются нару-
шением гемодинамики (артериальной гипер- или гипотензией, тахи- или бради-
кардией, экстрасистолией). Эпидуральная анестезия в таких ситуациях неэффек-
тивна, так как в иннервации структур верхнего этажа брюшной полости принима-
ют участие аортальное, пищеводное и диафрагмальное сплетения, блуждающие
нервы, поэтому дополнительно внутривенно вводят фентанил. При методике об-
щего обезболивания с эпидуральной анестезией применяют дополнительную ин-
фильтрационную анестезию аортального, пищеводного, диафрагмального (частич-
но) нервных сплетений или блуждающих нервов 0,25 % раствором лидокаина с
адреналином в разведении Г. 100 000 [3]. Для этого перед проведением манипуля-
ций на желудке и пищеводе в жировую ткань на участке ножек диафрагмы вводят
60 мл 0,25 % раствора лидокаина, что позволяет уменьшить общее количество
фентанила, сократить на 10—15 мин длительность операции.
Уменьшение афферентной ноцицептивной импульсации из зоны операции и
возникновение частичной двигательной блокады мышц передней брюшной стен-
ки и диафрагмы, благодаря применению эпидуральной анестезии и ингаляцион-
ных анестетиков, способствует уменьшению потребности в миорелаксантах. При
использовании регионарных методов обезболивания можно полностью отказаться
от бензодиазепинов и шире применять гипнотики ультракороткого действия, в
593
ЧАСТНАЯ АНЕСТЕЗИОЛОГИЯ
частности диприван, кетамин (125 мг), что позволит сделать анестезию более уп-
равляемой и уменьшить концентрацию закиси азота в смеси до FiO2 = 0,5.
Послеоперационный период
Преимущества эпидуральной анестезии у больных с морбидным ожирением
особенно заметны в ранний послеоперационный период [7]: не наблюдают сонли-
вости, депрессии дыхания, боли. Пациенты адекватно оценивают состояние, вы-
полняют дыхательную гимнастику и специальные физические упражнения, на-
правленные на профилактику легочных и тромбоэмболических осложнений. У
этих больных нет необходимости в проведении продленной ИВЛ. Экстубацию
проводят после полного пробуждения больного и прекращения действия миоре-
лаксантов. Потребность в ингаляции кислорода сохраняется в течение нескольких
дней после операции; оксигенацию улучшает положение больного сидя (припод-
нятый головной конец кровати под углом 45°).
Основными осложнениями после операции являются дыхательная и сердеч-
но-сосудистая недостаточности, ТЭЛА, нагноение операционной раны. Всем боль-
ным с морбидным ожирением проводят обязательную профилактику тромбоза
глубоких вен бедра (в Институте хирургии и трансплантологии АМН Украины
общепринята профилактика низкомолекулярными гепаринами в течение не менее
7—10 дней после операции).
ЛИТЕРАТУРА
1. Андреев Г.Н. Современные масочные методы наркоза и искусственной вентиля-
ции легких. — Л.: Медицина, 1985. — 208 с.
2. Белебезьев Г.И., Козяр В.В. Физиология и патофизиология искусственной вен-
тиляции легких. — К.: Ника-центр, 2003. — 312 с.
3. Бенсман В.М., Голдобин А.Б., Павленко С.Г. Роль тотальной продленной забрю-
шинной нейровегетативной блокады в профилактике и лечении пареза кишечника
при перитонитах// Вестник хирургии им. И.И. Грекова, 1991; №5—6. с. 36.
4. Гинзбург М.М., Крюков Н.Н. Ожирение. Влияние на развитие метаболического
синдрома. Профилактика и лечение. — М.: Медпрактика-м, 2002. — 128 с.
5. Зильбер А.П. Синдром сонного апноэ. — Петрозаводск: Издательство ПГУ, 1994. —
184 с.
6. Латто И.П., Роузен М. Трудности при интубации трахеи: пер. с англ. — М.:
Медицина, 1989. — 304 с.
7. Послеоперационная боль. Руководство. Пер. с англ./ Под ред. Ф. Майкла Феран-
те, Тимоти Г., ВейдБонкора. — М.: Медицина, 1998. — 640 с.
8. Суслов В.В. Роль регионарной анестезии в современной анестезиологии. Боль,
обезболивание и интенсивная терапия, 2003. — №14. — С. 28—31.
9. Чепкий Л.П. Анестезия и интенсивная терапия при ожирении. — К.: Здоровье,
1990. - 160 с.
10. Lavie Р., Hoffstein И Sleep apnea syndrome: a possible contributing factor to resistant//
Sleep, 2001; V. Sep 15, № 24 (6). - P. 72.
11. Casanueva F., Dieguez C. Neuroendocrine redulation and actions leptin. Ftont
Neuroendocrinol, 1999 Oct; 20 (4):317—63.
594
СПИСОК СОКРАЩЕНИИ
ABM — артериовенозная мальформация
АВР — активированное время рекальцификации
АД — артериальное давление
АДГ — антидиуретический гормон
АИК — аппарат искусственного кровообращения
АКТГ — адренокортикотропный гормон
АКШ — аортокоронарное шунтирование
АЛТ — аланинаминотрансфераза
АПФ — ангиотензин-превращающий фермент
ACT — аспартаминотрансфераза
АТФ — аденозинтрифосфорная кислота
АХ — ацетилхолин
АЧТВ — активированное частичное тромбопластиновое время
БИ — биспектральный индекс
БПГН — быстропрогрессирующий гломерулонефрит
В/в — внутривенный путь введения
В/м — внутримышечный путь введения
ВАШ — визуально-аналоговая шкала
ВГД — внутриглазное давление
ВП — вызванные потенциалы
В ПСП — возбуждающий постсинаптический потенциал
ВЧД — внутричерепное давление
ВЧИВЛ — высокочастотная искусственная вентиляция легких
ГАМК — гамма-аминомасляная кислота
ГБ — гипертоническая болезнь
ГД — гемодиализ
ГЛПС — геморрагическая лихорадка с почечным синдромом
ГОМК — гамма-оксимасляная кислота
ГСР — глазосердечный рефлекс
ГФ — гемофильтрация
ГЭБ — гематоэнцефалический барьер
ДВС — диссеминированное внутрисосудистое свертывание
ДГПЖ — доброкачественная гиперплазия предстательной железы
ДЗЛА — давление заклинивания в легочной артерии
ДЛА — давление в легочной артерии
ДЛП — давление в левом предсердии
ДНК — дезоксирибонуклеиновая кислота
ДО — дыхательный объем
595
ДПТ — двухпросветные трубки
ЖЕЛ — жизненная емкость легких
ЖКТ — желудочно-кишечный тракт
ЗГ — злокачественная гипертермия
ЗСН — застойная сердечная недостаточность
ИА — ингаляционные анестетики
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИК — искусственное кровообращение
ИМ — инфаркт миокарда
ИМТ — индекс массы тела
ИПП — индекс проницаемости плаценты
КДДлж — конечно-диастолическое давление в левом желудочке
КОС — кислотно-основное состояние
КПА — контролируемая пациентом аналгезия
КП РА — контролируемая пациентом регионарная аналгезия
КТ — компьютерная томография
МА — местные анестетики
МАК — минимальная альвеолярная концентрация
МВЛ — максимальная вентиляция легких
МКСБ — максимальная концентрация, ассоциирующаяся с сильной болью
ММФ — мофетила микофенолат
МОД — минутный объем дыхания
МОК — минутный объем кровообращения
МПД — мозговое перфузионное давление
МРК — массо-ростовой коэффициент
МРТ — магниторезонансная томография
МФК — микофеноловая кислота
МЭАК — минимальная эффективная аналгезируюшая концентрация
НГ — нормоволемическая гемодилюция
НИ — наркозный индекс
НЛА — нейролептаналгезия
НМГ — низкомолекулярный гепарин
НПВС — нестероидные противовоспалительные средства
ОГН — острый гломерулонефрит
ОДН — острая дыхательная недостаточность
О ЕЛ — общая емкость легких
ОИМ — острый инфаркт миокарда
ОИН — острый интерстициальный нефрит
ОИТ — отделение интенсивной терапии
ОКН — острый канальцевый некроз
ОО — остаточный объем
ОпечН — острая печеночная недостаточность
ОПЛ — острое повреждение легких
ОПМ — относительная плотность мочи
ОПН — острая почечная недостаточность
ОППН — острая почечно-печеночная недостаточность
ОПСС — общее периферическое сосудистое сопротивление
ОРД С — острый респираторный дистресс-синдром
ОТП — ортотопическая трансплантация печени
ОФВ — объем форсированного выдоха
596
СПИСОК СОКРАЩЕНИЙ
ОЦК — объем циркулирующей крови
П/к — подкожный путь введения
пдкв — положительное давление в конце выдоха
пдм — перфузионное давление мозга
пол — перекисное окисление липидов
понг — предоперационная острая нормоволемическая гемодилюция
ПЦР — полимеразно-цепная реакция
РНК — рибонуклеиновая кислота
РОГК — рентгенография органов грудной клетки
РЭС — ретикулоэндотелиальная система
САД — среднее артериальное давление
САК — субарахноидальное кровоизлияние
сгэ — среднее содержание гемоглобина в эритроците
СДЛА — среднее давление в легочной артерии
СДР — синдром дыхательных расстройств
СИ — сердечный индекс
СИА — стресс-индуцированная аналгезия
СКФ — скорость клубочковой фильтрации
солп — синдром острого легочного повреждения
соэ — скорость оседания эритроцитов
СОЭр — средний объем эритроцита
ССА — синдром сонного апноэ
тдэ — токсико-дисциркуляторная энцефалопатия
ТИА — транзиторная ишемическая атака
ткд — транскраниальная допплерография
ТУР — трансуретральная резекция
ТУРП — трансуретральная резекция предстательной железы
тэг — тромбоэластограмма
ТЭЛА — тромбоэмболия легочной артерии
тэнс — транскутанная электронейростимуляция
УГ — управляемая гипотензия
УЗИ — ультразвуковое исследование
УО — ударный объем сердца
УФО — ультрафиолетовое облучение
ФБС — фибробронхоскопия
ФВ — фракция выброса
ФЖЕЛ — форсированная жизненная емкость легких
ФНОа — фактор некроза опухоли альфа
ФОЕ — функциональная остаточная емкость
ФОИ — фиброоптическая интубация
ФПН — фетоплацентарная недостаточность
хдн — хроническая дыхательная недостаточность
хозл — хронические обструктивные заболевания легких
ХпечН — хроническая печеночная недостаточность
ХПН — хроническая почечная недостаточность
цАМФ — циклический аденозинмонофосфат
ЦВД — центральное венозное давление
цГМФ — циклический гуанинмонофосфат
ЦМВ — цитомегаловирус
ЦНС — центральная нервная система
цог — циклооксигеназа
597
ЦСЖ — цереброспинальная жидкость
ЧДД — частота дыхательных движений
ЧМН — черепномозговой нерв
ЧМТ — черепно-мозговая травма
ЧСВ — чрестрахеальная струйная вентиляция
ЧСС — частота сердечных сокращений
ШКГ — шкала комы Глазго
ЭА — эпидуральная аналгезия
ЭКГ — электрокардиография
ЭМГ — электромиография
ЭПО — эритропоэтин
ЭСА — эндартерэктомия из сонных артерий
ЭхоКГ — эхокардиография
ЭхоКС — эхокардиоскопия
АСС — Американский колледж кардиологов
АНА — Американская сердечная ассоциация
ASA — Американская ассоциация анестезиологов
Asp — аспартат
ВАЕР — аудиторные вызванные потенциалы
BE — дефицит или избыток оснований
СК — холецистокинин
Еп — энкефалин
Gal — галанин
GLP — глюкагонподобный пептид
Glu — глутамат
HAV — вирус гепатита А
НВс — вирус гепатита В сог
HbsAg — поверхностный антиген вируса гепатита В
HBV — вирус гепатита В
HCV — вирус гепатита С
HD — вирус гепатита D
НЕ — вирус гепатита Е
HLA — антигены лейкоцитов человека
Ig — иммуноглобулин
IL — интерлейкин
INR — международное нормализованное отношение
МНС — главный комплекс гистосовместимости
NMDA — N-метил-D-аспратат
NOS — NO-синтетаза
NY — нейропептид Y
NYHA — Нью-йоркская ассоциация кардиологов
рСО, — парциальное давление углекислого газа
PCR — полимеразно-цепная реакция
РКС — протеинкинза С
рО2 — парциальное давление кислорода
RHTMD — соотношение роста к тиреоподбородочному расстоянию
ROS — свободные кислородные радикалы
SP — субстанция Р
SSEP — соматосенсорные вызванные потенциалы
TMD — тиреоподбородочное расстояние
TNF — фактор некроза опухоли
VIP — вазоинтестинальный пептид
598
СОДЕРЖАНИЕ
Предисловие...................................................................3
Общая анестезиология
1. Триумф над болью: очерк по истории анестезиологии (Усенко Л. В., Царев А. В.).7
2. Теории и механизмы действие общих анестетиков (Дубов А.М.)................22
2.1. Теории наркоза..........................................................22
2.2. Стадии наркоза..........................................................26
2.3. Концепции анестезиологического обеспечения операций ....................27
3. Предоперационный период (Глумчер Ф.С., Мальцева Л.А.)....................33
3.1. Предоперационный осмотр.................................................33
3.1.1. Сбор анамнеза......................................................35
3.1.2. Физикальный осмотр.................................................36
3.1.3. Лабораторные и инструментальные методы исследования................37
3.1.4. Интерпретация результатов анализов и исследований .................38
3.1.5. Оценка жидкостного баланса организма...............................44
3.2. Оценка операционного риска..............................................45
3.2.1. Оценка состояния сердечно-сосудистой системы.......................47
3.2.2. Оценка состояния дыхательной системы...............................50
3.2.3. Оценка функции почек...............................................51
3.2.4. Оценка функции печени..............................................52
3.3. Предоперационная подготовка.............................................55
3.4. Выбор метода анестезии..................................................56
4. Премедикация (Мальцева Л.А.)............................................. 58
4.1. Исторические данные.....................................................58
4.2. Клиническая фармакология лекарственных средств для профилактической
премедикации.................................................................60
4.2.1. Антихолинергические препараты......................................61
4.2.2. Бензодиазепины.....................................................61
4.2.3. Нейролептики.......................................................62
4.2.4. Опиоидные аналгетики...............................................62
4.3. Критерии эффективности профилактической премедикации....................63
5. Неингаляционные методы общей анестезии.
Внутривенная общая анестезия (Дубов А.М.)....................................67
5.1. Исторические данные.....................................................68
5.2. Требования к “идеальному” внутривенному анестетику......................69
5.3. Клиническая фармакология лекарственных средств для внутривенной обшей
анестезии....................................................................69
5.3.1. Барбитураты........................................................69
5.3.1.1. Тиопентал-натрий...........................................70
5.3.2. Бензодиазепины.....................................................74
5.3.2.1. Диазепам...................................................74
5.3.2.2. Мидазолам..................................................78
5.3.3. Общие неингаляционные анестетики...................................80
5.3.3.1. Этомидат (гипномидат)......................................80
5.3.3.2. Пропофол...................................................81
5.3.3.3. Натрия оксибутират.........................................85
5.3.3.4. Кетамин....................................................86
5.3.4. Нейролептики.......................................................89
5.3.4.1. Дроперидол.................................................89
5.3.5. Опиоидные аналгетики...............................................91
599
5.3.5.1. Морфин...................................................97
5.3.5.2. Промедол................................................100
5.3.5.3. Фентанил................................................101
5.3.5.4. Суфентанил..............................................102
5.3.5.5. Альфентанил.............................................103
5.3.5.6. Ремифентанил............................................104
6. Клиническая фармакология мышечных релаксантов (Иеанюшко ВЛ.)......... 106
6.1. Исторические данные..................................................106
6.2. Строение и функции нервно-мышечного синапса..........................107
6.3. Механизм действия и классификация мышечных релаксантов...............109
6.4. Деполяризующие мышечные релаксанты...................................109
6.4.1. Сукцинилхолин (дитилин).........................................НО
6.5. Недеполяризующие мышечные релаксанты.................................112
6.5.1. Тубокурарин....................................................112
6.5.2. Ардуан..........................................................ИЗ
6.5.3. Тракриум.......................................................114
6.5.4. Павулон........................................................114
6.5.5. Норкурон.......................................................115
6.5.6. Эсмерон........................................................116
6.5.7. Мивакуриум (мивакрон)..........................................116
6.5.8. Алкурониум (аллоферин).........................................116
6.6. Декураризация........................................................117
6.6.1. Антихолинэстеразные препараты..................................117
6.6.2. Мониторинг нервно-мышечной блокады.............................118
6.8. Использование мышечных релаксантов при нейромиопатиях................118
7. Фармакология ингаляционных анестетиков (Глумчер Ф.С.)..................121
7.1. Требования к “идеальному” ингаляционному анестетику..................121
7.2. Химическая структура ингаляционных анестетиков.......................122
7.3. Минимальная альвеолярная концентрация................................122
7.4. Свойства ингаляционных анестетиков...................................124
7.5. Метаболизм ингаляционных анестетиков.................................125
7.6. Ингаляционные анестетики-жидкости....................................127
7.6.1. Галотан (фторотан).............................................127
7.6.2. Энфлюран.......................................................128
7.6.3. Изофлюран......................................................129
7.6.4. Десфлюран......................................................129
7.6.5. Севофлюран.....................................................130
7.7. Ингаляционные анестетики-газы........................................130
7.7.1. Закись азота...................................................130
7.7.2. Ксенон.........................................................133
7.8. Газы, используемые в анестезиологии..................................133
7.8.1. Диоксид углерода, или углекислый газ...........................134
7.8.2. Оксид азота....................................................134
8. Интубационный наркоз (Глумчер Ф.С., Москаленко В.Ф.)..................136
8.1. Вводный наркоз.......................................................136
8.1.1. Профилактика гемодинамических реакций перед интубацией трахеи....137
8.2. Применение мышечных релаксантов для интубации трахеи.................138
8.3. Интубация трахеи.....................................................140
8.3.1. Необходимый набор инструментов и аппаратуры для интубации трахеи.141
8.3.2. Методика интубации трахеи под общей анестезией.................141
8.3.3. Методика интубации трахеи под местной анестезией...............144
8.3.4. Трудная интубация..............................................145
8.3.4.1. Прогностические тесты трудной интубации трахеи............145
8.3.4.2. Алгоритм действий при трудной интубации трахеи............148
8.3.4.3. Альтернативные методы интубации трахеи..................150
8.3.5. Профилактика и лечение осложнений интубации трахеи.............152
600
СОДЕРЖАНИЕ
8.3.5,1. Осложнения во время интубации.............................152
8.3.5.1.1. Повреждение зубов................................152
8.3.5.1.2. Регургитация и аспирация желудочного содержимого.153
8.3.5.1.3. Кровотечение из задней стенки глотки...........154
8.3.5.1.4. Перегиб интубационной трубки...................154
8.3.5.1.5. Введение интубационной трубки в пищевод........154
8.3.5.1.6. Чрезмерно глубокое введение интубационной трубки
в трахею..................................................155
8.3.5.1.7. Повреждения трахеи и пищевода..................155
8.3.5.2. Осложнения интубации во время проведения ИВЛ и наркоза....156
8.3.5.3. Осложнения после экстубации трахеи......................156
8.4. Клиническое применение ларингеальной маски.............................159
8.4.1. Показания к применению.........................................161
8.4.2. Противопоказания к применению..................................162
8.4.3. Технические особенности использования..........................162
8.4.4. Побочные эффекты...............................................162
8.4.5. Методика введения..............................................163
8.4.6. Трудности при введении.........................................165
8.4.7. Обеспечение безопасности пациента во время анестезии...........166
8.4.8. Методика извлечения............................................167
8.4.9. Особенности применения в специализированных областях анестезиологии... 167
8.4.10. Модификации ларингеальной маски.................................170
9. Обеспечение общей анестезии во время операции (Глумчер Ф.С.).......... 173
9.1. Положение на операционном столе......................................173
9.2. Периоперационный мониторинг..........................................175
9.2.1. Мониторинг оксигенации.........................................177
9.2.2. Мониторинг вентиляции легких...................................178
9.2.3. Мониторинг кровообращения......................................179
9.2.4. Температурный мониторинг.......................................185
9.2.5. Мониторинг диуреза.............................................185
9.2.6. Мониторинг состояния нервной системы...........................186
9.3. Инфузионно-трансфузионная терапия во время операции..................188
9.3.1. Оценка адекватности периоперационной инфузионной терапии.......189
9.3.2. Оценка объема кровопотери......................................190
9.3.3. Гемотрансфузии.................................................191
9.3.4. Методы ограничения интраоперационной кровопотери..............192
9.4. Осложнения во время операции.........................................195
9.4.1. Остановка сердца и интраоперационная смерть....................195
9.4.2. Нарушения вентиляции...........................................198
9.4.3. Нарушения оксигенации..........................................198
9.4.4. Нарушения гемодинамики.........................................199
9.4.4.1. Артериальная гипотензия.................................199
9.4.4.2. Артериальная гипертензия................................200
9.4.5. Анафилактические реакции.......................................200
9.4.6. Нарушения терморегуляции.......................................202
9.4.6.1. Злокачественная гипертермия.............................202
9.4.6.2. Гипертермия.............................................205
9.4.6.3. Гипотермия..............................................205
9.4.7. Восстановление сознания во время общей анестезии...............206
10. Ранний послеоперационный период (Глумчер Ф.С.)........................210
10.1. Перевод пациента в палату, экстубация...............................210
10.2. Осложнения раннего послеоперационного периода.......................213
11. Послеоперационное обезболивание (Кобеляцкий Ю.Ю.).................220
11.1. Актуальность проблемы...............................................220
11.2. Патофизиология послеоперационной боли...............................222
11.3. Объективизация боли.............................................226
601
11.4. Лечение послеоперационной боли.........................................227
11.4.1. Лекарственные средства для лечения послеоперационной боли........227
11.4.1.1. Опиоидные аналгетики......................................227
11.4.1.2. Нестероидные противовоспалительные средства...............230
11.4.1.3. Местные анестетики........................................232
11.4.2. Методы контроля послеоперационной боли...........................232
11.4.2.1. Опережающее обезболивание.................................233
11.4.2.2. Сбалансированная аналгезия................................234
11.4.2.3. Контролируемая пациентом аналгезия........................236
11.4.2.4. Службы лечения острой боли................................240
11.5. Профилактика хронизации острой послеоперационной боли..................241
11.6. Оптимизация периоперационного обезболивания на основе принципов
доказательной медицины.......................................................243
11.6.1. Периоперационное обезболивание абдоминальной гистерэктомии.......243
11.6.2. Периоперационное обезболивание тотальной артропластики бедра.....245
11.6.3. Периоперационное обезболивание эндоскопической холецистэктомии...245
11.6.4. Периоперационное обезболивание резекции кишечника................246
11.6.5. Периоперационное обезболивание грыжесечения......................248
12. Клиническая фармакология местных анестетиков (Суслов В.В., Бондарь М.В.).252
12.1. Химическая структура местных анестетиков...............................252
12.2. Механизм действия местных анестетиков..................................254
12.3. Метаболизм местных анестетиков.........................................255
12.4. Местные анестетики эфирного ряда.......................................255
12.4.1. Прокаин (новокаин)...............................................255
12.4.2. Хлоропрокаин (несакаин)..........................................255
12.4.3. Тетракаин (дикаин)...............................................256
12.5. Местные анестетики амидного ряда.......................................256
12.5.1. Лидокаин (ксилокаин).............................................256
12.5.2. Бупивакаин (маркаин, сенсоркаин, омникаин).......................256
12.5.3. Омникаин (бупивакаин)............................................256
12.5.4. Мепивакаин (карбокаин)...........................................258
12.5.5. Этидокаин (дуранест).............................................258
12.5.6. Ропивакаин.......................................................258
12.6. Комбинирование местных анестетиков.....................................259
12.7. Адъювантные препараты..................................................259
12.8. Токсическое действие местных анестетиков...............................259
12.8.1. Аллергические реакции............................................259
12.8.2. Системное токсическое действие...................................260
12.8.3. Токсическое действие на ЦНС......................................261
12.8.4. Токсическое действие на сердечно-сосудистую систему..............261
13. Регионарная анестезия (Суслов В.В., Бондарь М.В.)........................262
13.1. Определение уровня сегментарного блока для проведения оперативного
вмешательства................................................................263
13.2. Спинальная анестезия...................................................263
13.2.1. Прикладная анатомия..............................................265
13.2.2. Эффекты спинальной анестезии.....................................265
13.2.3. Методика проведения спинальной анестезии.........................267
13.2.3.1. Спинальные иглы..........................................267
13.2.3.2. Положение пациента.......................................268
13.2.3.3. Доступы к пункции субарахноидального пространства........268
13.2.3.4. Постановка иглы..........................................269
13.2.3.5. Введение раствора местного анестетика в субарахноидальное
пространство........................................................269
13.2.3.6. Факторы, влияющие на уровень спинальной блокады...........270
13.2.3.7. Факторы, влияющие на длительность спинальной анестезии....271
13.2.4. Осложнения спинальной анестезии..................................271
602
СОДЕРЖАНИЕ
13.2.4.1. Осложнения во время проведения спинальной анестезии.....271
13.2.4.2. Послеоперационные осложнения спинальной анестезии.......272
13.3. Эпидуральная анестезия...............................................273
13.3.1. Прикладная анатомия............................................274
13.3.2. Эффекты эпидуральной анестезии.................................274
13.3.3. Методика проведения эпидуральной анестезии.....................275
13.3.3.1. Иглы для пункции и катетеризации эпидурального пространства ....275
13.3.3.2. Положение пациента......................................275
13.3.3.3. Пункция и катетеризация на поясничном уровне............275
13.3.3.4. Пункция и катетеризация эпидурального
пространства на грудном уровне....................................276
13.3.3.5. Постановка эпидурального катетера.......................276
13.3.3.6. Факторы, влияющие на уровень эпидурального блока........276
13.3.3.7. Факторы, влияющие на длительность эпидурального блока....277
13.3.4. Осложнения эпидуральной анестезии..............................277
13.3.4.1. Осложнения во время проведения эпидуральной анестезии....277
13.3.4.2. Послеоперационные осложнения эпидуральной анестезии.....279
14. Лекарственная интеракция и полипрагмазия в анестезиологии
(Глумчер Ф.С., Трещинский А.И.)............................................280
Частная анестезиология
15. Анестезиологическое обеспечение кардиохирургических вмешательств (Мазур А.П.) .... 287
15.1. Исторические данные...................................................288
15.2. Прикладная физиология сердечно-сосудистой системы.....................289
15.3. Клиническая фармакология лекарственных средств, часто применяемых
в кардиохирургии............................................................291
15.3.1. Препараты для вводного наркоза.................................291
15.3.2. Препараты для поддержания анестезии............................293
15.3.3. Мышечные релаксанты............................................293
15.3.4. Инотропные препараты...........................................294
15.3.5. Вазодилататоры.................................................295
15.3.6. Антиаритмические препараты.....................................296
15.4. Предоперационный период...............................................297
15.5. Интраоперационный мониторинг.........................................300
15.6. Искусственное кровообращение.........................................301
15.6.1. Методика проведения............................................302
15.6.2. Физиологические эффекты, профилактика осложнений...............304
15.7. Типичные протоколы проведения анестезиологических пособий
при кардиохирургических вмешательствах у взрослых..........................308
15.7.1. Операция аортокоронарного шунтирования.........................309
15.7.2. Операции на клапанах сердца....................................310
15.7.3. Повторные операции на сердце...................................311
15.7.4. Операции на аорте..............................................311
15.8. Транспортирование в ОПТ после кардиохирургических вмешательств.......313
15.9. Ранний послеоперационный период......................................314
16. Анестезиологическое обеспечение торакальных операций
(Глумчер Ф.С., Багиров М.М.)...............................................321
16.1. Операции на легких...................................................321
16.1.1. Предоперационный период........................................322
16.1.2. Интраоперационный период.......................................327
16.1.2.1. Обеспечение вентиляции при операциях на нижних дыхательных
путях, виды однолегочной вентиляции...............................328
16.1.3. Послеоперационный период.......................................331
16.1.3.1. Экстубация..............................................331
16.1.3.2. Уход за дренажами после торакотомии.....................332
16.1.3.3. Послеоперационное обезболивание.........................332
603
16.1.3.4. Профилактика и лечение послеоперационных осложнений.......333
16.2. Операции на трахее и главных бронхах................................336
16.3. Операции на пищеводе................................................339
16.4. Операции на органах средостения.....................................342
16.5. Операции на диафрагме...............................................342
17. Анестезиологическое обеспечение абдоминальных операций (Клигуненко Е.Н.).345
17.1. Прикладная физиология пищеварительной системы.......................345
17.2. Предоперационный период.............................................347
17.3. Интраоперационный период............................................351
17.4. Операции на желудке.................................................353
17.5. Операции на желчных путях...........................................355
17.6. Операции на поджелудочной железе....................................356
18. Анестезиологическое обеспечение урологических операций
(Суслов В. В., Тарабрин О.А.).............................................359
18.1. Прикладная физиология мочевыделительной системы.....................359
18.2. Клиническая фармакология анестезиологических лекарственных средств
при дисфункциях почек........................................................362
18.3. Особенности анестезиологического обеспечения при нарушениях
водно-электролитного обмена..................................................363
18.3.1. Гипокалиемия..................................................364
18.3.2. Гиперкалиемия.................................................365
18.3.3. Гипонатриемия.................................................367
18.3.4. Гипернатриемия................................................368
18.4. Клинические проявления, диагностика и лечение острой почечной
недостаточности...........................................................369
18.5. Особенности анестезиологического обеспечения урологических операций.376
18.5.1. Предоперационный период.......................................376
18.5.2. Интраоперационный период......................................378
18.5.3. Послеоперационный период......................................379
18.5.4. Диагностические и лечебные урологические манипуляции..........380
18.5.4.1. Трансуретральная резекция предстательной железы........381
18.5.4.2. Экстракорпоральная ударно-волновая литотрипсия.........382
18.5.5. Открытые операции на предстательной железе....................383
18.5.6. Нефрэктомия...................................................386
18.5.7. Онкоурологические операции....................................386
19. Обезболивание в акушерстве и гинекологии (Черний В.И., Кабанько Т.П.,
Ткаченко Р.А., Смирнова Н.Н., Колесников А.Н.)............................388
19.1. Обезболивание в акушерстве..........................................388
19.1.1. Прикладная физиология родовой боли............................388
19.1.2. Общая характеристика методов обезболивания родов..............392
19.1.3. Клиническая фармакология лекарственных средств, используемых
для обезболивания родов...............................................394
19.1.3.1. Опиоидные аналгетики...................................398
19.1.3.2. Бензодиазепины.........................................398
19.1.3.3. Нейролептики...........................................399
19.1.3.4. Барбитураты............................................400
19.1.3.5. Неингаляционные анестетики.............................400
19.1.3.6. Ингаляционные анестетики...............................401
19.1.3.7. Местные анестетики.....................................401
19.1.3.8. Нестероидные противовоспалительные средства............402
19.1.3.9. Гипотензивные средства.................................402
19.1.4. Обезболивание нормальных родов................................403
19.1.5. Обезболивание родов при тяжелых акушерской
и экстрагенитальной патологиях........................................414
19.1.6. Анестезиологическое обеспечение малых акушерских
и гинекологических операций...........................................415
604
СОДЕРЖАНИЕ
19.1.6.1. Ручное обследование полости матки.........................418
19.1.6.2. Операция извлечения плода за тазовый конец................419
19.1.6.3. Вакуум-экстракция плода...................................420
19.1.6.4. Операция наложения акушерских щипцов......................420
19.1.6.5. Эпизио- и перинеотомия, восстановление
целостности промежности, влагалища и шейки матки....................421
19.1.6.6. Плодоразрушающие операции.................................421
19.1.6.7. Операции искусственного прерывания беременности...........422
19.1.6.8. Диагностическое выскабливание полости матки...............424
19.1.7. Особенности анестезиологического обеспечения общехирургических
операций в различные триместры беременности..............................424
19.2. Анестезиологическое обеспечение операции кесарева сечения..............426
19.2.1. Показания и противопоказания к операции кесарева сечения.........426
19.2.2. Предоперационный период..........................................428
19.2.3. Интра- и послеоперационный периоды...............................430
19.2.3.1. Общая анестезия...........................................431
19.2.3.2. Регионарная анестезия.....................................437
19.2.3.3. Местная анестезия.........................................441
19.2.4. Особенности анестезиологического обеспечения операции кесарева
сечения при тяжелых акушерской и экстрагенитальной патологиях............442
19.3. Анестезиологическое обеспечение гинекологических операций..............443
19.3.1. Предоперационный период..........................................444
19.3.2. Интра- и послеоперационный периоды...............................447
20. Обезболивание в отоларингологии (Усенко Л.В.)............................457
20.1. Операции на придаточных полостях носа, в полости носа, носо- и ротоглотки.459
20.2. Операции на ухе и сосцевидном отростке.................................463
20.3. Операции на гортани....................................................464
20.4. Операции на шее........................................................467
20.5. Эндоскопические вмешательства..........................................468
20.6. Неотложные состояния в отоларингологии.................................470
21. Обезболивание в офтальмохирургии (Бондарь М.В.)..........................472
21.1. Прикладная физиология внутриглазного давления и глазосердечного рефлекса ....472
21.2. Клиническая фармакология офтальмологических лекарственных средств......473
21.3. Особенности анестезиологического обеспечения офтальмохирургических
вмешательств.................................................................474
21.3.1. Предоперационный период..........................................474
21.3.2. Интраоперационный период.........................................476
21.3.2.1. Ретробульбарная анестезия.................................476
21.3.2.2. Перибульбарная анестезия..................................477
21.3.2.3. Транскорункулярная анестезия..............................478
21.3.2.4. Общая анестезия...........................................479
21.3.2.5. Интра- и послеоперационные осложнения.....................479
21.4. Экстракция катаракты, пересадка роговицы, трабекулоэктомия,
восстановительные операции на веке и глазном яблоке, операции по поводу птоза
века, реконструктивные операции на веке, удаление крыловидной плевы роговицы....480
21.5. Проникающие (открытые) травмы глаза....................................481
21.6. Операции по коррекции косоглазия..........................................483
21.7. Дакриоцисториностомия, энуклеация, передняя и латеральная орбитотомии.....484
21.8. Операции на сетчатке......................................................485
22. Анестезиологическое обеспечение лапароскопических операций
(Бондарь М.В., Вьюницкий В.П.)...............................................487
22.1. Особенности анестезиологического обеспечения и проведения
лапароскопических операций ..................................................487
22.2. Лапароскопические операции на желчевыводящих путях.....................489
22.3. Лапароскопическая спленэктомия.........................................492
605
22.4. Лапароскопическая адреналэктомия.........................................493
22.5. Лапароскопические гинекологические операции..............................496
23. Обезболивание и интенсивная терапия при трансплантации органов
(Суслов В.В., Гриценко С.Н.)...................................................497
23.1. Смерть мозга.............................................................498
23.2. Донорская операция.......................................................499
23.3. Консервация органов, консервирующие растворы.............................500
23.4. Трансплантационная иммунология...........................................502
23.4.1. Механизмы отторжения аллотрансплантата.............................503
23.4.2. Лекарственные средства, обладающие иммуносупрессивным действием.504
23.5. Трансплантация почек.....................................................508
23.5.1. Предоперационный период............................................508
23.5.2. Интраоперационный период...........................................509
23.5.3. Послеоперационный период...........................................511
23.6. Ортотопическая трансплантация печени.....................................511
23.6.1. Предоперационный период............................................512
23.6.1.1. Патофизиология терминальной стадии печеночной недостаточности ...512
23.6.1.2. Клиническая фармакология анестезиологических лекарственных
средств при хронической печеночной недостаточности....................514
23.6.2. Интраоперационный период...........................................515
23.6.2.1. Добеспеченочная стадия......................................518
23.6.2.2. Беспеченочная стадия........................................518
23.6.2.3. Послебеспеченочная стадия...................................520
23.6.2.4. Метаболические и электролитные изменения...................522
23.6.2.5. Гемостаз............................’.......................523
23.6.2.6. Восполнение кровопотери.....................................524
23.6.3. Послеоперационный период...........................................525
23.7. Трансплантация сердца....................................................529
23.7.1. Предоперационный период............................................529
23.7.2. Интраоперационный период...........................................532
23.7.3. Послеоперационный период...........................................534
24. Принципы обезболивания у пожилых пациентов (Глумчер Ф.С., Москаленко В.Ф.).539
24.1. Возрастные физиологические изменения.....................................540
24.2. Сопутствующие заболевания................................................543
24.3. Особенности клинической фармакологии анестетиков и мышечных
релаксантов у пожилых пациентов................................................543
24.4. Особенности анестезиологического обеспечения хирургических вмешательств
у пожилых пациентов............................................................544
25. Анестезиологическое обеспечение операций на сосудах
(Мазур А.П., Никулъников П.И.).................................................548
25.1. Предоперационный период..................................................548
25.2. Интраоперационный период.................................................553
25.3. Послеоперационный период.................................................555
25.4. Каротидная эндартерэктомия...............................................557
25.5. Операции по поводу аневризм абдоминального отдела аорты..................559
25.6. Операции на периферических артериях......................................560
26. Принципы обезболивания у пациентов с сопутствующими заболеваниями..........563
26.1. Анестезиологическое обеспечение у пациентов с сопутствующей патологией
сердечно-сосудистой системы (Глумчер Ф.С., Мазур А.П.).........................563
26.1.1. Анестезиологическое обеспечение у пациентов с ишемической болезнью
сердца.....................................................................563
26.1.1.1. Предоперационный период.....................................563
26.1.1.2. Интраоперационный период....................................566
26.1.1.3. Послеоперационный период....................................568
606
СОДЕРЖАНИЕ
26.1.2. Анестезиологическое обеспечение у пациентов с гипертонической
болезнью..................................................................568
26.1.2.1. Предоперационный период....................................569
26.1.2.2. Интраоперационный период...................................571
26.1.2.3. Послеоперационный период...................................573
26.1.3. Анестезиологическое обеспечение у пациентов
с болезнями клапанов сердца...............................................573
26.1.4. Анестезиологическое обеспечение у пациентов с застойной сердечной
недостаточностью..........................................................575
26.2. Анестезиологическое обеспечение у пациентов с заболеваниями органов
дыхания (Глумчер Ф.С., Москаленко В.Ф.).......................................576
26.2.1. Анестезиологическое обеспечение у пациентов с бронхиальной астмой.577
26.2.2. Анестезиологическое обеспечение у пациентов с хроническим
бронхитом и эмфиземой легких..............................................579
26.3. Анестезиологическое обеспечение у пациентов с сахарным диабетом
(Глумчер Ф.С., Москаленко В.Ф.)...............................................581
26.4. Анестезиологическое обеспечение у пациентов с миастенией (myasthenia gravis)
(Глумчер Ф.С.)................................................................585
26.5. Анестезиологическое обеспечение у пациентов с алкоголизмом и наркоманией
(Глумчер Ф.С., Москаленко В.Ф.)...............................................587
26.6. Анестезиологическое обеспечение у пациентов с ВИЧ/СПИДом (Глумчер Ф.С.).589
26.7. Анестезиологическое обеспечение у пациентов с ожирением
(Бубало А.Ф., Мазур А.П.).....................................................589
Список сокращений.............................................................595
607
Учебное издание
Багиров Мамед Мансурович
Боцдарь Михаил Владимирович
Бубало Александр Федорович и др.
РУКОВОДСТВО
ПО АНЕСТЕЗИОЛОГИИ
Под редакцией профессора Ф.С. Глумчера,
профессора А. И. Трещинского
Подписан в печать 16.10.07. Формат 70x100 1/16.
Бумага офсет. Печать офсет. Гарн. Times.
Усл.-печ. лист 50,37.
Тираж 2500 экз. Зак. № 7-585.
Издательство “Медицина” 01034,
г. Киев, ул. Стрелецкая, 28.
Свидетельство о внесении в Государственный реестр
издателей, изготовителей и распространителей
книжной продукции
ДК№ 1585 от 01.12.2003
Тел.: (044) 581-15-67, 537-63-66
E-mail: med@books.com.ua
Отпечатано в ОАО „Белоцерковская книжная фабрика”,
09117, г. Белая Церковь, ул. Л. Курбаса,4.
<5c5r
РЖОЩСТВО
»ИНИИ
В учебном пособии лаконично представлена
история развития анестезиологии, большое
внимание уделено предоперационному осмотру,
оценке анестезиологического риска,
премедикации, фармакологии анестетиков,
интубационному наркозу, региональной анесте-
зии, проблемам профилактики осложнений и
ведению послеоперационного периода. Дана
характеристика технического оснащения, необ-
ходимого для проведения анестезии и контроля
состояния больного во время операции. Раздел
«Частная анестезиология» посвящен анестезио-
логическому обеспечению при различных видах
операций. Издание проиллюстрировано табли-
цами, схемами, рисунками.
Для студентов, врачей-интернов высших
медицинских учебных заведений III — IV уров-
ней аккредитации, а также врачей-анестезио-
логов, курсантов высших медицинских учебных
заведений (факультетов) последипломного
образования.