Text
Ф. П. ТРЕДВЕЛЛ
В. Т. ГОЛЛ
Проф. Цюрихского политехникума
Проф. Массачусетского технологического
института
КУРС
АНАЛИТИЧЕСКОЙ ХИМИИ
ТОМ ПЕРВЫЙ
КАЧЕСТВЕННЫЙ АНАЛИЗ
Перевод с девятого английского издания
под редакцией и с дополнениями
проф. А. С. КОМАРОВСКОГО
ИЗДАНИЕ ДЕВЯТОЕ (ВТОРОЕ ГОСХИМИЗДАТА)
Допущено Всесоюзным Комитетом по делам
высшей школы при СНК СССР в качестве
учебного пособия для химических специаль-
ностей высших учебных заведений.
ГОСУДАРСТВЕННОЕ НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
ХИМИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА 1946 ЛЕНИНГРАД
545
Т. 63
15-5-2
Книга является учебным руководством по
качественному анализу для студентов высших
химических учебных заведений, а также может
быть использована в качестве пособия при ра-
ботах по качественному анализу в химических
лабораториях.
Рассматриваемый в книге обширный факти-
ческий материал трактуется на основе современ-
ных научных достижений и с учетом новейшей
методики качественного анализа.
К ЧИТАТЕЛЮ
Издательство просит присылать ваши замечания и
отзывы off этой книге по адресу: Москва, Новая площадь,
д. 10, подъезд 11, Госхимиздат
СОДЕРЖАНИЕ
Предисловие к девятому русскому изданию
9
ЧАСТЬ I
Основные принципы
1. Реакции мокрым путем....................................... ,.,11
Закон действия масс...........................................
Теория электролитической диссоциации или ионизации . . . .
Закон действия масс с учетом коэфициентов активности . . ;.
Номенклатура ионов.........................................>•
Равновесие между твердым веществом и двумя жидкостями .
Влияние изменения концентрации на ионизацию электролитов .
Ионизация воды. Водородный показатель pH.......................
Произведение растворимости..................................
Образование комплексных ионов.................... . . . .
Реакции ионов.................................................
Окисление и восстановление .................................
Электродвижущий ряд и электродные потенциалы ......
Действие общего иона.........................................
Г идролиз..................................................«
Амфотерные электролиты......................................
Открытие кислот и оснований. Теория индикаторов . . . . .
Коллоидные растворы..........................................
Выпаривание кислот...........................................
Фильтрование и промывание осадков............................
12
14
22
24
25
26
29 .
32
41
42
44
54
63
66
72
75
78
83
84
II. Реакции сухим путем......................................... 85
Методы наследования вещества сухим путем..................«87
Спектральный анализ.........................................«94
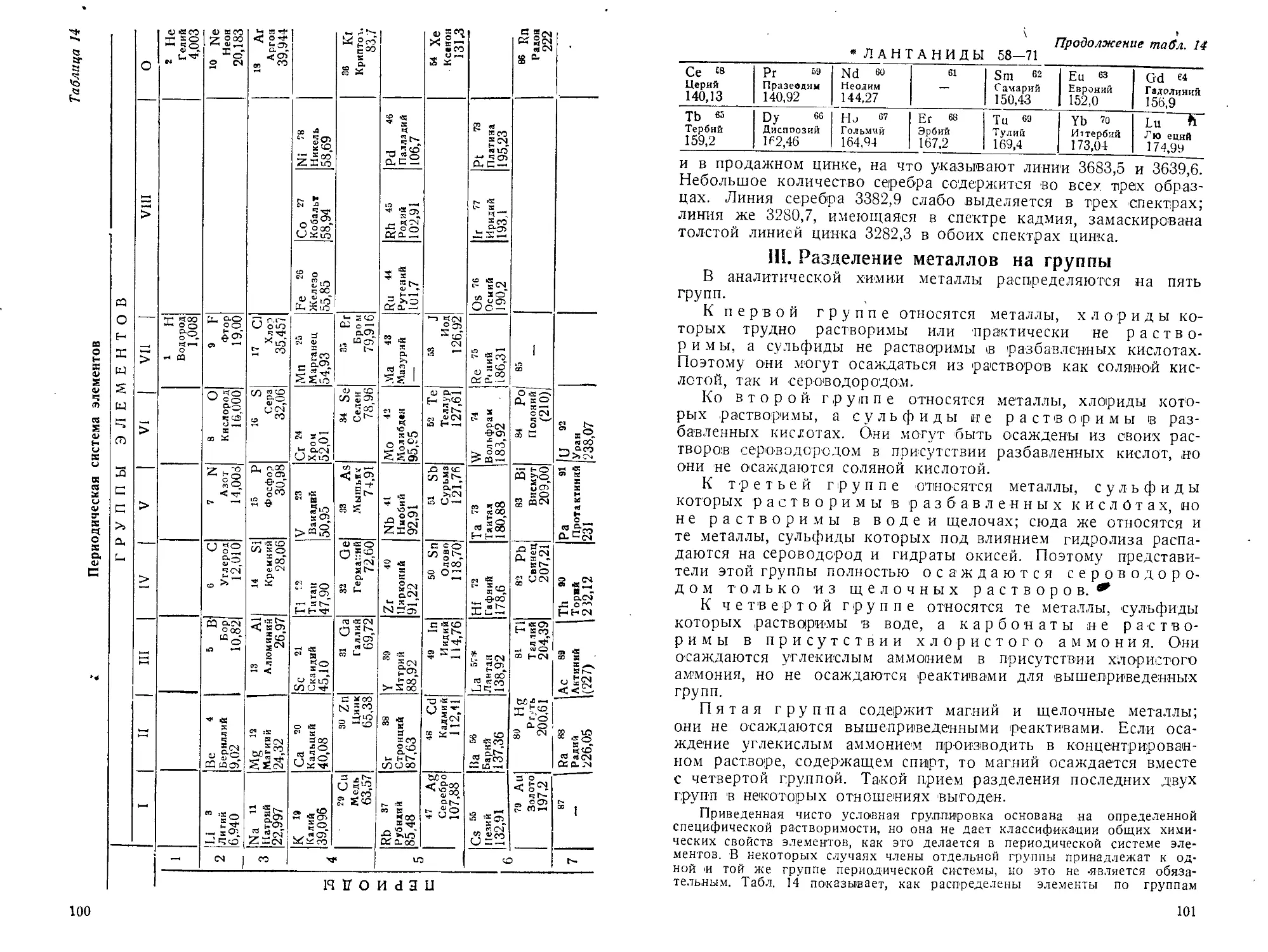
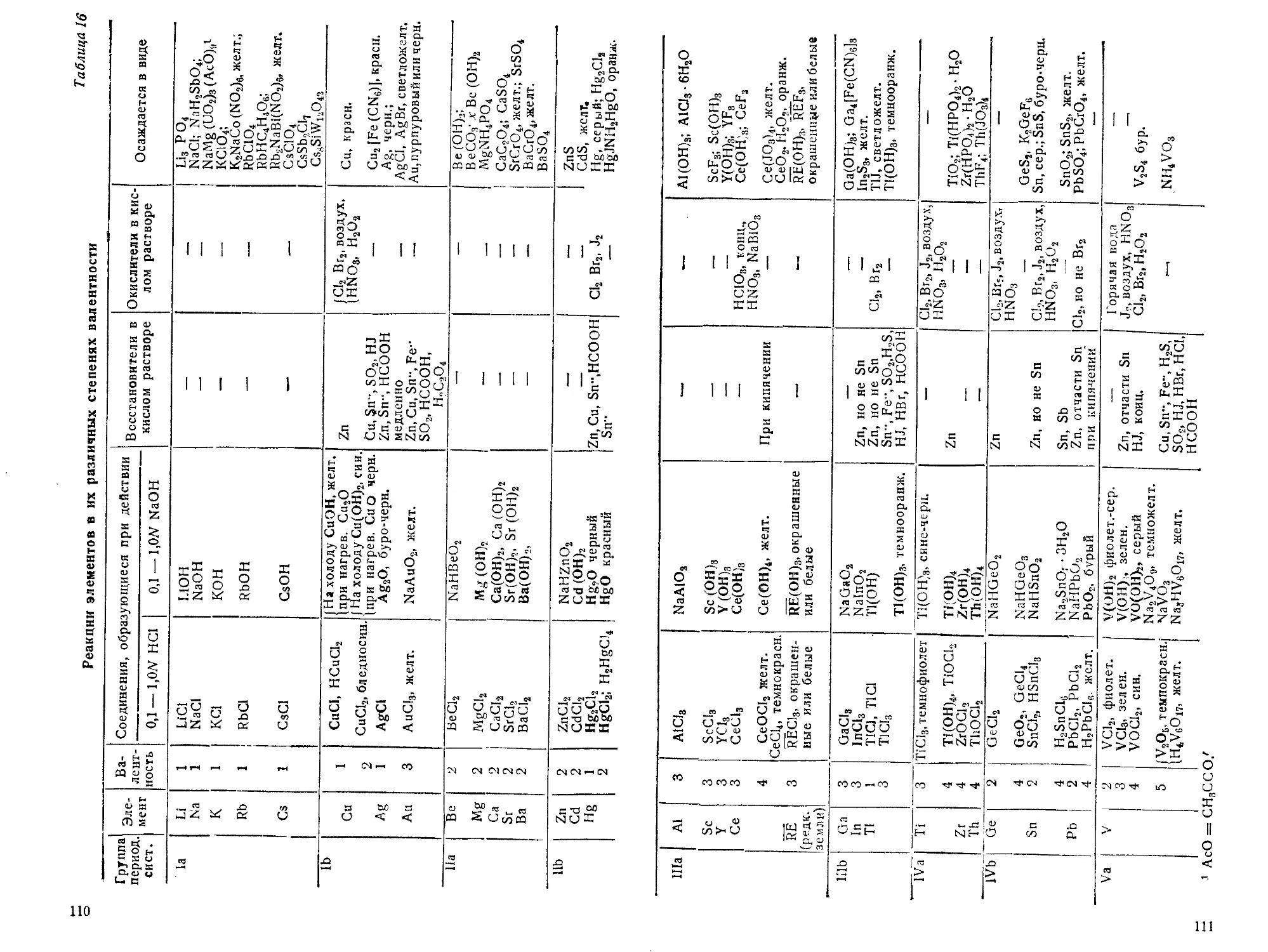
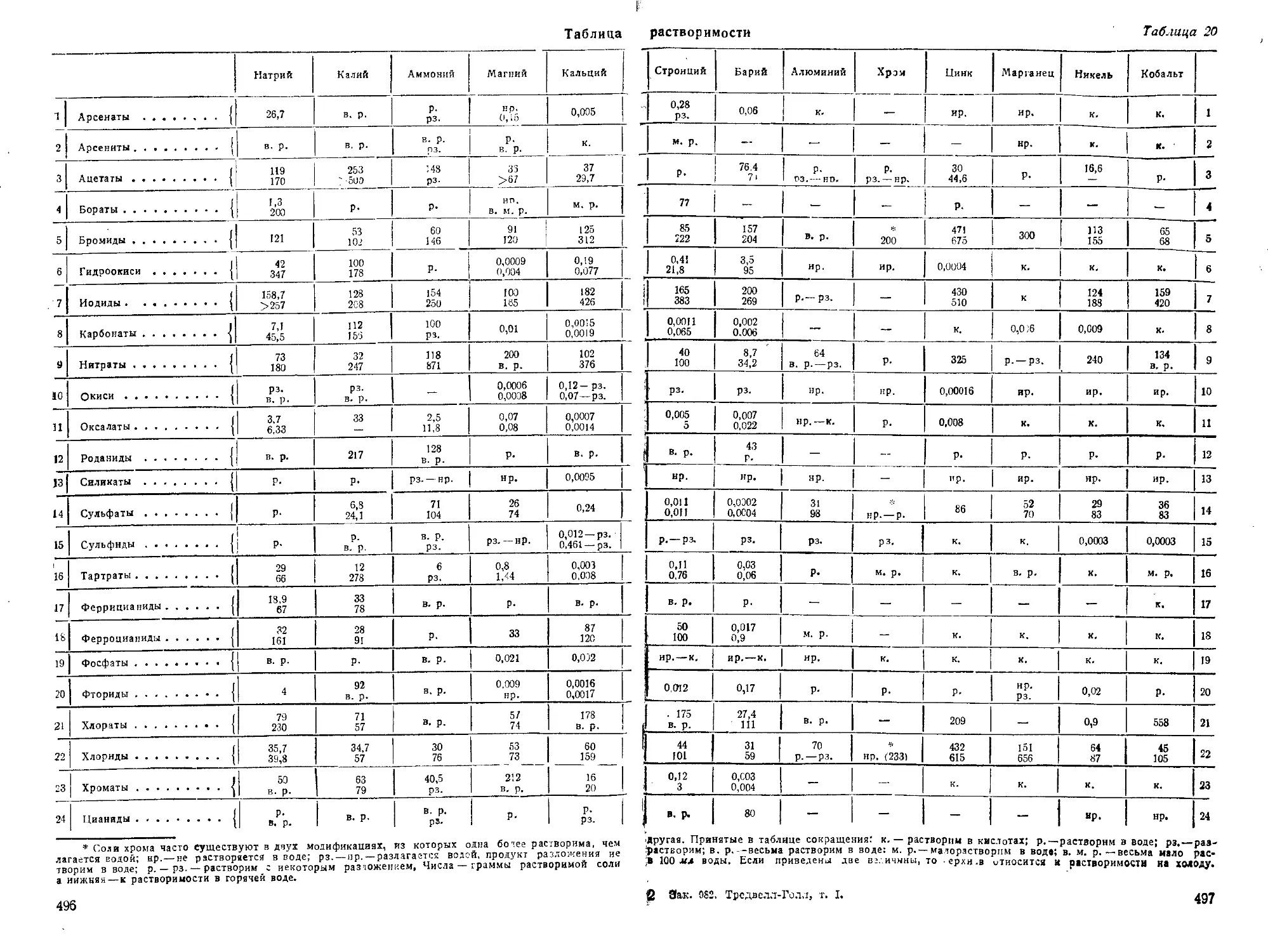
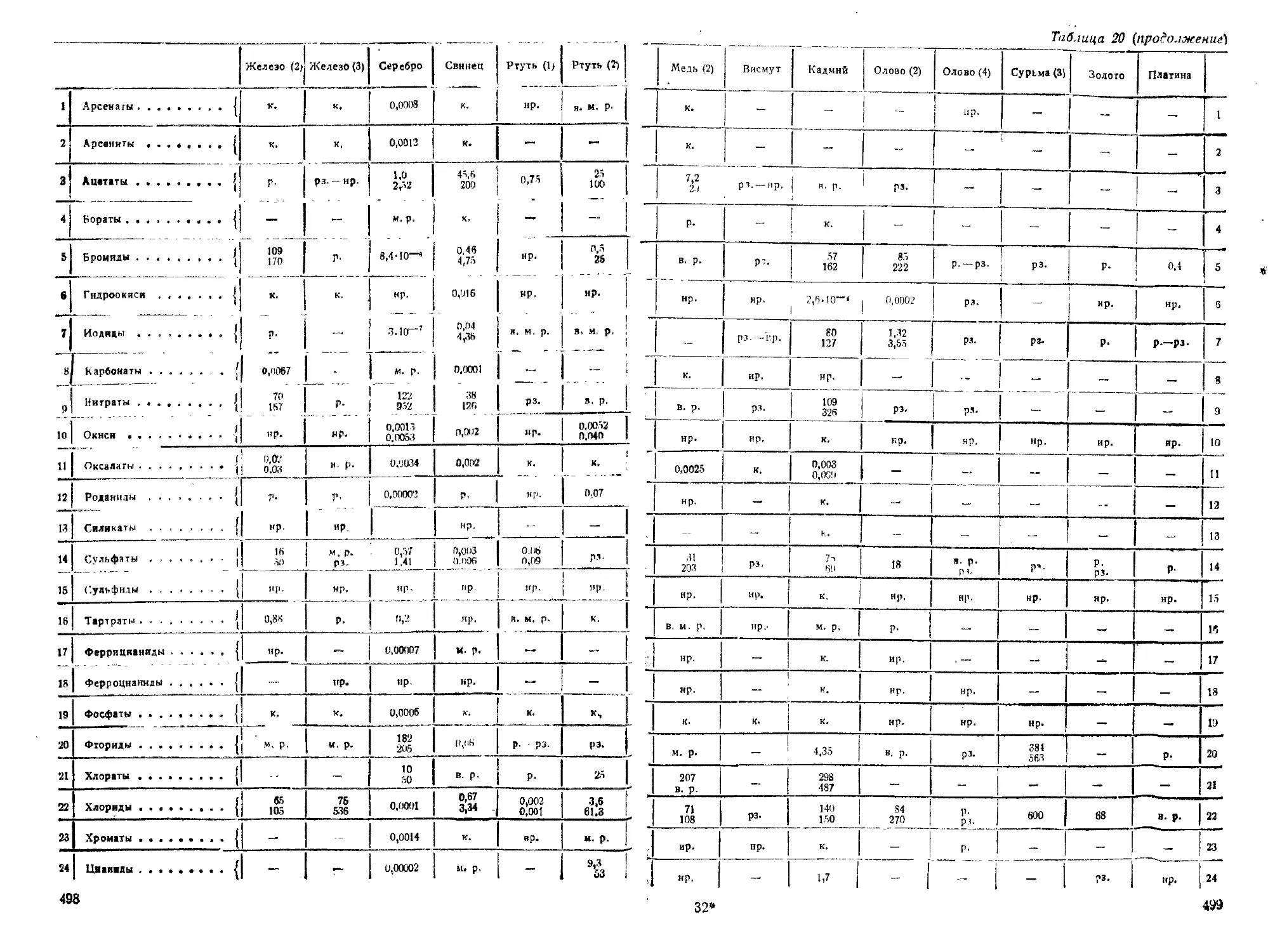
III. Разделение металлов1 на группы.................................101
IV. Концентрация реактивов.........................................102
V. Определение чувствительности реакций............................108
VI. Реакции элементов ............................................ 109
ЧАСТЬ II
Реакции катионов
Группа I
Серебро .................................................... ... 116
Ртуть................ . . . ......................................122
Соединения одновалентной ртути ........................... 124
Открытие ртути в специальных случаях...........................126
СвИне'ц.............................................................128
Анализ группы I .... •............................................ 134
Контрольные вопросы .............................................136
Группа II
Ртуть ..............................................................137
Соединения двухвалентной ртути . » ....................... 137
Свинец _ а л «1 ............................................143
1* " ’ 3
Висмут. . V • . • • • ............................................
Медь..............................................................
А. Соединения одновалентной меди ............................
Б. Соединения двухвалентной меди ............................
Кадмий..........................................................•
Мышьяк.................................................
А. Соединения трехвалентного мышьяка........................
Б. Соединения пятивалентного мышьяка.........................
В. Реакции, общие для всех соединений мышьяка...............
Сурьма ...........................................................
А. Соединения трехвалентной сурьмы...........................
Б. Соединения пятивалентной сурьмы...........................
Олово.............................................................
А. Соединения двухвалентного олова...........................
Б. Соединения четырехвалентного олова........................
Анализ группы II..................................................
Контрольные вопросы.............................................
143
148
150
151
159
163
164
169
173
180
181
184
188
189
193
200
208
Группа III
Алюминий..........................................................210
Хром..............................................................218
А. Соединения двухвалентного хрома ....................... 218
Б. Соединения трехвалентного хрома........................219
В. Соединения шестивалентного хрома........................222
Железо............................................................229
А. Соединения двухвалентного железа........................232
Б. Соединения трехвалентного железа........................236
Марганец..........................................................243
А. Соединения двухвалентного марганца ...................... 246
Б. Соединения шести- и семивалентного марганца (марганцовистая
и марганцовая кислоты) . . . •.........................253
Никель............................................................256
Кобальт...........................................................265
Цинк..............................................................273
Анализ группы III.................................................279
Контрольные вопросы.............................................286
Группа IV
Кальций........................................................289
Стронций.......................................................294
Барий..........................................................296
Магний.........................................................299
Анализ группы IV...............................................304
Контрольные вопросы ........................................ . 307
Группа V
Калий...........................................................309
Натрий..........................................................314
Перекись натрия............................................317
Перекись водорода..........................................317
Озон.......................................................320
Аммоний.........................................................320
Г идроксиламин.............................................326
Гидразин...................................................329
Анализ группы V.................................................331
Контрольные вопросы ......................................... 333
4
ЧАСТЬ III
Реакции анионов
Распределение кислот по группам................................334
Группа I
Хлористоводородная кислота...................................335
Открытие хлора в неэлектролитах..........................340
Хлор......................................................... 341
Хлорноватистая кислота.........................................343
Хлористая кислота..............................................346
Бррмистоводородная кислота.....................................346
Открытие брома в неэлектролитах.......................... 350
Брам...........................................................350
Иодистоводородная кислота......................................350
Открытие иода в неэлектролитах...........................355
Иод........................................................... 355
Открытие НО, НВг и HJ при одновременном их присутствии . . 357
Открытие галоидов в присутствии цианида..................360
Цианистоводородная (синильная) кислота ........................360
Дициан . ... ................................................... 368
Открытие азата в органических веществах по способу Лассеня . 363
Открытие HCN в присутствии НС1, НВг, HJ, H4[Fe(CN)e],
’ Hs[Fe(CN)c] и HCNS...........................................359
Железистосинеродйсгаводородная кислота.........................369
Железосииеродистоводородная кислота............................372
Роданистоводородная (тиоцианиСтсводородная) кислота............374
Специальные методы анализа роданидов .. .. ....................378
Открытие роданидов в присутствии галоидов и цианидов . . . 378
Открытие галоидов в присутствии роданидов................378
Испытание продажных щелочных роданидов на содержание хлора 379
Открытие ферри- и ферроцианидов в присутствии роданидов . . 379
Кобальтосннероднстоводородная кислота . .. .: ....... . 330
Группа II
’Азотистая кислота г . .... 381
Сернистоводородная кислота (сернистый водород)................. . 387
Открытие серы в неэлектролитах . . ..................391
Сера......................................................... 392
Селенистоводородная и теллуристоводородная кислоты ...... 393
Уксусная кисдота .......................................... 394
Циамавая кислота ..............................................396
Открытие цианата в присутствии цианида.................... . 398
Муравьиная кислота.............................................399
Фосфорноватистая кислота.......................................400
Азотистоводородная кислота (азоимид)...................... . . 402
Группа III
Сернистая кислота ........................................... 403
Селенистая, теллуристая, селеновая и теллуровая кислоты .... 407
Угольная кислота............................................. 497
Сернистый углерод..............................................411
Надугольная кислота............................................412
Борная кислота ......................................л .... 412
5
Надборйая кислота......................................... . . .
Щавелевая кислота................................................
Винная кислота......................................._...........
Лимонная кислота.....................................‘...........
фосфористая кислота.................... .........................
Метафосфориая кислота............. ...........................
Пирофосфорная кислота.........................................
Иоднов’атая кислота, . ..........................................
Группа IV
Молибденовая кислота.............................................
Фосфорная кислота................................................
Открытие фосфора в стали и в различных сортах железа . . .
Фосфорноватая кислота............................................
Фосфор...........................................................
Специальные реакции на фосфор...............................
Тиосерная.кислюта1 ............................................
Открытие сернистой, тиосерной и сернистоводородной кислот при
одновременном их присутствии................................
Гидр|осерииста'я кислота.........................................
Мышьяковистая, мышьяковая, хромовая и ванадиевая кислоты . . .
Иодная кислота ж , , . ...... . ................................
Группа V
Азотная кислота . . .............................................
Открытие азотной кислоты в присутствии азотистой кислоты - .
Хлорноватая кислота..............................................
Открытие хлористоводородной, азотной и хлорноватой кислот при
одновременном их присутствии...............................
416
419
424
427
430
431
432
435
435
440
441
442
443
445
450
451
451
452
454
458
459
462
Хлорная кислота.................................................463
Надсерная кислота.............................................. 465
Мононадсерная кислота (кислота Каро)............................467
Марганцовистая и марганцовая кислоты............................467
Группа VI
Серная кислота .................................................467
Фтористоводородная кислота .....................................470
Кремнефтористоводородная кислота................................476
Группа. VII
Кремневая кислота . . ..........................................477
А. Растворимые в воде силикаты..................I . , . . 479
Б. Не растворимые в воде силикаты..........................481
Кремний ....................................................... 484
Открытие кремния в железе и стали..........................484
Открытие кремния в карборунде и силицидах..................485
Вольфрамовая, титановая, ниобиевая и танталовая кислоты .... 485
ЧАСТЬ IV
Систематический ход анализа
А. Анализ твердого неметаллического вещества . . 487
I. Предварительное испытание.............................487
II. Растворение вещества ............................. 494
б
Ill, Методы превращения не растворимых ib кислотах -веществ в раство-
римое состояние ...................... ........ . 503
IV. Открытие катионов.............................. 508
V. Открытие анионов................................. 511
Метод Тредвелла...............................• . 511
Метод Нойеса ........ •.......................»; 514
Б. Анализ металлов и сплавов..................... • . 528
В. Анализ растворенного вещества.............528
Г. Анализ газов......................................530
Д. Дополнение. Качественный полумикроанализ . . . 530
Систематический анализ катионов .................. 531
Систематический-'анализ анионов................... Л 538
ЧАСТЬ V
Реакции редких металлов
Группа II
Молибден.............х -л :• . V . . ч ч : 543
Селен............................................................ 547
А. Селенистая кислота................................. . », 548
Б. Селеновая кислота..................................... 550
Теллур................. ................ ., м !.: >, 551
А. Теллуристая кислота...................................... 552
Б. Теллуровая кислота ........ . >. > 553
Германий ....... ...... . ... . 554
Золото............................................................ 556
Соединения трехвалентного- золота.......................... 557
Открытие золота в сплавах и рудах ........ ... 561
Платана.............................................. -. ., », 562
Соединения четырехвалентной платины..................,. 563
Отделение золота от платины . . .......... . 566
Палладий................................................. 567
А. Соединения двухвалентного палладия............... 568
Б. Соединения четырехвалеитного палладия ........ 570
Родий.............. Г.' •: ... Ч :.!............ • .: ... 571
Осмий......................................................573
А. Соединения четырехвалеитного осмия............... . 574
Б. Соединения восьмивалеитного осмия................ 574
Рутений................................................ г. 575
Иридий............................................. .. . ж 578
Разделение и открытие шести платиновых металлов . .. . л 580
Группа III
Бериллий . . . v . . .- .] . . . . у 584
Уран..............................................................587
..Титан.......................................................... 591
.,1 Цирконий.................................................... . 597
‘У.Торий...........................................................602
•Гафний.......................................................... 605
М е т а л л ы р е д к и х з е м е л ..............................605
Скандий.......................................................... 608
(ИТТРИЙ........................................................ (jog
7
Европий .........................................................
Гадолиний . . - .................................................
Тербий...........................................................
Диспрозий..........................................•.............
Голымий .........................................................
Эрбий ....................................................*.....
Тулий ...........................................................
Иттербий.........................................................
Лютеций, или Кассиопей...........................................
Церий и > ..................................................
А. Соединения трехвалентного церия............................612
Б. Соединения четырехвалентного церия.........................615
Лантан . .....................................................
Празеодим ....................................................
Неодим........................................................
Иллиний ......................................................
Самарий ......................................................
Таллий........................................................
610
611
611
611
611
611
611
611
612
612
617
618
618
619
619
619
А. Соединения одновалентного таллия ..........................620
Б. Соединения трехвалентного таллия .......................... 621
Индий . , , . , ..........................................
Галлий ...................................................
Ванадий...................................................
Земельные кислоты. . . ...................................
Вольфрам. ........................................... • •
Тантал ...................................................
Ниобий ...................................................
622
625
627
632
633
636
636
Общие реакции на тантал и ниобий...........................637
Специфические реакции на ниобий............................639
Одновременное открытие ниобия и. тантала...................640
Группа IV
Радий ................................. » . . 641
Группа V
Цезий . > >- »...................................... . 641
Рубидий...............................................643
Отделение калия и рубидия от цезия................645
Литий..............I................................ 645
Открытие лития, рубидия и цезия в присутствии калия и натрия. 647
РеНИЙ клип ............................ ... *• . 649
Предметный указатель . ... . ... .....................652
ПРЕДИСЛОВИЕ К ДЕВЯТОМУ РУССКОМУ ИЗДАНИЮ
Девятое русское издание дополнено и изменено согласно де-
вятому английскому изданию.
Не перечисляя всех изменений и дополнений, произведен-
ных Голлом, я укажу лишь наиболее важные из них. Так,
качественный анализ значительно пополнен новыми реакциями,
особенно с органическими реактивами й, главным образом, ка-
пельными реакциями. Нельзя не приветствовать помещенный
им краткий очерк качественного полумикроанализа, а также
заново обработанный раздел платиновых металлов. К сожа-
лению, идя навстречу желанию своего издателя не увеличи-
вать объема книги, Голлу пришлось, как он указывает в своем
предисловии, сократить в некоторых случаях текст предыду-
щего издания. Так, им исключено, например, описание свойств
гидразина и гидроксиламина — соединений, с которыми анали-
тикам приходится часто иметь дело. Выпущены также опре-
деление чувствительности реакций, приготовление платино-
хлористоводородной кислоты из платиновых остатков, опреде-
ление следов марганца в окиси никеля и кобальта и т. д. Эти
места предыдущего издания я счел нужным сохранить пол-
ностью.
Вероятно с той же целью экономии места Голл в подавляю-
щем большинстве случаев не называет авторов приведенных им
новых реакций и не указывает, где и когда последние были
опубликованы, что лишает читателей возможности в случае
надобности обратиться к оригинальному литературному источ-
нику. Я счел нужным восполнить этот пробел.
В заключение я должен остановиться еще на одном изме-
нении, сделанном Голлом, в целесообразности которого я со-
мневаюсь. Во всех предыдущих изданиях изучение качествен-
ного анализа начиналось со щелочных металлов, т. е. с V ана-
литической группы металлов, испытание на которые обыкно-
венно производится в конце систематического хода анализа.
Такой порядок прохождения качественного анализа Тредвелл
рекомендовал, исходя из тех соображений, что металлы, откры-
ваемые при систематическом ходе анализа последними, дают
по сравнению с элементами других групп наибольшее число
растворимых солей, которые весьма обычны и широко приме-
няются при отделении и идентифицировании металлов других
групп. Понимание химических реакций элементов этих послед-
них значительно облегчается знанием характерных свойств
элементов У аналитической группы, а это говорит в пользу
9
системы изучения качественного анализа, предложенной Тред-
веллом. Голл рекомендует теперь начинать изучение анализа
не с V, а с I группы, чтобы не вносить, по его мнению, пута-
ницы в понятия начинающих.
На основании моего личного многолетнего опыта я считаю
опасения Голла неосновательными: начинающие быстро осваи-
ваются с той системой, которая была принята в предыдущих
изданиях. Все же я решил в русском издании сохранить поря-
док, рекомендуемый Голлом, предоставляя самим преподавате-
лям выбор наилучшей , системы проработки качественности
анализа.
А. Комаровский
ЧАСТЬ’ I
ОСНОВНЫЕ ПРИНЦИПЫ
Аналитическая химия имеет своей целью установление
состава вещества (или смеси веществ), т. е. определение
образующих его элементов и их весовых соотношений. В со-
ответствии с этим аналитическая химия подразделяется на ка-
чественный и количественный анализ.
Методами качественного анализа выявляются образующие
данное вещество элементы или их характерные группировки;
установление же весовых соотношений элементов, образующих
исследуемое вещество, составляет задачу количественного ана*
лиза.
Впрочем, и 'качественные пробы могут дать приблизительное соотноше-
ние составных частей исследуемого соединения путем сравнения результа-
тов, получаемых при анализе определенных количеств исследуемого и заве-
домо чистого вещества. Количественные колориметрические методы, кото-
рыми часто пользуются для определения вещества в малых концентрациях,
а также для испытания чистоты исследуемого продукта, выполняются боль-
шею частью при помощи реакций, применяемых в качественном анализе.
Для распознавания какого-нибудь вещества мы большей
частью переводим его при помощи другого вещества в новое
соединение, свойства которого нам уже известны. Такое пре-
вращение мы называем химической реакцией, веще-
ство же, вызывающее последнюю,—реактивом (или ре-
агенто м).
Различают реакции, проводимые мокрым и сухим
путем.
1. Реакции мокрым путем
Для качественного, анализа применяются только те реакции,
которые легко воспринимаются нашими органами чувств —
преимущественно зрением («видимые реакции»). Такими
являются реакции, в результате которых происходит:
а) образование осадка, б) изменение цвета, в) выделение газа.
Распознаванию многих веществ помогает также и чувство обо-
няния. Так, сернистый и цианистый водород, пары брома, серо-
углерода и многих других веществ обладают весьма характер-
ным запахом. Так как некоторые из них ядовиты, то определе-
ние запаха лучше всего производить, рассеивая быстрым дви-
жением руки небольшое количество газа, выделяемого при
испытании данного вещества; это позволяет вдыхать газ, в зна-
11
чительной степени разбавленный воздухом. Бывают полезны
также и вкусовые ощущения, но ими редко пользуются ввиду
опасности отравления. Некоторую пользу может' иногда ока-
зать и чувство осязания. Так, графит дает на ощупь впеча-
тление жирного тела; алкалоид кокаин и другие родственные
ему вещества вызывают временную потерю чувствительности
языка и т. д.
Как правило, характерные реакции качественного анализа
осуществляются -путем добавления раствора реагента к рас-
твору исследуемого вещества. Такие реакции называются
реакциями мокрым путем в отличие от реакций
сухим путем; в последнем случае исследуемое вещество,
или сплавляют с флюсами (сода, бура, метафосфат натрия)'
или прокаливают его в пламени горелки на платиновой про-
волоке или на древесном угле.
Закон действия масс 4
Закон действия масс является одним из наиболее важ-
ных обобщающих законов, используемых аналитической хи-
мией. На основании изучения медленно протекающих обрати-
мых реакций Гульдберг (Guldberg) и Вааге (Waage) в 1’867 г.
показали, что скорость течения химической реак-
ции пропорциональна действующим массам
реагирующих веществ. Если два вещества А и В об-
разуют два другие вещества С и D согласно уравнению:
А + В Z2 С + D,
то в реакционной смеси установится равновесие, когда скорость
образования С и D за счет А и В будет точно равна скорости
образования А и В из С и D. Выражая действующие массы
каждого из четырех веществ (в любой данный момент) соответ-
ственно символами [А], [В], [С] и [D], мы будем иметь для
состояния равновесия следующее соотношение:
[С] [DJ _ „
[А] [В] -
Величина К называется константой равновесия,
а в частных случаях — константой ионизации, кон-
стантой гидролиза и т. д. *. Если в реакции принимает
участие более чем одна молекула каждого из веществ, как, на-
пример:
mA + лВ + .. • ^2 рС + qD + ...,
то состояние равновесия выразится следующим математическим
уравнением:
[СрX [DlgX • • • ;
[АГХ1ВГХ-.
1 Величина К постоянна только для данной системы веществ и при
данной температуре.
Во многих случаях действующую массу реагирующего ве-
щества можно считать равной его общей концентрации, т. е.
количеству вещества (выраженному в молях), содержащемуся
в единице объема (в 1 д').
Закон действия масс применим к состоянию гомоген-
ного (однородного) равное ес и я. Гомогенная система
характеризуется тем, что в ней любая часть не отличается ни-
чем от всякой другой ее части. Так, например, смесь двух твер-
дых веществ негомогенна. С другой стороны, раствор гомоге-
нен, так как в нем после полного смешения невозможно заме-
тить какое-либо различие между его отдельными частями.
Точно так же смесь газов представляет собой гомогенную си-
стему. Подобные гомогенные системы называются фазами.
Смесь твердого вещества, раствора и газа состоит из трех фаз;
смесь двух твердых веществ или двух не растворимых друг
в друге жидкостей представляет собою две фазы.
Закон действия масс позволяет устанавливать условия наи-
более выгодного течения реакций. Приведем следующий при-
мер. При действии хлора на треххлористый фосфор на холоду
образуется твердый пятихлористый фосфор. Если это веще-
ство нагреть, оно расщепляется на свои исходные компоненты.
Реакция обратима и может быть представлена следующим урав-
нением:
pcis z=: РС13 + Ch.
При всякой данной температуре устанавливается равновесие, ко-
торое согласно закону действия масс может быть выражено
математически:
[РС18] [CL] _
[РС15]
В этом уравнении [РС1з], [Ch] и [РСЕ] представляют со-
бой концентрации соответствующих веществ при установив-
шемся равновесии.
Если мы хотим перевести (путем нагревания) пятихлори-
стый фосфор в газообразное состояние так, чтобы диссоциация
его была возможно малой, то вышеприведенное уравнение даст
нам указание, как нужно для этого поступить. С увеличением
[РС1з] или [Ch] должна также увеличиться и [PClg], потому
[PC1S] [С1„]
что-------jp-Q-j- = const; иначе говоря, мы должны превра-
щать пятихлористый фосфор в газообразное состояние в ат-
мосфере треххлористого фосфора или хлора. Таким путем
Вюрц (Wiirtz) нашел плотность пятихлористого фосфора рав-
ной 6,80—7,42, т. е. близкой к вычисленной величине 7,2.
В Страссфурте встречается минерал карналлит MgCh'KCb
'6Н2О, образовавшийся путем выкристаллизовывания из рас-
твора хлоридов магния и калия. Эта двойная соль растворима
р воде менее, чем чистый хлорид магния, и более, чем чистый
Хлорид калия. При растворении карналлита в воде двойная
13
соль более или менее полно разлагается (в зависимости от раз-
бавления) согласно уравнению:
MgCh-KCl^ MgCh + KCl. .
Поэтому, если карналлит растворить в воде и раствор затем
упарить, то из него будет выпадать только хлорид калия.
Закон действия- масс помогает найти условия, при которых
из раствора будет выкристаллизовываться карналлит. Согласно
вышеприведенному уравнению мы для каждой концентрации
имеем:
[MgCl2][KCl]
[MgCI2 KClf
const.
Поэтому, чтобы воспрепятствовать разложению двойной соли,
к раствору необходимо добавить избыток MgCh. И . действи-
тельно, в Страссфурте этот минерал перекристаллизовывается из
23%-ного раствора хлористого магния.
Закон действия масс показывает, что когда1 концентрация
какого-либо вещества, участвующего в химической реакции,
увеличивается, то возрастает тенденция реакции протекать
в том направлении, при котором это вещество разлагается; если
какое-либо вещество, образующееся при химической реакции,
будет удаляться из реакционной смеси, то это увеличит тенден-
цию реакции итти в сторону образования этого вещества. Вы-
деление образующихся при реакции веществ в виде осадка или
газа способствует более полному течению реакции. Если уда-
лять газ путем кипячения, то реакция, при которой он обра-
зуется, будет протекать полностью. Равным образом, если ка-
кой-нибудь осадок был бы абсолютно не растворим в воде, то
реакция, при которой этот осадок образуется, протекала бы
также полностью.
Теория электролитической диссоциации или ионизации
Свойства водных растворов солей, кислот и оснований об-
наруживают ряд ненормальностей по сравнению со свойствами
других растворов. Приведем следующий пример. Как правило,
изменение точки кипения или замерзания данного неводного
растворителя будет одним и тем же, если в 1000 г его раство-
рить 1 моль любого вещества (на этом основано приближен-
ное определение молекулярного веса веществ). То же самое
справедливо в отношении водных растворов неэлектролитов,
т. е. веществ, водный раствор которых проводит электрический
ток не лучше, чем сама вода. Если же на основании изменения
точки замерзания или кипения водного раствора какого-нибудь
электролита (т. е. (вещества, водный раствор которого прово-
дит электрический ток значительно лучше, чем сама вода) мы
захотели бы определить молекулярный вес последнего, то по-
лучили бы слишком низкие величины; раствор ведет себя так,
как -если бы в нем было большее число молекул растворенного
вещества, чем можно ожидать на основании других данных.
14
К тому же заключению приводят И другие физические свой-
ства растворов электролитов, как, например, упругость паров
и осмотическое давление.
М. Фарадей (Faraday) при исследованиях законов электро-*
лиза, результаты которых он опубликовал в 1834 г., предпола-
гал, что первое действие электрического тока во время эле-
ктролиза сводится к расщеплению первоначальных молекул на
меньшие частицы, названные им ионами1.
Сванте Аррениус (Svante Arrhenius) в 1887 г. предложил
теорию ионизации, согласно которой расщепление молекул на
ионы происходит независимо от электрического тока: ионы об-
разуются в водных растворах тотчас по растворении вещества’.
Эта теория Аррениуса в настоящее время является общепринят
той. Исторически теория ионизации была развита на основа-
нии изучения чисто физических свойств водных растворов, ка-
ковыми являются точка замерзания, точка кипения, упругость
паров, осмотическое давление и отношение водных растворов
к электрическому току; особенно же важное значение теория
ионизации приобрела для объяснения химических свойств рас-
творов электролитов.
Если водный раствор хлористого бария смешать с разба-
вленным раствором серной кислоты, то образуется белый кри-
сталлический осадок сульфата бария:
BaCh -j-H2SOi := 2НС1 4- BaSO4.
Такой же осадок идентичного химического соста'ва может
быть получен и из любой другой растворимой бариевой соли,
причем вместо серной кислоты может быть взят любой раство-
римый сульфат.
Прибавление небольшого количества нитрата серебра к вод-
ному раствору хлористого’ бария вызывает появление белого
творожистого осадка хлористого’ серебра, темнеющего под
влиянием света:
ВаСЪЧ- 2AgNO3=Ba(NO3)2 + 2AgCl.
Тот же осадок образуется, если вместо хлористого бария
пользоваться соляной кислотой или каким-либо другим хлори-
дом, а вместо нитрата серебра какой-либо другой растворимой
солью серебра.
Таким же путем могут быть показаны определенные свой-
ства, которыми отличаются водные растворы всех кислот, как,
например, окрашивание синего лакмуса в красный цвет. Этими
так называемыми кислыми свойствами они обязаны водороду
кислот, который ведет себя совершенно иначе, чем водород
Других соединений.
1 Этот и другие термины, которыми Фарадей’ пользовался в 18Э-1 г.,
были приняты им по предложению его ученика William Whewell (1794—1866).
15
Основания также отличаются определенными характерными
реакциями, которые приписываются находящемуся в них гидро-
ксилу ОН. Водный раствор какого-нибудь основания окраши-
вает красный лакмус в синий цвет, реагирует с кислотами, обра-
зуя воду и т. д.
Франклин1, изучая свойства различных веществ, растворенных в без-
водном жидком аммиаке, предложил расширить понятие о кислоте, основа-
нии и соли, указывая, что NHV, образующийся из NHs и Н’, может рас-
сматриваться в таком растворе как кислота и что образование NH<’ в
среде жидкого аммиака может быть сравнено с образованием НгО при
гидратации водородного ирна в водном растворе:
Н* + Н2О->НзО’.
Н. Ф. Голл2 присоединился к подобным взглядам, применяя их к рас-
творам в безводной уксусной кислоте и в других такого же характера
растворителях. Бренстед3, Лоури4, Бьеррум5 также пытались расширить
в подобном направлении понятия о кислотах, основаниях и солях.
По этой концепции кислота определяется как донор водородного иона,
а основание — как его акцептор. Большое значение имеет тот факт, что
в водных растворах ион водорода гидратирован; негидратированный же
ион водорода, так же как водород in statu nascendi, способен только
к весьма кратковременному существованию. Продукт реакции водородного
иона (или протона) с ведой НзО' называется одними авторами иоиом
гидрония, другими—ионом гидроксония6.
В нашем руководстве нет необходимости придерживаться этой точки
зрения по следующим причинам: 1) она не дает для понимания реакций
в водных растворах чего-либо большего, по сравнению с общепринятой
ионной теорией; 2) она создает сбивчивую номенклатуру, потому что в
большей части современной литературы и во всей литературе за послед-
нее пятидесятилетие авторы исходили из других положений. Что же ка-
сается гидратации иона водорода, то этот факт известен уже много лет,
как и то, что гидроксильный ион ОН' представляет собою, вероятно,
НзОз' или НзОз'.
Как указано ранее (стр. 15), водные растворы кислот, осно-
ваний и солей показывают реакции, являющиеся характерными
не столько для самого растворенного вещества', сколько для
его составных частей. Это чрезвычайно важное обстоятельство
дает нам возможность определять компоненты какого-либо рас-
твора более или менее независимо от присутствия в нем других
компонентов. Мы можем, например, открывать барий совер-
шенно одним и тем же путем, безразлично, будет ли он нахо-
диться в виде хлорида или нитрата; точно так же" мы можем
обнаружить хлор одним и тем же реактивом независимо от
того, находится ли хлор в растворе в виде хлористоводород-
ной кислоты или в виде какого-либо хлорида. Этот факт'
1 Franklin, J. Ага. Chem. Soc. 46. 2137 (1924).
- Hall, The Nucleus 6, 91 (1929); J. Clieni. Education 7, 782—793 (1930).
8 Bronsted, Rec. trav. chim. 42, 718—728 (1923); J. phys. Chem. 30, 777
(1926); B. 61, 2049 (1928).
4 L owry, Chemistry and Industry 42, 43 (1923).
6 Bjerrum, Chem. Rev. 16, 287 (1935).
6 О гидратации ионов см.: А. Вернер, Новые воззрения в области неорга-
нической химии; We inland, Einfiihrung in die Chemie derKompIexverbindttngen,
стр. 518—23 (1920); Бет г ер, Основы качественного анализа, стр. 128'(1930)
и новейшие руководства по физической химии. Ред.
16
весьма замечателен потому, что химические свойства какого-
либо соединения обычно совершенно отличны от суммы свойств
составляющих его частей. Например, свойства -воды показы-
вают мало -сходства со свойствами водорода или кислорода, из
которых она образована. Свойства йодистого натрия также
совершенно отличны от свойств металлического натрия и сво-
бодного иода, как и свойства хлората калия отличны от
свойств составляющих его элементарных калия, хлора и кис-
лорода. Однако водные растворы кислот, -оснований- и солей
фактически обнаруживают аддитивные свойства, т. е. хлорид
натрия обладает в растворе свойствами, обнаруживаемыми на-
трием любой другой его соли, и свойствами хлора, которые
показывает любой другой хлорид. Аналогично можно -предпо-
лагать, что в водных растворах любых кислот кислотные водо-
роды находятся до некоторой степени в сходных условиях,
а также, что водный раствор какого-либо основания содержит
по меньшей мере часть своих гидроксилов в тех же условиях,
в каких они содержатся в водном растворе любого другого
основания, и что металлические и неметаллические составные
части солей находятся в водных растворах в значительной мере
в одинаковых условиях, независимо от природы первоначаль-
ной соли.
Для объяснения сказанного теория электролитической дис-
социации или ионизации предполагает, что все электролиты
(кислоты, основания, соли) в водных растворах расщеплены на
электрически заряженные атомы или атомные группы, называе-
мые ионами. Так, например, в водном растворе хлористого
натрия содержатся не молекулы его, а -положительно заряжен-
ные ионы натрия и отрицательно заряженные ионы хлора:
NaCl^r Na’ + Cl'.
Аналогично -ведут себя почти все соли, кислоты и основа-
ния; так, сульфат натрия распадается на и-оны согласно урав-
нению:
Na^-SOiNa' + Na' + SCh";
гидроокись натрия распадается на ионы:
NaOHcCNa' + ОН'.
Теория электролитической диссоциации весьма просто объ-
ясняет явление электролиза.
Поместим -в раствор какого-нибудь электролита два полюса
источника электрического тока, из которых один — анод — за-
ряжен положительным, а другой — катод — отрицательным эле-
ктричеством. Тогда анод будет отталкивать электроположи-
тельные ионы (катионы) и притягивать электроотрицательные
(анионы); последние, приходя в соприкосновение с анодом, от-
дают ему свой отрицательный заряд, становятся электроней-
2 Зак. 980. Тредвелл-Голл, т. I.
17
тральными и выделяются *. То же .самое происходит иа катоде,
где разряжаются электроположительные ионы.
Причиной, в силу которой водный раствор любой бариевой
соли с любым растворимым сульфатом образует сульфат бария,
является то обстоятельство, что в данном слуйае реакция .про-
текает исключительно между ионами и она .поэтому может
быть лучше всего выражена следующим уравнением:
Ва’• + SO4" ZTBaSOj.
Точно так же реакция между хлоридом бария и нитратом
серебра есть не что иное, как реакция ионов серебра с хлор-
ионами, приводящая к образованию хлорида серебра:
Ag' + Cl' Zt AgCl.
Большая часть реакций качественного анализа, протекающих
в водных растворах, совершается между ионами, а не между
молекулами.
Возьмем для примера действие разбавленного раствора хло-
ристоводородной (или какой-нибудь другой) кислоты на раз-
бавленный раствор гидроокиси натрия (или какого-либо дру-
гого основания). В разбавленном растворе хлористоводородная
кислота почти полностью диссоциирована на ионы водорода и
хлора; точно так же почти полностью диссоциирован разбав-
ленный (раствор гидроокиси натрия. В результате реакции об-
разуется вода, которая сама лишь весьма слабо ионизирована,
и реакция может быть выражена (с ионной точки зрения) сле-
дующим уравнением:
Н’ +Cl'+Na’ IW + Na' + СГ.
Если вычеркнуть одинаковые ионы, стоящие по обеим сто-
ронам знака равенства, то уравнение примет следующий вид:
Н' + ОН' ^Н2О.
Таким образом, нейтрализация разбавленного раствора ка-
кой-либо кислоты каким-либо основанием представляет собой
только реакцию водородного иона с гидроксильным ионом,
приводящую к образованию воды. Это находит подтвержде-.
ние в следующем. Образование 1 моля воды из 1 г водород-
1 Ион, переносящий электрический заряд ют одного электрода к дру-
гому, не всегда освобождается от своего заряда. Иногда он реагирует
с электродом, растворяя его, а иногда для него легче выделить свободный
водород или кислород из .воды, чем освободиться от носимого им заряда.
Так, при электролизе хлористого натрия натрий не выделяется на катоде,
если только последний не состоит из ртути, потому что выделение свобод-
ного водорода происходит легче, чем отдача ионом натрия своего заряда.
Если бы происходило образование свободного натрия, он тотчас реагиро-
вал бы с водой. Напротив, с ртутным катодом может иметь место обра-
зование амальгамы натрия.
18
ных и 17 г гидроксильных ионов сопровождается выделением
13 700 кал тепла; это же самое количество тепла выделяется,
когда эквивалентное количество разбавленного раствора хло-
ристоводородной (кислоты нейтрализуется /разбавленным рас-
твором гидроокиси калия или когда хлористоводородная кис-
лота заменена другой, например азотной кислотой. Выделяю-
щееся тепло представляет собой исключительно тепло образо-
вания 1 граммолекулы воды из ионов водорода и гидроксила.
Точно так же может быть показано, что когда какая-
нибудь кислота действует на металл с образованием соли и
газообразного водорода, выделяющееся количество тепла за-
висит только от природы металла, а не от природы кислоты;
анион кислоты не принимает участия в реакции.
В основу теории электролитической диссоциации Аррениуса
положены следующие предпосылки. Когда кислота, основание
или соль растворены в воде, их молекулы обычно диссоцииро-
ваны на меньшие электрозаряженные частицы, называемые
ионами. Сумма положительных зарядов, связанных с катио-
нами, точно равна сумме отрицательных зарядов, связанных
с анионами, и весь раствор'В целом является электрически ней-
тральным. Диссоциация представляет собой обратимую реакцию,
причем все электролиты являются полностью ионизированными
лишь при бесконечном разбавлении. Если исключить воздей-
ствие ионов друг на друга, являющееся результатом наличия
электрических зарядов и проявляющееся во взаимном притя-
жении и отталкивании их, то ионы могут рассматриваться как
независимые составные части ©аствора, наде^нные индиви-
дуальными и специфическими химическими и физическими
свойствами. Если растворенное в воде вещество диссоцииро-
вано лишь частично, то при удалении ионов из раствора путем
ли электролиза или какой-либо другой реакции вещество будет
тотчас дальше распадаться на ионы.
Хотя установлено, что большая часть кислот, оснований и
солей является ионогенами1, однако степень ионизации их
водных растворов весьма различна. Так, граммолекула хлори-
стого водорода, растворенная в 10 л (воды, содержит прибли-
зительно в 70 раз больше водородных ионов, чем эквивалент-
ное количество уксусной кислоты той же концентрации; то же
самое соотношение применимо к растворам гидроокиси натрия
и гидроокиси аммония. Так как сила кислоты или основания
определяется степенью их ионизации, то хлористоводородная
кислота приблизительно в 70 раз сильнее, чем уксусная кислота,
а гидроокись натрия или калия приблизительно в 70 раз силь-
нее, чем гидроокись аммония.
' ‘Ионогеном, как показывает назтание, является вещество, способ-
F Ное к образованию ионов. Согласно теории валентности Льюиса
C1G. N. Lewis. J. Am. Chem. Soc., 38, 762 (1916); см. также Langmuir, ibid.
Hl. 868, 1543 (1919)] ионоген является полярным соединением, в котором
валентный электрон перешел от одного атома к другому, образуя электри-
; ческий диполь (если соединение состоит из двух атомов).
2-' Г>
С другой стороны, граммолекула уксусной кислоты нейтра-
лизует то же весовое количество гидроокиси натрия, какое
нейтрализуется граммолекулой хлористоводородной кислоты;
граммолекула гидроокиси аммония в состоянии нейтрализовать
то же самое весовое количество какой-либо кислоты, какое
нейтрализуется граммолекулой гидроокиси натрия. В растворе
гидроокиси натрия и хлористоводородной кислоты вышеука-
занной концентрации приблизительно 90% всех молекул иони-
зировано и реакция нейтрализации сводится к соединению
водородных и гидроксильных ионов с образованием воды.
Когда нейтрализуется уксусная кислота той же концентрации,
то в ней вначале ионизировано только 1,3% общего числа
молекул. Образующиеся за счет этой ионизации ионы водорода
реагируют с гидроксильными ионами основания, давая воду;
но, как уже указано выше, вследствие удаления ионов водорода
из раствора происходит образование новых за счет ионизации
недиссоциированных молекул кислоты; этот процесс «продол-
жается до тех пор, пока все молекулы уксусной кислоты не
продиссоциируют. Поэтому .при нейтрализации уксусной кис-
лоты гидроокисью натрия конечный тепловой эффект не будет
равен тепловому эффекту соединения водородных ионов с ги-
дроксильными, но будет включать в себя также и энергию, тре-
бующуюся для ионизации уксусной кислоты3. Если какое-ни-
будь вещество ионизирует с такой же скоростью, с какой оно
растворяется, то тепловой эффект ионизации трудно отличить
от теплоты растворения. Подобно тому, как некоторые -веще-
ства растворяются с поглощением, а 'некоторые с выделением
тепла, так же й процесс ионизации может сопровождаться либо
поглощением, либо выделением тепла.
Следует отметить тот факт, что соли слабых кислот и
оснований обычно ионизируют почти в такой же степени, как
соли сильных кислот и оснований.
При растворении в воде двуосновной кислоты оба водород-
ных атома ионизируют не в одинаковой степени; ионизация
проходит в две стадии. Серная кислота, например, в первой
стадии ионизирует согласно уравнению:
HaSOi^HSCU' + H'.
Тот факт, что реакция протекает не до конца, отмечается
в уравнении двумя стрелками, обращенными в противоположные
стороны. В результате ионизации по первой стадии в растворе
устанавливается равновесие между тремя веществами:
H2SO4, HSOT и Н'.
1 Теплота нейтрализации слабой кислоты может быть больше или
меньше теплоты нейтрализации сильной кислоты (13 700 кал) в зависимости
от того, поглощается или выделяется теплота при ее ионизации. Так, те-
плота нейтрализации фосфорнонатистой кислоты равна 14 300 кал, уксус-
ной — 13 400 кал. Ред.
20
Ho HSCV подвергается вторичной диссоциации согласно
уравнению;
'HSO6 ,-n son 4- Н'.
Степень ионизации и в том и в другом случае зависит от
разбавления. Так, если растворить 0,5 граммоля серной кис-
лоты в 10 л воды, то первичной ионизации подвергнется около
90% всего количества имеющейся в растворе кислоты, вторич-
ной— меньше 50%. В рчень разбавленных растворах обе ре-
акции протекают почти полностью.
В случае угольной кислоты ионизация первого водорода:
Н-зСОз ;=НСОз' % Н'
составляет обычно дробную часть одного процента, ионизация
же второго водорода:
НСОз' СО.-;"-г Н‘
чрезвычайно мала (стр. 24).
Таковы же условия ионизации сероводородной кислоты.
Как уже упоминалось, соли этих слабых кислот ионизируют
большей частью полностью следующим образом;
NaaCOs Na' % .Na' % СОз";
N а з S N а %- N a -f- S .
На зависимость степени ионизации вещества от концентра-
ции было уже указано (стр. 19); несколько позже мы это вы-
ведем математически.
В аналитической химии часто приходится иметь дело с по-
нятием концентрация; так как существует несколько спо-
собов выражения этой величины, рассмотрим их более по-
дробно. Под концентрацией раствора мы разумеем количе-
ство вещества, растворенного в единице объ-
ема; числовое значение концентрации всецело зависит от еди-
ниц, в которых выражены масса растворенного вещества и
объем раствора. Если И7 представляет собою массу растворен-
ного вещества, выраженную в граммах, а V — объем раствора,
W
выраженный в литрах, тогда -у представляет концентрацию
раствора, выраженную в граммах вещества в 1 л (г/л).
Такое выражение концентрации не всегда удобно: равные
объемы растворов двух различных веществ с одной и той же f
концентрацией (например, 1 г/л) только в исключительных слу-
чаях бывают эквивалентны друг другу.
Удобнее измерять массу растворенного вещества числом мо-
лей его, находящихся в единице объема раствора (так назы-
ваемая м о л я р н а я ко н цен т р а ц и я). При таком способе
выражения объемы растворов различных веществ одной и той
же концентрации (например, 1 моль/л) будут вступать друг
с другом в реакцию в простых кратных отношениях (например,
I л раствора вещества А будет реагировать с 2 л раствора ве-
щества В).
21
Еще большее упрощение достигается, когда концентрация
измеряется числом граммэквивалентов1 растворенного веще-
ства, находящихся в единице объема раствора (так называе-
мая’нор м ал ьн а я концентрация). В этом случае при
равенстве концентраций в реакцию будут вступать равные
объемы растворов различных веществ. Раствор, содержащий
I граммэквивалент растворенного вещества в 1 л, называется
нормальным раствором; содержащий 2 граммэквивалента
в 1 л—двунормальным; полунормальным, если в литре нахо-
дится 0,5 граммэквивалента, и т. д. Такой способ выражения
концентрации растворов наиболее употребителен в аналитиче-
ской химии. .
Закон действия масс с учетом коэфициентов активности
Качественный анализ имеет дело преимущественно с разба-
вленными растворами, часто являющимися пересыщенными тем
или иным веществом с весьма малой растворимостью. В по-
добных случаях возможно применять закон действия масс с до-
статочной точностью, принимая действующую массу реагирую-
щего вещества равной общей его концентрации. Если же с такой
предпосылкой подходить к более концентрированным растворам
сильных электролитов (т. е. таких, которые ионизируют на 50%
и более), то будет допущена заметная ошибка; в этом; случае
между действующей, массой а (или активностью) реагирующего
вещества и его общей концентрацией с (выражаемой в молях на
литр) устанавливается следующее соотношение:
a = cf,
где величина f является коэфициеятом активности.
Поэтому равновесие реакции:
А % В С + D
выражается следующим уравнением:
[С] [D]/c/d
гливщ/в ’
в котором буквы, заключенные в скобках, обозначают концен-
трации веществ А, В, С и D в молях на литр, а /д , /в и т. д. —
соответствующие ’коэфициенты активности.
Эти коэфициенты активности не являются постоянными ве-
личинами. В случае бесконечно разбавленных растворов вели-
чина f приближается к единице и тогда активность а становится
равной концентрации с. С увеличением концентрации иона ве-
1 Напомним, что граммэквивалентом является такое количество веще-
ства, которое в данной реакции может отдавать или принимать 1 г (точ-
нее. 1,008 г) водорода, или 8 г кислорода, или эквивалентные им количества
других элементов и их групп. Так, моль хлористоводородной кислоты
является и граммэквивалентом ее; для серной же кислоты одним граммах-
вивалентом будет 0,5 моля ее.
22
дичина f уменьшается, проходя иногда через минимум. Коэфи-
циент активности иона какого-либо электролита зависит от ва-
лентности и свойств данного иона, а также от концентрации
и природы других присутствующих в растворе ионов.
Наши знания коэфициентов активности при различных усло-
виях весьма скудны. Некоторое представление об их измене-
нии в водных растворах при различных концентрациях дает
табл. 1.
Таблица I
Средние коэфициенты активности некоторых ионов1
Молярная концентрация 0,005 0,01 0,02 0,05 0,10 0,20 0,50 1,00 3,(0
По теории для ВА' 0,920 0,900 0,866 0,809 0.756 0,693 0,618 0,559 0,478
НС1 0,829 0,904 0,874 0,830 0,795 0,766 0,757 0,810 1,320
NaCl 0,928 0,904 0,876 0,829 0,789 0,742 0,683 0,659 0,709
КС1 0,926 0,899 0,866 0,812 0,763 0,713 0,649 0,601 0,571
кон 0,927 0,901 0,868 0,810 0,759 0,710 0,671 0,679 0,903
KNO3 .... 0,829 0,899 0,863 0,794 0,724 0,653 0,543 0.449
AgNOg .... 0,925 0,896 0,858 0,787 0,717 0,633 0,501 0,390 —
KJO3, NaJOa . 0,924 0,895 0,856 0,784 0,714 — —. —
По теории лля В" А". . . . . 0,562 0,460 0,359 0,238 0,165 0,101 0,066 0,045
MgSO4 .... 0,572 0,471 0,378 0,262 0,195 0,142 0,091 0,067
CuSO4 .... 0,560 0,444 0,343 0,230 0,164 0,098 0,086 0,044 —
По теории для В" А'., или В'»А" 0,776 0,710 0,634 0,523 0,439 0,362 0,274 0,229
ВаСЬ 0,781 0,725 0,659 0,556 0,496 0,440 0,396 0,399
РЬ(.ЫО3)2. . . 0,763 0,687 0,596 0,464 0,373 0,275 0,168 0,112 —
K,SO4 .... 0,781 0,715 0,642 0,529 0,441 0,361 0,262 0,210 —
Влияние присутствия посторонних ионов на коэфициенты
активности сильных электролитов может быть иллюстрировано
следующими примерами. В концентрированном растворе хло-
рида щелочного металла хлористый водород обнаруживает
большую концентрацию активного водорода, чем тот же хло-
ристый водород в чистой воде. Уксусная кислота являете^ бо-
лее сильной кислотой в присутствии большого количества хло-
ристого натрия. Этот факт интересен потому, что прибавление
ацетата натрия к раствору, содержащему водородные ионы,
приводит к уменьшению концентрации последних вследствие
образования недиссоциированных молекул уксусной кислоты.
Табл. 2 мы считаем полезной при изучении ионизации
электролитов. Она дает приблизительное процентное содержа-
ние активных ионов в 0,1 N растворах при 25°. В случае силь-
ных электролитов приводимые в таблице величины выражают
общую концентрацию ионов, умноженную на коэфициент актив-
1 Таблица составлена на основании данных. Sherrill, проф. Массачусет-
ского технологического института.
2&
кости. В случае слабых электролитов нет необходимости поль-
зоваться фактором активности. При многоосновных кис-
лотах число, стоящее против формулы 'кислоты, показывает
процент молекул, подвергающихся первичной ионизации с от-
дачей одного водородного иона (стр. 20); число, стоящее про-
тив иона, несущего один заряд, показывает степень вторичной
ионизации водородного иона, и, наконец, число, стоящее про-
тив иона с двумя зарядами, показывает степень диссоциации
в третьей стадии с отдачей третьего водородного иона из
первоначально нейтральной молекулы кислоты.
Таблица 2
Кажущиеся величины ионизации обычных электролитов в 0,1 N растворе
Наименование электролита
% ионизации
Соли типа В'А' (например, KNO3).......................
Соли типа Во'А" или В"А/ (например, K2SO4 или ВаСБ)1 .
Соли типа В3'Ат или Б'"А/ (например, Kj [Fe (CN)C1] или
Aicis)................: . . ......................
Соли типа В”А" (например, MgSO,)......................
КОН, NaOH ............................................
Ва(ОН)2...............................................
NH4OH.................................................
НС1, НВг, HJ, HSCN, HNO3, НС1О4, H2SO4, Н2СгО4 . . . .
н3ро4, h3aso4, h2so3, н2с2о4, hso;................ . .
HNOn, HF..............................................
СНзСООН, НС2О/, HSO3'.................................
H„S, H2CO3, H,POZ, HCrO'4.............................
HBO?, HAsO2, HCN, HCO3', нею..........................
HS', HPO4", HAsO4"....................................
НОН (при 25°).........................................
84
73
65
40
90
80
•1,3
90
20-45
7-9
1-2
0,1—0,2
0,002-0,008
0,0001-0,0002
0,0000002
Номенклатура ионов
Как уже указано выше, продукты диссоциации молекул элек-
тролитов в водных растворах, являющиеся носителями электри-
ческих зарядов, Фарадей назвал ионами. Ионы, несущие поло-
жительные заряды и движущиеся при прохождении тока по
направлению к отрицательному электроду — катоду, названы
Фарадеем катионами в противоположность ионам, несущим
отрицательные заряды и движущимся к положительному элек-
троду — аноду, названным им анионами2.
Для обозначения ионов имеются два способа. Так, например,
ионы соляной кислоты обозначаются знаками Н+ и Ci" или Н*
и СГ. Многие авторы предпочитают пользоваться последними
1 Исключения: CdC!2 ионизирует га— 47%; HgCk^ 0,С1%; HgBr2, HgJ2 и
Hg.CNp меньше, чем HgCl».
~ Слова ион. катод, анод и т. п. греческого происхождения; ион (’iT)
значит «идущий»; катод — от греческих слов ката (татя) — вниз и одбс
(ооб;)—путь; ана (ДД) — вверх.
24
обозначениями, занимающими меньше места; особенно громоздко
обозначение знаками плюс и минус поливалентных ионов.
Наименования некоторых ионов .приведены в табл. 3.
Наименования ионов
Таблица S'
Сим- вол Название Катион солей Сим- вол Название Анион солей
Ag‘ Са" Си” Fe” Fe'” Н' К' НН/ Серебряный ион (ион серебра) Кальций-ион (ион кальция) Ион двухва- лентной меди Иондвухвалент- ного железа Ион трехва- лентногр же- леза Водород-ион Калий-ион Аммоний-ион Серебра Кальция Окисной меди Закисного железа Окисного железа Водорода (кислот) Калия Аммония сг СЮ' сю/ сю/ сю/ W ОН' S" SO3" SO/' Хлор-ион Гипохлорит- Г!ОН Хлорит-ион Хлорат-ион Перхлорат- ной Нитрат-ион Гидроксил- ион Сульфид-ион Сульфит-иов Сульфат-ион Хлористоводо- родной кислоты. Хлорновати- стой кислоты Хлористой кис- лоты Хлорноватой кислоты Хлорной КИСЛО".ы Азотной кислоты Гидратов оки- сей (оснований) Сероводородной кислоты Сернистой кис- лоты Серной кислоты
Равновесие между твердым веществом и двумя жидкостями
Хотя чистая или подкисленная вода является наиболее часто
применяемым в аналитической химии растворителем, тем не
менее некоторые вещества более легко растворяются в какой-
либо другой жидкости. Так, растворимость свободного иода
в сернистом углероде приблизительно в 400 раз больше раство-
римости его в воде. Когда иод находится в соприкосновении
как с сернистым углеродом, так и с водой — а эти две жид-
кости лишь мало растворимы друг в друге — то он будет рас-
творяться, главным образом, в сернистом углероде. Более того,
если взбалтывать водный раствор иода с сернистым углеродом,
то последний по отстаивании его от воды будет содержать
почти весь иод. При этом устанавливается равновесие между
раствором иода в воде и раствором иода в сернистом углероде,
подчиняющееся так называемому закону распределения.
Если сд концентрация вещества в растворителе А и св концен-
трация в растворителе В, то равновесие устанавливается, когда:
что и является математическим выражением закона распределе-
ния. Константа К называется к оэфиц центом р а спреде-
25
-ле н и я. Необходимо отметить, что закон в этой простой
•форме применим только к тому случаю, когда состояние моле-
кул1 растворенного вещества в оооих растворителях одно и то
же. Если же, например, вещество диссоциирует в значительной
степени в одном растворителе и едва в другом, то должна
приниматься во внимание концентрация недиссоциированного
вещества в каждом растворителе. Обычно ионизирующее веще-
ство значительно более растворимо в воде, чем в каком-либо
другом растворителе; условие растворимости недиссоциирую-
щих веществ—обратное. Иод растворяется в значительно боль-
шей степени в растворе йодистого калия, чем в чистой воде,
вследствие образования КЛз. В таком растворе устанавливается
следующее равновесие:
KJ -ф J-2 KJ3.
Если такой раствор взболтать с сернистым углеродом, то закон
распределения имеет силу только для свободного иода, содер-
жащегося в обоих растворителях, как в сернистом углероде,
так и в воде<.
Коэфициент распределения иода в системе: «чистая вода —
сернистый углерод» при комнатной температуре равен 1 :400.
Теоретически невозможно удалить весь иод из воды путем одно-
кратного взбалтывания с сернистым углеродом. Но1 если сер-
нистый углерод отделить от воды при ' помощи делительной-
воронки, а водный раствор снова взболтать со свежей порцией
сернистого углерода, то после повторных операций количество
иода, остающегося в воде, практически будет равно нулю.
Иногда при анализе солей галоидных соединений приходится
удалять свободные галоиды из водного раствора; достигается
это на основе принципа распределения применением несмеши-
вающихся с водой растворителей (сернистый углерод и другие).
Хлорное железо- значительно более растворимо в эфире и хло-
ристоводородной кислоте, чем в подкисленной ею воде. По-
этому для открытия малых концентраций железа в исследуемом
продукте берут большое количество последнего и извлекают
хлорное железо путем взбалтывания солянокислого раствора
его с эфиром. Надхромовая кислота более растворима в эфире,
чем в воде; при взбалтывании разбавленного водного раствора
ее с небольшим количеством эфира получают в последнем кон-
центрированный раствор надхромовой кислоты, обладающей
красивой синей окраской, по наличию которой судят о при1-'
сутствии хрома.
Влияние изменения концентрации на ионизацию электролитов
Растворим 1 моль слабого основания, например гидрата
окиси аммония, в V литрах воды; основание при этом будет
частью ионизировано согласно уравнению:,
4-ОН'
26
ла ионы аммония и гидроксила. Обозначим через а часть моля
основания, подвергшуюся диссоциации (величина а, очевидно/
будет дробью, меньшей единицы). Тогда число неионизирован-
ных молей основания будет равно 1—а. Концентрации недис-
социированных молекул и ионов буду!' соответственно равны:
NH4OH NH4' 4- ОН'
1 — а а а
V V
Согласно закону действия масс имеем:
V ’ V «2 „
-j---- = К И 77-----777 = К.
1 — а (1 — а) V
Последнее выражение называется законом разведения
Оствальда. Из него следует, что при уменьшении абсолют-
ной величины концентрации слабой кислоты или слабого осно-
вания (т. е. при разбавлении раствора) относительные концен-
трации водородных и гидроксильных ионов (взятые по отноше-
нию к концентрации недиссоциированных молекул кислоты или
основания) будут увеличиваться. Так, например, если 1 моль
уксусной кислоты растворить в 1 л воды, то- концентрация Н’
при комнатной температуре будет равна 0,004 молярной, т. е.
кислота окажется ионизированной на 0,4%. Если то же самое
количество уксусной кислоты растворить в 1500 л воды, то кон-
центрация Н’ будет около 0,000097 молярной, но ионизация бу-
дет теперь составлять 14,7% от общего количества находящейся
в растворе кислоты.
Закон действия масс в применении к ионизации слабых
электролитов может быть выражен еще другим путем.
Пусть [НА], [Н‘] и [А'] представляют собой соответствен-
ные концентрации слабой кислоты НА и продуктов ее иони-
зации— Н‘ и А', образующихся согласно уравнению:
НА^Н’+А'.
Состояние равновесия согласно закону действия масс выра-
зится следующим уравнением:
[Н'ИА']_Г
[НА]
(константа Кв в данном случае носит название константы
ионизации).
Если кислота не очень слаба, можно пренебречь водород-
ными ионами воды и принять, что [Н’] = [А']. Больше того,
если кислота ионизирована меньше, чем на 10%, и мы удовле-
творяемся точностью до двух значащих цифр, то можно при-
нять концентрацию недиссоциированных молекул кислоты [НА]
равной первоначально взятой концентрации кислоты с. Тогда
вышеприведенное уравнение примет следующий вид:
^- = Ка и
Аналогично концентрация ОН' в водных растворах слабых
оснований выразится уравнением:
[ОН'] = УКъс.
В табл. 4 и 5 приведены константы ионизации некоторых
слабых кислот и оснований.
Таблица 4
Константы ионизации слабых кислот при 25°
Название кислот Ка Название кислот Ка
Азотистая ....... 4,5 -10 i Серная К2 3,0-10-2
Бензойная 6,7-10-5 , Сернистая 7<t .... 1,7-10-2
Винная 9,6-10-* » К2 . . . . 1,0-10-2
„ к2 2,9-10-5 | Сернистоводородная Ki 5,7-10-s
Лимонная К\ 8,7-10-* ! к2 1,2- 10-ю
К2 1,8- 10-5 Синильная 7,0-10-ю
К3 4,0 - 10-е Угольная К 3,5-10-1
Муравьиная 2,0-10-* К2 5,0-10-п
Мышьяковая 5,0-Ю-з Уксусная 1,7-lQ-s
Мышьяковистая .... 6,0- 10-ю Фосфорная Ад .... 1,4-10-1
Пирофосфорная Kt . . 1,4-10-1 ; К2 . . . . 2,0-10-1
, К> . 1,1-10-2 ; , Кз .... 3,6-10-18
„ к3 . . 2.9-10-1 ! Щавелевая Ki . - . . 6,5-10-2
„ Kt . . 3,6-10-э ; , К2 ... . 6,1-10-5
Примечание. В случае многоосновных кислот А^ обозначает константу
ионизации первого кислотного водорода, А’;— константу ионизации второго
водорода кислоты и т. д.
'Таблица 5
Константы ионизации слабых оснований при 25°
Название оснований Кь Название оснований Кь
Аммиа < Анилин Гидразин 1,75-10-5 4,0 • 10-ю 3,0 • io-6 Гидроокись свинца . . Метиламин Пиридин 1 1 7 7 7 ООО С0 ’4’ о —Г
Сильные электролиты, будут ли они кислотами1, основаниями или со-
лями, не имеют констант ионизации. Другими словами, для них величина К
при различных концентрациях не является постоянной. При 100% иониза-
ции величина К .была бы раляа бесконечности и такое значение К, конечно,
бесполезно. Иногда константу ионизации сильных кислот и оснований при-
нимают равной единице; по сравнению с константами диссоциации, дан-
ными в табл. 4 и 5, такая величина оказывается весьма большой. При при-
близительных подсчетах лучше всего принимать, что сильные электролита
полностью ионизированы, или пользоваться приблизительными данными,
приведенными в табл. 2.
28
> Ионизация воды. Водородный показатель pH
Ионизация воды согласно уравнению:
Н2О ^±Н' +ОН'
протекает в весьма малой степени: вода — очень слабый 5лек-
тролит. Согласно закону действия масс равновесие межд/ Н’
ОН'и НЮ выражается следующим уравнением:
[Н'ИОН'] _ „
[Н2О] —Л-
Так как концентрация недиссоциированных молекул воды [НгО]
(выраженная в молях на литр) очень велика по сравнению
с [Н’] и [ОН'], то ионизация воды заметно не изменяет вели-
чины [НЮ]. Поэтому концентрацию недиссоциированной воды
можно считать постоянной величиной. Тогда будем иметь:
[Н‘] [ОН'] = ^.
Величина Кю, называемая ионным произведением воды,
изменяется с температурой, как показывает табл. 6.
Таблица 6
Ионное произведение воды (К,,,) при различных температурах
[Н] [ОН']=№с
Температура в гС 1 Температура в °C
0 0,12 10—14 60 0,93- IO-*3
10 0,3 • 10-1* 70 2,1 -10-13
18 0,59-10-1* 80 2,3 10-13
25 1,0 • 10-1* 90 3,6 • 10“13
30 1,5 • 10-14 100 5,1 -10-11
50 5,5 • 10-и
Константа К,,,'имеет большое значение в аналитической хи-
мии, помогая разобраться в процессе нейтрализации кислот и
оснований. В чистой воде при температуре 25° концентрация
Н' и концентрация ОН' равны (каждая) ИГ7 молям в литре; по-
этому ионное произведение воды Kw равно 10 14. Ни в коем слу-
чае не следует думать, что любой образец дестиллированной воды,
находящийся в лаборатории, имеет точно такую концентрацию
Н’ и ОН'. Вода, находясь на воздухе, поглощает двуокись
углерода, что ведет к повышению концентрации водородных
ионов за счет образования угольной кислоты. Концентрация
водородных ионов может возрасти при этом в ~ 20 раз. Вода
же, хранящаяся в стеклянной посуде, растворяет стекло, при-
обретая щелочную реакцию. Кроме того, дестиллированная
вода часто содержит небольшие количества аммиака, образую-
•29
щего'ся при перегонке воды из находящихся в ией азотсодер-
жащих веществ.
Так как ионное произведение воды К при данной темпе-
ратуре — величина постоянная, легко определить концентрацию
ОН' какого-нибудь водного раствора, если известна концентра-
ция Н' и наоборот. *
Экспериментально величину [Н' ] находят потенциометриче-
ским методом. Определяемый при этом потенциал водо-
. 1
родного электрода пропорционален выражению 1g -щу •
Когда [Н‘] меньше единицы, величина 1g —j положительна
и ею удобно пользоваться при различных вычислениях. Вели-
чину 1g ущ обозначают символом pH, называя его водород-
ным показателем.
Соотношение между pH и концентрацией Н' или ОН'может быть иллю-
стрировано несколькими примерами. Так как логарифм дроби равен лога-
рифму числителя минус логарифм знаменателя, а логарифм 1=0, то вели-
чина lg .-л-; получается путем вычитания логарифма! [Н' ] из нуля. Это
|H-J
положение иногда формулируют следующим образом: pH есть отрицатель-
ный логарифм концентрации водородных ионов (выраженной в молях на
литр).
Если концентрация водородных ионов равна 10-7, то логарифм 10“’
равен 7 и тогда pH = 0—(—7) = 7. Эта величина соответствует нейтраль-
ной точке воды. Чем больше величина pH, тем меньше концентрация водо-
родных ионов; растворы, имеющие pH < 7, обладают большей кислотностью,
а имеющие pH > 7 — большей основностью по сравнению с чистой водой.
Когда pH = 6, концентрация Н" в 10 раз больше, чем в чистой воде; при
pH = 5 в 100 раз и т. д. •
Определим, чему равняется pH, если концентрация Н‘ равна
0,00046 -Иоля/.-г.
Как известно, любая десятичная дробь может быть представлена в виде
числа между 0 и 10, умноженного на 10 в соответствующей степени. Так,
число 0,00046 может быть представлено в (Виде 4,6 • 10~4. В этом случае
1 104
lg —g—jjj- 4 ~ lg -jg- . Чтобы найти pH, вычитаем 1g 4,6 из логарифма 10
104, который равен 4. Так как 1g 4,6 = 0,66. то искомая величина
pH = 4 — 0,66 = 3,34.
Чему равняется pH раствора, содержащего 0,00046 моля/л ОН'?
Подобно тому как концентрацию Н’ мы выражаем в величинах аодс
1
[Н ] ’
родного показателя
или в виде 1g
то же самое можно применить
и к концентрации ОН', вводя символ рОН = 1g • Точно так же для
|UH ]
ионного произведения воды можно ввести обозначение рКю = 1g = - =
K-w
= Ig Ду = 14 (при комнатной температуре). Очевидно pH + рОН = рКгр
и pH = 14 — рОН. Если ОН' = 0,00046, торОН = 3,34 и pH = 14 — 3,34 = 10,66.
Соотношения между pH и рОН приведены в табл. 7. (НС1 и NaOH
предполагаются полностью ионизированными).
33
Таблица 7
Соотношения между величинами pH и рОН (при комнатной температуре)
•jH рОН
/4
О 4t/zviiC/i
/.?
- - — -- ujPl 1 КД
/
U^UiNWCk ~~ ‘
Г 1?\Г PT-T г*ллп
3 - 6,/JY CilgbUlJil ft
с - !№
Раствор, соде рок. ащ ий • ~
£ /7.Л\ГСН3СООН и OjNCnzCGG№ 9
е — — 9
7 Чистая Зова T
8 ~ /7/ЛГЫ5зНР(1 8
9 Раствор, содержащий s
<г /7,/A7NH4ОН
<0 — —
11 £7/7x/nh4OH 3
!?. i — (7,/7/jVNa.OH -j 2'
<3 —/7./Л7 NaOH /
14 /.ZZTVNaOH 0
Произведение растворимости
При растворении какого-либо твердого вещества в жидкости
имеют место два взаимно противоположных процесса: 1) пере-
ход молекул (или ионов) растворяемого вещества в раствор и
2) выделение из раствора молекул растворяемого вещества на
его поверхности. Скорость первого процесса можно, допустить
пропорциональной поверхности растворяемого вещества; при
Достаточном избытке последнего ее можно считать постоянной.
Скорость обратного выделения молекул растворенного вещества
пропорциональна их концентрации в растворе. Эта скорость по
мере растворения твердого вещества, т. е. по мере повышения
концентрации раствора, непрерывно возрастает и в некоторый
момент может стать равной скорости перехода молекул в рас-
твор. Начиная с этого момента, концентрация раствора (при
постоянной температуре); очевидно, будет оставаться постоян-
ной, а раствор и твердое вещество будут находиться в состоя-
нии устойчивого динамического равновесия. Такой раствор
будет являться насыщенным.
Если в насыщенном растворе концентрация растворенного
вещества (при постоянной температуре) как-либо повысится
(например, за счет испарения), то это поведет к повышению
скорости выделения молекул из раствора, в результате чего она
превысит скорость перехода молекул в раствор; в этих усло-
виях часть растворенного вещества выделится из раствора и
между раствором и твердой фазой снова установится первона-
чальное равновесие.
Возьмем какую-либо трудно растворимую соль, например
хлористое серебро, растворимость которого в чистой воде равна
0,00001 /иоля/л (1,5 лг/л). В растворах с такой и меньшей кон-
центрацией хлористое серебро будет полностью диссоцииро-
вано согласно уравнению:
AgCl -> Ag’ + Cl'.
В силу этого скорость выделения молекул из раствора (п) бу-
дет пропорциональна концентрации каждого из ионов, т. е.
пропорциональна их произведению:
vi = k[Ag'] [Cl’].
В случае насыщенного раствора, находящегося над избыт-
ком твердого AgCl, эта скорость будет равна скорости пере-
хода молекул в раствор, которая при данных условиях, как
указано выше, является постоянной величиной. Тогда:
k[Ag’ ] [СГ] = const;
[Ag‘] [СГ] =5AgC1 .
Последнее выражение показывает, что произведение
концентраций ионов в насыщенном растворе
какой-либо трудно растворимой соли является
32
постоянной величиной1. Это произведение концентра-
ций ионов -получило название произведение рас тв о р и-
м о ст и; в общем виде его обозначают символами S,, (® англий-
ской литературе; от solubility product) или Lp (в немецкой ли-
тературе; от Loslichkeits-Produkt). Произведение растворимости
какого-либо определенного- вещества обозначают буквами S
(или L) с проставленной внизу формулой этого вещества (на-
пример, SAgCl, MgCl)-
В случае вещества, распадающегося в растворе более чем на
два иона, как, например, РЬЛ, произведение растворимости
его 5рьл, будет равно [Pb”] [J']2, где [РЬ”] и [J']—кон-
центрации ионов свинца и иода в воде, насыщенной иодистым
свинцом. Вообще, если вещество А,„В,г при ионизации дает
п/ ионов А и п ионов В, то произведение растворимости его
находят с помощью следующего уравнения:
SaA = iAlm iBi№>
где [А] и [В] —концентрации соответствующих ионов в насы-
щенном растворе (выраженные в молях в литре).
Приведем несколько примеров, иллюстрирующих метод вычисления
произведения рас твори мости.
Насыщенный раствор йодистого серебра содержит 3,0 • 10~6 г
{= 0,0030 мг) этой соли в 1 л. Молекулярный вес йодистого серебра равен
234,8. Поэтому (насыщенный раствор содержит:
л л « д
= 1,3 • 10 -8 моля/л.
Можно предположить, что при этом разбавлении иодистсе серебро пол-
ностью ионизировано:
AgJ -> Ag‘ + J'
и так как 1 моль йодистого серебра дает 1 моль ионов серебра и 1 моль
ионов иода, то, очевидно, что концентрации Ag’ и J' будут также равны
1,3-10 ® моля/л. Тогда произведение растворимости будет равно:
[Ag’ ] [J'J - (1,’3 • 10-s)(l,3 • 10-Ц = 1,7 • 10-ie = sAgJ.
Насыщенный раствор фосфорнокислого серебра содержит 6,5 • 1(У3 г
6,5 мг) последнего в 1 л. Это вещество значительно более растворимо
в воде, чем иодистое серебро, но произведение растворимости его меньше.
Молекулярный вес фосфата серебра равен 418,7. Поэтому насыщенный
раствор содержит:
6,5' IO’ 3 1А 1П 1
•--777г- = 1,6 • 10-5 МОЛЯ /!
При полной ионизации:
AgjPCh3Ag’ + POi'"
1 При условии, что температура остается постоянной.
3 Зак- 988. Тредвели-Голл, т. I.
33
I моль фосфата серебра дает 3 моля .ионов серебра1 w 1 моль фосфат-
ионов.. Произведение растворимости:
[Ag'J’lPO/"] = [3- 1,6- 1СГ353[1,6 - 10“5 *] = 1,8- 10-ie = SAgsPOi.
Обратно, по величине произведения растворимости можно вычислить
концентрации ионов и соли в насыщенном ее растворе (как в молях
в литре, так и в граммах в литре).
Например, произведение растворимости сернокислого бария:
^BaSO4 = 'ИЗО/'] — 1,2 • ICE10.
В растворе чистой соли концентрация Ва'' (выраженная в молях
в литре) будет равна концентрации! SO/' и
[Ва’ ’ИЗО/'] = .[Ва- •]«= [SO/']2 = 1,2-10-“;
откуда ________
[Ва"] = [SO/'J = /1,2 10-1° = 1,1 • 10-5 моля/л.
Так как молекулярный вес Ва = 137,36, a SO/'= 96,06, то ,в 1л насьг
щенногр раствора BaSOi находятся:
137,36’1,1 • 10-5 = 1,5 • 10“’ г/л ионов Ва
и
96,06’1,1 • 10“s — 1,05’10“’ г/л ионо® SO».
В качестве более сложного, примера рассмотрим фосфат свинца. Про-
изведение растворимости [РЬ ’ ’ ]а[РО/ ']2 = 1,5- 10н32. Если х молей
РЬз(РО4)з растворено в 1 л воды и соль полностью ионизирована, то
раствор содержит Эх моля РЬ' ’ и 2х моля РО/" и
(Зх)Ч2х)2 = 108х5 = 1,5- 10“32 = 1500’10“”;
xs=14’10“35; х = 1,7 Ю“7 * * (см. сноску2).
1 Если х молей AgsPOr .растворены в 1 л воды и AgsPCU полностью
ионизировано, то концентрация Ag’ равна Зх, а РО/" равна х, когда
концентрации выражены в молях в литре. Если же концентрации выражены
в граммэквивалентах в 1 л (стр. 22), то х молей AgsPCk дают Зх грамм-
эквивалента AgsPO'4, которые ионизируют на Зх граммэквивалента Ag‘J.
и Зх траммэквивайента РО/". Выражение закона действия масс:
[AglWI _ „
[Ag8PO4]
сохраняет свою силу для любого метода выражения концентраций, но
вообще проще и лучше выражать произведение растворимости в молях
в литре и считать, что в .насыщенном растворе нацело ионизированного
фосфата серебра, содержащем х молей AgsPCu,
,[Ag‘.]3 [РО/"]1 = 27х4.
2 С помощью таблиц логарифмов легко' извлечь корень пятой степени
из такого числа, как 14 • 10~33, так как корень из произведения равен про-
изведению корней отдельных множителей.
Корень пятой степени из 10“35 = 10“7.
1g 14 = 1,15
i/s 1g 14 = 1/5’1.1'5 = 0,23 = 18 1,7.
Таким образом., если' х5 — 14’ 10“85, то х= 1,7’ 10“7. Если показатель
степени 10 не делится на 5, то нужно преобразовать подкоренное чисдо так,
чтобы показатель степени делился. Так, |/ 1,4- 10“34 = |/14 • 10~35.
Точно так же производится извлечение и других корней.
34
- Ранее (стр. 30) уже было указано на удобство' пользования отрицатель-
дым логарифмом какого-нибудь числа для выражения малых коицеитраций.
Так, Кольтгоф (Kolthoff) в своих многочисленных .работах пользуется вместо
.произведения растворимости Sp величиной lg-j—=pS. Если произведение
рактво>рйм|асти AgsPOi = 1,8 • 10~18, то pS = 17,74.Р
Являясь характеристикой растворимости соли в чистой воде,
произведение растворимости позволяет учитывать изменение
концентрации одного из ионов трудно растворимой соли в слу-
чае изменения концентрации другого иона. Пусть к насыщен-
ному раствору сернокислого бария будет добавлен раствор
сернокислого натрия, так что концентрация ионов SOi" станет
равной 10-2 моля/л. Так как [Ва’’] [SOT'] = const, то это воз-
можно только в том случае, когда одновременно понизится кон-
центрация ионов Ва". Для данного случая ее можно опреде-
лить из соотношения:
[Ва'*]• IO-2 = 1,2 -10-10;
1 9.10-Ю
[Ва"] = -’-j-Q-g— = 1,2 • 10-8 моля{л,
т. е. по сравнению с раствором в чистой воде концентрация Ва'"'
понизится в
1,1 • Ю-о 1ЛПЛ
ИГКМ~1С0° Раз-
Приведенный пример иллюстрирует общее положение, что
растворимость трудно растворимой соли еще более понижается
(по сравнению с растворимостью ее в чистой воде) в присут-
ствии других солей, имеющих общие ионы с трудно раствори-
мой солью.
Однако из этого правила имеются исключения. Оно1 не при-
менимо к тому случаю, когда один из ионов осадка обнаружи-
вает тенденцию к образованию растворимого комплексного
иона с избытком осадителя. Так, хлористое серебро в очень
разбавленном растворе хлористого натрия, действительно, ме-
нее растворимо, чем в воде, но в насыщенном растворе пова-
ренной соли оно растворяется больше, чем в чистой воде,
вследствие образования комплексного иона. Сульфат бария ме-
нее растворим в разбавленном растворе серной кислоты, чем
в воде, но в концентрированной серной кислоте он легко
растворяется. В этом случае, вероятно, образуется ион HSO4";
следует отметить, что при этом растворителем является все же
концентрированная серная кислота, а не вода. Гидроокись алю-
миния осаждается при очень осторожной нейтрализации соли
алюминия, но она растворяется в избытке раствора гидроокиси
натрия с образованием алюмината натрия. Ни один из этих при-
меров не противоречит закону действия масс, но они показы-
вают, что необходимо учитывать все могущие происходить
реакции.
Применение вышеизложенного Принципа к солям, обладаю-
щим очень большой растворимостью в воде, редко бывает на-
3*
35
дежно. Хлористый натрий, например, значительно менее рас-
творим в концентрированных растворах соляной кислоты, чем
можно было бы ожидать.
Числовые значения констант произведения растворимости
зависят от единиц, которыми пользуются при измерении массы
растворенного вещества или ионов и объема раствора/ Обычно'
Принято выражать концентрацию в молях в 1 л. В табл. 8 рас-
творимость вещества выражена тремя способами: в граммах рас-
творенного вещества в 1 л, в молях в 1 л и, наконец, в величи-
нах произведения растворимости, отнесенных к молям в 1 л.
Растворимость большинства приведенных в таблице веществ на-
столько мала, что количеством растворенного вещества чаще
всего можно пренебречь и считать его не растворимым
б воде. Последний термин должен быть понимаем только с ого-
воркой, что нет веществ абсолютно не растворимых в воде.
Табл. 8 составлена по многим источникам и приведенные числовые дан-
ные основываются в некоторых случаях на определениях растворимости по
методам, которые в настоящее время не могут считаться точными. Однако
таблица дает хорошее представление об относительном порядке величин'.
Например, растворимость сернистой меди в таблице дана равной
8,8'КУ-21 г/л воды. Очевидно', что экспериментальное определение такого
малого количества сопряжено с трудностями и вероятность ошибки очень
велика. Так как практически такой ничтожной величиной можно пренебречь,
то часто указывается на нерастворимость сернистой мели в воде. Однако
поучительно сравнение произведений растворимости различных сульфидов,
на изучении которой были основаны важные методы их отделения. В табл. 8
приводятся только две значащие цифры; приведение большего числа цифр
оправдывалось бы для веществ с большей растворимостью, но даже первая
значащая цифра сомнительна для весьма трудно растворимых веществ.
Величины были определены при различных температурах и в присутствии
других веществ в растворе. Было бы необходимо старательное критическое
изучение всех этих экспериментальных данных, чтобы дать точное число
значащих цифр с указанием точной температуры.
При составлении табл. 8 .некоторые величины растворимости, выражен-
ные в граммах в 1 л, были высчитаны по числовым данным произведений
растворимости, найденным в литературе. Производя эти вычисления, мы
исходили из предположения, что вещества полностью ионизированы и что
исключены условия для их гидролиза. Так, в случае карбсиата кальция
Предположено, что в его насыщенном растворе ионы кальция и ионы кар-
боната находятся в одинаковом числе. В действительности же, однако,
в растворе имеет место реакция между водой и СОз"-иана.ми, которая
ведет к образованию НСОз'-ионов, и концентрация ОН' благодаря этому
становится большей, чем в чистой воде, в чем легко убедиться при помощи
индикаторов. Протекающая при этом реакция выражается уравнением:
СОз" + НЮ ZНСОз' + ОН'.
Результатом является следующее. Либо карбоната кальция должно раство-
риться больше, чем это было бы при других условиях, так что величина,
данная в таблице для веса растворенного СаСОз, слишком мала, если верна
величина произведения растворимости; либо, если вес растворенной соли
верен, то приведенная в таблице величина произведения растворимости
слишком велика. Степень гидролиза возможно вычислить <м> константам
диссоциации воды, кислоты и основания, образующих соль, но. это вычи-
сление трудно, потому что связано с решением кубического уравнения. То
обстоятельство, что гидролиз обыкновенно не принимался во внимание
в табл. 8. оправдывается тем, что числовые данные недостаточно точно
известны, чтобы поручиться за математическую работу, нужную для выпол-
нения необходимых вычислений, которые потребовались бы при допущении
36
Таблица 8
Растворимость трудно растворимых электролитов при комнатной
температуре
Вещество Растворимость Произведение растворимости
в граммах в литре В молях в литре
AgBr 1,1 -10-4 5,9-10-7 [AgJ [Вг] = 3,5 -10-13
AgBrOs 1,7 7,1 • Ю-з Ag] [BrOs] = 5,0-10-5
Ag2(CN)2 4,05 10-4 1,5-10-6 Ag] [Ag(CN)2] = 2,2 • 10-12
AgCNS 1,4 10-4 8,5 10-7 AgJJCNS] =7,1 • 10-13
AgoCOj 3,0 • 10-2 1,1 • 10-4 Ag]2[CO3] =5,0-10-12
Ag?C2u4 3,5 10-2 1,1 -10-4 Agl2[C2O4] = 5- 10-12
AgCl 1,5 -Ю-з 1,1 - 10-5 Ag (Cl] = 1,2-10-10
Ag2CrC)4 2,5 .10-2 7,5 10-5 Ag 2[CrO4] = 1,7 • 10-12
AgsCijO? 8,3 • 10-2 1,9-10-4 Ag 2 [Cr2O,] = 2,7 10-И
AgJ 3,0 • 10—6 1,3- 10-« Ag [J] = 1,7-10-16
AgJO3 4,4 13-2 1,5-10-4 Ag [JO3] = 2,3 • 10-8
Ag2O 2,1 -10-2 9,0-10-5 Ag [OH] = 1,9-10-s
AgOH 1,7 .10-2 1,4-10-4 Ag [OH] = 2,0 • 10-8
Ag3POt 6,5 - Ю-з 1,6-10-5 Ag]3 [PO4] = 1,8- 10-18
A'-S 7,3 .10-15 3,4-10-'7 Ag«[S] = 1,6- 10-49
Ag2SO4 8,0 2,6 10-2 [Ag 2[SO4] = 7,0-10~5
BaCO3 8,1 • 10-3 4,1 • 10-5 Ba [CO3] = 7,0-10-9
BaC»O4 9,2 10-2 4,1 10-4 Ba] C2O4] = 1,7-10-7
BaCrO4 3,8 • 10-з 1,5-10-5 Ba [CrO4j = 2,3-10-10
BaF, 1.3 7,5-Ю-з Ba] F]2= 1,7-10-6
Ba(JQ3)2 2,5 • 10-1 5,3-10-4 Ba] [JO3]2 = 6,0 • 10-ю
BaSO4 2,5 -Ю-з 1,1 -10-5 Ba] [SOJ — 1,2 - 10-ю
CaCO3 1,3 • 10-2 1,3 10-4 [Ca] [COS] = 1,7 • 10-8
CaC?O4 5,7 - Ю-з 4,5-10-5 [Ca [C2O4] = 2,0 • 10-9
CaC4H4O6 1,7 -10-1 . 8,8-10-4 [Ca] [C4H4O6] = 7,7 -10-7
CaCrO4 23' 1,5-10-1 [Ca] [CrO4] = 2,3 -10-2
CaF, 1,6 -10-2 2.0-10-4 Ca F]2 = 3,2 • 10-4
Ca(JO3)-> 2,1 5.4 • Ю-з Ca JO3]2 = 6,5 10-7
CaSO4 1,1 7,8-10—3 Ca] SO4] =6,1 - 10-s
CdCgO^ 2,0 • 10-2 1,0- 10-4 [Cd] [C2O4] = 1,1 • 10-8
CdS 8,6 -10-13 6,0 10-15 [Cd] [S] = 3,6 • IO-29
Ce2(C<>,O4)s 4,1 • 1С-4 7,5-10-7 [Ce]9 [C2O4]3 = 2,6-10-29
Се2(С4Н4О3)3 4,4 -10-2 6,1 10-5 [Ce]2 [C4H4O6]3 = 9,7 -10~20
(тартрат)
. Ce(JC3)3 1,3 1,9-Ю-з [Ce] [JO3P = 3,5 • 10-Ю
k Co(OH)2 5,5 -10-5 7,4-10-7 [Co] ]OH]2 =1,6 -10-is
s CoS 1,6 • 10-12 1,7- 10-13 [Co] [S] = 3 • 10-26
v Cu2Br2 2,9 -10-2 1,0-10-4 [Cu] Br] = 4,1-10-8
i Cuo(CNS)., 5,0 -10-4 2,1 • 10-6 [Cu CNS] = 1,7-10-П
iCu(C2O4) 2,6 -10-2 1,7 • 10 4 [Cu C2O4] = 2,9 -10-8
Cu.,Cl2 1,2 -10-1 6,0 1U-4 [Cu Cl] = 1,4-10-6
3,0 • 10-4 8,0-10-7 [Cu [J] = 2,6 -10-12
37
Продолжение табл. 8
Вещество Растворимость Произведение растворимости
в граммах в литре в молях в литре
Cu(JO8)2 3,0 7,2.10-3 [Си] [JO3]2 = 1,4 • 10—7 '
CuS 8,8 • 10-21 9.2-10-23 [Си] [S] = 8,5 • 10-45
Fe(OH)2 1,44-10-3 1,6-10-5 [Fe][OH]2 = 1,6-10-14
Fe(OH)3 4,8 -10-8 4,5 • 10-ю [Fe] [ОН]3= 1,1-10-36
FeS 3,4 -10-8 3,9 • 10-ю [Fe] [S] = 1,5 • 10-19
Hg2Br2 3,9 • 10-5 6,9 • 10-8 [Hg?J [Br]2 = 1,3- 10-21
HggCla 3,8 -10-4 8,0-10-7 [Hg2] [CS]2 = 2,0 • 10-18
Hg2J2 2,0 • 10—7 3,1 10-ю [Hg2] [J]-'.= l,2.10-28
HgO 3,2 -10-7 1.5-10-9 [Hg][OH]2= 1,4 -10-26
HgS 1,5 • 10-24 6,3-10-27 [HgJ [S] = 4-10-53
khc4h4o6 3,2 1,7-10-2 [K] [HC4H4O6] = 3,o • 10 -4
K2PtC Ig 11 2,3-10-2 LK]2 [PtClcl = 4,9 • 10-5
La2(C2Ot)3 6,0 -10-4 1,1 • 10-6 [La]2 [C2O4P = 2,0 • 10—38
Са2(С4Н4О3)з 5,2 -10-2 7,2-10-5 [La]5 [C4H4O6]3 = 2,0 • 10-19
La(JO3)3 1,5 2,2-Ю-з [La] [JO3]3 = 5,9 • 10-ю
MgCO3 4,3 -10-1 5,1 • 10-з [Mg] [CO3] = 2,6 • 10-5
MgC2O4 1,0 9,3 • 10-з [Mg] [G>0,] = 8,6 • 10-5
MgF2 7,4 -10-2 1.2-Ю-з [Mg| [Fl2 = 7,0 • 10-9
MgNH4PO4 8,6 • 1 Э-з 6 3 • 10-5 [Mg] INHJ • [PO4] = 2,5 • 10-13
Mg(OH)2 4,9 • 10-3 8,5 • IO-5 [Mg] [OH]2 = 1,2- 10-П
Mn(OH)2 1,9 -10-3 2,2 -10-5 [Mn] [OH]2 = 4,0-IO-»
MnS телес- ного цвета 2,2 -10-7 2,6 -10-8 [Mn] [S] = 7 - 10-Ю
MnS зеле- ного цвета 2,2 -10-9 2,5-10-н [Mn] [S] = 6,2 -10-22
Ni(OH)2 5,6 • 10-5 6,0-10-7 [Nil [OH]2 = 8,7 • 10-Ю
NiS наиме- нее раство- римая алло- троп. форма 7,0 -10-11 1,2 -10-12 [iv] [8] = 1,4 • 10-24
PbBr2 9,7 2,7-10-2 [Pb] [Br]2= 7,9-10-5
PbCO3 4,8 -10-5 1,8-10-7 [Pb] [CO3] = 3,3 10-14
РЬС2О4 1,7 -10-3 5,8-10-6 [Pb] [C2O4] = 3,4- 10-П
PbCI2 11,0 3,9-10-2 {Pb] [Cl]2 =2,4- 10-4
PbCrb4 4,3 -10-5 1,3- 10-7 [Pb] [CrO4] = 1,8-10-14
PbF2 2,9 -10-1 1,2-Ю-з [Pb] [F]2= 7,0- 10-9
PbJ, 6,8 .10-1 1,5-Ю-з [Pb] [J]2 = 1,4-10-s
Pb[JO,)2 1,6 • 10-2 4,2-10-5 [Pb] [JO3]2 = 3,0-10-13
Pb3(PO4)2 1,4 -10-4 1,7-10-7 [Pb]3[PO4]2= 1,5-10-32
PbS 4,9 .10-12 2,0 • 10-14 [Pb] [S] = 4,2 • 10-28
PbSO4 4,5 -10-2 1,1 • 10-4 [РЫ iSO4] = 1,1 .10-8
38
Продолжение табл. 8
Вещество Растворимость Произведение растворимости
в граммах в литре в молях в литре
SrCO3 5,9 - Ю-з 4,0-10-5 [Sr [СО3] = 1,6 • 10-9
SrC2O4 4,4-10-2 2,4 10—4 [Sr [С2О4] = 5,6 • ю-з
SrF2 2,3 • 10-1 1,8-10-3 [Sr [F]2 = 2,5-10-9
SrS04 9,6-10-2 5,3-10—4 [Sr] [S О4] = 2,8 • 10-7
TIBr 4,0-10-1 1,4-Ю-з [Tl] [Br] =2,0 -10-6
TlBrO3 3,0 9,1 • Ю-з [Tl] [BrO3] = 8,5 • 10—5
T1CNS 3,2 1,2-10-2 [Tl] [CNS] = 1,4-10—4
T1C1 3,4 1,4-10-2 [Tl] [Cl] = 2,0 • 10—4
TU 6,4 • 10-2 1,7 • 10—4 [Tl] [J] = 2,8-10—8
T1JO3 5,7-10-1 1,5-Ю-з [Tl] [JO3] = 2,2 • 10-6 ‘
Tl2s 2,9 • 10-6 6,6-10-9 [Tip [S] = 1,2 • 10-24 (
Zn(OH). 6,1 • 10-5 6,3-10-7 [Zn] [OH]2= 1,0-10-is
ZnS 3,3 -10-ю 3,5-10-12 [Zn] [S] = 1,2-10-23
наличия гидролиза', даже если бы он превышал 50%!, как в случае ₽ карбо1.,
натай кальция.
В литературе имеется большое число работ, посвященных раствори-
мости химических соединений, и часто бывает трудно согласовать некото-
рые приводимые данные. В табл. 8 мы пользовались величинами, взятыми
из труда Кольрауша (Kohlrausch), который вместе со своими учениками
опубликовал ряд статей между I860 и 1903 пг. Данные Кольрауша основаны
на измерениях электропроводности растворрв, приготовленных путем пере-
мешивания исследуемой соли с водой до установления равновесия. Беттгер
(Bottger) в 190,3 г. опубликовал данные о растворимости веществ, многие
из которых хорошо согласуются с данными Кольрауша!
В 1906 г. Вейгель (Weigel) опубликовал результаты обширного исследо-
вания по вопросу о растворимости сульфидов. Его результаты также осно-
вывались на измерениях электропроводности, но, устанавливая соотношения
между молярной растворимостью и произведением растворимости, он пред-
полагал, что сульфиды при растворении полностью гидролизуются. Данные,
полученные Вейгелем, при сравнении с данными' Кольрауша и Беттгера
показывают, что растворимость сульфидов (кроме сульфидов щелочных и
щелочноземельных металлов) меньше растворимости обычных трудно раство-
римых солей. Тем не менее данные Вейгеля не могут удовлетворительно
объяснить выпадение отдельных сульфидов из растворов различной кислот-
ности. Так, например, Вейгель нашел, что HgS является наименее раствори-
мым сульфидам, и определяет его растворимость равной 0,054.10“® моля/л,
в то время как растворимость ZnS найдена им равной 70,6 • 10~®, MnS
71,6 • 10~в и FeS 70,1 • 10“’. Все эти данные весьма плохо согласуются с усло-
виями осаждения указанных катионов сернистым водородом!. Они не дают
Достаточной разницы в растворимости HgS (наименее растворимого из
сульфидов) и MnS (наиболее растворимого ив них), Трудно объяснить,
почему HgS выделяется даже ив очень кислых растворов, в то время как
весьма низкая концентрация кислоты препятствует осаждению MnS. Известно
также, что ZnS может быть полностью осажден из, слабокислого раствора,
из которого ионы марганца не осаждаются; это не может быть объяснено
данными Вейгеля, по которым растворимость MnS почти равна раствори-
мости ZnS.
В 1909 г. Брунер (Bruner) и Завадский (Zawadski) подошли к раство-
римости сульфидов на основе закона действия масс и принципа произведе-
ния растворимости; в их распоряжении имелись также данные относительно
39
первичной и вторичной ионизации сернистого водорода. Пользуясь этими
данными, авторы подвергли пересчету результаты, полученные некоторыми
из предыдущих исследователей, и определили растворимость HgS равной
3,2 • 10-24 или 2,8 • 10-27, а растворимость MnS 2,6 • 10~8.
Такие противоречия встречаются и в величинах растворимости окисей
и гидроокисей. Так, Реми (Remy) и Кульман (Kuhlmann) в 19^4—1925 гг.
нашли, что в 1 л чистой воды растворяется l,8-10~s моля Zn(O'H)a, вели-
чина же, найденная Бриттаном (Britton) в 1925 г., равна 3,4-10~9.
Когда хотят узнать, какое количество осадка растворится при его про-
мывании водой, лучше пользоваться данными Вейгеля для сульфидов и
Реми и Кульмана для гидроокисей, хотя и они могут оказаться несколько
низкими. Если же встает вопрос, произойдет ли осаждение или возможно
отделение путем осаждения одного иона от другого, следует рекомендовать
для сульфидов пользоваться данными Бруннера' и Завадского, а для гидро-
окисей— данными Бриттона. Мы учитывали использование величин раство-
римости для последней цели при составлении табл. 8.
Солевой эффект. Ранее уже было указано (стр. 22), что закон дей-
ствия масс неточен, если считать «действующими массами» общие концен-
трации молекул или ионов. Произведение растворимости соли типа ВА, ко-
торая образует одновалентные ионы В’ и А', может быть выражено более
точно уравнением:
av. ' ° А = ^ВА1
где ав и 17А обозначают соответственно действующие массы ионов В' и А'.
Так как а = cf, то предыдущее уравнение принимает вид:
IB-] [А']/в/а = 5ВЛ.
В этом выражении Sba рассматривается как истинная константа, чего
нельзя сказать о величине коэфиц.иентов активности. В насыщенном рас-
творе трудно растворимой соли величины /в и fA могут считаться равными
единице и, следовательно, в этом случае коэфициентами активности можно
пренебречь. Если же. в растворе находится какой-либо электролит, не име-
ющий общего иона с осадком, то значения f в*- /д уменьшаются и общая
формула произведения растворимости будет:
%,
[В-] [Д'] =
Последнее выражение указывает, что растворимость осадка в растворе
какого-либо электролита, не имеющего с ним общего' иона, является боль-
шей, чем в чистой воде. Это явление называют солевым эффектом.
Солевой эффект не следует смешивать с процессом' высалива-
ния, когда к какому-нибудь коллоидному раствору прибавляют для коагу-
ляции значительное количество хлористого натрия.
Следующие данные иллюстрируют явление солевого эффекта. В 0,01 N
растворе КМОз растворяется AgCl на 12%, a BaSOi на 170% больше, чем
в таком же объеме чистой воды; оксалат кальция растворяется в 0,01 Л'
растворе NaCl на 60% больше, чем в чистой воде. Эти числа показывают
также, что действие прибавленного электролита, не содержащего общего
иона с осадками, повышается с валентностью ионов осадка; оно также
зависит и от природы прибавляемого электролита,.
Влияние температуры на растворимость. Если соль растворяется с по-
глощением тепла, причем растворение сопровождается охлаждением самого
раствора, то растворимость соли с повышением температуры увеличивается.
Это согласуется с принципом Ле Шателье (Le Cha teller): к а к о е-л ибо из-
менение факторов, определяющих равновесие, вызы-
вает смещение равновесия в направлении, противопо-
ложном эффекту произведенного изменения. Большинство
осадков растворимо в горячей воде больше, чем в холодной; это особенно
заметно в случае хлористого серебра, 21 .кг которого растворяются в 100 .ил
кипящей воды и лишь 0,9 .иг в том же объеме при 10е.
40
Образование комплексных ионов
Хлористое серебро легко растворяется в разбавленном рас-
творе аммиака, причем протекает следующая реакция:
AgCl + 2NH3 Ag(NH3)2Cl.
Изучение свойств этого нового вещества показывает, что
оно диссоциирует в водном растворе, главным образом, по урав-
нению:
Ag(NH3)2Gl [Ag(NH3)2]' + Cl'.
С ионной точки зрения эти два уравнения могут быть вы-
ражены следующими:
AgCl - Ag' + CI'; Ag' + 2NH3 =t [Ag(NH3)2]'.
Согласно закону действия масс повышение концентрации
аммиака будет сдвигать равновесие реакции слева направо.
В нормальном растворе аммиака отношение концентрации ионов
'[Ag(NH3)2]' к концентрации ионов серебра Ag' равно 107 : 1.
Ион [Ag(NH3)2]' не дает ряда реакций, характерных для про-
стого иона Ag'. Его называют комплексным катионом.
Если к раствору нитрата серебра прибавить цианистый ка-
лий, то образуется белый осадок цианистого серебра:
Ag' + CN' pAgCN,
который растворяется в избытке осадителя:
AgCN + CN'-> [Ag(CN)2]',
з результате чего серебро входит в состав комплексного аниона.
3 этом случае отношение концентрации комплексного иона
< концентрации простого иона даже больше, чем в случае се-
эебряно-аммиачного катиона.
Точно так же при действии избытка цианистого калия на
цианистое железо последнее растворяется с образованием желе-
зистосинеродистого калия:
Fe(CN)2 + 4CN'->[Fe(CN)6]"".
Этот анион не дает обычных реакций двухвалентного же-
леза.
Способность простых ионов обраэовывать такие комплексные соедине-
ния, особенно в концентрированных растворах, проявляется весьма часто.
Простые ионы могут присоединять нейтральные молекулы или ионы про-
тивоположного заряда, образуя с ними комплексные ионы. Если простой
ион присоединяет к себе нейтральную молекулу, например Н’О, Н2О2, NHs,
или органические молекулы, то не происходит никакого изменения ’ни в
первоначальной валентности, ни в электрическом заряде. Так, трехвалент-
ный кобальт способен образовывать окрашенный в темнокрасный цвет
комплексный ион с шестью молекулами аммиака, имеющий подобно перво-
начальному иону трехвалентный заряд:
Со- + 6NH3^[Co(NH3)e]-.
Если в таком комплексном ионе одна или больше аммиачных грусти
будут замещены отрицательным одновалентным ионом, то валентность ком-
41
плексного иона снижается ета единицу на каждый атом отрицательного
иона, вступающего в комплекс:
[Co(NHs)6]-; [Со (NH3)5 NO2]”; fco(^2H; ГеоfJJJM.
L [_ (1МЛз)з 1
В присутствии цианистого калия трехвалентный ион кобальт'Й соеди-
няется с шестью ионами CN', образуя с ними комплекс, который согласно
с вышеприведенным правилом имеет три отрицательных заряда. В а-
лентность (или электрический заряд) комплексного
иона равна алгебраической сумме валентностей (или
электрических з а р яд о а) компонентов.
Устойчивость этих комплексных ионов различна. Если комплекс очень
устойчив, то он не обнаруживает обычных реакций, присущих его компо-
нентам.
Кроме комплексных ионов известны соединения, называемые двой-
ными солями. Так, сульфаты калия и алюминия, вы.кристалл.изовы1ваясь
совместно, образуют квасцы K»SOi • АЩЗОф 24НгО. При растворении этой
соли в воде раствор дает все реакции ионов калия, алюминия и сульфата
и имеется мало данных, говорящих в пользу образования комплексного
нона. Чтобы выяснить, представляет ли данное соединение двойную .или
комплексную соль, нужно определить, дает ли она характерные реакции
простых ионов. Известна соль, формула которой KCrlCsCH)’ • 5HsO. Водный
раствор этрй соли легко дает реакции на ион калия, но реакции на ион
хрома или анион оксалата протекают весьма медленно. Очевидно, что ион
хрома и ион оксалата образуют комплексный анион, имеющий одну отри-,
нательную валентность; этот комплекс не отличается той устойчивостью,
какой отличаются другие вышеупомянутые комплексы. Трудно провести
строгую границу между двойными и комплексными солями и, быть может,
гораздо' логичнее относить двойные соли к ^о'мплаюсны'м солям, обладаю-
щим малой устойчивостью комплексного иона. Как общее правило, ком-
плексные соли, образованные из нейтральных солей сильных кислот, содер-
жат комплексные анионы, которые в разбавленных растворах в сильной
степени диссоциируют на простые ионы. Комплексные же ионы, образован-
ные за счет погожигелыных ионов и анионов слабых кислрт, обычно от-
личаются большой устойчивостью (табл. 9).
Таблица 9
Константы ионизации некоторых комплексных ионов
[Ag’J[NH3p [Ag(NH,)2-f = 6,8 10-8; fHgCi2] [C1T _ [Hgcipq 1,0-10-2;
[Ag- ] [NO./J2 !Ag(NO2)2'] = 1.5-10-3; [Mg- ] [Cl'p IHgCl/ ] 6,0 • 10-17;
[Ag][S2O3"J [AgS2O3'[ = 1,0 10-13; [Hg 1 [Br’]4 _ [HgBr4"] 2,2-10-22;
[Ag-HCNP IAg(CN)2'] = 1,0 10- 21; tHg-][JT . .. [HgJ/'j 5,0 • 10-31;
[Cu][CN'P [Cu(CN)4"'] = 5,0- 10-28; LHg' l [CNST lHg(CHS)4"l = 1 • 10-22.
Реакции ионов
Как уже было указано, большинство реакций качественного
анализа является ионными реакциями. Мы видели также, что
по существу все реакции обратимы, и научились понимать не-
которые законы, которым подчиняется течение этих обратимых
реакций.
42
В аналитической химии необходимо большей частью поль-
зоваться такими реакциями, которые протекают почти пол-
ностью з желаемом направлении. Если реакция не может про-
текать почти до конца в данном направлении, то она обладает
малой ценностью как в качестве чувствительной пробы, так и
в качестве метода отделения одних ионов от других. Исполь-
зуемые в качественном анализе протекающие практически до
конца реакции могут быть подразделены на четыре группы:
1) реакции, при которых образуются газообразные про-
дукты;
2) реакции, сопровождающиеся образованием осадка;
3) реакции, при которых образуется неионизированное ве-
щество;
4) реакции окисления и восстановления.
Образующиеся в результате химической реакции газообразные про-
дукты в большинстве случаев могут быть удалены из раствора при кипя-
чении, и все реакции такого типа можно заставить протекать полностью
Течение реакции может быть приостановлено, если воспрепятствовать уда-
лению газа, что указывает на обратимость реакции.
Когда при химической реакции образуется вещество, обладающее очень
малым произведением растворимости, большая часть его выделяется' из рас-
твора в виде осадка и реакция приходит практически до конца. Табл. 8
(стр. 37) показывает, что насыщенный раствор хлористого серебра содер-
жит только около Viooooo моля (= 0,0'1 миллимоля) соли в 1 л. Из той же
таблицы видно, что в насыщенном водном растворе хлористого серебра
произведение концентраций ионов серебра и хлора равно- 1,2-10-10. Диало-
гично сказанному выше относительно сернокислого бария (стр. 35), вводя
больший или меньший избыток хлор-ионов в раствор, содержащий ионы
серебра, возможно снизить концентрацию последних до любой заданной
величины, т. е. перевести в осадок практически полностью все находящееся
в растворе серебро.
Осажденное хлористое серебро полностью растворяется в цианистом
калии, потому что ион серебра образует с циан-исном комплексный ион
[Ag(CN)2]', ионизирующий в такой малой степени, что произведение рас-
творимости хлористого серебра уже больше не может быть достигнуто
даже в случае весьма большого избытка хлор-ионов. Хлористое серебро
растворяется также в концентрированных растворах НС1 или NaCl, веро-
ятно, с образованием [ AgCl? J'-ионов.
Образование неионизированного вещества также обусловливает полноту
протекания реакции. В табл. 2 приводится степень ионизации наиболее
часто встречающихся кислот, солей и оснований. Этой таблицей можно
пользоваться точно так же, как и таблицей произведения растворимости, и
предвидеть возможность осуществления течения реакции в данном напра-
влении. Равновесие между водой и ее ионами Н’ и ОН' было нами рас-
смотрено раньше. Такой же подход может быть применен к равновесию
между любым другим слабо ионизирующим веществом и его ионами. Вся-
кий раз, когда в такой раствор вводится избыток одного из находящихся
в нем ионов, происходит образование некоторого количества неиоиивиро-
ванного (Вещества. Так, если прибавить кислоту к раствору сульфида, то
происходит реакция отчасти потому, что образующийся сернистый водород
представляет собой очень слабый электролит, и отчасти потому, что он
является газообразным продуктом. Аналогично происходит растворение
фосфата кальция в кислотах,
* Дополнение редактора. В воде фосфат кальция растворяется очень
мало, диссоциируя при этом на ионы кальция и фосфат-ионы. При приба-
влении более сильной кислоты водородные ионы последней будут соеди-
няться с РО'Щ-ионом в мало диссоциированный анион H.-POj'. Следствием
43
этого' будет удаление фосфат-иоиа из раствора; произведение концентра-
ций ионов кальция и фосфата станет меньше произведения растворимости
фосфата кальция и поэтому будет происходить дальнейшее “его растворе-
ние, поскольку имеется достаточный избыток кислоты*.А. Я.
Наконец, многие реакции окисления и восстановления протекают почти
с абсолютной полнотой, хотя и эти реакции .могут быть отнесены к типу
обратимых реакций. Для понимания таких равновесий необходимо более
подробное рассмотрение процессов окисления и восстановления.
Окисление и восстановление
Термин окисление в более узком смысле этого слова
обозначает процесс .присоединения кислорода элементом или
соединением. Так, закись железа, будучи нагрета на воздухе,
превращается в окись железа, и эта реакция называется окис-
лением. Но так как хлорное железо относится точно так же
к хлористому железу, как окись железа относится к закиси
железа, то принято называть превращение хлористого железа
в хлорное железо также окислением, хотя нет совершенно ни-
какой необходимости, чтобы кислород принимал в этой реак-
ции какое-либо участие. В данном случае мы имеем интерес-
ный пример употребления обычного слова, в которое вклады-
вается значительно большее содержание, чем это соответствует
его первоначальному значению.
Восстановление — процесс, противоположный окислению, и
всякий раз, когда какое-либо вещество окисляется, некоторое
другое вещество восстанавливается. Прежде водород рассма-
тривался как типичный восстановитель и для определения про-
цесса окисления принималась примерно следующая формули-
ровка: окисление является присоединением кислорода (или его
эквивалента) к элементу или соединению, или же отнятием
водорода (или его эквивалента).
Реакция между хлористым железом и хлором:
' 2FeCk + Ch ->2FeCl3
выражается в ионной форме следующим уравнением:
2Fe” + Ch->2Fe" ‘ + 2СГ.
Другими словами, двухвалентный ион железа превратился
в трехвалентный, а нейтральная молекула хлора превратилась
в отрицательно заряженные хлор-ионы. При всех других реак-
циях, лри которых соль закиси железа окисляется, валентность
железа увеличивается на единицу, и современный взгляд на
окисление и восстановление формулируется весьма просто сле-
дующим образом.
Окисление представляет потерю атомом
или и о н 'О м одного или нескольких электронов
с одновременным повышением валентности в
положительном направлении; восстановле-
ние — приобретение атомом или ионом одно-
го или нескольких электронов с повышением
валентности в отрицательном направлении.
44
Согласно электронной теории строения материи атом любого элемента
состоит из нейтронов, положительно заряженных протонов и отрицательно
заряженных элек’иронов. Масса, соединенная с положительным электриче-
ством, значительно больше массы, соединенной с равным зарядом отрица-
тельного электричества; Электрой обычно рассматривается только как эле-
ментарный заряд отрицательного электричества. Потеряв электрон, перво-
начально нейтральный атом становится полр-ж-ительно заряженным, а атом,
присоединивший отрицательно заряженный электрон, становится отрица-
тельно заряженным; за счет сил электростатического притяжения происхо-
дит образование молекулы химического соединения. В свете электронной
теории элемент окисляется, когда- он теряет электрон, и восстанавливается,
когда электрон им приобретается. Это простейшая и -в то же время наи-
более понятная теория окислительно-восстановительных процессов.
Согласно этому воззрению окисление представляет собою по существу
электрическое явление. Поэтому легко допустить, что окисление и восста-
новление могут происходить при непосредственном воздействии электриче-
ской энергии. Опыт, действительно, доказывает что электролитическим
путем могут быть проведены бесчисленные реакции восстановления и
окисления. Обозначим единицу заряда отрицательного электричества —
электрон условным символом е. Так как атомы могут отдавать или присое-
динять только отрицательное электричество (электроны), причем потеря
одного или нескольких электронов ведет к приобретению атомом соот-
ветствующего числа положительных зарядов, мы можем выразить процесс
электролитического окисления следующим образом:
Fe' ’ — Fe’ ’ ’.
ч Такие окислительные процессы идут на аноде. Наоборот, на катоде соли
трехвалентного железа -могут быть восстановлены до двухвалентного;
F’ ‘ ‘ Ее’ '.
Не только все реакции окисления и восстановления могут протекать
под действием- электрического- тока, но и, наоборот, электрический ток
может быть щолучеи в результате какой-либо реакции окисления и восста-
новления. В качестве примера приведем следующий опыт. Возьмем два
стакана и в каждый из них вольем раствор хлористого натрия; в один из
стаканов добавим небольшое -количество хлорного железа и соединим оба
стакана U-образной трубкой, наполненной раствором1 хлористого натрия.
В цот и- в другой стакан поместим по платиновой пластинке (электроды) и
присоединим их к чувствительному вольтметру. Так как в растворах не
происходит -никаких окислительно-восстановительных процессов, то и не
образуется никакого электрического тока и стрелка вольтметра остается
неподвижной. Если же в стакан, содержащий хлористый натрий (без хлор-
- но-го железа), прибавить небольшое количество сероводородной воды, то
стрелка вольтметра тотчас отклонится, указывая наличие электрического
тока. Образование последнего объясняется следующим. Сульфид-ионы (S")
окисляются, переходя в элементарную серу и теряя свои электроны; эти
электроны но проволоке, соединяющей платиновые электроды, переходят
в раствор хлорного железа; в результате присоединения их к иону трех-
валентного железа (Fe’’’) происходит восстановление последнего, сопро-
вождающееся потерей одного положительного заряда и переходом в двух-
валентный ион (Fe’’). Ввиду понижения валентности железа в растворе по-
является избыток ионов хлора, которые по «солевому мостик у»
' (раствор хлористого натрия в U-образной трубке, соединяющей оба ста-
кана) переходят в раствор сероводородной воды, давая с находящимися
। здесь в избытке Н’ -ионами соляную кислоту. С химической стороны реак-
ция может быть выражена- следующим уравнением:
2Fe- + S"-»2Fe” + S.
Реакции окисления и восстановления по существу являются подобно
Другим химическим реакциям обратимыми, зависящими от концентраций
реагирующих веществ. Так, в вышеприведенном опыте интенсивность элек-
трического тока может быть значительно повышена, если взамен сернистого
45
водорода взять растворимый сульфид; последний значительно более диссо-
циировг|Н, и концентрация сульфидных исков в нем большая. Если же к
раствору хлорного железа прибавить какой-нибудь растворимый фторид
(соль фтористоводородной кислоты), то образуется весьма устойчивый ком-
плексный ион [FeFe]"' и вследствие уменьшения концентрации ионов
трехвалентного железа отмечается ослабление тока.
К наиболее важным окислителям, применяемым в аналитик
ческой химии, относятся галоиды, азотная кислоту
перманганат калия, би хром ат калия, перекись’
водорода и перекись я а гр и я.
Важными восстановителями являются: металлы, серни-
стая кислота, сернистый водород, соли двух-
валентного железа, двухлористое олово и
иодистый водород.
Окисляющее действие галоидов обусловливается превраще-
нием нейтрального галоида в галоидный анион.
Окисляющее действие галоидов на ионы двухвалентного
железа выражается в обравовании трехвалентного железа и
ионов галоида:
2Fe” + Ch -> 2Fe‘+ 2С1'
или
2FeCh + Ch ->2FeCh.
Интересно действие галоидов на сернистый водород. Прежде
всего происходит окисление сульфид-иона до свободной серы:
H2S 4~ Вгг-> 2Н- +2Вг' 4-S;
далее, если концентрация брома велика, реакция может проте-
кать дальше, и происходит окисление серы до серной кислоты,
так что вся реакция выразится следующим уравнением:
FhS + 4ВГ2 + 4FhO -> SCh" + 8Вг' + ЮН'.
Следует отметить, что составление уравнений реакций окис-
ления и восстановления производится очень легко на основа-
нии происходящих изменений в валентности. В последнем урав-
нении сера, имевшая отрицательную валентность, равную двум
(—2), переходит в серу, имеющую положительную валентность,
равную шести (+6), и таким образом изменение выразится
алгебраической суммой, равной 8, что соответствует потере ато-
мам серы 8 электронов, присоединяемых нейтральными молеку-
лами брома.
Окисляющее действие азотной кислоты обусловливается вос-
становлением иона азота. Степень восстановления зависит от
концентрации азотной кислоты и природы окисляемого веще-
ства. Чем концентрированнее азотная кислота, тем меньше она
восстанавливается; чем больше концентрация восстановителя и
чем сильнее восстанавливающая его сила, тем далее идет вос-
становление азотной кислоты. Обычным продуктом восстано-
вления азотной кислоты является окись азота NO, но часто об-
разуются и другие продукты, как двуокись азота, закись азота,
элементарный азот и даже аммиак.
46
. В азотной кислоте атом азота имеет пять положительных
.зарядов. При восстановлении до окиси азота NO азот имеет
только два положительных заряда, и следовательно, присоеди-
няет в этом случае три электрона. Реакция между солью двух-
валентного железа и азотной кислотой протекает по урав-
нению :
3Fe‘ ’ 4- NOs' + 4Н‘ 3Fe' • • + NO + 2НЮ
или
6FeSO4 + 2HNO3 + 3H2SO4 -> 3Fe2(SO4)3 + 2NO + 4H2O.
В последнем уравнении коэфициенты удвоены только для того,
чтобы -получить целое число молекул Fe2(SO4)3. В отсутствие
серной кислоты образовалась бы смесь сульфата и нитрата
трехвалентного железа:
3FeSO4 + 4HNO3 Fe2(SO4)3 + Fe(NO3)3 + NO 4- 2HsO.
Интересно действие азотной кислоты на сульфиды. Если
взять холодный, разбавленный (0,3 N) раствор азотной кислоты,
то'сера сульфида почти не окисляется и выделяется серово-
дород:
MnS-4-2H'-> Мп'* 4-H2S.
Если взята более концентрированная (например, 2N) азот-
ная., кислота, то наряду с образованием нитрата из сульфида
выделяется свободная сера. Так, при реакции между серни-
• стой .медью и горячей азотной кислотой каждый атом серы
теряет два электрона, а атом азота приобретает три электрона.
Реакция может быть выражена следующим уравнением:
3CuS 4- 8Н‘ + 2NO3'-> ЗСи' • + 4Н2О + 3S + 2NO.
Если азотная кислота очень концентрирована, то большая
- часть ее восстанавливается только до NO2, а сера окисляется
в серную кислоту, и уравнение реакции приобретает такой вид:
CuS + 8Н- + 8NO3' -> Си’ ’ + SCh" + 8NO2 + 4Н2О.
Окисляющее действие перманганата основано на переходе-
, марганца в соединения с более низкой валентностью. В анионе
перманганата MnCh' марганец имеет положительную валент-
ность, равную семи \ ПерхМанганат в кислом растворе обычно
'.восстанавливается до двухвалентного марганцового катиона, что
\соответствует потере пяти положительных зарядов или, точнее,
1 Следует заметить, что заряд такого иона, как МпО/, всегда пред-
оставляет собой алгебраическую сумму зарядов его компонентов. Семь из
.восьми отрицательных зарядоз четырех атомов кислорода нейтрализо-
вались семивалентным марганцем и, таким образом, ион Мп О.Г несет один
отрицательный заряд.
47
присоединению пяти электронов:
МпО/ + 5Fe’ ’ + 8Н' -> Мп’ ‘ -f- 5Fe’” 4* 4НгО;
2МпО«' + 5H2S + 6Н’ -> 2Мп ’ ’ + 5S + 8Н2О;
2МпО4' + 5Sn’ + 16Н’ -> 2Мп’ ’ + 5Sn---+ 8Н2О.;
2МпО/ + 10HJ + 6Н* -> 2Мп‘ ’ + 5J2 + 8Н2О.
Окисляющее действие хромата или бихромата обыкновенно
обусловливается образованием трехвалентного хром-иона. В хро-
мат- и бихромат-ионе атом хрома имеет положительную валент-
ность, равную шести, так что восстановление каждого атома
хрома сопровождается потерей трех положительных зарядов,
т. е. приобретением трех электронов. Хромат калия в кислом
растворе находится в равновесии с бихроматом:
2СгО<" + 2FT 2НСгО/ Н2О + СГ2О7*.
Поэтому при составлении уравнений совершенно безраз-
лично, будем ли мы исходить из хромата или бихромата, если
не считать только различия в количестве кислоты, потребной
в одном и другом случае:
СГ2О7" + 6Fe” 14Н’ -> 2Сг’ ’ ’ + 6Fe”* 4- 7НЮ;
- СГ2О7" + 3S" 4- 14Н’ -> 2Сг’ ” 4- 3S + 7НгО;
СггОт" 4-3Sn” 4- 14Н’-> 2Сг’’ ’ + 3Sn’ ” 4-7НЮ;
СГ2О7" J- 6J' 4- 14FT -> 2Сг’ ’ ’ 4- ЗЛ 4- 7НаО.
Перекись водорода действует и как окислитель и как вос-
становитель. Она окисляет хлористое железо до хлорного и
способна восстановить перманганат до соли закиси марганца.
Такое аномальное поведение ее послужило причиной обширных
дискуссий в специальной литературе. Нет необходимости вхо-
ДиТь в детали возникших споров, но уместно дать простое объ-
яснение указанной особенности. В большинстве соединений во-
дорода и кислорода первый положительно одновалентен, а вто-
рой отрицательно двухвалентен. Можно считать, что в перекиси
водорода водород также имеет нормальную валентность, соответ-
ствующую одному положительному заряду. Если, таким обрат
зом, водород является положительно одновалентным, то группу
'О — О в молекуле Н — О — О — Н нужно считать по отноше-
нию к водороду отрицательно двухвалентной (так. лее как и
один атом кислорода). Другими словами, связь двух атомов
одного и того же рода между собою взаимно насыщает по
одной валентности каждого атома. Такая связь называется
ковалентной связью, так как в данном случае нет ника-
ких данных в пользу допущения полярности между двумя груп-
пами ОН в НО — ОН.
Когда Н •— О — О — Н действует как окислитель, двухвалент-
ная группа — О — О — переходит в НгО, в которой мы считаем
кислород отрицательно двухвалентным; при этом двухвалентная
43
группа — О — О — переходит в два двухвалентных атома кисло-
рода, что соответствует двум восстановительным единицам или
отнятию двух электронов:
2Fe’ ’ + Н2О2 + 2Н- -> 2Fe' • • + 2НзО.
Восстановительная способность перекиси водорода также за-
висит от наличия группы —О — О—>. которая переходит при
этом в Ог. Для превращения отрицательно двухвалентной
группы — О — О — в О2 требуется перенести два электрона на
какой-либо другой элемент. Когда, например, на перекись во-
дорода в присутствии кислоты действует такой окислительный
агент, как MnOt', МпОг или СогОз, то каждая молекула Н2О2
выделяет по одной молекуле Ог, а два освобожденных электрона
присоединяются к марганцу или кобальту, вызывая восстановле-
ние этих элементов:
2MnO«' + 5Н2О2 + 6Н‘ -> 2Mn’ ' + 8Н2О +50г;
МпО2 + НгОг Ч~ 2Н’ Мп” + 2FhO + О2;
СогОз + Н2О2 + 4Н’ —> 2Со’ ’ ЗН2О' + О2.
* Дополнение редактора. Из большого числа теорий,, пытаю-
щихся дать объяснение своеобразному поведению перекиси во-
дорода проявлять себя то как окислитель, то как восстанови-
тель, приведу интересный взгляд Фриденхагена (Friedenhagen) С
Известно, что Н2О2 является слабой кислотой и как таковая
диссоциирует согласно1 уравнению:
Н2О2 О' —о'+ гн-
или, вернее,
Н2О2 i-H’ + О2Н'.
Если О'—O'-ион присоединит два электрона, то он восста-
новится, образовав два O''-иона, и перекись водорода функцио-
нирует, таким образом, как окислитель: •
О' —О' + 2е щ20";
О"-ионы реагируют с водой, образуя гидроксильные ионы:
20" 4~2НгО ^4 ОН'.
Напротив, Н2О2 веде'т себя как восстановитель, когда
О' — O'-ион отдает свои заряды и Превращается в газообраз-
ный О2:
О' — О'^Ог + 2е.
Таким образом, восстановительное действие Н2О2 связано
с выделением свободного кислорода (как при реакции с перман-
ганатом). * А. К.
Мы вкратце рассмотрели характерное действие более важ-
ных окислителей и нам остается еще описать характерные осо-
бенности наиболее важных восстановителей.
1 См. К о 11 h о f f, Massanalyse 296 (1928).
4 Зак. Э82. Тредаелл-Голл, т. I. 49
Так как каждое окисление сопровождается одновременно
происходящим восстановлением, то все вышеприведенные ре-
акции могут быть попользованы для иллюстрации как процес-
сов восстановления, так и процессов окисления.
Восстановительное действие водорода и металлов обусловли-
вается превращением нейтральных водорода 1 или металлов в по-
ложительно заряженные катионы.
Такое восстановление возможно в кислой, щелочной или ней-
тральной среде.
а) В кислой среде при применении цинка и других металлов,
Так, например:
Zn 4- 2Н' —> Zn'' + Нг.
В самой этой реакции заключается как процесс окисления,
так и процесс восстановления; металлический цинк, бывший
электронейтральным, приобрел два положительных заряда;
с другой стороны, ионы водорода серной кислоты (потеряли ка-
ждый по одному заряду и превратились в электронейтральный
газообразный водород2.
Если в растворе имеется другой ион, который легче восста-
навливается, чем водородный ион, то водород может совсем не
выделяться. Так, например, амальгамированный цинк не реаги-
рует с кислотой и тем не менее он восстанавливает ионы трех-
валентного железа до двухвалентного:
2Fe' ‘' -f- Zn-> Zn'' 4* 2Fe' ”
При действии цинка и очень разбавленной серной кислоты
легко превратить хлористое серебро в металлическое серебро:
2Ag' 4- Zn-* Zn' 4- 2Ag
1 Прежде, до разработки теории окислительно-восстановительных потен-
циалов, многие реакции восстановления в водном растворе приписывали
действию водорода в состоянии выделения. Такое название
дано водороду в том его состоянии, в котором он существует в момент
выделения в свободном виде из какого-либо соединения.
Раньше восстановительное действие сернистой кислоты приписывали
«сродству» этого вещества к кислороду. Если кислород получался из воды,
то предполагали, что водород в момент своего освобождения способен вы-
зывать восстановление, которого водород в обыкновенном состоянии не мо-
жет производить. Точно так же, когда цинк реагирует с разбавленной кис-
лотой, то выделяется водород; и по той причине, что цинк в присутствии
разбавленной кислоты вызывает восстановление, которого водород в нор-
мальном состоянии не способен производить, стали обыкновенно приписы-
вать это восстановительное действие водороду в состоянии выделения.
Но восстановительная сила какого-либо элемента обусловливается его
специфическим восстановительным потенциалом (стр. 61). Чем выше поло-
жение элемента в электродвижущем ряду, тем легче он окисляется и тем
больше его восстановительная сила. В настоящее время в большинстве слу-
чаев пользование термином «водород в состоянии выделения» не является
необходимым.
2 С точки зрения электронной теории цинк потерял два электрона, что
равнозначно его окислению. Эти два электрона присоединились к двум
ионам водорода, превратив их в электронейтральный водород, т- е. произ-
ведя их восстановление. Ред.
50
.ИЛИ СОЛЬ МЫШЬЯКОВИСТОЙ кислоты в мышьяковистый водород:
НдА^Оз' + 3Zn + 7Н’ -> 3Zn‘ ' + ЗНзО + AsH3.
Результат этого последнего уравнения указывает на окисле-
ние металлического цинка до двухвалентного иона цинка и на
восстановление мышьяка, получающего три отрицательных за-
ряда вместо трех положительных зарядов, которые он имеет
в НеАзОз'. Таким образом, каждый атом As теряет шесть по-
ложительных зарядов, а каждый атом Zn приобретает два за-
ряда, так что ’для восстановления одного аниона НгАзОз' тре-
буется три атома цинка Т
б) В щелочном растворе посредством цинка, алюминия, амаль-
гамы натрия или сплава Деварда (Си 50%, Zn 5%, Al 45%);
Zn 4- ОН' % Н2О -> HZnO2' % Н2;
2А1 % 2ОН' % 2НгО -> 2А1Ог' + ЗН2.
При пользовании сплавом Деварда восстановление заканчи-
вается значительно скорее, чем при употреблении одного цинка
или алюминия. Нитраты и хлораты могут быть восстановлены
им в присутствии нескольких капель едкого натра в несколько
минут. Реакция может происходить также и в нейтральной
среде, но она длится значительно дольше:
NO/ %' 4Zn % ЗОН' % 2HsO-> 4HZnO2' % NH3;
CI3O3 % 3Zn % ЗОН' -> 3HZnO'2' % СГ.
В нитрат-ионе азот имеет положительную валентность, рав-
ную %5; в аммиаке азот имеет отрицательную валентность, рав-
ную —3. Поэтому при восстановлении цинком азот теряет во-
семь положительных зарядов или приобретает восемь электро-
нов. В то же самое время цинк теряет два электрона, образуя
в нейтральном или щелочном растворе анион цинката. Таким
образом один атом азота нитрат-иона требует четыре атома
цинка, чтобы превратиться в аммиак.
Точно так же атом хлора в хлорат-ионе имеет положи-
тельную валентность, равную -4-5, и восстанавливается цинком
в нейтральном или щелочном растворе до хлор-иона с отрица-
тельной валентностью, равной —1.
Рассмотрение вышеприведенных равновесных реакций пока-
зывает, как это можно ожидать на основе закона действия
масс, что реакции должны протекать лучше в щелочной среде.
Восстановление посредством сернистой кислоты протекает
в умеренно кислом растворе и обусловливается тем обстоятель-
ством, что сера более устойчива, когда она имеет шесть поло-
1 Другими словами, положительно трехвалентный мышьяк для превра-
щения в отрицательно трехвалентный мышьяк в AsHt должен присоединить
шесть электронов, которые он может получить от трех электронейтраль-
ных атомов цинка; последние при этсч становятся1 положительно двух-
валентными. Ред.
4* 51
жительных зарядов, как в серной кислоте, чем в случае серни-
стой кислоты, в которой сера имеет только четыре положитель-
ных заряда. Соли трехвалентного железа легко восстанавли-
ваются этим реактивом, и так как железо приобретает только
один электрон, тогда как сера теряет два электрона, то, оче-
видно, что одна молекула двуокиси серы (ангидрид сернистой
кислоты) восстанавливает два иона трехвалентного железа в ионы
двухвалентного железа:
2Ре’' • + SO3" + Н2О-> 2Fe” 4- SCV + 2H'.
Таким образом очень легко восстанавливаются посредством
SO2 или ЗОз" арсенат-ион (ион мышьяковой кислоты) и многие
другие вещества:
H2ASO4' + SO3" -> H2ASO3' + SO«".
Избыток водного раствора сернистой кислоты прибавляют
к раствору, подлежащему восстановлению. Затем нагревают до
кипения и, продолжая кипячение, пропускают в то же время
через раствор ток углекислого газа, пока избыток сернистой
кислоты не будет удален.
Восстановление посредством сернистого водорода, в котором
атом серы имеет два отрицательных заряда, обусловливается
окислением ее до свободной электронейтральной серы. Таким
образом, два иона трехвалентного железа восстанавливаются1 до
двухвалентного железа одной молекулой сернистого водорода.
При реакции же с бихроматом калия на одну молекулу послед-
него требуются три молекулы сернистого водорода:
2Fe‘' • + H2S ->2Fe'' + 2Н’ 4-S;
СГ2О7" + 3H2S + 8Н' -► 2Cr‘ • ‘ 4- 3S + 7НгО.
Применение сернистого водорода в качестве восстановителя
не совсем удобно, так как отфильтровывание выделяющейся серы
представляет некоторые трудности. Кроме того, сернистый во-
дород применяется в качественном анализе, главным образом,
в качестве осадителя. Если раствор содержит какой-либо окис-
литель (например, азотную, хлорноватую, хромовую кислоты и
тому подобные вещества), сульфид-ион будет окисляться, выде-
ляя серу. Осажденные сульфиды будут при этом загрязнены
серой, затрудняющей дальнейшее их исследование. Если рас-
твор не содержит металлов, осаждающихся сернистым водоро-
дом, но в нем находятся окислители, то сера, осажденная по-
следними, часто вызывает сомнение, не смешана ли она с неко-
торым количеством осажденного- сульфида; вследствие этого
возникает необходимость дальнейшего исследования осадка.
Такое исследование зачастую может быть избегнуто, если пред-
варительно разрушить окислитель.
Сернистый водород восстанавливает:
а) галоиды:
Cl2+ HaS-> 2Н’ 4- 2СГ 4- S;
52
.6) азотную кислоту:
2Н' + 2NO3' + 3H2S-> 4Н2О + 2NO 4- 3S;
в) хлорноватую кислоту:
СЮз' + 3H2S -> СГ + ЗН2О + 3S;
г) соли окиси железа:
2Fe"' +H2S^ 2Fe” 4- 2FT + S;
д) бихроматы:
СГ2О7" 4- 3H2S + 8Н‘ -> 7Н2О + 2Cr' ’ ‘ + 3S;
е) марганцовую кислоту:
2МпО/ + 5H2S + 6Н- ->8НзО + 2Мп' ' + 5S
и многие другие вещества.
Восстановление хлористым оловом производят обыкновенно
в кислых растворах. Восстановление обусловливается дереходом
двухвалентного иона олова ® ион четырехвалентного олова;
SnOh 4- CI2—> SnCk
или
Sn" + С12 -> Sn' • + 2СГ.
Таким путем восстанавливаются соли трехвалентного железа,
хроматы, перманганаты, соли ртути и многие другие вещества:
2Fe‘’' + Sn'‘2Fe’’ + Sn'’ ’
2СгОГ + 3Sn" + 16H‘ -> 2Cr' '' +3Sn"-' -)-8H2O;
2HgOk 4- Sn” -> Sn" " 4- Hg2Cl2 4- 2C1';
Hg2Cl2 4- Sn" -> Sn' " ' 4- 2Hg 4- 2СГ.
Так как SnCla и SnCh легко гидролизуются и выпадают в осадок, то
при реакциях восстановления вводится избыток НС1; поэтому вместо катио-
нов Sn’ и Sn’"' вполне вероятно допустить наличие ионов SnCU" и
SnCle", в которых олово входит в состав аниона.
Восстановление иодистоводородной кислотой основано на
переходе иод-иона .в элементарный (свободный) иод. Можно
легко заставить большинство веществ, способных окисляться или
восстанавливаться, реагировать с иодистоводородной кислотой
или со свободным иодом. Присутствие свободного иода легко
открыть, и поэтому йодометрические реакции являются чрезвы-
чайно важными при изучении аналитической химии. Чтобы вос-
препятствовать окисляющему действию свободного иода, обы-
кновенно необходимо- прибавление избытка йодистого калия, и
часто принимают меры к удалению образующегося иода; это
находится в согласии с законом действия масс:
2Мп0г 4- ЮГ 4- 16Н'-> 2Мп' ' + 8Н2О 4- 5J2;
СГ2О7" 4- 6J' 4- 14Н' -+ 2Сг'' ' 4- 7НгО 4- 3J2;
2Fe" ' + 2J'->2Fe" 4-J2.
53
Электродвижущий ряд и электродные потенциалы
Если вещество, например сахар, находится на дне стакана,
наполненного водой, то молекулы сахара сами стремятся рас-
пределиться по всему раствору, в результате чего происходит
растворение сахара. Сила, обусловливающая переход твердого
вещества в раствор, подучила название упругости раство-
рения.
При достаточном количестве твердого вещества жидкость
благодаря диффузии достигнет состояния насыщения и при дан-
ной температуре сахар уже не будет больше растворяться. Это
объясняется тем, что существует некоторая сила, противодей-
ствующая упругости растворения и препятствующая дальнейшему
растворению твердого вещества в насыщенном растворе. Такой
силой является о с м о г и ч е с к о е давление раствора.
В насыщенном растворе осмотическое давление, определяе-
мое только числом молекул растворенного вещества и темпе-
ратурой, точно уравновешивается упругостью растворения твер-
дого вещества. Процесс растворения твердого вещества не со-
провождается каким-либо электрическим эффектом. Это отно-
сится также и к тому случаю, когда расстворяемое вещество
является электролитом, потому что цри растворении его обра-
зуется одинаковое число положительных и отрицательных
ионов, и поэтому раствор остается электронейтральным.
Металлы, приведенные в соприкосновение с водой, также
обнаруживают тенденцию к растворению, хотя в значительно
меньшей степени. При этом имеет место процесс окисления,
потому что по мере растворения металл превращается в электри-
чески заряженные ионы. Стремление металла растворяться на-
зывается электролитической упругостью раство-
рения. Точно так же, как и в случае с сахаром, осмотическое
давление растворенного иона противодействует упругости рас-
творения. Электролитическая упругость растворения имеет опре-
деленную величину, характерную для каждого металла.
Если какой-нибудь легко окисляющийся металл, как, напри-
мер, цинк, поместить в раствор какой-нибудь соли, то (даже
в случае насыщенных растворов наиболее хорошо растворимых
солей цинка) электролитическая упругость растворения цинка
будет больше осмотического давления его ионов и по-
этому некоторое количество положительно заряженных ионов
перейдет в раствор. При этом металл приобретает отри-
цательный, а раствор — положительный заряд. Результатом пе-
рехода ионов цинка, несущих положительные заряды, в раствор
является возникновение электростатической силы, которая стре-
мится направить металлические ионы обратно к металлу и дей-
ствует в том же направлении, что и осмотическое давление ионов
цинка, находящихся в растворе. Эта сила быстро возрастает
с числом ионов, переходящих от металла в раствор. Когда
осмотическое давление-ф электростатическая сила становятся
54
равными электролитической упругости растворения цинка, по-
следний практически перестает растворяться.
Если поместить более трудно окисляющийся металл, каким
является, например, медь, в раствор сульфата меди, то отноше-
ния будут обратные. В этом случае, за исключением крайне
разбавленных растворов, осмотическое давление больше упру-
гости растворения, и металл не растворяется; наоборот, некоторое
количество ионов меди разряжается на металле, принимая от
него электроны и сообщая ему положительный заряд, между
тем как раствор становится отрицательно заряженным. Как
только некоторое небольшое число ионов выделится на металле,
Между металлом и раствором установится равновесие.
Разность потенциалов между металлом и его раствором или,
что то же самое, электродный потенциал считают отрицатель-
ным, если раствор приобретает положительный заряд, как, на-
пример, в случае легко окисляющихся металлов, какими являются
магний, алюминий, цинк, железо и пр. Если же раствор при-
обретает отрицательный заряд (например, в случае трудно
окисляющихся металлов — медь, серебро, платина, золото), элек-
тродный потенциал считают положительным.
. При контакте металла с раствором, содержащим его ионы,
обыкновенно имеет место разность потенциалов между металлом
и раствором. Величина такого потенциала определяется отно-
шением между электролитической упругостью растворения металла
и осмотическим давлением раствора. В большинстве случаев
равновесие скоро достигается и простой контакт металла с рас-
твором его ионов не является непрерывным источником электри-
ческого тока. Но если два металла, обладающие различными
потенциалами, привести в соприкосновение с растворами их со-
лей (причем последние находятся в электролитическом контакте
Друг с другом), то образуются электрические заряды различ-
ных потенциалов; если теперь оба металла соединить вне жид-
кости проволокой, то от более высокого к более низкому по-
тенциалу потечет электрический ток. Так как первоначальная
разность потенциалов между растворами и металлами постоянно
восстанавливается, то результатом этого является непрерывный
ток. По этому принципу устроен гальванический элемент Да-
ниеля, в котором нормальный раствор сульфата меди отделен
пористой перегородкой от нормального раствора сульфата
цинка. В раствор сульфата цинка помещают цинковую палочку,
а в раствор сульфата меди — медную пластинку. Ток проходит
через проволоку от меди к цинку и через раствор — от цинка
к меди.
Для металлов электролитическая упругость растворения и
окислительный потенциал являются одним и тем же понятием.
Нернст, первый объяснивший происхождение электродвижу-
щей силы на основании теории осмотического давления, дал
формулу для вычисления разности потенциалов, которая суще-,
ствует в месте соприкосновения .металла с раствором его ионов;
Если Е—потенциал в вольтах, R — газовая константа, выражен-*
55-
ная в вольтах X кулоны (эрги или ватт-секунды), F — электро-
химический эквивалент или электрический заряд 1 граммэквива-
лента ионов любого металла, п — валентность ионов, Р — элек-
тролитическая упругость растворения, р — осмотическое давле-
ние и Т — абсолютная температура раствора., то формула Нерн-
ста имеет следующий вид:
Е — ^- In —
nF Р •
Если подставить числовые значения для R (8,32) и F (96 500),
разделить (для перехода к бригговым логарифмам) на 0,434 и
считать комнатную температуру равной 25° (298° абсолютной
шкалы), то вышеприведенная формула преобразится в:
„ 0.059, р
Ехг = -у- 1gт? вольт.
Так как в разбавленных растворах осмотическое давление
пропорционально концентрации раствора с, то последнюю вели-
чину можно поставить в формулу Нернста взамен р; анало-
гично взамен электролитической упругости растворения Р
можно ввести некоторую эквивалентную ей концентрацию С
(в ряде случаев гипотетическую), и ,тогда для протекающей на
электроде реакции:
М ;=» Мп + пе
формула Нернста принимает вид:
р „ 0-059. е
Так как логарифм частного равен логарифму числителя
минус логарифм знаменателя, то для одновалентных ионов урав-
нение может быть написано в виде:
Е25° — 0,059 (1g с — lg С) = — 0,059 lg C-f- 0,0591g с.
Величина С в последнем уравнении — константа, являющаяся
мерилом окислительного потенциала, специфичного для каждого
данного металла, хотя она и не может быть измерена непосред-
ственно. Принимая же концентрацию с равной одному молю
в литре, мы можем удалить из уравнения второй член, так как
1g 1=0 и тогда:
= —0,059 1g С~ Ео при 25°.
Эти значения обыкновенно приводятся в таблицах нормаль-
ных потенциалов. Чтобы определить величину Е->^ при какой-
нибудь другой концентрации ионов, можно воспользоваться
уравнением:
£25° = -Eo+0,059)g<:-
В табл. 10 даны величины нормальных потенциалов 20 ме-
таллов и шести неметаллов; более полная таблица приведена
на стр. 61.
56
Таблица 10
Нормальные потенциалы
Электродная реакция Eo в вольтах Электродная реакция E0 в вольтах
Li -» Li’ е —3,03 4~Н2 -> Н’ + е 0,00
К К 4-е —2,93 Bi -> Bi ” + Зг 4-0,2
Na -> Na’ + е -2,72 Sb -> Sb’” + Зг +0,2
Ва -> Ва” + 2е -2,8 As -> As’” + Зе +0,29
Mg-> Mg” + 2г -1,5 Cu -» Cu” + 2e +0,34
Zn -> Zn " -f- 2е —0,76 -1 -1'2 + e +9,58
S" -> S + 2e — 0,55 2Hg->Hg2”4-2e 4-0,80
Fe -> Fe” -J- 2e —0,43 Ag -> Ag’ 4- e 4-0,80
Cd-> Cd” 4-2г -0,40 Br' -> -1- Br„ + e H2O->_1_ O2 + 2H’ 4-2e ’ +1,10
Co -> Co + 2e Ni -> Ni” + 2г -0,23 -0,22 + 1,23
Sn-> Sn ” -J- 2г Pb -> Pb” + 2г -0,14 —0,13 Cl' -> 4 Cl2 4- e Au -» Au’ 4- e +L36 +1,5
Теория процессов окисления и восстановления основана на этих нор-
мальных электродных потенциалах. Сильные восстановители находятся в
верху таблицы, сильные окислители—в низу нее. Если поместить пла-
ст инку цинка (нормальный тотс|нциал — G-76V) в -раствор сульфата меди
(нормальный потенциал + 0.34V), то Цинк -будет переходить в раствор
с в-иде цинк-ион-ов, а ионы меди будут восстанавливаться, выделяясь в виде
металлической меди. Можно также сказать, что цинк -восстанавливает ионы
меди до -металла или что цинк окисляется ио-на?л-и мели.
Реакция окисления цинка протекает -по следующей схеме:
Zn ~т Zn' + 2е,
реакция восстановления меди:
Си ’ ’ 4- 2с -> Си.
Эти реакции положены в основу устройства элемента Даниеля. Когда
в нем цинковый -и медный электроды соединяют проволокой, то по прово-
локе электроны идут от цинка к меди, в растворе — от меди к цинку (при-
чем в последнем случае они переносятся анионами). Обычно принято изо-
бражать стрелкой направление электрического тока, которое считается
противоположным потоку электронов.
Пренебрегая- малым падением потенциала, обусловленным сопротивле-
нием раствора и проволоки, электродвижущую силу элемента (при условии
молярных растворов сульфата цинка и меди) можно выразить разностью
окислительных потенциалов цинка (—0,76V) и меди (+0.34V), т. е. 1,1V.
По мере работы элемента Даниеля концентрация Zn ’ ’ повышается;
это вызывает июнижение окислительного потенциала цинка. Одновремен-
ное понижение концентрации Си’' обусловливает повышение окисли-
тельного потенциала меди. Уравнение Нернста:
57
показывает, что окислительный потенциал каждого металла будет равен
—0,21V (среднее арифметическое между —0,76 и +0,34), когда концентра-
ция Zn ' ’ достигнет 7,9 • РО-18 моля/л и Си'' 5-IO-18 моля/л. Так-как раство-
римость ZnSCh в воде равна примерно 5 молям/л, а концентрация
63,6 • 5 • 10~18 является исчезающе малой величиной, то можно сказать, что
металлический цинк полностью вытеснит медь из раствора ее соли. Дей-
ствительно, такое замещение двухвалентных ионов протекает практически
полностью, если нормальные потенциалы обоих металлов разнятся друг от
друга не менее чем на 0,6V.
Та же таблица нормальных потенциалов показывает, что цинк
{Eq=—'0,76) будет выделять олово (Е0~—0,14) из его солей, что, действи-
тельно, имеет место в нейтральном растворе. Если же раствор содержит
Н’ (Ео = 0,00), то цннк не будет осаждать олова из его молярного раствора,
но будет выделять водород в свободном состоянии до тех пор, пока по-
тенциал водорода не станет равным потенциалу олова:
fas" = — 0,14 = 0,00 -|- 0,059 ig с (для водорода);
lgC = — -9’И _ _2 4-
g 0,059 ’ ’
pH = 2,4; с = 4 • 10t~3.
Легко понять, почему щелочные металлы разлагают воду с образова-
нием щелочных ионов и почему концентрация ионов цинка при авалогич-
ных условиях очень мала. Окислительный потенциал цинка в молярном
растворе цинковых ионов равен приблизительно —0,76V. Вода же иони-
зирована весьма слабо; ее ионное произведение, как указано на стр. 29,
равно 1 • 10~14 при 25°. Окислительный потенциал водорода по отношению
к такому очень разбавленному раствору ион|ов водорода равен не 0,0,
как указано ;в табл. 10, но приближается по величине к потен-
циалу цинка; он был бы примерно равен1 последнему, если бы ионное про-
изведение воды было равно 10x2». в соответствии с окислительными по-
тенциалами мы должны ожидать, что цинк будет разлагать воду с выделе-
нием водорода. Действительно, цинк в соприкосновении с водой несколько
окисляется (причем окисляющим агентом является водород воды), но реак-
ция не достигает каких-либо заметных размеров. Первыми продуктами
реакции являются ионы цинка и свободный водород, но за счет удаления
ионов водорода в растворе появляется избыток свободных пидроксил-ионов.
Произведение растворимости гидроокиси цинка согласно табл. 8 (стр. 37)
равно 1,0-10~18. Образующийся на поверхности металлического цинка слой
нерастворимой гидроокиси защищает его, предотвращая дальнейшее раство-
рение. Если же водород находится в виде кислоты, с анионом которой
цинк образует легко растворимую соль, то окисление цинка за счет ионов
водорода обыкновенно продолжается до тех пор, пока весь цинк не
растворится Ч
Табл. 10 дает также ценные данные для выяснения условий выделения
металлов при электролизе. Чем ниже расположен металл в этом ряду нор-
мальных потенциалов, тем легче происходит выделение его на катоде при
электролизе. Таблица дает ту величину потенциала, которая должна, быть
превзойдена, чтобы имело место выделение металла; поэтому, регулируя
t Имеется и другая важная причина, по которой цинк не реагирует
с водой. Водородные ионы отдают свой заряд с различной степенью ле.г-
кости при электролизе ,в зависимости от природы применяемого в качестве
катода металла. Наиболее легко водород освобождается от своего заряда,
когда электродом служит неполированная платина; больший вольтаж тре-
буется для электродов! из цинка и других металлов. Это так называемое
перенапряжение достаточно велико в случае цинка, чтобы позволить
произвести его количественное выделение путем электролиза' растворов, со-
держащих уксусную кислоту и ацетат натрия. Величины, данные1 на стр. 57,
основаны на нормальном разряде водорода, но если принимать в расчет
перенапряжение водорода по отношению к цинку, то окислительный потен-
циал водорода должен занять в указанном ряду напряжений белее высокое
положение.
58
еличину катодного потенциала, можно произвести электролитическое рао-
, едение металлов. Так, например, в случае молярных растворов для выделе-
ния свободного водорода потенциал должен быть на 0,34 V больше, чем
пдя выделения меди. Поэтому медь выделяется из раствора прежде, чем
нотород. Пользуясь уравнением Нернста, мы можем вычислить концентра-
ции Н’ и Си’ при которых они будут выделяться одинаково легко. Для
меди формула Нернста дает:
f25O = 0,34+^-lgc. (1)
Пусть мы хотим выделить медь из 100 мл раствора при условии, что
концентрация ионов водорода В' нем равна 1,5 моля/л, и количествами меди
меньше 0,1 .иг можно пренебречь. Возможно ли при этих условиях выде-
лить всю медь на катоде, прежде чем станет выделяться свободный водо-
род? Бели раствор непрерывно перемешивается, так что ионы меди всегда
находятся у катода, выделение водорода не будет иметь места до тех пор,
пока потенциал, обусловленный находящимися в растворе ионами меди, не
сравняется с потенциалом водорода,
Потенциал водорода равен: '
= 0,00 4- 0,059 lg с.
Если с = 1,5, то 1g с — 0,176 и Eyf = 0,059 • 0,176 = 0,0105; такова вели-
чина потенциала водорода в 1,5 молярном растворе его ионов. Подставим
эту величину в уравнение (1):
0,0'105 = 0,34 + 0,0295 1g с
с = 6,3 • 1(У’12.
Это показывает, что концентрация меди должна снизиться до:
прежде чем будет выделяться водород из 1,5-молярного раствора его ионов;
другими словами, концентрация остающихся в, растворе Си’ ’ будет исче-
зающе малой.
Формула Нернста может быть применена к любой обратимой окисли-
тельно-восстановительной реакции, имеющей место иа электродах. Общее
уравнение такой реакции можно написать в виде:
Ох +• Red,
где Ох—окисляющий, a Red—восстанавливающий ион; приложение фор-
мулы Нернста к такой реакции дает:
„ _ , 0,059 . [Ох]
£^=£0 + — 1g дар,
причем величина Ео может быть определена, когда концентрация
[Ох] = [Red] = одномолярной. В данном случае в уравнении Нернста учи-
тываются концентрации как восстанавливаемого, так и окисляемого ионов,
что не имело места в случае металла, так как концентрация металла, в
растворе была равна нулю и не зависела от количества присутствующего
Металла.
В случае электродной реакции, на течение которой влияет концентра-
ция Н’ как, например,
CrzO?" 4- бе 4- 14Н’ Tt 2Сг’ ’ ’ 4- 7НгО,
концентрация водородных ионов при определении, значения Ео должна быть
принята одномолярной. Таблица нормальных электродных потенциалов мо-
59
жет быть расширена, так как в нее возможно включить любую окисли-
тельно-восстановительную реакцию. Приводимые в таблицах данные всегда
относятся к молярным концентрациям участвующих в реакции компонентов.
В качестве полностью обратимой реакции в зависимости от концентра-
ции Н’ может быть взята:
НзАзОа 4- 2Н* + 2е НзАзОз + НзО,
нормальный окислительный потенциал которой равен 0,57 V; для любой
другой концентрации:
Е 0 57 ! °’059 Ь iH3As0<HHT
д25, - и,-f- 2 Jg [HgAso3] •
Последнее уравнение может быть представлено в виде:
р _ п „ , 0,059 [H3AsO4] 0,С5Э
Е26. _ 0,57 + — 1g -[Нзд7оз1 + 1g [Н ]'
и в такой форме им удобно пользоваться для вычисления эффекта, обу-
словленного изменением концентрации Н' при постоянном соотношении
LHsAsOi] и [НзАвОз].
Согласно табл. 11 олово и свинец занимают смежные места. В ней-
тральных растворах свинец не восстанавливает полностью катионы двух-
валентного олова, а олово не восстанавливает полностью катионы двухва-
лентного свинца. В реакционной смеси устанавливается равновесие, когда
концентрация ионов двухвалентного олова заметно превысит концентрацию
ионов свинца; в присутствии кислоты не происходит осаждения ни олова,
ни свинца по той причине, что ионы водорода восстанавливаются легче, чем
катионы свинца или олова, как это видно из табл. 11. С другой стороны,
восстановление четырехвалентного олова до двухвалентного, как показы-
вает таблица, протекает легче, чем восстановление водородных ионов;
поэтому в качественном анализе свинец может быть применен для восста-
новления кислого раствора соли четырехвалентного олова до двухвалент-
ного, не вызывая восстановления его до металла. Для этой же цели поль-
зуются также и сурьмой, хотя из табл. 11 это не вполне ясно видно, по-
тому что степени ионизации и комплексообразования недостаточно из-
вестны в отношении солей сурьмы и олова.
Большинство реакций окисления и восстановления являются обратимыми.
Сильный восстановитель, будучи окислен, становится слабым окислителем,
и наоборот, сильный окислитель, будучи восстановлен, становится слабым
восстановителем. Обыкновенно водород рассматривается как восстановитель,
но когда металл замещает водород кислоты, водородные ионы действуют
как окислитель.
Условия обратимости окислительно-восстановительных реакций не всегда
строго соблюдаются. В реакции:
Мп‘ + 4НЮ? МпОУ +8Н’ + 5е
уравнение Нернста для окислительного потенциала:
р -р ,0,059 [НТ [МпО4']
£25° ~ + 5 [Мп-]
не является точным. Это, вероятно, обусловлено образованием соединений
марганца промежуточной валентности. Хотя влияние концентрации Н' и не
столь велико, как можно было бы ожидать согласно последнему уравнению,
все же она оказывает очень большое воздействие на окислительный потен-
циал. При pH = 6 окислительный потенциал молярного МпО/ приблизи-
тельно на 0,6 V ниже окислительного потенциала при pH = 0 (нормаль-
ный по отношению к Н ’). Это может быть использовано для дробного
окисления галоидов. При pH — 5—6 ион иода окисляется до Ja, ионы же
брома и хлора не окисляются. При pH = 3 происходит окисление бро-
мида, а хлорид остается без изменения.
60
Таблица 11
Таблица окислительных потенциалов
Для всех растворимых в воде веществ потенциалы, указанные в таблице,
относятся к концентрации 1 моль!л. Таким образом, потенциал лития, зани-
мающего первое место вверху таблицы, является потенциалом металлического
лития по отношению к молярному раствору литиевой соли. В случае потен-
циала Fe”—*Fe'” предполагается, что концентрации солей как двух-,так и трех-
валентного железа равны одиомолярным. Потенциалы отнесены к потенциалу
газообразного водорода на электроде из платиновой черни. При устройстве
батареи из двух элементов, указанных в таблице, положительным будет
тот из них, который находится в ряду ниже другого. Жирным шрифтом
обозначены твердые вещества. При обозначении числовых величин обратным
знаком получится ряд восстановительных потенциалов.
Реакция f0 в вольтах Реакция Eo в вольтах
Li Ji Li’ 4-е —3,03 Cf Cr -f" s —0,04
К-К’ +е —2,93 Fe JtFe”’4-3e —0,04
Ba Ji Ва" 4- 2е -2,8 Ti JiTi 4-e -0,04
Na Ji Na’ 4"е -2,72 H2 газ Ji 2H’ 4- 2e ±0,00
Sr Ji Sr” + 2c —2,7 Sn Ji Sn”” 4- 4e 4-0,03
Ca JtCa”4-2e -2,6 2S2<V S4O6" 4- 2e 4-0,13(?)
Mg Ji Mg” 4-2e -1,5 Cu’Ji Cu” 4- e 4-0,17
Alx-АГ’ + Зе -1,3 Sb Ji Sb’” 4-3e 4-0,2
Mn JiMn” 4- 2e —1,1 Sn” Ji Sn"” + 2e 4-0,20
Zn JiZn”4-2e -0,76 Bi Jt Bi" 4- 3e 4-0,20
CrJiCr” + 2(? —0,6 J,4-12OH'Ji 4-0,21
S’JiS + 2e —0,55 ;jt2JO3'4-6H2O 4- 10c
US' 4- OH' Ji S 4- H2O 4- 2e -0,51 Ag 4- Cl' J± AgCl 4- c 4-0,23
Ag +2CN'Ji Ag (CN)2'+ e -0,51 it2HgCJ24-2^ 4-0,24
Fe Ji Fe"+2c —0,43 J' 4- 6OH' Ji 4-0,26
Cd Ji Cd” 4- 2e —0,40 j±JO3'4-3H2O4-6e
2Cu 4- 2OH' ji —0,35 2Hg4-2Cl' Ji 4-0,27
Y-» Cu?O -f- -f- Hg2Cl2 4- 2e
Pb 4- SO4 j* PbSO4 4- 2e —0,34 As Ji As’” 4- 3c 4-0,29
Tl^Tl’ + e —0,33 , CuJiCu”4-2e 40,34
Co ji Co” 4- 2c -0,23 2Ag4-2OH'Ji +0,35
NiJiNi”4-2e —0,22 Ag2^ ~h H2O + 2e
V’’JiV”’4-e -0,2 V ”4-H2O Ji JtVO” 4- 2H’ 4- e +0,4
C«4-J'jtCuJ4-e -0,17 4OH' Ji O2 4- 2H2O 4- 4e +0,41
Ag 4- J' AgJ 4- e —0,14 Co Ji Co'” 4-3c +0,42
Snii Sn’’ + 2e —0,14 Fe(CN)6""Ji +0,44
PbJiPb”4-20 —0,13 ?Fe(CN)6’"4-c
61
Продолжение табл. 11
Реакция E0 в вольтах Реакция Eo в вольтах
~ Вг2 жид. + 6ОН'^г +0,51 2H2O^O2 + 4H' + 4e +1,23
ВгО8' + ЗН2О + 5е Au +: Au"’ + 3e +1,3
Сц Cu‘ + е +0,51 2Cr'" + 7H„O +1,3
—Cr.O/'+ ШГ +fe
МпО> 4- 4ОН’ +0,52 +1,35
^*Мпб4' 4-2Н .О -рЗ<? Mn + 2H?O
5±MnO2+4H +2e
J'- у Ja + e +0,58 СГ Cl2 газ + e +1,36
H3AsO3 + Н2О H3AsO4 4-21Г +2e +0,58 Pb" + 2H,O7± 5±PbO2 + 4H' + 2e +1,44
Br' + 6OH'^ +0,60 СГ+ 3H«O?i +1,44
BrO3' 4- 3H2O + 5e CJOg'+ 6H'+ 6e
T1 д±ТГ" + Зе +0,72 Ce’"?i Ce"" +e + 1,45
Fe" Fe"’ 4- в +0,75 4 Br. + 3H2O ч~± +1,45
Ag^Ag -j-e +0,80 2
1 5± BrO3' + 6H' + be
Hg7± — (Hg2)" +e +0,80 ! Br' + 3H2O?± +1,48(7)
5±BrO3'+6H' +6e
H2O2?i O2 + 2H" + 2e +0,85 ! Au?i Au' + e +1,5
Cl2 газ 4- 20 H' ?J2HC1O + 2e +0,86 J Cl' + H.O +1,51
1 it HC1O + H' + 2e
Hg^Hg'4-2e +0,921 . Mn" + 4H2O«± +1,52
Hg2 »-2Hg + 2e +0,95 5tMnO4' + 8H' + 3e
NO газ + 2НоО?± +1,0 MnO2 + 4H,O?± +1,63
j±NO3'-t 4H' 4-3e 5±MnO4'+4H- + 3e
J' + 3H2O JO3' 4- 6FF 4- Ce +1.02(?) 2H2O?±H2O3 + 2H' +2e +1,66
2OH'^H2O24-2e +1,08 — Cl2 газ + H2O +1,67
J ^tHCIO + H' +e
Br' — Br2 жид. 4- e + 1,10
1 Co Co c +1,8
+ + 3H2O +1,19 O2 газ + H2O + 1,9
— JO3 +6H' 4-5e „'О, газ + 2H' 4- 2e
Au'52 Au"' 4-2e VO" 4- 3H,0 +1,2 +1,2 2H2O 2H- + H2O2 + 2e + 1,9
VO.W 4- 6H' 4- e F'^t Д- F. газ + e + 1,96
ТГ7±ТГ"4-2е + 1,21 2
1 Значения потенциалов двух приведенных в таблице соединений рту
в присутствии нормального раствора СГ соответственно равны — 0,27 и — 0,1
что объясняется очень малой растворимостью Hg2Cl2 и слабой ионизаци<
HgC!,.
62
Реакция VO " + 2НаО VOs' + 4H*. + e строго обратима. Уравнение
Нернста для этой реакции таково:
r„. = fo+0,0591Bt™-W.
Если [VOs'J = [VO ‘электродный потенциал равен +0,92 при Н’ = 1
и 0,68 при pH = 1.
Если какой-нибудь элемент способен давать соединения различной сте-
пени окисления, то возможно вычислить окислительный потенциал данной
степени окисления при условии, что потенциалы других степеней окисления
известны. Так, если мы знаем окислительный потенциал Fe/Fe‘ ' и
Fe’’/Fe’’’, мы можем .вычислить окислительный потенциал Fe/Fe’’’.
Работа, требующаяся для полного окисления, будет одна и та же, произ-
водят ли окисление сразу или постепенно. Работа, производимая электри-
чеством, измеряется количеством электричества (кулоны), умноженным на
соответственный вольтаж. Таким образом, обозначив через а вольтаж для
окисления Fe до Fe’’, через О — вольтаж для окисления Fc ’ до Fe’ ’ ’
и через с—для окисления Fe до Ее’’’ и пользуясь символом F, пред-
ставляющим собой фарадей или 96 500 кулонов электричества, мы получим,
что для окисления 55,84 г железа необходимо: 2Fa + Fb = 3Fc или
2И + b — Зс
Действие общего иона
Степень ионизации слабого электролита сильно зависит от
одновременного присутствия в растворе сильного электролита,
имеющего с ним общие ионы. Так, уксусная кислота в рас-
творе, содержащем ацетат щелочного металла, ионизирована
значительно меньше, чем в чистой воде. Хлористоводородная
кислота сильно понижает ионизацию сернистого водорода; ам-
монийная соль в заметной степени уменьшает ионизацию рас-
творов аммиака.
В водном растворе слабой кислоты НА степень ионизации
определяется величиной ее константы диссоциации:
_[Н’][А']
V<1 [НА] ’
Откуда концентрация водородных ионов:
В растворе уксусной кислоты и ее натриевой соли находятся
водородные ионы, образующиеся за счет ионизации, как уксусной
кислоты, так и воды; но ионизация последней настолько мала,,
что мы без большой ошибки можем предположить, что все Н‘
образуются за счет уксусной кислоты. Ацетатные ионы обра-
зуются за счет ацетата натрия и уксусной кислоты; однако, до-
бавив примерно эквивалентное количество ацетата натрия к рас-
твору уксусной кислоты, мы так понизим ее ионизацию, что
количество образуемых ею ацетат-ионов будет ничтожно мало
по сравнению с количеством их, образуемых ацетатам. Поэтому
без большой погрешности можно считать, что общая концентра-
ция ацетат-ионов в растворе обусловлена только наличием аце-
тата и будет равна концентрации этой соли. Если обозначить
концентрацию слабой кислоты через са, а концентрацию соли
(В
через cs (выразив обе концентрации в мелях на литр), то урав-
нение (1) примет вид:
(2)
*-s
Это уравнение можно рассматривать лишь как приближенное. Несколько
большей точности можно достигнуть, считая [НА] = са —[Н'] и
[А'] = с . + [Н’], потому что часть кислоты ионизирована и содержит
равное число ионов А' и Н". В этом случае уравнение (2) может быть
представлено в виде:
<3>
Получаемое при этом квадратное уравнение легко может быть решено,
если ввести в него числовые величины К„ и сА.. Для еще большей точ-
ности нужно было бы принимать в расчет не концентрацию соли с#, а- ее
активность.
Величина [Н'], вычисленная для ОДА уксусной кислоты в присутствии
ОДА ацетата натрия по уравнению (2), равна 0,0000174; по более же точ-
ному, только что приведенному способу вычисления получается практически
та же самая величина, что указывает на возможность применения для
большинства целей приближенного уравнения.
Если взять раствор слабого основания ВОН, ионизация ко-
торого на В’ и ОН' измеряется величиной его константы дис-
социации:
„ __ |В]|ОН']
Ль [ВОН] ’
то те же рассуждения приводят к заключению, что приближен-
ная концентрация ОН' в растворе слабого основания и какой-
либо его соли выражается уравнением:
[ОН'1=-^-/<-6 = ^6)
Lu J с8
а так как
lH'l=Wr (стр- 29)’
то
где cs—концентрация соли слабого основания и съ — концен-
трация основания.
Растворы, содержащие слабую кислоту и ее соль или слабое
основание и его соль, называются буферными раство-
рам и. При прибавлении к ним небольших количеств кислоты
или основания концентрация водородных ионов в них остается
почти без -изменения. Так, -раствор, содержащий уксусную кис-
лоту и ацетат натрия в концентрациях, равных 0,1 N каждого,
имеет pH = 4,75. Если к 100 пл раствора такой смеси прибавить
1 пл 0,lN едкого натра, то pH смеси будет равен 4,755. Такие
буферные -растворы широко используются в аналитической химии.
Иллюстрируем действия общего иона на такие слабые элек-
тролиты, как уксусная кислота, гидроокись аммония и серни-
64
стый водород. Величина констаны ионизации уксусной кислоты
при 25° равна 0,000017. На основании этого мы можем вычис-
лить концентрацию водородных (и равную ей ацетатных) ионов
в 0,lN растворе уксусной кислоты по формуле:
[Н'] = У~Кс == 1/1,7 • Ю-s - Ю'1 = 0,0013 моля/л.
Соли типа ацетата натрия (согласно табл. 2) диссоциируют
приблизительно на 84%. Поэтому 1 л 0,1 N раствора ацетата
натрия содержит 0,084 моля ацетат-ионов, между тем как 1 л
0,177 уксусной кислоты содержит только 0,0013 моля ацетат-
ионов. Приготовим раствор, содержащий уксусную кислоту и
ацетат натрия каждые в концентрациях, равных 0.1 Л/. Согласно
формуле (2) на стр. 64 концентрация водородных ионов в та-
ком растворе будет равна:
[Н‘] = ~-Ка = • 1,7 • Ю-5 = 0,000017 моля/л.
Cs и,1
Следовательно, при добавлении эквивалентного количества
ацетата натрия к 0,17V раствору уксусной кислоты концентрация
водородных ионов снизилась с 0,0013 до 0,000017 моля/л или,
что то же, ионизация снизилась с 1,3 до 0,02%.
Таково же действие аммонийной соли на ионизацию гидро-
окиси аммония. Согласно табл. 8 (стр. 37) произведение рас-
творимости гидроокиси железа равно 1,1-10“36, а гидроокиси
магния 1,2-10-11. Эти числовые значения показывают, что тре-
буется лишь крайне низкая концентрация гидроксильных ионов,
чтобы было достигнуто произведение растворимости гидроокиси
железа, и во много раз большая концентрация их для достиже-
ния произведения растворимости гидроокиси магния. Если при-
бавить гидроокись аммония к раствору, содержащему ионы
трехвалентного железа и магния, то выпадет осадок гидрооки-
сей как железа, так и магния1. Но при прибавлении к раствору
достаточного количества хлористого аммония ионизация осно-
.вания будет понижена точно так же, как понижается ионизация
уксусной кислоты в присутствии ацетата натрия, причем в та-
ких размерах, что магний не будет осажден, хотя осаждение
железа будет практически полным.
Аналогично действие водородных ионов на ионизацию сер-
нистого водорода. Произведение растворимости сернистой меди
равно 8,5 • 10-43, а сернистого цинка 1,2 -IO"-’3. Осаждение как
сульфида меди, так и сульфида цинка происходит практически
полностью в растворе, не содержащем избытка водородных
ионов. Однако в процессе осаждения металла из его солей
сероводородом, если не принимать специальных мер (например,
не вести осаждение в буферном растворе), образуется избыток
водородных ионов согласно уравнению:
Zn" 4-H2S -> ZnS%2H’.
Накопление этих водородных ионов ведет к понижению
ионизации сернистого водорода, и этим самым приостанавли-
5 Зак. 082. Тредаелл-Голл, г. L
65
вается 'дальнейшее осаждение цинка. Поэтому, если хотят оса-
дить медь и оставить цинк в растворе, необходимо предвари-
тельно прибавить 'немного кислоты. В 0,3N растворе кислоты
происходит практически полное осаждение меди в виде суль-
фида. между тем как цинк, если и осаждается, то в очень ма-
лой степени. Если же к раствору добавить небольшое количе-
ство ацетата натрия, то образуется слабо ионизированная
уксусная кислота и концентрация водородных ионов все время
остается низкой. Достигаемый этим эффект столь значителен,
что легче оказывается осадить сульфид цинка из раствора, со-
держащего уксусную кислоту и ацетат натрия, чем из раствора
хлористого цинка в воде. Концентрация водородных ионов
остается очень низкой, хотя раствор может даже сильно пах-
нуть неионизированной уксусной кислотой.
Действие общего иона проявляется также и при растворе-
нии осадка, что может быть показано на примере растворения
фосфата кальция в кислоте. Насыщенный раствор фосфата
кальция содержит ионы Са'" и РОД'. Прибавляя избыток мине-
ральной кислоты, мы можем практически полностью подавить
диссоциацию фосфорной кислоты по 2-й и 3-й ступени (Кз = 3,6-
• 10~13, Ki = 2• ](У7; см. табл. 4, на стр. 28); а это значит, что
в этих условиях в растворе будут находиться только ионы
Н2РО4', но не НРОт" и не РОГ". Так как растворимость
CafjHsPOi)’ значительно больше, чем Саз(РОД2, то, переводя за
счет прибавления минеральной кислоты ионы РОГ" в Н2РОГ,
возможно растворить осадок фосфата кальция.
Действие общего иона, проявляющееся почти в каждой ре-
акции осаждения и растворения, должно рассматриваться как
следствие закона действия масс.
Гидролиз
Реакция между кислотой НА и основанием ВОН может быть
выражена уравнением:
НА + ВОН НгО + BA. (1)
Течение реакции слева направо называется нейтрализа-
цией, а справа налево — гидролизом.
Если кислота и основание, так же как и соль, практически
полностью ионизированы, то анион кислоты и катион основа-
ния не участвуют в реакции и нейтрализация может быть выра-
жена уравнением:
И' +ОН'-> НЮ. (2)
Реакция между сильным основанием и сильной кислотой про-
текает практически полностью, и концентрации Н‘ и ОН' в конце
ее будут соответствовать ионизации воды (стр. 29). Соли силь-
ных кислот и сильных оснований не обнаруживают заметного
гидролиза. Если кислота, основание или оба вместе лишь слабо
ионизированы, то уравнение (2) не является точным выражением
66
реакции (1). Если кислота слабая, з основание сильное, то урав-;
нение реакции будет иметь вид;
на+он'^ню + а: (3)
В случае сильной кислоты и слабого основания имеем:
И' 4-ВОН^НгО + В'. (4)
Если, наконец, и кислота и основание слабые, то реакция
между ними выразится уравнением:
НА + ВОН НгО -Ь В’ + А'. (5)
Эти три последние реакции нейтрализации не протекают с та-
кой полнотой, как реакции между сильными кислотами и силь-
ными основаниями, и в этом случае становится заметной обрат-
ная реакция-гидролиз.
I. Гидролиз солей слабых кислот и сильных оснований
Основание, образующееся при гидролизе, сильно ионизиро-
вано, между тем как ионизация кислоты незначительна. Реак-
ция протекает справа налево по уравнению (3) и гидролиз мо-
жет быть представлен в следующем виде;
А' -Ь НгО гд НА + ОН'.' (6)
В результате гидролиза водный раствор соли будет иметь
большую концентрацию ОН', чем вода; другими словами, pH
водного раствора соли будет больше 7 (см. стр. 29).
Реакция (6) обратима и к ней применим закон действия масс:
[НА] [ОН/] _
[Az] —Кгидр- (7)
В этом выражении нет необходимости принимать в расчет
концентрацию самой воды, которую можно рассматривать как
величину постоянную. К:!1сР. называют константой гидролиза.
Ее можно рассматривать как простую функцию от Кп—кон-
станты ионизации кислоты и от К„,—-ионного произведения
воды (ICH1 при комнатной температуре, стр. 29).
Если умножить числитель и знаменатель в уравнении (7)
на концентрацию Н’ в растворе, то получим:
[НА][Н-][О1Г] .
[И’] [А'] —
Так как
и [Н-][ОН'] = ^,
то
[НА] [ОН^] _ __ fZ ,Q.
IA'] Д’ ‘'гидр • (j)
В уравнении (6) мы имеем равные концентрации НА и ОН',
образованных в результате гидролиза соли слабой кислоты и
сильного основания. Заменим поэтому в уравнении (9) вели-
5*
67
чину [НА] равной ей [ОН'], а взамен величины [А'] подставим
примерно равную ей концентрацию соли cs.
Тогда получим:
И [О1Т] = ]/Г'^с.
С i\a г
Так как
то
(Ю)
Решая это уравнение с помощью логарифмов, имеем:
lg lH']^j\gKa±~lgKw--~\gc
= (11)
Так как
pH lg р’у = - lg [М ],
P^=lg-r- = -lg^<o>
1Ха
r'W
то, вводя эти величины в уравнение (11), получим приближен-
ное выражение pH водных растворов соли слабой кислоты и
сильного основания:
pH = 7 + (12)
Определим, например, значение pH 0.025У раствора ацетата натрия.
Так как оба иона этой соли одновалентные, то концентрация ацетатного
иона будет равна концентрации соли, т. е. 2,5 -ПУ-2 холя/л. Логарифм этого
числа 2,40 или, что то же — 1,60. Поэтому числовое значение’A Igc = —0,80.
Константа диссоциации уксусной кислоты 0,000017 = 1,7 • 10"5 и pKa~i,76.
Вставив эти числа в уравнение (12), получим:
pH - 7 4- 2,38 — 0,80 = 8,58.
Вследствие наличия ионов ОН' в заметной концентрации все
соли этой категории показывают щелочную реакцию. К этому
типу солей принадлежат щелочные соли цианистоводородной,
хлорноватистой, угольной, борной и сернистоводородной кислот.
II. Гидролиз солей сильных кислот и слабых оснований
В данном случае условия обратные только что изложенным:
кислота почти нацело диссоциирована, диссоциация же осно-
68
вания незначительна. Реакция гидролиза протекает по уравне-
нию (4) справа налево. Закон действия масс для реакции:
В' 4- Н2О гдН' 4- ВОН
дает
(13)
[ВОН] [Н'1 _ „
jgTj------1\гидр
(14)
Умножив числитель и знаменатель на [ОН’], получаем:
[ВОН] m [ОН'] _ ‘
[B J [OH'J ~Кь~ ^идр' 1 °'
Из уравнения (13) видно, что ,в результате гидролиза обра-
зуются равные концентрации Н‘ и ВОН и можно пренебречь
очень малым количеством Я' за счет ионизации воды. Поэтому
в уравнении (14) можно [ВОН] заменить [Н ], а [В‘] заменить
концентрацией соли с и тогда:
[Н-р „ А4 „
(16)
откуда
[н-]=1/4|4
Логарифмируя это уравнение, получаем:
1g [Н‘] ==у lgKw + 4 Igc — Ig^s
и
— lg[H']= ——^Ig^ + ylgA'j. (17)
Подставляя
pH=— lg[Н ], рЛ’^ — 14 и РКЬ = — lg Kh,
получим числовое значение pH водного раствора соли слабого
основания и сильной кислоты:
pH = 7-4^<6-l]gc. (18)
Соли этого типа, как, например, соли аммония, хрома, алюми-
ния, железа и пр., показывают в водных растворах кислую
реакцию.
В случае поливалентных оснований гидролиз протекает по-
следовательно:
RC1.4 4- НЮ - RCh(OH) 4- И';
RC1" 4- 2НгО -RC1(OH)2 4- 2Н‘;
R- ’ • 4- ЗН2О R(OH)3 + ЗН'.
Хлориды трехвалентного железа, алюминия и хрома, имеющие
кислую реакцию в водных растворах, при выпаривании послед-
них досуха теряют значительное количество соляной кислоты
вследствие ее улетучивания; получающийся при этом остаток
69
представляет собой нерастворимую основную соль, которая мо-
жет быть растворена только га кислоте. При кипячении вод-
ного раствора хлористого аммония образующийся вследствие
гидролиза аммиак улетучивается значительно скорее хлористо-
водородной кислоты; дестиллат получается явственно щелоч-
ным, а оставшаяся жидкость становится более кислой.
III. Гидролиз солей слабых кислот и слабых оснований
Кислоты и основания, образующиеся при гидролизе, отли-
чаются слабой диссоциацией. В этом случае реакция идет по
уравнению (5) справа налево
В’ + А' + Н>0 " НА + ВОН.
Согласно закону действия масс:
[НА] [ВОН] _ „
(19)
Умножив числитель и знаменатель на [Н ] [ОН'] и помня,
что [НА] = [ВОН], получим:
[НА][ВОН] [1Г][ОН-] ___
[.Т] [A'] [B’j [ОН ] КаКъ гид1,‘
(20)
Если концентрацию -соли обозначить через с и предполо-
жить, что в уравнении (19) [А'] = [В] — с, получим из уравне-
ния (20):
[ВОН] = [НА] -с/(21)
Так как
ПнаТ-”^ и ’
то, вставив в уравнение (21) эту величину [НА] и -приняв
[А'] = с, получим:
Решение с помощью логарифмов дает,
lg [Н-] =1g 4-4 lg С — 4'‘g
и
~ ig [и']=-4 ig ка - 4 ig kw+4 \%кь.
Так как
рН = —lg[lT]; — lg^ = 14; — \g Ка = рКа и --lgKb=pKb,
то уравнение (22) принимает вид:
pH •— / -ф g Р^а 2 Р^Ъ‘
(23)
70
Нужно заметить, чт.о при вышеприведенных допущениях
[Н’] и pH не зависят от концентрации соли. Однако уравне-
ние (23) верно только приближенно, потому что нами была
принята полная ионная активность и равенство между [ВОН] и
[НА]. Хотя ни одно из этих предположений не является вполне
верным, формула все же дает достаточно точные результаты,
если только гидролиз проходит не более чем на 5%.
Соли этого типа особенно подвержены гидролизу, и когда
и основание и кислота ионизированы очень слабо, гидролиз до-
стигает значительной степени, причем раствор не обнаруживает
ни кислых, ни основных свойств.
Если ионизация кислоты превышает ионизацию основания,
раствор показывает кислую реакцию и, наоборот, раствор соли
обладает щелочной реакцией, если основание сильнее кислоты.
Нейтральный ацетат трехвалентного железа при кипячении
в водном растворе гидролизуется согласно уравнению:
Fe(CH3COO),3 + 2НЮ Fe(OH)2(CH3COO) + 2СН3СООН.
При этом осаждается основной ацетат трехвалентного же-
леза, который можно удалить, фильтруя горячий раствор. Если
дать последнему охладиться без фильтрования, реакция пойдет
в обратном направлении и некоторое количество основной соли
снова перейдет в раствор. Гидролизу всегда благоприятствуют
повышенная температура и разбавление Ч
IV. Гидролиз солей сильных кислот и сильных оснований
Соли этого типа при гидролизе дают кислоты и основания,
почти напело диссоциированные в разбавленных водных рас-
творах. Поэтому основное уравнение гидролиза имеет вид:
„ [В‘] [ОН'] [Н-] [А'] __ ... ПНЧ
Кгидр =----’[В-ПА7]--- ] [ОН ].
Н‘- и ОН'-ионы находятся в равновесии с иедиссоциированными моле-
кулами воды; раствор показывает нейтральную реакцию, и концентрация
в мем Н" - и ОН'-ионов соответствует ионизации воды; так как величина
эта очень мала, можно полагать, что соли этого типа не подвергаются
заметному гидролизу и приходится считаться только с их электролитиче-
ской диссоциацией.
Гидролитическое действие воды, а также закон действия масс весьма
Наглядно могут быть иллюстрированы следующим опытом. Если к раствору
треххлористой сурьмы в концентрированной соляной кислоте прибавить
немного воды, то образуется осадок хлорокиси сурьмы;
ZC1 /О
Sb-Cl +Н2о 5Ьф Ч-2НС1,
\С1
которая при прибавлении небольшого количества концентрированной соля*
ной кислоты снова растворяется. Из этого раствора основная соль снова
выпадает при дальнейшем прибавлении воды и образующийся осадок опять
1 Величина !'w (стр. 29) — 1,0 • 1(Е14 при 25° и 5.1 10~13 при 100°. Увели-
чение ионизации воды благоприятствует гидролизу.
71
растворяется от большего количества соляной кислоты и т, д. Очевидно,
что реакция протекает по уравнению слева направо при увеличении дей-
ствующей массы воды и справа налево при увеличении концентрации соля-
ной кислоты.
В аналитической химии часто требуется либо способствовать
гидролизу, либо по возможности препятствовать ему. Такой контроль тече-
ния реакции возможен на1 основе закона действия масс. Чтобы содейство-
вать химической реакции, необходимо увеличить концентрацию одного из
вступающих в реакцию веществ или уменьшить концентрацию одного из
образующихся продуктов. Исключая реакции окисления и восстановления,
полностью протекающими в водных растворах реакциями являются такие,
при которых можно практически пренебречь концентрацией одного из
образующихся веществ; это происходит в случае: 1) образования осадка,
2) выделения газа или 3) образования недиссоцифрованного вещества
(ср. стр. 43). Нейтрализация кислот основаниями происходит .в силу тенденции
к образованию недиссоциированной воды1. Обратная нейтрализации реакция
гидролиза обусловливается тем, что вода слегка диссоциирована. Гидролиз
происходит в том случае, когда одним из его продуктов является газ,
осадок или иедиссоциирсванное вещество. Так, гидролиз соли слабой кисло-
ты и сильного основания обусловлен незначительной диссоциацией слабой
кислоты. Равным образом гидролиз соли сильной кислоты1 и слабого осно-
вания обусловливается образованием' недиосоциированного основания..Гидро-
лиз происходит большей частью легко, когда и кислота и основание яв-
ляются слабыми, потому что тогда удаляются из раствора и Н’- и
ОН'-йоны с образованием мало диссоциированной кислоты и мало диссо-
циированного основания. Соль сильной кислоты п оильного основания не подвер-
гается гидролизу, потому что отсутствуют условия, способствующие удалению
Н' - и ОН'-ионов воды из раствора. Чтобы способствовать гидролизу, рекомен-
дуется кипячение, потому что вода значительно больше диссоциирована
при температуре кипения, чем на холоду. Часто реакция, протекающая при
кипячении, идет при охлаждении в обратном направлении просто по- той
причине, что происходит изменение ионизации самой воды.. Разбавление
благоприятствует гидролизу, потому что оно уменьшает концентрацию
образующихся веществ; концентрация ионов воды при этом не изменяется,
но происходит относительное увеличение концентрации их по сравнению
с концентрацией других присутствующих ионов. Также благоприятными
для гидролиза являются те условия, когда один из продуктов газообразен
или нерастворим. Так, карбонат аммония весьма легко гидролизуется, по-
тому что и аммиак и двуокись углерода летучи; ацетат трехвалентного
железа гидролитически расщепляется не только1 потому, что и кислота и
основание слабые, но также и в силу весьма малой растворимости основ-
ного ацетата железа. Наконец, чтобы воспрепятствовать гидролизу, необ-
ходимо только прибавить предварительно или немного свободной кислоты
или основания. Действие последних пропорционально степени их иониза-
ции. Если раствор становится щелочным вследствие гидролиза, то лучшим
способом приостановки последнего является прибавление небольшого коли-
чества едкой щелочи. Если же раствор становится кислым, то следует при-
бавить немного кислоты. Кроме того, рекомендуется работать на холоду
и с концентрированными растворами. Разбавленный водный раствор циани-
стого калия имеет запах свободной цианистоводородной кислоты и реаги-
рует по отношению к лакмусу как щелочь, но если прибавить немного
едкого кали, то гидролиз соли подавляется и запах цианистоводород-
ной кислоты уже не может быть больше обнаружен. Точно так же при
кипячении нейтрального раствора сульфата трехвалентиого железа обра-
зуется осадок соли основного сульфата, но образованию осадка можно
воспрепятствовать, если прибавить предварительно Немного серной кислоты.
Амфотерные электролиты
В течение первой половины XIX в. кислород рассматривался
как существенная составная часть всех .кислот. По дуалистиче-
ской теории Берцелиуса полагали, что существуют двоякого
72
рода окисли: положительные окислы, которые, соединяясь
с водой, образуют -основания, и отрицательные окислы, обра-
зующие при соединении с водой кислоты. Соли по этой теории
получаются от соединения положительных окислов с отрица-
тельными.
Термины положительный и отрицательный являются поня-
тиями относительными, так как некоторые окислы положительны
по отношению к одним и отрицательны по отношению к другим
окислам. Так, закись олова SnO может соединяться с более поло-
жительной окисью натрия Naz-O, образуя соли станнита натрия
NazO-SnO; но она может образовать также сульфат олова с более
отрицательной трехокисью серы SnO-SOs.
Характеристикой кислоты 1 служит ее способность отщеплять
в водном растворе водородные ионы, а характерным свойством
основания является его способность к образованию в водных
растворах гидроксильных ионов. Нейтрализация кислоты осно-
ванием характеризуется как процесс соединения водородных
ионов кислоты с гидроксильными ионами основания.
Однако химики рассматривают такие вещества, как силикат
двухвалентного железа FeSiOs, как соли, хотя ни закись железа,
ни двуокись кремния в воде не растворяются и, следовательно,
не дают ни водородных, ни гидроксильных ионов. Силикат за-
кисного железа рассматривается как соль гипотетической мета-
кремневой кислоты FfeSiOs, не отщепляющей водородных ионов
при смешении с водой. Кроме того, оба соединения если и су-
ществуют, то растворимость их в воде весьма мала и они не
могут давать необходимые для образования соли ионы 2.
Изучение, таблицы периодической системы элементов показы-
вает, что группы элементов, находящиеся в левой стороне ее,
более легко образуют основания, чем элементы, помещенные
в правых группах. Тенденция к образованию основания в ка-
кой-либо группе возрастает с атомным весом! элемента. Тенден-
ция к образованию кислоты у отдельных элементов увеличи-
вается с повышением их валентности. Так, например, фосфорная
кислота сильнее кремневой и слабее серной кислот. Кремний,
фосфор и сера находятся рядом в одном и том же' горизонталь-
ном ряду таблицы. Фосфорная кислота, в которой фосфор пя-
тивалентен, сильнее фосфористой кислоты с трехвалентным фос-
фором. Сурьма, находящаяся подобно фосфору в V группе,
образует более слабые кислоты, чем соответствующие кислоты
фосфора. Висмут, металл той же группы, почти не обладает
тенденцией к образованию кислот.
Как общее правило, чем больше положительный заряд ка-
кого-либо элемента, тем труднее протекает ионизация его ги-
дроокиси по типу основания и легче по типу кислоты. Таким
1 См. стр. 16.
2 Существование H2S1O3 было доказано1 Schwarz, В. 57, 1477 (1924);
58, 73 (1925). Не исключается возможность, что природный силикат FeSiOs
образуется из гидратированного кремнезема.
73
образом, чем выше положительный заряд атома, тем
более он становится отрицательным согласно старому воз-
зрению. Эго видимое противоречие не так уже велико, как это
кажется; оно происходит от смешения фактора интенсив-
ности электрической энергии с фактором количества
электричества. Все формы энергии слагаются из этих двух фа-
кторов, и такое смешение их является весьма обычным.
Количество электричества, соответствующее единице электрического за-
ряда, связанного с грамматомом какого-либо элемента, равно 96 500 кулонам.
Такой заряд несут все одновалентные элементы, в два разя больший заряд
несут все двухвалентные элементы. С другой стороны, сильно варьирует
стремление атома присоединять или отдавать электроны, как это видно из
табл. 11 (стр. 61). Принято говорить об элементах, обладающих большей
тенденцией терять один или несколько электронов (т. е. отрицательных
электрических зарядов), как об элементах, которые более положительны,
чем элементы с меньшей тенденцией к потере электронов. Другими сло-
вами, элементы, стоящие ближе к началу электродвижущего ряда, рассма-
триваются как более положительные, чем те, которые расположены в ряду
ниже их. Таким, образом, в старом воззрении на отрицательную и положи-
тельную природу элемента заключалось в значительной мере больше поня-
тия об электродвижущей силе или напряжении, чем об электрической при-
роде или количестве электричества. Это соответствует поведению элемента
и электрической паре батареи Даниеля: цинк в ней становится анодом,
а медь — катодом. Электроны движутся через батарею от меди к цинку,
и обычно говорят, что цинк в растворе заряжен по отношению к меди
положительно. Нужно уметь делать различие между значением слова «по-
ложительный», когда оно употребляется в смысле вольтажа,_и значением
его, когда им хотят охарактеризовать природу электрического заряда.
Вода представляет вещество, которое нанизирует в малой
степени и продуктами ионизации которого являются Н’ и ОН'.
Следовательно, вода может рассматриваться и как кислота, и
как основание. Имеются вещества, являющиеся кислотами, ко-
торые в то же время дают водородных ионов не больше, чем
вода. Точно так же имеются другие вещества основного хара-
ктера, не дающие больше гидроксильных ионов, чем вода. Вода
характеризуется именно тем, что при ее диссоциации одновре-
менно образуется равное количество водородных и гидроксиль-
ных ионов. Существуют другие гидроокиси, обладающие кис-
лыми и основными свойствами, что зависит от двоякого хара-
ктера их ионизации; в одном случае они диссоциируют как кис-
лоты, в другом — как основания. Такие вещества называются
а м ф от е ри ы м и эле к тр о л и т а м -и.
Гидроокись алюминия представляет такой амфотерный эле-
ктролит. Это вещество имеет очень малое произведение рас-
творимости, и концентрация его ионов, находящихся в насыщен-
ном растворе, чрезвычайно мала. Однако химическое поведение
гидроокиси алюминия показывает, что она способна диссоции-
ровать по двум направлениям:
А1(ОН)з -> А1(ОН)г‘ + ОН' (ионизация по типу основания);
А1(ОН)з-> Н’ + А1ОзН2'-» Н’ф- А1О2'+ Н2О
(ионизация по типу кислоты).
74
. Закон действия масс дает возможность предвидеть, какая
из этих двух реакций ионизации будет иметь место. В присут-
ствии сильной кислоты, например хлористоводородной, действие
общего водородного иона будет препятствовать гидроокиси
алюминия диссоциировать по типу кислоты; это действие зна-
чительно более заметно, чем действие ацетата натрия на уксус-
ную кислоту, потому что в этом случае различие в проценте
ионизации хлористоводородной кислоты и алюминиевой кис-
лоты значительно большее. С другой стороны, присутствие во-
дородных ионов благоприятствует ионизации гидроокиси алю-
миния по тину основания. Равновесие между Н', ОН' и Н2О
устанавливается, когда почти все ОН'-ионы гидроокиси алюми-
ния прореагируют с Н'-ионами хлористоводородной кислоты.
Вследствие удаления из реакционной смеси ОН' идет дальней-
шая ионизация А1(ОН)з; А1(СН)г‘ ионизирует на А1(ОН)' ’ и ОН’
и, наконец, А1(ОН)” ионизирует на АГ” и ОН'. Таким путем
происходит растворение А1(ОН)з с образованием АГ”.
Точно так же в присутствии гидроокиси «атрия действие вве-
денного в радт-зор об!дето ОН'-иона препятствует ионизации ги-
дроокиси алюминия по типу основания; Н’-ионы, образующиеся
при диссоциации его по типу кислоты, реагируют с ОН'-ионами
гидроокиси натрия. В результате весь алюминий растворяется
в виде алюмината натрия.
Всякий раз, когда окись или гидроокись растворяется при
химической реакции как в, кислоте, так и в едкой щелочи, за-
ключают, что данное вещество является амфотерным электро-
литом.
Открытие кислот и оснований. Теория индикаторов
Чтобы определить концентрацию свободных водородных или
гидроксильных ионов, пользуются некоторыми красящими орга-
ническими веществами, называемыми индикаторамщ Ин-
дикаторы являются либо весьма слабыми кислотами, либо’ весьма
слабыми основаниями, либо амфотерными электролитами. В сво-
бодном состоянии эти кислоты или основания неустойчивы и
приобретают устойчивость за счет перегруппировки атомов
в молекуле. Цвет какого-либо органического соединения обу-
словливается наличием некоторой определенной группировки
атомов, образующей так называемый хромофор; если эта
группировка меняется, окраска меняется также или совсем исче-
зает.
Концентрация водородных ионов может быть также опреде-
лена электрометрически путем измерения электродвижущей силы
водородного электрода, помещенного в раствор и соединен-
ного с электродом известной электродвижущей силы, каким
является каломельный элемент. Если определенную таким обра-
зом электродвижущую силу сопоставить с электродвижущей си-
лой нормального водородного электрода, то [Н’] возможно
вычислить, пользуясь формулой Нернста (стр. 56):
£2.о== о 4- 0,059 lg С,
75
где с — концентрация водородных ионов (в молях на литр)"
в исследуемом растворе. При помощи потенциометрических из-
мерений возможно определить концентрацию водородных ионов,
при которых данный индикатор меняет свой цвет. Так как при
протекающих полностью реакциях нейтрализации концентрация
водородных ионов всегда бывает малой, то более удобно поль-
зоваться выражением — — pH, чем концентрацией с.
Если кислота нейтрализована основанием, то образующийся
водный раствор соли будет иметь pH = 7 только в том случае,
когда кислота и основание ионизируют в одинаковой степени.
Если кислота сильнее основания, тогда водный раствор соли
будет иметь pH < 7, и наоборот, в водном растворе соли pH бу-
дет > 7, если основание сильнее кислоты. Обычная дестилли-
рованная вода всегда содержит угольную кислоту в количестве,
достаточном, чтобы pH равнялось приблизительно 5,5.
В качественном анализе наиболее употребительны следующие
индикаторы.
Метилоранж, имеющий красный или розовый цвет
в кислом растворе, переходящий в желтый цвет в щелочном;
фенолфталеин — бесцветный в кислых растворах и окра-
шивающийся в красный цвет в присутствии оснований; лак-
мус, или л а к мои д, становящийся красным от кислот и си-
ним от оснований; наконец, желтая куркума, буреющая от
оснований. Из этих четырех индикаторов метилоранж наиболее
чувствителен к основаниям, а фенолфталеин к кислотам. Из-
вестны индикаторы, которые меняют свой цвет при значениях
pH от 1 почти до 14. В табл. 12 во втором столбце приводится
окраска индикатора сначала в кислом, а затем в щелочном рас-
творе. В третьем столбце указаны интервалы pH, т. е. числовые
величины pH, при которых происходит изменение окраски (точки
перехода).
Таблица 12
Изменение цвета индикаторов и границы интервалов pH
Название индикатора Изменение цвета Интервалы pH
Тимолблау Красный — желтый 1,2- 2,8
Бромфенолблау Желтый — синий 3,0— 6,0
Метилоранж Красный — желтый 4,0— 5,0
Метилрот Красный — желтый 4,4— 6,0
Кошениль Желтый — лиловый 5,0— 6,0
Бромкрезолпурпур Желтый — пурпуровый 5,2— 6,8
Лакмус Красный — синий 6,0— 7,0
Бромтимолблау Желтый — синий 6,0— 7,6
Фенолрот Желтый — красный 6,8— 8,4
Фенолфталеин Бесцветный — красный 8,0— 9,0
К резол рот Желтый — красный 7,2— 8,8
Тимолблау Желтый — синий 8,0— 9,6
Крезолфталепн Бесцветный— красный 8,2— 9,8
Тимолфталеин Бесцветный — синий 9,0—10,0
Тропеолин О Желтый—оранжево-желтый 11—12
Тринитробензол Бесцветный — оранжевый 12—13
Беизопурпурин Желтый — красный 13—14
76
Для приготовления раствора метилоранжа растворяют 0,02 г твердого
вещества в 100 .мл горячей водь!, дают охладиться и, если необходимо,
фильтруют.
Для приготовления раствора фенолфталеину растворяют 1 г вещества
в 100 .ил 80%-кого спирта.
Для приготовления раствора лакмуса продажный продукт (в кубиках),
не растирая его в порошок, заливают в фарфоровой чашке таким количе-
ством 80%-ного спирта, чтобы лакмус был полностью им покрыт, и нагре-
вают на водяной бане при постоянном помешивании. Сливают раствор пу-
тем декантации и повторяют эту операцию три раза для удаления посто-
ронних окрашенных веществ. Экстрагируют остаток горячей водой и дают
экстракту отстояться в высоком цилиндре в течение нескольких дней. По-
средством сифона сливают прозрачную жидкость, выпаривают до г/з
первоначального объема и подкисляют уксусной кислотой, чтобы разложить
содержащийся в лакмусе карбонат калия. Выпаривают до сиропообразной
консистенции и приливают к массе достаточное количество 90%-ного спирта.
Фильтруют и растворяют остаток в таком количестве гооячей воды,
чтобы от трех капель раствора появилась заметная окраска 50 мл воды-
Для приготовления раствора метилрота растворяют 0,1 г твердого веще-
ства в 300 мл спирта и разбавляют водой до 500 мл.
Для приготовления растворов крезолфталеина растворяют 0,1 г чистого
0-крезолфталеина в 500 мл 95%-ного спирта.
Для приготовления растворов индикаторов тимолблау, бромфенолблау,
бромкрезолпурпур, бро'мтимолблау, фенолрота и крезолрота растирают
0,1 г твердого вещества с эквивалентным количеством 0.05N раствора едкого
натра. Разбавляют водой до 500 мл последние два индикатора и до 250 мл
четыре первые индикатора.
Обозначим через Н1п индикатор, имеющий кислотный характер, и через
InOH — индикатор основного характера. Для реакций ионизации:
HIn £Н- + In';
InOH £In- + ОН'
закон действия масс дает:
[HIn] ~ Кп
fin’] [ОНП г
|1пОМ] ''
где Ка и Къ — константы ионизации, которые в данном случае называются
константами индикаторов. Характерным для индикаторов яв-
ляется следующее. Когда индикатор выделяется в свободном состоянии
в виде кислоты и основания, в молекуле его моментально происходит
перегруппировка атомов, результатом чего является изменение окраски
индикатора. Так, фенолфталеин, являющийся бесцветной кислотой, имеет
такую структуру;
Это соединение получается из двух молекул фенола и одной молекулы
^ангидрида
фталевой
кислоты
С6Н
/С0\
дб >О . В бесцветной форме шесть
чсо/
< углеродных атомсв каждого из его трех СоНгколец связаны между собой
77
поочередно простыми и двойными связями; так, строение самого фенола
выражается формулой:
Н Н
НС
с==с
с---с
^сон
н н
Когда образуется соль, бензоидная структура
называемую хиноидную:
превращается в так
С==СЧ
= С< >С =
XC==CZ
и двухосновный окрашенный анион фенолфталеина имеет строение:
Коллоидные растворы
Если разбавленный раствор щелочного силиката смешать
с разбавленной хлористоводородной кислотой, то раствор
остается прозрачным, несмотря на то, что кремневая кислота
лишь слабо растворима в воде. Если жидкость, полученную та-
ким образом, влить в сосуд, стенки которого сделаны из пер-
гаментной бумаги или пузыря (так называемый диализ а-
т о р), и поместить его в чистую воду, то возможно извлечь из
раствора весь избыток хлористоводородной кислоты и хлори-
стого натрия. Такой процесс называется диализом. В ре-
зультате диализа кремневая кислота остается в диализаторе.
Кремневая кислота не находится при этом в состоянии истин-
ного раствора. Если раствор выпарить, то остается аморфная
желатинообразная масса, которая лишь слабо растворяется
в воде. Точки кипения и замерзания таких растворов кремневой
кислоты не отличаются значительно от точек кипения и замер-
зания чистой воды. От прибавления различных веществ, осо-
бенно солей, происходит затвердевание жидкости в виде студня,
в особенности если она была предварительно несколько сконцен-
трирована путем испарения на холоду.
Сходный опыт может быть произведен с .мышьяковистой
кислотой и сернистым водородом. Водный раствор трехокиси
мышьяка окрашивается в оранжево-желтый цвет и становится
опалесцирующим, если пропускать через него сернистый водо-
род; при этом не образуется никакого осадка, хотя сернистый
мышьяк лишь весьма слабо растворяется в воде. Жидкость про-
ходит неизмененной, через обыкновенный бумажный фильтр.
Если же прибавить к желтой опалесцирующей жидкости неболь-
шое количество хлористоводородной кислоты или немного рас-
78
твора какой-либо1 соли, то тотчас выпадает тяжелый осадок сер-
нистого мышьяка. ’
Если жидкость, в которой трудно растворимое вещество ка-
жется находящимся в растворенном состоянии в концентрации,
далеко превосходящей его обычную растворимость, не обнару-
живая, однако, свойств пересыщенного раствора, то такую сис-
тему называют коллоидным раствором.
Такие растворы образуются весьма часто трудно раствори-
мыми студенистыми веществами. Раньше полагали, что они
представляют собой истинные растворы трудно растворимых
веществ в форме растворимой коллоидной модификации;
позднейшие наблюдение с ультрамикроскопом показали, что
коллоидные растворы представляют суспензии (взвеси) мель-
чайших твердых частичек. Переход в коллоидное состояние
препятствует осаждению нерастворимых веществ, и так как
ббльшая часть отделений в аналитической химии основана на
образовании осадков, то коллоидное состояние особенно интере-
сует аналитиков, ибо они должны, насколько это возможно,
избегать е'го.
Взвешенные частички большинства коллоидов'несут электри-
ческий заряд; между частичками и жидкостью существует раз-
ность потенциалов. Иногда частички заряжены положительно,
как это бывает с коллоидными растворами гидроокиси железа,
алюминия и хрома, иногда — отрицательно, как это бывает
с коллоидными растворами кремневой и оловянной кислот, суль-
фидами мышьяка и кадмия, иодидом и хлоридом серебра, 3oJ
лотом, платиной и серебром. Вещества, в коллоидном состоя-'
нии несущие электрический заряд, осаждаются электролитами.
Отрицательно заряженные коллоиды осаждаются под действием
положительных ионов и, наоборот, положительно заряженные
коллоиды осаждаются отрицательными ионами. Осажденное
вещество захватывает с собой осаждающие ионы, образуя
с Ними адсорбционное соединение. Осаждающая способность
электролитов увеличивается с увеличением валентности осаждаю-
щего иона.
Заряд некоторых коллоидов невелик, и иногда он бывает
положителен в кислом и отрицателен в щелочном растворах.
Коллоиды с небольшим электрическим зарядом не осаждаются
разбавленными растворами электролитов. Эти коллоиды оса-
ждаются при нагревании или с помощью какого-либо другого
метода дегидратации, как, например, путем прибавления концен-
трированных растворов солей (метод высаливания) или путем
добавления другого растворителя, например спирта. Коллоиды,
которые не чувствительны к осаждающему действию электро-
литов, часто ведут себя в качестве защитных коллоидов, пре-
пятствуя осаждению других веществ. Так, дубильная кислота,
желатина и альбумин действуют как защитные агенты, вероятно,
путем образования защитных пленок.
Чтобы избежать при аналитической работе условий, способ-
ствующих переходу веществ в коллоидное состояние, необ-
79
ходимо принимать меры предосторожности. Тах как эле-
ктролиты вызывают осаждение коллоидов, то можно ожидать,
что их отсутствие будет служить фактором, благоприятствую-
щим образованию ' коллоидных растворов. Таким образом,
осадки, обладающие стремлением переходить в коллоидные рас-
творы, лучше промывать раствором индиферентных электроли-
тов, чем чистой водой. Далее, если производят осаждение из
очень разбавленных растворов таких веществ, как, например,
сернистый мышьяк, то лучше всего с самого начала вводить
в раствор какой-либо электролит. Необходимо также помнить,
что коллоиды увлекают с собой осаждающие ионы, поэтому во
избежание аналитических ошибок, могущих возникнуть вслед-
ствие потери других присутствующих в растворе ионов, обык-
новенно вводят в раствор какие-либо другие ионы в виде кон-
центрированной кислоты или раствора аммонийных солей. Про-
мывание осажденного коллоида хлористым аммонием или ни-
тратом аммония постепенно удаляет из осадка захваченные им
ионы, но очень трудно избежать опасности потерять их.
Если в исследуемом растворе имеются защитные коллоиды,
главным образом типа желатины или альбумина, сильно мешаю-
щие осаждению, то их необходимо разрушить; обыкновенно
это делают путем окисления, прежде чем ‘приступают к анализу.
При определении размеров таких малых частиц, какими являются моле-
кулы, ионы или коллоидные частицы, принято обычно пользоваться тремя
единицами, которые во много раз меньше миллиметра, а именно: микрон,
миллимикрон и ангстрем:
Г микрон -- 1 р. = 10~3 j/.v,
1 миллимикрон = 1 mp. = 10-6 мм,
1 ангстрем = 1 А — Ю-7 мм = 0,1 тр..
Для очень малых весовых величин часто пользуются 0,001 мг. Такую
единицу веса обозначают греческой буквой у (гамма).
Крахмал, имеющий молекулы.'большого размера, при растворении»в воде
дает частицы с диаметром, доходящим до 5 тр, и обнаруживает некоторые
свойства коллоида. Вообще можно сказать, что ноны или молекулы
растворенных в воде веществ резко достигают размеров, превышающих
1 тр, если они образуют истинный раствор. Ноны, даже и гидратирован-
ные, имеют обычно диаметр порядка нескольких ангстремов. Если водный
раствор какого-либо электролита осветить сильным лучом света и рассма-
тривать раствор под прямым углом к направлению луча, то нельзя обна-
ружить никакого рассеивания света; если же диаметр суспендированных
частиц превышает 10 тр, то наблюдается рассеивание света (явление Тин-
даля). Поэтому присутствие таких частиц может быть открыто под ультра-
микроскопом. Но то, что мы в действительности видим под ультрамикро-
скопом, не является самой частицей, а ее дифракционным изображением.
С обычным микроскопом частицы размером меньше 0,25 р не могут быть
открыты. . _
Коллоидные частицы характеризуются размером, варьирующим между
1 тр и 0,1 р; если частицы имеют размер больше 0,1 р, такую систему
называют суспензией. Между истинным раствором, коллоидным раство-
ром и суспензией может быть проведена только чисто условная граница.
Трехсернистый мышьяк очень мало раствощш в воде (в 1 л воды
растворяется только лишь около 0,5 мг). При взбалтывании же очень тонко
растертого сульфида мышьяка с водой или при насыщении раствора мышья-
ковистого ангидрида сернистым водородом можно получить раствор, со-
80
держащий 10 г AssSs в 1 л воды. Такой раствор будет казаться прозрачным
в • проходящем свете и мутным1 в отраженном, потому что в данном случае
мы имеем не истинный, а коллоидный раствор.
Физические свойства истинного раствора (осмотическое давление, поии-
жеиие точки замерзания, повышение точки кипения и пр.) определяются его
концентрацией. Коллоидные же растворы отличаются .малым понижением
точки замерзания и малым повышением точки кипения по сравнению с чи-
стым растворителем.
Различают два типа коллоидов. Одни из них обнаруживают лишь сла-
бое сродство к воде. Их растворы отличаются незначительной вязкостью и
при коагуляции (образование хлопьев) от прибавления к ним- какого-либо
электролита они осаждаются в виде легко отфильтровываемого осадка.
Такие коллоиды называются суспензоидами или гидрофобными
(лиофобными) коллоидами. Коллоид, находящийся в состоянии суспензии,
называется золем, скоагулироваь.ный коллоид—гелем!. Большая часть
трудно растворимых неорганических осадков, какими являются сульфиды
металлов, фосфорномолибденовокислый аммоний, иодистое серебро и пр.,
относится к этому -типу коллоидов. Другой тип коллоидов имеет заметное
сродство к воде, и такие коллоиды называют эмульсоидами или
гидрофильными (лиофильными) коллоидами. Чтобы вызвать их
коагуляцию, требуются относительно большие количества электролита,
осадок сильно адсорбирует воду, и коллоидные растворы отличаются
большой вязкостью. К этому пипу коллоидов относятся органические
соединения, например протеины и высшие углеводы, а также кремневая
кислота и гидроокись алюминия. Гели этого типа весьма гигроскопичны и
удаление из них последних следов влаги удается лишь с трудом путем
прокаливания; примером могут служить окись алюминия и двуокись
кремния. Прокаленный остаток также гигроскопичен.
Коагуляция и пептизация. В аналитической химии следует избегать
коллоидных растворов, потому что вещество, находящееся в коллоидном
состоянии, не может быть отделено от раствора путем фильтрования через
бумажный фильтр. Скоагулирова.нные частицы имеют большую поверхность
и значительную адсорбционную способность. Тонко раздробленные частицы
могут находиться во взвешенном состоянии за счет адсорбции ионов, причем
коллоид приобретает электрический заряд. Если адсорбируются преимуще-
ственно катионы, то коллоид приобретает положительный заряд; в случае
же преимущественной адсорбции анионов заряд коллоида становится отри-
цательным. Ионы, определяющие первоначальный за-ряд коллоида, обычно
остаются адсорбированными им во время, а. иногда и после коагуляции.
Однако скоагулироваиный коллоид обыкновенно подвергается старанию, в
результате чего уменьшается его общая поверхность и понижается адсорб-
ционная способность.
Каждый осадок обладает способностью адсорбировать образующие его
ионы. Так, сульфид какого-либо металла обладает сильной адсорбирующей
способностью в отношении сульфидных ионов; галоидные соли серебра
сильно адсорбируют как ионы серебра, так и ионы галоидов. Когда, про-
исходит адсорбция одноименно заряженных ионов., должны быть адсорби-
рованы и противоположно заряженные ионы, чтобы сохранялась электро-
нейтральность. Так, иг пример, если- осадок сульфида адсорбирует сульфид-
ные ионы (первичная адсорбция), то за этим следует адсорбция водородных
ионов (вторичная адсорбция). Первично адсорбированные ионы прочно свя-
заны с поверхностью коллоида; другие же ионы, которые можно .назвать
противоионами, находятся на .некотором близком расстоянии Ст
поверхности. Электростатические силы между отрицательными ионами,
адсорбированными поверхностью сульфидного осадка, и положительными
Водородными ионами весьма значительны, и между коллоидными частицами
и окружающим их раствором образуется двойной электрический слой. Су-
ществование последнего обусловливает стабильность коллоидов. Все кол-
лоидные частицы имеют одноименный заряд и ие могут поэтому придти
в тесное соприкосновение. Если разрушить двойной слой, частицы соеди-
нятся друг с другом, образуя частицы большего размера. Двойной слой
может быть уничтожен прибавлением достаточного количества электролита,
результатом чего является коагуляция. Требующиеся для этого количества
6 Зак. 982. Тредвелл-Голл, г. I. 81
электролитов различны. Так, чтобы скоагулиропать золь трехсернистого
мышьяка, нужно прибавить 103 эквивалента NaCl, 1,31 эквивалента СаСк
и лишь 0,062 эквивалента AlCk.
При промывании коллоидного осадка водой может быть удалено некото-
рое количество адсорбированных им ионов. Когда концентрация этих ионов
в промывной воде станет ниже той, которая требуется для коагуляции,
частицы коллоида могут снова перейти в состояние золя. Такое явление,
называемое пептизацией, может быть предупреждено, если произво-
дить промывку не чистой водой, а раствором соответствующего элек-
тролита.
Иногда адсорбционная способность коллоида с успехом используется
при анализе. Так, гидроокись олова в растворе разбавленной азотной
кислоты настолько сильно адсорбирует НзРСк и НзАзСК, что в присутствии
достаточного количества коллоида можно полностью удалить из раствора
НзРСк и НзАзСк.
Осадки из очень разбавленных или из очень концентрированных
растворов выделяются в очень мелко кристаллическом виде. Так, осаждая
сульфат бария из растворов, концентрация которых или выше 0,75N или
ниже 0,001/V, получают такой мелко кристаллический осадок, что он имеет
коллоидные свойства и его нельзя удалить из раствора обычным фильтро-
ванием. Осадок является настолько мелким, что кажется аморфным.
Старение осадков. Очень мелкие осадки часто могут быть отфильтро-
ваны, если их оставить стоять некоторое время в маточном растворе. На-
гревание при температуре, близкой к точке кипения, часто также помогает
нормальному фильтрованию; для этой же цели рекомендуется добавление
мелко изорванной фильтровальной бумаги. Если производить осаждение из
очень концентрированных растворов', то кристаллизация протекает на-
столько быстро, что получаются плохо образованные кристаллы. При стоя-
нии происходит самопроизвольная перекристаллизация осадка. Мелкие кри-
сталлы имеют несколько большую растворимость, чем большие; поэтому
первые растворяются и выкристаллизовываются на больших. Иногда обра-
зующийся осадок вначале находится в метастабильной модификации и пре-
вращается при стоянии в более устойчивую форму, обладающую меньшей
растворимостью.
Соосаждение. Осадки редко бывают совершенно чистыми. Они содер-
жат некоторое количество маточного раствора и часто вещества, легко
растворимые при данных условиях. Так, когда осаждают сульфат бария,
прибавляя к раствору сульфата калия хлорид бария, осадок содержит
немного калия, который с трудом удаляется при промывке, хотя сульфат
калия легко растворим в воде. В таких случаях говорят, что произошло
соосаждение калия с сульфатом бария. Соосаждение иногда обусловливается
адсорбционными свойствами поверхности осадка. Адсорбцию посторонних
ионов поверхностью осадка называют иногда окклюзией в отличие от
инклюзии — захватывания кристаллами во время их образования неко-
торого количества маточного раствора. Иногда происходит образование
твердого раствора (или смешанных кристаллов) двух
веществ, имеющих одинаковую кристаллическую структуру. Так, PbSCh
иногда кристаллизуется с BaSCh, образуя, повидимому, гомогенную массу
или одну фазу.
Последующее осаждение, Многие осадки выделяются медленно, и
раствор находится долгое время в пересыщенном состоянии. Так, при
осаждении оксалата кальция в присутствии большого количества магния
осадок вначале практически не содержит магниевых солей. Но если ему
дать стоять со своим маточным раствором, начинается медленное образо-
вание оксалата магния, причем присутствующий оксалат кальция ускоряет
это образование. Аналогичное явление наблюдается в случае сульфидов;
некоторые металлы очень медленно осаждаются сернистым водородом, но
присутствие какого-либо другого сульфида часто ускоряет их осаждение.
Так, при пропускании сернистого водорода в раствор цинка в 0,1А соляной
кислоте сульфид цинка не образуется, если не давать раствору стоять
долгое время; если же в растворе имеются ионы ртути или меди, осажде-
ние последних в виде сульфидов вызывает во много раз более быстрое
82
осаждение сульфида цинка, чем это щЯшсходит при других условиях.
Вероятно, это обусловливается тем фактом, что сульфиды заметно адсор-
бируют сернистый водород, увеличивая, таким образом, концентрацию по-
следнего на поверхности осадка.
Выпаривание кислот
Часто бывает необходимо уменьшить концентрацию кислоты
в каком-либо растворе. Простейшим приемом является нейтра-
лизация, но зачастую бывает нежелательно ‘ введение посторон-
них веществ в раствор, и в таких случаях удаление кислоты
может быть произведено путем выпаривания. Для предупре-
ждения потерь за счет разбрызгивания выпаривание рекомен-
дуется проводить в фарфоровой чашке на паровой бане; чтобы
сэкономить время, выпаривать можно также и на голом пла-
мени. В этом случае раствор необходимо перемешивать или стек-
лянной палочкой, или вращая чашку над пламенем то в одну,
то в другую сторону. При выпаривании на пламени часто поль-
зуются эрленмейеровскими колбами. Так как стенки колбы,
охлаждаясь воздухом, действуют как конденсатор, то они за-
медляют выпаривание, но в то же время они служат для преду-
преждения механических потерь, Разбрызгивание вызывается
или слишком быстрым образованием паров на дне чашки, или
образованием их под коркой кристаллов на поверхности жид-
кости, или, наконец, превращением в парообразное состояние
маточного раствора, включенного в твердое вещество1, выделив-
шееся при выпаривании; в последнем случае пары удаляются
лишь после того, как давление их становится значительным.
При нагревании на голом огне стеклянная посуда '.может лоп-
нуть вследствие перегрева несмачиваемых жидкостью частей.
Во избежание этого посуду надо непрерывно передвигать в пла-
мени; дно колбы и всякой другой посуды должно быть равно-
мерно смочено, если даже осталось немного жидкости.
Интересно поведение кислот при выпаривании. Раствор хло-
ристоводородной кислоты плотностью 1,10 кипит при 110° при
атмосферном давлении. Такой раствор содержит 20,2% хлори-
стого водорода, и его концентрация, таким образом, несколько
меньше 6N. Из всех возможных смесей хлористого водорода
с водой указанная смесь кипит при наиболее высокой темпера-
туре. Поэтому при испарении более разбавленной соляной кис-
лоты будет испаряться, главным образом, вода до тех пор, пока
не получится более концентрированная кислота вышеприведен-
ного состава с постоянной точкой кипения. Ести же концен-
трация превышает 20,2% хлористого водорода, то при кипяче-
нии или выпаривании будет удаляться, главным образом, хлори-
стый водород, пока не останется 20,2%-ная кислота с постоян-
ной точкой кипения.
Азотная кислота точно так же дает смесь с водой с постоян-
ной точкой кипения. Эта смесь кипит при 120,5' и содержит
68% азотной кислоты. Концентрация кислоты в смеси 15,5N.
6*
83
Серная кислота образует с водой смесь, кипящую при по-
стоянной температуре 330° и содержащую 98,3% безводной
серной кислоты.
Раньше полагали, что такие смеси кислот и воды с постоян-
ной точкой кипения являются определенными гидратами кис-
лот; но так как состав таких смесей варьирует с изменением
внешнего давления, то, очевидно, не существует подобных опре-
деленных соединений.
Когда хотят превратить раствор хлорида в раствор нитрата,
то это легко сделать путем однократного или двукратного- вы-
паривания его с азотной кислотой. Азотная кислота реагирует
с хлористоводородной согласно уравнению:
6НС1 + 2HNO3 4НаО + 2NO + ЗС12,
и при прибавлении избытка азотной кислоты весь хлорид раз-
лагается. Более экономично такое превращение может быть
осуществлено путем выпаривания хлорида почти досуха и до-
бавления затем небольшого количества концентрированной,
азотной кислоты. Выпаривание повторяют и прибавляют азот-
ную кислоту до тех пор, пока от добавления кислоты уже не
будут больше выделяться красные пары (NO 4- воздух дают
красную двуокись азота NO2).
Точно таким же образом можно перевести раствор нитрата
в раствор хлорида.. Как и в предыдущем случае, образуется
царская водкаг, и при действии избытка хлористоводородной
кислоты разлагается весь нитрат.
Замещение азотной или хлористоводородной кислоты сер-
ной кислотой основано на другом принципе. В этом случае
обменное разложение путем выпаривания производят до по-
явления густых паров серной кислоты. Более летучая кислота
может быть удалена полностью с потерей только очень неболь-
шого количества серной кислоты.
Фосфорная кислота еще менее летуча. При выпаривании
с фосфорной кислотой может быть отогнана даже серная кис-
лота без потери заметного количества фосфорной кислоты;
сама фосфорная кислота превращается при этом в пирофос-
форную или метафосфорную кислоту.
Превращение сульфата или фосфата в хлорид или нитрат
представляет более трудную задачу, чем простое выпаривание.
В таких случаях принято удалять фосфат- или сульфат-ионы
путем осаждения или же осаждают открываемый катион в виде
гидроокиси или карбоната и растворяют осадок в желаемой
кислоте.
Фильтрование и промывание осадков
Чтобы полученный осадок можно было подвергнуть дальней-
шему исследованию, его необходимо отделить от жидкости по-
средством фильтрования. Нужно отметить следующее
1 Название «царская водка» дано смеси из трех объемов концентриро-
ванной соляной и одного объема азотной кислоты-
84
правило. Размер фильтра должен быть выбран
в соответствии с количеством кадка, а не
с количеством жидкости. В тех случаях, когда дело
идет об открытии незначительных следов какого-нибудь веще-
ства, часто бывает необходимо манипулировать с большими ко-
личествами исследуемого продукта, которые требуют для рас-
творения соответственно больших количеств жидкости. Если
из такого раствора образуется ничтожный осадок, то при филь-
тровании его через большой фильтр он распределится по зна-
чительной фильтрующей поверхности и с трудом поддастся
дальнейшей обработке.
Перед исследованием всякий осадок необходимо предвари-
тельно полностью освободить от фильтрата, что достигается
посредством промывания. Последнее производится до тех
•пор, пока в промывных водах нельзя уже обнаружить удаляе-
мое вещество. Если, например, имеется раствор сернокислого
натрия, в котором находится во взвешенном состоянии углекис-
лый барий, то после фильтрования промывание водой должно
продолжаться до тех пор, пока весь сернокислый натрий не бу-
дет удален; это узнается по отдельной пробе промывной воды,
которая, будучи подкислена соляной кислотой, от прибавления
хлористого бария не.дает более осадка. Далее, следует соблю-
дать следующее правило. Никогда не следует смеши-
вать фильтрат с промывными водами, потому
что последние обусловят ненужное разбавление его.
Фильтр всегда должен быть меньше воронки, и не следует
наполнять его до краев осадком; осадок должен быть на 5 мм
ниже края фильтра. Следует также избегать больших осадков,
которые могут затруднить точность работы; фильтрование,
а также и промывание длятся при этом дольше.
II. Реакции сухим путем
Эти реакции применяются, главным образом, при так назы-
ваемом предварительном испытании, при испытании осадков на
чистоту и при исследовании минералов.
Важнейшие реакции этого рода состоят в испытании веще-
ства на: 1) плавкость, 2) способность окрашивать несветящееся
пламя газовой горелки, 3) летучесть, 4) отношение к окислению
и восстановлению.
Для выполнения этих реакций пользуются большей частью
несветящимся газовым пламенем. Для понимания нижеописы-
ваемых приемов необходимо знание состава светильного газа
и природы пламени.
Светильный газ (полученный путем сухой перегонки угля)
содержит около 1,6% СОг, 4,0% ненасыщенных углеводородов
С„Н2га1, 0,4%о О2, 8,5% СО, 49,8'% Н2, 29,5% СНр 3,0% С2Н6 и
1 Под С»Н2п разумеются ненасыщенные углеводороды преимущественно
этиленового ряда (С»Н« — этилен). Газ, кроме того, содержит небольшие
количества ацетилена СаН», бензола СвНв, их гомологи и некоторые дру-
гие углеводороды. Ред.
85
3,2% Na. Все эти составные части, за исключением СОз, О2 и Na,
находящихся в светильном газе лишь в незначительном коли-
честве, горючи и обладают восстановительными свойствами.
Светильный газ обычно горит светящимся пламенем; свечение
обусловливается находящимися в газе ненасыщенными углево-
дородами (С„Н2,г), главным образом этиленом, пропиленом,
ацетиленом, бензолом и пр. Если этилен нагреть до определен-
ной температуры, то он распадается на метан и углерод:
С2Н4 -» СН1 -J- С.
Последний накаливается и этим вызывает свечение пламени.
Подобно этилену ведут себя и другие ненасыщенные углеводо-
роды. Все же остальные горючие составные
части светильного газа горят несветящимся
пламенем. Если к светильному газу дать
доступ большому количеству воздуха, то
выделившийся углерод сгорает и пламя де-
лается несветящимся. Приток воздуха до-
стигается открыванием отверстий, находя-
щихся в нижней части всякой бунзеновской
горелки.
По Бунзену различают в несветящемся га-
зовом пламени следующие части (рис. I)1:
1) внутренний конус п л а м е н н
АВА, в котором не происходит никакого сго-
рания, так как для этого температура здесь
слишком низка. В этой части пламени на-
ходится несгоревший газ, в котором содер-
жится около 62% воздуха;
2) н а р у ж н ы й кон у с АС АВА, обра-
зуемый горящим светильным газом, смешан-
ным с воздухом;
3) светящийся язычок DBD, который не образуется,
если приток воздуха через отверстие горелки будет обильным.
В этих трех главных частях пламени Бунзен различает шесть
следующих реакционных зон.
1) Основание пламени в точке а. Здесь температура
сравнительно очень низка, так как сгорающий газ охлаждается
притекающим снизу холодным воздухом и, кроме того, холод-
ный край бунзеновокой горелки отнимает значительное коли-
чество тепла. Этой частью пламени пользуются для испытания
способности летучих веществ окрашивать пламя. В присутствии
многих окрашивающих пламя веществ часто удается распозна-
вать их по очереди, так как сначала появляется окрашивание
от наиболее летучего вещества, а затем, позднее, замечается
окраска от менее летучего и т. д. Такая градация невозможна
1 Линии Е • Е на рис. 1 представляю! мета.;; шчеекпй конус, стоящий
на подставке F—Г. Назначение этого конуса, которым должна быть
снабжена всякая горелка, — предохранять пламя or колебаний, вызывае-
мых движением воздуха,
£6
при более высоких температурах, так как все вещества испаря-
лись бы одновременно и вызывали бы появление смешанной
окраски.
2) Часть пламени, о б л а д а .ю щ а я наивысшей
температурой, находится в точке Ь, несколько выше первой
трети всей высоты пламени, на равном расстоянии от внешней
и внутренней границ конуса пламени, где ширина последнего
наибольшая. Так как здесь развивается наивысшая температура,
то этим местом пламени пользуются для испытания веществ на
плавкость и летучесть.
3) Нижнее окислительное пламя находится у са-
мого внешнего края обладающей наивысшей температурой части
пламени (точка с) и пригодно в особенности для окисления
растворенных в стеклянных шариках окислов.
4) Верхнее окислительное пламя (точка d)
образовано несветящейся вершиной пламени и действует наи-
более сильно при совершенно открытых отверстиях горелки.
В нем производят окисление проб, взятых в большом количе-
стве, обжигание летучих продуктов окисления и вообще все
процессы окисления, которые не нуждаются в слишком высо-
кой температуре.
5) Н и ж н е е восстановительное пламя находится
в точке е, на внутреннем крае, обращенном к темному конусу.
Так как в этом месте, восстанавливающие газы еще смешаны
с неиспользованным атмосферным воздухом, то некоторые
вещества, восстановляющиеся в верхнем восстановительном пла-
мени, здесь остаются без изменения. Исследование вещества
в этой части пламени дает весьма ценные указания, которых
нельзя получить с паяльной трубкой. Эта часть пламени в осо-
бенности ' пригодна для восстановления на угле и в стеклянных
шариках.
6) Верхнее восстановительное пламя образует
светящийся язычок f, который получается над темным конусом,
когда приток воздуха уменьшается посредством постепенного
закрывания отверстий горелки. Если светящийся язычок слиш-
ком велик, то введенная в него фарфоровая чашка, наполнен-
ная холодной водой, покроется слоем копоти, чего никогда не
должно быть. Светящаяся вершина пламени не содержит сво-
бодного кислорода, богата выделившимся углем и поэтому обла-
дает значительно ббльшими восстанавливающими свойствами,
чем нижнее восстановительное пламя. Этой частью пламени
пользуются особенно для восстановления металлов, когда хотят
получить их в виде налетов.
Методы исследования вещества сухим путем
1. Испытание на плавкость
Это испытание производится, главным образом, при исследо-
вании минералов, для чего по возможности малый осколочек их
укрепляется на платиновой проволоке толщиной с конский во-
лос и затем вносится в часть пламени, обладающую наивысшей
87
температурой. Через лупу наблюдают, закругляются ли края
пробы. Наивысшая температура, достигаемая в этой части пла-
мени, составляет около 2300° Ч Однако никогда не удается на-
греть до этой температуры исследуемые пробы, ввиду потери
ими теплоты путем лучеиспускания. Так как количество ис-
пускаемой теплоты пропорционально поверхности, то очевидно,
что наибольшее использование теплоты получится при употре-
блении возможно малых проб и держалок для последних. Вот
почему пользуются вышеупомянутой тонкой платиновой про-
волокой.
Различают следующие степени жара:
Начало красного каления 525° -2 5-1 магния 651°
Темнокрасное каление 700° О. К алюминия 658,7°
Яркокрасное каление 950° X ге о серебра 960,5°
Желтое каление 1100° £ « е сз f золота j меди 1063° 1083°
Начало белого каления 1300° S ч о к никеля 1452°
Полное белое каление 1500° Н ПЛ31ННЫ 1773°
Ниже температуры начала красного каления плавятся: олово
при 231,9°, висмут — при 271°, свинец — при 327°, цинк —
при 419,4°.
2. Испытание на окрашивание пламени
Вещество (лучше всего в виде хлористого соединения) сма-
чивают предварительно соляной кислотой, вносят на тонкой
платиновой проволоке1 2 3 в основание пламени и затем перехо-
дят с пробой в часть пламени с наивысшей температурой.
3. Испытание на летучесть
Небольшое количество вещества, нагревают в сухой туго-
плавкой пробирке; при этом летучие вещества превращаются
в пар (часто без предварительного плавления), снова конденси-
рующийся на более холодных частях стенок пробирки.
4. Окисление и восстановление
а) Восстановление и окисление в стеклянных перлах
В качестве массы для перла служит бура NaaBTO? • ЮНгО или
фосфорная соль NHiNaHPCk • 4НгО. Перл получается, если очень
1 Эта температура значительно понижается благодаря избытку воздуха.
Так, по Науману (Naumann) температура пламени светильного газа в
смеси с 114-кратным объемом воздуха — около ISIS'-1, но она понижается
еще более вследствие того, что исследуемые тела и держалки для ннх
испускают лучистую теплоту. Тончайшие платиновые проволоки плавятся
в этой части пламени, но .вышеупомянутые проволоки толщиной в кон-
ский волос не плавятся.
2 Все эти точки плавления заимствованы из «Circular of the Bureau of
Standards», Washington D. C., № 35, June 15, 1912. См. также G. К. В u r-
gess und H. Le C h a t e 1 i e r, «Die Messung hoher Temperaturen», 1913.
3 Вместо дорогостоящей платиновой про-волоки можно пользоваться
дешевыми магнезиальными палочками, изготовляемыми из того же мате-
риала, который применяется для газокалильных сеток. Двухлетний опыт
убедил меня в полной пригодности их не только для реакций окрашивания
пламени, но и для получения перлов буры и фосфорной соли. Ред.
88
тонкую платиновую проволоку длиной около 3 см, вплавленную
в стеклянную трубку, вытянутую в палочку (рис. 1), нагреть и
горячей быстро погрузить в находящуюся поблизости буру
или фосфорную соль. Небольшое количество соли приплавится
при этом к проволоке. Повторным нагреванием и погружением
в ту же самую соль получают, наконец, перл достаточной вели-
чины. Максимальная величина диаметра' не должна превышать
1,5 мм. Никогда не следует конец проволоки загибать в ушко,
потому что .при этом получается совершенно излишнее увели-
чение поверхности. Нечего также опасаться, что перл упадет,
если только держать проволоку/в пламени горизонтально и если
перл не слишком велик. Чтобы испытуемое вещество ввести
в перл, последний слегка увлажняют и прикасаются перлом
к растертому в тонкий порошок веществу; при этом небольшое
количество вещества .пристает к перлу. Лучше иметь в перле
мало вещества, чем слишком много,
потому что в последнем случае перл
может получиться слишком темным
или даже совсем непрозрачным. Окисле
ние вещества производят путем нагрева-
ния в нижнем окислительном пламени,
а восстановление — большей частью путем
нагревания в нижнем восстановитель-
ном пламени с последующим охлажде-
нием внутри темного конуса, чтобы из-
бегнуть могущего произойти окисления
Рис. 2.
на воздухе.
Для очистки проволок их снабжают перлом буры, который
нагревают, как указано на рис. 2, а, только с одной стороны;
при этом шарик движется в противоположную сторону вдоль
платиновой проволоки и растворяет все загрязнения последней.
Нагревая же перл с другой стороны, заставляют его (рис. 2,5)
двигаться в обратном направлении к концу проволоки, и в тот
момент, когда он достигнет конца последней, сбрасывают его
коротким толчком. После трехкратного повторения такого при-
ема проволока будет очищена от всего -постороннего, за исклю-
чением приставшего к ней ничтожного количества стекла, кото-
рое в свою очередь можно удалить, если проволоку прокаливать
в части пламени с наивысшей температурой до тех пор, пока
совершенно не исчезнет желтый цвет пламени натрия.
б) Восстановление на обугленной палочке
Эти в высшей степени изящные реакции принадлежат к чув-
ствительнейшим, какие только известны в аналитической химии.
Чувствительность их обусловлена тем. что реакция проводится
на кончике тонкой обугленной палочки, т. е. в одной точке, и
поэтому испытуемая проба не может распределиться по боль-
шой поверхности, как это бывает при обыкновенном восстано-
влении на угле с помощью паяльной трубки.
89
Для выполнения этих реакций необходимы маленькие обуг-
ленные палочки. Для этого можно воспользоваться, обыкновен-
ными лучинками с прямым расположением волокон. Эти лу-
чинки пропитывают содой следующим образом. Кристалличе-
скую соду ЫазСОз • ЮНзО нагревают в пламени, причем она пла-
вится в части своей 'кристаллизационной воды. Покрыв жидкой
содой 3/i палочки, последнюю прокаливают в пламени при по-
стоянном вращении вокруг ее оси до тех пор, пока сода не рас-
плавится и не проникнет в уголь. При удалении палочки из
пламени на ней не должно быть тлеющих мест, но если бы
это и случилось, то палочкой нужно быстро коснуться соды,
которую держат наготове. Таким образом получаются прочные
угольные палочки, которые могут долго подвергаться действию
жара, не сгорая.
Для производства какого-либо восстановления смешивают
небольшое количество исследуемого вещества с равным ко-
личеством прокаленной соды и, прибавив каплю расплавленной
соды, при помощи перочинного ножа приготовляют одно-
образную пасту. Прикоснувшись нагретой угольной палоч-
кой к пасте, ее переносят на кончик палочки. Затем пробу на-
гревают сначала в нижнем окислительном пламени до ее пла-
вления, после чего ее переносят в нижнее восстановительное
пламя; происходит тотчас сильное вскипание сплавленной массы,
обусловленное выделением образовавшейся угольной кислоты.
Восстановление закончено, как только масса начнет спокойно
плавиться. После охлаждения во внутреннем конусе ее удаляют
из пламени. Теперь металл находится на самом кончике палочки,
сосредоточенный в одном пункте. Отламывают кончик палочки,
бросают в агатовую ступку, обливают небольшим количеством
воды и раздавливают пестиком. Излишек соды растворяется,
уголь частью плавает на поверхности воды, а металл как более
тяжелый падает на дно. Представляет ли собой металл железо,
никель или кобальт, глазом распознать нельзя, но его можно
извлечь лезвием намагниченного ножа, на котором он по-
виснет в виде бородки, большей частью еще с примесью угля.
Высушенную посредством осторожного нагревания ле-звия бо-
родку снимают большим и указательным пальцами. К пристав-
шему к пальцу металлу снова прикасаются намагниченным но-
жичком, и теперь на клинке повиснет уже только чистый ме-
талл. Последний переносят на полоску фильтровальной бумаги 1
шириной в 3—4 /им и длиной 50 мда так, чтобы он был воз-
можно ближе к одному из концов полоски. Посредством капил-
лярной трубки к нему прибавляют одну каплю соляной и столько
же азотной кислоты и нагревают бумагу над пламенем до ис-
чезновения черного пятна (металла), после чего приступают
к окончательному испытанию.
1 Для этого необходима самая чистая фильтровальная бумага, по-
тому что обыкновенная (непромытая кислотами) фильтровальная бумага
большей частью содержит железо.
90
Для испытания на железо прибавляют каплю железистосине-
родистого калия, причем заметное образование берлинской ла-
зури служит признаком присутствия железа. Для испытания на
никель и кобальт металл растворяют в азотной кислоте, выпа-
ривают избыток кислоты, прибавляют затем к^плю концентри-
рованной соляной кислоты, причем бумага в присутствии ко-
бальта окрашивается в синий цвет; никель может дать лишь
весьма слабое зеленоватое окрашивание, но большей частью
он не дает никакого окрашивания. Прибавив затем немного
раствора едкого натра и подвергнув пробу действию бромных
паров, получают в случае присутствия как никеля, так и ко-
бальта буро-черное пятно в силу образования №(ОН)з или
Со(ОН)з.
Если исследуемый металл ковок, то его обыкновенно полу-
чают в виде расплавленного металлического зерна, которое боль-
шей частью уже на палочке может быть распознано с помощью
лупы. Медь выделяется не в виде зерна, а в виде спекшейся
красной массы. При раздавливании в агатовой ступке ковких
металлов последние образуют блестящие пластинки, отделяю-
щиеся легко путем отмучивания водой от легкого угля. Для
этой цели наклоняют агатовую ступку и сбоку на массу пускают
струю воды; при этом уголь всплывает наверх и уносится во-
дой, металл же остается в ступке в виде блесток. Перенесен-
ный на часовое стекло, он подвергается испытанию следующим
образом:
1) Металл белого цвета (Pb, Sn, Ag, Pt). Его обра-
батывают несколькими каплями разбавленной азотной кислоты
и осторожно нагревают. Свинец и серебро растворяются легко,
особенно при прибавлении небольшого количества воды. Серебро
открывают, прибавляя каплю соляной кислоты, вследствие чего
образуется растворимый в аммиаке белый осадок хлористого
серебра. Пробу на свинец проводят с разбавленной серной кисло-
той, причем в присутствии свинца должен получиться белый
осадок сернокислого свинца.
Если металл не изменяется при действии на неТо азотной кис-
лоты. то это указывает на наличие платины. Металл растворяют
в царской водке1, выпаривают досуха, растворяют в капле воды
и прибавляют каплю концентрированного раствора хлористого
калия. Образование желтого кристаллического осадка указывает
на присутствие платины. Если металл при обработке азотной
кислотой обращается в белый нерастворимый окисел, то это
свидетельствует о присутствии олова. В этом случае для испы-
тания на олово растворяют другую металлическую пластинку
в концентрированной соляной кислоте и на раствор действуют
хлорной ртутью или окисью висмута и едким натром.
1 Платина и золото, как показали исследования Е. С а л ь к о в с к о г о,
растворяются также в соляной кислоте (d = 1,125) в смеси с перекисью
водорода I hem. Ztg., 40, 448 (1916), а также Z. anal. Chem. 56, 54
(1917). Ред.
91
2) Цвет металла желтый или красный (Си, Ли).
Медь легко растворяется в азотной кислоте, и раствор с желе-
зистосинеродистым калием дает красно-бурый осадок. Золото
не растворяется в азотной кислоте, но растворимо в царской
водке. Если к выпаренному раствору прибавить хлористого
олова, то выделяется металлическое золото фиолетово-бурого
цвета.
в) Восстановление в стеклянной трубке
Восстановление можно производить не только в шарике
буры и на обугленной с содой палочке, но также и в стеклян-
ной трубке при помощи металлического натрия, калия или
магния.
Так, например, следующим образом «можно открыть малые
количества фосфорной кислоты в ее безводных солях. Испы-
туемое вещество всыпают в стеклянную трубку диаметром
3 мм и длиной 50 мм, запаянную с одного конца; в трубку же
бросают маленький кусочек свернутого в цилиндр калия, осво-
божденного от керосина (для чего его отжимают между листами
фильтровальной бумаги), или же. кусочек магниевой проволоки,
после чего нагревают трубку до размягчения стекла. Большей
частью восстановление сопровождается воспламенением. По
охлаждении стеклянную трубку раздавливают в фарфоровой
ступке, массу увлажняют, дыша на нее, причем явственно по-
является запах фосфористого водорода.
Подобным же образом открывают галоиды, серу и азот
в органических веществах (об этом см. в соответствующих
глазах).
г) Восстановление в верхнем восстановительном пламени
для получения металлических и окисных налетов
В этой части пламени могут быть с большой легкостью от-
крыты восстановляемые водородом и углем элементы, как, на-
пример, мышьяк, сурьма, кад-
мий, висмут, селен и теллур. Не-
большую пробу кислородного
соединения вещества вносят при
помощи тонкой асбестовой ни-
ти (платина при этом разру-
шается) в верхнюю восстанови-
тельную часть уменьшенного пла-
мени (рис. 3, с); здесь окисел
восстановится в летучий металл,
который в силу своей летучести
будет унесен в верхнее окисли-
рис. з. тельное пламя, где опять пре-
вратится в окисел. Если теперь
держать низко над пробой, как указано на рис. 3, Ь, наполнен-
ную водой фарфоровую и снаружи глазурованную чашку, то
пары металла конденсируются на чашке в виде металлического
92
налета. Напротив, если чашку держать несколько выше верх-
него окислительного пламени (рис. 3, а), то на ней образуется
тонкий, часто невидимый окисный налет.
В тех случаях, когда металлический налет должен быть об-
работан небольшим количеством растворителя, *ito, например,
необходимо при открытии селена и теллура, получают метал-
лический налет на пробирке, наполненной для охлаждения во-
дой. Пробирку эту с полученным налетом вставляют >в более ши-
рокую пробирку, в которой находится растворитель, и затем,
если нужно, нагревают. I
д) Восстановление на угле при помощи паяльной трубки
Эта реакция проводится при так называемом предваритель-
ном испытании. Для этой цели в куске хорошего древесного
угля (лучше всего липового) делают ножом маленькое углубле-
ние, в которое всыпают испытуемое вещество в количестве, по-
мещающемся на кончике ножа, смешивают с двойным количе-
ством обезвоженной соды и осторожно нагревают в восстано-
вительном пламени при помощи паяльной трубки. Так как
уголь — тело пористое, то он впитает в себя такие легко плавя-
щиеся вещества, как соли щелочных металлов. Остальные ве-
щества благодаря присутствию соды превратятся в карбонаты,
которые при нагревании распадутся на окислы и углекислый
газ. Окислы благородных металлов распадаются на кислород
и металл без участия в этом процессе угля, остальные же под
влиянием угля или восстанавливаются до металла, или остаются
без изменения. Так, С'иО, РЬО, ВггОз, БЬгОз, БпОг, FeaOs, NiO,
СоО дают металл или в виде сдавленного металлического зерна
(Pb, Bi, Sb. Sn), или в виде спекшегося металла '(Си), или,
наконец, в виде серых металлических блесток (Fe, Ni, Со).
Окиси цинка, кадмия и мышьяка не дают металлического
зерна, несмотря на то, что они легко восстанавливаются углем
до металла. Явление это обусловливается их большой лету-
честью; благодаря высокой температуре они превращаются .
в пар, который уносится по направлению пламени паяльной
трубки; пары, попадая за пределы восстановляющей зоны, до-
стигают окислительного пламени, где сгорают в трудно летучую
окись; последняя осаждается на угле в виде характерно окра-
шенного налета за пределами нагреваемой зоны.
Цинк дает желтый налет, который при охлаждении стано-
вится белым, кадмий — бурый налет, окислы мышьяка — легко
летучий белый налет. При улетучивании мышьяка появляется,
кроме того, характерный чесночный запах. Свинец, висмут и
олово дают также кроме металлических зерен типичные налеты
окисей.
Соли азотной, азотистой, хлорноватой кислот и т. п. узнаются
на раскаленном угле по быстрому сгоранию угля (вспыхиванию).
Вспыхивание не следует смешивать с треском, который по-
является при нагревании веществ с жидкими или газообраз-
93
ними включениями, как, например, каменная соль, плавиковый
шпат и т. п.; вещества эти вследствие быстрого превращения
заключенной в них жидкости в пар разрываются и разбрасы-
ваются.
Некоторые тугоплавкие вещества не просачиваются в уголь.
Так, соединения, богатые кремневой кислотой, сплавленные с со-
дой, дают шарики (стекла), которые только после продолжитель-
ного прокаливания теряют свою щелочь и оставляют неплавкую
белую двуокись кремния. Точно так же относятся к прокалива-
нию на угле фосфорнокислые и борнокислые соли, только они
не оставляют неплавкие окиси, а сплавленное стекло. Неплавкие
белые окиси, например, кальция, стронция, магния, алюминия и
многие окиси редких металлов (ауэровская калильная масса)
светят необычайно сильно, причем тем ярче, чем сильнее их
накаливание.
Спектральный анализ
Если пропустить луч белого света через стеклянную призму,
то он не только будет отклонен от своего первоначального1 на-
на цвета, причем отклонение красных
лучей будет наименьшее, а фиолето-
вых— наибольшее (рис. 4). На ‘полу-
чаемом на экране изображении спек-
тра цвета не разграничены резко, но
непрерьрвно переходят друг в друга.
Такой спектр называют сплош-
н ы м или непрерывным. Вся-
кое накаленное твердое или
жидкое тело испускает бе-
лый свет; с п е к т р в о всех та-
ких случаях непрерывен.
Совершенно иначе обстоит дело с
раскаленными парами и газами: они
испускают не белый свет, но только
характерные для каждого пара и для
каждого газа. Свет раскаленных паров или газов, разложен-
ный призмой, дает на экране изображение прерывистого
спектра. Исследуемый свет, пройдя через узкую щель и
призму, дает на экране изображение в виде отдельных цветных
линий (щелевые изображения), которые появляются всегда на
одном и том же месте при условии применения всегда одной и
той же призмы для разложения света. Для фиксирования места
появления линий в спектре пользуются спектроскопом
Бунзена и Кирхгоффа (рис. 5; рис. 6 представляет его попереч-
ный разрез).
Подлежащее испытанию тело в виде перла, находящегося на
платиновой проволоке, вносится в не светящееся газовое пламя
(буква А на рис. 6), где оно улетучивается. Излучаемый свет,
пройдя через отверстие щелевой трубы Sp, падает на призму,
где он преломляется, и через зрительную трубку С попадает
94
правления, но и разложен
Рис. 4.
Присный
Желтый
Фишта&ый
лучи,
в глаз наблюдателя. На стеклянной пластинке рр трубки Sk
нанесена шкала, освещаемая маленьким пламенем, помещенным
в В. Трубка Sk так наклонена к поверхности призмы аа, что
лучи, исходящие от шкалы, претерпевают полное отражение от
поверхности призмы и попадают вместе с исследуемыми лучами
Рис. 5.
в глаз наблюдателя, который, таким образом, видит отдельные
линии на определенных местах шкалы. Положение линий зави-
сит от рассеивающей способности стекла призмы и от ее угла
преломления; отсюда очевидно, что положение линий неоди-
наково для различных приборов. Так как каждому цвету отве-
чает световая волна определенной длины, то отмечают не поло-
§
Рис. 6.
жение появляющихся линий, но длины волн, соответствующие
появляющимся лучам определенного показателя преломления.
В табл. 13 приведены длины волн различных линий спектра.
В старых моделях спектроскопов шкалы градуированы в про-
извольных делениях, а не в длинах волн. Так, линия натрия
(589,3 ту) видна в таких спектроскопах на делении 50. Чтобы
по положению линий можно было судить о соответствующих
им длинах волн, необходимо составить график,. определив для
нескольких известных линий (например, линии К,, 1<?, Lia, Na,
95
Таблица 13
Длины волн различных линий спектра
Характеристика линий
Длины волн в тр.
Красная линия рубидия Rbg............................
. , Rb-(...............................
» , калия (двойная) ..........................
„ „ лития Lia.................................
, „ кадмия Cd.,...............................
Оранжево-желтая линия лития Ьь.......................
Желтая линия натрия (середина двойной линии) Na ... .
Зеленая линия кальция Са, ...........................
„ „ таллия Т1 • .............................
, „ кадмия1 Cda..............................
Синяя линия кадмия Cd^...............................
» » » Cdf ................................
„ » стронция Sr,-.............................
, „ цезия Csj.................................
» X м 6?Sa..................................
Сине-фиолетовая линия иидия 1п1......................
Фиолетовая линия рубидия Rb3 ........................
г » я Rb, ..............
» „ ИНДИЯ In5.............
, „ калия к3'.............
H (линия „С“ Фраунгофера)............................
795,0
781,1
( 766,9
I 766,5
670,8
643,9
610,8
589,3
554,4
535,0
508,6
480,0
467,8
460,7
459,3
455,5
451,1
421,5
420,2
410,1
404,4
396,8
Т!, Sr;, 1п«, 1п-з) их положение на шкале спектроскопа. По оси
абсцисс наносят деления шкалы; а по оси ординат — соответ-
ствующие длины волн. Соединив нанесенные точки, получают
кривую, которая показывает длину волны, соответствующую
любому делению шкалы. Современные спектроскопы дают воз-
можность определять длины волн с точностью до 0,2 ту-.
Для получения отчетливого спектра спектроскоп должен быть
установлен так, чтобы лучи из трубы со щелью выходили па-
раллельными и входили таковыми же в зрительную трубу. Для
этой цели последняя отвинчивается и точно устанавливается на
какой-либо возможно отдаленный предмет. Затем снимают
призму, трубу со щелью устанавливают против зрительной
трубы так, чтобы через последнюю можно было наблюдать
щель. Щелевую трубу необходимо удлинять или укорачивать до
тех пор, пока в зрительной трубе не появится ясное изображе-
ние щели. После этого прочно прикрепляют призму, устанавли-
вают точно шкалу, до получения ясного ее изображения в зри-
тельной трубе, удлиняя или укорачивая трубу со шкалой. С этого
момента прибор готов к работе.
В лабораторной практике полезным оказывается карманный
спектроскоп прямого зрения с указанной на рис. 7 системой
призм; -он особенно пригоден для быстрого открытия щелоч-
ных и щелочноземельных металлов.
1 Линии кадмия отчетливо ви ны только в искровом спек-ре.
96
Так как не все вещества летучи в пламени газовой горелки,
то можно воспользоваться электрической искрой (в которой
большинство веществ летучи в достаточной степени), чтобы
получать искровые спектры. Для этого, по Бунзену, прикрепляют
к двум платиновым проволокам' конические накоцрчники из
древесного угля, пропитанного' исследуемым раствором. При
проскакивании электрической искры между угольными наконеч-
никами происходит улетучивание достаточного количества соли,
чтобы получился искровый спектр, видимый в спектроскопе.
При этом, однако, появляются некоторые посторонние линии,
одни из которых обязаны своим происхождением угольным
электродам, другие — воздуху. Во избежание этого в так на-
зываемом фульгураторе в качестве анода используется раствор
исследуемой соли, а иридиевая проволока, которая почти ка-
сается поверхности жидкости, служит катодом. Таким путем
может быть открыто 0,002 мг кальция в 1 мл раствора. Иногда
Рис. 7.
одним из электродов вольтовой дуги служит сам исследуемый
металл или его порошок, помещенный в углубление нижнего
угольного электрода.
Для исследования спектров газа применяют небольшие гейс-
леровские трубки, содержащие исследуемый газ.
Помимо пламенного и искрового спектров пользуются иногда
спектрами поглощения. При прохождении белого света через
окрашенный раствор или газ поглощаются некоторые опреде-
ленные лучи и в полученном спектре эти лучи отсутствуют;
спектр оказывается прерванным черными полосами (полосы погло-
щения), характерными для данного вещества. Так, растворы
перманганата, солей неодима, празеодима и многих других ве-.
ществ дают характерные спектры поглощения; темные фраун-
гоферовы линии в солнечном спектре указывают на то, какие
элементы находятся в солнечной атмосфере. Характерен спектр
поглощения крови мыши, отравленной окисью углерода; послед-
нюю таким путем часто открывают в воздухе.
Спектроскоп для целей химического анализа был впервые
применен приблизительно в 1860. г. Кирхгоффом и Бунзеном.
Открытие с его помощью цезия (1860), рубидия (1861), таллия
(1861) и индия (1863) скоро показало, какие широкие возмож-
ности представляет спектроскоп при химических исследованиях.
Спектроскопия позволяет решать многие проблемы с боль-
шой экономией времени и избегать ошибок, являясь ценным
дополнением к обычному химическому анализу. Спектроскопия
позволяет производить: 1) быстрое качественное открытие всех
7 Зак. СС2. Тредвелл-Голл, т. I. 97
металлических компонентов, что может служить основанием для
планирования химического анализа; 2) приблизительный анализ
путем исследования с помощью визуального прибора; 3) иссле-
дование осадка на присутствие в нем посторонних веществ, ко-'
торые должны были быть отделены; 4) испытание чистоты хи-
мических реактивов; 5) открытие в минералах редких металлов
или неожидаемых; 6) открытие следов металлов; 7) анализ очень
малых количеств вещества; 8) контроль продукции металлурги-
ческих заводов.
Для визуального пользования желательно иметь «длинно-
волновой» спектроскоп. Последний конструируется различных
размеров; один из употребительных изображен1 на рис. 8. Для
веществ, содержащих большие количества Fe, Mn, Ni, Pt, Ti и
других металлов, имеющих сложные спектры, необходим аппа-
рат большего размера.
Рис. 8.
Хотя длинноволновой спектроскоп является весьма полез-
ным при решении вышеуказанных проблем, однако для боль-
шинства работ заводских лабораторий требуется кварцевый
спектрограф (аппарат для фотографирования спектра). Правда,
часто путем простого наблюдения в спектроскопе можно убе-
диться в присутствии или отсутствии какого-нибудь специаль-
ного компонента, но спектрограф вообще более полезен, потому
что, во-первых, ббльшая часть отличительных и чувствительных
спектральных линий находится в ультрафиолетовой части
спектра, которая для глаза не доступна; во-вторых, фотография
Дает сохраняющийся протокол; в-третьих, спектрограмму мо-
жет быстро получить опытный лаборант, химик же может за-
няться исследованием полученной фотографии в любое время.
Современный кварцевый спектрограф представлен на рис. 9.
Рис. 10 показывает типичную спектрограмму, полученную с его
помощью; на ней изображены три спектра: нижний — спектр
химически-чистого цинка; средний — спектр исследовавшегося
образца продажного цинка; верхний — спектр кадмия, при-
сутствие или отсутствие которого нужно было обнаружить
в исследовавшемся объекте. При рассмотрении этих спектров
легко обнаружить, что в среднем спектре имеются линии,
98
отсутствующие в нижнем, но резко выраженные в верхнем.
Таким образом, исследуемый продажный цинк дал спектр
с чувствительными линиями кадмия 3261,1, 3403,6, 3466,2 и
3610,5 и, следовательно, он содержит немного кадмия. Две ли-
нии 3247,5 и 3274,0, которые видны на всех трех спектрах,
являются последними линиями меди Ч Таким образом, даже цинк,
который считался химически чистым, содержит небольшие ко-
личества этого металла. Свинец присутствует как в кадмии, так
1 Исследования показали, что при уменьшении концентрации элемента
в испытуемом веществе, число линий его в спектре убывает. Линии, не
исчезающие прн малых концентрациях, называются либо «устойчивыми»,
либо «последними». См. Филиппов, Спектральный анализ и его приме-
нения, Москва 1937, стр. 249. РеД.
•j*
99
Периодическая система элементов
я V о и а а и
100
\ »
Продолжение табл. 14
• ЛАНТАНИДЫ 58—71
Се С8 Церий 140,13 Рг ю Празеодим 140,92 Nd «о Неодим 144,27 61 Sm 62 С амарий 150,43 Ей 63 Евроний 152,0 Gd М Гадолиний 156,9
ТЬ 65 Тербий 159,2 Dy 6G Диспоозий 162,46 Но Гольмий 164,94 Ег 68 Эрбий 167,2 TU 69 Тулий 169,4 Yb ’о Иттербий 173,04 Lu h •Гю ецнй 174,99
и в продажном цинке, на что указывают линии 3683,5 и 3639,6.
Небольшое количество серебра содержится во всех трех образ-
цах. Линия серебра 3382,9 слабо выделяется в трех спектрах;
линия же 3280,7, имеющаяся в спектре кадмия, замаскирована
толстой линией цинка 3282,3 в обоих спектрах цинка.
III. Разделение металлов на группы
В аналитической химии металлы распределяются на пять
групп.
К первой группе относятся металлы, хлориды ко-
торых трудно растворимы или практически не раство-
римы, а сульфиды не растворимы в разбавленных кислотах.
Поэтому они могут осаждаться из растворов как соляной кис-
лотой, так и сероводородом.
Ко второй группе относятся металлы, хлориды кото-
рых растворимы, а сульфиды не растворимы в раз-
бавленных кислотах. Они могут быть осаждены из своих рас-
творов сероводородом в присутствии разбавленных кислот, но
они не осаждаются соляной кислотой.
К третьей группе относятся металлы, сульфиды
которых растворимы в разбавленных кислотах, но
не растворимы в водей щелочах; сюда же относятся и
те металлы, сульфиды которых под влиянием гидролиза распа-
даются на сероводород и гидраты окисей. Поэтому представи-
тели этой группы полностью осаждаются сероводоро-
дом только из щелочных растворов.*
К четвертой группе относятся те металлы, сульфиды
которых растворимы в воде, а карбонаты не раство-
римы в присутствии хлористого аммония. Они
осаждаются углекислым аммонием в присутствии хлористого
аммония, но не осаждаются реактивами для вышеприведенных
групп.
Пятая группа содержит магний и щелочные металлы;
они не осаждаются вышеприведенными реактивами. Если оса-
ждение углекислым аммонием производить в концентрирован-
ном растворе, содержащем спирт, то магний осаждается вместе
с четвертой группой. Такой прием разделения последних двух
групп в некоторых отношениях выгоден.
Приведенная чисто условная группировка основана на определенной
специфической растворимости, но она не дает классификации общих хими-
ческих свойств элементов, как это делается в периодической системе эле-
ментов. В некоторых случаях члены отдельной группы принадлежат к од-
ной и той же группе периодической системы, но это не -является обяза-
тельным. Табл. 14 показывает, как распределены элементы по группам
101
в периодической системе. В каждой группе элементов разность между
наиболее низкой отрицательной валентностью и наиболее высокой поло-
жительной валентностью равна 8 единицам. Числа, помещенные рядом с
символами элементов, представляют собой так называемые порядковые
или атомные, номера элементов. Порядковый номер элемента (равно-
значен с числом положительных зарядов ядра атома и в то же время
с числом электронов, вращающихся вокруг этого ядра. Химические свойства
элемента обусловливаются числом этих электронов и характером их
распределения вокруг ядра.
IV. Концентрация реактивов
Чтобы с точностью уметь производить анализ, нужно изу-
чить не только реакции отдельных элементов, но также и чув-
ствительность каждой реакции. По величине образующе-
гося осадка аналитик должен судить о приблизительных коли-
чествах найденного вещества в исследуемом объекте. Но это
возможно только тогда, когда опыты производятся с опреде-
ленными весовыми количествами. Поэтому реактивы
должны быть определенной концентрации, и
действовать ими следует на известные весо-
вые количества отдельных веществ. По предложе-
нию Блохмана (R. В 1 о с h m а п п)* 1 растворы отдельных веществ
рекомендуется приготовлять: д в у н о ip м а л ь н ы е, нормаль-
ные, п о л у н о р'ма л ь н ы е или деци нормальные.
Нормальным называют такой раствор, в 1 л которого
находится 1 граммэквивалент соответствующего вещества, отне-
сенный к 1 грамматому водорода как единице (см. стр. 22).
Раствор, содержащий в 1 л 0,1 граммэквивалента, называется
децинормальным и т. д.
Так, например, в 1 л каждого из нижеследующих нормаль-
ных растворов содержится:
НС1 = 36,47 г 1
_h^_=w=49M2 '
=32,68 г
О о
NaOH = 40,01 г
КМпО4 158,03 01
5 5
KgCjjA = ??4,2 = 49,02 г 3
о 6
1 Вег. 23, 31 (1890).
2 Имеется в виду раствор КМпСЬ как окислитель, а не как осадитель.
Нормальный раствор перманганата калия как осадителя содержал бы в 1 л
1 моль соли. Так как две молекулы KMnCh в кисдом растворе отдают на
окисление пять атомов кислорода, эквивалентных 10 атомам водорода, то
г 2КМпО4 КМпО4
граммэквцвадент должен быть равен: -— =---?—*•
10 о
Понятие о нормальности устанавливается всегда по той цели, для кото-
рой данный раствор должен служить.
3 Также рассматривается как окислитель. Как осадитель (например, для
осаждения PbCrCh или BaCrOi) нормальный растврр КгСггО? должен со-
держать % моля в 1 л.
102
эквивалентны
1 грамматому
водорода
i Значительное преимущество такой системы состоит в том,
что всегда известно количество какого-либо раствора, которое
^необходимо' для того, чтобы реакция с данным количеством
другого раствора пошла до конца. Так, 1 мл 1/V •' раствора
едкого натра требует для нейтрализации 1 мл 1,01V или 2 мл
0,5/V или 10 мл 0,IN кислоты. Точно так же 1 мл 1,0М рас-
твора хлорида бария требует точно 1 мл l,0N серной кислоты
или 1 мл 1,0/V раствора, какой-либо сернокислой соли, чтобы
реакция осаждения сульфата бария протекла количественно.
В табл. 15 указаны наиболее употребительные реактивы,
плотность, весовые проценты, приблизительная концентрация
их, а также способ приготовления некоторых из них.
Таблица 15
Лабораторные реактивы
I. Концентрированные кислоты
Кислоты Плотность Весовые % Приблизи- тельная кон- центрация
Азотная 1,42 69,8 16W
Бромистоводородная .... 1,49 48 9У
Муравьиная 1,07 27 6W
Серная 1,84 96 36N
Уксусная 1,05 99,5 17W
Фосфорная 1,7 85 15V
Фтористоводородная 1,14 48 27N
Хлористоводородная 1,19 37,9 12W
Хлорная 1,54 60,0 9N
II. Разбавленные кислоты
Кислоты Плотность Весовые % Приблизи- тельная кон- центрация
Азотная 1,20 32,3 6W
Винная (150 г в 1 л) 2N
Кремневольфрамовая
H8S1O6 • 12WO3 • 22Н2О — 42 1N
Серная 1,18 24,8 6W
Сернистая . • • . (насыщенн. раств. SO2) 0,33 N
Уксусная 1,047 35,0 6W
Хлористоводородная 1,10 20,0 6W
Хлорная — 6N
103
Продолжение табл. 15
III. Основания
Основания Плотность Весовые °/0 Приблизи- тельная кон- центрация
Гидроокись аммония .... » » .... » бария , калия . натрия 0,90 0,96 [насыщенн Ва (ОН) 1,37 1,22 280/0 9.90/0 ыи раствор 2 • 8Н2О)] 36,9 19,7 15А 6А 0.4W 9W 6А
IV. Соли а) Соли аммон и я
Название соли Указания к приготовлению реактивов Концен- трация
Ацетат аммония CH3COONH4 Смешивают равные объемы 6^ уксусной кислоты и 6N аммиака 3/7
Карбонат аммония (NH4)2CO3 Растворяют 250 г свежерастертого порошка карбоната аммония в 1 л 6А' NH4OH. Продажная соль —NH4HCO3 + NH4COaNH2 6W
Молибдат аммония (NH4)2MoO4 Растворяют 90 г чистого молибдата аммо- ния в 100 мл 6VNH4OH, прибавляют 240 г NH4NO3 и разбавляют до 1 л Формула продажной соли (NH4)gMo7O24 • 4Н2О 1A(3W в отноше- нии NH4NO3)
Оксалат аммония (NH4)2C2O4 Растворяют 35 г (NH4)2C2O4 • Н2О в 1 л воды 0,5W
Полисульфид аммония (NH^S^ Настаивают в течение нескольких часов 1 л 6/7 раствора сульфида аммония с 25 г серного цвета, после чего раствор фильт- руют 6А
Сульфид аммония (NH4)2S Пропускают H2S в 200 мл VoN NH4OH в склянке, погруженной в холодную проточ- ную или ледяную воду до тех пор, пока не прекратится поглощение газа. Затем прибавляют еще 200 мл 15/7 NH4OH и разбавляют до 1 л 6А
Хлорид аммония NH4C1 Растворяют 54 г NH4C1 в 1 л воды 1А
Хлорид аммония NH4C1 J Растворяют 290 г NH4C1 в 1 л воды Насыщ.
104
Продолжение табл. 15
б) Другие соли
Название соли Формула Молек. вес Граммы в лигре Концен- трация
Бария хлорид .... ВаС12-2Н2О 244 122 ¥
Железа (3) нитрат . . Fe(NO3)3 9Н2О 404 135 ¥
Железа (3) хлорид . . FeCl-6HoO 270 90 ¥1 2 3
Кадмия нитрат . . . Cd(NO3)2 • 4Н2О 308 154 ¥’
Калня бихромат . . . К2СГ2О7 294 49 ¥1
Калия иодат KJO3 214 75 f 0.35W (как соль
Калия иодид .... KJ 166 166 ¥
Калия нитрит .... kno2 85 510 6¥
Калия оксалат .... K2Co04-H20 114 276 3¥
Калия перманганат . КМ11О4 158 10 0,31V4
Калия роданид . . . KCNS 97 97 ¥
Калия феррицианид . K3[Fe(CN)6l 379 422 ПО №
Калия ферроцианид . K4lFe(CN)6]-3H2O 105 ¥2
Калия хромат .... К2СГО4 194 291 3¥2
Калия цианид .... KCN 65 65 N
Кальция сульфат . . CaSO4-2H2O 172 2,6 Насыщ.
Кальция хлорид . . . CaCl2-6H2O 219 ПО ¥
Кобальта нитрат . . . Co(N03)2 • 6H2O 291 I 437 3N
1 44 0,3.7
Натрия арсенит . . . NaAsO2 130 130 ¥
Натрия ацетат .... CH3COONa • 3H2O 136 136 ¥
Натрия бикарбонат . NallCOs 84 84 N
[ 139 { или ( 69
Натрия бромид . . . NaBr-2H2O или NaBr { или 0,5¥
l юз 1 51
Натрия карбонат . . . NajCO, 106 159 3¥
Натрия нитрит . . . NaNO2 69 210 3¥5
Натрия пиросульфит1 NanS2O5 190 190 4¥
Натрия сульфат . . . Na2SO4- 10H2O 322 160 ¥
Натрия тиосульфат . NaoSo03 • 5H2O 248 124 0,57V6
Натрия фосфат . . . Na9HPO4 • 12BjO 358 119 ¥
Ртути (1) нитрат . . Hg2(NO3)2 • 2H2O 561 280 ¥
Ртути (2) хлорид . . HgCl2 272 27 0,2¥
Серебоа нитрат . . . AgNO3 170 17 0,1 ¥
Свинца ацетат .... (CH3COO)2Pb • 3H2O 379 190 N
Свинца Нитрат .... Pb(NO3)2 331 165 N
Уранила ацетат . . . (CH3C(JO2)UO2 • 2H2O 424 21 0,1/7
1 Кроме солей NasSOs и NaHSOs известен также так называемый «пиро-
сульфит» NaaSsOs. Эта соль отличается особенной устойчивостью и не под-
вержена окислению на воздухе. Кислую соль КНЗОз можно рассматривать,
как «пиросоль» с кристаллизационной водой: 2KHSOs = K2S2O5• НаО. Ред.
2 Как осадитель.
3 Эта соль не должна содержать сульфата.
4 Как окислитель.
5 В случае если соль содержит хлорид, смешивают с 1% (по объему
раствора нитрита) азотнокислого серебра. Взбалтывают и фильтруют. .На
этикетке необходимо отметить, что реактив содержит AgNOs.
. • Как восстановитель.
105
Продолжение табл. 15
V. Специальные ре активы
Бром жидкий: пользоваться химически чистым продуктом.
Висмута нитрат, приблизительно 4N: насыщают 6У уксусную кислоту нит-
ратом висмута Bi(NOs)s 5НзО.
Водорода .перекись, одномолярная: пользоваться химически чистым 3%-ным
раствором.
Гидроксиламина хлоргидрат, трехмолярный: растворяют 21 г NHaOH • НС1
в достаточном количестве воды и разбавляют до 100 мл.
Диметил глиоксим: растворяют 12 г в 1 л 95%-ного этилового спирта:
Железа(2) сульфат, 2У’ растворяют 280 г FeSO« • 7НгО в 500 мл 6N сер-
ной кислоты и прибавляют железных гвоздей.
Калия антимонат: прибавляют к 1 л кипящей воды 22 г лучшей продажной
соли KsHaSbaO? • НзО, кипятят почти до полного растворения соли,
быстро охлаждают, прибавляют 35 мл 10%-ного раствора КОН и, дав
.постоять до другого дня, фильтруют.
Калия карбонат, 50%: растворяют 100 г КзСОз в 100 мл воды.
Калий ртутноиодистый (реактив Несслера), 0,5У в отношении. KrfigJi:
растворяют 115 г HgJs и 80 г KJ в достаточном количестве воды
и доводят до 500 мл; прибавляют 500 мл GN NaOH и декантируют
раствор с осадка, могущего образоваться при стоянии. Запасный
раствор должен храниться в темноте. Употребляемые для приготовле-
ния реактива вещества, а также .вода, не должны содержать аммиака.;
Крахмал и иодистый калий: растирают 20 г растворимого крахмала с ие-
большим количеством воды в ступке до получения жидкой кашицы,
которую затем выливают в 1 л кипящей воды1. Кипятят 5 мин. и
фильтруют через неплотно вложенную в воронку вату. К фильтрату
добавляют 10 г KJ и 5 мл хлороформа.
Куркума: взбалтывают порошок куркумы с 95%-НЫм спиртом и филь-'
труют.
Магнезиальная смесь, 1N в отношении MgCU: растворяют 100 г MgClt’
• 6Н2О и 100 г NHiCl в воде, прибавляют 50 мл 15 N NH-iOH и раз-
бавляют до 1 л.
Магния-аммония нитрат, 1N в отношении MgCNOs)?, ЗУ в отношении
нитрата аммония: растворяют 130 г Mg(NOs)2 • ОНгО и 240 г NHiNOs
в воде, прибавляют 35 Мл 6N N'H-iOH и разбавляют до 1 л.
Магния-уранила ацетат: обрабатывают 8,5 г ацетата уранила и отдельно
50 г ацетата магния 6 мл ледяной уксусной кислоты и 95 мл -воды,
нагревая до 70°, до получения прозрачных растворов. Оба раствора
смешивают при той же температуре, дают охладиться и фильтруют,
дав предварительно фильтрату постоять в течение 2 час. при 20°.
МеТилвиолет: растворяют 1 мг индикатора в 25 мл 95%-ного спирта и 75 лл
воды.
Мочевина: растворяют 200 г мочевины в 1 л 6У НС1.
Натрия гипобромит NaBrO: приготовляется по мере надобности путем при-
бавления к 2 мл бромной воды 6N NaOH до образования бледно-
желтого раствора, после чего приливают еще такое же количество
NaOH.
Натрия нитрокобальти(3)ат, юдномолярный в отношении №зСо(НОг)в:
растворяют 207 г химически чистого NaNOa и 291 г Co(NOa)2 • 6НаО
в 500 мл воды, прибавляют 10 мл 6N уксусной кислоты и дают
смеси стоять по меньшей мере 24 часа. Фильтруют и разбавляют до
1 л. Реактив должен быть приготовлен не больше- чем за несколько
недель до его применения.
Натрия сульфид, ЗУ в отношении NaaS, 1У в отношении NasSs и Na.OH:
растворяют 480 г NaaS • 9НгО и 40 г NaOH в воде, прибавляют 16 г
серы, взбалтывают до полного растворения серы и разбавляют до 1 л.
Натрия тартрат кислый: применяют насыщенный раствор химически чис«
той соли.
106
Продолжение табл. 15
Натрия 6-хлор-5-нитротолуолметасульфонат, насыщенный: 100 мл воды на-
сыщают этой солью, приготовленной, как описано у Шульца (Schulz)
и Люкаса (Lucas), J. Am. Ch. Soc., 49, 298 (1927).
Олово двуххлористое, IN: растворяют 115 г SnCL • 2НаО в 170 мл 12N
НС1, разбавляют до 1 л и сохраняют в склянкдх, содержащих по-
лоску чистого олова.
Платинохлористоводородная кислота: растворяют 26,5 г Ha[PtCle] • 6Н3О
(что соответствует 10 г Pt) в 100 мл воды.
Ртуть металлическая.
Сурьма треххлористая, 6,0 М: растворяют 137 г SbCh в достаточном' коли-
честве 6N НС1 и доводят до 100 мл.
Тиомочевина: растворяют 100 г тиомочевины в 1 л воды.
Эфир, насыщенный хлористым водородом: насыщают сухой эфир (безвод-
ный) при 0° сухим НСЬгазои.
VI. Насыщенные растворы
1000 мл воды растворяют:
Бария гидроокись 68 г Ва(ОН)г • 8НгО при 20°
Бромная вода 32,68 г Вгг
Известковая! вода 1,3 г СаО
Кальция сульфат 2.6 г Са£О4-2НгО
Сернистая кислота 106 г SO2
Сернистый водород 4,2 г H2S
Хлорная вода 6,5 г С1г
VII. Специальные растворители
Амиловый спирт Уксусноэтиловый эфир
Метиловый спирт Хлороформ
Метиловый спирт Четыреххлористый углерод
(не содержащий ацетона) Этиловый спирт (99%-ный)
Сернистый углерод Этиловый эфир
VIII. Газы
Двуокись серы: прибавляют по каплям 18 N серную кислоту к твердой
СОЛИ Na'aSaOs.
Сернистый водород: приготовляют из сульфида железа FeS и 6V НС1 или
6 N H2SO4.
Хлор: приготовляют путем прибавления по каплям 12 N НС1 к кристалли-
ческому KMnOi.
Хлористый водород: приливают порциями по 5—10 мл концентрированную
серную кислоту из капельной воронки к 100 г хлористого натрия до
тех пор, пока не будет влито 100 мл кислоты. По мере надобности
подогревают смесь, но не выше 80°. Колбу, из которой выделяется
НС1, снабжают отводной трубкой малого диаметра; трубку капель-
ной воронки погружают в короткую пробирку, наполненную кон-
центрированной серной кислотой, и в таком виде укрепляют ее ц
колбе с хлористым натрием.
IX. Т в е р д ы е р е а к т и в ы
Алюминиевые стружки Бура Nas/EkO? • ЮН2О
Аммония нитрат NHiNOs Винная кислота HsC-iH-iOe
Аммония хлорид NH4CI Висмута двуокись; может быть прн-
Асбестовые волокна для фильтров менена вместо висмутата нат-.
Бария карбонат ВаСОз рия
Борная кислота НаВОз Железа (2) сульфат FeSOi • 7НгО
107
Железа сульфид FeS
Железные гвозди
Железо, порошок
Калия бихромат КгСггО?
Калия нодид KJ
Калия карбонат KaCOs
Калия нитрат KNOa
Калия сульфат кислый (сплавлен-
ный) KHSO4
Калия феррицианид KsFe(CN)e
Калия хлорат КОСИ
Кальция окись СаО
Кальция фосфат СазРСЬ
Кальция хлорид безводный CaCh
Кварцевый порошок
Крахмал
Кремнезем (осажденный) SiCh
Лакмусовая бумага, красная и синяя
Медная проволока или стружки
Натрия аммония фосфат
NaNHiHPO* • 4НгО
Натрия ацетат CH3COONa
Натрия бикарбонат NaHCOs
Продолжение табл. 15
Натрия битартрат, порошок
Натрия висмутат NaBiOs
Натрия карбонат Na»COs
Натрия нитрат NaNOs
Натрия нитрит NaNOs
Натрия нитропруссид
Nas[Fe(CN)5- NO] • 2Н=О
Натрия перекись Na-Os
Натрия сульфид Na«S • 9НгО
Олово (чистая фольга)
Парафин
Салициловая кислота
Свинец (тонко зерненый)
Свинца двуокись (не содержащая
Мп) РЬОа
Серный цвет
Серебра карбонат AgsCOa
Серебра сульфат AgaSCU
Стеклянная вата.
Сурьма, порошок
Хлорная известь
Цинк (тонко зерненый)
V. Определение чувствительности реакций
Чем меньше концентрация вещества, при которой можно от-
крыть его соответствующим реактивом по истечении опреде-
ленного промежутка времени, тем чувствительнее реакция. Та
концентрация, при которой вещество еще может быть обнару-
жено данным методом, носит назание предельной концентрации.
Величина предельной концентрации может служить характери-
стикой чувствительности реакции. От понятия «чувствительность
реакции» следует отличать открываемый минимум вещества. По-
следним термином обозначается то количество вещества, кото-
рое необходимо взять, чтобы имелась возможность обнаружить
его при предельной концентрации.
На нижеследующих примерах поясним указанные понятия.
Магниевые соли осаждаются посредством фосфорнокислого
натрия в присутствии хлористого аммония и аммиака в виде
фосфорнокислой аммониевомагниевой соли. Определим чувстви-
тельность этой реакции.
Возьмем 1 мл нормального раствора сернокислого магния,
прибавим к нему 3 капли раствора хлористого аммония', 3 капли
концентрированного аммиака и 2—3 капли раствора фосфорно-
кислого натрия: тотчас же образуется характерный белый осадок.
Разбавим теперь нормальный раствор сульфата магния в 10 раз
и повторим опыт с 1 мл разбавленного раствора; далее, разбавим
нормальный раствор в 100 раз, возьмем 1 мл этого разбавленного
раствора и проведем с ним тот же опыт. Так будем проводить
реакцию все с ббльшим и большим разбавлением до тех пор1,
108
пока после условно принятого нами бремени (например,
1—2 мин.) не будет наблюдаться образования осадка. Ниже
приводятся полученные при этом результаты.
Нормальность
раствора
1.0
0.1
0,01
0,001
0,0001
Концентрация
Mg- в мг)мл
12,0
1,2
0,12
0,012
0,0012
Скорость образования
осадка
Тотчас
Через несколько секунд
Спустя 1-2 мин.
Таким образом, предельной концентрацией, при которой
магний может быть открыт данным методом в течение 1—2 мин.,
можно считать 0.0001W или 0,0001 • 12 — 1,2 мг/л Mg. Для от-
крытия Mg нам надо было взять только 1 мл 0,00012V раствора,
который содержит 1,2 у Mg; эта последняя величина и бу-
дет являться открываемым минимумом при данных условиях
работы.
Если проводить реакцию в растворе чистой соли, то чув-
ствительность реакции в основном зависит только от выбран-
ного метода открытия вещества. Так, если открывать магний
антимонатом калия (который также дает с магнием характер-
ный белый осадок), то мы найдем, что предельной концентра-
цией, при которой в данном случае еще возможно открыть маг-
ний, будет, 800 мг/л, т. е. реакция с антимонатом калия будет
значительно менее чувствительна.
Другое наблюдается в отношении открываемого минимума.
Минимальным количеством раствора, с которым еще удобно
оперировать в обычной пробирке, можно считать 1 и и в слу-
чае осаждения магния в виде фосфорнокислой аммсниевомаг-
ниевой соли открываемый минимум мы нашли равным 0,0012 мг
Mg. Если же мы будем проводить реакцию под микроскопом,
взяв для этого одну каплю (—0,001 мл) 0,000IN раствора маг-
ниевой соли, то в этих условиях мы еще легко можем обнару-
жить образование осадка. Очевидно, при такой методике ра-
боты открываемый минимум будет в 1000 раз меньше, чем в слу-
чае пробирочного опыта, и будет равен 0,0012 у Mg.
VI. Реакции элементов
Приводимая табл. 16 характерных реакций элементов заимствована
в большей части из руководства Нойеса и Брея, Качественный анализ
редких элементов, ОНТИ, М. 1936.
Табл. 16 показывает поведение характерных катионов, расположенных
в порядке периодической системы элементов, по отношению к разбавлен-
ной соляной кислоте, к избытку разбавленного едкого натра и к наиболее
важным окислителям и восстановителям. В таблице приведены также сое-
динения, в виде которых элементы подвергаются окончательной иденти-
фикации.
Формулы, набранные жирным шрифтом, указывают на образование
трудно растворимого соединения; если растворимость его в воде все же
заметна, то формула набрана дважды и жирным и обыкновенным шриф-
том. Жирный шоифт не применен для формул осадков, получаемых при
конечных реакциях идентификации вещества. Цвет указан, когда осадки
или растворы не являются белыми или бесцветными.
109
Таблица Iff
Реакции элементов в их различных степенях валентности
Группа период, сист. Эле- Ва- лент- ность Соединения, образующиеся при действии Восстановители в Окислители в кис- Осаждается в виде
мент 0,1 — l,0^ НС1 0,1 — IflN NaOH кислом растворе лом растворе
1а Li Na К Rb Cs 1 1 1 1 1 LiCl NaCl KC1 RbCl CsCl L1OH NaOH KOH RbOH CsOH 1 Li3 РО4 NaCl; NaH,SbO4; NaMg (UO2j3 (АсО)<Д КСЮ4; K2NaCo (NO2)61 желт.; RbClOi RbHC4H4O6; Rb2NaBi(NO2)6, желт. CsC104 CsSb2Cl7 Cs8Si W12O42
1b Си Ag Au 1 2 1 3 CuCI, HCuCl2 CuCl2, бледносин. AgCl AuC!3, желт. (На холоду CuOH, желт. (при нагрев. Cu2O [ На холоду Cu(OH)2, сии. (при нагрев. Си О черн. Ag2O, буро-черн. NaAuO2, желт. Zn Cu, Sn-,SO2, HJ Zn,Sn-, HCOOH медленно Zn, Си, Sn", Fe" SO2,HCOOH, Н,С2О4 (С12 Вг2, воздух, IHNO3, Н2О2 Cu, красн. Cu2 fFe (CN6)], красн. Ag, черн.; AgCl, AgBr, светложелт. Au, пурпуровый или черн.
Па Be Mg Ca Sr Ba 2 2 9 2 2 BeCl2 MgCl2 CaCI2 SrCl3 BaCl2 NaHBeO2 Mg (ОН)2 Са(ОН)2, Са(ОН)2 Sr(OH)„ Sr (ОН)2 Ва(ОН),, 1 ! 1 1 1 i 1 1111 Be (ОН),; BeCOyx Be (OH)2 MgNH4PO4 СаС2О4; CaSO4 SrCrO4, желт.; SrSO4 BaCrO4, желт. BaSO4
11b Zn Cd Hg 2 2 1 2 ZnCl2 CdCl2 Hg2Cl2 HgCl2; H2HgCJ4 NaHZnO2 Cd (ОН)2 Hg2O черный HgO красный Zn, Си, Sn-,HCOOH Sn- С12 1 Q CQ ZnS CdS, желт. Hg, серый; Hg2Cl2 HgJNH2HgO, оранж-
Ша Al 3 A1CI3 NaAlO3 — A1(OH)S; A1C13-6H2O
Sc Y Ce RE (редк. земли) 3 3 3 4 3 ScCI3 YC13 CeCl3 CeOCI2 желт. СеС14, темнокрасн. REC13, окрашен- ные или белые Sc (OH)3 Y (OH)3 Ce(OH)3 Ce(OH)4, желт. RE(OH)3, окрашенные или белые При кипячении HC1O3, конц., HNO3, NaBiO3 ScF3; Sc(OH)3 Y(OH)3; YF3 Ce(OH'3; CeF3 Ce(JO3)4, желт. CeO2. H2O2, оранж. RE(OH)3" REF3, окрашеннуе или белые
Ulb О a In Tl 3 3 1 3 GaCl3 1пС13 T1C1, T1C1 T1C13 NaGaO2 NaInO2 Tl(OH) Т1(ОН)3, темноорапж. Zn, но не Sn Zn, но не Sn Sn-, Fe", SO2,H,S, HJ, HBr, HCOOH Cl2, Br2 Ga(OH)3; Ga4[Fe(CN)6]3 In2S3, желт. T1J, светложелт. TI(OH)3, темнооранж.
IVa Ti Zr Th 3 4 4 4 Т1’С13,темнофиолет Ti(OH)4, TiOCl, ZrOCl, ThOCl2 Ti(OH)3, сине-черн. Ti(OH)4 Zr(OH)4 Th(OH)4 Zn Cl2, Br2, J2, воздух, HNO3, H2O2 TiO2; Ti(HPO4)2 • H2O Zr(HPO4)2 • H2O ThF4; Th(JO3)4
IVb Ge Sn Pb 2 4 2 4 2 4 GeCl2 QeO., GeCl4 SnCl2, HSnCIg HaSnCl6 PbCI2, PbCl2 H9PbClfi. желт. NaHGeO2 NaHGeO3 NaHSnO2 NaaSnOr • 3H2O NaIIPbd2 PbO2, бурый Zn Zn, но не Sn Sn, Sb Zn, отчасти Sn при кипячении CU, Br«, J2, воздух, HNO3 CU, Br2, J2, воздух, HNO3, H2O2 Cl2, но не Br2 GeS2, K2GeF6 Sn, cep.; SnS, буро-черн. SnO2; SnS2, желт. PbSO4; PbCrO4, желт.
Va V 2 3 4 5 VC12, фиолет. VC13, зелен. VOC12, син. (V2O5, темнокрасн. IH4V6O17, желт. V(OH)2 фиолет.-cep. V(OH);, зелен. VO(OH)2, серый Na2V4O9, темножелт. NaVO3 Na3HVeOi7, желт. Zn, отчасти Sn HJ, коиц. Cu, Sn--, Fe-, H2S, SOs, HJ, HBr, HC1, HCOOH Горячая вода J2, воздух, HNO3 Cl2, Br2, H2O2 >—4 V2S4 бур. NH4VO3
’ АсО = СН3ССО/
Продолжение табл. 16
Группа период, сист. Эле- мент Ва- лент- ность Соединения, образующиеся при действии Восстановители в кислом растворе Окислители в кислом растворе Осаждается в виде
0,1 — I,ON НС1 0,1 = 1,(W NaOH
Va Nb 3 5 NbClg, фиолет. HNbOg ? HNbOg, Na8Nb6O19 Zn HNbOg
Та 5 HTaO3 HTaOg, NogTagO^g — HTaOg-, 2K2TaF7-Ta2O5
Vb As 3 5 AS2Og, AsClg H3AsO4 NaAsO2 Na3AsO4 Zn (до AsH3) Sn", SO2> HJ, HBr С12, Вг2 । As2S3 желт. As2S6, желт. MgNH4AsO4
Sb 3 5 SbOCl, HgSbClg HSbO3, HSbClg NaSbO2 NaSbOg Zn (до Sb и SbHg) SO2, HJ, HBr С12, Вг2 Sb, черн. Sb2S3, оранж. Sb2Or,
Bi 3 BiOCl, HBiCl4 BiO(OH) Zn — Bi, черн. BikOH)3; BiOCl
Via Cr 2 3 6 CrCI2, chh. CrClg, темнозелен. H2Cr2O7, оранж. Cr(OH)2, темно желт. Сг(ОН)3, серо-зел. NaCrO2 Na2CrO4, желт. Zn Sn-, H2S, SO2, ч Fe -.HJ, HBr, HC1, HCOOH Горячая вода, С12, Br2,J2, воздух,HN О3 HClOgB конц-HNOg Cr(OH)3, серо-зелен. PbCrO4, желт.
Mo 3 5 5-6 6 МоС1а, красн. МоОС13 зелен. Mo2O5 • хМоОд.син. M0O3, M0O3 • HC1 Mo(OH)a, чери. Мо(ОН)6, бурый Мо(ОН)6 + Na,MoO4 Na2MoO4 Zn Sn-, HJ H2S, so2, Fe" (частично) J2, воздух, HNOg, Fe-- (частью) С12, Вг2 MoS3, черн.
W 3-4 5 5-6 WClg, WC14, окра- шен. WOCIg, зелен. W2O5 • xWOg, СИН ? W(OH)5, бурый W(OH)6 + Na2WO4 Zn Cl2, Br2.J2, воз- дух, HNOg WS2, черн. W2O6-xWO3, CHH.
6 HSWO4, желт; Na,WO., Sn- •—» H2WO4, желт.
Зак. Э€<2. Трсдвелл-Голл,
U 0 4 6 ULlg, пурпур. UCI4, зелен. UO2C!2 желт. ? U(OH)4, зелен. Na2U2O7, желт. Zn Cu, Sn", H.S, SO2 HSO C!?, Br2, J2, воздух HNO3 UO2NH4PO4, желт. K2UO2[Fe (CN)eJ, темно- красн.
Vlb Se 4 6 H2SeO3 H2SeO4 Na2SeO3 Na2SeO4 Zn, Sn-, H2S, SO,, Fe--, HJ HBr, HC1 (но не H2S, SO2, Fe") Ci2, CrVl, MnVH Se, краев, на холоду Se, черн. при нагрев.
Ге 4 6 H2TeO3, TeCI4 HgTeOg Na2TeO3 Na,H.TeO6 Zn, Sn--, SO2 HJ, HBr, HCI (h > ne Sn", SO2) Crvi, MnVH Те, черн.
Vila Mn 2 3 4 6 7 MnCl2 H2MnCl5, бурый, МпО(ОН)2, бурый Н2МпС16, бурый МпО(ОН)2, бурый НМпО4, пурпу- ров. НМпО4, пурпур. Mn(OH)2 Мп(ОН)з, бурый МпО(ОН)4, бурый Na2MnO4, зелен. NaMnO4, пурпур. Кипящая вода Кипящая вода Кипящая вода Zn.Sn--, H2S, SO2, Fe-. HJ,HBr, HCI CI,, НСЮ3 конц. HNOg PbO2, BiO2 или NaBiOg МпО2, черн.
Villa Fe 2 2—3 3 FeCl2, светлозе- лен. FeCl2 + FeClg FeCig, желт. Fe(OH)2, белый Fe(OH)2-3, зелен, до черного Fe(OH)3 красновато- бурый Zn, Sn”, H2S, SO2, HJ,HCOOH (слабо) Cl2, Br,, воздух HNOaH2O2 Fe4[Fe(CN)6]3, синий Fe(OH)g красн.-бурый
Ru 2 3 4 RuCl2, темносин. H2RuCl5, оранж- чери. ? H2RuC16, оранж- черн. Ru(OH)2 (цвет?) R«(OH)3 чери. Na2RuO3 желт. Zn Sn,H2S,SO2 HJ, Fe", HBr, сла- бо J,. HNOg Cl2, Br2 НС1О4(дымящая) до RuO4 Ru, черн. RuaOg-*, черн.
Продолжение табл. 16 Осаждается в виде га Ml gill о O' eo <Z) $ О 1 CoS, черный ColOH)3, черн. K3Co(NO2)s, желт.; Rh(OH)4, зеленый; | Rh черный; [RhCI(NH3)sl c,2- желт- (для трехвалентн. Rh) Ir черн. Ir(OH)4, темносин. (NH4)2IrCls, красно-черн Ni—соль диметилглиок- сима Ni(OH)3, черн. Pd, черн. (NH4)2PdCle, оранж-кр. Pi, черн. (NH^jjPtCIg, желт.
Окислители |В кислом растворе 1 He существует 1 в кисл. раств. Не существует в кисл. раств. ! С12, HNO8 Не сущ. в кисл. р. II II сч о § □ Не сущ. в кисл. р. С12 С12, Вг2
Восстановители в кислом растворе Не существует в кисл. раств. Не существует в кисл. раств. HBr, НС1 । Zn Sn" Не сущ. в кисл. р. HJ, HBr, SO2, Fe", 1 с2н5он Кипящая вода Zn Кипящая вода Zn Sn”, Fe", H2S, SO2, HCOOH Не сущ. в кисл. р. Zn, Fe-, SO«, HCOOH Кипящая вода Zn, HCOOH Sn”, HJ
Соединения, образующиеся при действии 0,1—1,0V NaOH Na2RuO4, оранж-красн. NaRuO4, темнозелен. Na2RuO5 • Н2О, от оранж. до красы. Оз(ОН)3 темнооранж. Os(OH)4, черн. Na2OsO4, оранж. Na2OsO5-H2O, от желт, до оранж. На хол. Со(ОН)С1, синий при натр. Co(OH)2. роз. Со(ОН)з, черн. На хол. NaRhO2 желт. При нагр. Rh(OH)3, черн. Rh(OH)4t зелен. NaIrO2 1г(ОН)4 темносиний Ni(OH)2, бледнозелен. Ni(OH)3, черн. NaHPdO2, светлооранж. Pd(OH)4, темнобурый РЦОН^, темнобурый Na2Pt(OH)6
0,1 — IfiN НС1 H2RuCl6 С!2 H2RuCle4-Cl2 RuO4, желт. или Ruiv +С12 H30sC6, красы. H2OsClg, желт. H2OsCI64*OsO 4 OsO4 СоС12 розовый I СоС12+С12 H2RhC!5, HsRIiCIq, оранж-красн. H2RhCl6, синий Н31гС16оливк-зелен. | Н21гС16, черн. NiCl2, зелен. NiCl2+Cl2 PdCl2,H2PdCl4 тем- нооранж. H2PdCle, темнокр. HjPtCU, крас-черн. HsPtClg, желт.
Ва- лент- ность CD t- GO CO rf* CD 00 с» СО СО -S’СО Tb 04 co 04 ’^’ 04’^'
1 Эле- , мент О о х: U ctf Л — ч-> z: cu о.
Группа период, сист. ’ Villa VUIb ' Ville
114
При реакциях с НС1 образование комплексной кислоты указано только
тогда, когда элемент переходит преимущественно в это соединение. Если
даются две формулы комплексных соединений, то первая относится к ком-
плексу, получающемуся с разбавленной, а вторая — с более концентриро-
ванной кислотой.
При реакциях с NaOH формулы осадков, растворяющихся в избытке
едкой щелочи, не приводятся.
Что касается отношения элементов к окислителям и восстановителям,
то предполагается, что раствор их является однонормальным в отношении
HCI, если нет других специальных указаний, и что прибавляемый реактив
имеет малую концентрацию. В качестве восстановителей применяются Zn,
SnCla, HaS, SOs, разбавленная HJ, FeCh, горячая 7—9N HBr и горячая
6-12N HCI. i
Восстановительное действие этих веществ вообще уменьшается в том
порядке, в каком они приведены; цинк можно заменять металлическим
оловом, если это позволяют другие условия!. В случаях, когда низшая сте-
пень валентности не может быть восстановлена цинком, в таблице поме-
щены черточки. Предполагается, при отсутствии других указаний, что если
элемент в своей низшей валентности восстанавливается данным агентом,
то он будет также восстанавливаться и в высшей своей валентности. В ка-
честве окислителей приняты Ch, Bra, Ja, воздух и горячая 2—3N HNCh
(при отсутствии хлоридов). Если хлор не оказывает никакого окислитель-
ного действия, то в таблице в соответствующих местах проставлены чер-
точки.
ЧАСТЬ II
РЕАКЦИИ КАТИОНОВ
Разделение металлов на группы (стр. 100) основано на раз-
личии в растворимости хлоридов, сульфидов, гидроокисей и
карбонатов.
ГРУППА I. ГРУППА ХЛОРИСТОВОДОРОДНОЙ кислоты
СЕРЕБРО, РТУТЬ, СВИНЕЦ
Серебро, свинец и ртуть относятся к важнейшим /представи-
телям этой группы. Свинец никогда не выделяется полностью
с этой группой, а ртуть осаждается в виде хлорида только из
солей одновалентной ртути. Вместе с этой группой осаждается
также и хлористый таллий Т1С1, но этот элемент будет нами
рассмотрен вместе с редкими элементами в части V. Иногда
с этой группой осаждаются основные хлориды висмута и
сурьмы, BiOCl и SbOCl, но эти осадки легко растворяются в из-
бытке НС1 1 и поэтому не причиняют больших затруднений.
При некоторых условиях добавление НС1 к щелочному
раствору вызывает осаждение гидратированной WO3; этот слу-
чай будет рассмотрен в части V.
Серебро Ag. Ат. в. 107,88, Ат. н. 47
Плотность 10,49. Т. пл. 960,5°. Т. кип. 1944°.
Нахождение в природе. Серебро встречается в самородном состоянии
и в соединениях с другими элементами, главным1 образом с серой, мышья-
ком и сурьмой.
Из содержащих серебро минералов могут быть названы следующие:
роговое серебро AgCl; аргентит или серебряный блеск AgsS; сурьмяно-
серебряная обманка (пираргирит) AgsSbSs и мышьяково-серебряная об-
манка (прустит) AgsAsSs. Серебро встречается также с блеклыми рудами
(тетраэдрит) и .свинцовым блеском.
Свойства. Серебро — белый металл, тверже золота и мягче меди. Се-
ребро в виде паров, а также очень тонкие листочки серебра имеют фио-
летовый оятенок. В расплавленном состоянии серебро поглощает кислород
в количестве, в 20 раз превышающем его собственный объем, и при
охлаждении выделяет его с характерным разбрызгиванием жидкого ме-
талла. По ковкости и тягучести оно уступает только золоту, но по тепло-
и электропроводности серебро превосходит все остальные металлы.
1 Следует, однако, избегать большого избытка соляной кислоты, осо-
бенно же концентрированной, потому что & последней растворяются хло-
риды серебра и свинца с образованием комплексных кислот HaCAgCh] и
HetPbChl- Ред.
116
' Растворителем для серебра является азотная кислота. Серебро не рас-
творяется в разбавленных соляной и серной кислотах, ио легко раство-
ряется в кипящей серной кислоте с выделением сернистого ангидрида:
2Ag + 2H»SO4-> 2Н-0 + SCfe + AgsSCh.
Растворимостью серебра в серной кислоте пользуются для отделения
его из сплавов с золотом и платиной.
Серебро образует три скисла: закись серебра AgiO, окись AgaO и
перекись серебра Ag»O». Из этих окис.тов только Ag»O образует основа-
ние; известен лишь, один ряд солей.
Перекись серебра образуемся на аноде при электролизе концентриро-
ванного водного раствора нитрата серебра. Получающийся серо-черный
кристаллический порошок имеет следующий состав: AgiCh = Ag»O • AgaOs.
Его можно рассматривать как соль AgfAgOd гипотетической серебряной
кислоты HAgOa
Окись серебра AgaO — буровато-черный порошок, который при нагре-
вании до 300° полностью распадается на металл и кислород.
Серебряные соли большей частью бесцветны. Окрашены: бромистое
(желтого цвета), йодистое (желтого), сернистое (черного), фосфорнокислое
(желтого), мышьяковистокислое (желтого), мышьяковокислое (бурого),
хромовокислое (красно-бурого) и железосинеродистое (оранжевого). Боль-
шинство серебряных солей не растворимо в воде и под влиянием света,
разлагаясь, окрашивается в темный цвет.
В воде растворимы нитрат, хлорат, фторид и перхлорат; менее рас-
творимы нитрит, ацетат и сульфат. Серебряные соли органических кислот
относятся к наиболее трудно растворимым солям.
Галоидные соли серебра в противоположность окиси его чрезвычайно
устойчивы и плавятся, не разлагаясь. Хлорид плавится при 465°, бромид —
при 422° и иодид — при 552°.
Серебро быстро тускнеет на воздухе, содержащем сернистый водород.
Серебряная посуда чернеет от соприкосновения с яйцами, так как послед-
ние содержат серу. Легкость образования сернистого серебра используется
для открытия серы (реакция образования серной печени).
Реакции мокрым путем
1. Соляная кислота или растворимые
нейтральных и кислых растворов белое
серебро:
Ag’ + Cl' -> AgCl.
хлориды осаждают из
творожистое хлористое
Хлористое серебро заметно растворяется в чистой воде (стр. 32), осо-
бенно же при кипячении, но оно совершенно, не растворяется, если к воде
прибавить избыток нитрата серебра или незначительный избыток соляной
кислоты (стр. 35).
Хлористое серебро растворяется в значительной степени в большом
избытке соляной кислоты или хлоридов щелочных металлов вследствие
образования комплексных анионов [AgCls]"; оно значительно менее рас-
творяется в разбавленной азотной кислоте.
Хлористое серебро легко растворяется в аммиаке:
AgCl + 2NH»-> [Ag(NH3)2]' + СГ;
от прибавления к полученному раствору азотной кислоты осадок снова
выделяется:
[Ag(NH3)i] ’ + СГ+ 2Н‘ -> 2NHi’ + AgCl.
1 Brauner u. Kuzma, В. 40, 3371 (1907).
117
Хлористое серебро также легко растворяется в растворе цианистого
калия: <
AgCl.+ 2CN'-> [Ag(CN)»]'.+ Cl';
если такой раствор подкислить, то осаждается цианистое серебро:
[ Ag(CN)s]'.+ Н • -> HCN.+ AgCN.
В отсутствие кислот хлористое серебро легко растворяется в рас-
творе тиосульфата натрия* 1;
2AgCl + BS2O3" -» [Ag^SsOs]"".4-.2С1',
При кипячении полученного раствора медленно осаждается сульфид
веребра, если только имеется большой избыток тиосульфата натрия, но
гораздо1 быстрее это происходит при предварительном разбавлении.
Растворимость хлорида серебра при всех вышеприведенных реакциях
обусловливается образованием комплексных ионов, содержащих серебро
(стр. 41).
Все вышеприведенные комплексы разлагаются сильными кислотами
с возможным выделением наиболее трудно растворимой соли соответ-
ственной кислоты. Тиосульфатный комплекс распадается даже при кипяче-
нии, причем! выделяется осадок черного сернистого серебра.
Хлористое серебро при кипячении с концентрированной серной кисло-
той медленно разлагается, причем выделяется хлористый’ водород и обра-
зуется не растворимый в серной кислоте кристаллический сульфат серебра.
При кипячении С раствором едкого кали или натра оно разлагается
отчасти, на холоду же остается без изменения. Карбонаты щелочных ме-
таллов его не разлагают; только при сплавлении с углекислым натрием
хлористое серебро разлагается полностью:
4AgCl + 2Na2COs -> 4NaCl + 2СО2 + О2 + 4Ag.
При плавлении хлористого серебра образуется желтая жидкость, ко-
торая при охлаждении затвердевает в стекловидную массу; ее можно уда-
лить из тигля обработкой цинком и разбавленной серной кислотой
(стр. 119).
2. Едкие щелочи осаждают бурую окись серебра:
2Ag‘ 4- 2ОН' Н2О + Ag2O,
не растворимую в избытке осадителя, легко растворимую в азот-
ной кислоте и аммиаке. При стоянии аммиачного раствора вы-
деляется черный осадок, гремучее серебро Бертолле (Bertholle),
состав которого AgNs. Даже при небольшом толчке гремучее
серебро может дать взрыв большой силы2-
3. Аммиак. При осторожном приливании к нейтральному,
раствору серебряной соли аммиака первые капли его об-
разуют беловатый осадок, AgOH, быстро, однако, переходящий
в окись AgsO, бурого цвета. Большая часть серебра остается,
однако, в растворе в виде комплексной азотноаммиачносе-
ребряной соли [Ag(NHs)2]NO3; в избытке аммиака растворяется
также и окись серебра: ’
Ag2O + 4NHs + Н2О 2[Ag(NH3)2] *'+ 2ОН'.-
1 По Jonsson, В. 54, 2556 (1921) образуется двойная соль AgsSsCA’
•xNasSaOs (где х обыкновенно равно 1, 2 или 3). Ред.
1 Не следует растворять AgaO в аммиаке в отсутствие аммонийной
соли, потому что возможно образование гремучего серебра, взрывающе-
гося от малейшего сотрясения. Ред.
118
4. Углекислые щелочи осаждают белое углекислое серебро,
желтеющее при продолжительном кипячении вследствие разло-
жения незначительного количества его на окись серебра и
угольный ангидрид:
2Ag‘ ф СОз"-> AgsCOs;
AgaCOs -> Ag2O ф СОг.
5. Углекислый аммоний дает такой же осадок, который, од-
нако, растворяется !в избытке реактива вследствие образования
комплексного иона [Ag(NHs)2]’.
6. Сернистый водород осаждает из нейтральных, аммиачных
или кислых растворов черное сернистое серебро:
2Ag''ф H2S -> Ag»S ф 2Н’,
не растворимое в аммиаке, сульфидах щелочных металлов и
разбавленном растворе цианистого калия.
Растворимость сернистого серебра настолько’ мала, что в вод-
ных растворах, содержащих [Ag(NH3)2]‘ или [Ag(CN)2]', имеется
еще достаточно Ag', чтобы даже со слабо ионизированным сер-
нистым водородом превзойти величину произведения раствори-
мости AgaS. Сернистое серебро заметно растворяется в очень'
концентрированном растворе цианистого калия и легко раство-
ряется в разбавленной горячей азотной кислоте (стр. 47):
3Ag2S ф 2NO3''ф 8Н’ -> 6Ag’ ф 2NO ф 4НЮ ф 3S.
7. Тиоацетат аммония 1 осаждает сульфид серебра из кислых
растворов:
2Ag' ф СНз-COS' Ч- Н2О ->Ag2S фСНзСООН ф Н\
8. Восстановление солей серебра (в том числе и комплекс-
ных, как, например, цианидов) до металла протекает очень
легко. В качестве восстанавливающих агентов могут быть
взятые цинк, хлористое олово, сернокислое железо, муравьиная
кислота.
а) Цинк выделяет из всех растворов серебряных солей (простых и
комплексных) металлическое серебро. Если нерастворимое хлористое серебро
облить разбавленной серной кислотой и в нее положить кусочек цинка
так чтобы юн касался хлористого серебра, последнее восстановится до
металла:
2AgCI + Zn -> 2СГ + 2Ag + Zn'
б) Хлористое олово восстанавливает серебро из его аммиачных рас-
творов:
Sn •• + 2[Ag(NHs)s] ’ ->Sn-- • • + 2Ag + 4NHs.
1 Уксусная кислота имеет формулу НС2Н3О2 или СНзСООН (последняя
показывает ее строение). В тиоуксуоной кислоте кислород гидроксильной
'группы замещен серой; ее формула CHsCOSH. Она получается при Дей-
ствии пятисернистого фосфора на ледяную уксусную кислоту. Продукт
имеет неприятный залах; стоимость его довольно высокая.
Schiff и. Та,ruge [Z. апаЬ Chem. 34, 456 (1895)] рекомендуют
применение слабоаммиачных растворов аммонийной соли этой кислоты
(тиоацетат аммония) взамен сернистого водорода. Этот раствор хорошо
осаждает сульфиды. Тиосульфат натрия также осаждает сульфиды некото-
рых катионов, ио находящийся в нем атом серы, несущий два отрицатель-
ных заряда, менее подвижен, чем в тиоацетате аммония. Ред.
119
Смешивают небольшое количество испытуемого раствора с избытком
аммиака и отфильтровывают от могущих образоваться осадков. Берут
каплю прозрачного раствора на фильтровальную бумагу и добавляют
к ней каплю разбавленного раствора хлористого олова. В присутствии
0,1 Y серебра образуется черное пятно. Обработка аммиаком имеет целью
удаление висмута и ртути, мешающих реакции.
в) Сернокислая соль двухвалентного железа восстанавливает серебря-
ные соли медленно на холоду, быстро при нагревании до металлического
серебра серого цвета:
Ag' + Fe’ ‘ -» Ag + Fe’ '
Часто при этом выделяется еще основная соль закиси железа, осо-
бенно при употреблении очень разбавленных растворов. При нагревании
с разбавленной серной кислотой основная соль железа переходит в раствор.
Если действовать сернокислым железом на аммиачный раствор серебра,
содержащий сегнетову соль (для предупреждения выпадения гидрата же-
леза), происходит образование серого осадка; последний повидимому,
является закисью серебра AgiO или смесью тонко диспергированного ме-
таллического серебра с некоторыми органическими веществами.
г) Муравьиная кислота HCOOH медленно восстанавливает растворы
серебряных солей:
2Ag’ + HCOOH -» 2Ag + 2Н’ + СОз.
9. Хромовокислый калий осаждает буро-красное хромовокис-
лое серебро AgeCrOt, растворимое в аммиаке и азотной кислоте
и очень трудно растворимое в уксусной кислоте:
2Ag’ ’+ CrCU" ->Ag2CrOU
Этой чувствительной реакцией при выполнении ее в виде ка-
пельной можно открыть 2 у серебра.
1—2 капли (Испытуемого раствора смешивают на часовом стекле с рав-
ным объемом раствора карбоната аммония и отфильтровывают от осадка,
если последний образуется. К капле прозрачного фильтрата на фильтро-
вальной бумаге прибавляют каплю 1%-ного раствора хромата калия, ко-
торый содержит уксусную кислоту в концентрации, равной 1 N.
10. Двухромовокислый калий выделяет красно-бурый осадок
двухромовокислого серебра Ag-iCrzO:, растворимый в аммиаке и
азотной кислоте.
2Ag’ СггО?" -> Ag2Cr2O7.
11. Йодистый калий осаждает желтое творожистое иодистое
серебро, практически не растворимое в аммиаке, но легко рас-
творимое в растворах цианистого калия и тиосульфата натрия.
Катион [Ag(NHs)'2]' в водном, растворе дает больше катионов Ag’, чем
иодистое серебро, но ионы [Ag(CN)-2]' и [Ag2(SaO3)3]"" являются более
устойчивыми комплексами и дают меньше катионов Ag‘, чем иодид серебра.
12. Фосфорнокислый натрий выделяет из нейтральных рас-
творов солей серебра желтый осадок фосфата серебра:
3Ag-'+ 2НРО4" -+ Н2РО4' + Ag3PO4.
Фосфат серебра легко растворим в азотной кислоте и аммиаке. Раство-
римость eno в последнем обусловливается образованием комплексных сере-
бряно-аммиачных ионов:
AgsPCh + 6NH3 -> 3[Ag(NHs>2] ’ + РОГ". .
При нейтрализации аммиачного раствора азотной кислотой или азотно-
кислого раствора аммиаком фосфат серебра снова выпадает,
120
13. Тиосульфат натрия осаждает белый тиосульфат серебра,
растворимый в избытке осадителя; 'при кипячении раствора вы-
падает сульфид серебра:
2Ag' + S2O3" -> Ag2S2O3;
AgaSaOs 2S2O3,z -* [Ag2(S20s)3]"//;
[AgafSaOs^]"" + 2H' -> AgsS-|- 2S + H2O + SCU" + 2SO2.
Прибавление небольшого количества кислоты благоприят-
ствует осаждению сульфида согласно последнему уравнению
реакции.
14. р-Диметиламинобензилиденроданин \
HN — СО
। । /—\
SC С = сн/ 2N(CH3)2
образует красно-фиолетовую соль с ионами серебра. Соли рту-
.ти, золота, платины, палладия и одновалентной меди мешают
этой реакции.
В отсутствие этих элементов смачивают кусочек фильтровальной бу-
маги насыщенным раствором реактива в ацетоне и на высушенную затем
бумагу помещают каплю исследуемого раствора. Уже в присутствии 0,02 т
серебра появляется красно-фиолетовый осадок или пятно такого же цвета,
который легко отличить от желто-бурого цвета самого' реактива.
Если присутствуют ртуть и медь, то образовавшееся пятно смачивают
несколькими каплями разбавленной соляной кислоты или хлористого ам-
мония; последние растворяют ртутное соединение роданина с образова-
нием недиссоциированной хлорной ртути HgCb, не мешая открытию сере-
бра, потому что органическая соль последнего менее растворима, чем AgCl.
В присутствии золота, платины и палладия берут на капельную пла-
стинку каплю испытуемого раствора, каплю 10%-нопо раствора цианистого
калия и каплю реактива, растворенного в ацетоне, перемешивают и под-
кисляют разбавленной кислотой; в случае наличия серебра в количестве
2,5 7 получается розовое окрашивание.
NH — NH — С6Н5
15. Дитизон (дифенилтиокарбазон) SCZ дает
xn = n-c6h5
осадок фиолетового1 цвета.
Дитизон способен давать со многими тяжелыми металлами окрашен-
ные внутрикомплексные соединения, которым приписывают строение;
NH —N —С6Н5 NH-N — С6Н3
SC .... Me или SC Me
4N = N — С6Н5 = к — С6Н-
(где Me — одновалентный металл). Реакция чрезвычайно чувствительна, и
•поэтому обычная дестиллированная вода, всегда содержащая следы тяже-
лых металлов, реагирует с дитизоном.
В качестве реактива применяют раствор 1—2 ле дитизона в 100 мл СС14;
этот раствор окрашен в зеленый цвет.
1 F е i g 1, Z. anal. Chern. 74, 380 (1928).
121
Выполнение. К капле испытуемого нейтрального или слегка щелочного
раствора, находящегося в пробирке, емкостью 3 лл, прибавляют каплю
раствора дитизона и взбалтывают. При этом в слое растворителя (CCh)
появляется мелкий осадок фиолетового цвета, образующийся уже в при-
сутствии 0,3 у серебра. Открытие серебра не удается в присутствии благо-
родных метаилов и ртути, которые также дают с дитизоном осадки; но
серебро может быть открыто в присутствии свинца и сурьмы, если реакцию
производить в щелочном растворе, содержащем сегнетову соль (винно-
кислый калий-натрий).
Реакции сухим путем
Все соединения серебра при прокаливании с содой на угле
легко образуют белый ковкий металлический королек без на-
лета (отличие от свинца и олова), легко 'растворимый в азот-
ной кислоте (отличие от олова). Раствор не дает осадка с очень
разбавленной серной кислотой, но немедленно образует осадок
с соляной кислотой (отличие от свинца). '
Ртуть Hg. Ат. в. 200,61. Ат. н. 80
Плотность 13,6. T. пл. —38,9°. T. кип. 357°.
Нахождение в природе. Ртуть встречается в природе, главным образом,
в виде ромбоэдрически кристаллизующейся киновари HgS; в свободном
состоянии ртуть получают из руды путем дестилляции. Отложение кино-
вари в природе происходит, вероятно, из растворов ее тиосоли. Богатей-
шие месторождения киновари находятся в Калифорнии, где оиа встре-
чается вместе с серпентином, в Альмадене (Испания) и в Идрии (Австрия).
(В СССР имеется несколько месторождений, например, близ станции
Никитовки. Ред.). Киноварь часто находят в сопровождении небольших
количеств самородной ртути. Ртуть также является важной составной
частью многих разновидностей блеклой медной руды.
Свойства. Ртуть является единственным металлом, который находится
в жидком состоянии при обыкновенной температуре (редкий элемент гал-
лий плавится при 29,8°). Осажденная из растворов в тонко раздробленном
состоянии и будучи не совсем чистой, она образует темносерый порошок.
Ртуть не окисляется при обыкновенных температурах воздухом или кисло-
родом, но медленно окисляется при температуре ее кипения. Она раство-
ряет многие металлы, образуя амальгамы, имеющие важное промышленное
значение. Амальгамы часто получаются при электролизе растворов
с ртутным катодом. Ртуть не растворяется >в соляной и разбавленной сер-
ной кислотах, но растворяется в горячей концентрированной серной ки-
слоте с выделением двуокиси серы, причем образуется сульфат однова-
лентной или двухвалентной ртути в зависимости от того, что находится
в избытке — кислота или металл:
Hg + 2H2SO4 -> HgSOi ’+ 2НгО + SO2;
2Hg + 2H2SO4 Hg^SOi + 2H2O +.SO2.
Бромистоводородная кислота слабо действует на ртуть, но иодисто-i
водородная кислота легко растворяет ее с выделением водорода:
Hg + 4HJ -» .+ Ни.
122
Положение ртути в ряду, напряжений (стр. 61) показывает, что ртуть
не может быть окисленна Н" ионами за исключением того случая, когда
концентрация Hg-- чрезвычайно низка. Это делает понятным, почему
ртуть .не растворяется в разбавленных соляной и серной кислотах. Окисле-
ние ртути иодистоводородной кислотой объясняется тем, что иодистоводо-
родная кислота переводит ртуть в) соединение H«[HgJi], которое едва
диссоциирует на Hg’'-ионы (стр. 42).
Наиболее подходящим растворителем Для ртути является азотная
кислота.
При действии на металл горячей концентрированной азотной кислоты
получается азотнокислая соль двухвалентной ртути:
Hg + 4HNOs -> Hg(NOs> + 2Н-0 + 2NO2.
Но если азотная кислота действует на избыток ртути на холоду, то
получается азотнокислая соль одновалентной ртути-
Hg(NOs)2 + Hg -> Hga(NOs)2.
При действии хлора на ртуть образуется каломель (хлористая ртуть):
2Hg + Clj-^HgaCh.
Ртуть образует три окисла: черную закись ртути Hg2O, желтую или
красную окись HgO и красновато-бурую перекись HgC>2.
Закись ртути образуется при действии едкой щелочи на водный
раствор соли одновалентной ртути. Она не очень устойчива и в зависи-
мости от условий разлагается на ртуть и HgO или на ртуть и кислород.
Окись ртути приготовляется в широком масштабе путем нагревания
нитрата одновалентной ртути до тех пор, пока не прекращается выделение
паров NO2. Приготовленная таким путем она представляет собой ярко-
красное вещество. Желтая окись ртути, находящаяся, вероятно, в состоя-
нии более мелкого раздробления, может быть получена при действии
едкой щелочи на раствор соли двухвалентной ртути. При нагревании окиси
ртути последняя переходит в красный, затем в черный цвет, наконец раз-
лагается на ртуть и кислород. Не разложившаяся окись при охлаждении
приобретает свой прежний цвет.
Перекись ртути HgCh была получена путем обработки нитрата ртути
при 0° концентрированным раствором перекиси водорода (пергидрол). Она
очень устойчива на воздухе, но медленно разлагается в соприкосновении
с водой.
Существование гидроокисей ртути является до сих пор еще нерешен-
ным вопросом.
Окислы HgO и HgsO представляют собой основные ангидриды, от ко-
торых образуются два ряда солей: а) соли двухвалентной ртути, содержа-
щие iHg' ", и б) соли одновалентной ртути, содержащие ионы Hga’’ *.
Реакции соединений одновалентной ртути описаны ниже, реакции же солей
Двухвалентной ртути будут нами 'рассмотрены в группе II.
1 Вопрос о строении солей закиси ртути весьма неясен, вследствие того,
что существует равновесное состояние между одновалентной, двухвалент-
ной и металлической ртутью. Так, каломель при термической диссоциации
разлагается по уравнению:
Hg^Ch^HgCh-f-Hg;
между тем нитрат в водном растворе электролитически диссоциирует по
уравнению:
Hg^NOs)^ Hg2* • + 2NOj',
как это было установлено Одд, а затем подтверждено Шиловым (Z. anorg.
Chem. 133t 55 (1924). Ре&
123
Соединения одновалентной ртути
Все соли закиси ртути содержат двухвалентную группу ртути Hg2**J
и переходят более или менее легко с отщеплением одного атома ртути
в соли окиси ртути. Кислородсодержащие соли легко гидролизуются в
разбавленном водном растворе, превращаясь в основные соли; так, азотно-
кислая соль распадается по уравнению:
Hg2(NOs)2 + НОН -> HN’Os + Hg»(OH)NOs.
Реакции мокрым путем
1. Соляная кислота и растворимые хлориды осаждают белый
хлорид одновалентной ртути (каломель):
Hg2(NC'3)2 + 2СГ -> 2X04 + Hg2CI8.
Водный раствор аммиака скрашивает осадок в черный цвет,
обусловленный образованием белого хлористого меркураммония
(иногда называемого неплавким преципитатом) и черной мелко
раздробленной ртути:
Hg2Ch + 2ХН3 -> NH/ 4- Cl''4- Hg(NH2)CI 4- Hg.
При кипячении черного осадка с разбавленной НС1 или концентриро-
ванным раствором N‘H<C1 происходит растворение Hg(NHs>Cl и остаются
капельки металлической ртути. Каломель не растворима в воде и разба-
вленных кислотах, растворима в крепкой азотной кислоте и царской водке *.
Каломель при долгом кипячении с водой становятся серой, так как она
частично распадается на хлорную и металлическую ртуть. При кипячении
с концентрированной серной кислотой образуется сульфат двухвалентной
ртути с выделением двуокиси серы и хлористого водорода:
a) HgaCh + H-2S-O4 -> 2НС1 + HgeSOi;
б) HgsSO, + 2.H2SO; -> 2НЮ + SO2 + 2HgSO4
2. Едкие щелочи осаждают черную закись ртути:
Hg2(NO3)2 4- 2ОН' 2NO3' + НгО 4- Hg2O.
3. Аммиак (или углекислый аммоний) дает осадок меркур-
аммониевой соли1 2 и черной металлической ртути:
2Hg2(NO3)2 4- 4NH3 4- Н2О ->3.\H4NO:! 4- (Hg2ONH2)NO3 4- 2Hg.
Наличие металлической ртути в этом осадке можно легко
констатировать, если натереть небольшим количеством его чи-
стое золото; при этом получается золотая амальгама, обладаю-
щая серебристым блеском.
4. Углекислые щелочи дают сначала желтоватый осадок угле-
кислой соли, который быстро становится серым вследствие рас-
1 Каломель легко растворима в 2N НС! в присутствии Н2О2. РеД.
2 Строение получающейся меркураммониевой соли точно не устано-
влено; ей приписывают одну из двух формул:
ZHg
О< N
. XHg
NO3
Н
или NH2 — Hg — О — Hg — NO3.
Поэтому ее называют также оксиамидосоединением.
124
падения на окись ртути, металлическую ртуть и угольный ан-
гидрид:
Hg2(NO3)2 + №2СОз-> 2NaNO3 + Н&СО»;
Н§гСОз = HgO -ф Hg 4~ СО2.
5. Сернистый водород тотчас образует черный осадок, состоя-
щий из сернистой и металлической ртути (отличие от солей
двухвалентной ртути):
Hg2- • + H2S ->2Н :- HgS Hg.
Черный осадок не вполне растворяется в сернистом калии
(потому что металлическая ртуть остается нерастворенной), но
он полностью растворяется в полисульфидах щелочных ме-
таллов 4
Hg + HS2' 4- ОН' -> Н2О + HgS2".
Из полученного раствора хлористый аммоний выделяет
обратно сульфид ртути.
6. Тиоацетат аммония и тиосульфат натрия выделяют из кислых рас-
творов солей одновалентной ртути осадок, состоящий из черного суль-
фида ртути и мелко раздробленной металлической ртути в смеси с серой.
7. Хромовокислый калий осаждает при нагревании красную
хромовокислую соль закиси ртути:
Hg;.(NO3)2 4- К2СГО4 ->2КМОз Hg;CrO|.
8. Йодистый калий осаждает зеленую иодистую ртуть
Hg2(NO3)2 4- 2KJ -+ 2KNO3 4- Hg»J2,
частью растворимую в избытке осадителя с образованием комп-
лексной соли ртутноиодистопо калия и выделением ртути:
Hg2J2 + 2J'-> [HgJi]"4-Hg.
9. Цианистый калий осаждает металлическую ртуть с одно-
временным образованием цианистой ртути:
Hg2‘ ‘ 4- 2CN' -> Hg(CN)s + Hg.
Это одновременно происходящее окисление и восстановление
становится понятным, если принять во внимание, что в растворе
солей одновалентной ртути существует равновесие:
Hgo-- ^Hg-- 4~ Hg.
Бели ионы двухвалентной ртути будут удаляться путем оса-
ждения или образования комплексной соли, то должно происхо-
дить дальнейшее распадение ионов одновалентной ртути на ионы
двухвалентной и металлической ртути.
1 Полисульфиды щелочных металлов в воде гидролитически расще-
пляются на KHS2 и КОН; KHS2 со ртутью дает HgS и KHS, которые всту-
пают тотчас в реакцию с образовавшеюся едкой щелочью: HgS + KHS +
+ КОН-> Н2О 4-MHgSa). Ред.
125
10. Хлористое олово, прибавленное в очень малом количестве,
осаждает белую хлористую ртуть, но если прибавить его в ко-
личестве, превышающем эквивалентный вес двухвалентного олова,
то получается серая смесь из хлористой ртути и металлической
ртути; таким путем вся одновалентная ртуть может быть пре-
вращена в металлическую ртуть:
Hg2(NO3)2 + Sn* * -> Sn* + 2NOs' + 2Hg.
11. Металлическая медь (отполированная медная пластинка).
На пластинку меди помещают каплю почти нейтрального иссле-
дуемого раствора соли одновалентной ртути, причем происходит
выделение металлической ртути. Спустя короткое время каплю
смывают и место, на котором была последняя, слегка растирают
кусочком шерстяной ткани или бумаги, отчего получается се-
ребристобелое блестящее пятно (эта проба является реакцией на
ртуть обеих валентностей. А. К.).
Реакции сухим путем
Большинство ртутных соединений возгоняется при накалива-
нии в стеклянной трубке.
Хлорная ртуть сначала плавится, а затем легко переходит
в пары, которые конденсируются в виде кристаллов на более
холодных частях стенок трубки.
Хлористая ртуть возгоняется; возгон почти белого цвета1
с незначительным сероватым оттенком вследствие перехода не-
большой части хлористой ртути в хлорную с выделением метал-
лической ртути.
Иодная ртуть дает желтый возгон, становящийся красным при
трении палочкой.
Все кислородные соединения дают (более или менее полно)
металл.
Сернистая ртуть образует черный возгон.
Все ртутные соединения, смешанные с содой, при накаливании
в трубке дают серое зеркало, состоящее из мельчайших капель
ртути. Чтобы сделать эти капли видимыми, зеркало трут стек-
лянной палочкой, обернутой кусочком фильтровальной бумаги.
Тогда маленькие капли соединяются в большие капли, пристаю-
щие к бумаге, и таким1 образом их можно вынуть из трубки.
Открытие ртути в специальных случаях
Открытие ртути в моче 1
• Берут в стакан 500—1000 лл мочи, добавляют 0,5% соляной или серной
кислоты и 0,5 г мелконареэанной латунной фольги (употребляемой как елоч-
ное украшение); нагревают на водяной бане до 60-—80Р и в течение 10—>
15 мин. пропускают воздух через раствор, чтобы поддерживать его при
непрерывном перемешивании. Вся находящаяся в растворе ртуть замещается
при этом медью:
HgCh + Си -» СиС12 + Hg.
’Fubringer, Z. anal. Chem. 27, 526 (1888).
126
Выделяющаяся металлическая ртуть образует с избытком меди амаль-
гаму. Сливают жидкость и промывают медную фольгу путем дегаигтации
дестиллированной водой, спиртом и эфиром; отжимают медь между листами
фильтровальной бумаги (чтобы удалить следы эфира) и сжимают ее в ма-
ленький комочек; последний вносят в тщательно вымытую и основательно
просушенную пробирку из тугоплавкого стекла длиной 10 см и диаметром
0,5 см. На расстоянии 0,5 см выше медной фольги вытягивают пробирку в
капилляр диаметром 1 .ч.и. После того как пробирка остынет, нагревают
находящуюся в ней медную фольгу до темнокрасного каления; ртуть при
этом отгоняется и конденсируется на холодных местах пробирки в виде
серого зеркала, состоящего из мельчайших капелек ртути. Если содержание
ртути более или менее значительно, например более 1 мг, капли можно' от-
четливо различить в лупу.
Если содержание ртути в моче меньше 1 мг, зеркало получить трудно.
Чтобы заметить его, превращают металлическую ртуть в красную йоди-
стую ртуть. Для этого отрезают низ пробирки, как раз над
тем местом, где находится медная фольга, а верхнюю частр,
где должно быть ртутное зеркало, переносят в другую ши-
рокую пробирку, в которую предварительно кладут 1—2 ма-
леньких кристаллика иода. Осторожно нагревают дно внеш-
ней широкой пробирки; как только фиолетовые пары иода
достигнут мест отложений ртутц, последняя превращается
в красный иодид, который легко обнаружить, вынув вну-
треннюю пробирку и положив ее на Лист белой бумаги. Метод
очень
честве
Рис. И,
чувствителен и позволяет обнаружить ртуть в коли-
0,4 мг Ч
в
Открытие ртутиых паров в воздухе
небольшую стеклянную трубку помещают немного
смятого в комок чистого листового золота и пропускают
через идее в течение 1 часа исследуемый воздух (со ско-
ростью 1 л в минуту). Одновременно эвакуируют гейссле-
ровскую трубку указанной на рис. 11 формы. Эвакуирование
производят водоструйным насосом (но не ртутным!) и за-
крывают оба крана. Затем помещают золотой комок, кото-
рый в случае нахождения ртутных паров в воздухе содер-
жит ртуть в виде амальгамы, в трубку п и сразу открывают
кран а, снабженный широким отверстием. Золотой комок
будет при этом втянут в трубку и поместится у отверстия
капилляра с. После этого вытесняют из гейсслеровской
трубки воздух водородом следующим образом!. Дают просу-
шенному концентрированной серной кислотой водороду из прибора Киппа
входить ® течение 3 мин. через а и выходить через Ь; затем, не отъединяя
трубку от прибора Киппа, закрывают а и Ь, соединяют b с водяным насо-
сом 1 2 и эвакуируют трубку через Ь в течение 1—2 мин.; после этого за-
крывают Ь и открывают а, пропуская водород через трубку. Закрыв снова
кран а, открывают b и вновь эвакуируют. Эту операцию смены пропуска-
ния водорода и последующего эвакуирования повторяют 5—6 раз, совер-
шенно вытесняя воздух из трубки водородом, после чего эвакуируют еще
51—10 мин. и затем окончательно закрывают кран Ь. Установив капилляр
перед щелью спектроскопа, пропускают через трубку вторичный ток
индукционного аппарата. В присутствии минимальнейших следов ртути
появляется на холоду характерная зеленая линия 546 тц, а при несколько
больших количествах ртути — индигосиняя линия 456 m.j._ Если золотой
комок осторожно нагреть пламенем бунзеновской горелки, то спектр ртути
выступает еще более отчетливо.
1 О других методах открытия ртути в моче см. Jolies, Z. anal. Chern,
39, 230 (1900); Merge t, J. pharm. chim. i[5], 19, 444 (1889); Oppenheim,
Z. anal. Chem. 42, 431 (1903).
2 Между водоструйным насосом и гейсслеровской трубкой должна быть
включена хлоркальциевая трубка,
127
Примечание, Проба эта настолько чувствительна, что даже при кон-
трольных опытах, производимых в помещениях, в которых проделывалась
работа с ртутью, весьма ,часто обнаруживается присутствие этого металла.
Аппарат, служивший уже раз для открытия ртути, должен быть перед
повторным опытом подвергнут основательной очистке. Для этого, удалив
золото из трубки, всасывают в последнюю царскую водку и оставляют ее
в трубке на несколько минут. Затем дают кислоте стечь, трижды прополас-
кивают дести’ллированной водой, наконец абсолютным спиртом *, после
чего высушивают, пропуская через нагреваемую трубку в течение 5 мин.
водород, предварительно проходящий через промывалку с концентриро-
ванной серной кислотой. Если после введения в трубку предварительно
слабо прокаленного золота и эвакуирования спектр ртути не появляется,
то считают аппарат готовым для нового1 опыта.
Следует еще заметить, что обе платиновые проволоки в гейсслеров-
ской трубке не должны быть снабжены алюминиевыми наконечниками,
потому что алюминий амальгамируется ртутью и вследствие этого никогда
нельзя было бы освободить трубку от ртути для дальнейших опытов.
Свинец РЬ. Ат. в. 207,21. Ат. н. 82
Плотность 11,38—11,48. Т. пл. 327°, Т. кип. 1613°
Нахождение в природе. Свинец встречается в природе в виде сле-
дующих соединений: свинцовый блеск, иии галенит, PbS, правильной си-
стемы; церуссит, или белая свинцовая руда, РЬСОз, ромбической системы,
изоморфный с арагонитом СаСОз; англезит PbSO-i, ромбической системы,,
изоморфный с ангидритом CaSO«, целестином SrSO« и баритом BaSCh; пи-
роморфит, или зеленая свинцовая руда, РЬ5;(РО4)зС1, гексагональной си-
стемы1; миметезит PbsCAsOOaCl; ванадинит Pbs(VO«)sCl. Последние три мине-
рала изоморфны и принадлежат к группе апатита. Далее укажем на вуль-
фенит РЬМоО, квадратной системы1, изоморфный со стольцптом PbA'Ch, и
крокоит РЬСгСй, кристаллизующийся в моноклинической системе.
Свойства. Свинец представляет собой мягкий, ковкий, слегка тягучий
металл, синевато-серого цвета, который тускнеет на воздухе, покрываясь
пленкой окиси. Очень малые количества других металлов повышают его
твердость. Свинец отличается малой электро- и теплопроводностью. Он
кипит при, температуре кислородно-водородного пламени, но не может быть
подобно цинку или кадмию отогнан из закрытого сосуда: при температуре
ниже белого каления в отсутствие воздуха свинец не обладает заметной
летучестью. Свинец дает много ценных сплавов, как, например, баббит,
типографский металл, припой и пр.
На свинец действуют все кислоты. Но так как большая часть свинцо-
вых солей в воде очень трудно растворима, то металл обыкновенно покры-
вается слоем соли, защищающим его от дальнейшего1 действия кислоты.
Так, например, разбавленная серная кислота тотчас действует на свинец
согласно уравнению:
РЬ + Нз5О<-> РЬ5О« + На.
Но образовавшийся сернокислый свинец почти не растворим -в разба-
вленной серной кислоте и поэтому реакция тотчас прекращается. На этом
свойстве свинца основано применение свинцовых камер1 в фабричном про-
изводстве серной кислоты и свинцовых чренов для концентрации разбавлен-
ной «камерной кислоты». В этой операции не следует, как показы-
вает опыт, переходить известный предел, т. е. кислоту в свинцовом чрене
не следует концентрировать больше, чем до 78—82%, потому что в про-
1 Все эта операции должны производиться в помещениях, относительно
которых имеется уверенность, что в них ртути нет,
128
тивном случае предохраняющий свинец слой сернокислого свинца раство-
рится в горячей концентрированной серной кислоте с образованием раство-
римого кислого сернокислого свинца:
PbSO4 + H2SO4 -> Pb(HSO4)2,
после чего горячая концентрированная серная кислота начнет уже раство-
рять незащищенный свинец:
РЬ + 3H2SO< -»so2 + 2НгО + Pb(HSO«)3.
Аналогично относится свинец к соляной кислоте. На его поверхности
при этом образуется защитный слой хлористого свинца, который рас-
творяется в горячей концентрированной соляной кислоте с образованием
H(PbCh).. Поэтому свинец растворяется в концентрированной соляной
кислоте:
РЬ + ЗНС1 H(PbCh) + №.
При действии на свинец плавиковой кислоты образуется защитный
слой фтористого свинца, не растворяющегося в плавиковой кислоте. По-
этому для перегонки последней, а также для приготовления ее из пла-
викового шпата и серной кислоты применяют свинцовые реторты.
Разбавленная азотная кислота является наиболее подходящим раство-
рителем для свинца. Азотнокислый свинец не растворим в концентрирован-
ной азотной кислоте, поэтому свинец не растворим в слишком концентри-
рованной азотной кислоте; последнюю нужно настолько разбавлять водой,
чтобы образующийся азотнокислый свинец не выделялся из раствора.
Свинец образует шесть окислов: РЬгО, РЬО, РЬО? • ЗНзО, РЬгО», PbsOt,
PbCh.
Закись свинца РЬгО представляет собой черный порошок, получаю-
щийся при нагревании без доступа воздуха оксалата свинца РЬСгО» при
температуре ниже 300°. Она нестойка и настолько легко превращается в РЬ
и РЬО, что некоторые химики сомневались в ее существовании.
Окись свинца РЬО известна в двух модификациях — желтый глет и
красный масикот. Она образуется при прокаливании на воздухе РЬ, РЬОг,
РЬ»О», Pb(OH)«, РЬСО», РЬСгОа или Pb(NO»)2, причем цвет получающегося
продукта широко варьирует в зависимости от температуры прокаливания;
при высокой температуре получается соединение желтого цвета.
Полутораокись свинца РЬэОз получается в виде желтого осадка при
осторожном окислении щелочного раствора окиси свинца посредством
хлорноватистокислых солей, галоидов, переииси водорода или надсернокис-
лых солей:
2РЬ(ОН)г + 2NaOH + ,Ch -> 2NaCl + 3HsO + РЬ2О».
РЬО» может рассматриваться как свинцовая соль метаовинцовой кис-
лоты! [метаплумбат свинца (см. ниже)].
Окисел РЬзО» обыкновенно называется красным свинцовым суриком. Он
представляет собой яркокрасный порошок, который получается путем про-
должительного нагревания на воздухе при частом, перемешивании окиси
свинца при 400°. При более высокой температуре он разлагается, выделяя
кислород. РЬзО» может рассматриваться как свинцовая соль ортосвинцовой
кислоты или ортоплумбат свинца (см. ниже).
Оба вещества, РЬгО» и РЬзО», обладают свойствами солей: при обра-
ботке азотной кислотой они дают азотнокислый свинец и выделяют слабую
свинцовую кислоту (бурого цвета) подобно углекислому свинцу, дающему
при этих условиях азотнокислый свинец и угольную кислоту;
/О. /ОН
о = РЬ< )РЬ + 2Н‘ —> РЬ" 4- РЬО<
/Оч /ОН
о )РЬ4-2Н-—>рь"4-со< [со,4-н2о]
хон
/Оч /Оч /ОН
рь( >pi / >рь + 4Н- —> 2РЬ" +.н,о + рьо<
хон
9 Зак. 982, Тредаелл-Голл, т. I.
129
Эти солеобразные окислы вполне аналогичны таковым же окислам мар-
ганца; они выделяют с соляной кислотой хлор, так как образующаяся
в свободном ваде свинцовая кислота является сильным окислителем:
РЬО2 + 4НС1 -» 2НгО + PbCh + С1з;
РЫОз + 6НС1 -» ЗН’О + 2РЬС1г + Ch;
РЬзО4 + 8НС1 -> 4Н»О + ЗРЬСЬ + Ch.
Двуокись свинца РЬОз должна рассматриваться как кислотный ангид-
рид следующих двух кислот:
НО ОН ОН
/РЬ<^ или РЬ^О
но' он хон
оргосвинчовзя метасвин»овая
ьислоч! кислота
подобно тому, как S1O2, SnO-x СО» и МпО» рассматриваются как ангид-
риды кремневой, оловянной, угольной и марга.нцоватистой кислот.
ОН
Кислота РЬ = О получается при окислении гидрата окиси свинца в ще-
лочном растворе посредством хлорноватистых солей, хлора, брома, пере-
киси водорода или надсернокислого калия:
ОН ОН
Pb/ + 2ОН' + С1«—>11-0 + 2СГ + РЬ-0
ОН 4 ОН
Выделяющаяся бурая метасвинцовая кислота при 100° переходит
в ангидрид, который при накаливании переходит с выделением кислорода
в желтую окись свинца.
Из всех этих окислов только окись свинца РЬО обладает определенно
выраженными осксвными свойствами и от нее производятся все обычные
соли свинца. Правда, были получены соли, как, например, РЬС1, с одно-
валентным свинцом, а также соли с четырехвалентным катионом, например
тетрацетат свинца PWCH-iCOOP. но эти соли имеют малое значение и редко
встречаются. Окись свинца плавится при 980° и затвердевает при медлен-
ном охлаждении, образуя игольчатые кристаллы квадратной системы. Окись
свиниа обладает .тмфоа есщым характером, образуя как плумбиты, так и
обыкновенные соли двухвалентного свинца. <
Кроме свинцовых солей свинцовой кислоты известны также щелочные
и щелочноземельные плумбаты.
Свинцовые соли или трудно растворимы в воде. или совсем не рас
творимы, но все растворяются в разбавленной азотной кислоте. Очень
трудно растворим сплавленный хромовокислый свинец.
Реакции мокрым путем
1. Соляная кислота или растворимые хлориды осаждают из
умеренно концентрированных растворов хлопьевидный белый
хлористый свинец:
РЬ’ ' + 2СГ^РЬС12,
трудно растворимый в холодной воде (135 ч. воды растворяют
1 ч. PbCh). легче — в кипящей; при охлаждении раствора он
130
снова выделяется в виде блестящих игл или пластинок. В кон-
центрированной соляной кислоте и в концентрированных раство-
рах хлористых щелочных металлов хлористый свинец значи-
тельно легче растворим, чем в воде, (потому что1 он обра-
зует с этими веществами комплексные соединения, например
Н[РЬС1з], К[РЬС1з], которые, однако, при разбавлении водой
разлагаются, выделяя хлористый свинец.
2. Едкие щелочи осаждают белый гидрат окиси свинца
РЬ(ОН)г:
РЬ’ ' + 2ОН'-> РЬ(ОН)2,
растворимый в избытке осадителя с образованием солеобразных
соединений, плумбитов:
РЬ(ОН)2 + ОН’ -> НзО + НРЬОз'.
РЬ(ОН)2 незначительно растворяется также и в чистой воде,
но не в воде, содержащей углекислоту. Водный раствор гидрата
окиси свинца показывает слабощелочную реакцию. При доба-
влении перекиси водорода, гипохлорита или персульфата оса-
ждается темнобурая двуокись свинца РЬО2.
3. Аммиак осаждает белый гидрат окиси, не растворимый
в избытке реактива.
4. Углекислые щелочи осаждают белый основной углекислый
свинец; двууглекислые щелочи осаждает нормальный угле-
кислый свинец.
5. Фосфорнокислый натрий осаждает белую фссфорносвинцовую соль:
ЗРЬ‘ • + 4HPOi"-> 2НгРО/ + РЬДРООз,
не растворимую в уксусной и легко растворимую в азотной кислоте и в
едких щелочах.
6. Цианистый калий осаждает белый цианистый свинец, не растворимый
в избытке реактива.
7. Йодистый калий осаждает йодистый свинец желтого цвета:
Pb’ ’ + 2J' -> PbJ2.
Йодистый свинец значительно труднее растворим в воде, чем хлори-
стый; 195 ч. кипящей воды растворяют' 1 ч. йодистого свинца. Получается
бесцветная жидкость, из которой при охлаждении иодиегый свинец выде-
ляется в виде золотисто-желтых листочков.
В концентрированной иодистоводородной кислоте и в растворах йоди-
стых щелочных металлов йодистый свинец хорошо растворяется, образуя
свинцовоиодистоводородную кислоту Н[РЬ.1з] или ее соли, например
,K[PbJa], которые при разбавлении раствора водой разлагаются, выделяя
иодистый свинец.
8. Хромовокислые щелочи дают желтый осадок хромовокис-
лого свинца:
РЬ’ ’ + СгСЬ" -> РЬСгОт,
-не растворимого в уксусной, но растворимого в азотной кислоте
и едкой щелочи.
9. Сернистый водород выделяет даже из очень разбавленных
как слабокислых, так и нейтральных и щелочных растворов чер-
ный осадок сернистого свинца:
Pb” + H2S<- 2Н' -PbS.
9*
131
Из растворов, содержащих соляную кислоту, получается сначала оран-
жево-красный осадок сульфохлорида свинца:
РЬ-----С1
2РЬС12 + H2S —> 2Н' + 2СГ +
Pb-----Cl
Осадок этот при дальнейшем действии сероводорода тотчас переходит
в черный сернистый свинец.
Сернистый свинец растворим в разбавленной кипящей 2N азотной
кислоте с образованием азотнокислого свинца и выделением серы:
ЗРЬЗ + 2Н\’Оз + 6Н' -» ЗРЬ • • + 4НзО + 2NO + 3S.
Обычно окисление идет и дальше, причем часть серы окисляется в сер-
ную кислоту, вследствие чего образуется почти не растворимый в воде
сернокислый свинец. Количество образующейся серной кислоты (а следо-
вательно, и сульфата свинца) увеличивается с концентрацией азотной кис-
лоты.
Сернистый свинец растворяется также в концентрированной соляной
кислоте вследствие образования комплекса Н[РЬС!з]. В слабокислом рас-
творе чувствительность реакции свинца с H.'S сильно понижается, если
в растворе имеются значительные количества хлоридов.
10. Тиосульфат натрия осаждает белый осадок тиосульфата
свинца, растворимого в избытке осадителя, причем образуется,
как и в случае солей серебра, комплексный тиосульфат-ион.
В присутствии кислоты три кипячении выпадает сульфид свинца.
11. Тиоацетат аммония, добавленный к солянокислому раствору свинцо-
вых солей, сперва дает красный осадок сульфохлорида, который затем
переходит в черный сернистый свинец.
12. Серная кислота и растворимые сернокислые соли выде-
ляют из свинцовых солей белый трудно растворимый сернокис-
лый свинец:
Pb’' + SCh" ->PbSO4.
1 ч. соли растворяется при обыкновенной температуре в 23 800 ч. воды;
в воде, содержащей серную кислоту, эта соль еще труднее растворяется;
в спирте она совсем не растворяется. В азотной кислоте сернокислый свинец
весьма заметно растворяется, а в горячей концентрированной соляной
кислоте вполне растворяется. При охлаждении солянокислого раствора вы-
деляются иглы хлористого свинца.
Сернокислый свинец, как уже было указано (стр. 129), растворяется
также и в концентрированной серной кислоте, легко при нагревании и в
значительной степени на холоду, образуя кислый сернокислый свинец, раз-
лагающийся при разбавлении раствора водой с выделением сернокислого
свинца. Почти всякая продажная серная кислота содержит сернокислый
свинец. Для открытия последнего 200—300 .мл концентрированной кислоты
разбавляют равным объемом воды и оставляют стоять 12 час., причем
растворенный сернокислый свинец выделяется в виде белого порошка.
Сернокислый свинец растворяется также легко в едких щелочах и в
аммонийных солях многих органических кислот. Последнее обстоятельство
весьма важно для аналитика, так как такое свойство этой соли делает
возможным отделение ее от сернокислого бария, кремневой кислоты и тому
подобных веществ, не растворяющихся в аммонийных солях органических
кислот.
В качестве растворителя сульфата свинца большей частью пользуются
уксуснокислым и виннокислым аммонием; в присутствии BaSO< небольшое
количество сернокислого свинца остается нерастворимым.
132
Растворение PbSOi в концентрированном растворе ацетата (или тар-
трата) аммония происходит вследствие образования ацетата (или тартрата)
свинца, ионизация которого в присутствии избытка ацетатных (или тар-
тратных) ионов очень мала. Сульфат свинца растворяется также легко
в растворах едких щелочей с образованием плумбитов.
Из всех этих растворов, подкисленных уксусной кислотой, свинец мо-
жет быть осажден в виде хромата посредством хромата калия, в виде
сульфата при действии разбавленной серной кислотой или в виде суль-
фида сернистым аммонием.
13. Хлористое олово и иодистый калий образуют с двухвалентными
катионами свинца комплексное соединение 2PbJ •SnJa интенсивного оран-
жево-красного цвета. Так как в это комплексное соединеиие может быть
превращен и нерастворимый сульфат свинца, то этой реакцией (в виде
капельной пробы) можно пользоваться для открытия свинца в присутствии
других металлов.
Реактив ' должен быть свежеприготовленным. К раствору хлорида
олова(2), полученного путем растворения металлического олова в концен-
трированной соляной кислоте, прибавляют при взбалытывании насыщенный
раствор нодида калия до тех пор, пока жидкость не застынет в бледно-
желтую массу; последнюю растворяют, прибавляя по каплям насыщенный
раствор нитрата кадмия. Раствор устойчив к действию воды, но от приба-
вления серной кислоты выделяется желтый иодвд олова(2), поэтому при
проведении реакции на свинец необходимо обращать внимание на отсут-
ствие свободной серной кислоты.
Вып^тнение. На кусочек толстой фильтровальной бумаги наносят каплю
разбавленной серной кислоты, которой дают .впитаться в бумагу; после
этого в середину образовавшегося влажного пятна помещают каплю иссле-
дуемого раствора и затем еще каплю разбавленной серной кислоты, чтобы
превратить свинец в сульфат, выделяющийся на бумаге. Смачивают пятно
водой из капилляра, чтобы смыть растворимые соли. Выполнив это, по-
мещают на середину пятна, где находится сульфат свинца, каплю реак-
тива. В присутствии свинца образуется более или менее интенсивное оран-
жево-красное окрашивание. Открываемый минимум 10 у (предельная кон-
центрация 1:5000). ____ ________
14. Бензидин 1 С12Н8 (NH2,'2 или \ /NHs
иоснование Арнольда1 2 (СН3)2 N<^ у — СН2 — / >N(CH3)2
окисляются двуокисью свинца, образуя синие мерихиноидные продукты
окисления3; они могут быть использованы в качестве чувствительных
реактивов на свинец.
Выполнение. Кусочек фильтровальной бумаги смачивают аммиачным
раствором 3%-ной перекиси водорода и, поместив на увлажненное место
каплю исследуемого раствора, держат над водяными парами или дают по-
лежать на воздухе несколько минут. При этом образуется двуокись свинца
и происходит разложение избытка перекиси водорода. После этого смачивают
пятно каплей уксуснокислого раствора бензидина (см. стр. 222) или осно-
вания Арнольда. Открываемый минимум 1,5 т свинца.
* Примечание редактора- Реакция с бензидином однозначна в отсут-
ствие висмута. При наличии же его образуются высшие окислы висмута,
которые также вызывают слабое посинение бензидина. В этом случае сле-
дует пользоваться основанием Арнольда (см. стр. 252), если только ко-
личество висмута не превышает 11-кратного количества свинца. Обеим
реакциям не мешает присутствие Cu, Cd, Hg, As, Sb и Sn. * A. К.
15. Дитизон (дифенилтиокарбазон) образует со свинцовыми солями
в нейтральных, аммиачных, щелочных и цианистокалиевых растворах кир-
пично-красное комплексное соединение (см. стр. 121).
1 D е п i g ё s, Precis de Chimie analytique, 72 (1913).
2 A. Trill at, C. R. Acad. Sci. Paris. 156, 1205 (1863).
» W. S c h 1 e n c k, Lieb. Ann. 363, 313 (1908).
133
Выполнение. Сильно взбалтывают в маленькой пробирке каплю испы- .
туемого раствора с каплей дитизонового реактива. Последний готовится
растворением 1—2 мг дитизона в 100 мл четыреххлористого углерода.
Открываемый .минимум в нейтральном растворе 0,04 т свинца.. То обстоя-
тельство, что реакция проходит также .в растворах, содержащих цианистый
калий и тартраты щелочных металлов, делает е» специфичной для свинца
в присутствии других тяжелых металлов. Ею широко пользуются для
открытия свинца в моче и других биологических жидкостях.
, Реакции сухим путем
Все свинцовые1 соединения дают при накаливании с содой на
угле ковкое металлическое зерно' (королек), окруженное желтым
окисным налетом. На обугленной палочке (содовой) получается
только ковкое металлическое зерно.
Свинцовые стекла при нагревании в восстановительном пла-
мени чернеют вследствие выделения свинца.
Анализ группы I
Хлориды серебра, одновалентной ртути и свинца трудно растворимы
в воде. Согласно табл. 8 в 100 мл воды растворяется 0,038 лг HgsCh,
0,15 ж AgCl и около 1 г PbCh. Эти числовые данные показывают, что
осаждение катионов одновалентной ртути и серебра будет происходить
почти полностью и что, хотя хлористый свинец значительно меньше рас-
творим в растворе, содержащем избыток хлор-ионов, чем в воде, тем не
менее свинец никогда не осаждается полностью в виде хлорида из вод-
ного раствора. При прибавлении спирта может быть достигнуто почти пол-
ное осажцение свинца, що прибавление спирта в этой стадии анализа редко
допускается за исключением случаев анализа известных сплавов или соеди-
нений, богатых свинцом.
Хлористый свинец характеризуется значительно большей раствори-
мостью в горячей, чем в холодной воде. При растворении свинцового со-
единения в небольшом количестве соляной кисдоты хлорид свинца часто
выделяется из охлажденного раствора; такой прием отделения свинца
в этой части анализа' легче, чем осаждение его в виде сульфида с после-
дующим растворением в азотной кислоте и повторным осаждением в виде
сульфата.
В качестве группового осадителя можно применять соляную кислоту
или хлористый аммоний. Можно было бы достигнуть той же цели и лю-
бым другим растворимым хлоридом, но это мешало бы дальнейшему ходу
анализа. Если исходный раствор имеет щелочную реакцию, т(о прибавление
соляной кислоты может служить причиной образования некоторых посто-
ронних осадков. Так, щелочной раствор цианистых соединений, раствор
тиосолей в сернистом аммонии и щелочной раствор силиката обыкновенно
дают осадки по прибавлении какой-либо кислоты. Такие осадки часто, рас-
творяясь от прибавления несколько большего количества кислоты, не слу-
жат источником затруднений, но иногда бывает целесообразнее обрабаты-
вать осадок как нерастворимое вещество по методу, описанному ,з части IV.
Хлориды висмута, сурьмы и четырехвалеитного олова при разбавлении
водой .превращаются в нерастворимые основные соли. Осадки их могут
быть отфильтрованы и растворены на фильтре в небольшом количестве 2 N
соляной кислоты. Так как полученный таким образом раствор содержит
хлористый свинец, то лучше выпарить его приблизительно до 1 мл, раз-
бавить 25 мл воды и осадить сернистым водородом, не обращая внима-
ния на образование основной соли при разбавлении: такие основные соли
путем обменного разложения с сернистым водородом переходят в менее
растворимые сульфиды-
Анализ первой грзтшы металлов основан на растворимости хлористого
свинца в горячей воде, .'.лористого серебра в аммиаке и на почернении
однохлористой ртути при действии аммиака,
134
ТАБЛИЦА I. АНАЛИЗ ГРУППЫ СЕРЕБРА
Раствор может содержать все металлы. Прибавляют 6N соляную кислоту,
фильтруют и исследуют фильтрат на следующие группы.. Осадок обра-
батывают горячей водой (1)
Остаток: AgCl, Hg2Cl2. Его обливают на фильтре аммиаком (3)
Остаток: черный — Hg(NH2)Cl-f-Hg указывает на при- сутствие Hg Раствор: [Ag(NH3)2J- Прибавляют HNOZ-. белый осадок ука- зывает на присут- ствие Ag (4)
Раствор: РЬ". Прибавляют концен-
трированную H-jSOi. Отфильтровы-
вают PbSO± и обрабатывают его
горячим раствором CH3COONH±.
Прибавляют КчСгОк, желтый оса-
док РЪСгО± указывает на присут-
ствие РЬ (2)
Ход анализа
1. Холодный концентрированный раствор, могущий содер-
жать соли всех металлов, осаждают 6/V соляной кислотой; при-
бавление кислоты ведут сначала малыми порциями, а под конец
по1 каплям до тех пор, пока не прекратится дальнейшее образо-
вание осадка. Фильтруют через маленький фильтр (стр. 85) и
промывают осадок четыре раза небольшими количествами хо-
лодной воды, направляя тонкую струю последней ив промы-
валки вокруг верхнего края фильтра, и не наливая свежей пор-
ции воды до полного1 стекания жидкости с фильтра \ Для ка-
ждого промывания употребляют не больше 5 мл воды. Фильтрат
сохраняют для исследования на группы II, III, IV и V. Фильтр
с осадком обливают небольшим количеством горячей воды.
Остаток на фильтре исследуют по п. 3.
2. Первые 5 мл прошедшей через фильтр горячей воды ис-
следуют на свинец, прибавляя к ним несколько капель концен-
трированной серной кислоты. Если осадок образуется, его от-
фильтровывают, промывают один раз холодной водой и обли-
вают на фильтре 10 мл горячего 3N раствора уксуснокислого
аммония. К фильтрату прибавляют несколько капель раствора
хромата калия и 3 мл 6Х уксусной кислоты. Если свинец ‘присут-
ствует, то появляется желтый осадок хромата свинца. Хлориды
продолжают промывать на фильтре горячей водой до тех пор,
пока 5 мл стекающей с фильтра воды уже не будут больше да-
вать реакцию с хроматом калия.
3. Фильтр заливают 5 мл 6N аммиака и собирают стекающую
жидкость в пробирку. Окрашивание осадка в черный цвет указывает
на присутствие одновалентной ртути-
4. Фильтрат, полученный по п. 3, подкисляют азотной кисло-
той. Появление белого, творожистого осадка указывает на присут-
ствие серебра.
Если количество однохлористой ртути велико, а хлористого
серебра очень мало, то открытие серебра таким путем ненадежно.
1 Правило, которого нужно придерживаться при всяком промы-ваниЦ
осадка. Ред.
135
В таком случае промывают черный остаток и несколько раз про-
пускают через него (на фильтре) смесь из 3 мл 6N соляной
кислоты и 10 мл насыщенной бромной воды. При этом одно-
хлористая ртуть превращается в растворимую соль двухвалент-
ной ртути, а серебро остается на фильтре в виде хлористого
или бромистого серебра. Фильтр промывают горячей водой,
снова пропускают через него 5 мл аммиака и испытывают ам-
миачный раствор азотной кислотой.
* Примечание редактора. Отделение серебра от ртути на
основе окисления последней бромом рекомендуется проводить
следующим способом. Хлориды серебра и одновалентной ртути
нагревают с бромной водой, кипятят для удаления избытка
брома и фильтруют. В фильтрате находится ртуть в виде HgBra,
а осадок содержит AgCl или AgBr. Ртуть открывают посред-
ством раствора SnCh; появление белого осадка HgaCh, перехо-
дящего затем в серый (выделение Hg), служит признаком при-
сутствия ртути. Остаток после обработки бромом промывают
водой до полного исчезновения в фильтрате Hg, затем раство-
ряют в NH3 и раствор подкисляют азотной кислотой. Белый
осадок указывает на присутствие Ag.
Того же достигают, если вместо бромной воды пользуются
концентрированной НИОз. При этом HgiCk превращается в
HgC12.* А. К.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте в виде таблицы схему анализа раствора, содержащего смесь
Hg-2(NO.-j)’, AgNOs и1 Pb(NOs)2. Напишите формулы исходных веществ,
реактивов и получающихся продуктов реакций. Укажите цвета и
растворимость.
2. Произведение растворимости AgsPOi при комнатной температуре 1,8 • 10"18.
Сколько граммов его растворяется в 1 л воды? (Ат. в.: Ag = 108,
Р = 31, О = IG).
3. Напишите уравнения реакций:
а) действия NbhOH на осадок AgCl, б) действия Вгг и НС1 на чер-
ный осадок, образующийся при анализе группы I, .в) действия рас-
твора NHtOH на HgsCl».
4. Объясните на основе произведения растворимости, почему HgsCk меньше
растворяется в 2N HiLl, '.ем в воде, и больше растворяется в 6А НС1,
чем в воде?
5. Сколько миллилитров 96%-ной H2SO4 (d — 1,84) нужно для' приготовле-
ния 1 л 6А раствора HsSOi?
6. В 10 мл воды растворяется точно 0,11 г РЬСЬ. Вычислите произведение
растворимости хлорида свинца.
7. Если в анализируемом растворе находится РЬ'', объясните на основе
произведения растворимости, почему умеренный избыток NH4C1 спо-
собствует в ходе анализа более полному выделению свинца с 1 груп-
пой?
8. Напишите уравнения, выражающие все реакции при анализе осадков
группы серебра.
9. Какова должна быть навеска NHiCl для получения 3 .г 0.5N раствора
NH4CI?
10. Произведение растворимости А^гСггОт = 2,7 • IO-11; вычислите навеску
этой соли, нужную для получения 500 мл насыщенного раствора ее,
содержащего 0,170 г AgNCX.
136
ГРУППА П. ГРУППА СЕРНИСТОГО ВОДОРОДА
РТУТЬ, СВИНЕЦ, МЕДЬ, ВИСМУТ, КАДМИЙ, МЫШЬЯК,
СУРЬМА, ОЛОВО
В эту группу входят катионы, осаждаемые сернистым водоро-
дом в виде сульфидов из растворов, содержащих О,ЗА кислоту.
Она включает ртуть(2), свинец, медь, висмут, кадмий, мышьяк,
сурьму и олово. Катионы серебра и ртути(1) также осаждаются
при пропускании через их растворы сероводорода при указанной
концентрации кислоты, но они уже были отделены в виде хло-
ридов в группе I. Свинец всегда находят в этой группе, потому
что его выделение в виде хлорида неполное, если только не
поддерживать надлежащую концентрацию соляной кислоты и
не добавлять спирта.
Ртуть
Свойства само'о элемента, реакции солей одновалентной ртути, реакции
ртути сухим путем, а также открытие ее в специальных случаях были уже
рассмотрены в группе I.
Соединения двухвалентной ртути
Эти соли большей частью бесцветны. Иодная ртуть окрашена в крас-
ный и желтый цвет. Путем нагревания красной иодной ртути, кристаллизую-
щейся в квадратной системе, получается желтый возгон, состоящий из
ромбических игл, постепенно переходящих в красное видоизменение квад-
ратной системы. Этот переход совершается быстро, почти мгновенно при
трении. В данном случае мы имеем дело с общим для изодиморфных тел
явлением: симметрическая форма является почти всегда наиболее устой-
чивой.
Сернистая ртуть черного или красного цвета.
Хлорная ртуть растворима в воде, причем 10’0 .«.( воды растворяют
при 10’ 20° 50' 80° 100°
6,57 7,39 11,34 24,3 53,96 г HgCl2
Растворимость бромной ртути заметно меньше растворимости хлорной
(1 г Hg'Bro растворяется в 94 мл воды при 9°), а иодной во много раз
меньше. Галоидные соли ртути образуют с избытком галоидоводородных
кислот или щелочных солей последних устойчивые комплексы, раствори-
М|ость которых значительно повышается и уменьшается способность улету-
чиваться при выпаривании растворов. Всегда приходится считаться с поте-
; рей небольших количеств ртути, когда ее солянокислый раствор выпари-
вается досуха, в особенности же когда производится нагревание выпарен-
ного остатка для обезвоживания кремневой кислоты. Улетучивание HgBr>
при выпаривании (но не досуха) раствора, содержащего значительный из-
быток бромистоводородной кислоты, незначительно.
Водные растворы галоидных солей ртути, а также цианистой ртути
Весьма слабо ионизируют на простые иоиы двухвалентной ртути.
Для ионизирующих ртутных солей является характерной та легкость,
с которой они гидролитически расщепляются с образованием основных
трудно растворимых солей. Так, сульфат двухвалентной ртути в присут-
ствии большого избытка воды дает (особенно легко при нагревании; жел-
'• тую, основную, нерастворимую соль:
SHgSOr + 2НгО -» 2H.-SO4 + Hg3O2SO4.
Водородные ионы препятствуют этому гидролизу.
Нитрат также легко подвергается гидролизу, причем образуются более
или менее труднорасгворимые основные соли в зависимости от разбавления;
Hg(NOs)2 + НгО £ HNOs + Hg(OH)NOs
137
иди
2Hg(NOs)2'+ 2HsO;t Hg»O(OH)NO3 + 3HNO3.
Все растворимые соли ртути ядовиты.
Реакции мокрым путем
Для этих реакций следует пользоваться растворами хлорной и азотно-
кислой солей окиси ртути.
1. Сернистый водород осаждает из раствора солей окиси
ртути белый осадок, переходящий постепенно в желтый, затем
в бурый и, наконец, в черный.
Соединение белого цвета образуется согласно уравнению:
3HgCl2 4- 2f-hS ->4НС1 + Hg3S2Cl2.
. белого цвета
При дальнейшем действии сероводорода 'получается, наконец,
черная сернистая ртуть:
Hg3S2Cl2 4- H2S 2НС1 4- 3HgS.
Сернистая ртуть не растворяется в разбавленных кислотах даже при
кипячении1. Горячая концентрированная азотная кислота постепенно пре-
вращает ее в белую HgsSaCNOa)"'.
9HgS + 8HNOs ->2NO + 3S + 4H»O 4- SHgiS.^NO,,)^
которая при продолжительном кипячении растворяется, переходя в азотно-
кислую соль окиси ртути.
В царской водке HgS легко растворяется, образуя хлорную ртуть и вы-
деляя серу:
3HgS + 6НС1 4- 2HNO3 -> 3HgVh 4- 3S 4- 2NO 4-’ 4НгО.
Она не растворима в сернистом тош», в едком кали и едком натре
и легко растворима в сернистом калии:
HgS 4- S"-> HgSs".
Этот комплексный анион при разбавлении водой полностью гидроли-
зуется, образуя сульфид ртути и ионы сульфгидрата и гидроокиси калия:
HgS/' 4- НЮ £ ОН' 4- SH' 4- HgS.
Поэтому, чтобы подавить процесс гидролиза, растворение сернистой
ртути необходимо производить всегда в концентрированных растворах
сернистого калия или в растворах сернистого калия с высокой концентра-
цией едких щелочей.
Легкостью гидролиза KaHgSa объясняется происхождение киновари в
природе: в глубинах щелочных серных источников образуются сульфо-
соединения, которые, попадая на поверхность, подвергаются разложению
по вышеприведенному уравнению.
Хлористый аммоний осаждает сернистую .ртуть из ее раствора в серни-
стой щелочи. В противоположность сульфидам* серебра, свинца, висмута
и кадмия сернистая ртуть растворяется в растворе тиокарбоната и в про-
тивоположность сульфиду палладия ртуть осаждается из такого раствора
в виде сульфида углекислым газом.
2. Едкие щелочи осаждают желтую окись ртути:
HgCl2 + 2ОН'-> 2СГ + НЮ 4- HgO.
Гидраты окисей благородных .металлов в высшей степени непрочные
соединения: они большей частью в водном растворе отщепляют воду и
переходят в безводную окись.
1 Цо она растворяется в 2N соляной кислоте в присутствии Н2О2. Ред.
138
-> NH4C1 + Hg<
ХС1
При прибавлении к раствору хлорной ртути недостаточного коли-
чества едкого кали образуется красно-бурый осадок основной хлорной
ртути:
2HgCh + 2ОН' -> 2СГ + Н2О + Hg2OCh
или .
3HgCb + 4ОН'-> 4СГ + 2Н-0 + Hg2OCl2• HgO.
В присутствии хлористого аммония осадок, образованный едкими щело-
чами, не желтого и не красного, а белого цвета, каким он бывает при
осаждении аммиаком.
Окись ртути и ее основные соли легко растворимы в кисло-
тах.
3. Аммиак выделяет из раствора хлорной ртути белый осадок
хлористого меркураммония:
|q7j^nh NHa
Hg/ + NH
ХС1
Это соединение, так называемый «неплавкий белый цреципи- .
тат», улетучивается, не плавясь, при нагревании. Оно раство-
римо в кислотах и в горячем растворе хлористого аммония,
в последнем с образованием «плавкого белого преципитата»
(хлористый меркурдиаммоний);
zNH2
Hg< 4-NH.C1 -> Hg(NH3),CU
* ХС1
При действии аммиака на азотнокислую соль окиси ртути
всегда получается белое оксиамидосоединение 5
2Hg(NO3)-2 + 4NH3 + Н2О ->3NH4NO3 + (Bg2ONH2)NO3.
4. Йодистый калий дает красный осадок иодной ртути:
HgCh + 2J'^ 2СГ : HgJ2,
растворимый в избытке йодистого калия с образованием бесцвет-
ной комплексной соли:
HgJa + 2J'-> [HgJi]".
Раствор этой соли не содержит ионов двухвалентной ртути, так как он
не дает осадка с едким кали или натром.
Щелочной раствор ртутноиодистого калия, так называемый реактив
Несслера, служит для открытия ничтожных следов аммиака. При этом
образуется окрашенное в бурый цвет соединение Hg->ONHs]J, которое
растворяется в избытке несслеровского реактива с интенсивной желтой
окраской (стр. 324).
Посредством этой реакции могут быть открыты незначительные коли-
чества ртути. В этом случае к исследуемому раствору прибавляют йоди-
стый калий, а затем едкую щелочь и аммиак.
Иодная ртуть в воде практически не растворима (стр. 137); напротив,
растворимость ее в спирту значительна: 250 ч. спирта растворяют 1 ч.
1 Строение его см. сгр. 124.
139
иодида при обыкновенной температуре и 50 ч. спирта растворяют 1 Ч.
иодида при температуре кипения.
5. Углекислые щелочи осаждают из нитрата и хлорида на холоду
красно-бурый основной карбонат:
4Hg(NOs)a + 4NasCOs->
O-Hg-O-Hg
> 8NaNO3 -j- ЗСОз С—=0 .O
\o —Hg—O —HgZ
который при кипячении переходит в желтую окись ртути с отщеплением
двуокиси углерода.
6. Двууглекислые щелочи не дают никакого осадка в растворах хлор-
ной ртути, но выделяют его из раствора азотнокислой соли окиси ртути:
4Hg(NOs)2 + 8NaHC0s-> 8NaNOs 4- 4НаО + 7С0г + HgrOsCOs.
7. Цианистый калий не выделяет из растворов хлорной ртути осадка,
потому что цианиды, как и хлориды ртути, легко образуют с циан- и
хлор-ионами растворимые комплексные соединения, нз которых известны:
KL'HgCls], fctHgCh]. K[Hg(.CN)>Clj, K2[Hg(CN>C12] и K2[Hg(CN)4].
Из концентрированного раствора азотнокислой соли окиси ртути циа-
нистый калий осаждает цианистую ртуть:
Hg(NO3)2 + 2CN' -> 2N0a' + Hg(CN)2,
растворяющуюся в большом количестве воды и в растворе цианистого
калия.
Цианистая ртуть представляет собой единственное цианистое соеди-
нение тяжелых металлов, растворимое в воде. Она заметно растворяет
окись ртути, образуя комплексное соединение (HgCNW. Поэтому циани-
стая ртуть не осаждается ни углекислыми, ни едкими щелочами, так как
окись ртути растворяется в цианистом калии и цианистой ртути. Она не
разлагается разбавленной серной кислотой, но разлагается галоидоводород-
ными кислотами, причем труднее — хлористым1 и легче — йодистым водоро-
дом; сероводородом она разлагается с выделением сернистой ртути:
Hg(CN)z + HsS->2HCN + HgS.
8. Хромовокислые щелочи дают как с хлорной ртутью; так и с азот-
нокислой солью окиси ртути желтый осадок хромовокислой соли окиси
ртути, которая при стоянии, быстрее при кипячении, краснеет, вероятно,
вследствие образования основной соли.
9. Двухромовокислые щелочи не дают осадка в растворе хлорной
ртути, но выделяют желто-бурый осадок из раствора азотнокислой соли
окиси ртути.
10. Сернокислая соль закиси железа восстанавливает при кипячении
азотнокислую соль окиси ртути до металла:
Hg(NOs)2 + 2Fe' ’ -> 2Fe ’ 1 • + 2NCV + Hg.
Хлорная и цианистая ртуть не восстанавливаются сульфатом двухвалент-
ного железа.
11. Хлористое олово восстанавливает соли двухвалентной
ртути сначала до нерастворимой хлористой ртути (каломель):
2HgCb + Sn' • -> Sn’ ‘ • • + Hg2Cl2 + 2СГ
и при дальнейшем действии — до металла:
Hg2Cl2+ Sn‘’-*Sn” ” +2Hg + 2Cl'.
Ртуть, выделяющаяся при этом, находится в осадке (серый
порошок). Слив с осадка жидкость и прокипятив его с разба-
14Q
вленной соляной кислотой, получают капли металлической
ртути.
12. Алюминий, медь, циик, железо и муравьиная кислота выделяют
ртуть из раствора ее солей:
HgCIs'+ 2Cu -> CtuCls + Hg;
HgClj + Fe -» Fe‘ • + 2CF + Hg;
HgCh + HCOOH -> Hg + 2HC1 + CO2.
Капля раствора соли окиси или закиси ртути оставляет на блестящей
медной пластинке серое пятно, которое после просушки и трения приобре-
тает серебристый блеск.
Алюминий выделяет из раствора ртутной соли металлическую ртуть,
которая амальгамирует алюминий; последний в виде амальгамы легко
окисляется влажным воздухом в гидроокись. Освобождающаяся при этом
ртуть может амальгамировать новые количества алюминия. Таким образом,
следы ртути могут вызвать значительную коррозию поверхности блестя-
щей алюминиевой пластинки ’. Образовавшуюся гидроокись алюминия
можно обнаружить ализариновой пробой (см. группу III). Этим способом
можно открыть 0,0001 v ртути1 2.
13. Роданистый калий, прибавленный к раствору нитрата двухвалент-
ной ртути, дает белый осадок Hg(CNS)2. Ртуть может быть определена
количественно путем измерения объема раствора роданида калия, который
приливается до появления неисчезающего красного окрашивания, обусло-
вленного прибавлением к раствору в качестве индикатора небольшого ко-
личества соли трехвалентного железа. Точно так же определяется и серебро.
14. Тиосульфат натрия, прибавленный к кипящему раствору соли двух-
валентной ртути, постепенно выделяет осадок, состоящий из HgS и S:
Hg- ’ + ЗБгОз" + 2Н1 -> HgS + 2S + SOd" + Н2О + 2SO3.
15. Аммонийная соль хлорооловяиной кислоты и гипофосфит натрия
быстро реагируют в присутствии солей ртути (2).
Реакция
2Sn ‘ • • • + Н2РО2' + 2Н»О -> 2Sn ’ ’ + РОд"' + 6Н •,
протекающая очень медленно и неполностью, значительно ускоряется в
присутствии весьма малого количества соли двухвалентной ртути3. Мы
имеем тут дело с индуцированной реакцией. Присутствие Sn' ' может быть
обнаружено посредством какотелина (стр. 193), дающего с оловом фиолето-
вую окраску. Открываемый минимум: 0,1 у ртути4.
1 На поверхности алюминия нарастает вспученный слой гидро-
окиси алюминия. Ред.
- См. Ф. Фай г ль, Капельный анализ, стр. 191, изд. 2-е, 1937 г. Ред.
3 Если какая-либо реакция, не протекающая самопроизвольно или про-
текающая чрезвычайно медленно, проходит или ускоряется быстро проте-
кающей в ее присутствии другой реакцией, то такую реакцию называют
индуцированной или сопряженной. Двухвалентная ртуть быстро реагирует
с гипофосфитом натрия:
2Hg • • + Н2РО2' + 2 НЮ -> 2Hg + РО4"' 4- 6Н •
и оиа индуцирует вышеприведенную медленно протекающую реакцию
с оловом. В рассматриваемом случае вещество, участвующее в обеих реак-
циях, называется актором; вещество, ускоряющее другую реакцию, назы-
вается индуктором, а вещество, реакция которого стимулируется или уско-
ряется,— акцептором. В данном случае актором является гипофосфит,
индуктором Hg' ’, а акцептором Sn’’’-. Ред.
4 См. Ф а й г л ь, Капельный анализ, стр. 230. Ред.
141
16. р-Диметиламинобснзилиденроданин
HN — СО
SC С = СН/ (СН3)2
S
образует фиолетовый или розовый осадок с растворами двухвалентной
ртути.1 2 Реактивами служат спиртовый насыщенный раствор р-диметил-
бензилиденроданина и насыщенный водный раствор ацетата натрия. Каплю
исследуемого раствора на капельной пластинке смешивают с каплей
каждого из реактивов. Уже в присутствии 0.33 т ртути появляется розовая
окраска. Так как сам реактив от прибавления ацетата натрия приобретает
желтую или оранжевую окраску, то рекомендуется производить одновре-
менно слепой опыт. Ионы серебра и меди мешают реакций.
* Примечание редактора. Если хлориды отсутствуют и кислотность
раствора небольшая, то прибавление ацетата натрия отпадает. Серебряные
соли должны быть предварительно удалены соляной кислотой. Чтобы от-
крыть ртуть в присутствии меди, каплю испытуемого раствора смешивают
с 5 каплями 10%-ного фосфата натрия. Образующийся фосфат' меди не
реагирует с роданином.* А. К.
17. Дифенилкарбазид CO(NH • NHCoHsJs дает с растворами ртутных со-
лей осадки фиолетового или синего цвета. Состав осадка точно не уста-
новлен; вероятно, он представляет собой комплексное соединение ’ ртути
с дифенилкарбазидом или с его продуктом окисления, дифенилкарбазоном
NH — NHC6H5
ос<
' N = NCgH-,
Чувствительность этой реакции зависит от кислотности раствора и от
того, находится ли ртуть в виде галоидной соли или нет. Повышенная
кислотность понижает чувствительность, а слабо ионизирующая хлорная
ртуть реагирует во много раз медленнее, чем нитрат, сульфат или ацетат
ртути. В нейтральных растворах реактив дает цветные реакции с медью,
железом, кобальтом и другими ионами, цо в 0,2W азотнокислом растворе
реакция специфична для ртути при условии отсутствия хроматов и молиб-
датов. При указанной кислотности может быть открыта 1 т ртути (в виде
нитрата), если на фильтровальную бумагу, смоченную свежеприготовленным
1%-ным спиртовым раствором дифенилкарбазида *, поместить каплю иссле-
дуемого раствора.
18. Дитизон (дифснилтиокарбазон. см. стр, 121) дает оранжевое соеди-
нение, растворимое в четыреххлористом углероде. Открываемый минимум
в растворе, содержащем HgCh, 0,25 Y ртути. С этим реактивом реагируют
многие другие катионы, образуя окрашенные соединения, но если выпол-
нять реакцию в кислом растворе, могут мешагь только Sn. Sb, Bi, Си, Au
и металлы платиновой группы.
Выполнение. Смешивают каплю исследуемого раствора с двумя кап-
лями реактива (получающегося растворением 1—2 ты дитизона в 100 Дл,
четыреххлористото углерода). Выпарив жидкость, прибавляют еще немного
четыреххлористого углерода; в присутствии ртути раствор окрашивается
в оранжевый цвет.
.Мешающие реакции ионы двухвалентных жс.ъ за и олова устраняют
путем окисления; в присутствии сурьмы добавляют винную кислоту; в при-
1 К. Heller u. Р. Krumholz, Mikrochemie 7, 214 (1929). См. также
Ф. Файт ль, Капельный анализ, стр. 189. Ред.
2 FeigI u. N е u b е г, Z. anal. Chem. 62, 370 (1923); см. также
Файгль, Капельный анализ, стр. 186. Ред.
сутствии висмута — винную кислоту и небольшое количество азотной
кислоты. Ионы золота осаждают сернистой кислотой; металлы- -платиновой
группы удаляют добавкой порошка меди или серебра. В присутствии
меди раствор предварительно нейтрализуют и добавляют 95%-ную муравь-
иную кислоту до заметно кислой реакции; после этого прибавляют раствор
дитизона в четыреххлористо-м углероде. Слой последнего, окрашенный в
светлорозовый цвет, принимает в присутствии ртути оранжево-желтую
окраску.
Свинец РЬ
Свойства элемента и его соединений были рассмотрены в группе I.
Висмут Bi. Ат. в. 209,0. Ат. н. 83
* Птотность 9,8. Т. пл. 271°. Т. кип. 1490°
Нахождение в природе. Висмут встречается в самородном состоянии
обычно вкрапленным в -никелевые и кобальтовые рудные жилы. Второ-
степенное значение имеют следующие руды висмута: висмутовая охра
BisOs; висмутовый блеск BiaSs, ме дно висмутовый блеск BisCusSi, висмуто-
вый,-шпат 3(В!ОН)(СОз) -5Bi(OH)s.
Свойства. Висмут — хрупкий, красновато-белый металл, кристаллизую-
щийся в гексагональной системе. Нагретый до 1200°, металл начинает уле-
тучиваться, потому что упругость его паров при этой температуре равна
102 .м,«. Висмут в твердом состоянии двухатомен (металлы обыкновенно
одноатомны), но в парообразном состоянии он одноатомен. Он является
составной частью некоторых легкоплавких сплавов, а его окиси и соли
используются в качестве фармацевтических препаратов.
Растворителем для висмута служит азотная кислота:
Bi + 4HNOs-> Bi(NO3)3 + 2Н-:О + NO.
Металл we растворяется в соляной кислоте, но растворяется в горячей сер-
ной кислоте:
2В> + 6H»SO4 ->Bk(SO4)3 + 3SO’ + 6НЮ.
Висмут растворяется в соляной и даже в уксусной кислоте, если прибавить
немного концентрированной перекиси водорода (пергидрол). Царская водка
растворяет его, образуя треххлористый висмут.
Висмут образует три окисла: трехокись ВцОз, четырехокись BiaOi и
пятиокись висмута ВнОз.
Трехокись висмута представляет собой основной окисел1, произвол-’
ными которого является большая часть висмутовых солей.
Пятиокись висмута — вещество с коричневатым оттенком, ведет себя
как кислотный ангидрид, образуя кислоту HBiOs, соответствующую мета-
фосфорной кислоте. Соли этой кислоты никогда не были получены в чи-
стом состоянии. ВыОз теряет при прокаливании кислород, образуя желтую
трехокись ВиОз. При растворении в соляной кислоте ВнОз выделяет хлор,
образуя соли трехваледтного висмута:
ШзОз + 10НС1 -» 5Н»О + 2BiCls + 2С1з.
Четырехокись висмута — коричневый порошок, которым иногда поль-
зуются как сильным окислителем. Продажный висмутат натрия предста-
вляет собой, вероятно, смесь NaBiOs и BiaOi.
Висмутовые соли большей частью бесцветны и отличаются нераство-
римостью в большом -количестве воды вследствие происходящего гидро-
1 При некоторых обстоятельствах трехокись висмута проявляет себя
как слабая кислота (стр. 144).
143
лиза их с образованием нерастворимой основной соли; так, хлорид коли-
чественно разлагается на основной хлорид (хлорокись) висмута, часто
называемый хлористым висмутилом:
BiCis + Н»О -» BiOCl + 2НС1,
не растворимый в винной кислоте (отличие от сурьмы).
Хлористый ©исмутил легко растворим в соляной кислоте. Процесс этот
протекает по вышеприведенному уравнению справа налево. Поэтому эта
реакция обратима, и относительные количества воды и присутствующей
соляной кислоты определяют направление, по которому пойдет реакция.
Прибавление воды к слегка кислому раствору BiCis тотчас вызывает по-
явление белого осадка основного хлорида висмута. При добавлении соля-
ной кислоты осадок снова растворяется, но он опять выпадает от приба-
вления большего количества воды. Все остальные соединения висмута ве-
дут себя аналогично хлориду. Нитрат дает сначала аморфный осадок:
Bi(NOs)s + Н2О -> 2Н\Оз + BiO(NOs),
который при дальнейшем добавлении воды приобретает еще более основ-
ной характер и кристаллическую структуру:
2BiO(NOs) + HsO -> HNOs + BhO2(OH)NO3.
Последнее соединение, субнитрат висмута, находит широкое применение
в медицине под названием magisterium bismuti.
Реакции мокрым путем
1. Сернистый водород осаждает сульфид бурого цвета:
2Bi ’' ’ + 3H2S -> B12S3 4- 6Н'
не растворимый в холодных, разбавленных минеральных кисло-
тах и сернистых щелочах, растворимый в горячей разбавленной
азотной кислоте и в кипящей концентрированной соляной кис-
лоте :
Bi2S3 4- 8Н’ + 2NOs' -> 2Bi ’ • • 4- 2NO 4- 4НгО 4- 3S.
2. Едкие щелочи осаждают на холоду белую гидроокись вис-
мута:
Bi’ ’ ‘ 4- ЗОН' -> Bi(OH)3,
которая при кипячении становится желтоватой, превращаясь
в гидрат окиси висмутила (BiO—висмутил):
//°
Bi(OH)3-> НгО 4- Bi
хон
Оба гидрата едва растворимы в разбавленных едких щелочах,
но заметно растворимы в концентрированных едких щелочах,
вероятно, вследствие образования ВЮ-з'-ионов. При охлаждении
или при разбавлении гидрат снова выпадает.
Как гидроокись висмута, так и гидроокись висмутила, суспендированные
в щелочном растворе, окисляются хлором, бромом, гипохлоритом или
перекисью водорода, причем белый или желтоватый осадок гидроокисей
становится буроватым вследствие образования висмутовой кислоты:
BiO(OH) + 2ОН' + Ch -> Н»О + 2СГ + HBiOs.
3. Аммиак осаждает белую основную соль (но не гидроокись),
состав которой варьирует с концентрацией и температурой.
4. Углекислые щелочи осаждают в зависимости от темпера-
144
туры и концентрации различные основные соли, одна из кото-
рых образуется по уравнению:
2ВГ' • + ЗСОз" + НЮ 2В1(ОН)(СОз) + СО2.
5. Фосфаты щелочных металлов осаждают из слабого мине-
ральнокислого раствора белый порошкообразный фосфат, не
растворимый в разбавленной азотной кислоте, трудно раствори-
мый в соляной кислоте:
Bi’ ’ + 2НРО4" -> BiPCh + Н2РО4.
6. Йодноватокислый калий осаждает белую порошкообраз-
ную основную соль, трудно растворимую в минеральных кисло-
тах. не растворимую в уксусной кислоте.
7. Цианистый калий осаждает белую гидроокись (но не циа-
нид). Сначала образуется, вероятно, цианистый висмут, который
затем гидролитически расщепляется:
Bi’ ’' + 3CN' -> Bi(CN)3;
Bi(CN)3 + ЗНОН -> 3HCN + Bi(OH)3.
8. Двухромовокислый калий осаждает желтый порошкооб-
разный бихромат висмутила:
2ВГ ’ ’ + CnCV' + 2НгО -> 4Н’ + (ВЮ)2Сг2О7,
растворимый в минеральных кислотах и не растворимый в едких
щелочах (отличие от свинца). Чтобы подавить растворяющее
действие образовавшихся водородных ионов, прибавляют избы-
ток бихромата.
9. Станниты щелочных металлов (щелочной раствор хлори-
стого олова) выделяют черный осадок металлического' висмута
Эту очень чувствительную реакцию производят следующим об-
разом. К нескольким каплям хлористого олова прибавляют рас-
твор едкой щелочи, пока появившийся вначале белый осадок не
растворится. Полученный раствор станнита натрия NaHSnCh при-
ливают к холодному раствору висмутовой соли, причем- тотчас
появляется черный осадок. При этом имеют место следующие
реакции:
Sn” + 2ОН' ->Sn(OH)2;
Sn(OH)2 + ОН' ->НЮ + HSnO2';
2Bi• ’ ’ + 3HSnO2.' 4- 9OH' -> 6НЮ + ЗБпОз" + 2Bi.
Выполняя эту реакцию, необходимо избегать слишком концентрирован-
ного раствора едкой щелочи и нагревания, в противном случае сам станнит
может дать черный осадок металлического олова (стр. 190):
2HSnO2'-> SnO>" + Н2О + Sn.
Если применить слишком мало едкого кали, то на холоду после долгого
стояния выпадает черная закись олова, а при кипячении она иногда выпа-
дает быстро:
HSnOs'~> ОН' + SnO.
’Vanino u. Treubert, В. 31, 1113 (1898). Осадок часто содер-
жит BiO.
Ю Зак. 9S2. Тредвслл-Голл, т. I.
145
10. Йодистый калий осаждает черный иодистый висмут:
Bi" + 3J'-> BiJ3,
растворимый в избытке осадителя. Раствоо окрашен в желтый
или оранжевый цвет:
BiJ3 4-J' -> [BiJi]'.
При разбавлении раствора не слишком большим количеством
воды осаждается черный иодид, переходящий от прибавления
большого количества воды в иодокись висмута (основной иодид
висмута) оранжевого цвета:
BiJ3 + Н2О -> 2HJ 4- BiOJ.
11. Металлический цинк осаждает металлический висмут:
2Bi‘ ‘ ’ 4- 3Zn -> 3Zn' ’ 4- 2Bi.
12. Серная кислота, прибавленная к кислому раствору вис-
мутовой соли, не дает никакого осадка. Если раствор выпарить
до выделения паров серной кислоты, то получающийся кислый
сульфат висмута растворяется в воде, давая в большинстве слу-
чаев 'прозрачный раствор. Но спустя долгое время или скоро,
в случае присутствия большого количества висмута, выделяется
белый осадок пиросульфата висмутила (ВгОфБгОт-ЗНаО, кото-
рый иногда ошибочно принимают во время хода анализа за
сульфат свинца.
13. Тиоацетат аммония частично осаждает сернистый висмут иа холоду
и полностью — при кипячении:
3CH.COS' + 2В1’ • • + ЗНЮ-* ЗСНзСООН + BizSs + ЗН’.
Тиосульфат натрия, прибавленный к раствору соли висмута, не содер-
жащему слишком много кислоты, дает сначала желтое окрашивание; затем
выпадает черный осадок сульфида:
3HiO + 2Bi • + 3SsOs" » BisSa + 6H‘ + 3SO4".
14. Вода гидролизует все растворимые соли висмута, осаждая
нерастворимые основные соли. Это особенно относится к хло-
риду:
Bi' ’ ’ 4- Cl' 4- Н2О -> BiOCI + 2Н-.
Осадок легко растворяется в разбавленной минеральной кис-
лоте, но в противоположность хлористому антимонилу SbOCl он
не растворяется в винной кислоте. Осаждение хлористого висму-
тила является характерной реакцией висмута, и оно имеет место,
по крайней мере, до некоторой степени и в том случае, когда
хлорид или даже соляная 'кислота прибавляются к раствору ни-
трата висмута.
15. Циихоиии и иодистый калий прибавленные к слабокислому раство-
ру висмутовой соли, дают осадок или вызывают оранжево-красное окраши-
вание раствора, обусловленные образованием двойного иодида висмута и
цинхонина. Открываемый минимум: 0,14 Y висмута.
Цинхонин представляет собой органическое основание сложного со-
става. Он. как и многие другие органические основания, образует с висму-
1 F. Feigi u. F. Neuber. Z. anal. Chem. 62, 173 (1923).
146
ТМыми солями и иодистым калием двойные иодиды общей формулы
BiJs-B-HJ (В — молекула органического основания).
Реактив готовится растворением 1 г цинхонина в 100 .и.т горячей воды,
в присутствии небольшого количества азотной кислоты. После охлаждения
прибавляют 2 г йодистого калия.
Выполнение. На смоченную цинхониновым реактивом фильтровальную
бумагу помещают каплю слабокислого испытуемого раствора. Появление
оранжево-красного пятна указывает на присутствие висмута.
Соли меди, свинца и ртути реагируют с иодистым калием и могут
мешать этой реакции. Если же проводить ее на пропитанной реактивом
фильтровальной бумаге, то под действием капиллярных сил ионы различ-
ных металлов обыкновенно фиксируются в различных зонах цинхонинового
пятна. Так, белый центральный кружок содержит ртуть, вокруг кружка
оранжево-красное кольцо висмута, затем следует желтое кольцо йодистого
свинца и, .наконец, внешнее кольцо бурого цвета от иода, выделяемого
солями двухвалентной меди.
16. Щелочной раствор станнита и соль свинца'. Если смешать на ка-
пельной пластинке каплю 1%-ного раствора ацетата свинца с каплей щелоч-
ного раствора станнита, то слабая бурая окраска, обусловленная выделе-
нием металлического свинца, может быть замечена лишь через 3—10 мин.
Реакция
НРЬО? + HSnCV -> РЬ + SnOs" + Н-0
протекает очень медленно, но в присутствии следов висмута (которые не могут
быть уже обнаружены реакцией со станнитом щелочного металла) восстано.
вление свинца катализируется и реакция протекает во много раз быстрее.
Выполнение. Смешивают на капельной пластинке каплю испытуемого
иа висмут солянокислого раствора с каплей насыщенного раствора хлорида
свинца и двумя каплями раствора щелочного станнита. При наличии 0,01 Т
висмута появляется в течение 3 мин. бурое окрашивание. В присутствии
больших количеств висмута осадок металлического свинца появляется неме-
дленно.
Щелочной раствор станнита приготовляют, растворяя 5 г кристалличе-
ского хлористого олова в 5 ли концентрированной соляной кисдоты и раз-
бавляя водой до 100 ли. Перед 'выполнением1 реакции смешивают немного
раствора хлористого олова с равным объемом 25%-ного раствора едкого
натра.
Медь мешает реакции, потому что под влиянием станнита щелочного
Металла происходит медленное образование окрашенной в бурый цвет за-
киси меди. Чтобы воспрепятствовать этому, на капельную пластинку берут
по капле насыщенного раствора хлорида свинца, 27V едкого натра, 5%-ного
раствора цианида калия и испытуемого раствора, посте чего добавляют
две капли станнита щелочного металла и перемешивают’. Таким путем
можно открыть 0,1 Y висмута в присутствии 1 ,«г меди.
* Дополнение редактора. Кроме меди реакции мешают также серебро
и ртуть. Первое можно удалить в виде хлорида. Ртуть же, восстанавлива-
ющуюся щелочным станнитом до металла, удаляют следующим образом.
Каплю исследуемого раствора выпаривают досуха в фарфоровом; микро-
тигле и слабо прокаливают; ртуть при этом улетучивается, остаток раство-
ряют в капле 1Л1 соляной кислоты, после чего производят вышеописанную
реакцию на висмут.А. К.
Реакции сухим путем
Висмутовые соли окрашивают несветящееся пламя в грязный
зелено-белый цвет. При накаливании смеси их с содой на угле
посредством паяльной трубки получается хрупкий королек, окру-
женный желтым налетом окиси висмута.
1 F. Feigi и. Р. Krumholz, В. 62, 1138 (1929). Ред.
10*
147
При нагревании кислородных соединений висмута в верхнем восстано-
вительном пламени (стр. 87) бунзеновской горелки они восстанавливаются
до металла, который улетучивается и сгорает в верхнем окислительном пла-
мени в окись.
Если держать непосредственно над окислительным пламенем наполнен-
ную водой глазурованную снаружи фарфоровую чашку, последняя по-
кроется окисью висмута в виде едва заметного бледножелтого слоя; при
обработке его иодистым водородом он окрашивается в светлокрасный цвет,
причем образуется вис.мутоиодистоводородная кислота:
BiaOs + 8HJ -> ЗН-0 + 2H[BiJ<],
Необходимый для этого опыта иодистый водород получается весьма
просто следующим образом. Несколько асбестовых волокон, прикрепленных
к платиновой проволоке, пропитывают спиртовым раствором иода и затем
зажигают под охлаждаемой водой чашкой. При этом образуется доста-
точно йодистого водорода для превращения окиси висмута в красное йоди-
стое соединение.
Этот налёт, будучи увлажнен (для чего достаточно подышать на него),
исчезает и снова появляется по испарении воды. При действии на него
паров аммиака (для чего удобнее всего смочить раствором аммиаку сте-
клянную пробку склянки, содержащей NHs, и затем дуть на нее ртом так,
чтобы пары касались налета) он окрашивается в красивый оранжево-крас-
ный цвет вследствие образования аммонийной соли висмутоиодистоводород-
ной кислоты:
H[BiJ<] + NHs (NH<)[BiJ4],
в свою очередь исчезающей при увлажнении дыханием.
При смачивании этого налета щелочным раствором хлористого олова
выделяется черный металлический висмут.
Реакция в водородном пламени Ч Слегка прокаливают (в петле плати-
новой проволоки) в водородном пламени, длина которого не должна быть
больше 0,5 см, замешанный с водой в пасту карбонат кальция; затем по-
средством петли другой проволоки смачивают каплей испытуемого на висмут
раствора прокаленную пасту, выделившую немного окиси кальция, и снова
слабо прокаливают. После охлаждения приводят на короткое время полу-
ченную массу в соприкосновение с нижним краем водородного пламени.
В момент соприкосновения с последним, в случае присутствия висмута,
появляется шасильково-синее свечение. Открываемый минимум: 0,004 т
висмута. По мере накаливания окиси кальция свечение висмута исчезает,
так как оно маскируется известью.
Медь Си. Ат. в. 63,57. Ат. н. 29
Плотность 8,93. Т. пл. 1083°. Т. кип. 2310°
Нахождение в природе. Медь иногда встречается в самородном со-
стоянии. Из ее руд назовем: куприт (красная медная руда) Cu-О; медный
блеск CuaS; халькопирит (медный колчедан) CureSs; малахит СпДОНуСОз;
азурит (медная лазурь) Сиз(ОН)-(СОз)2 и атакамит СизО(ОН)С1 • НзО.
Свойства. Медь — светлокрасный ковкий металл. По своей прочности
она следует за железом. По теплопроводности медь уступает золоту и
серебру, а но электропроводности она ближе всего к серебру. Даже не-
большие количества примесей, особенно мышьяка, весьма заметно отра-
жаются на электропроводности меди. Сухой воздух не окисляет медь, но
во влажном воздухе, содержащем двуокись углерода, медь покрывается
слоем основного карбоната, защищающим металл о: дальнейшей коррозии.
Чистая вода не оказывает заметного действия на медь, но1 горячая вода,
содержащая растворенный кислород, вызывает коррозию. Важными спла-
вами меди являются латунь, бронза и нейзильбер (аргентан).
1 J. D о n a u. М. Chem. 34, 949 (1913); см. также Ф. Э м и х, Микрохи-
мический анализ, Госхкмтехиздат, Л., 1932.
148
Растворителем для меди является азотная кислота. Очищенная до блеска
медь не растворяется в соляной кислоте, но в присутствии какого-либо
слабого окислителя, например хлорного железа-, растворение металла совер-
шается легко. В горячей бромистово-дородной кислоте медь растворяется
с -выделением водорода и образованием комплексной медистобромоводород-
ной кислоты:
2Си + бНВгн- H<[Cu2Br«] + Hs.
В начале этой реакции раствор приобретает темнофиолетовый цвет за
счет образования соли двухвалентной меди медистобромоводородной ки-
слоты, обусловленного наличием окисло® меди на ее поверхности. Однако
раствор скоро обесцвечивается вследствие восстановления соли двухвалент-
ной меди металлической медью. При прибавлении -воды к прозрачному
раствору выделяется од-н.обромистая медь:
[СийЗгв]"" -> СигВгг + 4Вг'
Разбавленная серная кислота на медь не действует; я горячей концен-
трированной серной кислоте медь растворяется с образованием сульфата
меди(2) и с выделением двуокиси серы:
Си + 2H2SO4 -» CuSO« + 2НзО + БОг.
Отношение меди к кислотам объясняется ее положением в ряду напря-
жений (стр. 57); так как медь находится ниже водорода, она -может
быть -окислена ионами водорода только в том случае, когда концентрация
ее поддерживается весьма -низкой (стр. 59). Бромистоводородная кислота
растворяет медь в силу образования при этом слабо ионизированного
комплекса. Серная кислота растворяет медь за счет окислительной способ-
ности шестивалентной серы.
По литературным данным медь образует четыре окисла, СигО, СиО,
СигОз и СиОз, из которых изолированы были только первые да®, а именно,
краснан закись меди Си»О и черная окись меди СиО.
Закись -меди может быть получена нагреванием щелочного раствора
тартрата (виннокислой соли) меди (фелингов раствор) с солью мышьяко-
вистой кислоты или с некоторыми- восстанавливающими сахарами, нап-рнмер
с d-г-люкюзой. Этой реакцией широко пользуются при анализе сахара.
Закись меди СизО может быть также получена путем нагревания окиси
меди с металлической медью или путем восстановления раствора соли
двухвалентной меди гидроксила-мино-м NHsOH в -присутствии оснований.
Черная -окись меди СиО получается при нагревании на воздухе меди
или ее гидроокиси, карбоната, сульфата, нитрата и пр.
Перекись меди- СиОз и полут-ора-окись меди СизОз, если и существуют,
не имеют значения в- аналитической химии.
Как закись, так и окись меди являются основными ангидридами, обра-
зуя co-ли одновалентной и двухвалентной меди. Соли ряда закиси меди- со-
держат двухвалентную группу (ионы) Сиг’1, соли же ряда окиси меди
содержат простой Двухвалентный ион Си ’ ’.
Медь известна также и в трехвалентном состоянии1. Если выпаривать
дрсуха азотнокислый раствор теллуристой кислоты с небольшим количе-
ством азотнокислой меди и остаток обработать раствором едкого кали
(1 : 5), то он растворится. Если к прозрачному раствору малыми порциями
прибавить 4—6 г персульфата: аммония (NH-i^SaOs, держа раствор на водя-
ной бане, то произойдет окрашивание раствора в р-озовый цвет, причем
происходит превращение большей части теилура в теллуровую кислоту и
образование некоторого количества калиевой соли теллуромедной кислоты:
• Примечание редактора. Перекись меди СиОг была получена
путем обработки спиртового раствора CuCh 2НзО при —60° спирто-вы-м
1 Moser, Z. anorg. Chem. 54, 119 (1907); Brauner u. Kuzma, 40,
3362 (1907).
149
раствором едкого кали н перекиси водорода. Получившийся продукт темно,
коричневого цвета оказался по своим свойствам настоящей пере-
кисью * А К.
А. Соединения одновалентной меди
Соединения закиси меди крайне неустойчивы и быстро переходят на
воздухе в соединения окиси. Из солей одновалентной меди наиболее хорошо
изучены галоидные соли, роданиды, комплексные цианиды и весьма не-
устойчивые сульфаты и сульфиты. Соли одновалентной меди бесцветны, не
растворимы в воде, но легко растворимы в концентрированных галоидо-
водородных кислотах, причем образуются бесцветные растворы. Последние
содержат неустойчивые медисто-галоидоводоро'дные кислоты, вероятный
состав которой HiLCtuXe], где X может быть хлором, бромом или иодом.
Известны соли, соответствующие этим кислотам, например KafCusCle].
Медисто-галоидоводородные кислоты на воздухе темнеют: хлорное
соединение становится черновато-бурым, бромное соединение — темнофио-
летовым, вероятно, вследствие образования солей окиси меди медисто-
галоидоводородной кислоты.
Весьма важно отношение медисто-галоидоводородных кислот к окиси
углерода; она легко ими поглощается, образуя непрочное соединение хло-
ристой меди с окисью углерода:
ШСигСк + 2СО + 2НД) -* Cu;Ck 2СО 2Н=О ф 2НС1.
При кипячении раствора эго соединение распадается на окись углерода
и хлористую медь. Хлористая медь применяется в газовом анализе для
поглощения окиси углерода.
Реакции мокрым путем
Для этих реакций пользуются раствором хлористой меди в соляной
кислоте, который приготовляют следующим образом. Растворяют 2 г
окиси меди в 25.V.7 6N соляной кислоты, раствор вливают в склянку, при-
бавляют 1,6 г медных опилок и опускают в жидкость медную спираль так,
чтобы она доходила от дна склянки до шейки ее. Закрыв склянку пробкой,
оставляют ее на несколько дней в перевернутом состоянии, т. е. с пробкой,
обращенной книзу. Раствор, сначала темный, постепенно становится совер-
шенно бесцветным, и тогда его можно применять для нижеследующих
реакций.
1. Сернистый водород осаждает черный сульфид меди(1):
Си/ ' + FL-S ->21Г + СшБ,
растворимый в разбавленной азотной кислоте, с образованием синего
нитрата меди и выделением серы:
ЗСигЗ + 16НХОз -> 8Н>0 + 3S + 6Си" ’ -г 12\'Оз' + 4NO.
2. Едкое кали осаждает на холоду желтый осадок гидрата закиси меди:
Си/ ’ + 2ОН'-> Cu2(OHh,
который, теряя воду при температуре кипения, переходит в красную за-
кись меди:
Cui(OH)a Н’О ф СигО.
3. Цианистый калий осаждает белую цианистую медь:
Си/ ‘ + 2CN'-> Cu»(CN)j,
растворимую в избытке осадителя с образованием медиетосинеродистых
ионов:
Cu-(CN). + 6СХ" -» [Cu2(CN)s].
1 L. Moser, Z. anorg. Chem. 86, 380 (1914).
150
Полученный раствор почти не содержит ионов одновалентной меди и
не дает осадка ни с едким кали, ни с сероводородом. Было определено,
что в нормальном растворе цианистого калия отношение концентраций
комплексного аннона и простых ионов одновалентной меди равно прибли-
зительно 1У-“ : 1. Этим обстоятельством пользуются для отделения меди от
кадмия.
В отсутствие избытка CN'-ионов происходит заметная ионизация:
[Cu2(Ci\)8]'""'*2 Сиз’ ’ + 8CN', которая увеличивается с разбавлением
раствора. Из разбавленных растворов получаются соединения Кг[Сиг(С1Ч)«],
K[Cti2(CN)s] и, наконец, Cua(CN)2.
Все эти соединения даже в твердом состоянии разлагаются сероводо-
родом с осаждением черного сульфида одновалентной меди. Поэтому,
чтобы воспрепятствовать осаждению меди сероводородом, необходимо при-
сутствие большого количества цианистого калия, превышающего стехиоме-
трическое количество его, требуемое для образования комплексной соли
Kc[Cu2(CN)s].
Б. Соединения двухвалентной меди
Соли двухвалентной меди, содержащие кристаллизационную воду или
водный .раствор их — синего или зеленого цвета; в безводном же состоя-
нии они белого или желтого цвета.
Хлорид, нитрат, сульфат и ацетат двухвалентной меди растворимы в
воде, остальные большей частью в воде не растворимы, но растворимы в
кислотах.
Реакции мокрым путем
Для этих реакций следует пользоваться раствором сернокислой меди.
1. Сернистый водород осаждает из нейтрального или очень
слабокислого раствора черный сульфид меди (2) (возможно
с примесью CuaS), которая обладает тенденцией давать коллоид-
ный раствор (стр. 78) и проходить через фильтр:
Си'’+H2S-> 2Н-+CuS.
Чтобы воспрепятствовать образованию коллоидного раствора, осаждае-
мый раствор должен содержать некоторое количество электролита; обыкно-
венно для этого бывает достаточно присутствия соляной кислоты (на 100жл
раствора 10—20 мл даунормальной соляной кислоты).
Другим осложнением, с которым часто приходится сталкиваться, являет-
ся окисление на воздухе осажденной сернистой меди в сульфат. Если
фильтр с осадком сернистой меди стоит на воздухе, то образуется неболь-
шое количество сернокислой соли двухвалентной меди, растворимой в воде.
Прохождение через фильтр сернистой медн во многих случаях, повиди-
мому, обязано именно этому окислению до сульфата. При фильтровании
осадка сернистой меди следует придерживаться правила—никогда не да-
вать фильтру полностью опорожниваться до тех пор, пока не будет за-
кончено фильтрование и промывание. Последнее должно производиться
подкисленной сероводородной водой, препятствующей окислению.
Сульфид меди(2) растворяется в горячей разбавленной азотнрй кислоте:
3CuS + 8Н ‘ + 2ХОз' -» ЗСи • • + 2NO + 4НгО + 3S,
Сульфид не растворим в кипящей разбавленной серной кислоте (отли-
чие от кадмия); он растворим в цианистом калии с образованием медисто-
синеродистого калия:
2CuS + 9CN' ->[Сш(С.\’)в]""" 4- CNS' + S".
151
Из раствора этой соли мель не осаждается сернистым водородом.
Сульфид меди заметно растворим в сернистом аммонии, но не раство-
рим в сульфиде калия или натрия 1 (отличие от ртути).
2. Тиоацетат аммония полностью осаждает медь в виде сульфида из
горячих растворов, даже в присутствии кислоты:
СНзСОЗ' + Си’ ’ -J. НЮ -> CuS + СНзСООН + Н'.
3. Едкие щелочи выделяют на холоду синий осадок гидро-
окиси ''меди:
Си’ ’ 4- 2ОН' Си(ОН)2,
переходящей при кипячении в темнобурый, более бедный водой
окисел, вероятно, в ангидрид:
Си(ОН)2 -> НгО + СиО.
Си(ОН)2 обладает слабыми амфотерными свойствами и поэтому
растворяется, особенно при нагревании, в очень концентрирован-
ных растворах КОН или NaOH.
В присутствии винной, лимонной и многих других органических окси-
соединений едкие щелочи совсем не осаждают медь, но окрашивают рас-
твор в интенсивно синий цвет. Вероятно, при этом имеет место образо-
вание виутрикомплеконых солей. Если к такому щелочному раствору при-
бавить какой-либо вое стам ов и те ль, например виноградный сахар, альде-
гиды, мышьяковистую кислоту и т. in., то выпадает, особенно при нагре-
вании, желтый гидрат закиси меди, переходящий при кипячении в красную
закись меди. Щелочной раствор медного купороса, содержащий винную
кислоту, называют раствором Фелинга. Для получения последнего смеши-
вают равные объемы раствора, содержащего 34,649 г кристаллического
сульфата меди в 500 мл воды, и раствора, содержащего 173 г сегне-
товой соли (тартрата калия-натрия) и 52 г NaOH в 500 мл воды. Оба
эти раствора хранят раздельно и смешив.ают их непосредственно перед
употреблением. Фелингов раствор является реактивом на многие сахара,
альдегиды, гидроксиламин и т. н.
4. Карбонаты щелочных металлов осаждают зеленовато-синий основной
карбонат меди. При стоянии с избытком реактива достигается почти пол-
ное осаждение с образованием кристаллической соли ЗСиСОз • ЗСи(ОН)з •
• Н»О. Этот осадок растворяется в аммиаке, окрашивая раствор в синий
цвет, и в цианистом калии с образованием бесцветного раствора.
Этой реакции препятствуют аммонийные соли и некоторые органиче-
ские вещества, образующие с медью комплексные анионы.
5. Аммиак. При осторожном приливании небольших количеств
аммиака к раствору соли окиси меди образуется светло зеленый
порошкообразный осадок основной соли, который чрезвычайно
легко растворяется в избытке осадителя; жидкость при этом
окрашивается в лазурно-синий цвет:
2CUSO1 + 2NH1OH-» (NH4.)2SO4 + Cu2(OH)2SO4;
Cu2(OH)2SOi + (NH4)2SO4 + 6NH3 -> 2[Cu(NH3)4]SO4 • H2O.
Из концентрированного синего аммиачного раствора соли окиси меди
абсолютный алкоголь осаждает вышеприведенное вещество в виде сине-
фиолетового кристаллического порошка, который при нагревании посте-
пенно теряет весь аммиак и переходит в соль окиси меди. При пропуска-
1 Сульфид двухвалентной меди заметно растворяется в полисульфидах
щелочных металлов, особенно при доступе воздуха, с образованием соеди-
нений типа: NH^CuSi] и KfCuSi], См. Hof man u. Н б с h 11 е п, В. 36,
3090 (1903) и Biltz u. Не rins, Ibid. 40, 974 (1907).
152
iHHM аммиачного газа через безводные соли окиси меди последние с жад
ностью поглощают аммиак, образуя комплексные аммиачно-медные соли
с б.ХНч
CuCh 4- 6NHs-> [Cu(NHs)e]C12..
Эти соединения, которым вполне аналогичны подобные же соединения
никеля, кобальта и цинка содержат самое большее 6NH3 на 1 атом меди.
При , осаждении аммиачных растворов алкоголем получаются всегда соеди-
нения с 4\Нз на 1 атом меди.
Ионизация комплексного катиона:
LCu(NHs)4]- ’ 5±Cu” + 4NH.i
в присутствии избытка аммиака незначительна, но все же во много раз
превосходит ионизацию медистосинеродистого иона (стр. 151).
Соли аммония препятствуют осаждению основной соли двухвалентной
меди вследствие подавления ионизации гидрата окиси аммония в присут-
ствии общего иона. Таким образом при прибавлении аммиака к раствору
соли двухвалентной меди в присутствии аммонийной соли осадок часто
не образуется. Синий цвет комплекса заметен даже при значительном раз-
бавлении, и этим часто пользуются для количественного определения
меди. Количество последней может быть определено млн колориметрически,
или по объему стандартного раствора цианистого калия, который необхо-
димо добавить для обесцвечивания раствора. Соли никеля дают с аммиа-
ком менее ’интенсивное синее окрашивание, и в случае сомнения, находится
ли в растворе медь или никель, решающей реакцией является реакция
с железистосинеродистым калием (стр. 154).
Едкие щелочи, прибавленные к синему аммиачному раствору мели,
дают спустя некоторое время темносиний осадок гидроокиси меди. При
кипячении вся медь может быть осаждена в виде буро-черной окиси меди
СиО. Очень разбавленный раствор меди не дает заметного окрашивания
с аммиаком, но если взболтать раствор с несколькими каплями фенола, то
спустя некоторое время появляется синее окрашивание. '
6. Цианистый калий дает сначала желтую цианистую соль
двухвалентной меди, тотчас переходящую с отщеплением ди-
циана (в белую цианистую соль одновалентной меди; последняя
в избытке цианистого калия, как уже было упомянуто, раство-
ряется, образуя бесцветное соединение— медистосинеродистый
калий:
CtT ‘ + 2CN'-> Cu(CN)2;
2Cu(CN)2 -> Cu2(CN;2 4- (CN)2;
Cu2(CN)2 + 6CN' -> [Cu2(CN)8]""’.
Если прибавить к синему аммиачному раствору медной соли доста-
точно цианистого калия, то он обесцветится с образованием медистосиие-
родистого калия,
•Восстановление солей двухвалентной меди до одновалентной в аммиач-
ном растворе происходит за счет циан-иона, который окисляется в циа-
нат-ион:
2[Cu(NHs)4]• • + SCN' + 2ОН' [Cus(CN)e]""" + CNO' + 8NH3 + Н2О.
Из бесцветного раствора медистосинеродистого калия сероводород не
осаждает сернистой меди при условии присутствия достаточного количе-
ства цианистого калия (отличие от кадмия). Иногда, в особенности в при-
сутствии большого количества медной соли, при пропускании сероводорода
образуется красный кристаллический осадок рубеанового водорода
(CSNH2)2 (стр. 1.57).
7. Роданистый калий KCNS осаждает черную родановую (двуродани-
стую) медь
Си’ ’ +2С№'-» Cu(CNS)2,
153
которая постепенно (или сразу в присутствии сернистой кислоты) переходит
в белую роданистую соль одновалентной меди:
2Cu(CNS); 4- SOW + НЮ-> 2CNS' + SO/' + 2Н ' + Cu2(CNS)£.
Роданистая медь не растворима в йЬде и разбавленных соляной и сер-
ной кислотах.
8. Щелочные ксантогенаты выделяют из растворов солей двухвалентной
меди сначала бурый осадок ксантогената меди(2), который переходит
с отщеплением диксантогена в желтый ксантогенат одновалентной меди:
S S
II II
2NaS • С ОС2Н5 ф Си" —> 2Na' + Cu(S • С ОС,Н-)2
ксантогенат натрия
S S S
II II II
2Сн (S С • ос.;н5)2 —> Cu2 (S С • ОС >Н5)2 + (S • С ОС.Н5),
ксантогенат меди (1) диксантогеы
Ксантогенат натрия получают путем смешения сернистого углерода
со спиртовым раствором едкого натра:
S
zS II
С 4^ + C.2H5ONa —> NaS • С ОС2Н5.
S
Ксантогеновокислые щелочи редко применяются в качестве реактива
на соли окиси меди; наоборот, соли окиси меди служат реактивом на соли
ксантогеновой кислоты. Чаще же всего солями окиси меди пользуются для
открытия сернистого углерода в газовых смесях, для чего газ пропускают
через спиртовый раствор едкого натра; в присутствии сернистого угле-
рода образуется ксантогенат натрия, присутствие которого (после нейтра-
лизации уксусной кислотой) констатируют при помощи соли окиси меди.
9. Ферроцианид калия1 — железистосинеродистый калий
K<i[Fe(CN)fi] выделяет из нейтрального и кислого растворов
аморфный красно-бурый осадок железистосинеродистой соли
двухвалентной меди:
[Fe(CN)e]"" + 2Cu‘ Cu2[Fe(CN)e].
При наличии щелочных металлов последние принимают уча-
стие в образовании осадка, например:
[Fe(CN)u]"" + 2К- + Си’ ‘ CuK2[Fe(CN)6].
Железистосинеродистая соль двухвалентной меди не раство-
рима в разбавленных кислотах и растворима в аммиаке с синим
окрашиванием (отличие от железистосинеродистого молибдена,
раствор которого в аммиаке желтого цвета). Эта соль разла-
гается едким кали: на ‘ холоду получается светлосиний гидрат
окиси меди и железистосинеродистый калий, при нагревании —
черная окись меди (отличие от урана, дающего как с аммиаком,
так и с едкими щелочами желтый уранат).
10. Ацетилен при пропускании через аммиачный раствор, со-
держащий виннокислую щелочь, в котором медь была восстано-
1 Е. М ii i 1 е г, G. Wegelin и. К е 11 е г h о f, J. prakt. Chem. (2) 86,
82 (1912).
154
влена гидроксиламином до одновалентной, дает красно-бурый
хлопьевидный осадок ацетиленистой одновалентной меди С2С112 •
• НгО. Таким путем ионы меди могут быть отделены от других
катионов.
11. Йодистый калий осаждает белую иодистую одновалентную медь.
Но собственная окраска CuJ маскируется выделяющимся при реакции
иодом, и осадок поэтому кажется окрашенным в розовый, зеленый или
красновато-желтый цвет:
2Cu' ’ + 4Т-> Cu-jJ’ -f- Js.
В присутствии восстановителей свободный иод не выделяется. В коли-
чественном анализе содержание меди определяется путем измерения объ-
ема раствора тиосульфата натрия, идущего на реакцию с иодом;
J2 + 2S».Os" <- SiOe" + 2J'.
Осадок иодистой меди растворяется в избытке реагента. Йодистый
калий, прибавленный к разбавленному раствору соли двухвалентной меди,
окрашивает раствор в желтый цвет за счет выделившегося иода.
12. Бромистый калий. Если раствор бромистого калия смешать с кон-
центрированной серной кислотой и к охлажденной смеси прилить по стенке
пробирки немного .раствора медной соли, то в месте соприкосновения двух
растворов появляется красивое сине-красное окрашивание. При взбалтыва-
нии весь раствор окрашивается в красный цвет. По Сабатье (Sabatier)
окраска обусловливается образованием CuBrs • НВг • 2НзО
При большом количестве меди получается черный осадок бромной
меди. При разбавлении водой окраска -исчезает. Ионы двухвалентного
олова препятствуют реакции, вссстано.вляя двухвалентную медь до одно-
валентной. Если к сине-красному раствору прибавить двуокись серы, то
происходит образование белой однобромистой меди.
13. Железо осаждает из раствора медной роли красный осадок метал-
лической меди:
Си' ’ Fe -> Fe‘ ‘ Си.
Точно так же реагируют и другие металлы, как. например, цинк, алю-
миний и пр., которые в электродвижущем ряду стоят выше меди.
Медь может быть выделена на платине; для этого соединяют друг
с другом полоски платиновой фольги и соответствующего металла (цинк,
олово, алюминий и т. п.) и погружают их в раствор. В этом случае обра-
зуется гальваническая пара, причем платина является катодом, другой же
металл — анодом, который при этом растворяется.
14. Тиосульфат натрия обесцвечивает нейтральный или кис-
лый раствор медной соли 2. При кипячении этого раствора об-
разуется красновато-бурый осадок односернистой меди в смеси
с серой:
2Cu* ' + 2S2O3" + 2Н’О ->Cu2S + 4Н' + 2S0i" + S.
15. Роданомеркуриат аммония (NHiHHg^CNSb]3, прибавленный
к раствору, содержащему ионы цинка и двухвалентной меди, выделяет
темнофиолетовый кристаллический осадок комплексного соединения рода-
нидов цинка, ртути и меди. Реакция однозначна в отсутствие солей же-
леза(З), никеля и кобальта.
1 Реакция Сабатье [С. г. 125, 103 (1897)] по своей чувствительности
превосходит реакцию с EL'S и K4Fe(CN)e. Открываемый минимум 1.5 Y
в капле раствора бромида. Ред.
" Обесцвечивание происходит в слабокислом растворе -вероятно вслед-
ствие образования комплексной соли. Ред.
:t М о п t е q u t, Chem. Zentr. 1927, 1, 2453, F e i g 1, Microchemie 7, 6
(1929).
115
Реактив готовят растворением 8 г HgCL> и 9 г NHiCNS в 100 мл воды.
Выполнение. К капле 'испытуемого подкисленного раствора на капельной
пластинке прибавляют по капле 1%-ного раствора ацетата цинка и родано-
меркуриата аммония. В присутствии 0,1 у меди появляется темнофиоле-
товый осадок.
16. Бензидин1 не только легко окисляется обычными окислителями, пре-
вращаясь в синее мерихиноидцое соединение (стр. 222), но окисление его
происходит и в том случае, когда двухвалентная соль меди восстанавли-
вается в соль одновалентной меди посредством иодидов, бромидов, циа-
нидов и роданидов щелочных металлов. Файгль полагает, что в данном
случае окисление происходит за счет освобождающегося галоида.
Выполнение. На фильтровальную бумагу последовательно помещают
каплю испытуемого раствора, каплю бензидинового реактива и каплю на-
сыщенного раствора бромида калия. В присутствии меди появляется синее
пятно или кольцо. Открываемый минимум: 0,6 у 2.
Для приготовления реактива растворяют 1 г бензидина ,в 10 мл уксусно-
этилового эфира и, разбавив раствор 90 мл воды, хороню взбалтывают и
фильтруют.
17. Купрон (а-бензоиноксим)3 CoHsCH — С — СвНз образует с медью
I II
ОН NOH
зеленое соединение, не растворимое в разбавленном аммиаке. По Файглю
нерастворимость этого соединения обусловливается насыщением побоч-
ных валентностей меди (они обозначены пунктирными линиями) обеими
фенильными группами;
СвН6 —СИ—- С-С6Н6
! I II I
: О ON i
Cu
Выполнение, На фильтровальную бумагу помещают каплю слабокислого
испытуемого раствора, прибавляют каплю 5%-иого спиртового раствора
купрона и подвергают действию паров аммиака. Появление зеленого окра-
шивания указывает на присутствие меди. Открываемый минимум: 0,1 Т
меди. IB присутствии металлов, осаждаемых аммиаком, следует перед при-
бавлением! купрона смочить бумагу каплей 10%-кого раствора сегнето-
вой соли.
18. Каталитическое действие меди. Реакция между ионами трехвалент-
ного железа и тиосульфата приводит в конечном итоге к образованию
соли двухвалентного железа и тетратионата:
2Fe’ ’ • + 2S2O3" -> 2Fe‘' ф SiO»".
Эта реакция двухфазна. Сначала почти моментально образуется ком-
плексный анион темнофиолетового цвета; он довольно устойчив и медленно
реагирует с ионами трехва.тентного железа по уравнению:
[Ре(5гОз)2]’ + 2Fe‘ * *2Fe' +’ SiOs".
Эта вторая реакция ускоряется ионами двухвалентной меди, и фиолето-
вая окраска исчезает Значительно быстрее, чем в отсутствие меди. Если
реакцию производить в присутствии роданидов, которые образуют с Fe’
красный комплекс и одновременно задерживают вторую фазу реакции, то
измеряя время, необходимое Для полного обесцвечивания раствора, можно
открыть присутствие очень малых количеств меди.
1 F е i g-1 u. N e u b e r, 2. anal. Chem. 62, 375 (1923). Ред.
2 Нужно придерживаться указанного1 порядка помещения капель, в
противном случае реакция может стать менее чувствительной. Ред,
3 F е i g 1, В. 56, 2032 (1923); Mikrochemie 1, 76 (1923) и Файгль,
Капельный анализ, стр. 204 (1937)- РеД.
»
156
Выполнение. В одно из углублений капельной пластинки помещают
каплю испытуемого раствора, в другое, смежное углубление, каплю дестил-
лированной воды. К каждой капле прибавляют по капле реактива, приго-
товленного растворением 1,5 г хлорного железа и 2 г роданистого калия
в 100 мл воды, и по три капли 0,1М раствора тиосульфата натрия. Окраска
раствора, не содержащего меди (в слепой пробе), исчезнет через 1,5—2 мин.,
испытуемый же раствор, содержащий медь даже в количестве 1 у, теряет
свою окраску почти мгновенно. Разницу в скорости обесцвечивания раство-
ров можно заметить и> при 0,02 Г меди.
19. Дитизон 1 (см. стр. 121) образует с медью в нейтральных или амми-
ачных растворах и в растворах, содержащих аммонийные соли, желтовато-
бурое внутрикомплексное соединение. В присутствии других тяжелых ме-
таллов (за исключением благородных металлов и ртути) медь может быть
открыта в количестве 0,1 т, потому что она обладает большей тенден-
цией к реакции с дитизоном, чем другие ионы.
Выполнение. В закрытой пробкой маленькой пробирке сильно взбал-
тывают каплю нейтрального или слабоаммиачного испытуемого раствора
с каплей раствора 1—2 мг дитизона в 100 мл четыреххлористого углерода.
В присутствии меди зеленый цвет реактива переходит в желтовато-бурый.
Открываемый минимум: 0,03 Т меди.
20. Рубеановодородная кислота 2 дает в аммиачных или сла-
бокислых растворах солей меди черный осадок рубеаната меди.
В растворе рубеановюдородной кислоты (диамид дитио-щавелевой
кислоты) имеют место следующие равновесия:
S=C — NH, HS — С == NH rS — C = NIb"
| ' I JZT2H-+ (
S = C —NH3 HS — C = NH Ls-C = NHJ
В щелочной -среде равновесие сдвинуто вправо. Анион кислоты образует
с медью, никелем и кобальтом труднорастворимые окрашенные внутри-
комплексные соли, которым приписывают строение:
..........,/Nii
S--------с
Рубеановодородную кислоту получают путем одновременного пропу-
скания в спирт сухого дициана (образующегося из CuSOt и избытка KCN)
и сернистого водорода. Сначала образуется флавеановодородная кислота
CN • CS • NHa желтого цвета. При дальнейшем пропускании газов и при
избытке сернистого водорода получают красный осадок (SCNHs)’, который
перекристаллизовывают из спирта.
Выполнение. Каплю тщательно нейтрализованного испытуемого рас-
твора помещают на фильтровальную бумагу, пятно подвергают действию
щаров аммиака (держат бумагу над открытой склянкой с аммиаком) и
прибавляют каплю 0,5%-ного спиртового раствора реактива. Открываемый
минимум: 0,006 у меди.
Осадок не образуется в присутствии цианида калия. При определен-
ных условиях медь может быть открыта в присутствии никеля и кобальта.
Так как реакция чрезвычайно чувствительна, необходимо ставить слепой
опыт с дестиллированной водой.
1 F е i g 1, Mikrcchenie 8, 319 (1930). Ред.
2 Pr. Ray u. ДА. Ray, J. Soc. Chem. Ind. 3, IIS (1926); Z. anal. Chem.
79, 94 (1929). См. также Файгль, Капельный анализ, стр. 210 Ред.
157
21. Фосфорномолибденовая кислота1 образует с раствором медисто-
синеродистого калия молибденовую синь, которая представляет собой
смесь различных степеней окисления молибдена с валентностью ниже
шести2. Молибден в фосфорномолибденовой кислоте Н3М012РО40 обладает
большей реакционной способностью, чем в молибденовой кислоте.
Приготовление реактива. Фосфорномолибденовокислый аммоний (по-
лучающийся при осаждении раствора щелочной соли фосфорной кислоты
избытком молибдата аммония в присутствии горячей, разбавленной азот-
ной кислоты) вносят в нагретую царскую водку. Раствор выпаривают
досуха на водяной бане, сухой остаток растворяют в воде и дважды из
нее перекристаллизовывают. Высушенный препарат хранят в банках из
светлокоричневого стекла. Для реакции применяют 1%-ный водный раствор.
Выполнение. На фильтровальную бумагу наносят последовательно по
капле исследуемого раствора, 1%-ного раствора KCN, раствора фосфорно-
молибденсвой кислоты и разбавленной соляной кислоты. В присутствии
меди появляется синее окрашивание. Открываемый минимум: 1,3 у меди.
Реакция менее чувствительна, если в растворе находится большое коли-
чество других катионов, но все же можно еще открыть 4 у меди в при-
сутствии 300-кратного количества ртути, 300-кратного свинца, 120-кратного
висмута и 280-кратного количества кадмия. Следует избегать слишком
большого количества азотной кислоты.
22. Салицилальдоксим3 C7H-O2N в уксуснокислом растворе дает
с ионами двухвалентной меди светлый зеленовато-желтый осадок внутри-
комплексной соли СщСтНпОгМ)-?. Единственными элементами, мешающими
реакции на медь, являются палладий, дающий такой же осадок, и золото,
восстанавливающееся до металла:
Выполнение. К капле Нейтрализованного, а затем подкисленного уксус-
ной кислотой исследуемого раствора в микропробирке прибавляют каплю
реактива. В присутствии 0,5 У меди появляется опалесценция, при больших
количествах — бледнозеленый осадок.
Для приготовления реактива растворяют 1 г салицила ль доксима в 5 .к.?
спирта и раствор приливают по каплям к 95 .чл воды, нагретой до 30°.
Взбалтывают до почти полного исчезновения маслянистой суспензии, после
чего фильтруют.
.ОН
23. Купферрон (фенилиитрозогидроксиламин) СвНз — N дает оса-
\\О
док медной соли фенилнитрозогидроксиламина:
О' О—Си—О.
2С6НХ + Cu" <— C8H5-N< >N-C6H3,
XNO XNO NOZ
растворяющийся в аммиаке с синим окрашиванием.
1 F е i g 1 u. N е u b е г, Z. anal. Chem. 62, 376 (1923).
2 Состав молибденовой сини до си.х пор еще не выяснен. Большая
часть исследователей считает,-что она представляет собой комплексное
соединение шестивалентного с пятивалентным молибденом. Так, по К1 а*
son, В. 34, 158 (1901) состав ее отвечает формуле MoaOs • 24МоОз • хНгО,
по W. В i 11 z, Ibid. 38, 2964 (1905) — формуле МозОз.
а F. Е р h г a i ш, В. 63, 1928 (1930). Ред.
153
Реакции сухим путем
Перл буры и фосфорной соли гири высокой концентрации
медных солей окрашивается в окислительном 'пламени в зеленый,
а при малой — в синий, цвет; в восстановительном пламени в при-
сутствии малого количества меди он обесцвечивается, в случае же
большого количества он становится красно-бурым и непрозрач-
ным от выделившейся меди. Следы меди могут быть с точ-
ностью открыты следующим образом. К перлу, окрашенному
в .окислительном пламени в едва видимый синий цвет, прибавляют
ничтожное количество олова или какой-нибудь его соли и на-
гревают в окислительном пламени до полного растворения этого
металла; медленно1 переносят перл в восстановительное пламя и
быстро удаляют из него. В горячем состоянии перл бесцветен,
при охлаждении же он становится рубиново-красным и прозрач-
ным. При слишком долгом нагревании в восстановительном пла-
мени перл остается бесцветным; но при осторожном его окисле-
нии рубиново-красное окрашивание все-таки появляется. Эта
реакция очень чувствительна, и ею можно также пользоваться
для открытия олова.
При накаливании с -помощью паяльной трубки медной соли
в смеси с содой на угле, лучше же на обугленной содовой па-
лочке, получается губчатый металл, но не королек.
Соли меди окрашивают пламя в синий или зеленый цвет.
Смачивание пробы соляной кислотой повышает чувствительность
реакции.
Кадмий Cd. Ат. в. 112,41. Ат. и. 48
Плотность 8,6. Т. пл. 321°. Т. кип. 765°
Нахождение в природе. Кадмий обычно является спутником цинка
В его рудах. Он встречается также в виде гринокита CdS гексагональной
системы и в виде ок^си. CdO правильной системы.
Свойства. Кадмий — серебристо-белый кристаллический металл несколько
тверже олова и цинка й более вязкий, чем олово. Он легко” вытягивается
и очень ковок. При сгибании металла слышится хрустящий звук, который
присущ и олову. Выше 300° он заметно летуч и при получении металла
из его руд возможна отгонка как кадмия, так и цинка. О:и образует ряд
ценных сплавов с низкой точкой плавления; его сульфид находит приме-
нение в качестве желтой краски.
Кадмий образует только один важный окисел CdO, коричневато-жел-
того цвета, который получается при сгорании металла на воздухе или при
прокаливании гидроокиси, карбоната, нитрата, оксалата и пр.
Была описана черная закись кадмия, которая, невидимому, образуется в не-
больших количествах при сгорании металла на воздухе или при осторож-
ном прокаливании оксалата кад|мия без доступа воздуха; однако существо-
вание закиси кадмия оспаривается, и соли, являющиеся ее производными,
неизвестны. Таким образом, кадмий образует лишь один ряд солей, в ко-
торых он двухвалентен. Лучшим растворителем для кадмия является азот-
ная кислота. Разбавленные соляная и серная кислоты медленно растворяют
кадмий с выделением водорода.
Наиболее важной продажной солью является сульфат ЗСб5О<-8НгО;
перекристаллизация ее затруднительна; для очистки концентрированный
водный раствор этой соли обрабатывают спиртом, отфильтровывают вы-
делившиеся при этом кристаллы, промывают спиртом и высушивают на
листах фильтровальной бумаги.
К9
Кадмиевые соли большей частью бесцветны; сернистый кадмий окра-
шен в желтый или оранжевый цвет. В воде растворимы хлорид, нитрат и
сульфат кадмия.
Реакции мокрым путем
1. Сернистый водород образует, смотря по условиям опыта,
осадки различных оттенков, начиная от канареечножелтого и
оранжевого и кончая .почти коричневым.
В нейтральных растворах образуется как на холоду, так и при нагре-
вании светложелтый весьма трудно фильтруемый сернистый кадмий.
Из очень кислых холодных растворов (на 100 раствора 2—10 мл
концентрированной H2SO4 или 2—5 мл концентрированной НС!) тотчас вы-
деляется желтый, скоро переходящий в оранжевый осадок сульфид, ко-
торый очень легко фильтруется. Эти осадки не представляют собой чис-
тый CdS, но содержат всегда большие или меньшие ко.тичества CdaChS
или Cd»(SOpS и т. п. в зависимости от концентрации кислоты. Поэтому
кадмий не. определяется количественно в виде сульфида.
Сернистый кадмий не растворим в сернистых щелочах (отличие от
мышьяка), растворим в теплой разбавленной азотной кислоте, а также в
кипящей разбавленной серной кислоте (1 : 5) (отличие от меди) и особенно
легко в соляной кислоте вследствие образования комплексных соединений.
Он также не растворим в растворе цианистого калия (отличие от меди).
2. Сернистый аммоний образует желтый осадок сульфида
кадмия, имеющий тенденцию переходить в коллоидное со-
стояние и проходить через фильтр. Присутствие концентриро-
ванного раствора какого-либо электролита препятствует образо-
ванию коллоида (стр. 81).
3. Едкие щелочи дают белый аморфный осадок гидрата
окиси кадмия, не растворимого в избытке осадителя (отличие
от цинка и свинца):
Cd’ ’ + 2ОН' -> Cd(OH)2.
При умеренном накаливании гидрата окиси получается окись
бурого цвета, темнеющая при более сильном прокаливании. При
накаливании азотнокислого кадмия получается черная кристал-
лическая окись.
4. Аммиак также осаждает белый гидрат окиси, растворимый
в избытке реактива (отличие от свинца), с образованием' ком-
плексных кадмиевоаммониевых соединений, подобных аммоние-
вым соединениям цинка, никеля и др.:
Cd(OH)2 + 4NH3 -> [Cd(NHs)4]' ' + 2ОН'.
В нормальном растворе аммиака отношение концентрации
комплексного катиона к концентрации простого катиона кадмия
равно приблизительно 107: 1. В чистой воде ионизация прини-
мает большие размеры. При разбавлении и кипячении аммиачно-
комплексного соединения из раствора выделяется осадок гидро-
окиси кадмия.
5. Углекислые щелочи и аммоний осаждают белый основной
карбонат кадмия, нс [растворимый в избытке осадителя. * »
Соли аммония препятствуют осаждению, но п,риг кипячении
аммиак выделяется .в виде газа и происходит полное осаждение.
Осадок растворяется в растворе цианистого калия.
160
6. Цианистый калий осаждает белый аморфный цианид кад-
мия, легко растворимый в избытке осадителя:
Cd' ' +2CN'^ Cd(CN)2;
Cd(CN)2 + 2CN'-> [Cd(CN)4]".
Из раствора цианокадмиевой соли калия некоторые из выше-
приведенных реактивов не выделяют осадка. В нормальном рас-
творе цианистого калия отношение концентрации комплексного
аниона к концентрации простого катиона кадмия равно ДО17 : 1.
Очевидно, что этот комплекс значительно менее прочен, чем
медистосинеродистый анион; поэтому хотя произведение раство-
римости сернистого кадмия значительно .больше произведения
растворимости сернистой меди, сероводород осаждает сульфид
кадмия из раствора цианистого комплекса последнего (отличие
от меди):
[Cd(CN)4]" + H2S~> 2CN' + 2HCN + CdS.
7. Ферроцианид калия дает белый осадок (ср. Цинк).
8. Хлорнокислый аммоний выделяет кристаллический осадок
перхлората кадмия Cd(C104)2 (отличие от меди).
9. Роданистый калий не реагирует с солями кадмия (отличие
от меди).
10. Металлы, как железо, цинк, олово и т. п., не осаждают
кадмий из кислых растворов (отличие от меди). Цинк легко оса-
ждает кадмий из нейтральных растворов (стр. 57).
/NH-NH -- C6H4NO2
11. р-Дииитродифенилкарбазид1 О = С сообщает
\NH—NH — CsH4NO2
свежеосажденной гидроокиси кадмия бурую окраску, переходящую при
стоянии в зелено-синюю. Окраска обусловливается адсорбцией реактива
гидроокисью кадмй». В качестве реактива применяется 0.1%-ный спирто-
вый раств-е-р динитро дифенил-карбазида.
Выполнение. На капельной пластинке смешивают каплю кислого, ней-
трального или аммиачного испытуемого раствора с каплей 10%-кого рас-
твора едкого натра, каплей реактива и с двумя каплями 40%-ного фор-
мальдегида. Уже в присутствии 0,8 Y кадмия появляется синевато-зеленое
окрашивание, а при большем количестве кадмия — такого же цвета осадок.
Реактив в щелочном растворе окрашен в красный цвет, при прибавлении
формальдегида—в фиолетовый. Поэтому для открытия малых количеств
кадмия необходимо сравнение полученной окраски с окраской, получаю-
щейся -в слепом опыте с каплей чистой воды.
* Примечание редактора. В присутствии большого количества меди (но
не больше 4 г в lOO.w.r раствора.) необходимо каплю испытуемого раствора
перемешать с каплей раствора едкого натра и тремя каплями цианистого
калия до полного растворения гидроокиси -или цианида меди, после чего
смешать с двумя каплями реактива и тремя каплями- формальдегида. От-
крываемый при таких условиях минимум: 4 Т кадмия при 400-кратном
количестве меди. * А. К.
ZNH — NH — С0Н5
12. Дифенилкарбазид2 О = С< выделяет из нейтраль-
XNH —NH — CfiH-,
ного или слабокислого раствора, к которому в качестве буфера прибавлен
1 К. Heller u. Р. Krumholz, Mikrochemie 7, 217 (1929), а также
Файгль, Капельный анализ, стр. 217. Ред.
2 F. F е i g 1 u. N е u b е г, Z. anal. Chem. 62, 378 (1923). Ред.
11 За.к. 082. Тредвелл-Голл, т. I.
161
ацетат натрия, красновато-фиолетовый осадок. Дифенилкарбазид не
является специфичным реактивом на кадмий, ио последний может быть
открыт в присутствии умеренных количеств меди» свинца и ртути.
Приготовляют насыщенный раствор дифенилкарбазида в 90%-ном
спирте, насыщают его роданидом калия и прибавляют кристалл иодида
калия. Этим раствором смачивают фильтровальную бумагу, которую затем
высушивают. На такую бумагу наносят каплю испытуемого раствора и
держат ее в течение 1—2 мин. над открытой склянкой с аммиаком. Появ-
ление синевато-фиолетового1 окрашивания указывает на присутствие кад-
мия. Роданистый калий и иодид калия прибавляются, чтобы воспрепят-
ствовать реакции меди, свинца и ртути. Открываемый минимум в чистых
растворах кадмия 4 Т, в присутствии указанных металлов 8 ".
® Дополнение редактора. 13. Селенид натрия2. Если к аммиачному
раствору кадмиевой соли прибавить раствор, содержащий селенид калия
K»Se и цианид калия, то при больших количествах кадмия образуется
оранжево-желтый осадок. При малых количествах кадмия осадок не по-
является, но раствор окрашивается в желтый или красно-бурый цвет от
тонко диспергированного селенида кадмия. В этом случае осадок можно
сделать видимым, если к суспензии добавить эфир или какую-либо другую,
не смешивающуюся с водой жидкость. При .взбалтывании полученной
смеси на границе раздела «вода — органический растворитель» происходит
скопление тонко диспергированного осадка.
Выполнение. В пробирке емкостью около 10 .ил к 2 мл аммиачного
испытуемого раствора, содержащего аммонийную соль, прибавляют каплю
25%-иого раствора цианида калия, нагревают до кипения и добавляют пять
капель реактива (см. ниже). Охладив пробирку холодной водой, хорошо
взбалтывают с 1 мл эфира. По разделении слоев появляется на поверх-
ности раздела красно-бурая пленка селенида кадмия. Открываемый мини-
мум 2,5 Т кадмия.
Реактив готовится растворением 1 г селенида натрия в 100 лл воды
с добавлением 0,5 г цианида калия. Профильтрованный раствор в закры-
тых склянках сохраняется в темноте несколько дней. Кадмий может быть
открыт в присутствии Cu, Ni, Со и Zn путем маскировки последних циани-
дом калия. * А. К.
Реакции сухим путем
Кадмиевые соединения, нагретые на угле с содой, дают бурый
налет окиси кадмия.
При нагревании в верхнем восстановительном пламени бун-
зеноюской горелки соединения окиси кадмия восстанавливаются
до металла, который легко улетучивается и снова сгорает в верх-
нем окислительном пламени в окись; ее можно получить в виде
бурого налета на наружной глазурованной стороне фарфоровой
чашки. К этой окиси всегда примешано немного закиси кадмия,
легко восстанавливающей окись серебра до металла. Поэтому,
если смочить налет окиси кадмия раствором азотнокислого се-
ребра, .появится сине-черное окрашивание от выделившегося
серебра:
Cd»O + 2Ag- -> Cd‘ ' + Cd О + 2Ag.
Эта реакция весьма чувствительна.
Для испытания сероводородного осадка на кадмий посред-
ством этой реакции необходимо испытуемую пробу предвари-
тельно обжечь в верхнем окислительном пламени и затем уж по-
ступать, как выше описано.
1 На бумаге получается иная окраска, чем в пробирке. РеД.
’Krumholz ц. К г u h, Mikrochemie 17, 210 (1935).
162
Мышьяк As. Ат. в. 74,91. Ат. н. 33
Плотность металлической формы 5,7, желтой 2.0, аморфной 3,69
Т. пл. 817—818° при 35,8 ar. Т. кип. около 610э (возгоняется)
Нахождение в природе. Мышьяк очень распространен в природе;
в небольших количествах он встречается почти во всех сернистых соедине-
ниях, в том числе в цинковых обманках и пиритах; поэтому почти во
всяком продажном цинке и неочищенной серной кислоте находится мышьяк.
В самородном состоянии мышьяк встречается в форме почковидных
масс; встречается также в виде кислородного соединения— мышьяковистого
ангидрида As-Оз, кристаллизующегося или в правильной системе; (мышья-
ковый цвет), или в моноклинической (клаудетит).
Важнейшими мышьяковистыми рудами являются сульфиды, арсениды
и сульфосоли: реальгар AsjSj моноклинической системы; аурипигмент
AsaSs ромбической системы; мышьяковистый колчедан FeAsS ромбической
системы; светлая мышьяковосеребряная обманка (Аз5з)Ау.ч гексагональной
системы; арсениды (мышьяковистые металлы) железа, никеля, кобальта и
платины общей формулы MAsj; блеклая руда представляет собою пра-
вильно кристаллизующуюся смесь сульфомышьяковистокислых и сульфо-
сурьмя'Н.истокислы.х солей, главным образом меди, <ртути. железа и цинка.
Мышьяк существует в четырех аллотропных формах: металлической,
серой, желтой и коричневой. При нагревании его на воздухе образуется
трехокись мышьяка As-Оз. При горении1 мышьяка выделяется сильный чес-
ночный запах, который не замечается, когда подвергают сублимации чис-
тую трехокись мышьяка. Пары его ядовиты. По своим физическим свой-
ствам мышьяк похож на металл; однако характер взаимодействия его
с кислородсодержащими кислотами заставляет отнести его к неметаллам.
Подобно фосфору устойчивая молекула мышьяка содержит четыре атома.
В группе периодической системы элементов, в которой находится мышьяк,
первые члены ее, азот и фосфор, не имеют основных свойств. Находя-
щиеся ниже мышьяка сурьма и висмут обладают определенным металли-
ческим, а их трехвалентные окислы — определенно основным характером.
Мышьяк занимает промежуточное положение.
Мышьяк не растворим в ооде. Сухие фтор, хлор и бром образуют
соединения трехвалентного г мышьяка. В присутствии воды хлор и бром
окисляют его сначала в мышьяковистую, а затем в мышьяковую кислоту:
Ал + 10С1- + I6H2O-* 4H..AsO4 + 20НС1.
Мышьяк реагирует с серой, образуя As-S», As-Sa и AsaS.i. При комнат-
ной температуре концентрированная соляная кислота на него не действует;
в горячей кислоте он медленно окисляется, образуя сначала трехокись
мышьяка, а затем трихлорид мышьяка:
As4 + (НС1) + 6НгО-> 2Ав-Оз 4- 6Н2;
As-Оз + 6НС1-> 2AsC!s + ЗН-О.
Разбавленная азотная кислота растворяет мышьяк, образуя мышьяко-
вистую кислоту:
Asi + 4HNOs + 4НЮ -> 4FLiAsOs + 4X0.
Концентрированная азотная кислота и царская водка растворяю г его,
образуя мышьяковую кислоту:
As4 + 2OHNO3 -> 4HsAsO4 + 2ONO2 + 4НаС).
Раствор хлорноватистокислого натрия также растворяет мышьяк:
As4 + lONaClO + 6Н2О -> 4H3AsO4 + lONaCl.
Холодная разбавленная серная кислота не оказывает на него никакого
действия, но с горячей концентрированной серной кислотой образуется
трехокись мышьяка и двуокись серы:
As4 + 6H2SO4-» 2AsaOs + 6SO2 + 6Н-О.
11*
163
Мышьяк образует два окисла: AssOs и AszOs. В действительности,
формула низшего окисла AssOe, но принято пользоваться более простой
формулой AssOs,
А. Соединения трехвалентного мышьяка
Трехокись мышьяка образуется в виде белых, блестящих правильных
октаэдров при сгорании мышьяка на воздухе. При медленном охлаждении
паров трехокиси мышьяка они застывают в аморфную массу (мышьяковое
стекло), которая постепенно становится кристаллической (белой и непро-
зрачной наподобие фарфора).
Трехокись мышьяка известна в трех различных видоизменениях:
1) тре.хокись мышьяка правильной системы (белый мышьяк);
2) моноклиническая или ромбическая трехокись мышьяка;
3) аморфная, стекловидная трехокись мышьяка.
Моноклиническая модификация трудно растворима в воде (80 ч. холод-
ной воды растворяют 1 ч. мышьяковистого ангидрида), аморфная стекло-
видная—.значительно легче (25 ч. холодной воды растворяют 1 ч. мышья-
ковистого ангидрида).
Наиболее обычная модификация правильной системы (белый мышьяк)
водой не смачивается — она плавает на ней подобно муке; это свойство
часто помогает обнаружить присутствие белого мышьяка. ,
В соляной кислоте трехокись мышьяка растворяется довольно легко,
особенно при нагревании, и выделяется при охлаждении раствора в без-
водном состоянии в виде красивых кристаллов.
В качестве кислотного ангидрида трехокись мышьяка растворяется
даже в очень разбавленных растворах едких щелочей и углекислых ще-
лочных металлов, а также в аммиаке с образованием легкорастворимых
солей мышьяковистой кислоты, называемых арсенитами:
AssOs + 6ОН' -» ЗНаО + 2AsOs"’;
А«:Оз + ЗСОз" -> ЗСО2 + 2А80з'".
Трехметаллические арсениты, производные ортомышьяковистой кислоты
НзАзОз, обыкновенно неустойчивы. Хорошо известной солью этого типа
является только арсенит серебра AgsAsOs. Арсениты щелочных метал, >в
являются производными метамышьяковистой кислоты HAsOn, пиромышья-
ковистой кислоты HiAszOs или полимышьяковистой кислоты, например
HsAsiO». Так, соли калия и натрия известны только в виде KAsO» и
КгНзАззО», аммонийная соль в виде (NTLbAsiOs. Можно, однако, предпола-
гать, что в щелочном растворе находятся AsOs'''-и'аны.
Свободная мышьяковистая кислота не была изолирована; как очень
слабая кислота она подобно угольной кислоте распадается на воду и
ангидрид.
Мышьяк легко соединяется с хлором подобно фосфору, образуя AsCh
(треххлористый мышьяк), который как хлорангидрид мышьяковистой кис-
лоты обладает теми же свойствами, что и соответствующее соединение фос-
фора РС1з. Он представляет собой бесцветную кипящую при 134° жидкость,
которая, как и все хлорангидриды кислот, количественно гидролизуется
водой:
AsCh + ЗНгО ЗНС1 + НзАзОз-
Водный раствор треххлористого мышьяка и раствор трехокиси послед-
него в разбавленной соляной кислоте содержат мышьяк в виде мышьяко-
вистой кислоты. С увеличением концентрации хлористого водорода увели-
чивается концентрация треххлористого мышьяка, и в очень концентриро-
ванной хлористоводородной кислоте почти весь мышьяк находится в виде
треххлористого соединения. При кипячении раствора мышьяковистой
кислоты в концентрированной соляной кислоте треухлористый мышьяк вы-
деляется в газообразном состоянии. При одновременном пропускании хло-
ристого водорода (чем достигается наивысшая концентрация хлористого
водорода) легко удается выделить весь мышьяк из раствора в виде лету-
чего треххлористого мышьяка. Поэтому при выпаривании солянокисло: о
164
раствора мышьяковистой кислоты весь мышьяк может улетучиться в виде
треххлористого мышьяка. Но если мышьяк находится в виде мышьяковой
кислоты, то при выпаривании его раствора мышьяк не улетучивается.
Арсениты щелочных металлов растворимы в воде; остальные арсениты
в воде не растворимы, но растворимы в кислотах.
Реакции мокрым путем
1. Сернистый водород осаждает из кислых растворов хлопье-
видный трехсернистый мышьяк:
2H3AsO3 + 3H2S-> 6Н2О + As2S3;
2AsC13 + SH2S->6HC1 -j- As2S3.
Сернистый мышьяк не растворим в кислотах; его не раство-
ряет даже 6А соляная кислота, но при долгом кипячении с 12N
соляной кислотой он медленно переходит в летучий AsCl3 и H2S.
Концентрированная азотная кислота окисляет его в мышьяковую
и серную кислоты:
As2S3 4- 28HNO3 -> 3H2SOi + 28NO2 + 2HsAsO4 + 8Н2О.
Более легко сульфид растворяется в аммиачном растворе пе-
рекиси водорода:
As2S3 -ф 14112O2 + 12ОН' -> 2ОН2О + 3SO4" + 2AsO4\
Он также растворим в едких щелочах, углекислом аммонии и
сульфидах щелочных металлов:
A^S3 + 6ОН'—>ЗНгО -ф AsO3"''+ AsS3"';
As2S3 -ф ЗСО.3"-> ЗОО2 + AsO3"' + AsSs'";
As2S3 + 3S" -► 2AsS3"\
Подобно тому как HsAsOa может считаться производной ангидрида
AsaO.s, точно так же тиомышьяковистую кислоту (чиокислоту) HsAsSa
можно рассматривать как производную тиоангидрида AsaSs. Тиомышьяко-
вистая кислота не способна к свободному существованию, но известны ее
соли. При подкислении последних освобождающаяся кислота тотчас теряет
сероводород, образуя нерастворимый тиоа.нгидрид:
SAsSb'" + 6Н‘ -> 3H»S + AsaSs.
При действии кислоты на смесь тиоарсенита и арсенита осаждается
трехсернистый мышьяк:
АэОз"' + A§Ss'" + 6Н’ •> ЗН»О + AsaSs.
Осаждение бывает количественным только в разбавленных растворах;
из концентрированных растворов происходит улетучивание HaS, и поэтому
для осаждения всего мышьяка необходимо дополнительное пропускание
через раствор HaS.
При кипячении раствора' арсенита и тиоарсенита с гидроокисью, карбо-
натом или нитратом висмута происходит образование черного сульфида
висмута:
AsaSs"' + 2Bi(OH)s -> BisSa + AsOs'" + ЗНаО.
С окисью меди или с растворимой солью меди образуется черная сер-
нистая медь, а мышьяк окисляется в мышьяковокислую соль:
5CuO + AsSs'" + AsOs'"-* 2CuaS -f- 2AsC>4'" -f- CuS,
165
Способность мышьяка образовывать тиосоли является при-
чиной. того, что сероводород из водных растворов трехметал-
лических щелочных солей мышьяковистой кислоты не выделяет
никакого осадка, а в растворах одно- и двухметаллических солей
производит частичное осаждение:
AsCh"' ’+ 3H2S-> ЗНЮ'+ AsSs'";
6HAsO3" + I0H2S -> 18НЮ + As2s3 Н- 4AsS3"';
ЗНзАзОз' + 6H2S -* 9НгО + As2S3 + AsS3'"-
Поэтому, чтобы воспрепятствовать образованию растворимых
тиосолей при выделении мышьяка из растворов в виде трех-
сернистого соединения, необходимо всегда присутствие доста-
точного количества свободной кислоты.
Прокаливание трехсернистого мышьяка с карбонатом и нитратом на-
трия ведет к образованию сульфата и арсената:
5As»Ss + 16Na2COs + 28NaNO» -> JONasAsCh + 15NasSO4 + 16СОг + 14№.
При прокаливании в токе хлора происходит улетучивание треххлори-
стого мышьяка.
Та же реакция имеет место, если- сульфид со смесью из 5 ч. хлори-
стого аммония и 4 ч. нитрата аммония прокаливать в трубке в токе
воздуха.
2. Тиоацетат аммония, добавленный к горячему подкислен-
ному раствору7 арсенита, полностью осаждает мышьяк в виде
сульфида:
ЗСНзСОЗ' + 2AsO3"'.+ 9Н* -> ЗСНзСООН + As2S3 + ЗН2О.
3. Тиосульфат натрия количественно осаждает мышьяк:
2AsO3'" + ЗЗгОз" + 6Н’ -> As2S3 + 3SO-T + ЗН2О.
4. Азотнокислое серебро выделяет из нейтральных растворов
мышьяковистокислых солей желтый осадок серебряной соли
ортомышьяковистой кислоты (отличие от мышьяковой кислоты):
AsO3'" + 3Ag’ AgsAsOs
растворимый в азотной кислоте и аммиаке:
Ag3AsO3 + ЗН’ ->ЗА< + H3ASO3;
Ag3AsO3 + 6NH3—> 3Ag(NH3)2‘ + AsOs'".-
Первая реакция обусловливается образованием слабоионизирующей
мышьяковистой кислоты, которая в присутствии избытка водородных ионов
дает меньше AsO:i"'-hohob. чем трудно растворимое AgsAsOs, находящееся
в соприкосновении с водой. Причиной растворимости в аммиаке является
то, что [Ag(NHs)2]' -ион в .присутствии избытка NHs Дает меньше простых
Ag’-катионов, чем AgsAsCh, находящееся в соприкосновении с водой.
В водных растворах одно- и двуметал.тических солей осаждение азотно-
кислым серебром неполное:
ЗКНгАзОз -р 3AgNOs<i 3KNOs -f- SHsAsOs + AgsAsOs;
HaAsOs'J-^3Ag' AgsAsOs -J- 2H'S
Чтобы осаждение было количественным, необходимо .прибавление ка-
кой-либо Щелочи, лучше всего аммиака. Но так как раствор арсенита уже
имеет щелочную’реакцию, то достижение нейтральной точки весьма трудно.
Обычно прибавляют слишком много аммиака. В качественном анализе нет
необходимости при подобных реакциях добиваться полноты осаждения,
потому что по цвету осадка серебряной соли уже можно судить, имеем ли
мы дело с арсенитом или с арсенатом. Если же хотят произвести количе-
ственное осаждение, поступают следующим образом. К раствору нитрата
серебра прибавляют по каплям аммиак до тех пор. пока образовавшаяся
вначале окись серебра не растворится; полученный раствор содержит
вместо простых Ag‘ -ионов комплексные катионы [Ак(Гч’Нз)г]'. Пригото-
вленный таким образом реактив прибавляют к раствору арсенита, предва-
рительно слабо подкисленному азотной кислотой:
HsAsOs + 3[Ag(NHs)2]' + ЗН' -> 6NH4' + AgsAsOs.
Прибавление азотной кислоты необходимо потому, что в противном
случае раствор станет аммиачным и часть арсенита растворится.
Если исследуемый раствор содержит также хлорид, то его необхо-
димо осадить избытком нитрата серебра, предварительно подкислив раствор
азотной кислотой, и отфильтровать осадок. К фильтрату осторожно прили-
вают разбавленный аммиакЦ на границе соприкосновения обеих жидко-
стей появляется желтый осадок арсенита серебра. Реакция очень чувстви-
тельна.
5. Хлористый магний в присутствии аммиака и хлористого
аммония не образует никакого осадка в разбавленных растворах
мышьяковистокислых солей (отличие от мышьяковокислых
солей).
6. Иодный раствор обесцвечивается мышьяковистой кислотой,
окисляющейся при этом в мышьяковую кислоту; реакция проте-
кает количественно только в щелочном растворе:
H2ASO3' + Ja + IhO-> 2Н’ + 2J' + Hl’AsOi'.
Для количественного течения реакции слева направо раствор необхо-
димо поддерживал?.;. нейтральным; для реакции, которая протекала бы ко-
личественно справа налево, необходимо присутствие большого избытка
водородных ионов, что находился в строгом согласии с законом действия
масс. Для объяснения такого направления реакции высказывалось предпо-
ложение, что свободная иодистоводородная кислота является лучшим' вос-
становителем, чем иод-ионы. Однако более вероятно, что кислотность
растворов является важным фактором устойчивости мышьяковистых соеди-
нений. В щелочных растворах мышьяк более устойчив в высших степенях
своего окисления, и поэтому арсениты являются сильными восстановите-
лями в нейтральных или щелочных растворах. Мышьяковистая кислота
амфотерна и образует, как мы видели, треххлористый и трехсернистый
мышьяк- В присутствии избытка водородных ионов независимо от их про-
исхождения мышьяковистая кислота не обнаруживает заметной _ ионизации
как кислота, но проявляет стремление к образованию As ' ‘ ‘-катионов.
Мышьяковая кислота, вероятно, также амфотерна, хотя в значительно
меньшей степени. В сильнокислом растворе ионизация мышьяковой кислоты
подавляется до некоторой степени и проявляется тенденция ее к образова-
нию As......-катионов, которые, однако, значительно менее устойчивы,
чем As-катионы; поэтому мышьяковокислая соль в сильнокислом
растворе ведет себя как энергичный окислитель.
Это объяснение находится в согласии с результатами, полученными при
изучении восстановительных потенциалов (стр. 60). Прибавление кислоты
безусловно увеличивает окислительную способность мышьяковой кислоты
и только слабо уменьшает восстановительную способность иодида.
Для поддержания нейтральной реакции раствора при окислении мышья-
ковистокислых солей иодом нельзя пользоваться раствором едкой щелочи,
ибо последняя сама реагирует с иодом, образуя соли иодистоводородаой
1 Приливать аммиак следует по стенке пробирки так, чтобы жидкости
не смешивались. Гс;:.
167
и ио.дноватистой кислот. Обычно применяют бикарбонат натрия:
HCOj'+H‘-> Н2О + СО2.
Можно также пользоваться фосфорнонатрие.вой солью, образующей
с водородными ионами мало ионизирующие НаРСН'-ионы. Возможно при-
менять также и среднюю углекислую соль щелочного металла, если раствор
насытить углекислым газом, который будет препятствовать образованию
(вследствие гидролиза средней углекислой соли) достаточного количества
ОН'-ионов, вступающих в реакцию с иодом.
7. Хлористое олово [реакция Беттендорфа (Bettendorff)].
При прибавлении к концентрированной соляной кислоте несколь-
ких капель раствора, содержащего мышьяковистую кислоту, и
затем 0,5 м насыщенного раствора хлористого олова в соляной
кислоте жидкость быстро буреет и спустя некоторое время вы-
деляется черный осадок металлического мышьяка. Нагревание
ускоряет реакцию. Разбавленный водный раствор мышьякови-
стой кислоты этой реакции не дает. В концентрированной соля-
ной кислоте мышьяк находится в виде треххлористого соедине-
ния, и только последнее восстанавливается хлористым оловом,
а не мышьяковистая кислота:
2As ’ ’ * + 3Sn’ ’ 3Sn 2As.
* Дополнение редактора. Пробе на мышьяк по Беттендорфу мо-
гут мешать соли ртути, так как последние при указанных усло-
виях опыта также восстанавливаются до металла. Удаление
ртути простым прокаливанием в данном случае неприемлемо,
потому что вместе с ртутью может улетучиваться также и
мышьяковистое соединение. Но если мышьяк превратить в пиро-
мышьяковую соль, то удаление ртути прокаливанием не влечет
за собой улетучивания мышьяка. Поэтому Файгль1 рекомендует
следующее видоизменение реакции Беттендорфа. В небольшом
тигельке к капле испытуемого раствора прибавляют по одной-две
капли аммиака, 10%-ной перекиси водорода и 10%-ного рас-
твора хлорида магния и, перемешав, медленно выпаривают, а. за-
тем сильно прокаливают. Мышьяк, даже если он находится
в виде сульфида или щелочного раствора сульфосоли, полностью
превращается в MgzAsaO?, который устойчив к прокаливанию,
соли же ртути улетучиваются. Остаток от прокаливания нагре-
вают с одной-двумя каплями кислого раствора хлорида олова (2).
Выделение буро-черного осадка и окрашивание в такой же цвет
раствора указывает на присутствие мышьяка. Этим путем воз-
можно открыть 1 у As. * А. К.
8. Фосфорноватистокислый натрий МаНаРОг восстанавливает
в сильнокислом растворе мышьяковистуй) кислоту до’ металличе-
ского мышьяка, выделяющегося в виде коллоида. Весьма чув-
ствительная реакция.
9. Йодистый калий, прибавленный к горячему кислому рас-
твору, образует трехиодистый мышьяк красного цвета:
AsO3"' + 6Н' + 3J' -> AsJ3 % ЗНзО.
1 Файгль, Капельный анализ, стр. 22о.
168
В .концентрированном растворе получается красный осадок.
В количественном анализе часто восстанавливают арсенат до арсенита
посредством умеренного избытка йодистого калия:
АэОУ" + 2J' + 2Н • -> АзОз'" + НЮ + J2,
причем раствор скрашивается выделившимся иоДо-м в красный цвет. При
кипячении иод улетучивается и в случае концентрированного раствора по-
является окраска, обусловленная наличием трехиодистого мышьяка. В прак-
тике в большинстве случаев трудно сказать, когда весь иод улетучивается,
и поэтому .невозможно отогнать последние следы иода без потери некото-
рого количества йодистого мышьяка,
10. Сернокислая медь не осаждает мышьяк из водного рас-
твора мышьяковистой кислоты. Но если прибавить немного
едкой щелочи, то образуется желтовато-зеленая мышьяковистая
соль двухвалентной меди, которая растворима в избытке едкой
щелочи, и раствор окрашивается в синий цвет. При кипячении
этого раствора осаждается красная закись меди. Эта чувствитель-
ная реакция может служить для отличия соединений трехвалент-
ного и пятивалентного мышьяка, хотя нужно помнить, что
многие органические восстановители осаждают закись меди при
аналогичных условиях.
Б. Соединения пятивалентного мышьяка
Мышьяковый ангидрид, получающийся при прокаливании мышьяковой
кислоты, представляет сочбой белое плавкое .вещество, которое при сильном
прокаливании переходит в,- мышьяковистый ангидрид:
Азг'Оз -> As-’Оз + Ол
В воде мышьяковый ангидрид значительно растворяется, образуя
мышьяковую кислоту:
AsaOs + ЗН-эО -» 2HsAsO«.
Мышьяковая кислота может быть получена в твердом состоянии в виде
орторомбических призм, соответствующих формуле ^HaAsCH • ЬЮ. При
100° она теряет воду, давая ортомышьяковую кислоту НзАзСН в виде кри-
сталлического порошка.
При легком прокаливании ортомышьяковая кислота теряет воду, обра-
зуя пиромышьяковую кислоту H^AsaO?, которая при дальнейшем прокали-
вании переходит в метамышьяковую кислоту HAsOa. В этом отношении
мышьяковая кислота совершенно сходна с фосфорной кислотой. Как пиро-,
так и метакис,тота легко присоединяют воду и снова превращаются
в ортокислоту.
Соли мышьяковой кислоты называются арсенатами.
Подобно солям о-ртофосфорной кислоты известны одно-, двух- и трех-
метал.тические соли, например NaHaAsCh, NaaHAsOi и NasAsOi, Арсенаты
щелочных металлов растворимы в воде, все остальные соли в воде не
растворимы, ло легко растворимы в кислотах.
Реакции мокрым путем
1. Сернистый водород при пропускании в холодный раствор
арсената в 0,3N кислоте дает осадок только спустя долгое время,
причем образуется трехсернистый мышьяк. Если холодный рас-
твор содержит большой избыток концентрированной -соляной
Кислоты, то мышьяк осаждается в виде пятисернистого мышьяка.
169
Если же сернистым водородом действовать на горячий раствор
арсената в концентрированной соляной кислоте, то образуется
смесь из трехсернйстого и пятисернистого мышьяка.
Причины такого интересного и своеобразного отношения арсената
к сернистому водороду довольно сложны. Произведение растворимости как
трехсернистого, так и пятисернистого мышьяка чрезвычайно мало, и тре-
буется лишь незначительная концентрация As''- или As' -ионов для
достижения величины произведения растворимости с сульфид-ионами даже
столь слабо ионизированной сернистоводородной кислоты. Холодный раствор
мышьяковокислой соли в 0,3/V соляной кислоте не содержит заметного
количества As.....-катионов. Мышьяковая кислота приблизительно той же
силы, что и фосфорная кислота, и лишь присутствие большого избытка
соляной кислоты может подавить в заметной степени ионизацию первого
ее водорода. Однако логично допустить, что под влиянием концентриро-
ванной соляной кислоты образуется .небольшое количество As......-катио-
нов. которые реагируют с сернистым водородом, образуя весьма мало
растворимый пятисернистый мышьяк:
HaAsCh + 5Н" -> 4НгО + As.....;
2As '' ' + 5H2S -> As2S= + ЮН'.
Пятисернистый мышьяк настолько не растворим, что действие кислоты
вообще благоприятно: кислота способствует образованию As-катио-
нов и препятствует образованию коллоидного раствора AssSs.
Сернистый водород поглощается холодным раствором арсената в раз-
бавленной кислоте ji большей степени, чем это можно было бы ожидать
на основании растворимости сернистого водорода в воде. При этом имеет
место образование монотиомышьяковой кислоты:
HsAsOi 4- H2S -» HsAsOsS 4- H2O.
Сернистый водород оказывает также восстанавливающее действие на
арсенат. Это восстановление происходит медленно на холоду, но более
быстро при повышении температуры или при увеличении концентрации >
Н' (стр. 60): л’
HjiAsOi + ЗН' ф HaS -> As " ' + 4Н-0 + S;
2As" ' + 3HaS -> As«S;J 4- 6H'.
Как только в растворе появляется заметное количество Asили
As’'-ионов, тотчас происходит осаждение соответственного сульфида.
Температура раствора и концентрация кислоты являются чрезвычайно важ-
ными факторами при осаждении мышьяка сернистым водородом. Из двух
сульфидов большей нерастворимостью отличается пятисер.нистый мышьяк.
Чтобы скоро осадить мышьяк сернистым водородом из раствора
мышьяковокислой соли без применения значительного количества соляной
кислоты, необходимо лишь восстановить мышьяковую кислоту путем кипя-
чения с сернистой кислотой, избыток последней удалить затем кипячением
же и пропускать сернистый водород. При этом тотчас происходит осажде-
ние трехсернистого мышьяка.
Пятисернистый мышьяк подобно трехсернистому совершенно не рас-
творим в кипящей соляной кислоте (1 : 1), легко растворим в едких и сер-
нистых щелочах и углекислом аммонии:
AsjjSs 4- 6ОН'-> ЗНЮ + AsSi'" + AsOsS'";
AsjSs ’+ ЗСОз" -> ЗСО» + AsS?" + AsOjS'";
AssSr. 2AsS«'".
При подкислении этих растворов осаждается пятисернистый мышьяк:
2AsS4'" 4- 6Н' -> 3HsS + AsaSs;
AsSi'" .4- AsOiS'" -J- 6Н' ЗН:О 4- AssSj.
170
Пятисернистый мышьяк окисляется дымящей азотной кислотой в сер-
ную и мышьяковую кислоты; того же результата достигают аммиачным
раствором перекиси водорода и хлоратом калия в присутствии соляной
кислоты:
As«S5 4- 40HNOs-> 2HsAsO4 + 5H2SO4 + 40NO2'+ 12Н2О;
As2Ss + 20НЮ-2 + 16ОН' -> 28НэО + 5SO4" + 2AsO4"';
3As2Ss + 2ОНСЮ3 + 24НЮ -» 20HC1 + 6НзА$С>4 + I&H2SO4
или
3As2S5 + 5НС10з + 9НгО ->5HC1 + 6НзАвО4 + 15S.
2. Азотнокислое серебро осаждает из нейтральных растворов
мышьяковокислое серебро шоколадно-бурого цвета (отличие от
мышьяковистой и фосфорной кислот):
AsOi'" + 3Ag' ’ -> AgsAsOj,
растворимое в кислотах и аммиаке.
>43. Хлористый магний в присутствии хлористого аммония и ам-
миака выделяет белый кристаллический осадок мышьяковокислой
аммонийномагниевой соли:
AsOt'" -j- Mg’ ‘ + NHt ' -> MgNH4AsOt4.
Этот осадок почти не растворим в воде, содержащей аммиак,
И поэтому приведенной реакцией пользуются для количествен-
ного отделения мышьяка. При прокаливании он переходит
в пиромышьяковокислый магний:
2MgNH4AsOu НЮ + 2NH.3 + Mg2As2Oj.
4. Молибденовокислый аммоний, прилитый в большом из-
бытке, выделяет из азотнокислого раствора при температуре ки-
пения желтый кристаллический осадок мышьяковомолибденово-
кислого аммония:
AsO/" + 3NH4- + 12MoOi" + 24Н- -> 12Н2О ф-
4- (NH4)3AsO4. 12МоОз.
Этот осадок, подобно соответствующему молибденовому со-
единению с фосфорной кислотой, не растворим в разбавленной
аз'отной кислоте, содержащей нитрат аммония, но он легко рас-
творим в аммиаке и растворах едких щелочей:
(NH4)3AsO4. 12МоОз + 24ОН' -> 12НЮ + 3NH4’ ф- AsO/" ф-'
ф- 12М0ОЛ
Этот осадок растворим также и в мышьяковокислых солях
щелочных металлов с образованием других комплексных более
богатых мышьяком кислот, аммонийные соли которых в азотной
кислоте растворимы. Поэтому для осаждения мышьяковой кис-
лоты необходим всегда большой избыток молибденовокислого
аммония К
t Чувствительность реакции значительно увеличивается от прибавления
Концентрированного раствора нитрата аммония. См. стр. 104, табл. 15. Ре;'.
171
Фосфорная кисл-ота, как мы позже увидим, относится к магниевым
солям и молибденовокислому аммонию точно так же, как и мышьяковая
кислота. Поэтому при одновременном присутствии в растворе фосфорной и
мышьяковой кислот сначала осаждают мышьяк сероводородом в виде
сернистого соединения, фильтруют и окисляют сернистый мышьяк дымя-
щей азотной кислотой в мышьяковую кислоту. Образование осадка в та-
ком растворе посредством молибденовокислого аммония может быть те-
перь вызвано исключительно мышьяковой кислотой; получающийся же
желтый осадок от прибавления молибденовокислого аммония к фильтрату
от сернистого мышьяка, по удалении сероводорода, указывает на присут-
ствие фосфорной кислоты.
5. Йодистый калий в растворе, сильно подкисленном соляной
кислотой, восстанавливает мышьяковую кислоту и выделяет иод
(стр. 167):
HsAsOi + SH'+2J'-> As” ’J + 4H2O + Л.
Эта реакция протекает количественно, если удалять иод тиосуль-
фатом, но в отсутствии кислоты и в (присутствии избытка
NaHCOs реакция протекает количественно в обратном напра-
влении.
6. Сернокислая медь не дает осадка с мышьяковой кислотой,
но если прибавить немного едкой щелочи, то образуется сине-
вато-зеленый арсенат двухвалентной меди, который окрашивается
в красивый бледносиний цвет при дальнейшем добавлении едкой
щелочи, но не растворим в ее избытке.
7. Тиоацетат аммония и тиосульфат натрия дают с мышьяковой кис-
лотой такие же осадки, какие получаются и с мышьяковистой кислотой.
8. Концентрированная соляная кислота и хлористое железо
образуют летучий трехклористый мышьяк:
H3AsO4 + 2FeCl2 + 5НС1^ AsCh + 2FeCh + 4НгО.
Можно пользоваться и любой другой растворимой солью
двухвалентного железа или другим восстановителем, например
однохлористой медью, иодистым или бромистым калием и даже
сернистым водородом. После восстановления весь мышьяк мо-
жет быть удален путем перегонки в токе хлористого водорода.
Вместо соляной кислоты можно пользоваться бромистоводородной кис-
лотой, и так как последняя является восстановителем, то нет необходи-
мости в добавлении другого восстановителя. Так, например, если 1 г твер-
дого вещества кипятить с 10 мл 9N раствора НВг, то практически весь
мышьяк перегоиится ,в виде AsBrs, когда в сосуде для разложения оста-
нется лишь 3 мл жидкости. Если д&стиллат пропускать в бромную воду,
то получается раствор мышьяковой кислоты:
AsBrs + Bn + 4Н2О -> HaAsOi + 5НВг.
При аналогичных условиях летучи также селен и галлий в виде SeBr-t
и GaBrs.
* Дополнение редактора. 9. Молибденовокислый аммоний и хлористое
олово. Во всех случаях восстановления молибдена реакция приводит сна-
чала к продукту, окрашенному в синий цвет (так называемая молибдено-
вая синь, вероятно MoaOs), и заканчивается образованием продуктов низ-
шей степени окисления, окрашенных от бурого до желтого цвета. Однако
в присутствии фосфорной или мышьяковой кислоты восстановление Мо не
идет дальше образования молибденовой сини.
172
На этом Файгль ’ основал следующую реакцию на мышьяк. К иссле-
дуемой пробе приливают несколько капель насыщенного на холоду рас-
твора (NH-OsMoOt, затем избыток солянокислого раствора SnCk и нагре-
вают. Если мышьяк отсутствует, то появляющееся вначале синее окраши-
вание совершенно исчезает и раствор становится желтым или бурым. На-
против, в присутствии мышьяка эта синяя окраска раствора сохраняется
и интенсивность ее зависит от содержания мышьяка.
Этой прекрасной реакцией можно пользоваться только в отсутствие
фосфорной, кремневой и вольфрамовой кислот. Кроме того, необходимо,
чтобы мышьяк находился в виде мышьяковой кислоты. Так как при си-
стематическом ходе анализа мышьяк выделяется в виде AsaSs, то послед-
ний превращают в мышьяковую кислоту растворением его в царской водке
или, что еще лучше, в аммиачном растворе Н2О2. При очень малых коли-
чествах мышьяка синяя окраска может быть замаскирована окрашенными
в бурый цвет низшими продуктами восстановления молибдена. В этом
случае мышьяк удается открыть путем взбалтывания раствора с амиловым
алкоголем, в котором молибденовая синь растворяется. По своей чувстви-
тельности реакция превосходит все вышеописанные и ею можно открыть
мышьяков концентрации 0,001 .«г/.г, * А. К.
В. Реакции, общие для всех соединений мышьяка
1. Реакция Марша (Marsh) -
Все соединения мышьяка в кислом растворе восстанавливаются метал-
лическим цинком до мышьяковистого водорода АзНз:
AsOs'" + 3Zn 4- 9Н ’ -> 3Zn ‘ ’ + ЗН2О + AsHs;
AsO«'" + 4Zn + НН' 4Zn’ ‘ + 4НзО + AsH3;
As‘ + 3Zn ЗЙ' -t- 3Zn’ ' + AsHj.
Восстановление сернистых соединений мышьяка совершается медленно,
окислов же, даже при обыкновенной температуре, — быстро. В качестве
восстановителя применяют цинк с серной кислотой.
Образующийся весьма ядовитый бесцветный мышьяковистый водород
обладает одним свойством, которое дает нам возможность с уверенностью
открывать ничтожнейшие следы мышьяка, а именно до 0,7 у. При
пропускании через накаленную, наполненную водородом стеклянную трубку
мышьяковистый водород разлагается на водород и металлический мышьяк,
который отлагается на стенках трубки вокруг нагреваемой ее части в виде
буро-черного зеркала.
Эта реакция необычайно чувствительна и должна производиться
с величайшей осторожностью. Так как продажные реактивы, особенно цинк
и серная кислота, часто содержат незначительные следы мышьяка, то при
применении их легко впасть в ошибку, обнаруживая присутствие мышьяка
даже в том случае, когда исследуемая проба совершенно не содержит его.
Способ Марша или его видоизменения применяют для открытия таких
малых количеств мышьяка, которые уже не поддаются определению при
помощи вышеприведенных реактивов, как, например, в случаях отравления
и для открытия .мышьяка в обоях.
Образование и свойства мышьяковистого водорода
а) Образование. /Мышьяковистый водород, как уже было указано, по-
лучается путем 'восстановления мышьяковых соединений. В качестве вос-
становителей применяют совершенно чистые цинк н серную кислоту. При
пользовании другими металлами и' кислотами (например, оловом и соля-
1 F е i g 1 u. N e u b e r, Z. anal. Chem. 62, 369 (1923).
Z. angew. Chem. IS, 416 (1905); Chem.-Ztg. 36. 1465 (1912), а также
микрохимическое выполнение реакции по Billeter u. М а г f а г t, Helv.
Chem. acta 6, 771 (1923). Ред.
173
стой кислотой, железом и серной кислотой) мышьяковые соединения хотя
также восстанавливаются в мышьяковистый водород, но часть их (именно
при применении железа) превращается в твердый мышьяковистый водород,
остающийся в колбе, в которой производят восстановление, и поэтому
ускользающий от определения.
При применении олова и соляной кислоты восстановление проходит
полностью только при повышенной температуре *, между тем как восста-
новление цинком и серной кислотой идет при обыкновенной температуре
до конца. Химически чистый цинк почти совсем не растворяется в хими-
чески чистой разбавленной серной кислоте; поэтому необходимо активи-
ровать его посредством какого-либо постороннего металла. Прибавление
капли раствора платинохлористоводородной кислоты вызывает сначала
энергичное выделение водорода, которое, однако, скоро уменьшается и уже
больше не ускоряется от повторного прибавления платины. Кроме того,
прибавление платинохлористоводородной кислоты имеет тот недостаток,
что значительные количества мышьяка удерживаются платиной; этим ме-
тодом уже невозможно обнаруживать количество As.-Os меньше 5 71 2.
Значительно лучших результатов достигают посредством сплавов цинка
с платиной; так, Гефти (Hefti)3, пользуясь сплавом, содержавшим 10%
платины, нашел, что выделение водорода равномерно и длительно ускоря-
лось и что платиной удерживалось значительно меньшее количество
мышьяка. Таким путем можно находить As-Оз в количествах до 0,5 Т.
Еще лучшим активирующим материалом является медь, применяемая в виде
ее сплава с цинком. Этот сплав приготовляют следующим образом-. 20 г
химически чистого, свободного от мышьяка цинка расплавляют в неболь-
шом тигле; в жидкий металл вносят небольшое количество чистой меди,
после чего, выливая металл в воду, подвергают его грануляции. Необхо-
димо следить, чтобы окисный слой, поскольку возможно, оставался цели-
ком в тигле. При помощи такого сплава и 15%-ной серной кислоты полу-
чают длительное равномерное выделение газа и удается определять до
0,25 7 As-Оз.
В щелочном растворе As-Оз, As-Оз и AseSs могут быть легко восстано-
влены в мышьяковистый водород амальгамой натрия, алюминием1 или спла-
вом Деварда и едким кали. Восстановление протекает очень быстро, и
мышьяковистый водород может быть открыт посредством реакции Гут-.-
цейта (Gutzeit) (стр. 177). Присутствие органических веществ препятствует I.
реакции; 3 мл мочи, в которой был растворен 1 мг As-Оз, не показали и
следов мышьяковистого водорода после обработки в течение нескольких
часов сплавом Деварда и едким кали. В таких случаях органическое ве-
щество должно быть разрушено путем выпаривания с азотной, а затем
с серной кислотами.
Мышьяковистый водород получается также путем растворения неко-
торых мышьяковистых металлов в соляной или серной кислоте:
ZnsAsj + 6НС1 -> 3ZnCh + 2AsHs.
Мышьяковистые соединения железа с трудом поддаются действию
кислот и лишь в присутствии избытка железа выделяют газообразный и
твердый мышьяковистый водород; сернистое железо, содержащее мышьяк,
при действии кислот всегда выделяет сероводород с примесью мышьяко-
вистого водорода.
Соли мышьяковистой кислоты (арсениты), но не мышьяковой (арсе-
наты) могут быть восстановлены в щелочном растворе электролитически.
По Ковелли (Е. Covelli)4 арсениты могут , быть определены этим путем
в присутствии арсенатов.
1 Так, Vanino [Z. angew. Chem. 15, 82 (1902)] посредством олова и
соляной кислоты при обыкновенной температуре не мог определять коли-
честв меньше 2 мг АззОз; даже в присутствии платины нельзя было опре-
делить количества, меиыпне 0,1 мг.
-Bernstein, Inaug.-Dissert. Rostock. 1870.
3 F. Hefti, Inaug.-Dissert-, Zurich 1907.
4 Chem. Ztg. 33, 209 (1909).
174
Некоторые плесневые грибки, а именно Pen'fciilium b'revicaule, обладают
способностью в присутствии следов -мышьяка в питательной среде образо-
вывать летучее соединение—этилкакодилюксид L AsfCzHalaJaO Ч отличаю-
щееся чесночным запахом, что является чрезвычайно чувствительной реак-
цией на мышьяк. Нерастворимые арсенаты в присутствии вышеуказанных
грибков не выделяют этилкакодилоксида1 2.
б) Свойства. Мышьяковистый водород представляет собой бесцветный
с неприятным запахом, чрезвычайно ядовитый газ, который при нагревании
без доступа воздуха разлагается на мышьяк и водород:
4AsHs ->As* + 6Н-2.
При нагревании на воздухе он сгорает в воду и мышьяковистый ан-
гидрид. Иод в твердом состоянии превращает его- в иодистый мышьяк с
образованием йодистого водорода:
АзНз + 3Jz-> AsJs + 3H.J.
Эта реакция происходит
через кристаллический иод.
сероводород#)? мышь-
яковистого водорода,
так как первый не дей-
ствует на твердый иод,
но только на водные
растворы его 3. Серово-
дород не реагирует с
мышьяковистым водо-
родом при обыкновен-
ной температуре, но дей-
ствует при 230°, причем
образуются сернистый
мышьяк и водород.
Мышьяковистый во-
дород является силь-
ным -восстановителем:
серебряные соли вос-
станавливаются им до
металла (стр. 178).
Выполнение реакции
Целесообразно пользо-
ваться прибором, пред-
ставленным на рис. 12
при пропускании мышьяковистого водорода
Этим свойством пользуются для отделения
Рнс. 12.
и описаи-иым Локкема-
иом (G. Lockemann)4.
В колбу К емкостью .приблизительно 100—150 л.7 помешают 6-S? зер-'
неного, содержащего медь цинка и вливают около 20 .«.7- не содержащей
мышьяка 4N серной кислоты. Тотчас начинается энергичное равномерное
выделение водорода, и через 20 мин. воздух вполне вытеснен из прибора.
Зажигают 'выделяющийся ib п водород5, пламя которого достигает 2—3 .и.и
1 В. 47, 2640 (1914).
2 С. I. 1245 (1902).
3Jakobson, В. 20. 1999 (1887). По Политцеру [F. Р о 1 i t z е г.
Z. anorg. Chem. 64, 121 (1909)] действие сухого пода при обыкновенной
температуре едва заметно.
4 Z. angew. Chem. 18, 427 и 491 (1905).
6 Рекомендуется следующий безопасный способ зажигании водорода у
отверстия п. Маленькую пробирку наполняют выделяющимся газом, зажи-
гают последний и медленно приближают пробирку к п. Если газ чист, го
водород в пробирке будет спокойно -гореть некоторое время и газ у п
будет зажжен. Если же газ нечист, то моментально произойдет легкий
взрыв, в результате которого водорода в пробирке не останется, горение
его происходить не будет и газ, выходящий из п, не зажжется.
175
высоты. Во время всего опыта следят за тем, чтобы пламя сохраняло эту
высоту; если оно увеличивается, то колбу К охлаждают, ставя ее в холод-
ную воду; при уменьшении же пламени увеличивают последнее, приливая
в колбу немного серной кислоты- или ставя ее в теплую воду.
Перед каждым опытом необходимо убедиться, что применяемые реак-
тивы (цинк и серная кислота) не содержат мышьяка. Для этого оберну-
тую в медную проволочную сетку трубку из тугоплавкого стекла диамет-
ром 5 Л.к, оттянутую в капилляр, диаметром 1,5—2 м.ч, нагревают в В.
Если через 20 мин. не появляется мышьяковое зеркало в узком капилляре
справа от места нагревания, то это служит признаком чистоты реактивов, и
лишь тогда приступают к испытанию исследуемого вещества на мышьяк.
Исследуемый на мышьяк раствор, содержащий серную кислоту, не дол-
жен содержать органических вещест®, сульфидов, хлоридов, нитратов или
других окислителей. Зажегши под А обе горелки и накалив трубку до
темнокрасного каления, в колбу для разложения К вливают через во-
ронку Т, снабженную делениями, Либо всю исследуемую жидкость, либо
лишь часть ее. смсяря но тому, подозревают ли присутствие большого или
малого количества мышьяка. Выделяющийся из колбы газ проходит через
сушильную трубку С, наполненную гранулированным хлористым каль-
цием ’, и попадает в накаленную трубку А, в которой мышьяковистый во-
дород количественно разлагается на водород и мышьяк. Последний выде-
ляется ® капилляре в виде зеркала. Чтобы сделать границы образующегося
мышьякового зеркала по возможности резкими, на трубку навешивают
ламповый фитиль d, на который постоянно капает вода из чашки /V, снаб-
женной .резиновой трубкой а с зажимом g.
Через час весь мышьяк вытеснен. После этого -гасят пламя и охла-
ждают трубку в токе водорода; количество мышьяка может быть очень
точно определено сравнением полученного зеркала с зеркалами, пригото-
вленными из определенных кс-тичеств мышьяка.
Примечание. Если не нагревать трубку А. а только зажечь выхо-
дящий из п газ и в птамя внести холодную фарфоровую чашку, то на
последней в присутствии мышьяка образуется бурое мышьяковое пятно,
тотчас -исчезающее при смачивании свежим раствором хлорноватистокис-
лого натрия1 2 (отличие от сурьмы).
В таком -виде испытание на мышьяк впервые было предложено Джем-
сом Маршем3 и по его имени оно называется реакцией Марша не мышьяк/
Контрольные пробы. По охлаждении трубки А часть ее с полученным
зеркалом отрезают справа и слева от последнего и вносят ее в наклонном
положении в маленькое пламя (рис. 12); так как воздух проходит через
трубку, то мышьяк сгорает в мышьяковистый ангидрид, распространяю-
щий характерный чесночный запах, ясно чувствуемый у широкого отвер-
стия трубки уже в присутствии 0.01 .иг мышьякового ангидрида. По охла-
ждении трубки трехокись мышьяка осаждается в « в шде октаэдров с ал-
1 Локкеман (ioc. cit.) показал, что газ не следует -сушить хлористым
кальцием, заключенным между двумя пробками из хлопчатобумажной или
стеклянной ваты, так как эти пористые вещества окклюдируют за-метные
количества мышьяковистого водорода.
2 Раствор хлорноватистокислого натрия приготовляют следующим об-
разом. В 1-0 .мл воды растворяют 7 г чистого NaOH и пропускают в рас-
твор хлор ,до тех пор. пока ле получится увеличение веса на 4.4 г. Глав-
ное условие: раствор должен оставаться щелочным. Если раствор содержит
избыточный хлор, то с течением времени он становится кислым и тогда
он растворяет также и сурьмяные пятна. Свежеприготовленные растворы
гиплохлорита (полученные путем обменного разложения -раствора хлорной
извести с Na-СОз и отфильтрования СаСОз) не растворяют сурьмяных
пятен. После долгого стояния на воздухе они действуют растворяющим
образом [Chem.-Zig. 30. 209 (1916)]. Причину этого нужно, вероятно, ви-
деть в том, что при действии СО? воздуха выделяется хлор, который пу-
тем гидролиза распадается па Н-ОС1 и НО, следствием чего и является
кислая реакция раствора.
3 Edinb. New. Philos. Journ., 229 (1386) и Rep. f. d. Fharm., 9, 220(1887).
176
мазным блеском, которые можно распознать при помощи лупы, а часто
даже и невооруженным глазом.
Этих трех данных (металлическое зеркало, чесночный запах при сго-
рании его и образование октаэдров с алмазным блеском) достаточно,
чтобы с уверенностью заключить о присутствии мышьяка. Но чем больше
доказательств, тем надежнее результат. Обнаружив октаэдры,
тонкий конец трубки и вливают в нее посредством капилляра 1—2 капли
смачивают ею кристаллы
Ыаг5
запаивают
концентрированной чистой соляной кислоты;
мышьяковистого ангидрида, прибавляют 6—10
капель дестиллированной воды и пропускают
образуется трехсерни-
сероводород, причем
стый мышьяк.
Вата
н2за4
Рис. 14
Сероводород лучше всего получать из раствора сернистого натрия,
добавляя его к разбавленной серной кислоте, как указано на р.ис. 14.
В верхней части пробирки находится кусок ваты, препятствующей брызгам
жидкости попадать в мышьяковый раствор.
Как иа пример практического применения этого способа укажем на
весьма часто встречающийся случай определения мышьяка в обоях.
2. Способ Гутцейта (Gutzeit)1
Этот'способ основан на реакции мышьяковистого водорода с кон-
центрированным раствором азотнокислого серебра (1 :1) [по Эйдеибеицу
(Eidenbenz) лучше пользоваться азотнокислым серебром в твердом виде].
Сначала азотнокислое серебро окрашивается в желтый, а затем в черный
цвет; при этом происходят следующие реакции; ,
1) 6AgNOs + АзНз AsAg3 . 3AgNOs + 3HNOs; 2
желтого цвета
2) AsAgs • 3AgNOs'+ 3HQH -> НзАзОз + ЗНМОз + 6Ag.
Опыт производят следующим образом. В небольшую пробирку
[рис. 15) вносят незначительное количество испытуемого' вещества, приба-
зляют крупинку не содержащего мышьяка цинка, обливают все разбавлен-
чой серной кислотой и вставляют в верхнюю часть пробирки кусочек
заты, служащей фильтром. Отверстие пробирки покрывают куском фильт-
ровальной бумаги и кладут ня нее кристалл азотнокислого серебра.
В присутствии мышьяка азотнокислое серебро окрашивается в желтый
а затем тотчас в черный цвет.
1 Pharm. Ztg. 263 (1879).
2 В. 19, 2435 (1883).
12 Зак. 082. Тредвелл-Годл, т. I.
177
Эта реакция, часто применяемая для быстрого испытания .продажных
кислот на мышьяк, не так надежна, как способ Беттендорфа (стр. 168),
потому что фосфористый1 и сурьмянистый водород дают с азотнокислым
серебром совершенно аналогичные реакции, между тем как хлористым оло-
вом они не восстанавливаются.
При действии мышьяковистого водорода на разбавленный раствор
азотнокислого серебра не происходит образования желтого соединения
AsAgs • 3AgNO.i. потому что оно тотчас разлагается водой:
AsHa + 6AgNOa ф ЗН2О -> 6HNO3 + НзАзОз + 6Ag.
Если отфильтровать выделившееся серебро и прилить к фильтрату по
стенке пробирки аммиак так, чтобы обе жидкости не смешивались, полу-
чится желтое кольцо мышьяковистого серебра.
выделившееся се-
Эта реакция никогда не протекает количественно;
ребро всегда содержит небольшие количества AsAgs.
Если взять аммиачный раствор
яковистый
однако
мышьяк,
вой кислоты. Но если
щий азотнокислое серебро
аммоний, нагреть до кипения, то мышьяковистая
лота перейдет количественно
с выделением серебра 2:
2Ag- + АзОз'" + ОН'
Вумагаг
Вата
.ГППь—,..
Рис. 15.
сереора, то мышь-
водород будет количественно
выделившееся серебро все еще
а раствор — небольшие количества
аммиачный раствор,
и мышьяковистокислый
кис-
в мышья'ковую кислоту
поглощен;
содержит
мышьяко-
содержа-
->HAsO4" + 2Ag.
каждую молекулу AsHs
При таких условиях на
выделяется 8 атомов Ag:
АзНз + 8Ag' + ИОН'-» AsCh'" + 7LLO + 8Ag.
Отфильтровав выделившееся серебро и осторожно
нейтрализовав фильтрат азотной кислотой, получаю^
бурый осадок мышьяковистого серебра. Ь
Первоначальная реакция Гутцейта видоизменена Флюккигером (Fliicki-
ger) 3 и Леманом (Lehmann) 4; хотя эта модификация реакции менее чув-
ствительна, тем не менее она заслуживает полного внимания.
Флюккигер и Леман действуют мышьяковистым водородом не на
азотнокислое серебро, а па бумагу, пропитанную хлорной ртутью 5 *, при-
чем последняя окрашивается сперва в желтый цвет, а при дальнейшем дей-
ствии мышьяковистого водорода — в бурый в. Состав этого соединения
точно неизвестен. Возможно, что сначала образуется As(HgCl)3, а затем, при
дальнейшем действии АзНз, AsH(HgCl)’ и AsaHgs7:
AsHs + 3HgCl2-> ЗНС1 + As(HgCl)3;
2As(HgCl)3 ф AsHs-» 3AsH(HgCl)2j
As(HgCl).3 + AsHs-» 3HC1 -f- AgsHgs.
1 Продажный цинк часто содержит небольшое количество фосфора.
г R е с k 1 е b е n, Lockemann, Eckhardt, Z. anal. Chem. 45, 671
(1907).
3 Arch. Pharm. [3] 27 (1889).
4 Pharm. Ztg., 36 (1892).
5 Для ее получения фильтровальную бумагу смачивают спиртовым
раствором хлорной ртути, дают спирту испариться и повторяют эту
операцию 4—5 раз.
в А и g u s t Got the If, J. Soc. Chem. Ind. 22, 191 (1903).
7 Полагают, что кроме вышеуказанных соединений существует
AsH2(HgCl). Partheil, Arch. Pharm. 237, 121.
178
Для этих мышьяковистых соединений характерна их нерастворимость'
в 80%-ном спирте.
Сурьмянистый водород в незначительной количестве не дает никакой
окраски, а в несколько большем количестве он образует растворимое в
спирте бурое п^тно. Поэтому, когда наряду с мышьяковистым водоро-
дом имеется и сурьмянистый, присутствие первого узнается путем погру-
жения вырезанного йятна на бумаге в 80%-ный спирт, причем в течение
непродолжительного времени бурое сурьмяное пятно исчезает и явственно
проявляется желтое пятно мыщьяка. Но в присутствии большого количе-
ства сурьмянистого водорода образуется серо-черное пятно, которое при
обработке спиртом уже не исчезает, и в этом случае открытие мышьяка
становится невозможным.
$ 3. Способ Рейиша (Reinsch)
Этот способ очень удобен, хотя не так чувствителен, как преды-
дущие.
При погружении в солянокислый раствор мышьяковистой кислоты
блестящей медной подоски последняя окрашиваемся в серый цв^г вслед-
ствие выделения мышьяка и образования мышьяковистой меди состава
AszCus.
Из концентрированных растворив мышьяк выделяется уже на
холоду, из разбавленных — лишь при нагревании. В присутствии боль-
шого количества мышьяка серая мышьяковистая медь отслаивается от
меди. Так как сурьма из своих растворов также выделяется медью, то
присутствие мышьяка в серой массе должно z быть еще подтверждено
реакцией сухим путем. Мышьяковая кислота-' также восстанавливается
медыр, но только при нагревании. ' '
Реакцию Рейнша часто применяют для открытия мышьяка в обоах.
Нарезанные куски обоев обливают соляной кислотой (1:2) и нагред^ют
вместе с кусочком блестящей медной пластинки; образующееся при этом
серое окрашивание меди указывает на присутствие мышьяка.
Для идентифицирования нагревают посеревшую медную пластинку
в маленькой трубке из тугоплавкого стекла в токе водорода, причем
получается мышьяковое зеркало, которое подвергак^ дальнейшему иссле-
дованию, как описано на стр. 176—7.
Реакции сухим путем
Металлический мышьяк сгорает, распространяя чесночный за-
пах. Аналогично ведут себя все соединения мышьяка, смешанные
с содой и накаленные на угле.
Кислородные соединения мышьяка легко восстанавливаются
в верхнем восстановительном -пламени до „металла. Если непо-
средственно над пробой держать наполненную холодной водой
глазированную снаружи фарфоровую чашку, то пары металла
конденсируются на ней, образуя буро-черный налет, который при
смачивании хлорно-ватистокисдым' натрием тотчас исчезает \ при-
чем мышьяк окисляется в мышьяковую кислоту:
Asj lONaOCl + 6Н2О -HONaCl + 4H3ASO4;
Держа фарфоровую чашку не непосредственно над восстано-
вительным пламенем, а над верхним окислительным пламенем,
получают окисный налет, так как пары мышьяка, сгорая синевато-.
белым пламенем, образуют мышьяковистый ангидрид, осаждаю-
щийся на чашке.
1 Стр. 163.
12* 1»
Этот налет, смоченный (раствором азотнокислого серебра,
дает при действии на него паров аммиака Ag3AsO3, окрашенное
в цвет яичного желтка. Окраска исчезает от прибавления боль-
шего количества ам'миака (отличие от сурьмы):
АзгОз + 6AgNO3 + ЗН->0 -> 2Ag3AsO3 + 6HNO3.
Пары аммиака служат для нейтрализации образовавшейся
азотной кислоты, растворяющей мышьяковистокислое серебро.
В некоторых случаях, когда мышьяк находится в виде трехокиси
мышьяка, очень удобен микрохимический метод Гартвиха (Hartwich) и Тог-
генбурга (Toggenbourg) Исследуемое вещество смешивают с прокаленным
песком, окружают смесь, положенную на часовое стекло, стеклянным
цилиндром диаметром около 12 мм и высотой 10 мм. Верхний и нижний
края последнего должны быть тщательно отшлифованы. Цилиндр накры-
вают гладким покровным стеклом приблизительно в 50 мм1 2. Осторожно
нагревают часовое стекло пламенем микрогорелки. Высота пламени ие
должна превышать 5 мм, и расстояние между ним и часовым стеклом
должно быть равно 30—40 мм. После 10—15-М'инутного нагревания дают
стеклу медленно охлаждаться, после чего исследуют нижнюю поверхность
покровного стекла. Если имеется трехокись мышьяка, она возгоняется и
собирается на покровном стекле в виде красивых правильных октаэдров,
форма которых отчетливо видна под микроскопом. Уже при наличии
0,01 мг мышьяка можно получить видимые под микроскопом кристаллы.
Возгон может быть после этого идентифицирован также и реакцией
с серебром.
Сурьма Sb. Ат. в. 121,76. Ат. н. 51
Плотность 6,7. Т. пл. 630°. Т. кип. 1440°.
Нахождение в природе. Сурьма редко встречается в природе в само-
родном состоянии, хотя в последнее время в Австралии найдены значи-
тельные количества этого металла. Важнейшие соединения ее, так же как
и мышьяка, — сернистые соединения. Стибнит (сурьмяный блеск) БЬгЗз,
кристаллизующийся в ромбической системе; сурьмяная обманка SbsOSa,
или сероюкись сурьмы, — вещество, которое легко образуется при осажде-
нии сурьмы из водного раствора сероводородом.
Из кислородных соединений назовем диморфную трехокись сурьмы,
кристаллизующуюся в виде сенармонтита в правильной системе и в ром-
бической системе в виде валентинита и цервантита SbaOi. Далее, сурьма
встречается в многочисленных сульфосолях, из которых можно указать на
трехосновную сульфосеребряную соль сурьмы, или темную серебряную
руду AgsSbSs.
Сурьма применяется, главным образом для приготовления сплавов:
типографского металла, баббита, аккумуляторных пластинок и пр. Соеди-
нения сурьмы находят широкое применение. Так, сульфид SbaSs применяется
в качестве краски, а многие другие ее соединения используются в меди-
цине.
Сурьма представляет собой серебристобелый хрупкий металл. На воз-
духе она легко сгорает в трехокись сурьмы. Растворителем для сурьмы
является царская водка, причем она превращается в треххлористую или
пятихлористую сурьму. Азотная кислота действует на сурьму, превращая
ее в SbsCh, слегка растворимую в концентрированной, но не растворимую
в разбавленной кислоте. Сурьма легко растворяется в смеси азотной и вин-
ной кислот и в смеси соляной кислоты и брома
1 Schweiz, Wochenschrift f. Chem. u. Pharm. (1909), № 52.
2 Сурьма растворяется также в смеси соляной кислоты и перекиси
водорода. См. Salkowski, Z. anal. Chem. 56, 54 (1917). РеД,
180
Сурьма образует три окисла: трехокись сурьмы SbsOs, пятиокись
сурьмы SbaOs и четырехокись сурьмы Sb»O?, которая может рассматри-
ваться как антимонат трехвалентной сурьмы, химически весьма индифе-
рентное вещество. Трехокись сурьмы обыкновенно проявляет основные
свойства; пятиокись — обладает больше характером кислотного ангидрида.
А. Соединения трехвалентной сурьмы
При сгорании металла на воздухе получается трехокись, которая при
более сильном прокаливании на воздухе превращается в индиферентное
вещество SbaOi.
Трехокись растворяется в концентрированной соляной кислоте, образуя
треххлористую сурьму SbCla, — соединение, которое (подобно хлористому
висмуту) при действии воды легко превращается в основную соль; состав
последней зависит от концентрации реагирующих веществ: так, известна
хлорокись сурьмы SbOCl белого цвета:
SbС1з + Н2о -» 2НС1 + SbOCl.
В присутствии большого количества воды образуется также некоторое
количество трехокиси сурьмы:
2SbOCl + Н2О * 2НС1 + StsO?.
Смесь хлористого антимонила и трехокиси сурьмы известна под назва-
нием «альгаротова» порошка SbsOa • 2SbOCl. При кипячении с большим
количеством воды получается лишь одна окись.
Трехокись сурьмы образует три гидроокиси, ведущие себя, как слабые
кислоты: ортосурьмянистая НзБЬОз; пиросурьмянистая кислота HiSbaOs и
гипотетическая мегасурьмянистая кислота HSbOz.
Соли метасурьмянистсй кислоты известны, хотя сама свободная кислота
никогда не была изолирована.
Окись SbsOs при кипячении с концентрированными едкими щелочами
переходит в раствор, но при разбавлении большим количеством горячей
воды 8Ь»Оз снова выделяется. Если горячий раствор отфильтровать, то
из фильтрата при охлаждении выделяются кристаллы квадратной системы
NaSbOz. Но они очень неустойчивы и разлагаются при стоянии на воздухе
на углекислый натрий и трехокись сурьмы. При растворении трехокиси
сурьмы в крепком растворе едкой щелочи образуется, вероятно, сначала
ортссурьмянистокислая соль:
SbsOs + 6ОН'-> 2SbOs'" + ЗН2О,
которая при разбавлении гидролитически расщепляется Hai метасурьмя-
, нистокислую соль и гидроокись щелочного металла;
SbOs'" + Н-0 -» 2ОН' + SbOz'.
При дальнейшем разбавлении водой метасурьмянистая соль разлагается
на трехокись и едкую щелочь. Таким' образом, если прибавить к раствору
треххлористой сурьмы едкую щелочь или карбонат щелочного металла, то
происходит почти количественное осаждение SbaCh:
2SbC13 + 6NaOH -» 6NaCl + 3H2O + SbsOs;
2SbCls + 3Na2COs-> 6NaCl + ЗСО2 + SbsOs.
Хлорокись сурьмы SbOCl содержит одновалентную группу SbO, когбрую
называют антимонилом.
1S1
Таким образом, хлорокись сурьмы можно рассматривать как хлорид
антимонила. Известны также нитрат БЬО(МОз) и сульфат антимонила
(SbO)aSO4. Все эти соединения, легко гидролизующиеся на окись и кислоту,
редко встречаются в ходе анализа, за исключением хлорида антимонила.
ЭВачительно большей устойчивостью отличаются соединения антимо-
нила некоторых органических кислот (например, вийной кислоты).
При кипячении трехокиси сурьмы с раствором кислого тартрата (вин-
нокислого) ка.Тия. происходит растворение трехокиси с образованием так
называемого рвотного камщй:
2KHGH40e + Sb2Os-> НгО + 2K(Sb0)C4H4Oe,
который относителыно растворим в воде: 100 г воды растворяют 5,3 г при
8,7°; 7,9 г при 2Г“; 12,2 при 31е; 18,2 г при 5СЕ и 31.2 г при 75°.
Не только окись сурьмы ЗЬгОз, но и все соединения антимонила обра-
зуют комплексный анион с винной кислотой или с ее солью, тартратом;
так, хлористый антимонил растворяется в виннокислом калии — натрии
(соль Рошеля) или в ййнной Кислоте:
С4Н40о" + SbOCl -» СГ+ [(SbO)C4H,O«]/;
НзС4Н4Ов + SbOCl -> НС1 + H[(SbO)C4H4Oe],
Рвотный камень K(SbO)C4H4Oe является наиболее важным продажным
соединением сурьмы. Поэтому следует несколько остановиться на его от-
ношении к кислотам:.
Если на водный раствор тартрата антимонилкалия подействовать соля-
ной кислотой, то выделяется белый осадок хлорида антимонила:
K(SbO)C4H4Oe + 2Н- + С1'-> НгСтНтОв + К' + SbOCl,
который легко растворяется в избытке соляной кислоты:
SbOCl + 2НС1 НгО + SbCk,
но от прибавления воды снова выпадает и т, д.
Серная и азотная кислоты осаждает ортосурьмянистую кислоту из
раствора тартрата антимонилкалия, потому что образующееся сначала со-
единение антимонила тотчас же разлагается водой:
[(SbO)C4H4Oe]' + Н- -р2НгО -> НгС4Н40в + НзЗЬОз.
Вода, прибавленная к раствору, содержащему сурьму, обыкновенно
осаждает сурьмянистую кислоту или основную соль. При кипячении
раствора сурьмы любой валентности с азотЛЯй кислотой и после выпари-
вания почти досуха вся сурьма может быть осаждена в .вйде окиси. Если
последнюю отфильтровать и прокалить, то получается продукт, точно от-
вечающий формуле Sb-Cu. который можно рассматривать как антимонат
трехвалентной сурьмы. Винная кислота препятствует гидролизу.
Реакции мокрым путем
1. Сернистый водород осаждает из не слишком кислых рас-
творов хлопьевидный оранжево-красный трисульфид сурьмы:
2Sb”‘ +3H2S-> 6Н’ + Sb2S3.
Как помазывает уравнение, трисульфид сурьмы находится в равно-
весии с водородными ионами; в 12W кислоте он легко растворим (отли-
чие от мышьяка). С другой стороны, сульфид сурьмы менее растворим
в кислоте, чем сульфид олова; OTi может быть осажден из 2/V раствора
кислоты. Сульфиды низших степеней валентности как олова, так и сурьмы
несколько более растворимы, чем сульфиды высших степеней валентности
этих металлов. Если раствор сурьмы в концентрированной соляной кислоте
перед обработкой сернистым водородом разбавить водой, то может обра-
зоваться осадок SbOCl. Это, однако, не имеет значения, так как серни-
182
стый водород 'превращает хлористый антимонил в менее растворимый три-
сульфид. Если хотят осадить сульфид без предварительного образования
хлористого антимонила, то .перед разбавлением водой раствор должен быть
насыщен сернистым водородом, после чего раствор разбавляют и снова
насыщают сернистым водородом.
При нагревании оранжевой трехсернистой сурьмы в атмосфере инди-
ферентного газа (СО») образуется черная трехсернистая сурьма. При
обжиге на воздухе получается четырехокись Sb»Od.
При прокаливание Sb’Ss с нитратом натрия получают сульфат натрия
и пиросурьмянокислую соль. При нагревании в токе хлора или со смесью
из 5 ч. хлористого, аммония и 1 ч. нитрата аммония сурьма превращается
в хлорид, который летуч, хотя и менее, чем соответствующее соединение
мышьяка.
Трехсернистая сурьма растворяется в сернистом аммонии,
образуя растворимую тиосоль:
Sb2S3 + 3S" -> 2SbSs'"..
Триаммоииевая соль не была изолирована; V твердом состоянии из-
вестна только моносоль NHiSbSi (г. е. солу метатиосурьмянистой
кислоты HSbS»). Но в растворе, особенно же в присутствии большого из-
бытка сернистого аммония, вероятно, находится SbSs'''-ион1.
В желтом сернистом аммонии трехсернистая сурьма раство-
ряется, образуя соли сртотиосурьмяной и метатиосурьмяной
кислот:
Sb2S3 + 2(NHi)2S2 -> (NHOsSbSi + NHiSbS3.
Если раствор тиосурьмянистокислого аммония кипятить продолжи-
тельное время на воздухе, то часто осаждается окрашенный в красный
цвет оксисульфид (сероокись сурьмы, «сурьмяная киноварь»):
2i NHi)sSbS3 ф 40 г -> 2(NH«)»S».0s + 2NHs'+ НгО + SE-StO,
который при нагревании с сернистым аммонием снова растворяется, обра-
зуя тиосоль.
Эта сероокись сурьмы образуется также при кипячении хлористой
сурьмы с тиосульфатом натрия:
2Sb' • * + 38»Оз" -> 4SO2 + Sb-SaO.
Трехсернистая сурьма растворяется также в едкрм кали или натре
с образованием тио- и окситиосолей:
SbzSa + 20Н' -> НгО + SbOS' + SbS2'.
Эти тиосоли разлагаются кислотами, причем осаждается три-
сульфид и выделяется сернистый водород:
2SbS3"' + 6Н’ -+ 3H2S + Sb2S3;
SbOS' + SbS2' + 2Н’ -> Н20 + Sb2S3;
2SbS4"' + 6Н- 3H2S 4- Sb2S5.
При кипячении сернистой сурьмы в едком кали или в сульфиде щелоч-
ного металла с окисью висмута образуются нерастворимый сульфид висмута
и растворимый антимонит:
ВЬОз -f- SbSa'" -> BiaSa SbOa'".
Если кипятить раствор щелочного антимонита с окисью меди, то обра-
зуется смесь нерастворимых сульфидов одно- и двухвалентной меди и рас-
творимый антимонат:
4CuO 4- SbSa'" -г- SbOi " 4- CuiS 4- 2CuS.
183
Росфорная кислота, как мы позже увидим, относится к магниевым
солям и молибденовокислому аммонию точно так же, как и мышьяковая
кислота. Поэтому при одновременном присутствии в растворе фосфорной и
мышьяковой кислот сначала осаждают мышьяк сероводородом в виде
сернистого соединения, фильтруют и окисляют сернистый мышьяк дымя-
щей азотной кислотой в мышьяковую кислоту. Образование осадка в та-
ком растворе посредством молибденовокислого аммония может быть те-
перь вызвано исключительно мышьяковой кислотой; получающийся же
желтый осадок от прибавления молибденовокислого аммония к фильтрату
от сернистого мышьяка, по удалении сероводорода, указывает на присут-
ствие фосфорной кислоты.
5. Йодистый калий в растворе, сильно подкисленном соляной
кислотой, восстанавливает мышьяковую кислоту и выделяет иод
(стр. 167):
Нз AsOi 4-5Н ’ + 2Jr-> As’•+ 4Н2О + J4.
Эта реакция протекает количественно, если удалять иод тиосуль-
фатом, но в отсутствии кислоты и в (присутствии избытка
ЙаНСОз реакция протекает количественно в обратном напра-
влении.
6. Сернокислая медь не дает осадка с мышьяковой кислотой,
но если прибавить немного едкой щелочи, то образуется сине-
вато-зеленый арсенат двухвалентной меди, который окрашивается
,в красивый бледносиний цвет при дальнейшем добавлении едкой
щелочи, но не растворим в ее избытке.
7. Тиоацетат аммония и тиосульфат натрия дают с мышьяковой кис-
лотой такие же осадки, какие 'получаются и с мышьяковистой кислотой.
8. Концентрированная соляная кислота и хлористое железо
образуют летучий треххлористый мышьяк:
HsAsOi 4- 2FeCh 4- 5НС1-> AsCh 4- 2FeCl3 4- 4НгО.
Можно пользоваться и любой другой растворимой солью
двухвалентного железа или другим восстановителем, например
однохлористой медью, иодистым или бромистым калием и даже
сернистым водородом. После восстановления весь мышьяк мо-
жет быть удален .путем перегонки в токе хлористого водорода.
Вместо соляной кислоты можно пользоваться бромистоводородной кис-
лотой, и так как последняя является восстановителем, то нет необходи-
мости в добавлении другого восстановителя. Так, например, если 1 г твер-
дого вещества кипятить с 10 мл 9N раствора НВг, то практически весь
мышьяк перетопится в виде AsBrs, когда в сосуде для разложения оста-
нется лишь 3 мл жидкости. Если дестиллат пропускать в бромную воду,
то получается раствор мышьяковой кислоты:
AsBrs + Вг2 + 4Н2О -> HsAsOs + 5НВг.
При аналогичных условиях летучи также селен и галлий в виде SeBn
и СаВгз.
* Дополнение редактора. 9. Молибденовокислый аммоний и хлористое
олово. Во всех случаях восстановления молибдена реакция приводит сна-
чала к продукту, окрашенному в синий цвет (так называемая молибдено-
вая синь, вероятно MoaOs), и заканчивается образованием продуктов низ-
шей степени окисления, окрашенных от бурого до желтого цвета. Однако
в присутствии фосфорной или мышьяковой кислоты восстановление Мо не
идет дальше образования молибденовой сини.
172
На этом Файгль ’ основал следующую реакцию на мышьяк. К иссле-
дуемой пробе приливают .несколько капель насыщенного на холоду рас-
твора (NHOsMoO*, затем избыток солянокислого раствора SnCh и нагре-
вают. Если мышьяк отсутствует, то появляющееся вначале синее окраши-
вание совершенно исчезает и раствор становится желтым или бурым. На-
против, в присутствии мышьяка эта синяя окраска раствора сохраняется
и интенсивность ее зависит от содержания мышьяка.
Этой прекрасной реакцией можно пользоваться только в отсутствие
фосфорной, кремневой и вольфрамовой кислот. Кроме того, необходимо,
чтобы мышьяк находился в виде мышьяковой кислоты. Так как при си-
стематическом ходе анализа мышьяк выделяется в виде AsaSs. то послед-
ний превращают в мышьяковую кислоту растворением его в царской водке
или, что еще лучше, в аммиачном растворе НгОз. При очень малых коли-
чествах мышьяка синяя окраска может быть замаскирована окрашенными
в бурый цвет низшими продуктами .восстановления молибдена-. В этом
случае мышьяк удается открыть путем взбалтывания раствора с амиловым
алкоголем, в котором молибденовая синь растворяется. По своей чувстви-
тельности -реакция превосходит -все вышеописанные и ею можно открыть
мышьяк в концентрации 0,001 мг/л. * А. К.
В. Реакции, общие для всех соединений мышьяка
1. Реакция Марша (Marsh) -
Все соединения мышьяка в кислом растворе восстанавливаются метал-
лическим цинком до мышьяковистого водорода AsH.-g
AsCh'" + 3Zn + 9Н’ -» 3Zn' ’ + З'НзО + AsHs;
AsOC" + 4Zn + 11H* 4Zn' ‘ + 4НЮ + AsHs;
As' ‘ • + 3Zn + 3H- 3Zn‘ • + AsH,.
Восстановление сернистых соединений мышьяка совершается медленно,
окислов же, даже при обыкновенной температуре, — быстро. В качестве
восстановителя применяют цинк с серной кислотой.
Образующийся -весьма ядовитый бесцветный мышьяковистый водород
обладает одним свойством, которое дает -нам возможность с уверенностью
открывать ничтожнейшие следы мышьяка, а именно до 0,7 у. При
пропускании через накаленную, наполненную водородом стеклянную трубку
мышьяковистый водород разлагается на водород и металлический мышьяк,
который отлагается -на стенках трубки вокруг нагреваемой ее части в виде
буро-че-рного зеркала.
Эта реакция необычайно чувствительна и должна производиться
с величайшей осторожностью. Так как продажные реактивы, особенно цинк
и серная кислота, часто содержат незначительные следы мышьяка, то при
применении их легко -впасть в ошибку, обнаруживая присутствие мышьяка
даже в том случае, когда исследуемая проба совершенно -не содержит его.
Способ Марша или его видоизменения применяют для открытия таких
малых количеств мышьяка, которые уже не поддаются определению при
помощи вышеприведенных реактивов, как, например, в случаях отравления
и для открытия мышьяка в обоях.
Образование и свойства мышьяковистого водорода
а) Образование. Мышьяковистый водород, как уже было указано, по-
лучается путем восстановления мышьяковых соединений. В качестве вос-
становителей применяют совершенно чистые цинк и серную кислоту. При
пользовании другими металлами и- кислотами (например, оловом и соля-
1 Feigl u. Neuber, Z. anal. Chem. 62, 369 (1923).
- Z. angew. Chem. 18, 416 (1S05); Chem.-Zig. 36. 1465 (1912), а также
микрохимическое выполнение реакции по В i 11 е t е г u. М а г f а г t, Helv.
Chem. acta 6, 771 (1923). Ред.
173
г:ой кислотой, железом и серной кислотой) мышьяковые соединения хотя
также восстанавливаются в мышьяковистый водород, но часть их (именно
при .применении железа) превращается в твердый мышьяковистый водород,
остающийся в колбе, в которой производят восстановление, и поэтому
ускользающий от определения.
При применении олова и соляной кислоты восстановление проходит
полностью только при повышенной температуре *, между тем как восста-
новление цинком и серной кислотой идет при обыкновенной температуре
до конца. Химически чистый цинк почти совсем не растворяется в хими-
чески чистой разбавленной серной кислоте; поэтому необходимо активи-
ровать его посредством какого-либо постороннего металла. Прибавление
капли раствора платинохлористоводородной кислоты вызывает сначала
энергичное выделение водорода, которое, однако, скоро уменьшается и уже
болыце -не ускоряется от повторного прибавления платины. Кроме того,
прибавление платинохлористоводородной кислоты имеет тот недостаток,
что значительные количества мышьяка удерживаются платиной; этим ме-
тодом уже невозможно обнаруживать количество АззОз меньше 5
Значительно лучших результатов достигают посредством сплавов цинка
с платиной; так, Гефти (Hefti)1 * 3, пользуясь сплавом, содержавшим 10%
платаны, нашел, что выделение водорода равномерно и длительно ускоря-
лось и что платиной удерживалось значительно меньшее количество
мышьяка. Таким путем можно находить As»Os в количествах до 0,5 у.
Еще лучшим активирующим материалом является медь, применяемая в виде
ее сплава с цинком. Этот сплав приготовляют следующим образом. 20 г
химически чистого, свободного от мышьяка цинка расплавляют в неболь-
шом тигле; в жидкий металл вносят небольшое количество чистой меди,
после чего, выливая металл в воду, подвергают его грануляции. Необхо-
димо следить, чтобы окисный слой, поскольку возможно, оставался цели-
ком в тигле. При помощи такого сплава и 15%-ной серной кислоты полу-
чают длительное равномерное выделение газа и удается определять до
0,25 7 AsaOa.
В щелочном растворе As_>O.i, АззОз и AsjSs могут быть легко восстано-
влены в мышьяковистый водород амальгамой натрия, алюминием’ или спла-
вом Деварда и едким кали. Восстановление протекает очень быстро, и
мышьяковистый водород может быть открыт посредством реакции Гут-
цейта (Gutzeit) (стр. 177). Присутствие органических веществ препятствует
реакции; 3 .ил мочи, в которой был растворен 1 мг АззОз, не показали и
следов мышьяковистого водорода после обработки в течение нескольких
часов сплавом Деварда и едким кали. В таких случаях органическое ве-
щество должно быть разрушено путем выпаривания с азотной, а затем
с серной кислотами.
Мышьяковистый водород получается также путем растворения неко-
торых мышьяковистых металлов в соляной или серной кислоте:
Zn3As2 + 6НС1 -э- 3ZnCh + 2АзНз.
Мышьяковистые соединения железа с трудом поддаются действию
кислот и лишь в присутствии избытка железа выделяют газообразный и
твердый мышьяковистый водород; сернистое железо, содержащее мышьяк,
при действии кислот всегда выделяет сероводород с примесью мышьяко-
вистого водорода.
Соли мышьяковистой кислоты (арсениты), по не мышьяковой (арсе-
наты) могут быть восстановлены в щелочном растворе электролитически.
По Ковелли (Е. Covelli)4 арсениты могут быть определены этим путем
в присутствии арсенатов.
1 Так, Vanino [Z. angew. Chem. 15, 82 (1902)] посредством олова и
соляной кислоты при обыкновенной температуре не мог определять коли-
честв меньше 2 .иг АззОз; даже в присутствии платины нельзя было опре-
делить количества, меньшие 0,1 .иг.
4 Bernstein, Inaug.-Dissert. Rostock. 1870.
3 F. Hefti, Inaug.-Dissert., Ziirich 1907.
4 Chem. Ztg. 33, 209 (1909).
174
Некоторые плесневые грибки, а именно Penlcillium b'revicaule, обладтют
способностью в присутствии следов мышьяка в питательной среде образо-
вывать летучее соединение—этилкакоди.токсид 1 As(CrHs)shOотличаю-
щееся чесночным запахом, что является чрезвычайно чувствительной реак-
цией на мышьяк. Нерастворимые арсенаты в присутствии вышеуказанных
грибков не выделяют этилкакодилоксида1 2 *.
б) Свойства. Мышьяковистый водород представляет собой бесцветный
с неприятным запахом, чрезвычайно ядовитый газ, который при нагревании
без доступа воздуха разлагается на мышьяк и водород:
4АзНз -> As< + 6Н2.
При нагревании на воздухе он сгорает в воду и мышьяковистый ан-
гидрид. Иод в твердом состоянии Превращает его в иодистый мышьяк с
образованием йодистого водорода:
AsHa + 3Jj-> AsJs + 3HJ.
Эта реакция происходит
через кристаллический иод.
сероводорода от мышь-
яковистого водорода,
так как первый не дей-
ствует на твердый иод,
но только на водные
растворы его 5. Серово-
дород не реагирует с
мышьяковистым водо-
родом при обыкновен-
ной температуре, но дей-
ствует при 230°, причем
образуются сернистый
мышьяк и водород.
Мышьяковистый во-
дород является силь-
ным восстановителем:
серебряные соли вос-
станавливаются им до
металла (стр. 178).
Выполнение реакции
Целесообразно пользо-
ваться прибором, пред-
ставленным на рис. 12
и описанным Локкема-
ном (G. Lockemann)4.
при пропускании мышьяковистого водорода
Этим свойством пользуются для отделения
1(10—150 мл помешают 6-8 ? зер-‘
В колбу К емкостью приблизительно
неного, содержащего медь цинка и вливают около 20 л,г не содержащей
мышьяка 4N серной кислоты. Тотчас начинается энергичное равномерное
выделение водорода, и через 20 мин. воздух вполне вытеснен из прибора.
Зажигают выделяющийся ib п водород5, пламя которого достигает 2—3 л.в
1 В. 47, 2640 (1914).
- С. I. 1245 (1902).
’Jakobson, В. 20. 1999 (1887). По Политцеру [F. Politz.er,
Z. anorg. Chem. 64, 121 (1909)] действие сухого иода при обыкновенной
температуре едва заметно.
4 Z. angew. Chem. 18, 427 и 491 (1905).
6 Рекомендуется следующий безопасный способ зажигания водорода у
отверстия п. Маленькую пробирку наполняют выделяющимся газом, зажи-
гают последний и медленно приближают пробирку к п. Если газ чист, то
водород в пробирке будет спокойно гореть некоторое время и газ у п
будет зажжен. Если же газ нечист, то моментально произойдет легкий
взрыв, в результате которого водорода в пробирке не останется, горение
его происходить не будет и газ, выходящий из п, не зажжется.
175
высоты. Во время всего опыта следят за тем, чтобы пламя сохраняло эту
высоту; если оно увеличивается, то колбу К охлаждают, ставя ее в холод-
ную воду; при уменьшении же пламени увеличивают последнее, приливая
в колбу немного серной кислоты или ставя ее в теплую воду.
Перед каждым опытом необходимо убедиться, что применяемые реак-
тивы (цинк и серная кислота) не содержат мышьяка. Для этого оберну-
тую в медную проволочную сетку трубку из тугоплавкого стекла диамет-
ром 5 -и.к, оттянутую в капилляр, диаметром 1,5—2 .н.п, нагревают в В.
Если через 20 мин. не появляется мышьяковое зеркало в узком капилляре
справа от мест нагревания, то это служит признаком чистоты реактивов, и
лишь тогда приступают к испытанию исследуемого вещества иа мышьяк.
Исследуемый на мышьяк раствор, содержащий серную кислоту, не дол-
жен содержать органических веществ, сульфидов, хлоридов. Нитратов или
других окислителей. Зажегши под А обе горелки и накали® трубку до
темнокрасного каления, в колбу для разложения К вливают через во-
ронку Т, снабженную делениями, Либо всю исследуемую жидкость, либо
лишь часть ее. смотря по тому, подозревают ли присутствие большого или
малого количества мышьяка. Выделяющийся из колбы газ проходит через
сушильную трубку С, наполненную гранулированным хлористым каль-
цием !, и попадает в накаленную трубку А. в которой мышьяковистый во-
дород количественно разлагается на водород и мышьяк. Последний выде-
ляется в капилляре в виде зеркала. Чтобы сделать границы образующегося
мышьякового зеркала по возможности резкими, на трубку навешивают
ламповый фитиль d, на который постоянно капает вода из чашки N, снаб-
женной резиновой трубкой s с зажимом g.
Через час весь мышьяк вытеснен. После этого гасят пламя и охла-
ждают трубку в токе водорода; количество мышьяка может быть очень
точно определено сравнением полученного зеркала с зеркалами, пригото-
вленными из определенных количеств мышьяка.
Примечание. Если -не нагревать трубку А, а только зажечь выхо-
дящий из п газ и в тамя внести холодную фарфоровую чашку, то на
последней .в присутствии мышьяка образуется бурое мышьяковое пятно,
тотчас исчезающее при смачивании свежим раствором хлорноватистокис-
лого натрия'1 2 (отличие от сурьмы).
В таком виде испытание на мышьяк впервые было предложено Джем-
сом Маршем3 и по его имени оно называется реакцией Марша на мышьяк
Контрольные пробы. По охлаждении трубки А часть ее с полученны»
зеркалом отрезают справа и слева от последнего и вносят ее в наклонное
положении в маленькое пламя (рис. 13); так как воздух проходит чере:-
трубку, то мышьяк сгорает в мышьяковистый ангидрид, распространяю
щий характерный чесночный запах, ясно чувствуемый у широкого отвер
стия трубки уже в присутствии 0.01 ты мышьякового ангидрида. По охла
ждеиии трубки трехокись мышьяка осаждается в « в -виде октаэдров с ал
1 Локкеман (loc. cit.) показал, что газ -не следует сушить хлористым
кальцием, заключенным между двумя пробками из хлопчатобумажной или
стеклянной ваты, так как эти пористые вещества окклюдируют заметные
количества мышьяковистого водорода.
2 Раствор хлорноватистокислого натрия приготовляют следующим об-
разом. В 10 л.? воды растворяют 7 г чистого NaOH и пропускают в рас-
твор хлор до тех пор, пока не получится увеличение веса на 4.4 г. Глав-
ное условие: раствор должен оставаться щелочным. Если раствор содержит
избыточный хлор, то с течением времени он становится кислым и тогда
о-н растворяет также i: сурьмяные пятна. Свежеприготовленные растворы
гип.тохлорита (подученные путем обменного разложения раствора хлорной
извести с Na»COs и отфильтрования СаСОз) не растворяют сурьмяных
пятен. После долгого стояния на воздухе они действуют растворяющим
образом iChem.-Zig. 30. 209 (1916)]. Причину этого нужно, вероятно, ви-
деть в том, что при действии СО? воздуха выделяется хлор, который пу-
тем гидролиза распадается па НОС1 и НО, следствием чего и является
кислая реакция раствора.
3 Edinb. New. Philos, Journ., 229 (1886) и Rep. f. d- Fharm-, 9, 220(188/).
176
мазным блеском, которые можно распознать при помощи лупы, а часто
даже и невооруженным глазом.
Этих трех данных (металлическое зеркало, чесночный запах при сго-
рании его и образование октаэдров с алмазным блеском) Достаточно,
чтобы с уверенностью заключить о присутствии мышьяка. Но чем больше
доказательств, тем надежнее результат. Обнаружив октаэдры, запаивают
тонкий конец трубки и вливают в нее посредством капилляра 1—2 капли
концентрированной чистой соляной кислоты;
мышьяковистого ангидрида, прибавляют 6—10
капель дестиллированиой воды и пропускают
сероводород, причем образуется трехсерии-
стый мышьяк.
смачивают ею кристаллы
Рис. 14.
Сероводород лучше всего получать из раствора сернистого натрия,
добавляя его к разбавленной серной кислоте, как указано на рис. 14.
В верхней части пробирки находится кусок ваты, препятствующей брызгам
жидкости попадать в мышьяковый раствор.
Как на пример практического применения этого способа укажем на
весьма часто встречающийся случай определения мышьяка в обоях.
2. Способ Гутцейта (Gutzeit)1
Этот способ основан на реакции мышьяковистого водорода с кон-
центрированным раствором азотнокислого серебра (1 :1) [по Эйденбенцу
(Eidenbenz) лучше пользоваться азотнокислым серебром в твердом виде].
Сначала азотнокислое серебро окрашивается в желтый, а затем в черный
цвет; при этом происходят следующие реакции; ,
1) 6AgNO3 + AsHs AsAg3. 3AKNOs + 3HNOs; 2
желтого цвета
2) AsAgs . 3AgNOs + 3HOH -> HsAsOs + 3HNOs + 6Ag.
Опыт производят следующим образом. В небольшую пробирку
(рис. 15) вносят незначительное количество испытуемого ’ вещества, приба-
вляют крупинку не содержащего мышьяка цинка, обливают все разбавлен-
ной серной кислотой и вставляют в верхнюю часть пробирки кусочек
ваты, служащей фильтром. Отверстие пробирки покрывают куском фильт-
ровальной бумаги и кладут на нее кристалл азотнокислого серебра.
В присутствии мышьяка азотнокислое серебро окрашивается в желтый
и затем тотчас в черный цвет.
1 Pharm. Ztg. 263 (1879).
2 В. 19, 2435 (1883).
12 Зак. 983. Тредаелл-Годл, т. I.
177
Эта реакция, часто применяемая для быстрого испытания продажных
кислот на мышьяк, не так надежна, как способ Беттендорфа (стр. 168),
потому что фосфористый1 * и сурьмянистый водород дают с азотнокислым
серебром совершенно аналогичные реакции, между тем как хлористым оло-
вом они не восстанавливаются.
При действии мышьяковистого водорода на разбавленный раствор
азотнокислого серебра не происходит образования желтого соединения
AsAgs • 3AgNOs. потому что оно тотчас разлагается водой:
AsHa + 6AgNOs + ЗИЮ -» 6HNO? 4- HsAsOa ф 6Ag.
Если отфильтровать выделившееся серебро и прилить к фильтрату по
стенке пробирки аммиак так, чтобы обе жидкости не смешивались, полу-
чится желтое кольцо 'мышьяковистого серебра.
Эта реакция никогда не протекает количественно; выделившееся се-
ребро всегда содержит небольшие количества AsAga.
Если взять аммиачный раствор серебра, то мышь-
яковистый водород будет количественно поглощен;
однако выделившееся серебро все еще содержит
мышьяк, а раствор — небольшие количества мышьяко-
вой кислоты. Но если аммиачный раствор, содержа-
щий азотнокислое серебро и мышьяковистокислый
аммоний, нагреть до кипения, то мышьяковистая кис-
лота перейдет количественно в мышьяковую кислоту
с выделением серебра
2Ag' + AsOs'" + ОН' ->HAsOi" + 2Ag.
При таких условиях на каждую молекулу АЛЛ
выделяется 8 атомов Ag:
АзНз 4- 8Ag’ -f- 11ОН'-> AsO-i"' 4- 7НзО 4- 8Ag.
5/мага
Вата.
Рис. 15.
Отфильтровав выделившееся серебро и осторожно
нейтрализовав фильтрат азотной кислотой, получают
бурый осадок мышьяковистого серебра.
Первоначальная реакция Гутцейта видоизменена Ф.тюккигером (Fliicki-
ger) 3 и Леманом (Lehmann) 4; хотя эта модификация1 реакции менее чув-
ствительна, тем не менее она заслуживает полного внимания.
Флюккигер и Леман действуют мышьяковистым водородом не на
азотнокислое серебро, а на бумагу, пропитанную хлорной ртутью 5, при-
чем последняя окрашивается сперва в желтый цвет, а при дальнейшем дей-
ствии мышьяковистого водорода — в бурый 6 7. Состав этого соединения
точно неизвестен. Возможно, что сначала образуется As(HgCl)s, а затем, при
дальнейшем действии AsHs, AsH(HgCl)s и AsaHgs
AsH.3 + 3HgCh-> ЗНС1 + As(HgCl)3;
2As(HgCl)3 4- AsHs-> 3AsH(HgCl)2;
As(HgCl).3 4- AsH.3-> 3HC1 4- A&Hgs.
1 Продажный цинк часто содержит небольшое количество фосфора-
’Reckleben, Lockemann, Eckhardt, Z. anal. Chem. 45, 671
(1907).
3 Arch. Pharm. [3] 27 (1889).
4 Pharm. Ztg., 36 (1892).
E Для ее получения фильтровальную бумагу смачивают спиртовым
раствором хлорной ртути, дают спирту испариться и повторяют эту
операцию 4—5 раз.
с August G о 11 h е 1 f, J. Soc. Chem. Ind. 22, 191 (1903).
7 Полагают, что кроме вышеуказанных соединений существует
AsH2(HgCl). Partheil, Arch. Pharm. 237, 121.
178
Для этих мышьяковистых соединений характерна их нерастворимость'
в 80%-ном спирте.
Сурьмянистый водород в незначительном количестве не дает никакой
окраски, а в несколько большем количестве он образует растворимое в
спирте бурое гщтно. Поэтому, когда наряду с мышьяковистым водоро-
дом имеется и сурьмянистый, присутствие первого узнается путем погру-
жения вырезанного йятна на бумаге в 80%-ный спирт, причем в течение
непродолжительного времени бурое сурьмяное пятно исчезает и явственно
проявляется желтой пятно мышьяка. Но в присутствии большого количе-
ства сурьмянистого водорода образуется серо-черное пятно, которое при
обработке спиртом уже не исчезает, и в этом случае открытие мышьяка
становится невозможным.
3. Способ Рейнша (Reinsch)
Этот способ очень удобен, хотя не так чувствителен, как преды-
дущие.
При погружении в солянокислый раствор мышьяковистой кислоты
блестящей медной подоски последняя окрашиваемся в серый цве^г вслед-
ствие выделения мышьяка и образования мышьяковистой меди состава
AszCus.
Из концентрированных растводрв мышьяк выделяется ул£е на
холоду, из разбавленных — лишь при нагревании. В присутствии боль-
шого количества мышьяка серая мышьяковистая медь отслаивается от
меди. Так как сурьма из своих растворов также выделяется медью, то
присутствие мышьяка в серой массе должно быть еще подтверждено
реакцией сухим путем. Мышьядовая кислота также восстанавливается
медыр, но только при нагревании.
Реакцию Рейнша часто применяют для открытия мышьяка в обоах.
Нарезанные куски обоев обливают соляной кислотой (1:2) и нагре^ют
вместе с кусочком блестящей медной пластинки; образующееся при этом
серое окрашивание меди указывает на присутствие мышьяка.
Для идентифицирования нагревают посеревшую медную пластинку
в маленькой трубке из тугоплавкого стекла в токе водорода, причем
получается мышьяковое зеркало, которое подвергаирг дальнейшему иссле-
дованию, как описано на стр. 176—7.
Реакции сухим путем
Металлический мышьяк сгорает, распространяя чесночный за-
пах. Аналогично ведут себя все соединения мышьяка, смешанные
с содой и накаленные на угле.
Кислородные соединения мышьяка легко восстанавливаются
в верхнем восстановительном пламени до ...металла. Если непо-
средственно над пробой держать наполненную холодной водой
глазированную снаружи фарфоровую чашку, то пары металла
конденсируются на ней, образуя буро-черный налет, который при
смачивании хлорноватистокислом1 натрием тотчас исчезает1, при-
чем мышьяк окисляется в мышьяковую кислоту:
Ast + lONaOCl %- 6Н2О ->10NaCl -ф 4H3ASO4;
Держа фарфоровую чашку не непосредственно над восстано-
вительным пламенем, а над верхним окислительным пламенем,
получают окисный налет, так как пары мышьяки, сгорая синевато-
белым пламенем, образуют мышьяковистый ангидрид, осаждаю-
щийся на чашке.
1 Стр. 163-
12* 1М
Этот налет, смоченный раствором азотнокислого серебра,
дает при действии на него паров аммиака AgsAsOe, окрашенное
в цвет яичного желтка. Окраска исчезает от прибавления боль-
шего количества аммиака (отличие от сурьмы):
АэгОз + 6AgNOs -f- ЗН2О -> 2А§зАзОз -f- 6HNOs-
Пары аммиака служат для нейтрализации образовавшейся
азотной кислоты, растворяющей мышьяковистокислое серебро.
В некоторых случаях, когда мышьяк находится в виде трехокиси
мышьяка, очень удобен микрохимический метод Гартвиха (Hartwich) и Тог-
генбурга (Toggenbourg)1. Исследуемое вещество смешивают с прокаленным
песком, окружают смесь, положенную на часовое стекло, стеклянным
цилиндром диаметром около 12 мм и высотой 10 мм. Верхний и нижний
края последнего должны быть тщательно отшлифованы. Цилиндр накры-
вают гладким покровным стеклом приблизительно .в 50 лл2. Осторожно
нагревают часовое стекло пламенем микрогорелки. Высота пламени не
должна превышать 5 мм, и расстояние между ним и часовым стеклом
должно быть равно 30—40 мм. После 10—15-минутного нагревания дают
стеклу медленно охлаждаться, после чего исследуют нижнюю поверхность
покровного стекла. Если- имеется трехокись мышьяка, она возгоняется и
собирается на покровном- стекле в виде красивых правильных октаэдров,
форма которых отчетливо видна под микроскопом. Уже при наличии
0,01 лг мышьяка можно получить -видимые под микроскопом кристаллы.
Возгон может быть после этого идентифицирован также и реакцией
с серебром.
Сурьма Sb. Ат. в. 121,76. Ат. и. 51
Плотность 6,7. Т. пл. 630е. Т. кип. 1440°.
Нахождение в природе. Сурьма редко встречается в природе в само-
родном состоянии, хотя в последнее время в Австралии найдены значи-
тельные количества этого металла. Важнейшие соединения ее, так же как
и мышьяка, — сернистые соединения. Стибнит (сурьмяный блеск) SbzSs,
кристаллизующийся в ромбической системе; сурьмяная обманка SbiOSa,
или сероокись сурьмы,—вещество, которое легко образуется при осажде-
нии -сурьмы из водного раствора сероводородом.
Из кислородных соединений назовем диморфную трехокись сурьмы,
кристаллизующуюся в виде сенармонтита в правильной системе и в ром-
бической системе в виде валентинита и цервантита Sb’Oi. Далее, сурьма
встречается в многочисленных сульфосолях, из которых можно указать на
трехосновную сульфосеребряную соль сурьмы, или темную серебряную
руду AgsSbSs.
Сурьма применяется, главным образом для приготовления сплавов:
типографского -металла, баббита, аккумуляторных пластинок и пр. Соеди-
нения сурьмы находят широкое -применение. Так, сульфид SbsSs применяется
в качестве краски, а многие другие ее соединения используются в меди-
цине.
Сурьма представляет собой серебристобелый хрупкий металл. На воз-
духе оиа легко сгорает в трехокись сурьмы. Растворителем для сурьмы
является царская водка, причем она превращается в т-реххло-ристую или
пятихлористую сурьму. Азотная кислота действует на сурьму, превращая
ее в SbiOi. слетка растворимую в -концентрированной, но не растворимую
в разбавленной кислоте. Сурьма легко растворяется в смеси азотной и вин-
ной кислот и в смеси соляной кислоты и брома 2.
1 Schweiz, Wochenschrift f. Chem. u. Pharm. (1909), № 52.
2 Сурьма растворяется также в смеси соляной кислоты н перекиси
водорода. См. Salkowski, Z. anal, Chem. 56, 54 (1917). Ред,
180
Сурьма образует три окисла: трехокись сурьмы БЬЮз, пятиокись
сурьмы SbaOs и четырехокись сурьмы SbsCh, которая может рассматри-
ваться как антимонат трехвалентной сурьмы, химически весьма индифе-
ре-нтное вещество. Трехокись сурьмы обыкновенно проявляет основные
свойства; пятиокись — обладает больше характером кислотного ангидрида.
А. Соединения трехвалентной сурьмы
При сгорании металла на воздухе получается трехокись, которая при
более сильном прокаливании на воздухе превращается в индиферентное
вещество SbaOa.
Трехокись растворяется в концентрированной соляной кислоте, образуя
треххлористую сурьму SbCls, — соединение, которое (подобно хлористому
висмуту) при действии воды легко превращается в основную соль; состав
последней зависит от концентрации реагирующих веществ: так, известна
хлорокись сурьмы SbOCl белого цвета:
SbCls + Н2О -» 2НС1 + SbOCl.
В присутствии большого количества воды образуется также некоторое
количество трехокиси сурьмы:
2SbOCl + НзО * 2НС1 4- ЗЬ20з.
Смесь хлористого антимонила и трехокиси сурьмы известна под назва-
нием «а-льгаротова» порошка БЬаОз • 2SbOCl. При кипячении с большим
количеством воды получается лишь одна окисы
Трехокись сурьмы образует три гидроокиси, ведущие себя, как слабые
кислоты: ортосурьмянистая НзБЬОз; пиросурьмянистая кислота НдБЬзОз и
гипотетическая мета-сурьмянистая кислота НБЬО».
Соли метасурьмянистсй кислоты известны, хотя сама свободная кислота
никогда не была изолирована.
Окись БЬзОз при кипячении с концентрированными едкими щелочами
переходит в раствор, но при разбавлении большим количеством горячей
воды БЬзОз снова выделяется. Если горячий раствор отфильтровать, то
из фильтрата при охлаждении выделяются кристаллы квадратной системы
NaSbOa. Но они очень неустойчивы и разлагаются при стоянии на воздухе
на углекислый натрий и трехокись сурьмы. При растворении трехокиси
сурьмы в крепком растворе едкой щелочи образуется, вероятно, сначала
ортссурьмянистокислая соль:
SbsOs + 6ОН'-> 2БЬОз'" + ЗН>О,
которая при разбавлении гидролитически расщепляется на-- -.метасурьмя-
н-исток-ислую соль и гидроокись щелочного металла:
БЬОз'" + Н-.-0 -» 2ОН' + БЬОз',
При дальнейшем разбавлении водой метасурьмянистая соль разлагается
на трехокись и едкую щелочь. Таким образом, если прибавить к раствору
треххлористой сурьмы едкую щелочь или карбонат щелочного металла, то
происходит почти количественное осаждение БЬгОз:
2SbCls + 6NaOH -> 6NaCl + ЗНЮ + ЗЬЮз;
2SbCls + SNazCOs -> 6NaCl + ЗСО2 + Sb2Os.
Хлорокись сурьмы SbOCl содержит одновалентную группу SbO, котирую
называют антимонилом.
181
Таким образом, хлорокись сурьмы можно рассматривать как хлорид
антимонила. Известны также нитрат ЗЬО(МОз) и сульфат антимонила
(SbOjsSCh. Все эти -соединения, легко гидролизующиеся на окись и кислоту,
редко встречаются в ходе анализа, за исключением хлорида антимонила.
Значительно большей устойчивостью отличаются соединения антимо-
нила некоторых органических кислот (Да,пример, виИной кислоты).
При кипячении трехокиси сурьмы с раствором кислого тартрата (вин-
нокислого) ка.Ля.. происходит растворение трехокиси с образованием так
называемого рвотного камый:
2КНС4Н40в + ЗЬзОз-* Н»О + 2K(SbO)C4H4O6,
который относительно растворим -в воде: 100 г воды растворяют 5,3 г при
8,7°; 7,9 г при 21 “; 12,2 г при 31-; 18,2 < при 50- и 31.2 г при 75е’.
Не только окись сурьмы ЗЬгОз, но и все -соединения антимонила обра-
зуют комплексный анион с винной кислотой или с ее солью, тартратом;
так, хлористый антимонил растворяется в виннокислом калии — иатрии
(соль Рошеля) или в Линой Кислоте:
СаЬЬОо" + SbOCl -> Cl’ + Г(5ЬО)С4Н.,Оп]';
Н-ОНЮб + SbOCl -» HCI + H[(SbO)C4H4Oe],
Рвотный камень K(SbO)C4H4O6 является наиболее важным продажным
соединением сурьмы. Поэтому следует несколько остановиться на его от-
ношении к киСлотам.
Если на водный раствор тартрата антимонилкалия подействовать <юля-
ной кислотой, то выделяется белый осадок хлорида антимонила:
K(SbO)C4H4Oe + 2Н’ + С1'-> НэС4Н40о + К’ + SbOCl,
который легко -растворяется в избытке соляной кислоты:
SbOCl + 2НС1 * НгО + SbCls,
но от прибавления воды снова выпадает и т, д.
Серная и азотная кислоты осаждает ортосурьмянистую кислоту из
рас’гвора тартрата антимонилкалия, потому что образующееся сначала со-
единение антимонила тотчас же разлагается водой:
[(SbO)C4H4Oe]' + Н’ +'2НгО-» Н2С4Н40в + НзЭЬОз.
Вода, прибавленная к раствору, содержащему сурьму, обыкновенно
осаждает сурьмянистую кислоту или основную соль, При кипячении
раствора сурьмы любой валентности -с азо-тЖТй кислотой и после выпари-
вания почти досуха вся сурьм-а может быть осаждена в -вйде окиси. Если
последнюю отфильтровать -и прокалить, то получается продукт, точно от-
вечйющий формуле Sb-,04. который можно рассматривать как антимона’т
трехвалентной сурьмы. Винная кислота препятствует гидролизу.
Реакции мокрым путем
I. Сернистый водород осаждает из не слишком кислых рас-
творов хлопьевидный оранжево-красный трисульфид сурьмы:
2Sb”‘ +3H2S-> 6Н' 4-Sb2S3.
Как показывает уравнение, трисульфид сурьмы находится в равно-
весии с водородными ионами; в 12N кислоте он легко растворим (отли-
чие от мышьяка). С другой стороны, сульфид су-рьмы менее растворим
в кислоте, чем сульфид олова; сП) может быть осажден из 2/V раствора
кислоты. Сульфиды низших степеней -ва.тенфности как олова, так и сурьмы
несколько более растворимы, чем сульфиды высших степеней валентности
этих металлов. Если раствор сурьмы в концентрированной соляной кислоте
перед обработкой сернистым водородом разбавить водой, то может обра-
зоваться осадок SbOCl. Это, однако, не имеет значения, так как серки-
182
стый водород превращает хлористый антимонил в менее растворимый три-
сульфид. Если хотят осадить сульфид без предварительного образования
хлористого антимонила, то перед разбавлением водой раствор должен быть
насыщен сернистым водородом, после чего раствор разбавляют и снова
насыщают сернистым водородом.
При нагревании оранжевой трехсернистой сурьмы в атмосфере инди-
фереитного газа (СО») образуется черная трехсернистая сурьма. При
обжиге на1 воздухе получается четырехокись Sb’Oi.
При прокаливании Sb»Ss с нитратом натрия получают сульфат натрия
и пиросурьмянокислую соль. При нагревании в токе хлора или со смесью
из 5 ч. хлористого, аммония и 1 ч. нитрата аммония сурьма превращается
в хлорид, который летуч, хотя и менее, чем соответствующее соединение
мышьяка.
Трехсернистая сурьма растворяется в сернистом аммонии,
образуя растворимую тиосоль:
Sb2S3 + 3S" -> 2SbS3"'..
Триаммониевая соль не была изолирована; в твердом состоянии из-
вестна только моносоль NFhSbSs (г. е. соль мстатиосурьмянистой
кислоты HSbSs). Но в растворе, особенно же в присутствии большого из-
бытка сернистого аммония, вероятно, находится SbSa'''-ион1.
В желтом сернистом аммонии трехсернистая сурьма раство-
ряется, образуя соли сртотиосурьмяной и метатиосурьмяной
кислот:
Sb2S3 4- 2(NH4)2S2 -> (NH^sSbSi + NHiSbS3.
Если раствор тиосурьмянистокислого аммония кипятить продолжи-
тельное время на воздухе, то часто осаждается окрашенный в красный
цвет оксисульфид (сероокись сурьмы, «сурьмяная киноварь»):
2(NH4)3SbS3 + 402 -> 2(NH4):S2O3 + 2NHs + Н2О + SbsSsO,
который при нагревании с сернистым аммонием снова растворяется, обра-
зуя тиосоль.
Эта сероокись сурьмы образуется также при кипячении хлористой
сурьмы с тиосульфатом натрия:
2Sb • + ЗБгОз" -> 4SO2 + Sb&O.
Трехсернистая сурьма растворяется также в едком кали или натре
с образованием тио- и окситиосолей:
SbaSs + 20Н' -» Н2О + SbOS' 4- SbS2'.
Эти тиосоли разлагаются кислотами, причем осаждается три-
сульфид и выделяется сернистый водород:
2SbS3'" + 6Н’ 3H2S + Sb2S3;
SbOS' + SbS2' 4- 2Н‘ -> Н20 + Sb2S3;
2SbS4'" + 6H- -> 3H$S + Sb2Sa.
При кипячении сернистой сурьмы в едком кали или в сульфиде щелоч-
ного металла с окисью висмута образуются нерастворимый сульфид висмута
и растворимый антимонит:
В12О3 + SbSa'" -»Bi»S5 4- SbOs'".
Если кипятить раствор щелочного антимонита с окисью меди, то обра-
зуется смесь нерастворимых сульфидов одно- и двухвалентной меди и рас-
творимый антимонат:
4CuO SbSa'" —> SbCh'" 4- C112S 4- 2CuS.
183
2. Тиоацетат аммония и тиосульфат натрия осаждают из кислых рас-
творов тиосульфид сурьмы. При некоторых условиях тиосульфат натрия
может дать «сурьмяную киноварь» SbsSsO или смесь SbsSs и SbsOs.
3. Едкие щелочи, углекислые щелочи и аммиак осаждают
аморфный гидрат окиси сурьмы.
4. Вода часто осаждает основную соль £стр. 181).
5. Цинк осаждает из соединений сурьмы металлическую
сурьму. Для этого в солянокислый раствор сурьмы, находящийся
на платиновой пластинке, погружают кусочек цинка так, чтобы
оба металла соприкасались. Сурьма при этом выделяется на пла-
тине в виде черного пятна, не исчезающего при удалении цинка
(отличие от олова).
Свинец, олово и другие металлы реагируют точно так же, как
и цинк. Однако последний в противоположность железу, олову
и свинцу производит восстановление быстрее, частично превра-
щая сурьму в сурьмянистый водород SbHs:
2Sb”' +3Zn-> 3Zn" + 2Sb;
Sb‘ ’ ’ + 3Zn 4- 3H ’ -> 3Zn‘ ’ + SbH3.
Сурьмянистый водород при реакции по Маршу ведет себя так
же, как мышьяковистый водород, но сурьмянистое соединение
менее летуче и менее растворимо в растворе гипохлорита натрия.
6. Иодистый калий не выделяет свободный иод при действии
на него солянокислого раствора соединений трехвалентной
сурьмы (отличие от соединений пятивалентной сурьмы).
7. Фосфорномолибденовая кислота 1 восстанавливается раствором трех-
хлористой сурьмы до молибденовой сини. При систематическом ходе каче-
ственного анализа сульфиды мышьяка, сурьмы и олова растворяют в поли-
сульфиде щелочного металла и прибавлением кислоты осаждают AssSs,
SbsSs и SnSs. Обрабатывая осадок 6N соляной кислотой, в растворе полу-
чают SbCh и SnCU В этом растворе для сурьмы специфична следующая
реакция.
Каплю раствора наносят на фильтровальную бумагу, пропитанную фос-
форномолибденовой кислотой (стр. 158), и держат бумагу над парами
воды. В присутствии сурьмы появляется синее окрашивание. Открываемый
минимум: 0,2 ? Sb.
Б. Соединения пятивалентной сурьмы
Пятиокись сурьмы SbsOs образуется в виде желтого порошка при- оки-
слении сурьмьг концентрированной азотной кислотой с последующим сла-
бым прокаливанием полученной в результате реакции сурьмяной кислоты,
При сильном прокаливании она теряет кислород и переходит в весьма
устойчивый антимонат трехваленгной сурьмы SbsOi (= SbSbCh).
Пятиокись растворяется в концентрированной соляной кислоте, обра-
зуя пятихлористую сурьму:
SbzOs + 10НС1 -> 5НгО + 2SbCls,
Если к этому раствору прибавить воды, выделяется белый осадок
хлорокиси пятивалентной сурьмы SbOsCl, которая при дальнейшем доба-
1 Feigl u, N euber, Z. anal. Chem. 62, 382 (1923). Ред.
184
вле-нии воды и нагревании переходит в сурьмяную кислоту.
SbCls + 2НгО£ 4НС1 + SbOzCl;
SbOaCI 4- 2HOH;t HCI + HsSbOc
Винная кислота препятствует образованию хлорокиси сурьмы (5), по-
тому что. как и SbOCl (стр. 182), она растворим-а в винной кислоте.
Пятиокись сурьмы представляет собой кислотный- ангидрид, от кото-
рого, как и от РгОз, производятся следующие три кислоты;
H3SbO4 HSbO3 H4Sb2O-
ортосуръмяная метасурьмяяая пиросурьмяная
кислота кислота кислота
Все они получены. Из солей их. известны главным образом мета- и
пиросурьмянокислы-е соли. Трехметаллические соли ортосурьмяной кислоты
неизвестны, но известна однометаллическая соль. Все сурьмянокислые соли
(антимонаты) как соли слабых кислот очень неустойчивы- и легко гидро-
лизуются водой,
При оплавлении -пятиокиси сурьмы с избытком едкого кали получают
пла-в, содержащий, вероятно, трехметаллическую соль ортосурьмяной
кислоты. Если плав растворить в малом количестве воды и дать раствору
кристаллизоваться, то выделяются расплывающиеся кристаллы пиросурь-
мянокислого калия ЮБЬгОт.
Получающаяся вначале ортосоль разлагается водой следующим
образом:
2KsSbO4 + НгО^ 2КОН + KiSbsO.
Эта -расплывающаяся соль при действии на нее большого количества
холодной воды или, что еще быстрее, при непродолжительном кипячении
с малым количеством воды постепенно превращается в кислую соль с от-
щеплением КОН:
KiSbsO: + 2НЮ £2КОН + КгНгБЬЮт.
Последняя соль, кристаллизующаяся с 3,5 молекула-ми воды, предста-
вляет собой зернистый, трудно растворимый в холодной воде порошок,
значительно растворяющийся в в-оде при 40—50°. Раствором этим поль-
зуются для открытия, натрия, так как натриевая соль значительно труднее
растворима, чем соль калия.
При продолжительном кипячении с большим количеством воды КгНгЗЬгОт
постепенно присоединяет воду -и- переходит в легко растворимую мономе-
таллическую соль ортосурьмяной к-исл-оты:
КгНгБЬЮт + НгО # 2KH2SbO4,
которая при -выпаривании раствора получается -в виде клееобразной массы
состава 2K№SbO4 • Н2О, распадающейся при продолжительном кипячении
водного раствора вследствие гидролиза на КОН и аморфную оргосурьмя-
ную кислоту:
KH2SbO4 + НгО КОН + HsSbCh.
Все сурьмянокислые соли разлагаются кислотами, выделяя аморфную
кислоту.
Однометаллическая соль KH2SbO4 дает с -натриевыми солями аморфный
осадок, лишь постепенно делающийся кристаллическим, между тем как
пиросурьмянокислый калий дает кристаллический осадок непосредственно.
Отношения между сурьмянистой и сурьмяной кислотами и- антимони-
тами и антимонатами -полностью аналогичны соответствующим соединениям
мышьяка, В высших степенях -окисления резче проявляются кислотные
свойства, чем основные; сурьма, расположенная в периодической системе
ниже мышьяка, вообще обладает более резко выраженными основными
свойствами, чем мышьяк.
185
Реакции мокрым путем
Следует применять раствор очищенного сурьмянокислого калия
в соляной кислоте.
1. Сернистый водород осаждает из умеренно кислых раство-
ров оранжево-красную пятисернистую сурьму:
2Sb ’ ’' У + 5FhS -> ЮН' + Sb2S5.
Пятисернистая сурьма растворяется в 12W соляной кислоте с образова-
нием треххлористой сурьмы и выделением серы и сероводорода:
SbsSo + 6НС|-> 3H2S + 2S + 2SbCls.
Она подобно трехсеркясгой сурьме гас: вещается и едких и сернистых
щелочах и в аммиаке, но не в углекислом аммонии. При обработке серни-
стыми щелочами образуются тиосоли:
SteSs + 3S" -» 2SbSi'",
которые разлагаются кислотами с образованием нерастворимой пятисерни-
стой сурьмы и выделением сероводорода:
2SbS4z" + 6Н ’ -z ЗНгБ + Sb2S5.
В щелочах пятисернистая сурьма растворяется с образованием тио-
и окситиосоли:
SbiSs + 6ОН' -♦ SbS«'" + SbSOs'" + ЗНеО.
2. Тиоацетат аммония и тиосульфат натрия ведут себя так же, как
сероводород.
3. Йодистый водород восстанавливает соединения пятиокиси
сурьмы в кислом растворе в соединения трехокиси сурьмы с вы-
делением иода:
Sb---- + 2J'-> Sb" ' + J2
(отличие от соединений трехвалентной сурьмы).
4. Цинк, олово, железо, алюминий, магний и другие металлы,
стоящие в ряду напряжений выше водорода, восстанавливают
в кислом растворе соединения сурьмы до металлической сурьмы:
5Zn 4- 2SbO4"' + 16Н’ ->2Sb -j- 5Zn’ ’ + 8H2O.
Если в раствор сурьмы ввести платину и цинк, находящиеся
в контакте друг с другом, то цинк будет растворяться, а сурьма
выделится в виде черного пятна, на платине.
Однако цинк отличается от олова, железа или свинца в том
отношении, что некоторое количество сурьмы восстанавливается
до сурьмянистого водорода БЬНз:
4Zn 4- SbOi'" + 11Н' -> 4Zn‘ ’ 4~ 4НгО 4- SbHs.
Сурьмянистый водород, выделенный в приборе Марша (стр. 175), бу-
дучи пропущен через накаленную трубку, образует подобно мышьяко-
вистому водороду зеркальный налет металлической сурьмы*. Но так как
сурьмянистый водород значительно менее устойчив, чем соответственное
мышьяковое соединение, то он разлагается при более низкой температуре:
сурьмяное зеркало часто получается уже перед нагреваемым местом
(отличие от мышьяка).
Выделяющийся из прибора Марша сурьмянистый водород, будучи за-
жжен, сгорает бледнозеленым пламенем ,в воду и трехокись сурьмы. Если
держать крышку фарфорового тигля непосредственно над пламенем выхо-
дящего газа, то на крышке образуется металлическое сурьмяное пятно,
не исчезающее при смачивании хлорноватистокислым натрием (отличие от
мышьяка).
186
При действии сурьмянистого водорода на раствор азотнокислого се-
ребра образуется черный осадок сурьмянистого серебра:
SbHa + 3Ag’ -> AgsSb + ЗН-.
Другой метод, дающий (возможность отличить оба металла друг от
друга, tocTOHT в следующем.
Отделяют трубку, содержащую зеркало, от прибора Марша и про-
пускают через нее сернистый водород, слегка нагревая трубку в направле-
нии, обратном току сероводорода. При этом мышьяковое зеркало превра-
тится в желтый сульфид, а сурьмянистое зеркало—в оранжевый сульфид.
Затем пропускают через трубку ток сухого хлористого водорода: оранже-
вый сульфид исчезает, между тем как сульфид мышьяка остается.
5. Родамин В или тетраэтилродамин 1 дает с сурьмяной кислотой фио-
летовое окрашивание.
Этой реакции не мешают .небольшие количества железа, но аналогично
реагируют ртуть, золото, таллий, висмут, молибден и вольфрам.
Краситель имеет строение:
’ /N (C2H5I9
СО---О \N(C2H5')3
но состав образующегося при этой реакции соединения еще не установлен.
Сурьма должна находиться в виде пятивалентной, что при систематическом
ходе анализа достигается путем прибавления небольшого количества нит-
рита натрия к солянокислому раствору сульфидного осадка.
Выполнение. К 1 мл водного раствора 10 мг красителя в 100 мл воды
на капельной пластинке прибавляют каплю исследуемого рествора. В при-
сутствии сурьмы красный цвет флуоресцирующего красителя переходит
в фиолетовый. Открываемый минимум: 0.5 у сурьмы.
Реакции сухим путем
Соединения сурьмы'окрашивают пламя в бледный зеленовато-
белый цвет. Накаленные с содой на угле, они дают хрупкий
металлический королек, окаймленный белым налетом.
Кислородные соединения сурьмы при нагревании ,в верхнем
восстановительном пламени восстанавливаются до металла, ко-
торый, улетучиваясь, сгорает в верхней части пламени в окисел.
Его налет на наружной глазурованной поверхности фарфоровой
чашки от действия раствора азотнокислого серебра и паров ам-
миака чернеет вследствие выделения металлического' серебра:
Sb3O3 + 4AgNO3 + 4NH3 + 2НЮ -> 4NHiNO3 + SbXX + 4Ag.
При сплавлении сернистой сурьмы -с цианистым калием полу-
чаются металлическая сурьма и роданистый калий:
3KCN + Sb2S3 -> 2Sb '+ 3KCNS.
Если реакцию производить в шариковой- трубке или в токе
'двуокиси углерода, то получают металлический королек, а не
зеркало, как при реакции с -мышьяком.
Нагревание с углекислым натрием и цианистым калием в токе
водорода дает сурьмяное зеркало недалеко о-т места, в кото-
ром произошло разложение.
1 Е. Ее gr iw е, Z. anal. Chem. 70, 400 (1927). Ред.
187
Олово Sn. Ат. в. 118,7. Ат. н. 50
Плотность 7,31- Т. пл. 231.9°. Т. кип. 2270°
Нахождение в природе. Олово не встречается в самородном состоянии,
но почти исключительно в виде двуокиси SnOa, а именно в виде оловян-
ного камня (касситерит), кристаллизующегося в квадратной системе, изо-
морфного с рутилом Т1О2, цирконом ZrSiOa и полианитом МпОз.
Олово представляет собой серебристобелый металл, ковкий при обыкно-
венной температуре. При очень низкой температуре и при температурах,
близких к точке плавления, оно, напротив, 'настолько хрупко, что его
можно даже растереть в порошок. Поэтому для приготовления такого
порошка олово нагревают в фарфоровой чашке до плавления, снимают
с огня и быстро раздавливают пестиком. Оно становится хрупким при-
близительно при 200° и дает весьма тонкий порошок.
Ниже 20° образуется серое олово. Оловянные предметы в холодную по-
году портятся вследствие образования аллотропной модификации олова.
Образовавшись в одном месте, серое олово распространяется по всей поверх-
ности предмета. Серое олово называют оловянной чумой, так как при низ-
кой температуре оно заражает здоровый металл, превращая его в порошок.
Выше 200° образуются ромбические кристаллы олова, которые тверды
и хрупки.
При сгибании куска олова слышен характерный звук вследствие трения
между кристаллами.
Олово дает со многими металлами важные сплавы, как латунь, бронза,
баббит, типографский металл, легкоплавкий металл и т. п.
Олов'о растворяется в концентрированной соляной кислоте при нагрева-
нии, выделяя водород и образуя хлористое олово:
Sn + 2Н’ -> Sn ‘ ’ + Нз.
В присутствии платины при низкой температуре растворение совер-
шается значительно быстрее. Разбавленная соляная кислота растворяет
олово медленно.
Азотная кислота уд. в. 1,2—1,3 превращает олово в нерастворимую
метаоловянную кислоту:
3Sn + 4HNOs + НЮ -> ЗНгЗпОз + 4NO.
В холодной разбавленной азотной кислоте металл растворяется мед-
ленно, без выделения газа, причем образуются азотнокислые соли аммония
и закиси олова.
В этой реакции положительно пятивалентный азот азотной кислоты
восстанавливается до отрицательно трехвалентного азота аммиака, т. е.
приобретает 8 электронов; последние доставляются 4 атомами олова, кото-
рое переходит в Sn''-ионы. Таким образом, 1 молекула азотной кислоты
окисляет 4 атома олова, давая при этом 1 молекулу аммиака. Четыре иона
Sn' ' для образования нитрата требуют еще 8 молекул HNOs, а 1 ион
NH-Г еще одну' молекулу HNOs. Следовательно, всего на окисление 4 ато-
мов олова требуется 10 молекул азотной кислоты и реакция может быть
выражена уравнением:
4Sn + lOHNOs -> 4Sn(NOs)s + NHiNOs + ЗН2О.
В царской водке олово растворяется с образованием хлорного олова:
3Sn + 4HNOs + 12НС1 -> 4NO + 8Н2О + 3SnCU
В разбавленной серной кислоте олово растворяется очень медленно, но
легко в горячей концентрированной кислоте с образованием сернокислой
соли окиси олова и выделением сернистого ангидрида:
Sn + 4HsSO4-> 2SQ?+ 4НаО + Sn(SO«)i.
183
Олово образует два скисла:
SnO
окись оюва(2.)
(закись олова)
SnO2
окись олова(4)
Обеим степеням окисления соответствуют соли закиси и окиси олова.
Первые содержат двухвалентное, последние — четырехвалентное олово.
Олово имеет более основной характер, чем сурьма; закись олова проявляет
слабые амфотерные свойства (стр. 74), окись олова обладает более кис-
лотными свойствами.
А. Соединения двухвалентного олова
Окись олова(2) .в зависимости от способа получения ее представляет
собой оливково-зеленый или черный порошок, который при нагревании на
воздухе быстро переходит в белую окись олова(4).
Хлористое олово, кристаллизующееся с двумя молекулами воды,
SnCh-SH’O, так называемая оловянная соль, является наиболее важной
продажной солью. При растворении оловянной соли в небольшом коли-
честве воды получается прозрачный раствор; при прибавлении ббльшего
количества воды раствор мутнеет вследствие образования основной соли:
SnCh + НЮ £Н€1 + Sn(OH)Cl,
которая легко растворяется в соляной кислоте.
Прозрачный концентрированный раствор мутнеет также и на воздухе,
так как образуется та- же самая основная соль:
4SnCi» + О2 + 2НзО -> 4Sn(OH)Cl + 2Ch.
Однако хлор «е выделяется в свободном состоянии, но соединяется
с некоторым количеством двухвалентных ионов олова, образуя ионы четырех-
валентного олова:
Sn’ ' + Ch -> Sn' ’• ’ '+ 2СГ.
При действии на четыреххлористое олово металлического олова послед-
нее растворяется, а первое восстанавливается до двухлористого олова:
SnCh + Sn ->2SnCh.
Поэтому для сохранения раствора хлористого олова к нему прибавляют
соляную кислоту, чтобы воспрепятствовать образованию основной соли; и
металлическое олово, чтобы постепенно образующееся хлорное олово
превращалось ® хлористое.
Концентрация подобного раствора постепенно увеличивается, так как
металлическое олово постепенно растворяется. Если хотят, чтобы концент-
рация раствора не изменялась, что необходимо только для количественного
анализа, следует сохранять солянокислый раствор защищенным от воздуха
в атмосфере двуокиси углерода и без добавления металлического олова.
Почти все соединения двухвалентного олова бесцветны; закись олова
черного цвета, в сульфид-—темнобурого цвета.
Реакции, мокрым путем
1. Сернистый водород выделяет из не слишком кислого рас-
твора бурый осадок сернистого олова:
Sn" +H2S->2H- +SnS,
легко растворимого в концентрированной соляной кислоте; по-
этому из сильнокислого раствора сернистое олово не осаждается
сероводородом. Бели же сильиокислый раствор насытить серни-
183
стым водородом и затем разбавить водой, то происходит пол-
ное осаждение сернистого олова.
Сульфид двухвалентного олова не растворим в аммиаке и
карбонате аммония (отличие’ от мышьяка), а также в бесцветном
сернистом аммонии (отличие от мышьяка и сурьмы), но легко
растворим в желтом сернистом аммонии с образованием тиостан-
ната аммония:
SnS 4- (NH4)2S2 ->(NH4)2SnS3.
Если раствор тиостанната аммония подкислить какой-либо
кислотой, осаждается желтое двусернистое олово:
SnSs" + 2Н' -> H»S + SnS2.
2. Тиоацетат аммония полностью осаждает олово в виде сульфида из
горячего слабокислого раствора
CHsCOS' + Sn • • + НгО -> SnS + СНзСООН + Н',
3. Едкие щелочи дают белый студенистый осадок гидрата за-
киси олова:
Sn’ ‘ 4- 2ОН'-> Sn(OH)2,
легко растворимого в избытке осадителя с образованием стан-
нита щелочного металла:
Sn(OH)2 4- ОН'-> НгО 4- HS11O2'.
Гидрат закиси олова вследствие своего амфотерного характера рас-
творяется также и в соляной кислоте.
Щелочной раствор стсюнитов щелочных металлов иногда можно при-
нять черно-бурую или черную окраску (особенно при нагревании или при
применении концентрированного раствора едкой щелочи) вследствие выде-
ления или металлического олова, или закиси олова (стр. 145).
Из разбавленного раствора едкого кали постепенно выделяется при
долгом стоянии, быстрее при нагревании, черная закись олова:
HSnO2'-> ОН' + SnO.
Из очень концентрированного раствора едкого кали выделяется почти
исключительно черный осадок металлического олова:
2HSnO/ -> SnOs" + №0 + Sn.
4. Аммиак и углекислые щелочи осаждают белый гидрат
закиси, незначительно растворимый в избытке осадителя:
Sn' • + 2NH4OH ->Sn(OH)2 + 2NHE ;
Sn’ • 4- СОз" + НгО -> СОг 4- Sn(OH)2.
Винная кислота, добавленная в количестве, большем чем тре-
буется в случае сурьмы, препятствует осаждению.
5. Хлорная ртуть с растворами солей двухвалентного олова
дает белый осадок однохлористой ртути (каломель):
2HgCI2 )4- Sn' • -> Hg2Cl2 + Sn' ‘ ’ • + 2СГ.
Но если хлористое олово находится в избытке, то однохло-
ристая ртуть восстанавливается до металлической ртути:
Hg2a2 4- Sn’ ‘ -> Sn' + 2СГ 4- 2Hg.
190
6. Хлорное золото. Если к разбавленному раствору хлор-
ного золота прибавить следы хлористого олова, то выделяется
мелкораздробленное металлическое золото:
2Аи' ’' 4~ 3Sn'' -> 3Sn’" ’ ’ 4~ 2Au,
кажущееся коричневым в проходящем свете и зелено-синеватым
в отраженном.
7. Хлорная ртуть и анилин 1 реагируют с ионами двухвалентного олова
с образованием тонко раздробленной металлической ртути.
Реакция хлорной ртути с SnCla в кислой среде чувствительна, но для
капельной (пробы она не пригодна, так как образующаяся каломель белого
цвета «е заметна на белой бумаге. В щелочном растворе восстановление
Вдет до выделения металлической ртути, образующейся даже при избытке
ртутных солей. Для подщелачивания, можно взять едкие щелочи или аммиак,
но рекомендуется пользоваться анилином, потому что его щелочность на-
столько мала, что опасность помехи со стороны солей трехвалентной сурьмы
(также восстанавливающих сулему до металлической ртути) устраняется.
Выполнение. Кусок фильтровальной бумаги пропитывают концентриро-
ванным раствором хлорной ртути и высушивают. На высушенную бумагу
наносят каплю слабокислого испытуемого раствора, а затем на влажное
пятно—каплю анилина, уже в присутствии 0,6 7 олова появляется черное
или бурое пятно.
Если раствор содержит четырехвалентное олово, оно может быть вос-
становлено на часовом стекле небольшим кусочком магниевой проволоки.
8. Металлический цинк выделяет из растворов как солей
закиси олова, так и солей окиси металлическое олово в виде
губчатой массы, пристающей к цинку:
Sn’ ’ -j- Zn -> Sn -j- Zn’ ”,
Sn’ ’ ” + 2Zn -> Sn -j- 2Zn’ * .
Мелко раздробленный губчатый металл легко растворяется в концентри-
рованной соляной кислоте, и поэтому опыт производят в не слишком кис-
лом растворе; в противном случае вследствие могущего произойти сильного
выделения водорода одово отрывается от цинка и снова растворяется в кис-
лоте. Удобнее всего поступать следующим образом. Блестящую цинковую
пластинку погружают в несколько капель испытуемого не слишком кислого
раствора, налитого на платиновую пластинку; при этом цинк должен со-
прикасаться с платиной. Олово выделяется частью на одном, частью на
другом металле* 3, образуя серое пятно, тотчас исчезающее с платины при
удалении цинка, если только раствор имеет еще кислую реакцию (отличие
от сурьмы). Если действие цинка будет продолжаться до тех пор, пока не
прекратится выделение водорода, то, само собою разумеется, серое пятно
олова не исчезнет. Но от прибавления нескольких капель концентрированной
соляной кислоты начинается энергичное выделение водорода, и пятно
быстро исчезает. Олово осаждается на платине, несмотря на присутствие
концентрированиой кислоты, по следующей причине: при соприкосновении
платины и цинка образуется гальваническая пара, причем ток идет от цинка
к платине; последняя становится катодом, на котором и выделяется олово.
По удалении цинка из раствора ток прекращается, олово растворяется
в соляной кислоте, вследствие чего пятно исчезает.
9. Металлический свинец, соответственно его положению
в электродвижущем ряду (стр. 61), восстанавливает олово
до металла, но реакция прекращается, как только концентрация
1 N. Т a n a n а е f f, Z. anorg. Chem. 136, 372 (1924). Ред.
3 Из слабокислого раствора олово (выделяется преимущественно на
цинке, из сильнокислого раствора, какой употребляется большею частью
при анализе, — на платине.
191
Pb" становится почти равной концентрации Sn''. Когда кон-
центрация РЬ'' превышает концентрацию Sn’’, реакция идет
в обратном направлении. Эти реакции приостанавливаются уже
при относительно низкой концентрации Н’, потому что как
олово, так и свинец находятся в ряду выше водорода. Однако
в кислом растворе металлический свинец восстанавливает Sn""
до Sn' ’ (стр. 61).
Металлическая сурьма точно так же восстанавливает в кис-
лых растворах соли четырехвалентного олова до солей двух-
валентного олова:
2Sb 4- 3Sn"’? -> 2Sb" * 4- 3Sn"s
10. Тиосульфат натрия постепенно осаждает олово из не слишком кис-
лых растворов. Иногда осадок состоит, главным образом, из односернистого
олова:
Sn‘ ’ + S2O3" + НгО -> SnS + 2Н' 4- SOi",
а иногда из двусернистого олова и метао.товянной кислоты:
6Sn' ' + 2S2O3" + ЭНгО -> S11S2 + бНзЭпОз + 2S + 8Н‘.
В случае очень кислого раствора необходимо прибавление большего
количества тиосульфата ввиду протекающей реакции:
ЗзОз" + 2Н’ -> S + Н»О + SO2.
причем образующаяся двуокись серы будет частью реагировать с Sn'-".
3Sn ’' + SO2 + 6Н' -> 3Sn' ‘‘ + H2S + 2Н2О.
11. Азотнокислый висмут, прибавленный в небольшом количестве к ще-
лочному раствору соли олова, дает белый осадок гидроокиси висмута,
быстро переходящий в черный металлический висмут:
2Bi • ' • + ЗБпОг" + 6ОН' -> ЗБпОз" + ЗН2О + 2Bi.
12. Щавелевая кислота осаждает из нейтрального или слабокислого
раствора белое щавелевокислое олово:
Sn* ‘ + Н2С2О4 -»SnC.Oi + 2H'j
Хлористый аммоний препятствует осаждению. Раствор соли двухвалент-
ного олова, содержащий хлористый аммоний и большое количество щавеле-
вой кислоты, не осаждается сероводородом.
* Примечание редактора- Щавелевая кислота, прибавленная к соли двух-
валентного олова в нейтральном растворе, дает сначала осадок, который
в большем избытке осадителя растворяется. Из такого раствора сернистый
водород не осаждает олова, и так как сурьма при тех же условиях осаж-
дается в виде сульфида, то на этом различном отношении к щавелевой
кислоте сурьмы и олова основан метод не только качественного, но и ко-
личественного разделения их (см. De Koninck, Lehrbuch der qualitativen und
quantrtativen Analyse, II, 218). * A. K. ,
13. Перекись водорода выделяет из нейтрального раствора при нагрева-
нии белый осадок гидроокиси четырехвалентного олова.
14. Феррицианид калия и хлорное железо, прибавленные к кис-
лому раствору соли двухвалентного олова, выделяют осадок берлинской
лазури:
6[Fe(CN)]e"' + 8Fe' ' ' +3Sn’ ‘ -*3fn’ '" 4- 2Fe<[Fe(CN)e]3.
Реакция чувствительна, но ее дают н другие восстановители. Железо-
синеродный ион восстанавливается до железистосинеродистого иона, кото-
рый образует с хлорным железом синее окрашивание раствора или осадок
такого же цвета».
192
15. Диметилглиоксим (СНз)2(СМОН)г (см. стр. 260) и хлорное железо1
в присутствии двухвалентного олова дают красное окрашивание, обусло-
вленное образованием комплексной соли диметилглиоксима с двухвалент-
ным железом.
Реакция двухвалентного железа с диметилглиоксимом (стр. 236) весьма»
чувствительна; она позволяет открыть 0,04 у железа. Ион двухвалентного
олова восстанавливает моментально ион трехвалентного железа до двух-
валентного, который реагирует с оксимом.
Выполнение. На капельную пластинку наносят каплю испытуемого
сильнокислого раствора, прибавляют каплю 0,1N раствора хлорного железа
и, спустя минуту, кристаллик винной кислоты. После растворения послед-
ней прибавляют каплю раствора диметилглиоксима и раствор подщела-
чивают аммиаком. В присутствии олова появляется красное окрашивание
раствора. Открываемый минимум: 0,04 у олова. Добавление винной кислоты
имеет целью воспрепятствовать образованию гидроокиси трехвалентного
железа. •
16. Молибдат аммония 2 восстанавливается в сернокислом растворе со-
лями двухвалентного .олова, давая синее окрашивание.
Реакция более специфична и может быть проведена в присутствии
SbCh, если вместо растворимого молибдата применять нерастворимый фос-
форомолибдат аммония. Сперва приготовляют фосфорномолибденовую кис-
лоту, растворяя фосфоромолибдат аммония в царской водке, выпаривая
досуха и двукратно перекристаллизовывая из воды. Растворяют 5 г полу-
ченных кристаллов в 100 мл воды и этим раствором пользуются для
реакции.
Выполнение. Смачивают реактивом фильтровальную бумагу, держат ее
некоторое время над парами аммиака и высушивают. На высушенную бу-
магу наносят каплю испытуемого раствора; в присутствии олова появляется
синее окрашивание. Открываемый минимум: 0,3 Y олова. Запас реактивной
бумаги может сохраняться в темных хорошо закрывающихся склянках.
17. Какотелин [эдитропроизводное бруцина не установленного строения;
эмпирическая формула CzoHzsNsCMNOa^] в кислых растворах солей двух-
валентного олова дает фиолетовое окрашивание.
Выполнение. Пропитывают фильтровальную бумагу насыщенным водным
раствором какотелина и, не давая полностью высохнуть, наносят на. .нее
каплю испытуемого раствора; в зависимости от концентрации олова на жел-
той бумаге образуется красный кружок или кольцо, окаймленное бесцветной
зоной.
Получение какотелина. Растворяют 4 г бруцина в 100 .чл 10%-ной азот-
ной кислоты и прозрачный раствор нагревают до 60—70°; спустя несколько
минут появляется красное окрашивание и выделяется осадок. После четырех-
часового стояния при комнатной температуре осадок отсасывают, промы-
вают спиртом до полного удаления кислоты и высушивают в эксикаторе
над серной кислотой. В качестве реактива применяют насыщенный водный
раствор.
Б. Соединения четырехвалентного олова
Соединения четырехвалентного олова (которые все бесцветны, за исклю-
чением желтого сульфида SnSa) не могут быть получены путем растворения
окисн SnCh, производными которой они являются, потому что кислоты на
эту окись почти не действуют. Их получают непрямым путем или из метал-
лического олова, или из соединений двухвалентного олова.
Все простые соединения четырехвалентного олова гидролизуются более
или менее легко водой, так что аналитику почти никогда не приходится
с ними встречаться. Нитрат Sn(NO3)i и сульфат Sn(SO.i)2 легко разлагаются
на холоду на кислоту и гидроокись олова. Галоидные соединения более
1F. Feigl, Chem.-Ztg. 43, 861 (1919'' РеД.
2 F. Feigl, Z. anal. Chem. 62, 382'(1923). РеД.
13 Зак. 982* Тредвелл-Голл, т. L.
193
устойчивы и разлагаются лишь при кипячении с большим количеством воды.
Поэтому для нижеприводимых реакций следует пользоваться хлорным
оловом.
Хлорное олово представляет собой бесцветную жидкость, дымящую на
воздухе и кипящую при 120°. С небольшим количеством воды она затвер-
девает, образуя кристаллические гидраты: SnCh • ЗН2О, SnCh-SHaO,
SnCh-SHzO. Соль, кристаллизующаяся с 5 молекулами воды, является важ-
ным продажным продуктом, применяемым в качестве протравы в красиль-
ном деле.
При дальнейшем добавлении воды эти гидраты растворяются, образуя
прозрачный раствор; при кипячении свежеприготовленного разбавленного
раствора в последнем постепенно появляется муть вследствие выделения
объемистой гидроокиси олова:
SnCh + 4НОН -> 4НС1 + Sn(OH)<.
Если раствор очень разбавлен, муть появляется уже на холоду. Количе-
ственное осаждение образующейся таким образом гидроокиси олова(4) не
происходит ни на холоду, нн при нагревании, потому что значительная
часть ее остается в форме гидрозоля. Она может быть количественно
осаждена путем высаливания из горячего раствора (лучше всего азотно-
кислым аммонием).
Для аналитических целей хлорное или бромное олово могут быть легко
получены из хлористого олова путем хлорирования или бромирования.
При действии хлора на раствор хлористого олова на холоду образуется
хлорное олово:
SnCh +'Ch = SnCh.
Но так как хлор в разбавленном растворе бесцветен, то конец окисления
с трудом заметен. Поэтому более удобно пользоваться бромом.
Если к раствору хлористого олова прибавлять по каплям концентриро-
ванную бромную воду при постоянном помешивании, то окраска брома бу-
дет исчезать до тех пор, пока в растворе еще остается хлористое олово.
Как только последнее будет полностью окислено, раствор окрасится бромом
и будет содержать смесь хлорного и бромного олова:
2SnCls + 2Вгг-> SnCh 4- SnBu.
Ионы четырехвалентного олова проявляют склонность к образованию
комплексных ионов. Так, в концентрированных растворах едких щелочей
образуются станнат-ионы [Sn(OH)e)", точно так же образуются аналогич-
ные фторостаннаты с анионом [SnFe]", а в концентрированном растворе
какого-нибудь хлорида образуются хлоростаннаты с анионом [SnCle]", соот-
ветствующим хлорплатинат-мону [PtCls]". Но тогда как последний отли-
чается весьма большой устойчивостью, хлоростаииат-ион легко гидроли-
зуется с образованием хлор-иона и четырехвалентного иона олова.
При анализе часто пользуются образованием этих комплексных соеди-
нений для осаждения сероводородом сурьмы в присутствии олова. Красиво
кристаллизующуюся аммонийную соль хлоростанната (NH«)2[SnCl«] приме-
няют в красильном деле в качестве протравы под названием «розовой соли».
Иногда вышеприведенное хлорное олово SnCh называют а-хлорным оловом
в отличие от хлористого соединения олова (которое будет позже описано),
известного под названием (3-хлорного олова (илн хлористого станнила).
а-Соединения четырехвалеигиого олова
Реакции мокрым путем
1. Соляная и серная кислоты не дают осадка в умеренно кон-
центрированных растворах хлорного олова даже при долгом
стоянии (отличие от ^-соединений). Иногда в очень разбавлен-
ном сернокислом .растворе получается осадок основного суль-
фата. Также часто образуется легкая муть в очень разбавлен-
194
них солянокислых растворах. .Эта муть увеличивается при кипя-
чении раствора:
SnCh + 4НОН 4НС1 + Sn(OH)4.
2. Сульфат калия или натрия не осаждает олова на холоду
(отличие от хлористого станнила), но при кипячении все олово
осаждается в виде гидроокиси.
3. Едкие щелочи. При прибавлении едкой щелочи к раствору
четырехвалентного олова выпадает белый объемистый студени-
стый осадок:
SnCh 4* 4ОН' -> 4СГ + Sn(OH)4.
Осадок имеет вышеуказанную формулу, когда он высушен
на воздухе, но при высушивании над серной кислотой состав его
отвечает формуле HzSnOg.
Осадок легко растворяется в избытке едкой щелочи, образуя соли, ко-
торые не являются производными вышеуказанных соединений, а производ-
ными кислоты H2[Sn(OH)e], не полученной в изолированном состоянии:
Sn(OH)« + 2КОН -» Ks[Sn(OH)e].
Гидроокись о.-юва растворяется также и в аммиаке, но только в отсут-
ствии аммонийных солей.
При растворении в едкой щелочи гидроокись олова ведет себя как
кислота и по Беллучи (Bellucci) и Паравано (Нагауапо)1 гексагидрооловяиная
и хлорооловяиная кислоты находятся в таком же отношении друг к Другу,
в каком находятся гексагидроплатиновая и хлороплатиновая кислоты:
H>LPtClel H>[SnClo]
Н4РЦОНМ H4Sn(OH)»l
Соли гексаоксиоловянной кислоты называются для краткости станнатами
или а-станнатами, в отличие от (З-станнатов или метастаинатоэ, которые
являются производными полимера (НтбнСБ).-, (cip. 196).
Весьма характерной является для j-оловянной кислоты ее легкая раство-
римость .в холодных разбавленных минеральных кислотах. Она быстро
растворяется в соляной, серной, азотной кислотах, следовательно ведет себя
в этом отношении как основание. При кипячении разбавленного кислого
раствора (в особенности сернокислого) осаждается оловянная кислота, кото-
рая снова растворяется в холодных кислотах, если только кипячение не
продолжалось слишком долго, так как в противном случае получается
.р-оловянная кислота, не растворимая в разбавленных кислотах.
4. Углекислый калий осаждает оловянную кислоту из раство-
ров хлорного олова; осадок растворяется .полностью в избытке
осадителя (отличие от ^-оловянной кислоты):
SnCh + 2КеСОз + 2НеО -> 4КС1 + 2СОе -4 Sn(OH)4;
Sn(OH)4 4- К-СОз KeSnCh + 2НгО + CCh.
5. Углекислый натрий реагирует точно так же. но осадок не
так легко растворяется в избытке осадителя.
6. Аммиак осаждает оловянную кислоту из раствора хлор-
ного олова; винная кислота препятствует осаждению (отличие
от Р-оловянной кислоты).
1 Z. anorg. Chem. 45, 156 (.1905).
13* 196
Д
Р-Соединения четырехвалеитного олова
(Метастаннаты)
Реакции мокрым путем
При окислении металлического олова горячей азотной кислотой (d = 1,3)
первоначально образуется нитрат четырехвалентного олова, который пол-
ностью гидролизуется при кипячении с водой, образуя азотную кислоту и
белую метаоловянную кислоту, не растворимую в азотной кислоте. Высу-
шенная .над серной кислотой, она отвечает формуле НзБпОз, т. е. имеет тот
же эмпирический состав, что и гидроокись, осажденная при обработке
раствора хлорного олова едкими щелочами, хотя существенно отличается
по многим своим реакциям.
В то время как а-оловяиная кислота (как уже было указано) легко
растворима в разбавленных минеральных кислотах, (3-оловянная кислота
практически в них не растворима.
1. Концентрированная соляная кислота при кратковременном взаимо-
действии с 3-оловянной кислотой образует хлорид, не раствори-
мый в соляной кислоте, но легко растворимый в воде. Раствор содержит
так .называемое ^-хлорное олово (которое правильнее бы было назвать
хлористым станнилом) следующего состава: Sn5OsCla(OH)s.1
2. Соляная кислота при действии на водный раствор хлористого
станнила осаждает почти все олово в форме богатого хлором соединения
следующего состава: БпзОзСЦОНЭв • 4НаО.2 3
3. Нагревание до кипения водного раствора хлористого станнила ведет
к осаждению почти всего олова в виде р-оловянной кислоты, которая не
растворима в разбавленных кислотах.
Это различие в свойствах двух кислот, как и двух хлоридов может
быть объяснено следующим образом. Различные силикаты кремневой кисло-
ты, весьма напоминающей оловянную кислоту, производятся от ее различ-
ных полимерных форм. Так, (волластонит CaSiOs является производным
обыкновенной метакремневой кислоты, а т.ремолит CaMgsSi-tOis производным
(HaSiOs)^. Весьма вероятно, что оловянная кислота может существовать
в форме аналогичных полимеров. Один из этих полимеров соответствует
составу (НгЗпОз)5.
Если такое соединение подвергнуть действию соляной кислоты, гидро-
ксильные группы' будут замещаться хлором и полученное при этом соеди-
нение будет содержать олово, кислород и хлор, например SnsOsClio. Это
гипотетическое соединение (5-оловянной кислоты гидролизуется образуя
различные хлориды неодинаковой растворимости. Так, Энгель (Engel) на-
шел, что хлорид Sn5O5C12(OH)8 растворим в воде, а Вебер (Weber) показал,
что из водного раствора последнего соляная кислота осаждает соединение
Sn5O5C14(OH)e. 4НЮ.
Реакция, происходящая при растворении fJ-оловянной кислоты в соляной
кислоте и в'О'де, может быть выражена следующими уравнениями:
Sn6O5(OH)1() 10НС1 10Н2О -f- Sn3O5Cl!0 (не растворим в НС1);
р-оловянная или
метаоловянная
кислота
'ЗпзОзСЬо + 8НаО-^ 8НС1 + Sn5O5Cl2(OH)e ( растворим в воде);
Sn5O5Cl2(OH)e + 2НС1 ;-_2Н.>0 + SnsOsC14(OH)s ' (не растворим в НС1).
При кипячении водного раствора происходит полный гидролиз:
S-uO5Ck(OH)8 + 2НгО -> 2НС1 + Sn5O3(OH)i0.
1 R. Engel, Chem.-Ztg. 21, 309, 859 (1897).
2 Weber, Jahresber. 1869, 244 и Pogg. Ann. 122, 358.
3 Groth, Tabellarische Uebersicht d. Min. 148 (1898).
196
Если £-,оловянную кислоту подвергать продолжительному воздействию
концентрированной соляной кислоты, происходит полное разложение
ЗпзОз-группы и олово переходит в раствор в виде обыкновенного а-хлор-
ного олова:
Sn50;(OH)io + 20НС1 -> 15НаО + 5SnCh.
Приведем еще следующие реакции хлористого станнила (3-хлорного
олова):
4. Едкие щелочи осаждают из раствора хлористого станнила объеми-
стый осадок (3-оловянной кислоты, которая не растворяется в избытке
концентрированной едкой щелочи, но образует (3-станнат, легко раство-
римый в разбавленном растворе едкого кали:
2П5О5С12(ОН)8 + 2КОН -> 2КС1 + Sn503(OH)io;
р-оловянная кислота
Sns05(OH)io + 2КОН -> 2НгО+'Sn5O5(OK)2(OH)s
^-станиат калия
При длительном действии концентрированного едкого кали на (3-стан-
нат калия последний постепенно растворяется с образованием а-станната
калия. Такое превращение более легко, совершается путем сплавления
в серебряном тигле ₽-оловянной кислоты с твердой гидроокисью калия.
Если прибавить разбавленный раствор минеральной кислоты к (3-стан-
нату калия, то образуется объемистый осадок, состоящий частью из
(3-оловянной кислоты (не растворимой в избытке минеральной кислоты),
частью из а-оловянной кислоты (легко растворимой в избытке кислоты).
Последнее соединение образуется, когда для получения калиевой соли
применяется очень концентрированный раствор едкого кали.
5. Аммиак также осаждает ^-оловянную кислоту даже в присутствии
винной кислоты (отличие от а-хлорида олова).
Как мы видим, a-соединения легко превращаются в 3-соединения и
наоборот. Разбавленные водные растворы a-соединений постепенно превра-
щаются при обыкновенной температуре в ^-соединения, но более быстро
при кипячении; так, хлорид олова переходит в хлористый станнил:
5SnCh + 1ЗН2О £ 18НС1 + SnsOsChCOH)».
^-Соединения превращаются в a-соединения при кипячении с концен-
трированной соляной кислотой или с концентрированным раствором едкого
кали.
6. Сернистый водород осаждает из не слишком кислых растворов xaif
^-соединений, так и p-соединений желтое двусернистое олово:
SnCh + 2H2S £ 4НС1 + SnSa;
Sn5O5Cl2(OH)s + IOH2S # 2НС1 + 5SnS2 + 1ЗН2О.
Из З'Соединений четырехвалентного олова сероводород выделяет SnS2,
но только очень медленно, причем большая часть выделяется в гидрозоль-
ной форме; от прибавления солей гидрозоль коагулирует и выделяется в
виде хлопьев, всегда в смеси с 3‘олоВЯ|Нной кислотой. Если раствор хлори-
стого станнила обработать H2S и затем в герметически закрытом сосуде
нагреть на водяной бане, то олово очень быстро выделится в виде зелено-
вато-желтого сернистого оло-ва.
В чистом виде двусернистое олово желтого цвета, но оно часто бывает
бурым от примесей сульфидов других металлов. ,
Двусернистое олово растворяется в соляной кислоте; поэтому сернистый
водород не дает никакого осадка в сильнокислом растворе. Если же такой
раствор насытить сероводородом и сильно разбавить водой, то выпадает
сульфид.
Желтое двусернистое олово является ангидридом тиокислоты, и по-
этому оно дает с сернистыми щелочами, растворимые в воде тиосоли:
SnS2 + (NH«)2S -> (NHa)aSnS».
197
Из раствора такой тиосоли кислоты осаждают желтое двусернистое
олово;
SnSs" + 2Н* -> H’S +SnSa.,
Сульфид мало растворим в аммиаке и почти не растворим в углекислом
аммонии (отличие от мышьяка). Концентрированной азотной кислотой он
легко окисляется в р-оловянную кислоту; при обжиге на воздухе он пол-
ностью переходит в двуокись олова.
На полученное сухим путем двусернистое олово (сусальное золото)
азотиая кислота не действует; не растворяется оно также и в сернистых
щелочах. Царская водка превращает его в хлорное олоно с выделением
серы. Подобно природному оловянному камню лучше всего переводить его
и раствор путем сплавления с содой и серой (стр. 199).
Олово имеет тенденцию к образованию комплексных ионов, с которыми
сернистый водород не дает осадка сульфида. Щавелевая кислота (30—40 ч.
последней на 1 ч. олова) препятствует осаждению олова. Точно так же
препятствуют образованию сульфида олова фтористоводородная и фосфор-
ная кислоты.
7. Тиоацетат аммония осаждает двусернистое олово из горячих кислых
растворов:
2СНзСО8' + Sn* *•-•-+ 2НЮ ->SnSs + 2СНзСООН,+ 2Н*.
8. Тиосульфат натрия осаждает смесь гидроокиси четырехвалентного
олова, двусернистого олова и серы, если прибавить его к кислому раствору
соли четырехвалентного олова:
Sn* * • + 2SsCh" + 2НзО -> SnS2 + 4Н* + 2SO/';
Sn* 2S2O3" 4- НзО-> HaSnOj -f- 2S -T 2SO».
9. Металлическое железо восстанавливает хлорное олово до хлористого
олова, но не до металла:
Sn’" * + Fe Fe* * 4- Sn’"’.
Реакция протекает даже на холоду. Та же реакция происходит при кипяче-
нии с медью или сурьмой:
2Cu + Sn* ’ ’ ‘ -> Sn’ ‘ 4- Сиз* *;
2Sb 4- 3Sn ‘ 3Sn* ’ 4-2Sb"”.
10. Металлический цинк осаждает губчатое,, металлическое олово:
2Zn 4- Sn* * * Sn 4- 2Zn* *;
Если цинк находится в соприкосновении с платиной, то олово осаждает-
ся не на платине (что имеет место в случае сурьмы), а на цинке.
11. Хлорная ртуть не дает осадка в растворах соли четырехвалент-
ного олова.
12. Серная кислота й сульфаты щелочных металлов осаждают из рас-
творов хлористого станнита белый сульфат станнита, который при про-
мывании водой полностью превращается в ^-оловянную кислоту (отличие
от а-хлорного олова).
Растворение двуокиси олова
Встречающаяся в природе или полученная в результате сильного прока-
ливания двуокись олова не растворяется ни в одной из кислот. Для пере- .
ведении ее в раствор пользуются следующими приемами;
а) сплавлением с содой и серой;
б) сплавлением с едким натром (или кали);
в) сплавлением с цианистым калием;
г) восстановлением водородом при высокой температуре.
а) Сплавление с солон п серой. Сухое вещество кладут в небольшой
фарфоровый тигель, смешивают с шестикратным количеством смеси, состоя.
198
щей из равных частей кальцинированной соды и серы, закрывают тигель и
нагревают на маленьком пламени до тех пор. пока не отгонигся и не сго-
рит избыток серы. (Операция эта длится минут двадцать). По охлаждении
сплав обрабатывают теплой водой и, если нужно, фильтруют;
2SnO-j 4- 2NaaCOs 4- 9S 3SO? 4- 2N'a:SnSs 4-. 2СОз.
Если олово находится в смеси с железом, свинцом, медью или вообще
с металлами, сульфиды которых не растворимы в воде и многосернистых
щелочах, то при обработке водой последние не растворяются и путем филь-
трования отделяются от олова.
б) Сплавление с едким натром. Расплавляют в серебряном тигле (кото-
рый помещают в фарфоровый тигель для защиты от воздействия газового
пламени) немного едкого натра до удаления воды (масса при этом спокойно
плавится); дают немного охладиться, прибавляют мелкий порошок испы-
туемого вещества- и нагревают снова до образования прозрачной распла-
вленной массы. По охлаждении растворяют в воде;
SnO? -}- 2NaOH ->Na«SnOs 4- НгО.
При сплавлении с содой или поташом SnCb не вполне переводится
.в растворимое состояние.
в) Сплавление с цианистым калием. Немного цианистого калия распла-
вляют в фарфоровом тигле, в который затем всыпают исследуемый поро-
шок, продолжая плавление до тех пор, пока выделившееся олово не обра-
зует королька:
SnOi 4- 2KCN 2KCNO + Sn,
По охлаждении плав обрабатывают водой, о.юно отфильтровывают,
вальцуют в тонкую пластинку и растворяют в концентрированной соляной
кислоте.
г) Восстановление в струе водорода. Вещество кладут в фарфоровую
лодочку, вс.т'1вляют последнюю в открытую с обоих сторон трубку из туго-
плавкого < ..ла, пропускают через нее иа холоду (до -полного удаления
воздуха) струю сухого водорода и затем -нагревают при темнокрасном ка-
лении до тех пор, пока не прекратится выделение воды:
SnOi + 2Н_> -> 2Нз() + Sn.
Полученный металл .растворяют в соляной кислоте.
Реакции сухим путем
При накаливании посредством паяльной трубки на угле с со-
дой (или лучше с цианистым калием) -получаются большей
частью лишь маленькие белые ковкие зерна (корольки), кото-
рые, по удалении пламени, тотчас покрываются белым окисным
налетом. Последний заметен при отражении пламени на сплаве.
Если сплав поместить с небольшим количеством воды в агато-
вую ступку и раздавить его пестиком, то легко получаются ма-
ленькие оловянные листочки, отличающиеся от серебра и свинца
своей нерастворимостью в азотной кислоте, и, кроме того, от
серебра — растворимостью в концентрированной НС1. Эта реак-
ция изящнее и надежнее проводится на обугленной палочке
(содовой). Перл буры, окрашенный медью в бледносиний цвет,
становится в восстановительном пламени в присутствии лишь
следов олова рубиново-красным (прозрачным). Реакция весьма
чувствительна.
194
При нагревании одно- и двусернистого олова в токе хлора или при
прокаливании их со смесью из 5 ч. хлористого аммония и 1 ч. нитрата
аммония происходит улетучивание олова в виде его четыреххлористого сое-
динения. Если пользоваться током углекислого газа, пропускаемого через
бром, то образуется четырехбромистое олово, которое может быть отог-
нано.
Все соединения олова восстанавливаются при прокаливании с циани-
стым калием до металлического олова.
Водород, образуемый цинком и соляной кислотой в присутствии рас-
творимого или нерастворимого соединения олова, сообщает несветящемуся
пламени бунзеновской горелки характерное синее окрашивание *. Причина
этого явления еще не известна, но во всяком случае мы тут не имеем
дела с образованием оловянистого водорода, как это полагали раньше. Для
выполнения этой пробы к испытуемому твердому веществу или раствору
его в фарфоровой чашке прибавляют избыток концентрированной соляной
кислоты и несколько кусочков цинка; смесь перемешивают пробиркой с хо-1 2
лодной /водой, которую тотчас же вносят в несветящееся пламя бунзенов-/
ской горелки. В присутствии олова пробирка окружается синим пламенем \
Открываемый минимум: 0,03 Y олова.
* Дополнение редактора. Так как сами газы пламени содержат вос-
станавливающие вещества, то реакция окрашивания пламени может
быть вызвана даже одной каплей раствора, содержащего олово 3.
Выполнение. Выпаривают каплю исследуемого раствора ла магне-
зиальной палочке 4, держа последнюю в пламени микрогорелки так, чтобы
пламя находилось на расстоянии 0,5 см от капли. Сухой остаток смачи-
вают каплей концентрированной соляной кислоты и вносят его в восста-
новительную часть пламени. Если олово присутствует, то магнезиальная
палочка окутывается оболочкой синего пламени. Опыт окрашивания пла-
мени может быть многократно повторен путем смачивания того- же сухого
остатка концентрированной соляной кислотой, если только количество
олова превышает 0,25 у. Реакция окрашивания пламени не удается в при-
сутствии большего чем эквивалентное количество мышьяка. * Д. К.
Анализ группы II
Золото и платина, фактически- принадлежащие к этой группе, редко
встречаются в больших количествах при обычном минеральном ана-
лизе; открытие же малых количеств их настолько важно, что соответ-
ствующие испытания принято производить отдельно, как это будет изло-
жено в части V.
Металлы .второй группы осаждаются в виде сульфидов сернистым во-
дородом в присутствии 0,3N минеральной кислоты. Теория, обосновываю-
щая осаждение сульфидов, была, рассмотрена на стр. 39, 65 и др.
В 0,3W минеральной кислоте концентрация сульфидных ионов, обравует-
мых за счет ионизации сернистого водорода, становится настолько малой,
что произведение растворимости сульфидов цинка, никеля, кобальта, же-
леза и марганца не достигается, если концентрации этих элементов в рас-
творе невелики. При концентрациях металла до 5 г/л в кислоте указанной
концентрации имеется вероятность осаждения только сульфида цинка и
лишь в том случае, когда он одновременно осаждается со значительным
1 Н. Meissner, Z. anal. Chem. 80,247 (1930); F. Hahn, Z, anal. Chem.
82, 113 (1930). Ред.
2 Наблюдения Hahn показали, что вода в пробирке должна иметь
температуру, заметно превышающую комнатную. По его мнению необхо-
димы еще опыты для установления оптимальной температуры воды. Ред.
3 Ф а й г л ь, Капельный анализ, стр. 230. РеД.
4 См. подстрочное примечание на стр. 88.
200
количеством какого-нибудь металла второй группы. Произведение раство-
римости сульфида свинца около 4,2 • 10~28, сульфида кадмия 3,6 • 10~29, между
тем как произведение растворимости сульфида цинка 1,2 10~23. По сравне-
нию с сернистой ртутью, произведение растворимости которой равно
4,0 10~и, сернистый свиней можно считать заметно растворимым, но по
сравнению с сернистым цинком он значительно менее растворим. При осаж-
дении этих сульфидов наблюдается стремление их увлекать с собой неко-
торое количество металлов следующих групп (частью вследствие адсорбции);
но абсолютные количества соосаждаемых металлов настолько незначительны,
что даже при содержании цинка в исходном растворе в 2 лг его удается
открыть в ходе анализа в надлежащем месте, т. е. с металлами третьей
группы.
Растворимости сульфидов металлов второй группы настолько сильно
разнятся между собой, что возможно отделение их друг от друга путем
регулирования концентрации кислоты, чтобы создать концентрацию суль-
фидных ионов, достаточную для осаждения одного металла и недостаточ-
ную для осаждения другого, металла. По той же причине при пропускании
сероводорода через кислый раствор осаждается сначала наименее раство-
римый сульфид, и лишь после полного его осаждения выпадает незначи-
тельное количество более растворимого сульфида, если только образование
его вообще происходит. В этом отношении поведение мышьяка, составляет
Исключение, но это обусловливается, как это было уже указано (стр. 170),
отсутствием заметного количества катионов мышьяка в растворе арсената.
Порядок, в котором металлы осаждаются в виде сульфидов из холодных
растворов по мере постепенного уменьшения концентрации кислоты, при-
близительно следующий: мышьяк, ртуть и медь; сурьма, висмут и четырех-
валентное олово; кадмий, свинец и двухвалентное олово; цинк, железо, ни-
кель, кобальт и марганец. Следует отметить, что цинк находится немного
выше никеля и кобальта, что отвечает действительному порядку осажде-
ния; но спустя короткое время после осаждения сульфиды никеля и ко-
бальта становятся ‘нее растворимы, чем свежеосажденные сульфиды кад-
мия, свинца или двухвалентного олова.
Теория растворения сульфидов подробно рассматривается на стр. 232
и 268. Более растворимые сульфиды могут быть растворены простым увели-
чением концентрации водородных ионов. Так, сульфиды олова, свинца, кад-
мия, сурьмы и др. могут быть растворены в концентрированной соляной
кислоте. Нагревание раствора для удаления сернистого водорода ускоряет
растворение, но более эффективного результата достигают при прибавлении
окислителя, который окисляет сульфид-ионы тотчас же по мере их образо-
вания. Таким образом, легко растворяются даже сульфиды ртути и мышь-,
яка, если на них подействовать царской водкой или бромной водой.
Мы опишем анализ этой группы по методу, разработанному А. Нойе-
сом и его учениками. Первоначальный осадок сульфидов обрабатывают
раствором многосернистого натрия, который растворяет сульфиды ртути,
мышьяка, сурьмы н олова; в остатке остаются свинец, висмут, медь и кад-
мий. считающиеся нерастворимыми в многосернистом натрии или аммонии.
В действительности, большая часть сульфидов группы меди обладает
небольшой растворимостью в многосернистом натрии или аммонии. Так,
в многосернисдом аммонии может раствориться 5—10 мг CuS и 0,5—1,0 мг
HgS. Ни один из сульфидов не растворяется в сколько-нибудь заметной
степени в бесцветном односернистом аммонии. В многосернистом натрии
рекомендуемой нами концентрации при нормальных условиях не .раство-
ряется больше 1 мг сульфидов меди и висмута; другие сульфиды группы
меди-растворимы еще менее. Преимущество пользования многосернистым
натрием состоит в том, что в большинстве случаев он дает возможность
более полно отделять группу олова от группы меди, чем при польэлра-
нии полисульфидом аммония. В отсутствие меди лучше иногда пользо-
ваться для отделения тиокислот от тиооснований сульфидом аммония, чем
сульфидам натрия. В сульфиде аммония HgS не растворяется и переходит
в группу меди и остается нерастворенной в азотной кислоте (табл. III, § 1).
Растворение HgS и проба на ртуть посредством SnCh производятся по
табл. IV, п. 3.-
201
ТАБЛИЦА 11. ОТДЕЛЕНИЕ ГРУППЫ МЕДИ ОТ ГРУППЫ ОЛОВА
Раствор может содержать катионы всех металлов, за исключением серебра
и одновалентной ртути. Доводят концентрацию НС1 в растворе до 0,3N и
насыщают сероводородом. Фильтруют и исследуют фильтрат на группы
III, IV и V. Осадок обрабатывают раствором ИаДМ и фильтруют (1)
Остаток: PbS, Исследуют Bi2S3, CuS, CdS по табл. Ill Раствор: [HgS2]", [AsS4]'" [SbS4j[SnS3]" Прибавляют HCI и фильтруют (2)
Осадок: HgS, As.,S5, SboS;, SnS2, S Исследуют no табл. IV Фильтрат: NaCl Выливают
Ход анализа
1. Фильтрат от группы I должен иметь объем около 100 мл
и содержать около 30 миллиэквивалентов НС1 или НЫОз (т. е.
5 ли 6N раствора). Раствор сливают, не обращая внимания на
могущий образоваться (при разбавлении фильтрата от группы
1) осадок BiOCl или SbOCl, в эрленмейеровскую колбу емкостью
200 мл, снабженную пробкой с двумя отверстиями; в одно вста-
влена трубка, согнутая под прямым углом, один конец которой
достигает почти дна колбы. Пропускают медленный ток (около
трех пузырьков в секунду) HeS до тех пор, пока после закрытия
второго отверстия пробки и взбалтывания колбы пузырьки газа
уже не будут больше появляться в растворе. Фильтруют, про-
мывают осажденные сульфиды горячей водой, нагревают филь-
трат до кипячения и пропускают H»S в горячий раствор еще
в течение 10 мин.
В случае появления при второй обработке сероводородом
желтого осадка AseSs его отфильтровывают \ прибавляют 5 мл
12/V НС1 и вышаривают досуха. К остатку после выпаривания
прибавляют 10 мл 6N соляной кислоты, насыщают сероводоро-
дом на холоду, а затем, нагрев приблизительно до 80°, пропу-
скают Hz’S еще п течение 10 мин. Отфильтровывают осажден-
ный сульфид, промывают его горячей водой и соединяют
с сульфидами, полученными пои первом пропускании HaS. Филь-
трат исследуют п:1 группы 111, IV и V (табл. V—VIII).
Переносят осажденные сульфиды в фарфоровую чашку и
прибавляют 3—10 мл раствора многосернистого натрия. Чашку
накрывают часовым пеклом и слегка нагревают в течение ко-
роткого времени aipu постоянном взбалтывании. Разбавляют
10 мл воды, фильтруют п промывают горячей водой. Остаток
исследуют по методу, представленному в общих чертах
в табл. III, а раствор — по п. 2.
1 Если осадок AseSa оставить в растворе, может произойти его раство-
рение ,во время выпаривания с HCI и Н.\'Оз с образованием HaAsCh и HsSOj.
Последняя вызовет осаждение В-Г ' в виде BaSOj, который можно при-
нять по ошибке за серу.
202
2. К раствору, полученному при действии многосернистого
натрия, прибавляют соляную кислоту до тех пор, пока переме-
шанный раствор не покажет кислой реакции по лакмусу, после
чего прибавляют еще 1 ял 6N кислоты. Хорошо взбалтывают
и фильтруют. Фильтрат выливают, а осадок, полученный от при-
бавления соляной кислоты к раствору сульфидов в полисуль-
фиде натрия, исследуют по методу, указанному в табл. IV.
Если осадок состоит только из серы, что может быть
установлено путем сравнения цвета его с цветом осадка,
полученного при прибавлении 5 ял 6N кислоты к 3 ял реактив-
ного раствора сернистого натрия, разбавленным 7 ял воды, то
нет необходимости производить испытание на ртуть, мышьяк,
сурьму или олово. В случае сомнения осадок переносят в фар-
форовую чашку и нагревают его короткое время с 8 ял 6N
NHiOH; последний легко растворяет сернистый мышьяк, а также
небольшие количества сульфидов сурьмы и олова. Осадок от-
фильтровывают, причем в случае наличия ртути он содержит
черную HgS и серу, возможно, вместе с малыми количествами
буровато-черных BiaSa и CuS. Если темная окраска осадка не
•появляется, нет необходимости в дальнейшем испытании на
ртуть. К аммиачному фильтрату прибавляют 5 капель реактив-
ного раствора (NHijsS, нагревают до кипения и, если нужно,
фильтруют. ПрИ'б ’ЛЯЮТ 10 ял воды, подкисляют соляной кис-
лотой и хорошо взбалтывают; присутствие мышьяка, сурьмы и
______________ТАБЛИЦА Ш. АНАЛИЗ ГРУППЫ МЕДИ_________________
Остаток по табл. II: PbS, Bi2S3, CuS, CdS. Кипятят c 3NHNO-, и фильтруют (1)
Остаток: S обыкновенное примесью суль- Раствор: РЬ”',ВГ", Cu", Cd”. Прибавляют H-SOit выпаривают, разбавляют и фильтруют (2)
фидов, коли- чеством кото- рых можно пренебречь. Осадок: PbSO4 Растворяют в CH3COONHi и прибавляют K^CrOi- Жел- тый осадок PbCrOi указы- вает на при- сутствие РЬ (3) Фильтрат: Bi”', Cu", Cd”. Прибавляют NHJJH в избытке и фильтруют (4)
Выбрасывают Осадок: Bi(OH)3 Прибавляют NaHSnCP- Чер- ный осадок подтверждает присутствие Bi (5) Фильтрат: [Cu (NH3)4]" и [Cd(NH3\]"
Синий цвет рас- твора указы- вает на присут- ствие Си Велу чае сомне- ния прибавля- ют снъсоон и Ktlf-'e (CN)6] к небольшой части раство- ра. Красный ссадок Cu2[Fe(CN)6] подтверждает присутствие Си К большей час- ти раствора прибавляют H^SOi 11 Ре. Фильтруют и насыщают сбильтратНгЗ. Желтый осадок указывает на присутствие Cd
203
олова обнаруживается по цвету образующегося осадка суль-
фида, но нужно помнить, что смесь сульфидов сурьмы и олова
во многих случаях имеет бурую окраску.
Ход анализа группы меди
1. Остаток, полученный после обработки многосернистым на-
трием, переносят в чашку, прибавляют 5—15 мл 3N азотной кис-
лоты и медленно нагревают до кипения. После 3-минутного
кипячения фильтруют и остаток выбрасывают. (В некоторых слу-
чаях он может содержать почти 2 мг Hg. Испытание на послед-
нюю может быть произведено по и. 3 табл. IV.) Раствор иссле-
дуют по п. 2.
2. К азотнокислому раствору, полученному по п. I, приба-
вляют 3 мл 18N H2SO4 и выпаривают в чашке до появления
густых белых паров H2SO4. Если выделяется большой осадок,
прибавляют еще 2 мл 18N HaSCh. Охладив смесь, осторожно
приливают ее небольшими порциями к 10 мл холодной воды
в пробирке, охлаждая последнюю после каждого добавления.
Спустя 5 мин. фильтруют и промывают осадок 2N H2SO4 и
затем 5 мл холодной воды. Фильтрат исследуют по п. 4, а оса-
док по п. 3.
Иногда в присутствии большого количества висмута часть
последнего осаждается в виде основного сульфата при добавле-
нии воды. Этот осадок не является таким мелкокристалличе-
ским, как PbSOi. Если кажется, что осадок содержит основную
соль Bi, его обрабатывают ДО мл горячей 6N НС1, прибавляют
3 мл 18Л1 H2SO4 и снова повторяют выпаривание. После этого
При разбавлении не должно происходить образования основ-
ного сульфата висмута, так как большая часть висмута пере-
ходит в фильтрат после первой обработки серной кислотой.
3. Полученный по п. 2 осадок PbSOi растворяют на фильтре,
сбливая осадок небольшими порциями горячего 3N раствора
уксуснокислого аммония, весь объем которого не должен пре-
вышать 25 мл. Фильтр промывают после каждой прилитой пор-
ции ацетата горячей водой. К полученному таким путем рас-
твору прибавляют несколько капель раствора КаСгСЬ и 5 мл 6N
уксусной кислоты. Желтый осадок PbCrOi указывает на присутствие
свинца.
4. Фильтрат по осаждении PbSO4(2) нейтрализуют аммиаком,
прибавляя последний до сильного аммиачного запаха. Поси-
нение раствора указывает на присутствие меди. Белый осадок
указывает на присутствие висмута- Осадок отфильтровывают и
промывают горячим, разбавленным аммиаком, после чего его
исследуют по п. 5, а фильтрат—по пп. 6 и 7.
5. На фильтр, содержащий хорошо промытый осадок В1(ОН)з,
заливают холодный, свежеприготовленный раствор NaHSnOs.
[К нескольким каплям раствора SnCh прибавляют 5 мл воды и
раствор NaOH небольшими порциями до полного растворения
осадка Sn(OH)»]. Немедленное почернение осадка подтверждает при-
сутствие Bi (стр. 145),
204
6. Четвертую часть фильтрата, по осаждении ЕИ(ОН)з по п. 4,
берут для испытания на медь, а остаток — для реакции на кад-
мий. Для реакции на медь аммиачный раствор подкисляют
уксусной кислотой и прибавляют каплю раствора K4[Fe(CN)e].
В присутствии меди образуется красный осадок Cu2[Fe(CN')s] .
7. Для испытания на кадмий аммиачный раствор его нейтра-
лизуют 6N серной кислотой, после чего прибавляют еще избы-
ток последней в 5 мл. Нагревают приблизительно до 50°, при-
бавляют (если присутствие меди было обнаружено) около 0,5 г
порошка железа и слегка взбалтывают смесь около 1 мин. Филь-
труют, прибавляют несколько капель 6N H2SO4 (если фильтрат
мутен) и насыщают сероводородом. Желтый осадок CdS указы-
вает на присутствие кадмия. В случае получения черного осадка,
образующегося вследствие- неполноты удаления меди же-
лезом или вследствие присутствия Hg (если железо не применя-
лось), осадок нагревают с 5 мл 3N HNOa, выпаривают с 2 мл 18N
серной кислоты, разбавляют 15 мл воды, снова обрабатывают
железным порошком, фильтруют и насыщают сероводородом.
Таким путем удаляют могущие присутствовать Си, РЬ или Hg.
В случае присутствия мышьяка или сурьмы в анализируемом
образце желтый осадок CdS целесообразно обработать 10 мл
горячего NHiOH содержащего немного (NHi)aS; благодаря
этому сульфиды ьишьяка, сурьмы и олова растворятся.
Вместо только что описанного хода испытания на кадмий очень хо-
рошим способом идентифицирования последнего оказывается следующий.
Если аммиачный раствор окрашен в -синий цвет, прибавляют раствор
цианистого калия до обесцвечивания или же лишь несколько капель его,
если раствор уже с самого начала бесцветен. Пропускают в раствбр сер-
нистый водород в течение У» минуты. В присутствии кадмия появляется
желтый осадок сульфида кадмия. Может образоваться красный осадок
(CSNHsX если было добавлено слишком много H?S (стр. 157).
Примечание. Иногда при испытании на кадмий получается Не-
большой черный осадок; большей -частью это вызывается малыми коли-
чествами ртути или свинца, недостаточно хорошо удаленных из раствора.
В таких случаях осадок отфильтровывают, промывают -водой до полного
удаления цианидов и слабо кипятят в течение 5—-10 мин. в прикрытой
чашке с 15 мл l,2N серной кислоты (6N серную кислоту разбавляют
четырьмя 'Объемами воды). Эта операция служит для растворения суль-
фида кадмия, причем сульфиды меди и ртути не растворяются, а свинец
превращается в сульфат свинца. Фильтруют, разбавляют трехкратным ко-
личеством воды и насыщают сернистым водородом, После этого в при-
сутствии кадмия образуется желтый осадок.
Ход анализа группы олова-мышьяка
1’. Переносят сульфидный осадок (освобожденный, насколько
возможно, от влаги, путем отсасывания) в -пробирку и нагревают
его, опустив пробирку в кипящую: воду, в течение 10 мин. с 10 мл
12N соляной кислоты. Затем пропускают в горячий раствор
в течение 1 мин. сероводород (для осаждения следов -ртути и
мышьяка), медленно прибавляют, перемешивая, 3 мл воды и
фильтруют через сухой фильтр, пользуясь насосом. Фильтр
205
ТАБЛИЦА 1V. АНАЛИЗ ГРУППЫ ОЛОВА-МЫШЬЯКА
Осадок по табл. II: HgS, As^S;, Sb2S5, SnS2, S. Нагревают с V2NHCI
и фильтруют (1)
Остаток: HgS, As;S5, S Прибавляют
ПН.С)Н. Фильтруют (2)
Раствор: HSbCl4, H2SnCl6. Разбавля-
ют, нагревают и насыщают серо-
водородом.. Фильтруют (5)
Остаток: HgS, S. |
Прибавляют НС1
и КСЮ?,. Реакция
на ртуть с SnCB.
Осадок Hg2Cl2
или Hg2Cl2 -f- Hg
указывает иа при-
сутствие Hg (3)
Раствор: AsS4'",
AsO^S"'. Выпарива-
ют почти досуха,
прибавляют HNO.,
снова выпаривают
и прибавляют
NH^OH. Фильтру-
ют, если нужно;
прибавляют
Mg(NO$)% Белый
осадок должен быть
MgNH4AsO4. Филь-
труют, промыва-
ют осадок малым
количеством воды
и прибавляют
AgNO3u СН3СООН.
Красный осадок
Ag»AsO4 подтверж-
дает присутствие As
Осадок: Sb2S3.
Растворяют в НС1
и прибавляют ме-
таллическое оло-
во. Черный осадок,
не растворимый в
NaBrO, указывает
на присутствие Sb
Раствор: H2SnCl6
Частично нейтра-
лизуют и испы-
тывают сероводо-
родом. Выпарива-
ют, не фильтруя,
и кипятят с ме-
таллической сурь-
мой. Реакция на
двухвалентное
олово с HgClfr Бе-
лый или серый
осадок указывает
на присутствие Sn
(7)
должен быть вставлен в меньший фильтр из твердой фильтро-
вальной бумаги и хорошо прилегать к стенкам воронки. Оса-
док промывают сначала 6/V НС1, а затем горячей водой. Филь-
трат исследуют на HSbCH и HeSnCle по п. 5, а осадок — на
мышьяк и .ртуть — по и. 2.
2. Нагревают при перемешивании остаток приблизительно
с 10 мл 6N аммиака, в котором растворяется сульфид мышьяка
и не растворяется сульфид ртути. Последний отфильтровывают
и промывают разбавленным аммиаком. Фильтрат исследуют на
мышьяк по п. 4.
3. Осадок, состоящий из сернистой ртути и избытка серы,
растирают с 5 мл соляной кислоты и небольшим количеством
хлората калия. Кипятят до исчезновения запаха хлора, разба-
вляют до 15 мл водой и прибавляют сухой хлорат калия не-
большими порциями до тех пор, пока не исчезнет черный оса-
док HgS. Раствор кипятят до исчезновения запаха хлора, но
не выпаривают его, ввиду летучести HgCla; по мере испарения
кислоты последнюю добавляют. Раствор, освобожденный от
хлора, разбавляют 10 мл воды и фильтруют. К фильтрату при-
бавляют несколько капель раствора SnCls, а затем еще 2—5 мл.
206
Белый осанок HgzCI-i или темный осадок, содержащий некоторое коли-
чество свободной Hg, указывает на присутствие ртути.
4. Аммиачный раствор монотиоарсената и тетратиоарсената
аммония выпаривают почти досуха. Это иногда может
повести к выпадению сульфида, но в предлагаемых условиях
он окисляется 6N азотной кислотой до мышьяковой кислоты.
К концентрированному раствору, полученному путем выпарива-
ния, прибавляют 5 мл 6N азотной кислоты и кипятят до тех
пор, пока весь остаток не растворится и останется лишь не-
много серы. Выпаривают почти досуха, прибавляют 3 мл ам-
миака и, если нужно, фильтруют. После этого мышьяк нахо-
дится в виде арсената аммония. К прозрачному раствору при-
бавляют реактивный раствор нитрата магния, сильно1 перемеши-
вают и дают пробе некоторое время постоять. Белый кристалли-
ческий осадок мышьяковокислого магний-аммония указывает на при-
сутствие мышьяка. Фильтруют, осадок промывают небольшим
количеством воды и i ливают смесью из 1 мл раствора азотно-
кислого серебра с шестью каплями уксусной кислоты. Появление
темнокрасного окрашивания от образовавшегося мышьяковокислого
серебра подтверждает присутствие мышьяка.
5. Раствор, полученный в п. 1, разбавляют водой до 55 мл
и насыщают сероводородом приблизительно при 90°. Сероводо-
род пропускают через горячий раствор 8 мин. для осаждения
сернистой сурьмы БЬгБз. Фильтруют и промывают осадок горя-
чей водой. Фильтрат исследуют на олово по1 п. 7.
6. Осадок сернистой сурьмы переносят в небольшую чашку,
растворяют в 5 и концентрированной соляной кислоты, нагре-
вая в случае необходимости. Если не получается прозрачный
раствор, то прибавляют 5 мл воды и фильтруют, отбросив затем
остаток. Фильтрат выпаривают приблизительно' до 2 мл, охлаждают
и вносят в него гладкую пластинку блестящего металлического
олова. Спустя 10 мин. сливают жидкость, промывают металл
водой и исследуют черное1 пятно на сурьму. Для этого оло-
вянную пластинку обливают приблизительно 2 мл свежепригото-
вленного раствора бромноватистокислого натрия 2. Черное пятно,
не растворяющееся в бромноватистокислом натрии (в противополож-
ность мышьяку}, указывает на присутствие сурьмы.
7. Чтобы убедиться, имеется ли олово, производят следую-
щую предварительную реакцию. К фильтрату, полученному
в п. 5, прибавляют точно 4 мл концентрированного аммиака и
насыщают сероводородом. Если осадок не выделяется в тече-
ние 10 мин., то дальнейшее испытание на олово излишне. В слу-
чае образования осадка выпаривают, не фильтруя, до объема
в 15 мл или до меньшего объема, если сульфид не растворится.
Прибавляют около 5 г сурьмы в порошке и слегка кипятят 2 мин.:
1 Может выделиться осадок меди, но она красного или бурого цвета.
2 К 2 мл насыщенной бромной воды прибавляют по каплям раствор
NaOH до тех пор, пока раствор не станет бесцветным или желтым, затем
прибавляют еще столько же капель раствора NaOH,
207
Фильтруют и прибавляют сразу 2 мл соляной кислоты и немного
раствора хлорной ртути. Белый или серый осадок указывает на
присутствие олова.
Примечание. Если сульфидный осадок, полученный при подкис-
лении полисульфидного раствора, состоит, главным образом, из пятисер-
нистого мышьяка, то последний лучше всего сначала перевести в раствор
посредством углекислого аммония (стр. 170). Нерастворимый остаток
SbaSs, SnSa и S исследуют на сурьму и олово.
Чтобы открыть мышьяк в растворе ) глекислого аммония, прибавляют
соляную кислоту, которая осаждает пятисернистый мышьяк. Последний
растворяют, как указано в табл. IV, и убеждаются в присутствии
мышьяка, как выше было описано.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Задачи по осаждению сероводородом
1. Насыщенный раствор H’S при 20° приблизительно 0,1 молярен, кон-
станта его первичной ионизации 5,7 • 10~8, константа вторичной иони-
зации 1,2-IO-15. Вычислите [H']2[S"J в насыщенном растворе.
2. Если произведение растворимости PbS равно 4,2 . КО28 и раствор содер-
жит З-КГ2! мюля S", вычислите количество РЬ в .чг, которое должно
находиться в 400 мл раствора, чтобы образовался осадок PbS.
3. Дайте формулы всех веществ, осаждающихся в виде сульфидов, когда
раствор, 3N по Н’, насыщен H2S.
4. Если раствор Bi’’’ разбавить водой, образуется белый осадок ВЮС1,
который переходит в черный Bi’Ss, когда на него действуют H2S.
Произойдет ли то же самое с суспензией Bi(OH)s? Предполагается,
что произведение растворимости BiaSs равно 5- 10~23 и произведение
растворимости В1(ОН)з приблизительно равно 1,2• 10-3es
Задачи по отделению посредством Na2Sj
1. Напишите формулы сульфидов групп Си и Sn, которые окрашены
а) в желтый, б) черный или бурый и в) оранжевый цвет.
2. Сколько NaaS . 9Н’О (мол. в. 240), NaOH (мол. в. 40) и S (ат. в. 32),
нужно взять для приготовления 1 л реактива, который должен быть
3N по NaaS, IN по NaOH и IN по Na’S’ (образующемся при действии
№гЗ на S).
3. Что произойдет при действии кислоты на раствор Na’Sa? Напишите
уравнение реакций, протекающих при действии разбавленной кисло-
той на Nas’HgS’, NasAsSi, NasSbSi и NaaSnSs.
4. Сколько мл 3N NH4OH требуется для растворения 0,5 г As’Ss?
5. Как ведут себя сульфиды групп меди и олова, если подействовать на
них (NHi^Ss, а не Na^Sa? При каких условиях лучше пользоваться
аммиачным раствором?
6. Напишите уравнения реакций, показывающих двухфазность гидролиза
Na>’S. Почему прибавляют к реактиву (NaaS) NaOH? Почему S рас-
творяется в этом реактиве?
7. Если осадок сульфидов обработан 8 мл реактивного раствора Na»S,
содержащего NaaS в концентрации 3N, NaOH IN и Na2Ss IN, сколько
6N НС1 потребуется для полного выделения AssSs; Sb’Ss и SnS’?
8. Какова концентрация S" в 0,lN растворе H2S, в том же растворе
после добавления к нему равного объема 0,lN НС1 и в 0,lN растворе
H’S. разбавленном равным объемом 0,lN NaOH? Константа первичной
ионизации H2S приблизительно 5,7 • Кб8, вторичной—1,2-IO-15.
208
9. Сколько необходимо реактивного раствора NaeSs, чтобы растворить
0,5 г Sn, находящегося в виде SnS? Реактив IN по Na^Sj. 1
10. Напишите уравнения, выражающие реакции между сульфидами Bi, Си,
Sn и Sb и реактивным раствором' NasSs.
Задачи по группе меди
1. Дайте в форме таблицы схему анализа группы меди, исходя от осадка
сульфидов.
2- Сравните действие NaOH и NHiOH при прибавлении каждого в отдель-
ности к растворам Bi’ ’ *> Си’ ’, Cd’ ’ и Pb”. Отметьте влияние из-
бытка реактива. Напишите уравнения для иллюстрации ваших ответов.
3. С помощью закона действия масс объясните: а) влияние избытка H2SO4
на растворимость PbSCh, б) действие раствора NHiAc на PbS04,
в) почему CuS растворяется в горячей разбавленной HNOs лучше, чем
в более концентрированной НО?
4. Сколько 6Л' HsSO4 нужно для осаждения 200 л/г РЬ в виде PbS04?
5. Напишите уравнения: а) разевания осадка при прибавлении NH4OH
к раствору, содержащему Bi; б) действия раствора NHs на Си’’;
в) действия раствора NHs на Cd’’; г) получения раствора NaHSnOa;
д) действия HSnCV на осадок Bi(OH)s; е) обесцвечивания [Си<(ЫНз)б]
цианистым калием.
6. Каков объем газообразного H2S, 'Измеренного при 20° и 760 мм давле-
ния, требующегося для осаждения из кислого раствора 0,500 г Bi
в виде Bi2Ss?
7. Напишите уравнения, показывающие действие горячей ЗА' HNOs на
смесь HgS, CuS и Bi2Ss.
Задачи по группе олова
1. Напишите уравнения, показывающие: а) реакцию между HgCh
и SnCh, б) действие раствора/ NaBrO на As; в) действие концентриро-
ванной НС1 на SbeSs; г) действие Mg(NOs)2 на раствор AsCh'"; д) дей-
ствие СНзСООН и AgNOs на осадок, образованный при реакции «г»;
е) реакцию НС1 и КСЮз, приводящую к образованию Ch; ж) реак-
цию НС1 и КСЮз, приводящую к образованию СЮг.
2. Объясните, почему металлическое Fe осаждает Си, но не Cd из раз-
бавленных кислых растворов? Укажите два случая, когда тот же
принцип используется при анализе группы олова, и напишите урав-
нения, иллюстрирующие эти случаи.
3. Расположите элементы Sn, Pb и Zn в порядке, в котором они нахо-
дятся в ряду восстановительных потенциалов. Если бы Sb была заме-
щена Zn в реакции на Sn, как нужно было бы изменить испытание?
4. Составьте схему анализа группы олова в виде таблицы.
5. Напишите уравнения реакций: а) растворения HgS в растворе №282;
б) открытия олова.
6. Напишите уравнения реакций, происходящих при открытии As по
Маршу.
7. Напишите уравнения реакций, применяемых в схеме качественного ана-
лиза, при помощи которых: а) соль олова (2) может быть превращена
в соединение олова (4) и обратно; б) соединение Sb(3) может быть
превращено в соединение Sb(5) и обратно; в) As(3) может быть
окислен в As(5) и наоборот?
8. Нижеследующие уравнения допишите до конца и подберите в них
коэфициенты:
a) HgS + КСЮз + НС1 —- б) AseSs + NH4OH —
в) HsAsCh + Zn + Н’ —> г) SnCle" +. Sb —» д) AsaSs + КСЮз + НС1—*
14 Зак. 9S2. Тредвелл-Го л л, т. I. 209
ГРУППА Ш. ГРУППА СЕРНИСТОГО АММОНИЯ
АЛЮМИНИЙ, ХРОМ, ЖЕЛЕЗО, ЦИНК, МАРГАНЕЦ, НИКЕЛИ,
КОБАЛЬТ1
Алюминий А1. Ат. в. 26,97. Ат. и. 13
Плотность 2,70. Т. пл. 658,7. Т. кип. 1800°
Нахождение в природе. Алюминий очень распространен в природе. Он
особенно часто встречается в форме многочисленных силикатов, из кото-
рых а первую очередь мы назовем полевые шпаты, слюды и продукты их
разложения:
KAlSi3O8 КН2Д18 (SiO4)s H4AI2S12O9
ортоклаз мусковит каолин
(полевой шпат) (слюда) (продукт разложения
полевого шпата)
Нечистый каолин называется глиной.
Далее, заслуживают внимания: авгиты и роговые обманки, которые
состоят, главным образом,из силикатов щелочных земель, магния и алюми-
ния переменного состава. Криолит моноклинической системы NasAlFe;
топаз Ah(F,OH)-’SiO4; шпинель MglAIOab (алюминат магния) правильной
системы, изоморфная с магнетитом Fe(FeOe)- и хромитом Fe(CrOa)2;
хризоберилл Ве(А10з)2; легко растворимый алунит КА1з(ОН)в(ЗО4)з; далее,
гидроокиси алюминия: гидраргиллит А1(ОН)з моноклинической системы;
боксит H4AI2O5 и диаспор НА1О» ромбической системы; корунд АБОз гек-
сагональной системы, изоморфный с Fe^Os и Сг»Оз; твердость его 9, следо-.
вателыно, по твердости он лишь мало уступает алмазу.
Окись алюминия, окрашенная небольшими количествами окисей ме-
таллов, образует высокой ценности благородные камни; так, например,
окись алюминия, окрашенная окисью хрома, представляет собой красный
рубии; окрашенная окисями титана и железа — синий сапфир. Наждаком
называют микрокристаллическую форму окиси алюминия.
Свойства и получение. Алюминий — металл серебристобелого цвета,
очень легкий и прочный (учитывая плотность). Он получается путем эле-
ктролиза окиси алюминия, растворенной в расплавленном криолите, при-
близительно при 1000°. Теплопроводность его вдвое меньше теплопровод-
ности меди; электропроводность около 60% электропроводности меди при
Одинаковых поперечных сечениях обоих металлов, но если сравнивать
равные весовые количества, то алюминий проводит электричество в два
раза лучше, чем медь. Он применяется для отдельных частей автомобилей,
кухонной посуды н в качестве раскислителя в производстве стали, Один
из наиболее важных сплавов- его содержит 92% алюминия и 8%, меди.
Дуралюмин содержит 94% алюминия, 4.5% меди, 0,75% магния и 0,75%:
марганца.
Атмосферный воздух мало действует на алюминий. По своему поло-
жению в электродвпжущемся ряду (стр. 6!) сн должен был бы легко под-;
вергаться атмосферному воздействию; если такое действие незаметно, то
это объясняется тем, что алюминий покрывается очень тонким плотно
пристающим к нему защитным покровом окиси.
Алюминий трехвалентнен во всех своих соединениях; он образует
только одну окись АЬОз амфотерного характера. Металл растворяется в кис-
лоте, образуя соль последней; в едкой щелочи алюминий растворяется
с образованием алюмината щелочного металла-. Алюминий легко замещает
водород соляной кислоты, менее, легко он растворяется в разбавленной
серной кислоте и становится пассивным при обработке азотной кислотой.
1 В прежних изданиях этой книги титан и уран рассматривались
здесь вместе с другими элементами этой группы. Но нам кажется лучше
рассматривать их в части V наряду с другими редкими элементами,
210
Одна из теорий объясняет причину пассивности образованием тонкой
плотно пристающей к металлу пленки окисла
Действие алюминия на разбавленную соляную кислоту и на водный
раствор едкой щелочи выражается следующими ионными уравнениями;
2А1 + 6Н' -> 2АГ" + ЗНг;
2AI + 2ОН' + 2Н,>0 -+ 2 А10з' + ЗН...
Соляная кислота и едкая щелочь наиболее пригодны для растворения
алюминия.
Соли алюминия обыкновенно бесцветны, и те из них, которые рас-
творимы в воде, показывают в водных растворах кислую реакцию, по-
тому что они в значительной мере гидролизуются. Этим объясняется тот
факт, что при выпаривании раствора хлористого алюминия в воде полу-
чается не хлористый алюминий, а нерастворимая скись или гидроокись:
AlCIs + ЗНОН ^А1(ОН)з ЗНС1.
Весьма характерна для люминия его способность к образованию
квасцов. Квасцы! представляют собой двойные соли сульфата алюминия
с сульфатами калия, цезия, рубидия или аммония общей формулы
RAI(SO«)2 • 12НзО, IB которой R представляет собой один из только что
указанных одновалентных металлов. Подобные же соли, в которых алю-
миний замещен трехвалентиым железом: или хромом, также называются
квасцами. Они кристаллизуются в правильной системе, обычно в виде
октаэдров. Обыкновенные калиевые квасцы во много раз менее раство-
римы в холодной 'воде, чем в горячей. Так, 100 ,it,j воды растворяют при
15° 10,7 ?, а при 100’’ 283 а квасцов.
Сульфид алюминия может быть получен только' сухим путем. Он
бледножелтого цвета и разлагается гидролитически даже холодной водой
на сернистый водород и гидроокись алюминия;
Al:Si + 6H2O->3H;S + 2AI(OH)-.
Гидроокись алюминия амфотерна; она играет роль основания по отно-
шению к сильным кислотам и ведет себя, как кислота, по отношению
к сильным основаниям.
Реакции мокрым путем
1. Аммиак с солями алюминия дает гидроокись алюминия:
АГ ' • + 3NH3 + ЗН->0 -> А1(ОН)з 4- 3NHT,.
которая легко образует коллоидный раствор (гидрозоль); из по-
следнего гидроокись алюминия может быть выделена в виде
студенистого осадка (гидрогель) путем добавки аммонийных солей'2.
Поэтому, когда хотят осадить алюминии из раствора аммиаком, реак-
цию ведут в присутствии аммонийных солен и, в частности, хлори-
стого аммония.
Свежеосажденный гидрат окиси алюминия легко растворим в разба-
вленных кислотах; после стояния в растворе какой-либо соли в продол-
жение некоторого времени, особенно после продолжительного кипячения,
он делается значительно труднее растворимым, так что для полного его
растворения необходима длительная обработка его кислотой.
Произведение растворимости гидроокиси алюминия настолько мало,
что осаждение алюминия аммиаком происходит даже в присутствии аммо-
нийной соли, но вследствие амфотерного характера гидроокиси алюминия
1 До сих пор нет еще удовлетворительного объяснения явления пас-
сивности металлов. Теория пассивности еще не вполне разработана. Ред.
• На этом принципе основан применяемый в технике способ «отсолки»
коллоидальных красящих вещее;в из их растворов.
14*
211
последняя начинает растворяться, когда pH > 9. Алюминий не обнаружи-
вает стремления к образованию растворимых комплексных катионов
с аммиаком.
2. Едкие щелочи 'подобно аммиаку образуют такой же оса-
док, который, однако, растворяется в избытке осадителя, обра-
зуя щелочной алюминат:
АГ -- 4- ЗОН -> А1(ОН)з;
А1(-ОН)3 + ОН'^ АЮа' + 2НгО.1
При действии разбавленной кислоты на раствор алюмината
выделяется сперва гидроокись алюминия, которая при дальней-
шем добавлении кислоты растворяется:
АЮг' + Н’ + НаО -> А1(0Н)3;
А1(ОН)з + ЗН ’ -> АГ ’ + ЗНгО.
Гидрат окиси алюминия растворяется в нейтральных виннокислых
щелочах; поэтому вышеприведенные реактивы не дают никакого осадка
в присутствии винной кислоты. В этом случае алюминий (находится
в растворе не в азиде иона алюминия, а в виде комплексного отрицатель-
ного иона;
Al(OH)s + СЛЮв" -> С4Нг(А1ОН)Ов" + 2НЮ.
Подобно винной кислоте теми же свойствами обладают многие другие
органические омсикислоты и оксисоединения, как, например, яблочная
и лимонная кислоты, различные сахара; крахмалы и т. д.
3. Уксуснокислые щелочи в нейтральных растворах на хо-
лоду не дают никакого осадка, но при кипячении (раствора об-
разуется весьма объемистый осадок основного ацетата алю-
миния:
АГ ЗСНзСОО'-* А1(СНзСОО)3 (на холоду)
растворим
/ОН
Al (СН3СОО)3 + 2НОН Al^OH +2СН3СООН
\ооссн3
(при кипячении)
Бели раствору дать охладиться, то основной ацетат алюми-
ния снова растворяется. Чтобы реакция прошла полностью по
уравнению слева направо, раствор должен быть горячим и не-
обходимо ввести такое количество ацетата щелочного металла,
при котором концентрация водородного иона была бы равна
приблизительно 3 • 10-6 [pH = 5,5 (стр. 63 и след.)].
4. Фосфорнокислый натрий дает студенистый осадок фосфата
алюминия:
2НРОГ + АГ-’ - ->А1РО4 + Н2РО4;
Образование алЮминат-иона можно представить как присоедине-
ние к А1(ОН)з гидроксильной группы, в результате чего образуется ком-
плексный ион [А1(ОН)4]'. Ред. М. JL
212
Эта реакция протекает количественно в присутствии аммиака:
НРОГ 4-| А1 .4- NHs -> NH4- 4- AIPO4.
Фосфорнокислый алюминий растворим в минеральных кисло-
тах, не растворим в уксусной кислоте (отличие от Са, Sr, Ва
и Mg) и легко растворим в едких щелочах с образованием алю-
минат-иона:
Д1РО4 4- 4ОН'-> А1О2' 4- РОГ' 4- 2НЮ.
При кипячении щелочного раствора (полученного’ при по-
следней реакции) с хлористым1 аммонием образуется осадок,
состоящий из смеси фосфата алюминия и гидроокиси алюминия;
хлористый барий, напротг осаждает фосфат бария, оставляя
алюминий в растворе.
5. Сернистый аммоний выделяет осадок гидроокиси. Серни-
стый алюминий, образующийся только сухим путем, полностью
гидролизуется водой, даже холодной:
AI2S3 4- 6НОН -> 2А1(ОН)3 4- 3H2S.
В водном растворе сернистого аммония вследствие гидролиза
образуются NH4OH и H2S и поэтому в нем имеется достаточно
ОН'-ионов, чтобы вызвать осаждение А1(ОН)з.
6. Углекислые щелочи осаждают гидроокись алюминия
(гидролиз):
АГ ” 4- ЗСОз" 4- ЗНОН-» 2А1(ОН)з 4- ЗСОг-
7. Углекислый барий, суспендированный в воде и прибавлен-
ный к раствору алюминиевой соли, также осаждает гидроокись:
2АГ • ‘ 4- ЗВаСОз 4- ЭНОН -> ЗВа ’' 4- ЗСОз 4- 2А1(ОН)з.
8. Щавелевая кислота и ее соли не осаждают алюминий из растворов
его солей. Это помогает отличать алюминий от ряда редких земель, отно-
сящихся к этой же аналитической группе (церия, лантана, неодима, празео-
дима и эрбия), а также от щелочноземельных элементов.
9. Тиосульфат натрия №2826)3, прибавленный в избытке, ко-
личественно осаждает алюминий в виде гидроокиси из разба-
вленного раствора при кипячении до полного удаления SO2:
2А1 • Н- ЗЗЮз" 4- ЗНОН—3S 4- 3SO2 4- 2А1(ОН)3.
Введение тиосульфата натрия имеет целью нейтрализовать Н‘ -ионы,
образованные гидролизом соли алюминия; свободная H2S2O3 настолько не-
устойчива, что происходит разложение ее на S и SO2; равновесие при этом
нарушается вследствие осаждения А1(О.Н)з и выделения SO2 в виде газа.
10. Морин1 CisHioCh • 2НаО (красящее вещество желтого дерева), при-
бавленный к нейтральному или уксуснокислому раствору, содержащему
А], дает зеленую флуоресценцию; формула образующегося соединения
(С15Н»От)зА1. Чтобы открыть алюминий в присутствии мешающих ионов,
прибавляют к испытуемому раствору избыток NaOH, фильтруют, каплю
фильтрата помещают на черную капельную пластинку, подкисляют 2N
1 F. Goppelsroeder. Z. anal. Chem. 7, 195 (1868); Eegriwe, Z.
anal. Chem. 76, 438 (1929), Ред.
уксусной кислотой и прибавляют каплю насыщенного раствора морина
в метиловом алкоголе. С)ткрываемый минимум: 0,2 у алюминия.
* Примечание редактора. Чувствительность' этой реакции может быть
повышена до 0,005 7 при проведении ее на фильтровальной бумаге. См.
Файгль, Капельный анализ, стр. 284 *. А. !(.
11. Эфир осаждает из концентрированных растворов, насыщенных НС1,
белый кристаллический AlCls • 6НзО. Таким путем можно отделить алюми-
ний от бериллия.
12. Тинктура алканы‘. прибавленная к нейтральному раствору алюми-
ниевой соли, скрашивает жидкость в красно-фиолетовый цвет с оранжево-
желтой флуоресценцией. Разбавленные растворы дают характерный спектр
поглощения.
О
II
С он
/\/ \z\OH
13. Ализарин| | | | .Свежеприготовленный 0.01 %-н.ый раствор
ализарина, содержащий уксусную кислоту в концентрации 0.6W и ЗА аце-
тат натрия, окрашивает свежеосажденную гидроокись алюминия в красный
или розовый цвет. В случае большого осадка малое количество послед-
него взбалтывают в пробирке с мелко изорванной фильтровальной бума-
гой и прибавляют 3 ли ализаринового реактива. (О выполнении этой реак-
ции на фильтровальной бумаге, пропитанной спиртовым раствором ализа-
рина, см. Файгль, Капельный анализ, стр. 285.)
о он
14. Ализаринсульфокислый натрий * 2\/\/\/SOsNa желтый краси-
О
тель, называемый ализарином S, образует с А! красный осадок или лак,
соответствующий формуле AKCmHtOiSOsIs. Образующийся в аммиачных
растворах лак устойчив по отношению к уксусной кислоте. Фиолетовая
окраска, вызываемая действием ОН' на избыточно прибавленный реактив,
исчезает при подкислении уксусной кислотой и желтый цвет красителя
регенерируется.
Выполнение. К капле испытуемого раствора после добавления избытка
NaOH для образования иона алюмината АЮг' прибавляют каплю 0,1%-ного
раствора ализарина S; добавляют уксусную кислоту до исчезновения фио-
летового окрашивания, после чего еще каплю ее. В присутствии алюминия
появляется красное окрашивание, интенсивность которого' увеличивается
при стоянии; при большом количестве алюминия образуется осадок.
Открываемый минимум: 0,65 7 в капле3.
15. Алюминон (аммонийная соль ауринтрикарбоно'вой кислоты С22Н14О»)
образует яркокрасный лак с солями алюминия *. Аналогично реагируют, но
давая более светлый оттенок, бериллий, иттрий, лантан, церий, неодим,
эрбий, цирконий, торий и, вероятно, скандий. Однако все лаки с этими
элементами, за исключением лаков с бериллием и алюминием, раство-
ряются или обесцвечиваются при действии на них умеренного избытка
карбоната аммония. Это, быть может, самая чувствительная реакция, какая
когда-либо предлагалась, на ионы а.тютшния, и ее лучше всего произво-
дить с осадком А1(ОН)з, получающимся при обычном ходе анализа.
‘Formaneck. Z. anal. Chem, 39, 409, 673 (1900); Dub sky u.
Wagner, Mikrochemie 17, 186 (1935). Ред.
2 A t a c k, J. Soc. Chem. Ind. 34, 936 (1915). Ред.
3 При очень малых количествах следует произвести слепой опыт
с каплей 1N NaOH и полученную окраску сравнить с окраской, которая
получается с испытуемым раствором. Ред.
‘Hammetu. Sottery, J. Am. Chem. Soc. 47, 142 (1925).
214
Выполнение. Растворяют А1(ОН)з в 5 мл N НС1; прибавляют 5 мл 3N
раствора ацетата аммония и 5 мл 0,1%-ногО' водного раствора алюминона.
Тщательно перемешав, прибавляют к раствору смесь NHiOH и (NH^aCOs.
Яркокрасный осадок, устойчивый в аммиачном растворе, указывает на
присутствие алюминия.
16. Хинализарин (1, 2, 5, 8-тетрагидроксиа1нтрахинон) СиНЮХОНЬ или
НО О он
также весьма
чувствительный реактив на алюминий '. Необ-
но о
ходимую реактивную бумагу готовят следующим образом. 10 мг хинали-
зарина растворяют в 2 мл пириди , разбавляют 20 мл ацетона и пропи-
тывают полученным раствором безе .льную фильтровальную бумагу.
Выполнение. Наносят каплю испытуемого раствора на реактивную
бумагу и держат последнюю непродолжительное время над склянкой
с концентрированным аммиаком, а затем над ларами уксусной кислоты
до тех пор, пока не исчезнет синее окрашивание, образуемое аммонийной
солью хинализарина, и пока несмоченная испытуемым раствором часть
бумаги не приобретет бурой окраски, характерной для свободного хина-
лизарина. В присутствии алюминия остается красно-фиолетовое или красно-
ватое (в зависимости от количества' алюминия) пятно. Открываемый мини-
мум: 0,005 у в капле ( = 0,1 мл).
ОН N
17. Оксин (8-гидроксихинолин) |
осаждает гидроксихинолят
алюминия из уксуснокислых растворов, забуференных ацетатом натрия.
В качестве реактива применяют раствор 2,5 ; оксина в 100 мл 6%-ной
уксусной кислоты.
18. Сульфат калия, добавленный к концентрированному раствору алю-
миниевых солей, вызывает осаждение калиевых квасцов KA1(SCXi)2 12НЮ.
Сходные кристаллы могут быть образованы другими элементами щелочной
группы, в частности рубидием и цезием. Два последних элемента дают
трудно растворимые квасцы.
Открытие алюминия в присутствии органических веществ, препятствующих
его осаждению вышеприведенными реактивами
Присутствие винной кислоты или других нелетучих органических
.оксисое.динений препятствует осаждению алюминия вышеприведенными
реактивами. Чтобы открыть в таких случаях присутствие алюминия, при-
бавляют к исследуемому раствору 5—10 г ацетата аммония, нагревают до
кипения и добавляют свежеприготовленный 2%-ный раствор таннина до
образования гряэнобелого или светложелтого хлопьевидного осадка. Реак-
.ция очень чувствительна, но растворы' циркония п тория дают подобный
же осадок. Для окончательного идентифицирования алюминия танниновый
осадок отфильтровывают, промывают, прокаливают и с остатком произво-
дят реакцию на угле с нитратом кобальта (стр. 217).
Таким же образом в растворе тартрата с таннином реагирует целый
ряд других элементов; получаются характерно окрашенные осадки (см.
Ст, Fe, V, Ti, Та, Nb) 2.
* Н a h n, Mikrochemie 11, 33 (1932). РеД.
* S с h о е 11 е г a. Webb, Analy st 54, 709 (1929).
215
Переведение в раствор нерастворимой окиси алюминия
При сильном прокаливании гидрат окиси алюминия теряет
воду и переходит в ангидрид АЬОз, который не растворим в со-
ляной и азотной кислотах. В концентрированной серной кис-
лоте с добавкой небольшого количества воды он растворяется
при длительном нагревании. Прокаленную окись алюминия,
а также и естественный корунд легко перевести в раствор по-
средством оплавления с пиросернокислым калием. Сплавление
производят следующим образом. Сначала нагревают продаж-
ный кислый сернокислый калий в количестве, превышающем
приблизительно в 12 раз количество окиси, подлежащей раство-
рению, в большом платиновом или кварцевом тигле на малень-
ком пламени. Соль очень легко плавится при температуре около
300° и, выделяя воду (вспенивание), переходит в пиросерно-
кислый калий:
2KHSO1—* Н2О + K2S2O7.
Превращение в пиросернокислую соль закончено, как только
прекратится образование пены. Затем к пиросернокислой соли
прибавляют сухую окись и продолжают йагревание до тех пор,
пока плав не начнет отвердевать (признак образования значи-
тельных количеств- K2SO4, труднее плавящегося, чем пиросерно-
кислый калий), после чего температуру снова повышают и про-
должают прокаливание до полного растворения окиси в спла-
вленной массе (в тигле должна получиться прозрачная жид-
кость). При прокаливании пиросернокислого калия выделяется
50з, который при высокой температуре весьма реакционноспо-
собен:
K2S2O7 = K2SO4 + 50з.
При слишком быстром прокаливании теряется 'много 50з.
Полученный плав по окончании реакции содержит алюми-
ний в виде сернокислого алюминия наряду с сернокислым ка-:
лием:
3K2S2O7 АЬОз —> А1а(5О4)з + 3K2SO4.
Обработав плав водой, получают водный раствор сернокис-
лого алюминия.
Окись, полученная прокаливанием гидрата окиси, может быть переве-
дена в растворимое состояние также путем сплавления ее с едкими щело-
чами:
АЬОз + 2КОН-» 2КА10г + Н2О.
Эту операцию проводят в серебряном, но не в платиновом тигле, так
как последний от этого сильно разрушается.
Встречающаяся в природе АЬОз (корунд, рубин, сапфир, наждак)
может быть переведена в растворимое состояние только путем сплавления
с пиросериокислым калием или натрием.
Реакции сухим путем
Соединения алюминия при нагревании с содой на угле перед
паяльной трубкой дают белую неплавкую сильно светящуюся
216
окись, которая, будучи смочена раствором азотнокислого ко-
бальта, образует синюю неплавкую массу (тенарова синь):
Co(N03)2-> СоО + N2O5
А1 —Оч
А12034-Со0= >Со
А1 — СГ‘
генарова синь
(а. юминат кобальта)
При этой реакции необходимо безусловно избегать избытка
раствора азотнокислого кобальта, ибо нитрат кобальта, взятый
в избытке, при прокаливании оставляет черную закись кобальта,
которая может замаскировать синюю окраску алюмината ко-
бальта. Кроме того, нужно обращать внимание на то, чтобы
синяя масса была неплавкой, так как все расплавленные стекла
окрашиваются кобальтом в синий цвет (перлы буры, фосфорной
соли, силикат кальция и пр.).
Эту реакцию обыкновенно проводят с осадком гидроокиси
алюминия. Для лучшего ее выполнения поступают следующим
образом. Растворяют весь осадок или часть его в 5 мл 2N
HNO3. Прибавляют 5—10 мл воды, 2—15 капель Q,3N раствора
Со(МОз)2 и 3 мл 6N NH«OH. Фильтруют, промывают осадок во-
дой и отсасывают его, насколько возможно, с помощью водя-
ного насоса. Захватывают немного осадка возможно маленьким
кусочком бумаги, закрепленным в петле платиновой проволоки,
смачивают посредством стеклянной палочки каплей концентри-
рованной серной кислоты и нагревают сначала осторожно,
а к концу прокаливают очень сильно. Кремний, наиболее часто
принимаемый за окись алюминия, дает плавкую блестящую
массу СоЗЮз, окись же алюминия образует тусклую, темно-
синюю неплавкую ма>ссу Со(А10г)2С
Все плавкие .стекла, как, например, перлы буры, фосфата натрия и пр.,
окрашиваются окисью кобальта в синий цвет. Синее окрашивание полу-
чается также с некоторыми другими неплавящимися соединениями, не со-
держащими алюминия, например с фосфатами щелочных земель.
Соли алюминия нелетучи и не окрашивают пламени. При
прокаливании на воздухе все соли алюминия, за исключением
фосфатов и силикатов, разлагаются, давая окись:
4А1С1з + ЗО2-> 2А1гОз + 6CI2;
2A1(NO3)3 — AI2O3 4- 3N2O5;
Ah(SO4)3 — AI2O3 + 350з.
1 011 о, J. Am. Chem. Soc. 48, 1604 (1926).
217
Хром Сг. Ат. в. 52,01. Ат. н. 24
Плотность 7,138. Т. пл. 1600. Т. кип. 2200°
Нахождение в природе. Хром встречается в природе в виде хромита
Fe(CrO%, изоморфного со шпинелью (см. алюминий); далее, в виде кро-
коита PbCrO-i моноклинической системы и лаксманнита, представляющего
собой двойное соединение фосфорнокислой соли свинца и меди и основ-
ного хромокислого свинца (РЬ. Си)з(РО4)з • РЬзО(СгО4)з. Хром, кроме того,
встречается в малых количествах во многих силикатах, например в муско-
витах, биотитах, авгитах и т. д., и. следовательно, также и в продуктах
выветривания горных пород, содержащих эти минералы, как, например,
в различных длинах, боксите и т. п.
Металл и его окиси. Хром—< кристаллический металл несколько более
серого цвета, чем серебро. Нагретый на воздухе до 200—300=, он сгорает
в СгаОз. Он нековок и не обладает магнитными свойствами. Широко
используется в производстве специальных сталей, многие из которых со-
держат и .никель. Нержавеющая сталь содержит 8—14% хрома. Нихром,
содержащий около 80% никеля и 20% хрома, применяется в качестве про-
волоки высокого сопротивления в электрических нагревательных приборах
и для треугольников под тигли в химических лабораториях. Хромирование,
в значительной степени замещающее никелирование, создает защитные
покрытия для менее устойчивых металлов. Металлический хром может
быть получен: а) путем прокаливания СгЮз с углем, б) путем термиче-
ского процесса Гольдшмидта, при котором окись хрома восстанавливается
алюминиевым порошком, в) путем сплавления СгС1з с Zn, Cd или Mg и
с КС! и NaC! в качестве плавней. При определенных условиях он может
быть получен электролитическим путем из водных растворов его солей.
Металл легко растирается в порошок. Он растворяется в хлористо-
бромксто- и иодистоводородной кислотах, а также в серной и щавелевой
кислотах с выделением водорода и образованием соли закиси или смеси
солей закиси и окиси хрома. Он легко пассивируется при погружении
в азотную кислоту или при анодной поляризации. Пассивный хром сохра-
няет свой блеск на воздухе, не растворим в разбавленных кислотах и похож
на благородные металлы. Поэтому он является существенной составной
частью нержавеющей стали.
Хром образует с кислородом следующие окислы:
Закись или окись хрома(2) СгО; окись хрома(З) СгаОз; хромовый
ангидрид СгОз и, кроме того, целый ряд перекисей хрома; CrOt, CrsOi,
CraOti и СгзОи (стр. 226).
Окислы СгО ,и СгзОз являются основными ангидридами и при раство-
рении в кислотах дают соответствующие соли двухвалентного и трех-
валентного хрома. Трехокись хрома, представляющая собой ангидрид гипо-
тетической хромовой кислоты НзСгО4, образует с основаниями хроматы.
Перекиси хрома никогда не были получены в чистом виде, соли же над-
хромовой кислоты были изолированы и анализированы (стр. 226).
А. Соединения двухвалентного хрома
Закись или окись хрома(2) известна только в виде гидроокиси
Сг(ОН)з, которая при высушивании теряет водород и воду, превращаясь
в окись хрома(З):
2Сг(ОН% -> Нз + Н?О +СгЮз.
Подобно гидроокиси хрома(2) все соли хрома(2) чрезвычайно не-
устойчивы и легко переходят .на воздухе в соли трехвалентного хрома.
В сухом состоянии известны только галоидные соли, а также фосфат,
карбонат и ацетат; сульфат известен только в растворе. Ацетат
Сг(СНзСОО); • НзО представляет собой красновато-бурое кристаллическое
вещество, не растворимое в воде, но легко растворимое в соляной кислоте.
Этот раствор ‘подобно веем солям двухвалентного хрома жадно поглощает
218
кислород, и поэтому им пользуются в газовом анализе для определения
кислорода в газовых смесях. Растворы соединений двухвалентного хрома
получаются путем восстановления соединений трехвалентного хрома цин-
ком <н кислотой без доступа воздуха.
Ввиду малой устойчивости этих соединений аналитику редко прихо-
дится с ними встречаться.
Б, Соединения трехвалентного хрома
Все соединения! окиси хрома содержат хром в виде трехвалентного эле-
мента; они окрашены в зеленый или фиолетовый цвет и большей частью
растворимы в воде. Не растворимы ,в воде: окись, гидроокись, фосфат,
безводный хлорид и сульфат после сильного прокаливания его в токе
двуокиси углерода,- Полученный сухим путем -.иолетового цвета хлорный
хром СгС1з в кислотах 'не растворяется, -но о-;. легко растворяется в воде
в присутствии следов хлористого хрома СгС1з или хлористого олова (ста-
ниоль и -немного соляной кислоты). При растворении серо-зеленого гидрата
окиси хрома -в соляной кислоте получается зеленый растз.ор, в котором
часть хлора входит ,в состав комплексного иона (сере-бро его не выделяет).
Это объясняется строением хлорного хрома, эмпирическая формула кото-
рого СгС1з 6Н2О. Свежеприготовленный раствор хлорного хрома претер-
певает при стоянии на холоду следующие превращения С
[Сг(НЮ)iCl,.]С! • 2Н-Ю-* [Сг(НЮ)5С1]СВ • НЮ -> [Сг(НЮ)в]С1з.
При этом зеленый цвет переходит сперва в бледнозеленый, а затем —
в фиолетовый. Известны также зеленые комплексные сернокислые соли
трехвалентного хрома, которые при прибавлении к ним иона бария
остаются прозрачными и дают осадок сернокислого бария лишь после
некоторого стояния. Эти соединения трехвалентного хрома -медленно пере-
ходят в ионизирующие соли в разбавленном горячем растворе.
Сульфат окиси хрома образует с сульфатами калия, аммония, цезия и
рубидия правильно кристаллизующиеся хромовые квасцы, водный раствор
которых -имеет кислую реакцию, как и все остальные соли окиси хрома
(гидролиз).
Сульфид хрома CrsSs может быть получен только сухим путем. При
Действии на него воды он разлагается количественно на гидроокись и
сернистый водород.
Хром обнаруживает большое стремление к образованию комплексных
иОнов с цианистоводородной и серной кислотами, органическими соедине-
ниями, содержащими -гидроксил, а также с аммиаком, аминами, пиридином
и т. п. Эти комплексные соединения не дают многих характерных реакций
на хром.
Реакции мокрым путем
1. Аммиак образует серо-зеленый студенистый осадок гидро-
окиси хрома:
Ст’’ ‘ 4-ЗОН'—> Сг(ОН)>
Гидроокись трехвалентного хрома несколько растворима в избытке
аммиака, причем раствор окрашивается в фиолетовый цвет. Это растворе-
ние особенно легко происходит, если осаждение производить в фиолето-
вом растворе соли окиси хрома. При этом образуется комплексная соль
1[Сг(МНз)в] С1з, которая, однако, при кипячении раствора до исчезновения
избытка аммиака количественно разлагается с выделением хрома в виде
гидроокиси. Таким образом, если хотят количественно осадить хром в
виде гидроокиси из раствора соли трехвалентного хрома, то осаждение
ведут при температуре кипения возможно малым -избытком аммиака. Оса-
док при этом -обыкновенно загрязнен заметными количествами основной
соли.
1 A. Werner u. Al Gubser, В. 24, 1579 (1901); В j е г г и т,
Z. physikal. Chem. 59, 336, 581 (.1907).
219
При прокаливании гидроокиси хрома получают зеленую окись хрома,
которая после долгого прокаливания не растворима в кислотах. Для рас-
творения ее необходимо сплнзлять с пиросернокислым калием, как это
делается с окисью алюминия; или же сплавляют с углекислым натрием
в присутствии небольшого количества селитры в платиновом тигле, причем
получается легко растворимый хромовокислый натрий:
2СггОз + 4Na2COs + 30г-> 4Na2CrO« + 4СОг.
Растворив плав в воде, подкислив раствор соляной кислотой и при-
бавив спирт, легко получают после кипячения раствор хлорного хрома
зеленого цвета (стр. 225), из которого хром может быть осажден аммиа-
ком. При сплавлении окиси хрома с содой н селитрой в платиновом тигле
последний немного разрушается, так что в растворе плава будет нахо-
диться немного платины; она может быть удалена из раствора, если
последний подкислить соляной кислотой, пропустить через него сернистый
водород и отфильтровать выпавший сульфид платины.
2. Едкие щелочи дают такой же осадок, как и аммиак, только
этот осадок легко растворяется в избытке осадителя, образуя
зеленые хромиты:
Сг'*' '+ ЭОН' —»Сг(ОН)3; Сг(ОН)3 + ОН' г^СгОг' + 2Н2О.
Гидрат окиси хрома играет в данном случае роль слабой кис-
лоты Эта реакция обратима. Присутствие большого количе-
ства воды обусловливает течение реакции по1 уравнению справа
налево; особенно легко совершается этот процесс при темпе-
ратуре кипения. При кипячении разбавленных растворов проис-
ходит полный гидролиз: гидрат окиси хрома почти количе-
ственно вылакает снова (отличие от алюминия).
Гидроокись хрома часто вызывает соосаждение других осно-
ваний в виде нерастворимых хромитов, в особенности цинка1,
щелочных земель и магния.
Осаждению гидроокиси хрома какой-либо из описанных
здесь реакций препятствуют винная, лимонная и щавелевая кис-
лоты, а также сахар. Иногда осаждение совсем не происходит,
если же осадок и образуется, то никогда не бывает количествен-
ным. Таннин, прибавленный к кипящему раствору тартрата, со-
держащему соль трехвалентного хрома и избыток ацетата ам-
мония, выделяет зеленоватый осадок.
3. Карбонаты щелочей и бария, сернистый аммоний и тио-
сульфаты щелочей осаждают гидроокись хрома (аналогично со-
лям алюминия).
4. Фосфорнокислый натрий дает зеленоватый аморфный оса-
док фосфата хрома(З):
2НРОП + Сг ’' — СгРО4 + НгРО/.
Фосфорнокислая соль трехвалентного хрома легко растворима
в минеральных кислотах и в холодной уксусной кислоте. При
кипячении уксуснокислого раствора фосфат хрома снова выпа-
дает. Щавелевая кислота препятствует осаждению фосфата
1 О растворимости гидроокиси хрома в концентрированных растворах
едких щелочей см. Ztschr. ph. Chem. 110, 363 (1924).
220
трехвалентного хрома вследствие образования комплексного
хромоксалатного иона.
5. Уксуснокислые щелочи не дают в растворах солей трех-
валентного хрома никакого осадка даже при кипячении. Об-
Гг (CHqCOO)'fil
разуется устойчивый гексаацетатныи комплекс v /bj;
представляющий собой одновалентный 'положительный ион (ка-
тион). Но при одновременном присутствии больших количеств
солей алюминия и солей окиси железа достигается почти полное
осаждение хрома вместе с алюминием и железом в виде основ-
ной уксуснокислой, соли. Если же преобладает хром,‘ то только
часть этого металла осаждается в виде 'сновной соли, филь-
трат же содержит на ряду с хромом еще железо и алюминий.
Осаждение алюминия и железа уксуснокислыми щелочами в присут-
ствии хрома всегда ненадежно. * Это свойство солей окиси хрома
обусловливается тем, что1 хром в комплексном соединении
[Сгз(СНзСОО)б(ОН)2] ’ может частью замещаться алюминием и
железом Е* Ред.
6. Перекись водорода, см. стр. 226.
7. Перекись натрия и едкая щелочь, прибавленные к соли
трехвалентного хрома, превращают последний в хромат-ион,
в котором хром положительно шестивалентен:
2Сг,~- + 3Na2O2 + 40Н'—> 2CrO«" + 6Na' + 2Н2О.
8. Сернистый водород не действует на кислый раствор соли хрома(З);
сульфид хрома может быть получен только сухим путем; водой сульфид
гидролизуется. В щелочном растворе, содержащем хромит-анионы, серни-
стый водород осаждает гидроокись хрома:
2СгОг' + HaS + 2НгО-> 2Сг(ОН)з + S".
Кислые растворы хроматов и бихроматов восстанавливаются до солей
трехвалентиого хрома с выделением серы (стр. 53).
9. Превращение в хроматы и бихроматы соединений трехвалентного
хрома лежит в основе следующих четырех реакций, весьма ценных для
открытия очень малых количеств хрома после предварительного превраще-
ния ионов хрома(З) в хроматы или бихроматы. Реакция образования хро-
мата серебра или свинца дает положительный результат при 6 Т хрома,
дифенилкарбазидная реакция при 0,25 t в щелочном растворе и при 0,8 7
хрома в кислом растворе и бензидинная реакция при 0,25 1' хрома.
а) Наносят каплю испытуемого раствора «а фильтровальную бумагу,
прибавляют каплю концентрированного раствора едкой щелочи ;и держат
бумагу над бромными парами. После этого прибавляют каплю сильно под-
кисленного уксусной кислотой . раствора ацетата свинца или нитрата
серебра. В присутствии хрома появляется желтый осадок PbCrCh или крас-
ный AgaCrOi.
б) На капельной пластинке к капле испытуемого раствора, подкислен-
ного минеральной кислотой, прибавляют каплю насыщенной бромной воды
и 2—3 капли 2N раствора NaOH. Раствор должен показывать по лакмусу
явно щелочную реакцию. Перемешав палочкой, прибавляют кристаллик
фенола, каплю 1%-ного спиртового раствора дифенилкарбазида и, нако-
нец, по каплям 2N серную кислоту до исчезновения красного окрашива-
ния, вызываемого реакцией дифенилкарбазида с едкой щелочью. В при-
сутствии хрома появляется сине-фиолетовая окраска. Реакции могут по-
1 См. vV е i п 1 а п d u. Gussmann, В. 42, 3881 (1909); Z. anorg. Chem.
66, 157 (1910).
221
метать соли кобальта и марганца, которые взаимодействуют с бромом и
едкой щелочью, образуя черные осадки Co(OHh и МпО(ОН)з '.
* Примечание редактора. Реакция хромата с дифеиилкарбазидом мо-
жет быть замаскирована тажже и теми металлами, гидроокиси и окиси
которых окрашены. Поэтому выпавшие окрашенные осадки должны быть
удалены до прибавления реактива. Фенол добавляется для удаления из-
бытка брома, с которым он образует трибромфенол. * А. К.
в) К капле кислого испытуемого раствора на капельной пластинке при-
бавляют каплю насыщенного раствора персульфата щелочного металла и
каплю 2%-ного раствора нитрата серебра. Спустя 2 мин. прибавляют
каплю спиртового раствора дифени.ткарбазида. В присутствии хрома по-
является фиолетовая или розовая окраска. Марганец мешает этой реакции,
так как он окисляется персульфатом в МпО<" также фиолетового цвета.
Но если прибавить небольшое количество азида натрия, то МпОС восста-
навливается, хромат же остается без изменения* 2.
г) На фильтровальную бумагу наносят каплю умеренно концентри-
рованного свежеприготовленного водного раствора перекиси натрия и за-
тем каплю исследуемого раствора. Образовавшийся при этом СгОС' пере-
мещается за счет капиллярных сил во внешнюю зону капельного пятна,
где он может быть открыт каплей уксуснокислого раствора бензидина (рас-
творяют 0,05 г бензидина в 10 л/л уксусной кислоты, разбавляют водой до
100 мл и фильтруют) по образованию бензидиновой сини3. Бензидин
смсрихиноидаос» соединение, в котором 1 моль амина и 1 мюль имина
соединены с да; мя эквивалентами кислоты:
2H2bZ
)NH2 4- 2СН3СООН + о —►
—>H5O+[h,N\ У~\ \NH2-NH=/_____________/=\__ /=NHj • 2СН3СООН.
При этой реакции должны приниматься особые меры предосторож/
кости, если присутствуют ванадий или марганец.
В. Соединения шестивалентного хрома (хроматы,)
Трехокись хрома (хромовый ангидрид) СгОз представляет собой крас-
ные ромбические иглы, плавящиеся при IDS’ (образуя черную жидкость)
и разлагающиеся приблизительно • при 250° иа окись хрома и кислород.
Трехокись хрома расп.пинается на воздухе и растворяется очень легко
в воде; водный раствор окрашен в оранжево-красный цвет. При нейтрали-
зации едким кали этот раствор становится желтым, и при испарении его
выделяется красивая, окрашенная в желтый цвет соль К.СгОд — калиевая
соль хромовой кислоты Н^СгОт. Напротив, если подкислить желтый рас-
твор хромовокислого калия и •подвергнуть его кристаллизации, то поду-
чаются кристаллы двухромовокислого калия КгСггО- в виде столбиков
триклинической системы, окрашенных в великолепный оранжево-красный
цвет.
Водный раствор хромовокислого калия KsCrO-i содержит бесцветные
ионы калия и желтые ионы СгОт":
КтСгОт —>- 2К’ + СгОС';
водный же раствор двухромовокислого калия содержит на ряду с бео
цветными ионами калия оранжево-красные ионы СгдЪ":
КаСггОт -> 2К’- + СггОт".
'Cazeneuve, С. R. Acad. Sci. Paris. 131, 346 (1900); Heller u.
Krumholz, Mikrochemie 7, 220 (1929).
2 Ibbotson a. Howd en, Chem. News. 90, 320 (1904); см. также
Файгль, Капельный анализ, стр. 269. Ред.
3 Т а п a n а е f f, Z. anorg. Chem. 140, 327 (1924).
222
Поэтому уже по цвету раствора хромата можно судить о природе на-
ходящегося в растворе хромат-иона.
Свободные кислоты Н2СГО4 и НгСгзО не были изолированы; при по-
пытке их получения в чистом состоянии выделяется их ангидрид СгОз,
обладающий большой растворимостью в воде. Когда трехокись хрома
растворяется в воде, то имеет место следующая реакция:
СгОз + НзО^ НзСгОз.
Первичная ионизация этой кислоты характеризует последнюю как
сильную кислоту (стр. 24), и поэтому большая часть HsCrOi подвергается
ионизации по мере ее образования:
HsCrCh X Н’ 4- НСгО.
Однако вторичная ионизация соответствует очень слабой кислоте и в
присутствии ионов водорода ион НСгОС вообще едва ионизирует. Однако
НСгОС обнаруживает тенденцию к отщеплению воды, и тогда устанавли-
вается следующее равновесие:
2НСгОГ 2дНгО + СгзО:
Присутствие водородных ионов благоприятствует образованию бихро-
мат-иона, тогда как разбавление будет благоприятствовать обратной реак-
ции— образованию хромат-иона; присутствие же ОН'-ионюв будет вызы-
вать исчезновение 'бихромат-ионов, на место которых появятся желтые
хромат-ионы СгОГ'.
Примечание. Хотя мы можем судить о цвете ионов по цвету их
раствора и часто предугадывать, каков должен быть цвет твердой соли,
однако мы не можем сказать, каков будет цвет раствора на основании
цвета самой твердой соли. Так, желтый иодид свинца при растворении
в воде дает бесцветный раствор, а. желтый и красный иодиды ртути (хотя
и мало растворимые) также не дают окрашенных растворов.
Если раствор соли окрашен, сама соль будет окрашена; обратное по-
ложение не всегда оправдывается.
Все хроматы ие растворимы в воде, за исключением хроматов щелоч-
ных металлов, кальция, стронция и магния. Все хроматы растворимы
в азотной кислоте, кроме сплавленного хромата свинца, растворяющегося
с трудом.
Образование хроматов
Все соединения хрома .могут быть легко окислены до хроматов. В за-
висимости от растворимости или нерастворимости данного соединения
в воде применяются различные методы для его окисления.
Чт.обы вывести уравнение процесса окисления хрома, необходимо по-
мнить, что хром со своими тремя положительными валентностями (в виде
трехвалентных катионов или хромит-анионов) превращается при окислении
в хром с шестью положительными валентностями (в виде хромовой кисло-
ты, хромат- .и бихромат-ионов). Когда окисление производится посредством
галоида, последний переходит из своего нейтрального состояния в галоид-
ный ион, несущий один отрицательный заряд. Если окислителем является
гипохлорит, то единица положительного заряда хлорного атома теряется
и ее место занимает единица отрицательного заряда, что отвечает потере
двух положительных зарядов. Точно так же двуокись свинца и перекись
водорода могут проявить свою окислительную силу, выражающуюся поте-
рей двух единиц зарядов положительного электричества.
Валентность хрома в анионах СгО'. CrCh" и СгзО." определяют
согласно с приведенным на стр. 42 правилом путем вычитания числа еди-
ниц зарядов из произведения числа находящихся в анионе кислородных
223
атомов иа их валентность, равную двум. При составлении уравнений
важно быть уверенным в том, что алгебраическая сумма положительных и
отрицательных зарядов с одной стороны знака равенства точно равна
алгебраической сумме зарядов с другой.
При небольшом опыте легко определить, требуются ли для составле-
ния уравнения ионы водорода, гидроксила или молекулы воды.
Окисление в щелочном растворе
а) Посредством галоидов. Если в раствор соли трехвалентного хрома
в присутствии избытка едкого кали или натра пропускать хлор или при-
ливать бром, то окисление совершается в несколько минут; раствор зеле-
ного хромита становится светложелтым:
2СгОг' + 8ОН' + ЗС12 -> 2СгО4" + 6С1' + 4НгО.
Соединения трехвалентного хрома могут быть также окислены галои-
дом в присутствии ацетата натрия; реакция протекает чрезвычайно мед-
ленно на холоду и очень быстро при нагревании:
2Сг •' • + ЗС12 + 8Н2О -> 2СгС>4" + 6СГ + 16Н'.
Ацетат натрия сильно понижает концентрацию водородных ионов и
обусловливает этим течение реакции слева направо (стр. 63).
б) Посредством гипохлорита (гипохлорит натрия, хлорная известь
и т. п.):
2СгО? + ЭОС1' + 2ОН' -> 2СгС>4" + ЗС1' + НгО.
в) Посредством двуокиси свинца. Щелочной раствор кипятят с дву-
окисью свинца:
2СгОг' + ЗРЬО_> + 8ОН' -> ЗРЬОг" + 2СгО4" + 4НгО.
г) Посредством перекиси водорода:
2СгОг' + ЗНгОг + 2ОН'-> 2СгО4" + 4Н2О.
Реакция протекает при нагревании.
д) Посредством свежеосажденной двуокиси марганца. Реакция происхо-
дит при кипячении нейтрального или слабокислого раствора:
2Сг’ ‘ ’ + 3MnO2 + 4ОН' -> 2СгО4" + ЗМп‘ ' + 2 НЮ.
Последнее уравнение показывает, что присутствие гидроксилионов
должно, очевидно, благоприятствовать окислению, а водородных ионов —
препятствовать ему. С другой стороны, двуокись марганца весьма мало
растворима в щелочных растворах. Поэтому необходимо, чтобы раствор
был нейтральным или даже слегка кислым, чтобы получить достаточную
концентрацию четырехвалентного марганца в растворе.
В кислых растворах создаются благоприятные условия для устойчи-
вости трехвалентного катиона хрома, в щелочных растворах —для хромат -
аниона. Поэтому в кислых растворах легко происходит восстановление
хромата до соли трехвалентного хрома, а в щелочных растворах легко
окисляется соль трехвалентного хрома до хромата.
Окисление в кислом растворе
Окисление в кислом растворе может быть произведено путем кипяче-
ния с энергичными окислителями, какими являются, например, концентри-
рованная азотная кислота и хлорат калия, висмутат натрия (или четырех-
окись висмута) или перманганат калия:
2Сг' ’ ’ -f-'SNaBiOs + 4Н' -> СггОг" + 3Na ’ + ЭВГ ' ' + 2НгО.
При выполнении этой реакции нельзя пользоваться хлоридом или дру-
гой солью, анион которой способен к окислению; из кислот следует при-
менять азотную или серную кислоту.
224
Окисление -в кислом растворе проходит очень легко под действием
персульфата щелочного металла в присутствии небольшого количества
серебряного иона ’В качестве катализатора. Серебряный ион, вероятно, об-
разует нестойкий двухвалентный ион или нестойкую перекись серебра *.
2Сг’ '' + 3SsO8" + 7'НгО -> СГ2О7" + 6SOi" + 14Н'.
Окисление нерастворимого хромового соединения, как, например,
сильно прокаленной окиси хрома или встреча егося в природе минерала
хромита, производят путем сплавления с карбонатом натрия и каким-либо
окислителем, как, например, '.нитратом или хлоратом калия, или перекисью
натрия (стр. 220,223). Получающиеся, таким образом, хромовокислые щелочи
окрашены в интенсивно желтый цвет и очень легко растворяются в воде.
Восстановление хроматов
Хромовая кислота, хроматы и бихроматы в кислом растворе являются
сильными окислителями. Окисление происходит даже в очень разбавлен-
ном растворе, и поэтому бихроматом калия часто пользуются в количе-
ственном анализе, определяя количество восстановителя по объему раствора
бихромата калия, затраченного при реакции. Ионы двухвалентного же-
леза, сернистая кислота, сероводород и иодистоводородная кислота окис-
ляются им при обыкновенной температуре. Щавелевая кислота и спирт
медленно окисляются при обыкновенной температуре и очень быстро при
нагревании. Хлористоводородная и бромистоводородная кислоты окис-
ляются только в горячих растворах. Первоначальный оранжевый цвет рас-
твора переходит в зеленый — цвет ионов трехвалентного хрома:
СггОт" + 6Fe- • + 14Н' 2Сг’ • ' + 6Fe’ ’ * + 7Н»О;
СгзОт" + 3SOs" '+ 8Н- -> 2Сг‘ ' + 3SO1" + 4Н2О;
СгЮт" + 3H2S + 8Н’ -> 2Сг‘ • ' + 3S + 7Н2О;
Сг2О?" + ЗН2С2С>4 + 8Н’ -> 2Сг’ '' + 6СО2 + 7Н-О;
СггОт" 4- 6J' + 14Н‘ -> 2Сг‘ • • + 3J2 + 7Н2О;
СггОт” + 6НС1 + 8Н- -> 2СГ • • + ЗС12 + 7НгО.
Последняя реакция протекает только при нагревании; ею удобно поль-
зоваться для получения хлора в малых количествах для аналитических це-
лей, так как с прекращением нагревания прекращается и выделение хлора.
При этом необходим всегда избыток соляной кислоты; в противном слу-
чае хлор не будет выделяться вследствие образования калиевой соли
хлорохромовой кислоты КСгОзО:
Cr2O?" + 2НС1 -> 2(СгОзС1)' + №0,
которая разлагается при добавлении большого количества соляной кислоты:
2(СгОзС1)' + 4НС1 + 8Н' ->2Сг’ 1' + 6Н2О + ЗС1з.
Если спирт и соляная кислота одновременно действуют на хромат,
то происходит восстановление последнего (при слабом нагревании, без вы-
деления хлора), причем' спирт окисляется в альдегид:
СггОт" + ЗС-НзОН + 8Н' -> 2Сг’' ' + 7Н2О + ЗСНзСНО.
альдегид
1 Образующаяся перекись серебра играет роль переносчика кислорода.
Сначала происходит реакция между нитратом серебра и персульфатом:
2Ag‘ + S-Os" + 2НгО -> Ag-’Оз + 2SOi" + 4Н‘;
а затем реакция между солью окиси хрома и Ag-Os:
2Сг’ ’ ‘ -)- 3Ag2Q2 + 3H2SO4 Н2О -> Cr2O?" -f- 3Ag»SO4 4- 8Н’.-
15 Зак. 0S2. Тггдве.т.т-Го.тл, т. I.
Ред.
225
Этой реакцией чаще всего пользуются для восстановления хромовой
кислоты, потому что альдегид (узнается по своеобразному запаху) и из-
быток спирта могут быть легко удалены при кипячении раствора, и в
растворе тогда остаются только хром и металл хромата в виде хлоридов.
При нагревании хромовокислых солей с концентрированной серной
кислотой происходит восстановление хромовой кислоты с выделением кис-
лорода:
ЗКгСггО? SHsSCh-* 2K2SO4 + 2Cri(SO4)s + 8Н2О + 30г.
Надхромовые кислоты
Характерно отношение свободной хромовой кислоты к перекиси водо-
рода. Хромовая кислота превращается в синие надхромовые кислоты, рас-
творимые в эфире: НтСгОю, НзСгО? или НзСгОв.
Если на холодный щелочной раствор хромата подействовать нейтраль-
ной перекисью водорода, раствор окрасится в красный цвет вследствие
образования щелочной соли надхромовой кислоты:
2К2СгС>4 + 7Н2О2 + 2КОН-> 8Н2О + 2KsCrOs.
Красная окраска мало-помалу исчезает с выделением кислорода и рас-
твор снова становится желтым:
4КзСгОв + 2Н2О -> 4К0Н + 4КгСгО4 + 70г.
Если на холодный нейтральный раствор бихромата калия подейство-
вать перекисью водорода, раствор окрасится в фиолетовый цвет вслед-
ствие образования калиевой соли надхромовой кислоты НзСгОг, несколько
отличной по составу от вышеприведенной:
КгСггОт + бНгОг-* ЗНгО + SKHsCrCh.
В свою очередь фиолетовая окраска постепенно исчезает с выделением
кислорода и регенерацией бихромата:
4КН2СгО? -> 2К2СГ2О7 + 50г +4НгО.
Если красный пли фиолетовый растворы, полученные вышеописанным
путем, взболтать с эфиром, последний остается бесцветным.
Совершенно отлично отношение растворов хроматов к избытку пере-
киси водорода в присутствии разбавленной серной кислоты. При этом не-
изменно образуется наиболее богатая кислородом надхромовая кислота
HiCrOio, раствор приобретает интенсивно синюю окраску. Последняя
через короткое время исчезает, и раствор становится зеленым вследствие
превращения всего хрома в трехвалентный ион:
2НтСгО10 -f- 3H2SO4 -> CrXSO4)3 4- ЮН2О + 50г.
Надхромовая кислота легко растворима в эфире и при взбалтывании
водного раствора с эфиром переходит в последний, окрашивая его в кра-
сивый синий цвет. Надхромовая кислота лучше сохраняется в эфирном
растворе, чем в водном.
Так как надхромовая кислота окрашена в интенсивно синий цвет и
легко образуется, то ее образование является весьма чувствительной реак-
цией на свободную хромовую кислоту. Реакцию проводят следующим об-
разом. К 1—2 мл раствора перекиси водорода приливают несколько капель
разбавленной серной кислоты и около 2 мл эфира и сильно взбалтывают;
затем прибавляют несколько капель раствора хромовой кислоты или хро-
мовокислой соли и снова сейчас же взбалтывают. В присутствии только
0,1 мг хромовой кислоты всплывающий наверх эфирный слой окраши-
вается в интенсивно синий цвет; даже в присутствии 0,007 мг хромовой
кислоты еще заметно синее окрашивание эфира. [Ленер (Al. Lehner)] *,
1 Еще чувствительнее, чем реакция с перекисью водорода, является
ранее упоминавшаяся реакция Cazeneuve с дифенилкар’базидом (стр. 222). Ред.
226
Так как большинство хроматов не растворимо в воде И очень харак.
терно окрашено, то открытие хрома легче всего удается, когда он нахо-
дится в виде хромата. Проба на окислители с MnCla в концентрированной
соляной кислоте (стр. 252) легко выполняется с хроматом.
Реакции мокрым ••тем
1. Серная кислота. Разбавленная серная кислота вызывает са-
мое большее, перемену окраски в оранжевый цвет. Выделения
газа не бывает.
Концентрированная серная кислота вызывает на холоду пере-
мену окраски в оранжевый цвет и часто выделение красных игл
СгОз,' при нагревании раствор становится зеленым, так как хро-
мовая кислота восстанавливается в соль окиси хрома с выделе-
нием кислорода:
4СгОз + 6H2SO4 ->6Н2О + ЗО2 + 2Сг2(5О4)з.
2. Азотнокислое серебро осаждает из нейтрального раствора
хромовокислых солей буро-красный осадок хромовокислого се-
ребра:
СгОт" + 2Ag’ -> Ag2CrOi1,
растворимого в аммиаке вследствие образования комплексного
иона серебра и в минеральных кислотах (соляная кислота пре-
вращает его в белое нерастворимое хлористое серебро и хро-
мовую кислоту) и почти не растворимого в уксусной кислоте.
От прибавления азотнокислого серебра к умеренно концентри-
рованному раствору двухромовокислого калия образуется крас-
но-бурый осадок двухромовокислого серебра:
СГ2О7" 4- 2Ag’ -> Ag2Cr2O7,
которое при кипячении с водой распадается на хромовую кис-
лоту и менее растворимое хросмовокислое серебро:
2Ag2Cr2O7 + НЮ -> 2Ag2CrO4 4- H2Cr2O7.
В присутствии ацетата натрия превращение бихромата се-
ребра в хромат происходит на холоду (стр. 63, 121).
3. Уксуснокислый свинец образует в растворах хромовокис-
лых и двухромовокислых солей желтый осадок хромовокислого
свинца, растворимого в азотной, не растворимого в уксусной
кислоте, почти не растворимого в уксуснокислом аммонии, что
отличает егоотРЬ504, который не растворим в азотной кислоте,
но растворим в уксуснокислом аммонии:
CrCU" + Pb' ->PbCrOi;
СГ2О7" + 2РЬ(СН-зСОО)2 + Н2О -> 2СН3СООН 4- 2СН3СОО'.+’
ч- 2РЬСгО4.
Применяя азотнокислый свинец, для полноты осаждения не-
обходимо прибавлять уксуснокислый натрий.
4. Хлористый барий осаждает из растворов хромовокислых
солей желтый осадок хромовокислого бария:
СгОГ 4- Ва' ' -•> BaCrOj,
15*
227
растворимого в минеральных кислотах и не растворимого
в уксусной кислоте.
Из растворов двухромовокислых солей полное осаждение
получается только при прибавлении уксуснокислых щелочей
(стр. 227).
5. Азотнокислая ртуть (закисная) дает на холоду бурый
осадок аморфной хромовокислой соли закиси ртути:
СгСЦ" + Hg2’ ‘ -> Hg2CrO4,
который при кипячении переходит в кристаллический хромат
закиси ртути огненнокрасного' цвета С
6. Сернистый водород выделяет из растворов хромовой кислоты
в отсутствии минеральных кислот сперва бурый осадок основ-
ного хромата окиси хрома СгзОв ‘2, смешанный с серой, а при
дальнейшем воздействии TBS — зеленый осадок окиси хрома,
также смешанный с серой. В присутствии минеральных кислот
образуется раствор зеленого цвета с суспендированной в нем се-
рой:
1. ЗСгОз + 3H2S— ЗНгО + 3S + СгзОв ]
2. 2Сг3Ов + 3H2S-’ ЗНзО + ЗЗ + ЗСг^з / В ВОДНОМ Ра™ре
3. 2СгОз + 6НС1 + 3H2S -> 6Н2О + 3S + 2СгС1з в кислом
растворе
7. Прокаливание. Трехокись хрома при прокаливании распа-
дается на окись хрома и кислород: 4СгОз = 2Сг2Оз + ЗО2. Вполне
аналогично относятся к прокаливанию хромовокислые соли
аммония и ртути. Так, например, хромовокислый аммоний дает
окись хрома, аммиак, азот и воду. Восстановлению хроматов благо-
приятствует восстанавливающее действие находящегося в из-
бытке аммиака:
2(NH4),2CrO4 -> 2ЫНз + № + 5Н2О -4- СггОз.
Бихромат аммония выделяет только воду и азот:
(NH4)2Cr2O7 -> 4НгО + № + СггОз. *
Это расщепление сопровождается воспламенением. Остаю-
щаяся СггОз очень объемистого вида и напоминает зеленые чай-
ные листья.
Хромовокислые соли ртути распадаются при прокаливании на
окись хрома, металлическую ртуть и кислород:
4Hg2CrO4-> 2СггОз -I- 8Hg 4- 50г.
Двухромовокислые щелочи дают при сильном накаливании нор-
мальную хромовокислую соль, окись хрома и кислород:
4К2Сг2О7—* 4КгСгО4 + 2Сгг0з + ЗО2,
1 F. Fichte, г u. G. О es terh eld, Z. anorg. Chem. 76, 347 (1912).
’ (СгО)гСгО*.
228
Реакции сухим путем
Все хромовые соединения окрашивают перл буры или фос-
форной соли как в окислительном, так и в восстановительном
пламени в изумрудно-зеленый цвет.
Будучи прокалены с содой на угле при помощи паяльной
трубки, они дают зеленые шлаки, которые после долгого1 про-
каливания оставляют зеленую неплавкую окись хрома. При спла-
влении с содой и селитрой в платиновой спирали все хромовые
соединения дают желтый плав, состоящий из хромовокислой
щелочи:
2Сг20з ф- 4№агСОз + ЗО2-> 4Na2CrOi ф- 4СОг.
Растворив плав в воде, подкислив раствор уксусной кисло-
той и прибавив к нему азотнокислого серебра, можно получить
буро-красную соль хромовокислого серебра. Эта реакция чрез-
вычайно чувствительна и применима для открытия ничтожней-
ших следов хрома. Последний может быть по этому методу
открыт в сукне, протравленном хромовыми солями. Для этого
достаточно! золы от нити длиной 5 см.
Железо Fe. Ат. в. 55,85. Ат. н. 26
Плотность 7,93. Т. пл. 1553°. Т. кип. 2450°
Нахождение в природе. Самородное железо встречается на земном
шаре только спорадически. В некоторых базальтах оно находится в виде
чрезвычайно мелких вкраплений; далее — на гренландском острове Лиско —
с виде глыб весом в несколько десятков тонн, в сопровождении Ni, Со, С,
S и Р; наконец, самородное железо находят в метеоритах.
Важнейшие железные руды — окислы железа и -сернистые его соеди-
нения.
Упоминания заслуживают: гематит FeaOs ромбоэдрической системы
(изоморфен с корундом); магнитный железняк FesO-i правильной системы
(изоморфен со шпинелью); гетит FeO(OH) ромбической системы (изоморфен
с диаспором и манганитом); лимонит Fe4Os(OH)e; болотная железная руда
Ре(ОН)з, применяющаяся для очистки светильного газа; далее, сидерит
FeCOs ромбоэдрической системы; пирит FeSa правильной системы и мар-
казит FeSa ромбической системы; таким образом, двусернистое железо
диморфно; вивианит Fes(PO4)2 • 8Н»О моноклинической системы.
Металл и его сплавы- Чистое железо, которое может быть получено
путем электролиза или нагреванием чистых железных солей в токе водо-
рода, имеет серебристобелый цвет. Оно ковко и из всех ковких металлов
обладает наибольшей твердостью; по -вязкости оно уступает только ко-
бальту и никелю. Тонкий порошок железа сгорает на воздухе. Ковкое
железо содержит менее 0,2% углерода и -по содержанию последнего оно
подобно сварочной стали. Железные спла-вы, содержащие меньше 1,7%
углерода, называются сталями, с большим количеством углерода — чугу-
ном. Стали, кроме углерода, содержат всегда небольшие количества других
элементов, главным образом марганца, фосфора, серы- и кремния: прини-
маются меры, чтобы содержание последних трех элементов было очень
небольшим. Так называемые специальные стали могут содержать заметные
количества никеля, хрома, ванадия, -вольфрама или других элементов.
Чугуны -содержат больше серы и кремния, чем большинство сталей. Свой-
ства стали и чугуна определяются отчасти химическим составом и в зна-
чительной мере температурой, которая применялась при их обработке.
Так, данный образец стали, накаленный до высокой температуры, может
стать очень твердым при быстром охлаждении (закаленная сталь), и тот
же образец стали будет относительно мягким, если дать ему медленно
229
охлаждаться (отпущенная сталь). Чугун, содержащий определенный про-
цент углерода, может быть очень твердым и хрупким, если углерод в нем
находится в виде FesC (карбид железа), или он может быть значительно
мягче и менее хрупким, если углерод в нем находится в виде графита.
Кремний действует на FesC, разлагая карбид железа на Fe + графит; сера
препятствует этому разложению. Состав стали очень тщательно контроли-
руется химическим анализом и исследованием вытравленных шлифов под
микроскопом (металлографический анализ). При микроскопическом иссле-
довании возможно во многих случаях устанавливать не только приблизи-
тельное содержание углерода в данном образце стали, но и определять
термическую обработку, которой подвергалась сталь. Микроскоп обнару-
живает также присутствие примесей, например сульфида марганца или ка-
кой-либо окиси металла, образующих в металле гнезда, вредно отражаю-
щиеся на механических свойствах и качестве металла. Такие включения
в металлах часто обнаруживаются посредством Х-лучей *.
При растворении продажного железа в кислотах (соляной, серной) вы-
деляется водород с примесью небольших количеств углеводородов, серо-
водорода, фосфористого и кремнистого водорода, придающих газу непри-
ятный запах; такое железо почти всегда оставляет нерастворимый остаток,
состоящий большею частью из углерода.
Азотная кислота взаимодействует с металлическим железом различно
в зависимости от концентрации кислоты и температуры. С разбавленной
азотной кислотой реакция может протекать без выделения газа и с обра-
зованием ионов двухвалентного железа и аммония:
4Fe + ЮН' + 4Fe' ' NH/ + ЗНгО,
При действии более концентрированной азотной кислоты образуются
ионы трехввлентного железа и окись азота или, если применяется наиболее
концентрированная кислота—двуокись азота:
Fe ф 4HNO3 Fe(NOs)s + 2Н:О + NO;
Fe 4- 6HNOs -> Fe(NOs)s + ЗН2О -}- 3NOa.
Холодная концентрированная азотная кислота пассивирует железо; же-
лезо , в состоянии пассивности не реагирует на холоду с разбавленной
азотной кислотой и не выделяет меди из водного раствора соли двух-
валентной меди.
Железо бывает двух-, трех- и редко шестивалентным и образует сле-
дующие окиси:
FeO Fe;O3 Fe3O< FeO3
закись железа окись железа закись-^кись трехо/.исъ
железа железа
Трехокись железа FeOs, содержащая шестивалентное железо, никогда
не была изолирована. Она играет роль кислотного ангидрида в солях
железной кислоты (ферраты) общей формулы R:FeO< (R — одновалентный
металл), В них положительно шестивалентное железо образует с кислоро-
дом отрицательный комплексный анион FeOi". Ферраты легко разлагаются
водой с потерей кислорода и с образованием гидроокиси железа.
FesOi представляет собой, вероятно, железистую соль (феррит — одно-
валентный анион FeO:', аналогичный хромитам) двухвалентного железа
/О—Fe=O
Fe< или Fe(FeO-):, а не смесь ИеЮз и FeO. Известны и дру-
\О-Fe=O
гие ферриты, например C'(FeO2)2, Ba(FeO2)2 и Zn(FeO2)2.
1 Сульфиды железа и марганца и фосфид железа в различных сортах
железа и стали в большинстве случаев не распределены равномерно
в отвердевшем металле, ,а скопляются в образующихся гнездах и в них
содержание серы и фосфора особенно велико. Об открытии в железе
и стали таких вредных включений, см. Файгль, Капельный анализ,
стр, 535—537. Ред.
230
При растворении окислов железа в кислотах образуй........я соответ-
ствующие соли железа:
FeO +2Н’ -» НЮ + Fe - •
FesOs + 6Н" -> ЗН2О + 2Fe '
FesOi + 8Н’-> 4H2O + 2Fe- ’ ’ + Fe‘
Таким образом, железо образует два ряда солей: 1) соли закиси же-
леза, в которых железо двухвалентно; 2) соли окиси железа, содержащие
трехвалентное железо. Оба ряда солей относятся совершенно различно
к целому ряду реактивов.
Безводные соли двухвалентного железа (или закиси железа) белого
цвета, содержащие кристаллизационную воду — зеленоватого цвета. Разба-
вленные растворы их бесцветны, концентрированные — окрашены в зеле-
новатый цвет. На воздухе соли закиси железа окисляются. Окисляются они
также в растворах за счет растворенного кислорода. Результатом этого
является образование основных солей, например:
4FeSOi +'О2-> 2Fe2O(SC>4)2
илц
,ОН
4Ре8О4 + О2 4- 2НЮ —> 4Fe<
xso4
Положение металлического железа в электродвижущем ряду показы-
вает, что оно способно окисляться водородными ионами; поэтому воз-
можно допустить окисление его в измеримых количествах водородными
ионами воды. Тщательно поставленные опыты показали, что абсолютно
чистая вода, не содержащая растворенного кислорода, не действует за-
метно на железо: хотя, очевидно, что следы его растворяются, но металл
покрывается тонким слоем водорода, препятствующим дальнейшему воз-
действию воды. Положение двухвалентного железа в ряду напряжений
показывает, что водородные ионы не могут его заметно окислить в трех-
валентиое. Присутствующий же растворенный кислород (что является
нормальным для всех вод, соприкасающихся с воздухом) может окислить
ионы двухвалентного железа до трехвалентного и способствовать также
окислению металлического железа до его закисной формы. Этим путем
железо под влиянием влаги и кислорода окисляется, или ржавеет. Про-
цессу ржавления благоприятствует соприкосновение железа с более благо-
родным металлом, например с платиной, медью или никелем. При этом
образуется гальваническая пара и железо становится положительным по-
люсом, причем водород, освобожденный действием железа на воду, выде-
ляется на более благородном металле, который становится отрицательно
заряженным полюсом. Присутствие менее благородного металла, например
цинка, препятствует разъеданию железа (коррозия), так как вместо железа
разъедается цинк.
Поэтому для ржавления железа нет абсолютной необходимости в при-
сутствии какой-либо кислоты. Однако увеличение концентрации водород-
ных ионов будет значительно ускорять растворение металла. В присут-
ствии угольной кислоты образуется сначала гидрокарбонат двухвалентного
железа Бе(НСОз)г; когда двухвалентное железо окисляется до трехвалент-
ного, угольная кислота освобождается, потому что карбонат трехвалеит-
ного железа не существует. Освобожденная кислота снова оказывает свое
действие на металл, и скорость его ржавления значительно увеличивается.
Ряд веществ способствует пассивированию железа, особенно концен-
трированная азотная кислота. Пассивное железо не подвержено быстрой кор-
розии (см. Алюминий, стр. 210). С другой стороны, некоторые вещества
могут нарушать пассивное состояние железа, переводя его в активирован-
ное железо, Так, раствор обыкновенной поваренной соли является акти-
вирующим агентом.
Различные сорта железа и стали ржавеют с различной степенью ско-
рости. Чугун часто защищен пленкой, образующейся при отливке (casting
skin). Примеси, находящиеся в стали, часто благоприятствуют ее ржавле-
нию, обусловливаемому образованием гальванических пар.
231
А. Соединения двухвалентного железа
Соли закиси железа могут получаться путем растворения металличе-
ского железа, закиси и гидрозакиси железа, карбоната двухвалентного
железа, сернистого железа и т. п. в кислотах. В кристаллическом состоя-
нии они обычно зеленоватого цвета, в безводном—они белого, желтого
или зеленоватого цвета. Концентрированные растворы их зеленого цвета,
а разбавленные почти бесцветны.
Кислые растворы солей двухвалентного железа довольно устойчивы на
воздухе, нейтральные и щелочные растворы, напротив, жадно поглощают
кислород воздуха и быстро превращаются в соли трехвалентного железа.
Они являются сильными восстановителями.
Реакции мокрым путем
1. Аммиак из нейтральных растворов осаждает зеленовато-
белый гидрат закиси железа. Осаждение неполное:
FeCl2 + 2.\'Нз + 2Н2О Fe(OH)2 4- 2NH4C1;
в данном случае происходит то же самое, что и с солями магния
(стр. 301). В присутствии аммонийных солей реакция протекает
но уравнению оправа налево; аммиак без доступа воздуха не
дает никакого осадка в растворах солей закиси железа, содер-
жащих достаточно аммонийной соли. >Но при доступе воздуха
образуется быстро увеличивающаяся муть, которая сначала окра-
шена в зеленоватый цвет, переходящий затем почти в черный
и, наконец, в бурый. Это происходит оттого, что находящееся
в растворе очень незначительное количество гидрата закиси же-
леза превращается кислородом воздуха сначала в почти нерас-
творимый гидрат закисигокиси железа и, наконец, в гидрат окиси
железа.
2. Едкие щелочи в отсутствии воздуха осаждают количе-
ственно белый гидрат закиси железа:
Fe'' + 2ОН' -> Fe(OH)2,
который быстро окисляется на воздухе в гидроокись железа.
При прибавлении перекиси натрия окисление происходит момен-
тально:
2Fe‘' + Na2O2 ф- 2ОН' + 2Н2О -> 2Fe(OH)3 + 2Na .
3. Сернистый водород не выделяет осадка из кислых раство-
ров солей закиси железа; из разбавленных нейтральных раство-
ров осаждается небольшое количество черного сернистого железа.
Но если в растворе имеется значительное количество щелочной
соли уксусной кислоты, то сернистый водород осаждает значи-
тельно больше сернистого железа (но не полностью все), не-
смотря на то, что сернистое железо легко растворяется в уксус-
ной кислоте. Этот интересный факт является поучительной ил-
люстрацией закона действия масс.
Из табл. 8 (стр. 38) видно, что в 1 л воды растворяется 3,4 X ГО-8 г
сернистого железа, которое почти полностью распадается на Fe’" и
S''-ионы (FeS -> Fe' ' + S"). Если прибавить к раствору уксусную кислоту,
которая является значительно более сильной кислотой, чем сернистый
232
водород (стр. 28), то установится равновесие между водородными ионами при-
бавленной кислоты и образующимися при диссоциации H2S: 2Н’ Д- S".?i H2S;
вследствие образования недиссоцинрованных молекул HaS раствор
не будет содержать ионов S" в концентрации, достаточной для достиже-
ния произведения растворимости FeS. Чтобы восстановилось нарушенное
равновесие между FeS и его ионами, должно будет происходить дальней-
шее растворение твердого сернистого железа. Если еще, сверх того, кипя-
тить раствор, то сернистый водород будет по мера его образования уле-
тучиваться. Следовательно, состояние равновесия не может быть достиг-
нуто до тех пор, пока не растворится все сернистое железо. Растворение
совершается благодаря действию водородных ионов:
FeS + 2H’ ->Fe’ ' + H2S.
С другой стороны, если ионизацию уксусной кислоты подавить приба-
влением к раствору ацетата щелочного 'металла (стр. 63) и сделать кон-
центрацию сернистого водорода возможно большой путем насыщения
раствора газом, то течение реакции примет обратное направление — и не-
которое количество железа будет осаждено в виде сульфида.
4. Сернистый аммоний осаждает количественно железо в виде
.черного сернистого железа:
FeCh + (NHO2S -> 2NHtC1 + FeS,
которое легко растворяется в кислоте, выделяя сернистый водо-
род. Во влажном воздухе оно скоро приобретает бурую окра-
ску вследствие частичного выделения серы и образования основ-
ного сульфата трехвалентного железа.
5. Тиоацетат аммония не реагирует с кислым раствором соли закиси
железа; в щелочном же растворе осаждается сернистое железо:
CHsCOS' + Fe’ • 4- 2ОН' СНзСОО' 4- FeS + Н2О;
тиосульфат натрия осадка не дает.
6. Углекислые щелочи осаждают белую углекислую соль
FeCh 4- №гСОз — 2NaCl + FeCO3,
которая на. воздухе быстро становится зеленой и затем бурой,
так как она переходит с отщеплением угольной кислоты в ги-
драт окиси железа:
4FeCO3 + 6Н2О + О2— 4СО2 + 4Fe(OH)3.
Углекислая соль закиси железа подобно карбонату кальция (стр.
291) растворяется в воде, насыщенной угольной кислотой, обра-
зуя кислую углекислую соль закиси железа:
FeCO3 Н2СО3 -» Fe(HCO3)2,
соединение, встречающееся почти во всех углекислых минераль-
ных водах, содержащих железо; это соединение подобно сред-
ней соли под влиянием кислорода воздуха разлагается, выделяя
гидрат окиси железа:
4Ре(НСОз)г 4- 2НгО 4~ О2-> 8СО2 4- 4Fe(OH)3.
Поэтому железистые минеральные воды при соприкосновении
с воздухом выделяют бурый осадок гидрата окиси железа, чем
и объясняется часто наблюдаемое помутнение этих вод. Для
устранения образования осадка гидрата окиси железа бутылки
должны быть так наполнены водой и закупорены, чтобы в них
233
не могли попасть и следы воздуха: ничтожнейшие следы по-
следнего обусловливают помутнение воды, потому что образую-
щийся гидрат окиси железа совершенно не растворим в угле-
кислоте.
7. Цианистый калий осаждает желто-бурое цианистое железо
Fe” + 2CN' —>Fe(CN)2,
которое растворимо в избытке осадителя с образованием ком-<
плеюоного циано-ферри(2)ат-иона:
Fe(CN)2 + 4ON' -> [Fe(CN)6]""?
Комплексный циано-ферри(2)ат-аииоя, несомненно, находится ® равно-
весии с простыми катионами двухвалентного железа, но концентрация по-
следних в водном растворе настолько мала, что они не дают ни одной из
вышеприведенных характерных реакций двухвалентного железа. Раствори-
мость цианистых металлов в цианистом калии представляет собой явление
общего характера; так, в цианистом калии растворяются цианистые сере-
бро, никель, железо (закись и окись) и кобальт, образуя следующие ком-
плексные ионы: [Ag(CN)2]', [Ni(CN)4]", [Fe(CN)e]'"', [Fe(CN)e]"',
[Co(CN)e]"', соответствующие следующим кислотам: H[Ag(CN)2],
H2[Ni(CN)4], H4[Fe(CN)e], Hs[Fe(CN)e], Hs[Co(CN)»].
В действительности, возможно получение только трех последних
кислот, первые же две кислоты никогда не были получены: они тотчас
распадаются на цианид металла и цианистоводородную кислоту, подобно
тому как угольная кислота распадается на воду и двуокись углерода.
Железо дает два ряда цианистых соединений: железистосинеродистые
и железосинеродистые. Первые содержат четырехвалентный ци,ано-ферри
(2)ат-анион, а вторые — трехвалентный циано-ферри(3)ат-анион.
Железистосинеродистый калий K4[Fe(CN)e] обычно называют ферро-
цианидом калия и еще до настоящего времени за ним сохранилось назва-
ние желтой кровяной соли; аналогично железосинеродистый калий
Ks[Fe(CN)e] называют феррицианидом калия (старое, еще сохранившееся
название—‘Красная кровяная срль). Растворимость щелочных и щелочнозе-
мельных солей, нерастворимость и цвет солей тяжелых металлов (в част-
ности, трехвалентного и двухвалентного железа) весьма характерны для
циано-ферри(2)ата и циано-ферри(3)ата.
8. Ферроцианид калия K4[Fe(CN)e] выделяет из растворов
солей двухвалентного железа (при полном отсутствии воздуха) белый
осадок железистосинеродистого железа(2)-калия или железисто-
синеродистого железа(2) в зависимости от того, реагирует ли
с Одной молекулой реактива одна или две молекулы соли
железа(2):
K4[Fe(CN)e] + FeSOi^ K2SO4 + K2Fe[Fe(CN)e];
K4[Fe(CN)e] + 2FeSCU-> 2K2SO4 + Fe2[Fe(CN)e];
Хотя указанные осадки белого цвета, они получаются почти
светлосиними, потому что тотчас же окисляются на воздухе
с образованием солей окиси железа железистосинеродистоводо-
родной кислоты:
6Feanv[Fe(CN)e] 6НгО _<ЗО2 ->2Fe4in[Fe(CN)6]3 + 4Fe(OH)».
берлинская лазурь
234
Так же быстро вследствие окисления переходит в берлинскую
лазурь и белая железистосинеродистая соль закиси железа и
калия.
9. Феррицианид калия Кз[Ре(СМ)б], прибавленный к раствору
соли закиси железа, выделяет темносиний осадок (турнбулева
синь), состоящий из циано-ферри(3)ата железа(2), смешанного
с циано-ферри(2)ато1м железа(3)-калия:
2K3[Fe(CN)6].+ SFeCh-> 6KCI + Fe3n[Fe(CN)6]2
и
Ks[Fe(CN)6] + FeCh ->KFeIU[Fe(CN)e] + 2КС1.
Другими словами, циа1но-ферри(3)ат-ион действует1 и как осадитель и
как окислитель *, и синяя окраска появляется, когда железо находится
в катионе в степени окисления, отличной от степени окисления железа,
находящегося в анионе. Циано-ферри(3)ат-ион представляет собой сильный
окислитель и в щелочном растворе он легко окисляет гвдрозакись железа
до гидроокиси железа. Турнбулева синь мало растворима в кислых раство-
рах, в щелочном же растворе разлагается, причем весь комплексный анион
трехвалентного железа превращается в циано-ферри(2)ат:
Fe3ii[Fe(CN)6]2 + 8КОН ->2К4Ее(СЫ)б] + 2Fe(OH)> + Fe(OH).;
KFeiH[Fe(CN)6j +. ЗКОН ->K4[Fe(CN)e] + Fe(OH)s.
10. Роданистый калий
лентного железа (отличие
KCNS не реагирует с солями двухва-
от солей трехвалентного железа).
Нами было уже указано, что соли закиси железа на воздухе оки-
сляются в соли окиси железа; так, сульфат двухвалентного железа посте-
пенно переходит в бурый основной сульфат трехвалентного железа:
4FeSO4 + Ог-> 2Fe2O(S04)2 f°^S'~24> Fe—О—Fe(f,
I&/ . \O—
который не растворим в воде. Поэтому часто случается, что сульфат двух-
валентного железа при растворении в воде дает непрозрачный, бурый мут-
ный раствор. Последний можно сделать прозрачным, если прибавить
кислоты, которая превращает основную соль трехвалентного железа
в растворимую нейтральную соль:
Fe2O(S04)2 + H2SO4 -> Fe2(SO4)s + НЮ.
Полученный раствор, содержащий сернокислую соль окиси железа, уже
реагирует с роданистым1 калием (стр. 238). Для освобождения! раствора от
соли окиси железа следует кипятить его без доступа воздуха с металли-
ческим железом; при этом соль окиси железа снова восстановится в соль
закиси1:
Fe2(SC>4)s + Fe -> SFeSCh.
Посредством сильных окислителей можно быстро и полностью перевести
соли закиси железа в соли окиси, о чем подробно говорилось во введе-
нии (стр. 51—53).
11. а-Нитрозо-(3-нафтол CioHe(NO)OH (см. стр. 271) дает с разбавлен-
ными растворами солей закиси железа зеленое окрашивание; при стоянии
из раствора выделяется хлопьевидный осадок соли двухвалентного железа
с-нитрозо-р-нафтола. Этой реакции препятствуют водородные ионы даже
в такой концентрации, какая образуется при гидролизе соли трехвалент-
ного железа. В последнем случае необходимо прибавление ацетата натрия.
Осадок легко окисляется в соответствующее соединение трехвалентного
железа.
1 Ср. Erich Miiller J. prakt. Chem. [2]. 84, 353 (1911).
235
12. Диметилглиоксим (CHs)2(CNOH)a (см. стр. 260), прибавленный
к раствору соли двухвалентного железа в присутствии винной кислоты,
образует после прибавления аммиака темнокрасное окрашивание. Окраска
по мере окисления железа ослабевает. Реакция чувствительна.
Добавление редактора. Диметилглиоксим реагирует также и с никелем;
образуя как и с железом, внутрикомплексную соль, окрашенную в крас-
ный цвет. Поэтому, чтобы открыть железо в присутствии никеля, при-
бавляют кристаллик цианистого калия, образующего с Ni’’ растворимую
соль (Ni(CN)-i]Ка, не реагирующую с диметилгиоксимом. Винная кислота
прибавляется для предотвращения выпадения гидроокиси трехвалентного
железа при прибавлении к раствору аммиака- Реакция эта очень чувстви-
тельна; в 0,05 ял можно открыть 0,04 т железа *. А. К.
N N
13. л-сР-Дипиридил CioHsNa или |||| Дает с ионами двухва-
лентного железа двухвалентный комплексный катион, окрашенный в темно-
красный цвет. Этот реактив, применяемый в виде 2%чного раствора в раз-
бавленной соляной кислоте или в спирту, не реагирует с трехвалентным
железом. Образуемый дипиридилом с Fe’ ’ комплексный катион подобен
образуемому аммиаком с Си" ’. Дипиридил реагирует также и с другими
металлическими ионами в кислом растворе, но образующиеся соединения
не имею: интенсивной окраски и не мешают реакции на железо. Реакция
очень чувствительна: в одной капле можно открыть 0,03 Т железа.
Добавление редактора. Хотя ионы трехвалентного железа не реагируют
с .дипиридилам, но большие количества его своей собственной желтой
окраской могут помешать открытию малых количеств двухвалентного же-
леза. В таких случаях следует прибавлять фторид калия, переводящий
Fe’' -ион в бесцветный LFeFe]"'. Реакцию необходимо выполнять в ти-
гельке, покрытом внутри парафином. К капле кислого испытуемого раствора,
окрашенного в желтый цвет за счет наличия ионов Fe’’’, прибавляют
несколько кристалликов KF и к обесцвеченному раствору несколько капель
реактива. В зависимости от количества Fe ’ ’ появляется красное или розо-
вое окрашивание *. А. К.
Открытие закиси железа в присутствии металлического железа
Смесь обрабатывают большим избытком нейтрального раствора хлор-
ной ртути, нагревая на водяной бане. При этом металлическое железо
переходит в раствор в виде хлористого железа:
2HgCh + Fe FeCh + Hg2Ch
Осадок отфильтровывают и испытывают фильтрат посредством»железо-
синеродистого калия: появление осадка турнбулевой сини указывает на
присутствие в первоначальном веществе металлического железа.
Остаток на фильтре промывают холодной водой до тех пор, пока не
будет удалено все хлористое железо, а затем действуют на него разба-
вленной соляной кислотой. Если полученный раствор снова дает осадок
турнбулевой сини с железосинеродистым' калием, то это указывает на при-
сутствие в исследованном объекте закиси железа.
Если при растворении в соляной кислоте выделяется водород, то это
обуславливается еще оставшимся металлическим железом. В этом случае
опыт должен быть повторен, причем-дают смеси постоять на водяной бане
с раствором HgCls.
Б. Соединения трехвалентного железа
Окись железа FeaOs красновато-бурого цвета после сильного прокали-
вания становится серовато-черной, но при растирании дает красный
порошок.
Соли трехвалентного железа обыкновенно желтого или бурого цвета,
но железно-аммонийные квасцы бледнофиолстового цвета. Водный раствор
236
солей окиси железа имеет желтовато-бурую окраску и показывает кислую
реакцию (гидролиз).
Разбавление и нагревание благоприятствуют гидролизу настолько, что
все сильно разбавленные растворы солен окиси железа при кипячении вы-
деляют основные соли:
Fe2(SO4)3 + НзО -> Fe2O(SO4)2 + H2SO4.
Соли окиси железа и слабых кислот часто выделяют все железо в виде
основной соли; так, ацетат при кипячении его разбавленного раствора
реагирует следующим образом:
ре(СНзСОО)з + 2FhO -> Fe(OH)s(CH<OO) + 2СНзСООН.
При добавлении кислоты все основные соли снова превращаются
в нейтральные соли.
Реакции мокрым путем
1. Едкие щелочи и аммиак осаждают бурый студенистый
гидрат окиси железа:
Fe‘ •' +ЗОН'^ Fe(OH)3.
Произведение растворимости гидроокиси железа настолько
мало (стр. 28), что она осаждается полностью даже в присут-
ствии аммонийных солей.
Гидрат окиси железа легко растворим в кислотах. При про-
каливании он теряет воду и переходит в окись, трудно раство-
римую в разбавленных кислотах. Легче всего перевести ее в рас-
твор путем продолжительной обработки концентрированной со-
ляной кислотой при умеренном нагревании.
Несмотря на малую растворимость гидрата окиси железа, он не обра-
зуется в присутствии многих органических веществ, которые образуют
с ионами треивалентнюго железа комплексы (см. ниже реакцию 5).
2. Углекислый натрий дает бурый осадок основной углекис-
лой соли, совершенно разлагающейся гидролитически на гидрат
окиси и угольный ангидрид при температуре кипения:
2FeCh + 3Na2CO3 + ЗН2О -> 2Fe(OH)3 + 6NaCl -f- ЗСО2.
3. Окись цинка, окись ртути и карбонат бария также оса-
ждают железо в виде гидрата окиси:
2FeCl3 + 3ZnO 4- ЗН2О—>2Fe(OH)3 + 3ZnCl2.
Эта реакция находит широкое применение в количественном
анализе.
4. Фосфорнокислый натрий осаждает желтовато-белую фос-
форнокислую соль окиси железа:
FeCh + 2Na2HPO4-> 3NaCl + №НгРО4 + FePO4.
Фосфорнокислая соль окиси железа не растворима в уксусной
кислоте и легко растворима в минеральных кислотах. Поэтому
осаждение железа посредством кислой фосфорнонатриевой соли
бывает полным только при избытке осадителя или в присутствии
уксуснокислой щелочи:
FeCh + Na2HPO4 + CHsCOONa -> 3NaCl + СНзСООН + FePO4.
237
В последнем случае осаждается все железо й вся фосфорная кислота.
Этой реакцией часто пользуются для количественного осаждения фосфор-
ной кислоты. Можно достигнуть полного осаждения железа из его раствора
не только при помощи прибавления уксуснокислой щелочной соли, но
также .и посредством кислой фосфорнонатриевой соли, если последнюю
предварительно точно нейтрализовать аммиаком:
NazHPOi + NHiOH + NasNHiPCU;
Na2NH<PO4 + 'FeCb -*2NaCl + NH4C1 + FePO«.
Но если прибавить к соли окиси железа избыток аммиака и фосфорно-
натриевой соли, то осаждение железа будет неполным, потому что фос-
форнокислая соль окиси железа в присутствии аммиака или углекислого
аммония растворяется в избытке фосфорнонатриевой соли, образуя ком-
плексные соли бурого цвета.
Посредством аммиака фосфорнокислая соль окиси железа превра-
щается в бурую основную фосфорнокислую соль; при действии едкого
кали она почти целиком переходит в гидрат окиси железа и фосфорио-
калиевую соль; при сплавлении с едкими или углекислыми щелочами она
совершенно разлагается.
5. Уксуснокислые шелочи дают в холодном и нейтральном
растворе темнобурое окрашивание, обусловленное образованием
комплексного одновалентного положительного иона., гексаацетата
Г„ (С2НуОо)61
окисного железа ге3 (ОЛ)," р'при кипячении разоавленного
раствора происходит значительное гидролитическое расщепление..
Железо при этом выделяется количественно в виде основного
ацетата в хлопьях бурого цвета. В присутствии органических
оксикислот (как винная, яблочная, лимонная и т. п.) и много-
валентных спиртов (например, глицерин, эритрит, манит, сахара)
образуются более устойчивые комплексные соли, которые при
кипячении не выделяют осадка железа (см. Алюминий, стр. 212).
Таннин, однако, дает фиолетово-черный осадок в виннокислом
растворе, содержащем ацетат аммония.
6. Роданистый калий дает в растворах солей окиси железа
кровавокрасное окрашивание:
Fe" ’ + 3CNS' тд Fe(CNS)3.
Эта реакция обратима; красный цвет бывает наиболее интенсивным
при избытке соли окиси железа или роданистого калия.
При взбалтывании раствора с эфиром Fe(CNS')3 переходит в последний.
Родановое железо легко соединяется с роданистым калием, образуя ком-
плексную соль феррироданид калия:
Fe(CNSb J- 3KCNS [Fe(CNS)«] Кз.«
вполне аналогичную феррицианиду калия:
[Р'е(С.\)б1 Кз.
Комплексная соль в эфире не растворима, растворимо только Fe(CNS).,;
поэтому красное окрашивание происходит от образования роданового
железа, а- не от комплексной соли.
Эта .реакция чрезвычайно чувствительна, однако не всегда надежна.
1 [Fe(CNS)e]K3 • 4НгО. См. Rosenheim, Z. anorg. Chem. 27, 208
(1901).
238
В растворах трехвалентного железа, окрашенных более или менее в
красный цвет находящимися в них железоацетатными комплексными иона-
ми, красный цвет, обусловливаемый родановым железом, может быть виден
только после прибавления большого количества соляной кислоты. Равным
образом, когда раствор содержит щавелевую, винную, лимонную, малоно-
вую, йодноватую, фосфорную, мышьяковую или плавиковую кислоту *,
красная окраска роданового железа не может быть получена, за исключе-
нием того случая, когда в растворе имеется азотная кислота. В этом слу-
чае испытание должно производить с холодным раствором, потому что
горячая азотная кислота разлагает родан-ион, и в то же время нитрит-ион
в свою очередь дает красное окрашивание с роданидом -’. Впрочем, окраска,
вызываемая нитритом, исчезает при нагревании с небольшим количеством
спирта, который не оказывает никакого действия на родановое железо.
Чувствительность реакции может быть несколько увеличена, если после
прибавления избытка свежеприготовленного раствора роданида калия
взболтать смесь с эфиром. В присутствии хлорной ртути совершенно
исчезает красная окраска, так как хлорная ртуть реагирует с родановым
железом, образуя бесцветную растворимую двойную соль ртути, которая
ионизирует даже меньше, чем родановое железо:
2Fe(CNS)3 + 6HgCk -»2FeCls + 3[Hg(CNS)2 • HgCk].
7. Ферроцианид калия K4[Fe(CN)e] осаждает из нейтральных
или кислых растворов солей трехвалентного железа берлинскую
лазурь интенсивно синего цвета:
3[Fe(CN)6]"” + 4Fe‘ ’ ’ -> Fe4™[Fen(CN)6]3.
Берлинская лазурь, соль трехвалентного железа и железистосинеро-
диставодорадной кислоты, не растворима в воде, но растворима в щавеле-
вой кислоте (синие чернила). Она растворима также и в концентрированно!!
соляной кислоте, но выпадает из раствора при разбавлении. Как соль трех-
валентного железа и железистосинеродистоводородной кислоты она ведет
себя по отношению к едким щелочам подобно другим солям трехвалент-
ного железа: образует гидроокись железа и щелочную соль железисто-
синеродастоводородной кислоты:
Fe4[Fe(CN),]3 + 12ОН' -+ 4Fe(OH)3 + 3[Fe(CN)e]"".
Кроме нерастворимой берлинской лазури существует еще растворимая
модификация ее, получающаяся при прибавлении к соли трехвалентного
железа избытка ферроцианида калия:
4Ki[Fe(CN)e] + 4FeCl8 -> 12КС1 -f- 4KFeHl[FeiI 2(CNk].
Ту же соль, т. е. растворимую берлинскую лазурь, получают при при-
бавлении соли железа(2) к избытку феррицианида калия:
K3[Fem(CN)d + FeCk kFeiH[Fen(CN)6] + 2КС1.
Это вещество в воде образует коллбидный раствор и может быть
выделено из раствора («высолено») прибавлением нейтральных щелочных
солей. Для этого к раствору прибавляют много хлорида, нитрата или суль-
фата щелочного металла, после чего выпавший осадок может быть от-
фильтрован.
Темиосиняя окраска берлинской лазури и турнбулевой сини обусло-
вливается наличием в их молекулах атомов железа различной валент-
1 Все эти кислоты дают с трехвалентным железом устойчивые ком-
плексы. Ред.
2 Нитрит-ион дает с родан-ноном в кислом растворе роданид нитро-
зила NO CNS, цвет которого очень сходен с цветом роданового же-
леза. Ред.
239
пости, находящихся между собой в окислительно-восстановительном равно-
весии согласно уравнению:
Fe- ’ * + [Fe^CN)»]"" Fe*' + [FeHI(CN)e]"'.
Реакция образования берлинской лазури весьма чувствительна. В одной
капле можно обнаружить 0,1 т железа1.
8. Феррицианид калия K3[Fe(CN)e] не дает осадка в растворах
солей трехвалентного железа, но образует только бурое окраши-
вание (отличие от солей двухвалентного железа):
[Fe(CN)6]'" + Fe’ • • 2Fe(CN)3.
9. Сернистый аммоний, прибавленный к (раствору соли трех-
валентного железа, дает осадок сульфида железа(З) Fe2S3 черного
цвета:
2Fe‘ • • -j- 3S" -> Fe2S,3.
Сульфид железа(З) растворим в разбавленной холодной со-
ляной кислоте, а также в уксусной кислоте, причем образуется
соль железа(2), сероводород и выделяется сера:
Fe2S3 + 4Н- 2Fe ’' + 2H2S ф S.
Раньше предполагали, что образованный сернистым аммонием осадок
состоит из сульфида железа(2) и серы. В действительности же осадок пред-
ставляет собой сульфид железа(З), что окончательно доказано Стоксом
(Н. N. Stokes)2, ибо при действии на осадок аммиачного раствора гидрата
окиси цинка образуется бурый гидрат окиси железа и белый сернистый
цинк.
Л. Гедель (Gedel)3 также доказал, что сернистый водород при пропу-
скании через раствор хлорного железа-, подщелоченный аммиаком, дает
FeaSs. Но если раствор соли трехвалентного железа имеет кислую реакцию,
то сернистый водород или сернистый аммоний производит восстановление
трехвалентного железа до двухвалентного, прежде чем образуется какой-
либо осадок.
Сульфид железа(З) гидролитически расщепляется водой на
холоду постепенно, при 100° моментально:
Fe2S3 + 6Н2О -> 2Fe(OH)s ф 3H2S.
Поэтому влажные осадки на фильтре спустя несколько часов
принимают бурую окраску.
10. Сернистый водород восстанавливает соли окиси железа
в соли закиси с выделением серы:
2FeCl3 + H2S — FeCk ф 2НС1 ф-S.
Кроме сероводорода для восстановления солей окиси железа
в сода закиси служит, как уже было упомянуто (стр. 51—53), ряд
других веществ: металлы, хлористое олово, сернистая кислота,
иодистый водород и т. п.
1 Такова чувствительность реакции на бумаге. На капельной пластинке
чувствительность еще большая, а именно 0,05 г в капле. Ред.
3 J. Am. Chem. Soc. 29, 304 (1907); V. R о d t, Z. angew. Chem. 21, 422
(1916).
3 «Ueber Schwefeleisen», Karlsruhe (1905).
140
11. Тиоацетат аммония в кислой среде восстанавливает соли
трехвалентного железа и осаждает сульфид двухвалентного же-
леза в щелочной среде:
2Fe’ * • + CHsCOS' + H2O~> 2Fe‘' ф СНзСООН ф Н’ фБ;
2Fe‘ • ’ + 3CH3COS' + 6ОН'-* 2FeS ф ЗСНзСОО' ф ЗНЮ ф S.
12. Эфир при взбалтывании с раствором хлорного железа
в 6Ф соляной кислоте растворяет большую часть хлорного
железа. При отделении эфира посредством делительной воронки
и при повторных операциях взбалтывания со свежим эфиром
остающегося водного раствора (поддерживая в нем концентра-
цию НС1 6N), можно из последнего извлечь почти все железо'
(стр. 26).
13. Купферрон (аммонийная соль фенилнитрозогидроксиламина) СвНз —
/ОН
— N (см. стр. 158) осаждает комплексную соль железа красного цвета.
'Чю
Осадок растворим в эфире, не растворим в кислотах и при обработке
аммиаком превращается в Fe(OH).?.
14. Тиосульфат натрия NaeSeOs окрашивает растворы ней-
тральных солей окиси железа в фиолетово-красный цвет, но
окраска быстро исчезает и в растворе образуется соль закиси
железа и тетратионовонатриевая соль:
2Na2S2O3 + 2FeCl3-> 2NaCl"+ 2FeCl2 ф Na2S40e.
Состав получающегося вначале фиолетово-красного вещества
неизвестен; быть может, образуется серноватистокислая соль
окиси железа Ч
15. а-Нитрозоф-нафтол CioHe(NO)OH (см. стр. 271) в нейтраль-
ном или слабокислом растворе дает объемистый буровато-чер-
ный осадок соли трехвалентного железа нитрозоф-нафтола.
16. Хлористый кобальт, растворенный в концентрированной
соляной кислоте, дает темносиний раствор. Если небольшое ко-
личество этой синей жидкости прибавить к раствору, содержа-
щему небольшое количество ионов трехвалентного железа, то
раствор окрашивается в зеленый цвет. Винэбл (Venable) пред-
ложил эту реакцию для открытия ионов трехвалентного железа
в кислотах или для открытия их в присутствии двухвалентного
железа.
17. Аллоксантин CsHeOsNi дает синее окрашивание с ионами
трехвалентного железа и разбавленным раствором едкого натра1 2.
Открытие железа в его комплексных солях
Как мы вМдели, существует множество соединений железа, содержа-
щих последнее в виде комплексного иона, в которых открытие его посред-
1 По F. Hahn и G. Leimbach [В. 55, 3070 (1922)] фиолетово-
красное вещество представляет собой натриевую соль, комплексный анион
которой [Fe(S20s)2]' реагирует затем с ионом трехвалентного железа!;
[Fe(S20s)2]' + Fe’ ‘ 2Fe’ ’ ф SiOe",
2 Denig 6s, C. r. 180, 519 (1925).
16 Зак. Э82. Тредвелл-Голл, т. I. 241
ством обычных реактивов невозможно. Сюда относятся комплексные
соединения органических оксисоединений, а также железисто- и железо-
синеродистые соединения. Для открытия железа в таких соединениях по-
ступают различно, смотря по тому, находится ли железо в виде органи-
ческого оксисоединения или в виде железисто- и железосинеродистых
солей.
Железо в присутствии органических соединений может быть осаждено
сернистым аммонием в -виде сернистого соединения; можно также разру-
шить органическое вещество путем прокаливания, причем остаются метал-
лическое железо или его окись и уголь. Обработав кислотами остаток,
получившийся при прокаливании, переводят железо в раствор, который
фильтрованием отделяют от угля.
Из железисто- или железосинеродистого соединения железо не может
быть выделено даже сернистым аммонием; для открытия железа обычными
методами эти соединения должны быть предварительно совершенно разру-
шены, что производится: а) путем прокаливания, б) путем сплавления
с поташом или содой или в) путем выпаривания с концентрированной сер-
ной кислотой.
а) Разрушение путем прокаливания. Все железо- и железистосинероди-
стые соединения разрушаются при прокаливании, но в зависимости от
условий получаются различные продукты разложения. Щелочные соли при
прокаливании дают щелочные цианиды, карбид железа и азот, при этом
получаются также цианистоводородная кислота, двуокись углерода, аммиак
и дициан. Реакция обратима, и ее можно использовать для фиксации атмо-
сферного азота; так, при нагревании железа, угля и щелочных карбонатов
на воздухе образуется некоторое количество железистосинеродистой соли.
Остаток от прокаливания комплексных цианидов обрабатывают сначала
водой; цианистый калий при этом переходит в раствор, а нерастворившийся
карбид железа после фильтрования обрабатывают соляной кислотой, в кото-
рой он растворяется, образуя хлорное железо, с выделением углеводород
дов и углерода.
б) Разрушение путем сплавления с поташом. Испытуемое вещество на-
каливают с равным количеством поташа до спокойного плавления. При
этом получается смесь цианистого и циановокислого калия, растворимых в
воде, а также металлическое железо:
K4[Fe(CN)«] + К2СО3 -> 5KCN + KCNO + СО? + Fe.
Смесь выщелачивают водой, а остающееся железо растворяют в соля-
ной кислоте. При сплавлении влажной соли всегда появляется запах ам-
миака.
в) Разложение путем выпаривания с концентрированной серной кисло-
той. Этим способом разлагаются не только соединения закиси и окиси
железа, но все комплексные цианистые соединения. При этом металлы
переходят в сернокислые соли, азот циана — в сернокислый аммоний, угле-
род же циана улетучивается в виде окиси углерода:
K4[Fe(CN)e] + 6HaSO4 + 6НЮ =
s= 2K2SO4 + FeSO4 + 3(NH4)2SO< + 6CO;
2Ks[Fe(CN)e] + 12H»SO4 + 12HaO =
= 3K2SO4 + Fea(SO4)3 + 6(NH4)2SO4 + 12CO.
Выпаривание лучше всего производить в наклонно поставленном фар-
форовом тигле, направив пламя .на верхнюю часть тигля. Нагревают до
исчезновения паров серной кислоты. Остаток, состоящий из безводных
сернокислых солей, обрабатывают малым количеством концентрированной
соляной кислоты, затем нагревают, прибавляя шостепенно воду. Таким
путем сульфаты легко переводятся в раствор; при помощи же только
одной воды это удается с большим трудом.
242
Реакции сухим путем
Перл буры или фосфорной соли 'при слабом насыщении
.испытуемым веществом окрашивается в окислительном пламени
в желтый цвет, при охлаждении становится бесцветным, а в вос-
становительном пламени приобретает бледнозеленоватый цвет.
При сильном насыщении перла испытуемым веществом в окис-
лительном пламени появляется бурое окрашивание, переходящее
при охлаждении в желтое и в бутылочнозеленое при нагревании
в восстановительном пламени.
Все соединения железа, накаленные в смеси с содой на угле
перед паяльной трубкой, оставляют серые пластинки металличе-
ского железа, большей частью невидимые глазом, но могущие
быть отделенными от угля посредством магнита. Значительно
точнее и изящнее удается получение металлического железа по-
средством нагревания пробы, как это указано (стр. 89), на
обугленной палочке с содой.
Марганец Мп. Ат. в. 54,93. Ат. н. 25
Плотность 7.2. Т. пл. 1264 ’. Т. кип. 1SGO '
Нахождение в природе. Важнейшими марганцовыми минералами яв-
ляются: пиролюзит (бурый марганец) МпОз ромбической системы; полиа-
нит МпОг, кристаллизующийся в квадратной системе (изоморфен с оловян-
ным камнем и рутилом); браунит МпзОз квадратной системы; манганит
НМпОа ромбической системы (изоморфен с гетитом и диаспором); гаусма-
нит МпзОл квадратной системы; марганцовый шпат МпСОз гексагональной
системы (изоморфен с кальцитом). Марганец — постоянный спутник железа,
так что его находят в различных количествах почти во всех железных
рудах.
Свойства. Марганец — металл серо-белого цвета с красноватым оттен-
ком, хрупкий, не обладающии магнитными свойствами; твердость его, по-
добно железу, значительно повышается в результате сплавления с углем.
Марганец легко окисляется и разлагает воду, выделяя водород, при темпе-
ратурах, несколько превышающих комнатную. Металл растворяется ,в раз-
бавленных кислотах и даже в уксусной кислоте. В виде ферромарганца
(сплав марганца и железа, содержащий до 60% Мп) он широко приме-
няется в производстве стали. Небольшие количества марганца служат для
раскисления стали, а большие количес тва его -— для весьма сильной «само-
закалки» стали. Двуокись марганца применяется в сухих элементах, в каче-
стве сушителя («сиккатива») для красок и лаков и для окраски стекла
и керамических изделий.
Окиси, гидроокиси и соли. Известны пять окислов марганца и суще-
ствуют соли, соответствующие шестому окислу МпОз.
Закись марганца МпО образуется при прокаливании Мп(ОН)., MnCOs
или МпСгОт без доступа воздуха или же при прокаливании другого какого-
нибудь окисла марганца в токе водорода. Она представляет собой серый
или зеленовато-серый порошок, окисляющийся на воздухе в MnsOi. Гидро-
закись марганца Мп(ОН)з образуется при действии едкой щелочи на соли
двухвалентного мйрганца. Она легко окисляется, образуя Мп(ОН)з или
МпО(ОН).
Окисел MihOs может быть получен из МпОз при продолжительном
накаливании1 при 700°. С кислотами МпзОз дает нестойкие соли трехва-
’По Schneider прокаливание производится в течение 20 час. Pog.
Ann. 107, 6С5 (1859). Ред.
16*
243
лентного марганца, но обыкновенно он ведет -себя так, как если бы со-
стоял из одного атома двухвалентного марганца и одного атома мар-
ганца четырехвалентного, что и оправдывает его название марганцова-
тистокислой соли двухвалентного марганца.
Окисел МпзО1 встречается в природе в виде -минерала гаусманита. На
основании его отношения к разбавленной азотной или серной кислоте он
может рассматриваться как ортомарганцоватистокислая соль двухвалент-
ного марганца.
Двуокись марганца МпОг, известная в природе в виде пиролюзита,
может быть получена при нагревании нитрата двухвалентного марганца на
воздухе при 200° или при кипячении соли двухвалентного марганца- с кон-
центрированной азотной кислотой и хлоратом калия. Она может рассма-
триваться как ангидрид метамарганцоватистой кислоты НзМпОз.
Окисел МпОз никогда не был изолирован. Он является ангидридом
марганцовистой кислоты НзМпСЬ, которая существует только в виде солей.
Окисел МпгО? — ангидрид марганцовой кислоты; он представляет со-
бой маслянистую красновато-бурую жидкость, которая настолько неустой-
чива, что уже при слабом нагревании сильно взрывает.
При действии на какой-либо окисел марганца, за исключением МпО,
холодной разбавленной соляной кислоты получается зеленовато-бурый
растрор, который при нагревании -выделяет хлор и обесцвечивается.
Раствор в таком случае содержит соль двухвалентного марганца—произ-
водное МпО. Закись марганца растворяется в кислоте без выделения
хлора:
МпО + 2НС1 -> НзО + MnCh;
МпзОз + 6НС1-» ЗНзО + 2МпС1з + Ch;
МпзО4 + 8НС1-» 4НзО + ЗМпСЬ + Ch;
МпОз + 4НС1 -» 2НзО + MnCh + Ch;
МпаО? + 14НС1 -> 7НзО + 2MnCh + 5Ch.
В концентрированной серной кислоте при нагревании растворяются все
окислы марганца, выделяя кислород и образуя сернокислую закись мар-
ганца. Исключение представляет МпО, растворяющаяся без выделения
кислорода:
МпО + H2SO4 НгО + MnSO4;
2МпзОз + 4H2SO4 4НгО + 4MnSO4 + О2;
2МпзО4 4- 6H2SO4 -> 6Н2О + 6MnSO4 + О2;
2МпОз + 2H2SO4-> 2Н2О 4- 2MnSO4 + Ог.
Весьма интересно отношение окислов МпОг, МпгОз и МП3О4 к кипя-
щей разбавленной азотной или серной кислоте. На Мп-Ог разбавленные
кислоты совсем не действуют; -при действии кислот на МпгОз половина
марганца образует соль закиси марганца и соответствующей кислоты, дру-
гая же половина остается нерастворенной в виде бурого гидрата двуокиси
/ОН
марганца Мп —О . В этих же условиях из МпзО4 две трети марганца
\ОН
идет на образование соли, а остальная треть выделяется также в виде
бурого гидрата двуокиси марганца.
НгМпОз выделяется подобно тому, как выделяется кремневая кислота
из силиката при действии на последний сильных кислот:
/°\ /°Н
Si=o\ca4-2H’ = Si=O 4-Са"
ХОН
Действительно, гидрат двуокиси марганца' в большинстве случаев
играет роль кислоты; окислы МпзОз и МпзО4 обладают свойствами мар-
ганцевых солей этой кислоты и должны рассматриваться как мангаииты.
244
Таким образом, МпЖЭз можно считать марганцоватистокислой солью
/О
закиси марганца Мп =0 / Мп,
которая по своему составу аналогична
О
углекислой соли закиси марганца
и кремнекислой соли закиси
такому представлению при электролити-
марганца Si=o /Мп. Согласно
диссоциации должны образовываться катионы Мп' ' и анионы
что при действии на МпзОз разбавленной
кислоты половина марганца идет на образование соли, а другая
ческой
МпОз"; поэтому легко понять,
азотной
переходит в марганцоватистую кислоту;
/О /ОН
Мп=о\мп + 2HNO3 Мп (NOg)2 + Мп=О
О
MnsCh или
°\
/ Мп, отдающий две трети марганца на
образование соли, должен рассматриваться как производное ортомарганцовати-
но. уОН
СТОЙ КИСЛОТЫ /Мп<
но/ /он
При действии на МпзСЬ азотной кислоты образуется сначала непроч-
ная ортокислота, которая, отщепляя воьду, переходит в метамарганцовати-
стую кислоту:
/°\ /°\ но\ /ОН
Мп< )Мп/ >Mn + 4HNOg —>2Mn(NOg)o+ >Мп<
/Q/ /Q/ ’ НО7 ЧОН
НО. /ОН /0Н
>Мп< =Н,0 + Мп=0
но/ /он 0„
МпОз находится в таком же отношении к НзМпОз, .в каком СОг
к НгСОз, SiOa к HzSiOs и БпОг к НгБпОз; таким образом МпОз обладает
свойствами кислотного ангидрида. Однако двуокись марганца подобно
SnOs может функционировать и как основной ангидрид, образуя, например,
соль MnCh. Для .получения последней действуют холодной концентриро-
ванной соляной кислотой на МпОз; последняя растворяется, образуя четы-
реххлористый марганец буро-зеленого цвета; MnCh растворяется в эфире,
окрашивая последний в зеленый цвет. Поэтому при взбалтывании соляно-
кислого раствора с эфиром всплывающий наверх эфирный слой окраши-
вается в зеленый цвет.
Известны также Мп(Б04)г и Мпз(БО4)з. Эти соли легко гидролизуются,
образуя НзМпОз и МпМпОз:
Mn(SO4)2 + ЗНзО/i НзМпОз + 2H3SO4;
Мпз(5О4)з 4- ЗНзО МпзОз + 3HsSO4,
Кроме манганитов двухвалентного марганца известен ряд других манга-
нитов. Некоторые из них играют очень важную роль в аналитической
химии, как, например, биманганиты цинка и кальция, 2пНз(МпОз)з,
СаНз(МпОз)з, которые являются аналогами бикарбоната кальция СаНз(СОз)з.
Биманганит цинка образуется при объемном определении марганца (см.
том II). Биманганит кальция имеет техническое значение, являясь проме-
жуточным продуктом при регенерации марганца в вельдоновском процессе
производства хлора.
245
Закись марганца МпО является единственным окислом марганца,
всегда проявляющим свойства основного ангидрида. Путем растворения
этого окисла в кислотах получают соли закиси марганца, в которых мар-
ганец является двухвалентным элементом.
МпОз не был еще изолирован, но известны производные его марган-
цовистокислые соли или манганаты (ЪМпОз (стр. 253). Окисел МпгОт является
ясно выраженным кислотным ангидридом, производными которого являются
соли марганцовой кислоты или перманганаты RMnOi.
При изучении реакций .марганца рассмотрим сначала соединения за-,
киси марганца, затем манганаты и, наконец, перманганаты.
А. Соединения двухвалентного марганца
Соли закиси марганца в кристаллическом состоянии, а также и в
растворах окрашены в бледнорозовый цвет; в безводном состоянии все
соли закиси марганца, за исключением сульфида, белого цвета.
Реакции мокрым путем
1. Едкие щелочи осаждают белый гидрат закиси марганца:
Мп' • + 2ОН'-> Мп(ОН)2,
быстро буреющей на воздухе с образованием марганцоватисто-
кислой соли закиси марганца.
Сначала часть гидрата закиси марганца окисляется кислородом воз-
духа в марганцоватистую кислоту:
2Мп(0Н)г + Ch = 2НгМпОз,
которая с гидратом закиси марганца тотчас образует соли—манганиты:
НгМпОз + Мп(ОН)а = 2НзО + МпМпОз
или
2НгМпОз -Г Мп(ОН)а = 2НзО -}- МпНг(МпОз)2.
Это окисление протекает на воздухе лишь постепенно; напротив, при
действии хлора, брома, хлорноватистокислых солей, перекиси водорода
и т, п. окисление происходит моментально:
Mn(OH)a + 2NaOH + Ch = 2\аС1 + Н-0 + НгМпОз;
Mn(OH)a + NaOCl — NaCl НаМпОз;
Мп(ОН)з + НгОз = НЮ 4- Н'МпОз.
Осажденная марганцо-ватистая кислота растворяется в растворе кислого
щавелевокислого «алия, давая великолепное красное окрашивание раствора,
обусловленное образованием комплексного иона марганца и щавелевой
кислоты.
Образование манганитов имело раньше техническое значение для полу-
чения вельдонова ила (регенерирование бурого марганца). Остатки, полу-
чавшиеся при приготовлении хлора из природной двуокиси марганца (пиро-
люзита) и соляной кислоты, состояли, главным образом, из хлористого
марганца. При прибавлении к этим остаткам извести получался
гидрат закиси марганца. Смесь последнего с известью подвергалась дей-
ствию воздуха для получения марганцоватистой кислоты, которая с из-
вестью давала манга-нит кальция, и таким образом весь марганец путем
окисления превращался в марганцоватистую кислоту:
2Мп(0Н)а + О.- + Са(ОН);-> СаН2(МпОз)2 + 2НзО.
При обработке же соляной кислотой полученного ила получалось то
же самое количество хлора, что и из первоначально взятой двуокиси мар-
ганца:
2Мп0а + 8НС1 -> 4Н;О + 2MnCh + 2С1-;
СаНг(МпОз)г -Г ЮНС1 -> 6Н-20 + 2MtiCk + CaCh 4- 2С12.
Конечно, в последнем случае наблюдается несколько большая затрата
соляной кислоты, потому что часть ее служит для освобождения марган-
цоватистой кислоты из ее соли.
2. Аммиак осаждает марганец из нейтрального, свободного
от аммонийных солей (так же как в случае солей закиси железа
и магния) раствора в виде белого гидрата. Осаждение неполное;
MnCh + 2NH3 + 2Н2О Мп(ОН)2 + 2NH4CI.
При достаточной концентрации хлористого аммония аммиак не дает
никакого осадка (стр. 301). В этом случае марганец находится в растворе,
главным образом, в виде хлористого марганца и лишь незначительная часть
его в виде гидрата закиси марганца (соответственно растворимости послед-
него). На воздухе растворенный гидрат закиси марганца переходит в
трудно растворимую марганцоватистую кислоту (гидрат двуокиси марган-
ца), выделяющуюся в виде бурых хлопьев. В растворе вновь устанавли-
вается равновесие за счет образования новых количеств гидрата закиси
марганца, вследствие чего снова выделяется некоторое количество марган-
цоватистой кислоты и т. д. до тех пор, пока весь марганец не выделится
в этой форме; это обстоятельство должно быть принято во внимание при
отделении марганца от солей окиси железа, алюминия и т. п. Если
к раствору, содержащему хлорное железо и хлористый марганец, приба-
вить достаточное количество хлористого аммония и затем аммиака, то
только железо выпадет в виде красно-бурого гидрата окиси, марганец же
останется в растворе. Но стоит раствор до фильтрования оставить на
продолжительное время на воздухе, как марганец начнет постепенно выде-
ляться в виде марганцоватистой кислоты. Поэтому для отделения марганца
от железа и др. прибавляют к раствору достаточный избыток хлористого
аммония, нагревают до кипения для удаления, насколько только возможно,
воздуха из раствора и затем осторожно осаждают аммиаком так, чтобы
ощущался только слабый запах его, после чего тотчас фильтруют. Это
отделение не является количественным, но для целей качественного ана-
лиза оно вполне достаточно.
Окислители в присутствии аммиака осаждают марганец в виде
НзМпОз. Обыкновенно пользуются в качестве окислителя бромом, но не-
обходимо при этом соблюдение ряда предосторожностей для полноты
осаждения марганца.
При окислении соли двухвалентного марганца в нейтральной среде
посредством брома осаждение марганца в виде НгМпОз никогда не бывает
пелным:
Мп" + Вгз + ЗНзОдс 4Н' + 2Вг'+ НзМпОз.
Осаждение марганца может протекать количественно, если согласно'за-
кону действия масс (стр. 12) водородные ионы, образующиеся при реак-
ции, будут нейтрализованы. Бромистый натрий не восстанавливает в ней-
тральном растворе НаМпОз, которая восстанавливается бромистым водо-
родом. Раствор может быть нейтрализован едкими или углекислыми щело-
чами, ацетатом щелочного металла (стр. 63) или аммиаком. Раствор соли
двухвалентного марганца может содержать даже значительный избыток
уксусной кислоты, и тем ие менее марганец будет осаждаться полностью
в присутствии ацетата натрия.
Аммиак в этом случае как нейтрализующий агент не совсем удовле-
творителен, потому что он реагирует как с бромом, так и с бромистоводо-
родной кислотой. Если бром прибавить к раствору аммиака, то протекает
бурная реакция с выделением азота:
8NH4OH + ЗВг2-> 6NH«Br + 8НзО + Ns.
При прибавлении брома к раствору хлористого аммоиия происходит
медленное окисление, результатом которого является также выделение
азота:
2МНГ +ЗВгз^8Н‘ +6Вт',+ Ns.
247
Если же к такому раствору прибавить ацетат натрия, то реакция
сильно ускоряется вследствие уменьшения концентрации водородных ионов,
и при нагревании, раствора, увеличивающем скорость реакции и вызыва-
ющем скорое выделение газа, вся аммонийная соль может быть разложена
посредством весьма малого избытка брома.
Присутствие аммонийной соли препятствует осаждению марганца бро-
мом и ацетатом натрия; когда вся соль аммония окислена до азота, марга-
нец может быть осажден в виде НаМпОз, если только принять меры к тому,
чтобы раствор не был кислым.
Более благоприятно условие для осаждения марганца, когда в раство-
ре имеются гидроксильные ионы, как это имеет место в аммиачном
растворе. Прибавление брома ж такому раствору обыкновенно вызывает
немедленное осаждение некоторого количества марганца, но вследствие
действия брома на аммиак или аммонийную соль раствор обычно приобре-
тает кислую реакцию, и тогда осаждение неполно. Чтобы осадить весь
марганец посредством аммиака и брома, лучше всего поступать следующим
образом.
Разбавляют раствор приблизительно до 200 мл и нейтрализуют, если
необходимо, аммиаком. Прибавляют немного бромной воды, небольшой
избыток аммиака и перемешивают для ускорения образования осадка
Раствор нагревают, прибавляют несколько больше бромной воды и снова
слегка подщелачивают аммиаком. В случае заметного увеличения количе-
ства осажденного марганца при последней обработке посредством брома
и аммиака снова повторяют эту операцию. Отфильтровывают осажденную
марганцоватистую кислоту, концентрируют немного фильтрат путем выпа-
ривания и снова обрабатывают бромом и аммиаком. Иногда НзМпОз оса-
ждается ®о время выпаривания на стенках сосуда. Обработка бромом и
аммиаком должна продолжаться до тех пор, пока полученный фильтрат
уже не будет больше давать осадка с указанными реактивамих.
3. Углекислые щелочи осаждают белую углекислую соль
двухвалентного марганца:
Мп‘ ' + СОз" -> МпСОз,
которая при долгом кипячении на воздухе частью переходит
в менее растворимую марганцоватистую кислоту:
2МпСО3 + 2НгО + Оа ^2СО2 + 2Н2МпО3.
4. Углекислый аммоний осаждает белый карбонат даже в при-
сутствии аммонийных солей (отличие от магния).
5. Углекислый барий производит осаждение только из горя-
чего раствора.
6. Фосфорнокислый натрий осаждает белую трехметалличе-
скую соль двухвалентного марганца и фосфорной кислоты:
4НРОГ + ЗМп' ‘ ->2Н2РО4' + Мп3(РО4)2,
растворимую в минеральных кислотах и уксусной кислоте:
Мп3(РО4)2 + 2Н • - ЗМп’ • + 2НРО4".
При прибавлении избытка аммиака к кипящему раствору
этого осадка в кислоте выделяется, как и в случае магния
1 Вышеприведенное пространное объяснение дано ввиду важности его
для количественного анализа. Факты, на которых это объяснение основано,
были тщательно проверены количественными опытами, выполненными в
Массачусетском технологическом институте S. G. Simpson.
248
(стр. 302), фосфорноаммониевомарганцовая соль в виде бледно-
розовых чешуек:
НРОГ + NHiOH - NHC 4- РОГ' + Н2О;
Мп ’' + NH4 ’ + PGV" 4- 7НгО -> Mn(NH4)PO4 • 7Н2О.
Кристаллический осадок телесного цвета практически не рас-
творим в воде.
7. Двуокись свинца и концентрированная азотная кислота
[реакция Крума (Crum)] L Если к раствору, содержащему следы
марганца, прибавить двуокиси свинца и концентрированной азот-
ной кислоты, то после кипячения и разбавления водой отстояв-
шаяся от избытка двуокиси свинца жидкость окрасится в замет-
ный фиолетово-красный цвет вследствие образования марганцо-
вой кислоты:
2Мп” + 5РЬОз + 4Н ’ -> 5РЬ" + 2Н2О + 2МпО4'.
Эта чрезвычайно чувствительная реакция, которой можно
определить даже такое количество, как 5 у марганца, дает
отрицательные результаты в присутствии большого количества
соляной кислоты или хлористых соединений, так как последние
разрушают марганцовую кислоту:
2НМпО4 + 14НС1 -> 8Н2О + 2МпС12 + 5С12.
* Примечание редактора. Эта реакция не удается при боль-
ших количествах соли марганца, потому что образующаяся мар-
ганцовая кислота вступает в обменное разложение с избытком
соли марганца, образуя двуокись марганца. * А. К.
8. Висмутовокислый натрий1 2 (висмутат натрия), прибавлен-
ный к холодному раствору соли двухвалентного марганца в раз-
бавленной азотной кислоте (уд. в. около 1,13), вызывает обра-
зование марганцовой кислоты. Этот реактив, отвечающий при-
мерной формуле NaBiOg, готовят путем сплавления окиси вис-
мута с перекисью натрия. Он не растворим в воде, и избыток
реактива по завершении реакции может быть отфильтрован че-
рез асбест. Реакция может быть выражена следующим уравне-
нием:
2Мп' ’ + 5NaBiO3 + 16Н' -> 5Na’ 4- 5Bi‘ ‘ - + 7Н2О + 2НМпО4.
Эта реакция чрезвычайно чувствительна, если в растворе нет
веществ, могущих реагировать с марганцовой кислотой. Нерас-
творимый углеродистый остаток, какой может быть получен при
растворении в кислотах чугуна, исследуемого на содержание
в нем марганца, должен быть отфильтрован до прибавления ре-
актива. При нагревании раствора марганцовая кислота разру-
шается и выделяется осадок марганцоватистой кислоты.
Вместо висмутата натрия можно применять двуокись висмута
ВЮг.
1 Crum, Liebigs Ann. Chem. 55, 219 (1845); 198, 362 (1879). Ред.
2 Schneider, Monatsch. 9, 242 (1888). Ред.
249
9. Надсернокислый аммоний 1. При нагревании слабо подкис-
ленного серной или авотной кислотой раствора соли марганца
с надсернокислым аммонием постепенно .'выделяется весь марга-
нец в виде марганцоватистой кислоты:
Мп' ’ + S2O8" + ЗН2О -» 2SOj" + 4Н' + Н2МпО3.
Но если к раствору прибавить следы азотнокислого серебра
в качестве катализатора, то при малых количествах марганца
последний целиком окисляется в марганцовую кислоту и рас-
твор окрашивается в фиолетовый цвет:
2Мп’' + 5S2O8" + 8Н2О -И6Н' + lOSOP' + 2МпО4'.
Эта реакция может служить для количественного определе-
ния малых количеств марганца в отсутствие веществ, могущих
реагировать с марганцовой кислотой.
В виде капельной эту реакцию проводят следующим обра-
зом. Смешивают в фарфоровом микротигле каплю испытуемого
раствора с каплей концентрированной серной кислоты и каплей
0,1%-иого раствора нитрата серебра. К смеси прибавляют ще-
потку персульфата аммония и слабо нагревают. Появление фио-
летового окрашивания указывает на присутствие марганца. Та-
ким путем можно открыть 0,1 у Мп2.
10. Сернистый аммоний осаждает из растворов солей мар-
ганца гидратированный сернистый марганец телесного цвета:
Мп” + S" -> MnS.
При кипячении с большим избытком сернистого аммония он
превращается в более бедный по содержанию воды сернистый
марганец зеленого цвета состава 3MnS • Н2О.
Произведение растворимости MnS относительно велико
(стр. 38), и чтобы осадить марганец в виде сульфида, необхо-
дим избыток S''-ионов. Осадок легко растворяется в разбавлен-
ных кислотах, что является следствием удаления S''-ионов, обра-
зующих неионизированный сернистый водород.
11. Цианистый калий. При прибавлении к раствору соли за-
киси марганца цианистого калия образуется буроватый осадок,
растворимый в избытке осадителя. Полученный раствор также
буроватого цвета. При стоянии или при нагревании из этого'
раствора выделяется объемистый зеленый осадок, состоящий из
K[Mn(CN)3], который от дальнейшего прибавления цианистого
калия растворяется, образуя K4[Mn(CN)e]. Полученная при этом
жидкость.— желтого цвета:
Мп’ ’ + 2CN' Mn(CN)2; Mn(CN)2 + KCN K[Mn(CN)s];
K[Mn(CN)3] + 3CN' К‘ + [Mn(CN)6]"".
‘Marschall, Z. anal. Chem. 43, 418, 655 (1304).
2 Ф a ft г л ь, Капельный анализ, стр. 272. Ред,
230
Последняя соль очень непостоянна: она может существовать
в растворе только в присутствии большого количества циани-
стого калия. В силу этого при разбавлении желтого раствора
водой вновь выделяется зеленая соль:
K4[Mn(CN)6] j±K[Mn(CN)j] +3KCN.
При нагревании же разбавленного раствора до кипения про-
исходит под влиянием воды полное разложение на цианистый
калий, синильную кислоту и белый гидрат закиси марганца:
[Mn(CN6)]'"' + 2НОН - 4CN' + 2HCN + Мп(ОН)2.
Устойчивость этого комплексного цианида значительно меньше устой-
чивости соответственного соединения никеля (стр. 262). На этом основан
интересный метод отделения никеля от марганца.
Сернистый никель значительно менее растворим, чем сернистый марга-
нец (стр. 38), так что .возможно осаждение сернистого никеля сероводо-
родом в присутствии уксусной кислоты и ацетата натрия. Марганец при
аналогичных условиях не осаждается в виде сульфида. Но если, с другой
стороны, прибавить сернистый аммоний к горячему разбавленному рас-
твору, содержащему комплексные цианиды марганца и никеля, то никель
останется в растворе, а осаждение марганца в виде сульфида будет пол-
ным:
[Mn(CN)o]"" + S" -> 6CN' + MnS.
Однако в присутствии большого избытка цианистого калия. [Mn(CN)e]"''-
анион приобретает такую устойчивость, что марганец на холоду совер-
шенно не осаждается сернистым аммонием.
12. Хлорат калия. При кипячении раствора соли двухвалент-
ного марганца [в концентрированной азотной кислоте с избытком
хлората калия весь марганец осаждается в виде МпО2:
Mn(NO3)2 + 2КС10з MnO2 Д- 2KNOs + 2С10г.
13. Ферроцианид калия осаждает белый железистосинеродистый мар-
ганец (2) Mn2[Fe(CN)o], трудно растворимый в соляной кислоте. Осадок
может быть получен также в растворе, в котором находятся винная кисло-
та и аммиак.
14. Феррицианид калия образует бурый железосинеродистый марганец
Мпз[Те(СМ)в]2, слегка растворимый в холодной соляной кислоте и не
растворимый в аммиаке.
15. Бромат калия, прибавленный к холодному сернокислому раствору
соли двухвалентного марганца, дает фиолетовую окраску перманганата.
Хлорат и иодат не дают этой реакции.
16. Перйодат калия образует темнокрасный осадок1, вероятно,
йоднокислого марганца (2); разбавленные растворы окрашиваются в крас-
ный цвет. В соляной кислоте осадок растворяется с выделением хлора;
1 Мы приводим эту реакцию так, как она описана у Н а 1 1 по
Benedict, предложившему ее в Am. Chem. J. 34, 581 (1905). Другие
авторы (Treadwell, Me. А 1 р i п) интерпретируют ее по Willard и
Greothouse [J. Am. Chem. Зое. 39. 2366, (1917)], по мнению которых
реакция протекает не с образованием осадка перйодата марганца, а с об-
разованием марганцовой кислоты:
2Mn(NO3)2 + 5KJ01 + ЗН2О = 2HMhOj + 5KJOs + 4HNOs.
На этой реакции авторы основали колориметрический метод опреде-
ления марганца. Ред.
251
едкий натр и даже аммиак превращают его в черную марганцоватистую
кислоту НаМпОз. Реакция чувствительна, и нагревание благоприятствует ей.
17. Окислители, прибавленные к насыщенному раствору хлористого мар-
ганца в концентрированной соляной кислоте, дают при нагревании темпо-
бурую или черную окраску, обусловливаемую образованием четыреххло-
ристого марганца. Эту реакцию дают нитрат, хлорат, гипохлорит, хромат
и двуокись свинца. Не дают этой реакции хлорнокислые соли (перхлораты),
броматы, бром, перекись натрия, персульфат, нитрит и свинцовый сурик Ч
18. Бензидин 1 2 (стр. 222) образует с марганцем в щелочном растворе
синее окрашивание. Катионы двухвалентного марганца реагируют с ОН',
образуя Мп(ОН)г, который быстро окисляется растворенным кислородом
в МпОз. Двуокись в свою очередь окисляет бензидин. Реакция может быть
выполнена (на фильтровальной бумаге. Ред.) с каплей испытуемого рас-
твора. Открываемый минимум: 0.15 T марганца.
19. Перйодат и основание Арнольда (р-тетраметилдиа.минодифенилме-
тан). Основание Арнольда получается при действии формальдегида
(формалина) на раствор диметиланилина в метиловом алкоголе и кон-
центрированной соляной кислоте. В качестве реактива служит 1%-ный рас-
твор указанного основания в хлороформе.
Выполнение. В углублении капельной пластинки помещают каплю
исследуемого раствора и последовательно по капле насыщенного раствора
KJOi, 2N уксусной кислоты и две канли хлороформенного раствора осно-
вания Арнольда. В присутствии марганца хлороформ окрашивается в ин-
тенсивно синий цвет. Хром должен отсутствовать, потому что он, окислив-
шись в хромат, дает ту же реакцию с основанием Арнольда. Реакция
чрезвычайно чувствительна, она дает возможность открывать марганец
в количестве 0,001 у.
20. Щелочные гипобромиты и медные соли. Бромноватистокислые соли
в щелочном растворе осаждают черную двуокись марганца. Если же в
растворе находятся небольшие количества Си'', окисление идет далее и
вместо темнокоричневого осадка появляется фиолетовое окрашивание рас-
твора:
2Мп' ' + 5ВгО' + 6ОН' ->2МпО«' + 5Вг' + ЗН2О.
Повидимому, первоначально в щелочной среде происходит осаждение
Си(ОН)?, пл поверхности которой идет каталитическое разложение анионов
ВгО' на Вг' и кислород, который и окисляет Мп ‘ ‘ в МпО/. Кобальт и
никель ведут себя аналогично, но каталитическое воздействие их выра-
жено слабее. Присутствие хрома мешает реакции, так как желтый цвет
образующихся СгО/'-анионов может маскировать окраску МпО/. Реак-
ция не является такой чувствительной, как с персульфатом или висмута-
том.
Выполнение. В небольшую пробирку берут 2 мл 1%-ного раствора суль-
фата меди, добавляют каплю испытуемого раствора и 8—10 мл 0,1А рас-
твора NaBrO. Умеренно нагревают, после чего- в жидкости, находящейся
над осадком, появляется розовое (или фиолетовое) окрашивание; откры-
ваемый минимум 2,5 Т Мп. Реакцию можно провести и следующим обра-
зом. Берут в пробирку 10 мл кислого испытуемого раствора, добавляют
каплю насыщенного раствора сульфата меди, 0,2 г КВгОз и 0,3 г КВг.
Реакция бывает положительной, если в 10 мл раствора находится
3 т марганца.
21. Аммиачный раствор нитрата серебра дает с ионами Мп ’ осадок
МпО» и тонкораздроблен,ного Ag-;
Мп" ‘ + 2[Ag(NH3)] ' + 4ОН' -> МпСЬ + 2Ag -|- 4МНз + 2НаО.
Выполнение. Помещают каплю испытуемого раствора на фильтроваль-
ную бумагу; добавляют каплю насыщенного раствора нитрата серебра,
к которому был прибавлен концентрированный аммиак до растворения
1 De К о п i п с k. Z. anal. Chem. 43, 418 (1904).
2 F е i g 1, Chem.-Ztg. 44, 68Q (1920); Z. anal. Chem. 60, 24 (1921). Ред.
252
выпавшего осадка окиси серебра, после чего добавлено еще такое же ко-
личество аммиака. В присутствии 0,7 у марганца при нагревании наблю-
дается почернение.
Б. Соединения шести- и семивалентного марганца (марганцови-
стая и марганцовая кислоты)
Марганцовистая кислота в свободном состоянии не получена. При по-
пытке выделения ее из зеленого сплава марганцовистокислой щелочи по-
средством какой-либо кислоты всегда получают марганцовую кислоту и
гидрат двуокиси марганца: одна часть нестойкой марганцовистой кислоты
окисляет другую часть в марганцовую кислоту, восстанавливаясь сама в
двуокись марганца:
ЗНгМпСН -+ 2НМпО« + НзМпОз + НгО.
Это превращение совершается так легко, что уже при простом стоя-
нии раствора марганцовистокислой соли на воздухе получается под влия-
нием угольной кислоты красно-фиолетовый перманганат:
ЗКгМпСЬ + 2СОз + НзО ->2KsCO3 4- НзМпОз + 2КМпО<.
Реакция протекает значительно быстрее при прибавлении нескольких
капель более сильной кислоты.
Окисление одной молекулы за счет другой молекулы того же самого
вещества — явление, весьма часто встречающееся в химии. Оно всегда
сопровождается потерей свободной энергии, которой первоначально обла-
дает система. Вся энергия, которой обладает какая-либо система, состоит
частью из свободной, частью из связанной энергии. Самопроизвольно про-
текающая реакция характеризуется тем, что свободная энергия системы
по завершении реакции меньше той, которой обладала система до реакции.
Состояние с наименьшим запасом свободной энергии является наиболее
устойчивым.
Можно было бы сделать и такое заключение, что наиболее устойчивы
те системы, которые обладают наименьшим количеством общей энергии
(связанной и свободной); но при внимательном рассмотрении можно ви-
деть, что течение химической реакции обусловлено не общим запасом
энергии, а свободной энергией.
При изменениях, которые претерпевает какой-либо элемент, увеличе-
ние общей энергии не должно обязательно всегда сопровождаться
увеличением свободной энергии, связанной с элементом.
Тот факт, что раствор манганата (соли марганцовистой кислоты), в ко-
тором валентность марганца равна шести, легко разлагается, указывает
только, что свободная энергия в системе, состоящей из четырех- и семи-
валентного марганца, меньше свободной энергии, заключающейся в си-
стеме, содержащей весь марганец в шестивалентной форме. Часто условия
бывают как раз обратные, и наиболее устойчивым состоянием является
состояние промежуточной валентности. Так, перманганат и соль двухвалент-
ного марганца реагируют, образуя четырехвалентный марганец.
Приведем несколько реакций, аналогичных реакции разложения
Н2МПО4.
Гипохлориты при нагревании их водного раствора превращаются в хло-
раты и хлориды; одновалентный атом хлора при окислении превращается
в пятивалентный за счет двух атомов хлора, которые при этом восстана-
вливаются (имея первоначально по одному положительному заряду, они
в результате реакции становятся одноотрицательно заряженными):
ЗСЮ'-> СЮз'+ 2СГ.
При нагревании хлората образуется перхлорат, хлорид и свободный
кислород. Здесь один атом хлора увеличивает свою валентность ,иа две
единицы, другой атом хлора теряет шесть зарядов, и остающиеся четыре
253
заряда производят окисление двух отрицательно заряженных атомов кис-
лорода:
2NaCIO3 ->NaC!Oi ф NaCl ф Ог.
Азотистая кислота превращается в водном растворе в азотную кис-
лоту и окись азота, при этом один атом азота приобретает два заряда, а
два других теряют по одному заряду:
3HNO2 ->HNO> + 2NO ф Н2().
Фосфорноватистая и фосфористая кислоты могут превратиться в фос-
форную кислоту н фосфористый водород:
2НзРОз -> НзРОт ф РНз; 4НзРОч -> ЗНзРОг + РНз.
Тиосульфаты и сульфиты щелочных металлов превращаются при про-
каливании в сульфаты и сульфиды:
4Na2S20.3 ->3\a2SO4 ф Na»S.>; 4Na«SO3 -ЗХазЗО: ф NTa2S.
Марганцовая кислота HMnOi хотя и значительно более устойчива, чем
марганцовистая кислота, тем не менее она известна только в водном рас-
творе; ангидрид же ее МпгОт изолирован. При осторожном добавлении
концентрированной серной кислоты к охлажденному раствору перманга-
ната выделяются маслянистые капли Мп2О? красно-бурого цвета, которые
при нагревании (для этого достаточна даже теплота реакции) со взрывом
воспламеняются:
2Мп20т ф 4H2SO4 -+ 4MnSO4 ф 4НгО Ф 50».
Все соли марганцовой кислоты (перманганаты) растворяются в воде,
окрашивая ее в красно-фиолетовый цвет. Все они — весьма энергичные
окислители. В кислом растворе семивалентный марганец перманганата
обыкновенно восстанавливается до соли двухвалентного марганца; в щелоч-
ном или почти нейтральном растворе восстановление происходит до
четырехвалеитного марганца, т. е. до двуокиси марганца.
Окисление в кислом растворе
Типичные уравнения окисления перманганатом были уже разъяснены
на стр. 48. Здесь мы повторим только несколько реакций, причем не счи-
таем необходимым детальное рассмотрение метода составления уравнений.
Чтобы избежать повторений, уравнения, приводимые ниже, даны в моле-
кулярной, а не в ионной форме:
2КМпО4 + 3H2SO4 ф ЮНО -КФО. + 2MnSO4 ф 8НгО + 5С12;
2КМпО4 + 31 hSO4 + 1OHJ -> K2SO4 ф 2MnSO4 ф 8Н2О ф 5J»;
2КМпО4 ф 3H2SO4 ф 5H2S -+ K2SO4 ф 2'MnSOi ф 8Н2О ф 5S;
8КМпО4 ф 12H2SO4 ф 5РНз -+ 4KsSO4 ф SMnSCh ф 12НЮ ф ЗНФ’Сф
2КМпОд ф 6SO» ф2Н»О -> 2KHSO4 ф 2MnSOi ф Н&Оо.
В последнем уравнении соотношение между сульфатом и дитионовой
кислотой меняется с температурой и концентрацией раствора '.
2КМпС>4 ф 5(СООН)2 ф SHeSQj K»SO4 ф гМгФСФ ф 8НаО ф ЮСО»;
2КМпО4 ф 5НгОг ф 41-kSOt -> 2KHSO1 ф 2MnSOi ф 8Н2О ф 50»;
1 На холоду образуется больше дитионовой кислоты, при нагревании
больше серной кислоты. Если концентрация серной кислоты в реакционной
смеси доходит до 20% по объему, то вся дитионовая кислота окисляется
в серную кислоту. Ред.
254
SKMnCh + бКгСгОв + I4H2SO4 -» 12KHS01 + 2MnS0«ф(8НгО + ЮСОг + 50г Ф
Надсерная кислота, аналогичная надугольной кислоте, не обесцвечи-
вает раствора марганцовой кислоты.
Интересна реакция, протекающая в почти нейтральном растворе,
между перманганатом и ионом двухвалентного марганца. Главным продук-
том является двуокись марганца МпОг. которая выпадает с некоторым
количеством двухвалентного марганца в виде соли марганцоватистой кис-
лоты (если не прибавить избытка каких-либо других ионов, образующих
нерастворимые манганиты, например цинк- или кальций-ионов):
2КМпО1 + 3MnS0< + 2HzO -> 2KHS0« 4- 5MnCh + H2SO4.
Окисление в щелочном растворе
Многие органические вещества окисляются перманганатами в щелоч-
ной среде с выделением двуокиси марганца. Так, муравьиная кислота окис-
ляется в угольную, этиловый спирт — в альдегид и уксусную кислоту,
целлюлоза (бумага) — главным образом в щавелевую кислоту и т. д.; по-
этому-то марганцовокислый калий нельзя фильтровать через бумагу. При
кипячении концентрированного раствора марганцовокислого калия с кон-
центрированным раствором едкого кали выделяется кислород и образуется
марганцовистокислая соль; жидкость поэтому окрашивается в зеленый
цвет:
4КМпО4 4- 4К0Н -+ 4К2МпО4 4- 2НгО 4- Ог.
При нагревании твердой марганцовокалиевой соли до 240'' происходит ее
распад с образованием марганцовистокислого калия, кислорода и двуокиси
маргавда:
2КМпО4-> КгМпО4 + Ог + МпОг.
Реакции сухим путем
Перл буры или фосфорной соли при слабом насыщении его
соединениями марганца окрашивается в окислительном пламени
в аметистовый цвет, при сильном насыщении — почти в бурый
цвет и в этом случае может быть принят за перл никеля. На-
гретый в восстановительном пламени перл марганца обесцвечи-
вается, а никеля—становится серым.
При сплавлении какого-либо соединения марганца с едкими
или углекислыми щелочами на воздухе (на платиновой пла-
стинке) или, что еще лучше, в присутствии кислородотдающих
, веществ (азотнокислый, хлорноватокислый калий и т. п.) обра-
зуется зеленый плав, обусловленный окислением марганца
в марганцовистокислую щелочь, как это видно из следующих
уравнений:
МпО -ф ИааСОз -ф Оз -> СОз -ф NaaMnOj;
MnSOi -ф 2№гСОз -ф Оз 2СОз -ф NasSOi -ф ЫагМпОт;
2МпОг -ф 2№зСОз -ф Оз -» 2СОз -ф 2Na2MnO4;
1 КоС206—калиевая соль надугольной кислоты (перкарбонат) имеет
строение:
О, -О
рС — О — О-Сф
ко7 хок
показывающее е>е. генетическую связь с перекисью водорода (ср. два по-
следних ура®нения). РеД.
255
2Mn2O3 + 4Na2CO3 + 30а -» 4СО2 + 4Na2MnO4;
2МпзО4 + 6Na2CO3 + 5O2 —> 6СО2 + 6Na2MnO4.
Кислород в данном случае -получается или из воздуха или из
азотнокислой или хлорноватокислой соли:
2KNO3 ->2K'NO2 + О2;
2КС1Оз-»2Ка + ЗОг.
Эта реакция в высшей степени чувствительна: уже доли мил-
лиграмма какого-либо марганцового соединения легко дают
сплав зеленого цвета.
Все окислы марганца при прокаливании на воздухе перехо-
дят в МпзСЧ:
6МпО + Ог ->> 2Мп3О4;
ЗМпО2 -> Мп»04 + О2;
6Мп2Оз~>4МпзО4 О2.
Никель Ni. Ат. в. 58,69. Ат. н. 28
Плотность 8,9. Т. пл. 1452°. Т. кип. 2900°
Нахождение в природе. В самородном состоянии встречается только
в метеоритах. Чаще всего никель находится в соединении с серой, мышья-
ком и сурьмой в минералах, кристаллизующихся в правильной и гексаго-
нальной системах. Важнейшим из этих минералов являются:
А. Правильной системы:
NiAs2
хлорантит,
или белый никелевый
колчедан
NiAsS
герсдорфит,
или иикелевомышья*
ковый колчедан
NiSbS
ульманит,
или сурьмяно-
никелевый блеск
В. Гексагональной системы:
N12AS2
ннколит,
или мышьяковистый
никель
NUSb2
брейтгауптит,
или сурмяиистый
никель
Ni2S2
миллерит,
или волосистый
колчедан
Далее никель встречается в 1виде правильно кристаллизующейся окиси,
бунзенита NiO, изоморфного с периклазом MgO и манганозитом МпО;
в виде гарниерита, или нумеита, HXNiMg)3iO4 + aq и, наконец, в виде
аннабергита (никелевые цвета) Ni^AsOi), • 8Н2О, изоморфного с эритритом.
Металлический никель обладает серебристобелым цветом! и прекрасно
полируется. Он тверже чистого железа, ковок и тягуч, обладает магнит-
ными свойствами, но теряет их выше 345°. Так как он не окисляется при
обыкновенной температуре в сухом или влажном* воздухе, то никелировка
металлов имеет широкое применение.
Никель дает ряд важных сплавов: никелевую сталь, содержащую 5 И
более процентов никеля; хромоникелевую сталь, содержащую 1% хрома И
3% никеля; «иивар»—сплав,содержащий 36% никеля и имеющий очень ма-
лый коэфициент расширения; монель-металл, содержащий 2 ч. никеля и
1 ч. меди с небольшим количеством железа и марганца; нихром,
содержащий 11—25% хрома, до 25% железа и остальное никель; нейзиль-
бер, содержащий 50—65% меди, 10—30% никеля и цинка.
256
Тонко раздробленный никель способен поглощать водород в объеме,
превышающем его собственный объем в 17 раз; на этом основано приме-
нение его ,в ряде процессов гидрогенизации.
Никель трудно растворим в соляной и серной кислотах \ во легко
растворим в разбавленной азотной кислоте. Он становится пассивным при
действии на него концентрированной азотной кислоты.
Окиси и гидроокиси. Зеленый или серовато-зеленый окисел никеля N1O
(закись никеля) получается при прокаливании карбоната, нитрата или гид-
роокиси никеля. Светлозеленая гидрозакшсь Ni(OH)2 образуется при при-
бавлении к раствору соли никеля едкой щелочи. Железо, никель и ко-
бальт—-элементы, тесно связанные по своим свойствам, находятся ® одной
группе периодической системы элементов под порядковыми номерами 26,
27 .и 28. Можно было бы ожидать, что никель подобно железу образует
окислы NhOs и NisOi. Существование таких окислов некоторые авторы
брали под сомнение, предполагая, что при действии на раствор соли ни-
келя едкого кали и галоида образуется гидрат двуокиси никеля NiOs • Н»О
вместо №(О’Н)з. Мы будем считать, что- в данной реакции имеет место об-
разование буровато-черной окиси МгОз1 2.
При растворении того или другого окисла никеля в кислоте получаются
всегда соли двухвалентного никеля:
NiO+ 2HCI-> Н2О + NiCk;
NfeOj + 6HCI -> ЗНзО + 2NiCI2 + Ch;
2\ЧгОз + 4H2SO4 -> 4НЮ + NiSCh + O2.
Закись никеля NiO ведет себя как основной ангидрид, -окись же ни-
келя №гОз никогда не образует солей трехвалентного никеля.
Соли никеля в кристаллическом состоянии и их водные растворы зеле-
ного цвета, в безводном состоянии они обычно желтого цвета. Большая
часть солей растворима в воде; сульфид, карбонат и фосфат не раство-
римы.
Реакции мокрым путем
1. Едкие щелочи осаждают гидрат закиси никеля яблочнозе-
леного цвета:
Ni’ ’ + 2ОН' -> Ni(Ofi)2
не растворимый в избытке осадителя и легко растворимый
в кислотах.
Кипячение раствора с добавкой перекиси водорода или иода не при-
водит к окислению гидрата закиси никеля; превращение последнего в чер-
ную гидроокись достигается при действии бромной вады, гипохлорита
натрия, феррицианида калия или персульфата.
Присутствие нелетучих органических кислот и сахара препятствует
осаждению гидроокисей двухвалентного и трехвалентного никеля.
Гидрат закиби никеля растворяется в растворе карбоната аммонияс об-
разованием зеленовато-синей жидкости, а также в цианистом калии, обра-
зуя циано-никель(2)ат калия. Он также медленно растворяется в смеси
аммиака и хлористо-по аммония, образуя комплексные аммиачные ионы
двухвалентного никеля.
1По Сальковскому (Е. Salkowski) никель растворяется в разба-
вленной серной кислоте (1 : 5) + Н2О2 [Chem.-Ztg., 40, 448 (1916), а также
Z. anal. Chem. 56, 54 (1917)]. Ред.
2 При попытке получения МйОз получалась смесь Ni(OH)2 + NiCh
•хНаО, причем №Оз можно было обнаружить лишь в небольшом коли-
честве как промежуточный продукт окислеаия. • См. Pascal, т. X. Ред.
17 З&к. 982-. Тредвелл-Голл, т. I,
257
2. Аммиак осаждает (из нейтральных растворов, не содержа-
щих аммонийных солей) зеленую основную соль:
2NiSOi Ч- 2NH<OH -> (NHO2SO4,'+ N1s(SO4)(0H)2,
растворимую (с синей окраской) в избытке аммиака с образо-
ванием комплексных аммиачно-никелевых ионов:
Ni2SO4(OH)2 + 12NHs-> 2[Ni(NH3)e]' ‘ + 2ОН' + SOA
В присутствии достаточного количества аммонийной соли
аммиак не дает (так же, как с солями магния, закиси железа и
марганца) никакого осадка; напротив, едкое кали и едкий натр
дают зеленый N.i(OH)2 (отличие от кобальта, стр. 266).
Безводные хлорид и сульфат никеля легко поглощают ам-
миак с образованием безводных комплексных цммиачно-никелг-
вых солей:
NiCh + 6NH3 [Ni(NH3)e] CI2;
N1SO4 + 6NH3-> [Ni(NH3)e]SO4.
Комплексные аммиачно-никелевые катионы весьма устой-
чивы в присутствии избытка аммиака. В чистой воде они нахо-
дятся в равновесии с небольшими количествами ионов никеля,
растворенного газообразного аммиака и гидрата окиси аммония:
[Ni(NH5)e] ’ ‘ ?=* Ni' ’ + 6NH3; NH3 + Н2О NH«OH.
3. Углекислые щелочи осаждают яблочнозеленый карбонат
никеля:
Nf'4-COg" -> NiCOg.
4. Углекислый аммоний относится к солям никеля точно
так же, только образующийся осадок растворим в избытке оса-
дителя, причем образуется карбонат аммиачно-никелевого ком-
плекса.
5. Карбонат бария не дает осадка на холоду, но при про-
должительном кипячении весь никель осаждается в виде основ-
ного карбоната.
6. Сернистый водород не осаждает никеля из растворов,
содержащих минеральные кислоты или много уксусной кислоты,
но из раствора, слабо подкисленного последней и содержащего
уксуснокислую щелочь, весь никель осаждается в виде чёрного
сернистого никеля:
Ni: + 2СН'зСОО' + H2S ->2СНзСООН + NiS.
Сернистый никель, полученный из слабого' уксуснокислого
раствора, представляет собой хлопьевидный хорошо фильтрую-
щийся осадок.
7. Сернистый аммоний также осаждает из нейтрального рас-
твора черный сульфид никеля:
NiCl2 + (NH«)2S — 2NH4C1 + NiS.
258
Сернистый никель обнаруживает большую склонность к об-
разованию (коллоидных растворов, обладающих, особенно в при-
сутствии аммиака или большого избытка сернистого аммония,
интенсивно бурой окраской. Путем слабого подкисления бурого
раствора уксусной кислотой и кипячения гидрозоль сверты-
вается, после чего его можно отфильтровать. Свертыванию ги-
дрозоля способствует также присутствие аммонийных солей.
Для выделения никеля в виде сульфида из его аммиачного раствора
последний очень слабо подкисляют и, если аммиака было мало, к нему
прибавляют еще немного хлористого аммония, нагревают до кипения и
при постоянном помешивании приливают по каплям бесцветный сернистый
аммоний до прекращения выделения осадка, после чего прибавляют еще
0,5—1 лл сернистого аммония. Полученный таким путем сернистый никель
легко отфильтровывается, и в фильтрате совсем не содержится никеля. Не-
обходимо следить за тем, чтобы- фильтр все время был наполнен жид-
костью во избежание окисления, что весьма легко происходит на воздухе.
В качестве промывной жидкости применяют горячий 51—10%-ньгй раствор
аммонийной сюли, прибавив к нему немного бесцветного сернистого аммо-
ния. Можно также вести промывание сероводородной водой, не боясь об-
разования гидрозоля.
Сернистый никель весьма трудно растворим в разбавленных минераль-
ных кислотах1; напротив, он легко растворим в концентрированной азот-
ной кислоте и в царской'водке2 с выделением серы:
3NiS + 6НС1.+ 2HNOs -+ 3NiCk> + 2NO + 4 НЮ + 3S.
Сера при этом выделяется большею частью в виде черной пленки. Это
происходит оттого, что сера вследствие теплоты’ реакции плавится, обво-
лакивая небольшие количества черного сернистого' никеля и тем1 самым
предохраняя последний от действия кислоты;. При продолжительном дей-
ствии царской водки весь сернистый никель растворяется и сера остается
в виде желтых капелек, постепенно окисляющихся в серную кислоту н
переходящих в раствор:
S + 2HNOs -+ H2SO4 + 2NO.
Сульфиды никеля и кобальта хотя и нс осаждаются сернистым водо-
родом из разбавленного солянокислого раствора, но с трудом растворяются
в значительно более концентрированных кислотах. Это, вероятно, объяс-
няется тем обстоятельством, что указанные сульфиды существуют в двух
аллотропных формах различной растворимости. Свеже осажденный, суль-
фид легко растворяется в кислоте, но при стоянии он превращается в значи-
тельно менее растворимую аллотропную модификацию. Большинство схем
качественного анализа основано на отношении этих сульфидов к кисло-
там. Так, никель и кобальт отделяют от цинка и марганца путем’ обра-
ботки осадка, образованного сернистым аммонием, холодной разбавленной
соляной кислотой. В таких случаях немного никеля и кобальта всегда пе-
реходит в, раствор, причем в количествах значительно больших, чем это
обыкновенно предполагается. Если поверхность сульфида, никеля, под-
вергающаяся действию кислоты, значительна, или если сульфид находится
в тонко диспергированном состоянии {что может произойти при растворе-
нии сульфидов других металлов), в раствор могут перейти значительные
количества никеля в относительно короткий отрезок времени. Обратная
1 Относительно растворимости различных модификаций сульфида ни-
келя см. Thiel u. Gessner, Z. anorg. Chem. 86, 1 (1914)-
2 Мною было найдено, что как сернистый никель, так и сернистый
кобальт растворяются в разбавленных кислотах и даже в уксусной кис-
лоте в присутствии перекиси водорода. См. A. S. Komarovsky, Z. anal.
Chem. 72, 293 (1927). Ред.
. 17*
259
реакция — осаждение сульфида никеля сернистым водородом из весьма
слабокислого раствора — также постоянно имеет место, хотя скорость ее
очень незначительна *.
8. Реакция Вилье — весьма чувствительная реакция, основан-
ная на образовании бурого коллоидного раствора сульфида ни-
келя. К раствору соли никеля добавляют винную кислоту и не-
большой избыток едкого натра, после чего раствор насыщают
сероводородом; часть никеля при этом всегда остается в рас-
творе, окрашивая последний в бурый цвет. При такой обработке
раствора ионы кобальта осаждаются в виде сульфида кобальта
за исключением тех случаев, когда кобальт находится в виде
следов, которые могут также дать бурую окраску; едкий натр,
однако, вызывает полное осаждение сульфида кобальта.
9. Тиоацетат аммония осаждает сульфид /никеля из аммиачного раствора.
Тиосульфат натрия не оказывает никакого действия на кислый раствор, но
медленно выделяет сульфид никеля из нейтрального или щелочногс
раствора.
10. Молибдат аммония выделяет при нагревании до 70° из
нейтральных или слегка кислых растворов солей никеля зелено-
ватобелый осадок.
11. Дициандиамидинсульфат HN = C—NH—С—О, применяемый
nh2 nh2
в виде 10%-ного водного раствора, образует желтый кристалли-
ческий осадок дициандиамидина никеля (С2Н5^О)2Мь2Н2.О2.
Вначале реакция протекает несколько слабо, но она чувстви-
тельна и характерна. Если раствор никеля содержит аммиак и
хлористый аммоний, то после прибавления реактива и едкого
натра синий цвет раствора сразу переходит в желтый и посте-
пенно выделяется осадок.
12. Диметилглиоксим СН3— С —NOH (реакция Чугаева).
I
СН3 — C — NOH
Если к раствору соли никеля прибавить аммиак до слабощелоч-
ной реакции, затем немного раствора диметилглиоксима и про-
кипятить, то образуется кристаллический осадок никелевой соли
диметилглиоксима красного цвета:
‘Noyes, 'Bray a. Spear, J. Am. Chem. Soc. (1908).
2 По Grossmann u. S c h ii с k, предложившим эту реакцию [см. В
39, 3356 (1906) и Chem.-Ztg. 31, 535, 911 (1907)], образуется внутрикомплекс
ная соль никеля:
;.........N1..........
HN = С — N = С — OZXb — С = N — С = NH
II II
H2N H-.N NH., NH,
260
2
CH3— C = NOH
CHg — C = NOH
+ Ni“4- 2NH3 -+ 2NH/ +
0 °H
CH3—C = N N = c — CH,
CH., — C = N/Z \N = c __ CH
1 'I
OH A
Если количество никеля очень мало, то вначале образуется
желтоватый раствор, из которого при охлаждении выделяются
красные иглы. Этой реакцией можно открыть 0,16 у никеля;
предельная концентрация: 1:300 000. Реакцию возможно прово-
дить в присутствии десятикратного количества кобальта-
Для открытия следов никеля в солях кобальта рекомендуется следую-’
щий ход анализа.
К раствору соли кобальта прибавляют концентрированный аммиак до
получения прозрачного раствора, затем приливают несколько мл перекиси
водорода и кипятят несколько минут для разрушения избытка последнего.
После этого прибавляют диметилглиоксим и снова нагревают до кипения.
В присутствии очень малого количества никеля образуется красная пена,
и стенки пробирки покрываются пленкой розово-красных кристаллов. При
еще меньших количествах никеля лучше всего наблюдать окраску на
фильтре, через который был профильтрован раствор и который был про-
мыт горячей водой.
Реакция Чугаева — лучшая, какую только мы имеем, для открытия
никеля в присутствии кобальта.
* Примечание редактора. Вышеприведенный метод открытия следов
никеля в кобальтовых солях не совсем безупречен. Дело в том, что
образующийся в аммиачной среде трехвалентный кобальт также реаги-i
рует с диметилглиоксимом, образуя растворимые комплексные соединения,
бурый цвет которых может помешать распознаванию малых количеств
никеля. Кроме того, диметилглиоксим никеля заметно растворяется в рас-
творе образующегося комплексного соединения кобальта. Поэтому заслуг
живает внимания метод, опубликованный Файглем и Капулитцасом (Fr.
Feigl и Kapulitza's) *. Он состоит в следующем. К исследуемому раствору,
прибавляют цианистый калий и перекись водорода, чтобы перевести Ni и
Со в соответственные комплексные цианиды Ka[Ni(CN)4] и Кз[Со(СМ)в].
Затем, прибавив формальдегид, проводят реакцию с диметилглиоксимом.
Формальдегид не изменяет [Co(CN)e]-комплекса, и поэтому последний
с диметилглиоксимом не реагирует, между тем как комплексный цианид
никеля разлагается с образованием калиевого соединения нитрила гликоле-.
вой кислоты и цианистого никеля:
/ОК
К2 [Ni (CN)d + 2СН»О —> 2СНг< 4~Ni(CN),
XCN
формальдегид К-соль нитрила
гликолевой кислоты
Образующийся цианид никеля тотчас реагирует с диметилглиоксимом *
А. К.
Фортини (Vortini) - рекомендует следующий метод открытия никеля в
сплавах.
1 F. Feigl u. J. Kapulitzas, Mikrochemie Emich-Festschr. 1930,
128; Z. anal. Chem. 82. 417 (1930).
2 V. Vortini, Chem.-Ztg. 36, 1461 (1912),
261
Нагревают металл, .предварительно очищенный от г.рязи и жирных ве-
ществ. в окислительном пламени паяльной трубки. Охлаждают и смачи-
вают каплей раствора 0,5 г диметилглиоксима. в 5 мл спирта и 5 мл кон-
центрированного аммиака. В присутствии никеля сразу появляется красное
пятно. При наличии меди окраска никеля появляется раньше окраски,
обуславливаемой аммиачным раствором меди.
Испытание на никель может быть проведено в присутствии окисного
железа, если предварительно прибавить достаточное количество винной
кислоты, препятствующей осаждению гидроокиси железа аммиаком. Реак-
ции мешает соль двухвалентного железа; она дает с реактивом раствори-
мую весьма интенсивно окрашенную красную соль
13. Рубеановодородная кислота (см. стр. 157) образует с ни-
келем в аммиачных растворах синевато-фиолетовую внутри-
комплексную со ть которой приписывают следующее строение:
HN = с — с = \11
i । I i
i s s \
Выполнение. На фильтровальную бумагу помешают каплю исследуе-
мого раствора, бумагу держат над открытой склянкой с концентрирован-
ным аммиаком, после чего прибавляют каплю 1%-ного спиртового рас-
твора рубеаеюводородпой кислоты. В присутствии никеля появляется сине-
фиолетовое пятно или фиолетовое кольцо.
Приведенный способ позволяет открывать 0.012 у никеля в 0.015 мл
раствора. •
Как указано на стр. 157, открываемый минимум меди .в реак-
ции с рубеановодородной кислотой составляет 0,006 y (соответ-
ствующие предельные концентрации меди и никеля — 1 : 2500000
и 1 : 1250000). Несмотря на это, все же возможно приведенной
реакцией однозначно открыть никель в присутствии меди. Эта
возможность основывается на различной скорости передвижения
ионов в порах фильтровальной бумаги. Если иЪны меди и
никеля перевести в соответствующие аммиачные комплексы
[Си(МНз)д‘‘ и Ni(NHs)«'’], то наибольшей скоростью передви-
жения будет обладать комплексный аммиачно-никелевый ион.
При помещении капли раствора, содержащего оба1 2 комплексных
иона, на фильтровальную бумагу, в центре пятна будет наблю-
даться повышение концентрации ионов меди, на периферии
.пятна—повышение, концентрации ионов никеля. Нанося на край
пятна каплю спиртового раствора рубеановодородной кислоты,
наблюдают образование синего кольца рубеаната никеля вокруг
бурого кружка соответствующего соединения меди.
Аналогичный прием позволяет открывать никель в присут-
ствии солей кобальта.
14. а-Нитрозоф-нафтол CioH6(NO)OH (см. стр. 271), дает
бурый осадок состава L^ioHsO(NO)]2Ni. Осадок растворяется
в соляной кислоте.
1 Эта соль по cboimj строению аналогична никелевой соли диметил-
глиоксима. РеД.
2 R. М. R я v и. Рг. R j у, ,1. .'Же. Chem. Ind. 3, Us (192i>); '/-• anal.
Chem. 79, y5 Ред.
262
15. Хромовокислый калий только медленно реагирует на
холоду с нейтральным раствором никелевой соли; при темпера-
туре кипения образуется шоколадно-бурый основной хромат
NiCrC)4.NiO, который легко растворяется в кислотах или в ам-
миаке.
16. Цианистый калий образует светлозеленый осадок циа-
нистого никеля, легко растворимого в избытке осадителя с об-
разованием никельсинеродистого калия:
Ni’ ' Д- 2CN'-* Ni(CN)2;
Ni(CN)» 4- 2CN' -Ч Ni(CN)4".
Анион [Ni(CN)4]" является устойчивым комплексом, но при
прибавлении к нему кислоты он разлагается. Это происходит
вследствие того, что Н»| Ni(CN)4| весьма слабая кислота и по-
добно угольной кислоте неустойчива;
[Ni(CN)4]" 4- 2Н’ H2[Ni(CN)4];
Н2| Ni(CN)4] 2HCN + Ni(CN)2.
В щелочном • растворе, содержащем избыток цианида,
[Ni(CN)4] "-анион не диссоциирует в достаточной степени на
простые Ni’ ’-катионы, чтобы давать осадок с сернистым аммо-
нием (отличие от марганца и цинка), но он легко разлагается
такими окислителями, как хлор, бром, гипохлорит или гипо-
бромит:
2[Ni(CN)4]" + 4ОН' + 9BrO' + 2Ni(OH)3 + 8CNO' + 9Bf
или
2[Ni(CN)4]" + 6ОН' + 9С12 -» 2Ni(OH)3'-}- 8CNC1 + 10С1\
В приведенных реакциях прежде всего происходит окисление присут-
ствующего избытка цианида щелочного металла до циановокислой соли
или хлористого циана CNC1. При отсутствии избытка щщн-ионоъ [Ni(CN)4]"-
начинает диссоциировать:
FNi(CN)4]"-> Ni’ ’ + 4CN'
и по мере образования иоиов CN' происходит их окисление.
Бели ионы кобальта подвергнуть действию избытка циан-ионов, то
образуется ц:иано-кобальти(2)-ат-аниои [Co(CN)e]'"', который легко оки-
сляется даже кислородом воздуха в циано-кобаяьти(3)ат-иои [Co(CN)e]'".
Эти анионы настолько устойчивы, что они не разлагаются окислителями
в щелочном растворе, так что кобальт не осаждается вместе с Ni(OH)s при
вышеуказанной обработке окислителями. Благодаря этому возможно от-
крытие 0,2 .иг никеля в присутствии 300 яг кобальта.
Испытание на никель может быть произведено в растворе, получаю-
щемся при растворении сульфидов в царской водке, следующим образом.
Выпаривают раствор почти досуха, чтобы удалить большую часть кислоты,
прибавляют около 5 лл воды и затем по каплям раствор едкого шатра до
нейтральной реакции или до появления иеисчезаюшего осадка. Прибавляют
раствор цианистого калия по нескольку капель сразу, до тех пор пока
весь или почти весь осажденный цианид снова не растворится, после чего
добавляют еще 0,5—3 ял раствора цианистого калия в зависимости от
возможного количества имеющегося в растворе никеля и кобальта. Нагре-
вают в открытой чашке до 50—60° несколько минут или дольше, если
раствор не посветлел. При этом проистсодит окисление циано-кобальти(2)-
263
ата-иона в циано-кобальти(3)ат. Фильтруют, к фильтрату прибавляют
около 3 мл 2N раствора едкого натра и пропускают в раствор хлор на
холоду или прибавляют немного бромной воды. В течение 5 мин. должен
появиться осадок №(ОН)з.
17. Феррицианид калия осаждает желтовато-бурый ферри-
цианид никеля №з[Ре(СМ)б]г. Осадок трудно растворим в соля-
ной кислоте. В присутствии винной кислоты и большого избытка
аммиака феррицианид калия образует прозрачный, буровато-
желтый раствор.
18. Ферроцианид калия осаждает зеленоватый ферроцианид
никеля N12[Fe(CN)e], растворимость которого в разбавленной
соляной кислоте незначительна.
19. Азотистокислый калий не выделяет осадка из разбавлен-
ных растворов никеля (отличие от кобальта). Из очень концен-
трированного раствора выпадает буровато-красный осадок
Ni(NO2)2.-4KNO2; в присутствии щелочноземельных солей обра-
зуется желтый кристаллический осадок, например Ni(NO2)z-
• Ba(NO2)2 • 2KNO2, трудно растворимый в холодной и легко
растворимый в кипящей воде; раствор окрашивается в зеленый
цвет.
20. Тиокарбонат калия 1 K2CS3 окрашивает раствор никелевой
соли в концентрированном аммиаке в темнобурый цвет. Если
раствор разбавлен, получается красновато-желтая окраска.
Это — чувствительная реакция на никель, которой не мешают
ионы кобальта, но мешают ионы марганца и цинка.
21. Гипохлорит натрия осаждает в присутствии едких ще-
лочей весь никель в виде буровато-черной гидрооксии никеля
Ni(OH)3. Сперва под действием едкой щелочи образуется
гидрат закиси никеля, который затем окисляется гипохлоритом
в гидроокись никеля:
2Ni'' + 4ОН' + СЮ' + Н2О -+ 2Ni(OH)3 -ф СГ.
Гидроокись никеля образуется точно так же, если к раствору
соли никеля в присутствии едкой щелочи прибавить хлор или
бром:
2Ni(OH)3 -ф 2ОН' + CI2 -> 2Ni(OH)3 -ф 2СГ.
22. Фосфорнокислый натрий осаждает яблочнозеленый фос-
фат никеля:
3Ni ’ ’ -ф 4НРОГ 2Н2РО4' -ф Ni3(PO4)2,
легко растворимый в кислотах (даже в уксусной кислоте).
Реакции сухим путем
Перлы буры и фосфорной соли окрашиваются солями ни-
келя в окислительном пламени в бурый цвет, почти такого же
оттенка, как и перл, сильно насыщенный марганцем; в восстано-
1 Соль тритиоугольной кислоты (HShCS.
264
вительном пламени перл становится серым вследствие образо-
вания небольшого количества металлического никеля. При рас-
сматривании перла под микроскопом можно заметить мелко
раздробленный металл, суспендированный в бесцветном стекле.
При прокаливании никелевых солей с карбонатом натрия на
древесном угле 'получается серая чешуйка металлического ни-
келя. Реакцию лучше всего выполнять на обугленной (содовой)
палочке по способу, приведенному на стр. 89. Получающийся
таким; путем металл помещают на кусочек фильтровальной
бумаги, растворяют в азотной кислоте, прибавляют каплю
концентрированной соляной кислоты и осторожно высу-
шивают бумагу, передвигая ее над пламенем. В присутствии
никеля бумага окрашивается в зеленоватый цвет (при очень
малом количестве никеля бумага бесцветна) или в си-
неватый при наличии также и кобальта. Если теперь пятно смо-
чить едким натром или кали и подвергнуть его действию паров
брома (выделяемых из широкогорлой склянки при взбалтыва-
нии в ней небольшого количества, бромной воды), то в присут-
ствии никеля или кобальта образуется черное пятно, обусловлен-
ное образованием гидроокиси трехвалентного металла (стр. 264).
Часто почернение вначале не происходит; в этом случае бумагу
смачивают еще раз едким кали и снова обрабатывают бромом.
На этот раз пятно, если никель присутствует, окрасится в чер-
ный цвет.
Кобальт Со. Ат. в. 58,94. Ат. н. 27
Плотность 8,8. Т. п.П. 1480°, Т. кип. 2900°
Нахождение в природе. Подобно никелю самородный кобальт найден
только среди метеоритов. В земной коре он встречается, главным образом,
в виде сульфида, арсенида и в виде солей тиомы'шьяковистой и тиосурь-
мянистой кислот. Почти всегда его спутниками являются никель и железо.
Наиболее важными рудами являются шпейсовый кобальт CioAss, кобальтит
CaAsS, скуттередит СоАзз—'Все правильной системы; эритрит Cos(AsOi)2 •
• SH2O моноклинической системы, изоморфный с вивианитом Fe8(PCh)2 • 8Н2О
и анабергитом Ni3<AsOs)2 • 8Н2О.
Свойства. Металлический кобальт, серовато-стального цвета, по внеш-
нему виду сходен с железом, но тверже его и никеля. В тонко раздроб-
ленном состоянии он легко окисляется во влажном воздухе. При темпе-
ратуре белого каления он сгорает в СозСЦ. Магнитные свойства, кото-
рыми он обладает, теряются при температуре выше 115°. Из сплавов
кобальта назовем стеллит, сталь, содержащую кобальт и хром, отличаю-
щуюся весьма большой твердостью и противокоррозийными свойствами;
карбалой, сплав карбида, вольфрама с кобальтом, также отличается своей
очень большой твердостью; магнитную сталь, содержащую 35% кобальта.
Окись кобальта служит для окраски стекла и эмали в синий цвет.
Металл медленно растворяется в горячей разбавленной соляной или
серной кислотах и более быстро в горячей разбавленной азотной кислоте.
Кобальт образует три окисла. Закись кобальта СоО серого или зеле-
новатого цвета, получается при осторожном прокаливании гидрозакиси
или карбоната или при прокаливании других окислов кобальта в токе
водорода.
Окись кобальта С02О3 черного цвета, может быть получена при нагре-
вании нитрата двухвалентного кобальта приблизительно при 180°‘.
265
Черная закись-юкись кобальта CosOi, наиболее стойкая из окислов
кобальта, может быть получена при прокаливании до красного каления
окисей, гидроокисей, карбоната или оксалата кобальта.
При растворении этих трех окислов в кислотах всегда получаются
соли, производные закиси кобальта, содержащие двухвалентный кобальт:
Со() + 2НС1—> НЮ + C0CI2;
СогОз + 6НС1 -+ ЗН,>О + 2СоС)е + cis;
С0Ю4 + 8НС1 -+ 4НЮ + ЗСоСЬ + Ск.
Простые co.'ih трехиалентного кобальта неизвестны, но существуют
гидроокись и многие комплексные соли с трехвалентным кобальтом, на-
пример -нитри-кобальтнМат калии, циано-кобальти(3)ат калия, рксалато-
кобальти(3)ат калия и многочисленные аммиачно-кобальтовые соединения.
Соединения закиси кобальта как в .кристаллическом состоянии, так и
в водном растворе розового цвета; н безводном состоянии синего, желтого
или зеленого цвета; ,в водном растворе в присутствии концентрированной
соляной ккепогы соединения закиси кобальта окрашены в синий цвет.
Условия р;'-сгвбримосгн соединений закиси кобальта Те же. что и солей
марганца и никеля.
Реакции мокрым путем
1. Едкие щелочи осаждают на холоду синюю основную соль:
Си • С СГ 4- ОН' ->Со(ОН)С1,
которая при нагревании подвергается дальнейшему взаимодей-
ствию с гидроксил-ионами, причем образуется розово-красный
гидрат закиси кобальта:
Со(ОН)С1 + ОН' СГ + Со(0Н)2.
Иногда при применении умеренно концентрированного раствора едкой
щелочи на холоду образуется розово-красный гидрат закиси, иногда же
только по истечении некоторого времени. Скорость реакции всецело зави-
сит от копией грации едкой щелочи.
Гидрат закиси кобальта на воздухе постепенно буреет, переходя
в гидрат окиси;
4Со(()Н), + 211’0 0; -> 4Со(ОН)з.
В этом отношении кобальт сходен с железом и марганцом и отли-
чается от никеля, так как гидрат закиси последнего при действии кисло-
рода воздуха не дает высшей степени окисления,
О г (прибавления к щелочному раствору кобальтовой соли хлора,
бррма, хлорноватисто-кислой соли, перекиси водорода и т. п. образуется
тотчас (как с солями никеля1 и марганца) гидрат окиси кобальта:
2Co(OH)s + 20Н' + С12 -> 2СГ + 2СоГОН)»;
2Co(OH)s + НОН + ОСГ -> С1' 4- 2Co(OH)s.
Из аммиачных растворов кобальта вышеприведенные окислители не
выделяют никакого осадка, но вызывают лишь красное окрашивание; при-
бавление едкого кали не вызывает в этом случае образования рсадка
(отличие от никеля).
Присутствие нелетучих органических кислот или углеводов препят-
ствует осаждению гидратов закиси и окиси кобальта..
Со(ОН)а при известных условиях ведет себя как слабая кислота. При
прибавлении к раствору кобальта очень концентрированного раствора КОН
1 Гидрат закиси никеля образует черный гидрат окиси никеля с хло-
ром, бромом, гипохлоритами, по не с перекисью водорода. РеД.
266
или NaOH образующийся вначале осадок растворяется с синим окраши-
ваиием, т. е. происходит совершенно то же самое, что и с медью. Приба-
вление к синему кобальтовому раствору сегнетовой ооли вызывает или
почти полное исчезновение синего юкрашиваиия, или появлеиие слабо-
розового окрашивания, в то время как раствор медной соли, обработанный
точио таким же. образом, окрашивается в более интенсивный синий цвет.
Цианистый калий окрашивает синий кобальтовый раствор в желтый цвет,
переходящий от соприкосновения с воздухом в интенсивно бурый;
раствор же медной соли обесцвечивается цианистым калием.
При прибавлении к концентрированному раствору едкого кали или
натра, к которому заранее прибавлено немного глицерина, небольшого
количества кобальтового раствора (или твердого углекислого кобальта*)
получают раствор синего цвета, интенсивность которого увеличивается
с нагреванием, причем не образуется осадка. Этот синий раствор, погло-
щая на воздухе кислород, окрашивается постепенно, а от перекиси водо-
рода тотчас— гв зеленый цвет.
2. Аммиак осаждает из нейтрального раствора кобальтовой
соли в отсутствие аммонийных солей -синюю основную соль, рас-
творимую в хлористом аммонии5, Поэтому в присутствии до-
статочного количества хлористого аммония аммиак в растворе
кобальтовой соли не образует осадка. Грязноже.ттый аммиачный
раствор кобальта -на воздухе постепенно краснеет, так как обра-
зуются весьма прочные комплексные аммиачные соединения
трехвалентного кобальта.
Едкие кали и натр из этого раствора осадка не выделяют
(отличие от никеля).
3. Углекислые щелочи образуют красноватый осадок основ-
ной соли меняющегося состава.
4. Углекислый аммоний осаждает красноватую основную
соль, растворимую в избытке вго.
5. Углекислый барий без доступа воздуха на холоду не оса-
ждает кобальта, но при доступе воздуха, весь кобальт посте-
пенно выпадает из раствора в виде гидроокиси; это осаждение
происходит быстрее от прибавления гипохлорита или переписи
водорода:
2Со • ’ + 2ВаСО3 4- ЗН2О 4 ОС'Г - 2Ва’ ‘ 4- СТ + 2Со(ОЪ)з 4- 2’СО».
При нагревании раствора до кипения весь кобальт выделяется
в виде основной соли даже в отсутствие воздуха.
6. Сернистый водород -не. дает никакого осадка в растворах:
кобальтовых солей, содержащих минеральные кислоты. Из ней-
тральных же растворов в присутствии ацетата щелочного
металла сероводород выделяет весь кобальт в виде черного
су л ь ф и д а к с б а л ьт а.
7. Сернистый аммоний осаждает черный сернистый кобальт:
Со' ’ + S" CoS,
который менее склонен к образованию коллоидных растворов,
чем сернистый никель.
Он не растворим в сернистом аммонии, уксусной кислоте и
весьма трудно растворим в разбавленной соляной кислоте;
1 Из кис.ч-. и раствора основная со ,ъ ле осаждается аммиаком. Ред.
267
в азотной кислоте и царской водке он растворяется с1 выделе-
нием серы 1:
3CoS + 8HNO3 -> 4НгО + 2NO + 3S + 3Co(NOs)2.
При более продолжительном действии концентрированной
азотной кислоты вся сера переходит в раствор в виде серной
кислоты.
Растворению нерастворимого сульфида в кислоте всегда помогает при-
бавление какого-либо окислителя. Раствор, соприкасающийся с осадком
сульфида, содержит сначала сульфид-ионы в достаточной концентрации,
чтобы достигалось произведение растворимости сульфида. По прибавле-
нии ионов водорода происходит образование неионизированного серни-
стого водорода, если только произведение растворимости не настолько мало,
что сульфид-ионов остается в растворе меньше того количества, которое
могло бы образоваться при ионизации H2S. Если образуется заметное ко-
личество H’S, то последний может быть удален из раствора как газ, и
сульфид растворится. (Впрочем, иногда- процесс этот длится очень медленно,
и тогда добавление окислителя иеобходимо. Сульфид-ионы в растворе
окисляются при этом до свободной серы. Произведение растворимости
сульфида не достигает (необходимой величины, потому что по мере раство-
рения сульфида тотчас происходит окисление сульфид-ионов.
8. Тиоацетат аммония осаждает из аммиачного раствора сульфид ко-
бальта. Тиоацетат натрия в кислом растворе не дает осадка, в нейтраль-
ных же растворах происходит неполное осаждение сульфида кобальта.
9. Цианистый калий осаждает из нейтрального раствора
красно-бурый осадок, растворимый на холоду в избытке оса-
дителя с образованием циано-кобальти(2)ата калия (раствор
бурого цвета):
Со' ’ + 2CN' -+ Co(CN)2; Co(CN)2 -ф 4CN' -> [Co(CN)6]"".
При нагревании на воздуха в течение некоторого времени
окрашенный в бурый цвет раствор постепенно становится яркю-
желтым и содержит, после этого циано-кобальти(3)ат калия,
аналогичный по строению с феррицианидом калия2. Об-
разование соли трехвалентного кобальта идет при участии кис-
лорода воздуха:
4[Co(CN)e]"" + Оа + 2Н>0 -> 4[Co(CN)6]"' + 4ОН'.
Эта реакция протекает более быстро в присутствии хлора, брома,
гипохлорита и т. п.:
2[Co(CN)e]"" + Cl’->2[Cp(CN)e]'" ф 2С1'.
Избыток хлора, брома и т. д. не вызывает разложения соли окиси ко-
бальта (отличие от никеля).
Кобальтицианид калия существенно отличается от кобальтоцианида
калия своим большим постоянством. Соляная кислота, прибавленная
к бурому раствору кобальтоцианида калия, осаждает из последнего жел-
тый цианистый кобальт и выделяет синильную кислоту:
[Co(CN)e]"" + 4Н’ 4HCN ф Co(CN)2,
тогда как кобальтицианид калия не разлагается соляной кислотой.
1 О растворимости сульфида кобальта в соляной кислоте в присутствии
перекиси водорода см. подстрочное примечание на стр. 259.
2 По аналогии с соответственными солями железа K4[Co(CN)e] можно
назвать также кобальтоцианидом, a Ks[Co(CN)e] — кобальтицианидом калия.
Ред.
268
Кобальтицианид калия образует с большинством тяжелых металлов
характерно окрашенные, трудно растворимые или совсем нерастворимые
соли. Так, с кобальтовыми солями получается кобальтицианид кобальта
розовато-красиого цвета:
2[Co(CN)e]"' + ЗСо' ‘ -> Соз[Со(СМ)б)]г,
а с никелевыми солями — зеленоватый кобальтицианид никеля.
Поэтому раствор кобальтовой соли, содержащий еще никель, после
осаждения цианистым калием, растворения осадка в избытке последнего
и кипячения выделяет от прибавления соляной кислоты зеленоватый оса-
док кобальтицианида никеля:
2[Co(CN)e]"' + 3[Ni(CN)i]" + 12Н‘-> 12HCN + Nis [Co(CN)e]2.
Состав осадков несколько вариирует в зависимости от природы и ко-
личества имеющейся щелочной соли
10. Феррицианид калия осаждает буровато-красный ферри-
цианид кобальта Co3[Fe(CN)e]2, /едва растворимый в соляной
кислоте. Если винную кислоту или хлористый аммоний и избы-
том аммиака прибавить к раствору, содержащему простые ионы
кобальта, то раствор остается прозрачным; если же к послед-
нему прибавить феррицианид, то появляется желтовато-красная
окраска. Эта чувствительная реакция рекомендовалась для от-
крытия кобальта в присутствии никеля.
И. Ферроцианид калия осаждает ферроцианид кобальта
Co2[Fe(CN)e], трудно растворимый в соляной кислоте.
12. Азотистокислый калий в присутствии уксусной кислоты
тотчас выделяет из концентрированных растворов кобальтовых
солей желтый кристаллический осадок нитрокобальти(3)ата ка-
лия, называемого солью Фишера. В разбавленных растворах
осадок образуется только после долгого стояния, быстрее — при
трении стеклянной палочкой о стенки сосуда.
В процессе этом отмечаются следующие стадии:
СоС12 + 2KNO2 ->Co(NO2)2 + 2КС1
СН3 СН.3
2KNO2 + 2 | =2| +2HNO,.
СООН COOK
Свободная азотистая кислота окисляет азотистокислую соль
двухвалентного кобальта в азотистокислую соль трехвалентного
кобальта:
Co(NO2)2 + 2HNO2 = Н2О + NO + Co(NOa)s,
которая, реагируя с избытком! азотистокислого калия, превра-
щается в азотистокобальтовокалиевую соль:
Co(N02)s + 3KNO2 = Кз[Со(МОг)в].
Эта реакция представляет собой прекрасное средство для
открытия малых количеств кобальта в никелевых солях.
13. Роданистый аммоний [реакция Фогеля (Vogel)] Если
прилить концентрированный раствор роданистого аммония
к раствору кобальтовой соли, то появляется прекрасное синее
1 Ср. Dis. J. U. К u b 1 i, ЕТН (1925).
2 В. 12, 2314 (1879); Treadwell, Z. anorg. Chem. 26, 105 (1901).
2G9
окрашивание, 'обусловливаемое превращением кобальта в ко-
бальтистороданистый аммоний:
Со” -4-4CNS' -HCo(CNS)4J",
синего цвета
От прибавления воды исчезает синяя окраска и появляется
красная, присущая кобальтовой соли. Но при взбалтывании рас-
твора с амиловым алкоголем 1 (или, что еще лучше, со смесью
1 объема алкоголя и >10 объемов эфира) последний, всплывая
наверх, окрашивается в синий цвет. Реакция эта настолько
чувствительна, что синее окрашивание заметно даже при со-
держании в растворе 0,02 ,vr кобальта. Синий раствор показы-
вает, кроме того, характерный спектр поглощения2 3. Никелевые
соли не вызывают окрашивания амилового алкоголя. Присут-
ствие железа в виде окиси обусловливает образование красного
роданового железа Fe(CNS)s, которое также извлекается ами-
ловым алкоголем, окрашивая последний в красный цвет, вслед-
ствие чего синее кобальтовое окрашивание становится неявствен-
ным, а иногда даже совсем; незаметным. Но если к раствору
•прибавить 2—3 жл концентрированного раствора уксуснокислого
аммония и 2—3 капли 50%-ного раствора винной кислоты и
взболтать, то красная окраска Fe(CNS)a исчезает и отчетливо
выделяется синее окрашивание соединения кобальта
Синий цвет является, вероятно, цветом недиссоциированной соли
<NH4hlCo(CNS)4]. При разбавлении раствора происходит ионизация соли и
комплексный анион находится, таким образом, в равновесии с кобальт-ио-
нами. С увеличением разбавления увеличиваемся ионизация (стр. 27). Ал-
коголь и эфир, невидимому, растворяют только недиссоциированную со.н>
(NH4)jLCo(CNS)4]. некоторое количество которой остается после взбалтыва-
ния со смесью алкоголя и эфира в водном растворе, хотя цвет ее затем-
няется цветом ионов кобальта.
* Примечание редактора. Чувствительность родановой реакции
значительно повышается, если ее выполнять по Колытофу
(K'Olthoff)4. Для этого к испытуемому раствору следует приба-
вить насыщенный раствор роданистого аммония в ацетоне.
В зависимости от количества кобальта тгоявляется зеленая или
синяя окраска. Чувствительности, I : 100 000.
Для открытия кобальта в присутствии железа(З) Кольтгоф
рекомендует пользоваться вместо винной! кислоты фтористым
щелочным металлом, превращающим железо в трудно раство-
римую комплексную соль Мез[Ь'еНй|, которая с родан-ионом не
образует окрашенного в красный П'вег Fe(CNS)s. Эту реак-
цию можно выполнять на белой фарфоровой пластинке. Для
1 М орел ь (Morell) впервые показал, что кобальтовые соли дают
с роданистым аммонием синее окрашивание, исчезающее при добавлении
воды и появляющееся от прибавления алкоголя. Z. anal, Chem. 16,251 (1877).
•-Wolff, Z. anal. Chem. 18, 38 (1879).
3 Необходимо тщательно избегать большого избытка винной кислоты,
потому что в противном случае образование синего кобатьтового соеди-
нения может совсем не .произойти. Powel рекомендуй вместо винной
кислоты пирофосфорнокислый натрий |С. 11, 324 (1917)). Ред.
4 К о 11 h о f f, Mikrochemie 8, 176 (1930).
270
этого к 1—2 каплям испытуемого слабокислого раствора приба-
вляют несколько миллиграммов фтористого аммония, а затем
5 капель ацетонового раствора роданистого аммония. При таких
условиях возможно обнаружить 1 ч. кобальта в присутствии
1 ООО-кратного' количества железа *. Д. К.
NO
(-/\--/\он
14. а-Нитрозо-^-нафтол I I I дает объёмистый пурпурно-
красный осадок соли трехвалентного кобальта |'CioHe(NO)0 |цСо,
которая не растворима в холодной азотной и соляной кислотах Ч
В качестве реактива применяется насыщенный раствор а-нитрозо-
р-нафтола в 30%-ной уксусной кислоте.
Этот реактив служит не только для целей качественного анализа, но
он также применяется для количественного определения кобальта в при-
сутствии никеля. Испытанию можно с удобством подвергать раствор, по у-
чающийся при обычном ходе качественного анализа по удалении всех
металлов, за исключением никеля и кобальта. Часть раствора может быть
применена для чувствительной реакции на никель посредством диметил-
глиоксима (с'р. 200), а остаток— для испытания нс< кобальт.
Раствор разбавляют приблизительно до 50 мл, прибавляют 4 .ул 4N
соляной кислоты и 20 мл 6N уксусной кислоты. Нагревают, прибавляют
50 мл раствора а-нитрозо-^-нафтола и кипятят. Уже при наличии 0,1 мз
кобальта образуется красный осадок или муть давке в присутствии 250 мг
никеля. Впрочем, если никеля больше 150 мг, то после охлаждения раствора
выпадает некоторое количество буровато-желтого соединения никеля
[CioH6(N010]fNi.
Применяемый для этой реакции реактив должен быть свежепригото-
вленный, так как нитроз,о- (3-нафтол постепенно разлагается на воздухе и
цвет его переходит из желтого в бурый и даже черный. Он может быть
очищен, если его растворить в горячем растворе карбоната натрия, от-
фильтровать и осадить -из фильтрата серной кислотой.
Реакция на кобальт может быть сделана более чувствительной, если
к испытуемому раствору прибавить равный объем спирта. Для открытия
следов кобальта можно пользоваться также водным раствором' реактива,
но так как 1 г последнего растворяется лишь в 5000 мл воды, то ясно,
что водный раствор а-нитрозо- (3-нафтала недостаточен для больших коли-
честв кобальта. Необходим избыток реактива, так как часть последнего,
затрачивается на окисление кобальта до трехвалентного состояния.
Медь дает с этим реактивом характерный кофейнобурый осадок п
благодаря этому возможно отделение меди от свинца, кадмия и пр. Трех-
валентное железо дает буровато-черный осадок, который настолько трудно
растворим, что этой реакцией можно пользоваться для отделения железа
от алюминия, ма-ргаица и пр. Двухвалентное железо в нейтральном рас-
творе также образует осадок зеленоватого цвета. Однако из всех этих
осадков кобальтовое соединение наиболее характерно, и на него меньше
всего (влияет присутствие кислоты. Таким образом, при вышеуказанной
кислотности присутствие небольших количеств трехвалентного в двух-
валентного железа не мешает реакции
1 Hinski u. V. К п о г г е, В. 18. 699 (1885).^
2 Открытие кобальта в присутствии весьма больших количеств Железа
ня фильтровальной бумаге возможно, если к капле испытуемого раствора
прибавить каплю насыщенного раствора фосфа и аммония. На бумаге об-
разуется FePO« и Соз(РО.Щ, из которых только последний реагирует
с а-нитрозо-jil-нафтолом. См. Файгль, Капельный анализ, erg,. 161f
1933 г. Ред.
271
Этэк (Atack)1 приготовляет этот реактив, растворяя 0,1 г а-нитрозо-
0-нафтола в 20 мл воды и 1 мл разбавленного едкого натра, фильтруя го-
рячий раствои и разбавляя до 200 мл. Этим реактивом по В. Бетгеру2 от-
крывается 0,006 т кобальта в 0,01 мл раствора. На фильтровальную бумагу
помещают каплю испытуемого раствора. Если исследуемый раствор сильно-
кислый, бумагу держат над открытой склянкой с концентрированным ам-
миаком, после чего прибавляют каплю нитрозонафтолового реактива и
затем каплю 2N H2SO4.
15. Диметилглиоксим (см. стр. 260) не образует осадка с солями кобальта
в аммиачном растворе, но в присутствии сернистого водорода или серни-
стого аммония раствор окрашивается в виннокрасный цвет.
16. Дициандиамидиисульфат NH : C(NHa) • NH • СО • Х'Нз не образует
осадка в аммиачном растворе кобальта после прибавления едкоро натра.
Если прибавить достаточное количество тростникового сахара (сахарозы),
то с последним образуется комплексный ион темнокрасного цвета и в этом
случае устраняется возможность осаждения кобальта едким натром в виде
гидроокиси. Красное окрашивание может быть наблюдаемо после осажде-
ния никеля дициандиамидинсульфатом 3.
17. Эфир, насыщенный хлористым водородом, не осаждает
безводной кобальтовой соли в противоположность никелю, но
растворяет безводный хлорид кобальта, окрашивая раствор в си-
ний цвет. На этом основан метод отделения никеля от кобальта.
18. Хромовокислый калий дает буровато-красный осадок
основного хромата двухвалентного кобальта CoCrOi • СоО • НзО.
Осадок растворим в кислотах и аммиаке.
19. Рубеановодородная кислота4 образует в присутствии аммиака или
большого количества ацетата натрия желтовато-бурый осадок рубеаната
кобальта:
HN = С — С = NH
I I i
i S S :
1..—''
Реакция ‘возможна в отсутствие никеля (стр. 262) и меди (стр. 157);
она позволяет открывать 0,03 т кобальта.
Выполнение. Каплю исследуемого раствора на фильтровальной бумаге
подвергают действию паров аммиака, после чего пятно смачивают каплей
1%-ного спиртового раствора рубеанового водорода.
* Дополнение редактора. Рубеановодородная кислота является весьма
^чувствительным реактивом не только на кобальт, но также на никель и
медь. Поэтому открытие одного из этих металлов в присутствии двух дру-
гих в пробирке невозможно, а возможно только в виде капельной реакции
на фильтровальной бумаге. Благодаря различной скорости адсорбции об-
разующихся ионов фильтровальной бумагой, на последней образуются три
окрашенные зоны: в центре буро-зеленое кольцо рубеаната меди, затем
бурое кольцо рубеаната кобальта и внешнее синее кольцо рубеаната ни-
келя. * А. К.
20. Тиокарбонат калия K2CS3, прибавленный к аммиачному
раствору соли кобальта, окрашивает раствор в буроватый или
черный цвет в присутствии большого количества кобальта и
в винножелтый цвет — в присутствии малых количеств.
1 J. Soc. Chem. Ind. Japan, 34, 641 (1915).
2 Mikrochemie, Emich-Festschr. 28 (1930).
3 H. Grossmann u. B. S c h ii c k, Chem.-Ztg. 31, 535 (1907) и Gross-
mann u. H e i 1 b о r n, B. 41, 1878 (1908).
4 Pr. Ray, Z. anal. Chem. 79, 94 (1929).
272
Открытие следов кобальта в никелевых солях
Для испытания какой-нибудь соли никеля на кобальт при*
бавляют к концентрированному нейтральному или слабо подкис-
ленному уксусной кислотой раствору исследуемой соли концен-
трированный раствор роданистого аммония и взбалтывают с не-
сколькими миллилитрами смеси амилового алкоголя и эфира
(1 : 10) или только с амиловым алкоголем. Если всплывающий
на поверхность алкогольный раствор бесцветен, то это указы-
вает на отсутствие в соли никеля как железа, так и кобальта;
появление красной или красноватой окраски указывает на при-
сутствие железа. В этом случае прибавляют 2—3 ял концентри-
рованного раствора уксуснокислого аммония и 2—3 капли 50%-
ного раствора винной кислоты, которые препятствуют образо-
ванию роданистого железа, и снова взбалтывают. Присутствие
кобальта обнаруживается по синей окраске эфирноспиртового
слоя.
Иногда при очень малом количестве кобальта вследствие интенсивно
зеленого окрашивания раствора, обусловливаемого солями никеля, может
появиться сомнение относительно окраски амилового спирта. В таком слу-
чае реакцию проводят в делительной воронке, дают стечь зеленому слою,
находящемуся под слоем амилового алкоголя, прибавляют к последнему
5 мл 30—40%-ного роданистого аммония, 1 мл раствора ацетата аммония
и 1 каплю 50%-ной винной кислоты и взбалтывают. По разделении обоих
слоев можно ясно наблюдать синюю окраску.
Реакции сухим путем
Перл буры или фосфорной соли окрашивается в синий цвет
как в окислительном, так и в восстановительном пламени. При
более продолжительном нагревании перла в верхнем восстанови-
тельном пламени удается восстановить кобальт до металла, от-
чего перл, как и при никеле, приобретает серый цвет.
На обугленной палочке (содовой) кобальтовые соединения
дают серый магнитный металл, который отделяют от угля при
помощи намагниченного ножа, как это было описано в введении
(стр. 90); растворяют его на фильтровальной бумаге в соляной
кислоте и сушат, причем бумага синеет (отличие от никеля).
Прибавив затем едкого натра и подвергнув действию паров
брома, получают черный гидрат окиси кобальта Со(ОН)з.
Цинк Zn. Ат. в. 65,38. Ат. н. 30
Плотность 7,14. Т. пл. 419,4°. Т. кип. 918°
Нахождение в природе. Цинковый шпат, называемый также галмеем
ZnCOs, изоморфный с кальцитом СаСОз и т. п., кремнистая цинковая руда
(ZnaSiC>4 • НаО) ромбической системы, гемиморфна, называется также геми-
морфитом; красная цинковая руда (Zn, Мп)О гексагональной системы и
франклинит L(Fe, Мп, Zn) (FeOahj правильной системы. Важнейшей цинко-
вой рудой является цинковая обманка Zn3 правильной системы. Сернистый
цинк встречается также в виде вюрцита, гексагональной системы.
Свойства. Металлический цинк синевато-белого цвета. При низкой тем-
пературе и приблизительно около 200° он настолько хрупок, что его
можно растереть в порошок; при НО—150° он ковок, может вытягиваться
в проволоку и подвергаться прокатке. Цинк применяется в качестве за-
18 Зак. 982. Тредвелл-Голл, т. I.
273
щитного покрытия для железа, входит в состав латуни, используется в су-
хих элементах и в виде окиси является белой краской.
Цинк согласно своему положению ® электродвижущем ряду раство-
ряется легко во всех кислотах; в соляной ’, серной и уксусной кислоте он
растворяется с 'Выделением водорода:
Zn -J-2H’-» Zn’’ + Нг.
Цинк является сильным восстановителем и легко восстанавливает азот-
ную кислоту, причем в зависимости от концентрации последней полу-
чаются различные продукты восстановления. В очень концентрированной
кислоте наблюдается образование некоторого количества NOs, между тем
как разбавленная азотная кислота восстанавливается до аммиака; в обыч-
ной кислоте выделяется NO:
3Zn + 8HNO3 -» 3Zn’ ’ + 6NO3' + 4НгО + 2N'O;
4Zn + IOHNO3 -» 4Zn' • + 8NO3' + NH<NOs + ЗН2О..
Цинк медленно растворяется в концентрированной азотной кислоте,
так как образующийся нитрат цинка в ней мало растворим.
Подобно алюминию цинк растворяется в едких щелочах, выделяя водо-
род и образуя цинкат;
2Zn 4- 4ОН' -» 2HZnO-/ + Ik
Цинк образует только один окисел ZnO. который может быть получен
при нагревании на воздухе цинка или при прокаливании его гидроокиси,
карбоната, нитрата, оксалата, сульфида или какого-нибудь его органиче-
ского соединения. Окись цинка представляет собой белый неплавкий поро-
шок, окрашивающийся при нагревании в желтый цвет и при охлаждении
делающийся опять белым. Окись цинка легко растворяется в кислотах с
образованием цинковых солей:
ZnO 4- 2Н‘ ->• Zn' • т- Н>0
и в едких щелочах с образованием цинкатов, например NaHZnO2’.
ZnO 4- ОН'—> HZnOs'.
Существует только один ряд цинковых солей, в которых цинк всегда
двухвалентен. Большинство цинковых солей белого цвета. В воде раство-
ряются хлорид, нитрат, сульфат и ацетат цинка, остальные соли в воде не
растворяются, но легко растворяются в минеральных кислотах.
Реакции мокрым путем
1. Едкие щелочи осаждают белый студенистый гидрат окиси
цинка:
Zn” +2ОН' >Zn(OH);,
легко растворимый в избытке осадителя с образованием цин-
ката 1 2:
2п(ОН)з + ОН'-» Н2О + HZnOc'.
1 Абсолютно чистый цинк растворяется в этой кислоте очень .медленно,
но растворение происходит быстро, если прибавить следы какого-либо
металла, находящегося ниже цинка в электродвижущем ряду.
2 По Гантчу [A. Hantzsch, Z. anorg. Chem., 30, 289 (1902)] цинк
в щелочном растворе находится не в виде цинката, но, вероятно', в виде
гидрозоля гидрата окиси цинка. В умеренно концентрированном растворе
цинк несомненно находится в виде цинката, потому что Ферстер и Гюнтер
[F. Foerster и. О. Gunther, Z. Elektroch. 6, 301 (1SC0)] получили из
такого раствора цинкат натрия NaHZnOz • ЗН2О в виде шелковисто-блестя-
щих игл.
274
Поэтому гидроокись цинка является не только основанием,
но, подобно гидроокиси алюминия, также и слабой кислотой.
При кипячении разбавленного раствора цинката происходит
гидролиз, ведущий к выпадению гидроокиси цинка:
HZnOi' + НОН ->Zn(OH)2 + ОН'.
Если же .раствор содержит избыток едкой щелочи, то выде-
ления гидроокиси совсем не происходит.
2. Аммиак осаждает из нейтральных растворов, не содержа-
щих аммонийных солей, гидроокись цинка:
Zn ’ ’ + 2NH3 -б 2НаО -> Zn(0H)2 + 2NH4'.
В присутствии аммонийных солей концентрация гидроксил-
исно-в недостаточна для осаждения гидроокиси цинка, как и
гидроокисей остальных двухвалентных металлов группы серни-
стого аммония.
Гидроокись цинка растворяется в избытке аммиака с обра-
зованием комплексного цинк-аммиачного соединения:
Zn(OH)-> + 6NH3-> [Zn(NH3)e]' ' + 2ОН'.
3. Углекислые щелочи осаждают белую основную углекислую
соль меняющегося состава, как и при солях магния (стр. 302).
4. Углекислый аммоний дает такой же осадок, но только рас-
творимый в избытке осадителя с образованием аммиачного ком-
плекса. Аммонийные соли препятствуют образованию осадка.
5. Углекислый барий на холоду не осаждает цинка, при ки-
пячении же весь цинк выпадает в виде основной углекислой
соли.
6. Фосфорнокислый натрий осаждает студенистую среднюю
фосфорнокислую соль цинка, быстро переходящую в кристал-
лическую форму и растворимую в кислотах и аммиаке:
3ZiT ’ + 4НРОГ-> гЬЬРОГ + Zn3(PO4)2.
В присутствии аммонийной соли осаждается менее раствори-
мая фосфорноцинковоаммонийная соль:
Zn’ + NHE + 2НРОГ' НЕРОГ + ZnNHJPOj.
Как последняя соль, так и фосфат цинка легко растворяются
в разбавленных кислотах вследствие образования весьма мало1
ионизирующего НРОГ', а также в разбавленном аммиаке вслед-
ствие образования цинк-аммиачного комплексного соединения.
Таким образом, кислоты удаляют из раствора анионы РОГ",
превращая их в НРОГ', а аммиак — цинк-ионы, превращая их
в [Zn(NHS)e]' ’.
7. Сернистый водород осаждает цинк из нейтрального рас-
твора цинковой соли в виде сульфида:
Zn’ ’ + H3S -> ZnS 4~ 2Н ’.
13»
275
Произведение растворимости сульфида цинка (стр. 39) около 1,2 •10'-23.
При 25° концентрация насыщенного раствора сернистого водорода равна
приблизительно 0,1 молярной и константа ионизации при полной диссо-
циации HaS:ri2H'+S" была определена равной 1,1 • 10-23. Концентрация
сульфид-иона в таком растворе равна приблизительно 1,2 • 10“15 моля в
литре. Таким образом при насыщении водного раствора цинковой соли
сернистым водородом произведение растворимости сульфида цинка будет
превзойдено и произойдет его осаждение. Принцип закона действия масс,
примененный к полной ионизации сернистого водорода, показывает, что
концентрация сульфид-ионов обратно пропорциональна квадрату концент-
рации водородных ионов. Если концентрация водородных ионов увеличи-
вается в тысячу раз (в растворе находится децинормальная минеральная
кислота), то концентрация сульфид-ионов снизится до одной миллионной
части той величины ее, какую она имеет в чистой воде.
Отделение второй группы металлов от третьей группы обычно выпол-
няется пропусканием сероводорода в раствор, содержащий приблизительно
0,3.-V соляную или азотную кислоту. Концентрация сульфид-иона в таком
растворе, насыщенном сероводородом, равна при 25° приблизительно
1,1 • 10-22. Чтобы достигнуть произведения растворимости сульфида цинка
-в 0,3N кислоте, концентрация ионов цинка должна быть равной приблизи-
тельно 0,11 моля в литре или 0,7 г в 100 ял *. Если концентрация цинковой
соли больше только что указанной, то в растворе указанной кислотности
некоторое количество сернистого цинка может быть осаждено сернистым
водородом. Очевидно, осаждение будет неполным, потому что вследствие
увеличения концентрации водородных ионов (являющегося результатом
осаждения сульфида) ионизация ..сернистого врдорода будет непрерывно
понижаться.
Если, однако, к кислому раствору прибавить большое количество аце-
тата натрия или аммония, то концентрация водородных ионов настолько
уменьшится, что ионизация сернистого водорода достигнет больших раз-
меров, и в этом случае возможно настолько полно осадить цинк в виде
сульфида, что в растворе останется меньше 1 яг цинка.
Сернистый цинк легко растворяется в нормальной соляной кислоте.
Сульфид-ионы, отделяемые сульфидом цинка, вступают в равновесие с во-
дородными ионами кислоты с образованием сернистого водорода.. В одно-
нормальном кислом растворе, насыщенном сернистым водородом, концент-
рация сульф(ид-ионов равна приблизительно 1,2 • 10-23, концентрация же
сульфид-ионов в воде, насыщенной ZnS, равна приблизительно 3,5-10-12.
8. Сернистый аммоний осаждает из нейтральных или щелоч-
ных растворов весь цинк в виде аморфного сернистого цинка:
Zn'' + S"-> ZnS.
Осажденный из щелочного раствора сернистый цинк трудно
отфильтровать и особенно -промыть, так как он проходит даже
через мелко пористую фильтровальную бумагу.
Сернистый цинк удается, однако, легко скоагулировать, если
к нагретому раствору прибавить несколько граммов аммонийной
соли. После этого осадок легко отфильтровывается и промы-
вается водой, содержащей аммонийную соль. Выпадению осадка
в виде хлопьев благоприятствует кроме того нейтрализация рас-
твора или слабое подкисление его.
Явление прохождения через фильтр присуще почти всем
сульфидам и многим аморфным веществам, как глинозем, тита-
новая, вольфрамовая кислоты и т. д.
1 Эта величина лишь приблизительна; она получена на основании вели-
чин, не обладающих абсолютной точностью.
276
Для получения сернистого цинка в хорошо фильтруемой
форме осаждение сернистым аммонием лучше всего произво-
дить из кипящего раствора, содержащего уксусную кислоту и
большое количество аммонийных солей. Промывание можно
производить раствором хлористого аммония, к которому при-
бавлено немного сернистого аммония.
9. Тиоацетат аммония осаждает из аммиачных (но не кислых) раство-
ров ZnS. Тиосульфат натрия осадка не дает.
10. Цианистый калий дает белый осадок цианистого цинка,
растворимого в избытке осадителя;
Zn’ + 2CN' -> Zn(CN)2
и
Zn(CN)’ + 2CN' [Zh(CN)t] ".
, Ципкоцианид легко разлагается кислотами и сернистыми
щелочами:
Zn(CN)i" + 2Н’ -» 2HCN + Zn(CN)3;
Zn(CN)2 + 2Н’ -» 2HCN + Zn’';
Zn(CN)i" + S"-> 4CN' + ZnS.
11. Ферроцианид калия осаждает белый ферроцианид цинка-
калия:
2Fe(CN)o'"' + 2К’ + 3Zn' ’ -> Zn3K2[Fe(CN)6]2.
Так как щелочной металл принимает участие в образовании осадка, то
состав последнего зависит также от природы и концентрации применяемого
щелочного металла: литий и натрий не осаждаются; калий и рубидий входят
.в состав соли по одному иону на каждый ион [Fe(CN]в]""; цезий участвует
в образовании осадка в двойном количестве.
При обработке бромом осадок переходит в желтый продукт окисления.
12. Феррицианид калия осаждает коричневато-желтый ферри-
цианид цинка Zns[Fe(CN)e]2, растворяемый в соляной кислоте
и аммиаке.
13. Феррицианид калия и диэтиланилин образуют осадок ферроцианида
цинка, окрашивающегося продуктом окисления диэтиланилина в желтый,
бурый или красноватый цвет.
Феррицианид калия может окислить диэтиланилин, как и, другие аро-
матические амины, с образованием окрашенных органических веществ и
ферроцианида калия. Реакция протекает очень медленно, но в присутствии
веществ, которые подобно Zn’’ тотчас реагируют с образующимся
[Fe(CN)e]"", окисление диэтиланилина согласно закону действия масс про-
текает значительно быстрее. Ускорение реакции указывает на присутствие
цинка, при условии отсутствия других элементов, реагирующих с ферро-
цианидом. Эта реакция удобна для открытия цинка в присутствии алюми-
ния и хрома, но она не применима в присутствии кобальта, никеля, мар-
ганца, меди или большого количества железа. Посредством этой реакции
можно открыть меньше 1 мг цинка.
Выполнение. Смешивают на капельной пластинке 15 капель 2%-ного
раствора феррицианида калия с 10 каплями раствора 0,25 г диэтиЛ'аи,илина
(не содержащего моносоединения) в 200 мл ISN серной кислоты или рас-
твора 0,5 г диэтиланилина в 200 мл 50%-ной фосфорной кислоты. От при-
бавления капли испытуемого раствора появляется в случае наличия цинка
277
осадок, окрашенный в темный красновато-бурый или красновато-желтый
цвет. Окраску эту можцо наблюдать в течение 5 мин.
14. Перйодат калия дает в водных растворах белый осадок. ;В при-
сутствии хлористого аммония на холоду осаждение затрудняется, но при
кипячении .весь цинк выпадает в осадок.
15. Дитизон (см. стр. 121) образует в нейтральном, щелочном или
уксуснокислом растворах пурпурнокрасную соль цинка, растворимую
в СС14.
Выполнение. Растворяют I—2 л? дитизона в 100 ул СС1«. Каплю этого
реактива прибавляют к капле испытуемого раствора в маленькой пробирке.
В присутствии цинка при взбалтывании зеленый цвет реактива переходит
в пурпурнокрасный. Таким путем можно открыть 0.9 у цинка2.
* Примечание редактора. Эта чрезвычайно чувствительная реакция, даю-
щая возможность открывать 0,025 т Zn, неспецифична. так как многочис-
ленные другие тяжелые металлы также окрашивают при реакции с дити-
зоном четыреххлористый углерод. В силу этого обычная дестиллированная
вода, содержащая следы тяжелых металлов, реагирует с дитизоном. Эту
реакцию можно сделать специфичной для цинка, если учесть наблюдение
Ринекера и Шифа ;i. что из всех тяжелых металлов только дитизонат цинка
окрашивает в щелочном растворе не только слой ССР, но также и- водный
слой. Благодаря этому открытие цинка становится более однозначным,
если выполнять реакцию в условиях, рекомендуемых указанными авторами,
следующим образом.
а) В пробирке. Сильно взбалтывают несколько капель испытуемого рас-
твора с 0,5 мл 2N едкого натра и 0,5 y.i раствора дитизона (Юл.’ дитизона
в 100 л 1 ОСЬ). Красное окрашивание «одного слоя указывает на присут-
ствие цинка.
б) В виде капельной реакции. К капле испытуемого раствора на часо-
вом стекле прибавляют каплю 2N раствора едкого натра и несколько ка-
пель раствора -дитизона. Перемешивая стеклянной палочкой, полностью
испаряют четыреххлористый углерод. Малиновокрасный раствор указывает
па присутствие цинка,. На цвет образующихся иногда хлопьев осадка не
обращают .внимания. Таким путем можно открыть 5 Т цинка в 1 капле.
Эта реакция специфична только в отсутствие меди и ртути. Однако послед-
ние могут быть легко и быстро удалены сероводородом в трубке Эмиха. *
А. К.
* Добавление редактора.
16. Роданомеркуриат аммония и соль кобальта4. Как соли
цинка, так и соли кобальта реагируют с роданомеркуриатом ам-
мония (NH4)2[Hg(GNS)4] с образованием трудно растворимых
солей: Zn[Hg(CNS)j] (белого цвета) и Co[Hg(-CNS)4] (синего
цвета). Однако обе эти реакции при малых количествах цинка
и кобальта протекают медленно. Но если к раствору соли ко-
бальта, настолько разбавленному, что синий осадок образуется
лишь при долгом стоянии, прибавить цинковой соли, то даже
при очень малых количествах последней тотчас образуется си-
ний осадок. Крумхольц, и Вакэ (Krumholz u. ;Vasquez) рассматри-
вают эту реакцию как индуцированное осаждение цинка, Файгль3
1 Кроме изменения окраски от прибавления цинка происходит также
появление мути. См. оригинальную работу £. Е е g г i vv е, Z. anal. Chem. 74,
228 (1928). РеД.
2 Можно открыть еще меньшие количества в зависимости от условий.
См. Fischer, Z. angew. Chem. 42, 1025 (1929) и Файгль, Капельный
анализ, стр. 280. Ред.
3 Rieniicker it. Schiff. Z. anai. Chem. 94, 410 (1933); Файгль,
Капельный анализ, стр. 280.
4 Mikrochemie 15, 114 (1934)-
5 Файгль, Капельный анализ, стр 282.
27й
же полагает, что осаждение связано с уничтожением .пересыщен-
ного состояния для обоих двойных роданидов, дающих изо-
морфные кристаллы.
Выполнение. В углублении капельной пластинки или в микротигле сме-
шивают .каплю исследуемого раствора с каплей раствора хлорида кобальта
(0,02% СО в 0.5N НС1) и каплей раствора роданомеркуриата аммония1 и
потирают около 15 сек. стенки сосуда стеклянной палочкой. В зависимости
от количества цинка образуется тотчас или не позже чем через 2 мин.
синий осадок. В отсутствие цинка через 2—3 мин. начинается осаждение
роданомеркуриата кобальта. Открываемый минимум в нейтральном растворе
0,2 у (предельная концентрация 1:250 000), а в 0,5N солянокислом рас-
творе 0,5 у (предельная концентрация 1 : 100 000). * А. К.
Реакции сухим путем
При нагревании с содой на угле перед паяльной трубкой не-
возможно получение металлического цинка вследствие его лету-
чести, но происходит образование налета ZnO желтого цвета
в горячем состоянии и белого — ври охлаждении.
Окись цинка (или такие соединения цинка, которые пере-
ходят в окись при прокаливании), смоченная нитратом ко-
бальта, при прокаливании образует зеленую неплавкую
массу—зелень Ринмана. Эту пробу производят по способу, ука-
занному для алюминия (стр. 217).
Анализ группы III
Отделение металлов группы III от щелочных и щелочноземельных
металлов
Отделение металлюв группы сернистого аммония от щелочных и щелоч-
ноземельных металлов производится посредством сернистого аммония в
присутствии хлористого аммония. Но если исследуемый раствор содержит
фосфорную, щавелевую или много борной кислоты, то при нейтрализации
раствора вместе с металлами рассматриваемой группы выпадают в осадок
также кальций, стронций, барий и магний в виде фосфатов, оксалатов
или боратов. В присутствии фтористоводородной кислоты 'наблюдается
в этих условиях осаждение фтористого кальция.
Для устранения затруднений, вызываемых наличием фосфорной кислоты,
можно пользоваться любым из нижеизложенных четырех методов.
1. Оловяииый метод. При кипячении олова с концентрированной азот-
ной кислотой образуется нерастворимая метаоловяннан кислота, которая
хорошо адсорбирует НзРОт и НзАзОд; применяя достаточное количество
олова, мрЖ'НО удалить из раствора всю НзРО«. На практике поступают
следующим образом. Фильтрат после осаждения группы II упаривают до
небольшого объема, добавляют 10 мл концентрированной азотной кислоты,
снова .выпаривают (для уверенности в полном удалении' СГ) и, прилив еще
HNOs, прибавляют небольшими порциями металлическое олово до тех пор,
пока раствор не перестанет давать реакции на НчРОг с раствором молиб-
дата. Метод дает хорошие результаты, но сопряжен с большой затратой
времени, и образующийся осадок трудно отфильтровывается.
2. Метод основного ацетата. Этот метод приведен в таб.т. V. Он тре-
бует присутствия не меньше одного моля 1~е' на каждый моль РОГ”,
тщательной нейтрализации и кипячения с раствором ацетата аммония. При
1 Sc хлорида ртути и 9 г роданида аммония растворяют в 100 .хл воды.
Применять спустя несколько дней.
279
таких условиях РОГ" осаждается в виде FePOd, а избыток Fe’ ' —в виде
основного ацетата.
3. Метод хлористого (хлорокиси) цирконила. ZrOCla осаждает POi'" из
раствора, содержащего 0,3N НС1. Избыток Zr может быть удален путем
кипячения в течение нескольких минут с NH-iOH, который осаждает Zr
в виде Zr(OH)4. Осадки Zr(HPOi)2 и Zr(OH)4 трудно растворяются в раз-
бавленной соляцой кислоте.
Для выполнения этой операции удаляют H»S из фильтрата от группы II
и прибавляют аммиак. Если образуется осадок, то небольшое количество
раствора подкисляют азотной кислотой до ясно кислой реакции, нагревают
почти до кипения и проводят реакцию на Н3РО4 с молибдатом аммония.
При положительной реакции прибавляют 2 г NH«C1 и по каплям 10 .мл
раствора ZrOCl» (322 г ZrOC12-8H»O в 1 .?). Сильно перемешивают, при-
бавляют 0,2 г асбеста, подщелачивают аммиаком и кипятят 2 мин. Горя-
чий раствор фильтруют под слабым разрежением. В случае необходимости
фильтрование повторяют и испытывают фильтрат на присутствие НзРОз.
4. Сульфатный метод имеет целью воспрепятствовать осаждению щелоч-
ных земель (но не магния) в виде фосфатов, оксалатов или фторидов при
нейтрализации раствора аммиаком. К раствору прибавляют 5 мл концентри-
рованной H2SO4 и выпаривают до выделения густых паров. После охлаж-
дения очень осторожно приливают 15 мл воды и 45 мл спирта, что при-
водит к осаждению сульфатов Ba, Sr и Са. Раствор фильтруют и фильт-
рат исследуют на группы III и V. Осадок кипятят с 3N Na»COs, фильт-
руют, повторяют кипячение с NaaCOs и промывают осадок до тех пор, пока
промывные воды не докажут нейтральной реакции по лакмусу. Промытый
осадок растворяют в разбавленной уксусной кислоте и производят обыч-
ным путем испытания на Ba, Sr и Са,
Ход анализа
Предварительно проводят испытание на фосфорную кислоту.
Для этого небольшую часть фильтрата от группы II кипятят до
полного удаления сероводорода, затем вливают ее .в смесь из
5 мл 6N азотной кислоты и 5 мл реактивного раствора молиб-
дата аммония, нагревают до 60° и дают постоять 10 мин. Если
появляется желтый осадок фосфорномолибденовокислого аммо-
ния, то после нейтрализации раствора аммиаком и сернистым
аммонием в осадке могут оказаться металлы группы IV. В зави-
симости от наличия или отсутствия фосфатов анализ ведут со-
гласно пп. 6 или 5 предлагаемой методики.
1. Фильтрат от группы II кипятят до удаления сернистого
водорода, после чего подщелачивают аммиаком. (Непоявление
осадка указывает на отсутствие А1, Сг, Ее и фосфатов щелочных
земель). Прибавляют небольшими порциями реактивный серни-
стый аммоний до тех пор, пока после взбалтывания сосуда (в ко-
тором производят осаждение) и удаления из него паров проду-
ванием не произойдет почернения влажной свинцовой бумажки1,
поднесенной к горлу сосуда. Нагревают почти до кипения, взбал-
тывают и дают постоять около 3 мин. Фильтруют, промывают
осадок водой, содержащей 1% сернистого аммония, и, наконец,
чистой водой. При медленном фильтровании воронку во избежа-
ние окисления осадка покрывают часовым стеклом. К фильтрату
1 Для получения свинцовой бумажки фильтровальную бумагу смачи-
вают раствором уксуснокислого свинца.
280
ТАБЛИЦА V. АНАЛИЗ ГРУППЫ III1
3 В таблице дается (в несколько измененном виде) метод, приведенный Нойесом в его руководстве по качественному
анализу.
281
прибавляют несколько капель сернистого аммония и нагревают,
чтобы видеть, не образуется ли черный осадок. В последнем слу-
чае его отфильтровывают через свежий фильтр. Фильтрат со-
храняют для исследования на группы IV (стр. 305) и V (стр. 331).
2. Осадку дают постоять несколько минут с 5—15 мл холод-
ной 6N соляной кислоты, после чего кипятят в течение корот-
кого времени. Если1 при этом остается черный остаток, то к го-
рячему, но не кипящему раствору прибавляют немного растер-
того в порошок хлората калия, кипятят 1 мин. и фильтруют.
Остаток (представляющий собой серу), который может быть чер-
ного цвета от включенного в нем небольшого количества суль-
фидов, выбрасывают. Раствор выпаривают почти досуха, чтобы
удалить избыток кислоты, разбавляют приблизительно до 25 мл
и тщательно нейтрализуют чистым едким натром. Если при этом
образуется очень большой осадок, то лучше всего разбавить
еще небольшим количеством воды. К холодному раствору осто-
рожно прибавляют немного перекиси натрия в порошке.- (При-
нимая во внимание бурный характер реакции перекиси натрия
с водой, она должна прибавляться не слишком быстро и не к го-
рячему раствору. Перекись натрия берется каждый раз из
склянки в небольшом количестве посредством стеклянного шпа-
теля, но никоим образом не посредством бумаги, и тотчас при-
бавляется к раствору.) Затем кипятят раствор- для разложения
избытка перекиси -натрия, разбавляют равным объемом воды и
фильтруют. Осадок содержит гидрат двуокиси марганца, гидро-
окись железа, гидроокись кобальта и гидрат закиси никеля.
В фильтрате находятся алюминат, хромат и цинкат натрпя. Отделе-
ние цинка может быть не полным; при большом количестве железа,
никеля или кобальта с осадком может быть увлечено до 5 иг,
а при значительном -количестве марганца до 20 мг цинка. Это,
вероятно, обусловливается амфотерной природой осажденных
гидроокисей и нерастворимостью цинковых солей соответствую-
щих кислот. Исследование фильтрата на алюминий, цинк -и хром
производят по п. 12.
3. Растворяют осадок в горячей 6N азотной кислоте, приба-
вляют перекись водорода в количестве, необходимом для вос-
становления марганца и кобальта до двухвалентных (стр. 49).
Выпаривают раствор досуха, прибавляют 15 мл 16N азотной
кислоты, около 1 г порошка хлората калия и нагревают до ки-
пения. Затем, прибавив еще 10 мл концентрированной азотной
кислоты, нагревают до кипения, удаляют пламя и прибавляют
еще 0.5 г хлората калия. Последний повторно добавляют до тех
пор, пока все количество -его не будет составлять около 3 г.
Нельзя прибавлять хлорат калия к азотной кислоте во время
кипения, так как при этом возможен взрыв, но кипятить сле-
дует по прибавлении каждой порции хлората. Обработку хло-
ратом калия лучше всего производить в эрленмейеровской ко-лбе
емкостью 250 ты. Если образуется осадой МпОа, то фильтруют
через тонкий слой хорошего качества асбеста, положенного на
небольшое количество стеклянной ваты в обыкновенной воронке.
282
Фильтрат испытывают на марганец, прибавив 1 г хлората калия
и подвергнув раствор снова кипячению. Осадок промывают не-
большим количеством азотной кислоты, которую освобождают
от HNOa кипячением с хлоратом калия непосредственно -перед
-применением. Фильтрат исследуют на железо, кобальт, никель
и цинк по -п. 5 или п. 6 в случае наличия НзРОт.
4. Растворяют осажденную двуокись марганца в небольшом
количестве горячей 6N азотной кислоты, прибавив несколько
капель перекиси водорода. Кипятят для разложения избытка по-
следней и охлаждают до комнатной температуры. Прибавляют
немного висмутата натрия, вгбалты-вают и дают осадку осесть.
Пурпурный цвет раствора указывает на присутствие марганца
(стр. 249).
5. В случае отсутствия фосфата вливают холодный фильтрат,
полученный при операции 3, -в 6N раствор аммиака, объем ко-
торого в четыре раза больше объема концентрированной азотной
кислоты, взятой при операции 3. Темнокрасный осадок указы-
вает на присутствие железа. Фильтруют и исследуют фильтрат
на никель, кобальт и цинк по п. 7. Гидроокись железа на филь-
тре обрабатывают смесью из 2 мл реактивного железистосине-
родистого калия и 10 капель 6N уксусной кислоты. Темносиняя
или зеленая окраска осадка на фильтре подтверждает присутствие
железа.
6. В случае присутствия фосфорной кислоты реакцию на же-
лезо проводят следующим образом. Выпаривают 1/ю ч. рас-
твора, полученного при операции 3. почти досуха, нагревают
с 3 w 6.V соляной кислоты до прекращения выделения хлора
и прибавляют 20 мл воды с небольшим количеством железисто-
синеродистого калия. В присутствии железа появляется темносиняя
окраска.
Остаток азотнокислого раствора, полученного при опера-
ции 3, нейтрализуют аммиаком, прибавляя последний до по-
явления незначительного осадка, не исчезающего -при взбалты-
вании в течение 15 сек. В случае непоявления осадка приба-
вляют аммиак до щелочной реакции и переходят к п. 7. Если
осадок образуется, приливают 50 мл воды и 15 мл 3N раствора
ацетата аммония. Если раствор не будет окрашен в красный
цвет, то прибавляют раствор нитрата трех-валентного железа пор-
циями по 1 мл до тех пор, пока не -появится темнокрасное окра-
шивание. Смесь осторожно кипятят 3 мин., прибавив еще 50 мл
воды ;в случае -образования большого осадка. (Если железо
не выпадает в осадок, а образует коллоидный раствор, то, при-
бавив 30 капель аммиака, снова кипятят). При этом фосф-о-рная
кислота осаждается в виде фосфата трехвалентного железа,
а -избыток прибавленного железа — в виде основного ацетата
(стр. 237). Фильтруют раствор еще горячим и осадок выбрасы-
вают. Фильтрат подщелачивают аммиаком, если нужно, филь-
труют, и исследуют его, как указано в и. 7.
7. Фильтрат, полученный при операции 5 или 6, насыщают
сероводородом, отфильтровывают осажденные сульфиды кобаль-
283
та, никеля и цинка и выливают фильтрат, за исключением того
случая, когда был найден фосфат, и анализ проводился, как опи-
сано в п. 6. В этом случае фильтрат исследуют на барий, каль-
ций, стронций и магний, но не на щелочные металлы, так как
последние прибавлялись во время предшествующих операций.
Поэтому нельзя смешивать этот фильтрат с тем, который по-
лучается при первоначальном отделении группы Ш от группы IV.
Последний во всех случаях исследуют отдельно на присутствие
катионов щелочных и щелочноземельных металлов. Осажден-
ные сульфиды обрабатывают 10—30 мл нормальной соляной
кислоты для растворения могущего быть некоторого количе-
ства сернистого цинка; при этой обработке небольшое количе-
ство никеля и следы кобальта также могут перейти в раствор.
Раствор исследуют на цинк по п. 9 и 11.
8. Сульфидный осадок, полученный при операции 7, соеди-
няют с осадком, получающимся от перекиси натрия при опе-
рации 9, и совместно исследуют их на никель и кобальт 'Сле-
дующим образом. Осадок растворяют в чашке в 5—15 мл £>N
соляной кислоты, нагревая до кипения и прибавляя понемногу
порошок хлората калия к горячему раствору1. Отфильтровы-
вают от могущей выделиться серы и выпаривают раствор до-
суха, избегая перегревания остатка. Растворяют в 5 мл 6N
раствора уксусной кислоты, прибавляют 3 .мл 6Nазотистокислого
калия и дают постоять по меньшей мере 15 мин., время от вре-
мени взбалтывая. Желтый осадок нитрскобальти(3)ата калия ука-
зывает на присутствие кобальта. При большом количестве осадка
прибавляют к смеси еще 10 мл 6N раствора нитрита калия и
около 3 г растертого в порошок хлористого калия. Дав по-
стоять еще 15 мин. при частом взбалтывании, фильтруют и вы-
брасывают осадок.
К части фильтрата прибавляют 10 мл воды и 4 мл раствора
диметилглиоксима. Нагревают до кипения и дают постоять не-
сколько минут. Красный осадок указывает на присутствие никеля.
9. Нейтрализуют раствор, полученный при операции 7, едким
натром и прибавляют NazOs, как указано в п. 2. Фильтрат ис-
следуют по п. 11.
10. Если находят рациональным, то осадок Ni(OH)a и
Со(ОН)з в случае его образования при операции 9 может быть
присоединен к сульфидному остатку, полученному при опера-
ции 7, после чего проводят реакции на никель и кобальт, как
указано ;в п. 8.
И. Фильтрат, полученный при операции 9, подкисляют
уксусной кислотой и насыщают сероводородом. Образующийся
белый осадок может являться сернистым цинком. Осадок от-
фильтровывают, растворяют в 5—10 мл 6N азотной кислоты,
1 Проще и удобнее растворять сульфиды никеля и кобальта либо в
0,5/V соляной кислоте, либо в 2N уксусной кислоте в смеси с Н2О2. После
растворения и кипячения для разложения Н2О2 можно непосредственно
испытать раствор на никель и кобальт. См. A. S. К о it. а г о w sky, Z. anal.
Chem. 72, 293 (1927). Ред.
281
повторно' пропуская кислоту через фильтр с осадком. К рас-
твору прибавляют из капельницы 1—3 капли 0,3N Со(МОз)г.
Смесь выпаривают досуха и прибавляют 1—3 мл 3N раствора
ЫагСОз. Снова выпаривают досуха в фарфоровой чашке и про-
каливают остаток при температуре ниже красного каления (пе-
редвигая при этом чашку) до исчезновения пурпуровой окра-
ски, обусловливаемой кобальтом. Охлаждают и смачивают
остаток водой. Появление зеленой окраски указывает на при-
сутствие цинка. Если масса становится черной вследствие силь-
ного прокаливания \ то прибавляют несколько капель HNOs,
выпаривают досуха, прибавляют, как и раньше, раствор NaaCOs,
выпаривают и снова прокаливают.
12. Фильтрат от операции 2 подкисляют НС1, прибавив сна-
чала 5 мл 6N кислоты, а затем, дав охладиться, чтобы избежать
восстановления хромата до соли трехвалентного хрома, приба-
вляют сразу еще 2 мл указанной кислоты. К полученному рас-
твору приливают 5 мл 3N раствора NHjCl и столько 6Л; раствора
аммиака, чтобы смесь после взбалтывания и удаления паров про-
дуванием пахла аммиаком. В заключение прибавляют еще 5 мл
NHiOH, нагревают до кипения, отфильтровывают осадок А1(ОН)з
и промывают его горячей водой. Фильтрат исследуют на хром
и цинк по п. 14 и убеждаются (п. 13), что полученный осадок
представляет собой действительно А1(ОН)з.
13. Осадок, полученный по п. 12, растворяют в 5 мл 1N НО,
прибавляют 5 мл 3N раствора ацетата аммония и 5 мл 0,1 %-него
водного раствора алюминона. Тщательно смешивают и под-
щелачивают смесью из NHaOH и (МН^гСОз. Образование
светлокрасного нерастворимого лака, устойчивого в аммиачном
растворе, указывает на присутствие алюминия. Реакцией образо-
вания тенаровой сини (стр. 217) подтверждают наличие алю-
миния.
14. К фильтрату, полученному при операции 12, прибавляют
15 мл 3N раствора №зСОз и выпаривают в фарфоровой чашке
до исчезновения паров аммиака. При наличии цинка появляется
белый осадок основного карбоната цинка. Фильтруют и про-
мывают горячей водой. Осадок исследуют по п. 15, а фильтрат
по п. 16.
15. Осадок, полученный в п. 14, растворяют в 10 мл горячей
3N соляной кислоты. Подщелочив раствор аммиаком, приба-
вляют еще 3 ли 6N' аммиака. Если в растворе имеется много
цинка, то вблизи нейтральной точки появляется осадок, снова
растворяющийся в избытке аммиака. Если при этом остается
какой-либо осадок, то это может быть А1(ОН)з, Сг(СН)з или
НгБЮз. Его отфильтровывают и выбрасывают. Раствор слегка
подкисляют уксусной кислотой и насыщают сероводородом. По-
явление белого осадка подтверждает присутствие цинка.
1 При сильном прокаливании образуется черная закись-окись кобальта.
Ред.
235
16. К фильтрату, полученному в п. 14, прибавляют уксусной
кислоты до кислой реакции и затем 20 мл воды. Нагревают до
кипения и прибавляют немного раствора ацетата свинца. При
наличии хрома образуется желтый осадок хромата свинца. При
охлаждении обычно появляется белый осадок вследствие обра-
зования хлористого свинца, что не имеет значения. Хромат-
анион имеет определенно желтый цвет и поэтому нет необхо-
димости в реакции с уксуснокислым свинцом, если раствор бес-
цветен.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Осаждение группы Ш
1. Напишите: а) формулы соединений, осаждаемых при Действии
на металлы группы III NH4OH и (NH4)sS; б) цвета осадков;
в) результат действия НС1 и HNOs на соединения, получающиеся по
п. «а»; г) результат действия NaOH и Na»O-2 на каждое из соедине-
ний, образующееся при реакции «в».
2. а) Если элементы группы серебра ,не были осаждены при первом доба-
влении NHtCI, то' где бы они могли появиться? б) Если РЬ не был
полностью осажден ШЗОъ где он может появиться? Покажите урав-
нениями реакций, как это происходит.
3. Почему при анализе на катионы производится испытание на фосфаты?
Напишите уравнение .используемой для этого реакции. Напишите урав-
нение, показывающее действие КСЮз при растворении осадка суль-
фидов. Почему необходимо удалить H’S перед добавлением NHiOH?
Почему иногда бывает целесообразнее пропускать HsS в аммиачный
раствор, чем прибавлять (NH4);>S?
4. Напишите полностью уравнения реакций: a) FesSs+H’; б) NiCla 4- из-
быток NH4OH; в) МпСЕ’ + Na.>O-2 + Н2О; г) Al-S.i + Н-.О; д) СгС1з +
+ NasCb + Н2О.
5. а) Каков будет результат, если при анализе до отфильтровывания суль-
фидов от раствора, содержащего аммиак и сернистый аммоний, будет
допущено поглощение СОг из воздуха? б) Почему перед добавле-
нием сернистого аммония удаляют HsS кипячением?
6. Почему AI2S3 не осаждается при добавлении (NH4)iS?
7. Если 200 .мл раствора NasCrCh, содержащего 0,520 г Сг, кислотность ко-
торого доведена соляной кислотой до 0.3/V, насытить H2S и уда-
лить S, сколько нужно буде т мл 6N NHjOH для нейтрализации такого
раствора и сколько еще нужно будет аммиака для полного осажде-
ния Сг(ОН)з?
8. Вычислите pH раствора, содержащего 3 миллиэквивалента НС1 и 5 г
CHsCOONa • ЗН2О в 600 .мл раствора. Предполагается полная иониза-
ция соли; константа ионизации уксусной кислоты 1,8-10";'.
9. Найдите pH раствора, содержащего 3 мл 6А NH4OH и 5 г МЬС! в 400 .мл.
Предполагается, что соль полностью ионизирована и что константа
ионизации основания 1.8 • I0-5.
10. Произведение растворимости Fei(OHh равно 1,1 • 1(НВ. Определите ве-
личину pH раствора, ниже которой I .иг Fe’” не будет осажден
в виде гидроокиси. Предполагается, что ]Н’ ИОН'] = 1<Г14.
11. Вычислите pH: a) 0.0028А NaOH; б) 0,028А СНзСООН и в) 0.028А
NH4OH, принимая, что сильное основание полностью ионизировано и
что константы 'ионизации уксусной кислоты и аммиака равны прибли-
зительно 1.8- 10-5. Предполагается, что [Н’ ][ОН'] = 10~14.
12. Раствор содержит 200 мг Си' ’. 200 мг Fe’’’. 150 .мг Сг в виде СпО-
И он является ЗА по И’. Объем раствора 400 м.г, HeS пропускается
в него не более, чем нужно для завершения всех химических реак-
ций. Напишите уравнения реакций, выражающие все происходящие
286
при этом превращения и вычислите нормальную концентрацию Н'
после происшедшего осаждения и восстановления.
13. Напишите уравнения, показывающие действие H.'S на KMnOi, К2СГ2О7 и
FeCh в кислом растворе.
Группа алюминия
1- Напишите в виде таблицы схему анализа группы алюминия.
2. Напишите полные уравнения реакций: а) две фазы воздействия НС1 на
NaAlOs; б) две фазы воздействия НС1 на NaHZnO’; в) Сг’’’4-
Ч-NaBiOa-Н Н’->; г) СгзОт" + HsS + Н'д) Zn ’ ’ 4-из'быток Гх'НЮН
е) Сг’“ + ОН' 4- NasOs ->.
3. Допишите уравнения: a) NaAlO» + HNOs (1 эквивалент); б) Х’аАЮг
+ HNOs (в избытке); в) Со<МОз).' + А1(\'Оз.)з <выс\шивание и прока-
ливание); г) NaHZnO» + НХОз (1 эквивалент); д) NaHZnOj + HNO-(
(в избытке).
4. Известна ли вам гидроокись, которая, не образуя комплексной аммиачной
соли, растворяется в избытке аммиачного раствора и не растворяется
в NaOH? Может ли гидроокись быть легко растворимой в растворе
NaOH и почти не растворимой в избытке NHiOH?
5. Дано 500 мг Сг в виде хромата в присутствии избытка НС1. Сколько мл
сернистой кислоты уд. веса 1,04, содержащей 10% по весу SOs, по-
требуется для восстановления СгОд" до Сг’’’?
6. К нейтральному раствору, содержащему 150 лг Ag. 200 .v,1 Cd и 250 да
Мп в виде МпО/ было прибавлено 5 мл 6N HNO-! и 5 мл 1/V рас-
твора NH4CI. Осадок был отфильтрован и фильтрат был насыщен H?S.
а) Напишите уравнения всех реакций, имевших при этом место,
равно как и реакций, происшедших по прибавлении аммиака к филь-
трату, из которого H’S был удален кипячением, б) Вычислите сколько
мл GN NHiOH нужно прибавить для точной нейтрализации фильтрата
от сульфидного осадка?
7. а) Может ли NH4AIO2 существовать в присутствии воды? Чго случится
если его кипятить с водой? Уравнение, б) Если при анализе аммиак
не дает осадка до добавления (NH4)2S для осаждения групп Fe и А1,
какие элементы можно считать 'отсутствующими?
8. а) Напишите уравнения реакций взаимной превращаемости СгО«" и
СпОт". б) Назовите четыре восстановителя, действующих «а СгО«"
в кислом растворе. Иллюстрируйте реакции восстановления уравне-
ниями.
9. Почему при осаждении А! избытком NH4OH не осаждается Сг? Почему
не осаждается цинк? Почему вредно 'прибавление большого избытка
NH4OH? б) Каковы цвета растворов КзСгзО-, Сг(СНзСОО)з, NaeCrCX?
в) Что называется адсорбцией? Какая реакция, применяемая для от-
крытия А1, может иллюстрировать это явление?
10. Дано 520 мг Сг в виде хромата. Сколько мл 0,125 1У раствора SnCh
нужно взять для реакции с ними в присутствии НС1?
Группа железа
1. Дан раствор, содержащий KMnCh, FeCh и Zn(NOs)2. Напишите уравне-
ния реакций, показывающих, что происходит при каждом из ниже-
следующих этапов анализа:
а) раствор после добавления NH4CI был насыщен H2S; б) по удале-
нии избытка H’S фильтрат от «а» был обработан NH4OH; в) раствор,
не будучи отфильтрован, был обработан (NHi).’S.
2. Допишите уравнения следующих реакций: a) Fe” ’ + СНзСОО'ф Н2О
!б) Fe ’ ’ + NaOH ф NasOs-* ; в) Мп ’ ’ 4- NaOH ф Na^O» -*; г) Ain’ ’ ф
ф Na'BiOs 4- Н ’ .
3. Опишите оловянный метод удаления HO’Oi, применяемый вместо метода
основного ацетата.
4. Как относятся Fe’ ’ и Fe” ’ к [Fe(CN)e]'"', [Fe(CN)e]"' и CNS'?
287
5. Если железо отсутствует и раствор содержит 0,248 г Р в виде фосфата,
сколько мл 1N раствора Fe(NOa)3 нужно прибавить, чтобы воспре-
пятствовать осаждению фосфатов щелочных земель при нейтрали-
зации?
6. Если константа ионизации СНзСООН равна 1,8 • 10Ц вычислите концент-
рацию Н’ в молях на литр: а) в 0,\N растворе СНзСООН и б) в 250 мл
раствора, содержащего 6.0 г СНзСООН (мол. в. 60) и 16,4 г
CHsCOONa • ЗНзО (мол. в. 136).
7. Допишите уравнения следующих реакций:
а) МпОз • №0 + НКОз 4- Н»Оз; б) Со(ОН)з 4- НХ’Оз + НзОз; в) МпО/ +
+ Н20з 4- НХ'Оз: г) ВЮз 4- НХОз + Мп' '; д) Мп’ ' 4- НСЮз; е) Fe' " +
4- избыток NHiOH.
8. Укажите условия, которые более всего могут благоприятствовать по-
явлению Zn в группе Fe. Какое возможно дать этому объяснение?
&. Нейтральный раствор содержит 50 мг Ag', 200 .кг Cd'' и 250 лг Мп
в виде МпО/; к нему прибавлено 5 мл 6N HNOs и 5 мл 1А рас-
твора NHjCI и образовавшийся осадок отфильтрован. Фильтрат раз-
бавлен до 100 мл и насыщен HaS. Сколько мл 6N NH'.OH нужно при-
бавить до нейтральной точки? Напишите уравнения реакций для
каждого компонента смеси.
Никель, кобальт и др.
1. Как приготовляется Н-S для лабораторий? Как можно было бы приго-
товить HaS из пирита?
2. Напишите уравнения нижеприводимых реакций:
a) Ni и диметилг.тиоксим; б) Со и нитрит натрия; в) перл буры и
СоО; г) C0CI2, KCN и Вг в присутствии КОН; д) та же реакция
с NiCk.
3- Дайте в виде таблицы ход анализа группы Fe (включая отделение Ni и
Со) в отсутствие фосфата; укажите цвета, формулы и растворимость
всех тех веществ, которые важны для их идентификации.
4. Что произойдет с Zn(NOs)2 и Co(NOp2 при их раздельном прокаливании?
Что происходит при контрольной реакции на цинк?
5. Напишите уравнения, показывающие превоащения Со в Со(ОН)з,
K3[Co(NO2)e] и K4rLCo(CN)e]. Как ведет себя Ni при действии на него
тех же реактивов?
6. Если осадок, содержащий FeS, MnS, NiS и CoS, будет анилизирован по
ходу анализа, данному для группы II, где будут обнаружены Fe, Мп,
Ni и Со?
7. Если Cu. Bi, Zn и Cd не были предварительно осаждены, какую помеху
создадут они при анализе группы III?
ГРУППА IV. ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ И МАГНИЙ
КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, МАГНИЙ
Все металлы группы щелочных земель двухвалентны; они тя-
желее воды и медленно разлагают ее мри обыкновенной темпе-
ратуре, выделяя водород и образуя трудно 'растворимые гидро-
окиси, водный раствор которых имеет сильнощелочную реак-
цию. Соли их большею частью бесцветны и весьма мало
растворимы в воде. Галоидные соединения, нитраты, нитриты и
ацетаты в воде растворимы. Карбонаты не растворяются в воде
и разлагаются при прокаливании на двуокись углерода и белую
неплавкую, сильно светящуюся окись:
СаСО'з СаО -Ц СОз.
Карбонат стронция менее легко разлагается, чем карбонат
кальция, карбонат же бария теряет двуокись углерода только
288
при белом калении; его окись при накаливании обладает мень-
шей силой свечения.
Весьма трудно растворимы сернокислые и щавелевокислые
соли. Из сернокислых солей наиболее трудно растворима барие-
вая, наиболее легко — кальциевая, а из щавелевокислых солей
наименее растворима кальциевая соль. Растворимость стронцие-
вых солей занимает среднее место между солями бария и каль-
ция, как это и следовало ожидать, так как свойства элементов
являются функциями их атомных весов, а по атомному весу
стронций занимает именно это место. Галоидные соли летучи и
окрашивают несветящееся газовое пламя в характерные цвета.
Щелочноземельные металлы образуют окиси состава RO и
перекиси состава RO2; последние при действии на них кислот
дают перекись водорода и соли, отвечающие окиси RO:
RO2 + 2НС1 -+ Н2О2 + RCI2.
Магний по своим свойствам примыкает к этой группе
больше, чем к группе щелочных металлов. Он может быть оса-
жден совместно со щелочными землями при прибавлении к кон-
центрированному раствору их группового осадителя—карбоната
аммония с равным1 объемом спирта.
Кальций Са. Ат. в. 40,08. Ат. н. 20
Плотность 1,55. Т. пл. 810°. Т. кип. 1712°.
Нахождение в природе. Кальций очень распространен в природе. Огром-
ные залежи его находятся во всех осадочных образованиях в виде карбо-
ната (известняк, мрамор, мел). Углекислая соль СаСОз диморфна: она кри-
сталлизуется в фюрмах ромбоэдрической системы, как кальцит или из-
вестковый шпат, in ib формах ромбической системы, как арагонит. Далее,
значительные массы кальция встречаются в виде сернокислой соли то в
форме моносимметрически кристаллизующегося гипса CaSOi 2Н»О, то в
форме безводной сернокислой соли, как ангидрит CaSOi (ромбической си-
стемы). Встречается он также в виде фтооистого соединения — плавикового
/С1
шпата CaF’ правильной системы; в виде апатита ЗСав(РО4)г • Са б гек-
F
сагональной системы, затем в виде многочисленных силикатов, из которых
назовем моноклинический волластонит CaSiOs и триклинический анортит
CaAbJisOs. (
Двукальциевый силикат Ca^SiOi, искусственно приготовленный Ле-Ша-
телье (Le Chatelier), являющийся часто составной частью шлаков домен-
ных печей и цементов 'Высокого обжига, при охлаждении рассыпается в
тонкий порошок вследствие внутримолекулярной перегруппировки.
Кальциевые минералы являются главными представителями важных
минералогических изоморфных групп.
Группа кальцита
(гексагональн. система)
Кальцит СаСОз
Магнезит MgCOs
Доломит СО3
Сидерит FeCOs
Цинковый шпат ZnCOs
Марганцовый шпат МпСОз
19 Зак. 982. Тредвелл-Голл, т. I.
1руппа арагонита
(ромбич. система)
Арагонит СаСОз
Стронцианит SrCOs
Витерит ВаСОз
Церуссит РЬСОз
289
Группа ангидрита
(ромбич. система)
Ангидрит CaSOi
Целестин SrSOi
Барит BaSOi
Англезит PbSOi
Группа апатита
(гексагональн. система)
Апатит 'SCasfPOth • Ca(Cl,F)->
Пироморфит ЗРЬзСРОАг • PbCh
Миметизит 3Pbsi(AsO4)2 PbCla
Ванадинит ЗРЬз(УО4)г > PbCk>
Свойства. Металлический кальций в чистом виде серебристобелого цвета.
Он окисляется на воздухе, образуя гидроокись кальция Са(ОН)? и карбонат
кальция СаСОз. Разлагает воду с выделением водорода и образованием
гидроокиси. С ртутью он образует амальгаму. Небольшие количества каль-
ция приплавляются иногда к свинцу для придания ему твердости. Металличе-
ский кальций получается при электролизе расплавленного СаСБ.
Окись кальция СаО, или негашеная известь, легко реагирует с водой,
выделяя большое количество тепла (гашение извести). Гидроокись (гаше-
ная известь) значительно менее растворима в воде, чем гидроокиси бария
и стронция; она образуется при прибавлении гидроокиси щелочного металла
к концентрированному раствору кальциевой соли. Гашеная на воздухе
известь содержит карбонат кальция.
Перекись кальция СаСБ • 8ГБО получается при добавлении к гидроокиси
кальция HsOs или Na«Os. Хлорид и нитрат кальция растворимы в абсо-
лютном спирте или в смеси равных частей спирт;:' и эфира; Из соответ-
ственных солей бария и стронция только хлорид последнего растворяется
в спирте.
Нитрат кальция значительно более растворим в концентрированной
азотной кислоте, чем нитрат бария, а хлорид его значительно более рас-
творим з соляной кислоте, чем хлорид бария.
Реакции мокрым путем
L Аммиак в отсутствие углекислоты не даст осадка; при
стоянии же на воздухе поглощается углекислота, и тогда по-
является помутнение от образовавшейся углекислой соли.
2. Углекислый аммоний или другой какой-либо растворимый
нормальный карбонат осаждает белый карбонат кальция. Осадок
сначала объемист и хлопьевиден, но скоро становится кристал-
лическим, особенно при нагревании:
Са* *- 4- СО/'-» СаСО;!. (])
Осадок заметно растворим в водных растворах аммонийных
солей сильных кислот:
СаСО3 4- 2NH4* ->Т;Г ’ 4- 2NH:i -f- Н2О + СО». (И)
Если осадителем служит углекислый аммоний, то уравне-
ние (11) по существу своему представляет собой процесс, обрат-
ный тому, который выражен уравнением (I), и закон действия
масс показывает, при каких условиях реакция может пойти по
тому или другому направлению. Избыток карбоната аммония
будет благоприятствовать течению реакции по уравнению (1),
а кипячение с большим количеством аммонийной соли, напри-
мер хлористого аммония, будет способствовать протеканию
реакции по уравнению (II).
Карбонат аммония — 'вещество неустойчивое (стр. 325). Продажный кар-
бонат аммония представляет собой смесь из приблизительно эквивалент-
ных количеств бикарбоната ам.мония NrhHCO.r и карбамата аммония
290
NH4CO2NH2; последняя соль соответствует нормальному карбонату аммония,
лишенному одной молекулы1 воды. Карбамат кальция вполне растворим
в воде, но при нагревании с водой при 60° он переходит в нерастворимый
карбонат кальция. Для приготовления реактивного раствора углекислого
аммония пользуются вместо воды 6N раствором аммиака; последний пре-
пятствует гидролизу соли и превращает бикарбонат в карбонат аммония.
Бикарбонат кальция растворим в воде, так что любая кислота, которая
диссоциирует в большей степени, чем НСОз', будет растворять карбонат
кальция:
СаСОз + Н' щ С.Г • Д НСОз'.
Таким образом, уксусная кислота легко растворяет карбонат кальция. Ки-
пячение благоприятствует реакции растворения, так как НСОз' также нахо-
дится в равновесии с Н' и НзСО», а эта последняя с НЮ и СОг:
НСОз' + Н* —>НзСОз -> НзО + СОз,
причем двуокись углерода может быть полностью удалена при 100° (стр. 43).
Осаждение карбоната кальция из кипящего разбавленного раствора,
содержащего аммонийные соли, всегда более или менее неполно по причи-
нам, изложенным только что выше; но осаждение может быть практически
полным, если его производить из холодного, концентрированного1 раствора
в присутствии значительного количества спирта.
3. Щавелевокислый аммоний дает на холоду в нейтральных
или щелочных растворах трудно фильтрующийся крайне мелко-
кристаллический осадок; при нагревании же образуется легко
фильтрующийся крупнокристаллический осадок щавелевокислого
кальция моноклинической системы:
СОО' сооч
; -ф Са" гиг / Са
СОО' СОО7
Оксалат кальция -практически не растворим в воде и уксусной
кислоте, но легко растворим в минеральных кислотах:
СаС3О4 ф- 2Н’ ю Са' ’ + Н2С2О4.
Оксалат кальция в противоположность карбонату кальция не раство-
ряется в уксусной кислоте ио следующим причинам: 1) произведение рас-
творимости оксалага кальция равно приблизительно 2-10“®, карбоната же
кальция 1.7- 10" (cip. 37). что указывает ла несколько ббльшую раствори-
мость в воде карбоната, чем оксалата; 2) константа ионизации НСОз'
равна 5 • Кг13, тогда как константа и< низании НОО/ равна 6,1.10-5, а уксус-
ной кислоты 1.7 • этого достаточно для объяснения малого растворяю-
щего действия уксусной кислоты па оксалат кальция. Чтобы легко рас-
творить оксалат кальция, необходимо пользоваться кислотой, достаточно
сильной, чтобы подавить ионизацию первого водородного иона щавелевой
кислоты, для которого константа ионизации равна 6,5 10"2; 3) отсутствие
компонента, отличающегося своей летучестью, как это имеет место ® слу-
чае карбоната, не может способствовать реакции растворения оксалата.
Аммиак снова осаждает пз минера,тьнокне.того раствора оксалат каль-
ция, так как он нейтрализует как избыток водородных ионов, гак и щаве-
левую кислоту, которая образуется в растворе. Оксалат кальция при ки-
пячении с раствором карбоната натрия легко превращается в карбонат
кальция:
СаСзОт + СОз''Г± СаСОз + СзОз”.
Эта реакция протекает слева направо, если имеется избыток СОз", не-
смотря на то, что оксалат кальция несколько менее растворим, чем карбо-
нат кальция. Это согласуется с законом действия масс (стр. 12).
При избытке СзО/'-ионов реакция протекает налево.
291
4. Серная кислота или щелочные соли ее выделяют из кон-
центрированных растворов осадок моноклинических игл. Эта
реакция пригодна для микрохимического открытия кальция:
Са‘ ‘ + SOj"-^ CaSOi.
Однако осаждение может быть полным, если раствор содержит
около 75% этилового спирта.
100 г воды растворяют при 40° 0,214 г CaSOi-2Н2О, но в том же
объеме спирта растворяется меньше 1 мг. В присутствии небольшого из-
бытка сульфат-ионов растворимость сульфата кальция уменьшается, но от-
ношение последнего к водородному иону такое же, как и карбоната каль-
ция. Гидросульфат кальция значительно более растворим, чем нормальный
сульфат кальция, и любая кислота, способная подавить ионизацию HSOi',
действует растворяющим образом на CaSOc Такое действие может ока-
зать сама серная кислота или другая сильная кислота.
Сульфат кальция растворяется также в концентрированном растворе
сульфата аммония вследствие образования комплексного аниона:
CaSCh + (NH^SOi-* (NH4)2[Ca(SO4)2j.
5. Гипсовый раствор не дает никакого осадка в растворах
кальциевых солей (отличие ют стронция и бария).
6. Фосфорнокислый натрий дает в нейтральных растворах
белый хлопьевидный осадок кислой фосфорнокальциевой соли:
Са' ’ + НРОГ-> СаНРОь
При одновременном же прибавлении аммиака осаждается трехметалли-
ческая кальциевая соль ортофосфорной кислоты:
HPOi" + ОН'-> Н2О + РО4'";
ЗСа” + 2РО4"'-> Саз(РО4)г.
Оба эти фосфата кальция растворяются под влиянием водор.одных ионов.
Таблица на стр. 28 показывает, что даже уксусная кислота подавляет иони-
зацию Н2РО4' до такой степени, что она будет оказывать слабое раство-
ряющее действие на СаНРО< и Саз(РО4)г. Однако в. присутствии раствори-
мого ацетата уксусная кислота заметным образом .не растворяет Саз(РО4)з.
Из раствора, полученного растворением фосфата кальция в кислоте, аммиак
Выделяет трехметаллическую соль.
7. Хромовокислые щелочи в разбавленных растворах не дают
никакого осадка (отличие от бария). В концентрированном же
растворе соли кальция по прибавлении к нему хромата калия
медленно образуется1 через некоторое время или же тотчас по
прибавлении двух или трех объемов спирта осадок CaCrCU •
• 2НгО. Осаждению благоприятствует аммиак; уксусная кислота
препятствует ему.
8. Абсолютный спирт или смесь равных частей абсолютного
спирта и эфира растворяют нитрат и хлорид кальция.
Все расплывающиеся соли, за исключением карбоната калия, рас-
творяются в абсолютном спирте. Все остальные -соли вообще не
растворимы или трудно растворимы в абсолютном спирте.
Исключением из этого правила является хлорная ртуть, кото-
рая не расплывается, но растворимость ее в спирте значительно
большая, чем в воде.
292
9. Фтористый барий осаждает фторид кальция СаРг. Этим
реактивом можно обнаружить 0,8 мг кальция в 10 мл раствора.
10. Ферроцианид аммония дает с кальциевыми солями белый
кристаллический осадок Ca(NH4)a[Fe(CN)6]. Если’ каплю иссле-
дуемого раствора смешать с несколькими каплями концентриро-
ванного раствора (NH4)4[Fe(CN)6] и с каплей спирта, то по-
является кристаллический осадок уже при наличии 0,025 мг каль-
ция или муть, когда количество последнего меньше 0,05 у
11. Озазон диоксивинной кислоты
C6H5NH — N = С — СООН
I
C6H5NH — N = С — СООН
дает в водных растворах щелочноземельных солей хлопьевид-
ный осадок, в котором водородные атомы двух карбоксильных
групп замещаются щелочными землями. В качестве реактива
пользуются натриевой солью озазона диоксивинной кислоты
(в твердом виде), посредством которой возможно открыть 0,01 у
кальция. С помощью этой реакции удается даже открыть каль-
ций в капле смеси из 1 ч. водопроводной и 30 ч. дестиллиро-
ванной воды1 2. Эту реакцию следует выполнять на черной ка-
пельной пластинке или на черном часовом стекле, прибавляя
к капле исследуемого раствора крупинку реактива.
12. Вода разлагает карбид, фосфид (фосфористый кальций)
и нитрид (азотистый кальций) кальция при обыкновенной тем-
пературе следующим образом:
а) Карбид
СаСа + 2НОН -+ Са(ОН)г. + С2Н2.
ацетилен
При этом выделяется ацетилен, пахнущий чесноком газ3; при
пропускании в аммиачный раствор хлористой меди он дает
яркокрасный осадок ацетиленистой меди; последняя в сухом со-
стоянии очень сильно взрывается от удара, трения или нагре-
вания, но во влажном состоянии она совершенно безопасна.
б) Фосфид
СазРа + 6НСН ->ЗСа(ОН)2 + 2РНз.
Выделяющийся при этом фосфористый водород имеет чес-
ночный запах; он воспламеняется сам собою, потому что всегда
1 По Feigl u. Pave 1k а реакция на кальций с ферроцианидом зна-
чительно чувствительнее, если ее выполнять в пробирке, так как трудно
заметить небольшую муть в каплях из-за малой толщины слоя. См. Mikro-
chemie 2, 85 (1924). Ред.
- См. Ф а й г л ь, Капельный анализ, стр. 312. Ред.
3 Чистый ацетилен ,не имеет запаха. Чесночный залах обусловливается
следами фосфористого водорода. Почти всякий карбид кальция содержит
следы фосфида кальция, который при действии воды выделяет фосфори-
стый водород с чесночным запахом.
293
содержит небольшие количества жидкого самовоспламеняюще-
гося фосфористого водорода (Р2Н.1).
в) Нитрид
Саз№ + 6Н0Н -> ЗСа(ОН)2 + 2NH3.'
Реакции сухим путем
Кальциевые соединения при накаливании с содой на угле
перед паяльной трубкой дают карбонат, который затем распа-
дается, образуя белую неплавкую окись. Немного окиси обра-
зуется при прокаливании карбоната в фарфоровом тигле на бун-
зеновском пламени средней величины. Если охлажденный оста-
ток облить небольшим количеством воды, то образуется Са(ОН)2,
который окрашивает фенолфталеин в красный цвет (отличие от
карбонатов стронция и бария, которые в фарфоровом тигле на
бунзеновском пламени средней величины не подвергаются за-
метному разложению).
Летучие соединения кальция окрашивают пламя бунзеновской
горелки в кирпичнокрасный цвет.
Пламенный спектр. Оранжево-желтая двойная полоса (620,3; 618,2 mjx)
и желто-зеленая полоса (554,4; 551,8 пцх); обе эти полосы принадлежат
окиси кальция. Если и пламя ввести хлористый кальций, смоченный соляной
кислотой, то получают целый ряд других полос, например 593,4 тн--
В фиолетовой части различается большей частью с трудом первая линия
главной серии 422,7 тр.
Стронций Sr. Ат. в. 87,63. Ат. н. 38
Плотность 2,6. Т. пл. 752-. Т. кии. 1639-"
Нахождение в природе. Стронций встречается всюду, где и кальций,
но большей частью в очень малых количествах. Настоящих стронциевых
минералов известно немного; важнейшие шз них: стронцианит ЗгСОз ромби-
ческой системы, изоморфный с арагонитом и целестин SrSOa ромбической
системы, изоморфный с баритом.
Свойства. Цвет '.металлического стронция принято считать серебристо-
белым, хотя по мнению некоторых авторитетных химиков он по цвету
напоминает латунь. Вероятно желтый оттенок его обусловливается приме-
сями. По своим химическим' свойствам он аналогичен кальцию. Получают
его электролизом водного раствора хлорида стронция с ртутным катодом;
образующуюся амальгаму нагревают в токе водорода для удаления ртути.
Можно получать его также путем прокаливания окиси с алюминием в ваку-
умной печи при 1000°. Гидроокись его более растворима в воде, чем гидро-
окись кальция, и требуется более высокая температура дня превращения
ее в окись. Гидроокись применяется в свеклосахарной производстве, а ни-
трат— для приготовления фейерверков и красных сигнальных огней.
Белая окись стронция SrO образуется при прокаливании гидроокиси,
карбоната или соли какой-либо органической кислоты, причем для этого
требуется более высокая температура, чем для соответствующих соединений
кальция. В 100 л/л воды растворяется около 0,7 г SrO. Перекись БгОг-вНгО
получается при действии на гидроокись перекиси водорода. Она мало рас-
творима в ваде или'в аммиаке, но легко растворима в кислоте пли в рас-
творе, содержащем хлористый аммоний.
Реакции мокрым путем
1. Аммиак действует так же, '.как и на соединения кальция.
2. Углекислый аммоний действует так же, как и на соединения
кальция.
294
3. Щавелевокислый аммоний действует так же. как и на
' соединения кальция, только щавелевокислый стронций не-
сколько растворим в уксусной кислоте.
4. Серная кислота (разбавленная) дает белый осадок серно-
кислого стронция:
SrCh + HeSCh-» 2НС1 +SrSO4.
z Сернокислый стронций значительно труднее растворим, чем
сернокислый кальций (6900 ч. воды растворяют при комнатной!
температуре 1 ч. SrSOj), но легче, чем сернокислый барий. Он
несколько растворим в кипящей соляной кислоте и .не раство-
рим в сернокислом аммонии. При кипячении с раствором угле-
кислого аммония или углекислой щелочи сернокислый стронций
превращается в углекислый:
SrSO4 + СОз" щБгСОз % SO/'.
5. Гипсовая вода дает спустя некоторое рщемя в нейтраль-
ных или слабокислых растворах осадок сернокислого стронция:
SrCi» 4- CaSO4->SrSO4 + СаС12.
6. Хромовокислые щелочи не выделяют осадка из разбавлен-
ных растворов (отличие от бария), только из очень концентри-
рованных растворов стронциевых солей осаждается хромовокис-
лый стронций. Хромат стронция значительно труднее растворим
в разбавленном спирте, чем в воде; так 100 мл 53%-ного по
объему спирта растворяют при комнатной температуре 0,002 г
SrCrO4; 100 мл 29%-него спирта растворяют при тех же усло-
виях 0,0132 г SrCrO4 Ч Осадок растворяется в уксусной кислоте.
7. Абсолютный спирт. Азотнокислый стронций не рас-
плывается на воздухе и не растворяется в абсолютном спирте.
Хлористый стронций слабо расплывается и безводная соль
едва растворяется в абсолютном спирте: напротив, 1 ч. водной
соли (SrCk • 6H2O) по Фрезениусу (Fresenius)1 2 растворяется
в 116,4 ч. холодного и 262 ч. кипящего абсолютного спирта.
/ 100 ч. 66%-ного спирта при 18J растворяют 49,8 ч. водной
’ соли.
8. Сульфит натрия осаждает сульфит стронция из нейтраль-
i ного или уксуснокислого раствора; осадок растворяется в соля-
ной кислоте.
СО—СО—С—ONa
9 Родизоиат натрия3 I II образует в нейтральных рас-
СО—СО—C-ONa
творах буровато-красные осадки с Ва и Sr. Посредством капельной реакции
можно открыть 3,9 у Sr, превратив барий в нерастворимый ВаСгОт
1 W. Fresenius u. F. Ruppert, Z. anal. Chem. 30, 667 (1891).
2 Ann. 59, 127 (1846).
a Feigl, Mikrochemie 2, 187 (1924).
295
Выполнение- Фильтровальную бумагу пропитывают хроматом калия,
смочив ее насыщенным раствором последнего и затем высушив. На приго-
товленную таким образом бумагу наносят каплю исследуемого раствора и
спустя минуту смачивают пятно каплей 5%-ного раствора родизоната.
Реакции сухим путем
Стронциевые 'соединения при прокаливании на угле перед
паяльной трубкой ведут себя аналогично соединениям кальция.
Летучие стронциевые соли окрашивают несветящееся газовое
пламя в карминовокрасный цвет.
Пламенный спектр. Ряд линий в красной и оранжево-желтой и одна
в синей частях спектра. Никаких полос в зеленой части. В красной части
686,3; 674,7; 662,8 и 649.9 гпр.; в оранжево-желтой 646,5; 635,1 и 606,0 т,и.;
в синей 460,7 nip..
Барий Ва. Ат. в. 137,36. Ат. н. 56
Плотность 3,5. Т. пл. 850э. Т. кип. 1140°
Нахождение в природе. Барий встречается подобно стронцию всюду,
где находится кальций, но только в малых количествах. Важнейшие барие-
вые. минералы: витерит ВаСОз ромбической системы, изоморфный с араго-
нитом; барит, или тяжелый шпат, Ва8О< ромбической системы, изоморфный
с ангидритом. Упомянем еще о силикате бария-алюминия-—гармотоме
BaAhHaSioOis • 41-ЪО моно-симметрической системы, относящемся к классу
цеолитов.
Свойства- Металлический -барий обычно характеризуется как металл
серебристобелого цвета, хотя по мнению некоторых наблюда!елей он об-
ладает золотистожелтым цветом. Концентрированные растворы бариевых
солей дают осадок хлорида бария с концентрированной соляной кислотой
и осадок нитрата бария -с концентрированной азотной кислотой. Поэтому
нерастворимые -соли бария более легко растворяются в разбавленных со-
ляной и азотной- кислотах, чем в концентрированных. Растворимые соли
бария ядовиты.
Тонко измельченный сульфат бария применяется -в виде прочной белой
краски, выгодно отличающейся от свинцовых белил тем, что она не тем-
неет на воздухе, содержащем- сероводород. Сульфат бария, -кроме того,
входит в состав литопонных красок. Небольшие количества металлического
ба-рия находят применение в электронных лампах, а сплав бария с нике-
лем применяется в зажигательной системе двигателей внутреннего сгорания.
Металлический барий может быть получен путем электролиза распла-
вленного хлорида бария или электролизом водного раствора хлорида с при-
менением ртутного катода; образующаяся амальгама разлагается при на-
гревании в атмосфере водорода.
При нагревании окиси бария до 500—600° в атмосфере кислорода об-
разуется перекись бария ВаОд которая при более высоком нагревании раз-
лагается на окись бария и кислород.
Гидроокись бария более растворима в воде, чем гидроокиси -других
щелочноземельных металлов; она плавится без разложения при красном
калении. В 100 мл воды при комнатной температуре растворяется около
3 г гидроокиси бария и около 100 г — при температуре кипения. На воз-
духе растворы гидроокиси бария'мутнеют за счет поглощения СО.- и обра-
зования 'ВаСОз. Окись может быть получена при прокаливании гидроокиси,
карбоната, нитрата или солей органических кислот, однако -при значи-
тельно более высокой температуре, чем окиси кальция и стронция.
Так, при количественном определении кальция легко удается получить
окись кальция из оксалата путем прокаливания его при 900°; при прокали-
вании же оксалата бария в этих условиях образуются только следы окиси.
296
Реакции мокрым путем
1. Аммиак и углекислый аммоний действуют так же, как и на
соединения кальция и стронция.
2. Щавелевокислый аммоний действует так же, как и на со-
единения кальция и стронция, с той лишь разницей, что обра-
зующийся щавелевокислый барий значительно легче растворим
в воде (1 гв 2,6 л холодной воды); он вполне растворим в ки-
пящей уксусной кислоте.
3. Фосфорнокислый натрий образует в нейтральных или
щелочных растворах солей бария белый осадок фосфата бария,
как и в растворах солей стронция и кальция. По Фрезениусу
ВаНРОг превращается лишь частично в Ваз(РО4)2 после прибав-
ления аммиака.
4. Хромовокислые щелочи осаждают из нейтральных раство-
ров бариевой соли желтый хромовокислый барий (отличие от
кальция и стронция):
Ва"' + CrOf'^ BaCrOj.
Табл. 2 (стр. 24) показывает, что ионизация НСгО/ в O,1W растворе
составляет от 0,1 до 0,2%. <В присутствии более сильной кислоты иониза-
ция ее уменьшается и равновесие:
И’ + СгО4%ГНСгО4' и гнСгСЬ'дД НЮ + СпОт"
сдвигается в правую сторону. Однако конечный результат равновесия за-
висит также от концентрации CrOi" в растворе. В насыщенном водном
растворе хромата стронция имеется достаточно СгО4"-ионов, чтобы при
добавлении к раствору небольшого количества уксусной кислоты имело
место образование в большом количестве HCrO-i', и таким путем легко вос-
препятствовать осаждению ионов стронция даже в кояичестве 0,5 г. С дру-
гой стороны, хромат бария настолько менее растворим, что необходим
большой избыток уксусной кислоты, чтобы растворимость его была
сколько-нибудь заметна. Таким образом возможно отделение небольшого
количества бария от весьма большого количества стронция посредством
CrOi" в присутствии достаточного количества уксусной кислоты.
Если в растворе находится более сильно ионизирующая кислота, на-
пример соляная, то барий не осаждается в виде хромата, но при добавле-
нии ацетата натрия цтр. 65) концентрация водородных ионов может быть
настолько понижена, что делается возможным осаждение даже малых ко-
личеств бария в виде хромата.
5. Разбавленная серная .кислота выделяет даже из очень раз-
бавленных растворов осадок сульфата бария:
Ва"" + SOi" -> BaSOj.
Согласно табл. 8 (стр. 37) в 1 л воды растворяется около 2.5 мг суль-
фата бария. В небольшом избытке серной кислоты он еще менее раство-
рим вследствие действия, оказываемого общим ионом (стр. 35). Как и в слу-
чае сульфатов кальция и стронция, присутствие избытка- водородных ионов
повышает его растворимость вследствие образования кислого-сульфата. Это
повышение растворимости заметно уже в присутствии соляной и азотной
кислот, но так как растворимость сульфата бария очень мала, то-Для пере-
хода значительного количества его в раствор требуется -воздействие на него
горячей -концентрированной серной -кислоты. Разбавление такого раствора
водой снова вызывает выпадение сульфата бария:
BaSO4 + HzSCh^ Ba(HSO4)2.
297
При кипячении с концентрированным раствором карбоната натрия
сульфат бария согласно закону действия масс частично превращается в бо-
лее растворимый карбонат бария:
BaSO4 + СО?."У—ВаСО:;-)- SO)".
Для полного превращения сернокислого бария в углекислый нужно
было бы несколько раз кипятить его с раствором соды и затем фильтро-
вать, повторяя это до исчезновения в фильтрате реакции на серную кис-
лоту. Превращение тем полнее, чем концентрированнее раствор соды. Выс-
шая степень концентрации соды достигается при сплавлении сухого серно-
кислого бария с большим количеством безводной соды-
Чтобы количественно перевести в раствор нерастворимый сульфат ба-
рия, лучше(®сего поступать следующим образом. Смешивают сухой сульфат
бария с четырех-игестикратным количеством безводного карбоната- натрия
и смесь сплавляют -в платиновом тигле. По охлаждении плав кипятят с не-
большим количеством воды до тех пор, пока не произойдет полное его
распадение, после чего фильтруют. Остаток промывают горячим нормаль-
ным раствором карбоната натрия до исчезновения в фильтрате -реакции на
сульфат-ионы и только после этого приступают к промыванию небольшим
количеством воды. Полученный таким образом карбонат бария растворяется
в разбавленной соляной, азотной или уксусной кислотах.
Если бы продукт сплавления обрабатывался значительным количеством
воды или осадок промывался сразу очень горячей водой, то растворенный
сульф-ат натрия реагировал бы с нерастворенным карбонатом- бария, обра-
зуя менее растворимый сульфат бария. Чтобы воспрепятствовать этому,
пользуются согласно закону действия масс достаточно большой концентра-
цией карбоната натрия.
6. Кремнефтористоводородная кислота дает кристаллический
белый осадок 1кремнефтористо-водородно!го бария:
HcSiFe + ВаС1» -+ 2НС1 -% BaSiFe.
Для полного выделения осадка необходимо продолжительное
время. Кремнефтористоводородная соль бария трудно раство-
рима в воде и разбавленных кислотах и не растворима в спирте.
7. Абсолютный спирт не растворяет ни хлорида, ни ни-
трата бария (обе эти соли не расплываются). 100 ли 66/'о-ного
спирта растворяют при 18е 3,3 г хлорида бария (ВаС1г • 2НгО).
8. Концентрированная соляная и азотная кислоты осаждают
из достаточно концентрированных растворов бариевых солей
хлористый или азотнокислый -барий.
9. Ферроцианид калия дает с концентрированным -раствором
бариевой -соли белый кристаллический осадок железистосинеродистокислой
соли- бария И калия Bai«Fe(CN)«l • ЗНаО. В присутствии аммонийных солей
состав осадка вариируен Осадок более растворим, чем соответственная
соль кальция.
10. Сульфит натрия образует белый осадок сульфита бария ВаЗОз, рас-
творимость которого в уксусной кислоте или в разбавленной соляной кис-
лоте невелика.
11. Родизоиат натрия Na-jCoOe (см. стр. 295). На фильтровальную бумагу
помещают каплю исследуемого нейтрального или кислого раствора и смачи-
вают влажное пятно каплей 3%-ного раствора родизон-ата натрия. Если при
этом бурое пятно не появляется, заключают об отсутствии бария и стронция.
В случае появления бурой окраски пятна смачивают последнее разбавлен-
ной соляной кислотой, причем превращение бурого цвета пятна в красный
298
i указывает на присутствие бария; бурое же пятно, обусловленное строн-
’{ цием, полностью растворяется в кислоте.
* Примечание редактора. Цвет пятна может быть бурым или красно-
бурым в зависимости от количества бария. Открываемый минимум 0,25 т
бария, что отвечает предельной концентрации 1 200 000. Эта реакция дает
возможность открывать 0,53 у в присутствии 53-кратного количества строн-
ция 1. Однако ею можно пользоваться только в пределах группы щелочно-
земельных металлов, так как тяжелые металлы часто дают также окра-
шенные осадки. ’ А. К.
Реакции сухим путем
Бариевые соединения при накаливании с содой на угле перед
паяльной трубкой не дают подобно Са и Sr сильно светящейся
массы, потому что образующийся в данном случае углекислый
барий при температуре, при которой происходит накаливание,
не распадается на ССа и неплавкую окись, дающую характерное
свечение, а образует только несколько спекшуюся без заметного
разложения ‘массу.
Летучие бариевые соли окрашивают несветящееся газовое
пламя в желто-зеленый цвет. Сернокислая соль несколько ле-
туча только В' самом горячем пламени; в обыкновенном газовом
пламени появляется едва заметное окрашивание. Для получения
окраски сернокислую соль превращают в хлористую, для чего
небольшую порцию ее восстанавливают на платиновой проволоке
в верхнем восстановительном пламени в сернистое соединение;
последнее смачивают соляной кислотой (при помощи капилляра)
и затем вносят в пламя, причем ясно замечается характерное
окрашивание.
Пламенный спектр имеет много весьма интенсивно окрашенных зеле-
ных линий, более слабых в оранжево-желтой части спектра и одну синюю
линию.
Оранжево-желтая часть спектра (654.0 и 629.3 тц), (624,0; 617.9;
610,9 и 603,2 mix). Желтая линия 528,5 т/, желтая тройная линия (576.9,
572 и 564,8 юД. (Зеленые линии 553,5; 534.7; 524,3; 513,7 и 500.0 гл/. Синяя
линия 484.7 in/.
Магний Mg. Ат. вес 24,32. Ат. н. 12
Плотность 1.75. Т. пл. 651’- Т. кип. 1380'’
, Нахождение в природе. Соединения магния очень распространены в
; природе, важнейшие его минералы: .магнезит MgCOs гексагональной системы,
изоморфный с кальцитом; доломит СаМк(СОз)з; бруцит Mg(OH)2 гексаго-
5 вальнюй системы; карналлит MgCh • КС1 • 6Н2О ромбической системы; кизерит
t MgSOi-H’O моноклинической системы; горькая соль MgSOa • 7Н»О ромби-
1 ческой системы; шпинель MgAhOi правильной системы, изоморфная с маг-
' нитным железняком FesOi и хромитом РеСггОь Далее, магний встречается
в многочисленных силикатах. Так, почти все минералы оливиновой группы
содержат большие или меньшие количества магния. К этой группе при-
надлежат форстерит Mg-.-SiCh, монтичеллит CaMgSiOi и оливин. FeMgSiO-i
ромбической системы. Важным продуктом разложения оливиновых минера-
1 F е i g 1, Miki ochemie 2, 1S8 (1924); Файгль, Капельный анализ,
стр, 309.
299
лов является серпентин MgsHiSiaOs. Почти все минералы пироксен-амфи-
боловой группы, -производные энстатита MgSiOs, содержат -магний: авгит
MgAhSi-Oe; роговая обманка, изоморфная смесь MgsCaSiiOiz и 2(MgA12&'iOe)
и тремолит CaMgsSiiOia; все три минерала моноклинической системы. Раз-
новидностью тремолита является а-с-бест. обладающий тонковолокнистой
структурой. Морская пенка — силикат магния, состав которого HiMg^SisOio;
этот минерал -сходен с тальком H’MgsSiiOi», иногда называемым стеатитом
(жировиком). Магний встречается также в растительном царстве, вхо^я
в состав хло-рофила.
Свойства. Магний—-металл серебристобелого цвета; получается путе-м
электролиза расплавленного безводного хлористого магния. Большое при-
менение находит -сплав его с алюминием, обладающий высоким сопроти-
влением разрыву (на единицу веса), применяемый в самолетостроении и
для изготовления коромысел точных химических весов. Карбонатом магн-ия
пользуются- в больших размерах в качестве изолирующего материала для
покрытия паровых труб. Горькая соль MgSOi-yHaO находит применение в
медицине.
Магний очень медленно разлагает -воду с образованием окиси MgO,
мало растворимой в воде и переходящей -в гидроокись магния; малое ко-
личество -последней, находящейся в растворе, настолько сильно ионизиро-
вано, что раствор приобретает слабощелочную реакцию. Магний горит на
воздухе ослепительно белым светом с образованием окиси. При 300° металл
соединяется с азотом, образуя нитрид магния- MgaNs. который легко разла-
гается водой с выделением гидроокиси магния и аммиака:
MgsN2 + 6НОН -> 3Mg(OH)2 + 2NHs.
Почти все соли магния бесцветны, растворимы в -воде и имеют горький
вкус. Произведение растворимости гидроо-ки^и, карбоната, фосфата, арсе-
ната и арсенита настолько мало, что эти вещества могут рассматриваться
как нерастворимые. Сульфид, который может быть получен только сухим
путем, полностью разлагается водой на гидроокись и сернистый водород
(гидролиз). При выпаривании- водного раствора хлористого ма-гния на во-
дяной бане досуха и нагревании остатка (MgCIs • 6№О) до 106° или -выше
образуется основная соль, не раствор-имая в воде:
2MgCh + №0-* MgsOCh + 2НС1.
Если насыщенный раствор хлористого магния смешать с окисью маг-
ния, то происходит быстрое затвердевание смеси с образованием твердой
как камень массы, известной под названием магнезиального цемента, со-
стоящего из основного хлорида магния.
Магний образует только одну окись, производными которой являются
все его соединения. Эта окись, MgO, может быть получена -путем сжига-
ния металла- па -воздухе или путем прокаливания гидроокиси1, карбоната,
сульфата, оксалата- и т. п. Гидроокись, Mg(OH)2, по сравнению с гидрооки-
сями железа, алюминия и пр., значительно -более растворима и для своего
осаждения требует более высокой концентрации ОН'-ионов.
Реакции мокрым путем
1. Сильные основания, как гидроокиси натрия, калия, бария,
осаждают белый -студенистый осадок гидроокиси магния, при-
чем осаждение практически количественное в -отсутствие аммо-
нийных солей и-ли при -полном -.разложении последних путем ки-
пячения с избытком сильного основания (стр. 322):
Mg" +2OH'->Mg(OH)2.
Произведение растворимости гидроокиси -магния (стр. 38) равно при-
близительно 1,2 • 10~п при комнатной температуре. Насыщенный раствор в
чистой воде содержит -около 0,000085 моля или 0,005 г Mg(OH)s в I л.
В присутствии избытка ОН' растворимость гидроокиси магния еще больше
300
уменьшается, что является следствием действия, вызываемого общим ионом
(стр. 63); возможно при небольшом объеме раствора и применении малого
избытка реактива! снизить содержание магния в растворе до 1 мг и менее.
Осаждение гидроокиси магния посредством слабо ионизированной
гидроокиси аммония никогда не может быть количественным, а если рас-
твор уже содержит достаточный избыток аммоний-ионов, то осадок гидро-
окиси магния вообще не образуется. Больше того, при кипячении осадка'
гидроокиси магния с раствором аммонийной соли, например с хлористым
аммонием, осадок растворяется. Такое поведение гидроокиси магния обус-
ловливается тем обстоятельством, что ионизация гидроокиси аммония в
присутствии аммонийной соли (стр. 65) до такой степени подавляется, что
концентрация ОН'-иснов является недостаточной для достижения произведе-
ния растворимости гидроокиси магния.
Раньше неполнота осаждения магния гидроокисью аммония объясня-
лась предположением, что при реакции образуются комплексные соли
вроде NHpMgChJ или (NPKHMgCh], ио в настоящее -время это объяснение
оставлено >. С другой стороны, тормозящее действие аммонийных солей на
осаждение магний-аммоний-фосфата1 и гидроксихинолата- заставляют пред-
полагать возможность образования комплексных магниевых ионов.
2. Гипоиодиты щелочных металлов. Следующая реакция,
дающая возможность открывать 0,3 y магния в одной капле,
основана на образовании красновато-бурого адсорбционного
соединения гидроокиси магния с иодом.
Выполнение. К капле нейтрального или кислого исследуемого раствора,
находящегося на белой капельной пластинке, прйоавляют небольшую
каплю 1N раствора едкого натра и такую же каплю 1N раствора иода.
Перемешивают стеклянной палочкой и спустя I мин. прибавляют столько
едкой щелочи, чтобы раствор окрасился в бледножелтый цвет2.
3. Углекислый аммоний в отсутствие других аммонийных со-
лей осаждает основную соль (обыкновенно только при кипяче-
нии или после долгого стояния). Состав осажденной соли варьи-
рует с температурой и концентрацией раствора. Часто обра-
зуется следующая соль:
4Mg‘" + 4(NH4)2CO3 + НгО-> Mg4(CO3)3(OH)2 + СО2 + 8NHT.
Прибавление избытка карбоната аммония (стр. 104) и та-
кого же объема 95Я -ного спирта к холодному концентрирован-
ному раствору магниевой соли вызывает полное осаждение маг-
ния в виде MgCOs • (NH4)2CO3 + 4НгО.
Двойная углекислая соль магния и аммония хорошо раство-
ряется в воде, и растворимость ее быстро увеличивается с повы-
шением температуры. Таким образом осадок совсем1 не обра-
зуется, если углекислый аммоний прибавить к горячему разба-
вленному раствору магниевой соли, содержащему хлористый
аммоний и не содержащему спирта. (Отличие от бария, строн-
ция и кальция.)
• 4. Фосфорнокислый натрий, характерный реактив на магний,
дает в растворах, содержащих хлористый аммоний, в присутствии
1 L о v е п, Z. anorg. Chem. И, 404 (1896); Treadwell ibid. 37, 326
(1903); Herz, ibid. 38, 138 (1903).
2 В присутствии магния в желтом растворе можно заметить бурые
хлопья адсорбционного соединения Mg(OH)s с иодом. См. Файгль, Ка-
пельный анализ, стр. 313. Ред.
301
аммиака белый кристаллический (ромбической системы, геми-
морфный) осадок фосфорнокислой аммонийно-магниевой соли:
Mg’ ' + NH/ + РО4'".+ 6Н2О - MgNHjPOi • 6Н2О.
Трение о стенки пробирки стеклянной палочкой ускоряет обра-
зование осадка. Из очень разбавленных растворов осадок вы-
деляется часто лишь после долгого стояния.
Согласно табл. 8 (стр. 38) произведение растворимости фосфорнокислой
аммонийномагниевой соли равно 2,5- IO-13; около 0.C0S6 а соли раство-
ряется при комнатной температуре в 1 л. Растворимость в воде увеличи-
вается за счет гидролитического расщепления:
MgNHiPOi + НОН Ci • + НРОГ + NHiOH.
(I)
Тенденция к гидролизу быстро увеличивается с температурой (стр. 72). По-
добное расщепление вызывается также водородными ионами:
MgNHiPCh + Н Mg' ' + НРО4" + NHC,
(П)
которые подавляют ионизацию НРОд"; поэтому осадок тотчас раство-
ряется в присутствии какой-либо к-ислогы, -которая ионизирует сильнее,
чем НР.От", даже, например, в присутствии уксусной кислоты (стр. 24).
Согласно закону действия масс гидроокись аммония препятствует гидро-
лизу. Вот почему необходимо прибавление избытка раствора аммиака. Хло-
ристый аммоний благодаря действию общего иона уменьшает количество
Mg’-, требующееся для достижения произведения растворимости, и слу-
жит причиной течения реакции (.11) справа налево; ио, с другой стороны,
он несколько благоприятствует реакции (I), поскольку подавляет ионизацию
гидроокиси аммония. -В действительности, соли аммония обыкновенно за-
медляют образование осадка, но безусловно не делают его более раство-
римым. если имеется -избыток а-ммиака.
Нейбауэр (Neubauer) 1 -показал, что усл-ов-ия еще более усложняются
вследствие наблюдаемой тенденции к образованию студенистого Mgs(PO4)4
и кристаллической соли, соответствующей формуле Mg(NH4)<(PO4)±. Трех-
металлический фосфат Mg»(PO4)4 образуется на холоду в сильно подще-
лоченном аммиаком растворе, содержащем мало аммонийной соли. В ней-
тральном же или слегка подщелоченном растворе, содержащем значи-
тельные количес1ва аммонийных солей, образуется четырехаммонийная
фосфорномагниеная соль.
По исследованиям Б. Шмитца (В. Schmitz) - можно получить красивый
кристаллический осадок в присутствии аммонийной соли, если к кипящему
кислому раствору магниевой соли прибавить фосфа г натрия или аммония.
Прибавив затем третью часть по объему 6N аммиака или дав раствору
охладиться, достигают полного осаждения магния в виде NHiMgPCh • 6Н2О.
5. Ферроцианид калия, прибавленный к холодному раствору магниевой
соли, -образует белый осадок KsMg[Fe(CN)e'|. В присутствии NH«* оса-
ждается KNH4MgLFe(CN)«l. Чувствительное1Ь этой реакции значительно по-
вышается в присутствии Rb‘ или Cs’, кото-рые замещают в осадке К' или
NH1’.
6. Оксин (8-гидроксихинолин; см. стр. 215) полностью осаждает
магний из аммиачных растворов, пе содержащих слишком много аммоний-
ных солей. Осадок Mg(C»HsNO)2 часто рекомендуется для количественного
определения магния. Осадок может быть взвешен или его обрабатывают
1 Z. angew. Chem. 9, 429 (1896). См. Gooch ti. Austin, Z. anorg.
Chem. 20, 121 (1899).
- Z. anal. Chem. 45, 512 (1906). Cm. Jorgensen, ibid 45, 278 (1906).
302
известным количеством брома, избыток которого затем определяют титро-
ванием. Одна молекула осадка реагирует с восемью атомами брома1.
7. р-Нитробензол-азо-т-нафтол
N=N-;
2 и р-нитро-
бензол-азо-резорцин
ОНявляются весьма чув-
ствительными реактивами на магний. Первый дает возможность открывать
0,19 т Mg’' в капле раствора, а второй 0,5 у Mg' '. Реактивы готовят
растворением 1 .«< красителя в 100 .v.t 2N едкого натра. С их помощью
можно открыть магний в капле водопроводной воды и в золе фильтроваль-
ной бумаги для качественного анализа.
Выполнение. Смешивают каплю исследуемого раствора с 1—2 каплями
реактива на Калединой пластинке. В зависимости от количества магния об-
разуется либо синий осадок, либо переход красновато-фиолетового цвета
реактивного раствора в синий. Необходимо всегда обеспечивать раствор
достаточным избытком едкой щелочи. Если раствор сильнокислый, то по-
является желтая окраска совободного красящего вещества. При открытии
следов магния необходимо полученную окраску сравнивать с окраской
слепого опыта 2.
8. Хинализарин (I, 2. 5, В-тетрагидрокснанпрахинсн)3 4
НО О НО
лает возможность открывать в капле 0,25 " магния.
Выполнение. На капельную пластинку помещают каплю исследуемого
раствора, прибавляют каплю воды и смешивают с двумя каплями раствора,
содержащего 10-20 мг хинализарина » 100 ,«л спирта. Если раствор кис-
лый, смесь окрасится в желтовато-красный цвет. Затем прибавляют по
каплям 2N раствор едкого натра до перехода окраски в фиолетовый цвет,
после чего прибавляют еще едкой щелочи в количестве 25 -50% от общего
объема жидкости. В присутствии магния появляется синий осадок или та-
кого же цвета, окрашивание. Слепая проба остается окрашенной в сине-
фиолетовый цвет.
* Примечание редактора. Хинализарин реагируе! не только с Mgr’но,
как показали дальнейшие исследования тшалогично относятся к этому
реактиву также и редкие земли, цирконий и торий. Поэтому реакция на
магний .может быть однозначной только ® отсутствие этих элементов *. А. К.
9. Титановая желтая А5. Эю красящее вещество N^CnsHisNsSdOe имеет
желтый цвет в нейтральных водных или спиртовых растворах и желто»,
бурый—в щелочных растворах. В присутствии магния желто-бурый цвет
1 F. L. Hahn, Z. angew. Chem. 39, 1195 (1926k Z. anal. Chem. 71, 23
(1927).
-Feigl. Mikrochcmic 8, 356 (1936). См. 1акже Файгль, Капельный
анализ, стр. 317. Тим же даются указания для открытия магния в присут-
ствии других элементов. Ред.
3 F. L. Hahn, Н. Wolf u. G. .Jager. В. 57, 1894 (1924).
4 A. Komarovsky u. I. К о гептан. Z. anal. Chem. 94, 247 (1933).
5 I. М. Kolthoff. Cheni. Weekbl. 24, 254 (257). Об оп<рытии магния
посредством этого реактива в присутствии других улементов см. Файгль,
Капельный анализ, стр. 316. Ред.
303
переходит в красный. Эта окраска обусловливается, невидимому, адсорб-
цией красящего вещества гидроокисью магния. Посредством этого реак-
тива можно обнаружить 1,5 )' магния в капле исследуемого раствора.
Выполнение. В углублении капельной пластинки смешивают каплю
исследуемого раствора с каплей 1%-ного раствора титановой желтой А и
каплей 0.1N едкого натра.
* Добавление редактора. 10. Дифенилкарбазид CO(NHNH • СвНз)2
реагирует -с карбонатом, окисью, фосфатом магния, а также со
всеми растворимыми в воде 'Солями этого элемента. Поэтому
представляет большой интерес реакция магния, предложенная
Файглем % которая служит не только для открытия магния, но
и для идентификации его п сомнительных случаях. Для послед-
ней цели осадок магниевой соли на фильтре обливают горячим
спиртово-щелочным раствором дифенилкарбазида и промы-
вают до обесцвечивания стекающей воды; в отсутствие Mg
осадок будет иметь свой первоначально белый цвет, а в присут-
ствии его—красно-фиолетовый.
Самое же открытие Mg можно производить непосредственно
с любой растворимой солью его. Для этого раствор, не содер-
жащий аммонийных солей, нагревают с указанным реактивом до
кипения и промывают выделившийся осадок на фильтре, как
выше указано. Этой реакции не мешают Ba, Са, Sr, Sn, Cr, Al,
Mn, Fe. * A. K.
Реакции сухим путем
Окись ртути, нагретая с твердым хлоридом магния, превра-
щает последний в окись, не растворимую в воде. Окись ртути
переходит при этом в хлорную ртуть, а избыток ее улетучи-
вается.
Все магниевые соединения при прокаливании на воздухе бо-
лее или менее изменяются, оставляя окись или основную нерас-
творимую соль. При прокаливании перед паяльной трубкой на
угле смеси какого-нибудь магниевого соединения с содой
остается белая сильно светящаяся в горячем состоянии окись
магния. Этим же свойством обладают соединения кальция,
стронция и алюминия.
Магниевые соли нелетучи и поэтому не окрашивают пла-
мени, не дают спектра пламени, но дают искровый спектр.
Анализ группы IV
Разделение кальция, стронция, бария и магния
При систематическом ходе анализа кальций, стронций и барий всегда
получаются в виде их нерастворимых карбонатов, безралично, будет ли
осаждение их произведено посредством карбоната аммония (стр. 290) или
путем сплавления их сульфатов с карбонатом натрия. Магний не осаж-
дается со щелочными землями, если раствор разбавлен и содержит значи-
тельное количество аммонийной соли.
1 F. F е i g' 1, Z. anal. Chem. 72, 113 (1927).
304
Был предложен ряд прекрасных методов анализа группы щелоч-
ных земель. Характерные реакции бария, стронция и кальция настолько
сходны между собой, что трудности возникают при любой схеме анализа
всякий раз, -когда -приходится открывать небольшое количество одного из
этих элементов в присутствии большого количества другого из них. Так,
осадок, образованный большим количеством стронция1, может быть смешан
с осадком малого количества бария.
Ниже юписан ход анализа этой группы, рекомендуемый Нойесом
(A. A. Noyes).
Ход анализа
1. Фильтрат от группы III выпаривают досуха в чашке на во-
дяной бане (во избежание толчков). Затем прокаливают на голом
огне до исчезновения паров. Охлаждают и, если при анализе
применялась хлорная кислота, прибавляют 1 лу 3 W NHkCl, вы-
паривают и снова прокаливают. Охлаждают, прибавляют 10 мл
ТАБЛИЦА VI. АНАЛИЗ ГРУППЫ IV
Раствор может содержать: Ba", Sr", Са", Mg", К', Na', NH4‘. Концентри-
руют до 10 мл, прибавляют 15 мл (NHi)2CO3 или, если необходимо, больше-,
прибавляют равный объем С2Н-,ОН. Взбалтывают, дают постоять 30 мин.
и фильтруют. Исследуют фильтрат на Na и К' по табл. VII. Осадок,
который может содержать ВаСО3, SrCO3, СаСО3 и MgCO3 (NHj)-, СО3-4Н2О,
растворяют в 6N СНЗСООН и прибавляют CH-,COONHi и K2CrO± (1).
Осадок: ВаСгО4.
Растворяют в
НС1. Выпаривают
досуха. Обраба-
тывают 3 мл 6N
СН3СООН, 20 мл
3N CH3C00NHx и
15 мл воды. На-
гревают до кипе-
ния и прибавляют
раствор KiCrOi-
Желтый осадок
ВаСгО4 указывает
на присутствие
Ва (2)
Фильтрат: Sr", Са", Mg". Прибавляют NH^OH. На-
гревают до 65° и приливают 15 мл С2Н-аОН. Взбал-
тывают раствор с бумажной массой 1 и фильтруют (3)
Осадок: SrCrO4.
Растворяют в
10 мл кипящей во-
ды; прибавляют
1 мл 3N Na.,С О3 п
12 мл 3N КъС2О^ и
кипятят. Фильт-
руют и фильт-
рат отбрасыва-
ют. Осадок рас-
творяют в 5 мл
1N СН3СООН и
прибавляют 2 мл
IN Na2SOt. Белый
осадок SrSO4 ука-
зывает на присут-
ствие Sr (4)
Фильтрат разбавляют 50 мл воды-,
прибавляют Змл 3N К-,С2О<>. Если оса-
док образуется, прибавляют, если
нужно, еще К2С2О\, нагревают и
фильтруют (5)
Осадок: СаС2О4.
Растворяют в 5мл
6N Н2ЗО1 и при-
бавляют 20 капель
аЩОН. Приба-
вляют еще 10 МЛ
аН-.ОН. Белый
осадок CaSO4 ука-
зывает на присут-
ствие Са (6)
Фильтрат: Mg".
Прибавляют
NHiOHuNa^HPOi.
Растворяют оса-
док в 5 мл 2N
H2SOi, приливают
20 мл С2Н-аОН и,
если нужно, филь-
труют. Приба-
вляют NHpjH и
Na2HPOi. Осадок
MgNH4PO4 указы-
вает на присутст-
вие Mg (7)
хДля получения бумажной массы, облегчающей фильтрование проходящих
через фильтр осадков, фильтровальную бумагу, разорванную на мелкие кусочки,
сильно взбалтывают с 10 мл дестиллировавной воды в закрытой пробирке и из
полученной волокнистой массы отжимают большую часть воды между паль-
цами. Ред.
20 Зак. Э82. Тредве.т.т-Гол.т, т. I.
ЗС5
воды и нагревают до кипения. Фильтруют и к Голодному филь-
трату прибавляют 15 ли 6N (Гх'НОаСОз и 15 ли С2Н5ОН. Вели
выпадает большой осадок, то прибавляют еще то 15 ли этих
реактивов. Хорошо взбалтывают и дают стоять Сз часа, время
от времени взбалтывая. Фильтруют и промывают небольшим
количеством раствора углекислого аммония. В фильтрате нахо-
дятся ионы ще,точных металлов, анализ фильтрата проводят
согласно табл. VII (стр. 331).
Карбонаты растворяют на фильтре в горячей уксусной
кислоте, прибавляемой небольшими порциями, и выпаривают
раствор досуха, не перегревая остаток. Остаток смачивают 2 ли
6N СНзСООН, 10 .ii.z 3N СХзСООГхНт и 10 мл воды. Нагревают
до кипения и осаждают барий в виде хромата, прибавляя горя-
чий 3N раствор КгСгОт по каплям до тех пор, пока не прекра-
тится дальнейшее образование осадка и раствор не окрасится
в ясножелтый цвет. Слегка кипятят еше около 2 мин. и затем
фильтруют через .мелкопористую фильтровальную бумагу (не
пропускающую очень мелких кристаллов).
2. Если получают значительный осадок карбоната стронция
при операции 3 (см. ниже), то возможно, что небольшой осадок,
полученный при операции 1, может быть хроматом стронция, и
тогда необходимо провести повторную, подтверждающую
реакцию на барий. Для этого фильтр, содержащий осадок
хромата, обливают несколько раз 5 ли горячей 6N НС1 и выпари-
вают раствор совершенно досуха. Сухой остаток обрабатывают
растворами уксусной кислоты, ацетата аммония и хромата калия
точно так, как при операции 1. Если снова появляется осадок
желтого хромата, то это служит признаком присутствия бария.
3. Чтобы осадить стронций, прибавляют NHtOH к фильтрату,
полученному при операции 1, до тех пер, пока оранжевый цвет
раствора не перейдет в желтый, после чего прибавляют еще 5 мл
NHtOH. Нагревают приблизительно до 65° и приливают 15 мл
спирта, порциями по 5 ли каждая, взбалтывая после каждого
добавления !в течение 15 сек. Охлаждают и дают стоять 1по
меньшей мере 5 мин. Если количество хромата стронция значи-
тельно, прибавляют еще 5 ли раствора х’ромата калия, 15 ли
спирта, бумажной мякоти, снова взбалтывают и фильтруют
под вакуумом, но не промывают. В фильтрате проводят опре-
деления кальция и магния.
4. Повторно обливают фильтр, содержащий осадок хромата
стронция, 10 ли кипящей воды. Приливают к раствору точно
1 мл 3N раствора Na^COr, и 12 ли 3N раствора К2С2О4 и слабо
кипятят в течение 5 мин. в закрытой чашке. Фильтруют раствор
горячим (фильтрат выливают). Осадок содержит стронций
в виде карбоната с некоторой .примесью оксалата кальция. Его
тщательно промывают водой и растворяют карбонат в 5 мл хо-
лодной IV СНзСООН. К раствору прибавляют 2 мл нормаль-
ного раствора сульфата натрия, нагревают до кипения и дают
ему постоять 10 мин. Белый осадок указывает на присутствие
стронция.
306
5. Разбавляют аммиачный фильтрат, полученный по п. 3,
50 мл воды, прибавляют точно 3 мл 3N раствора К2С2О4 и
дают смеси постоять по '.меньшей мере 15 мин. Если осадок
оксалата кальция при этом не выделяется, то переходят непо-
средственно к операции 7.
Если образуется осадок, то смесь нагревают до кипения и
прибавляют еще 3 -1() мл раствора К2С2О4 в соответствии с ве-
личиной осадка карбоната, полученного по п. 1. Нагревают
5 м'ин., фильтруют и промывают горячей водой. Фильтрат
испытывают на магний согласно п. 7.
6. Осадок или небольшую часть его обрабатывают 5 мл 6N
H2SO4, к которым прибавляют 20 капель спирта. Затем прили-
вают еще 10 мл спирта и дают смеси посте ять несколько минут.
Белый осадок сульфата кальция укалывает на присутствие кальция.
7. Для испытания на магний прибавляют 15 мл 15N NH4OH
и 25_ль? IN Na-jHPCH к фильтрату, полученному после реакции
с К2С2О4 (и. 5). Охлаждают, взбалтывают и дают постоять по
меньшей мерс 30 мин. Фильтруют, фильтрат отбрасывают и про-
мывают осадок один раз спиртом. Чтобы окончательно убе-
диться в присутствии магния, осадок растворяют в 5 мл 2N сер-
ной кислоты, прибавляют 20 мл спирта и хорошенько пере-
мешивают в течение 2—3 .мин. Отфильтровывают от могущего
образоваться сульфата кальция и повторяют осаждение магния
в виде фосфата (стр. 302). Белый кристаллический осадок
MgNHiPO-i укалывает на присутствие магния.
Таблица 17
Растворимость щелочноземельных солей
Числа в таблице показывают растворимость в миллиэквивалентах в литре
при 20°. Буквы в. р. (весьма растворим) показывают, что растворимость пре-
вышает 1 грамм-эквивалент в 1 л
Аг ион Mg Са Sr Ва
Сульфат в. р. 30 1,5 0.02
Хромат в. р. to 12 0,03
Карбонат 20 0,2 0,2 0,2
Гидроокись .... 0,3 45 130 450
Фторид 3.8 0.4 1,9 18
Оксалат 5,0 0,09 0,5 0,8
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Составьте таблицу, показывающую относительную растворимость суль-
фатов, карбонатов, фторидов, оксалатов и гидроокисей Ва”, Mff”,
Са’ ’ и Sr”. В таблице напишите формулы тех хлоридов или нит-
ратов, которые растворимы в смеси спирта и эфира.
2. Укажите основные, химические реакции, имеющие место при каче-
сгвенном анализе группы Ва'", Са”, Sr'' .и предполагая,
что в каждом случае получены чистые осадки.
3. Если раствор содержит 0,2748 г Ва'' и 0,2(529 г Sr”, сколько мл 3N
IvCrCh необходимо, чтобы осадить один Ва''. и сколько нужно для
осаждения обоих катионов, добавляя избыток осадителя в количе-
стве 50% ?
20"
307
4. Укажите, какими реакциями, применяемыми в качественном анализе,
можно получить чистый Ва(КОз)" из ВаСВ и Ва(СНзСОО)а из BaSCh?
Напишите уравнения этих реакций.
5. Можно ли NH4HCO3 считать пригодным реактивом для группы щелоч-
ных земель? Дайте подробное объяснение.
6. Объясните, почему Sr не осаждается, когда к уксуснокислому раствору
Ва ’', Sr''. Са’' и Mg'* прибавляют избыток КзСгО4.
7. Какая химическая реакция происходит при прибавлении NH4OH к филь-
трату от осадка ВаСгО4?
8. Напишите химические реакции, показывающие превращение СгОз"
в НСгОз' и НСгО4' в СггО-". Напишите выражение закона действия
масс для каждой из этих реакций. Из этих двух выражений выведите
математическую зависимость между концентрацией Н. и отношением
концентраций СгО4" и Сг2О7",
9. Раствор содержит 200 мг Ва и 300 мг Sr. Сколько нужно прилить лл
ЗУ KsCrOi для получения хроматов этих элементов без применения
избытка реактива?
ГРУППА V. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
КАЛИЙ, НАТРИЙ, АММОНИЙ
Калий и натрий являются наиболее активными металлами из
всех часто встречающихся электроположительных элементов
(стр. 58). Они очень быстро окисляются на воздухе и разла-
гают воду при обыкновенной температуре; водород воды вос-
станавливается до газообразного состояния, а металл окисляется
до гидроокиси. Гидроокиси щелочных металлов являются весьма
сильными основаниями, что видно ПО' степени их ионизации
(стр. 24). В твердом виде они являются наиболее стойкими из
всех остальных гидроокисей и не расщепляются на окись и воду
даже при плавлении. Получение чистых окисей удается лишь
с большим трудом; осторожное нагревание металлов на воздухе
ведет к образованию наряду с окисью значительного количества
перекиси. Окиси белого цвета, перекиси желтоватого.
Гидроокиси натрия и калия могут быть получены путем рас-
творения металла или окиси в воде, действием окиси щелочно-
земельного металла на раствор карбоната щелочного металла
или путем электролиза водного раствора хлорида щелочного
металла. Последний метод является единственным1, имеющим
индустриальное значение.
Гидроокиси натрия и калия применяются в качестве реакти-
вов в качественном анализе. При прибавлении их к растворам,
содержащим растворимые соли катионов других аналитических
групп, образуются нерастворимые осадки гидроокисей, за исклю-
чением мышьяка, бария, стронция и кальция. Избыток гидро-
окиси щелочного металла растворяет амфотерные гидроокиси
свинца, сурьмы, олова, алюминия и цинка.
Аммоний отнесен к группе щелочных металлов, потому что
растворимость его солей сходна с растворимостью солей калия.
Радикал аммоний отличается от щелочных металлов своей спо-
собностью к окислению, причем обычным продуктом окисления
308
является азот. Гидроокись аммония — значительно более слабое
основание, чем другие гидроокиси; -соли аммония при нагрева-
нии либо летучи, либо разлагаются.
Большая часть солей калия, натрия и аммония бесцветна и
легко растворяется в воде. Карбонаты, трехметаллические и
двухметаллические фосфаты, цианиды, бораты -и силикаты по-
казывают в водном растворе щелочную реакцию (гидролиз).
Соли щелочных металлов более или менее летучи и сообщают
несветящемуся пламени характерные окраски.
/ Калий К. Ат. в. 39,096. Ат. н. 19
Плотность 0.862. Т. пл. 62,ЗР. Т. кип. 760^
Нахождение в природе. Калий входит -в состав различных минералов,
например сильвина КС1 правильной системы и карналлита MgCh • КС1 • 6Н2О
ромбической -системы, встречающихся -в Стассфурте1 вместе с каменной
солью и ангидритом. Он входит в состав селитры KNOs (ромбические
призмы), а также встречается в очень многих силикатах, важнейшими из
которых являются: кали-евый полевой шпат [адуляр, ортоклаз KAlSisOs] и
мусковит [калийная слюда KH’AlsShOiz]. Оба минерала моноклинической
системы-. Калий входит в виде органических -солей в -состав растений, кото-
рые пр-и озолении превращаются -в карбонат -калия (поташ).
Получение и свойства. Металлический калий, не имеющий широкого
промышленного применения, получается путем электролиза расплавленного
хлористого калия. Впервые он был получен- Дэви (Davy) в 1807 г. После
цезия и рубидия он имеет из всех металлов наибольший восстановитель-
ный потенциал. Он быстро окисляется во влажном воздухе, и его хранят
обыкновенно в керосине. Он настолько сильно разлагает воду, что выде-
ляющийся водород горит фиолетовым пламенем. Эта окраска пламени вы-
зывается небольшими количествами па-ров калия-.
Окислы. Окись калия может быть получена при осторожном нагревании
в ограниченном объеме воздуха; перекись калия ICOi образуется при на-
гревании калия в избытке кислорода. Перекись калия представляет собой
желтый порошок и является сильным -окислителем.
Растворимость. Металл и его окиси быстро растворяются в воде и вы-
деляют при этом значительное количество тепла. Калий растворяется также
в спирте с выделением водорода и образованием алкоголята:
2С2Н5ОН + 2К -> 2С2Н5ОК ф Нз.
Карбонат и сульфат -не -растворимы в спирте. Почти все соли калия
растворяются в горячей воде, за исключением некоторых силикатов и ком-
плексных соединений, в которых процентное содержание калия незначи-
тельно. Чтобы- осадить -соли калия из водных растворов, объем последних
должен быть малым и охлаждаться после осаждения; обычно бывает необ-
ходимо прибавление спирта. Трудно растворимыми солями ка-лия, которые
могут служить для открытия его ионов- (за счет образования -осадков),
являются: хлороплатинат, кислый тартрат, фторосиликат, п-икрат, фосфоро-
молибдат, перхлорат, периодат, фто-ротитанат, фюроцирконат, а также
двойная соль с сульфатом циркония, двойная серебряная соль гексани-
трокобальти(3)ата- и соль р-дипикрил-амина.
1 Большие залежи калиевых солей найдены в СССР вблизи Соликамска.
По богатству Соликамские месторождения превосходят Стассфуртские. Ред.
309
Реакции мокрым путем
1. Платинохлористоводородная кислота H^fPlCls] 1 2 даетвкон-
центрированых растворах хлорида калия желтый осадок хлоро-
платината калия:
[PtCl<|" •+ 2К’ K2[PtCl(i],
который состоит из октаэдров правильной системы (видимых
ясно в лупу). В не очень концентрированных растворах солей
калия осадок часто не получается сразу и образование его уско-
ряется трением стеклянной палочкой о стенки пробирки или
чашечки, в которой производят реакцию. Ионы N'Hi’, Cs' и Rb‘
дают аналогичные осадки.
Характерно отношение хлороплатината калия к прокаливанию: он раз-
лагается при эти на хлор, платину и хтористый катин:
КД PtCIr, | 2KCI + Pt + 2CI-.
Если остаток от прокаливания обработать полой и отфильтровать от
платины, то полученный фильтрат с платиноклористоводородной кислотой
снова дает желтый кристаллический осадок KnEtCIsJ (ог.шчие от хлоро-
платината аммония).
Растворимость хлороплатината калия в воде. В 100 ,чл виды раство-
ряется KsiPtClc]:
при 0" . . • . 0.70 г при 20- .... 1,12 г
» 1СР . . . . 0,90 » к 100- .... 5,18 »
В насыщенном растворе КС!, равно как и в 754-пом спирте, он
почти не растворим.
Для этой реакции лучше всего пользоваться хлористым калием. Йоди-
стый калий от прибавления платинохлористоводородной кислоты окраши-
вается в интенсивным буро-красный цвет, так как происходит превращение
LPtCle]" в LPtJd", калиевая соль которого более растворима:
LPtCUl" + 6.1' -> IPt.Js]" -J- 6 21.
Таким образом, в умеренно концентрированных растворах йодистого
калия осадок не образуется.
Точно так же не осаждается платинохлористоводородной кислотой и
цианистый калий, потому что образуются растворимые комплексные пла-
тино-цианистые соединения.
Если калий находится в виде подпетой или цианистой соли, то его
превращают в хлористое соединение и затем уже производят реакцию на
калий с ллатнпохлористоводородной кислотой -.
1 Хлорная платина PtCh не дает осадка с калиевыми солями. Только
после долгого стояния, путем присоединения1 к ней КС1 образуется
KsfPtCle], который затем осаждается. Платинохлористоводородная кислота
двухосновна: она получается посредством растворения платины в царской
водке.
2 Йодиды щелочных металлов удобнее превращать в хлориды
следующим* образом. К раствору, подкисленному соляной кислотой, при-
бавляют по каплям хлорной воды до тех пор, пока раствор, ставший при
продолжительном кипячении бесцветным, уже не станет больше окраши-
ваться ,в желтый цвет при дальнейшем прибавлении хлорной воды. Циа-
нистые щелочные металлы превращают в хлориды путем вы-
паривания их под хорошо действующей тягой с разбавленной соляной
кислотой.
310
2. Винная кислота HaCiHaOe дает в не слишком разбавленных
нейтральных растворах белый кристаллический осадок кислой
виннокалиевой соли:
К' 4- КНС1Н4Ой 4- Н".
Образование осадка ускоряется трением стеклянной палочкой о стенки
пробирки 1.
Кислая виннокалиевая соть легко растворима в .минеральных кислотах,
но трудно растворима в уксусной кислоте и воде; в 100 ч. воды раство-
ряется при 10° 0.425 г соли. Если к раствору прибавить ацетат натрия, то
образующиеся при вышеприведендои реакции ионы водорода будут связы-
ваться ацетат-ионами с образованием слабо диссоциированной уксусной
кислоты (.стр. 64):
И’ + СНзСОО'-» СНзСООН,
благодаря чему чувствительность реакции становится значительно большей.
Однако слишком ботьшое количество ацетата натрия оказывает растворяю-
щее действие на кислый трргрл калия2. Осадок распгоряетея и горячей
виде и в разбавтонных растворах едких щелочей и аммиака:
KHCill-iO,. -г ОН' ->К' -• C-iHiOi/' т НтО.
При прокаливании кислого впенокис..'ого калия выделяются газообраз-
ные продукты сухой перегонки (запах пригорелого сахара), п в остатке
получаются сго.ть и карбонат калия. 11 т > ।,i, t-i i ы л я масса, обитая соляпон
кис.’Ю1 ой, сильно liCiie.HHBac |СЯ.
3. Тиосульфовисмутлат натрия Niia| Bi(S,>0:)):)'| (реакция
Карно)3. Если к капле иолунсрмального раствора азотно-
кислого висмута прибавить 2—3 капли такого же раствора
тиосульфата натрия и 10—15 .ил абсолютного спирта (могу-
щую при этом образоваться муть снова растворяют осто-
рожным прибавлением небольшого количества волы), то полу-
чается чувствительный реактив на ионы калия, в ко юром вис-
мут входи: в состав комплексного аниона:
1й‘ • ‘ -J- G4V -> jHitSiO-O::]"’.
Натриевая соль растворима в спирту, напротив желтая соль'
калия в нем не растворима:
Bi(S:>(h).r J- ЗК'-> KHBi(S2Q»)sl.
Присутствие хлористого аммония мешает реакции.
* Примечание редактора. Лутц (Lutz)4 рекомендует выполнять
эту реакцию следующим образом. К 3 каплям раствора висмута
прибавляют о мл воды, 3 капли тиосульфата натрия и 5 мл
1 По beirepy кри, та.т'изацшо и-, пересыщенного раствора еще легче
можно «вызвать, вноси н чакон раствор в «иле ззгравки кристаллик той
соли, выделения в осадок которой добиваются, В данном случае вносят
в раствор посредством стеклянной палочки или на ушке платиновой про-
волоки кристаллик КНСгНтОс, после чего сильно набалтывают. Ред.
- Вследствие образования легко растворимого нейтрального щелочного
тартрата К и Na, обладающего формулой Ix.NaCTHjOe:
:i Z. anal. Chem. 36. 512 (1S97>.
« U. Lutz., Z. a«l. Chem. 59, 156 <1920;.
311
спирта. Если к смеси осторожно 'прибавить (по стейке про-,
бирки) 1—2 капли исследуемого раствора, то в месте соприкос-
новения их со спиртовым раствором появляется желтый оса-
док. * А. К.
4. Кремнефтористоводородная кислота HeSiFe, прибавленная
в большом избытке к раствору калиевой соли, осаждает студе-
нистый кремнефтористый калий:
[SiFe]" + 2К- -» KafSiFe],
который трудно растворим в воде и разбавленных кислотах и
не растворим в спирту.
При прокаливании он разлагается на летучий фтористый
кремний и фтористый калий:
KafSiFo] ->2KF + SiF4.
Раствор не должен быть щелочным, в противном случае
ион [SiFe]" подвергается разложению и осаждается кремневая
кислота:
[SiF6]" + 4ОН'-> Si(OH)4 + 6F'.
5. Хлорная кислота НС1О4 осаждает белый кристаллический
перхлорат калия:
НС1О4 + К- -» Н- +КС10'4.
100 мл воды при 0е растворяют 0,07 г. а при 100° —19,8 ? KCICL. Он
настолько слабо растворим в 97%-ном спирте, что количества меньше
2 мг калий-ионов могут быть им открыты.
6. Нитрокобальти(3)ат натрия Хаз[Со(ХОг)е] осаждает из
нейтрального или слабокислого раствора желтый нитроко-
бальти(3)ат калия и натрия:
Na3[Co(NO2)e] + 2КС1—> K2Na[Co(N02)6] + 2NaCl.
Подобные же осадки получаются с NH-T, Rb' и Cs (а также с солями
Li и Т1. Ред.). Реакция не должна производиться в щелочном растворе,
в противном случае выпадает Со(ОН)з. Если реактив приготовлен по Биль-
ману (Billmann) \ то возможно открывать даже такие малые количества
калия, как 0,9 T, в присутствии 4000 эквивалентов натр'ия. В присут-
ствии Ag’ чувствительность сильно повышается, так как происходит обра-
зование соли K2Ag[Co(?<0::)e], которая менее растворима, чем соответству-
ющая натриевая соль. В присутствии серебра можно открыть 1 т калия
следующим образом. К капле нейтрального или слабокислого исследуемого
раствора на черной капельной пластинке прибавляют каплю 0,05%-ного
раствора AgNOs и немного Хаз[Со(\Оа)в] в твердом виде.
* Примечание редактора. По исследованиям Лутца1 2 из всех качествен-
ных реакций на калий вышеописанная заслуживает предпочтения. Ее чув-
ствительность варьирует в зависимости от условий опыта. Так, по Файглю
предельная концентрация по капельному методу в отсутствие серебра
1:12 500; в присутствии серебра 1:50 000. По Баузеру3 чувствительность
1 Z. ana!. Chem. 39, 284 (1900).
2 Z. anal. Chem. 59, 156 (1920).
3 Bowser, J. Am. Chem. Soc. 32, 78 (1919); 33, 1566 (1911). Ред.
312
реакции (в виде пробирочной) значительно повышается, если прибавить
равный объем 95%-ного спирта, и предельной концентрацией является
1:500 000; наконец, по Берджерс и Кэм1 в присутствии серебра предельной
концентрацией является 1:100 000.* А. К.
7. Пикриновая кислота или пикрат натрия, фосфоровольфра-
мат натрия и фосфорномолибденовая кислота (см. стр. 158;
реактивы, которыми пользуются для открытия алкалоидов) дают
осадки с солями калия. С пикриновой и фосфорномолибдено-
вой кислотой осадки желтого цвета, а с фосфорновольфрамовой
кислотой — белого цвета.
8. Сульфат циркония Zr(SOd)2. Концентрированный раствор
этой соли осаждает двойной сульфат даже в присутствии зна-
чительных количеств натрия, аммония, лития, рубидия и цезия.
В 2 пл раствора соли калия можно открыть 1 ли калия 2.
* Примечанье редактора. В другой своей работе Рид и Уизроу3
сообщают о дальнейших своих наблюдениях над реакцией с Zr(S04%. Соли
калия осаждаются этим реактивом количественно. Присутствие ионов на-
трия и аммония не оказывает никакого влияния на открытие калия: в
растворе, насыщенном солью аммония, им удалось открыть 0,24 мг калия
в 1 мл. Реакции -с Zr(SO<)2 мешают Mg, Li, Rb и Cs. Следует применять
свежеприготовленный 11,3%-ный раствор сульфата циркония*. А. К.
9. р-Дипикриламин 4 5 (гексанитродифениламин) [CeHeGNOsRbNH дает
с солями калия мелко-кристаллический оранжево-красный осадок калиевой
соли дипикриламипа. ।
Выполнение. На фильтровальную бумагу наносят каплю нейтрального
испытуемого раствора и сразу же прибавляют каплю реактива. В присут-
ствии калия на бумаге образуется оранжево-красное пятно, не изменяю-
щееся при смачивании 1—2 каплями 2N соляной кислоты. Рубидий, цезий
и большие количества аммония дают подобные же осадки.
Получение р-дипикриламипа. Дифениламин растворяют в концентри-
рованной' серной кислоте и полученный раствор вливают в дымящую азот-
ную кислоту; при этом происходит образование гексанитродифениламина
согласно уравнению:
__NO» NO2_
(CGH-,)2 NH %-6HNO3—> NO»/ NH—/ /ф!О» + 6Н2О.
no2 NO»-
После прекращения бурного течения реакции нитрование продолжают еще
некоторое .время при слабом нагревании. Смесь вливают в ледяную воду,
фильтруют и промывают до полного удаления кислоты и перекристаллизо-
вывают из ледяной уксусной кислоты. Для получения нужного раствора
растворяют 0.2 г желтого красящего вещества (т. пл. 234°) в 2 мл N NaaCOs
и 20 мл воды, нагревают до кипения и фильтруют. Натриевая соль р-дипи-
криламина растворяется в воде.
* Примечание редактора. Дипикриламином можно пользоваться в пре-
делах 4 и 5 групп. Мешающие соли аммония должны быть удалены. Нье-
венбург и Гук (Nienwenburg a. van der Hock) -• нашли, чю дипикриламин
является прекрасным средством для микроскопического открытия К и Rb
в присутствии Cs. * А. К.
’Burgerss a. Kamm, J. Am. Chem. Soc. 34, 652 (1912). РеД.
’Reed a. W i throw, J. Am. Chem. Soc. 51, 1062 (1929).
3 J. Am. Chem. Soc. 50, 2985 (1928).
4 N. S. Poluektoff, Mtkrochemie 14, 265 (1933-34).
5 Mikrochemie 18, 175 (1935).
313
Реакции сухим путем
Соли калия окрашивают несветящееся газовое -пламя в фио-
летовый цвет. В присутствии даже незначительных количеств
нартия фиолетовое пламя калия совершенно маскируется желтым
натриевым .пламенем. Но если смотреть на пламя через кобаль-
товое стекло или, что еще лучше, через разбавленный раствор
метилвиолета, то будут проходить только розово-фиолетовые
лучи калия, желтые же лучи натрия будут совершенно погло-
щены.
Силикаты, содержащие калий, дают окраску- пламени после
смачивания плавиковой кислотой.
Пламенный спектр. Соли калия дают характерный пламенный спектр.
Двойная красная линия 769,9 и 766,5 ту. (кажется одинарной линией при
более слабой дисперсии); слабая фиолетовая линия 404,4 появляется
при сравнительно низких температурах. При более высокой температуре
пламени (пламя горелки Тек.ту, кислородное пламя или пламя вольтовой
дуги. Ред.) видны другие линии в желтой части спектра: 583.2; 580,2 и
578,2 пщ и в зеленой части 535.1 и 511.3 Шу.
Натрий Na. Ат. в. 22,997. Ат. н. 11
Птотность 0,47. 'Г. пл. 95,6. 'Г, кии. 882,9’’
Натрий -- серебристобелый металл с металлическим блеском, если
только он не успел покрыться н:т воздухе окисью. Натрий является хоро-
шим проводником тепл:’.. На воздухе он быстро окисляется и поэтому его
хранят п бензине или керосине. Натрий -разлагает воду, -но не так энер-
гично, как калий (освобождающийся при этом водород иногда воспламе-
няется). Натрии сгорает при температуре красного каления, давая желтое
пламя.
Нахождение в природе. Натрий весьма широко распространен в при-
роде. Важнейшим его минера том является галит, или каменная соль (NaCl)
прави льной системы. Гадиг образует очень мощные отложения, часто-встре-
чается совершенно чисчым, но обычно загрязнен глиной, ангидритом и
гипсом. Растворенный хлористый натрий находится и больших количествах
н водах океанов и во .многих соляных источниках. Натрий также встре-
чается в природе и виде каобопата (например, термонатрит МазСОз • Н>()
ромбической системы; натри), или сода. NaiCOn йОНзО моноклинической
системы; трона NasCOs• МаНСОз • 2Нг() той же системы); натриевой, или
чилийской селитры, NaNO.i гексагональной -системы, ромбоэдрической формы;
тинкала (бура) NaiBdh* Н’НзО моноклинической системы; криолита NasAlFe
моноклинической системы и входит в состав многих силикатов, например
натриевого полевого шпата, альбита NaAlShOs триклинической системы.
Окиси и гидроокиси. При горении натрия на воздухе образуется пере-
кись Na»Oi>, которая превращается в окись NasO при нагревании с натрием-.
Окись очень гигроскопична. При нагревании до температуры выше 400’
.\'азО переходит в КагО« -и Na. Перекись натрия является прекрасным оки-
слителем. Она растворяется в воде, образуя NaOH и Os. и в кислотах
с образованием соли натрия я перекиси водорода. Немного перекиси водо-
рода образуемся, когда перекись натрия растворяется в холодной воде, но
перекись -водорода устойчива только в кислых растворах, в щелочных же
она быстро распадается при нагревании. Гидроокись натрия подобно гидро-
окиси калия лучше всего получается путем электролиза водного раствора
хлорида, .но она может бьнь также получена растворением либо окиси -в
воде, либо действие»» на раствор карбоната натрия окиси щелочноземель-
ного металла; от образующегося при этом нерастворимого карбоната ще-
лочноземельного металла раствор гидроокиси -натрия отфильтровывают.
314
Перекись, гидроокись, карбонат и другие соли «атрия находят весьма
широкое применение в качественном анализе в качестве реактивов. Они
обладают теми же .свойствами, что и соответствующие соли калия. Боль-
шая часть натриевых солей легко растворяется в воде. Только хлористый
натрий слабо растворяется в воде, насыщенной НО. Из такого раствора
спирт полностью осаждает NaCl.
Для открытия натрия чаще всего пользуются получением осадков анти-
моната натрия, тройного ацетата натрия и урана с цинком, магнием или
кобальтом и тройного нитрата натрия, цезия и висмута.
Реакции мокрым путем
1. Антимонат калия KHaSbOr1 2 дает в нейтральном или
слабокислом растворе медленно образующийся тяжелый, белый
кристаллический осадок; образование его ускоряется три трении
стеклянной .палочкой о стенки сосуда:
KHcSbOi + Na‘ ->NaH2SbO4 + К’.
Реакция не должна производиться в кислом растворе, так как в про-
тивном случае выделяется аморфный осадок сурьмяной кислоты.. Аммоние-
вые соли сильных кислот также даю г при стоянии аморфный осадок:
вследствие гидролиза аммоние»(ой соли образуется кислота, результатом
чего является осаждение сурьмяной кислоты. Кроме щелочных металлов,
в растворе не должно быть других металлов, потому что последние также
дают осадки с сурьмяной кислотой.
2. Винная кислота и нлатинохлористоводородная кислота не
осаждают натрий- ионон, так как натриевые соли этих кисло г
растворимы в спирте так же хорошо, как и в воде (отличие от
калия). Хлороплатинат натрия оранжевого цвета.
3. Хлористоводородная кислота и спирт осаждают хлорид
натрия. Если пропускать в ИЮ мл спиртового раствора натрие-
вой соли сухой ток хлористого водорода, то в растворе остается
меньше 1 мг натрия
4. Магния-уранила ацетат, прибавленный к 5 мл (не больше)
водного раствора хлористого натрия, осаждает полностью Б—50 мг
натрия в виде зеленовато-желтого Ь»аМ§(иОе)з(СНзСОО)9 • 6,5На().
Нойес и Брей 3, прибавляя .к 5 мл водного раствора натриевой
соли 1 мл спирта и 5 мл реактива, «юлучали осадок с 0.5 дат натрия,
причем 2 :мг лития или И) мг NH4, К, КЬ или CS не мешают ре-
акции. По. Файг.тю можно открыть 12,5 у Na.
Кэ:ш н Фо.:к (Ciiley a. Faulk)4 * 6 не прибавляют спирта, но применяют
100 мл реактива, ее nt г, растворе имеется 10 или меньше .«,• натрия. Вместо
ацегата магния бьгк> предложено вводит н состав реактива ацетат пинка3
или ацетат кобальта1'.
1 Этот реактив прежде называли пироангимонатом калия. Следует от-
метить, что K’HzSbX): • НФ) идентичен с 2KH-jShOi.
2 Эту реакцию .нельзя считать особенно характерной для’ N’ai Необхо-
дима еще проверочная реакция более надежным реактивом. Ред.
3 Качественный анализ редких элементов, стр. 219, ОНТИ, М. 1936.
4 .1. Am. Ch. Soc. 51, 1664 (1929).
6 Koi th off. Z. an.-il. Спет, 70, 397 (1927).
6 С a 1 e y, J. Am. Ch. Soc. 51, 965 (1929;.
315
* Примечание редактора. Голд приводит реакцию по Нойесу и Брэю
посредством водно-спиртового раствора магнийуранилацетата. причем
указывает, что чувствительность реакции по Файглю выражается величи-
ной в 12,5 у (в капле) натрия. Необходимо отметить, что указанная чув-
ствительность была найдена Файглем не с магнийуранилацетатом, а с цтшж-
уранилацетатом, причем без добавления спирта. По исследованиям Кагана
(Kahane)1 добавление спирта к реактиву чрезвычайно повышает чувстви-
тельность реакции, но в ущерб ее специфичности. Он рекомендует поль-
зоваться водноспиртовым реактивом лишь в том случае, когда необходима
большая чувствительность реакции для открытия следов натрия и когда
в исследуемом растворе другие вещества отсутствуют. О приготовлении
реактива цинкуранилацетата см. Файгль, Капельный анализ *. А. К.
5. Щавелевокислый калий или аммоний. Оксалат натрия
ИазСгОт значительно менее растворим в воде и разбавленном
спирте, чем соответствующие соли калия и аммония. Для испы-
тания на натрий Винклер (Winkler) 2 рекомендует прибавлять
раствор KaCiOt и немного спирта. Мейерфельд3 для той же цели
рекомендует применение насыщенного раствора оксалата аммо-
ния, между тем как Шорль (Schoorl)4 5 взбалтывает 0,5 г твердого
вещества, исследуемого на натрий, с 2.5 мл 20-%ного раствора
оксалата калия.
6. Реактив Болла (Ball). Раствор нитритов висмута и цезия
в разбавленной азотной кислоте дает с солями натрия осадок,
отвечающий формуле 6NaNO2 • 9CsNOs • 5В1(ДОг)з.
Чо'пп (Tsc-hopp)3 использовал эту реакцию для микрохимиче-
ского1 определения небольших количеств натрия.
Для приготовления реактива в склянку емкостью 100 мл всыпают 30 г
чистого KNOa, растворяют приблизительно в 60 мл воды и прибавляют
раствор 3 г В1(МОз)з • 5НгО в разбавленной азотнэй кислоте в количестве,
как раз достаточном, чтобы воспрепятствовать осаждению основной соли
висмута. Затем прибавляют водный раствор 1,6 г CsNO» и разбавляют
смесь до 100 лл. Оставляют стоять на ночь, а затем фильтруют- Чтобы
открыть небольшие количества натрия, прибавляют к концентрированному
испытуемому раствору на каждый предполагаемый в растворе миллиграмм
Na по 3 лд хорошо охлажденного реактива, взбалтывают смесь, закрывают
склянку пробкой и оставляют на ночь в леднике.
* Примечание редактора. Нойес и Брэй не рекомендуют этой реакции,
главным образом, вследствие высокой стоимости и нестойкости реактива.
Кроме того, чрезвычайно чувствительная реакция на натрий может при-
вести к ошибкам, так как незначительные количества этого элемента мо-
гут попасть в исследуемый раствор .из реактивов -или из стекла посуды*. А. К.
Реакции сухим путем
Эти реакции на натрий являются очень важными, так как
они чрезвычайно чувствительны. Соли натрия окрашивают не-
светящееся газовое пламя в монохроматический желтый цвет,
1 Kahane, Bull. Soc. Chim. 4, 53, 655 (1923); см. также Z. anal. Chem.
99, 130 (1934).
2 Pharm. Centralhalle 66, 150 (1925).
й Z. anal. Chem. 67, 150 (1925).
4 Pharm. Weekblad 63, 555 (1S2G).
5 Helv. Chim. Acta 8, 893 (1925).
316
легко отличаемый от желтого пламени светильного газа сле-
дующим образом. Если осветить белым светом (все накаленные
твердые тела испускают белый свет) какое-либо тело, окрашен-
ное в оранжевый цвет, например палочку сургуча или кристалл
двухромовокислого калия, то красные и желтые лучи будут от-
ражены и тело будет казаться оранжевым. Но при освещении
того же самого тела монохроматическим натриевым светом бу-
дут отражаться только желтые лучи и тело будет казаться жел-
тым (очень чувствительная проба).
Пламенный спектр. Желтая двойная линия (589,6 и 587,0 тн-), совпа-
дающая с линией D солнечного спектра. Эта реакция необычайно чув-
ствительна: 1 • 1С-7 мг натрия может быть еще открыта при помощи
спектроскопа.
Перекись натрия Na2O->
Перекись натрия, ставшую вследствие своих энергичных окислительных
свойств продажным препаратом, получают путем сжигания сухого натрия
на воздухе; она имеет вид тяжелого желтоватого порошка, обладающего
следующими характерными реакциями.
Отношение к воде. При прибавлении к этому веществу небольшого ко-
личества воды происходит энергичнее выделение кислорода (тлеющая лу-
чина загорается) \ сопровождаемое сильным нагреванием и шипением.
Вода разлагает перекись натрия по уравнению:
NaiOi + 2НгО -> 2NaOH + НЛ.
выделяя перекись водорода.
Так как при этой реакции выделяется довольно значительное количе-
ство тепла, то часть перекиси водорода разлагается на воду и кислород.
Но если перекись натрия вносить небольшими порциями в охлажденную
льдом воду, то этим устраняется нагревание, кислород почти не выде-
ляется и получается прозрачный сильнощелочной раствор, показывающий
все реакции перекиси водорода.
Перекись натрия, помещенная на часовом стекле под колоколом подле
чашечки с водой, переходит по истечении 12 час. в белый гидрат (NaaOa-
• 8Н2О), растворяющийся при обыкновенной температуре в воде без выде-
ления кислорода. Восьмиводная перекись натрия, помещенная над серной
кислотой в эксикаторе, переходит в двухводную NazOz • 2НЮ.
Перекись водорода Н2О2
Перекись водорода очень мало устойчива в щелочном растворе: уже
на холоду происходит ее разложение, что узнается по выделению кисло-
рода. При кипячении разложение протекает в несколько минут. Значи-
тельно долее сохраняется перекись водорода в кислом растворе: даже
после кипячения в течение многих часов '.можно еще обнаружить перекись
водорода. Однако постепенно она вполне разлагается. Поэтому, если хотят
разрушить перекись водорода, раствор делают щелочным и нагревают
несколько минут до кипения.
Перекись водорода может легко присоедини’.!, два электрона1 (окисля-
ющее действие) или отдать их (восстанавливающее действие) согласно
следующим двум уравнениям:
НЮз + 2е -v 2ОН';
, НЛ- 2е— 2Н’ + О2.
1 При этом может произойти взрыв, так как продажный продукт
иногда содержит металлический натрий, который при действии на воду
выделяет водород; .образующийся же одновременно кислород дает с по-
следним гремучий газ, взрывающийся от приближения к нему тлеющей
лучины. [Частное сообщение Констама (Е. Konstam).]
317
Некоторыми веществами она присоединяется непосредственно в виде
кристаллизационной перекиси водорода или с образованием надокиси.
Реакции перекиси водорода
а) В кислом растворе
Если хотя г примени и, для реакций на перекись водорода водный
paciBOp перекиси натрия, то pacieop необходимо при охлаждении под-
кислить предварительно разбавленной серной кислотой.
1. Сульфат титана дает отчетливое желтое окрашивание,
обусловленное образованием надтитановой кислоты:
ТЕ ‘ ' + Н2О2 д- 2НгО -> 4Н' У- ILTiCh.
Некоторые химики для надтитановой кис юты предпочитают
формулу Т1О2 • Н2О2, которая вместо шестивалентного титана
предполагает перекисное строение соединения.
Это — чувствительнейшая реакция на'перекись водорода. Не-
обходимый для реакции -сернокислый тиган приготовляют 'путем
сплавления 1 ч. продажной двуокиси тагана с 15—20 ч. .пиро-
сульфата калия и растворения -полученного плава по охла-
ждении в холодной разбавленной серной кислоте. Его можно
также приготовить путем нагревания двуокиси титана с концен-
трированной серной кислотой, после чего охлажденный раствор
осторожно разбавляют водой.
При прибавлении едкой щелочи, аммиака или карбоната
аммония к кислому раствору надтитановой кислоты выделяется
желтовато-оранжевый осадок, снова растворяющийся в избытке
щелочного реактива. На этой реакции Классен (Classen) основал
метод отделения титана от трехвалентного железа1.
2. Хромовая кислота. Если взболтать кислый раствор 'пере-
киси водорода с эфиром, не содержащим спирта, затем при-
бавить ничтожное количество раствора двухромовокислого ка-
лия и снова взболтать, то плавающий на поверхности эфирный
слой окрасится в красивый синий цвет вследствие образования
надхромовой кислоты (стр. 226).
Эта реакция отличается весьма большой чувствительностью.
С ее помощью можно открыть 0,1 жт -перекиси водорода. При
производстве этого испытания необходимо всегда проделывать
слепой опыт с одним лишь эфиром, ибо в последнем при -стоя-
нии на воздухе может образоваться некоторое количество пере-
киси этила (СгН^тОз (?), которая относится к хромовой кис-
лоте, 'как перекись водорода. Эфир возможно освободить от
этой перекиси, дав ему постоять -в течение ночи в соприкосно-
вении с металлическим натрием, после чего подвергают ею
отгонке.
3. Марганцовая кислота в кислом растворе обесцвечивается,
выделяя кислород:
2МпО/ + 5Н2О2 ф 6Н- -> 2Mif ' ф 8Н2О 5О2.
1 В. 21, 370 <1888).
313
Подобно перманганату многие другие окислители восстана-
вливаются перекисью водорода, выделяя кислород, например
AgaO, PbsOi, РЬОг, МпОг, СогОз и т. п.:
AgaO ф Н2О2 ->Н>0 ф О2 щ 2Ag;
МпО2 -t- Н2О2 ф 2FT -> Мп’ ' 4- 2HzO -г О2;
С02О3 ф Н2О2 ф 4Н' -»2Со' ’ ф ЗН2О ф О2.
4. Феррицианид калия и хлорное железо. Прибавив к ней-
тральному, возможно более разбавленному раствору хлорного
железа ничтожное количество (следы) феррицианида калия так,
чтобы жидкость была заметно окрашена в желтый цвет, и
прилив затем почти нейтральный раствор перекиси водорода,
получают зеленое окрашивание раствора, из которого спустя
некоторое время выделяется берлинская лазурь. При этом ферри-
цианид калия восстанавливается в ферроцианид- дающий с хлор-
ным железом берлинскую лазурь:
2| Fc(GN)e]ф Н2О2 - 2. Fe(CN')«J"" ф Os ф 21Г
и
31 Fe(C\')«]"" ф 4Fe’ ’ ’ Fei[Fe(CN)B]3.
По Шенбейну (Schonbein)1 этот способ дает возможность
открывать ничтожнейшие следы перекиси водорода (0,02 мг
Н2О2 в 1 л). Но так как восстановление феррицианида калия
возможно и многими другими веществами (SnCl?, SO2 и т. п.), то
одна эта реакция на перекись водорода не может всегда счи-
таться надежной.
5. Крахмальный клейстер и иодистый калий. Если к кислому
раствору, содержащему крахмал и иодистый калий, .прибавить
немного перекиси водорода, то тотчас появляется синее окра-
шивание:
2KJ ф Н2О2 -> 2КОН п- Jz.
С помощью этой реакции можно открыть 0,05 л;г* *перекиси
водорода в 1 л. На разбавленный нейтральный раствор йоди-
стого калия Н2О2 действует очень «медленно, напротив, очень
быстро — в присутствии FeSO-i, действующего как катализатор2,
б) В щелочном растворе
1. Хлорное золото при обыкновенной температуре 'восстана-
вливается до металла, выделяя кислород. Металлическое золото
образует коллоидный раствор, кажущийся в отраженном свете
коричневым, а в проходящем — зелено-синим:
2Аи' ’ ' ф ЗН2О2 ф 6С Н' -> 2Аи ф 6Н2О ф 3(Ф.
1 J. prakt. Chem. 79, 07 (I860). Ред.
* М ь и с h о t u. \V i . h с 1 ш, В. 34, 2479 (1901). Ред.
319
2. Марганцовые и кобальтовые соли, но не соли никеля, дают
осадки бурого и черного цвета:
Мп’ • + 2ОН' + Н2О2 — Н2О + МпО(ОН)г;
бурого цвета
2Со’ ' + 4ОН' + Н2О2 -> 2Со(ОН)3.
черного цвета
Гипохлориты дают аналогичные реакции с солями марганца
и кобальта, но они не реагируют с хлорным золотом.
Озон Оз
Озон образуется при тихом электрическом разряде в атмосфере кис-
лорода, а также при электролитическом получении кислорода при боль-
шой плотности тока. По Брунку (Brunk) кислород, получаемый путем на-
гревания хлорноватокислого калия, содержит небольшие количества озона.
Озон представляет собой сильный окислитель и во многих отношениях
очень сходен с перекисью водорода; от последней озон отличается тем,
что он
1) не дает с сернокислым титаном желтого окрашивания;
2) из растворов соединений золота не выделяет последнего;
3) тотчас выделяет иод из разбавленного нейтрального раствора
иодисрого калия;
4) выделяет бром из кислого раствора бромистого натрия;
5) окрашивает тотчас блестящее металлическое серебро в стальносиний
цвет.
Чувствительность последней реакции очень велика, в особенности если
производить ее по Манхоту (W. Manchot) и Кампешульте (W. Kampeschulte) J.
Нагревают серебряную пластинку приблизительно до 240° и дают подей-
ствовать на нее озону; тотчас появляются стальносиние пятна с фиолето-
выми краями. При пользовании чистым серебром эта реакция на холоду
не игра ходит; но стоит только потереть серебро наждачной бумагой, и
реакция наступает и. на холоду. При натирании серебряной пластинки наж-
даком, содержащим железо, на ней остаются следы окиси железа,
действующей как сильный катализатор. Подобно окиси железа' каталитиче-
ское действие проявляют еще и многие другие окиси, как, например AgaO,
СоО, NiO, BiaOs, РЬзО4, V2O5. МпО-2. CuO, ThOa, CeOa, TiO->, WOs, UsOe;
менее сильно действуют МоОз, HgO, СаО, ВаО. Если чистое серебро под-
вергнуть травлению азотной кислотой, оно после высушивания дает реак-
цию на озон также и на холоду.
Аммоний (NHJ
Нахождение в природе. В небольших количествах находится в воздухе
в виде углекислой и азотистокислой соли; в трещинах действующих вулка-
нов— в виде хлористого аммония NH4CI. Аммиак встречается во многих
минералах, как, например, в карналлите, аммонийных квасцах, апофилите
и в небольших количествах почти во всех кристаллических породах, от-
куда он путем выщелачивания попадает в минеральные источники. Аммиак
образуется также при гниении азотсодержащих органических веществ —
белковых веществ, мочевины и т. д.
СО(\Н>\- + НЮ СО,> + 2NHs
мочесина
и при сухой перегонке многих азотсодержащих веществ, как, например,
каменный уголь, рог. волос и т. д.
Хотя аммоний известен только в виде своей амальгамы, тем не менее
можно рассматривать его как металл, потому что аммонийные соли при
1 В. 40, 2S91 (1907).
320
электролитической диссоциации распадаются на катион NHf и соответствен-
ный анион; кроме того, соли аммония изоморфны с солями каетия.
Аммиак NHs сгущается в жидкость при —34° и плавится при —79°.
Упругость паров аммиака при 25° равна 9,9 ат. Он энергично соединяется
с кислотами с образованием солей одновалентного аммоний-иона. При 0°
1 объем воды абсорбирует 1300 объемов, а при 20° — 700 объемов аммиака.
Водный раствор действует как осадитель подобно гидроокисям калия и
натрия. Он осаждает некоторые гидроокиси в виде нерастворимых осад-
ков, но многие гидроокиси, которые осаждаются, например, едким натром,
не осаждаются аммиакрм частью вследствие наличия в растворе аммиака
малого количества гидроксильных ионов, частью вследствие тенденции
NHs к образованию комплексных ионов со многими катионами. Так, гид-
роокиси серебра, меди, кадмия, никеля, кобальта и цинка растворяются в
водном растворе аммиака, потому что происходит образование раствори-
мых ионов аммиакатов, например Си(№Нз)б’’, а гидроокись магния, почти
полностью осаждающаяся гидроокисью натрия, не осаждается аммиаком в
гго‘ису'стЧИИ ботьшого кощмества NHi-coth, потому что последняя настолько
подавляет ионизацию NH-iOH, что произведение растворимости Mg-(OH)a не
ДОС1И1 аСТСЯ.
Аммиак получается синтетически взаимодействием азота и водорода в
присутствии катализатора [процесс Габера (Haber), процесс Клода (Claud)]
и при действии водяных паров на цианамид кальция СаСЬЪ, получающийся
из карбида кальция СаС-2 и Na при высокой температуре. Аммиак полу-
чается также в виде побочного продукта при коксовании угля.
Соли аммония по многим своим реакциям чрезвычайно сходны с солями
калия.
Реакции мокрым путем
1. Сильные основания [NaOH, КОН, Са(ОН)г и пр.]. Аммо-
нийные соли при нагревании с водным раствором сильных осно-
ваний разлагаются с выделением аммиака:
NHtCI + NaOH -> NaCl + NH3 + H2O,
который узнается по запаху, по образованию дыма хлористого
аммония при внесении палочки, смоченной 12А НО, .в пары ам-
миака, по окрашиванию красного лакмуса в синий цвет и по
способности окрашивать в черный цвет бумагу, смоченную ни-
тратом одновалентной ртути:
24g—NO3 /н£\
| -HNH.,+HoO -> 3(NHJNO34-(\ >NH,— NO3-|-Hg3.
Hg—NO3 ' xHg/
черного цвета
Реакция сильных оснований с солями аммония может быть объяснена
законами химического равновесия. Аммиак NHs — газ, хорошо растворяю-
щийся в холодной и не растворяющийся в кипящей воде; при 100° весь газ
может быть вытеснен, так как в данном случае не имеется постоянной
точки кипения смеси, как в случае хлористоводородной кислоты (стр. 335).
Раствор аммиака в воде при лабораторной температуре находится в
равновесии с гидроокисью аммония;
NHs + HsO^LNHiOH
NHiOHyNH/ + ОН';
21 Зак. 9S2. Тредведл-Голл, т. I.
321
и
последнее равновесие
уравнением:
выражается по закону действия масс следующим
№•] [ОН']
[NH4OH]
ЛГ= 1,75-10-5.
Аммонийные соли в противоположность свободному основанию сильно
ионизированы. Поэтому, если к раствору аммонийной соли прибавлен избы-
ток ОН', то для установления равновесия между NHs’ и ОН' необходимо,
чтобы большая часть NHs’ превратилась в NH4OH, и затем для установле-
ния равновесия .между NHsOH и NHs около 2/s NHsOH должны превра-
титься в NHs. При кипячении раствора NHs улетучивается и вышеуказанные
состояния равновесия нарушаются. Конечным результатом этого является
превращение первоначального NHs’ в NHs-газ. Посредством испытания
лакмусом можно открыть меньше 0,2 .иг аммония, если производить эту
реакцию надлежащим образом. Кипячение 'нужно стараться производить
так, чтобы брызги щелочной жидкости не попадали ни в лицо, ни иа
реактивную бумагу.
Некоторые амидные и комплексные аммонийные соединения
при нагревании с едким натром иногда совсем не отщепляют
аммиак или отщепляют только часть его. Если нагреть, например,
чистый хлористый меркураммоний (меркуриамидохлорид) с ед-
ким натром, то часть азота выделится в виде аммиака; но если
наряду с меркураммонием находится избыток соли окиси ртути,
то при нагревании с едким натром не происходит выделения
даже и следов аммиака; напротив, последний выделяется тотчас,
как только к раствору прибавить сернистого калия или серни-
стого натрия:
,NH3
Hg< + K2S + Н2О HgS + КС1 + KOH + NH3.
ХС1
'Сама вода в некоторых случаях служит причиной выделения
аммиака. Она разлагает многие нитриды, амиды металлов и
цианамиды, причем выделяется аммиак:
Mg3N3 + 6НОН = 3Mg(OH)2 4- 2NH3
нитрид магния При ОбЫЧНОЙ
NHoNa + НОН = NaOH + NH3 температуре
натрийамид )
CaCNj + ЗН2О = СаСОз + 2NHs (при
цианамид
кальция
высокой температуре).
2. Платинохлористоводородная кислота дает желтый кристал-
лический осадок:
H2[PtCle] +2NHi‘-> (NH4)2[PtCIe] +2Н’,
который совершенно не растворим в концентрированном рас-
творе хлористого аммония и в спирту. Эта соль отличается от
соответственной калиевой соли:
а) своим отношением к прокаливанию,—она оставляет
только платину:
3(НН4)2[Р1С16] -> 2N2 + 2NH3 + 18НС1 + 3Pt,
322
б) своим отношением к сильным основаниям, при обработке
Которыми появляется запах аммиака:
(NH4)2[PtCl6] + 2NaOH -> Na2[PtCl6] + 2Н2О + 2NHS.
3. Винная кислота дает, как и с калиевыми солями, белый
кристаллический осадок кислого виннокислого аммония. При-
бавление уксуснокислого натрия и трение о стенки пробирки
благоприятствуют образованию осадка:
H2C4H40e + NHi NH4HC4H4O6 + Н .
Кислый виннокислый аммоний, как и соответственная калие-
вая соль, растворим в щелочах и минеральных кислотах. От
калиевой соли он отличается своим отношением к прокалива-
нию: остается только уголь, и осадок, облитый соляной кисло-
той, не шипит; далее, он выделяет аммиак при нагревании с рас-
твором едкой щелочи.
4. Нитрокобальти(3)ат натрия дает с NHi’ желтый осадок,
сходный с осадком, который образуется с калий-ионом. По-’
этому, прежде чем производить реакцию с этим реактивом на
калий, необходимо удалить аммонийные соли путем выпарива-
ния раствора досуха в фарфоровой чашке и нагревания до пол-
ного исчезновения паров солей аммония. Небольшие количества
аммонийных солей могут быть удалены путем кипячения с не-
большим количеством нитрита натрия и уксусной кислоты:
NH4‘ + NO/-» N2 + 2Н2О.
5. Пикриновая кислота, вольфрамат натрия и фосфорно-
молибденовая кислота (см. стр. 158) осаждают ионы аммония,
как и ионы калия. Хлорная кислота и антимонат калия осадков
не дают.
б. Йодистый калий и гипохлорит натрия. Растворы этих со-
лей осаждают черный иодистый азот:
2NH4- Ч- 2J' + 2С1О'-» NHJ2 + NH3 + 2СГ + 2Н2О.
’Для выполнения этой чувствительной реакции к нейтральному
или щелочному раствору аммонийной соли прибавляют не-
сколько капель 10%-ного иодида калия и каплю насыщенного
раствор гипохлорита натрия.
7. р-Нитродиазобензол в присутствии едкой щелочи дает
с солями аммония красновато-желтый хлопьевидный осадок, при-
чем раствор окрашивается в желтый или красный цвет. Эта
реакция основана на образовании аммонийной соли р-нитро-
фенилнитрозамнна Ч _____
O3N<^ ^)N2C1 Д-2NHjOH->
-> O2N< = NONH4 4- NH4C1 + H2O.
'Выполнение. На капельную пластинку помещают 1 каплю слабокис-
лого или нейтрального исследуемого раствора, прибавляют каплю рас-
твора реактива и добавляют немного (па кончике ножа) окиси кальция.
* Е. Ri egl е г, Chem.-Ztg. 21, 307 (1897).
21*
323
В присутствии аммонийных солей вокруг окиси кальция тотчас появляется
красный кружок. В отсутствие аммонийных солей окраска появляется
только после долгого стояния. Открываемый минимум: 1 т NHs.
Для приготовления реактива> растворяют при нагревании 1 г р-нитр-
анилкна в 20 мл дестиллированной воды, содержащей 2 мл соляной кис-
лоты; к полученному раствору добавляют 160 мл воды, взбалтывают, охла-
ждают и постепенно приливают 20 мл 2,5%-ного раствора нитрита натрия.
С течением времени раствор мутнеет, но после фильтрования его можно
сиова применять.
8. Реактив Несслера (см. стр. 106). Вышеприведенные реакции
недостаточны для открытия таких минимальных количеств ам-
миака, какие встречаются в питьевых и минеральных водах.
В этом случае пользуются реактивом Несслера (щелочной рас-
твор ртути о-и о ди стог о калия: K2[HgJj]. Большие количества
аммиака дают бурый осадок:
2K2HgJ4 + 4ОН' + NHH [HgeONHe]J + ЗН2О + 4К’ + 7J'.
Осадок представляет собой иодид так называемого основания Миллона;
его структурная формата1, вероятно,
/Hg\
[О< )NH2]J.
\Hg/
Соответствующий
ему черный нитрат образуется при реакции на аммиак посредством бумаги,
смоченной нитратом одновалентной ртути. Исдкд основания Миллона обла-
дает такой громадной красящей силой, что малейшие следы аммоний-ионов
узнаются по заметному желтому окрашиванию жидкости. Реакция удается
даже с обыкновенной дестиллированной водой. Так как аммиак часто по-
является в воде вследствие загрязнения ее разлагающимися органическими
веществами, то реакция на него дает возможность решить «опрос о при-
годности данной воды для питья.
Чтобы произвести реакцию Несслера, необходима вода, не содержащая
аммиака. Для этого к обыкновенной дестиллированной воде прибавляют
немного карбоната натрия и небольшое количество перманганата калия и
подвергают ее перепонке, отбросив первую четверть дестиллата. Перегонку
прерывают, как только 3/о первоначального количества воды перейдет в
дестиллат, так как остаток, как и первая фракция отгона, может содержать
аммиак. Средняя порция дестиллата дает лучшую по качеству воду для
химической лаборатории. Для большинства точных работ Необходимо
несслеровский реактив готовит именно на такой воде (стр. 106) и самое
испытание на аммиак должно производиться в лаборатории, в которой
отсутствуют аммиачные пары.
Для испытания питьевой воды на присутствие в ней следов аммоний-
ных ионов следует пользоваться прибором, представленным на рис. 16.
Прежде всего необходимо, чтобы в самом приборе не содержалось следов
аммонийной соли. Для этого вливают в .реторту около 500 мл воды, при-
бавляют 1 мл прокипяченного насыщенного раствора карбоната натрия и
перегоняют воду, присоединив шейку реторты к форштосу холодильника.
Не следует пользоваться резиновым соединением между шейкой реторты
и холодильником; можно обойтись даже без пробки1, так как конденсирую-
щаяся вода служит достаточным герметическим затвором.
Перегонку продолжают до тех пор, пока 50 мл дестиллата, собранного
в градуированном цилиндре из белого стекла или в так называемом
несслеровском цилиндре, по прибавлении 1 мл несслеровского реактива не
перестанут давать окраску в течение о мин. После этого прибор считается
готовым к применению.
Выполнение опыта. Опорожнивают через тубус реторту, вливают в нее
500 мл исследуемой воды, 1 мл насыщенного раствора соды и отгоняют
50 мл; прибавляют к ним 1 мл несслеровского реактива и перемешивают.
В присутствии больших сравнительно количеств аммиака тотчас появляется
желтое окрашивание, становящееся оранжевым спустя некоторое время;
324
при очень больших количествах получается бурый осадок; если же в воде
находятся только следы аммиака, жидкость окрасится в слабожелтый цвет
лишь после некоторого стояния.
Путем сравнения интенсивности окраски с окраской, вызванной извест-
НЫ'М количеством хлористого аммония, можно произвести весьма близкую
оценку точного количества имеющегося в исследуемой жидкости аммиака
или его соли.
Рис. 16.
Реакции сухим путем
Все соли аммония — относительно неустойчивые соединения.
Степень их устойчивости зависит вообще от силы кислоты, ко-
торая образует соль. Карбонат разлагается заметно уже при
обыкновенной температуре и, выставленный на воздух, он по-
степенно исчезает в виде аммиака, двуокиси углерода и воды.
При нагревании в закрытой трубке происходит разложение всех
аммонийных солей, причем выделяется либо- аммиак, либо ка-
кое-нибудь другое летучее соединение азота.
Если кислота при температуре разложения соли летуча, то вся
соль улетучивается, часто без предварительного плавления; при
охлаждении паров аммиака и кислоты снова происходит их со-
единение с образованием твердого вещества. Этим объясняется
появление аммонийных паров при прокаливании сухих остатков,
содержащих аммонийные соли; этим также объясняется обра-
зование возгона (сублимата) при нагревании хлористого аммо-
ния в закрытой трубке. К кислотам, образующим нелетучие
соли, относятся борная, фосфорная, хромовая, молибденовая,
вольфрамовая и ванадиевая.
Нужно, однако, помнить, что азот аммиака может легко
окисляться; это окисление часто имеет место в процессе разло-
жения аммонийной соли.
325
Так, разложение нитрата ведет к образованию закиси азота
N2O, а при разложении нитрита, сульфата и бихромата выде-
ляется газообразный азот.
Реакции, протекающие при нагревании в закрытой трубке
типичных аммонийных соединений, могут быть выражены сле-
дую щ и м и ур авнени ями:
Nl hCl NHs 4- НС1;
NHiXOs-* 2НаО + №0;
NH4NO2 -> 2НгО + Ns;
3(NH4)2SO4 -> N2 + 4NH.3 + 6Н2О + 3SO2;
(NHikCsCU -> 2NH3 + H2O + CO + CO21;
NaNHiHPOi • 4H2O -> NH3 + 5HiO + NaPOs;
2(NH4)aPO4 -> 6NH3 + 2HsO + 2НРОз;
(ЫНфСгЮт -> 4НгО + Ns + СГ2О3.
При последней реакции окись хрома остается в виде объеми-
стой массы, видом своим напоминающей листочки зеленого чая.
Соли аммония не дают характерного окрашивания пламени и
лишь его края слепка окрашиваются в зеленоватый цвет.
Гидроксиламин NHa(OH)
Т. пл. 33°. Т. кип. 58° при 22 мм давления
Образование. При электролизе азотной кислоты с ртутным или свин-
цовым электродом происходит восстановление ее в гидроксиламин NH2OH.
Фабричным путем гидроксилямин приготовляется по способу Рашига
(Raschig) путем восстановления нитрита натрия посредством бисульфита
натрия:
ONa HSOBNa /0Н
==ХаОН -j-N-SO3Na
'О HSO3Na \so„Nn
натриевая соль
гидроксиламин-
дисульфоиовой
кислоты
Если к полученной натриевой соли, которая отличается очень боль-
шой растворимостью, прибавить КО, то образуется трудно растворимая
калиевая соль, легко отделяемая от маточного раствора. При нагревании
калиевой соли с разбавленной серной кислотой под давлением при 130°
образуется сернокислый гидроксиламин, кристаллизующийся в красивых
столбиках моноклинической системы:
/ОН
2N-SO31\ -f 41 Ь>0 + I12SO4->4KHSO4+ [Nl 12(О11)]5 1USO4.
4SO3K
Путем обработки сульфата хлористым барием получают солянокислый
гидроксиламин:
ХТкОН • НС1.
1 При последней реакции образуется некоторое количество дициана
(CN)i из оксалата.
326
Как сернокислый, так и солянокислый гидроксиламин являются про-
дажными препаратами. Первый легко растворяется ,в воде, в спирту же
не растворим; второй легко растворяется в воде и спиртах, особенно
в метило-вом.
Гидроксиламин является сильным восстановителем. В зависимости от
условий он окисляется до №, N.O или NO. В некоторых же условиях
он может вести себя и как окислитель, восстанавливаясь при этом до-
аммиака.
Реакции мокрым путем
1. Фелингов раствор (см. стр. 152) восстанавливается уже на
холоду (быстрее при нагревании) с выделением закиси азота и
осаждением красной закиси меди:
2NH2OH + 4Cu’ ’ + 8ОН' -> 7Н2О + №0 + 2Си_О.
Так как №0 формально можно рассматривать как ангидрид азотно-
ватистой кислоты (.последняя распадается согласно уравнению: H2N2O2 —
№гО + НвО), то можно предположить, что гидроксиламин сперва окис-
ляется за счет кислорода окиси меди в неустойчивую азотноватистую кис-
лоту, которая затем тотчас распадается на воду и закись азота:
2NH-2OH + 4Сп • • + 8ОН' -> 6НгО + НО — N = N —< ОН .+ 2СизО
и
НО — N = N — ОН -* НЮ + №0.
Чувствительность 1:70 000 в отсутствие аммиака; в присутствии же
последнего 1 :7000.
2. Хлорная ртуть восстанавливается до металла только в при-
сутствии едкого кали или натра:
2NH2OH + 2HgCh + 4ОН' = 2Hg 4- N2O + 4СГ + 5Н2О.
Выполнение. К раствору, исследуемому на присутствие гидроксил-
a.MHHai прибавляют каплю едкого натра, затем прикасаются к стенкам
пробирки палоч,кой, смоченной раствором HgCh, и взбалтывают. При
содержании NHzOH в отношении 1:10 000 000 появляется на холоду за-
метное серое окрашивание, которое лучше всего наблюдается в отражен-
ном свете, если пробирку поставить против темного экрана. Одновременно
с этим опытом производят контрольный опыт с тем же количеством едкого
натра и HgCh, причем если взято не слишком много HgCh, раствор
остается совершенно прозрачным. В присутствии аммиака контрольный рас-
твор дает синеватую муть вследствие образования хлористого меркурам-
мония; но если к такому раствору прибавить гидроксиламин, то уже при
концентрации 1:1000 000 синеватый оттенок явственно переходит
в серый.
3. Нитриты щелочных металлов. Если к концентрированному
раствору какой-либо соли гидроксиламина приливать по каплям
концентрированный раствор нитрита щелочного металла1, то вы-
деляется закись азота, которую 'можно принять за кислород, так
как тлеющая лучинка в ней зажигается. Этот газ отличается от
кислорода тем, что он с окисью азота не дает бурых паров
(NO2).
1 Но <не наоборот, ибо в противном случае реакция примет бурный
характер,
327
При 'действии нитрита на соль гидроксиламина образуются сперва
свободный гидроксиламии и свободная азотистая кислота, которые затем
реагируют друг с другом с образованием весьма нестойкой азотновати-
стой кислоты, которая тотчас распадается иа закись азота и воду:
.^а) NHa(OH)• HCI-рNaONO -* NaCl>+NHs(OH)-ЦНО—tNO;
Z HO —N —Гн-; H—О—N
6) i ? i -+ H2O + и ;
HO — N — H — О — N
в) OH — N = N — OH НЮ + N»O.
4. Ванадиевая кислота. Если к кислому раствору ванадата
щелочного металла прибавить соль гидроксиламина, то рас-
твор окрашивается в синий цвет, так как ванадиевая кислота
восстанавливается в соль ванадила с выделением азота:
2HVO3 + 2(H3NOH)‘ + 2Н' Na + 6Н2О + 2VO’' \
Эта реакция не отличается особенной чувствительностью.
5. Соли окиси железа в кислом растворе восстанавливаются
при нагревании в соли закиси железа. Если соль окиси железа
находится в большом избытке, то гидроксиламии (восстанавли-
вается количественно до закиси азота:
4Fe‘ • ’ + 2(H3NOH)‘ -> 4Fe’’ + 6Н‘ + №0 + НаО;
при малом же количестве соли окиси железа наряду с указан-
ной реакцией протекает еще и следующая:
3Fe’' • + (H3NOH) 3Fe’ ‘ + 4Н‘ + NO.
Здесь, как и в предыдущей реакции, гидроксиламин действует
восстановляющим образом; по отношению же к солям закиси
железа в щелочном растворе он действует как окислитель:
NHj —ОН + Н2О + 2Fe(OH)2 — 2Fe(0H)s + NHs.
6. Платинохлористоводородная кислота не дает осадка (от-
личие от аммиака).
7. Реакция Бамбергера (Bamberger)1 2. Эту чрезвычайно чув-
ствительную реакцию производят следующим образом.
К исследуемому раствору (большею частью минеральнокис-
лому) прибавляют избыток ацетата натрия и следы хлористого
бензоила (которые целесообразно вводить в раствор при по-
мощи тонкой стеклянной палочки), после чего взбалтывают до
исчезновения резкого запаха, на что требуется около 1 мин.;
1 В этом уравнении (H$N0H)‘ является катионом соли гидроксиламина',
например хлоргидрата его, образующейся по типу хлористого аммония.
ГН. /Н
,н/ \он.
Строение такой соли может быть представлено в виде
С(. Ред.
2 В. 32, 1805 (1899).
328
затем (прибавляют (разбавленной соляной кислоты и несколько
капель'раствора хлорного железа. В присутствии гидроксиламина
раствор окрашивается в фиолетовый цвет.
Хлористый бензоил переводит гидроксиламин в бензгидрю-
ксамовую кислоту, которая с FeCh дает характерную окраску:
С6ЧБСО.
nh2 (он)-f-с6нБсос1-> на + Лх—он
хлористый бензгидроксамовая
бензоил кислота
Чувствительность этой реакции очень велика; по Бреннеру
можно открыть гидроксиламии в отсутствие аммиака пои кон-
центрации 1 : 200 000 и в присутствии аммиака — при концентра-
ции '1 :5000.
Примечание. В присутствии свободного аммиака раствор подкис-
ляют разбавленной соляной кислотой и поступают далее так, как выше
указано. Так как присутствие слишком большого количества соляной ки-
слоты мешает появлению фиолетового окрашивания, Бреннер рекомендует
•прибавлять к уксуснокислому раствору FeCls и затем по каплям соляной
кислоты до тех пор, пока бурая окраска не перейдет в фиолетовую.
N = На
Гидразин |
N H>
Плотность 1,013. Т. пл. 1,4°. Т. кип. 113°
Образование. По Рашигу 1 при действии гипохлоритов щелоч-
ных .металлов на аммиак образуется сперва монохлорамин, ко-
торый при дальнейшем взаимодействии с аммиаком дает
гидразин:
1. NaOCl + ЫНз-> NaOH +NH2CI;
монохлорамин
2. NH2CI + NH3-> HCI+NH2 —NH2.
Для получения гидразина растворяют 100 г NaOH в возможно малом
количестве воды, прибавляют 600 г льда, пропускают хлор до увеличения
веса на 71 г и разбавляют водой до 1 л. К 100 мл этого раствора прили-
вают смесь из 200 мл 20%-ного аммиака и 5—40 мл 10%-ного раствора
клея, препятствующего разложению образующегося в качестве промежу-
точного продукта монохлорамина2, быстро нагревают до кипения и кипя-
тят до тех пор, пока не исчезнет запах аммиака. После охлаждения при-
бавляют при помешивании большой избыток концентрированной HaSO-i,
при этом через несколько минут выпадает кислый сульфат гидразина.
Гидразин находится в продаже в виде хлоргидрата и сульфата:
N2H4 • НС1
хлоргидрат
гидразина
N2H4 • h2SO4
сульфат
гидразина
n2h4 • Н2О
гидрат
гидразина
1 Chem.-Ztg. 31, 926 (1907), и Chem. Zentr, II, 1387 (1907).
2 Образующийся промежуточный продукт NH2C1 легко разлагается, вы-
деляя азот. Клей препятствует этому разложению, являясь антикатализато-
ром. Ред.
329
Свободный гидразин легко соединяется с водой с образованием гидрата
гидразина. Все эти вещества представляют собой сильные восстановители;
они легко отщепляют водород и выделяют азот (отличие от гидроксил-
а.мина).
Реакции мокрым путем
1. Иодаты восстанавливаются медленно на холоду, быстрее
при нагревании, до иода с выделением азота:
4JCV + 5№Нт + 4Н' — 12НгО + 5№ + 2Ъ.
Выполнение. К раствору йодата приливают несколько капель разбав-
ленной H2SO4, прибавляют крахмал в испытуемый на присутствие гидра-
зина раствор, после чего смешивают эти растворы и нагревают до начи-
нающегося кипения. В присутствии гидразина раствор по охлаждении
окрашивается в синий цвет. Чувствительность 1:100 000.
2. Перманганаты в кислом растворе обесцвечиваются. Чувстви-
тельность 1 : 2 000 000.
3. Фелингов раствор (см. стр. 152) восстанавливается при на-
гревании, выделяя красную закись меди:
NeH: 4- 4Cu ’ ’ + 8ОН'-> 2Cu2O + Na + 6H2O.
Чувствительность 1 : 70 000.
4. Иодный раствор обесцвечивается долями гидразина в при-
сутствии NaHCOs:
N2H4 + 2Ja -» 4J' 4- 4Н‘ + N2.
Чувствительность 1 : 10 000 000.
5. Ванадиевая кислота окрашивается при нагревании в кислом
растворе <в синий цвет:
4НУОз -г N2H4 + 8Н’ 8Н2О + Ne + 4VO’
Чувствительность 1 : 50 000— 1 : 100 000.
6. Хлорная ртуть восстанавливается до металла в присутствии
едкого натра, но не в присутствии одного лишь ацетата натрия:
N2H4 + 2НцСЪ + 4ОН' ->2Hg 4- N2 + 4СГ 4НгО.
Чувствительность 1 : 70 000.
7. Хлорное золото восстанавливается в щелочном растворе
до металла:
4Аи" • ’ + 3N2H4 -> 12Н’ + 3N2 + 4Au.
Чувствительность 1 :10 000 000.
8. Аммиачный раствор серебра восстанавливается до металла:
4[Ag(NHa)2] ’ N2H4 ->4NH<' -f- 4NH3 j-Na -f- 4Ag.
Чувствительность 1 : 10 000 000.
330
9. Бензойный альдегид дает t солями гидразина, яучше всего
й присутствии очень .малого количества разбавленной H2SO4,
ВКе.лтый кристаллический осадок бензальдазина (т. пл. 93°)j
с6н5
Н —С = О
н—с = о
С6Н6
бензойный
адьдегяд
Н2 = хХ
наД
-> 2НаО +
С6Н5
н —C = N
н—c=i
С6Н5
беизальдазии
Это самая лучшая реакция для констатирования присутствия
гидразина1. Чувствительность 1 : 100 000.
10. Азотистая кислота образует с сожми гидразина взрыв*
чатую азотистоводородную кислоту:
N2H4 + Н\+ NO/ -► 2НЮ + NsH.
О выполнении этой весьма опасной реакции см. главу об азотисто-
водородной кислоте (стр. 402).
Анализ группы V
ТАБЛИЦА VII. АНАЛИЗ ГРУППЫ V
Фильтрат от группы IV может содержать NH'4., К' и Na’
выпаривают а прокаливают остаток. Растворяют в воде, прибавляют
ВаСБ (для удаления SO^'), затем (NH^CO^ (для удаления Ва-). Выпари-
вают и снова прокаливают (1)
Пары: Соли NH4. Испытание на NH\ проводят непосред- ственно в исходном анализируемом продукте путем кипячения с NaOH. Посинение лакмусо- вой бумажки укачи- вает на присутствие N«4 (Д Остаток: КО, NaCl. Прибавляют НС1О& выпаривают, охлаждают, прибавляют спирт и фильтруют (2)
Остаток: KCIO4. Растворяют в горя- чей воде, приба- вляют Na3[Co(NOzk]- Желтый осадок K2Na[Co(NO/e] подтверждает при- сутствие К (2) Фильтрат: NaC104. Насыщают газо- образным на (3)
Осадок NaCl. Растворяют в воде и приба- вляют KH,SbOt. Белый кристал- лический осадок NaH2SbO± под- тверждает при- сутствие Na (3) Фильтрат: отбросить
Ход анализа
Г. Для удаления аммонийных солей выпаривают раствор до-
суха в небольшой чашке и прокаливают остаток сперва умеренно,
а затем при температуре ниже красного каления до тех пор,
1 Си г tins и. Jay, J. prakt. Chesn. (2), 44, 39 (1891).
331
пока не прекратится выделение белых паров. Захватив чашку
щипцами, обогревают как ее стенки, так и дно, вращая ее над
маленьким пламенем. Охлаждают, прибавляют 5 мл воды и
2—10 мл раствора ВаС1г для удаления сульфата. Даже в том
случае, когда в первоначальном веществе сульфат отсутствует
и когда серная кислота не применялась при анализе, в ходе его
может образоваться небольшое количество сульфата (Вследствие
окисления сернистого аммония, применяемого при осаждении
третьей группы. Сульфат должен быть удален, так как в про-
тивном случае выпадает NaaSOi, когда прибавляют спирт при
испытании на калий. Кипятят в течение 2—3 мин. и отфильтро-
вывают ВаЗОк К фильтрату прибавляют 5 мл (ИНДгСОз, дают
смеси постоять 5 мин., нагревают почти до кипения и отфиль-
тровывают ВаСОз. Фильтрат выпаривают досуха и прокаливают,
как выше было описано. Охлаждают чашку, прибавляют 5 мл
воды и фильтруют через небольшой фильтр. Фильтрат выпари-
вают еще раз и снова прокаливают. Белый остаток, с трудом
различаемый в фарфоровой чашке, указывает на присутствие
КС1 или NaCl или обоих вместе.
2. Для разделения натрия и калия к прокаленному остатку
прибавляют 2—5 мл 6N хлорной кислоты и выпаривают, вращая
чашку над голым огнем до тех пор, пока не начнут выделяться
тяжелые пары хлорной кислоты. Охлаждают и прибавляют при
комнатной температуре 10—20 мл 95%-ного этилового спирта.
Перемешивают в течение нескольких минут, фильтруют и про-
мывают осадок спиртом. Фильтрат сохраняют для испытания
на натрий. Осадок перхлората калия растворяют в несколь-
ких мл горячей воды, охлаждают и прибавляют 5 мл нитроко-
бальти(3)ата натрияЕ Появление желтого осадка подтверждает
присутствие калия.
3. Фильтрат от осадка перхлората калия вливают в неболь-
шую колбочку и насыщают его сухим газообразным НС1. От-
фильтровывают осажденный хлорид натрия и промывают не-
большим количеством спирта, самый же фильтрат выливают.
(Этот фильтрат, нагретый или выпаренный, может дать опасный
взрыв 1 2). Хлорид натрия растворяют в 10 мл воды и выпаривают
раствор досуха. К сухому остатку прибавляют 1 мл воды и не-
сколько капель раствора едкого кали, чтобы сделать раствор
щелочным. Прибавляют 2 мл антимоната калйя и дают (смеси
постоять некоторое время. Появление белого кристаллического
осадка подтверждает присутствие натрия. Если образуется хлопье-
видный осадок, то более тяжелый натриевый осадок мо-
жет быть обнаружен, если взболтать' смесь и через несколько
секунд слить жадность путем декантации с более тяжелого анти-
моната натрия, пристающего обыкновенно к стенкам стеклян-
ной посуды.
1 О концентрации применяемых реактивов см. «Специальные реактивы»
(стр. 106). Ред.
2 Взрыв обусловливается образующимся этвдперхлоратом. Ред.
332
4. Для испытания на аммоний к небольшому количеству перво-
начально взятого для анализа вещества или раствора (соответ-
ствующего приблизительно 0,25 г твердого вещества) в пробирке
прибавляют около 2 ли 6N едкого натра, нагревают -почти до
кипения и в выделяющихся парах держат кусочек красной лак-
мусовой бумаги, обернув ею конец стеклянной палочки. Посине-
ние лакмусовой бумажки указывает на присутствие аммония. Следует
следить за тем, чтобы лакмус не приходил в соприкосновение
с едкой щелочью при разбрызгивании последней или при
прикосновении бумаги к внутренним стенкам пробирки. Некото-
рое представление об имеющемся в исследуемом объекте коли-
честве аммонийных солей может дать запах. Если хотят открыть
следы аммония, то производят испытание по Несслеру, как опи-
сано на стр. 324.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1, а) Объясните принцип отделения Na от К посредством КС1О4.
б) Назовите три относительно нерастворимые соли К и напишите
их формулы.
в) Укажите реакцию, подтверждающую наличие Na; напишите фор-
мулу конечного получающегося вещества и укажите его важные
физические свойства.
2. а) Как открыть NHK в неизвестном веществе? В какой части анализа
вы будете производить испытание на него?
б) Укажите другую реакцию на NHr. Как ее провести?
3. Что произойдет, если раствор HCIQ4 и спирт нагревать на голом
пламени?
4. Как удаляют SO4" и чем объясняется его постоянное присутствие?
5. Если раствор нитрокобальти(3)ата натрия 0.3N по содержанию
Nas[Co(NO2)«], 0,ЗУ по содержанию NaNOs и 1N по содержанию
СНзСООН, сколько граммов каждого из этих веществ содержится
в 1 мл реактива?
6. Напишите схему анализа группы щелочных металлов в виде таблицы.
7. Как приготовляют раствор KEESbCK?
8. Напишите уравнение окисления спирта в Н2О и СОг при действии
НСЮ4 с превращением последней в НС1. Вычислите объемы обра-
зующихся НС1 и ССй, если они будут измерены сухими при 80° и
780 мм давления.
9. Сколько можно получить K’Na[Co(NO2)e] ив 0,25 г KCI?
10. Если осадок K2Na[Co(NO2)c] подвергнуть действию КМпСй в присут-
ствии кислоты, то образуются К'", Na', Мп'', Со''м NO<’ и НЮ,
Напишите уравнение реакции.
ЧАСТЬ HI
РЕАКЦИИ АНИОНОВ
РАСПРЕДЕЛЕНИЕ КИСЛОТ ПО ГРУППАМ
Классификация кислот, данная в этой книге, была впервые
опубликована Р. Бунзеном (R. Bunsen) в 1878 г. (в виде ману-
скрипта) для его учеников. Эта классификация была принята
(с согласия автора) В. Мейером (V. Meyer) и Тредвеллом в издан-
ных ими «Таблицах качественного анализа». Она основана на
различной растворимости бариевых и серебряных солей.
Группа I содержит кислоты, серебряные соли которых не рас-
творимы ни в воде, ни в азотной кислоте, но бариевые соли которых
в воде растворимы.
К этой группе принадлежат: хлористоводородная, хлорнова-
тистая, хлористая, бромистоводородная, иодистоводородная,
цианистоводородная, железистосинеродистоводородная, железо-
синеродистоводородная, роданистоводородная и кобальтосине-
р о ди стово д ор о дная к ис л оты.
Группа II содержит кислоты, серебряные соли которых раство-
римы в азотной кислоте, но трудно растворимы или не растворимы
в воде, и бариевые соли которых в воде растворимы.
Сюда относятся: азотистая, сернистоводородная, селенистово-
дородная, теллуристоводородная, уксусная, циановая, муравьиная,
фосфорноватистая и азотистоводородная кислоты.
Группа III содержит кислоты, серебряные соли которых белого
цвета и ’растворимы в азотной кислоте, бариевые же соли также,
растворяются в азотной кислоте, но трудно растворимы или не рас-
творимы в воде.
Сюда относятся: сернистая, селенистая, теллуристая, селеновая,
теллуровая, угольная, надугольная, борная, надборная, щавелевая,
винная, лимонная, фосфористая, метафосфорная, пирофосфор-
ная, йодноватая и молибденовая кислоты.
Группа IV содержит кислоты, серебряные соли которых окра-
шены и растворимы в азотной кислоте, бариевые же соли не раство-
римы в воде, но растворимы в азотной кислоте.
Сюда относятся: фосфорная, фосфорноватая, тиосерная, ги-
Дросернистая, мышьяковая, мышьяковистая, хромовая, вана-
диевая и иодная кислоты.
Группа V содержит кислоты, серебряные и бариевые соли кото-
рых растворимы в воде,
334
К ней относятся: азотная; хлорноватая, хлорная, надсерная,
моноиадсерная, марганцовистая и марганцовая кислоты.
Группа VI содержит кислоты, серебряные соли которых в воде
растворишы и бариевые соли которых в азотной кислоте не рщ>
творимы.
К ней относятся: серная, фтористоводородная и кремнефто-
ристоводородная кислоты.
Группа VII содержит нелетучие кислоты, образующие со щело-
чами растворимые соли. w
К ней относятся: кремневая, вольфрамовая, титановая, нио-
биевая и танталовая.
ГРУППА I
Азотнокислое серебро дает не растворимый в азотной кислоте
осадок.
Хлористый барий не дает осадка.
I-
Хлористоводородная кислота НС!
Нахождение в природе. Хлористоводородная кислота в свободном
состоянии редко встречается в природе (например, в продуктах выделе-
ния вулканов); соли же ее, главным образом щелочных металлов, широко
распространены.
Наименование «соляная кислота» (которое обычно применяется в ана-
литической химии) относится к V2N водному раствору, содержащему около
39,1% по весу хлористого водорода и имеющему плотность 1.2. Безводный
хлористый водород при обыкновенных температурах—бесцветный газ
с характерным удушающим1 и раздражающим- запахом. В твердом состоя-
нии он плавится при —111° и кипит при —85°; критическая температура
51,3° и критическое давление 83 ат. Кислота с плотностью 1,10 содержит
20,4% НС1 и обладает постоянной точкбй кипения 110°. На основании этой
постоянной температуры кипения можно было бы думать, что НС1 обра-
зует ,с НаО химическое соединение; в действительности же указанная
ысислота представляет постоянно кипящую смесь, соответствующую прибли-
зительно 6N раствору. Кислота, плотность которой больше 1,10, теряет при
'испарении хлористый водород быстрее, чем воду, а при плотности, мень-
шей 1,10, вода испаряется быстрее, чем хлористый водород. В обоих слу-
чаях смесь стремится при испарении или при кипении приблизиться к ки-
слоте с постоянной точкой кипения.
Получение. Хлористоводородная кислота обыкновенно получается при
действии серной кислоты на поваренную соль. При этом выделяется значи-
тельное количество хлористоводородного газа даже на холоду с образова-
нием бисульфата натрия:
NaCl + H2SO4-3- NaHSOi + HCI.
При нагревании происходит дальнейшая реакция между бисульфатом и
хлористым натрием;
NaHSCh + NaCl -» Na»SOi + Н!С1.
Если в двухосновной кислоте замещается лишь один водород, то полу-
чающуюся соль обычно обозначают приставкой би перед названием' ани-
она: бикарбонат натрия NaHCOs, бисульфат натрия NaHSCh и т. д. В таких
солях на эквивалент основания приходится в два раза больше кислоты,
чем в нормальной соли.
335
В лабораториях газообразный хлористый водород удобно получать
путем прибавления по каплям концентрированной серной кислоты к
соляной кислоте. Он также образуется при действии воды на некоторые
хлор ангидриды:
PCls + ЗН2О -> НзРОз + ЗНС1.
Свойства. Хлористый водород легко растворим в воде (один объем
воды растворяет при 18° 451 объем хлористого водорода). Плотность
насыщенного водного раствора 1,21, и в 100 мл такого раствора содержится
50,7 г безводного хлористого водорода. Концентрированная соляная кислота,
применяемая в лаборатории, приблизительно 12 нормальна и содержит от
36 до 39% по весу НС1. Водный раствор хлористого водорода является
одной из сильнейших кислот. В разбавленном растворе кислота почти пол-
ностью ионизирована:
HCl-H’+Cl',
и такой раствор хорошо проводит электрический ток.
Характерно отношение хлористого водорода к окислению, при ко-
тором образуетси вода и выделяется свободный хлор:
4НС1 + 2НгО + 2С1г.
Это окисление не происходит ни на воздухе, ни даже в атмосфере
чистого кислорода *, а только под влиянием сильных окислителей: высших
окислов тяжелых металлов, нитратов, нитритов, хлоратов, гипохлоритов,
хроматов, селенатов и теллуратов.
Перекиси металлов не выделяют хлор, но образуют перекись водорода:
ВаОг + 2НС1-* BaiCh + Н2О2.
1. Окисление хлористого водорода высшими окислами тяжелых металлов
Двуокисью марганца:
4НС1 + МпОг ->2НгО + MnCh + Ch.
Четырехвалентный марганец восстанавливается до двухвалентного, а
отрицательно заряженный ион хлора превращается в нейтральный атом
хлора (газообразный хлор). Таким образом, один атом марганца окисляет
два атома хлора,
б) Двуокисью свинца:
4НС1 + РЬО2 -> 2Н.-0 + PbCh + Ch.
в) Трехокисью хрома (ангидридом хромовой кислоты):
2СгОз + 12НС1 -> 6Н2О + 2СгС1з + 3Ch.
2. Окисление хлористого водорода азотной кислотой и другими
окислителями
При действии концентрированной азотной кислоты на концентрирован-
ную соляную кислоту продуктами реакции являются вода, хлористый
иитрозил и свободный хлор:
HNOs + ЗНС1 -> 2Н.»О +' NOC1 + С1г.
1 Эю положение верно только в том случае, если подвергать взаимо-
действию НО и Ог при обычных температурах и в отсутствие катализато-
ров. При повышенных же температурах и в присутствии катализаторов
окисление хлористого водорода кислородом воздуха протекает достаточно
легко. Так, широко распространенный раньше в технике процесс получе-
ния свободного хлора по Дикону основывался на окислении НС1 кислоро-
дом воздуха при температуре 450° в присутствии CuCh. Ред. М. Л.
336
В этой реакции валентность азота снижается с пяти до трех, а два
атома хлора окисляются, образуя электронейтральную молекулу хлора-
Смесь одного моля азотной и трех молей соляной кислоты известна
под названием царской водки; Для получения царской водки кислоты сме-
шивают не по весу, а по объему.
Таким образом, царская водка является хлорной водой с тем отли-
чием, что хлор в ней находится в состоянии выделения (in statu nascendi).
Этим объясняется значительно более энергичное действие царской водки,
чем обыкновенной хлорной воды.
Аналогично реагируют с хлористым водородом нитриты, хлораты, гипо-
хлориты, селенаты и теллураты. >
Соляная кислота одноосновна; соли ее называются хлоридами.
Растворимость хлоридов. Большинство хлоридов растворимо в воде;
не растворимы или трудно растворимы:
Хлористая ртуть HgeCls
Хлористое серебро AgCl
Хлористая медь СизСБ
Хлористый свинец РЬСБ
Хлористый таллий Т1С1
Хлористое золото AuCl
Хлористая платина PtCla
Хлорокись висмута В1ОС1
Хлорокись сурьмы SbOCl
Хлорокись ртути НдгСЬО
Все не растворимые в воде хлориды более растворимы в концентри-
рованной соляной кислоте. Хлориды одновалентного золота и двухвалент-
ной платины легко растворяются в царской водке вследствие происходя-
щего при этом окисления, но хлористое серебро весьма слабо раство-
ряется даже в царской водке.
При кипячении нерастворимых хлоридов с концентрированным раство-
ром углекислого натрия они (за исключением хлористого серебра) легко
разлагаются, например:
Hg2Cl + Na.COs -> 2NaCl + СО2 + Hg2O.
При фильтровании получают раствор хлорида, не содержащий тяже-
лого металла.
При сплавлении с карбонатом натрия подвергается разложению даже
и хлористое серебро:
4AgCl + 2Ма2СОз ->4NaCl + 2СОг + Оа + 4Ag.
О разложении хлорида серебра металлами и разбавленной кислотой см.
стр. 120.
Все расплывающиеся хлориды (хлористые литий, кальций и стронций)
растворяются в абсолютном алкоголе (этиловом) и даже в амиловом
спирте.
Хлористый натрий и барий в концентрированной соляной кислоте почти
не растворимы. Поэтому их легко отделить от большинства других хлори-
дов путем насыщения раствора хлористым водородом и затем фильтрова-
нием.
Большая часть хлоридов не растворима в эфире; растворимы: хлорная
ртуть, хлорное и хлористое олово, хлорное золото и хлорное железо.
Реакции мокрым путем
Для реакций следует пользоваться нейтральным раствором какой-либо
щелочной соли хлористоводородной кислоты.
Все хлориды, за исключением хлоридов ртути и кадмия, ионизированы
в водном растворе полностью, так что безразлично, какой хлорид приме-
няется для нижеследующих реакций, если только катион его не будет
принимать участия в реакции.
22 Зак. 9S2. Тредвелл-Голл, т. I.
337
1. Разбавленная серная кислота (1 :10) не реагирует нй на
холоду, ни при нагревании.
2. Концентрированная серная кислота разлагает на холоду
почти все, а при нагревании все хлориды. При этом образуются
сернокислая соль и бесцветный хлористый водород, легко .рас-
познаваемый по запаху, по образованию облака на влажном воз-
духе или с парами .аммиака (смоченная последним стеклянная
палочка подносится к краю ‘Пробирки), а также по окрашиванию
синей лакмусовой бумаги в красный цвет. Вода не мутится от
хлористого водорода (отличие от фтористого кремния).
Хлористое серебро и хлористая ртуть с трудом разлагаются серной
кислотой, причем последняя соль с выделением двуокиси серы; сульфат
одновалентной ртути (образующийся вначале) окисляется в сульфат двух-
валентной ртути (за счет кислорода серной кислоты):
Hg:Cl: + HeSO< -> HgcSO4 + 2НС1;
Hg:SCW 2H?SOs -> 2HgSO4 + 2H:O + SO:.
При нагревании хлорида и окисляющего агента с концентрированной
серной кислотой выделяется свободный хлор (стр. 336).
3. Фосфорная кислота при нагревании с хлоридом также вы-
деляет хлористый водород. При одновременном присутствии
окислителя выделяется хлор.
4. Азотнокислое серебро выделяет белый творожистый оса-
док хлористого серебра:
СГ + Ag’-> AgCl,
не растворимый в азотной кислоте, растворимый в аммиаке, циа-
нистом калии и тиосернокислом натрии (см.. Серебро).
Из аммиачного раствора хлористого серебра кислоты снова осаждают
хлористое серебро. Из раствора в цианистом калии кислоты выделяют
цианистое серебро.
Если хотят испытать раствор сульфата двухвалентного железа не при-
сутствие в нем малых количеств хлорида, необходимо предварительное
сильное подкисление азотной кислотой, потому что в противном* случае
выделится осадок металлического серебра, что может послужить причиной
неясности результата (стр. 120). Для открытия соляной кислоты в сульфате
двухвалентного железа лучше всего подщелоченный содой раствор послед-
него прокипятить и отфильтровать. В фильтрате кислоты исходного
раствора будут находиться в виде их натриевых солей в присутствии
избытка карбоната натрия; раствор перед добавлением нитрата серебра
должен быть подкислен азотной кислотой.
Открытие хлора, когда он находится в виде хлорида тяжелого металла,
производится таким же образом. Любой нерастворимый хлопнд, за исклю-
чением хлорида серебра, может быть разложен таким же пу ем, т. е. кипя-
чением с раствором карбоната натрия.
Чтобы открыть присутствие хлора в хлористом серебре, на последнее
действуют разбавленной серной кислотой и цинком (стр. 120). Спустя ко-
роткое время раствор сливают с выделившегося серебра и его испытывают
нитратом серебра. Можно также хлористое серебро сплавить с карбонатом
натрия, сплав выщелочить водой, отфильтровать, подкислить азотной
кислотой и испытать азотнокислым серебром.
5. Нитрат ртути (1) и ацетат свинца выделяют осадки хлори-
стой ртути и хлористого свинца. Последний осаждает из раствора
хлорного золота двойной хлорид золота и* свинца.
338
6. Двухромовокислый калий и серная кислота. Если к сухому
хлориду, находящемуся в небольшой реторте, прибавить твер-
дый двухромовокислый калий и концентрированную серную' кис-
лоту, то при нагревании будут выделяться бурые, похожие на
бром (пары, стущающиеся в .приемнике в бурую жидкость (хло-
ристый хромил CrO’Cla):
КгСгаО? + 4NaCl + 6H2SO4 -> ЗНЮ + 4NaHSOi +
4- 2KHSOj + 2СгОгС12.
•
Хлористый хромил как хлорангидрид кислоты шестивалент-
ного хрома легко расщепляется водой на хромовую и хлористо-
водородную кислоту:
CrOsCh + 2НзО -> Н2СГО4 + 2НС1.
При действии едкого натра или кали получается хлористый
щелочной металл и щелочная соль хромовой кислоты (желтого
цвета). Если подкислить этот раствор, влить его в раствор пере-
киси водорода, к которой прибавлен эфир; то при взбалтывании
получится окрашенный в синий цвет эфирный слой, что служит
признаком присутствия хромовой кислоты; а так как последняя
может попасть в приемник только в присутствии хлорида, то
этим самым доказывается и присутствие хлора (отличие от брома
и иода).
При малом количестве исследуемого вещества поступают сле-
дующим. образом. Нагревают в пробирке смесь бихромата калия
и хлорида с концентрированной серной кислотой и держат стек-
лянную палочку, смоченную раствором едкого натра, в пробирке
высоко над поверхностью жидкости, чтобы сконденсировать вы-
деляющийся C1-O2CI2; после этого1 стеклянную палочку обмывают
несколькими каплями воды, которую собирают в 'чистую про-
бирку, подкисляют разбавленной серной кислотой, прибавляют
эфир, затем перекись водорода и тотчас взбалтывают. Посине-
ние эфирного слоя указывает на присутствие иона хлора.
Реакция на хлор-ион может быть выполнена еще следующим образом.
К твердому исследуемому веществу или к остатку, полученному от выпа-
ривания досуха исследуемого раствора, прибавляют немиого бихромата
калия s порошке и очень малое количество концентрированной серной
кислоты. Жидкость перегоняют, пропуская пары через 1%-ный раствор
дифенилкарбазида (с гр. 221), который окрашивается хлористым хромилом
в фиолетовый цвет. Этой реакцией можно открыть 1,5 Т хлор-иона1.
7. Перманганат калия окисляет хлорид в кислом растворе;
значительно легче окисляются бромистоводородная и иодисто-
водородная кислоты.
Отношение хлоридов к прокаливанию
Хлориды щелочных и щелочноземельных металлов плавятся
(без заметного разложения) при нагревании на воздухе. Хло-
1 Более подробное описание зтой реакции дается в книге Файгля,
Капельный анализ, стр. 334. Ред.
22*
339
риды (полутораокисей при прокаливании на воздухе более или
менее полностью разлагаются. Так, хлорное железо разлагается
почти количественно на окись железа и хлор:
4РеС1з + 30'2 —> 2РегОз + 6CI2.
В присутствии хлористого водорода или хлористого аммония хлорное
железо может полностью улетучиться без какого-либо разложения.
Хлориды золота и платиновых металлов легко разлагаются
на хлор и металл:
2А.иС1з -+ 2 Au 4- ЗС1г;
PtCb -> Pt + 2С1г.
Остальные хлориды, за исключением хлористого аммония
(стр. 325), большею частью летучи без заметного разложения.
Открытие хлора в неэлектролитах
Хлор, помимо соединений с металлами и водородом, образует также
соединения с неметаллами, например РС1з, PCls, AsCls, AsCls, SbCls, CCh,
Si Ch и пр.
Все эти соединения, которые могут быть рассматриваемы как хлоран-
гидриды кислот, разлагаются водой с образованием хлористоводородной
кислоты, реакция на которую производится обычным путем. Обычно
гидролиз происходит при обыкновенной температуре. Так, треххлористый
фосфор дает с водой фосфористую и соляную кислоты:
РС1з + ЗНОН-» НзРОз + ЗНС1,
а пятихлористый фосфор дает фосфорную и соляную кислоты:
PCh + 4Н0Н-> НзРОд + 5НС1.
Подобным же образам разлагаются водой и другие хлорангидриды
при обыкновенной температуре, за исключением четыреххлористого угле-
рода, разложение которого водой происходит только при нагревании в
запаянной трубке:
СС14 + 2№0-> СО + 4НС1.
Хлор, действуя на большинство углеводородов, образует продукты за-
мещения, которые являются неэлектролитами и, следовательно, не дают
реакций на хлор-ион. Если, например, хлороформ СНС1з взболтать с вод-
ным, раствором нитрата серебра, то образование осадка хлористого сере-
бра не произойдет. Чтобы открыть и определить в подобных соединениях
хлор .(как это бывает часто необходимо при изучении органических соеди-
нений), хлор должен быть превращен в хлористоводородную кислоту по
одному из следующих методов.
* Добавление редактора. 1. Проба Бейльштейна (Beilstein) *. Если га-
лоидсодержащее органическое вещество на прокаленной медной прово-
локе ввести в пламя бунзеновской горелки, то пламя приобретает в случае
присутствия, хлора- зеленую окраску, а в присутствии брома или иода —
голубоватую. При очень летучих веществах применяют с успехом
вместо медной проволоки пористый медный порошок, который нагревают
на краю глиняного черепка. Эта реакция очень чувствительна: даже совсем
небольшие количества соляной кислоты, имеющиеся в атмосфере, могут
дать положительную реакцию *. А. К.
1 В. 5, 620 (1872),
340
2. Способ Кариуеа (Cailus). Исследуемое вещество нагревают е дымя*
щей азотной кислотой в запаянной трубке в присутствии азотнокислого
серебра, причем происходит полное разложение органического соединения
и галоид превращается в галоидоводородную кислоту, которая вступает
с азотнокислым серебром в обменное разложение, образуя серебряную
соль галоидоводородной кислоты; последнюю отфильтровывают И восста-
навливают цинком и серной кислотой; в полученном растворе, после филь-
трования, открывают галоидоводородную кислоту вышеприведенными ре-
акциями.
3. Прокаливание с известью. В небольшую утиной 25 см и шири-
ною 1 см трубку из тугоплавкого стекла, один конец которой запаян, на-
сыпают сначала небольшой слой свободной от хлора зерне,ной извести,
затем смесь исследуемого вещества с известью и, наконец, больший слой
зерненой извести.
Посредством легкого постукивания трубкой образуют канал между
верхней стенкой ее и известковым слоем для прохода газов, выделяющихся
при нагревании. Затем трубку кладут горизонтально на небольшую газо-
вую печь и нагревают сначала переднюю часть известкового слоя до
темнокрасного каления, затем задний слой и постепенно доводят содержи-
мое всей трубки до темнокрасного каления. При этом органическое ве-
щество совершенно разрушается, хлор же соединяется с известью, образуя
хлористый кальций. По охлаждении трубки содержимое ее растворяют в
очень разбавленной азотной кислоте, фильтруют для отделения от угля и
фильтрат пробуют на присутствие ионов хлора посредством азотнокис-
лого серебра.
4. Прокаливание с натрием. В узкую пробирку всыпают немного
исследуемого сухого вещества, затем маленький кусочек очищенного от
керосина натрия, поверх натрия снова испытуемое вещество и прокали-
вают на пламени бунзеновской горелки. Разложение сопровождается внезап-
ным воспламенением. Еще горячую пробирку опускают в стаканчик с водой,
причем пробирка лопается и образующийся хлористый натрий, наряду
с другими натриевыми соединениями, легко растворяется. Фильтрую,т,
фильтрат подкисляют азотной кислотой и пробуют на хлор (галоиды)
азотнокислым серебром.
Примечание. В случае органических веществ, содержащих азот,
только что описанная реакция дает цианид щелочного металла, который
с AgNOa также образует осадок. В этом случае в отфильтрованную
щелочную жидкость при температуре кипения пропускают до тех пор
СОа, пока выделяющийся газ, пропускаемый в подкисленный раствор
азотнокислого серебра, уже не будет больше давать мути, обусловливае-
мой образованием цианистого серебра. Лишь после этого подкисляют
жидкость азотной кислотой и добавляют нитрат серебра. В случае обра-
зования осадка, с уверенностью можно судить о присутствии галоидов.
Хлор С12. Ат. в. 35,457. Ат. н. 17
Плотность (жидкого хлора) 1,57. Т. ,цл. —100,5°. Т. кип. —33,9°
Свободный хлор, получающийся путем окисления хлориставодор-одной
кислоты и при прокаливании некоторых хлоридов, представляет собой
зеленовато-желтый газ с удушливым запахом. Он растворим в воде (при
10° около 2,7 объема на 1 объем воды), причем образуется хлорная вода —
жидкость зеленовато-желтого цвета, плохо проводящая электрический ток
(но все-таки лучше, чем чистая вода, что указывает на присутствие в ней
свободных ионов). Небольшие количества хлора вступают в реакцию с в-о-
Дой, образуя хлористоводородную и хлорноватистую кислоты:
НОН + Ск 2Н’ .+ СГ + СЮ'.
В этой реакции один атом хлора окисляется до одноположительно
варяженного за счет восстановления другого до одноотрицательно заря-
341
женното (атр. 253). Как показывает закон действия масс, этой реакции
благоприятствует присутствие гидроксильных огонов и препятствуют водо-
родные ионы-. Поэтому, если кроме слабо ионизирующей воды будет при-
сутствовать разбавленный раствор едкой щелочи, то реакция будет проте-
кать количественно слева направо:
Ch + 2ОН' -> Cl' + CIO' + Н>0.
Хлорная вода является сильным окислителем.
Хлорная вода, прибавленная к раствору йодистого калия, выделяет
иод и раствор окрашивается в желтый или бурый цвет:
2J' + Ch -> 2С1'.+ .h.
Если такой желтый раствор взболтать с сернистым углеродом Или
хлороформом, последние окрасятся за счет растворения в них иода в
красно-фиолетовый цвет. От прибавления большого количества хлорной
воды раствор снова обесцветится, так как иод окисляется при этом в бес-
цветную йодноватую кислоту:
Js + 6HiO + 5Ch -> 12Н' + 10С1' + 2JCh'.
Для констатации свободного иода можно вместо сернистого углерода
н т. п. воспользоваться крахмальным клейстером, дающим с иодом синее
окрашивание (см. Иод).
1, Азотнокислое серебро выделяет из хлорной водь: белый осадок хло-
ристого серебра, но осаждение это неполное, так как ч. первоначально
имеющегося в хлорной воде хлора превращается в хлорат-ион (см, Хлор-
новатистая кислота) и не осаждается ионом серебра, потому что хлорат
серебра легко растворим:
3Ch + 5Ag' + ЗН2О = 5AgCl + СЮ/ + 61Г.
Чтобы осадить весь хлор количественно в виде хлористого серебра,
его необходимо предварительно восстановить до хлор-иона ио одному из
следующих методов:
а) действием аммиака:
ЗСЬ + 8NHs-> 6NH1 • + 6СГ + N»;
б) действием перекиси водорода в присутствии едкого кали или натра:
Ch + 2ОН' + IhO»-> 2НЮ + 2СГ + О;;
в) прибавлением избытка сернистой кислоты, причем тотчас происходит
восстановление:
Ch + 2НЮ + SO» -> 2НС1 J- H2SO4.
Затем прибавляют азотную кислоту и кипятят для окисления избытка
сернистой кислоты, после чего осаждают раствором серебра.
2. Металлическая ртуть при действии на нее хлора при обыкновенной
температуре превращается в хлористую ртуть:
Hg2 + Ch-> HgiCh.
Поэтому при взбалтывании хлорной воды с металлической ртутью до
исчезновения запаха хлора получается нейтральный свободный от хлора
раствор. Если же в хлорной воде была хлористоводородная кислота, рас-
твор будет иметь кислую реакцию ш с азотнокислым серебром даст хло-
ристое серебро, потому что хлористоводородная кислота не действует на
ртуть. Этой реакцией пользуются для открытя хлорн,’;плодородной кис-
лоты в присутствии хлора.
3, Металлический цинк также реагирует с хлорной водой:
Zn + Ch ->Zn’ ' -f- 2C1'.
342
4. Раствор индиго обесцвечивается хлорной водой. При применении
разбавленного раствора индиго обесцвечивание является чувствительной
реакцией на хлор.
5. Иодокрахмальная бумага (бумага, смоченная крахмальным клейсте-
ром, содержащим иодистый калий) окрашивается в синий цвет. Эта реак-
ция также чувствительна, если применять раствор крахмала, содержащий
иодистый цинк.
Хлорноватистая кислота»НСЮ
Получение. Раствор свободной хлорноватистой кислоты полмчают путем
взбалтывания х.торноц поды с жетон окисью р:у ги до исчезновения
запаха хлора:
Hg-Cl
2IlgO + 2С12 + Н2О = ^>0 -J-2H0C1.
' Hg — Cl
При этом образуется бурая не растворимая ib воде хлорокись ртути н
в растворе хлорноватистая кислота. Слив с основной ртутной соли жид-
кость и подвергнув последнюю перегонке, получают чистый раствор хлор-
новатистой кислоты, которая, однако, под влиянием света скоро разла-
гается на хлористый водород и кислород:
2Н0С1 -> 2ИС1 +,О«.
Свойства. Хлорноватистая кислота неизвестна в свободном состоянии.
Ее ангидрид СЕО при обыкновенной температуре представляет собой газ
темножелтого цвета с неприятным раздражающим запахом. При нагре-
вании он взрывает, разлагаясь на хлор и кислород. Разбавленные водные
растворы хлорноватистой кислоты могут перегоняться. Кислота эта
очень слабая: константа ее диссоциации 3,7 • КС8 (при 17°).
Раствор хлорноватистой кислоты представляет собой сильно белящее
средство: лакмус и индиго быстро обесцвечиваются ею.
Щелочные соли хлорнаватистой кислоты (гипохлориты) получают или
нейтрализацией кислоты разбавленными растворами едких щелочей, или,
что является обычным методом нх получения, путем пропускания хлора
в разбавленный раствор едкой щелочи при охлаждении:
Ch + 20Н' -> СГ + ОС!' + НгО.
Аммонийные соли могут быть получены только при очень низких тем-
пературах. так как азот аммиака быстро окисляется.
Все гипохлориты при нагревании быстро переходят в хлораты и хло-
риды *:
ЗК0С1 2КС1 + КСЮз.
Поэтому гипохлориты могут быть получены в холодных, разбавленных
растворах.
Превращение гипохлоритов в хлораты достигает наибольшей скорости
в очень слабощелочном растворе2; в сильнощелочном растворе недостает
1 В присутствии 40 и больше процентов КОН гипохлорит калия при
нагревании распадается на КС1 и кислород, хлорноватокислая же соль при
этом совсем не образуется. См. Винтелер (Winteler), Z. angew. Chem. 33,
778 (1902).
1 Для вышеприведенной реакции необходимы хотя бы очень малые
количества свободной НСЮ. В растворе же гипохлорита эта реакция идет
потому, что вследствие гидролиза в нем всегда находится свободная кис-
лота и она появляется даже в присутствии небольших количеств гидро-
ксильных ионов, не могущих остановить гидролиза, ибо хлорноватистая
кислота — весьма слабая кислота. Ред.
343
нужной НОС1, поэтому щелочные растворы гипохлоритов обладают доста-
точным постоянством; напротив, в кислом растворе недостает гипохлорит-
ных ионов СЮ' для заметно энергичного образования хлората. Значи-
тельно быстрее происходит аналогичное превращение у гипобромита и
почти моментально — у гипоиодита.
Важнейшим продажным гипохлоритом является хлорная известь, кото-
рую получают путем пропускания хлора нац известью при обыкновенной
температуре. Образующийся при этом продукт может рассматриваться как
смесь хлористого кальция, хлорноватистокислого кальция и окиси кальция
с небольшим количеством воды. Разбавленные растворы гипохлорита нат-
рия известны под названием: «хлорокс», «оксол», «зонит» и т. д. Жавелева
вода представляет собой разбавленный водный раствор КСЮ и КО.
Реакции мокрым путем
Все гипохлориты растворимы в воде и разлагаются кислотами (даже
угольной кислотой).
1. Хлористоводородная кислота окисляется гипохлоритами
с выделением хлора:
СЮ' + С1' + 2Н’-> НгО+Ск.
Этой реакции благоприятствует присутствие водородных
ионов; присутствие гидроксильных ионов благоприятствует
обратной реакции (стр. 342).
2. Серная кислота разлагает гипохлориты с образованием
свободной хлорноватистой кислоты:
2NaOCl + H2SO4 -> Na2SO4 + 2НОС1.
Аналогично действует и угольная кислота, хотя и менее энер-
гично:
NaOCl + Н2СО3 _> ЫаНСОз + HOCI.
Вследствие того что гипохлориты легко разлагаются с образованием
хлора, они обладают сильным отбеливающим действием; раствор индиго
(раствор последнего в серной кислоте) моментально обесцвечивается ими.
Гипохлориты действуют как окислители не только в кислых, но также
и в щелочных растворах при обыкновенной температуре (отличие от хло-
ратов); многие металлические гидроокиси окисляются ими до гидроокисей
более высокой степени окисления. Так гидроокись железа(2) легко окис-
ляется в красновато-бурую гидроокись железа(З):
2Fe(OH)3 + СЮ' + НЮ -> СГ + 2Fe(OH)3;
также окисляются с образованием буровато-черных гидроокисей высшей
валентности гидроокиси низшей валентности свинца, марганца, никеля и
кобальта.
Меньше 1 мг гипохлорита можно открыть путем кипячения его с рас-
твором ацетата свинца:
РЬ’ ‘ + СЮ' + НЮ ->РЬО2 + 2Н ’ + СГ.
Для образования двуокиси свинца раствор перед выполнением реакции
должен быть подкислен уксусной кислотой.
3. Азотнокислое серебро производит в растворах гипохлори-
тов неполное осаждение хлористого серебра. Третья часть хлора
остается в растворе в виде хлорноватокислой соли:
ЗОСГ 4- 2Ag- -> СЮ'з + 2AgCl.
344
Хлорноватистая кислота отличается от хлора своим отноше-
нием к ртути, от хлористоводородной кислоты своим окисляю-
щим действием, а от хлорноватой кислоты своим частичным
осаждением нитратом серебра и окисляющим действием в ще-
лочных растворах.
4. Иодокрахмальная бумага .в слабощелочном растворе окра-
шивается хлорноватистокислыми солями в синий цвет вследствие
выделения иода:
2KJ + NaOCl + НЮ -»2КОН + NaCl J2
или
2J' + ОСГ + НЮ 20Н' + СГ + J2.
Интенсивность реакции зависит от концентрации гидроксиль-
ных ионов; только в разбавленной едкой щелочи образуется иод
в количестве, достаточном для окрашивания крахмала1.
,5. Хлористый марганец, в концентрированной соляной кислоте
окрашивается хлорноватистой кислотой в темный цвет. Эта ре-
акция не специфична: она показывает лишь присутствие окис-
лителей.
6. Металлическая ртуть. При взбалтывании раствора, содер-
жащего свободную хлорноватистую кислоту, с металлической
ртутью образуется не растворимая в воде, но растворимая в со-
ляной кислоте бурая основная хлорная ртуть (хлорокись ртути):
2Hg 4- 2Н0С1 -> (HgCl)2O 4- Н2О.
При тех же условиях свободный хлор при взбалтывании со
ртутью образует белую хлористую ртуть, которая в соляной кис-
лоте не растворима.
Этой реакцией пользуются для открытия хлорноватистой кислоты^ при-
сутствии свободного хлора. Смесь взбалтывают со ртутью до тех пор,
пока небольшое количество раствора уже не будет окрашивать иодокрах-
мальную бумажку, раствор затем осторожно сливают с осадка, к которому
прибавляют соляную кислоту. При этом происходит растворение основного
хлорида ртути, образованного хлорноватистой кислотой, между тем как
хлористая ртуть остается нерастворенной:
(HgCl)2O.:+ 2НС1 ->НЮ + 2Hg-Ch.
Если в отфильтрованный раствор пропустить сероводород, то появле-
ние осадка сернистой ртути будет указывать на нахождение в исходном
растворе хлорноватистой кислоты.
Соли хлорноватистой кислоты относятся 'Иначе к ртути — они образуют
ие растворимую окись ртути и растворимый хлорид:
Hg + NaOCl -> HgO + Na>CI.
I
7. Перманганат (раствор) не обесцвечивается хлорноватистой
кислотой. Лакмус и индиго медленно обесцвечиваются в щелоч-
1 В сильнощелочном растворе иод, необходимый для реакции с крах-
малом, будет расходоваться на образование иодида и йодата щелочного
металла:
3J2 + 60Н' 5J' + JOa' + ЗН2О. Ред.
345
ном растворе и более быстро в присутствии кислоты. Если
мышьяковистую кислоту окрасить в синий цвет посредством
индиго, то ,последнее не обесцвечивается до тех пор, пока вся
мышьяковистая кислота не окислится в мышьяковую кислоту.
Хлористая кислота НСЮ,
Эта >в высшей степени нестойкая кислота известна только в водном
растворе; соли ее, напротив, более стойки.
Получение хлористокислого калия (хлорита калия) *.
Напревают на водяной бане до температуры, не превышающей 70°,
смесь КСЮз и щавелевой кислоты с разбавленной серной кислотой. При
этом выделяется равномерным током двуокись хлора вместе с двуокисью
углерода;
2КС10з + Н2С2О4-> КзСОз + СОз + №0 + 2СЮз.
i
Газ пропускают и холодную воду, в которой он растворяется, окраши-
вая раствор в желтый цвет. Под влиянием воды происходит медленное
гидролитическое расщепление по уравнению:
2С10» + НзО-> Н’ + СЮз' + НСЮ».
При выпаривании нейтрализованного раствора выделяется сначала хло-
рат щелочного металла, хлорит же остается (в обогащенном маточном
растворе.
Напротив, возможно моментально превратить двуокись хлора в
хлорит по А. Рейхлеру (Reychier)1 2 годным раствором перекиси натрия
(или щелочным раствором перекиси водорода):
2С10з + 20Н' + НзОз -> 2С10з' + Оз + 2НзО.
Конец реакции может быть точно установлен по обесцвечиванию рас-
твора.
Реакции мокрым путем
1. Азотнокислое серебро дает трудно растворимый желтый осадок
хлористокислого серебра.
2. Уксуснокислый свинец выделяет сперва белый хлопьевидный осадок,
который при взбалтывании быстро становится кристаллическим.
3. Йодистый калий не окисляется хлоритами, если pH раствора) выше 7
(отличие от гипохлоритов); при pH ниже 7 происходит' быстрое выделение
иода (отличие от хлоратов). Поэтому открытие хлорит-иона в присутствии
гипохлорит-иона весьма трудно.
Бромистоводородная кислота НВг
Нахождение в природе. Бром в природе является постоянным спут-
ником хлора; поэтому его находят в морской воде и во многих мине-
ральных водах.
Получение. Бромистый водород может быть получен непосредственно
из водорода и брома в присутствии подходящего катализатора, например
платины. Он может быть получен при действии восстановителей (например,
сернистый водород или двуокись серы) на) бром:
Вг2 + 80s + 2НгО~> ILSOj + 2НВт
1 В. Carison, J. G е 1 h аи г - М а п s b о, Chem.-Ztg, 32, 605 (1903).
2 Bull. chim. [3] 25, 659 (1901).
346
или при гидролизе трех’бромвстого фосфора:
РВгз Ч- ЗНОН -> НзРОз + ЗНВг.
Достаточно чистый бромистый водород может быть получен при дей-
ствии серной или фосфорной кислоты на водный раствор щелочных бро-
мидов. Если концентрация серной кислоты достигает 9N, то при нагрева-
нии наряду с бромистым водородом образуется также свободный бром:
2NaBr + I-kSCU -> Na2SO< + 2HBr;
2HBr +. H»SO<-> 2НЮ +; SO» + Br».
Свойства. Бромистый водород подобно хлористому водороду — бесцвет-
ный газ с удушливым запахом, дымящий во влажном воздухе и образую-
щий с парами аммиака белое облако бромистого аммония. Критическая
температура 89,8° и критическое давление около 84 от. Твердый бромистый
водород плавится при —87°, кипит при —66,7°. Газ хорошо растворим в
воде: 100 г воды растворяют при комнатной температуре 193 г бромистого
водорода. Раствор, содержащий 47% НВг, соответствующий точно НВг-
• 5НзО, имеет постоянную точку кипения при 126°. Название «бромисто-
водородйая кислота», принятое в химической литературе, обыкновенно от-
носится к водному раствору бромистого водорода. Бромистоводородная
кислота менее устойчива, чем хлористоводородная, и более устойчива, чем
иодистоводородн-ая.
В то время как хлористый водород неограниченно долго сохраняется
в водном растворе, раствор бромистого водорода уже через короткое
время становится бурым вследствие выделения брома. Бромистый водород
окисляется даже кислородом воздуха:
4НВг + О» -» 2Н»О + 2Вт».
Ввиду малой растворимости однобромистой меди бромистоводородиая
кислота растворяет в присутствии небольшого количества свободного брома
медь, хотя последняя в электродвижущем ряду находится ниже водорода
(стр. 57 и 149).
В концентрированных растворах бромистый водород быстро окисляется
теми же окислителями, что и хлористый водород, т. е. высшими окислами
тяжелых металлов, азотно-, азотисто- и хромовокислыми солями и т. п. *.
Перманганат окисляет на холоду даже разбавленный слабокислый раствор
бромида.
Бромистоводородная кислота—одноосновная кислота; соли ее назы-
ваются бромидами. Она является одной из самых сильных кислот, и вод-
ные растворы ее ионизированы в такой же мере, как и растворы соля-
ной кислоты.
Растворимость бромидов аналогична растворимости хлоридов.
Реакции мокрым путем
1. Разбавленная серная кислота (1 :10) не выделяет из бро-
мидов на холоду бромистого водорода, но выделяет его ига бро-
мидов щелрчных металлов при нагревании.
2. Концентрированная серная кислота выделяет из всех бро-
мидов при нагревании бромистый водород и бром2. Раствор
окрашивается в бурый цвет и при нагревании его1 бром выде-
ляется в виде желто-бурых паров (отличие от хлористого водо-
рода), которые вследствие содержания в них бромистого водо-
1 В разбавленном растворе иа холоду перечисленные окислители не
действуют на бромистый водород (отличие от йодистого водорода).
s На фюмиетое серебро серная кислота действует лишь с трудом.
347
рода дымят на влажном, воздухе, обладают острым запахом и
не дают мути с водой (отличие от кремнефтористоводородной
кислоты).
3. Фосфорная кислота выделяет бромистый водород; при
одновременном присутствии окислителей выделяется бром.
4. Азотнокислое серебро дает желтоватый творожистый оса-
док бромистого серебра, не растворимый в азотной кислоте, рас-
творимый в аммиаке, цианистом калии и тиосернокислом натрии.
Кислоты снова выделяют из аммиачного раствора бромистое се-
ребро.
Так как растворимость бромистого серебра в воде меньше
растворимости хлористого серебра, то при обработке бромистым
калием хлористое серебро превращается в бромистое серебро:
AgCl + KBr KOI + AgBr.
Действие же хлора при нагревании на бромистое серебро
легко превращает последнее в хлористое серебро:
2AgBr 4- С1г -> 2AgCl 4- Вгз.
5. Хлорная вода, прибавленная к раствору растворимого бро-
мида, выделяет свободный бром, который растворяется в сернис-
том углероде или хлороформе, окрашивая последние в бурый
цвет; при избытке хлорной воды окраска переходит ,в желто-
ватую за счет образования хлористого брома BrCI (отличие
от иода).
6. Флуоресцеин окрашивается в красный цвет бромом, выде-
ляемым каким-либо окислителем из бромида в присутствии кис-
лоты.
Желтое красящее вещество, флуоресцеин С20Н12О3 или
при действии на него брома переходит в тетрабромфлуоресцеин (эозин)
красного цвета. Бром выделяется из бромидов при действии на них Дву-
окиси свинца в присутствии уксусной кислоты:
2Вг' _+. РЬО».+_ 4СН»СООН -> P^CHsCOO)» 4- 2CHsCOO' + 2НгО 4- Вг».
Выполнение. В маленькую пробирку помещают каплю исследуемого
раствора, несколько крупинок твердой двуокиси свинца и немного уксус-
ной кислоты. Вместо двуокиси свинца можно пользоваться каплей 25%-
ного раствора хромовой кислоты, Нагревают и дают парам прнтти в кон-
348
в 50%-ном спирте. Этой реакцией можно открыть 2 у
такт с фильтровальной' бумажкой, пропитанной насыщенным раствором
флуоресцеина
бромида *,
7. Фуксин
'-П5
образует с бисульфитом бесцветный продукт (присоединения. Если раствор
фуксина, обесцвеченный бисульфитом натрия NaHSOs, взаимодействует
с небольшим количеством брома, то получается бромозамещенный краси-
тель, окрашенный в синий цвет2. Так как хлор и иод не дают этой цвет-
ной реакции, то фуксиновая проба оказывается весьма ценной для откры-
тия малых количеств бромида в присутствии значительных количеств
иодида и хлорида.
Выполнение. В маленькую пробирку помещают каплю исследуемого
раствора или небольшое количество исследуемого твердого вещества и при-
бавляют 2—4 капли 25%-ного раствора хромового ангидрида СгОз. Конец
пробирки вытягивают в капилляр, в который вводят каплю 0.1%-ного рас-
твора фуксина, обесцвеченного небольшим количеством бисульфита нат-
рия. Осторожно нагревают, не доводя до кипения. В присутствии бромида
капля окрашивается в фиолетовый цвет. Эта реакция дает возможность
открывать 3,2 Т брома3.
8, Азотистая кислота не выделяет брома на1 холоду ив (разба-
вленного раствора бромида (отличие от иодида).
9. Бихромат калия не выделяет брома в присутствии разба-
вленной серной кислоты из водных растворов бромидов; при
взбалтывании раствора с сернистым углеродом последний
остается бесцветным (отличие от иодида).
10. Бихромат калия и концентрированная серная кислота.
Если к смеси твердого бромида с твердым бихроматом добавить
концентрированной серной кислоты и подвергнуть перегонке, то
получается окрашенный в бурый цвет десгиллат (как с хлори-
дом), который содержит бром, но не содержит хрома:
СггОт" 4- 6Вт' + 14Н' ->20- • • + 2НгО + ЗВг2.
При прибавлении к дестиллату разбавленного едкого натра
получают бесцветный (или иногда бледножелтый) раствор, ко-
торый после подкисления серной кислотой не дает (реакции на
хром с разбавленной серной кислотой и перекисью водорода.,
а только бурое окрашивание, обусловленное выделением свобод-
ного брома (отличие от хлорида).
11. Перманганат калия окисляет бромистоводородную кислоту
более легко, чем хлористоводородную, и менее легко, чем иоди-
стоводородную кислоту.
1 Этой реакции не мешают хлориды, но иодиды мешают. В растворе
должны отсутствовать азотистая и азотная кислоты. См. Файгль, Ка-
пельный анализ, стр. 335 и Tableaux des Reactifs pour 1'Analyse minerale,
стр. 298. Ред.
2Guareschi, Z. anal. Chem. 52, 45, 538, 607 (1913); см. также
Файгль, Капельный анализ, стр- 336. Ред.
’ Эту реакцию удобно производить в приборчике, указанном Ф а й г-
лем (стр. 336). Ред.
349
Открытие брома в неэлектролитах
Применяются точно те же методы, какие были приведены для откры-
тия хлора и неэлектролитах (стр. 3'40).
Бром Вг. Ат. в. 79,916. Ат. н. 35
Плотность (жидкого) 3,19. Т. пл. 7,3. Т. кип. 63°
Свободный бром, получающийся окислением бромистоводородной кис-
лоты, представляет собою при обыкновенной температуре бурую жидкость,
растворяющуюся в воде; раствор окрашен также в бурый цвет. Бром
быстро испаряется при обыкновенной температуре. Пары брома буровато-
красного цвета и очень ядовиты. Холодный, насыщенный водный раствор
брома содержит 2—3% последнего. Концентрированная соляная кислота
растворяет значительно больше брома; насыщенный раствор, содержащий
около 13% брома, является энергичным окислителем. Спирт, эфир, сер-
нистый углерод, четыреххлористый углерод и хлороформ очень легко рас-
творяют бром. В последних трех растворителях, которые тяжелее воды и
не смешиваются с нею в сколько-нибудь заметной степени, растворимость
брома настолько велика, что большая часть его может быть извлечена из
его водного раствора при взбалтывании со значительно меньшим объемом
каждого из этих растворителей. Бромная вода, как и хлорная, разлагается
под влиянием света. Если взболтать ее со ртутью, то последняя реагирует со
свободным бромом и присутствие бромистоводородной кислоты может
быть констатировано по кислой реакции.
Поэтому открытие бромпстоводородной кислоты в присутствии брома
выполняется точно таким же путем, какой был указан для открытия
хлористоводородной кислоты в присутствии свободного хлора (стр. 342).
Бром подобно хлору действует как сильно белящее вещество (краски
окисляются) и соединяется непосредственно с металлической ртутью, об-
разуя нерастворимую бромистую ртуть.
Свободный бром реагирует с бром-ионом, образуя трибром-ион:
Вг'.+ Вгг-» Вгз'.
Молекула брома гидролитически расщепляется водой подобно хлору:
Ви + НОН- Н- + Вг' + НВгО.
Полученный раствор является сильным! окислителем и действует беля-
щим образом.
Чтобы осадить бром в виде бромистого серебра, его необходимо сна-
чала восстановить до бром-иона точно так же, как это было указано при
хлоре.
Бром действует на растворы едких щелочей точно так же, как и хлор:
а) на холоду в разбавленном растворе:
Brs + 2ОН' -»Вг'.+ ВгО' + НгО;
б) при нагревании-.
ЗВгз'+' 6ОН'-> 5Вг'.+ ВгОз':+ ЗНгО.
Реакция с аммиаком протекает согласно уравнению:
ЗВгз + 8NHs-> 6NHiBr + №.
Иоднстоводородная кислота HJ
Нахождение в природе. В природе иод встречается в виде иодида и
йодата1, чаще всего й виде иодида, причем его всегда находят в нсболь-
1 В чилийской селитре в количестве до 0,5%,
350
ппгх количествах наряду с хлором и бромом', например, в морской воде
и минеральных водах.
Кроме того, иод находится в небольших количествах в каменной соли,
во многих минеральных солях, а также в некоторых каменных углях И1 из-
вестняках1. Встречается также в животном организме, а именно в щито-
видной железе (Thyreoidea). По исследованиям Ф. Фаленберга. (V. Fahlen-
berg) следы иода чрезвычайно распространены повсюду. Его находят в па-
хотной земле и ib растениях.
Получение. Иодистый водород может быть получен в чистом виде пу-
тем разложения иодангидридов кислот водой:
PJs + ЗНгО-> НзРОз 4- 3IHJ.
При получении йодистого водорода .путем разложения иодистьтх метал-
лов серной кислотой, даже разбавленной, получают еще менее чистый
продукт, чем1 при получении таким же путем брюмистого водорода. Наряду
с иодистым водородом получаются продукты восстановления серной кисло-
ты. Состав последних вариирует в1 зависимости от концентрации применяе-
мой кислоты и раствора иодида. Так, при большом количестве концентри-
рованной серной кислоты получается двуокись серы:
2NaJ 4- ЗНзЗОд-» 2NaHSO4 4- 2Н»О 4- SO2 4- Jt.
При большом же количестве иодида серная кислота восстанавливается
до серы и даже до сернистого водорода:
6KJ + 7H»SO4 -> 6KHSO4 + S 4- 4№О + 3 Js;
8К J + 9H-_>SCb -> 8KHSO4 4- H2S 4- 4НаО 4- 4.к.
Разбавленный раствор иодистоводородной кислоты1 может быть полу-
чен, если пропускать сернистый водород, через суспензию иода в воде:
H:S 4-^2-* 2HJ4-S.
Иоднстоводородная кислота может быть также получена при нагрева-
нии иодида щелочного металла с фосфорной кислотой и поглощении выде-
ляющихся паров холодной водой или путем взаимодействия фосфора,
иода и воды:
2Р 4- 5Jj 4- 8Н-.0 -»2НзРОз 4- 1OHJ.
Свойства. Чистый иодистый водород — бесцветный удушливого запаха
газ, критическая температура которого 150° и критическое давление 71 ат.
В твердом состоянии плавится при —51° и кипит при --35,53. При 180°
иодистый водород начинает диссоциировать на водород и иод, но еще при
1000° его диссоциация достигает лишь 29%. С водой он образует смесь,
имеющую постоянную точку кипения при 127°; такая смесь содержит
57% HJ и имеет плотность 1,7'1. Растворы большей плотности дымят на
воздухе.
Водный раствор йодистого 'водорода еще менее устойчив, чем раствор
бромистоводородной кислоты; он весьма скоро окрашивается в бурый цвет
выделяющимся иодом:
3HJ -Е о2 ->2НгО 4- 2Jj.
(воздух)
При действии сероводорода на такой побуревший раствор происходит
обесцвечивание последнего с выделением серы:
J: 4- №S -> 2HJ 4- S.
Ввиду чрезвычайно слабой ионизации комплексных ртутно-иодистых
анионов, иоднстоводородная кислота способна растворять ртуть, несмотря
1 Z. angew. Chem- 23, 342, 1910.
351
на более низкое положение ее по сравнению с водородом в электродвиг
жущем ряду (стр. 57 и 122):
Mg + 4HJ -> №[HgJ«] + Н..
Иоднстоводородиая кислота (подобно хлористоводородной и бромисто-
водородной кислотам) окисляется высшими окислами тяжелых металлов,
нитратами, нитритами, хроматами и пр. с выделением иода. Окисление
совершается настолько легко, что даже очень разбавленные растворы этой
кислоты окисляются азотистой и хромовой кислотами уже на, холоду.
Иоднстоводородиая кислота одноосновна; ее соли называются иоди-
дами. Она принадлежит к очень сильным кислотам; ее разбавленные вод-
ные растворы почти полностью ионизированы.
Растворимость йодидов почти аналогична растворимости соответствую-
щих солей хлористо- и бромистоводородной кислот. Соли одновалентной
меди, серебра, ртути и палладия значительно менее растворимы, чем соот-
ветственные хлористые и бромистые соединения.
Реакции мокрым путем
1. Разбавленная серная кислота (1 :10) действует на иодиды
щелочных металлов только -при нагревании.
2. Концентрированная серная кислота реагирует на холоду
(стр. 351).
3. Азотнокислое серебро выделяет желтый творожистый оса-
док йодистого серебра, не растворимый в азотной кислоте,
очень мало растворимый в аммиаке \ легко в цианистом калии
и тиосернокислом натрии.
Иодистое серебро легко превращается при действии на него
хлора в хлористое серебро:
2AgJ + Cl 2 -+ 2AgCl 4- J2.
Напротив, хлористое и бромистое серебро при обработке рас-
твором йодистого калия переходят в иодистое серебро:
AgCl 4-KJ-> КС1 4-AgJ;
AgBr 4- KJ -» КВ г 4- AgJ.
Эта кажущаяся аномалия легко объясняется. Пэ своему положению в
электродвижущем ряду свободный хлор может замещать бром или иод
в их солях; у него имеется большая тенденция переходить путем восста-
новления в хлор-ион. 'С другой стороны, иодистое серебро значительно
менее растворимо, чем бромистое серебро, которое в свою очередь менее
растворимо, чем хлористое серебро, и по этой причине иод-ионы заме-
щают хлор- или бром-ионы в их серебряных солях.
4. Свинцовые соли осаждают желтый подпетый свинец, рас-
творимый в большом количестве горячей воды; <при этом полу-
чается прозрачный раствор, из которого при охлаждении выде-
ляются пластинки PbJa золотистожелтого цвета.
5. Хлористый палладий (лучше всего применять натриевую
соль палладистохлористоводородной кислоты NaaCPdCh]) оса-
1 При обработке аммиаком иодистое серебро окрашивается в более
светлый цвет.
352
ждает из разбавленных растворов какого-нибудь иодида иодй-
стый палладий черного цвета (отличие от брома и хлора):
Na2[PdCh] + 2KJ 2NaCl + 2КС1 + PdJ2,
легко |раст®фиМ'ЫЙ в избытке йодистого калия.
6. Соли окиси меди восстанавливаются иодидами с выделе-
нием окрашенной в бурый цвет смеси, состоящей из иодистой
меди и иода:
2CuSO4 + 4KJ -+ 2K2SO4 4- Cu2J2 4- J2.
В присутствии избытка иодида часть ионов иода и меди
остается в растворе в виде комплексных ионов CuJ4".
От прибавления к раствору сернистой кислоты, тиосульфата
натрия или сульфата двухвалентного железа CU2J2 выделяется
почти совершенно белой, потому что иод превращается в йоди-
стый водород вследствие восстановления:
SO3" 4- НгО 4- Л SO4" 4- 2Н‘ 4- 2J'p
2S2O3'' 4- J2-> S4Oe* 4- 2J'.
7. Азотистая кислота. При прибавлении к разбавленному рас-'
твору иодида азотистой кислоты выделяется иод, отчего рас-
твор окрашивается в же.пый или бурый цвет (отличие от бро-
мидов);
2HNO2 4- 2HJ -+ 2NO 4- J2 4- 2НгО.
Эту чрезвычайно чувствительную реакцию выполняют лучше
всего следующим образом.
Приготовляют раствор азотистой кислоты в концентрированной серной
кислоте путем нагревания трехокиси мышьяка с азотной кислотой (плот-
ность 1,30—1,35) и выделяющийся при этом газ (NO2 и NO) пропускают
в серную кислоту (плотность 1,75—1,80):
‘AS2O3 4- 2НЫОз—* As?Os 4- НзО 4- NO2 4- NO;
ЮН /ОН
2SO2< 4- no2 4- NO -> H2O + 2SO2<
XOH XONO
/ОН
Сернокислый раствор нитрозилсерной кислоты SO26 называют
XONO
нитрозой. Раствор может сохраняться некоторое время, но водою он раз-
лагается, образуя азотистую и серную кислоты:
/ОН /ОН
soZ + нон -> so2( 4- hno2.
XONO XOH
К (Испытуемо,му раствору прибавляют несколько капель нитрозы, при-
ливают сернистый углерод или хлороформ и взбалтывают, причем послед-
ние извлекают из водного раствора иод и окрашиваются в фиолетовый
цвет.
23 Зак- 9S2. Тредвелл-Голл, т. I.
353
Иод также может быть узнан по синему окрашиванию крах-
мального клейстера (см. стр. 356).
8. Двухромовокислый калий выделяет на холоду в присут-
ствии разбавленной серной кислоты из разбавленных растворов
иодидов -иод, который может быть открыт путем взбалтывания
с хлороформом или сернистым углеродом (отличие от брома):
СггСт" 4- 6J' + 14Н’ -» 2Сг‘ ’ ’ + 7Н2О + 3J2.
При нагревании смеси из твердого иода и твердого двухро-
мовокислого калия с концентрированной серной кислотой полу-
чают по вышеприведенному уравнению иод, перегоняющийся
с водяными .парами и сгущающийся в -приемнике. В дестиллате,
однако, хром не находится (отличие от хлора).
9. Соли окиси железа выделяют из растворов иодидов иод,
переходя при этом в соли закиси железа:
2Fe’'' + 2J'-> 2Fe’ ’ + J2.
10. Перманганат калия окисляет йодистоводородную кислоту
легче, чем бромистоводородную и хлористоводородную кислоты.
Если реакцию выполнять в кислой среде, то иод-ион окисляется
в свободный иод, а в нейтральной или щелочной среде про-
дуктом окисления является йодноватая кислота:
:iOJ' + 2MnCV + 16Н’ -» 5J2 + 2Mn" ’ + 8FkO;
J' + 2MnOF + H2O -> JO/ + 2MnO2 + 2OH'.
11. Хлорная -ртуть образует яркокрасный иодид ртути, -рас-
творимый в избытке йодистого калия:
Hg’ ’ + 2.1'-> HgJ2;
HgJ2 + 2J'-> [HgJi]".
Если к раствору иодида щелочного металла прибавить ам-
миак, немного едкого кали и несколько капель хлорной ртути,
то получается красновато-бурый осадок иодисто-го димеркур-
аммония. Эта реакция чувствительна.
12. Хлорная вода выделяет из иодидов иод:
2KJ + CI2 ->2КС1 + J.>,
который окрашивает сернистый углерод в красновато-фиолето-
вый цвет, а крахмальный клейстер — в синий.
При добавлении избытка хлорной воды фиолетовая окраска
исчезает вследствие окисления иода в йодноватую кислоту:
J2 + 6Н2О + 5СЬ -» 10НС1 + 2ШОз.
13. Бромная вода реагирует с иод-ионами аналогично хлорной воде.
Следующая реакция дает возможность открывать 0.1 7 иода, находя-
щегося в виде иодида. Исходный иодид окисляют в иодат, избыток окис-
354
лнтеля удаляют путем реакции его с фенилом или муравьиной кислотой и
дают образовавшемуся иодагу прореагировать с небольшим количеством
прибавленного иодида и кислоты:
J' + ЗВгг + ЗНЮ-> JOs' + бН' + бВг';
ЗВга + СеНЮН-^СЛВгзОН + ЗНВг, или
Вге + НСООН-> 2НВг + СОг.
Интересной особенностью этой реакции является то. что для откры-
тия иода, бывшего в исходном веществе в виде иодида, применяется иодид.
Выполнение. К капле нейтрального испытуемого раствора в фарфоро-
вом микротигле прибавляют каплю насыщенного раствора бромной воды,
осторожно нагревают и удаляют избыток брома, прибавляя кристаллик
фенола (или каплю 80%-ной муравьиной кислоты). Охлаждают, подкис-
ляют, прибавляют кайлю 5%-ного раствора йодистого калия и каплю рас-
твора крахмала. Появление синего окрашивания служит признаком нали-
чия иода
Открытие иода в неэлектролитах
Метод анатогичсн описанному
тах (стр. 340).
для открытия хлора в неэлектроли-
Иод J. Ат. в. 126,92. Ат. н. 53
Плотность 4,9-12. Т. пл. 113,5'. Т. кип. 184,353
Свободны!; иод образует чешуйки, сходные по внешнему виду с гра-
фитом. Уже при обыкновенной температуре он обладает большой упру-
гостью паров -и поэтому легко возгоняется.
Иод слабо расызорим ,в воде (100 ч. воды растворяет 0,02 ч. нода),
но он в значительной -мерс растворим в спирте и эфире, образуя -рас-
творы бурого цвета, и еще больше растворим он в сероуглероде, четы-
реххлористом углероде и хлороформе, образуя растворы фиолетового
цвета % практически весь иод может быть извлечен из его водного рас-
твора путем нескольких взбалтываний последнего с каким-либо нз ука-
занных растворителей (стр. 25). ‘
Иод хорошо растворяется в иодистоводородной кислоте или в рас-
творах иодидов щелочных металлов с образованием трико д-иоиов. Рас-
творы окрашены в бурый цвет:
J' + Ъ J:;'.
Раствор трпподида показывает все реакции свободного- иода, но упру-
гость паров иод;! во :>!ного раз меньше, чем в чисто -водном его растворе,
так как количество свободного иода в нем оказывается в действительности
небольшим.
Продажный под всегда содержит воду, хлор, бром и часто циан
(иодистый циан) в виде примесей.
1 Реакция между иодидом и йодатом протекает по уравнению JO»' +
+ 5J' + 6H‘ З.Ь-.-3tL(>. Так как при окислении 1 моля иодида обра-
зуется 1 моль и-одага, а этот последний! при реакции его с иодидом выде-
ляет б атомов пода, то отсюда следует, что чувствительность реакции на
иод повышается в данном случае в шесть ра-з. Ред.
2 Как правило, растворы -иода обладают бурой или коричневой окрас-
кой в органических растворителях, содержащих кислород (спирт, эфир);
в растворителях же, не содержащих кислорода (сероуглерод, четыреххло-
ристый углерод и др.)> расг-воры иода окрашены в фиолетовый цвет.
23*
355
"Водный раствор иода является слабым окислителем. Он обесцвечи-
вается сероводородом и становится мутным вследствие выделения серы:
H2S + Js-» 2HJ + S.
На иод в твердом состоянии сероводород при обыкновенной темпера-
туре не оказывает никакого действия; газообразный иодистый водород
является эндотермическим соединением и поэтому для его образования
необходим приток тепла извне. В водном же растворе необходимая для
этой реакции теплота получается от растворения образующегося йодис-
того водорода. Так как твердый иод не действует на сероводород, но
способен разлагать мышьяковистый водород, то для получения сернистого
водорода, свободного от мышьяка, из пиритов, содержащих мышьяк,
смесь газов пропускают над твердым иодом; последний удерживает только
мышьяковистый водород.
Реакции мокрым путем
1. Тиосульфат натрия обесцвечивает растворы иода с образо-
ванием тетратионата натрия и йодистого натрия:
2S2O3" + J2 -> SjOe" -f- 2J'.
Хлор и бром реагируют точно таким же образом, если только они не
находятся в избытке. В последнем случае реакция идет далее и тетратио-
нат окисляется до сульфата и серной кислоты с выделением серы; послед-
няя также постепенно окисляется галоидами в серную кислоту:
2S«O6" 4-. 12Н.’О + 8С1г -» 16С1' + 6SO4" + 24Н- + 2S;
2S + 8Н2О + 6С12 -> 16Н- + 2SO<" + 12СГ.
Другие слабые окислители, например соли трехвалентного железа и
двухвалентной меди, действуют на тиосульфат подобно иоду (.см. Тио-
серная кислота).
2. Крахмальный клейстер. Свободный иод окрашивает крахмальный
клейстер в синий цвет, но только в присутствии йодистого водорода или
растворимых иодидов. Относительно состава синего вещества, «иод-
крахмала» мнения расходятся. Одни считают иод-крахмал химическим
соединением, другие же — твердым1 раствором1 или адсорбционным соеди-
нением 2.
По Милиусу (Mylius)3 «иод-крахмал» представляет собой иодисто-
водородное соединение продукта присоединения к крахмалу иода; соеди-
нение это содержит около 18% иода. Фоомула его (С24Н4оОгоЗ)4 HJ. Оно
обладает характером кислоты. При образовании иод-крахмала в ней-
1 Твердые вещества могут давать однородные смеси, подобные тем,
какие, например, дают спирг и вода. В таких однородных твердых смесях
один компонент является как бы растворенным <в другом, причем отноше-
ние растворенного твердого вещества к твердому растворителю может
меняться при сохранении однородности1. Вант-Гофф (Vant-Hoff) такого
рода однородные смеси подвел под понятие «твердые растворы». К таким
твердым растворам относят сплавы металлов, изоморфные смеси, сме-
шанные кристаллы, окрашенные кристаллы, стекла и т. п. Твердые рас-
творы показывают многие свойства жидких растворов, и поэтому они под-
чиняются тем же законам, что и последние. Мы наблюдаем в них явле-
ния пересыщения (нарушение однородности), диффузию (проникновение
углерода в фарфор, в железо) и т. д. Ред.
2 К ii s t е г, А.П. 283, 689 (1894); С. Harz, Chem. Zentr. I, 1018 (1898);
Andrews a. Gotsch, J. Am. Chem. Soc. 24, 865 (1906); Pa dr a u.
Savori Chem. Zentr. 1, 1593 (1905); K. Katayama, Z. anorg. Chem. 56,
209 (1907).
3 В. 20, 688 u. C. bonnes, Z. analyt. Chem. 33, 409 (1894).
356
тральном растворе в присутствии иодидов образуются соли этой кислоты,
из которых Милиусу удалось выделить бариевую соль. Соли эти могут
быть рассматриваемы как двойные соли, подобные карналлиту MgCh-KCl-
6Н2О. Как таковые они должны в разбавленном растворе диссоциировать
на свои компоненты; например, калиевая соль:
[C21H4oOsoJ]4-KJ 4~4[ С24Н40О20 J J + KJ’;
если допустить, что C.hHioOxiJ бесцветен, то водный раствор иод-
крахмала также должен быть бесцветным; с увеличением же концентрации
иодида должно произойти уменьшение диссоциации двойной соли и должно
появиться синее окрашивание, что в действительности и происходит. Если
приливать по каплям к водному раствору крахмала водный раствор иода
(получающийся путем взбалтывания иода с водой), то в местах падения
капель образуется слабое синее окрашивание, тотчас исчезающее при
перемешивании. Иодистый калий (или какой-нибудь другой иодид), при-
бавленный к такому бесцветному раствору, тотчас вызывает появление не-
исчезающего синего окрашивания
Переходящее синее окрашивание, вызываемое первой каплей иодного
раствора, происходит, вероятно, по той причине, что иод вступает с крах-
малом в реакцию замещения и дает иодистый водород, отчего создаются
условия для образования иод-крахмала.
Что крахмальный раствор, содержащий иодид. чувствительнее чистого
водного раствора крахмала—представляет собой уже давно известный
факт.
Открытие хлористо-, бромисто- и иодистоводородной кислот
при одновременном их присутствии
Метод А
Исследуемый раствор должен содержать соли щелочных металлов
вышеприведенных кислот. Половину его употребляют для испытания на
бром и иод, а другую половину — на хлор.
а) Испытание на бром и иод
1. Раствор подкисляют разбавленной серной кислотой, приливают около
1 .мл бесцветного сероуглерода или хлороформа, прибавляют несколько
капель хлорной воды и взбалтывают. В присутствии иоДа сероуглерод
окрашивается в красно-фиолетовый цвет даже тогда, когда в растворе
находится также и бром.
Для открытия брома продолжают приливать хлорную воду, причем
красно-фиолетовая окраска сероуглерода исчезает, как только иод вполне
окислится в йодноватую кислоту; сероуглерод после этого принимает бу-
рую окраску брома и при дальнейшем прибавлении хлорной воды окраши-
вается в винножелтый цвет.
2. Для выделения иода часто бывает более удобным пользоваться
вместо хлорной воды азотистой кислотой (особенно при очень малых ко-
личествах иода, какие встречаются, например, в минеральных водах). При
этом поступают следующим образом. Испытуемый на иод и бром раствор
слабо .подкисляют разбавленной серной кислотой, прибавляют сероуглерод
и несколько капель нитрозы1 2 и затем взбалтывают. Появление красно-
фиолетовой окраски указывает на присутствие иода. Для открытия брома
сливают с сероуглерода водный раствор, и фильтруют его через смочен-
ный водой фильтр для удаления взвешенных в нем Окрашенных в фиоле-
товый цвет капелек сернистого углерода, которые при фильтровании
1 При нагревании раствора окраска исчезает, но при охлаждении снова
появляется.
2 См, стр, 353.
357
остаются на фильтре. К полученному фильтрату приливают хлорную воду
и снова взбалтывают с сернистым углеродом: окрашивание последнего в
бурый цвет указывает на присутствие брома.
б) Испытание на хлор
Простейший и наиболее точный способ отделения хлора от брома и
иода состоит в дробном осаждении 'посредством азотнокислого серебра.
Если к раствору, содержащему все три галоида в форме галоидных метал-
лов, прибавлять по каплям разбавленный раствор азотнокислого серебра,
то сначала осаждается иод в виде желтого йодистого серебра, затем бром
в виде бледножелтой серебряной соли и, наконец, хлор в виде совершенно
белого хлористого серебра. Поэтому поступают следующим образом. Не-
сколько капель испытуемого раствора разбавляют водой приблизительно
до 5 лл, подкисляют азотной кислотой, прибавляют каплю разбавленного
раствора азотнокислого серебра (1:100), кипятят и взбалтывают, причем
образующийся осадок свертывается. IB присутствии брома или иода осадок
окрашен в желтый цвет. Осадок отфильтровывают, к фильтрату снова
прибавляют каплю азотнокислого серебра и т. д. до тех пор, пока, нако-
нец, не получится .совершенно белый1 осадок хлористого серебра; в от-
сутствие хлора белый осадок, конечно, не образуется.
* Примечание редактора. Ион хлора может быть открыт в присутствии
ионов Вг и J еще и другим путем. К подкисленному азотной кислотой
раствору приливают избыток AgNOs. Осадок отфильтровывают и промы-
вают его до полного исчезновения реакции на Ag. Затем осадок взбал-
тывают с раствором (NHiJaCOa, после чего фильтруют и к прозрачному
фильтрату прибавляют несколько капель раствора КВг. Появление желтого
осадка или мути служит признаком присутствия СГ.
Эту реакцию можно объяснить следующим образом. Углекислый аммо-
ний как соль слабого основания и еще более слабой кислоты подвергается
гидролизу. В растворе появляется, правда, в небольшой концентрации,
NH4OH, в котором AgCl (но не AgBr и AgJ) несколько растворимо. Если
теперь к такому раствору прибавить бромид калия, то произведение рас-
творимости для AgBr будет превышено. Следовательно, появление осадка
AgBr может произойти только в том случае, когда . исследуемый раствор
содержит СГ.
Опыт показал, чю студентам открытие иона хлора легче удается по
этому методу, чем но вышеприведенному методу дробного осаждения *.
А. К.
Метод Б
Этот метод основан на различии в скорости, с которой ионы иода,
брома и хлора окисляются 1%-ным раствором перманганата калия. В раз-
бавленном растворе, содержащем немного уксусной кислоты и значитель-
ное количество ацетата натрия, происходит немедленное окисление пер-
манганатом иодида с выделением иода. Последний может быть извлечен
при взбалтывании с растворителем, не смешивающимся с водой (стр. 26).
За тот промежуток времени, который необходим для указанной опера-
ции с иодидом. не ннблюдается сколько-нибудь заметного окисления бро-
мида или хлорида. При увеличении концентрации 'Водородных ионов, за
счет прибавления определенного количества серной кислоты, бромид’ очень
быстро окисляется, между тем как соответствующая реакция с хлоридом
протекает настолько медленно, что почти не происходит образования сво-
бодного хлора. Раствор может быть даже доведен до кипения без потери
сколько-нибудь заметного количества хлор-.ионов, имевшихся в первона-
чальном растворе.
Увеличение окислительной способности перманганата при повышении
концентрации водородных ионов является прямым следствием закона дей-
ствия масс (стр. 60).
1 Чтобы убедиться в том, приобрел ли осадок чисто белый цвет или
сохранил еще бледножелтую окраску, лучше всего его отфильтровать: ма-
лейшая желтая окраска тотчас будет замечена на белом фильтре.
358
При реакции между перманганатом и галоидными ионами происходит
связывание водородных ионов:
2MnOd' + 6J' + 8Н- -> 2МпОг + 4Н»О + ЗЪ
или
2МпО<' + ЮГ + 16Н- -> 2Мп‘ • + 8НаО + 5Ъ.
Если концентрация водородных ионов в .растворе мала, то перманганат
восстанавливается только до двуокиси марганца, но в присутствии боль-
шого количества кислоты происходит образование катионов двухвалентного
марганца.
При /выполнении анализа по этому методу весьма важно строго при-
держиваться указаний относительно количеств прибавляемой кислоты.
Ход анализа
Если исследуемый раствор имеет кислую реакцию, то прибавляют по
каплям раствор карбоната натрия до тех пор, пока раствор не перестанет
окрашивать синюю лакмусовую бумагу в красный цвет. Если случайно
прибавлено слишком много карбоната натрия, то прибавляют по каплям
разбавленный раствор азотной кислоты до слабокислой реакции. После
этого прибавляют 8 мл 1N раствора ацетата натрия, 2 мл 6N уксусной
кислоты и, если образуется осадок, фильтруют. К фильтрату прибавляют
3 мл хлороформа и до тех пор приливают по 1 мл 1%-ного раствора пер-
манганата, пока водный раствор после сильного взбалтывания не приобре-
тет розово-красной окраски перманганата. Если исследуемый раствор со-
держит иодид, то хлороформ окрашивается свободным иодом в пурпурный
цвет.^
Смесь фильтруют через влажный фильтр для отделения хлороформа
и образовавшейся двуокиси марганца. Смачивание фильтра водой необхо-
димо. чтобы помешать хлороформу проходить через поры фильтра.
Фильтрат, если необходимо, взбалтывают со свежей порцией хлороформа,
чтобы извлечь оставшийся в водном растворе мод (стр. 26), и фильтруют,
каждый раз через свежий фильтр.
По удалении всего иода раствор переливают в делительную воронку,
прибавляют 3 лгл свежего хлороформа, 5 мл 6N серной кислоты и 1 з/л
разбавленного перманганата, если раствор не содержит избытка последнего.
Сильно взбалтывают и дают хлороформу собраться под водой. В присут-
ствии брома хлороформенный слой окрашивается в желтый или оранже-
вый цвет.
Осторожно выпускают хлороформ из делительной воронки, а водный
раствор переливают в фарфоровую чашку. Прибавляют от 5 до 20 мл раз-
бавленного раствора перманганата в зависимости от количества могущего
быть бромида, и смесь кипятят около 5 мин. или до тех пор, пока объем
раствора не уменьшится до 10 мл. Отфильтровывают осадок двуокиси мар-
ганца и, если раствор еще окрашен в розовый цвет, прибавляют по каплям
сернистую кислоту до обесцвечивания раствора. Кипячение имеет целью
окисление последних следов бром-ионов, причем, как указано выше, в этих
условиях не наблюдается сколько-нибудь заметного окисления хлор-ионов.
Избыток перманганата реагирует с ионами двухвалентного марганца
(образовавшимися при восстановлении перманганата), и продуктом этой
реакции является двуокись марганца:
2МпОт" + ЗМп ' ‘ + 2НгО -» 5МпО2 % 4Н’,
но присутствие .водородных ионов, как и следует по закону действия
масс, мешает. Поэтому, вследствие ли недостатка ионов двухвалентного
марганца и растворе или слишком большой концентрации .водородных
ионов, для восстановления последних следов перманганата часто бывает
необходимо прибавление сернистой '.кислоты:
2МпО/ + 580% 4.611' 2.Vlii' ' + oSOi" + 3HsO.
359
Раствор разбавляют до 100 мл, фильтруют, если нужно, прибавляют
20 мл GN азотной кислоты и немного раствора азотнокислого серебра.
В присутствии хлорида образуется творожистый осадок хлористого серебра.
Примечание. Приведенный выше метод разделения галоидов дает
прекрасные результаты. Твердое вещество может быть испытано на хло-
рид, бромид и иодид, если около 2 г его подвергнуть перегонке с 25 мл
воды и 10 мл 85%-ной фосфорной кислоты. В дестиллат при этом перей-
дут иодистоводородная, бромистоводородная и хлористоводородная кис-
лоты. Однако в случае наличия в исследуемом веществе какого-либо
окислителя будут образовываться в нижеследующем порядке свободные
иод, бром и хлор. Свободные галоиды могут быть удалены путем взбал-
тывания дестиллата с хлороформом. Образовавшийся свободный хлор
растворится в хлороформе. Иод и бром узнаются по окраске, которую
они сообщают хлороформу, а хлор и бром — по выделению иода из йоди-
стого калия. По удалении свободных галоидов из дестиллата последний
может быть исследован на присутствие иодистоводородной, бромистоводо-
родной и хлористоводородной кислот, как описано на стр. 357 и1 358.
При перегонке с фосфорной кислотой галоиды получаются даже из хло-
ратов и броматов, если в перегоняемом веществе имеется какой-либо
восстановитель.
Открытие галоидов в присутствии цианида
Через слабощелочной раствор пропускают при температуре кипения
двуокись углерода до тех пор, пока выделяющийся газ, пропущенный
через подкисленный азотной кислотой раствор азотнокислого серебра, не
будет больше давать осадка или мути цианистого серебра.
Углекислый газ получают в аппарате Киппа ;из мрамора и разбавлен-
ной соляной кислоты и пропускают через раствор бикарбоната натрия.
Угольная кислота вытесняет более слабую цианистоводородную кислоту из
ее солей (стр. 24). Так как цианистоводородная кислота чрезвычайно ядо-
вита, работа должна производиться под хорошо действующим вытяжным
шкафом.
По удалении цианистоводородной кислоты испытывают раствор обыч-
ным путем на галоиды.
Цианистоводородная (синильная) кислота HCN
Нахождение в природе. Цианистоводородная кислота встречается в свя-
занном состоянии в растительном царстве, в глюкозидах, содержащих
синильную кислоту, например в амигдалине, находящемся в лавровишне
(Prunus laurocerasus) и в ядрах косточковых плодов. Амигдалин легко
расщепляется гидролитически в кислом растворе на виноградный сахар,
бензойный альдегид и синильную кислоту.
Расщепление происходит даже в, нейтральном растворе под влиянием
энзима эмульсина:
C2bH27NOu + 2Н2О = С6Н5СОН + 2С6Н12О6 + HCN.
амигдалин бензойный сахар
альдегид
При вымачивании в воде растений, содержащих амигдалин, получают
жидкость, в состав которой входит синильная кислота (горькоминдальная,
лавровишневая вода).
Синильная кислота встречается в природе также и в свободном состоя-
нии. Так, растущее на Яве дерево (Pangium edule) содержит большие
количества ее, особенно в своих семенах.
Получение. При пропускании аммиака через накаленный уголь обра-
зуется цианистый аммоний; поэтому эта соль, так же как и другие циа-
нистые соединения, находится в газовой воде, получающейся при сухой
перегонке каменного угля.
360
Синильная кислота может быть получена при действии разбавленных
кислот на многие цианистые соединения. При перегонке желтой кровя-
ной соли с .разбавленной серной кислотой получается вода, содер-
жащая синильную кислоту, которая при стоянии над хлористым кальцием
легко обезвоживается и дает бесцветную, с запахом горького миндаля,
чрезвычайно ядовитую жидкость, кипящую при 26,5°:
2K4Fe(CN)e] + 6HaSO4-> 6KHSO4 + K2Fe[Fe(CN)e] + 6HCN.
Безводную синильную кислоту приготовляют лучше всего по Вэду и
Понтингу Ч Смесь из ранных объемов концентрированной серной кислоты
и воды прибавляют по каплям к твердому 98%-ному цианистому калию.
Выделяющийся цианистый водород с примесью ничтожных количеств воды
высушивают, оставляя стоять над прокаленным хлористым кальцием.
Свойства- Цианистый водород — прозрачная подвижная жидкость, ки-
пящая при 26.5° и застывающая при —15°. При горении дает пурпурное
пламя, .образуя НзО, СО и N2. Он смешивается в любых отношениях с во-
дой, спиртом и эфиром,.
Водный раствор синильной кислоты не может долго сохраняться',
вскоре появляется бурый осадок, с одновременным образованием муравьи-
нокислого аммония:
HCN + 2НОН ->HCOONH4.
Значительно дольше сохраняется синильная кислота в присутствии не-
большого количества минеральной кислоты, но и в этом случае с течением
времени происходит вышеприведенное расщепление на аммиак и муравьи-
ную кислоту.
Холодная концентрированная соляная кислота превращает синильную
кислоту в формамид (амид муравьиной кислоты):
/°
HCN+H3O = H —СС
Это соединение при нагревании претерпевает почти полное расщепле-
ние на окись углерода и аммиак.
Синильная кислота в водном растворе очень слабо проводит электри-
ческий ток, являясь очень слабой кислотой, ионизированной лишь в ни-
чтожной степени. Константа ее диссоциации равна 7 • Ю”10 при 18°. В O,1N
растворе она ионизирована лишь на 0,006%.
Соли цианистоводородной кислоты, цианиды, по своим свойствам
весьма сходны с соответствующими солями галоидных соединений; от
последних они отличаются своей способностью к образованию комплексных
солей, в водных растворах которых концентрация циан-ионов чрезвычайно
мала и которые поэтому не дают некоторых реакций, характерных для
цианистоводородной кислоты.
Цианистоводородная кислота, а также ее соли чрез-
вычайно ядовиты.
Растворимость цианидов. Цианиды щелочных и щелочноземельных ме-
таллов легко растворимы в воде, но подвергаются в значительной мере
гидролизу (стр. 67):
CN' + FkO ->ОН' + HCN.
Так как цианистоводородная кислота ионизирована лишь в слабой сте-
пени, водные растворы цианидов щелочных металлов ведут себя так, как
раствор едкой щелочи, содержащей свободную синильную кислоту, кото-
рую легко узнать по запаху. Соли синильной кислоты разлагаются кисло-
тами, даже слабой угольной кислотой.
Остальные цианиды за исключением цианистой ртути Hg(CN)2 в воде
не растворимы.
* Wade, Panting, Proc. Chem. Soc. 190, 49 (1897—1898).
361
Характерным свойством цианидов тяжелых металлов является их лег-
кая растворимость в растворах циаиидов щелочных металлов с образова-
нием очень стойких комплексных соединений, которые рассматриваются
как соли следующих кислот:
H[R'(CN)2], Ha[Rn(CN)4], H3[RIIr(CN)6] и H*[R n(CN)e].
Первые две кислоты настолько нестойки, что они разлагаются на
цианистоводородную кислоту и цианид, как только их выделяют в свобод-
ном состоянии:
H[R(CN)2] -> HCN + RCN;
Hs[R(CN)4] -> 2HCN + R(CN)s.
Поэтому все соли этих кислот выделяют уже на холоду цианистоводо-
родную кислоту при действии на них разбавленной соляной или серной
кислоты. К таким соединениям относятся:
K[Ag(CN)i], K[Au(CN).’], K2[Ni(CN)4], K^ZnfCNp], K2[Cd(CN)4] и т. п.
Эти соли должны рассматриваться как комплексные соединения (стр. 41),
потому что их водные растворы почти не содержат ионов тяжелых метал-
лов; они не осаждаются едкими и углекислыми щелочами или аммиаком.
Следствием этого является растворимость окисей этих металлов в циани-
' дах щелочных металлов с образованием следующих комплексных солей:
AgiO + 4CN' + №0 ->20Н' + 2[Ag(CN)-]';
NiO + 4CN' + Нт О -э20Н' + [№(СМ";
ZnO + 4CN' + НЮ-> 2ОН' + |Zn(CN’)->]";
CdO + 4CN' + Н2О -> 20Н' + L Cd(CN)4]".
Сероводородом легко разлагаются серебряная и кадмиевая соли, трудно
цинковая, а никелевая совсем не разлагается.
В противоположность вышеприведенным кислотам сравнительно боль-
шей устойчивостью обладают кислоты формул Hs[Rin(CN)o] tfHjJR1 (CN)u];
они большей частью могут быть получены из своих солей на холоду при
действии минеральной кислоты без выделения синильной кислоты; при на-
гревании, напротив, они выделяют синильную кислоту.
Типичными представителями этих кислот являются железо-, железисто-
и кобальто-3-синеродистоводоролные кислоты <
Железисто-, железо- и кобальто-3-синеродистоводородная кислоты
будут рассмотрены отдельно.
Реакции мокрым путем
1. Разбавленная серная кислота разлагает на холоду все рас-
творимые цианиды (за исключением цианистой ртути), выделяя
свободную синильную кислоту, узнаваемую по запаху.
Нерастворимые цианиды разлагаются разбавленной серной
кислотой только при нагревании.
2. Концентрированная серная кислота разлагает при нагре-
вании все соли синильной кислоты как простые, так и комплекс-
ные, .причем металлы превращаются в сернокислые соли, угле-
1 Кобальто(2)синеродистоводородная кислота крайне неустойчива, так же
как марганцово- и марганцовистссииеродистоводородные кислоты. Их соли
выделяют на холоду при действии минеральной кислоты синильную кислоту,
<362
род циана — в окись углерода, а азот циана.— в аммиак, точ-
нее— в сернокислый аммоний:
Ni(CN)s + 3H2SO4 + 2НгО -» NiSO4 + 2(NH4)HSO4 4- 2СО *.
Цианистая ртуть выделяет наряду с окисью углерода анги-
дриды сернистой и угольной кислот, потому что она при тем-
пературе кипения серной кислоты распадается на циан и метал-
лическую ртуть; последняя растворяется в горячей серной кис-
лоте с выделением сернистого газа и образованием сернокислой
соли окиси ртути:
Hg(CN)a + 6H?SO4 -» 2(NH4)HSO4 + Hg(HSO4)2 4- CO 4-
+ CO2 + SO2 + SO3.
3. Двуокись углерода. Бели пропускать на холоду через
раствор цианистого металла в присутствии бикарбоната натрия1 2
углекислый газ, то происходит постепенное выделение циани-
стого водорода, значительно быстрее—при температуре кипе-
ния. При пропускании выделяющегося газа в раствор азотно-
кислого серебра, подкисленный азотной кислотой, выделяется
белый осадок цианистого серебра (отличие от хлористоводо-
родной, бромистоводородной, иодистоводородной, железисто-
синеродистоводородной, железосинеродистоводородной и ро-
данистоводородной кислот).
4. Азотнокислое серебро. Если к раствору цианистого ще-
лочного металла приливать по каплям азотнокислое серебро, то
каждая капля образует белый творожистый осадок цианистого
серебра, который, однако, при помешивании тотчас исчезает,
растворяясь в избытке цианида:
CN' + Ag’ -> AgCN;
AgCN 4- CN'-> [Ag(CN)2]'.
Комплексный ион [Ajj-(CN)-]' при дальнейшем поибавлении азотнокис-
лого серебра полностью превращается в цианистое серебро:
[Ag(CN)2]' + Ag’ -> 2AgCN.
Поэтому осаждение бывает полным только в присутствии избытка
азотнокислого серебра. Чувствительность 1 0,03 .«,• в 1 л.
Цианистое серебро ,в воде и разбавленной азотной кислоте нераство-
римо, заметно растворимо в концентрированной азотной кислоте и очень
легко — в аммиаке, тиосернокислом натрии и цианистом калии. Разба-
вленная азотная кислота выделяет снова цианистое серебро из его аммиач-
ного раствора или из раствора в цианистом калии.
Концентрированная соляная кислота разлагает при нагревании циани-
стое серебро, выделяя синильную кислоту и образуя хлористое серебро
(отличие от хлористого, бромистого и йодистого серебра).
1 Концентрированная серная кислота превращает даже на холоду
цианистые щелочные металлы в сернокислые соли с выделением окиси
углерода.
2 Щелочные соти железисто- и железосинеродистоводородной кислот
разлагаются в нейтральном растворе с обильным выделением HCN, чего
Не бывает в присутстьин достаточного количества бикарбоната натрия.
ЗоЗ
При прокаливании цианистого серебра получается дициан, металличе-
ское серебро и трудно летучий, окрашенный в бурый цвет полимер циана
(парациан), который при дальнейшем накаливании совершенно улетучи-
вается, и тогда остается чистое серебро:
2AgCN-> 2Ag + (CN)2.
Более надежное открытие синильной кислоты основано на реакциях
образования берлинской лазури и роданового железа.
5. Реакция образования берлинской лазури. Берлинская лазурь
образуется при действии солей окиси железа на железистосине-
родистый калий (стр. 239).
3[Fe(CN)e]"" + 4Fe‘ ‘ ' -> Fe4[Fe(CN)e]3.
Таким образом, чтобы этой реакцией обнаружить цианистый калий,
необходимо последний превратить в железистосинеродистый калий. Для
этого прибавляют соль закиси железа, отчего сначала образуется циани-
стое железо, растворяющееся в избытке цианистого калия с образованием
железистосинеродистого калия:
Fe' • + 2CN'-> Fe(CN)2
и
Fe(CN)2 + 4CN' -> [Fe(CN)e]"".
Образование железистосинеродистого калия совершается еще легче при
действии цианистого калия на гидрат закиси железа:
Fe(OH)2 + 2CN' -» Fe(CN)2 + 2ОН';
Fe(CN)2 + 4CN'-> [Ee(CN)e]"".
Для образования железистосинеродистого калия необходимо мало же-
леза и много цианистого калия-. Поэтому щелочной раствор цианистого
щелочного металла кипятят с очень малым количеством сернокислой соли
закиси железа, затем подкисляют соляной кислотой и приливают хлорное
железо, причем тотчас происходит образование берлинской лазури. В при-
сутствии следов цианида солянокислый раствор окрашивается в зеленый
цвет, но спустя некоторое время из него выделяются синие хлопья бер-
линской лазури.
Примечание. Если присутствуют лишь следы цианида, то берлин-
ская лазурь в желтом растворе хлорного железа кажется зеленого цвета.
Чтобы избавиться от желтого цвета хлорного железа, можно прибегнуть
к сильному разбавлению, но тогда железо в значительной мере переходит
в коллоидное состояние вследствие образования основной соли под влия-
нием гидролиза. Такой раствор реагирует очень медленно с железистосине-
родистой солью. Поэтому для обнаружения следов железистосинеродистой
кислоты (а следовательно, и цианидов) рекомендуется применять насыщен-
ный раствор сульфата двухвалентного железа взамен хлорного железа.
Такой раствор содержит достаточно ионов трехвалентного железа, чтобы
образовать берлинскую лазурь с железистосинеродистыми ионами. Однако
при количествах железистосинеродистых ионов, больших, чем следы, реак-
цию следует выполнять с хлорным железом, как выше описано.
Реакцией образования берлинской лазури пользуются для открытия
азота в органических веществах по способу Лассеня (Lassaigne) (стр. 368).
Чувствительность 1 : 500 000.
6. Реакция образования роданового железа. Роданистые ще-
лочные -металлы образуют в растворах солей окиси железа рас-
творимое родановое железо кровавокрасного цвета (стр. 238):
3CNS' + Fe’ ‘ •-> Fe(CNS)3.
3S4
Поэтому цианид должен быть сначала превращен в родани-
стое соединение, что легко осуществить или путем сплавлении
с серой:
KCN + S -»KCNS,
или путем обработки многосернистыми щелочами.
Присоединение серы к цианистому калию лучше всего про-
изводить при помощи многосернистого аммония:
KCN + (NHi)2S2 -» (NHj)2S + KCNS.
Для этой цели на крышке фарфорового тигля прибавляют к не-
скольким каплям исследуемого концентрированного раствора несколько
капель желтого сернистого аммония, выпаривают досуха на водяной бане,
подкисляют небольшим количеством соляной кислоты 1 и прибавляют
каплю хлорного железа, причем появляется характерное кровавокрасное
окрашивание даже в присутствии следов цианида. Чувствительность
0,1 .иг ,в 1 .1.
7. Азотнокислая соль закиси ртути при добавлении к раство-
рам цианистых щелочных металлов выделяет серый осадок
металлической ртути (отличие от хлора, брома и иода):
Hg2‘' + 2CN'-> Hg(CN)2 + Hg.
8. Реакция образования нитропруссида. К раствору цианисто-
водородной кислоты или ее щелочной соли прибавляют не-
сколько капель раствора нитрита щелочного металла, 2—3 капли
хлорного железа и такое количество очень разбавленной сер-
ной кислоты, чтобы бурое окрашивание от образовавшейся соли
трехвалентного железа перешло в светложелтое. После этого
нагревают до начала, кипения, охлаждают и прибавляют доста-
точно аммиака, чтобы осадить железо. Фильтруют и к филь-
трату прибавляют несколько капель сероводородной воды, от-
чего раствор окрашивается в фиолетовый цвет.
Эта реакция зависит от образования нитропруссидного иона
[Fe(CN)5N’O]", который дает с сульфид-ионами красновато-фио-
летовое окрашивание.
9. Синий раствор иод-крахмала обесцвечивается следами
цианистой щелочи в присутствии небольших количеств серной
кислоты: иод реагирует с цианистоводородной кислотой, обра-
зуя иодистый циан и иодистоводородную кислоту:
HCN + Ji -> CNJ + HJ.
Эта реакция весьма чувствительна, но синий раствор иод-
крахмала обесцвечивается многими другими веществами. Чув-
ствительность 1 : 50 000.
1 Подкисление необходимо для разложения (ЫНфЗ, в противном слу-
чае последний с хлорным железом образовал бы черное сернистое железо,
которое замаскировало бы окраску роданового железа.
365
10. Ацетат меди и ацетат бензидина. Бесцветный ацетат бензидина
превращается при окислении в синий имид, имеющий хиноидное строение
(стр. 222). Окисление может быть произведено солями двухвалентной
меди в присутствии цианистоводородной кислоты:
Си(СНзСОО)2 + 2HCN-» Cu(CN)« + 2СНзСООН;
2Cu(CN)s + НгО ->Cuj(CN)2 + 2HCN + О.
В маленький фарфоровый тигель помещают каплю испытуемого рас-
твора, добавляют каплю bN серной кислоты и плотно прикрывают тигель
фильтровальной бумагой, смоченной каплей смеси равных объемов рас-
твора ацетата меди (2,86 г/л) и раствора ацетата бензидина (475 мл на-
сыщенного водного раствора ацетата бензидина, к которому добавлено
525 мл воды). В присутствии цианидов вокруг пятна на фильтровальной
бумаге образуется синее кольцо.
Открываемый минимум: 0,25 7 CN.
11. Сернистая медь растворяется в растворе цианистого калия:
CuS + 4KCN -> KeCu(CN)4 + K->S *.
В 100 мл воды растворяют 0,12 г кристаллического сульфата
меди, прибавляют несколько капель аммиака и /пропускают в рас-
твор сернистый водород. Каплю суспензии сернистой меди по-
мещают на фильтровальную бумагу или в углубление капельной
пластинки и /прибавляют каплю исследуемого щелочного рас-
твора. В присутствии цианида сульфид растворяется.
Эту реакцию можно выполнить еще следующим образом. Ку-
сочек фильтровальной бумаги смачивают аммиачным 0,1%-ным
раствором меди и высушивают. Непосредственно перед опытом
бумагу на короткое время подвергают действию сероводорода,
отчего она равномерно окрашивается в желто-бурый цвет. На-
несенная на такую бумагу капля исследуемого раствора обра-
зует в случае присутствия цианида белый кружок. Открываемый
минимум: 1,25 у циана.
Свойства цианистой ртути
Цианистая ртуть Нц(СХ)г. являющаяся неэлектролитом, вполне раство-
ряется в воде, спирте я эфире и совершенно отличаеюя от всех других
цианидов. Все вышеприведенные реакции, за исключением реакции образо-
вания роданового железа, не удаются с этим соединением. Цианистая
ртуть не дает осадка с нитратом серебра, но образует с ним легко раство-
римую двойную соль Hff(CN)j • AgNO.i • 2'НзО.
Точно так же не образуется осадок с аммиаком, иодиегым калием, ед-
кими или углекислыми щелочами, потому что все эти реактивы дают при
обыкновенных условиях с соединениями ртути осадки, которые раство-
ряются в цианистом калии:
HgO + 2KCN + Н-гО-> 2КОН + Hff(CN)?.
Сама окись ртути легко растворяется в цианистой ртути:
Hg---CN
HgO+Hg(CN)3 —>
CN
1 О. L. В а г n е b у. J. Am. Chem. Soc. 36 1092 (1914); Файгль,
Капельный анализ, стр. 349,
366
Хлористоводородная, бромистоводородная и иодистоволородная кисло-
ты легко разлагают цианистую ртуть, но разбавленная серная кислота на
нее почти не действует. Однако в присутствии какого-либо растворимого
хлорида цианистая ртуть легко разлагается не только серной кислотой, но
даже щавелевой или винной кислотами. Поэтому, если к раствору циани-
стой ртути прибавить поваренной соли и подвергнуть его перегонке с раз-
бавленной серной, щавелевой или винной кислотой, то дестиллат будет со-
держать цианистоводородную кислоту, которая дает все характерные для
нее реакции.
На1 раствор цианистой ртути действует сернистый водород или сульфид
щелочного металла с образованием серной ртути и цианистоводородной
кислоты или ее щелочной соли. Удалив фильтрованием черный осадок
серной ртути, можно ® фильтрате легко провести реакцию образования
роданового железа.
* Примечание редактора. В присутствии едкой щелочи циано-
вая группа в цианиде ртути приобретает свою обычную реакционную спо-
собность. Едкая щелочь реагирует с образованием комплексной соли;
Hg (CN)» + КОН -L- Н2О —►
CN
Н,0
CN1
Hg
ОН
анион которой распадается согласно уравнению:
‘CN CN1'
Hg —> CN' 4- Н2О + Hg (CN) ОН.
Н.,0 он]
Образование этого комплекса возможно также в присутствии любой
щелочной соли слабой кислоты, например ацетата натрия, которая в рас-
творе показывает щелочную реакцию вследствие гидролиза.
Таким образом, открытие циана в цианистой рту;и может быть произ-
ведено так: к капле исследуемого кислого раствора на часовом стекле
прибавляют азотнокислое серебро; раствор при этом остается прозрачным;
затем прибавляют каплю раствора ацетата натрия; в присутст вии Hg(CN)a
появляется осадок AgCN. Чувствительность 1:10 000 У* J. К.
Отношение цианидов к прокаливанию
Цианистые щелочные металлы плавятся в отсутствие воздуха,
не разлагаясь. При прокаливании же на воздухе они жадно
поглощают кислород, образуя соли циановой кислоты:
2KCN +О2 —»2KCNO.
Поэтому все цианистые щелочные металлы являются силь-
ными восстановителями (сир. 199).
Цианиды щелочных земель распадаются при нагревании на
цианамид и углерод:
Ca(CN)2 —» СаС№ + С.
цианамид
кальциз
Цианиды двухвалентных тяжелых металлов распадаются при
прокаливании без доступа воздуха па азот и карбид металла;
» Файгль, Капельный анализ, стр. 352.
367
последний же часто претерпевает дальнейшее разложение на
металл и углерод:
3Fe(CN)2 —* Fe3C + С + 2(CN)2 + N?;
Pb(CN—> РЬ — 2C — N;.
Цианиды трехвалентных металлов в свободном состоянии
неизвестны; цианиды благородных металлов разлагаются при
прокаливании на металл и дициан:
2AgCN -> 2Ag + (CN)ij
Hg(CN)i -> Hg + (CN)9.
Дициан (CN)2
Дициан, получающийся при прокаливании цианидов благородных. ме-
таллов,— бесцветный с острым запахом газ, горящий красноватым пламе-
нем и хорошо растворяющийся в воде (25 ч. воды растворяют 100 ч. ди-
циаца). Водный раствор недолго сохраняется без изменения; он постепенно
выделяет бурые хлопья азульмовой кислоты CiHsNsO, причем: в растворе
образуются цианистый, углекислый и щавелево-кислый аммоний и мочевина.
Подобно тому как хлор действует на едкую щелочь с образованием
хлористого металла и хлорноватистокислой соли, так же и дициан дает
соли синильной и циановой кислот:
СЬ + 2КОНч- КС1 + НаО -Н КОС!;
(CN)s + 2КОН-> KCN + Н2О + KOCN.
Если пропускать сероводород в раствор дициана, то сначала обра-
зуется желтый флавеановый водород, который при избытке сернистого
водорода превращается в кристаллический рубеановый водород красного
цвета (стр. 157):
C = N S = C-NH, S = C-NH2
I + H,s | +H.,s > |
C = N C = N S = C —NH,
флавеановый рубеановый
водород водород
Открытие азота в органических веществах по способу Лассеня
(Lassaigne)
При нагревании в тугоплавкой пробирке органического азотсодержа-
щего вещества с небольшим количеством металлического натрия или ка-
лия азот и углерод соединятся с натрием-, образуя цианистый натрий.
После'двухминутного прокаливания 1 еще горячую пробирку опускают в не-
большое количество воды; стекло при этом лопается и содержимое про-
бирки растворяется в воде. Раствор, содержащий цианистый натрий, от-
фильтровывают от углерода и осколков стекла, прибавляют немного
сернокислой соли закиси железа, кипятят, прибавляют затем несколько
капель раствора хлорного железа и подкисляют соляной кислотой.
1 Взаимодействие органического вещества с металлическим калием или
натрием сопровождается вспышкой. Чтобы иметь уверенность, что азот
действительно прореагировал с углеродом и натрием с образованием циа-
нида, необходимо вести нагревание до появления такой .вспышки, после
чего, не вынимая пробирки из пламени горелки, продолжить прокаливание
в течение 2—3 мин, и далее поступать, как указано выше. *
368
Присутствие азота .обнаружится по образованию осадка берлинской
лазури.
Примечание. Некоторые органические азотсодержащие вещества разла-
гаются с выделением азота еще до достижения температуры, необходимой
для образования цианида >, так что реакция Лассеня для таких соединений
не применима; в других случаях реакция не удается вследствие крайней
летучести органического вещества1 2.
По Кереру (Keherer)3 реакцию Лассеня можно применять и в этих слу-
чаях, если только пары органического вещества пропускать через предва-
рительно накаленный натрий. Опыт этот производят в трубке, вытянутой
так же, как при испытании на мышьяк (рис. 13, стр. 177). Вещество вносят
в вытянутый запаянный конец трубки, а в более широкую часть ее (непо-
средственно в месте, где трубка начинает расширяться) — маленький свер-
нутый сухими пальцами в цилиндрик кусочек натрия, предварительно
очищенный от керосина при помощи фильтровальной бумаги. Нагрев
натрий до каления, нагревают посредством второго маленького пламени
испытуемое вещество так, чтобы юно сначала плавилось и чтобы пары его
достигали только До накаленного металла, но не переходили через него.
Удаляя по временам маленькое пламя, можно снова сгущать пары и снова
подводить их к раскаленному металлу. В дальнейшем поступают, как уже
выше указано.
При открытии следов азота лучше после подкисления добавлять не
хлорное железо, а насыщенный раствор сульфата двухв>алентного же-
леза (стр. 365).
Открытие цианистоводородной кислоты в присутствии галоидоводородных,
железисто-, железосииеродистоводородной и роданистоводородиой кислот
Из всех .вышеприведенных кислот цианистоводородная кислота является
наиболее слабой и в противоположность всем остальным вытесняется из
своих солей при температуре кипения воды угольной кислотой. На этом
основании открытие ее производится следующим образом.
Испытуемый раствор вливают в небольшую эрленмейеровскую колбу
и прибавляют 0,5—1 г NaHCOs; колбу закрывают резиновой пробкой,
снабженной двумя отверстиями, через одно из которых проходит доходя-
щая до дна гаэоподводящая трубка, а через другое — газоотводящая
трубка, заканчивающаяся непосредственно под пробкой. Пропускают дву-
окись углерода в колбу с исследуемым раствором, постепенно нагревают до
кипения и выходящий газ пропускают в подкисленный азотной кислотой
раствор азотнокислого серебра. В присутствии синильной кислоты очень
скоро образуется белый осадок цианистого серебра. Чтобы убедиться
в этом, сливают с осадка жидкость, несколько раз промывают его, декан-
тируя, водой, прибавляют немного желтого сернистого аммония, кипятят,
фильтруют, выпаривают фильтрат до небольшого объема, подкисляют
соляной кислотой и прибавляют несколько капель хлорного железа. Появле-
ние кровавокрасного окрашивания служит признаком присутствия синиль-
ной кислоты.
Железистосинеродистоводородная кислота H4(Fe"(CN)6)
Получение и свойства. Железистосинеродистово-дородная кислота пред-
ставляет собой белое твердое вещество, легко растворимое в воде и спирте;
водный раствор ее разлагав! карбонаты и быстро синеет на воздухе
вследствие частичного окисления, приводящего к образованию берлинской
лазури. Соли этой кислоты, обладающие гораздо большей устойчивостью,
приготовляются из ее калиевой соли, называемой желтой кровяной солью.
Последняя является важнейшей продажной солью железистосинеродисто-
1 G г ab е, В. 17, 117? (1К84).
2 F е i s t, В. 35, 1559 (1902).
3 В. 35, 2523 (1902).
24 Эак. 982. Тредвелл-Голл, т. I.
369
водородной кислоты. Она получается путем сплавления содержащих азот
и серу органических веществ (кровь и т. п.) с поташом и металлическим
железом без доступа воздуха; полученный плав выщелачивают водой.
В плаве находятся сернистое железо и цианистый калий, которые при
обработке водою превращаются в сернистый и железистосинеродистый
*
FeS + 6KCN = K:S + K<[Fe(CN)<J.
Последняя соль при выпаривании раствора выделяется с тремя моле-
кулами воды в виде больших желтых октаэдров квадратной системы.
В настоящее время железистосинеродистый калий получается в каче-
стве побочного продукта при производстве светильного газа; в процессе
его очистки образуются берлинская лазурь и роданистый аммоний.
Нижеследующие уравнения дают представление о получении железисто-
синеродистого калия:
Fe<[Fe(CN)e]a + 6Са(ОН)г -> 4Fe(OH). + 3Caj[Fe(CN).];
Cai [Fe (CN)6] + 2KC1 —► K2Ca [Fe (CN)6] + CaCls;
весьма трудно
растворимый
KsCa[Fe(CN)«] + KaCOs -> CaCOa + K4[Fc(CN)a].
Растворимость ферроцианидов (солей жейезистосинеродастоводородиой
кислоты). Железистосинеродистые соли щелочных и щелочноземельных ме-
таллов растворяются в воде, остальные же (также и соли редких земель,
Се, Th, Y, Zr и пр.) трудно или вовсе не растворимы ни в воде, ии в
холодных разбавленных кислотах. Известен ряд смешанных солей, как,
например:
Ca(NH4)2[Fe(CN)e], Mg(NH4)2[Fe(CN)e] и K2Sr[Fe(CN).].
Растворимые ферроцианиды, содержащие кристаллизационную воду, жел-
того цвета, безводные — бесцветны.
Реакции мокрым путем
1. Разбавленная серная кислота. Ферроцианиды не разла-
гаются на холоду разбавленной серной кислотой, но при темпе-
ратуре кипения происходит их разложение с выделением циани-
стоводородной кислоты:
2K4[Fe(CN)6] + 6H2SO4 -» K2Fe[Fe(CN)c] -F SKHSOt + 6HGN.
2. Концентрированная серная кислота разлагает при нагре-
вании все соли железистосинеродистоводородной кислоты с вы-
делением окиси углерода, горящей синим пламенем:
K4[Fe(CN)6] -F IIH2SO4 + 6Н2О->
-► FeSO4 + 4KHSO4 + 6(NH4)HSO4 + 6СО.
При этом всегда выделяется SOs, так как часть сернокислой соли за-
киси железа окисляется серной кислотой в сернокислую соль окиси железа:
2FeSC>4 + 2H2SO4 -> Fe-(SC>4)» + 2НгО + SOt.
3. Азотнокислое серебро выделяет белый осадок ферроци-
анида серебра:
,[Fc(CN)g]"" + 4Ag‘ -> Ag4[Fe(CN)s].
370
Осадок нер-зшворим в разбавленной азотной кислоте и аммиаке, растворим
в цианистом калии. При действии концентрированной азотной кислоты
иселезистосииеродистое серебро окрашивается в оранжевый цвет вследствие
окисления его в железосинеродистое серебро; последнее растворимо в ам-
миаке.
4. Хлористый барий не дает осадка. Кальциевая соль значительно менее
растворима.
5. Соли окиси железа образуют в нейтральных или кислых растворах
берлинскую лагерь (стр. 239). Реакция удается с 1 Y К4[1;е(С\)с],
6. Соли закиси железа выделяют голубые осадки, переходящие на воз-
духе в синие (стр. 234).
7. Соли окиси меди и соли уранила образуют осадки бурого цвета;
первая в присутствии разбавленной уксусной кислоты.
8. Цинковые соли даю г белый осадок KsZiniFefCNle'h, не растворимый
в разбавленных кислотах. Этот осадок легко растворяется в едкой щелочи:
KsZns[Fe(CN)eh + 90H'«-2[Fe(C\)]o"" + 31 IZnCV + 2К’ + 3ILO.
При пропускании в полученный раствор СОз образуется нерастворимый
карбонат цинка.
9. Свинцовые соли осаждают белый железистосинеродистый
свинец, не растворимый в разбавленной азотной кислоте.
10. Азотнокислый торий образует с щелочными солями желе-
зистосинеродистоводородной кислоты в слабокислом растворе
нерастворимый и трудно отфильтровываемый белый осадок
(отличие от жслезосинсуодистов'одсродной и роданистоводо-
родной кислот).
11. Двуокись углерода. Ферроцианиды щелочных металлов
не разлагаю 1ся на холоду двуокисью углерода, но разложение
происходит, если углекислый газ пропускать в горячий раствор.
Растворы ферроцианидов, подщелоченные карбонатом натрия,
при перегонке в токе двуокиси углерода не выделяют циани-
стоводородной кислоты; то же самое -происходит, если вместо
карбоната натрия применять бикарбонат натрия.
12. Соляная кислота. Если к не слишком разбавленному рас-
твору ферроцианида калия прибавить соляной кислоты, а затем
эфира, то в зоне соприкосновения эфирного и водного слоя на-
блюдается образование твердой железистосинеродистоводород-
ной кислоты. •*-
Анализ нерастворимых ферроцианидов
Чтобы о отрыть в нерастворимых железистосинеродистых металлах
присутствие группы [Fe(CN)o], их кипятят с раствором едкого кали или
натра, причем большею частью образуются нерастворимый гидрат . окиси
металла и железистосинеродистый калий.
Так, берлинская лазурь дает гидрат окиси железа и железистосине-
родистый калий:
Fei[Fe(CN)c,]s ф 12OI1'-» 4Fe(OH)3 + 3[Fe(CN)o]
Нерастворимый гидрат окиси отфильтровывают, фильтрат подкисляют
разбавленной соляной кислотой и прибавляют хлорное железо, причем
снова образуется берлинская лазурь.
Берлинскую лазурь часто применяют для окраски обоев. Для ее от-
крытия разрезают на кусочки 100 с.н2 обоев, кипятят с едким кали, филь-
24*
371
труют и с фильтратом поступают так, как выше указано. По истечении
нескольких часов появляется на дне сосуда заметный осадок берлинской
лазури.
Не все нерастворимые железистосинеродистые металлы выделяют при
обработке едким кали металл в виде гидрата окиси. Так. железистосине-
родистый уранил, окрашенный в бурый цвет, дает нерастворимый уранит
(урановокислый) калия желтого цвета и растворимый железистосинероди-
стый калий; напротив бурый железистосинеродистый молибден раство-
ряется нацело в аммиаке и едких щелочах с образованием ионов ферро-
цианида и молибдата.
Отношение ферроцианидов к прокаливанию
При прокаливании ферроцианиды дают карбид железа,
цианид, дициан и азот:
3K4[Fe(CN)e] 12KCN + Fe3C + С + 2(CN)2 + N2;
3Ag4[Fe(CN)6] 12Ag 4- Fe3C + C + 8(CN)2 + N2.
Железосинеродистоводородная кислота HJFeIII(CN)J
Безводная железосинеродистоводорюдная кислота Hs'[Fe(CN)e] не ле-
туча; она представляет собой твердое кристаллическое вещество бурого
цвета, легко растворимое в воде. Водный раствор ее обладает сильно-
кислыми свойствами и является сильным окислителем. В свободном состоя-
нии она мало устойчива и быстро разлагается с отщеплением цианистого
водорода.
Соли этой кислоты, железосинеродистые металлы, или феррицианиды,
весьма устойчивы и получаются путем окисления соответственных солей
железистосинер'одистоводородной кислоты.
Важнейшую из них, железосинеродистый калий (красная кровяная
соль) Ks[Fe(CN)e], получают путем окисления хлором железистосинероди-
стого калия:
2K4[Felr(CN)e] + Ch -» 2КС1 + 2Ks[Fenr(C\)el-
Вместо хлора можно применять бром, перекись водорода, двуокись
свинца и т. п.
Растворимость феррицианидов. Соли щелочных, щелочноземельных
металлов, редких земель (Се, Th, Y, Zr и пр.) и окиси железа растворимы
в воде, остальные не растворимы даже в разбавленных кислотах.
Реакции мокрым путем
1. Разбавленная серная кислота выделяет синильную кислоту
только при нагревании, но не на холоду (отличие от цианидов).
2. Концентрированная серная кислота разлагает при нагрева-
нии все соли железосинеродистоводородной кислоты, образуя
сернокислые соли и окись углерода:
Ks[Fe(CN)e] + IIH2SO4 + 6Н2О -»FeH(SO4)2 + 3KHSO4 +
+ 6(NH4)HSO4 + SCO.
3. Азотнокислое серебро осаждает оранжевое железосинеро-
дистое серебро:
[Fe(CN)r,]"' + 3Ag- Ag3[Fe(CN)6],
растворимое в аммиаке и не растворимое в азотной кислоте.
372
4. Хлористый барий не образует осадка.
5. Соли закиси железа дают в нейтральных и кислых раство-
рах турнбулеву синь (стр. 234).
6. Соли окиси железа осадка не дают, но образуют бурое
окрашивание.
7. Соли окиси меди образуют железосинеродистую медь зе-
леного цвета:
2 £Fe(CN)e]+ 3Cu‘ ’ -> Cu3[Fe(CN)6]2.
8. Соли кадмия дают бледножелтый феррицианид кадмия, не
растворимый в кислотах (отличие от роданистоводородной
кислоты):
2[Fe(CN)o]"' + ЗСсГ ’ -► Cd3[Fe(CN)6]2.
9. Нитрат тория не образует никакого осадка в слабокислом
растворе (отличие от ферроциан-иона).
10. Хлористый марганец в концентрированной соляной кис-
лоте окрашивается в темный цвет под действием железосинеро-
дистоводородной кислоты. Эта реакция указывает только при-
сутствие окислителя.
11. Двуокись углерода. Водные растворы феррицианидов
реагируют с двуокисью углерода точно так же, как и ферроциа-
ниды (стр. 371).
12. Сернистый водород восстанавливает феррицианиды ще-
лочных металлов в ферроцианиды:
2[Fe(CN)e]"' + H2S-> 2[Fe(CN)6]"" + 2Н’ + S.
13. Бензидин окисляется железосинеродистоводородной кисло-
той с образованием нерастворимого мерихиноидного соединения
синего цвета (стр. 222). Эта реакция однозначна в отсутствие
других окислителей (хроматы, молибдаты и т. п.).
К капле исследуемого раствора на капельной пластинке прибавляют
каплю холодного ,насыщенного раствора' бензидина' в 2N уксусной кислоте.
Уже при 1 K.6Fe(CN)eJ получается синий осадок или такого же цвета
раствор. В присутствии ферроцианида образуется белый осадок, вследствие
чего требуется большая затрата реактива, так как ферроцианид бензидина,
подобно сульфату бензидина, практически не растворим в воде. Чтобы
открыть феррицианид при наличии значительного количества ферроцианида,
прибавляют к исследуемой капле (до прибавления ацетата бензидина)
каплю 1%-ного раствора нитрата свинца. Последний образует нераствори-
мый ферроцианид свинца и таким образом устраняется мешающий реакции
ферроцианид.
14. Свойства феррицианидов в щелочном растворе. Железо-
синеродистоводородная кислота в щелочном растворе является
сильным окислителем и легко восстанавливается в железистоси-
неродистые щелочи: сероводородом, иодистым водородом, сер-
нистой кислотой, гидратами закисей железа и марганца, окисью
373
свинца, щавелевой кислотой, крахмалом, сахаром, клетчаткой
(бумагой) и т. д.:
2(Fe(CN)fi]'" 4~ S" -*2[Fe(CX)6]"" + 5;
2[Fe(CN)d"' + 2J'-> 2[Fe(CX)6]"" -p
2[Fe(CN)6]"' + SO3" 4- 2OH' -> 2[Fe(CX)6]"" ~ SO/' + FLO;
2[Fe(CN)e]"' + РЬО 4- 2OH' -* 2[Fe(CN)6]"" + PbO2 4- H2O;
[Fe(CN)6]'" 4- Fe(OH)2 4- OH'-* [Fe(CX)e]"" 4- Fe(OH)3;
2[Fe(CN)e]"' 4- H2O2 4- 2OH'-> 2[Fe(CX)6]"" 4- 2H2O 4- O2.
Ферриниапилы восстанавливаются при нагревании даже аммиаком
с выделением азота:
6[Fe(CN)o]'" + 8NHs -» 6[Fe(CN)6j"" Ф Ф бХНР .
Вследствие легкой восстановляемостн жслезоспнеродистоводородной
кислоты часто весьма трудно, а иногда н невозможно констатировать ее
присутствие, особенно если она находится н виде нерастворимой соли.
При разложении, например, турнбулевой сини едким кати получается
в осадке смесь гидратов закиси и окиси железа, а в растворе — железисто-
синеродистый калий, потому что образовавшийся железосинеродистый ка-
лий окисляет часть гидрат закиси железа в гидрат окиси (стр. 234).
15. Окись ртути. Весьма важно отношение железосинеродистых солей
к действию желтой окиси pi ути, суспендированной в воде. Почти нее
цианиды как простые, так и комплексные (за исключением кобальтосине-
родистого калия) разлагаются при этом полностью, причем образуются
цианистая ртуть и окиси принимающих участие и реакции металлов. По-
следние, если только они нерастворимы, могут быть путем фильтрования
отделены от цианистой ртути. Феррнцнан- и ферр.онпан-ионы, а такаю
берлинская лазурь разлагаются следующим образом окисью ртут:
[Fe(C\’)6?" + 3HgO ж ЗИЮ -> 3Hg-(CN)2 ф Fe(OH);! ф ЗОН';
[Fe(C\)»?"' Ф 3HgO ф- ЗНЮ -х 3Hg(CX): Ф Fe(OH)= ф 4ОН';
Рет:Ге(СХ)вф ф 9HgO ф 9H.>O-»3Fe(OH)» ф 4Fe(OH)3 ф 9Hg(C\’)2.
Этой реакцией разложения комплексных цианидов окисью ртути часто
пользуются в количественном анализе для отделения циана о г металлов.
Отношение феррицианидов к прокаливанию
Железосинеродистые соли разлагаются на карбид железа,
цианид, дициан и азот:
6K3[Fem(CN)e] -* 2ЬЪС 4- 18KCN 4- 6X2 4- 3(СХ)2 г ЮС.
При накаливании железосинеродистых мета тлев в тугоплав-
кой пробирке выделяется горящий красноватым пламенем ди-
циан.
Роданистоводородная (тиоцианистоводородная)
кислота HCNS
Нахождение в природе. Роданис!«водородная кислота в виде натрие-
вой соли в небольших ко.тнчесшах находится в слюне и моче.
374
Получение. Щелочные соли родамистоводородной кислоты мюгут быть
получены из соответственных цианидов путем сплавления последних
с серой:
KCN + S ->KCNS,
Они могут быть также получены при комнатной температуре посред-
ством обработки цианистоводородной кислоты или ее щелочных солей
многосернистыми щелочами:
KCN + (МВДА -> (NWS + KCNS
или путем кипячения с раствором тиосульфата щелочного металла:
NaACh +. KCN-> NasSOj + KCNS.
Роданистый аммоний легче всего получается, если смеси, состоящей
из 30 мл концентрированного аммиака, 30 мл спирта и 7 мл сернистого
углерода, дать постоять 1—2 дня, а> затем выпарить на водяной бане.
Сперва образуется тиокарбаминовокислый аммоний
ZNHa
CS2-J-2NH.-* С = S
который при выпаривании отщепляет сероводород и переходит в роданид
аммония:
zNHa
c=s -
\SNHi
H2S + C
\SNH*
Свойства. Свободная кислота представляет собой бесцветную мало
устойчивую жидкость, обладающую острым запахом. Ее темп. пл. 5°,
темп. кип. 85°. Она растворима в воде и спирте, причем в водных 'рас-
творах она является примерно такой же сильной кислотой, как и соля-
ная; в разбавленных растворах она почти полностью ионизирована. Ввод-
ном растворе она более устойчива, чем в безводном состоянии. Соли ее—
роданиды значительно более стойки, чем сама кислота. Продуктами раз-
ложения концентрированной роданистоводородной кислоты являются
цианистоводородная и желтая пертиоцианистоводородная Hs(CNS)sS
кислоты.
Растворимость роданидов. Большинство роданидов растворимо в воде;
не растворимы: роданистые серебро, ртуть, медь и золото. Роданистый
свинец трудно растворим в воде и разлагается при кипячении с послед-
ней.
Реакции мокрым путем
1. Разбавленная серная кислота (2N) не реагирует.
2. Умеренно концентрированная серная кислота (14.W) разла-
гает роданистые металлы с выделением сероокиси углерода,
горящей синим пламенем:
KCNS 4- 2HcS0t + H2O4.KHSO4 4- (NH«)HSOj, 4- CQS,
375
3. Концентрированная серная кислота энергично разлагает ро-
даниды с выделением резко пахнущих паров (COS, HCOOH, CS2,
СО2, SO2) и серы.
Роданистые щелочные металлы в присутствии бикарбоната
натрия не разлагаются углекислотой ни на холоду, ни при кипя-
чении (отличие от цианидов).
4. Азотнокислое серебро осаждает белое творожистое рода-
нистое серебро:
CNS' + Ag’ AgCNS,
не растворимое в разбавленной азотной кислоте и растворимое
в аммиаке.
5. Соли окиси железа образуют неионизирующее кроваво-
красное родановое железо:
3CNS' + Fe’ ’ ’ Fe(CNS)3,
хорошо растворимое в эфире (стр. 238).
Эта реакция не удается в присутствии щавелевой, винной и других
органических оксикислот, а также фосфорной и железистосинеродистово-
дородной кислот и иодидов. Все эти вещества, за исключением последнего,
образуют комплексные соединения с Fe’’’, которые мешают образованию
Fe(CNS)s. Йодиды метают реакции, потому что иод-ион окисляется ионом
трехвалентного железа в свободный иод, который окрашивает водный рас-
твор в красный цвет.
6. Нитрат ртути(2) осаждает белую родановую ртуть:
Hg’ ’ -f-2CNS'-> Hg(CNS)2,
трудно растворимую в воде, но легко — в избытке роданистого
калия:
Hg(CNS)2 + CNS' = [Hg(CNS)3]'.
При прокаливании сухой соли K[Hg(CNS)3] происходит силь-
ное (вспучивание ее (фараоновы змеи).
7. Хлорная ртуть выделяет осадок ’только после долгого
стояния.
8. Нитрат ртути(1) дает серый или черный осадок. Если
к умеренно концентрированному раствору роданистого калия
прибавлять по каплям азотнокислой соли одновалентной ртути,
то образуется серый осадок металлической ртути, а раствор
содержит калиевую соль ртутнороданистоводородной кислоты:
Hg2” +3CNS'-» [Hg11 (CNS)3]' + Hg.
Продолжая прибавлять азотнокислую соль одновалентной
ртути до тех пор, пока не прекратится выделение ртути, и затем
профильтровав раствор1, получают в фильтрате ртутно-родани-
стый калий. Если к раствору этого соединения прибавить еще
азотнокислой соли одновалентной ртути, то образуется родани-
стая ртуть совершенно белого цвета:
2[Hg(CNS)s]' .4- 3Hg2’ ’ -> 2Hg’ ’ + 3Hg2(CNS)2.
376
Белый осадок роданистой ртути удается получить непосред-
ственно, если к очень разбавленному раствору азотнокислой
соли закиси ртути приливать столь же разбавленный раствор
роданистого калия:
Hg/ ‘ + 2CNS' ->Hg2(CNS)2.
9. Соли окиси меди. Несколько капель сернокислой меди,
прибавленных к раствору роданида, вызывают изумрудное окра-
шивание, переходящее в черное (образование родановой меди)
от дальнейшего прибавления сернокислой меди. Прилив серни-
стую кислоту или сульфат гидроксиламина, получают белый оса-
док роданистой меди:
2Cu-' + SO3" 4- 2CNS' 4- Н-0 Cu2(CNS)2 4- 2Н' 4- SO/,
не растворимой в разбавленной соляной и серной кислотах.
10. Кобальтовые соли. Если раствор, содержащий роданиды,
взболтать в присутствии небольшого количества кобальтовой
соли со смесью равных объемов амилового спирта и эфира,
то плавающий на поверхности эфирно-спиртовый слой окра-
шивается в лазуревосиний цвет (стр. 269).
Эта реакция аналогична с такой же реакцией на циановую
кислоту (стр. 398).
11. Азотная кислота, даже разбавленная, разлагает рода-
ниды, причем образуются окись азота, двуокись углерода и сер-
ная кислота:
3CNS' 4- ЮН' 4- 13NO3' -» 16NO 4- ЗСО2 4- 3SO/ 4- 5НгО.
12. Цинк, прибавленный к кислому раствору роданида, вызы-
вает образование сернистого водорода:
Zn 4- CNS' 4- ЗН’ -» Zn' • 4- H2S 4- HCN.
13. Азид натрия NaNs и иод реагируют в присутствии раство-
римых и нерастворимых роданидов с выделением азота.
Реакция 2NaNs 4- J2 -* 2NaJ 4- 3№ в отсутствие катализатора
протекает либо крайне медленно, либо совсем не происходит.
Роданиды катализируют эту реакцию.
Смешивают на капельной пластинке каплю исследуемого раствора
с каплей раствора азида натрия (3 г азида натрия растворяют в 100 Мл
O,1N раствора иода). Выделение азота происходит уже при 1,5 T KCNS.
Эта реакция потому заслуживает внимания, что она в противополож-
ность реакции с хлорным железом может производиться в присутствии
иодидов. Однако последние тормозят реакцию и при большом количестве
их следует перед прибавлением раствора азида добавить каплю хлорной
ртути, дающей комплексный ион [HgJyJ". Сульфиды и тиосульфаты также
катализируют иодазидную реакцию, но их мешающее действие может
быть устранено хлорной ртутью, с которой они образуют осадок сернистой
ртути. Осадок отделяют фильтрованием и в фильтрате открывают роданид.
Отношение роданидов к прокаливанию
Роданистые щелочные металлы легко плавятся и окраши-
ваются сначала в желтый, бурый, затем зеленый и, наконец,
в синий цвет, который при охлаждении снова переходит в белый.
377
Роданистые соли тяжелых металлов разлагаются с отщепле-
нием сернистого углерода, дициана и азота и образованием сер-
нистого металла; так, например, роданистая медь разлагается
согласно уравнению:
4Cu,(CNS)2 — 4Cu2S 2CSa + 3(CN)2 + N2.
Роданистая и родановая ртуть при прокаливании сильно,
вспучиваются (фараоновы змеи).
Специальные методы анализа роданидов
Открытие роданидов в присутствии галоидов и цианидов
Сперва необходимо удалить циан, для чего прибавляют немного бикар-
боната натрия и при температуре кипения; пропускают СОа до тех пор1,
пока выделяющийся газ не будет больше давать мути с подкисленным
раствором азотнокислого серебра. В растворе, освобожденном от циани-
дов, в случае отсутствия иодидов открывают роданиды, подкисляя раствор
соляной кислотой и прибавляя несколько капель хлорного железа. Кро-
вавокрасное окрашивание служит признаком присутствия роданидов. Если
же анализируемый раствор содержит иодиды, только что описанный метод
не приемлем, так как иодиды при прибавлении хлорного железа выделяют
иод. В этом случае раствор, освобожденный от цианидов, подкисляют азот-
ной кнелотои и прибавляют избыток азотнокислого серебра;, отчего гало-
иды и роданиды выпадают .в виде серебряных солей. Жидкость сливают
с осадка, последний промывают 2—3 раза, декантируя водой, прибавляют
аммиак, сильно взбалтывают и фильтруют. При этом в раствор переходят
AgCl, АцВг п AgCNS, медистое же серебро остается перастворенным.
К фильтр,ai.v приливают бесцветный сернистый аммоний, сильно взбалты-
вают и отфильтровывают сернистое серебро. К фильтра iу прибавляют не-
сколько капель раствора соды, выпаривают до небольшого объема, под-
кисляют соляной кислотой и проводят реакцию на роданиды, как выше
указано, с FeClj.
* Примечание редактора. Еще проще применить в рассматриваемом
случае подазидную реакцию, приведенную выше. * А. К.
Открытие галоидов в присутствии роданидов
Метод Фольгарда
К исследуемому азотнокислому раствору приливают избыток раствора
азотнокислого серебра и отфильтровывают досуха под вакуумом; осадок
переносят в фарфоровую чашку и нагревают с концентрированной азотной
кислотой на водяной бане в течение 45 мин. При этом происходит полное
разложение роданидов:
6AgCNS + 4НаО + 16HNOs -> 3AgsSC>4 + 3(NH4)jSC>4 + 6СО2 + 16NO;
галоидосеребряные же соли остаются без заметного изменения. После раз-
бавления водой их отфильтровывают и промывают несколько раз горячей
водой. Осадок восстанавливают цинком н разбавленной серной кислотой
(стр. 120), фильтруют и фильтрат исследуют по стр 357.
Более быстрым оказывается следующий метод. Промытые серебряные
соли напревают до кипения с серной кислотой (1 :1) до тех пор, пока оса-
док не почернеет и не соберется в комок; при этом разрушается только
роданид серебра;
2AgCNS ф 2H;SO< + ЗН2О -» 2NH4HSO4 + COS + СО2 + Ag.S.
Разбавив затем распюр водой, отфильтровывают гатоидные соли серебра
вместе с сернистым серебром, промывают водой, восстанавливают цинком и
378
серной кислотой, фильтруют, разбавляют фильтрат водой и кипятят до
удаления сероводорода, а затем подвергают его исследованию на присут-
ствие галоидов (сip. 357).
Примечание. Разложение роданистого серебра следует всегда про-
изводить перед восстановлением цинком и серной кислотой, потому что
в противном случае образовалась бы цианистоводородная кислота1:
2AgCNS б- 3Zn ж 6Н' -> 2Ag + 2НС.Х ф 21ФЗ ф 3Zn‘
Испытание продажных щелочных роданидов на содержание
хлора
[по Манну (С. Mann)] * * * 8
Так как в данном случае может быть речь только о малом количестве
хлора, то для исследования приводится брать большое количество ве-
щества. Растворяют около1 5 г роданида в 20 ял воды и прибавляют
к этому раствору 20 г кристаллической сернокислой меди, растворенной
в 100 ял воды. Образуемся черный осадок родановой меди:
Си' ‘ + 2CNS'-> Cu(CN'S)2.
В раствор пропускают сероводород до тек пор, пока осадок не станет
почти белым:
2Cu(CNS),. ф HS -»Cur(CNS)- ---S 4 2HC.XS.
Далее, как только синяя жидкость над осадком начинает буреть, преры-
вают ток сероводорода и дают распюру постоять несколько часов. При
этом роданистово.тородная кисло!а, образовавшаяся в результате выше-
приведенной реакции, также выпадает в виде одноридапистой .меди по
уравнению:
2Cu(CNS)2 + 2CuS-> 2Cu-4C.NS)1 + 2S.
Фильтруют я в фи.’нлр.'ие открывают хлор-ион азотнокислым серебром.
Примечание. Таким же хорошим является следующий метод.
К раствору роданида прибавляют избыток раствора медного купороса,
а затем до тех пор пропускают сернистый газ, пока осадок не станет
совершенно белым, после чего дают несколько часов постоять. Отфиль-
тровав роданистую медь, прибавляют к фильтрату азотную кислоту для
окисления избытка сернистой кислош и производят реакцию на СГ по-
средством нитрата серебра.
Взамен сернистой кислоты для восстановления медных солей может
быть взят сульфат гидроксиламина.
Открытие ферри- и ферроцианидов в присутствии .роданидов
[по Браунингу (Р. Е. Browning) и Паль.меру (Н. Е. Palmer)] *
Разбавленный раствор щелочных солей этих кислот слабо подкисляют
уксусной или соляной кислотой и прибавляют раствор1 азотнокислого то-
рия, причем выпадает н .мелко раздробленном состоянии ферроцианид то-
рия. Так как эта соль плохо фильтруется, раствор взбалтывают с мелкими
волокнами асбеста, после чего фильтруют и промывают холодной водой.
Если осадок облить разсаьленпым раствором едкого натра, то фильтрат,
1 По А. Гофма>пу [A. Hofmann, В. 1, 79 (1SGS)] свободная родависто-
водородная кислота при восстановлении пинком в кислой среде дает тио-
формальдегид, метиламин, аммиак ц сероьод<.цюл
8 Z. analyt. Chem. 28, 668 (1889).
> Z. anorg. Chem. 54, 313 (19U<)#
379
подкисленный соляной кислотой, по прибавлении хлорного железа дает в
присутствии железистосинеродистоводородной кислоты осадок берлинской
лазури.
К фильтрату от ферроцианида тория прибавляют сернокислый кадмий,
взбалтывают раствор с мелкими волокнами асбеста, отфильтровывают
феррицианид кадмия, промывают водой и растворяют его на фильтре
в растворе едкого натра. Фильтрат подкисляют соляной кислотой и при-
бавляют сернокислую соль закиси железа. Появление осадка турнбулевой
сини указывает на присутствие железосинеродистоводородной кислоты.
Фильтрат от феррицианида кадмия дает но прибавлении хлорного же-
леза в случае присутствия роданистоводородиой кислоты кровавокрасное
окрашивание роданового железа.
* Примечание редактора. Открытие железистосинеродистой и роданисто-
водородной кислот при совместном их присутствии реакциями образования
берлинской лазури и роданового железа невозможно, если реакцию выпол-
нять обычным путем в пробирке Если же реакцию проводить на фильтро-
вальной бумаге, возможно одновременное их открытие. Для этого на бу-
магу, пропитанную раствором хлорного железа и затем высушенную, на-
носят каплю кислого испытуемого раствора. Ферроциан-ион тотчас реагирует
с FeCh, на бумаге образуется синее пятно или кольцо, окаймленное крас-
ным кольцом роданового железа. Таким путем возможно открытие
[Fe(CN)e]'"-HOHa в присутствии 2000-кратного количества CNS'. При еще
больших количествах роданида и очень малых количествах ферроциан-иона
на бумаге может появиться только красное пятно роданового железа. Если
это пятно смочить раствором хлорной ртути или тиосульфата натрия, то
оно исчезнет, и при наличии ферроциан-иона обнаружится синее пятно или
кольцо берлинской лазури (см. G u t z е i t, Helv. Chiiu. Acta,, 12, 829, 1929,
а также Файгль, Капельный анализ, стр. 359)* А. К.
Кобальтосинеродистоводородная кислота Н3 [Co(CN)J
Получение. Кобальтосинеродистоводородную кислоту в свободном со-
стоянии можно получить путем пропускания сероводорода в водную сус-
пензию свинцовой или медной соли этой кислоты; ионы свинца или меди
превращаются при этом в менее растворимые сульфиды. Отфильтровав
сульфид, получают водный раствор кобальтосинеродистоводородной кис-
лоты, которая при выпаривании выделяется в твердом виде.
Свободная кислота может быть также получена при действии на ка-
лиевую соль ее азотной кислоты. Выпарив раствор на водяной бане,
экстрагируют кислоту спиртом. После испарения спирта остаются игольча-
тые расплывающиеся на воздухе кристаллы состава Hs[Co(CN)e],
Свойства. Кобальтосинеродистоводородная кислота чрезвычайно устой-
чива: она не разлагается при кипячении с концентрированной соляной или
азотной кислотой, при действии хлора, при кипячении с HgO; только пу-
тем выпариваия с концентрированной серной кислотой она разлагается
с выделением окиси и двуокиси углерода:
2Hs[Co(CN)e] + 8H2SO4 + 13Н2О-> 2CoSOi ф 6(NHi)2SO4 ф 11СО ф СОг.
Течение этой реакции можно разбить на следующие стадии: сначала
комплекс разлагается серной кислотой на ион трехвалентного кобальта и
синильную кислоту. Так как ион трехвалентного кобальта — сильный оки-
слитель, то он тотчас окисляет часть синильной кислоты до циановой
кислоты, превращаясь в ион двухвалентного кобальта:
2(Co(CN)«]"' .+ ЮН’ ф НЮ -> 2Со’ ’ ф 11HCN ф HCNO.
Цианистоводородная и циановая кислоты подвергаются в сернокислом
растворе гидролизу:
HCN + Н- + Н2О -> NH<- .+ СО
HCNO±H‘ ±HiO -> NH<- ф СО»,
380
Растворимость. В воде растворимы соти щелочных, щелочноземельных
металлов, трехвалентного железа и других трехвалентных металлов. Боль-
шинство других солей двухвалентных и тяжелых металлов не растворимы
ни в воде, ни в кислотах.
Реакции мокрым путем
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота разлагает все соли кобальтосине-
родистоводородной гислоты с выделением СО и СОз и с образованием
безводного сульфата закиси кобальта яркосинего цвета.
3. Азот"окислое серебро образует белый осадок, не раство(римый в
азотной кислоте, растворимый в аммиаке.
4. Уксуснокислый свинец не дает осадка.
5. Азотнокислый кобальт дает розово-красный осадок, не растворимый
в азотной кислоте, растворимый в аммиаке.
6. Сернокислый иикель образует синий осадок, не растворимый в азот-
ной кислоте, растворимый в аммиаке.
7. Сернокислая медь выделяет бледносиний осадок, не растворимый в
азотной кислоте, растворимый в аммиаке с синим окрашиванием.
8. Сульфаты кадмия и цинка дают белые осадки, не растворимые
а азотной кислоте, растворимые в аммиаке.
9. Сернокислая соль закиси железа образует белый осадок, не раство-
римый в азотной кислоте.
10. Хлорное железо не дает осадка.
11. Хлорная ртуть не дает осадка.
12. Азотнокислая ртуть(2) выделяет объемистый белый осадок, не
растворимый в азотной кислоте.
13. Азотнокислый торий не дает никакого осадка.
Реакции сухим путем
Все соли кобальтосинеродистоводородной кислоты’ разла-
гаются при прокаливании, после чего остаются цианид и карбид
кобальта. Щелочные и щелочноземельные соли окрашивают перл
буры в окислительном и восстановительном пламени в синий
цвет.
Группа II
Азотнокислое серебро дает растворимый в азотной кислоте
осадок.
Хлористый барий осадка не образует.
Азотистая кислота HNO,
Нахождение в природе. Азотистая кислота встречается только в виде
своих солей, нитритов >. .В виде нитрита аммония ее находят в воздухе,
а также во многих почвах и водах, особенно в таких, которые загрязнены
аммиаком и гниющими органическими веществами.
Аммиак окисляется при участии микроорганизмов (Monas nitrificans)
в азотистую кислоту, которая с избытком аммиака образует нитрит
аммония.
1 Свободная азотистая кислота образуется в виде следов во время
грозовых разрядов из азота и кислорода воздуха. Ред.
381
Получение и свойства азотистой кислоты и се солей. Азотистая кислота
образуется при осторожном восстановлении азотной кислоты. При кратко-
временном взаимодействии цинка с разбавленной азотной кислотой послед-
няя восстанавливается в азотистую кислоту:
Zn + ЗНХОз -> Zn(NO.i)« +, UNO» + HsO,
но восстановление легко может пойти дальше до образования NO, N:O, Ns
и, наконец, до NHsOH или даже до аммиака.
При (нагревании азотной кислоты (плотность 1,3) с мышьяковистой
кислотой, крахмалом и т. п. получается смесь окиси и двуокиси азота,
которая при охлаждении до —21° сгущается в синевато-зеленую жидкость
\40з, ангидрид азотистой кислоты. Действуя на ангидрид ледяной водой,
получают синеватю-зеленую жидкость, содержащую азотистую кислоту,
обычно в смеси с азотной кислотой, потому что NsOs соединяется с водой,
образуя азотистую и азотную кислоты и окись азота:
2NsOs + HsO -> HNOs + HNOs + 2NO.
При более высокой температуре азотистая кислота постепенно перехо-
дит в азотную:
3HNOs-> HNOs + 2NO + II:O.
Таким образом чистая азотистая кислота неизвеста. В водных раство-
рах она является кислотой средней силы, константа ионизации которой
0,45-1 (г3; в 0,1?/ растворе она приблизительно в 20 раз более ионизиро-
вана по сравнению с уксусной кислотой.
Если пропустить в концен(рпрованную серную кислоту смесь окиси
и двуокиси азота, то оба газа легко поглощаются ею с образованием ни-
трозилсерной кислоты:
2’LSOi + NO NO: -> ПгО -I- 2H(NO)SO«.
Раствор иитрозилсерной кислоты в серной кислоте иногда называют
«нитрозой». Если раствор иитрозилсерной кислоты влить в холодную воду,
то образуются азотистая и серная кислоты:
Н(.\'0)30т + Н.О -> HNOs + H.-SOi.
Раствор иитрозилсерной кислоты может сохраняться неограниченно
долгое время' и поэтому является удобным реактивюм для непосредствен-
ного получения азотистой кислоты, как только s этом появляется необ-
ходимость.
Соли азотистой кислоты, нитриты, значительно более устойчивы, чем
свободная кислота; они могут быть получены ну гем прокаливания нитратов:
2NaNOs -» 2NaNOs -j-Os.
Нитриты, полученные таким путем, всегда содержат некоторое коли-
чество окиси и нитрата г. ’виде примесей 5 Для получения Hiictoro нитрита
обрабатывают нитрит серебра вычисленным количеством хлорида какого-
либо щелочного металла:
AgNOs + NaCl -> AgCl + NaNOi-
Растворимый нигрит о (деляют от нерастворимого хлорида сереора
фильтр рванием.
Растворимость нитритов, О я исключенном (рудпо растворимого нитрита
серебра все нитриты рас торимы в воде.
‘Если нитрат нагреть с каким-либо мега г том, например со свинцом,
то восстановление протекает почти количественно при более низкой темпе-
ратуре.
382
Реакции мокрым путем
Так как все нитриты растворимы в воде, то дня открытия азотистой
кислоты больше приходи ich пользоваться цветными реакциями, основан-
ными на окислении или восстановлении, чем реакциями осаждения.
Азотистая кислота является иногда окислителем, а иногда восстано-
вителем.
1. Разбавленная серная кислота разлагает все нитриты на хо-
лоду с выделением бурых паров:
NaNOe + H2SO4 NaHSCh + HNO_>;
3HNO2 -> НХОз + 2NO + Н >0;
2X0 - О2 2.ХО2
(но йух) (бурый I а <)
2. Концентрированная серная кислота реагирует точно так же,
как и разбавленная, но только более энергично.
3. Азотнокислое серебро осаждает из растворов нитритов
азотистокислое серебро в виде тонких кристаллических игл,
трудно растворимых в холодной воде (300 ч. воды растворяют
при обыкновенной температуре 1 ч. азотистокислого серебра;.
В кипящей воде азотистокислое серебро значительно легче рас-
творяется.
4. Кобальтовые соли образуют с избытком азотистокалиевой
соли в присутствии уксусной кислоты желтый кристаллический
осадок азотистокобальтовокалиев1ой соли (стр. 269).
5. Индиговый раствор при нагревании обесцвечивается азоти-
стой кислотой (нитрит и минеральная кислота), причем индиго
окисляется в изатин.
6. Алюминий в присутствии едкого натра восстанавливает
растворы нитритов до аммиака. Аналогично реагируют и ни-
траты:
NO2' + 2А1 у- ОН' 4- НгО-> 2А1О2' + NH3.
7. Хлористый аммоний, прибавленный к кипящему раствору
нитрита в разбавленной уксусной кислоте, вызывает выделение
азота:
NHi’ -J-NOa'-*- 2НгО-J-N2.
8. Бруцин, растворенный в концентрированной серной кис-
лоте, не дает, по исследованиям Г. Лунте и А. Львова ника-
кого окрашивания с нитрозилсерной кислотой.
Сухое перекристаллизованное азотистокислое серебро с 70,05% серебра
(по теории 70,09) давало с бруцином (см. Азотная кислота) в атмосфере
угольной кислоты слабую, но все-таки заметную реакцию на азотную кис-
лоту (красное окрашивание), потому что азотистокислое серебро содер-
жало все-таки еще измеримые следы азотнокислого серебра. Но когда
15 лг того же азотистокислого серебра были растворены в воде
И затем, по прибавлении эквивалентного количества NaCl, раствор был
разбавлен до 1 л, то получился раствор азотистокислого натрия, 1 лд
которого, прибавленный по каплям при постоянном помешивании к 4 лл
1 Z. angew. Chem. 7, 245 (1894).
383
концентрированной серной кислоты, давал нитрозу, ие показывающую
с каплей раствора бруцина и следов красного окрашивания. Но стоило
только к такому раствору прибавить ничтожнейшее количество азотной
кислоты, чтобы тотчас появлялось красное окрашивание жидкости. Поэтому
бруцин представляет собой реактив на, азотную кислоту в присутствии
азотистой кислоты.
9. Дифениламин, растворенный в концентрированной серной
кислоте, окрашивается азотистой кислотой в интенсивно синий
цвет. То'чно так же реагирует азотная кислота и многие другие
окислители, как селеновая и хлорноватая кислоты, хлорное же-
лезо и др. (см. Азотная кислота).
10. Соли закиси железа восстанавливают нитриты в слабо-
кислом растворе до окиси азота:
Fe’ ’ + NO2' + 2Н’ -> Fe’ ‘ • + НгО + NO;
последняя с избытком реактива дает интенсивно окрашенные
в бурые цвета продукты присоединения (FeSOj)x(NO)y \ хара-
ктерные для открытия азотистой кислоты.
Для выполнения этой реакции к слабо подкисленному концентрирован-
ному раствору сульфата двухвалентного железа осторожно приливают (по
стенке пробирки) испытуемый раствор нитрита так, чтобы жидкости не
смешивались; в месте соприкосновения обеих жидкостей появляется темно-
бурое окрашивание.
Азотная кислота дает эту реакцию лишь по прибавлении концентри-
рованной серной кислоты; для реакции же на нитриты достаточна уже
концентрация Н’-ноною, создаваемая лимонной или уксусной кислотой.
И. Иодистоводородная кислота окисляется азотистой кисло-
той с выделением иода:
2J' + 4Н- + 2NOa' -> 2НЮ + 2NO + J2.
Поэтому подкисленный серной или уксусной кислотой рас-
твор йодистого калия при прибавлении к нему раствора нитрита
окрашивается в желтый цвет вследствие выделения иода. При
взбалтывании такого раствора с хлороформом или сернистым
углеродом последние окрашиваются в красно-фиолетовый цвет.
Выделившийся иод может быть также узнан по синему окраши-
ванию крахмального клейстера.
Как показывает вышеприведенное уравнение, для этой реак-
ции необходимы водородные ионы. Уксусная кислота в присут-
ствии большого количества ацетата натрия не выделяет иода из
иодида;. прибавление же нескольких капель сильной минераль-
ной кислоты вызывает немедленное выделение иода, что является
прекрасной иллюстрацией ..акона действия масс (стр. 12) и дей-
ствия общего иона (стр. 63).
Эту чрезвычайно чувствительную реакцию дает также боль-
шое число других окислителей, и поэтому ею можно пользо-
ваться лишь в том случае, когда известно, что все другие окис-
ляющие вещества отсутствуют.
1 При этол образуется комплексная соль, катион которой—[Fe(NO):.>] ’ ’,
Ред.
384
Так как соли окиси железа также выделяют иод из иодидов
(стр. 53), то очевидно, что вышеприведенная реакция не может,
служить для открытия азотистой кислоты в присутствии солей
окиси железа. Однако если к исследуемому раствору прибавить
большой избыток фосфата натрия вместе с небольшим количе-
ством иодида калия и серной кислоты, то иод не будет выде-
ляться солями окиси железа и в этих условиях возможно от-
крытие даже следов азотистой кислоты. Ионы трехвалентного
железа превращаются в весьма мало ионизированный кислый
фосфат железа; обусловленная последним концентрация ионов
трехвалентного железа в растворе столь мала, что взаимодей-
ствие* их с ионами иода практически становится незаметным.
Так, Артман (Artmann) ’, предложивший эту реакцию для от-
крытия нитрита в воде, содержащей соли окиси железа, реко-
мендует прибавлять к 100 ли исследуемой воды 8 г NaaHPO-i •
• 12НгО, 0,2 г KJ, 5 мл 4N H2SO4 и немного крахмального рас-
твора. Уже при наличии 0,3 мг N2O3 тотчас появляется интен-
сивно синее окрашивание.
12. Реактив Грисса2. Для открытия малых количеств азотистой кис-
лоты, какие могут встречаться, например, в питьевых водах, из всех выше-
приведенных реакций достаточной для этого чувствительностью отли-
чается только реакция с иодидом калия* и крахмалом!. Но так как в иссле-
дуемой воде могут находиться также перекись водорода и соли трехваь
лентного железа, каждая из которых выделяет иод из кислого раствора
иодида калия, то очевидно, что пользование одной только этой реакцией
часто приводило бы к ошибкам.
Поэтому, чтобы открыть следы азотистой кислоты, пользуются реак-
цией, впервые предложенной Гриссом, которая является специфичной
только для одной азотистой кислоты. Она основывается на образовании
Интенсивно окрашенного азокрасителя.
Грисс пользовался в качестве реактива фенилендиамином, который при
реакции с азотистой кислотой превращался в желтый краситель бисмарк-
браун. Вместо этого реактива в настоящее время применяют по предложе-
нию Илосвай-Илосва3 уксуснокислый раствор сульфаниловой кислоты и
а-нафтиламина. По Лунге 4 лучше всего пользоваться смесью растворов
обоих последних реактивов.
Реактив приготовляют следующим образом: 1) растворяют 0,5 г сульф-
аниловой кислоты в 150 мл разбавленной уксусной кислоты; 2) кипятят
0,2 г а-нафтиламина в 20 мл воды и к бесцветному раствору, слитому
с сине-фиолетового осадка, прибавляют 150 мл разбавленной уксусной
кислоты и затем смешивают с первым раствором.
По Реклебену (Reckleben), Локкеману (Lockemann) и Экхардту
(Eckardt)5 реактив под влиянием света окрашивается в красноватый цвет
и уже более не обесцвечивается цинковой пылью. При хранении же раствор!
в темноте, даже в не совсем наполненных склянках, раствор остается
совершенно прозрачным и бесцветным в течение целого ряда месяцев.
Выполнение. К 50 мл испытуемой воды приливают 2 лл вышеописан-
ного реактива, перемешивают и дают постоять 5—10 мин. Малейшие следы
азотистой кислоты вызывают окрашивание жидкости в красный цвет.
25
1 Chem.-Ztg. 37. 501 (1913).
2 В. 12, 427 (1879).
3 II os vay V. 1 1 о s v a, Bull. chim. [3] 2, 317 (1889).
’Lunge, Z. angew. Chem. 2, 666 (1889),
5 Z. anal. Chem. 46, 684 (1907).
3ur. S52.
Тредвелл-Голл, т. I.
385
13. Марганцовокислый калий. Кислый, теплый (около 40е)
раствор марганцовокислого калия обесцвечивается азотистой
кислотой, ппп-ге'м последняя окисляется в азотную кислоту:
2МпО/.+ 5NO2' + 61-Г -> 5ЫОз' + 2Мп’' + ЗН2О.
В этой реакции азотистая кислота ведет себя как восстано-
витель,
14. Резорцин СбН1(ОН)2 дает возможность открывать неболь-
шие количества азотистой кислоты, растворенной в концентри-
рованной серной кислоте. Эту реакцию проводят следующим
образом.
К 1 мл концентрированной серной кислоты прибавляют следы резор-
цина и разбавляют 5 м воды. В присутствии уже следов азотистой
кислоты получается желтая окраска.
15. Роданистый калий не реагирует с нейтральным или слабо-
кислым раствором нитрита, но по прибавлении крепкой мине-
ральной кислоты получается темнокрасное окрашивание, сход-
ное с окрашиванием, получающимся при действии хлорного же-
леза на роданистый калий. Оно обусловливается окислением по-
следнего азотистой кислотой. Прибавление спирта или легкое
кипячение разрушает окраску, вызываемую азотистой кислотой;
встряхивание с сернистым углеродом удаляет большую часть
окраски.
16. Сернистый водород выделяет с азотистой кислотой серу:
2NO2' 4- H2S 4- 2Н‘ -> 2NO 4- 2НгО 4- Si
Реакция проходит очень быстро в кислых растворах и очень
медленно в нейтральных.
17. Тиомочевина CS(NH->)2 реагирует с азотистой кислотой,
образуя роданистоводородную кислоту и выделяя азот:
HNO2 4- CS(NH-2)-2 -> \4 4- HCNS 4- 2НэО.
Этой реакцией лучше всего пользоваться в очень разбавлен-
ных уксуснокислых растворах, содержащих ацетат натрия. При-
сутствие азотистой кислоты узнается по выделяющемуся газу и
по красной окраске, которую дает образующаяся1 при реакции
роданистоводородная кислота с ионами трехвалентного железа.
18. Мочевина реагирует с азотистой кислотой, выделяя азот
и двуокись углерода:
CO(NH2)2 4- 21IXO2 -> 3H2O + СОг + 2Ns.
В этой реакции азот мочевины со своей отрицательной ва-
лентностью, равной трем, окисляется азотом азотистой кислоты,
который имеет такой же величины положительную валентность.
С мочевиной реагируют также и галоиды, но в щелочном рас-
творе, в кислом же растворе реакция с азотистой кислотой
является чувствительной и характерной.
19. Хлористый марганец в растворе концентрированной соля-
ной кислоты буреет под действием азотистой кислоты. Эта ре-
акция вообще указывает на 'присутствие окислителя.
3S6
Сернистоводородная кислота (сернистый водород) H2S
Нахождение в природе и получение. Сернистый водород находится
в вулканических областях, во многих минеральных .водах (так называемые
«серные» воды) и вообще всюду, где вещества', содержащие серу, подвер-
гаются гниению или приходят в соприкосновение с гниющими веществами.
Сульфаты легко превращаются в сульфиды благодаря деятельности микро-
организмов, находящихся в воздухе; вот почему многие минеральные ВОДЫ,
содержащие сульфаты, в закупоренных бутылках начинают спустя некото-
рое время пахнуть сероводородом. Однако если подвергнуть бутылку и
пробку предварительной стерилизации, вода сохраняется неограниченно
долгое время.
Образование сернистого водорода из сульфатов происходит стедующим
образом. Углеродсодержащие вещества (пыль и т. н.) восстанавливают
сульфат под действием микроорганизмов сначала в сульфид:
NasSO4 ф 2С -> 2СО> ф Na^S,
который затем разлагается угольной кислотой:
Na.-S + 2НгС()я-> 2NaHC().i -!- U.S.
Тот же процесс, какой приводит к образованию в закрытой бутылке
сернистого водорода из сульфата натрия под влиянием органического
вещества, происходит и и природе, вызывая образование сернистого водо-
рода ®о многих минеральных водах.
Для лабораторных целей сернистый водород получается действием
разбавленной серной или соляной кислоты на сульфид, обыкновенно серни-
стое железо FeS .вследствие его дешевизны и устойчивости; пирит FeSs
не реагирует с разбавленными минеральными кислотами.
Свойства. Сероводород представляет собой бесцветный, пахнущий гни-
лыми яйцами газ. Он заметно растворим в воде (1 объем воды растворяет
от 2 до 3 объемов сероводорода, при комнатной температуре). Насыщен-
ный раствор сероводорода (при 25°) приблизительно 0,1 молярен или 0,2V.
Растворимость его, как и всех газов, уменьшается с повышением темпера-
туры. Величина первой константы диссоциации:
1111^ = ^ = 0,57.10-';
и величина второй константы диссоциации HS'-> IP ф S";
Н1Ж1 = Кг = 1,2 • 10-ts.
В насыщенном растворе при 25° концентрация водородного иона равна,
приблизительно 0,9-10~4 молям в литре, а сульфидного иона достигает
лишь 1,2-JO-1’'. Поэтому согласно табл. 12 (стр. 76) насыщенный раствор
сероводорода должен иметь кислую реакцию по фенолфталеину, но не по
метилоранжу.
Раствор сернистого водорода становится мутным при стоянии на воз-
духе вследствие окисления кислородом .воздуха:
2ITS ф Ог -» 2НЮ + 2S.
На воздухе сероводород сгорает синеватым пламенем с образованием
воды и двуокиси серы:
2НгЙ ф 30г -> 2ITO ф 2SOs.
Сернистый водород может быть сгущен до твердого состояния с точ-
кой плавления при 83 ; температура кипения жидкого сероводо-
рода —60,2°.
Соли сернисгоно.тороднои кислоты называкыся сульфидами.
Растворимость сулыЬи.юв. Сульфиды щелочных ме i a. i.km, гидро- и
полисульфиды щелочных земель растворимы в иоде. Сульфиды щелочных
25*
387
земель, особенно сульфид кальция CaS, трудно растворимы в воде, но
постепенно они в соприкосновении с водой переходят в растворимые
гидросульфиды:
2CaS + 2НЮ -> Са(ОН)г + Ca(SH)2.
Остальные сульфиды в воде не растворимы. Из этих последних FeS,
MnS и ZnS разлагаются разбавленной соляной кислотой с выделением сер-
нистого водорода; другие требуют для растворения концентрированной
соляной кислоты, например SbaSs, SnSs, PbS, NiS, CoS. CdS; остальные не
растворимы в концентрированной соляной кислоте, но все растворимы
в царской водке с выделением серы.
* Примечание редактора. У многих сульфидов, например у сульфидов
железа и платиновых металлов, отмечаются явления старения, т е. раство-
римость осажденного сульфида уменьшается при стоянии вследствие про-
исходящего процесса полимеризации. Но для растворения трудно раство-
римых сульфидов нет необходимости прибегать к царской водке. Как было
показано мной в свое время, все трудно растворимые сульфиды раство-
ряются в разбавленных соляной и серной кислотах в присутствии перекиси
водорода. Сульфиды никеля и кобальта растворяются даже в уксусной
кислоте в присутствии 3%-ной перекиси водорода **. А. К.
Реакции мокрым путем
Свободный сернистый водород, как было выше указано, является очень
слабой кислотой (даже более слабой, чем угольная кислота). Растворимые
нейтральные соли RzS в растворе ионизируют на ионы металла и сульфид-
но под влиянием воды некоторое количество двухвалентных S''-ионов
превращается в одновалентные HS'-ионы:
НОН + S" HS' + ОН';
в растворе остается тем больше двухвалентных сульфидных ионов, чем
концентрированнее раствор.
Ввиду того что водный раствор сульфида содержит как S''-ионы, так
и HS'-ионы. между тем как свободная кислота содержит, главным обра-
зом. неионизированный HsS, во многих реакциях первый' реагирует
несколько отлично от последней-
1. Разбавленная серная кислота разлагает растворимые и не-
которые не растворимые в воде сульфиды с выделением серо-
водорода.
2. Концентрированная серная кислота разлагает при нагрева-
нии все сульфиды с выделением сернистого ангидрида и серы:.
’ Na->S + 2HsSOt -> Na->SOj %- 2Н->0 + SO? ф-S.
Но и сера при дальнейшем нагревании с серной кислотой
переходит в конце концов в сернистый ангидрид:
2H2SO4 + S-> 2НзО + 3SO2.
3. Азотнокислое серебро образует черный осадок сернистого
серебра:
2Ag’ ф- S"-> AgaS.
Сернистое серебро не растворяется в разбавленной азотной
кислоте на холоду, но растворяется в ней при кипячении.
1 Z, anal. Chem. 72, 293 (1927).
38S
4. Хлористый барий не дает никакого осадка.
5. Свинцовые соли (лучше всего раствор их, содержащий
избыток едкой щелочи) выделяют черный осадок сульфида
свинца.
Все сульфиды, разлагаемые соляной кислотой, выделяют сер-
нистый водород; если последний привести в соприкосновение
с кусочком фильтровальной бумаги, смоченной щелочным рас-
твором свинца, то наблюдается окрашивание ее в черный цвет.
Нерастворимые сульфиды (пирит, сернистый мышьяк, серная
ртуть и т. п.) выделяют сернистый водород при действии на них
соляной кислоты и олова или цинка.
Для исследования нерастворимого сульфида, например пирита, поме-
щают в пробирку немного тонких стружек олова, обливают их 6N соля-
ной кислотой и слегка нагревают. Над выделяющимися парами держат
кусок фильтровальной бумаги, смоченной щелочным раствором плумбита
натрия ’. Если при этом произойдет почернение бумаги, то само олово
.содержит небольшое количество сульфида и оно не может применяться
для особенно тонких реакций. Обычно наблюдаемое почернение с одним
оловом бывает настолько малым, что таким оловом в большинстве случаев
все же можно пользоваться. После этой предварительной пробы приба-
вляют исследуемое вещество с добавлением еще небольшого количества
олова. Следы сульфида вызовут почернение бумаги, пропитанной плумби-
том щелочного металла.
6. Нитропруссид натрия Na> [Fe(CN)s(NO)] • 2НаО окрашивается
в красновато-фиолетовый цвет ионами S", но не ионами HS'. По-
этому сам сернистый водород этой реакции не дает, если не
прибавить едкой щелочи. Эта реакция очень чувствительна, но
все же менее .предыдущей. Ею можно обнаружить 1 у суль-
фида натрия1 2. Образующееся соединение имеет формулу
Nai[Fe(CN)3NOS]; его можно рассматривать или как продукт
присоединения или же как соединение, содержащее комплексный
ион двухвалентного железа:
г z(CN)5
7. Металлическое серебро чернеет как от свободной сернисто-
водородной кислоты, так и от растворимых сульфидов (реакция
образования серной печени):
4Ag + 2HsS + О2 -> 2Н2О + 2Ag2S;
4Ag + 2Na2S + 2H2O -J- O2-> 4NaOH + 2Ag2S.
(ВОЗДУ1.)
В отсутствие кислорода или воды не происходит образования
сульфида. Серебряная пластинка, остававшаяся в течение 14 час.
в углекислой минеральной воде, содержавшей сероводород, была
1 К уксуснокислому свинцу прибавляют такой избыток раствора едкого
натра, чтобы в нем растворилась первоначально выпавшая гидроокись
свинца.
2 См. Файгль, Капельный анализ, стр. 369. сед,
389
совершенно чиста, и на ней нельзя было обнаружить и следов
побурения; напротив, последнее появлялось при кратковременном
пребывании пластинки на воздухе.
Совершенно сухой сернистый водород в присутствии сухого
же 'кислорода хотя и действует на серебро при обыкновенной
температуре, но крайне медленно; напротив, действие это про-
исходит моментально в присутствии малейших следов влаги.
Для открытия серы' в .нерастворимых сульфидах их сплавляют с не-
большим количеством едкого натра (на крышке фарфорового тигля) для
переведения в растворимый сульфид натрия:
NiS ф 2№аОН -> НзО + NiO + NajS.
При этом образуется некоторое количество сульфата, но водный рас-
твор полученного сплава .всегда содержит достаточное количество щелоч-
ного сульфида, чтобы дать положительную .реакцию.
8. Окисляющие вещества, как галоиды, азотная кислота, соли
хромовой и марганцовой кислот, соли окиси железа и многие
другие, окисляют сероводород с выделением серы.
9. Метиленовая синь. Эта реакция, предложенная Эмилем Фи-
шеоом (Emil Fischer), 1 принадлежит к самым чувствительным
реакциям на сероводород. Ею открываются следы сероводорода
в минеральных водах даже в тех случаях, когда остальные ре-
акции оказываются для этого .недействительными.
К исследуемой на сероводород жидкости прибавляют 0,1 ее объема
концентрированной соляной кислоты, щепотку (на кончике ножа) серно-
кислого диметилпарафенилендиамина 2 NH; Cr.fl, • УЦСНб? НгЗОъ переме-
шивают до растворения последнего и затем приливают 1—2 капли раз-
бавленного раствора хлорного железа.
В присутствии лишь 0,02 .ис/.г сероводорода можно ясно констатировать
синее окрашивание .после получасового стояния, между тем п<ак свинцовые
соли и нитропруссидный натрий не дают никакой реакции.
При слишком малом количестве соляной кислоты появляется красное
окрашивание жидкости, вызываемое димети.тпарафенилендиамино» в слабо-
кислом .растворе .по прибавлении хлорного железа. В 'присутствии боль-
шого количества соляной кислоты жидкость не окр опивается в красный
цвет.
Образование метиленовой сини может быть выражено сле-
дующим уравнением:
2[NH-> • СвНт • N(CH3)2 • НС1] 4- 6FVf’ + S"->
/СсНз— N (СН..'2
>S +6Fe,,4-NH44-4H’4-Cl'.
^CuH3<<-N(CH:.)2
Cl
* Добавление редактора. 10. Азид натрия и иод, как показали
наблюдения Ф. Рашига3, непосредственно не реагируют друг
1 В. 16, 2234 (18S3).
2 Эго соединение н.тишают также р-ампдодиметпланилином,
а R :i s с h i ц. В, 48, 2US3 (1919).
390
с другом; в присутствии же следов сульфида, тиосульфата или
роданида (соединения, содержащие двухвалентную серу) тотчас
протекает бурная реакция, сопровождающаяся выделением
элементарного азота и исчезновением иода:
2NaN3 + J2 -> 2NaJ ф- 3№.
Па этом принципе Файгль1 основал следующую реакцию на
сульфиды.
К капле испытуемой жидкости на часовом стекле прибавляют
каплю раствора иод-азида. Тотчас появляющиеся пузырьки газа
и обесцвечивание иода служат признаком присутствия сульфида.
Предельная концентрация 1 : 2 500 000.
В качестве реактива пользуются раствором 1 г азида натрия и
1 г иодида калия в 3 ды воды; к раствору прибавляют кристал-
лик иода.
Иод-язидная реакция дает возможность открывать сульфид-
ную серу не только в растворимых сульфидах, но и в нераство-
римых, например в HgS, и в сульфидных минералах и рудах.
Иод азидная ,реакция специфична только в отсутствие тио-
сульфатов и роданидов; в случае наличия последних в растворе
сульфид осаждают в виде CdS или ZnS и проводят реакцию
с полученным хорошо промытым осадком.А. К.
Отношение сульфидов к прокаливанию
Большинство сульфидов при накаливании без доступа воздуха
остается без изменений; сернистые мышьяк и ртуть возгоняются.
Многосернистые металлы (полисульфиды) выделяют серу, ко‘
торая 1возтоняется. Сернистые платина и золото отщепляют серу
и оставляют металл. Накаленные три доступе воздуха все суль-
фиды выделяют сернистый ангидрид, который легко распо-
знается по запал}’ горящей серы.
Открытие серы в неэлектролитах
Открытие серы .в неэлектролитах производится большею частью путем
Прокаливания вещества в тугоплавкой пробирке с металлическим натрием
(стр. 341) и испытания водной вытяжки сплава нитропруссидным натрием.
А<Можно также остаток от прокаливания подкислить разбавленной соляной
кислотой и выделяющийся при этом гав испытать на сероводород посред-
ством бумажки, пропитанной раствором свинцовой соли.
Весьма точен следующий- способ открытия серы,. Ее переводят в сер-
ную кислоту, ирисуы ладе которой консташруют затем хлористым барием
в кислом растворе. Наиболее надежный способ переведения серы в сер-
ную кислоту — это способ Кариуса, согласно которому вещество нагре-
вают с концентрированной азотной кислотой в запаянной трубке. Для
веществ же труднолетучих и содержащих ’мало серы, пригоден способ
сплавления их с перекисью натрия в никелевом тигле. Но так как это
окисление часто сопровождается взрывами, то перекись натрия применяют
ие в чистом виде, а в смеси с углекислым калием-пагрием, отчего сожже-
ние протекает не столь бурно, но во всяком случае доходит до конца.
1 файгль, Капельный анализ, стр. 309 и сл.
391
Смешивают 1 ч. исследуемого вещества (0,1—5 ?, смотря по содержанию
серы) с 10 ч. углекислого калия-натрия и 3 ч. перекиси натрия в никеле-
вом тигле, вставляют его в отверстие наклонно поставленного асбестового
картона1 и нагревают в течение 5—10 мин. После охлаждения сплав
выщелачивают водой, подкисляют соляной кислотой и испытывают хло-
ристым барием на серную кислоту.
* Примечание редактора. Быстро и просто производится открытие серы
в .неэлектролитах при помощи иод-азидной реакции. См. Файгль, Ка-
пельный анализ, стр. 428. * А. К.
Сера S. Ат. в. 32,06. Ат. н. 16
Плотность 1,92—2,07. Т. пл. 112,8—119,3°. Т. кип. 444,5°
Нахождение в природе. Сера в свободном состоянии .встречается в вул-
канических местностях в виде ромбических пирамид, а также вблизи сер-
ных источников как продукт окисления выделяющегося сероводорода.
Основные же количества ее встречаются в природе в связанной форме
в виде сульфатов и сульфидов. .
Получение и свойства. Подобно галоидам сера образуется при окисле-
нии ее водородного соединения:
2H2S + Оа -> 2НаО + 2S.
Сера получается также при прокаливании полисульфидов или сульфи-
дов благородных металлов (золота и платины).
Сера существует по меньшей мере в двух жидких формах — Sy
(вероятно Ss) и S у- (Se) и в трех твердых модификациях:
1. Ромбическая сера с т. inn. 112,8° получается при кристаллизации из
раствора при температуре ниже 95°. Плотность ее при 0° 2,06. Плавясь,
о.на переходит в ST. Ромбическая сера при температуре 96° переходит в
моноклиническую серу, устойчивую выше указанной температуры.
2. Моноклиническая сера с т. пл. 119,3° получается при кристаллизации
расплавленной серы при температуре немного ниже 120°. Плотность ее 1,96.
Плавясь, она переходит в Sy,
3. Аморфная сера получается при быстром охлаждении нагретой до
250° серы, которая -при этом становится вязкой, или три быстрЬ'М охла-
ждении образующейся .при еще более высокой температуре совсем жидкой
серы.
Оба кристаллические видоизменения серы легко растворяются в сер-
нистом углероде, причем при выпаривании раствора сера получается всегда
в виде октаздров. Аморфная сера не растворяется в сернистом углероде.
Находящийся в (продаже серный цвет состоит из кристаллической и
аморфной серы, и поэтому растворимость его в сернистом углероде не-
полная.
Если .расплавленную моноклиническую серу держать несколько часов
при температуре лишь на несколько, градусов ниже ее точки плавления
(119,3°) и затем .охладить, то она: затвердевает при 114,5°. Если нагревать
расплавленную серу, она превращается из 'подвижной желтого цвета жид-
кости в темнокрасную вязкую жидкость и достигает максимальной вязкости
приблизительно при 200°. При более высокой температуре текучесть жид-
кости 'Увеличивается, но цвет темнеет и становится почти черным. Если
при температуре, близкой к точке кипения <444,5°), вылить расплавленную
серу в холодную воду, получают мягкую, тягучую эластичную массу; напо-
минающую резину. В гечекие нескольких ч..сов она иречращается в обы-
кновенную ромбическую форму, .представляющую собой .устойчивое состоя-
ние серы при комнатной температуре.
1 Чтобы воспрепятствовать доступу к содержимому тигля пламени, мо-
гущего содержать сернистые соединения.
3S2
По своим химическим свойствам сера занимает промежуточное место
между кислородом <и селеном; все три элемента принадлежат к шестой
группе периодической системы. В своей низшей валентности сера, нахо-
дится в сернистом водороде (—2) и в высшей — в серной кислоте (+6).
На воздухе сера горит синим пламенем, образуя двуокись серы, а в при-
сутствии катализаторов (платина, окись железа или хрома)—трехокись
серы; поэтому в газах, выходящих из печей для обжига колчеданов,
всегда находится двуокись серы наряду с трехокисью.
Сера не растворима в воде, но растворима в едких щелочах с образо-
ванием тиосульфата и сульфида:
6NaOH ф 4S ЗНЮ ф Na^SeOa + 2Na:S.
При дальнейшем действии серы NasS превращается в NaaSa, N‘a»S; и
тому подобные полисульфиды.
Реакция совершенно аналогична образованию гипохлорита и хлорида
при действии хлора на холодный разбавленный раствор едкой щелочи:
2.\аОН ф С12 -> NaOCl ф NaCl ф НгО.
Сера растворяется при нагревании с сернистой щелочью, образуя поли-
сульфиды:
NttS +S-> NasSs;
Nai^> ф 4S -N82)33.
Сера также растворима в сульфитах щелочных металлов с образова-
нием тиосульфата:
Nai’SOs ф S -> NasSiOa.
Горячая концентрированная азотная кислота, бром и соляная кислота,
царская водка, а также смесь хлората калия и соляной кислоты посте-
пенно действуют на серу, превращая ее в серную кислоту.
В виде солей известны следующие четырнадцать кислот, со-
держащих серу. Кислоты, обозначенные звездочкой, неустой-
чивы и разлагаются при выделении их в свободном состоянии
из солей действием минеральной кислоты:
Сернистоводородная кислота (сернистый водород) H2S
Сульфоксиловая кислота * H2SO2
Гидросернистая кислота* H2S2O4
Сернистая кислота H2SO3
Серная кислота H2SO4
Пиросерная кислота H2S2O7
Мононадсерная кислота (кислота Каро) H2SO5
Надсерная кислота * H2S2O8
Тиосерная (серноватистая) кислота * H2S2O3
Дитионовая кислота H2S2O6
Тритионовая кислота H2S3O6
Тетратионовая кислота H2S4O6
Гексатионовая кислота * H’SeOe
Селенистоводородная и теллуристоводородная
кислоты
Ввиду малого практического значения указанные кислоты нами не
рассма гриваются.
Уксусная кислота СН3СООН
Нахождение в природе. Уксусная кислота находится в некоторых
растительных соках частью в свободном состоянии, частью в виде калие-
вой или кальциевой соли.
Получение. Она образуется при сухой перегонке дерева и при окис-
лении этилового спирта.
Свойства. Безводная уксусная кислота (называемая также ледяной
уксусной кислотой) затвердевает при температуре ниже +16,6°, образуя
бесцветные блестящие пластинки. Кислота обладает острым запахом;
она смешивается во всех отношениях с водой, спиртом и эфиром. Темп,
кип. 118°.
Уксусная кислота представляет собой слабую одноосновную кислоту;
ксистаита диссоциации ее при 18° равна 1,8 • 10~г'; щелочные соли ее,
называемые ацетатами, показывают по фенолфталеину щелочную реак-
цию. Ацетаты большею частью растворимы в воде. Трудно растворима
серебряная соль.
Важнейшими продажными солями являются уксуснокислые натрий и
свинец [свинцовый сахар РЬ(СНзСОО)з • ЗНзО].
Нейтральный уксуснокислый свинец растворяет окись свинца, образуя
основные если:
рь(сн3соо)^ т рьо + ню гснзсоо — рь — е.>н;
СНзСОО — РЬ — О ч
РЬ(СJ Р.СОО)’ + 2РЬО >РЬ
СНзСОО — РЬ — 0х
Угольная кислота осаждает углекислый свинец из растворов основ-
ных и средних уксуснокислых солей. Поэтому при растворении этих
солей в дестиллирюванной воде почти всегда получаются мутные рас-
творы, так как дестиллированная вода очень часто содержит углекислоту.
Но если к мутному раствору прибавить несколько капель уксусной кис-
лоты, осадок тотчас растворяется и раствор становится прозрачным.
Реакции, мокрым путем
Для реакции следует употреблять раствор уксуснокислого натрия.
1. Разбавленная серная кислота выделяет уксусную кислоту
из ее солей; цтри этом легко летучая уксусная кислота узнается
по запаху.
2. Концентрированная серная кислота также освобождает
уксусную кислоту при действии на ее соли. Если одновременно
прилить немного спирта и нагреть, то образуется уксусно-
этиловый эфир;
сн3
соон
CHS
4-Н0С2Н3 H2O-j- |
спирт СОО(СаНБ)
уксусная
кислота
уксусноэтиловый
эфир
легко узнаваемый по приятному фруктовому запаху/
3. Азотнокислое серебро образует в умеренно концентриро-
ванных растворах ацетатов белый кристаллический осадок
394
уксусносеребряной соли (100 i воды при 20" растворяю*! 1,04 г.
а .при 80' — 2,52 г уксуснокислого серебра).
4. Хлорное железо окрашивает нейтральные растворы уксусно-
кислых солей в темно-коричневый цвет. При кипячении разба-
вленных растворов все железо выпадает в виде основного аце-
тата (стр. 238).
5. Нитрат ртути(1) осаждает белый ацетат:
’ + 2СН.чСОО'-> Hg2(CH3COO)2.
1 г этой соли растворяется при 15’ в 133 м.1 воды. Осадок
значительно более растворим в горячей воде; при охлаждении
снова выкристаллизовывается соль, окрашенная в серый цвет
вследствие небольшого восстановления ее в нейтральном рае-
дворе.
Ацетат одновалентной ртути растворяется в избытке раствора
нитрата одновалентной ртути.
’ 6. Хлорная ртуть не дает осадка (отличие от муравьиной
кислоты).
7. Окись свинца РЬО растворяется при нагревании в разба-
вленной уксусной кислоте; при применении избытка окиси свинца
раствор содержит основной ацетат свинца и показывает щелоч-
ную реакцию; при охлаждении не происходит выделения кри-
сталлов.
8. Нитрат лантана дает с иодом, аммиаком и ацетатными ионами кра-
сивый темноси-ний осадок, который, вероятно, обусловливается адсорбцией
иода основным ацетатом лантана. Если присутствуют фосфаты иди суль-
фаты, .последние ‘лучше всего удалить, осадив их нитратом бария.
Выполнение. В углубление капельной пластинки помещают каплю ис-
следуемого раствора ,и прибавляют каплю 15%-ного раствора La(NOs)s и
каплю -раствора иода. Спустя минуту прибавляют каплю 1/V ам-
миака и дают реакционной смеси- постоять несколько .минут. В присутствии
ацетата образуется вокруг капли аммиака синее или синевато-бурое кольцо
уже .при наличии i),W> .к,- ацетата
* ДоВктление pewiup;i. 9. Открытие уксусной кислоты по об-
разованию индиго-. При сухой перегонке ацетата кальция обра-
зуется ацетон:
(СНзСОО)гСа -> СНзСООНз 4- СаСОз.
Если ацетоном подействовать на щелочной -раствор о-нитро-
бенза.тьдегида, то образуется красящее вещество индиго. При
Небольших количествах ацетата кальция можно действовать -па-
рами ацетона на пропитанную о-нитробензальдегидом реактивную
бумагу и таким образом безупречно открывать уксусную кис-
лоту в присутствии всех .минеральных кислот.
Выполнение. Каплю кислого испытуемого раствора выпаривают с кар-
бонатом -кальция и тугоплавкой пробирке. Если испытуемое вещество чв.ер-
1 Kruger u. Tschirch, 62, 2776 (19'29): Файгль, Капельный ана-
лиз, стр. 491.
2 Feigl, Zap pert и VJzqe?, Mikroclieniie, 17, 165 (193-5); см. также
Файгль, Капельный анализ, стр. 491,
3( б
дое, его смешивают с небольшим количеством окиси и карбоната кальция
и смесь всыпают в пробирку. Открытый конец пробирки йокрывают круж-
ком фильтровальной бумаги, пропитанной щелочным раствором о-нитро-
бензальдегида. Пробирку укрепляют в прорезе асбестового картона и по-
степенно подвергают нагреванию. Выделяющийся при этом ацетон улету-
чивается, и бумага, окрашенная альдегидам в желтый цвет, принимает
синий или сине-зеленый цвет. При малых количествах уксусной кислоты
(а следовательно, и ацетата кальция) рекомендуется после перегонки снять
кружок бумаги и смочить его каплей разбавленной соляной кислоты. Жел-
тая бумага обесцвечивается кислотой, и синий цвет индиго ясно выделяется
на белом фоне. Этой реакцией можно открыть 0,06 лг уксусной кис-
лоты. * А. К.
Реакции сухим путем
Все ацетаты разлагаются при прокаливании с образованием
карбонатов, окислов или свободных металлов и выделением го-
рючих ларов и газов.
Ацетаты щелочных металлов разлагаются на карбонат и
ацетон:
2CH3COONa -> ЫагСОз + (СН3)2СО.
Ацетаты щелочных земель при прокаливании, всегда оста-
вляют окись металла, а ацетаты благородных металлов —
металл.
Какодиловая реакция. При нагревании сухой уксуснокислой
соли (лучше всего щелочной соли) с мышьяковистым ангидри-
дом образуется отвратительно пахнущий газ, окись какодила:
сн3 сн3. . сн3
4| ' -f-As,O3 -> 2Na2CO,4- >As —О—As< +2СО2
COONa " СН/ \СН3
окись какодила
Несмотря на чувствительность этой реакции, она все-таки не-
надежна, потому что и другие органические кислоты, как, на-
пример, масляная и валериановая, дают подобные же реакции.
Циановая кислота HOCN, HNCO1
Получение. Эта в высшей степени нестойкая кислота получается путем
нагревания полимерной циануровой кислоты (HCNO)a в виде бесцветной
1 Для циановой кислоты принимаются следующие две формулы:
Н — О -- С N;
циановая кислота
Н- N = С = О,
изоциановая кислота
Некоторые реакции циановой кислоты легко объяснить, если принять
первую из указанных формул; другие же реакции — если принять вторую
формулу. Вероятно, жидкая циановая кислота состоит из смеси обоих
изомеров.
396
с чрезвычайно острым запахом жидкости, тотчас распадающейся в водном
растворе на угольную кислоту и аммиак1:
HNCO + НЮ -> СОг + NHs,
которые соединяются, образуя кислый углекислый аммоний:
СОз + NHs + НзО -> (NH^HCOs.
Соли циановой кислоты, называемые цианатами, более устойчивы и
получаются путем окисления цианидов.
При простом плавлении цианистого калия на воздухе образуются уже
заметные количества циановокислого калия. При накаливании же циани-
стого калия с окислителями (РЬОг, В12О3, КгСггОт и т. п.) удается пол-
ностью превратить его в цианат. При пропускании дициана в едкую
щелочь образуется цианат наряду с цианидом:
2ОН' + (CN)2 -> NCO' + CN' + НгО/
Свойства. Цианиты щелочных Металлов в сухом состоянии довольно
устойчивы, но на воздухе они расплываются и при действии воды посте-
пенно переходят в кислую углекислую щелочь и аммиак:
KNCO + 2НЮ ->КНСОз + NHs.
Растворимость цианатов. Щелочные и щелочноземельные соли циано-
вой кислоты растворимы в воде. Не растворимы в воде цианаты серебра,
закиси ртути, свинца и меди. В азотной кислоте все цианаты растворимы
с выделением СОг.
Реакции мокрым путем
Для этих реакций следует 'пользоваться свежеприготовленным холод-
ным раствором циановокислого калия.
1. Разбавленная серная кислота выделяет свободную циано-
ву/т кислоту, которая, как уже указано, тотчас распадается на
угольную кислоту и аммиак. Поэтому при действии на цианаты
разбавленной серной кислоты сразу происходит сильное выделе-
ние двуокиси углерода:
NCO' + Н’ -> HNCO;
HNCO +2Н2О^ NH4‘ + НСОз';
НСОз' + Н' -> НгО + СОг.
1 Сперва циановая кислота присоединяет воду и переходит в очень не-
стойкую карбаминовою кислоту:
/О /0Н
которая тотчас распадается на аммиак и углекислый газ:
/ОН
С=О-> NH3-J-СОа
XNH2
Совершенно иначе ведет себя изомерная гремучая кислота (С = N —
— ОН), которая распадается на муравьиную кислоту и гидроксиламин:
С = N — ОН + 2НзО-> HCOOH 4-NHsfOH.
397
Выделяющийся углекислый газ увлекает с собою небольшие ко-
личества неразложенной циановой кислоты, которую можно
узнать по чрезвычайно острому запаху. После разложения рас-
твор содержит сернокислый аммоний, что узнается по выделе-
нию аммиака при нагревании с едким натром.
2. Концентрированная серная кислота реагирует точно так же.
3. Азотнокислое серебро образует белый творожистый осадок
циановокислого серебра
NCO' + Ag' -» AgNCO,
растворимого в аммиаке и азотной кислоте (отличие от циани-
стого серебра).
4. Хлористый барий не образует осадка.
5. Уксуснокислый кобальт окрашивается раствором цианово-
кислого калия в лазуревосиний цвет. При этом образуется
открытая Бломстрандом кобальтистоциановокалиевая соль
[Co(NCO)iJКг1, которую можно получить в виде темнолазурево-
синих кристаллов квадратной системы.
Это синее соединение легко растворяется в воде, окрашивая послед-
нюю в синий цвет. В присутствии большого количества воды синяя окраска
исчезает, потому что комплексная соль распадается на свои составные
части:
[CofN'COh]" +4NCO'.
Прибавляя к полученному бесцветному растворе избыток циановокис-
лого калия, снова получают раствор, окрашенный в синий цвет. Тог же
эффект достигается прибавлением спирта.
Открытие цианата в присутствии цианида
Почти всякий продажный цианистый калий содержит циановокислую
соль калия.
Чтобы открыть в нем циановую кислоту, необходимо сначала вытес-
нить синильную кислоту, (потому что кобальтовая реакция в присутствии
этой кислоты дает отрицательный результат.
При этом поступают по способу Е. А. Шнайдера (Schneider) следующим
образом2. Растворяют 3—5 г исследуемого цианистого калия в 30— 50 мл
холодной воды и пропускают в течение 1—IV2 час. через жидкость угле-
кислый газ; при этом синильная кислота вытесняется и образуется кислый
углекислый калий:
KCN + НгСОз -> HCN + КНСО.1.
Заметного разложения циановокислого кадия не наблюдают.
К 1 мл жидкости приливают 25 мл абсолютного спирта (для осажде-
ния гидрокарбоната калия) и фильтруют. К спирюному фильтрату при-
бавляют несколько капель уксусной кислоты и затем несколько капель
спиртового раствора уксуснокислого кобальта.
При помощи этой реакции можно открыть присутствие 0,5% цианово-
кислого калия в исследуемом цианистом кяшн ."<> явственному синему
окрашиванию. (Аналогичную реакцию даю г и ролшшды.)
1 .1. praht. Chem 12), 3, 20b (137%.
= В. 28, 1540 (i;s95).
3S8
Муравьиная кислота HCOOH
Нахождение в природе. Эта кислота в природе встречается в орга-
ническом мире (в организмах красных муравьев, некоторых гусениц и
в жгучей крапиве).
Получение. 1. Путем омылеиия цианистоводородной кислоты, хлоро-
форма, хлорал-гидрата и гремучей кислоты:
a) HCN + 2Н~О -> NHs + HCOOH;
б) CHCls + ЗКОН ->ЗКС1 + НЮ + HCOOH;1
хлороформ
в) СС1зСН(ОН)2 + KOH->CHCls + НСООК + НаО;2 * 4
хлорал-гидрат хлороформ
г) CNOH + 2НЮ ->NH:OH -f- HCOOH. ’
гремучая гидроксиламин
кислота
2. При быстром нагревании щавелевой кислоты:
СООН
| ->СОг+HCOOH.
СООН
3. Действием окиси углерода на твердый гидрат окиси натрия при 16U'’
(лучше всего под давлением) *:
СО + NaOH-> HCOONa.
г
По этой реакции проходит процесс технического получения муравьи-
нокислого натрия.
4. При действии влажной двуокиси углерода на металлический калий
при обыкновенной температуре5:
2СОг +, 2К + НгО -> КНСОз,+ НСООК.
5. При окислении метилового спирта:
СНзОН + О2 TtHaO + HCOOH.
метиковый
спирт
Свойства. Муравьиная кислота — бесцветная жидкость с резким запа-
хом и едкими свойствами. Кипит при 101° и плавится при +8,3°. Кон-
станта диссоциации ее равна 2-10-4.
Реакции мокрым путем
1. Разбавленная серная кислота выделяет из формиатов (со-
лей муравьиной кислоты) муравьиную кислоту, узнаваемую по
ее резкому запаху.
1 Путем кипячения с концентрированным раствором едкого кали.
2 Действием разбавленного раствора едкого кали на холоду.
8 При омылении концентрированной соляной кислотой гремучая кис-
лота распадается, как указано в пункте г); при действии едкого кали
образуется изомерная циановая khctoiu НОС.Х, см. Wieland, Die Knall-
satire. Stuttgart, 1909.
4 Ann. 202, 317 (1880).
8 Ann. 119, 251 (1861)
399
2. Концентрированная серная кислота разлагает все формиаты
с выделением окиси углерода, горящей синим пламенем:
HCOOH —140 СО.
3. Азотнокислое серебро выделяет из концентрированного
раствора белый кристаллический осадок формиата серебра, ко-
торый при нагревании выделяет металлическое серебро:
2HCOOAg -> СО2 + HCOOH + 2Ag.
В присутствии аммиака выделение серебра не происходит.
4. Нитрат ртути(1) дает белый осадок формиата закисной
ртути, который при нагревании выделяет металлическую ртуть:
(HCOO)2Hg2 + СО2 + HCOOH ф- 2Hg.
5. Хлорная ртуть даже в наиболее разбавленных растворах
вызывает осаждение хлористой ртути:
HCOOH + 2HgCh -> 2НС1 ф- СО2 4- Hg2Cl2.
Присутствие большого количества НС1 или хлорида щелоч-
ного металла препятствует реакции.
6. Фелингов раствор не восстанавливается муравьиной кисло-
той, но медленно восстанавливается окисью углерода.
Фосфо эчонатчст^я кис пота Н3РО2
Получение и свойства. Фосфорноватистая кислота получается при раз-
ложении ее бапиевой соли серной кислотой или ее кальциевой соли щаве-
левой кислотой. В <пни!,н7рир,‘Л'’нних растворах она сиропообразна и
подобно фосфористой кислоте превращается при нагревании в отсутствие
воздуха в фосфорит ю кислот у и самопроизвольно воспламеняющийся газ —
ф‘<4 ор! с ый во юрод. Ию.юта одноосновна и умеренно сильная, хотя
только один из ее водородных атомов замещается металлами. Ее константа
диссоциации 9 10~:.
Фосфорноватистой кислоте обычно приписывается структурная формула
.Oil
/
О = Р-Н и считается, что только водород, связанный с кислородом1,
\н
заметается мета тлям1.
Принимая водородные атомы одноположительно заряженными, а кисло-
родные- - двуотрицательно, имеем в фссфорноватистой кислоте однополо-
жтпе.тьно заряженный атом фосфора. Нижеприводимые реакции фос-
форноватисюй кислоты (например, 4, 6 и др.) хорошо согласуются с такой
заряженн' стью фтосфора.
Гипофосфит натрия (фосфорноватистокислый натрий) — прекрасный
восстановитель. Он восстанавливает хлорное олово, соли палладия и йо-
даты при соответствующих условиях. Гипофосфиты получаются при кипя-
1 Ьолее наглядно способность фосфорноватистой кислоты замещать ме-
таллом лишь один водород обьясняется предложенной для нее комплексной
формулой Вернера-Льюиса:
Н [°^°] М. ZT,
400
чении белого фосфора с разбавленными растворами едких щелочей, причем
образуется также газообразный фосфористый водород:
2Р4 + ЗВа(ОН)2 + 6НЮ -»ЗВа(Н2РО2)2 + 2РНз;
Р< + ЗКОН + ЗН=О -> ЗК(НгРОг) ф РНз.
Полученный таким путем фосфористый водород самопроизвольно iboc-
пламеняется вследствие присутствия в нем небольших количеств жидкого
фосфористого водорода РгН4. Он, однако, смешан с большим количеством
водорода, потому что едкая щелочь реагирует с гипофосфитом щелочного
металла с выделением водорода (си. ниже, п. 6).
Растворимость гипофосфитов. Все гипофосфиты растворимы в воде.
Реакции мокрым путем
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота восстанавливается при
нагревании до сернистой кислоты.
3. Хлористый барий, хлористый, кальций и ацетат свинца не
Дают осадка (отличие от фосфористой кислоты).
4. Азотнокислое серебро дает белый фосфит серебра, кото-
рый уже при комнатной температуре восстанавливается до ме-
таллического серебра. В зависимости от относительных коли-
честв реагирующих веществ наблюдается или не происходит вы-
деление водорода:
2Н2РО2' + 2Ag' ф 4Н2О •> 2НзРО1 ф 2Ag 4- ЗН2;
Н2РО2' + 4Ag’ ф 2НгО -> HsPOr ф 4Ag ф ЗН\
5. Молибдат аммония и несколько капель раствора сернистой
кислоты дают темносиний осадок или окрашивают раствор в си-
ний цвет. Этой о'чень чувствительной реакции мешают серни-
стый водород, тиосульфат, хлорат и хлористое олово.
6. Концентрированные едкие щелочи. При кипячении с кон-
центрированной едкой щелочью гипофосфиты окисляются
в фосфаты с выделением водорода:
Н2РО2' ф 2ОН' ^РСФ" ф 2Н2.
7. Хлорная ртуть, прибавленная в избытке к горячему рас- )
тво>ру гипофосфита, выделяет осадок хлористой ртути;
4HgC12 ф Н2РО2' + 2НгО _> 2Hg-.C). ф ЗН’ ф Н3РО4 ф 4СГ.
8. Цинк в разбавленной серной кислоте восстанавливает фос-
форноватистую кислоту в фосфористый водород (см. Фосфори-
стая кислота).
9. Соли меди ртути и золота восстанавливаются до металла.
1 Восстановление солей меди может дэйти до образования гидрида
меди. См. Wurtz, С. г. 18, 102 (1844).
26 Зак. 982. Тредвелл-Голл, г. I.
401
Реакции сухим путем
При прокаливании свободной фосфорноватистой кислоты или
ее солей получают фосфат и фосфористый водород, воспламе-
няющийся на воздухе:
2НзРОг-> НзРОт + РНз;
'4NaH2POa -> NaiPzO? + Н2О + 2РНз;
2Са(Н2РО2)2 -> СагРгО .Щ НгО + 2РНз.
Азотистоводородная кислота (азоимид) HN,
Свойства. Азотистоводородная кислота представляет собой бесцветную
легко подвижную жидкость с запахом, напоминающим фосфористый водо-
род. Ее строение мажет быть представлено формулой (не вполне дока-
ванной);
,N
H-N( ||
XN
Ее пары действуют на слизистые оболочки и при соприкосновении
с пламенем чрезвычайно сильно взрывают. Водный раствор ее бесцветен;
по силе своей она приблизительно равна уксусной кислоте, имея константу
ионизации 1,9 10~s при 25°. Соли ее .называются азидами. Подобно хлору,
могущему замещать ОН-группу ,в органических кислотах с образованием
хлорида кислоты, азидная группа также может быть введена на место ОН
карбоксильной группы с образованием органического азида.
Азотистоводородная кислота и ее соли чрезвычайно взрывчаты. При
нагревании или при ударе они взрывают с большой разрушительной силой,
Азотистоводородная кислота растворяет металлы, образуя азиды и вы-
деляя водород:
2HN» + Zn -> Zn(Ns)2 + Hs,
причем часть азотистоводородной кислоты восстанавливается до гидразина
NHs-NIL’ и аммиака:
3Zn + 7HNs -> 3Zn(Ns)s + NHs + NsHi.
Другие восстановители также ведут к образованию аммиака и гидра»
вина. Дымящая иодистоводородная кислота образует азот, аммиак и иод:
HNs + 2HJ -> Ns + NHs j- Js.
Большинство азидов растворимо в воде.
Окислители, особенно иод, приводят к образованию азота:
2HNs + Js -» 2HJ + 3Ns.
Соли четырехвалеитного церия являются весьма пригодным реактивом
для разложения азотистоводороднюй кислоты; они превращаются при этом
в соли трехвалентного церия и выделяют азот.
Реакции мокрым путем
Работа студентов с азотистоводсродной кислотой Должна
производиться только в ^присутствии руководителя!
1. Азотнокислое серебро дает в нейтральном растворе белый
осадок азида серебра:
Ag' , AgN,j.
402
Осадок сходен с хлористым серебром, но он растворим в раз-
бавленной азотной кислоте.
2. Нитрат ртути(1) и нитрат свинца вызывают образование
белых азидов этих металлов.
3. Хлорное железо дает, как и с родан-ионом, характерное
красное окрашивание.
4. Соли двухвалентной меди выделяют бурый трудно раство-
римый осадок Си(№)г.
5. Сульфат одновалентного таллия выделяет желтый трудно
растворимый Т1№.
ГРУППА 1П
Азотнокислое серебро образует белые осадки, растворимые
в азотной кислоте.
Хлористый барий реагирует точно так же.
Сернистая кислота HSO,
Нахождение в природе и получение. Двуокись серы ('сернистый газ)—
ангидрид еернисюй кислоты SOs находится в выделениях действующих
вулканов и образуется при сжигании серы или сульфидов на воздухе;
t S + Оз -» SO,;
4FeS2 + 1 Юз ->2РегОз + SSOs
или при восстановлении серной кислоты путем нагревания с серой, суль-
фидами, углем, органическими веществами и некоторыми металлами:
2H2SO4 + S -> 2НзО + 3SOs;
2H2SO4 + С -» 2Н*О + СО> + 2S(h;
2Нз8О1 + Си-» 2НзО -f- CuSO, -|- SO.-.
Подобно меди реагируют ртуть, серебро, олово и т. л.».
Двуокись серы выделяется также при разложении сульфитов и тио-
сульфатов сильными кислотами:
SO," ф 2Н- -> HiSO, ->НзО -J-' 50з;
S,O," + 2Н- ->HjSsOs -» НзО + SO, + S.
Сернистую кислоту для лабораторных целей можно приготовить из
концентрированного раствора кислого сернистокислого натрия, влитого
в снабженную газоотводной трубкой колбу, в которую прибавляется по
каплям (из капельной воронки) серная кислота; при этом получают (без
нагревания) равномерный ток сернистого газа.
Свойства. Сернистый ангидрид — бесцветный с острым- характерным за-
пахом газ, легко растворимый в воде и спирте: 1 объем воды при 15°
растворяет 45,36 объема SO,, а 1 объем спирт при 15° растворяет
116 объемов SO,.
В водном растворе существует равновесие, между SO2, SOs • 6НгО и
HaSOs. Свободная сернистая кислота не может быть изолирована, так как она
разлагается при испарении на. воду и двуокись серы и поэтому-она известна
только в водном растворе. Это -- средней силы двухосновная кислота. Кон-
станты диссоциации: К> = 1.7 10~- и К-> — 1,0 • 10*’. При нейтрализации
раствора едкими щелочами или карбонатами получаются сравнительно стой-
кие соли сернистой кислоты, называемые сульфитами. Сульфиты в растворе
26“ 403
постепенно окисляются растворенным кислородом в сульфаты. 'Сернистая
кислота является хорошим восстановителем.
Растворимость сульфитов: сернистокислые соли щелочных металлов в воде
растворимы, остальные сульфиты или трудно, или совсем нерастворимы; все
они растворяются в соляной кислоте.
Реакции мокрым путем
1. Разбавленная серная кислота выделяет на холоду из всех
сульфитов сернистый ангидрид, который можно узнать по за-
паху.
2. Концентрированная серная кислота действует, как и разба-
вленная, но только значительно энергичнее.
3. Азотнокислое серебро выделяет из нейтральных растворов
сульфитов и из водных растворов сернистого ангидрида белый
кристаллический осадок сернистокислого серебра:
SO3" 4- 2Ag‘ -> Ag2SO3,
растворимого в избытке сернистокислой щелочи с образованием
натриевой соли серебряносернистой кислоты:
Ag2SO3 4- NasSOs -> 2Na[AgSO3].
При кипячении этого раствора серебро осаждается в виде
серого металла:
2[AgSO3]' -> SOT' + SO2 4- 2Ag.
При кипячении взвешенного в воде осадка сернистокислого
серебра поло'вина серебра выделяется в виде металла^ а осталь-
ная часть 'переходит в раствор в виде сернокислой соли:
2AgsSO3 -> AgiSOi -ф SO2 -4 2Ag.
Сернистокислое серебро' растворяется также в аммиаке и
азотной кислоте.
4. Хлористый барий не дает осадка в водном растворе сер-
нистой кислоты, но из нейтральных растворов сульфитов выде-
ляет белый осадок сернистокислого бария:
Na^SOa 4-BaCh-» 2NaCl 4- BaSO3,
легко растворимого в разбавленной холодной азотной кислоте.
При кипячении постепенно образуется осадок сернокислого
бария. Так как сульфиты .в водном растворе постепенно пере-
ходят в сульфаты (соли серной кислоты), то последние часто
содержатся в продажных -сернистокислых солях. В этом случае
осадок, образованный хлористым барием, содержит сернокислый
барий и не вполне растворяется в разбавленной соляной или
азотной кислотах. Если сернокислый барий отфильтровать и
к фильтрату прилить хлорную или бромную воду, то в присут-
404
ствии сернистой кислоты образуется обильный белый осадок
сернокислого бария:
БОз" + С12 + Ва' ’ + Н2О 2Н’ + 2СГ + BaSO4.
5. Стронциевые и кальциевые соли реагируют аналогично
бариевым солям.
Щелочноземельные соли сернистой кислоты отличаются друг
от друга -по своей растворимости в сернистой кислоте и воде.
Кальциевая соль легко растворяется в избытке сернистой кис-
лоты, образуя кислый сернистокислый кальций:
СаБОз + НгБОз -> Ca(HSO3)2.
При кипячении такого раствора выделяется сернистый анги-
дрид, и сернистокислый кальций снова выпадает.
Стронциевая соль также растворяется в сернистой кислоте,
но только значительно труднее; бариевая соль почти не рас-
творима.
Растворимость щелочноземельных солей сернистой кислоты в воде при 18°
1 г CaSOs растворяется в 800 мл воды
1 » SrSOs » » 30 000 » »
1 » BaSOf » > 46 000 » »
Трудная растворимость сернистокислого стронция исполь-'
зуется при открытии сернистой кислоты в присутствии тиосерной
кислоты (об этом см. ниже).
6. Свинцовые соли осаждают белый сернистокислый свинец,
трудно растворимый в воде, растворимый в холодной разбавлен-
ной азотной кислоте; при кипячении осаждается сернокислая
соль свинца.
7. Нитропруссидный натрий и сульфат цинка. Разбавленный
раствор нитропруссидного натрия слабо окрашивает нейтраль-
ный раствор сульфита в розово-красный цвет. Но окраска ста-
новится явственно красной, если прибавить большой избыток
сернокислого цинка. Чувствительность реакции еще повышается
в присутствии незначительного количества железистосинероди-
стого калия, причем образуется красный осадок (отличие от
тиосерной кислоты). Хотя эта реакция очень чувствительна,
но она не так надежна, как реакция осаждения посредством
хлористого стронция.
8. Растворы иода обесцвечиваются сернистой кислотой:
H2SO3 + Н2О + J2 -> 2HJ + H2SO4.
9. Перманганат калия в кислом растворе также обесцвечи-
вается, причем образуется серная и дитионовая кислоты в коли-
чествах, меняющихся в зависимости от концентрации и темпе-
ратуры. При определенных условиях реакция может протекать
согласно уравнению:
2МпО/ + 6SO3" + 8Н’ —>2Мп’ • + 4SO»" + S20g" .+ 4ЩО.
405
В других условиях сернистая кислота может быть полностью
окислена в серную кислоту.
Поэтому количественное определение сернистой кислоты по-
средством перманганата невозможно.
10. Хромовая кислота легко восстанавливается в соль окиси
хрома зеленого цвета:
2СгО<" + ЗБОз'' + ЮН’ -» 2Сг’ • ’ + 3801" + 5НгО.
11. Хлорная ртуть не изменяется свободной сернистой кисло-
той при обыкновенной температуре; при кипячении же выде-
ляется белая хлористая ртуть:
2HgCh + SOs" + НгО -> SOt" + 2Н- + 2СТ + Hg->C12,
которая при большем количестве сернистой кислоты восстана-
вливается дальше до металла серого цвета.
12. Нитрат ртути(1) тотчас восстанавливается как свободной
сернистой кислотой, так и растворами ее с.•лей, причем выде-
ляется черный осадок.
13. Растворы золота также восстанавливаются до металла.
14. Цинк в присутствии разбавленной соляной кислоты вос-
станавливает-сернистую кислоту в сернистый водород, который
узнается по запаху и -по способности окрашивать в черный цвет
бумагу, смоченную свинцовой солью. Цинк е водным раствором
сернистой кислоты дает также гидросернистую кислоту H2S2O4.
которая является очень сильным восстановителем:
Zn + 2SOs" + 6Н- -> Zn’ ' -Ь H2S2O4 + 2НгО.
15. Сернистый водород восстанавливает сернистую кислоту*
в разбавленных растворах. Основное напрг.здение реакция может
быть выражено уравнением:
H2SO3 + 2H2S -> ЗН2О -I- 3S,
но при этом могут образоваться иентатионовая H2S.-,0e и другие
политионовые кислоты:
5H>SOs'+ 5H>S -> FkSsOe + 9НЮ + 5S.
16. Малахитовая зелень обесцвечивается сульфитами. В углу-
бление капельной пластинки помешают каплю раствора, содер-
жащего 10 мг малахитовой зелени в 500 м./ воды, и сме-
шивают ее с каплей нейтрального исследуемого раствора. Уже
в присутствии 1 у gOa происходит обесцвечивание раствора.
Реакции сухим путем
Сернистокислые соли щелочных металлов при прокаливании
без доступа воздуха превращаются в сульфат и сульфид;
4Na2SO3 3N32SO4 4- NasS,
40в
Эта реакция протекает легко при прокаливании сернисто-
кислой щелочи в запаянной трубме, причем сера не возгоняется
(отличие от тиосернокислых солей). При обработке полу-
ченного охлажденного сплава соляной кислотой обильно
выделяется сероводород.
Остальные сульфиты распадаются при прокаливании без дО
ступа воздуха на сернистый ангидрид и окись или- металл;
СаБОз -> СаО + SO*;
2Ag2SOs-> 4Ag ф 2SO2 + O2.
При накаливании какого-либо сульфита с содой на угле обра-
зуется сернистый натрий. Полученный плав, будучи смочен во-
дою на чистой серебряной пластинке (серебряной монете), чер-
нит серебро, так как образуется сернистое серебро (реакция
образования серной печени):
2Na«SO3 + ЗС _> ЗСОг Ч- 2Na2S;
2Na-’S 4- 4Ag + 2Н2О + О2 -> 4NaOH + 2AgaS.
Эта реакция присуп^а всем соединениям серы, поэтому она
только указывает на присутствие серы. Необходимый для этой
реакции кислород доставляется воздухом.
Селенистая, теллуристая, селеновая и теллуровая
кислоты
Свойства и реакции указанных кислот см. стр. 548—554.
Угольная кислота Н„СО3
Нахождение в природе. Угольная кислота НгСОз, так же как и серни-
стая, в свободном состоянии не известна; она существует только ,в водном
растворе. Ее ангидрид СОг- образующийся при сгорании угля и углероди-
стых соединений, очень распространен в -природе (в -малых количествах
-в атмосферном воздухе, в колоссальных количествах в вулканических мест-
ностях, где он выделяется из трещии вемной -коры). Двуокись углерода
встречается также во многих минеральных водах и в жидком состоянии
во многих кварцсодержащих породах, особенно в более древних, а именно
в виде включений в кварце, в полевых .шпатах и т. п. В огромных коли-
чествах угольная кислота встречается в виде -солей, как известняк, мрамор,
арагонит, доломит и т. -п.
Чистый воздух содержит 0,035—0,040% СО». В жилых помещениях
количество углекислого газа значительно увеличивается вследствие дыхания
и других процессов горения. При ^наличии в воздухе 3—4%. ’СОл как это
иногда бывает в рудниках, дыхание становится затруднительным и лампа
рудокопа начинает гореть тускло.
Свойства. Двуокись углерода— газ, без цвета и запаха со слабокислым
вкусом. Плотность его 1,32. Будучи в полтора раза тяжелее воздуха, о-н
может быть перелит из одного сосуда в другой. Он не поддерживает
горения; горящая свеча гаснет на воздухе, содержащем 8—10% СОа1..
1 Двуокись углерода н-е только не поддерживает горения, но она пре-»
пятствует ему', в силу чего ею пользуются в огнетушителях. Образуясь при
сгорании углерода, она больше, чем какой-либо другой инертный газ, будет
стремиться подавлять реакцию горения согласно закону действия масс.
407
Растворимость двуокиси углерода в ваде не очень велика. При 15е
и 760 л.к давления 1 л воды растворяет равный ему объем газа. При более
высокой температуре растворимость его уменьшается и его легко совер-
шенно вытеснить из раствора. В водном растворе устанавливается следую-
щее равновесие:
СОа + НзО 72 НгСОз 72 И' + НСОз';
НСОз'72? Н' + СОз".
Константы диссоциации Ki = 3,5 • 10~7 и К-2 = 5 • 10*11. Согласно этим вели-
чинам ионизация угольной кислоты по первой стадии достигает приблизи-
тельно 0,1%; в 1 л насыщенного раствора двуокиси углерода при 15й со-
держится только около 0.0006 моля водородных ионов. Ионизация по вто-
рой ступени, от которой зависит концентрация ио^ов СОз" в растворе, про-
ходит лишь в незначительной степени.
От прибавления к раствору какой-либо сильной кислоты почти пол-
ностью подавляется диссоциация угольной кислоты и по первой ступени.
Точно так же при -прибавлении водородных ионов к какому-нибудь карбо-
нату образуется двуокись углерода; это происходит даже при прибавлении
уксусной кислоты, и углекислый газ может быть легко- полностью выделен
при нагревании. Единственными кислотами, не разлагающими карбонатов-,
являются цианистоводородная, сернистоводородная и борная.
Со-ли угольной кислоты, карбонаты, образуются:
1) при пропускании углекислого газа в растворы гидратов окисей
металлов:
2NaOH + СО2 -> Н-.-О + NasCOs;
Ва(ОН)2 + СOs -> Н2О + ВаСОз;
2) при действии -углекислого газа на цианиды, сульфиды и бораты
щелочных и щелочноземельных металлов;
3) путем прокаливания солей органических кислот (стр. 311 и 396).
Примером получения последним путем карбонатов в больших -разме-
рах может служить приготовление поташа путем сжигания дерева и отхо-
дов свеклосахарного производства, особенно богатых калиевыми солями
различных органических -кислот.
Растворимость карбонатов. Из средних углекислых солей в воде рас-
творяются только карбонаты щелочей, причем водный раствор их -имеет
щелочную реакцию вследствие гидролитического -расщепления;
СОз" + НОН 72 ОН' + НСОз'.
Поэтому -водный раствор -карбонатов ведет себя так, как водный рас-
твор едкой щелочи и бикарбоната щелочного металла.
В -избытке угольной кислоты многие карбонаты растворяются, образуя
-монометаллические карбонаты (бикарбонаты, двууглекислые соли); сюда
относятся -прежде всего карбонаты щелочных земель:
СаСОз + НгСОз 72 Са( НСОз)з.
При -кипячении раствора кислого углекислого кальция отщепляются вода
и двуокись углерода и углекальциевая соль выпадает из раствора:
Са(НСОз)г 27 НаО + СОг + СаСОз.
Так как почти во всех питьевых водах находятся кислые углекальцие-
вая и углемагниевая соли, то в них наблюдается образование осадка и на-
кипи при кипячении.
Все карбонаты, растворяются в разбавленных холодных минеральных
кислотах с выделением углекислого газа (шипение).
Природные карбонаты магния и железа (магнезит, сидерит и доломит)
не шипят, если кусочек минерала облить холодной разбавленной минераль-
ной кислотой, но реакция сразу наступает, если минерал предварительно
растереть в тонкий (порошок; при нагревании все карбонаты легко- раство-
ряются в -кислоте.
408
Реакции мокрым путем
1. Разбавленная серная кислота разлагает все карбонаты на
холоду за исключением магнезита, сидерита и доломита, разла-
гающихся при нагревании; разложение сопровождается шипе-
нием.
Так как воздух всегда содержит двуокись углерода, особенно в лабо-
ратории, где много горящих газовых горелок, необходима особая осто-
рожность при выполнении реакции с небольшим количеством углекислого
газа. Если исследуемое вещество не шипит при действии на него кислоты,
то дальнейшее испытание на углекислоту излишне. Так как, однако, дву-
окись углерода лишена запаха, то на основании одного шипения нельзя
заключить о наличии карбоната, если выделяющийся газ пахнет, например,
сероводородом или двуокисью серы.
Следующий простой способ может служить пробой на углекислый газ.
Всыпают в одюбирку около 1 г растертого в порошок твердого вещества,
наливают туда же около 10 мл воды и кипятят приблизительно в течение
1 мин., чтобы удалить воздух из вещества и из воды. Прибавив затем
немного 6<V соляной кислоты, внимательно следят, не происходит ли шипе-
ние (хотя бы слабое). В положительном случае отмечают, имеет ли выде-
ляющийся газ какой-либо запах. Погрузив затем две стеклянные палочки
(употребляемые для помешивания) в раствор едкого барита, захватывают
одну из них вторым и трётьи^ пальцем, а другую третьим и четвертым
пальцем; после этого одну палочку вносят внутрь пробирки, не прикасаясь
к ее стенкам, а другую держат вне пробирки. В присутствии карбоната
гидроокись бария скорее помутнеет на палочке, находящейся внутри про-
бирки, чем на находящейся вне ее, т. е. на воздухе. Эта реакция, однако,
однозначна лишь в случае отсутствия сульфита, потому что последний
также вызывает помутнение гидроокиси бария *.
Приведенная реакция не дает, конечно', возможности с уверенностью
открывать следы карбонатов, но она удовлетворяет обычному испытанию
при условии отсутствия сульфита. Для открытия следов карбоната, даже
в присутствии сульфита, можно. применить следующий прием. Склянку
в 100 мл закрывают резиновой пробкой с двумя отверстиями. Через одно
отверстие вставляют маленькую капельную воронку так, чтобы конец ее
доходил почти до дна склянки; в другое отверстие вставляют согнутую
под прямым углом стеклянную трубку для отвода выделяющегося газа во
вторую склянку; во> второй склянке находится около. 5' г хромового анги-
дрида СгОз, растворенного в небольшом количестве воды и 25' мл, 6N сер-
ной кислоты. Эта склянка служит для окисления сернистой кислоты или
сернистого водорода, могущих выделяться из анализируемого вещества.
Трубки во второй склянке устанавливают так, чтобы газ поступал
в склянку у самого дна, проходил через раствор и выходил из склянки
через отводную трубку, заканчивающуюся непосредственно под резиновой
пробкой. Эту склянку присоединяют таким же путем к третьей склянке,
выходная трубка которой соединена с хлоркальциевой трубкой, наполненной
натронной известью, чтобы воспрепятствовать попаданию в прибор угле-
кислоты из воздуха. Растертое в порошок вещество1 всыпают в первую
склянку, куда затем наливают 25 мл воды. Через прибор, включая и
третью порожнюю склянку, пропускают в течение 10 мин. ток воздуха,
свободного от двуокиси углерода, одновременно нагревая воду в первой
склянке. Для этого присоединяют хлор кальциевую1 трубку третьей склянки
к насосу, а в горлышко капельной воронки (присоединенной к (первой
склянке) вставляют на резиновой пробке трубку с натронной известью.
Для удаления двуокиси углерода из просасываемого .воздуха можно поль-
зоваться вместо натронной извести раствором! едкого кали (1:2). По вы-
теснении двуокиси углерода из прибора отключают .насос, закрывают кран
1 Для однозначности этой реакции необходимо также отсутствие тио-
сульфата, потому что последний под влиянием! кислоты разлагается на SO»
и S. Ред.
409
капельной ворЪнки, удаляют пламя и быстро вливают в третью склянку
около 25 .мл раствора гидроокиси бария; Обеспечив плотное соединение
всех частей прибора, вливают 25 мл QN серной кислоты в капельную во-
ронку и дают кислоте медленно притекать к исследуемому веществу
в склянке. Если выделение газа недостаточно, чтобы вызвать помутнение
раствора гидроокиси бария, прибегают к слабому отсасыванию, как ука-
зано выше. После того как в аппарате установится слабый вакуум, осто-
рожно открывают кран капельной воронки, присоединив к ней предвари-
тельно трубку с натронной известью, и постепенно нагревают серную кис-
лоту до кипения. Если необходимо, продолжают просасывать воздух через
аппарат еще в течение 15 миЯ. В случае получения очень слабой мути
в растворе гидроокиси бария лучше всего поставить глухой опыт.
Никогда не следует заключать о наличии карбоната, не получив вполне
убеди тельного результата.
В этой пробе хромовая кислота, применяемая для окисления сернистой
кислоты, может быть заменена другим окислителем, например перекисью
водорода или иодом.
2. Концентрированная серная кислота реагирует так же,
ко значительно энергичнее.
3. Азотнокислое серебро осаждает белое углекислое серебро;
избыток реактива выделяет желтоватый осадок. При кипячении
углекислое серебро1 отчасти (разлагается на .двуокись углерода и
окись серебра (бурого цвета); полное удаление угольной кис-
лоты происходит лишь при 200°. Углекислое серебро легко рас-
творимо в азотной кислоте и аммиаке.
4. Хлористый барий осаждает на холоду объемистый осадок
углекислого бария, который при стоянии раствора постепенно,
а при кипячении — быстро становится кристаллическим и зна-
чительно плотнее.
5. Хлористый свинец, прибавленный к водному раствору кар-
боната щелочного металла или бикарбоната, дает молочнобелый
осадок карбоната свинца. Свободная угольная кислота препят-
ствует реакции; уксусная кислота растворяет осадок.
6. Розоловая кислота С—СВН4О.Н. 0,2%-ный спиртовый
раствор ро'золовой кислоты, к которому прибавлен раствор
гидроокиси бария до появления к-расного опрашивания, обес-
цвечивается свободной угольной кислотой.
7. Реактив Несслера не дает реакции с аммиаком в присут-
ствии свободной угольной кислоты или гидрокарбонатов. Этой
реакцией можно пользоваться для открытия свободной угольной
кислоты или гидрокарбонатов в растворе.
Реакции сухим путем
КарбонаГы щелочей плавятся почти без всякого разложения.
Углекислый барий на угле не плавится и не разлагается при
температуре, развиваемой паяльной трубкой. Лишь при бело-
калильном жаре .он распадается на окись бария и двуокись угле-
410
рода. Все остальные карбонаты легко распадаются при темпе-
ратуре паяльной трубки на окись металла и двуокись углерода.
Окиси благородных металлов претерпевают дальнейшее разло-
жение на металл и кислород.
Сернистый углерод CS?
Плотность 1,292. Ti кип. 49,04°. Т. воспл. 113°
Получение. Сернистый углерод образуется путем прямого соединения
углерода с серой при температуре красного каления и потому его нахо-
дят в (Продуктах сухой . перегонки каменного угля' (в неочищенном све-
тильном газе). Кроме того, CS2 образуется при разложении роданидов
серной кислотой наряду с COS. HCN, С()д SOa и т. д.
Свойства. Сернистый углерод — бесцветная жидкость, сильно прелом-
ляющая свет, не растворимая в воде и смешивающаяся во всех отноше-
ниях со спиртом, эфиром н бензолом.
В чистом состоянии CS; обладает приятным эфирным запахом. При
продолжительном слиянии на свету он постепенно разлагается с выделе-
нием окрашенного и бурый цвет вещества, приобретает желтый цвет и
противный запах.
Так как сернистый углерод не смешивае!ся с водой, им часто поль-
зуются для извлечения из водных растворов растворенных веществ. СЗа
нс проходит через фильтр, смоченный водой; сероуглеродные растворы
могут быть о। филь гронаша только через сухие фильтры или смоченные
спиртом, эфиром или бензолом.
Сернистый углерод весьма летуч. Ядовтиые пары его легко сгорают
С образованием СО; и ЗОо
CSe + ЗО-> -> С()-> 4- 24()д.
Ввиду низкой температуры воспламенения и образования с воздухом
гремучих смесей работа с сернистым углеродом должна проводиться при
соблюдении всех мероприяiип пожарной безопасности!
Реакции мокрым путем
Путем присоединения к сернистому углероду соответствующих основа-
ний можно но,тучи II, анионы, ко|о,?ые со многими катионами тяжелых
металлов дают ipj-дно .растворимые или интенсивно окрашенные соли и
являются реактивами на них.
1) Образование ксантогената. Как уже было указано выше (см. Медь),
сероуглерод легко соединяется с а.ткоголятом с образованием ксантоге-
цат-иопа:
/$>'
CS2 + С2Н-(У С = S
\ос2н-,
который п уксуснокислом или аммиачном растворе дает осадки с катио-
нами многих тяжелых металлов (стр. 154),
2) Образование тритиокарбоната. Если сернистый углерод оставить
на несколько днеи в закрытой склянке с концентрированным аммиачным
1 Так как сернистым углеродом аналитикам приходится нередко поль-
зоваться в качестве растворителя серы, жиров, брома и иода, считаем
необходимым оставить все, чю приводилось о нем в предыдущем изда-
нии. Ред.
411
раствором сернистого аммония, то образуется раствор тритиокарбэиата
аммония (тритиоуглекислый аммоний) желтого цвета:
/SNH4
CS2 + (NH4)2S -► c = s
\snh4
двухвалентный анион которого CSa" дает со многими катионами тяжелых
металлов весьма интенсивные окраски или осадки.
3) Триэтилфосфии [Гофман (Hofmann)]. Эфирный раствор триэтил-
фосфина дает с сернистым углеродом кристаллический осадок великолеп-
ного красного цвета:
Р(СзНз)з + CS2 -> Р(СзН5)з • CSz.
триэтилфосфин
Эта реакция настолько чувствительна, что ею можно пользоваться не
только для качественного, но также и для количественного определения
сернистого углерода в светильном газе.
/ОН
о=с<
хо
Надугольная кислота Н2С2О6 0
о=с(
хон
Свободная надутольная кислота неизвестна; напротив, надуглекислый
калий (перкарбонат калия) КгСаОв оказывается веществом вполне стойким
в сухом состоянии. В присутствии влаги он тотчас распадается на пере-
кись водорода и двууглекислый калий:
КаСаОб + 2НзО -> Н2О2 + 2КНСОз.
Если эту соль, отличающуюся своей слабо синеватой окраской, всы-
пать в большое количество разбавленной холодной серной кислоты, она
растворится с выделением СО, образуя сернокислый калий и перекись
водорода. Такой раствор показывает все реакции перекиси водорода.
Чтобы отличить иадугольную кислоту от перекиси водорода, раство-
ряют 10 г подпетого калия в 30 лл воды и прибавляют 0,1—0,3 г перкар-
боната калия, растертого в очень тонкий порошок, причем происходит
моментальное выделение обильного количества иода:
СзОо" + 2J' -> 2СОз" + К
Перекись водорода выделяет иод из раствора йодистого калия значи-
тельно медленнее.
1. Азотнокислое серебро и хлористый барий дают белые осадки, рас-
творимые в азотной кислоте.
2. Перманганат калия обесцвечивается перкарбонатами с выделением
большого количества газов; в нейтральном растворе осаждается двуокись
марганца:
ЗС:О0" + гМпОГ ->4СОз" + 2С0а + 2МпОз + 30г;
бСзОб" + 2МпО/ + 16Н- -> 2МгГ + 1ОСО2 + 502 + 8Н2О.
Борная кислота Н3ВО3
Нахождение в природе. Борная кислота встречается в природе в сво-
бодном состоянии ® виде сассолина; в виде натриевой соли, буры, или
гинкала NasBiO? • ЮНаО; в виде борацита 2Mg3BsOis • MgCh и во многих
силикатах, как например, аксинит, турмалин, датолит и др-
412
Свойства. Кристаллическая борная кислота представляет собой бесцвет-
ные с перламутровым блеском чешуйки, легко растворимые в воде (100 ч.
ноды растворяют при 15° 4 ч. борной кислоты и 33 ч. при 100°).
Водный раствор имеет весьма слабую кислую реакцию и плохо про-
водит электрический ток; первая константа диссоциации равна 1,7 • 10-0
при 18° и 2,3- 10'“ при 25°. IB присутствии нейтрального глицерина или, что
еще лучше, маннита СвНв(ОН)в образуется комплексная глицерин- или
маннитборная кислота, константа диссоциации которой составляет около
7 • 10-в.
При 100° борная кислота теряет 1 молекулу воды и переходит в мета-
борную кислоту НВОг; последняя при дальнейшем нагревании до 160° пре-
вращается в пироборную (тетраборную) кислоту fwBiOt, которая при про-
каливании теряет всю воду и оставляет ангидрид борной кислоты, трех-
окись бора В’Оз, в виде труднолетучего гигроскопического стекла.
Соли барной кислоты (бораты) являются производными мета- и пиро-
борной кислот. Соли орт-оборной кислоты НзВОз в чистом виде неизвестны.
В нескольких специальных реакциях бор функционирует как металл,
образуя соединения 1 ’и 1 ISO •• »>, (B0)»SC)4, BFs, ВРОз и т. п. Последнее со-
единение не растворимо в воде и разбавленных кислотах, но легко рас-
творимо в едких щелочах.
Растворимость боратов. Бораты щелочей растворяются в воде; водный
раствор имеет щелоцую реакцию.
Концентрированный раствор буры ведет себя, как раствор метаборно-
кислого натрия, свободной борной кислоты и небольшого количества едкого
натра: ♦
ВЮ?" + ЗНЮ ->2ВОз' + 2НзВОз;
ВО/ 4- 2Н-0 -+ ОН' + НзВОз.
Чем разбавленнее раствор, тем большие размеры принимает гидролиз
согласно вышеприведенному второму уравнению и очень разбавленный рас-
твор буры ведет себя так, как раствор едкого» иатра и борной кислоты.
Поэтому раствор щелочного бората должен различно относиться к ре-
активам, смотря по его концентрации и температуре.
Остальные бораты в воде трудно растворимы', легко растворимы в кис-
лотах и в растворе хлористого аммония.
Реакции мокрым путем
Для этих реакций следует пользоваться раствором буры.
1. Разбавленная серная кислота не .реагирует. Серная или
хлористоводородная кислота, прибавленная к концентрирован-
ному водному раствору бората, может осадить борную кислоту.
2. Концентрирования серная кислота не производит видимой
реакции.
Большинство боратов разлагается концентрированной серной
кислотой с выделением борной кислоты; свободная борная кис-
лота окрашивает несветящееся газовое пламя в характерный зе-
леный цвет.
3. Концентрированная серная кислота и спирт. Если к бор-
нокислой соли щелочного или щелочноземельного металла
в фарфоровом тигле прилить спирт (лучше всего метило-
вый), затем концентрированную серную кислоту, перемешать и
зажечь, то края пламени будут окрашены в зеленый цвет вслед-
ствие образования борнометилового эфира В(ОСНз)з.
Лучше всего поступают следующим образом. Около 0,2 г твердого
вещества или остатка, полученного при выпаривании подщелоченного NaOH
раствора, помещают в 15-сч пробирку, закрытую (резиновой пробкой
с двумя отверстиями. Через одно из них проходит трубка, кончающаяся
413
непосредственно под пробкой и оттянутая снаружи я капилляр; через
другое — доходящая почти до дна пробирки трубка, согнутая снаружи под
прямым углом и служащая для продувания воздуха. Прибавляют к веще-
ству 1 мл концентрированной серной кислоты и осторожно приливают 6 -МД
метилового спирта СНзОН. Продувая воздух через жидкость, приводят
выходящие пары в соприкосновение с бесцветным пламенем бунзеновской
горелки. В присутствии борной кислоты происходит образование борно-
мети.тового эфира, пары которого сообщают пламени характерную зеленую
окраску. Проводимой таким путем реакции Ва и Си не мешают.
4. Азотнокислое серебро образует в умеренно концентриро-
ванных холодных растворах буры белый осадок метаборнокис-
лсго серебра:
NacB-iO; + ЗН2О -I- 2AgNOs -> 2Na,\:O:> 2НзВ()з + 2AgBO2.
При нагревании образуется бурый осадок окиси серебра:
2AgBO,- + ЗН2О ->2НзВОз 4- AgsO.
В очень разбавленных растворах окись серебра осаждается
уже на холоду.
Борнокислое серебро растворимо в аммиаке и азотной
кислоте.
5. Хлористый барий осаждает из умеренно концентрирован-
ных растворов белый .мстаборат бария:
Na2B4O7 1- BaCh + 3H>0 ->2NaCl + 2Н.зВОз + Ва(ВО2)г.
Метаборат бария растворим в избытке хлористого бария и
в хлористом аммонии.
6. Кальциевые и свинцовые соли реагируют аналогично ба-
риевым солям.
7. Куркума. Куркумовая бумага, смоченная водным раство-
ром свободной борной кислоты, нс изменяется в окраске, но,
будучи высушена, она окрашивается в красно-бурый цвет. При
погружении побуревшей бумаги снова в раствор борной кислоты
окраска не изменяется; не изменяется она также при погруже-
нии в разбавленную соляную или серную кислоту (отличие от
щелочей). Красно-бурая бумага, смоченная раствором едкого
кали или натра, окрашивается в переходящий сине-черный цвет
или при малых количествах борной кислоты в серовато-синий
цвет.
Оттенок и интенсивность окраски вариируют с количеством как кур-
кумы, так и борной кисло гы. При очень малых количествах борной кис-
лоты и куркумы в очень разбавленных растворах едкого натра появляется
почти чисто фиолетовая окраска; при значительной же концентрации бор-
ной кислоты и едкой щелочи образуется зелено-черная окраска.
Растворы борнокислых солей, подкисленные разбавленной соляной кис-
лотой, дают ту же реакцию. Этой весьма чувствительной и удобной ре-
акцией для открытия борной кислоты необходимо пользоваться осторожно,
так как солянокислые растворы циркония, титановой, танталовой, ниобие-
вой и молибденовой кисли г также окрашивают куркумовую бумагу в бу-
рый цвет.
Реакцию можно сделать значительно более чувствительной следующим
образом. Экстрагируют несколько кусочков корня куркумы этиловым спиртом
414
и к 2—3 каплям полученного желтого раствора прибавляют в Фар-
форовой чашке испытуемую на борную кислоту жидкость; затем, под-
кислив уксусной кислотой, выпаривают на водяной бане досуха. В при-
сутствии 0,02 лг ВзОз остаток окрашивается очень явственно в красно-
бурый цвет и даже 0,002 лег дают еще видимую реакцию -[Гена
(F. Henz)].
Об открытии следов бора в органических веществах с помощью кур-
кумовой реакции см. Г. Бертран и Г. Лгулон (Bertrand ct Н. Agullion) К
8. Соли окиси ртути дают красный осадок основных ртутных
солей. В присутствии больших количеств свободной борной
кислоты осадок не образуется. Осадок растворим в разбавленных
кислотах.
* Добавление редактора. 9. Хромотроп 2В (р-нитробензолазо-
хромотроповая кислота), относящийся к азокрасителям и имею-
щий следующее строение:
ОН ОН
является чувствительным реактивом для открытия борной кис-
лоты 2. В фарфоровую чашечку помещают каплю исследуемого
слабощелочного раствора и .выпаривают досуха.. К еще теплому
остатку прибавляют 2—3 капли 0,005%-ного раствора «хромой-
тропа 2В» в концентрированной серной кислоте, перемешивают
и охлаждают. В присутствии борной кислоты происходит изме-
нение голубовато-фиолетовой окраски в зеленовато-голубую*
С помощью этой реакции можно открыть еще 0,08 у бора’
в 0,04 мл раствора, что отвечает предельной концентрации
1 :500 000. Реакции мешают фториды и окислители. Об усло-
виях выполнения реакции в присутствии последних см. ориги-
нальные работы. Там же приведен синтез хромотропа 2В. *А. К.
Отношение боратов к прокаливанию
Щелочные бораты, ’содержащие воду, при плавлении сильно
вспучиваются, образуя бесцветные стекла.
Эти стекла обладают способностью растворять при высокой
температуре многие окислы металлов, причем часто образуются
характерно окрашенные метаборнокислые соли (перл буры);
так, например, окись меди растворяется, образуя синее стекло:
NaoBiOy-b CuC -> 2NaBOs + Cu(BO2)2,
’ Bull. chim. [4] 15, 197 (1914).
- А. С- Комаровский и H. С. Полуэктов, Ж. Пр. X., 7, 811
(1934) и Mikrocheniie 14, 314 (1933—1934).
415
При нагревании перла в восстановительном пламени (следо-
вательно, с углем) возможны два случая:
а) Окрашенная соль окиси меди восстанавливается в бесцветную
соль закиси:
4NaBO2 + 2Си(ВОг)2 + С -> СО + 2Na2B4O7'+ 2NaBO2 -ф
4* Си2(ВОг)2.
б) Соль окиси меди восстанавливается до металлической меди,
перл становится красно-бурым и непрозрачным:
4NaBO2 + 2Си(ВО2)г + 2С->2СО ф 2Na2B4O7 ф 2Cu.
Надбормая кислота НВО3
Все соли надборной кислоты (пербораты) в большей или меньшей
степени гидролизуются водой. Водный раствор их дает характерные реак-
ции перекиси водорода и метаборат-ионов:
ВОз' + НгО -> ВОг’ + НгОг.
Типичные реакции аниона надборной кислоты основаны на его окисляю,
гцем действии.
Реакции мокрым путем
1. Бихромат калия переходит в надхромовую кислоту, раство-
ряющуюся в эфире с синим окрашиванием (стр. 226). Раствор
хромовых квасцов также дает синюю окраску при взбалтывании
с перборатом и эфиром (отличие от надугольной кислоты).
2. Треххлористый титан дает красное окрашивание, а трех-
хлористый церий окрашивается в желтый цвет.
3. Перманганат калия обесцвечивается; в случае нейтрального
или щелочного раствора выпадает черная двуокись марганца.
4. Соли марганца, никеля и кобальта (нитраты или сульфаты)
дают черный осадок MnOs, Ni(OH)s и Со(ОН)з.
5. Иодистый калий выделяет иод только в кислом растворе.
соон
Щавелевая кислота И,С,О., I
'' 4 СООН
Нахождение в природе. Щавелевая кислота весьма распространена
в растительном царстве в виде кислых солей кальция и калия. Она была
также найдена в форме включений в бурых углях в виде щавелевокислых
солей двухвалентного железа ih кальция. В моче животных всегда имеются
небольшие количества щавелевокислого кальция'.
Получение, Щавелевую кислоту .получают в больших количествах на-
греванием древесных опилок с расплавленным едким кали. Получающуюся
калиевую соль осаждают известковым молоко-м, дающим нерастворимую
кальциевую соль, которую затем .разлагают серной кислотой. Щавелевая
кислота образуется также при окислении концентрированной азотной кис-
лотой многих органических веществ, как, например, сахара, крахмала и
целлюлозы (бумаги).
416
Щавелевая кислота кристаллизуется из водного1 раствора в виде моно-
клинических бесцветных призм Н2С2О4 •’2НгО. Содержащая кристаллиза-
ционную воду кислота растворяется в воде, спирте и эфире: 100 ч. воды
при 20° растворяют 11,1 ч., 100 ч. спирта при 15° — 33,2 ч. и 100 ч. эфира
при 15°—1,5 ч. щавелевой кислоты.
Водная кислота при стоянии над серной кислотой теряет воду, пре-
вращаясь в безводную кислоту, которая' при температуре около 150° возго-
няется в виде игл. При более высокой температуре она полностью раз-
лагается на воду, двуокись и окись углерода:
НгСгО4-> Н12О 4- СОг + СО.
Свойства. Щавелевая кислота — довольно сильная двухосновная кислота,
образующая нейтральные и кислые соли, например оксалат калия КгСгО4;
биоксалат калия КНС2О4; тетраоксалат калия КНСгСЧ • НзСгО1* • 2НгО.
Растворимость оксалатов. Соли щавелевой кислоты, называемые окса-
латами, большею частью не растворяются в воде, за исключением солей
магния и щелочных металлов.
Характерной для щавелевой кислоты является ее способность к обра-
зованию комплексных анионов с ионами трехвалентного хрома и ионами
металлов группы железа следуюп^го1 типа:
[РеП1(СгО4)9]'"; [СгШ(С2О4)3]'"; [МЩСгО^]" и т. п.
На образовании комплекса с трехвалентным железом основано удаление
тетраоксалатом калия КНС2О4 • Н2С2О4 • 2Н«О пятен ржавчины с тканей.
Щавелевая кислота является также хорошим растворителем для фос-
фата трехвалентного железа.
Все оксалаты растворимы в минеральных кислотах.
Реакции мокрым путем
Для нижеследующих реакций следует пользоваться раствором щавелево-
кислого аммония.
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота при нагревании, отни-
мая воду, выделяет равные объемы двуокиси и окиси углерода;
последняя горит синим пламенем:
(СООН)2-> Н2О 4- со 4- СО2.
3. Азотнокислое серебро осаждает белое творожистое щаве-’
левокислое серебро:
(СОО)2" 4- 2Ag- -> (COOAg)s,
почти не растворимое в воде, легко растворимое в аммиаке и
азотной кислоте.
4. Хлористый барий осаждает белый щавелевокислый барий,
растворимый при кипячении в избытке щавелевой и уксусной
кислот.
5. Хлористый кальций осаждает белый щавелевокислый каль-
ций, не растворимый в щавелевой и уксусной кислотах и щаве-
левокислом аммонии (отличие от фосфорной кислоты), легко
растворимый в -соляной и азотной кислотах. Из раствора в ми-
неральных кислотах аммиак снова осаждает щавелевокислый
27 Sait. 982. Тредвелл-Голл, т. I.
417
кальций. Последний наиболее трудно растворим из всех окса-
латов *.
6. Свинцовые соли осаждают белый щавелевокислый свинец,
растворимый в азотной кислоте.
7. Двуокись марганца, смешанная с щавелевой кислотой или
с оксалатом, при нагревании в воде, подкисленной несколькими
каплями концентрированной серной кислоты, вызывает окисление
оксалата, сопровождаемое сильным выделением двуокиси угле-
рода:
MnO'2 -J- Н2С2О4 + H2SO4 -> MnSOi + 2СО? + 2Н2О.
Точно так же действует марганцевокислый калий и разбавлен-
ная серная кислота при температуре около 60°; оксалат окис-
ляется в двуокись углерода и МпОт'-ион обесцвечивается:
2КМ11С1 + 5Н2С2О4 -h 3H2SO4-» 2K2SO4 -J- 2MnSO4 4- 8Н2О +
+ IOCO2.
8. Сульфат марганца и едкий натр. Чувствительная реакция
на щавелевую кислоту в присутствии соляной, серной, азотной,
фосфорной, уксусной, масляной, валериановой, лимонной, вин-
ной, бензойной и салициловой кислот, а также в присутствии
фенола или небольших количеств муравьиной кислоты произ-
водится следующим образом.
Растворяют небольшой кристалл (3—5 лз) сульфата марганца в несколь-
ких каплях воды, прибавляют каплю раствора едкого натра, немного на-
гревают и, охладив, прибавляют по каплям раствор щавелевой кислоты или
оксалата, слегка подкисленный серной кислотой и не содержащий восста-
новляющих веществ. Осадок марганцоватистокислой соли двухвалентного
марганца, образовавшийся при действии едкого натра на сульфат марганца,
растворяется при действии щавелевой кислоты, и появляется красное окра-
шивание, которое, вероятно, обусловлено образованием [Мп(СгО1)з]"'.
9. Сульфат или хлорид марганца дают почти белый кри-
сталлический осадок оксалата марганца:
Мп’ • + GOi' + ЗН2О -> MnCeCh • ЗН2О.
10. Фосфат окиси железа в растворе фосфорной кислоты
две г темножслтую окраску с теплым раствором оксалата.
11. Резорцин C«Hi(OH)2, растворенный в 100-кратном (по
весу) количестве концентрированной серной кислоты, дает си-
нее окрашивание при добавлении к сухому оксалату и нагрева-
нии до появления паров серной кислоты,
* Добавление редактора. 12. Образование анилиновой сини2.
При сплавлении щавелевой кислоты с дифениламином образуется
1 За исключением оксалатов редких земель, которые весьма трудно рас-
творимы в рззщщленных минеральных кислотах.
’Feiy! u. Гт eh den, М.Ю uclicii.i-j 18, 272 (1C35),
418
анилиновая синб, краситель 'фуксинового ряда. Эта реакция
отличается своей специфичностью и однозначностью. Открывае-
мый минимум: 5у щавелевой кислоты.
Выполнение. Кристаллик исследуемого вещества (если последнее нахо-
дится в растворе, его выпаривают досуха) сплавляют в микропробиркс
с небольшим количеством дифениламина на голом огне. Плав растворяют
в капле спирта; синее окрашивание служит указанием на присутствие
щавелевой кислоты. * А. К.
Анализ оксалатов
Оксалаты щелочноземельных металлов при кипячении с концентриро-
ванным раствором карбоната натрия подвергаются обменному раз-
ложению, причем образуются нерастворимые карбонаты щелочных земель
и растворимый оксалат натрия. Отфильтровав осадок, раствор можно
испытать на щавелевую кислоту. Но такое обменное разложение не всегда
удается с оксалатами некоторых других металлов, потому что вследствие
образования комплексных солей осаждение карбоната часто бывает непол-
ным. Так, например, оксалат никеля образует растворимую натриевую соль,
аниои которой [NKCsCh)»]". В так«х случаях для получения! водного рас-
твора щавелевой кислоты ив нерастворимого оксалата и для удаления ка-
тиона, мешающего реакциям на щавелевую кислоту, лучше всего неболь-
шое (количество вещества, растертого в порошок, всыпать в теплую воду
и насытить сернистым водородом. При этом образуется более трудно рас-
творимый сульфид, а раствор содержит щавелевую кислоту и, сернистый
водород:
NiCsOi + HsS -»NiS + НгСгО<.
Отношение оксалатов к прокаливанию
Вес оксалаты при прокаливании разлагаются с незначитель-
ным обугливанием. Щавелевокислые щелочные металлы,
а также и щавелевокислый барий дают карбонат с выделением
окиси углерода. Щавелевокислые соли благородных металлов,
а также железа, 'никеля, кобальта, меди и т. п. оставляют при
прокаливании металл, а остальные-— металлические окислы.
Винная кислота Н,С,Н,ОЬ.
i -1 4 Ь
Нахождение в природе. Винная кислота встречается во. многих плодах,
особенно в виноградном соке, частью в свободном состоянии, частью
в виде ее кислой калиевой соли.
Свойства. Свободная кислота кристаллизуется в прозрачных монокли-
нических призмах без кристаллизационной воды.
Рассмотрение структурной формулы винной кислоты
НО — сн — соон
I
НО —СН—соон
показывает, что в ее молекуле находятся два углеродных атома, каждый
из которых своими четырьмя валентностями связан ,с. различными атомами
или атомными группами. Так, каждый из этих углеродных атомов имеет
одну валентность, связанную с Н, одну —с ОН, одну — с СООН и одну
с С.Н(ОН)СООН. Такой углеродный атом называется - асимметрическим
углеродным атомом, и наличие его обусловливает существование так назы-
ваемых стереоизомерных соединений, т. е. соединений, у которых при оди-
наковом химическом сосщве атомы и атомные группы различно распо-
ложены вокруг асимметрического углеродного атома.
27*
419
Такого рода изомерные соединения обыкновенно имеют одинаковые
химические свойства, но отличаются друг от друга по формам своих кри-
сталлов и по способности отклонять в противоположных направлениях
поляризованный луч света, проходящий через их растворы.
Два асимметрических углеродных атома в молекуле винной кислоты
обусловливают существование четырех модификаций последней; изучение
этих кислот сыграло важную роль в развитии теоретической химии.
В одной из этих модификаций атомы расположены вокруг каждого асим-
метрического углеродного атома в таком порядке, что плоскость поляризо-
ванного света вращается ею вправо. Это — обыкновенная винная кислота,
называемая d-винной кислотой. В другой кислоте расположение атомов
Таково, что поляризованный луч отклоняется ею в противоположную сто-
рону; она называется I-винной кислотой Кристаллы этих веществ отно-
сятся друг к другу, как предмет к своему зеркальному изображению, или
как правая рука относится к левой руке; обе модификации образуют
сходные гемнэдрические кристаллы, но определенные плоскости располо-
жены у одной из них справа, у другой — слева.
Третья изомерная модиф»- лщ’т называе-’-'щ рацемической винной кис-
лотой (ь.щ виноградной кислотой). Она состоит из равных частей обеих
вышеописанных кислот и оптически неактивна. Четвертый изомер назы-
вается мезонинной кислотой. Он также оптически неактивен, потому что
внутри самой молекулы влияние атома, вращающего луч вправо, нейтра-
лизуется влиянием другого атома, настолько же вращающего плоскость по-
ляризованного луча влево.
Винная кислота очень легко растворима в воде (100 ч. воды растворяют
132 ч. винной кислоты при 15°) и спирте, но нерастворима в эфире.
Она является довольно сильной кислотой, первая константа диссоциации
которой равна 9,6 • 10~4 при 25°. Соли ее называются тартратами.
Растворимость тартратов. Нейтральные щелочные соли и кислая натрие-
вая соль винной кислоты очень легко растворимы в воде; трудно раство-
римы кислые калиевая и аммониевая соли.
Остальные тартраты в воде трудно растворимы, но все более или ме-
нее легко растворимы в нейтральных щелочных солях винной кислоты
с образованием комплексных солей. Эти комплексные соли часто маски-
руют реакции, которые типичны для металлических ионов, содержащихся
в них. Так, аммиак не осаждает из растворов тартратов железо, алюминий,
титан: хром, сурьму и олово Комплексные тартраты образуются также
марганцем, кобальтом, никелем, свинцом, медью, бором, молибденом и
другими элементами.
Важнейшими продажными виннокислыми солями являются:
винный камень, или «кремортартар», КНСдН-Юв,
сегнетова соль (соль Рошеля) KNaCiHiOe
и рвотный камень K(SbO)C4HiO6.
Реакции мокрым путем
Следует пользоваться раствором сегнетовой соли.
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота при нагревании обугли-
вает винную кислоту и ее соли с выделением сернистого анги-
дрида, окиси и двуокиси углерода и других газов.
3. Азотнокислое серебро не дает осадка в растворе с обод-
ной винной кислоты, но из растворов нейтральных ее солей тот-
час выделяет белый творожистый осадок виннокислого серебра:
СтНЮб" + 2Ag‘ _> C4H4O6Ag2,
1 Буквой d обозначают вращение плоскости поляризованного луча
вправо, буквой 1—влево. Ред.
420
Легко растворимого в азотной кислоте и аммиаке и в избытке
щелочной виннокислой соли. При нагревании аммиачного рас-
твора серебряной соли выделяется металлическое серебро.
Эту весьма важную для открытия винной кислоты реакцию выполняют
следующим образом. К чистому раствору виннокислой соли прибавляют
раствор азотнокислого серебра до прекращения дальнейшего образования
осадка; затем прибавляют несколько капель раствора едкого натра и также
по каплям очень разбавленный аммиак только до растворения осадка;
после этого пробирку с раствором ставят в воду, нагретую до 60—70°.
Спустя 15—20 мин. серебро выделяется на стенках пробирки в виде краси-
вого блестящего зеркала. В присутствии других кислот эта весьма чувстви-
тельная реакция не может быть с уверенностью произведена непосред-
ственно. В таких случаях выделяют сначала винную кислоту в виде кислой
виннокалиевой соли. Для этого концентрируют раствор до небольшого
объема и прибавляют поташ K»COj в твердом виде до щелочной реакции;
винная кислота превращается при этом в легко растворимую нейтральную
виниокалиевую соль. При осторожном подкислении полученного раствора
ледяной уксусной кислотой выделяется тотчас в присутствии более или
менее значительных количеств винной кислоты кислая внннокалиевая соль,
которую затем отфильтровывают, промывают малым количеством холодной
воды н растворяют по возможности в разбавленном растворе едкого натра.
Таким образом, получается раствор, легко дающий с азотнокислым сере-
бром н аммиаком серебряное зеркало.
Если при прибавлении ледяной уксусной кислоты осадок не образуется,
то прибавляют немного спирта, отчего тотчас появляется осадок. Послед-
ний отфильтровывают, промывают разбавленным спиртом, сушат и только
после этого, растворив в разбавленном едком натре, поступают, как выше
указано. Неудаление спирта может иногда, даже в отсутствие винной
кислоты, обусловить появление серебряного зеркала.
4. Хлористые кальций и барий. Хлористый кальций, приба-
вляемый по каплям к концентрированному раствору нейтральной
виннокислой щелочной соли, в отсутствие аммонийных солей
дает белый аморфный осадок, снова растворяющийся с образо-
ванием комплексного виннокальциевого аниона:
2С4Н40б" [Са(С4Н40б)г]\
Лишь по прибавлении хлористого кальция в количестве, доч
статочном для полного разложения виннокалиевой соли, обра-;
1уется неисчезающий хлопьевидный, скоро кристаллизующийся
эсадок нейтрального виннокислого кальция:
[Са(С4Н4О!б)г]" -f- Са’ '' -> 2СаС4Н4Об.
г
В разбавленном растворе осадок от прибавления хлористого кальция
значале часто не образуется; только после продолжительного стояния или
быстрее при тренин стеклянной палочкой о стенки пробирки выделяется
кристаллический осадок: CaCiHaOs • 4НгО. Виннокислый кальций трудно
растворим в воде: 100 ч. воды растворяют при 15° 0,0159 ч., а 100 ч. ки-
пящей воды—0,0285 ч. кристаллической соли. Осадок растворяется в уксус-,
яой кислоте (отличие от щавелевокислого кальция), а также и в умеренно
концентрированном (1 : 5), свободном от угольной кислоты едком кали или
натре, вероятно, вследствие образования комплексной соли:
2CaC4HiOo + 2ОН'-> НгО + [(CaCiHiOtJsO]",'
При кипячении этого раствора виннокальциевая соль выделяется в виде
объемистого студенистого осадка, который при охлаждении снова раство-
421
ряется1. Присутствие хлористого аммония замедляет образование винно-
кальциевой соли, но не препятствует ему: после продолжительного стояния
выделяется тяжелый кристаллический осадбк (отличие от лимонной кислоты).
Кальциевая соль d, /-винной (виноградной) кислоты менее растворима,
чем кальциевая соль (/-винной кислоты, и обладает шелковистым блеском.
В присутствии ионов алюминия, трехвалентного железа и антимонила,
образующих с винной кислотой комплексные соли, тартрат кальция не
выпадает.
5. Калиевые соли не выделяют осадка из нейтральных рас-
творов виннокислых щелочей; при подкислении же раствора
уксусной кислотой выпадает тотчас или спустя некоторое время,
смотря по концентрации раствора, кристаллический кислый вин-
нокислый калий:
CiHlOe" + К’ + Н KHCiHiOe.
Кислый виннокислый калий в воде трудно растворим (100 ч. воды
растворяют 0,45 ч. соли), а также в уксусной кислоте; напротив, легко
растворим в минеральных кислотах, едких и углекислых щелочах.
Осадок может быть растворен в небольшом количестве аммиака, и
с раствором может быть произведена реакция с хлористым кальцием
(стр. 421).
Хлористый калий дает с концентрированным раствором свободной
винной кислоты осадок винного камня (кислого виннокислого калия), не-
смотря на присутствие образующейся свободной соляной кислоты; в раз-
бавленных растворах осадок образуется лишь по прибавлении уксусно-
кислого натрия (стр. 312).
Присутствие большого количества борной кислоты либо очень заме-
дляет, либо совсем задерживает осаждение кислого тартрата калия, В этом
случае открытие винной кислоты производят следующим образом. К воз-
можно концентрированному раствору прибавляют хлористый аммоний,
затем избыток раствора хлористого кальция и для ускорения образования
осадка трут внутренние стенки пробирки стеклянной палочкой. При боль-
шом количестве винной кислоты тотчас образуется кристаллический осадок;
при малом же — лишь после продолжительного стояния (24 часа). Для
идентификации винной кислоты отфильтровывают осадок, промывают
2—3 раза разбавленным спиртом, растворяют его на холоду в ввежеприго-
товленном растворе едкого кали (1:5) и фильтруют. При кипячении филь-
трата выделяется аморфный тартрат кальция. Другой надежный метод
идентификации винной кислоты в кальциевом осадке состоит в следующем.
Промытый осадок переносят в пробирку, прибавляют кристалл азотно-
кислого серебра, несколько капель аммиака и нагревают, поставив пробирку
в горячую воду. В присутствии винной кислоты на стенках пробирки обра-
зуется отчетливое серебряное зеркало.
6. Уксуснокислый свинец выделяет из нейтрального раствора
белый хлопьевидный осадок тартрата свинца, легко раствори-,
мый в азотной кислоте и аммиаке.
7. Магнезиальная смесь. Если к концентрированному раствору
винной кислоты прибавить избыток хлористого магния, 10 лл
концентрированного аммиака и такой же объем спирта и за-
тем, взболтав, оставить на 12 час., то винная кислота выделится
1 Эту реакцию производят следующим образом. Приблизительно
к 0,5 мл не очень разбавленного раствора сегнетовой соли прибавляют по
каплям CaCh до образования .неисчезающего осадка. Затем по каплям же
приливают концентрированный раствор едкого кали или натра и взбалты-
вают; осадок при этом легко растворяется. Разбавив полученный раствор
приблизительно 15 .«.< воды и прокипятив, тотчас наблюдают выделение
аморфной соли,
422
количественно в виде основного кристаллического тартрата маг-
ния, который в 50%-ном спирте совершенно не растворим (от-
личие от яблочной и янтарной кислот):
ПНЮ/' 4- 2Mg' ' % 2ОН' + НЮ+ Н2О.
Если промытый 50%-иым спиртом и высушенный осадок растереть
в пробирке с раствором азотнокислого серебра при помощи стеклянной
по.ючки, затем прибавить аммиак и нагрегь првб.нгплельио до 60° на
водяной бане, то образуется серебряное зеркало.
8. Соль окиси железа(2), прибавленная в небольшом коли-
честве к свободной винной кислою или к ее щелочной соли,
дает с двумя каплями перекиси водорода или несколькими кру-
пинками перекиси натрия красивую фиолетовую окраску. Этой
чувствительной реакции не-дают лимонная, малоновая и янтарная
кислоты.
9. Хромат калия. Если кристалл винной кислоты облить при
комнатной температуре раствором хромат калия, то люлучается
пурпурнофиолетовое или черное окрашивание раствора, причем
выделяется двуокись углерода. Кристаллы лимонной кислоты
при тех же условиях дают кофейнобурое окрашивание.
Для проведения реакции в водном растворе к раствору тар-
трата добавляют небольшое количество разбавленной серной кис-
лоты, 1—2 капли раствора хромата или бихромата и некоторое
время нагревают; желтая окраска хромата постепенно изменяется
в синевато-фиолетовую.
10. Молибдат аммония в слабокислых растворах с небольшим
количеством винной кислоты и 1—2 каплями перекиси водорода
дает при нагревании до 60' сперва бледножелтую окраску, ко-
торая переходит в зеленую, и, наконец, в синюю.
11. Резорцин в концентрированной серной кислоте (1:100)
с небольшим количеством твердой винной кислоты или тартрата
дает при нагревании до появления .паров серной кислоты винно-
красное окрашивание. Этой реакцией можно обнаружить следы
винной кислоты; нитраты, нитриты, хлораты и другие окислители
мешают реакции.
* Добавление редактора. 12. Галловая кислота 4 При нагрева-
нии винной кислоты или ее кальциевой соли с галловой кисло-
той в присутствии концентрированной верной кислоты появляется
синее, а при малых количествах тартрата—сине-зеленое или
желто-зеленое окрашивание. Эта реакция основана на том, что
винная кислота путем окисления и отщепления СОг превра-
щается в гликолевый альдегид НСО — СНзОИ, который с гал-
ловой кислотой дает окрашенный продукт конденсации.
Выполнение. Небольшое количешво кальциевого осадка, исследуемого
на присутствие винной кислоты, собранного и промытого на плотном
фильтре,' осторожно снимают с фильтровальной бумаги (избегая попадания
1 Е. Е I g г i v е, Z, anal. Chem. 89, 121 (1932).
423
волокон бумаги, которые дают аналогичную реакцию), переносят в про-
бирку и нагревают с 1 .ил реактива (0,01 г галло-вой кислоты в 100 лл
96%-ной серной кислоты) ва голом огне до 120—150°. В зависимости от
количества винной кислоты получают раствор, окрашенный в синий цвет
(при 100 Y винной кислоты) и в желтовато-зеленый (при 2 т).
При очень малых количествах осадка кальциевую соль растворяют на
фильтре в серной кислоте и для реакции берут* каплю фильтрата * А. К.
Реакции сухим путем
Свободная винная кислота шлавится при 170° и разлагается
при более высокой температуре с выделением угля и продуктов
сухой перегонки (имеющих запах жженого сахара).
Щелочные тартраты также разлагаются при прокаливании,
причем остаются уголь и углекислая щелочь.
Остаток от прокаливания при действии на него кислоты
шипит.
Виннокислый аммоний оставляет только уголь; остаток от
прокаливания не шипит при прибавлении кислоты.
Щелочноземельные тартраты оставляют наряду с углем кар-
бонат, при более сильном прокаливании — окись.
Виннокислые соли тех металлов, окиси которых восстанавли-
ваются углем до .металла, дают в остатке металл (Ag, Pb, Fe, Ni,
Со и т. п.).
сн2-соон
Лимонная кислота Н3СЦН-О; но-с—соон
сн.-соон
Нахождение в природе и свойства. Лимонная кислота находится в соке
многих плодов. Она является трехосновной кислотой, легко растворимой
в воде и спирте и трудно растворимой в эфире. Чистая кислота пред-
ставляет собой кристаллы без цвета и запаха, обыкновенно содержащие
три молекулы кристаллизационной воды НзСвНзО? • ЗН>0. Осторожно на-
гретая до 55°, она теряет кристаллизационную воду; безводная кислота
плавится при 153°, а при более высокой температуре начинает разлагаться,
выделяя резко пахнущие пары, запах которых сходен с запахом продуктов
разложения, образуемых винной кислотой в тех же случаях. Водный
раствор ее оптически недеятелен и обладает довольно сильными кислот-
ными свойствами; величина ее первой константы диссоциации 8,7 • 16~4
(при 25°). Прозрачные кристаллы лимонной кислоты выветриваются на воз-
духе, теряя кристаллизационную воду; кристаллы при этом становятся
непрозрачными и рассыпаются в порошок.
Соли лимонной кислоты называются цитратами.
Растворимость цитратов. Щелочные цитраты легко растворимы в воде
и образуют легко растворимые комплексные соли с трудно растворимыми
лимоннокислыми солями тяжелых металлов; последние растворы не дают
осадка с едкими и углекислыми щелочами, аммиаком и т. п.
Реакции мокрым путем
Следует употреблять раствор лимоннокислого калия.
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота при нагревании, как и
в случае большинства оксикислог, сперва отщепляет муравьиную
424
кислоту, которая распадается на СО и НгО; наряду с этим обра-
зуется ацетондикарбоновая кислота, дающая при отщеплении
CQ2 ацетон:
СЩ—СООН
I /ОН
С<
|хсоон
сн2—соон
лимонная
кислота
-» HCOOH 4-
сна~соон
I
с = о
муравьиная
кислота
сн2—соон
ацетондикарбоновая
кислота
нсоон -> ср + НгО
СН2 —СООН сн3
С = О -> 2СО2+ С = О
сн2—соон сн3
ацетон
Часть лимонной кислоты при этом обугливается; уголь же
восстанавливает серную кислоту до SO2.
3. Азотнокислое серебро образует в нейтральных растворах
хлопьевидный осадок лимоннокислого серебра AgsCeHsO?, легко
растворимый в азотной кислоте и аммиаке. При нагревании
аммиачного раствора до 60° не образуется серебряного зеркала
(отличие от винной кислоты); но при нагревании раствора до
кипения происходит постепенное выделение серебра.
4. Хлористые барий и кальций не выделяют осадка из ней-
тральных растворов (отличие от винной кислоты). Но если
к раствору прилить едкий натр в присутствии избытка хлори-
стого кальция, то тотчас появляется хлопьевидный осадок сред-
него лимоннокислого кальция, не растворимого в едком кали и
легко растворимого в хлористом аммонии. При кипячении рас-
твора, содержащего хлористый аммоний, выделяется кристалли-
ческий лимоннокислый кальций, который уже не растворяется
в хлористом аммонии.
5. Известковая вода, прибавленная в избытке, не дает осадка
в нейтральных растворах лимоннокислых солей, при нагревании
же осаждается трехосновный лимоннокислый кальции в виде
хлопьевидного белого осадка, почти вполне растворяющегося
при охлаждении.
6. Уксуснокислый свинец осаждает белый аморфный лимонно-
кислый свинец РЬ3(СбН5О-)2 • Н;О как из растворов свободной
кислоты, так и из растворов нейтральных солей.
7. Реакция Штаре (L. Stahre) >. К водному раствору свободной лимон-
ной кислоты или к раствору цитрата в очень разбавленной серной или
> Z. anal. Chem. 36, 195 (1897); далее Alfred W б h I k, ibid. 41,94(1902).
425
азотной кислоте (но не соляной) прибавляют 2—5 капель 0.17V раствора
перманганата калия и нагревают в течение непродолжительного времени
до 30—40° (только не кипятить!). Как только раствор побуреет или по-
мутнеет от незначительного выделения двуокиси .марганца, прибавляют
1—2 капли раствора оксалата аммония н около 1 мл 10%-ной серной кис-
лоты, причем жидкость становится прозрачной, как вода. Теперь прибав-
ляют несколько капель бромной воды. При этом происходит выделение
кристаллического осадка пентабромацетона. Бромная вода может быть
добавлена до прибавления раствора перманганата и в некоторых случаях
это дает лучшие результаты.
Эта реакция настолько чувствительна, что ею в 1 дл воды можно от-
крыть 0,3 мг лимонной кислоты.
При реакции Штаре происходят следующие процессы:
а) Перманганат калия окисляет лимонную кислоту при 30—40’ в аце-
тондикарбоновую кислоту с выделением СО_>:
СН2—СООН сн2 —соон
I /ОН I
с< 4 О —> СО., 4 Н,0 4- с = о
рсоон |
сн2—соон сн2—соон
лимонная кис юта ацетондикарбоновая
кислота
б) ацеюндикарбоновая кислота дает с бромом пенгабромацетон:
СН, —СООН СНВг2
с = О -4- 5Вг., —> 2СО2 4- 5НВг -I- С = О
I “ I
СН»—СООН СВг,
ацетоидитрбонова» пентабром-
кислота ацетон
Но та® как ацетовдикарбоновая кислота переходит с отщеплением СО:
постепенно на холоду и быстро при нагревании в ацетоны
СН2 —СООН СН3
С = О —> 2СО. 4- СО
I ‘ I
сн,—соон сн3
ацетондякарбоновая ацетон
кислота
который бромной водой не бронируется, то очень важно не выходить за
пределы предписываемой температуры в 30—403.
Цитраты дают с бромом непосредственно иенгабрэмацетоп без предва-
рительного окисления перманганатом:
СН, —COOK СНВг,
I /ОН I
с< 4- 6Вг, —► ЗКВг 4- ЗСО, 4- 4НВг 4- с = о
Iхсоок I
СН2— COOK СВг’
Реакция с успехом может быть проведена также в присутствии винной,
малоновой, щавелевой, серной и фосфорной кислот, только приходится
затрачивать несколько больше перманганата.
428
В. Реактив Дениже (Denigfa) 5 г окиси ртути растворяют в смеси
из 100 мл воды и 20 мл концентрированной серной кислоты. К раствору,
содержащему цитрат, прибавляют ’/sn объема вышеприведенного реактива,
нагревают до кипения и приливают 3—10 капель раствора перманганата;
тотчас образуется белый кристаллический осадок:
HgsO2SO< • 2[CO(CHeCOO)2]Hg.
Осадок представляет смесь основного сульфата ртути:
/О - Hg.
Hg/ >so4
\o-Hg/
й ртутной соли ацетондикарбоновой кислоты:
СН.,- СОО *
С = О >Hg
сн2—cooz
Реакция очень чувствительна: 0,5 г лимонной кислоты в. 1 д дают еще
отчетливую реакцию.
Реакция, однако, не специфична, так как присуща всем кетосоедине-
ииям.
9. Окрашивание при нагревании. Лимонную кислоту можно отличить
от щавелевой, винной щ малоновой кислот по сивей или зеленой окраске,
получающейся следующим путем. В трубку из тугоплавкого стекла, за-
паянную с одного конца, вносят по меньшей мере 0,01 г лимонной кис-
лоты и избыток аммиака (3 мл). Другой конец трубки запаивают так,
чтобы над жидкостью оставалось очень небольшое пустое пространство.
Трубку нагревают в течение 6 час. при 110—120". Охладив, обламывают
конец трубки и содержимое ее выливают в неглубокую фарфоровую
чашку. Спустя несколько часов, при стоянии чашки на свету, продукт
реакции окрашивается в синий или зеленый цвет.
Эту характерную окраску можно получить еще следующим образом.
К лимонной кислоте прибавляют немного глицерина (несколько меньше взя-
того количества лимонной кислоты) и слегка нагревают до тех пор, пока
масса не начнет вспучиваться. После этого остаток растворяют в аммиаке,
выпаривают большую часть жидкости, прибавляют немного воды и 2 капли
дымящей азотной кислоты, разбавленной 5-кратным количеством воды.
• Сперва появляющееся зеленое окрашивание переходит при нагревании на
' водяной бане в синий цвет. Вместо азотной кислоты можно пользоваться
перекисью водорода.
Реакция сухим путем
\ Лимоннокислые соли относятся к прокаливанию точно так
же, как и виннокислые.
Фосфористая кислота Н8РО8
Получение. При медленном сгорании фосфора на воздухе образуется
трехокись фосфора — ангидрид фосфористой кислоты, дающий с холодной
водой фосфористую кислоту:
РЮз + зню -^гНзРОл.
Еще легче получить ее путем разложения трехгалоидных соединений
фосфора водой:
PCh + ЗНОН -> ЗНС1 + НзРОз.
1 С. г. 13$, 32 (1904) и Z. ашН. Chem, 38, 718 (1899); 40, 121 (1901).
427
Образующуюся хлористоводородную кислоту удаляют выпариванием,
а воду — путем нагревания до 180°. По охлаждении масса отвердевает
в расплывающееся кристаллическое вещество, плавящееся при 73,6°.
При нейтрализации фосфористой кислоты основаниями получаются соли
ее, называемые фосфитами. При этом, однако, никогда не удается заместить
металлами больше двух водородных атомов, и поэтому фосфористую
кислоту обыкновенно рассматривают как двухосновную кислоту1 *, средней
силы с константами диссоциации: Ki = 1 • 10~3; Кг = 2 • 10~’.
Чтобы подчеркнуть неравноценность водородных атомов (способность
только двух из них замещаться на металл) фосфористой кислоты, ей при-
писывают формулу:
НО, /О
нох хн
Комплексная формула Вернера-Льюиса имеет вид:
Н
2
Г н 1
ОРО
° J
(см. примечание к стр. 400).
Фосфористая кислота — сильный восстановитель: уже на воздухе она
превращается в фосфорную кислоту.
Растворимость фосфитов. Только щелочные соли фосфористой кис-
лоты растворяются в воде, в кислотах же растворяются все соли.
Реакции мокрым путем
Следует употреблять раствор фосфористокислого натрия.
1. Разбавленная серная кислота не реагирует.
2. Концентрированная серная кислота на холоду не реагирует;
при нагревании же серная кислота восстанавливается фосфори-
стой в сернистую кислоту:
НзРОз;+ H2SO4 -> НзРОз + НгО + SO2.
3. Азотнокислое серебро сначала образует белый осадок
фосфористокислого серебра:
НРОз" 4-2Ag'Ag2HPO3,
которое при ведении реакции в концентрированном растворе
уже на холоду, а в разбавленном растворе при нагревании, выде-
ляет черное металлическое серебро:
AgaHPOs rh Н2О -> Н3РО4 + 2Ag.
4. Хлористый барий осаждает белый фосфористокислый ба-
рий, растворимый во всех кислотах.
5. Уксуснокислый свинец осаждает фосфористокислый сви-
нец, не растворимый в уксусной кислоте.
6. Хлорная ртуть восстанавливается фосфористой кислотой
в хлористую, медленно на холоду, быстро при нагревании:
2HgCk 4* НзРОз 4~ НгО-> Н3РО4 4с 2НС1HgjCh.
1 В органической химии известны соединения, являющиеся производ-
ными трехосновной фосфористой кислоты НзРО».
428
В присутствии избытка фосфористой кислоты восстановление
при нагревании (но не на холоду) идет дальше, причем выде-
ляется серая металлическая ртуть:
HgzCh + НзРОз Н2О-> НзРО4 + 2НС1 + 2Hg.
7. Сернистая кислота восстанавливается фосфористой кисло-
той до сернистого водорода:
ЗНзРОз + H2SO3-> ЗНзРОа + H2S.
В кипящем растворе происходит выделение серы:
SO2 + 2НРОз" S -J- 2НРОЛ
8. Цинк в сернокислом растворе восстанавливает фосфори-
стую кислоту в фосфористый водород:
НзРОз + 3Zn + 6Н- -> 3Zn' ’ + ЗН2О + РНз.
' При действии фосфористого водорода на концентрированный раствор
нитрата серебра (1:1) или, что еще лучше, на твердый нитрат серебра
последний окрашивается в желтый цвет (так же как мышьяковистым водо-
родом):
РНз + 6AgNOs ->PAg3 • 3AgNOs + 3HNOj.
Это желтое соединение разлагается водой с выделением серовато-белого
серебра:
PAgs • 3AgNOs + ЗНгО -> ЗН1УОз + НзРОз + 6Ag.
Но образующаяся при этой реакции фосфористая кислота тотчас оки-
сляется азотной кислотой в фосфорную кислоту:
ЗНзРОз + 2HNO3 -> НзО + 2NO + ЗНзРОз.
Если зажечь смесь водорода с фосфористым водородом при выходе
ее из трубки с платиновым наконечником, то она горит изумруднозеленым
пламенем.
9. Концентрированный раствор едкого кали. Фосфористо-
кислая соль при кипячении с очень концентрированным раство-
ром едкого кали превращается с выделением водорода в фос-
форнокислую соль:
КгНРОз + КОН -> К3РО4 + Н2.
С разбавленным раствором едкого кали водород почти не
выделяется.
10. Молибдат аммония выделяет из горячего раствора фос-
фита желтый кристаллический осадок (ЫН4)гНРОз • бМоОз • 2НЮ.
11. Раствор иода в растворе гидрокарбоната щелочного ме-
талла быстро восстанавливается фосфористокислыми солями.
Восстановление происходит также и в кислом растворе, но мед-
ленно (отличие от солей фосфорноватистой кислоты, восстана-
вливающих в кислом растворе быстрее).
429
Реакции сухим путем
Фосфористая кислота подобно хлорноватистой кислоте пере-
ходит при нагревании за счет своего собственного кислорода
в соединение высшей степени окисления, причем часть кислоты,
являющейся окислителем, восстанавливается в водородное соеди-
нение;
ЗНС1О-» НСЮз + 2НС1;
4НзРОз -> ЗНзРОт + РНз.
Точно так же ведут себя и соли фосфористой кислоты:
SNaaHPOs -> 4Na3PO4 + ИщРгОт 4-НгО.+ 2РНз.
Метафосфорная кислота НРО,
Получение и свойства. Одноосновная метафосфорная кис.тогЬЦ полу*
чается при обработке пятиокиси фосфора холодной водой:
PiOs + HsO-* гире»,
в также при сильном прокаливании ортофосфорной кислоты:
НзРОа-> НгО :+ НРОз.
Метафосфорная кислота — бесцветная, стекловидная гигроскопичная
масса. При кипячении ее водных растворов или медленно на холоду она
присоединяет воду и переходит в ортофосфорную кислоту:
HPOs + НгО -> HsPOu
Метафосфаты быстро получаются прн нагревании однометаллических
солей ортофосфорной кислоты:
NaHsPOi ->Н-0 + NaPOs
или при прокаливании натрийаммонийфосфата:
NaNHsHPOi-* Н;О + NHs + NaPOs.
Метафосфаты ' переходят в ортофосфаты при кипячении их водных
растворов в присутствии минеральных кислот.
Существует по крайней мере восемь различных модификаций мета-
фосфатов, отвечающих общей формуле (МРОз)п, где М — одновалентный
металл. Многие из них способны давать соответствующие полимеры сво-
бодной кислоты типа (НРОз)л. Некоторые метафосфаты натрия растворимы
в воде, другие — не растворимы'. Растворимый гексаметафосфат натрия
(NaPOs)e в настоящее время находит применение для удаления накипи и
умягчения воды. Он известен под названием «кальгон» (Calgon).
Растворимость метафосфатов. Метафосфаты щелочных металлов и маг-
ния растворимы в воде; остальные соли трудно растворимы или совсем не
растворимы в воде, но легко растворимы в азотной кислоте и в избытке
метафосфорной кислоты или метафосфата щелочного металла.
Реакции мокрым путем
Следует употреблять раствор метафосфата натрия.
1. Серная кислота не дает видимой реакции.
2. Азотнокислое серебро осаждает белое метафосфорнокислое
серебро, растворимое в аммиаке и минеральных кислотах:
РОз' + Ag’ -> AgPO3.
430
3. Хлористый барий осаждает хлопьевидный белый метафос-
фат бария, растворимый в избытке метафосфата натрия; из по-
лученного раствора аммиак не выделяет осадка. Повидимому,
образуется диметафосфат бария-натрия (или другой какой-либо
полиметафосфат).
4. Белковый раствор коагулируется водным раствором сво-
бодной кислоты (отличие от пиро- и ортофосфорной кислот),
но не растворами щелочных метафосфатов. В последнем случае
для коагуляции раствор метафосфата подкисляют CHsCOOH.
5. Магниевые соли не образуют осадков в умеренно разба-’
вленных растворах ни на холоду, ни при кипячении (отличие от
ортофосфорной кислоты).
6. Молибдат аммония на холоду не Дает осадка; при кипяче-
нии же метафосфорная кислота в кислом растворе переходит
в ортофосфорную, и тогда образуется характерный желтый
осадок.
7. Цинк в кислом растворе не восстанавливает метафосфорной
кислоты (отличие от фосфористой кислоты)^
Реакции сухим путем
Щелочные соли метафосфорной кислоты в расплавленном
состоянии представляют собой стекловидную массу, раство-
ряющую многие металлические окислы с характерным окрашива-
нием, причем образуется ортофосфорнокислая соль («перлы
фосфорной соли», см. Фосфорная кислота). При сплавлении
с содой соли метафосфорной кислоты превращаются в соли
ортофосфорной кислоты,
но он
I I
Пирофосфорная кислота Н4Р2О7 о=р-о—р=о
но он
Получение. Четырехоснонная пирофосфорная кислота образуется при
нагревании ортофосфорной кислоты до 213°:
2НзРО<-> НзРаОт + ЙгО.
При стоянии водного раствора, быстрее при кипячении, происходит
присоединение воды с обратным образованием ортофосфорной кислоты.
Пирофосфорная кислота представляет собой мягкую стекловидную массу,
хорошо растворимую в воде. В водном растворе она является кислотой
средней силы с ясно выраженной последовательной диссоциацией, четыре
константы которой имеют следующие величины:
Ki = 1,4-10-»; Лг = 1,1;- КГ»;
К1= 2,9- 10-’; Г4 = 3,6- 10"’.
Следовательно, ион НзРзСЪ" показывает нейтральную реакцию по
метилоранжу, а ион НРаО?"'— нейтральную по фенолфталеину.
Соли пирофосфорной кислоты, пирофосфаты, легко получаются при
прокаливании двуметалличеоких солей фосфорной кислоты:
2NaaHPO4 -> НгО ± NaiPiOa,
431
Растворимость пирофосфатов. Пирофосфаты щелочей растворимы
в воде, все остальные трудно или совсем1 не растворимы; в кислотах легко
растворимы все пирофосфаты, а многие — и в избытке пирофосфата
натрия *.
Реакции мокрым путем
Следует употреблять раствор пирофосфорнокислого натрия.
1. Серная кислота не реагирует.
2. Азотнокислое серебро дает белый творожистый осадок,
растворимый в аммиаке и азотной кислоте.
3. Хлористый барий дает белый аморфный осадок, не раство-
римый в уксусной, растворимый в минеральных кислотах (отли-
чие от фосфорной кислоты). V
4. Белки не коагулируются свободной пирофосформой кисло-
той (отличие от метафосфорной кислоты).
5. Молибдат аммония не дает никакого осадка на холоду.
Но уже после непродолжительного нагревания образуется до-
статочное количество фосфорной кислоты^ чтобы появилось
желтое окрашивание, а затем произошло выпадение фосфорно-
молибденовокислого аммония.
6. Хлористый кадмий дает белый осадок в уксуснокислом
растворе. Этой реакции не дают ни метафосфорная, ни орто-
фосфорная кислоты.
7. Сульфат окиси меди дает бледносиний осадок.
8. Хлористый магний образует белый осадок, растворимый
в избытке как магниевой соли, так и пирофосфата натрия. При
кипячении этого раствора образуется осадок, который не раство-
ряется при охлаждении.
Реакции сухим путем
Все пирофосфаты при сплавлении с содой переходят в орто-
фосфаты (соли обыкновенной фосфорной кислоты):
NaiP’Ch 4- ЫагСОз -> СОа 4~ 2ЫазРО1.
Йодноватая кислота HJO3
Нахождение & природе: в чилийской селитре в виде KJO: и в неболь-
ших количествах в морской воде в виде йодноватокислого натрия.
Получение. Йодноватая кислота получается путем окисления иода
дымящей азотной кислотой или при действии хлора на иод, суспендирован,
ный в воде:
3J2 + lOHNOs ->6HJO3 + 10NO + 2Н’О;
Ь + 6НзО + 5Ch -> I0HC1 + 2HJO.1.
Свойства. Йодноватая кислота представляет собой бесцветные кристаллы
ромбической системы. Ее ангидрид J2O5 получается в виде белого кристал-
1 Об условиях растворимости других пирофосфатов см. R. S с h 1 е п с к
в Abegg-Handbuch, III. 3, 415.
432
лического порошка. Как кислота, так и ее ангидрид растворяются в воде;
при нагревании они разлагаются на иод, кислород и воду. Йодноватая
кислота относится к числу сильных кислот, ее водные растворы сильно
диссоциированы.
Соли йодноватой кислоты называются иодатами, Важнейшей из них
является KJOs, получающаяся при действии иода на слегка подкисленный
раствор хлората калия:
5КС10з + 3J2 + ЗНзО ->5KJOs + HJOs + 5НС1.
Иодаты получаются также при действии иода на раствор едкой ще-
лочи:
3J2 + 6КОН -> 5KJ + KJO3 + ЗНЮ.
В щелочном растворе иодиды окисляются в йодаты гипохлоритами и
Перманганатом калия.
Растворимость йодатов. Иодаты щелочных металлов растворимы в воде,
остальные же йодаты либо трудно растворимы, либо совсем не растворимы.
Реакции мокрым путем
1. Серная кислота. Йодноватая кислота не разлагается ни
разбавленной, ни концентрированной серной кислотой, но в при-
сутствии восстановителей (например, иодистоводородной кис-
лоты, сернистого водорода, соли закиси железа и т. п.) йодно-
ватая кислота восстанавливается, выделяя иод:
«Юз' + 5J' 6Н’ -> ЗН»О ЗЛг.
2. Азотнокислое серебро осаждает белый творожистый иодат
серебра, трудно растворимый в азотной кислоте, но легко рас-
творимый в аммиаке. При нагревании йодата серебра с соляной
кислотой выделяется хлор и треххлористый иод, серебро же
остается в виде хлорида серебра:
AgJO3 4- 6Н- 4- 6СГ -> AgCl 4- С12 4- JC13 4- ЗНзО.
3. Хлористый барий осаждает белый иодат бария, трудно рас-
творимый в горячей воде (в 100 ч. кипящей воды растворяется
0,6 ч. соли) и слабо растворимый в разбавленной соляной или
азотной кислотах.
4. Ацетат свинца осаждает белый иодат свинца, трудно рас-
творимый в воде и слабо растворимый в азотной кислоте.
5. Нитрат тория осаждает белый кристаллический осадок
йодата тория, почти не растворимый в разбавленной азотной
кислоте (йодаты редких земель значительно легче растворимы).
6. Восстановители, а) Иодистоводородная кислота восстанавли-
вает йодноватую кислоту, выделяя иод:
ЛОз' 4- 5J' 4- 6Н’ -> ЗН2О 4- 3Ja.
Присутствие кислоты необходимо, и реакция продолжается лишь до
тех пор, пока в растворе еще имеются водородные ионы. Таким образом,
нейтрализация раствора производится в данном случае иод- и йодат-
ионами.
28 Зак. 082. Тредвелл-Голл, т. I.
433
б) Сернистая кислота также выделяет иод, если она не приба-
влена в большом избытке:
2Юз' + 550з" 4- 2Н‘ -> 55ОГ + НЮ + J2;
Юз'.+ 35ОГ -> 3sor+J'.
Восстановление протекает по последнему уравнению, если на
1 молекулу йодата приходится 3 молекулы сернистой кислоты;
сернистая кислота реагирует со свободным иодом (стр. 405).
в) Цинковая пыль (лучше сплав Деварда) восстанавливает ней-
тральные растворы йодата до иодида.
г) Сернистый водород реагирует с йодноватой кислотойЛдричем
осаждается сера и сперва выделяется иод:
2«Юз' + 5H2S + 2Н ’ J2 + 5S + 6Н2О,
но при дальнейшем добавлении сернистого водорода иод исче-
зает:
J2 + HjS-> 2Н’ +2J' + S.
Поэтому вся реакция по прибавлении избытка сероводорода
выражается следующим уравнением:
Юз' + 3H2S -> «Г + ЗНаО + 3S.
д) Фосфор как красный, так и белый энергично реагируют
с йодноватой кислотой даже в разбавленных растворах:
Р4 + 4HJOs + 4НаО ->4НзРО4 4- 2Ю
е) Фосфорноватистая кислота1 восстанавливает йодноватую кис-
лоту даже на холоду до иодида. Реакция протекаете три стадии:
Юз' 4- ЗНзРОа -> ЗНзРОз 4- J';
5J' 4- Юз' 4- 6Н' -> ЗНЮ 4- ЗЪ;
НзРОз 4- J2 4- НЮ -> НзРОт 4- 2HJ.
Первые две стадии реакции протекают очень быстро, третья — мед-
ленно и освобождающийся при is горой реакции иод может быть легко
обнаружен. Таким образом, реакция между гипофосфитом и йодноватой
кислотой может быть использована для открытия даже таких малых ко-
личеств, как 1 Y HJOs.
Выполнение. Смешивают на капельной пластинке каплю нейтрального
испытуемого раствора с каплей крахмального раствора и 2 каплями раз-
бавленной фосфорноватистой кислоты. В присутствии йодата появляется
исчезающее синее окрашивание.
Реакции сухим путем
При нагревании на угле все йодноватокислые соли вспыхи-
вают, но менее энергично, чем хлорноватокислые соли; все
йодаты разлагаются при нагревании частью с выделением, частью
1 А. В г tl k 1 и. М. Behr, Z. anal. Chem. 64, 23 (1924); см, также
Файгль, Капельный анализ, стр. 364. Ред.
434
без выделения иода. Так, все нейтральные йодаты щелочных
металлов разлагаются на иодид и кислород, между тем как
бииодаты одновременно выделяют также и иод.
2KJO.3 -> 2KJ + -ЗОе;
4[КЛОз • НЛОз | -л 4KJ + ПО? f 2НЮ + 2J2.
ГРУППА IV
Азотнокислое серебро выделяет из нейтральных растворов
окрашенные осадки, растворимые в азотной кислоте.
Хлористый барий также дает растворимые в азотной кислоте
осадки.
Молибденовая кислота
Свойства и реакции молибденовой кислоты см. стр. 543—547.
Фосфорная кислота Н3РО4
Получение и свойства. Оргофосфорная кислота получается путем окис,
ления фосфора азотной кисло гой или ну, ем кипячения мега- и пирофос-
форной кислот с водой.
Ангидрид ее РзОа (являющийся ангидридом также мета- и пирофос-
форной кислот.) — белое, похожее на снег вещество. На воздухе он быстро
поглощает воду и является наиболее эффективным веществом для высу-
шивания газов».
Оргофосфорная кислота НзРО; образует прозрачные, очень гигроско-
пичные кристаллы; на воздухе она быстро приобретает сиропообразную
консистенцию. При сильном нагревании в открытой чашке она улетучи-
вается- Пары ее дымят на воздухе. Существует немного кислот, которые бы
при таком сильном нагревании улетучивались без разложения.
Фосфорная кислота (под которой обычно подразумевают ортокислоту,
если при ней нет приставки мета- или пиро-) представляет собой трех-
основную кислоту, образующую соли, в которых один, два или три водо-
родных атома кислоты могут' быть замещены металлом. Соли, подобные
NaHsPO; и Ca(H2PO;)->, называют первичными фосфатами, а также одно-
замещенными или одноосновными фосфатами. Соли, подобные NasHPO; и
СаНРО), называют вторичными, а также двузамещенными или двухоснов-
ными фосфатами. Наконец, соли, подобные NasROr и CasfPChh, являются
третичными (трехзамещенными, трехосновными) фосфатами.
Первый водород фосфорной кислоты соответствует водороду умеренно
сильной кислоты (стр. 28). Второй водород ионизирует приблизительно
в той же степени, как первый водород угольной или сернистоводородной
кислоты; ионизация его еще достаточна, чтобы показывать кислую реак-
цию по фенолфталеину, но не по метилоранжу. Третий водород фосфорной
кислоты едва ионизирует, его можно приблизительно сравнить со вторые
водородом сернистого водорода.
Если раствор фосфорной кислоты нейтрализовать едким натром
в присутствии метилоранжа как индикатора, то конечная точка будет до-
стигнута, когда вся фосфорная кислота превратится в первичный фосфат,
или, другими словами, когда в каждой молекуле НзРСЬ будет нейтрализо-
ван один водород. При нейтрализации по фенолфталеину в качестве инди-
катора конечная точка достигается, когда образуется вторичный фосфат
натрия.
Водный раствор первичного фосфата натрия NaPEPCh нейтрален по от-
ношению к метилоранжу и является кислым по отношению к фенолфта-
леину; водный раствор вторичного фосфата натрия показывает щелочную
реакцию по отношению к метилоранжу и нейтральную к фенолфталеину.
28* 435
Водный раствор третичного фосфата натрия является щелочным в отноше-
нии всех индикаторов.
Смесь едкого натра и фосфорной кислоты, взятых в отношении iVz
моля основания и 1 моль кислоты, будет показывать кислую реакцию по
фенолфталеину и щелочную по метилоранжу; для нейтрализации раствора
такой смеси потребуется ровно столько 0.5N кислоты в присутствии
метилоранжа, сколько потребуется 0.5N едкой щелочи для нейтрализации
такого раствора в присутствии фенолфталеина.
Растворимость фосфатов. В воде растворимы щелочные фосфаты.
Растворимы также однометаллические соли щелочных земель; двуметалли-
ческие соли почти не растворимы в воде; трехметаллические же соли и
все остальные фосфаты совсем не растворимы. Минеральные кислоты слу-
жат растворителями для всех фосфатов. f';
Реакции мокрым путем
Для этих реакций следует употреблять раствор двухосновного фос-
форнокислого' натрия. ,
1. Серная кислота разбавленная или концентрированная не
вызывает видимого разложения.
2. Азотнокислое серебро дает желтый осадок фосфорнокис-
лого' серебра (отличие от мета- и пирофосфорной кислот)
2НРОГ ф 3Ag‘ -> AgaPOi ф НгРО/,
легко растворимого в минеральных кислотах и аммиаке. Оса-
ждение, таким образом, количественно только в нейтральной
среде.
3. Хлористый барий осаждает белый аморфный фосфорно-
кислый барий:
НРОГфВа”-> BaHPOj.
В присутствии аммиака осаждается трехметаллическая соль:
2HPCV ф ЗВа‘ ’ ф 2NH3 -> Ва3(РО4)2 ф 2NH/ .
Фосфаты бария (так же, как и фосфаты других щелочных
земель) легко растворимы в минеральных кислотах, а также и
в уксусной кислоте (отличие от трехвалентных элементов). Из
этих кислых растворов аммиак снова осаждает фосфат.
* Примечание редактора. Растворимость фосфата бария Ваз(РОф,
соли кислоты средней силы, в более слабой уксусной кислоте становится
понятной, если сравнить величины констант последовательной диссоциа-
ции фосфорной кислоты с константой диссоциации уксусной кислоты. Для
трех констант диссоциации НзРСЦ имеются следующие величины: Ki =
= 1,4 • 10—1, К? ~ 2 • И'г; и Кз = 3,6-1Щ13, константа же диссоциации уксус-
ной кислоты равна 1,8 • IO-5. Следовательно, Н2РО/ и HPOi" менее диссо-
циируют, чем уксусная кислота, водородные ионы последней будут пода-
влять их диссоциацию. Когда Ваз(РОф соприкасается с водой, образуется
небольшое количество РОГ'-ионов, но в -присутствии уксусной кислоты
образуются ионы НзРО? и HPCh" и, таким образом, из раствора исчезают
РОГ"-ионы, вследствие чего произведение концентрации ионов фосфата
бария делается меньше его произведения растворимости и поэтому будет
происходить его дальнейшее растворение в уксусной кислоте. * А. К.
436
4. Магнезиальная смесь (водный раствор хлористого 'аммония,
аммиака и хлористого магния) выделяет из очень разбавленных
растворов белый кристаллический осадок фосфорнокислого маг-
ний-ам^ния MgNHiPOi • 6Н2О:
HP От" + Mg’ + NHs -» MgNH4PO4,
практически не растворимый в 2,5%-ном аммиаке, но легко рас-
творимый даже в очень слабых кислотах (стр. 302).
5. Хлорное железо. Раствор хлорного железа выделяет из
раствора фосфорнокислого натрия желтовато-белый осадок фос-
форнокислой соли окиси железа:
НРОГ + Fe1 • • Н‘ + FePOj.
При этой реакции происходит образование водородных ионов и, как
можно ожидать на основе закона действия масс, осаждение фосфорной
кислоты не будет количес твенным до тех пор, пока не будет удалена боль-
шая часть водородных ионов. Это может быть достигнуто путем добавле-
ния ацетата аммония, так как при этом водородные ионы будут образовы-
вать слабо ионизирующую уксусную кислоту, находящуюся в равновесии
с ацетат-ионами (сгр. 63);
НРО< " + CHiCOO' + Fe- • СНзСООН + FePCh.
Кроме того, если проводить реакцию в кипящем разбавленном рас-
творе, избыток железа может быть осажден в виде основного ацетата.
Если профильтровать раствор горячим, то полученный фильтрат будет
свободен и от железа и от фосфорной кислоты. Если же фильтровать его
по охлаждении, то часть железа перейдет обратно в раствор и, так как
фосфат железа заметно растворим в растворе ацетата железа, в раствор
перейдет также некоторое количество фосфорной кислоты.
Так как фосфат железа, в отличие от фосфатов щелочных земель, не
растворим в уксусной кислоте, то фосфорная кислота может быть удалена
из раствора щелочноземельных фосфатов в уксусной кислоте; для этого
прибавляют хлорное железо и избыток растворимого ацетата и кипятят
раствор.
При этом- поступают следующим образом. Фосфорнокислую соль, под-
лежащую испытанию, растворяют в возможно малом количестве соляной
кислоты, к раствору прибавляют углекислый аммоний до образования не-
большого неисчезающего осадка, который затем снова растворяют в не-
скольких каплях разбавленной соляной кислоты; затем прибавляют избы-
ток уксуснокислого аммония и по каплям — хлорное железо до тех пор,
пока жидкость над образующимся желтовато-белым осадком фосфорнокис-
лой соли окиси железа не окрасится в буроватый цвет за счет гидроокиси
железа. После этого, разбавив сильно водой, нагревают до кипения и
фильтруют жидкость горячей. Чтобы открыть фосфорную кислоту в об-
разовавшемся осадке, последний растворяют в азотной кислоте, выпари-
вают до небольшого объема и прибавляют молибденовокислый аммоний,
причем образуется желтая кристаллическая амшонийная соль фосфорно-
молибденовой кислоты (реакция 6). Можно поступить также следующим
образом. Осадок растворяют в разбавленной соляной кислоте и приба-
вляют 2 г винной кислоты, а затем аммиак до щелочной реакции (железо
при этом не осаждается, стр. 237. реакция 4). Из такого аммиачного рас-
твора фосфорная кислота легко осаждается магнезиальной смесью в виде
фосфорнокислого магний-аммония.
6. Молибденовокислый аммоний, прибавленный в большом
избытке, осаждает (спустя некоторое время) на холоду из
азотнокислого раствора желтый кристаллический осадок фос-
437
форяомолибденовокислого аммония; осаждение совершается
быстрее при слабом нагревании:
НзРСи + 12(NH4)2MoO4 + 21HNOs-> (КН4)3РО< • 12МоО3 +
+ 2INH4NO3 + 12Н2О '.
Эта реакция вполне аналогична .реакции на мышьяковую кислоту, с той
только разницей, что мышьяковое соединение образуется быстро лишь при
температуре кипения- Присутствие большого избытка азотнокислого аммо-
ния в высшей степени благоприятствует образованию осадка.
Фосфорномолибденово-кис-тый аммоний легко растворяется в щелочах
и аммиаке:
(NH4)3PO4 12МоОз 4- 23ОН' ->3NHn + НРО<" + 12Мо(Ц" + ПНЮ,
а также в избытке раствора фосфата щелочного металла с Г. бразованием
соединений, содержащих меньше молибдена. Поэтому всегда необходимо
препятствовать образованию таких соединений путем добавления большого
избытка молибдата аммония.
7. Молибдат аммония и бензидин1 2. Бензидин CuHsfNH-’)-’ не
окисляется молибденовой кислотой или ее нормальной солью,
но окисляется фосфорномолибденовой кислотой и солями этой
кислоты. При взаимодействии последних с бензидином обра-
зуются два продукта реакции, которые окрашены в синий цвет:
продукт окисления бензидина (бензидиновая синь) и продукт
восстановления молибденовой кислоты (молибденовая синь).
Выполнение. На кусочек фильтровальной беззольной бумаги наносят
каплю кислого исследуемого раствора, поверх нее каплю 5%-ного молиб-
дата аммония т 0.32V HNOs и каплю 0,05%-ного бензидина в 10%-ной ук-
сусной кислоте, после чего держат бумагу над горлом открытой склянки
с концентрированным аммиаком. В присутствии фосфорной кислоты по-
является синее пятно даже при количествах меньших, чем 1.5 у Р»(Ъ.
* Примечание редактора. Аналогично фосфорной кислоте с молибда-
том аммония и уксуснокислым бензидином реагируют также мышьяковая и
кремневая кислоты. Чтобы открыть фосфорную кислоту в присутствии
последних, прибавляют винную кислоте’, с которой молибденовая кис-
лота дает стабильные комплексные соединения, не реагирующие с бензи-
дином. Для выполнения этой .реакции на фильтровальную бумагу наносят
каплю исследуемого раствора, затем каплю азотнокислого молибдата аммо-
ния, содержащего винную кислоту. Подержав бумагу над нагретой про-
волочной сеткой, прибавляют каплю бензидина и далее подвергают пятно,
как .выше указано, действию паров аммиака. Синее окрашивание обуслов-
ливается при этом только фосфорной кислотой. * А. К.
8. Нитрат висмута дает кристаллический осадок трехметалли-
чеокой соли, обладающий шелковистым блеском и не раствори-
мый в разбавленной азотной кислоте.
9. Нитрат ртути(1) осаждает из нейтральных растворов белый
фосфат одновалентной ртути, не 'растворимый в уксусной, но
растворимый в азотной кислоте.
10. Цинк в кислом растворе не восстанавливает фосфорной
кислоты (отличие от фосфористой и фосфорноватистой кис-
лоты).
11. Метаоловянная кислота. Если прибавить металлическое олово
к азотнокислому раствору фосфорной кислоты или кжого-либо фосфата,
то олове превращается в метао.ювянную кислоту, адсорбирующую фос-
1 Образующийся фосфорномолибденовокис.тый аммоний правильнее
рассматривать не как двойную, а как комплексную соль, строение которой
может быть представлено формулой (МНрзНфЕЦМоаОт)»] Ред.
2 F е i gr 1, Z. anal. Chem. 61, 454 (1922); 74, Ж (I92s); 77, 099 (1999).
См. также Файгль, Капельный анализ, стр 390. Ред.
433
форную кислоту. Этой реакцией пользуются для удаления фосфорной
кислоты.
Образующийся при этом осадок раньше рассматривался состоящим из
метаоловянной и фосфорной кислот или представляющим собою комплекс-
ную фосфорнооловянную кислоту; однако Мекленберг1 доказал, что этот
осадок нужно рассматривать скорее как адсорбционное, чем как химиче-
ское соединение. Осаждение фосфорной кислоты может быть выполнено
добавлением коллоидной гидроокиси олова, образованной путем обработки
олова азотной кислотой. Соляная кислота пептизирует или растворяет ад-
сорбционное соединение, поэтому реакция осаждения фосфорной кислоты
не удается в присутствии большого количества соляной кислоты. По Гат-
терману (Gattermann) ц Шиндгенму (Schindheim) - фосфорная кислота мо-
жет быть осаждена из разбавленного солянокислого раствора холодным
концентрированным свежеприготовленным раствором хлорного олова (2—3 г
SnC14 на 0,5 г НзРОД
Для получения гидрата оловянной кислоты поступают следующим об-
разом. К 75 .кл концентрированной HNOs, разбавленной таким же объемом
воды, прибавляют небольшими порциями при энергичном взбалтывании 15 г
гранулированного олова, поддерживая температуру равной 0 . Полученный
коллоидный раствор вливают в 1 л воды, причем гидрат двуокиси олова
выпадает количественно. Осадку дают осесть, несколько раз промывают
декантацией и, наконец, на фильтре горячей водой почти до полного ис-
чезновения кислой реакции. Студенистый осадок сохраняют во влажном
состоянии в широкогорлой склянке.
12. Хлорокись циркония ZrOCh осаждает из слабокислых рас-
творов белый осадок Zr(HPOr)c. Избыток реактива может быть
удален аммиаком, осаждающим Zr(OH)4; после непродолжитель-
ного кипячения Zr(O'H)4 и ZrfHPOr)?. становятся не растворимыми
в разбавленных кислотах.
13. Ацетат свинца дает белый осадок фосфата свинца, почти
не растворимый в уксусной кислоте:
2НРО4" + ЗРЬ’ ‘ + 2СНзСОО'-> 2СНзСООП -J- РЬ3(РО4)е.
14. Белки не коагулируются ортофосфорной кислотой.
Реакции сухим путем
Трехметаллические соли щелочных металлов плавятся не раз-
лагаясь, двуметалличеокие при плавлении теряют воду и обра-
зуют пирофосфорнокислую соль, а одномеюллические дают
метафосфорнокислую соль в виде стекловидной массы.
Употребляемая в качестве реактива так называемая «фосфор-
ная соль» — кислый фосфорнокислый натрий-аммоний — пла-
вится при накаливании, теряя воду и аммиак и образуя мета-
фосфорнокислый натрий в виде прозрачного стекла:
Na(NH4)HPO< • 4НгО -> 5НЮ ф NHs ф NaPOs.
При плавлении этой соли на платиновой проволоке обра-
зуется прозрачный шарик, «перл фосфорной соли».
Подобно тому как мегафосфорная кислота при кипячении
с водою присоединяет последнюю, образуя ортофосфор,ную
кислоту
ИРОзф Н>0 -ИПРСЧ
1 Z. anal. Chem. 52, 293 (1913).
* В. 49, 2416 (.19107; Z. anal. Chem. 56, 205 (1917).
439
форномолибденовокислого аммония; осаждение совершается
быстрее при слабом нагревании:
НзРО« + 12(NH4)2MoO4 + 21HNOs-> (NH4)3PO4 • 12МоО3 4-
4-2INH4NO3 + 12Н2О
Эта реакция вполне аналогична реакции на мышьяковую кислоту, стой
только разницей, что мышьяковое соединение образуется быстро лишь при
температуре кипения. Присутствие большого избытка азотнокислого аммо-
ния в высшей степени благоприятствует образованию осадка.
Фосфорномолибденовокислый аммоний легко растворяется в щелочах
и аммиаке:
(МНфРО, • 12МоОз + 23ОН' -> З.ХШ' + HPCV + 12Мо(%" + ! 1 НЮ,
а также в избытке раствора фосфата щелочного металла с образованием
соединений, содержащих меньше молибдена. Поэтому всегда необходимо
препятствовать образованию таких соединений путем добавления большого
избытка .молибдата аммония.
7. Молибдат аммония и бензидин2. Бензидин Ct2Hs(NH2)2 не
окисляется молибденовой кислотой или ее нормальной солью,
но окисляется фосфорномолибденовой кислотой и солями этой
кислоты. При взаимодействии последних с бензидином обра-
зуются два '.продукта реакции, которые окрашены в синий цвет:
продукт окисления бензидина (бензидиновая синь) и продукт
восстановления молибденовой кислоты (молибденовая синь).
Выполнение. На кусочек фильтровальной беззольной бумаги наносят
каплю кислого исследуемого раствора, поверх нее каплю 5%-ного молиб-
дата аммония й О,ЗА HNOi и каплю 0,05%-ного бензидина в КН;’,-ной ук-
сусной кислоте, после чего держат бумагу над горлом открытой склянки
с концентрированным аммиаком. В присутствии фосфорной кислоты по-
является синее пятно даже при количествах меньших, чем 1.5 7 РЮ.-,.
* Примечание редактора. Аналогично фосфорной кислоте с молибда-
том аммония и уксуснокислым бензидином реагируют также мышьяковая и
кремневая кислоты. Чтобы открыть фосфорную кислоту в присутствии
последних, прибавляют винную кислоту, с которой молибденовая кис-
лота дает стабильные комплексные соединения, не реагирующие с бензи-
дином. Для выполнения этой реакции на фильтровальную бумагу наносят
каплю исследуемого раствора, затем каплю азотнокислого молибдата аммо-
ния, содержащего винную кислоту. Подержав бумагу над нагретой про-
волочной сеткой, прибавляют каплю -бензидина и далее подвергают пятно,
как выше указано, действию паров аммиака. Синее окрашивание обуслов-
ливается при этом только фосфорной кислотой. * А. К.
8. Нитрат висмута дает кристаллический осадок трехметалли-
чеакой соли, обладающий шелковистым блеском и не раствори-
мый в разбавленной азотной кислоте.
9. Нитрат ртути(1) осаждает из нейтральных растворов белый
фосфат одновалентной ртути, не растворимый ь уксусной, но
растворимый в азотной кислоте,
10. Цинк в кислом растворе не восстанавливает фосфорной
кислоты (отличие от фосфористой и фосфорновати-стой кис-
лоты).
11. Метаоловянная кислота. Если прибавить металлическое олово
к азотнокислому раствору фосфорной кислоты или какого-либо фосфата,
то олове превращается в метаоловянную кислоту, адсорбирующую фос-
1 Образующийся фосфорномолибденовокислый аммоний правильнее
рассматривать не как двойную, а как комплексную соль, строение которой
может быть представлено формулой (М-ЬрНЦРСМоЮ-)» 1 Рец.
= F е i я 1, Z. anal. Chem. 61, 454 (1922); 74, 386 (1928); 77, 299 (1929),
См. также Файгль, Капельный анализ, стр 390. Ред.
433
форную кислоту. Этой реакцией пользуются для удаления фосфорной
кислоты.
Образующийся при этом осадок раньше рассматривался состоящим из
метаоловянной и фосфорной кислот или представляющим собою комплекс-
ную фосфорнооловянную кислоту; однако Мекленберг1 доказал, что этот
осадок нужно рассматривать скорее как адсорбционное, чем как химиче-
ское соединение. Осаждение фосфорной кислоты может быть выполнено
добавлением коллоидной гидроокиси олова, образованной путем обработки
олова азотной кислотой. Соляная кислота пептизирует или растворяет ад-
сорбционное соединение, поэтому реакция осаждения фосфорной кислоты
не удается в присутствии большого количества соляной кислоты. По Гат-
терману (Gattermann) ц Шиндгейму (Schindlieini)2 фосфорная кислота мо-
жет быть осаждена из разбавленного солянокислого раствора холодным
концентрированным свежеприготовленным раствором хлорного олова (2—3 г
SnCU на 0,5 г HsPCU).
Для получения гидрата оловянной кислоты поступают следующим об-
разом. К 75 мл концентрированной Н.\'Оз, разбавленной таким же объемом
воды, прибавляют небольшими порциями при энергичном взбалтывании 15 г
гранулированного олова, поддерживая температуру равной 0 . Полученный
коллоидный раствор вливают в 1 воды, причем гидрат двуокиси олова
выпадает количественно. Осадку дают осесть, несколько раз промывают
декантацией и, наконец, на фильтре горячен водой почти до полного ис-
чезновения кислой реакции. Студенистый осадок сохраняют во влажном
состоянии в широкогорлой склянке.
12. Хлорокись циркония ZrOCla осаждает из слабокислых рас-
творов белый осадок Zr(HPOr)e. Избыток реактива может быть
удален аммиаком, осаждающим Zr(OH)r; после непродолжитель-
ного кипячения Zr(OH)i и ZrfHPOi)*. становятся не растворимыми
в разбавленных кислотах.
13. Ацетат свинца дает белый осадок фосфата свинца, почти
не растворимый в уксусной кислоте:
2HPCV -р ЗРЬ' • -у- 2СИзСОО'-> 2СНзСООН - РЬ(РО)..
14. Белки не коагулируются ортофосфорной кислотой.
Реакции сухим путем
Трехметаллические соли щелочных металлов плавятся не раз-
лагаясь, двуметалличеокие 'При плавлении теряют воду и обра-
зуют пирофосфорнокислую соль, а одиометалличсские дают
метафосфорнокислую соль в виде стекловидной массы.
Употребляемая в качестве реактива так называемая «фосфор-
ная соль» — кислый фосфорнокислый натрий-аммоний—пла-
вится при накаливании, теряя воду и аммиак и образуя мета-
фосфорнокислый натрий в виде прозрачного стекла:
Na(NH4)HPO4 • 4Н2О -> 5НгО + NH3 + NaPO3.
При плавлении этой соли на платиновой проволоке обра-
зуется прозрачный шарик, «перл фосфорной соли».
Подобно тому как метафосфорная кислота при кипячении
с водою присоединяет последнюю, образуя ортофосфорную
кислоту
ПРО» + НЮ ->lI3P(h,
’ z. anal. Chem. 52, 293 (1913).
2 13. 49, 2416 (J91(y; Z. .mal. Chem. 56,205 (1917).
439
точно так же и метафосфорнокислый натрий при плавлении при-
соединяет многие окислы, образуя характерно окрашенные
ортофосфорнокислые соли
NaPO3 + CuO - XiiNaPCh,
синим перл
которые в восстановительном 'пламени могут быть превращены
в метафосфаты:
CuNaPO44-C CO + Cu-f-NaPO3,
оуро-красяый
непрозрачный керл
Многие безводные фосфаты при прокаливании с магнием вос-
станавливаются в фосфористые металлы, которые, будучи смо-
чены водой (для чего достаточно подышать на прокаленную
пробу), дают характерный чесночный запах фосфористого водо-
рода:
Са3(РОф + 8Mg 8MgO + Са3Р2;
СазР2 + 6НаО -> ЗСа(ОН)2 + 2РНз.
Открытие фосфора в стали и в различных сортах железа
Фосфор в стали и железе находится в очень малом количестве в виде
фосфористого железа (большею частью '.меньше 0,1%). Открытие фосфора
производится путем превращения его в фосфорную кислоту, которая за-
тем определяется посредством одной из вышеприведенных реакций. Но
так как количества фосфора в железе очень малы, то для получения за-
метных осадков необходимо брать для анализа большие количества иссле-
дуемого материала. Лучший прием для этого следующий. Растворяют
5—10 г железа или стали в 60 мл 6N азотной кислоты раствор выпари-
вают досуха и /прокаливают на голом пламени при постоянном помеши-
вании стеклянной палочкой до тех пор, пока не прекратится выделение
красно-бурых паров. Таким путем разрушаются все органические 'веще-
ства, обезвоживается кремневая кислота, а фосфор полностью окисляется
в фосфорную кислоту. По охлаждении полученные окислы растворяют
при умеренном нагревании в 50—60 .ил 12N соляной кислоты, избыток по-
следней удаляют выпариванием, разбавляют водой и отфильтровывают от
кремневой кислоты.
В фильтрате находятся все железо и вся фосфорная кислота, которая
может быть открыта или реакцией о молибденовокислым аммонием или
магнезиальной смесью. Для открытия фосфорной кислоты посредством
первой реакции фильтрат выпаривают досуха, растворяют в возможно ма-
лом количестве 6N азотной кислоты, прибавляют 50 мл .молибденовокислого
аммония и 15—20 лл 75%-«ого раствора азотнокислого аммония, затем,
после слабого нагревания оставляют стоять в течение 1 часа.
Появление желтого кристаллического осадка служит признаком присут-
ствия фосфорной кислоты.
Для открытия фосфорной кислоты при помощи второй реакции
(с магнезиальной смесью) необходимо сначала удалить, большую часть же-
леза. Для этой цели солянокислый фильтрат нейтрализуют аммиаком, при-
бавляют насыщенный раствор сернистого ангидрида и кипятят, отчего рас-
твор, сначала окрашенный в темнобурый цвет, обесцвечивается совсем или
делается зеленоватым. Прибавив 20 мл 12N соляной кислоты, продолжают
кипячение до удаления избытка сернистого ангидрида. При такой обра-
1 При растворении железа или стали в НС1 или HsSOi часть или весь
фосфор улетучивается в виде фосфористого 'водорода, между тем как
азотная кислота окисляет весь фосфор в фосфорную кислоту.
440
ботке вся соль окиси железа восстанавливается в соль закиси. После этого
прибавляют несколько капель хлорной воды, отчего образуется небольшое
количество соли окиси железа, нейтрализуют аммиаком, разбавляют водой
до 1 л, приливают 3 мл насыщенного .раствора уксуснокислого аммония
и 5 мл уксусной кислотьр и нагревают до кипения; при этом вся соль
окиси железа осадится в виде фосфорнокислой и основной уксуснокислой
соли, между тем как большая часть железа останется в растворе в виде
соли закиси железа. Небольшой бурый осадок отфильтровывают через ма-
ленький плоеный фильтр, промывают горячей водой и растворяют в раз-
бавленной соляной кислоте. Выпаривают фильтрат почти досуха, приба-
вляют 2 г лимонной (или винной) кислоты, растворенной в возможно ма-
лом количестве воды, прибавляют избыток аммиака и осаждают фосфор-
ную кислоту магнезиальной смесью. Белый кристаллический осадок ука-
зывает на присутствие фосфорной кислоты.
Фосфорноватая кислота Н4Р2О6 2Н2О
Получение ,ч свойства. Эта кислота, имеющая некоторое значение
в аналитической химии, может быть по .учена при медленном окислении
белого фосфора во влажном воздухе, путем нагревания белого фосщеро
с раствором нитрата меди или путем анодного окисления фосфида меди
в разбавленной серной кислоте. При тщательной нейтрализации углекис-
лым натрием и ацетатам натрия выкристаллизовывается трудно раство-
римая кислая соль КагНзРзОв 4НЮ. Возможно также получение кристаллов
NasHPaOe 9Н’О и NarPsOe • 10Н»О.
Состав свободной кислоты, кристаллизующейся в орторомбических кри-
сталлах, отвечает формуле НгРзОв • 2Н2О. Ее растворы являются сильно
кислыми, хотя проводимость указывает на слабую ионизацию. При заме-
щении всех четырех водородов натрием образующаяся соль подвергается
в водном растворе гидролизу, чем обусловливается заметная щелочная
реакция раствора.
Определения молекулярного веса говорят скорее за формулу Н^РгОв.
чем за формулу Н’РОз, хотя в некоторых случаях несомненно существо-
вание мономолеку .тарной формы- Обычно ей приписывается еле,дующая
структура:
НО. /ОН
>-Р<
НО7 II II хон
о о
Кислота обнаруживает сильную склонность к образованию смешанных
солей с щелочными металлами и цинком, медью, марганцем и т. н.
Фосфорноватокислый торий (гипофосфит тория) ThPzOe не растворим
в концентрированной соляной кислоте, и поэтому фосфорноватой кислотой
пользуются для отделения тория от других редких земель. Четырехва-
лентные титан, цирконий и церий дают подобные же осадки в кислых
растворах,, но ториевый осадок в противоположность гипофосфату цирко-
ния не растворяется в щавелевой кислоте; , он образуется в присутствии
перекиси водорода, которую прибавляют, чтобы воспрепятствовать осажде-
нию гипофосфатов титана и церия: титан при этом окисляется в надтита-
новую кислоту, а соль четырехвалентного церия восстанавливается до соли
трехвалентного церия.
Кислота довольно трудно подвергается окислению. Она не восстана-
вливает растворов золота и серебра, и не реагирует в водном растворе
с перекисью водорода или хромовой кислотой. Если прибавить перман-
ганат к фосфорноватой кислоте в присутствии большого количества серной
кислоты, пурпурная (фиолетово-красная) окраска, перманганата остается
некоторое время без изменения. Однако при нагревании происходит вне-
запное обесцвечивание раствора, причем протекает следующая реакция:
2МпО«' + 5Н4Р20в + 6Н‘ + 2НгО -> 2Mn‘ ’ + 10bfePO<.
Фосфорноватая кислота не восстанавливается цинком и разбавленной
серной кислотой (отличие от НзРОг и НзРОз) и образу^ с, нитратом се-
441
ребра белый осадок, который не темнеет на свету (отличие от НзРОг и
НзРОз).
Фосфор Р. Ат. в. 30,98. Ат. н. 15
Нахождение в природе. Фосфор -встречается в природе только в виде
фосфатов, из которых фосфат кальция самый -важный. Апатит, кристал-
лизующийся в гексагональной системе, имеет состав Са5(С1,Р)(РО«)з; за-
грязненный он известен под названием фосфорита, который широко
применяется в качестве удобрительного материала. Фосфат кальция
является также важной составной частью костей и семян растений.
Фосфор встречается также в виде пироморфита (стр. 128), изоморф-
ного с апатитом, ванадинитом и миметезитом.
Свойства. Фосфор существует в четырех аллотропных -модификациях:
а) обыкновенный, или белый фосфор; б) красный кристаллический фос-
фор; в) светлокрасный фосфор; г) черный, кристаллический фосфор1.
Белый фосфор ядовит; в чистом состоянии он бесцветен (выставлен-
ный на свет он становился желтым и -покрывается пленкой красного фос-
фора), плавится при 44,Р и -воспламеняется на воздухе при 60°; его со-
храняют под водой, в которой он не растворяется. Он легко растворяется
в сернистом углероде и мало растворяется в эфире. Азотная кислота
легко окисляет его -в фосфорную кислоту:
ЗРа + 20HNO3 + 8НЮ -> 12НзРО< + 20NO.
Во влажном воздухе -белый фосфор в отличие от красного окисляется
н фосфо-рноват-истую и фосфористую кислоты. Это обусловливает появле-
ние характерного фосфористого запаха и бледнозеленого свечения -в тем-
ноте. При действии ларов фосфора или фосфористого водорода на влаж-
ную бумагу, пропитанную нитратом серебра, происходит почернение бу-
маги вследствие образования фосфористого (фосфида) и металлического
серебра. Повидимому, реакция протекает следующим образом: сначала
фосфор реагирует с водой, образуя фосфин и фосфорноватистую кислоту:
Р« + 6Н2О-> ЗНзРОг + РНз,2
которые реагируют с нитратом серебра:
НзРОг 4- 2Н-0 -I- 4AgNCh-> 4Н-\Оз 4- НзРОз + 4Ag;
РНз 4- 3AgNOs-> 3HNOs 4- AgaP.
Эта исключительно чувствительная реакция па белый фосфор была от-
крыта III о и е р о м (Scheiier) 3. Она однозначна лишь в отсутствие1 других
веществ, реагирующих с -нитратом серебра, как, например, lk>S, HsAs, HsSI>,
муравьиный альдегид, муравьиная кислота.
Красный фосфор имеет кристаллическую структуру (гексагональной
системы, ромбоэдры) и образуется при нагревании белого фосфора при-
близительно до 250° в отсутствие воздуха. Он не ядовит, не растворяется
в сернистом углероде и -воспламеняется- лишь при '256°. Он -не светится
в темноте, не -окисляется па воздухе, ио легко окисляется азотной кис-
лотой в фосфорную кислоту.
Светлокрасный фосфор получают по Шенку (Schenk)4 путем нагре-
вания -в течение -нескольких часов раствора белого фосфора и трехброми-
сто.м фосфоре с обратно поставленным холодильником. Выделившийся при
таких условиях .фосфор бледн-окрасного цвета, неядовит, но обладает боль-
шой реагирующей способностью, что и отличает его от красного фос-
фора; так, он -растворяется в концентрированном растворе едкого кали
или натра с бурным -выделением фосфористого водорода; растворение его
1 Черная модификация фо-сфо-р-а называется некоторыми а-вто-рами метал-
лической формой фосфора.' Ред.
2 Сами по себе фосфор и вода так не реагируют между собою, но
в присутствии нитрата серебра, возможно, такая реакция имеет место.
5 Ann. Chem. Phvs. 112, 214 (.1859).
4 В. 36, 979 (1993).
442
происходит даже легче, чем белого 'фосфора- Облитый концентрирован-
ным аммиаком, он окрашивается в черный цвет.
Черный фосфор получается при нагревании красного фосфора со свин-
цом в запаянной трубке до красного каления; по охлаждении массы по-
следнюю обрабатывают разбавленной азотной кислотой, причем свинец
растворяется, а черный фосфор остается. При 360° он 'переходит в белый
фосфор.
Фосфор находится во многих органических веществах. Для открытия
фосфора в органических веществах исследуемое соединение нагревают
в трубке с дымящей азотной кислотой, причем органическое соединение
разрушается, а фосфор окисляется в фосфорную кислоту, которую откры-
вают посредством- ранее описанных реакций.
Специальные реакции на фосфор
Открытие белого (ядовитого} фосфора
(по Митчерлиху
Эта очень чувствительная проба основана на способности белого фос-
фора светиться во влажном воздухе в темноте. Реакция настолько чув-
ствительна. что ею пользуются для открытия фосфора! в случаях от-
равления. 1 2
Выполнение. Мелко измельченное исследуемое вещество помещают
в колбу К емкостью приблизительно 1 л (рис. 17) и приливают
столько воды, сколько необходимо для- образования жидкой кашицы. За-
тем, чтобы нейтра.тизо-вать могущий присутствовать аммиак, .прибавляют
при взбалтывании винную кислоту до слабокяслой реакции. Соединяют
колбу с трубкой'Я и нагревают до кипения. Эту операцию проделывают
в темном помещении. Если н исследуемом объ.
екте имеется лишь -несколько миллиграммов
фосфора, то при .прохождении паров через хо-
лодильник Ав последнем наблюдается свечение
зеленого цвета. При больших количествах
фосфора в дестил.тате в колбочке В образуют-
ся небольшие шарики фосфора, .которые при
слабом нагревании и перемешивании собира-
ются в большие капли; кроме того, дестй.т.тат
содержит водный раствор фосфористой ки-
слоты, присутствие которой .может быть кон-
статировано реакцией Б.тон дло-Дюзара (.Blon-
dlot-Dusart) (стр. 444).
Если во время перегонки в темноте по-
является свечение, то присутствие белого фос-
фора вероятно, но еще ле. доказано, ибо и
сернистый фосфор PiS:i, применяемый для за-
мены фосфора в спичечном производстве, све-
тит иногда 'в аппарате Митчерлиха в частно-
сти, когда .к жидкости шрибавляют немного
окиси пинка, чтобы связать могущий образо-
ваться H’S, препятствующий свечению. Наши
наблюдения показали, чго некоторые препарат,
фосфора, светят и без прибавления окиси цинка. Причиной этого является
Рис. 17.
не содержащие свободного
1 J. prakt. Client. 66, 238 (18.65).
2 J. Mai u. F. Schaffer, В. 36, 870 (1903), далее Leo Vignon,
Bull. Soc. Chim. [3], 33, 805 (1905) и Schenk ti. Scharff, B. 39, 1522
(1906). Между прочим замечу, что не все продажные препараты P-iSs све-
тят в аппарате Митчер.тих-я. Кальбаумовский препарат ие обнаружил ни
малейшего -свечения ни при кипячении с -водой, ни с концентрированным
раствором поваренной соли. Препарат содержал по Ингельдеру (Inlielcler)
1' ~ 55.82; .8 = 44,14, вместо Р = 56,3-1; .8 -
443
следующее обстоятельство: сернистый фосфор с трудом смачивается
водой; плавая на поверхности жидкости, он достигает стенки пер1 2 онной
колбы и может вследствие перегревания распасться на серу и фосфор и
обусловить этим свечение. В таких случаях рекомендуется нагревание
колбы производить не непосредственно, а путем пропускания в нее водя-
ного пара.
Во всяком случае, при пользовании явлением свечения для открытия
белого фосфора в сернистом фосфоре необходима большая осторожность.
Непоявление свечения не служит доказательством и^сутствия белого
фосфора, так как свечение не наблюдается в присутствии стедов аммиака,
сероуглерода, паров спирта, эфирных масел и ненасыщенных углеводоро-
дов. В этом с.рчае нельзя слишком рано прерывать перегонку, ибо часто
бывает, что явление свечения появляется после того, как -вещества, ме-
шающие ему, переходят в лестиутат Но -спи и носе этого не появляется
свечение, то дестиллат исследуют на присутствие фосфора. Для этого об-
рабатывают часть раствора кенп'нтпип ванной 1 от ой водой выпаривают
до небольшого объема на водяной бане и производят реакцию на фос-
форную -ислоту (стр 437 и 438).
По Пезэ (J. Peset)1 свечение появляется очень ясно в колбе, если жид-
кость нагреть до кипения. зате:ч неско нжо охладить и снова нагреть до
кипения. Этим путем можно открыть 4 у фосфора.
Открытие фосфора и фосфористой кислоты
(по Блсндло-Дюзару)г
Нижеописываемый метод основан на -наблюдении, сделанном Дюзаром
(Dusart), что водород, содержащий фосфористый водород, будучи зажжен
при выходе из трубки с платиновым наконечником, горит пламенем, вну-
тренняя часть которого окрашена в изумруднозеленый цвет. Особенно ясно
видна зеленая окраска,
когда- -в пламя вводят хо-
лодную фарфор-овую чаш-
ку.
Так как фосфор, а
также фосфористая и фос-
фор,новатистая кислоты
(но не фосфорная) легко
восстанавливаются цинком
и серной кислотой, то до-
статочно только- зажечь
выделяющийся газ, чтобы
открыть малейшие следы
фосфора по зеленой ок-
раске пламени. •
Органические веще-
ства -могут мешать появле-
нию зеленой окраски; по.
рис jg. этому предварительно- от-
деляют от них фосфор
следующим образом. Рас-
твор, содержащий фосфор, или полученный по методу Митчерлиха дестил-
лат вливают в склянку для выделения газа, прибавляют цинк, не содер-
жащий фосфора, и разбавленную серную кислоту (1:7) и пропускают
выделяющийся газ в нейтральный раствор азотнокислого серебра, причем
образуется черный осадок фосфористого серебра. Этот осадок в случае
присутствия в газе сероводорода может содержать также и сернистое
1 Z. anal. Chem. 48, 35 (1909).
2 L. Dusart, С. г. 43, 1126 (1856) и В I о n d 1 о t, J. Pharm. Chem. [3],
40, 25 (1854).
444
серебро. Отфильтрованный осадок тщательно промывают водой и пере-
нося, в wnapai Ьйоидло (рис. 18).
Для выделения водорода из цинка (свободного от фосфора) и раз-
•бавленнюй серной кислоты (1:7) пользуются 0,5 литровой склянкой
Вульфа W. В трубке U находятся кусочки пемзы, смоченные концентри-
рованным раствором едкого кали. После полного вытеснения воздуха из
аппарата закрывают "зажим а, что заставляет кислоту подняться
в резервуар Т (бутыль с отрезанным дном). Теперь открывают кран а
достаточно широко, чтобы дать возможность постоянной струе водорода
выходить из газоотводящей трубки, сделанной из калийного стекла и снаб-
женной платиновым наконечником1. Пламя зажженного газа не должно
быть слишком большим.
Если пламя при введении в него фарфоровой чашки не дает в тем-
ноте зеленого свечения, заключают об отсутствии в водороде фосфора,
после чего можно приступить к самому опыту.
Смывают полностью черный осадок серебра через склянку Т
в склянку И/. Если осадок содержит фосфор, внутренняя зона пламени
будет ясно зеленой, особенно же, если в пламя ввести фарфоровую чашку.
Сернистый водород, который может быть увлечен газом, будет удер-
живаться кусочками пемзы-, пропитанными концентрированным раствором
едкого кали, в трубке U.
Ввиду того, что как метод Митчерлиха, так и метод Блондло-Дюзара
кроме белого фосфора обнаруживают также и сернистый фосфор, большой
интерес представляет-метод Шейка, и Шарфа2, позволяющий открывать бе-
лый фосфор в присутствии сернистого фосфора. Шенк и Шарф исполь-
зовали для этого свойство белого фосфора ионизировать воздух, чего не
делает сернистый фосфор даже при его свечении. С -подробностями этого
испытания можно ознакомиться по оригинальной работе.
Тиосерная кислота H2S2O3
Эта чрезвычайно неустойчивая кислота, в которой один атом серы
положительно шестивалентен, а другой отрицательно двухвалентен, подвер-
гается быстрому разложению даже в разбавленном -водном растворе на
сернистую кислоту и серу:
Н’БзОз -> H’SOs + S.
Поэтому тиосерная кислота в свободном состоянии не существует. Если
водный раствор соли тио-серной кислоты подкислить .разбавленной соляной
или серной кислотой, то раствор остается некоторое время прозрачным,
но скоро в. нем появляется муть вследствие выделения серы, которая
в этом случае (в противоположность большинству осадков серы) окра-
шена в желтый цвет.
Соли тиосер-ной кислоты, тиосульфаты, значительно более устойчивы,
чем свободная кислота.
* Тиосерная -кислота называется часто (а раньше почти исключительно)
серноватистой кислотой; соответственно этому соли ее называются гипо-
сульфитами (ср. хлорноватистая кислота — гипохлориты). Однако суффикс
«о-ватист» -применяется в русском языке (так же как приставка «гипо»
в иностранных языках) для обозначения низшей степени окисления метал-
лоида. Согласно такой номенклатуре сера в серноватистой кислоте должна
находиться в низшей степени окисления по сравнению с сернистой кис-
1 Для этого- можно пользоваться маленьким платиновым наконечником
паяльной трубки или, еще лучше, свернутой в трубку платиновой- фольгой.
2 R. S с h е n k u. Е- Scharff, В. 39, 1522 (1906). Об открытии бе-
лого фосфора в присутствии фосфорноватистой и мышьяковистой -кислот
см. Lecliv-e, Chem. Zentr. (1912), I, 684.
445
лотой (ср. например хлорноватистая кислота НС1() и хлористая НСЮз).
Принимаемая в настоящее время структура тиосерной кислоты;
НО. //°
или Н..
HSZ X)
ГО О
S
S о
иоказывае!, что и ней один атом серы положительно шестивалентен,
т. е. находится в высшей степени окисления по сравнению с сернистой
кислотой и поэтому' название «серноватистая» кислота (так же как на-
звание «гипосульфиты» для ее солей) является неправильным. Структура
рассматриваемой кислоты показывает, что она аналогична серной кислоте,
в которой один атом кислорода замещен серой. Такие кислоты носят на-
звание «тиокис,тот» (ср. например уксусная кислота СНзСООН и тиоуксус-
ная кислота CHsCOSH; см. примечание на стр. 119). Поэтому для рас-
сматриваемой кислоты правильным названием является «тиосерная» кис-
лота, а для ее сотей «тиосульфаты». Впрочем1, до настоящего времени соли
тиосерной кислоты в химической литературе, и особенно в технике, ши-
роко называются гипосульфитами. РеД.
Получение. 1. Путем кипячения сульфитов с серой:
SO./' + 5
2. Путем кипячения серы с едкой щелочью или с гидроокисями ще-
лочных земель;
4S + 6ОН' ->2S" SeCh" + ЗНтО.
Эта реакция аналогична происходящим при действии галоидов и фос-
фора на растворы щелочей и приводящим к образованию хлорида и ги-
похлорита, фосфористого водорода, и гипофосфита и т. и. (стр. ,342 и 442).
Аналогия становится еще более полной, если рассматривать взаимо-
действие серы со щелочами, как протекающее ио стадиям; в качестве пер-
вых продуктов реакции образуются сульфит и сульфид согласно уравнению;
3S + 6\аОН -> NasSOs + 3NasS + ЗНЮ;
образовавшиеся же сульфит и сульфид реагируют с избытком свободней
серы, приводя к образованию тиосульфата и нолисульфидов:
NasSOs + S -> NasSaOi;
NasS + S -» Na-’Si и т. д.
.3. Путем обработки нолисульфидов щелочных металлов сульфитом ще-
лочного металла на холоду;
N’asS.-, 4Na2SO, -> 4NasSsOs 4- Na:S.
1. Пулем окисления полисульфидов’.
2.\'аг8г ф 301 -> 2\a.-Sv().!.
Эта реакция протекает при кипячении растворив многосернистых со-
единений на воздухе, а также при продолжительном стоянии их. Желты)
сернистый аммоний при стоянии на воздухе превращается в тиосернокис-
лый аммоний с выделением серы.
Тиосульфаты в водном растворе при отсутствии угольной кислоты со-
храняются довольно хорошо. В присутствии угольной кислоты они по-
степенно разлагаются с выделением серы.
446
Важнейшей продажной солью является тиосульфат натрия (NasSsOs*
•&Н2О), называемый обычно гипосульфитом.
Растворимость тиосульфатов. Тиосульфаты щелочных металлов- легко
растворяются в воде, остальные — трудно; многие растворяются в избытке
тиосернокислой щелочи с образованием комплексных солей. i
Тиосульфаты металлов групп серебра и меди при кипячении с водой
обычно разлагаются с образованием нерастворимых сульфидов, так что
тиосульфат натрия в некоторых случаях может замени 1ь сернистый водо-
род в качестве осадителя. В этом отношении он впрочем не так эффек-
тивен, как тиоацетат аммония.
Реакции мокрым путем
Следует применять раствор тиосульфата натрия.
1. Серная кислота. Как разбавленная, так и концентрирован-
ная серная кислота разлагает тиосульфаты с выделением жел-
той серы.
2. Азотнокислое серебро дает белый осадок, который быстро
желтеет, затем буреет и, наконец, становится черным по мере
выделения сернистого серебра:
S2O3" + 2Ag’ -> AgaSA;
AgaScOs _+ Н2О -> H2SO4 + AgaS.
Тиосульфат серебра растворяется в избытке осадителя. Сна-
чала образуется трудно растворимое Na[AgS20a]:
AgaSiOa + S2O3" -> 2[AgS2O3]',
которое в присутствии большего количества тиосульфата натрия
легко растворяется с образованием растворимой комплексной
соли [Ag2(S20s)3]Na4:
2[AgSaO3]' + S2O3" -> [Ag.-(SaO3)3]"';
При кипячении этого раствора выделяется сернистое серебро:
[Ag2(SiO3)3] -> S2O3" + SOj" ,-р SO2 + S 4- AgaS.
Подобно серебру отщепляются в виде сульфида из комплекс-
ных тиосульфатов и многие другие металлы, преимущественно
HaS-группы. Таким путем соли свинца, закиси ртути и олова при
нагревании легко превращаются в сульфиды.
3. Хлористый барий, применяемый в избытке, выделяет бе-
лый кристаллический осадок тиосульфата бария, трудно раство-
ряющегося в холодной воде (480 ч. воды при 18° растворяют
1 ч. ВаЙзОз) и легко в горячей. Так как тиосульфат бария
весьма склонен к образованию пересыщенных растворов, то
образованию осадка способствует трение стеклянной палочкой
о стенки пробирки или внесение «затравки».
4. Хлористый стронций образует только в концентрирован-
ных растворах белый кристаллический осадок, легко раствори-
мый в воде (3,7 ч. воды при 18’ растворяют 1 ч. ЬгЬгОз).
447
’5. Уксуснокислый свинец осаждает белый тиосульфат свинца,
растворимый в избытке тиосернокислой щелочи. При кипячении’
образуется объемистый осадок, состоящий из сернистого и
сернокислого свинца.
6. Раствор иода обесцвечивается тиосульфат-ионом, причем
последний количественно' окисляется <в тетратионат-ион:
25гОз" -ф J2-> 2J' + S4(V.
тетратиоиат-иои
Реакция f тиосульфатом хлора и брома, взятых в избытке, имеет дру-
гое направление (стр. 356). Если ввести хл ор (или бр ом) в раствор тиосуль-
фата натрия, происходит образование значительного1 осадка серы, которая
при дальнейшем действии галоидов исчезает:
SzOs" + НгО + С12-» 2СГ + 2Н’ + SO/' + S.
S + 4НЮ ф ЗС1г -> 8Н‘ + 6С1' + SOZ.
7. Сульфат меди окисляет тиосульфат до тетратионата
с образованием бесцветных одновалентных ионов меди:
25Юз" ^-ф 2’Cu -> S-fOez/ -ф Сиг .
Избыток тиосульфата образует бесцветный комплексный
ион:
Си2" ,-ф 2S2O3"-> [Сиэ(5гОз)2]*.
Прибавление едкой щелочи к образующемуся бесцветному раствору
вызывает медленно на холоду, быстро при нагревании выделение желтого
гидрата закиси меди, который при кипячении приобретает более темную
окраску. Если подкислить и прокипятить раствор, то выпадает черный
сульфид меди C112S. Железисто-синеродистый калий осаждает из нейтраль-
ного раствора указанной комплексной соли почти белый {бледнорозовый)
осадок железистосинердиктой меди (одновалентной).
8. Сульфаты цинка и кадмия не дают осадка (отличие от
сульфидов).
9. Хлорное железо образует в растворах тиосульфата натрия
сначала темнофиолетовое окрашивание (вероятно, ©следствие
образования тиосульфата окиси железа), которое спустя неко-
торое время исчезает, и раствор, содержащий после этого хло-
ристое железо и тетратио,новокислый натрий, становится бес-
цветным:
2S2O3' + 2Fe' ‘ 2Fe’ ‘ -ф SiOe".
10. Цианистый калий. При кипячении тиосульфата с циани-
стым калием и едким натром тиосульфат переходит в сульфит,
а цианид в роданид:
S2O3" -ф CN' -> SO3" -ф CNS'.
Если подкислить раствор, удалить кипячением избыток циа,-
нистого водорода и прибавить затем хлорное железо, то обра-
зуется кровавокрасное родановое железо (отличие от суль-
фитов).
448
11. Сернокислый цинк и нитропруесид натрия не Дают крае-
н,ого окрашивания с тиосульфат-ионом (отличие от сульфитов).
12. Цинк в кислом растворе выделяет сернистый водород
с образованием некоторого количества гидросернистой кислоты:
3Zn + 2H2S2O3.+ 6Н' -> 3Zn' ’ + H2S2O4 + 2НаО + 2HaS.
13. Перманганат сразу обесцвечивается тиосульфатом в кислом
растворе. Полное окисление тиосульфата приводит к образо-
ванию сульфата:
8МпО4" ф 0S2O3" + 14Н‘ ->8'Мп’-' + IOSO4" .4- 7Н2О1.
14. , Молибдат аммония (10%-ный раствор), смешанный с рав-
ным объемом раствора тиосульфата: и осторожнр прибавленный
к небольшому количеству концентрированной серной кислоты
(в пробирке), дает в зоне соприкосновения двух; слоев синее
кольцо.
15. Хромовокислый калий в кислом растворе сразу восстана-
вливается до солей трехв’алентного хрома:
SCrOZ ф 3SiO3" 4- 34Н- -> 8Сг* ’ • 4- 6SO4" 4~ 17Н2О.
В нейтральном растворе образуется бурый осадок гидроокиси
хрома и серы:
2СгО4" 4- 3S*0s" 4- 5НЮ-> 350% ф 4ОН' 4- 3S 4- 2Ог(ОН)«.
16. Нитропруссид натрия, водный раствор которого подвер-
гался действию воздуха и солнечного света до появле-
ния коричневой окраски или к которому добавлены
!1—2 капли раствора железосинеродистого калия и такое же
количество раствора едкого натра, дает с тиосульфатом синее
окрашивание, которое при стоянии, нагревании или при Доба-
влении небольшого количества железосинеродистого калия ста-
новится более интенсивным (отличие от сульфитов и тетратио-
натов).
* Добавление редактора. 17. Азид натрия и иод. Наиболее
.чувствительная и специфичная реакция для открытия тиосерной
кислоты может быть основана на способности, ее каталитически
ускорять неизмеримо медленно протекающую реакцию между
азидом натрия и иодом:
2Na№ 4~. J2 -> 2Na J 4- 3N«.
Впервые это свойство сульфидов и тиосульфатов было от-
мечено Рашитом1 2; Файгль3 на основе его предложил
реакцию как на тиосульфаты, так и на сульфиды и роданиды,
1 Количественное окисление тиосульфата перманганатом- в сульфат про-
исходит только в щелочном растворе, в кислом же растворе тиосульфат
окисляется до сульфата и тетратионата. Ред.
г F. Raschig, В. 48, 2088 (1915).
3 р, Feigl, Z. anal. Chem. 74, 309 (1928). См. также того же автора
«Капельный анализ», стр. 380.
29 Зак. 582. Тредвелл-Гилл, т. I. . 449
т. е. на соединения, содержащие двухвалентную серу. Эта реак-
ция однозначна на тиосульфаты только в отсутствие сульфида
и роданида.
Выполнение. К капле исследуемого раствора на часовом стекле при-
бавляют каплю иодного раствора азида натрия (1 г азида в 100 .и.т 0.1W
раствора иода). В зависимости от количества тиосульфата наблюдается
более или меиее сильное выделение пузырьков элементарного азота. От-
крываемый минимум; 0,15 у тиосульфата натрия, 'предельная концентрация
1 : 330 000. * А. К.
Реакции сухим путем
При прокаливании щелочных солей тиосерной- кислоты
без доступа воздуха образуются сначала сульфат и полисуль-
фид; последний затем расщепляется на сульфид и серу:
4Na2S*O3 •* 3Na2SO4 ф Na2Ss;
NaeSs -> Na2S ф 4S.
Если эту реакцию производить в запаянной трубке, то полу-
чают возгон серы (отличие от сульфитов). Остаток после про-
каливания, смоченный кислотой, выделяет сероводород.
Открытие сернистой, тиосерной и сернистоводородной кислот
при одновременном их присутствии
а) По Воточеку (Е. Votocek)1
Принцип метода. Сульфиты, сульфиды и полисульфиды щелочных ме-
таллов в слабощелочном растворе обесцвечивают водный раствор фуксина,
малахитовой зелени или смесь обоих красителей. Но если к обесцвечен-
ному раствор}' 'прибавить раствор уксусного или муравьиного альдегида,
окраска снова- возвращается. Бисульфиды, тиосульфаты и тиоиапы (соди
политионовых кислот) нс обесцвечивают растворов указанных красителей,
Реактив. Растворяют отдельно 0,025 г фуксина и 0,025 г малахитовой
зелени в 100 мл, воды. Смешивают 3 ч. (по объему) раствора фуксина
с 1 ч. раствора малахитовой зелени.
Выполнение. Предполагается, что исследуемый раствор щелочной. -Его
исследуют сперва на сульфиды (средние и кислые соли сернистоводород-
ной кислоты 'И ‘многосер'нистые соли). Для этого к небольшой части рас-
твора -прибавляют 2—3 капли раствора нитропруссида натрия. Красно-фио-
летовое окрашивание раствора служит признаком присутствия сульфидов.
В случае положительного результата к остатку раствора прибавляют
углекислый кадмий, сильно взбалтывают и дают образовавшемуся серни-
стому кадмию осесть. Фильтруют и снова пробуют небольшую часть филь-
трата посредством нитропруссида натрия, чтобы убедиться в полном от-
сутствии сульфидов. По удалении сульфидов, к фильтрату прибавляют
каплю фенолфталеина и пропускают С Оз до обесцвечивания .раствора.
К 2—Э мл обесцвеченного раствора прибавляют 2—3 капли фуксина и .ма-
лахитовой зелени. Если окраска тотчас исчезает,'то эго указывает на
присутствие сульфита, яеисчезающая же окраска указывает на отсутствие
последнего. После этого к раствору прибавляют немного разоавленнои
1 В. 40, 414 (1917).
450
соляной кислоты, кипятят несколько минут и наблюдают, не происходит ли
выделение серы, что всегда имеет место в присутствии тиосульфата. Если
же расIвор остается прозрачным, заключают' об отсутствии тиосульфата.
Это лучший метод для открытия сульфида, сульфита и тиосульфата,
при одновременном их присутствии.
б) По Аутеириту (Autcnrieth) И Виндаусу (Windau») 1
Предполагается, что все три кислоты находятся в растворе в виде
щелочных солей. К умеренно конце-нтрированно1му растворе- прибавляют
углекислый кадмий, взбалтывают и отфильтровывают образующийся сер-
нистый кадмий и избыток карбоната. К фильтрат)- прибавляют раствор
азотнокислого стронция и оставляют на ночь, после чего отфильтровывают
выделившийся сернистокислый стронций и промывают- последний неболь-
шим количеством холодной воды. Обработав на фильтре сернистокислый
стронций разбавленной соляной кислотой, получают в растворе сернистую
кислоту, которая узнается по обесцвечиванию раствора иода. В фильтрате
от сернистокислого стронция находится тиосульфат, присутствие которого
констатируется по выделению серы из ‘подкисленного соляной кислотой
и нагретого раствора.
Таблица 18
Растворимость сульфитов и тиосульфатов в воде
Катион Сульфит Тиосульфат
Кальций 1 : 800 1 :2
Стронций 1 :30 ООО 1 :3,7
Барий 1 :46 СОО 1 1480
Гидросернистая кислота HSO
Гидросернисгая кислота была впервые приготовлена Бертол.те в 1789 г.
Он установил, что железо, находящееся в соприкосновении с водным рас-
твором двуокиси серы, растворяется без выделения водорода; позже
Шенбейн (Schonbein) указал на сильно восстановительные свойства этой
кислоты. Натриевая соль ее была впервые получена Шутценбергером
(Schutzenberger) в 1869 г. при действии цинка на концентрированный рас-
твор бисульфита натрия и отделена от сульфитов путем дробного осаж-
дения:
Zn + 4\’aHSCh-> NajSiCh + ZuSOt + NaiSOj + 2HsO.
Раствор свободной кислоты может быть получен при добавлении
щавелевой кислоты к раствору гидросульфита натрия. Раствор свободной
кислоты имеет желтый цвет и разлагается на элементарную серу, дву-
окись серы, миогосернистые водороды и политионовые кислоты.
Мышьяковистая, мышьяковая, хромовая и ванадиевая
кислоты
О мышьяковистой и мышьяковой кислотах, относящихся к этой
группе, см. стр. 165—173; о .хромовой кислот—стр. 227; о ванадиевой
кислоте — стр. 62" 632.
’ Z. anal. Chem. 37, 295 (1*98). О другом методе открытия сульфита
в присутствии тиосульфата см. F. Е. Weston, Chem. Zcntr. (1910), I, 379,
29* 451
Иодная i ислота'HJCh
Нахождение в природе. Иодная кислота а виде натриевой соли нахо-
дится в небольших количествах в чилийской селитре.
Свободная кислота обладает большой склочностью давать различные
гидраты общей формулы (HJO«)3• (Н Наиболее хорошо известен ги-
драт с двумя молекулами воды HJO4’2H-*O, который получается при вы-
сушивании кислоты над серной кислотой. Он представляет соб' й призмы,
сходные с кристаллами гипса, плавящиеся при температуре 133°. При бо-
лее высокой температуре происходит распад его с выделением воды, кис-
лорода и J2O5. Характерной особенностью указанных гидратов является
способность замещать на металлы не только кислотный водород, но также
и водороды воды. Например, кислота Н.1О4-2НгО способна вести себя как
пятиосиовная кислота HsJOs, давая серебряную соль состава AgsJOe и ба-
риевую Bas(JOe)2.
Некоторую аналогию в данном случае можно провести с фосфорными
кислотами, если принять для них общую формулу (НРОз)ж • (НгО)^; тогда
метафосфорная кислота НРОз получится при х = 1, у = 0; ортофосфорная
кислота Н3РО4 (НРОз • НаО) при х = 1. у = 1; пирофосфорная кислота
Н4РгОт (2НРОз-Н2О) при х = 2, у — 1. Однако переход в ряду гидратов
иодной кислоты совершается более легко, чем в ряду фосфорных кислот.
В водных растворах иодная кислота является заметно более слабой
кислотой, чем иодно-ватая кислота. Ее константа диссоциации равна
2,3-IO-2. При нейтрализации по метилоранжу (pH 4) она дает одно-
основные соли, например NaJOi-SHsO; при нейтрализации по фенолфта-
леину (pH«8) оиа дает двуосновные соли, производящиеся от кислоты
HJCh-HaO, например Na-HJOs.
Как окислитель иодная кислота является более активной, чем йодно-
ватая кислота.
Соли иодной кислоты носят название перйодатов; их получают из йодно-
ватокислых солей (йодатов) или путем анодного окисления щелочных
растворов с применением платиновых электродов, или путем окисления
щелочных растворов хлором:
NaJOs + ЗХ’аОН + Ch -> 2NaCl + Na-HJOs + H2O.
Растворимость перйодатов. Соли щелочных металлов иодиой кислоты
мело растворимы в воде; еще меньшая растворимость солей 'щелочнозе-
мельных и тяжелы?: металлов. Все соли ее относительно легко раство-
ряются в минеральных кислотах, особенно в азотной кислоте.
Реакции мокрым путем
Следует применять иоднокислый натрий.
1. Серная кислота в разбавленном растворе не реагирует.
2. Азотнокислое серебро дает бурый осадок Ag-,JO6, причем
раствор приобретает кислую реакцию. Осадок при стоянии,
быстрее при нагревании, окрашивается в буро-черный цвет и
растворяется в азотной кислоте (отличие от йодатов) и в ам-
миаке.
3. Хлористый барий осаждает белый осадок, растворимый
в азотной кислоте. ,
4. Азотнокислый торий не дает никакого осадка (отличие от
йодатов).
5. Нитрат ртути(2) выделяет красно-бурый осадок, не меняю-
щийся при кипячении и не растворимый в азотной кислоте и
аммиаке.
452
6. Ацетат свинца осаждает белую свинцовую соль иодной
кислоты, не растворимую в азотной кислоте.
7. Йодиды. В противоположность йодатам иоднокислые
соли выделяют из нейтрального или даже из слабощелочного
раствора иодидов иод:
JO/ + 2J' 4- НгО -> JO3' 4- J2 4- 2ОН'.
В результате образования ОН'-ионов реакция раствора стано-
вится щелочной. При долгом стоянии щелочная реакция исчезает,
так как свободный иод реагирует с избытком соли иодной
кислоты:
5JO/ 4- Ь 4- 2ОН' ->7JO3' 4- НгО.
В сильнокислом растворе взаимодействие иодидов и перйода-
тов протекает количественно согласно уравнению:
JO/ 4- 7J' 4- 8Н‘ -> 4J2 4- 4НгО.
8. Сернокислый марганец в сильно разбавленном кислом
растворе окисляется при нагревании до марганцевой кислоты;
в нейтральном или щелочном растворе окисление идет до
гидрата двуокиси марганца и иодноватокислой соли марганца.
9. Щавелевая кислота быстро окисляется до СОг при нагре-
вании, особенно в присутствии сернокислого марганца в качестве
катализатора. Образующийся при этом иодид с избытком пе-
рйодата выделяет свободный иод.
* Добавление редактора. 10. Сульфат меди и персульфат калия.
При нагревании щелочных растворов медных солей с перйодатом
(или теллуратом) в присутствии персульфата калия или натрия
появляется интенсивное буро-красное окрашивание. При этом
происходит образование комплексного аниона, содержащего
трехвалентную медь1 (стр. 149). Комплексное соединение трех-
валентной меди с перйодатами (а также с теллуратами) на-
столько интенсивно окрашено, что даже в очень разбавленных
растворах можно открыть иодную кислоту по желтому окраши-
ванию. Открытие иодной кислоты по этому методу однозначно
в отсутствие теллуровой кислоты.
Выполнение К капле исследуемого щелочного раствора прибавляют
каплют сульфата меди (1:50 000), каплю 2N едкой щелочи и, наконец,
иемно о твердого персульфата калия или натрия, после чего нагревают до
кипегТя. Желтая окраска указывает иа присутствие иодной (илн теллуро-
вой), 'ислоты. Таким путем можно открыть 2 )' перйодата. Предельная
конов,трация I : 25 000. * А. К.
jnd
в Реакции сухим путем
•ля нци иодной кислоты теряют приблизительно при 300'’ кисло-
ро;же1 превращаются в йодаты, которые при более высокой
______в з_____
Ора г a u n е г u. Kuzma, В. 40, 3362 (1907); М. V г i t i s, Rec. des
tra' chim. des Pays-Bas. 45. 429 (1925).
(..M. u (J z e I, Mikrochemie 19, 132 (1936).
453
Иодная кислота HJO4
Нахождение в природе. Иодная кислота в виде натриевой соли нахо-
дится в небольших количествах в чилийской селитре.
Свободная кислота обладает большой склочностью давать различные
гидраты общей формулы (HJCh).-, • (И Наиболее хорошо нз^стен ги-
драт с двумя молекулами воды Н2О4’2НзО, который получается при вы-
сушивании кислоты над серной кислотой. Он представляет соб й призмы,
сходные с кристаллами гипса, плавящиеся при температуре 133°. При бо-
лее высокой температуре происходит распад его с -выделением воды, кис-
лорода и J2O5. Характерной особенностью указанных гидратов является
способность замещать на металлы не только кислотный водород, но также
и водороды воды. Например, кислота НЛО4-2НгО способна вести себя как
пятиосиовная кислота HsJOs, давая серебряную соль состава AgsJOe и ба-
риевую Bas(JOe)s.
Некоторую аналогию в данном случае можно провести с фосфорными
кислотами, если принять для них общую формулу (НРОз)ж • (НзО)^; тогда
метафосфо.риая кислота НРОз получится при х = 1, у = 0; ортофосфо-рная
кислота Н3РО4 (НРОз’НгО) при х = 1, у = 1; пирофосфориая кислота
Н4Р2О7 (2НРОз • НаО) при х = 2, у = 1. Однако переход в ряду гидратов
иодной кислоты совершается более легко, чем в ряду фосфорных кислот.
В водных растворах иодиая кислота является заметно более слабой
кислотой, чем йодноватая кислота. Ее константа диссоциации равна
2,3 • 10~2. При нейтрализации по метилоранжу (pH 4) она дает одно-
основные соли, например NaJCh-SHzO; при нейтрализации по фенолфта-
леину (pH г» 8) она дает двуосновные соли, производящиеся от кислоты
HJCh-НЮ, например NasHJOs.
Как окислитель иодная кислота является более активной, чем йодно-
ватая кислота.
Соли иодной кислоты носят название перйодатов; их получают из йодно-
ватокислых солей (йодатов) или путем анодного окисления щелочных
растворов с применением платиновых электродов, или путем окисления
щелочных растворов хлором1:
N'aJOs -I- 3Na.OH + Ch 2NaCl + NasHJOs + НзО.
Растворимость периодатов. Соли щелочных металлов иодной кислоты
мало растворимы в воде; еще меньшая растворимость солей 'щелочнозе-
мельных и тяжелых металлов. Все соли ее относительно легко раство-
ряются в минеральных кислотах, особенно в азотной кислоте.
Реакции мокрым путем
Следует применять иоднокислый натрий.
1. Серная кислота в разбавленном растворе не реагирует.
2. Азотнокислое серебро дает бурый осадок Ag.-JOe, причем
раствор приобретает кислую реакцию. Осадок при стоянии,
быстрее при нагревании, опрашивается в буро-черный цвет и
растворяется в азотной кислоте (отличие от йодатов) и в ам-
миаке.
3. Хлористый барий осаждает белый осадок, растворимый
в азотной кислоте. ,
4. Азотнокислый торий не дает никакого осадка (отличие от
йодатов).
5. Нитрат ртути(2) выделяет красно-бурый осадок, не меняю-
щийся при кипячении и не растворимый в азотной кислоте и
аммиаке.
452
6. Ацетат свинца осаждает белую свинцовую соль иодной
кислоты, не растворимую в азотной кислоте.
7. Иодиды. В противоположность йодатам иоднокислые
соли выделяют из нейтрального или даже из слабощелочного
раствора иодидов иод:
JO/ + 2J' 4- НгО JO3' 4- J2 4- 2ОН'.
В результате образования ОН'-ионов реакция раствора стано-
вится щелочной. При долгом стоянии щелочная реакция исчезает,
так как свободный иод реагирует с избытком соли иодной
кислоты:
5JO4' 4- Ji 4- 2ОН' ->7JO3' 4- НгО.
В сильнокислом растворе взаимодействие иодидов и перйода-
тов протекает количественно согласно уравнению:
JO/ 4- 7J' 4- 8Н‘ -> 4J2 4- 4НгО.
8. Сернокислый марганец в сильно разбавленном кислом
растворе окисляется при нагревании до марганцевой кислоты;
в нейтральном или щелочном растворе окисление идет до
гидрата двуокиси марганца и иодноватокислой соли марганца.
9. Щавелевая кислота быстро окисляется до СОг при нагре-
вании, особенно в присутствии сернокислого марганца в качестве
катализатора. Образующийся .при этом иодид с избытком пе-
рйодата выделяет свободный иод.
* Добавление редактора. 10. Сульфат меди и персульфат калия.
При нагревании щелочных растворов медных солей с перйодатом
(или теллурзгом) в присутствии персульфата калия или натрия
появляется интенсивное буро-красное окрашивание. При этом
происходит образование комплексного аниона, содержащего
трехвалентную медь1 (стр. 149). Комплексное соединение трех-
валентной меди с перйодатами (а также с теллурата.ми) на-
столько интенсивно окрашено, что даже в очень разбавленных
растворах можно открыть иодную кислоту по желтому окраши-
ванию. Открытие иодной кислоты по этому методу однозначно
в отсутствие теллуровой кислоты.
Выполнение2. К капле исследуемого щелочного раствора прибавляют
каплю сульфата меди (1:50 000), каплю 2 Л' едкой щелочи и, наконец,
немного твердого персульфата калия или иатрия, после чего нагревают до
кипения. Желтая окраска указывает на присутствие иодной (или теллуро-
вой) кислоты. Таким путем можно открыть 2 у перйодата. Предельная
концентрация 1 :25 000.* А. К.
Реакции сухим путем
"оли иодной кислоты теряют приблизительно при 300'’ кисло-
ро; и превращаются в йодаты, которые при более высокой
В г a u n е г u. Kuzma, В. 40, 3362 (1907); М. V г i t i s, Rec. des
tra'ux chim. des Pays-Bas. 45. 429 (1925).
F ei s I u. U z. e 1, MiKrochemie 19, 132 (1936).
453
температуре разлагаются, также теряя кислород, как это было
указано при йодноватой кислоте (стр. 434). Разложение может
сопровождаться взрывом.
ГРУППА V
Азотнокислое серебро не выделяет осадка ни в кислом, ни
в нейтральном растворе.
Хлористый барий также не образует осадка.
Азотная кислота HNO,
Нахождение в природе. Азотная кислота н виде нитратов встречается
почти всюду в природе в небольших количествах; так, аммонийная coin
плотной кислоты находится в атмосферном воздухе и почве; кальциевая соль
встречается в старых каменных кладках; натриевая соль встречается в за
сушлизых местностях, особ! нно же в Чили (чилийская селитра').
Азотная кислота является конечным продуктом окисления аммиака; она
находится всюду, где азотсодержащие органические вещества подвергаются
гниению, образуя аммиак. Под действием микроорганизма (Monas nitrifi-
cans согласно Виноградскому) аммиак сначала превращается а азотистую
кислоту:
2\Нз + 30» > 2Н»(> % 2HNO»
и при дальнейшем окислении •- в азотную:
2HNO» + О»-> 2HNOs.
Свойства. Чистая азотная кислота — бесцветная жидкость, плотность
которой при 20' 1.54. Она застывает в белые кристаллы при температуре
ниже —‘У'; при плавлении она частично разлагается на Н»О и . При
86' она начинает кипеть с разложением, выделяя ангидрид, который под-
вергается дальнейшему распаду на двуокись азота NO» (бурые пары) и
кислород. За счет потери NsOs азотная кислота становится все более и
более разбавленной, и ее точка кипения постепенно повышается, пока не
достигнет постоянной точки кипения при 120,5'-'; при этой температуре
перегоняется 68%-ная азотная кислота плотностью 1.414. При дестиллдцян
более разбавленной кислоты сначала перегоняется вода, причем точка ки-
пения повышается, пока температура не достигнет 120,5', при которой
снова перегоняется 68%-иая кислота.
Красная дымящая азотная кислота получается путем пропускания NO»
в бесцветную концентрированную азотную кислоту. Наиболее концентри-
рованная кислота имеет плотность 1,55.
При действии воды на дымящую азотную кислоту последняя окраши-
вается в зеленый цвет, при этом выделяется окись азота, которая в сопри-
косновении с воздухом окрашивается в бурый цвет. Растворенная двуокись
азота NO» (или лучше N2O4). будучи смешанным ангидридом, превращается
в азотную н азотистую кислоты:
N2O4 + Н»О -> HNOs + HNOs;
азотистая же кислота за счет теплоты реакции частью превращается р
азотную кислоту с выделением окиси азота:
SHN'Os -> Н»О + HNOs + 2NO
и
2NO + О2 -> 2NOs
(бурые пары)
Азотная кислота является энергичным окислителем (стр. 46). Она
одноосновна и подобно галои.юводородным киснлам относится к силь-
нейшим кисло гам (пр. 24). Она образует устойчивые co in (нитраты), рас-
творимые в воде; некоторые из них при взанмоденсi ими с водой пу.езра-
454
щаются в основные соли (например, соли висмута и двухвалентной ртути),
не растворимые в воде, но растворимые в разбавленной азотной кислоте.
Азотная кислота окисляет и растворяет все металлы (за исключением
хрома, алюминия, золота и платиновых металлов), образуя иитраты со
всеми металлами, за исключением олова, сурьмы н мышьяка. Реакция
с медью, серебром, свинцом и ртутью приводит обыкновенно к образова-
нию нитрата и окиси азота NO. При реакции с цинком в зависимости от
концентрации и количества кислоты образуются следующие продукты вос-
становления: NOa, NO, Ns, NH2OH, HNO2 и NH4NO3.
Гидрат закиси железа ' может восстановить нитрат-ион до аммиака;
в присутствии серной кислоты сульфат двухвалентного железа производит
восстановление только до окиси азота. Углерод (но не графит) окисляется
горячей концентрированной азотной кислотой до COs. Щавелевая кислота
окисляется в воду и COs. Hj[Fe(CN)eJ окисляется в Hs[Fe(CN)s; и затем
в гидронитрожелезосинеродистую кислоту HsEFetCNjsNOaJ, натриевая соль
которой Na2[Fe(CN)sNO2] обыкновенно называется нитропруссидом на-
трия и которая применяется в качестве реактива для открытия серы.
HCNS окисляется азотной кислотой, причем сера переходит в сульфат.
Фосфор и те его соединения, в которых валентность фосфора ниже пяти,
окисляются в Н3РО4. Соляная кислота вместе с азотной кислотой образуют
царскую водку, которая разлагается на NO и Cis или иа NOCI И Cis.
Бромистоводородная кислота окисляется с выделением свободного брома;
при действии концентрированной азотной кислоты на иодистоводородную
кислоту образующийся вначале иод окисляется в HJOs.
Реакции мокрым путем
Азотная кислота не образует характерных, нерастворимых солей, и
поэтому она не может быть открыта посредством реакций осаждения; ее
идентификация основывается на реакциях окисления. Необходимо соблю-
дать большую осторожность при решении вопроса о наличии этой кис-
лоты, потому что и другие окислители дают подобные, а иногда даже те
же самые реакции.
1. Разбавленная серная кислота не дает реакции (отличие от
азотистой кислоты).
2. Концентрированная серная кислота выделяет из всех ни-
тратов при нагревании желтоватые или бурые пары (NO2) с ха-
рактерным острым запахом.
3. Азотнокислое серебро и хлористый барий осадка не дают.
4. Соли закиси железа окисляются азотной кислотой с выде-
лением окиси азота NO.
Если реакция проходит на холоду, то окись азота соединяется
с избытком соли закиси железа, образуя окрашенные в темнобурый цвет
крайне непрочные соединения FeSCh-xNO1. Пр.и нагревании эти соедине-
ния распадаются на соль закиси железа и окись азота, которая выделяется,
бурая окраска при этом исчезает. В присутствии же малого количества
соли закиси железа, другими словами, когда количество азотной
кислоты превышает то, какое необходимо для превращения соли закиси
железа в соль окиси, окраска становится более красноватой вследствие
образования Fe»(SO4)s • 4NO.
Выполнение. Испытуемое на нитраты вещество растворяют в про-
бирке в 5 .кд воды, добавляют равный объем концентрированной серной
кислоты и охлаждают под краном’ до комнатной температуры. Осторожно
добавляют по стенке пробирки 5 ,и.( насыщенного раствора суль-
фата железа(2) так, чтобы жидкости не смешивались. В присутствии нит-
рата в зоне соприкосновения раствора сульфата железа и сернокислого
раствора образуется бурое кольцо; если присутствуют большие количества
1 См. подеiponi.oc прьмечание на dp. 3S4. РеД.
455
нитрата, может окраситься весь слой раствора сульфата железа; в присут-
ствии следов нитратов в зоне соприкосновения наблюдается розовая
окраска. Реакция ненадежна в присутствии иодидов, хроматов, цианидов,
ферроцианидов, роданидов, сульфитов и тиосульфатов.
Эту реакцию можно выполнить также и на капельной пластинке С Для
этого кристалл железного купороса величиной с булавочную головку по-
мещают в углублении капельной пластинки, прибавляют каплю исследуе-
мого раствора и подводят сбоку каплю концентрированной серной кислоты.
Уже при наличии 2,5 Т нитрата вокруг кристаллика железного купороса
появляется бурое кольцо.
* Примечание редактора. Если реакция происходит от прибавления
даже разбавленной серной кислоты, то это служит признаком присутствия
азотистой кислоты. Нужно заметить, что эту реакцию азотистая кислота
дает даже с уксусной кислотой. * А. К.
5. Раствор индиго .при нагревании обесцвечивается азотной
кислотой, как и многими другими окислителями.
6. Иодистый калий не окисляется чистой разбавленной азот-1 2
ной кислотой (отличие от азотистой кислоты).
Если к раствору какого-нибудь нитрата прибавить иодистый калий,
несколько капель кислоты (лучше всего уксусной) и немного цинка, то
азотная кислота быстро восстановится в азотистую, действующую уже
окисляющим образом на иодистый водород; раствор вследствие выделения
исда окрашивается в желтый цвет.
При взбалтывании раствора с сероуглеродом последний окрашивается
в красновато-фиолетовый цвет; иод может быть также констатирован до-
бавлением небольшого количества крахмального клейстера.
Реакции, которые при этом происходят, могут быть представлены сле-
дующими уравнениями:
Zn + NOs' + 2Н‘ -> Zn‘ ' + NOz' + НгО;
2NOfe'+ 2J'+ 4Н--> 2NO + 2Н.Ю + Jz.
Если хотят открыть иод растворением его в сероуглероде, последний
нельзя приливать до окончания реакции цинка с кислотой. В противном
случае выделение иода часто не происходит, так как цинк восстанавливает
сероуглерод в тиомуравьиный альдегид и сернистый водород, а последний
реагирует с образующимся иодом, превращая его снова в иодистоводо-
родную кислоту.
CSz + 4Н- + 2Zn -> 2Zn- • + CHzS + H«S;
HzS + Jz -> 2HJ + S.
7. Дифениламиновая реакция (реакция Лунге) Реактив
приготовляется растворением. 0,5 г дифениламина в .смеси из
100 мл чистой концентрированной серной кислоты и 20 мл воды.
Выполнение. В пробирку вливают несколько миллилитров раствора
дифениламина и осторожно по стенке пробирки вливают испытуемый
на азотную кислоту раствор так, чтобы жидкости не смешивались. В при-
сутствии азотной кислоты в месте соприкосновения обеих жидкостей по
истечении нескольких минут появляется синее окрашивание, напоминаю-
щее цвет васильков.
Эта в высшей степени чувствительная реакция, к сожалению, не мо-
жет считаться специфичной на азотную кислоту, так как она получается
также в присутствии азотистой, хлорноватой и селеновой кислот, солей
окиси железа, ванадиевой кислоты и многих других окислителей. Эту реак-
цию дает даже 30%-ная дымящая серная кислота, 20%-ная не дает. По-
этому, когда хотят исследовать высокопроцентную дымящую серную кис-
1 Файгль, .Капельный анализ, стр. 384.
2 L u n g е, Z. angew. Chem. 7, 345 (1894).
456
лоту на присутствие HNOs, ее предварительно разбавляют чистой концен-
трированной H2SO4 и затем уже прибавляют дифениламин.
В отсутствие селеновой кислоты и- солей окиси железа эта реакция
применима для открытия кислот азота в серной кислоте. В этом случае
в пробирку вливают сначала исследуемую концентрированную серную кис-
лоту и затем осторожно по стенке пробирки — более легкий по удельному
весу раствор дифениламина. 1 мл кислоты, в литре которой содержится
0,05 мг азота, дает еще ясно заметную реакцию.
8. Бруцин Ч Реактив приготовляется путем растворения 0,2 г
бруцина в 100 мл концентрированной чистой серной кислоты.
Выполнение. К раствору, исследуемому на азотную кислоту, приливают
тройное по объему количество концентрированной серной кислоты и 1 мл
раствора бруцина и смешивают; при этом появляется красное окрашива-
ние, быстро переходящее в оранжевое, затем медленнее в лимонно- или
золотистожелтое и, наконец, в зелено-желтое окрашивание.
Азотистая кислота этой реакции не дает при том условии, если она
находится в виде нитрозы, т. е. растворена в концентрированной серной
кислоте. Водные растворы нитритов при подкислении серной кислотой
всегда дают небольшие количества азотной кислоты и поэтому реагируют
с бруцином.
Серная кислота часто содержит небольшие количества азотной кис-
лоты. Если концентрированную кислоту разбавить до плотности 1,4 и ки-
пятить в течение некоторого времени в платиновой чашке, то HNOa и
HNOs могут быть полностью удалены.
9. Нитрон* 2 (дифенил-эндоанило-дигидротрпазол-1, 2, 4).
Раствор нитрона (10$) 'В уксусной кислоте выделяет белый оса-
док нитрата нитрона. Эта реакция неспецифична для нит'рат-
ионов, потому что нерастворимые соединения с нитроном дают
также бромиды, иодиды, нитриты, хроматы, хлораты, перхло-
раты, роданиды, ферро- и феррицианиды, оксалаты и пикраты.
10. Цинк или алюминий в щелочных растворах и сплав Де-
варда восстанавливают нитраты:
ЗЫОз' + 8А1 -ф 5ОН' + 2Н2О -> 8АЮ2' + 3NHS.
При кипячении раствора нитрата с цинковой пылью и едкой
щелочью происходит выделение аммиака:
NO.3' + 4Zn 4- ЗОН' + 2Н2О -»4HZnO2' + NH3.
Эта реакция, в частности, особенно пригодна для открытия
азотной кислоты в присутствии хлорноватой кислоты (стр. 462).
Азотная кислота может быть также открыта путем переведения ее
в азотистую кислоту, дающую красное окрашивание с сульфаниловой кис-
лотой и а-нафтиламииом 3.
В углубление капельной пластинки помещают каплю нейтрального или
уксуснокислого исследуемого раствора, смешивают ее с каплей 1%-ного
'Lunge, Z. ang. Chem. 7, 348 (1894).
2 М. Bu sch, В. 38, 861 (1905).
» P. Griess, В. 12, 427 (1879); I. Blom, В. 59, 121 (1926).
457
раствора сульфаниловой кислоты в 30%-ной уксусной кислоте и с каплей
0,3%-ного раствора я-нафтиламина в 30%-ной уксусной кислоте. После
прибавления нескольких миллиграммов цинковой пыли появляется красное
окрашивание, обусловленное образованием азокраски CeH4SOsH>- Ns •
С1оНв(МНг)г. Этой реакцией можно открыть 0,05 7 НХОз (предельная кон-
центрация I : 1 000 ООО)'.
11. Хлористый марганец. Насыщенный раствор хлористого
марганца в концентрированной соляной кислоте дает с нитра-
тами темное чернобурое окрашивание за счет образования MnCla.
Эту реакцию дают также и другие окислители.
12. Салициловая кислота (раствор 2 г в 30 концентриро-
ванной сенной 'Кислоты) при 1нагревании с сухими нитратами дает
желтое окрашивание за счет образования нитросалициловой кис-
лоты.
Реакции сухим путем
Азотнокислые соли щелочных металлов при прокаливании
теряют кислород и переходят в нитраты (соли азотной кислоты),
которые при битее сильном накаливании превращаются в окись:
2KNO3 ~> 2KNO® + Ог;
4KNO-J * 2КеО +4NC) + ()•_>.
Все нитраты вспыхивают при нагревании на угле; правильнее
было бы сказать, что уголь горит за счет кислорода нитратов
с ярким свечением.
Открытие азотной кислоты в присутствии азотистой кислоты
Нет ни одной вполне падежной качественной реакции, которая
позволяла бы открывать в водных растворах следы нитратов в присут-
ствии больших количеств нитритов.
Было предложено много методов, основанных на разложении азоти-
стой кислоты, однако все они не достигают полностью цели, по-
тому что до разложения азотистой кислоты последняя должна быть выде-
лена в свободном состоянии какой-либо кислотой; при этом, однако, не-
значительная часть ее всегда переходит в азотную кислоту, которая может
быть затем, открыта, хотя бы в первоначальном растворе ее и не было.
Большие количества азотной кислоты в присутствии азотистой кислоты
лучше всего открыва л, ио способ. Пичини (Piccini) -, для чего к концен-
трированному раствору солей обеих' кислот приливают концентрированный
раствор мочевины, смешивают .и 'Посредством пнпетки осторожно по стен-
кам пробирки прибавляют разбавленную серную кислоту. При этом про-
исходит энергичное выделение азота и двуокиси углерода, прекращаю-
щееся через несколько .минут:
CO(NHs)s + 2HNOs -> СО2 + ЗНД) + 2Ns.
моквина
По окончании выделения газа азо гну ю кислоту открывают посредством
дифениламиновой реакции.
’ Файгль, Капельный анализ, стр. 38S.
2 Z. anal. Chem. 19, 35-1 (I33i.)).
433
При разложении азотистой кислоты мочевиной реакция протекает не
настолько быстро, чтобы следы азотной кислоты не успели образоваться
согласно уравнению:
3HNO» -> НгО + HNOs + 2NO.
В выделяющемся азоте можно всегда по запаху констатировать при-
сутствие окислов азота1 и открыть азотистую кислоту посредством иодо-
ьрахмальной бумаги, а в растворе обнаружить присутствие образовавшейся
азотной кислоты посредством дифени.(аминовой реакции Лунге.
Азотистая кислота разлагается также при кипячении раствора азоти-
стокислой щелочи в течение нескольких часов с нейтральным раствором
хлористого аммония; ни при этом всегда также образуются следы азотной
кислоты, которые могут быть открыты2.
Таким образом, ио очень интенсивной реакции с дифениламином после
разложения азотистои кислоты мочевиной можно заключись о присут-
ствии азотной кислоты; но слабая реакция не дает еще нрава заключать,
что азотная кислота имелась в исходном растворе, ибо при разложении
азотистой кислоты всегда образуется азотная кислота.
Повидимиму, наиболее удовлетворительными методами .разрушения
азотистой кислоты (перед проведением реакции на азотную кислоту)
являются: 1) взаимодействие азотистой кислоты с азидом натрия NaN* и
2) взаимодействие азотистой кислоты с амидисульфоиовой кислотой.
По первому методу, предложенному Зоммером и Панкасом3, к ней-
тральному раствору солей обеих кислот прибавляют избыток азида нат-
рия, подкисляют уксусной кислотой и через несколько минут нагревают
ди кипения, чтобы разрушить избыток азотистоводородной кислоты. Раз-
ложение изогиетой кислоты происходит на холоду согласно уравнению:
HNs + HNCh -» N? + №0 + НгО.
Согласно второму методу, предложенному Баукмгартеном и Маргграфом 4,
смешивают исследуемый раствор с 0,5";,-ным раствором амидосульфоновой
кислоты. Реакция проходит настолько быстро даже с концентрированными
растворами, что не приходится опасаться образования каких-либо коли-
честв HNOs за счет окисления HNOa.
Разложение азотистой кислоты проходит согласно уравнению:
HNOa + N'HsSOjH -> H2SO< + НгО + Ns.
Хлорноватая кислота НСЮ3
Получение. Хлораты образуются при пропускании хлора в горячий
раствор едкой щелочи или гидроокисей щелочных земель, при электро-
лизе горячего раствора'хлорида или при окислении гипохлоритов.
Свойства. Свободная хлорноватая кислота неустойчива и разлагается
при 40-г на хлорную кислоту, хлор и кислород (стр. 254):
ЗНСЮз -> НгО + 2СЮг + НСЮ<
2С1Ог -» С1г + 2О_>.
Водный раствор хлорноватой кислоты является сильной кислотой;
в 0,52V растворе она диссоциирована на 88%. Путем выпаривания в вакууме
водный раствор ее может быть сконцентрирован до плотности г-1,2s; эта
' 1 Эта реакция заметно проходит даже при 0° и в токе двуокиси
углерода.
2 Разложение азотистой кислоты едва происходит при выпаривании,
с углекислым аммонием-
3 Sommer, Р i и с a s, В. 48. 1969 (1915).
* Baumgarten, Margfr* f, В. 63, 1019 <1930).
459
плотность соответствует составу НСЮз-ТНзО или 40,1%-ной НСЮз; при
данной концентрации кислота довольно устойчива, но все же медленно рас-
падается с выделением СГ и Оз.
Следующие три уравнения выражают пути, по которым может про-
исходить разложение НСЮз:-
4НСЮз ->ЗНС1О« + HCI;
2НСЮз -> 2НС1 + 30г;
4НС10з-> 4СЮг + Ог 4- 2НгО.
Хлорноватая кислота и ее соли являются сильными окислителями; хло-
рат калия применяется в спичечном производстве, пиротехнике и произ-
водстве взрывчатых веществ. Хлорноватая кислота окисляет оксалаты
в СОг, HCNS — в серную кислоту, и цианистый водород, соединения фос-
фора низшей валентности — в НзРОз, соединения серы низшей валент-
ности— в Н2ЗО4, НС1 — в С1з, НВт — в Вгг и J2— в KJO-i и JCls. Магний
растворяется в хлорноватой кислоте с образованием Mg(C10a)2 и Нг; цинк
и разбавленная серная кислота могут восстановить CIOs' до СГ. Сульфат
двухвалентного марганца не окисляется одной хлорноватой кислотой, но в
присутствии концентрированной азотной кислоты- может образоваться чер-
ная гидратированная МпО2, а в присутствии фосфорной кислоты
[МщРО«)г]"' фиолетово! и цвета.
Растворимость хлоратов. Все хлораты растворимы в воде, но соли
ртути, висмута н олова без подкисления подвергают гидролизу. Хлораты
двухвалентных ртути и железа весьма неустойчивы. Хлорат калия отли-
чается наименьшей растворимостью: в 100 мл холодной воды растворяется
только 6.6 г КСЮз, между тем как то же самое количество воды раство-
ряет 315 г НСЮз.
Реакции мокрым путем
1. Разбавленная серная кислота выделяет из хлоратов хлор-
новатую кислоту, которая, как уже выше указано, постепенно
разлагается, теряя хлор и кислород. Поэтому раствор ее дей-
ствует как окислитель, особенно при нагревании; он окраши
вает иоднокалиевый крахмал в синий цвет:
CIOs'+ 6J'+ 6Н'-> СГ + ЗНЮ + 3J2.
Скорость .реакции между хлоратом и иодидом зависит от
концентрации водородных ионов. Соли хлорноватой кислоты
в нейтральном растворе не проявляют сильных окисляющих
свойств (отличие от гипохлоритов).
2. Концентрированная серная кислота разлагает все хлораты,
выделяя из них двуокись хлора, газ зеленовато-желтого цвета,
окрашивающий серную кислоту в желтый цвет и сильно взры-
вающий при нагревании:
КСЮз + 3H2SO4 -> 3KHSO4 + НС1О4 + 2С10г'+ Н2О.
Очень маленький кристаллик хлората, прибавленный к 1 мл концентри-
рованной серной кислоты, окрашивает кислоту, причем выделяется газ,
по запаху похожий на хлор.
3. Азотнокислое серебро и хлористый барий не выделяют
осадка.
460
4. Рпг''т^но”нтели в^-ст-^н^вливают хлораты в хлориды в кис-
лом г CriBT'J;
Восстановление t. кистом растворе '-ожет быть произведено цинком и
разбавленной серной кислотой, сернисто кислотой или нитритом натрия:
3Zn 4 СЮз' + 6Н- -» 3Zn‘ • + СГ + ЗНзО;
ЗБОз" + С10з'-> СГ + 3SO«";
3NOs' + СЮз'-> 3NOs' + СГ,
Восстановление в щелочной или нейтральной1 среде может произво-
диться при кипячении раствора с цинковой пылью, алюминиевым порошком,
сплавом Деварда (стр. 51) или омедненным цинком 2.
СЮз' + 3Zn + ЗОН' -> 3HZnO2' + СГ.
Отфильтровав оставшийся после восстановления металл, раствор под-
кисляют азотной кислотой3, прибавляют нитрат серебра и получают харак-
терный творожистый осадок хлористого серебра.
5. Концентрированная соляная кислота разлагает все хлораты
с выделением хлора, окрашиваясь последним в желтый цвет.
СЮз' + бН’ +5С1'-»- ЗН2О+ЗСЬ.
Это уравнение не совсем верно, потому что некоторое количество
СЮз всегда примешано к С12. Более точно реакция может быть выражена
следующим уравнением:
ЗСЮз' + 7СГ + ЮН’ -> 5НЮ + 2С10з + 4С1:.
Количество образующихся С1О2 и СР зависит от концентрации реаги-
рующих веществ и температуры.
Если соляную кислоту предварительно подкрасить в синий цвет посред-
ством индиго, то произойдет обесцвечивание ее окраски под действием
свободного хлора.
6. Соли закиси железа. При кипячении хлоратов с солями
закиси железа в присутствии разбавленной кислоты быстро про-
исходит полное восстановление их до хлоридов (отличие от
хлорной кислоты):
СЮз' 4- 6Fe‘ ’ 4- 6Н‘—> ЗН2О 4- СГ 4- 6Fe’ ’
7. Дифениламин реагирует так же, как и с азотной кислотой.
8. Сернокислый анилин. К исследуемому твердому веществу
прибавляют около 1 мл концентрированной серной кислоты и
одну или две капли водного раствора сульфата анилина: в при-
сутствии хлората получается темносиняя окраска. Нитрат не
дает этой реакции.
9. Индиговая проба. К раствору хлората прибавляют раствор
индиго в концентрированной серной кислоте, в количестве, до-
1 В нейтральном растворе реакция протекает очень медленно.
2 Обрабатывают гранулированный цинк 1%-ным раствором сульфата
меди, промывают и высушивают.
’ При подкислении азотной кислотой выделяется тяжелый осадок
Zn(OH)2, который растворяется в прибавляемой азотиой кислоте.
461
статочном, чтобы окрасить исследуемый раствор в светлосиний
цвет. Прилив разбавленную серную кислоту, прибавляют по
каплям раствор сернистой кислоты или сульфита натрия, резуль-
татом чего является быстрое исчезновение синей окраски.
Сернистая кислота реагирует с хлоратом, образуя хлор или
гипохлорит, которые окисляют индиго. Проба чувствительна.
10. Хлористый марганец, растворенный в концентрированной
соляной кислоте, окрашивается хлорноватой кислотой в бурый
цвет. Реакция указывает на присутствие окислителей.
11. Сульфат марганца, растворенный в концентрированной
фосфорной кислоте, дает при нагревании с хлоратом комплекс-
ный фосфат трехвалентного марганца красно-фиолетового
цвета ’.
СЮз' 4- 6Мп’ ’ ф 12НяРО<-+ б(Мп(РОф]"' + СГ ф ЗОН’ + ЗНгО.
Точно так же реагируют персульфаты и перйодаты. Первые можно
разложить выпариванием сернокислого раствора с небольшим количе-
ством нитрата серебра в качестве катализатора:
2H2S3O- + 2H2O-»4H2SO- + О2.
В присутствии же перйодатов открытие хлората вышеприведенной
реакцией не удается.
Выполнение. В маленькой фарфоровой чашечке помещают каплю
исследуемого раствора 'вместе с каплей насыщенного раствора сульфата
марганца и прибавляют каплю сиропообразной фосфорной кислоты. После
слабого нагревания появляется фиолетовое окрашивание раствора. Очень
слабая окраска может быть усилена добавлением капли 1%-ного спирто-
вого раствора дифени.ткарбазида; карбазид окисляется при этом в про-
дукт фиолетового цвета. (С помощью этой чрезвычайно чувствительной
реакции можно открыть 0,05т хлората, что соответствует предельной кон-
центрации 1:1 000 000. Ред.)
Реакции сухим путем
Все хлорноватокислые соли при прокаливании превращаются
в хлориды, выделяя кислород. При прокаливании на угле про-
исходит вспышка.
Исследование хлоратов иа содержание в них гипохлоритов
/Для открытия гипохлоритов в хлоратах растворяют около 2 г соли
в 200 .и.г воды, прибавляют 3 мл 10%-ного раствора йодистого калия и
3 мл крахмального раствора (но никоим образом не прибавлять серной
кислоты). Даже в присутствии следов гипохлорита раствор тотчас сильно
синеет; реакцию дает 0,1 мг гипохлорита.
Открытие хлористоводородной, азотной и хлорноватой кислот
при одновременном их присутствии
Метод А
Сначала констатируют присутствие хлористоводородной кислоты по-
средством осаждения небольшой части испытуемого раствора азотнокислым
1 Файгль, Капельный анализ, стр. 563.
462
серебром. Появление осадка хлористого серебра указывает на наличие хло-
ристоводородной кислоты. К остальной части раствора прибавляют серно-
кислое серебро до тех пор. пока не прекратится датьнейшее образование
хлористого сере-бра, и затем фильтруют.
Фильтрат кипятят с небольшим1 количеством едкого кали для удаления
могущего быть в растворе аммиака, после чего кипятят с небольшим коли-
чеством сплава Деварда; азотная кислота узнается при этом по выделяю-
щемуся аммиаку. Раствор фильтруют, фильтрат подкисляют азотной кисло-
той и прибавляют азотнокислое серебро. Осадок хлористого серебра ука-
зывает на присутствие хлорноватой кислоты.
Метод Б
Часть раствора испытывают избытком азотнокислого серебра на хло-
ристоводородную кислоту, отфильтровывают выделившийся осадок и при-
бавляют к фильтрату немного разбавленной сернистой кислоты, причем
образуется снова хлористое серебро, если только в исследуемом растворе
была хлорноватая кислота.
Другую часть раствора исследуют на азотную кислоту, как уже выше
указано, посредством сплава Деварда.
Хлорная кислота НСЮ(
Получение. Хлорная кислота является наиболее устойчивой из кисло-
родсодержащих кислот хлора. Она может быть получена путем выпарива-
ния раствора хлорноватой кислоты и путем перегонки перхлората (хлорно-
кислого) калия с концентрированной серной кислотой. Таким путем обра-
зуется твердый кристаллический моногидрат НС10«-НгО, который при
дальнейшем нагревании разлагается при НО' на маслянистый дигидрат и
переходящую ® дестил,таг НСЮ«. При 203° перегоняется и ди-гидрат.
Перхлорат калия, встречается в виде примеси в чилийской селитре.
Соль эта может быть полечена из хлората калия. При плавлении послед-
него соединения происходи! енжча. та .сильное выделение кислорода, скоро,
однако, уменьшающееся. План становится вязким; он. гостомi из хлорида
и перхлората калия:
2КС1СН -> КС1 + КС1О« + Ок;
последний может быть отделен от более растворимого хлорида калия пу-
тем перекристаллизации.
Перхлорат аммония легко получается из перхлората натрия—• побоч-
ного продукта при электролитическом производстве хлората натрия. Если
перхлорат аммония обработать горячей разбавленной соляной кислотой
и небольшим количеством азотной кислоты, то Nil,' окисляется в N'aO
и получается разбавленный раствор НС1О<. При выпаривании этого раствора
до тех лор, пока температура не поднимется1 до 180-200', удаляются
полностью азотная и соляная кислоты, после чего путем перегонки в ваку-
уме (2—7 л.и) получают 70—73,6%-ный раствор хлорной кислоты. Это наи-
более безопасный путь получения хлорной кислоты.
Свойства. Безводная хлорная кислота, затвердевающая приблизительно
при —12' и кипящая около 130°, является взрывоопасным веществом!.
Если ее приготовить путем перегонки в вакууме и дать постоять при ком-
натной температуре, она постепенно окрашивается в соломенный, затем
в бурый цвет и, наконец, взрывает. Разложение ее, повидимому, уско-
ряется присутствием отличающихся своей неустойчивостью окрашенных
продуктов восстановления, образующихся в результате фотохимического
синтеза. Взрыв часто вызывается соприкосновением кислоты с кусочками
угля, дерева, бумаги или пыли. Концентрированная хлорная кислота при-
чиняет весьма болезненные раны, медтенио поддающиеся лечению.
463
Безводную кислоту можно сохранять неограниченно долгое время при
очень низкой температуре. Горячая концентрированная хлорная кислота
представляет собой подобно серной кислоте сильное обезвоживающее сред-
ство и является таким же хорошим окислителем, как и смесь хромовой
и серной кислот; на холоду она теряет свои окислительные свойства.
Хлорная кислота представляет собой также ценный реактив. Ею поль-
зуются в качественном анализе для открытия калия, а также в качестве
растворителя и окислителя. Перхлорат калия в пиротехнике является за-
менителем хлората калия. Перхлорат магния называемый ангидроном, при-
меняется в качестве обезвоживающего вещества, для той же цели служит
перхлорат бария, известный под названием дезихлора.
Соли этой одноосновной кислоты, перхлораты, замечательно устойчивы;
они содержат семи-положительно заряженный хлор и изоморфны с пер-
манганатами.
Растворимость перхлоратов. Все перхлораты, за< исключением солей
аммония, калия, рубидия и цезия, легко растворимы в воде. Трудно рас-
творимые щелочные соли растворяются в горячей воде; калиевая, рубидие-
вая и цезиевая соли выпадают практически полностью, если прибавить к их
холодному насыщенному раствору равный объем спирта.
Реакции мокрым путем
1. Концентрированная серная кислота не действует.
2. Азотнокислое серебро и хлористый барий не дают ни-
какого осадка.
3. Хлористый калий осаждает белый кристаллический осадок
КООт, весьма мало растворимый в воде, не растворимый
в 90—97%-ном спирту. Соли аммония дают такой же осадок.
4. Хлористый титан TiCl3, гидросернистая кислота H2S3O4 и
низшие окислы ванадия, молибдена и вольфрама восстанавли-
вают перхлораты в хлориды.
Восстановление хлористым титаном может быть проведено следующим
образом. К исследуемому раствору прибавляют концентрированную серную
кислоту в таком количестве, чтобы раствор был четырехнормальным, затем
прибавляют немного осажденной титановой кислоты и около 1 г электро-
литически осажденного кадмия, после чего кипятят около часа с обратно
поставленным холодильником. Таким образом, соль хлорной кислоты коли-
чественно восстанавливается до хлорида. Раствор фильтруют, осторожно
окисляют соль трехвалентного титана перманганатом и испытывают на
хлор-ион нитратом серебра.
5. Цинковая пыль, сплав Деварда, сернистая кислота и кислые
растворы солей двухвалентного железа не восстанавливают пер-
хлоратов в хлориды.
Реакции сухим путем
При нагревании на угле перхлораты вспыхивают; при пла-
влении они выделяют кислород и оставляют хлорид, который
по растворении в воде дает 'все реакции, характерные для соля-
ной кислоты. При оплавлении перхлората с хлоридом, напри-
мер с хлоридом цинка, выделяется хлор. Если вытеснить хлор
двуокисью углерода в раствор йодистого калия, то произойдет
выделение свободного иода. При наличии нитратов последние
464
можно сначала удалить вы-париванием досуха с концентрирован-
ной соляной кислотой; затем, чтобы быть уверенным в полном
удалении даже следов нитратов, Гуч и Крейдер рекомендуют
производить выпаривание с хлористым марганцем и концентри-
рованной соляной кислотой, после чего провести повторное вы-
паривание с последней. Далее, осаждают марганец карбонатом
натрия, фильтруют, фильтрат выпаривают досуха и сухой оста-
ток исследуют на присутствие перхлората путем сплавления
с хлордом цинка.
Иногда бывает желательно удаление хлорной кислоты из рас-
твора, в котором нужно определить щелочные металлы. Это
достигается лучше всего выпариванием раствора досуха и про-
каливанием остатка с солью аммония:
3NaC10i + 8NH1C1 -> 3NaCl + 4Nj + 8НС1 + 12НгО.
Надсерная кислота НДО8
Получение. Надсерную кислоту впервые получил Маршал (Marshall)1
путем электролиза умеренно разбавленной серной кислоты при очень низ-
кой температуре. В процессе электролиза водородные ионы отдают свои
заряды на катоде, образуя молекулы водорода, анионы же HSCh', раз-
рядившись на аноде, соединяются попарно, образуя надсериую кислоту:
2H--SO4-* Н> + HsSOs.
Совершенно аналогично происходит получение персульфата аммония,
который является исходным продуктом для получения других персульфатов 2.
Смесью надсерной и хлорной кислот часто пользуются для разруше-
ния органического вещества, когда хотят открыть в нем неорганические
составные части.
Важнейшими солями (персульфатами) являются аммониевая, калиевая
и бариевая соли. (NHOzSzOs кристаллизуется в моноклинической системе
и легко растворяется в воде; KzSzOs трудно растворим в холодной, более
растворим в горячей воде; при быстром охлаждении раствора он выкри-
сталлизовывается в виде столбиков; ВаБгОв^НгО получается путем расти-
рания надсернокислого аммония с гидратом окиси бария; эта соль довольно
легко растворяется в воде.
Персульфаты — весьма сильные окислители; калиевая и аммониевая
соли находят широкое применение в химическом анализе. При надлежащих
условиях они окисляют Fe ‘ в Fe''', Сг' в СггО?", Т1 " ’ в Ti"",
Со'' в Со'"’, Ni ” в Ni"‘, Мп’* в МпОг и МпО/ (в присутствии
Ag’), Се’'* в Се'”’ и т. д. Соли галоидоводородных кислот окисляются
персульфатами в свободные галоиды или в соли кислородных кислот
галоидов (в присутствии Ag’ ).
Реакции мокрым путем
Следует применять раствор надсернокислого аммония.
1. Вода. Все надсернокислые соли распадаются в водном рас-
творе на сернокислую соль, свободную серную кислоту и кисло-
1 J. Chem. Soc- 59, 771.
2 Теоретический интерес и большое практическое значение приобрел
новый метод получения персульфатов Фихтера и Гумперта (Fichter и
Н u m р е г (). Водный раствор KHSO« реагирует с элементарным фтором,
образуя персульфат калия: 2KHSCh + Fa — KaSzOs + 2HF. См. Helv. chim.
Acta 6, 640 (1923). РеД.
30 Зак. 382. Тредвелл-Голл, т. I.
465
род. Этот распад совершается медленно на холоду, быстро —
при нагревании:
2SeOs" + 2Н2О -> 4HSO/ + О2,
2BaS2O8 + 2НгО -> 2BaSO4 4- ЗНгБСк +' О2.
Значительная часть кислорода выделяется в виде озона,
легко распознаваемого по запаху и по синему окрашиванию
иодкрахмальной бумаги. Разбавленный раствор надсернокислого
аммония медленно разлагается приблизительно при 20° без вы-
деления кислорода, так как последний идет на окисление части
азота в азотную кислоту:
4(NH4)2S20s -г ЗН2О -> 7(NH4)HSO4 + H2SO4 + HNO3.
2. Разбавленная серная кислота действует так же, как и вода.
3. Концентрированная серная кислота. Если растворить твер-
дую надсернокислую соль в концентрированной серной кислоте
при 0°, то получается жидкость, обладающая сильными окисли-
тельными свойствами. Такую смесь называют кислотой Каро
(Саго).1 Более подробные сведения об этой кислоте см. ниже.
4. Азотнокислое серебро дает черную перекись серебра:
2Ag‘ + S2O8" + 21ЪО -> 2HSO4z + 2Н’ + Ag2O2.
Но если к концентрированному раствору надсернокислого ам-
мония прибавить аммиак и очень мало серебряной соли, то про-
исходит сильное выделение азота, причем жидкость нагревается
до кипения. Сначала образуется^ перекись серебра, которая окис-
ляет аммиак и элементарный азот (явление катализа)2.
5. Соли марганца, кобальта, никеля и свинца окисляются
в щелочном растворе:
Мп Ч- S20s" 4- 4ОН' -> 2SCU" 4- Н2О 4- Н2МпО».
В этой последней реакции надсерная кислота аналогична перекиси водо-
рода, от которой, однако, она существенно отличается тем, что не обес-
цвечивает раствора марганцовокислого калия, не образует желтого окраши-
вания с сернокислым титаном и не дает с хромовой кислотой перекиси
хрома (стр. 226 и 318).. Надсерная кислота легко окисляет соли закиси
железа в соли окиси, а также соли закиси церия в соли окиси церия жел-
того цвета; последние избытком персульфата в присутствии серной кислоты
не обесцвечиваются (отличие от перекиси водорода).
Соли марганца и свинца количественно осаждаются персульфатом ще-
лочного металла из нейтральных и слабокислых растворов, кобальт оса-
ждается неполно из нейтральных растворов и совсем не осаждается из
кислых растворов, никель же осаждается только в присутствии едкой ще-
лочи. Перекись водорода выделяет осадки во всех указанных растворах
только в присутствии едкой щелочи. В горячих азотнокислых растворах
двухвалентный марганец окисляется персульфатом в перманганат и присут-
ствии ионов серебра, действующих каталитически:
SSzOs" + 2Мп' • + 8НгО-»2НМпО4 + lOSCh" + 14Н’.
t Z. angew. Chem. 11, 845 (1898); В. 34, 853 (1901); В. 41, 1839 (1909).
г Z. physikal. Chem. 37, 255 (1901).
466
6. Хлористый барий вначале не дает осадка со свежеприго-
товленным холодным раствором персульфата; осадок сульфата
бария выделяется через некоторое время или при кипячении
раствора.
7. Иодистый калий реагирует с нейтральным растворам "Пер-
сульфата, выделяя свободный иод:
2J''+ S2O8" -> 2SO/
* Примечание редактора. Иодистый калий реагирует быстрее с подкис-,
ленным раствором персульфата. * А. К.
Перкарбонаты и пербораты не дают этой реакции.,
Мононадсерная кислота (кислота Каро) H2SO5
Эта кислота образуется при гидролизе надсерной кислоты:
HsSsOs + Н2О -> H2SO4 + H2SO5
н при действии пергидрола (30%-ная перекись водорода) на серную кислоту.
H2SO4 Н2О2 -> НгО + H2SO5.
Надсерная кислота и кислота Каро являются производными переписи водо-
рода, т. е. содержат характерную для последней группировку из двух
атомов кислорода: —О—О—.
В противоположность перекиси водорода кислота Каро не восстанавли-
вает перманганата; она более легко выделяет иод из растворов иодида
калия, чем персульфаты:
H2SO5 + 2Н' + 2J'-> H2SO4 + НгО + J*.
Марганцовистая и марганцовая кислоты
Свойства и реакции этих кислот приведены на стр. 253—256.
ГРУППА VI
Азотнокислое серебро не дает осадка.
Хлористый барий образует белый осадок, не растворимый
в кислотах.
Серная кислота H2SO4
Получение. В технике серная кислота получается тремя способами:
камерным, башенным и контактным, сырьем для которых служит SOa, обра-
зующийся при сжигании серы или обжиге сульфидов, например пирита
FeSa. При камерном и башенном способах SCh окисляется окислами азота
и воздухом в SOs, который, соединяясь с водой, образует H2SO4. Кон-
тактный способ, который в значительной мере заменил старый камер-
ный способ, основан на окислении 30г кислородом воздуха в присутствии
контактных веществ (катализаторов).
Свойства. Чистая серная кислота — при обыкновенной температуре бес-
цветная маслообразная жидкость с плотностью 1,836; при низких темпера-
турах она застывает .и плавится при 10,5°. При перегонке она подвергаемся
частичному разложению, причем сначала выделяются тяжелые белые пары
§0з, а при 338° перегоняется 98%-ная кислота. При температуре красного
каления происходит ее разложение на Н2О, SO2 и Ог. Обыкновенная про-
30*
467
дажная серная кислота имеет плотность 1,83—1,84 и содержит 93—96%
H2SO4. Максимальная плотность 1,8415 достигается при 97,35% H2SO4.
Продажная серная кислота часто содержит сульфат свинца, селе-
новую кислоту, платину, палладий, мышьяковистую кислоту, кислоты азота
и в виде примесей небольшие количества органических веществ (отчего
она часто окрашена в бурый цвет).
Чистая безводная HfcSCh не может быть получена путем выпаривания
или перегонки, ио может быть получена добавлением небольшого избытка
SOs к 98%-ной кислоте и пропусканием через кислоту сухого воздуха для
удаления избытка SOs. Ангидрид серной кислоты SOs растворяется в кон-
центрированной серной кислоте, образуя пиросерную кислоту H2S’O7, ко-
торая плавится при 35° и теряет £Оз при более высокой температуре.
В технике раствор SOs в серной кислоте носит название олеума, который
приготовляют растворением соответствующего количества SOs в концен-
трированной H2SO4. Олеум сильно дымит и поэтому называется Дымящей
серной кислотой.
Серная кислота двухосновна и образует как средние, так и кислые
соли.
Серная кислота — сильная кислота. Если ее выпаривать с более лету-
чими кислотами или с солями последних, то она начинает выделять белые
пары только после практически полного вытеснения этих кислот. На этом
основано применение серной кислоты в аналитической практике для удале-
ния других более летучих кислот; признаком, указывающим на пол-
ноту удаления летучих кислот, является появление густых паров серной
кислоты. При нагревании выше температуры ее кипения серная кислота
вытесняется из ее солей менее летучими — фосфорной, борной или кремне-
вой кислотами.
Серная кислота смешивается с водой во всех отношениях; при этом
выделяется значительное количество тепла и нужна большая осторожность
при разбавлении серной кислоты водой. Серную кислоту следует приба-
влять к воде небольшими порциями и избегать прибавления воды к кис-
лоте. После того как кислота 'смешана с равным объемом воды, исчезает
какая-либо опасность разбрызгивания. Серная кислота представляет собой
сильное обезвоживающее средство и ею часто пользуются для высушивания
газов и поглощения водяных паров; поэтому ее применяют для наполне-
ния эксикаторов и сушильных трубок. Она также отнимает воду от орга-
нических соединений, часто вызывая их обугливание.
Растворимость сульфатов. Большинство сульфатов растворимо в воде;
сульфат кальция трудно растворим, сульфаты стронция и свинца весьма
трудно растворимы, а сульфат бария практически не растворим в воде.
Имеется также ряд основных сульфатов, ие растворимых в воде,
например основные сульфаты Hg, Bi и Сг, но все они легко растворяются
в разбавленных кислотах.
Реакции мокрым путем
1. Азотнокислое серебро не дает осадка в разбавленных рас-
творах, но из концентрированного раствора выделяет белый
кристаллический осадок сернокислого серебра (100 ч. воды рас-
творяют ири 18° 0:58 ч. соли).
2. Хлористый барий осаждает из разбавленных растворов бе-
лый не растворимый в кислотах сульфат бария.
3. Уксуснокислый свинец осаждает сернокислый свинец бе-
лого цвета, растворимый в концентрированном едком кали, кон-
центрированной серной кислоте, уксуснокислом и виннокислом
аммонии (стр. 132).
Чтобы открыть в нерастворимых сульфатах ион SO/', их обрабатывают
содой, причем образуются нерастворимый карбонат и растворимый серно-
кислый натрий.
468
Сернокислый свинец (а также еериокиелые кальций и стронций) легко
разлагается при кипячении с раствором соды. Сернокислый барий при тех
же условиях не вполне разлагается, но легко разлагается при сплавлении
с четверным количеством соды (стр. 298).
Впрочем, для целей качественного анализа часто можно ограничиться
кипячением даже сульфата бария с содой.
4. Металлы в кислой среде не восстанавливают сульфатов.
СО-СО-С—ONa
5. Родизонат натрия । ii
СО-СО-С—ONa
дает красный осадок с ионами бария; красный осадок разла-
гается в присутствии сульфат-ионов и происходит его обесцве-
чивание.
Выполнение. На фильтровальную бумагу наносят каплю свежепригото-
вленного 5%-ного раствора родизоната натрия и прибавляют каплю раствора
хлористого бария; образуется красное пятно. Если последнее смочить каплей
кислого или щелочного раствора, содержащего SO/', то произойдет обес-
цвечивание пятна.
Реакции сухим путем
Нейтральные соли щелочных металлов плавятся без разло-
жения при высокой температуре, кислые же соли щелочных ме-
таллов легко плавятся, теряя воду и ЙОз (стр. 216).
Сульфаты щелочных земель и свинца при накаливании в пла-
мени бунзеновской горелки не подвергаются разложению.
Остальные сульфаты более или менее сильно разлагаются.
При прокаливании с кремневой кислотой происходит коли-
чественное разложение:
MgSO< + SiOs -» MgSiO3 + SOs.
Все сульфаты при прокаливании с содой на угле дают сер-
нистый натрий, который на серебряной чистой пластинке при
смачивании водой оставляет черное пятно сернистого серебра,
например:
CaSOi 4- NasCOs -> СаСОз 4- NasSOc
NasSOi + 2С -» 2СО2 + Na»S;
2Na’S + 4Ag 4- 2HsO + O2 -> 4NaOH 4- 2Ag2S.
Эту реакцию называют реакцией образования серной печени;
она проходит со всеми соединениями, содержащими серу.
Весьма чувствительная реакция на сульфаты в отсутствие дру-
гих серусодержащих соединений состоит в нагревании образца
в маленькой пробирке с небольшим кусочком металлического ка-
лия, причем образуется сульфид калия. Если после этого сплав
растворить в воде, то ирисутствие сульфида может быть обна-
ружено нитропруссидной реакцией (стр. 389) или посредством
реакции с азидом натрия (стр. 390).
469
Фтористоводородная кислота HF
Нахождение в природе. Фтористый водород встречается в природе
только в виде фторидов. К важнейшим минералам, содержащим фтор, отно-
сятся фторид алюминия и натрия NasAlFe, криолит, кристаллизующийся
в моноклинической системе, затем плавиковый шпат CaF2 правильной си-
стемы. Плавиковый шпат часто является спутником цинковых обманок, свин-
цового блеска и пиритов. Кроме того, фтор является существенной
составной частью апатита Саз(РО4)г • Ca(F, Cl, ОН)г; он находится также во
многих силикатах, например в топазе, лепидолите, хондроите и т. п.
Фтор является также постоянной составной частью растений и живот-
ного организма. В золе хлебных злаков и трав содержится 0,3—1% фтора;
в золе костей 0,4—4%.
Получение. Фтористоводородную кислоту получают путем разложения
плавикового шпата концентрированной серной кислотой в платиновых или
свинцовых рётортах:
CaFj + H2SO4 -> CaSCh + 2HF.
Свойства. Фтористый водород при температурах выше 20° — бесцветный
газ, который при охлаждении сгущается в дымящую на воздухе, легко
подвижную жидкость, кипящую при 19,4°. Пары фтористого водорода обла-
дают резким запахом и чрезвычайно ядовиты. Попав на тело, концентри-
рованная плавиковая кислота вызывает весьма болезненные раны.
При температуре ниже —83° фтористый водород превращается в твер-
дое вещество. Диэлектрическая постоянная ишдкого фтористого водорода
при 0° выше диэлектрической постоянной воды. При нагревании концен-
трированного ©одного раствора перегоняется сначала газ H2F2, а затем
38,2%-ная кислота, обладающая постоянной точкой кипения. До +40°
кислота бимолекулярна, выше же 80° она мономолекулярна. В интервале
этих температур в кислоте существует равновесие между HF и H2F2.
В разбавленных водных растворах превалируют простые молекулы, в кон-
центрированных же растворах при комнатной температуре имеется значи-
тельное количество H2F2.
Фтористоводородная кислота отличается от всех кислот своей спо-
собностью растворять кремневую кислоту. Этим ее свойством пользуются
в технике для вытравления стекла, а в аналитической химии — для от-
крытия фтора и кремневой кислоты, а также для переведения силикатов
в растворимое состояние.
Так как плавиковая кислота действует на стекло, ее необходимо со-
хранять в платиновых, парафиновых или каучуковых бутылках и пригото-
влять в платиновых или свинцовых сосудах.
Растворение кремневой кислоты в плавиковой происходит согласно
уравнению;
S1O2 + 4HF -> 2НЮ + S1F4
и ,
SiF4 + 2HF-> HsSi'Fe.
Скорость реакции зависит от степени гидратации и кристаллического
строения кремневой кислоггы, а также от крупности взятого материала.
Так, Макинтош (Mackintosh)1 при действии избытка 9%-ной плавиковой
кислоты на кварцевый и опаловый порошок нашел, что кварц потерял
через час 1,56%, а опал — 77,28% своего первоначального веса.
Если осажденную и прокаленную кислоту облить концентрированиой
плавиковой кислотой, она почти моментально растворится, причем раство-
рение сопровождается шипением и сильным нагреванием, порошок же
кварца переходит в раствор лишь постепенно.
Большинство силикатов в отношении растворимости их в плавиковой
кислоте занимает промежуточное место между осажденной кремневой кис-
лотой и кварцем; однако существует ряд силикатов, которые рас-
1 Chem. News, 54, 102 (1886).,
470
творяются еще труднее, чем кварц, а некоторые только лишь частично
могут быть переведены плавиковой кислотой в растворимое состояние.
Фтористоводородная кислота в разбавленных водных растворах являет-
ся слабой одноосновной кислотой; она, как и другие слабые кислоты
(угольная, уксусная и т. д.), окрашивает синий лакмус в красный цвет. Ее
константа диссоциации 7,2-КУ4 и в 0.1N растворе она ионизирована при-
мерно на 10%. В концентрированных растворах она обладает склонностью
к образованию гидрофторид-ионов:
HF + F' -> HFa';
первая константа диссоциации двуосновной НгРа значительно больше, чем
маномолекулярной HF. Водные растворы фторидов щелочных металлов
обладают резко выраженной щелочной реакцией-
Для фтористоводородной кислоты так же, как и для цианистоводо-
родной кислоты характерна ее способность к образованию весьма устой-
чивых комплексных металлофтористоводородных кислот. Так, известны
H[AgF2], Н[КРг], H[NaF2] и HfNHiFa], а также соли Na3[FeFe],
NasfAIFo] и т. п.
Комплексные фтористые соединения являются довольно устойчивыми
в противоположность соответственным комплексным цианистым соедине-
ниям, свободные кислоты которых либо совсем не существуют, либо пред-
ставляют собой весьма неустойчивые соединения. Так, аргенто-фтористо-
водородная кислота H[Ag-F2] разлагается лишь при слабом нагревании на
фтористое серебро и фтористоводородную кислоту, a H[KF2] разлагается
лишь при прокаливании; поэтому последним соединением пользуются для
разложения трудно разлагаемых силикатов, циркониевых и титановых
минералов и т. п.,, на которые фтористоводородная кислота лишь слабо
действует.
Сходство между фтористоводородной и хлористоводородной кислотами
значительно менее заметно', чем между хлористоводородной и бромисто-
водородной кислотами. Хотя фтор — самый легкий галоид, фтористоводо-
родная кислота имеет значительно более высокую температуру кипения,
чем все остальные галоидоводороды. В то время как последние легко
окисляются, фтористоводородную кислоту трудно окислить; кислородные
кислоты, соответствующие хлорноватистой, хлористой, хлорноватой и хлор-
ной кислотам, для фтора не известны.
Растворимость фторидов. Фториды щелочных металлов, серебра, алю-
миния, олова и ртути растворяются в воде; фториды щелочных земель,
свинца, меди и цинка не растворимы или весьма трудно растворимы. Фто-
ристое серебро очень легко растворимо в воде, и соль в твердом состоя^
нии расплывается во- влажном воздухе. Весьма характерно различие в рас-
творимости щелочно-земельных и серебриной солей фтористоводородной
кислоты и соответственных солей хлористо-. бромисто- и иодистоводород-
вой кислот, - -
Реакции мокрым путем
Для реакций 1, 2 и 3 следует употреблять фтористый кальций в по-
рошке, а для реакций 4, 5, 6 и 7 — раствор фтористого натрия.
1. Разбавленная серная кислота действует слабо.
2. Концентрированная серная кислота легко реагирует при
нагревании, выделяя фтористый водород:
CaFs Н- H2SO4 CaSO4 + 2HF. \
Для этой реакции более всего пригодна 90%-ная серная кислота. Кис-
лота, содержащая ангидрид SOs, может образовать трудно летучую
фторсульфо-новую кислоту HSOsF.
При выполнении этой реакции в пробирке фтористый водород дей-
ствует на стекло, образуя фтористый кремний и соли кремнефтористово-
471
дородной кислоты; последние разлагаются концентрированной серной
кислотой иа сульфат, фтористоводородную кислоту и фтористый кремний:
NagCaSieOu + ПН?!7? 14НгО + NasSiFe CaSiFe 4SiFe;
натриевое
стекло
NazSiFe + HsSOj -> NasSOj + H2F2 + SiFil
CaSiFe + HsSOa-» CaSOa + H2F2 + SiFi.
Образующийся при этой реакции фтористый кремний представляет
собою бесцветный с резким запахом газ, который водой легко разлагается
с образованием фтористоводородной кислоты и геля кремневой кислоты:
SiFi + 4№О -> H4SiO4 + 2H2F2.
Фтористый кремний легко соединяется также с фтористым водородом,
образуя кремнефтористоводородную кислоту:
SiFa + 2HF ->H2[SiFe],
Это последнее соединение водой уже не разлагается. При действии
SiFi на воду процессы, представленные последними двумя уравнениями,
протекают одновременно, и потому всю реакцию можно выразить следую-
щими уравнениями:
3SiF< + 4НзО -э-Н^Юе + 2H2[SiF«],
Итак, если нагреть в пробирке фторид с концентрированной серной
кислотой и выделяющиеся при этом пару привести в соприкосновение
с водой, помещая для этого в пробирку палочку, смоченную водой, то
вода на палочке помутнеет.
Хотя приведенная реакция всегда удается при применении больших
количеств фторидов, тем''не менее некоторые фторсодержащие минералы,
как, например, топаз, турмалин и т. п„ этой реакции не дают. Она может
не получиться также и с чистым фторидом, когда небольшое количество
последнего смешано с избытком той модификации кремневой кислоты, на
которую легко действует фтористый водород. Согласно 'Даниэлю1 это
объясняется образованием устойчивого оксифторида, вероятная формула
которого SiOF2. Образование этого оксихлорида происходит в резуль-
тате взаимодействия первоначально получающегося четырехфтористого
кремния с избытком кремневой кислоты согласно уравнению:
SiFi + SiO2-> 2SiOF2
(эта реакция протекает лишь весьма медленно с кварцевым порошком или
с таким силикатом, как стекло).
Положительный результат получается всегда, если реакцию проводить
в платиновой посуде с относительно большим количеством фторида и
сравнительно малым количеством аморфной кремневой кислоты или сили-
ката (большие количества кварца не оказывают влияния на реакцию);
с другой стороны, реакция дает отрицательный результат, если ее прово-
дить в платиновой посуде не с кремневой кислотой, а с кварцем и фтори-
дом. Такое различие в течении реакции объясняется тем, что фтористо-
водородная кислота с трудом действует на кварц.
Пробу на фтор Даниэль рекомендует проводить следующим образом.
Вещество, исследуемое на присутствие фтора, смешивают приблизительно
с тройным количеством (по объему) прокаленного порошка кварца и раз-
мешивают в пробирке с концентрированной серной кислотой ,в жидкую
кашицу. Затем пробирку закрывают пробкой, снабженной одрим отвер-
стием и боковой вырезкой. Через отверстие пробки проходит утолщенная
внизу, покрытая черным асфальтовым лаком стеклянная па.точка, на ниж-
1 Daniel, Z. anorg. Chem. 38, 239 (1904).
472
нем конце которой висит капля воды. Палочку настолько вдвигают в про-
бирку, чтобы расстояние нижнего конца ее от реагирующей массы равня-
лось приблизительно полуторному диаметру пробирки. Если теперь слабо
нагревать пробирку над небольшим пламенем, то на водяной капле почти
моментально образуется венчик студнеобразной кремневой кислоты, кото-
рый резко выделяется на черном фоне асфальтового лака. В пробирке
диаметром 1 см .могут быть открыты количества фтора, эквивалентные
1 мг фтористого кальция; в пробирках же, диаметр которых 0,5 см,—ко-
личества фтора, эквивалентные 0,1 .иг фтористого кальция. При пользова-
нии пробиркой малого диаметра серную кислоту лучше всего вводить по-
средством небольшой капиллярной пипетки во избежание смачивания сте-
нок пробирки. ,
Если вещество содержит значительные количества аморфной кремневой
кислоты или если оно является фторокисью. например топазом, который
с трудом разлагается серной кислотой, то проба не удается и тогда не-
обходимо пользоваться реакцией вытравления стекла.
3. Реакция вытравления стекла. Испытуемое на фтор веще-
ство, не содержащее кремневой кислоты, обливают концентриро-
ванной серной кислотой в платиновом тигле; последний покры-
вают часовым стеклом, выпуклая часть которого снабжена тон-
ким восковым покровом; на воске делают надпись или проводят
черты, проходящие до самого стекла. При слабом нагревании
тигля надпись вытравляется на стекле. Чтобы воск при этом
не расплавлялся, на часовое стекло предварительно наливают
воду.
Для открытия следов фтора тигель со стеклышком оставляют на 12 час.
при обыкновенной температуре и лишь зате.м нагр.евают в течение не-
скольких минут. В присутствии 0,3 мг фтористого кальция вытравление
еще удается, если только для1 опыта взят маленький тигель.
При содержании в испытуемом соединении большого количества
аморфной кремневой кислоты, как это имеет место в топазе, турмалине и
других минералах, реакция вытравления дает отрицательный результат,
потому что фтор выделяется в виде фтористого кремния, не разъедаю-
щего стекла.
Чтобы открыть небольшие количества фтора в силикатах, фтор сна-
чала выделяют в виде фтористого кальция и с последним проводят реак-
цию вытравления стекла.
Для этого силикат, растертый в тонкий порошок, смешивают с 6 ч.
соды, смесь сплавляют в платиновом тигле и по охлаждении выщелачи-
вают плав водой, причем получают раствор, содержащий весь фтор
в виде фтористого натрия, а кремневую кислоту—-в виде кремнекислого
натрия. Кремневую кислоту осаждают избытком углекислого аммония,
слегка нагревая раствор и оставляя реакционную смесь стоять 12 час.
Отфильтровав кремневую кислоту, выпаривают раствор до небольшого
объема и прибавляют немного фенолфталеина, окрашивающего раствор
в розовый цвет вследствие его небольшой щелочности; после этого осто-
рожно прибавляют при помешивании соляную кислоту до обесцвечивания
раствора и нагревают до кипения, что вызывает снова появление окраски.
Охлажденный раствор опять обесцвечивают соляной кислотой и повторяют
эту операцию до тех пор. пока раствор при кипячении не останется лишь
улабо окрашенным. После этого прибавляют раствор хлористого кальция
•и снова кипятят. Образующийся при этом осадок состоит из карбоната и
фторида кальция; его отфильтровывают, промывают, сушат и прокаливают
в платиновом тигле. Золу обрабатывают разбавленной уксусной кислотой,
выпаривают досуха, выщелачивают водой и отфильтровывают нерастворив-
шийся фтористый кальций. Последний высушивают, фильтр сжигают и
с остатком проводят пробу вытравления стекла.
4. Азотнокислое серебро не выделяет осадка из растворов
фторидов.
473 •
5. Уксуснокислый барий осаждает фтористый барий, раство-
римый в избытке минеральной кислоты и в солях аммония.
Следы фтора, прибавляемые к кормам, растворам и пр. в качестве
консервирующего средства, могут быть открыты, если к испытуемому
раствору прибавить немного сульфата калня (около 0,3 г), нагреть до ки-
пения и медленно прилить еще 10 мл 10%-ного раствора ацетата бария.
Осадок сульфата и фторида бария испытывают на вытравление стекла *.
6. Хлористый кальций выделяет белый слизистый осадок,
трудно (растворимый в соляной и азотной кислотах, почти
не растворимый в уксусной кислоте и чрезвычайно трудно от-
фильтровываемый; поэтому фтористый кальций осаждают всегда
в присутствии углекислого кальция и таким образом получают
легко отфильтровывающуюся смесь, которая после прокаливания
и обработки уксусной кислотой дает растворимый в воде
уксуснокислый кальций и нерастворимый фтористый кальций;
последний вследствие прокаливания становится плотнее и легко
отфильтровывается.
7. Хлорное железо выделяет из концентрированных растворов
фторидов щелочных металлов белый кристаллический осадок,
соответствующий общей формуле Мз[РеРе]. Эти соли, аналогич-
ные криолиту №з[А1Рбф трудно растворимы в воде, и их насы-
щенные водные растворы не дают реакции на железо с родани-
дом калия, если их не подкислить кислотой. Эти комплексные
фтористые соединения также частично разлагаются аммиаком
с образованием основного фторида трехвалентного железа.
8. Уксуснокислый лантан Ьа(СНзСОО)з выделяет желатинооб-
разный осадок, медленно переходящий в кристаллический LaFs1
• ЗНгО. Осадок трудно растворим в разбавленных кислотах, но
постепенно растворяется в концентрированных минеральных
кислотах.
9. Хлористый цирконий ZrCh и ализаринсульфокислый на-
о он
трий ( \ I lso3Na реагируют друг с другом2, образуя крас-
новато-фиолетовое соединение, которое при прибавлении флор-
ионов теряет окраску3 вследствие образования бесцветных
комплексных анионов [ZrFe]'. Этой реакции мешают большие
количества сульфата, тиосульфата, фосфата, арсената и оксалата.
Выполнение. Для открытия фтюр-иона поступают следующим образом *.
Полоску фильтровальной бумаги, пропитанную цирконализариновым рас-
1 См. В 1 а г е z, Chem. News 91, 39 (1905); см;. также Woodman
а. Т а 11 b о t, J. Am. Chem. Soc. 27, 1437 (1905).
5 J. H. de Boer, Chem. Weekbl. 21, 404 (1924); Chem. Zentr. (1925),
I, 133. Ред.
3 Раствор принимает желтую окраску, присущую свободному ализа-
рину. ред.
* См. Файгль, Капельный анализ, стр. 341, а также Mikrochemie 7,
13 (1929).
474
твором и затем высушенную, смачивают каплей 50%-ной уксусной кислоты.
На влажное красное пятно наносят каплю нейтрального исследуемого рас-
твора. В присутствии фторидов пятно тотчас приобретает желтый цвет.
Этой реакцией можно открыть 1 т F. При малых количествах фтора реко-
мендуется для ускорения реакции бумагу нагревать над водяной баней.
В случае присутствия оксалатов последние перед выполнением реакции
разрушают путем прокаливания пробы. При наличии сульфата к пробе
исследуемого раствора прибавляют немного хлоргидрата бензидина и за-
тем каплю суспензии сульфата бензидина переносят на реактивную бумагу.
Окрашивание красной реактивной бумаги в желтый цвет, в случае присут-
ствия фторида, ясно наблюдается иа обратной стороне бумаги.
Приготовление цирконализариновой бумаги. Нагревают окись цирко-
ния с 2N соляной кислотой и фильтруют; раствор должен содержать
около 0,5 мг Zr в 1 мл. К небольшому количеству раствора хлористого
циркония прибавляют малый избыток спиртового раствора ализаринсуль-
фокислого натрия. Чтобы убедиться, имеется ли избыток ализарина, взбал-
тывают небольшое количество раствора с эфиром; последний принимает
желтую окраску, если был прибавлен избыток ализарина. Смесь нагревают
в течение 10 мин. на водяной бане; пропитывают раствором бумагу и за-
тем высушивают ее.
* Примечание редактора. Как выше было указано, этой реакции ме-
шают также фосфаты. Последние могут быть удалены, если щелочной или
нейтральный испытуемый раствор осадить хлористым кальцием. Осадок,
состоящий из фосфата и фторида кальция, обрабатывают минеральной
кислотой, в которой CaF» трудно растворим. Отделив его фильтрованием,
проводят с ним, как описано выше, реакцию с ализариновым лаком цир-
кония. Эта реакция удается даже с твердыми CaFa, AlFs при прибавлении
их к солянокислому раствору реактива. * А. К.
Реакции сухим путем
Средние соли щелочных металлов фтористоводородной кис-
лоты не разлагаются при прокаливании, но подобно фтори-
стому кальцию заметно летучи.
При прокаливании на влажном воздухе, особенно в присут-
ствии кремневой кислоты, происходит медленное разложение
фторидов:
CaF» -j- Н2О + SiCh-> CaSiCh + H2F2J
2HzF2 4- S1O2 -> SiF« 4- 2H2O.
Кислые фториды выделяют при нагревании фтористый водо-
род, замечаемый по сильному разъеданию стекла пробирки,
в которой производится нагревание.
Переведение в раствор нерастворимых фтористых соединений
fi) Фтористый кальций не разлагается 'полностью при сплавлении с кар-,
бонатом натрия. Водная вытяжка сплава хотя и содержит всегда значи-
тельные количества фтористого натрия, но никогда фтор полностью не
переходит в раствор. Если однако фторид смешать с кремневой кислотой
или силикатом, то при сплавлении с содой происходит, полное разложение
его.
Кремневая кислота разлагает фторид, образуя фторосиликат кальция
и силикат кальция, которые при сплавлении с содой разлагаются. При
обработке плава водой фторид натрия и силикат натрия переходят в рас-
твор, между тем как кальций превращается в карбонат, который может
быть растворен в разбавленной соляной кислоте.
Чтобы открыть фтор в силикатах, последние прежде всего сплавляют
С содой.
475
б) Все фториды разлагаются при нагревании с концентрированной сер-
ной кислотой, превращаясь в сульфаты1.
Открытие фтора во фторсодержащих силикатах
Переведение в раствор топаза и других подобных минералов весьма
трудно. Но если их прокалить с кислым сернокислым калием KHSCh
в тугоплавкой стеклянной трубке, то они легко разлагаются с выделением
SiFi, который пропускают в раствор едкого натра. После этого открытие
фтора уже возможно вышеприведенными реакциями.
Открытие фтора в пиритах по Ф. П. Тредвеллу
Некоторые пириты содержат небольшие количества фтора, который
вредит производству серной кислоты контактным способом. Непосред-
ственное открытие фтора представляет трудности вследствие большого со-
держания серы в пирите.
Смешивают 2 г растертого в тончайший порошок пирита с 1'2 г пере-
киси натрия и 1 , Na.iCOs2. Смесь переносят в большой никелевый тигель,
насыпают поверх ее 2 г перекиси натрия и нагревают закрытый крышкой
тигель над очень маленьким пламенем. Через несколько минут наступает
бурная реакция- причем сера переходит количественно в сульфат, а же-
лезо— в РезОз:
2FeSa + 15\аЮ2 -> РегОз + 4Na->SCh + HNaaO.
Как только масса начинает спокойно плавиться, ей дают охладиться,
выщелачивают водой и фильтруют. Весь фтор находится в фильтрате;
его выделяют в виде фтористого кальция и констатируют его присутствие
пробой на вытравление стекла (стр. 473).
Кремнефтористоводородная кислота H2SiF6
Получение. Как уже сказано, эта кислота образуется при действии
четырехфтористого кремния на воду:
3SiFi + 4№О-> 2№LSiFe] + HiSiO,.
Отфильтровывая кремневую кислоту, получают сильнокислый раствор,
содержащий кремнефтористоводородную кислоту. При выпаривании рас-
твора кислота разлагается на четырехфтористый кремний и фтористый
водород:
Hs[SiFe] -> Sib + №1Д.
Кремнефтористоводородная кислота известна только в водных раство-
рах; ее соли весьма устойчивы.
растворимость фторосиликатов. Большинство фторосиликатов раство-
римо в воде; исключение представляют соли калия и бария, трудно рас-
творимые в воде и не растворимые в спирте.
Реакции мокрым путем
Для этих реакций следует применять раствор кремнефтористокислого
натрия NaaSiFe.
1 Безводный фтористый алюминий AlFs не растворим в воде
и при кипячении с концентрированной №SOi не разлагается; его можно
разложить только сплавлением с содой. При нагревании он возгоняется
без разложения. Напротив, фтористые соединения алюминия, содержащие
воду (А1Бз • ЗЬ№0 и 2AlFs • HF • 8№О), растворяются1 в воде и легко раз-
лагаются серной кислотой.
2 Если пирит не содержит горной породы, то прибавляют еще 0,1 ?
кремневой кислоты.
476
1. Разбавленная серная кислота действует очень слабо.
2. Концентрированная серная кислота легко разлагает все
кремнефтористые металлы с выделением фтористого кремния и
фтористого водорода:
NaaSiFe -]- H2SO4 №286)4 + SiFr + H2F2.
Выделяющийся при этой реакции (производимой в платино-
вом тигле) газ разъедает стекло; капля воды мутится им.
3. Азотнокислое серебро не дает осадка.
4. Хлористый барий выделяет кристаллический осадок (1 г
BafSiFe] растворим в ~ 3750 /ил воды при 173).
5. Хлористый калий выделяет из не очень разбавленных рас-
творов студенистый осадок кремнефтористокислого калия (1 г
Ks[SiFe] растворим в 835/ил воды при 17°). Эта соль значительно
труднее растворяется в избытке хлористого калия; в хлористом
аммонии она легко растворима; в 50%-ном спирте почти не
растворима.
6. Аммиак разлагает при нагревании все растворимые крем-
нефтористые соли с выделением осадка кремневой кислоты:
Na2SiF« + 4NHtOH -> 2NaF + 4NH4F + H4S1O4.
7. Едкие щелочи реагируют 'подобно аммиаку, но при этом
в раствор переходит также и кремневая кислота в виде кремне-
кислой щелочи.
Реакции сухим путем
Все фторосиликаты при нагревании разлагаются на фто-
ристый металл и фтористый кремний:
KcSiFe-» 2KF + SiF4.
Выделяющийся газ вызывает помутнение воды, а остаток
дает все реакции фтористоводородной кислоты.
ГРУППА VII
В эту группу входят нелетучие кислоты, образующие с щелоч-
ными металлами растворимые соли.
Кремневая кислота H4SiO4 и H2SiO3
Нахождение в природе. Вышеприведенные кислоты, образующие весьма
устойчивые соли, неизвестны в свободном состоянии, так же как угольная
и сернистая кислоты. Хотя и существуют аморфные природные' минералы,
состоящие из гидратированной S1O2 с вариирующими -количествами воды
[бесцветная разновидность опала содержит 36% -(-водный опал), благо-
родный опал 5—12% и гиалит приблизительно 3% воды], но ни один из
этих минералов не представляет собой соединения постоянного состава.
Ангидрид SiCh встречается в виде ромбоэдрических кристаллов кварца
(горный хрусталь) и в виде тридимита, кристаллизующегося также в гекса,
гональной системе.
477
Кроме того, очень часто встречается смесь аморфной кремневой кис-
лоты с кристаллическим ангидридом (кремень, агат, халцедон, яшма и т. л.)
Чаще же всего кремневая кислота встречается в виде своих солей —
силикатов.
Получение и свойства. Кремневая кислота может быть легко получена
путем гидролиза ее' фторида:
3SiF4 + 4НгО ->2H2SiFe + H4S1O4
или путем разложения силиката щелочного металла (жидкого стекла) кис-
лотами:
NasSiOs + 2НС1 -> 2NaCl + HsSiOs.
Получающаяся таким образом кремневая кислота представляет собой
аморфную желатиноподобную массу, заметно растворимую в воде и кис-
лотах и легко растворимую даже в разбавленных растворах едких щело-
чей и карбонатов щелочных металлов. Свежеприготовленная кремневая
.кислота легко и полностью растворяется при непродолжительном нагрева-
нии иа водяной бане с 5%-ным (или даже с 1%-ным) раствором карбоната
натрия. При высушивании кремневая кислота постепенно теряет воду, и
при слабокрасном калении она переходит в ангидрид.
В соответствии с степенью дегидратации растворимость кремневой кис-
лоты уменьшается как в кислотах, так и в едких щелочах.
1. Высушенная на воздухе кремневая кислота с 16,65% 1 воды (что со-
ответствует формуле SSiOs-aHsO) заметно растворяется в кислотах и
вполне в 1%-ном растворе соды при нагревании с последним на водяной
бане в течение %—часа.
2. Высушенная при 100° кислота приблизительно с 13,60% воды (что
соответствует составу 25Юг • НгО) в кислотах почти не растворима и легко
растворима при нагревании в течение % часа на водяной бане с 1%-ным
раствором соды, еще легче — при кипячении.
3. Высушенная при 200° кислота с 5,66%- воды (5SiOa • Н2О) н высушен-
ная при 300° с 3,40% (9£Ю2-НгО) воды растворяется вполне, хотя и мед-
леннее, чем предыдущие, при нагревании с 1%-ным раствором соды на
водяной бане.
4. Получающийся при слабокрасном калении ангидрид (SiOs) уже не
растворяется вполне прн получасовом ттгревании с 1- или 5%-ным рас-
твором соды на водяной бане, но только при двухчасовом кипячении.
5. Сильно прокаленный ангидрид растворяется в 5%-ном растворе соды
только после продолжительного повторного кипячения, напротив, легко
растворяется в концентрированном растворе едкого натра или кали при
температре кипения.
6. Встречающийся в природе ангидрид (кварц), растертый в агатовой
ступке в порошок, почти не растворим в 5%-ном растворе соды, а в кипя-
щем едком кали чрезвычайно трудно растворим. В виде весьма тонкого
порошка, каким он получается путем отмучивания, ангидрид вполне рас-
творяется и в 5%-нои растворе соды.
Из вышесказанного следует, что растворимость кремневого ангидрида
в углекислых щелочах зависит от степени измельчения материала.
Кремневые кислоты, а также и ангидрид растворяются в водном рас-
творе плавиковой кислоты, причем образуется кремнефтористоводородная
кислота;
SiCfe + 6HF-> 2НгО + 1H2S iF«.
При выпаривании этого .раствора улетучиваются фтористые водород и
фтористый кремний и остается небольшое количество кремневой кислоты,
потому что фтористый кремний гидролитически расщепляется водой
(стр. 476). Поэтому, чтобы произошло полное улетучивание кремневой кис-
1 Содержание воды вариирует с продолжительностью сушки и баро-
метрическим давлением-. См. van В е m m е 1 е n, Z. anorg. Chem. 13, 243-
(1897).
478
лоты при помощи плавиковой кислоты, необходимо уничтожить гидроли-
тическое действие воды, что достигается путем прибавления концентри-
рованной серной кислоты.
Для этой цели к кремневой кислоте прибавляют сначала немного воды
и, самое большее, 0,5 мл концентрированной серной кислоты, затем при-
ливают плавиковую кислоту, выпаривают на водяной бане до исчезновения
запаха плавиковой кислоты и удаляют избыток серной кислоты, нагревая
на голом огне наклонно поставленный тигель. В присутствии большого
количества кремневой кислоты операцию эту необходимо повторить
2—3 раза.
Соли кремневой кислоты, силикаты, чрезвычайно многочисленны и боль-
шею частью весьма устойчивы. Многие настолько устойчивы, что на них
не действуют даже концентрированные кислоты; некоторые же кислотами
разлагаются легко.
Соответственно с различной растворимостью силикатов различают:
А. Растворимые в воде силикаты.
Б. Не растворимые в воде силикаты1, которые в свою очередь подраз-
деляются на:
а) разлагаемые кислотами и
б) не разлагаемые кислотами.
Кремневая кислота не растворима в воде, но может в известных слу-
чаях образовывать коллоидные растворы; концентрация водородных ионов
в таких растворах ничтожно мала, так как кремневая кислота представляет
собой очень слабую кислоту; она практически нелетуча и поэтому
способна при высоких температурах вытеснять из солей сильных кислот
свободные кислоты, если только само основание при температуре, при кото-
рой происходит разложение соли, нелетуче. Поэтому силикаты весьма
устойчивы при высоких температурах. Природные силикаты являютсяшро-
изводиыми ортокремневой кислоты H^SiOi, метакремиевой кислоты НзЗЮо.
а также поликремневых кислот FLSisOs и H12S13O12. Растворимость силика-
тов зависит от двух факторов: от растворимости окиси основания и от
содержания кремневой кислоты. Соли орто, и метакремиевой кислот
являются вообще более растворимыми, чем соли поликремневых кислот. Так,
орто- и метасиликаты натрия и калия растворимы в воде, полисиликат же,
в состав которого щелочной металл может входить как главное основание,
не разлагается даже коицентрированной соляной кислотой. Такие силикаты
могут быть разложены путем сплавления с какой-либо твердой кислотой,
например с борной, или путем обработки минеральной кислотой в запаян-
ной трубке.
Соли оснований, прокаленные окиси которых весьма трудно раство-
римы, например АБОз, иногда образуют нерастворимые орт,о. и мета-
силикаты.
А. Растворимые в воде силикаты
Силикаты, растворимые в воде, получаются при сплавлении кремневого
ангидрида с едкими щелочами или с карбонатами щелочных металлов:
ЗЮз + №аСОз -> NaaSiOs 4- СОг. .
1. Отношение к кислотам. Водные растворы щелочных силикатов обла-
дают сильнощелочной реакцией, что указывает на заметное гидролитическое
разложение соли:
£Юз" + 2НЮ ->2О1Н'+ HsSiOs.
, Кремневая кислота, выделяющаяся при гидролизе в свободном состоя-
нии, находится в растворе в виде гидрозоля. При добавлении кислоты
' едкая щелочь превращается в соль и часть кремневой кислоты коагули-
; рует, если только раствор не очень разбавлен. Осаждение никогда не
бывает количественным; значительное количество кремневой кислоты
остается в растворе. При определенных условиях она может фактически
Вся остаться в растворе разбавленной кислоты. Так, если 10%-ный рас-
твор кремнекислого натрия медленно приливать к соляной кислоте плот-
ностью 1,1—1,3, то никакого осаждения не будет. Однако после непродол-
жительного' стояния все содержимое сосуда превращается в студень.
479
В случае аналогично обработанного 1%-ного раствора кремнекислого
натрия осадок не появляется даже в течение целого года.
Таким образом, кремневая кислота, осаждаемая, кислотой, заметно рас-
творима в разбавленных кислотах. Для полноты выделения из растворов
кремневая кислота должна быть превращена в менее гидратированную
форму (например, гБЮз-НзО) путем нагревания до 100° (стр. 478). Для
этого подкисляют раствор соляной, азотной или серной кислотой и выпа-
ривают на водяной бане до полного подсыхания (остающаяся масса не
должна пахнуть кислотой). Сухой остаток смачивают сильной кислотой,
слегка нагревают, добавляют воды и отфильтровывают кремневую кислоту.
Небольшое количество ее, остающееся в растворе, может быть удалено
большею частью полностью при повторном выпаривании фильтрата.
2. Отношение к аммонийным солям. Если на раствор силиката подей-
ствовать солью аммония, большая часть кремневой кислоты будет выде-
лена в виде гидрата; осаждение более полное, чем то, которое получается
при прибавлении разбавленной кислоты на холоду:
SiOs'' + 2NHj’ -> 2NH3 + HsSiOs;
NHs + NHiUH.
Гидроксильные ионы оказывают заметное растворяющее действие на
кремневую кислоту. Поэтому осаждение более полно с солью аммония
сильной кислоты, чем с солью аммония слабой кислоты, так как последняя
в значительной степени гидролизирована. Удаление аммиака кипячением
позволяет достичь большей полноты реакции. Применение углекислого
аммония, дающего менее удовлетворительные результаты, бывает необхо-
димо в тех случаях, когда в исследуемом растворе требуется открыть на-
личие хлорида.
Более полно, чем углекислым аммонием, возможно выделить кремне-
вую кислоту из растворов посредством аммиачного раствора гидрата окиси
цинка:
SiO"3 + [Zn(NH3)e](OH)2 -> 2ОН' + 6NH3 + ZnSiOs,
потому что образующийся кремнекислый цинк труднее растворим в раз-
бавленном щелочном растворе, чем свободная кремневая кислота.
Приведем один часто встречающийся пример выделения кремневой
кислоты из растворимых силикатов посредством углекислого аммония.
Многие горные породы, особенно циркониевые сиениты Норвегии и Гол-
ландии, многие граниты и трахиты содержат небольшие количества сода-
лита, хлорсодержащего силиката из группы лейцитов состава NaCl •
•3NaAlSiOa. Чтобы открыть в такой горной породе хлор, поступают сле-
дующим образом. Тонко растертый порошок силиката смешивают е ше-
стикратным количеством соды и сплавляют в платиновом тигле; плав по
охлаждении выщелачивают водой и фильтруют. Фильтрат содержит крем-
некислый натрий и весь хлор в виде хлористого натрия. К раствору,
нейтрализованному азотной кислотой, прибавляют углекислый аммоний,
слегка нагревают, оставляют на 12 час. и затем отфильтровывают выде-
лившуюся кремневую кислоту.
Для удаления остатка кремневой кислоты к раствору прибавляют не-
много аммиачного раствора гидрата окиси цинка кипятят до исчезнове-
ния аммиачного запаха и отфильтровывают осадок, состоящий из кремне-
кислого цинка и окиси цинка; подкисляют фильтрат азотной кислотой и
пробуют на хлор посредством азотнокислого серебра.
3. Молибдат аммония и бензидин. Кремневая кислота подобно фос-
форной и мышьяковой образует комплексные кислоты с молибденовой
кислотой; в отличие от других аммонийная соль (NHi^SiOi 12МоОз рас-
творима в азотной кислоте. Нижеприводимая реакция позволяет открыть
1 Аммиачный раствор гидрата окиси цинка получается путем растворе-
ния чистого цинка в азотиой кислоте; раствор нейтрализуют чистым ед-
ким кали и отфильтрованный и промытый осадок (гидрат окиси цинка)
растворяют в 6А аммиаке.
480
0,1 Т растворенной кремнекислоты и может быть проведена с фильтра-
том после осаждения фосфоромолибдата аммония.
В качестве реагентов применяют: 1) раствор молибдата аммония,
приготовленный растворением 5 г продажной соли в 100 мл воды, после
чего раствор вливают в 35 мл 6N HNOs; 2) раствор бензидина, приго-
товленный растворением 0,5 г основного или солянокислого бензидина
в 10 мл ледяной уксусной кислоты и разбавленный водой до 100 мл;
3) насыщенный раствор ацетата натрия.
Берут каплю испытуемого раствора (его кислотность должна быть не
выше 0,57V) в маленький фарфоровый тигель и добавляют каплю рас-
твора молибдата аммония. Осторожно нагревают на сетке до появления
пузырьков. Охлаждают и к холодному раствору добавляют каплю рас-
твора бензидина и несколько капель раствора ацетата натрия. В при-
сутствии кремневой кислоты появляется синее окрашивание (Файгль).
С тиглем, в котором проводится реакция, должен быть поставлен сле-
пой опыт, чтобы убедиться, что кремневая кислота не переходит из него.
Получающаяся синяя окраска называется «молибденовой синью»; она обу-
словлена восстановлением молибдена и образованием синего хиноидного
соединения, получающегося .в результате окисления бензидина.
Б. Не растворимые в воде силикаты
а) Силикаты, разлагаемые кислотами
Значительное число встречающихся в природе силикатов разлагается
при выпаривании с соляной кислотой, и выделяющаяся при этом кремне-
вая кислота получается то в виде студня, то в виде порошка. Сюда от-
носятся прежде всего же цеолиты и ряд искусственных силикатов: порт-
ландский, романский, шлаковый и тому подобные цементы.
Чтобы из таких силикатов выделить кремневую кислоту, к исследуе-
мому материалу, растертому в тонкий порошок, приливают разбавленную
соляную кислоту и выпаривают на .водяной бане досуха*. Во время вы-
паривания досуха соли, подобные хлористому алюминию, хлорному же-
лезу и т. п., подвергаются гидролизу, н некоторое количество их пре-
вращается в окиси или в основные соли, не растворимые в воде. Поэтому
для отделения кремневой кислоты от солей прежде всего необходимо пре-
вратить такие окиси или основные соли снова в хлориды. Это. достигается
смачиванием сухого остатка концентрированной соляной кислотой. После
нагревания остатка с кислотой около 10 мин. разбавляют горячей водой,
нагревают до кипения и отфильтровывают кремневую кислоту через без-
зольный фильтр.
С полученной кремневой кислотой всегда должна быть поставлена
поверочная реакция. Для этого хорошо промытый осадок вместе с филь-
тром переносят во взвешенный платиновый тигель и ставят его наклонно
на треугольник. Осторожно высушивают фильтр с осадком над неболь-
шим пламенем горелки, поставленной перед тиглем, и затем прокаливают
при возможно низкой температуре, поставив горелку под тигель, до тех
пор, пока не сгорит углерод фильтра.; после этого сильно прокаливают,
дают тиглю охладиться, переносят его в эксикатор и взвешивают после
полного охлаждения. Взвешенный остаток в тигле обрабатывают плави-
ковой и серной кислотами, как указано на стр. 479, прокаливают и снова
взвешивают после охлаждения. Разница в весе до и после обработки
указанными кислотами указывает не толыко присутствие кремневого ан-
гидрида, но также и количество его. Этот количественный метод необ-
ходим Для открытия малых количеств1 кремневой кислоты. Если кремне-
вая кислота чиста, ничего не должно оставаться после ее выпаривания
с плавиковой и серной кислотами. Впрочем, почти всегда остается не-
большой остаток окисей алюминия и трехвалентного железа, которыми
в большинстве случаев можно пренебречь. Если получается значительный
остаток, последний подлежит испытанию на титановую кислоту, сернокис-
лый барий и двуокись олова.
31 Зак. 982. Тредее.тл-Голл, т. I.
481
Для открытия кремневой кислоты качественным путем проводят реак-
цию образования SiFi и разложения его водой по Даниэлю *. Хорошо
промытый осадок сжигают, как выше указано, в платиновом тигле, затем
тщательно смешивают его в ступке с тройным количеством углекислого
калия-иатрия и смесь сплавляют в платиновом тигле. После охлаждения
плав слабо нагревают с небольшим количеством воды н обрабатывают
для разложения образовавшегося силиката и избытка карбоната разбавлен-
ной серной кислотой; после этого смесь выпаривают, поставив тигель иа
асбестовый картон, почти досуха или до тех пор, -пока не останется
плотная студенистая масса кремневой кислоты. По охлаждении приба-
вляют тройное количество плавикового шпата Спо объему первоначального
осадка), немного магнезита и столько’ концентрированной серной кислоты,
чтобы образовалась жидкая кашица. Смешав все платиновой проволокой,
помещают на внутреннюю сторону крышки, покрытую асфальтовым лаком,
каплю воды, слабо нагревают тигель и от времени до времени снимают
крышку, чтобы убедиться, ие произошло ли помутнение капли воды. Ча-
сто бывает, что образовавшаяся вначале муть исчезает, если плавиковая
кислота была взята в большом избытке. Поэтому необходимо часто сле-
дить за каплей воды, чтобы не проглядеть образования мути.
Эта реакция на кремневую кислоту весьма чувствительна, если только
проводить ее в очень маленьком платиновом тигле (емкостью 0,5—1 лл).
Если такового нет. то определение очень малых количеств кремневой
кислоты (0.01 и меньше) лучше всего производить, как выше указано,
количественно.
б) Силикаты, не разлагаемые кислотами
Сюда ютпосится большая часть силикатов (полевые шпаты, слюды,
искусственные стекла, фарфор и т. д.).
Чтобы выделить из таких веществ кремневую кислого. их нужно пе-
ревести в растворимое состояние, что достигается различными путями:
1) сила,внешнем с углекислой щелочью;
2) сплавлением е окисью свинца или борным ангидридом;
3) •выпариванием с серной и плавиковой кис.ютами;
4) сплавлением с хлористым аммонием и карбонатом кальция ’.
Сплавление силиката с карбонатом щелочного металла или с плавкой
окисью какого-либо Meia.i.ia, например свинца, имеет целью увеличение,
соотношения между основанием и кремневым ангидридом .в .молекуле си-
ликата. Когда содержание основания увеличивается, увеличивается также
растворимость силиката, если только само основание легко растворяется
в кислоте. Поэтому совсем нет необходимости переводить всю кремневую
кислоту в силикат натрия или силикат свинца путем сплавления с карбо-
натом натрия или с окисью свинца, но вполне достаточно, сс.тп силикат
превратится в состояние, при котором он разлагается кислотой. Такое
сплавление превращает силикат в соединение типа орто- или метакислоты
и делает его разлагаемым кислотами. После сплавления, например с .кар-
бонатом натрия, часть натрия превращается в растворимый в воде силика!
натрия, а другая часть — в двойной силикат, разлагаемый кислотами. Часть
натрия и часть силиката могут быть выщелочены из плава горячей водой.
1. Сплав л е н и е с у г л е к и. с л ы ми щелочами
Этот метод переведения в растворимое состояние применяется обык-
новенно в тех случаях, когда хотят открыть кремневую кислоту н осно-
вания, за исключением щелочей.
Смешивают растертое в тонкий порошок исследуемое вещество в пла-
тиновом тигле с 4-6-кратным количеством кальцинированной соды (или
со смесью равных частей углекислого натрия и калия; такай смесь пла-
1 Z. anorg, 'Chem- 38. 299 (1904).
"2 Считая метод сплавления силикатов с хлористым аммонием и кар-
бонатом кальция важным для определения щелочных металлов в силикат
вых породах, я его привожу и в настоящем издании, /’ед.
482
вится легче, чем одна сода), перемешиваю! пек-лянной палочкой и очень
осторожно нагревают сначала, чтобы избегнуть разбрызгивания вследствие
слишком сильного выделения двуокиси углерода. Постепенно повышая
температуру, пока не будет достигнута максимальная температура горелки,
продолжают оплавление, и когда прекратится выделение угольной кислоты
и масса начнет спокойно плавиться, прокаливают еще' приблизительно
’/♦ часа на паяльной горелке (или на горелке Теклу. Ред.) Пригото-
вляют спираль из платиновой проволоки, обмотав ею стеклянную палочку
для помешивания, и погружают приготовленную таким образом спираль
в горячий плав. Быстро охлаждают тигель, направив струю холодного
воздуха на его стенки, ,и когда содержимое тигля будет еще теплым, ио
не горячим настолько, чтобы давать брызги, его обливают небольшим
количеством воды из промывалки. Спустя несколько минут плав можно
извлечь с помощью платиновой спирали. Дальнейшая обработка плава
производится, как описано на стр. 482.
2. С п л а в . 1 е н и е с окисью свинца или г р е х ,о к и с ь ю б о р а
Этот метод имеет в качественном анализе ограниченное применение,
поэтому здесь не описывается, В количественном же анализе этот способ
превращения силиката в растворимое состояние играет весьма важную роль,
3, Разложение плавиковой кислотой
Этот метод применяют, главным образом, в тех случаях, когда в си-
ликате нужно открыть присутствие щелочей, титановой кислоты и бария.
Для этой цели поступают следующим образом. К тонко растертому си-
ликату в платиновой чашке прибавляют около 2 ,*л чистой серной кислоты
(I объем концентрированной серной кисло ты + 2 объема волы) и около
й .«.! свежеперегнанной плавиковой' кислоты и выпаривают все на водя-
ной бане, перемешивая по временам толстой платиновой проволокой, до
исчезновения запаха плавиковой кислоты. После этого, прибавив еще 5 л,т
К1.1ВИКОВОЙ кислоты, снова выпаривают; наконец, чашку осторожно на-
гревают па голом огне, под хорошим вытяжным шкафом до тех пор, пока
большая часы, избытка серной кислоты не будет удалена’. По охлажде-
нии массу обрабатывают водой, причем большею частью после непро-
должительного нагревания на водяной бане все .переходит в раствор.
Остающийся осадок исследуется на сернокислый барий и титановую кис-
лоту. Раствор служит для испытания на щелочи, но может быть также
применен для испытания на другие металлы.
4. С п л а в л е н и е с ,х л о р и с г ы м аммонием и к а р' б о н а г о м
к а л i> ц и я
При нагревании до красного каления растертого в тончайший поро-
шок силиката с избытком смеси из I ч. хлористого аммония и 8 ч. кар-
боната кальция .происходи! деполимеризация н разложение силиката без
сплавления массы:
2КАкЧйО« + бСиСО.ч + 2NH«C1-*
>6CaSi< )л 4- АБ(Ъ + 2KCI Д 2\Нл Д Нм ) + 6СГ)=,
При обработке прокаленной массы водой в раствор переходят щелочи
в виде хлоридов.
При выпаривании с соляной кислотой кремневая кислота получается
в виде студия, металлы же переходят в раствор в виде хлоридов.
1 Масса при этом не должна- накаляться, в противном случае часть
образующихся сульфа iов превратится в окислы, не растворимые в воде.
См. .об отношении сернокислых алюминия и железа к прокаливанию
(стр. 217 и 243).
31*
483
Реакции сухим путем
При накаливании небольшого количества кремневой кислоты
или силиката в перле фосфорной соли металлические окислы
растворяются, кремневая же кислота большею частью остается
в перле в виде белой студенистой массы (кремневого скелета)
во вэвёшенном состоянии. Но никогда не следует ограничи-
ваться только одной этой реакцией, ибо многие силикаты цео-
литовой группы дают прозрачный раствор в перле фосфорной
соли, не образуя скелета.
Кремний Si. Ат. в. 28,06. Ат. и. 14
Свойства. Кремний существует в двух модификациях: аморфной и
кристаллической. Аморфный кремний представляет собой темнобурый по-
рошок, который, будучи нагрет на воздухе, может окисляться; кристал-
лический же кремний не изменяется при прокаливании на воздухе
или даже в атмосфере кислорода; при прокаливании на воздухе, содер-
жащем углекислый газ, он окисляется в двуокись кремния, причем вы-
деляется углерод:
СО-j + Si-* SiOe + С.
На кристаллический кремний ие действует ни одна из кислот, не
исключая и плавиковой кислоты, ио он легко растворяется при кипячении
с концентрированным раствором едкого кали или натра с выделением во-
дорода:
Si + 2ОН' + Н2О -> SiOs" + 2Hs.
Кремний соединяется со многими металлами, образуя силициды.
Силициды легких металлов, магния, кальция и пр. разлагаются разбав-
ленной соляной кислотой с образованием самовоспламеняющегося кремне-
водорода
Mg’iSi 4- 4Н’ -> 2Mg' ’ + SiHi.
Кремиеводород в чистом виде не воспламеняется, а воспламе-
няется лишь в случае примеси водорода, что почти всегда имеет место.
Для открытия кремния в таких соединениях их окисляют азотиой
кислотой, причем кремний большею частью окисляется в кремневую
кислоту.
Открытие кремния в железе и стали
Чтобы открыть кремний в различных сортах железа (стали, чу-
гуне и т. Д.), употребляют большие количества исследуемого материала,
потому что количество кремнистого железа в этих сплавах часто бывает
весьма .незначительно. Берут 5—10 г исследуемого материала, лучше всего
в виде стружек, и обрабатывают их в большом стакане 60 мл &N азотиой
кислоты. Тотчас происходит энергичная реакция с выделением бурых па-
ров окислов азота. Как только реакция ослабеет, нагревают до кипения
до тех пор, пока ше исчезнут бурые пары, после чего всю массу выли-
вают в фарфоровую чашку емкостью >200 мл, выпаривают насколько воз-
можно на водяной бане и затем нагревают до полной просушки на голом
огне при постоянном помешивании стеклянной с оплавленным концом па-
лочкой. После этого прокаливают до тех пор, пока нитраты не превра-
тятся полностью в окиси, что узнается по исчезновению бурых паров.
По охлаждении окиси обрабатывают приблизительно 50 мл дымящей со-
1 Кремневодороды называются также силанами. Различают силан
SiH4, дисилан St.>He и т. д. ред.
484
ляной' кислоты, нагревают при постоянном 'помешивании почти до кипе-
ния, выпаривают досуха, смачивают концентрированной соляной кислотой,
выщелачивают водой, фильтруют и остаток исследуют (в платиновом или
свинцовом тигельке) на кремневую кислоту; для этого прибавив несколько
капель чистой плавиковой кислоты и каплю разбавленной серной кислоты,
выпаривают и прокаливают; при' этом кремневая кислота совершенно уле-
тучивается.
При исследовании чугуна кремневая кислота получается большею
частью со значительной примесью графита, который путем долгого про-
каливания в платиновом тигле сжигают, и лишь тогда приступают к ис-
пытанию на кремневую кислоту.
Открытие кремния в карборунде и силицидах
Другие кремнистые соединения, как карборунд SiC, не разлагаются
азотной кислотой; но путем сплавления с едкими щелочами в серебряном
тигле легко удается перевести кремний в раствор:
SiC + 4КОН 4- 2НЮ -> КзЗЮз + КгСОз + 4На.
При подкислении плава выделяется кремневая кислота.
Углеродистый кремний разлагается также, если тончайший порошок
его, полученный путем отмучивания, сплавить со смесью углекислых на-
трия и калия:
ЗК2СО3 + SiC -> KsSiOs + 2КгО + 4СО
Методом сплавления кремнистых соединений с едкими щелочами поль-
зуются для переведения в раствор некоторых силицидов. На многие сплавы
меди с кремнием царская водка едва действует. Но при сплавлении таких
сплавов с едким кали в серебряном тигле легко образуются кремнекислый
калий, металлическая медь и водород:
SiCus + 2ОН' + НЮ SiOs" + 2Cu + 2Н2.
Отделение кремнекислого «алия от меди производят выщелачиванием
плава водой.
Вольфрамовая, титановая, ниобиевая и танталовая
кислоты
Вольфрамовая кислота см. стр. 634; титановая кислота см. стр, 593;
ниобиевая и танталовая кислоты см. стр. 637.
1 См. О. Muhlhauser, Z, anal. Chem. 32, 564 (1893).
485
ЧАСТ Ь IV
СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА
Задачей качественного анализа является не только определе-
ние элементов, находящихся в данном исследуемом веществе, но
также и оценка их относительных количеств. Продажный хло-
ристый марганец, получающийся, например, из пиролюзита, по-
чти всегда содержит следы кальция, магния, никеля, кобальта
и железа. Если бы аналитик, найдя все эти вещества, в своем
отчете указал, что «исследованное вещество состоит из хлори-
стых соединений кальция, магния, никеля, кобальта, железа и
марганца», то это- понятно, могло бы привести к ошибочным
заключениям. Ответ ' аналитика должен был бы быть следую-
щим: «исследованное вещество является хлористым марганцем
с примесью следов кальция, магния и т. д.».
Чтобы иметь .возможность оценить относительные количе-
ства составных частей какого-нибудь -вещества, необходимо
исходить из определенного -количества вещества (почти всегда
достаточно 1/2—1 г) и сравнивать между собой количества от-
дельных осадков, Такая оценка для всякого начинающего
была бы невыполнимой, если для проведения качественных
реакций исходить из неизвестных количеств исследуемого ве-
щества. Научившись же работать с определенными количествами,
скоро приобретают также навык к оценке приблизительных
количеств -соответственных элементов в исследуемом веществе
-по величине образующихся осадков.
Целесообразно начинать проработку анализа каждой труппы,
исходя из раствора, содержащего но 20 каждого из элемен-
тов. Тогда путем сравнительной оценки легко установить при
анализе неизвестного раствора приблизительное количество
каждого из компонентов. Так, исходя из навески в 1 / перво-
начального вещества. часто бывает .удобно количество найден-
ного компонента называть лнымда при весе его до 10 /иг, сред-
ним— при весе от 10 до 50 /иг и большим — при весе свыше 50 мг.
При определении малых .количеств вещества важную коли-
чественную характеристику дают также цветные реакции. Срав-
нивая полученную при реакции окраску с той, которую дает
определеннее количество вещества, можно установить содержание
его во взятой пробе. Такой прием часто дает более точные
486
результаты, чем проведение количественного определения весо-
вым или объемно-аналитически.м путем. Для вышеуказанных
определений необходимо иметь растворы, содержащие соответ-
ствующий компонент в определенной концентрации, например
10 /иг в 1 /ил. Три небольшие капли такого раствора содержат
приблизительно 1 /иг данного вещества.
Каждый анализ распадается на три части:
I. Предварительное испытание.
II. Открытие металлов (катионов/.
111. Открытие неметаллов (анионов).
Анализируемое вещество может быть:
А. Твердым и неметаллическим.
Б. Металлом (в частности сплавом).
В. Раствором (жидкостью).
Г. Г алом.
Никогда не следует употреблять для анализа все количество
данного вещества, но всегда часть его необходимо сохранять
для непредвиденных случайностей. Часть, взятая для анализа,
в свою очередь делится на две порции, из которых одна слу-
жит для открытия электроположительных, а другая — электро-
отрицательных составных частей.
Прежде чем приступить к анализу, вещество необходимо
тщательно исследовать макроскопически и микроскопически и
отметить результаты этих наблюдений. Часто на основании за-
паха, цвета и кристаллической формы можно лритти к весьма
важным заключениям.
А. АНАЛИЗ ТВЕРДОГО НЕМЕТАЛЛИЧЕСКОГО ВЕЩЕСТВА’
I. Предварительное испытание
Не следует никогда опускать предварительное испытание,
так как оно часто дает возможность значительно сократить
весь ход анализа, а иногда даже делает излишним дальнейшее
исследование. Оно состоит из следующих .простых проб: 1) на-
гревания в тугоплавкой пробирке, 2) испытания вещества на его
способность окрашивать перл буры или фосфорной соли,
3) нагревания небольшого количества вещества на угле перед
паяльной трубкой, 4) нагревания .вещества с содой на угле перед
паяльной трубкой, 5) испытания вещества на окрашивание несве-
тящегося пламени1 и 6) предварительных испытаний на анионы.
1. Нагревание в тугоплавкой пробирке
• Последняя представляет собой пробирку длиной около 10 см и
диаметром’ 0,5 см.
Небольшую щепотку (сколько 'может поместиться на кон-
чике ножа) исследуемого вещества- растертого в тонкий поро-
» «Б», <В» и *1\ см. стр. 528 и 530.
48?
шок, всыпают в пробирку так, чтобы к ее стенкам ничего не
пристало, укрепляют ее в горизонтальном положении и, осто-
рожно нагревая, тщательно наблюдают происходящие при этом
изменения.
Вещество полностью улетучивается
а) Вещество целиком возгоняется без выделения воды; оно не
содержит нелетучих веществ.
Возгон белого цвета: могут присутствовать галоидные соеди-
нения аммония *, хлорная и бромная ртуть, хлористый меркур-
аммоний, мышьяковистый и мышьяке,-..:й ангидриды.
Мышьяковый ангидрид плавится перед превращением в мышьякови-
стый ангидрид.
Возгон окрашен:
в серый цвет — все кислородные соединения ртути, а также
цианистая ртуть, свободный иод и мышьяк.
Цианистая ртуть оставляет бурую массу (парациан), которая исчезает
лишь после сильного и продолжительного прокаливания;
в желтый — сернистые соединения мышьяка, сера и иодная
ртуть.
Иодная ртуть при трении стеклянной палочкой становится сейчас же
красной;
в серо-бурый—сернистая ртуть.
б) Вещество полностью улетучивается с выделением воды и газо-
образных продуктов — большинство аммонийных солей (за
исключением галоидных) и свободная щавелевая кислота.
При осторожном нагревании щавелевая кислота возгоняется, но
обычно она распадается на воду, угольный ангидрид и окись углерода.
Вещество частично улетучивается
При этом могут выделяться газы и пары:
кислород — из перекисей, нитратов, хлоратов, йодатов и т. п.;
двуокись углерода—из карбонатов и органических веществ;
последние большею частью выделяют углерод и горючие пары
с запахом гари;
хлор —из хлористых соединений платины, золота, меди, же-
леза и т. п.;
иод — из иодидов в присутствии окисляющих веществ;
сера — из многих сульфидов и тиосульфатов;
мышьяк—-из мышьяковистокислых и мышьяковокислых со-
лей в присутствии угля или органических веществ.
Соли мышьяковистой кислоты выделяют мышьяк и без участия угля
или органических веществ, причем они переходят в соли мышьяковой
кислоты:
ЮКзАвОз ->6KsAsO* + 6К2О + Asa;
вода — из веществ, содержащих- кристаллизационную воду, из
кислых солей, из органических веществ, из аммонийных солей
1 В случае аммонийных солей, например NHiCl, имеет место не непо-
средственный возгон: при нагревании NHiCl дает газообразные NHa и НСЬ
которые соединяются при охлаждении.
488
фосфорной, борной, хромовой, ванадиевой и вольфрамовой
кислот.
Выделяющуюся воду, которая конденсируется в холодной
части пробирки, всегда пробуют лакмусовой бумажкой. Щелоч-
ная реакция воды указывает на происхождение последней из
аммонийных солей, кислая — на присутствие легко разлагаю-
щихся солей сильных кислот или фторидов, расщепляющихся
гидролитически водой. В этом случае стекло пробирки сильно
разъедается.
Если нагреваемое вещество возгоняется, то производят сле-
дующий опыт. Вещество тщательно смешивают с тройным количе-
ством кальцинированной соды и нагревают в пробирке. В присут-
ствии аммонийных солей появляется аммиачный запах. Ртутные
соединения дают серый металл (стр. 126). Мышьяк и его кислород-
ные' соединения дают большей частью серый металл (но не
в виде капель, что отличает мышьяк от ртути) и выделяют чес-
ночный запах.
Кислородные соединения мышьяка не дают металла, если их прока-
ливать с чистым карбонатом натрия. Но продажный карбонат натрия
обычно загрязнен достаточным количеством бумажных волокон, чтобы
вызвать восстановление до металла.
2. Испытание вещества на его способность окрашивать перл
буры или фосфорной соли
Возможно тонкую платиновую проволоку снабжают (как
уже указано на стр. 89) перлом буры или фосфорной соли,
захватывают перлом сначала очень мало вещества, а затем по-
степенно большие количества и приступают к нагреванию сначала
в окислительном пламени, причем наблюдают окраску горячего,
а также и холодного перла, после чего переносят в восстанови-
тельное пламя.
Большею частью для этих опытов пользуются бурой, фос-
форной же солью — только в тех случаях, когда необходимо
констатировать присутствие кремневой и титановой кислот, или
когда вещество является белым. Только окрашенные окислы
могут окрасить перл буры.
Некоторые окислы восстанавливаются до металла, поэтому перл окра-
шивается в восстановительном пламени в серый цвет (см. табл. 19). CuSOt
в безводном состоянии белого цвета, но он тотчас окрашивается в синий
цвет от прибавления воды.
Следующие вещества окрашивают перл буры и фосфорной
соли в характерные цвета: железо, марганец, никель, кобальт,
хром, уран, медь (неодим, празеодим, церий, ванадий, титан и
вольфрам).
Так как окраска изменяется в зависимости от температуры
и количества вещества, то в табл. 19 приведены условия этих
реакций (значения букв в таблице: г. — горячий; х. — холодный:
гх. — горячий и холодный; слн.— слабо насыщенный; сн.—
сильно насыщенный).
48г
Таблица 19
Окрашивание перлов буры и фосфорной соли ’
буры фосфорной соли
Цвет перла в окислительном пламени в восстапознгель- ном пламени в окислительном пламени в восстанови- тельном пламени
Бесцвег- ный SiO:> (без скеле- та), щелочнозе- мельные метал- лы, Hg, Pb, Bi, Sb, Cd, Zn, Sn.Ti SiO2(6e.3 скелета), щелочноземель- ные и земельные металлы, Mn, Nd, Pr, Се. Си (слн.> 3;О2(дает боль- ) шей частью ске-1 лет), щелочнозе- 1 мельиые и земель-; ные металлы (сн. мутный) SiO2 (дает боль- шей частью ске- лет), щелочно- земельные и зе- мельные метал- лы, Mn, Се, Nd. Pr, Си (СЛН.)
W, Mo, be (СЛН., X.) W, Ti
Серый Ag, Pb, Bi, Sb, Cd, Zn, Ni Ag, Pb, Bi, Sb, Cd, Zn, Ni
Желтый (илн бурый) Fe (слн.. i.), Ag (r.), Ce (r.|, U (г.), V (r., ch.), Ni (x.) (бурый) Ti ir.), W (i.), V (r.), Mo 1 i.) Ее (слн., г.), Ре (сн-, х.), Се (г.), V(r.),U(r.),Ni(x.) (бурый), Ag (г.) Fe (г.), Ti (r.)
Зеленый Cr (\.), Cu (i.l Fe (rx.), F, Cr, V (i .) Cr (х.). Cu (1 Мо (г.), Г (х„ сн.) Cr (X.). U (x.), V (x.), Mo (x.j
Синий Co (rx.j, Cu (X.) Co (rx.) Со /и.), Си |х.) Co (rx.), W (x.)
Фиолето- вый Mn (rx.), Nd, Pr (rx.), Ni (содер- жащий кобальт) Mn (rx.j, Nd, Pr (rx.) Ti (x.)
I
Красный । Fe (i. chi. Cu (сн.) непро- Fe (г., сн.). Си, как в перле
Се (r.) зрачный; при очень слабом насыщении со следами Sn— рубнново-крас ный и прозрачный Се (г.) буры. Ti и W (в присутствии железа) кроваво- красного цвета
3. Нагревание небольшого количества вещества на угле
перед паяльной трубкой
При этом наблюдают, не происходит ли вспыхивание (азотно-
кислые, азотистокислые, хлорноватокислые, иодноватокислые и
тому подобные соли).
1 Значения букв в эюй таблице указаны на стр. 489. Ред.
490
4. Нагревание вещества с содой на угле перед
паяльной трубкой
Для этой цели в ямку, сделанную в хорошем липовом угле,
всыпают щепотку смеси, состоящей из исследуемого вещества
нагревают в восстановительной
и двойного количества соды, и
части пламени паяльной трубки.
При этом получается;
а) Металл без налета . .........
б) Металл с налетом . , . , .
в) Надет без металла............. .
г) Белая неплавкая сильно светя-
щаяся масса..........................
[ в виде ковкого королька: Au, Ag, Sn,
Си1; корольки, раздавленные в ага-
товой ступке, дают листочки;
в виде серых пластинок; Pt, Fe, Ni,
и Со. Платина может быть раздавле-
на в агатовой ступке. Железо, никель
и кобальт притягиваются магнитом
и могут быть извлечены намагничен-
. иым ножом (стр. 90).
( в виде хрупкого металлического
I королька: Sb (налет белый), Bi (на-
| лет желтый); корольки при разда-
। вливании в агатовой ступке рассы-
j паются в порошок;
I в виде ковкого королька: РЬ (налег
i желтый).
{белый, при нагревании желтый; Zn;
бурый: Cd;
белый: As (чесночный запах).
I Са, Sr, Mg, Al н редкие земли.
д} Соединения серы восстанавливаются в сульфиды. Плав, перенесенный на
серебряную монету, чернит последнюю, если ею смочить водой (реакция
образования терний печени).
5. Испытание вещества на окрашивание несветящегося пламени
Сначала небольшую порцию вещества посредством платино-
вой 'проволоки вносят в основание пламени (стр, 86) и затем
в часть пламени с наивысшей температурой плавления, после,
чего, смочив проволоку разбавленной соляной кислотой, повто-
ряют опыт.
При этом могут быть узнаны:
нитриИ по монохроматически желтому окрашиванию пла-
мени; кристалл двухромовокислого калия, освещенный таким
пламенем, кажется желтым (точно так же и красная палочка
сургуча);
калий (цезий и рубидий)—по фиолетовому пламени, кото-
рое, однако, совершенно маскируется пламенем натрия. При
1 Си получается не в виде королька, а в виде спекшейся губчатой массы.
491
рассматривании пламени через кобальтовое стекло натриевое
пламя исчезает, а калиевое .пламя кажется розовым;
литий—по карминовокрасному пламени (в спектроскопе крас-
ная линия);
стронций—по карминовокрасному пламени (в спектроскопе
несколько линий в оранжевой части и одна светлая линия в си-
ней части спектра);
кальций—по кирпичнокрасному пламени (в спектроскопе
одна оранжевая и одна зеленая линия, обе приблизительно на
одинаковом расстоянии от тпт1 чптрия);
барии—но желто-зеленому пламени.
Когда барий находится в виде сернокислой сети, зеленое
окрашивание пламени выступает неягственно или совсем не по-
является. Чтобы и в этом случае констатировать присутствие
бария, небольшую пробу вещества прокаливают в верхнем вос-
становительном пламени, смачивают по охлаждении соляной
кислотой (запах H2S) и снова прокаливают, причем зеленое
пламя бария отчетливо выделяется;
таллий — по изумруднозеленому пламени.
Если наблюдается зеленое окрашивание пламени, то произво-
дят испытание на борную кислоту с новой порцией вещества,
смочив ее концентрированной серной кислотой и приблизив
к пламени. Зеленая окраска последнего характерна для борной
кислоты. В присутствии меди эта реакция ненадежна.
Для открытия борной кислоты рекомендуется1 нагреть в пробирке
твердое испытуемое вещество с этилсернокислым калием; при этом вы-
деляется летучий борноэтиловый эфир В(О(СзНз)з, горящий зеленым пла-
менем. Хлорная медь не препятствует этой реакции.
Свинец, мышьяк и сурьма окрашивают пламя в бледносиний
цвет, медь — в зеленый или синий.
6. Предварительные испытания на анионы
а) Разбавленная серная кислота (2/V). Обливают около 1 г ве-
щества в маленькой пробирке разбавленной серной кислотой и
наблюдают, не происходит ли реакция уже на холоду (выделение
газов).
При этом могут выделиться газы:
HCN — из цианидов (залах синильной кислоты!)2,
H2S — из растворимых сульфидов (запах; черное окрашива-
ние бумаги, пропитанной свинцовой солью);
NO2— из нитритов (бурые пары);
SOa— без выделения серы — из сернистокислых солей (запах
горящей серы);
SO2 с выделением серы — из тиосульфатов; выделившаяся
сера желтого цвета, особенно после нагревания;
СОц — из карбонатов и циановокислых солей (баритовая
вода мутнеет).
1 V. Castellina, Chem. Zentr. 1< 1619 (1905).
8 Цианистая ртуть при этой реакции не выделяет синильной кислоты.
492
При кипячении с разбавленной серной кислотой могут еще
быть открыты: растворимые железисто- и железосинеродистые со-
единения— по выделению синильной кислоты; уксуснокислые
соли—по запаху уксусной кислоты; хлорноватистокислые соли —
по выделению хлора (который, впрочем, выделяется также и на
холоду); перекиси щелочей1 и щелочных земель — по выделению
кислорода.
б) Концентрированная серная кислота. Когда вещество не реа-
гирует с разбавленной серной кислотой, то новую пробу его
нагревают с 3—4 мл концентрированной серной кислоты. Но
если вещество реагирует с разбавленной серной кислотой, ре-
акция его с концентрированной кислотой протекает очень бурно,
и быстро выделяющийся газ увлекает с собою капельки серной
кислоты, что может ввести в заблуждение, так как выделяю-
щийся газ в этом случае будет иметь острый запах и вызовет
помутнение баритовой воды даже в отсутствие углекислоты.
В этом случае к новой пробе вещества приливают по каплям
разбавленную серную кислоту до прекращения реакции, затем
5 мл концентрированной кислоты и нагревают.
При этом могут выделяться газы и пары — бесцветные или
окрашенные.
Бесцветные
НС1 — из хлоридов; дымит на воздухе, обладает острым за-
пахом; вода не мутнеет;
AgCl и HgCh выделяют НС1, но очень медленно; так же ведет себя
и HgjCk, причем в последнем случае наблюдается также выделение ЗОз;
SiF< — из фтористых металлов; дымит на воздухе, обладает
резким запахом; вызывает помутнение воды;
SiFi обрэауется. когда проба проводится в пробирке; в платиновом
тигле фтористые металлы, в отсутствие кремневой кислоты, выделяют H2F2,
от которого вода не мутится;
SO2 (без выделения серы). Если при обработке вещества раз-
бавленной серной кислотой сернистый ангидрид не выделялся,
то появление последнего обязано самой серной кислоте; в ис-
следуемом веществе могут быть металлы, сера, сульфиды,
уголь или нелетучие органические вещества, как винная, лимон-
ная кислоты, сахар, крахмал и пр. В присутствии нелетучих
органических веществ происходит при нагревании обугливание;
SO2 (с выделением серы) указывает на присутствие роданидов,
при условии, что отсутствие тиосульфатов было доказано при
реакции с разбавленной серной кислотой;
СО, не дымящий, не имеющий запаха и горящий синим пла-
менем газ служит признаком присутствия щавелевокислых со-
лей и других органических веществ, а также цианатов.
* Перекиси ше.точных металлов выделяют кислород также при дей-
ствии воды (.стр. 317).
493
Окрашенные
Cl2, желтый с удушливым запахом газ, окрашивающий иод-
крахмальную бумагу в синий цвет, указывает на одновременное
присутствие хлоридов и окисляющих веществ;
СЮе, желтый, очень похожий на хлор газ, который, однако,
при нагревании сильно взрывает; он выделяется из хлорновато-
кислых солей. Если масса при накаливании на угле вспыхивает,
то для опыта с концентрированной серной кислотой необходимо
брать немного вещества; количество последнего можно увели-
чить, если взрыв при нагревании не происходит;
НВг — из бромидов, дымящий с острым запахом газ, всегда
окрашенный в желто-бурый цвет вследствие выделяющегося
брома (жидкость сначала окрашивается в бурый цвет при усло-
вии, что испытуемое вещество содержало только бесцветные
бромиды; при кипячении быстро обесцвечивается);
СгОгСк. бурого цвета (сходен с бромом); одновременное при-
сутствие хлоридов и хромовой кислоты;
Л, фиолетового цвета. В присутствии лишь бесцветных
иодистых солей серная кислота сначала’ окрашивается в бурый
цвет, если иода мало; в присутствии же большого количества
иодистых солей выделяется твердый иод серого цвета, улету-
чивающийся при нагревании в виде паров фиолетового цвета.
Часто при большом количестве иодида происходит выделение
SOs или даже HsS (стр. 351);
МпаО7, фиолетового цвета, образуется из марганцовой кис-
лоты; разлагается при нагревании, часто со взрывом, сопрово-
ждающимся появлением пламени;
NOy, бурые с. резким запахом пары. образ}тощиеся из ни-
тратов.
II. Растворение вещества
После предварительных испытаний переходят к растворению
пробы.
В качестве растворителей применяются:
1) вода;
2) соляная кислота;
3) азотная кислота;
4) царская водка *.
В большинстве случаев достаточно первых трех растворителей, и
лишь редко приходится пользоваться царской водкой, как эю видно из
табл. 20, приведенной на стр. 4Мб—499.
Качественный анализ в значительной мере основывается н.ч различной
растворимости типичных солей. Измерение растворимости или количества
вещества, растворяющегося в данном объеме растворителя, занимало вни-
мание. многих химиков, и этому вопросу было посвящено много работ.
Однако измерение, растворимости сопряжено с рядом трудностей, особенно
в тех случаях, когда приходи>ся иметь дело с трудно растворимыми веще-
ствами. Поэтому мы до настоящего времени не имеем, точных данных
о растворимости многих веществ.
1 Многие соединения, растворяющиеся только в царской водке, раство-
ряются также в смеси HCI 4- НьОг. Ред.
494
Существую! различные методы определения растворимости какого-
либо вещества. По одному методу растворитель взбалтывают с избытком
твердого вещества при постоянной температуре до тех пор. пока не пре-
кратится дальнейшее его растворение. По другому методу получают пере-
сыщенный раствор, которому дают стоять до прекращения выделения
растворенного вещества. Третий метод состоит в получении трудно рас-
творимого вещества путем реакций обменного разложения и нахождении
количеств компонентов, требующихся для образования осадка1.
К сожалению, каждый метод измерения сопровождается некоторой
неизбежной сшибкой, и в случае весьма трудно растворимых веществ эта
ошибка может достигать нескольких сотен процентов. Так. например, если
измерять растворимость цианистого серебра, взяв навеску последнего н
определив после взбалтывания с водой количество оставшейся нераство-
ренной соли или количество соли, остающееся после выпаривания раствора
досуха, то окажется, что аналитическая ошибка может при этом достиг-
нуть величины в 0,0010 между тем как истинное количество растворенной
соли составляет около 0,0002
Трудности, возникающие при определении растворимости кристалличе-
ских веществ, достаточно велики, но еще хуже обстоит дело, когда веще-
ства аморфны или студенисты. Если взбалтывать некоторое время тонко
раздробленное вещество с водой, то оно может образовать суспензию,
проходящую через обыкновенный бумажный фильтр, ,т студенистые веще-
ства будут давать при этом коллоидные растворы. Ошибки при определе-
нии растворимости, обусловливаемые образованием коллоидного раствора
и суспензий, могут быть очень велики.
Непосредственное практическое использование данных о величинах
растворимости также связано с некоторыми затруднениями. В практической
аналитической работе химик редко имеет время дожидаться установления
полного равновесия. При растворении вещества он обыкновенно получает
ненасыщенный раствор, а при осаждении — пересыщенным раствор. Кроме
того, многие вещества, подобно сульфиду .никеля, гидроокиси алюминия
и кремневой кислоте, оказываются значительно менее растворимыми, после
того как с ни некоторое .время постоят на воздухе, чем в евежеосажденном
состоянии; так. например, сернистый никель труднее осаждается, чем сер-
нистый цинк, тем не менее последний растворяется более легко в холодной
разбавленной кислоте, чем первый.
Таблица растворимости на стр. 496—499 дает приблизительное предста-
вление о растворимости обыкновенных солей. Числовые величины показы-
вают выраженный в граммах вес вещества, растворяющегося в f00 v.i
воды. Если приводятся две величины, то верхняя относился к раствори-
мости в холодной воде, нижняя- в горячей. Тире в таблице указывают,
что растворимость данной соли не изучена или не могла быть установлена.
Дальнейшие1 сведения относительно растворимости трудно растворимых со-
лей можно заимствовать в табл. S (vip. 37). Таблица, помещенная здесь-
имеет целью дать студенту некоторое представление об относительной
растворимости для руководства при лабораторных занятиях, но для полу-
чения более точных сведений ему придстси обратиться к соответствующим
справочникам.
Растворимые в воде соли кислот
I группы (стр. 3J5)-'
1. Хлориды. Все кроме AgCl, CujCL, Hg2Clj, PtCl- , AuCI, BiQCl,
SbOCl, Mg-jOCL. Трудно растворимы PbCl. и T1C1.
2. Гипохлориты. Все.
3. Бромиды. Растворимость та же, что и хлоридов.
4. Йодиды. Все кроме AgJ, Hg2J->. HgJ->, CucJa, PbJ2. T1J;
очень трудно растворим PbJj.
5. Цианиды. Только цианиды щелочных и щелочноземель-
ных металлов и цианистая ртуть. .
495
Таблица
Натрий Калий Аммоний Магний Кальций
Л Арсенаты { 26,7 в. р. Р- рз. нр. 0,15 0,005
2 в. р. в. р. в. р. рз. Р. в. р. к.
3 Ацетаты { 119 170 253 ? 500 148 рз. 33 >67 37 29,7
4 Бораты | 1,3 200 Р- р. во. в. м. р. м. р.
Бромиды { 121 53 102 60 146 91 120 125 312
6 Гидроокиси { 42 347 100 178 р. 0,0009 0,004 0,19 0,077
7 Йодиды { 158,7 >257 128 208 154 250 100 165 182 426
8 Карбонаты 7,1 45,5 112 155 100 рз. 0,01 0,0015 0,0019
9 Нитраты | 73 180 32 247 118 871 200 в. р. 102 376
10 Окиси { рз. в. р. рз. в. р. — 0,0006 0,0008 0,12- рз. 0,07—рз.
п Оксалаты { 3.7 6.33 33 2,5 11,8 0,07 0,08 0,0007 0,0014
12 Роданиды { в. р. 217 128 в. р. Р« в. р.
13 Силикаты | р. р. рз. — нр. нр. 0,0095
14 Сульфаты { р- 6,8 24,1 71 104 26 74 0,24
15 Сульфиды { р. Р- в. р. в. р. рз. рз. — нр. 0,012 —рз. 0,461 — рз.
16 Тартраты { 29 66 12 278 6 рз. 0,8 1,44 0,003 0,008
17 Феррицианиды { 18,9 67 33 78 в. р. р. в. р.
18 Ферроцианиды { 32 161 28 91 р. 33 87 120
19 в. р. р- В. р. 0,021 0,032
20 Фториды { 4 92 в. р. в. р. 0,009 нр. 0,0016 0,0017
21 Хлораты { 79 230 71 57 в. р. 57 74 178 в. р.
22 Хлориды { 35,7 39,8 34.7 57 30 76 53 73 60 159
23 Хроматы 50 в. р. 63 79 40,5 рз. 212 в. р. 16 20
24 Цианиды | 1 в. р. В. р. 1 в. р. 1 ps- р. Р. рз.
* Сохи хрома часто существуют в двух модификациях, из которых одна более растворима, чем
латается водой; нр. — не растворяется в воде; рз. — нр.— разлагается водой, продукт разложения ие
творим в воде; р. — рз. — растворим с некоторым разложением, Числа — граммы растворимой соли
а нижняя—к растворимости в горячей воде.
растворимости
Таблица 20
Стронций Барий Алюминий Хрэм Цинк Марганец Никель Кобальт
- 0,28 рз. 0,06 1 - — ир. нр. к. к. 1
м. р. — — — — нр. к. к. 2
р. 76.4 7< р. пз.—-но. Р. рз. — нр. 30 44,6 р. 16,6 р- 3
77 — — р. — — — 4
85 222 157 204 в. р. 200 471 675 300 113 155 65 68 5
0,41 21,8 3,5 95 нр. нр. 0,0004 к. к. к. 6
165 383 200 269 р.—рз. — 430 510 к 124 183 159 420 7
0,0011 0,065 0,002 0.006 — — к. 0,0)6 0,009 к. 8
40 100 8,7 34,2 64 в. р. —рз. р- 325 р. —рз. 240 134 в. р. 9
рз. рз. нр. нр. 0,00016 ир. ир. ир. 10
0,005 5 0,007 0,022 нр. —к. р. 0,008 к. К. К. И
В. р. 43 Р- — — р* р. р. р- 12
нр. нр. Нр. — пр. ир. нр. Нр. 13
0,011 0,0П 0,0902 0,0004 31 98 Нр. —р. 86 52 70 29 83 36 83 14
р. —рз. рз. рз. рз. К. к. 0,0003 0,0003 15
0,11 0.76 0,03 0,06 р. м. р. к. в. р. к. м. р. 16
в. р. р. — — — —. — к. 17
50 100 0,017 0,9 М. р. — к. к. к. к. 18
нр. — к. ир. — к. нр. к. к. к. к. к. 19
0,012 0,17 р- р. р- нр. рз. 0,02 р. 20
. 175 в. р. 27,4 111 в. р. — 209 — 0,9 558 21
44 101 31 59 70 р. —рз. нр. (233) 432 615 151 656 64 87 45 105 22
0,12 3 0,С03 0,004 — к. к. к. к. 23
1 в- * 80 — — — — нр. Нр. 24
другая. Принятые в таблице сокращения: к. — растворим в кислотах; р,—растворим в воде; рз,—раз-
!растворим; в. р,— весьма растворим в воде: м. р. —малорастворим в вода; в. м. р. — весьма мало рас-
; 100 мл воды. Если приведены две величины, то архи.в относится к растворимости на холоду.
Q За.к. 0S2. Трсдвслл-Голл, г. I.
497
496
Таблица 20 (продолжение}
Железо (2; Железо (3) Серебро Свинец Ртуть (1) 1 Ртуть (2) Медь (2) Висмут Кадмий Олово (2) Олово (4) Сурьма (3J Золото Платина
1 Арсенаты { К. к« 0,0008 к. нр. н. м. р. | К. - - up. — — — 1
2 к. к. 0,0012 j 1 к. —-1 к. - — — — -- — 2
3 Ацетаты ......... || р. 1 рз-нр. 1,0 I 2р2 | 4\б 200 0,75 25 100 7,2 2J рз, —нр. н. р. рз. — — — 3
4| Бораты .......... — J — и. р. к. Р. - к. - — — 4
5 Бромиды 109 I 170 р. 8,4 •IO-’ 0,46 4,75 нр, 0,5 25 в. р. р'. 57 162 85 222 р, —рз. рз. р. 0.4 5 If
б| Гидроокиси . || j ! к. нр. 0,016 нр, нр. нр. нр. 2,6.10 ~ * 0,0002 рз. - нр. нр. 6
7 Иодиды j р. *— 3.10--’ 0,04 4,36 в. м. р. в. м р. — рЗ.---Ер. 80 127 1,32 3,55 рз. рг- р- р—рз. 7
» Карбонаты . / 0,0067 м. р. 0,0001 к. ир. нр. — -- — — — 8
9 Нитраты , •[ 70 167 1 р* 122 952 38 126 рз. в. р. 1 в. р. рз. 109 326 рз. рз. т
______ _ - — — . . -- —. _ . — -
10 Окиси j пр. нр. 0,0013 0,0053 0,002 нр. 0.0052 0,040 нр. нр. к, кр. нр. нр. ир. яр. 10
11 Писала гы { 0,0! 0.03 н. р. 0,0034 оде к. К. 0,0025 к. 0,003 0,1)09 — — — — —. 11
12 Роданиды | г- г- о.гкюо? яр. 0,07 нр. — к. 12
— - -
13 { нр. нр. нр. — — — - — — — — 13
14 I Сульфаты । 16 ЙО М. р. рз. 0,57 1.41 0,003 О.П06 0.06 0,09 рз. 31 203 7~> 69 18 а. р. Рч- р. р. 14
.— - -..— — —_——— — р рз.
15 Сульфиды . . . - . . - . | нр. нр. Нр. лр. "Р- нр. ир. к. ир. ир. нр. нр. 1 нр. 15
16 Тартраты .... { 0,8К р. П,2 яр. Я, М. р. к. в. м. р. нр.. м. р. р- — — — — 16
17 Феррицианиды ...... | нр. 0,00007 М. р. — — нр. — к. ир. . — — — — 17
18 Ферроцианиды { — Ир. tip. нр, _ , „ - ___ нр. — к. нр. нр. — — —. 18
19 Фосфаты | X. 0,0006 к. к. X., к. к. к. нр. нр. нр. — 19
20 Фториды | м. р. и. р. 182 205 р. - рз. рз. м. р. 4,35 в. р. рз. 381 565 р- 20
21 Хлораты | 10 50 в. р. р. 25 207 в. р. — 298 487 — — — — 21
22 Хлориды | «5 105 76 536 0,0001 0,67 3,34 0,002 0,001 3,6 61,3 71 108 рз. 140 150 84 270 р- рз. 600 68 в. р. 22
23 Хроматы | — - 0,0014 К, вр. м. р. ир. нр. к. — р. — 23
24 4£ Цианиды ......... { 8 — — [ 0,00002 | м* Р’ i ”* 9,3 33 k нр. 32* 1,7 - 1 _ ! рз. нр. 24 499
6. Ферроцианиды. Только соли щелочных и щелочноземель-
ных металлов.
7. Феррицианиды. Как и предыдущие.
8. Роданиды. Щелочные и щелочноземельные соли, родано-
вое железо.
9. Кобальтицианиды. Соли щелочных и щелочноземельных
металлов, окиси железа, окиси ртути и свинцовая соль; все
прочие нерастворимы.
// группы (стр. 381);
10. Нитриты. Все. Азотистокислое серебро трудно рас-
творимо.
11. Сульфиды. Только сульфиды щелочных и щелочноземель-
ных металлов. CaS трудно растворим.
12. Ацетаты. Все. Серебряная соль, соль закиси ртути и
некоторые основные соли трудно растворимы.
13. Цианаты. Щелочные, щелочноземельные и большинство
остальных. Нерастворимы циановокислые серебро и свинец.
14. Гипофосфиты. Все.
Ill группы (стр. 403):
15. Сульфиты. Щелочные соли и кислые соли щелочных
земель.
16. Селениты. Соли щелочных металлов; остальные трудно
растворимы.
17. Теллуриты. Только соли щелочных металлов.
18. Селенаты. Все кроме бариевой и свинцовых солей,
19. Теллураты. Только соли щелочных металлов.
20. Карбонаты. Соли щелочных металлов; в холодной воде
растворимы бикарбонаты Са, Sr, Ва, Mg и Мп.
21. Бораты. Только соли щелочных металлов; остальные
трудно растворимы в воде, но, как правило, растворимы в хло-
ристом аммонии.
22. Оксалаты. Только соли щелочных металлов; остальные
трудно растворимы или нерастворимы. Большинство оксалатов,
за исключением оксалатов Са, Sr и Ва, образуют растворимые
комплексы с щелочными оксалатами.
23. Тартраты. Тартраты щелочных металлов и битартраты Na
и Li; остальные нерастворимы в воде, но растворимы в избытке
щелочных тартратов, образуя' комплексные соли.
24. Цитраты. Только соли щелочных металлов; нераствори-
мые цитраты обычно растворяются в избытке щелочного цитрата.
25. Метафосфаты. Только соли щелочных металлов.
26. Пирофосфаты. Только соли щелочных металлов.
27. Иодаты. Только соли щелочных металлов.
28. Молибдаты. Только соли щелочных металлов.-
SCO
IV группы (стр. 435):
29. Фосфаты. Только щелочные соли.
30. Тиосульфаты. Почти все растворимы; серебряная, барие-
вая и свинцовая соли трудно растворимы.
31. Арсенаты. Только щелочные соли.
32. Арсениты. Только щелочные соли.
33. Хроматы. Растворимы хромовокислые щелочи, Са, Sr, Mg,
Zn, Fe и Си; остальные или трудно растворимы, или совсем не
растворимы.
34. Ванадаты. Соли ортованадиевой кислоты неустойчивы;
соли пиро-, мета- и поливанадиевых кислот большею частью
растворимы в воде. Нерастворимы свинцовая соль, соль закиси
ртути, а также ванадаты группы железа.
35. Перйодаты. Более или менее растворимы в воде. Йодно-
кислая соль серебра нерастворима.
V группы (стр. 454):
36. Нитраты. Все, кроме некоторых основных солей.
37. Хлораты. Все.
38. Перхлораты. Все.
39. Манганаты и перманганаты. Все.
VI группы (стр. 467)'
40. Сульфаты. Все кроме солей Са, Ва, Sr, РЬ и некоторых
основных солей.
41. Фториды. Щелочные, серебряная и ртутная соли; осталь-
ные трудно растворимы или совсем не растворимы.
VII группы (стр. 477):
42. Силикаты. Только щелочные соли.
43. Вольфраматы. Только щелочные соли.
Из нерастворимых в воде солей растворяются в кислотах (соля-
ной или азотной) все кроме: AgCl, AgBr, AgJ, AgCN. AuCl, PtCh,
BaSCb, SrSCh, PbSOi, HgS, Fe4[Fe(CN)e].3, СаРг, Sn^S (сусальное
золото), SiO2 и многих силикатов, также сплавленного PbCrCh;
далее сильно прокаленных окислов: АБОз, СггОз, ТЮг, SnO2,
Sb2O4 *. TiO2, SnO2 и Sb2O4 растворяются при продолжительном
кипячении с концентрированной соляной кислотой.
Из веществ, не растворяющихся в кислотах, растворимы в царской
водке: PtCl2, AuCl, HgS, Sb2O4, SnS2 и Fe4[Fe(CN)e]3 (после про-
должительной обработки).
В царской водке не растворимы: AgCl, AgBr, AgJ, AgCN, BaSCh,
SrSOi, PbSO4, CaFe2 2, сплавленный РЬСгСЦ, AI2O3, Сг2Оз, встре-
1 Окислы сурьмы переходят при продолжительном прокаливании на
воздухе в Sb20i.
2 При продолжительном воздействии царской водки фтористый каль-
ций растворяется.
501
чающийся в .природе ТЮг (рутил, анатаз, брукит), SnOa (оло-
вянный камень), SiOa, Si, .многие силикаты, углерод, карбо-
рунд и из металлов—предварительно сильно прокаленный ири-
дий (родий, рутений и осмий).
Чтобы растворить эти вещества, их необходимо подвергнуть
специальной обработке.
Способ обработки зависит от природы веществ. Поэтому
вначале определяются общие свойства нерастворимого соедине-
ния посредством следующих простых опытов с нерастворимым
в кислотах остатком.
1. Нагревают небольшое количество остатка с содой на обуг-
ленной содовой палочке и наблюдают, происходит ли образо-
вание металлического королька.
а) Металлический королек не образуется. Этим доказывается
отсутствие серебра, свинца и олова.
б) Металлический королек образуется. Его расплющивают
в агатовой ступке и испытывают образующиеся листочки на
растворимость в кислотах.
а) Королек растворяется в азотной кислоте, образуя про-
зрачную жидкость; этим доказывается отсутствие олова. Соля-
ная кислота, прибавленная к азотнокислому раствору, в присут-
ствии серебра образует белый творожистый, не растворимый
в воде осадок AgCl, легко растворимый в аммиаке.
Азотнокислый раствор мутнеет при прибавлении серной кис-
лоты в присутствии свинца.
₽) При растворении металлического королька в азотной кис-
лоте получается не прозрачный раствор, но белый нерастворимый
порошок: метаоловянная кислота. Другой металлический ли-
сточек обрабатывают концентрированной соляной кислотой, при-
чем он (если серебро отсутствует) легко растворяется при на-
гревании. Хлорная ртуть выделяет из солянокислого раствора
белый осадок HgaCl-?, указывающий на присутствие олова.
2. Вторую пробу остатка нагревают в пробирке с концентри-
рованной серной кислотой и наблюдают, не мутнеет ли вода от
выделяющегося газа.
Помутнение обусловливается присутствием нерастворимых
'фтористых металлов (CaFa).
3. Новую пробу остатка нагревают на платиновой проволоке
в восстановительном пламени газовой горелки, охлаждают во
внутреннем конусе пламени, омачивают разбавленной соляной
кислотой (посредством капилляра), наблюдают, не появляется ли
запах H2S. и испытывают подкисленную пробу на ее способ-
ность окрашивать пламя, Присутствие сульфатов обнаруживается
ио сероводородному запаху, а но окрашиванию пламени можно
решить, имеется ли только барии или смесь его с кальцием и
стронцием.
4. Далее нагревают пробу остатка в перле фосфорной соли;
кремневая кислота и силикаты часто дают кремневый скелет
(стр. 484).
£.02
Так как эта реакция иногда не происходит несмотря на при-
сутствие силикатов, то необходимо всегда в случае отрицатель-
ного результата произвести другую реакцию на кремневую кис-
лоту по стр. 479—48 L
5. Перл фосфорной соли нагревают в восстановительном пла-
мени для реакции на двуокись титана, распознаваемому по фио-
летовому окрашиванию перла. Реакция окрашивания протекает
скорее, если к перлу прибавить ничтожное количество олова
(станиоля). При одновременном же присутствии железа, как это,
например, почти всегда бывает в рутиле и т. п., перл
в восстановительном пламени окрашивается в буро-красный
цвет.
6. Присутствие хрома часто узнается по зеленой окраске
остатка. Если в испытуемом веществе имеется хромистый же-
лезняк, то небольшую .пробу сплавляют с содой и селитрой
в платиновой спирали (стр. 229), причем получают в присут-
ствии хрома желтый плав, который по растворении в воде и
подкислений уксусной кислотой дает с азотнокислым серебром
красно-бурый осадок хромовокислого серебра.
7. Если остаток окрашен в черный или серый цвет, его не-
обходимо испытать на присутствие углерода. Для этой цели
небольшое количество остатка прокаливают на платиновой пла-
стинке, (причем масса истлевает, оставляя большей частью более
светлую зону. В сомнительных случаях расплавляют небольшое
количество хлорноватокислого калия в пробирке и прибавляют
немного остатка. В присутствии углерода наблюдается заметное
тление и вспыхивание вещества. При этой реакции необходимо
следить за тем, чтобы в плав не попали волокна фильтроваль-
ной бумаги и тому подобные вещества.
8. Кремнии, кремнистые соединения (карборунд и т. п.)
встречаются редко; они обладают большой устойчивостью по
отношению к названным выше реактивам. В растворимое со-
стояние их можно легко перевести путем сплавления с едким
кали в серебряном тигле, причем выделяется водород. Очень хо-
рошо разлагаются силициды путем оплавления их с окисью
свинца.
При растворении плава е воде и подкислении соляной кис-
лотой^осаждается, особенно при выпаривании, кремневая кис-
лота в виде студня.
Ш. Методы превращения не растворимых в кислотах
веществ в растворимое состояние
1. Нерастворимые галоидные соединения (имеются в виду
только соединения серебра) превращаются в растворимое со-
стояние следующим образом. Массу нагревают до плавления,
дают ей охладиться, после чего, прибавив немного разбавлен-
ной серной кислоты, погружают в последнюю кусочек чистого
5U3
цинка так, чтобы он находился в соприкосновении с исследуе-
мым веществом. Спустя некоторое время сливают жидкость,
содержащую галоидоводо<родную кислоту вместе с сернокислым
цинком, и сохраняют для испытания на кислоты (стр. 357).
Остаток промывают дестиллированной водой, растворяют метал-
лическое серебро в разбавленной азотной кислоте, фильтруют и
пробуют раствор на присутствие серебра соляной кислотой.
2. Нерастворимые сульфаты превращаются в растворимое со-
стояние путем сплавления с 4—5-кратным количеством кальцини-
рованной соды или со смесью равных частей углекислых натрия
и калия в платиновом тигле. Тонко измельченное вещество сме-
шивают в платиновом тигле с содой, смесь покрывают тонким
слоем соды и, закрыв тигель, сначала напревают на маленьком
пламени, чтобы удалить воду, всегда содержащуюся в соде,
а затем повышают постепенно температуру до тех пор, пока
масса не расплавится, после чего продолжают нагревание в те-
чение часа при той же температуре. Еще накаленный горя-
чий тигель охлаждают быстрым погружением в холодную де-
стиллированную воду, причем плав сжимается и большею частью
легко отстает от стенок тигля. Плав нагревают с неболь-
шим количеством воды на водяной бане до тех пор, пока он
совершенно не распадется и под палочкой не перестанут ощу-
щаться твердые комочки, после чего жидкость фильтруют.
В фильтрате находится серная кислота в виде сернокислого на-
трия, в остатке — щелочные земли в виде углекислых солей.
Последние промывают несколько раз концентрированным рас-
твором соды, затем 5%-ным раствором соды до исчезновения
в промывных водах серной кислоты и только после этого про-
мывают горячей водой до исчезновения щелочной реакции
(стр. 298). Углекислые соли растворяются в азотной кислоте и
раствор исследуют по стр. 305.
Разложение нерастворимого сульфата, достаточное для качественного
испытания на катион и анион, достигается простым кипячением вещества,
растертого в очень тонкий порошок, с 3N раствором карбоната натрия.
Там, при кипячении 1 г растертого в порошок сульфата бария с 25 мл
3N карбоната натрия1 около 80% нерастворимого сульфата превращается
в нерастворимый карбонат и растворимый в воде сульфат:
BaSO< + NasCOs -> ВаСО» + NasSOi. '
•
После тщательного промывания для удаления сульфата около 80% остат-
ка растворяются в разбавленной кислоте. Таким методом достигается прак-
тически полное разложение сульфатов кальция и стронция (также а висмута).
3. Сульфат свинца может быть разложен путем кипячения
с концентрированным раствором карбоната натрия, причем сви-
нец .превращается в основной карбонат и образуется раствори-
мый сульфат натрия; при кипячении с едким натром образуются
растворимый плумбит натрия и сульфат натрия; возможно1
также превращение в растворимое состояние посредством аце-
тата аммония (стр. 133).
504
4. Кремневая кислота и силикаты превращаются в раствори-
мое состояние путем сплавления с карбонатом натрия или путем
обработки серной кислотой и фтористоводородной кислотой,
как указано на стр. 482.
5. Метаоловянная кислота, получающаяся при окислении ме-
таллического олова азотной кислотой, легко растворяется при
кипячении с малым количеством концентрированной соляной
кислоты с последующей обработкой большим избытком холод-
ной воды (стр. 196)-
Встречающаяся в природе двуокись .олова (оловянный ка-
мень), а также сильно прокаленная метаоловянная кислота не
могут быть растворены таким путем, но их легко перевести
в раствор по одному из приведенных на стр. 199 способов.
Большею частью применяют разложение посредством сплавле-
ния с содой и серой.
6. Нерастворимые фториды разлагаются путем выпаривания
с концентрированной серной кислотой, причем дальнейшая об-
работка образующихся сульфатов производится по способу, ука-
занному в п. 2.
7. Двуокись титана разлагается путем сплавления в плати-
новом тигле с пиросернокислым калием (стр. 216), а также по-
средством сплавления с содой, выщелачивания плава холод-
ной водой и обработки остатка соляной кислотой (стр. 592).
При нагревании в течение некоторого времени с концентри-
рованной серной кислотой чистая двуокись титана растворяется.
Раствор разбавляют по охлаждении.
Сплавление с пиросульфатом калия применимо также для
разложения природной окиси алюминия (корунда).
8. Окись хрома и хромистый железняк разлагаются путем
сплавления с карбонатом натрия в присутствии небольшого ко-
личества селитры в платиновом тигле или с перекисью натрия
в никелевом или железном тигле (стр. 220).
9. Нерастворимые комплексные цианистые (синеродистые)
соединения вполне и легко разлагаются при кипячении в фарфо-
ровой чашке с едким натром.
После кипячения со щелочью разбавляют водой и фильтруют. Филь-
трат содержит кислоты в виде натриевой соли, а иногда также цинк и
алюминий. Поэтому фильтрат насыщают двуокисью углерода, кипятят и
отфильтровывают могущий образоваться осадок [А1(ОН)з или ZnCOs],
растворяют его в соляной кислоте и исследуют раствор на присутствие
в нем алюминия и нинка. Щелочной фильтрат после подкисления соляной
кислотой исследуют на железисто- и железосинеродистоводородную кисло-
ты, как указано на стр. 369 и 372.
Растворимые комплексные цианистые соединения (железисто-, железо-
и кобальтосинеродистые щелочные металлы) также должны быть разло-
жены до проведения анализа путем выпаривания их с концентрированной
серной кислотой (стр. 241),
505
Реакции, происходящие при процессе растворения
При растворении какого-нибудь вещества как в воде, так И
в кислотах часто наблюдаются явления, имеющие большое зна-
чение для дальнейшего хода анализа. Так, на основании окра-
ски, реакции раствора и могущего происходить выделения га-
зов можно* притти к весьма важным заключениям. Сначала
испытывают растворимость в воде, прибавив Приблизительно
к 0,5 г тонко измельченного вещества немного холодной воды и
наблюдая, не выделяются ли пузырьки газа.
Газ выделяют:
а) Перекиси щелочных или щелочноземельных металлов, ча~
стично распадающиеся на гидрат окиси и кислород:
2Na2O-> + 2HsO -> 4NaOH 4- Ог;
2BaOi + 2HiO 2Ba(OH)2 + Ot
Перекись бария выделяет кислород только при нагревании.
Выделяющиеся газы испытывают на кислород посредством
тлеющей лучины.
В щелочном растворе (красный лакмус окрашивается в си-
ний цвет) еще находится некоторое количество неразложив-
шейся перекиси.
Раствор разбавляют большим количеством воды, осторожно подкис-
ляют серной кислотой, прибавляют немного ?фира и немного раствора
бихромата калия и взбалтывают смесь. При наличии перекиси верхний
эфирный слой окрашивается в синий цвет. Еще лучше может быть от-
крыта перекись, если к раствор), подкисленному серной кислотой, приба-
вить несколько капель раствора сернокислого титана, даже в присутствии
следов перекиси, появляется ясно желтая окраска (стр, 317).
б) Карбиды щелочных земель (карбид кальция) разлагаются на
ацетилен (газ своеобразного запаха, горящий светящимся пла-
менем) и гидроокись кальция:
СаС2 -J- 2Н2О -> Са(ОН)2 4- СгНг.
в) Нитриды щелочных земель (нитрид магния) выделяют при
кипячении аммиак, который легко узнать то запаху:
Mg3N2 j- 6Н2О -> 3Mg(OH)2 4- 2NHa.
При добавлении большого количества воды не происходит
выделения газа, потому что аммиак растворяется в воде; но
при кипячении раствора выделяется газообразный аммиак., ко-
торый легко узнается по запаху,
,06
г) Фосфиды щелочей и щелочных земель (фосфид кальция) выде-
ляют фосфористый водород, пахнущий чесноком, часто само-
в осп л ам еняю Ш;И й с я:
Са3Р2 ф 6Н0Н -> ЗСа(ОН)2 ф 2РНз;
2СаР ф 4Н0Н -> 2Са(ОН)2 ф Р2Н4.
д) Некоторые галоидные соединения металлоидон (РС1з, PClr, и т. п.)
распадаются на галоидоводородную кислот}' и кислородные
кислоты металлоидов:
РС1.-> ф 4НЮ -> 5НС1 ф Н3РО4.
е) Некоторые сульфиды (MgS, AI-2S3 и г. п.) выделяют при
растворении в воде сероводород, который узнается по запаху
и по почернению свинцовой бумаги:
MgS ф 2НОН -> Mg(OH)2 ф H2S.
После того как реакция с малым количеством воды окон-
чится (или когда она совсем не происходит) приливают боль-
шое количество воды (около 10—15 мл) и, нагрев до кипения,
Дают охладиться.
Если при этом происходит полное растворение, то, само со-
бою 'разумеется, нет необходимости при анализе отыскивать
не растворяющиеся в воде вещества.
В случае нерастворяющегося остатка часть вещества может
все-таки раствориться, в чем легко убедиться, декантируя рас-
твор через фильтр (так, чтобы остаток по возможности остался
в пробирке) и осторожно выпарив несколько капель фильтрата
досуха на платиновой пластинке (или часовом стекле). При
этом не следует слишком нагревать пластинку, так как в про-
тивном случае от наблюдения могут ускользнуть летучие со-
единения. Убедившись на этой пробе ® присутствии раствори-
мых в воде соединений, последние удаляют по возможности
полностью путем многократной обработки остатка небольшими
порциями воды. Полученные таким путем водные вытяжки со-
единяют и исследуют отдельно. Не растворимый ® воде остаток
пытаются растворить в кислотах, причем, если возможно, сна-
чала в соляной кислоте. В присутствии свинца или серебра, от-
крываемых большею частью уже при предварительном испыта-
нии, для растворения употребляют азотную кислоту.
Растворение в кислотах лучше всего производится, если
остаток, облитый 0,5—1 мл концентрированной кислоты (при-
чем следует обращать внимание на могущее произойти выде-
ление газа), прокипятить и затем разбавить водой для раство-
рения не растворимых в соляной кислоте хлоридов. Не следует
при этом забывать, что висмутовые и сурьмяные соли дают
с большим количеством воды нерастворимые основные хлориды,
поэтому нельзя прибавлять слишком много воды.
Если после обработки кислотами остается нерастворимая
часть, последнюю переводят в раствор по одному из вышеопи-
санных методов (стр. 503 и след).
>07
IV. Открытие катионов
ТАБЛИЦА VIII. ОБЩАЯ СХЕМА РАЗДЕЛЕНИЯ МЕТАЛЛОВ НА ГРУППЫ
Раствор может содержать катионы всех групп. Прибавляют небольшой
избыток HCi (1)
Осадок:
группа I.
Исследуют
по таби I
стр. 135
(-’)
Фильтрат: группы II, III, IV и V. Пропускают H2S до насыщения (3)
Осадок: группа II. Исследуют по табл. II, стр. 202 (4) Фильтрат: группы Ш, IV и V. Исследуют на фосфорную кислоте. Прибавляют ПНрЭН и (5)
Осадок: группа III. Исследуют по табл. V, стр. 281 (6) Фильтрат: группы IV и V. Прибавляют СО3 (7)
Осадок: группа IV. Исследуют по табл. VI, стр. 305 (8) Фильтрат: группа V. Исследуют по табл. VII, стр. 331 (9)
Ход анализа
1. Прибавляют НС1, как указано на стр. 135. Если анализируемое ве-
щество полностью растворяется в разбавленной НС1, то это указывает на
отсутствие солей серебра ,и одновалентной ртути. Часто при наличии
свинца раствор остается прозрачным в горячем состоянии, но при охла-
ждении хлорид свинца, осаждается. Такой осадок лучше всего отфиль-
тровать, хотя дальнейшему исследованию он не мешает, (потому что пои
пропускании ЩБ для осаждения второй группы ои превратится в менее
растворимый сульфид свинца. Если первоначальный раствор имеет щелоч-
ную реакцию по фенолфталеину или лакмусу, то возможно появление
осадка и в отсутствие металлов первой группы. Так, раствор силиката
натрия дает белый студенистый осадок кремневой кислоты, раствор воль-
фрамата щелочного металла дает осадок вольфрамовой кислоты, растворы
тиосолей мышьяка, сурьмы или олова выделяют при подкислении
окрашенные осадки сульфидов этих металлов,, а раствор комплексных
цианидов может выделить осадок уже при нейтрализации. Однако эти
осадки трудно смешать с хлоридами серебра, свинца или ртути-
В присутствии силикатов абсолютно необходимо удалить кремневую
кислоту в самом начале анализа методом, указанным на стр. 480; точно
таким же методом может быть удалена вольфрамовая кислота. В при-
сутствии тиосолей осадок исследуют по табл. IV, стр. 206, а испытание на
щелочные и щелочноземельные металлы проводят по табл. V.!, стр. 30.5
И табл. VII, стр. 331. Если первоначальный раствор имеет щелочную ре-
акцию, то испытание на железо необходимо проводить лишь в том слу-
чае, когда раствор содержит нелетучие органические вещества, потому
что последние препятствуют осаждению его гидроксил-ионами. Прибавле-
ние соляной кислоты может вызвать осаждение BiOCl; при разбавлении
возможно осаждение BiOCl, SbOCl или основных солей некоторых других
508
металлов, в особенности титана и олова. За исключением осажденного ти-
тана, такие Основные соли легко растворяются, если их отфильтровать
и обработать 6/V соляной кислотой. Кроме того, основные соли сурьмы,
висмута и олова, не будучи отфильтрованными, могут быть превращены
в менее растворимые сульфиды при пропускании HaS.
2. Исследуют осадок Hg2Cl2, РЬС12 и AgCl, как указано на стр. 135.
Об открытии таллия, который иногда осаждается с этой группой, см.
часть V.
3. Фильтрат, полученный в п. 1, вливают в эрленмейеровскую колбу
емкостью 300 мл и закрывают ее резиновой пробкой с двумя отверстиями;
через одно отверстие проходит согнутая под прямым углом стеклянная
трубка, нижний конец которой заканчивается непосредственно у нижней
поверхности пробки; через другое отверстие 'проходит также согнутая
под прямым углом стеклянная трубка, почти достигающая дна колбы. Сна-
чала выдвигают вверх более ’длинную трубку, чтобы она находилась над
поверхностью раствора, затем нагревают последний до кипения и начи-
нают пропускать сильную струю НгЗ через длинную трубку. Удалив
пламя, закрывают короткую трубку при помощи короткой резиновой
трубки со вставленным в иее куском стеклянной палочки и опускают
более длинную стеклянную трубку, чтобы она накодииась ниже уровня
жидкости. Раствор сильно взбалтывают, оставляя его под давлением HaS.
Таким1 путем, по мере осаждения сульфидов, раствор остается насыщен-
ным сероводородом без излишней траты его. Когда, осаждение покажется
законченным, прерывают ток сероводорода, открывают колбу, прибавляют
равный объем холодной воды и снова насыщают НгБ-газом. Закрывают
короткую трубку и взбалтывают раствор 2—3 мин., держа его под давле-
нием H2S, после чего отфильтровывают осадок hz быстро промывают его
Н25-водой. Если в исследуемом растворе имеются окислители \ то происхо-
дит выделение серы и осаждение сульфидов сильно задержится. Чтобы
узнать, ие содержит ли осадок только серу, промывают его несколько раз
спиртом, затем сернистым углеродом (в стороне от огня) и потом снова
спиртом. Таким путем удаляется сера.
До пропускания HsS должна быть установлена концентрация кислоты
в растворе путем учета количества кислоты, потраченной на растворение
вещества и иа осаждение первой' группы. После разбавления водой, как
выше было указано, кислотность раствора должна быть приблизительно
0,3N; при большей концентрации кислоты ие будут осаждаться сульфиды
кадмия .и свинца, при меньшей—возможно осаждение сульфидов цинка,
никеля и кобальта. Вообще же менее опасна ошибка при недостаточной
кислотности, потому что в фильтрате всегда будет оставаться еще доста-
точно цинка, никеля н кобальта, чтобы произвести испытание на них;
присутствие же этих элементов не будет служить серьезным препятствием
•при анализе второй группы. Подобно кадмию циик дает с ферроцианидом
белый осадок при идентификации меди, а никель дает бледносинюю
окраску с аммиаком; как никель, так и кобальт могут мешать конечной
реакции на кадмий» но по ходу анализа, изложенному на огр- 202, эти
трудности устраняются. Если после осаждения сернистым водородом по-
лучается мутный фильтрат вследствие выделившейся свободной серы, то,
приготовив некоторое количество бумажной массы путем взбалтывания
кусков фильтровальной бумаги в бутылке с горячей водой, прибавляют
небольшое количество этой массы к фильтрату и фильтруют через све.
жий фильтр. Осадок сульфидов несколько окисляется иа воздухе, образуя
небольшое количество растворимых сульфатов; последние могут дать оса-
док с H2S в фильтрате. Поэтому осадок сульфидов нужно быстро про-
мывать сероводородной водой, не давая жидкости полностью стекать
с фильтра до тех пор, пока ие будет закончено промывание. Если филъ-
1 При наличии большого1 количества окислителей или мышьяковой кис-
лоты следует пропускать в горячий раствор 80s до полного восстановле-
ния их и затем удалить избыток SO2 током СО?. Удаление SO« необхо-
димо, так как в противном случае произойдет реакция с H2S:
2H;S + SOs -> 2HsO + 33,
509
трование сильно замедляется, фильтр переносят вместе с осадком в стакан,
взбалтывают с сероводородной водой и фильтруют через свежий фильтр.
В качественном анализе все промывные воды после первого' промывания
обычно выливаются.
4. Сульфидный осадок исследуют, как указано на стр. 202. В присут-
ствии золота, платины или большого количества олова и свинца послед-
ние могут остаться вместе с сернистой ртутью. Если предполагают при-
сутствие этих элементов, то, сохранив небольшую часть остатка для испы-
тания на ртуть, всю остальную часть сплавляют в фарфоровом тигле со
смесью равных частей цианистого калия и карбоната натрия. По охла-
ждении экстрагируют растворимые щелочные соли водой и выливают рас-
твор. Золото, платина, олово и свинец остаются в виде металлов. Их
обрабатывают разбавленной азотной кислотой и испытывают раствор на
свинец серной кислотой обычным путем (cip. 204). Остаток, состоящий из
золота, платины и метаолоэянной кислоты, нагревают с концентрирован-
ной соляной кислотой. Разбавляют, фильтруют и производят пробу на
олово обычным путем посредством HgCb (стр. 208). Золото и платину, остав-
шиеся после обработки соляной кислотой, растворяют в царской водке,
прибавляют хлористый аммоний, выпаривают досуха на водянойюане и при-
бавляют к остатку небольшое количество >в,оды. Желтый осадок
указывает на присутствие платины. Фильтруют, нреводят пробу посред-
ством FeSOa на золото и идентифицируют последнее реакцией на обуглен-
ной палочке (стр. 561).
5. Небольшое количество фильтрата, полученного после насыщения
сероводородом (3), кипятят для удаления H»S> прибавляют немного бром-
ной воды для окисления ‘могущего присутствовать железа и следов сер-
нистого водорода и подщелачивают раствором аммиака. Если образуется
осадок, то он может состоять из фосфатов бария, щронция, кальция, маг-
ния или фторидов и оксалатов щелочных земель, а также Fe(OFI)s,
А1(ОН)з и т. д.
Так как фосфорная кислота часто встречается в минералах, то для
анализа группы 111 и IV чеоо ip-nlyeccH спжшкк.-ный .метод. Не отфиль-
тровывая осадок, .образованный аммиаком, его растворяют, осторожно
прибавляя разбавленную азотную кислоту, нагревают раствор почти до
кипения и приливают равный объем; реактивного раствора молибдата ам-
мония. Желтый осадок, образование которого может происходить мед-
ленно, указывает на присутствие фосфорной кислоты. ‘Мышьяковая кис-
лота дает подобный же осадок (стр. 171), но в этой части анализа мышьяк
не (может присутствовать. Если фосфорная кислота обнаружена, исс.тедо-
ванне ведут, как указано на стр. 279. Если при предварительном испыта-
нии, особенно посредством концентрированной серной кислоты, обнару-
жено присутствие щавелевой или фтористоводородной кислоты, то лучше
всего удалять их путем нагревания исходного вещества с. концентриро-
ванной серной кислотой (стр. 505). Последняя может после разбавления
дать нерастворимый осадок сульфатов щелочных земель, которые иссле-
дуют по стр. 298. Если при предварительном испытании (прокаливание,
в тугоплавкой пробирке) было обнаружено присутствие нелетучих -органи-
ческих веществ, то последние, прежде чем приступить к анализу группы 111,
необходимо удалить, потому что винная и лимонная кислоты, сахар, крах-
мал и тому подобные вещества -препятствуют осаждению аммиаком железа,
алюминия и хрома. Такие органические вещества -могут быть удалены
путем повторной обработки концентрированными серной и азотной1 кис-
лотами. Для этого прибавляют около 5 мл концентрированной серной
кислоты, такой же объем концентрированной азотной кислоты и -выпари-
вают до появления обильных паров серной кислоты, -после чего охла-
ждают и повторяют выпаривание с азотной кислотой столько раз, сколько
это необходимо. Такая обработка часто приводит к образованию нераство-
римых AhOs, СггОз, FeaOs и Si О:. Их -сплавляют с КНЗОз и исследуют
отдельно. После обработки серной и азотной кислотами -может остаться
нерастворимый сульфат; его сплавляют с карбонатом натрия (стр. 298).
6. Группу III анализируют по методу, приведенному на стр. 281. Мно-
гие элементы этой группы часто встречаются в различных степенях окис-
ления. В отчете о конечном результате анализа недостаточно констати-
510
ровать присутствие железа хрома или марганца, но необходимо указать,
в каком состоянии находился каждый элемент в полученном ДЛЯ анализа
образце. Для этого пользуются специальными испытаниями и характерными
реакциями, описанными в части 11 при элементах, о которых идет речь.
7. Фильтрат, 'Полученный после операции по ть 5, обрабатывают угле-
кислым аммонием, как указано на стр. 305.
8. Осадок, полученный <н (NHdsCOa, исследует с я. как указано <иа стр. 305.
9. Группе щелочных .мета.ьчок нсстедуюг, кжк указано на с гр. 331 для
анализа группы V. Часгь первоначального вещества исследуют на присут-
ствие аммония,
V. Открытие анионов
А. Метод Ф. П. Тредвелла1
Открытие кислот (анионов) 'производится всегда после от-
крытия металлов (катионов), так как уже на основании пред-
варительного испытания (нагревание вещества в тугоплавкой
пробирке и нагревание его с разбавленной и концентрированной
серной кислотой), а также на основании растворимости и всего
хода анализа можно сделать заключение о 'Присутствии или от-
сутствии многих кислот.
Чтобы избегнуть побочных реакции, при испытании на кис-
лоты пользуются только нейтральными солями щелочных ме-
таллов.
Ирш отопление рнс'гнора для испытания на кислоты
Необходимо рзвлпчать .тв.1 г.т\ч;ш:
1. Исходное вещество не содержит тяжелых металлов
я/ Вещество растворяется в воде. <Определяют реакцию раствора лак-
мусовой бумагой.
Щелочная реакция присущ,! miaunciьы и лзт истокислым солям щелоч-
ных мсга.нок8. f>i>рнокцелым го 1Я.м, третичным солям фосфорной кислоты,
СОЛЯМ Щелочных МО I ;1.|.1ОВ 1 IpIK ИС. II > I СгрНИС 1око.1ородной КИСЛОТЫ, кремне-
Ной КИСЛОТЫ II Некоторым другим.
Кислои реакцисн обладают многие idic iwe соли.
Полученный paeiHpp деляг на дне чисти. Если раствор ней гриден. его
пеноергдегвентго исследуют на киситы; при щелочной реакции одну поло-
вину раствора точно иейi р.1лжз\ю i уксусной кислотй, а другую - азот-
ной-1; кис.чыи piiciHop Ш'йтрЛГиз.с io 1 распором СОДЫ.
б) Вещество очень rpyjfro растворяется или совсем не растворяется
в воле, но mi ко н разбавленных кислоте. В данном случае могут быль
кислоты только III и IV групп.
Твердое вещество кипятят с небольшим количеством концентрирован-
ного раствора соды и фильтруют. Фильтрат содержит все кислоты в виде
натриевых солеи, за исключением фосфорной кислоты, присутствие кото-
рой узнается уже при испытании на металлы,
Полученный раствор нейтрализуют разоав.кннпи азотной кислотой.
в) Вещество не растворяется ни в воде, ни в разбавленных кислотах.
Могут быть: BaSO«. SrSOi. (CaSOO, Cal-V- силикаты, которые часто содер-
жат Н»РО<> НВОг, H:SO«. НЕ и НС!.
’ Основан на бунзеновской классификации ioic.ioi (с гр. 334i.
* Совершенно чистые азотистокислые щет,очи имеют нейтральную ре-
акцию. Щелочная реакция продажной соли зависит от присутствия окиси
щелочного металла или силиката.
При этом тиосолн, силикаты, цинкаты, емннагы, алюминаты,
молибдаты, вольфраматы и т, п. дают осадки. В таких случаях осадки
Исследуют по стр. 508.
511
трование сильно замедляется, фильтр переносят вместе с осадком в стакан,
взбалтывают с сероводородной водой и фильтруют через свежий фильтр.
В качественном анализе все промывные воды после первого промывания
обычно выливаются.
4. Сульфидный осадок исследуют, как указано на стр. 202. В присут-
ствии золота, платины или большого количества олова и свинца послед-
ние могут остаться вместе с сернистой ртутью. Если предполагают при-
сутствие этих элементов, то, сохранив небольшую nacib остатка для испы-
тания па ртуть, всю остальную часть сплавляют в фарфоровом тигле со
смесью равных частей цианистого калия и карбоната натрия. По охта-
жденин экстрагируют растворимые щелочные сочи водой и выливают рас-
твор. Золото, платина, олово я свинец остаются в виде металлов. Их
обрабатывают разбавленной азотиой кислотой и испытывают раствор на
свинец серной кислотой обычным путем (cip. 204). Остаток, состоящий из
золота, платины и метаоловянной кислоты, нагревают с концентрирован-
ной соляной кислотой. Разбавляют, фильтруют и производят пробу на
олово обычным путем посредством HgCE (стр. 208). Золото и платину, остав-
шиеся после обработки соляной кислотой, растворяют в царской водке,
прибавляют хлористый аммоний, выпаривают досуха наводяноййанеи при-
бавляют к остатку небольшое количество воды. Желтый осадок (NHOslPtCloJ
указывает на присутствие платины. Фильтруют, проводят пробу посред-
ством FeSOa иа золото и идентифицируют последнее реакцией на. обуглен-
ной палочке (стр. 561).
5. Небольшое количество фильтрата, полеченного после насыщения
сероводородом (3), кипятят для удаления HsS- прибавляют немного бром-
ной воды для окисления могущего присутствовать железа и следов сер-
нистого водорода и подщелачивают раствором аммиака. Рюли образуется
осадок, то он может состоять из фосфатов бария, стронция, кальция, маг-
ния или фторидов и оксалатов щелочных земель, а также Fe(OH)s,
А1(ОН)з и т. д.
Так как фосфорная кислота часто встречается в минералах, то для
анализа группы III и IV часто требуется специальный .метод. Не отфиль-
тровывая осадок, ,образованны!) аммиаком, его растворяют, осторожно
прибавляя разбавленную азотную кислоту, нагревают раствор почти до
кипения и приливают равный объем 'реактивного раствора молибдата ам-
мония. Желтый осадок, образование которого может происходить мед-
ленно, указывает на присутствие фосфорной кислоты. Мышьяковая кис-
лота дает подобный же осадок (стр. 171), но в этой части анализа мышьяк
не Может присутствовать. Если фосфорная кислота обнаружена, исследо-
вание ведут, как указано на стр. 279. Если при предварительном испыта-
нии, особенно посредством концентрированной серной кислоты, обнару-
жено присутствие щавелевой или фтористоводородной кислоты, то лучше
всего удалять их путем нагревания исходного вешеетва с концентриро-
ванной серной кислотой (стр. 505). Последняя может после разбавления
дать нерастворимый осадок сульфатов щелочных земель, которые иссле-
дуют по стр. 298. Если при предварительном испытании (прокаливание,
в тугоплавкой пробирке) было обнаружено присутствие нелетучих органи-
ческих веществ, то последние, прежде чем приступить к анализу группы 111,
необходимо удалить, потому что винная и лимонная кислоты, сахар, крах-
мал и тому подобные вещества препятствуют осаждению аммиаком железа,
алюминия и хрома. Такие органические вещества могут быть удалены
путем повторной обработки концентрированными серной и азотной1 кис-
лотами. Для этого прибавляют около 5 мл концентрированной серной
кислоты, такой же объем концентрированной азотной кислоты и выпари-
вают до появления обильных паров серной кислоты, после чего охла-
ждают и повторяют выпаривание с азотной кислотой столько раз, сколько
это необходимо. Такая обработка часто приводит к образованию нераство-
римых А1аОз, СГ’Оз, FesCV и SiO. Их сплавляют с КНЗОт и исследуют
отдельно. После обработки серной и азотной кислотами может остаться
нерастворимый сульфат; его сплавляют с карбонатом натрия (стр. 298).
6. Группу III анализируют по методу, приведенному на стр. 281. Мно-
гие элементы этой группы часто встречаются в различных степенях окис-
ления. В отчете о конечном результате анализа недостаточно констати-
510
ровать присутствие железа хрома или марганца, но необходимо указать,
в каком состоянии находился каждый элемент в подученном для анализа
образце. Для этого пользуются специальными испытаниями и характерными
реакциями, описанными в части 11 при элементах, о которых идет речь.
7. Фильтрат, ‘полученный после операции по п. 5. об|->абатьтвают угле-
кислым аммонием, как указано на с гр. 305.
К. Осадок, полученный о) (NHosCOs, исслсдуекя. как указа-но«а стр. 305.
9. Группу щелочных Meia.noM ксстедуют. к» указано На стр. 331 для
анализа группы V. Част первоначального вещества исследуют на присут-
ствие аммония.
V. Открытие анионов
А. Метод Ф. П. Тредвелла1
Открытие кислот (анионов) 'производится всегда после от-
крытия металлов (катионов), так как уже на основании пред-
варительного испытания (нагревание вещества в тугоплавкой
пробирке и нагревание его с разбавленной и концентрированной
серной кислотой), а также на основании растворимости и всего
хода анализа можно сделать заключение о присутствии или от-
сутствии многих кислот.
Чтобы избегнуть побочных реакций, при испытании на кис-
лоты пользуются только нейтральными солями щелочных ме-
таллов.
tl рш (ггоплинпе рис гнори ИЛЯ ИСПЫТАНИЯ НИ КИСЛОТЫ
Необходимо различиiь два случая:
1. Исходное вещество не содержит тяжелых металлов
а) Вещество растворяется в воде. < шределяют реакцию раствора лак-
мусовой бумагой.
Шс лонная реакция присуща цианщ-1ым и азо)игтокистым солям ше.тич.
НЫХ мс П1.1 -1«Н борнокислым СО 1Я.М, 1 ре I 11ЧРЫ" СОЛЯМ фосфорной кислоты,
солям щелочных мс i а |.юк i ipikнс-к।г С'-рнис lomi.pipiijnoi'i kikjoih, кремне-
Holt кис.рпы il MCKfiHipblM другим.
Кислой реакцией обладаю) многие kiic-ihc ruin.
Полученный par i в,г>р де ш г на .w части. Если раствор нейтрален, его
непосредстнентго нее тел vfo г пч khcioih; .при щелочной реакции одну поло-
вину раствора точно нсГщ>алщ\ки уксусной кисло|ой, я другую - азот-
ЦОЙ'1; кнелыи раечвор ней Гр,I ни ио) расширим 1'0.11,1.
б) Вещество очень трудно растворяется или совсем но. растворяется
в воле, нп м-i ко в рилбавм'ннык кислотах. В данном случае могут быть
КИСЛОТЫ ТОЛЬКО 111 и IV ['РУПП,
Твердое вещество кипятят с небольшие количеством концентрирован-
ного рагтнотш соды и фнльтрукгг. Фильтрат содержит все кислоты к виде
натриевых солей, за исключением фосфорной кислоты, присутствие кото-
рой узнается уже при испытании на металлы.
Полученный раствор нейтрализуют разбавленнои азо i ной кислотой.
в) Вещество нс растворяется ни в воде, ни в разбавленных кислотах.
Могут быть: BaSO<, ErSOr. (CaSOi), Cal-;, силикаты, которые часто содер-
жат НяРОъ НВО2, H;SO4, НЕ и HCI.
’ Основам на бунзеновской классификации кислот (огр. 334).
’Совершенно чистые азотистокислые щелочи имею! нейтральную ре-
акцию. Щелочная реакция продажной соли зависит от присутствия окиси
щелочного металла или силиката.
1 При этом тиосоли, силикаты, цинкаты, станниты, алюминаты,
молибдаты, вольфраматы и т. п. дают осадки, В таких случаях осадки
исследуют по сер. 508.
511
Переводят вещество в раствор, сплавляя с содой в платиновом тигле,
выщелачивают водой и после нейтрализации пробуют водный раствор на
кислоты.
Если вещество отчасти растворимо в воде и в кислотах, то выщела-
чивают сначала водой, затем раствором соды и остаток сплавляют с содой;
выщелачивают плав водой и исследуют все три раствора в отдельности.
2. Вещество содержит тяжелые металлы
а) Вещество растворимо в воде или разбавленных кислотах и не со-
держит нелетучих органических веществ (не наблюдается обугливания при
прокаливании). К твердому веществу -прибавляют концентрированный рас-
твор соды до слабощелочной реакции *, кипятят и фильтруют. В присут-
ствии аммонийных солей кипячение продолжают до исчезновения аммиач-
ного запаха и только после этого фильтруют.
Полученный раствор делят на две части и одну из них нейтрализуют
уксусной кислотой, а другую — азотной.
б) Исследуемое вещество растворимо в воде или разбавленных кисло-
тах и содержит нелетучие органические вещества. Если обнаружено при-
сутствие металлов Нгй- и (NHaViS-rpynn, то в сла-бокислый раствор пропу-
скают HaS до насыщения, фильтруют, прибавляют к фильтрату аммиак до
слабощелочной реакции, фильтруют и, прибавив немного уксусной кислоты,
выпаривают до небольшого Объема; отфильтровывают выделившуюся серу,
пересыщают фильтрат твердым поташом, если нужно—снова фильтруют,
фильтрат осторожно подкисляют азотной кислотой, основательно переме-
шивают и отфильтровывают выделившийся винный камень, который под-
лежит дальнейшему исследованию, как указано при описании реакции на
винную кислоту (стр. 420). Фильтрат пробуют на< остальные кислоты.
в) Вещество не растворимо в сильных кислотах. Кроме солей, при-
веденных под рубрикой 1 в) (стр. 511), могут быть еще следующие: AgCl,
AgBr, AgJ, AgCN, PbSOa, силикаты (железисто- и железосинеродистые
соли).
Присутствие Ag указывает на присутствие галоидов. Восстановляют
посредством Zn и H»SOa, фильтруют н исследуют фильтрат по табл. XI
на НС1, HJ, НВг и HCN.
Если нерастворимое вещество содержит РЬ, его кипятят с раствором
NaaCOs, фильтруют и, подкислив фильтрат НС1, пробуют на серную кис-
лоту посредством ВаСЬ.
В присутствии силикатов необходимо еще исследование на НзРОа, HF,
НВО’, НС1, H’SOa .
Полученный тем, или иным путем раствор исследуют на его отношение
к азотнокислому серебру и хлористому барию для открытия (группового)
имеющихся в исследуемом веществе кислот (см. табл. IX и X на стр. 513 и
514).
Лишь после этого приступают к специальным реакциям, характерным
для отдельных кислот, входящих в эти группы.
Группа I
Кислоты этой группы исследуются по табл. XI (стр. 515).
Группа II
Кислоты этой группы почти всегда открываются при предварительном
испытании. О специальных реакциях на эти кислоты см. стр. 381 И след.
Группа III
SO», СО», Н’СаОа узнаются при предварительном испытании. НРОз,
НтР-От, НВО» и винная кислота узнаются по специальным реакциям
(стр. 403 и след.).
Группа IV
СгОз, НзРОз, H2S2O3 узнаются при предварительном испытании и при
анализе металлов.
1 Следует избегать большого -избытка соды, потому что ^многие кар-
бонаты растворяются в концентрираванном растворе соды;
512
Группа V
НСЮз и HNOs большей частью открываются при предварительном испы-
тании. Их присутствие помимо этого следует всегда констатировать по
стр. 462.
ТАБЛИЦА IX. ИСПЫТАНИЕ НИТРАТОМ СЕРЕБРА
К первоначальному нейтральному водному раствору или раствору,
нейтрализованному уксусной или азотной кислотой, приливают
избыток раствора азотнокислого серебра
Осадок ие Л ,
образуется ОсаД°к образуется
Отсутствуют:
все кислоты
I, 111 и IV
групп.
См. стр. 334.
В концентрированном растворе осадок может быть обусловлен серебряной солью СН3СООН, HNO2 или H2SO4.
Осадок растворяется Добавляют воды и нагревают Осадок ие растворяется
Отсутствуют: кислоты I, III и IV групп Могут присутствовать: кислоты I, III и IV гр. Нагревают раствор с разбавленной HNO3 растворяется Осадок не Растворяется
Присутствуют: кислоты Ill и IV групп. Отсутствуют: кислоты I группы. Присутствуют: кислоты I группы Фильтруют и к фильтрату по каплям приливают раз- бавленный аммиак так, что- бы жидкости не смешивались Образуется Мутное кольцо мутное кольцо не образуется
Присутствуют: кислоты1 III или IV групп. Кольцо желтое: мышьяковистая или фосфорная кислота. Кольцо красное: хромовая кислота. Кольцо бурое2: мышьяковая кислота. Кольцо белое: сернистая, ме- тафосфорная, пирофосфорная, щавелевая или винная кислота. Отсутствуют: кислоты III и IV групп.
1 Борная кислота не осаждается в случае нейтрализации свободной
кислоты аммиаком. Необходимо провести отдельную пробу.
2 Не исключается возможность образования бурой AgaO при действии
аммиака на раствор серебра; если ,в зоне конта1кта образуется бурое кольцо,
раствор осторожно встряхивают,- удаляя этим путем помутнение; добав-
ляют несколько большее количество аммиака и при некоторой опытности
легко устанавливают, обусловлена ли окраска образованием AgaO или
AgsAsOa.
33 Зак. 982. Тредвелл-Голл, т. I.
513
ТАБЛИЦА X. ИСПЫТАНИЕ ХЛОРИСТЫМ БАРИЕМ
К первоначальному водному, нейтральному раствору или к пробе,
нейтрализованной уксусной кислотой, прибавляют избыток
хлористого бария
Осадок не
образуется
Осадок образуется
Отсутствуют: все
кислоты
III, IV и VI групп.
Подкисляют разбавленной НС1 и нагревают1
Осадок Осадок не
растворяется растворяется
Отсутствуют:
кислоты
VI группа
Присутствуют: кислоты VI группы
Фильтруют и нейтрализуют
фильтрат разбавленным раствором
чистого КОН или NaOH (не содер-
жащим карбоната и пр.).
Осадок не
образуется
Осадок образуется
Отсутствуют:
кислоты III и IV
групп
Присутствуют:
кислоты III и IV
групп2
Группы VI и VII
Узнаются большей частью при 'предварительном испытании. Присут-
ствие их проверяют реакциями, приведенными прн HsSOa, HF и SiOs.
Присутствие или отсутствие групп Ill и IV при отсутствии HF можно еще
лучше констатировать, прибавив к не слишком концентрированному нейтраль-
ному раствору СаС12, который не осаждает серной кислоты, ио осаждает
кислоты групп III и IV за исключением тиосериой кислоты.
Б. Метод А. А. Нойеса (Noyes)
Согласно этому упрощенному методу испытания на обычные
кислотные компоненты, которые встречаются в минералах и
продажных продуктах, вещества подразделяются на: 1) природ-
ные и огнеупорные 'вещества и 2) неогнеупорные вещества.
К первой категории принадлежат минералы, руды, шлаки,
абразивы, стекло, фарфор и другие продукты керамики. Эти
вещества исследуются на присутствие боратов, карбонатов, сили-
катов, сульфатов, сульфидов, фосфатов, фторидов, хлоридов
и цианидов. Ко второй категории относятся различные хими-
ческие препараты, минеральные краски (пигменты), удобрения
1 При этом разрушаются углекислые, сернистокислые и тиосернокислые
соли; на них пробуют отдельно.
2 На борную кислоту надо произвести испытание отдельно.
5U
ТАБЛИЦА XI. ИССЛЕДОВАНИЕ ГРУППЫ I
Сначала производят реакцию на HCN. Поместив немного раствора на ча-
совое стекло, прибавляют несколько капель желтого сернистого аммония,
осторожно выпаривают досуха, сухой остаток подкисляют НС1 и при-
бавляют каплю раствора ЕеС13. Появление кровавокрасного окрашивания
указывает на присутствие HCN. В этом случае удаляют HCN, прибавив
К большей части нейтрального раствора избыток сульфата никеля,1
и отфильтровывают осадок
Осадок
NI (CN)2
отбрасывают
Раствор
Обрабатывают раствор, не содержащий цианистоводо-
родной кислоты, небольшим количеством едкого натра
(не содержащего галоидов), кипятят и отфильтровывают
осадок Ni (ОН)^ Фильтрат делят на две части, одну из
которых исследуют на присутствие НВг и HJ, а другую
на НС1
Проба на HJ и НВг
Проба на НС1
Подкисляют раствор разба-
вленной H^SOi, прибавляют по
каплям хлорную воду и взбал-
тывают раствор с CS2 или
СНС13. Если последние окра-
шиваются в фиолетовый цвет,
то наличие HJ доказано.Если
при дальнейшем добавлении
хлорной воды происходит
полнейшее обесцвечивание CS2
или СНС13, то заключают об
отсутствии НВг', если они
окрашиваются в желтовато-
бурый цвет, то зто указы-
вает на присутствие НВг.
При добавлении избытка
хлорной воды получается
винножелтая окраска
Слегка подкисляют растсор
HNOS и прибавляют по кап-
лям AgNO3. Сначала выпа-
дают AgJ и AgBr (желтого
цвета). Фильтруют и при-
бавляют к фильтрату еще
AgNO3. Если продолжает вы-
деляться желтый осадок, то
его отфильтровывают через
новый фильтр и снова при-
бавляют AgNO3 а так про-'
должают до тех пор, пока
не получится осадок (AgCl)
белого цвета, указывающий-,
на присутствие НС1
и препараты, получающиеся при невысоких температурах. Эти
вещества исследуются на присутствие арсенатов, арсенитов, бо-
ратов, бромидов, гипохлоритов, иодидов, карбонатов, нитратов,
нитритов, оксалатов, роданидов, силикатов, сульфатов, сульфи-
дов, сульфитов, феррицианидов, ферроцианидов, фосфатов, фто-
ридов, хлоратов, хлоридов, хроматов и цианидов.
Фосфат и силикат обыкновенно' открываются во время рас-
творения вещества и исследования его на катионы.
1 Если присутствует железосинеродистоводородная кислота, то приба,-
вляют также немного сульфата двухвалентного железад Железистосине-
родистоводородная кислота полностью осаждается сульфатом никеля.
зз* до
Анализ природных и огнеупорных веществ
ТАБЛИЦА XII. ОТКРЫТИЕ СУЛЬФАТА, КАРБОНАТА, СУЛЬФИДА
И ЦИАНИДА
Кипятят 0,5 г вещества в перегонной колбе с НС1 и Zn, собирают 3 мл
дестиллата в раствор Ва (ОН)2\ смесь, оставшуюся в колбе для перегонки,
фильтруют (1)
Фильтрат: Прибавляют
BaCl* Белый осадок
BaSO4 указывает на
присутствие сульфата (2)
Дестиллат: Белый осадок ВаСО3 указывает на
присутствие карбоната. Раствор может содержать
В aS и Ba (CN), (3)
К части раствопа при-
бавляют СНЗСООН и
РЬ (СНгСОО)ъ. Черный
осадок PbS указывает на
присутствие сульфида (3)
К остатку раствора
прибавляют FeCl$, ки-
пятят и прибавляют
НС1. Образование бер-
линской лазури указы-
вает на присутствие
цианида (3)
Ход анализа
1. В колбу А (рис. 19) емкостью 50 мл помещают 0,5 г вещества, рас-
тертого в тонкий порошок, приблизительно такое же количество гранули-
рованного цинка и приливают 10 мл 3N НС1, предварительно подвергнув
ее в течение 1 мин. кипячению ,в пробирке. Обе применяемые колбы дол-
жны быть из хорошего стекла. Предохранительная трубка В длиной
около 25 см достигает почти диа колбы А. Отводная трубка С длиной
50 см доходит до нижней поверхности резиновой пробки в А и до дна
колбы D, помещенной в стакан с холодной водой. В колбе D находятся
25 мл раствора гидроокиси бария. Обе колбы снабжены резиновыми проб-
ками с двумя отверстиями; одно отверстие в пробке колбы D оставлено
открытым.
.516
Нагревают смесь в колбе А и медленно перегоняют около 3 мл жид-
кости в D. Жидкость, оставшуюся в А, исследуют по п. 2, а жидкость
в D — по п. 3,
2. Фильтруют содержимое колбы Дик фильтрату прибавляют хлори-
стый барий. Белый осадок сульфата бария служит признаком присутствия
сульфата.
3. К 2/з жидкости в колбе D прибавляют уксусную кислоту порциями
по 1 мл до тех пор, пока, раствор не покажет 'кислой реакции по лакму-
совой бумаге. Белый осадок ВаСОз, который частью или полностью рас-
творяется по прибавлении кислоты, указывает на присутствие карбоната.
В случае появления лишь слабой мути сравнивают последнюю
с результатом слепого опыта, получающегося при перегонке только одной
кислоты с цинком.
Прибавляют 5 мл раствора ацетата свинца: черный осадок PbS указы-
вает на присутствие сульфида. В сомнительных случаях необходимо про-
извести слепой опыт только с кислотой и цинком, выполняя перегонку
точно таким же способом.
Остаток дестиллата испытывают на цианид: прибавляют 1 мл рас-
твора FeCk, кипятят 1 мин. и затем подкисляют соляной кислотой. Обра-
зование берлинской лазури указывает на присутствие цианида.
ТАБЛИЦА XIII. ОТКРЫТИЕ ХЛОРИДА, ФТОРИДА И БОРАТА
Перегоняют 1 г вещества: а) только с H^SO^ и б) с H^SOi и СН^ОН (4)
а) Часть первого дестиллата испы-
тывают посредством AgNO3. Бе-
лый осадок AgCl указывает на при-
сутствие хлорида.
К другой части прибавляют СаС1<>.
Белый осадок CaF2 указывает на
присутствие фторида (5)
б) Второй дестиллат испытывают
посредством НС1 и раствора кур-
кумы. Оранжевый или красный цвет
указывает на присутствие бората (6)
4. В колбу для перегонки А (рис. 19) помещают 1 г вещества, растер-
того в тонкий порошок, и 3 мл концентрированной серной кислоты, а в
колбу D вливают 5 мл воды. Перегоняют до тех пор, пока жидкость в
колбе А не приобретет маслообразной консистенции и колба не наполнится
белыми парами. Во время перегонки убирают на момент огонь из-под
колбы, чтобы дать жидкости, собравшейся в предохранительной трубке,
стечь обратно в колбу. Эту операцию проделывают два раза. Дестиллат
иеследуют на присутствие хлорида и фторида, как описано в п. 5. По
охлаждении содержимого дестилляционной колбы до комнатной темпера-
туры вливают в нее 8 мл метилового спирта и взбалтывают. Отгоняют
большую часть спирта, собирая дестиллат ,в колбе, в которую вливают
8 мл 12N НС1, разбавленной 3 мл воды. Этот второй дестиллат исследуют
по п. 6.
5. Первый дестиллат, полученный при операции, указанной в гг. 4, ки-
пятят около 1 мин. и, если он мутен, фильтруют. Приблизительно к х/«
его объема прибавляют 2 мл 6N HNOs и немного раствора AgNOs. Белый
осадок AgCl указывает на присутствие хлорида. К остатку дестиллата при-
бавляют 5 мл раствора СаСк и дают смеси постоять 15 мин. Белый оса-
док CaFz указывает на присутствие фторида. Производят его идентифика-
цию по Даниэлю, как описано на стр.* 472.
6. Второй дестиллат, полученный по п. 4, переливают в градуирован-
ный цилиндр, разбавляют до 20 мл и прибавляют 2 капли спиртового
раствора куркумы (стр. 106). Оранжевый или красный цвет указывает на
присутствие бората (стр. 414).
517
ТАБЛИЦА XIV. ОТКРЫТИЕ СУЛЬФАТА, ФТОРИДА, БОРАТА И
СИЛИКАТА В ВЕЩЕСТВАХ, НЕ РАЗЛАГАЕМЫХ КИСЛОТАМИ
Сплавляют вещество с Na2CO3. Плав выщелачивают водой. Нерастворимый
остаток выбрасывают. Раствор делят на две части (7)
Выпаривают 2/8 водного экстракта до 6 мл. Прибавляют НС1, филь- труют, остаток выбрасывают и прибавляют к фильтрату В‘аС1ч- Фильтруют (8) К остатку водного экстракта при- бавляют НС1 и выпаривают досуха. К плотному остатку прибавляют НС1, разбавляют и фильтруют (10)
Осадок: Белый осадок BaSO4 ука- зывает на присут- ствие сульфата (8) Фильтрат: Прибавляют CH3COONa и СаС1ч. Белый осадок CaF2 указывает на присутствие фторида (9) Осадок: Студенистый оса- док H2SiO3 ука- зывает на присут- ствие силиката (10) Фильтрат: Испы- тывают на борат спиртовым рас- твором куркумы. Красный илн оранжевый цвет указывает на присутствие бората (11)
7. Если первоначальное вещество не разлагается минеральными кис-
лотами при обработке его ими в открытой чашке или если остается после
такой обработки нерастворимый остаток, то вышеописанные реакции на
сульфат, фторид и борат могут дать отрицательные результаты даже
при наличии этих ионов.
В этом случае сп-лавляют 1 г анализируемого вещества или остаток,
не растворяющийся в кислотах, с шестикратным количеством безводного
карбоната натрия в никелевом тнгле емкостью 30 мл в пламени горелки
Мекера. Содержимое тигля защищают от продуктов сгорания светильного
газа, держа тигель закрытым и плотно поместив его в отверстие асбесто-
вого картона так, чтобы последний находился несколько ниже верхнего
края тигля. После сплавления тигель охлаждают и переносят его в 40—•
60 мл воды. Кипятят до размельчения плава, после чего фильтруют. Не-
растворимый остаток выбрасывают или применяют для испытания на катионы.
8. Выпаривают 2/з водного экстракта приблизительно до 6 мл и при-
бавляют по 10 капель 6А НС1 до тех пор, пока раствор не покажет кис-
лой реакции по лакмусу. Фильтруют и осадок, если бы он выделился, вы-
брасывают. К фильтрату прибавляют 1 мл НС1 и немного раствора ВаС1г.
Белый осадок BaSOt указывает на присутствие сульфата. Так как све-
тильный газ содержит немного серы, то это служит иногда причиной по-
явления слабой мути. В сомнительных случаях производят слепой опыт
сплавления в никелевом тигле такого же количества карбоната натрия, ио
без исследуемого вещества.
9. В случае образования по п. в сульфата бария последний отфильтро-
вывают и прибавляют к фильтрату еще ВаСЬ, чтобы убедиться в полноте
осаждения сульфат-нона. Затем прибавляют 10 мл 3N раствора CHsCOONa
и 10 мл реактивного раствора СаСЬ. Белый осадок CaFt, образующийся
в течение 15 мин., указывает на присутствие фторида. Для подтверждения
его присутствия проводят реакцию Даниэля (стр. 472).
10. К оставшейся части водного экстракта прибавляют соляную кис-
лоту и выпаривают досуха. Остаток, получившийся в результате выпари-
вания, омачивают соляной кислотой, растворяют в воде и фильтруют.
Образование студенистого осадка H2S1O3 указывает на присутствие сили-
ката. Окончательную идентификацию его проводят как указано на стр. 480.
11. Кремневую кислоту, полученную по п. 10, отфильтровывают и про-
водят реакцию на борат, прибавив к фильтрату 5 мл 12.V НС1, 8 мл
СЛОН и две капли спиртового раствора куркум^, как указано в п. 6.
Появление красного или оранжевого окрашивания указывает на присут-
ствие бората.
518
Анализ неогнеупорных веществ
ТАБЛИЦА XV. ПРИГОТОВЛЕНИЕ РАСТВОРА, ОПРЕДЕЛЕНИЕ ГРУПП
Кипятят 2,5 г порошка с 3N раствором Па2 СО-, фильтруют и промывают
остаток, который исследуют на сульфид по табл. XII. Раствор употреб-
ляют для испытаний, описываемых ниже и в табл. XVI—XX
Прибавляют AgNOz,
КаПО2 и HNO:i. Оса-
док указывает на при-
сутствие членов груп-
пы галондоводород-
ных кислот. Исследу-
ют на S", CN', '
[Fe (CN)6]ZZZZ,
[Fe(CN)6]zzz, SCN', СГ,
Brz, J', СЮ' и C1O3Z no
табл. XVI, XVII и
XVIII
Прибавляют
CHACOOH, BaCl2
и CaCI2. Осадок
указывает на при-
сутствие одного
или нескольких чле-
нов группы суль-
фата. Исследуют
на SO4/Z, SO3",
СгО4", F' и С2О/'
по табл. XIX
Прибавляют
Мп,СЬ> и НС1. Тем-
ное окрашивание
указывает на при-
сутствие окислите-
лей. Если темное
окрашивание не по-
лучается, испыта-
ние на [Fe(CN)6]",z,
СЮ', СЮ/, СгО/',
NO/ и NO./ изли-
шне
Г
Прибавляют НС1,
ЕеС1ъиКъ[Ее(СП)ъ}.
Образование бер-
линской лазурн
указывает на при-
сутствие восстано-
вителей. Непояв-
ление окраски
берлинской лазурн
делает дальней-
шее испытание на
S", [Fe(CN) 6]"zz Jz,
SO3ZZ и NO/
излишним
Ход анализа
Приготовление раствора и определение групп
В закрытой фарфоровой чашке осторожно кипятят 2,5 г вещества,
растертого в тонкий порошок, с 25 мл 3N НагСОз. Фильтруют и промы-
вают остаток горячей водой, после чего исследуют его на присутствие
в нем сульфида по методу, описанному в табл. XII. Водный экстракт раз-
бавляют точно до 30 мл и отдельные порции раствора употребляют дли
исследований по А, Б, В и Г, как описано ниже, и в табл. XVI—XX.
А. К 1 мл содового экстракта прибавляют 5 мл воды, 3 капли 3N рас-
твора NaNOa, не содержащего хлоридов, 1 .мл реактивного раствора
AgNCh и 2 мл 6N HNOs. Если образуется нерастворимый осадок серебря-
ной соли, то проводят исследование по табл. XVI.
Б. Разбавляют 2 мл содового экстракта равным объемом воды, приба-
вляют порциями по 5 капель 6N СНзСООН до кислой реакции, после чего
добавляют еще 5 капель ее. Фильтруют, если необходимо, и прибавляют
1 ил реактивного раствора ВаСЬ и 3 мл такого же раствора CaCh. Нагре-
вают до кипения н дают постоять 10 мин. Если образуется осадок нерас-
творимой бариевой или кальциевой соли, то исследуют другую порцию
содового экстракта по методу, описанному в табл. XIX.
В. К 1 мл содового экстракта прибавляют 4 мл насыщенного раствора
МпСБ в концентрированной НС1 и нагревают почти до кипения. Темнобу-
рое или черное окрашивание раствора за счет образования МпС1з ука-
зывает на возможное присутствие нитрата, хлората, нитрита, гипохлорита,
перманганата, хромата или феррицианида. Непоявление окраски говорит
об отсутствии этих кислот.
Г. К 1 мл содового экстракта прибавляют 3 мл воды, 1 мл 6N НС1,
2 капли реактивного раствора FeCh н 2 капли Ks[Fe(CN)e]. Синее нли зеле-
ное окрашивание раствора (берлинская лазурь) указывает на возможное
Присутствие сульфида, ферроцианида, иодида, сульфита или нитрита. Непо-
явление окраски свидетельствует об отсутствии этих кислот.
В случае положительных результатов испытания по В исследуют 2 мл
содового экстракта на NOs' и NO»' по табл. XX. Во всех случаях иссле-
дуют на борную кислоту 3 мл содового экстракта по табл. XX. Если при
исследовании на катионы был обнаружен мышьяк, то 3 .«л содового
экстракта испытывают на арсенит и арсенат также по табл. XX.
519
ТАБЛИЦА XVI. РАЗДЕЛЕНИЕ ГАЛОИДОВОДОРОДНОЙ ГРУППЫ
НА ПОДГРУППЫ _________’
К 6 мл содового раствора (табл. XV) Прибавляют PbfNOzfa и, если
необходимо, фильтруют (1)
Осадок:
Черный осадок
PbS указывает на
присутствие
сульфида
Фильтрат: Прибавляют СН$СООН и раствор
Ni(NO^ (2)
Осадок:
N;, [Fe (CN)6],
Ni3 [Fe (CN)6]2,
Ni (CN)2.
Исследуют no
табл. XVII
Фильтрат может содержать SCN', J',
Вг', СГ, С1О3'. Прибавляют AgNOz
и HNOZ (3)
Осадок: AgSCN,
AgJ, AgBr, AgCl.
Исследуют no
табл. XVIII
Фильтрат может
содержать CIOs'.
Прибавляют
NaNO^. Белый
осадок AgCl ука-
зывает на присут-
ствие хлората или
гипохлорита (4)
Открытие отдельных компонентов
1. Если AgNOs дает осадок при способе, указанном в табл. XV, то
часто уже цвет осадка указывает на определенные члены этой группы.
Так, AgsS — черного цвета, AgJ — желтого, AgBr — светложелтого,
Ags[Fe(CNe)]— оранжевого, AJCI, Ag-CN, AgSCN .и Ag4 [Fe(CN)e]—белого
цвета. Но белые осадки под влиянием света темнеют. Для систематического
определения отдельных членов галоидоводородной группы поступают сле-
дующим образом.
Прибавляют 5 лл воды и 1 каплю LV раствора Pb(NO»)2 к 6 мл содо-
вого экстракта. Если образуется серый или черный осадок PbS, то это
служит признаком наличия сульфида. Образование белого основного кар-
боната свинца указывает на отсутствие сульфида. Отфильтровывают и
осадок выбрасывают-
2. К фильтрату прибавляют порциями по 10 капель 6N уксусную кис-
лоту до тех пор, пока при перемешивании раствора реакция последнего не
станет кислой, после чего прибавляют еще кислоту в количестве, равном Vs
уже прибавленного. Если образуется осадок, его отфильтровывают и выбра-
сывают. К фильтрату прибавляют 3—-10 мл N раствора Ni(NOs)2, дают
смеси постоять 10 мин., часто взбалтывая. Если образуется осадок
Ni(CN)2, Ni2[Fe(CN)e] или Nis[Fe'(CN)sj2, его отфильтровывают, промывают
водой и исследуют по табл. XV1L В случае студенистого осадка и трудно-
сти его фильтрования прибавляют немного влажного волокна, приготовлен-
ного из фильтровальной бумаги, сильно взбалтывают в течение 1—2 мин.,
затем фильтруют под слабым разрежением.
3. К фильтрату, полученному в п. 2, прибавляют 2 мл 6N HNOs и
некоторое количество раствора AgNOs. Если образуется черный осадок
AgsS, обусловливаемый недостаточным количеством прибавленной ранее
свинцовой соли, то, прибавив еще 5 мл HNOs, слегка кипятят 1—2 мин.
Белый осадок указывает на присутствие хлорида или роданида, а желтый
на присутствие иодида или бромида. Фильтруют и исследуют осадок по
табл. XVIII, а фильтрат, в случае нахождения окисляющих компонентов
при испытании по В табл. XV, исследуют как указано: в п. 4.
4. Прибавляют еще несколько капель раствора AgNOs и от 5 до 20
капель ЗА/ раствора NaNOa, не содержащего хлорида. Белый осадок AgCl
указывает на присутствие хлората или гипохлорита. Так как при кипя-
520
чении с NasCOs гипохлорит превращается в хлорат, то первоначальное
вещество должно быть испытано на хлорат и гипохлорит,
К 0,5 г первоначального вещества прибавляют 10 мл холодной воды,
взбалтывают и фильтруют. К половине фильтрата прибавляют по нескольку
капель 6N СНзСООН до тех пор, пока раствор не приобретет кислой
реакции. Затем прибавляют 3 мл реактивного раствора РЬ(СНзСОО)г, на-
гревают до кипения и дают постоять 5 мин. Бурый осадок PbOs указы-
вает на присутствие гипохлорита1 (стр. 344). Если реакция на гипо-
хлорит дает положительный результат, то прибавляют к другой половине
водного растворе.' еще 20 мл воды, 5 мл HNOs, 5 л л 1А раствора NaAsO»,
не содержащего хлорида, и 5 мл реактивного раствора AgNOs. Арсенит
натрия восстанавливает гипохлорит до хлорида, не действуя на хлорат.
Отфильтровывают хлористое серебро и в фильтрате восстанавливают хло-
рат посредством раствора NaNOs. Снова образующийся белый осадок хло-
ристого серебра показывает теперь присутствие хлората. Получение реакти-
вов, не содержащих хлориде®, настолько трудно, что при этой реак-
ции часто получают муть и в отсутствие хлоратов. Поэтому всегда необ-
ходимо провести реакцию идентификации хлората, пользуясь характерным
отношением последнего к концентрированной серной кислоте (стр. 460).
ТАБЛИЦА XVII. ОТКРЫТИЕ ОТДЕЛЬНЫХ ЦИАНИДОВ
Осадок солей никеля (табл. XVI) обрабатывают на фильтре 3N ИгЦОН.
К полученному таким образом раствору, который может содержать
[Ni(NH3)J(OH)t, (Ш^[Бе(СХ)6;. (NHJ3 [Fe (CN)6] и NH^CN, прибавляют
AgNO3 и Na.BO3 (5)
Осадок:
Ag* [Fe (CN)6J.
Прибавляют HCI
и Fe (NO3)3. Поси-
нение остатка за
счет образования
берлинской лазури
в смеси с белым
AgCl) указывает
на ферроцианид
или феррициа-
нид (6)
Фильтрат: NH4 [Ag (CN)J, Ni (NO.,)., AgNO3 и NH4NO3.
Прибавляют HN03 (7)
Осадок: AgCN.
Прибавляют (NH^St (8)
Осадок: Ag2S. Раствор: NH^CNS.
Выбрасывают Прибавляют Fe(NO3)3. Крас- ное окрашивание подтверждает присутствие цианида (8)
Фильтрат: Ni", Ag'
и NH) в виде
нитратов.
Выбрасывают
5. Находящийся на фильтре осадок нерастворимых никелевых солей,
полученных по табл. XVI, промывают три раза ЗА NHjOH порциями по
10 мл. К аммиачному раствору прибавляют 2—5 мл AgNOs и по нескольку
капель 1/V раствора NasSOs, взбалтывая после каждого прибавления, пока
не исчезнет бурая окраска раствора. Если образуется осадок, его иссле-
дуют по п. 6, а фильтрат — по п. 7.
6. Белый осадок Ag4[Fe(CN)e] указывает на присутствие ферроцианида
или феррицианида в первоначальном веществе. Осадок на фильтре обли-
вают смесью 1 мл QN НС1 и 1 мл 1N раствора Fe(NOs)s. Образование бер-
1 От прибавления РЬ(СНзСОО)а к раствору, содержащему С1'-ионы
в присутствии СЮ', образуется белый осадок хлорида свинца, который при
кипячении превращается в двуокись свинца: PbCh -f- CIO' + Н»О-> PbO« +
+ ЗС1' + 2Н'. ред.
52;
линской лазури подтверждает последнее заключение. Чтобы определить,
находится ли в первоначальном веществе ферроцианид или феррицианид,
разбавляют 1 мл содового раствора (табл. XV) 5 мл воды и прибавляют
1 мл 6N НС1 и 1 мл 1N раствора Ре(МОз)з. Образование берлинской лазури
указывает на присутствие ферроцианида. Фильтруют (если нужно, несколько
раз) и прибавляют 1 мл раствора FeCh. Образование турнбулевой сини
указывает на присутствие феррицианида-
7. К фильтрату от нерастворимого1 Ag4[Fe(CN)e], полученному по п. 5,
прибавляют НМОз до исчезновения запаха NHs и затем еще 5 мл кислоты.
Образование белого осадка указывает на присутствие цианида. Фильтруют,
фильтрат выливают.
8. Несколько раз заливают на фильтр по 5 мл реактивного раствора
(NHijaSs, раствор выпаривают досуха и к остатку прибавляют 2 мл НС1 и 2 мл
раствора Fe<NOs)s. Образование красного роданида железа подтверждает
присутствие цианида (стр. 364).
ТАБЛИЦА XVIII. ОТКРЫТИЕ РОДАНИДА, ИОДИДА,
БРОМИДА И ХЛОРИДА
Осадок серебряных солей, полученный по табл. XVI, п. 3: AgSCN, AgJ,
AgBr, AgCl, обрабатывают растворами NH^OH и S и фильтруют (9)
Осадок: Ag2S. Выбра- сывают Раствор: может содержать SCN', J', Вг', О'. Выпаривают. При- бавляют HN0%, Fe (NOe)g и СС1±. Взбалтывают и дают по- стоять для образования двух слоев. Красная окраска водного слоя указывает на присутствие роданида
СС14-СЛОЙ; Пурпурная окраска указывает на присут- ствие иодида (10) Водный слой: Вг', Cl', Fe(CNS)3 и немного J2. Кипятят для удаления иода, охлаждают, прибавляют КМпО± и СС\ (11)
Пары; J2 ССЦ-слой: Оранжевый цвет указы- вает на присутствие бромида (11) Водный слой: Кипятят для удаления всего Brit прибавляют NaNO^ и AgNOe (12)
Пары: Вг2 Осадок: AgCl указывает на присутствие хлорида (12)
9. Осадок нерастворимой серебряной соли (табл. XVI, п. 3) переносят
в небольшую фарфоровую чашку и обрабатывают его 5 мл концентриро-
ванного NHiOH. Прибавляют по 10 капель (МНДзБ до тех пор, пока при
нагревании смеси почти до кипения дальнейшее прибавление реактива
к жидкости над осевшим осадком не будет давать больше осадка суль-
фида серебра. Фильтруют и осадок выбрасывают.
10. Фильтрат выпаривают до исчезновения запаха аммиака, прибавляют
5 лл воды и фильтруют, если имеется осадок. Раствор переливают в неболь-
шую делительную воронку прибавляют 1 мл 6N HNOj, 3—8 мл IN
раствора Fe(NOs)3 и 1 мл ОСЬ. Сильно взбалтывают смесь и дают ей от-
стояться. Пурпурная окраска нижнего слоя указывает на присутствие
иодида (стр. 364). В случае отсутствия иода сразу переходят к п. 11.
Красный цвет водного слоя указывает на присутствие роданида или боль-
шого количества иодида.
522
Если иодид обнаружен, то выпускают из воронки CCh-слой, приба-
вляют к оставшемуся в воронке водному раствору свежего CCh и взбалты-
вают, после чего снова выпускают нижний слой и повторяют эту опера-
цию до тех пор, пока CCh не перестанет окрашиваться в красный цвет.
Водный раствор переливают в фарфоровую чашку и кипятят 1 мин. Пере-
ливают обратно в делительную воронку, прибавляют 1 мл CCh и взбалты-
вают. Красное окрашивание водного раствора указывает на присутствие
роданида.
И. Прибавляют к смеси в делительной воронке 2 мл 6N HNCh и до
тех пор по 2 капли 0,2V KMnCh, пока водный слой не окрасится в пур-
пурный цвет перманганата. Взбалтывают и дают обоим слоям отстояться.
Желтый или оранжевый цвет CCh-слоя указывает на присутствие бромида.
12. Водный раствор, перелитый в колбу, разбавляют приблизительно
до 40 мл. Если был найден бромид или роданид, то смесь кипятят 5 мин.
и прибавляют еще раствор KMnCh в случае исчезновения пурпурной
окраски. Затем прибавляют 3N раствор NaNOs, не содержащего хлорида, до
тех пор, пока раствор не обесцветится и не растворится могущий образо-
ваться осадок двуокиси марганца. Затем прибавляют немного AgNOa.
Белый осадок хлористого серебра указывает на присутствие хлорида.
ТАБЛИЦА XIX. ОТКРЫТИЕ СУЛЬФАТА, СУЛЬФИТА, ХРОМАТА,
ФТОРИДА И ОКСАЛАТА
К 6 мл содового раствора (табл, XV) прибавляют раствор AgNO$, если
был найден сульфид по п. 1 или роданид по п. 10 и фильтруют. Подки-
сляют НС1, и если необходимо, фильтруют. Прибавляют BaCl-p.
Фильтруют (13)
Осадок: BaSO4
указывает на
присутствие
сульфата (13)
Фильтрат может содержать SO3'7, Cr2O7'7, F',
С2О/< Прибавляют раствор Brt. Фильтруют (14)
Осадок: BaSO4
указывает на
присутствие
сульфита (14)
Фильтрат: может содержать Сг2О7",
F', CiOt". Прибавляют CH^COONa
и СаС1ъ Желтый осадок указывает
иа присутствие хромата и на возмож-
ное присутствие фторида или окса-
лата. Белый осадок указывает на
присутствие фторида илиоксалата(15)
Часть осадка
испытывают на
присутствие фто-
рида по Даниэлю,
стр. 472 (16)
Часть осадка рас-
творяют в HNO^,
прибавляют
КМп(Д и перего-
няют, собирая па-
ры в раствор
Ва (ОН)г. Белый
осадок ВаСО3
указывает на
присутствие
оксалата (17)
13. Если был получен осадок при выполнении реакции по табл- XV,
Б, то к 6 лл первоначального содового раствора (табл. XV) прибавляют,
в случае открытия сульфида по п. 1 или роданида по п. 10, избыток
раствора AgNOs. Бели не удалить эти кислоты, то при добавлении брома
по п. 14 образуется немного сульфата. Фильтруют и подкисляют слегка
фильтрат, прибавляя НС1 порциями по 10 капель. Отфильтровывают от
523
образовавшегося осадка хлористого серебра, который выбрасывают. При-
бавляют еше 1 мл НС1 и 5 мл раствора хлористого бария. Белый осадок
ВаЗОл указывает на присутствие сульфата.
14. Отфильтровывают BaSOi и к фильтрату прибавляют по 1 мл на-
сыщенной бромной воды до тех пор, пока жидкость после взбалтывания
не будет сохранять запах брома. Нагревают почти до кипения. Появление
белого осадка ВабОз указывает на присутствие сульфита. Осадок отфиль-
тровывают.
15. К фильтрату прибавляют 10 мл 3N раствора СНгСООХа и 10 лл
1N раствора Саск. Желтый осадок указывает на присутствие хромата.
Белый осадок может быть обусловлен фторидом или оксалатом. Сильно
взбалтывают и, разделив смесь на две части, фильтруют каждую из них
через отдельный фильтр. Фильтраты выливают, а осадки промывают водой.
16. С одним из осадков поступают, как указано на стр. 472 для откры-
тия фторида.
17. Для открытия оксалата с другим осадком поступают следующим
образом. Заливают на фильтр несколько раз по 5 мл горячей 6W HNO»
и раствор переносят в колбу А (рис. 19). Прибавляют 5 мл 0.2N раствора
КМпОь предварительно подкисленного азотной кислотой, и нагревают до
кипения. Содержимое колбы кипятят 2—3 мин. и собирают дествллат
в 25 мл раствора Ва(ОН)з. Белый осадок ВаСОз указывает на присутствие
оксалата (стр. 417).
ТАБЛИЦА XX. ОТКРЫТИЕ НИТРАТА, НИТРИТА, БОРАТА,
АРСЕНАТА И АРСЕНИТА
Для этих реакций пользуются содовым раствором, полученным
по табл. XV
Если по табл. XV, В, были найдены кислоты - окисли- тели, то кипя- тят 2 мл раство- ра с NaOH и At. Пары испыты- вают на NH3 по- средством Красный осадок HgO • HgNH.J указывает на при- сутствие нитрита или нитрата (18) Если реакция на нитрит или нит- рат получилась положительная, прибавляют CHgCOOH и CS (NH«)2* Выделение N2 и образование по прибавлении FeCl3 красного Fe(CNS)3 указывает на при- сутствие нитрита (19) Прибавляют На.СгНъОН и раствор куркумы. Оранжевый цвет указы- вает иа при- сутствие бората (20) Прибавляют HNOg, NH<OH и Mg(NO^. Фильтруют (21)
Осадок: MgNHjAsOi. Прибавляют раствор AgNO%. Красное окрашива- ние осадка указывает иа присут- ствие арсе- ната (21) Фильтрат: может со- держать AsO2'. Про- пускают H^S. Жел- тый осадок As2S3 указы- вает на присутствие арсенита (21)
18. При положительной реакции с МпСБ (табл. XV, В) производят
испытание на нитрат или нитрит путем образования аммиака при восста-
новлении алюминием в щелочном растворе. Если первоначальное вещество
содержит аммоний, кипятят 2 мл содового" раствора, полученного ио
табл. XV, с 10 мл воды и 3 мл 6N едкого натра до уменьшения объема
жидкости до 1/з. При отсутствии аммониевой соли в первоначальном веще-
стве кипячение излишне, если только содовый раствор не стоял некоторое
время открытым в лаборатории. К холодному щелочному раствору, содер-
жащему NasCOs и NaOH, прибавляют около 0,5 г алюминиевых стружек и
524
слабо нагревают так, чтобы не происходило быстрое выделение водорода.
В выделяющихся парах держат стеклянную палочку, смоченную раство-
ром реактива Несслера. Оранжевый или красный осадок на палочке ука-
зывает на присутствие нитрата или нитрита.
Чтобы определить количество нитрата или нитрита, выделяющиеся
пары проводят в пробирку с 5 мл воды; пробирку для охлаждения поме-
щают в стакан с водой. К десгиллату прибавляют реактив Несслера до тех
пор, пока не прекратится образование осадка, и сравнивают его с тем
количеством осадка, который образуется в растворе хлористого аммония,
содержащем известное количество соли.
19. Если реакция по п. 18 дала положительный результат, берут новую
порцию в 1 мл первоначального содового раствора и постепенно приба-
вляют к нему 1 мл 6N уксусной кислоты (причем, если роданид ил» иодид
были обнаружены, то содовый раствор взбалтывают с 0,5 г твердого
AgsCOa и фильтруют). По прибавлении 1 мл QN уксусной кислоты при-
ливают равный объем раствора тиомочевины. Смеси дают постоять 5 мин.
Образование пузырьков таза указывает на присутствие нитрита. Затем при-
бавляют 1 мл НС1 и 1 д.г раствора Ре(МОз)з. Красное окрашивание под-
тверждает присутствие нитрита. Если красное окрашивание не появляется,
то это служит признаком присутствия нитрата. (В этой схеме анализа не
предусматривается открытие нитрата в присутствии нитрита. Ср. стр. 457).
20. К 3 мл первоначального содового раствора приливают небольшими
порциями точно 8 мл 42М НС1. Затем, прибавив 8 мл этилового спирта,
дают хлористому натрию осесть и декантируют раствор в другую
пробирку. Из капельницы прибавляют точно 2 капли спиртового раствора
куркумы и дают смеси постоять 10 мин. Оранжевое или красное окрашива-
ние раствора указывает на присутствие бората. Сравнивают с окраской,
которую получают с известным количествам борнокислого натрия NaBCh.
Хлорат, нитрат, нитрит и хромат действуют на цвет куркумы, а в при-
сутствии иодида появляется муть, обусловливаемая выделением иода во
время реакции. В случае наличия одного из этих мешающих реакции ве-
ществ выпаривают 3 мл содового раствора досуха, осторожно прибавляют
2 мл V2N НС1 и снова выпаривают досуха. К остатку прибавляют 1 мл
3N NaaCOs и 2 мл воды, нагревают до кипения и, если нужно, фильтруют,
после чего выполняют вышеописанную реакцию на борат. Во время такой
обработки вещества часть борной кислоты теряется вследствие улетучива-
ния.
21. Если при испытании на катионы обнаруживается мышьяк, то 5 мл
содового раствора разбавляют двукратным количеством воды и прибавляют
по 1 мл HNOs до кислой реакции раствора. Затем прибавляют по нескольку
капель 6N NFEOH до появления после перемешивания щелочной реакции
по лакмусу. Следует избегать избытка аммиака. Если необходимо, филь-
труют и прибавляют 10 мл реактивного раствора Mg(NOs)». Смеси дают
постоять 10 мин. при частом взбалтывании ее. Фильтруют и промывают
осадок нормальным NH»OH. Белый осадок MgNHiAsOt или MgNHtPOt
указывает на присутствие арсената или фосфата. Фильтрат испытывают
сернистым водородом, чтобы убедиться, не содержит ли он трехвалентного
мышьяка. Немедленное появление желтого AsvSa указывает на присутствие
мышьяковистой кислоты.
Фильтр с нерастворимой магниевой солью обливают 1 лл раствора
AgNOs, к которому было прибавлено несколько капель уксусной кислоты.
Окрашивание осадка в темнокрасный цвет служит признаком мышьяковой
кислоты. Если осадок окрашивается в желтый цвет и появляется сомнение
в наличии арсената, то пропускают через фильтр несколько раз по> 5 мл
6N НС1 и прибавляют 1 мл раствора KJ и 1 лл ССЕ. Взбалтывают, и если
четыреххлористый углерод окрашивается в пурпурный цвет, то заключают
о присутствии арсената (стр. 172).
Если при реакции образования AssSs цвет полученного осадка воз-
буждает сомнение, то осадок исследуют на мышьяк по табл. IV, стр- 2С6.
Открытие карбоната и сульфида в первоначальном веществе
Испытание производят согласно табл. XII, п. 3.
525
ТАБЛИЦА XXI
Водный раствор сплава, обработанного азотной кислотой, прозрачен. Сплав не содержит ни олова, ни сурьмы.
Раствор по прибавлении 2 мл концентрированной H2SOi выпаривают до обильного выделения тяжелых белых
паров серной кислоты, после чего дают охладиться, разбавляют приблизительно 50 мл воды и фильтруют
Остаток: PbSO4. Промы- вают водой, растворяют в CH3COONH3 Раствор: Может содержать; Bi, Cu, Cd, Fe, Al, Мп, Ni, Со, Zn, Н3РО4. Насыщают сероводородом и фильтруют
и прибавляют K2CrOi. Желтый осадок РЬСгО4 указы- вает на присут- ствие РЬ Осадок: Растворяют в горячей разбавленной HNOs, отфильтровывают выделив- шуюся S, прибавляют избыток NH% и фильтруют Раствор: FeSO4, Al, (SO4)3, MnSO4, NiSO4, CoS04, ZnSO4, H3PO4 Нагревают до кипения для удаления H2S, окисляют Fe" несколькими каплями конц. HNO3, прибавляют 10 мл раствора NHiCl и осаждают при температуре кипения, приливая по каплям NH3 до появления неисчезающего запаха последнего и быстро фильтруют
I 1 Раствор: МпС12, [Co(NH3)G] Cl2, [Ni (NH3)BJ Cl2. [Zn(NH3)G]Cl2. Насыщают H2S и фильтруют. Фильтрат от- брасывают !. Осадок, состоящий из сульфидов Мп, Со, Ni и Zn, обрабатывают холодной раз- бавленной НС! и фильтруют
Осадок: Bi (OH)S белый. Растворяют в малом коли- честве НС1 и приливают ще- Раствор: [Cu (NH3)4] so4 [Cd (NH3)6] SO4. Синяя окраска раствора указы- вает на присут- ствие Си. Осадок: Fe(OH)3, А1(ОН)3, (Al, Fe) РО4. Растворяют в ма- лом количестве HN03, и несколько капель раствора Остаток:Рас творяют в Н С1 и ксю3 и выпарива- ют досуха. Прибав- ляют Раствор: МпС12, ZnCl2 Кипятят для удаления H2S, осаждают избытком КОН и фильтруют
«а-.-™-. Улочнбй раствор SnCl2. К раствору при- бавляют KCN до обесцвечивания и затем (NH^S. Желтый осадок CdS указывает на присутствие Cd пробуют на Fe по- средством раствора KdP^CNhl. Образование бер- линской лазури указывает на при- сутствие Fe. Другую пробу раствора иссле- дуют на фосфор- ную кислоту по- средством молиб- деновокислого аммония. Желтый кристалли- ческий осадок ука- зывает на присут- ствие Р. СНзСОН и KNO2. Желтыйоса-
Черный осадок указывает на при- сутствие Bi док указы- вает на при- сутствие Со. Фильтру- ют, приба- вляют ди- метилгли- оксим. Крас- ный осадок указывает на присут- ствие Ni Осадок: Мп (ОН)2, Небольшую про- бу осадка сплавляют с со- дой и селитрой на платиновой пластинке. Плав зеленого цвета указывает на присутствие Мп Раствор: KHZnO2. Подкисляют уксусной кисло- той и пропу- скают H2S. Белый осадок ук юывает на при- сутствие Zn
Основную массу раствора осаж- дают избытком КОН и фильтруют. Фильтрат, содер- жащий А1 в виде КА!О2, подкисляют НС1 и прибавляют NH3.
Белый студенистый осадок указывает на присутствие А1
При отсутствии в сплаве железа и алюминия фильтрат исследуют на фосфорную кислоту. Для этой цели его выпари-
ьэ вают до небольшого объема, отфильтровывают, если нужно, от выделившейся серы и пробуют на фосфорную кислоту
молибденовокислым аммонием. В случае содержания в сплаве магния последний открывают в этом фильтрате па стр. 301,
Б. АНАЛИЗ МЕТАЛЛОВ И СПЛАВОВ
Исследование металлического сплава значительно проще, чем исследо-
вание смеси солей, потому что в первом случае -нет необходимости прово-
дить открытие кислот. Из электроотрицательных элементов обращается
внимание при анализе сплавов большей частью только на углерод, крем-
ний, фосфор и серу-
Так как все металлы, за исключением золота, платины, олова и сурьмы,
растворяются в азотной кислоте, то сплавы почти всегда переводятся
в раствор азотной кислотой, и только в немногих случаях необходимо- при-
менение царской водки. Некоторые богатые кремнием сплавы (например,
кремнистая медь) чрезвычайно трудно растворимы или совсем не раство-
римы даже -в царской водке. Такие сплавы лучше всего разлагать путем
сплавления с едким кали в серебряном тигле; плав затем обрабатывают
азотной кислотой.
Соляная кислота для растворения сплавов не рекомендуется, потому
что часто находящиеся в них в небольших количествах фосфористые, угле-
родистые, кремнистые, сернистые и мышьяковистые металлы разлагаются
кислотами, причем отрицательные элементы могут улетучиваться в виде
летучих водородистых соединений и таким образом- ускользать от наблю-
дения. Для исследования обычно встречающихся сплавов -поступают сле-
дующим образом. 1—2 г сплава (лучше1 всего в виде стружек) обливают
в фарфоровой чашке емкостью 200 мл под хорошим вытяжным шкафом
приблизительно 20 мл азотной кислоты плотностью 1,25—1,30 (1 объем
концентрированной HNCh + 1 объем НЮ). По окончании реакции, вначале
протекающей бурно, нагревают до тех пор, пока не исчезнут бурые пары,
после чего осторожно выпаривают при помешивании, избегая пере-
гревания *. Выпаривание производят почти досуха, приливают около 50 мл
воды и нагревают.
а) Масса вполне растворяется. Сплав не содержит ни олова, ни сурьмы;
дальнейшее исследование производится по табл. XXI (стр. 526).
б) Масса не вполне растворяется. Остается белый или зеленоватый
остаток. Сплав содержит олово или сурьму или оба металла вместе; даль-
нейшее исследование производят по табл. XXII (стр. 529).
В. АНАЛИЗ РАСТВОРЕННОГО ВЕЩЕСТВА
Уже на основании окраски, запаха и реакции на лакмусовую бумагу
можно вывести весьма важные заключения.
а) Раствор показывает нейтральную реакцию-, он не содержит ни сво-
бодных кислот, ни щелочей, ни кислых солей или таких солей, которые
вследствие гидролиза показывают щелочную или кислую реакцию. Если
раствор не содержит осадка, то в исследуемом веществе нерастворимых
в воде солей нет.
Прежде всего необходимо убедиться, находятся ли в исследуемом
растворе твердые составные части, для чего .небольшое количество его вы-
паривают досуха при возможно низкой температуре, чтобы не потерять
летучих соединений, могущих быть в растворе. В случае получения при
этом остатка последний -исследуется как указано в разделе А, стр. 487.
б) Раствор показывает щелочную реакцию. Щелочная реакция может
быть обусловлена наличием1 гидроокисей щелочных и щелочноземельных
металлов, перекисей, карбонатов, боратов, цианидов, силикатов, сульфидов
(цинкатов, алюминатов, молибдатов, вольфраматов) щелочных металлов, а
также аммиака и щелочных гипохлоритов.
Если в растворе находятся, например, гидраты окисей или -карбонаты
щелочей, то в нем -отсутствуют все те вещества, которые осаждаются
ими, за исключением веществ, находящихся в растворе в виде комплекс-
ных ионов (цианистые соединения, виннокислые соли и тому подобные
соединения).
1 В противном случае образуются не растворимые в воде основные
соли. В случае образования последних, что часто узнается по темной
окраске остатка, прибавляют концентрированную азотную кислоту, нагре-
вают и затем уже обрабатывают водой.
528
ТАБЛИЦА ХХЧ
Сплав, обработанный азотной кислотой, не вполне растворяется о воде.
Сплав содержит олово или сурьму или оба металла вместе.1
Фильтруют
Остаток: SnO2, Sb2O3, Sb2O6, Р2О5, As2O6, Bi2O3 вместе
co следами Cu, Pb, Fe и т. п.
Промывают НК), прибавляют КОН до щелочной реак-
ции и затем 5—10 мл бесцветного концентрирован-
ного раствора КК>, нагревают продолжительное время
на водяной бане и фильтруют
Раствор:
Этот раствор
подлежит даль-
нейшему иссле-
дованию по
табл, XXI
Остаток:
Bi2S3, PbS, CuS
и т. д. Раство-
ряют в HNO3,
отфильтровы-
вают от выде-
лившейся серы и
приливают
фильтрат к ис-
ходному раство-
ру сплава в
азотной кислоте
Раствор: K2SnS3, K3SbS3, KaAsSj, К3РО4. Разбавляют водой, подкисляют раз- бавленной НС1 и фильтруют
Осадок: SnS2, Sb2S3 или Sb2Sb, As2S5. Растворяют в конц. НС1, кипятят, раз- бавляют малым ко- личеством Н-,0, фильтруют для от- деления от серы и фильтрат иссле- дуют по табл. IV (стр. 206) на Sn и Sb Раствор: КН2РО4, КС1. Выпаривают до небольшого объе- ма, добавляют избыток NH3 и сернокислого магния. Белый кристалли- ческий осадок ука- зывает на присут- ствие Н3РО1; сле- довательно на Р-
1 Некоторые сплавы, содержащие кремний (некоторые сорта железа), вы-
деляют при обработке HNO3 кремневую кислоту, количество которой в таких
случаях большей частью ничтожно. Открытие кремневой кислоты произ-
водится, как указано в главе о кремневой кислоте.
2 Для подтверждения осадок растворяют в HNO3 и пробуют раствором
молибд-та аммония.
Прежде всего раствор следует исследовать на присутствие перекисей,
гидратов окисей и карбонатов щелочей, а также сульфидов щелочных
металлов.
Чтобы констатировать присутствие перекиси (НгОа) *, часть раствора
нагревают с несколькими каплями раствора азотнокислого кобальта: чер-
ный осадок указывает на присутствие Н2О22; или прибавляют к раствору,
1 См. стр. 493.
2 В присутствии хлорноватистокислых солей или сульфидов азотнокис-
лый кобальт также дает черный осадок; вышеприведенная реакция на Н2О2
имеет силу только в отсутствие гипохлоритов и сульфидов. Если послед-
ние вещества имеются в растворе, то в нем не может быть Н2О2, так как
гипохлориты восстановились бы перекисью водорода в хлориды, а суль-
фиды окислились бы в сульфаты.
Присутствие гипохлоритов узнается большей частью по запаху; при
подкислении раствора разбавленной серной кислотой появляется хлорный
запах. Сульфиды при подкислении выделяют сероводород- Гипохлориты в
сульфиды не могут быть в растворе одновременно.
34 Зак. 982. Тредвелл-Голл, т, I. 529
сильно подкисленному на холоду серной кислотой, сернокислый титан:
в присутствии Н2О2 появляется желтое -окрашивание жидкости *.
Еще чувствительнее реакция с разбавленным раствором FeCls и
Кз[Ее(СМ)в]1 2. Малейшие следы НгОг окрашивают красный раствор в зеле-
ный цвет, и спустя яекоторое время выделяется берлинская лазурь.
Чтобы в присутствии Н2О2 обнаружить гидраты окисей и карбонаты
щелочей, кипятят в течение продолжительного времени новую пробу рас-
твора в фарфоровой чашке для разложения Н2О2 и к раствору прили-
вают до тех пор BaCls, пока не прекратится образование осадка. Если
жидкость, находящаяся над осадком, показывает щелочную реакцию, то
заключают о присутствии гидратов окисей щелочей3. Если при растворе-
нии образовавшегося от -ВаС1г осадка в кислотах происходит выделение
газа с шипением и от этого газа мутнеет баритовая вода, то присутствуют
карбонаты. Наконец, если раствор имеет аммиачный запах, небольшую
пробу его выпаривают досуха, чтобы убедиться, нет ли других каких-
либо соединений, и исследуют остаток, как указано в разделе А, стр. 487.
в) Раствор показывает кислую реакцию; он может содержать все рас-
творимые в воде и кислотах вещества, а также свободные кислоты. Не-
большое количество его выпаривают досуха, чтобы узнать, находятся ли
в нем -вообще нелетучие соединения. Если осадок -не получается, раствор
нейтрализуют содой и пробуют на кислоты. Если осадок получается, его
исследуют, как указано в разделе А, стр. 487.
Г. АНАЛИЗ ГАЗОВ
Этот случай рассматривается во II томе при газовом анализе.
Д. ДОПОЛНЕНИЕ. КАЧЕСТВЕННЫЙ ПОЛУМИКРОАНАЛИЗ
В современном развитии химического анализа все более и более прояв-
ляется стремление к выработке методов открытия и идентификации возможно
малых количеств вещества, что имеет весьма большое значение -во всех тех
случаях, когда в распоряжении исследователя находятся очень малые количе-
ства анализируемого объекта, В результате такого направления аналитической
химии появились многочисленные микрохимические реакции (большое число
которых было описано ® -настоящем руководстве), дающие возможность про-
водить работу с долями миллиграмма исследуемого вещества. Большин-
ство этих микрохимических реакций требует применения довольно слож-
ных органических реактивов (о которых студент имеет слабое представление),
и это обстоятельство является основным возражением против существующей
в настоящее время тенденции заменить систематическое изучение макро-
анализа полумикроанализом. Признавая всю ценность микрохимических
реакций, мы тем не менее не можем рекомендовать начинающему огра-
ничиться только ими, так как при таком подходе студент взамен углуб-
1 Открытие НаОг легко производится также хромовой кислотой, хотя
меиее надежно, чем с сернокислым титаном. Для этого поступают следую-
щим образом. Сначала раствор осторожно подкисляют на холоду разба-
вленной H2SO1, приливают эфир, свободный от спирта, взбалтывают и
приливают несколько капель двухромовокислого калия и снова взбалты-
вают. Синяя окраска эфирного слоя служит признаком присутствия Н2О2.
2 S с h 6 п е, В. 7, 1695 (1874).
’ Или из первоначального раствора, или образовавшихся путем гидро-
лиза перекисей.
Автор уже много лет успешно применяет этот метод определения
ОН'-исщо-в наряду с карбонатами. Из -всех известных методов настоящий
является наиболее точным. Необходимо только следить за тем, чтобы был
большой избыток ВаС)г, так как в противном случае может появиться
щелочная реакция (красное окрашивание фенолфталеина), обусловливаемая
BaCOs, который несколько растворим в воде, ио не растворим в растворе,
содержащем ВаС1г.
530
данного анализа закономерностей химического процесса, должен ограни-
читься одной лишь рецептурой, мало дающей в отношении химического
развитий. Поэтому на микрохимические реакции мы смотрим^ как на под-
собное средство, сознательное применение которого возможно только на
основе систематического изучения макроанализа.
В качественном полумикроанализе обыкновенно пользуются меньшими
навесками и объемами растворов, чем в макроанализе. Для открытия всех
катионов достаточно около 20 мг исследуемого ‘вещества, а для анализа
раствора около 5 мл последнего, потому что реакции могут быть выпол-
нены с несколькими каплями исследуемого раствора и несколькими каплями
реактива. Фильтрование обыкновенно заменяют центрофугированием в руч-
ной центрофуге. Раствор вместе с осадком помещают в З-миллИлитровую
центрофужную пробирку и после центрофугирования удаляют жидкость
(центрофугат) с осадка посредством капиллярной пипетки. Чтобы промыть
оставшийся осадок, приливают немного промывной жидкости, перемеши-
вают осадок посредством платиновой проволоки, снова подвергают цеитро-
фугированию и удаляют жидкость с осадка, как выше указано. Для филь-
трования вполне достаточным является фильтр диаметром 25 мм (в верхней
части); для отсасывания жидкости можно пользоваться толстостенной
склянкой емкостью не более 25 .ил. Пробирки и тигли берут емкостью
приблизительно 5 кл; для нагревания пользуются микрогорелкой.
Нижеследующий систематический ход анализа1 выполняется приблизи-
тельно тем же путем, какой был описан для макроанализа, за исключением
некоторых деталей в манипуляциях.
Большая часть реакций, описаиных >на стр.‘ 487—494, требует очень
мало материала. Реакции иа угле и с перлами могут быть опущены, если
работающий не приобрел еще достаточного опыта в работе с паяльной
трубкой. Реакции в тугоплавкой пробирке и реакции с концентрированной
серной кислотой должны всегда выполняться; для последних реакций сле-
дует применять пробирки емкостью 2 лл или тигельки емкостью 5 .ил.
Реакция на №)«'. К 2 мг исследуемого продукта или к остатку, полу-
ченному при выпаривании досуха нескольких капель раствора, прибавляют
несколько капель 3N NaOH, осторожно нагревают и испытывают выделяю-
щиеся пары влажной красной лакмусовой бумажкой, п-ричем отмечают
также, не появляется ли ощутимый запах (стр. 321).
Проба на растворимость. К очень небольшой порции исследуемого
продукта в 5-миллилитровой пробирке (или в еще меньшей) прибавляют
несколько капель воды и нагревают на маленьком пламени. Если вещество
заметно растворяется, испытывают раствор лакмусом. Если вода не рас-
творяет вещества, исследуют действие на него HCI, HNOs- царской водки
и пр. Ход исследования аналогичен описанному на стр. 494—503 с rijjl
лишь разницей, что эти опыты производятся в очень маленьких пробирках
и только с несколькими миллиграммами вещества.
Систематический анализ катионов
При систематическом ходе анализа придерживаются того же плана,
который приведен в табл. VIII на. стр. 508. Для анализа берется навеска
приблизительно в 20—50 мг и ее обрабатывают, как указано при предва-
1 См. G. G u t z е i t, Helv, Chim. Acta 12, 829 (1929). Heller u. Krumholz,
Mikrochemie 7, 213 (1929), K. Heller, Mikrochemie 8, 33 (1930), C. J. van
Nieuwenburg, Mikrochemie 3, 199 (1931), van Niewenburg
u, Dulfar, Qualitative Analysis by Drop Tests, изд. 2 (1935), En geld er,
Dunkelberger a. Schiller, Semi-micro Qualitative Analysis (1935),
В e n e d e 11 i-P i c h 1 e r a. Spikes, Introduction to Microtechnique of
Qualitative Analysis (1935), E m i c h-S c h n e i d e r, Microchemical Laboratory
Manual (1935), Winkley, Janowski a. Hynes, Mikrochemie 21,
102 (1936), Беренс-Клей, Микрохимический анализ, Госиздат, М. 1928,
Эм их, Микрохимический анализ. Госхимтехиздат, Л. 1932, Файгль, Ка-
пельный анализ, ОНТИ, М. 1937.
34»
531
рительиых испытаниях растворимости, растворителем, взятым приблизи-
тельно в количестве 2 мл. Если для растворения или разложения образца
применяется НС1, то Ag, одновалентная Hg и, возможно, РЬ будут оса-
ждены в виде хлоридов при разбавлении полученного раствора. Получен-
ный таким путем осадок должен быть исследован на присутствие Ag, Hg,
Pb или других нерастворимых веществ (стр. 503—505).
Группа I
Осаждение. 1 мл водного или слабо подкисленного азотной кислотой
раствора помещают в 3-миллилитровую центрофужную пробирку, при-
бавляют каплю (или, если необходимо, больше) концентрированной НС1
и перемешивают платиновой проволокой. Вынув проволоку, концом ее
прикасаются к кусочку синей лакмусовой бумаги, чтобы убедиться, что
раствор имеет кислую реакцию. Муть, исчезающая от прибавления не-
сколько большего количества кислоты, указывает на присутствие Bi, Sb
или Sn; нужно, однако, помнить, что AgCl растворяется в избытке кон-
центрированной НС1 и осаждается при разбавлении. Если осадок не обра-
зуется, переходят к группе II.
Если образуется осадок нерастворимых хлоридов, раствор нагревают
до кипения, пробирку помещают в центрофугу, уравновешивают другой
подобной же пробиркой и центрофугируют для осаждения осадка на дно
пробирки. Центрофугат сливают или отсасывают посредством капиллярной
пипетки. К осадку в пробирке приливают 2 мл горячей воды, снова центро-
фугируют и полученный теперь центрофугат (могущий содержать PbCh)
прибавляют к первому. Эту обработку горячей водой повторяют по мень-
шей мере еще один раз; после двукратной обработки горячей водой сле-
дующие центрофугаты выливают. Первый центрофугат пробуют на пол-
ноту осаждения, прибавив к нему каплю соляной кислоты. Если при этом
образуется осадок, подвергают последний только что описанной обработке.
На образование кристаллического осадка РЬС1г, могущего выпасть при
охлаждении раствора, не обращают внимания; такой осадок легко отли-
чить от творожистого осадка AgCl и HgaCh (стр. 134).
Открытие Ag и Hg. К осадку в центрофужной пробирке прибавляют
5 капель 5%-ного раствора KCN, слегка нагревают на микрогорелке и
центрофугируют. Полученный раствор будет содержать Ag(CN)a' или
Hg(CN)a', если в исследуемом продукте находятся Ag илн одновалентная Hg.
На фильтровальную бумагу (для этих целей пригодна только специальная
фильтровальная бумага, так называемая, капельная) помещают каплю полу-
ченного раствора, прибавляют каплю 2N HNOs и затем каплю насыщен-
ного раствора р-диметиламинобензилиденроданина в ацетоне (см. стр. 121).
При наличии серебра образуется красное пятно". Ионы ртути дают ука-
занную реакцию в отсутствие цианидов.
К другой капле раствора на капельной бумаге прибавляют каплю све-
жеприготовленного раствора SnCU и каплю прозрачного свежеперегнан-
вого анилина. Появление черного, бурого или серого пятна (обусло-
вленного тонко раздробленной Hg) указывает на присутствие в иссле-
дуемом продукте Hg2’
Группа II
Осаждение. Центрофугат от группы I или первоначальный раствор,
если он не дал осадка AgCl или HgsCls, выпаривают, в случае надобности,
приблизительно до 1 мл, прибавляют 1 мл концентрированной НС1 и, на-
грев до кипения, насыщают под давлением сероводородом в течение
5 мин. Уменьшают кислотность приблизительно до 0.3N прибавлением
посредством капиллярной пипетки концентрированного аммиака, снова на-
гревают до кипения и пропускают НгЗ еще 3 мин. Центрофугируют, от-
деляют центрофугат, а осадок промывают 3 мл горячей воды. Снова
центрофугируют и полученный второй центрофугат прибавляют к первому.
Для уверенности в полноте осаждения группы II центрофугат снова насы-
1 В зависимости от количества серебра образуется красно-фиолетовый
осадок, либо пятно, либо только красно-фиолетовая окраска. Ред.
532
щают HaS. Если осаждение оказалось неполным, центрофугат е суспен-
дированным новым осадком переносят в центрофужную пробирку с перво-
начальным сульфидным осадком и опять подвергают центрофугированию.
Осадок промывают горячим 1.%-ным раствором NH4CI, а затем 1%-ным
NHiNOs до тех пор, пока раствор не станет слабокислым. Первые две
промывные жидкости приливают к центрофугату, содержащему Ш, IV и
V группы (стр. 202).
Разделение подгрупп. К осадку прибавляют 5—10 капель реактивного
раствора Na2S (стр. 106)> перемешивают платиновой проволокой и нагре-
вают не меньше 1 мин. Центрофугируют и переливают центрофугат в дру-
гую центрофужную пробирку. В центрофугате будут находиться AsS/'',
SbSi"', SnSs" и HgSa", если эти элементы находились в исследуемом об-
разце, осадок же может содержать PbS, ЕИаЗз, CuS и CdS (стр. 202).
К осадку прибавляют еще 3 капли раствора NaaS, немного воды, пере-
мешивают, нагревают и снова центрофугируют. Эту операцию повторяют
до тех пор, пока не будут полностью извлечены Hg, As, Sb и Sn. Каждый
центрофугат исследуют, прибавляя к капле его на предметном стекле не-
большой избыток НС1 и сравнивая с аналогично обработанной НС1 каплей
реактива. При наличии As, Sb, Sn или Hg получаются осадки HgS, AsaSs,
SbaSs или SnSa (стр. 202).
Анализ группы меди. Нерастворившиеся сульфиды промывают неболь-
шими порциями горячей воды, каждый раз центрофугируя, и повторяют
операцию до тех пор, пока промывные воды не будут показывать лишь
слабую щелочную реакцию по лакмусу. К промытому осадку прибавляют
5 капель 3N HNOs и осторожно нагревают в течение 1 мин..Центрофуги-
руют и раствор переносят в маленький тигелек. Так>ю обработку неболь-
шими порциями HNOs повторяют до полного перехода в раствор Pb, Bi,
Си и Cd. Остаток обыкновенно состоит из серы, обволакивающей неболь-
шое количество неразложившихся сульфидов. Иногда он содержит HgS.
Его можно испытать на присутствие Hg, растворив в НС1 и КСЮз и про-
водя с раствором реакцию с SnCK, как описано при исследовании As—
Sn-подгруппы.
К раствору в тигле прибавляют 3 капли концентрированной H2SO4 и
осторожно выпаривают до появления густых паров H2SO4. Охлаждают и
посредством пипетки переносят содержимое тигля в центрофужную про-
бирку с 3—5 каплями холодной воды. Центрофугируют и пробуют центро-
фугат на содержание в нем Bi, Си и Cd.
Открытие РЬ. Оставшийся в центрофужной пробирке РЬЗО< промы-
вают два раза, применяя для этого по 2 мл воды, после каждого промы-
вания центрофугируют, прибавляя центрофугат к главному раствору.
К промытому остатку прибавляют 3 капли 3N раствора CH3COONH4 и на-
гревают для растворения РЬ5О<. К полученному раствору прибавляют
каплю раствора К»СгО4. Образование желтого осадка указывает на при-
сутствие РЬ (стр. 135).
Открытие Bi. К раствору, полученному после отделения РЬЗО4, при-
бавляют пипеткой концентрированный NH4OH до щелочной реакции. При
этом выпадает Bi(OH)3, а Си и Cd остаются в растворе в виде аммиач-
ных комплексов. Если образуется осадок гидроокиси висмута, его отделяют
и промывают путем центрофугирования. С осадком проводят реакцию на
Bi посредством NaHSnO» (стр. 145). Рекомендуется небольшое количество
осадка Bi(OH)s перенести на кусочек фильтровальной бумаги и смочить
бумагу каплей свежеприготовленного раствора NaHSnOs.
Открытие Си. Если раствор окрашен в синий цвет, нет необходимости
в другой какой-либо реакции на медь. В сомнительных случаях помещают
каплю раствора на белую капельную пластинку, подкисляют СНзСООН и
прибавляют каплю реактивного раствора K4[Fe(CN)sJ. Красный осадок
Сиг[Ре(СЦ)о] подтверждает присутствие Си (стр. 203).
Открытие Cd. Если констатировано присутствие Си, прибавляют по
каплям до полного обесцвечивания синего раствора 1N раствор KCN и на-
сыщают H2S. Образование желтого осадка CdS указывает на присутствие
Cd. В случае отсутствия Си аммиачный раствор остается только слегка
подкислить серной кислотой и пропустить через него сероводород.
533
Анализ группы олова. Центрофугат, полученный после обработки сер-
нистым натрием, точно нейтрализуют 3N соляной кислотой для осаждения
сульфидов Hg, As, Sb и Sn, ^центрофугируют и центрофугат выливают.
К осадку прибавляют около 5 капель концентрированной соляной кислоты
и кипятят для растворения SbaSs и SnSs. Разбавляют 5 каплями воды,
Цеитрофугируют и переносят центрофугат в маленькую пробирку. Осадок
несколько раз промывают горячей водой, употребляя для этого по 1 мл
последней. Первую промывную воду прибавляют к раствору SbCls и SnCB,
остальные же выливают. К промытому осадку в центрофужной пробирке
прибавляют 3—6 капель 6N аммиака, перемешивают, нагревают и перено-
сят жидкость, находящуюся над осадком, в другую центрофужную про-
бирку. Осадок тщательно промывают аммиаком порциями в 6 капель и
каждую промывную жидкость прибавляют к аммиачному раствору, могу-
щему содержать AsO?" и AsSC". Каждую слитую промывную жидкость
исследуют, не будет ли выделять капля ее после подкисления желтый оса-
док AsaSs.
Извлечение аммиачной водой продолжают до тех пор. пока не полу-
чится центрофугат, не дающий уже после подкисления желтого осадка.
Открытие Hg. Если после обработки аммиаком остается черный оса-
док, то можно заключить о наличии в нем сернистой ртути. Осадок рас-
творяют в 'небольшом количестве концентрированной НС1 с добавлением
кристаллика KCIOs* 1, раствор переносят в маленький тигель и исследуют
на ртуть, как выше указано при анализе подгруппы меди.
Открытие As. К части аммиачного раствора прибавляют соляную кис-
лоту до кислой реакции. Появляющийся при этом желтый осадок указы-
вает на присутствие As (стр. 165). К остатку аммиачного раствора в ма-
ленькой пробирке прибавляют немного цинка и несколько капель 6N сер-
ной кислоты. Необходимо испытать каплю раствора на лакмус, чтобы быть
уверенным в том, что прибавлен избыток кислоты; в пробирку вставляют
кусочек ваты, смоченный раствором (СНзСОО)гРЬ, а верх пробирки накры-
вают кусочком бумаги, смоченной 50%-ным раствором нитрата серебра
(стр. 177). Присутствие мышьяка обнаруживается по образованию желтого
или серого пятна AsAgs • 3AgNOs.
Открытие Sb. К 1—2 каплям раствора хлористой сурьмы и хлорного
олова иа капельной пластинке прибавляют несколько кристалликов нитрита
натрия2 и 1—2 капли концентрированной соляной кислоты. Когда прекра-
тится шипение, прибавляют каплю 0,01%-ного водного раствора красителя
родамина В (см. стр. 187). Если при этом яркокрасный флуоресцирующий
раствор красителя приобретет фиолетовый оттенок, то это служит при-
знаком наличия сурьмы. Другую каплю раствора помещают на предметное
стекло, напревают почты до кипения и прибавляют кристалл тиосульфата
натрия; в присутствии сурьмы появляется на поверхности кристалла крас-
ное окра ши ванне, обусловленное образованием «сурьмяной киновари»
Sb»SiO (стр. 184).
Открытие Sn. Приготовляют немного фосфорномолибденовой кислоты,
действуя на раствор фосфата щелочного металла азотной кислотой и избыт-
ком реактивного раствора (стр. 104) молибдата аммония. Некоторое коли-
чество полученного желтого осадка растворяют в горячей царской водке,
раствор выпаривают досуха, остаток растворяют в воде и очищают
фосфорномолибденовую кислоту перекристаллизацией из воды. Кусочек
фильтровальной бумаги пропитывают водным раствором фосфорно.молибде-
иовой кислоты и держат его над парами аммиака. Восстанавливают соля-
нокислый центрофугат, содержащий треххлористую сурьму и четыреххлори-
стое олово, посредством кусочка магниевой ленты. Отфильтровывают и
помещают каплю восстановленного раствора на бумагу, пропитанную
* Вместо KCIOs можно прибавить 1—2 капли перекиси водорода. Ред.
1 Для окисления трехвалентной сурьмы в пятивалентную, так как рода-
мин В реагирует только с последней. Ред.
534
фосфорномолибденовой кислотой; в присутствии двуххлорйстого олова
тотчас образуется темносинее пятно. Эта реакция удается даже с 0,03 д
Sn. Sb реагирует аналогично, если бумагу подержать над парами воды,
ио вышеуказанное восстановление магнием (или цинком) превращает
четыреххлористое олово в двуххлористое (что для реакции необходимо) и
осаждает металлическую сурьму, не мешающую реакции.
Группа Ш
Если в центрофугате, полученном при отделении группы II, находятся
фосфорная, щавелевая или фтористоводородная кислоты, то анализ осло-
жняется (стр. 279), так как щелочные земли и магний могут выпасть
вместе с группой III. Присутствие хрома также создает затруднения
(стр. 220). Приведем метод анализа в отсутствие фосфата, исходя из пред-
положения, что железо, алюминий и хром могут быть отделены от никеля,
кобальта, марганца и цинка посредством аммиака. Затем будет показан
ход анализа в присутствии вышеуказанных мешающих веществ.
Анализ в отсутствие оксалатов, тартратов, фторидов и фосфатов
Раствор, из которого была удалена посредством сероводорода группа II,
помещают в 5-миллнлитровую центрофужную пробирку, прибавляют 5 ка-
пель бромной воды для окисления двухвалентного железа и кипятят для
удаления избытка брома. Прибавив затем 5' капель 10%-ного раствора
NH4Q, чтобы воспрепятствовать осаждению Mg(OH)a, доводят раствор до
ясно щелочной реакции концентрированным аммиаком. Перемешивают пла-
тиновой проволокой и центрофугируют. Центрофугат переносят в другую
центрофужную пробирку, промывают осадок два раза 1 мл 6N аммиака,
присоединяя промывные воды к главному центрофугату, могущему
содержать (помимо щелочных и щелочноземельных металлов): NifNHsjr ’,
Со(МНз)4‘ ’, Zn(NHs)4' ' и Мп" (раздел Б)., Осадок в первой центро-
фужной пробирке может содержать Fe(OH)s, МпО(ОН)г, Сг(ОН)з и А1(ОН)з
(раздел А).
Раздел А
Отделение железа и марганца от хрома и алюминия. К осадку приба-
вляют 3 капли воды, 3 капли 6N едкого натра и небольшую щепотку пере-
киси натрия, следя за тем, чтобы раствор был холодным. По прекращении
шипения центрофугируют и переносят центрофугат в другую пробирку.
Осадок может содержать Fe(OH)s и МпО(ОН)гЦ)- В центрофугате могут
быть АЮа' и СгО4"(2). Осадок промывают небольшими порциями холодной
воды и растворяют в 4 каплях разбавленной азотной кислоты, к которой
добавлено несколько капель 3%-иой перекиси водорода.
1) Открытие Fe. Каплю последнего раствора помещают на белую ка-
пельную пластинку, прибавляют каплю разбавленной соляной кислоты и
каплю реактивного раствора K4Fe(CN)o (стр. 239).
В случае положительной реакции определяют также, находилось ли
железо в анализируемом продукте в виде двухвалентного или трехвалент-
ного или же в обеих степенях окисления. Для этого несколько миллиграм-
мов исходного продукта обрабатывают концентрированной соляной кисло-
той, выпаривают большую часть избытка кислоты и разбавляют несколь-
кими каплями воды. В три углубления белой капельной пластинки поме-
щают по капле исследуемого раствора и прибавляют к одной каплю рас-
твора KCNS, к другой—кашлю раствора K4Fe(CN)s и к третьей — каплю
свежеприготовленного раствора 5 мг KsFe(CN)s в Э мл воды (стр. 234 и 239).
Открытие Мп- К капле раствора на капельной пластинке прибавляют
небольшой избыток NaBiOs в порошке (стр. 249).
2) Открытие Сг. Если раствор имеет желтый цвет, дальнейшее испыта-
ние становится ненужным. В противном случае к капле кислого раствора
на капельной пластинке прибавляют уксусную кислоту и немного ацетата
535
свинца в порошке. Появление' желтого осадка указывает на присутствие
хрома (стр. 227). К капле раствора в маленькой пробирке прибавляют каплю
концентрированной азотной кислоты и несколько капель 3%-ной перекиси
водорода. Перемешивают, приливают равный объем эфира и смотрят, не
окрасится ли последний в синий цвет (стр. 226).
Открытие А1. К остатку раствора AIO2' и СгОС' прибавляют азотную
кислоту лишь до кислой реакции, прибавляют немного твердого ацетата
аммония, 5 капель реактивного раствора ализарина или ализарина S, или
алюминона и подщелачивают аммиаком; центрофугируют и наблюдают, не
появилось лн красное окрашивание осажденной гидроокиси алюминия
(стр. 214).
Раздел Б
Фильтрат, полученный при отделении элементов раздела А от элемен-
тов раздела Б, насыщают сероводородом для осаждения сульфидов никеля,
кобальта, марганца и цинка. Если осадок образуется, его центрофугируют
и оставляют центрофугат для испытания на присутствие элементов групп
IV и V. Осадок промывают несколькими небольшими порциями горячей
воды и присоединяют промывные воды к центрофугату- Осадок растворяют
в 1 мл 6N НС1 с добавлением, если нужно, небольшого количества хлората
калия. Выпаривают для удаления хлора и около половины всей кислоты.
Открытие Ni. Помещают каплю раствора на капельную пластинку, при-
бавляют каплю 1%-ного спиртового раствора диметилглиоксима и каплю
6А едкого натра (стр. 260).
Открытие Со. К капле раствора на капельной пластинке прибавляют
аммиак, чтобы довести раствор до слабокислой реакции, затем каплю
раствора з-нитрозо-З-.нафтола (растворяют 0.1г д-нитрозо-(3-нафтола в 20 мл
воды с добавлением 1 мл 6N едкого натра; раствор отфильтровывают и
разбавляют до 200 мл). При наличии кобальта появляется красновато-бурый
осадок (Стр. 270).
Открытие Мп Выпаривают каплю раствора с азотной кислотой н про-
буют, как вышеуказано, с висмутатом натрия NaBiOs.
Открытие Zn. Приготовляют немного реактивной бумаги, импрегниро-
ванной цианидом трехвалентного кобальта. Для этого раствором 4 г
Кз[Со(СЫ%] н 1 г КС1 в 100 мл воды смачивают кусочек фильтровальной
бумаги и высушивают ее при комнатной температуре или при 100°. К раствору,
оставшемуся после проведения реакций на Ni, Со и Мп, приба-
вляют HNOs в количестве, чтобы концентрация ее стала равной 5% (1 мл
концентрированной HNOs содержит приблизительно 1 г HNOs). Каплю по-
лученного таким путем раствора наносят на кружок реактивной бумаги
диаметром приблизительно 1 с.м. Бумагу высушивают над микрогорелкой, а
затем сжигают. В присутствии цинка зола окрашивается в зеленый цвет
(ср. стр. 279).
Анализ в присутствии тартратов, оксалатов, фосфатов и фторидов
.4, В присутствии оксалатов, тартратов и фторидов. Выпаривают филь-
трат после отделения группы II досуха в фарфоровом тигле. Прибавляют
несколько капель концентрированной серной кислоты и нагревают до
выделения паров №£04. Если происходит обугливание, охлаждают, приба-
вляют несколько капель концентрированной азотной кислоты и снова на-
гревают до появления густых паров H»£O-i. Такую обработку раствора
повторяют до тех пор, пока не получится практически прозрачный раствор.
Охлаждают, разбавляют водой и, прибавив тройное количество спирта,
центрофугируют. Осадок может содержать Ва£От, SrSOr и 'CaS04, центро-
фугат— группу III, Mg- и щелочные металлы. Промывают осадок не-
большими порциями 6N серной кислоты, разбавленной тройным количе-
ством спирта. Промытый осадок переносят в фарфоровую чашку, при-
бавляют 2 ,чл 3N карбоната натрия, накрывают чашку часовым стеклом и
нагревают на водяной бане. Содержимое чашки смывают горячей водой
в центрофужную пробирку, центрофугируют и центрофугат выливают. По-
добную обработку осадка содой повторяют еще два раза, каждый раз
отбрасывая центрофугат. Таким путем большая часть сульфатов щелоч-
ных земель превращается в нерастворимые карбонаты (стр. 298). Их рас-
творяют в нескольких каплях 6N азотной кислоты и производят реакции
на Ва, Sr и Са, как это будет указано при анализе группы IV.
В. В присутствии фосфатов. Вышеприведенная обработка серной кисло-
той в значительной мере устраняет затруднения, вызываемые фосфатом
при анализе группы III. Нижеследующий ход анализа приводит к удалению
фосфат-ионов (стр. 280).
Центрофугат, полученный после отделения группы II. кипятят для удале-
ния H5S, после чего прибавляют для окисления Fe’’ достаточное количе-
ство НгОг. Раствор слегка подщелачивают аммиаком и растворяют образо-
вавшийся осадок, прибавляя по каплям НС1 и избегая избытка ее (если
осадок от прибавления аммиака не образуется, то это служит признаком
отсутствия катионов 111 и IV групп, за исключением Ni, Со и Zn, фосфаты
которых легко растворимы в избытке аммиака). Часть раствора испыты-
вают, как выше указано, на присутствие Fe’’’. К слабокислому раствору
прибавляют 0.25 г твердого CHaCOONHi (стр. 238). Если количество
трехвалентного железа, находящегося в 'растворе, больше того количе-
ства. которое необходимо, чтобы связать всю фосфорную кислоту в виде
FePO«, то раствор краснеет. В противном случае прибавляют еще раствор
хлорного железа до покраснения раствора. Прибав-ив немного воды, нагре-
вают до кипения. Осадок может состоять из FePOi, Ре(СНзСОО)(ОН)г,
Д1РО4 и CrPO-i. Осадок исследуют на присутствие А1 и Сг, а центрофугат
служит для реакций на Mn, Ni, Со, Zn, Са, Ba, Sr, Mg, К и Na по обыч-
ному ходу анализа.
Группа IV
К центрофугату, полученному после отделения группы III, прибавляют
немного твердого NHiCl и реактивного раствора (Х’НфСОз (стр. 104) в ко-
личестве, достаточном для осаждения всех щелочноземельных металлов
в виде карбонатов (стр. 305). Центрофугируют и сохраняют центрофугат
для испытания на элементы группы V.
Открытие Са. Осадок карбонатов растворяют в возможно малом ко-
личестве азотной кислоты. Раствор переливают в небольшую фарфоровую
чашку и выпаривают досуха. Сухой остаток нагревают на голом огне
(обводя им вокруг дна чашки), добиваясь полного его обезвоживания.
К раздавленному стеклянной палочкой и охлажденному остатку приба-
вляют около 1 мл абсолютного ацетона. Перемешивают и отбирают
пипеткой отстоявшуюся жидкость, могущую содержать Са(\Оз)з. Осадок
сохраняют для исследования на Ва и Sr. К ацетоновому раствору
прибавляют каплю щавелевокислого аммония и 5 капель воды. Образо-
вание белого осадка CaCVC указывает на присутствие Са. Смочив осадок
соляной кислотой, производят испытание в пламени газовой горелки
(стр. 294).
Открытие Ва. Остаток, не растворившийся в ацетоне, растворяют в не-
большом количестве воды, прибавляют 2 капли 6/V уксусной кислоты и
равный объем раствора 3N ацетата аммония, нагревают и к кипящему
раствору прибавляют по каплям хромат калия в количестве, достаточном
для осаждения всего бария. Смесь центрофугируют и сохраняют центро-
фугат для реакции на стронций. Хроматный осадок растворяют в разба-
вленной НС1 (избегать избытка), исследуют раствор в бесцветном пла-
мени горелки и в случае сомнений разбавляют двойным количеством воды
и каплю раствора испытывают каплей разбавленной серной кислоты.
Открытие Sr. К центрофугату, полученному по выделении BaCrCh,
прибавляют по каплям аммиак до получения лнмонножелтой окраски рас-
твора; выпадающий при этом бледножелтый осадок является хроматом
стронция (стр. 296). С осадком проводят контрольную реакцию на окра-
шивание пламени.
537
Группа V
Открытие Mg. К капле цеитрофугата после отделения группы IV при-
бавляют 1—2 капли раствора р-нитробензол-азо-а-нафтола или р-нитро-
бензол-азо-резорцина (получают растворением 1 мг красителя в 100 мл
2N NaOH; см. стр. 303).
Появление синей окраски служит признаком наличия магния. Необхо-
димо следить за тем, чтобы раствор был щелочным. Если исследуемый
раствор имеет силыную кислую реакцию, необходимо прибавить к нему не-
сколько капель раствора едкого натра. Если получается очень слабая
реакция, рекомендуется поставить параллельный опыт с каплей дестилли-
рованной воды.
Открытие NHt’. Эта реакция всегда выполняется с исходным веще-
ством и она уже была описана (стр. 321 и след.).
Удаление солей NHt. После проведения реакции на магний к центро-
фугату от группы IV прибавляют избыток азотной кислоты и выпари-
вают досуха в маленькой фарфоровой чашке. Остаток нагревают на голом
огне, держа в руках горелку и медленно обводя чашку пламенем. Нагрева-
ние продолжают до прекращения выделения паров. Охлаждают, смывают
со стенки чашки небольшим количеством воды и снова повторяют выпа-
ривание и нагревание. В заключение остаток обрабатывают 1 мл горячей
воды и фильтруют.
Открытие К. Каплю раствора .помещают на капельную пластинку, при-
бавляют каплю раствора AgNOs и немного твердого NasCo(NO2)e. Жел-
тый осадок указывает ща> присутствие К (стр. Э12). Испытывают .в пламени,
наблюдая окраску его через синее стекло.
Открытие Na. К 2 каплям, раствора в маленькой пробирке прибавляют
16 капель реактивного раствора магнийуранилацетата. Желтый осадок
NaMg(UO2)3 • (СНзСОО)», медленно образующийся, указывает на присут-
ствие Na (стр. 315).
Открытие Li. К оставшемуся раствору прибавляют каплю концентри-
рованного аммиака и 0,2А раствор фосфата натрия в количестве Vio объема
исследуемого раствора. Белый осадок указывает на присутствие Li
(стр. 645). Осадок на. платиновой проволоке, омоченный соляной кислотой
и внесенный в несветящееся пламя, окрашивает последнее в красный цвет.
Систематический анализ анионов
Предварительные испытания на кислоты должны выполняться, как опи-
сано на стр. 492—494, но с небольшими количествами исходного вещества.
При приготовлении раствора для анализа применяются методы, указанные
на стр. 511—512. Для микрохимического анализа удобно разделить анионы
на 4 группы *. 'В большинстве случаев необходимый для анализа раствор
получают путем кипячения образца с содой с последующим фильтрованием.
Группа I
Карбонат, цианид, нитрит, сульфид, сульфит и тиосульфат
Предварительное испытание. Приблизительно к 10 мг исследуемого про-
дукта в пробирке емкостью 5 мл прибавляют немного вады, .нагревают до
кипения и прибавляют несколько капель разбавленной соляной кислоты.
Шипение может быть вызвано выделением С Оз (бесцветного лишенного
запаха газа) из карбонатов, SOs (газа с запахом горящей серы) из суль-
фитов и тиосульфатов, H2S (с запахом гнилых яиц) нз разложимых суль-
1 См. Eng el de г, Dunkelberger a. S с h i 11 е re Semi-micro Qua-
litative Analysis, New-York, 1936 г« '
538
фидов, H'CN (с запахом горького миндаля) из цианидов и NO» (бурые
лары) из нитритов. 'Сера может выделяться из тиосульфатов или при
взаимодействии HaS и SO2.
Открытие СОз". См. стр. 409 и 492.
Открытие CN'. Обыкновенно для открытия ядовитой цианистоводо-
родной кислоты достаточен ее запах, появляющийся при действии кис-
лоты на простой цианид. Чтобы открыть CN' в водном растворе цианида
щелочного металла, помещают каплю раствора в маленький фарфоровый
тигель, прибавляют каплю 3N H2SO4 и накрывают тигель фильтровальной
бумагой, Пропитанной ацетатами меди и бензидина. Последние реагируют
с выделяющимся цианистым водородом, окрашивая бумагу в синий цвет.
Окисляющие и восстановляющие вещества должны отсутствовать.
Для приготовления реактивной бумаги смешивают незадолго, перед
применением ее немного раствора, содержащего 2.86 г ацетата меди
Си(СНзСОО)г • Н?О я 1 л .воды с равным объемом раствора, полученного
путем Смешения 475 мл насыщенного водного раствора ацетата бензидина
с 525 мл воды.
В указанной реакции образуется синий продукт окисления бензидина
(мерихиноидное > соединение); эта реакция неспецифична в присутствии
окислителей, или восстановителей. Окисление бензидина обусловливается
восстановлением двухвалентной меди в медноцианистый бесцветный ком-
плекс (стр. 153).
Открытие NOi. Выделение бурых паров при добавлении разбавлен-
ной соляной кислоты служит достаточным признаком присутствия нитри-
тов. Газ выделяет иод из иодидов и окрашивает иодкрахмальную бу-
магу в синий цвет. Очень чувствительна реакция с сульфаниловой кис-
лотой (стр. 385).
Открытие S". Чувствительной пробой на выделяющийся сероводород
является реакция с ацетатом свинца (стр. Э89).
Открытие SOa". За1.метное выделение газа с запахом SO» при действии
разбавленной соляной кислоты на небольшое количество испытуемого ве-
щества указывает на наличие сульфита. Наличие сульфита в отсутствие
HCN, HNOs и H2S может быть подтверждено обесцвечиванием выделяю-
щимся газом капли раствора, KMnOi, находящегося в петельке платиновой
Проволоки (стр. 405).
Открытие SaOs". Следующая реакция может служить для открытия
SsOs" даже в присутствии S". Она основана на том, что HgCIs реагирует
с H2S с образованием белого осадка 2HgS • HgCh (стр. 138), а с S2O3"
с образованием HgS и H2SO4 (стр. 141):
S" + Hg • • -> HgS;
SaOe" + Hg - • + HbO-> HgS + SO1" + 2H’;
На капельной пластинке смешивают каплю нейтрального испытуемого
раствора с каплей 2%-ного раствора HgCla и, прибавив немного КС1 для
превращения избытка HgCla в KaHgCU, пробуют синей лакмусовой бу-
мажкой. Покраснение последней указывает на присутствие в испытуемом
веществе тиосульфата.
Группа II
Арсенит, арсенат, фосфат, силикат, фторид, сульфат, борат, оксалат,
тартрат и хромат
Предварительное испытание. К нескольким кашлям приготовленного
раствора (стр. 919) прибавляют небольшой избыток НС1 и кипятят для
удаления СО». Тщательно нейтрализуют (табл. X, стр. 514Ц аммиаком
(капля раствора на лакмусовой бумаге должна показывать нейтральную
реакцию). Прибавляют по капле реактивных растворов ВаС1г й СаС1»
(стр. 519). Если осадок ие образуется, то возможно отсутствие кислот этой
группы, хотя следует напомнить, что некоторые фосфаты, фториды и
539
силикаты с трудом разлагаются при кипячении с содой, а образование
боратов кальция и бария происходит медленно или совсем не происходит
в присутствии солей аммония. Желтый осадок с групповым реактивом
обусловлен образованием ВаСгОа.
Открытие АзОз". К нескольким каплям раствора прибавляют каплю 6N
соляной кислоты (или больше, если необходимо для получения кислой
реакции) и пропускают НгЗ. Немедленное образование желтого осадка
AssSs указывает на наличие АзОз'". С другой порцией раствора проводят
контрольные реакции 6 и 7 на стр. 167 и 168.
Открытие АзО?". К нескольким каплям раствора прибавляют большой
избыток НС1, нагревают до кипения и насыщают НзЗ. Появление желтого
осадка (стр. 169) может быть обусловлено присутствием AsCh"'. Наличие
его подтверждается реакциями 2 или 5' на стр. 171 и 172.
Открытие РО*"'. К нескольким каплям раствора прибавляют избыток
6N HNOs. Нагревают до кипения и прибавляют 1 мл раствора (NH4)2MoO4
(стр. 437). Эту реакцию выполняют после предварительного осаждения
мышьяковой кислоты (если она присутствует) в виде сульфида посред-
ством HsS (см. выше).
Открытие ЗЮз". Помещают каплю раствора в центрофужную пробирку
и прибавляют каплю 6N аммиака и 3—5 капель 6А нитрата аммония. Сту-
денистый осадок указывает на наличие ЗЮз". Эту реакцию повторяют,
применяя вместо аммиака концентрированную соляную кислоту. Если обе
реакции дают отрицательные результаты и исследуемое вещество не рас-
творяется в кислотах, то небольшое количество его сплавляют с содой
в платиновом тигле. Плав выщелачивают горячей водой, после чего про-
водят вышеуказанные реакции. Получив положительный результат, про-
водят реакцию Даниэля (стр. 482).
Открытие F'. Помещают немного исследуемого вещества в маленькую
пробирку, прибавляют несколько капель серной кислоты, нагревают и ис-
пытывают выделяющиеся пары каплей воды (стр. 471).
Открытие 8 Оз". См. стр. 468, реакция 2.
Открытие ВОз"'. В пробирку помещают несколько миллиграммов твер-
дого испытуемого вещества (или остатка, полученного при выпаривании
досуха раствора, подщелоченного едким натром), прибавляют немного ме-
тилового спирта и несколько капель концентрированной H2SO4. В от-
верстие пробирки вставляют резиновую пробку, снабженную двумя трубками,
аналогичными имеющимся в промывалке, причем наружный конец корот-
кой трубки должен быть вытянут в капилляр, а длинная трубка, погру-
женная в жидкость, служит для вдувания воздуха. Пары из раствора вду-
вают в несветящсеся пламя небольшой горелки. В присутствии борной
кислоты летучие пары ее метилового эфира будут окрашивать пламя
в яркий зеленый цвет. При этом возникает некоторая опасность взрыва,
если наружное отверстие трубки, выходящей из пробирки, не оттянуто
в капилляр. Положительную реакцию дают даже весьма малые количества
борной кислоты. До выполнения этой реакции не следует выпаривать
досуха водный кислый раствор, потому что НзВОз летуча с парами воды.
Открытие С2О4". К небольшому количеству содового раствора иссле-
дуемого вещества прибавляют уксусную кислоту до кислой реакции и
немного раствора хлорида кальция. Выделение осадка может быть вызвано
образованием СаСзОз или СаЕг. Осадок центрофугируют, промывают го-
рячей водой и растворяют в нескольких каплях горячей 6А серной кис-
лоты. К горячему раствору прибавляют 2 капли 6N серной кислоты и
небольшую каплю раствора КМпО4. Отмечают, происходит ли обесцвечи-
вание последнего и выделение СО? (стр. 418, реакция 7). ।
Открытие СзНзОв". Нагревают в тигле небольшое количество иссле-
дуемого продукта с концентрированной серной кислотой. Обугливание и
запах жженого сахара указывают на присутствие тартрата. Для подтвер-
ждения этого берут 0,20 г исходного вещества и, если оно не является
свободной кислотой или ее щелочной солью, кипятят с небольшим коли-
чеством ЗА карбоната калия. Центрофугируют и подкисляют раствор ле-
дяной уксусной кислотой. Охлаждают и сильно перемешивают, что
должно вызвать образование KHCiHiOe (стр. 422, реакция 5). Если осадок
540
образуется, жидкость декантируют и промывают кристаллический осадок
50%-ным спиртом. Растворяют в небольшом количестве NH<OH и приба-
вляют раствор CaCh. Фильтруют и промывают холодной водой. Осадок
обрабатывают 6N едким натром на холоду; щелочной экстракт кипятят,
чтобы увидеть, не образуется ли осадок (стр. 421, реакция 4).
Открытие СгО/'. Если раствор не окрашен в желтый цвет, заключают .
об отсутствии СгО/'-ионов. Если хром был найден при реакциях на ка-
тионы, он может находиться в виде СгО»" (или СгаО?"). Две капли рас-
твора, приготовленного для исследования на анионы, помещают в малень-
кую пробирку, прибавляют каплю концентрированной HNOs, 3—5 капель
эфира и 1—2 капли Н.»Ог (стр. 226).
Группа III
Феррицианид, ферроцианид, роданид, иодид, бромид и хлорид
Для реакций на кислоты этой группы несколько капель приготовлен-
ного для анализа раствора подкисляют в маленькой пробирке азотной
кислотой, нагревают до кипения и прибавляют 1—2 капли раствора, AgNOs
(табл. XVI). Ag3[Fe(CN)e] — красновато-бурого цвета и растворимо
в NFhOH. Ag-4[Fe(CN)eJ, AgCNS и AgCl белого цвета: последние две соли
растворимы в NH4OH. AgJ — желтого цвета и не растворимо в NFLOH.
AgBr—бледножелтого цвета и по своей растворимости в NH»OH (равно
как и в HNOs) занимает промежуточное положение между AgJ и AgCl.
Открытие [Fe(CN)e]""> (Fe(CN)e]'7CN£'. См. стр. 371, реакция 5;
373, реакция 5; 376, реакция 5. На бумагу для капельных реакций по-
мещают каплю 1,07V раствора Pb(NOs)2 и каплю испытуемого раствора,
подкисленного уксусной кислотой. В центре пятна будет находиться
Pb2[Fe(CN)e], между тем как Fe(CN)e"' и CNS' будут удалены от центра.
В центр пятна помещают каплю воды, чтобы вызвать дальнейшее про-
движение последних двух анионов. Когда распространение пятна по бу-
маге закончится, проводят через него тонкую линию 0,1 N раствором
FeCh, находящимся в капиллярной пипетке. Перпендикулярно к этой черте
проводят такую же линию O,1N раствором FeSCh. Если присутствуют все
три аниона, то близко к средине пятна, по линии, начерченной хлорным
железом, образуется берлинская лазурь, несколько дальше от последней
на той же линии появится красное родановое железо и близко к пери-
ферии пятна по линии, нанесенной раствором FeSO» — турнбулева синь.
Открытие J' и Вт'. К небольшому количеству приготовленного для
анализа раствора в маленькой пробирке прибавляют четыреххлористый
углерод в количестве, достаточном для образования заметного слоя под
водным раствором, и медленно приливают по каплям раствор NaOCl. После
каждой прилитой капли смесь взбалтывают и наблюдают окраску слоя
четыреххлористого углерода. Первым выделяется иод, который окраши-
вает CCh в красновато-фиолетовый цвет. Дальнейшее добавление NaOCl
приводит к окислению .Ь в бесцветную йодноватую кислоту HJOs; затем
прибавляют несколько капель 6N HsSO», и в присутствии брома ССЬ-слой
окрашивается в желтый цвет. В случае сомнений относительно брома сле-
дует произвести слепой опыт с водой.
Открытие С!'. СК — самый обычный анион рассматриваемой группы,
по белому осадку, который он образует с Ag’ в подкисленном азотной
кислотой растворе, его легко обнаружить; однако образующийся осадок
по внешнему виду сходен с Agi[Fe(CN)e], AgCNS и немногим отличается
от AgBr. При наличии других анионов этой группы нейтрализуют азотной
кислотой небольшое количество приготовленного для анализа раствора
и прибавляют раствор КМпО» до неисчезающей фиолетово-красной окраски
раствора. Центрофугируют и отбрасывают осадок. К центрофугату при-
бавляют раствор Hg(NOs)2, центрофугируют и снова отбрасывают осадок.
Раствор подкисляют HNOs, центрофугируют, центрофугат выливают,
а к осадку прибавляют несколько капель концентрированного аммиака и
проверяют, образуется ли снова AgCl при подкислении азотной кислотой.
При очень слабой реакции на Cl'-ион, производят слепой опыт со всеми
541
применявшимися реактивами; карбонат (натрия содержит почти всегда •
следы хлорида; нередко немного хлорида содержится в азотной кислоте
(за счет загрязнения при пользовании ею).
Группа IV
Ацетат и нитрат
Открытие СНзСОО'. К нескольким каплям раствора в небольшой про-
бирке прибавляют 5 капель этилового спирта и 5 капель концентриро-
ванной серной кислоты. При наличии ацетата появляется характерный за-
пах уксуснокислого эфира (стр. 394, реакция 2).
К другой части раствора прибавляют нитрат бария для устранения ме-
шающих ионов, фильтруют и к фильтрату прибавляют каплю 5%-ного
раствора нитрата лантана Ьа(МОз)з, каплю 0.02N спиртового раствора иода
и несколько капель разбавленного аммиака. Нагревают до кипения н смо-
трят, не появляется ли синяя окраска (стр- 395).
Открытие NOa'. Кипятят с водой не меньше 10 мг исследуемого веще-
ства, фильтруют, если это необходимо, и выпаривают до небольшого
объема. В углубление капельной пластинки помещают небольшой кристал-
лик FeSOa-THsO (или соли Мора), каплю испытуемого раствора и каплю
концентрированной серной кислоты. В случае присутствия нитрата< вокруг
кристалла соли двухвалентного железа образуется бурое кольцо (стр. 455,
реакция 4).
ЧАСТЬ V
РЕАКЦИИ РЕДКИХ МЕТАЛЛОВ
ГРУППА II. ГРУППА СЕРНИСТОГО ВОДОРОДА
МОЛИБДЕН, СЕЛЕН, ТЕЛЛУР, ГЕРМАНИЙ, ЗОЛОТО, ПЛАТИНА,
ПАЛЛАДИЙ, РОДИЙ, ОСМИЙ, РУТЕНИЙ, ИРИДИЙ1
Молибден Мо. Ат. в. 95,95. Ат. н. 42
Плотность 10,2. Т. пл. 2622
Нахождение в природе. Встречается в виде .молибденита (молибдено-
вого блеска) MoSa, вульфенита PbMoOi и повелита CaMoCU
Свойства. Металлический молибден имеет серебристобелый цвет; он
является достаточно вязким и ковким; по твердости он мягче стекла.
Металлический молибден трудно окисляется воздухом или водой при. обык-
новенной температуре, но при нагревании выше 600° он окрашивается
в бурый, затем в синий и, наконец, в белый цвет. Конечным продуктом
окисления является МоОз белого цвета. В производстве стали для' быстро-
режущих инструментов находит применение молибденовое железо. В этом
состоит главное промышленное применение молибдена; меньшие количества
его используются в производстве электрических ламп и радиотрубок.
Ангидрид молибденовой кислоты МоОз, применяющийся в производстве
красок и чернил, представляет собой важный химический реактив. Металл
растворяется в азотной кислоте, царской водке и в концентрированной
серной кислоте. Молибден может быть 2-х, 3-х, 4-х, 5-ти и 6-тивалент-
ным; он образует следующие окислы: МоО, Мо2Оз, МоОз и МоОз, из которых
первые три представляют собой основные окислы, а последний МоОз, является
кислотным ангидридом; МоОз представляет собой белую массу (желтую при
нагревании), легко плавящуюся и возгоняющуюся при сильном нагревании
в виде бесцветных прозрачных, тонких ромбических листочков. Раствори-
мость ангидрида в воде весьма мала, но он легко растворяется в едких
щелочах и аммиаке с образованием молибдатов. Молибденовая кислота
может быть получена .в виде твердой массы при подкислении раствора
молибдата щелочново металла; она растворима в избытке кислоты (отли-
чие от вольфрамовой кислоты). В кислых растворах, вероятно, имеется
1 Некоторые редкие элементы с трудом распределяются по группам,
установленным старой классификацией качественного анализа. Так, Тред-
велл помещает таллий, ванадий, молибден и вольфрам в эту группу. Но
против такой классификации имеются возражения. С аналитической точки
зрения отмечается например, сходство вольфрамовой кислоты, с одной сто-
роны, с молибденовой кислотой, с другой—с кремневой. Селен и теллур
в своих соединениях имеют определенно кислотный характер и их не сле-
довало бы относить к катионам.
543
г
некоторое количество катионов шестивалентного молибдена. Важнейший
продажный молибдат, кислый молибденовокислый аммоний имеет следую-
щий состав: 1
(МНЩМотСЩ • 4Н»О или 3(NH4)’MoOi • 4(МоОз • НгО).
Молибденовая кислота растворяется в соляной, серной и органических
кислотах, образуя комплексные соединения. При нагревании МоОз в токе
хлористого водорода при 150—200° происходит возгонка соединения
МоОз • 2НС1 *, конденсирующегося в виде бесцветных кристаллов. Путем
восстановления этой оксохлорокислоты или молибдата щелочного металла
в солянокислом растворе получают последовательно следующие молибде-
новые комплексы:
(MoVI03Cl,]" —> [MovOC!5]" —> [MoIVO;CtJ'
бесцветный зеленый бурый
—> [Моп,С1в]'" —> [Мо3пС13 (ОН)8]
красный
желтый
Известны также и простые галоидные соединения молибдена той же
валентности:
MoF62 M0CI5 МоСЦ МоС13 (МоС12)3
бесцветный зелено-черный бурый темно-красный желтый
Щелочные соли молибденовой кислоты растворяются в воде, ’осталь-
ные большею частью не растворимы в воде, но растворимы в1 кислотах.
Реакции мокрым путем
Следует употреблять раствор молибденовокислого аммония.
1. Разбавленные кислоты осаждают из концентрированных
растворов молибденовокислых щелочей белую НгМоОг, раство-
римую в избытке реактива.
Фосфорная кислота растворяет осадок, образуя комплексную
фосфорномолибденовую кислоту НзРОг-12МоОз, желтого цвета,
которая служит специфическим реактивом на ряд катионов. Так,
ионы щелочных металлов (особенно Cs), одновалентного таллия,
аммония, замещенные ионы аммония (алкалоиды) и диазония,
а также белки осаждаются в виде солей этой кислоты.
2. Концентрированная серная кислота. Если выпарить в фар-
форовой чашке почти досуха следы какого-нибудь молибдено-
вого соединения с каплей концентрированной серной кислоты, то
затвердевающая после охлаждения масса окрашивается в интен-
1 По Weinland это соединение представляет собой комплексную кис-
лоту, формула которой:
Н2[Мо%]
ее называют оксохлоромолибденовой кислотой. Ред.
2 Ясно выраженный кислотный галогенид; т. пл. 17°, т. кип. 35°.
544
сивно синий цвет. Реакция очень чувствительна. Образующееся
соединение представляет собой содержащий воду окисел прибли-
зительно следующего состава: МоэОв • хНгО. В этом соединении
(молибденовая синь) молибден находится в разных степенях
окисления1. Этой реакции мешает пятиокись сурьмы, большие
количества олова и другие примеси.
3. Концентрированная азотная кислота. Если к концентриро-
ванному раствору молибдата прибавить концентрированной
'(лучше всего — дымящей) азотной кислоты, то осаждается
аморфная, гидратированная трехокись молибдена, чрезвычайно
мало растворяющаяся в азотной и хлорной кислотах. .
4. Фосфорнокислый натрий. Если к раствору молибдата,
сильно подкисленному азотной кислотой, прибавить несколько
капель раствора фосфорнонатриевой соли, получается спустя
некоторое время уже на холоду и быстро при нагревании желтый
кристаллический осадок фосфорномолибденовоаммониевой соли
(стр. 431). Подобный же осадок получается при действии
мышьяковой кислоты (стр. 171)-
5. Азотнокислая ртуть (1) осаждает из нейтральных растворов
белую 1молибденовокислую соль закиси ртути, растворимую в HNOs.
6. Уксуснокислый свинец осаждает белый молибдат свинца,
растворимый в азотной кислоте.
7. Сернистый водород сперва окрашивает кислые растворы
молибдата в синий цвет, затем постепенно осаждается бурый
трехсернистый молибден M0S3, растворимый в сернистом аммо-
нии с образованием бурого раствора, из которого кислоты снова
выделяют M0S3. Осаждение лучше всего проводить путем* насы-
щения кислого раствора сероводородом под давлением (в закры-
той склянке и при нагревании на водяной бане). При действии
концентрированной азотной кислоты или при обжигании на воз-
духе сернистый молибден переходит в МоО>з.
8. Цинк. При действии цинка на подкисленный соляной или
серной кислотой раствор молибдата происходит окрашивание
раствора сначала в синий, затем в зеленый и, наконец, в бурый
цвет. Точно так же реагируют и другие восстановители, как
SnCb, Hg2:(NO3)2 и т. п.
9. Сернистая кислота не восстанавливает разбавленных силь-
нокислых растворов молибдатов ни на холоду, ни при нагрева-
нии. Нейтральные же или слабокислые растворы восстанавли-
ваются. причем раствор окрашивается в синий цвет.
10. Роданистый калий не реагирует с подкисленными раство-
рами молибдатов, но в присутствии цинка или SnCh получается
кровавокрасное окрашивание раствора (роданистый молибден).
То же происходит и в присутствии фосфорной кислоты (отличие
от железа). При взбалтывании с эфиром в последний переходит
роданистый молибден. Этой реакции мешает винная кислота,
образующая с молибдатами комплексные соединения.
1 Образующаяся молибденовая синь представляет собой, невидимому,
соединение двух окислов: МоОз • МоаОз • хНаО. Ред.
35 962. Тредвелл-Голл, т. I.
545
Следующим путем! можно открыть 0,1 у молибдена в 0,05 мл раствора.
На фильтровальную бумагу, смоченную соляной кислотой *, наносят
каплю испытуемого раствора и прибавляют каплю роданида калия; если
присутствует железо, появляется красное пятно Fe(CNS)s, которое исчезает
от прибавления капли SnCh или NasSsOs, и появляется красное пятно, вы-
званное образованием Кз[Мо(СК5)в].
И. Ферроцианид калия образует красновато-бурый осадок.
Реакция весьма чувствительна.
Растворы молибдена, содержащие свободные щавелевую, уксусную или
фосфорную кислота, обыкновенно не осаждаются ферроцианидом калия,
ио лишь окрашиваются в бурый цвет. Ферроцианид молибдена не раство-
рим в разбавленных минеральных кислотах, но растворим в концентри-
рованной соляной кислоте, причем он снова выпадает при разбавлении. Ои
легко растворим в растворах едких щелочей и аммиака, и в этом отно-
шении он отличается от ферроцианидов двухвалентной меди и уранила
(стр. 154 и 590). Чтобы открыть ферроцианид-ион в ферроцианиде молиб-
дена, растворяют последний в аммиаке, насыщают сероводородом, под-
кисляют разбавленной серной кислотой, отфильтровывают сернистый мо-
либден и испытывают фильтрат раствором хлорного железа (стр. 373).
12. Фенилгидразин CeFLNH—NHs реагирует с кислым раствором молиб-
дата, выделяя красный осадок или окрашивая раствор в красный цвет.
Фенилгидразин окисляется молибдатом в соль диазония, последняя соеди-
няется с избытком^ фенилгидразина' и молибдатом, образуя окрашенное со-
единение.
Каплю раствора на капельной пластинке смешивают с каплей раствора
фенилгидразина в ледяной уксусной 'кислоте. При наличии молибдена
появляется красное окрашивание. Таким путем можно открыть 0,33 Y Мб
в капле (предельная концентрация 1 : 16 000).
* Примечание редактора. Эта реакция еще более чувствительна при
выполнении ее на фильтровальной бумаге следующим образом,. На бумагу
наносят каплю реактивного раствора и прежде чем она успеет впитаться
бумагой, прибавляют каплю испытуемого раствора. В случае присутствия
молибдена образуется через несколько минут вокруг капельного пятна
красное кольцо. Таким путем можно открыть 0,13 " Мо (предельная
концентрация 1 : 300 000). * А. К.
13. Перекись водорода. Если выпарить досуха на водяной бане
испытываемый на молибден раствор, прибавить концентрирован-
ный ИНздо щелочной реакции и затем 3—4%-ную перекись водо-
рода, раствор тотчас окрасится в розовый или красный цвет
(в зависимости от количества имеющегося молибдена. Ред.1 2). Если
к выпаренному розовому или красному раствору прибавить сер-
ную или азотную кислоты, то появляется желтое окрашивание
вследствие образования надмолибденовой кислоты НМоОц
14. Сульфат железа (2) и серная кислота добавленные к кис-
лому раствору молибдата, дают устойчивое синее окрашивание.
* Добавление редактора. 15. Ксантогенат калия KS—CS —
ОС2Н5 является наиболее чувствительным и специфическим реак-
тивом на молибден, давая с молибдатами интенсивное красно-синее
окрашивание. Комплексное соединение МоОз • [8С(5К)ОС2Нз]2,
1 Если присутствует вольфрамовая кислота, могут образоваться в усло-
виях опыта низшие окислы вольфрама синего цвета, понижающие чув-
ствительность и однозначность реакции на. молибден. Вредное влияние
вольфрамата устраняется соляной кислотой, выделяющей нерастворимую
вольфрамовую кислоту. Ред.
2 При этой реакции образуется надмолибденовокислый аммоний, состав
которого (NHpsCh • М0О4 • Н2О2 [ЖРФХО, 44, 608 (1912)]. Реакция отли-
чается большой чувствительностью, ред.
.545
образующееся при этом, растворяется в хлороформе и других
органических растворителях. Присутствие органических кислот,
дающих с молибдатами комплексные соединения, понижает чув-
ствительность реакции. Для выполнения реакции прибавляют
к капле испытуемого нейтрального’ или слабокислого раствора
кристаллик ксантогената калия, а затем 2 капли 2N НС1.
Чувствительность реакции 0,04 г в 0,05 ж, что отвечает пре-
дельной концентрации 1 : 250 000 х. * А. К.
Реакции сухим путем
Молибдаты щелочных металлов дают при нагревании на угле
(с содой или без нее) серый металл с белым налетом МоОз.
Перл фосфорной соли. Все соединения молибдена в зависи-
мости от концентрации дают в окислительном пламени буро-
желтый или желтый перл, переходящий при охлаждении
в желто-зеленый и становящийся затем бесцветным. В восстано-
вительном пламени перл в горячем состоянии темнобурого, а на
холоду травянистозеленого цвета. Окраска перла буры анало-
гична, но не столь характерна1 2.
Селен Se. Ат. в. 78,96. Ат. н. 34
Плотность 4,28—4,5. Т. пл. 217—220. Т. кип. 690°
Нахождение в природе и получение. Хотя селей достаточно распростра-
нен в природе, тем не меиее он встречается в небольших количествах,
главным образом, как заместитель серы в сернистых соединениях свинца,
меди, серебра и ртути, а именно в виде клаусталита PbSe, берцелианита
(Си, Ag, TIHSe, -иаумаиита (Ags, Pb)Se, тиманита HgSe, лербахита
(Pb, Hg)Se, о-иофрита Hg(SeS), эйкайрита (Ag, Cu)2Se. Далее он встречается
в очень милых количествах в -некоторых пиритах и а^едных колчеданах,
и именно эти чрезвычайно бедные селеном минералы служат источником
получения почти всего продажного селена. При обжигании этих руд (при
производстве серной кислоты) подти весь селей попадает в свинцовые
камеры, где он осаждается в виде ила, из которого селей -получается путем
выщелачивания раствором цианистого калия и затем осаждением из рас-
твора какой-либо кислотой:
KCN + Se -> KCNSe и KCNSe + HCI = КС1 + HCN + Se.
Свойства. Селен подобно сере существует в нескольких аллотропных
формах. Стекловидная форма а-селе-н растворяется медленно, но полностью
в сернистом углероде. Красный (3-селен получается путем, восстановления
холодного раствора селенистой кислоты сернистой кислотой. Эта модифи-
кация несколько менее растворима в сернистом углероде. При действии
металлической ртути иа раствор селена в сернистом углероде осаждается
черный селенид ртути. При иагреваиии красного селена в течение некоторого
времени в воде он переходит в черный у-селен, не растворимый в сер-
нистом углероде. Это самая устойчивая модификация, -в которую перехо-
дят все остальные.
При накаливании на воздухе селен сгорает синеватым пламенем, рас-
пространяя запах гнилой редьки, в двуоукись селена SeCb, белое кристал-
лическое вещество, возгоняющееся в атмосфере кислорода. Селен образует
1 S. L. М а 1 о w а п, Z. anorg. Chem. 108, 73 (1914); J. Koppel, Chem.
Ztg, 43, 777 (1919) и Ф а й гл ь,. Капельный анализ, стр. 232.
2 U. Lutz, Z. anal, Chem, 47, 1 (1908).
35*
547
один окисел SeOs, ангидрид селенистой кислоты и две кислоты: селе-
нистую HsSeOs и селеновую HsSeCh. Пары двуокиси селена —желтого
цвета.
Если селен нагревать в атмосфере водорода, то образуется селенистый
водород — газообразное вещество, которое по своим реакциям аналогично
сернистому водороду.
Селенистая кислота HsSe-Os получается в виде длинных бесцветных игл,
легко растворяющихся в воде, при окислении селена азотной кислотой
или царской водкой ’, а также при растворении SeOs в воде. На воздухе
селенистая кислота не переходит, как сернистая кислота, в высшую сте-
пень окисления, но восстанавливается до селена (вследствие действия
пыли и т. и.), выделяющегося в виде красного порошка. Селенистая кис-
лота двухосновна и образует средние и кислые соли.
Из средних солей в воде растворимы только щелочные соли, кислые
соли все растворимы.
Раствор селеновой кислоты HsSeOi получают, пропуская хлор через
воду, в которой взвешен селен или растворена селенистая кислота:
Se + ЗС1г + 4НгО -> HsSeOi + 6HCI.
Путем сплавления селена с содой и селитрой получают селеновокислый
натрий.
Селеновая кислота двухосновна; она проявляет себя как сильный окис-
литель; так, например, при кипячении с концентрированной соляной кис-
лотой она выделяет хлор, восстанавливаясь в селенистую кислоту:
HsSeOi + 2HCI ->НгО + HsSeOs + Ch.
Нойес и Брэй рекомендуют начинать проведение качественных опре-
делений с удаления селена в виде SeBn совместно с AsBrs и GeBn, при-
меняя НВг в качестве растворителя вместе с бромом. Этим достигается
отделение селена от теллура и от других элементов.
Электрическая проводимость серого селена при комнатной температуре
или в отсутствие света весьма мала, но при выставлении на свет или при
повышении температуры сопротивление его сильно падает. На ?том- его
свойстве основано действие селенового фотоэлектрического элемента; чув-
ствительность последнего настолько велика, что при известных условиях
даже свет звезды вызывает заметный эффект. Селен находит применение
в стекольном производстве при приготовлении рубиновокрасного стекла,
для придания огнеупорности кабелям, в производстве резины, а также
в производстве стали- Селенистая кислота приобрела значение важного
химического реактива; небольшое количество ее в значительной мере
ускоряет разрушение органического вещества серной кислотой, произво-
димое при определении азота по Кьельдалю.
'Реакции мокрым путем
А. Селенистая кислота
Следует употреблять раствор селенистокислого калия или селенистой
кислоты.
1. Сернистый водород выделяет из растворов селенистокислой
соли, подкисленных соляной кислотой, или из -водного раствора
селенистой кислоты лимонножелтый осадок, состоящий из смеси
селена и серы:
H2SeO3 + 2H2S -> ЗН2О +Se + 2S.
Этот осадок легко растворяется в (NH-r^S.
1 При выпаривании раствора селена в царской водке теряются значи-
тельные количества его вследствие улетучивания; потери уменьшаются при
добавлении NaCl или КС1.
548
2. Восстановители, а) Сернистая кислота осаждает как на холоду,
так и при нагревании в концентрированном и разбавленном рас-
творе, содержащем соляную или серную кислоту \ красный
селен, который при долгом кипячении становится серо-черным.
б) Хлорид олова (2) осаждает красный селен даже в, при-
сутствии большого количества серной кислоты.
в) Сульфат железа тотчас .выделяет из концентрированных
растворов селенистой кислоты в присутствии соляной кислоты
красный селен; из разбавленных же растворов это выделение
совершается постепенно; из сернокислых растворов осаждение
совершается очень медленно и не доходит до конца.
г) Солянокислый гидроксиламин (или сернокислый) осаждает
при долгом кипячении из солянокислого, азотнокислого или
сернокислого растворов селенистой кислоты красный селен,
постепенно переходящий в серый:
2NHzOH + H2SeO3 -> Se 4- NsO 4- 4Н2О.
л) Солянокислый гидразин выделяет из кислого (можно из
азотнокислого) и щелочного' раствора при нагревании сначала
красный, переходящий затем постепенно в серый, селен.
е) Иодистый калий и соляная кислота осаждают красный селен
на холоду (отличие от теллура).
Пользуясь этой реакцией, можно открыть 1 у селена, применяя ка-
пельный метод 1 2.
Кусочен фильтровальной бумаги смачивают каплей концентрированной
иодистоводородной кислоты (или раствором KJ и каплей •концентрирован-
ной соляной кислоты) и на средину влажного пятна наносят каплю кис-
лого исследуемого раствора. В присутствии селена появляется красновато-
бурое пятно, не исчезающее при смачивании раствором тиосульфата
натрия.
ж) Цинк осаждает из кислого раствора красный селен; цинк
покрывается селеном и выгладить так, как если бы он был по-
крыт медью.
3. Хлористый барий осаждает из нейтральных растворов селе-
нитов белый осадок селенита бария ВаБеОз, растворимый в раз-
бавленных кислотах.
4. Сернокислая медь при кипячении с растворами селенитов
щелочных металлов образует зелено-синий кристаллический оса-
док Си5еОз-2Н2О, не растворимый в водей растворимый в кисло-
тах (отличие от селеновой кислоты).
5. Тиомочевина CS(NH3)2 осаждает из холодных разбавлен-
ных растворов красный селен. На фильтровальную бумагу по-
мещают немного порошка тиомочевины, которую смачивают
каплей исследуемого раствора. При наличии селена выделяется
оранжево-красный селен. Таким путем можно обнаружить 0,1 у
селена. Нитраты и большие количества меди мешают реакции.
Теллур и висмут дают желтые осадки.
1 При очень большой концентрации серной кислоты, восстановление
селенистой кислсты очень замедляется или совсем не происходит.
2 N. S. Poluektoff, Mikrochemie 15, 32 (1934).
349
Б. Селеновая кислота
Следует употреблять раствор селеяовокислого калия.
1. Сернистый водород не дает осадка^ но при кипячении рас-
твора с соляной кислотой селеновая кислота восстанавливается
в селенистую, после чего выпадает осадок лимонножелтой смеси
селена и серы.
2. Хлористый барий дает белый осадок Селеновокислого бария
BaSaOi, не растворимый в воде и разбавленных кислотах, но
растворимый при кипячении с соляной кислотой, причем выде-
ляется хлор:
BaSeO; + 4HCI BaCh + HsSeCh + Ch + НгО.
3. Сернокислая медь не дает осадка.
4. Сернистая кислота и другие восстановители (за исключе-
нием гидразина, который при нагревании осаждает весь селен)
не восстанавливают селеновой кислоты; лишь при кипячении
с соляной кислотой происходит восстановление.
Исследование серной кислоты на присутствие селена по Драгендорфу1
Растворяют немного кодеина в концентрированной серной кислоте2 и
Прибавляют 5—6 капель исследуемой на присутствие селена серной кис-
лоты. Появление зеленого окрашивания характерно для селена.
Реакции сухим путем
Все селеновые соединения, смешанные с содой и накаленные
перед паяльной трубкой на угле, дают характерный запах гнилой
редьки.
При накаливании селенового соединения на асбестовой нити
в верхнем восстановительном пламени бунзеновской горелки
происходит восстановление до металла. Если непосредственно
под пламенем держать пробирку, наполненную холодной водой,
то на стенках ее образуется красный налет селена. Если теперь
пробирку ic налетом селена поместить в более широкую пробирку
с несколькими каплями концентрированной серной кислоты3
(предварительно опорожнив первую так, чтобы наружные стенки
ее не смочились), то селен растворится В' концентрированной
серной кислоте4 и раствор окрасится в зеленый цвет. От при-
1 Dragendorff, С. (1900), 944.
2 Раствор сернокислого кодеина должен быть свежеприготовленным,
в противном случае реакция может не удаться.
3 Серную кислоту предварительно несколько минут нагревают почти
до кипения в платиновом тигле, чтобы ее вполне обезводить, и затем охла-
ждают в эксикаторе над пятиокисью фосфора.
4 Медленно на холоду, быстро при нагревании.
60
бавления небольшого количества воды к раствору из последаегс
выделится красный селен (отличие от теллура);
SeSOa + Н2О -> Se + H2SO4.
зелеиогз цвета красный
Теллур Те. Ат. в. 127,61. Ат. н. 52
Плотность 6,1—6,4. Т. пл. 452°. Т. кип. 1390°
Нахождение в природе. Теллур еще менее распространен1 в природе,
чем 'селен; он обычно встречается в виде теллуристы-х соединений, боль-
шей частью благородных металлов1, например калаверит СиТе2, креннерит
и сильванит (Au, Ag)Te2, нагиагит—минерал сложного состава, содержа-
щий Pb, Au, Sb, S и Те, колорадоит HgTe и теллуристое серебро AgaTs;
далее, следы его находятся в свинцовом блеске и во многих медных рудах.
Эммонзит представляет собой теллурит окиси железа.
Свойства. Теллур —синевато-белое хрупкое вещество, перегоняющееся
в струе водорода. Теллур сгорает на воздухе с сине-зеленым пламенем
в двуокись теллура. Он не растворим в сернистом углероде и в соляной
кислоте и окисляется азотной кислотой в теллуристую кислоту. При
сплавлении с цианистым калием без доступа воздуха теллур превращается
в теллуристый каЛйй (теллурид калия):
2KCN + Те -> К2Те + (CN)2,
легко растворяющийся в воде, причем раствор окрашивается в вишнево-
красный цвет. При пропускании воздуха в этот раствор теллур осаждается
в виде черного порошка (отличие от селена):
2КаТе + 2НгО + О2 -> 4КО-Н + 2Те.
Таким путем его можно отделить от селена: для этого из водного рас-
твора сплава- обоих элементов с цианистым калием! осаждают теллур, про-
пуская в раствор воздух, а из фильтрата выделяют селен посредством НО.
Теллур образует два окисла: ТеОа и ТеОз.
Двуокись теллура, или ангидрид теллуристой кислоты ТеОг, предста-
вляет собой белое вещество, которое, плавясь при умеренном -прокалива-
нии, дает желтую жидкость. Двуокись теллура не возгоняется {отличие
от SeOa). Она почти не растворима -в воде, мало растворима в аммиаке
и разбавленных кислотах, напротив, легко -растворима в концентрированных
кислотах и едком кали. В умеренно концентрированной серной кислоте
ТеОз растворяется, образуя основную сернокислую соль TeaOs-SOi,
а в азотной кислоте с образованием основного -нитрата Те2Оз(ОН)МОз.
Эти соединения под влиянием воды претерпевают сильное гидролитиче-
ское расщепление, выделяя нерастворимую теллуристую кислоту, которая
тотчас отщепляет воду и дает ангидрид.
При растворении ТеОз в едком кали получается теллуристокислый ка-
лий КгТеОз. В воде растворяются только щелочные соли теллуристой
кислоты.
Трехокись теллура, или ангидрид теллуровой кислоты ТеОз, полу-
чается при иагревании Н2ТеОз. Ангидрид теллуровой кислоты—желтый
порошок, не растворимый в воде; он не растворяется в азотной кислоте и
почти не растворяется при кипячении в концентрированной НС1, но раство-
ряется при нагревании в концентрированном растворе едкого кали (но не
едкого натра), причем образуется теллуровокислый калий КгТеОа.
1 Эти теллуриды рассматриваются иногда как сплавы теллура с ме-
таллами.
551
Б. Селеновая кислота
Следует употреблять раствор селеновскислого калия.
it Сернистый водород ие дает осадка, но при кипячении' рай
твора с соляной кислотой селеновая кислота восстанавливаете#
в селенистую, после чего выпадает осадок лимонножелтой смеси
селена и серы. р
2. Хлористый барий дает белый осадок селеновокислого барне;
BaSeOi, не растворимый в воде и разбавленных кислотах, ио
растворимый при кипячении с соляной кислотой, причем выде,
ляется хлор:
BaSeOj 4- 4НС1 -> BaCh + FhSeCh + Ch + Н2О.
3. Сернокислая медь не дает осадка.
4. Сернистая кислота и другие восстановители (за исключе-
нием гидразина, который при нагревании осаждает весь селен)
не восстанавливают селеновой кислоты; лишь при кипячении
с соляной кислотой происходит восстановление.
Исследование серной кислоты на присутствие селена по Драгендорфу1
Растворяют немного .кодеина в концентрированной серной кислоте 2 i
-прибавляют 5—6 кашель исследуемой на присутствие селена серной кис-
лоты. Появление зеленого окрашивания характерно для селена.
Реакции сухим путем
Все селеновые соединения, смешанные с содой и накаленные
перед паяльной трубкой на угле, дают характерный запах гнилой
редьки.
При накаливании селенового соединения на асбестовой нити
в верхнем восстановительном пламени бунзеновской горелки
происходит восстановление до металла. Если непосредственно
под пламенем держать пробирку, наполненную холодной водой,
то на стенках ее образуется красный налет селена. Если теперь
пробирку с налетом селена поместить в более широкую пробирку
с несколькими каплями концентрированной серной кислоты3
(предварительно опорожнив первую так, чтобы наружные стенки
ее не смочились), то селен растворится в концентрированной
серной кислоте4 и раствор окрасится в зеленый цвет. От при-
1 Dragendorff, С. (1900), 944.
2 Раствор сернокислого кодеина должен быть свежеприготовленным,
в противном случае реакция может не удаться.
3 Серную кислоту предварительно несколько минут нагревают почти
до кипения в платиновом тигле, чтобы ее вполне обезводить, и затем охла-
ждают в эксикаторе над пятиокисью фосфора.
4 Медленно на холоду, быстро при 'нагревании.
£50
бав^ения небольшого количества воды к раствору из последнего
выделится красный селен (отличие от теллура):
SeSOs + Н2О Se 4- H2SO4.
зеленого цвета красный
Теллур Те. Ат. в. 127,61. Ат. н. 52
Плотность 6,1—-6,4. Т. пл. 452;'. Т. кип. 1390°
Нахождение в природе. Теллур еще менее распространен в природе,
чем селен; он обычно встречается в виде теллуристых соединений, боль-
шей частью благородных металлов1, например калаверит СиТе2, креннерит
и сильванит (Au, Ag)Te2, нагиагит — минерал сложного состава, содержа-
щий Pb, Au, Sb, S и Те, колорадоит Hg-Te и теллуристое серебро AgsTe;
далее, следы его находятся в свинцовом блеске и во многих медных рудах.
Эммонзит представляет собой теллурит окиси железа.
Свойства. Теллур—синевато-белос хрупкое вещество, перегоняющееся
в струе водорода. Теллур сгорает на воздухе с сине-зеленым пламенем
в двуокись теллура. Он не растворим в сернистом углероде и в соляной
кислоте и окисляется азотной кислотой в теллуристую кислоту. При
сплавлении с цианистым калием без доступа воздуха теллур превращается
в теллуристый калий (теллурид калия):
2KCN + Те -» КаТе + (CN)2,
легко растворяющийся в воде, причем раствор окрашивается в вишнево-
красный цвет. .При пропускании воздуха в этот раствор теллур осаждается
в виде черного порошка (отличие от селена):
2КгТе + 2HsO + О2 -» 4КОН + 2Те.
Таким путем его можно отделить от селена: для этого из водного рас-
твора сплава обоих элементов с цианистым калием. осаждают теллур, про-
пуская в раствор воздух, а из фильтрата выделяют селен посредством М€1.
Теллур образует два окисла: ТеОг и ТеОз.
Двуокись теллура, или ангидрид теллуристой кислоты ТеОг, предста-
вляет собой белое вещество, которое, плавясь при умеренном прокалива-
нии, дает желтую жидкость. Двуокись теллура не возгоняется (отличие
от SeOs). Она почти не растворима в воде, мало растворима в аммиаке
и разбавленных кислотах, напротив, легко растворима в концентрированных
кислотах и едком кали. В умеренно концентрированной серной кислоте
ТеОг растворяется, образуя основную сернокислую соль ТегОз • SOi,
а в азотной кислоте с образованием основного нитрата ТегОз(ОН)№Оз.
Эти соединения под влиянием воды претерпевают сильное гидролитиче-
ское расщепление, выделяя нерастворимую теллуристую кислоту, которая
тотчас отщепляет воду и дает ангидрид.
При растворении ТеОг в едком кали получается теллуристокнслый ка-
лий КаТеОз. В воде растворяются только щелочные соли теллуристой
кислоты.
Трехокись теллура, или ангидрид теллуровой кислоты ТеОз, полу-
чается при нагревании' НаТеСм. Ангидрид теллуровой кислоты — желтый
порошок, не растворимый в воде; .он не растворяется в азотной кислоте и
почти не растворяется при кипячении в концентрированной НС1, но раство-
ряется прч нагревании в концентрированном растворе едкого кали (но не
едкого натра), причем образуется теллуровокислый калий КгТеСЬ.
---------1-------
1 Эти теллуриды рассматриваются иногда как сплавы теллура с ме-
таллами.
551
Б. Селеновая кислота
Следует употреблять раствор селене®окислого калия.
1Т Сернистый водород не дает осадка^ но при кипячении1 рас-
твора с соляной кислотой селеновая кислота восстанавливается
в селенистую, после чего выпадает осадок лимонножелтой смеси
селена и серы.
2. Хлористый барий дает белый осадок селеновокислого бария
BaSeOi, не растворимый в воде и разбавленных кислотах, но
растворимый при кипячении с соляной кислотой, причем выде-
ляется хлор:
BaSeOj + 4НС1 -> BaCh + H2SeO2 + Cl2 + H2O.
3. Сернокислая медь не дает осадка.
4. Сернистая кислота и другие восстановители (за исключе-
нием гидразина, который при нагревании осаждает весь селен)
не восстанавливают селеновой кислоты; лишь при кипячении
с соляной кислотой происходит восстановление.
Исследование серной кислоты на присутствие селена
по Драгендорфу 1
Растворяют немного .кодеина в концентрированной серной кислоте 2 и
прибавляют 5—6 капель исследуемой на присутствие селена серной кис-
лоты. Появление зеленого окрашивания характерно для селена.
Реакции, сухим путем
Все селеновые соединения, смешанные с содой и накаленные
перед паяльной трубкой на угле, дают характерный запах гнилой
редьки.
При накаливании селенового соединения на асбестовой нити
в верхнем восстановительном • пламени бунзеновской горелки
происходит восстановление до металла. Если непосредственно
под пламенем держать пробирку, наполненную холодной водой,
то на стенках ее образуется красный налет селена. Если теперь,
пробирку ic налетам селена поместить в более широкую пробирку
с несколькими каплями концентрированной серной кислоты3
(предварительно опорожнив первую так, чтобы наружные стенки
ее не смочились), то селен растворится в концентрированной
серной кислоте4 и раствор окрасится в зеленый цвет. От при-
1 Dragendorff, С. (1900), 944.
2 Раствор сернокислого кодеина должен быть свежеприготовленным,
в противном случае реакция может ие удаться.
3 Серную кислоту предварительно несколько минут нагревают почти
до кипения в платиновом тигле, чтобы ее вполне обезводить, и затем охла.
ждают в эксикаторе над пятиокисью фосфора.
4 Медленно на холоду, быстро при нагревании.
50
бав,тения небольшого количества воды к раствору из последнего
выделится красный селен (отличие от теллура):
SeSOs + Н2О Se + H2SO4.
зеленого цвета красный
Теллур Те. Ат. в. 127,61. Ат. н. 52
Плотность 6,1—6,4- Т. пл, 452°. Т. кип. 1390°
Нахождение в природе. Теллур еще менее распространен в природе,
чем селен; он обычно встречается в виде теллуристых соединений, боль-
шей частью -благородных металлов1, например калаверит СиТе2, креннерит
и сильванит <Au, Ag)Te2, нагиагит—минерал сложного состава, содержа-
щий Pb, Au, Sb, S и Те, колорадоит HgTe и теллуристое серебро AgaTe;
далее, следы его находятся в свинцовом блеске и во многих медных рудах.
Эммонзит представляет собой теллурит окиси железа.
Свойства. Теллур — синевато-белое хрупкое вещество, перегоняющееся
в струе водорода. Теллур сгорает на воздухе с сине-зеленым пламенем
в двуокись теллура. Он не растворим в сернистом углероде и в соляной
кислоте и окисляется -азотной кислотой в теллуристую кислоту. При
сплавлении с цианистым калием без доступа воздуха теллур превращается
в теллуристый калий (теллурид калия):
2KCN + Те -> К2Те + (CN)2,
легко растворяющийся в воде, причем раствор .окрашивается в вишнево-
красный цвет. .При пропускании воздуха в этот раствор теллур осаждается
в виде черного порошка (отличие от селена):
2К2Те + 2НЮ + О2 -> 4КОН + 2Те.
Таким путем его можно отделить от селена: для этого из водного рас-
твора сплава, обоих элементов с цианистым калием; осаждают теллур, про-
пуская в раствор воздух, а из фильтрата выделяют селей посредством НС1.
Теллур образует два окисла: ТеОг и ТеОз.
Двуокись теллура, или ангидрид теллуристой кислоты ТеОа, предста-
вляет собой белое вещество, которое, плавясь при умеренном прокалива-
нии, дает желтую жидкость. Двуокись теллура не возгоняется (отличие
от Seda). Она почти не растворима в воде, мало растворима в аммиаке
и разбавленных кислотах, напротив, легко растворима в концентрированных
кислотах и едком кали. .В умеренно концентрированной серной кислоте
ТеОг растворяется, образуя основную сернокислую соль ТегОз • SOj,
а в азотной кислоте с образованием, основного нитрата Те2Оз(ОН)ЫОз.
Эти соединения под влиянием воды претерпевают сильное гидролитиче-
ское расщепление, выделяя нерастворимую теллуристую кислоту, которая
тотчас отщепляет воду и дает ангидрид.
При растворении ТеО> в едком кали получается теллуриртокислый ка-
лий КаТеОз. В воде растворяются только щелочные соли теллуристой
кислоты.
Трехокись теллура, или ангидрид теллуровой кислоты ТеОз, полу-
чается при иагревании НаТеОз. Ангидрид теллуровой кислоты—желтый
порошок, не растворимый >в воде; он не растворяется в азотной кислоте и
почти не растворяется при кипячении в концентрированной НС1, но раство-
ряется при нагревании в концентрированном растворе едкого кали (но не
едкого натра), причем образуется теллуровокислый калий КаТеОа.
1 Эти теллуриды рассматриваются иногда как сплавы теллура с ме-
таллами.
551
Теллуровая кислота H’TeOi • 2Н?О, представляющая собой весьма сла-
бую кислоту получается в виде бесцветной кристаллической массы при
окислении теллуристой кислоты хромовой кислотой с последующим оса-
ждением концентрированной азотной кислотой. Таким способом получен-
ная кислота, легко растворяющаяся в воде и не растворяющаяся в спирту,
превращается концентрированной соляной кислотой в теллуристую кис-
лоту, причем выделяется хлор. Теллуровая кислота легко растворяется
в едком кали и натре, образуя растворимые в воде теллуровокислые ще-
лочи, раствор которых имеет сильнощелочную реакцию.
При умеренном нагревании гидрата теллуровой кислоты получается без-
водная кислота HaTeOi в виде белого порошка, совершенно отличающегося
от кислоты, содержащей воду. В то время как водная кислота легко
растворяется в воде и щелочах и претерпевает полное восстановление
в теллуристую кислоту при кипячении с концентрированной соляной кис-
лотой, безводная кислота HaTeCh не растворяется в воде или в кипящем
едком натре, и только ничтожнейшие количества (следы) ее изменяются
при кипячении с концентрированной соляной кислотой, но она легко рас-
творяется при нагревании в едком кали .
В воде растворяются только щелочные соли теллуровой кислоты,
остальные представляют собой большей частью аморфные, растворимые
в кислотах осадки.
Реакции мокрым путем
А. Теллуристая кислота
Следует употреблять раствор теллуристокислого калия.
1. Сернистый водород осаждает из кислых растворов бурую
смесь теллура и серы2, легко (растворимую в (NH«)2S.
2. Восстановители, а) Сернистая кислота осаждает полностью
теллур в виде черного порошка только из разбавленного соляно-
кислого раствора (также и в присутствии винной кислоты);
напротив, из раствора, содержащего избыток соляной кислоты,
даже при кипячении SOs совсем не осаждает теллура (отличие
от селена). Для опыта1 следует употреблять соляную кислоту
плотностью 1,18. Из сернокислого раствора SO не выделяет
никакого осадка (отличие от селена).
б) Хлорид олова (2) тотчас осаждает черный теллур из не
слишком кислого раствора (отличие от селена). Растворы стан-
нита щелочного металла осаждают теллур как из растворов
теллуристой, так и теллуровой кислот.
в) Сульфат железа (2) не восстанавливает ни теллуристой, ни
теллуровой кислот (отличие от селена).
г) Солянокислый гидроксиламин (или сернокислый) не дает
осадка в растворах теллуристой кислоты в присутствии мине-
ральных кислот; напротив, весь теллур осаждается из аммиач-
ного раствора при продолжительном кипячении:
2NH2OH + ТеОз" + 2Н' -> 4Н2О + N;O + Те.
1 К. В. Н е b е г 1 е i n, Dissert. 1G5, Basel 1898.
'Pell ini, Chem. Zentr. 30, 790 (1909).
552
д) Солянокислый гидразин осаждает как из кислого, так и из
щелочного раствора при продолжительном кипячении весь тел-
лур в виде черного порошка:
N2H4 • 2НС1 + ТеОз" -> ЗН2О + № + Те + 2СГ.
е) Подпетый калий и соляная кислота не дают осадка, но обра-
зуют красно-бурое окрашивание, которое при разбавлении рас-
твора переходит в светложелтое (отличие от селена),
ж) Цинк (железо, сурьма, олово, кадмий, ртуть, свинец и медь)
осаждает черный теллур,
з) Фосфорноватистая кислота осаждает теллур как из теллури-
тов, так и из теллуратов.
и) Фосфористая кислота осаждает теллур только из концентри-
рованных растворов и совсем не осаждает из разбавленных
растворов на холоду.
3. Соляная,кислота образует белый осадок НгТеОз.
4. Фосфат натрия и хлорид бария выделяют белый осадок.
5. Хлористый магний (реактивный раствор) образует аморф-
ный осадок теллурита магния (с селенистой кислотой выделяется
кристаллический осадок селенита магния).
Б. Теллуровая кислота
Следует употреблять раство-р те.тлуровокислого калия.
1. Соляная кислота осадка не дает, но выделяет при кипяче-
нии хлор, и при разбавлении раствора водой осаждается теллу-
ристая кислота-
2. Сернистый водород и восстановляющие вещества дей-
ствуют при нагревании, как на НаТеОз. На холоду никакого
осадка не образуется (соли тяжелых металлов могут быть
отделены от теллура действием сероводорода на холоду).
3. Солянокислый гидразин осаждает из кислого или щелоч-
ного раствора при долгом кипячении весь теллур в виде чер-
ного порошка:
3(ЫгН4 • 2НС1) -ф 2ТеОФ ->8Н2О -ф 2Н’ -ф 6С1' -ф 3N2 -ф 2Те.
4. Свинцовые соли осаждают весьма трудно растворимую
свинцовую соль теллуровой кислоты.
* Добавление редактора. 5. Сульфат меди и персульфат калия.1
При нагревании щелочных растворов медных солей с теллуратом
щелочного металла, в присутствии персульфата калия или натрия
появляется интенсивная красно-бурая окраска раствора. В раз-
бавленных растворах окраска желтая. При этом происходит
образование комплексного аниона, составной частью которого
является трехвалентная медь2. Эта реакция дает возможность
открывать очень малые количества теллуровой кислоты.
'Feigl u. R. U z e 1, Mikrochemie 19, 32 (1936).
2 Braun er u. Kuzma выделили соединение Сю Оз • ЗТеОг • 2КзО •
• 13Н2О.
553
Выполнение. К капле исследуемого щелочного' раствора прибавляют
каплю раствора сульфата меди (1 :50 000), каплю 2Л1 едкой щело.чи и затем
немного твердого персульфата калия или нагория, после чего нагревают до
кипения. Появление желтой окраски указывает на присутствие теллуровой
кислоты. Эта реакция дает возможность открыть 0,5 т теллура (в виде
НвТеСь). Реакция позволяет открыть 1 у теллура ,в присутствии 500 7 селе-
новой кислоты. Подобно теллуровой кислоте реагирует также и иодная
кислота (см. стр. 453).
6. Уничтожение каталитического действия меди *. Окисление
солей закиси марганца гипобромитом натрия приводит к 'Обра-
зованию МпОг; в тех же условиях в присутствии солей меди,
являющейся катализатором, окисление идет до перманганата.
Каталитическое действие меди объясняется образованием трех-
валентной меди. Файгль и Узел нашли, что каталитическое
действие меди парализуется теллуровой, а также иодной кисло-
тами. На этом они основали еще более чувствительную, чем
предыдущая, реакцию на теллуровую кислоту.
Выполнение. К капле 'испытуемого раствора в маленькой! пробирке
прибавляют по капле растворов марганцовой и медной солей и каплю
гипобромита натрия. Одновременно ставится слепой опыт с реактивами и
каплей воды. Обе пробирки ставят на несколько минут в кипящую воду
или нагревают на, голом огне до кипения. В присутствии теллуровой
(а также иодной) кислоты испытуемый раствор остается бесцветным или
окрашенным в желтоватый цвет, раствор же слепого опыта приобретает
ясную окраску перманганата. С помощью этой реакции можно открыть
0,2 г теллура (в виде НвТеОв) в капле (предельная концентрация 1 :250 000).
Реакция позволяет открыть 2,5 7 теллура в присутствии 20 000-кратного
количества селеновой кислоты. * А. К.
Реакции сухим путем
При нагревании любого теллуристого соединения ® верхнем
восстановительном пламени образуется металлический теллур,
который можно получить на наружной поверхности пробирки,
наполненной водой, в виде черной пленки, растворимой в кон-
центрированной серной кислоте. Получающийся, раствор окрашен
в карминовокрасный цвет (отличие от селена); от прибавления
воды выделяется черный теллур:
TeSOs + Н2О -> Те + H2SO4.
карминовокрасного чермый
цвета
Германий Ge. Ат. в. 72,60. Ат. н. 32
Плотность 5,35. Т. пл. 916° на воздухе, 958°—® водороде; превращается
в GeO при 1250°
Нахождение в природе. Германий был открыт Винклером (Winkler)
в 1886 г. в минерале аргиродите 4AgsS • GeSa, впервые изученном Вельсба-
хом (Welsbach) в 1885 г. Винклеру, анализировавшему этот минерал, уда-
лось установить, что он содержит кроме серебра и серы около 6—7%(
одного нового элемента, свойства которого были предугаданы Менделее-
ве i g 1 u. LJ z е 1, ibid.
554
вым в его периодической системе элементов и который был назван им
экасилицием. Этот элемент был найден также в одном южноафриканском
минерале, названном германитом. Обычно его получают путем перегонки
остатков, образующихся при обжиге цинковых руд (цинковой обманки).
Свойства. Германий принадлежит к четвертой группе периодической
системы элементов и занимает место между кремнием и оловом,. Его окись
GeOs дает с холодной водой коллоидный раствор, который при нагревании
переходит в истинный раствор, имеющий слабокислую реакцию, что указы-
вает на существование германиевой кислоты FhGeOs. Подобно- гидроокиси
олова гидроокись германия амфотерна, образуя соли как с кислотами, так
и с основаниями.
Соединения. Сульфид германия GeSs белый, тонкий порошок, может
быть получен при действии HsS на водный раствор окиси. Сульфид за-
метно растворяется в воде и легко растворяется в растворах едких или
сернистых щелочей.
Фторид германия GeFi известен -в виде гигроскопических кристаллов
гидрата GeF< • ЗН2О, а также в виде солей кислоты HsGeFe.
Четыреххлористый германий Ge-CU является жидкостью, кипящей
при 75°, с плотностью 1,87; водой медленно гидролизуется.
Четырехбромистый германий GelBn бесцветен и кипит при 186°, Четы-
рехиодистый германий — красный порошок, плавящийся при 144°.
Двуххлористый германий GeCh — бесцветная жидкость, дымящая на
воздухе и .окрашивающая корковую пробку в красный цвет. Раствор его
в соляной- кислоте является сильным восстановителем.
Германиевый хлороформ G^H-Cls1 получается при пропускании HCl-газа
над слегка нагретым германием, растертым в порошок. Он представляет
собой жидкость, кипящую при 75° и имеющую плотность 1,39; водой она
гидролизуется, образуя Се(ОН),г:
Ge + ЗНС1 -> СеНС1з + Н2;
GeHCls + 2НгО -> Ge(OH)2 + 3HCI.
Аналитическая характеристика. Для отделения германия от других эле-
ментов Нойес и Брей рекомендуют следующий прием. Около 1 г твердого
вещества кипятят в течение 10 мин. с 10 мл 9 А НВг, причем дестиллат
собирают в насыщенный раствор брома. Дестиллат вместе с бромом выли-
вают затем обратно в дестилляционную колбу и перегоняют до тех пор,
пока объем жидкости в последней не уменьшится до 3 мл. Дестиллат
собирают в приемник с 5 мл насыщенного раствора брома. Приемник охла-
ждают в ледяной воде. При таких условиях -из дестилляциснной колбы
перегоняются практически полностью AsBrs, SelBr« и GeBr«.
К дестиллату прибавляют 1-молярный раствор метабисульфита, натрия
NasSsOs2 до тех пор, пока избыток Вг2 не -будет почти весь удален (но. не
полностью), после чего осаждают селен путем кипячения с 1 мл 3-моляр-
ного раствора солянокислого гидроксиламина NH2OH • НО.
Отфильтровав выделившийся селен, осаждают в фильтрате мышьяк и
германий сероводородом в виде сульфидов. Последние растворяют в пла-
тиновой или бакелитовой3 чашке в 6—8 мл 6N аммиака, прибавляют 2/з
(по объему имеющейся жидкости) 27N HF и снова пропускают H2S; при
этом выпадает желтый осадок сернистого мышьяка. Фтористоводородная
кислота превращает германий- в FBGeFe, анион которой GeFe" настолько
1 Так названо это соединение по аналогии с углеродистым соедине-
нием хлороформом СНСЬ. Ред.
2 Кроме Na«SOs и NaHSOs существует еще «пиро»-фарма сульфита
NaaSaOj. Эта'соль в продаже называется «метабисульфитом». Она отли-
чается своей большой устойчивостью и рядом других химических свойств
-от обыкновенного сульфита. Ред.
3 Баке лит—пластическая масса, получающаяся путем конденсации
формальдегида с фенолами посредством едких щелочей. Кислоты, в част-
ности HF, на бакелит не действуют, ред.
555
устойчив, что он не реагирует с H?S, хотя в растворе, содержащем другие
минеральные кислоты, GeSs может образоваться. По удалении сульфида
мышьяка фильтрованием приступают к удалению всего фтора путем вы-
паривания (до появления белых паров) с 10 мл ISA H2SO4. Затем, п-ри-
бавив 25 мл воды и насытив НгБ-газом, получают в случае присутствия
германия белый осадок GeSs.
Лучшая реакция для идентификации германия состоит в следующем.
Осадок GeSa растворяют в небольшом количестве 3N NHiOH в платиновом
тигле, выпаривают досуха и нагревают с небольшим количеством HF. При
этом образуется FhGeFe. Если раствор непрозрачен, его отфильтровывают
от выделившейся серы, пользуясь бакелитовой воронкой, и выпаривают пол-
ностью досуха для удаления кремневой кислоты. Если после этого при-
бавить 10 капель HF, 10 капель &N .раствора КгСОз и 1 мл воды и на-
греть до кипения, то получается прозрачный осадок KaGeFe серовато-белого
цвета, вязкой консистенции:
3GeS2 + 6NH4OHt=;[GeO3]" + 2[GeS3]" + + 3HsO;
GeSa + SHF HaGeFe + 21H2S.
Германий легко спутать с мышьяком при реакции Марша.
* Добавление редактора. Открытие германия посредством молибдено-
вой кислоты и бензидина1. Германий подобно кремнию и фосфору обра-
зует комплексные соединения с молибденовой и вольфрамовой кислотой,
а именно HetGefMoaOM и Hs[Ge(\V2O7)e]. Эти кислоты обладают подобно
аналогичным комплексным соединениям кремневой и фосфорной кислот
повышенной окислительной способностью. Так, бензидин, не окисляющийся
молибденовой кислотой, окисляется в присутствии кремневой кислоты.
Поэтому многие реакции кремневой и фосфорной кислот, основанные на
образовании подобных комплексных соединений, присущи также и герма-
ниевой кислоте и могут быть использованы для открытия германия ка-
пельным методом.
Выполнение. К капле щелочного или слабокислого испытуемого раство-
ра в фарфоровой чашечке или на кусочке фильтровальной бумаги приба-
вляют по одной капле молибденового реактива (1,5 г молибдата аммония,
растворенного в 10 мл концентрированной азотной кислоты) и 0,1%-ного
уксуснокислого раствора бензидина; затем для уменьшения кислотности
прибавляют несколько капель насыщенного раствора ацетата натрия или,
если реакция производится на бумаге, подвергают последнюю действию
аммиачных паров. В присутствии германия появляется синее окрашивание
вследствие образования молибденовой и бензидиновой сини. Таким путем
можно открыть 0,25 Г Ge в 0,025 мл.
Об определении германия в присутствии SiOs и РаОз, а также мышьяка
и селена, понижающих чувствительность реакции на германий, см. ориги-
нальную работу авторов. Там же дается метод определения германия
в рудах, минералах и т. п. * А. К.
Золото Au. Ат. в. 197,2. Ат. н. 79
Плотность 19,33. Т. пл. 1063°
Нахождение в природе. Золото обыкновенно встречается в свободном
состоянии в кварцевых жилах и в речных песках. В виде теллуристого
золота оно находится в сильваните (Au, Ag)Te» и в нагиагите — сложном
по составу минерале, содержащем Pb, Au, Те, S и Sb; в малых количе-
ствах его находят во многих пиритах и в других сульфидных рудах.
Свойства. Чистое золото — металл желтого цвета; плавясь, оно не окис-
ляется. Оно не тускнеет от воды или сернистого водорода и не раство-
ряется ни в одной 'из кислот, взятых в отдельности. Поэтому его назы-
вают благородным .металлом. Золото представляет собой наиболее ковкий
3А. S. Ко m а г о wsk у u. N. S. Poluektoff, Mikrochemie 18, 66
(1935). " '
556
металл, могущий дать листочки толщиной 10-4 лги, которые пропускают
свет с синевато-зеленой окраской, но сохраняют в отраженном свете жел-
тый цвет.
Растворителем для золота является царская водка; оно растворяется
также в бромной или хлорной воде с образованием тригалоидного со-
единения:
2Au + 2HNOs + 6НС1 -> 4НгО + 2AuCb +2NO;
2Au + ЗВг” -> 2АиВгз.
Очень легко растворяется золото в смеси цианистого калия и пере-
киси водорода:
2Au + 4CN' + НзОг -> 2[Au(CN)4]' + 2ОН'.
Таким путем1 осадок золота, выделенного на платиновом электроде,
может быть количественно переведен в раствор.
Золото растворяется также и в одном цианистом калии при доступе
кислорода воздуха (процесс технического получения золота).
Золото образует два окисла:
Аи2О и Аи.,О3
закись золота окись золота
Оба окисла крайне неустойчивы и уже при слабом накаливании диссо-
циируют на металл и кислород (свойство, общее всем «благородным»
металлам).
Все соли золота малоустойчивы. Даже наиболее устойчивый среди них
хлорид АиС1з превращается при слабом нагревании в желто-белый AuCl:
АиС1з-> AuCl + Ch.
При более сильном прокаливании теряется и третий атом хлора и
золото остается в виде металла желтого цвета.
Соли. В воде однохлористое золото аналогично хлористому серебру,
не растворимо. При кипячении однохлористое золото превращается в трех,
хлористое золото с выделением металлического золота. Эта реакция
медленно протекает и на холоду. Этому процессу весьма благоприятствует
присутствие соляной кислоты благодаря происходящему образованию золо-
тохлористоводородной кислоты:
ЗАчС! -> АиС1з -j- 2Аи;
AuCls + НС1-» H[AuCh],
Так как при растворении золота в окисляющих растворителях всегда по-
лучаются соли трехвалентного золота, то только они имеют аналитическое
значение.
АиС1з может быть извлечено из водного раствора, содержащего очень
небольшой избыток НС1, серным эфиром или этиловым эфиром уксусной
кислоты. Последний растворитель предпочтительнее, потому что в нем
растворяются и АиС1з и HgCh. Если уксусноэтиловый экстракт взболтать
с 3N NHiCl, то почти вся HgCh и только весьма незначительное количество
АиС1з перейдут в водный раствор. Таким путем возможно отделение золота
от ртути, а также отделение этих металлов от платиновых металлов.
Соли трехвалентного золота большею частью желтого цвета и легко
растворимы в воде. Сульфид черного цвета и растворим только в царской
водке.
Соединения трехвалентного золота
Реакции мокрым путем
Для этих реакций следует употреблять раствор золотохлористоводород-
ной кислоты H[AuCh],
1. Едкие щелочи. При прибавлении по каплям едкого
кали к концентрированному раствору хлорного золота обра-
557
зуется объемистый красно-бурый осадок гидрата окиси золота
Аи(ОН)з, совершенно сходный по виду с гидратом окиси железа.
Если прилить больше едкого кали, то гидрат окиси золота рас-
творяется с образованием аурата калия:
[AuCh]'+ ЗОН'-> Аи(ОН)з + 4СГ;
Аи(ОН)з + ОН' -> [АиОг]' + 2НгО.
Если осторожно подкислить светложелтый раствор аурата
калия азотной кислотой, то выпадает золотая кислота (красно-
бурого цвета), растворимая в избытке азотной кислоты; при раз-
бавлении и кипячении большая часть ее снова выпадает.
Обычно едкое кали не дает осадка в растворах хлорного
золота, потому что последние обыкновенно применяются на-
столько разбавленными, что количество прибавляемой едкой
щелочи обыкновенно бывает достаточным, чтобы сразу обра-
зовался аурат.
2. Аммиак осаждает желтоватую смесь иминохлорида золота
и иминоамида золота:
АиС1з + 3NH3 -> 2NH1C1 + Au(NH)Cl;
AuCh + 5NH3-> 3NH1C1 + Au(NH)NH2,
которая в сухом виде взрывает при нагревании или при ударе
(гремучее золото)Ч
Для открытия золота наиболее важными являются реакции,
основанные на свойстве соединений трехвалентного золота крайне
легко восстанавливаться. Соединения трехвалентного золота
относятся к сильным окислителям.
3. Мышьяковистый и сурьмянистый водород осаждают пол-
ностью золото:
2Ац- ’ ' + АэНз + ЗНеО -> НзАзОз + 6Н’ + 2Аи.
4. Бензидин Ci2Hs(NH2)2 окисляется трехвалентным золотом
с образованием синего красящего вещества1 2 (стр. 222). Реакция
очень чувствительна и с ее помощью можно открыть 0,02 у зо-
лота. Для этого каплю испытуемого раствора и каплю
0,05%-ного раствора бензидина в 10%-ной уксусной кислоте на-
носят на фильтровальную бумагу. В присутствии золота по-
является синее окрашивание.
5. р-Диметиламинобензилиденроданин3 дает красно-фиолето-
вый осадок. Серебро, ртуть и палладий должны отсутствовать,
1 Rasch ig, Ann. Chem. Pharm. 235, 325 (1886).
2 Mol ate st a, Di N о 1 a, Bull. chim. farm. 52, 461 (1913); N. T а па-
па e f f, Dolgow, Chem, Zentr. (1930) 1, 2190.
3 Holzer, Mikrochemie 8, 275 (1930); Feigl, Krumholz, R a j-
m a n n, Mikrochemie 9, 165 (1931).
558
так как они также дают >с этим реактивом1 окрашенные соеди-
нения (см. стр. 121).
Выполнение. Фильтровальную бумагу смачивают насыщенным спирто-
вым раствором р-диметиламинобензилиденроданина и высушивают. На вы-
сушенную бумагу помещают каплю нейтрального’ или слабокислого испы-
туемого раствора. Уже 0,1 у золота образует фиолетовое пятно или
кольцо. Предельная концентрация 1 : 500 000.
6. Сульфат железа (2), а также щавелевая кислота осаждают
золото из нейтрального раствора даже при обыкновенной тем-
пературе (отличие от платины):
H[AuCh] + 3Fe' ’ 3Fe’ ’* + Н’ + 4СГ + Au;
2H[AuCh] + ЗН2С2О4 -> 8H’ -J- 8СГ + 6CO2 + 2Au.
7. Муравьиная кислота осаждает золото из горячего хлорно-
кислого (НС1СН) раствора:
2H[AuCh] + ЗНСООН -> ЗОО2 + 8НС1 + 2Аи.
Этот реактив полностью осаждает также ртуть, платину и пал-
ладий и некоторые количества иридия, родия и серебра. (В схеме
анализа, предложенной Нойес и Брэй, эти металлы составляют
группу золота).
8. Перекись водорода 1 тотчас осаждает золото из щелочного
раствора в виде тонко раздробленного металла:
2 Ап • ’ • + ЗН2О2 4- 6ОН' -> 6Н2О 4- 30г 4- 2Аи.
Осажденный металл кажется в отраженном1 свете буровато-
черным и в проходящем синевато-зеленым; достаточно 0,03 мг
золота в 10 мл жидкости, чтобы получилась красноватая окраска
с синеватым отсветом.
9. Сернистый водород осаждает из растворов золота на хо-
лоду черное двусернистое золото:
2Аи’ ’ ’ + 3H2S ->6Н’ 4- S 4- AuaS2.
Сернистое золото не растворимо в кислотах, но легко рас-
творимо в царской водке с образованием хлорного золота АиС1з.
Двусернистое золото трудно растворимо в сернистом аммонии и хорошо
растворяется в полисульфиде калия с образованием тиос.оли:
AusSs + K2S2 -» SKAuSa.
Из этого раствора соляная кислота осаждает желтовато-бурый сульфид:
2KAuS2 4- 2Н- -> 2К- + H2S + Au£Ss(?).
Из горячего раствора сернистый водород осаждает бурое
металлическое золото:
8Au • ‘ • 4- ЗНгЗ + 12Н2О -> ЗОН' + 3804" + 8 Au.
1 Vanino u. £ е е m a n п, В. 32, 1968 (1899).
□59
Тонко раздробленное металлическое золото растворимо в полисуль-
фиде калия или натрия с образованием тиосоли:
2Au + K2S4 ->2KAuS2.
10. Иодистый калий, прибавленный к разбавленному щелоч-
ному раствору, выделяет осадок золота:
2Au” ’ + 6J% 3J2 + 2Au.
11. Хлористое олово легко восстанавливает растворы золота
до металла:
2Au ’ ‘ + 3Sn ’ ’ 2Au + 3Sn ‘' Ч
Внешний вид образующегося при этом осадка меняется в зависимости
от условий опыта. Если реакция протекает в концентрированном, сильно
подкисленном соляной кислотой растворе, то осадок состоит из чистого
тонко раздробленного золота с его характерной бурой или черно-бурой
окраской. Напротив, когда реакция протекает в очень разбавленных слабо
подкисленных растворах, то получают розовые или пурпурнокрасиые
осадки (кассиев золотой пурпур), представляющие собою адсорбционную
смесь коллоидного золота и гидрата окиси слова1 2. В очень разбавленном
растворе хлорное олово, образующееся согласно с вышеприведенным ура-
внением, подвергается гидролитическому расщеплению на хлористый водо-
род и коллоидный гидрат окиси олова, который и выпадает вместе с кол-
лоидным золотом в виде адсорбционного соединения.
Скоагулированный кассиев пурпур растворяется в аммиаке и в очень
разбавленном растворе едкого кали. Раствор окрашен в красный цвет. На
холоду такие растворы сохраняются продолжительное время совершенно
прозрачными и даже могут быть нагреваемы до кипения1 без разложения;
при значительной концентрации часть кассиева пурпура выделяется в виде
хлопьев, которые, однако, снова растворяются, если ввести избыток
аммиака.
Реакция с хлористым оловом очень чувствительна: в присутствии 0,3 мг
золота, растворенного в 100 мл жидкости, появляется явственная бурая
окраска; при -меньшем количестве золота жидкость окрашивается в жел-
тый цвет.
12. Сернистая кислота восстанавливает растворы золота:
2Аи’ ’ ’ + 3SOa + 6Н2О -> 12Н’ '+ 3SO4" + 2Au.
13. Цинк. Следующая реакция на золото является весьма
чувствительной3; к нескольким каплям разбавленного раствора
золота прибавляют несколько капель раствора мышьяковой
кислоты, 2—3 капли раствора хлорного железа и 2—3 капли
соляной кислоты и разбавляют до 100 мл. Каплями этого рас-
твора обливают кусочек цинка. Раствор вокруг последнего при-
обретает пурпурную окраску, которая при передвижении цинка
в растворе распространяется по всей жидкости, окрашивая ее
в розовый или пурпурный цвет. Если раствор содержит 0,03 мг
золота, то в течение 15 мин. он приобретает красивый красно-
ватый цвет.
Кроме вышеприведенных реактивов имеется еще ряд других,
например муравьиный альдегид в присутствии едких щелочей,
1 D б г i n g, Chem. Zentr. (1900) I, 735.
2 Zsigmondi, Ann. Chem. Pharm. 301, 361 (1898).
3 Pharm. Chem. Zbl. 27, 321.
560
сульфат гидразина, которые способны восстанавливать золото
из его растворов.
Реакции сухим путем
Все соединения золота, прокаленные с содой на обугленной
палочке, дают ковкий металлический королек, растворяющийся
только в царской водке. Раствор в этом реактиве должен быть
выпарен, остаток растворен в воде и испытан реакциями с хло-
ристым оловом, перекисью водорода, цинком или иодистым
калием.
Отрытие золота в сплавах и рудах
Ввиду мягкости золота последнее всегда сплавляют с серебром и медью,
если им желают пользоваться для чеканки монет и для ювелирных изде-
лий. При обработке такого сплава азотной кислотой медь и серебро
растворяются, золото же обыкновенно остается в виде буроватого по-
рошка. Для испытания на присутствие золота раствор фильтруют через
маленький фильтр, высушивают его, затем сворачивают его в трубку и обма-
тывают последнюю платиновой проволокой. Поднеся огонь к бумаге, дают
ей медленно сгореть. Зола не должна слишком сильно накаляться, в про-
тивном случае золото может расплавиться и дать сплав с платиновой про-
волокой. Золу сплавляют с небольшим количеством соды на обугленной
палочке; пря этом золото получается в виде королька с характерной жел-
той окраской. В агатовой ступке золотой королек расплющивают в листо-
чек, переносят его на часовое стекло и растворяют в небольшом количе-
стве царской водки, причем образуется хлорное золото. Раствор осторожно
выпаривают досуха, остаток растворяют в небольшом количестве воды, при-
бавляет разбавленный раствор хлористого олова; присутствие золота
узнается по образованию кассиева золотого пурпура. Еще более чувстви-
тельны реакции с перекисью водорода и с цинком.
Когда дело идет об открытии очень малых количеств золота (например,
во многих медных монетах), вышеприведенный метод непригоден. Для
таких испытаний золото и серебро извлекают путем шлакования и купе-
ляции.
Поступают при этом следующим образом. 5—<10 г (иногда и больше)
меди, содержащей золото, сплавляют приблизительно с 120 г чистого свинца
в плоской чашке из огнеупорного камня в муфельной печи при доступе
воздуха. При этом медь и часть свинца окисляются до окиси, образующей
с кремнеземом чашки легкоплавкий шлак. Последний покрывает собою
неокисленную часть свинца, в котором растворены золото и серебро. Такую
операцию называют «первой проплавкой пробы». После этого расплавлен-
ную массу выливают в полу шаровидное углубление, находящееся в желез-
ном листе, предварительно покрыв его слоем мела1. Как только масса
охладилась, ударами молотка иа наковальне освобождают от шлака свинцо-
вый королек и взвешивают его. После этого его переносят в «купель»
(плоский тигелек из костяной золы) равного или несколько большего веса,
чем королек, и снова нагревают В’ муфельной печи при доступе воздуха.
Свинец плавится и окисляется; образовавшаяся окись свинца, плавящаяся
при 980°, частью всасывается порами купели, частью улетучивается, между
тем как королек, состоящий из серебра и золота, остается на купели. Вы-
ковав из королька ударами молотка пластинку, обрабатывают ее азотной
кислотой, причем серебро растворяется, а золото остается большей частью
в виде бурого порошка. Фильтруют, сушат и плавят на обугленной палочке
1 Железо покрывают мелом, чтобы вылитый на него свинец не приста-
вал к нему. Еще лучше для этой цели покрыть железо тонким слоем
воска.
36 Зав. 982. Тредвелл-Голл, т. I. 561
(содовой), как указано выше. Если полученный путем купелирования сплав"
золота и серебра содержит на одну часть первого три части второго дк
при отделении азотной кислотой золото остается в виде бурой тонкой,’как
бумага, сплошной массы, отвердевающей после прокаливания и принимаю,
щей характерную желтую окраску. Если отношение серебра к золоту
больше, чем 3 : 1. то отделение серебра от золота посредством азотной кис-
лоты бывает полное, и золото остается в виде порошка. При отношении
же серебра к золоту меньше, чем1 3:1, отделение этих металлов азотной
кислотой неполное, и обработанный золотой листочек выглядит большей
частью желтым и содержит еще серебро. В этом случае прибавляют еще
серебра и купелируют снова с 1 г свинца, после чего отделение становится
полным. I
Точно таким же образом открывают небольшие количества золота
в рудах.
Если под рукой нет муфельной печи, то приходится прибегнуть к более
сложному способу открытия золота, а именно—мокрым путем. Чтобы до-
казать, например, присутствие золота в пиритах, значительное количество
руды обжигают на воздухе до полного сгорания серы, обливают затем
бромной водой и оставляют на 12 час. в темноте. По истечении этого вре-
мени раствор, содержащий теперь все золото в виде бромного золота,
фильтруют, кипятят для удаления избытка брома, прибавляют железный
купорос и немного серной кислоты, снова кипятят и фильтруют через
маленький фильтр, который после промывки и просушки сжигают, и полу-
ченную золу сплавляют на обугленной палочке (содовой). Таким путей
могут быть с точностью открыты количества золота меньше 0,1 мг.
ПЛАТИНОВЫЕ МЕТАЛЛЫ
ПЛАТИНА, ПАЛЛАДИЙ, РОДИЙ, ОСМИЙ, РУТЕНИЙ
И ИРИДИЙ
Платина Pt. Ат. в. 195,23. Ат. н. 78
Плотность 21,5. Т. пл. 1771°
Нахождение в природе. Платина встречается в природе в самородном
состоянии, обыкновенно с доугими сопутствующими ей, так называемыми,
платиновыми металлами.
Свойства. Платина — серовато-белый металл, который в тонко раздро"
бленном состоянии кажется черным (платиновая чернь). Чистая платина
мягче серебра; примеси других металлов, особенно иридия, делают ее
более твердой. Она несколько менее ковка, чем золото или серебро. Губ-
чатая платина образуется при прокаливании хлороплатината аммония.
Тонко раздробленная платина (платиновая чернь, губчатая платина) обла-
дает способностью оказывать каталитическое воздействие, на многочислен-
ные реакции: гидрогенизацию масел, контактный процесс производства
серной кислоты из SO» и кислорода, окисление спиртов и ряда других
органических соединений, соединение водооода с хлором и т. п. Мине-
ральные кислоты обыкновенно не оказывают никакого действия на пла-
тину; она растворяется в царской водке,' образуя платинохлористоводород-
ную’кислоту HtiPtCk' (но не хлорную платину’ PtCU). Отчасти платина
растворяется в кипящей концентрированной серной кислоте; так, при кипя-
чении последней в платиновой -чашке каждые 10 мл ее растворяют в тече-
ние 10 мин. 3,8 мг платины. Сплав платины с достаточным количеством
серебра растворяется в азотной кислоте с образованием бурого раствора.
Подобно олову платина образует два окисла: закись платины PtO и окись
платины РЮз.
Соединения платины. Оба окисла могут быть получены при очень
осторожном прокаливании соответствующих гидроокисей. Они чрезвычайно
неустойчивы и разлагаются уже при умеренном прокаливании на металл и
кислород; аналогично ведут себя все остальные платиновые соединения.
Наиболее важными из них являются хлориды платины. При раство-
рении платины в царской водке получается всегда платинохлористоводо-
родиая кислота, из которой могут быть получены1 тетра» и дихлориД пла-
тины; соединяясь с соляной кислотой, они образуют комплексные кислоты;
PtCh’+2НС1 -> Ha[PtCle] (платинохлорнстоводородиая кислота — оран-
жево-красные кристаллы);
PtCh + 2НС1-> HatPtCk] (платинистохлористов о дородная кислота — из-
вестна только в растворе).
Водный раствор платинохлористоводородной кислоты желтоватооран-
жевого цвета; раствор платинистохлористоводородной кислоты, содержащей
то же количество платины, темнобурого цвета.
Калиевая и аммониевая соли платинистохлористоводородной кислоты
растворимы в воде; соответствующие соли платинохлористоводородной
кислоты трудно растворимы в воде и не растворимы' в 76%-ном спирту.
Соединения четырехвалентной платины
Реакции мокрым путем
Для реакций следует употреблять раствор платинохлористоводородной
кислоты.
1. Хлористый аммоний и хлористый калий дают желтые
кристаллические осадки (стр. 322 и 310):
[PtCle]" + 2NH4 • -> (NHUh [Ptde]; [PtCl8] " + 2К' -> К2 [PtCI#]',
которые заметно растворимы в воде. В нижеследующей таг
блице дана растворимость щелочных солей платинохлористо-;
водородной кислоты:
Таблица 21
Соли Граммы и 100 мл Мол. концентрация насыщенных растворов
K?PtCl9 0,852 1,7.10-’
(NH4),PtCl6 0,67 1,5-10-’
Rb,PtCle 0,028 4,9-10-*
Cs2PtCie 0,0086 1,3-10-*
Растворимость уменьшается от прибавления спирта; так,
например, растворимость KaPtCle в 10%-ном спирте падает на-
половину, в 50%-HOMi спирте —до ’/го.
Реакцией с NHiCl или КС1 пользуются для отделения пла-
тины и иридия от золота, палладия и родия. Чтобы открыть,
имеется ли в> красноватом осадке, полученном при действии
NH«C1, желтый (NH*)2PtCle и черный (NH^IrCle, осадок обра-
батывают 10 мл концентрированной НС1 и 0,5 мл концентриро-
ванной HNOs в течение 15 мин. при 90°, прибавляя время от вре-
мени понемногу HNO3. Выпаривают на водяной бане до
36» 563
исчезновения запаха кислоты, прибавляют 5 мл воды и 2 мл
молярного раствора NaHCOs. Нагревают в водяной бане 5 мин.
и, если раствор не показывает щелочной реакции по лакмусу,
прибавляют еще NaHCOs. Охладив несколько, прибавляют 1 мл
бромной воды и еще немного гидрокарбоната, затем нагревают
10 мин. Образующийся NaBrO осаждает иридий в виде черной
1гО2. Фильтруют, (подкисляют НС1, выпаривают досуха и убе-
ждаются в присутствии платины, повторив реакцию с NHrCl.
2. Бромистый калий дает с (платинохлористоводородной кис-
лотой сначала желтый осадок K2PtCle. При кипячении с кон-
центрированным раствором бромистого калия хлор замещается
бромом. При охлаждении выделяется K2PtBre в виде яркокрас-
ного осадка. Осадок образуется также при растворении свеже-
осажденного гидрата двуокиси платины в разбавленной бромисто-
В'одородной кислоте с последующим добавлением бромистого
калия.
3. Сернистый водород осаждает бурую двусернистую платину
весьма медленно на холоду и быстро при нагревании:
H2[PtCle] + 2H2S-> 6НС1 + PtS2.
Сернистая платина не растворима в минеральных кислотах,
но легко растворима в царской водке. Она трудно растворима
в растворах моносульфидов щелочных металлов, но более легко
растворима в полисульфидах щелочных металлов с образова-
нием тиосоли. Последняя разлагается кислотами с выделением
Осадка сульфида платины.
4. Йодистые щелочные металлы. Иод-ион вытесняет хлор из
аниона платинохлористоводородной кислоты с образованием тем-
ного красно-бурого иона [PtJe]". Для1 полного вытеснения
хлор-иона по уравнению:
[PtCle]" + 6J'-> [PtJe]" + 6СГ
необходим избыток иод-иона. Эта реакция, требующая для ее
завершения некоторого времени, весьма чувствительна. При кон-
центрации в 10-4 моля в литре появляется еще желтое окрашива-
ние при нагревании в течение нескольких минут. Реакция наи-
более чувствительна в слабом минеральнокислом растворе. Серо-
водород, сульфиты и тиосульфаты как восстановители мешают
реакции, также мешает реакции хлорная ртуть вследствие обра-
зования с иод-ионом комплексного соединения.
5. Цианистый калий. Циан-ион вытесняет при долгом кипя-
чении хлор-ион из хлорплатината, причем происходит обесцве-
чивание раствора. Поэтому циан-ион препятствует вышеприве-
денным реакциям.
6. Азотистокислые щелочи. Нитрит-ион ведет себя подобно
циан-иону. Он вытесняет при продолжительном нагревании хлор-
ион из хлороплатината. Поэтому вышеприведенные реакции не
выполнимы в присутствии КОг'-иона.
7. Восстановители легко1 восстанавливают соли четырехва-
лентной платины до металла. В зависимости от выбранного вос-
664
становителя и условий опыта получают либо порошкообразную
платину в легко отфильтровываемой форме, либо в виде кол-
лоидной суспензии с окраской от бурого до черного цвета.
Осторожное восстановление на холоду благоприятствует обра-
зованию коллоидного осадка платины. Удается также восстано-
вление доводить лишь до двухвалентной платины.
а) Цинк, кадмий, алюминий и т. п. особенно легко восстанавли-
вают соли четырехвалентной платины в слабокислом растворе
до металла, выде ;пощегося в виде тончайшего порошка, легко
проходящего при промывании водой через фильтр.
Можно получить прозрачный фильтрат, если промывание ве-
сти раствором какой-либо соли.
б) Хлористое олово восстанавливает платинохлористоводород-
ную кислоту до платинистохлористоводородной кислоты, но не
до металла.
в) Щавелевая кислота не осаждает платину. Гидроксиламин
в кислом растворе и в растворе едкого натра, ацетилен и пере-
кись водорода также не осаждают платину (отличие от золота).
г) Хлоргидрат гидразина быстро восстанавливает аммиачные
растворы платинохлористоводородной кислоты до металла.
Часть металла выделяется в виде зеркала на стенках сосуда:
(NH4)2 [PtCle] + 6NH3 + H->N • NH2 • 2HCl-> 8NH4CI + N2 + Pt.
д) Муравьиная кислота осаждает из нейтральных растворов
при температуре кипения всю платину в виде черного порошка:
H2[PtCk] + 2НСООН -> Pt + 2СО2 + 6HCI.
е) Формальдегид осаждает из щелочного раствора платину
в весьма тонко раздробленном состоянии. В присутствии солей
осадок фильтруется, но при промывании водой проходит легко
через фильтр:
[PtCh]" + НСНО -ф 4ОН' -> 6СГ + СО2 + ЗНгО + Pt.
ж) Глицерин восстанавливает соли четырехвалентной платины
в горячем щелочном растворе до черного порошкообразного
металла, причем углерод глицерина окисляется до карбоната и
оксалата. Виннокислые соли щелочных металлов в горячем ще-
лочном растворе также восстанавливают соли платины до
металла:
СзНз(ОН)з + 3[PtCl6j" 4- 16OH'->
-> 18СГ + СОз" + С2О4" + 12НгО 4- 3Pt.
3) Окись углерода. Если в раствор платинохлористоводород-
ной кислоты, к которому прибавлен небольшой избыток
уксуснокислого натрия, пропускать окись углерода, то обра-
зуется красный коллоидный металл (отличие от палладия).
После продолжительного стояния вся платина выделяется в виде
565
черного порошка, а раствор над последним становится бесцвет-
ным. При этом происходит следующая реакция:
[PtCle]" + 2СО + 2Н2О -> 6СГ + 4Н • + 2СО2 + Pt.
и) Сернокислое двухвалентное железо не восстанавливает .в кис-
лом растворе платинохлористоводородную кислоту (отличие от
хлорного золота), но в растворе, подщелоченном содой, вся
платина при нагревании восстанавливается до металла:
[PtCle]” + 6СО3” + 4Fe’ ’ + 6Н2О 6СО2 + 6СГ + 4Fe(OH)3 + Pt.
к) Фосфорноватистокислый натрий NaFhPCh дает в соляно-
кислом растворе при нагревании бурую окраску, которая, оче-
видно, обусловливается образованием иона двухвалентной пла-
тины. (Отличие от солей золота, восстановляющихся до ме-
талла.)
Реакции сухим путем
Все соединения платины при прокаливании с содой на угле
дают губчатый металл серого цвета, принимающий металличе-
ский блеск при растирании его пестиком- в агатовой ступке.-
Своим серовато-белым цветом он отличается от золота, а не-
плавкостью и нерастворим остью в кислотах—от свинца, олова
и серебра.
Отделение золота от платины
Из концентрированного раствора платину осаждают раство-
ром хлористого аммония, фильтруют и выделяют золото из
фильтрата посредством сернокислой соли закиси железа.
Отделение золота от платины производится лучше всего по Нойесу
и Брэю следующим образом. Выпаривают раствор в царской водке до
объема, меньшего, чем 1 мл, следя за тем, чтобы остаток не перегревался.
Прибавляют 12 мл воды, кипятят, и если нужно, фильтруют. Прибавив
1 каплю 6N соляной кислоты, сильно взбалтывают в делительной воронке
с 10 мл чистого уксусноэтилового эфира. Отделяют водный слой, который
взбалтывают со свежей порцией уксусноэтилового эфира. В органическом
растворителе растворяется практически все золото, и совсем не раство-
ряется платана. Соединенные эфирные экстракты выпаривают на водяной
бане досуха и остаток прокаливают только до видимого красного каления.
Охлаждают, прибавляют 1 ,мл Y2N соляной кислоты и несколько капель
концентрированной азотной кислоты. Выпаривают почти досуха и, при-
бавив 5 мл воды и 2 мл 6N едкого натра, нагревают до кипения. При этом
происходит осаждение тонко раздробленного золота и пурпурная окраска
замечается уже при 0,2 мг Au. Водный раствор, полученный при экстраги-
ровании этилацетатом, выпаривают почти досуха, прибавляют 1 .мл воды
и снова выпаривают на водяной бане до исчезновения запаха кислоты.
Прибавляют 2 капли 6N соляной кислоты, не больше 1 мл воды и затем
NHiCl в порошке до тех пор, пока не прекратится его растворение при
перемешивании или взбалтывании. Охлаждают в ледяной воде. При нали-
чии 0,3 мг платины получается заметный осадок (NH^aPtCle,
LG6
Палладий Pd. Ат. в. 106,7. Ат. н. 46
Плотность 11,8. Т. пл. 1550°. Т. кип. 2200°
Нахождение в природе. Палладий встречается как спутник платины
в типичных платиновых рудах. Иногда его находят также в золотых и,
в виде следов, в серебряных рудах.
Свойства. В самородном состоянии металл имеет цвет серебра. Оса-
жденный из растворов, он представляет собой черный порошок, обладаю-
щий способностью хорошо растворять газообразный водород. Так. напри-
мер, один объем губчатого палладия поглощает при комнатной темпера-
туре 700 объемов водорода. Но эта растворимость водорода значительно
повышается, если палладий находится .в коллоидном состоянии. Самород-
ный палладий также в состоянии поглощать большие количества водорода,
если его охладить в атмосфере водорода.
Палладий, насыщенный водородом, является чрезвычайно сильным вос-
становителем, с которым очень удобно производить многочисленные про-
цессы восстановления в водном растворе. Так, например, раствор соли
трехвалентного железа очень быстро восстанавливается до двухвалентного,
если его нагреть с палладиевой спиралью, насыщенной водородом.
Если водород и кислород (воздух) одновременно пропускать через
слегка накаленный мелко, раздробленный'металлический палладий, то водо-
род окисляется в воду; аналогичным путем окись углерода может превра-
титься в двуокись углерода ‘. Метан разлагается только при более сильном
прокаливании палладия и этим путем возможно, отделение его от смеси Нз
и СО.
Коллоидный палладий обладает замечательным каталитическим дей-
ствием- Так, при пропускании водорода в раствор ненасыщенных органиче-
ских соединений часто происходит прямое восстановление (гидрогениза-
ция) их в присутствии небольшого количества коллоидного палладия.
При слабом накаливании на воздухе металл покрывается синей побе-
жалостью вследствие поверхностного окисления; при юолее сильном, прока-
ливании происходит распадение окиси.
Палладий образует два окисла: PdO и РбО», обладающие характером
основных ангидридов., и два ряда солей: соли двухвалентного и четырех-
валентного палладия. Соединения четырехвалентного палладия мало устой-
чивы и обнаруживают стремление к переходу в двухвалентную форму;
двуокись палладия отдает половину своего кислорода при слабом нагрева-
нии. Раствор четыреххлористого палладия, образующийся в виде бурого
раствора из двухлористого палладия при пропускании в него хлора, снова
отдает присоединенный хлор при выпаривании на водяной бане. Поэтому
при анализе большею частью имеют дело с солями двухвалентного палла-
дия.
Палладий в противоположность другим металлам платиновой группы,
растворяющимся только в царской водке, может медленно растворяться
в горячей азотной кислоте (и даже в холодной, будучи сплавлен с дру-
гими металлами—"Cu, Ag и т. д.). При этом образуется раствор бурого
цвета нитрата двухвалентного палладия.
Губчатый палладий, осажденный из растворов., растворяется в соляной
кислоте при взбалтывании с воздухом или еще быстрее —при добавлении
перекиси водорода. Менее легко происходит растворение в серной кислоте.
При сплавлении с пиросульфитом калия образуется растворимый сульфат
палладия PdSCU.
Лучшим растворителем для палладия является царская водка.
При .растворении тонко раздробленного палладия в соляной кислоте
образуется PdCh; при растворении в царской водке—смесь PdCh и PdCh;
1 Возможно окисление СО даже в отсутствие кислорода но в присут-
ствии воды и палладиевой черни: СО + НзО-» СОг ф Ь Водород погто'
щается палладием, ред. р
567
если последний раствор выпарить досуха, PdCk нацело превращается
в PdCk. i
А. Соединения двухвалентного палладия
Реакции мокрым путем
Следует употреблять раствор хлористого палладия.
1. Едкие щелочи осаждают коричневую основную соль, рас-
творимую в избытке осадителя. Если раствор предварительно
подкислить НО, то КОН не дает осадка (отличие от платины).
Осаждение коричневой основной соли происходит полностью
при кипячении раствора, нейтрализованного NaHCOs до pH = 6.
2. Углекислый натрий осаждает гидрат закиси палладия
Pd(OH)2, растворимый в избытке осадителя и снова осаждаю-
щийся при кипячении.
3. Сернистый водород осаждает из кислого' или нейтрального
растворов черный сульфид палладия, не растворимый в сернистом
аммонии и сернистых щелочах, но растворимый в кипящей со-
ляной кислоте и еще более легко в царской водке.
Сульфид палладия PdS растворяется в растворе тиокарбоната
калия и из раствора вновь не выпадает при действии двуокиси
углерода. (Сульфид свинца не растворяется в тиокарбонате ка-
лия, а сульфид ртути после растворения в тиокарбонате калия
снова может быть осажден двуокисью углерода.)
4. Аммиак выделяет осадок мясокрасного цвета [Р^МНз^СЦи1,
растворимый в избытке аммиака с образованием бесцвет-
ного раствора, содержащего хлористый тетрамин палладия
[Рс1(ЫНз)4]С12. При подкислении соляной кислотой выпадает
желтый кристаллический осадок хлористого диамина палладия
[Pd(NH3)2]C12. Последнее соединение трудно растворимо в разба-
вленной соляной кислоте, и им пользуются для приготовления
чистого палладия.
В растворе нитрата палладия аммиак не дает осадка, но обра-
зует бесцветный нитрат тетрамина палладия [Рб(ПНз)4](ПОз)г.
5. Хлористый аммоний. Если раствор хлористого палладия
или хлоропалладита натрия обработать хлористым аммонием и
выпарить досуха на водяной бане, то остаток может быть рас-
творен в очень малом количестве воды. Если этот раствор под-
кислить азотной кислотой, весь палладий постепенно осаждается
в виде красного (NH4)2[PdCle] (отличие от платины).
6. Хлористый калий осаждает только из концентрированных
растворов красно-бурый KstPdCU] (правильные октаэдры). При
окислении, например, хлорной водой выпадает Кг[РбОб], кото-
рый значительно труднее растворим.
7. Иодистый калий и иодистоводородная кислота осаждают
черный иодистый палладий PdJ2 даже из очень разбавленных
1 Это соединение является изомером хлористого диамина палладия;
формула его иногда пишется так: PdCls • Pd(NHa)4Cls.
568
растворов. Осадок не растворим в воде, спирту, эфире и HF,
но растворим в NH3 и избытке KJ.
8. Цианистая ртуть Hg(CN)2 выделяет желтовато-белый, жела-
тинообразный осадок цианистого палладия Pd(CN)2, трудно рас-
творимого в разбавленной соляной кислоте, легко растворимого
в избытке цианистого калия и аммиака. Применяя в качестве
осадителя едва ионизирующую цианистую ртуть, избегают рас-
творяющего действия избыточных циан-ионов, хлорные же ионы
(большой избыток которых действует растворяющим образом)
будут связываться ионами ртути(2).
Так как Pd(CN)2 восстанавливается до металла хлористым оловом, а
цианистые соединения золота и платины им не восстанавливаются, то на
этом основана следующая капельная реакция для открытия палладия в при-
сутствии золота и платины. Помещают на кусочек фильтровальной бумаги
каплю насыщенного раствора цианистой ртути, каплю испытуемого рас-
твора и затем еще каплю раствора цианистой ртути. Палладий при этом
выделяется в центре пятна, золото же и платина перемещаются кнаружи и
их можно совершенно смыть несколькими каплями воды. Если теперь
прибавить каплю раствора хлористого олова, то при наличии палладия
центр пятна окрасится в темнооранжевый или золотисто-желтый цвет.
Таким путем можно открыть 0,6 Т Pd в 0,03 мл (предельная концентрация
1 : 50 000) 1.
9. Ацетилен осаждает ацетиленистый палладий, растворимый
в аммиаке, цианистом калии и бисульфите натрия.
10. Диметилглиоксим дает желтый осадок, легко растворимый
в растворе цианистого калия или в аммиаке; осадок лишь
слегка растворяется в 50%-нем спирте и разбавленных кисло-
тах. Золото и платина мешают этой реакции, потому что их
соли восстанавливаются до металла, но другие платиновые ме-
таллы не мешают.
Путем этой реакции Pd может быть осажден из 0,8—0,9 N
НС1 в присутствии Pt, которая остается в растворе.
11. а-Нитрозо-^-нафтол (насыщенный раствор в 50%-ной
уксусной кислоте) дает даже в 9 • 10-5-молярном растворе палла-
диевой соли объемистый красно-бурый осадок нитрозонафтоло-
вой соли двухвалентного палладия;
/NO-. /ON\
Н6С10< >Pd\ >С10Н6
XOZ 4OZ
(отличие от платины).
12. Восстановители. Ион двухвалентного палладия, соответ-
ственно своему окислительному потенциалу благородного ме-
талла, весьма легко восстанавливается до металла многочислен-
ными восстановителями, как, наприме-р, неблагородными метал-
1 N. A. Tananaeff и. К. Dolgow, Chem. Zentr. (1930) I, 2130.
569
лэми (цинк, кадмий, железо), солями двухвалентного железа,
одновалентной меди \ сернистой и муравьиной кислотами и
спиртом.
Весьма типично восстановление окисью углерода1 2.
В присутствии соляной кислоты хлористое олово образует
сначала красный, затем бурый и, наконец, зеленый раствор;
в отсутствие кислоты хлористое олово восстанавливает соли
палладия частично до металла и окрашивает раствор в зеленый
цвет. Взбалтывание с серебром или ртутью вызывает осаждение
металлического палладия.
13. Роданистый калий не дает осадка в растворах палладие-
вых солей (отличие от меди).
14. Азотистокислый калий дает в не очень разбавленных рас-
творах желтый кристаллический осадок.
* Добавления редактора. 15. р-Диметиламинобензилиденрода-
нин (см. стр. 121), Файгль и его сотрудники нашли!, что соли
палладия дают в нейтральном или слабокислом растворе с р-ДИ-
метиламинобензилиденроданином красно-фиолетовый осадок,
который, вероятно, представляет собой продукт присоединения
хлористого палладия к органическому соединению.
Выполнение. На фильтровальную бумагу, пропитанную насыщенным
спиртовым или ацетоновым раствором реактива, наносят каплю нейтраль-
ного или слабокислого испытуемого раствора; в зависимости от количества
палладия образуется красно-фиолетовое пятно в кислом растворе и сине-
фиолетовое — в нейтральном растворе.
Чуйствителыность в 'первом случае 1 : 8 500 000, а во 'втором 1 :12500 000.
Р-Диметиламинобензилиденроданин дает с солями золота, платины,
серебра и ртути также нерастворимые окрашенные осадки; об открытии
палладия в присутствии указанных элементов см. оригинальную работу3. *
А Я.
Б. Соединения четырехвалентного палладия
Соединения четы.рехвалентного палладия вследствие своего
легкого перехода в соединения двухвалентного палладия дают
те ж;е самые реакции, что и последние. Наиболее характерная
реакция основана на нерастворимости аммонийной соли палладо-
хлористоводородной кислоты. Если взболтать концентрирован-
1 Однохлористая медь не восстанавливается Pd в присутствии больших
количеств НС1 или NaCl.
2 Свойства хлористого палладия — восстанавливаться посредством СО
до металла (PdCh + СО + НгО-> 2НС1 + СОа + Pd) —- дает весьма ценное
средство для открытия малых количеств СО в тазовой смеси, например
в воздухе. Для этой цели исследуемый воздух просасывают сперва через
промывалку с едким кали для удаления HaS >и СОа, могущих мешать реак-
ции, затем помощью тонкой стеклянной трубки через 10 мл раствора, со-
держащего 1 мг PdCla и 2 капли (разбавленной HCI. В присутствии СО
выделяется черный палладий, и раствор постепенно обесцвечивается [см.
Potain и Drouin, С. г. 126, 938 (1898)].
В присутствии большого количества НС1 соли палладия не восстана-
вливаются окисью углерода, напротив восстановление количественное, если
к раствору прибавить уксуснокислый натрий,
3 F е i g 1, Krumholz u. Rajman n, Mikrochemie 9, 165 (1931).
5.0
„ый холодный раствор хлористого палладия с хлорной водой и
затем прибавить хлористый аммоний, то скоро выделяется крас-
ный кристаллический осадок (NH^LPdCleJ.
Реакции сухим путем
Все палладиевые соединения при прокаливании выделяют ме-
талл, который растворим в азотной кислоте и царской водке;
раствор может быть испробован вышеприведенными реакциями.
Родий Rh. Ат. в. 102,91. Ат. н. 45
Плотность 12,5. Т. пл. около 1985°
Родий по внешнему виду похож на алюминий; он менее плавок, чем
платина. Горячий расплавленный металл разбрызгивается при охлаждении
и покрывается вследствие окисления синей побежалостью. Растворимость
родия всецело зависит от степени его раздробления; сплав платины с ро-
дием тверже и прочнее чистой платины. Родий вместе с платиной приме-
няется при изготовлении термоэлементов для температур, превышающих
1000°.
Осажденный из раствора своего хлорида посредством муравьиной кис-
лоты или других восстановителей при температуре, не превышающей 100°,
родий находится в чрезвычайно тонко раздробленном состоянии (родиевая
чернь) и легко растворяется в кипящей концентрированной серной кислоте
и еще более легко в царской водке. Но если тонко раздробленный металл
сильно прокалить, он подобно компактному металлу становится почти не
растворимым в царской водке.
При растворении в царской водке образуется RhCls, который подобно
CrCls существует в двух модификациях, сильно различающихся по своей
растворимости.
Если родий сплавлен с большим количеством других металлов (Pb, Zn,
Bi, Си и т. п.), он при обработке сплава кислотами выделяется в тонко
раздробленном состоянии, после чего его можно растворить в царской
водке. Когда родий сплавлен с большим количеством платины или палла-
дия, значительные количества его растворяются в царской водке, но если
он сплавлен с малым количеством платины, то большая часть родия и
часть платины остаются нерастворенными.
При сплавлении с пиросульфатом калия образуется двойная сернокис-
лая соль калия и родия, растворяющаяся в воде с образованием желтого
раствора, который становится красным' от прибавления соляной кислоты.
Родий образует три окисла: закись RhO, окись RhsOs и двуокись
RhOa; все они обладают ясно выраженным основным характером. Только
окись RhaOs1 дает ряд солей, в которых родий входит в состав аниона;
из них наиболее важное значение для аналитических целей имеет хлороро-
диат натрия. В виде этого соединения родий легче всего перевести в рас-
твор. Эту соль получают путем тщательного смешения тонко раздроблен-
ного металла с двукратным количеством сухого хлористого натрия и после-
дующего слабого прокаливания смеси в фарфоровой лодочке в токе влаж-
ного хлора. Получающаяся таким образом соль NasfRhCle] растворяется
в воде (45 ч. воды растворяют 1 ч. соли). Из этого раствора могут быть
выкристаллизованы большие темнокрасные блестящие триклинические
призмы Nas[RhCl«] • 9НгО.
1 Бунэенол: была получена двойная) сернистокислая соль родия и на-
трия состава 4RhS'Oa ’ 6NasSOs' 9HiO.
571
Реакции мокрым путем
Следует пользоваться раствором хлорородиата натрия NaslRhCl»].
1. Сернистый водород осаждает весьма медленно на холоду
но значительно быстрее при нагревании черный сульфид родия
RI12S3 или Rh(SH)3, не растворимый в сернистом аммонии, рас-
творимый в концентрированной азотной кислоте, броме или цар-
ской водке. Моносульфид кали'я, прибавленный в избытке, оса-
ждает двойной -сульфид родия и калия, разлагаемый водой.
2. Едкие щелочи вначале не выделяют никакого осадка,
но спустя некоторое время выделяется желтый осадок гидро-
окиси родия Rh(OH)a • Н2О. Осадок растворяется в избытке оса-
дителя и снова выпадает -при кипячении -в виде буровато-черного
Rh(OH)3.
Из раствора двойного сульфата родия и калия едкое кали
тотчас осаждает желтый осадок.
При добавлении едкого кали к хлориду родия осадок вна-
чале не выделяется, но после прибавления небольшого количе-
ства спирта осаждается буровато-черная гидроокись родия.
3. Аммиак образует в концентрированных растворах спустя
некоторое время желтый осадок двухлористого хлоро-пентамина
родия [RhCl(NH3)a]C12, не растворимый -в холодной соляной
кислоте.
4. Нитрит калия, нагретый -с -раствором хлорородиата -натрия,
выделяет трудно растворимый, оранжево-желтый осадок гек-са-
нитрородиата калия Ks[Rh-(NO2)s], растворимый в соляной кис-
лоте.
Если применяется NaNOs, образуется растворимый Nas[Rh(NO2)e], ко-
торый не реагирует с разбавленным раствором NaOH. Также ведет себя я
иридий' -и этим путем иридий и родий могут быть отделены от группы
меди.
Если раствор NapR/itNOpe] и №з[1г(!УО’)в] выпарить досуха с соляной
кислотой (избегая слишком высокой температуры), нитритные комплексы
разлагаются и образуются NaslRhCls] -и Nas[IrCle]. Если нагреть их с раз-
бавленным раствором соды, образуются -растворимый NalrOs и нераствори-
мый светложелтый Rh(OH).;; при добавлении небольшого количества брома
и избытка соды осаждаю i-ся сине-черный 1гО» и зеленый RhO». Осажден-
ные 1гОа и RhOs могут» быть растворены в небольшом количестве 9/V НВг
(обладающей сильными восстановительными свойствами), при выпаривания
полученного раствора с НС1 и MNOs иридий и родий получаются в виде
НзПтСк] и HsERhClc]. Чтобы убедиться, что весь 1г перешел в четырех-
в?.-ле-нтиг>1Й, добавляют НС1, снова выпаривают и обрабатывают НС1 и С1г.
При добавлении избытка твердого NHiCl выпадает черный осадок
(NHO'b тгС1в], родий же остается в растворе в виде красного (N’HpslRhCle].
При фильтровании и упаривании с концентрированным NHsOH родий пре-
вращается в я;елтый Дъхлорид хло-р-пентаммина родия LRhCl(NTHi).-,]Cl2, час-
тично растворимый -в горячей &N НС1 и -осаждающийся -в виде желтого
кристаллического порошка при охлаждении. (Вышеприведенная операция
может служить прекрасным методом открытия Rh и 1г при совместном
присутствии.)
5. Восстановители. Муравьиная кислота в -присутствии аце-
тата аммония, так же как и цинк, в присутствии кислот, осаждает
черный металл. Сульфат тидроксиламина не реагирует (отличие
от золота). При встряхивании с золотом или ртутью металли-
572
цеский родий ме выделяется (отличие от золота, -платины и
палладия).
Реакции сухим путем
Все .родиевые соединения при прокаливании в атмосфере
водорода или с содой на угле перед паяльной трубкой восста-
навливаются до металла. Металл легко идентифицировать по
его нерастворимости в царской водке; его переводят в раствор
путем сплавления с персульфатом калия; обрабатывая получен-
ный плав водой -и добавляя КОН и немного спирта, наблю-
дают образование бурой гидроокиси; особенно характерным
является получение розово-красного раствора при растворении
продукта, образующегося путем сплавления металла с хлоридом
натрия в атмосфере хлора (стр. 571).
Осмий Os. Ат. в. 190,2. Ат. н. 76
Плотность 21,3—22.48. Т. пл. 2700. Т. кип. > 5300°.
Осмий и рутений отличаются от других платиновых металлов лету-
честью окисей.
Свойства. Осмий — самый тяжелый из всех металлов; в компактном
виде он своим синевато-белым цветом напоминает цинк. Он может быть
сплавлен в электрической печи Очень тонко раздробленный осмий окис-
ляется воздухом2 при обыкновенной температуре; приблизительно при
400° ом воспламеняется и быстро сгорает |В четырехокись осмия OsCU, кото-
рая летуча при 100°. Чем плотнее металл, тем выше должна быть темпе-
ратура для его окисления. Осмий был открыт Теннаном (Tennant) в 1803 г.
В компактном состоянии осмий не растворяется ни в одной из кислот,
но в тонко раздробленном состоянии (в каком он получается при раство-
рении его сплава с цинком в азотной кислоте) он растворяется в азотной
кислоте, еще более легко в царской водке, а особенно в дымящей азотной
кислоте с образованием четырехокиси осмия, которая может быть выде-
лена из раствора путем дестилляции.
Компактный осмий может быть переведен в раствор путем сплавления
с едким натром в смеси с «ишратом1 или хлоратом калия. Плав содержит
соль надосмиевой кислоты (OsOi).
Осмий образует пять окислов;
Os,O3
полутораохись,
не растворимая
тах
Осмий образует пять
OsO
закись осмия, серовато-
черная, не растворимая
в кислотах
черная,
в кисло-
[ОвО3]
осмиевая кислота,
известны только ее
производные
OsO2
двуокись осмия, черно-
серого цвета, не раство-
римая в кислотах
OsO4
четырехокись осмия,
бесцветные иглы,
растворимые в воде
важное соединение для аналитических
осмия на воздухе, при растворении
кислоте или царской
Четырехокись осмия — наиболее
целей, получается при окислении
тонко раздробленного металла в -дымящей азотиой
водке, либо при сплавлении с едким натром в смеси с нитратом или хло-
ратом калия, обработкой плава азотной кислотой с последующей перегон-
кой. Четырехокись осмия — бесцветные кристаллы, возгоняющиеся при
сравнительно низкой температуре и плавящиеся при 100°. Пары ее напоми-
1 F. Му Hus, Dietr, В. 31, 3-187 (1898).
г См. Ot Sul е, Z. anorg. Chem. 19, 332 (1899).
573
нают по запаху хлор; они сильно раздражают слизистые оболочки и отли-
чаются ядовитостью.
Хлориды осмия могут быть, получены только сухим путем.. Известны
OsCh, OsCls и OsCh. Калиевая соль гипотетической хлороосмиевой кис-
лоты HaOsCle, образующая темнокрасные октаэдры,, растворима в воде и
разлагается при кипячении раствора. При прокаливании тонко раздроблен-
ного осмия с хлоридом калия в токе хлора образуется Кг[О«С1»]; эта
соль растворяется в воде, причем раствор окрашен в красный цвет.
А. Соединения четырехвалентного осмия
Реакции мокрым путем
Следует пользоваться раствором хлороосмеата калия Кг[ОзС1в].
1. Перегонка с кислотой. Если раствор хлористого или бро-
мистого осмия обработать разбавленной азотной или хлорной
кислотой, смесь подвергнуть перегонке из маленькой реторты
и пары пропускать в раствор едкого натра, то последний окра-
сится в желтый цвет вследствие образования [OsOi(OH)2]". При
подкислении этого раствора выделяется четырехокись осмия,
которая может быть узнана по своему резкому запаху. Если
к кислому раствору прибавить немного тиосульфата натрия и
нагреть, то выделяется бурый осадок сульфида осмия.
2. Сернистый водород осаждает буровато-черный сульфид
осмия, не растворимый в сернистом аммонии. Осадок выделяется
как из кислых, так и из щелочных растворов.
3. Едкое кали, аммиак или карбонат калия осаждают красно-
вато-бурую гидроокись ОСМИЯ Os(OH)4.
4. Восстановители. При действии на раствор хлорида осмия
таинина и спирта с добавлением небольшого количества соляной
кислоты, раствор окрашивается в темносиний цвет вследствие
образования двухлористого осмия OsCh. Иодистый калий вос-
станавливает восьмивалентный осмий до четырехвалентного
с выделением иода; раствор окрашивается в темный красновато'-
пурпурный цвет.
5. Перекись натрия. Сплавление с перекисью натрия превра-
щает осмий в NaaOsOi, который растворяется в воде,' образуя
оранжево-желтый раствор. Если последний подкислить и на-
греть, то' выделение летучей четырехокиси осмия не наблю-
дается при условии сохранения осмия в восстановленном1 состоя-
нии, что достигается добавлением спирта; последний изменяет
оранжево-желтый цвет раствора в розовато-лиловый.
Б- Соединения восьмивалентного осмия
Реакции мокрым путем
Четырехокись осмии, опущенная в кипящую воду, плавится и медленно
растворяется. Получающийся раствор бесцветен, не показывает кислой
реакции, но отличается своим неприятным запахом. Пары OsO< весьма
ядовиты и вызывают воспаление глаз.
1. Сульфат двухвалентного железа осаждает черную двуокись осмия.
2. Раствор индиго обесцвечивается.
574
3. Сернистый водород сначала окрашивает раствор в темнобурый цвет;
при добавлении кислоты получается бурый осадок четырехсернистого осмия
OsSi, который не растворим в едких и углекислых щелочах и |в сульфидах.
4. Едкое кали, прибавленное в избытке к концентрированному раствору,
окрашивает последний в желтый цвет. При кипячении такого щелочного
раствора большая часть четырехокиси перегоняется (весьма характерно),
остающаяся же часть разлагается иа кислород и осмиат калия KzOsOi;
после долгого кипячения из последнего образуются четырехокись осмия,
гидроокись осмия и едкое кали.
5. Нитрит калия образует красные кристаллы осмиата калия. То же
самое соединение может быть получено при восстановлении раствора
четырехокиси осмия спиртом.
6. Иодистый калий восстанавливает четырехокись осмия в кислых рас-
творах. Если смешать 2 лл 1%-ного раствора йодистого калия я 20 капель
концентрированной серной кислоты с каплей раствора осмиевой соли, то
получается зеленый раствор HaOsJi; это окрашенное соединение может
быть извлечено эфиром.
7. Хлористое олово дает бурый осадок, растворяющийся в соляной
кислоте с образованием окрашенного ® бурый цвет раствора;
8. Сернистая кислота восстанавливает четырехокись осмия, причем рас-
твор постепенно окрашивается в желтый, красновато-бурый, зеленый и,
наконец, в индигово-синий цвеТ.
9. Цинк и другие металлы в кислом растворе осаждают металлический
осмий.
* Добавление редактора. 10. Тиомочевина. При нагревании раствора,
содержащего четырехокись осмия, в течение нескольких минут с избытком
тиомочевины и с несколькими каплями соляной кислоты жидкость окраши-
вается в красный цвет (реакция Чугаева) ‘.
11. Открытие осмия путем активирования раствЬра хлората. Хлораты
щелочных .металлов обладают весьма малой окисляющей способностью в
нейтральном или слабокислом растворе, но в присутствии даже следов
четырехокиси осмия (а также гидроокиси рутения) растворы хлоратов
активируются, приобретая способность легко восстанавливаться до хло-
рида в присутствии какого-либо восстановителя. Так, например, хлорат
выделяет иод из иодида калия в присутствии следов четырехокиси осмия.
Нужно, однако, считаться с тем, что сама четырехокись осмия действует
окисляющим образом на раствор иодида, но1 это только при больших ко-
личествах ее. Поэтому при реакции на осмий следует настолько разбавить
раствор его, чтобы реакция между ним и иодидом не происходила.
Эту чрезвычайно чувствительную реакцию целесообразно производить
по Файглю в виде капельной реакции2.
На часовом стекле (или >в фарфоровой чашечке) к капле раствора
хлората и иодида (в 10 мл по 1 г каждой соли)) прибавляют каплю
серной кислоты (1 : 1000) и по 1 капле нейтрального испытуемого и крах-
мального растворов. В присутствии осмия появляется синее окрашивание.
Чувствительность 1:10 000 000.* А. К.
Реакции сухим путем
Все осмиевые соединения восстанавливаются до металла при
нагревании в атмосфере водорода.
Рутений Ru. Ат. в. 101,7. Ат. н. 44
Плотность 12,26 (кристалл.); 11,0 (сплавл.). Т. пл. 21450°. Т. кип. 2700°
Свойства. Рутений может быть получен в виде темносерого или чер-
ного порошка и в виде блестящих пористых палочек; он хрупок, может
быть растерт в порошок и плавится в пламени гремучего газа.
1 Т s с h u g a i е w, С. г. 167, 235, (1918).
2 Файгль,- Капельный анализ, стр. 283.
575
При плавлении часть рутения окисляется в четырехокись рутения, ле-
тучее вещество с резким запахом, подобным запаху OsOa. Расплавленный
металл разбрызгивается при охлаждении.
Практически рутений не растворяется ни в одной из кислот, даже
в царской водке. При сплавлении с КОН и KNOs (или КСЮз) он окис-
ляется в рутенат калия КзГИиОд].
При прокаливании с КС1 в атмосфере хлора он образует растворимый
KsfRuCl»]. Получающийся зеленовато-черный плав растворяется в воде,
образуя оранжево-желтый раствор, окрашивающий кожу в черный цвет.
Постепенно при стоянии или тотчас при кипячении образуется черный
объемистый коллоидный осадок (чувствительная реакция). На рутений не
действует сплавление с персульфатом калия.
Рутений образует следующие окислы: RuO, RuaOa, RuOa, [RuOa],
[RuaOr], RuOa.
Важнейшим из этих окислов является RuOa. Он получается:
а) путем обжига самого металла или его окислов при температуре
выше 1000° (осмий образует летучую четырехокись при 400°);
б) путем оплавления металла с КОН и KNOs в серебряном тигле с по-
следующим растворением плава >в воде, насыщением холодного раствора
хлором и перегонкой раствора из маленькой реторты:
KzRuOa + Cb-> 2КС1 + RuOa;
в) путем обработки раствора рутената калия КОН и С12 с последующей
перегонкой;
г) путем перегонки рутената калия с КСЮз и НС1.
При перегонке разбавленного раствора после прибавления азотной кис-
лоты RuOa не выделяется 1 (отличие от осмия). Но при выпаривании рас-
твора с хлорной кислотой до появления паров последней RuOa улетучи-
вается.
Четырехокись рутения образует золотистожелтые блестящие ромбиче-
ские иглы, которые летучи и обладают характерным запахом; она кипит
при 100° и отличается малой растворимостью в воде. При добавлении
спирта и соляной кислоты она превращается в треххлористый рутений
RuCls (или RuzCle). Если раствор этой соли подщелочить аммиаком, приба-
вить тиосульфат натрия и нагреть, то появляется интенсивная красновато-
фиолетовая окраска (весьма чувствительная и характерная реакция).
При действии на раствор рутената калия азотной кислоты осаждается
черная гидроокись рутения Ru(OH)3; она растворяется в соляной кислоте
с образованием раствора, окрашенного в желтый или бурый цвет.
Реакции мокрым путем
Следует пользоваться раствором хлорида рутения RuCls.
1. Сернистый водород сначала не выделяет осадка, но спустя
некоторое время раствор приобретает лазуревосинюю окраску и
осаждается бурый сульфид рутения (весьма чувствительная и
характерная реакция).
2. Гидроксиламии восстанавливает четыреххлористый руте-
ний в треххлористый (отличие от платины).
3. Роданистый калий в отсутствие других платиновых метал-
лов постепенно окрашивает раствор в красный, затем в пурпур-
ный, а при нагревании в фиолетовый цвет (весьма характерная
реакция).
1 Однако в присутствии концентрированной азотной кислоты обра-
зуется RuCU:
2K2RuO4 + 4HNOa -> 4KNOs''+ 3Ru(OH)< + RaCb.
4. Йодистый калий осаждает черный йоДид; реакция уско-
ряется нагреванием.
5. Едкие щелочи осаждают черную гидроокись рутения
Ru(OH)s, растворимую в кислотах, но не растворимую в едких
щелочах.
6. Сернистый аммоний осаждает буровато-черный сульфид,
трудно1 растворимый в избытке осадителя.
Если раствор рутения слетка подщелочить содой и короткое
время кипятить с нитритом калия, то после охлаждения неболь-
шое количество сульфида аммония окрашивает раствор в кра-
сивый карминовокраюный цвет, который может перейти в бурый.
Большее количество' сульфида аммония дает бурый осадок. Крас-
ный цвет раствора обусловливается образованием комплексного
аниона [Ru(NOs)e]".
7. Цинк вначале окрашивает раствор хлорида в лазуревоси-
ний цвет, но постепенно раствор обесцвечивается и выпадает
металлический рутений. Взбалтывание раствора рутения с золо-
том или ртутью не приводит к осаждению металлического руте-
ния (отличие от золота, платины и палладия).
* Добавление редактора. 8. Тиомочевина CS(NHs)2 дает с со-
лями рутения при нагревании в кислом растворе интенсивное
синее окрашивание. При добавлении избытка аммиака окраска
становится розовой. При подкислении снова появляется синее
окрашивание. Цветная реакция осмиевых солей с тиомочевиной
(см. Осмий, реакция 10) от аммиака не изменяется
9. Рубеановый водород (SCNHs)2 в сильно кислом растворе
реагирует с солями рутения, образуя синее растворимое соеди-
нение. Осмий не реагирует с рубеановодородной кислотой, что
весьма важно для открытия рутения в присутствии столь сход-
ного с |ним по своим реакциям осмия. Так как платина и пал-
ладий реагируют с рубеановый водородом, образуя красные
кристаллические осадки, то их можно отделить от рутениевого
растворимого продукта, окрашенного в синий цвет, фильтрова-
нием или центрофугированием.
Выполнение2. В микротигельке слабо нагревают на пламени микро-
горелки каплю солянокислого исследуемого раствора с 1—2 каплями рас-
твора рубеановодородной кислоты в ледяной уксусной кислоте (см.
стр. 157). В зависимости от количества рутения образуется более или
менее интенсивное окрашивание; чувствительность 1:250 000.* А. К.
Реакции сухим путем
Рутений растворяется при долгом плавлении в перле селитры
на магнезиальной палочке, причем перл окрашивается в бурый
цвет; растворение рутения в селитре происходит значительно
медленнее, чем растворение осмия. Того же эффекта достигают
посредством перла из смеси селитры и едкого натра. Плав
1 Wohler u. Metz, Z. anorg. Chem. 138, 368 (1924); Steiger,
Mikrochemie 16, 196 (1935).
2 Файгль, Капельный анализ, стр. 249.
37 BteK. 082. Тредвелл-Голл, т. I.
577
растворяют б соляной кислоте и исследуют раствор на присут-
ствие рутения посредством тиомочевины.
Иридий 1г. Ат. в. 193,1. Ат. н. 77
Плотность 22,4. Т. пл. 2350°. Т. кип. 4800°
Свойства. Иридий сходен с платиной, отличается от иее своей лом-
костью. Сплав его с платиной применяется для изготовления разновесок,
наконечников вечных перьев и пр.
Иридий получается путем прокаливания хлороиридата аммония
(NHpsflrCle] в виде серой губчатой массы, весьма трудно растворяю-
щейся в царской водке. После сильного прокаливания он почти совсем не
растворяется в царской водке.
Он более растворим в царской водке, если его осадить из растворов
в тонко раздробленном состоянии посредством муравьиной кислоты или
если он сплавлен с другими металлами (Au, Pt). Сплавление с персульфа-
том калия на него не оказывает никакого действия (отличие от родия).
Он окисляется при сплавлении с NaOH и KNOs в серебряном тигле, но
образующееся при этом соединение (соединение IraOs с натрием) лишь
отчасти растворяется в воде. Если же плав обработать царской водкой,
то получают темнокрасный раствор Nas[IrCle]’.
При прокаливании металла с Na'Cl в атмосфере хлора легко обра-
зуется Naa[lrCle]s водный раствор которого окрашивается в красновато--
бурый цвет.
Иридий образует следующие окислы:
1ггО3(?)
синевато-черный
1гО2
иглы с металлическим
блеском
и гидроокись: 1
1г(ОН)4
ИНДИГОВОСИНИЙ
порошок
Весьма характерен темный цвет^ хлоридов:
1гС13 1гС14
темнозеленый черный
и бурый 1
Реакции мокрым путем
Следует пользоваться раствором NasflrCle],
1. Сернистый водород сначала обесцвечивает раствор вслед-
ствие восстановления тетрахлорида в трихлорид иридия, сопро-
вождающегося выделением серы; после этого осаждается- бурый
IraSa, легко растворимый в (NH^S. Из всех платиновых металлов
иридий наиболее трудно осаждается сероводородом. Он легче
осаждается из солянокислых, чем из хлорнокислых растворов.
2. Хлор. Если пропускать хлор в разбавленный раствор тетрахлорида
иридия, то раствор приобретает по Пальмеру (Palmaer)2 красновато-фио-
1 По W. Palmaer [Z. anorg. Chem. 10, 322—326 (1896)]. IrCh и его
двойные соли существуют в двух модификациях: темнозеленой и бурой.
2 Z. anorg. Chem. 10, Зг-З (1895).
578
летовую окраску; спустя некоторое время на место красной окраски по-
является бурая. Ту же самую красную окраску наблюдал Ферстер (Foera-
ter) 1 на иридиевом) аноде в серной кислоте. Согласно Пальмеру красный
цвет обусловливается образованием иридиевого соединения, в котором
валентность иридия больше четырех.
3. Хлорид калия осаждает буровато-черный хлороиридат ка-
лия К2[1гС16], не растворимый в спирте, трудно растворимый
в воде.
4. Едкий натр. При прибавлении едкого1 натра к раствору
темнокрасный цвет последнего переходит в зеленый; при нагре-
вании раствор сначала окрашивается в красноватый цвет и, на-
конец, в лазуревосиний:
2IrCh + 2NaOH -> 21гС1з + Nad + НЮ + NaOd.
Если теперь подкислить раствор соляной кислотой, прибавить
немного спирта2 и хлористый калий, то осадок не будет вы-
деляться, потому что образующийся при этом KsflrCle] легко рас-
творим в воде и в растворе хлорида калия (отличие от пла-
тины).
При добавлении гипохлорита или гипобромита к щелочному
раствору образуется синяя двуокись 1гОз.
5. Хлористый аммоний осаждает темнокрасный хлороиридат
аммония (NH^CIrCk], не растворимый в насыщенном растворе
осадителя.
Если на раствор калиевой или аммониевой соли Н2[1гС1б]
в горячей воде подействовать нитритом1 калия, то образуется
оливковозеленая калиевая или аммониевая соль Нз[1гСк]:
K2[IrCle] + KNTOa-> K3[IrdeJ + NO2.
Соль выкристаллизовывается при охлаждении. Но если при-
бавить к горячему зеленому раствору избыток нитрита) калия,
то раствор окрасится в желтый цвет и, наконец, выделится белый
осадок.
6. Восстановители обыкновенно либо изменяют окраску рас-
твора в зеленоватый цвет, вследствие восстановления тетрахло-
рида в трихлорид, либо раствор обесцвечивается и выделяется
тонко раздробленный металл.
Так, при нагревании раствора с нитритом калия получается оливково-
зеленая окраска:
IrCh + KNOj -* IrCls + КС! -f-’NOs.
Если раствор кипятить в течение некоторого времени с избытком
KNOz, он становится желтым и часть иридия выделяется в виде желтова-
тп-6елого осадка, тоудно растворимого в холодной соляной кислоте или
в кипящей воде. Осадок имеет состав 3Ks[lr(NO2).] Кз[1гС1.].
1 Z. Elecrrochetn. 10, 175.
г Спирт восстанавливает NaOCl в NaCl.
37*
579
Муравьиная кислота не полностью восстанавливает растворы иридия
до металла; восстановленный металл трудно растворяется в царской
водке. Взбалтывание раствора иридия с серебром или ртутью не восста-
навливает иридия до металла (отличие от Pt, Pd и Au).
Щавелевая кислота, сульфат железа (2), хлористое олово и гидроксил-
амин восстанавливают тетрахлорид в трихлорид; цинк восстанавливает до
металла так же, как и муравьиная кислота, если ее применять при нагре-
вании в присутствии ацетата аммония. Менее легко протекает реакция вос-
становления в присутствии большого количества минеральной кислоты.
Кипячение с хлористым оловом с добавлением избытка едкой щелочи
выделяет осадок телесного цвета.
Реакции сухим путем
При сплавлении с содой в нижнем восстановительном -пламени
может быть получен серый хрупкий металл, не растворимый
в царской водке. Сплавление с перекисью натрия в никелевом
тигле превращает иридий в окись или натриевую соль, которая
не растворима в воде, но легко растворима в соляной кислоте.
Разделение и открытие шести платиновых металлов
Разделение и открытие рутения, родия, палладия, осмия, иридия и
платины (элементы 44, 45, 46, 76, 77 и 78 периодической системы) пред-
ставляют ряд трудностей, потому что все эти металлы, принадлежащие
к одной и той же VIII группе (стр. 101), обладают сходными свойствами.
Кроме того, элементы эти редки и весьма -рассеяны; поэтому важно от-
крытие весьма малых количеств их. Долгое время авторитетными счита-
лись работы Сент-Клер-Девилля (Sainte-Claire-Deville), Дебрея (Debray) и
Стаса (Stas)1; в первых изданиях настоящего руководства излагалась
также схема анализа, предложенная Милиусом и Дитцом (MjOius и.
Dietz)2. В последних изданиях рекомендовался ход анализа, разработан-
ный Нойесом и его учениками. Совсем недавно Джилкрист (Gilchrist) и
Вихерс (Wichers)3 предложили более простой метод, являющийся в то же
время и наиболее точным. Этот метод дает возможность определять от
0,015 до 0,3 г любого элемента или всех членов этой группы элементов
с точностью +0,3 мг. Нижеследующая схема анализа базируется на этом
методе Джилкриста и Вихерса, не затрагивая, однако, всех деталей и предо-
сторожностей, которые необходимы для точного количественного анализа.
Почти 'все схемы анализа используют летучесть OsOi и RuOi. Четырех-
окись осмия улетучивается при кипячении раствора, сильно подкисленного
азотной кислотой, или смесью последней с хлорной кислотой, или серной
кислотой. Нойес рекомендует перегонку обоих окислов производить из
смеси азотной и хлорной кислот; Джилкрист и Вихерс предпочитают от-
гонку OsO« из раствора, содержащего азотную кислоту, и после удаления
осмия прибавляют бромноватокислый калий и затем отгоняют RuCh. Сле-
дующий ход анализа, основанный на их методе, дает возможность открыть
1 мг какого-либо металла в присутствии 200-кратного количества любого
другого из членов платиновой группы. При этом предполагается, что ко-
личество всех шести платиновых металлов не больше 0,3 г.
Перегонный прибор. 700-миллилитро-вая колба А (рис. 20) закрывается
пришлифованной пробкой, снабженной: 1) трубкой, доходящей почти до
дна, через которую можно пропускать воздух в колбу во время пере-
1 Proces verbaux du comiti intern, des poids et mesures 1877—1878.
2 B. 31, 3187 (1898).
s J. Am. Chem. Soc. 57, 2565 (1935).
о
гонки; 2) капельной воронкой для введения в колбу раствора и 3) отводя-
щей трубкой, через которую пары пропускаются в три 300-миллилитровые
эрленмейеровские колбы —
/?, С и D. Каждая из этих
трех колб снабжена стек-
лянной- пришлифованной
пробкой, так что газ, вы-
деляющийся из колбы А,
не соприкасается с рези-
новыми пробками или со
смазанными стеклянными
кранами; в (противном
случае, четырехокись ос-
мия, соприкасаясь с орга-
ническим веществом, тот-
час разложилась ‘бы с
выделением OsCh. Шли-
фы герметизируют плен- «
кой воды. Между прием-
никами В и С в газоот-
водящую трубку впаяна
капельная воронка Та, через которую можно прибавлять раствор Na-НСОз.
Только одна часть аппарата смазана жиром —это кран капельной воронки
71. Во время дестилляции рекомендуется время от времени промывать трубку
капельной воронки 71 водой, чтобы удалять четырехокись осмия, которая
может проникнуть в нее. ___________
1. Отделение осмия в виде OsOi. В колбу В вливают 150 мл &N НС1,
предварительно свеженасыщенной £Оа, и по 50 мл того же раствора в каж-
дую из колб С я D. Для качественных реакций необходима только одна
поглотительная колба. Исследуемый раствор вливают в дестилляциовную
колбу А и разбавляют, если необходимо, приблизительно до 100 мл. Через
воронку 71 добавляют 40 мл 7,5N азотной кислоты. Про)1ывают в0ронку и
трубку 10 мл воды. Просасывают слабый ток воздуха через аппарат, при
помощи насоса, присоединенного к трубке Е. Раствор в А нагревают до
кипения и продолжают кипятить в течение часа. (Ьсли осмий находится
в виде OsCle", на дестилляцию потребуется 7—8 час., чтобы удалить весь
осмий из раствора, содержащего 0,3 г этого металлу в этом случае пред-
почтительнее пользоваться концентрированной серной кислотой с добавле-
нием небольшого количества азотной кислоты вместо вышеуказанных
40 л»л последней. Это значительно сократит время дестилляции). Практически
в первом приемнике В происходит поглощение (всего осмия. Раствор, остаю-
щийся в дестилляционной колбе, будет содержать только Ru, Pt, P'd, Rb
и Ir (см. 3).
2. Открытие осмия. Для качественных целей Достаточно исследовать
только содержимое приемника В. Раствор переливают в стакан и выпари-
вают почти досуха на водяной бане. К остатку прибавляют 10 мл 12W НС1
и оставляют тга водяной бане на 15 мин. Полученный раствор делят на
три части, которые применяют для следующих трех реакций'.
а) Разбавляют 1 ч. раствора приблизительно до 100 лы и насыщают
сероводородом; появление темнобурого осадка сульфида указывает на
присутствие осмия.
б) Выпаривают из другой части раствора большую часть кислоты, раз-
бавляют небольшим количеством воды и прибавляют немного твердой тио-
мочевины; в присутствии Os появляется густая розовая окраска. Реакция
очень чувствительна.
в) Выпаривают третью часть раствора досуха. Растворяют в 50 мл
воды нагревают до кипения и нейтрализуют 1О/о-ным раствором NaHCOa
до появления осадка или до тех пор, пока раствор не покажет щелочной
реакции по бромфенолблау (переход желтой окраски в синюю при рН=4).
Образование красновато-бурой водной двуокиси осмия OsOa указывает на
присутствие осмия. „
3. Отделение рутения в виде RuOi. Раствор, оставшийся в колбе А
после обработки его, описанной в п. 1, переливают в стакан или чашку и
581
580
выпаривают досуха на паровой бане. Прибавляют 10 мл 12У соляной кис-
лоты и снова выпаривают. Такую обработку повторяют до тех пор, пока
не прекратится выделение окислов азота. Остаток растворяют в 20 ли
воды и осторожно выпаривают до появления тяжелых паров серной кис-
лоты. Охлаждают, осторожно прибавляют (сначала по каплям) 10 мл воды
и переливают сернокислый раствор обратно в ту же колбу А, которой
пользовались для отделения осмия. Если в стакане выделяется некоторое
количество платины, ее смывают в колбу. Раствор разбавляют до 100 ли,
прибавляют 100 мл 10%-ного раствора бромата калия и перегоняют, как
указано в п. 1, в три приемника со свежими порциями НС1—SO2. После
перегонки в течение приблизительно 90 мин. при слабом нагревании и
пропускании через раствор тока воздуха прибавляют еще 25 мл раствора
бромата и отгоняют в течение еще 1 часа. Во время перегонки целесооб-
разно прибавлять время от времени понемногу насыщенного водного рас-
твора SO2 через капельную воронку Тг, этим достигается наличие в аб-
сорбенте избытка SO2. После 21/2-часовой перегонки практически весь ру-
тений отгоняется в виде RuO<. Оставшийся в колбе А раствор сохраняют
для реакций на Pt, Pd, Rh и Ir (и. 5).
4. Открытие рутения. Содержимое приемника В, в котором находится
большая часть рутения, переносят в стакан и выпаривают на водяной бане
до получения влажного остатка. Прибавив затем 10 мл 12W соляной кис-
лоты и накрыв стакан часовым стеклом, оставляют его еще на 1 час на
водяной бане, после чего прибавляют 50 мл воды и нагревают до кипении,
чтобы растворить оставшееся соединение рутения. Раствор делят на три
части и производят с ними следующие реакции:
а) Подщелачивают раствор аммиаком и прибавляют немного раствора
тиосульфата натрия; появление красновато-фиолетовой окраски служит
признаком наличия рутения.
б) К раствору прибавляют немного тиомочевины; зеленоватая или си-
няя окраска раствора указывает на присутствие рутения.
в) Разбавляют раствор до 200 мл, нагревают до кипения и тщательно
нейтрализуют 10%-ным раствором соды, пока раствор не приобретет ще-
лочной реакции по индикатору бромкрезолпурпур. Переход желтой окраски
индикатора в синюю происходит приблизительно при рН= 6. Если руте-
ний присутствует, то выделяется окрашенный в темный цвет осадок водной
трехокиси рутения.
5. Выделение палладия, родия и иридия в виде водных двуокисей.
Содержимое колбы А после операции, описанной в п. 3, переносят
в литровый стакан и осторожно разлагают остаток бромата прибавлением
12N соляной кислоты. Выпаривают раствор до небольшого объема и для
большей уверенности в разложении бромата прибавляют еще соляной
кислоты. (Иногда колба А окрашивается двуокисью иридия 1гОг. Послед-
няя может быть растворена в небольшом количестве царской водки, но
раствор не следует приливать к главному раствору до разложения нитроз-
ных соединений путем двукратного выпаривания с концентрированной
соляной кислотой). Наконец, выпаривают, насколько возможно, на водяной
бане и разбавляют водой до 200 мл.
Если заранее известно, что исследуемый раствор не содержит ни ос-
мия, ни рутения, то операции, описанные в пунктах 1, 2, 3 и 4. отпадают.
В таких случаях испытуемый раствор выпаривают с соляной кислотой на
водяной бане до получения влажного остатка и, если азотная кислота при-
менялась для растворения исследуемого вещества, снова выпаривают с со-
ляной кислотой. Прибавив затем 2 г NaCl и 5 мл 12W НС1, выпаривают
досуха. К остатку прибавляют 2 дл 12N НС1 и разбавляют до 200 мл.
Нагревают раствор, содержащий Pt, Pd, Rh и 1г, до кипения и при-
бавляют 20 мл 10%-ного раствора бромата натрия. Осторожно приливают
10%-ный раствор NaHCOs до тех пор. пока в зеленом растворе не обра-
зуется неисчезающий осадок. При рН=6 весь родий и иридий и большая
часть палладия выделяются -в виде водных двуокисей. Указанное значение
pH можно контролировать индикатором — бромкрезолпурпуром, который
меняет свой цвет из желтого в синий. Поэтому время от времени кипящий
раствор подвергают следующему испытанию. В раствор опускают стеклян-
ную палочку и тотчас вынимают ее; затем дают капле 0,01%-ного рас-
582
твора бромкрезолпурпура стечь по палочке к вынутой капле испытуемого
раствора, повисшей на ее конце. Если капля бромкрезолпурпура, попадая
на каплю раствора, находящегося на палочке, окрасится в синий цвет, то
это будет служить указанием, что прибавлено достаточное количество
NaHCOs. После этого прибавляют еще 10 мл 10%-ного раствора бромата
и кипятят в течение 5 мии. Затем повышают pH до 10, добавляя по кап-
лям раствор бикарбоната натрия до тех пор, пока капля раствора, испы-
танная, как выше описано, с 0,01%-ным раствором крезолрот. не окра-
сится в розовый цвет. После этого прибавляют еще 10 мл 10%-ного рас-
твора бромата натрия и кипятят 15 мин. Фильтруют и фильтрат исследуют
на присутствие в нем платины; осадок же, состоящий из водных двуокисей
PdOa, RhOs и IrOs, промывают 1%-ным раствором хлористого натрия и его
исследущт, как описано в п. 7—9.
6. Открытие платины. Осторожно прибавляют к фильтрату соляную
кислоту до разложения всего бикарбоната натрия. После этого прибавляют
еще 20 мл концентрированной соляной кислоты и выпаривают досуха; при-
бавив затем еще 10 мл 12W соляной кислоты, снова выпаривают досуха,
чтобы быть уверенным в полном разложении бромата. Наконец, приба-
вляют еще 5 мл 12N соляной кислоты, нагревают, разбавляют приблизи-
тельно до 100 мл и фильтруют. Раствор делят на три части и производят
испытания на платину, пользуясь реакциями 4, 7д и 7з, приведенными на
стр. 564 и 565.
7. Открытие палладия. Осажденные окиси палладия, родия и иридия
растворяют, нагревая с 10 .мл концентрированной соляной кислоты на во-
дяной бане. Несколько разбавив, фильтруют и разбавляют фильтрат при-
близительно до 400 мл. Прибавляют небольшой избыток 1%-ного раствора
диметилглиоксима в 95%-ном спирте (на каждый находящийся в рас-
творе миллиграмм Pd следует применять 0,2й мл реагента). Спустя час от-
фильтровывают осадок и промывают его горячей водой. Желтый осадок
представляет собой Pd(CsHi4N4O«) и содержит 31,6% Pd. В дальнейшей
идентификации Pd нет необходимости.
8. Открытие родия. К фильтрату, полученному после осаждения палла-
дия, прибавляют 10 мл концентрированной серной кислоты и выпаривают
до выделения паров последней. При этом происходит обугливание нахо-
дящегося в растворе избытка прибавленного диметилглиоксима. Охла-
ждают, прибавляют около 2 мл концентрированной азотной кислоты и на-
гревают до тех пор, пока снова не начнут выделяться густые пары. По-
добную операцию повторяют до полного окисления угля. Затем, выпарив
снова До появления паров, охлаждают, осторожно прибавляют 20 мл хо-
лодной воды и снова выпаривают до выделения паров, чтобы быть уве-
ренным в полном удалении всей азотной кислоты. Охладив, наконец, рас-
твор, прибавляют по каплям воду, сначала в таком количестве, чтобы
объем ее был равен объему имеющейся кислоты, после чего разбавляют
приблизительно до 200 мл. Нагревают до кипения и прибавляют по каплям
20%-ный раствор треххлористого титана для осаждения родия.
В присутствии избытка треххлористого титана жидкость над осадком
кажется слегка пурпуровой. В присутствии большого количества иридия о
полноте осаждения родия судят по прекращению дальнейшего образования
осадка и по окрашиванию раствора над осадком в оранжевый цвет1. Ки-
пятят 2 мин., фильтруют и промывают осадок 2,5%-ной серной кислотой.
Фильтратом пользуются для реакции на иридий.
Если хотят подтвердить реакцию на родий в случае малого осадка,
последний вместе с фильтром нагревают с серной и азотной кислотами
точно так, как это было указано для удаления избытка диметилглиоксима.
После полного окисления угля при действии горячей концентрированной
серной кислоты охлаждают, разбавляют 20 мл воды и снова выпаривают
до появления паров серной кислоты. Охлаждают и повторяют реакцию
с треххлористым титаном.
9. Открытие иридия. Фильтрат, полученный по выделении родия,
охлаждают, поместив стакан в сосуд с дробленым льдом. Чтобы осадить
1 Иридий в противоположность родию не выделяется треххлористым
титаном в виде металла, но изменяет цвет раствора. Ред.
583
избыток титана, прибавляют небольшой избыток охлажденного, свежепри-
готовленного раствора купферрона. Отфильтровывают и промывают осадок
2,5%-ной серной кислотой. Фильтрат выпаривают досуха и разрушают
избыток купферрона обработкой азотной кислотой, как это описано в п. 8.
В дальнейшем прибавлении серной кислоты нет необходимости. По удале-
нии органического вещества, которое, повидимому, мешает гидролитиче-
скому осаждению окиси любого члена этой группы металлов, раствор ней-
трализуют и осаждают водную двуокись иридия бикарбонатом и броматом
натрия точно так, как описано в п. 6. Образование при данных условиях
осадка служит достаточным' доказательством наличия иридия.
ГРУППА Ш. МЕТАЛЛЫ ГРУППЫ (NH4)2S
БЕРИЛЛИЙ, УРАН, ТИТАН, ЦИРКОНИЙ, ТОРИЙ, ГАФНИЙ,
СКАНДИЙ, ИТТРИЙ, ЦЕРИЙ, ЛАНТАН И ДРУГИЕ
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ, ТАЛЛИЙ, ИНДИЙ, ГАЛЛИЙ
И ВАНАДИЙ
Бериллий Be. Ат. в. 9,02. Ат. н. 4
Плотность 1,84. Т. пл. 1370°
Нахождение в природе. Хризоберилл Ве(АЮ2)а; фенацит BesSiCh; бе-
рилл BesAhSieOis; эвклаз AlBeHSiOs; мелифанит BeaCasNaSisOioF и лейкофа-
яит BeCaNaSisOeF.
Свойства. Бериллий является двухвалентным металлом, образующим бе-
лую окись ВеО, растворимую в кислотах. Металл устойчив на воздухе, на
него не действует вода, но он растворяется в разбавленных соляной и сер-
ной кислотах, а также в едком натре или кали с выделением водорода:
Be + 2Н’Be’' + На; Be + 2ОН' -э-ВеОг" + Hs.
Бериллий подобно алюминию пассивируется при действии азотной
кислоты. Его электропроводность превосходит электропроводность меди;
твердость его почти равна твердости кварца. Иногда им пользуются вместо
алюминия в качестве окна в рентгеновских трубках. Изучены некоторые
его сплавы. Прибавление окиси бериллия вместо окиси кальция к стеклу
увеличивает твердость последнего и повышает точку плавления, но высо-
кая цена препятствует его промышленному использованию. ВеО может
применяться в качестве огнеупора взамен MgO.
Гидроокись бериллия Ве(ОН)2 сходна с гидроокисью алюминия по
своему внешнему виду н по своим амфотерным свойствам. Подобно
А1(ОН)з гидроокись бериллия с трудом растворяется в кислотах, если дать
ей постоять некоторое время после осаждения-
По своим химическим свойствам бериллий очень сходен с алюминием.
Соли его в водном растворе показывают кислую реакцию и обладают
сладковатым вяжущим вкусом.
Реакции мокрым путем
Следует употреблять раствор сульфата бериллия.
1. Аммиак и сернистый аммоний дают белый осадок Ве(ОН)г,
сходный ню виду с А1(ОН)з, едва растворимый в избытке оса-
дителя и легко растворимый в НС1 с образованием бесцветного
раствора. Часто наблюдающаяся желтая окраска раствора гидро-
окиси бериллия в НС1 обусловлена следами хлорного железа.
2. Едкое кали осаждает белый студенистый гидрат окиси
584
бериллия, легко растворимый в избытке осадителя с образованием
бериллатов:
Be' ‘ + 2ОН' -> Ве(ОН)2; Ве(ОН)2 + 2ОН' -> ВеОг" + 2HsO.
Бериллаты щелочей легко расщепляются гидролитически при нагрева-
нии с водою; поэтому разбавленный раствор бериллата щелочного металла
отщепляет при кипячении весь бериллий в виде гидрата окиси.
По Габеру (Haber) и Ордту (v. Ordt)1 гидрат окиси бериллия, выде-
лившийся при кипячении раствора бериллата щелочного металла, значи-
тельно плотнее, чем гидрат, свежеосажденный аммиаком, и отличается от
него своей нерастворимостью в углекислом калии и трудной раствори-
мостью в углекислом аммонии; он также значительно труднее растворяется
в разбавленных кислотах. Если к раствору прибавить большой избыток
едкой щелочи, то при кипячении гидрат окиси бериллия не выделяется.
Винная кислота препятствует осаждению гидроокиси бериллия.
3. Углекислый аммоний дает белый осадок углекислого1 бе-
риллия, легко растворимого в избытке осадителя (отличие от
алюминия); при кипячении раствора бериллий выделяется в виде
белого основного карбоната. Отношением (NFIiJeCOs к солям
бериллия пользуются для отделения их от солей алюминия и
железа. Однако это отделение, как и отделение посредством
КОН, не является полным.
По Фрезениусу раствор необходимо подвергать нагреванию.
Для количественного отделения бериллия гидроокись или карбо-
нат его снова растворяют и осаждение повторяют несколько раз.
По Парсону (Parson) и Барнесу (Barnes)2 для отделения бе-
риллия от алюминия может служить кипячение в 10%-ном рас-
творе гидрокарбоната натрия, причем гидроокись алюминия оса-
ждается, а бериллий остается в растворе.
4. Карбонаты щелочей дают белый осадок меняющегося со-
става; обыкновенно образуется основной карбонат. Свежеоса-
жденный карбонат растворяется в большом избытке раствора
карбоната натрия или калия, но растворимость его В1 углекис-
лом аммонии значительно больше. При кипячении углеаммоние-
вого раствора происходит вновь осаждение бериллия, чего’ не
бывает с углекалиевым или угленатриевым раствором, если
только он не очень разбавлен.
5. Карбонат бария осаждает гидрат окиси бериллия.
6. Щавелевая кислота, а также щавелевокислый аммоний не
дают осадка (отличие от тория, циркония и редких земель).
7. Сульфат калия образует с сернокислым бериллием красиво
кристаллизующуюся двойную соль K2Be(SO4)2-2H2O, растворимую
в концентрированном растворе K2SO4 (отличие от Се, La, Nd, Pr).
8. Эфир и соляная кислота. Смесь равных объемов воды и
эфира, насыщенных соляной кислотой, растворяет хлористый
бериллий. Этим он отличается от алюминия. (Лучший способ
отделения бериллия от алюминия3.)
I 1 Z. anorg. Chem. 38, 382 (1904).
2 Z. anal. Chem. 46, 292 (1907).
3 F. S. Havens, Z, anorg. Chem. 18, 147 (1898); далее H. E. Brunner,
Diss., Zurich 1920.
585
9. Фосфат аммония (NHt^HPOt осаждает студенистый фос*
фат бериллия, растворимый в избытке осадителя. При осторож-
ном добавлении аммиака (избегая избытка его) образуется при
кипячении кристаллический осадок фосфорнобериллиевоаммо-
ниевой соли. Лимонная кислота, препятствуя осаждению алюми-
ния, не препятствует осаждению бериллия, но в присутствии
большого количества алюминия последний удерживает бериллий
в растворе.
10. Морин не дает флуоресценции с раствором соли бе-
риллия.
11. Тиосульфат натрия не осаждает бериллия.
12. Ацетилацетон1 СНз — СО — СНз— СО — СНз образует в
своей энольной форме с ионом бериллия в очень слабокислом
растворе весьма устойчивую внутрикомплексную соль2:
СН3— С-------(\ /О-----------с — сн8
II >Ве< II
НС — С = о- •'О = С —сн
сн3 сн3
легко растворимую в воде, спирте, эфире и сернистом углероде.
Ащетилацетонат бериллия плавится при 108°, при 100° начинает
возгоняться и кипит без разложения при 270°. Аналогичное
соединение алюминия плавится при 194° и кипит при 314°3.
Ацетилацетонат бериллия образует бесцветные моноклиниче-
ские призматические кристаллы, отличающиеся4 от ацетилацето-
натов алюминия и редких земель отношением своих осей
а :й : с= 1,4765 : 1 : 1,3592 и р = 52°20'5.
13. Хлороформ. Для отделения бериллия от алюминия Габер
и Ордт используют растворимость ВеО • ЗВе(СНзСОО)2 в хлоро-
форме 6. Гидроокиси этих элементов в свежеосажденном состоя-
нии растворяют в ледяной уксусной кислоте, выпаривают с не-
большим количеством! воды и остаток экстрагируют хлоро-
формом.
Чтобы открыть небольшие количества бериллия в присутствии боль-
шого количества алюминия, Рэсслер (ROssler)7 рекомендует следующий ме-
тод. Растворяют гидроокиси в соляной кислоте, выпаривают досуха и
остаток растворяют в малом количестве воды, прибавив, если необхо-
димо, немного соляной кислоты. Раствор вливают в толстостенную
1 Combes, С. г. 119, 1221 (1894). Можно также применять аммиачный
раствор ацетилацетона и водный раствор. Beds [W. В i 11 z- Ann. 331, 336
(1904) и Z. anorg. Chem. 82, 439 (1913)].
2 G. T. Mdrgan a. H. W. Moss, J. Chem. Soc., London, 105, 193
(1914).
’Combes, Ацетилацетонат алюминия—шестиугольные моноклиниче-
ские пластинки.
4 Gaglioti, Chem. Zentr. II, 1739 (1927).
5 F. M. Jaeger, Rec., 33, 394 (1914).
e Z. anal. Chem. 40, 465 (1901).
7 Z, anorg, Chem. 13* 435 (1897), , ,
586
стеклянную трубку, запаянную с одного конца, прибавляют сульфат ка-
лия в количестве, превышающем в 12 раз имеющееся количество алюми-
ния, и достаточно воды, чтобы при нагревании соль растворилась. Запаи-
вают другой конец трубки и нагревают в течение получаса при 180°.
После охлаждения открывают трубку, отфильтровывают основной суль-
фат алюминия-калия и осаждают бериллий аммиаком. Чтобы очистить
гидроокись бериллия, его быстро растворяют в соляной кислоте, при-
бавляют немного лимонной кислоты и осаждают бериллий из кипящего
раствора, в виде фосфорнобериллиевоаммониевой соли.
* Добавление редактора. 14. Щелочной раствор хинализарина
(1, 2, 5, 8-тетрагидрсжсианТ'рахинон) дает с щелочным раствором
бериллиевой соли васильковосинее окрашивание. В отсутствие
бериллия щелочной раствор окрашивается в фиолетовый цвет,
присущий самому хинализарину.
Чувствительность реакции чрезвычайно велика: 0,5 у Be в 1 мл
или 1 : 2 000 000.
Об открытии Be в присутствии Mg, дающего ту же реакцию
с хинализарином (стр. 303), см. оригинальную работу Г. Фи-
шера Ч* А. К.
Реакции сухим путем
Соли бериллия, омоченные раствором нитрита кобальта,
при прокаливании дают серую массу. Сплавленная с двукрат-
ным количеством кислого фтористого калия НКРг масса рас-
творяется в воде, содержащей фтористоводородную кислоту.
При тех же условиях фторид калия-алюминия не раство-
ряется.
Весьма хорошо удается открытие бериллия в искровом спектре по
двойной линии 313,1 и 313,0 {лр..
Уран U. Ат. в. 238,07. Ат. н. 92
Плотность 18,7. Т. пл. около 1850°
Нахождение в природе. К главным минералам, содержащим уран, отно-
сятся урановая смоляная руда UsOe; карнотит K5(UO2)2(VO4)2 • 8Н2О и авту-
нит Са(иОг)2 • (POi) • 8Н2О. Его находят также в более редких минералах,
как уранит (UOa^CufPOps • 8Н2О; самарскит (ниобиевая соль железа, ит-
трия, церия и эрбия, содержащая меняющиеся количества урана) и либи-
гит U(COs)2 • 2CaCOs • ЮН2О.
Свойства. Металлический уран похож по внешнему виду на никель.
Он ковок и тягуч, превосходно полируется, но во влажном воздухе быстро
тускнеет; в тонко раздробленном состоянии подобно железу он горит на
воздухе, разбрасывая искры, если его нагреть до 170°. Уран медленно раз-
лагает воду при комнатной температуре и довольно быстро при кипячении.
Уран является элементом, обладающим наибольшим1 атомным' ве-
сом. В периодической системе он находится в одной группе с серой и
хромом, которые в своей высшей положительной валентности (+6) дают
с кислородом двухвалентные анионы SOi" и СгСЬ". Так как согласно
общему правилу чем ниже положение элемента в группе, тем сильнее
выражены его основные свойства, то уран в своей высшей положитель-
1 Н. Fischer, Z. anal. Chem. 73, 5 (1928).
587
ной валентности (+6) дает с кислородом двухвалентный катион UOa’’- во
многих отношениях напоминающий нон магния. Так, он образует осадок
UO2NH4PO4 • 6Н2О, соответствующий MgNHiPCh • 6Н2О, который при про-
каливании превращается в (UOahPaO-, аналогичный MgzPzO?. С другой сто-
роны, уран с валентностью +6 образует подобно хрому двухвалентные
анионы биураната U2O7".
Окислы урана применяются в керамике для производства желтых и
флуоресцирующих стекол. Их используют также в сталелитейной промы-
шленности в качестве заменителя вольфрама, но спрос на них мал, воз-
можно вследствие их высокой цены.
Окиси и гидроокиси. В литературе описаны пять окислов урана: UO2,
U2O5, UOs, UsOe и UO4. Из них определенно известны UO2, UOs и UsOe,
хотя последняя, может быть, является соединением UO2 и 2Ь’0з. Темно-
бурая двуокись UO2 получается при сгорании урана на воздухе при 150—
170° или при нагревании UsOe в токе водорода приблизительно при 625—
650°. Трехокись урана UOs кирпичнокрасного цвета образуется при нагре-
вании ураната аммония (NhhIsUaO? или карбоната уранил-аммония
(NH4)4(UO2XCOs)3 при температуре, не превышающей 300°. Эта окись по-
добно WOs и МоОз обладает амфотерным характером, причем ее кислот-
ные свойства менее выражены. Она образует два гидрата, желтый моно-
гидрат иОз-НзО и дигидрат иОз-2НгО- Первый может вести себя как
урановая кислота H2UO4, а второй — как гидроокись уранила UOa(OH)2,
являющаяся по своим реакциям основанием.
Без доступа воздуха двуокись урана растворяется в сильных кислотах
с образованием урановых солей:
UO2 + 4НС1 -> 2НгО + UCh; UO2 + 2H2SO4 -> 2НгО + U(SO4)2.
Урановые соли чрезвычайно нестойки и на воздухе быстро образуют
ураниловые соли, содержащие двухвалентную группу UCh:
2UCh + Оз + 2НгО -> 2UO2CI2 + 4НС1; '
2U(SO4)s + Оз + 2НгО-> 2UO2SO4 + 2H2SO4.
Трехокись урана растворяется в кислотах, образуя ураниловые соли:
UOs + 2НС1 -> UO2CI2 + Н2О4 -
При прокаливании урана на воздухе получается UsOe или ^UOs-UCh). Эта
окись без доступа воздуха растворяется в сильных кислотах с образо-
ванием урановых и ураниловых солей:
(2UOs UO2) + 4Н2=С>4 -> 2UO2SO4 + U(SO4)2 + 4Н2О.
При растворении в царской водке получают хлористый уранил:
ЗШОа + 18НС1 + 2HNOs -> 9UO2CI2 + 2NO + ЮН2О.
Ниже приведены реакции только солей уранила.
Все ураниловые соединения окрашены в желтый или желтовато-зеленый
цвет. Большая часть их растворима в воде, за исключением окиси, суль-
фида, фосфата и ураната. В минеральных кислотах все урановые соедине-
ния растворимы, за исключением железистосинеродистого уранила.
При систематическом ' ходе анализа бериллий сопутствует урану. Их
разделение основано на том, что выпаренный уксуснокислый раствор аце-
тата уранила не растворим в безводном хлороформе, тогда как основной
ацетат бериллия растворим в хлороформе.
Реакции мокрым путем
1. Едкое кали осаждает аморфный желтый урановокислый ка-
лий (уранат калия). Реакция протекает в три стадии.
Сначала образуется гидроокись уранила:
UO2” + 2ОН' ->иОз(ОИ)2,
588
которая тотчас отщепляет воду и переходит в диурановую кис-
лоту;
2UO2(OH)2 ->'НгО + H2U2O7.
При дальнейшем добавлении едкого кали осадок превра-
щается в диурановокислый калий (диуранат калия):
НгПгОт + 2К ’ + 2ОН' K2U2O7 + 2Н2О,
который при осторожной нейтрализации теплого раствора^ вы-
кристаллизовывается и может быть получен в легко отфильтро-
вываемой форме. Напротив, он весьма трудно отфильтровы-
вается, когда он находится в состоянии студня. То же самое
относится и к осаждению аммиаком.
2. Аммиак осаждает желтый аморфный уранат аммония:
2UCV * 4- 6NH4OH -> (NH4)2U2O7 4- 4NHf 4- ЗН2О.
Уранаты щелочных металлов растворимы в карбонатах щелочных ме-
таллов, в особенности в карбонате аммония, с образованием комплексных
солей:
(NHihUsO: + бШНрзСОз + ЗНгО-^ШОфЦОгССОМ + 6NH4OH.
Поэтому в присутствии достаточного количества карбоната щелочного
металла аммиак не осаждает ураиа. Винная и лимонная кислоты (и другие
органические вещества) также препятствуют его осаждению аммиаком и
едкими щелочами подобно тому, как они препятствуют осаждению железа,
хрома и алюминия, между тем как таннин дает темнобурый осадок в
растворе тартрата, содержащего ацетат.
3. Карбонат натрия выделяет из концентрированных раство-
ров оранжево-желтый осадок натриевой соли уранил-карбоната:
UCMNOsh 4- ЗЫагСОз -> 2NaNO3 + Na4 [UO2(CO3)3].
Натрий-уранил-карбонат растворим в большом избытке воды,
поэтому осаждение не удается в разбавленном растворе. Еще
более растворим он <в .растворе карбоната натрия, особенно же
в растворе гидрокарбоната натрия. Из такого1 раствора едкий
натр снова осаждает уранат натрия, но аммиаком он не оса-
ждается.
4. Карбонат бария осаждает на холоду весь уран в виде ба-
риевой соли уранил-карбоната:
UO2(N'O3)2 4- ЗВаСОз -> Ba(NO3)2 4~ Ва2[и02(СОз)з].
В присутствии солей МН/ выделение урана не бывает количе-
ственным.
5. Сернистый аммоний осаждает бурый сульфид уранила:
UO2(NOs)2 4- (NH4)2S ->2NH4NOs 4- UO2S,
растворимый в разбавленных кислотах и углекислом аммонии:
UO2S 4- 3(ЫН<)2СОз -> (NH4)2S ф- (ЫН4)4[иО2(СОз)з].
589
Поэтому сернистый аммоний не осаждает сернистый уранил
из растворов ураниловых солей в присутствии углекислого
аммония.
При кипячении раствора урановой соли, к которой был прибавлен
сернистый аммоний, сернистый уранил разлагается на серу и черную дву-
окись урана UO2, которая не растворима в избытке сульфида аммония и
раствора карбоната аммония. Если сульфид уранила остается на некоторое
время в соприкосновении с избытком сульфида аммония, то он при до-
ступе воздуха постепенно превращается в красное вещество или в черное,
если доступ воздуха исключен: повидимому, эта реакция обусловливается
образованием тиосульфата аммония.
6. Фосфат натрия осаждает желтовато-белый фосфат ура-
UOz(NO3)2 + NasHPOt -> 2NaNOs + UO2HPO4.
В присутствии же уксуснокислого аммония осаждается фосфорно-
ураниламмониевая соль:
UO2(NO3)2.+, NaaHPCU + CH3COONH4 -> 2NaNO3 -f CHsCOOH +
4- UO2NH4PO4.
Оба осадка не растворимы в уксусной кислоте, но растворимы
в минеральных кислотах.
7. Железистосинеродистый калий K4[Fe(CN)e] выделяет бу-
рый осадок, а в очень разбавленных растворах образует буро-
красное окрашивание:
[Fe(CN)e]"" + UO2’ ’ -> (U02MFe(CN)e].
Едкое кали превращает буровато-красный осадок в желтый
вследствие образования диураната калия:
(UO2MFe(CN)6] + 6КОН -> K4[Fe(CN)e] + ЗНгО г K2U.-O7.
(Этой реакцией, а также тем обстоятельством, что железисто-
синеродистый уранил не образуется в разбавленном уксусно-
кислом растворе, пользуются для открытия меди и молибдена
в присутствии урана).
Реакция на UOa' ’ с железистосинеродистым калием весьма чувстви-
тельна и удается даже при количествах урана меньше 1 т. Реакция может
быть выполнена в присутствии железа и меди, если прибавить иодистый
калий для восстановления железа до двухвалентного, а меди до однова-
лентной. Двухвалентное железо и одновалентная медь с ферроцианидом
не реагируют. Выделяющийся при реакции иод обесцвечивают тиосуль-
фатом натрця, после чего уран может быть открыт ферроцианидом калия.
По опытам Файгля 1 восстановление до ионов двухвалентного, железа и
одновалентной меди целесообразно производить одним только тиосульфа-
том натрия. Присутствующая медь действует как катализатор при восста-
новлении железа.
8. Цинк (а также кадмий) восстанавливают в присутствии раз.
бавленной серной кислоты желтую ураниловую соль до зеленой
соли четырехвалентного урана:
UO2 * 4Н Ц- Zn —» Zn 2НгО + U •
1 См. Файгль, Капельный анализ, стр. 299—300. Ред.
590
9. Окись ртути в виде суспензии осаждает полностью уран
при кипячении раствора, содержащего хлористый аммоний.
(Отделение урана от ионов стронция, кальция и щелочных ме-
таллов и менее удовлетворительно от барий-ионов.)
10. Перекись водорода осаждает желтоватую перекись урана,
не растворимую в соляной кислоте. Присутствие сульфат-иона
препятствует осаждению. Перекись урана растворяется в растворе
карбоната аммония, образуя темножелтый раствор. Если осадок,
образованный перекисью водорода, растворить в серной кислоте
и раствор взболтать с небольшим количеством эфира, то послед-
ний окрашивается в синий цвет-
11. Перекись натрия выделяет желтый осадок, растворимый
в избытке реактива; от прибавления спирта выделяется желтый
осадок надурановокислого натрия NaaUOs-SHaO.
12. Куркумовая бумага окрашивается водными растворами
ураниловых солей,' особенно нитрата уранила, в бурый цвет.
Реакции препятствует присутствие значительного количества
кислоты.
Реакции сухим путем
Перл буры (или фосфорной соли) окрашивается в окисли-
тельном пламени в желтый, а в восстановительном пламени
в зеленый цвет.
Титан Ti. Ат. в. 47,90. Ат. н. 22
Плотность 4,49. Т. пл. 1793°. Т. кип. > 3000°
Нахождение в природе. Титан встречается в природе чаще всего в виде
двуокиси: рутил квадратной -системы, анатаз квадратной системы и брукит
ромбической систе-мы. Далее он образует минералы: перовскит CaTiOs,
титанит или сфен CaSiTiOs и, наконец, ильменит FeTi-Оз, а также входит
в состав многих кристаллических руд.
Свойства. Металлический титан по своему серому цвету -весьма сходен
с железом; на воздухе он легко сгорает, образуя белую двуокись титана;
он также соединяется с азотом, образуя нитрид. Металл достаточно тверд,
чтобы чертить стекло; он очень хрупок на холоду, но при красном кале-
нии он ковок и может быть вытянут в проволоку. По своим химическим
свойствам он сходен с церием, торием, цирконием и гафнием- Чрезвычайно
большие количества двуокиси титана применяются для производства белых
красок; титановые краски отличаются большой кроющей способностью и
хорошо противостоят действию воздуха.
Окислы. В литературе описаны четыре окисла титана. Окись ти-
тана TiO или TiaOa, получаемая путем 'восстановления- ТЮг при высокой
температуре углеродом или магнием. Она обладает основными свойствами,
но ее соли нестойки и имеют малое значение. Трехокись или, как ее
раньше называли, полутораокись титана TiaOs, образуется в виде черных
блестящих кристаллов при нагревании TiOa в токе водорода. Ее соли
фиолетового или зеленого цвета являются чрезвычайно сильными восста-
новителями; треххлористый титан TiCla по своим восстановительным свой-
ствам близок к хлористому олову SnCls и им пользуются в количественном
анализе для титрования солей трехвалентного железа. Гидроокись ТЦОН)з,
образующая при прибавлении едкой щелочи или аммиака к соли трехва-
лентного титана, окрашена в темный цвет и отличается большой нестой-
костью. -Важнейшим скислом титана- является двуокись ТЮг, представля-
591
ющая собой наиболее устойчивый продукт окисления титана. Гидроокись
Ti(OH)4 или TiO(OH)s обладает амфотерными свойствами, причем основной
характер ее более резко выражен, чем кислотный; даже ее щелочные соли
не растворимы в воде вследствие их гидролина. Гидроокись титана
TiO(OH)s чаще называют метатитановой кислотой.
Двуокись титана, встречающаяся в природе (рутил и пр.), не раство-
рима ни в одной из кислот. Чтобы перевести ее в раствор, лучше всего
сплавлять ее с пиросульфатом калия, причем она превращается в сульфат
титана:
TiO2 + 2K2S2O7 -> Ti(SO4)2 + 2К2?О4.
Охлажденный плав растворяется в холодной воде1 Двуокись титана
можно также перевести в раствор путем сплавления с карбонатом натрия
с последующей обработкой плава 6N соляной кислотой.
При действии на кислый раствор соли гитана перекиси водорода обра-
зуется перекись титана. Для перекиси титана были предложены формулы:
TiOs, Т1О2 • Н2О2 и HaTiOs; она также получила название* надтитановой
(пертитановой) кислоты. Для соединения, получающегося при добавлении
Н2О2 к сульфату титана, принята формула НгСТЮг^О*)*].
Растворимость. Металлический титан легко растворяется в фтористо-
водородной кислоте. Четырехфтористый титан TiF4 кипит при 284° и со-
единяется с избытком фтористоводородной кислоты с образованием ком-
плексной фторотитановой кислоты HsTiFe, калиевая соль которой КгТ1Р«
трудно растворима. В количественном анализе часто приходится иметь
дело с водной кремневой кислотой, содержащей некоторое количество вод-
ной ТЮг. Количество SiO2 определяется путем прокаливания осадка до
постоянного веса,, после чего его нагревают с серной и плавиковой кисло-
тами, снова прокаливают и взвешивают остаток. Первое взвешивание дает
сумму SiOa + ТЮ2. При обработке плавиковой кислотой образуются SiF«
и, возможно, TiF4. При нагревании с серной кислотой фтористый кремний
целиком улетучивается, a TiF4 превращается в Ti(SO4)2, который при даль-
нейшем нагревамии теряет SOs и остаток после окончательно,го нагревания
представляет собой TiCh.
Титан растворяется в горячей разбавленной соляной кислоте, образуя
TiCls, если раствор защищен от окисления. При действии на титан раз-
бавленной азотной кислоты медленно образуется НгТЮз; значительно
быстрее происходит ее образование при действии концентрированной азот-
ной кислоты; растворимость FhTiOs мала. Царская водка растворяет металл,
но действие ее быстро прекращается вследствие образующегося на металле
защитного покрова НгТЮз. Холодная, разбавленная серная кислота раство-
ряет титан с образованием TK(SO4)s и водорода; горячая же концентриро-
ванная серная кислота, образует Ti(SO4)2 и SO2. Свежеосажденная
(из холодных растворов) гидроокись титана Ti(OH)4 или TiO(OH)2 легко
растворяется в разбавленных минеральных кислотах, а также в растворе
карбонатов щелочных металлов или аммония-, но если осадку дать постоять
некоторое время или прокалить его, то он теряет свою способность
растворяться в разбавленных кислотах и заметно не растворяется при ки-
пячении в едких или углекислых щелочах. Такую гидроокись можно,
однако, растворить, хотя и медленно, действуя на нее концентрированной
серной кислотой при нагревании. Сульфат Ti(SO4)a растворим в холодной
разбавленной серной кислоте, но при недостаточном количестве последней,
легко гидролизуется с образованием нерастворимого основного сульфата
титанила TiO-SO4 или метатитановой кислоты НгТЮз [или TiO(OH>].
Четыреххлористый титан представляет собой жидкость, кипящую при
136°. Он так же, как и четырехиодистый титан, применяется для производ-
ства металлического титана; галоидные соединения титана восстанавли-
ваются натрием или гидридом последнего. Соли четырехвалентного титана
бесцветны.
Реакции мокрым путем
Для этих реакций пользуются раствором сернокислого титана или
раствором гидрата окиси титана в соляной кислоте.
592
1. Едкие щелочи осаждают на холоду белую студенистую
ортотитановую кислоту:
Ti” " + 4ОН'-> Н4Т1О4,
почти не растворимую в избытке осадителя и легко раствори-
мую в минеральных кислотах.
При нагревании же едкое кали осаждает весь титан в виде
метатитановой кислоты:
Ti' ’ 4- 4ОН' -> Н2О + TiO(OH)f,
которая в разбавленных кислотах очень трудно растворима.
При длительной обработке концентрированной соляной или сер-
ной кислотой она переходит постепенно в раствор. При накали-
вании обеих титановых кислот получается ангидрид ТЮе, мало
растворимый в концентрированной соляной кислоте, но легко
растворимый в горячей концентрированной серной кислоте.
2. Аммиак, сернистый аммоний и углекислый барий осаждают
на холоду подобно едким щелочам ортотитановую кислоту,
легко растворимую в кислотах, а при нагревании — трудно
растворимую метатитановую кислоту:
TiCk + 4NH4OH -> 4NH4C1 + Н4ТЮ4;
TiCk + 2(NH4)2S + 4НгО ч- 4NH4C1 + 2H2.S + Н4Т1О4;
TiCk + 2ВаСОз + 2НЮ-> 2ВаС12 + 2СОг + Н4Т1О4
3. Уксуснокислые щелочи количественно осаждают при тем-
пературе кипения титан в виде метатитановой кислоты:
ТГ • ’ • + 4СНзСОО' + ЗН2О ->4СН3СООН + TiO(OH)».
4. Хромотроповая кяслота (1,8-диоксинафталин-3,6-дисульфокислота)
___SO3H
НО\_____/
но\ /
SO3H
дает интенсивное бурое окрашивание (Гофман1). Эта реакция дает
возможность открыть 5 у ТЮг в капле раствора. Так как соли
трехвалентного железа и уранила также реагируют с хромотроповой кис-
лотой и мешают реакции на титан, то добавляют хлористое олово (при
этом наблюдается некоторое ослабление окраски). Для реакции на титан и
уран при одновременном их присутствии применяют водную вытяжку
плава, получающегося при сплавлении с K2S2O7. Небольшое количество
раствора нейтрализуют аммиаком, прибавляют каплю раствора сульфида
натрия, смешивают с избытком карбоната аммония и фильтруют. На
фильтре остаются Ti(OH)« и различные сульфиды, уран же находится
в фильтрате. Смочив последним кусочек фильтровальной бумаги, проводят
на ней реакцию на уран посредством капли раствора железистосинероди-
стого калия. Для реакции же на титан прибавляют к небольшому коли-
честву первоначального раствора сульфата титана немного хлористого
олова, слегка нагревают и переносят каплю прозрачного раствора на филь-
1 К. A. Hofmann, В. 45, 2480 (1912).
38 Зак. 982. Тредвелл-Голл, т. I.
593
тровальную бумагу, пропитанную 5%-ным раствором натриевой соли хро-
мотроповой кислоты *.
5. Фосфат натрия. Из разбавленного сернокислого раствора
титана фосфат натрия осаждает фосфат титана:
Ti(SCU)2 + 2Na2HPO4 -+ Ti(HPO4)2 + 2Na2SO4.
Цирконий дает подобную же реакцию даже в присутствии перекиси
водорода, окисляющей титан в надтитановую кислоту и препятствующей
осаждению его в виде фосфата. Поэтому в присутствии циркония воз-
можно отделение его от титана посредство.м фосфата натрия и перекиси
водорода. Осажденный Zr(HPO«)2 отфильтровывают, к фильтрату приба-
вляют NaaSOs для восстановления титана и осаждения его в виде фосфата.
Такая комбинация перекиси водорода с фосфатом натрия представляет со-
бой один из наилучших способов для открытия титана. Пригодной для
этой цели концентрации кислоты достигают путем выпаривания раствора
с 3 мл 6N серной кислоты до выделения ее паров, после чего охлаждают и
прибавляют 5 мл воды, 10 мл одномолярной Н2О2 и 10 мл 1N раствора
NaaHPOa.
6. Перекись водорода окрашивает нейтральный или слабокис-
лый раствор сернокислого титана в оранжево-красный цвет,
в присутствии же малого количества титана — ,в светложелтый
цвет. Эта реакция окрашивания, основанная на образовании
кислоты HcCTiOifSO^a] 1 2, очень чувствительна, и ею очень удобно
пользоваться для открытия следов титана в минералах. Эта
реакция, выполняемая на капельной пластинке, дает возможность
открыть в 1 капле 2 у титана. Хроматы, ванадаты, молибдаты и
соли церия (4) должны отсутствовать, так как они также окра-
шиваются Н2О2.
Если к раствору сернокислого титана прибавить большой из-
быток перекиси водорода и затем прилить едкое кали, то обра-
зуется осадок, растворяющийся в большом избытке едкого кали,
причем раствор окрашивается в желтоватый цвет. Полученный
таким путем раствор остается долгое время прозрачным, но
мало-помалу выделяется яркожелтый осадок.
Если сплавить в никелевом тигле какое-либо нерастворимое
титановое соединение с перекисью натрия Na?O», то при обра-
ботке плаза водой титан переходит в раствор. При сильном
подкислении полученного раствора серной кислотой появляется
оранжево-красная окраска надтитановой кислоты. При одновре-
менном присутствии в исследуемом веществе железа последнее
остается при обработке водою в остатке.
Если к нейтральному раствору соли титана прибавить перекиси нат-
рия, а затеи кипятить, то происходит количественное осаждение титана
в виде Т1О2. Надтитановая кислота подобно перекиси водорода неустой-
чива в щелочном горячем растворе.
По схеме анализа Нойеса и Брэя титан и цирконий, если только они
не были предварительно осаждены путем гидролиза, осаждаются вместе
с группой железа по ацетатному методу при рН=5,5. Осадок растворяют
в 6N соляной кислоте и удаляют из раствора галлий вместе с железом
1 N. А. Та. nanaeff, G. Pantschenko, Z. anorg. Chem. 150, 163
(1926).
2 R. Schwarz u. W. S e x a n e г, B. 60, 500 (1927); R. Schwarz,
Z. anorg. Chem. 210, 303 (1938).
594
путем взбалтывания с эфиром. Затем выпаривают раствор почти досуха
с азотной кислотой, растворяют остаток после выпаривания в 10 мл воды,
подщелачивают едким натром и обрабатывают перекисью натрия. После
кипячения из охлажденного раствора выпадают полностью Ti, Zr, In и
редкие земли. Осадок обрабатывают НС1 и HF, обрзующими растворимую
HaTiFe1 и нерастворимые фториды редких земель. Отфильтровывают,
фильтрат выпаривают с серной кислотой и в полученном растворе сульфа-
тов открывают Ti и Zr, как описано в нижеследующей реакции 7.
7. Пиросульфат-таннин. Сульфат титана, полученный при
сплавлении окиси титана с .пиросульфатом калия, растворяется
в горячем 1%-ном (растворе таннина в 1,8 IV серной кислоте.
В этом отношении титан, как и цирконий, отличаются от тантала
и ниобия.
По Шеллеру (Schoeller)2 это отношение титана и цир-
кония к сернокислому раствору таннина служит лучшим способом
отделения их от тантала и ниобия. Окиси титана и циркония
обладают достаточно выраженным основным характером, чтобы
образовать вполне определенные сульфаты, чего нельзя сказать
о ТагОз и NbaOs. В отсутствие таннина отделение менее удовле-
творительно, потому что основные окиси стремятся к образо-
ванию соединений с ТагОв и ЫЬгОз и, таким образом, некоторое
количество тантала и ниобия растворяется, а некоторое коли-
чество титана и циркония осаждается. Таннин образует адсорб-
ционное соединение с ТагОз и ЫЬгОз, желтый цвет которого
подобен цвету серы (стр. 638).
Для указанного отделения сплавляют в кварцевом тигле 0,1—0,2 г оки-
сей с 2—3 г пиросульфата калия. Дают плаву затвердеть тонким слоем
по стенкам тигля. По охлаждении обрабатывают плав горячим 1%-ным
раствором таннина в 5%-ной серной кислоте. Кипятят около 5 мин. Филь-
труют и обрабатывают фильтрат Н2О2 и NasHPOa (см. реакция 5).
8. Цинк или олово (а также и Cd) дают в кислых (пред-
почтительно солянокислых) растворах титановых солей фиоле-
товую окраску, обусловленную образованием трехвалентного
титана:
2TiCh + Zn -> ZnCh + 2TiCl3.
Соединения четырехвалентного титана не восстанавливаются
сероводородом или сернистой кислотой, но частично восстанавли-
ваются гидросульфитом (солью гидросернистой кислоты H2S2O4).
9. фторид титана при выпаривании с серной кислотой с по-
следующим прокаливанием количественно превращается в дву-
окись (отличие от кремневой кислоты):
TiF4 + 2H2SO4 -> 4HF + TiO2 + 2SO3.
10. Эфир не растворяет хлорид титана. Поэтому при взбал-
тывании 6N солянокислого раствора с эфиром возможно отде-
ление хлорного железа от хлорного титана.
1 В раствор перейдет также HsZrFc.
2 Analyst. 54, 453 (1929); Schoeller a. Deering', ibid. 52, 633 (1927).
38* 595
II. Купферрон (стр. 158) осаждает из кислого раствора жед.
тую титановую соль нитрозофенилгидроксиламина:
ТГ * • • + 4CeH5NO - NO'-> Ti(C6H5NO.NO)4.
В присутствии винной кислоты железо может быть удалено
аммиаком и сернистым аммонием, а титан осажден в подкислен-
ном фильтрате купферроном.
12. Гидросериистая кислота H2S2O4, которая может быть получена при
действии цинка на сернистую кислоту, или ее натриевая соль NasSiOi
дают фиолетовую или красноватую окраску с разбавленными растворами
солей титана. Образующееся окрашенное вещество не извлекается эфиром.
Эта реакция, почти настолько же чувствительна, как и реакция с пере-
кисью водорода; она протекает по Брунку (Brunck) по уравнению слева
направо в кислой среде и справа налево —в щелочной;
2TiCh + Na2S2O4 to 2TiCh + 2NaCl + 2SCh.
13. Тиосульфат натрия полностью осаждает титан из кипящего раствора
в виде метатитановой кислоты;
TiCk + ЗЦагЗгОз + НаО -> 4NaCl + 2S + 2SCh + Н2ТЮз.
Железистосинеродистый калий выделяет из слабокислык растворов
осадок.
. Вода. Не только ацетат титана, ио также все соли титана подвер-
1 гидролитическому разложению водой.
исутствие винной и лимонной кислот и многих других органических.
PLTWTJ ГГ гх а ГТ гт тм-»-г—. . гч я» --
или ее натриевая соль Na2Ssb«
14.
бурый
15.
гаются
соединений препятствует вышеприведенным реакциям. Нейтрализованный
кипящий раствор тартрата или цитрата, содержащий ацетат аммония, пря
добавлении таннина, дает нерастворимое, объемистое, хлопьевидное адсорб-
ционное соединение, обладающее поразительно яркой красной окраской.
Легкость, с которой растворимые соли титана подвергаются гидролизу
с образованием нерастворимой титановой кислоты, является основанием
старейшего метода отделения титана от алюминия, железа, хрома и пр.;
окислы этих металлов сплавляют с пиросульфатом калия, плав растворяют
в холодной воде1 и раствор нагревают до кипения. Титан при этом пол-
ностью осаждается в виде зернистой легко отфильтровываемой метатита-
новой кислоты, между тем как другие металлы остаются в виде сульфа-
тов в растворе:
Ti(S0«)2 4- ЗН2О -> 2HaSO« + Н2ТЮ3.
Так как эта реакция подобно всем реакциям гидролитического разложе-
ния обратима, то для полноты осаждения м>етатитановой кислоты необхо-
димо по возможности снизить концентрацию свободной кислоты2, применять
большие количества воды и поддерживать раствор горячим во время филь-
тро вания.
В схеме анализа, разработанной Нойесом и Брэем, к твердому веще-
ству прибавляют НВг и перегоняют мышьяк, 'германий и селен в виде
бромидов. Раствор, освобожденный от этих элементов, выпаривают с НС1О»
почти досуха. Остаток служит для осаждения Sb, Sn, W, Та, Nb и др-
в виде окисей или фосфатов. Поскольку титановые соли легко гидроли-
зуются, то при обыкновенных условиях в этом остатке остается весь ти-
тан, за исключением 4 мг его. Присутствие циркония препятствует полному
осаждению титана, но как цирконий, так и титан осаждаются, когда врас-
1 Плав несравненно быстрее растворяется, если пропускать через жид-
кость струю воздуха, чтобы она находилась в постоянном движении.
2 В присутствии слишком малого количества кислоты могут выпасть
в осадок железо и алюминий.
гворе присутствуют фосфаты. При обработке осадка плавиковой кислотой
с последующим выпариванием с серной кислотой вышеприведенные окиси
и фосфаты растворяются и при действии на раствор аммиака и сернистого
аммония: Sb, Sn и W(Mo) превращаются в растворимые тиосоли, а полу-
чающийся осадок содержит водные окиси TiOs, ТагОз, NbaOs и, возможно,
Zr. Если этот осадок кипятить с большим избытком разбавленного рас-
твора салицилата натрия и салициловой кислоты (3 г NasCOs и 15 г сали-
циловой кислоты в 400 мл горячей воды), то TiOs растворится в виде
комплексной соли салициловой кислоты (Ti или TiO замещает Н в1 феноль-
ной группе салициловой кислоты). Отфильтровав затем и выпари® рас-
твор, удаляют салициловую кислоту, добавив серную кислоту и взболтав
раствор с эфиром; титан переосаждают путем' выпаривания и последую-
щего прибавления к нему небольшого избытка разбавленного едкого натра.
Полученный осадок растворим в горячей 6N азотной кислоте. Азотнокис-
лый раствор дает реакцию на титан с Н2О2 или с фосфатом натрия,
Реакции сухим путем
Соединения титана не окрашивают шерла буры или фосфор-
ной соли в окислительном пламени; при продолжительном на-
гревании в ©оостановительном 'пламени перл окрашивается
в желтый цвет в /горячем состояния и в фиолетовый в холод-
ном. Значительно быстрее появляется фиолетовая окраска перла,
если .прибавить немного олова. Добавление железа вызывает
буровато-красную окраску перла.
При сплавлении титановой кислоты с карбонатом натрия
образуется метатитанат натрия, растворяющийся <в горячей 6 N
соляной кислоте. При добавлении к солянокислому раствору го-
рячей воды происходит разложение метатитановокислого натрия
с образованием метатитановой кислоты, трудно растворяющейся
в разбавленных кислотах. Даже в холодной воде титанат натрия
подвергается гидролизу и не растворяется.
Цирконий Zr. Ат. в. 91,22. Ат. н. 40
Плотность 6,5. Т. пл. 1927°. Т. кип. 2900°
Нахождение в природе. Циркон ZrSiCh квадратной системы, изоморф-
ный с рутилом ТЪОа, торитом (оранжитом) ThSiO-t, касситеритом ЗпгО,.
полианитом MnaOi и плантеритом РЬзСк. Бадделеит ZrO2 моноклинической
системы.
Свойства. Металл существует в двух аллотропных формах; кристал-
лическая модификация имеет стальной цвет; аморфная — представляет со-
бой черный порошок. Трудно получаемый очень чистый цирконий мягок,
ковок и тягуч.' Уже незначительные примеси сильно изменяют механиче-
ские свойства металла. Так, например, металл, содержащий до 1% приме-
сей, является твердым и хрупким.
Тонкие прлоски циркония горят на воздухе. При нагревании в атмо-
сфере водорода цирконий образует гидрид, а в атмосфере азота — нитрид;
оба вещества диссоциируют при 700°. Цирконий соединяется с галоидами
с образованием тетрагалоиднык солей. Во многих циркониевых соедине-
ниях находится ион ZrO’". Так, соль ZrOCh, называемая хлористым
цирконилом, может быть названа также основным хлоридом или хлор-
окисью циркония.
Компактный цирконий трудно растворяется в кислотах; едкие щелочи
только очень медленно взаимодействуют с металлом. Металл растворяется
в фтористоводородной кислоте и царской водке; смесь азотной и фтористо-
водородной кислот действует весьма эффективно', хотя одаа азотная кислота
597
реагирует слабо. Горячая концентрированная серная кислота энергично
действует на металл с образованием растворимого в воде сульфата цир-
кония Zr(SO«)2. Спрос на металлический цирконий невелик; он находит
применение для некоторых сортов стали.
Цирконий образует только одну важную окись, а именно двуокись
ZrOa. Она может быть растворена путем нагревания в течение долгого
времени в смеси двух частей концентрированной серной кислоты и одной
части воды с последующим1 разбавлением водой.
Цирконий образует соли четырех родов: нормальные соли, соли цир-
конила, цирконаты и комплексные соли, например ZrClt, ZrOCh, NasZrOa
и KafZrFe]. Для циркония характерны его амфотерная природа и стремле-
ние к образованию комплексных солей.
Минерал циркон ZrSiOi не разлагается при нагревании с кислотами.
Для его разложения необходимо растереть его в тонкий порошок и спла-
вить с четырехкратным количеством соды при высокой температуре в пла-
тиновом тигле; прн этом образуются силикат натрия NaiSiOi и цирконат
натрия NasZrOs. Прн обработке плава водой силикат растворяется, а цир-
конат гидролитически разлагается, образуя гидроокись натрия и порошко-
образную нерастворимую гидроокись циркония; последняя весьма прочно
удерживает некоторое количество едкого натра. Промыв осадок, его на-
гревают без предварительного высушивания с концентрированной серной
кислотой при температуре, близкой к точке кипения; таким путем полу-
чают безводный Zr(SOi)2. Последний, будучи облит водой, превращается
в гидрат Zr(SO«)2 • 4Нг(), который медленно растворяется в холодной воде,
но более легко в горячей, образуя раствор, обладающий кислой реакцией.
Минерал циркон разлагается также при оплавлении с кислым фтори-
стым калием; при этом образуется фторосиликат калня KafSiFe] и фторо-
цирконат калия Ks[ZrFeJ. При прокаливании циркона с углеродом обра-
зуется карбид; если нагреть последний в токе хлора или с четыреххло-
ристым углеродом при 450°, то возгоняется растворимый в воде хлорид
циркония ZrCU; этот последний при действии на него небольшого коли-
чества воды превращается в хлористый цирконил ZrOCh, который раство-
рим в воде, но в противоположность хлорному железу, не растворим
в эфире.
Реакции мокрым путем
Для нижеследующих реакций можно пользоваться раствором нитрата
циркония Zr(NOs)4 или свежеприготовленным раствором хлорокиси цирко-
ния ZrOCh • 8НгО.
1. Едкие щелочи выделяют белый студенистый осадок
Zr(OH)4, не растворимый в избытке осадителя (отличие от А1
и Be). Если осадок выделяется на холоду, то' он легко раство-
ряется в разбавленных кислотах; осажденный из кипящего рас-
твора, он легко растворяется только в концентрированных кис-
лотах.
Винная кислота препятствует вышеприведенному осаждению вследствие
образования комплексной кислоты HaCZrOtCrf-hOe)-], щелочные соли ко-
торой растворимы. Если в исходном растворе имеются ионы трехвалент-
ного железа, они могут быть осаждены сернистым аммонием в виде суль-
фида трехвалентного железа, цирконий же подобно алюминию и бериллию
остается в растворе. Таннин в щелочном растворе тартрата образует
с цирконием грязноватобелый осадок (отличие от титана),
2. Аммиак, сернистый аммоний и перекись натрия также
образуют белый студенистый осадок Zr(OH)4, не растворимый
в избытке осадителя; осадок растворяется в смеси разбавленных
соляной и фтористоводородной кислот (отличие от редких
598
земель, которые при такой обработке образуют нерастворимые
фториды).
При кипячении разбавленного ацетатного раствора (pH « 5,3) выделяется
осадок Zr(OH>4. Путем осаждения основных ацетатов1 можно отделить
Fe‘ ’ ’, Ga• • , Cr • • •, АГ ’ ', In’ • Ti • • • • н Zr"”, от Мп • ’, Zn • Со• •,
Ni' UOa’ ’, Be’ ’, редких и щелочных земель. Но в присутствии фосфата
некоторые фосфаты редких земель осаждаются даже при прибавлении
к раствору большого количества трехвалентного железа.
3. Углекислый аммоний образует белый хлопьевидный осадок
основного карбоната, легко растворимого ,в избытке осадителя
и 'снова выпадающего при кипячении раствора.
4. Углекислые щелочи выделяют белые осадки, раство-
ряющиеся лишь в очень концентрированных растворах угле-
кислых щелочей и очень мало растворяющиеся в 2N растворах.
Из этих растворов цирконий осаждается при разбавлении их
горячей водой и пересыщении аммиаком.
5- Углекислый барий не дает полного осаждения даже при
кипячении.
6. Щавелевая кислота образует белый хлопьевидный осадок
оксалата циркония, легко растворимый в избытке щавелевой кис-
лоты и щавелевокислого аммония и трудно в разбавленной со-
ляной кислоте.
7. Щавелевокислый аммоний относится точно так же, как и
щавелевая кислота.
Цирконий из раствора в щавелевокислом аммонии не оса-
ждается соляной кислотой (отличие от тория).
Примечание. Совершенно иначе, чем нитрат и хлорокись, относится
К щавелевой кислоте н щавелевокислому аммонию сернокислый цирконий.
Хотя на это обстоятельство в свое время было обращено внимание Берце-
лиусом (Berzelius) и Пфаффом (Pfaff), тем не менее почти все химики
упускали его из виду до тех пор, пока Руэр (R. Ruer)1 опять не напомнил
о нем.
Если к водному раствору сернокислого циркония прибавить щавелевую
кислоту или щавелевокислый аммоний, осадок не образуется; осадок не
образуется даже в растворах нитрата нли хлорокиси, если только они
содержат в достаточном количестве серную кислоту или ее натриевую или
аммониевую соль.
Такое ненормальное явление объясняется тем, что цирконий дает
с серной кислотой и сернокислыми щелочами комплексные соединения. Так,
раствор сернокислого циркония содержит кислоту FbtZrCKSOOs], и при
прибавлении к раствору хлорокиси циркония (или нитрата) сернокислого
натрия или аммония (но не сернокислого калия, см. п. 9) образуется
натриевая или аммониевая соль циркониевосерной кислоты:
ZrOCh +. 2Na2SO<-> SNaCl + Na2[ZrO(SO4)2]
e довольно устойчивым анионом [ZrO(SO4)2]", так что щавелевая кис-
лота не осаждает оксалата циркония.
8. Фтористый водород не дает обыкновенно осадка (отличие
от тория, цер ия и других редких земель), но из концентрирован-
ных растворов циркония при осторожном прибавлении плавико-
- J Z. anorg. Chem. 42, S5 (1904),
599
вой кислоты может быть выделен объемистый осадок, раство-
ряющийся в избытке осадителя. Получающийся анион ZrFe"
является наиболее устойчивым комплексом, образуемым цирко-
нием. Разрушение его производится путем выпаривания с серией
кислотой.
9. Сернокислый калий. Концентрированный раствор K2SO4
постепенно осаждает на холоду весь цирконий в виде двойной
сернокислой соли циркония и калия, не растворимой в избытке
реагента (отличие от А1 и Be). Сернокислая соль циркония-калия,
полученная на холоду, легко растворяется в избытке разбавлен-
ной НС1. Если же осадок образован при нагревании, то полу-
чаются вследствие гидролиза основные сернокислые соли
циркония, едва растворяющиеся в НС1 (отличие от Th и Се).
10. Сернокислый натрий не дает осадка даже при кипячении
подкисленного H2SO4 раствора (отличие от Ti).
11. Ализаринсульфокислота. Концентрированный солянокис-
лый раствор ализаринсульфокислоты, обладающий желтой окра-
ской, образует по прибавлении к нему циркон-иона лак фиоле-
тово-красного! цвета. Если к лаку 'прибавить фтор-ион, то об-
разуется ZrFe" и снова появляется желтая окраска ализаринсуль-
фокислоты. *
12. Перекись водорода (30%) осаждает из слабокислых рас-
творов при непродолжительном стоянии объемистый белый оса-
док перекиси циркония, которая при нагревании с концентриро-
ванной соляной кислотой выделяет хлор. Если к раствору,
содержащему Zr, прибавить фосфат натрия и перекись водорода,
то осаждается Zr(HPO4)2. [Н2О2 препятствует осаждению
Ji(HPO4)2.]
13. Тиосульфат натрия осаждает при нагревании весь цирко-
ний в виде гидрата окиси, к которому всегда примешивается S.
14. Куркумовая бумага, смоченная солянокислым раствором
какой-либо циркониевой соли и высушенная на водяной бане,
окрашивается в красно-бурый цвет (отличие от Th).
15. Соляная кислота. Чтобы констатировать присутствие цир-
кония, Руэр1 рекомендует следующий способ.
Осаждают цирконий на холоду аммиаком, фильтруют, промывают, от-
деляют пир возможности осадок от фильтра и растворяют в соляной кис-
лоте или, если удаление с фильтра невозможно вследствие малого коли-
чества осадка, нагревают этот последний вместе с фильтром с не очень
концентрированной соляной кислотой и фильтруют. Солянокислый раствор
выпаривают иа водяной бане почти досуха и растворяют осадок по воз-
можности в малом количестве воды. К холодному насыщенному раствору
прибавляют по каплям концентрированную соляную кислоту: в присут-
ствии циркония образуется обильный осадок хлорокиси циркония. Полу-
ченный осадок снова растворяют при нагревании и раствору дают охла-
диться. Через некоторое время выкристаллизовываются нежные, блестя-
щие, как шелк, иглы хлорокиси (ZrOCh • 8Н2О).
Прокаленная двуокись циркония ZrOs не растворима в соляной кис-
лоте. Ее сплавляют с KHSOi в кварцевом тигле или превращают в суль-
фат циркония путем нагревания с концентрированной серной кислотой
1 Z. anorg. Chem., 42, 85 (1904).
600
(2:1), растворяют плав, в воде, осаждают цирконий аммиаком в виде-ги-
дроокиси и поступают с ией, как выше указано,
16. Иодат натрия выделяет из слабокислых растворов объ-
емистый осадок йодата циркония, растворимого в горячей раз-
бавленной соляной кислоте. Эта реакция чувствительна к изме-
нению кислотности раствора, и так как известны другие нерас-
творимые йодаты, то она не имеет практического значения для
открытия циркония, хотя она и рекомендуется для отделения
циркония от алюминия.
17. Фосфат натрия Na;HPO-t осаждает белый Zr(HPOi)2 даже
из растворов, содержащих 20% (по весу) серной кислоты. Ни
один из других элементов не образует при таких условиях не-
растворимого фосфата, за исключением титана, который, однако,
может оставаться в растворе в виде надтитановой кислоты, если
перед добавлением фосфата натрия прибавить достаточное ко-
личество перекиси водорода.
18. Селенистая кислота bfeSeOs является прекрасным осади-
телем циркония в виде селенистого цирконила; последний при
стоянии превращается в Zr(SeO3)2.
19- Купферрон полностью осаждает цирконий в виде белого,
творожистого осадка из холодных растворов, содержащих
5—10% по объему концентрированной серной кислоты (отделе-
ние от алюминия).
20. Железистосинеродистый калий выделяет из нейтральных
растворов белый осадок, из кислых зеленовато-желтый осадок
железистосинеродистого циркония. В растворах сульфатов оса-
ждение очень неполное или вовсе не происходит.
* Добавление редактора. 21. р-Диметиламиноазофениларсиновая
кислота
(СН3)-. n/-^>N = n/— ^>AsO (ОН)2
реагирует в солянокислом растворе с солями циркония, образуя
окрашенный осадок соли циркония, не растворимый в кислотах:
(НС1 • (СН3)2 N = N\~yAsO3]2Zr
Окраска образующейся соли отличается от окраски самого
реактива; особенно это заметно, если пользоваться для откры-
тия циркония капельной реакцией. Последнюю выполняют сле-
дующим образом. На фильтровальную бумагу, пропитанную
раствором 0,1 г реактива в 5 мл концентрированной соляной кис-
лоты и 100 мл спирта и затем высушенную, помещают каплю
исследуемого раствора. При больших количествах циркония
тотчас образуется бурое пятно. Поместив бумагу на короткое
время в раствор 2N соляной кислоты, нагретой до 50—60°,
можно быстро удалить избыток реактива, после чего отчетливо
выделяется циркониевое пятно или кольцо.
Чувствительность реакции 1 : 500 000.
601
Сульфат-ион заметно понижает чувствительность реакции,,;
Кроме того, реакции препятствуют фосфаты, фториды, а также
органические кислоты, дающие с цирконием1 стабильные ком-
плексы. Единственным металлом, который препятствует откры-
тию циркония, является тантал.
Об условиях'открытия циркония в присутствии трехвалентного
железа, сурьмы, таллия, а также молибдатов1, вольфраматов, со-
лей олова(4) и титана, дающих с реактивом также бурое пятно,
см. оригинальную работу Ч Таким образом, эта реакция является
особенно ценной по своей большой чувствительности и
своей специфичности. * А. К. ;
Реакции сухим путем
ZrO2 не плавится в пламени гремучего газа "(отличие от
остальных земель) и отличается своим сильным свечением.
Торий Th. Ат. в. 232,12. Ат. к. 90
Плотность <11,7. Т. пл. 1845°. Т. кип. >3000°
Нахождение в природе. Торит (оранжит) ThSiO» с 50—58% ThO2; то-
рианит, минерал, содержащий 72—76% ThOz и 11—12% UOs с примесью
окислов Pb, Fe, Се, La и др. Небольшие количества (до 8%) были найдены
в гадолините Y2O3 • 3(Ве, Fe)O-2SiO2 в монаците (Се, La, Pr, NdjPCh с 2—8%(
•ThOa, а также в редких минералах — колумбите, самарските, пирохлоре,
эвксените и т. п. Эвксенит представляет собой, главным образом, титанат
и ниобат Се, La, Pr, Nd и обычно содержит UO2 и FeO.
Торит, монацит и гадолинит разлагаются кислотами, лучше всего — сер-
ной кислотой.
Получения и свойства. Нечистый металл получается при прокали-
вании ThCU или KzThCle с металлическим натрием. На воздухе он устой-
чив и бладает раиоактивностью. Металл растворяется в соляной кислоте
с выделением водорода; он более легко растворяется в серной и плави-
ковой кислотах и практически не растворим в растворах едких щелочей.
Он является самым тяжелым элементом IV группы периодической си-
стемы. В этой группе элементы титан, цирконий, гафний и торий весьма
близки друг к другу по своим свойствам. Подобно цирконию торий су-
ществует в двух аллотропных формах: кристаллической и аморфной. По-
добно тому же цирконию металл сгорает на воздухе, образуя ТЬОа. Он
также горит в атмосфере хлора, брома, иода или в парах серы при 450°.
Торий более электроположителен, чем магний, и легко сплавляется с дру-
гими металлами, например с алюминием, медью, никелем и цинкам. Спла-
вом его с вольфрамом пользуются для изготовления нитей накаливания для
электрических ламп.
Двуокись тория в совершенно чистом состоянии белого цвета. Она
входит в состав калильных сеток и образуется при прокаливании Th(NOs)i.
Газокалильная сетка, приготовленная из чистого нитрата тория, дает лишь
слабое свечение с легким красио-ватым оттенком. Примесь же следов СаО
или СеОг дает значительно более яркий свет. Наиболее яркий свет
с желтоватым оттенком достигается при 1% или большем количестве СеОа.
Прокаленная двуокись тория ThCL может быть растворена путем вы-
паривания с концентрированной серной кислотой; охлажденный раствор
вливают в ледяную воду или разбавленную серную кислоту; она не рас-
творяется в других кислотах даже после сплавления со щелочами. Торий
Обнаруживает стремление к образованию коллоидных растворов, но спо-
‘Felgl,'Krumholz u. Raj mann, Microchemie, 9, 395 (1931).
602
собность его к образованию комплексов меньше, чем у церия, циркония
или титана.
Продажный нитрат тория с 48—49% Th Os обыкновенно содержит
больше 5% Th(SO<)2. Однако присутствие сульфата не может быть от-
крыто, если предварительно не выделить торий посредством щавелевой
кислоты. Смесь сульфата и нитрата при прокаливании плавится -и разла-
гается. чрезвычайно увеличиваясь в объеме, оставляя после свечения объ-
емистую белую окись мягкой консистенции. После прокаливания в окисли-
тельном пламени бунзеновской горелки в течение нескольких минут она
должна оставаться совершенно белой. Если замечается розовый оттенок,
то это служит признаком наличия неодима и празеодима,
Реакции мокрым путем
Следует пользоваться раствором Th(SOc)2 или Th(NOs)i. Безводный
сульфат тория легко растворяется в ледяной воде, но- при нагревании кон-
центрированного раствора или даже при стоянии раствора при комнатной
температуре выделяется .мало растворимая водная соль Th(SO«)2 • 8Н2О или
Th(SOi)s • 9HsO (отличие от Al, Be, Ti, Zr). Это свойство может быть ис-
пользовано для отделения тория от небольших количеств других редких
земель. Гидраты с 8 или 9 молекулами воды превращаются при темпе-
ратуре выше 45°- в Th(SOi)2 • 4№О; растворимость последней соли падает
с повышением температуры. В контакте с кипящим раствором она является
стабильной фазой.
1. Карбонаты щелочных металлов осаждают белый карбонат,
растворимый в избытке осадителя и не осаждаемый из (получен-
ного раствора; аммиаком. При кипячении раствор мутнеет и
-становится прозрачным при охлаждении.
2. Аммиак, сульфид аммония или едкие щелочи выделяют бе-
лый осадок Th(OiH)4, не растворимый в избытке осадителя, но
растворимый в разбавленных кислотах -непосредственно после
осаждения. При кипячении с нитратом1 тория или при доба-
влении небольшого количества хлористого алюминия, хлорного
железа или соляной кислоты легко получается коллоидный рас-
твор гидроокиси тория. Последний может быть также легко по-
лучен путем диализа ториевых солей в чистой воде. При про-
каливании гидроокиси получается ThCh, растворимая в концен-
трированной серной кислоте только1 при долгом воздействии.
3. Карбонат аммония осаждает белый карбонат, легко раство-
римый в избытке осадителя; при нагревании до 50° осаждается
основной карбонат, снова растворяющийся при охлаждении
раствора. Аммиак в этом растворе не дает осадка.
4. Карбонаты бария или свинца полностью осаждают торий
на холоду в виде ТЬ(СОз)г-
5. Щавелевая кислота осаждает из -не слишком кислых рас-
творов весь торий в виде белого кристаллического щавелевокис-
лого тория, практически не растворимого в избытке щавелевой
кислоты и разбавленных минеральных кислотах.
Формула осадка: ТЦСЮйа • 6Н2О. Оксалат тория растворяется в рас-
творе ацетата аммония, содержащем немного уксусной кислоты. При тем-
пературе кипения он растворяется в концентрированном' растворе оксалата
щелочного металла, особенно в оксалате аммония с образованием
весьма устойчивых комплексных ионов: [ТИССгО^]"", [ThfCsCMs]" или
[Th»(CsO«)5]". При охлаждении осаждение не происходит, если было -взято
СОЗ
достаточное количество оксалата аммония (отличие от ионов Се, La, Рг,
Nd и частью от Y и Ег). При прибавлении соляной кислоты происходит
разложение комплексного оксалатного иона и выделение осадка оксалата
тория.
При слабом прокаливании оксалата образуется двуокись тория, кото-
рая с соляной или азотной кислотой дает коллоидный раствор; получаю-
щийся золь — молочнобелого цвета в отраженном свете и прозрачно жел-
тый в проходящем свете.
6. Щавелевокислый аммоний также осаждает щавелевокислый
торий, который при температуре кипения легко растворяется
в избытке щавелевокислого аммония. Раствор по охлаждении
остается прозрачным, при условии если 'первоначальный раствор
ториевой соли не содержал слишком много свободной серной
кислоты и если прибавлено достаточно оксалата аммония. Из
кипящего раствора двойной щавелевокислой соли аммония и то-
рия соляная кислота выделяет почти весь торий (отличие от
Zr). О составе различных двойных комплексных оксалатов то-
рия и аммония см. Гаузер и Вирт (О. Hauser И F. Wirth) *.
В присутствии уксуснокислого1 аммония оксалат аммония не
выделяет осадка, но последующая добавка НС1 осаждает из
этого раствора почти весь торий в виде оксалата.
7. Тиосульфат натрия осаждает при температуре кипения весь
торий.
8. Фтористый водород осаждает из разбавленных растворов
на холоду объемистый белый осадок ThF^bhO, который
превращает весь раствор в студень, не растворяющийся ни
в воде, ни в плавиковой кислоте (отличие от алюминия, берил-
лия, циркония и титана).
9. Фосфорноватокислый натрий NaHPOs по Коссу (Koss)2
осаждает полностью из концентрированного солянокислого рас-
твора аморфный фосфорноватокислый торий ТЬРгОв-ПНгО, не
растворимый в воде и едких щелочах (отличие от трехвалентных
земель). Самая чувствительная реакция на торий. Это осаждение
приобретает особенно большое значение для отделения тория
в монацитном песке.
10. Иодат калия образует белый осадок Th(J0s)4 даже в при-
сутствии 50% (по объему) концентрированной азотной кислоты;
хлориды должны отсутствовать. Таким же образом осаждаются
цирконий и четырехвалентный церий, но йодаты трехвалентных
редких земель легко растворяются в азотной кислоте. Эта реак-
ция на торий очень чувствительна; осадок может быть освобо-
жден от следов других йодатов (за исключением Zr и Се), если
его обработать несколькими миллилитрами горячего раствора,
приготовленного растворением 4 г КЛОз в 500 мл 1,2N азотной
кислоты.
11. Железистосинеродистый калий образует в нейтральных
или слабокислых растворах белый осадок; в нейтральных рас-
творах реакция более чувствительна.
* Z. anorg. Chem. 78, 75 (1912).
‘ Chem. Ztg. 36, 696 (1912).
604
12. Сернокислый калий осаждает двойную соль K4Th(SOi)4 •
2НгО, трудно растворимую в воде и не растворимую в концен-
трированном растворе H2SO4 (отличие от Y). Соответствующая
натриевая соль хорошо растворима в воде.
13. Перекись водорода, прибавленная к горячему нейтраль-
ному раствору или к раствору, слабо подкисленному серной или
азотной кислотой, или даже к раствору в углекислом аммонии,
осаждает весь торий в виде белого гидрата перекиси тория.
14. Азид калия KN3 осаждает из слабокислых растворов оса-
док гидроокиси тория или основного азида тория с выделением
азотистоводородной кислоты:
Th ’ ’' ’ + 4Ns' + 4НгО -> Th(OH)4 + 4Н№.
По Денни (Dennis)1 эта реакция характерна для тория; по
Курциусу (Curtius)2 цирконий аналогично реагирует на холоду,
а иттрий при кипячении.
15. Едкое кали и хлор не растворяют тория.
Характерных реакций на торий сухим путем нет.
Гафний Hf. Ат. в. 178,6. Ат. и. 72
Этот элемент принадлежит к четвертой группе периодической системы;
он находится между цирконием, с которым он наиболее сходен, и торием-.
Посредством рентгеновского спектрального анализа гафний найден почти
во всех циркониевых минералах. Ои может быть отделен от циркония
только путем повторных дрюбных осаждений. Так, KsHfFe несколько бо-
лее растворим! в воде, чем KsZrFe, и HfOCk менее растворима, чем ZrOCb.
Гидроокись Hf(OH)4 обладает более .основным характером, чем Zr(OH)i, и
поэтому он менее легко осаждается аммиаком или тиосульфатом натрия.
Кроме того, Hf(SO«)2 устойчив при 500% между тем как Zr(SO‘4)2 разла-
гается уже при 400°. Плотность ZrOs 5,73, HfOs 9,67, так что содержание
гафния в -смеси .обоих элементов может быть определено по плотности
такой смеси
МЕТАЛЛЫ РЕДКИХ ЗЕМЕЛЬ
Элементы скандий и иттрий третьей группы -периодической системы
и элементы с порядковыми номерами от 57 (лантан) до 7’1 (лютеций) об-
разуют группу редких земель 3.
Ввиду чрезвычайного сходства свойств последних 15 элементов не
может быть речи о разделении их теми средствами, которыми обычно поль-
зуются в качественном анализе. Для этого слишком малы различия в рас-
творимости их аналогичных солей. Кроме того, разделение их особенно
затрудняется той легкостью, с которой соли этих элементов вследствие их
изоморфного строения образуют твердые растворы.
» Z. anal. Chem. 34, 82 (1в95).
* Ibid. 38, 49 (1899).
3 Обыкновенно цирконий и торий причисляют к группе редких земель,
поскольку они встречаются вместе. Они отличаются от редких земель тем,
что являются всегда только четырехвалентными. Ред.
€05
Наша задача сводится лишь к характеристике общих свойств этих
элементов и краткому очерку разделения обеих важнейших групп цериевых
и иттриевых земель.
Металлы иттриевых или гадолинитовых земель составляют группу трех-
валентных элементов. Они встречаются в виде силикатов в минералах га-
долините и ровлендите, в виде фосфатов—в ксенотите и в виде дисба-
тов— в эвксените, итдротанталите и некоторых других редких минералах.
В этих минералах элементы скандий, иттрий, европий, гадолиний, тербий,
диспрозий, гольмий, эрбий, тулий, иттербий и лютеций преобладают над
редкими элементами группы церитовых металлов, которые встречаются
с инми и которые по своим химическим свойствам заметно разнятся от
них. Из всех элементов группы иттриевых земель иттрий и эрбий встре-
чаются в наибольших количествах, и они рассматриваются как два наи-
более важных элемента. Однако и скандий весьма широко распространен
в природе, и он недавно был найден в некоторых вольфрамовых и же-
лезных рудах. Остальные элементы встречаются «крайне редко. По месту
нахождения и по химическим свойствам весьма сходны между собой ев-
ропий, гадолиний и тербий; точно так же сходны между собой диспро-
зий, гольмий, эрбий и тулий и, наконец, иттербий и лютеций.
Неритовые металлы встречаются в некоторых количествах в только
что .названных минералах. Наиболее важным и чаще других «встречаю-
щимся является церий. Неритовые металлы встречаются в «виде силикатов
в минералах церите [НэСа«(СеА1)з51зО1з] и ортите (алланите) (HCaaCesSisOis);
в виде фо«сфатов—«в монаците; в виде ниобатов и танталатов— в эшините;
в виде фтористых соединений — во фтороцерите и в целом ряде других
минералов сходного состава.
Лучшим способом переведения минералов в растворимое состояние
является их обработка концентрированной серной кислотой. Силикаты
церит, ортит и гадолинит могут быть разложены повторным выпариванием
с концентрированной соляной кислотой. Фосфаты (монацит, ксено-тит и пр.)
плохо разлагаются соляной кислотой; после нагревания с концентрирован-
ной сериой кислотой избыток последней должен быть удален путем выпа-
ривания и влажную массу медленно вливают при перем«ешива«нии в холод-
ную воду. Ниобаты, танталаты и титанаты (фергусонит, эвксенит, эшинит)
лучше всего сплавлять с 5—6-кратным количеством гидросульфита натрия.
По охлаждении плава прибавляют несколько капель «концентрированной
серной кислоты для «пополнения потерн ее вследствие улетучивания, после,
чего твердый остаток обрабатывается водой; при этом происходит отде-
ление ниобиевой и танталовой кислот. Большинство минералов (за исклю-
чением ниобатов и танталатов) разлагается также плавиковой кислотой,
которая действует даже на холоду: земельные кислоты переходят в рас-
твор, а фтористые земельные металлы остаются нераствореиными.
Характерным для редких земель является осаждение их щавелевой и
фтористоводородной кислотами из сильнокислых растворов, благодаря чему
вся группа их может быть повторным осаждением отделена от других
металлов. Правда, фтористый скандий несколько растворим в избытке фто-
ристоводородной кислоты. Карбонаты и фосфаты также не растворимы
в воде.
Сами металлы, получаются путем электролиза расплавленных хлоридов
или фторидов. Они белого или бледножелтого цвета и весьма устойчивы
иа воздухе. Плотность их колеблется в пределах 6,15 (лантан) и 7,7 (са-
марий); «плотность церия 7,04. Они являются хорошими «восстановителями
и могут применяться вместо металлического магния. Иттрий ие был полу-
чен в совершенно чистом виде. В нечистом состоянии он представляет
собой серый порошок. Он имеет высокую точку плавления и сгорает
в окись. Получают его путем электролиза расплавленного хлорида иттрия
и натрия или путем восстановления металлическим магнием.
Металлический церий отличается сильными пирофорными свойствами;
при ударе или трении о сталь он дает искры. Пирофорным сплавом церия
и железа пользуются в газовом освещении. Металл сгорает в кислороде
с ярким свечением. Он медленно разлагает воду и хорошо растворяется
в кислотах с .выделением «водорода.
606
Трехвалентные элементы скандий, иттрий, лантан, гадолиний, иттербий
и лютеций являются гомологами алюминия. Их окиси и соли — белого
цвета. 5сгОз обладает слабыми основными свойствами; LazOs обладает
почти такими же основными свойствами, как и СаО.
Из элементов гадолинитовой группы иттрий после всех осаждается
в виде гидроокиси; нитрат его разлагается последним при прокаливании
нитратов. Из этой группы, (повидииому, лишь один тербий способен да-
вать высший окисел ТЬЮ/, вещество черного цвета в чистом виде. Малые
количества этой окиси окрашивают другие окиси этой группы в желтый
цвет. При накаливании в несветящемся пламени окись иттрия дает белое
свечение, а окись эрбия испускает интенсивно зеленый свет.
За исключением скандия соли этих металлов, образованные даже со
слабыми кислотами, трудно гидролизуются. Способность к образованию
комплексных солей меньше» чем у тория и циркония, но больше, чем
у церитовых земель. Для отделения иттриевых от церитовых земель наи-
более важное значение имеет бблывая растворимость двойных сульфатов
элементов иттриевой группы. Получение двойных нитратов при обыкно-
венной температуре затруднительно. Хлориды кристаллизуются с 6 моле-
кулами воды и при нагревании до 120° они теряют воду и хлористоводород-
ную кислоту, превращаясь В' нерастворимые основные хлориды типа YOC1,
Растворимость хлоридов иттриевой группы в пиридине больше, чем хло-
ридов церитовых металлов. Безводные хлориды трудно летучи; хлориды
скандия и иттрия являются наиболее летучими из всей группы.
В ряду церитовых металлов смесь окисей, полученная путем прокали-
вания оксалатов, выделенных из какого-нибудь типичного минерала, окра-
шена в буровато-красиый цвет и может рассматриваться как содержащая
соли трехвалеятных металлов с четырехвалентвым церием в качестве кис-
лотного компонента. Церий является единственным членом этой группы,
образующим устойчивую окись или соль в четырехвалентном состоянии.
При более высоких температурах окиси становятся кристаллическими, при
температуре вольтовой дуги они слепка летучи. Окиси церитовых металлов
легче растворяются в кислотах, чем окиси иттриевых металлов, и хотя иа
растворимость оказывает влияние предшествующая обработка, тем не менее
прокаленные окиси .растворяются в кислотах, если только количество окиси
церия СеОз не превышает 50—05%. Церитовые земли являются сильными
основаниями и выделяют аммиак из солей аммония даже на холоду. Ги-
дроокись лантана является примерно таким же сильным основанием, как
и гидроокись кальция, ио -основность уменьшается в ряду в следующей
порядке: трехвалентный церий, празеодим, неодим, самарий. Четырех-
валентный церий образует амфотерную гидроокись; по своей силе она
занимает промежуточное положение между гидроокисями циркония и
тория.
Хлориды этих трехвалентных элементов обыкновенно кристаллизуются
с 6 молекулами воды, за исключением хлористого празеодима, кристалли-
зующегося с 7 молекулами воды. Нитраты также кристаллизуются с 6 мо
лекулами воды. Они образуют двойные соли типа R(NOs)s • 2№KNOs.
•6Н2О; устойчивость и нерастворимость солей уменьшается с повышением
атомного веса от лантана к самарию. При прокаливании хлоридов или
нитратов получаются нерастворимые основные соли ROX (отличие от
иттриевых земель); соли металлов с низким атомным весом наиболее
устойчивы.
Сульфаты кристаллизуются с 4, 8, 9 и 12 молекулами воды. При на.
гревании до 400 или 500° образуются безводные сульфаты, легко раствр.
ряющиеся в ледяной воде. Таким путем полученные концентрированные
растворы являются при комнатной температуре пересыщенными относи-
тельно некоторых из гидратированных солей, которые выделяются при
стоянии или при взбалтывании растворов. Растворимость этих гидратиро-
ванных сульфатов 'обыкновенно уменьшается с повышением температуры.
Этим свойством иногда пользуются для отделения редких земель от дру.’
гих элементов.
Карбонаты церитовых металлов более или менее легко растворяются
в концентрированных растворах (Х'НДгСОз, ЫазСОз и КзСОз, образуя трудно
607
растворимые двойные соли, из которых калиевая соль значительно более
растворима, чем соответствующие соли натрия или аммония. Осторожное
разбавление углекалиевого раствора вызывает осаждение кристаллических
двойных углекислых солей этой группы в следующем порядке: La, Рг, Се
Nd. В первую очередь осаждается двойная . углекислая соль лантана, ио"
она склонна к образованию пересыщенных растворов.
В ряду церитовых металлов наиболее основной элемент, лантан, об-
разует наиболее растворимый оксалат.
Скандий Sc. Ат. в. 45,10. Ат. н. 21
Этот элемент был найден как в типичных минералах редких земель,
так и в оловянных, вольфрамовых и циркониевых .рудах. Его свойства
были предсказаны Менделеевым, назвавшим его «экабором». Открыл его
затем впервые Нильсон в 1879 г. Он принадлежит к группе бор-алюминий
периодической системы1, но соли его сходны с солями двухвалентного1 бе-
риллия и четырехвалентньгх тория и циркония. Соли его легко гидро-
лизуются.
Для очистки скандиевых солей приготовляют трудно растворимые соли
Зсг(ЗС)4)з • 3K2SO4, 8с»(СОз)з • 4№зСОз 6Н2О или ScFs. Последняя соль пол-
ностью растворяется в концентрированном растворе фтористого щелочного
металла, причем образуется двойная фтористая соль, например NHjScFi;
благодаря этому легко отделить фтористый скандий от других фтористых
солей редких земель. Оксалат ScHCaOah • 5НгО значительно более раство-
рим в разбавленных минеральных кислотах, чем оксалаты, других редких
земель, и его полное осаждение достигается только при добавлении к кис-
лому раствору большого избытка щавелевой кислоты. Оксалат скандия рас-
творяется в избытке щелочного оксалата.
Подобно цирконию и торию гидроокись скандия осаждается при ки-
пячении с раствором тиосульфата натрия, что также отличает этот эле-
мент от других элементов редких земель.
Скандий подобно титану может быть отделен количественно, от цир-
кония из кислого раствора перекисью водорода и фосфатом натрия:
Zr(HPOa)2 осаждается, между тем как Sc и Ti остаются в растворе. Если
затем обработать раствор для разложения перекиси водорода сульфитом,
то скандий выпадает вместе с TiflHPCL)’, хотя его фосфат значительно бо-
лее растворим.
Скандий может быть подобно цирконию отделен от тигана, если его
кислый раствор прилить по каплям к холодной 3%-ной перекиси водорода,
содержащей аммиак: титан при этом остается в растворе в виде надти-
тановой кислоты.
Скандий не осаждается с торием: или четырехвалентным церием: йода-
том калия в присутствии концентрированной азотной кислоты, если только
количество его не превышает 30 мг.
Если выпаривать раствор NH«ScF4 с концентрированной серной кисло-
той, то выделяется ScsfSCLX Это отличает скандий от титана и циркония,
но не от других редких земель. При разбавлении холодной водой
Sca(S0«)3 переходит в раствор и при .прибавлении NHiOH выпадает нерас-
творимый Sc(OH)s. Если осадок растворить в НО и раствор ScCh выпа-
рить, то от одной капли 27N HF выделится осадок ScFs, который отли-
чается от фтористых солей других редкоземельных металлов своей раство-
римостью в кислом растворе фтористого аммония.
Иттрий Y. Ат. в. 88,92. Ат. и. 39
Плотность 4,57
Нахождение в природе. Иттрий является важной составной частью
гадолинита УгОз-ЗСВе, Fe)O-2Sith и иттротанталита Y4[(Nb, Та^О]»
изоморфной смеси пиротанталата и пирониобата иттрия. Элементы этой
группы были также найдены в церите, торите и монаците.
608
Окись иттрия — белого цвета, но в случае загрязнения ее окисями
других элементов иттриевой группы она — желтого цвета.
Гидроокиси иттриевых земель по своей основности занимают место
между группой щелочных земель и алюминием. Наиболее сильными основ-
ными свойствами обладает иттрий, другие же элементы по своей основности
могут быть расположены в следующем порядке: гадолиний, тербий, эрбий,
иттербий.......скандий. Вследствие отличительного положения- зани-
маемого ими в периодической системе, возможно, что элементы между
иттрием и скандием более близки между собой и что по той же причине
скандий в некоторых отношениях похож на бериллий, а в некоторцх
других отношениях — на торий и цирконий. При дробном осаждении
щелочами или при разложении путем прокаливания нитратов элементы
обнаруживают ту же постепенность в свойствах: иттрий, как уже выше
было указано, осаждается и разлагается последним. Отделение его от
других иттриевых земель основано на том, что последние фракции обы-
кновенно обогащаются иттрием.
Окись иттрия Y2O3 является главной составной частью так называемых
иттриевых земель.
Нижеследующие реакции общи всем иттриевым землям. Исключения
будут указаны. Предполагается, что исходным раствором служит раствор
Y(NO3)».
Реакции мокрым путем
1. Аммиак или сернистый аммоний осаждают белую гидроокись, не
растворимую в избытке осадителя.
В присутствии винной или лимонной кислоты гидроокись не оса-
ждается, но при прибавлении аммиака к виннокислому раствору осаждается
белый хлопьевидный осадок двойной виннокислой соли аммония и иттрия.
2. Едкие щелочи осаждают белую гидроокись, не растворимую в из-
бытке реактива; присутствие- винной кислоты не препятствует осаждению,
но в этом случае осадок .представляет собой тартрат иттрия (отличие от
Al, Be, Th и Zr). При прокаливании осадка получается окись, легко рас-
творяющаяся в кислотах.
Гидроокись, выделенная из горячего раствора, имеет консистенцию
студня, легко отфильтровываемого; осадки же из холодных растворов
слизисты и трудно промываются. Гидроокиси иттрия и эрбия поглощают
двуокись углерода из воздуха.
3. Карбонат аммония дает белый осадок карбоната, легко раствори-
мого в избытке реактива; раствор спустя некоторое время мутнеет вслед-
ствие выделения двойной соли Уз(СОз)з • 2С\Н4)зСОз • 2НаО.
Подобный же раствор эрбия мути не дает.
Раствор чистой гидроокиси в избытке углекислого аммония полностью
осаждается при кипячении; ио если присутствует хлористый аммоний, то
при дальнейшем кипячении происходит полное разложение осадка с выде-
лением аммиака и переходом- иттрия обратно в раствор.
4. Углекислые щелочи осаждают белый карбонат,. легко растворимый
в избытке осадителя; при стоянии раствора из него выделяется нераство-
римая двойная соль.
Растворимость карбоната иттрия в избытке осадителя значительно
больше растворимости карбонатов церитовых земель, и это служит осно-
ванием для его отделения- Карбонат иттрия растворяется легче в гиДро-
карбонате калия и в карбонате аммония, чем -в нормальном карбонате ка-
лия, но растворимость его не так велика, как растворимость соответствую-
щего бериллиевого осадка.
Эрбий ведет себя как иттрий, только карбонатный раствор его не
мутится при стоянии.
5. Щавелевая кислота осаждает белый оксалат иттрия, -не растворимый
в избытке осадителя, трудно растворимый -в НС1 и заметно растворимый
в оксалате аммония.
В растворах солей эрбия щавелевая кислота дает светлокрасный по-
рошкообразный осадок, во всем остальном сходный с оксалатом иттрия.
Отношение к щавелевой кислоте является важной характерной особен-
39 Зак- 962- Тредвелл-Голл, т. I.
609
ностью всей группы редких земель (за исключением циркония), которая
отличает их от алюминия и бериллия. Растворимость оксалатов иттриевых
земель вообще больше растворимости соответственных солей элементов
церитовой группы, и при кипячении с концентрированным раствором ок-
салата щелочного металла оксалаты иттриевых земель, особенно же окса-
лат скандия, растворяются более легко, чем оксалаты неритовой группы.
После разбавления и охлаждения осадок обыкновенно вновь выделяется
(отличие от тория).
6. Сульфат калия образует двойную соль, растворимую в растворе
KjSO4 (отличие от Zr> Th, Се, Las Nd и Pr).
Точно так же ©едет себя эрбий.
В пределах группы иттриевых земель (исключая весьма легко растэо.
римый двойной сульфат скандия) двойные сульфаты европия, гадолиния <
тербия наименее растворимы; они занимают среднее положение междз
церитовыми Н другими иттриевыми землями.
7. Фтористый водород выделяет белый аморфный осадок YFa, кото
рый при нагревании становится порошкообразным. Он не растворим
в воде и в HF (отличие от Al, Be, U и Ti).
Осадок растворяется ® минеральных кислотах, если он не был пред-
варительно прокален; после сильного прокаливания он менее растворим. ,
Фтористый скандий слабо растворяется в концентрированной соляной
кислоте, после же прокаливания для растворения его требуется концентри-
рованная серная кислота. Фтористый скандий подобно фтористому цирко-
нию легко образует растворимые двойные соли, ,и этим1 скандий отличается
от фтористых солей других редких земель.
8. Тиосульфат натрия не осаждает иттрий из кипящего раствора. Скан-
дий является единственным членом из всей иттриевой! группы, относя-
щимся к Na&SsOs подобно алюминию, торию и цирконию.
9. Перекись водорода выделяет из щелочного раствора студенистый,
весьма неустойчивый осадок гидратированной перекиси общей формулы
R(O • ОН)(ОН)2.
10. Йодноватая кислота или йодаты образуют осадок, легко раствори-
мый в азотной кислоте даже в присутствии избытка осадителя (отличие
от тория и циркония).
11. Фосфориоватокислый натрий не выделяет осадка из концентриро-
ванного солянокислого раствора (отличие от тория}.
Спектры поглощения особенно важны при исследовании этой группы
металлов; они являются почти единственным средством проверки чистоты
получающихся при кристаллизации фракций. Наиболее1 важными полосами
дт.'я эрбия являются 653, 523, 487, 450 и 442 пцх; для диспрозия 753, 475,
451,5 и 4(27,5 тц. Раствор иттрия не дает спектра! поглощения.
Цвет окисей и солей часто помогает распознаванию элементов. Так,
окись эрбия розового цвета, и такого же цвета растворы его солей. Соли
европия слегка розоваты, и более определенно розового цвета соли голь-
мия. Соли диспрозия и тулия светлозеленого или сииевато-зеленого цвета.
Окиси и соли остальных металлов белы или бесцветны,
Реакции сухим путем
Окись Иттрия при накаливании сильно светит; других реакций сухим
путем не дает.
Окись эрбия при накаливании в ушке платиновой проволоки окрашивает
пламя в ясно зеленый цвет. При рассматривании пламени в спектроскопе
наблюдается целый ряд ярких линий в темнозелеиой части спектра, тесио
примыкающих к темным линиям, получающимся в спектре поглощения.
Европий Ей. Ат. в. 152,0. Ат. н. 63
Этот элемент встречается в количестве до 0,002% в монацитном песке.
По своим свойствам он занимает положение между самарием1 (церитовой
группы) и гадолинием, хотя этого не следовало бы ожидать по их атом-
ным весам. Чистая соль его была получена путем перекристаллизации
610
тройной азотнокислой соли магния — висмута — европия. Окись EusOs и
юли ее — розового цвета. Спектр поглощения показывает относительно
слабые линии при X = 579, 526, 400—393, 376—374, 364—361 тр. Европий,
<ак и самарий, образует двухвалентные хлориды при нагревании треххло-
ристых солей их >в токе сухого водорода.
Гадолиний Gd. Ат. в. 156,9. Ат. н. 64
Соли этого элемента трудно отличимы от солей европия и тербия. Его
отделение трудно даже путем частичного разложения при прокаливании
нитратов или посредством образования комплексной азотнокислой соли
с висмутом и магнием.
Окись и соли его бесцветны; они дают четыре яркие полосы погло-
щения в ультрафиолетовой части спектра при X = 31'1, 306, 305,5 и 305 тр.
Окись гадолиния является почти таким же сильным основанием, как и
УзОз.
Тербий ТЬ. Ат. в. 159,2. Ат. н. 65
Этот элемент был выделен Урбэном (Urbain) из других редких земель
путем повторной кристаллизации двойной азотнокислой соли тербия и вис-
мута и соединения его с этилсульфатом. Окись ТЬгОз—'белого цвета; рас-
творы его солей бесцветны, хотя в концентрированном растворе они
дают слабую полосу поглощения при X = 488 тр.
Высший окисел ТЬОз черного цвета в чистом состоянии, но желтого
или коричневого, когда в нем! имеются примеси.
Диспрозий Dy. Ат. в. 162,46. Ат. н. 66
Этот элемент был выделен путем дробной кристаллизации этилсульфат-
ного соединения и двойной азотнокислой соли висмута. Бесцветная окись
DysOs образует зеленовато-желтые соли, дающие рассеянные полосы по-
глощения при X — 753, 475, 451 и 427 тр.
Гольмий Но. Ат. в. 164,94. Ат. и. 67
Чистая соль этого элемента была получена путем дробной кристалли-
зации т-нитробензолсульфоната. Окись НозОз бледножелтого, а соли —
светлооранжевого цвета. Главные полосы поглощения находятся при
Х = 639—640, 536, 486—485, 453—449, 420—417 тр.
Эрбий Ег. Ат. в. 167,2. Ат. н. 68
Этот элемент был выделен в 1908 г. Гофманом из слабоосиовной
фракции иттриевых земель путем комбинирования операций: а) разложение
нитратов прокаливанием, б) дробная кристаллизация муравьинокислых со-
лей, в) дробная кристаллизация этилсульфатов и пр. Окись ErsO3 как и
соли ее отличаются своим красивым, нежным розовым цветом. Они дают
очень красивый спектр поглощения при X = 653—651, 54b 523, 491—487,
453—450 тр; более слабая полоса видна при 420 тр.
Тулий Ти. Ат. в. 169,4. Ат. н. 69
По своим основным свойствам этот элемент занимает место между
эрбием и иттербием; ои был получен путем дробного осаждения бромата.
Соли окрашены в зеленовато-синий цвет и дают полосы поглощения при
X = 702, 684 и 464 тр.
Иттербий Yb. Ат. в. 173,04. Ат. н. 70
Этот и следующий за ним элемент были найдены ® наиболее слабо-
основной части иттриевых земель. Они были выделены в виде чистых
39* 611
смей путем фракционирования аммониевого двойного оксалата и повтор,
ной кристаллизацией нитратов в азотнокислом растворе. Этот элемент на.
зывался также альдебаранием.
Лютеций Lu, или Кассиопей Ср. Ат. в. 174,99. Ат. н. 71
Получение солей этого элемента было указано при описании иттербия.
Церий Се. Ат. в. 149,13. Ат. и. 58
Плотность 6,9. Т. пл. 640°
Церий образует две окиси: СезОз и СеОз; первая обладает основным,
а вторая — амфотерным характером. Соли закиси церия белого, а окиси
церия оранжево-красного цвета. Растворы бесцветны; они обладают слад,
ким и вяжущим вкусом.
А. Соединения трехвалентного церия
Реакции мокрым путем
Следует употреблять раствор нитрата церия (3) Ce(NOs)s.
1. Аммиак или сернистый аммоний образуют белый осадок
Се(ОН)з, не растворимый в избытке осадителя, легко раствори-
мый в кислотах. В присутствии винной, лимонной и других
кислот вышеуказанные реактивы не дают осадка (отличие от Y).
Белый гидрат закиси Се(ОН)з постепенно переходит на воз-
духе вследствие медленного окисления в Ce(O>H)t, причем цвет
его становится синевато-серым, затем синевато-фиолетовым и,
наконец, желтым.
2. Едкие щелочи также осаждают Се(ОН)з даже в присут-
ствии винной кислоты. Белый Се(ОН)з постепенно приобретает
на воздухе желтый цвет вследствие окисления в Се(ОН)4.
3. Растворимые карбонаты образуют белый осадок, не раство-
римый в избытке осадителя. Аморфный вначале осадок
постепенно становится кристаллическим. В концентрированных
растворах карбонатов щелочных металлов образуется весьма
мало растворимая двойная соль; наименее растворима калиевая
соль. ' _
4. Щавелевая кислота или щавелевокислый аммоний осаждают
белую щавелевокислую' соль закиси церия, не растворимую в из-
бытке реактива, а также в разбавленных минеральных кислотах.
При прокаливании остается нерастворимый СеОг, окрашенный
в светложелтый цвет1.
5. Карбонат бария медленно осаждает весь церий на холоду.
6. Сульфат калия. Если к нейтральному раствору соли закиси
церия прибавить до насыщения твердого K2SO4, то осаждается
постепенно при обыкновенной температуре, быстрее при нагре-
вании, весь церий в виде кристаллического двойного сульфата
1 Только в том случае, когда оксалат закиси церия чист. В присут-
ствии следов празеодима СеОг окрашивается в темножелтый цвет, цвет
терракоты или семги; при большем количестве празеодима цвет СеОг буро,
коричневый.
612
калия и закиси церия (Се2(5О4)з • 3K2SO4. Эта соль совершенно не
растворима в концентрированном растворе сернокислого калия,
но растворима в большом количестве воды, а еще легче — в силь-
ных кислотах. Из слабокислых растворов при пересыщении их
сульфатом калия весь церий выпадает в виде Сег(8О4)з • 2K2SO4 •
•НгО (отличие от Al, Be и иттриевых земель).
Сульфат натрия относится совершенно аналогично (отличие
от Th и Zr).
7. Фтористый водород образует е нейтральных и слабокислых
растворах солей закиси церия студенистый осадок, который
после продолжительного нагревания превращается в порошок
(СеРз • НаО). Осадок почти не растворим в плавиковой кислоте н
в воде, но растворим в сильных минеральных кислотах (отличие
от Al, Be, Zr и Ti).
8. Перекись водорода. Если осадить соль закиси церия
аммиаком и прибавить избыток перекиси водорода, то обра-
зуется красновато-бурый осадок гидроокиси перекиси церия
СеОз • лНаО или [Се(ОН)з • О • ОН(?)], не обладающей устойчи-
востью. При кипячении в течение некоторого времени происхо-
дит разложение как Н2О2, так и осадка, и остается чистый
желтый Се(ОН)4.
Эту реакцию можно сделать весьма чувствительной для открытия сле-
дов церия в растворе редких земель следующим образом. К нейтральному
или слабокислому раствору прибавляют Н2О2 и по каплям очень разбавлен-
ный аммиак до образования небольшого неисчезающего осадка. В при-
сутствии церия сначала осаждается слабоосновная гидроокись перекиси
церия в виде красновато-бурого осадка; .в отсутствие церия осадок сине-
вато-белого цвета-1 Не менее чувствителына реакция, если аммиак заме-
нить избытком ацетата щелочного металла и нагреть раствор по приба-
влении НгОг до 50—60°; при этом церий выделяется в виде красновато-
бурого основного ацетата перекиси церия (реакция Гартлея)2. Н2О2 может
применяться для колориметрической реакции -на следы церия. Если к рас-
твору редких земель прибавлять теплый очень концентрированный рас-
твор карбоната калия до тех пор, пока образовавшийся осадок не раство-
рится в избытке осадителя, то по прибавлении Н2О2 раствор окрасится в
желтый цвет даже в присутствии следов церия. При осторожном разбавле-
нии водой до тех пор, пока большая часть других карбонатов не выпа-
дет3, можно очень легко заметить, что жидкость .над осадком окрашена
в желтый цвет4. В присутствии большого количества, церия постепенное
прибавление Н2О2 вызывает переход оранжево-красного цвета раствора
в густой кровавокрасный цвет вследствие образования двойной соли кар-
бонатов калия и перекиси церия. При добавлении большого количества
Н2О2 цвет раствора бледнеет и Се осаждается в виде желтого осадка,
невидимому, производного СеОс
Вышеуказанный углекалиевый раствор может быть окислен также и
при пропускании через него воздуха, но в этом случае конечным продук-
том является двойная углекислая соль калия и четырехвалентного церия и
раствор становится желтым независимо от количества церия. Сперва под
действием воздуха часть церия окисляется в перекись; но соль перекиси
1 Маге, В. 35, 2370 (1902).
2 Hartley, J. Chem. Soc. 41, 202 (1882).
3 При этом большая часть других редких земель выпадает в -виде
двойных углекислых солей. РеД.
4 Job, С. г. 126, 246 (1898); R. J. Meyer, Z. anorg. Chem. 41, 94
(1904).
613
церия непосредственно реагирует с неизмененной частью соли трехвалект-
ного церия, превращаясь в соль четырехвалентного церия, которая устой-
чива по отношению к кислороду.
Вместо карбоната калия можно пользоваться избытком винной кис-
лоты, а затем прибавить аммиак. Если такой раствор кипятить при до-
ступе «воздуха, то в присутствии следов церия происходит изменение жел-
той окраски в бурую; -более быстрого окисления достигают прибавлением
небольших количеств Н?О-- '.
9. Хлор. При 'пропускании хлора в раствор соли закиси це-
рия, к которому был прибавлен избыток едкой щелочи, осадок
опрашивается в желтый цвет (СеОг • ЗН2О).
При продолжительном пропускании хлора осадок целиком
переходит в раствор.
10. Бром относится, как хлор, только осадок не растворяете^
при действии избытка окислителя (отличие от лантана, неодима
и празеодима).
11. Окислители. Соли закиси церия могут быть окислены
в соли окиси церия:
а) путем нагревания «с РЬОг и HNO3 (1 :2),
б) путем нагревания с надсернокислым аммонием в присут-
ствии небольшого количества серной кислоты
в) путем электролиза и
г) посредством NaBiOs.
При «всех этих реакциях раствор окрашивается в желтый или
оранжевый цвет.
12. Тиосульфат натрия не дает осадка даже в кипящих
растворах солей трехвалентного церия (отличие от Th).
* Добавление редактора. 13. Бензидиновая реакция.1 2 Если
каплю исследуемого раствора, нанесенную на фильтровальную
бумагу, привести в соприкосновение с каплей едкой щелочи и
затем смочить уксуснокислым бензидином, то появление синего
окрашивания будет указывать на присутствие церия. Реакция во
много раз чувствительнее реакции с Н2О2.
14. Фосфорномолибденовая кислота Нт[Р(Мо2С>7)в]3. К капле
исследуемого раствора в фарфоровой чашке прибавляют каплю
насыщенного раствора реактива и каплю 40%нного раствора
NaOH. В зависимости от количества Се(3) появляется более
или «менее интенсивное -синее окрашивание, обусловливаемое
образованием молибденовой «сини. Открываемый минимум
0,52 у, Се. Предельная концентрация 1 :61 000. Фосфорномолиб-
деновая кислота является строго специфическим реактивом на
трехвалентный церий только в пределах труппы редких земель,
включая торий и цирконий *. А. К.
1 Wirth, Chem. Ztg. 37, 773 (1913).
2 F е i g 1, Oester. Chem-Ztg., 22, 124 (1919).
'Комаровский и Коренма-н, Mikrochemie, 12. 211 (1932); см.
также: Редкие металлы, 1, Ns 1—2 (1932).
614
Б. Соединения четырехвалентного церия
Для нижеследующих реакций можно пользоваться оранжевожрасным
раствором нитрата Ce(NOj)« или двойной азотнокислой солью окиси церия
и аммония Ce(NH4)2(NOs)e - НаО.
Сульфат четырехвалентного церия желтого цвета, раствор его окрашен
в темножелтый цвет; фосфат и иодат также желтого цвета. В последнее
время сульфат четырехвалентного церия предложен в качестве окислителя
вместо КМпО« или КзСг-^От. Четырехвалентный церий весьма легко вос-
станавливается даже горячим раствором хлористоводородной кислоты.
Образование соединений окиси церия. Как уже было упомянуто, ги-
драт закиси церия на воздухе желтеет, так как он постепенно переходит
в гидрат окиси. Этот переход совершается тотчас при действии хлора или
хлорноватистокислых солей. При пропускании хлора в раствор соли закиси
церия в присутствии КОН образующийся сперва белый Ce<OH)s быстро
окрашивается в светложелтый цвет гидрата окиси церия Ce(OH)i, легко
растворяющегося в разбавленных кислотах; раствор окрашен в оранжево-
красиый цвет. В концентрированной НС1 он растворяется с выделением
хлора, образуя хлорид трехвалентного церия. При прокаливании на, воздухе
белого гидрата закиси церия последний теряет воду и переходит вСеОа—
соединение почти белое на холоду (при нагревании оно темнооранжевого
цвета), совершенно не растворимое в концентрированных НС1 и HNOs.
В присутствии восстановляющих веществ-, как KJ, FeSCh, оно растворяется
в кислотах, образуя соли закиси церия; так, например, в концентрирован-
ной НС1 в присутствии KJ протекает следующая реакция:
2СеОа + 8НС1 + 2KJ -> 2КС1 + 4НЮ + J2 + 2СеС1а.
Если СеОг слегка нагревать с небольшим избытком концентрированной
серной кислоты, то она количественно превращается в сульфат Ce(SOi)2.
Это является наиболее удобным путем получения раствора соли четырех-
валентного церия. Если же нагревание производить с большим- количеством
серной кислоты при температуре кипения последней, то происходит разло-
жение и образование сульфата трехвалентного церия с выделением кис-
лорода. Раствор соли четырехвалемтного церия может быть также получен
путем окисления азотнокислого раствора трехвалентного церия висмутатом
натрия на холоду.
При прокаливании смеси гидратов закиси церия и празеодима на воз-
духе получается коричневая масса, содержащая весь церий в виде дву-
окиси, легко растворяющейся в разбавленных кислотах с образованием со-
лей окиси церия. При растворении в концентрированной НС1 происходит
выделение хлора и восстановление в соль закиси церия. Концентрированная
азотная кислота также растворяет эту смесь с образованием солей закиси
и окиси церия; при этом происходит заметное выделение -кислорода.
Легкость растворения в кислотах коричневой массы, содержащей пра-
зеодим, объясняется следующим: СеОг, как МпОг и РЬОг (стр. 244 и V29),
может -играть роль -кислотного ангидрида; поэтому бурая смесь окислов
содержит празеодим в виде празеодимовой соли цериевой кислоты. При
обработке этой соли более сильной кислотой образуется празеодимовая
соль этой кислоты с выделением, цериевой кислоты (гидрата окиси
церия), которая в гидратированной форме легко растворяется, образуя соль
окиси церия.
Основные соли четырехвалентного церия. Если раствор нитрата Се(4)
выпарить на водяной бане до сиропообразной консистенции, то охлажден-
ная масса легко растворяется в воде; полученный раствор можно кипя-
тить, причем он не мутится. Но если прибавить немного азотной кислоты,
то тотчас образуется желтый осадок, состоящий из основного нитрата
четырехвалентного церия; если же прибавить большее количество кислоты,
осадок снова растворится. Это может быть объяснено следующим образом.
При действии на раствор нитрата четырехвалентного церия большого ко-
личества воды происходит гидролитическое расщепление, но образую-
615
щаяся при этом основная соль находится в состоянии гидрозоля, который
превращается кислотой в гидрогель.
Так как соли лаитана, празеодима и неодима при таких условиях не
дают основных солей, то этим свойством церия можно пользоваться для
отделения его от этих металлов.
Характерно для церия образование с аммонием двойной кристалличе-
ской соли азотной кислоты: Ce(NO3>4• 2NHiNOs• НЮ.
Все соли четырехвалентного церия легко восстанавливаются до солей
трехвалентного церия обычными восстановителями (спирт, HJ, SO2>
H2S, HNO2, Н2О2 и т. п.).
Реакции мокрым путем
1. Едкие щелочи и аммиак осаждают желтую гидроокись
церия Се(ОН)4. Она растворяется в азотной кислоте, образуя
красный раствор; при растворении же в соляной кислоте выде-
ляется хлор и образуется хлористый церий СеС1з:
2Се(ОН)4 + 8Н’ + 2С1' -> 2Се’ " + С12 + 8НЮ.
Гидроокись церия(4) — слабое основание; соли четырехвалеитного це-
рия легко восстанавливаются в кислых растворах. Четыреххлористый це-
рий известен только в растворе, и он легко разлагается подобно четырех-
хлористому марганцу.
При растворении гидроокиси церия в серной кислоте образуется смесь
сульфатов четырехвалеитного и трехвалентного церия. Известен также
в твердом состоянии сульфат четырехвалентного церия, который может
быть получен с четырьмя молекулами кристаллизационной воды. При
нагревании в сернокислом растворе эта соль разлагается:
4Ce(SO<)2 + 2НЮ -> 2CeKSO0s + 2H2SO4 + О2.
2. Щавелевая кислота образует в концентрированных раство-.
рах солей окиси церия осадок сперва грязно оранжевого цвета,
который при дальнейшем прибавлении щавелевой кислоты пере-
ходит в желтый цвет и приобретает студенистую консистенцию,
переходящую затем в кристаллическую форму. Осадок рас-
творяется в большом избытке щавелевой кислоты, образуя жел-
тый раствор; который на холоду постепенно’ мутнеет (быстрее
при нагревании), так как при этом соль окиси церия переходит
с выделением СОг в соль закиси и, как таковая, полностью вы-
падает (отличие от Th, солей закиси церия, La, Nd, Pr и иттрие-
вых земель).
Щавелевокислый аммоний относится так же, как и щавелевая
кислота.
3. Нитрат аммония дает в концентрированном азотнокис-
лом растворе относительно не растворимый двойной нитрат
Ce(NH4)a(NO3)e. Другие церитовые металлы образуют двойные
нитраты, отличающиеся своей большей растворимостью в азот-
ной кислоте.
4. Перекись водорода восстанавливает кислые растворы со-
лей .четырехвалентного церия:
2Се'' ’ ‘Н2О2 ->2Се‘ ‘ ’ ф- 2Н' + О2.
616
Реакции сухим путем
Перл буры в горячем состоянии окрашен в окислительном
пламени в темнокрасный цвет; на холоду он светложелтого
цвета или почти бесцветен; в восстановительном пламени перл
совершенно бесцветен. Сильно1 прокаленная двуокись церия
остается в перле во взвешенном' состоянии, отчего он кажется
мутным и желтоватым.
Лантан La. Ат. в. 138,92. Ат. н. 57
Плотность 6,16. Т. пл. 826°
Лантан образует только одну окись *, LazOs, которая легко раство-
ряется в кислотах даже после сильного прокаливания. Соли его бесцветны
и ие дают спектра поглощения; этим лантан отличается от неодима!,
празеодима и эрбия. Искровый спектр дает, однако, характер-
иые линии в фиолетовой и ультрафиолетовой частях. Из всех редких
земель лантан отличается своей наибольшей основностью. Окись в чистом
состоянии белого цвета и похожа на окись кальция по своему отношению
к воде и углекислому газу. Сульфат La2(SOi)3 • ЭНаО слабо растворяется
в воде; безводный сульфат растворяется значительно легче в ледяной воде
(стр. 607).
Присутствие фосфорной кислоты способствует растворению этих суль-
фатов. Минерал церит, будучи выпарен с серной кислотой, очень легко
растворяется в воде при комнатной температуре.
Реакции мокрым путем
Следует употреблять раствор азотнокислого лантана La(NOs)s.
1. Аммиак или сернистый аммоний осаждают плохо филь-
трующуюся белую основную соль. Присутствие винной кислоты
препятствует осаждению (отличие от иттрия).
2. Едкие щелочи осаждают белый гидрат окиси лантана
Ьа(ОН)з, не растворимый в избытке осадителя. При обработке
окисляющими веществами изменения в окраске не происходит
(отличие от церия)- La(OH)g окрашивает в синий цвет крас-
ную лакмусовую бумагу и разлагает при нагревании аммоний-
ные соли, выделяя аммиак. Прокаленная окись легко раство-
ряется в разбавленных кислотах.
3. Карбонат аммония выделяет белый, мало растворимый
в избытке реактива осадок (отличие от алюминия); после долгого
стояния выделяется на холоду кристаллический карбонат лан-
тана и аммония.
4. Щавелевая кислота дает белый кристаллический осадок,
не растворимый в избытке осадителя, но хорошо растворимый
в разбавленной соляной кислоте (отличие от тория); в щавелево-
кислом аммонии осадок не растворим (отличие от циркония и
церия).
1 Полагают, что Н2О2 образует LazOs, Z. anorg. Chem. 21, 70 (1899).
617
5. Сульфат калия образует кристаллический осадок LaaCSOi)'»;
•3K2SO4 белого цвета, не растворимый в концентрированном
растворе K2SO4.
6. Сернокислый лантан в безводном состоянии легко раство-
ряется в ледяной воде. При нагревании раствора до 30° почти
весь лантан осаждается в виде мало растворимого La2(SO<)s-
• ЭНаО. Растворимость этой соли в четыре раза меньше раство-
римости Ce2(SO4)3 • 8Н2О и Cea(SO4)3 • 9НгО.
7. Иод. Если к холодному разбавленному уксуснокислому
раствору прибавить аммиак, полученный слизистый осадок проч
мыть водой и посыпать небольшим количеством кристалличеч
ского иода, то образуется синее окрашивание, постепенно рас-
пространяющееся по всей массе и напоминающее собою синее
окрашивание иодного крахмала. Синяя окраска уничтожается
кислотами и щелочами.
Иодная реакция на лантан ненадежна, если он находится
в смеси редких земель, потому что празеодим дает при тех же
условиях синевато-фиолетовое окрашивание, а церий, окисляясь
на воздухе, также окрашивается в синевато-серый иди синевато-
фиолетовый цвет.
8. Фтористый водород осаждает белый желатинообразный
становящийся затем кристаллическим фтористый лантан (LaFs-
ЗН2О) не растворимый в избытке осадителя, а также в разбав-
ленных кислотах; в более концентрированных минеральных
кислотах осадок постепенно растворяется.
9. Тиосульфат натрия не осаждает лантана.
Празеодим Рг. Ат. в. 140,92. Ат. н. 59
Плотность 6,60. Т. пл. 940°
Этот элемент был найден в церитовых минералах в количестве в два
раза меньшем, чем; неодим. При дробной кристаллизации комплексной
аммоние-вомагниевой соли азотной кислоты празеодим находят в фракциях
между лантаном и неодимом.
Окись празеодима РпОз, от которой производятся соли, желтого цвета-;
при нагревании в кислороде при 300° или при сплавлении с хлоратом
натрия она переходит в черную двуокись РгОа.
Спектр поглощения празеодима показывает пять полос, которые
с увеличением разбавления разделяются на очень узкие, резко ограничен-
ные полосы, максимум абсорбции которых следующий: 596,4; 588,2; 481,8;
468,8 и 442,2 тц.
Чтобы открыть бесцветный лантан в солях празеодима, необходимо
исследование искрового спектра-
Неодим Nd1. Ат. в. 144,27. Ат. н. 60
Плотность 6,90. Т. пл. 840°
Соли этого элемента выделяют из остатков, получающихся при произ-
водстве тория из монацитовой руды путем повторной кристаллизации
1 Смешанные соли празеодима и неодима раньше назывались солями
дидима и для смеси обоих элементов применялся символ Di.
618
двойных нитратов магния и марганца. Окись неодима NdsOi после прока-
ливания окрашена в светлосиний цвет со слабой красноватой флуоресцен-
цией (если она совершенно чиста). Малейшие примеси празеодима или
марганца дают желтовато-бурую смешанную окраску.
Соли неодима красновато-фиолетового цвета и отличаются красивой
розово-синей или розово-фиолетовой флуоресценцией. Эта флуоресцен-
ция особенно заметна в отраженном свете, если соль неодима, например
оксалат его, поместить на белую бумагу. Раствор нитрата дает следующие
спектры поглощения: 677, 578—572, 532—509, 475, 479, 427 mi*.
Иллиний II. Ат. в. 146—148. Ат. н. 61
Открытием иллиния1 заполнилась группа редких земель. Иллиний,
названный по штату Иллинойсу и его университету, где производились
главные работы над этим элементом, принадлежит, вероятно, к наименее
распространенным в природе из всех элементов этой группы. Он может
быть открыт путем рентгеновского спектрального анализа и определен
магнитно-оптическим методом. Его свойства сходны со свойствами других
элементов. Количества его, находимые в отходах монацита при производ-
стве газокалильных сеток или в минералах (например, гадолинит), на-
столько малы, что фракционированных осаждений, производившихся еже-
дневно в течение трех лет и требовавших много тысяч операций, оказа-
лось недостаточно для получения сколько-нибудь значительного количе-
ства чистой иллиниевой соли. Исследования показали, что его основность
немного более основности иттрия и значительно больше основности сама-
рия. В общем основность редких земель понижается с повышением атом-
ного номера. Исключение представляет иттрий.
Основность изменяется в следующем порядке:
Ат. н. 57 59 60 62 61 64 39 66
Символ La Pr Nd Sm II Gd У Dy
Самарий Sm. Ат. в. 150,43. Ат. и. 62
Самарий из всей группы церитовых земель обладает наименьшей ос-
новностью и несколько приближается к тербию, из группы иттриевых земель.
Его соли типа трехвалентного металла окрашены в топазовожелтый цвет.
Реакции его аналогичны реакциям других членов этой группы. Двойной
нитрат его наиболее растворим и наименее устойчив из всей группы. Глав-
ные полосы поглощения самария находятся при 560, 500, 480, 463, 417 тц,
но полосы его значительно менее очетливы, чем полосы поглощения нео-
дима и празеодима.
Таллий TI. Ат. в. 204,39. Ат. н. 81
Плотность 11,9. Т. пл. 302°. Т. кип. 1650°
Нахождение в природе. Таллий весьма мало распространен в при-
роде. Его находят в небольших количествах во многих пиритах и как
спутника калия в карналлите и сильвине; в некоторых слюдовых поро-
дах, содержащих литий, и во многих минеральных водах. Он может
отчасти замещать серебро в медносеребряных селенидах [крукезит (Ag,
Tl> CujsSe (правильной системы), берцелианит (Си, Ag, Tl)sSe (ромбической
системы)]. Характерные таллиевые минералы неизвестны. Главным источ-
ником для получения таллиевых соединений служат отбросы сернокис-
лотных заводов, перерабатывающих колчеданы, содержащие таллий.
Свойства. По цвету, мягкости, высокой плотности и низкой точке
плавления таллий напоминает свинец.
1 Harris, Hopkins a. Yutema, J. Am. Chem. Soc. 48, 1585 (1926).
. 619
Таллий легко растворяется в серной и азотной кислотах и труднее
в соляной. Он образует два окисла: закись ТЬО н окись Т1»Оз. Оба
они имеют основной характер и образуют соли, в которых таллий может
фигурировать в качестве одновалентного и трехвалентного элемента.
А. Соединения одновалентного таллия
Соединения закиси таллия бесцветны и большинство из них растворимо
в воде. Сульфид, хлорид, бромид, иодид и хромат в воде не растворимы.
Закись таллия представляет собой темный порошок; ее водный раствор
имеет щелочную реакцию и с жадностью поглощает двуокись углерода из
воздуха. Кипячение с азотной кислотой не окисляет соли закиси таллия,
но при действии царской водки, хлора и брома происходит окисление их
в соли трехвалентного таллия.
Таллий по своей плотности и растворимости его галоидных соединений
подобен свинцу; с другой стороны, он сходен с щелочами по раствори-
мости н щелочной реакций гидроокиси и карбоната, по образованию не-
растворимого хлороплатината, по образованию квасцов и по нераствори-
мости комплексной соли с нитритом трехвалентного кобальта.
Реакции мокрым путем
Для следующих реакций следует пользоваться сульфатом закиси тал-
лия.
1- Сернистый водород не дает осадка в минеральнокислых
растворах солей закиси таллия; в нейтральном растворе проис-
ходит неполное осаждение черного сернистого таллия TI2S. T12S
легко растворяется в минеральных кислотах и не растворяется
в уксусной кислоте и сернистых щелочах. На воздухе происходит
быстрое окисление сернистого таллия в сернокислую соль закиси
таллия.
2. Сернистый аммоний выделяет весь таллий ,в виде TI2S.
3. Едкие щелочи и аммиак не дают осадка.
4. Углекислые щелочи образуют осадок только в очень кон-
центрированных растворах, так как карбонат таллия достаточно
растворим (100 ч. воды растворяют 5 ч. соли).
5. Платинохлористоводородная кислота осаждает светложел-
тый хлороплатинат таллия Т12[Р1С1б], который почти не раство-
рим в воде; 1 ч. растворяется в 15 600 ч. Н2О при 15° и в 1950 ч.
при 100°.
6. Сульфат алюминия. При выкристаллизовывании раствора
сернокислого таллия с сернокислым алюминием получаются
блестящие бесцветные октаэдры таллиевых квасцов T1A1(SOa)2-
•12Н2О.
7. Феррицианид -калия осаждает ив щелочного раствора
бурый Т1(ОН)з:
2[Fe(CN)e]'" + ЗОН' + ТГ ->2[Fe(CN)e]"" + Т1(ОН)«.
8. Хлористо- и бромистоводородная кислоты выделяют тяже-
лые осадки белого Т1С1 и бледножелтого Т1Вг. Хлорид заметно
растворим в горячей воде, бромид менее растворим, а иодид
почти не растворим. Фторид же, например, легко растворим
в воде.
620
9. Йодистый калий осаждает желтый иодид T1J даже из раз-
бавленных растворов. Подобно йодистому свинцу T1J не раство-
ряется в холодном растворе тиосульфата натрия.
TeJ менее растворим, чем РЬЪ. При комнатной температуре 1 л воды
растворяет 0,61 г PbJa и лишь 0,08 г T1J. Кроме того*, PbJ2 более раство-
рим в избытке KJ, потому что образуется комплексный анион PbJ<", йоди-
стый же таллий от прибавления к нему общего иона становится еще ме-
нее растворимым.
10. Хромовокислые щелочи осаждают желтый хромат одно-
валентного таллия, не растворимый в холодной азотной или
серной кислоте.
ThCrOi более растворим, чем РЬСгСЧ. Один литр воды при
60° растворяет 0,3 г ThCrOi и лишь 0,1 r PbCrOi.
11. ) Гексанитрокобальтиат натрия осаждает светлокрасный
гексанитрокобальтиат таллия:
[Co(NO2)«]"' + ЗТГ -> Т1з[Со(МОг)в].
12. Цинк, алюминий или магний осаждают металлический
таллий в виде черных мелких кристаллов:
Zn-f-2Tl’ -» Zn' ‘ 4-2Т1.
* Добавление редактора. 13. Фосфорномолибденовая и броми-
стоводородная кислоты Ч Соли одновалентного таллия дают
с фосфорномолибденовбй кислотой фосфоромолибдат одно-
валентного таллия. Если к последнему прибавить концентриро-
ванную бромистоводородную кислоту, то образуются молибде-
новая синь и бромид трехвалентного таллия. Эта весьма чув-
ствительная реакция может быть использована для открытия
таллия(1). Необходимо только отсутствие таких восстанови-
телей, которые образуют с фосфорномолибденовой кислотой
молибденовую синь, например соли меди(1), олова(2), сурьмы(З),
железа(2) и др.
Выполнение. На фильтровальную бумагу наносят каплю насыщенного
раствора фосфорномолибде,новой кислоты и на середину пятна помещают
каплю исследуемого раствора, после чего прибавляют кайлю бромисто-
всдородной кислоты. В зависимости от количества таллия образуется бо-
лее или менее интенсивное синее пятно. Таким путем можно в 1 капле
(0,025 ял) открыть 0,13 Т Т1 (1). Чувствительность 1:200 000.* А. К.
Б. Соединение трехвалентного таллия
Хотя соли закиси таллия могут быть окислены царской водкой, хло-
ром или бромом в соли окиси таллия, все же лучшим способом получения
последних является растворение окиси таллия в кислотах2. От соединений
закиси таллия они отличаются легкой гидролизуем остью в водном рас-
творе. Так, сернокислая соль окиси таллия TlsCSObs разлагается при кипя-
чении ее водного раствора на H2SO4 и бурый гидрат окиси таллия
Т1(ОН)з; точно так же ведет себя и нитрат окиси таллия.
1 Н. С. Полуэктов, Редкие металлы 2, 41 (1933).
2 Концентрированная серная кислота не действует на ТКОз иа холоду,
но только при нагревании. Значительно легче растворяется в кислотах
,Т1О(ОНХ
621
Хлорный таллий TlCls представляет собой расплывающееся, очень
легко разлагающееся вещество; уже при 100° происходит обильное выде-
ление хлора и образование соли закиси таллия.
Реакции, мокрым путем
1. Едкие щелочи и аммиак осаждают бурую гидроокись таллия
Т1(ОН)з из растворов солей трехвалентного таллия, которая при
стоянии на воздухе переходит в ТЮ(ОН); Т1(ОН)з трудно рас-
творяется в кислотах и не растворяется в избытке едких ще-
лочей.
2. Соляная кислота и хроматы щелочных металлов не дают
осадка.
3. Иодистый калий осаждает иодистый таллий с выделением
иода:
+ TIJ + J2.
4. Сернистый водород восстанавливает в кислых растворах
трехвалентный таллий:
H2S + ТГ ’• _ ТГ +2Н* 4-S.
При нейтрализации кислоты осаждается сульфид однова-
лентного таллия.
Восстановление солей трехвалентного таллия возможно также
и металлической ртутью. Так, при взбалтывании Т1С1з со ртутью
выпадает Т1С1:
Т1С1» 4- 2Hg_> Hg'2C12 + Т1С1.
Соли трехвалентного таллия восстанавливаются также серни-
стой кислотой; TI2SO4 в отличие от PbSCU растворим в воде.
5. Эфир. Треххлористый таллий подобно FeCh и GaCh бо-
лее растворим в смеси НС1 с эфиром, чем в водном растворе
НС1. Эти три хлорида могут быть извлечены из 6N раствора
НС1 путем взбалтывания с эфиром.
6. Ацетаты щелочных металлов осаждают при кипячении
ТЮ(ОН).
Реакции сухим путем
Таллиевые соли окрашивают несветяицееся пламя бунзенов-
ской горелки в великолепный изумрудно-зеленоватый цвет.
Пламенный спектр. Единственная зеленая линия 535 ту, которая почти
совпадает с линией бария, но смешение их исключается, так как линия
таллия значительно интенсивнее окрашена и характер свечения ее иной,
чем у линии бария.
Индий In. Ат. в. 114,76. Ат. н. 49
Плотность 7,3. Т. пл. 155°
Индий был открыт в цинковых рудах; его находят также вместе
с вольфрамом. Свободный элемент представляет собой белый блестящий
622
мствлл, напоминающий по внешнему виду платину’. Он очень мягок, ковок
и оставляет черту на бумаге. Он медленно окисляется на воздухе, но ме-
нее легко, чем цинк. Металл растворяется в разбавленных соляной и сер-
ной кислотах, причем выделяется водород и образуются трехвалентные
ионы индия:
21п + аН’ -> 2Яп* + ЗНг.
Азотная кислота его легко растворяет; в серной кислоте выделяется
безводная соль.
Индий образует три хлорида: InCi, InCh и; InCb, но в водном растворе
устойчивы только соли трехвалентного металла. Окись индия 1пгОЬ бледно-
желтого цвета на холода и красновато-бурого цвета в горячем состоянии.
При прокаливании в атмосфере водорода, или с углем ойа восстанавли-
вается до металла. Прокаленная окись медленно растворяется в холодных
кислотах, но более легко в горячих разбавленных кислотах. Соли индия
бесцветны; сульфат, нитрат и хлорид растворимы в воде.
Реакции мокрым путем
1. Едкие щелочи и аммиак осаждают белую студенистую
гидроокись индия:
In’” + ЗОН' -> In(OH)3.
Осадок по своим свойствам и по внешнему виду похож на
гидроокись алюминия. Винная кислота препятствует осаждению.
Он растворяется в избытке едких щелочей, но жидкость мут-
неет при стоянии и при кипячении с хлористым аммонием вслед-
ствие снова выделяющейся гидроокиси.
NasOj также осаждает In(OH)s. Осадок растворим в HF. Его можно
отделить от Ti(OH)4 и Zr(OH)» путем частичной нейтрализации HF-раствора
посредством NH-tOH и пропускания в раствор HsS. При этом осаждается
желтый InsSs. В присутствии значительных количеств редкоземельных ме-
таллов (например1, Се) 1п(ОН)з часто не удается растворить в HF. В та-
ком случае лучше всего отделить In от редких земель путем разложения
фтористых соединений выпариванием с HsSO», осадить 1п(ОН)з вместе
с гидроокисями редких земель аммиаком, растворить In(OH)3iB6W СНзСООН
и осадить сероводородом 1пг£з.
2. Растворимые карбонаты осаждают белый студенистый
карбонат 1п2(СОз)з. Он растворяется на холоду .в растворе кар-
боната аммония и при кипячении снова осаждается.
3. Карбонат бария осаждает основную соль даже на холоду
(отличие от Zn, Mn, Со, Ni и Fe’' ’).
4. Фосфорнокислый натрий дает белый объемистый осадок.
Обыкновенно индий не осаждается из кислых растворов фосфатом на-
трия в виде фосфата индия, но в1 присутствии циркония и титана он может
выпасть вместе с 2г(НРС>4)г и ТХНРСМз. Поэтому до испытания на Zr или
Ti посредством №гНРО» необходимо удаление индия.
5. Щавелевокислый аммоний осаждает из концентрированных
растворов белый кристаллический оксалат индия.
6. Ацетаты щелочных металлов не осаждают из растворов
чистого 1пС1з даже малых количеств основной соли индия, при
pH около 5,3; но в присутствии большого количества трехва-
лентного железа осаждение индия в виде основной соли практи-
чески полное.
623
7. Сернистый водород выделяет из слабокислого раствора
желтый осадок сульфида индия:
21п ’' 4- 3H2S -> In2S3 4- 6Н'.
Осадок образуется в присутствии 6N уксусной кислоты, но не
выделяется в О,ЗА' минеральной кислоте.
8. Сернистый аммоний осаждает белый сульфид. При кипяче-
нии желтого сульфида с желтым сернистым аммонием получается
белый сульфид, который до некоторой степени растворим; при
охлаждении из раствора выделяется белый объемистый сульфид.
Точно еще не выяснено, какова должна быть формула желтого
и белого сульфида.
9. Ферроцианид калия выделяет белый осадок железистосине-
родистого индия.
10. Феррицианид, роданид и бихромат калия не дают осадка.
КгСгО1 выделяет желтый осадок.
11. Цинк осаждает индий в виде белых блестящих хлопьев.
* Добавление редактора. 12. Ализарин и хинализарин1 дают
с индием окрашенные лаки, причем первый темнокрасный, а вто-
рой сиреневый. Обе реакции отличаются большой чувствитель-
ностью и могут быть выполнены в виде капельных реакций-
а) Ализарин. На, фильтровальную бумагу, пропита,иную насыщен-
ным спиртовым раствором ализарина . и затем высушенную, поме-
щают каплю нейтрального или слабокислого испытуемого раствора
и дают последнему впитаться в бумагу. Полученное пятно под-
вергают действию паров аммиака. В присутствии индия появляется крас-
ный индиевый лак, в отсутствие же индия образуется фиолетовое окра-
шивание ализарината аммония. Так как при малом количестве индия
фиолетовая окраска может помешать видимости индиевого лака, то бумагу
погружают в насыщенный раствор борной кислоты. При этом фиолето-
вая окраска, вызываемая аммиаком, исчезает и вместо нее появляется
желтая окраска красителя, на фоне которой, хорошо выделяется индиевый
лак ализарина. В одной капле (0,25 мл) можно открыть 0,05 у In.
б) Хинализарин. Фильтровальную бумагу пропитывают раствором
0,01 г хинализарина в 2 мл пиридина; разбавляют 20 мл ацетона. Бумагу
хранят после высушивания в закрытой склянке. Реакцию выполняют точно
так, как указано при предыдущей реакции. После обработки насыщен-
ным раствором борной кислоты в присутствии индия появляется на розо-
вом фоне сиреневое пятно. Чувствительность реакции та же, что и пре-
дыдущей.
Так как большое число элементов группы сернистого аммония дает
такие же окраски или окрашенные гидроокиси с обоими реактивами, то
открытие индия без предварительного отделения этих элементов невоз-
можно. Однако авторы цитируемой работы нашли, что индий может быть
открыт в присутствии целого ряда элементов третьей группы путем под-
бора надлежащих маскирующих средств (см. оригинальную работу). * А. К.
Реакции сухим путем
При прокаливании солей индия на угле поверхность послед-
него покрывается блестящим металлическим налетом.
Соли индия окрашивают пламя в синевато-фиолетовый цвет.
В спектре ясно видны две линии при 451,1 и 410,1 ту.
1 A. Komarovsky nJ N. S. Poluektoff, Mikrochemie, 16, 227
(1934/1935).
624
Таллий Ga. Ат. в. 69,72. Ат. н. 31
Плотность 5,96. Т. пл. 301°
Нахождение в природе. Галлий встречается в природе обыкновенно
в малых количествах. Он находится во многих образцах сфалерита и
бокситов, а также в других минералах. Он представляет собой твердый
белый металл, не очень ковкий и не легко окисляющийся.
Свойства. Соляная кислота, едкое кали и аммиак растворяют галлий
с выделением водорода:
2Ga + 6Н ‘ -> 2Ga ’ ‘+ З1Н2;
2Ga + 2ОН'->2[СаОг]'+ Н2;
2Ga + 6Н2О 8NH3 2 [Са(Ы'Нз)«] ’ * -Г ЗНз -Г 6ОН'.
Металл пассивируется холодной азотной кислотой, но при нагрева-
нии он растворяется с выделением бурых паров:
Ga + 6HNO3 -> Са(МОз)з + ЗНзО + 3NO2.
Галлий в своих солях бывает двухвалентным и трехвалентным. Сое-
динения двухвалентного галлия неустойчивы и легко окисляются. Окись
галлия Ga2Q3 и гидроокись Са(ОН)з белого цвета. Соли трехвалентного
галлия бесцветны или белы. Треххлористый галлий—бесцветное гигро-
скопическое вещество, плавящееся при 75° и кипящее при 215—220°. При
выпаривании растворов GaCl3 происходит улетучивание последнего, но
в присутствии серной кислоты галлий не теряется^.
Реакции мокрым путем
1. Едкие щелочи и аммиак осаждают белый хлопьевидный оса-
док гидроокиси галлия’:
Ga’ ” + ЗОН' -> Ga(OH)3,
легко растворяющийся в избытке осадителя:
Ga(0H)3 + ОН'-» GaO2' + 2HzO.
При кипячении аммиачного раствора осадок снова медленно
выделяется. Винная кислота препятствует осаждению галлия
аммиаком.
2. Растворимые карбонаты выделяют белый осадок. В избытке
карбоната аммония осадок растворяется.
3. Карбонат бария полностью осаждает галлий на холоду.
4. Кислые сернистокислые щелочи осаждают галлий из ней-
трального или слабокислого раствора при температуре кипения
в виде хлопьевидного осадка гидрата окиси галлия (отличие
от цинка).
5. Сернистый водород не осаждает галлий из разбавленных
кислых растворов. Однако небольшие количества его могут
выпасть в виде сульфида, если одновременно осаждается какой-
либо металл группы меди.
6. Эфир извлекает GaCh из водного солянокислого раствора.
Также извлекаются эфиром FeCh и Т1С1з. Если взболтать эфир-
ный раствор, разбавленный водой, со ртутью для восстановле-
ния железа и таллия, то при вторичном взбалтывании с эфиром
йудет экстрагирован только один GaCh.
40 Зак. 982. Тредвелл-Голл, т. I. 625
7. Уксуснокислые щелочи. При- кипячении раствора галлиевых
солей, значение ipH в котором доведено до 5,3 путем прибавле-
ния щелочного ацетата, наблюдается выделение основной соли
галлия. Осаждение не полное, если раствор является более
кислым или щелочным.
8. Сернистый аммоний выделяет сульфид галлия только
тогда, когда в растворе имеет место образование другого не-
растворимого сульфида.
9. Ферроцианид калия в присутствии разбавленной кислоты1
выделяет белый или синевато-белый осадок ферроцианида галлия.
* Добавление редактора. 10. Ализарин2. Если к испытуемому
раствору прибавить несколько капель спиртового раствора али-
зарина, каплю аммиака и немного хлористого аммония и смесь
взболтать с эфиром, то в плоскости раздела водного и эфирного
слоев собирается окрашенный в розовый цвет лак галлия. Таким
путем можно открыть 1 у в 2 мл испытуемого раствора, что
отвечает предельной концентрации 1:2000 000- Такие же окра-
шенные лаки дают А1 и In.
11. Ферроцианид и соль марганца (2)3. Соли двухвалентного
марганца образуют с феррицианидом бурый нерастворимый
осадок. Такой же осадок получается, если к кислому раствору
соли двухвалентного марганца прибавить в присутствии окисли-
теля (KNO2, КВгОз) ферроцианид. Однако при определенной
концентрации окислителя и соли марганца образование бурого-
осадка не происходит. Если к такому раствору прибавить соль
галлия, то появляется красновато-бурая окраска раствора или
такого же цвета осадок. Очевидно образующийся ферроцианид
галлия индуцирует осаждение ферроцианида двухвалентного
или ферроцианида трехвалентного марганца.
Выполнение. В фарфоровой чашечке смешивают каплю исследуемого
кислого раствора с 4 каплями раствора хлорида марганца и затем доба-
вляют каплю раствора ферроцианида калия, содержащего окислитель.
В присутствии галлия образуется красновато-коричневый осадок или такого
же цвета муть. В одной капле (0,04 мл) можно обнаружить 5 у галлия,
Предельная концентрация 1:8000.
Для этой реакции необходимы следующие реактивы:
1) 0,5%-ный раствор хлорида марганца в 6N НС1;
2) 5%-ный раствор K«Fe(CN)e, к каждым 20 мл которого добавлено
10 капель 0,lN раствора бромата калия.* А. К,
Реакции сухим путем
Галлий дает в искровом спектре две фиолетовые линии между
линиями G и Н при 417,0 и 403 mjj.. В пламени бунзеновской горелки
видна лишь одна слабая линия.
1 Кислотность должна варьировать в пределах 1—2N. Ред.
2 N. S. Poluektoff, Mikrochemie 19, 248 (1936).
3 N. S. Poluektoff, loc. cit.
626
Ванадий V. Ат. в. 50,95. Ат. н. 23
Плотность 5,82. Т. пл. 1720°. Т. кип. 3400°
Нахождение в природе. Ванадинит PbsCVOihCl, моттрамит (Си,
Pb)5(VO4)2 • 2НгО, карнотит *; кроме того, ванадий встречается во многих
глинах и почти во всех гранитных породах.
Свойства. Металлический ванадий серебристобелого или бледносерого
цвета. Его часто получают из его руд в виде феррованадия, находящего
применение в производстве стали.
Металл является сильным восстановителем; он растворяется в соляной
кислоте; из металлов ванадий обладает наибольшей твердостью.
Ванадий образует пять окислов: VaO, V2O2, V2O3, V2O4 и V2O5. Первые
три окисла обладают основным характером. Как с самими этими окислами,
так и с их солями в качественном анализе обычно не приходится встре-
чаться за исключением тех случаев., когда при реакциях на ванадий 'соли
его подвергают действию энергичных восстановителей.
Окись V2O2 темнооерого блестящего цвета. Эта окись не растворима
в воде, но растворима в разбавленных кислотах, образуя окрашенные в
синий цвет растворы, которые благодаря своим сильно восстановляющим
свойствам обесцвечивают органические красящие вещества.
Окись ванадия V2O3 черного цвета, не растворима в кислотах (за
исключением фтористоводородной и азотной кислот) и в растворах едких
щелочей. При прокаливании в токе водорода она не восстанавливается, но
на воздухе медленно превращается в окись ванадила V2O4. Растворы, со-
держащие соли трехвалентного ванадия, зеленого цвета.
Окиси V2O4 и V2O5 являются наиболее обычными ванадиевыми соеди-
нениями.
Окись ванадила V»O4 (называемая также четырехокисью ванадия) пред-
ставляет собой ангидрид гипсванадиевой кислоты У2О2<ОН)4. Последнее
соединение, обладая амфотерным характером, дает соли как с кислотами,
так и с основаниями. Сама окись гаанадила имеет вид синего порошка,
растворяющегося в концентрированных кислотах с образованием дивана-
диловых солей1 2 чисто синего цвета:
V2O4 + 2Нг5О< -> VsCMSCMa + 2Н2О.
При осторожном прибавлении к сернокислому диванадилу NaaCOs ил!и
NHs (избегая избытка) осаждается гипованадиевая кислота сероватого
цвета, раствор которой в кислотах, как и раствор ангидрида, синего цвета,
а раствор в щелочах бурого цвета. Гнпованадаты щелочных металлов
имеют формулы NaaVaOs и NasViOe. Гилованадаты Других металлов боль-
шей частью не растворимы в воде; они могут образоваться при нейтра-
лизации кислых растворов, содержащих соли ванадия и какого-либо ме-
талла. Соединения диванадила легко образуются при восстановлении
сернистой кислотой (стр. 630) растворов пятиокиси в минеральных кисло-
тах, и их синей окраской пользуются для открытия ванадия.
Пятиокись ванадия V2O5, являющаяся ангидридом ванадиевой кислоты,
представляет собой оранжево-красное, легко плавящееся, но не летучее
вещество. Она обладает малой растворимостью в воде, образуя слабо-
кислый раствор желтого цвета, и легко растворяется в концентрированных
растворах едких щелочей с образованием ванадатов. При нагревании
с азотной кислотой или с царской водкой, а также при сплавлении с ще-
лочным окисляющим плавнем все низшие окислы переходят в пятиокись
ванадия или в какую-либо из ее солей.
1 Карнотит содержит 18% VsOs и 55% UOs, а также К, Са, Ва, As и Р
[(См. Hill ebrand a. Ransome, Am. J. Science 10, 138 (1910)].
2 VO —ванадил, VsOa — диванадил.
40* 627
Подобно фосфорной кислоте ванадиевая кислота существует в виде
мета-, пиро-, орто- и полисоединений, из которых метасоединения являются
наиболее устойчивыми, а ортосоединения наименее устойчивыми. Так, вод-
ный раствор калиевой или натриевой соли ортованадиевой кислоты гидро-
литически расщепляется даже на холоду на пиросоль и гидроокись щелоч-
ного металла:
2№вУС>4 + Н2О S NaiVsO? 4- 2NaOH;
при кипячении происходит образование метасоли:
NaiVsO? + Н2О ?± 2NaVOs + 2№ОН. *
Щелочные соли мета-, пиро- и ортованадиевой кислоты бесцветны или
бледножелтого цвета, поливаиадаты же, например тетра- и гексаванадаты,
окрашены в интенсивно оранжевый или красноватый цвет. Бесцветные или
бледножелтые растворы орто-, мета- и пированадатов от прибавления
кислоты окрашиваются в интенсивно оранжевый цвет.
Сильные кислоты' растворяют пятиокись ванадия с образованием крас-
ных или желтых растворов. Подобные растворы, вероятно, содержат пяти-
валентный ванадий в виде катиона, как, например, УОг', УО’ ‘' и, воз-
можно, V’' ' ’ ‘.
Равновесие между ванадатами и солями ванадия иллюстрируется сле-
дующими уравнениями.
V2O7"" + 6Н- ДД2УОг' + ЗН2О;
2УО2- + 60 Н- V2O7"" + ЗН2О;
V2O7"" + ЮН’дД2У0‘ • • + 5Н»0;
V2O7"" + 14Н- ^?2У — • ’ + 7Н2О;
2V....+ 14ОН'^?У2О7'"' + 7Н2О.
В кислых растворах ванадий легко восстанавливается до синей соли
ванадила; такое превращение происходит медленно при стоянии или выпа-
ривании раствора в соляной кислоте.
Кроме приведенных ванадиевых соединений существует еще надвана-
Диевая кислота HVO4, образующаяся при действии перекиси водорода на
кислый раствор ванадата.
Реакция четырехвалентного и пятивалентного ванадия будут рассма-
триваться совместно; другие же соединения ванадия столь редко встре-
чаются в аналитической практике, что в описании их характерных реакций
нет необходимости.
Реакции мокрым путем
1. Хлористый аммоний- Если к раствору какой-либо вана-
диевокислой соли щелочного металла в присутствии1 аммиака
прибавить твердый хлористый аммоний, то выделяется бесцвет-
ная аммонийная соль метаванадиевой кислоты, трудно раствори-
мая в концентрированном растворе хлористого аммония:
NaiVeO? + 4NH1C1 -> 2NH4VO3 + 2NH3 + Н2О + 4NaCl.
2. Уксуснокислый свинец количественно осаждает ванадиевую
кислоту в виде желтого ванадата свинца:
ЗРЬ" +2VO4"'-> Pb3(VO4)2.
Так как этот осадок более растворим в разбавленной азотной кислоте,
чем; хромат свинца, то возможно отделение хромовой кислоты от вана-
диевой «кислоты путем обработки раствора этих двух кислот нитратом
свинца в разбавленном азотнокислом растворе. При надлежащих условиях
осаждается весь хром, за исключением дробной доли миллиграмма его,
628
между тем как 100 мг ванадия не осаждаются *. Ванадий может быть от-
крыт в фильтрате реакцией с перекисью водорода.
3. Аммиак, прибавленный на холоду к кислому раствору вана-
дата, содержащему немного ванадия в виде катионов, изменяет
зеленую окраску в желтую. После того как раствор нейтрализо-
ван, дальнейшего изменения не наблюдается, если раствор не
содержит других катионов, кроме щелочных металлов. В присут-
ствии же других катионов ион ванадиевой кислоты ведет себя
как фосфатный ион: от прибавления аммиака могут выпасть
ванадаты трехвалентного железа, алюминия, урана и бария.
NH1OH, прибавленный к соли диванадила, осаждает темносе-
рую гипованадиевую кислоту:
V2O2CI4 + 4NH4OH -> 4NH1C1 + V2O2(0H)4.
Осаждение не количественное, и .небольшие количества ванадия остаются
в растворе, если последний содержит только соль диванадила. Но в при-
сутствии избытка хлорного железа при прибавлении аммиака происходит
количественное осаждение ванадия. Это относится как к ванадиевой
кислоте, так и к соли диванадила; в первом случае выпадает ванадат
железа, во втором гипованадат.
Вместо хлорного железа для той же цели можно пользоваться солью
алюминия или урана.
4. Едкий иатр, прибавленный к кислому раствору пятивалентного вана-
дия, дает бурый осадок, растворимый в избытке осадителя, причем раствор
окрашивается в желтовато-зеленый цвет.
5. Сернистый аммоний не дает осадка, но окрашивает раствор
бурый цвет вследствие образования тиосоли.
Если сернистый водород пропускать в концентрированный аммиачный
раствор ванадата или гипованадата, то раствор сначала окрашивается в
желтовато-красный цвет, но затем, после насыщения сероводородом, раствор
приобретает характерный фиолетово-красный цвет. Этой реакции несколько
мешают - соли аммония, но влияние последних преодолевается избытком
аммиака. Красный цвет обусловливается, -поводимому, образованием тио-
ванадата аммония. Таким путем по появлению красного окрашивания можно
обнаружить 0,2 мг ванадия.
Прибавление кислоты к раствору, окрашенному в красный цвет, вызы-
вает появление черного осадка V2S4 или VaSs, Осаждение неколичествен-
ное; фильтрат окрашен всегда в синий цвет и содержит определяемые ко-
личества солей диванадила. Осадок растворим в едких, углекислых и сер-
нистых щелочах, причем раствор окрашивается в бурый цвет. Если сульфид
нагреть до 500-4500° в атмосфере H2S, то образуется черный V2S3, не
растворимый в концентрированной соляной кислоте. V2S3 растворяется
в царской водке с образованием ванадиевой кислоты, но при выпаривании
раствора с избытком НС1 образуется синяя соль диванадила.
Красная окраска вызывается также молибденом', если он не был пол-
ностью удален предшествовавшей обработкой сероводородом в кислом
растворе, и ® таком случае он маскирует вышеописанную реакцию на вана-
дий и может быть принят за последний.
Сернистый аммоний, прибавленный к кислому раствору пятивалентного
ванадия, осаждает бурый V2S5, который медленно растворяется в избытке
реактива.
1 Раствор точно нейтрализуют NaOH, прибавляют 2 мл HNOs (плот-
ность 1,20) и избыток 20%-ного раствора Pb(NOs)s,
629
6. Сернистый водород не осаждает сульфида из кислого
раствора ванадиевой кислоты. Он (подобно другим восстановите-
лям (SO2, НС1, муравьиная кислота, Fe”, щавелевая кислота,
винная кислота, этиловый спирт, сахар и т. п.) восстанавливает
ванадиевую кислоту до соли диванадила синего цвета. Реакция
протекает медленно на холоду, но более быстро при нагревании:
2H3VO4 + H2S + 4Н’ ->V2O2‘ •'' + 6Н2О + S;
2H3VO4 + 2Fe’ ' + 6Н‘ ^V2O2’' ’ ’ + 2Fe’ ’' + 6Н20;
2H3VO4 + HCOOH + 4Н' ->V2O2'' ’ ’ + СО2 + 6Н2О.
HJ производит дальнейшее восстановление до трехвалентного ванадия,
зеленого цвета:
HsVO4 + 2HJ + ЗНС1 -> VC13 + 4НгО + J2.
Зеленая окраска замечается по удалении иода кипячением.
Металлы, как цинк, алюминий, кадмий, восстанавливают ванадиевую
кислоту еще дальше, что узнается по цвету раствора, окраска которого
сначала синяя (соли ванадила), затем зеленая (трехвалентньГй ванадий) и,
наконец, фиолетовая (двухвалентный ванадий). Гидроокись аммония, доба-
вленная к полностью восстановленному раствору, дает коричневый, легко
окисляющийся осадок.
Реакции восстановления могут быть представлены следующими ура-
внениями:
V2O5 + Cd + 6Н' ->ЗН2О + Cd' ‘ + VsOs'"'
V2O2-'" + Cd +4Н' ->2H2O + Cd” +2V'”-
2V ’ ’ +Cd ->Cd" +2V '.
Если к раствору ванадия, восстановленного кадмием, прибавить раствор
фторида, то V'” образует с фтором комплексное соединение. Благодаря
изменению отношения концентраций [V’”]: [V'], происходящему при
этом и вызывающему относительное увеличение концентрации [V’’], вос-
становительная сила смеси V и V” повышается настолько, что метал-
лический Cd выделяется из раствора, т. е. течение реакции согласно выше-
приведенному уравнению направится справа налево.
7. Бикарбонат натрия не осаждает ванадия, но в присутствии
урана может выпасть двойная ванадиевокислая соль натрия и
уранила UCteNaVCU.
8. Перекись водорода. Если к кислому раствору ванадата при-
бавить несколько капель Н2О2 и взболтать, то раствор вследствие
образования надванадиевой кислоты HVO4 (или сульфата пере-
киси ванадия* 1) окрашивается в красновато-бурый цвет. HVCh
в эфире не растворяется. Эта реакция, проводимая в 2—6N
растворе HNO3 или H2SO4 и в отсутствие избытка Н20г2,
является очень чувствительной.
Реакция дает возможность открыть 2,5 т ванадия в капле раствора.
Для ее выполнения смешивают каплю исследуемого раствора в углублении
капельной пластинки или в микротигле с каплей 4N HaSOi. Спустя несколько
минут прибавляют 1—2 капли 1%-ной Н2О2. В присутствии ванадия появ-
ляется красноватая окраска.
‘Meyer u. Pawleta, Z. anal. Chem 69, 15 (1926).
1 Избыток Н2О2 вызывает частичное обесцвечивание. Ред.
630
9. Хлористый барий (но не хлористый стронций или кал^
ций), а также нитрат серебра выделяют желтые осадки, которУё
становятся белыми при стоянии или при нагревании.
10. Нитрат одновалентной ртути осаждает из нейтральных
растворов белый ванадат ртути(1); осадок растворим в азот-
ной кислоте.
11. Ферроцианид калия, прибавленный к кислому раствору
пятивалентного ванадия, дает зеленый, хлопьевидный осадок
ферроцианида ванадия. Осадок не растворим в 12%-ной H2SO4.
12. Соли уранила, 'Прибавленные к аммиачному или слабо-
кислому раствору, содержащему ацетат аммония, дают оса-
док ванадата ураниламмония (UO2)NHiVO4 • Н2О.
Посредством этой реакции ионы ванадата могут быть от-
делены от щелочных и щелочноземельных металлов и от ионов
марганца, цинка и меди. Осадок значительно более растворим,
чем1 фосфат ураниламмония (UO2)NH4PO4.
13. Окислители превращают диванадиловые соединения в ва-
надиевую кислоту. Окисление может быть произведено;
а) бромом в солянокислом растворе:
[V2O2] ’ ’ ‘' + Вг2 + 6НЮ 2VO4'" + 2Вг' + 12Н’;,
б) разбавленным перманганатом кадия в горячем, очень раз-
бавленном сернокислом растворе:
5[V2O2] • ’ ’ ' + 2МпО4 + 22НЮ -> IOVO4'" + 2Мп’ ‘ 44Н\
в) перекисью натрия в щелочном растворе:
[V2O2] ’ ’'' + Na^O'2 + 8ОН' 2VO4'" + 2Na’ + 4НаО.
Посредством этой реакции могут быть отделены хром, алюминий, вана-
дий, уран и цинк от железа, никеля, кобальта и марганца; хром остается в
растворе в виде хромата натрия NazCrCh, алюминий — в виде алюмината
натрия NaAlOs, ванадий—в виде ванадата натрия NasVO,, уран—в виде
надурановокислого натрия и цинк в виде цинката натрия NasZnOs, железо же
осаждается в ваде Ре(ОН)з, никель—тв виде Ni(OH)», кобальт—в виде
Co(OH)s, марганец в виде водной МпСЪ.
14. Хлорное железо и диметилглиоксим. Реакция:
V2O2' • •' + 2Fe1 ’ • + 4H2O^2HV0s + 2Fe ” + ЗН’
протекает в щелочном растворе слева направо, а в кислом растворе —•
справа налево согласно закону действия масс. Диметилглиоксимовая реак-
ция является чувствительной реакцией на двухвалентное железо. Так как
ванадиевая кислота « ванадаты легко восстанавливаются в соль ванадила
при нагревании с концентрированной соляной кислотой, то реакцию на
Fe’ ‘ посредством диметилглиоксима можно использовать для открытия
ванадия-
Выполнение. К капле исследуемого щелочного раствора в маленьком
тигле прибавляют 2 капли концентрированной НС1 и выпаривают почти
досуха. Остаток после выпаривания переносят на кусок фильтровальной
бумаги, прибавляют каплю 1%-ного раствора FeCh и 3 капли 1%-ного
спиртового раствора диметилглиоксима. При наличии 1 T ванадия появ-
ляется вишнево-красное или бурое окрашивание. Слепой опыт Должен
быть произведен с реактивами; другие восстановители должны отсутство-
631
вать. Нагревание с концентрированной соляной кислотой обыкновенно
Приводит к окончательному удалению восстановителей.
15. Оксии (8-гидроксихинолин; см. стр. 215) 1 реагирует с вана-
датами в присутствии уксусной кислоты с выделением желтого осадка
(C»HeNOH)2 • H2VЮн, который при нагревании переходит в (CsHeNOH^VsO»
густого темноаинего цвета. Подобные же реакции дают молибден, вольф-
рам и титан. Если пользоваться раствором, приготовленным путем спла-
вления или кипячения с NaaCOs, то молибденовая и вольфрамовая кислоты
могут быть отделены подкислением раствора уксусной кислотой с добавле-
нием раствора ацетата бария. Трехвалентное железо также дает бурый
осадок с реактивом и поэтому мешает реакции. Его можно удалить, при-
бавив немного концентрированного раствора едкого натра, после чего
отфильтровывают выделившийся осадок гидроокиси железа и подвергают
фильтрат испытанию на ванадий.
Выполнение. К нескольким каплям раствора в ^маленькой пробирке,
подкисленным несколькими каплями уксусной кислоты, прибавляют 1—
2 капли 2,5%-ного раствора оксина в 6%-ной уксусной кислоте. Раствор
взбалтывают с небольшим количеством хлороформа. Даже 0,1 т ванадия
окрашивает хлороформ в красный или буровато-фиолетовый цвет.
Ортованадаты и метаванадаты можно отличить следующими
реакциями.
16. Соли меди дают с метаванадатами синевато-зеленый поро-
шкообразный осадок, а с ортованадатами — осадок яблочно-
зелендго цвета.
17. Свинцовые соли образуют белый осадок с ортованадатами,
а серебряные соли — оранжево-красный осадок.
Реакции сухим путем
Перл буры, слабо насыщенный соединением ванадия, остается
бесцветным в окислительном пламени; при сильном насыщении
он окрашивается в желтый цвет, а в восстановительном пла-
мени — в зеленый.
ЗЕМЕЛЬНЫЕ КИСЛОТЫ
ВОЛЬФРАМ, ТАНТАЛ, НИОБИЙ
Эти три металла выделены в отдельную группу, потому что они при
действии кислот, обычно употребляемых в качестве растворителей, не
образуют растворимых в воде солей и поэтому не попадают вместе с дру-
гими металлами в раствор при систематическом ходе качественного анализа,
описанном в части IV этой книги.
В этом отношении они сходны с кремнием, который удаляется из
раствора в виде кремневой кислоты до осаждения аналитических групп.
Вольфрам, тантал и ниобий образуют кислотные ангидриды WCh,
Ta^Os, NbaOs, которые подобно кремневой кислоте реагируют с гидрооки-
сями щелочных металлов, образуя растворимые вольфраматы, танталаты и
•ниобаты. В противоположность кремневой кислоте они образуют ком-
плексные соединения с щавелевой, винной и с другими органическими
оксикислотами.
Из этих трех кислот вольфрамовая является довольно сильной кислотой,
образующей ясно выраженные устойчивые соли, подобные молибдатам,
1 М о n t е q u i, М. Gallego- Ап. Soc. espan. Fisica Quim. 32, 134
(1934); см.'также A. S. Ko ma rowsky u. N. S. Poluektoff, Chem.-
Zentr. (1934) I, 373 и Редкие металлы 2, № 4, 44 (1933).
632
между тем как танталовая и ниобиевая кислоты представляют собой очень
слабые кислоты (особенно первая), обнаруживая резкое сходство с сурь-
мяной кислотой.
Вольфрам W. Ат. в. 183,92. Ат. н. 74
Плотность 19,1. Т. пл. около 3400°
Нахождение в природе. Вольфрам не очень распространен в природе,
тем не менее известен целый ряд хорошо выкристаллизовывающихся воль-
фрамовых минералов, большею частью встречающихся в оловянных руд-
ных жилах и в происшедших из последних наносных россыпях. К мине-
ралам шеелитовой группы принадлежат: шеелит CaWOc шеелева медная
руда (Са, Cu)WO4, рейнит FeWCh, штольцит (шеелевасвинцовая руда) PbWOi.
Эти минералы кристаллизуются в квадратной системе и образуют с повелитом
СаМоОа и вульфенитом (желтой свинцовой рудой) РЬМоО< изоморфную
группу. Другую группу вольфраматов, кристаллизующихся в моноклини-
ческой системе, составляют гюбнерит MnWC>4, вольфрамит (Мп, Fe)WOj
и ферберит FeWCh. Важнейший из них — вольфрамит, содержащий боль-
шею частью небольшие количества кремневой, танталовой и ниобиевой
кислот.
Свойства. Вольфрам обладает наибольшим сходством со своим пред-
шественником в шестой группе периодической системы—с молибденом.
Таю например, они легко восстанавливаются до сильноокрашенных низ-
ших степеней окисления и склонны к образованию комплексных кислот.
Вольфрам образует два устойчивых окисла:
WO, и WO3
двуокись трехокись
вольфрама вольфрама
Двуокись вольфрама представляет собой бурый порошок, который
может быть легко получен путем восстановления WOs в токе водорода при
температуре темнокрасного каления. Она пирофорна, и прежде чем выста-
вить ее на воздух, необходимо ее охладить в токе водорода. При сильном
прокаливания в токе водорода WOs восстанавливается до серого порошко-
образного, не меняющегося иа воздухе металла. Такое свойство окиси
весьма важно для количественного определения вольфрама.
Трехокись вольфрама является кислотным ангидридом. Она получается
при прокаливании вольфрамовой кислоты и вольфрамовокислых солей
аммония и ртути(1), далее —- при окислении двуокиси вольфрама путем
прокаливания на воздухе, а также при прокаливании металла ' в. токе
кислорода.
Полученная таким образом трехокись представляет собой канареечно-
желтый порошок, растворяющийся в едких щелочах и аммиаке с образова-
нием вольфраматов (солей вольфрамовой кислоты). Легче удается раство-
рение путем предварительного сплавления с карбонатом натрия:
WOs + NasCOs -> NasWOi -f- COs.
При этом нормальный вольфрамат, соединяясь с трехокисью, образует
комплексные поливольфраматы.
При сплавлении с пиросернокислым калием трехокись превращается в
вольфрамовокислый калий:
WOs + Кг5гОт-> K2WO4 + 2SOs.
Вольфрам при обработке плава водой обыкновенно не переходит в
раствор, потому что плав содержит всегда наряду с вольфрамовокислым
калием избыток пиросернокислого калия; при растворении в воде послед-
ний разлагает вольфрамовокислую соль, выделяя не растворимую в воде
и кислотах вольфрамовую кислоту:
K2WO4 + KzSsCh + HsO -> 2K2SO4 + H2WO4.
633
В тех случаях, когда обрабатываемый водой плав не содержит пиро-
сернокислого калия в количестве, необходимом для вышеуказанного раз-
ложения, вольфрам переходит в раствор, но не количественно.
Если к воде прибавить немного' серной кислоты, вольфрам совсем не
растворяется. Этим свойством вольфрама пользуются для его отделения от
титана. Но если к воде прибавить углекислый аммоний, вся вольфрамовая
кислота переходит в раствор. Последним свойством пользуются для отде-
ления вольфрамовой кислоты' от кремневой.
При частичном восстановлении вольфраматов при нагревании обра-
зуются вольфрамовые бронзы, отличающиеся разнообразием оттенков
цветов между синим и желтым и совершенной нерастворимостью в кислотах.
Они могут быть переведены в растворимый вольфрамат путем прокали-
вания с кислым1 сернистокислым аммонием.
Если кипятить вольфрамовую кислоту с вольфраматом калия, то она
постепенно переходит в метавольфрамат (соль метавольфрамовой кислоты) *:
WOi" + 3WOs-> WtOu".
Минеральные кислоты не выделяют осадка в растворах метавольфра-
матов. Но если раствор долго кипятить с избытком кислоты, то раствори-
мая метавольфрамовая кислота постепенно переходит в обыкновенную
вольфрамовую кислоту, выпадающую из раствора:
HjWiOw :+ ЗНгО !H:WOi.
Спрессованные и уплотненные .палочки из металлического порошка пе-
реходят при прокаливании при температуре приблизительно 2500° в вытя-
нутые отдельные кристаллы с сохранением первоначальной формы пало-
чек или проволоки. Благодаря этому они при любой деформации оказы-
ваются весьма мягкими и эластичными.
Компактный металл весьма устойчив по отношению к царской водке
и концентрированной азотной кислоте. Для переведения его в раствор, не-
обходимо сначала окислить его в токе кислорода до WOe, которую затем
растворяют, как выше было указано.
При темнокрасном калении металл реагирует с хлором, воспламеняясь,
с образованием шестихлористого вольфрама WCle (т. пл- 275°, т. кип- 347°),
дающего черно-фиолетовый кристаллический возгон. При нагревании по-
следнего с водородом образуются хлориды более низких степеней окисле-
ния вольфрама.
При прокаливании металла с углем или СО образуются карбиды воль-
фрама, твердость которых подобна твердости алмаза.
Реакции мокрым путем
Следует употреблять раствор вольфрамовокислого натрия.
1. Минеральные кислоты HNOs. НС и HaSCh выделяют на
холоду белый аморфный осадок водной вольфрамовой кис-
лоты H2WO4 • НЮ. Винная кислота препятствует осаждению.
Промывание осажденной вольфрамовой кислоты необходимо
всегда производить водой, содержащей кислоту или какую-
нибудь соль, потому что в противном случае вольфрамовая кис-
лота пептизируется и проходит через фильтр.
Фосфорная кислота относится к вольфрамовокислым щело-
чам иначе, чем остальные минеральные кислоты; он дает бе-
лый осадок, растворяющийся в избытке реактива за счет обра-
зования легко растворимой комплексной соли фосфорноволь-
1 О составе метавольфрамовой кислоты см. Н. С о р a u х Z. anorg.
Chem. 74. 363 (1912).
634
фрамовой кислоты, например ЫазРСЦ- 12\¥0з, с которой выпол-
нимы те же реакции, какие дает аналогичная фосфорномолибде-
новая кислота.
2. Органические кислоты (лимонная, винная и др.) образуют
с вольфрамовой кислотой комплексные ионы и предотвращают
ее осаждение.
3. Нитрат ртути(1) осаждает из нейтрального раствора бе-
лый вольфрамат одновалентной ртути.
4. Уксуснокислый свинец, хлористый барий и азотнокислое
серебро осаждают из нейтрального раствора вольфраматы бе-
лого цвета.
5. Сернистый водород не дает никакого осадка в кислом
растворе.
6. Сернистый аммоний не дает осадка с раствором вольфра-
мата щелочного металла, но образует тиовольфраматы WS/'.
Если же раствор подкислить, то осаждается светлобурый
трехсернистый вольфрам WS3, дающий с водой коллоидные
растворы и совершенно не растворимый в соляной кислоте.
В (NH4)zS трехсернистый вольфрам WS3 снова растворяется,
образуя WS4".
7. Хлористое олово дает сначала желтый осадок, который
при прибавлении НС1 и при нагревании становится синим. Это
одна из наиболее чувствительных реакций на вольфрамовую
кислоту.
8. Олово. Если вольфрамат калия восстанавливать соляной
кислотой и оловом приблизительно при 50° до тех пор, пока
окраска, начиная от синего цвета, пройдя через фиолетовый и
красно-бурый цвета, не станет темножелто-зеленой, и затем на-
сытить хлористоводородным газом, то выкристаллизовывается
желто-бурая соль [W?Ch]K3 с трехвалентным вольфрамом. Ана-
логичная рубидиевая соль зелено-желтого, а цезиевая соль жел-
того цвета.
9. Цинк. Если к раствору вольфрамата щелочного металла
прибавить НС1 и цинк, то осажденная соляной кислотой воль-
фрамовая кислота тотчас окрашивается в красивый синий цвет,
вызываемый образованием промежуточной окиси WCI51.
10. Сульфат двухвалентного железа дает желтовато-бурый
осадок, который при подкислении не становится синим (отли-
чие от молибдена).
11. Ферроцианид калия с небольшим количеством кислоты
дает буровато-красный раствор и осадок того же цвета.
Реакции сухим путем
Перл фосфорной соли остается бесцветным в окислительном
пламени, в восстановительном же пламени перл окрашивается
в синий цвет и становится кровавокрасным от прибавления
небольшого количества FeSOi.
1 Образующийся вначале осадок снова растворяется в концентрирован-
ной соляной кислоте, после чего восстановление цинком идет дальше, при-
чем раствор становится сначала синим, затем зеленым и, наконец, бурым.
635
Тантал Та. Ат. в. 180,88. Ат. н. 73
Плотность 16,6. Т. пл. 2800°
Ниобий Nb. Ат. в. 92.91. Ат. н. 41
Плотность 7,37. T. пл. 1950°
Эти два редких элемента принадлежат к пятой группе периодической
системы и в соответствии с этим образуют пятиокиси общей формулы RsOs,
являющиеся ангидридами танталовой и ниобиевой кислот, называемых «зе-
мельными кислотами». Оба элемента не только всегда встречаются сов-
местно в минералах, но за весьма малыми исключениями, дают одни и те
же химические реакции; (поэтому отделение их друг от друга может быть
выполнено только путем фракционирования. Отделение их от других эле-
ментов усложняется тем обстоятельством, что они в противоположность
большинству металлов не образуют простых растворимых в воде солей и
поэтому для растворения их приходится превращать в комплексные соеди-
нения.
Нахождение в природе. Наиболее часто встречающимся минералом
является ниобит (или колумбит), соединение гипотетической ниобиевой кис-
лоты HNbOa с закисью железа: Fe(NbOa)2 или FeO-NbaOs. Тантал всегда
присутствует в нем, замещая часть ниобия, между тем как марганец заме-
щает часть железа. Поэтому общая формула минерала следующая: (Fe,
Mn)O-;(Nb, Та)?О.з. С увеличением содержания тантала (повышается удельный
вес минерала от 5 до 7 и выше, и иногда минерал называется танталитом.
Он считается редким и ценным минералом-
Земельные кислоты, кроме того, встречаются в целом ряде редких ми-
нералов, образуя соединения с окисями титана, тория, урана и иттриевыми
земельными металлами, как. например, в иттротанталите, самарските, фер-
гюссните и эвксените. Танталовая кислота найдена также в монаците
(Се, La, Nd, Pr)POj, в котором она частично замещает фосфорную кислоту.
Свойства. Так как тантал и ниобий всегда сопутствуют друг другу
и чрезвычайно сходны между собой, то изучение их значительно облег-
чается при их совместном рассмотрении.
а) Тантал представляет собой белый, твердый, ковкий и тягучий ме-
талл, не изменяющийся на воздухе при обыкновенной температуре; на
него не действуют кислоты; за исключением фтористоводородной. Он рас-
творяется в смеси плавиковой и азотной кислот с образованием, вероятно,
HaTaF? или H.TaFsO, дающих при гидролизе TaeOs. При высокой темпера-
туре он легко соединяется с кислородом, водородом н азотом, образуя
соответственно пятиокись, гидрид и нитрид тантала.
Ниобий по своим химическим свойствам очень сходен с танталом.
б) Пятиокиси обоих элементов представляют собой белые порошки.
Танталовая кислота при прокаливании остается белой, ниобиевая же кис-
лота при прокаливании становится желтой и принимает первоначальный
цвет при охлаждении. Окиси растворяются в расплавленном бисульфате
щелочного металла. При выщелачивании плава водой остаются гидрати-
рованные земельные кислоты в виде нерастворимого белого осадка, кото-
рый удерживает неопределенное количество адсорбированной серной кис-
лоты. Бисульфатный плав растворяется в оксалате или тартрате аммония.
в) Пятиокиси растворяются в расплавленном карбонате калия с выде-
лением двуокиси углерода и с образованием растворимых в воде танталата
и ниобата калия KsTaeOi» и KsNbeOi». Эти соли известны под названием
«гексасолей», но так как это название может ввести в заблуждение, их
иногда обозначают как 4 : 3-соли, обозначая этим отношение КЮ к TasOs
илн NbaOs в молекуле. Таким образом, KsTaeOi» можно представлять в веде
4 КаО • ЗТааО-,. Если раствор калиевых солей насытить твердым хлоридом
или нитратом натрия, то выделяются белые кристаллические осадки, имею-
щие состав 4NaaO • ЗТагОз н 7NaaO • 6Nb2Oo. Невидимому 4 : 3-натрий-ниобат
не существует.
636
г) При подкислении растворов танталата или ниобата щелочного ме-
талла уксусной или минеральной кислотой выделяются гидратированные
земельные кислоты в виде белых хлопьевидных осадков. Этим гидратиро-
ванным кислотам нельзя приписать определенной формулы: они состоят из
пятиокисей, соединенных с меняющимся количеством воды. При прокали-
вании они дают безводные пятиокиси. Они растворимы в фтористоводо-
родной, а также и в фосфорной кислотах. Фосфорнокислый раствор ниоби-
евой кислоты восстанавливается до окрашенного низшего окисла, тантало-
вая же кислота такому восстановлению ,не подвергается.
д) Осажденные земельные кислоты способны адсорбировать дубильную
кислоту (таннин). Если раствор этого реактива прибавить к суспензии оса-
жденной земельной кислоты, то образование комплексного адсорбционного
соединения узнается по изменению цвета: осадок танталовой кислоты при-
обретает бледножелтую окраску, а ниобиевой — оранжево-красный. Таннин
является наиболее важным реактивом как для качественного 'Открытия, так
и для количественного определения земельных кислот.
Адсорбционные комплексные соединения земельных кислот с танинном
получаются также при действии последнего на растворы щавелевокислых
ими виннокислых комплексных соединений тантала' и .ниобия. Танталовый
осадок имеет красивую окраску цвета серы (а не светлобурую, как указано
в некоторых руководствах); всякая другая окраска указывает на примеси
(титан, железо); ниобиевый осадок более объемист, чем предыдущий, и от.
личается своей яркой алой окраской.
е) Виннокислые комплексы земельных кислот не осаждаются аммиаком,
но кипячение с большим избытком соляной или азотной кислоты вызывает
почти количественное осаждение гидратированных земельных кислот. Ща-
велевокислые же комплексы1 последних, напротив, осаждаются аммиаком и
не полностью—'минеральными кислотами.
ж) Надтанталовая и надниобиевая кислоты образуются при действии
иа бисульфатный плав (стр. 636, б) смеси перекиси водорода и разбавлен-
ной серной кислоты. Плав растворяется с образованием бесцветной жид-
кости (отличие от титана).
з) Пятифтористые тантал и ниобий образуют с фторидом калия кри-
сталлические двойные соли. До аналитического применения таннина этим
пользовались в качестве единственного главного, хотя далеко' несовершен-
ного, метода в анализе земельных кислот для отделения тантала от ниобия.
При выпаривании раствора фтористого тантала с надлежащим количеством
фтористопо калия выпадает фторотанталат калия KaTaF? в виде трудно
растворимых красивых белых игл. Соответствующее ниобиевое соединение
значительно более растворимо; при небольшой кислотности раствора двой-
ная соль подвергается гидролизу с образованием1 легко растворимой фтор-
окиси ниобата:
KsNbF? + 2Н?О KaNbOFs • Н»О + 2HF.
Фторониобат калия, выделенный из концентрированных растворов в
виде пластинчатых кристаллов, растворяется в 12—13 ч. воды. Фторотанта-
лат калия растворим приблизительно в 200 ч. воды при 15°.
Реакции мокрым путем
Общие реакции на тантал и ниобий
1. Кислоты. Сплавляют растертый в порошок минерал или
окись (0,1 г) с карбонатом калия (1 г) в платиновом тигле на
горелке Мекера (при отсутствии последней можно пользоваться
паяльной горелкой. Ред.) и растворяют плав в 5 и LV едкого
кали. Раствор, отфильтрованный в случае надобности, дает
с .минеральными кислотами белый хлопьевидный осадок, не
растворимый в избытке осадителя, но легко растворимый в фто-
637
ристоводородной кислоте. Эта реакция неспецифична, так как
ее дают некоторые другие металлические кислоты, как .воль-
фрамовая, оловянная и сурьмяная кислоты (см., однако, реак-
ции 4 и 7).
2. Фтористый калий. Если на раствор осадка земельных
кислот в плавиковой кислоте (реакция 1) подействовать 0,1 г
фторида калия (или карбоната, реагирующего с имеющимся
в растворе избытком фтористоводородной кислоты) в малень-
кой платиновой или золотой чашке, выпарить до начала выде-
ления кристаллов и затем охладить, то образуется кристалличе-
ский бесцветный осадок фторотанталата калия КгТаР?. Осадок
может быть высушен между кусочками фильтровальной бумаги;
под сильной лупой или под микроскопом можно увидеть игло-
образные ромбические призмы.
Эта реакция не очень чувствительна, и поэтому она не при-
годна для открытия малых количеств тантала. Ниобий при
вышеуказанных условиях не реагирует, потому что двойная фто-
ристая соль остается растворенной в маточном растворе.
3. Хлорид натрия. Щелочной раствор, приготовленный как
указано в реакции 1, при насыщении твердым1 хлоридом натрия
дает белый кристаллический осадок:
KsTaeOis + 8NaCl -> Na8Ta6O19 + 8КС1;
2KsNb80i9 + 14NaCI + НЮ NauNbiiOb + 14KCI + 2KOH.
Эта реакция специфична для земельных кислот, но следует
помнить, что сурьмяная кислота дает аналогичный осадок.
Однако сурьмянокислый натрий при действии на его соляно-
кислый или виннокислый раствор сернистого водорода выделяет
оранжево-красный сульфид сурьмы, в виннокислом же растворе
земельных кислот сернистый водород не дает никакого осадка.
4. Раствор таннина. а) К суспензии белого хлопьевидного
осадка земельных кислот, полученного в реакции 1, прибавляют
5 мл 2%-ного свежеприготовленного раствора таннина. Осадок
окрашивается в бледножелтый цвет.
б) Растворяют бисульфатный плав (см. «Свойства», б) при
нагревании в 50 мл насыщенного раствора оксалата аммония и
к полученному раствору прибавляют раствор таннина как в реак-
ции «а». Образуется хлопьевидный осадок цвета серы или же
раствор того же цвета. В случае образования последнего при-
бавляют к кипящему раствору по’ каплям 0,5W аммиак до выде-
ления хлопьевидного осадка с вышеуказанной окраской.
5. Гидролиз в винной кислоте С Порошок минерала или
окись (0,1 г) сплавляют в кварцевом тигле с бисульфатом калия
(2 г), плав растворяют в горячем растворе винной кислоты (3 г
в 10 мл воды); вместо винной кислоты можно применять рас-
твор се аммонийной соли. Полученный раствор (если нужно
профильтрованный) кипятят с концентрированной соляной кис-
лотой, взятой в количестве */з имеющегося раствора. Появле-
1 Scheier, Analyst 54, 456 (1S29).
638
ние белого хлопьевидного осадка, выделяющегося сразу или
спустя некоторое время, служит указанием на присутствие зе-
мельных кислот.
Эта реакция опецифична для тантала и ниобия. При указан-
ных условиях осаждается также и вольфрамовая кислота, но
осадок желтого цвета и получается только в концентрирован-
ном растворе, кроме того осаждение неполное. Титан при этих
условиях не реагирует; если в исследуемом материале превали-
рует цирконий, материал должен быть сначала подвергнут обра-
ботке пиросульфатом и таннином (реакция 7, стр. 595); получен-
ный при этой операции осадок прокаливают, сплавляют с би-
сульфатом и подвергают гидролитическому разложению в вин-
ной кислоте.
Специфические реакции на ниобий
6. Раствор таннина. а) Суспензию белого хлопьевидного
осадка, выделенного в реакции 1, подвергают действию тан-
нина', как указано в реакции 4. Осадок окрашивается в оран-
жево-красный цвет.
б) Обрабатывают горячий оксалатный раствор бисульфатного
плава, как описано в реакции 4,6. При нейтрализации 0,5М
аммиаком или избытком раствора ацетата аммония образуется
объемистый хлопьевидный осадок цвета киновари.
Эта реакция не является абсолютно специфичной для нио-
бия, потому что двуокись титана после сплавления с бисуль-
фатом щелочного металла, растворения в оксалате аммония и
нейтрализации образует почти идентичный осадок. Но окись
титана не дает реакций 1 и 6, не растворяется в расплавленном
карбонате калия и не дает красного осадка с таннином в рас-
творе, содержащем свободную минеральную кислоту, т. е. не
дает всего того, что характерно для ниобия. Кроме того, титан
в растворе оксалата интенсивно окрашивается перекисью водо-
рода в желтый или оранжевый цвет, между тем как соответ-
ствующий раствор ниобия остается бесцветным.
7. Циик в присутствии кислоты, а) Водную вытяжку из плава,
полученного при оплавлении с карбонатом калия (реакция 1),
подкисляют 7 мл концентрированной серной кислоты и раствор
выпаривают до тех пор, пока осажденные земельные кислоты
вновь не растворятся; затем по разбавлении 15 мл воды жид-
кость кипятят с 1 г цинковой пыли; раствор в присутствии нио-
бия (в зависимости от его количества) окрашивается в бурый
или чернильночерный цвет Ч
б) Осадок земельных кислот растворяют в платиновой чашке
в небольшом количестве плавиковой кислоты; прибавляют к рас-
твору немного серной кислоты и смесь нагревают до выделения
густых паров серного ангидрида; после охлаждения раствора
прибавляют к нему небольшие количества соляной кислоты и
цинка; появление синей окраски, обусловленной образованием
Giles, Chem. News; 95, 1 (1907).
639
NbClg, указывает на присутствие ниобия. Если восстанавливаемый
раствор- с плавиковой кислотой пропустить, пользуясь редукто-
ром Джонса, через амальгаму цинка и собрать в раствор хлорной
ртути, то происходит образование белого осадка хлористой
ртути.
Одновременное открытие ниобия и тантала
Описываемое здесь испытание основывается на том факте,
что танталовая кислота значительно легче осаждается таннином,
чем ниобиевая кислота \
8. В отсутствие дитана. Сплавляют смесь окисей (от 0,05 до
0,2 г) с бисульфатом калия и плав растворяют при кипячении
в 50 мл раствора оксалата аммония (как в реакциях 5 и 6). Не-
большое количество раствора подвергают испытанию перекисью
водорода, чтобы убедиться в отсутствии титана. К оставшемуся
раствору прибавляют 0,2—0,3 г таннина и затем* 1 по каплям 0,5N
аммиак до выделения хлопьевидного осадка. Окраска послед-
него в бледно- или яркожелтый цвет служит указанием на при-
сутствие тантала; появление окраски от оранжевого до крас-
ного цвета указывает на наличие ниобия, причем тантал либо-
совсем отсутствует, либо находится в очень малых количествах.
При окраске от оранжевого до красного цвета осадок отфиль-
тровывают, промывают водой, переносят обратно в первоначаль-
ный сосуд, кипятят с 25 мл насыщенного раствора оксалата ам-
мония и растворяют его, постепенно приливая серную кислоту.
После прояснения раствора прибавляют 0,1—0,2 г таннина, про-
должают кипятить и прибавляют по каплям 0,5^ аммиак до
тех пор, пока осадок снова не выпадет. Он будет теперь жел-
тым, если количество имеющейся в нем танталовой кислоты не
слишком мало. При появлении же снова оранжевой окраски
осадка последний должен быть отфильтрован, и вышеуказан-
ная обработка его должна быть повторена. Применяя такого
рода очистку, можно открыть и определить следы тантала
в ниобиевой кислоте 2.
В присутствии большого количества тантала ниобий может
быть легко открыт в фильтрате от желтого осадка, образован-
ного таннином. Жидкость кипятят, прибавляют большее ко-
личество таннина и избыток ацетата аммония; ниобий оса-
ждается при этом в виде красного адсорбционного таннинового
комплекса.
9- В присутствии титана. Сплавляют смесь окисей с бисуль-
фатом калия в кварцевом тигле и выщелачивают плав 1%-ным
раствором таннина в 5%-ной серной кислоте, как указано на
стр. 595 (реакция 7). Осадок после выщелачивания промывают
2%-ной серной кислотой, прокаливают, снова сплавляют с би-
1 Powell a. Schoeller, Analyst 50, 494 (1925).
1 Описание этого хода анализа см- Analyst 50, 496 (1925). Исследования
Schoeller, Powell и их сотрудников по химическому анализу тан-
тала и ниобия изложены в Analyst т. т. 47, 49 и след.
640
сульфатом и растворяют плав в горячем концентрирован-
ном растворе винной кислоты. Полученный раствор кипятят
с концентрированной соляной кислотой, взятой в количестве */з
имеющегося раствора (реакция 5). Это осаждение, служащее
между прочим для подтверждения реакции на земельные кис-
лоты, имеет целью добавочную очистку от титана. Осадок, вы-
деленный гидролизом, промывают, прокаливают и обрабатывают
его по реакции 8.
Реакции сухим путем
Перл фосфорной соли окрашивается в восстановительном
пламени в синий, фиолетовый или бурый цвет в зависимости
от количества ниобиевой кислоты; от прибавления сульфата
железа(2) перл становится красным. Окись тантала при указан-
ных условиях не окрашивает перла фосфорной соли. Окиси
тантала и ниобия совершенно неплавки.
ГРУППА IV. ГРУППА ЩЕЛОЧНЫХ ЗЕМЕЛЬ
Радий Ra. Ат. в. 226,05. Ат. н. 88
Радий по своим реакциям весьма сходен с бариемс Так как важное
значение радия обуславливается его 'физическими свойствами и для от-
крытия весьма малых количеств его служат физические методы, то иден-
тификация этого элемента является делом скорее физика, чем химика»
ГРУППА V. ГРУППА ЩЕЛОЧНЫХ МЕТАЛЛОВ
ЦЕЗИЙ, РУБИДИЙ, ЛИТИЙ
Цезий Cs. Ат. в. 132,91. Ат. н. 55
Плотность 1,87. Т. пл. 26,5°. Т. кип. 670°
Нахождение в природе. Цезий и рубидий, строго говоря, не являются
редкими элементами, потому что они находятся почти всюду, но всегда
в очень малых количествах. Так, цезий замещает калий во многих шпатах
и слюдах и его находят во многих горных породах, содержащих эти ми-
нералы, равно как и в минеральных .водах источников, вытекающих из них.
Цезий и рубидий были открыты в 1860 г. Бунзеном и Кирхгофом в маточ-
ном рассоле одного минерального источника (в Дюркгейме).
Встречающийся на Эльбе, родственный лейциту, кристаллизующийся в
правильной I системе минерал поллуцит (поллукс) является типичным цезие-
вым минералом состава HsCsdAl/SiOsle.
Свойства. Цезий представляет собой серебристобелый, тягучий мяг-
кий металл. Выставленный на воздух, он плавится и в конце концов
воспламеняется, сгорая красновато-фиолетовым пламенем. Он воспламе-
няется также, будучи брошен в воду. Из всех металлов цезий наиболее
электроположителен.
По всем своим реакциям цезий и рубидий обнаруживают почти пол-
ное сходство с калием. Главное различие между этими тремя элементами
состоит в различной растворимости их соответственных солей.
Карбонат цезия в противоположность карбонатам других щелочных
металлов растворяется в спирте.
41 Зак. 98Й. Тредвел.т-Голл, т. I.
641
Реакции мокрым путем
Следует употреблять раствор хлористого цезия.
1. Платинохлористоводородная кислота дает желтый кристал-
лический осадок Cs2[PtCl»] более светлого цвета, чем соответ-
ственное соединение калия, и значительно труднее его раствори-
мый в воде. 100 ч- воды растворяют при 0° 0,024, а при 100°
0,377 ч. соли.
2. Винная кислота образует, как и с солями калия и рубидия,’
белую кристаллическую соль CsHC^Oe. 100 ч. воды раство-
ряют при 25° 9,7 ч. соли, при 100° 97,1 ч.
3. Раствор хлорного олова в концентрированной НС1 вы-
деляет из концентрированных растворов белый осадок
CsafSnCU] (правильные октаэдры). Соли аммония дают ту же
реакцию, соли калия и рубидия не дают.
4. Железосинеродистый свинец. Смесь насыщенных на хо-
лоду растворов железосинеродистого калия и уксуснокислого
свинца даете солями цезия (лучше всего — нитрата цезия) хо-
рошо кристаллизующийся оранжево-красный осадок состава
Css[Fe(CN)6] • РЬ(СНзСОО)2, образующий типичные четырехуголы
ные листочки. (Наблюдение производить под микроскопом.)
Осадок, промытый спиртом, довольно легко растворяется
в теплой воде. Все остальные щелочные металлы, а также И
рубидий не дают никакого осадка.
5. Треххлористая сурьма (раствор в 6У соляной кислоте)'
осаждает белый хлорантимонит цезия:
3Cs’ -hSbCle"' ->Cs3SbCl6.
При добавлении 10 капель реактива (137 г SbCl3 в 100 мл
6N НС1) к 3 мл раствора Rb- и Cs-ионов в 6У НС1 весь Cs за
исключением 5 мг будет осажден, между тем как по меньшей
мере 100 мг Rb останутся в растворе.
6. Нитрат висмута и нитрит натрия осаждают желтый тройной
нитрит:
Bi’ • • + Na’ '+ 2Cs' + 6NO2' ->Cs2NaBi(NO2)6.
Осаждение лучше всего производить из очень малого объема раствора
цезиевой соли, к которому прибавляют Ув по объему 47V раствора Bi(NO»)>
в &N уксусной кислоте. Смеси дают постоять по меньшей мере 15 мин. в
ледяной воде. Таким путем может быть отделен 1 мг цезия или рубидия от
10 мг калия.
7. Кремневольфрамовая кислота HsSiOe>12WO3 осаждает бе-
лый Cs8SiWi2O42. Уже 0,5 мг Cs в присутствии 8 мг Rb дают оса-
док, рубидий же остается в растворе.. Этой реакции не мешают?
другие щелочные или щелочноземельные металлы.
8. Нитрокобальти(3)ат натрия Nae[Co(NO2)6] осаждает жел-
тый Cs2Na[Co(NC2)e]. Как этот осадок, так и осадки соответ-
ствующих соединений Rb и К значительно менее растворимы
в воде, чем перхлораты. При слабом прокаливании их полу-
642
чается смесь нерастворимого ОозСЬ и легко растворимого ни-
трита щелочного металла
3Cs2Na[CO(NO2)»]->6CsNO2 + 3NaNOa +
-f- СО3О4 4NO -f- 5NOa.
CH3
9. 6-хлор-5-нитротолуолметасульфонат натрия Cl^\
NOgl^-^JsOgNa
осаждает белый хлорнитротолуолметасульфойат цезия. Этот
осадок значительно более растворим, чем осадок сответствую-
щей рубидиевой соли.
10- Хлорсвинцовая кислота FLPbCle осаждает CsaPbCle.
Этот реактив получают при пропускании хлора в насыщенный раствор
PbCh в концентрированной НС1. При действии на сухой хлорид цезия 4 мл
концентрированной соляной кислоты и 2 мл реактива практически осаж-
дается весь цезий и рубидий в присутствии 50 мг калия, которые остаются
в растворе. Прежде чем висмутоиитритный метод приобрел свое значение,
применение хлорсвинцовой кислоты представляло собой лучший способ от-
деления калия от рубидия и цезия.
* Добавление редактора. 11. Двойная соль иодидов натрия и се-
ребра служит специфическим1 реактивом на цезий Ч К испытуе-
мому раствору хлоридов щелочных металлов прибавляют каплю
реактива (5 г AgNOs в 20 мл воды -с добавлением, 20—21 r NaJ)
и затем каплю 96%-кого спирта. Образуется желтовато-бе-
лый осадок из тонких игл. Rb, К и Li при этих условиях осадка
не дают. Таким путем можно открыть 1,3 у C's в 0,01 мл (пре-
дельная концентрация 1 : 7700). * А. К.
Реакции сухим путем
Фиолетово-розовое окрашивание пламени почти такое же,
как у калия.
Пламенный спектр. Интенсивно синяя двойная линия (455,5 и 459,3 тр).
При более высокой температуре появляется ряд слабых линий второсте-
пенного значения: в красной части спектра 697,3 и 672,3 тр., в оранжево-
желтой 621,3 и 601 тр. и в зеленой 566,4 и 563,5 тр.
Рубидий. Ат. в. 85,48. Ат. н. 37
Плотность 1,52. Т. пл. 38°. Т. кип- 700°
Нахождение в природе. Рубидий является почти постоянным спутником
цезия и поэтому встречается во многих Минеральных источниках; далее, в
стассфуртском карналите, в трифилине [(Fe, Мп) (Li, Cs, Rb)POi], в лепи-
долите (Li, К. Na)2AL(F. OHlSisOe2. Рубидий находится также в трифане
(сподумене) (Li, Na)AI(SiOs)2 — минерале пироксеновой группы. Типичного
рубидиевого минерала, насколько известно, нет.
Рубидиевые соли были найдены в красной свекле.
1 Н. Graverstein, Mikrochemie, Emich. Festschrift, 135 (1935).
2 Роценский лепидолит особенно богат рубидием: в нем находится
около 0,54% Rb и 0,0014% Cs.
41*
643
По своей растворимости соли рубидия занимают среднее положение
между солями калия и 'цезия. В отдельных случаях растворимость рубидие-
вых солей оказывается наименьшей, например растворимость хлорнокислого
рубидия.
Реакции мокрым путем
1. Платинохлористоводородная кислота выделяет, как и из
растворов цезиевых и калиевых солей, желтый кристаллический
RbafPtCle], труднее растворяющийся, чем калиевая соль, и легче,
чем цезиевая. При 0° растворяются в 100 ч. воды 0,134, а при
100° 0,634 ч. соли.
2. Хлорное олово (раствор,в концентрированной НС1) выделяет
только из очень концентрированного раствора белый осадок.
Эта соль легче растворима, чем соответственная соль цезия; тем
не менее эта реакция не пригодна для отделения этих двух
металлов друг от друга Ч
3. Винная кислота выделяет только из очень концентрирован-
ного раствора осадок RbHCiHiOe. При 25° 100 ч. воды раство-
ряют 1,18 ч„ а при 100° — 94,1 ч. соли. Соответственная соль
цезия наиболее легко, а соль калия — наиболее трудно раство-
ряются.
4- Нитрат висмута и нитрит натрия осаждают желтую тройную
соль азотистой кислоты:
ВГ ‘ + 2Rb' + 6NO2' + Na’ -> Rb2NaBi(NO2)6.
5. Хлористая сурьма, нитрокобальти(3)ат натрия, кремневольфрамовая
кислота, хлорсвинцовая кислота и 6-хлор-5-нитротолуолметасульфонат
натрия осаждают соли рубидия, как и соли цезия (см. выше). Полное раз-
деление рубидия и цезия невозможно при однократном осаждении какимь
либо из указанных реактивов. Гидротартрат и хлорнитротолуолметасульфо-
нат рубидия значительно менее растворимы, чем соответствующие соедине-
ния цезия, между тем как хлор антимонит и силиковольфрамат цезия менее
растворимы, чем соответствующие соли рубидия. При действии на концен-
трированные растворы щелочных солей HsSbCJe прежде всего осаждается
весь Cs за исключением 5 мг и не менее 100 мг Rb остаются в растворе.
После удаления CssSbCle, раствор может быть испытан «а рубидий
посредством гидротартрата натрия или, еще лучше, посредством хлорни-
тротолуолсульфоната натрия, причем небольшое количество цезия, оставше-
гося в растворе, не будет мешать этой реакции.
Реакции сухим путем
Окрашивание пламени такое же, как и у цезия.
Пламенный спектр. Фиолетовая двойная линия 420,2 и 421,5 тр, да-
лее— красная двойная линия 781,1 и 795,0 тр.. При высокой температуре
получают непрерывный спектр от желтой до синей части спектра, в ко-
тором можно видеть следующие более слабые линии второстепенного зна-
чения: в оранжево-желтой части 629,8; 626,1; 620,6; 617,1 тр; желто-зеле-
ной 572,4; 564,8 и в зеленой 543,5; 536.5 и 527,0 тр.
1 Stolba (Z. anal. Chem. 12, 440) рекомендует эту реакцию для разде-
ления рубидия и цезия, но Godeffroy (В. 7, 375) и С о s s a (Z. anal.
Chem. 17, 350) получили лучшие результаты с сурьмянистохдористоводород-
ной кислотой.
644
Отделение калия и рубидия от цезия
Метода Столба (Stolba)
К концентрированному раствору щелочных солей прибавляют раствор
треххлористой сурьмы в концентрированной соляной кислоте, который
быстро осаждает хлорантимоиит цезия. Фильтруют и промывают концен-
трированной соляной кислотой. Применять следует плотный фильтр.
Литий Li. Ат. в. 6,94. Ат. н. 3
Плотность 0,534. Т. пл. 186°. Т. кип. 1400°
Нахождение в природе. Литий значительно более распространен в при-
роде, чем цезий и рубидий: в трифилине (Fe, Mn)(Li, Cs, Rb)POi; в пета-
лите Al(Li, Na., HISidHio, называемом также кастором, встречающемся на
Эльбе минерале из группы полевых шпатов, затем в трифане (сподумене)
Al(Li, Na)(SiOs)2, амблигоните Li(Al, F)POi асимметрической системы, далее,
в лепидолите, во многих турмалинах, мусковитах, а также в эпидоте и
ортоклазе, поэтому и во многих минеральных источниках. Количество'|лития
в некоторых из них доходит до 36 лг/л.
Свойства. Литий является самым легким металлом; он плавает в нефти.
На воздухе он быстро окисляется и разлагает воду при обыкновенной тем-
пературе, образуя LiOH, медленно растворяющийся в воде; раствор пока-
зывает сильнощелочную реакцию и с жадностью притягивает из воздуха
углекислый газ, образуя в воде трудно растворимый карбонат LiaCOs.
Сплав РЬ — Са — Li применяется в качестве металла для подшипников,
a Al—Li («склерон»); — как заменитель латуни. Соединения,ми лития поль-
зуются в медицине и пиротехнике; они также находят некоторое примене-
ние в производстве стекла.
Безводный хлористый литий растворяется в смеси этилового спирта
с эфиром, а также в амиловом спирте (отличие от остальных металлов
этой группы).
Реакции мокрым путем
Следует употреблять раствор хлористого лития.
1. Платинохлористоводородная кислота не образует осадка.
2. Винная кислота не образует осадка.
3. Фосфорнокислый натрий выделяет из умеренно концентри-
рованного щелочного раствора белый осадок трехметаллической
литиевой соли фосфорной кислоты:
НРОГ + ЗУ + ОН'-> LiaPOi + Н2О.
Если к сухой щелочной соли прибавить 3 ял 95%-ного спирта,
2 капли концентрированного аммиака 1 (отфильтровав, если нужно), приба-
вить еще 3 мл аммиака и немного реактивного раствора NaaHPOi, то оса-
док фосфата лития получается даже при наличии 0,1 мг Li2. Прибавление
большого количества спирта сопряжено с опасностью осаждения NaaNHiPOi.
Фосфат лития в противоположность фосфату магния и щелочных земель
легко плавится.
4. Углекислый аммоний и аммиак при нагревании с концен-
трированным раствором лития выделяют углекислый литий L12CO3
в виде белого порошка. Эта соль в противоположность всем
1 Для осаждения элементов предыдущих групп, могущих быть в
растворе.
2 Перед прибавлением NaaHPOi раствор следует нагреть до 35—40°. Ред.
645
остальным углекислым щелочам трудно растворяется в воде:
100 ч. воды растворяют при 15° 1,31 ч. ГЛгСОз. В присутствии
большого количества хлоридов щелочных металлов или хлори-
стого аммония осадок не образуется.
5. Фтористый аммоний в аммиачном растворе медленно оса-
ждает белый студенистый фтористый литий:
21л’ Н-Fa" ->Li2F2.
Для растворения 1 г осадка требуется 3500 мл воды; то же
самое количество1 фтористого натрия растворяется в 70 мл воды,
а растворимость других фтористых щелочей еще большая. По-
этому Карно (Carnot)1 пользуется этой реакцией для отделе-
ния лития от других щелочных металлов. Реактив должен быть
чист и не содержать кремнефтористого аммония.
Для открытия небольших количеств лития раствор выпаривают с фто-
ристоводородной кислотой на водяной баке ,в платиновом тигле и обраба-
тывают остаток небольшим количеством аммиака.
* Добавление редактора. 6- Диоксан (диэтилендиоксид). Раство-
римость хлорида лития и полная нерастворимость хлоридов
натрия и калия в диоксане по А. Синка (Sinka) дает возможность
количественного отделения лития от натрия и калия путем экстра-
гирования прокаленных хлоридов отогнанным над металлическим
натрием диоксаном. Отделение настолько полное, что в экстракте
натрий не может быть обнаружен по окрашиванию пламени2.
Реакции сухим путем
Чистые соли лития окрашивают несветящееся пламя газовой
горелки в красивый карминовокрасный цвет. В присутствии
Таблица 22
Растворимость некоторых щелочных солей
(р. — растворим; в. р.— весьма растворим; л. р. — легко растворим;
н. р.— нерастворим: цифры указывают растворимость в 100 г растворителя)
Темп. °C Литий Натрий Калий Рубидий Цезий
( о в. р. в. р. 0,74 0,184 0,024
Хлорплатинаты в воде . . . . 1 20 в. р. в. р. 1,12 0,141 0,079
1 50 в. р. в. р. 2,17 0,203 0,177
Гидротартраты в спирте . . — Л. Р. Л. р. в. р. н. р. в. р.
Гидротартраты в воде .... ( 25 в. р. в. р. в. р. в. р. 0,425 0,70 1,18 9,7
Квасцы в воде Хлориды в смеси спирта и 17 13,1 2,27 0,619
эфира — л. р. и. р. н. р. в. р. и. р.
Карбонаты в абс. спирте . — и. р. и. р. в. р. в. р. Р-
Перхлораты в воде ( 14 1 25 67/7 1,44 1,92 0,76 1,4 1,17 1,93
1 Z. anal. Chem. 29, 332 (1890).
’ Z. anal. Chem. 80, 430 (1930).
646
натриевых солей литиевая окраска совершенно маскируется; но
при наблюдении пламени через кобальтовое стекло красный цвет,
пламени становится явственно видным.
Пламенный спектр. Интенсивно красная двойная линия 670,8 тр- и при
более высокой температуре бледная оранжево-желтая линия 610,3 mjx-
Открытие лития, рубидия и цезия в присутствии калия
и натрия1
1. Удаление NHi’. Так как соли аммония мешают определениям, то
в первую очередь необходимо их удалить. Для этого фильтрат, полученный
после осаждения щелочных земель, выпаривают досуха и нагревают на
пламени, передвигая его под чашкой, до исчезновения паров. Необходимо
избегать высокой температуры ввиду опасности улетучивания щелочных
солей. Охлаждают, прибавляют 5 мл воды и каплю &N аммиака2. Филь-
труют и отбрасывают осадок.
2. Удаление SO,". Сульфат мешает анализу этой группы, потому что
NaaSO, и NaHSO, немного растворимы в спирту. К раствору прибавляют
1 мл концентрированной HNOs и, выпарив досуха, слегка прокаливают
остаток. Охлаждают, прибавляют 5 мл воды и по каплям нормальный рас-
твор Pb(NOs)2 до тех пор, пока не прекратится образование PbSO-i.
Взбалтывают, дают постоять 5 мин., затем фильтруют, промывают неболь-
шим количеством воды и осадок выбрасывают. Фильтрат насыщают серни-
стым' водородом, нагревают для коагуляции осадка, фильтруют и выбра-
сы'вают (осадок PbS.
3. Отделение К, Rb и С«. К раствору в чашке емкостью в 25 мл при-
бавляют 1—5 мл 9N раствора НС1О, и осторожно выпаривают до выделе-
ния паров НСЮ,. Количество реактива должно быть достаточным, чтобы
связать -все щелочные ионы, имеющиеся «в растворе, и нагревание должно
продолжаться до полного удаления HNOs. Дают жидкости вполне охла-
диться, холодный раствор вливают в небольшую сухую колбу и прили-
вают 99%-ный спирт в количестве, превышающем в 4 раза количество при-
мененной НС1О,. (Прибавление спирта к горячей НСЮ, сопряжено с опас-
ностью взрыва-) Смесь в колбе охлаждают, сильно взбалтывают и дают
ей постоять 15 мин. Фильтруют через маленький сухой фильтр в сухую
колбу. Осадок промывают 2 мл 99%-ного спирта. Он содержит весь К, Rb
и Cs в виде хлорнокислых солей, а фильтрат содержит растворимые хлор-
нокислые соли Li и №.
4. Отделение Li от Na. Спиртовый раствор насыщают сухим НС1-газом,
причем колбу держат в ледяной воде и газ пропускают в нее через узкую
стеклянную трубку. Пропускание газа продолжают до тех пор, пока НС1
не начнет выделяться из спиртового раствора. Раствору дают постоять
полчаса, после чего фильтруют через сухой маленький фильтр. Осадой
промывают небольшим количеством (не больше 5 мл) 99%-ного спирта, на-
сыщенного HCl-газом. Фильтрат за один прием разбавляют водой, взятой
в количестве % объема фильтрата для разложения могущего образоваться
С2Н5СЮ1 и для уменьшения опасности взрыва при последующем выпари-
вании. Такой обработкой можно отделить до 0,5 мг Na в виде NaCl от
100 мг Li, остающегося в растворе в виде LiCl.
5. Реакция идентификации Na. Осадок NaCl растворяют на фильтре,
через который пропускают несколько раз 5 мл -воды. К раствору приба-
вляют 1 мл 95%-ного спирта и 5 мл реактивного раствора ацетата уранила
п магния. Уже такое малое количество, как 0,5 .«г Na, дает почти веме-1
дленво осадок NaMg-(UOa)3(CHaCOO)9 • 9НгО зеленовато-желтого цвета, между
1 Предполагается, что другие катионы были удалены обычным ходом
качественного анализа.
2 Аммиак прибавляется с целью осаждения а-люминия, который может
попасть в раствор из фарфоровой чашки при производимом в ней выпари-,
вании и прокаливании. Ред.
647
тем как 10 мг К, Rb, Cs или Са ие дают никакого осадка. 2 мг Li не дают
осадка, но 5—10 мг Li образуют спустя несколько минут осадок, постепенно
увеличивающийся. В случае получения очень небольшого осадка вопрос,
состоит ли осадок из NaCl >или LiCl, решают реакцией окрашивания пламени.
6. Открытие Li. Спиртовый раствор, полученный, как описано в п. 4,
выпаривают на водяной бане (выпаривание на пламени может вызвать
сильный взрыв) до объема, равного объему HClOi, примененному в п- 3-
По охлаждении до комнатной температуры прибавляют очень медленно по
каплям концентрированную азотную кислоту до прекращения реакции. Азот-
ная кислота необходима для окисления спирта, оставшегося еще после
выпаривания1. Важно удалить спирт, прежде чем приступить к нагреванию
хлорной кислоты при температуре выше 100°. Затем, прибавив избыток
концентрированной азотной кислоты в количестве 1 мл, нагревают на водя-
ной бане в течение 15 мин. Прибавив еще 1 мл концентрированной азотной
кислоты, нагревают чашку на проволочной сетке до полного удаления
HCIO4. (При тщательном выполнении всех этих указаний взрыв не должен
произойти,, но если он и произойдет, то при таком способе работы он не
будет сильным.) Наконец, чашку нагревают в течение 1—2 мин, на голом
огне до температуры ниже красного каления. Охлаждают, прибавляют 3 мл
95%-ного спирта и 2 капли концентрированного NH4OH. Фильтруют и
осадок выбрасывают. К раствору прибавляют 3 -«.! концентрированного
NH«OH, нагревают до 35—40° и прибавляют 2 капли 0,5N раствора NaaHPCh.
Взбалтывают для растворения локального осадка2 NasHPCh. Если обра-
зуется осадок 1ЛзРС>4, прибавляют 2 мл воды и еще NaaHPCh до тех пор,
пока не прекратится образование осадка. Даже 0,1 мг Li дает заметный
осадок LiaPOi.
7. Превращение KCIO4, RbClOi и CsClCh в нитриты. Для отделения друг
от друга К, Rb и Cs необходимо, чтобы соли этих щелочных металлов на-
ходились в виде легко растворимых солей, предпочтительно — в виде ни-
тритов. Для этого перхлораты превращают в менее растворимые комплекс-
ные нитрюкобальтиаты, а- эти последние разлагают путем прокаливания,
причем образуются нитрит щелочного металла и CosCh. Хлорнокислые соли,
осажденные по п. 4, переносят в. чашку, растворяя их на фильтре в неболь-
шом количестве горячей воды. Раствор выпаривают досуха и к остатку
прибавляют 3—12 мл 1-молярного реактивного раствора, NaatCofNOz)»],
смешанного с половинным количеством (по объему) 6А уксусной кислоты.
Дают постоять 10—15 мин. при частом перемешивании и отфильтровывают
осадок, который может состоять из KaNa[Co(NO2)e], Rb2-Na[Co(NC>2)e] и
CsaNa[Co(N02)e]. Осадок промывают 5—10 мл реактива, разбавленного
10 объемами воды. Фильтрат выливают. Осадок переносят в чашку ем-
костью 25 мл, прибавляют 1 мл 9N раствора NaNO2, не содержащего калия,
выпаривают досуха и слегка прокаливают до сплавления и прекращения
выделения пузырьков газа. Охлаждают, прибавляют 5—10 мл воды, филь-
труют и выбрасывают черный осадок С03О4. Прибавив по капле &N уксус-
ной кислоты до перехода щелочной реакции в кислую (проба лакмусовой
бумагой), фильтруют, если необходимо, и выбрасывают осадок.
8. Отделение Rb и Cs от К. Нижеописываемое отделение основывается
на том. факте, что Rb и Cs реагируют с NaNC>2 и В1(НОз)з, образуя мало
растворимые соли RteNsBii'NCL)# и Cs’Na'Bi(NO)e. Чтобы отделение было
наиболее полным, необходим небольшой объем раствора щелочных солей,
к которому должно прибавить большое количество NaNO и относительно
малое количество Bi(NOs)s. К раствору нитритов в небольшой пробирке при-
бавляют Ve по объему реактивного раствора Bi(NOs)3, взбалтывают, пока не
растворится локально образующийся осадок, закрывают пробкой и оставляют
пробирку на 15—30 мин. в ледяной воде. Затем нагревают до 30° в течение 5 мин.
или больше при частом взбалтывании. (Желтый кристаллический осадок указы-
1 А также для разложения очень взрывчатого этилперхлората
C2H5CIO4. Ред.
2 Локальным осадком называется осадок, обраеующийся в растворе на
месте падения капель осадителя и растворяющийся при помешивании
раствора. Ред,
648
вает на присутствие Rb или Cs.) Если образуется большой осадок, приба-
вляют по 0,5 мл реактивных растворов NaNOa и Bi(NOa)s и дают еще 30 мин.
постоять в ледяной воде. Фильтруют через небольшой сухой фильтр и
промывают не больше чем 2 мл смеси из 9N раствора NaNOa и ’4 по
объему реактивного раствора В104Оз)з, охлажденной во льду. При таком
способе работы возможно выделить 1 мг Rb или Cs из смеси с 500 мг К-
9. Открытие К. К фильтрату, полученному по отделении осадка азоти-
стовисмутовых сюлей Rb и Cs, прибавляют из капельницы каплю 0,ЗМ
раствора Со(МОг)2 и нагревают >в течение 10 мин. до 35°. Это делается
с целью осаждения того количества Rb, которое могло не выпасть в виде
комплексного нитрита. Охлаждают в ледяной воде, дают постоять 1 час,
фильтруют и осадок выбрасывают. К фильтрату прибавляют 0,5 мл 6N
уксусной кислоты, 2 мл воды и 0,2—2 мл 3N раствора Со(\!0’)’. Смеси
дают постоять по меньшей мере 30 мин. Желтый осадок K2Na[Co(NO2)e]
получается уже в присутствии 1 мг калия. Это количество калия несомненно
осаждается при первом добавлении Со(МОз)2 к раствору нитрита, но1 в
фильтрате остается еще достаточно калия, чтобы обнаружить его при
испытании на него после удаления Rb.
10. Частичное отделение Cs от Rb. Следующий способ приводит к оса-
ждению Cs, если количество его превышает 5 мг, причем 100 мг Rb остаются
в растворе. Растворяют осадок, образованный висмутовой солью (п. 8),
в 3 ли &N НС1, кипятят несколько минут для вытеснения окислов азота,
охлаждают, прибавляют 10 капель 6-молярного реактивного раствора SbCls
и дают постоять полчаса при частом помешивании. Выпадает белый кри-
сталлический осадок CssSbaCle, если количество Cs превышает 5 мг. Филь-
труют через небольшой фильтр и осадок выбрасывают.
11. Окончательное отделение Rb от Cs. К фильтрату по отделении
CssSbzCh прибавляют 15 мл воды и насыщают НзЗтазом для осаждения
Sb и Bi. Фильтруют и выбрасывают осадки Sb и (Bi. Фильтрат выпаривают
досуха, прибавляют 2 мл воды, снова насыщают сероводородом и филь-
труют через маленький фильтр в короткую пробирку из стекла «пирекс».
Осторожно выпаривают раствор досуха, охлаждают и прибавляют 5 капель
насыщенного раствора кислого виннокислого натрия (еще лучше 1 ли на-
сыщенного раствора хлорнитротолуо.тметасульфоната натрия). Часто пере-
мешивают по меньшей мере в течение 5 мин., затем прибавляют еще 0,5 мл
реактивного раствора тартрата и дают постоять 10 мин. При наличии 1 мг
Rb получается белый кристаллический осадок RbHCiHaOe. Cs не дает
осадка, если количество его не больше 10 мг. Калий реагирует с обоими
реактивами и дает осадки подобно Rb.
12. Окончательная реакция иа Rb. Фильтр, содержащий осадок
RbHCiHiOe, обливают 0,5—5 Мл 9N раствора NaNOs, прибавляют 3—30 ка-
пель реактива Bi(NOs)s, взбалтывают и дают постоять 30 мин. в ледяной
воде. Желтый осадок в этой стадии анализа представляет собой
RbaNaBKNCMe.
13. Окончательная реакция на Cs. К фильтрату по осаждении Rb гидро-
тартратом натрия прибавляют 3 мл реактивного 1-молярного раствора
кремневольфра.мовой кислоты и дают смеси постоять по меньшей мере
30 мин. Образование нежного, белого осадка CssSiWi2O42 указывает на при-
сутствие Cs, но нужно помнить, что количество Cs, превысившее 5 мг,
было уже осаждено в виде CssSbaCIe (п. 10).
Рений Re. Ат. в. 186,31. Ат. н. 75
Плотность около 10. Т. пл. >' 3100°
Среди недавно открытых элементов наиболее интересным является рений,
открытый посредством рентгеновского спектрального анализа В. Ноддаком,
И. Таке и О. Бергом (W. Noddack, I. Таске, О. Berg-). В периодической
системе Менделеева имелись пробелы для трех элементов в группе VII.
Менделеев указал, что должны быть открыты элементы, которые воспол-
нят эти пробелы, и он, кроме того, предсказал их свойства- Элемент 43
он назвал эка-марганцом, а элемент 715—двиимарганцом.
649
Ренйй соответствует дви-маргаицу, а мазурий Ма, также открытый
Ноддаком и его сотрудниками, соответствует эка-марганцу. О мазурии
имеется мало сведений, хртя в рентгеновском спектре были открыты линии,
которые вызываются, повидимому, наличием очень малых количеств этого
элемента в некоторых редких минералах, как колумбит, сперрилит. Третий
элемент этой группы под номером 85 должен быть аналогом иода; он был
назван эка-иодом. Аллисон и Мерфи полагают, что они открыли этот эле-
мент «магнетооптическим» анализом. Они назвали его алабамием Ат
с атомным весом 221 *.
Рений был открыт не менее чем в 100 минералах, но максимальное
количество его не превышало приблизительно 0,001%. То обстоятельство,
что он образует не растворимый в кислотах сульфид Re2S?, который может
быть превращен в окись ResO?, отличающуюся своей летучестью, дало
возможность открывать ничтожные количества окиси рения в минералах,
содержащих очень мало рения. При восстановлении окиси водородом был
получен металлический рений в ваде тяжелого серого порошка. По внеш-
нему виду металлический рений похож на платину и после вольфрама он
наиболее трудно плавящийся из всех металлов. Рений легко растворяется
в азотной кислоте, но вместо! ожидаемого Re(NOs)2 Образуется надрениевая
кислота HReOi:
3Re + 7NOV + 7Н' SHReOi + 7NO + 2НгО.
Он медленно растворяется в серной кислоте, но НС1 или HF на него
не действуют.
Было описано не меньше пяти окислов .рения. Черная двуокись рения
ReOa соответствует по своему составу МпОа. Она была получена при до-
бавлении KJ к концентрированному солянокислому раствору KReOi с после-
дующей нейтрализацией едким натром. При аналогичных условиях марга-
нец дал ’бы MnCh и осадок Мп(ОН)2. Двуокись рения была также полу-
чена при добавлении к раствору перрената в 50% КОН значительного ко-
личества солянокислого гидразина NHa NHs • 2НС1.
Трехокись рения ReOs была описана как красный порошок. Имеются
также указания на промежуточный окисел ReeOs фиолетового или синего
цвета.
Желтая семиокись рения ReaO? легко получается при нагревании ме-
таллического рения на воздухе или в кислороде выше 150°. Она плавится
при 220° и сублимируется при несколько более низкой температуре.
Белый окисел ReaOs образуется, если рений или какой-либо из его
более низких ркислов нагревается ниже 150°. Он плавится при этой же
температуре и быстро превращается в ResO?. Эти два окисла, Read? и
Re»Oe, являются кислотными ангидридами и легко растворяются в воде;
более низкие окислы обладают слабыми основными свойствами. Подобно
манганатам соли рениевой кислоты HaReOi довольно устойчивы в щелочном
растворе и медленно разлагаются на двуокись рения и перренат;
3ReO4" + 2Н2О -> 2ReO4' +, ReOt + 4ОН'.
Перренаты менее устойчивы в щелочных и значительно’ более устой-
чивы в кислых растворах. Рениевая кислота HReCh довольно сильная
кислота н она значительно более устойчива, чем марганцовая кислота. Она
растворяет гидроокиси, например А1(ОН)з, выделяет СО» из карбонатов и
растворяет металлы, выделяя водород. Водный раствор ReaOs реагирует
подобно перекиси.
* Добавление редактора. Открытие рения путем каталитического вос-
становления теллуровой кислоты* 2. Эта реакция основана на способности
солей рениевой кислоты катализировать чрезвычайно медленно протекаю-)
’Открытие Аллисона и Мерфи как этого элемента, так и эле.
мента 87, названного ими виргинием, считается сомнительным. Ред.
2 Н. С. Полуэктов, Ж. прикладной хим. 9, 2312 (1936).
650
щее на холоду восстановление теллуровой кислоты хлористым’ оловом. Та-
кое свойство рения было использовано для открытия его капельным
путем. Реакция весьма чувствительна. Нужно заметить, что рений анало-
гично действует и на восстановление селеновой кислоты, поэтому селенит
натрия и хлористое олово также могут служить для открытия рения.
Выполнение. Каплю исследуемого раствора смешивают в фарфоровой
чашечке с каплей раствора SnCh (10 г SnCh в 20 мл концентрированной
HCi), затем добавляют каплю 1%-ного раствора теллурата натрия. В при-
сутствии рения появляется черный осадок или черная муть от выделивше-
гося элементарного теллура. При малых количествах рения рсадок по-
является не сразу, а через некоторое время. Рекомендуется ставить слепой
опыт. Открываемый минимум 0,025 т в 0,05 мл (предельная концентрация
1:2 000 000). Об открытии рения в присутствии некоторых мешающих эле-
ментов, особенно М|о, обычно сопутствующего рению и также катализирую-
щего восстановление теллуровой кислоты, см. оригинальную работу *. А. К-
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Авгит 210, 300
Автунит 587
Агат 478
Адуляр 309
Азоимид 402
Азот, откр. в орг. вещ. 368
Азотистая к-та 381
полумикр. опред. 539
р-сть солей 500
реакции 383
Азотистоводородная к-та 402
реакции 402
Азотиа я к-та 454
лаб. реактив 103
окисл. действие 46
откр. в прис. НС1 и НСЮз 462
— в ирис. HNOa 458 j
полумикр. опред. 542
р-сть солей 496—499, 501
реакции 455
Азурит 148
Аксинит 412
Активность, коэфициент 22 сл.
Актор 141
Акцептор 141
Алабамий 650
Ализарин 214, 624, 626
Ализарин S, см. Ализаринсульфо-
кислый натрий
Ализаринсульфокислота 600
Ализаринсульфокислый натрий 214,
474
Алкана 214
Аллоксантин 241
Алунит 210
Альбит 314
Алюминий 210
окись нераств., переведение в
раствор 216
откр. в прис. орг. вещ. 215
полумикр. опред. 536
р-сть солей 497
реакции 211
Алюминон 214
Амблигонит 645
Аммиак, см. Аммоний
Аммоний 32Qr
652
ауринтрикарбоновокислый 214
Аммоний, гидроокись, лаб. реактив
104
полумикр. опред. 538
р-сть солей 496
реакции 321
соли, лаб. реактивы 104
Амфотерные электролиты 72 сл.
Анализ
систематический ход 486 сл.
спектральный 94 сл.
Анатаз 591
Ангидрит 289
Англезит 128
Анилиновая синь 418
Анионы 17, 24
открытие 511 сл.
полумикр. опред. 538 сл.
предварит, испытание на — 492
реакции 334 сл.
Аннабергит 256
Анортит 289
Апатит 289
Апофилит 320
Арагонит 289
Аргентит 116
Аргидродит 554
Арнольда основание 133, 252
Аррениуса теория 15
Арсенаты, см. Мышьяковая к-та
Арсениды 163
Арсениты, см. Мышьяковистая к-та
Асбест 300
Атакамит 148 •
Атомный номер элемента 102
Ауринтрикарбоновокислый аммоний,
см. Алюминон
Аурипигмент 163
Ацетаты, см. Уксусная к-та
Ацетилацетон 586
Ацетилен 154
Бадделеит 597
Бамбергера реакция 328
Барий 296
гидроокись, лаб. реактив 104, 107
полумикр. опред. 537
Барий р-сть солей 497
реакции 297
хлорид, лаб. реактив 105
Барит 296
Бейльштейна проба 340
Белая свинцовая руда 128
Белый мышьяк 128
Белый никелевый колчедан 255
Бензидин 133, 156, 222, 252, 373,
438, 480, 556, 558, 614
Бензидиновая синь 222, 438, см.
также Бензидин
а-Беизоиноксим, см. Купрон
Бензойный альдегид 331
Бензопурпурин 76
Берилл 584
Бериллий 584
реакции 584
Берлинская лазурь 239, 371
Берцелианит 547, 619
Беттендорфа реакция 168
Бихроматы, окисл, действие 48
Блеклая руда 163
Блеск
висмутовый 143
медновисмутовый 143
медный 148
молибденовый 543
свинцовый 128
сурьмяноникелевый 256
сурьмяный 180
Боксит 210, 625
Болла реактив 316
Болотная железная руда 229
Бораты, ом. Борная к-та
Борацит 412
Бориая к-та 412
отнош. к прокал. 415
полумикр. опред. 540
р-сть солей 496—499, 500
реакции 413
Браунит 243
Брейтгауптит 256
Бром 350
жидкий, лаб. реактив 106
откр. в неэлектролитах 350
Бромиды, см. Брюмистоводород. к-та
Бромистоводородная к-та 346
лаб. реактив 103
откр. в прис. НС1 и HJ 357
полумикр. опред. 541
р-сть солей 495, 496—499
реакции 347
Бромкрезолпурпур 76, 77
Бромтимолблау 76, 77
Бромфенолблау 76, 77
Брукит 591
Бруцин 383, 457
Бруцит 299
Бунзенит 256
Бура 412
Буферные растворы 64
Валентинит 180
Ванадиевые к-ты 627, 632
р-сть солей 501
Ванадий 627
реакции 628
Ванадинит 128, 627
Вивианит 229
Вилье реакция 260
Винная к-та 419
лаб. реактив 103
р-сть солей 496—499, 500, 646
полумикр. опред. 540
реакции 420
Виргиний 650
Висмут 143
нитрат, лаб. реактив 106
полумикр. опред. 533
р-сть солей 499
реакции 144
Витерит 296
Вода
ионизация 29
ионное произведение 29
Водород, восстан. действие 50
Водорода перекись 317
лаб. реактив 106
реакции 318
Водородный показатель 29 сл.
Волластонит 289
Волосистый колчедан 256
Вольфрам 633
реакции 634
Вольфрамит 633
Вольфрамовая к-та 633
р-сть солей 501
Восстановительное действие
водорода 50
иодистоводородной к-ты 53
металлов 50
перекиси водорода 49
сернистого водорода 52
сернистой к-ты 51
хлористого олова 53
Восстановительное пламя 87
Восстановление 44
в пламени 92
в стекл. перлах 88
в стекл. трубке 92
на обугл. палочке 89
на угле 93
Вульфенит 128, 543
Выпаривание кислот 83
Высаливание коллоидов 40, 79
Вюрцит 273
Гадолиний 611
Гадолинит 602, 608
Галенит 128
Галит 314
Галлий 625
Галловая к-та 423
Галмей 273
653
Г алоиды
окисл. действие 46
откр. в прис. роданидов 378
— в ирис, цианидов 360
Гамма (у) 80
Гармотом 296
Гарниерит 256
Гаусманит 243
Гафний 605
Гексанитродифениламин, см. р-Ди-
пикриламии
Гель 81
Гематит 229
Гемиморфит 273
Германий 554
Германит 555
Герсдорфит 256
Гетит 229
Гидразин 329
реакции 330
Гидраргиллит 210
Гидроксиламин 326
реакции 327
хлоргидрат, лаб. реактив 106
8-Гидроксихинолин, см. Оксии
Гидроксония ион 16
Гидролиз 66 сл.
Гидрония ион 16
Гидрооксиси металлов, р-сть 496—499
Гидросернистая к-та 451
Гидротартраты, р-сть 646
Гидрофильные коллоиды 81
Гидрофобные коллоиды 81
Гипофосфиты, см. Фосфориоватистая
к-та
Гипохлориты, см. Хлорноватистая
к-та
Г ипс 289
Гольмий 61Г
Гомогенное равновесие 13
Горькая соль 299
Гринокит 159
Грисса реактив 386
Гутцейта способ 177
Гюбиерит 633
Далолит 413
Двойные соли 42
Деварда сплав 457, 464
Действии масс закон 12 сл.
Дениже реактив 427
Диаспор 210
Дидим 618
Диспрозий 611
р- Диметил аминоазофениларсиновая
к-та 61
р-Диметиламинобензилиденродаиии
121, 142, 558, 570
Диметилглиоксим 193, 236, 260 272
569, 631
пригот. реактива 106
Диметилпарафеиилендиамни серно- |
654
кислый 390
р-Динитродифенилкарбазид 161'
Дноксан 646
Диоксивинной к-ты озазои 293
Г8-Диоксинафталии - 3,6-дисульфо-
кислота 593
р-Дипикриламин 313
а -а'-Дипиридил 236
Диссоциация электролитическая 14
Дитизон 121, 133, 142, 157, 278
пригот. реактива 121
Дитиощавелевой к-ты диамид, см.
Рубеановодородная кислота
Дифениламин 384, 4б6, 461
Дифенил-эндоанило-дигидротриазол-
1.2,4, см, Нитрон
Дифенилкарбазид 142, 161, 221, 304
Дифенилтиокарбазон см. Дитизои
Дициан 368
Дициандиамидинсульфат 260, 272
Диэтиланилин 277
Диэтиленоксид 646
Доломит 299
Европий 610
Едкий натр, лаб. реактив 104
Железо 229
двухвалентное, откр. в прис. ме-
таллич. железа 236
— р-сть солей 498
— реакции 232
— сульфат, лаб. реактив 106
откр. в комплексных солях 241
полумикр. опред. 535
трехвалентное, нитрат, лаб. реак-
тив 105
— 1 р-сть солей 498
— реакции 236
— хлорид, лаб. реактив 105
Железистосинеродистоводородная
к-та 359
нераствор. соли, анализ 371
откр. в прис. роданидов 379
полумикр. опред. 541
р-сть солей 496—499, 500
реакции 370
Железная руда болотная 229
Железняк магнитный 229
Железосинеродистоводородиая к-та
372
откр. в прис. роданидов 379
отношение к прокаливанию 374
полумикр. опред. 541
р-сть солей 496—499, 500
реакции 372
Жировик 300
Закон
действия масс 12 сл.
разбавления Оствальда 27
распределения 25
Зеленая свинцовая руда 128
Земельные кислоты 632 сл.
Золото 556
отделение от платины 566
откр. в сплавах и рудах 561
р-еть солей 499
реакции 557
Золь 81
Известковая вода, лаб. реактив
107
Известковый шпат 289
Известняк 289
Иллиний 619
Ильменит 591
Индиго образование, реакция 395
Индиговая проба 461
Индий 622
реакции 623
Индикаторы 75
границы интервалов pH 76
изменение цвета 76
константы 77
приготовление растворов 77
теория 75
Индуктор 141
Инклюзия 82
Иод 355
откр. в неэлектролитах 355
реакции 356
Иодаты, см. Йодноватая к-та
Йодиды, см. Иодистоводородная к-та
Иодистоводородная к-та 350
восстан. действие 53
откр. в прис. НС1 и НВг 357
полумикр. опред. 541
р-сть солей 495, 496—499
реакции 352
Иодная к-та 452
р-сть солей 452^ 501
реакции 452
Йодноватая к-та 432
р-сть солей 500
реакции 433
Ион общий, действие 63
Ионизация 14
воды 299
комплексных ионов, константы 42
константа 27
электролитов (таблица) 24
— влияние изменения концентра-
ции 26
Ионогены 19
Ионное произведение воды 29
Ионы 15, 17
валентность 42 •
комплексные 41
— константы ионизации 42
общий, действие 63
номенклатура 24 сл.
реакции 42
Иридий 578
реакции 578
Иттербий 611
Иттриевые земли 609
Иттрий 608
реакции 609
Иттротанталит 608, 636
Кадмий 159
нитрат, лаб. реактив 105
полумикр. опред. 533
р-сть солей 499
реакции 160
Какодиловая реакция 396
Какотелин 193
Калаверит 551
Каления температуры 88
Калиевый полевой шпат 309
Калий 309
гидроокись, лаб. реактив 104
отделение от цезия 645
полумикр. опред. 538
р-сть солей 496, 646
реакции 310
соли, лаб. реактивы 106
Калийная слюда 309
Кальций 289
полумикр. опред. 537
р-сть солей 496
реакции 290
соли, лаб. реактивы 289
Каменная соль 314
Камень оловянный 188
Каолин 210
Карбонаты, см. Угольная к-та
Карборунд, откр. кремния 485
Кариуса способ 341
Карналлит 299, 309, 320
Карно реакция 311
Карнотит 587, 627
Каро кислота 467
Кастор 645
Кассиопей 612
Касситерит 188
Катионы 17, 24
открытие 508 сл.
полумикр. опред. 531 сл,-
реакции 116 сл.
Кварц 477
Квасцы, р-сть 646
Кизерит 299
Кислоты
выпаривание 83
открытие 75
распределение по группам 324
Клаудетит 163
Клаусталит 547
Коагуляция 81
Кобальт 265
нитрат, лаб. реактив 105
откр. следов в никелевых солях
273
полумикр. опред. 536
р-сть солей 497
655
Кобальт реакции 266
шпейсовый 265
Кобальтит 265
Кобальтосинеродистоводородная к-та
380
р-сть солей 500
реакции 381
Коллоидные оастворы 78 сл.
Колорадоит 551
Колчедан
волосистый 256
медный 148
мышьяковистый 163
никелевомышьяковый 256
никелевый белый 256
Колумбит 602, 636
Комплексные ионы 41
валентность 42
константы ионизации 42
Комплексные соли, откр. железа в
них 241
Константы
индикаторов 77
ионизации 27
— комплексных ионов 42
— слабых кислот 28
— слабых оснований 28
равновесия 12
Концентрация
молярная 21
нормальная 22
предельная 108
реактивов 102 сл.
Корунд 210
Кошениль 76
Коэфициент
активности 22 сл.
распределения 25
Красная медная руда 148
Красная цинковая руда 273
Крахмал и KJ, лаб. реактив 106
Крезолрот 76, 77
Крезолфталеин 76, 77
Кремень 478
Кремневая к-та 477, см. также Си-
ликаты
Кремневольфрамовая к-та, лаб. ре-
актив 103
Кремнефтористоводородная к-та 476
Кремний 484
откр. в железе и стали 484
— в карборунде и силицидах 485
Кремнистая цинковая руда 273
Креннерит 551
Криолит 210, 314
Кристаллы смешанные 82
Крокоит 128
Крукезит 619
Крума реакция 249
Куприт 148
Купрон 156
Купферрон 158, 241, 596, 601
Куркума 591, 600
пригот. реактива 106
реакция на борную к-ту 414
Лазурь
берлинская 237
медная 148
Лакмус 76, 77
Лаксманнит 218
Лантан 617
нитрат 395
реакции 617
уксуснокислый 474
Лассеня способ 368
Лейкофанит 584
Лепидолит 643
Лербахит 547
Летучесть, испытание 88
Либигит 587
Лимонит 229
Лимонная к-та 424
р-сть солей 500
реакции 424
Литий 645
QTKp. в прис. К и Na 647
полумикр. опред. 538
р-сть солей 646
реакции 645
Лунге реакция 456
Лютеций 612
Магнезиальная смесь, лаб. реактив
106
Магнезит 299
Магний 299
полумикр. опред. 538
р-сть солей 496
реакции 300
Магнитный железняк 229
Магния-аммония нитрат, лаб. реак-
тив 106
Магния-уранила ацетат, лаб. реак-
тив 106
Мазурий 650
Малахит 148
Малахитовая зелень 406
Манганаты, см. Марганцовистая
к-та
Манганит 243
Марганец 535
двухвалентный, реакции 246
полумикр. опред. 536
р-сть солей 497
семивалентный, реакции 253
шестивалентный, реакции 253
Марганцовая к-та 254, 467
окисл. действие 47
р-сть солей 501
Марганцовистая к-та 253, 467
р-сть солей 501
Марганцовый шпат 243
Марказит 229
656
Марша реакция 173
Медная лазурь 148
Медная руда, красная 148
Медновисмутовый блеск 143
Медный блеск 148
Медный колчедан 148
Медь 148
двухвалентная, р-сть солей 499
— реакции 151
одновалентная, реакции 150
полумикр, опред. 533
Мел 289
Мелифанит 584
Металлы
анализ 528
восстан. действие 50
окиси, р-сть 496—499
разделение на группы 101
редких земель 605 сл,
Метафосфорная к-та 430
р-сть солей 500
Метилвиолет 106
Метиленовая синь 390
Метилоранж 76, 77
Метилрот 76, 77
Миллерит 256
Миметезит 128
Минимум открываемый 108
Молибден 543
реакции 544
Молибденит 543
Молибденовая к-та 435
р-сть солей 500
Молибденовая синь 158
Молибденовый блеск 543
Молярная концентрация 21
Монацит 602, 636
Монопадсерная к-та 467
Монтичеллит 299
Морин 213
Морская пенка 300
Моттрамит 627
Мочевина 386
лаб. реактив 106
Мрамор 289
Муравьиная к-та 399
лаб. реактив 103
реакции 399
Мусковит 210, 309
Мышьяк 163
общие реакции 173 сл.
полумикр. опред. 534
пятивалентный, реакции 169
трехвалептный, реакции 165
Мышьяковая к-та 169, 451
полумикр. опред. 510
р-сть солеи 496—499, 501
Мышьяковистая к-та 164, 151
полумикр. опред. 510
р-сть солей 496—499, 501
Мышьяковистый колчедан J63
Мышьяковистый никель 256
Мышьяковосеребр. обманка 116, 163
Мышьяковый цвет 163
Нагиагит 551, 556
Надборная к-та 416
реакции 416
Надсерная к-та 465
реакции 465
Надугольная к-та 412
Наждак 210
Натриевый полевой шпат 314
Натрий 314
ализаринсульфокислый 214, 474
гидроокись, лаб. реактив 104
нитропруссид 389, 405, 449
перекись 317
полумикр. опред. 538
соли лаб. реактивы 106
— р-сть 496, 646
реакции 315
Науманит 547
Нейтрализация 66
Неодим 618
Нерастворимые в к-тах вещ., пре-
вращение в раствор,состояние 503
Нернста формула 56
Несслера реактив 324, 410
приготовление 106
Никелевсмышьяковый колчедан 256
Никель 256
мышьяковистый 256
сурьмянистый 256
полумикр. опред. 536
р-сть солей 497
реакции 257
Николит 256
Ниобиевые к-ты 485, 636, 637
Ниобий 636
откр. одновременно с Та 640
реакции, общие с Та 637
— специфические 639
Нитраты, см. Азотная к-та
Нитриты, см. Азотистая к-та
о-Нитробензальдегид 395
р-Н итробензолазо- а -нафтол 303
р-Нитробензол азорезорцин 303
р-Нитробеизолазохромотроповая к-та,
см. Хромотроп 2 В
р-Нитродиазобензол 323
а-Нитрозо-£-нафтол 235, 241, 262,
271, 569
Нитрон 457
Нитропруссид
натрия 389, 405, 449
образование иона 365
Номер элемента, порядковый (атом-
ный) 102
Нормальные
концентрация 22
раствор 22
потенциалы (табл.) 57
Нумеит 256
42 Зак. 982. Тредвелл-Голл, т. I.
657
Обманка
мышьяковйстосеребряиая 116, 163
роговая 210, 300
сурьмяная 180
сурьмяносеребряиая 116
цинковая 273
Общий ион, действие 63
Озон 320
Окиси металлов, р-сть 496—499
Окисление 44
в пламени 88
в стекл. перлах 88
Окислительное пламя 87
Окислительные потенциалы (табл.) 61
Окисляющее действие 46 сл.
азотиой кислоты 46
бихромата 48
галоидов 46
перманганата 47
перекиси водорода 48
хромата 48
Окклюзия 82
Окрашивание пламени, испытание 88
Оксалаты, см. Щавелевая к-та
Оксин 215, 302, 632
Оливин 299
Олово 188
двуокись, растворение 198
двуххлористое, лаб. реактив 107
двухвалентное, р-сть солей 499
— реакции 189
полумикр. опред. 534
четырехвалентное, р-сть солей 499
— а-соединения, реакции 194
— ^-соединения, реакции 196
Оловянный камень 188
Онофрит 547
Ортоклаз 210, 309
Осадки
промывание 84
старение 82
фильтрование 84
Осаждение последующее 82
Осмий 573
восьмивалентный, реакции 574
реакции 574
четырехвалентный, реакции 574
Основание Арнольда 133
Основания, открытие 75
Оствальда закон разведения 27
Открываемый минимум 108
Охра висмутовая 143
Палладий 567
двухвалентный, реакции 568
реакции 568
четырехвалентный, реакции 570
Пенка морская 300
Пептизация 81
Перекись водорода 317
восстан. действие 49
окисл. действие 48
Перекись водорода, реакции 318
Перекись натрия 317
Перйодаты, см. Иодная к-та
Периодическая система элементов
100
Перлы стеклянные 88
окрашивание 489 сл.
Перманганаты, см. Марганцовая к-та
Перовскит 591
Перхлораты, см. Хлорная к-та
Петалит 645
Пикриновая к-та 313
Пираргирит 116
Пирит 229
Пиролюзит 243
Пироморфит 128
Пирофосфорная к-та 431
р-сть солей 500
реакции 432
Пирохлор 602
Плавиковый шпат 289
Плавкость, испытание 87
Пламя
восстановительное 87
окислительное 87
окрашивание 88, 491
строение 86
Платина 562
р-сть солей 499
реакции 563
Платиновые металлы 562
разделение и открытие 580
Платинохлорнстоводородная к-та
пригот. реактива 107
р-сть солей 563, 646
Повелит 543
Полевой шпат 210
калиевый 309
натриевый 314
Полианит 243
Поллуцит 641
Полумикроанализ 503 сл.
Порядковый номер элемента 102
Последующее осаждение 82
Потенциалы
нормальные (табл.) 57
окислительные (табл.) 61
электродные 54
Празеодим 618
Предельная концентрация 108
Произведение растворимости 32
таблица 37
Проба Бейльштейна 340
Промывание осадков 84
Противоионы 81
Прустит 116
Равновесие
гомогенное 13
константа 12
между твердым веществом и
двумя жидкостями 25
658
Радий 641
Разведения закон Оствальда 27
Распределения
закон 25
коэфициент 25
Растворения упругость 54
Растворенное вещество, анализ
528
Растворимость
влияние температуры 40
солей (табл.) 496—497
трудно растворимых электролитов
(табл.) 37
хлороплатинатов (табл.) 563
щелочно-земельных солей (табл.)
307
щелочных солей (табл.) 646
Растворы
буферные 64
коллоидные 78
насыщенный 32
твердые 82
Реактивы
Болла 316
Грисса 385
Дениже 427
концентрация 102 сл.
Несслера 324, 410
— пригот. 106
Реакции
Бамбергера 328
Беттендорфа 168
«видимые» 11
Вилье 260
индуцированная 141
ионов 42
какодиловая 396
Карно 311
катионов 116 сл.
Крума 249
Лунге 456
Марша 173
мокрым путем 11 сл.
скорость 12
сопряженная 141
сухим путем 12, 85
Фогеля 269
чувствительность 103
Чугаева 260, 575
Штаре 425
элементов 109 сл.
Реальгар 163
Редкие металлы, реакции 543 сл.
Резорцин 386, 418, 423
Рейнит 633
Рейшиа способ 179
Реиий 649
Роговая обманка 210, 300
Роговое серебро 116
Родамин В 187
Роданиды, см. Роданистоводородная
к-та
Роданистоводородная к-та 374
откр. в прис. галоидов и циани-
дов 378
полумикр. опред. 541
р-сть солей 496—499, 500
реакции 375
соли продажные, опред. хлора 379
спец, методы анализа 378
Родизонат натрия 295, 298, 469
Родий 571
реакции 572
Розоловая к-та 410
Ртуть
двухвалентная, р-сть солей 498
— реакции 138
— хлорид, лаб. реактив 105
одновалентная, р-сть солей 498
— реакции 124 СЛ.
— хлорид, лаб. реактив 105
откр. в моче 126
пары, откр. в воздухе 127
полумикр. опред. 532, 534
цианистая 366
Рубеановодородная к-та 157, 262,
272, 368, 577
Рубидий 643
реакции 644
отделение от цезия 645
откр. в прис. К и Na 647
р-сть солей 646
Рубин 210
Рутений 575
реакции 576
Рутил 591
Ряд электродвижущий 54
Салициловая к-та 458
Салицилальдоксим 158
Самарий 619
Самарскит 587, 602, 636
Сапфир 210
Сассолин 412
Свинец 128
ацетат, 'лаб. реактив 105
нитрат, лаб. реактив 105
полумикр. опред. 533
растворимость солей 498
реакции 130 сл.
Свинцовый блеск 128
Селен 547
опред. в серной к-те 550
реакции 548
Селенистая к-та 407, 548
Селенаты, см. Селеновая к-та
р-сть солей 500
реакции 548
Селениты, см. Селенистая к-та
Селениетоводородная кислота 393
Селеновая к-та 407, 548
р-сть солей 500
реакции 530.
42*
659
Селитра 309
натриевая 314
чилийская 314
Сенармонтит 180
Сера 392
откр. в неэлектролитах 391’
Серебро 116
нитрат, лаб. реактив 105
полумикр. опред. 532
р-сть солей 498
реакции 117 сл.
роговое 116
теллуристое 551
Серебряная руда темная 180
Серебряный блеск 116
' Серная к-та 467
лаб. реактив 103
нераствор. соли, перев в рас-
твор. сост. 504
опред. в ирис. Se 550
полумикр. спред. 540
р-сть солей 496—499, 501
реакции 468
Сернистая к-та 403
восстан. действие 51
лаб. реактив 103, 107
откр. в прис. HaSsOs и Н;3 450
полумикр. опред. 539
р-сть солей 451, 500
реакции 404
Сернистоводородная к-та 387
восст. действие 52
лаб. реактив 107
откр. в прис. Н230з и H5S 450
отношение солей к прокалива-
нию 391
полумикр. опред. 539
р-сть солен 496—499, 500
реакции 388
Сернистый углерод 411
реакции 411
Серпентин 300
Сидерит 229
Силикаты
не разлаг. к-тами 482
полумикр. опред. 540
разлагаемые к-тами 481
р-сть 496—499, 501
растворимые в воде 479
Силициды, откр. кремния 485
Сильванит 551, 556
Сильвин 309
Синь
анилиновая 418
бензидиновая 222, 438
молибденовая 158
тенарова 217
турнбулева 235
Синильная к-та, см. Цианистоводо-
родная к-та
Скандий 608
Скорость реакции 12
660
Скуттередит 2G5
Слюда 20
калийная 309
Смешанные кристаллы 82
Смоляная руда урановая 587
Сода 314
Солевой эффект 40
Соли двойные 42
Соосаждение 82
Спектр 94 сл.
Спектральный анализ 94 сл.
Спектрограф 98
Спектроскоп 95, 98
Сплав Деварда 457, 464
Сплавы
анализ 528
откр. Au 561
Сподумен 643, 645
Старение осадков 82
Стеатит 300
Стибнит 180
Столба метод 645
Стольцит 128
Стронцианит 294
Стронции 294
полумикр. опред. 537
р-сть солей 497
реакции 294
Сульфаты, см. Серная к-та
Сульфиды, Сернистоводородная к-та
Сульфиты, см. Сернистая к-та
Сурьма 534
пятивалентная, реакции 186
трехвалентная, р-сть солей 499
— реакции 182
треххлористая, лаб. реакт. 107
Сурьмяная обманка 180
Сурьмянистый никель 256
Сурьмяноникелевый блеск 256
Сурьмяносеребряная обманка 116
Сурьмяный блеск 180
Сфалерит 625
Сфен 591
Таллий 619
одновалентный, реакции 620
трехвалентный, реакции 622
Тальк’ 300
Таннин 638, 639
Тантал 636
реакции 637
Танталит 636
Танталовая к-та 485
Тартраты, см. Винная кислота
Твердые растворы 82
Теллур 551
реакции 552
Теллураты, см. Теллуровая к-та
Теллуриты, см. Теллуристая к-та
Теллуристая к-та 407, 55-1
р-сть солей 500
реакции 552
Теллуристоводородная к-та 393
Теллуристое серебро 551
Теллуровая к-та 407, 552
р-сть солей 500
реакции 553
Темная серебряная руда 180
Тенарова синь 217
Теория
Аррениуса 15
индикаторов 75
электролит, диссоциации 14
Термонатрит 314
1 Й5,8-Тетра!пидро1кс1на'нтр ахин он,'
см. Хинализарин
р-Тетраметилдиаминодифеннлметан,
см. Основание 'Арнольда
Тетраэтилродамин 187
Тербий 611
Тиманит 547
Тимолблау 76, 77
Тимолфталеин 76
Тинкал 314, 412
Тиомочевина 386, 549, 575, 577
лаб. реакт. 107
Тиосерная к-та 445
откр. в прис. НаЗОз и H2S 450
полумикр. опред. 539
р-сть солей 451, 501
реакции 447
Тиосульфаты, см. Тиосерная к-та
Тиоцианистоводородная к-та, см. Ро-
данистоводородная к-та
Титан 591
реакции 593
Титанит 591
Титановая желтая 303
Титановые к-ты 485, 592
Топаз 210
Торианит 602
Торий 602
реакции 603
Торит 602
Тремолит 300
Тридимит 477
Тринитробензол '76
Трифан 643, 645
Трифилин 643, 645
Трона 314
Тропеолин О 76
Тулий 611
Турмалин 412
Турнбулева синь 235, 373
Тяжелый шпат 296
Угольная к-та 407
полумикр. опред. 539
р-сть солей 496—499, 500, 646
реакции 409
уксусная к-та 394
лаб. реактив 103
полумикр. опред. 542
р-сть солей 496—499, 500
Уксусная к-та, реакции 394
Ульманит 256
Упругость растворения электролити-
ческая 54
Уран 587
реакции 588
Уранила ацетат, лаб. реактив 103
Уранит 587
Урановая смоляная руда 587
Фелингов раствор 327, 330, 400
Фенацит 584
Фенилгидразин 546
Фенилнитрозогидрскаиламип, см.
Купферрон
Фенолрот 76, .77
Фенолфталеин 76, 77
Ферберит 633
Фергрюсснит 636
Феррицианиды, см. Железосинероди.
стоводород-ная к-та
Ферроцианиды, саь Железистосине"
родистоводородная к-та
Фильтрование 84
Фишера реакция 390
Флавеановый водород 368
Флуоресцеин 348
Фогеля реакция 269
Фольгарда метод 378
Формула Нернста 56
Форстерит 299
Фосфаты, см. Фосфорная кислота
Фосфиты, см. Фосфористая кислота
Фосфор 442
белый, откр. 443
откр. в стали и в железе 440
специальные реакции 443
Фосфористая к-та 427
реакции 428
Фосфорная к-та 435
лаб. реактив 103
полумикр. опред. 539
р-сть солей 496—499, 501
реакции ‘436
Фосфорноватая к-та 441
Фосфорноватистая к-та 400
р-сть солей 500
реакции 401
Фосфорномолибденовая к-та, приго-
товление реактива 158
Франклинит 273
Фтор
откр. в пиритах 476
—< во фторсодер. силикатах 476
Фториды, см. Фтористоводородная
к-та
Фтористоводородная к-та 470
лаб. реактив 103
полумикр. опред. 540
р-сть солей 496—499, 501
реакции 471
Фуксин 349
661
Халькопирит 148
Халцедон 478
Хинализарин 215, 303, 587, 624
Хлор 341
откр. в неэлектролитах 340
лаб. реактив 107
реакции 342
б-Хлор-5-нитротолуолметасульфонат
натрия 643, 644
пригот, реактива 107
Хлорантит 256
Хлораты, см. Хлорноватая к-та
Хлориды, ом. Хлористоводородная
к-та
Хлористоводородная к-та 335
лаб. реактив 103
откр. в црис. НВг и HJ 357
— в црис. HNOs и НСЮз 462
отношение солей к прокаливанию
339
полумикр. опред. 541
растворимость 495, 496—499, 646
реакции 337
Хлористая к-та, реакции 346
Хлористое олово, восстаи действие
53
Хлористый водород, лаб. реактив 107
Хлористый титан 460
Хлорная вода, лаб. реактив 107
Хлорная к-та 463
лаб. реактив 103
р-сть солей 501, 646
реакции 464
Хлорноватая к-та 459
откр. в прис. НС1 и HNOs 462
р-сть солей 496—499, 501
реакции 460
соли, опред. сод. гипохлоритов
462
Хлорноватистая к-та 343
р-сть солей 495
реакции 344
Хлороплатинаты, см. Платииохлори-
стоводородная к-та
Хризоберилл 210, 584
Хром 218
двухвалентный 218
полумикр. опред. 535
р-сть солей 497
трехвалентный, реакции 219
щестивалентный, реакции 227
Хроматы, см. Хромовая к-та
окисл. действие 48
полумикр. опред. 541
р-сть 496—499, 501
Хромит 218
Хромовая к-та 229 сл., 451
Хромотроп 2В 415
Хромотроповая к-та 592
Царская водка 84
Цвет мышьяковый 163
Цезий 641
отделение от К н Rb 645
откр. в ирис. К и Na 647
реакции 642
Целестин 294
Цементы 481
Цеолиты 481
Цервантит 180
Церий 612
трехвалентный, реакции 615
четырехвалентный, реакции 616
Церуссит 128
Цианаты, см. Циановая к-та
Цианиды, см. Цианистоводородная
к-та
Цианистая ртуть 366
Цианистоводородная к-та 360
откр. в прис. галоидоводородных
кислот, H.i[Fe(CN)e],
H3[Fe(CN)e] и HCNS 369
отнош. солей к прокалив. 367
полумикд. опред. 539
р-сть солей 495, 496—499
реакции 362
Циановая к-та 396
откр. в прис. цианида 398
р-.сть солей 500
реакции 397
Цинк 273
полумикр. опред. 536
р-сть солей 497
реакции 274
Цинковая обманка 273
Цинковая руда
красная 273
кремнистая 273
Цинковый шпат 273
Цинхонин 146
Циркои 597
Цирконий 597
реакции 598
Цитраты, см. Лимонная к-та
Чувствительность реакций 108
Чугаева реакция 260, 575
Шеелева
медная руда! 633
свинцовая руда 633
Шеелит 633
Шпат
висмутовый 143
известковый 289
марганцовый 243
плавиковый 289
полевой 210
— калиевый 309
— натриевый 314
тяжелый 296
цинковый 273
652
Шпейсовый кобальт 265 Электролиз 17
Шпинель 210, 299 Штаре реакция 425 Электролитическая диссоциация 14 сл.
Штольцит 633 Щавелевая к-та 416 Электролитическая упругость рас- творения 54 Электролиты
анализ солей 419 полумикр. опред. 540 амфотерные 72 сл. ионизация 26
р-сть солей 496—499, 500 реакции 417 Щелочные земли 641 Эвклаз 584 Элементы, реакции 109 сл. Эммонзит 551 Энстатит 300 Эффект солевой 40 Эрбий 611
Эвксенит 602, 636 Эйкарит 547 Электродвижущий ряд 54 Электродные потенциалы 54 окрашивание пламени 610 Эритрит 265 Яшма 478
Редактор М. И. Лапшин Техн, редакторы: М. С. Лурье и П. В. Погудкин
Сдано в производство 2 /I 19-15 г. Подписано к печати 2</Щ 1946 г, Л 01183. Формат бОХ^/ц.
Печатных лист в 41,5. Уч.-издат. листов €5. Число типогр. знаков в 1 печ. листе 60080.
Тираж 25 000 экз. Заказ № 982. Цена в переплете 42 руб.
4-я типография пи. Епт. Соколовой треста «По.тиграфпяпга» ОГИЗа
при Совете Минис:ров ГСФСР; Ленинград, Измайловский рр., 29.
К ЧИТАТЕЛЮ
Прежде чем пользоваться книгой, исправьте следующие опечатки
Стр. Стропа Напечатано 1 | Должно быть
10 10 св. качественности качественн: го
16 10 св. Н„О Н3О'
35 11 СИ. HSO'i HSO'
40 31 св. /в * А /в и А
42 1 св. атом отрицательного иона, вступающего в комплекс отрицательный ион, вступающий в комплекс
42 3 св. Г (№2)2 1 Со L (NH3)4 J Г (no2)2 1 Со L (NH3)J
45 28 св. F- Fe"'
50 27 св. Zn' Zn"
51 22 св. CI3O3 СЮ'
63 3 св. [vo'} [H]« [VO'][H'P
[VO"} [VO"]
68 2 св. Cs c
105 табл. 15,2-я графа, последняя строка (CH3COO2)UO2 • 2Н,0 (СН3СОО)2ио2 2H2O
133 11 св. 2PbJ • SnJ2 2PbJ2 SnJ2
145 8 св. Bi" Bi'"
155 13 св. 4— >
OH:NOH \/ H C = NOH
158 27 св. 2 | /Xoh ч /Хон
165 19 св. 2AsO" 2AsO"'
203 табл. 111,2-я стр. св. Раствор: РЬ" Раствор: РЬ' >
213 22 св. Al'" 2АГ"
236 26 св. Fe''-ион Fe"'-HOH
328 18 сн. (HSNOH) (HgNOH)'
371 16 св. 4 •—>
397 14 св. Цианиты Цианаты
455 15 св. H2[Fe(CN)5NO2] H2[Fe(CN)6NO]
16 св. Na2[Fe(CN)6NO2] Na,[Fe(CN)bNO]
458 17 св. нитраты (соли азотной нитриты (соли азотистой
Продолжение
Стр. Строка Напечатано Должно быть
466 24 св. и элементарный в элементарный
479 29 св. H2SiOe H2SiO3
519 Табл. XV. графа В, 2 стр. св. Мп,С12 Мп С С
527 5-я графа, 1 стр. св. СНОСОМ СНЗСООН
;550 14 сн. под над
613 17 св. гидроокиси гидрата
Зак. № 982. Тредвелл, Голл, т. 1.