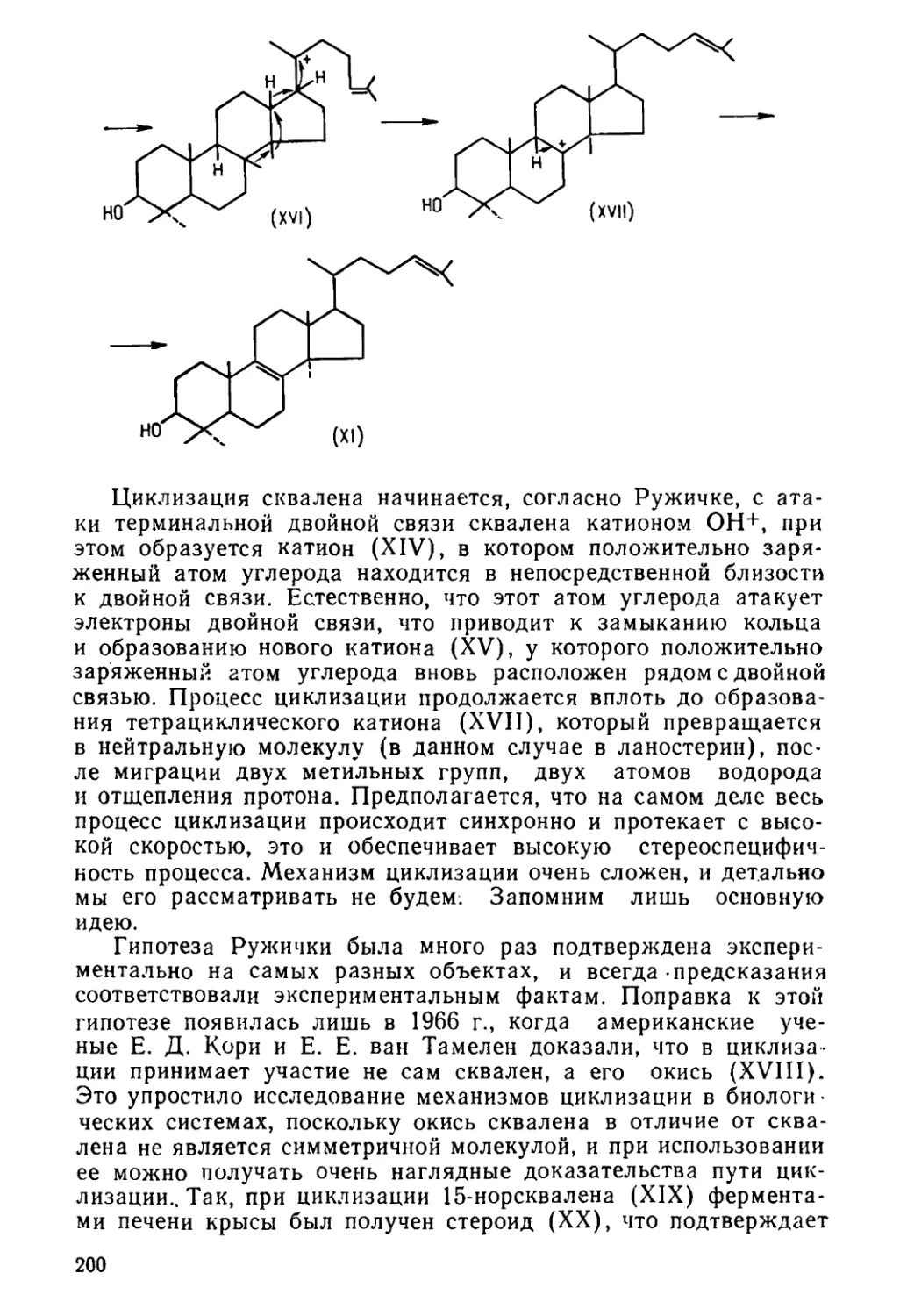
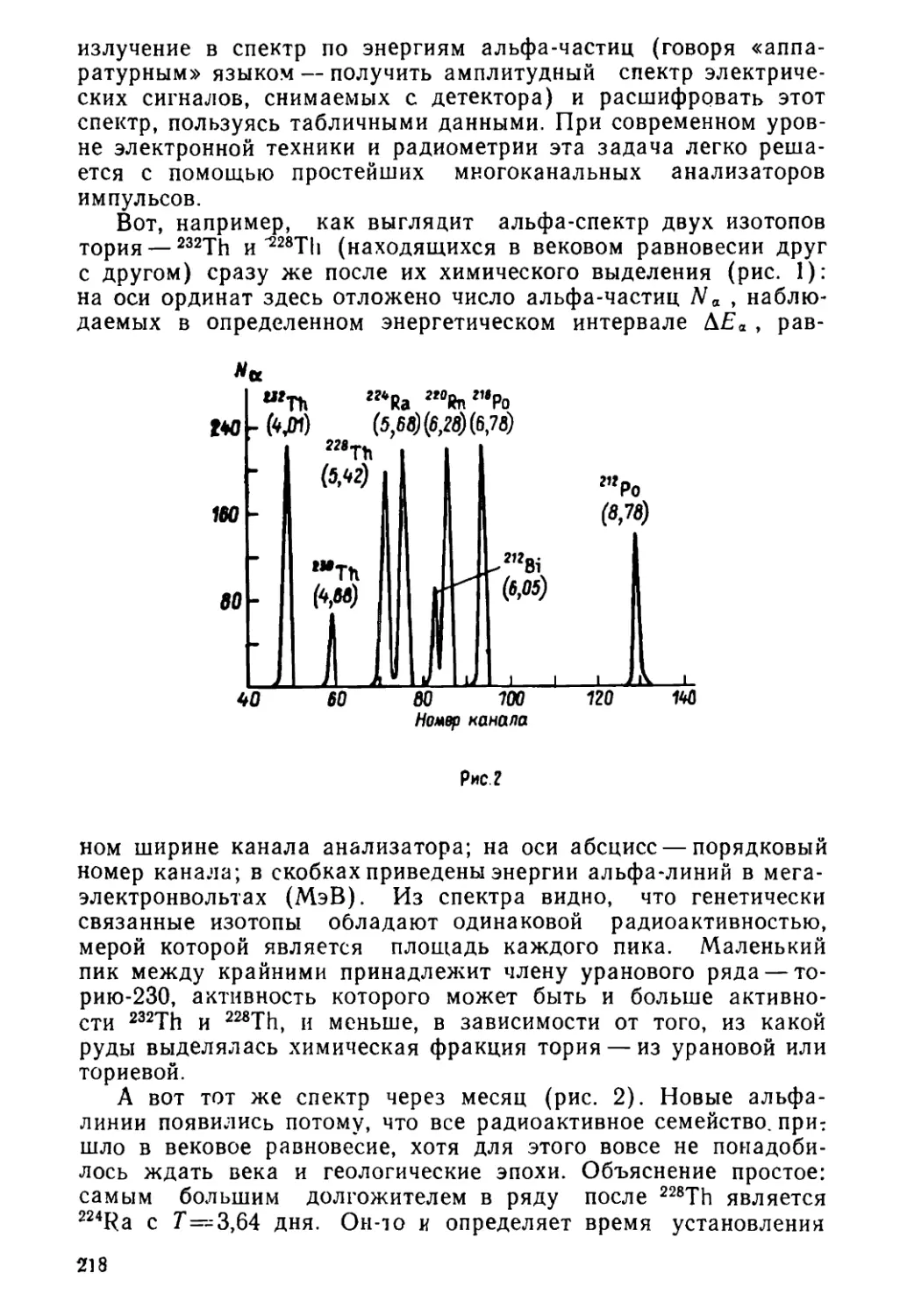
Author: Богданов Р.В.
Tags: химия химические науки геохимия физическая химия органическая неорганическая химические исследования химические материалы
Year: 1985
Text
ЛЕНИНГРАДСКИЙ
ОРДЕНА ЛЕНИНА
И ОРДЕНА ТРУДОВОГО
КРАСНОГО ЗНАМЕНИ
ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ
имени А. А. ЖДАНОВА
химия-
И ТРАДИЦИОННАЯ
*Р
ПАРАДОКСАЛЬНАЯ
Под общей редакцией
канд. хим. наук
Р. В. Богданова
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА
1985
Печатается по постановлению
Редакционно-издательского совета
Ленинградского университета
ББК 24
Х46
УДК 54(0.21.4)
Х46 Химия — традиционная и парадоксальная/
Д. Ю. Ступин, М. К. Хрипун, Г. А. Скоробогатов
и др.; Под ред. Р. В. Богданова — Л.: Изд-во Ле-
нингр. ун-та, 1985. — 312 с.
В книге нашли отражение некоторые разделы неорганической,
физической и аналитической химии, био- н геохимии, а также некоторые
вопросы методологии химии, химического образования и взаимосвязи
химии с другими областями знания. Особенность данного издания состоит
в том, что эти темы не просто «отражены>, а показаны своими
малоизвестными или неожиданными сторонами, изложены в необычном
освещении или в новой трактовке. В книге можно прочитать о некоторых
новых областях исследования, новых методах, новых взглядах и
идеях, в общем, о всем том, что и принято называть «развитием науки»,
показанном на конкретном химическом материале.
Для широкого круга специалистов и вообще для всех читателей,
интересующихся современной химией. Ил. 70. Табл. 12.
ББК 24
Рецензенты: д-р хим. наук А. А. Макареня (ЛГПИ
им. А. А. Герцена), канд. хим. наук И. С. Дмитриев (ЛГУ)
(©Издательство
х1801000000-140 80_8Б %££££Г
076(02)—85 1985 г
СОДЕРЖАНИЕ
Введение:
Между обыденным и парадоксальным (Р. В. Богданов) ... 5
Химия трех агрегатных состояний:
Химические соединения без химических связей (Д. Ю. Ступин) 13
«Парадоксы» концентрированных растворов (М. К. Хрипун) 42
Быстрые реакции... инертных газов (Г, А. Скоробогатов) . . 69
Химия физических воздействий:
Активированная вода (А. А. Онацкая, И. И. Музалевская) . 88
Химия и вычислительная техника:
ЭВМ изучает структуру жидкости (Е. М. Пиотровская) . . . 114
Химия и метрология:
Ионоселективные электроды — искусственные сенсоры
(Т. Я. Барт) 138
Химия и познание:
Анализ, аналитика, метрология и поэтика (А. К. Чарыков) 159
Химия фундаментальная и прикладная:
Где кончается химический анализ и начинается аналитическая
химия? (Л. Н. Москвин) 172
Химия: конкретная диалектика развития:
Неожиданная логика бионеорганической химии (Д. В. Ко- .
рОЛЬКОв) , ■ jgj
Химия и медицина:
Стратегия поиска новых лекарственных веществ (А. Г. Шавва) 192
Химия и геология:
Судьба дочернего урана (Р. В. Богданов) 212
Химия и образование:
Как постигнуть огромный мир химии (В. И. Яванский) . . 253
Химия и жизнь:
«Контрапункты» Менделеева (И. Н. Семенов) 273
Химия и Universum:
Больцмановские кинетические уравнения: от атомов до
Вселенной (Г. А. Скоробогатов) 289
МЕЖДУ ОБЫДЕННЫМ
И ПАРАДОКСАЛЬНЫМ
ет, читатель, не ищите в этой книге хитроумных
головоломок, тонких софизмов, каверзных химических
задач. Не поможет вам эта книга «подтянуть» ваши
знания по химии или сдать вступительные экзамены
в вуз. (Вообще, на узкоутилитарный подход она вряд
ли рассчитана.) Две мысли, две стороны химии мы стремились
отразить в книге и тем самым представить эту область знания
как бы в двух измерениях. Первая сторона — ее идейное
богатство, неисчерпаемость творческих возможностей, органическая
связь со всем, что есть на Земле, что сотворено умом и руками
человека. Эта мысль давно уже в доказательствах не
нуждается, но каждое время иллюстрирует ее по-своему.
Химия — словно великолепный бриллиант, играющий
разноцветными гранями. Мы высвечиваем одну из них,
наслаждаемся блеском и переливами красок; потом поворачиваем кристалл
другой плоскостью и видим картину иную, но не менее
захватывающую; рассматриваем третью грань, четвертую... И число
их столь велико, что, кажется, имеешь дело с россыпью
самоцветов, с каким-то сказочным калейдоскопом, строгой
фантазией его бесчисленных узоров, которые никогда не повторяются.
А когда думаешь о химическом исследовании, то
представляется шахматная партия, где едва заметное отклонение от
теории в дебюте, один нетрадиционный ход — и вся партия
приобретает непредсказуемое развитие, становится тысячью загадок,
благодатным полем для игры ума, изобретательности и
многоходовых комбинаций. Как бы хотелось, чтобы книга о химии
была бесконечной толщины с бесконечным числом авторов!
Такую книгу пишет Время. А пока ограничимся той дюжиной
рубрик, которые представлены в «Содержании» книги и
которые, конечно, лишь в малой степени отражают все
бесчисленные грани этой науки.
5
Обратимся к названию книги. В нем заключена вторая
мысль, которую мы хотели бы донести до читателя и которая,
по нашему замыслу, должна объединять все очерки. Эту мысль
однажды точно выразил доктор химических наук О. Ю. Охло-
быстин: «Подлинно научное знание парадоксально и в большом
и в малом» (Химия и жизнь, 1983, № 10). В одних очерках
эта сторона химической науки нашла отраженье уже в теме,
заглавии; в других проявляется не столь наглядно, но тем не
менее элемент нетрадиционности присутствует везде.
Заглянем, например, в очерк Д. Ю. Ступина, посвященный
клатратам. Обнаружение таких веществ явилось когда-то
большой неожиданностью, но к настоящему времени пора
удивлений и восхвалений прошла: все строго обосновано, рассчитано,
проверено и, казалось бы, нечем поразить воображение
читателя. Но если бы так! Природа клатратов столь необычна, что
обыденное восприятие не всегда может примириться с их
существованием. Сошлемся на одну научную дискуссию.
Во многих минералах обнаруживается явно избыточное
количество изотопа 40Аг относительно его материнского
радионуклида 40К. Первое и наиболее естественное объяснение такое:
аргон был захвачен растущим минералом из окружающего
флюида с последующим образованием соединений включения,
подобных клатратам. В качестве альтернативных предлагаются
варианты: 1) кажущийся избыток изотопа аргона является
результатом более высокой скорости радиоактивного распада
изотопа 40К в ранние геологические эпохи; 2) избыточное
количество 40Аг объясняется спонтанным делением вымерших
радиоактивных элементов с номерами 108 и выше.
Разумеется, и у тех, и у других ученых имеются свои
аргументы, обсуждать справедливость которых не беремся. Этим
примером мы хотели лишь показать, что на чашу весов,
уравновешивающую такую скромную химическую модель, как клат-
ратообразование, ставятся столь экзотические гипотезы, как
непостоянство мировых констант или распад элементов,
которых до сих пор никто не видел.
Так что, видите, есть клатраты, а верится в них с трудом
и не всегда. Вот такой парадокс нашего мышления. А ведь это
далеко еще не «дальновидение» и не «феномен НЛО».
Отдавая дань строгому расчету, анализу строения и свойств
клатратов, автор очерка показывает нам всеобъемлемость,
вездесущность, универсальность этих не слишком стойких, порой
эфемерных, но все же реальных веществ.
Другой пример, другой очерк. Слово «ЭВМ» сейчас стало
расхожим. Электронно-вычислительные машины не только
символизируют революцию в науке и технике, но и неотступно
входят в наш дом, быт, повседневную жизнь. ЭВМ облегчает
труд человека, выполняя за него многие рутинные операции.
Но мы предостерегаем читателя от такого традиционного вос-
6
приятия названия очерка Е. М. Пиотровской «ЭВМ изучает
структуру жидкости». (Ради еще одной иллюстрации
быстродействия компьютера не стоит отнимать время у читателя.)
Обратите внимание на слово «изучает». Здесь ЭВМ
действительно не обрабатывает полученные в эксперименте
результаты (выполняя как бы подсобную работу), а сама набирает
массив экслриментальных данных. Здесь ЭВМ — не
обслуживающий персонал, а «соавтор» научного исследования.
Видимо, читатель испытывает некоторое недоверие к этим
словам? — Вполне естественно. В таком же положении
оказался в 1968 г. Комитет по делам открытий и изобретений,
когда получил заявку на открытие так называемого Г-слоя—
нового физического эффекта в магнитогидродинамических
генераторах. И как тут не удивиться, если реальное физическое
явление открыто не под пером физика-теоретика и не в
результате лабораторных исследований, а в ходе «вычислительного
эксперимента», который выполнила ЭВМ. После периода
сомнений предсказанное компьютером явление было
зарегистрировано как открытие под номером 55 в Государственном
реестре.
Е. М. Пиотровская иллюстрирует возможности и принципы
«вычислительного эксперимента» на примере изучения
жидкости. Однако объектом такого эксперимента может служить
любая система с достаточно большим числом частиц,
взаимодействием между которыми нельзя пренебречь. (В противном
случае такую систему можно было бы изучить методом
статистической физики.) Главная же забота исследователей при
постановке численного эксперимента — задать машине в
математической форме адекватный закон взаимодействия между
частицами, а машина сама будет перебирать варианты
поведения системы в различных ситуациях. (Для такого перебора
используют генератор случайных чисел, например на основе
метода Монте-Карло.) Такое машинное моделирование
природных явлений, такой «мысленный» эксперимент применяют
с успехом особенно тогда, когда эксперимент -реальный по тем
или иным причинам поставить невозможно.
Очерк Т. Я. Барт называется «Ионоселективные
электроды— искусственные сенсоры». Такой заголовок вполне
правомерен: чудесный аналитический инструмент, каким является
ионоселективный электрод, обладает свойством «чувствовать»
присутствие тех или иных веществ в газах, растворах (в том
числе—биологических). Это прибор, которого давно ждали,
но который является детищем последних десятилетий: на
наших глазах он появился на свет, развивался, мужал и,
вероятно» в будущем, совмещенный on line с ЭВМ, станет нашим
советчиком и «управляющим» по многим делам. Контуры этого
°УДущего видны уже сейчас. Многие знают (а некоторые —
и на собственном опыте), что в настоящее время нет необхо-
7
димости в долгом и неприятном зондировании для определения
кислотности желудочного сока. Достаточно проглотить на
короткое время компактный стеклянный электрод,
чувствительный к ионам водорода, и стрелка милливольтметра покажет
значение рН. Столь же экспрессно ионоселективные
электроды позволяют определять в крови человека концентрацию
калия, кислорода, углекислого газа, что важно при несчастных
случаях или в процессе сложных хирургических операций.
Выполняют эти датчики и другие важные аналитические
функции, диапазон которых будет расти по мере
совершенствования конструкций приборов.
Это одна сторона дела, как раз та, которая чаще всего
попадает на страницы массовых изданий. А вот оценит ли
читатель вторую, более сложную, но не менее привлекательную
сторону данной темы? Вся ионометрия — это своего рода
«термодинамический нонсенс». Термодинамика накладывает
принципиальный запрет на возможность определения активности
отдельного сорта ионов: измерять можно только активность
электролита в целом. И как раз ионоселективный электрод дал
возможность — нет, не преодолеть этот запрет, не перешагнуть
через него, а деликатно обойти. Пусть в какой-то степени
условно, относительно, но дело с мертвой точки он все-таки
сдвинул. А это очень важный шаг в познании окружающей нас
природы. Каким путем это достигается, читатель и узнает из
очерка Т. Я. Барт.
Мы, наконец, начинаем понимать, что нужно не «побеж-
дать» природу, а учиться у нее. Изучаем строение тел рыб,
и других морских животных, чтобы создавать оптимальные
конструкции плавательных аппаратов; оценили бионику и уже
используем принципы й особенности жизнедеятельности
организмов для создания новых приборов и механизмов; обратили
внимание на природную архитектуру, чтобы и от нее
заимствовать рациональное зерно. И, конечно, лечить болезни мы
тоже стараемся, по возможности, народными, а это значит,
природными средствами с их мягким и всесторонним действием
на организм. Но, видимо, не все, что создано природой, и есть
самое совершенное. Существует точка зрения, что в наших
генах уже заложена программа старения человека. И чтобы эту
программу изменить, чтобы продлить жизнь «венца»
природы— человека, влить в его организм естественные защитные
силы, нужно идти наперекор природе, применить те средства,
которые сама природа не предусмотрела. Не об этом ли писал
К. Чапек: «Для того чтобы осуществить то, что делает
природа, он <человек>... вынужден подходить к делу
совершенно иначе. В этом и состоит невероятность и парадоксальность
изобретений»? Иллюстрацией такой стратегии при
создании новых лекарственных препаратов служит очерк
А. Г. Шаввы.
а
Конечно, рассказывая читателям о чем-то новом и даже
необычном, сами авторы вряд ли непременно испытывают
«священный трепет» прикосновения к очередной загадке природы.
Для них процесс «постижения непостижимого» заканчивается
раньше, чем для читателя, после чего наступают научные
будни. К. Маркс в работе «Заработная плата, цена и прибыль»
писал: «Научные истины всегда парадоксальны, если судить на
основании повседневного опыта, который улавливает лишь
обманчивую видимость вещей». Свою мысль Маркс далее не
развивает, но смысл ее ясен: то, что для рядового наблюдателя
или читателя еще лежит в сфере парадоксального, для
специалиста уже подчас лишено ореола загадочности и
приобрело вполне прозаический характер. «Чудеса исчезают, как
только мы разберемся в них», — говорил Вольтер. Эта особенность
восприятия научных истин специалистом, а следовательно, и их
преподнесение читателю невольно проявились и в данной книге.
В качестве примера сошлемся на очерк А. К. Чарыкова
«Анализ, аналитика, метрология и поэтика». Столь неожиданный
ракурс, отраженный в этом заголовке, уже сам по себе
интересен. Мы не будем пересказывать причудливые повороты
сюжета и одновременно единство аналитического подхода,
развиваемого автором. Обратим внимание на одну историческую
метаморфозу. Чарыков пишет: «Таким образом, эпитет
„химический*1 перед словом „анализ*' означает не способ анализа,
а характеризует уровень рассмотрения состава и структуры
веществ — атомный, молекулярный и надмолекулярный».
И этими словами очерк заканчивается, можно сказать,
обрывается. Но за ними скрывается так много смысла, что
хочется поставить не точку, а двоеточие.
Кто сейчас не наслышан (или не начитан) о таких
методах определения химического состава веществ, как
эмиссионный спектральный анализ, атомно-абсорбционный анализ, рент-
геноструктурный анализ, рентгенофлуоресцентный анализ,
нейтронно-активационный анализ и т. д. Хотя эти методы
прочно вошли в арсенал химии, осуществляться в
инструментальном варианте они вполне могут оператором, не имеющим
химического образования. Химик здесь лишь ставит задачу.
И если читать очерк Чарыкова глазами такого
техника-оператора, то ничего необычного в сочетании слов «химический
анализ» мы не заметим. Если же употреблять этот термин в его
первозданном смысле (т. е. как набор тонких химических
операций, скрупулезно и искусно выполняемых
химиками-аналитиками), то противоречие между традиционным восприятием
этих двух слов и вкладываемым в них современным
содержанием разительно. Целый век понадобился, прежде чем в эти
старые мехи было влито молодое вино. Таков результат,
говоря общими словами, научно-технического прогресса; такова
неизбежная диалектика развития химических понятий и тер-
9
минов. Взаимопроникновение наук, интеграция идей и
методов и одновременно дифференциация областей научного
познания (о чем более подробно рассказывается в очерке
Д. В. Королькова, посвященном бионеорганической химии) —
своеобразный диалектический парадокс науки XX в.
Очерк Л. Н. Москвина ставит нас перед другой нелегкой
проблемой: где кончается прикладная наука и начинается
фундаментальная? Ответ на этот вопрос не так прост, как
может показаться. Предметом раздумий автора является
аналитическая химия, но этот вопрос можно в той или иной мере ад-
^совать и другим областям химии. Например, наглядно и
даже слегка гротескно проявляется он в радиохимии. Сколько
радиохимиков на Земле, столько, вероятно, и дефиниций этой
науки. В частности, широко распространено мнение, что если
в исследовании применяются меченые атомы (радиоактивные
индикаторы), то такая работа является радиохимической.
Работа-то, может, и радиохимическая, да радиохимии не
принадлежит. И парадокса в этом никакого нет. Радиохимический
метод вовсе не тождествен радиохимической задаче. Главное,
утверждает Москвин, цель исследования. Цель определяет все.
Ни метод, ни стены, ни паспорт, выданный
санитарно-эпидемиологической станцией, никакие иные деловые или
околоделовые соображения значения не имеют. Только цель. А отсюда
нетрудно уже перекинуть мостик и дальше — к определению
понятия соответствующей химической дисциплины, к
содержанию учебных курсов и методологии преподавания.
Не будем утомлять читателя реферированием или
комментированием всех очерков без исключения. Вряд ли необходим
столь подробный путеводитель по книге, как и докучливый
посредник между автором и читателем. Коснемся еще лишь
очерка «Активированная вода» (А. А. Онацкая, Н. И. Музалев-
ская). Его название невольно наводит на мысли о «княгине
Марье Алексевне». И не потому, что очерк неинтересен (как
раз наоборот), а потому, что эта тема каким-то образом
(скорее всего из-за небрежности отдельных исследователей)
умудрилась заработать клеймо «лженаука». И это несмотря на то,
что активированная вода или, точнее, активированные водные
растворы снимают накипь в котлах, оказывают действенную
помощь в сельском хозяйстве, лечат людей. Сама по себе
данная тема, как видно из очерка, не несет никакой
сенсационности. Поэтому, думается, что те ее критики, имена которых
появляются на страницах научно-популярных журналов, когда
надо «разоблачить» очередную «лженауку», путают, как это
часто бывает, тему исследования и уровень оформления
эксперимента, т. е. адекватность применяемого
исследовательского метода (если, конечно, не руководствуются более
элементарными соображениями). Ответить им здесь можно ювелирно-
точными словами академика А. Б. Мигдала: «Я был бы очень
10
рад, если бы серьезные экспериментаторы непредвзято
изучали явления такого рода» как телепатия... Исследуйте телекинез,
вертящиеся столы, сгибающиеся под взглядом вилки,
расцветающие от прикосновения рук цветы, пугающиеся человеческих
угроз деревья, — исследуйте, ставьте эксперименты, но только
эксперименты научные, по правилам, принятым в науке со
времен Френсиса Бэконам (Наука и жизнь, 1982, № 1). С
другой стороны, можно изучать, скажем, строение ядра, но если
выводы о приложимости капельной модели делать на основании
спектрофотометрических или калориметрических измерений, то
это и будет лженаукой в чистом виде.
Конечно, каждый исследователь не застрахован от
промаха, даже такие гении, как Резерфорд, Эйнштейн, Ферми. Но,
перефразируя известный афоризм, заметим, что может
ошибаться отдельный исследователь все время или все
исследователи некоторое время, но невозможно, чтобы ошибались все
исследователи все время. (Если только все они не совершают
одну и ту же систематическую ошибку, чего в условиях
десятков различных лабораторий и методов практически невозможно
достичь, даже если к этому стремиться.) В статистической
теории ошибок рассматриваются, как известно, ошибки двух
родов: 1) возможность не заметить искомый сигнал и 2)
возможность принять за него сигнал фона. Заручившись уровнем
значимости, скажем, 0,0001, а следовательно, доверительной
вероятностью результатов 0,9999, мы застрахуем себя от ошибки
второго рода и не примем ложный сигнал за ожидаемый
эффект. Но в этом случае, к сожалению, мы пропустим и нужный
сигнал, если таковой появится. Ячейки сита, через которые
просеиваются ошибки, должны быть шире. Иначе на нашу
долю останется фиксировать лишь обыденное и никогда не
встретиться с парадоксальным. Истина пройдет где-то рядом.
Кстати, к вопросу об истине и популярных книгах.
Приятнее всего, наверное, писать такие книги, где излагаются
конечные результаты исследовательского труда и их эффектное
применение в практике, будь то освоение космоса, лазерная
техника, волоконная оптика и т. п. Все это просто само просится
на страницы популярных книг. Но при таком подходе к
изложению нередко из повествования выпадает самое главное —
долгий и трудный путь добывания этого конечного результата,
путь медленного приближения к истине. Нет, говорят авторы
данной книги, мысль читателя должна пройти тот же самый
путь, какой прошла мысль исследователя, хотя это и трудно,
а порой, может быть, и скучно. И поэтому легкой жизни
авторы книги не создают ни себе, ни читателю. Вместо
окончательных истин в праздничных упаковках они вводят в свои
рассказы рядовой, будничный химический эксперимент, и
читатель становится его свидетелем и судьей. В стремлении
к точности и аргументированности авторы демонстрируют нам
11
таблицы, графики, расчеты, реакции, модели... А некоторые
даже рискнули ввести в очерки оригинальные исследования, не
опубликованные еще в специальной литературе. Поэтому у
читателя имеются неограниченные возможности не только для
выработки собственной точки зрения, но и для конструктивной
критики. И эту критику авторы книги, несомненно, учтут и
примут с благодарностью.
ХИМИЧЕСКИЕ СОЕДИНЕНИЯ
БЕЗ ХИМИЧЕСКИХ СВЯЗЕЙ
«В ТЕ ВРЕМЕНА УКРОМНЫЕ, ТЕПЕРЬ ПОЧТИ БЫЛИННЫЕ...»
первой трети XX столетия в США начались
промышленная эксплуатация месторождений природного
газа и строительство магистральных газопроводов.
В холодное время года на некоторых из них стали
происходить аварии — разрывы труб,
сопровождавшиеся большими потерями газа и пожарами. Причиной аварий
оказались «пробки» из кристаллогидратов природного газа,
забивавшие газопровод на протяжении десятков и сотен
метров. Это послужило толчком для интенсивных исследований
газовых гидратов, относящихся к особому классу нестехиомет-
рических соединений включения — клатратам.
Первый газовый гидрат получил знаменитый английский
химик Хэмфри Дэви. В 1810 г. на лекции в Лондонском
Королевском обществе он сообщил, что водный раствор оксиму-
риевой кислоты, представлявшей собой газ желто-зеленого
цвета (который он предложил назвать хлором), замерзает при
температуре выше 273 К, т. е. при более высокой температуре,
чем чистая вода. О столь несущественном факте, подумает
читатель, вряд ли стоило докладывать Королёвскому обществу.
Стоило, читатель, стоило. И Дэви, и его коллеги отлично
знали, что растворы хорошо растворимых в воде веществ — и
неорганических (солей, кислот, щелочей), и органических
(спиртов, альдегидов, кетонов, углеводов и др.)—замерзают при
температурах ниже 273 К. Например, насыщенный водный
раствор NaCl кристаллизуется вблизи 250 К (и это его свойство
иногда используют для устранения ледяного покрова на
тротуарах, посыпая их солью), а концентрированные водные
растворы этиленгликоля и глицерина не замерзают и при 233 К,
поэтому эти растворы-антифризы заливают зимой в радиаторы
автомобилей. В то же время газы, за исключением сильно
полярных галогеноводородов, аммиака и некоторых кислотных
13
оксидов, растворяются в воде плохо: концентрации их
насыщенных растворов при давлении газа 1 атм (1013 гПа), и Г =
= 273 К обычно не превышают 10~3—Ю-5 моль/л. И вот из
такого разбавленного раствора почему-то выделяется
кристаллогидрат, скажем, при 275 или 278 К («сдвиг вверх» от 273 К
определяется давлением газа). Этот незначительный научный
факт, замеченный Дэви, позже окажется открытием нового
класса соединений — клатратов.
В 1823 г. не менее знаменитый, чем Дэви, его ученик и
помощник Майкл Фарадей установил, что состав
кристаллического гидрата хлор!а приблизительно соответствует формуле
С12-10Н2О. Однако Фарадей указал на возможность неполной
осушки кристаллов и частичной потери газа в ходе анализа.
Работа Фарадея выявила большие сложности при проведении
прямого анализа газовых гидратов. И если учесть, что в те
времена господствовали представления о строгой стехиометрии
химических соединений, то можно не сомневаться в
ожесточенности споров о составе газовых гидратов.
В последующие 100 лет были определены условия
кристаллизации, примерные составы и термодинамические
характеристики, т. е. теплоты образования и равновесные давления
паров при 273 К, примерно для 40 гидратов: Cl2, H2S, C02,
СНС13, S02, Аг, Кг, Хе, некоторых углеводородов, эфиров и
аминов. Одновременно химики пытались выяснить природу сил,
объединяющих молекулы таких газов, как, например,
инертные, и молекулы воды в кристаллические соединения. Здесь
уместно напомнить, что твердые газовые гидраты Аг, Кг и Хе
были известны задолго до 1962 г., когда Н. Бартлет сначала
предсказал существование, а затем синтезировал фторплати-
нат ксенона XePtF6 оранжевого цвета, после чего инертные
газы перестали считать благородными.
Так вот. Было очевидно, что в гидратах газов действуют
силы, значительно более слабые, чем обычные валентные,
поскольку гидраты легко разлагаются. Открылась и еще одна их
особенность: при попытках провести прямой анализ газового
гидрата в нем всегда обнаруживается либо жидкая вода, если
гидрат получали при температуре выше 273 К, либо лед, если
температура была ниже 273 К. Кроме того, равновесное
давление паров над любой гидратной системой (а оно равно сумме
давлений газа и паров воды) не зависит от содержания воды
в ней, и определяется только температурой.
Мы только что применили термин «гидратная система»
и чувствуем, что в дальнейшем разговоре о газовых гидратах
без некоторых новых понятий не обойтись. «Ничто так не
враждебно точности суждения, как недостаточное
различение»,— эти слова англичанина Берка А.С. Пушкин собирался
использовать в качестве эпиграфа к 1-й главе «Евгения
Онегина». И мы последуем этому совету.
14
НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ
«Гидратная система» — этот термин подчеркивает;
принципиальное отличие газовых гидратов от обычных стехиомет-
рических соединений. Любое из этих последних имеет строго
определенный состав, в большинстве случаев не
изменяющийся в широком интервале температур и давлений, а также
определенные температура плавления и кипения. У газовых же
гидратов эти характеристики отсутствуют, а состав
непостоянен, С точки зрения термодинамики их следует отнести к
твердым растворам, т. е. фазам переменного состава. Иногда
термином «фаза» обозначают агрегатное состояние вещества:
твердое, жидкое или газообразное (например, лед, жидкая
вода или водяной пар), и в этом случае любая из фаз имеет
постоянный состав. Но, во-первых, вода в твердом
состоянии (лед) существует в 9 различных модификациях, и
каждая из них тоже является фазой постоянного состава;
во-вторых, имеется гораздо большее число газообразных, жидких
или твердых веществ, называемых растворами, состав которых
можно варьировать в широких пределах, а изменения
агрегатного состояния или появления границы раздела при этом не
наблюдается. Жидкими фазами переменного состава
являются, например, бензин, морская вода, водные растворы сахара
или спирта; твердыми растворами — монетные сплавы или
окрашенные драгоценные камни (красный цвет рубина
вызывается присутствием малых количеств оксида хрома в
бесцветном оксиде алюминия — корунде, а синий цвет сапфира —
оксидами железа и титана в нем). Поэтому более строго фазу
определяют как область пространства, однородную по составу
на всем своем протяжении. Поскольку состав газового гидрата
может изменяться при изменении температуры или давления
газа, то газовые гидраты относят к фазам переменного состава.
В 1876 г. американский физик Уиллард Гиббс вывел
знаменитое правило фаз, которое дает ответ на следующий
вопрос: «Если химическая система находится в равновесии и
состоит из с компонентов и ф фаз, то какому числу интенсивных
термодинамических переменных можно одновременно придать
произвольные значения?». Что такое фаза, мы уже знаем. Под
числом же компонентов с понимают минимальное число
веществ, необходимых для определения состава системы.
Например, в равновесной системе
СаСОз(Тв)^СаО{ТВ) + С02(г) (1)
имеются 3 вещества, но 2 компонента, так как в каких бы
соотношениях мы ни брали эти 3 вещества, каждый раз смесь
будет реагировать до тех пор, пока в системе не установится
одно и то же равновесное давление ССЬ, определяемое темпе-
15
ратурой. Следовательно, наличие любых двух веществ
автоматически определяет равновесную концентрацию третьего.
Можно поместить в сосуд 1 г равновесной системы (1) или 103 г ее
в сосуд большего объема, все равно при определенной
температуре в обоих сосудах будет одно и то же давление С02.
Равновесная система (1) состоит из трех фаз — двух твердых и
одной газовой. Конечно, можно так нагреть сосуд, что весь СаС03
разложится и в системе останутся 2 фазы: твердый СаО и
газообразный С02, но это уже будет не первоначальная система.
Чтобы оставить ее трехфазной, необходимо увеличить
концентрацию С02, введя в сосуд дополнительное количество С02
или уменьшив объем сосуда при неизменной массе веществ.
Наконец, термодинамическими переменными системы
называют измеряемые на опыте величины: объем системы V,
давление газа Р, температуру 7, объемы фаз V,-, их массы пц,
теплоемкости Cvi и СР/, показатели преломления пи
концентрации компонентов в фазах, например *н,0 и *so2 для си"
стемы Н20—SO2. Все эти свойства называют еще
макроскопическими. Некоторые из них не зависят от общего
содержания веществ в системе, поэтому их называют интенсивными.
К ним относятся температура и давление (они одинаковы в
любой точке системы), концентрации компонентов и некоторые
другие. А такие термодинамические переменные, как объем
системы, ее масса или число молей, энергия системы,
называются экстенсивными, поскольку их значения зависят от общего
количества вещества в системе.
Математическая запись правила фаз выглядит просто:
/ = 2 + с-ф,
где / — число степеней свободы. Чуть ли не основным
доказательством его справедливости послужило исследование
трехфазных равновесий в гидратной системе Н20—S02,
проведенное в 1884—1887 гг. выдающимся немецким химиком Г. Роозе-
бумом. Эта огромная по объему почти четырехлетняя работа
не только подтвердила правило фаз, но выявила те особенно:
сти газовых гидратов, о которых мы говорили выше.
«ВРЕМЯ СОБИРАТЬ КАМНИ...»
В 1849 г. немецкий химик Ф. Велер сообщил о получении
двух соединений гидрохинона с сероводородом —4СбН4(ОН)2Х
XH2S и 3C6H4(OH)2-H2S. И хотя в соответствии с
теоретическими представлениями того времени на целое число молекул
гидрохинона (Q) должно было приходиться целое число
молекул газа (М), Велер предположил, что он имел дело с одним
соединением, в котором на 3 молекулы гидрохинона
приходилось дробное число молекул H2S. Позже были получены со-
16
единения других газов с гидрохиноном с различным мольным
отношением M/3Q:
Аг Кг Хе НС1 НВг R.S SO, C02 СН3ОН
M/3Q .... 0,3—0,85 0,74 0,84 0,85 0,36 0,64 0,88 0,74 0,97
Другой немецкий химик К. Гофман в 1897 г. обнаружил,
что при добавлении бензола к раствору цианида никеля в
водном аммиаке образуется кристаллическое соединение состава
Ni(CN)2-NH3-C6H6, причем бензол удерживается в нем
настолько прочно, что удалить его можно только кипячением
с разбавленным водным раствором аммиака или перегонкой
с водяным паром в присутствии аммиака.
В 1914 г. русский химик А. П. Дианин, изучая реакции
конденсации фенола с непредельными кетонами, получил новое
соединение [4-(л-оксифенил) -2,2,4-триметилхроман]
следующего строения:
Дианин пытался выделить это. соединение в кристаллической
форме, но не сумел: какие бы растворители он ни выбирал,
продукт перекристаллизации обязательно содержал в себе
растворитель (М). Получались так называемые аддукты
следующих составов (в скобках дано соотношение числа молекул
хромана к числу молекул М): с (С2Н5)20 (8:1); с С9Н5ОН
(4: 1); с (СНз)2СО (4: 1); с СН3СООН (4:1); с CHCi3 (4:1).
Все эти аддукты оказались устойчивыми кристаллами с весьма
высокими температурами плавления (Тпл аддукта с диэтило-
вым эфиром, например, равна 171—172°С), что
свидетельствовало об образовании соединений, но без обычных химических
связей, поскольку из них можно было извлечь как хроман, так
и растворитель.
В 1930-е годы советский радиохимик Б. А. Никитин
получил кристаллические соединения фенола с газами: H2S, SOo,
НС1, НВг, СН3Вг, CH2Ci2 и исследовал их фазовые равновесия.
Он же изучал термодинамические основы сокристаллизации
газов в виде гидратов и сумел таким способом выделить
практически чистый радон из смеси с другими благородными
газами. На основании своих исследований Никитин заключил,
что кристаллические молекулярные соединения газов
образованы вандерваальсовыми связями (последние названы по име-
17
ни выдающегося голландского физика Я. Ван дер Ваальса,
предложившего в начале XX в. уравнение состояния реальных
газов).
ВРЕМЯ СТРОИТЬ
В 1947 г. английские химики Д. Палин и Г. Пауэлл
провели рентгеноструктурный анализ соединения гидрохинона с S02
и установили, что связанные между собой водородными
связями молекулы гидрохинона образуют 2 трехмерные подрешет-
ки, вставленные одна в другую. При этом получаются почти
сферические полости одинаковых размеров. Вся решетка в
целом была названа р-структурой, она отличается от обычной
кристаллической а-формы
гидрохинона меньшей плотностью
и, следовательно, большим
молярным объемом. Плотность
р-структуры равна 1,26Х
X Ю3 кг/м3, а стабильной
сестру ктуры — 1,33-103 кг/м3.
Разница вроде бы невелика,
всего 5%, но попробуйте
взятое наугад твердое тело
растянуть или сжать так, чтобы его
объем увеличился или умень-
шился на 5%! Металлические
гидоохинп* р-Ю¥чщро*йохиит балки, прочность которых
испытывают на специальных раз-
°ИС1 рывных машинах, рвутся
задолго до достижения такого
увеличения их длины. Все
знают, что наполненный водой закрытый стеклянный
сосуд, а иногда и открытый, но с узким горлом, непременно
разорвется при ее замерзании, поскольку плотность льда
примерно на 10% меньше, а удельный объем
соответственно больше, чем у жидкой воды. Так что
перестройка структуры гидрохинона в более рыхлую со сферическими
полостями требует энергетических затрат и, по сути дела,
определяет возможность или невозможность образования
соединения с газом. (3-структура гидрохинона представлена на
рис. 1. Кружки обозначают атомы кислорода: 6 атомов
кислорода от 6 молекул гидрохинона связаны между собой
водородными связями и образуют шестиугольник. Эти шестиугольники,
в свою очередь, связаны между собой ароматическими
кольцами, так что 2 атома кислорода от одной молекулы
гидрохинона принадлежат двум разным шестиугольникам. В полостях
р-решетки, напоминающих клетки, располагаются молекулы
SO2 или других газов, перечисленных выше.
18
Так как во всех соединениях гидрохинона с газами р-решет-
ка оказалась одинаковой, Палин и Пауэлл назвали ее
решеткой «хозяина», а молекулы внутри полостей — «гостевыми»
молекулами. Само строение этих соединений подсказало Пауэллу
их общее название — клатраты (греч. clathros — клетка).
В 40-х годах XX в. начались структурные исследования
газовых гидратов. Рентгеноструктурный анализ показал, что гид-
ратные решетки подобно решетке* льда образованы из
четырежды координированных и связанных между собой
водородными связями молекул воды. Но если кристалл обычного льда
имеет гексагональную симметрию и поэтому физические
свойства его, например теплопроводность и сжимаемость,
неодинаковы вдоль разных направлений (кристалл анизотропен), то
у гидратов газов решетки имеют кубическую симметрию и
являются изотропными. Именно на этом различии было основано
в XIX в. обнаружение ледяной фазы в образце гидрата:
анизотропные кристаллы льда поворачивают плоскость
поляризации у поляризованного светового луча, а газовый гидрат
«оставляет» луч неизменным. У водной решетки в газовых гидратах
больший, чем у решетки льда, молярный объем, и в ней
имеются полости с расположенными в них молекулами
газов-гостей. Отсюда следовало, что эти соединения являются клатра-
тами,' и в дальнейшем мы будем называть их клатратными
гидратами.
По аналогии с клатратами гидрохинона решетку клатрат-
ного гидрата называют р-решеткой, а ту фазу (жидкую воду
или лед), из которой его получают и которая находится с ним
в равновесии, — а-фазой.
Оказалось, что все клатратные гидраты, за исключением
гидрата брома, имеют одну из двух возможных структур:
1 или II. Тип структуры определяется размерами гостевых
молекул. Маленькие молекулы, такие, как 02, N2, Аг, Кг, Хе,
СН4, С12, окись этилена, образуют структуру I; большие —
С3Н8, CBrClF2, SF6, цикло-СбНю — структуру II. Вообще
клатраты с водой образуют очень многие неполярные или
слабополярные газы и жидкости с Гкип не выше ~335 К. Эта
температурная граница установлена экспериментально, но что-то
ведь скрывается за ней. Во-первых, в полостях водной решетки
могут поместиться молекулы не слишком большие, иначе
произойдет сильная деформация решетки и она разрушится. А чем
больше молекулы вещества, тем они тяжелее и тем выше Г„ип
этого вещества. Например, легкие углеводороды с числом
атомов углерода пс от I до 4 при обычных условиях — газы,
углеводороды с Лс от 5 до 8 — жидкости, Гкип которых тем выше,
чем больше Пс ; если лс>8, то эти углеводороды — твердые
вещества, трудно возгоняющиеся. Во-вторых, вещества могут
состоять из относительно малых молекул, например СН3СООН
или QH5OH, но их большие дипольные моменты создают
19
вблизи себя столь сильные электростатические поля, что эти
молекулы притягивают молекулы воды и разрушают
водородные связи, поэтому и клатрат образоваться не может.
Теперь давайте изобразим модели гидратов структур I и II
(рис. 2). В гидратах структуры I элементарная ячейка имеет
форму куба с длиной ребра 1,2 нм и содержит 46 молекул Н20
(приставляя такие кубики друг к другу, можно построить
кристалл клатрата, видимый невооруженным глазом). Эти 46
молекул воды образуют в элементарной ячейке 8 полостей —
6 больших 14-гранников (тетрадекаэдров) и 2 малых 12-гран-
ника (додекаэдра). Кружками на рис. 2 изображены молекулы
у
16 - гра ннин 12 • гранник 14 - гранник
(гексадекаэдр) (додекаэдр) (тетрадеказдр)
*" ■ Структура II Структура I
Рис 2
Н20. В додекаэдре все грани — правильные пятиугольники,
в тетрадекаэдре кроме 12 пятиугольных граней имеются еще
2 шестиугольные грани, параллельные друг другу.
В гидратах структуры II элементарная ячейка тоже
кубическая, но имеет длину ребра 1,75 нм и содержит 136 молекул
воды, которые образуют 8 больших полостей—16-гранников
(гексадекаэдров) и 16 малых — додекаэдров. В гексадекаэдре
12 пятиугольных граней и 4 шестиугольных, расположенных под
тетраэдрическими углами (~109°) по отношению друг к
другу (под такими углами расположены перпендикуляры,
опущенные из центра полости на эти грани). Средний «свободный»
диаметр додекаэдра равен 0,5 нм, а диаметры больших
полостей 0,58 и 0,66 нм соответственно для структур I и II.
Додекаэдр построен из 20 молекул Н20, тетрадекаэдр — из 24, а
гексадекаэдр— из 28 молекул Н20.
«НЕЗВАНЫЙ ГОСТЬ ХУЖЕ ТАТАРИНА»
Словно по пословице времен татаро-монгольского
нашествия строятся взаимоотношения молекул-гостей (М) и клат-
ратной решетки.
20
Если все 8 полостей в элементарной ячейке структуры
I заполнены молекулами М, то состав гидрата должен
отвечать формуле 8М-46Н20, или М-5,75Н20. Такой или близкий
к нему состав (так как не все полости могут быть заполнены)
имеют гидраты газов СН4, Аг, Кг, Хе, N20. В этом случае
вандерваальсов диаметр гостевых молекул не превышает
0,50 нм.
Многие вещества образуют клатратные гидраты
структуры I, что доказывается рентгеноструктурным анализом, но их
состав близок к формуле М-8Н20. Оказывается, что молекулы
этих веществ имеют диаметры в пределах от 0,50 до 0,54 нм
и не могут разместиться в малых полостях, т. е. являются
«незваными гостями». В то же время они легко помещаются
в больших полостях структуры I. Поскольку этих полостей 6
на элементарную ячейку, идеальный состав таких клатратов
2
должен соответствовать формуле 6М-46Н20, или М-7-^Н20.
Клатраты данной формулы образуют С12, СН3С1, СЮ2, С2Н5,
СН3Вг, COS, CH3SH и другие газы.
Молекулы с вандерваальсовыми диаметрами от 0,56 до
0,66 нм образуют клатратные гидраты структуры II. Они
распределяются только по большим полостям, и, следовательно,
идеальный состав таких гидратов должен соответствовать
формуле 8М-136Н20, или М-17Н20. Подобных гидратов имеется
много, например, гидраты SF6, CH3I, CHBrF2, C2H5C1, CHC13,
СзН8, тетрагидрофурана. Малые полости в этом случае
остаются пустыми, а их в 2 раза больше, чем больших, —
запомним это.
В каждом из упомянутых гидратов молекулы-гости М были
одного вида. Такие гидраты называют простыми. Очевидно,
что в общем случае по полостям кристаллической решетки
могут распределяться молекулы разных веществ, и мы тогда
будем иметь дело со смешанными гидратами. Например, из
смеси СН31, СНС13 и воды получается смешанный гидрат
структуры II, а при кристаллизации воды в присутствии газовой
смеси H2S+N20+Ar+CH4 образующийся гидрат имеет
структуру I и содержит все эти газы. Любая гостевая молекула
является трехмерным объектом, поэтому ее диаметры в разных
направлениях могут различаться: например, диаметр молекулы
нормального пентана СН3—СН2—СН2—СН2—СН3 вдоль
углеродной цепи несомненно больше, чем у молекулы неопентана
СН3
I
СН.3—С—СНз. На рис. 3 даны приблизительные значения наи-
СНЯ
больших вандерваальсовых диаметров некоторых молекул
и структуры образуемых ими гидратов.
21
rf,KM
0,65
0,60
0,55
0,50
0,45
OfiO
- CBr?F2
f
- (CH3)3CH7 (CH3)3CF, C2H5Br, окись пропилена, ц-бутанон
- CH3CH=CH2,CHC13,CC13F
^
- С^^-Сз^^^^Н^СНС^СНзСНП^ф^ра^а^етон §.
- C2H5Cl>CCl2F2,CH3CF2Cl,CBrClF2
- u-c5h101ch2ci2,chci2f,(ch3)2o,
— тетрагидрофдоан
- SF6,CBrF3
- CH3l, CHBrF2
— 1,3 - диоксолан
- CDS,C2H21CH2=CHF, CH3CHF2?CH3SH
- BrCl, С2НЦ, (СНг)3, C2H5F, CHC1F2
- сю2,сгнБ
- Cl2,SbH3,CH2ClF, (CH2)20
- CHF3,CF,,CH3C1
- N20, S02
- AsH3, CH2F2
- co2
- CH3F
- Xe,H2Se,PH3
"~* N2^ H2S?CH^
- Kr, 02
- Ar
дигидрофуран
,(CH2)30
?
1
a
."5 '
1
§1.
eg ^
5 §—i
QQ «o
тура I
i
to
!
Г
_
Рис З
Мы много раз употребляли выражение «вандерваальсов
диаметр молекулы». Что же это такое? Очевидно, что он
непосредственно связан с объемом, занимаемым одной молекулой/
т. е. с объемом, непроницаемым для молекул, кинетическая
энергия которых равна тепловой энергии при обычных
температурах. Следовательно, вандерваальсов диаметр, а точнее
радиус данной молекулы определяется расстоянием от нее до
другой молекулы (такого же типа или иного), при котором их
взаимная потенциальная энергия минимальна, иначе говоря,
силы отталкивания электронных оболочек равны силам
притяжения. Более строгое количественное определение вандерва-
альсового диаметра молекулы связано с дебройлевской длиной
волны ее наружного валентного электрона, но рассмотрение
этого подхода увело бы нас слишком далеко от клатратных
соединений.
22
«ЦАРИЦА МИРА И ЕЕ ТЕНЬ»
Предположим, что 1 моль газа М (1013 гПа, 7 = 273 К)
переселился из газовой фазы в полости гидратной решетки
структуры I и образовался 1 моль гидрата состава М-6Н20.
Согласно рентгеноструктурному анализу, 1 моль воды
занимает в такой решетке объем 22;в см3, и, следовательно, 1 моль
клатратного гидрата имеет объем 6-22,8=137 см3. Если
пренебречь собственным объемом молекул Н20, то именно этот
объем занимают теперь молекулы газа, а ведь до перехода
в кристалл они находились в объеме 22,4-103 см3. Более точные
расчеты показывают, что газ в клатрате как бы сжат до 8—
10 МПа. Очевидно, что при таком переходе произошло сильное
«упорядочение» системы: на каждую молекулу М приходится
теперь значительно меньший объем, а именно — свободный
объем полости. Пусть читатель задаст себе вопрос: может ли
газ сам по себе ни с того, ни с сего сжаться в 100 раз? Ответ
однозначен — вероятность такого события ничтожна. И, чтобы
измерить вероятность осуществления определенного состояния
химической системы (состояния с заданной энергией), нам
необходима новая термодинамическая величина — энтропия.
Поскольку обычно химическая система состоит из очень
большого числа молекул (порядка 1 моля, т. е. 6,02-1023), то
можно, конечно, огромным числом способов так
перераспределить импульсы и координаты этих частиц, что энергия системы
останется неизменной. В статистической термодинамике,
создателем которой является У. Гиббс, доказывается, что состояние
химической системы тем вероятнее, чем больше способов его
осуществления имеется. Например, энергия 1 моля идеального
одноатомного газа определяется только его температурой и
равна (3/2)RTy но само собой разумеется, что газ заполняет весь
предоставленный ему объем в сосуде, а не собирается
произвольно в какой-то одной его части. На языке математики это
явление можно описать как большую вероятность заполнения
газом всего объема сосуда, а не его части.
Еще один простой пример поможет ощутить необходимость
введения вероятностной функции при описании химических
систем. Пусть в сосуде объемом V находится смесь равных
количеств газов 3Не и 4Не при достаточно низком давлении,
когда вероятность столкновения двух частиц мала. Эта смесь
изотопных молекул по свойствам близка к идеальному газу,
так как молекулы не взаимодействуют между собой. Очевидно,
что практически невероятно такое самопроизвольное
распределение молекул смеси, при котором в одной половине сосуда
окажется газ 3Не, а в другой — газ 4Не. А ведь при таком
перераспределении газов давление в сосуде не изменится,
энергия газа тоже. Так что же изменится? Молекулам каждого
газа теперь предоставлены вдвое меньшие объемы, хотя число
23
молекул сохранилось. Можно безусловно утверждать, что
увеличилась упорядоченность системы: вместо случайного
хаотического распределения молекул обоих газов по всему объему
они теперь «разделены», но вероятность самопроизвольного
осуществления этого конечного состояния исключительно мала.
Такое разделение на практике производят в массепараторах,
и оно требует огромных энергетических затрат.
Представим теперь мысленно, читатель, что в сосуде
имеется всего 1 молекула идеального газа. Очевидно, что
равновероятно в любой момент времени найти ее и в левой, и в правой
половине сосуда — она всегда где-нибудь да находится. Если
поместить в сосуд еще одну молекулу, то вероятность того, что
в произвольный момент времени они обе окажутся, скажем,
в левой половине, равна 1/4, т. е. произведению вероятностей
для каждой из молекул. Это происходит потому, что
молекулы не «чувствуют» друг друга. Для трех молекул
соответствующая вероятность равна 1/8, а для N молекул— (1/2)N. Во всех
этих случаях подсчитывали вероятность одновременного
совершения N независимых (случайных) событий, которая равна
произведению вероятностей каждого из них. Если мысленно
отделить перегородкой не половину сосуда, а, например, 1/4 его,
то вероятность до для отдельной молекулы находиться в этом
меньшем объеме равна теперь 1/4, а в остальной, большей
части сосуда — 3/4. Или, другими словами, вероятность для
отдельной молекулы находиться в объеме V пропорциональна
этому объему: wcr>V. Для N молекул газа вероятность
одновременно находиться в объеме V составляет W=(w)Nc^VN.
Энтропия системы должна быть каким-то образом связана
с W. Но каким? Все термодинамические свойства системы
делятся, как мы говорили выше, на интенсивные (не зависящие
от числа N частиц в системе) и экстенсивные (зависящие от
числа N частиц). Интуитивно чувствуется, что энтропия
должна быть свойством экстенсивным: чем больше молекул газа
в сосуде, тем невероятнее всем им одновременно собраться
в какой-то его части, пусть даже чуть меньшей всего объема.
Следовательно, энтропия, а ее обозначают латинской буквой 5,
должна быть пропорциональна числу частиц в системе, но,
поскольку N входит в формулу Wcr> VN в показателе степени,
S должна быть пропорциональна логарифму У. И в самом
деле
S = k\nW. (2)
Коэффициент пропорциональности k назван постоянной Больц-
мана в честь знаменитого австрийского физика Людвига Больц-
мана, установившего физический смысл энтропии и ее
экстенсивные свойства. Сам Больцман этой формулы никогда не
писал (это сделал другой великий физик — Макс Планк, а свет
она увидела в первом издании его лекций по теории теплового
24
излучения), но он говорил о пропорциональности между
энтропией и логарифмом вероятности состояния. «Высеченная на
памятнике Больцману на Венском кладбище эта формула парит
на фоне облаков, плывущих над могилой великого Больцма-
на», — так написал по поводу знаменитой формулы, одной из
основных в современной теоретической физике, А. Зоммер-
фельд — немецкий физик-теоретик в своей книге
«Термодинамика и статистическая физика» (М., 1955, с. 265).
Из формулы (2) следует, что при изотермическом
(7=const) расширении 1 моля газа (N=jVa=6,02- 1023
молекул) от объема Vn (начального) до объема VK (конечного)
изменение энтропии AS=kNpi]n(VJ</Vn) =R In (Ук/Ун).
Постоянную R—k-Nb называют газовой постоянной. Теперь
очевидно, что процесс расширения газа сопровождается увеличением
его энтропии: AS>0; наоборот, сжатие газа никогда не
происходит самопроизвольно, поскольку энтропия системы при этом
уменьшается.
В упомянутой книге А. Зоммерфельда есть слова другого
немецкого физика Р. Эмдена об энтропии: «В гигантской
фабрике естественных процессов принцип энтропии занимает
место директора, который предписывает вид и течение всех сделок.
Закон сохранения энергии играет лишь роль бухгалтера,
который приводит в равновесие дебет и кредит». Именно поэтому
Эмден и назвал энтропию «царицей, мира», а энергию — лишь
«ее тенью».
О МЕХАНИЗМЕ НАРКОЗА
Ты еще не уснул, читатель? Тогда мы поможем тебе.
Поговорим немного о связи клатратных гидратов с анестезирующим
(усыпляющим) действием некоторых газов.
Еще в XVIII в. было замечено, что вдыхание небольших
количеств оксида азота (I) вызывает легкий наркоз или
состояние эйфории — безудержного веселья. Этому газу было дано
даже специальное название «веселящий». В наши дни все, кто
сталкивался с медициной, знают, что для общей анестезии на
лицо больного перед операцией накладывают специальную
маску и подают в нее из баллона газообразный N2O под
давлением 91,2 кПа.
Известно также, что анестезирующим действием обладают
и другие вещества. Например, хирург Н. И. Пирогов применял
при оперировании диэтиловый эфир и хлороформ.
Анестезирующую способность проявляют и весьма инертные в
химическом отношении газы: легкие углеводороды — метан, пропан,
циклопропан; благородные газы — Аг, Кг, Хе; некоторые фреоны —
галогензамещенные производные метана (например, CF2Cl9,
CF.3CI, CFCI3, CBrClF2, CBrF3), SF6, C02.
Однако о механизме действия наркотических агентов ров-
23.
ным счетом ничего не было известно вплоть до 1961 г., когда
два американских исследователя независимо друг от друга
написали о нем: Это были крупнейший химик современности Л.
Полинг и биохимик С. Миллер. Оба автора поместили область
действия наркотического агента в водную фазу нервных клеток.
Вода, как известно, составляет основную часть всех
физиологических жидкостей — плазмы крови, секреторной,
внутриклеточной, желудочного сока и др. И Полинг, и Миллер начали
с сопоставления имеющихся опытных данных и установили, что
некоторые газы с анестезирующим эффектом образуют клат-
ратные гидраты. Оказалось, что анестезирующая способность
газа линейно коррелирует со стабильностью соответствующего
*>|-19Ран
VI
от-
от
#$г<
СС1оГг
CHjU
СН*ип§СН»
СзН8
I I f\
J L
J_L
J I L
4PA
I ■ ' ■ «I L-
0,01 0,1
Рис ч
w
гидрата, т. е. прямо пропорциональна равновесному давлению
газа над гидратной системой при 0°С (это давление называют
давлением диссоциации гидрата). На рис. 4 приведена
взаимосвязь давления анестезии и давления диссоциации гидратов
при 0°С (кружки — гидраты структуры I, квадраты — гидраты
структуры II).1
В чем же состояла, по мнению авторов гипотезы, функция
анестезирующего агента? И Полинг, и Миллер предположили,
что газ, растворенный в жидкости нервных клеток,
стабилизирует структуру воды.
1 Формулу циклопропана на рис. 4 следует читать так: СН2СН2СН2.
26
В наиболее распространенной, так называемой двухструк-
турной модели жидкой воды предполагается, что жидкая вода
является смесью «свободных», таких, как в равновесном с ней
паре, молекул воды и остатков ледяной структуры —
«кластеров», построенных из переменного числа молекул Н20. Это
число пробегает значения от нескольких единиц до нескольких
десятков. Некоторые молекулы в кластере связаны с ним
одной водородной связью, другие — двумя, тремя или четырьмя.
«Льдоподобные» молекулы Н20 непрерывно обмениваются
местами со «свободными» молекулами Н20. В образце жидкой
воды при данных условиях имеется, во-первых, некоторое
распределение кластеров но размерам, т. е. по числу входящих
в них молекул Н20, и, во-вторых, равновесие между этими
молекулами воды и свободными. Равновесие, конечно же,
является динамическим. Каждый отдельно взятый кластер «живет»
не дольше 10~10 с, но концентрация таких кластеров,
состоящих из некоторого числа молекул, в среднем сохраняется
постоянной: если распадаются одни, то образуются другие. Так
вот, если в подобный кластер попадает гидрофобная молекула
инертного газа, она перестраивает его в клатратоподобную
полость и стабилизирует ее, увеличивая время жизни молекулы
Н20 в кластере.
Однако применение этой гипотезы к живым организмам
встречает, по крайней мере, одно серьезное затруднение, а
именно: нормальная температура тела человека оказывается
слишком высокой, чтобы клатратные гидраты наиболее
распространенных анестезирующих агентов могли существовать.
Разберемся, почему это так. Читателю должно быть ясно, что при
повышении температуры давление диссоциации любого гидрата
растет и кстати весьма быстро. Это связано с тем, что
образующиеся при повышении температуры более горячие
молекулы жидкой воды, из которой кристаллизуется гидрат, труднее
затормозить и связать в клатратоподобную сетку из
водородных связей. Необходимо прикладывать более высокие
давления газа, чтобы заполнить в этой сетке по возможности
большее число пустот. Например, при 0°С давление диссоциации
гидратов С12-7Н20, S02-6H20, CH4-6H20 и SF617H20 равно
соответственно 33,4 кПа; 29,4 кПа; 2,58 МПа и 81 кПа, а при
+ 10°С —59,8 кПа; 86,1 кПа; бМПа и 0,56 МПа.
Иногда при повышении давления (и даже при
одновременном, естественно небольшом, увеличении температуры) газ
может начать ожижаться. И если уж появилась новая фаза —
жидкий гидратообразователь, то давление такого газа при
любой температуре определяется равновесным давлением его
паров над жидкостью. И повысить его нельзя: при сжатии
газовой фазы газ перейдет частично в жидкость, а его давление не
изменится. Именно такой случай наблюдается для оксида
азота (I): при +10°С давление диссоциации гидрата N20-6H20
27
(^д.г) равно давлению паров (Рп) жидкого N20, но при
любой температуре выше +Ю°С Рд.г >PnN2o. Поэтому при
температуре выше + 10СС гидрат не может существовать.
Но если даже предположить невозможное и экстраполировать
график температурной зависимости давления диссоциации
гидрата N20 до температуры человеческого тела 36,5°С, то
равновесное давление N20 над гидратом составит 33,4 МПа.
Поскольку давление анестезии для N20 равна о> 0,09 МПа,
становится очевидным, что условий гидратообразования в
организме не существует. Значит, гипотеза американских ученых
неверна? И как же быть с анестезией?
Один из возможных выходов предложил Полинг. Его идея
сводится к следующему. При растворении неэлектролитов в
воде всегда имеют место эффекты гидратации. Гидратация
бывает гидрофильной или гидрофобной (последняя, например,
в случае анестезирующих газов). Если в состав молекулы
неэлектролита входят полярные группы, такие, как —ОН, —NH2,
^NH,^С=0, —СООН,—S03H,toohh взаимодействуют споляр-
ными молекулами Н20, ориентируя их соответствующим
образом, и разрушают структуру воды — это гидрофильная
гидратация. Слабополярные группы —СН3, ^СН2, —CF3, —С6Н5
и другие, наоборот, стабилизируют структуру воды, и такая
гидратация называется гидрофобной. От соотношения числа
полярных и неполярных групп в молекуле зависит
растворимость веществ в воде. Так, низшие спирты — метанол, этанол,
изопропанол — хорошо растворимы в воде, у спиртов же с
более длинной молекулярной цепью растворимость уменьшается,
а изоамиловый спирт почти не растворяется в воде. Или,
например, ацетон смешивается с водой в любых соотношениях,
а метилизобутилкетон растворяется в ней настолько плохо, что
служит прекрасным экстрагентом из воды комплексных
соединений металлов. Оба кетона содержат группу ^С=0, но во
втором случае она экранирована от молекул воды
гидрофобной частью — изобутильным радикалом.
Мы не будем далее углубляться в сложные проблемы
теории растворов. В нашем контексте важно лишь, что у молекул
нуклеиновых кислот, пептидов, протеинов и липидов
«гидрофобные» части весьма велики и около таких молекул вода уже
сильно структурирована. Если в такую воду попадают
молекулы инертных в химическом отношении газов, то могут
образоваться, по Полингу, микрокристаллы гидратов размером до
3 нм. Боковые цепи протеинов уже при 27°С делают гидратную
решетку стабильной и в отсутствие анестезирующего газа.
Именно это обстоятельство объясняет, по-видимому, анестезию,
наблюдаемую при понижении температуры теплокровных
животных (гипотермия).
Нервные импульсы передаются по нейронам, и механизм
этой передачи электрический. Нейронная мембрана (оболочка)
28
образована из молекул протеинов, липидов и других
соединений, имеющих полярные группы (например, пуриновые
основания, аминогруппы, карбоксильные группы). Эти группы
притягивают ионы Na+ и К+ из окружающей жидкости, в которой
плавает клетка. Поэтому около нейронной мембраны создается
двойной электрический слой, в результате чего она заряжена
до потенциала 0,05—0,07 В и обладает некоторым
электрическим сопротивлением. Микрокристаллы гидратов
анестезирующих агентов устраняют потенциал мембраны (механизм этого
процесса неизвестен; возможно, например, раздвигание
двойного слоя и увеличение его емкости или закрывание пор в
мембране и прекращение перехода через них ионов Na+ и К+ из
физиологической жидкости). Во всяком случае мембрана
деполяризуется, и нервный импульс через нее не проходит. В этом
и состоит анестезирующий эффект.
ЭНЕРГЕТИЧЕСКИЙ КРИЗИС
Итак, мы теперь знаем, что решетка в клатратах име\ет
больший молярный объем, чем устойчивая при обычных
условиях а-фаза, из которой она образуется. Например, молярные
объемы жидкой воды, льда, клатратного гидрата структуры I
и клатратного гидрата структуры II равны соответственно 18,0;
19,6; 22,8 и 23,0 см3. Очевидно, что образование р-решетки из
льда энергетически невыгодно: для этого необходимо совершить
работу расширения против сил внутреннего сцепления. Из-за
большого уменьшения энтропии невыгоден и переход гостевых
молекул М из газовой фазы в конденсированную.
Рассмотрим теперь энергетику этого перехода. Пусть
молекула М состоит из п атомов (это может быть молекула SF6,
CHBrCIF, СОС12, C4H4S или какая-то другая). Тогда в
газовой фазе она имеет три поступательные (трансляционные)
и три вращательные степени свободы. Это означает, что
молекула может двигаться прямолинейно в любом направлении,
пока не столкнется со стенкой или с другой молекулой, и,
кроме того, может свободно вращаться вокруг любой своей оси.
В механике принято движение материальной точки в
произвольном направлении представлять в виде суммы движений
вдоль трех фиксированных осей прямоугольной системы
координат, отсюда термин «три поступательные степени свободы».
Произвольное вращение тела, в нашем случае жесткой
молекулы, тоже можно представить в виде суммы трех вращений
вокруг трех взаимно перпендикулярных осей, в этом случае
говорят о трех вращательных степенях свободы. Эти движения
молекулы происходят в пространстве относительно выбранной
нами лабораторной системы координат, поэтому указанные
шесть степеней свободы молекулы называются внешними.
Кроме них у нее имеются (Зл—6) внутренних, или колебательных,
29
степеней свободы (п атомов молекулы совершают (З/i—6)
колебаний, независимых друг от друга).
Оказывается, что при переходе молекулы М из газа в
кристалл из-за слабого взаимодействия ее с решеткой практически
не изменятся ее частоты колебаний и связанная с ними
колебательная энергия молекулы. Это означает, что колебательные
степени свободы молекулы М не изменились. Если внутри
полости молекула М может свободно вращаться, а это так и есть
для малых молекул (например, СН4, СО, N2, 02), то
«вращательная» энергия ее останется прежней и равной (3/2) kT. Но
уж совершенно точно, что молекула М не сможет свободно
двигаться поступательно, а будет стучаться о стенки полости
и превратится, как говорят, в трехмерный вибратор — будет
совершать трансляционные колебания внутри полости.
Энергия молекулы, связанная с этим колебательным движением,
будет равна 3kT (или 3RT на 1 моль газа). Следовательно, при
переходе малых молекул М из газовой фазы в кристалл
должно произойти увеличение их энергии от (3/2)RT до 3/?Г, т. е.
на (3/2)Д7\
Если молекулы М не смогут свободно вращаться внутри
полостей (что и наблюдается для большинства молекул), то
они все-таки будут совершать ограниченные повороты около
центра масс в произвольных направлениях. Эти повороты
снова можно представить в виде суммы трех крутильных
колебаний вокруг трех взаимно перпендикулярных осей. Каждое
такое колебание аналогично крутильному колебанию маятника,
при котором он поворачивается вокруг оси, проходящей через
его центр масс, то в одну, то в другую сторону на
определенный угол. Такие колебания молекул называют либрационными,
и на каждое из них приходится энергия RT. Происходит,
следовательно, увеличение и вращательной энергии гостевых
молекул на величину (3/2)/?Т. Тогда вся энергия молекул
М,связанная с их «внешними» координатами, должна увеличиться на 3RT.
В общем, переход молекул из газовой фазы в кристалл
требует энергетических затрат. Где же взять такое количество
энергии, чтобы перекрыть затраты и на деформацию решетки,
и на уменьшение энтропии, и на увеличение энергии гостевых
молекул? Ведь клатраты образуются довольно легко и в
природных условиях — в газовых скважинах и газопроводах —
с их образованием приходится даже бороться, для чего в
скважины закачивают многие тонны метанола, разрушающего
гидраты или нарушающего условия их образования.
Все дело, как читатель, по-видимому, догадался, в энергии
взаимодействия гостевых молекул с хозяевами. Именно эта
вроде бы небольшая энергия (вандерваальсовы взаимодействия
уж слишком слабые!) и способна компенсировать все затраты.
Но перед обсуждением этого вида энергии снова необходимо
вернуться к термодинамике.
30
«ПАЛКА О ТРЕХ НАЧАЛАХ»
Закон сохранения энергии есть первое начало
термодинамики, существование функции состояния — энтропии,
определяющей направление химической реакции, составляет суть ее
второго начала, а утверждение о равенстве нулю энтропии
любого вещества при абсолютном нуле температуры есть ее
третье начало. Именно поэтому кто-то из физиков назвал
термодинамику «палкой о трех началах». Их выполнение
обязательно во всех химических и физических процессах.
Говоря о тепловом эффекте химической реакции, надо
обязательно учитывать условия ее протекания. Вспомним, что
даже для нагрева на определенное число градусов AT одного
моля некоторого газа, например фреона С C12F2, используемого
в холодильных машинах, могут потребоваться совершенно
различные количества теплоты q. Если фреон находится в сосуде
постоянного объема, то цу=^Су -AT, здесь С у — теплоемкость
газа при постоянном объеме; но если одна из стенок сосуда
подвижна— является поршнем в цилиндрическом сосуде, — roqp =
= СР-Д7\ где Ср — теплоемкость газа при постоянном
давлении. Во втором случае необходимо подвести больше тепла:
Яр>Чуу так как часть его пойдет на совершение работы
против сил внешнего давления.
Если химическая реакция или процесс фазового
превращения (например, плавление, кипение, переход из
кристаллической а-фазы в р-фазу) протекает при постоянных давлении
и температуре, то тепловой эффект реакции равен изменению
не внутренней энергии системы, а изменению теплосодержания,
или энтальпии, обозначаемой буквой Н. Отметим, кстати, что
почти всегда в химии нас интересуют не абсолютные значения
внутренней энергии U, энтальпии Н или энтропии 5 системы,
а изменения этих функций — Д£/, АН и AS — при переходе
системы из начального состояния в конечное. Так вот, изменение
энтальпии системы (или теплота реакции) есть AH=AU+PAV.
Отсюда видно, что АН отличается от изменения внутренней
энергии AU на величину работы PAV, производимой системой
(или над ней) против сил внешнего давления. Если ДЯ<0,
теплота выделяется из системы в окружающую среду и мы
имеем дело с экзотермической реакцией, если ДЯ>0, то
реакция эндотермическая. Экзотермические реакции протекают,
как правило, значительно легче.
Мы уже говорили, что переход молекул М из газовой фазы
в конденсированную невыгоден по энтропии (Д5<0) и для
осуществления таких процессов необходимо произвести работу.
Так, при изотермическом сжатии идеального газа, при котором
его внутренняя энергия остается постоянной (для 1 моля
газа она равна (3/2)RT), а энтропия уменьшается на
величину AS=R 1п(Ук/Ун), мерой этой работы при очень медлен-
31
ном, или, как говорят, обратимом, осуществлении процесса
является величина ГЛ5. Поэтому истинной энергетической
мерой возможности протекания любого химического процесса
является не просто его тепловой эффект, а изменение свободной
энергии Гиббса:
AG = Atf- ГА5.
Слово «свободная» означает, что эта часть теплового
эффекта реакции может быть, в принципе, полностью
превращена в работу, например электрическую при протекании реакции
в гальваническом элементе. Часть же теплового эффекта
реакции, равная TAS, теряется на изменение степени порядка
в системе и называется «связанной» энергией. Химическая
реакция возможна, если при ее протекании функция G
уменьшается, т. е. Д<3<0.
Пусть теперь в сосуде протекает реакция образования
клатратного гидрата структуры II из льда и газа М. Этот
процесс можно представить в виде двух последовательных стадий:
1) перестройка структуры льда в клатратную fj-решетку и
2) внедрение в образовавшиеся полости гостевых молекул М.
Тогда тепловой эффект реакции вычислим по формуле
А Якл = А Ял-мсл + Д Нх + 2RT, (3)
здесь ДЯд^кл —изменение энтальпии при перестройке
структуры льда в клатратную; Д#, — изменение энтальпии при
внедрении молекул М в полость; 2RT — поправочный член,
происхождение которого связано, во-первых, с увеличением энергии
молекул М на 3RT при их переходе в кристалл из газовой
фазы, а во-вторых, с тем, что' энтальпия (но не энергия) 1 моля
газообразных молекул М на RT больше энтальпии их в
конденсированном состоянии.
В таком же виде запишем и изменение других
термодинамических функций:
Д5КЛ = А5Л.КЛ + Д^, (4)
А Окл = Д (7л-.кл + A Gf. (5)
Между прочим, подобные записи для величин Д#кл, Д^кл
и ДСКЛ означают, что «решеточная» часть термодинамических
функций выделена и не зависит от типа гостя М. Все различия
в устойчивости клатратов должны определяться вторыми
слагаемыми в уравнениях (3) — (5). И нам, химикам и физикам,
необходимо научиться их вычислять.
«Я ГОВОРЮ ЛИШЬ — ПРЕДПОЛОЖИМ ЭТО»
На страницах данного очерка мы уже упоминали имя:
выдающегося голландского физика Яна Дидерика Ван дер Ва-
альса, который в 1910 г. за работы в области молекулярной
32
теории газов был удостоен Нобелевской премии. В его честь
слабые межмолекулярные силы были названы вандерваальсо-
выми. Они-то и определяют устойчивость клатратов.
А статистическую теорию клатратов в середине 50-х годов
создал тоже Ван дер Ваальс, но младший. Зададимся
вопросом: «А в чем, собственно, состоит задача теории?». Она
должна не только хорошо объяснять известные экспериментальные
факты, но и предсказывать новые. В случае с клатратами
теория должна дать формулу для расчета основной их
характеристики— равновесного давления над клатратом при любой
температуре. Для решения этой задачи следует, во-первых,
правильно представлять строение клатратов, т. е. расположение
в пространстве молекул-хозяев и распределение молекул-гостей
по полостям решетки (это распределение имеет
статистический характер и обеспечивает минимальное значение энергий
всей системы — клатрата, отсюда и название «статистическая
теория»). Во-вторых, следует правильно выбрать форму
потенциала (энергии) взаимодействия между гостевыми
молекулами и решеткой, а также между решеточными молекулами.
В-третьих, в теории должны быть правильно учтены вклады
в энергию кристалла от всех взаимодействий, при этом какие-
то из них окажутся основными, а другими можно будет
пренебречь.
Ван дер Ваальс младший (дальше речь будет идти только
о нем) за основу теории взял предположение о том, что во
всех клатратах определенной структуры решетка остается
неизменной, какие бы гости ни занимали ее полости. Далее он
предположил, что гостевая молекула движется только внутри
полости (что она там «вытворяет!») и взаимодействует только
с ближайшими соседями-хозяевами, образующими эту полость.
Взаимодействием гостевых молекул между собой, даже .если
они находятся в соседних полостях, теория Ван дер Ваальса
пренебрегает. Наконец, в теории предполагается, что в
каждой полости может находиться лишь одна гостевая молекула.
Перед изложением получающихся результатов еще раз
обратимся к реакции образования клатратного гидрата из льда
и газа. Она протекает при постоянных давлении и температуре
и, в принципе, возможна, если свободная энергия Гиббса всей
системы при этом понижается: AGKJl< 0. Переиначивая слова
поэта, можно сказать, что в физическом мире «удел всего —
катиться вниз»: шарик скатывается с горы, но никогда
самостоятельно на нее не заберется, электрический заряд
перетекает по проводам из области высокого потенциала в область
низкого, но не наоборот. Ну, а химическая система стремится
понизить свой запас свободной энергии, причем, с нашей
точки зрения, безобразно: она всегда «хочет» рассеять его в
тепловую энергию окружающего пространства. И чтобы этот
запас энергии использовать, человек изготавливает аккумуля-
2 779
33
торы, гальванические элементы, химические генераторы тока —
топливные элементы, илиг уж в крайнем случае, строит
тепловую машину, например паровую турбину, используя при этом
энергию химической реакции горения.
Возвращаясь к гидратам, перепишем еще раз равенство (5)
для ДОкл и более внимательно посмотрим на вклады в эту
величину:
Д Окл = Д Ол-^кл + Д Gt.
ДСл-*кл есть свободная энергия перестройки ледяной а-струк-
туры в клатратную р-решетку. Этот вклад, во-первых, одинаков
для всех гидратов определенной структуры и, во-вторых, всегда
положителен (ДСл_;кл>0), потому что р-решетка неустойчива.
Необходимый суммарный эффект ДОКЛ<0 достигается при
внедрении в полости р-решетки гостевых молекул М, так как
AG,<0 и, конечно, |AG,-| > | ДОл_^кл ].
. Чтобы стабилизировать р-решетку, требуется какая-то
минимальная степень заполнения ее полостей. Если в решетке
имеется Nt полостей 1-го типа и степень их заполнения есть 0*,
то это означает, что число таких полостей, в которых находятся
молекулы М, равно biNi. Отсюда следует, что 0г- изменяется от
О до 1. Например, в гидратах структуры I молекулы N2, 02, Аг,
Кг, Хе, S02, N20, H2S, CH4 могут заполнять полости обоих
типов— и додекаэдры и тетр а декаэдры, — поэтому степени
заполнения их 9i и 82 для разных газов могут различаться. А
молекулы СЬ, QH4 или CF4 могут разместиться только в больших
полостях — тетрадекаэдрах, поэтому в образуемых ими клат-
ратах 02=0 (индекс 2 относится к малым полостям), a 8i
должна быть близка к 1.
Такие же рассуждения справедливы и для гидратов
структуры II, поскольку их образуют еще более громоздкие
молекулы: SF6, CCI2F2, Ц-С5Н10, CHCI3, C2H5SH, С3Н8, циклобутанон.
Вандерваальсовы диаметры этих молекул (см. рис. 3)
позволяют им расположиться только в гексадекаэдрах, и степень
заполнения таких полостей 02 должна быть близка к 1, а 01=0
(в структуре II индексом 1 обозначаются малые полости, а
индексом 2 — большие). Оказалось, что во всех гидратах
структуры II 02==О,996ч-О,998, т. е. практически одинакова. Почему же
необходима столь высокая степень заполнения гексадекаэдров?
Да потому, что водная решетка структуры II еще более рыхлая,
чем решетка структуры I, к тому же малые полости —
додекаэдры, которых в 2 раза больше, чем гексадекаэдров, такими
громоздкими молекулами не могут быть заняты. Следовательно,
уж большие-то полости надо заполнить по возможности до
предела. Чтобы этого достичь, каждое из перечисленных выше
веществ должно иметь совершенно определенное давление.
34
КЛАТРАТ И АКТИВИРОВАННЫЙ УГОЛЬ —
ЧТО МЕЖДУ НИМИ ОБЩЕГО!
Теория Ван дер Ваальса приводит к уравнению,
связывающему 8/ с давлением газа р:
Ъ-сатш+сюр]. (6)
В этом уравнении С:(Т) есть константа при выбранной
температуре. Обычно Сгр<С1, и тогда 6;~Сгр, что означает прямо
пропорциональную зависимость между степенью заполнения
полостей 1-го типа и давлением газа.
Уравнение (6) в точности совпадает по форме с уравнением,
описывающим поглощение газов поверхностью твердых или
жидких веществ (адсорбция) в том случае, если на один
«поглощающий центр» поверхности приходится одна
адсорбированная молекула. В этом случае в,- по смыслу есть степень
покрытия поверхности монослоем адсорбированных молекул. Само
уравнение (6) называется уравнением (изотермой) Ленгмюра по
имени знаменитого американского физико-химика Ирвинга
Ленгмюра, лауреата Нобелевской премии 1932 г. за открытия
в области поверхностных явлений в химии. Хорошими
адсорбентами являются активированный уголь, силикагель, цеолиты,
мелкодисперсное стекло.
Из-за указанного сходства и для клатратов константа Сг-
называется константой Ленгмюра. Она зависит от
температуры и от типа полости в решетке: ясно, что одна и та же
молекула, например, СН4, удерживается по-разному в большой
и в малой полостях. Поэтому d(T) характеризует как бы силу
удерживания молекулы М в данной полости и должна быть
связана с энергией взаимодействия молекул-гостей и молекул-
хозяев.
Как известно, адсорбенты чрезвычайно широко используются
в химической технологии: для разделения природных газов
и санитарной очистки газовых выбросов в атмосферу, для
очистки сточных вод и разделения продуктов органического
синтеза и во всех ионообменных процессах. Близкое
физико-химическое сходство между процессами адсорбции и клатратообразо-
вания предполагает использование клатратов в целях
разделения и очистки. Например, кристаллический никель-метилпи-
ридин-роданидный комплекс Ni(4MePy) (CNS)2, образующий
клатраты с ароматическими углеводородами, позволяет решить
трудную задачу — разделение смеси пара- и мета-изомеров
ксилола, необходимое в * производстве терефталевой кислоты,
являющейся основой полиэфирных смол (терефталевая кислота
получается только из пара-ксилола).
В производстве высококипящего реактивного топлива часто
требуется удалить из него углеводороды нормального
строения для снижения температуры застывания. Здесь применяют
35
клатраты с мочевиной. При этой операции депарафинизации
в качестве растворителя используют жидкий S02 и извлекают
углеводороды, начиная с н.-пентана и выше. Октановое число
бензина повышается при этом с 95 до 102.
«СВОБОД ХОТЕЛИ ВЫ! СВОБОДЫ ВАМ ДАНЫ...»
Вот такие речи произносил гусар А. Шишков, приятель
А. С. Пушкина, по поводу изменений в гусарской форме —
замены узких панталон на широкие брюки, отчего ногам гусара
стало свободнее. Так и гостевая молекула движется лишь
в пределах «свободного объема» полости. Причем у разных
молекул с одинаковыми вандерваальсовыми диаметрами,
например у SF6 и СВгЕз, в одной и той же полости, в данном случае
гексад^каэдре, свободные объемы оказываются различными.
Почему бы это?
Посмотрим еще раз на рис. 2. Мы заметим, что формы
полостей близки к сферическим. Это означает, что все 28
молекул НгО в гексадекаэдре расположены почти на одном и том
же расстоянии от его центра, т. е. на поверхности сферы. То
же относится к 20 молекулам Н20, образующим додекаэдр,
и в несколько меньшей степени — к молекулам Н20 в тетра-
декаэдре (большой полости в структуре I). Близки к
сферическим и полости в гидрохиноновых клатратах. Таким образом,
свободный объем полости можно представить в виде сферы,
каждая точка которой доступна для центра масс молекулы М.
И если этот центр масс находится на поверхности свободного
объема, то М уже соприкасается со стенкой полости, т. е. с
какой-то из молекул-хозяев. Следовательно, центр масс
молекулы М не может выйти за поверхность сферы. Если бы
молекула М свободно двигалась в полости и единственной причиной
ее движения была тепловая энергия, то вероятность найти
молекулу М на расстоянии г от центра полости, т. е. на
поверхности сферы радиуса г, равнялась бы просто площади
поверхности этой сферы 4лт2. Свободный же объем для молекулы М
был бы равен геометрическому объему полости, т. е. интегралу
"пол
V=4n f гЧт.
о
Но гостевая молекула движется в силовом поле,
создаваемом молекулами воды. Учитывая сферическую форму полостей,
Ван дер Ваальс предположил, что потенциал молекул-хозяев
равномерно распределен по сферической поверхности, а
взаимодействие гость — хозяин описывается потенциалом 6—12 Лен-
нард-Джонса (сокращенно потенциал Л-Д 6—12):
i/(r)-4e[(c/r)»-(a/r)«]. (7)
В этом уравнении физический смысл параметров е и а легко
понять из рис. 5: a — это расстояние, на котором взаимная по-
?6
тенциальная энергия двух молекул равна 0, а е —
минимальное значение этой энергии. Эти параметры для многих газов
и паров летучих жидкостей рассчитаны из экспериментально
Определенной зависимости вязкости газа от его давления. Если
же, как в нашем примере, взаимодействуют две различные
молекулы (молекула Н20 и молекула М), то о и е рассчитывают
по формулам среднегеометрического и среднеарифметического:
е=:]/£Н2о-£м , а=(ан,о+ам)/2.
Посмотрев еще раз на уравнение (7), мы заметим, что
величина U зависит только от г, следовательно, является
сферически-симметричным потенциалом. В таком случае, если
молекула М движется в поле молекул-хозяев со
сферически-симметричным потенциалом,
вероятность Рг найти ее на расстоянии г
от центра полости выражается
формулой
Рг = 4ъг2ехр(-и1ЬТ), (8)
а свободный объем для молекулы
М определяется интегралом от этой
величины по геометрическому
объему полости
^пол
Z = 4* } r2exv{-UlkT)dr. (9)
и
Следовательно, свободный объем —
это не просто геометрическое
понятие. Он рассчитывается с
учетом силового поля, в кото-
тором движется гостевая молекула М, взаимодействуя с этим
полем. И чем больше поляризуемость молекулы М, а еще
лучше, если у нее есть постоянный дипольный момент, тем больше
ее свободный объем Z в полости.
Примеры свободных объемов атома Аг в малой и большой
полостях гидратной структуры I показаны на рис. 6
(кружки— молекулы НгО). Эти объемы рассчитали американские
ученые Дж. Тестер, Р. Бивин и С, Херрик в 1972 г., и эти
рисунки мы взяли из их статьи. На рис. 6, а изображена
верхняя половина додекаэдра. Сферическая форма свободного
объема соответствует сферической симметрии и самого гостя —
молекулы Аг, и полости. На рис. 6, б показана верхняя
половина тетрадекаэдра. Из-за несферичности, о которой шла речь
выше, свободный объем Аг тоже является не вполне сферой.
Величина Z определяет прочность удерживания молекулы М
в полости. Пусть читатель вспомнит, что константа Ленгмюра
С, тоже характеризует эту прочность. Поэтому можно ожидать,
что Ci~Z.
U
Рис-5
37
Но есть причина, ослабляющая связь молекулы М с
полостью,— ее тепловая энергия. Именно теплота заставляет
молекулу М бешено крутиться и метаться во всех направлениях
с частотами, порядка 1012—1013 Герц. И, следовательно, этот
размывающий фактор kT должен входить в знаменатель
выражения для Z. Теперь, наконец, можно написать формулу для
константы Ленгмюра:
Сг = (4фТ) JJlr2exp(-UlkT)dr. (10)
о
А затем мы можем рассчитать ее для любого гостя в i-й
полости. Это главный результат статистической теории клатра-
тов Ван дер Ваальса. Зная С/, легко определить 6* — степень
Рис.6
заполнения 1-х полостей при данном давлении газа р и при
любой температуре, для этого надо воспользоваться
уравнением (6), или, наоборот, зная 8/ из состава клатрата, можно
рассчитать р— давление диссоциации газа.
ЗАДАЧА ОБ УСТОЙЧИВОСТИ СТОЛА
Сч ПРОИЗВОЛЬНЫМ ЧИСЛОМ НОЖЕК
Проще всего рассчитать давления диссоциации гидратов
моноатомных гостей Аг, Кг и Хе, поскольку для них все
просто— ведь они благородные. В этом случае мы поступаем, как
физик-теоретик, которого просят рассчитать устойчивость
обычного стола с 4 ножками. «Он довольно быстро приносит первые
результаты, относящиеся к столу с одной ножкой и к столу
с бесконечным числом ножек. Остальную часть своей жизни он
безуспешно решает общую задачу о столе с произвольным
числом ножек» (из книги «Физики продолжают шутить». М., 1968,
с. 292).
В табл. 1 мы приводим результаты расчетов давления
диссоциации гидратов Аг, Кг и Хе при 273 К (ен2о/& = 257,3 К,
38
оп,о=0,25 нм). Чем больше величина е/&, тем «энергичнее»
молекула, т. е. больше ее силовое поле. Сравнение значений
Лшсп и Ррасч показывает, что даже для благородных газов
имеются расхождения между теорией и экспериментом. Еще
хуже обстоят дела для многоатомных гостей, как это следует
из табл. 2, в которой приводятся те же величины,
рассчитанные по модели потенциала Л-Д 6—12.
Таблица 1
Молекула М
(гость)
Аг
Кг
Хе
•м-'*- к
175,6
209,8
236,3
V нм
0,295
0,305
0,323
°1
0,957
0,965
0,968
б2
0.960
0,958
0,956
''эксп.,
МПа
9,70
1,42
0,145
"расч.,
МПа
9,70
1,33
0,083
Расхождение, %
0
7
43
Таблица 2
Молекула М
(гость)
Аг
Кг
Хе '
сн4
CF4
N2
02
со2
с2н6
с2н4
С1а
so2
SF6
с3н8
v*-к
119,5
166,7
225,3 !
142,7
152,5
95,5
117,5
205,0
243,0
199,2
257,0
252,0
200,9
242,0
V нм
0,341
0,368
0.407
0,381
0,470
0,370
0,358
0,407
0,395
0,452
0,440
0,429
0,551
0,504
я;е°Р-кПа 1
11346
1438
58
1752
102
10940
, 7395
101,3
63
23
52
9,6
49
4,7
е./в*
1,012
1,028
1,022
1,018
0,414
1,003
1,013
1,017
1,037
0,777
0,918
0,977
—
~~
PJJJcn' кПа
9117
1449
152
2583
4204
15195
, 11346
1256
530
552
33
29
81
175
«И ВЕЧНЫЙ БОЙ! ПОКОЙ НАМ ТОЛЬКО СНИТСЯ»
Ну, наконец-то, читатель, мы снова пришли к тому, с чего
начали. Швейк, горячо желавший попасть на фронт, вышел
однажды пешком из городка Путима и, посетив множество
населенных пунктов, через несколько дней пришел опять в Путим.
Так и мы, проплутав по лабиринтам теории Ван дер Вааль-
39
са в ее простейшем варианте, вернулись к исходной точке —
равновесному давлению диссоциации клатрата, причем
убедились в не слишком большом успехе теоретических
представлений. А ведь, в конце концов, хотелось бы найти способ
расчета условий гидратообразсвания в многокомпонентных газовых
смесях, таких, как природные газы, например. У этих г^зов
от месторождения к месторождению изменяются и состав, и ха*
рактеристики газового потока — его скорость, температура,
давление, влажность, содержание конденсата (легкокипящие
углеводородные фракции). Все эти параметры влияют на гидрато-
образование.
Существует несколько вариантов теории клатратов: водном
учитывается форма молекул и вводится потенциал
взаимодействия молекулы М с молекулой НгО не сферически-симметрич*
ный, а зависящий от ориентации и положения М в полости
(потенциал Кихары); в другом за основу берется дискретная
структура взаимодействий — точная геометрия решетки и
принимаются в расчет взаимодействия молекулы М не только
с ближайшими соседями (например, с 20 или 24 молекулами
Н20 в структуре I), а с очень большим числом молекул
решетки, вплоть до 1200. Но заметного улучшения сходимости
теоретических и экспериментальных результатов по всему ряду
клатратов пока не получается.
И В ГЛУБИНЕ МОРОКОЙ, И НА ЗЕМЛЕ, И В НЕБЕ
Что помогает рыбе плавать? Наполненный газом
плавательный пузырь. Поглощая или выделяя газ, рыба регулирует
объем пузыря и меняет таким образом глубину погружения.
При этом давление газа в пузыре всегда равно
гидростатическому давлению, действующему на рыбу. Этот орган,
превращающий рыбу в своеобразный плавающий буй, был найден
и у глубоководных рыб. В 1967 г. были пойманы две особи
с хорошо развитым плавательным пузырем на глубинах от
4575 до 7160 м. Оказалось, что около 90% газа, наполняющего
пузырь, составляет кислород, остальные 10% приходятся на
азот и углекислый газ. На таких глубинах давление газа
равно нескольким десяткам мегапаскалей (сотням атмосфер).
А у рыб с глубины 3500 м содержание кислорода эквивалентно
его парциальному давлению в пузыре ~32 МПа. Для воды
при 2°С (типичная температура на больших глубинах)
равновесное давление диссоциации гидрата 02 равно примерно
14,8 МПа. Очевидно, что условия для гидратообразования в
пузыре существуют. Вопрос в том, образуется ли гидрат
кислорода, а если нет, то что этому препятствует? А
может быть рыба «хранит» кислород в виде клатратного гидрата?
На эти вопросы читатель может попытаться ответить сам.
40
Условия для гидратообразования существуют и в полярных
ледниковых шапках, да к в условиях вечной мерзлоты часть
природного газа находится в земле в виде клатратных
гидратов.
Но не только «твердь земная и глубина морская» создают
условия для существования газовых гидратов. Самое
неожиданное применение они нашли в атмосфере. Венгерскому
журналисту Ф. Шебеку принадлежит чрезвычайно удачная мысль:
«Вода, падающая с небес в виде дождя именно тогда, когда
в ней есть потребность, несравненно лучше самого
совершенного орошения». В наши дни имеются службы, вызывающие
искусственные дожди. Но чтобы было понятно, как же они
создаются, напомним читателю, что облака состоят из очень
мелких (в диаметре от долей микрометра до десятков и сотен
микрометров) капелек воды при температурах ниже 0°С, т. е.
переохлажденных. Они не падают в виде дождя на землю, так
как этому препятствуют воздушные потоки, и не
кристаллизуется в лед, потому что имеют очень большую собственную
поверхность и очень малую массу. Молекулы воды в таких
капельках обладают избыточной энергией, и капля не замерзает.
Чтобы облако пролилось дождем, в нем должны образоваться
так называемые ядра конденсации. Для этого следует ввести
в капли зародыши твердой фазы, которые по размерам и
форме соответствовали бы ледяным зародышам. Если какие-то
капли замерзнут, то из-за того, что давление паров воды надо
льдом меньше, чем над переохлажденными жидкими
каплями, эти последние будут испаряться, а их пар —
конденсироваться на кристаллике льда, который будет расти, пока в виде
крупной капли не упадет на землю. Еще в 1946 г.
американские исследователи, среди которых был И. Ленгмюр, провели
испытания многих веществ в качестве кристаллизаторов
жидких капель. Они нашли, что лучше всего подходят для этих
целей Agl и сухой лед (твердый С02), только вводить их в
облако необходимо при определенной температуре с учетом
направления воздушных течений.
В 1970 г. канадский химик, специалист по клатратным
гидратам Д. Глю запатентовал способ осаждения атмосферных
водных масс при помощи распыления в облаках гидратообра-
зователей. Идея способа состоит в том, что распыленное в
облаках вещество (например, твердая углекислота или жидкий
пропан), во-первых, сильно охлаждает окружающую среду и,
во-вторых, образует зародыши клатратиой фазы в каплях воды.
Эти зародыши вызывают затем быструю кристаллизацию
капель.
Можно было бы рассмотреть и ряд других применений
клатратных соединений, скажем, для опреснения соленых вод
(морской или шахтных)—этот способ, кстати, один из самых
дешевых, — или для концентрирования фруктовых соков, нако-
41
нец для хранения газов. Все они основаны на особенностях
физико-химических свойств клатратов.
Однако наше рассмотрение химии клатратных соединений
заканчивается. Мы ограничились только их равновесными
свойствами, которые определяются динамикой клатратной
решетки (ее колебаниями) и движением гостевых молекул в
полостях. Эти «микроскопические» движения изучаются
спектральными методами — методами инфракрасной спектроскопии,
спектроскопии ядерного магнитного резонанса, электрической
спектроскопии (измерением диэлектрических свойств). Именно
они помогают определить и понять место клатратов среди
других химических соединений.
При первом знакомстве клатраты представляются нам
простыми соединениями: химическая связь между гостями
и хозяевами почти отсутствует, поэтому и те, и другие
сохраняют свою индивидуальность. Хочется, читатель, чтобы твое
мнение о клатратах не изменилось, как мнение об известном
гоголевском персонаже. «...В первую минуту разговора с ним
не можешь не сказать: „Какой приятный и добрый человек!"
В следующую за тем минуту ничего не скажешь, а в третью
скажешь: „Черт знает, что такое!" — и отойдешь подальше».
Поэтому я говорю себе: «Хватит!».
«ПАРАДОКСЫ»
КОНЦЕНТРИРОВАННЫХ РАСТВОРОВ
Научное сознание всегда терзается
двумя противоречивыми тенденциями:
прогрессивной, или революционной, тенденцией
открывать новые факты и консервативной,
или реакционной, тенденцией сводить их
к знакомым, привычным представлениям,
т. е. объяснять в рамках старой схемы.
Я. И. Френкель
еловек, занимающийся исследованием, помимо
глубоких знаний, умения ставить и решать различные
задачи, должен обладать хорошо развитым
воображением, быть фантазером в серьезном смысле этого
слова. В науке о растворах за самым простым
экспериментальным фактом подчас кроется целый комплекс
сложнейших взаимосвязей компонентов, находящихся в постоянном
движении. Подобно тому как человек, живущий в обществе,
сложными взаимоотношениями связан с окружающими его
людьми и со структурой общества в целом, так и любой
компонент раствора проживает свою жизнь, находясь в тесной
связи и с ближайшим его окружением, и со структурой всего
раствора. Только интервал его жизни измеряется другими вре-
42
менными характеристиками, не соответствующими привычным
нам годам, часам или даже секундам. Вот при переходе от
временных характеристик человеческого бытия к временным
характеристикам жизни составных частей ратвора (это, как
правило, 10~8—10~12 секунд) и требуется умение
фантазировать. Важно лишь, чтобы фантазия, следующая заданной
логике рассуждений, не нарушала законов этой логики, дабы не
превратиться в фантасмагорию.
Примерами такой плодотворной фантазии явились идеи Бер-
нала, Фаулера и О. Я Самойлова о структуре жидкой воды,
модель структуры водных растворов электролитов,
предложенная Фрэнком и Веном, гидратационные представления
Самойлова.1
Бернал, Фаулер и Самойлов высказали идею о том, что
жидкая вода обладает определенной, не повторимой в природе
собственной структурой. Твердая вода, или лед, имеет
правильную кристаллическую структуру, законы построения которой
диктуются строгой направленностью водородных связей. Это
тетраэдрическая структура с пустотами, которую часто
называют ажурной. При плавлении льда такая структура не
исчезает полностью. Из-за теплового движения рвутся некоторые
водородные связи, и освободившиеся из «жесткой» структуры
льдоподобного каркаса молекулы воды заполняют пустоты
этого каркаса. Таким образом, жидкая вода сохраняет
фрагменты структуры льда, размытые тепловым движением. С
позиций этой концепции прекрасно объясняются все аномальные
свойства жидкой воды.
Фрэнк и Вен, «увидевшие» раствор как микрогетерогенную,
многозонную структуру, предположили, что ионы, попадая
в воду, разрушают собственную тетраэдрическую структуру
воды и определенным образом ориентируют молекулы воды
около себя, создавая ионную зону. Ориентированные
молекулы, в свою очередь, пытаются подобным же образом
ориентировать соседние молекулы воды, находящиеся за пределами
ионной зоны и испытывающие ориентирующее воздействие
собственной структуры воды, не «Шуюрченной» растворенными
ионами. Природа этих воздействий различна, поэтому в
растворе появляется «промежуточная» вода, которая не может
следовать ни одной ориентации, она лишена определенной
структуры, очень подвижна и называется деструктурированной. Так
смотрели на структуру раствора Фрэнк и Вен, так же
смотрим на нее и мы.
При исследовании свойств растворов электролитов было
обнаружено, что растворы некоторых солей имеют «отрица-
1 Самойлов О. Я. Структура водных растворов и гидратация ионов.
М., 1957.
43
тельную» вязкость, т. е. их вязкость меньше вязкости чистой
воды. Для интерпретации этого факта Самойлов предложил
свое объяснение, которое не так давно было признано научным
открытием. Сущность его заключается в следующем.
Появляющиеся в растворе ионы с большой поверхностной
плотностью заряда (это, как правило, ионы большого заряда
или малого размера, например ионы алюминия или лития)
образуют гидратную зону, в которой молекулы воды менее
подвижны, чем в чистой воде. Такие ионы названы положительно
гидратированными. Вязкость растворов, содержащих подобные
ионы, всегда больше вязкости чистой воды. Если же в
растворе появляются большие по размеру низкозарядные ионы
(кпримеру, ионы цезия), то, разрушив
структуру воды, они
оказываются не в состоянии «затормозить»
движение ее молекул в первой
гидргтной зоне. Эта вода
становится более подвижной, чем
вода в собственной структуре.
Такие ионы названы отрицательно
гидратированными, вода около
них деструктурирована, и
вязкость растворов, содержащих эти
ионы, меньше вязкости чистой
, , | воды.
о г ч С помощью данных концепций
т,моль/юоо-нго легко и непринужденно
объясняется любой экспериментальный
риМ факт, интерпретируется любое
свойство разбавленных
растворов (растворов не очень высоких концентраций).
Посмотрим, например, как меняется относительная скорость
протонной релаксации1 в растворах солей, содержащих
положительно и отрицательно гидратированные ионы.
Для этого представим графически изменение (l/Ti)0TH
с изменением концентрации при температуре 25°С для двух
солей — СаС12 и CsCI (рис. 1). В растворе хлорида
кальция (l/7i )отн>1 и повышается с увеличением
концентрации соли. Это означает, что общая подвижность молекул
воды в растворе соли, содержащей положительно гидратирован-
ный ион кальция, меньше, чем в чистой воде. И наоборот, в рас-
1 Скорость протонной релаксации (1/Т\) дает информацию о
вращательной подвижности молекул воды в растворе: чем больше \/Т\у тем более
жестко связаны молекулы воды, тем меньше их подвижность, и наоборот.
Относительная скорость протонной релаксации (1/7*1) 0тн— это отношение
скоростей протонной релаксации в растворе заданной концентрации и в
чистой воде.
44
творе хлорида цезия (отрицательно гидратированного иона)
(1/7'i)oth< 1, т. е. в этом случае общая подвижность молекул
воды больше, чем в чистой воде. Катион кальция «наводит»
в растворе порядок, такие ионы называют структуроукрепляю-
щими, а катион цезия «создает» беспорядок, и такие ионы
называют структуроразрушающими. Этим, казалось бы, логично
объясняются наблюдаемые эффекты.
Однако исследование растворов при различных
температурах выявило условность деления ионов на положительно и
отрицательно гидратированные. Оказалось, что с повышением
температуры растворы, содержащие отрицательно
гидратированные ионы, начинают вести себя так же, как растворы с
положительно гидратированными ионами при комнатной
температуре: подвижность молекул воды в таких растворах
оказывается меньше, чем в чистой воде при той же температуре, т. е.
отрицательно гидратированные ионы переходят в класс
положительно гидратированных. Этот факт объяснялся так. С
повышением температуры общая подвижность частиц, составляю-
25 50 75 100 15 50 15 100
t,°C
Рис?
щих раствор, в том чид^е и молекул воды, увеличивается, но
в растворе подвижность молекул воды увеличивается
медленнее, чем в чистой воде. В этих условиях, когда собственная
структура воды разрушена, 'молекулы воды оказываются под
влиянием электростатических зарядов ионов. Отсюда был
сделан вывод о том, что с ростом температуры происходит
усиление гидратационной способности ионов.
ПЕРВОЕ НЕДОРАЗУМЕНИЕ
Все было просто с обсуждением экспериментальных
данных, пока не началось наступление на область растворов
высоких концентраций. И вот первая неожиданность. Обратимся
к рис. 2. Перед нами две похожие в структурном отношении
45
соли: CsCl состоит из слабо положительно гидратированного
аниона хлора и сильно отрицательно гидратированного
катиона цезия, NaC104 — из слабо положительно гидратированного
катиона натрия и сильно отрицательно гидратированного
аниона С10^". Эти соли не гидролизуются, имеют высокую
растворимость в воде, поэтому естественно было бы ожидать
сходство в их поведении. Раствор хлорида цезия ведет себя так,
как этого и следовало ожидать: для всех концентраций CsCl
с повышением температуры (l/T^otH увеличивается, т. е.
относительная подвижность молекул воды уменьшается. Это
подтверждает правильность сделанного ранее вывода об усилении
гидратационной способности ионов с повышением температуры.
А вот поведение раствора перхлората натрия не вписывается
в те рассуждения, которые мы проводили для раствора CsCl.
При сравнительно невысоких концентрациях соли (1 т, 3 т)
картина аналогична той, которую мы наблюдали в растворе
хлорида цезия: с повышением температуры (I/^Ooth
увеличивается (см. рис. 2). Зато при концентрациях NaC104,
больших 6 т, (I/T^oth уменьшается с ростом температуры,
увеличивается относительная подвижность молекул воды в
растворе, т. е. раствор перхлората натрия при высоких
концентрациях начинает «разжижаться» скорее, чем чистая вода.
Почему же столь похожие на первый взгляд соли так по-
разному ведут себя в концентрированных растворах? У них
имеется одно, но, как оказалось, принципиальное различие:
CsCl при насыщении кристаллизуется из раствора в виде
безводной соли, a NaC104— в виде кристаллогидрата.
Следовательно, раствору небезразлично, в каком состоянии
растворенный компонент при концентрации будет уходить из него, и
задолго до насыщения, до появления твердой фазы, раствор
начинает «готовиться» к этому событию. Поэтому все соли
следует разделить на две группы — безводные и кристаллогидрат-
ные. Растворы первых солей, для которых в широком
интервале концентраций применимы модель структуры раствора,
предложенная Фрэнком и Веном, и гидратационные представления
Самойлова, назовем обычными, растворы вторых, для которых,
начиная с определенных концентраций, требуется новый
модельный подход, — кристаллоидными.
ВСЕГДА ЛИ ВОДА РАСТВОРИТЕЛЬ!
Попробуем представить себе структуру
концентрированного раствора кристаллоидной соли. Поскольку такие соли
кристаллизуются из раствора в виде . кристаллогидратов, то
вполне логично предположение о том, что структурной
доминантой этих растворов является структура соответствующего
кристаллогидрата, температура плавления которого понижена
примесным компонентом — избыточной водой. Значит, в каче-
46
стве рабочей гипотезы концентрированный раствор кристалло-
идной соли можно рассматривать как расплавленный
кристаллогидрат, в котором растворяется избыточное количество
молекул воды, причем вода в таком растворе играет двоякую
роль: с одной стороны, она является составной частью
структурной доминанты, с другой — растворенным веществом.
Где же та граница, начиная с которой мы должны
рассматривать воду как растворенное вещество? Попробуем поискать
ответ в эксперименте. Проследим, как меняется относительная
скорость протонной релаксации в растворах солей разной
природы — CsCl и CaCU — при различных температурах в
зависимости от концентрации электролита (рис. 3). Для раствора
т,моль/ТС00г Ht0
Рис.3
хлорида цезия, который мы называем обычным, это
непересекающиеся кривые, а в растворе хлорида кальция, кристалло-
идном, происходит инверсия в расположении изотерм (1/7*1 )0Тн.
Все семейство кривых (на рисунке для простоты представлены
только две кривые) пересекается в одной точке. Концентрация,
при которой все изотермы относительных свойств
пересекаются в одной точке, называется инверсионной концентрацией.
Таким образом, до инверсионной концентрации картина в
растворах солей различной природы однотипна и может быть
интерпретирована как усиление гидратационной способности
ионов. Температурная чувствительность (I/T^oth в этой области
концентраций ниже, чем в чистой воде. После инверсионной
концентрации температурная чувствительность (1/Г))0Тн в растворе
оказывается выше, чем в чистой воде, причем с увеличением
температуры (l/Ti)0TH уменьшается. Можно думать, что именно
в районе инверсионной концентрации формируется структура
определенного кристаллогидрата. Система структурных связей
в таких растворах оказывается более температурно-чуъствитель-
ной, чем в чистой воде, отсюда и феномен инверсии изотерм.
47
КОЕ-ЧТО ОБ ИНВЕРСИОННОЙ КОНЦЕНТРАЦИИ
Настало время от эксперимента перейти к теории и более
детально разобраться в характере изменения относительных
свойств растворов солей различной природы при варьировании
температуры. Молекула воды в чистой воде и в растворе
характеризуется определенным временем жизни, которое
называется временем корреляции и обозначается Тс. Это время,
в течение которого молекула воды «помнит» о своем
состоянии. Через время хс она либо совершит поворот, либо
перескочит в соседнее положение. Время пребывания молекулы воды
в заданном положении зависит от энергии активации — той
энергии, которую молекула должна накопить, чтобы перейти
в другое положение. Время пребывания молекулы воды в
чистой воде тс°ив растворе в зоне катиона или аниона т*
математически может быть записано следующим образом (по
Самойлову) :
тО = т0ехр(£а°кт//?Г),
т±=т0ехр(£-±т/#Г),
где £°кт Еа±т —энергия активации вращения молекул воды
в соответствующих состояниях; то— предэкспоненциальный
множитель, который считается одинаковым для молекул воды
в любом состоянии, что, строго говоря, не так, однако на ход
наших рассуждений это не повлияет. В первом приближении
подвижность молекул воды в зоне иона по сравнению о ее
подвижностью в собственной структуре воды можно представить
как
т±/т°^ехр(Д£акт//?Г).
Для положительно гидратированных ионов £а±т >£а°кт и
отношение т*/т£>1, для отрицательно гидратированных ионов
С этой точки зрения расположение изотерм для растворов
хлорида цезия (обратимся снова к рис. 3) не вызывает
удивления. Действительно, при комнатной температуре в растворе
этой соли общая подвижность молекул воды больше, чем в
чистой воде, по той причине, что катион цезия является
отрицательно гидратированным, структуроразрушающим ионом, а ион
хлора погоды не делает, так как он находится на границе
положительной и отрицательной гидратации. С увеличением
концентрации соли в растворе ионы цезия и хлора все чаще
«встречаются» друг с другом — усиливается их контактное
ион-ионное взаимодействие, в которое вода не включается (напомним,
что CsCl уходит из раствора в безводном состоянии, не увлекая
за собой молекулы воды). Следовательно, в любой области
48
концентраций хлорида цезия энергия активации вращения
молекул воды всегда меньше* чем в чистой воде. Тетраэдрическая
структура воды в присутствии хлорида цезия разрушается,
а новых структурных образований, типа гидратных зон с
заторможенной водой не образуется. Поскольку Д£акт<!0, то с
повышением температуры отношение т^+/тс0 должно
увеличиваться, что и наблюдается в эксперименте (см. рис. 3).
В растворе соли, содержащем положительно гидратирован-
ные ионы (в случае хлорида кальция тон поведения раствору
задает катион кальция), на первый взгляд положение кажется
более сложным. Вода в первой гидратной зоне катиона
кальция имеет меньшую подвижность, чем в собственной структуре
воды, энергия активации вращения молекул больше (Д£акт>0)г
и с повышением температуры следовало бы ожидать
уменьшения отношения tj/t'^ что из эксперимента не следует (см.
рис. 3): хотя и не так сильно, как в растворе хлорида цезия,
но (I/^Ooth в растворе хлорида кальция с повышением
температуры увеличивается.
Для объяснения этого неожиданного эффекта обратимся
снова к модели структуры растворов Фрэнка и Вена. Согласно
этой модели, в разбавленных растворах в присутствии
положительно гидратированных ионов всегда существует деструкту-
рированная вода между первой гидратной зоной катиона и
собственной структурой воды. В этой воде отсутствует
определенная структура, она высоко подвижна и по своей природе
похожа на воду в растворе хлорида цезия. Следовательно, в
растворах солей, содержащих положительно гидратированные ионы,
в области невысоких концентраций присутствуют два сорта
молекул воды: для одного из них Д£акт>0, а для другого
Д£акт<0. При повышении температуры т^/т? уменьшается
(при этом должна уменьшаться и (1/Fi)oth), а т^стр /т1)с
увеличивается ((1/^Оотн также увеличивается). Поскольку де-
структурированных молекул воды в разбавленном растворе
заметно больше, чем структурированных (чисто геометрически
получается, что ^кость второго слоя больше емкости первой
гидратной зоны), то основной вклад в температурную
чувствительность вносит деструктурированная вода. По мере
повышения концентрации соли в растворе сначала исчезает
собственная структура воды, затем начинает уменьшаться количество
деструктурированной воды и, наконец, наступает момент
взаимной компенсации двух противоположных эффектов. При
дальнейшем увеличении концентрации основную долю будет
составлять вода, входящая в структуру кристаллоидных образований,
для которой Д£'акт>0, и характер изменения (1/Т\)0тн после
инверсионной концентрации с повышением температуры
представляется совершенно понятным.
Таким образом, инверсионная концентрация может служить
49
той границей, которая условно, но вполне определенно делит
всю концентрационную область существования раствора на две
зоны — доинверсионную, где применима модель Фрэнка и
Вена, и постинверсионную, где доминирующей является
структура определенного кристаллогидрата. Конечно, не следует
думать, что такая структура возникает мгновенно, ее фрагменты
начинают зарождаться в доинверсионной области,
доминирующей же она становится после инверсионной концентрации.
«ЗАМЕЧАТЕЛЬНАЯ» КОНЦЕНТРАЦИЯ
Казалось бы, в растворах всех солей, образующих
кристаллогидраты/если верить нашим рассуждениям, должна иметь
место инверсия в расположении изотерм относительных свойств
с характеристической точкой их пересечения — инверсионной
концентрацией. Однако природа всегда готовит нам очередные
РиС ч
сюрпризы. Выяснилось, что в растворах некоторых солей
относительная подвижность молекул воды с повышением
температуры увеличивается при всех концентрациях, т. е. мы
встречаемся с расположением изотерм, характерным для
постинверсионной области кристаллоидного | раствора (см. рис. 3 для
СаС12). Такой солью, например, является сульфат натрия.
И сразу же возникает вопрос о правомерности использования
гидратационной модели при обсуждении природы солей поуб-
ного типа.
Но коль скоро существует необходимость
дифференцированного подхода к обсуждению природы разбавленных и
концентрированных растворов, то, видимо, должен быть и более
общий критерий деления раствора на две зоны, нежели
инверсионная концентрация? Действительно, как нам кажется,
такой критерий можно найти. Это концентрация,
соответствующая эвтектике на политерме растворимости.
50
Небольшой комментарий для читателя, не знакомого с
понятием эвтектики. Политерма растворимости дает зависимость
температуры замерзания раствора от концентрации
растворенного вещества. При последовательном увеличении его
концентрации температура замерзания раствора уменьшается, а из
раствора при этом вымораживается растворитель — вода.
Начиная с определенной концентрации, температура замерзания
раствора начинает расти, и из раствора кристаллизуется
растворенное вещество. Та концентрация (строго определенная
для каждого вещества), при которой происходит
одновременная кристаллизация растворителя и растворенного вещества,
называется эвтектикой. Убеждение о возможности
использования эвтектики как критерия деления раствора на две зоны
появилось на основании того факта, что инверсионная
концентрация, если она существует для раствора, соответствует
эвтектической концентрации. И тогда в наших рассуждениях можно
сделать следующий шаг: в растворах солей, где на изотермах
относительных свойств отсутствует инверсия (безводные и
некоторые кристаллогидратйые соли), границей применимости
модели Фрэнка и Вена может служить концентрация,
соответствующая эвтектике на политерме растворимости соли.
Рассмотрим, что из себя представляют политермы
растворимости трех солей — LiCl, Na2S04 и CsCl (рис. 4). В растворе
хлорида лития эвтектика составляет 7,9 т, а инверсионная
концентрация на изотермах относительной скорости протонной
релаксации и относительной вязкости — 6,7 и 7,2 m
соответственно. Нет ничего удивительного в том, что эти
концентрации несколько отличаются друг от друга. Эвтектика
показывает, что именно при этой концентрации в растворе обе
структурные доминанты (доэвтектическая и постэвтектическая)
равноправны. Как мы упоминали ранее, структура кристаллоид-
ного раствора начинает зарождаться еще в доинверсионной
области. А каждый метод в силу своей специфичности,
чувствительности и избирательности чувствует ее главенствующую
роль в разное время (при разных концентрациях). Отсюда
становится понятным отсутствие инверсионной концентрации на
изотермах относительных свойств в растворе сульфата натрия:
как правило, исследование растворов начинают с
концентрации ~ 1 т, а это в данном растворе уже постэвтектическая
область (эвтектика равна 0,3 т, см. рис. 4), когда в растворе уже
реализована новая доминирующая структура, соответствующая
кристаллогидрату Na2S04- IOH2O. И только
высокопрецизионные измерения свойств в области очень разбавленных
растворов могут показать, что в очень узкой области концентраций
действительно имеет место инверсия в расположении изотерм.
Такое положение характерно для солей, образующих
стабильные кристаллогидраты с большим количеством кристаллиза-
51
ционной воды. Глауберова соль как раз и есть такой
кристаллогидрат.
И, наконец, казалось бы, такая простая соль, как CsCl,
предстает нашим глазам в совсем другом свете. Эвтектика на
политерме ее растворимости, как и во всех безводных солях,
очень сильно смещена в область высоких концентраций,
близких к насыщению (на рис. 4 это 8 т). После точки эвтектики,
когда на политерме растворимости появляется ветвь
кристаллизации безводной соли, мы должны дать иное толкование
концентрированного раствора хлорида цезия. Структурной
доминантой такого раствора теперь является
квазикристаллическая решетка безводной соли, в которой растворена вода. Хотя
это и покажется необычным, но хлорид цезия в области
высоких концентраций должен выступать в роли растворителя.
Поскольку вода не включается в формирование новой
структурной доминанты, реализация последней возможна только при
достаточно близком контакте ионных пар. Отсюда резкое
смещение эвтектики в область высоких концентраций, как это
видно из рис. 4, узкая область существования раствора с хлоридом
цезия в функции растворителя, трудность сохранения
концентрированного раствора в гомогенной фазе — любое стечение
обстоятельств в растворе приводит к «убеганию» безводной
соли из концентрированного раствора. В самом деле, если вы
приготовите насыщенный раствор CsCl, закроете колбу пробкой
и оставите на некоторое время, то вскоре можно будет
увидеть, как сухая соль начинает «вылезать» из раствора.
Концентрированные же растворы кристаллогидратных солей можно
хранить сколь угодно долго, и этого не произойдет. Но здесь
зачастую мы встречаемся с трудностями другого рода —
выделить кристаллогидрат из раствора, ведь право образовывать
пересыщенные растворы принадлежит только кристаллогидрат-
ным солям.
Итак, эвтектика является той замечательной точкой,
которая позволяет нам ориентироваться в распределении ролей —
растворитель и растворенное вещество в растворе. И еще одно
замечание. Известно, что удельная электропроводность в
растворах солей, образующих кристаллогидраты, имеет максимум,
находящийся в области эвтектики. После эвтектики
электропроводность раствора уменьшается. В растворах безводных
солей максимум смещается в область, близкую к насыщению.
Этот экспериментальный факт подтверждает мысль о том, что
структура квазикристаллической решетки безводной соли как
устойчивая модификация начинает формироваться достаточно
поздно, только вблизи нас^цения.
Вернемся еще раз к изотерме растворимости LiCl (см.
рис. 4). Давно известно, что любая жидкость, в том числе
и раствор, имеет строго определенную температуру кипения.
Когда говорят о замерзании раствора, то речь идет о темпера-
.52
туре начала кристаллизации, при этом из раствора начинает
вымораживаться растворитель. (Вспомните пресные горы
льда — айсберги в соленом океане). Что нам дает политерма
растворимости соли? Первая ветвь кристаллизации — лед,
затем при единственной, строго определенной концентрации,
характерной для данной соли, идет кристаллизация
одновременно двух компонентов — льда и кристаллогидрата. При
дальнейшем увеличении концентрации соли начинает
вымораживаться новый растворитель, т. е. появляются ветви
кристаллизации различных кристаллогидратов или, как это видно для
раствора CsCl, безводной соли. В развитии концепции/строения
концентрированных растворов остается сделать еще один шаг,
а именно: если соль характеризуется большим разнообразием
кристаллогидратов, то и в концентрированном растворе следует'
ожидать последовательного изменения структурных доминант,
следующего за ветвями кристаллизации на политерме
растворимости. Этот вопрос затрагивает более тонкие моменты
биографии растворов и подробно будет обсуждаться дальше.
Идея родства природы концентрированного раствора и
кристаллогидрата сама по себе не нова. Еще Д. И. Менделеев
считал, что одним из путей к познанию природы растворов
является исследование кристаллогидратов. В. И. Данилов,1 изучая
рассеяние рентгеновских лучей в растворах, отмечал
проявление структуры кристаллогидратов в структурных особенностях
концентрированных растворов. Автор современных идей о
гидратации ионов О. Я. Самойлов, указывая на ограниченность
применимости модели Фрэнка и Вена, говорил, что необходимо
выработать новые воззрения для концентрированных растворов
с позиций сходства их с соответствующими
кристаллогидратами. Сейчас трудно найти исследователя растворов, который бы
отрицал столь очевидную истину. Однако в высшей степени
привлекательные и целиком оправдавшие себя идеи Самойлова,
объясняющие поведение растворов в достаточно широком
интервале концентраций, в какой-то степени явились ;тормозом
в исследовании концентрированных растворов. Слишком
трудно было отказаться от этих блестящих воззрений. При переходе
к растворам более высоких концентраций, характеризующихся
дефицитом молекул «растворителя» — воды, делаются попытки
приспособить и несколько видоизменить эти идеи, появляются
понятия о перегидратации, координационной дегидратации
и т. д. И только в том случае, когда оказывается невозможным
объяснить то или иное свойство с этих позиций, вспоминают
об особенностях кристаллогидратных структур.
Идея, даже самая блестящая, остается только идеей,
одиноко звучащей нотой, если на ее основе не будет создан целый
Данилов В. И. Рассеяние рентгеновых лучей в жидкостях. М.; Л.,
53
круг воззрений выработана новая концепция, позволяющая
свежим взглядом посмотреть на явления уже ставшие
привычными, снять еще один покров с тайн природы. И потому
весьма актуально звучат слова, сказанные русским физико-
химиком Е. В. Бироном: «В настоящее время одним из
очередных вопросов в химии нужно считать вопрос о
концентрированных растворах. Требуется не поправка к уже существующим
теориям, а совершенно новые взгляды и гипотезы, словом,
особая теория концентрированных растворов».
ОТ ПРОСТОГО К СЛОЖНОМУ
Для того чтобы глубже понять природу бинарного раствора
соль—вода, можно пойти по пути наблюдения за «реакцией»
этого раствора на введение в него третьего компонента,
например другой соли. Поскольку инверсионная концентрация на
Рис 5
изотермах относительных свойств некоторых растворов
является характеристической для раствора данной соли, посмотрим,
как отразится введение определенного количества другого
компонента на ее положении. Для этого выберем два электролита
сходной природы — LiCl и СаС12, кристаллизующихся из
раствора в виде кристаллогидратов LiCl-НгО и СаСЬ-бНгО
и имеющих инверсию изотерм относительной скорости
протонной релаксации при 6,7 и 3,4 т соответственно.
Эксперимент состоял в следующем. В раствор хлорида
лития разных концентраций вводили 1 моль хлорида кальция и
измеряли скорость протонной релаксации при двух
температурах— 25 и 90°С. А дальше сравнивали (1/7*1 )0Тн для систем
54
LiCl —Н20 и LiCl—1 т СаС12 —Н20. Опыт показал (рис. 5),
что при введении 1 моля хлорида кальция в раствор хлорида
лития инверсионная концентрация LiCl смещается в область
меньшего содержания его в растворе (на рис. 5 это смещение
показано стрелкой). Приверженцы гидратационных
представлений, прокламирующие их справедливость во всем
концентрационном интервале существования раствора, такой факт
объясняют достаточно просто. Введение в раствор соли,
содержащей положительно гидратированный катион, другого
компонента такой же природы должно привести к дополнительному
связыванию воды, что и отражается на смещении инверсионной
Рис.б
концентрации в область меньшего содержания исходной соли.
А теперь поступим наоборот. Будем вводить в раствор
хлорида кальция различных концентраций 1 моль хлорида лития
и посмотрим, что произойдет с инверсионной концентрацией
(см. тот же рис. 5). Результат оказывается весьма
неожиданным. Инверсионная концентрация смещается в область
больших количеств хлорида кальция, что с позиций
гидратационных .представлений уже никак объяснить не удается. Значит,
нужна новая идея для объяснения этого необычного факта.
Американский физик Ричард Фейнман писал:. «Новые идеи
придумывать очень трудно. Для этого требуется совершенно
исключительное воображение». И все-таки попробуем. А для того
чтобы дать пищу воображению, давайте обсудим еще один
эксперимент.
Измерим скорости протонной релаксации при различных
концентрациях хлорида кальция в чистой воде и в сложном
растворителе 7 т LiCl — Н20 и хлорида лития в чистой воде
и в сложном растворителе 4 т СаС12 — Н20 и сравним поведе-
55
ние этих солей в сложном растворителе с их поведением в
чистой воде (рис. 6, температура 25°С). Концентрации сложных
растворителей выбраны неслучайно: именно при этих
концентрациях в данных растворах уже сформировались структуры
соответствующих кристаллогидратных образований.
Относительная скорость протонной релаксации раствора СаС12 в чистой
воде равна
/ 1 Л _. 1/^1(я молей СаС1»-Н,0) ,л\
{ Ti /отн ^(Н-О).
а в сложном растворителе 7m LiCl —Н20
/ 1 \ ^1Т\(П молей СаПа-7/п LiCl-H?Q) ,оч
V Т* /отн llTl{7m LlCl-HoO)
Возвращаясь к рис. 6, мы увидим, что кривая 1 для бинарного
раствора лежит ниже кривой 2 для тройного раствора. Это
говорит о том, что в растворе хлорида кальция со сложным
растворителем относительная скорость протонной релаксации
выше, чем в воде, значит, в сложном растворителе происходит
дополнительное структурирование и связывание воды. По
отношению к кристаллоидному раствору хлорида лития СаС12
ведет себя как структуроукрепляющий компонент. По аналогии
с положительной гидратацией в воде вполне допустимо
говорить о положительной сольватации хлорида кальция в кристал-
лоддном растворителе LiCl. Этот результат полностью
соответствует данным, приведенным на рис. 5, слева. Поскольку
хлорид кальция образует с концентрированным раствором хлорида
лития единую систему структурных связей, то происходит
дополнительное вовлечение молекул воды в новые структурные
образования, что находит отражение в смещении инверсионной
концентрации в область меньшего содержания соли в
растворе.
А теперь проследим, как меняется (\1Т\)0ТК при увеличении
концентрации LiCl в воде и в сложном растворителе 4 m
СаС12 — Н20 (см. рис. 6, кривые V и 2'). В сложном
растворителе первые порции хлорида лития вызывают сначала
разрушение структуры растворителя 4 т СаС12 — Н20 (кривая 2'
для него лежит ниже, чем кривая V для чистой воды), затем
с увеличением концентрации LiCl скорость протонной
релаксации начинает увеличиваться и, наконец, становится больше,
чем в бинарном растворе. Следовательно, хлорид лития
несовместим со структурой, задаваемой кристаллоидным раствором
хлорида кальция, соответствующим структуре его гексагидрата
СаС12-6Н20. Поэтому здесь можно говорить об отрицательной
сольватации. По всей видимости, хлорид лития видоизменяет
гексагидратоподобную структуру •. сложного растворителя
и только с модифицированной структурой образует единую
систему структурных связей. Подобно тому, как отрицательно
56
гидратированные ионы при повышении температуры переходят
в класс положительно гидратированных, так и соли,
отрицательно сольватированные в структуре сложного растворителя,
могут стать положительно сольватированными при изменении
структурной доминанты сложного растворителя.
Теперь становится понятным смещение инверсионной
концентрации в область большего содержания хлорида кальция
при введении 1 моля хлорида лития (см. рис. 5). Хлорид лития
несовместим с гексагидратной структурой хлорида кальция,
а значит, LiCl мешает СаС12 реализовать эту структуру.
Скорее всего, хлорид кальция вынужден будет образовывать
структуру, свойственную кристаллогидрату, обедненному водой, ту,
которая будет пригодна для совместного сосуществования двух
солей. А раз воды для этого требуется меньше, то и
формироваться она начнет позже, при более высокой концентрации
хлорида кальция.
То, что приведенные рассуждения правомочны, доказывает
вид изотермы растворимости системы LiCl — СаС12 — Н20. Эта
изотерма имеет четыре ветви кристаллизации: СаС12-6Н20,
СаС12-4Н20, CaCl2-LiCl-5H20, LiCI-H20. Добавление в
насыщенный раствор СаС12 первых порций LiCl приводит к
появлению на изотерме растворимости ветви кристаллизации
СаС12-6Н20. При дальнейшем увеличении концентрации
хлорида лития появляется ветвь кристаллизации — СаС12-4Н20. Этим
подтверждается правильность наших рассуждений о
несовместимости хлорида лития с гексакристаллогидратной структурой
хлорида кальция и о перестройке ее на структуру, обедненную
водой. Опыт показывает, что это структура тетрагидрата, и
именно с этой структурой хлорид лития способен образовывать
единую систему структурных связей.
Если пойти с другой стороны и вводить в концентрированный
раствор хлорида лития первые порции СаС12, то мы увидим, что
начнется высаливание хлорида лития и появится ветвь
кристаллизации LiCbH20. Венцом же структурных модификаций
в растворе будет образование соединения состава
LiCl-CaCl2-5H20. По внешнему виду формулы это соединение
представляется сочетанием двух соседних с этой ветвью
кристаллизации гидратов — LiCl-H20 и СаС12-4Н20. Логика
нашей концепции, однако, подсказывает другой ответ. По мере
высаливания моногидрата хлорида лития концентрация LiCl
в тройном растворе уменьшается, и со стороны; хлорида лития
раствор переходит в зону кристаллизации его дигидрата (см.
политерму растворимости LiCl на рис. 4). Поэтому логично
предположить, что соединение LiCl-CaCl2-5H20 рождается на
основе двух кристаллогидратных структур — 1лСЬ2Н20 и
СаС12-4Н20, образующих единую «решетку» с одной общей
молекулой воды. В этом и проявляется единая система
структурных связей.
57
СОЧЕТАНИЕ СОЛЕЙ-АНТИПОДОВ
Итак, совместное присутствие в растворе двух кристалло-
гидратных солей может привести, как мы это только что
видели, к образованию соединения определенного состава. А теперь
посмотрим, как поведут себя в одном растворе соли различной
природы — хлорид кальция, кристаллизующийся в виде гекса-
гидрата, и хлорид цезия — безводная при кристаллизации соль.
В этом разделе мы не будем анализировать получившиеся
экспериментальные результаты, а ограничимся лишь общими
рассуждениями. Читателю придется поверить, что эксперимент
не противоречит логике рассуждений автора.
Система СаС12—CsCl — Н20 является одной из
интереснейших тройных систем, она богата различными, самыми
неожиданными соединениями и характеризуется большой
взаимной растворимостью солей. Изотерма растворимости имеет
четыре ветви кристаллизации: CaCl2-CsCI, CaCl2-2CsCl-2H20,
CaCl2-5CsCl, CsCl. Попробуем понять, какие события в
растворе приводят к появлению различных соединений на основе этих
двух, таких разных солей.
Свои рассуждения начнем со стороны концентрированного
раствора хлорида кальция, в который вводится хлорид цезия.
И прежде всего зададимся вопросом, в каком виде будет
существовать хлорид цезия в концентрированном растворе хлорида
кальция? Ясно, что ни о какой диссоциации хлорида цезия речи
быть не может, ведь растворяется он не в воде, а в структуре,
свойственной гексагидрату хлорида кальция. Поэтому логично
представить себе его существование в таком растворе в виде
недиссоциированных молекул (еще их можно назвать
контактными ионными парами, или диполями), которым нужно как-то
разместиться в системе структурных связей
концентрированного раствора СаС12.
Первой ветвью изотермы растворимости со стороны хлорида
кальция является ветвь кристаллизации CaCl2-CsCl. Почему
образуется именно такое соединение? Рассуждать можно
следующим образом. В концентрированном растворе СаС12
диполи хлорида цезия в силу большого размера — большего, чем
размер молекул воды,— разместиться не могут и, разрушая
структуру гексагидратного состава, освобождая для себя место,
вынуждают ее перестраиваться на гидратную структуру,
обедненную водой, типа тетрагидрата (по аналогии с действием
хлорида лития). То, что хлорид цезия разрушает структуру
концентрированного раствора хлорида кальция, показывает
уменьшение вязкости этого раствора в присутствии очень
малых количеств CsCl (всего лишь 0,2 моля). В насыщенном же
растворе СаС12, находящемся в равновесии с твердой фазой
CaCl2-CsCl, не обнаружено даже следов хлорида цезия, он це-
58
ликом уходит из раствора, уводя с собой определенное
количество СаС12. Почему CsCl вырывает хлорид кальция из
собственной, обжитой и привычной структуры? Вероятно, это
энергетически выгодно. Причины такого явления установить
нелегко, но можно поискать аналогию, например, в| расплавах
таких солей. Действительно, в расплавах смеси солей, состоящей
из СаС12, LiCl и CsCl, хлориды лития и кальция образуют
различные соединения с хлоридом цезия. Но вот что интересно.
Среди этих соединений самым стабильным является CaCl2-CsCl,
конгруэнтно (без разложения) плавящееся при температуре
1030°С. Скорее всего, и в концентрированном растворе, и в
расплаве это явления одного порядка. И хотя причина
стабильности соединения CaCI2-CsCl неясна, факт появления ветви его
кристаллизации на изотерме растворимости уже не может
вызвать удивления у специалиста, ибо по всем законам
формирования изотерм растворимости первой ветвью
кристаллизации со стороны кристаллогидратной соли должна быть ветвь
соответствующего кристаллогидрата, а не безводной соли.
Следующей ветви кристаллизации на изотерме
растворимости отвечает соединение CaCl2-2CsCl-2H20. По своей
формуле оно напоминает тетрагидрат хлорида кальция, в котором
две молекулы воды замещены на два диполя хлорида цезия.
Как мы уже предполагали ранее, хлорид цезия разрушает
структуру гексдгидрата хлорида кальция, заставляя ее
перестраиваться в структуру, характерную для тетрагидрата, и в
этой видоизмененной структуре диполи хлорида цезия находят
себе место, вытесняя молекулы воды и ориентируясь хлором
к иону кальция. О том, что в процессе таких структурных
перестроек действительно освобождается вода, можно судить
по сильному увеличению давления насыщенного пара (воды)
над тройным раствором.
Продолжим наши рассуждения с другой стороны — со
стороны концентрированного раствора CsCl, в который вносится
СаС12. Мы говорили уже, что в растворе CsCl до эвтектики
(8 т) растворителем является вода, а после эвтектики
доминирующей структурой является квазикристаллическая решетка
безводной соли, в которой растворены молекулы воды.
Поскольку процесс растворения, коль скоро он происходит, есть
химическое взаимодействие, то вносимый в концентрированный
раствор хлорида цезия СаС12 начинает взаимодействовать
с компонентом наиболее слабо выраженной структуры, т. е.
с водой, компонент же доминирующей структуры при этом
высаливается. Так появляется ветвь кристаллизации безводного
хлорида цезия.
Следующая за CsCl ветвь кристаллизации соответствует
соединению CaCl2*5CsCI. Какие же события в растворе могут
приводить к появлению такого соединения? По всей видимости,
добавление к концентрированному раствору хлорида цезия еще
59
большего количества СаС12 приводит к разрушению
квазикристаллической решетки CsCl, тем более, что содержание CsCl
в растворе уменьшилось из-за высаливания. В такой ситуации,
когда имеются две разрушенные структуры (CsCl и Н20),
предпочтительным может оказаться процесс сольватации
катиона кальция диполями хлорида цезия, причем цезий будет
находиться на периферии квазисольвата. Предпочтительность
процесса сольватации перед процессом гидратации может быть
обусловлена большим дипольным моментом ионной пары
Cs+—С1~ по сравнению с таковым у молекул воды.
Эксперимент же при этом показывает, что в области высоких
концентраций CsCl относительная вязкость раствора уменьшается,
а давление паров воды над растворами увеличивается. Гидро-
фобность катионов цезия исключает сцепление таких
конгломератов через молекулы воды или каким-то другим способом,
а освобождающаяся от воздействия катиона кальция вода
придает этому раствору большую текучесть.
ЧТО ТАКОЕ ДВОЙНАЯ СОЛЬ)
В любом учебнике по неорганической химии можно
прочитать, что двойная соль — это комплексное соединение, которое
нацело диссоциирует в водном растворе. Нам представляется,
что сведения о двойных солях можно дополнить новой
информацией. Рассмотренные в предыдущих разделах соединения,
рождающиеся из сочетания двух солей в растворе, являются
представителями широкого класса двойных солей.
Таким образом, существуют два типа двойных солей,
механизм образования которых различен. Один из них образуется
при совместной кристаллизации двух солей одинаковой
природы. Если смешать растворы двух солей, кристаллогидраты
которых изоморфны, то их изотерма растворимости будет иметь
одну ветвь кристаллизации твердого раствора. Тогда
концентрированный тройной раствор при любых соотношениях
концентраций компонентов представляет собой единую систему
структурных связей, которую можно назвать зоной кристалло-
идного изоморфизма со взаимозамещаемыми изморфными крис-
таллоидными структурами. Примером является система
СаС12— S:C12 — Н20, в которой гексагидраты хлоридов
кальция и стронция изоморфны.
Если кристаллогидраты исходных солей неизоморфны
(рассмотренная нами система LiCl — СаС12 — Н20), но в процессе
их смешения происходит взаимная модификация их
доминирующих структур в растворе, которая может привести к рождению
новой единой кристаллической ячейки, тогда образуется
двойная соль. Механизм ее образования заключается в структурно-
вынужденном сопряжении двух модифицированных в растворе
кристаллогидратных структур.
60
Второй тип двойных солей возникает при сочетании двух
разных по природе солей (например, уже известная нам
система СаСЬ — CsCl — Н2О). Двойная соль этого типа
образуется в результате замещения молекул воды в кристаллогид-
ратной структуре одного компонента на диполи безводной соли.
Из раствора при этом кристаллизуются либо полностью
безводные сольваты, либо гидросольваты как продукт неполного
замещения молекул воды на диполи безводной соли. Чем
больше /способность к ассоциации, к образованию контактных
ионных пар в растворе безводной соли, тем ярче проявляется
ее возможность выступать в роли растворителя,
конкурирующего с водой в процессах гидратации.
Способность к ассоциации в ряду хлоридов щелочных
металлов выражена следующим образом: CsCl>RbCl>KCl>
>NaCl. В этом же направлении меняется способность этих
солей образовывать двойные соли. Наибольшее количество их
образуется с участием хлорида цезия, гораздо меньшее — с
участием хлорида калия. На основе хлорида натрия такие
соединения с кристаллогидратными солями не образуются никогда.
Ионы натрия и хлора в разбавленных растворах относятся
к категории ионов, находящихся на границе положительной
и отрицательной гидратации. Эта их неопределенность в гид-
ратационных характеристиках переносится и в
концентрированный раствор. Нельзя сказать вполне точно, является ли
такая соль безводной солью или кристаллогидратом. Если
насыщать раствор при комнатной температуре, то она
кристаллизуется в виде безводной соли, если же при более низких
концентрациях замораживать раствор, образуется
кристаллогидрат NaCl-2H20. Такая двойственность в поведении NaCl
и приводит к отсутствию ярко выраженной принадлежности ее
к тому или иному классу. Однако сам факт возможности
образования кристаллогидрата, пусть при низких температурах,
указывает на определенные трудности формирования
устойчивой квазикристаллической решетки безводной соли в
концентрированном растворе и возможности ее участия в процессах
сольватации.
Что же можно сказать о диссоциации двойных солей? С
позиций развиваемой нами модели такие соли находятся в
диссоциированном состоянии только в области доэвтектических
концентраций. После эвтектики они существуют сначала как
фрагменты на фоне доминирующей структуры соответствующего
растворителя, а затем как структурная доминанта вблизи
ветвей их кристаллизации.
61
БИОГРАФИЯ КОНЦЕНТРИРОВАННОГО РАСТВОРА
ХЛОРИДА ЛИТИЯ
Мы закончили путешествие по концентрированным
многокомпонентным растворам и в общих чертах можем теперь
представить себе, насколько сложны и своеобразны
взаимоотношения компонентов в них. Обогатившись новыми идеями, снова
вернемся к простой бинарной системе соль — вода и попробуем
более детально обсудить особенности концентрированного
раствора хлорида лития. Почему именно эта соль привлекла
наше внимание? Она интересна тем, что характеризуется высокой
растворимостью и богата кристаллогидратами различного
состава. Это LiCl-5H20, LiCI-3H20, LiCl-2H20 и, наконец, при
насыщении LiCl-H20. Все кристаллогидраты, кроме последнего,
существуют при пониженных температурах, иногда на
несколько десятков градусов ниже комнатной температуры. Но если
раствор, по аналогии с водой, обладает «структурной памятью»
(«помнит» о том, в каком состоянии он кристаллизовался при
замораживании), то после эвтектики следует ожидать
последовательного изменения структурной доминанты раствора вслед
за сменой кристаллогидратов при концентрировании.
Возможность проникнуть в тайны раствора, рассмотреть
взаимоотношения компонентов на молекулярном уровне
предоставляют нам современные физические методы. Одним из
таких методов является метод протонной магнитной релаксации
в присутствии парамагнитного иона, когда релаксация
определяется в основном диффузионными перемещениями
ближайшей к парамагнитному иону воды (это первая
координационная зона иона). При этом, естественно, состояние молекул
воды в ближайшем окружении такого иона будет зависеть от
состояния и структуры среды, в которой он находится.
Эксперимент проводили следующим образом. К раствору
хлорида лития разных концентраций добавляли каждый раз
постоянное количество соли с парамагнитным катионом. Такой
солью был хлорид марганца, концентрация которого
составляла 10~3 моль/1000 г Н20. Из данных по скорости протонной
релаксации, полученных в широком температурном интервале,
с использованием известных в теории ядерного магнитного
резонанса уравнений рассчитали микрокинетические
характеристики воды, находящейся в ближайшем соседстве с ионом
марганца, — %Су то, £акт., -Кмп-н. Интерпретация этих
характеристик с позиций предлагаемой концепции строения
концентрированных растворов позволяет более глубоко проникнуть
в тайны микромира исследуемого раствора.
Прежде чем обсуждать результаты эксперимента, коротко
поясним физический смысл микрокинетических характеристик.
Тс —это время корреляции вращательного движения микро-
компонента, в состав которого входит ион марганца. Посколь-
62
ку время обмена молекул воды на 4—5 порядков больше
времени корреляции, то £акт является энергией активации
вращения этого микрокомпонента. /?мп-н—расстояние от центра
катиона марганца, до протона ближайшей к нему молекулы воды.
Эта величина непосредственно из расчета не получается, а
определяют параметр, который является функцией числа
молекул воды ближайшего окружения иона марганца л+ и #мп-н .
Хотя изменение этого параметра с изменением состава
раствора описывается изменением как /г+, так и /?мп-н. можно
разделить эти два вклада и отметить определенные
закономерности в тех изменениях, которые происходят в растворе. Если
исходить из различных кристаллогидратов марганца, то ока-
V10 "с
*Дж
моль
0 I /8 /1Z /16
-J id l_£_I i_/J
4/8 / 12 /16
Лед Ш-5Нг0 LiCV3H20 LiCl-2H20 Лед LiC1-5H20 LiCV3H20 LiCTZH^O
m Li С1,моль/Шг Н20 т И'С1,моль/10Шг H*Q
Рис.7
жется, что расстояние #мп-о в них колеблется в пределах от
0,208 до 0,222 нм. Из этих данных можно рассчитать интервал
изменения расстояний /?мп-н в кристаллогидратах, он
составляет 0,276-^-0,292 нм. Современные физические методы
показали,, что /?мп-о в концентрированных растворах мало отличается
от #мп-ов соответствующих кристаллогидратах. Значит, и
реальные расстояния /?мп-н, полученные из эксперимента, при
постоянном я+ должны лежать в тех же пределах, которые
соответствуют твердым кристаллогидратам, т. е. доверительный
интервал изменения #мп-н составляет 0,276ч-0,292 нм. Сложнее
всего дело обстоит с определением физического смысла
характеристики т0. Не вдаваясь в детали, отметим лишь, что
параметр то отражает размеры микрокомпонента, включающего
ион марганца, его пространственную протяженность. Увеличе-
63
ние размеров микрокомпонента приводит к уменьшению to
и одновременно к увеличению энергии активации его вращения.
Что же показали результаты расчета микрокинетических
характеристик воды в первой координационной зоне иона
марганца, помещенного в растворы хлорида лития разных
концентраций? Обратимся для этого к рис. 7. Во всей области
концентраций LiCl xc возрастает, но интенсивное увеличение
тс начинается только после концентрации, соответствующей
эвтектике на политерме растворимости LiCl (после 7,9 /п), при
переходе в область кристаллоидного раствора.
Но судить более конкретно о структурных модификациях
в растворе хлорида лития нам поможет анализ изменения
других микрокинетических характеристик — то, £акт, /?мп-н. До
концентрации 4,5 т LiCl все микрокинетические
характеристики соседствующей с марганцем воды как в растворе, так
и в чистой воде практически одинаковы. Микрокомпоненту,
включающему ион марганца, безразлично, находится ли он
в чистой воде или в ней присутствует посторонняя соль (L1C1).
Это обусловлено тем, что в растворе хлорида лития до
концентрации 4,5 т доминирующей является структура воды и в воде
как растворителе существует микрокомпонент [Мп(Н20)6]2+.
В области от 5 т до 9 т LiCl наблюдается резкое
увеличение £акт и уменьшение то (на рисунке это выглядит как
увеличение —Into), #мп-н при этом также увеличивается. Что
это означает? По концентрации хлорид лития приближается
к эвтектике, это уже область концентрированного раствора со
структурной доминантой, соответствующей структуре LiCl-
•бНгО (посмотрите еще раз на политерму растворимости LiCl,
изображенную на рис. 4). Уменьшение то свидетельствует об
увеличении эффективного размера микрокомпонентов,
включающих ион марганца, иными словами, образуется единая
система структурных связей между первой гидратной сферой
катиона марганца и структурными группами, соответствующими
пентагидргту хлорида лития. Отсюда и увеличение £акт
и #мп-н —вращаться такому «разбухшему» микрокомпоненту
становится трудно. Вода ближайшего окружения иона
марганца, включаясь в образование связей с новой структурной
доминантой раствора, как бы немного «отходит» от своего
непосредственного партнера.
В области концентраций 9—11 т LiCl замедляется рост
Еакт и резко увеличивается то (на рисунке уменьшение
величины —1пт0). В этой области концентраций, согласно
политерме растворимости LiCl, структурная доминанта раствора
перестраивается из LiCb5H20 на LiCI-3H20. При этом
уменьшается эффективный размер микрокомпонента, включающего ион
марганца (увеличение т0). Расчетные значения #мп-н в
предположении шестиводного окружения марганца оказываются
неправдоподобно большими, выходящими за принятый нами до-
64
верительный интервал. Расстояние #мп-н при л+=6 меняется
в пределах от 0,298 до 0,308 нм, верхняя же граница
доверительного интервала составляет 0,292 нм. Попробуем
пересчитать значения /?мп-н в предположении, что вокруг иона
марганца располагаются не 6, а 4 молекулы воды. Расчет
приводит к реальным значениям: 0,279—0,288 нм. Отсюда можно
сделать вывод, что в области концентраций 9—11 т LiCl
происходит изменение ближайшего окружения иона марганца
с шестиводного на четырехводное, а поскольку
координационное число катиона марганца в растворе всегда равно 6, то
можно предположить, что в его первую координационную
сферу входят два иона хлора.
При дальнейшем увеличении концентрации хлорида лития,
в области 11—14 т, где доминирующей является структура,
свойственная тригидрату хлорида лития, £акт опять резко
увеличивается, а т0 уменьшается. Это означает, что структурная
доминанта такого раствора естественным образом включает
в свою структуру модифицированный на четырехводное
окружение микрокомпонент марганца, снова образуя с ним единую
систему структурных связей, в результате чего резко
возрастает эффективный размер микрокомпонента. Таким образом,
микрокомпонент на основе марганца эффективно включается
в структурные группы как типа LiCl-5H20, так и типа LiCl-
•ЗН2О, однако форма его существования при этом разная, так
как указанные структурные доминанты навязывают
микрокомпоненту различное строение.
При концентрациях LiCl больше 14 т характер
зависимостей £акт и то снова изменяется, что указывает на переход
микрокомпонента в следующую структурную доминанту.
Последняя, согласно политерме растворимости LiCl, соответствует
структуре дигидрата хлорида лития. Незначительное
увеличение £акт и резкое увеличение to свидетельствуют о том, что
микрокомпонент состава [Мп2+-4Н20-2С1_] плохо совместим
с новой доминирующей структурной группой. Для того чтобы
к ней приспособиться, в нем должны произойти очередные
структурные перестройки.
Вот так, следя за состоянием ближайшего окружения
парамагнитной метки (иона марганца) в различных
концентрационных областях раствора диамагнитной соли (в нашем
случае это LiCl), можно почувствовать «дыхание» раствора. И
если справедливо распространенное мнение о «структурной
памяти» воды, то не менее справедливым будет и утверждение
о «структурной памяти» раствора. Несмотря на то, что из
определенных концентрационных зон раствора соли различные
кристаллогидраты кристаллизуются при разных температурах,
иногда очень низких, раствор долго «помнит» о том; какого
типа растворитель из него вымораживается. И как свидетель-
3 779
65
ствуют различные /экспериментальные данные, «структурная
память» раствора сохраняется даже при увеличении
температуры на 100—150° от температуры кристаллизации.
СТРУКТУРНО-ВЫНУЖДЕННОЕ КОМПЛЕКСООБРАЗОВАНИЕ
При исследовании структурных модификаций в
концентрированном растворе LiCl примесный парамагнитный ион
марганца служил своего рода зондом. Однако на этот ион можно
посмотреть и как на объект исследования в процессах комплек-
сообразования в растворах. Катионы переходных металлов
часто образуют различные по составу комплексы, и, поскольку
очень часто эти комплексы получают из раствора, правомерно
задать вопрос: какие события в растворе предшествуют
зарождению таких соединений?
Почти все катионы переходных металлов образуют
комплексные соединения с роданидным анионом SCN~, и ион
марганца в этом отношении не является исключением. Посмотрим,
как отражается образование комплексных частиц в растворе
на характере изменения скорости протонной релаксации.
Опыты показывают, что при изменении концентрации роданида
натрия (NaSCN) в присутствии небольшого постоянного
количества иона марганца (10~3 моль/1000 г Н20) изменяется и
величина 1/Ти причем эти изменения скорости протонной
релаксации начинаются при малых концентрациях роданид-иона
(около 0,1 т). Согласно закону действия масс, с изменением
1/Тх меняется п+ — число молекул воды в первой гидратной
сфере марганца. Идет классическое комплексообразование по
схеме замещения в гидратной сфере иона марганца одной
молекулы воды на один роданид-ион. И хотя концентрационная
константа образования комплекса [Мг^НгО^БСЫ]1* невелика
(при 25°С она равна 1,87±0,50) и комплекс не очень
устойчивый, образуется он при весьма малой концентрации роданид-
ного иона.
Совсем иная ситуация в растворах хлоридов. Например,
увеличение концентрации диамагнитной соли NaCl до 3 молей,
СаС12 до 2 молей или LiCl до 4,5 молей вообще не влияет на
величину 1/Ти а это значит, что скорость протонной
релаксации в растворе Ю-3 m MnCl2 в чистой воде и с добавлением
указанных солей сохраняется постоянной. Приведенные
концентрации диамагнитных солей являются доэвтектическими,
где преобладает структура воды. Таким образом, для катиона
марганца ион хлора как лиганд — слишком слабый конкурент
воды, и классическое комплексообразование не имеет места.
Увеличение концентрации диамагнитной соли —
поставщика ионов хлора — приводит к изменению величины 1/7^ и,
следовательно, к изменению микрокинетических параметров молег
кул воды ближайшего окружения иона марганца (это мы и ви-
66
дели на примере хлорида лития), но> е1це долгое время; ион
марганца сохраняет свое шестиводное окружение. И только
при концентрации хлорида лития, равной Ют, в контакте
с ионом марганца оказывались два иона хлора. Подобное
явление можно было бы, как это часто и делается, объяснить
обычным концентрационным эффектом, значительным
увеличением в ратворе ионов хлора. Однако это не так. В качестве
контраргумента приведем следующий экспериментальный
факт.
В 6 m растворе хлорида кальция с добавкой 10~3 моля
хлорида марганца изменяются все микрокинетические
характеристики молекул воды, связанных с марганцем, кроме параметра
/Z+, — ион марганца остается в окружении шести молекул
воды. И хотя концентрация ионов хлора в растворе СаС12
велика (12 молей/1000 г Н20), комплексообразования,
аналогичного тому, какое наблюдается в растворе LiCl после 10 т, не
происходит. Таким образом, комплексообразование в растворе
LiCl после 10 т можно назвать структурно-вынужденным.
Структурная доминанта раствора, соответствующая
кристаллогидрату LiCl-3H20, вынуждает примесный компонент
[Мп(Н20)6]2+ перестраиваться в структурную группу
[Мп2+(Н20)42С1-], образуя с ним единую систему структурных
связей. Вероятно, при дальнейшем увеличении концентрации
хлорида лития доминирующая новая структура, свойственная
дигидрату хлорида лития, вынудит марганец к еще одной
перестройке — возникнут группы [Мп2+(Н20)2-4С1-], и в конце
концов появится известный твердый комплекс Li2[MnCl4] •
•2Н20.
Теперь легко провести параллель между ранее
обсуждавшейся системой LiCl—СаС12—Н20, в которой образуется
двойная соль по механизму структурно-вынужденного сопряжения,
и системой LiCl—MnCI2—Н20, которую мы только что
рассматривали. Нетрудно заметить, что процессы, происходящие
в обеих системах, удивительно похожи. Чем же в таком
случае следует считать образующееся в последней системе
соединение—комплексом или двойной солью? И вообще, существует
ли критерий, позволяющий различить комплексное соединение
и двойную соль?
Как нам представляется, при образовании того или иного
соединения следует различать два эффекта:
структурно-вынужденное и истинное комплексообразование. В том случае, когда
фрагменты будущего комплекса как устойчивая группировка
начинают образовываться только в области достаточно
высоких концентраций, т. е. после эвтектической концентрации,
речь может идти о чистом структурно-вынужденном комплек-
сообразованищ протекающем по двум механизмам: или это
структурно-вынужденное сопряжение кристаллогидратных
структур, или это сольватация кристаллогидратного компонен-
67
та диполями безводной соли/Кристаллизующиеся при этом из
раствора соединения можно назвать структурно-вынужденными
комплексами, или, используя традиционную терминологию,
двойными солями. В области доэвтектической концентрации
они находятся в диссоциированном состоянии.
Если лиганд появляется в первой координационной сфере
того или иного иона в области малых концентраций (задолго
До эвтектики), где доминирующей является собственная
структура воды, можно говорить об истинном комплексообразовании
с характеристическими константами устойчивости тех или иных
форм комплексных частиц. Увеличение концентрации лиганда
может привести к появлению новых, более сложных форм
комплексных частиц — это так называемый концентрационный
эффект. Однако, приближаясь к концентрации,
соответствующей эвтектике, а особенно в постэвтектической зоне, мы не
можем не считаться с действием структурных эффектов. И
тогда на чистое комплексообразование накладывается
структурно-вынужденное.
У исследователя появляются новые задачи — выявить роль
структурных эффектов в процессах комплексообразования.
Механизмы структурно-вынужденного комплексообразования, по
всей видимости, остаются прежними, а вот результат влияния
структурных эффектов может быть самым неожиданным.
Можно привести много примеров, когда увеличение концентрации
соли — поставщика лигандов — приведет к последовательному
ступенчатому комплексообразованию. Бывают случаи, когда
в процессе последовательного комплексообразования имеет
место «проскок» некоторых ступеней комплекса. Это означает,
что данная форма комплекса несовместима со структурной
доминантой раствора соли, поставляющей лиганд. Наконец,
может быть и такой вариант. В разбавленной области раствора
ион-комплексообразователь образует комплексные частицы
с лигандами, поставляемыми другой солью, но по мере
увеличения концентрации последней, после эвтектики, может
оказаться, что доминирующая структура раствора вообще
затормозит процесс комплексообразования в силу ее несовместимости
с образовавшимися ранее комплексными частицами.
Если у читателя хватило терпения дочитать очерк до
конца, то ему должна стать ясной основная мысль автора о роли
модели в работе исследователя. Хорошо сделанный
эксперимент безгрешен, а потому сам по себе скучен. Определенную
греховность, а стало быть, и притягательную силу придает ему
интерпретация экспериментатора, в основе которой всегда
лежит модель. Предлагаемую здесь модель структуры
концентрированных растворов можно принять или отвергнуть. В конце
концов, как писал Я. И. Френкель, любая модель есть
карикатура на явление. И пусть модель в конечном итоге умрет, но
если она поможет увидеть и понять что-то новое, обнаружить
68
и объяснить явления, до сих пор скрытые от глаз
исследователя, объяснить то, что было неподвластно другой модели,
значит она сделала свое дело. Девизом же исследователя
должны быть слова, сказанные Альбертом Сент-Дьёрдьи:
«Исследовать— это значит видеть то, что видели все, и думать так,
как не думал никто».
БЫСТРЫЕ РЕАКЦИИ... ИНЕРТНЫХ ГАЗОВ
Наука... становится в какой-то степени
романтикой нашего времени, поражающей
воображение людей новыми горизонтами,
новыми мирами...
Я. Н. Семенов
ИНЕРТНЫ ЛИ БЛАГОРОДНЫЕ ГАЗЫ)
ет 30 назад считали, что инертные (благородные)
газы, имея 8 электронов во внешней электронной
оболочке и проявляя «нулевую» валентность,
вообще не способны вступать в химические реакции
с другими элементами. Но вот в 1961 г. канадский
химик Нейл Бартлет получил первое соединение ксенона —
XePtF6. Ныне синтезировано более ста вполне устойчивых
соединений радона, ксенона и криптона: XeF2, XeF4, XeF6, RnF2,
KrF2, Xe03, Хе04, KrF2-SbF5, 2KrFrTiF4, RnF2-SbF5 и многие
другие. И если раньше инертные газы помещали в нулевую
группу периодической системы элементов Д. И. Менделеева,
то теперь им отведена главная подгруппа восьмой группы
таблицы (Villa группа), а чтобы подчеркнуть их ограниченную
инертность, за ними оставили название «благородные газы».
В настоящее время известно более 100 000 неорганических
соединений, т. е. в среднем на элемент приходится их более
1000. А число органических и элементоорганических соединений,
в принципе, неограниченно. Но из благородных газов
неорганические соединения получены только с такими
электроотрицательными элементами, как фтор, кислород и некоторые
другие, а элементоорганических они вообще не способны давать.
Поэтому без большой натяжки эти малодеятельные элементы
можно именовать и по-старому — «инертными газами».
Действительно, когда химикам для синтеза или хранения каких-
нибудь реакционноспособных соединений требуется инертная
атмосфера или инертный разбавитель, они, как и раньше,
используют для этих целей аргон, неон или гелий, но могут взять
криптон или ксенон — ведь последние теряют инертность лишь
в присутствии элементарного фтора или некоторых его
соединений.
69
Таблица I
Элемент
Не
Ne
Аг
Кг
Хе
Возбужденное
состояние атома
He(iSo)
He(23S)
He(2>S)
Ne(iSo)
Ne(3A)
Ne(3P,)
Ne(3/>0)
Ne(ip,)
Ar(i50)
Ar(3/>2)
Аг(3Л)
Ar(3Po)
Аг(«Л)
Kr(>50)
Kr(3P2)
Кг(зр,)
Kr(3P0)
Кг(>Л)
Хе(>50)
Хе(зр2)
Хе(зр1)
Хе(зр0)
Хе(1Л)
Электронная
конфигурация
1$2
ls2s
\s2s
2р6 |
2/>5(2/>з/2 )3s
2^(2p0/2)35
3/7^
*p'i*P03l2)4s
4рв
4^(2р0/2 )5s
4pb(^,2)5s
5р*
5^(=Р«/2)б5
5p5f 2p0/2 )6s
Энергия,
эВ
0
19,81
20,60
0
16,61
16,66
16,71
16,85
0
11,54
11,62
11,72
11,82
0
9,91
10,03
10,56
10,65
0
8,30
1 8,43
9,40
9,57
Радиационное
время жизни, с
оо
7900
0,03
сю
24
5-Ю-9
430
2-10~9
со
56
4,110-9
45
2,5-10~9
1
со
85
4,4-Ю-9
0,5
10-Ю-9
со
150
3,7- Ю-9
0,08
4,5-10"9
Однако исследование химии благородных газов в
традиционном аспекте — получении новых соединений — не является
целью данного очерка. Мы хотим познакомить вас с быстрыми
реакциями инертных газов, которые физикохимики изучают уже
более 30 лет. В чем же причина столь необычного поведения
70
благородных газов? Мы привыкли под химией элементов
понимать химию стабильных молекул и невозбужденных атомов.
Между тем на единственное невозбужденное * состояние атома
любого элемента приходятся тысячи электронно-возбужденных
состояний, и атом в каждом из таких состояний не похож на
себя в любом другом и менее всего похож на себя в основном
состоянии.
Обратимся к табл. 1, в которой приводятся обозначение,
структура и свойства некоторых электронно-возбужденных
состояний благородных газов (кроме радона). Можно заметить,
что атом благородного газа в низших возбужденных состояниях
обладает одновременно электронной структурой галогена и
щелочного металла (сравним, например, конфигурацию 2p53s
возбужденного неона Ne(3P) с конфигурацией 2р5 фтора или
2p63s натрия). Понятно, что такой бирадикал, как, например,
Ne(2p53s) или Ar(3p54s), должен проявлять чудовищную
реакционную способность, обладая в одно и то же время
химическими свойствами атомарного галогена и щелочного металла.
Правда, время жизни некоторых электронно-возбужденных
состояний не превышает миллионных долей секунды (см. табл. 1),
но для химика и для химии это не помеха, так как даже за
такое время атом успевает испытать тысячи и десятки тысяч
столкновений с окружающими молекулами и полностью
проявить свой химический нрав. А время жизни, измеряемое
долями секунды и тем более десятками и сотнями секунд, — это
делая вечность для свободного бирадикала. Вот эту-то химию
активнейших электронно-возбужденных атомов благородных
газов мы и рассмотрим в настоящем очерке.
Здесь небезынтересна будет аналогия с явлениями
радиоактивности. После того как физики научились с помощью
ускорителей и ядерных реакторов синтезировать радиоактивные
изотопы, они убедились, что на каждый стабильный изотоп
приходится до десяти радиоактивных изотопов и сотни корот-
коживущих возбужденных состояний, причем каждый из этих
радиоактивных нуклидов обладает своими уникальными
ядерно-физическими свойствами. Ядерная физика несказанно
обделила бы себя, если бы ограничивалась изучением одних лишь
стабильных изотопов. Но именно стабильные состояния
соединений изучала химия на протяжении 300 лет своего
существования как науки. И только теперь физикохимики приступили
к изучению свойств химически нестабильных атомно-молеку-
лярных частиц: электронно-возбужденных атомов и электронно-
колебательно-вращательно-возбужденных молекул. Правда,
возбужденные состояния благородных газов изучаются в боль-
1 В квантовой механике невозбужденное состояние атома называют
основным состоянием.
71
шем масштабе, так как с ними меньше хлопот: по окончании
всех процессов в экспериментальной установке инертный газ
оказывается в свободном виде и не загрязняет внутренней
поверхности установки, оптических окон, через которые ведется
наблюдение за процессами, вакуумных насосов и т. д.
ХИМИЯ ВОЗБУЖДЕННЫХ АТОМОВ БЛАГОРОДНЫХ ГАЗОВ
За последние годы экспериментальная техника для изуче^
ния быстропротекающих реакций с участием возбужденных
атомно-молекулярных частиц чрезвычайно усложнилась. Лет
20—30 назад в лучших лабораториях мира использовались им-
пульсно-фотохимические установки, в которых за судьбой
возбужденных частиц следили методами кинетической
спектроскопии, т. е. путем регистрации меняющегося во времени
оптического спектра исследуемой смеси с временным разрешением
в тысячные или миллионные доли секунды. Теперь для
селективного возбуждения атомов и молекул применяют лазеры,
а за судьбой возбужденных частиц следят с помощью
кинетической абсорбционной, эмиссионной или вынужденной (с
помощью лазеров, конечно) рамановской или внутрирезонаторной
спектроскопии с временным разрешением в миллиардные или
даже триллионные доли секунды.
Однако такие «кинетические» эксперименты дают лишь
информацию о константах скорости реакций с участием частиц,
термализованных (достигших равновесия с окружением) по
поступательным и некоторым другим степеням свободы. Чтобы
получить более детальные сведения о частицах, вернее, инфор^
мацию об эффективных сечениях их реакций в заданном
квантовом состоянии с заданной начальной скоростью,
используются установки на молекулярных пучках — полные аналоги
ускорителей, ко только не для атомных ядер и элементарных
частиц, а для атомов и молекул.
Вообще говоря, кинетические эксперименты, дающие
информацию о константе скорости какой-то реакции, позволяют
найти и эффективное сечение соответствующего элементарного
процесса. В самом деле, если kij;i,m—константа скорости
элементарного процесса
A(i) + B(j)-+C(l) + D(m)y (1)
то
К, ,..<П- V%)°\, ,JBt)e-^ %fr, (2)
где \х— приведенная масса реагирующих частиц; Et — их отно-
72
сительная трансляционная энергия; i, j и /, т — колебательно-
вращательные квантовые числа исходных и конечных частиц
соответственно; k — постоянная Больцмана. Применение
обратного преобразования Лапласа к уравнению (2) позволяет
получить явное выражение для реакционного сечения
где р=(Л7)-1.
Соотношения (2) и (3) могут натолкнуть на мысль, что
кинетические измерения зависящих от температуры констант
скорости делают ненужными молекулярно-пучковые эксперименты
по измерению реакционных сечений. Или, наоборот, мо^но
думать, что современные молекулярно-пучковые установки
должны привести к вымиранию кинетических экспериментов. Однако
практика показывает, что до сих пор нет ни одного случая,
когда кинетические эксперименты позволили бы вычислить
правильные сечения, а имеющиеся данные о сечениях
позволили бы правильно вычислить .константу скорости. Дело в том,
что для корректного выполнения этих вычислений необходимо
абсолютно точно знать детальный механизм рассматриваемого
процесса. Но абсолютно точное знание — это идеал, который
вряд ли достижим сейчас хоть в одной области науки.
Кроме того, чтобы по формуле (2) вычислить k(T) хотя бы
в одной температурной точке 7\ нужно иметь значения G*(Et)
во всем диапазоне энергий Et от 0 до оо. И наоборот, для
вычисления по формуле (3) сечения а* хотя бы для одного
значения энергии Et надо знать k(T) для всех температур от 0 до
нескольких тысяч градусов. Но измерения и сечений в широких
диапазонах энергии Et, и констант скорости в широком
температурном интервале чрезвычайно трудны и в настоящее время
выполнены для очень ограниченного круга химических
реакций. Таким образом, на сегодняшний день и в обозримом
будущем кинетические и пучковые методы будут развиваться
одновременно, дополняя и обогащая друг друга.
Для нас здесь важно то, что соотношение (2) можно
коротко записать так:
где скобки <>■ означают усреднение по скоростям v
реагирующих молекул. Приближенно равенство (4) перепишем
в виде
.А,Л/..(7')=<«><«;1/;(,я>. (5)
Здесь <»>•— средняя скорость молекул при данной темпера-
73
туре Г, так что среднее сечение <Oi,j;i,m > при температуре Т
оказывается прямо пропорциональным константе скорости при
той же температуре. В дальнейшем мы и будем пользоваться
везде не константами скорости, а усредненными эффективными
сечениями, обладающими большей наглядностью. (Читатель
же, при желании, легко может перейти от <а> к k(T) с
помощью формулы (5).)
Вернемся, однако, к экспериментальным методам. Мы уже
говорили о том, что современные экспериментальные установки
для исследования возбужденных атомно-молекулярных частиц
являются сложнейшими устройствами, создать которые способ-
асосу
Рис 1
на далеко не каждая лаборатория. Поэтому может показаться
удивительным, но 95% всей информации о реакционноспособ-
ности возбужденных атомов получено и получают сейчас на
«простеньких» проточно-разрядных установках. В такой
установке (рис. 1) в реакционный объем 3 вдувается поток
благородного газа, возбужденного по пути высокочастотным
разрядом, создаваемым молибденовыми электродами 2, и вследствие
этого содержащего электронно-возбужденные атомы. Из
другой трубки в тот же объем вдувается газообразный реагент,
реакции которого с возбужденными атомами желает изучить
экспериментатор. Полную информацию об исходных частицах
и всех продуктах получают спектральными методами.
Например, на рис. 1 изображен эмиссионный вариант спектрального
анализа, при котором излучение исходных и конечных
возбужденных частиц в реакционном объеме через окно 4 и линзу 5,
выполненных из кварца или фторида лития, попадает в спект-
74
рограф 6У регистрируется и полученный спектр
расшифровывается. Весь прибор, за исключением оптической части,
находится в термостате / при заданной экспериментатором
температуре Тэ. Повторяя измерения при нескольких значениях Гэ,
достаточно различающихся между собой, получают зависимость
изучаемых процессов и их констант скорости от температуры
реакционной среды.
К настоящему времени лучше всего изучены процессы
дезактивации электронно-возбужденных атомов инертных газов
X* в среде различных реагентов М, идущие по схеме
X* + М*-^ X + продукты, (6)
где Адез=<^><аДез> — константа скорости дезактивации
атомов X*, а под «продуктами» подразумевается результат
любых физико-химических превращений молекулы М: ионизации,
электронного или колебательно-вращательного возбуждения,
диссоциации, изомеризации и т. д. Изучено действие несколь:
ких десятков соединений в роли М на ряд возбужденных
состояний X* для каждого благородного газа X. Наиболее ин-
Таблица 2
м
вг.к.
Кг
Хе
Hg
н2
СО
N2
о2
F2
со2
SF6
CF4
СН4
с2нв
С<ню
He('S)
26
28
36
—
2,2
24
12
45
—
85
53
—
27
43
70
| Не(а$)
25
8
10
—
1,2
7
5
18+2
—
47 + 3
21
—
10
19
32
Лг('Л)
46
0,3
73
-
15±3
15±1
9+1
52
260
132
200 + 20
—
78
150
200
<%e<)
Аг(*Я0)
46
0,5
58
219
4
21
2,5
41
160
108
38
8
74
—
—
для X*
Аг(3/>,)
46
3±1
50
—
11±1
10±3
2 + 1
42
180
89
142
—
62
100
100
А г («Я»)
46
2+1
43±3
194
4+1
3+J
6±1
30 + 5
160 + 30
98 + 2
60 + 20
8
65 ±20
115±5
160±15
Кг(зЯг)
52
—
— •
124
2
11
0,7
31
146
85
51
0,2
54
93
166
•Хе(зр2)
66
—
—
<0,001
1
7
4
44
161
103
75
0,1
49
125
170
Примечания. 1. аг к —газокинетическое поперечное сечение атома X. 2.
Погрешности указывают расхождение между данными различных авторов.
75
тересные, с нашей точки зрения, данные вошли в табл. 24
(Течения <а}> мы выражаем в квадратных ангстремах
(А)2 = 10-16 см2, являющихся удобной единицей для атомар^
ных процессов.)
Для химика данные табл. 2 обладают чрезвычайной
ценностью: ведь соответствующие строгие и даже приближенные
квантовомеханические расчеты никто не проводил, да и вряд
ли они будут проведены в ближайшие 20—30 лет, а какой-либо
надежной или даже ненадежной количественной эмпирической
закономерности тоже пока не обнаружено. Так что проблема
остается: требуется сделать для молекул то, что для
элементов сделал Д. И. Менделеев, а именно — найти эмпирическую
количественную закономерность для <адез>, обладающую
предсказательной силой. Действительно, кое-какие
качественные закономерности присутствуют в табл. 2. Во-первых, во
всех случаях <<тдез> для криптона на 1—2 порядка меньше,
чем для ксенона в роли М, что согласуется с большей
инертностью криптона. Во-вторых, сечение <сгдез> для таких
химически весьма инертных молекул, как СО, N2 и CF4, всегда
на 1—2 порядка меньше, чем для таких молекул, как Ог, С02
или СН4, обладающих заметной рёакционноспособностью.
Наконец, сечения <<тдез> достигают 200 А2 и более (что в
несколько раз превышает газокинетические сечения аг. к) для
таких активнейших частиц, как Hg или F2.
В табл. 2 прослеживается еще одна общая закономерность:
для всех изученных электронно-возбужденных атомов
благородных газов сечения <(ТД^3> огромны и часто превышают
даже газокинетическое сечейие столкновения аг. к реагирующей
пары Х*+М. Это и понятно: ведь электронно-возбужденный
атом благородного газа—это одновременно и атомарный фтор,
и атомарный цезий!
Схема (6) ничего не говорит о продуктах, в которые
превращается молекула М. Между тем именно здесь химик
может натолкнуться на новые явления. Действительно,
возбужденные благородные газы вызывают такие превращения всех
молекул М, которые не могут возникнуть ни под действием
атомарных галогенов, ни под действием щелочных металлов.
Рассмотрим более подробно процесс (6):
-X4-M+ + £+Qi (ионизация по Пеннингу) (7.1)
>(ХМ)++ е + Q2 (ассоциативная ионизация) (7.2)
X* + М—|->Х + М* + Q3 (передача возбуждения) (7.3)
-X + M* + Av4-Q4(дезактивация со свечением) (7.4)
-Х+продукты превращений М. (7.5)
1 Более полную сводку эффективных сечений дезактивации <аДеэ>
метастабнльных атомов инертных газов различными соединениями при 300 К вы
Можете найти в работах: V е 1 a z со J. E. е. a.—J. Chem. Phys., 1978, vol.69,
p. 4357; S с h т е 1 t е к о р f A. L. е. a.— J. Chem. Phys., 1970, vol. 53, p. 3173.
76
Таблица 3
Реакция
х*мсл гХ+Сё++Г
<°Ион>. А2
х*+н2-
< 5ИОН > »
X* + С05
<аион>»
-*н2+
-(ХН)+
А*
>—
А2
-СО+ |
->(ХС02)+
1 Не(2 'S)
__
85
10
2,2
2.6
3
68
9
23
0
59
He(2»S)
58
42
45
88
8,1
2.1
1,5
4
69
4,5
27
0
63
1 Ne(3V)
50
50
f 46
| 78
22
0
0
3
99.4
0
0
0.6
37
Сумме реакций (7—3), (7—4), (7—5) соответствует процесс
(6), сечение которого равно <адез>; сумме же ионизационных
процессов (7—1) и (7—2) соответствует сечение <аИОн>.
В табл. 2 приведены только значения <адез>. Между тем
измерения показывают, что <сгИон> и <сгдез> соизмеримы,
а иногда ионизация даже более вероятна, чем дезактивация.
Таблица 4
Реакция
X* + НаО -
X» + D20 -
-+Х+Н+ОН
->х+н2+о
-Х+2Н+0
-*X+D+OD
+ X + D2-fO
->X+2Q+0
Ar(V,)
54±5
0
46±5
52±4
3±3
45±5
* Kr(3P2)
86±4
3±3
11 ±5
90±2
0±4
10±4
Xe(V2)
100 + 6
0±6
**
100±14
0+14
**
Примечание. Две звездочки означают, что реакция невозможна из-за ее эндо-
термичности.
77
Из данных табл. 2 нельзя видеть, в какой химической1 форме
оказываются конечные продукты. Для этого необходимы более
детальные исследования. Например, для процессов: ионизации
кадмия, водорода и углекислого газа такие данные получены1
(в табл. 3 дан выход различных ионов (в %) при
взаимодействии этих, соединений с возбужденным атомом X* инертного
газа). Изучались также каналы ветвления и для нейтральных
конечных продуктов, например для обычной и дейтерированной
воды2 (в табл. 4 приводятся относительные коэффициенты
ветвления в %).
Может показаться, что данные таблиц 3 и 4 — это настолько
узкая область химии, что она может заинтересовать лишь очень
узкий круг любителей химической экзотики. Такое
представление ошибочно. В конце очерка мы покажем, сколь
крупномасштабная технология возможна на основе процессов,
фигурирующих в этих таблицах. Да и с то^ки зрения химической экзотики
их данные интересны широчайшим кругам химиков.
Действительно, из табл. 3 и 4 видно, что без всяких катализаторов
такие «прочные» молекулы, как НгО или С02, дробятся на
отдельные атомы под действием возбужденного атома
благородного газа, да еще с полной регенерацией последнего.
Безусловно, результаты, представленные в табл. 3 и 4,—
это не предел изощренности современных физикохимиков.
Например, помимо давно известных процессов передачи энергии
► Х + АВ* (8)
>- X + А* + В (9)
X* + АВ-
для галогенидов RY (Y — атом галогена) обнаружены
процессы рождения так называемых эксимерных молекул (т. е.
молекул, распадающихся после потери электронного возбуждения
в первом же колебании):
X*+RY->R + (XY)*
Л (Ю)
Х+ Y + /zv.
Установлены также новые каналы образования электронно-
возбужденных молекул. Вот несколько примеров:
Аг(3Р2) + СОС12 -^Аг + СО + C1J, (11)
Аг(3Я2) + SCI2 +Ar + S + <Х (12)
*Ar + N2(C3IIJ
Ar(3P2) + N2
(13)
1 West W. P., e. a.—J. Chem. Phys. 1975, vol. 63, p. 1237; Rise-
berg L. A., e. a.—Phys. Rev., 1973, vol. A8, p. 1962.
2 Balamuta.J., Golde M. R— J. Chem. Phys. 1982, vol. 76,
p. 2450.
78
Хе(3Я2) + CH3ONO-
*Хе + NO(A) + продукты (<4)
► Хе + N0(5) + продукты,
рде Л, В и С обозначают электронные термы соответствующих
Молекул. Возможно и полное расщепление молекулы М на
составляющие атомы:
Ar(3P2) + N02+ Ar + N + 20 + 1,9 эВ; (15)
Ar(3A) + N,0-vAr + 2N+ 0 + 0,1 эВ; (16)
Аг(3Я2) + Н20 -> Аг + 2Н + О + 2,0 эВ; (17)
Аг(3Я2) + S02 ^ Ar + S + 20 + 0,5 эВ. (18)
Остановимся подробнее на реакции (10) образования экси-
мерной молекулы. Например, в случае атомов Аг(3Ро,2) и
фторидов RF изучались два конкурирующих канала
Ar(3P0,2) + RF —
*Ar('S0) + RF П9)
.(ArF)* + R.
Оказалось, что для достижения высокого выхода эксимерных
молекул {ArF)* подходит далеко не всякая молекула фторида
RF: при использовании F2, NF3 или N2F4 выход эксимера
(ArF)* в реакции (19) достигает 20-5-40 %, но равен нулю, если
в качестве фторида взять CC13F, CF4, CF3H или SiF4. Значит,
и при получении других эксимеров химик должен очень удачно
подобрать исходные реагенты.
По определению эксимерные молекулы — это молекулы,
имеющие несвязывательное основное электронное состояние.
Поэтому-то после высвечивания избыточной энергии эксимер-
ная молекула распадается при первом же колебании своих
атомов. Но электронный переход с верхней (связывательной)
потенциальной кривой на нижнюю (несвязывательную)
кривую происходит у эксимеров так же, как и у вполне
устойчивых молекул, так что они высвечивают широкую
«молекулярную» полосу света, как обычные молекулы. Например, (ХеВг)*
высвечивает фотоны с длиной волны 280—370 нм, (Xel)* —
с длиной волны 250—330 нм, a (KrF)* — с длиной волны
— 250 нм и т. д.
О необычных реакциях электронно-возбужденных атомов
благородных газов можно еще много рассказывать, но
ограниченность объема очерка заставляет автора остановиться лишь
на двух моментах.
79
Прежде всего, как мы отмечали в начале очерка,
электронная структура возбужденных атомов благородных газов
такова, что они должны обладать одновременно свойствами
галогена и щелочного металла. Насколько выполняется эта
аналогия в кинетических свойствах атомов? Высокую точность этой
аналогии легко заметить, если обратиться к табл. 5:1 констану
ты скорости k (в см3/(молекул-с)) для Ne* и F* — величину
одного порядка. Одно это уже говорит о большом сходстве
между атомами Ne* и F*, так как, вообще говоря, две
произвольные химические реакции могут иметь константы скорости,
различающиеся на 10—20 порядков! К тому же наблюдается
значительная симбатность в скорости взаимодействия Ne* и F*
е весьма различными реагентами.
Таблица 5
Реакция
Ne*+ Xe—
->Xe++Ne+_*
->(NeXe)++7
Ne*+NF3-+NeF*-bNF2
Ne*+F2-*NeF*-fF
Ne*+2Ne^
► Ne'-j-Ne
ft-lQ10
0,7
1.1
5,3 1
4
Реакция
-rXe++F+7
i F* + Xe—
U(XeF)++*
f*+nf3-.f;+nf3
F*+F2-^F*+F
| F*-f-2Ne->np04yKTbi
Л-ш»°
3
2,5
5,1
P.1
П р и кг е ч а/н и е. Ne* означает №<2/ОД) и F* означает F(2p*(:,P)3s).
И второй момент. Конечно же, вышеизложенные
кинетические результаты отнюдь не являются вершиной
физико-химических исследований в этой области. Экспериментаторы могут
теперь следить не только за составом конечных продуктов и их
электронным состоянием, но и за их распределением по
колебательно-вращательным уровням. Так, в 1983 г. была получена
новая, более детальная информация о реакции (14) (в скобках
дан выход молекул NG в колебательном состоянии v')\
Xe* + CH3ONO-
">NO(i4> v' = 0) + продукты
->NO{A, v' = 2) +
->N0(4, т/ = 3) + ...
(77%)
(15%)
(5%)
(3°>
(14.1)
*>■
1 Huestis D. L. e. a.—J. Chem. Phys., 1978, vol. 69, p. 5133.
80
Xe*+CH30NO
->N0(5, v' =*= 0) + продукты (68%)
->N0(5, т>' = 1) + ... (17%)
->NO(£, x/' = 2) + ... (9%)
->NO(£, v' = 3)+ ... (4%)
->NO(£, */ = 4) + ... (1,396)
-N0(5, v' =S) + ... (0,7%).
(14.2)
Лет 20—30 назад о таких экспериментальных данных химики
могли только мечтать. Теперь же эсе чаще в печати появляются
работы, в которых описывается распределение реакционных
продуктов по индивидуальным колебательно-вращательным
уровням.
Но и это не предел! Любые кинетические эксперименты, как
это следует из уравнения (5), дают лишь реакционные сечения
jla(j2p)+CfHf
Kr(3P>Q2 Ar(J/»)+HBr
Рис.?
а*, усредненные по скоростям v молекул при данной
температуре. Наличие информации о температурной зависимости
констант скорости позволяет до некоторой степени судить о
зависимости сечения 0* от и, но, как уже отмечалось выше, на
практике использовать соотношение (3) почти никогда не
удается из-за ограниченного диапазона температур, в котором
измерена константа скорости, и из-за неполного знания
детального механизма любого химического процесса. И вот здесь
ценную информацию дают эксперименты на молекулярных
пучках. На рис. 2 результаты для возбужденных атомов
благородных газов представлены в графическом виде.1 Здесь на
1 Рис. 2 выполнен по данным Виникура и Фрайтеса (см.: W i п i с и г .D. Н.,
Fraites J. L.—J. Chemical Physics, 1974, vol. 61, p. 1548; 1976, vol. 64,
P- 89).
81
оси абсцисс отложена начальная относительная кинетическая
энергия (Е) сталкивающихся частиц, а на оси ординат —
измеренные сечения дезактивации (а) метастабильного атома X*
молекулой М. Из рис. 2 видно, сколь разнообразны
взаимодействия для различных возбужденных атомов и молекул.
Показательно тем не менее, что кривые для сечений реакции
Аг(3Я)+НВг и К+НВг лежат рядом и сходны по топологии.
Это и есть экспериментальное доказательство химического
сходства между возбужденным атомом благородного газа
и атомом щелочного металла. Сходство же последних с
атомарными галогенами отражено в табл. 5.
ЭКСИМЕРЫ БЛАГОРОДНЫХ ГАЗОВ
Электронно-возбужденные атомы благородных газов,
будучи чрезвычайно активными, должны обладать , способностью
«расшевелить» любой инертный газ. Подтверждается ли это
экспериментом? Да, подтверждается.
Электронно-возбужденный атом X* в среде благородного
газа X в результате тримолекулярной рекомбинации с большой
скоростью превращается в эксимерную молекулу Х2:
^рекомб
х* + х + х—-*х; + х.
(20)
где X* —атом Х(ЪР\) или Х(3Л>), а Х*2 —синглетная Х2{11>и)
или триплетная Х2(32и)
электронно-возбужденная молекула
Х2. Например, для ксенона
в роли X измерения дали
значение Арекомб (300 К)=ЗХ
ХЮ"32 см6/ (молекул2- с). С
помощью этой константы
скорости нетрудно вычислить
время полуисчезновения атомов
Хе(3Р) в процессе (20) : 50—
60 не при атмосферном
давлении, 5—6 не при 10 атм
(10.100 гПа), и т. д. .(1 нс =
= 10-9с).
Рассмотрим схему
энергетических уровней молекул Х2
и Х2, которая приведена на
рис. 3, но предварительно рас-
Рис.5
В*
шифруем обозначения, данные на рлсунке: г — межъядерное
расстояние; ге — равновесное межъядерное расстояние эксимер-
ной молекулы Х2; ^о — ее. энергия диссоциации; Ет— средняя
тепловая энергия атомов газа X; гх—газокинетический радиус
атома X при температуре Т. Из этого рисунка видно, что
соединение двух невозбужденных атомов X.(]So) дает совершенно
неустойчивую синглетную «молекулу» Хг^Я^), обладающую
четной (g) волновой функцией с молекулярным термом 2,
которому соотзетствует «суммарное», квантовое число Л=0. Со-
Таблица 6
ч
He^Sn)
<35L)
Ne^OSn)
(я2«)
<32«)
<32J
dJ,9b
2,47
2,2
0,57
0,50
0,68
0,6).
0,8±0,1
0.7±0,1
0,9±0,1
1 0,8 ±0,1
>д' нс
—
3
10
4
3
0,3
6
0,1
<°де..
Y=Kr
—
—
300
100
—
:
> Y> Aj
Y-Xe
—
—
3200
8)0
780
10Э
1
1
h v,, нм
60±2
74 ±3
107±4
124±6
147±10
h v,,, им
80^-90
1004-115
125-^135
1404-H5
1604-175
Примечание. В табл. 6 вошли лишь некоторые данные из следующих книг:
«Э к с и м е р н ы олазеры»/Под ред. Ч. Роудза (М., 1981); Смирнов Б. М.
«Возбужденные атомы» (М., 1982).
единение атома X^Sq) с возбужденным атомом Х(3Р2) дает
триплетную молекулу Х2(32и) с нечетной (и) волновой
функцией, а соединение атома X(1S0) с возбужденным атомом
X(3Pi)—синглетную молекулу X2(,2U) также с нечетной (и)
волновой функцией.
Эксимерные молекулы Х2 обладают заметной энергией
диссоциации Do (табл. 6), так что вполне термически
стабильны вплоть до температур порядка 1000 К. Тем не менее они
быстро исчезают в результате радиационной дезактивации
трад
X2(2J—^X2('^)+Av2 (21)
XCU + XCSo). (22)
Данные табл. 6 показывают, что радиационные времена жизни
трад эксимерных молекул благородны^ газов не превышают
83
10 нс, но время, за которое происходит распад (22), равно
времени одного колебания молекулы Х2(12^), т. е. составляет
— 0,001 нс, так что эксимер Х2—долгожитель по сравнению
с «разлетной» молекулой Х2.
Помимо радиационной дезактивации (21) к исчезновению
эксимерных молекул приводит их столкновительная
дезактивация на любом реагенте М:
л < °дез > м
Х2 + М X('.S0) + Х(1«50) + продукты. (23)
Сечения (константы скорости) этих процессов огромны. Даже
для таких инертных реагентов М, как, например, криптон или
ксенон, сечения дезактивации <адез>м составляют несколько
сотен квадратных ангстремов, что в десятки раз превышает
газокинетические сечения реагирующих молекул (см. табл. 6).
Наконец, очень эффективно протекает процесс (23) в том
случае, когда в роли реагента М выступают сами молекулы X?
Х2* + X;-* Х+ + е + X('S0) + X('So). (24)
Так, для ксенона в роли X сечение реакции (24) составляет
~ 100 А2.
Еще более разнообразны процессы с участием электронно-
возбужденных атомов X* в среде благородного газа Y с
большим атомным номером, чем у атома X. Тогда помимо реакций
(20)—(24) становится возможной передача возбуждения от
X* или от Х1 к Y:
Х(1.з/>) + Y(150)^^--X(150) + Y(i.3p); (25)
Х2* + YCS0)^^L2X(*S0) + Y?.*P). (26)
Затем атомы Y* (как и X*) вступают в реакции (20) — (24),
где реагентом М являются все присутствующие в смеси атомы
и молекулы. Сечения дезактивации <Са>Аг, кг и <а>кг, \е
достигают нескольких тысяч квадратных ангстремов. Такова
реакционноспособность «инертных» газов, когда они находятся
в форме эксимерных молекул.
Интересно, что эксимеры Х2 можно получать
фотовозбуждением непосредственно из невозбужденных атомов Х(150).
Как это происходит, помогает понять рис. 3: при заданной
температуре Т два атома Х(!50), находящиеся в состоянии
столкновения, фактически образуют «молекулу» X2(l2>g) с
межъядерным расстоянием порядка гх, и эта молекула вполне может
поглотить квант света (ftvi на рис. 3). Действительно, широкие
молекулярные полосы поглощения, на первый взгляд очень
странные для атомарных благородных газов,
физики-спектроскописты наблюдали еще в 30-е годы (значения длин волн для
квантов ftvi см. в табл. 6).
84
ТЕХНИЧЕСКИЕ ПРИЛОЖЕНИЯ ... ЭКСИМЕРНЫХ МОЛЕКУЛ
Правомочно начать с вопроса: «возможна ли какая-нибудь
технология на основе таких объектов, как эксимерные
молекулы, если они живут-то всего миллиардные доли секунды?». Да,
возможна. Некоторые фирмы уже получают прибыли от экси-
меров. (Как тут не вспомнить Майкла Фарадея, который еще
в то время, когда его электромагнитная индукция едва-едва
отклоняла магнитную стрелку, предсказывал, что в скором
времени правительства будут взимать с нее налоги.)
Сейчас на основе эксимеров созданы газовые импульсные
лазеры, обладающие уникальными свойствами. Схема такого
лазера представлена на рис. 4, а принцип действия его можно
объяснить по рис. 3. Накачка энергии осуществляется с по-
Рисл
мощью сильноточного ускорителя электронов, состоящего из
вакуумной камеры 4, катода 2, заземленного корпуса / и
высоковольтного источника 3. Импульс электронов длительностью
Зч-10 не (с энергией от 10 до 2000 Дж) срывается с катода
и сквозь фольгу окна 7 попадает в рабочий объем 5 эксимер-
ного лазера, где находится благородный газ X под давлением
в несколько десятков атмосфер. Поскольку ускоренные
электроны имеют большую длину пробега, они пронизывают всю
толщу газа X в рабочем объеме и возбуждают его:
XVS0) + e-+X(**P) + e. (27)
Из получившихся атомов X* по реакции (20) образуются
эксимерные молекулы Хг, которые в отсутствие зеркал 5
резонатора за счет переходов (21) дают мощную люминесценцию
/iv2, вырывающуюся из объема 8 через оптическое окно 6. При
85
наличии же оптического резонатора возникает короткий
(5-ИО не) и мощный импульс стимулированного излучения
Х2* + h\ -> Х2С 2^) + 2 Л v2. (28)
Для ксенонового эксимерного лазера мощность импульса
оказывается столь большой, что после двух-трех импульсов
разрушаются зеркала резонатора, а полная энергия импульса
достигает 1 Дж. Кстати, первый ксеноновый эксимерный лазер
(Я == 172 нм) был создан в СССР,1 а ряд фирм на Западе
выпускает эксимерные лазеры как физические приборы.
Интересно, что помимо накачки энергии пучком ускоренных
электронов существует возможность оптической накачки эксимерных
лазеров,2 но пока эта заманчивая возможность остается
нереализованной.
Эксимерные лазеры являются уникальными устройствами:
они дают очень мощные и короткие лазерные импульсы с
перестраиваемой (!) длиной волны и в то же время перекрывают
ультрафиолетовую и вакуумно-ультрафиолетовую (вплоть до
126 нм) область спектра, где никакие другие лазеры не
действуют. Использование эксимерных лазеров привело к
гигантскому прогрессу фотохимических исследований в области
кварцевого и вакуумного ультрафиолета — там, где раньше в
распоряжении исследователя были лишь кварцевые лампы
непрерывного спектра да ртутные или водородные источники
редких резонансных линий.
А вот еще одна, правда пока «сырая», неапробированная
идея практического использования реакций
электронно-возбужденных атомов благородных газов. Будем считать, что читатель
знаком с широко обсуждающейся идеей перевода современной
промышленности с электрической энергии на водородную и что
он читал или слышал об инженерных разработках, в которых
пытаются создать безмеханические системы прямого
превращения тепла и других видов энергии в электричество (что
сулит повысить надежность и к.п,.д. тепловых, солнечных и
атомных электростанций). Интересно то, что с переходом на
водородную энергетику проблема прямого безмеханического
превращения атомной и термоядерной энергии (а за ними
будущее) в энергоноситель — водород — существенно упростится.
Нерешенных проблем еще очень много. И один из возможных
путей создания рентабельных и надежных технических устройств
по переведению энергии ионизирующего излучения в запасы
водорода или кислорода — это реакции
электронно-возбужденных атомов благородных газов с углекислым газом или водой
(см. табл. 3 и 4).
1 Басов Н. Г. и др. — Письма журя, эксперим. теор. физики, 1970,
т. 12, с. 473.
2Скоробогатов Г. А. — Журн. техн. физики, 1975, т. 45, с. 827.
86
Таким образом, мимолетные и эфемерные возбужденные
состояния и эксимеры «инертных» газов начинают служить
людям. Это еще раз доказывает огромную значимость
фундаментальной науки: любая химическая и не только химическая
экзотика в умелых руках может служить человеку.
Но, может быть, все-таки бывают такая сверхэкзотика,
такие «сверхтонкие» эффекты, что от них никакой практической
пользы никогда не будет? Ответ на этот вопрос дал лауреат
Нобелевской премии академик Н. Н. Семенов в одной из своих
статей: «На любом эффекте возможно создание технологии».
Остается только добавить: чем тоньше и экзотичнее физико-
химический эффект, тем проще и надежнее технология, так
как изобретателю-инженеру уже «почти ничего» не надо будет
додумывать.
АКТИВИРОВАННАЯ ВОДА
Глава «Вода» в великой книге
познания занимает большое место, но пока она
только начата.
Дж. Пиккарди
хтивированная вода... Так обычно называют воду
с временно измененными физико-химическими
свойствами, приобретенными ею после обработки разного
рода физическими воздействиями: магнитным или
электрическим полем, ультразвуком, резким
диспергированием, дегазацией, нагреванием с прохождением через
точки фазовых переходов (температуры плавления и кипения,
критическая точка воды) и др. Необычность свойств такой
воды состоит прежде всего в том, что ее нельзя рассматривать
как термодинамически равновесную систему, которая должна
возвращаться (релаксировать) в исходное состояние после
физического воздействия практически мгновенно — за время
порядка 10"9 с. Для активированной воды время релаксации
много больше и составляет часы, сутки, а в отдельных случаях
даже годы. Таким образом, вода долго «помнит» свою
предысторию, длительное время сохраняя неравновесное метастабиль-
ное состояние с аномальными свойствами, не характерными для
ее обычного состояния.
Необычные свойства активированной воды обнаруживались,
как правило, случайно, причем в первую очередь была
замечена биологическая активность некоторых видов этой жидкости.
Например, удивительное влияние талой воды на живые
организмы известно человеку с незапамятных времен. Давно
замечены такие факты, как бурный расцвет жизни у кромки
тающего льда в арктических морях, пышная растительность
альпийских лугов, расположенных вблизи тающих ледников,
особые качества горных ледниковых озер. Издавна используется
в медицине омагниченная вода. Благотворное влияние на
организмы оказывают дождевая вода и вода электролизная.
88
Братья Зелепухины1 обнаружили биологически активное
действие воды, дегазированной путем нагревания и последующего
охлаждения («холодный кипяток»).
Все эти свойства активированной воды широко используются
на практике. Например, ингаляции талой водой применяются
в медицине для профилактики заболеваний носоглотки. При
употреблении талой, дегазированной, омагниченной воды, а
также воды, обработанной механоакустическими воздействиями,
устойчиво повышаются привесы в животноводстве и
урожайность сельскохозяйственных культур. Подобных примеров
практического использования активированной воды в биологии
и медицине можно привести еще очень много.
Активированная вода широко применяется и в технике.
Только для омагниченной воды можно назвать сотни аспектов
ее применения в химических и физико-химических процессах,
строительном деле, машиностроении, энергетике, нефтедобыче
и т. д. Наиболее известен и распространен метод удаления
накипи в теплообменной аппаратуре магнитной обработкой воды,
открытый в 1945 г. бельгийцем Т. Вермайреном. Применяется
в технологических процессах и электрохимически обработанная
вода, и вода, активированная ультразвуком,
электрогидравлическим ударом, механическим диспергированием и др.
Несмотря на огромное количество экспериментальных
данных, убедительно свидетельствующих о появлении аномальных
свойств у обработанной физическими воздействиями воды, до
сих пор не существует единой теории активации воды, так как
остается неясной сама природа этого явления. Поэтому
теоретическое изучение свойств активированной воды находится пока
в стадии гипотез, причем среди исследователей нет
общепринятого мнения о причинах, вызывающих эффект активации.
Сама ли вода или растворенные в ней примеси ответственны
за изменение свойств активированной воды? Происходят ли
в воде в результате физических активирующих воздействий
химические превращения? Эти вопросы и многие другие ждут
своих ответов. Отсюда сложность и дискуссионность проблемы
активации воды, которые затрудняют развитие теоретических
исследований в данном направлении. К тому же нет ясности,
с каких позиций следует подходить к изучению этого явления —
с позиций физики или физической химии.
Отсутствие теоретической базы явления активации
вызывает негативное отношение к ней ряда ученых. Например, чл.-
кор. АН СССР М. В. Волькенштейн на вопрос корреспондента
одной из газет об отношении к этой проблеме заявил, что к
возможности получать активированную воду «относится, мягко
говоря, отрицательно». А академик И. М. Франк на этот же
1 Зелепухин В. Д., Зелепухин И. Д. Ключ к «живой» воде. Алма-
Ата, 1980.
89
вопрос ответил прямо противоположно: «Убежден, что
проблема достойна изучения и требует изучения».1 Обсуждая эти
полярные мнения, можно привести слова Р. Тагора: «Мы
закрыли дверь, чтобы туда не вошло заблуждение, но как же теперь
войти истине?». А критерием истины, как известно, служит
практика. О чем же говорят экспериментальные исследования
активированной воды? Об этом мы и хотели бы рассказать
в предлагаемом очерке. Но прежде чем перейти к изложению
имеющихся данных, напомним вкратце об основных свойствах
воды и особенностях ее структуры, так как, не зная их, трудно
обсуждать возможные причины появления необычных свойств
активированной жидкости.
О СВОЙСТВАХ ВОДЫ И ЕЕ СТРУКТУРЕ
Такая привычная и, казалось бы, обыкновенная жидкость,
как вода, обладает многими явно выраженными аномальными
свойствами. Так, например, у нее необычно высокие
температуры кипения и замерзания по сравнению с другими водородными
соединениями элементов Via группы периодической системы —
серы, селена, теллура. Плотность воды при нагревании не
уменьшается плавно, что характерно для многих других
жидкостей, а проходит через максимум при температуре +4°С.
Теплоемкость воды аномально высока (4,2 Дж/(г-град.)),вто
время как теплоемкость органических жидкостей почти вдвое
меньше. Воде свойственны исключительно высокие значения
поверхностного натяжения и диэлектрической проницаемости.
Последнее обусловливает ее большую растворяющую-
способность, поэтому вода в природе в чистом виде не существует —
в ней всегда содержится какое-то количество примесей. Даже
дважды и трижды перегнанную воду нельзя называть чистой
водой, в действительности это разбавленный водный раствор.
Здесь уместно сделать небольшое отступление. Так как при
проведении экспериментальных исследований процесса
активации воды физическим воздействиям подвергали, как правило,
воду не чище тридистиллята, то появление аномальных свойств
у таких активированных водных сред может быть обусловлено
как изменением состояния самой воды, так и влиянием
растворенных в ней примесей. Поэтому, строго говоря, термин
«активированная вода» не совсем точен, правильнее было бы
говорить об активированных водных средах. Однако с учетом этой
оговорки для простоты изложения мы будем пользоваться
наиболее часто употребляемым термином «активированная вода»,
подразумевая под ним активированную водную среду,
содержащую природные примеси. Из ионных примесей в воде при-
1 Малинов А. Есть ли тайны у соединения Н20. — Советская Россия.
26 сент. 1981 г.
90
сутствуют в основном катионы Са2+, Mg2+, Na+, K+ и анионы
С023~, SO^~, HC03~,C1-. О степени очистки воды от ионных
примесей судят по значению ее электропроводности.
Предельно чистая вода, перегнанная в вакууме, при комнатной
температуре имеет электропроводность порядка (6-^7) • 10~8Ом-1 см-1,
а вода, перегнанная в воздухе, — (1-г-4)-10~6 Ом"1 см-1, т. е.
почти на два порядка большее значение.
Все аномалии в свойствах чистой воды, конечно же,
обусловлены особенностями строения ее молекул и характером
межмолекулярных связей. Из десяти имеющихся в молекуле
воды электронов две пары остаются неподеленными. Смещение
электронной плотности в сторону кислорода приводит к
появлению в молекуле воды эффективных разноименных зарядов,
в результате чего молекула воды является диполем. За счет
электростатического притяжения между атомом водорода
одной молекулы и атомом кислорода другой образуется
дополнительная связь, называемая водородной. Благодаря
водородным связям молекулы воды чрезвычайно сильно притягиваются
друг к другу, что обусловливает своеобразие структуры воды.
Первую модель структуры воды на основании данных рент-
геноструктурного анализа предложили Дж. Бернал и Р. Фау-
лер в 1934 г. Согласно их. представлениям, ядро структуры воды
составляют театраэдральные группировки молекул, в которых
центральная молекула связана с четырьмя соседними
молекулами водородными связями. Вследствие этого вода имеет
ажурное строение с наличием пустот в ее решетке.
Большой вклад в развитие современных теоретических
представлений о структуре воды внес О. Я- Самойлов,1 показавший
важную роль полостей в тетраэдральной льдоподобной
решетке воды. Согласно его модели, при плавлении льда решетка
частично разрушается, и в пустоты каркаса попадают
молекулы, совершившие трансляционное перемещение в пустоту из
прежнего положения в каркасе.
Известно много моделей структуры воды. Условно их
можно разделить на два класса: модели, в которых однородная
структура воды равномерно распределена по всему объему,
и смешанные модели, предполагающие существование в жидкой
воде различных типов структур. Последние получили
наибольшее распространение. К смешанным моделям относятся и
кластерные модели. Они исходят из того, что в воде существуют не
льдоподобные группировки, а более крупные ассоциаты
(кластеры), например пентагональные додекаэдры— 12-гранники из
20 молекул (модель Л. Полинга). Кластерные модели, в
развитие которых внесли большой вклад также Фрэнк и Вен, Не-
мети и Шарага, Р. Хорн и др., интересны своей идеей о не-
1 Самойлов О. Я. Структура водных растворов электролитов и
гидратация иоков. М.. 1957.
91
прерывном формировании и разрушении ассоциатов воды
и о кооперативности водородных связей. В настоящее вр^мя
ученые отдают предпочтение модели, в которой структура
жидкой воды напоминает тетраэдрическую структуру льда
и представляет собой кооперативную сетку, водородные связи
которой непрерывно искажаются, разрываются и
восстанавливаются вновь. В пользу этой модели говорят данные рентгено-
структурного анализа воды, подтвердившие наличие в ней
тетраэдрального порядка.
Примеси, растворенные в воде, весьма сильно и
разнообразно влияю! на ее структуру, вызывая заметное изменение
свойств водной среды. О. Я. Самойлов рассматривает характер
взаимосвязи растворенных ионов с молекулами воды по
аналогии с твердыми растворами замещения и внедрения. Он
полагает, что одноатомные ионы распределяются в решетке воды,
как бы замещая ее молекулы, а многоатомные ионы
располагаются в большинстве случаев в пустотах льдоподобной
структуры воды. По последнему типу растворяются и газы.
Самойлов ввел понятие положительной и отрицательной гидратации
ионов. Одни ионы, например Fe3+, Al3+, Fe2+, Mg2+, Ca2+, Na+,
СОд~, НС03~, S02~, ослабляют трансляционное движение
окружающих их молекул воды (положительная гидратация),
тогда как другие ионы (К+, Rb+, Cs+, Cl~, Br-, I~), наоборот,
усиливают их подвижность (отрицательная гидратация).
Вследствие этого первая группа ионов упорядочивает структуру
воды, а вторая группа ионов ее разрыхляет.
Л. Д. Кисловский особую роль в стабилизации структуры
воды отводит ионам кальция, точнее образующемуся в воде
гексааквакомилексу [Са(Н20)б]2+, поскольку диаметр этого
комплекса, равный 0,52 нм, соответствует размеру полости
в додекаэдрической структуре воды.
Однако, несмотря на обилие теоретических моделей
структуры воды и водных растворов, единой теории, объясняющей
все многообразие свойств этой удивительной жидкости, пока
не существует. Тем не менее и те данные, которые имеются
в нашем распоряжении, позволяют объяснить многие свойства
воды и наметить некоторые пути к пониманию явления
активации водных сред.
ТАЛАЯ И СВЕЖЕКОНДЕНСИРОВАННАЯ ВОДА
Необычные свойства талой воды 1 послужили поводом к
изучению ее физико-химических свойств. Так как биологическая
активность талой воды сохраняется довольно долго — в
течение 10—12 ч, то исследования ее свойств проводили, как пра-
1 Гуман А. К. Особенности талой воды. — В кн.: Строение и
свойства воды в живых организмах. Л., 1966, с. 179—J 89.
-92
вило, во времени. Оказалось, что диэлектрическая
проницаемость талой воды во время таяния льда не является постоянной
величиной. После того как лед полностью растает, она
постепенно возрастает и достигает стабильного значения только
через 15—20 мин. Вязкость талой воды становится равной
табличной только через 3—6 сут после полного исчезновения
льда.
У свежеконденсированной (только что перегнанной) воды
физико-химические свойства также самопроизвольно меняются
во времени, постепенно приближаясь к свойствам исходной
воды. Так, свежеперегнанная вода имеет более высокую
плотность и меньшую вязкость, чем чистая вода, сохраняя эти
аномальные свойства в течение нескольких суток.
Такие изменения свойств талой и свежеконденсированной
воды исследователи объясняют структурной перестройкой в
жидкости. Рентгеноструктурный анализ показал, что структура
воды изменяется с изменением температуры. Так, при 0°С чистая
вода имеет структуру, весьма похожую на структуру льда.
Талая вода отличается от льда меньшей прочностью водородных
связей и большей размытостью каркасной решетки, а от
обычной воды — наличием в ней в течение длительного времени
льдоподобных структур, т. е. талая вода в большей степени
структурирована, чем обычная вода. При кипячении воды
происходят частичная деформация и нарушение водородных
связей, при этом отдельные молекулы попадают в пустоты
каркаса. И для того чтобы в свежеконденсированной охлажденной
воде нарушенная структура вернулась к исходному состоянию,
необходимо какое-то время для преодоления молекулами
потенциальных барьеров, удерживающих их в пустотах.
Кисловский пытается объяснить необычные свойства талой
воды образованием в ней свободных радикалов (осколков
молекул с неспаренным электроном на внешней электронной ор-
битали), которые появляются вследствие возникновения
разности потенциалов на границе лед — вода. Эти потенциалы
замерзания, открытые в 1950 г. английскими физиками Воркма-
ном и Рейнольдсом, могут достигать сотен вольт. Авторы
объясняют их возникновение структурными изменениями в точке
фазового перехода.
ДЕГАЗИРОВАННАЯ ВОДА
Вода, дегазированная в результате кипячения, а затем
быстро охлажденная (так называемый «холодный кипяток»),
приобретает ряд аномальных свойств, которые сохраняются при
контакте с воздухом в течение суток. В табл. 1 мы приводим
некоторые физико-химические параметры дистиллированной
воды (дистиллята) до и после дегазации, измеренные при 20°С.
Примечательно заметное увеличение водородного показателя
93
Таблица 1
Дегазированная вода
Содержание кислорода, мг/л . . . . j 9,05±0r14 I 4,25 + 0,88
Удельная электропроводность-106,
Om-1-cm-i 3,63 2,95
Водородный показатель (рН) .... 6,00 8,15
Поверхностное натяжение, мН/м . . | 72,75 | 75,32
и особенно поверхностного натяжения дегазированной воды.
Увеличение поверхностного натяжения воды после ее обработки
на 2,57 мН/м весьма необычно, так как оно характеризует
изменение свободной энергии поверхности, которая всегда
стремится к уменьшению. А если свободная энергия поверхности
возрастает, значит происходит перестройка поверхностного
слоя дегазированной воды, в результате чего упрочняются
межмолекулярные связи в ней.
ВОДА ПОСЛЕ НАГРЕВАНИЯ В АВТОКЛАВАХ
Эффект температурной активации воды в герметично
закрытых сосудах (автоклавах) подробно изучен Ф. А. Летниковым
с сотр.1 Оказалось, что измененные после нагревания до 300—
400°С физико-химические свойства воды (повышение степени
диссоциации и электропроводности, понижение рН) сохраняют
свои значения и при охлаждении воды до комнатной
температуры. У активированной таким способом воды возрастает
растворяющая способность по отношению к некоторым
химическим соединениям, в частности к карбонатам кальция и
магния. Но прежде чем анализировать изменение этих свойств,
остановимся на самом процессе термоактивации воды.
Предварительно из ;свежеперегнанной дистиллированной
воды кипячением в течение 45—60 мин удаляют растворенные
в ней газы, после чего ее быстро охлаждают. Термоактивацию
воды проводят в автоклавах с вкладышами из инертных
материалов— золота, платины или предварительно
пассивированного титанового сплава, устойчивого в области изменения рН
от 2 до 12. Эти материалы, как показали контрольные
эксперименты, в активированной воде не растворяются. Сначала
воду постепенно, за 8—9 ч, нагревают до требуемой
температуры. Затем следует собственно активация при заданных
давлении и температуре в течение Зч, после чего воду медленно
охлаждают до комнатной температуры.
1 Летников Ф. А., Кащеева Т. В., Минцас А. Ш.
Активированная вода. Новосибирск, 1976.
Показатель
Обычная
вода
94
Таким образом, помимо предварительной активации за счет
перегонки, конденсации и дегазации при длительном
нагревании в автоклавах на воду оказывается дополнительное
физическое воздействие, которое, безусловно, наиболее сильно
влияет на ее структуру. Действительно, рентгеноструктурный
анализ термически активированной воды, выполненный в Иркутском
государственном университете (А. Б. Киселев), показал
наличие разупорядоченной структуры, которая постепенно, через
3—5 ч после получения первой дифракционной картины,
приближается к структуре обычной чистой воды.
Таблица 2
Температура активации,
До активации (25°С)
200
300
400
°с
рН
6.32
5,42
5,35
5,26
х-10"
Ом'-'см-1
0,89
7,1
10,0
11,0
Значения электропроводности х и рН термоактивированной
воды, приведенные в табл. 2, свидетельствуют о том, что
наибольший эффект активации отмечается в области температур
300—400°С, т. е. в области . критической точки воды (4p =
=374°С).
Сколько времени будут сохраняться активные свойства во-,
ды, зависит от условий ее хранения. При контакте с воздухом
дезактивация воды происходит за 2—3 ч. В герметичных
сосудах без доступа воздуха вода проявляет свои активные
свойства очень долго. Так, например, активированная вода,
хранившаяся в закрытых пробирках в течение 3 лет, полностью
сохраняла повышенную растворяющую способность. На
сохранность аномальных свойств термоактивированной воды
положительно влияет также атмосфера углекислого газа, водорода
или быстрое замораживание жидкости. Напротив,
электролиты и особенно кислоты, введенные в активированную воду,
вызывают ее дезактивацию, разрушая метастабильность
структуры воды и возвращая ее к исходному состоянию. Например,
при подкислении неактивированного дистиллята соляной
кислотой рН закономерно уменьшается, а электропроводность
растет (рис. 1), тогда как для термоактивированной воды эти
зависимости имеют совершенно необычный характер. При
добавлении первых порций кислоты рН воды увеличивается (!),
приближаясь к значению рН неактивированной воды, и только
при последующем подкислении этот параметр начинает, как
95
обычно, уменьшаться. Весьма необычно изменяется и
электропроводность активированной воды при ее подкислении: сначала
уменьшается, а затем возрастает.
Эффект аномального поведения рН и электропроводности
термоактивированной воды при добавлении кислоты настолько
явно выражен, что может служить методом идентификации
явления активации воды.
Но если нарушается структура обработанной в автоклавах
воды, то должны изменяться и свойства этой жидкости как
Р* Актибир Soda (Шс'С)
НС1,мкмоль/л НС1,мкмоль/л
Рис 1
растворителя. С этой точки зрения интересно было изучить
влияние температуры активации на такую термодинамическую
величину, как коэффициент активности у растворенной в воде
соли. Эксперимент заключался в следующем. Определяли
температуру замерзания растворов хлористого калия,
растворенного в обычном и активированном дистиллятах. В контрольных
опытах температуры замерзания активированной и
неактивированной воды совпадали, а добавка КС1 не уничтожала
эффекта активации воды вплоть до концентрации КС! 0,2 моль/1000 г
воды. Если коэффициенты активности соли, растворенной
в обычной воде и активированной, различны, то должна
наблюдаться и разница в величинах температур замерзания этих
растворов, поскольку понижение температуры замерзания
раствора, определенное в эксперименте, и коэффициент активности
соли в растворе связаны прямой зависимостью, позволяющей
рассчитывать последнюю величину. Результаты проведенного
96
ьООХ
Акти&ир.бода
200°C 300°C
-0—Ю-
НеактиВир. Вода
0,1 0,2 OJ 0>
эксперимента показали, что в термоактивированной вол"
(рис. 2) коэффициенты активности КС1 больше, чем в обычной
воде, но особенно они велики для воды, активированной при
400°С (почти в 3 раза больше, чем для неактивированной
воды).
Представленные данные по коэффициентам активности КС
в термообработанной воде, по-видимому, нельзя рассматривать
как строго количественные, так как такие воздействия на
активированную воду, как введение в нее электролита и
замораживание раствора, все-таки должны
снижать эффект активации во- ц\
ды, хотя и незначительно. Но
даже с учетом этого
обстоятельства полученные результаты 2,0
весьма интересны и
подтверждают высказанное нами выше
предположение о том, что свой- 7^
ства термообработанной воды,
как растворителя, сильно
отличаются от свойств обычной воды. о ил */ м^Шг£0
Возрастание коэффициентов ' '
активности веществ, растворен- Рис 2
ных в активированной воде,
может заметно влиять на
кинетику химических и биохимических процессов, в которых
принимают участие эти вещества. Поэтому рассмотренные данные,
на наш взгляд, чрезвычайно важны, так как дают возможность
понять механизм влияния активированной воды на изменение
хода некоторых химических процессов.
ОМАГНИЧЕННАЯ ВОДА
Суть магнитной обработки воды состоит в том, что при
движении этой жидкости в магнитном поле заметно изменяются
многие ее физико-химические свойства, причем эти измененные
свойства сохраняются в течение нескольких часов. Как
оказалось, эффект активации наиболее ярко выражен только у
движущейся жидкости.
За последнее десятилетие исследования омагниченной воды
проводятся особенно интенсивно. Но одно дело — получить
экспериментальные данные о свойствах омагниченной воды
(таких данных накопилось довольно много), а другое —
интерпретировать и обобщить их, дать им определенное
теоретическое толкование. Результаты, полученные различными
исследователями, порой плохо воспроизводятся, находятся в
сильной зависимости от напряженности и градиента магнитного
поля, скорости и характера движения воды, типа и количества
содержащихся в ней примесей и от многих других факторов,
4 779
97
в, мН/м
ЬидиС^аппят
PocmSop Na - ГДС(2 10"моль/л)
пока еще мало изученных. Для получения достоверных
данных необходимо провести большое количество экспериментов
в строго фиксированных условиях.
Тем не менее изменение свойств омагниченной воды по
сравнению с необработанной — это экспериментально
установленный факт, и омагниченная вода широко и эффективно
применяется на практике для улучшения конечных результатов
многих биологических и технологических процессов.1
Факторов, влияющих
на эффект активации
воды под действием
магнитного поля, настолько
много, что трудно найти
единый теоретический
подход к пониманию
механизма этого процесса,
отсюда дискуссионность
рассматриваемой
проблемы. Приведем лишь два
высказывания. Академик
В. Л. Гинзбург: «Считаю,
что никаких
специфических магнитных свойств
у чистой воды не суще-,
ствует. А есть вопросы
о магнитных
примесях в воде и о влиянии магнитного поля на поведение этих
примесей». Чл.-кор. АН СССР Б. В. Дерягин: «Особенно
прискорбно видеть, когда пытаются истолковывать результаты
магнитной обработки воды намагничиванием каких-то
примесей... В конечном счете критерием истины служит практика».
Экспериментальные исследования свойств омагниченной
воды показывают, что ряд фактов можно объяснить влиянием
примесей2, однако есть и такие, которые с этих позиций
объяснить трудно. Например, улучшение кристаллизации солей,
особенно кальциевых, в омагниченной воде многие исследователи
объясняют определенной ориентацией в магнитном поле
парамагнитных окислов железа, присутствующих в воде и
создающих центры кристаллизации. Однако можно привести и
другие примеры. Скажем, поверхностное натяжение а раствора
гексадецилсульфата натрия (Na-rDC) в бидистилляте заметно
уменьшается после обработки этого раствора в магнитном, поле
(рис. 3, данные А. Н. Гребнева и др., 1971), причем
изменение сг имеет синусоидальную зависимость от напряженности
700 125
Н,кА/аа
РисЗ
1 Кла.ссен В. И. Омагничивание водных систем. М., 1982.
2Давидзон М. И. О действии магнитного поля на слабопроводящие
водныезсистемы. — Изв. вузов. Физика, 1985, № 4, с. 89—94.
98
поля Н и по абсолютной величине на порядок превышает
возможную, ошибку. Увеличение адсорбции поверхностно-активных
веществ (ПАВ) на границе жидкость —газ происходит не
только после магнитной обработки раствора, но и после
добавления ПАВ к ранее омагниченному дистилляту, причем
уменьшение поверхностного натяжения в. этом случае может быть
значительным (6—8 мН/м по данным В. И. Миненко). Эти
результаты влиянием магнитного поля на поведение примесей
объяснить довольно трудно.
Отмечается повышенная растворяющая способность омаг-
ниченной воды. Так, карбонаты кальция и магния лучше
растворяются в этой воде, нежели в обычной. Не в том
ли,причина эффективного удаления омагниченной водой накипи, основу
которой составляют эти трудно растворимые соли? Другой
причиной может быть преимущественная кристаллизация солей
в толще раствора, а не на стенках теплообменников.
Замечено также увеличение растворимости кислорода в воде,
прошедшей магнитную обработку, причем отмечается
повышение химической активности этого газа. Такой «активацией»
кислорода в омагниченной воде многие исследователи
объясняют появление у нее бактерицидных свойств, а также влияние
этой воды на кинетику некоторых химических реакций.
Возможно, что с этих позиций можно понять такие
экспериментальные факты, как образование в омагниченной воде перекиси
водорода или изменение скорости разложения этого вещества
в воде после ее магнитной обработки.
В омагниченной воде по сравнению с необработанной водой
существенно изменяются такие физико-химические свойства, как
электропроводность, диэлектрическая проницаемость, вязкость,
причем в отдельных случаях имеет место обычная для омагни-
ченных сред полиэкстремальная зависимость параметров от
напряженности поля.
Исследование А. В. Корякиным и др. омагниченной воды
методом инфракрасной спектроскопии показало, что структура
ее упорядочена и близка к структуре талой воды. При этом
форма ИК-спектров в области 3600 см-1 изменялась только
при омагничивании бидистиллята, содержащего растворенный
кислород, в отсутствие его изменений в ИК-спектре не
наблюдалось. Отсюда был сделан вывод, что за перестройку
структуры воды под действием магнитного поля в основном
ответствен растворенный кислород.
Таким образом, огромный фактический материал по
вопросу магнитной обработки воды (а мы привели только малую
часть его) сделал свое дело: несмотря на длительное
негативное отношение многих ученых к этой проблеме, представители
фундаментальных наук постепенно стали уделять ей внимание.
В последние годы сформировались такие научные направления,
как магнитохимия, магнитобиология, появились теоретические
99
работы, посвященные изучению влияния магнитного поля на
воду и водные системы. Безусловно, до формирования теории
магнитной обработки сред еще далеко, но первые шаги в этом
направлении уже делаются.
ЭЛЕКТРОЛИТНАЯ ВОДА
Необычные свойства электролитной (электролизной) воды
были обнаружены значительно позже, чем свойства, например,
талой или омагниченной воды. Это связано с тем, что при
изучении давно известного процесса электролиза воды и ее
растворов основное внимание уделялось продуктам
электрохимических процессов, образующимся на электродах, а свойства
самой воды долгое время оставались вне поля зрения ученых.
Наиболее интенсивно свойства электролизной воды и
различные аспекты ее применения стали изучаться лишь в
последние годы. В. М. Бахир с сотр.1, например, обнаружили, что при
электрохимической 'обработке минерализованных природных
вод с разделением анодного и катодного пространств
диафрагмой получаются две фракции активированной жидкости:
кислотная у анода (анолитная фракция) и щелочная у катода (ка-
толитная фракция), обладающие необычными свойствами.
Необычность заключается, безусловно, не в изменении
кислотности среды в приэлектродных зонах (этот эффект хорошо
известен в электрохимии), а в том, что эти фракции ведут себя в ряде
случаев, как сильные щелочи и кислоты. В них растворяются
органические и неорганические вещества, как правило,
растворимые только в концентрированных растворах кислот и
щелочей. Наблюдается также увеличение адгезии электрообработан-
ной воды к поверхности твердых тел.
Электроактивированная вода уже широко используется на
практике, например, для улучшения качества буровых
растворов в газовой промышленности. При этом достигается экономия
химических реактивов и повышается скорость бурения.
Сильное влияние электролитная вода оказывает на
протекание биологических процессов: анолитная вода, обладая явно
выраженными бактерицидными свойствами, угнетает развитие
микроорганизмов; католитная вода способствует заживлению
ран, интенсифицирует рост растений. Эти свойства воды были
замечены, и электролизная вода стала применяться в медицине,
в сельском хозяйстве, для биологической очистки сточных
вод и тч д.
Причины изменения свойств воды после ее
электрохимической активации пока не ясны. Ответ на многие вопросы могли
бы дать систематические исследования физико-химических
1 Евсеев Е. Эти активированные жидкости. — Техника и наука, 1981,
Хо 11 и 12.
100
свойств электрообработанной воды и приготовленных на ней
растворив, как это было сделано, например, для термоактиви-
рованноп и омагниченной воды. Однако данные этих
исследований в литературе практически отсутствуют. Чтобы в какой-то
степени ликвидировать образовавшийся пробел, мы поставили
ряд экспериментов, в которых основное внимание уделили
изучению таких величин, как водородный показатель и
окислительно-восстановительный потенциал (редокс-потенциал)
среды, поскольку к изменению этих величин весьма чувствительны
многие химические и особенно биологические процессы.
Как известно, при электролизе воды с инертным анодом на
электродах происходят окисление и восстановление молекул
воды согласно реакциям:
Катод: 2Н20 + 2г->Н2 + 2 0Н~ (водородная система),
Анод: 2Н20—4е-^02 + 4Н+ (кислородная система).
Таким образом, в приэлектродных зонах образуются
различные окислительно-восстановительные системы, рН которых
существенно различаются. Взаимосвязь рН и
окислительно-восстановительного потенциала для этих систем хорошо изучена
и выражается уравнениями
£B--0,06pH-0,031g/7H2,
Ек = 1,23 — 0,06рН + 0,015 lg /?0a,
где Ев и Ек— окислительно-восстановительные потенциалы
водородной и кислородной систем соответственно, а рн2 и ро3
парциальные давления водорода и кислорода,
пропорциональные содержанию этих газов в воде. Как видно из этих
выражений, при насыщении анолитной воды кислородом и католит-
ной воды водородом (при постоянстве парциальных давлений
газов) величины Е линейно зависят от рН (рис. 4).
Для сравнения мы подвергали активации деионизирован-
ную и водопроводную воду с электропроводностью (2^-3) • 10~*
и Ы0~4 Ом-1-см-1 соответственно. Исследование
водопроводной воды интересно потому, что именно такая вода,
содержащая примеси, используется во многих технологических и
биологических процессах.
Электролиз воды проводили с инертными электродами и
разделительной диафрагмой из целлофана. рН и редокс-потен-
циалы измеряли на рН-метре типа рН-673. Обратимся к рис. 4.
Мы видим, что подкисление анолита в ходе активации
сопровождается увеличением окислительнорвосстановительного
потенциала. Однако для деионизированной воды значения Е
анолита явно занижены, значит, выделяющийся ца аноде
кислород либо не растворяется в воде, либо система находится
101
в сильно неравновесном состоянии, и реальное соотношение
окисленных и восстановленных форм веществ не отражается
на величине £. На наш взгляд, вторая причина более
правомерна, поскольку нет видимых препятствий для растворения
кислорода в воде, не насыщенной этим газом, а удаление его
за счет возможного нагревания воды не должно иметь места,
так как температура жидкости в ходе эксперимента остается
практически постоянной. Напротив, при активации
водопроводной воды наблюдается ее заметное нагревание, что должно
способствовать уменьшению растворимости газа в этой
жидкости. Однако, судя по характеру
кривой для анолитной
водопроводной воды, снижение
содержания кислорода в анолите не
происходит.
В католитной воде
зависимость £— рН имеет более
сложный характер, чем в анолите,
и отражает постепенный переход
от кислородной окислительно-
восстановительной системы
исходной воды, содержащей
растворенный кислород, к водородной
системе по мере выделения
водорода и растворения его в воде.
Исследования показали, что
потенциал в католитной воде
нестабилен и после окончания
активации меняется во
времени'даже в герметично закрытом
сосуде.
Обращает на себя внимание
быстрое смещение в сторону отрицательных значений редокс-
потенциала католитной водопроводной воды (см. рис. 4). По-
видимому, это связано с заметным растворением водорода в ка-
толите, несмотря на его нагревание, которое должно, в
принципе, препятствовать растворению. Применение такой воды в
химических процессах восстановления металлов из их растворов
показало, что она интенсифицирует выделение металла, как бы
катализируя процесс. Эти данные наводят на мысль об
аномальных восстановительных свойствах католитной воды.
Действительно, растворяющийся в католите молекулярный
водород, хотя и является восстановителем, но при обычных
условиях не восстанавливает металлы из растворов. Вероятно,
в католите существуют какие-то еще более активные
восстановительные агенты, чем Н2. Такими восстановителями могут
быть атомарный водород и гидратированный электрон. Эти
частицы образуются в католите в результате холодной эмиссии
электронов с катода под влиянием высокого градиента
потенциала в двойном слое на границе металл —раствор, их
последующей гидратации и взаимодействия с водой с выделением
атомарного водорода. По мнению Л, И. Антропова, при
смещении рН католита в щелочную сторону соотношение между
содержанием в воде атомарного водорода и гидратированного
электрона должно сдвигаться в сторону преимущественного образования
последнего. Возникновение атомарного водорода в католите
возможно и по другому механизму. Известно, что выделение
молекулярного водорода на катоде проходит через стадию
образования адсорбиро-
- В католите
- Са - ЛС 8 деионизир. бодв
'Ванолите
ванного атомарного
водорода. Не исключено,
что этот радикал
попадает в воду за счет
десорбции с
поверхности катода при
условиях,
благоприятствующих этому процессу
(например, при
использовании
электродов, слабо
адсорбирующих атомарный
водород) .
Здесь важно
отметить, что католитную
воду для
восстановительных целей
использовали не сразу после
приготовления, а
спустя примерно час,
тогда как время жизни
атом арного водорода
или гидратированного
электрона в обычной
воде исчисляется
долями секунды. На наш взгляд, такое длительное сохранение
аномальных восстановительных свойств католита может быть
обусловлено как изменением структуры воды при электролизе
(в частности, в католите увеличивается концентрация
катионов Са2+, Mg2+, Na+, K+ и др.}, так и возможностью возникно
вения в веде цепи вторичных свободно-радикальных процессов
инициируемых первичными радикалами» При этом вполне воз
можна стабилизация образующихся продуктов в измененно!
каркасной решетке воды.
Проведенные исследования окислительно:восстановительны
свойств электролитной воды безусловно носят пока предвари
тельный характер. Необходимо дальнейшее систематическс
Рис.5
1'
изучение электроактивированной воды с количественной
оценкой растворимости газов и использованием современных
Методов идентификации свободных радикалов.
Нестабильность состояния воды после ее электрохимической
обработки сказывается и на величине поверхностного
натяжения: с увеличением времени активации отмечается четкая
тенденция к увеличению а. Причем этот эффект нельзя объяснить
изменением величины рН, так как уже на следующие сутки
при том же значении рН поверхностное натяжение
обработанной воды и обычной было одинаковым. Вспомним, что факт
увеличения свободной энергии поверхности имел место и при
других видах активации воды, например при ее дегазации (см.
табл. 1), магнитной обработке (с. рис. 3).
Предположив, что после электрообработки воды должен
измениться характер взаимодействия с ней растворенных
веществ, мы провели следующий эксперимент.
Поверхностно-активное вещество — лигносульфонат кальция (Са-ЛС, 20 мг/л) —
растворяли в обычной деионизированной воде, а также в ка-
толитной и анолитной фракциях, полученных при электролизе
этой же воды в течение одной минуты. Анион лигносульфоната
дает характерный спектр в ультрафиолетовой области с двумя
максимумами поглощения (рис. 5). Строгая стабильность
этого спектра в обычной воде и независимость его от рН широко
используются на практике для количественного определения
лигносульфонатов. В активированной воде спектр
лигносульфоната претерпевает изменения, наиболее заметные в области
первого пика поглощения. За существование этого максимума
ответственна гидрофильная сульфогруппа — S03H
примененного нами ПАВ. Поэтому наблюдаемые изменения в спектре
лигносульфоната можно объяснить, по-видимому, изменением
характера взаимодействия с активированной водой именно этой
группы, обладающей наибольшим сродством к воде по
сравнению с другими группировками молекулы лигносульфоната.
ВОДА, АКТИВИРОВАННАЯ МЕХАНИЧЕСКИМИ
И МЕХАНОАКУСТИЧЕСКИМИ ВОЗДЕЙСТВИЯМИ
Еще один вид активации воды — различного рода
механические воздействия: ультразвуком, электрогидравлическим
ударом, механическим диспергированием и др. Например, под
влиянием ультразвука в воде возникают кавитационные пустоты —
пузырьки, на поверхности которых вследствие неравномерного
распределения зарядов может возникнуть довольно большая
разность потенциалов (до нескольких сот В/см), достаточная для
пробоя полости. В результате разрядов происходит
возбуждение, ионизация компонентов среды с образованием ионов и
свободных радикалов: перекиси водорода, гидроксильных
радикалов, атомарного водорода, кислорода и др. Таким образом,
под действием ультразвука в воде происходят химические пре-
104
вращения, обусловливающие изменение ее свойств. Иногда
наблюдается свечение воды, обработанной ультразвуком, — это
излучают свет возбужденные молекулы.
Аналогичные процессы должны происходить и при действии
на воду электрогидравлическим ударом с разрядом при
разности потенциалов между электродами до 60—100 кВ, а также
при резком механическом диспергировании этой жидкости.
К активированным жидкостям можно отнести и воду,
облученную потоком улучей, заряженных частиц (радиолиз) и
ультрафиолетовым излучением (фотолиз). При таких воздействиях
на воду также происходит разрыв молекулярных связей
с образованием свободных радикалов, временно увеличивается
электропроводность воды, у нее появляются аномальные
восстановительные свойства, связанные с возникновением гидратиро-
ванного электрона и атомарного водорода. Появление этих
частиц в облученной воде в настоящее время экспериментально
доказано:
Из существующих теоретических подходов к обоснованию
эффекта активации механическими воздействиями ни один пока
нельзя считать удовлетворительным.
ВОЗМОЖНЫЕ ПРИЧИНЫ ПОЯВЛЕНИЯ АНОМАЛЬНЫХ СВОЙСТВ
АКТИВИРОВАННОЙ ВОДЫ
Мы рассмотрели различные способы активации воды и те
аномальные свойства, которые она при этом приобретает.
Читатель, видимо, обратил внимание на некоторое сходство в
проявлении свойств, а именно: влияние активированной воды на
кинетику химических реакций, биологическую активность,
длительное сохранение аномальных характеристик. Естественно
предположить, что существует единая природа эффекта
активации при различных физических воздействиях.
Попытаемся разобраться, почему изменяется кинетика
химических превращений при использовании активированной воды.
Скорость химической реакции, как известно, зависит от
активности (концентрации) веществ, принимающих в ней участие,
и от энергии активации. Чем больше активность исходных
веществ и чем меньше энергия активации, тем быстрее протекает
реакция. Таким образом, чрезвычайно важно знать, как
изменяются в активированной воде эти основные параметры,
определяющие кинетику химических реакций.
Одна из главных причин изменения свойств воды после
физических воздействий — это нарушение ее структуры, сохраняющееся
довольно долго, как правило, в течение нескольких часов.
Например, для талой, омагниченной и термоактивированной воды
такое изменение структуры экспериментально доказано, для
других видов активированной воды оно рассматривается как
вполне вероятное, но пока недостаточно изученное ябление.
Естественно предположить, что изменения в структуре воды приве-
105
дут к изменению активности веществ, растворенных в ней.
Читатель, конечно, помнит рис. 2 нашего очерка, на котором
приведены коэффициенты активности КС1 в активированной воде.
Там мы отмечали заметное возрастание активности вещества
в термообработанной воде, причем наиболее наглядно этот
эффект проявлялся при оптимальном температурном режиме
активации. К сожалению, такого рода данные для других видов
активированной воды практически отсутствуют, а они
чрезвычайно валены для понимания специфики влияния этой
необычной жидкости на кинетику химических реакций.
Не менее важен вопрос об изменении энергии активации
химических реакций в активированной воде. Обычно, чтобы
снизить энергию активации и тем самым ускорить процесс,
используют катализаторы. Возникает вопрос: «Не образуются ли
в воде после ее физической обработки частицы, которые могли
бы служить катализаторами химических превращений?».
Такими катализаторами, на наш взгляд, могут быть свободные
радикалы, появление которых весьма вероятно в
активированной воде, подвергнутой различным воздействиям. Например,
в воде, обработанной механоакустическими воздействиями,
и в омагниченной воде образование свободнорадикальных
частиц экспериментально установлено, тогда как в
термообработанной, талой и электролитной воде их появление лишь
предполагается. Образование свободных радикалов в активированной
воде нередко связывают с действием электрических сил:
возникновением «потенциалов замерзания» на границе раздела
лед — талая вода, индуцированием электрических токов при
магнитной обработке воды, появлением разности потенциалов в
пузырьках, полостях в воде при механических воздействиях на нее
ультразвуком, электрогидравлическим ударом и резким
механическим диспергированием и, наконец, с
образованием большого градиента потенциала в двойном слое на
границе электрод—вода при электрохимической обработке.
В силу своей природы свободные радикалы несут в себе
большой запас энергии, полученный ими при разрыве
межмолекулярных связей. Они чрезвычайно реакционноспособны,
легко взаимодействуют с компонентами водной среды. Энергии
активации реакций с этими активными частицами очень малы,
а это значит, что такие химические превращения идут с
большими скоростями.
Появление в активированной воде свободных радикалов
может породить в ней цепь свободнорадикальных реакций,
которые затухают постепенно, по мере рекомбинации этих частиц
в молекулы. Такие процессы должны способствовать
возбуждению молекул воды и других веществ, растворенных в ней,
и в конечном счете приводить к свечению активированной
жидкости, что и наблюдалось в ряде экспериментов, например при
обработке воды ультразвуком.
106
Таким образом, нарушение структуры воды и появление
в ней свободных радикалов, по-видимому, и являются теми
основными факторами, которые приводят к изменению активности
веществ, растворенных в обработанной воде, и энергии
активации химических реакций с участием этих веществ, а
следовательно, и к изменению кинетики химических превращений
в активированной воде.
Теперь попытаемся разобраться, почему аномальные
свойства активированной воды сохраняются длительное время. Это
может быть связано с возможной стабилизацией активных
радикальных частиц в полостях структуры воды. В. М. Вдовенко
с сотр. изучали методом ядерного магнитного резонанса время
существования в воде свободных радикалов ОН и НОг,
образующихся при облучении УФ-лучами водных растворов
перекиси водорода. Оказалось, что эти частицы исчезают не сразу
после облучения, а живут довольно длительное время — в
течение 15—20 ч. Одновременно облученные растворы
пересыщаются кислородом. На основании этих данных высказано
предположение, что продолжительность жизни свободных
радикалов в воде увеличивается потому, что эти частицы образуют
комплексы с кислородом. По мнению Л. Д. Кисловского,
близость диаметра этих комплексов к размеру полостей в
структуре воды наводит на мысль о возможности стабилизации этих
вторичных образований в пустотах каркаса воды.
Весьма примечательно, что появление свободного радикала
перекиси водорода и увеличение растворимости кислорода
отмечены и у омагниченной воды, т. е. и здесь возможен тот же
механизм стабилизации свободных радикалов в воде, о
котором мы только что говорили. В таком случае, почему бы не
допустить ту же причину длительного сохранения аномальных
свойств и у других видов активированной воды?
Направленная генерация свободнорадикальных частиц
определенной природы возможна, по-видимому, лишь при
электрохимическом способе обработки воды. Действительно, в като-
литной зоне воды могут возникать частицы-восстановители
(атомарный водород, гидратированный электрон), а в анолит-
ной — радикалы-окислители (атомарный кислород, радикал
ОН — промежуточные продукты электродного процесса на
аноде). При других же способах активации воды получается, как
правило, смесь частиц различной природы. Таким образом, для
получения активированной воды и практического ее
использования наиболее перспективным, на наш взгляд, следует считать
электрохимический метод обработки воды.
107
О ВОДЕ «ЖИВОЙ» И «МЕРТВОЙ»
Нам осталось рассмотреть биологическое действие
активированной воды. Мы отмечали благоприятное влияние на живые
организмы талой, омагниченной, дегазированной и облученной
воды, а также католитной фракции электрохимически
обработанной воды. В литературе по физической обработке воды
такую воду называют «живой» водой. Сообщается и о
живительном действии на организм воды, обработанной резким
механическим диспергированием, электрогидравлическим ударом
и воды с низким содержанием дейтерия. Наряду с этим при
использовании обработанной воды могут возникнуть эффекты
противоположного характера: угнетение функциональной
активности ряда ферментов или метаболизма в целом,
подавление микрофлоры. Такую воду называют «мертвой». К ней
относят анолитную фракцию воды, обработанной
электрохимическим методом, а также омагниченную воду, полученную в
специальных режимах обработки.1
Откуда появились такие названия? «Живой», как правило,
называют воду, которая при воздействии на организм
вызывает в нем благоприятные изменения: интенсифицирует
метаболические процессы в тканях, ускоряя, например, рост
растений или заживляя раны, улучшает самочувствие, снижает
восприимчивость к воздействию неблагоприятных факторов, т. е.
повышает общую резистентность организма. «Мертвая» вода,
напротив, замедляет обменные процессы, может гибельно
действовать на микроорганизмы, в том числе и на патогенную
микрофлору. 1
То, что вода, обработанная различными способами,
проявляет сходные черты биологического действия, наводит на мысль
о существовании единого универсального механизма такой
активности. С методологической точки зрения для поиска этого
механизма есть два пути. Первый — от тщательного
сопоставления разрозненных экспериментальных фактов к обобщению.
Второй — от анализа известных универсальных биологических
механизмов к определению наиболее вероятного и
последующей проверке гипотезы на опыте. Применение первого,
индуктивного, метода для решения нашей задачи затруднительно,
поскольку многие из имеющихся к настоящему времени
результатов получены на любительском уровне и составляют
пеструю разноплановую картину, а изложение фактов в
популярной печати не всегда отвечает требованиям, предъявляемым
к научному описанию экспериментов. Более перспективным
представляется второй, дедуктивный, метод.
Попытаемся представить себе основные принципы, которы-
1 Подробнее см. в книге В. И. Классена «Омагничивание водных систем>
(М„ 1982, с. 92—104).
108
ми могла «руководствоваться» природа, создавая «живую»
воду.
Прежде всего заметим, что создать некий универсальный
целебный эликсир возможно только при условии, если в
основе механизмов различных патологических процессов
имеются общие ключевые типовые звенья.
В предисловии к русскому изданию «Биоэнергетики» (М.,
1970) американский биохимик Альберт Сент-Дьёрдьи писал:
«Я глубоко убежден, что мы никогда не сможем понять
сущность жизни, если ограничимся молекулярным уровнем... То,
что мы называем „химической энергией", управляющей
жизненными процессами, — это энергия электронов. Живые
организмы построены из материи и приводятся в движение
энергией. С какой бы стороны ыц ни подошли к биологии — со
стороны ли материи или со стороны энергии, мы так или иначе
придем к электронам» (курсив наш. — А. О., Н. М.).
Действительно, химические реакции переноса электронов от
донора электронов (восстановитель) к акцептору электронов
(окислитель), т. е. окислительно-восстановительные реакции,
играют решающую роль в обмене веществ и энергии. При
различных заболеваниях или вредных воздействиях на живой
организм происходит нарушение баланса
окислительно-восстановительных процессов. Правильнее, впрочем, было бы сказать,
что сама патология есть результат дисбаланса этих процессов,
закрепление их адаптационного отклонения от нормы. Особая
роль в генезисе патологической картины отводится
неферментативному свободнорадикальному окислению биополимеров,
которое может являться начальным этапом деградации
структурных белков, липидов и, возможно, нуклеиновых кислот.
Считается общепризнанным, что активация свободнорадикального
окисления в тканях организмов прослеживается при
авитаминозах, поражающем действии экзогенных химических агентов
(отравление кислородом, алкоголем, никотином при курении
и др.) и физических.факторов (холод, повышенные
температуры, радиационное поражение и др.), при хроническом
эмоциональном стрессе и атеросклерозе, при сердечно-сосудистой
патологии (ишемическая болезнь сердца, инфаркт миокарда
и сердечная недостаточность), в патогенезе злокачественных
новообразований, при старении и других патологических
процессах.1
Сдвиг донорно-акцепторного равновесия в пользу
акцепторов приводит к дефициту концентрации реакционноспособных
электронов. В этом и состоит типовое ключевое звено
обширного класса патологических процессов, протекающих в живых
организмах.
1 Биоантиокислители в регуляции метаболизма в норме и патологии. М,
1982.
109
При восстановлении утраченного равновесия используются
вещества, являющиеся донорами электронов, т. е.
антиокислители (антиоксиданты, антиоксигены). Антиокислительная
активность большинства индивидуальных соединений связана
с наличием у них подвижного атома водорода —
универсального восстановителя, донора электрона. Молекулу антиоксидан-
тов (А) представляют в виде А—Н, где Н — подвижный атом
водорода, который определяет взаимодействие антиоксиданта
с активными радикалами типа* R* и ROO* по схеме
R- + A-H->RH + A-,
ROO- + А-Н -> ROOH + А\
В такой реакции происходит замена активных радикалов
субстрата R* или ROO* на малоактивный радикал А', который
не способен к продолжению цепи свободнорадикального
окисления и превращается в стабильные молекулярные продукты.
Неудивительно, что важнейшие витамины —Е, С, Р, РР,
К — и ряд веществ, входящих в обычные продукты питания,
являются антиоксиданта ми. Создавая универсальные «вещества
жизни», природа наделила их способностью повышать в
конечном счете концентрацию электронов во внутренней среде
организма, используя для этого восстановительные свойства
подвижного атома водорода в составе сложных соединений (А—
Н). Этот же универсальный механизм может лежать и в основе
биологического действия «живой» воды — донора реакцион-
носпособных электронов, образующихся в результате свобод-
норадикальных процессов в воде при физико-химических
воздействиях на нее.
Проверка этого предположения для всех видов активации
воды — задача многотрудная. Сегодня можно привести доводы
в пользу существования восстановительных частиц (гидратиро-
ванного электрона, атомарного водорода и др.) в облученной
воде, воде, обработанной ультразвуком, в католитной фракции
электролитной воды. Поскольку последний метод обработки
наиболее существенно изменяет свойства воды, остановимся
подробнее на свойствах католита.
Мы уже говорили о том, что при электролизе воды
возможно образование в католите сильных восстановителей —
атомарного водорода и гидратированного электрона. Показателем
восстановительных свойств католита является отрицательное
значение редокс-потенциала от —600 до —800 мВ в наших
экспериментах (см. рис. 4).
Немаловажную роль в проявлении восстановительных
свойств католитной воды могут играть, на наш взгляд, и
неравновесные явления на границе жидкость — газ в пузырьках,
образуемых водородом. В результате возможного пробоя в
пузырьках или их схлопывания (кавитация) образуется цепь сво-
ио
боднорадикальных реакций, которые могут быть
дополнительным источником радикалов-восстановителей подобно тому, как
это имеет место при обработке воды ультразвуком.
Механизм действия «живой» воды (а точнее катодной
фракции электроактивированной воды) на живые системы оказался
очень похожим на действие антиоксидантов. Активация и
оптимизация обменных процессов, вызываемая антиоксидантами,
дает положительный эффект при лечении целого ряда
заболеваний, поэтому современная медицина успешно применяет
в комплексной терапии витамины и ряд препаратов,
обладающих выраженными свойствами восстановителей.
Многочисленные опыты на животных в лабораториях и на
зверофермах показали, что курс поения «живой» водой
приводит к активизации защитных сил организма, снижению
восприимчивости к простудным и инфекционным заболеваниям,
положительно влияет на репродуктивные качества животных,
позволяет экономить дорогостоящий рацион витаминов и
обеспечивает дополнительный привес. Интересно, что в опытах
с мышами, в которых предусматривалась возможность выбора
между обычной водой и катодной и анодной фракциями
электролизной воды, животные пили «живую» воду в 3—5 раз чаще,
нежели обычную, причем самцы выпивали гораздо больше
самок.
Благоприятно воздействуют антиоксиданты и на развитие
растений. Семена злаков, замоченные в 3%-ном растворе а-
токоферола (витамина Е), впоследствии лучше развиваются.
Растения из этих семян не полегают, имеют повышенную
морозостойкость, устойчивость к вирусным поражениям. У
клубней картофеля при аналогичной обработке быстро
залечиваются повреждения (порезы, царапины, ушибы), они меньше
подвержены болезням, лучше сохраняются. Растения (овес,
пшеница, томаты) при поливе катодной фракцией
электролитной воды обгоняют в росте контрольные, дают больший уро-
жай>
Под действием «живой» воды быстрее излечиваются,
конъюнктивиты, некоторые кожные заболевания, трофические язвы
различной этиологии (при периодическом орошении слизистых
оболочек и кожи).
Обсуждая сущность воздействия католита на живые
организмы, мы остановились на важнейшем звене механизма
активации воды — усилении ее восстановительных свойств.
По-видимому, есть и другие звенья, которые вносят свой вклад
в наблюдаемые эффекты. Так, практически не изучена роль
увеличения концентрации ионов Са2+ в католите, хотя,
согласно представлениям Кисловского, эти ионы могут существенно
влиять на стабилизацию структуры жидкости. Очевидно также,
что изменения в структуре воды должны приводить к
изменению функциональной активности белков, в том числе и фер-
ш
ментов, в кооперативных системах биосубстратов. Несомненно,
что серьезнме перспективы открывает исследование роли
водорода католита в протонном цикле клетки, т. е. непосредственно
в биоэнергетических процессах. Вопросов еще много, и они
ждут своих исследователей.
Несколько слов о «мертвой» воде (анолит:). Согласно
нашим рассуждениям, это должен быть суострат-окислитель
с редокс-потенциалом, существенно превышающим редокс-по-
тенциал исходной волы. Проводя электролиз дистиллята
и пресной воды, мы не наблюдали в анолитной фракции
существенного увеличения этой величины (см. рис. 4).
Неудивительно поэтому, что микробиологическая экспертиза не
обнаружила бактерицидных свойств у такой воды. «Мертвой» аио-
литную фракцию назвали исследователи группы В. М. Бахира
(Среднеазиатский НИИ природного газа), которые применяли
для экспериментов сильно засоленные природные воды.
Бактерицидное действие анолита в этом случае можно объяснить
растворением в ней хлора, выделяющегося на аноде, о чем
свидетельствует и значение редокс-потенциала анолитной воды
(£«1350—1370 мВ), близкое к потенциалу хлорной системы
2С!"—2г^±:С12. Однако вполне вероятно, что при определенных
режимах обработки воды, в особенности при использовании
анодов, слабо адсорбирующих радикалы-окислители
(атомарный кислород, радикал ОН), эти частицы могут попадать
в толщу анолитной воды. При этом возможно появление
бактерицидного действия у анолита, полученного при обработке
водных сред, не содержащих хлоридного аниона.
ЗАКЛЮЧЕНИЕ
Заканчивая очерк об активированной воде, хотелось бы
привести цитату из повести американского фантаста Роберта
Шекли «Обмен разумов»: «Некий мудрец однажды спросил:
„Что будет, если я войду в Искаженный мир, не имея
предвзятых идей?". Дать точный ответ на такой вопрос
невозможно, однако мы полагаем, что к тому времени, как мудрец
оттуда выйдет, предвзятые идеи у него появятся». Таков
зачастую и путь развития науки: анализ парадоксальных на} первый
взгляд явлений природы рождает идеи, гипотезы, что приводит
в конечном счете к появлению новых научных открытий.
Таков, по-видимому, будет и путь познания тайн активированной
воды.
Уже сегодня можно утверждать, что в воде под влиянием
физических воздействий происходят как физические изменения
структуры, так и химические превращения с образованием сво-
боднорадикальных частиц. Примеси, содержащиеся в исходной
воде, безусловно, могут вносить существенный вклад в
конечный эффект активации. Следовательно, проблема активации
112
воды есть физико-химическая проблема, и успех ее изучения
зависит от взаимной согласованности в работе специалистов
различных областей знаний и в первую очередь физики, химии
и биологии.
Особый интерес, на наш взгляд, представляют следующие
направления в исследовании свойств активированной воды:
— исследование длительности сохранения метастабильных
структурных изменений в активированной среде;
— изучение влияния активированной воды на кинетику
химических и биологических процессов;
— изучение особенностей структуры воды и ее растворов
после физических воздействий на них;
— идентификация первичных свободных радикалов и более
стабильных продуктрв их взаимодействия с компонентами
среды;
— поиск оптимальных условий генерации свободноради-
кальных частиц определенной природы;
— изучение влияния примесей на конечный эффект
активации водных сред.
Естественно, никакой перечень не в состоянии охватить всех
аспектов проблемы. Приведенный перечень — не исключение.
Но «дорогу осилит идущий», и редко кому выпадает, удача
с достаточной точностью предугадать, что откроется за
следующим поворотом. Как тут не вспомнить слова Винни Пуха,
любимого героя известной сказки: «Мы все время ищем Дом и не
находим его. Вот я и думаю, что если мы будем искать эту
Яму, то мы ее обязательно не найдем, и тогда мы, может быть,
найдем то, чего мы как будто не ищем, а оно-то и есть то, что
мы на самом деле ищем».
ЭВМ ИЗУЧАЕТ СТРУКТУРУ ЖИДКОСТИ
...Основная проблема состоит во
взаимодействии мира экспериментального и
мира математического.
Я. Бурбаки
предисловии к своей книге «Физика жидкого
состояния» (М., 1974) известный австралийский ученый-
физик, один из наиболее уважаемых специалистов
в области теории жидкостей Клив Крокстон написал:
«Физика жидкого состояния теперь уже не имеет
привилегированного статуса интеллектуальной «грушки —
своего рода чистилища между физикой газа и теорией твердого тела,
каких-то статистико-механических дебрей, в которые рискуют
забираться только безрассудные храбрецы и ученые
академического склада. Смежные области науки предъявляют к
физике жидкостей все возрастающие требования, так что в эту
область невольно вовлекается много людей, оставляющих более
привычные и более благодарные пути. Очевидно, что наука,
которая до сих пор не смогла дать удовлетворительного
объяснения фазового перехода между жидкостью и твердым телом,
не страдает от отсутствия проблем — но этим она и
привлекательна». Как видим, эти слова были написаны всего
десятилетие назад.
Высказывание К. Крокстона, разумеется, приведено
неслучайно. Хочется, чтобы с первых же строк очерка читатель
проникся важностью и сложностью той задачи, которая будет
обсуждаться нами в дальнейшем. Можно с уверенностью
сказать, что в настоящее время проблемы жидкого состояния
вещества относятся к числу наиболее актуальных проблем
физики и физической химии, ибо в природе существует весьма
немного процессов, в которых не участвовала бы жидкость. Не
только такие разделы науки, как физическая химия,
молекулярная физика, электрохимия, физика и химия поверхностей,
самым тесным образом традиционно связаны с физикой
жидкости, но и физика атмосферы, молекулярная биология,
биохимия, фармакология и очень многие другие не могут успешно
114
развиваться без совершенствования теории жидкого состояния.
Даже медицина и физиология постоянно сталкиваются с
проблемами, связанными с поведением растворов, так как
человеческий организм почти на 2/3 состоит из воды.
«Так ли это?»—может спросить неискушенный читатель.
«Действительно ли в теории жидкости так уж много
неразрешенных проблем? Ведь в повседневной жизни мы постоянно
сталкиваемся с жидкостями и очень многое о них знаем». Да,
нам хорошо известно, например, такое свойство жидкости, как
текучесть; мы знаем, что при нагревании жидкости переходят
в газообразное состояние, а при охлаждении кристаллизуются.
Все это так. Однако не стоит торопиться с выводами. Ни
в коем случае не следует смешивать два разных понятия: факт
существования какого-либо явления, с одной стороны, и
возможность объяснения сущности этого явления — с другой.
Вероятно, мы уже убедили читателя в том, насколько важны
исследования в области теории жидкого состояния.
Совершенно очевидно, что неполнота наших знаний в этой области не
позволяет, решить очень многие неотложные задачи физики,
химии, биологии и других естественных и технических наук.
В реальной жизни чистых жидкостей не существует, все,
что нам удается наблюдать, — это растворы. Чистые
жидкости— тот предел, к которому в практике эксперимента удается
приблизиться только с большим трудом. Однако при
теоретическом рассмотрении, разумеется, прежде всего изучаются
чистые жидкости, для которых проще создать строгую теорию.
Для химиков наиболее существенной задачей, конечно,
является исследование растворов, но следует помнить, что основой
для создания различных по строгости и сложности теорий
растворов служат теории чистых жидкостей. Именно поэтому
в нашем очерке речь пойдет как о чистых жидкостях,
представляющих наибольший интерес в настоящее время для
теоретиков, так и о растворах, являющихся основой! всей нашей жизни.
ИЗ ИСТОРИИ НАУКИ О ЖИДКОСТЯХ
Твердое тело при нагревании переходит в газообразное
состояние в подавляющем большинстве случаев не путем прямой
возгонки, а последовательно через плавление и испарение.
Таким образом, жидкое состояние вещества является
промежуточным между твердым и газообразным, и этим объясняется
то, что жидкость обнаруживает непрерывную гамму свойств,
примыкая в области высоких температур и низких давлений
к газам, а в области низких температур и высоких давлений
к твердым телам.
Относительно низкая плотность газов при обычных условиях
означает, что взаимодействие молекул в них осуществляется
главным образом путем парных соударений, в то время как
115
одновременные столкновения между тремя и более
молекулами весьма мало вероятны. Обычно частица газа движется
свободно, т. е. находится в состоянии свободного пробега между
столкновениями, причем длина свободного пробега может
в несколько сотен раз превышать молекулярный диаметр.
Отсюда следует, что молекулы газа могут удерживаться в
некотором объеме только при наличии непроницаемых стенок, при
этом распределение частиц в объеме является почти
хаотическим.
Совершенно противоположная картина наблюдается в
кристаллических твердых телах, для которых характерна
правильная периодическая структура. Каждая молекула
взаимодействует с большим числом своих соседей, при этом перемещения
молекулы из одного узла решетки в другой сравнительно
редки.
Жидкость в отличие от твердого тела не обладает
правильной кристаллической структурой и молекулы ее могут
перемещаться по всему объему. Однако, как и в случае твердых тел,
каждая молекула жидкости одновременно взаимодействует
с большим числом соседних молекул, а плотность жидкости
близка к плотности кристалла.
При построении теории для газов и кристаллов
использовались простые модели, соответствующие предельным случаям
идеального газа и идеального кристалла. Идеальный газ — это
полностью неупорядоченная система, в которой отсутствуют
межмолекулярные взаимодействия. Идеальный кристалл — это
система с полностью упорядоченной периодической структурой.
Обе модели сравнительно легко описываются методами
статистической термодинамики,и являются тем базисом, на котором
строились кинетическая теория газов и статистическая
механика кристаллических твердых тел, достигшие к настоящему
времени очень высокой степени совершенства.
Для жидкости же, в силу отмеченных выше ее особенностей,
не существует общей, сравнительно простой и в то же время
достаточно оправданной модели, которую можно было бы
использовать в качестве нулевого приближения при построении
теории жидкого состояния.
Первые успехи в области теории жидкости относятся к 70-м
годам прошлого столетия и связаны с именем Яна Дидерика
Ван дер Ваальса. Основой его теории служило представление
о том, что и жидкость, и газ имеют близкие по характеру
структуры. Это предположение позволило объяснить не только
непрерывный переход из жидкого состояния в газообразное, но
и качественно установить связь между критическими
параметрами 1 вещества и его молекулярными характеристиками.
1 Под критическими параметрами понимают значения параметров
системы в точке фазового перехода, например критическая температура,
критическое давление, критический объем и т. д.
116
Развитие идей о единстве жидкостей и газов привело к
объяснению существования критической точки при фазовом переходе
жидкость — пар. Однако описать явления, происходящие в
жидкостях при более низких температурах и в особенности вблизи
температуры кристаллизации, с точки зрения этих
представлений оказалось невозможным. После классической работы Ван
дер Ваальса в микроскопическую теорию жидкости не было
внесено практически ничего нового вплоть до начала 30-х
годов нашего столетия.
Следующий очень важный этап в развитии теории жидкости
связан с именами Дебая, Френкеля, Кирквуда, Онзагера; в их
работах развиваются представления о большой общности
твердых и жидких тел. Появление такого предположения,
разумеется, не было случайным, целый ряд факторов
свидетельствовал в пользу этого. Отметим наиболее существенные из них.
Известно, что относительное увеличение объема вещества
при плавлении весьма невелико (порядка 10%). Поэтому
вероятно, расположение частиц в жидкости должно, хотя бы до
некоторой степени, повторять расположение частиц в твердом
теле, во всяком случае вблизи температуры плавления. Еще
один важный экспериментальный факт заключается в том, что
скрытая теплота плавления обычно намного меньше
(примерно в 30—40 раз), чем скрытая теплота испарения. А это
значит, что при плавлении веществ силы притяжения между
молекулами уменьшаются столь незначительно, что происходит
несущественное увеличение межмолекулярных расстояний в
жидкостях по сравнению с твердыми телами. При испарении же,
наоборот, силы притяжения значительно уменьшаются и
частицы разлетаются на большие расстояния друг от друга.
Наконец, из опыта известно, что теплоемкость веществ мало
изменяется при плавлении, следовательно, характер теплового
движения в жидкости, по крайней мере вблизи точки плавления,
близок к тому, который имеется в твердых телах, т. е.
сводится в основном к малым колебаниям частиц около положений
равновесия. Перечисленные выше три фактора находятся
в полном согласии друг с другом. Кроме того, при очень
больших сдвиговых напряжениях наблюдается пластическая
текучесть твердых тел, подобная вязкому потоку жидкости, в то
время как в жидкостях обнаружена упругость на сдвиг,
обычно сильно замаскированная их большой текучестью.
Наиболее существенный толчок в развитии новой теории
жидкого состояния дали экспериментальные исследования по
рассеянию жидкостями рентгеновских лучей.
117
КАК ОХАРАКТЕРИЗОВАТЬ СТРУКТУРУ ЖИДКОСТИ!
С помощью рентгенографических методов структурного
анализа было обнаружено, что расположение частиц в
жидкостях не является абсолютно беспорядочным, как в газах, а
сохраняет следы кристаллической структуры твердого тела. Но
как количественно описать упорядоченность в жидких
системах? В качестве такой характеристики предложено
использовать радиальную функцию распределения, которая вводится
следующим образом.
Допустим, что мы ведем наблюдение за жидкостью (будем
называть ее системой), находясь в центре какой-либо молекулы.
Тогда на расстоянии примерно одного молекулярного
диаметра мы обнаружим скопление из 9 или 10 молекул (напомним,
что в твердом теле с плотной упаковкой вокруг каждого атома
' располагается 12 других). Это бу-
qtf дет первая координационная сфера
4 m для той молекулы, которую мы при-
J ||1 няли за центральную. Двигаясь
Ijl мысленно дальше в глубь жидко-
\\\ д сти, на расстоянии примерно двух
L I'\ /'V -j1\. молекулярных диаметров мы об-
_Lj_^___y_|_>4__^^=^ Наружим вторую координационную
I j \y j I сферу, однако значительно более
I / | | j рыхлую, чем первая. При исследо-
rmi rm? rm^ r вании жидкости вблизи точки
кристаллизации нам, возможно,
рис1 удастся обнаружить третью и
даже четвертую координационные
сферы, но во всех случаях на достаточно большом расстоянии
от выбранной частицы мы вообще перестанем замечать какую-
либа корреляцию в расположении молекул по отношению
к центральной.
Как можно описать это явление, если использовать такое
понятие, как плотность жидкости? Общая плотность жидкости,
конечно, величина постоянная (при данных условиях),
усредненная по всему объему, и таблицы плотностей жидкости
приведены в справочной литературе. Но если рассматривать не
среднюю, а местную (локальную) плотность, то окажется, что
она на разных расстояниях от выбранной молекулы различна.
На малых расстояниях (порядка нескольких молекулярных
диаметров) существует вполне определенное, более вероятное
расположение частиц друг относительно друга, в tq время как
на больших расстояниях это упорядоченное распределение
частиц отсутствует. Функция, описывающая изменение локальной
плотности (т. е. распределение частиц), происходящее в
системе вблизи выбранной частицы, называется радиальной
функцией распределения. Ее обозначают как g{r), где г — расстоя-
118
ние от центральной частицы до выбранной. Схематическое
изображение радиальной функции распределения для однокомпо-
нентной атомарной жидкости1 приведено на рис. 1. Из этого
рисунка видно, что функция g(r) для жидкости является
плавной кривой, на которой при небольших значениях г имеются
минимумы и максимумы, исчезающие на больших расстояниях.
При очень малых г функция g(r) равна нулю, так как в силу
конечных размеров молейул мало вероятно, чтобы частицы
могли подойти друг к другу на расстояние, меньшее
молекулярного диаметра, а по определению вклад выбранной
центральной молекулы в функцию g(r) не учитывается.
Расстояния, отвечающие максимумам на кривой g(r) (гШ|, гШ2 и т. д.),
являются наиболее вероятными расстояниями между
частицами и могут рассматриваться как радиусы соответствующих
координационных сфер (гт,—радиус первой координационной
сферы, гт,— радиус второй координационной сферы и т. д.).
В жидкостях существует
ненулевая вероятность найти частицу на лю- д(г)
бом расстоянии от центральной, что \
говорит об отсутствии в них
правильной периодической структуры.
Наличие пиков g(r) при малых г и
отсутствие их при больших г
свидетельствует о существовании в жидкостях
ближнего порядка и отсутствии
дальнего порядка. Чтобы лучше
разобраться в этом, сравним радиальные Рис ?
функции распределения для
жидкости и для кристалла. Радиальная функция распределения
для идеального одноатомного кристалла (рис. 2)
характеризуется наличием пиков на расстояниях, отвечающих радиусам
координационных сфер (соответственно первой--г,, второй —
г2 и т. д.), при этом в промежутках между пиками g(r)=0.
На больших расстояниях пики g(r) сохраняются. Такой вид
функции g(r) указывает на существование строгой
упорядоченности в расположении молекул на любом расстоянии от
центральной частицы, что свидетельствует о наличии в кристаллах
как ближнего, так и дальнего порядка.
Вид радиальной функции распределения и для кристаллов,
и для жидкостей зависит от температуры. С изменением
температуры изменяется положение пиков на кривой g(r), их
высота. При понижении температуры на кривой g(r) для жидкости
максимумы и минимумы становятся более выраженными, а это
значит, что увеличивается ближняя упорядоченность в
расположении молекул, при этом положения максимумов прибли-
1 К таким жидкостям относятся расплавы чистых металлов, сжиженные
инертные газы.
И 9
жаются к положениям пиков функции g(r) для твердого тела,
в которое при кристаллизации переходит данная жидкость.
Роль радиальной функции распределения в теории жидкого
состояния очень существенна в, силу целого ряда обстоятельств.
Если известна g(r) как функция температуры и плотности,
а также известен потенциал межмолекулярного
взаимодействия U(г), то эти две функции полностью определяют все
равновесные термодинамические свойства системы. Добавим к
этому, что функция g(r), вернее ее трехмерный фурье-образ,
может быть непосредственно измерен при рассеянии
рентгеновских лучей или нейтронов.
СОВРЕМЕННОЕ СОСТОЯНИЕ ТЕОРИИ ЖИДКОСТИ
Открытие в жидкостях ближней упорядоченности привело
к формированию нового подхода к проблеме жидкого
состояния: жидкость стали рассматривать как искаженное твердое
тело. Естественно, что при этом прежде всего получили свое
развитие простейшие теории жидкости, так называемые
модельные теории, в основу которых были положены упрощенные
модели жидкой фазы. Первыми из них были решеточные
теории. Они строились на представлении о том, что в жидкости
существует определенная кристаллоподобная решетка. В более
поздних решеточных теориях предполагалось наличие разупо-
рядоченности в системе, которая создается введением в такую
правильную квазикристаллическую решетку свободных мест-
вакансий (это так называемые дырочные теории). . Несмотря
на то, что все варианты решеточных теорий явно
преувеличивали структурированность жидкой фазы, они сыграли свою
весьма положительную роль в развитии современных
представлений о жидкостях. В особенности это относится к
исследованию с помощью решеточных моделей жидкостей и растворов,
образованных сложными, в частности полярными, веществами
со специфическими взаимодействиями. Эти работы и по сей
день не утратили своей значимости, так как исследование
подобных систем строгими методами оказалось весьма
затруднительным.
Особое внимание в настоящее время уделяется развитию
строгой теории жидкого состояния. Эта теория (так же как
теория газов и теория кристаллических твердых тел) должна
привести к установлению связи между макроскопическими
свойствами вещества (например, плотность, теплоемкость и др.)
и функциями, описывающими взаимодействие между
отдельными молекулами. Но раньше мы отмечали, что все
термодинамические и структурные характеристики жидких систем могут
быть получены, если известна радиальная функция
распределения g(r) и установлена связь между этой функцией и
потенциалом межмолекулярного взаимодействия.
120
Представления о функциях распределения (одна из них —
радиальная функция распределения) послужили фундаментом
для разработки теории жидкости, основные положения которой
были сформулированы Дж. Г. Кирквудом в 1935 г. И когда из
общих представлений статистической физики выводится
формальная связь между радиальной функцией распределения
и потенциалом межмолекулярного взаимодействия, метод
функций распределения является вполне строгим. Однако решить
полученное интегральное уравнение не так-то просто. При
строгом решении приходится сталкиваться с огромным
количеством трудностей как чисто математического, так и
физического характера, разрешить многие из которых в настоящее
время не представляется возможным. Поэтому пока для
записи и решения основного интегрального уравнения предложены
различные приближенные теории, хотя не вызывает никаких
сомнений, что совершенствование точных теорий жидкого
состояния было, есть и будет одним из наиболее перспективных
направлений в этой области научных исследований,
В последние десятилетия в связи с бурным развитием
электронно-вычислительной техники появился совершенно новый
подход к изучению жидкостей, связанный с применением
численных методов — метода молекулярной динамики и метода
Монте-Карло. Метод молекулярной динамики состоит в
численном решении на ЭВМ уравнений движения системы многих
частиц, взаимодействующих согласно заданному потенциалу.
При этом прослеживается поведение системы во времени.
Метод Монте-Карло в статистической термодинамике — это
метод непосредственного расчета свойств системы с заданным
потенциалом межмолекулярного взаимодействия путем
усреднения этих свойств по большому числу наиболее вероятных
конфигураций, которые выбираются случайным образом. Оба
метода находят самое широкое применение при исследовании
жидкостей. Однако отметим, что метод молекулярной
динамики более информативен, тан как он позволяет получать и
равновесные, и кинетические свойства систем. Но если изучаются
только равновесные свойства системы, то, вероятно, следует
отдать предпочтение методу Монте-Карло, так как он требует
меньших затрат дорогостоящего машинного времени.
Мы поведем разговор о применении метода Монте-Карло
к изучению свойств жидкостей, поэтому более подробно
остановимся на основных преимуществах его и недостатках, но
сначала попробуем задать себе вопрос:
КАК ЗАГЛЯНУТЬ ВНУТРЬ ЖИДКОСТИ)
Итак, после несколько затянувшегося вступления, ибо все
сказанное выше можно рассматривать только как прелюдию
к основной теме, мы, наконец, подошли к сути очерка. Попро-
121
буем разобраться, как с помощью современных электронно-
вычислительных машин изучают структуру и
термодинамические свойства жидкостей.
Казалось бы, самый очевидный способ моделирования
жидкости на ЭВМ следующий. Рассматривается макроскопическая
система с числом частиц порядка постоянной Авогадро, т. е.
1023 частиц, задается потенциал межмолекулярного
взаимодействия U(г). Затем на ЭВМ перебираются все возможные
состояния системы, при этом рассчитываются энергии,
термодинамические функции и структурные характеристики
соответствующих состояний при заданных условиях. Этот путь хотя
и самый очевидный, но зато самый сложный. Если бы мы
когда-нибудь научились последовательно решать такие задачи, то
тем самым были бы получены ответы на все или почти все
вопросы, возникающие в теории жидкости. Однако на практике
все гораздо сложнее. Решить такую задачу прямым путем, как
говорят, «в лоб», пока невозможно. Дело в том, что даже
в системе из небольшого числа частиц (порядка нескольких
сотен) имеется такое количество конфигураций, что для их
перебора потребовалось бы неразумно большое количество
машинного времени. Да и вообще такой подход не оправдан из-
за его прямолинейности. Как писал Ричард Чепмен,
«статистика не заменяет мышления». Если подумать, то задачу можно
значительно упростить. Известно, что вероятность различных
конфигураций, т. е. расположение молекул друг относительно
друга в жидкости,- в конечном итоге определяется энергией
системы Еу а точнее величиной e-£lkT,. где k — константа
Больцмана, Т—абсолютная температура. Согласно основным
принципам статистической физики, заданная конфигурация
системы реализуется тем чаще, чем ниже ее энергия.
Естественно, возникает вопрос, нельзя ли придумать такой
случайный процесс, в котором из бесчисленного множества
конфигураций системы выбирались бы только наиболее вероятные,
которые могут полномочно представить систему в целом. Один
из таких методов был разработан известным американским
ученым Н. Метрополисом и его сотр. в 1953 г. Он являлся;
приложением уже известного тогда метода Монте-Карло к
решению задач молекулярной физики.
НЕКОТОРЫЕ СВЕДЕНИЯ О МЕТОДЕ МОНТЕ-КАРЛО
Интересна история возникновения метода Монте-Карло.
В книге известного советского специалиста в области
математической статистики И. М. Соболя «Численные методы Монте-
Карло» (М., 1973) говорится, что методом Монте-Карло
называется численный метод решения математических задач при
помощи моделирования случайных величин. В этом
определении подчеркивается, что в процессе вычислений используются
122
случайные числа, а следовательно, в расчеты вносятся
вероятностные элементы.
Город Монте-Карло в княжестве Монако известен во всем
мире своими казино и игорными домами, а игра в рулетку, так
распространенная в Монте-Карло, есть как раз один из
простейших способов генерирования случайных чисел. Отсюда
и название метода.
Идеи моделирования случайных явлений появились очень
давно, однако они не нашли своего развития до создания ЭВМ,
так как проводить моделирование вручную — весьма сложный
и не очень благодарный труд. Тем не менее одна важная
работа была выполнена без применения ЭВМ, и в ее основе
лежит использование случайного процесса. Имеется в виду
экспериментальное определение числа я английским математиком
А. Холлом в 1873 г. Думается, что краткое описание этой
работы поможет легче разобраться в основных идеях метода
Монте-Карло.
Известно, что число я есть отношение длины окружности
к ее диаметру d, тогда площадь круга равна nd2J4. Если
описать вокруг этой окружности квадрат, то его площадь будет
равна d2. Следовательно, площадь круга относится к площади
квадрата как я/4. Зная это, Холл поступил следующим
образом. На листе бумаги он нарисовал окружность, а вокруг нее
описал квадрат. Взял иголку, закрыл глаза и стал
беспорядочно тыкать иголкой в рисунок. Подсчитав, сколько раз он
попал в круг, а.сколько раз — в квадрат, Холл определил
вероятность того, что иголка, попавшая в квадрат, оказывается
и в круге. А эта вероятность равна я/4. Таким образом, Холл
вычислил число я, экспериментально воспроизводя событие,
вероятность которого выражается через это число.
Официальной же датой рождения метода Монте-Карло
принято считать 1949 г., когда в американском научном
журнале Journal American Statistical Association появилась статья
Н. Метрополиса и С. Улама под названием «Метод Монте-
Карло». Несколько лет спустя С. Улам вспоминал ту задачу,
которая легла в основу метода. Возможно, она покажется вам
странной, но перед ученым стоял вопрос, как рассчитать,
какая часть пасьянсов сходится до последней карты. Общее
решение Уламу найти не удалось, и он попытался решить ее
эвристическим путем и хотя бы приближенно представить себе
характер решения. Предстояло разложить большое количество
пасьянсов, записывая их результаты. Это оказалось идеальной
задачей для ЭВМ, а затем дало толчок к развитию численного
метода Монте-Карло.
Бурный рост вычислительной техники, появление все новых
поколений ЭВМ, постоянное увеличение их быстродействия
й объема машинной памяти привели к тому, что метод Монте-
Карло стал очень широко применяться в самых различных об-
123
ластях науки и техники. Если первоначально его
использовали для решения задач нейтронной физики, то в настоящее
время круг проблем, решаемых этим методом, резко расширился.
Прежде всего это различные задачи статистической физики
и среди них задачи по изучению структуры жидкостей. К
разделам науки, в которых все шире применяется метод Монте-
Карло, следует отнести задачи теории игр и массового
обслуживания, математической экономики, задачи теории передачи
сообщений при наличии помех и многие, многие другие. Все
перечисленные выше приложения метода Монте-Карло
относятся к решению задач физического и прикладного характера.
Однако он оказывает существенное влияние и на дальнейшее
развитие методов вычислительной математики (вычисление
интегралов, решение дифференциальных уравнений, систем
алгебраических уравнений и т. д.). Можно предположить, что
области применения метода Монте-Карло будут расширяться
в связи с появлением новых фундаментальных и прикладных
задач.
Везде в предыдущих рассуждениях мы употребляли термин
«метод Монте-Карло», хотя очень часто как в отечественной,
так и в зарубежной научной литературе встречается термин
«методы Монте-Карло». Это связано с тем, что существуют
различные реализации метода, используемые при решении
конкретных задач. Принципиальное сходство этих вариантов
заключается лишь в том, что. в их основе лежит закон больших
чисел, а в алгоритме решения обязательно применяются
датчики случайных чисел. В дальнейшем мы будем пользоваться
термином «метод Монте-Карло и его варианты».
МЕТОД МОНТЕ-КАРЛО В СТАТИСТИЧЕСКОЙ ТЕРМОДИНАМИКЕ
Рассмотрим подробнее один из вариантов метода Монте-
Карло, который чаще всего используется при моделировании
жидкости. Этот вариант был предложен в 1953 г. в Лос-Аламосе
Н. Метрополисом и его сотрудниками.
Допустим, мы собираемся следить за некоторой системой
из N молекул, расположенных произвольным образом. Задав
парный потенциал межмолекулярного взаимодействия,
рассчитаем энергию системы. Произвольно сместим одну частицу.
Используя любой датчик случайных чисел, найдем новые
координаты смещаемой частицы. При этом, естественно, изменится
и энергия системы. Обозначим энергию новой конфигурации
£"н, а энергию старой конфигурации .Ест- Тогда, если £н<£,Ст,
то новая конфигурация оказывается энергетически более
выгодной, чем старая. Эту новую конфигурацию мы примем как
следующее, более вероятное, состояние системы, после чего
изменим положение другой частицы. Если теперь £,н>£'ст, то
мы не отбросим сразу эту новую конфигурацию, считая ее энер-
124
гетически невыгодной, а выберем еще одно случайное число
(например, а), равномерно распределенное в интервале от О
до 1, и сравним это число с выражением е-(Ен~ь\т)1кТ, Если
выполняется условие е~(£н-Есг)1кТ>а, то новая конфигурация
принимается; в противном случае в цепи конфигураций еще раз
учитывается старая конфигурация.
Таким образом, в целом ряде случаев за следующее
состояние принимается менее выгодная конфигурация, имеющая
большую энергию. Однако появление невыгодных
конфигураций в общей цепи событий было намеренно предусмотрено
авторами метода, ибо природа стремится постоянно к
максимальному разнообразию, в частности и в состояниях систем
тоже. В физике это выражается через принцип возрастания
энтропии. Поэтому, если в цепи конфигураций возникают не
только более выгодные, но и менее выгодные, чем предыдущие,
конфигурации, то при этом увеличивается общее число
возможных состояний системы, а следовательно, возрастает энтропия.
То же, разумеется, происходит и в реальных системах, а не
только в модельных, реализуемых на ЭВМ. Конечно, чем выше
температура системы, тем больше энергия, а значит, тем
разнообразнее возможные конфигурации.
Итак, мы рассмотрели один элементарный шаг в методе
Метрополиса — сдвиг одной частицы. Затем смещается другая
молекула, третья и т. д. При этом выбор номера сдвигаемой
молекулы может происходить как случайным образом (т. е.
путем выброса случайного числа), так и по заранее заданному
порядку (например, подряд).1 Метрополис показал, что если
достаточно долго моделировать описанную выше цепь
конфигураций, то в конце концов мы получим набор состояний,
который будет определять все основные свойства реальной
исследуемой нами системы при заданной температуре.
Таковы основные принципы предложенной Метрополисом
и сотр. модификации метода Монте-Карло, применяемой при
решении задач статистической термодинамики. В дальнейшем
мы будем пользоваться только этим методом, подразумевая под
термином «метод Монте-Карло» вариант метода в
формулировке Метрополиса.
МЕТОДИЧЕСКИЕ ОСОБЕННОСТИ РЕАЛИЗАЦИИ
МЕТОДА МОНТЕ-КАРЛО
Мы познакомились с общими принципами метода Монте-
Карло и, казалось бы, можем приступать к непосредственному
моделированию интересующих нас систем на ЭВМ, но... Давай-
1 Такие последовательности состояний с условными вероятностями
переходов от одной конфигурации к другой носят название цепей Маркова в честь
известного русского математика А. А. Маркова, положившего начало всей
современной теории случайных процессов.
125
те подумаем, так ли это? Все ли нам известно? Оказывается,
далеко не все. Существует целый ряд вопросов, на которые
нам предстоит ответить, прежде чем проводить расчеты на ЭВМ.
Во-первых, мы пока еще ничего не знаем о том, как можно
получать случайные числа. Во-вторых, как мы уже упоминали,,
расчеты на современных ЭВМ удается проводить за доступное
время только для нескольких сотен частиц и редко для тысяч
частиц, а это микросистема, которая не обладает свойствами
обычной макроскопической системы. Как же поступать в этом
случае? И, наконец, третий очень важный вопрос. Мы теперь
знаем, что свойства реальной системы получаются только в том
случае, если генерируются достаточно длинные цепи
конфигураций. Так вот, необходимо установить тот предел, который
позволял бы, с одной стороны, получить достоверную
информацию об исследуемой системе, а с другой — не проводить
лишних вычислений, т. е. разумно расходовать дорогостоящее
машинное время.
Постараемся ответить на все эти вопросы.
Прежде всего при расчетах по методу Монте-Карло
возникает необходимость генерировать случайные числа.
Простейшими датчиками случайных чисел могут служить хорошо
перетасованная колода карт, игральные кости, рулетка. Разумеется,
использовать такие способы получения случайных чисел при
серьезных расчетах на ЭВМ никому не приходило в голову.
Достаточно удобны в работе так называемые генераторы
случайных чисел. Это могут быть любые технические
устройства, вырабатывающие случайные величины. Чаще всего для
построения таких датчиков используют «шумящие»
радиоэлектронные приборы (диоды, тиратроны, газотроны и др.). Однако
подавляющее большинство задач решено методом Монте-Карло
без применения этих генераторов, ибо рни не лишены целого
ряда недостатков и это прежде всего следующие:
последовательность полученных случайных чисел невозможно
воспроизвести, что затрудняет методы проверки расчетов; приходится
постоянно следить за исправностью того специального
устройства, которое является датчиком.
Практика расчетов на ЭВМ методом Монте-Карло
показала, что наиболее целесообразно использование
псевдослучайных чисел, т. е. таких случайных чисел, которые выдает сама
вычислительная машина по какому-либо заданному алгоритму.
Псевдослучайными они называются потому, что заранее задан
закон, по которому они определяются, а запас чисел в
последовательности ограничен, хотя и очень велик.
Второй вопрос, на который нам предстоит ответить, — как,
изучая систему из нескольких сотен частиц, получать
макроскопические свойства жидкостей. Ведь исследуемая система
представляет собой очень маленькую каплю, в которой
значительная часть молекул находится на поверхности. Кстати,
126
в обыкновенной дождевой капле число молекул воды порядка
1020! И, конечно же, по свойствам малой системы (из
нескольких сотен молекул) никак нельзя судить о доведении
реальных макроскопических систем с числом частиц порядка
постоянной Авогадро. Для того чтобы избежать влияния
поверхностных эффектов и получить свойства для макроскопических
систем, ограничиваясь в то же время рассмотрением небольшого
числа частиц, при расчетах по методу Монте-Карло вводят так
называемые граничные периодические условия. Как они зада-
ются, проследим на примере трехмерной системы.
Допустим, что малая система содержит N произвольно
расположенных частиц в кубе объемом У, причем значение V
выбрано таким образом, чтобы
обеспечивалась заданная
плотность в системе. Эту ячейку с N
частицами принято называть
основной ячейкой Монте-Карло.
Далее будем считать, что
пространство, окружающее основную
ячейку Монте-Карло, заполнено
точно такими же ячейками
объемом У, как и основная, и в
каждой из них содержится N
частиц. Тогда, согласно рис. 3,
основная кубическая ячейка
(центральная) окружена 26
точно такими же ячейками, 6 из
которых соприкасаются с ней
гранями, 12 —ребрами и 8 —
вершинами. При подсчете
полной энергии системы
учитываются взаимодействия частиц не только внутри ячейки Монте-
Карло, но и с частицами в соседних ячейках. Методом
Монте-Карло изучаются лишь те изменения координат
частиц, которые происходят в одной ячейке, правда, при
допущении, что все конфигурации основной ячейки в точности
повторяются в окружающих ячейках. Если одна из частиц,
например а (см. рис. 3), вследствие изменения своих координат
выйдет за пределы основной ячейки через -определенную грань
и займет положение Ъ' в соседней ячейке, то в основную ячейку
Монте-Карло через противоположную грань войдет образ
частицы а — частица а" — и займет положение Ь. Аналогичные
изменения произойдут во всех ячейках, образующих систему.
Разумеется, введение граничных периодических условий,
рассмотрение макроскопических систем как совокупности
одинаковых малых подсистем, является приближением, которое
становится тем точнее, чем больше' число частиц в ячейке Монте-
Карло. Можно оценить их влияние на конечные результаты, про-
127
х
а
■t
-t
wV7
■tA
'.'в
изводя расчеты при разном количестве частиц N в основной
ячейке, при этом точный результат для исследуемой системы
получится при экстраполяции на N-+oo. Погрешность,
связанная с введением граничных периодических условий,
оказывается порядка ЛМ, поэтому в случае нескольких сотен частиц.
в ячейке Монте-Карло она очень мала. Такая погрешность при
расчетах по методу Монте-Карло носит название
систематической.
Имеется целый ряд объектов, для которых нет
необходимости вводить граничные периодические условия. Это так
называемые малые системы, к которым относятся микрокапли,
микрокристаллы. Для этих систем самую существенную роль играет
наличие развитой поверхности.
Наконец, последний вопрос. Какой длины должна быть
генерируемая в расчетах по методу Монте-Карло цепь
конфигураций? Обычно начальное
расположение частиц в системе
f задается произвольным
образом, поэтому чаще всего эта
конфигурация далека от
равновесной, наиболее выгодной.
Энергия системы или какое-
либо другое
термодинамическое свойство F при этом
далеки от равновесных, и маши-
_ на перебирает «плохие» со-
л стояния. Постепенно система
приближается к состоянию
равновесия, а ее энергия
(либо свойство) начинает колебаться вблизи своего среднего
значения (рис. 4).
Обычно в методе Монте-Карло усреднение свойств системы
проводится по сериям из п конфигураций, причем п порядка
103—104 конфигураций. Это делается в силу того, что средние
по сериям при приближении к состоянию равновесия
совершенно очевидно испытывают меньшее отклонение от общего
среднего значения, чем свойства для отдельных конфигураций.
При расчетах всегда производится оценка средних
квадратичных отклонений определяемого для каждой серии
конфигураций свойства системы от среднего значения этого же
свойства по всем конфигурациям. Когда эти отклонения
приблизятся к постоянному значению, мы можем сказать, что полученное
нами среднее значение свойства системы является истинным
равновесным свойством. На этом следует прекращать расчеты.
Длина цепи конфигураций в каждом конкретном случае, для
каждой конкретной системы будет различна, что определяется
скоростью сходимости изучаемого свойства системы к его
равновесному значению. Практика показала, что число конфигу-
128
раций, необходимых для вычисления объемных свойств жидких
систем, порядка 10е, в случае малых систем для получения
достоверных результатов число конфигураций возрастает в 5—
10 раз. Погрешность, вносимая в расчеты методом Монте-Карло
и обусловленная конечностью цепи испытаний, носит название
статистической.
Вот теперь можно переходить к записи задачи для расчетов
ее на ЭВМ.
ДИАЛОГ С ЭВМ
Программы расчета свойств различных систем методом
Монте-Карло имеют ту отличительную особенность, что в них кроме
обычных арифметических операций имеется очень много
логических операций, переходов и т. д. Все это необходимо
предусмотреть заранее. Всегда при любых расчетах надо помнить, что
сама ЭВМ думать не умеет, она может только последовательно
и однозначно выполнять указания, данные ей программистом.
Нельзя сказать машине: «Если произойдет что-то необычное,
непредвиденное, дай мне сигнал». Нужно четко представлять
себе, что именно может произойти необычного. Например,
число, используемое в каком-то выражении в качестве делителя,
обращается в нуль, или выражение под знаком логарифма
становится отрицательным — в этих случаях машина
останавливается, сообщая о наличии ошибки. Чтобы остановки не
произошло, программист должен предвидеть возможность такой
ситуации и найти выход из создавшегося положения заранее,
обойдя каким-то образом те места, в которых происходит
нежелательная остановка. В общем при описании программы для ЭВМ
возникает много весьма непростых ситуаций. Машина не умеет
задавать вопросы, приходится ее все время спрашивать, при
этом все вопросы должны быть поставлены очень* грамотно,
иначе машина откажется на них отвечать.
Допустим, что мы написали программу на языке ЭВМ для
расчета методом Монте-Карло свойств некоторой жидкой
системы. Можно с уверенностью сказать, что программа получи-
лась сложная и довольно-таки длинная. Необходимо
удостовериться теперь, что она работает правильно, что в ней не
допущены никакие ошибки. Как это сделать?
Существуют различные традиционные методы проверки
программ. Первый путь —непосредственная проверка. Расчет
проводится на ЭВМ для системы из небольшого числа частиц,
выводится информация о промежуточных вычислениях, и эти же
результаты проверяются вручную. Это, конечно, надежный, но
достаточно трудоемкий путь. Другой метод проверки связан
с дублированием результатов. Результаты для выборочных
точек должны воспроизводиться в нескольких программах,
имеющих разные цели и возможности. Программы при этом могут
5 779
129
быть написаны разными авторами, могут использоваться
различные датчики псевдослучайных чисел, расчеты могут
выполняться на ЭВМ разных систем — результаты во всех случаях
должны воспроизводиться. Наконец, еще один важный путь
проверки программ заключается в сопоставлении получаемых
результатов с предельными аналитическими выражениями.
Существуют некоторые модельные задачи, имеющие точные решения.
Именно они и служат в качестве базисных моделей при
проверке сложных программ расчета по методу Монте-Карло.
МЕТОД МОНТЕ-КАРЛО —
МЕТОД ЧИСЛЕННОГО ЭКСПЕРИМЕНТА
Итак, мы выяснили, что при расчетах по методу
Монте-Карло в качестве исходной информации используются самые общие
закономерности статистической термодинамики, а также
предположение о виде потенциала межмолекулярного
взаимодействия. Задавшись определенным потенциалом взаимодействия,
мы получаем численные значения макроскопических
характеристик системы при заданных условиях. В этой связи интересно
заметить, что случайный стохастический характер самого
метода Монте-Карло приводит к тому, что подобные расчеты ближе
по своей сути к эксперименту, чем к теоретическому расчету
в общепринятом смысле, когда некоторые свойства систем
вычисляются по строго заданным математическим формулам.
Поэтому метод Монте-Карло можно назвать методом численного
эксперимента. Аналогии между расчетами по методу Монте-
Карло и обычными экспериментами можно продолжать и
дальше. Так же, как и в случае экспериментальных исследований,
эти расчеты требуют постановки отдельного эксперимента для
каждой системы при заданных условиях; при проведении
лабораторных работ экспериментатор должен пройти стадии
создания установки и ее калибровки, так и исследователь при
расчетах методом Монте-Карло должен написать программу (создать
установку) и отладить ее (откалибровать). Ценность подобных
«экспериментальных» исследований значительно возрастает,
если оценены систематическая и статистическая ошибки.
Метод Монте-Карло как новый мощный экспериментальный
метод дает очень ценную информацию физикам и физикохими-
кам. Прежде всего это проверка различных теорий, дающих
приближенную трактовку той или иной модели. Сопоставление
с опытом в данном случае часто непоказательно, так как трудно
оценить относительную роль ошибок, обусловленных
приближенным характером модели и приближенным способом ее
обработки. А метод Монте-Карло позволяет получать практически
точные в пределах статистической ошибки результаты для
исследуемой модели. Кроме того, метод Монте-Карло позволяет
получать в ряде случаев такую информацию, которую пока не-,
130
возможно извлечь из реальногб эксперимента. И, конечно же,
можно предположить, что машинный эксперимент окажется^
дешевле реального, особенно при исследовании веществ в
экстремальных условиях. Наконец, с помощью метода Монте-Карлб
можно изучать влияние различных микроскопических
переменных (например, форма межмолекулярного потенциала, трехчас-
тичные силы и т. д.) на измеряемые макроскопические
характеристики.
В тесной связи с теми задачами, которые целесообразно
решать с помощью метода Монте-Карло, находится и выбор
объектов исследования. Так, результаты метода Монте-Карло для
системы^ твердых сфер позволили оценить качество различны^
приближений в строгой теории жидкости. В настоящее время
с помощью этого метода изучаются жидкие системы с боле§
сложным потенциалом межмолекулярного взаимодействия. Это
системы с потенциалом взаимодействия Леннард-Джонса,
системы, образованные частицами несферической формы
(например, типа гантели), полярными молекулами, полимерами, и одна
из самых сложных жидкостей — вода. Кроме того, в последние
годы широко развиваются исследования методом Монте-Карло
жидкостей на границе со своим паром и на границе с твердым
телом. При моделировании используются самые различные виды
потенциалов межмолекулярных взаимодействий. Широко
[исследовались методом Монте-Карло и решеточные модели
жидкостей, как неполярных, так и полярных, что позволило -оценить
погрешности, обусловленные применением различных
приближенных теорий при обработке этих моделей.
Это, конечно, только краткий перечень тех жидких систем,
которые изучаются методом численного эксперимента —
методом Монте-Карло. И хотя достоинства его очень велики, не стоит
все-таки их преувеличивать. Этот метод позволяет получать
многие свойства систем, даже дает возможность воочию увидеть
наиболее вероятные расположения частиц, определить характер
движения молекул в системе, но он, в принципе, не способен
дать общих аналитических зависимостей, однозначно
связывающих потенциал межмолекулярного взаимодействия с
термодинамическими и структурными характеристиками системы.
ЖИДКОСТИ, КАК ИХ ВИДИТ ЭВМ
Английская пословица гласит: «Для того чтобы узнать,
хорош ли пудинг, надо его съесть». Воспользуемся этой народной
мудростью и обратимся к результатам, полученным для
жидкостей методом Монте-Карло. Рассмотрим некоторые, наиболее
распространенные модели жидких систем.
131
Система твердых сфер
Простейшей моделью, о которой можно сказать, что она
передает некоторые свойства жидкостей, является система
твердых сфер. Она описывается парным потенциалом (рис. 5).
Щг)~
О
при г<о,
При Г^а,
где г — расстояние между центрами сфер; а — диаметр сферы.
Это простейший вид потенциала взаимодействия, в котором
учитываются только силы отталкивания; силы притяжения
отсутствуют.
Простота и наглядность модели твердых сфер делают ее
очень привлекательной. Мы уже говорили о том, что для жид-
pVo/ffkT
10}-
V
I
h-CM
Рис 5
костей в отличие от газов и кристаллов отсутствует простая
модель, которую можно было бы рассматривать как идеальную
жидкость. Однако в целом ряде случаев систему твердых сфер
используют в качестве нулевого приближения для жидкостей
и, в частности, в силу своей простоты ее можно пр|инять как
эталонную при проверке различных приближений для решения
строгих уравнений. Точное аналитическое решение для системы
твердых сфер не найдено, и здесь нам преходит на помощь
метод Монте-Карло, который для исследуемой модели дает точные
в пределах статистической ошибки результаты, если
генерируются достаточно длинные цепи конфигураций. Поэтому система
твердых сфер очень подробно изучалась методом Монте-Карло.
В результате расчетов для системы твердых сфер были
получены изотермы, т. е. зависимости давления (р) от объема
(V) при постоянной температуре (V0 — объем системы твердых
сфер при плотной упаковке). Изотермы расщепляются на две
V32
ветви: при больших плотностях существует твердая фаза
(ветвь / на рис. 6), а при малых —жидкая (ветвь 2 на рис. 6).
Это значит, что в системе твердых сфер наблюдается фазовый
переход первого рода по типу плавление—кристаллизация,
В области, где сосуществуют две фазы, поведение изотермы
неопределенно, и эту область (на рисунке отмечена пунктирной
линией) не удается описать методом Монте-Карло. Полученные
результаты послужили критерием для оценки качества
различных приближений теории жидкого состояния.
Читатель, безусловно, знает, что жидкостей, в которых
частицы не притягиваются, а только отталкиваются, не существует,
поэтому перейдем к рассмотрению более реальных моделей
жидких систем.
Леннард-джонсовские жидкости
Существует большое количество различных потенциалов,
позволяющих описывать взаимодействия в реальных системах.
Одним из самых простых и наиболее распространенных
является потенциал Леннард-Джонса. Он относится к простым
жидкостям, состоящим из сферически-симметричных неполярных
молекул с изотропными взаимодействиями. Если наш
уважаемый читатель не выборочно знакомится с очерками, а его
интересует абсолютно все, как говорится «от корки до корки», то
ему не покажутся новыми аналитическая запись потенциала
взаимодействия Леннард-Джонса (см. с. 36)
f/(r) = 4e[(a/rV2^(a/r)«]
и его графическое представление (рис. 7). В этом выражении
первый член характеризует отталкивание между молекулами,
а второй — притяжение. Потенциал Леннард-Джонса
используется для описания многих простых жидкостей, таких, как
инертные газы, кислород, азот,
углекислый газ, метан и другие,
а также их смесей. Параметры г
(глубина потенциальной ямы) и о
(расстояние между частицами, при
котором {/(г)=0) для этих
веществ определены из
экспериментов по исследованию зависимостей
P—V—T.
Что же показали результаты
расчета методом Монте-Карло
систем с потенциалом взаимодействия
Леннард-Джонса? Напомним, что
для характеристики структуры
жидкостей и жидких растворов
необходимо знать радиальную функцию Рис.7
133
распределения. Для многих простых жидкостей она получена
экспериментальным путем из данных о рассеянии рентгеновских
лучей. Сравнение этих функций с рассчитанными по методу
Монте-Карло дает возможность оценить, насколько правильно
удается описать структуру Жидкостей путем моделирования ее
на ЭВМ при использовании потенциала Леннард-Джонса.
Оказалось, что методом Монте-Карло можно не только
качественно, но и количественно описывать свойства простых жидкостей.
Например, как видно из рис. 8, на котором представлена
радиальная функция распределения g(r) для аргона при Т=
= 126,7 К, наблюдается удовлетворительное согласие между
экспериментальной функцией (точки на рисунке) и
рассчитанной методом Монте-Карло (сплошная линия).
Если далеко не все ясно в теории чистых жидкостей, то в
теории растворов неразрешенных вопросов еще больше. Метод
Монте-Карло может дать много новых и ценных сведений о
свойствах и структуре растворов. Известно, что экспериментальные
данные о структуре растворов часто очень разноречивы, а
получение радиальных функций распределения для растворов —
задача весьма трудная, так как, например, для бинарного
раствора (А—В) необходимо иметь данные о рассеянии электронов,
нейтронов и рентгеновских лучей. В то же время метод Монте-
Карло позволяет весьма просто рассчитать для раствора,
образованного молекулами сортов А и В, взаимодействующими
между собой согласно потенциалу Леннард-Джонса, все возможные
радиальные функции распределения — gAа, #вв и £ав (рис.9).
Кроме того, изучение наиболее вероятных конфигураций в цепи
позволяет получать наглядную картину распределения частиц
разных сортов в системе.
134
А теперь обратимся к исследованиям методом Монте-Карло
сложных жидких систем.
Вода
О том, что вода является одной из самых сложных
жидкостей, пишут часто и много. Изучением воды, ее
структуры занимаются ученые уже давно, однако до сих
пор законченных представлений нет, хотя многое о воде
известно.
Еще школьнику на уроке химии говорят о том, что в воде
молекулы связаны между собой водородными связями —
довольно прочными связями между атомом водорода одной молекулы
и атомом кислорода другой. Экспериментальные исследования
воды с помощью инфракрасной спектроскопии и спектроскопии
комбинационного рассеяния показали, что в воде почти не
существует таких молекул, которые не участвовали бы в
образовании водородных связей. Таким образом, вода — это очень
сложное структурное образование, в котором почти все молекулы
связаны со своими соседями, при этом водородные связи могут
рваться, могут образовываться новые, длина связей может
меняться. Думается, что сложность исследований воды уже ни
у кого не вызывает сомнений.
Один из ключевых моментов при расчетах свойств воды
методом Монте-Карло заключается в выборе потенциала
межмолекулярного взаимодействия. Предложены различные парные
потенциалы для воды, но, к сожалению, ни один из них; не дает
совпадения по всему известному набору экспериментальных
данных.
При моделировании свойств воды большое внимание
уделяется расчету структурных характеристик, т. е. корреляционных
функций для атомов кислорода goo, водорода gm\ и атомов
кислорода и водорода #он. Очень важную информацию о
структуре жидкой воды, причем недоступную в реальном
эксперименте, удается получать при изучении геометрических и
энергетических характеристик водородной связи. Численный
эксперимент позволяет определить наиболее вероятные длины
водородных связей в воде, возможный характер искривлений
водородных связей, средние расстояния между атомами
кислорода соседних молекул.
Расчеты методом Монте-Карло подтверждают установленный
экспериментальный факт, что в воде почти нет молекул, не
образующих водородных связей. Многие молекулы воды
участвуют в образовании максимального числа водородных связей —
четырех, но существуют и такие, которые образуют одну, две
или три связи. Таким образом, можно сказать, что наши знания
о структуре жидкой воды весьма расширились благодаря
проведению численных экспериментов на ЭВМ.
135
Разумеется, мы привели далеко не полный перечень тех
результатов, которые получены методом Монте-Карло для
простых жидкостей и сложных жидких систем.
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
Вычислительные машины очень помогли нам в получении
новых сведений о поведении молекул в жидкостях, но еще
многое предстоит узнать. Вопросы остаются. «Как показывает
опыт, ничто с такой силой не побуждает высокие умы к работе
над обогащением знания, как постановка трудной и в то же
время полезной задачи». Эти слова принадлежат великому
математику прошлого Иоганну Бернулли.
Все развитие теории жидкого состояния свидетельствует
о том, что только комбинация строгих аналитических методов,
расчетов, согласно модельным представлениям, и численных
экспериментов позволяет глубоко проникать в природу
жидкости. А это означает, что дальнейшее развитие и
совершенствование метода Монте-Карло в применении его к решению задач,
встающих в теории жидкости, является совершенно
необходимым. Перечислим ряд направлений, исследования в области
которых позволят резко расширить возможности численных
методов.
Прежде всего это касается определения новых потенциалов
взаимодействия, с помощью которых можно было бы описывать
все свойства реальных систем в широком интервале
температур, плотностей и др. Эти задачи успешно решаются
физиками и химиками, но поле деятельности в данной области
еще достаточно широко, тем более, что существует мало
потенциалов для описания смешанных взаимодействий в
растворах. Следующая очень важная проблема состоит в том, что
практически всегда при исследовании жидких систем расчеты
методом Монте-Карло проводились при учете только парных
взаимодействий молекул, хотя совершенно очевидно, что в
жидкостях существенную роль должны играть трехчастичные и
даже более сложные взаимодействия. Таким образом, введение
трехчастичных сил взаимодействия может дать совершенно
новую информацию о свойствах жидкостей. И, наконец,
известно, что методом Монте-Карло не удается точно локализовать
фазовый переход жидкость — твердое тело. Для решения этой
задачи, а также некоторых других вопросов, ответить на
которые пока не удается, нужно, вероятно, разработать новые
модификации метода Монте-Карло. Все эти проблемы могут быть
решены и должны решаться совместными усилиями физиков,,
химиков и математиков.
Вопросы.ждут своих ответов, многие задачи уже поставлены,,
но еще не решены, а сколько вопросов мы еще даже и задать
не можем — не умеем. Но ученые всегда стремились познать не-
136
знаемое и добились уже очень многого. Американский физик
Ричард Фейнман, лауреат Нобелевской премии, писал:
«Отыскивание законов физики — это вроде детской игры в кубики, из
которых нужно собрать целую картинку». Такой игрой в кубики
и заняты физики и химики, стремящиеся познать природу
жидкости. Из груды имеющихся кубиков надо подобрать такие,
которые имели бы что-то общее, характеризующее жидкость.
Задача сложная, но она обязательно будет доведена до конца.
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ —
ИСКУССТВЕННЫЕ СЕНСОРЫ
Способ является частью истины в той
же мере, что и результат.
Карл Марке
КОНЦЕНТРАЦИЯ И АКТИВНОСТЬ
гновной задачей химии был и остается вопрос «что
есть что?», т. е. проблема анализа всего, что окружает
человека, а также биохимических сред, составляющих
человеческий организм и обеспечивающих его
нормальную жизнедеятельность. И неудивительно, что
химики всех поколений особое внимание уделяли анализу
жидких растворов, и в первую очередь водных, так как вода
является важнейшим химическим соединением на Земле.
Главная характеристика раствора — это его качественный
и количественный состав, который принято выражать через
концентрации составляющих раствор веществ (компонентов
раствора). Концентрацией называют количество данного
компонента в определенном количестве раствора или растворителя,
т. е. компонента, присутствующего в растворе в избытке;
остальные компоненты раствора называют растворенными
веществами.
При растворении между компонентами раствора
осуществляются разного рода взаимодействия: разрываются связи
между молекулами исходных веществ; происходит диссоциация,
т. е. распад молекул растворенного вещества (электролита) на
заряженные частицы (ионы); образуются новые связи между
молекулами растворителя и растворенного вещества;
возникают всевозможные ассоциаты — между молекулами воды и
молекулами или ионами растворенного вещества (гидраты),
между гидратированными ионами с противоположными знаками
заряда (ионные пары); под воздействием растворенного
вещества диссоциируют молекулы воды, распадаясь на ионы гидро-
ксония Н30+ и гидроксила ОН-; ионы, соответствующие слабым
(плохо диссоциирующим) кислотам или основаниям, гидроли-
зуются, т. е. «отнимают» от воды ионы водорода или
гидроксила.
138
Все эти процессы находятся в подвижном равновесии,
причем в зависимости, от состава раствора равновесие смещается
в ту или иную сторону. Чем концентрированнее раствор, тем
сильнее проявляются взаимодействия в нем. Это приводит
к тому, что аналитические концентрации растворенного
вещества и растворителя, которые мы задавали, когда готовили
раствор, не соответствуют истинным. Протекание различных
процессов в растворе определяется так называемой активностью,
или иначе «активной» концентрацией, характеризующей
эффективную способность вещества вступать в химические реакции
(как правило, активность меньше общей концентрации
вещества).1 Поэтому, когда требуется рассчитать скорость
химической реакции, константу химического равновесия, т. е. когда
нужно выяснить реальное состояние компонентов в растворе,
возникает необходимость знать их активности. Но электролиты
в растворе существуют в виде ионов, и во многих случаях
полезно, а иногда даже жизненно важно знать именно активность
ионов данного, вида. Например, жесткость воды определяется
активностью ионов кальция и магния. При определенной
активности ионов калия нормально протекает фотосинтез в
растениях, активизируется работа многих растительных ферментов,
усиливается водоудерживающая способность протоплазмы
растительной клетки, что препятствует увяданию растения. Такие
физиологические процессы, как свертывание крови, сокращение
мышц, проводимость нервных клеток и др., зависят от
активности ионов кальция, магния, калия и натрия. От активности
ионов калия в крови зависит деятельность сердца, а изменение
в крови активности ионов лития вызывает нарушение или
восстановление нормальной психической деятельности человека.
Заметим, что в биологических жидкостях особенно велико
различие между общей аналитической и активной концентрациями
ионов. Так, активность ионов кальция в крови в несколько раз
отличается от общей концентрации кальция.
Активность — величина термодинамическая. И для расчета
термодинамических величин применяется активность, а не
концентрация раствора. Но парадоксальность положения
заключается в том, что термодинамика наложила однозначный и
категорический запрет на возможность определения активности
отдельного сорта ионов. Можно рассчитать активность
растворителя, измерив, например, давление его пара над раствором;
можно определить общую активность электрода аэл, не
разделяв? ее на активность отдельных ионов; можно даже условно
1 Активность называют иногда «экспериментально исправленной
концентрацией». Связь между концентрацией с и активностью а выражается
уравнением я=/.с, где f — коэффициент активности. Несмотря на то, что
физический смысл этих двух величин (а и с) в значительной степени не
совпадает, практически важно, что в определенных условиях при /=const
активность и концентрация прямо пропорциональны друг другу.
139
«разделить» активность электролита и иметь дело со средне-
ионной активностью а±» но нельзя измерить активность
отдельного иона (а+ или а_), поскольку невозможно разделить
и изучать в отдельности растворы, содержащие только
положительно или только отрицательно заряженные ионы.
Тем не менее химики научились определять активности
отдельных ионов. Для этих целей стали применять специальные
устройства, так называемые ионоселективные электроды (ИСЭ).
Это электрохимические датчики, потенциалы которых
однозначно определяются активностью определенного сорта ионов в
растворе, и этот сорт ионов называется потенциалобразующим.
Отсюда ясно, почему электроды названы ионоселективными:
«селективный» — значит, ^избирательный». Разработкой и
изучением ИСЭ занимается ионометрия — раздел физической
химии, который объединяет в себе достижения аналитической,
неорганической, органической химии, биохимии и электрохимии.
Но прежде чем обсуждать принципы действия ИСЭ,
вспомним, что называется электродом в электрохимии.
ЭЛЕКТРОД, ЭЛЕКТРОДНЫЙ ПРОЦЕСС,
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
Самый простой пример электрода — металл, погруженный
в раствор его соли. Рассмотрим, что происходит на границе
между ними.
Известно, что абсолютно нерастворимых веществ не
существует. При соприкосновении любых двух фаз2 начинается их
взаимное перемешивание, растворение. Металл (пусть,
например, это будет серебро) можно представить состоящим из
ионов Ag+ и электронов е. Электроны характеризуются очень
малой растворимостью в воде, а катионы серебра, напротив,
легко переходят в воду с образованием гидратированных
катионов. Учитывая, что активность ионов серебра в фазе металла
всегда выше, чем даже в насыщенном растворе его соли, металл
будет переходить в раствор. Это означает, что на границе фаз
будет, происходить окислительно-восстановительная реакция.
Схематически контакты двух фаз можно изобразить так:
Ag+|Ag,
1 Связь между указанными величинами активности выражается
уравнением a*n = (a±Y = аЧ- - а'—, где v+—число катионов, v_—число анионов,
v=v++v-—общее число ионов, на которое диссоциирует электролит.
2 Фазой называется однородная на всем своем протяжении по
химическим и физическим свойствам среда. Любой электрод является гетерогенной
системой, т. е. состоит из нескольких фаз. В нашем примере две фазы —
металл и раствор.
140
где вертикальная черта символизирует границу фаз; слева от
нее ионы серебра Ag+ в водном растворе, справа — атомы Ag
в металле. Химическая реакция, происходящая на границе фаз,
запишется следующим образом:
Ag ^ Ag+ + е.
Это реакция обратимая, т. е. из водного раствора часть гидра-
тированных ионов серебра сорбируется на поверхности металла
и, теряя свою гидратную оболочку, встраивается в
кристаллическую решетку металла, взаимодействуя с электронами. Таким
образом, между металлом и раствором устанавливается
подвижное ионообменное равновесие.
В зависимости от того, какова будет активность ионов
серебра в растворе (tfAg+), из металла перейдет в раствор то или
иное количество ионов серебра. Однако процесс перехода ионов
в любом случае быстро затормозится, так как в этой
гетерогенной (межфазной) реакции имеет место пространственное
разделение заряда (металл заряжается отрицательно, раствор —
положительно) и сила электростатического притяжения
препятствует дальнейшему переносу зарядов через границу фаз. При
этом на границе фаз образуется скачок электрического
потенциала ф 4Ag называемого электродным потенциалом. Зависимость
электродного потенциала от активности ионов серебра в
растворе выражается уравнением Нернста
*Ag = 90Ag + ^'gaArb
здесь q>Ag и О—величины, постоянные при данных температуре
и давлении; q>° — это характеристическая величина для данного
металла, qpAg =q>Ag при aAg+ = 1; О измеряется в милливольтах
и при 20°С составляет 58 мВ; ZAg+— заряд ионов серебра,
2Ag+ = + l. В величину фАйвходит также контактная разность
потенциалов фк между серебром и металлом токоотводящего
провода.
Таким образом, измерив электродный потенциал, мы можем
определить aAg+- Предварительно следует прокалибровать
электрод в стандартных растворах с известной активностью a\g^
для определения постоянной фле.
Однако измерить электродный потенциал одного электрода
невозможно. На практике мы можем только сравнивать
потенциалы двух различных электродов, составляющих
гальваническую цепь (или гальваническую ячейку).
Схематически изображенный на рис. 1 гальванический
элемент состоит из индикаторного электрода 1 и электрода
сравнения 2, погруженных в раствор 4 и замкнутых измерительным
прибором иономером 3. Разность потенциалов между электро-
141
дами будет наибольшей в отсутствие тока в цепи, поскольку
только в этом случае электроды будут находиться в равновесии
с раствором. Такая разность потенциалов называется электро-
движущей силой (ЭДС или Е) данного гальванического
элемента: Б=фА2—фг. Для того чтобы «разделить» измеренное
значение ЭДС на два электродных скачка потенциала, в
электрохимии предложена условная шкала, в которой за ноль
отсчета принят потенциал стандартного водородного электрода.
Водородный электрод называют стандартным, если
платинированная платиновая пластинка погружена в раствор кислоты с
активностью ионов водорода „равной единице, и омывается током
газообразного водорода, давление которого
равно 1 атм (1013 гПа). При равенстве нулю
потенциала электрода сравнения, в
нашем случае водородного электрода (фг =
=0), ЭДС гальванического элемента
равна электродному потенциалу
индикаторного электрода (£=фдй ), и зависи-
fe*
j ^ мость ее от активности ионов металла
Y (аА +) в растворе тоже выразится урав-.
нением Нериста
E = E« + blgaAs+y
р где Е°— постоянная величина при
постоянных давлении и температуре (в нее
будет также входить величина ф2, если
потенциал электрода сравнения будет равен не нулю, а какой-
то ПОСТОЯННОЙ, Т. е. ф2 = СОП81).
Мы рассмотрели так называемый электрод первого рода, или
такой электрод, где в равновесии с раствором находится одна
фаза — металл. Если в равновесии с раствором находятся две
фазы, например погруженное в раствор хлористого натрия
металлическое серебро, покрытое труднорастворимым осадком
хлорида серебра, то это будет электрод второго рода. Его
потенциал зависит от активности ионов хлора
<Рс1 = Ф°с1-д1еаС1-
(знак минус появился потому, что 2ci-=—1).
Таким образом, с помощью электродов второго рода
возможно определение активности анионов в растворе. Казалось бы,
проблема решена: с помощью обратимых электродов первого
и второго рода можно измерять активности как катионов, так
и анионов в растворе. Но приведенным выше уравнениям
подчиняются только обратимо работающие электроды, такие, на
которых протекает обратимая химическая реакция, способная
легко изменить свое направление (в прямую или обратную
сторону) при изменении внешних условий. Количество же ме-
142
таллов, способных обратимо обмениваться ионами с раствором,
невелико. К ним относятся в определенных условиях Ag, Hg,
Zn, Cu, Pb, Cd и некоторые другие. Обычно же на
металлических электродах могут происходить посторонние окислительно-
восстановительные реакции. Например, на том же серебряном
электроде может идти реакция восстановления кислорода
02 + 4Н+ + Ае г 2Н20.
При этом потенциал серебряного электрода будет зависеть уже
не только от активности ионов серебра, но и от активности
ионов водорода, да и от активности растворенного кислорода.
Это обстоятельство помешало широкому распространению
металлических электродов в качестве датчиков активности.
Решением проблемы стало применение ионоселективной мембраны,
отделяющей металлический электрод от исследуемого раствора
и способной обмениваться ионами с раствором.
КОЕ-ЧТО О МЕМБРАНАХ И СВОЙСТВАХ
ИОНОСЕЛЕКТИВНЫХ ЭЛЕКТРОДОВ
В электрохимии мембраной называют перегородку,
разделяющую две фазы и пропускающую некоторые (но не все!)
компоненты этих фаз. Электрохимические исследования мембран
тесно связаны с развитием биоэлектрохимии. Это лишь одно
направление более общей науки—мембранологии, поэтому сначала
несколько слов о биологических мембранах. В биологии
мембрана — одно из самых совершенных творений живой
природы. В переводе с латинского membrana — значит «кожица».
Хорошо знакомой всем мембраной является наша кожа.
Мембрана— это оболочка, ограничивающая организм в целом,
каждый его орган, каждую клетку и внутриклеточные тельца (ор-
ганеллы). Совершенно особая роль у клеточных — протоплазма-
тических — мембран. Можно сказать, что жизнь на Зем*ц£
появилась с момента возникновения клеточных мембран, которые
обеспечили главную функцию живого организма — обмен
веществом и энергией с окружающей средой с сохранением
постоянства внутреннего состава. Мембрана — защитный барьер
и «руководитель» всей жизни клетки. Через мембраны
осуществляется контакт между клетками, благодаря которому
возникает единое целое — организм. Нарушение функционирования
мембран приводит к различным патологическим изменениям,
например, по одной из гипотез, к развитию раковых клеток,
которые отличаются от нормальных клеток неспособностью
принимать информацию от своих клеток-соседей, что приводит к их
бесконечному делению.
Функции клеточных мембран очень разнообразны, и
значительная часть мембранных явлений в живом организме связана
с селективным переносом ионов через мембраны и возникнове-
143
нием при этом мембранных разностей электрических
потенциалов.
В конце XIX в., как только было выявлено важное значение
клеточных мембран, началось изучение физико-химических,
в том числе электрохимических, свойств их искусственных
упрощенных моделей. В качестве моделей рассматривали несмеши-
вающиеся с водой жидкости, пористые коллоидные мембраны
и твердые мембраны из ионообменных смол и различных
минералов. Эти исследования были очень полезны для развития
теории ионной селективности мембран, хотя практическая их
избирательность была еще низкой.
Первые шаги ионометрии были сделаны в начале нашего
века ^ 1909 г.), когда Ф. Габер и И. Клеменсевич показали, что
открытую М. Кремером в 1906 г. способность
стеклянной мембраны изменять свой потенциал в
зависимости от концентрации водородных ионов
Л в растворе можно использовать для регистрации
активности ионов водорода или, что удобнее, в ви-
-2 де рН, «водородного показателя» (рН=—lgaH+).
Это было рождение рН-метрии, прародительницы
ионометрии в ее современном состоянии. Иономет-
^з Рия сформировалась в середине 60-х годов, когда
появилась серия мембран с высокой селективностью
к разным ионам и арсенал ионометрии пополнился
^» фактически всеми существующими сейчас типами
\^ мембранных электродов.
Ионоселективный электрод устроен весьма
просто (рис. 2). Он состоит из корпуса 1> обычно пла-
РисЗ стмассового, внутреннего вспомогательного
электрода 2, погруженного во внутренний раствор 3,
и, наконец, самой существенной его части — мембраны 4.
Мембрану называют чувствительным элементом ИСЭ, а
внутренний раствор со вспомогательным электродом (обычно
это электрод второго рода)—токоотводом, так как их роль
заключается в обеспечении перехода от ионной проводимости
мембраны к электронной проводимости металлических
проводов. Таким образом, ИСЭ — более высокая ступень развития
потенциометрических датчиков (металлический электрод
является составной его частью).
Ионоселективные электроды часто называют мембранными
и даже принято классифицировать их по типу мембраны:
стеклянные, кристаллические, жидкие и пленочные. Основные типы
ИСЭ будут рассмотрены ниже. Существенно же то, что все
мембраны содержат электродноактивные вещества, которые
и обеспечивают процесс селективного обмена ионами между
мембраной и раствором.
При погружении ИСЭ в исследуемый раствор его мембрана
отделяет внутренний раствор от исследуемого внешнего раство-
Н4
pa. Между фазой мембраны и обоими растворами начинается
процесс обмена ионами, которые двигаются в сторону фазы
с меньшей активностью ионов данного вида. Поскольку
мембрана часть ионов не пропускает, то на обеих ее сторонах вскоре
возникают скачки электрических потенциалов, препятствующие
дальнейшему переходу ионов между фазами. Таким образом
достигается равновесное распределение заряженных частиц
между растворами и мембраной. Гальванический элемент с ионо-
селективным электродом можно изобразить следующей схемой:
Электрод
сравнения
(внешний)
Мембрана! Внутренний
Исследуемый
раствор!
Электрод
раствор | сравнения
(внутренний),
ИСЭ
где фь ф2, фз, ф4 — равновесные скачки электрических
потенциалов между сосуществующими фазами; фм — мембранный
потенциал, состоящий из суммы двух граничных потенциалов ф3 и ф4
и диффузионного потенциала фо, возникающего при
передвижении ионов внутри мембраны (в жидких и пленочных
мембранах). На опыте мы измеряем ЭДС гальванического элемента,
состоящую из алгебраической суммы всех перечисленных
скачков потенциала и зависящую от активности потенциалообразую-
щего иона ах, т. е.
Е = Ф1 + Ф2 + Фз + Ф4 + Фо = <Pi + ?4 + Фм = Е° + — lg ях,
здесь фЬ ф2 и ф4 — постоянные величины и входят в Е°.
Эффективность работы ИСЭ определяется следующими его
свойствами:
1. Угловым коэффициентом зависимости потенциалгжлектро-
да от логарифма активности потенциалобразующего иона: чем
ближе его значение к теоретическому (Ф=58 мВ при 20°С), тем
лучше электрод.
2. Диапазоном концентраций, в котором зависимость
потенциала электрода от lgax линейна. Обычно это область
концентраций от нескольких молей до 10~5 моль/л, иногда до
Ю-10 моль/л (от рХ«0 до рХ5, иногда до рХЮ).
3. Временем установления значения потенциала после
резкого изменения концентрации в исследуемом растворе. Его
иногда называют временем отклика электрода, и оно составляет от
нескольких секунд до нескольких минут (в разбавленных
растворах).
4. Устойчивостью потенциала во времени. Нестабильность
потенциала называют «дрейфом» потенциала; чем меньше дрейф,
145
тем лучше электрод (обычно значение дрейфа меньше, чем
±1 мВв сутки).
5. Временем «жизни» электрода, иначе говоря временем
эксплуатации, в течение которого электрод сохраняет свои
начальные или близкие к ним /Характеристики. Для электродов
с твердыми мембранами время эксплуатации составляет
несколько лет, с пленочными —несколько месяцев, с жидкими —
несколько недель.
6. Селективностью. Это основная характеристика электрода.
В идеальном случае потенциал электрода должен реагировать
на изменение активности только одного вида ионов. На самом
деле этого достичь невозможно, потому что у каждого вида ионов
имеются аналоги, близкие ему по свойствам. Чем более похожи
два иона (например, основной А+.и мешающий В+), тем
меньше различает их мембрана ИСЭ. Селективность количественно
выражается через коэффициент селективности /Са/в электрода
к иону А+ в присутствии иона В+. Чем меньше значение этого
коэффициента, тем меньшее влияние иона В+ на потенциал
электрода и тем селективнее электрод к ионам А+.
В 30-х годах Б. П. Никольский разработал ионообменную
теорию действия стеклянных электродов. Его уравнение для
ЭДС гальванического элемента со стеклянным электродом
применимо ко всем ИСЭ, помещенным в смешанный раствор,
содержащий ионы А+ и В+ (с активностью ад+ и ав+):
ИСЭ СО СТЕКЛЯННЫМИ МЕМБРАНАМИ
Ионоселективный электрод со стеклянной мембраной, часто
называемый стеклянным электродом (рис. 3), представляет
собой стеклянную трубку (корпус) /, к которой припаяна
шарообразная мембрана 3 из электродного стекла.
| ' Внутрь электрода заливают раствор 4, в кото-
pgzg_ рый погружают вспомогательный электрод 2.
Исключительно высокая селективность стек-
j лянных электродов к ионам водорода
обусловлена химической природой стекла, которое
является сплавом силикатов в основном щелочных
~2 и щелочноземельных металлов. Обычно состав
стекла выражают в процентном содержании
оксидов, например: 72% Si02, 6% СаО, 22%
Na20. Как известно, соли слабой кремниевой
кислоты в водном растворе подвергаются
гидролизу, что и происходит на границе стекло -^
раствор, при этом ионы щелочных металлов
Рис 3 обмениваются на ионы водорода из раствора.
На поверхности стекла образуется слой геля
146
(желеобразной массы) кремниевой кислоты толщиной 1—100-нм,
в котором и происходит ионообменная реакция с раствором.
Высокая селективность стеклянных электродов к ионам
водорода обусловлена особенностями самого атома водорода: очень
малым радиусом по сравнению с радиусами других катионов
и способностью передвигаться по мостиковым водородным
связям (как в воде — туннельный эффект), что обеспечивает ионам
водорода чрезвычайную подвижность.
Таким образом, на границе стекло — раствор происходят
реакции
^H^„o+Nan
О
I
-O-Si-OH
I
о
+ +н"*" ^=^н +
стекло^ раствор*— стекло ' раствор
I
о
I
-O-Si-0
О
раствор»
которые и определяют величину потенциала стеклянного
электрода относительно раствора.
Интервал измерения рН с помощью стеклянных электродов
составляет от —1 до 14. Коэффициент селективности
относительно почти всех катионов /Сн/мс ~ Ю-12.
Основы тебрии функционирования стеклянного электрода,
заложенные Б. П. Никольским и развитые его школой на
химическом факультете Ленинградского университета, описывают
фактически все существующие сейчас ИСЭ. Можно только
добавить, что вариации состава стекла позволили получить
стеклянные электроды не только с водородной, но и с
металлическими функциями, а также стеклянные электроды для
измерения окислительно-восстановительных потенциалов растворов.
Последний тип электродов, так называемые редокс-электроды,
успешно конкурируют с традиционными платиновыми редокс-
электродами, так как они нечувствительны к^растворенным
газам (02 и Н2) и к некоторым веществам, «отравляющим»
поверхность платиновых электродов.1
ИСЭ С ТВЕРДЫМИ МЕМБРАНАМИ
Первые попытки исследовать электроды с твердыми
поликристаллическими мембранами были предприняты
одновременно с изучением стеклянных мембран. Однако судьба этих ис-
1 Более подробно свойства стеклянных электродов изложены в брошюре
Б. П. Никольского, М. М. Шульца и А. А. Белюстина «Стеклянный электрод
н химическое строение стекол» (Л., 1971).
147
следований сложилась менее удачно, чем для стеклянных
мембран, и причины в значительной мере были связаны с
несовершенством техники. Дело в том, что твердые диски
предварительно расплавленных солей или спрессованных кристаллов
имели очень большое сопротивление при толщине,
обеспечивающей необходимую прочность, и из них нельзя было выдуть
тоненький пузырек, как из стекла. К тому же эти кристаллы,
представляющие собой соли серебра, подвергались действию
света, окислителей и восстановителей.
Первым ионоселективным электродом с
поликристаллической мембраной стал электрод на основе иодида серебра,
внесенного в полимерную матрицу, обеспечившую механическую
прочность и даже эластичность мембране. Его сделал
венгерский ионометрист Е. Пунгор с сотр. в 1961 г. Американские
ученые М, Франт и Дж. Росс в 1966 г. в качестве гомогенной
мембраны для ИСЭ вместо поликристаллов применили
монокристалл трехфтористого лантана.
Кристаллы солей могут быть применены в качестве элект-
родноактивного вещества, если ионы, составляющие соль,
способны перемещаться по дефектам кристаллической решетки под
действием электрического поля. Селективность такой мембраны
обеспечивается строением кристаллической решетки.
Например, в мембране из монокристалла фторида лантана ионы
фтора обладают высокой подвижностью, передвигаясь в
кристаллической решетке согласно схеме
LaF3 + вакансия («дырка»)~^ЬаР^ + F-.
Потенциал ЬаКз-электрода линейно зависит от lgflF- в
интервале концентрации 10и—10~6 моль/л. Селективность этого
электрода в определении ионов F- такова, что более чем 1000-
кратные избытки большинства анионов не влияют на его
потенциал. Мешают работе электрода только те ионы, которые
образуют комплексы с ионами F~. Это в первую очередь ионы
Н+ (образование комплекса происходит по реакции H++3F~ =
= HF|~~), а также многозарядные катионы металлов,такие, как
Al3+, Fe3+, Th4+, ионы Li+ и анионы ОН-, реагирующие с La3+
с образованием гидрооксида La(OH)3. Поэтому такой
высокоселективный электрод может работать только в ограниченной
области рН (от 5—5,5 до 9—13).
В электродах на основе солей серебра ионную проводимость
осуществляет ион Ag+. Поскольку чувствительность электрода
к ионам в разбавленных растворах обусловлена произведением
растворимости (ПР) соли,1 то определять концентрацию Ag+
1 ПР соли характеризует ее растворимость и равно произведению
концентраций составляющих соль ионов в степенях, соответствующих v+ или
v-(cm. стр. 140). Так, nPAg,s=c^ + -с 2-
148
лучше всего с помощью мембраны из Ag2S, так как nPAgas =
= 10~51 и электрод способен «почувствовать» до 10~20 моль/л,
т. е. буквально несколько ионов серебра в 1 мл раствора. В
определенных условиях и активность ионов S2- можно измерить
этим электродом до 10~19 моль/л. На основе этой соли
изготовляются поликристаллические электроды, селективные к другим
анионам, в том числе к ионам галогенов. Для получения
мембран смешивают соли AgX (где Х- = С1~, Br~, I~, CN~,
SCN-) с Ag2S или прессованием, или внесением в инертную
матрицу, например в силиконовый каучук. Чем меньше ПРлех,
тем меньшие концентрации анионов X" можно определить
этими электродами. Так С1~ определяется в интервале
концентраций от 6 до 10~5 моль/л, а 1~ — до Ю-6 моль/л.
Селективность этих электродов тоже возрастает с
уменьшением ПР.
На этом же принципе основаны электроды с твердыми
мембранами, селективные к катионам других металлов — Cu2+, Pb2+,
Cd2+, Fe2+, мембраны которых состоят из смеси сульфида
данного металла и сульфида серебра.
Электроды с твердыми мембранами менее подвержены
воздействию посторонних ионов, чем электроды с жидкими
мембранами; кроме того, они обладают большой механической
прочностью, долговечностью, просты в устройстве и более
удобны для создания «полностью твердофазных электродов», т. е.
электродов без внутреннего раствора, с токоотводом,
непосредственно контактирующим с твердой мембраной. Однако
большинство ионометристов работают не с твердыми, а с жидкими
мембранами. И дело здесь не столько в том, что не так уж
много кристаллических соединений, удовлетворяющих
требованиям обратимого ионного обмена с растворами, а, скорее
всего, в том, что в случае жидких мембран имеется больше
возможностей в целенаправленном изменении мембранных
свойств.
ИСЭ С ЖИДКИМИ И ПЛЕНОЧНЫМИ МЕМБРАНАМИ
Жидкие и пленочные электродные мембраны представляют
собой раствор электродноактивного вещества — органического
ионообменника или нейтрального комплексообразователя —
в органической жидкости, несмешивающейся с водой. В
пленочных мембранах предъявляются более высокие требования к
органическому растворителю. В нем должно растворяться не
только электродноактивное вещество, но* и высокомолекулярное
вещество матрицы, т. е. растворитель должен быть
пластификатором применяемого в качестве матрицы полимера. От
электродов со стеклянными и кристаллическими мембранами эти
электроды выгодно отличаются простотой изготовления, поэто-
149
му их изучением могут заниматься практически в любой
химической лаборатории.
Электрод с жидкой мембраной (рис. 4) помимо
вспомогательного электрода / во внутреннем водном растворе 2
содержит органический раствор 3 с электродноактивным веществом.
Гайка 4 прижимает пористую перегородку 5, пропитанную
органическим раствором.
Первые электрохимические исследования жидких мембран
тоже относятся к началу нашего века, но широко ИСЭ с
жидкими мембранами начали применять в 60-х годах, когда
американский исследователь Дж. Росс разработал
селективный кальциевый электрод с жидкой
мембраной. Селективность жидких мембран определяется
в первую очередь экстракционными{ свойствами
органической фазы. Разность потенциалов на
границе двух несмешивающихся жидкостей возникает
юлько в случае неодинаковой растворимости в них
катионов и анионов. Различие в распределении
ионов разного знака в этих жидкостях проще всего
получить, растворив в органической фазе ионооб-
менник.
Ионообменник должен удовлетворять
следующим требованиям: не растворяться в воде,
образовывать прочное соединение с потенциалобразую-
щим ионом и обладать способностью быстро
обмениваться ионами с раствором. Существуют ка-
тионо- и анионообменники.
В качестве катионообменников применяются
соли с крупными органофильными анионами,
например:
Рис*
R-04^0
R — о' ^0
Т ["R-°vsT
Диалкипфосфат
Диалкилдитиофосфат
Тетрафенил&орат
где R — углеводородный радикал. Роль анионообменников
выполняют соли с крупными гидрофобными катионами, такими,
как
1 Экстракция — извлечение вещества жидкостью из другой жидкости
или твердой фазы.
=150
Тетраалнил-
аммоний
краситело грифенилметанового ряда
Ге!
и*
Органометаллическии
комплекс
Рассмотрим принцип работы жидкой мембраны (рис. 5).
В органическом растворителе S находится соль AR (или
BR)> В данном случае крупный органический анион R~
нерастворим в воде и не может выйти за пределы мембраны. Его
присутствие в органической фазе не позволяет войти в
мембрану одноименно с ним заряженным анионам Х~. Свободно
переходят границы фаз только катионы А+ и В+. В отличие от
мембран с твердыми ионообменниками на основе
кристаллических солей в жидких мембранах органофильные
(гидрофобные) ионообменники (R-4- в нашем примере) подвижны. Кроме
того, более подвижными в жидких мембранах (по сравнению
с твердыми) становятся обменивающиеся с водным раствором
ионы А+ и В+. При переходе из водного раствора в
органический ионы А+ и В+ участвуют в нескольких процессах: они
теряют полностью или частично гидратную оболочку (процесс
дегидратации), сольватируются органическим растворителем
(процесс сольватации), взаимодействуют с анионами R-
(процесс ассоциации) и перемещаются внутри мембраны. Все эти
процессы влияют на величину мембранного потенциала, и
именно их варьирование позволяет целенаправленно воздействовать
на селективность жидкой мембраны.
Например, замена катионообменника (если вместо соли ди-
алкилфосфата использовать соль диалкилдитиофосфата)
позволяет получить селектив-
Внешннн Жидкая t внутренний
ные (в присутствии
катионов щелочных и
щелочноземельных металлов)
электроды к металлам
«сероводородной» rpyif*
пы - Hg(II), Ag(I),
Cu(II), Bi(III), Pb(II),
Cd(II), Ni(II), Zn(II).
Напротив, замена анио-
нообменника (если
вместо фенантролинового
комплекса никеля (или
железа) применить тет-
Зодный
раствор
X"-
мембрана
- S
А"
В*
- AR
- BR
РИС 5
Водный
растдор
:а*
151
раалкиламмониевое основание) не дает ощутимого эффекта
и не изменяет установленного для анионов ряда селективности
R->CIO->SCN->I->N03->Br->Cl->OAc->
>F->H2PO->S02->OH-t
где R~ — анионы высокомолекулярных органических кислот.
В первом примере доминирующим фактором при переходе
катионов металлов из водного раствора в мембрану является их
взаимодействие с обменником, а во втором случае
определяющим становится процесс дегидратации анионов, что
подтверждается расположением анионов в ряду в порядке возрастания
их энергии гидратации. Этот ряд в какой-то мере напоминает
ряд активности металлов: ионоселективный электрод на основе
рассмотренных анионообменников (см. с. 161) селективен
к данному иону только в присутстрии тех анионов, которые
находятся в ряду правее его. Величина энергии гидратации
определяет также ряд селективности для электродов с функциями
одновалентных катионов:
R+>Cs+>Rb+>K+>Na+>Li+,
где R+ — катион органического основания, например ацетил-
холина или тетраалкиламмония.
Плодотворным для изменения селективности оказалось
варьирование растворителя в органической фазе мембраны.
Например, электрод с мембраной, содержащей- кальциевую соль
диалкилфосфорной кислоты, растворенную в диоктилфенилфос-
фате, селективен к ионам кальция в присутствии ионов магния,
а при растворении того же катионообменника в деканоле
получается электрод, реагирующий на сумму ионов кальция и
магния, услешно, кстати, применяемый для определения
жесткости воды.
Но самым удачным стало использование в качестве
специфически сольватирующих веществ так называемых
нейтральных переносчиков, или мембраноактивных комплексонов,
которые обеспечивают высокую селективность мембранам, не
содержащим ионообменника. Впервые такой комплексон—вали-
номицин — в качестве электродноактивного вещества для ИСЭ
с калиевой функцией применил швейцарский ученый В. Симон
с сотр. в 1967 г. Эта работа ознаменовала новый этап в
развитии ионометрии.
Мембраноактивные комплексоны могут быть как
природного, так и искусственного происхождения. Они представляют
собой крупные органические молекулы, содержащие полярные
группы, способные «сольватирова?ь» определенного размера
ионы. Таким мембраноактивным комплексоном является и ва-
линомицин (Val). Валиномицин — макроциклическое
соединение, размер внутренней полости которого хорошо соответствует
152
размеру иона калия. На границе с водным раствором
образуется комплекс валиномицина с ионом калия, который попадает
внутрь «короны» из атомов кислорода (см. рис. 2 на с. 186),
при этом снаружи оказываются неполярные углеводородные
группы. Комплекс [KVal] + легко переходит от границы сводным
раствором в глубь органической фазы мембраны. Валиномици-
новый электрод характеризуется высокой селективностью
к ионам калия по сравнению с ионами натрия, /Ск/ка = 10~\
т. е. электрод селективно реагирует на кал,«й в присутствии
более чем 1000-кратного избытка ионов Na+, а также других
катионов (Са2+, Mg2+, Li+). Это привело к тому, что калиевые
электроды на основе валиномицина широко используются в
различных областях науки и народного хозяйства, так как пара
К+—Na+ встречается очень часто и в живых организмах, и в
воде океанов, и в почвах и т. д.
Известны природные и созданные в химических
лабораториях соединения, обладающие избирательностью к другим
катионам, например к катионам щелочноземельных металлов,
к катиону аммония и т. д. Но прежде чем синтезировать такие
соединения, с помощью квантовой химии и
электронно-вычислительных машин рассчитывают необходимые размеры и
свойства внутренней полости макроцикла. Вслед за швейцарской
школой во главе с Симоном и Морфом в разработку этого
интереснейшего направления ионометрии вносят большой вклад
и советские ученые, в том числе ученые химического
факультета ЛГУ.
Что касается анионов, то для них высокоселективных
макроциклов пока не найдено. Однако некоторые успехи в последа
ние годы есть и здесь. В частности, подбирают специфические
растворители, способные селективно сольватировать некоторые
из анионов, образуя тоже своего рода комплексы. Работы этого
направления позволили* повысить селективность электродов
с функциями анионов слабых кислот. Эти анионы являются
льюисовскими основаниями, т. е. они могут вступать в донор-
но-акцепторную связь в качестве доноров электронов. При
внесении в электродную мембрану льюисовских кислот, например
производных трифторацетофенонового ряда, увеличивается
селективность электрода к основным анионам, т. е. к анионам
слабых кислот (например, к СО2-, НСО^~, НРО^ОАс и
другим низкомолекулярным анионам органических кислот) в
присутствии анионов сильных кислот, таких, как СЮ^", N0^
и др., т. е. изменяется «гидратационный» ряд селективности,
приведенный выше.
Изменение состава жидкой мембраны позволяет очень тонко
дифференцировать ее селективность, что делает исследования
в этой области и увлекательными, и полезными.
153
ГАЗОВЫЕ ЭЛЕКТРОДЫ
Особое место среди ИСЭ занимают газовые и ферментные
электроды. Газовые электроды по сути уже не просто ИСЭ,
а целые гальванические элементы, с помощью которых
возможно определять концентрацию газов в воздухе и в растворе. Но
возможно ли с помощью ИСЭ определять концентрацию
нейтрального вещества? Ведь ИСЭ — это прибор для определения
активности ионов, т. е. заряженных частиц, при чем же здесь
газы? Дело в том, что газы можно перевести в ионизированную
форму, используя промежуточную химическую реакцию, чаще
всего реакцию гидролиза, в которую вступает газ при
растворении в воде. Например,
NH3 + H2O^NH+ + ОН".
И тогда можно найти концентрацию исходного аммиака #ли
по активности ионов аммония, или по активности ионов гидро-
ксила. Для определения активности ионов ОН~ применяют
хорошо известный стеклянный электрод с водородной функцией
и высокой чувствительностью.
В газовом электроде (рис. 6) имеются два вспомогательных
электрода: (внутренний 1 и внешний 2) и стеклянный
водородный электрод 3. Газопроницаемая гидрофобная мембрана 5 не
дает выливаться раствору 4, в который диффундирует газ, из
внутренней камеры электрода, и не пропускает заряженные
частицы, она проницаема только для газов. Варьируя размеры
пор мембраны, можно получить некоторую селективность к
газам с различной величиной молекул. Во внутренний раствор 4У
в котором находится чувствительная стеклянная мембрана
водородного электрода, вводят посторонний электролит для
создания постоянной ионной силы и небольшое количество
электролита с одноименным с-газом ионом (в случае
аммиака, например, — NH4C1). Это приводит
к повышению чувствительности электрода и
стабильности его потенциала. Потенциал газового
электрода линейно зависит от логарифма
давления газа — так для аммиака £'=£0+'e,lgPNH3,
поэтому для калибровки электродов используют
газ под различным давлением.
Газовыми электродами можно определять,
например, давление растворенного С02 в крови
и в других биологических жидкостях.
Ассортимент электродов, чувствительных к газам, уже
сейчас.достаточно широк, это электроды на NH3,
С02, N02, H2S, HCN, HF, CH3COOH, Cl2,
Br2, Ь.
Справедливости ради заметим, что большое
распространение получили также газовые элект-
Рис.б
*54
роды, основанные на амперометрическом датчике, регистрирую*
щем изменение электрического тока в цепи, а не потенциала.
Например, так устроен известный кислородный электрод
Кларка. Но описание амперометрических систем не входит в тему
нашего рассказа.
ФЕРМЕНТНЫЕ ЭЛЕКТРОДЫ
Если искусственные мембраны можно рассматривать как
подражание естественным, природным, то мембраны
ферментных электродов в значительной мере заимствованы у природы.
Ферменты — это катализаторы-белки, вырабатываемые живыми
организмами, с их помощью в организме на клеточном уровне
происходят всевозможные биохимические реакции. В каждом
ферменте имеется активный центр, способный
катализировать вполне определенный тип реакции.
Вещество, подвергаемое реакции, называется
субстратом. Удивительная особенность ферментов
заключается в их высокой специфичности.
Существуют ферменты,, катализирующие реакцию с
определенным типом субстрата, например оксидаза
L-аминокислот катализирует только реакцию
окисления аминокислот. Но есть ферменты,
катализирующие реакцию только с одним веществом: уреаза
катализирует реакцию гидролиза мочевины, ури-
каза — разложение мочевой кислоты, лактатдегид-
рогеназа — дегидрирование молочной кислоты и
т. д. Эта исключительная селективность ферментов
особенно интересна для ионометристов.
Принцип устройства ферментного электрода
(рис. 7) прост: слой фермента 2 нанесен на
чувствительную мембрану ионоселективного
электрода / (в данном случае — стеклянного электрода).
Если ферментом, нанесенным на электрод, является глюкозоок-
сидаза, то мы имеем дело с селективным электродом для
определения глюкозы. При погружении такого электрода в раствор,
в котором содержится глюкоза, в слое фермента будет идти
следующая реакция:
глюкоза + Н20 + О2глюкозооксидаз-?глкжоновая к-та + Н202.
Появление глюконовой кислоты вызовет изменение рН в при-
электродном слое фермента, которое зафиксирует стеклянный
водородный электрод. Эта реакция окисления строго
специфична: глюкозооксидаза катализирует только реакцию окисления
глюкозы, а никакого другого сахарида и вообще никакого
другого вещества. Это ли не путь к электроду с идеальной
селективностью? Более того, ферментный электрод позволяет потен-
циометрическим методом определить активность вещества
(субстрата), которое не несет заряда. Таким образом, возможности
155
ионометрии значительно расширяются с появлением
ферментных электродов.
Разумеется, на практике все несколько сложнее. Сначала
фермент следует выделить из живого организма, закрепить его
на мембране электрода (этот процесс называется
иммобилизацией) и при измерениях этим электродом создавать ферменту
привычные для работы условия, такие, как в ж|ивой клетке:
оптимальные температуру (как правило, не выше 40°С),
ионную силу и рН. Иначе фермент потеряет свою активность. Эту
сложную проблему решают не только усовершенствованием
технологии производства ферментов, но и более оригинальным
способом. На мембрану подходящего ИСЭ предложили
наносить живые клетки, содержащие нужный фермент. Уже
известны ферментные электроды со слоем живых бактерий на
мембране или, например, с кусочком тыквы. При этом электрод
работает довольно успешно, и исключаются трудоемкие
операции по выделению и очистке фермента.
О КОНСТРУКЦИЯХ ИСЭ
Разнообразие ионоселективных электродов состоит не
только в большом количестве ионов, активность которых можно
определить с их помощью, но и в разнообразии конструкции
электродов даже для определения одного и того же иона.
Например, для определения активности ионов калия в почве, в
глубине моря, в крови оперируемого или в клеточной жидкости
нужны различные конструкции калиевого ИСЭ. Для двух
первых существенны прочность мембраны, способность
выдерживать большие наружные давления на большой глубине в море
и защищать от подземных животных, червей и насекомых
в почве. Для этих целей в мембрану вводят прочный каркас.
Чтобы измерить рК в крови, прочность не самое главное,
а главным становится создание электродов малых
размеров. Сейчас ведутся работы по выполнению
электродов в виде узкого катетера, который можно
ьвести даже в вену человека. В случае же
биохимических измерений в клетке требуется даже не
катетер, а микроэлектрод, с помощью которого
внутри клетки измеряют активность ионов Н+, К+,
Na+, Cl~, Са2+ и др. Кончик такого микрокатетера
имеет диаметр 0,5—1 микрометр. На рис. 8
схематически изображен такой микроэлектрод, его
корпус выполнен из закаленного стекла, жидкая
мембрана 3 находится в кончике — игле, во
внутренний водный раствор 2 погружен внутренний
вспомогательный электрод /.
При создании миниатюрных электродов очень
эффективным оказалось осуществление твердого
156
v
контакта между ионоселективной мембраной и токоотводом
электрода. Этим исключается внутренний раствор в ИСЭ,
а значит, такие электроды можно применять в любом
положении, даже «вверх ногами» и в условиях невесомости, они не
боятся встряхиваний и их потенциалы не зависят от состава
внутреннего раствора.
Новым направлением в ионометрии является разработка
ионоселективных полевых транзисторов (ИСПТ), в которых
контакт между ионоселективной мембраной и токоотводом
осуществляется через полупроводник. В случае твердого контакта
в ИСЭ самое основное — это обеспечить обратимый переход от
ионной проводимости мембраны к электронной проводимости
токоотвода. Проще всего такой переход реализуется в
электродах с твердыми мембранами на основе солей серебра, которые
обладают одновременно и ионной, и электронной
проводимостью.
ПРИ ЧЕМ ЖЕ ЗДЕСЬ СЕНСОРЫ!
Сенсорами называют органы чувств (от латинского senso-
rium — орган чувств). Это природные анализаторы,
позволяющие человеку и животным ориентироваться в окружающей
среде. Органы чувств выполняют две функции: они
воспринимают внешнее раздражение и передают информацию в
центральную нервную систему. Чувствительными элементами,
обеспечивающими работу органов вкуса и обоняния, являются
особые рецепторные клетки. Это так называемые хеморецепторы,
чувствительные к химическому составу среды и часто высоко
селективные к отдельным химическим соединениям. Очевидная
аналогия в принципе действия природных анализаторов и ИСЭ
привела в зарубежной литературе к употреблению термина
«сенсор» вместо ИСЭ, в особенности для ферментных
электродов, которые называют бирсенсорами.
Сравнивая возможности ИСЭ с естественными сенсорами,
можно заметить, что ионометрия кое в чем догоняет и даже
перегоняет естественные анализаторы. Так, человек может
определить на вкус не менее 0,001 моль/л кислоты, т. е. раствор,
имеющий рН 3, а водородный стеклянный электрод позволяет
различать всю гамму перехода от кислых к щелочным
растворам (изменение рН от 1 до 14). Чуткий нос собаки ощущает
наличие масляной кислоты при концентрации 10 000 молекул
в 1 см3 воздуха, а поликристаллическая мембрана серебряного
электрода реагирует на присутствие нескольких ионов серебра
в 1 см3 раствора. Такая высокая чувствительность ИСЭ пока
редкость, но как метод анализа применение ионоселективных
электродов обладает большими достоинствами.
Процесс проведения анализа с ИСЭ чрезвычайно прост.
ИСЭ с функцией определенного иона (конечно, предварительно
157
прокалиброванный в стандартных растворах) и электрод
сравнения опускают в исследуемый раствор и подключают к ионо-
меру. Через минуту (иногда через несколько минут) стрелка
на шкале иономера покажет значение активности
определяемого иона X, выраженной в логарифмических единицах рХ.
Экспрессность этого метода анализа, простота и малая
трудоемкость измерений, отсутствие разрушающих воздействий на
исследуемый образец являются большими преимуществами
перед другими методами анализа. Хроме того, возможна
непрерывная запись показаний, т. е. метод легко автоматизируется.
Приборы для ионометрических измерений небольшие и легкие,
что позволяет использовать их в любых условиях. Для
исследуемого образца, как правило, не требуется никакой
предварительной подготовки, измерения возможны непосредственно
в исследуемой среде, будь то океан, почва, живой организм или
отдельная клетка. Все эти качества способствуют широкому
распространению ИСЭ во многих областях науки и
производства. Сейчас известны ИСЭ, с помощью которых удается
определить большинство элементов периодической системы. Как
утверждает Камман, известный специалист по ионометрии, для
каждого иона имеется оптимальный способ анализа. Найти
его — прямая задача ионометрии.
АНАЛИЗ, АНАЛИТИКА,
МЕТРОЛОГИЯ И ПОЭТИКА
Все подвергай анализу.
Юстус Либих
«АНАЛИЗ—... РАЗЛОЖЕНИЕ ВЕЩЕСТВА НА СТИХИИ,
НА НАЧАЛА ЕГО»
одившись в недрах классической древнегреческой
философии более 2000 лет назад, понятие «анализ»
прочно вошло в обиход естественных и
гуманитарных наук, логики, философии, искусства и политики,
т. е. стало общенаучным термином. Оно
определяется так: анализ — процесс расчленения, мысленного или
фактического разложения целостного объекта на составные части, их
последующее сопоставление и сравнение по тем или иным
признакам. Цель анализа — познание частей как элементов целого.
На языке теории систем анализ можно определить как
операцию, проводимую „над аналитической (т. е. анализируемой)
системой, целью которой являются выделение и
идентификация ее структурных элементов и установление соотношений
между ними, а также между слагающими ее подсистемами.
Это определение в свою очередь содержит термины и понятия,
которые нуждаются в пояснении.
Под системой следует понимать любой объект, имеющий
структуру, т. е. состоящий из структурных элементов
различной природы, связанных между собой отношениями
определенного рода. Аналитическая система может включать в себя ряд
подсистем, которые, с одной стороны, выступают как
структурные элементы системы, а с другой — заключают в себе другие,
«нижележащие» элементы, или единицы более глубоких
уровней структурной организации. Это означает, что анализ
представляет собой многоуровневую операцию (может быть
проведен на разных уровнях), где выделению и сопоставлению
подлежат структурные элементы разной степени сложности.
Аналитическими системами могут быть 1) образец горной
породы — как объект химического анализа; 2)
электрокардиограмма— как объект кардиологического анализа; 3)
стихотворное произведение — как объект стиховедческого анализа;
159
4) сводка данных о возрастном и национальном составе
населения некоторой области — как объект демографического
анализа и т. д.
В роли подсистем в приведенных примерах выступают:
1) отдельные минералы, составляющие самостоятельные
кристаллические фазы в образцах горной породы (химический
анализ горных пород); 2) характерные участки на кардиограмме,
соответствующие работе того и другого желудочка или
предсердия (кардиологический анализ); 3) отдельные стихи,
строфы или строки поэтического произведения (стиховедческий
анализ); 4) отдельные национальные или возрастные группы
(демографический анализ).
Структурными элементами, подлежащими различению,
сравнению или пересчету, являются: 1) элементы или оксиды
элементов,—в химическом анализе; 2) точки перегиба и
огибающие профили на кардиограмме — в кардиологическом анализе;
3) стихотворные слоги или стопы1 — в стиховедческом
анализе; 4) лица разной национальности и разных возрастных
групп — в демографическом анализе.
Установление соотношения между элементами
(подсистемами) может носить характер однозначного выбора по схеме
«есть — нет». Такой подход лежит в основе идентификации:
присутствует или не присутствует минерал рутил — Ti02 в
составе данной породы;Усйндром WPW — на кардиограмме,
дактиль— в данном стихотворении Н. А. Некрасова, индейский
этнический элемент — в современном этническом составе
населения Калифорнии. Идентификация, однозначный выбор
в соответствии со схемой «есть — нет», эквивалентна
проведению качественного анализа аналитической системы.
Другое соотношение, устанавливаемое в ходе анализа,—
это соотношение «больше — меньше». Оно предполагает
сравнительную оценку свойств или качеств одного элемента по
отношению к другим и представляет собой пример
сравнительного анализа. Так, например, при анализе метеорологических
данных можно заключить, что сентябрь этого года был самым
холодным за последние десять лет.
Количественный анализ предполагает измерение
содержания данного элемента и установление отношения его
содержания к общему содержанию всех элементов, составляющих
данную систему и относящихся к одному уровню структурной
организации. Количественный анализ имеет отчетливо выражен-
1 В русском силлабо-тоническом стихе — группа слогов, состоящая из
одного ударного и одного или нескольких безударных, повторение которых
определяет размер стиха. По количеству слогов стопы делятся на дву-, трех-
и четырехсложные. Двусложные стопы — хореическая... и ямбическая...,
трехсложные— дактилическая..., амфибрахическая... и анапестическая. (Словарь
литературоведческих терминов. М., 1974, с. 386.)
160
ный метрологический характер (метрология — наука о мерах
и методах точных измерений). ""
Кроме того, учитывая уровень структурной организации
объектов материального мира (ядерный
(нуклеарный)—атомарный — молекулярный — надмолекулярный), можно
выделить еще одну специфическую аналитическую задачу — задачу
последовательного анализа, которая решает вопрос о
последовательности соединения отдельных элементов структуры между
собой, например о последовательности сочетания отдельных
аминокислотных остатков в полипептидных цепях белковых
молекул.
Другой пример. Анализ ритмической организации
стихотворного произведения, заключающийся в определении
последовательности ударных и безударных слогов, сочетанием которых
образуются стопы и соответствующие стихотворные размеры.
Например, в некрасовской строке «Плакала Маша, как лес
вырубали» метрическая схема выглядит так: —ww|—wu[
—\jkj | — w (здесь черта означает ударный слог, знак w —
безударный слог, вертикальная черта разделяет стопы). Эта
строка состоит из трех дактилических и одной конечной
хореической стоп, ударения падают на первый, четвертый, седьмой
и десятый слоги.
Особым видом анализа является классификационный
анализ. Он предполагает разбиение аналитической системы на
отдельные классы, группы, отряды — на таксоны, как их принята
называть у биологов. Таксоны — единицы классификации, не
пересекающие друг друга, т. е. составные элементы каждого
таксона входят только в этот таксон, но, с другой стороны,
таксоны более высокой степени классификации включают все
таксоны низшей степени. | Так, все множество живых организмов
образует огромное число видов, виды объединены в роды,
роды— в семейства, семейства — в отряды, отряды — в^ классы
и т.^д^ ^Элементы периодической""системы Д. И. Менделеева
объединены в подгруппы, подгруппы — в группы, группы —
в систему. Особенность периодической системы состоит в «дву-
мерности» классификации, которая дает возможность
сопоставлять свойства элементов как по вертикали (по группам), так
и по горизонтали (в периодах).
АНАЛИТИЧЕСКАЯ ХИМИЯ И АНАЛИТИКА
Приведенные примеры демонстрируют общность и
однотипность задач, возникающих при анализе объектов различной
природы, и позволяют заключить, что наука аналитика
(термин «аналитика» впервые был употреблен еще Аристотелем)
имеет право на существование. Однако содержание э.того
термина далеко от того смысла, который придают ему немецкие
авторы в книгах «Analytikum» (Руководство по аналитической
б 779
161
химии/Под ред. Ю. А. Клячко. М., 1975) и «Аналитика» (авт.
К. Данцер, Э. Тан и Д. Мольх. М., 1981). Авторы полагают,
что усложнение задач аналитической химии, переход от
анализа стабильных объектов к анализу динамических
(изменяющихся ^до^времени) систем, переход от анализа среднего
химического состава пробы к послойному анализу или локальному
анализу в плоскости образца равносильны переходу от
аналитической химии к новой науке — Аналитике. С их точки зрения,
здалитика — более общая по сравнению с аналитической
химией наука, поскольку измерение аналитического сигнала
(физическое свойство, пропорциональное массе анализируемого
компонента) проводится в отличие от классической
аналитической химии в системе не двух, а трех координат, где третьей
координатой является время (динамическая аналитика) или
пространственная координата (локально-распределительная
аналитика).
Мы, в полном согласии с мнением академика И. П. Алима-
рина *, считаем, что сущностей конечная.цель, химического ана-
лизз^^-Определение "и измерение химического состава
вещества— остаются неизменными, и переходить от твердо
установленного понятия «аналитическая химия» к новому понятию
«аналитика» нет никаких оснований. Вместе с тем,
по-видимому, „анадитика^ имеет право на существование именно как наука
об общих задачах" ~и методах "проведения анализа
безотносительно к конкретной природе анализируемых систем. Для
иллюстрации этого положения сформулируем три типовые задачи
качественного анализа.
1. Содержится ли элемент X (ртуть — в сточной воде, вирус
гепатита — в биосубстрате, нулевая группа крови — в данной
популяции) в анализируемой системе?
2. Какой из элементов: а, р, .♦., о содержится в
анализируемой системе? ртуть, кадмий, ..., мышьяк определяет токсические
свойства материала? радий, стронций-90, ..., калий-40
обусловливает повышенную радиоактивность почвы? Какой из
вирусов: Л, В, С, ... является причиной массовой инфекции?
3. Какие из элементов: Л, В, С, ..., Z содержатся в
анализируемой системе (химические элементы — в горной породе,
бактерии — в биосубстрате, размеры — в поэме)?
Так как эти задачи являются общими, то они могут быть
сформулированы в терминах теории множеств и теории
информации. Нетрудно показать, что решение задачи первого типа
равносильно получению одного бита информации2, второго
типа— получению числа битов, равного log2^ третьего — п битов,
1 Алимарин И. П. Современное представление о науке
«аналитическая химия». — Журн. аналит. химии, 1983, т. 38, № 3.
2 Бит — единица количества информации в двоичной системе счисления,
получаемой при выборе одного из двух равновероятных состояний.
162
где п — число элементов в аналитической системе. Оставляя
в стороне вопрос о строгом применении этих разделов
математики, отметим, что решение рассмотренных типовых задач
основывается на идентификации (установлении тождественности)
элементов анализируемого множества стандартным, или
эталонным, множествам элементов. Один из способов
идентификаций— пересечение разнородного анализируемого множества
{Л, Л..., В, В..., С, С..., Z, Z...}, состоящего из подмножеств-
{Л, ;4...}...{Z, Z...}, однородным множеством {R, /?, ..., /?},
элементы которого однозначно соответствуют элементам
идентифицируемого подмножества {С, С...С}, причем подмножество
{CR, CRy ...,С7?} обладает характеристическими свойствами,,
допускающими его однозначную идентификацию. Этот прием
избирательного сочетания элементов одного сорта со
специфическим «реагентом» широко используется в химическом,
бактериологическом, гистологическом, гематологическом анализе.
Так, например, если в ходе качественного химического
анализа при действии на анализируемый раствор серной кислоты
выпадает осадок, можно предполагать наличие в нем хотя бы
одного из катионов — Са2+, Sr2+, Ba2+ или РЬ2+. Если после
переведения осадка сульфатов в карбонаты, их последующего
растворения в уксусной кислоте и прибавления раствора НС1
вновь выпадает осадок, можно с большой надежностью
считать, что исходный раствор содержал ионы свинца. Таким об-
разом, схема качественного обнаружения свинца
{К+, Na+, Mg2+, ... , Са2+, Sr2-, Ва2+, Pb2-, ... , Fe3+,
Ai3+, Cr3+, Bi3+, ...)n(H,S04) = ((Ca, Sr, Ba, Pb)S04}J->
^°4((Ca, Sr, Ba, Pb)C03W^^MCa2+, Sr2^
Ba2+, Pb2+)n(HCI)==PbCi2j
состоит из двух пересечений (знак [\ ) и двух отображений
(знак ->) множества анализируемых частиц на эквивалентные
множества продуктов их взаимодействия с реагентами (ИагСОз
и СНзСООН).
Другой способ проведения качественного анализа состоит
в вычитании множеств: из множества элементов, обладающих
свойством Л, вычитается множество элементов, обладающих
свойством В. Пусть, например, качественный анализ анионов
показал присутствие окислителя, но раствор не окрашен.
Следовательно, круг возможных анионов может быть заметно сужен:
{МпОГ, Cr,02-, Fe(CN)*-, N03", N0~} -
окислители
-{МпОГ, CrX>2-, Fe(CN)3-, Fe(CN)«-} = {NOjt, N02"),
окрашены окислители,
но не окрашены
163
Следует заметить, что отрицательные тесты в качественном
анализе обладают большой информативностью, так как
отрицательный ответ сразу существенно сужает круг подлежащих
обнаружению элементов.
Задачей количественного анализа в рамках аналитики как
единого подхода является определение (уместно употребить
также термин «измерение») количества или доли структурных
■единиц (элементов данного сорта) от их общего числа. В
терминах теории множеств количественный анализ — это
разбиение неупорядоченного множества на однородные
непересекающиеся подмножества. Результат количественногб анализа
выражается в форме: процент калия в золе; количество
лейкоцитов в 1 микролитре крови^) количество двусложных стоп с
пропущенным ударением ""(пиррихиев) в первой песне поэмы
А. С. Пушкина «Полтава». :' Полный количественный анализ
предполагает оценку количества всех элементов, составляющих
анализируемую систему.
В принципе, подразделение анализа на качественный и
количественный условно и оправдано лишь относительным
несовершенством методов анализа. Рассмотрим два примера из
области химического анализа. Пусть перед нами стоит задача
провести качественный анализ морской воды. Очевидно, без
особого труда в образце морской воды мы обнаружим ионы
С1-, Na+, SO|-, Mg2+, Са2+, K+> НС03-, (COJ-). Более
тщательный и кропотливый анализ позволит также обнаружить
ионы железа, алюминия, марганца, фосфатные ионы, ионы
Br-, F~, I~, NH+, борную и кремниевую кислоты.
Специальными высокочувствительными методами с применением
приемов предварительного обогащения удастся обнаружить в
морской воде еще целый ряд элементов: стронций, цинк, литий,
барий, медь, хром, титан, олово, свинец и даже следы серебра
и золота. По-видимому, не будет преувеличением сказать, что
в морской воде содержится большая часть элементов
периодической системы, но одни из них в больших, другие — в меньших,
третьи — в исчезающе малых количествах» Поэтому постановка
задачи качественного химического анализа безотносительно
к количественным критериям теряет свой смысл. Логически
более правильна постановка другой задачи: какие элементы
содержатся в морской воде в количествах, не меньших 0,05%,
или, скажем, какие элементы содержатся в морской воде в
количествах, превышающих 10~4%?
Другой пример. В ходе количественного определения
окрашенного соединения будем последовательно разбавлять раствор
в два раза. Рано или поздно наступит такой момент, когда мы
не только не сможем с достаточной надежностью оценить хотя
бы приблизительно количество определяемого вещества, но
и потеряем возможность уверенно отличить видимый результат
164
анализа от результата, полученного при анализе «холостой»
(заведомо не содержащей определяемого компонента) пробы.
Количественная оценка содержания компонента перейдет в
разряд качественных оценок, поскольку перед нами встанет вопрос,
содержится или нет определяемое вещество в анализируемом
образце: да или нет, есть или нет.
«НАУКА НАЧИНАЕТСЯ С ИЗМЕРЕНИЯ»
Приведенные примеры свидетельствуют о том, что
химический анализ представляет собой осрбую метрологическую
операцию, в которой качественная и количественная стороны ¥ы-
ступают в нераздельном единстве. Своеобразие количественного
анализа как метрологической процедуры состоит в том, что
измерению подлежит количество или число (количество атомов
или ионов — в химическом, количество бактерий — в
бактериологическом, число мужчин определенных возрастных групп —
в демографическом анализе). Когда это число не слишком
велико, ,как, например, число строк в стихотворной поэме,
написанных данным размером, исчисление можно провести путем
«поштучного перебора». Но если исчислению подлежит
'количество ядер, ионов, атомов или молекул данного сорта в
реальных ^ объектах, поштучный перебор невозможен. В таких
ситуациях прибегают к измерению какого-либо экстенсивного
свойства.1
В химическом анализе реальным воплощением
экстенсивного свойства является аналитический сигнал, который
проходит через максимум или'точку перегиба при
характеристических значениях интенсивного параметра или параметра
развертки аналитического сигнала. Примерами экстенсивных
(пропорциональных массе и в конечном счете — числу определяемых
частиц) величин в химическом анализе могут служить
интенсивность излучения (эмиссионный спектральный анализ,
люминесцентный анализ), расход титранта (титриметрические методы
анализа), масса осадка (гравиметрия — весовой анализ), сила
тока (полярографические методы анализа). В качестве
интенсивного параметра могут выступать частота излучения поглощаемого
или излучаемого света (оптические методы анализа), период
полураспада (радиометрические методы), потенциал
(полярография и амперометрия). Характеристические значения
интенсивного параметра определяются индивидуальной качественной
природой компонентов анализируемой системы, а координаты
точки максимума или перегиба на двумерной диаграмме раз-
1Эксхед£ивньш. называется такое свойство, величина которого
пропорциональна массе или концентрации. Напротив, интенсивные свойства —
такие свойства, которые не зависят от массы и характеризуют как бы меру
энергетической напряженности процесса.
165
вертки аналитического сигнала содержат информацию о
качественной и количественной характеристиках анализируемого
объекта. Таким образом, аналитический сигнал представляет
собой зримый геометрическим оораз диалектического единству
качества и количества в приложении к определению химиче-
ского состава.
На рис 1 изображен инфракрасный спектр диметилфталата.
(Штрихи па нижней оси в области максимумов поглощения
отвечают характеристическим частотам колебаний отдельных
групп.) Рис. 2 иллюстрирует типичные данные
полярографического анализа — полярограмму восстановления ионов РЬ2^
и Си2+ на ртутном капающем катоде. Характеристическим зна-
часкэта,сх1
то 1600 то kjp
ВДСОК© @CH3 C0OR @*
Рис.1
Рис?
чениям потенциалов полуволны <р, и <pVi соответствуют
предельные диффузионные токи Г и Г РЬ2+ и Си2+,
пропорциональные концентрациям этих ионов в растворе.
^Аналитический сигнал — величина, подлежащая измерению
в ходе химического анализа, обладает рядом специфических
особенностей в отличие от таких традиционных для
метрологии величин, как, например, длина, масса или время.
Во-первых, аналитический сигнал представляет-собой много-
кратно опосредованную величину, связанную с концентрацией
или содержанием определяемого компонента цепочкой
превращений, или, если воспользоваться языком теории множеств,
отображений. Например, при определении содержания
элементов методом эмиссионного спектрального анализа имеет место
следующая последовательность превращений, часть из которых
протекает нераздельно во времени или пространстве. Проба,
помещенная в канал угольного электрода, испаряется, атомы
166
/
А
Ч^У—
г
z, <
а
л
1 J
L]A
/
V
X
?г
элементов переходят в возбужденное состояние, испускают
характеристическое электромагнитное излучение, которое
проходит через щель спектрографа, расщепляется призмой или
дифракционной решеткой и засвечивает отдельные
характеристические линии на фотопластинке. При проявлении и
фиксировании происходят химические процессы восстановления серебра
в светочувствительном слое и комплексообразования ионов
серебра в фиксирующем растворе. Высушенная пластинка
содержит спектр, состоящий из отдельных более или менее темных
линий, плотность
почернения которых можно
измерить на специальном
приборе —
микрофотометре. Именно плотцрсть
почернения и является
аналитическим сигналом
в эмиссионном
спектральном анализе с
фотографической регистрацией
спектра и может служить
мерой концентрации
определяемых элементов.
Саму концентрацию
находят с помощью градуи-
ровонных графиков,
предварительно построенных
для ряда стандартных
образцов. Рассмотренный
пример свидетельствует о
том, что образованию
аналитического сигнала
предшествует целый ряд
превращений, или
отображений: множества
атомов на множество
квантов
электромагнитного излучения, множества
квантов на множество скрытых центров изображения и т. д.
Путь от анализируемой пробы до ее метрологического образа
долог и тернист.
t^gTOfibix*, аналитические сигналы различных компонентов
аналитической системы не индифферентны по отношению друг
к другу. Они взаимно накладываются, гасят или усиливают
друг друга, т. е. как бы интерферируют,^ традиционной
метрологии измерения однородных величин взаимно независимы.
Пусть, например, X — длина, Y—ширина, a Z — высота
параллелепипеда (рис. 3, а). Тогда его высота не зависит от точки,
в которой она измерена, иными словами 1Ф^(Х)Ф(р(У). В хи-
Рис 3
167
мическом анализе аналитические сигналы, а следовательно,
и соответствующие им измеряемые концентрации определяемых
компонентов — взаимно зависимые величину;. Например, если
% = Cuov) , Y = Czr> Z—Cju-'- концентрации урана (IV),
циркония и тория, определяемые фотометрически с реагентом ар-
сеназо III, тогда каждый из сигналов X, Y или Z зависит от
аналитических сигналов других элементов (рис. 3, б), т. е.
Z=f{X)=q>(Y)9 в частности ZX(XU Y^)фZ2(X2y Y2).
Другое принципиальное отличие аналитических сигналов от
традиционных метрологических величин и измерений состоит
в том, что количественный анализ допускает получение разных
аналитических сигналов от одного объекта. Иначе говоря,
анализ можно проводить на разных уровнях, где идентификации
и исчислению подлежат структурные элементы разной степени
Рис *♦
сложности. Многоуровневый характер количественного анализа
предопределен наличием последовательно усложняющихся
уровней строения материи, на каждом из которых можно
провести идентификацию и количественное определение. Так,, при
исследовании живой материи можно выделить уровни
элементарных частиц, атомов, молекул, молекулярных комплексов,
макромолекул и биополимеров, субклеточный, клеточный уровни
и т. д.
Например, при анализе вещества белковой природы можно
поставить задачу определения элементарного состава.
Результат такого анализа выражается в процентном содержании
элементов-органогенов — углерода, водорода, кислорода, азота
и серы. Для белков различной природы элементный состав
колеблется в узких пределах: С — от 50 до 55%, Н — от 6,5 до
7,3%, О —от 21 до 24%, N —от 15 до 18%, S —от 0 до 2,4%.
Но можно поставить и другую задачу: определение
аминокислотного состава белковой молекулы, скажем А-цепи
фермента инсулина (рис. 4), состоящей из 21 аминокислотного
168
остатка, связанных между собой пептидной связью — СО—NH—,
которая образуется при соединении а-аминокислот по схеме
R"
H2N-CH-COJOHTH|NH~CH-COOH -^Н20 +
R"
I
+ H2N-CH-CO-NH-CH-COOH,
I
R'
дипептид
Здесь R' и R" — радикалы, определяющие индивидуальность
отдельных а-аминокислот. Если R = H, то мы имеем дело
с аминоуксусной кислотой, или глицином («гли») (на рис. 4
даны сокращенные названия аминокислот). Радикалу
—СНг—CH(CH3h соответствует аминокислота лейцин («лей»),
радикалу —СН2—SH — цистеин («цис»), радикалу —СН2—
СООН — аспарагин («асп»). Нетрудно подсчитать, что в
составе А-цепи инсулина содержится один остаток глицина,
два — лейцина, четыре — цистеина, два — аспарагина и т. д.
Информация подобного рода равносильна проведению
количественного анализа белкового вещества на уровне
аминокислотного состава.
Определение последовательности, в которой сочетаются
отдельные аминокислотные остатки в полипептидной цепи,—
пример последовательного, или позиционного, анализа. Еще
более сложной задачей является определение «третичной»
структуры полипептидов — формы цепей, обусловленной
сшивкой отдельных аминокислот между собой. Оставляя в стороне
вопрос о том, как проводятся аминокислотный,
последовательный и структурный анализы веществ белковой природы,
отметим лишь, что решение задач подобного рода лежит заведомо за
пределами компетенции традиционной метрологии.
МЕТРОЛОГИЯ И ПОЭТИКА
Для иллюстрации принципиального различия в
метрологическом; и аналитическом описании объекта попробуем взглянуть
глазами метролога и аналитика на один и тот же объект —
роман А. С. Пушкина «Евгений Онегин». В качестве
метрологической характеристики можно избрать параметр L [метр] —
общую длину строк романа, которую легко оценить как
произведение общего числа строк на их среднюю длину М. В
соответствии с изданием 1974 г. L = 312,5 M. Другой, не более ин-
169
формативной метрологической характеристикой могло бы
служить общее число строк или печатных знаков в романе.
В целях стиховедческого анализа рассмотрим начальное
четверостишие и заключительное шестистишие романа:
Мой дядя самых честных правил.
Когда не в шутку занемог,
Он уважать себя заставил
И лучше выдумать не мог.
Блажен, кто праздник жизни рано
Оставил, не допив до дна
Бокала полного вина,
Кто не дочел ее романа
И вдруг умел расстаться с ним,
Как я с Онегиным моим.
Изобразим построчно ритмическую структуру выбранных
строф, используя в соответствии с принятой в стиховедении
системой обозначений знак v^ для безударных, знак — для
ударных слогов, для разграничения стоп используем знак | . Тогда
двусложная стопа, образованная чередованием безударного
и ударного слогов, в котором безударный предшествует
ударному (ямб), запишется как |w—|. Двусложная стопа из двух
безударных слогов (пиррихий) имеет вид |ww|. Ритмическая
структура выбранных строф будет выглядеть так:
V^~ I ^ ~" I ^ ^ I v^ — •
В компактной форме результат стиховедческого анализа
приведенных строф можно записать иначе:
I - 4 {Ж-М-Ж-М}; {5-Я }; П: {2/3; 3/1; 4/3 },
II-6 {Ж-М-М-Ж-М-М}; {5-Я}; П: {3/3; 4/1; 6/3}.
В переводе на язык русской силлабо-тонической системы
стихосложения эта запись содержит следующую информацию:,
первая строфа состоит из 4, вторая — из 6 строк (стихов); обе
строфы написаны двусложным размером, ямбом, точнее
четырехстопным ямбом (еще точнее, неполно-размерным пятистопным
ямбом). Система рифмовки: перекрестная — чередование жен-
170
ских и мужских ] рифм (Ж—М—Ж—М) в первом
четверостишии и сочетание опоясывающей Ж—М—М—Ж рифмовки со
смежной мужских рифм (М—М) в заключительном
шестистишии. Распределение пиррихиев в начальном четверостишии:
третья стопа во второй строке, первая стопа в третьей строке,
третья стопа в четвертой строке. Аналогичным образом можно
проследить распределение строк и стоп с пропуском
метрических ударений в заключительном шестистишии романа.
Более тщательный анализ позволяет обнаружить еще
немало структурных особенностей в гениальном произведении
А. С. Пушкина. Так, для него характерна особая
четырнадцатистрочная строфа с системой рифм типа AbAbCCddEffEggyrjxe
прописные буквы соответствуют женской, а строчные —
мужской рифме. При видимой сложности строфа построена крайне
просто —она содержит комбинацию из всех трех основных
типов рифмовки: АЬАЬ — перекрестная, CCdd — смежная
п EffE— опоясывающая. Четырнадцатистрочная строфа,
состоящая из трех четверостиший и заключительного двустишия,
оказалась удобной для произведения такого жанра, каким
является роман в стихах «Евгений Онегин».
Заканчивая на этом примере обсуждение вопроса^о
соотношении метрологического и янялитицргкрго ттг>гсурп/)р, р^мУтнуг,
что, хотя измерение и вхопит в качргтар тгт^цпй частивана-
лиз, последний являет^ *?рр<жненно. более широким и
разносторонним методом исследования. Что касается химическогб
анализа, то ему принадлежит особая роль, ибо объектами его
исследования являются все тела живой и неживой природы,
включая и космические. Методы анализа могут быть самыми
разными: химическими, например осаждение или титрование;
физико-химическими, например кондуктометрия (измерение
электропроводности) и спектрофотометрия; физическими,
например рентгенофлуоресцентный анализ или ядерный. ^;Рез°-
нансный метод. Цель и основная задача всех методов
безотносительно к их природе — определение химического состава
вещества. Таким образом, эпитет «химический» перед словом
«анализ» означает не способ анализа, а характеризует уровень
рассмотрения состава и структуры веществ — атомный,
молекулярный и надмолекулярный.
* Мужская рифма (М) — если рифмуются концевые ударные слоги,
женская рифма (Ж) — если рифмуется предпоследний ударный вместе с
последним безударным слогом.
ГДЕ КОНЧАЕТСЯ ХИМИЧЕСКИЙ АНАЛИЗ
И НАЧИНАЕТСЯ АНАЛИТИЧЕСКАЯ ХИМИЯ!
Философия мстит за себя задним
числом естествознанию за то, что последнее
покинуло ее.
Ф. Энгельс
Химики-аналитики должны взять
инициативу в свои руки и предложить новый
подход к изучению своего предмета.
У. Ф. Пиккеринг
ОБЛАСТЬ* ПОЗНАНИЯ ИЛИ СФЕРА ОБСЛУЖИВАНИЯ!
ожалуй, ни в одном из разделов химической науки
в последние годы не было столько дискуссий о
целях, задачах и направлениях развития своей области
знаний, как в аналитической химии. / Предложен не
один десяток дефиниций аналитической химии.
Рассматриваются варианты от сугубо прикладного раздела химии
до новой науки «аналитики», поднявшейся на один
классификационный уровень с математикой и физикой по крайней мере
по созвучию названий.^,
Бесплодные cnopTSf всегда утомительны. Да и, в конце
концов, так ли уж важно знать точное определение содержания
науки? Не все ли равно, к прикладным или фундаментальным
разделам науки отнести аналитическую химию? Важен
конкретный результат. И если основной критерий — практика,
а практическая значимость аналитической химии ни у кого не
вызывает сомнения, то, казалось бы, нет повода для дискуссий.
С другой стороны, мы привыкли к главенствующей роли
в семье химических наук неорганической, органической и
физической химии и принимаем как должное, когда от этих
основополагающих наук отпочковываются новые разделы,
стремящиеся подняться на один классификационный уровень со
своими родителями: электрохимия, коллоидная химия, химия
твердого тела, химия высокомолекулярных соединений и т. д.
Перестали удивляться появлению все новых и новых наук на
стыках химии с физикой и биологией, таких, как радиохимия
и радиационная химия, биохимия и химическая физика,
кристаллография и квантовая химия. И только для аналитической
химии трудно найти место в этой иерархической системе.
Корни аналитической химии уходят в предалхимическую
и алхимическую эпоху. Формирование ее как науки относится
к середине XVII в., когда Р. Бойль начал систематически
использовать химические реакции для распознавания веществ. От
172
него до наших дней додшш лакмусовая бумажка и само понятие
«анализ». Прослеживая историю развития химической науки,
один из крупнейших историографов химии М. Джуа приходит
к выводу, что «аналитическая химия,., составляет основу всех^
данных в област?Гхимии». казалось бы, достаточно веские осно^
"вания считать аналитическую химию старейшиной всех
химических наук, а ее методы — стадом китов, на которых держится
химия. Но в то же время, отталкиваясь от тех же
предпосылок, читатель, не столь доброжелательно расположенный к
аналитической химии, может утверждать, что она просто основной
поставщик экспериментальных данных для других разделов
химии, но не более. Для того чтобы таскать каштаны из огня,
нужна или железная воля, или асбестовые рукавицы, большого
интеллекта не требуется.
В чем здесь дело? Почему один и тот же раздел науки
можно одинаково логично поднять до уровня фундаментальных
основ химических знаний и низвести до решения прикладных
задач? Попробуем разобраться в этом.
Содержание науки определяется теми делямл> которые она
преследует; а не методами, которые использует, и не областями
человеческой деятельности, где она лаходит применение. Также
безоговорочно сначала принимаешь тезис о том, что если
химия в целом познает строение веществ и закономерности их
превращений на атомно-молекулярном уровне, то
аналитическая химия ставит своей целью установление качественного
и количественного состава веществ на том же уровне познания.
Но попробуем на* этом моменте остановиться и поразмышлять.
Казалось бы, все просто. Если вы химик-аналитик, то вот вам
вещество и извольте сказать, из каких элементов оно состоит
и сколько каждого содержит. Не плохо бы установить и
структуру химических соединений. И все. На этом роль химика-
аналитика в научном познании исчерпывается. Зачем нужна
знать состав вещества, какие законы природы позволяют его
установить — это в цели аналитической химии не входит. В
своих рассуждениях мы как будто нигде не свернули в сторону со
столбовой дороги логических следствий, а пришли к
малопривлекательным выводам. И хотя такая трактовка основной цели
аналитической химии, как установление состава веществ,
привычна для нас и кажется очевидной, она невольно вызывает
чувство неудовлетворенности.
Определение состава вещества — безусловно, не самоцель,
оно по смыслу подчинено каким-то более общим целям,
поставленным разделами наук или отраслями промышленности,
нуждающимися в аналитической информации. Мы приходим к тому,
что аналитическая химия в самом общем смысле является
инструментом познания, и, следуя законам формальной логики,
мы должны отнести ее к прикладным разделам химической
науки. Может быть, в этом "и нет ничего зазорного, если вопрос
173
о месте аналитической химии в ряду других химических
дисциплин обсуждается в кругу единомышленников. Но сегодня
претензии к аналитической химии со стороны потребителей ее
результатов растут быстрее, чем расширяется арсенал ее
возможностей. Любому химику-экспериментатору, а теперь часто
и физику необходимо знать качественный и количественный
состав объекта исследования и достоверность имеющейся
информации, уметь проследить изменения в составе данного объекта
в процессе эксперимента.
(Химические процессы в любой сфере человеческой
деятельности немыслимы без аналитического контроля. Даже если мы
представим себе идеальный замкнутый химико-технологический
цикл будущего или любой другой технологический процесс,
сопровождающийся протеканием химических реакций, химический
анализ все равно необходим на стадии отработки процесса.
Отсюда и требования к химикам-аналитикам: скорее, точнее,
чувствительнее! автоматизируйте и унифицируйте! вы
сдерживаете дальнейший прогресс! В то же время не часто услышишь,
чтобы успехи, достигнутые в других областях естественных наук
и в промышленности, связывали с достижениями в области
аналитической химии. Стало обычным отношение к
аналитической химии как к одной из составляющих сферы обслуживания.
Как это ни парадоксально, но-учениму-аналитику часто прихо-
Дйтся доказывать, что OHjcojuiera в сфере иоз^ния_о}^ж£к^
1цет мират я не обслуживающий персонал. И делать это
приходится не ради престижных соооражений, а ради дальнейшего
развития аналитической химии как науки.
Наконец, цельлаукнх)др.еделяет„ее содержание.Если цель —
определение химического состава, то аналитическая химия —
«наука о принципах и методах анализа». Мы приходим к
пониманию аналитической химии как простой совокупности
методов. Ее будущее укладывается в рамки кумулятивной модели
развития науки как постепенное расширение арсенала методов
и средств химического анализа. Но если аналитическая химия
является простым объединением методов по признаку
практической направленности, то каждый метод может существовать
и развиваться сам по себе, и вовсе не нужно стремиться к
установлению общности закономерностей и явлений, лежащих
в основе аналитической химии, искать взаимосвязь между ними.
Не является ли некоторая разобщенность между аналитиками,
специализирующимися в различных направлениях
аналитической химии, следствием такого подхода к этой науке в целом?
У нас в стране много блестящих специалистов по отдельным
методам определения, разделения и концентрирования
веществ, но лишь немногие из них поднимаются до уровня
обобщений, критически оценивают возможности различных методов
во всей их совокупности.
174
ДОГОВОРИМСЯ О ЦЕЛИ НАУКИ
Мы пришли к удручающему выводу, что в рамках
общепринятого на сегодня понимания цели аналитической химии
бесполезно доказывать ее право на место в кругу
фундаментальных разделов химической науки. Значит ли это, что нужно
смириться с существующим положением? Здесь необходимо
вспомнить о двойственности в понимании целей науки. Если
отталкиваться от утилитарных потребностей человека, то в рамках
такого подхода логична и цель аналитической химии —
определение химического состава. Но тогда целью астрономии,
умышленно воспользуемся наиболее далекой параллелью, окажется
не познание Вселенной, а использование космической энергии
и материальных ресурсов космоса в практической деятельности
человека. Конечно, тоже не так уж и плохо в плане
максимального удовлетворения материальных потребностей, но не
ради же этого ше|л на костер Джордано Бруно.
Насколько пагубно для фундаментальных разделов наук
сведение их целей к удовлетворению сиюминутных
потребностей, не требует доказательства. Фундаментальные науки
имеют право на общую цель в "рамках естествознания: познание
окружающего нас мира и его законов. Очевидно, что
прикладные аспекты развития естественных наук никогда не должны
выпускаться из виду, но они являются следствием, а не
причиной. Обилие таких прикладных аспектов для аналитической
химии, с одной стороны, не может не радовать — оно
доказывает важность и практическую значимость этой науки, но*
с другой стороны, оно сыграло и негативную роль в ее
формировании,— произошло накопление множества относительно
разрозненных фактов и практических следствий в ущерб развитию*
общих законов их взаимосвязи. ...
Академик Д. И. Блохинцев, говоря о соотношении
фундаментальных и пракладных исследований, отмечал, что
«направленность фундаментальной науки вытекает из важнейшей
особенности Человека как биологического существа: из его
любознательности... Стремление к познанию природы заложено
в глубинах человеческого разума и составляет первую суть
Человека». В чем же дело, — возразит оппонент, — и сегодня
химик-аналитик удовлетворяет свое любопытство, анализируя,,
например, метеоритное вещество или донные отложения из
Марианской впадины. Никаких материальных потребностей. А дело
в том, что для аналитика это любопытство праздное,
выходящее за пределы интересов его науки. Научное любопытство пря
этом удовлетворяет геохимик. Думая о будущем аналитической
химии, необходимо стремиться понять ее собственную цель
в естествознании. Едва ли здесь может быть другое мнение..
Спорить можно о том, в чем состоит эта цель.
175
В философских размышлениях Г. В. Плеханова есть
интересная мысль: «Узнать данную вещь — именно и значит узнать
ее свойства». Если аналитическая химия в прикладном аспекте
стремится к установлению химического состава веществ, то
установление химического состава веществ должно строиться
на фундаменте познания законов проявления таких свойств
вещества, которые бы являлись для него характерными. Отсюда
цель аналитической химии: познание закономерностей
проявления характеристических свойств веществ, являющихся
отражением их химического состава. При этом под химическим
составом будем понимать совокупность индивидуальных веществ,
каждое из которых или вся совокупность обладает своими
характеристическими свойствами. Критерий «индивидуальности»
вещества находится на изотопном, атомарном, молекулярном
или структурно-фазовом уровне. Трансформируя эту мысль
в привычной аналитической терминологии, можно говорить
о характеристических свойствах, присущих определяемым
веществам и объекту анализа.
Характеристические свойства проявляются ядром атома при
радиоактивном распаде, ионом в растворе при образовании
труднорастворимых соединений, молекулой газа при изменении
его теплопроводности. Способность образовывать ионные ассо-
циаты или координационные соединения, переходящие из
водных растворов в органическую фазу, — это тоже
характеристическое свойство, но уже используемое в процессах
разделения.
Волее неожиданными могут показаться представления о
характеристических свойствах объекта анализа, проявляющиеся
в закономерностях формирования его химического состава.
Возьмем пример из волнующих всех нас проблем экологии.
В^связи с бурным развитием атомной энергетики уже никого
не устраивает информация о суммарных выбросах в атмосферу
радиоактивных веществ. Учитывая резко различную
биологическую опасность отдельных радионуклидов, в настоящее время
необходимо определять содержание в выбросах около 60
различных радиоизотопов. И дело здесь не в числе
контролируемых примесей. При современной технике измерений 7_излУче~
ния и средствах обработки информации с использованием ЭВМ
это вполне посильная задача. Проблема лишь в том, что
нормируемые уровни допустимого содержания для многих
радионуклидов лежат в диапазоне К)-'5—10~20 Кюри/л, в то время
как нижний предел обнаружения для у-спектрометрической
аппаратуры составляет 1СН0 Кюри. Традиционный прием
концентрирования в данном случае оказывается малоэффективным.
Судите сами: для надежного определения радионуклидов их
необходимо выделить из 100 000 куб. м воздуха. Конечно,
можно поставить и такой эксперимент. В поисках далеких
трансурановых элементов проводят концентрирование и из больших
176
объемов, причем не газообразных, а жидких сред. Но здесь
речь идет о повседневном рутинном технологическом контроле.
И вот,_пожалуй,^единственный разумный выход—:этоус^щдщ1Т^
закономерности "формирова^ния примесного состава объекта
анализа, выявить в^срдшктивше источники радиоактивных
ДР.Ш£С£Й. А установив характер закономерностей, несложно
создать расчетный метод анализа, где прямое определение всех
радионуклидов производится только в среде, являющейся
источником радиоактивных примесей в газоаэрозольных выбросах.
В выбросах же определяется лишь наиболее легко
обнаруживаемой изотоп-репер.
Подобные проблемы возникают не только в радиоэкологии,
но и в связи с определением в объектах окружающей среды
химически токсичных загрязнений. Таким образом^
параллельно с аналитическими методами, в основе которых лежит
проявление характеристических свойств определяемого вещества,
имеют право на существование и методы, основанные на
характеристических свойствах объекта анализа. В приведенном
примере— это свойство изменять содержание примесей в воздухе
по определенному закону по отношению к их содержанию
в теплоносителе ядерного реактора
Если признать за аналитической химией право на
самостоятельную цель в естествознании и принять предлагаемую
формулировку этой цели, то напрашивается и новое
определение этой науки. Аналитическая химия — это наука о
характеристических свойствах веществ, являющихся отражением их
химического состава.
При таком определении аналитической химии не нужно
специально подчеркивать наличие в ней своих теоретических
разделов. Как любая область естественных наук, она имеет право
на свои теории, обобщения и экспериментально установленные
закономерности, на свою сферу практического приложения.
ЧТО БУДЕТ С ПРИВЫЧНЫМИ ПРЕДСТАВЛЕНИЯМИ,
ЕСЛИ ВЗГЛЯНУТЬ НА НИХ
С НЕПРИВЫЧНОЙ ТОЧКИ ЗРЕНИЯ
Любое новое определение пугает не. само по себе, а теми
последствиями, к которым оно может привести. Что будет
в рамках нового понимания аналитической химии с ее
традиционно-привычной целью — определением химического состава
веществ? Не является ли такая трактовка цели аналитической
химии подтверждением правоты тех, кто пытается вырвать ее
за пределы химии в некую междисциплинарную науку?
177
Определение химического состава веществ остается той
вторичной, прикладной целью, которая имеется у любой
естественной науки с тех пор, как наука в целом стала производительной
силой общества. Здесь уместно вспомнить, что ведущие
химики-аналитики нашей страны, академик И. П. Алимарин й чл,-
кор. АН СССР Ю. А. Золотов отмечали необходимость
разграничения понятий «аналитическая химия» и «химический
анализ» настолько, насколько вообще можно разграничить
науку и ее прикладные аспекты. И тогда возникает логически
Строгое построение: аналитическая химия познает
закономерности проявления характеристических свойств веществ,
являющихся отражением их химического состава; химический анализ
обеспечивает установление качественного и количественного
состава веществ. Различия проявляются и в том, что прямая
и обратная связи в системе химический состав —
характеристическое свойство далеко не равнозначны. По пути от химического
состава к характеристическому свойству идет аналитическая
химия, от познанных характеристических свойств к химическому
составу идет химический анализ.
Теперь о месте аналитической химии среди естественных
наук. Действительно, в основе целого ряда характеристических
свойств веществ, отражающих их химический состав, лежат
Явления, открытые и изучаемые в рамках других разделов
химии или физики. Но как только мы переходим к установлению
характера корреляций состав — свойство, начинается
аналитическая химия. Физикохимик стремится познать природу
обменной функции ионоселективного электрода, но на "вопрос, как
влияет состав примесей на эту функцию, насколько она
чувствительна к изменению форм существования определяемого
вещества в растворе, отвечает химик-аналитик. Физику,
изучающему схемы распада радиоактивных ядер, не безразличен
химический состав примесей в источнике излучения, но только как
мешающий фактор. Химику-аналитику в активационном
анализе схема распада помогает идентифицировать интересующий
элемент, но главным для него оказывается выявление именно
тех факторов, которые д'ля физика были мешающими! И не
просто выявление, а установление количественных зависимостей,
знание которых открывает возможность выбора условий, в
которых максимально проявляются индивидуальные особенности
химического элемента.
На стыке с другими науками аналитическая химия
сохраняет свою индивидуальность в рамках единой цели. И
неважно, физическими или химическими являются
характеристические свойства, закономерности проявления которых изучает
аналитическая химия. Важно то, что они являются
отражением химического состава веществ. Отсюда все попытки
рассматривать аналитическую химию как междисциплинарную науку
на стыке химии, физики, информатики и техники, как некую
178
«аналитику», приходится отнести к информационным шумам,
а сам термин «аналитика» применительно к аналитической
химии— не более, чем профессиональный жаргон. Аналитическая
химия была и остается одним из важнейших разделов
химической науки.
Наконец, последний вопрос — о проблемах преподавания,
которые возникнут, если рассматривать аналитическую химию
с иных позиций, чем это было принято до сих пор.
Аналитическая химия является одной из основ химических знаний.
Нужно иметь хотя бы элементарные представления о ее
современных возможностях, чтобы использовать их в своей
практической деятельности. Где можно сегодня почерпнуть эти
знания? Ни современные учебные программы, ни подавляющее
большинство учебников не соответствуют уровню современного
развития аналитической химии. У. Ф. Пиккеринг в предисловии
к учебнику «Современная аналитическая химия» (М., 1977)
пишет: «...существует одна химическая дисциплина, в которой
необходимое равновесие, т. е. одновременное развитие науки
и изменение учебных программ, было нарушено». Эта
диспропорция представляется закономерным следствием понимания
аналитической химии как свода методов анализа. Число
методов непрерывно растет, происходит' постоянная переоценка их
значимости. Программа курса аналитической химии не в
состоянии уместить все увеличивающийся поток информации
и своевременно откликаться на происходящие изменения в
относительной значимости тех или иных методов анализа.
Необходимость поиска новых подходов к преподаванию
аналитической химии стала одной из насущных проблем
химического образования. И здесь, если исходить из толкования
аналитической химии как науки о характеристических свойствах
веществ, являющихся отражением их химического состава,
легче найти общую теоретическую платформу, которая бы
объединила отдельные разрозненные методы анализа.
Приведем простой пример. В настоящее время даже хроматографи-
ческие методы часто рассматриваются вне тесной взаимосвязи
друг с другом. Особенно резко проводится грань между
экстракционными, сорбционными и хроматографическими методами
разделения, хотя в основе всех этих методов лежит общее
характеристическое свойство веществ — по-разному распределяться
между двумя несмешивающимися фазами. Различия же
определяются лишь способом осуществления процесса межфазного
распределения. Иногда одно и то же свойство лежит в основе
совсем уж далеких на первый взгляд методов: метода
определения и метода разделения. Селективная мембрана, с одной
стороны, — чувствительный элемент ионоселективного электрода,
с другой — основа диализных и электродиализных методов
разделения. И от комплексного подхода к изучению природы се-
179
лективности мембран — от прямой потенциометрии и
мембранных методов разделения — наука только выиграет.
Если допустить, что исходные предпосылки верны, то
пришло время пересмотреть наши взгляды на аналитическую
химию и проблемы ее преподавания. Нео&зддим качественно
новый курс основ аналитической химии. Судет ли в нем служить
отправной точкой понимание аналитрщеской химии как науки
о характеристических свойствах веществ, являющихся
отражением их химического состава, или будет найдена другая
естественнонаучная платформа, покажет будущее.
НЕОЖИДАННАЯ ЛОГИКА
БИОНЕОРГАНИЧЕСКОЙ ХИМИИ
Они сошлись. Волна и камень,.
Стихи и проза, лед и пламень
Не столь различны меж собой.
Сперва взаимной разнотой
Они друг другу были скучны;
Потом понравились; потом...
Л. С. Пушкин
азвитие любой науки воплощает в себе две главные,
взаимосвязанные, дополняющие друг друга и
противоположные в своем единстве тенденции: 1)
дифференциацию науки и специализацию знания и 2)
интеграцию науки и универсализацию знания. А
поскольку развитие той или иной науки — процесс
непрекращающийся, то мы можем рассматривать его не только в
историческом аспекте, но и на основе представлений о современном
состоянии науки. Как и любая другая область естествознания,
химия на всех этапах своего развития предоставляла и
предоставляет прекрасные примеры для иллюстрации этого общего
тезиса.
«ТРИ СЛОНА» В ХИМИЧЕСКОЙ НАУКЕ
Примерно полтора столетия назад в химии произошло
событие, значение которого трудно переоценить: из единой
химической науки выделилась и стала стремительно развиваться
органическая химия. Основой этого ответвления послужил тот
факт, что химические соединения живых организмов содержат,
как правило, лишь такие элементы, как водород, кислород,
азот, углерод и серу (позднее к ним был причислен фосфор).
Обособлению органической химии в отдельную область
химической науки, безусловно, способствовало еще и убеждение
в невозможности синтезировать в лаборатории те вещества,
которые образуются живыми организмами в процессе их
жизнедеятельности.
Вскоре стала очевидной необходимость соответствующего
обособления неорганической (или минеральной) химии как
антипода химии органической. И несмотря на" то, что в 1828 г.
Ф, Вёлер превратил типичное неорганическое соединение циа-
<D
1^
181
нат аммония в типичное органическое вещество мочевину, это
разделение химической науки продолжало углубляться. Когда
же в конце XIX в. сформировалась биологическая химия, стало
возможным при обсуждении главных особенностей развития
химии основываться уже на трех ее ветвях, а именно: на
неорганической, органической и биологической.
Таким образом, в развитии химической науки действительно
находит отражение общая тенденция к дифференциации
(разделению) знаний, и проявляется это прежде всего в том, что
в химии на всех этапах ее развития возникают новые
направления. Но для развития химии в полной мере характерна и
тенденция к интеграции (объединению) знания, это находит свое
отражение в том, что в химии — опять-таки на всех этапах ее
развития — формируются пограничные дисциплины. Речь идет
о таких областях исследования, которые лежат на границе,
отделяющей сферы действия одной химической ветви от другой.
Эти «промежуточные» области нельзя однозначно отнести ни
к одной из упомянутых ветвей.
Материалистическая диалектика утверждает, что основой
интеграции наук и общей предпосылкой формирования
пограничных наук являются взаимосвязь и взаимопревращение форм
движения материи, принцип единства мира. При этом
существующие закономерности во взаимоотношениях между
различными формами движения материи определяют направления, по
которым происходит формирование пограничных наук. Важно,
что интеграционные процессы в естествознании неотделимы от
общих научных принципов (принципы соответствия,
дополнительности, симметрии, сохранения, инвариантности и др.),
выражающих фундаментальные объективные закономерности
материальной действительности. Иными словами, общей
причиной возникновения пограничных наук является стремление
к единству знания, к многогранности знания как основе
общечеловеческой мудрости.
Действительно, здание современной науки огромно, и всеми
научными знаниями не может овладеть ни один человек.
Работать на профессиональном уровне можно лишь будучи
специалистом в той или иной конкретной области науки. Книгу
природы никому не дано прочитать целиком, каждый читает
лишь свою главу в этой книге (конечно же, соразмерно со
своими возможностями). Но значит ли это, что человечество
читает всю эту книгу целиком? Есть ли гарантия в том, что важ^
нейшие главы ее не проходят мимо нас? Такой гарантии,
безусловно, нет. И именно стремление к получению такой
гарантии является движущей силой поисков, открытия и развития
новых областей знаний на стыках уже сформировавшихся
и устоявшихся наук. Возникновение пограничных областей
обогащает качественно новыми знаниями не только науку в целом,
но и дает толчок к развитию тех областей, на стыке между ко-
Д82
торыми возникает новое знание. Как не вспомнить здесь слов»
Бернарда Шоу: «Если у вас есть яблоко и у меня есть яблоко,,
и мы обменяемся этими яблоками, то у вас и у меня останется
по яблоку. А если у вас есть идея и у меня есть идея, и мы
обменяемся этими идеями, то у каждого будет по две идеи».
ПОГРАНИЧНЫЕ НАУКИ В ХИМИИ
Пограничные области в химической науке стали
формироваться в начале XX в. Уже в 30-е годы на фоне
продолжающегося расхождения органической и неорганической химии
(хотя закономерность такого разделения никогда не была
несомненной) начался процесс воссоединения этих дисциплин,,
и на границе их раздела формируется элементоорганическая
(или металлоорганическая) химия. Быстрое развитие химии
элементоорганических соединений привело к тому, что к
середине текущего столетия она превратится в самостоятельную-
и интересную область химического естествознания, с
собственной методологией и проблематикой. Успехи элементоорганиче-
ской химии выразились в открытии новых классов химических
соединений, среди которых первыми были лжомплексы
переходных металлов во главе с ферроценом, открывающим плеяду
сендвичевых соединений, а также необычные, ранее не
встречавшиеся ни в одной области химии «неклассические»
соединения, образуемые переходными металлами с различными
ненасыщенными углеводородами, а именно: олефиновые и
ацетиленовые комплексы, комплексы я-аллильного типа и другие,
играющие очень важную роль в каталитических превращениях
органических молекул.
Привлеченные кажущейся легкостью протекающих в природе
процессов образования сложных органических соединений,
химики-органики берут на себя смелость воспроизводить реакции,,
подобные тем, которые идут в живых организмах. Так в 60-е
годы на стыке органической химии и биохимии возникает
биоорганическая химия. В задачи этой пограничной науки входят
изучение механизма действия ферментов, создание
искусственных ферментов, а также разработка практически важных
методов синтеза, включая синтез лекарственных препаратов.
Рождение элементоорганической и биоорганической химии
знаменовало собой исчезновение двух границ раздела (из
имеющихся трех) в системе главных ветвей химической
науки— органической, неорганической и биологической. Оставался
еще один, последний, стык—между неорганической химией
и биохимией. Слишком различными казались эти две области
химического естествознания, чтобы можно было предполагать
возможность их взаимного проникновения и возникновения
новой, промежуточной химической дисциплины. И тем не менее
это произошло — всего десятилетие назад родилась новая
183
пограничная область — бионеорганическая химия (иногда ее
называют неорганической биохимией). И за столь короткое
время бионеорганическая химия превратилась в суверенную
и быстро развивающуюся науку.
Правомерен вопрос: «Что же общего может быть между
неорганикой, изучающей „мертвые" соединения, и биохимией,
стремящейся проникнуть в таинства сложнейших реакций
в живых организмах?». В том-то и дело, что рождение
бионеорганической химии было продиктовано всей логикой развития
современной теоретической и экспериментальной химии. С ее
рождением получила свое завершение схема дифференциации
химического естествознания и последующей интеграции трех
главных ее ветвей, отразившей
возникновение трех пограничных
наук (рис. 1, черный кружок в
центре символизирует когда-то
единую и неделимую химию). Эта
схема наглядно отражает взаимосвязи
всех фундаментальных областей
химии, их генезис и возможную
эволюцию. Пусть не удивляет читателя
отсутствие на этой схеме всех
остальных ныне существующих
областей химической науки. Свое
достойное место в химическом
естествознании занимают физическая,
аналитическая, коллоидная химия,
радиохимия, электрохимия и другие
общехимические дисциплины, а
также такие новые направления, как
плазмохимия, космохимия, химия океана, химия
полупроводников, химия кластеров, лазерная химия и т. д. Все вместе они
образуют цельное здание химической науки на триедином
фундаменте.
БИОНЕОРГАНИКА: ПРОБЛЕМЫ И РЕШЕНИЯ
Интерес к бионеорганической химии объясняется не только
тем, что это самая молодая область современной химии,
таящая в себе много неожиданных и нераскрытых явлений и
ставшая модной наукой. На это есть еще одна и весьма веская
причина. Дело в том, что если в XVII—XVIII вв. господствующее
положение в естествознании занимала механика, в XIX и
первой половине XX в. были сделаны исключительно важные
открытия в области физики, то начиная с середины нашего
столетия лидирующая роль в естествознании переходит к
биологии, и эта наука становится «центром интеграции» естественно*
научных знаний. Именно поэтому в настоящее время более все-
Рис1
184
го развиваются науки, находящиеся на стыке с биологией,
и в частности бионеорганическая химия.
,Что же изучает бионеорганика? Каковы ее проблемы,
объекты и методы исследования? На эти вопросы сейчас уже
можно дать обстоятельные ответы. Ведь несмотря на свою
молодость, она сделала поразительные успехи, которые нашли свое
отражение в периодических журналах и монографиях.1
Объектами исследования в бионеорганической химии
являются биокомплексы (или биокоординационные соединения),
принимающие участие во многих биологических процессах.
В состав комплексов входят биометаллы — «металлы жизни»
(Na, К, Mg, Ca, Mn, Fe, Со, Си, Zn, Mo, а также, вероятно, Cd,
V, Cr, Ni), а в качестве лигандов выступают различные
атомарные и многоатомные группы, от самых простых (Н20, О,
ОН-, S, SH-, CI", SO*-, СО*", РО}-и т. д.) до самых сложных
(полисахариды, белки, нуклеиновые кислоты и др.).
Арсенал методов исследования в бионеорганике охватывает
практически все существующие экспериментальные
физико-химические методы и теоретические методы квантовой химии. Это
не только традиционные методы изучения структуры,
электронного строения и свойств биокоординационных соединений и
механизмов реакций с их участием, но и совершенно новый метод
«спиновых меток», а также всевозможные тесты на
биологическую активность.
Бионеорганическая химия развивается по нескольким
направлениям.
1. Исследование биологически активных веществ и, в
частности, переносчиков кислорода и переносчиков ионов (ионофо-
ров), т. е. таких веществ, которые избирательно связывают
катионы металлов и переносят их через липидные барьеры
в мембранах.
2. Исследование антитоксинов и процессов миграции
токсичных металлов в природе.
3. Изучение структуры и механизма действия металлофер-
ментов. Это направление развивается по пути моделирования
реакционных центров металлоферментов, коферментов и
некоторых других биологически активных металлокомплексов
(гемоглобин, витамин Bi2, нитрогеназа и многие другие) и
сравнения свойств модельных комплексов со свойствами природных
систем.
4. Исследование и воспроизведение важнейших
биохимических процессов строится на конструировании функциональных
моделей биопроцессов, причем главное место здесь занимают
1 Яцимирский К. Б. «Введение в бионеорганическую химию». (Киев,.
1976); «Неорганическая биохимия». Под ред. Г. Эйхгорна (М., L978); Хен-
рици-Оливэ Г., Оливэ С. «Координация и катализ» (М., 1980);
Хьюз М. «Неорганическая химия биологических процессов» (М., J983).
185
реакции, катализируемые металлоферментами, и в том числе
темновые и фотохимические окислительно-восстановительные
реакции (фиксация молекулярного азота, конверсия моноокиси
углерода, фотохимическое разложение воды и т. д.), а также
сложные в кинетическом отношении процессы, в частности
колебательные (или периодические) биохимические редокс-реакции.
Ионофоры представляют собой макроциклические лиганды—
макроциклические сложные эфиры карбоновых и (или)
аминокислот. В их молекулярной структуре имеется полость строго
/ I
V 4 °Ч> <
' vv /" он %^ь
ч
* Валиномицин
%
Рис.2
юпределенного размера и формы, со строго фиксированным
расположением в пространстве донорных атомов (обычно это
атомы кислорода). В эту полость может поместиться только
подходящий по размерам катион щелочного или
щелочноземельного металла, она как бы надевается на сферический катион,
как корона на голову. Так возникает неожиданно прочный
союз пептида-комплексона с катионом металла, в котором
катион удерживается в молекулярной полости комплексона в
основном за счет ион-дипольных связей. На этом явлении и
основано биологическое действие мембранно-активных пептидрв-
комплексонов, которые способны избирательно связывать
катионы металлов в результате согласованного взаимодействия
186
этих катионов с несколькими карбонильными группами
пептидного остова. Например, специфическое свойство валиномицина,
представляющего собой 36-членный цикл (рис. 2), — это
исключительно высокая K/Na-избирательность комплексообразования.
Устойчивость К+-комплекса валиномицина на 4 порядка больше
устойчивости Na ^комплекса, именно поэтому валиномицин
переносит через мембраны только катионы калия (как говорят,
индуцирует калиевую проводимость), но не переносит
катионы натрия. Аналогичные явления составляют основу действиж
некоторых антитоксинов. Так, циклический декапептид антама-
* Ос-с-0
и
о h»
V Л
Антаманнд
Рис.3
нид (рис. 3), выделенный из экстрактов бледной поганки, инпь
бирует токсическое действие фаллотоксинов — мощных ядов*
необратимо поражающих печень млекопитающих.
Предполагают, что антитоксическое действие антаманида основано на
образовании комплексов его с катионами Na+ или Са2+,-,хемисор-
бированными на поверхности клеточной мембраны, тем самым
снижается проницаемость клеток по отношению к токсинам.
Пожалуй, главным направлением современной
бионеорганической химии является исследование металлоферментов (или
металлоэнзимов) — их структуры и механизма действия. Уже
первые результаты показали, что главное действующее лицо ме-
таллофермента — это его активный центр, содержащий атом
(иногда два или несколько атомов) металла: например, атомы
Fe в гемоглобине, Мо в нитрогеназе, Со в витамине BJ2, Mn
в хлорофилле. Атомы металла в активных центрах образуют
18?
со своим ближайшим окружением неорганический комплекс,
связанный с белковой структурой в единый металлофермент.
Именно на таких активных центрах и протекают реакции,
катализируемые металлоэнзимами. В частности, на молибден со
держащем активном центре нитрогеназы идет реакция
восстановления молекулярного азота в аммиак или гидразин. Протопорфи-
риновый комплекс железа в гемоглобине обеспечивает
транспорт, обратимую координацию и активацию кислорода. Мар-
ганецсодержащий активный центр хлорофилла катализирует
важнейшую фотохимическую реакцию 2Н20-^2Н2+02. Основы
катализа металлоферментами окончательно еще не
разработаны, но и имеющихся результатов достаточно для того, чтобы
составить ясное представление о той огромной роли, которую
играют в биохимических процессах неорганические комплексы
металлов в составе различных белков.
В кратком очерке невозможно охватить все проблемы бионе-
-органической химии, тем более что круг ее интересов, как мы
только что видели, необычайно широк. Но самое главное
состоит в том, что процессы с участием биокоординационных
соединений таят в себе огромные возможности и их реализация
в искусственных условиях открывает захватывающие
перспективы для технологии получения самых различных веществ,
в том числе таких видов топлива, которые не оказывали бы
пагубного воздействия на существующие экологические
системы (водород, гидразин). Но попытки в точности повторить
процессы, идущие в природе,скопировать ее конкретные приемы и
методы заведомо обречены на неудачу. Поэтому первостепенной
задачей бионеорганической химии является создание небелковых
аналогов биологических систем. По сути дела, моделирование
биологических систем (структур и реакций) на основе
достаточно простых неорганических или металлоорганических
комплексов— это ее вторая, пожалуй, наиболее важная проблема.
Сложность биологических структур и процессов, включающих
многие сотни реакций, да еще со сложной кинетикой, ставит
перед химическим моделированием следующую главную цель:
выделить из биологических структур наиболее важные узлы
(центры), а из биохимических процессов — наиболее
интересные и важные реакции. При химическом моделировании
биологических структур и биохимических процессов неизбежно
приходится прибегать к их видоизменению и упрощению, так
как даже самая сложная химическая модель не в
состоянии передать полностью то или иное биологическое
явление.
С помощью моделей стала возможной расшифровка
химического механизма ряда сложных природных процессов. Но дело
здесь не только в чисто научном интересе. Разработка
функциональных моделей металлоферментов и процессов с их участием
тесно связана с развитием теории и практики гомогенного и ге-
188
терогенного катализа, с решением энергетической проблемы
и т. д. Так, с использованием более простых, чем металлофер-
мевты, моноядерных и кластерных комплексов, включающих
различные переходные металлы, но чаще всего V, Fe, Mn, Ru,
Re и особенно Мо, удается при обычных условиях в протонсо-
держащих средах превращать молекулярный азот в аммиак,
осуществлять реакции конверсии моноокиси углерода,
фотохимически разлагать воду на водород и кислород под действием
обычного видимого света. Тем не менее предстоит решить
еще немало проблем, прежде чем координационные
соединения металлов смогут по своему действию приблизиться к
естественным биометаллокатализаторам.
В природе существуют совершеннейшие биохимические
процессы и это несмотря на то, что условия, в которых они
происходят, жестко лимитированы (низкие температура и давление)
и имеющиеся материалы тратятся до предела экономно. Именно
поэтому биохимические принципы, перенесенные в другие —
«неорганические» — условия (повышенные давления, широкие
температурные диапазоны, избыток реагентов), могут дать
поразительные результаты, которые сейчас даже трудно
предвидеть.
НЕОРГАНИКА И МЕДИЦИНА
Видимо, мы не особенно удивим читателя, если скажем, что
многие неорганические (иногда весьма простые) соединения
оказывают разнообразные лечебные действия. Но лишь
сравнительно недавно выяснилось, насколько велика роль
некоторых металлов в биохимических процессах, поэтому еще одним
важным направлением бионеорганической химии стало медико-
бйологическое. Достигнутые в этой области успехи существенны
для клинической химии и фармакологии, поскольку оказалось,
.что от содержания того или иного металла в организме
зависит его нормальная жизнедеятельность. В частности, многие
заболевания связаны с нарушением всасывания или выведения
из организма микроэлементов: недостаток железа вызывает
анемию, меди — деструкцию сосудов; при недостаточном
количестве цинка снижается активность многих ферментов,
недостаток магния приводит к разрушению рибосом, при недостатке
селена увеличивается восприимчивость к канцерогенным
веществам. Напротив, избыток железа вызывает сидерозис, меди —
болезнь Вильсона, избыток кальция способствует отложению
солей на стенках кровеносных сосудов. Не исключена
взаимосвязь между содержанием кадмия и гипертонией, содержанием
лития и депрессивным психозом.
Изменять в нужную сторону содержание того или иного
металла в организме можно с помощью комплексообразующих
веществ. Неслучайно в состав многих лекарств входят лиган-
189
ды, специфически взаимодействующие только с определенными
металлами или группой металлов. В качестве примера укажем
на комплексы платиновых металлов. Эти комплексы в
большинстве своем хорошо изучены и с давних пор занимают
важное место в развитии теоретических представлений
координационной химии. Они широко применяются не только в
различных областях химии, но и в химической технологии, в
гомогенном и гетерогенном катализе. Однако комплексы платиновых
металлов всегда сохраняли репутацию веществ, далеких от
событий в живой природе. И вдруг неожиданность. Эти
комплексы оказались биологически активными. В настоящее время их
медико-биологические функции проявляются в
противоопухолевой активности, хотя для полного доказательства необходимы
дальнейшие исследования, направленные на установление
строгой взаимосвязи противоопухолевой активности этих
комплексов с их строением, физико-химическими свойствами и
механизмами их молекулярно-биологического и химического действия.
СТАРТ В БУДУЩЕЕ
Бионеорганическая химия — наука молодая, и ее
дальнейшее развитие существенно зависит от того, кто и как
будет заниматься решением ее проблем. Что мы имеем в* взду?
Австрийский физик Эрвин Шрёдингер в своей книге «Что
такое жизнь? С точки зрения физика» (М., 1972) писал: «Мы
унаследовали от наших предков острое стремление к цельному,
всеобъемлющему знанию. Само название высших институтов
познания — университеты — напоминает нам, что с давних пор
и на протяжении многих столетий универсальный характер
знаний — единственное, к чему может быть полное доверие.
Но расширение и углубление отраслей знания в течение
последних ста с лишним лет поставило нас перед странной дилеммой.
С одной стороны, мы чувствуем, что только теперь начинаем
приобретать надежный материал для того, чтобы свести в единое
целое все до сих пор известное, а с другой стороны, становится
почти невозможным для одного ума полностью овладеть более
чем одной небольшой специальной областью науки. Я не вижу
выхода из этого положения (чтобы при этом наша основная
цель не оказалась потерянной навсегда), если только
кто-нибудь из нас не рискнет взяться за синтез фактов и теорий
(курсив мой. — Д. К)у хотя наше знание в некоторых областях
неполно и хотя мы можем подвергнуться опасности показаться
невеждами». Блестящим примером плодотрорного
проникновения специалиста-физика в тайны другой науки — биологии —
явились в 40-е годы работы самого Э. Шрёдингера, который с
позиций теоретической физики обсудил общие проблемы
физического подхода к различным явлениям жизни, включая механизм
наследственности и мутации. Его теоретические представления
190
предвосхитили многие открытия в биологии и явились
стимулом для новых исследований, а его книга до сих пор, несмотря
на прошедшие десятилетия, остается актуальной.
В теории познания философия выделяет эмпирический и
теоретический уровни знания — качественно своеобразные ступени
знания, различающиеся между собой полнотой, глубиной и
всесторонностью описания изучаемых явлений. На эмпирическом
уровне содержание знания в основном приобретается из опыта,
из наблюдений и экспериментов, при определенной и
рациональной обработке и интерпретации результатов. На уровне
теоретического познания изучаемое явление всесторонне
отражается не только на основе данных, получаемых в опыте, но
и в ходе абстрактного мышления. В любой области науки
существуют свои теоретические построения, составляющие основу
описания всех ее явлений.
Бионеорганическая химия еще не имеет своей строгой
теоретической основы и находится пока на «эмпирическом уровне»,
что, разумеется, не означает отсутствия в ней теоретических
подходов к решению, возникающих проблем. Чем менее развита
новая пограничная наука, тем слабее ее внутренняя логика, тем
сильнее влияние на эту науку соответствующих смежных наук.
Таково сейчас положение и юной бионеорганической химии.
Конечно, со временем она окрепнет, сформулирует свои
фундаментальные теоретические принципы и, не порывая с породившими
ее ветвями химии, превратится в самостоятельную науку со
своим индивидуальным почерком решения задач, которые ставиг
перед нами Природа.
СТРАТЕГИЯ ПОИСКА
НОВЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Бог создал мир из ничего.
Учись, художник, у него.
К. Бальмонт
ет тайны в том, что желание людей быть здоровыми
всегда превосходит возможности существующих
лекарств. В борьбе этих двух противоположностей
проходит на Земле уже не одно столетие, а может быть,
и тысячелетие. Наверное, именно отсюда и
проистекает постоянный поиск, неугомонное стремление фармакологов,
медиков, химиков получать новые, все более совершенные
лекарственные препараты. Одни из них надолго задерживаются
в клинике, другие быстро уходят. Примером
лекарства-долгожителя является диэтилстильбэстрол, который американский
ученый Хюггинс впервые применил в. 1941 г. для лечения рака
предстательной железы. И в наши дни он используется весьма
эффективно, несмотря на то, что применение -больших доз
эстрогенов, к которым как раз и относится диэтилстильбэстрол,
отрицательно сказывается на сердечно-сосудистой системе. Но
что же поделаешь — лучших-то лекарств пока нет!
В настоящем очерке мы расскажем о том, как ведется поиск
новых лекарственных препаратов, какой вклад вносят работы
в области химии природных соединений, биоорганической
химии, молекулярной биологии в прогнозирование синтеза новых
биологически активных соединений с улучшенными свойствами.
Конечно же, целесообразно вести поиск новых лекарственных
веществ в ряду природных соединений, ибо они не являются
для человека чем-то чужеродным и дают меньше побочных
эффектов, чем синтетические препараты, а при передозировках
легче нейтрализуются организмом.
Первые сведения о наличии в каком-либо природном
объекте биологически активных веществ поступают, как правило,
из современной биологии или народной медицины. Не всегда,
правда, эти сведения оказываются истиной в конечной
инстанции, но ка^ую-то полезную информацию они содержат. Чаще
192
всего о химической природе лекарственных растительных средств
известно очень мало, и предстоит пройти целый ряд этапов,
прежде чем удастся ввести в широкую практику новые
лекарственные препараты. Даже на самом раннем этапе
исследования возникает множество вопросов: нельзя ли сузить спектр
биологического действия вещества, если для лечения
конкретной болезни нужно только одно его свойство; нельзя ли
получить более активное вещество, чем имеющееся, сэкономив при
этом ресурсы для его синтеза, и т. д. Но чтобы ответить на
эти многие вопросы, необходимо в первую очередь выделить
биологически активное соединение из очень сложной смеси,
которая зачастую содержит главным образом «балластные»
вещества. Только работая с абсолютно чистым препаратом,
можно быть уверенным в том, что данное биологическое действие
принадлежит именно этому соединению, а не какому-то
микрокомпоненту смеси. Когда эта задача будет решена, можно
приступать к установлению строения нового соединения. Методы
установления строения новых веществ подробно рассмотрены
в книге В. Р. Полищука «Как разглядеть молекулу», и мы
рекомендуем ее тем, кто специально заинтересуется методами
структурной химии.
ПРИРОДА — САМЫЙ ИСКУСНЫЙ ФАРМАЦЕВТ!
Неколебимой истине
Не верю я давно.
В. Брюсов
С момента установления строения биологически активного
вещества и начинается поиск новых лекарственных
препаратов — более пригодных для человека, чем те, которые может
предложить Природа. Правда, многие из нас считают (по
крайней мере, втайне, «для себя»), что природное — это и есть
лучшее. Взять, к примеру, весьма совершенные регуляторы
важнейших жизненных процессов или тот синтетический арсенал,
которым располагает Природа. Все это безусловно верно, но...
соединения, имеющие улучшенное биологическое действие па
сравнению с природными, уже получены! А значит, нужно
искать новые. С чего же следует начать? Прежде всего
исследователи модифицируют структуру природных объектов: удаляют
некоторые функциональные группы, чтобы выяснить их
значимость для реализации биологического действия; вводят новые
заместители или удаляют старые; изменяют взаимное
пространственное расположение функциональных групп. В результате
такой работы накапливаются сведения о связи между
химическим строением данной группы веществ и их биологической
активностью. Желательно ввести в молекулу биологически ак-
7 779
193
тивного соединения радиоактивные или стабильные изотопы —
это позволит проследить «судьбу» вещества после его введения
в организм: узнать скорость его выведения из организма;
выяснить, в какие соединения превращается введенный препарат;
в каких органах накапливается. Ведь иногда бывает и так, что
биологическое действие принадлежит не самому введенному
веществу, а продуктам его метаболизма. Зная все это, можно
предугадать, как следует изменить структуру, чтобы препарат
существовал в организме как можно дольше, или наоборот, как
можно быстрее распадался. Можно даже заранее наметить себе
путь, по которому следовало бы модифицировать соединение
для проявления у него противоположного биологического
действия, чем то, которым обладало природное вещество. Но об
этом чуть позже.
И, наконец, самое важное для химика-синтетика: если речь
идет о сложном соединении, синтез которого традиционными
методами не так-то просто осуществить, то не лучше ли
попробовать разгадать, каким образом оно получается в природе.
Может быть, что-то удастся перенять у нее в идее синтеза,
и тогда мы говорим о биогенетически подобном синтезе. И хотя
в наших руках такой синтез еще недостаточно эффективен, как
хотелось бы, важно, что начало уже положено!
В нашем очерке мы рассмотрим пример создания
лекарственных препаратов и новых биологически активных веществ
(еще не ставших лекарственными средствами) главным образом
в ряду стероидов. Это удобно сделать потому, что практическая
значимость стероидов привела к такой интенсификации работ
по изучению синтеза, биосинтеза и механизма действия этого
класса соединений, которой нет, вероятно, ни в какой другой
области химии физиологически активных веществ.
О СТРУКТУРЕ СТЕРОИДОВ И ТРИТЕРПЕНОВ
...Великая книга природы открыта перед
всеми, и в этой великой книге до сих пор..,
прочтены только первые страницы.
Д. И. Писарев
Почти все стероиды образуются в природе из ланостерина,
относящегося к классу тритерпенов. Первый представитель три-
терпенов — бетулин (I)1 был выделен в довольно чистом виде
около 200 лет назад, в 1788 г., членом Петербургской Академии
наук Товием Ловицем из коры березы. (В этом объекте бету-
лина очень много. Даже студент IV или V курса химического
факультета ЛГУ за 2—3 недели может получить из него до
1 В дальнейшем римской цифрой, стоящей после названия соединения,
мы будем нумеровать его структурную формулу.
194
200 г чистого бетулина). Однако детальное изучение этого
соединения началось только через 150 лет — структурная
формула (I) была установлена лишь в 1954 г. Справедливости ради
следует, однако, сказать, что уровень развития химии в течение
долгого времени не позволял изучать вещества такого сложного
строения.
Молекула бетулина содержит 4 циклогексановых кольца,,
имеющих конформацию «искаженного кресла», и одно цикло-
пентановое кольцо, тоже неплоское. Всего в молекуле 10
асимметрических (хиральных) атомов углерода. На листе бумаги
мы, конечно же, изображаем только проекцию молекулы на
плоскость. Связи в виде пунктирных линий показывают, что
соответствующий заместитель или атом водорода находится
в пространстве ниже плоскости бумаги, связи в виде сплошных;
линий сидетельствуют о том, что заместители лежат выше
плоскости листа:
В США в поисках новых противоопухолевых средств
изучают биологическую активность экстрактов из растений. Так,
в 1973 г. был исследован экстракт одной из разновидностей
ольхи — Alnus oregona. Оказалось, что он тормозил рост клеток
рака носоглотки. Одно из соединений, выделенное из этого
экстракта с весьма низким выходом, обладало указанной
активностью, и этим соединением был... бетулин. Спустя два года
сотрудники Ленинградского университета синтезировали на
основе бетулина соединения, обладающие биологическими
свойствами, подобными гормону дезоксикортикостерону (II). Таким
образом, после многолетнего перерыва химия бетулина вновь
заинтересовала исследователей.
Иная судьба у соединений, действием которых определяется
нормальное протекание важнейших жизненных процессов.
Примером стероида со счастливой судьбой является эстрадиол (III).
Уже задолго до его выделения в чистом виде было известно, что
он находится главным образом в яичниках и влияет на
репродуктивную функцию организма. Важность этого вещества для
медицинской практики сомнений не вызывала, поэтому изуче*
195
ние эстрадиола на всех стадиях исследования носило
форсированный характер. Основная трудность состояла в том, что
эстрадиол имеет очень высокую биологическую активность,
(т. е. для достижения биологического эффекта нужны малые
дозы вещества), а это означает, что количество эстрадиола в
организме очень мало. В 1935 г. были закончены работы по
выделению эстрадиола из яичников свиней, проводившиеся под
руководством известного американского биохимика Э. Дойзи. Для
получения 25 мг чистого препарата потребовалось
переработать около 4 тонн яичников, так что известное выражение
«в грамм добыча — в год труды» оказалось бы здесь слишком
оптимистичным. Ни о каких «граммах» даже и думать не
приходилось. И хотя впоследствии были найдены источники с
большим содержанием эстрогенов, пришлось разрабатывать и
осуществлять синтетические пути синтеза эстрогенов, так как это
было и проще, и дешевле. Сейчас синтетический эстрадиол
широко используется в медицине и сельском хозяйстве.
Интересна история исследования стероидных гормонов коры
надпочечников. В 1927 г. в опытах на животных было показано,
что оперативное удаление обоих надпочечников приводит к
быстрой смерти. Если же животным с удаленными
надпочечниками вводить солевой экстракт из надпочечников,
продолжительность жизни заметно возрастает. Ясно, что наблюдаемый эффект
связан с веществами, содержащимися в экстракте. Интерес
к ним был огромен, и вот уже к 1943 г. в различных странах
из 450 кг желез, полученных от 20 000 голов крупного рогатого
скота (представьте себе масштаб опытов!), было выделено
28 стероидов. Формулы некоторых из них, наиболее активных,
мы приводим ниже:
сн2он сн2он сн2он
(IV) (V) (VI)
Если принять во внимание близость структур этих стероидов
(и, следовательно, близость их физико-химических свойств),
а также несовершенную технику выделения соединений из
сложных смесей, то нужно признать, что интенсивность исследования
была очень высокой. Оказалось, что в коре надпочечников боль-
196
ше всего кортизона (IV) —около 200 мг. А вот дезоксикортикос-
терон (II) и 11-дегидрокортикостерон (VI) являются
микрокомпонентами (их в коре надпочечников содержится всего 12,5
и 6,0 мг соответственно). Выделение стероидов в чистом виде
было необходимо не только для доказательства их строения,
но и потому, что их биологические свойства оказались
совершенно различными. Так, например, производные дезоксикорти-
костерона (II) главным образом влияли на обмен минеральных
солей, тогда как производные кортизона (IV) регулировали
синтез гликогена в печени.
ПРИРОДА ЛИШАЕТСЯ ПАТЕНТА
Как удивительны все эти перемены1 Не
знаешь, что с тобой будет в следующий
миг.
Л. Кэрролл
Постепенно накапливались сведения о строении тритерпенов
и стероидов. Почему мы так упорно подчеркиваем близость
в строении этих веществ? Логично думать, что сходные по
структуре вещества образуются в природе сходным путем,
т. е. в основе их синтеза лежит один и тот же принцип, и этот
принцип можно иногда понять, сравнивая как раз близкие по
структуре вещества с их далекими «родственниками».
Еще в 1896 г. Отто Баллах указал на то, что в основе
углеродного скелета всех известных к тому времени терпенов лежит
углеродный скелет изопентана. Терпены как бы являются
продуктами полимеризации изопрена, отчего они и входят в состав
группы полиизопреноидов. В 1922 г. швейцарский химик-органик
Леопольд Ружичка, будущий лауреат Нобелевской премии,
отметил, что «изопреновые единицы», т. е. фрагменты с
углеродным скелетом изопентана, расположены в молекулах терпенов
не как угодно, а в соответствии с определенным
«архитектурным» правилом: «голова к хвосту», как в формуле (VII), или
«хвост к хвосту» (VIII):
С
£>С-С—С-С-С-С-С £>С-С—С-С-С-С<£
(VII) (VIII)
Вот как можно расчленить на «изопреновые единицы» уже
известный нам бетулин (I), а-амирин (IX), р-амирин (X), од-
197
нако ланостерин (XI), наиболее близкий по строению к
стероидам, расчленить на «изопреновые единицы» не удается:
Есть и другие полиизопреноиды с подобной архитектоникой,
к которым данное правило неприменимо. И все же многим ис*
следователям казалось, что обнаруженная закономерность
в строении неслучайна и является следствием какой-то более
сложной закономерности.
Внешне незначительный, а на самом деле очень важный
результат был получен в 1926 г. английским биохимиком X. Чен-
ноном. Он показал, что добавление в пищу крыс сквалена (XII)
приводит к увеличению в их печени количества холестерина
(XIII). Само по себе это могло быть не слишком интересным —
мало ли какие вещества могут изменить интенсивность синтеза
и распада холестерина в печени крыс! Но здесь важное
значение имела близость структур сквалена (XII), холестерина
(XIII) и ланостерина (XI). Известный английский
химик-органик, основатель химии природных соединений Роберт Робинсон
отметил, что структура сквалена очень напоминает по контурам
198
структуру холестерина, если первую «сложить» особым образом
(ХПа).
Если из молекулы (ХПа) удалить три метильные группы
и превратить ее в циклическую структуру, то «получится»
углеродный скелет холестерина. Он предположил, что сквален
превращаете^ в холестерин в печени крысы.
Такую гипотезу очень трудно проверить экспериментально,
но все же ее проверили... через 27 лет. Трудность состояла
в том, чтобы синтезировать сквален, меченный в определенных
положениях, — синтетический сквален не желал превращаться
в холестерин ферментами печени крысы. Дело было в том, что
в синтетическом сквалене никак не удавалось получить то же
расположение двойных связей, что и в природном. Эту
трудность обошли следующим образом: сначала подобрали условия,
при которых ферменты печени крысы превращали
радиоактивную уксусную кислоту в сквален, сквален выделили в чистом
виде, установили распределение в нем меченых атомов, а затем
превратили этот сквален в холестерин под действием гомоге-
ната печени крысы. Теперь оставалось только сопоставить
распределение меченых атомов в холестерине с тем, которое
ожидалось по гипотезе Р. Робинсона. И здесь исследователей ожидал
сюрприз: распределение «метки» в холестерине не
соответствовало ожидаемому по гипотезе Р. Робинсона. Но главное было
сделано — экспериментально доказано, что именно сквален
превращается в холестерин в печени крыс. Осталось только
развернуть молекулу сквалена иным образом, как (XII),—
и все стало на свои места; Теперь распределение «метки»
в сквалене соответствовало таковому в холестерине.
И вот здесь, после тридцатилетнего перерыва, на сцену вновь
вышел Л. Ружичка. Ему удалось связать все
экспериментальные факты, накопившиеся к тому времени, и предложить
биогенетическое изопреновое правило, согласно которому все три-
терпены образуются в природе циклизацией сквалена. Он даже
предсказал стер'еохимические особенности циклизации в каждом
конкретном случае. Ход циклизации определяется конформацией
сквалена, которая создается ферментом. Мы рассмотрим
упрощенный механизм циклизации (стрелками на схеме показана
миграция ионов водорода и метильных групп):
199
Циклизация сквалена начинается, согласно Ружичке, с
атаки терминальной двойной связи сквалена катионом ОН+, при
этом образуется катион (XIV), в котором положительно
заряженный атом углерода находится в непосредственной близости
к двойной связи. Естественно, что этот атом углерода атакует
электроны двойной связи, что приводит к замыканию кольца
и образованию нового катиона (XV), у которого положительно
заряженный атом углерода вновь расположен рядом с двойной
связью. Процесс циклизации продолжается вплоть до
образования тетрациклического катиона (XVII), который превращается
в нейтральную молекулу (в данном случае в ланостерин),
после миграции двух метальных групп, двух атомов водорода
и отщепления протона. Предполагается, что на самом деле весь
процесс циклизации происходит синхронно и протекает с
высокой скоростью, это и обеспечивает высокую стереоспецифич-
кость процесса. Механизм циклизации очень сложен, и детально
мы его рассматривать не будем. Запомним лишь основную
идею.
Гипотеза Ружички была много раз подтверждена
экспериментально на самых разных объектах, и всегда предсказания
соответствовали экспериментальным фактам. Поправка к этой
гипотезе появилась лишь в 1966 г., когда американские
ученые Е. Д. Кори и Е. Е. ван Тамелен доказали, что в
циклизации принимает участие не сам сквален, а его окись (XVIII).
Это упростило исследование механизмов циклизации в
биологических системах, поскольку окись сквалена в отличие от
сквалена не является симметричной молекулой, и при использовании
ее можно получать очень наглядные доказательства пути
циклизации.. Так, при циклизации 15-норсквалена (XIX)
ферментами печени крысы был получен стероид (XX), что подтверждает
200
именно ту последовательность миграции метильных групп,
которую допускал Ружичка:
(XVIII) (XIX) (XX)
НЕТ НИЧЕГО ПРАКТИЧНЕЙ ХОРОШЕЙ ТЕОРИИ
...Синтетики должны заниматься только
тем, чего не может предсказать ЭВМ.
А. Эшенмозер
Интересно, что гипотеза Л. Ружички нашла сторонников
еще до своего экспериментального подтверждения, она в той
или иной степени применяется при доказательстве строения
новых природных полийзопреноидов. Так, использование
биогенетического изопренового правила позволило значительно
упростить доказательство строения цеорина. Вот как это произошло.
На первых этапах исследования как из спектральных данных,
так и из результатов химической деструкции цеорина можно
было предложить несколько равновероятных формул, которые
объясняли полученные результаты. Далее в таких случаях
проводят новые опыты с тем, чтобы уточнить, какая из нескольких
структур и есть истинная. При планировании дальнейших
исследований было учтено, что некоторые из- имевшихся формул
нельзя «вывести» на основании гипотезы Ружички, и такие
структуры сразу перешли в разряд маловероятных. Уменьшение
числа возможных формул для цеорина позволило резко
сократить объем работы.
Стероидные гормоны и препараты, полученные на их основе,
имеют большое практическое значение, поэтому разработаны
самые различные методы получения этих соединений. Мы
остановимся сейчас на пути синтеза, подсказанном самой
природой,— биогенетически подобной циклизации. Одно из последних
исследований в этой области — это синтез ацетата
гидрокортизона, осуществленный В. С. Джонсоном с сотр. по следующей
схеме:
201
(сндяск
(XXIII)
(XXIV)
Ключевой стадией является превращение соединения (XXI)
в тетрациклический продукт (XXIII), из которого ацетат
гидрокортизона получают довольно стандартным путем. Механизм же
ключевой стадии весьма напоминает тот, который мы недавно
рассматривали: сначала происходит отщепление ОН-группы
с образованием катиона (XXII), который циклизуется по
только что приведенному механизму.
Ту же идею использовали в 1983 г. голландские химики
А. Макко и X. Вакк при получении гетероциклического
соединения (XXVI):
С(СН3/3
(XXV)
Хотя степень стереоселективности реакции циклизации
довольно высока, ее,~вероятно, можно еще повысить, изменяя
комбинации растворителей и условия реакции. Как знать, может
быть скоро мы станем свидетелями повторения достижения
Природы — полной стереоспецифичности реакции.
202
ОТ СТРОЕНИЯ СОЕДИНЕНИЙ
К ИХ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
И больше всего я дорожу аналогиями.
Я. Кеплер
На ранних этапах исследования всегда выясняют значимость
функциональных групп в осуществлении данного биологического
действия. Так, например, было установлено, что соединения
группы кортизона обладают противовоспалительной
активностью, причем для ее проявления необходим кислородный
заместитель при С-11. Ввести его в молекулу в ходе синтеза
достаточно сложно. Возникает вопрос, а нельзя ли обойтись без
него?
При решении этой задачи на помощь пришел метод аналогии.
В 1959 г. 'американские химики Р. Додсон и Р. Твеид
синтезировали 1-ацетилтиокортексолон (XXVII) —
снгон
первый стероид, лишенный кислородной функции при С-11, но
имеющий противовоспалительную активность. В чем же здесь
дело? Давайте сравним структуры этого соединения и
кортизона (IV). Легко видеть, что кислородный атом заместителя
при С-1 стероида (XXVII) лежит примерно в той же области,
что и кислородный атом кортизона в кольце С. А раз это так,
то не исключено, что сравниваемые соединения должны
обладать, по крайней мере в первом приближении, одной и той ж§
биологической активностью. Так в действительности и
оказалось. Более того, стероид (XXVII) способствует отложению
гликогена в печени, как и кортизон.
В данном случае авторы могли принимать поздравления.
Однако все не так просто, чтобы каждый раз можно было
надеяться на положительный результат. Начать хотя бы с того,
что мы не знаем точно, где лежит граница между аналогией
истинной и аналогией кажущейся. К тому же часто приходится
решать гораздо более сложные задачи, чем та, которую решили
американские ученые. И, наконец, самое главное: при решении
принципиально новых задач аналогий просто нет, нет потому,
что задача решается впервые. Поэтому в настоящее время при
203
решении новых задач приходится все глубже проникать в
тайны молекулярной биологии. Но об этом пойдет речь в
следующем разделе очерка.
СТЕРОИДЫ ПРОТИВ АТЕРОСКЛЕРОЗА
И бездна нам обнажена.
Ф. Тютчев
Вернемся к эстрогенам, которые мы на время оставили.
Долгое время они применялись при лечении гормональной
недостаточности, некоторых форм рака молочной и
предстательной железы. Но со временем выяснилось, что эстрогены имеют
и серьезные недостатки: при длительном их применении есть
вероятность возникновения злокачественных опухолей. Поэтому
интерес к ним резко упал, и сейчас их стараются использовать
только в тех случаях, когда других средств нет. Прекращен
и синтез модифицированных соединений на осйове эстрогенов.
Оправдано ли это? Нужно ли совершенно отказываться от
эстрогенов, уже немало послуживших человечеству? Нельзя ли
все же получить препараты, лишенные недостатков природных
гормонов?
Известно, что до 40 лет коронарный атеросклероз встречается
у женщин в 16 раз реже, чем у мужчин. С возрастом
заболеваемость женщин атеросклерозом увеличивается, и у пожилых
людей различия в частоте заболевания стираются вообще. Ряд
ученых сопоставляет эти факты с гормональным статусом
организма: пока в организме женщин функционируют эстрогены,
вероятность заболевания невелика, но по мере угасания
функции яичников (а они являются основным поставщиком
эстрогенов) риск заболевания резко возрастает. Другими словами,
природные эстрогены в определенной степени являются
естественными защитниками организма от коронарного
атеросклероза. Не означает ли это, что поиск лекарственных препаратов
следует вести на их основе? Разумеется, такие препараты
должны быть полностью лишены гормонального
действия — это не только снизит риск их применения до нуля,
но и позволит использовать эти соединения для лечения
мужчин.
В США довольно легко были получены аналоги эстрогенов
с пониженной гормональной активностью и заметным антиате-
росклеротическим действием, но дальнейшее снижение
гормональной активности сопровождалось исчезновением антиатеро-
склеротического действия. Поиск же самих стероидов для
предварительных испытаний проводился фактически без всяких
критериев отбора — испытывались любые синтезированные
соединения. Результат оказался обескураживающим — из более чем
204
600 стероидов (аналогов эстрогенов) ни один не обладал
нужными свойствами.
Совершенно очевидно, что такой метод проб и ошибок не
оправдал себя. И чтобы синтезировать стероиды, обладающие
необходимыми свойствами, нужно сначала изучить механизм
действия природных эстрогенов. Что же известно о механизме
действия эстрогенов? До 1962 г. о нем было известно очень
мало, и преже всего потому, что количество эстрогенов в
организме невелико, к тому же они действуют не сами по себе, а в
связи с соединениями неизвестной структуры, которых еще
меньше. Последние называются рецепторами эстрогенов. Было лишь
известно, что эти рецепторы локализованы главным образом
в «органах-мишенях», т. е. в органах, в которых они способны
накапливаться и на которые они могут действовать. В 1962 г.
американские химики Е. Дженсен и X. Джекобсен
синтезировали эстрадиол, в высокой степени меченный тритием. Это
позволило экспериментально зафиксировать связывание эстрадио-
ла с рецепторами в органах-мишенях. Оказалось, что рецепторы
имеют белковую природу, действительно присутствуют в малых
количествах, но обладают очень высоким сродством к эстрадио-
лу. Позднее было установлено следующее правило: чем выше
сродство стероида к рецепторам, тем больше вероятность того,
что такой стероид обладает высокой гормональной активностью.
Таким образом, если бы удалось выявить закономерности
связывания аналогов эстрогенов с рецепторными белками и
сопоставить их с влиянием модификаций на антиатеросклеротиче-
ское действие, то, в принципе, можно было бы рекомендовать
структуру стероидов с заданным действием. Эта работа и была
проведена в лаборатории химии природных соединений
Ленинградского университета.
К началу исследований было известно, что гидроксильные
группы эстрадиола играют важную роль в связывании с
рецепторами— их модификация или удаление уменьшают сродство к
рецепторам. Используя эти данные, мы получили аналоги
эстрогенов с заместителями, влияющими на связывание как гидрок-
сильной группы при С-3, так и гидроксильной группы в
кольце D. Кроме того, в исследованиях мы использовали 8-изоана-
логи (т. е. аналоги, в которых атом водорода при С-8 имеет
иную ориентацию, чем в стероидах природного ряда)—такие
соединения легче синтезировать, а это не последний довод при
выборе модельных соединений. Сравнивая сродство различных
8-изоаналогов к рецепторам, мы надеялись установить,
происходит ли связывание гидроксильных групп независимо друг
от друга, и если одна из гидроксильных групп важнее для
связывания, определить, какая именно. С этой целью были
синтезированы стероиды (XXVIII) —(XXXIII) (в .% дано
относительное сродство к рецепторам эстрадиола матки
крысы):
205
(XXXI), 24%
О
(XXXII), 10%
(XXXIII), б У.
В принципе, введение в стероид какого-либо заместителя
может приводить как к увеличению сродства
модифицированного соединения к рецепторам, так и к уменьшению. Сравнивая
сродство к рецепторам эстрадиола соединений (XXVIII)
и (XXXI), мы отмечаем, что введение кетогруппы в положение
С-6 приводит к падению сродства к рецепторам. Этот эффект
удобно характеризовать фактором влияния (это отношение
величины сродства,модифицированного соединения к величине
сродства ^модифицированного стероида). Легко заметить, что
фактор влияния кетогруппы при С-6 на связывание с рецепторами
не является постоянной величиной: в паре (XXVIII) — (XXXI)
он равен 0,24, в паре (XXIX) —(XXXII)—0,31, а в паре
(XXX) — (XXXIII) —0,46. Почему это так? Мы видим, что по
мере все более заметных модификаций в кольце D,
усиливающихся в ряду (XXXIII)-^(XXXIV)-^(XXXV), фактор влияния
кетогруппы как бы приближается к единице. Иными словами,
роль гидроксильной группы в кольце А этих соединений в
связывании с рецепторами становится все меньше (поэтому одна
и та же модификация — введение кетогруппы в положение С-6—
оказывает все меньшее влияние на связывание). А это значит,
что у всех синтезированных нами соединений доминирующая
роль в связывании с рецепторами принадлежит гидроксильной
группе в кольце D, иными словами, условия для наиболее
благоприятного взаимодействия с рецепторами создаются в первую
очередь для гидроксильной группы в кольце D.
Этот вывод очень важный, но как его подтвердить? Основная
идея простая: нужно синтезировать стероид, в котором
связывание гидроксильной группы в кольце D с, рецепторами было
бы очень затруднено или вообще невозможно по простран-
206
ственным причинам. Тогда доминирующая роль в связывании
волей-неволей перейдет к гидроксильной группе в кольце А.
В этом случае в рассмотренной нами модификации (введение
котогруппы в положение С-6) заметно ухудшатся связывание
с рецепторами (т. е. фактор влияния должен быть заметно
меньше 1). Для проверки этого вывода были синтезированы стероиды
(XXXIV) и (XXXV), изучено их связывание с рецепторами
эстрадиола. Сделанный ранее вывод
получил полное экспериментальное подтверждение: фактор
влияния кетогруппы в этой паре оказался равным 0,17. Отсюда
можно сделать и второе важное заключение: при синтезе
стероидных эстрогенов, не обладающих гормональной активностью,
совершенно обязательно проводить модификации в районе
обеих гидроксильных групп. Если эти модификации не
приводят к катастрофическому увеличению размеров стероида, то
можно надеяться, что у него сохранится антиатеросклеротиче-
ская активность. Теперь уже недалеко и до рекомендаций,
касающихся структуры аналога эстрогенов с антиатеросклероти-
ческим действием, но без гормональной активности.
Желаемыми свойствами могло бы обладать, например,
соединение (XXXVI). Оно было синтезировано и изучено в
Институте экспериментальной медицины им. акад. И. П. Павлова.
Заданные свойства этого стероида подтвердились._Сейчас на
кафедре химии природных соединений Ленинградского
университета получено уже 8 стероидов с заданными свойствами, но
точку ставить рано, ведь есть несколько типов атеросклероза,
препараты нужны для каждого из них.
207
СТЕРОИДЫ ПРОТИВ РАКА
Болезни отчаянные излечивают и
средства только отчаянные.
У. Шекспир
Оригинальные результаты чаще всего получают на основе
фундаментальных исследований. Так, изучая механизм действия
эстрогенов, группа американских и английских ученых пришла
к очень важным результатам при создании препаратов против
рака молочной железы.
Клиницистам уже давно было известно, что существуют,
грубо говоря, две формы рака молочной железы. Одна — гор-
монозависимая, в присутствии эстрогенов опухоль растет
гораздо быстрее. Вторая — гормононезависимая. Много сил было
отдано для разработки методов диагностики, так как для их
лечения используются различные средства, но особых успехов
достигнуть не удалось. Однако с изучением механизма действия
эстрогенов был сделан заметный шаг вперед и в области
диагностики.
Идея проста: эстрогены реализуют свое действие,
связываясь с рецепторами. Значит, если рецепторы эстрадиола в
опухоли есть, она гормонозависимая, если их нет —опухоль
гормононезависимая. В действительности дело обстоит не
совсем так (причины этого мы рассматривать не будем),
тем не менее точность диагностики заметно повысилась,
и это весьма важно, поскольку при эндокринной терапии
неоперабельных больных с гормонозависимыми опухолями молочной
железы часто применяют оперативное удаление яичников. Так
как эстрогены синтезируются именно в яичниках, то операция
приводит к уменьшению размеров опухоли. На некоторое время
наступает улучшение состояния больных, но затем все
возвращается «на круги своя»: эстрогены начинают синтезироваться
в других органах, например в надпочечниках. Что же, удалять
и и*? Но механизм действия эстрогенов в общих чертах уже
известен. Для проявления эстрогенной активности гормоны
должны связаться с рецепторами. А не поискать ли соединения,
предотвращающие это связывание, т. е. не синтезировать ли
антиэстрогены? Они нейтрализуют действие эстрогенов и
станут... противораковыми препаратами для лечения гормонозави-
симых опухолей. Такие антиэстрогены уже найдены, и один из
них 16р-этилэстрадиол (XXXVII). Однако наиболее
эффективным оказался тамоксифен (XXXVIII):
он
{XXXVIII)
(XXXVII)
208
Естественно, что антигормональные препараты используют
и при лечении других гормонозависимых опухолей, например
рама предстательной железы.
МЕТАБОЛИЗМ НА СЛУЖБЕ УЧЕНЫХ
Свой тайный смысл доверят мне предметы.
Б. Ахмад длина
Многие из нас, использовав для лечения удачно
подействовавший лекарственный препарат, наивно полагают, что именно
он и помог выздоровлению. В известной степени это так: не
прими мы данный препарат, выздоровление могло бы
затянуться. Но без детального исследования нельзя сказать,
подействовал ли сам введенный препарат или те соединения, которые
образовались из него в организме человека. Вот почему изучение
метаболизма лекарственных препаратов — важный этап
работы при создании новых лекарственных веществ.
Вот пример. Только что мы упомянули о противораковом
препарате тамоксифене, который помог уже не одной тысяче
больных. Дошла очередь до изучения его метаболизма — и что
бы вы думали? Оказалось, что он превращается в организме
в другое соединение, которое является намного более сильным
антиэстрогеном. Так что не исключено, что уже в скором
времени мы станем свидетелями создания нового противоракового
средства, и появление его окажется возможным только
благодаря исследованию метаболизма тамоксифена.
Метаболические превращения лекарств происходят под
действием ферментов, вот почему полезно знать их локализацию
в организме. Иногда это позволяет запланировать получение
лекарственного препарата с более направленным-действием и,
следовательно, с меньшим побочным эффектом. Помните, в
начале очерка мы отметили, что диэтилстильбэстрол, применяемый
при лечении рака предстательной железы, неблагоприятно
действует на сердечно-сосудистую систему? Две зарубежные
фирмы предложили новый препарат — фосфорилированный
диэтилстильбэстрол (названия препарата «хонван», «цитозан»). Чем
этот препарат лучше? Неблагоприятное действие диэтилстиль-
бэстрола обусловлено во многом его гормональным действием,
как, впрочем, и его действие на опухоль предстательной железы.
Фосфорилированное же соединение гормональным действием
практически не обладает. Идея заключалась в том, что в
предстательной железе находится фосфатаза, способная превращать
фосфорилированный диэтилстильбэстрол в гормонально
активное соединение, дефосфорилируя его. В других органах фосфа-
таз с подобными субстратными свойствами нет, поэтому дейст-
209
вие хонвана будет направлено главным образом на опухоль.
Что и говорить—прекрасное решение проблемы.
Еще один интересный пример. Мы уже говорили, что при
заболевании эстрогензависимым раком молочной железы наличие
в организме эстрогенов нежелательно и раньше их удаляли из
организма, лишая человека органов, в которых синтезируются
эстрогены. Знание путей биосинтеза эстрогенов позволяет
выбрать и другой путь. Установлено, что эстрадиол может
образовываться в организме человека и животных из тестостерона
(XXXIX) по схеме
ин
(XXXIX)
Представлялось интересным найти ингибиторы фермента
ароматазы, осуществляющей стадию ароматизации в этом
процессе. Оказалось, что соединение (XLI) связывается с аромата-
зой в том же центре, что и соединение (XL), но в отличие от
последнего оно не может превращаться в эстрадиол и потому
неопасно. В опытах на животных многократно показано, что
стероид (XL1) предотвращает развитие эстрогензависимых
опухолей. Кто знает, может быть в скором времени мы увидим
этот препарат в клинике!
МОЖНО ЛИ УПРАВЛЯТЬ ТРАНСПОРТОМ ЛЕКАРСТВ?
Какой же вред ты видишь в
осторожной попытке?
Эсхил
Если бы на этот вопрос можно было ответить положительно,
то тогда появилась бы возможность доставлять лекарства
только к пораженному болезнью органу и не заботиться о побочных
эффектах препаратов. Другой вопрос — как это сделать?
Сейчас еще только нащупывакуГся пути к решению этой проблемы.
210
В 1981 г. М. Сузуки с сотр. изучали транспорт
противоопухолевого антибиотика митомицина С в опухолевые клетки. Они
показали, что под действием амида ангиотензина-2 (вещества
пептидной природы), увеличивающего в определенной дозе
артериальное давление до 150 мм, возрастает поток крови в
опухолевую ткань примерно в 5,7 раза по сравнению с потоком
крови в непораженные органы. Естественно, что при этом имел
место более направленный транспорт митомицина С в опухоль
и отмечалось более сильное противоопухолевое действие его.
Может быть, эта работа станет важной вехой в деле
управления транспортом лекарств, хотя бы противоопухолевого
назначения?
В последние годы довольно широко исследуются в качестве
носителей лекарственных средств липосомы. Это сложные
комплексы, содержащие фосфолипиды и другие соединения.
Внешний слой липосом по структуре в некоторой степени
напоминает мембрану клетки. Встроенные в эту мембрану вещества
могут направлять всю липосому в определенные органы. Так,
в 1982 г. Р. И. Салганик с сотр. (г. Новосибирск) показали, что
включенный в состав липосом эстрадиол обеспечивает
транспорт липосом в орган-мишень эстрадиола — матку крысы.
Конечно, это первые попытки на пути решения проблемы, но
результаты обнадеживают.
ВМЕСТО ЗАКЛЮЧЕНИЯ
...когда заходит речь о будущем, не
находится ни достаточно умного, ни
достаточно дальновидного.
Гай Саллюстий Крисп
Можно ли прогнозировать синтез лекарственных препаратов
с направленным биологическим действием? Думается, что
материал очерка убедительно свидетельствует об этом. Учет всех
факторов, влияющих на биологическое действие препаратов,
безусловно, важен, и он оказывает огромную помощь при
планировании эксперимента. Вместе с тем напомним, что для
получения принципиально новых результатов требуется ни много,
ни мало принципиально новый подход, хотя бы в какой-то
части, исследования. А он начинается тогда, когда удается
перепрыгнуть через барьер кажущейся очевидности и взглянуть на
проблему другими глазами. Это удается не каждому
исследователю и тем более не каждый день. Поэтому нельзя предсказать,
в каком именно направлении современной науки произойдет
качественно новый скачок, позволяющий синтезировать новые
лекарственные препараты на качественно новом уровне. Мы
изложили лишь современное состояние вопроса. И, как говорил
А. Фет, «несбыточное грезится опять».
211
СУДЬБА ДОЧЕРНЕГО УРАНА
Я плавал морями в заботах о ней,
Я лазил по скалам за горстью камней,
И все же не в силах понять до сих пор:
Когда превращается в истину спор?
В. В. Чердынцев. Десятая муза.
ридцать лет назад был открыт эффект разделения
в природе четных изотопов урана — 238U и 234U.
Казалось бы, «тихий» научный факт, не имеющий
прямого технологического или хозяйственного
предназначения. Но как и любое добротное научное
исследование, это открытие породило длинный «Шлейф» новых
научных работ, (которые проводятся и до сих пор) и неминуемо
привело к ряду полезных применений: для геологического
датирования и понимания геохимических процессов, изучения
гидрологических систем, для разведки урановых месторождений,
а также в связи с задачами захоронения радиоактивных
отходов, защиты окружающей среды от радиоактивных
загрязнений и т. д.
Прошло несколько десятилетий, и эффект разделения в
природе изотопов урана-234 и урана-238 представляется столь
очевидным, так естественно вытекающим из развития
радиохимических знаний, что кажется, будто и открывать-то было нечего.
Но это впечатление — лишь иллюзия, лишь очередное
«колумбово яйцо». В действительности природное разделение
изотопов урана — эффект тонкий и связан с таким множеством
причин и факторов, что для его объяснения пришлось привлекать
сразу несколько областей знания: минералогию,
гидрогеологию, геохимию, физику твердого тела, учение о
радиоактивности, химию «горячих» атомов... И все равно многое до конца
неясно.
Вот об этом сложном и любопытном явлении — эффекте
естественного разделения изотопов 234U и 238U — мы и хотим
рассказать в нашем очерке.
212
РАДИОАКТИВНЫЕ «ОТЦЫ» И «ДЕТИ»
Бренность бытия является характерной
чертой атома и резко проявляется в
земной коре.
В. И. Вернадский
Возьмем в руки обычный камень, один из тех, что в
бесчисленном множестве оставлены в наших краях прошедшим
когда-то ледником. Не будет преувеличением сказать, что мы
найдем в нем (конечно, с помощью высокочувствительных
методов химического анализа) почти все элементы
периодической системы, в том числе и радиоактивные. Попав по воле
случая в минерал и затем в горную породу, захваченные
кристаллической решеткой, атомы покорно и пассивно миллионы
лет томятся в ней, как в темнице. Правда, о радиоактивных
атомах так, пожалуй, не скажешь: они словно бы
сопротивляются судьбе и ведут действительно «активный» образ жизни.
Мало того, что они постоянно излучают энергию в
окружающую среду в виде гамма-квантов, альфа- и бета-частиц и
благодаря этому попадают в бесконечные химические «истории»,
они еще и видоизменяются, превращаются в новые
радиоактивные атомы, те, в свою очередь, — в другие и т. д. Образуются
длинные радиоактивные цепочки, или, как их называют,
радиоактивные ряды, или семейства. Говоря словами великого
французского ученого и мыслителя Анри Пуанкаре, «дверь,
запирающая внутренний мир атома... время от времени приотворяется;
это происходит, когда, испуская частицу гелия, атом
разрушается и спускается на один ранг в иерархии
радиоактивности». Например, изотоп урана с атомной массой 238 испускает
альфа-частицу и превращается в изотоп тория с массой 234,
торий излучает бета-частицу и превращается в протактиний-234
и т. д. Эти последовательные превращения, образующие
урановый ряд, можно изобразить следующей схемой:
238(J 4 234Th X 234ра !> 234JJ 4 230^ 4 226Ra 4 222Rn4 —
Каждый член в таком ряду является дочерним по отношению
к предыдущему — материнскому. Конечно, в природе есть и
другие семейства, например ториевое:
232Th4228Ra4228Ac^228Th4224Ra4220Rn42l6Po4...
Для всех радиоактивных рядов справедлив один и тот же
закон распада и накопления, а именно: в состоянии равновесия
величина радиоактивности всех членов данного радиоактивного
семейства одна и та о/се. («В состоянии равновесия»—:запомним
эти слова, но задерживаться на них пока не будем.) Это
означает, что и уран-238, ядро которого живет миллиарды лет, и ра-
213
дсн-222 со временем жизни в несколько дней и полоний-214,
появляющийся на белый свет на ничтожные доли секунды,—
все члены этого семейства имеют одну и ту же величину
радиоактивности. Неудивительно ли это? Здесь мы вторгаемся в
кинетику мономолекулярных (спонтанных) процессов, частным
случаем которых является радиоактивный распад.
Пусть в данный момент времени в образце имеется N не-
распавшихся радиоактивных ядер, тогда в ближайшую
секунду должно произойти примерно KN распадов, если буквой Я
обозначить вероятность распада ядра в единицу времени. Это
число распадов и называется радиоактивностью (или просто
активностью) данного образца. Обозначив ее буквой Л, можно
записать, что
Величина X получила название постоянной распада и служит
мерой неустойчивости атомных ядер. Формально (да и по сути)
К аналогична константе скорости мономолекулярной
химической реакции.
Распавшиеся ядра прекращают свое существование,
превращаясь в новые, поэтому количество распадов за истекшую
секунду уменьшается на л¥. Уменьшение N за единицу времени
есть взятая с обратным знаком производная этой величины по
времени. Отсюда получаем дифференциальную форму закона
радиоактивного распада
Интегрирование этого дифференциального уравнения дает
выражение
ft = N0e~xt, (1)
где N=jVc(/ = 0)—число ядер в образце в момент времени,
принятый за начальный.
Интегральная форма закона радиоактивного распада (1)
показывает, сколько еще осталось нераспавшихся материнских
ядер по прошествии времени t. «Печать случая», лежащая на
этом законе, выражается в его экспоненциальной форме: в
равные промежутки времени всегда распадаются равные доли (но
не равные количества) имеющихся радиоактивных атомов.
Отрезок времени, за который распадается половина имеющегося
их количества, называют периодом полураспада Т. (С равным
успехом за эту долю можно было бы принять 1/3, 1/4, 1/10 часть
распавшихся атомов, но 1/2 — самый простой случай.) Период
214
полураспада и константа распада связаны между собой обрат-
но пропорциональной зависимостью 7,=1п2/Я, вытекающей из
определения 7V
ЗАКОН РАДИОАКТИВНОГО СЕМЕЙСТВА
Закон — это постоянная связь между
предыдущим и последующим...
А при Пуанкаре
Получив экспоненциальный закон радиоактивного
распада (1), мы тем не менее не ответили пока на вопрос: каково
соотношение активностей дочерних и материнских
радионуклидов в радиоактивном ряду?
Обратимся снова к дифференциальным уравнениям. Изме-
dN2
нение числа дочерних ядер ~^р происходит в результате
накопления дочерних ядер при распаде материнских со скоро-
стыо —fo~ и распада дочерних с образованием «внуков» со
скоростью A,2iV2. Эти два процесса можно учесть в одном
дифференциальном уравнении
fa fa Л2 /V2 — AliVl A2iV2»
где индексы 1 и 2, как нетрудно понять, относятся
соответственно к материнским и дочерним ядрам. Решение его с
помощью стандартных приемов и с учетом соотношения (1) дает
Это уравнение несложно, но в таком общем виде не достаточно
наглядно. Поэтому, примем три допущения, которые помогут
нам его упростить, не нарушая в то же время физического
смысла.
1 Пусть элементарная, «учебниковая» форма изложения материала не
создает у читателя ложного представления, что здесь все ясно и данный
вопрос имеет лишь педагогический или исторический интерес. Отнюдь нет.
(В науке надо бояться не рутинных вопросов, а рутинных.ответов!) И
сейчас, в 80-е годы, в физических журналах появляются статьи, в которых при
выводе экспоненциального — его называют «квазиэкспоненциальным» —
закона радиоактивного распада к временной форме уравнения Шредннгера
применяют преобразование Лапласа. При этом абсолютно строгий и точный
вывод затруднен, и приходится прибегать к некоторым допущениям,
касающимся состояния конечных ядер. Высказываются также мысли, что
экспоненциальная форма закона выполняется не во всем интервале времен
распада: при /-50 Т скорость распада замедляется. Полагают, что именно
благодаря этому отклонению от экспоненты на Земле сохранилось некоторое
количество изотопа плутония 2,4Ри.
215
1. Пусть Л;2(о)=0. Это означает, что материнское вещество
в тот момент, когда мы начали за ним наблюдать, не
содержало дочернего вещества (например, было полностью очищено
от накопившихся дочерних ядер). Следовательно, Л^2(0)^~х^=0.
2. Пусть ><2>^ь т. е. дочернее вещество распадается
значительно быстрее материнского (скажем, быстрее в 100 и более
раз). Тогда Аг—h^h. (Обратное допущение hi>ta физически
бессмысленно, поскольку тем самым мы лишаем себя
материнского нуклида.)
3. Пусть интервал времени, в течение которого мы
наблюдаем за процессом накопления дочернего вещества, мал по
сравнению с периодом полураспада материнского. (Например,
ведем наблюдение в течение месяца за накоплением 222Rn из
226Ra, а период полураспада последнего 1620 лет.) Тогда N\ ~
~jVi(0) йг^ = г^2/^1,
В результате всех допущений приходим к выражению
Это уравнение, описывающее временной закон накопления
дочерних ядер из материнских, обладает одной замечательной
особенностью: с увеличением t второй член в скобках быстро
стремится к нулю, и, следовательно, число дочерних ядер
приближается к предельной, «равновесной» величине N2=(h\lX2)N]y
откуда uiAfi=X2Ar2. Поскольку любое дочернее ядро является
материнским по отношению к своему потомку, то и для всех
членов радиоактивного семейства имеет силу закон равенства
активностей
л1Л^1=л2М = Х3ЛА3= ... =\lNi. (2)
Именно об этом предельном законе, характеризующем
состояние так называемого векового равновесия в радиоактивном
семействе, мы и хотели рассказать в этом разделе очерка.
Заметим, что вековое равновесие достигается довольно быстро:
с хорошей точностью через 5—10 периодов полураспада
наиболее долгоживущего дочернего нуклида в семействе. И пока
неизменна (конечно, лишь в рамках допущения 3)
радиоактивность материнского вещества, радиоактивность всех его
потомков также будет постоянной величиной, равной активности
родоначальника семейства. Уменьшаться же дочерние, внучатные,
правнучатные и т. п. активности будут только вместе с
распадом материнского вещества, чутко прислушиваясь к скорости
его распада. К счастью, время жизни ядер 232Th, 235U, 238U
слишком велико, чтобы в наших дальнейших рассуждениях
принимать в расчет распад этих ядер.
216
РАВНОВЕСИЕ НА ЭКРАНЕ АЛЬФА-СПЕКТРОМЕТРА
Достоинство хорошей методы состоит
в том, что она уравнивает способности; она
вручает всем средство легкое и верное.
Ф. Бэкон
Кто-то из мудрых сказал, что важен не столько сам закон,
сколько отклонения от него. Эта мысль имеет непосредственное
отношение к нашему рассказу, но чтобы она нашла
подтверждение в опытных данных, нужны тонкие экспериментальные
методы. Говорить о равновесии между радионуклидами (или об
отсутствии его), о химическом поведении отдельных изотопов
можно лишь при условии, если мы, как минимум, умеем эти
изотопы различать. Традиционные химико-аналитические
приемы здесь ничего не дают. Не всегда надежна при работе с
природными радионуклидами и регистрация гамма- и
бета-излучений, рентгеновских лучей или осколков деления. Что же
остается в этой, если не пустыне, то «голодной степи» методов
распознавания природных изотопов? Отдельным спасительным
оазисом виднеется здесь спектроскопия альфа-излучений.
Метод альфа-спектроскопии tT04Hee> спектрометрии) не
имеет себе равных по чувствительности, точности,
универсальности и простоте технического оформления при изучении
многих природных радионуклидов и искусственных актинидных
элементов. В основе его лежат два физических факта: факт
первый — электрический заряд, создаваемый альфа-частицей
в веществе детектора при процессах ионизации,
пропорционален ее энергии; факт второй — все ядра, склонные к альфа-
распаду, испускают альфа-частицы строго определенной энергии
(или ограниченной группы энергий), характерной для каждого
конкретного ядра.
Естественный вывод из этих
двух посылок: измеряя заряд,
создаваемый альфа-частицей в
детекторе, можно определить ее
энергию и по справочным
таблицам отыскать соответствующий
радионуклид, которому эти
альфа-частицы принадлежат. Зная
же эффективность счетной
установки (из предварительных
калибровочных опытов), нетрудно
рассчитать и количество
интересующего нас альфа-излучателя.
Следовательно, задача
экспериментатора состоит в том, чтобы
разложить изучаемое альфа-
N
120
80
<*0
ft
тЪ
\
i «»T1
ш
ф,42)
1
[
40 60 120
Номер канапа
Рис.1
217
излучение в спектр по энергиям альфа-частиц (говоря
«аппаратурным» языком — получить амплитудный спектр
электрических сигналов, снимаемых с детектора) и расшифровать этот
спектр, пользуясь табличными данными. При современном
уровне электронной техники и радиометрии эта задача легко
решается с помощью простейших многоканальных анализаторов
импульсов.
Вот, например, как выглядит альфа-спектр двух изотопов
тория — 232Th и -228X1, (находящихся в вековом равновесии друг
с другом) сразу же после их химического выделения (рис. 1):
на оси ординат здесь отложено число альфа-частиц Na ,
наблюдаемых в определенном энергетическом интервале Д£"а , рав-
1 ш
к 1
Li
Th "*Ra гмйп
ВО (5,B8)(6,28)
1 М|
1
wTh
ш
МП
Ё
г"Ро
(6,7а)
II ги^
тн»,»)
j 11 i
гчРо
(8,78)
1
1
1 i
IV 1
\ 1 \ 1\ А* \*1 \\1 \ \ I 1 /Д |_
ЬО 60 80 100 120 Ш
Номер канала
Рис. Z
ном ширине канала анализатора; на оси абсцисс — порядковый
номер канала; в скобках приведены энергии альфа-линий в
мегаэлектронвольтах (МэВ). Из спектра видно, что генетически
связанные изотопы обладают одинаковой радиоактивностью,
мерой которой является площадь каждого пика. Маленький
пик между крайними принадлежит члену уранового ряда — то-
рию-230, активность которого может быть и больше
активности 232Th и 225Th, и меньше, в зависимости от того, из какой
руды выделялась химическая фракция тория — из урановой или
ториевой.
А вот тот же спектр через месяц (рис. 2). Новые альфа-
линии появились потому, что все радиоактивное семейство, при:
шло в вековое равновесие, хотя для этого вовсе не
понадобилось ждать века и геологические эпохи. Объяснение простое:
самым большим долгожителем в ряду после 228Th является
224Ra с Г—-3,64 дня. Он-то и определяет время установления
218
равновесия. Два пика меньшей высоты по сравнению с
остальными (212Bi и 2,2Ро) отнюдь не свидетельствуют об отсутствии
равновесия в семействе. Просто в этих звеньях радиоактивной
цепочки часть радиоактивных превращений устремилась по
руслу бета-распадов.1
Теперь обратимся к главному герою нашего очерка — к
урану. Альфа-спектр его изотопов имеет вид, показанный на
рис. 3. Как и на ториевом спектре (см. рис. 1), в вековом
равновесии друг с другом находятся только активности крайних
пиков, т. е. только четные изотопы урана — материнский 238U
и дочерний 234U. Уран-235 генетически
не связан с 238U и как родоначальник Ncc ыа,
и «патриарх» является главой
собственного радиоактивного семейства.
Количественной характеристикой §до|
равновесия, как и мерой отклонения
от него, является отношение величины
дочерней альфа-активности к материн- ьоо\
ской. По отношению к изотопам урана
это отношение принято обозначать
греческой буквой уу т. е. 200\
Т = ^234 А/034А2З8 /V238 = ^234/^238*
U(V4) ,J*u(Vfl
Естественно, что при равновесии у=\.
В специальной литературе вместо
буквы А часто записывают символ
соответствующего изотопа,
подразумевая при этом, что речь идет все же
об отношении активностей, а не об
отношении масс.
ЬО 80 110
Номер канала
РисЗ
ЗАКОН ЕСТЬ ЗАКОН, НО..
То, что казалось школьным, настольным,,
скучным, отжившим, давним,—
вдруг оказалось краеугольным
камнем...
Я. Белинский
Мудрый читатель детективов, наверное, уже понял, что за
эпически-спокойным описанием незыблемых законов природы
последует крутой поворот сюжета. И он прав. Изложенные
выше сведения, конечно же, не являются «откровением от
физики». Казалось бы, что тут было проверять советскому геофи-
1 Альфа-спектры мы приводим в слегка «приглаженном» виде, без учета
их тонкой структуры. При изучении природных веществ большая
прецизионность, как правило, является избыточной.
219
зику и геохимику В. В. Чердынцеву? Равновесие есть
равновесие. Но, как заметил однажды гроссмейстер М. Таль,
шахматист экстракласса отличается от любителя тем, что играет
на исключениях из правил.
На III сессии Комиссии по определению абсолютного
возраста геологических формаций в марте 1954 г. В. В. Чердынцев
сообщил, что им и его учеником П. И. Чаловым (ныне чл.-кор.
АН КиргССР) в некоторых природных водах обнаружено
отклонение изотопного отношения 224U/238U от равновесного:
значения у, кдк правило, были больше единицы.
Исследователи работали на юге СССР и, в частности, в
Казахстане, поэтому в докладе В. В. Чердынцева фигурируют
такие названия, как Заилийский Ала-Тау, Талгар, река Иртыш,
источник Алма-Арасан и т. д. Как сильно отличались значения
у от единицы? В одном ледниковом озере, расположенном
высоко в горах в Казахстане, у в пределах точности определений
не отличалось от единицы, зато в некоторых горных источниках
оно составляло от 1,5 до 3,0, а в ручье под названием Джанбир-
Чинбулак в бассейне Иртыша отношение изотопов урана
достигло 8,0±1,3.
Интересовал исследователей и состав изотопов урана в
твердой фазе. Одним из изученных ими минералов был шрекинге-
рит.1 Легкорастворимый и недолговечный в природе, он
оказался, по словам Чердынцева, «удачной находкой». Соотношение
изотопов урана в этом минерале было равно 3,7±0,5.
В. И. Вернадский еще в 1934 г. писал: «... должно быть
обращено внимание на возможность различных темпов и форм
миграции для одного и того же химического элемента,
характеризуемого одним и тем же атомным числом для всех его
изотопов». И. Е. Старик в 1943 г. и Е. С. Щепотьева в 1944 г.
близко подошли к идеологии неравновесного изотопного состава
радиоэлементов в окружающей нас природе, но, очевидно, время
открытия еще не пришло. До него оставалось еще 10 лет.
Стоит подивиться экспериментальному мастерству и
интуиции Чердынцева и Чалова, которые в очень трудоемких опытах
при низком уровне радиометрии смогли обнаружить эффект
нарушенного изотопного равновесия. Из-за малого содержания
урана в природных водах для одного опыта приходилось брать
от 10 до 200 литров воды, ибо чувствительность и точность
определений в начале 50-х годов были очень низкими. Вот как
описывает Чердынцев технику альфа-спектрометрии в своей
книге «Уран-234» (М., 1969): «Первые поиски проводили на
весьма несовершенной аппаратуре... Препарат покрывали
слоями папиросной бумаги для фильтрации альфа-излучения.
Поскольку энергия альфа-частиц 234U на. 16% больше, чем у 238U
(точнее, на 13,8%. —Р. £.)» можно было ожидать, что при пра-
1 Приблизительная формула ЫаСаз^ОгКСОзЫЗО^-Р-ЮНгО.
220
вилъном подборе фильтра удастся поглотить основную массу
альфа-частиц 238U и сохранить некоторое количество излучения
234U». Невольно вспомнишь слова Г. Лейбница: «На свете есть
вещи поважнее самых прекрасных открытий, — это знание
метода, которым они были сделаны».
ВСЕМИРНЫЙ РОЗЫСК «ЕДИНИЦЫ»
Да был ли мальчик-то, — может
мальчика-то и не было?
М. Горький. Жизнь Клима Самгина.
Сообщение В. В. Чердынцева вызвало большой интерес в
научном мире. Начались аналогичные исследования сначала в
Советском Союзе, затем в США, Японии, Индии, Австралии
и в ряде других стран. Эффект естественного разделения
изотопов урана-234 и урана-238, который по справедливости можно
было бы назвать именем его первооткрывателей, подтвердился.
В ходе исследований тщательному изотопному анализу
подверглись воды рек, озер, морей, океанов, минеральных
источников, артезианских скважин, разломов земной коры; изучались
минералы, горные породы, почвы, ископаемые кости и т. д.
и т. п.1 Если нанести на географическую карту мира
имеющиеся сейчас сведения по величинам у для различных типов вод,
то эти цифры довольно плотно распределятся по всему
земному шару так, что «белых пятен» останется немного. И вовсе уж
немного нам встретится случаев, когда значение у в точности
окажется равным 1.
Вот некоторые цифры. Волховская вода имеет почти
равновесное соотношение изотопов урана—1,06. В Волге (в районе
г. Углича) 7=1»31; в реке Нерли—1,46. В такой равнинной
реке США, как Миссисипи, у = 1,25; в засоленных и горных
реках штата Юта у повышается до 1,98—2,00, а в горной речке
Уильям Грик (штат Айдахо) у достигает 6,35.
В озерах интервал колебаний у несколько меньше: 1,05—
1,72. Здесь величина у отражает, как правило, совокупное
отношение изотопов урана в питающих ручьях и реках (верхняя
граница указанного интервала относится к озеру Севан).
В свою очередь, всякий крупный внутренний водоем оказывает
влияние на окружающую среду. Когда измерили соотношение
изотопов урана в атмосферных осадках, выпавших в районе
г. Грозного, то нашли величину у=1Д Оказалось, что она
1 Об этих исследованиях, в частности, можно прочесть в книгах: Ч а-
jiob П. И. Изотопное фракционирование природного урана. Фрунзе, 1975;
Сыромятников Н. Г. и др. Радиоактивные элементы как геохимические
индикаторы породо- и рудообразования. М,., 1976; Зверев В. Л. и др.
Радноизотопная геохимия. М., 1980.
221
в точности совпадает с этой характеристикой для вод
Каспийского моря. Моря и океаны характеризуются несколько
меньшей величиной y» чем озера. Так, по различным данным,
в разных точках Мирового океана она колеблется в пределах
1,13—1,18. В качестве среднего значения сейчас принята, по
всей видимости, наиболее точная и наиболее универсальная
величина Y"l>!5±0,01, представляющая собой одну из мировых
констант в геологии. Она служит основой для многих расчетов
прикладного характера.
Итак, в какой воде мы купаемся, ясно. Какую воду мы пьем
при некоторых заболеваниях? Нарзан: 7= 1,40—1,60; Джермук:
7=1,51 —1,68; Арзни: 7 = 1,85—2,44. К слову, упомянем и о
«радоновых» водах. Благотворное действие радоновых ванн
связано обычно с избыточным по сравнению с равновесным
количеством, определяемым уравнением (2), содержанием
растворенных изотопов радона.
Интересно, что подземные воды, к которым можно отнести
и минеральные источники, как правило, имеют более высокие
значения уу чем поверхностные. Этот параметр, без сомнения,
зависит (хотя не всегда понятен механизм этой зависимости) от
происхождения вод, от типа пород, где формируются воды, или
пород, которые эти воды омывают. Приведем максимальные}
значения у—234U/*38U для подземных вод различного
происхождения:
Вода в породах: 7
метаморфических 1,6—1,9
вулканических 2,0
осадочных . . 2,6
изверженных 3,15—3,50
Вода в зоне тектонических нарушений . 7—9
Вода в периоды сейсмической активности до 11
Как здесь не вспомнить одно из изречений эллинской науки:
«Вода такова, какова порода, по которой она протекает».
Ограничимся пока приведенными цифрами. В отдельности
они все равно мало о чем говорят читателю. Звучать все эти
«гаммы» начинают только в едином многоголосом хоре, только
в сопоставлении друг с другом и приведенные в
соответствующую систему. Тогда в общем «звучании цифр»
профессиональное ухо уловит свои диссонансы, свои проблемы.
Интереснейшей из них является, например, проблема океанического урана.
Еще в 1969 г. В. В. Чердынцев писал: «Уран продолжает
поступать в Океан и сверху и снизу и ждет ученого, который
объяснит, где этот элемент находит себе пристанище». С тех
пор, как было осознано существование этого «уранового
парадокса», много всякой воды утекло, но сколько-нибудь полного
объяснения до сих пор нет.
222
В ПОПЫТКАХ ПОВТОРИТЬ ПРИРОДУ
Физик или наблюдает процессы
природы там, где они проявляются в наиболее
отчетливой форме и наименее затемняются
нарушающими их влияниями, или же, если
это возможно, производит эксперимент при
условиях, обеспечивающих ход процесса
в чистом виде.
Карл Маркс
Раздумывая над причиной дисбаланса изотопов урана в
различных природных водах, мы интуитивно чувствуем, что
разгадка кроется в процессах взаимодействия вод с
горными породами, в каких-то тонких деталях этого
взаимодействия. Поэтому сначала вспомним некоторые свойства
горных пород, которые пригодятся в дальнейших
рассуждениях.
Отличие природных кристаллов от их искусственных
собратьев не только в более сложном и часто невоспроизводимом
химическом составе, но и (что особенно важно) в специфической
дефектности их внутренней структуры. Минерал за время
существования в породах земной коры испытывает постоянное
воздействие различных факторов и в первую очередь давление
тектонических сил, вызывающих напряжение и появление
микроскопических трещин в природном кристалле. Ширина таких
трещин, беспорядочно рассекающих тело кристалла,
первоначально сопоставима с несколькими межатомными
расстояниями. Эта микронарушения способны увеличиваться в своих
размерах по мере дальнейшего разрушения минерала и
превращаться в капилляры, поры, полости и т. д. Таким образом,
минералы представляют собой типичные поликристаллические
образования— скопление зерен, разделенных промежутками
и внутренними границами. И вот мы подошли к главному:
большая внутренняя поверхность — важнейшая характеристика
природного кристалла.
А дальше вступает в действие вода. Находясь, как и вся
окружающая порода, под давлением вышележащих слоев
земной коры, вода заполняет эти разнообразные дефекты и,
воздействуя на их стенки, вызывает дальнейшее разрушение
минерала, уже, так сказать, химическое. Это взаимодействие дает
начало природным растворам и рассолам, ибо они в
значительной мере формируются за счет капиллярных (поровых)
вод. И если бы мы рассуждали не об изотопных эффектах,
а просто, скажем, о факте нахождения урана или любого
другого элемента в природных водах, то темы для дискуссий не
•было бы. Химические свойства большинства членов
радиоактивных цепочек разные, и переход их в водную среду из
минерала, естественно, не может быть одинаковым, а следовательно,
223
равновесие между ними просто не может, не име:ет права не
нарушиться.
Еще в 30-х годах советский радиохимик и геохимик
И. Е. Старик экспериментально доказал, что из урановых
минералов можно извлечь радий «мягким» воздействием
растворов солей или разбавленных кислот на минералы, которое он
назвал выщелачиванием. Оказалось, что радий относительно
легко переходит из твердой фазы в такие водные вытяжки.
Понять это можно. Как один из дочерних продуктов распада
урана, радий обладает совершенно иными кристаллохимическими
свойствами, чем материнский атом, а потому он чужд
кристаллической решетке уранового минерала. Радий или не входит
в кристаллическую решетку, или занимает в ней «незаконное»
положение, легко переходит в микродефекты и далее в воздей-
Таблица 1
Образец
Содержание
урана
в образце, %
40-60
0,2-7,9
0,07-0,6
Ю-4-10-3
10-4-Ю-з
0,03-0,35
0,03-0,26
Доля урана,
перешедшего
в вытяжки, %
0,08-5,8
3,8-39,0
0,05—0,5
1,0-25,0
0,5-7,5
1,3—3,4
0,9-4,8
т
в вытяж
1,0—U
1,0-1,25
1,0-1,5
1,2-2,4
2,1—3.8
2,8-5,2
3,0-7,2
Оксиды урана
Руды с вкраплениями настурана . .
Акцессорные и пегматитовые
минералы
Осадочные породы ...
Изверженные породы
Уран-фосфатные руды .
Уран-молибденовые руды
ствующие растворы. И, конечно, при этом нарушается
равновесие между оставшимся в минерале ураном, торием и
цепочкой нуклидов, следующих за радием.
Но если это понятно по отношению к разным элементам, то
можно ли ожидать фракционирования изотопов одного и того
же элемента при выщелачивании? Ведь химические свойства
изотопов одинаковые, а небольшая разница в массах для столь
тяжелых ядер не может объяснить наблюдаемых эффектов.
Внести ясность в эту ситуацию поможет эксперимент.
Приготовим раствор, в какой-то мере отражающий состав природных
вод, например 1%-ный раствор Na2C03. Зальем этим раствором
порошки различных пород и минералов и оставим их на
несколько суток, время от времени встряхивая сосуд.
Что же мы обнаружим в вытяжках? Ответ на этот вопрос
можно найти в работах многих исследователей и, в частности,
в указанных выше монографиях. Некоторые данные такого
эксперимента мы приводим в табл. 1. Видно, что изотопы ура-
224
на переходят в жидкую фазу действительно в различной
степени. Налицо необычное явление — «теоретически» эффекта
разделения урака-234 и урана-238 вроде бы быть не должно, а он
есть. Не удивительно ли, что такая, казалось бы, простая
процедура, как действие содового раствора на минерал, приводит
к весьма значительному разделению изотопов урана, по
крайней мере для некоторых из образцов. Видно, не так уж прост
этот процесс выщелачивания, если он способен тонко
чувствовать различие между атомами, даже если эти атомы
принадлежат одному и тому же элементу.
Если мы сопоставим данные, приведенные на с. 222, и
данные табл. 1у то увидим, что значения у для пород одного и того
же типа, например для осадочных или изверженных пород,
близки. Тем самым можно провести аналогию между
природными и лабораторными процессами выщелачивания.
Разумеется, чем меньше урана переходит в раствор, тем в большей
степени обработка минерала похожа на вытяжку, а не на
растворение, и, надо думать, тем большее значение имеет у. Колонка
цифр, относящихся к содержанию урана в образцах, тоже
важна для понимания этих процессов. Так, например, с
уменьшением концентрации урана в образце у, в общем, растет, хотя
здесь есть свои тонкости: при близких концентрациях урана
в твердой фазе существенно влияет на эффект разделения то
состояние, в котором находится уран — в атомно-дисперсном или
минерально-дисперсном.
Итак, отвлекаясь от деталей, которых мы могли бы найти
еще много, в качестве рабочей гипотезы можно предположить,
что и в лаборатории, и в природе эффект фракционирования
изотопов урана вызывается одними и теми же процессами —
выщелачиванием урана из пород и минералов, выщелачиванием,
протекающим с разной интенсивностью для изотопов 238U
и 234U.1 Несомненно, что имеется немало различий между
природными процессами и модельными опытами. Вот некоторые
из них, наиболее заметные.
1. Массивы горных пород — это отнюдь не граммы
порошков, с которыми имеют дело в лабораториях. И поверхность и
доступность к внутренним полостям и капиллярам у них
различная.
2. Длительность выщелачивания в природных условиях
измеряется не часами или сутками, а веками и тысячелетиями.
3. Состав природных растворов и особенно свойства поро-
вой воды сильно отличаются от состава и свойств их лаборатор-
ных аналогов.
1 Пожалуй, интересно отметить такой факт. Изучая лунные образцы,
доставленные «Аполлонами» 11 и 12, американский исследователь Дж. Н. Ро-
шолт не обнаружил в них и намеков на неравновесное соотношение
изотопов урана. Этот результат в специальной литературе рассматривается как
неопровержимое доказательство решающей роли воды во
фракционировании изотопов урана.
V28 779
225
Неслучайно В. В. Чердынцев говорил, что «лабораторные
данные по выщелачиванию можно только с большой
осторожностью переносить на природные процессы обогащения вод
радиоэлементами». А П. И. Чалов не без юмора писал, что для
проведения чистых лабораторных экспериментов «нужны
кристаллы с различным содержанием и равномерным
распределением в них урана, искусственно выращенные несколько сот
тысяч лет назад». К этому можно лишь добавить, что неплохо
бы иметь и одинаковую внутреннюю поверхность природных
и искусственных образцов.
Наверное, немного было бы ценности в любом
исследовании, если бы оно было посвящено очень узкому вопросу,
единичному случаю, не имеющему широкого звучания и не
являющемуся следствием более общего природного явления. Чтобы
у читателя не сложилось впечатления, что разделение изотопов
урана в природе — такой уж скучно-экзотический факт,
заметим, несколько забегая вперед, что неодинаковое поведение
изотопов при выщелачивании — удел не только урана, но и
других членов радиоактивных семейств тория, радия, свинца
и т. д. По-видимому, это общий закон взаимодействия
выщелачивающих растворов с минеральными образованиями.
Например, при действии содовых растворов на горные породы
отношение активностей дочернего и материнского изотопов тория —
1>28Th/232Th — в отдельных вытяжках достигает 14, а в среднем
составляет примерно 6. Так что, очевидно, многие
закономерности, касающиеся и дочернего урана, и дочернего тория, в
природе одни и те же. Хотя в последнем случае, несомненно,
появляется и своя специфика, связанная с повышенным
выщелачиванием изотопа 22SRa, материнского по отношению к 228Th, что
еще более усиливаем дисбаланс изотопов тория.
ИЗ ИЗОТОПНОЙ БУХГАЛТЕРИИ
Где убудет несколько материи, то
умножится в другом месте.
М. В. Ломоносов, 1760 г.
Итак, поверим тому, поскольку in situ этого все равно не
увидишь, что широко распространенные изотопные сдвиги
урана в природе связаны с неодинаковым выщелачиванием его
четных изотопов природными водами из горных пород. Поверим,
но в то же время поищем косвенные доказательства этого
процесса, и в первую очередь в духе универсального закона
М. В. Ломоносова, ибо этот закон еще ни разу не подвел.:
Если дочерний уран переходит в воды в большей степени,
чем материнский, то, следовательно, в минералах или породах
должна обнаружиться его нехватка. Правда, случай с шрекин-
геритом, казалось бы, эту гипотезу не подтвердил, но шрекин-
226
герит — не единственный минерал, изученный Чердынцевым.
Для одного образца лимонита (т Fe203-nH20) значение у было
равно 0,67! Сейчас известны уже сотни образцов минералов
и пород с у<\. Некоторые из минералов с дефицитом урана-
234 мы приводим в табл. 2. (Вполне понятно, что в подобных
опытах исследователи прибегают не к методу выщелачивания,
а к полному растворению минерала.)
В большинстве случаев значения у, относящиеся ко всему
имеющемуся в минерале урану, не слишком отличаются от еди-
Таблица 2
Образец
2MThp2Th
Урановые минералы:
(Остаточные черни
зона окисления
зона цементации
Отенит, зона окисления
Уранофан
Настуран
Урановая руда (штат Юта, США)
Урансодержащие минералы:
Апатит
Цирконы
Молибдениты
Кальцит
0,68
0,78-0,85
0,62-0,87
0,79
0,86-0,95
0,59
0,99
0,95
0,80
0,86
0,85
1,00
0,78
—
—
—
—
0,81
0,90
0,83
0,83
0,47
0,98
0,70
ницы и лежат часто в пределах 0,90—0,99. В зоне окисления
урановых минералов встречаются образцы с у = 0,65—0,80.
Пожалуй, наименьшее значение 7 имеют отдельные образцы
урановой руды из штата Юта (США). Конечно, в таблице
приведена только малая часть минералов со смещенным изотопным
составом. На самом деле их значительно больше. Можно даже
сказать, что совсем не легко найти природный образец,
характеризующийся строго равновесным соотношением четных
изотопов урана, у может отличаться от 1 на сотые доли, на
тысячные, но разница во многих случаях все же
обнаружится.
227
Однако почему мы должны считать, что дефицит урана-234 —
это результат выщелачивания, а не какого-либо иного
процесса? На этот вопрос ответить можно так. Геологический возраст
по крайней мере некоторых из указанных в табл. 2 минералов
столь велик, что если бы эти минералы образовались лишь из
одного изотопа 238U (что даже теоретически невозможно
представить), то но закону накопления к настоящему времени
изотопы 238U и 234U были бы в равновесных соотношениях.
Дисбаланс изотопов свидетельствует о том, что это результат
позднейших (и относительно недавних) химических воздействий на
уже образовавшийся минерал.1 Конечно, можно вообразить себе
какой-либо физический процесс, ответственный за нехватку
урана-234, например, «выгорание» его в результате захвата
нейтрона. Но тогда в первую очередь выгорал бы изотоп 235U,
имеющий более высокое, чем у изотопа 234U, сечение захвата
нейтронов. Между тем отношение изотопов 235U/238U в
минералах с большой точностью остается постоянным. Исключением
являются лишь урановые минералы в районе природного
ядерного реактора в Габоне, где уран-235 выгорел.
Правомерен и другой вопрос: если нарушение равновесия
между изотопами урана есть результат процессов
выщелачивания, то почему существенному сдвигу изотопного состава в
жидкой фазе соответствует значительно более скромный сдвиг в
оставшихся минералах? Объяснение очевидно: поскольку
абсолютное содержание урана в минералах значительно больше той
его части, которая переходит в раствор как в природе, так и в
лабораторных опытах (см. табл. 1), то эффект выщелачивания
в твердой фазе нивелируется большой массой остающегося урана.
Наконец, третий очень важный вопрос — о факторе времени.
Время способно свести на нет все эффекты и в жидкой фазе,
и в твердой. И если мы еще наблюдаем изотопный сдвиг
урана, то, следовательно, процессы выщелачивания произошли не
в какие-то далекие геологические эпохи, а относительно
«недавно», скажем, 500—800 тыс. лет тому назад. Эти цифры,
конечно, близки к верхнему пределу обнаружения. На самом деле
все произошло гораздо позже. Взгляните на цифры в третьей
колонке табл. 2. Недостаток дочернего тория-228 по отношению
к материнскому изотопу тория указывает, что последнее
выщелачивание произошло, скорее всего, совсем недавно, скажем,
10—20 лет назад.2 Это означает, что процессы выщелачивания
в земной коре идут и в наши дни, идут постоянно и постоянно
нарушается равновесие в радиоактивных рядах. Конечно,
эффективность этих процессов зависит от конкретных условий,
1 Через три миллиона лет после образования минерала количество
урана-234 будет отличаться от равновесного на 0,0002.
2 Возврат к равновесному содержанию изотопов тория в минерале
определяется скоростью накопления наиболее долгоживущего в радиоактивной
цепочке изотопа радия-228, период полураспада которого составляет 6,7 года.
228
сложившихся в данном регионе, от характера взаимодействия
природных вод с породами, от интенсивности процессов
выветривания. Ясно, что для одного и того же минерала, добытого
в разных регионах или с разнырс глубин, с хорошей точностью
никогда не получится одно и то же значение у.
Казалось бы, вопросы исчерпаны. Но как тогда объяснить
избыток урана-234 в шрекингерите? Не нарушает ли он логику
наших рассуждений? Как это ни странно — не нарушает. Более
того, подтверждает. Избыток урана-234 в некоторых минералах
возникает естественным путем, когда из вод, обогащенных ура-
ном-234, образуются урановые или урансодержащие минералы.
Если такие минералы возникли относительно недавно, так что
избыток дочернего урана не успел распасться и хотя бы
частично дожил до светлых дней альфа-спектрометрии, он
непременно будет' обнаружен. А чтобы читатель убедился, что не
только в шрекингерите обнаружен избыток урана-234, мы
приведем еще несколько образцов с у>1*
Рудные тела в стадии становления,
питающиеся ураном природных вод: 7
уранофан и отенит в меловых
конгломератах (возраст 50 тыс. лет) 2,45
уранофан в выветренных гранитах
(возраст 7,5 тыс. лет) .....' 2,94
Урансодержащие минералы:
карбонатит 1,15
редкоземельные минералы , 1,19
арагонит 1,30
киноварь ... 2,5
ископаемые кости до 15
Хотя считается, что в среднем для урановых месторождений
отношение изотопов урана близко к равновесному, но, как
показывают эти данные и данные табл. 2, для отдельных
минеральных тел возможно значительное разделение изотопов.
Недостаток урана-234 в продуктах разрушения настурана
(остаточных урановых чернях) и его избыток в переотложенных
минералах могут возникать лишь в том случае, когда развит
процесс выщелачивания урана из первичных урановых руд. Если
же, скажем, настуран как первичный минерал разрушается
в природе путем полного растворения, то и остаточные черни,
и вторичные переотложенные минералы будут иметь
равновесное отношение 234U/238U. Все в конце концов зависит от того,
какими водами питаются вторичные (растущие) минералы.
Такова логика движения изотопов урана в минеральном
хозяйстве Земли.
1 Szabo В.—Geochim. et Cosmochim. Acta, 1982, p. 1675.
9 779
229
Иногда значения у во вторичных минеральных образованиях
существенно больше тех, которые мы только что привели. Вот
как выглядит, например, альфа-спектр изотопов урана в
минерале маггемите (кубическая модификация ИегОз) из
северовосточной Японии (рис. 4). Значение уу насколько это можно
оценить из спектра, приближается к 15. Полагают, что минерал
омывался водами, имевшими высокое содержание не столько
урана-234, сколько торня-234, который превращался в дочерний
уран уже на поверхности растущего минерала. Реально ли это
при периоде полураспада изотопа 234Th, равном 24 дням,
сказать трудно. Это еще один из бесчисленных вопросов, который
ставит нам природа и который ждет своего ответа.
1500
1000
500
О
ВВЕРХ И ВНИЗ ПО ЛЕСТНИЦЕ, ВЕДУЩЕЙ ВГЛУБЬ
...Она пробралась по' узкому
коридорчику и наконец ^очутилась в чудесном
саду среди ярких цветов и прохладных
фонтанов.
Льюис Кэрролл
Процесс взаимодействия минерала с раствором идет не
только во времени, но и в пространстве — в реальном
пространстве минерала и в конкретной кристаллической структуре. В нее
мы и должны мысленно заглянуть, ибо там и разыгрываются
все важнейшие химические события.
В 1963 г. американский радиохимик и геохимик К.
Ричардсон показал, что верхние слои гранитов Конвея (штат Нью
Хемпшир, США) на 15% обеднены ураном-234 по сравнению
с ураном-238, а в более глубоких участках минералов
соотношение изотопов равновесное. Этого, конечно, и следовало
ожидать, но сразу возникает ряд вопросов. Первый —
методический: пытаясь наблюдать последствия природного
выщелачивания в обедненном ураном образце, исследователь обычно
20 чо 60
Номер канала
РисЛ
230
растворяет минерал целиком и при таком анализе получает,
конечно же, завышенное значение у. А эти последствия надо было
бы изучать в том поверхностном слое, который и подвергался
действию вод. Только где проходит граница, отделяющая
поверхностный слой от глубинного?
В работах научной школьц И. Е. Старика, в которых
последовательно развивалась модель капиллярного выщелачивания,
подчеркивалось, что между полностью разрушенной частью
решетки (капилляры, поры, трещины) и ненарушенной решеткой
нельзя провести резкой границы. Существует промежуточная
область, в которой атомы структурно хоть и связаны с
решеткой, но' химический состав этой области несколько иной, чем
всего минерала в целом. Таким образом, напрашивается
следующий методический подход: многократное химическое
воздействие на минерал, благодаря
которому обеспечивается
последовательное стравливание
поверхностных слоев минерала и
переход от внешних его зон к
внутренним, от дефектных
областей структуры к регулярным.
Хорошей иллюстрацией
такого подхода является
исследование П. И. Чалова и сотр. по
многократному выщелачиванию рИС5
урана из настурана. Результаты
их исследования представлены
на рис. 5 в виде гистограммы изменений величины y=234U/238U
в семи последовательных вытяжках. Перед нами на рисунке как
бы «разрез» области микронарушений, хотя оценить реальную
толщину такого слоя нелегко. Штриховая линия проведена на
уровне 7 = 1,02, т. е. того изотопного отношения, которое
характерно для данного образца настурана в целом. Авторы так
объясняют свои результаты. Избыток 234U, находящегося в
микронарушениях, переходит в раствор уже при первом
выщелачивании (дистиллированной водой), поэтому зона
микронарушений оказывается обедненной дочерним ураном и в последующих
вытяжках у меньше, чем в среднем по минералу. Затем в
вытяжках начинает преобладать уран, переходящий в раствор из
кристаллической решетки, и у снова повышается, приближаясь
к 1,02. Надо отметить, что такое четкое наблюдение эффектов
в столь малом диапазоне изменения измеряемой величины
возможно лишь при очень высоком уровне
альфа-спектрометрического эксперимента, который обеспечивается в данном случае
применением ионизационных камер.
В урано-фосфорной и урано-молибденовой рудах, изученных
И. П. Кошелевым и Н. Г. Сыромятниковым, такой зависимости
не наблюдалось. Даже после пяти-девяти повторных вытяжек
231
значение у в несколько раз превышало равновесное. А для пары
228Th/232Th после изйлечения избытка тория-228 из
микронарушений торита (силиката тория) повторное выщелачивание
показало явный дефицит дочернего тория, а в оставшемся после
выщелачивания образце отношение изотопов вообще упало до
0,52. Это говорит, с одной стороны, об интенсивных процессах
выщелачивания, вызванных действием 0,2 моль/л раствора
НС1; с другой стороны, свидетельствует о том, что примерно
половина, дочернего тория по своим кристаллохимическим
свойствам (возможно, по расположению в структуре минерала)
отличается от тория материн-
"*и/ши
ского и благодаря этому
легче покидает минерал.
А вот как причудливо
изменяется отношение 234U/
238U в последовательных
вытяжках в зависимости от
состава выщелачивающего
раствора (рис. 6). Эти
результаты получены П. Дж.
Ширвингтоном1 при
исследовании образцов глин в
пределах одной урановой
минерализации в Австралии.
Штриховой линией, как и на
предыдущем рисунке,
отмечено значение у при полном
растворении минерала.
Верхняя гистограмма относится
к урану в вытяжках,
нижняя (с двойной штриховкой)
показывает долю урана-238, вымытого из глин на данном этапе
выщелачивания, а цифрами внизу обозначены соответствующие
выщелачивающие агенты: У—1,6 моль/л HNQ3; 2—1,6 моль/л
HNO3+0,3 %-ная Н202; 3 — 0,16 моль/л HNO3+0,03 %-ная
Н202; 4—1,6 моль/л НС1; 5 — 0,1 моль/л NaOH+З %-ная Н202;
6 — 0,1 моль/л К2С03; 7—8,0 моль/л HN03; S — 0,1 моль/л
N2H4-H2S04.
В отличие от одного из персонажей Агаты Кристи Ширвинг-
тон не «хотел обманывать природу» и наряду с карбонатными
растворами использовал сильные кислоты. Однако, как
показали опыты, результаты не слишком зависят от реагента
(сравните вытяжки 4, 5, 6). Способность к комплексообразованию
с уранил-ионом UO|+ по мнению Ширвингтона, также не
является определяющей для величины изотопного отношения. Автор
не дает объяснения наблюдаемым минимумам и максимумам
Рис б
1 Geochim. et Cosmochim. Acta, 1983, vol. 47, p; 403.
232
на экспериментальной зависимости, но, думается, наиболее
уместна здесь интерпретация Н. Г. Сыромятникова и
Л.А.Трофимовой. Они связывают наличие пиков на кривых
выщелачивания с дискретным характером растворения природного
образца. Согласно их данным, максимальный относительный
избыток урана-234 (когда у>1) приурочен как раз к пикам кривой
выщелачивания урана-238, т. е. к периодам наиболее
интенсивного разложения образца, и, наоборот, в точках провала
выхода урана-238 и y<.L Это явление объясняется подключением
к выщелачиванию свежих зон зерна минерала, чем и
определяется пульсирующий характер процесса растворения.
Действительно, на рис. 6 можно
отметить определенную
корреляцию между верхней и
нижней гистограммами.
Наверное, читатель
заметил, что и в описанных
экспериментах, и во всех наших
рассуждениях отсутствует один
важный параметр, а именно —
валентность урана. И это
неслучайно: почти нет работ, в
которых бы валентное
состояние урана изучалось
непосредственно в вытяжках, тем более
в последовательных
многократных вытяжках. А учти
исследователи этот параметр, и,
возможно, многие из
полученных зависимостей приобрели
бы иной вид — ведь уран, как правило, находится в
минералах в нескольких валентных формах, по крайней мере в двух:
U4+ и U6"1". Правда, Ширвингтон четырехвалентного урана в
минералах не обнаружил.
Давайте снова вернемся к исследованию К. Ричардсона об
обеднении поверхностных слоев конвеевского гранита ураном-
234. Помня о том, что четырехвалентный уран не образует
карбонатных комплексов и с большим трудом переводится из
минералов в раствор, чем уранил-ионы, можно предположить, что
образец Ричардсона был обеднен в основном тем ураном-234,
который находился в «подвижном» состоянии U02"1-. Фракции
же четырехвалентного урана процесс выщелачивания коснулся
в меньшей степени.
Что касается гранита, то это только наши предположения.
А вот по ортиту1 имеются экспериментальные данные, под-
10,0
г!С1,моль/л
Рис 7
1 Ортит — природный силикат примерно следующего состава: (Се, Са^Х
X(Fe2+, Fe3+, Mg)Al2[0|OH|Si04|Si207].
233
тверждающие возможность дифференцированного
выщелачивания валентных форм урана. Эти данные (рис. 7) получены в
лаборатории альфа-спектрометрии химического факультета ЛГУ
для одного из образцов ортита. Выщелачивание проводили
соляной кислотой с постепенным увеличением ее концентрации
(в присутствии аскорбиновой кислоты). Валентные формы
урана в вытяжках разделяли хроматографически. Верхняя
гистограмма относится к U4+, нижняя — к U6+. Из рис. 7 видно, что
в распоряжении исследователей оказался образец, уже
подвергавшийся действию природных вод, поскольку 7б на поверхности
образца существенно меньше единицы (0,67). По мере перехода
к более глубинным слоям минерала
7б увеличивается, достигая значения
0,94 или больше. В то же время
фракция четырехвалентного урана даже в
самых внешних, наиболее доступных
частях микронарушений имеет
практически равновесное отношение
изотопов (74 = 0,98). Четырехвалентного
урана здесь хоть и немного, но все же
по своему изотопному составу он
отличается от шестивалентного. В
вытяжках в 0,1 моль/л НС1 еще
наблюдается изотопное различие между
U4+ и U6+, а в 0,5 моль/л НС1ивНС1
больших концентраций обе
зависимости идут весьма близко друг от друга
и, возможно, в пределах точности
эксперимента неразличимы между собой.
Это значит, что вдали от микронару-
0,01
0,1
Рис.8
1,0 10,0
нсп,моль/л шений, т. е. в самой структуре ортита,
изотопное фракционирование между
валентными формами неэффективно.
Хочется задать вопрос: «Почему?». Но мы уклонимся от ответа,
придерживаясь принципа, высказанного Льюисом Кэрроллом:
«...сначала приключения... Объяснять очень долго». И, если
откровенно, пока неизвестно, как.
Картина, которую вполне можно было бы назвать зеркально
противоположной только что описанной для ортита,
характеризует другой минерал, изученный в нашей лаборатории, — бри-
тол ит ' (рис. 8). Этот минерал, так же как и ортит, подвергали
последовательной обработке соляной кислотой различной
концентрации с добавлением постоянного количества аскорбиновой
кислоты. Если в поверхностных зонах минерала отношение
изотопов уранл в обеих валентных формах близко к равновесному
1 Бритолит — смешанный фторсиликат-фог.фат
(Na, TR, Ca)5[F(SiO<, P04)3].
следующего состава:
23-1
значению, то по мере углубления в структуру бритолита
(кстати, метамиктную) зависимости для у4 (верхняя гистограмма)
и yg (нижняя гистограмма) все больше и больше расходятся
в координатном пространстве. Дочерним ураном при этом
обогащается фракция четырехвалентного урана за счет обеднения
им шестивалентного урана. В 4 моль/л НС1, где происходит
практически полное разложение бритолита, у4 достигает
значения 1,38, а у6 падает до 0,87.*
Если же уран не делить на две валентные формы, а
проводить выделение суммарного урана из минерала путем
кислотного разложения образца или же выщелачивать уран
раствором соды, то в обоих случаях значения у не отличаются от
единицы. Вот что значит учесть валентные формы урана в
экспериментах по выщелачиванию. Сколько неожиданностей
открывается здесь исследователю, сколько приятных сюрпризов!
ПРИЧУДЫ АЛЬФА-ОТДАЧИ
Да, с нравами такими невозможно
Установить какой-нибудь закон.
Софокл
Обратим внимание на одну немаловажную деталь, о которой
мы вскользь уже упоминали. При выщелачивании изменяется
соотношение только четных изотопов урана — 234U и 238U, а
соотношение изотопов 238U и 235U всегда остается постоянным
и равно 1:0,045 по величине активности. Можно сделать вывод,
что фракционирование четных изотопов связано с их
генетическим родством, а по сути/с тем, что они разделены
несколькими ядерными превращениями: альфа-распадом и двумя бета-
распадами. «Ну и что из этого следует? — спросите вы. —
Химические явления происходят на уровне электронов и атомов,
а альфа- или бета-распады — на ядерном уровне. Где же
пересекаются их пути?».
Да, вопрос закономерен. Мы вступаем здесь в сложную
область химических процессов, вызванных ядерными
превращениями. Эти процессы чрезвычайно многообразны, часто непонятны,
порой неимоверно запутаны, особенно в твердой фазе. К счастью,
для создания приемлемой модели для нас важен в основном
только один эффект — эффект ядерной отдачи при
альфа-распаде ядра 238U. Возможность этого упрощения спасительно
облегчает задачу автора очерка.
Из закона сохранения импульса в системе альфа-частица —
остаточное ядро следует, что кинетическая энергия отдачи
дочернего ядра Е\ при альфа-распаде определяется выражением
1 Разумеется, в контрольных опытах при выбранных условиях
отсутствовал переход урана между фракциями U4+ и U6+
235
£t =4/Aftse ,
где Mi — масса дочернего ядра в атомных единицах массьь
а £2 —энергия испускаемой альфа-частицы. Учитывая, что при
распаде урана-238 еЛ =4,2 МэВ, а масса остаточного ядра тория
составляет 234 ат. ед., находим, что энергия отдачи близка
к 72 кэВ (килоэлектронвольт). Может быть, в ядерном
масштабе это и не очень высокая энергия, но для мира атомов эта
порция энергии огромна. В судьбе атома тория и,
следовательно, в судьбе образующегося потом урана-234 она играет
«роковую» роль, являясь главным зачинщиком всех событий,
приводящих к нарушению равновесного изотопного состава в
урановом семействе. Напомним, что энергия тепловых колебаний
частиц в кристалле составляет при Г=300 К лишь малые доли
электронвольта (эВ); суммарная энергия химических связей,
удерживающих атом в узле решетки, порядка 10—15 эВ.
Естественно, что, обладая кинетической энергией, на 4 порядка пре*
вышающей энергию обычных химических связей, атом тория
покидает «насиженное» место своего родителя — урана-238 —
и стремительно внедряется в окружающую решетку, неся с собой
хаос и рузрушения. Пролетев 10—20 нм и растеряв на этом
пути весь запас энергии, атом тория останавливается, хотя еще
какое-то время быстро колеблется около положения равновесия.
Так примерно можно было бы описать ядерную катастрофу
в жизни атома, вызванную альфа-отдачей.1
Для понимания этих процессов важно, 4То при движении
в твердом теле атом отдачи по-разному взаимодействует с
атомами решетки. Одних он слегка касается и лишь незначительно
изменяет направление собственного движения после такой
встречи, с другими сталкивается в «лобовых» соударениях, выбивая
их со своих мест и резко изменяя при этом траекторию своего
полета. Выбитые атомы способны, в свою очередь, смещать
другие, те — третьи, в результате чего возникает каскад
смещений, создающий вдоль движения атома отдачи сильно разупо-
рядоченную область. По аналогии со следами, которые
оставляют в твердых телах осколки деления, путь атома отдачи
называ-ют треком. Однако нужно помнить, что кинетическая
энергия в случае альфа-отдачи в 1000 раз меньше, чем энергия
осколка деления, а следовательно, механизм торможения включает
только упругие взаимодействия с ядрами атомов. Как
образуется каскад смещений в треке атома отдачи, иллюстрирует рис. 9.
Расчеты процессов ядерного торможения, а следовательно,
и параметров трека основываются на законах классической ме-
1 Согласно недавним измерениям японского исследователя Т. Хашимото,
пробег тория-234 в U02 составляет 13,2 мкг/см2 (12 нм), в U308 —
16,9 мкг/см2 (20 нм) (J. inorg. nucl. Chem., 1981, vol. 43, p. 2233). Эти
величины находятся в хорошем согласии с имеющимися теоретическими
расчетами ДЖ. Линдхарда.
236
ханики. Если предположить, что свободный пробег
движущегося атома больше сферы действия того атома, с которым
предстоит столкнуться, то весь процесс при образовании каскада
можно рассматривать на основе представлений о парных
столкновениях. Такое допущение вполне справедливо для аморфных
и поликристаллических тел, а с определенными поправочными
коэффициентами и для кристаллических.
При рассмотрении упругого столкновения в системе
координат центра масс энергии £2, передаваемая атому решетки с
массой М2 атомом отдачи, равна
Е _ Е ш,м2 2 _е_ (3ч
Здесь Е{ и ЛЬ —энергия и масса атома отдачи; Afi/(Afi+AJ2)
и Af2/(Afi+Af2)— приведенные массы налетающего и
покоящегося атомов; 0— угол отклонения движущегося атома от пер-
воначальнрго направления.
конец
движения
Начало
дбимеш*
а.моопица
РиС.Р
Выражение (3) кратко характеризует ту закономерность,
что при лобовых соударениях потери энергии, приходящиеся на
одно столкновение, могут стать весьма большими, т. е.
сравнимыми или даже равными кинетической энергии налетающего
атома. В последнем, правда, относительно редком случае
(сечение строго центрального соударения невелико) движение
атома отдачи быстро затормозится, а если Afi=Af2, то атом
сразу остановится, и роль возмутителя относительного
спокойствия и порядка в решетке возьмет на себя выбитый атом.
Однако для описания трека неважны конкретные «персональные
заслуги» той или иной частицы, а важно знать так называемую
каскадную функцию N(Ei), т. е. зависимость числа смещенных
атомов от энергии атома отдачи.
Смещение атома из своего узла произойдет в том случае,
если переданная ему порция кинетической энергии превзойдет
некоторую минимальную (пороговую) величину Edl
называемую энергией смещения. Считается, что эта величина ненамного
превосходит суммарную энергию химических связей,
удерживающих атом или ион в узле, и в среднем составляет 20—
237
30 эВ.1 Тогда в первом приближении максимальное число
смещений в каскаде мы можем оценить из соотношения
ЛГ(£,) = £,/£,,
полагая, что каждое столкновение приводит к смещению и
энергия всегда передается только порциями, равными £<*. Однако
ясно, что значительная часть энергии движущегося атома
тратится при подпороговых столкновениях и рассеивается в виде
тепла. Если считать, что столкновения под любым углом 8
равновероятны и, следовательно, равновероятны передачи энергии
во всем интервале величин от нуля до максимальной величины
4 M^M2l(M\JrM2)2-E\, определяемой уравнением (3), то
выражение для каскадной функции приобретает коэффициентов,т. е.
ЩЕ,) = Е:12Еа. (4)
Впервые выражение (4) было выведено в 1955 г. на основе
наиболее простой модели жесткосферных столкновений. Тем не
менее линейная зависимость между Е\ и N в области упругого
взаимодействия была получена и в позднейших более
изощренных и усовершенствованных теориях. Однако экспериментально
наблюдаемое число смещенных атомов в каскаде оказывается
меныше рассчитываемого по уравнению (4). Эту разность
сначала приписывали рассеянию энергии первичного атома за
пределы каскада при каналировании выбитых атомов,
фокусированных соударениях, коррелированных замещениях и т. д.
Однако машинные эксперименты (т. е. моделирование
процессов смещения методами Монте-Карло и молекулярной динамики
с учетом многочастичного характера взаимодействия
движущегося атома с атомами решетки) показали, что причина
заключается в другом,
В первых теоретических расчетах рассматривали Ed как
минимальную энергию, которая дает возможность атому покинуть
узел (безотносительно к тому, произойдет ли впоследствии
аннигиляция атома и вакансии). Но постепенно стало ясно, что
Еа нужно рассматривать как минимальную энергию,
необходимую для необратимого смещения атомов, ибо именно эта
величина измеряется в экспериментах. Для того чтобы смещение
атомов было необратимым, расстояние между вакансией и меж-
узельным атомом должно быть достаточно большим, в
противном случае произойдет спонтанная рекомбинация. Именно этот
фактор — эффект спонтанной рекомбинации (как бы
первичный отжиг в решетке) — и уменьшает число смещенных атомов
в треке. Как показывают расчеты, рекомбинационный объем
1 Вместе с тем отдельные значения Ed существенно отличаются от
средних, например, смещение атомов в алмазе, оксидах бериллия и цинка
требует 60—80 эВ.
238
(объем неустойчивости) для дефекта Френкеля1 в металлах
составляет примерно 100 узлов вокруг межузельного атома.
Этот фактор учитывается введением поправочного
коэффициента £ в выражение (4). Таким образом,
^V(£1) = E£l/2£,dl (5)
где I для поликристаллических веществ, а также для
многоатомных кристаллических структур или упорядоченных сплавов
приближается к 0,8. Для некоторых одноатомных металлов g
может понизиться до 0,2 (из-за неразличимости атомов). К
сожалению, недостаточно экспериментальных сведений накоплено
о каскадах смещений в регулярных ионных структурах типа
щелочно-галондных кристаллов. Не исключено, что
значительный заряд ионов и наличие маделунговского потенциала
понижают степень разупорядоченности в треке атома отдачи,
увеличивая линейные размеры каскада.
Оценим число смещений в треке атома отдачи Th-234.
Поскольку единой величины Ed для минералов не существует, то
оценим ее приближенно, введя разумный произвол. Определим
Ed как линейную комбинацию парциальных величин Ed
отдельных атомов, считая, что в условном минерале на долю атомов О
приходится 50% атомных долей, £^(О)=70 эВ; на долю
атомов Si и Me приходится по 25%, Ed (Si) =25,4 эВ и £^(Ме) =
= 65 эВ. Мы выбираем заведомо завышенные значения
порогов смещения, чтобы определить не верхний, а нижний предел
числа смещенных атомов в каскаде. Тогда для условного
минерала мы получаем усредненное значение £d = 57,6 эВ, и,
согласно (5), N = (0,8-72-]О3)/2-57,6 = 500.
Таким образом, в треке атома отдачи 234Th должно
находиться не менее 500 смещенных атомов, успешно переживших
процессы мгновенной рекомбинации. Если считать, что каждая френ-
келевская пара дефектов имеет энергию 5 эВ (как в металлах),
то общая запасенная энергия в треке составит примерно
2500 эВ. На самом деле в многокомпонентных системах, к
которым относятся минералы, степень разупорядоченности и
энергозапас в треке еще выше, поскольку: а) столкновения с
замещениями вдоль плотноупакованных атомных рядов приводят
к появлению в узлах решетки «чужих» атомов; б) вероятность
воспроизводства первоначальной структуры в результате
аннигиляции генетически несвязанных френкелевских пар
пропорциональна 1/ai, где п — число' компонентов в катионной или
анионной подрешетке (при равной концентрации компонентов).
Поэтому физико-химические свойства вещества в треке,
имеющего более высокий химический потенциал, отличаются от
1 Дефект Френкеля в кристаллической решетке — это пара: атом в меж
узлии и освободившийся узел (вакансия).
239
свойств окружающей решетки, что, в частности, проявляется
в его повышенной растворимости. Если на минерал
воздействуют не слишком агрессивным раствором, то протравливаться
(корродировать) в первую очередь будут именно места выхода
треков на поверхность, доступную раствору. Следовательно,
в первую очередь (и преимущественно) в раствор будет
переходить структурно-неупорядоченное вещество, содержащее
виновника всех пертурбаций — атом отдачи, а это означает
безвозвратную его потерю данного минерала, для данного
кристаллического зерна.
Таким образом, ядерная альфа-отдача является той основой,
тем необходимым элементом суммарного процесса, который
в итоге и приводит к нарушению закона векового равновесия
в породах земной коры. Поэтому, имея в виду альфа-отдачу,
а не Антигонуг вспомним еще раз Софокла:
Она уж тем строптивость показала,
Что дерзостно нарушила закон.
В ЛАБИРИНТЕ ПОР, D МОЗАИКЕ ЗЕРЕН ...
Нельзя развязать узел, не зная, как он
завязан.
Аристотель
Ну что ж, читатель, мы подошли к заключительным
разделам очерка, к той его части, которая в диссертациях получила
бы название «Обсуждение результатов». Нам следует обобщить
известные факты и на основе определенной гипотезы
предложить, по возможности, адекватную модель изучаемых нами
процессов.
Но сначала еще раз напомним, что типичный минерал не
является идеальным (и даже реальным) монокристаллом,
а представляет собой поликристаллическое образование,
скопление блоков и зерен разных размеров, разделенных порами
и трещинами, заполненными водой или газом (что
объединяется общим понятием — флюид). Многое в судьбе атома урана-234
как раз и зависит от того, где затормозился движимый отдачей
атом тория-234, как расположен трек относительно границы
зерна. И здесь имеются три возможности, три исхода в судьбе
атома отдачи. Их иллюстрирует рис. 10.
Вариант /. Атом урана-238 претерпевает распад вблизи
поверхности зерна или кристаллита. Импульс отдачи направлен
не в глубь зерна, а наружу. Этот случай предусматривает, что
поры между зернами заполнены водой, в которой
останавливается атом отдачи тория-234. Уран-234 также образуется в поро-
вой жидкости. Считается, что наиболее высокие изотопные
отношения 234(j|238y являются следствием именно этого механиз-
240
ма, обеспечивающего максимальное обогащение природных
растворов дочерним ураном.
Вариант II. Атом отдачи тория, как и в предыдущем случае,
покидает первоначальное зерно, но, поскольку поровое
пространство заполнено газом, атом легко пересекает его и
внедряется в соседнее зерно, образуя в нем трек. В этом треке и
возникает атом урана-234. Обеднение минерала дочерним ураном
происходит при более позднем поступлении жидкости в поры
Вариант Щ
Рис 10
и трещины и выщелачивании вещества из области треков.
Возможна также диффузия атома отдачи по треку к поверхности
зерна, но это относится в большей мере к изотопам радона.
В простом эксперименте яцонский химик К. Кигоши показал,
что эффективность перехода атомов Th-234 непосредственно при
альфа-отдаче с поверхности минерала в жидкую фазу в 2 раза
выше, чем при последующем выщелачивании атомов тория,
накопившихся в сухих минералах, и в 5 раз выше, чем
накопившихся в вакуумированных образцах того же минерала.
241
Вариант III. Зерно, в котором происходит распад,
относительно велико по сравнению с пробегом атома отдачи, так что
трек и начинается, и заканчивается вдали от его поверхности.
Разделения изотопов урана непосредственно в ходе такого
процесса не происходит, но две предпосылки для этого создаются.
Первая — зарядовая: при двух последовательных р-распадах
заряд ядра 234U возрастает на 2 единицы по сравнению с
зарядом ядра 234Th без соответствующей компенсации его оболо-
чечными электронами. Это значит, что если даже материнский
уран был в химической форме U4+, то дочерний уран с
большой вероятностью может стабилизироваться в форме U6+.
Вторая— структурная: материнский уран находится в регулярной
структуре минерала, дочерний — в разупорядоченной области.
Поэтому, если минерал подвергается действию тектонических
или геостатических нагрузок, вследствие чего образуются новые
трещины и поры и, следовательно, возрастает поверхность
минерала (либо минерал измельчают в лаборатории), то
последующее проникновение растворов может привести к более
предпочтительному выщелачиванию дочернего урана. Конечно, эти
рассуждения справедливы при условии, что треки сохраняются
к моменту воздействия растворов на минерал, а не
залечиваются в результате самоотжига кристаллической структуры.1
Итак, три варианта, три возможности, три модели. Но какое
бесчисленное разнообразие конфигураций, ориентации,
геометрий и размеров! Нечего даже и думать о том, чтобы предложить
какие-то детерминированные теоретические построения,
предполагающие знание свойств изучаемой среды (в данном
случае— пространства минерала) в каждой конкретной то^ке. По
какому сценарию будет в каждом отдельном случае развиваться
маленький ядерный спектакль — предсказать невозможно. Как
же подойти к анализу фактов с количественной меркой? Где
найти ту единственную ниточку, потянув которую, можно
безошибочно распутать весь этот замысловатый клубок
случайностей и неопределенностей?
Конец этой нити уходит в более чем полувековую историю,
когда немецкий радиохимик Отто Хан заинтересовался
закономерностями эманирования (выделения изотопов радона из
минералов), а затем его ученик Карл Ерик Цименс выполнил
в Берлинском университете диссертационную работу на эту
тему. Именно при анализе вопросов эманирования и родилась
задача о зернах, порах и альфа-отдаче. Решение ее последовало
в 1939 г. в журнале «Zeitschrift fur physikalische Chemie»
в итоговой статье С. Флюгге и К. Цименса. Используя как раз
преимущество бесконечно большого разнообразия ситуаций,
1 В реальности самозалечивания дефектов можно убедиться на таком
примере: монацит имеет хорошо выраженную кристаллическую решетку,
а ортит характеризуется метамиктной структурой, хотя и концентрация
радиоэлементов, и возраст образцов могут быть одинаковыми или близкими.
242
связанных с альфа-отдачей в минералах, ученые создали «ста-
тистически-усредненную модель судьбы атома радона. Их
работа, войдя во многие монографии и учебники, поистине стала
классической.
Затем нить исследований обрывается, и снова мы находим
ее лишь через двадцать лет, уже после открытия Чердынцевэ
и Чалова. Московские радиохимики В. И. Баранов, К. Б. Забо-
ренко, А. М. Бабешкин расширили теоретический подход Флюг-
ге и Цименса на область экспериментов по выщелачиванию
изотопов радия из природных и искусственных образцов. Они учли
как ширину пор, так и взаимодействие поровых растворов с
поверхностными слоями зерен, определив тем самым влияние
нескольких факторов на процессы выщелачивания атомов отдачи.
Проходит еще 20 лет, и модель Флюгге и Цименса получает
математическое завершение в цикле работ американского
ученого Роберта Фляйшера и сотр. Фляйшеру удалось дать
наиболее полное (на сегодняшний день!) и универсальное описание
последствий отдачи в зернах минералов. Поэтому изложение
математической модели фракционирования изотопов урана мы
построим в основном «по Фляйшеру», используя
преимущественно его обозначения и, пожалуй, подтвердив тем самым известную
истину, что в науке чаще всего выигрывает не тот, кто приходит
первым, а тот, кто приходит последним.
АРИАДНИНА НИТЬ МАТЕМАТИКИ
Научный метод — это совокупность
правил... которые помогают исследователю
в пути через джунгли поначалу
разрозненных, противоречащих друг другу фактов.
Джордж Паджет Томсон
«После того как опыты
проделаны,— пишет далее Д. П. Томсон в
книге „Дух науки" (М., 1970), —
предварительные результаты надо
обычно проанализировать
математически, исходя из доступных
теорий и гипотез». Примерно это и
предстоит нам теперь сделать.
Для удобства математического
подхода рассмотрим зерно
сферической формы.1 В глубине его
выберем точку Р, расположенную на
расстоянии г от центра зерна
диаметром D, как это в разрезе изо-
РисП
1 В эт°й Условности уже проявляется статистически-усредненный подход
к началу эффектов альфа-отдачи.
243
бражено на рис. 11. Пробеги Rs атомов отдачи изотропно
(и, следовательно, сферически-симметрично) распределены в
пространстве вокруг точки Р. Покинуть зерно могут те атомы
отдачи, импульсы которых ориентированы в часть сферы
радиусом Rs (около точки Р)у лежащей выше плоскости АВ. Доля
атомов отдачи, покидающих телесный угол в этом сферическом
сегменте, равна отношению поверхности шарового сегмента
с высотой (R*—х) к общей поверхности шара с радиусом Rs:
fR - 21с RS{RS - x)jA * Rl = (Rs - x)j2RS9
где x=[(D/2)2—r2—R2s]/2r и, являясь функцией г, вычисляется
из простого равенства
*;2
х2 = (D/2)2 - (г + х)\
откуда
/* —
\(2RsjD + 2r/D)2] _ i
16r2^/D2
Тогда для зерна в целом долю ^Л покидающих его атомов
отдачи получим интегрированием по всему объему поверхностного
слоя толщиной Rb:1
F*= £W I //?-4тгг2с?г, или /?/? = -5p(l—Jg-L (6)
— />/2-/? Ч '
где a=2R6/D. Выражение (6) и есть формула Флюгте-Цименса.
Поскольку второй член в скобках содержит (2RS/D)2, то при
малых R4, т. е. при Rs<^lD, Fr при0лижается к нулю, будучи
пропорциональной 3RS/2D. Наоборот, если R8=D7 то FR
становится равной единице, так как даже ядра отдачи, стартующие
на поверхности, могут пересечь все зерно. Эти крайние случаи
легко видеть из хода кривой «одно зерно» на рис. 12.
Результат (6), вывод
которого здесь дан, вполне
тривиален, а заслуга Фляйшера — в
другом, в создании
математической модели, учитывающей
распределение зерен минерала
по размерам. В этой модели
доля атомов отдачи,
освобождающихся из минерала,
является усредненной величиной по
всем имеющимся зернам.
Числовое распределение n\(D)y
1 Ясно, что материнские атомы, лежащие от поверхности зерна на
глубине, большей, чем Rs, не дают вклада в Er при альфа-распаде.
244
соответствующее постоянному числу зерен каждого диаметра
вплоть до предельного диаметра Dtoax, можно задать в
следующем виде:
п (D) 1 ^ ° ПрИ D>Dm™
'I =1/Dmax при D<D
max*
Поскольку доля зерен, размеры которых лежат в диапазоне
AD, равна я,(/))-Д£>, то усредненная по всем размерам доля
освободившихся из зерен атомов отдачи F^ представляет собой
интеграл вида
F(fi = jFRni(D)dD9
о
что дает
ып Л1|п 2 < 3? + Р3 т
Fr =t4-ln-^-r-r + -32-1 (/)
где p=27?4/Dmax. Анализ выражения (7) показывает, что
функция F^ быстро затухает при размерах зерен, близких к
максимальному (на рис. 12 зависимость ti\(D) от соотношения
2RS/D резко падает до нуля). Такое распределение лучше всего
описывает те породы, в которых большая часть объема занята
крупными зернами, а мелкие зерна присутствуют в качестве
акцессорных минералов.
Если же речь идет о порошке, который получается при
дроблении и характеризуется более или менее однородным
распределением зерен по размерам, или о почве, размеры частиц
которой не слишком отличаются друг от друга, то, согласно
Фляйшеру, для их описания более подходит распределение вида
«W=° пРи/)<°-"»
'I =DmJD* при D>D
Если последнюю функцию интегрировать по аналогии с ti\(D),
то получим
F% = [FRnAD)dD,
fW = 3 т/8 - т3/64 при т < 2,
Z7^ = 1 — 3/4т при Т>2,
где y=2Rs/Dm\n. При больших £>га1п(у^2) это невыгодное
распределение для ядер отдачи, поскольку относительный разброс
размеров зерен мал. Зато при yS^2 величина интеграла весьма
велика, в чем читатель может убедиться самостоятельно.
Полученные уравнения и иллюстрирующие их кривые на
рис. 12 показывают максимум потерь атомов отдачи из зерна
245
Геометрия 1
или ансамбля зерен в зависимости от соотношения параметров.
Дальнейшая судьба атомов отдачи, как мы знаем из
предыдущего раздела очерка, двояка: или они останавливаются в по-
ровом пространстве, или внедряются в соседние зерна.
Попробуем эти случаи описать математически.
Условно (как условно мы считаем зерно шаром) представим
себе поровое пространство в виде щели с шириной до, имеющей
плоскопараллельные стенки
(рис. 13). Атом отдачи
вылетает из левого зерна и летит по
направлению к правому,
долетая до него (геометрия 1) или
останавливаясь в поровом
пространстве (геометрия 2). Для
дальнейших выкладок полезна
заменить ширину w
приведенной шириной wRs/Rf, где RF —
пробег атома отдачи в поровом
флюиде (воздухе или воде).
По своему смыслу приведенная
ширина эквивалентна такому
отрезку, как если бы флюид в
порах имел ту же самую
тормозную способность, что и
твердое тело. Тогда нетрудно,
с одной стороны, оценить долю
атомов отдачи, уходящих из
зерна (точка Р на глубине х
от поверхности), а с другой —
разделить эту долю на две
части: те атомы, которые
останавливаются во флюиде, и те,
которые внедряются в
смежные зерна.1
Долю /> атомов отдачи, которая входит в 2я-пространствен-
ный угол по направлению к поре и останавливается во флюиде,
находим из выражений
Геометрия 2
Q
<ишЛ
Рис.13
wRsjRF
w
~TTf
для {Rs~x)>wRsIRf
Rs — x
Rs
■-j$- Для (Rs
x)<wRs/RF.
1 Если читателю эти выкладки покажутся малоинтересными, он может
их пропустить. Но все же лучше помнить мудрые слова Леонардо да Винчи
о том, что «ни одно человеческое исследование не может назваться
истинной наукой, если оно не прошло через математические доказательства».
246
(Здесь наглядно видно удобство использования приведенной
ширины.) Оба равенства как раз соответствуют геометриям I
и 2 на рис. 13, с той лишь разницей, что геометрия 1 дает
результат, не зависящий от д:. Это понятно, поскольку часть
сферы радиусом Rs, лежащая между двумя секущими ее
параллельными плоскостями, имеет площадь, величина которой
зависит только от расположения плоскостей.
Интегрируя в интервале 0<Cx<^Rs, т. е. по всем значениям х,
для которых атомы отдачи покидают зерно, получаем среднюю
долю остановок в поре: />=6(2—6)/2, где 6 = w/RF. Подобным
же образом получаем долю атомов отдачи, внедренных в
соседнее зерно, усредняя (1—x)/(Rs—б) по интервалу Q^x^RsX
Х(1—wlRF), в котором некоторые атомы отдачи входят в зерно.
Тогда ft = 1/2—6-f62/2. Так как половина атомов отдачи,
движущихся к поверхности зерна из глубины RSi останавливается
в первоначальном зерне, а половина испускается, то fF+ft = l/2.
Следовательно, доля FFy которая останавливается в поровом
пространстве (из тех, что покидают зерно), составляет 2/F,
а доля Fit входящая в смежное зерно (тоже из тех, что
покидают первоначальное зерно), составляет 2ft. Отсюда
FF = 2b-b\
Ft = 1 - 2 8 + S2.
Как мы уже упоминали, вопросами роли и размеров пор, их
влияния на фракционирование изотопов радия много
занимались В. И. Баранов и сотр. Фляйшер же учел возможность
распределения пор по ширине, что более соответствует описанию
реальных пород и минералов. При этом постоянное
распределение больше подходит для аппроксимирования каналов в
структуре почвы или ансамбле мелких зерен. Оно
записывается так:
. \ =0 при w>w0,
n(w)\ v ^ °
I = 1/®о ПРИ TtxCWo-
Экспоненциальное распределение предполагает наличие
большого числа узких пор и более всего подходит для описания
пористости горных пород:
n(w) = (llw0)e~w'w\
Учитывая, что доля атомов, покидающих зерна и
достигающих соседних зерен, равна
F| = J Fin(w)dw,
о
для экспоненциального распределения получаем
Л= (1 —2е) + 2е2(1 - с^)\
247
для постоянного распределения
^=1-е + г>/3, (8)
где z = wo/RFf a wQ — характеристическая ширина пор._Доля
атомов, останавливающихся в порах, всегда равна (1—Ft).
Выражение (8) действительно для е<1. Но и для е>1,
независимо от вида распределения и значения w0y существует
конечная вероятность внедрения атомов отдачи в соседние
зерна, так как в реальных случаях всегда имеется хоть небольшая
доля узких пор. В этом выводе одно из достоинств моделей,
развитых Фляйшером.
Профессор Квинслендского университета Ричард Чепмен
в своей книге «Геология и вода» (Л., 1983) писал:
«...прикладная математика в естественных науках часто бывает либо
тривиальна, либо непомерно трудна». Завершая этот раздел, автор
выражает надежду, что ему все же удалось удержаться на
тонкой грани, не раздражающей читателя ни нарочитой
усложненностью, ни очевидной простотой.
«ПОВЕРИМ ГАРМОНИЮ» АРИФМЕТИКОЙ
Точных наук не существует.
Дени М. Шоу
Интересно, какую практическую пользу для суждения об
атоме отдачи 234Th (234U) принес нам математический экзерсис?
Конечно, заманчиво было бы уметь предсказывать состояние
нарушенного равновесия 234IJ/238U для конкретной породы или
почвы, но для этого нужно знать соответствующее
распределение зерен и пор по размерам, а именно эта информация в
большинстве случаев и отсутствует.
Для проверочных оценок зададимся несколькими крайними
значениями Дпах. Пусть мелкий монацитовый песок
описывается распределением /ii(Anax) со^значением Dmax = 100 мкм. Если
/?s=20 нм. то 2#6/Dmax=4-10~4« Воспользовавшись
выражением (7), находим, что доля атомов отдачи, покинувшая зерна,
составляет 0,002. Следовательно, в твердом теле ожидается
отношение активностей 234U/238U, равное 0,998.
Если же уран преимущественно находился в субмикронных,
богатых ураном минералах, описываемых распределением
«l(Anax) с Апах=0,1 мкм и 2/?&/£>тах=0,4, тогда F^ =0,64,
а для оставшегося минерала у=0»36 (эти цифры можно
получить также непосредственно из кривой ti\(D) на рис. 12).
Заметим, что использование для расчетов выражения (7), как
и рис. 12, возможно только при допущении, что все атомы
отдачи, покидающие зерна, тормозятся в поровом флюиде. А если
248
часть из них и достигает противоположного «берега», то все
равно извлекается омывающими его водами.1
Считая, таким образом, что выщелачивание происходит
с 100%-ной вероятностью, оценим вклад (или соотношение)
двух механизмов нарушения равновесия изотопов урана —
непосредственной остановки атомов отдачи тория в порах и
выщелачивания атомов из стенок пор. На основе теории Ландхарда,
примем пробег атомов отдачи тория-234 в сухой поре равным
50 мкм, в воде — 50 нм. Будем считать распределение размеров
пор в почве или в мелкодисперсных урановых минералах (где
Отах=0,1 мкм) постоянным с характеристической шириной пор
ш0=0,03 мкм. Тогда для сухой почвы w0IRs=Q,Q006y и,
согласно равенству (8), имеем Ft-= 1—0,0006+ (0,0006)2/3~1. Для
влажной почвы ш0/#^ = 0,6 и Fi=l—0,6+(0,6)2/3=0,52. В
первом случае из тех атомов, которые покидают исходное зерно,
все пересекают поры и внедряются в соседнее зерно, откуда,
как мы предположили, позднее выщелачиваются. Во втором
случае из тех атомов, которые покидают исходное зерно, 52%
достигают соседних зерен, а 48% теряются в лабиринте пор.
Отсюда следует, что даже если почва никогда не бывает сухой,
то все равно и в этом случае большая часть эффекта (52/48)
обеспечивается выщелачиванием внедренных атомов отдачи. Но
реально эта доля еще выше. Действительно, если ft — доля
времени, когда пора влажная, вклад от выщелачивания будет
равен 1-(1—ft)+0,52//= 1—0,48/г. Другими словами, при таких
мелких порах выщелачивание внедренных атомов может
явиться (теоретически!) основным механизмом выделения изотопа
урана-234.
Для кристаллических пород, которые, скорее, описываются
экспоненциальным распределением с ш0~0,1 мкм, вклад от
выщелачивания составит, конечно, меньшую величину. Она
приблизительно равна 1—0,85f*.
Таким образом, несмотря на ряд допущений (а может быть,
и упущении) и на все трудности практического использования
выведенных формул, математические модели Роберта Фляйше-
ра правильно отражают главные черты природного
фракционирования изотопов урана и могут служить отправным
методологическим подходом к пониманию и количественному описанию
этих процессов. Вероятно, это тем более справедливо, если
вспомнить, что полностью адекватных моделей вообще не
существует, а самая строгая на сегодняшний день теория верна лишь
в определенных рамках. Как писал Д. П. Томсон, «особых
оснований считать природу подчиняющейся математическим
закономерностям нет...».
1 Это, конечно, явная натяжка (вспомним опыт Кигоши!), но она
необходима нам для оценок.
10 779
249
«МОМЕНТ ИСТИНЫ»!
...Пора завершенья. И тайна ясна.
И в нервах последняя смолкла, струна.
В. В. Чердынцев, Десятая муза.
Итак, кажется, загадка фракционирования изотопов урана
в природе нами понята до конца. Все, как говорится, разложено
«по полочкам», и точки над i везде старательно расставлены.
Даже математическая модель процессов создана, чтобы
последователи Леонардо да Винчи не сделали упрек нам, что
«никакой достоверности нет в том, что не имеет связи с
математикой». Теперь можно удобнее устроиться в кресле и созерцать
возведенное нами прекрасное здание.
Стоп. Если бы это было действительно так, то наука была
бы самым скучным занятием на Земле, суетным и тщетным.
К счастью, все обстоит не так тоскливо: ведь наши знания
о фракционировании изотопов урана касаются только самого
начала — общих причин и, возможно, частично механизма
попадания атомов отдачи из минералов в природные воды.
А больше ничего мы не знаем. Главное, что мы не знаем
конкретной химии в треке атома отдачи.
Вы думаете, автор сгущает краски ради необходимой
риторической фигуры в конце очерка? Отнюдь нет. Вернемся
к рис. 6. Штриховая линия, проведенная на уровне у—\,
отражает примерно равновесное отношение изотопов урана в
минерале в целом. Отметим для себя, что, следовательно, образец
не обеднен ураном-234. Да, не обеднен, но во всех вытяжках,
независимо от состава выщелачивающего раствора, у<\, т. е.
вытяжки обогащены материнским изотопом, а не дочерним.
А ведь это никак вроде бы не согласуется с традиционными
воззрениями на природу фракционирования урана-234,
изложенными в предыдущих разделах.
Надо отдать должное Ширвингтону: он, кажется, решил
эту шараду. Скорее всего, ядра отдачи Th-234 попадают после
альфа-отдачи в октаэдрические узлы в некоторых глинистых
минералах, изоморфно замещая там Al3+, Fe3+ и другие
многовалентные ионы. Благодаря этому дочерний уран
удерживается в твердой фазе даже после энергичного химического
разложения образцов (и, кстати, несмотря на свое якобы
шестивалентное состояние).
Другой пример для раздумий — рис. 8. Как это себе
представить: более 90% урана в бритолите находится в
шестивалентном состоянии, а уран-234 стремится обогащать более
восстановленную форму урана? О подобных результатах
сообщила группа исследователей из Токийского университета,1 за-
1 Ко b as hi А. е. a.—Radiochim. Acta, 1979, vol. 26, p. 107.
250
нимавшихся изучением минерала эвксенита (Y(Ti, Nb)206),
содержащего примесь урана. Они получили у4 = 1»24 и ^6=0,95,
хотя и в эвксените основная масса урана находится также в
шестивалентном состоянии. Выходит, из материнского урана,
находящегося в состоянии U6+, может образовываться дочерний
уран в состоянии U4+! Где же логика? Ведь после двойного
{$-распада в цепочке 234Th->234Pa-^234U все должно происходить
как раз наоборот! И где те скрытые причины, определяющие
выбор между валентными формами, который совершает уран-
234? Чем вообще определяется изотопный сдвиг между двумя
валентными формами урана в минерале? Отсутствием
изотопного (электронного) обмена в твердой фазе? Наличием
определенных мест в структуре, обеспечивающих изоморфное
замещение или сохранение четырехвалентного состояния?
Присутствием некоторых координационных анионов, защищающих атомы
отдачи от «нежелательных» химических связей? Почему эта
ситуация не реализуется в ортите, где четырехвалентного
урана много? Какова роль (и доля) промежуточных валентных
состояний, в которых могут стабилизироваться атомы отдачи
урана-234? Как вообще влияет химическая природа минерала
на результат ядерно-химических процессов, в которых
принимает участие уран-234 (или Th-234, Ра-234)?
Ответа на эти вопросы нет. И не исключено, что ответов
будет почти столько же, сколько и разных урансодержащих
минералов на Земле. Разобравшись в кинематике процессов, мы
только сейчас подошли к их химии. И одна из задач
исследователей заключается именно в поиске тех химических условий
эксперимента, при которых становится возможным заметить
различие изотопного состава урана между его валентными
формами. По сути дела, химическая проблема не решена, а только
поставлена. Все оказалось сложнее, чем думалось вначале. Но
не хочется говорить — «к сожалению», правильнее повторить —
«к счастью»._Уж лучше состояние озадачивающей, но
осознанной неопределенности, чем четкой, но искусственной простоты.
Сложность задачи исследователей еще никогда не пугала.1
По мере того, как будет углубляться наше понимание
химических процессов, сопутствующих ядерной отдаче, и механизма
фракционирования изотопов, будет расширяться и сфера
применения этих любопытных и сложных эффектов. Сейчас мысль
исследователей направлена на решение нескольких проблем
1 Запутанность ситуации усугубляется еще и тем, что под влиянием
электронно-микроскопических и микрорентгеноспектральных исследований
двух последних десятилетий рушатся устойчивые представления о якобы
широко развитом в природе изоморфизме. Гетерогенность, сосуществование
большого числа микрофаз — вот действительная причина сложности состава
большинства минералов. Этот «взрыв» новой минералогической информации
неминуемо волнами пройдет по многим областям исследований, поколебав
и там устоявшиеся концепции.
251
первостепенной важности, например: можно ли на основе
изотопных сдвигов урана и тория давать определенные
рекомендации к разработке урановых месторождений методом
подземного выщелачивания; как, пользуясь параметром у» выработать
строгие критерии при поиске алмазоносных кимберлитовых
трубок; пригодны ли изотопные параметры подземных вод в
качестве предвестников приближающихся землетрясений и т. д.
Сами по себе эти исследовательские и практические задачи
весьма привлекательны, и, конечно, описание их «могло бы
составить тему нового рассказа, — как говорил Ф. М.
Достоевский,— но теперешний рассказ наш окончен».
КАК ПОСТИГНУТЬ
ОГРОМНЫЙ МИР ХИМИИ
Цените время: дни уходят невозвратно!
Но наш порядок даст привычку вам
Распределить занятья аккуратно.
Я. В. Гете
...Учись, мой сын, наука сокращает нам
опыты быстротекущей жизни...
А. С. Пушкин
ремя— вот что сначала незаметно, но с возрастом все
сильнее заставляет нас предпринимать непрерывные
усилия, опускать в отчаянии руки перед неудачами,
хвататься за первую попавшуюся надежду. Такое
поведение часто характеризует людей, избравших своей
жизненной целью научный поиск. Если к этому добавить
постоянно увеличивающийся объем общей и специальной
информации, от направленной переработки которой ученый никуда
не может уйти, то рамки времени оказываются еще более
тесными.
Постижение мира химиц, в этом смысле, отнюдь не
исключение. Напротив, положение осложняется еще и тем, что химия
как наука об электронных превращениях вещества за
последние годы теряет свои границы (впрочем, это относится не
только к химии), проникает во владения других наук и, в свою
очередь, принимает на вооружение идеи, выдвинутые совсем не
химиками. Таким образом, современный химик должен
обладать познаниями, позволяющими ему ориентироваться в
смежных с химией областях, например в физике, биологии,
медицине, агрономии и т. д. Но не уподобится ли тогда химик
штангисту, поднявшему над головой непомерно тяжелую штангу и не
сумевшему удержаться на ногах? Чтобы избежать этого,
можно избрать два пути.
Первый путь — использование современной техники для
сокращения времени рутинной работы, без которой не обойтись
в любой области науки, для выдачи количественных
характеристик, подсчета статистической вероятности, автоматизации
аналитических операций и т. д. Другой путь заключается в
овладении специалистом-химиком (и опять-таки не только
химиком) общими принципами научного мышления, законами
информатики, математическим планированием эксперимента,
§
253
в укреплении психологической готовности к научной
деятельности. Иными словами, ученый должен владеть методами
обобщения, классификации, т. е. индуктивным и дедуктивным
методами * логики, методологией данной науки и,,наконец,
психологическими навыками в управлении своей творческой
деятельностью. На вопросах реализации второго пути, позволяющего
химику вести современный научный поиск наиболее
рационально и эффективно, мы и остановимся в данном очерке. Начнем
с принципов научного мышления, но для того чтобы это
намерение не прозвучало слишком отвлеченно, разберем одну
парадоксальную ситуацию, описанную в книге Н. А. Подгорецкой
«Изучение приемов логического мышления у взрослых» (М.,
1980).
Группе участников психологического эксперимента,
состоящей из 5 старшеклассников, 29 абитуриентов, 16 студентов
и 20 специалистов с высшем образованием, предложили решить
следующую задачу, которая в разных вариантах встречается
в серии «Занимательные науки»: «Представьте себе, что земной
шар один раз опоясан по экватору веревкой. Мысленно
прибавьте к этой веревке один метр и расположите эту новую
веревку над первой как концентрическую окружность.
Спрашивается, пройдет ли в образовавшийся зазор апельсин среднего
размера?».
Результаты эксперимента оказались обескураживающими:
82% ответов оказались неправильными; характерно, что 76%
не посчитали необходимым обратиться к математической
формуле и были уверены в своей практической сметке и
интуитивной правильности ответа; более того, почти половина
опрашиваемых, которые применили математические формулы, не
поверили полученным результатам и просто растерялись. А дело
в том, что вполне образованные люди не владели методами
логического заключения и предпочли воспользоваться
практическим опытом и интуитивным запретом. Автор приводит
следующие характерные высказывания испытуемых: «А что мне
формула? Я и так представляю. Тут и иголка не пройдет», «Нечего
считать — очень маленький зазор будет».
Мы убеждены, что и наш читатель, пытаясь решить
данную задачу, испытает на себе тяжесть сомнения в правильности
своего ответа.
Ключ к решению задачи лежит в том, что изменение зазора
зависит от соотношения диаметра и длины окружности, а не
только от величины последней. Но эта логическая связь
затемнена кажущимся поверхностным восприятием
явления.
1 Индуктивный метод основан на способе рассуждения от отдельных,
частных фактов и положений к общим выводам и обобщениям. Дедуктивный
метод, наоборот, — от общих положений к частным.
254
Как же выделить необходимую логическую связь, каковы
законы ее образования? Попытаемся, хотя и кратко, ответить
на эти вопросы.
ЛОГИКА НАУЧНОГО МЫШЛЕНИЯ
А потому, мой друг, на первый раз,
По мне, полезно было бы для вас
Курс логики пройти...
...О, все пойдет на лад:
В редукцию лишь надо вникнуть,
К классификации привыкнуть.
И. В. Гете
Логический аспект научного мышления, или логика науки,
существует независимо от желания человека и отражает
порядок и связи предметов и явлений в объективной реальности.
Согласно законам логики, правильное мышление должно
удовлетворять трем основным требованиям: определенности, после-
довательности и доказательности. Кроме того, всякие мысли,
мнения о предметах или явлениях в нашем человеческом
представлении неразрывно и объективно связаны с их языковым
выражением, с грамматическим предложением. Поэтому
логическая форма любого высказывания включает в себя три
обязательные составные части: субъект суждения 5 (подлежащее),
предикат суждения Р (сказуемое) и связь между субъектом
и его предикатом — отношение в суждении. Оперируя этими
понятиями, мы должны учитывать объем их содержания,
отношение одного понятия к другому. Например, понятие о
субъекте «химические элементы» включает в себя целый ряд
понятий— «галогены», «лантаниды», «трансурановые элементы»,
значительно меньших по объему содержания. А понядия «атом»
и «электроотрицательность» не исключают друг друга, но
объемы их содержания перекрываются лишь частично. На
правильном определении объема понятия о субъекте или
предикате основывается точная классификация химических
явлений, веществ реакций. Но при такой классификации должно
быть единое основание для всех сравниваемых объемов
понятий, и обозначен признак деления, т. е. критерий, по которому
мы относим то или иное понятие к определенному классу
химических признаков. Предположим, надо разделить, или на
химическом языке классифицировать, понятие «кислота».
Возможна такая классификация: а) неорганические кислоты; б)
органические кислоты; в) аминокислоты; г) нуклеиновые кислоты.
Но в такой классификации кислот нарушено деление по
одному и тому же основанию, так как нуклеиновые кислоты, по
представлениям 'Бренстеда, вообще не являются кислотами.
255
Нарушен здесь и признак деления: аминокислоты относятся
к органическим кислотам.
А вот более жизненная ситуация. Один из посетителей
аптеки попросил продать ему какое-либо успокаивающее
средство. Когда провизор ответил, что в аптеке есть
транквилизаторы, антидепрессанты, анальгетики, барбитураты на выбор,
а посетитель сказал: «Все равно, лишь бы успокоило», то
с точки зрения логики и провизором, и посетителем была
допущена ошибка в перечислении, классификации данных
лекарственных средств. Дело в том, что подвести общее основание
под приведенные группы лекарств по признаку
«успокаивающие» нельзя. Определенно успокаивающий эффект оказывают
только транквилизаторы, все остальные медикаменты
проявляют разное, по существу, действие на человека —
тонизирующее, обезболивающее, снотворное, которые не могут быть
объединены одним словом «успокаивающее». Отсюда ясно, что надо
точно знать не только содержание понятия, но и правильно
определить его принадлежность к данному классу
понятий.
Обобщение понятий приводит к образованию4 другой
логической категории — к суокдению. Суждения могут быть общими,
частными и единичными. Поэтому, высказывая суждение,
прежде всего нужно точно установить его логический смысл. Это не
всегда просто сделать. Например, известно общее суждение
«все металлы электропроводны», из которого может вытекать
частное суждение «медь электропроводна», и, следовательно,
если общее суждение истинно, то и частное суждение истинно.
Но обратный ход рассуждения здесь оказывается
неправильным. В самом деле, если частное суждение «оксид цинка
проявляет полупроводниковые свойства» истинно, то общее
суждение «все оксиды металлов обладают полупроводниковыми
свойствами» является ложным. Значит, истинность частного
суждения еще не дает нам права рапространить это
утверждение на соответствующее общее суждение. Другими словами,
дедуктивное суждение (первый случай) оказывается более
строгим, чем индуктивное (второй случай). Это надо иметь
в виду любому исследователю (не только химику), делающему
заключение на основании результатов своей научной работы.
Сопоставление суждений помогает нам установить границы,
диапазон мыслимого исследования. Помимо четкости в
определении цели исследования, уточнения оптимальных границ его
логический ход мышления ведет нас от возможности вывода
простого умозаключения к более сложным обобщениям
фактов, суждений.
Рассмотрим простое дедуктивное умозаключение —
силлогизм,, которое мы выводим из двух достоверных посылок,
суждений;
256
1. Все формы пенициллина имеют асимметрический атом углерода.
2. Все сосдпнекня с асимметрическим атомом углерода вращают пло-
скость поляризованного луча, т. е. оптически активны.
Вывод: все формы пенициллина оптически активны.
В этом категорическом силлогизме проводится мысль, что
•сравнительно небольшой класс химических соединений — пени-
циллинов— входит в состав более значительного класса
соединений, объединенных общим признаком оптической активности.
Но в недрах этого умозаключения зреет и еще одно обобщение,
более сложное по содержанию и приближающееся к научной
гипотезе. Известно, что многие биологически активные
вещества обладают оптической активностью. Можно ли построить
•силлогизм, в котором класс оптически активных соединений
входил бы в более обширный класс биологически активных
веществ? Нет, такой силлогизм построить нельзя по двум
причинам. Во-первых, суждение «все формы пенициллина имеют
асимметрический атом углерода» в рассмотренном силлогизме
вполне достоверно, чего нельзя сказать о суждении «все
оптически активные вещества являются биологически активными».
И, во-вторых, мысль об оптически активных веществах по
содержанию относится к классу химических или физических
явлений, и она не нарушается в первом силлогизме, а в
гипотетическом силлогизме нельзя усмотреть дедуктивную связь между
химическим и биологическим содержанием суждений. Итак,
силлогизм построить нельзя, но можно упомянутую мысль
выразить в виде гипотезы.
Построение гипотезы есть также логическая операция, но
обобщение более высокого порядка.
Многие из химиков зозьмут на себя смелость построить
гипотезу, но немногие смогут логически доказать ее значимость.
А между тем существуют определенные правила составления
гипотезы, основанные на приблизительно равном содержании
предикатов двух суждении. Если подобное равенство
предикатов существует, то задача построения гипотезы сводится к
распространению закономерности или мысли об одном субъекте
на второй субъект, конечно, при наличии единого основания для
такого переноса. Чем шире основание гипотезы, тем больше
вероятность гипотезы. Вообще в отличие от силлогистических
умозаключений гипотеза имеет недостоверный характер до тех
пор, пока она не превратится в закон. Вот логическая формула
гипотезы:
Р'-Х
S^X при Р^Р\
(Здесь X символизирует новый, гипотетический субъект.) Эта
запись означает, что если свойства предмета или результат про-
257
цесса тождественны (Р~,Р')> то и закономерности, лежащие
в основе сравниваемых явлений, должны быть аналогичными.
Основной критерий правильности гипотезы — совпадение-
содержания гипотезы с сущностью наибольшего числа
следствий, выводимых из нее. Если сущность хотя бы одного
следствия находится в противоречии с гипотезой, последняя должна
быть отвергнута. Для иллюстрации этого положения вернемся:
к умозаключению о связи оптически активных веществ с их
активными биологическими свойствами. Сначала надо установить
относительное тождество предикатов. Предположим, что и
оптическая, и биологическая составляющие явления вызывают
один и тот же лекарственный эффект. Теперь надо осуществить
перенос субъекта. Закономерность в первом субъекте уже
есть — оптически активный пенициллин действительно
оказывает определенный лекарственный эффект и имеет химическую»
структуру
ИООС — СИ — N — С = 0
Н,С.1 J J
ь н
И тут нам приходит в голову мысль, что другое оптически
активное вещество может давать совсем другой лекарственный
эффект. Вот и рассыпалось тождество предикатов, а
построение гипотезы ускользает из рук. Словом, как говорит Фауст,
И если первая причина исчезает,
То и второму не бывать никак.
Но оставим пенициллин и попытаемся построить гипотезу*
в совсем другой области — нефтехимии. Всем известно, что
вопрос о происхождении нефти (органическом или
неорганическом) окончательно не решен. Построение гипотезы о
происхождении нефти дает неожиданный результат: логически
гипотезы об органическом и неорганическом происхождении неф™
равновероятны. Тождество предиката здесь
налицо—независимо от происхождения вид нефти и ее назначение остаются
одинаковыми. Первый субъект S — условия возникновения нефти-
из углеводородов в присутствии алюмосиликатных
катализаторов и карбида железа в добиологические времена
(неорганическое происхождение нефти). Второй субъект X — искусственное
моделирование предполагаемых природных условий. Еслет
S&X и тождество предикатов при этом сохраняется, то
гипотеза становится весьма вероятной. Точно также мы можем
поступить и с гипотезой об органическом происхождении нефти
(XzzS). В обоих случаях все решает эксперимент.
Итак, мы видим, что дедуктивный метод в научном мышлении
химика используется для определения принадлежности одного
258
явления к другому, подчиненности одного явления другому,
утверждения классификационных признаков. Логический метод
построения гипотез может быть полезен химику, скажем, при
установлении механизма реакции, закономерности процесса
и даже при формировании новой теории.
Наконец, еще одним видом обобщения в процессе
мышления является индукция. Подавляющее большинство химиков
пользуется индуктивным методом, не задумываясь об этом.
В своей основе этот метод вероятностный и уступает в
достоверности, например, силлогистическому образу мышления.
Лишь только полная индукция, т. е. наличие исчерпывающего
количества частных характеристик вещества, дает нам
возможность сделать общий достоверный вывод о природе этого
вещества. Так, различные физико-химические константы,
конкретные химические свойства в совокупности дают нам право
утверждать, что мы имеем дело' с определенным чистым
веществом, отвечающим принятому названию, например золоту.
Но в исследовательской работе химик чаще всего
пользуется (иногда бессознательно) методами неполной индукции.
Умозаключения по этим методам в значительной мере носят
вероятностный характер, так как обычно ограничены рамками
эсперимента. Наиболее удобную классификацию методов
неполной индукции дал английский философ Ф. Бэкон еще
в XVII в.
Первый из них — метод единственного сходства — можно
проиллюстрировать на примере разделения катионов (или
анионов) в качественном анализе, когда мы последовательно
осаждаем катионы четырех групп, чтобы убедиться, наконец, в том,
что в растворе содержатся ионы калия или натрия. Набор
катионов всех пяти аналитических групп (учитываются две
подгруппы четвертой группы катионов) схематически изображен
1.
Z. +HC1
J. ♦Н25(рН~5)
4. *H2S(pH~$)
S- 4NHv)2C03
I II IN V IV IV
© © ©© © ©
© ©© © ©
© © ©
0 ©
©
Рис.1
259
на рис. 1. Строки 1—5 означают последовательные воздействия
на указанную химическую систему четырьмя различными
реагентами. Сначала на раствор смеси солей разделяемых
катионов действуют соляной кислотой. В осадок выпадает хлорид
серебра — катион первой подгруппы четвертой группы. Затем
при действии сероводорода в кислой среде (рН~5) выпадают
в осадок катион второй подгруппы четвертой группы Hg2_b
и катион пятой группы Sn4+.
Действие сероводорода при рН~9 приводит к выпадению
в осадок А134* — катиона третьей группы. И далее, прибавляя
к раствору карбонат аммония, осаждаем катион Ва2+,
принадлежащий к второй группе. После всех этих операций в
растворе остаются только катионы первой группы—катион калия.
Единственное сходство во всех пяти случаях состоит в наличии
в анализируемых растворах ионов калия. В самом общем плане
метод единственного сходства, применяемый в
исследовательской работе, включает последовательное сужение круга
побочных явлений, второстепенных условий опыта с целью выяснения
основной причины события или установления структуры.
Второй метод Бэкона — метод единственного различия.
В химии он реализуется путем поочередного выключения или
включения одного экспериментального фактора в системе
факторов или химического соединения в смеси веществ.
Единственным различием в этих операциях является то, что лишь один
фактор или одно вещество значительно влияет на изменение
основного результата исследования.
Скажем, рацион кролика включает пять различных
витаминов: А, Вь С, Д, Е. Было замечено, что внесение их в пищу
приводит к обострению зрения животных. Возникает вопрос:
синэргично их действие или один какой-то витамин ответствен
за эффективность упомянутого действия? На рис. 2 пять
кружков означают пять витаминов, а строка символизирует их
смесь. Заштрихованный кружок — отсутствие соответствующего
витамина в смеси. Пользуясь методом единственного различия,
исследователь, например, может установить, что именно
присутствие витамина А в смеси витаминов, прибавляемых в корм
кроликам, повышает остроту зрения животных.
Третий метод Бэкона — обобщение двух предыдущих.
Четвертый— ме-юд остатков. Он является наименее достоверным
из всех видов^ неполной индукции, но иногда исследователи им
пользуются. Скажем такой пример. При идентификации
полученного инфракрасного спектра какого-либо органического
соединения оказалось, что подавляющее большинство
характеристических частот совпадают с ожидаемыми, но происхождение
некоторых частот выяснить не удалось. Тогда полагают, что
спектр в целом тождествен ожидаемому, а остаток
невыясненных частот (волнистая линия на рис. 3) просто приписывают
этому спектру в первом приближении.
260
Наконец, пятый метод Бэкона — метод сопутствующих
изменений. Содержание его заключается в том, что среди
необходимых параметров, определяющих сущность явления, можно
найти такой, изменения которого вызовут изменения другого
единственного параметра; остальные параметры при этом
будут сохранять постоянное значение. Этот метод неполной
индукции применяется, например, при настройке приборов,
проведении однофакторного эксперимента и т. д.
Мы бегло изложили некоторые формы логического
мышления, которые после некоторой практики обращения с ними
прививают химику-исследователю ясный, четкий взгляд на весо-
'- ФОООО
* 0§00О
* ООФОО
^.OOOiO
5 О О ОО ®
Рис 2
Рис 3
мость научного вывода, перспективу, исследования, позволяют
объективно оценить ограниченность и достоверность научных
результатов. Но самое важное в другом: они дают
возможность довольно быстро и правильно проникать в суть любой
области науки, ибо законы логики всеобщи.
Но если законы логического мышления обеспечивают
стратегическую направленность исследования, то тактика химика-
исследователя в своей работе зиждется на знании методологии
химии. В отличие от логики методология определяет систему
понятий и закономерностей, относящихся лишь к конкретной
науке, в нашем случае к химии.
МЕТОДОЛОГИЯ В НАУЧНОМ МЫШЛЕНИИ
...Живой предмет желая изучить,
Чтоб ясное о нем познанье получить, —
Ученый прежде душу изгоняет,
Затем предмет на части расчленяет...
Я. В. Гете
Каждый, кто приступил к углубленному изучению химии,
довольно долго испытывает чувство необъятности изучаемого
материала, «ощущает» его громоздкость и в конце концов
концентрирует свои усилия, интересы, внимание в сравнительно
261
узкой области химии. Но творческая деятельность
специалиста не может активно развиваться, если он не видит перед со-,
бой картины состояния современной химии в целом. Кроме
того, постоянный приток информации не толькд в области
химии, но и в смежных требует четкой ориентации в принципах
и закономерностях химии, знания расчетных операций и основ
моделирования. И здесь приходит на помощь методология.
«Красные нити» методологических обобщений «пронизывают»
всю толщу химии. Вот некоторые из них.
В настоящее время каждое химическое явление правильно
рассматривать под тремя углами зрения: квантовой химии,
термодинамики и кинетики. Такое рассмотрение химического
явления связано с единством микрохимических и макрохимиче-
ских представлений о строении вещества и путях реакций.
Возьмем, например, уравнение константы равновесия реакции
К=Ае «т .
Обозначения здесь традиционные: АН—изменение энтальпии,
RT — произведение универсальной газовой постоянной на
температуру. Константа равновесия К — величина
термодинамическая, т. е. макрохимическая. Множитель А выражает
термодинамическую вероятность протекания реакции в Данном
направлении, эффективность столкновений атомов и молекул,
характеризующихся лцшъ их поступательным движением.
Индивидуальные особенности реагирующих частиц здесь не
учитываются. Теперь заменим коэффициент А на выражение ZnonlZHa4y
где Z — квантово-статистическая сумма состояний отдельных
молекул, участвующих в реакции. Эта характеристика связана
с набором величин, относящихся к поступательному,
вращательному и колебательному движениям молекулы и является
микрохимической величиной. Тогда уравнение константы
равновесия реакции запишется в виде
z -—
•^нач
Такая форма записи связывает микро- и макрохарактеристики
равновесной реакции и позволяет получить более точные и
достоверные результаты.
Другим методологическим обобщением в химии является
учение о промежуточных веществах в реакции — интермедиатах.
Здесь особенно важны пространственные и энергетические
характеристики интермедиатов, от которых, как теперь
установлено, полностью зависят направление и эффективность
химического процесса.
В органической химии предметом настойчивого внимания
химиков всего мира стала циклическая форма многих химиче-
262
ских соединений. Разработана и методология для этого класса
соединений. В ней закреплены принципиальные особенности
систем, вносящие четкость и перспективу в любые исследования
в области этих соединений. Плоский цикл, цикл в форме
«ванны», «кресла», динамическое «выворачивание» кольца
(инверсия), вращение атомов в кольцевой молекуле (конформацион-
ные превращения) —
бензол Циклогексан Циклогексан
[Плоский цикл) Кресло Ванна Инберсия
эти и другие пространственные признаки циклической системы
методологически принадлежат к одной группе стереохимиче-
ских явлений.
Ароматические органические соединения (например,
бензол), гетероциклические органические соединения (например,
пиридин), неорганические циклы (боразол, циклофосфазен)
отличаются друг от друга спецификой электронного
взаимодействия атомов в циклической системе, но методологически все
они могут быть рассмотрены с общих позиций электронной
теории в химии.
Наконец, циклические соединения можно рассмотреть на
топологической основе, когда изменения в структуре цикла
происходят без нарушения целостности структуры, без
перераспределения химических связей. Такие превращения имеют
место в химии катенанов, ротаксанов, в процессе получения
ленты Мёбиуса (рис. 4). В случае ленты Мёбиуса, где
тороидальное кольцо л-электронной плотности бензола заменяется
изогнутой и замкнутой полоской постоянной ширины, мы можем,
не нарушая химических связей, а только изгибая полоску, как
показано на рисунке, изменять энергию л-электронной системы
бензола. При этом ароматическая система перейдет в
антиароматическую.
Разумеется, каждому из описанных выше методологических
подходов к изучению природы циклических соединений соот-
OR
Катенач Ротаксанм Лента Мёбиуса
Рис и
263
ветствуют определенные закономерности, но только
сфокусировав методологические точки зрения, можно по-настоящему
глубоко проникнуть в существо явления, вскрыть особенности
циклических соединений, классифицировать их, сделать
обобщения.
Таким образом, знание методологии химии позволяет
специалисту-химику не терять из виду панораму сегодняшней
химии, своевременно учитывать эволюцию общих воззрений на
эту область науки.
ПСИХОЛОГИЯ НАУЧНОГО МЫШЛЕНИЯ
...В ее границах
Начнут сейчас дрессировать ваш ум,
Держа его в ежовых рукавицах,
Чтоб тихо он, без лишних дум
И без пустого нетерпенья,
Всползал по лестнице мышленья...
Я. В. Гете
Научное мышление есть процесс непрерывного
взаимодействия человека с окружающим его миром, в ходе которого
происходит интенсивное преобразование поступающей к нему извне
информации. Активное участие человека в этом процессе
отражается в содержании психологического аспекта научного
мышления. Известно, что развитие науки в истории человечества на
ее разных этапах характеризовалось соответствующей
совокупностью общих принципов научного мировоззрения. К таким
основополагающим принципам принадлежали греческая
атомистика, средневековый механицизм. Причем эти принципы не
только определяли развитие конкретных наук, но и
способствовали формированию психологии научного мышления на какой-
то период существования человеческого общества.
В наше время наука также руководствуется несколькими
фундаментальными положениями. Но, поскольку эти
положения сформировались сравнительно недавно, мы затрачиваем
еще много усилий, чтобы преодолеть высокий психологический
барьер, отделяющий новый взгляд, новый подход к научному
исследованию от старого привычного.Так, нам до сих пор
нелегко освоиться с превращением трехмерного евклидова
пространства, в четырехмерное (четвертый параметр — время).
Мало кто может похвастаться тем, что легко разобрался,
например, в общей теории относительности. Квантовомеханический
подход в естественных науках привел к замене наглядных
классических представлений на абстрактные толкования картины
физического мира. Психологические трудности при восприятии
абстрактных, умозрительных систем, например системы
молекулярных и атомных орбиталей, общеизвестны. Принцип си-
264
стемности в современной науке (кибернетический подход)
также связан с существенной перестройкой психологического
аппарата исследователя. Химикам, видимо, еще предстоит
преодолеть психологический барьер при установлении связи между
понятиЯхМи «энтропия» и «информация».
Что же может предпринять начинающий
химик-исследователь для создания психологического комфорта при изучений
нового необычного материала, новых связей в явлениях?
Прежде всего среди профессиональных навыков
современного химика важное место должен занять психологический
тренинг определенной направленности. В тренинг входят общие
приемы интенсификации умственной деятельности и
специальные приемы, представляющие интерес для химиков. К общим
приемам относятся: практика переформулирования задачи,
которую невозможно решить по привычному алгоритму;
максимальное сближение аналитической стадии мышления (что
задано?) с целью мышления (что требуется?); выяснение
основного звена задачи; метод аналогий; развитие «бокового» мышн
ления; развитие способности к преодолению функциональной
фиксированности («нестандартное» мышление) и др.
Для химиков, как мы полагаем, особое значение имеют три
психологические установки, также отрабатываемые в условиях
тренинга. Речь идет о пространственном мышлении, о
психологии знаковой информации и психологической установке на
опасность работы.
До тех пор пока исследовались объемные параметры
атомов, молекул, кристаллов в их статическом состоянии, особых
трудностей для восприятия пространственных представлений
такого рода не предвиделось. Положение резко изменилось,
когда одной из задач химии стало исследование динамической
природы атомов и молекул, их перемещения в пространстве
и, наконец, объема реакции. Главная психологическая
трудность в восприятии таких пространственных представлений
заключается в том, что нужно сохранять и удерживать в
воображении одновременно несколько меняющихся во времени
динамических структур и схем. Такая трудность возникает,
например, при изучении поворотной изомерии многоатомной молекулы
с несколькими функциональными группами или оптической
изомерии молекул с несколькими асимметрическими атомами
углерода. Химическая специфика требует, чтобы при поворотной
изомерии, при инверсии циклов или атомов постоянно
сохранялись наиболее вероятные соотношения между фрагментами
молекулы. Иначе создается хаотическая картина любых
пространственных превращений атомов и молекул, не входящая
в рамки принятой классификации. Обычно исследователь в
подобных случаях избирает так называемую зрительную опору,
вокруг которой (или на ее основе) строит другие
пространственные модели.
265
Большие психологические трудности возникают при
восприятии последовательности пространственных операций над
двумя или более молекулами с целью выяснения сходных
элементов структуры (операции симметрии). Причины затруднений
заключаются в том, что эти пространственные перемещения
одновременно кодируются, т. е. сама операция по времени в
процессе мышления не осуществляется, а лишь обозначается. Это
осложняет работу нашего ума, привыкшего оперировать
физическими модельными представлениями.
Итак, молодому специалисту-химику нашего времени
следует особое внимание обратить на пространственные
представления в химии, научиться быстро ориентироваться в динамике
этих превращений, постоянно развивать объемное воображение
в специальном тренинге.
За последнее десятилетие резко возрос объем научной
информации, что требует новых методов ее переработки. В этом
плане важное значение имеет психологическая готовность к
восприятию знаковой информации. В кристаллографии есть
термин «плотная упаковка», так вот применительно к знаковой
информации ее можно определить как информацию «по спосо-
бу плотной упаковки». Например, уравнение Шредингера7
описывающее состояние электрона с помощью пространственных
и энергетических параметров, записывается весьма кратко:
//^=£,ф. Но зрительное восприятие знакового языка и самое
главное — раскрытие смысла знаков, не прерывая логическую
последовательность конкретного научного рассуждения, или,
наоборот, кодирование процесса мышления, требует огромного
психического напряжения.
Химический знаковый язык в виде химических формул
и уравнений по своей сложности и многообразию можно
сравнить только с математическим. Свободное владение
химическим языком обусловлено одновременным восприятием химиче-
ческого знака и пониманием смысла информации, заложенной
в этом знаке. Механическое сопоставление знаковой
комбинации и ее названия обычно недолго удерживаются в памяти.
Особенно трудно воспринимаются знаковые системы в
органической химии, ибо количество знаков в ней небольшое, но
число их возможных сочетаний огромно. Здесь психологически
важно установить критерии правильности кодирования и
декодирования структуры органического соединения, которые
сохраняются и при химическом превращении этой структуры.
Такие критерии вырабатываются на основе распределения
электронных зарядов в молекуле, валентности атомов, стереохими-
ческих законов выделения функциональных групп. Возьмем
в качестве примера известное органическое соединение —аце-
тоуксусный эфир СН3СОСН2СООС2Н5. Опытный взгляд
химика-исследователя сразу отмечает наличие двух карбонильных
групп, дефицит электронов у метиленовой группы, способ-
266
ность к образованию енольной формы, возможность омыления
сложноэфирной группы.
Развитие аналитико-срнтетической стадии мышления
оказывается совершенно необходимым при изучении формульного
языка органической химии.
Помимо формульного языка сущность химического явления,
превращения веществ кодируется, обобщается с помощью
различных графических изображений. Хотя в повседневной
практике (не только в химии) графический язык широко
распространен, понимание его часто наталкивается на значительные
психологические трудности. Наглядным примером является
расшифровка спектрограмм. Сейчас каждый химик в той или
иной степени пользуется инфракрасной, ультрафиолетовой
спектроскопией, масс-спектроскопией, методом ядерного
магнитного резонанса. Научиться снимать спектры можно
сравнительно быстро. Но два* психологических барьера в овладении
спектральным языком (не беря в расчет
специалистов-спектроскопистов) во многих случаях остаются непреодолимыми.
Первый барьер — установление ясной и понятной связи между
физическим содержанием данного вида спектров, принципом
действия спектрографа и полученной спектральной кривой.
Второй барьер — установление истинного соотношения между
пиками спектральной кривой и химическими свойствами
соединения в основном или возбужденном состоянии. Так, применение
ядерного магнитного резонанса для установления структуры
вещества основано на обмене энергией между спиновым
вращением ядра атома и внешне направленным магнитным полем.
Причем на возникающий магнитный резонанс оказывает влияние
внешнее электронное окружение ядра. Мысленное связывание
определенных пиков на спектрограмме с интерпретацией
сложного взаимодействия электронов близких между собой ядер
требует максимальной сосредоточенности и значительного
волевого усилия. В ИК-спектре существуют валентные и
деформационные характеристические частоты. И опять-таки
связывание визуальных пиков спектральной кривой с физической
картиной колебаний по длине внутримолекулярных связей или
величины угла между этими связями вызывает значительное
психологическое напряжение.
Наряду с формульным и графическим языками в химии
используется еще ряд специальных знаковых языков: кванто-
во-механический — для описания природы и вида химической
связи и электронного строения молекулы;
кристаллографический— для описания кристаллов и состояний твердого тела;
алгоритмический язык для ЭВМ и некоторые другие.
Чаще всего операции над знаками заключаются в
идентификации знака и создании информативного образа, .в котором
достигается соответствие между определенной совокупностью
знаков и конкретным материальным процессом или логическим
267
заключением. Такие операции выполняются на уровне
абстрактного мышления, и основное психологическое усилие
затрачивается на сравнение идентифицированных знаков и
информативных образов с соответствующими эталонами памяти,
отражающими накопленный опыт в данной области науки.
Отработка психологического тренинга в этих случаях
связана с еще одним важным обстоятельством для специалистов
естественных наук — удержанием смысловой нагрузки
знакового кода на уровне решения или подготовки к решению
конкретной проблемы химии, физики, биологии и т. д.
Таковы логический, методологический и психологический
аспекты научного мышления. Но знание и владение общими
принципами научного мышления — это лишь одна сторона
творческой деятельности исследователя. Другими не менее важными
сторонами этой деятельности являются умение пользоваться
научной информацией и совершенствование методов решения
экспериментальных задач.
ИНФОРМАЦИОННЫЙ ПОИСК
В пергаменте ль найдем источник мы
живой?
И. В. Гете
Любой исследователь в наше время, приступая, к поиску,
обработке и оценке научно-технической информации,
сталкивается, с одной стороны, с гигантским объемом непрерывно
поступающей общей информации, с другой стороны, с дефицитом
информации по конкретной теме. Положение
химика-исследователя, а тем более преподавателя, осложняется еще и тем, что
сравнительно узкая тема исследования требует основательной
проработки специальной литературы, в то время как для
поддержания компетентности в химической науке в целом
необходимо обобщение разрозненной информации, чтение
разнообразной литературы. Причем, если специальные статьи, монографии,
патенты штудируются по признаку, затрагивающему тему
конкретной исследовательской работы, то при знакомстве с
многопрофильной литературой часто задаются вопросом: насколько
важна замеченная информация и полезна ли она вам вообще.
Здесь можно посоветовать всю информацию, привлекшею ваше
внимание, заносить в тетрадь или на карточку. Как говорит
Мефистофель,
...Старательно пишите все в журнал,
Как будто б дух святой вам диктовал.
Значительность той или иной статьи, заметки
рекомендуется отметить условным знаком. У опытных химиков постепенно
формируется круг определенных информационных запросов,
268
которые они стремятся удовлетворить. Например,
химика-органика могут интересовать природа химической связи, катализ
в органической химии, отдельные области биохимии, вопросы
преподавания химии в высшей школе и другие вопросы.
Конечно, излишняя многопредметность информационного поиска
приведет лишь к разбросанности, поверхностному суждению
о существе информации.
Химику-исследователю не обойтись без знания
библиографии информационного поиска. Под этим понимается по крайней
мере свободное обращение с реферативными журналами
«Химия» и «Chemical Abstracts» и их указателями, дескриптор-
ным изданием «Chemical Titles», серийными изданиями
«Advances in...», обзорными журналами типа «Успехи химии»,
«Angewande Chernie», многотомными справочниками Гмелина,
Меллора, Ландольта, Бельштейна.1
Информационный поиск в настоящее время иногда
отождествляется с представлением об информационно-поисковом
образе, в основе которого лежит принцип системности. Это значит,
что наряду с традиционным поиском характеристик вещества,
методов синтеза и других сведений исследователь изучает
информацию о взаимосвязях (внутренних и внешних) в
химической системе.
Предположим, что исследуется гидрирование конкретного
непредельного соединения в условиях гетерогенного катализа.
При осуществлении этой реакции используются не только
литературные данные, характеризующие начальное и конечное
соединения, но и информация о принципах гетерогенного
катализа вообще, о механизме каталитического гидрирования,
методах приготовления нужного катализатора, о конструктивном
оформлении реакции, об уже проведенных реакциях такого
типа и т. д. Так вокруг стержневого вопроса (конкретная
реакция— гидрирование) образуется целая сеть литературных
данных иногда причинно-следственного характера. Пользуясь
таким «клубком» информационных сведений, химик переходит от
простого фиксирования результатов эксперимента к выявлению
закономерностей процесса, к обдумыванию перспективы или
коррекции исследования. Так создается развернутая научная
картина предпринятой работы, а дальнейшие информационные
запросы приобретают многоцелевой характер массивного
поискового образа, сложившегося в мыслях исследователя.
Но поиск, обработка и хранение научной информации — это
не просто подготовительная стадия в предпринимаемом опыте,
а неотъемлемая и необходимая часть самой исследовательской
работы на всем ее протяжении. Из этого следует, что специа-
1 Для молодого химика большую помощь окажет книга В. М. Потапова
и Э. К. Кочетовой «Химическая информация» («Что, где и как искать
химику в литературе?>) (М., 1978).
269
лист (не только химик) должен обладать определенными
навыками и осведомленностью в процессе освоения научной
информации. К таким навыкам относятся: 1) выбор кратчайшего
и надежного пути от энциклопедии, обзора к первоисточнику;
2) классификация научной литературы по степени важности по
личному выбору; 3) использование ключевых слов
(дескрипторов) и словаря специфических химических терминов
(тезауруса) для конструирования информационно-поискового образа;
4) выбор способа обработки и хранения научной информации;
5) владение методом ретроспективного поиска; 6) свободное
владение техникой информационного поиска (перевод и
конспектирование иностранных первоисточников без подстрочника,
скорочтение, знание библиографических правил, режим работы
с научной литературой и т. д.). К этому надо добавить, что
каждый исследователь и сам выдает информацию, и,
следовательно, он должен знать, как правильно и технически грамотно
написать научную статью, подготовить научный доклад,
составить научный отчет, как оформить заявку на авторское
свидетельство или патент.
МАТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ЭКСПЕРИМЕНТА
Сажая деревцо, садовник уже знает,
Какой цветок и плод с него получит он.
И. В, Гете
В настоящее время общенаучные методы, применяемые при
разработках конкретного научного направления, оказались
полезными и в планировании эксперимента. В широком смысле
планирование эксперимента явилось отражением
кибернетического подхода к пониманию сложных явлений, например
деятельности мозга, познания Вселенной и т. д.
Суть этого подхода сводится к следующему. Если мы имеем
сложную работающую систему, для которой известны входные
(х) и выходные (у) данные, слабо действующие величины на
систему (w) и общая направленность действия системы
(рис. 5), то, не разбирая конкретный механизм этого действия,
можно установить зависимость выходных данных от входных
методом факторного анализа. Такая зависимость носит
вероятие ш, to.
х.. +•
хг -
X, ►
1 1 J
Рис 5
270
ностный характер. Это и понятно, поскольку результаты
одновременного взаимодействия многих величин могут быть
истолкованы лишь с помощью законов больших чисел —
статистических законов. Метод факторного анализа включает в себя
уравнение регрессии и дисперсионную оценку. Уравнение
регрессии— это математическая модель процесса, которая линейна
относительно его параметров и представляет собой конечный
степенной ряд. Так, если требуется получить оптимальный
результат (у) работы заданной системы, в которой одновременно
действуют три фактора (хи х2, х3), причем каждый из них
может приобретать два значения (уровня), то математически у
будет являться функцией независимых переменных хи х2у хЪу
т. е. y=f(xu x2y хг). Вариации различных сочетаний факторов
воспроизводятся с помощь^) коэффициентов регрессии, и само
уравнение регрессии можно представить тогда в виде
у = Ь0 -J- Ьхх{ + Ь2Ху + Ь:1х.л.
Очевидно, самым важным этапом в решении данного уравнения
является определение коэффициентов регрессии. Для этого
предварительно заданные факторные величины и результат
эксперимента записывают в форме матрицы планирования
(табличная форма), пользуясь свойствами матрицы по формуле
1 N
1=1
здесь Xji — величина фактора в /-м столбце на i-м уровне; у\ —
результат эксперимента на i-м уровне; jV — число
запланированных опытов.
Далее нужно оценить коэффициенты регрессии с помощью
дисперсионного анализа. Известно, что экспериментальное
рассеивание случайных результатов взаимодействия различных
факторов с увеличением количества этих результатов все
больше подчиняется статистическим законам. Изучением
закономерностей в рассеивании (дисперсии) результатов эксперимента
и занимается дисперсионный анализ. По существу, с помощью
дисперсионного анализа устанавливают оптимальное
соотношение между шкалой отклонения всяких значений случайных
величин от их максимального значения и математическим
ожиданием этого максимума (рис. 6). Чем больше проведено
экспериментов, тем ближе среднее статистическое их результатов
к величине математического ожидания, т. е. к желаемому
оптимуму. Но большое количество экспериментов невыгодно
экономически и просто нерационально. Таким образом, надо свести
к минимуму рассеивание результатов (уменьшить количество
экспериментов) при сохранении достаточного приближения
среднего статистического к величине математического
ожидания.
271
I Математическое
ожидание
В факторном анализе есть математическая операция,
называемая оценкой дисперсии. Результат этой операции
позволяет вывести степень значимости коэффициентов в уравнении
регрессии. В целом факторный анализ занимает важнейшее
место в планировании химического эксперимента и позволяет
решить по крайней мере две задачи: 1) определить
значительность влияния какого-либо фактора в многофакторном опыте
на изменение основной закономерности, выводимой из данного
опыта; 2) установить
оптимальный параметр
многофакторной реакции в одном
определенном направлении.
Заканчивая очерк, мы
надеемся, что хотя бы частично
(для полного ответа рамки
очерка слишком малы)
ответили на вопрос: как
постигнуть огромный мир химии?
Действительно, много должен
знать, уметь и даже чувствовать человек, вступивший на
нелегкую тропу химика-исследователя. Но только так, только
трудом, а вернее, только при разумной организации этого труда
можно вкусить «сладкий плод учения». Именно в постижении
искусства управления своей творческой деятельностью — с
помощью не слишком сложных общенаучных законов, методов
и навыков — скрыт залог непременного успеха.
Поле рассеивания
случайных величин
Шкала отклонений
Рис б
«КОНТРАПУНКТЫ» МЕНДЕЛЕЕВА
...Землю попашет
попишет стихи.
В. Маяковский
а ближайших страницах разговор пойдет не столько
о химии самой по себе, сколько об ее творцах,
точнее— об одном из них. Речь пойдет о том, как
великий ученый, в силу своей гениальности, не может
подавить в себе стремления охватить явления
окружающего мира во всей их широте, со всеми возможными их
последствиями, во всех проявлениях, от «пола» до
«потолка».
Отсюда, с одной стороны, полет воображения, умение
заглянуть вдаль, а с другой — «заземленность» (где нужно) и
дисциплинированное подчинение своей деятельности требованиям
практики, внимание к деталям, добросовестная скрупулезность
в работе. Отсюда и невероятная жадность в выборе тематики
своего творчества, контрасты деятельности, отсюда же
неизбежный выход на то, ради чего и существует наука, — на
практику. А результат всего этого —польза для науки, для своей
страны, для всего мира.
«ЗАЧЕМ ЖЕ ВХОДИТЕ НЕ В СВОЕ ДЕЛО!»
Примерно 100 лет назад, 1 июля 1882 г., в Москве, в Малом
зале Благородного собрания, произошло событие, которое не
заслуживало бы упоминания сейчас, в связи с разговором о
химии и химиках, если бы не одна деталь. Событие это —
открытие торгово-промышленного съезда, а деталь — то, что на
открытии съезда выступил с докладом о перспективах развития
русской промышленности не кто иной, как человек,
прославившийся открытием периодического закона, — Дмитрий Иванович
Менделеев.
Почему именно Менделеев? Да потому, что к этому времени
48-летний ученый имел столь солидный опыт и авторитет па
273
вопросам экономического развития России, что Общество для
содействия русской промышленности и торговли,
организовавшее съезд, именно его, университетского профессора химии,
сочло наиболее подходящим докладчиком по столь важному
вопросу. Прошло уже 13 лет после открытия периодического
закона. Блестяще подтвердились предсказания Менделеева
относительно галлия и скандия. Пришло международное
признание. Как раз в 1882 г. Королевское общество
Великобритании— одно из авторитетнейщих научных учреждений мира —
присудило Менделееву за открытие периодического закона
высшую награду — золотую медаль имени X. Дэви.
Сейчас, сто лет спустя, мы склонны смотреть на творческий
путь ученого главным образом с точки зрения триумфа учения
о периодичности. Слава открывателя периодического закона
затмевает в наших глазах другую сторону его деятельности —
неустанную борьбу за развитие русской промышленности, за то,
чтобы превратить Россию из отсталой сельскохозяйственной
страны в мощную индустриальную державу. А между тем эта
борьба занимала столь большое место в жизни Дмитрия
Ивановича, что он шутя говорил друзьям, что считает себя скорее
экономистом, чем химиком.
Он был воспитан «в Сибири на заводе», которым
управляла мать. Его молодость проходила в период становления в
промышленных странах мира мощной химической,
коксохимической, нефтяной промышленности. Он — страстный патриот, с
горечью наблюдающий экономическую отсталость России. По
своему уму, энциклопедичности знаний, умению смотреть
вперед, в будущее, наконец по своему темпераменту он не мог
замкнуться в одних только рамках «чистой» науки. Но в то же
время он не мог отказаться и от радости познания тайн
природы через науку.
Вот и влекут Менделеева два стремления: к познанию
мира средствами науки и к преобразованию мира средствами
промышленности. «Наука и промышленность — вот мои мечты»,—
скажет он в конце жизни, подводя ее итоги. Между этими
стремлениями, этими мечтами нет антагонизма. Скорее это
контрапункты необычайно широкой по охвату проблем
деятельности ученого. И контрапункты эти сливаются в мощную
симфонию менделеевского творчества. Кому, как ни ему,
изучившему множество отраслей промышленности, изъездившему
главные промышленные районы России, да и многих других
стран тоже, имеющему многолетний опыт «сельского хозяина»,
не знать, что «промышленность и истинная наука друг без
друга не живут, друг от друга получают силу, и этот союз
родит блага, без него не веданные».1
1 Здесь и далее цитируется по изданию: Менделеев Д. И. Соч.
В 25-ти томах. Л.; М., 1937—1954.
274
Был в жизни ученого момент, когда он подумывал:
«выскажешься почти весь в отношении к химии — не пора ли будет
тогда и покончить с ней? Не завести ли завод?». Но, сделав
такую запись в дневнике в канун 1862 г., тут же добавил:
«Такие мысли приходят часто, но часто и гонишь их прочь — не то
мое назначение». А когда вскоре своими рекомендациями
помог крупному нефтепромышленнику В. А. Кокореву превратить
убыточное производство в доходное и получил предложение
работать у Кокорева на весьма выгодных условиях,— отказался.
Хотя, быть может, нотка сожаления звучит в словах
Менделеева, когда лет сорок спустя вспоминает: «Приезжает ко мне
тогда В. А. Кокорев и предлагает поехать править его дело
в Баку, в год получать по 10 тысяч рублей да 5% с чистого
дохода... Ни минуты не думая, отказался, чего, конечно, не
сделал бы на моем месте ни англичанин, ни француз, ни немец.
Стал меня умница В. А. Кокорев допрашивать о причинах
отказа, опроверг все мои доводы (о пенсии, о возможности
работать для наукд и т. п.) или отговорки и очень верно
заключил, что все это барские затеи, от которых России плохо
двигаться вперед».
Больно уж независимым был характер у этого человека,
гордившегося, что не служил «ни капиталу, ни грубой силе, ни
своему достатку», чтобы мог он заставить себя служить чьим-
то частным интересам, даже если на какое-то время они
совпадали с интересами страны. И не стал он ни заводчиком, ни
фабрикантом, ни торговцем, избрав другое назначение, другую
службу: оставшись исследователем, одновременно взял на себя
роль, как сам говорил, «указательного пальца» в отношении
путей промышленного развития России. Под конец жизни,
подводя ее итоги, Менделеев мог сказать, что помимо двух служб
Родине—как ученый и как педагог — нес еще одну—«на
пользу роста русской промышленности».
Наверное, часто приходилось Менделееву сталкиваться с
недоуменными вопросами окружающих: «Ведь вы химик, а не
экономист, зачем же входите не в свое дело?», если в «Основах
фабрично-заводской промышленности» посчитал нужным
привести и этот вопрос, и свой ответ на него: «Быть химиком не
значит еще вовсе чуждаться заводов и фабрик и их положения
в государстве, а следовательно, и сущности экономических
вопросов, сюда относящихся; ...правильного решения
экономических вопросов можно ждать впереди только от приложения
опытных приемов естествознания». А потому, говорит ученый,
«я спокойно остаюсь химиком и защищаю меры для развития
фабрик и заводов в России».
Он согласен не только не получать личных выгод от
реализации своих предложений, но даже выслушивать упреки.
В 1888 г., мечтая «затеять... проектец с миллионными
расходами» для улучшения судоходства по Донцу, чтобы облегчился
275
вывоз донецкого угля, он сетует: «А то разве одни
гидротехники, специальные инженеры вступятся, да скажут, что химик
не за свою специальность берется. Хоть бы они, право, зачали,
я же готов нести ответ — лишь бы дело сделалось...»
ОСНОВА И ДЕТАЛИ
Во всяком деле — от построения системы элементов до
изучения промышленности — Менделеев стремился найти главное,
основу, от которой зависит все остальное. «Основа» — его
любимое слово. Он пишет «Основы химии». Потом «Основы
фабрично-заводской промышленности», где говорит во введении:
«все собранное стараюсь претворить в желаемую форму
изложения такими же, по существу, приемами, каких держался
в другом своем сочинении „Основы химии"». Даже когда
собирался издавать газету, одно из первых названий, которое
пришло ему в голову, было «Основа»,— «как „Основы химии"»,—
объяснял он друзьям. А когда доказывал молодежи, что
«развитой» человек — это прежде всего мастер своего дела,
пояснял: у такого человека есть «основа».
В своей «третьей службе» он тоже стремился найти
«основные промышленные дела, требующие большего, чем иные,
развития»— это, считает он, «каменноугольное, железное, маши-
ноделательное, судостроительное и лесохимическое». На них,
а также на русское нефтяное дело Менделеев и направил свои
усилия.
Выявляя основу, он не гнушался кропотливой работы над
деталями, над собиранием фактов, над их аккуратной
обработкой. Его сын вспоминал: «Отец всякое исследование начинал
с кропотливой и колоссальной работы по собиранию и
обработке отдельных фактов... Казалось сначала, что он работает
исключительно над частностями, всецело погружен в них. Но
из этих частностей под конец вырастало как бы само собой
обобщение, универсальный закон».1 Учитывая удивительную
менделеевскую работоспособность, можно себе представить,
сколько фактического /материала он обрабатывал, чтобы
выявить основу.
В молодости, идя к открытию периодического закона,
Менделеев нашел необходимую основу—атомные массы
элементов. А к этой основе долго и кропотливо собирал недостающие
факты. В зрелые годы, став управляющим Главной палаты мер
и весов, взявшись за создание в России метрологической
службы, отвечавшей потребностям времени, он начал с основы, с
обновления прототипов — стандартных образцов мер и весов.
1 Д. И. Менделеев в воспоминаниях современников/Сост. А. А. Макареня,
И. Н. Филимонова, Н. Г. Карпило. М, 1973.
276
И при всей значимости и ответственности этих основных задач
не молодой уже и не столь крепкий здоровьем человек не
отказался от личного труда в проведении весьма трудоемких
измерений. А когда были опубликованы результаты первой
всероссийской переписи населения 1897 г., не кто иной, как
Менделеев с сотрудниками взялся за самоотверженный труд
обработки и осмысления этого огромного материала — так родилась
работа «К познанию России».
В конце &0-х годов Менделеев взялся за изучение основы
топливной базы промышленности — каменного угля. Для этого
поехал в Донбасс, чтобй на месте изучить запасы угля,
способы добычи, возможности ее роста, причины, этот рост
сдерживающие. И здесь ученый не гнушался деталей, черновой работы:
спускался в шахты для отбора проб рудничного газа,
изучал фарватеры рек, даже собирал сведения о простоях
железнодорожных вагонов и разрабатывал рекомендации, какие
штрафы или, наоборот, премии надо учредить, чтобы свести
простои к минимуму.
Вроде бы, можно на этом и остановиться, сказать себе:
дальше не моя специальность, не моя забота. Наверное,
другой бы на его месте так и поступил. А Менделеев идет дальше:
разрабатывает предложения о гидротехнических работах,
печется о развитии «железного» судостроения на юге России,
прикидывает, какие заводы из существующих могли бы
производить сталь, прокат, котлы и машины для судов и какие
заводы потребуется заново организовать. Он обсуждает даже
типы судов, которые надо строить, вплоть до таких, которые
годились бы «к перевозке десанта на случай военной
необходимости»; обсуждает детали финансирования постройки этих
судов вплоть до величины процента, под который следует
предоставлять кредит Государственного банка, и каким будет
обеспечение этого кредита.
Взяв за основу уголь как источник энергии, Менделеев
набрасывает план развития других отраслей промышленности.
Донбасс, доказывает он, может производить для страны и на
экспорт (вывозя через Черное и Средиземное моря на тех
самых судах, постройку которых ученый считает необходимой)
такую продукцию, как сталь, соду, стекло, керамику,
химические продукты. Словом, исходя из основы — угля, ученый
прогнозирует паутину тонких экономических связей во всех
деталях
Однако подходя к тому или иному вопросу как экономист,
Менделеев порой предлагает программу, на первый взгляд
противоречащую насущным требованиям экономики. Так, много
занимаясь вопросами освоения Арктики на рубеже XIX
и XX столетий, он, настаивающий постоянно, что «победить
полярные льды надобно... для прямой промышленной (курсив
мой. — И. С.) пользы», вдруг заявляет, что эту задачу надо
277
решать «сперва со стороны достижения Северного полюса», но
«ничуть не с практического (торгового) конца».
Почему? Ответ, очевидно, в том, что ученый и здесь хочет
выделить основу, общее решение проблемы, на базе которого
потом можно решать ее в частных деталях. Такой основой
Менделеев считал достижение полюса на специально
оборудованном судне, с проведением обширного комплекса
исследований. Решив задачу в таком экстремальном варианте, считает
он, попутно решат и вторую задачу — освоение конкретных
транспортных маршрутов в Арктике «со стороны правильного
торгового движения». И поскольку тогда ему не удалось
настоять на решении той задачи, которую он считал первой,
основной,— экспедиции к полюсу, ученый потом считал себя
вправе бросить упрек: «Лет десять тому назад сам я с
адмиралом С. О. Макаровым рвался к выполнению первой задачи,
да вторая много помешала осуществлению. Если бы хоть
десятая часть того, что потеряно при Цусиме, была затрачена на
достижение полюса, эскадра наша, вероятно, пришла бы
в Владивосток, минуя и Немецкое море и Цусиму».
«ОТ БОРОНЬБЫ ЗЕМЛИ ДО СКОРОСТИ ПЕРЕВОЗКИ»
— такие слова Менделеев употребил, перечисляя меры для
«покровительства» промышленности. Для него индустрия и
сельское хозяйство — это тоже слагаемые полифонии, два
тесно связаных аспекта экономического развития страны. Он
вообще был против того, чтобы сельское хозяйство
противопоставлять промышленности, даже предпочитал называть его
«сельскохозяйственной промышленностью». В будущем, по его
мнению, «должно исчезнуть резкое различие между сельским
хозяйством и остальными видами промышленности, потому
что сельское хозяйство будет так же много заимствовать от
других видов промышленности, как и они от него (курсив
мой. — И. С)». Конец фразы наводит на мысль: не имел ли
в виду Дмитрий Иванович то, что теперь называют
экологизацией производства?
Каждым удобным случаем пользуется Менделеев, чтобы
доказывать современникам, что сельское хозяйство только
выиграет от индустриализации страны. «Интересы сельского
хозяйства и фабрично-заводской промышленности не
противоречат одни другим, а, наоборот, находятся в полнейшей связи»,—
заявляет он. А в том самом докладе 1882 г., с которого
началась наша беседа о многогранности ученого, он иронизирует по
поводу монокультуры пшеницы — основы тогдашнего экспорта
России: «Земельное истощение замечается в самых богатейших
местах чернозема, и с ним, конечно, связано появление всяких
червей, жучков и тому подобных египетских казней, которыми
Россия карается в последние годы за свое убеждение в том,
278
что она — страна исключительно земледельческая». Он может
так утверждать — ведь он и сам «сельский хозяин», в 60-х
годах организовавший обширные сельскохозяйственные опыты,
за несколько лет добившийся удвоения урожая зерновых на
своем опытном поле.
Тогда, в сельскохозяйственной России, Менделеев берет на
себя роль прежде всего поборника индустриализации. Но он
знает, что этот акцент на индустрию является лишь временной
необходимостью: «Мы живем в эпоху, когда богатство и сила
народов определяются преимущественно индустриею, а наши
дети и внуки, вероятно, доживут до того, что богатство и вся
сила народная будут определяться умелым сочетанием
индустрии с сельским хозяйством».
Что же касается «скорости перевозки», т. е. транспорта
и всего с ним связанного, то Дмитрий Иванович и
железнодорожные порядки изучал, и свое мнение «о способах для
поощрения мореходства и судостроения» высказывал. Он и планы
полярных экспедиций разрабатывал уже на старости лет, и
ледокол проектировал. Словом, и эта тема влилась в контрасты
его творчества...
ХИМИК ... ПРОТИВ СУПЕРФОСФАТА!!
Результаты сельскохозяйственных опытов 60-х годов
привели Менделеева к выводу, кажущемуся парадоксальным:
удобрение суперфосфатом невыгодно! Ученый даже высказывает
едкие замечания в адрес «чересчур рьяных последователей Ли-
биха» (основоположника учения о минеральных удобрениях),
которые наводят «сомнение и страх на сельских хозяев...
стращают народами, погибшими от истощения почвы фосфорными
и щелочными началами».
В чем же дело? Может быть, великий химик не верит в
химизацию сельского хозяйства и, в частности, в минеральные
удобрения? Нет, дело обстояло гораздо сложнее. Не надо
забывать, что Менделеев — не только химик, но еще и
экономист, а потому причин, по которым он не советует увлекаться
минеральными удобрениями, две.
Первая — чисто экономическая. Удобрения, говорит он, надо
применять тогда, когда они дают «скорый, пропорциональный
затрате доход, и оставить мысль о таких, которые требуются
только теоретическими построениями». Это явный намек на
«теорию полного возврата» Либиха. Что же касается
суперфосфата, то на большинстве почв России он не давал тотчас
выгоды. Почему? Прежде всего потому, что в ту. эпоху мировой
экономический рынок ставил в крайне трудные условия
русское сельское хозяйство, однобоко ориентированное на экспорт
хлеба. Тогда интенсивно осваивались целинные земли в
Америке, Африке, Австралии, из-за чего цена хлеба на мировом
279
рынке падала: с 60-х до 90-х годов она упала почти в три
раза! Суперфосфат же был импортным (своего еще не
производили) и потому дорогим.
Вторая причина — непосредственные данные экспериментов.
Из них следовало, что зачастую суперфосфат не давал замет-
ного увеличения урожая даже тогда, когда в почве, как
показывали анализы, было мало фосфора. Парадокс? Да, для тех,
кто уповал на суперфосфаты как на некий универсальный эЛек-
сир плодородия. Дмитрий Иванович признавался, что и сам
«был предубежден... в пользу фосфорного удобрения», но
потом «вылечился», потому что увидел невероятную сложность
(а тогда — и малую изученность) процессов, происходящих
в почве. А для хода этих процессов оказалось важным то, что
почвы районов, где ставились опыты, были, во-первых, бедны
органикой, во-вторых, имели далеко не оптимальную структуру,
а потому плохо усваивали азот—не менее важный элемент
плодородия, чем фосфор. Употребляя выражения агрономов-
практиков, ученый говорит, что почвы оказались грубы, их надо
было довести до «спелости» путем «ухаживания»: правильной
вспашкой, известкованием, мергелеванием, регулярным
введением органики, применением севооборота. «Вот тогда-то, —
пишет ученый, —и подействуют минеральные вещества —
фосфаты и т. п.».
Отсюда следовал вывод, который кажется внешне не
научным: «...навоз, хорошая обработка и известкование, а не
фосфаты нужны нам». И потому химик, предостерегая от
примитивно-химического подхода к почве — системе, где «своя
сложная жизнь», считал правильным в ту эпоху не употреблять
суперфосфат. Но это отнюдь не означало, что Менделеев призывал
вообще отказаться от фосфорных удобрений. Напротив, он
убеждал: «Эпоха надобности в суперфосфатах придет, — не
сейчас, но она придет». И потому как химик боролся за
налаживание в России производства минеральных удобрений, искал
пути, как добиться, чтобы «суперфосфаты впоследствии
доставались России дешево».
Здесь читатель вправе задать вопрос: а как же истощение
почвы? Ведь если не вводить в нее фосфорные удобрения, то,
отдавая урожай за урожаем, она, естественно, будет обедняться
фосфором. Может быть, все-таки правы были те, кто стращал
судьбою внуков?
Но и этот вопрос легко разрешить, если взглянуть на вещи
глазами ученого. Да, почва теряет фосфор. Действительно,
к внукам она перейдет более бедной теми элементами, которые
определяют урожайность. Но Менделеев оптимист, верящий
в могущество науки и техники, в их невиданный прогресс в
будущем. А потому он уверен, что, располагая мощными
техническими средствами, люди смогут вернуть в почву те
химические элементы, которые, мигрируя по цепочке поле — хлеб —
280
город—река — море, в конечном итоге скапливаются в океане.
Стало быть, в этом плане он не тревожится за «фосфорную»
судьбу внуков. В свою же эпоху, когда хлеб везли за границу,
а в то же время в неурожайные годы целые губернии голодали,
потому что крестьянам тот же хлеб не на что было купить,
ученый видел главную задачу в том, чтобы любой ценой, даже
за счет временного истощения пахотных земель, сделать
сельское хозяйство рентабельным,
ХЛЕБ И УГОЛЬ
В статье, посвященной донецкому каменному углю, есть
интересная параллель: уголь и хлеб. Как и многие
менделеевские сравнения, оно и широкое, потому что охватывает
предметы и явления, на первый взгляд далекие друг от друга,
и глубокое, потому что вскрывает суть, основу.
Менделеев начинает со сравнения цен на хлеб и уголь,
находя в них сходство: и то и другое — товар сравнительно
дешевый, и значительную часть его цены составляет стоимость
перевозки. Затем он проводит более глубокое сравнение, включая
химический состав: и уголь, и хлеб содержат одни и те же
главные химические элементы, в частности связанный азот. Значит,
есть принципиальная возможность, «что из угля... произведут
питательные вещества, потому что в угле все для того начала
содержится. Ведь произвели же и фабрикуют из угольного
дегтя... краски, часть которых может вырабатываться только
редкими растениями теплых стран».
Но это — з идеале, где-то в будущем, если придется
питательные вещества синтезировать на заводах. В сходстве
химического состава угля и хлеба (это, отнюдь не явное, сходство
надо было еще суметь разглядеть!) ученый нашел то, что
можно с выгодой использовать и в рамках традиционного
сельского хозяйства. Заметив, что добыча угля растет гораздо
быстрее, чем производство хлеба, он делает вывод: «уголь своим
содержанием азота... поравняется когда-нибудь с хлебом». Если
этот уголь будут не просто сжигать (при этом соединения азота
разлагаются), а сначала превращать в газообразное топливо,
собирая при этом «азотистые продукты угля», то с ростом
потребления угля будет получаться все больше сырья для
производства азотных удобрений, т. е. в конечном итоге — хлеба
(«эти азотистые продукты угля способны сильно возвышать
урожаи хлеба»). Значит, рост индустрии и как следствие —
энергопотребления создает условия и для прогресса в
производстве питания.
Таким образом, у Менделеева оказываются тесно
связанными три аспекта угля и хлеба как продуктов промышленности
и сельского хозяйства: экономический (цена и динамика
производства и потребления), химический (содержание азота)
И 779
281
и технологический (способы переработки и использования угля
как топлива, а соединений азота — для производства в
конечном итоге пищевого белка). Заметим, кстати, что в этой статье
ученый публикует и идею подземной газификации угля.
«РЕАЛИСТ», «ЖИВОПИСЦЫ» И «КЛАССИКИ»
Для Менделеева собственно наука начиналась там, где он
видел меру и число. Сотрудникам Главной палаты мер и весов
он говорил: «Дайте мне прежде всего цыфирку». Со
сторонниками той точки зрения, что Россия должна оставаться страной
аграрной, считал возможным «бороться только числами».
В «Заветных мыслях» он сетует: из-за отсутствия
статистических данных «живописцы» (по-видимому, он имеет в виду
людей, склонных скорее к эмоциональному, чем к количественно-7
му подходу в принятии решений) берут верх в споре на эту
тему.
Один из последних своих трудов, можно сказать, свое
завещание потомкам, «К познанию России», Менделеев начинает
словами: «Всегда и в каждом деле для сознательности
совершаемых в нем действий преполезно подсчитаться». И тут же,
ка первой странице, напоминает, что сам он «реалист». Свой
«реализм» он противопоставляет «классицизму». Это одно из
его любимых бранных слов, которое может означать
«антинаучный, старозаветный, помещичий, чиновничий, реакционный».
Без индустриализации страны и без естественнонаучного
образования, говорит он, «все будет классическим бредом тупых
исканий».
Итак, как борец за индустрию, он за реализм, практичность.
Значит ли это, что он — «сухарь», технопоклонник,
предпочитающий все заводское, искусственное?
Конечно же, нет. Об этом свидетельствует и содержание,
и стиль его серьезных сочинений. Насыщенные фактическим
материалом, они тем не менее написаны языком неказенным,
живописным, даже порою поэтическим. Таков, кстати, и стиль
«Заветных мыслей» и «К познанию России». Это стиль
рассказа о том, что глубоко продумано, выстрадано, в правильности
чего он убежден сам и страстно хочет убедить других. А как
написана «Уральская железная промышленность»! Здесь и
красочные описания местностей, через которые направляется на
Урал экспедиция, возглавляемая Менделеевым, и портреты
людей, которых встречает ученый.
Недаром редактор французского перевода «Основ химии»
пишет в предисловии к переводу о «шарме» менделеевского
текста и одновременно об «исключительно ясной форме,
которую месье Менделеев умеет придать своим работам». А в
предисловий к первому изданию «Основ» на английском редактор
и переводчик заявляют, что «лучше пойти на некоторую неэле-
282
гантность языка, чем рисковать потерей точного смыслового
оттенка, который стремится передать автор», и потому
предпочитают «буквальную передачу оригинала».
Читая Менделеева, постоянно ощущаешь сочетание, с одной
стороны, реализма, с другой — художественной натуры ученого,
тяги к красоте. А потом видишь: это, в сущности,
контрапункты одного — стремления открыть или создать гармонию. Ведь
и о главном его труде — «Основах химии» — академик А. А. Бай-
ков сказал, что «это памятник, который по силе своего
замысла, по совершенству выполнения и глубине мысли является
таким же величайшим проявлением человеческого гения, как
„Божественная комедия" Данте, как „Страшный суд" Микел-
анджело, как 9-я симфония Бетховена».
Он видит живописность Донца, «его современную
непригодность для судоходства и великую пригодность для живописцев,
в его прелестном нетронутом виде, с нависшими скалами, с
висячими деревами, завтра долженствующими упасть в воду и ее
заградить, с байдачными и всякими другими мельницами —
вместо пароходов, с переменным руслом, с перекатами и
бродами, а рядом с омутами и глубокими плесами, с красивыми
петлями извилин и заливов, с косами противу балок, — словом,
со всею прелестью природного неблагоустройства». Он знает,
что в силу логики экономического развития («одумаются ведь
когда-нибудь»), скоро всего этого не станет («уголь повезут,
дым всюду, реку поравняют»), и приветствует эти грядущие
изменения ради достижения иной, рукотворной гармонии.
Только не забывает предупредить: «Спешите А. И. Куинджи,
И. И. Шишкин — скоро ничего этого не найдете».
Этот «реалист» увлекался живописью, фотографией. Он был
членом Совета Петербургской Академии художеств! У себя
дома Менделеев организовал знаменитые «среды», куда без
особых приглашений приходили и художники, и
естествоиспытатели. И это не случайно — он искал гармонию двух
контрастирующих видов человеческой деятельности: естествознания и
искусства и даже пытался связать эволюцию живописи с
эволюцией науки. «У великанов живописи XVI ст., — писал в статье
„Перед картиною А. И. Куинджи", — пейзаж, если бйл, то
служил лишь рамкою. Тогда вдохновлялись лишь человеком...
В науке это выразилось тем, что ее венцом служили
математика, логика, метафизика, политика. В искусстве людское
самообожание выражено в том, что художников занимал и
вдохновлял человеческий образ». Позже, с развитием естественных
наук, основанных на экспериментальном изучении природы, она
«стала не рабой, не рамкой — подругой, равной человеку, женой
мужу. И мертвая, бесчувственная ожила перед глазами
людей». Так родился пейзаж, и «как естествознанию принадлежит
в близком будущем еще высшее развитие, так и пейзажной
живописи— между предметами художества».
m
А вот еще образчии менделеевской научной лирики, иначе
это не назовешь. В своем серьезнейшем труде «О
сопротивлении жидкостей» он пишет: «В деле изучения природы — набег
никогда не удается, потому что природа, во-первых, не враг,
а во-вторых, не дремлет. Она раскрывает и отдает в
распоряжение все свои силы, словом как бы покоряется — только
тогда, когда за ней долго ухаживают, когда свои мысли и
требования сообразуют с ее условиями, когда покоряются и ей
самой, словом тогда, когда она стоит на равной ноге с
обладателем или искателем, и лишь тогда, когда союз произошел на
этих условиях, она становится доброй хозяйкой в практических
делах, нет — так будет только их портить».
Он смотрит в далекое будущее, «когда жителей земли
станут считать десятками миллиардов», знает, что тогда и
планету и весь образ жизни людей придется сильно изменить. Даже
пищу придется когда-нибудь производить на заводах, сначала
микробиологическим путем, а потом и просто синтезировать.
В будущем ему повсюду видятся города, заводы;
индустриализацию и урбанизацию он считает неизбежными. А по адресу
тех, кто жалеет, что исчезает «первичный патриархальный быт»,
замечает: «Легко -плакаться о потере такого быта. Плакались
не только такие передовики, как Жан-Жак Руссо, но и теперь
плачутся люди, подобные графу Л. Н. Толстому. Плач их
поистине должно считать полуребяческим...». Он знает, что
придется отказаться от чего-то из сельского быта, из природного
неблагоустройства: «Сам я, уже старик, не могу отречься от
любви и к сельскому быту и к земледелию, но я полагаю, что
понимаю дух времени и предстоящее» («К познанию России»).
В то же время Менделеев надеется, что даже в далеком
будущем люди сохранят растительность не только из
утилитарных соображений, но «для всей обстановки своего жилья»,
т. е. из человеческой потребности иметь ее возле себя. И, зная,
что промышленность и урбанизация где-то заставят нетронутую
природу потесниться, он, как это ни покажется странным, в
самой промышленности видит средства для спасения природы:
в угле — средство для спасения леса, в способности
промышленности перерабатывать отходы — средство для охраны среды,
ибо «от фабрик и заводов... получаются и средства для борьбы
с вредом отбросов».
«силою осторожно —
смелой предусмотрительности»
Общеизвестен тот факт, что в конце жизни Менделеев
весьма скептически отнесся к двум научным событиям: созданию
теории электролитической диссоциации и открытию
радиоактивности, а следовательно, к признанию сложной структуры
атома. В чем же причина, что ученый, сделавшей столь блес-
284
тящее открытие, как открытие периодического закона, внесший
огромный вклад в развитие других областей науки, вдруг
оказался столь консервативен, что не хотел признать двух
крупных шагов вперед в развитии учения о веществе?
Скорее всего, дело в следующей черте, свойственной всякой
творческой деятельности. Человек, достигший успеха в своем
творчестве, пользуясь каким-то одним инструментом, попросту
может не испытывать потребности в другом инструменте,
потому что для него очевидны возможности (в том числе еще
неиспользованные) первого. Может быть, по этой причине в
старину мастер, прекрасно владевший топором, строил храм без
единого гвоздя. Вероятно, этим же можно объяснить, почему
Чарлз Чаплин долго.противился переходу к звуковому кино —
кому, как не творцу шедевров кино немого, не знать еще не
исчерпанные возможности своего творческого инструмента и не
спешить брать в руки другой.
Наверное поэтому ученый, успешно использовавдшй одну
концепцию или теорию, порой не признает альтернативной
концепции не потомуг что не понимает ее, а просто потому, что
верит в рабочие возможности первой. Менделеев, в руках
которого унитарная теория (отрицавшая деление элементов на
положительно и отрицательно заряженные) сделалась одним из
инструментов для объединения всех элементов в единую
систему, просто не хочет преждевременно отказываться от столь
хорошо поработавшего орудия. Отсюда неприятие теории
электролитической диссоциации, исходившей как раз из
наличия разноименно заряженных частиц в составе вещества.
Когда ученый начинал работать над системой элементов
и учением о периодичности, в науке уже существовала
концепция (гипотеза Проута), согласно которой атомные массы
элементов являлись кратными величинами атомной массы
водорода, что наводило на мысль о принципиальной возможности
построения из водорода более сложных атомов. Менделеев,
развивая учение о периодичности, обошелся без привлечения
этой концепции. Первоначально относясь к гипотезе Проута
с интересом, он затем этот интерес утрачивает, что можно
проследить по последовательным изданиям «Основ химии».
Поэтому, когда была открыта радиоактивность, ученый не торопился
принять новую концепцию — о сложности атома; у него не было
потребности в таком инструменте, чтобы развивать дальше
учение о периодичности. Кстати, ему приходилось слышать вполне
серьезные заявления, что будто бы удалось химическим путем
превратить одни атомы в другие. Вот он и защищает
концепцию вечности атомов, смешивая ее с концепцией вечности
материи, а в справедливость последней он верит как
естествоиспытатель.
В вечности и непревращаемости атомов, как полагал
Менделеев, кроется неповторимая химическая индивидуальность
285
каждого элемента, каждого рода химических частиц, и ему
трудно было примириться с физической концепцией растворов,
обезличивающей частицы в растворе, сводящей их свойства прежде
всего к заряду. Поэтому он с таким пылом защищает
представление об индивидуальности элементов, приписывая им свойства
личности: «Ведь вы же сознаете свою личность. Предоставьте
же и Кобальту и Никелю сохранить свою личность!» или
убеждая в том, что радия на Земле столь мало, что из-за него не
следует ломать существующие представления о вечности атомов.
Словом, когда речь идет о принятии новых теоретических
концепций, Менделеев крайне осторожен. Но если дело касается
вещей более практических — изобретений, технических
разработок, тут он, как правило, реагирует быстро, даже с известной
долей энтузиазма. Вероятно, сказывается то, что он живет
в эпоху, которой вообще свойствен научно-технический
оптимизм. Ведь нарастает лавина технических новинок,
изобретений, казавшихся удивительными, почти фантастическими.
А кроме того, Менделееву, с его отличным знанием как
технологии различных производств, так и экономики, легко было
оценить перспективность изобретения, проекта, технического
решения. Да он и сам выдвигает смелые технические идеи —
достаточно вспомнить идею подземной газификации угля,
связанную им потом с электрификацией России, его проекты
гидротехнических работ.
В конце жизни Менделеев настойчиво добивался
применения ветряных двигателей (простых в обслуживании и не
требующих подвоза топлива) для орошения Поволжья. В те
времена, когда открывались новые месторождения угля и нефти,
когда именно в них виделось энергетическое будущее
промышленности, когда, казалось бы, можно было не думать об
энергетическом голоде, он смотрел гораздо дальше вперед,
обращаясь к теме, которая в наше время называется
«альтернативные источники энергии». И если в его эпоху, скажем, лес терял
свое значение как топливо, заменяясь углем и нефтью, то
Менделеев в своих работах пишет о значении в будущем
растительного топлива. Притом не только о дровах, он пишет даже
о травах! Еще совсем недавно это вызывало улыбку у его
биографов— дескать, старческое чудачество. Однако в последние
годы энергетики снова обратились к однолетним растениям как
к аккумуляторам солнечной энергии.
Увидев на Всемирной выставке в Париже новый материал —
вискозу, Менделеев сразу, прямо из Парижа, послал в Россию
статью «Вискоза на Парижской выставке». В результате он,
уже немолодой (65 лет!) ученый, стал автором первой статьи
о вискозе на русском языке. Вскоре после этого он подробно
рассматривает вискозу в «Учении о промышленности» и, хотя
и предупреждает, что это дело новое, о котором надо говорить
еще с осторожностью, все-таки берется утверждать, что это
286
новое торжество науки, и не боится предсказывать, какое
значение может иметь производство вискозы для России «с ее
палестинами лесов и трав». Перебирая многочисленные
потенциальные применения этого материала, на первое место он
ставил искусственное волокно. Теперь-то мы знаем, насколько он
оказался прав.
Но, может быть, пожилой ученый впадает в другую
крайность, слишком восторженно относясь к любой новинке, к
любому «прожекту»? Отнюдь нет. С увлечением поддерживая
грандиозные проекты, веря в могущество науки и техники,
Менделеев остается все тем же «реалистом», чуждым
беспочвенного мечтательства. Перед тем, как дать оценку того или
иного предложения, изобретения, идеи, он разбирает их «по
косточкам».
Вот пример. В 1902 г. министр финансов С. Ю. Витте
передал Дмитрию Ивановичу на рассмотрение одно письмо, где
содержалось предложение провести опыты «над вызовом дождя
взрывами и электрическими разрядами». Надо сказать, что
правительство вообще часто пользовалось услугами
Менделеева, когда требовалась компетентная техническая экспертиза
или консультация. Несмотря на то значение, которое могли бы
иметь для России способы искусственного вызывания дождя,
и не отрицал, что, в принципе, это возможно, ученый тем не
менее весьма трезво оценивает состояние исследований и
практические достижения, в этой области. Изучив литературу «о сем
предмете», он приходит к выводам: «Теоретические и опытные
основания приемов, которыми надеются вызвать дождь,
доныне нельзя считать твердо установленными и скорее должно
признать шаткими»; причину засух в России он видит
«прежде всего в удаленности морей и в направлении ветров», из-за
чего в воздухе нет той концентрации водяных паров, которая
нужна для образования дождя на обширных площадях; так
как опыты такого рода очень дороги, то производить их надо,
тщательно спланировав, под руководством не случайных лиц,
а достаточно компетентных ученых, чтобы не бросать средства
«на ветер». Как видите, оценка весьма реалистичная.
* *
*
Итак, мы рассмотрели некоторые контрасты творчества
одного из величайших творцов мировой науки. Мы увидели
сложное, насыщенное контрапунктами творчество гениального
мыслителя, стремившегося объять своею мыслью мир стфль
широко, как это могли лишь немногие. И в этом мысленном охвате
мира, в своем труде ученого, во взгляде в будущее он умел
проявить и полет фантазии, и, где нужно, реализм.
Почему именно Д. И. Менделеев послужил нам примером?
Причин несколько. Во-первых, и эт<? главное, сама по себе ко-
287
лоритная, жадная до деятельности личность ученого. Во-вторых,
как не вспомнить его именно сейчас, когда мир совсем недавно
отметил 150-летие со дня рождения этого великого человека.
В-третьих, борьба (и гармония!) традиционного и
парадоксального в творчестве Менделеева тоже отмечает своего рода
годовщину: события почти ровно столетней давности, с которых
начался наш рассказ, явились одним из кульминационных
моментов этой борьбы. Именно тогда, в начале 80-х годов
прошлого века, говоря словами самого ученого, его «отношение
к промышленности России получает яркую определенность».
Оценивая это «распутье» в жизни Менделеева по прошествии
100 лет, мы вправе сказать, что гармоничная борьба между
стремлениями к «чистой» науке н к практике экономической
жизни страны'дала резкий крен в сторону практической
экономики и промышленных дел. И как это ни кажется на первый
взгляд странным, химик, открывший периодический закон, во
второй половине своей творческой жизни большую часть сил
отдал развитию экономики России. Эта служба Родине стала
логическим завершением всей его деятельности.
БОЛЬЦМАНОВСКИЕ КИНЕТИЧЕСКИЕ
УРАВНЕНИЯ: ОТ АТОМОВ
ДО ВСЕЛЕННОЙ
Если бы вся Вселенная обратилась в
одно государство, то как не установить
повсюду одинаковых законов?
Козьма Прутков
ажется очевидным — и эта иллюзия поддерживается
потоком популярных книг и брощюр, что современная
физика, т. е. физика, базирующаяся на квантовой
теорий и релятивистской механике, родилась в
начале нашего века. Действительно, А. Эйнштейн создал
в 1905 г. релятивистскую механику, обобщающую механику
Ньютона. В том же году Эйнштейн совместно с М. Смолухов-
ским, исследуя броуновское движение, доказал реальность
существования и движения молекул с достаточной для того
времени «очевидностью». Наконец, в 1907—1925 гг. А. Эйнштейн,
Н. Бор, Э. Шрёдингер и другие создали сначала теорию
квантов, а затем квантовую механику.
Тем не менее парадигму (философию) современной физики
заложили еще в XIX в. английский физик Дж. К. Максвелл
и австрийский физикохимик Л. Больцман. Действительно,
теория относительности (релятивистская механика) была бы
невозможна, если бы еще в 1865 г. Максвелл не доказал
электромагнитную природу света. Волновая механика Шредингера,
квантовая теория поля и общая теория относительности были
бы невозможны, если бы с 1873 г. не были известны так
называемые уравнения Максвелла для электромагнитного поля,
которые приучили физиков к «полевой» идеологии и дали первый
образец физической реальности, описываемой непрерывными
полями, не поддающимися механической интерпретации в
отличие, например, от гидродинамики, уравнения для которой
вывел еще Эйлер исходя из ньютоновой механики. Наконец,
квантовая теория атома не родилась бы, если бы к 1905 г. не была
доказана реальность его существования. Реальность же
существования атомов и молекул с количественными
характеристиками их движения давала кинетическая теория газов,
созданная в 1860—1872 гг. Максвеллом и Больцманом.
289
В этом очерке, однако, мы рассмотрим другое важнейшее
следствие кинетической теории. Как уравнения Максвелла
ввели в обиход физиков полевую идеологию, так кинетическая
теория послужила основой для всей современной статистической
термодинамики и ввела в обиход физиков и химиков понятия
и аппарат функций распределения.
ГРУБОЗЕРНИСТАЯ ФУНКЦИЯ РАСПРЕДЕЛЕНИЯ
Функция распределения — не вполне очевидное понятие,
наблюдать ее экспериментально нельзя, а некоторые вопросы
обоснования процедуры построения функции распределения
обсуждаются еще и поныне.
Формально одномерная функция распределения (плотность
распределения) f(x, t) определяется как вероятность dw =
=f(x, t) dx обнаружить систему в момент времени t в
элементе объема dx вблизи точки х. Многомерная функция
распределения f(xu x2y ..., xNi t) определяется как вероятность
обнаружить систему в момент времени t в элементе объема dx\, dx2,...»
dxN вблизи точки с координатами (хи х2, ..., xN). Но
необходима немалая
изобретательность, чтобы в каждом
конкретном случае суметь
построить функцию распределения,
пользуясь этим определением.
Причем мы не учитываем еще
того, что под «пространством»
необязательно нужно понимать
наше реальное евклидово
пространство, а можно понимать
пространство абстрактное, так
что N может быть и больше 3.
Посмотрим на рис. 1. Здесь
изображены однотипные
элементы (кружки), «плавающие»
в однородной среде некоторого
ресурса, и все это заключено
в некоторую емкость, которая
удерживает ресурс и элементы
в одном месте, что и дает
систему. Элементы могут
обмениваться ресурсом между
собой, например, в «мгновенных»
| парных взаимодействиях.
Конкретными примерами
вышеперечисленных систем
элементов, различающихся по
запасу того или иного ресурса, яв-
®
Рис.1
290
ляются, например, дождевое облако (элементы — капли,
ресурс—вода), любые эмульсии (элементы — капли, ресурс —
диспергированная жидкость), все газы (элементы — молекулы,
ресурс — кинетическая энергия) и т. д. Всего на рис. 1
изображен 61 элемент, запас ресурса в каждом из них (в
относительных единицах) обозначен числом. Как для этой системы
построить функцию распределения?
Можно составить таблицу, в которой элементы расположены
в порядке возрастания их величины, и указать для каждого
элемента количество (х=1, 2, ..., 151) заключенного в нем
ресурса и число (п\ ) элементов с запасом ресурса х:
„; = о, п'2 = о, п;=о, п\ = \, п;=о, ... , *;51 = i, «;ш = о.
О)
На рис. 2 эти данные представлены графически
столбиками п"х.
Однако произведенная процедура дает мало пользы —
можно лишь вычислить среднее значение ряда (1)
1 " 151
<^> = ж2я'=61'3
и его дисперсию1 а2 = < (п'х—<л^'>)2>, но это отнюдь не
открывает какой-либо закономерности в системе, изображенной
1 В теории вероятностей значение дисперсии характеризует меру
рассеяния случайной величины около ее среднего значения.
291
на рис. 1. Кроме того, «функция», даваемая столбиками пх на
рис. 2, не дифференцируема и не интегрируема, так что с ней
невозможно работать. Правда, из рисунка видно, что столбики
п"х в диапазоне х от 35 до 80 расположены гуще, чем при
других значениях х. Это наблюдение дает какую-то зацепку, с
помощью которой можно продвинуться дальдге. А именно оценим
количественно густоту расположения столбиков п"х вдоль оси*.
Для этого представим графически число столбиков пх,
например, на отрезках Ах длиной 5 единиц х. При этом получаются
столбики п.
п[ = 1, п'2 = 0, п'ъ = 5, п\ = 2, п'ь = 7, ... , п!а = 1, п'>31 = 0,
(2)
которые в виде гистограммы представлены на том же рис. 2.
Получившаяся картина едва ли лучше ряда (1), но не
будем отчаиваться — ведь и для столбиков (2) заметно, что они
выше и гуще расположены в диапазоне / от 7 до 16. Поэтому
посильнее огрубим информацию (но надо знать меру!). Для
этого найдем вместо ряда (2) число столбиков пх на отрезках
Ах длиной 20 единиц. Это дает ряд щ
л, =8, /г2 = 24, пг = 25, /г4 = 20, л5=14, я6 = 7, л7 = 3, "/г8=1
гистограмма которого также приведена на рис. 2. Полученная
картина уже обладает определенной гармонией: гистограмму
nt можно приближенно представить гладкой и монотонной
огибающей кривой /(*), которую можно записать аналитически
(в виде формулы), а затем интегрировать, дифференцировать,
разлагать в ряды и т. д. и т. п. Функция /(х), приближенно
представляющая гистограмму «чисел заполнения» щ в
«пространстве» ячеек /, называется грубозернистой функцией
распределения.1
В каждый фиксированный момент времени t функция
распределения f(x, t) однозначно описывает свою систему ресур-
сообменивающихся элементов. Конечно, полного описания
функция f(x, t) не дает: представленная в f(x, t) информация
огрублена ровно настолько, чтобы выявить (но еще не утерять)
системные свойства изучаемого набора ресурсообменивающихся
элементов. Пример, приведенный на рис. 1 и 2, показывает, что
построение функции распределения требует определенного
искусства при выборе размера «зерен» Ах на оси свойства х.
(Читатель, возможно, обратил внимание на то, что мы часто ис-
1 Компактное и ясное изложение этого вопроса и многих других
фундаментальных вопросов кинетической теории дается в книге Р. Айзеншица
«Статистическая теория необратимых процессов» (М., 1963).
292
пользуем термины «система», «системные свойства» и т. п. Это
делается нами сознательно, чтобы, с одной стороны, обратить
внимание на ценность для теории систем аппарата и методов
кинетической теории, а с другой — показать единство самых
разнообразных физико-химических явлений, если взглянуть на
них с системной точки зрения.)
Вообще говоря, априорно можно было бы допустить
существование самых разнообразных одномерных функций
распределения: f=a{t)e~bit)x>, или
а(1)е-ь«)х, или a{t)e-Hi)V* и
так до'бесконечности.
Например, на рис. 3 изображены
три варианта
экспоненциального распределения а ехр (—Ьх)
для трех значений Ь (все
функции отнормированы к
единице). Однако за 100 лет
существования кинетической
теории ученые убедились, что
для физико-химических систем,
достигших равновесия, т. е. не
претерпевающих никаких
изменений с течением времени,
универсальной является
экспоненциальная функция распределения
/равн(*) = ае-Ьх%
где а — нормирующий множитель и &>0 — некоторая
постоянная, причем a yl b от времени t не зависят. Выше уже
указывался физический смысл функции распределения, но теперь
/(х, t)d\ — это не вероятность обнаружить систему в элементе
объема dx> а число элементов физико-химической системы
в элементе объема dx вблизи точки x=(a:i, ..., xN).
Нормирующий множитель подобран так, чтобы полное число частиц
составляло 100%:
J ae~bxdx = 1.
Например, если «элементами» являются атомы или
молекулы, а «ресурсом» — кинетическая энергия Е, то распределение
(3) превращается в так называемый канонический ансамбль
Гиббса
РисЗ
(3)
f (ё) = —e~Eikr
(4)
где Z — плотность состояний, помимо нормировки
учитывающая вырождение некоторых энергетических уровней;
Г—абсолютная температура; k — постоянная Больцмана. Конкретным
293
примером ансамбля Гиббса является полученное задолго до
Гиббса распределение Максвелла — Больцмана, описывающее
распределение молекул газа в зависимости от величины
импульса р,
//0 Г) = const expf- v2l2m+uW )
ДР' V) (2nmkTf> eXPl Ы У
здесь p2/2m — кинетическая энергия молекулы с массой т;
U (г) — ее потенциальная энергия во внешнем поле.
По экспоненте (3) распределены капельки жидкости, в
равновесном тумане и капельки жира в молоке. Кинетические
энергии звезд в звездных скоплениях и галактиках также
распределены по экспоненте. Экспоненциальный вид имеет
функция, определяющая число галактик в интервале величин их
светимости от М до M±dM. Спектр гамма-всплеска, как и вообще
тормозного излучения оптически тонкой, т. е. прозрачной для
своего излучения, горячей плазмы, описывается содержащей
экспоненту формулой
/(£)~£*-*'*г.
Примеры можно продолжать до бесконечности — для всех
физико-химических явлений от атомов до скоплений галактик
характерны экспоненциальные (с некоторыми вариациями
в предэкспоненциальном множителе) функции распределения.
БОЛЬЦМАНОВСКИЕ КИНЕТИЧЕСКИЕ УРАВНЕНИЯ
Возможность единого описания ансамбля того или иного
типа частиц — это еще не главная польза, приносимая
грубозернистой функцией распределения. Главное же в том, что она
дает возможность математически описать временную эволюцию
выщерассмотренных ансамблей частиц. (Именно в этом смысле
соответствующее уравнение, которому подчиняется эволюция
во времени функции f(x, t), носит название «кинетического».)
Рассмотрим, как это сделать.
Как мы уже установили, грубозернистая функция
распределения f(xt t) однозначно описывает систему ресурсообмени-
вающихся элементов в момент времени t. Если предоставить
систему самой себе, то по
истечении какого-то времени она
может так измениться, что из-
f «г.ы ZM,) ШЛ,) менится и ее функция
распределения. Например, на
рис. 4 приведена функция
распределения f\ для одной и той
же системы в различные
моменты времени — f\(xy /i),
fx(x9 /2), f\(x9 h). В рам-
294
ках принятого огрубления информации изменение. f(xy i) во
времени вполне однозначно описывает временную эволюцию
системы ресурсообменивающихся элементов. Функции
распределения различных физико-химических систем могут
эволюционировать совершенно по-разному (см. функции f2(xt tz) и /3(д:, 4)
на рис. 4), но все они рано или поздно приближаются к
равновесному распределению (3). Найдем то уравнение, которому
подчиняется изменяющаяся во времени функция
распределения \(х, t).
Рассмотрим самый простой, но все же не тривиальный
случай, когда изменение элементов во времени происходит в
результате протекания лишь двух типов процессов. Первый тип —
элемент А» превращается в элемент А*+1 в результате
извлечения из резервуара порции ресурса R, равной величице
крупноструктурной ячейки Ах:
А, + (R) -_*(° - A,+l + (R - Д х), (о)
k(i+\)
где k и /7—константы скорости соответственно прямого и
обратного процессов, зависящие от значения индекса i. Второй
тип — пара элементов А/ и Aj с запасами ресурса i и / при
взаимодействии обменивается ресурсом R, в результате чего
получается пара А/ и Ат с запасами ресурса I и т:
k(i, /; /, т)
At + А7«- А, + Ат, (6)
1 J k(l, m\ it j) l m
причем количество ресурса в акте обмена (6) сохраняется:
i + j = l + m. (7)
Если не вдаваться в тонкую динамику элементарных
процессов (5) и (6), а рассматривать их как мгновенно протекающие
акты (т. е. и время рассматривать «грубозернисто»), то
элементарные процессы (5), (6) для полного набора элементов
Aj, A2, .♦., А», ..., Ащах можно описать с помощью обычной
химической кинетики:
4М'=£(/+ l)[R][Af+I] -*(i)[R]['A,] + W- l)[R][A,_,l-
max max max
-*(01R] [A/] + 2 2 2 *('• m> '• Л [AJ [Aj -
/=»1 /71 = 1 y = l
max max max
-^S^^.^NIA,], (8)
где i=l, 2, .-.., max. В уравнениях (8) [Q] означает
концентрацию компонента Q, причем в правой части все
положительные члены описывают приход компонента А*- (увеличение его
концентрации) в процессах (5), (6), а отрицательные члены
295
описывают расход компонента А*. В членах, содержащих
константы скорости k(l, га; f, /) и k{i, /; /, га), суммирование
произведено по всем значениям индексов /, /, га, так как в общем
случае в реакциях (6) компонент А,- может провзаимодейство-
вать с любым компонентом А/ и породить любую пару
компонентов А/, Агл, лишь бы выполнялось соотношение (7).
Для реальных систем значение t = max может составлять
миллионы и миллиарды, столько же уравнений будет
содержаться в наборе (8), поскольку каждое из этих уравнений
описывает приход — расход лишь одного компонента А/. Решить
такой набор зацепляющихся уравнений практически
невозможно, а если и можно было бы, то бесполезно, так как
никакой разум не обнаружит какой-либо закономерности или
тенденции в решенной задаче, когда она представлена миллионом
или миллиардом функций. Но мы уже научились разумно
огрублять информацию. Действительно, для момента времени
/ упорядоченный набор концентраций [Ai], [A2], ..., [А*], ...,
[Ат?х], эквивалентный набору чисел заполнения П\у п2, ..., л,-,
...» Лтах, можно без большой ошибки заменить грубозернистой
функцией распределения /(#, /).
При удачном выборе величины ячеек Ах наборы констант
скорости k(i), k(i) и k(i, /; /, га) также можно с приемлемой
точностью представить «грубозернистыми» функциями k(x),
k(x) и k(x, y\ z, и) соответственно. Наконец, суммы в
уравнениях (8) при достаточно мелких ячейках Ал: можно хорошо
аппроксимировать интегралами. Таким образом, весь набор
уравнений (8) заменяется одним интегродифференциальным
уравнением 1
df(xt t) rn1 dk{x)f{x% t) m1 <?&(*)/(■*, t) ,
Si = lR1 Ш lKJ di r
+ jjj>(z, it; X, y)f{z, t)f(tt% t) —
о
—k(x, y; z, u)f(x, f)f(y% t)]dydzdu, (9)
которое и является искомым уравнением, описывающим
временную эволюцию грубозернистой функции распределения.
Конечно, оно достаточно сложно, но все равно несравненно проще
набора уравнений (8) для концентраций [Ai], ..., [А,-],....
Уравнение (9) и есть искомое кинетическое уравнение.
Впервые подобное уравнение на примере молекулярного газа
было получено Людвигом Больцманом в 1872 г., поэтому теперь
уравнения вида (9) называют уравнениями больцмановского
типа. Первые два члена в правой его части — это «дрейфовые
члены». Так они названы потому, что отражают дрейф функции
^коробогатов Г. А., Дзевицкий Б. Э. — Журн. физ. химии,
1973, т. 47, с. 566.
296
распределения в результате того, что каждая частица изменяет
свой запас ресурса под действием некоторого внешнего
потенциала или внешнего резервуара ресурса. Интегральный член
называют «столкновительным интегралом», так как в случае
атомов и молекул интегральный член отражает изменение
функции распределения за счет парных столкновений частиц.
Сколь полезны и сколь точны кинетические уравнения?
Ведь, казалось бы, можно полностью описать временную
эволюцию всей системы элементов вместе с ресурсом и сосудом
через временную эволюцию каждого элемента в отдельности
с помощью уравнения Шрёдингера или, если ограничиться
классическим приближением, с помощью уравнения Ньютона.
(Такой подход называется методом Лагранжа.) Однако для
реальных систем, содержащих триллионы и квадриллионы
частиц, потребуется составить и решить также триллионы и
квадриллионы уравнений. Такая задача еще менее выполнима, чем
решение системы уравнений (8), и никакому разуму не удаст*
ся не то что осмыслить, а даже обозреть решение. Таким
образом, необходимо как-то укрупнить, огрубить информацию,
посмотреть на систему «издали», как теперь геологи смотрят на
Землю из космоса.
Первое огрубление производится путем перехода от
уравнений динамики к уравнениям (8), но оно, как уже отмечалось
выше, недостаточно. Второе огрубление осуществляется при
переходе к грубозернистой функции распределения и уравнению
(9) (такой подход называют методом Эйлера). Уравнение (9)
уже достаточно просто и компактно и позволяет уловить
наиболее общие свойства рассматриваемой системы. Так что дальше
мы будем работать с этим уравнением и пожинать плоды
применения метода Эйлера.
ЭКСПОНЕНЦИАЛЬНОЕ РАСПРЕДЕЛЕНИЕ
(ФИЗИКО-ХИМИЧЕСКИЕ СИСТЕМЫ)
Для всех физико-химических систем характерно то, что
у них акты (6) обмена ресурсом между парами элементов
имеют одинаковую вероятность как для прямого, так и для
обратного процесса, т. е. константы скорости прямого и обратного
процессов равны:
k(i* У; Л /ю) = Л(/, m\ i, У). (10)
Соотношение (10) является одним из выражений так
называемого принципа детального равновесия, который для
физико-химических систем так же непреложен, как, например, закон
сохранения энергии. Термином «детальное равновесие» физики
и химики хотят подчеркнуть, что имеется в виду не только
макроскопическое равновесие, но и равновесие в каждой
микроскопической стадии общего процесса.
297
Следует помнить, конечно, что если в актах обмена (6) нет
закона сохранения ресурса (7), то принцип детального
равновесия может и не соблюдаться. Например, в столбе пыли или
струе песка твердые частички обмениваются кинетической
энергией, однако при этом из-за трения заметная часть энергии
уходит в тепло, т. ё. закон сохранения ресурса (7) нарушается,
а потому нет никаких оснований ожидать выполнения
соотношений (10). Но на атомно-молекулярном уровне и тем более
в мире элементарных частиц любые парные взаимодействия (6)
протекают без всякого трения, а потому для них принцип
детального равновесия выполняется и соответствующая
грубозернистая функция k(xy y\ z, и) оказывается симметричной:
k(x, у; z, u) = k{z, u\ х, у), (11)
В результате этого уравнение (9) значительно упрощается:
—К— + IKJ ^ |К| ^
"ША(Х* У; *' ЛИК*. <)/(«, ')-/(*• ')/(У. Wydzdu. (12)
о
В силу принципа детального равновесия в процессах (5)
константы скорости прямого и обратного процессов также
равны, т. е. k{x)=k(x)y и уравнение (12) приобретает следующий
вид:
JA*0_+[R1 »«*£*•» =$tfk(x, у; z,u)X
X[f(z, 0/(и, t)-f(x, t)f{y, t)]dydzdu, (13)
где величина [R] может зависеть от времени t, но не от х.
Если же в рассматриваемой системе [R] зависит от х, то
вместо (13) из (12) получим
д/(х, t)
u^xmx.t)=^k(x y^ u)
х
dt
X[f(z, *)/(«. t)-f(x, *>/(У, t)]dydzdu, (14)
где U=d[R]/dx. Именно такая ситуация реализуется в случае
газа, находящегося во внешнем (например, гравитационном)
поле, для которого, собственно, Больцман и вывел свое
уравнение. В этом случае величина U(x) идентифицируется с
внешним потенциалом.
Рассмотрим теперь один частный, но весьма интересный
и важный случай. А именно положим, что резервуар ресурса
исчерпан ([R]=0), а система достигла равновесного
состояния, т. е., как мы указывали (см. с. 293), f(x, t) во времени
уже не изменяется (df(x, t)/dt=0). Найдем получившуюся
равновесную функцию распределения /равн(*). При условии [R] =
298
= 0 и df (х9 /)/<Э/ = 0 столкновительный интеграл в
уравнении (13) равен нулю. Поскольку функция k(xy y\ г, и)
неотрицательна, то в силу известных теорем интегрального исчисления
столкновительный интеграл может стать равным нулю только
при условии, что тождественно равно нулю выражение,
стоящее в квадратной скобке подынтегрального выражения:
/равн(г)/равн(а ) — /равн(*)/равн(>>) = 0. (15)
Чтобы найти равновесное распределение /Равн(*), нам
осталось решить функциональное уравнение (15). При выполнении
закона сохранения ресурса (7), или, иначе, z-\-u=x-\-y,
единственной функцией, удовлетворяющей уравнению (15),
является экспонента
fP»«(x)=ae->*, (16)
где а>0, Ь>0 — некоторые постоянные. То, что уравнение (16)
удовлетворяет (15), читатель может проверить
непосредственной подстановкой, а доказательство того, что решение (16)
единственно, — сможет найти, например, у Черчиньяни.1
Экспоненциальное распределение (16) и есть искомое
равновесное , распределение в одномерном случае. В трехмерном
случае постоянную а следует разделить на плотность
состояний. Например, если «элементами» являются атомы или
молекулы, а «ресурсом» — энергия Е> то (16) превращается в
канонический ансамбль Гиббса (4).
Получение равновесной функции распределения (16) или
(4)—это лишь самый простой пример той пользы, которую
принесло открытие Больцманом кинетического уравнения типа
(9) или (14). Кинетическое уравнение, даже если оно и не
решено аналитически, все равно позволяет извлекать ценную
информацию о функции распределения. Так, сам Больцман исходя
из (14). доказал знаменитую Н-теорему, согласно которой для
любого момента времени и для любой функции распределения,
описывающей молекулярный газ, справедливо неравенство
-g-<0, (17)
где
H = ^f(x, t)\nf(x, t)dx.
Больцман связал величину Н с энтропией 5 газа
S - —//,
и, таким образом, соотношение (17) является кинетическим
доказательством 2-го начала термодинамики, согласно которому
энтропия замкнутой физико-химической системы может только
возрастать.
1 Черчиньяни К. Теория и приложения уравнения Больцмана. М.,
1978.
299
Внимательный читатель наверное заметил, что
распределение (16) в точности совпадает с уравнением (3). Это означает,
что эмпирически найденная равновесная функция (3) и ее
универсальность получили теоретическое обоснование в
кинетическом уравнении Больцмана (14).
Кинетическое уравнение Больцмана позволяет получить
кинетическое обоснование не только равновесного распределения
(3) и 2-го начала термодинамики, но и других
феноменологически открытых уравнений вязкого течения газа или жидкости,
диффузионного уравнения, уравнения движения броуновской
частицы и т. д. Без грубозернистой функции распределения
и кинетических уравнений современные физика и химия были
бы немыслимы. Поразительно, но применение функций
распределения и кинетических уравнений оказалось чрезвычайно
плодотворным не только в физико-химических, но и в
биологических, и социальных науках. Но об этом речь пойдет в
следующей части очерка.
СТЕПЕННОЕ РАСПРЕДЕЛЕНИЕ
(ЖИВЫЕ СИСТЕМЫ)
Какие же функции распределения реализуются в живых
системах, в особенности в системах, связанных с человеком и
человеческим обществом? Можно думать, что по физическим
и умственным характеристикам х люди распределены в
соответствии с нормальным законом
/(*) = —1=^ <?-<*-«№", (18)
который был введен в теорию вероятностей К. Гауссом. В
уравнении (18) о2 — дисперсия распределения. Но нормальное
распределение характерно для величин, порождаемых чистой
случайностью, поэтому сомнительно, чтобы предприятия, города
и государства (в зависимости от их размеров), ученые,
научные институты и журналы (в зависимости от объема
выдаваемой ими научной информации), граждане (в зависимости от их
доходов) и т. д. подчинялись нормальному распределению (18).
Что показывают факты? В 1897 г. итальянский экономист
В. Парето опубликовал количественные данные о распределен
нии числа граждан и предприятий наиболее развитых
государств Европы по величине их доходов х. Оказалось, что это
распределение имеет1 степенной вид
/(*) = const •*-«, (19)
где показатель п близок к 2.! Экономисты называют функцию
1 Более подробно этот вопрос освещается в статье Д. Прайса «Малая
наука, большая наука», помещенной в книге «Наука о науке» (М., 1966,
с. 281—384).
300
(19) «распределением Парето» (кривая 4 на рис. 5 в
координатах lg/—Igz).
В 1926 г. А. Дж. Лотка построил распределение числа
научных сотрудников в зависимости от числа опубликованных
ими статей. Получилась функция (19) со значением л,
варьирующим от 2 до 3. Науковеды стали называть распределение
(19) «законом Лотки» (кривая 1 на рис. 5 в координатах
lg/-lg*)-
Американский социолог Герберт Саймон построил
распределение городов по количеству их населения, и также
получилось распределение (19) с
показателем я, близким к 2. Лингвисты,
подсчитав встречаемость
различных слов в литературном и
разговорном языке, тоже получили
распределение (19), которое они
называют «распределением Ципфа».
Недавно мы изучили
распределение филателистов г.
Ленинграда в зависимости от величины и
стоимости их коллекций и получили
распределение (19) с показателем
пу изменяющимся от 1 до 2 (по
мере роста х) (кривая 2 на рис. 5
в координатах lg/—lgr/).1 Мы
построили также распределение
вкладчиков г. Москвы по величине
их вкладов. Опять получили
распределение (19) с показателем п=
= 1-ь2 (кривая 3 в тех же
координатах).
Итак, похоже, что в первом
приближении элементы любых систем
для любых ресурсов, порожденных
человеком и человеческим
обществом, распределены не по
экспоненциальному, а по степенному закону.
То, что различные социальные системы в первом приближении
дают один и тот же закон (19) для распределения населения
по доходам, нет ничего удивительного, так как на Земле пока
еще не было государств, отменивших экономический закон
стоимости. Различие социальных систем сказывается на более
тонких особенностях функции распределения f(x), которые
выявляются в более точном втором приближении. Национальные
особенности разных государств с одинаковым социальным
строем могут быть выявлены, очевидно, лишь в еще более точ-
1 Коняева А. С, Скоробогатов Г. А.■
ханика, 1980, № 11, с. 85.
18 ЦЕ
Рис 5
■Автоматика и телеме-
30!
ном третьем приближении и т. д. Эти особенности
математически будут выражаться различиями в параметрах каких-то
функций, более общих, чем (19).
Попытаемся вскрыть причину, по которой все массовые
явления, связанные с человеческим обществом, распределены по
степенному закону (19), а все неживые системы — по
экспоненте (16). Естественно предположить, что человеческое общество
отличается от неживых физико-химических систем наличием
кибернетической обратной связи. Руководствуясь этой гипотезой,
проанализируем распределения (16) и (19).
Хотя уравнения (16) и (19) — стационарные (не зависящие
от врейени) распределения, для отыскания причины их
расхождений необходимо привлечь динамическое рассмотрение, т. е.
обратиться к уравнению (9), члены которого имеют следующий
смысл: k(x)—функция, показывающая, с какой скоростью
элемент, обладающий запасом ресурса х, извлекает ресурс из
общего резервуара; [R], как и раньше, концентрация ресурса
в резервуаре; k(xy у\ г, и)—вероятность того, что в
результате парного взаимодействия двух элементов с запасами ресурса
х и у_ получатся два элемента с запасами ресурса z и w.
Функция к(х) показывает, с какой скоростью элемент,, обладающий
запасом ресурса х, выделяет ресурс в общий резервуар.
Поскольку в человеческом обществе принцип детального
равновесия не обязан выполняться, то функции k(x) и k(x) не
обязаны совпадать друг^с другом. Далее мы везде и ограничимся
моделью, в которой k(x)=0.
Анализ уравнения (9) показывает, что его стационарное
решение при /г=0 имеет экспоненциальный вид (16) в том
и только том случае, когда k(x) является постоянной
величиной:
*нежив(*) = COnst. (20)
Если же функция к(х) линейно растет с х, т. е.
кжнв(х) = ах (*><>), (21)
то из уравнения (9) получается стационарное решение
степенного вида (19).
Формула (20) означает, что эффективность извлечения
ресурса из общего резервуара (например, кинетической энергии —
молекулами газа, находящегося во внешнем потенциале)
одинакова для всех элементов независимо от того, сколько данный
элемент уже приобрел этого ресурса. Напротив, для живых
систем из формулы (21) следует, что элемент с тем большей
эффективностью продолжает извлекать ресурс, чем большим его
запасом уже обладает.
Функция (21) означает выполнение принципа «ресурс идет
к ресурсу». То, что «деньги идут к деньгам» и «успех идет
302
к успеху», знали еще в древнем Риме. Но сила математики
в том и заключается, что теперь мы знаем (см. формулу (21)):
степенное распределение получается только тогда, когда
«ресурс идет к ресурсу» точно в первой степени (а не в квадрате,
не по экспоненте и т. п.). Формула (21) одновременно
выражает и искомую нами кибернетическую обратную связь для
живых систем. Видно, что это положительная обратная связь:
элемент тем эффективнее развивается, чем более он развит.
В системах, где нет степенного распределения (19), нет и
обратной связи!
Найден и вид функции k(x, у\ z, и), которая при подста
новке в столкновительный интеграл уравнения (9) приводи!
к стационарному решению вида (19). В самом общем виде эт&
функция такова:
k(x, у; z% и) = Цг + и — х- y)x*y*e«*+y-wЦх)Цу)Цг)Ци),
(22)
где Я —любая функция в классе непрерывных
неотрицательных функций; а, с — постоянные; 6 — дельта-функция Дирака.1
Функция (22) обладает двумя важными свойствами:
k(x, y;z, и) фк(г, и; хг у) (23)
и
k(xr y\ z% u)^k{z, u\ х, у), если x<z, и<у. (24)
Свойство (23) означает неподчинение принципу детального
равновесия. (Действительно, соблюдение принципа детального
равновесия (11) обязательно привело бы к экспоненциальному
стационарному распределению (16).) Свойство же (24), как
нетрудно заметить, опять означает выполнение принципа «ресурс
идет к ресурсу».
Вышеизложенный системный подход позволяет
формализовать и, следовательно, в какой-то мере подвергнуть
математическому анализу не только материальную, но и многие другие
стороны духовной жизни людей. Например, феномен поэзии
можно рассматривать как систему, «элементами» которой
являются поэты, а ресурсом, заключенным в каждом
«элементе»,— например, число человеко-минут, в течение которых
читатели читают или вспоминают стихи конкретного поэта. Ака-
1 Поль Дирак определил 6-функцию б(х) как функцию, обладающую
сю
двумя свойствами: 6(*)=0 при *=£0j 6(x)dx=l. Академик Я- Б. Зельдо-
вич называет ее «замечательной функцией», но читатель не найдет ее во
многих учебниках математического анализа. Как писал Зельдович в 1965 г.,
математики предпочитают возможно дольше не знакомить учащихся С этой
математической ересью, «подобно тому как школьников оберегают от
Мопассана и Есенина».
303
логично формализуется феномен музыки, кинематографии или
драматургии. Филателия — это система, образованная
филателистами, различающимися по величине собранных ими
коллекций.
Вообще говоря, в настоящее время уже известны и многие
другие подходы к математическому описанию экономических
и социальных процессов. Более того, еще Д. И. Менделеев
пытался математически описывать стоимости различных товаров
как удельные веса различных тел. Однако только
грубозернистая функция распределения и больцмановские кинетические
уравнения позволили извлечь доселе скрытую информацию
о феноменологических коэффициентах (константах скорости)
из обычных статистических данных о распределении доходов,
численности населения городов, продуктивности ученых й т. д.
Интересно, что линейная зависимость (21) с точки зрения
статистической физики фактически означает подчинение
статистике Бозе — Эйнштейна. Действительно, в статистической физике
доказывается, что если одинаковые частицы бросаются
случайным образом в некоторые ячейки с вероятностью, не зависящей
от количества частиц, уже попавших в ячейки в предыдущих
бросаниях, то распределение таких частиц описывается
классической статистикой Больцмана. Если же частица попадает
в ячейку с вероятностью, прямо пропорциональной количеству
частиц, уже находящихся в этой ячейке, то результирующее
распределение частиц описывается квантовой статистикой Бозе —
Эйнштейна. Но формула (21) как раз и означает, что порции
ресурса из внешнего резервуара попадают в ресурсодобывающий
элемент с вероятностью, прямо пропорциональной . количеству
ресурса х, уже добытого элементом.
В этой связи ряды любителей сводить химию и биологию
к физике пополнились желающими свести к физике и
социологию. Для этого достаточно было объявить деньги бозонами по
отношению к гражданам, а граждан — бозонами по отношению
к предприятиям или городам и т. д., после чего уже «без труда»
получалось степенное распределение (19). Протест против
такого редукционизма был заявлен, самим Саймоном.1 С нашей же
стороны мы добавим следующее.
Из рис. 5 видно, что, реализующиеся в человеческом
обществе функции распределения f(x) имеют вид (19) далеко не во
всем диапазоне изменения независимой переменной х: по мере
уменьшения х начиная с некоторого значения х0 показатель
степени п=2-^3 перестает быть постоянным, уменьшаясь до 1,5
или даже до 1,0. Ясно, что такое отклонение от закона (19)
является следствием отклонения функции k(x) от
идеализированной зависимости (21) или функции k(x, у; z, и) от
идеализированной зависимости (22).
l I j I г I Y., Simon Н. А.— Ргос. Nat. Acad. Sci. USA, 1975, vol. 72,
p. J 654.
304
Посмотрим, какой вид должны иметь функции k(x), чтобы
вместо (19) получались реальные функции распределения,
изображенные на рис. 5. Ограничимся минимальным обобщением
зависимости (21), а именно будем рассматривать только
функции k (x) степенного вида
k(x, t) = a(t)x? (a > 0, р > 0). (25)
Для этого обратимся к исходному уравнению. (14), в которое
подставим (25), а функцию k(x, у; z, и) положим тождественно
равной нулю, так как ее мы сейчас не касаемся. В результате
получим
_i_ mxj)_ + х,щ± + pxP_I/(jCjt) = 0 (26>
с нормированной начальной функцией
оо
\f{x,Q)dx=\.
а
Поскольку статистические данные показывают, что
изображенные на рис. 5 и другие функции распределения в
человеческом обществе со временем не меняют своей формы и топологии,,
то при поиске решений уравнения (26) ограничимся лишь
классом функций J(x, t), представимых в виде произведения
/(*. 0 = Ф(*Ж*); где ф(0) = 1. (27)
Подставляя (27) в (26) и разделяя переменные, будем иметь
! *Ш = _ |> _J_ *К*> + Bjc?-i 1= const = т-1 (28V
Решение первого уравнения с начальным условием cp(0) = t
приводит к следующей функции:
Ф(0 = ехр!(Т - 1 )U\ *{t)dt\. (29>
Мы рассматриваем только процесс перехода ресурса из
резервуара в элементы, поэтому в (29) и в дальнейшем считаем:
Y>1. Тогда интегрирование второго уравнения (28) дает
<!>(*) =
ТГ—1 Г / 7-»
^(■f)7. прир=1 (30>
^ ехР [- т=р (я1'* - я'"3)] при р < 1.
305.
Отсюда видно, что идеализированное распределение (19) может
получиться в результате решения кинетического уравнения (14)
только лишь при р = 1. Реальные же функции распределения
типа тех, что изображены на рис. 5, описываются нижней
формулой (30), т. е. получаются из функции (25) при (5<1.
Числовая подгонка значений а, р и y к функциям распределения,
изображенным на рис. 5, показала, что им соответствуют значения
р от 0,6 до 0,7,-
Поскольку р=т^1, то становится ясным, что деньги, люди
и другие ресурсы человеческого общества не имеют никакого
отношения к бозонам. А вот общие кибернетические
закономерности к человеческому обществу оказываются вполне
применимыми— ведь функция (25) по-прежнему означает наличие
положительной обратной связи в ресурсодобывающей деятельности
элементов. Правда, показатель степени р в (25) несколько не
дотягивает до 1, как это было в (21).
КОСМИЧЕСКИЕ ЛУЧИ
В заголовке очерка мы сказали о почти безграничной
применимости больцмановских уравнений: «от атомов до
Вселенной». Дистанция между ними, оказывается, не столь уж
велика. Выше шел разговор об атомах и макрообъектах, теперь же
остановимся на космических объектах.
В начале очерка отмечалось, что кинетическая энергия
звезд в звездных скоплениях и галактиках имеет
экспоненциальное распределение и что экспоненциальный вид имеет
функция, определяющая число галактик в интервале величин их
светимости от М до M+dM. Значит, и для астрофизических
объектов справедливо то, что мы обнаружили для всех
равновесных физико-химических систем, а именно — универсальность
экспоненциального распределения (3). Тем более удивительно,
что известен один физико-химический, а точнее астрофизический
феномен, который не подчиняется этой закономерности. Речь
идет о космических лучах.
Первичное космическое излучение внесолнечного
происхождения состоит из положительно заряженных частиц — протонов
и более тяжелых нуклидов. Например, для энергии частиц
около 10 ГэВ протоны составляют 92%, а-частицы — 7%, ядра
с Z = 3-j-5—примерно 0,12%, с £=6ч-9— около 0,5% и т. д.
Распределение элементов в космических лучах отличается от
распределения элементов в звездах.
Интегральный спектр первичного космического излучения
в огромном диапазоне изменения энергии аппроксимируется
степенным законом (кривая 5 на рис. 5 в координатах \gf—
-IgE)
306
/(£) = £-т.
(30)
причем при £<109 эВ характер спектра внесолнечных
космических лучей не установлен из-за влияния солнечного ветра
и межпланетных магнитных полей. При £=1015 эВ обнаружен
излом в спектре: у=2,75 при £'<1015 эВ и v=3,2 при
£>1015 эВ.1 При £~1019 эВ также наблюдается изменение у9
однако эти спектральные данные пока противоречивы.
Космическое излучение изотропно, но в связи с изменением спектра
при £~1019 эВ было высказано предположение о наличии
анизотропии при этой энергии. Энергия космических лучей ( 1^к.л)
сравнима с энергией основных форм материи во Вселенной —
с кинетической энергией вещества и энергией магнитных полей:
WK. д ^ WH = Я2/8 тг = nkT~ Ю-12 эрг/см3.
Одной из основных задач теории происхождения
космических лучей является объяснение степенного энергетического
спектра. Степенное распределение получается при любом
механизме ускорения космических частиц, если приращение
энергии пропорционально самой энергии.2 Действительно,
уравнение плотности космических частиц в области ускорения имеет
вид
!s¥L=-и- [«<*■ О т] - ^ + "^ '>■ (31 >
где п(Е, t)—плотность частиц; тср—среднее время жизни
частиц в области ускорения; q(E, t)—функция источника.
Если ускорение длится время /0 и Тср-.^о, будет достигнуто
стационарное состояние dn/dt=0. Если к тому же
т=а£>' (32>
из уравнения (32) следует
п(Е) = const -f"7,
где т=1 + (атСр)-1. Вышеуказанный механизм ускорения
предложил Энрико Ферми в 1949 г. Однако, будучи примененным
к ускорению частиц.в межзвездной среде, он дает спектр (30)
только в диапазоне одного порядка величины энергии, а
возможность применения этого механизма для ускорения частиц
в самих источниках космических лучей- неясна.
1 Более подробную информацию о космических лучах вы можете найти
а книге В. Л. Гинзбурга «Теоретическая физика и астрофизика» .(М., 1975).
2 Гинзбург В. Л., Сыроватский С. И. Происхождение
космических лучей. М., 1963.
307
Несмотря на то, что было предложено множество моделей
ускорения частиц, пока ни одна из них не позволяет получить
степенной спектр во всем изученном диапазоне энергий.
Полагают, что частицы с энергией до 1019 эВ рождаются в нашей
Галактике, а излом спектра при 1019 эВ обусловлен тем, что
частицы с большей энергией имеют метагалактическое
происхождение. Наиболее вероятными источниками космических
лучей в Галактике считаются сверхновые звезды, так как только
энергия, сравнимая с энергией взрыва сверхновой звезды,
достаточна для ускорения космических частиц. Другими
механизмами ускорения частиц, обеспечивающими подобную
энергетику, являются вращение пульсаров, а также процессы
в ядре Галактики. Гинзбург и сотр. рассматривали и модель
ускорения частиц в гало Галактики. Метагалактическими
источниками космических лучей могут быть квазары и ядра активных
галактик.
Доля электронов в первичном космическом излучении
гораздо меньше доли протонов, так как электроны тратят большею
энергию на излучение. Предполагается, что спектр первичных
электронов имеет степенную форму, но показатель степени
пока точно не измерен. Возможными механизмами ускорения
электронов являются либо непосредственное ускорение в
источниках, либо процессы распада типа л-+ц-+ё, где пионы
рождаются в результате ядерных столкновений. Однако механизм
второго типа не подтверждается, ибо наблюдаемая
интенсивность позитронов в первичном излучении меньше, чем она
должна быть, если бы этот механизм был преобладающим.
Вид спектра антипротонной составляющей первичного
космического излучения также степенной. И хотя рассмотрено
несколько возможных механизмов образования антипротонной
составляющей,1 ни один из них не позволяет понять, почему
энергетический спектр антипротонов имеет степенную форму.
Таким образом, несмотря на обилие гипотез и моделей,
в проблеме происхождения космических лучей, по словам
академика В. Л. Гинзбурга, остается «неясность в главном
вопросе— в выборе модели происхождения основной части
космических лучей».
Интересно, что механизм ускорения космических частиц,
предложенный Э. Ферми, а также закон возрастания энергии
космических лучей (32) можно выразить формулой
k(E) = aE, (33)
которая совпадает е формулой (21) для живых систем,
обладающих положительной обратной связью. Поэтому неудивитель-
iBuffington A., Schindler S. M., Pennypacker С R.—
Astrophys. J, 1981, vol. 248, p. 1179.
308
но, что до сих пор никому не удалось придумать естественный
физический механизм, обеспечивающий степенной спектр
первичного космического излучения: ведь естественные
физико-химические элементы «не умеют» извлекать ресурс из внешнего
резервуара с положительной обратной связью. На это
способны только живые организмы. В связи с этим не кажется
фантастическим предположение 1 о том, что космические лучи —
побочный продукт деятельности внеземных цивилизаций (ВЦ).
В соответствии с теми рассуждениями, которые мы провели
на с. 301, распределение ВЦ как по производимой ими
энергии, так и по максимальному значению энергии отбрасываемых
частиц, должно быть степенным. Тогда, если предположить,
что космические лучи — это отходы различных энергетических
установок и средств транспорта ВЦ, их энергетический спектр
также должен быть степенным. Действительно, энергия отходов
ВЦ в виде космических лучей (£к. л) связана с полной энергией,
производимой ВЦ (£), линейным соотношением
где £отх — энергия прочих отходов; т| — среднее значение к.п.д.
для ВЦ. Так как ВЦ существует достаточно долго, чтобы
между отходами различных типов установилось термодинамическое
равновесие, то £к. л = р>Е0ТХ., так что из (34) следует линейное
соотношение между Ек. л и Е
^к.л—у^-О-ч)^ (35)
и, следовательно, тождественность спектров Ек. л и £ (здесь
|г —некоторый численный множитель).
Полученный вывод, вообще говоря, не вполне строг. Но он
не меняется, если предположить, что каждая силовая установка
ВЦ данной мощности производит в виде отходов частицы
одной энергии. Действительно, рассмотрев распределение F(E)
всех силовых установок всех ВЦ по мощности или
производимой ими в течение определенного времени энергии Е, которое
также должно быть степенным (см. с. 301), получаем опять
степенной спектр для частиц-отходов
N(E) = h(E— E')F{E')dE' = F(E)^E~\
6
1Скоробогатов Г. А.— Химия и жизнь, 1982, № 12, с. 118.
309
Вывод о том, что космические лучи являются отходами
деятельности ВЦ, разрешает основную проблему поиска ВЦ —
кажущееся отсутствие каких-либо следов их деятельности.
Космические лучи как раз и есть тот объективный признак
существования ВЦ, игнорируя который многие авторы приходили
к выводу о малочисленности ВЦ. Напротив, именно
существование космических лучей, энергетический спектр которых
является степенным, и является фактом («космическим чудом», по
терминологии И. С. Шкловского), свидетельствующим в поль-*
зу множественности ВЦ.
Согласно известной теореме Дайсона, разумность ВЦ
определяется количеством производимой ими энтропии. Интересно,
что степенное распределение с показателем степени 2,65
отвечает максимуму энтропии.1 В спектре космических лучей
показатель у примерно равен 2,7, т. е. космические лучи также
распределены по закону, соответствующему максимуму энтропии.
Эти данные вполне согласуются с теоремой Дайсона.
Проанализируем энергетику космических лучей. Как
известно, плотность их энергии W~ 10~13 Дж/м3, так что в
дисковой части Галактики их полная энергия £=1047 Дж. Чтобы
получить такую энергию, следует допустить, что почти около
каждой «спокойной» звезды существует в течение 2ч-5 млрд.
лет ВЦ, которая производит 1020 Дж/с. Действительно, полное
число «спокойных» звезд составляет ~ 1010. Так как среди
звезд этих классов существуют звезды, которые старше Солнца
на 5—6 млрд. лет, будем считать, что наиболее старые ВЦ
существуют ~5 млрд. лет или ~1017 с. Тогда средняя мощность
отходов, порождаемых такими ВЦ, составляет
wov - jfceh = 102° Дж/С- <36>
Даже если rj в формуле (35) равно 99,99%, то и тогда
производимая ВЦ мощность не превышает 1023-^1024 Дж/с. Хотя
подобная мощность превосходит мощность, вырабатываемую
современным человечеством, в 1011 раз, тем не менее она на
3 порядка меньше мощности, которую вырабатывает ВЦ,
освоившая энергию своей звезды (1026-*-1027 Дж/с). Но именно
такие ВЦ, согласно В, С. Троицкому,2 наиболее распространены
в Галактике. Мощность (36) не является фантастической даже
для Земли. Так, при сохранении существующих темпов роста
^Доказательство см. в журнале «Автоматика и телемеханика», /1980,
№ 11, с. 85.
2 Троицкий В. С.— В кн.: Проблема поиска Внеземных цивилизаций.
М., 1981, с. 5.
310
производства (3—4% в год) человечество уже через 103 лет
освоит подобную же мощность: если (1,03) т= 10й, то Т=
= ll/lgl,03-=103 лет.
Таким образом, если принять точку зрения
множественности ВЦ, то невероятный на первый взгляд вывод о том,
что.космические лучи — это в основном отходы ВЦ, оказывается
очевидным и даже тривиальным. Конечно, в космосе существуют
различные ускорительные процессы, так что часть космических
лучей обязательно имеет естественную природу. Но вряд ли
в масштабах всей Галактики существует универсальный
механизм с положительной обратной связью (32) или, что то же,
(33), который работал бы во всем изученном диапазоне
энергий, давая степенное распределение (30).
ИБ № 2173
Химия — традиционная и парадоксальная
Редактор Л, П. Макаренкова
Оформление художника А. И. Гришина
Художественный редактор А. Г. Голубев
Технический редактор Г. М. Матвеева
Корректоры £. К. Терентьева, В, А. Латыгина
Сдано в набор 03.12.84. Подписано в печать 23.08.85. М-28021. Формат 60X90!/ie- Бум. тип. М 2.
Гарнитура литературная. Печать высокая. Усл. печ. л. 19,5. Уч.-изд.л. 19,49. Усл. кр.-отт. 19,62;
Тираж 4768 экз. Заказ № 779. Цена 2 руб.
Издательство ЛГУ им. А. А. Жданова. Ленинград, Университетская наб., 7/9.
Сортавальская книжная типография Государственного комитета КАССР по деламиздательств
полиграфии и книжной торговли. 186750. Сортавала, ул. Карельская, 42.