Author: Черных В.П.
Tags: классификация органических соединений элементоорганические соединения органическая химия химия
ISBN: 966-615-155-3
Year: 2005
Text
УДК 547.1(075.8)
ББК 24.2я73
Л43
Рекомендовано
Министерством образования и науки Украины
(письмо № 14/18.2-690 от 14.04.2003 г.)
Рецензенты:
В. Д. ОРЛОВ, доктор химических наук, профессор, заведующий
кафедрой органической химии Харьковского национального уни-
верситета им. В. Н. Каразина;
П. А. БЕЗУГЛЫЙ, доктор фармацевтических наук, профессор, за-
ведующий кафедрой фармацевтической химии Национального фар-
мацевтического университета.
В лекщях з оргашчно! xiMii, як! протягом багатьох рок!в читаються
студентам фармацевтичного ушверситету, в просйй i доступнш форм! ви-
кладеш загальн! п!дходи до розгляду теоретичних питань сучасно! оргашч-
но! xiMii'. Даються уявлення про реакцп та реагенти, мехашзми орган (ч них
реакщй та ix напрями, ф!зичн! i xiMi4Hi властивосй оргашчних речовин.
Пщкреслена роль i значим!сть оргашчно! xiMii як науки, показаний гене-
тичний зв’язок мЬк класами оргашчних сполук.
Для студенпв фармацевтичних вуз!в ! факультетов.
Лекции по органической химии В. П. Черных: Учеб.
Л43 пособие для студ. вузов. — X.: Изд-во НФаУ; Золотые стра-
ницы, 2005. — 480 с.
ISBN 966-615-155-3.
ISBN 966-400-000-0.
В лекциях по органической химии, которые на протяжении многих
лет читаются студентам фармацевтического университета, в простой и до-
ступной форме изложены общие подходы в рассмотрении теоретических
вопросов современной органической химии. Даны представления о реак-
циях и реагентах, механизмах органических реакций и их направлениях,
физических и химических свойствах органических веществ. Подчеркнута
роль и значимость органической химии как науки, показана генетическая
связь между классами органических соединений.
Для студентов фармацевтических вузов и факультетов.
УДК 547.1(075.8)
ББК 24.2я73
ISBN 966-615-155-3
ISBN 966-400-000-0
© Черных В. П., 2005
© Национальный фармацевти-
ческий университет, 2005
Посвящается
моим дочерям
Юле и Владе
ПРЕДИСЛОВИЕ
Вот уже четыре десятилетия я каждый раз с волнением вхожу
в лекционную аудиторию, где на меня устремлены более двухсот
пар пытливых и внимательных глаз студентов.
Моя задача — донести до каждого из них все богатство содер-
жания и красоту структурных формул королевы химических наук —
Органической Химии. Именно она является тем фундаментом, на
котором возводится величественное и значимое здание фарма-
цевтических специальностей. Без знания органической химии не-
возможно успешно освоить фармацевтическую, токсикологиче-
скую, биологическую, аналитическую химию, фармакогнозию
и другие дисциплины учебного плана.
Мой опыт чтения лекций и наблюдения за восприятием их
студентами убедили меня в необходимости издания курса органи-
ческой химии именно в предлагаемом виде.
Кафедра органической химии Национального фармацевтиче-
ского университета имеет большой опыт создания и издания учеб-
ной литературы. Написание и издание учебников и учебных по-
собий по дисциплине преподавательский коллектив считает своей
первейшей задачей и святым долгом перед студентами. Исключи-
тельно богатый многолетний опыт преподавания, творческий под-
ход позволили создать учебно-методический комплекс по ор-
ганической химии в виде учебника, практического руководства
и методических указаний.
Учебник «Органическая химия» в трех книгах, изданный на
русском и украинском языках, удостоен Государственной премии
Украины, широко используется в преподавании курса в фарма-
цевтических вузах и классических университетах Украины, Рос-
сии, Беларуси и других стран СНГ. Практическое руководство
к лабораторным и семинарским занятиям на русском и украин-
ском языках выдержало три издания. Новый подход к органиче-
скому синтезу, а именно комбинаторный синтез, воплощен в учеб-
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ
по органической _
ХИМИИ
Учебное пособие
для студентов высших учебных заведений
ХАРЬКОВ
ИЗДАТЕЛЬСТВО НФаУ
«ЗОЛОТЫЕ СТРАНИЦЫ»
2005
4
нике, который органично дополняет фундаментальный учебник
по органической химии.
Нужно сказать, что курс лекций по органической химии пре-
терпевал качественные изменения в зависимости от количества
часов, выделенных на дисциплину в типовых учебных планах, с не-
изменной тенденцией к их уменьшению. Все это требовало твор-
ческого подхода к чтению лекций со стороны преподавателей.
И следует отдать должное: преподавательский корпус кафедры
органической химии всегда отличался высокой требовательнос-
тью к лекторскому мастерству, высокой культурой, эмоциональ-
ностью, интеллигентностью, свободным владением материалом.
Профессор П. А. Петюнин, доцент Н. Н. Валяшко и я читали
курс в полном объеме, постоянно совершенствуя его и дополняя
новой информацией. Сегодня из-за уменьшения количества лек-
ционных часов преподавателям приходится читать урезанный курс,
что очень сложно. Но сложно и студентам разобраться в большом
объеме материала, изложенного в учебнике или вынесенного на
самостоятельную работу, возникает масса вопросов. Поэтому я счел
возможным предоставить студентам тексты своих лекций, кото-
рые не заменяют учебник, а скорее дают курс в сжатом изложе-
нии, акцентируют внимание на наиболее трудноусваиваемых сту-
дентами понятиях, разделах, механизмах реакций.
Достоинством издания, с моей точки зрения, является и то,
что органическая химия здесь представлена в системе фармацев-
тического образования, подчеркнута ее роль в освоении специ-
альных дисциплин.
Основные понятия изложены не сухим, академическим сти-
лем, а живым, понятным языком, приближенным к разговорной
речи.
Буду рад, если мой труд поможет вам в освоении курса орга-
нической химии, в самостоятельной работе, при подготовке к прак-
тическим занятиям, коллоквиумам и семинарам.
Всю жизнь (сведения об авторе лекций вы можете прочесть
в конце этой книги) я посвятил любимому делу — органической
химии, науке, которая верой и правдой служит человеку. Ее роль
и значение в нашей жизни как нельзя лучше характеризуют слова
великого М. В. Ломоносова: «Широко распростирает химия руки
свои в дела человеческие. Куда ни посмотрим, куда ни оглянемся,
везде обращаются пред очами нашими успехи ея прилежания».
Я надеюсь, что, познав и поняв органическую химию, вы по-
любите ее так же, как и я, и перед вами откроются широкие гори-
зонты ее практического применения в вашей жизни, в вашей про-
фессии.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Каждый период развития органической химии отмечен попыт-
ками ученых каким-то образом привести разнообразие химиче-
ских соединений в единую систему.
Важнейшими признаками, которые положены в основу совре-
менной классификации органических соединений, являются стро-
ение углеродной цепи и природа функциональных групп.
Классификация по строению углеродной цепи. В зависимости от
расположения углеродных атомов в молекуле органические со-
единения делят на несколько больших групп.
Различают два типа органических соединений: ациклические
и циклические. Ациклические, или алифатические (от греч. али-
фар — жир), соединения — это вещества с открытой (незамкну-
той) цепью, другое их название — соединения жирного ряда. Среди
ациклических различают: насыщенные (предельные) соединения,
содержащие только простые углерод-углеродные связи, и ненасы-
щенные (непредельные) — структуры с кратными (двойными, трой-
ными) углерод-углеродными связями.
6
CH,—CH,
ta/ 1-J
сн,=сн2
CH —CH —C OOH
предельные
алифатические
соединения
сн=сн—соон
непредельные
алифатические
соединения
К циклическим относятся соединения, содержащие в своей
структуре замкнутые цепи атомов — циклы (от грея, циклос —
круг). Природа атомов, входящих в цикл, лежит в основе деления
всех циклических соединений на две большие группы: карбоцик-
лические и гетероциклические. В молекулах карбоциклических со-
единений цикл состоит только из атомов углерода. Гетероцикли-
ческие соединения имеют в своей структуре циклы, содержащие
наряду с атомами углерода атомы других элементов, чаще всего
О, S, N.
Н2С—СН2
Н2С—СН2
алициклическое
соединение
ароматическое
соединение
НС—сн
НС сн
N
карбоциклические
соединения
гетероциклическое
соединение
Карбоциклические соединения в свою очередь делятся на али-
циклические и ароматические.
Алициклические структуры подобно алифатическим соединениям
по степени насыщенности подразделяются на насыщенные и не-
насыщенные:
насыщенное
алициклическое
соединение
ненасыщенное
ал ициклическое
соединение
Среди гетероциклических соединений различают насыщенные,
ненасыщенные и ароматические структуры:
1. Классификация и номенклатура органических соединений
7
насыщенный
гетероцикл
ненасыщенный
гетероцикл
ароматический
гетероцикл
Соединения, молекулы которых состоят только из атомов угле-
рода и водорода, называются углеводородами. Замеще-
ние одного или нескольких атомов водорода на функциональные
группы ведет к образованию других классов органических соеди-
нений.
Классификация по природе функциональной группы. Функцио-
нальная группа — структурный фрагмент молекулы, характеризу-
ющий свойства соединений данного класса. Например, свойства
карбоновых кислот характеризуются наличием карбоксильной
группы —с' ; в спиртах функциональная группа — спиртовый
гидроксил —ОН; к аминам относятся соединения, содержащие
группу —NH2 и т. д.
По количеству и однородности функциональных групп орга-
нические соединения делят на моно-, поли- и гетерофункцио-
нальные.
Вещества с одной функциональной группой называют моно-
функциональными, с несколькими одинаковыми функциональными
группами — полифункциональными. Соединения, содержащие несколь-
ко различных функциональных групп,— гетерофункциональные.
Соединения одного класса объединены в гомологические ряды.
Гомологический ряд — это ряд органических соединений с одина-
ковыми функциональными группами и однотипным строением,
каждый представитель гомологического ряда отличается от пре-
дыдущего на постоянную единицу (—СН2—), которую называют
гомологической разностью. Члены гомологического
ряда называются гомологами.
Н3СОН — метанол гомологический ряд
Н5С2ОН — этанол г одноатомных спиртов
Н-С.ОН — пропанол и т. д. J (алканолов) С Н- .ОН
f _1 J (• jLt г I 4-
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Химическая номенклатура — совокупность названий индиви-
дуальных химических веществ, их групп и классов, а также пра-
вила составления их названий.
8
Соблюдать соответствия между существующей классификацией
веществ и их наименованиями позволяют номенклатурные системы.
Номенклатура органических соединений складывалась на про-
тяжении всего периода возникновения и становления органиче-
ской химии как науки. Для названий органических соединений
применяют несколько номенклатурных систем: тривиальную, ра-
циональную, международную (ИЮПАК).
Тривиальная номенклатура. На первых этапах развития орга-
нической химии соединения назывались случайно. Это было свя-
зано с их нахождением в природе: щавелевая кислота, яблочная
кислота и другие, или с источником их получения: древесный
спирт, муравьиная кислота и др. Многие тривиальные названия
прочно укоренились и до сих пор широко применяются.
Рациональная номенклатура. В основе рациональной номенкла-
туры используется принцип деления органических соединений на
гомологические ряды. Вещества рассматриваются как производные
простейшего представителя данного ряда: для алканов — метана,
алкенов — этилена, алкинов — ацетилена и т. д., например:
НС=СН
ацетилен
метилацетилен
H3C-+C=CJ-CH3
диметил ацетилен
В настоящее время применение рациональной номенклатуры
ограничено. Основные ее принципы нашли свое отображение в ра-
дикало-функциональной номенклатуре.
Международная номенклатура (ИЮПАК). Первая попытка со-
здать номенклатурную систему, которая позволяла бы дать од-
нозначное название любому органическому соединению, была
предпринята химиками в 1892 году на международном конгрессе
в Женеве (женевская номенклатура). Правила современной но-
менклатуры были разработаны на XIX конгрессе Международно-
го союза теоретической и прикладной химии в 1957 году. Эти
правила известны под названием номенклатуры ИЮПАК.
Номенклатурные правила ИЮПАК предусматривают несколько
вариантов образования названий органических соединений. Наи-
более широко применяются заместительная и радикало-функци-
ональная номенклатуры.
Заместительная номенклатура. Согласно заместительной номен-
клатуре органические соединения рассматривают как производ-
ные углеводородов, в молекулах которых один или несколько ато-
мов водорода замещены на другие атомы или атомные группы.
1. Классификация и номенклатура органических соединений
9
Прежде чем перейти к рассмотрению заместительной номен-
клатуры, дадим определение основным понятиям: родоначальная
структура, радикал, заместитель.
Родоначальная структура — структурный фрагмент молекулы
(молекулярный остов), лежащий в основе названия соединения:
главная углеродная цепь атомов для ациклических соединений,
цикл — для карбо- и гетероциклических.
сн3
он;
/Ч^соон
\^гон
родоначальная структура
Родоначальное название может быть систематическим, триви-
альным или полусистематическим.
В органической химии для .^-гибридизированного углерода су-
ществуют такие понятия, как первичный, вторичный, третичный.
Атом углерода, связанный о-связью только с одним атомом
углерода, называется первичным, с двумя — вторичным, с тремя —
третичным.
Н3С—СН—СН—СН3
сн3
I Г I,
первичные атомы углерода
Радикал — остаток углеводорода, образующийся в результате
удаления одного или нескольких атомов водорода. Свободную
валентность в радикалах обозначают черточкой.
По количеству свободных валентностей различают одно-, двух-,
трехвалентные радикалы:
10
H3C—CH—CH —
одновалентный
радикал
н3с—сн—сн=
-СН — СН — сн —
двухвалентные
радикалы
Н3С—с=
трехвалентный
радикал
В зависимости от того, у какого атома углерода находится сво-
бодная валентность, различают первичные, вторичные и третич-
ные радикалы:
н3с—сн—сн2—сн2
сн3
первичный радикал
вторичный радикал
третичный радикал
Заместителем называют атомы или атомные группы, вклю-
чая углеродсодержащие функциональные группы: —СООН,
^О
—, JX=O, которые не входят в родоначальную структуру.
Н
Положение заместителей в молекуле указывают цифрами или
буквами, которые называют локантами. Для обозначения несколь-
ких одинаковых заместителей или кратных связей применяют мно-
жительные (умножающие) приставки: ди- (два), три- (три), тетра-
(четыре), пента- (пять) и т. д.
Составление названий проводят в определенном порядке:
1. Среди всех функциональных групп, имеющихся в соедине-
нии, выбирают старшую. Следующие группы перечисляют в по-
рядке уменьшения их старшинства:
—СООН, —SO3H, —COOR, —CONH?, —C^N,
X) .
—CZ , /С=О, —ОН, —SH, —NH,
н
В названии органического вещества старшая функциональная
группа обозначается в суффиксе, все остальные — в префиксе;
некоторые функциональные группы всегда находят свое отраже-
ние в префиксе:
1. Классификация и номенклатура органических соединений
11
F, — Cl, —Br, —I, —OR, —SR,
N
Их не рассматривают по старшинству.
2. Устанавливают родоначальную структуру. Если соединение
содержит кратные связи, то они должны войти в родоначальную
структуру.
3. Проводят нумерацию атомов родоначальной структуры та-
ким образом, чтобы старшая функциональная группа получила
по возможности меньший номер.
4. Составляют название соединения в целом: первым указыва-
ют в алфавитном порядке функциональные группы (кроме стар-
шей) и углеводородные радикалы в префиксе, затем — название
родоначальной структуры в корне и в конце названия — старшую
функциональную группу в суффиксе.
Степень насыщенности обозначается суффиксами: -ан — для
насыщенных, -ен — для двойной, -ин — для тройной связи.
Локанты, буквенные или цифровые, и множительные пристав-
ки располагают перед названием заместителей или кратных связей.
Пример составления названий:
3-амино-2,4-диметилпентановая кислота
сн3
1
сн,—с=сн—с—сн,—он
I I
Вг СН3
4-бром-2,2-диметил-3-пентен-1 -ол
Радикало-функциональная номенклатура. Согласно радикало-
функциональной номенклатуре в основе названий соединений
лежит название класса, к которому относится данное соединение;
перед названием класса перечисляются названия радикалов и за-
12
местителей в них, положения которых указывают буквами грече-
ского алфавита, например:
в У 0 а
н3с—сн—СН—СН2ОН
nh2
у-аминобутиловый спирт
н3с—о—сн3
диметиловый эфир
Н2С=СН—С1
винилхлорид,
хлористый винил
метил этилкетон
Буквой а обозначают ближайший к старшей функциональной
группе атом углерода.
В дальнейшем при изучении различных классов органических
соединений мы расширим приведенные краткие пояснения на мно-
гочисленных примерах.
ХИМИЧЕСКАЯ СВЯЗЬ.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ
В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Остановимся на одном из важнейших вопросов химии: как
осуществляется связь атомов в молекулах? Используя знания, по-
лученные в курсе неорганической химии, рассмотрим вопросы
природы химической связи между атомами, то есть типы хими-
ческой связи.
Современная теория химической связи базируется на кванто-
во-механических представлениях о строении молекулы. Впервые
электронную теорию химической связи предложили в 1916 году не-
мецкий ученый В. Коссель и американский ученый Дж. Н. Льюис.
Авторы электронной теории выдвинули идею о том, что химиче-
ская связь — результат взаимодействия внешних электронных обо-
лочек атомов. Образуя химическую связь, каждый атом стремится
заполнить внешнюю электронную оболочку до конфигурации,
присущей инертным газам. При этом атом принимает участие в об-
разовании общей электронной пары, отдает или принимает элек-
троны. Принцип заполнения валентных оболочек до конфигурации
инертных газов получил название октетное правило.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Согласно принятой в настоящее время классификации суще-
ствует несколько типов химической связи: ионная, ковалентная,
водородная, металлическая и др. По способу образования хими-
ческой связи различают две основные: ионную и ковалентную.
ИОННАЯ СВЯЗЬ
Ионная связь характерна для атомов, значительно отличающихся
по электроотрицательности. Ионный тип связи характерен для
неорганических соединений.
Рассмотрим, как осуществляется связь в натрии хлориде:
Na- + Cl: -------
» •
Na+Cf
ионная связь
Хлор по сравнению с натрием обладает большей электроотри-
цательностью, то есть большим сродством к электрону. Вслед-
ствие этого электрон переходит с внешней оболочки натрия на
внешнюю оболочку хлора, при этом образуются положительный
и отрицательный заряды, между которыми действуют силы элек-
тростатического притяжения. Ион натрия приобретает электрон-
ную конфигурацию неона, а ион хлора — конфигурацию аргона.
Соединения с ионной связью характеризуются относительно
большим дипольным моментом, хорошей электропроводимостью,
высокими температурами плавления.
КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь — основной тип связи в молекулах органи-
ческих соединений. Она возникает между атомами, имеющими
одинаковую или близкую по значению электроотрицательность.
Для образования ковалентной связи каждый из атомов предостав-
ляет по одному электрону, при этом образуется общая пара элек-
тронов, которая в равной степени принадлежит обоим атомам. На
письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молеку-
ла метана:
С + 4Н
*
Атом углерода содержит на внешнем электронном уровне че-
тыре валентных электрона, и, чтобы доукомплектовать этот слой
до октетной конфигурации, он образует четыре общие электрон-
ные пары с четырьмя атомами водорода.
В зависимости от электроотрицательности атомов, между ко-
торыми образовалась ковалентая связь, она может быть полярной
или неполярной.
Если электроотрицательность атомов одинакова, то общая
электронная пара находится на одинаковом расстоянии от ядра
каждого из атомов. Такая связь называется ковалентной неполярной'.
ковалентная неполярная связь
2. Химическая связь. Взаимное влияние атомов в органических соединениях 15
При возникновении ковалентной связи между атомами с раз-
личной электроотрицательностью общая электронная пара сме-
щается к более электроотрицательному атому. В этом случае об-
разуется ковалентная полярная связь.
ковалентная полярная связь
Стрелка в формуле указывает на полярность ковалентной свя-
зи. С помощью греческой буквы 8 («дельта») обозначают частич-
ные заряды на атомах: 8+ — пониженную, 8~ — повышенную элек-
тронную плотность.
По числу электронных пар, образующих ковалентную связь,
различают связи простые — с одной парой электронов и крат-
ные — с двумя или тремя парами.
кратная ковалентная связь
простая ковалентная связь
Основные характеристики ковалентной связи: длина связи (рас-
стояние между центрами атомов в молекуле); энергия связи (энер-
гия, которую необходимо затратить на разрыв связи); полярность
связи (неравномерное распределение электронной плотности между
атомами, образующими связь, обусловленное различной электро-
отрицательностью); поляризуемость (легкость, с которой смеща-
ется электронная плотность связи к одному из атомов под влия-
нием внешних факторов); направленность (ковалентная связь,
направленная вдоль линии, соединяющей центры атомов).
Донорно-акцепторная связь, или координационная,— разновид-
ность ковалентной связи, которая отличается способом образо-
вания.
Донор — атом, который имеет неподеленную пару электро-
нов, а акцептором может быть любой атом (в том числе и протон),
у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-
акцепторному механизму. Ковалентная связь образуется за счет
того, что атом азота (донор электронов) отдает неподеленную пару
электронов на образование ковалентной связи протону (акцепто-
ру электронов):
Н—N—Н + Н+---- Н—N—Н
I I
н н
Вновь образовавшаяся связь N—Н ничем не отличается от ос-
тальных N—Н-связей, которые имелись у аммиака. Такая связь
называется еще координационной.
Атомы некоторых элементов (кислорода, азота, серы, галоге-
нов и др.) расходуют не все внешние электроны при образовании
связи для формирования октетной оболочки. Такие оставшиеся
электроны называют неподеленными, необобществленными или
п-электронами.
•N: + ЗН
неподеленная пара
электронов
Семиполярная связь — частный случай донорно-акцепторной
связи. Она образуется между атомами, один из которых имеет
неподеденную пару электронов, а другой содержит на внешнем
энергетическом уровне шесть электронов (секстет), то есть имеет
вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле три-
метиламина оксида:
донор акцептор
н3сх
- Н3С—N—О=(СН;)..Х—О
н3сх
Неподеленная пара електронов атома азота помещается на ва-
кантную орбиталь атома кислорода; в результате образования связи
атом кислорода (акцептор) приобретает отрицательный заряд,
а атом азота (донор) — положительный. Такая связь называется
еще полуполярной, и ее обозначают следующим образом:
N-
или
О
Соединения с семиполярной связью не проводят электриче-
ский ток, несмотря на наличие наряду с ковалентной связью
и ионного взаимодействия.
2. Химическая связь. Взаимное влияние атомов в органических соединениях 17
ВОДОРОДНАЯ СВЯЗЬ
Водородная связь образуется в результате электростатического
взаимодействия между атомом водорода, несущим дробный поло-
жительный заряд, и неподеленной парой электронов другого ато-
ма. Обычно такие атомы водорода называют активными.
Водородную связь графически изображают тремя точками:
водородная связь
Водородная связь бывает внутримолекулярная и межмолеку-
лярная.
Примером соединений с внутримолекулярной водородной свя-
зью могут быть салициловый альдегид и о-хлорфенол.
салициловый альдегид о-хлорфенол
Межмолекулярные водородные связи (МВС) возникают между
двумя или большим числом молекул с образованием димеров или
ассоциатов:
димер акриловой кислоты
ассоциат этанола
Водородная связь тем сильнее, чем более электроотрицателен
элемент, с которым связан атом водорода. По сравнению с обыч-
ной ковалентной связью {Е = 340...360 кДж/моль) энергия водо-
родной связи невелика (10...40 кДж/моль), но наличие этого вида
связи существенно отражается на физико-химических свойствах
веществ. За счет межмолекулярной водородной связи повышается
температура плавления «-нитрофенола (114 °C) по сравнению
с о-нитрофенолом (45 °C). Этиловый спирт, который представля-
ет собой ассоциат, имеет температуру кипения значительно выше
(78 °C), чем у неспособного образовывать водородную связь ди-
метилевого эфира (-24 °C).
СТРОЕНИЕ АТОМА, АТОМНЫЕ ОРБИТАЛИ
Как уже отмечалось, современная теория химической связи
основана на квантово-механическом рассмотрении молекулы как
системы из электронов и атомных ядер.
Из курсов неорганической химии и физики известно, что элек-
троны представляют собой вид материи, обладающий одновре-
менно свойствами частицы и электромагнитной волны.
Согласно квантовой теории состояние электронов в атоме опи-
сывается с помощью четырех квантовых чисел: п — главное кван-
товое число, I — азимутальное квантовое число, т — магнитное
квантовое число и $ — спиновое квантовое число.
Электрон в атоме находится на определенной атомной орби-
тали. Атомная орбиталь (АО) — это область пространства, внутри
которой наиболее вероятно нахождение электрона.
Состояние электрона определяется расстоянием электронного
облака от ядра, его формой, ориентацией в пространстве и вра-
щением электрона вокруг собственной оси.
В зависимости от расстояния электрона от ядра атома изменя-
ется траектория его движения, то есть форма атомной орбитали
(рис. 2.1). Существуют s,p, d, f-атомные орбитали, которые отли-
чаются друг от друга запасом энергии, а следовательно, и формой
электронного облака, то есть траекторией движения электрона.
s-орбиталь
р-орбиталь
«/-орбиталь
Рис. 2.1. Геометрическая форма 5-, р- и J-атомных орбиталей
Для атомных орбиталей 5-типа характерна сферическая сим-
метрия, для электронов p-типа существуют три одинаковые по
энергии гантелеобразной формы орбитали, которые отличаются
2. Химическая связь. Взаимное влияние атомов в органических соединениях 19
друг от друга лишь ориентацией в пространстве: рх, р, ^.-атомные
орбитали. В каждой из них существует узловая область ^-орбита-
ли, где вероятность нахождения электрона равна нулю. Для
d-атомных орбиталей существуют пять более сложных геометри-
ческих форм.
Электроны s-орбитали ближе находятся к атомному ядру
и с большей силой притягиваются к нему, чем у?-электроны, ко-
торые более удалены и имеют большую подвижность. Энергия
электрона падает в следующем ряду:
/> d>р>s
Атомная орбиталь, не занятая электронами, называется в а-
кантной и условно обозначается как □.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Согласно квантово-механическим представлениям о химиче-
ской связи число образуемых атомом ковалентных связей опреде-
ляется количеством одноэлектронных атомных орбиталей, то есть
количеством неспаренных электронов. Однако в действительности
атомы элементов образуют большее число ковалентных связей, чем
содержат неспаренных электронов на внешнем энергетическом
уровне. Например, атом углерода в основном (не^возбужденном)
состоянии имеет два неспаренных электрона (1г 2s 2р ), а образует
четыре ковалентные связи. Это можно объяснить возможностью
основное состояние углерода возбужденное состояние углерода
Таким образом, на внешнем энергетическом уровне атома
углерода находятся четыре неспаренных электрона: один — 5
и три — р. Поскольку химические связи образуются валентными
электронами, то связи, например в молекуле метана СН4, должны
были бы быть неравноценными: одна связь С—Н образована
5-электроном, а три остальные — р. В действительности в молеку-
ле метана все связи совершенно равноценны. Для объяснения этого
факта в квантовой механике вводится понятие о гибридизации
атомных орбиталей. Слово гибридизация означает взаимодействие,
20
перекрывание, перемешивание. При перекрывании одного 5-элек-
тронного облака с тремя р-электронными облаками образуются
четыре качественно новых гибридизированных электронных об-
лака или атомные орбитали:
15 + Зр = 4sp\
Таким образом, из нескольких различных по форме и близких
по энергии АО путем комбинирования (смешивания, сочетания)
образуется такое же количество одинаковых по форме и равных
по энергии гибридизированных атомных орбиталей:
Гибридизированные орбитали по сравнению с негибридизи-
рованными более выгодны геометрически, так как позволяют уве-
личить площадь перекрывания с орбиталями других атомов, что
ведет к образованию более прочных связей. Результатом перекры-
вания большей доли гибридной орбитали с орбиталями других
атомов является ковалентная связь.
Атом углерода может претерпевать три вида гибридизации
с участием s- и р-орбиталей, каждому из которых соответствует
определенное валентное состояние атома.
Первое валентное состояние углерода (sp3-гибридизация). Обра-
зование о-связи. Состояние sp3-гибридизации —- результат взаи-
модействия одной s- и трех /7-атомных орбиталей (рис. 2.2).
2 s-орбиталь
2рл-орбиталь
2рх-орбиталь
2ри-орбиталь
четыре sp-гибридные орбитали
Рис. 2.2. Схема образования
и расположение в пространстве
гибридных sp3-орбиталей
2. Химическая связь. Взаимное влияние атомов в органических соединениях 21
Четыре равноценные орбитали между собой образуют угол
109° 28' и ориентированы в пространстве от центра правильного
тетраэдра к его вершинам. Такое размещение связано со стремле-
нием АО к максимальному удалению друг от друга за счет взаим-
ного электростатического отталкивания. Расположение атомных
орбиталей определяет название состояния sp3-гибридизации как
тетраэдрическое.
Доля 5-облака в каждой из четырех гибридных sp -орбиталей
равна 1/4. В результате перекрывания таких орбиталей с другими ор-
биталями (5, р, дм гибридными sp3, sp2, sp) вдоль линии, соединя-
ющей центры атомов, образуются только простые ковалентные, или
о-связи (греч. «сигма»). Перекрывание атомных орбиталей вдоль ли-
нии, соединяющей центры атомов, называюто-п ерекрывани-
е м, или осевым, так как максимальная электронная плотность
при этом находится на оси, соединяющей два ядра (рис. 2.3).
этан
Н Н
Н—С— С— Н
1° г
н н
а-перекрывание
Рис. 2.3. Образование о-связей в молекуле этана
Состояние sp3- гибридизации характерно для алканов. Рассмот-
рим образование о-связей на примере этана.
В молекуле этана в результате осевого 5—sp -перекрывания обра-
зуются шесть о-связей С—Н, а за счет перекрывания sp—sp -
орбиталей — одна С—С-связь.
о-Связи во многих органических соединениях образуются пре-
имущественно за счет перекрывания гибридизированных орби-
талей.
Второе валентное состояние углерода (sp -гибридизация).
Образование л-связи. Состояние sp2- гибридизации — результат вза-
имодействия одной 5- и двух р-орбиталей (рис. 2.4).
Образованные три эквивалентные sp -гибридные орбитали на-
ходятся в одной плоскости под углом 120°, поэтому sp -гибриди-
зация называется тригональной. Негибридизированная р -орбиталь
22
25-орбиталь 2рх-орбиталь 2р^-орбиталь три sp -гибридные
орбитали
три $р2-гибридные орбитали Рис. 2.4. Строение атома углерода
в sp2-гибридизации
и pz-орбиталь
расположена в плоскости, которая перпендикулярна плоскости
расположения гибридных орбиталей. Условно доля 5-облака в каж-
дой из трех sp2-гибридных орбиталей равна '/3. Такая гибридиза-
ция характерна для соединений с двойными связями, например
для этилена (рис. 2.5).
о-перекрывание (о-связь)
Рис. 2.5. Образование л-связи в молекуле этилена
Атомы углерода в молекуле этилена находятся в sp-гибридиза-
ции. За счет перекрывания трех гибридных АО каждого из атомов
образуются о-связи (четыре С—Н и одна С—С); а перекрывание
двух негибридизированных р-орбиталей в плоскости, перпендику-
лярной плоскости a-связи (л-перекрывание), приводит к образо-
ванию я-св язи. Ее максимальная электронная плотность сконцен-
трирована в двух областях — выше и ниже оси, соединяющей
центры атомов, л-Связь менее прочна, чем о; она образуется только
между атомами, которые находятся в sp2- или sp-гибридизации.
2. Химическая связь. Взаимное влияние атомов в органических соединениях 23
Третье валентное состояние (^-гибридизация). Состояние
5р-гибридизации — результат взаимодействия одной s- и одной
р-орбиталей (рис. 2.6).
2з-орбиталь
2рх-орбиталь
две sp-гибридные орбитали
две зр-гибридные и , р^-орбитали
б
Рис. 2.6. Строение атома углерода
в sp-гибридизации:
а — схема образования гибридных sp-орбита-
лей; б — взаимное размещение орбиталей
при .^-гибридизации
sp-Гибридизацию называют еще линейной потому, что две
лр-гибридные орбитали расположены под углом 180°. Остальные две
негибридизированные р - и рг-орбитали находятся в двух взаимно
перпендикулярных плоскостях и расположены под прямым углом
к sp-гибридным АО. Доля 5-облака в каждой из двух гибридных
лр-орбиталей равна 1/2. Такой тип гибридизации характерен для со-
единений с тройной связью, например для ацетилена (рис. 2.7).
В молекуле ацетилена sp-гибридизированные атомы образуют
две простые ст-связи С—Н и одну о-связь между двумя атомами
углерода, а негибридизированные p-АО образуют две л-связи, рас-
положенные во взаимно перпендикулярных плоскостях.
Для описания химической связи с позиций квантовой меха-
ники пользуются двумя основными методами: методом валент-
ных связей (МВС) и методом молекулярных орбиталей (МО).
Метод валентных связей был предложен в 1927 году В. Гайтле-
ром и Ф. Лондоном. Основные положения метода заключаются
в следующем. Химическая связь представлена в виде пары элект-
ронов с противоположными спинами. Она образуется в результа-
те перекрывания атомных орбиталей.
24
тс-перекрывание (л-связь)
ст-перекрывание (сг-связь)
Рис. 2.7. Образование л-связи в молекуле ацетилена
При образовании молекулы атомные орбитали остаются без
изменений, а пара связывающих электронов локализована между
двумя атомами.
В отличие от метода валентных связей метод молекулярных
орбиталей рассматривает молекулу не как совокупность атомов,
сохраняющих свою индивидуальность, а как единое целое. Пред-
полагается, что каждый электрон в молекуле движется в суммар-
ном поле, создаваемом остальными электронами и всеми ядрами
атомов. Иначе говоря, в молекуле различные АО взаимодейству-
ют между собой с образованием нового типа орбиталей, называе-
мых молекулярными орбиталями.
Перекрывание двух атомных орбиталей приводит к образова-
нию двух молекулярных орбиталей (рис. 2.8).
Одна из них имеет более низкую энергию, чем исходные АО,
и называется связывающей орбиталью, другая обладает более вы-
2. Химическая связь. Взаимное влияние атомов в органических соединениях 25
со кой энергией, чем образующая ее АО, и называется разрыхляю-
щей, или антисвязывающей орбиталью. Заполнение молекулярных
орбиталей электронами происходит аналогично заполнению атом-
ных, то есть по принципу Паули и в соответствии с правилом
Гунда. Молекулярная разрыхляющая орбиталь в основном состо-
янии остается вакантной. Ее заполнение электронами происхо-
дит при возбуждении молекулы, что ведет к разрыхлению связи
и распаду молекулы на атомы.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ
В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Согласно современным представлениям, природа и механизм
взаимного влияния атомов определяются характером распределе-
ния электронной плотности в молекуле и поляризуемостью кова-
лентных связей.
Электронные смещения в органических соединениях подраз-
деляют на два вида: индуктивный эффект — смещение электрон-
ной плотности по цепи о-связей и мезомерный эффект — смеще-
ние по системе л-связей.
Индуктивный эффект. Рассматривая типы химических связей,
мы отмечали, что между атомами с одинаковой электроотрица-
тельностью пара электронов связи в равной мере принадлежит
обоим атомам (ковалентная неполярная связь). Например, связи
в молекулах метана, бутана —• неполярные, электронная плотность
в них распределена симметрично, и молекула не имеет дипольно-
го момента. Если же в молекуле бутана один атом водорода заме-
стить на галоген — хлор, то электронная плотность связи С—С1
смещается к более электроотрицательному атому хлора (ковалент-
ная полярная связь):
S'"4 5"+ 8'+ 8" 3"
4 3 2 1 0
Н.С-СН,—СН~ СН. Н.С—СН—СН—СН,—С1
J J «5 Л* Ar
я-бутан, р = 0
1-хлорбутан, р* 0
Пара электронов о-связи С—С1 принадлежит как углероду,
так и хлору, но несколько смещена к хлору, поэтому хлор приоб-
ретает частично отрицательный заряд <У, а атом углерода связи —
равный по величине частично положительный заряд 5+.
Уменьшение электронной плотности на С приводит к тому,
что последний, проявляя акцепторные свойства, смещает на себя
26
электроны 8-связи от соседнего атома углерода. Происходит по-
ляризация связи С3—С1, и частичный положительный заряд воз-
никает также на С2, что в свою очередь ведет к поляризации связи
С2—С3 и возникновению частичного положительного заряда на
С3, и т. д. При этом дробный положительный заряд на атомах
углерода в цепи от С1 до С4 уменьшается: 8+ > 8,+ > 8"+ > 5",+.
Поляризация одной связи углерод-галоген вызывает поляри-
зацию молекулы в целом и, следовательно, появление дипольно-
го момента.
Индуктивный (индукционный) эффект — передача электронно-
го влияния заместителя вдоль цепи о-связей, которая возникает
в силу различной электроотрицательности атомов.
Индуктивный эффект обозначается буквой /, а смещение
электронной плотности изображают с помощью стрелки вдоль
простой о-связи, острие которой указывает на направление сме-
щения.
По направлению электронного влияния заместителей раз-
личают положительный +Z и отрицательный -I индуктивный
эффекты.
Отрицательный индуктивный эффект проявляют заместители,
притягивающие электроны о-связи, например: —NO2,—C=N,
—СООН, —Hal, —ОН.
Отрицательный индуктивный эффект, как правило, увеличива-
ется с ростом электроотрицательности атомов. Он сильнее выра-
жен для заместителя с тройной связью, так как в его составе нахо-
дится более электроотрицательный 5/7-гибридизированный атом
углерода. В свою очередь атом углерода в .ур-гибридизации, как
менее электроотрицательный, в составе заместителя проявляет
+/по отношению к атомам углерода в sp- и sp2-гибридизации:
Положительный индуктивный эффект проявляют заместители,
отталкивающие от себя электроны о-связи, чаще всего это ал-
кильные группы (Aik). Электронодонорные свойства у алкильных
заместителей возрастают с ростом длины углеводородной цепи
(—С4Н9 > —СН3) и увеличиваются при переходе от первичных
к третичным радикалам ((СН3)3С— > (СН3)2СН— > СН3СН2— >
> СН3—). Последнее объясняется тем, что индуктивный эффект
затухает по цепи.
2. Химическая связь. Взаимное влияние атомов в органических соединениях 27
Суммируя вышеизложенное, кратко остановимся на основных
свойствах индуктивного эффекта:
1. Индуктивный эффект проявляется лишь при наличии в мо-
лекуле атомов с различной электроотрицательностью.
2. Индуктивный эффект распространяется только через о-свя-
зи и в одном направлении.
3. Индуктивный эффект быстро затухает по цепи. Максимум
его действия — четыре о-связи.
4. Индуктивное смещение определяется наличием дипольного
момента: ц ф 0.
Мезомерный эффект (эффект сопряжения). Прежде чем рассмат-
ривать передачу электронного влияния заместителей по системе
л-связей, определим понятия сопряженная система и сопряжение.
Сопряженной называется система, в которой имеет место чере-
дование простых и кратных связей, или система, в которой при ато-
ме углерода с кратной связью находится атом, имеющий вакантную
орбиталь или неподеленную пару электронов. Сопряженные сис-
темы бывают с открытой и замкнутой цепью сопряжения:
бутадиен-1
сн=сн—сн,+
СН=СН—С1
хлорэтен
нафталин
аллильный катион
Сопряженные системы называются еще конъюгированными,
а цепи сопряжения — цепями конъюгации (от лат. перекрывание,
наложение). В них имеет место сопряжение — дополнительное пе-
рекрывание л- и p-АО, имеющих параллельные оси симметрии
(компланарные). За счет сопряжения происходит перераспределе-
ние (делокализация) л-электронной плотности и образование еди-
ной л-электронной системы.
В зависимости от вида перекрываемых орбиталей различают
несколько видов сопряжения’. л,л-сопряжение (перекрывание двух
л-орбиталей), р,л-сопряжение (перекрывание р- и л-орбиталей)
(рис. 2.9).
Сопряжение — энергетически выгодный процесс, протекаю-
щий с выделением энергии. Сопряженные системы характеризу-
ются повышенной термодинамической устойчивостью.
28
лдг-сопряжение делокализованная
вакантная р-орбиталь
Рис. 2.9. Сопряженные системы бутадиена-1,3, винилхлорида
и аллильного катиона
Дав определение сопряжению и сопряженным системам, рас-
смотрим электронные эффекты, которые наблюдаются при вве-
дении в такие системы различного рода заместителей.
Эффект сопряжения, или мезомерный эффект (М), — процесс
передачи электронного влияния заместителя по сопряженной сис-
теме л-связей. Смещение электронной плотности в сопряженных
системах возможно лишь при включении в систему электронодо-
норных или электроноакцепторных заместителей.
Например, в молекуле бензола имеется сопряжение, но нет
заместителей, поэтому мезомерный эффект отсутствует. В мо-
лекуле фенола гидроксигруппа входит в сопряженную систему,
и в такой системе имеет место мезомерный эффект. В молекуле
бензилового спирта —ОН-группа изолирована от сопряженной
системы группой —СН2, поэтому со стороны —ОН-группы мезо-
мерный эффект проявляться не будет.
2. Химическая связь. Взаимное влияние атомов в органических соединениях 29
бензол
фенол
он
бензиловый спирт
Мезомерный эффект обозначают буквой М, а смещение элек-
тронной плотности в сопряженной системе — изогнутой стрел-
кой. По направляющему действию заместителя мезомерный
эффект делится на положительный (+Л/) и отрицательный (-М).
Положительный мезомерный эффект (+М) проявляют атомы
и атомные группы, имеющие неподеленные пары электронов или
отрицательный заряд (доноры электронов):
,СН3
—О’; —; —NHCH3; — NH2; —б-СН3;
СН3
* * «4 • « * •
—ОН; —F; —С1; —Вг
Максимальный +М у атомов с отрицательным зарядом. Заме-
стители, содержащие неподеленные пары электронов, имеют тем
больше +М, чем меньше в пределах периода электроотрицатель-
ность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект (-М) проявляют замести-
тели, смещающие на себя электронную плотность сопряженной
системы:
6r2;
Максимальный —М проявляют заместители, несущие поло-
жительный заряд.
Рассмотрим несколько примеров проявления мезомерного эф-
фекта со стороны заместителей:
фенол
+М
хлорэтен
30
бензальдегид
акролеин,
пропеналь
и-аминобензолсульфоки слота
Мезомерный эффект по сравнению с индуктивным вызывает
более сильное смещение электронной плотности и практически
не затухает по цепи.
Совместное проявление индуктивного и мезомерного эффектов
заместителя. Мезомерный и индуктивный эффекты одного замес-
тителя могут совпадать или не совпадать по направлению. На-
X)
пример, в молекуле акролеина альдегидная группа —про-
Н
являет — I и —М, а гидроксильная группа в молекуле фенола
обладает —но +М-эффектом.
-A +М
фенол
акролеин
Как видно из приведенного примера, в молекуле фенола про-
тивоположное электронное смещение приводит к тому, что эти
два эффекта как бы «гасят» друг друга. А в молекуле акролеина
индуктивный и мезомерный эффекты усиливают друг друга. Ме-
зомерный эффект заместителя обычно больше, чем индуктивный,
так как л-связи поляризуются легче, чем о-связи.
Поляризация, обусловленная мезомерным эффектом, имеет
альтернирующий характер: под
влиянием заместителя смещаются
не только л-электронные облака,
—+М нои облака о-связей. Это явление
наблюдается в системах с откры-
той и замкнутой цепью сопряже-
анилин
ния:
2. Химическая связь. Взаимное влияние атомов в органических соединениях 31
Хотя аминогруппа проявляет -7-эффект, вызывает понижение
электронной плотности на всех атомах углерода ароматического
цикла, но за счет +Л/-эффекта, который больше —7, наблюдается
повышение электронной плотности в целом в бензольном коль-
це, особенно в положениях 2, 4, 6. Таким образом в сопряженной
системе возникает альтернирующий (чередующийся) заряд.
В молекулах с открытой цепью сопряжения максимальные за-
ряды сосредоточены по концам сопряженной системы:
акрилонитрил
Эффект сверхсопряжения (гиперконъюгация). Наряду с тг,тг-
и р,%-сопряжением имеет место особый вид сопряжения —
о,л-сопряжение (гиперконъюгация, или сверхсопряжение).
Эффект сверхсопряжения — взаимодействие, которое возникает
при перекрывании электронных облаков о-орбиталей связей С—Н
с тг-орбиталями кратной связи. Такой вид перекрывания элект-
ронных облаков представляет собой о,л-сопряжение (рис. 2.10).
Смещение электронов о-связей при этом изображают с помощью
изогнутой стрелки. Любая из о-связей метильной группы пропе-
на может участвовать в о,тг-сопряжении.
о, л-соп ряжение
Рис. 2.10. Схема перекрывания сг-орбиталей связи С—Н
с я-орбиталью кратной связи в молекуле пропена
Величина эффекта гиперконъюгации тем выше, чем больше
атомов водорода при углероде, связанном с ненасыщенной сис-
темой. Понятие о сверхсопряжении объясняет повышенную
реакционную способность, подвижность сх-водородных атомов
в молекулах альдегидов, кетонов, кислот и их производных.
Иногда сверхсопряжение называют по имени открывших его
ученых эффектом Натана—Беккера.
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛ
Термин изомерия (от греч. isos — одинаковый, meros — часть)
впервые был введен в 1830 году, когда стали известны вещества,
имеющие одинаковый качественный и количественный состав,
но обладающие различными физическими и химическими свой-
ствами.
Изомерия — это явление, заключающееся в существовании
соединений, имеющих одинаковую молекулярную формулу, но раз-
личающихся порядком связывания атомов в молекуле или распо-
ложением атомов в пространстве и вследствие этого различающихся
по физическим и химическим свойствам.
Такие соединения называются изомерами. Различают два основ-
ных вида изомерии — структурную (изомерия строения) и про-
странственную (стереоизомерия).
3. Изомерия органических соединений. Пространственное строение молекул 33
СТРУКТУРНАЯ ИЗОМЕРИЯ
Структурные изомеры — это соединения, имеющие одина-
ковую молекулярную формулу, но отличающиеся друг от друга
порядком связывания атомов в молекуле.
Структурная изомерия подразделяется на изомерию углерод-
ной цепи, изомерию положения и изомерию функциональных
групп.
Изомерия углеродной цепи обусловлена различной последова-
тельностью связывания атомов, образующих углеродный скелет
молекулы. Например, для алкана состава С4Н10 можно написать
два изомера:
С<Н10
сн—сн2—сн—сн3
сн—сн—сн3
//-бутан
сн3
изобутан
Для органических соединений циклического строения изоме-
рия цепи вызвана величиной цикла.
С6Н12
циклогексан
м етил ни кл опентан
Изомерия положения обусловлена разным положением функ-
циональных групп, заместителей или кратных связей в молекуле.
С4Н10О СН — СН— СН— СН— он
сн3
он
сн3
бутанол-?
бутанол-1
н2с=сн—СН— сн3
бутен-1
сн—сн=сн—сн3
бутен-2
Изомерия функциональных групп обусловлена присутствием
в изомерах одинакового состава различных по природе функ-
циональных групп.
С2Н6О СН3— СН2— ОН СН—О—СН3
этанол
диметиловый эфир
34
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
(СТЕРЕОИЗОМЕРИЯ)
Пространственные изомеры — это соединения, имеющие оди-
наковую молекулярную формулу, одинаковый порядок связыва-
ния атомов углерода в молекулах, но отличающиеся друг от друга
расположением атомов в пространстве.
Пространственные изомеры называют также стереоизомерами
(от греч. stereos — пространственный).
Пространственная изомерия подразделяется на конфигураци-
онную и конформационную.
Но прежде чем перейти к рассмотрению этих видов стерео-
изомерии, остановимся на способах изображения пространствен-
ного строения молекул органических соединений.
Для изображения пространственного строения молекул, их
конфигураций или конформаций на плоскости применяют спе-
циальные стереохимические формулы.
Для наглядного представления молекул как органических, так
и неорганических соединений используют молекулярные модели,
которые дают возможность судить о порядке связывания и взаим-
ном расположении атомов в молекуле.
Наиболее часто используют три основных типа моделей: ша-
ростержневые (модели Кекуле—Вант-Гоффа), скелетные (модели
Драйдинга) и полусферические (модели Стюарта—Бриглеба).
Модели позволяют судить не только о взаимном расположе-
нии атомов в молекуле; они также удобны для рассмотрения ва-
лентных углов и возможности вращения вокруг простых связей.
Модели Драйдинга учитывают межатомные расстояния, а модели
Стюарта—Бриглеба отражают также и размеры атомов.
Ниже, на рис. 3.1, приведены модели молекул этана и этилена.
СН—СН3 СН2=СН2
этан этилен
Стереохимические формулы. Для изображения пространствен-
ного строения молекулы на плоскости чаще всего используют сте-
реохимические и перспективные формулы, а также проекцион-
ные формулы Ньюмена.
В стереохимических формулах химические связи, располо-
женные в плоскости чертежа, изображают обычной чертой; связи,
находящиеся над плоскостью,— жирным клином или жирной
3. Изомерия органических соединений. Пространственное строение молекул 35
а б
в
Рис. 3.1. Модели молекул
этана (слева) и этилена (справа):
а — шаростержневые; б — Драйдинга;
в — полусферические (Стюарта — Бриглеба)
чертой, а расположенные под плоскостью — штриховым клином
или пунктирной линией:
этан
Перспективные формулы описывают пространственное строе-
ние на плоскости с учетом рассмотрения молекулы вдоль одной
из углерод-углеродных связей. По внешнему виду они напомина-
ют лесопильные козлы:
СН3
н-бутан
этан
36
При построении проекционных формул Ньюмена молекулу рас-
сматривают в направлении одной С—С-связи таким образом, что-
бы атомы, образующие данную связь, заслоняли друг друга. Из
выбранной пары ближний к наблюдателю атом углерода изобра-
жают точкой, а дальний — окружностью. Химические связи ближ-
него атома углерода с другими атомами представляют линиями,
берущими начало от точки в центре круга, а дальнего — от окруж-
ности:
—СН—СН—СН
сн
я-бутан
Проекционные формулы Фишера представляют собой как бы
проекцию молекулы на плоскости.
Рассмотрим построение проекционной формулы Фишера для
бутанола-2 СН3—СН(ОН)—СН2—СН3. Для этого модель моле-
кулы располагают таким образом, чтобы атом углерода, связан-
ный с гидроксильной группой, находился в плоскости чертежа,
а заместители, расположенные горизонтально, были над плоско-
стью, расположенные вертикально — за плоскостью чертежа. При
проецировании такой модели на плоскость получают проекцион-
ную формулу Фишера, в которой связи, находящиеся над плоско-
стью, изображают горизонтальной линией, а связи, находящиеся
за плоскостью,— вертикальной линией. В точке пересечения этих
линий находится атом углерода, который обычно не обозначается
символом:
сн
сн
проекция Фишера
СН3—СН—СН—СН
он
бутанол-2
3. Изомерия органических соединений. Пространственное строение молекул 37
КОНФИГУРАЦИОННАЯ ИЗОМЕРИЯ
К конфигурационной относится оптическая и геометрическая
изомерия.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
В 1815 году Ж. Био открыл существование оптической ак-
тивности для органических соединений. Было установлено,
что некоторые органические соединения имеют способность вра-
щать плоскость поляризации поляризованного света. Вещества,
которые обладают такой способностью, называются оптически
активными.
Если луч обычного света, в котором, как известно, электро-
магнитные колебания распространяются в разных плоскостях, про-
пустить через призму Николя*, то выходящий свет будет плоско-
поляризованным. В таком луче электромагнитные колебания
совершаются только в одной плоскости. Эту плоскость называют
плоскостью поляризации (рис. 3.2).
Рис. 3.2. Схема образования поляризованного света и вращения
плоскости поляризации оптически активным веществом:
1 — обычный свет; 2 — призма Николя; 3 — плоскость поляризации;
4 — поляризованный свет; 5 — оптически активное вещество
При прохождении поляризованного луча света через оптиче-
ски активное вещество плоскость поляризации отклоняется на оп-
ределенный угол а вправо или влево. Если вещество отклоняет
плоскость поляризации вправо (при наблюдении навстречу лучу),
его называют правовращающим, если влево,— левовращающим.
Правое вращение обозначают знаком (+), левое — знаком (—).
Оптическую активность измеряют с помощью приборов, на-
зываемых поляриметрами.
* Призма Николя — призма, изготовленная из двух кристаллов исландского
шпата (СаСО5), склеенных канадским бальзамом.
Явление оптической активности распространено среди орга-
нических соединений, особенно среди природных (гидрокси-
и аминокислот, белков, углеводов, алкалоидов).
Оптическая активность большинства органических соедине-
ний обусловлена их строением.
Одной из причин возникновения оптической активности орга-
нических молекул является наличие в их структуре 5/7-гибриди-
зированного атома углерода, связанного с четырьмя разными за-
местителями. Такой атом углерода называется хиральным, или
асимметрическим. Часто для него применяют более общее назва-
ние — хиральный центр. В структурных формулах асимметриче-
ский атом углерода принято обозначать звездочкой — С*:
Н
сн3—с~сн2—сн3
Cl
с—соон
он
2-хлорбуган
молочная кислота
Соединения, содержащие один асимметрический атом угле-
рода, существуют в виде двух стереоизомеров, относящихся друг
к другу как предмет к своему зеркальному отображению. Такие
изомеры называются энантиомерами.
Рис. 3.3. Модели энантиомерных молекул бромйодхлорметана
Для изображения пространственного строения оптических изо-
меров на плоскости могут быть использованы стереохимические
формулы. Например, энантиомеры бутанола-2, изображенные
с помощью стереохимических формул, имеют следующий вид:
СН3
3. Изомерия органических соединений. Пространственное строение молекул 39
Однако стереохимические формулы не всегда удобны для изоб-
ражения стереоизомеров. Поэтому чаще всего оптические изоме-
ры изображают на плоскости с помощью проекционных формул
Фишера. Например, так выглядят энантиомеры 2-бромбутана,
изображаемые с помощью проекции Фишера.
Вг
СН3
Вг-------Н
С2Н5
Энантиомеры очень похожи друг на друга, но, тем не менее,
не тождественны. Они имеют одинаковый состав и последова-
тельность связывания атомов в молекуле, но отличаются друг от
друга относительным расположением их в пространстве, то есть
конфигурацией. В том, что эти молекулы разные, легко убедиться
при попытке наложения их моделей друг на друга.
Свойство молекул не совмещаться со своим зеркальным изоб-
ражением называется хиральностью (от греч. cheir— рука),
а молекулы называют хиральными. Наглядным примером могул
служить левая и правая руки, которые являются зеркальным отра-
жением друг друга, но вместе с тем их нельзя совместить. Моле-
кулы, которые совместимы со своим зеркальным изображением,
называют ахиральными.
Хиральность молекул является обязательным условием для про-
явления веществом оптической активности.
Как установить: является ли молекула хиральной? Хиральность
молекулы можно легко обнаружить путем построения модели мо-
лекулы и модели ее зеркального изображения с последующим их
совмещением. Если модели не совмещаются — молекула хиралъ-
на, если совмещаются — ахиральна. Такой же вывод можно сде-
лать и на основе стереохимических формул молекул по наличию
или отсутствию элементов симметрии, так как причиной опти-
ческой активности органических соединений является их асим-
метрическое строение. Поскольку молекула представляет собой
трехмерное образование, ее строение можно рассматривать е точ-
ки зрения симметрии геометрических фигур. Основными элемен-
тами симметрии являются плоскость, центр и ось симметрии. Если
в молекуле отсутствует плоскость симметрии, то такая молекула
хиральна.
Энантиомеры обладают одинаковыми физическими и хими-
ческими свойствами (температурой кипения, температурой плав-
40
ления, растворимостью, электропроводностью и др.), вращают
плоскость поляризации поляризованного луча на один и тот же
по величине угол, но отличаются знаком вращения, один вращает
плоскость поляризации поляризованного луча влево, другой —
вправо; они с различной скоростью реагируют с другими хираль-
ными соединениями, а также имеется различие в физиологиче-
ском действии. Например, лекарственный препарат левомицин —
антибиотик широкого спектра действия. Если его эффективность
принять за 100, то правовращающая форма составит только 2 %
от эффективности левовращающей формы.
Значение величины угла поворота плоскости поляризации по-
ляризованного света зависит от природы вещества, толщины слоя,
через которую проходит поляризованный свет, и длины волны.
Для растворов угол а зависит также от природы растворителя и кон-
центрации оптически активного вещества. В меньшей степени
оптическое вращение зависит от температуры.
Для сравнительной оценки оптической активности различных
соединений используют значение удельного вращения [а]. Удель-
ное вращение является константой оптически активного веще-
ства. Оно характеризует оптическую активность раствора с кон-
центрацией оптически активного вещества 1 г/мл при толщине
слоя 1 дм.
Удельное вращение вычисляют по одной из приведенных
формул:
а -100
для веществ в растворе
для жидких веществ
а
где а— измеренный угол вращения, град.;
I — толщина слоя, дм;
с — концентрация оптически активного вещества, г/100 мл
раствора;
р — плотность жидкого вещества.
Если молекула имеет один асимметрический атом, то она су-
ществует в виде двух изомеров, если же молекула имеет несколь-
ко асимметрических атомов углерода, то число возможных изоме-
ров увеличивается. Число оптических изомеров определяют по
формуле:
3. Изомерия органических соединений. Пространственное строение молекул 41
N= 2п,
где N— количество изомеров;
п — число асимметрических атомов углерода.
Так, при наличии в молекуле двух асимметрических атомов
углерода число изомеров равно 22 = 4, трех — 2 =8, четырех —
24 = 16 и т. д.
Например, бромяблочная кислота, содержащая два асиммет-
рических атома углерода, существует в виде четырех стереоизоме-
ров (I-IV).
*СНОН
*СНВг
СООН
СООН
н—он
Н----Вг
СООН
I.
СООН
но----н
Вг---Н
СООН
II.
СООН СООН
н—он но—-н
Вг---Н Н-------Вг
СООН СООН
III. IV.
Стереомеры I и II, а также III и IV относятся друг к другу как
предмет и его зеркальное изображение и являются энантио-
мерами.
Стереоизомеры I и III, I и IV, а также II и III, II и IV не
являются зеркальными отображениями друг друга, они отличают-
ся конфигурацией при одном из асимметрических атомов углеро-
да. Такие стереоизомеры называют диастереомерами. В отличие
от энантиомеров диастереомеры имеют различные физические
и химические свойства.
Для соединений, содержащих два хиральных атома углерода,
связанных с одинаковыми заместителями, общее число стереоизо-
меров уменьшается до трех. Например, винная кислота должна су-
ществовать в виде четырех стереоизомеров (2 = 4), а известно лишь
три. Это обусловлено появлением у одного из стереоизомеров
такого элемента, как плоскость симметрии.
СООН
*снон
*соон
I
СООН
СООН
н----он
но----н
СООН
I.
СООН
но----н
н----он
СООН
II.
СООН
он
н---он
СООН
III.
плоскость
симметрии
42
Стереомеры I и II являются энантиомерами. Стереоизомер III
(жезо-форма) является оптически неактивным. Молекула мезовин-
ной кислоты ахиральна. Каждый энантиомер винной кислоты по
отношению к жсзо-форме является диастереомером.
Номенклатура оптических изомеров
В номенклатуре оптических изомеров наряду с названием
соединения указывают также конфигурацию и направление вра-
щения плоскости поляризованного света. Последнее обозначают
знаком (+) для правовращающего изомера или знаком (-) для ле-
вовращающего изомера.
Для обозначения конфигурации оптически активных соеди-
нений существуют D,L- и 7?,5-стереохимические системы.
Р,£-Система обозначения конфигурации. Установить абсо-
лютную конфигурацию молекул оказалось для химиков довольно
сложной задачей. Впервые это удалось лишь в 1951 году методом
рентгеноструктурного анализа. До этого времени конфигурацию
оптических изомеров устанавливали методом сравнения со специ-
ально выбранным стандартным веществом. Такая конфигурация
получила название относительной. В 1906 году русским ученым
М. А. Розановым в качестве стандарта для установления относи-
тельной конфигурации был предложен глицериновый альдегид.
СН2ОН
D-(+)~ глицериновый
альдегид
L- (-)-глицериновый
альдегид
Для правовращающего изомера произвольно выбрали форму-
лу Фишера, в которой гидроксильная группа у хирального атома
углерода находится справа, а для левовращающего — слева. Кон-
фигурация правовращающего изомера обозначается буквой Р, а ле-
вовращающего — L.
С использованием в качестве эталона сравнения глицерино-
вого альдегида была разработана Р,/.-система стереохимической
классификации хиральных соединений, то есть отнесения соеди-
нений соответственно к D- или L-стереохимическим рядам.
Р,//-Система главным образом применяется в ряду многоатом-
ных спиртов, гидрокси-, аминокислот и углеводов:
3. Изомерия органических соединений. Пространственное строение молекул 43
сно соон соон
он h2n
сн,он
сн2
соон
сн2
соон
£)-(+)-глицериновый
альдегид
Д-яблочная
кислота
L-аспарагиновая
кислота
Для соединений с несколькими асимметрическими атомами
углерода, такими как а-гидроксикислоты, а-аминокислоты, вин-
ные кислоты, конфигурацию условно определяют по верхнему
асимметрическому атому углерода (по гидроксикислотному клю-
чу), в то время как в молекуле углеводов конфигурацию устанав-
ливают (условно) по нижнему асимметрическому атому углерода.
СНО
ОН
но
СНО СООН СООН
СН2ОН НО-----н н--------он
СН2ОН
Д-(+)-глицериновый
альдегид
СООН
D- винная
кислота
сн3
£-треонин
Д-глюкоза
R,S-Система обозначения конфигурации. -Система оказа-
лась практически неприемлемой для соединений, мало похожих
на глицериновый альдегид. Поэтому Р. Каном, К. Ингольдом
и В. Прелогом была предложена /?, 5-система обозначения абсолют-
ной конфигурации оптических изомеров. R,5-Система построена
на определении старшинства заместителей у хирального центра.
Старшинство заместителей определяется величинами атомных
номеров элементов. Чем больше атомный номер, тем старше за-
меститель. Например, в молекуле бромйодхлорметана старшин-
ство заместителей уменьшается в ряду:
531 > 35Вг > 17С1 > ,Н
44
После установления старшинства заместителей модель моле-
кулы ориентируют так, чтобы заместитель с наименьшим поряд-
ковым номером был направлен в сторону, наиболее удаленную от
наблюдателя (рис. 3.4). Если старшинство трех остальных замес-
тителей убывает по направлению часовой стрелки, то молекула
имеет конфигурацию, обозначаемую буквой (от лат. rectus —
правый), а если старшинство заместителей убывает против часо-
вой стрелки, конфигурацию обозначают буквой 5 (от лат. sinister —
левый):
,Н
53l-C-3sBr
17С1
S-конфигурация
^-конфигурация
I > Вг > Cl > Н
Рис. 3.4. Определение конфигурации по R,5-системе
для молекулы бромйодхлорметана
Рассмотрим определение старшинства заместителей и конфи-
гурации для более сложных молекул на примере молочной кисло-
ты (рис. 3.5). Уже по первому слою (8О, 6С, tH, 6С) становится
понятно, что старшим заместителем является группа ОН, а млад-
шим — водород. Для выяснения старшинства двух других замес-
тителей —СН3 и —СООН с одинаковым атомным номером (6С)
по первому слою, необходимо рассмотреть второй слой. Сумма
атомных номеров второго слоя СН3-группы равна 1 + 1 + 1 = 3,
а группы —СООН составляет 8 + 8 • 2 = 24. Значит, —СООН-груп-
па старше группы —СН,. Старшинство заместителей вокруг асим-
СООН СООН
^-конфигурация S-конфигурация
Рис. 3.5. Определение конфигурации по R,5-системе
для молочной кислоты
3. Изомерия органических соединений. Пространственное строение молекул 45
метрического атома углерода в молекуле молочной кислоты умень-
шается в ряду: —ОН > —СООН > —СН3 > —Н
СН3—СН—СООН
он
молочная кислота
Рацематы. Смесь равных количеств энантиомеров оптически
неактивна, ее называют рацемической смесью (рацематом). Раце-
маты отличаются от индивидуальных энантиомеров физическими
свойствами, они могут иметь различную температуру плавления,
растворимость; отличаются спектральными характеристиками.
На практике чаще приходится сталкиваться не с индивидуаль-
ными энантиомерами, а с рацематами, которые образуются в ре-
зультате химических реакций, протекающих с образованием хи-
рал ьных молекул.
Для разделения рацематов на энантиомеры пользуются тремя
методами:
1. Механический метод. В результате кристаллизации некото-
рых оптически активных соединений могут образовываться две
формы кристаллов, похожих друг на друга как предмет и его зер-
кальное отображение. Их можно отделить под микроскопом пре-
паративной иглой (механически).
2. Биохимический метод основан на том, что определенные
виды микроорганизмов предпочитают одну из энантиомерных
форм и поедают ее, вторая остается и может быть легко выделена.
3. Химический метод. В основе химического метода лежит пе-
ревод энантиомеров при помощи оптически активных реагентов
в диастереомеры, которые уже отличаются друг от друга по физи-
ческим свойствам. Диастереомеры гораздо легче разделить.
Например, следует разделить рацемическую смесь двух кислот
(А + В). Для этого к смеси добавляют оптически активное основа-
ние (С). Между рацемической формой и оптически активным ос-
нованием протекает реакция
(А + В) + С---* АС + ВС.
АС и ВС — это диастереомеры. Они обладают различной рас-
творимостью, и методом последовательной кристаллизации мож-
но выделить два диастереомера отдельно.
Но так как АС и ВС образованы слабой органической кисло-
той и основанием, то используют для их разложения минераль-
ные кислоты.
46
AC + HC1----- A + C • HC1
BC + HCI
В + C • HC1
Таким образом получают чистые энантиомеры А и В.
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Причиной возникновения геометрической изомерии является
отсутствие свободного вращения вокруг о-связи. Этот вид изоме-
рии характерен для соединений, содержащих двойную связь, и для
соединений алициклического ряда.
Геометрические изомеры — это вещества, имеющие одинако-
вую молекулярную формулу, одинаковую последовательность свя-
зывания атомов в молекулах, но отличающиеся друг от друга раз-
личным расположением атомов или атомных групп в пространстве
относительно плоскости двойной связи или плоскости цикла.
Причиной возникновения данного вида изомерии является
невозможность свободного вращения вокруг двойной связи или
о-связей, образующих цикл.
Например, бутен-2 СН3—СН—СН—СН3 может существовать
в виде двух изомеров, которые различаются расположением ме-
тильных групп в пространстве относительно плоскости двойной
связи:
^«с-бутен-2
/пранс-бутен-2
или 1,2-диметилциклопропан существует в виде двух изомеров,
которые различаются расположением метильных групп в простран-
стве относительно плоскости цикла:
СН3 СН3
цис- диметилциклопропан лпр^л/с-диметилциклопропан
Для обозначения конфигурации геометрических изомеров ис-
пользуют цис-, транс-систему. Если одинаковые заместители
3. Изомерия органических соединений. Пространственное строение молекул 47
расположены по одну сторону от плоскости двойной связи или
цикла, конфигурацию обозначают цис-, если по разные сторо-
ны, — транс-.
Для соединений, у которых при атомах углерода с двойной
связью находятся различные заместители, применяют E,Z-chctc-
му обозначений.
/^-Система является более общей. Она применима к геомет-
рическим изомерам с любым набором заместителей. В основе этой
системы лежит старшинство заместителей, которое определяют
у каждого атома углерода отдельно. Если старшие заместители из
каждой пары расположены по одну сторону от двойной связи, кон-
фигурация обозначается буквой Z (от нем. zusammen — вместе), если
по разные стороны,— буквой Е (от нем. entgegen — напротив).
Так, для 1-бром-1-хлорпропена возможно два изомера:
Z-1-бром-1 -хлорпропен
и
Е-1 -бром-1 -хлорпровен
Старшим заместителем у одного атома углерода является ме-
тильная группа (заместители ГН и 6СН3), а у другого — атом брома
(заместители 7С1 и 35Вг). В изомере I старшие заместители распо-
ложены по одну сторону от плоскости двойной связи, ему припи-
сывают Z-конфигурацию, а изомеру II — Е-конфигурацию (стар-
шие заместители расположены по разные стороны плоскости
двойной связи).
Геометрические изомеры имеют разные физические свойства
(температуру плавления и кипения, растворимость и так далее),
спектральные характеристики и химические свойства. Такое раз-
личие в свойствах позволяет довольно легко установить их кон-
фигурацию с помощью физических и химических методов.
КОНФОРМАЦИОННАЯ ИЗОМЕРИЯ
Конформационная (поворотная) изомерия обусловлена вра-
щением атомов или атомных групп вокруг одной или нескольких
простых о-связей. В результате вращения вокруг С—С-связей мо-
лекулы могут иметь различные пространственные формы, кото-
рые называют конформациями.
48
Например, молекула этана вследствие вращения вокруг угле-
род-углеродной связи может принимать бесконечное множество
конформаций, каждая из которых характеризуется определенным
значением потенциальной энергии. Две крайние конформации
называют заслоненной и заторможенной.
заслоненная конформация этана
заторможенная конформация этана
Для представления конформаций на плоскости используют
формулы Ньюмена и перспективные формулы.
В заслоненной конформации этана атомы водорода метиль-
ных групп, если смотреть вдоль связи углерод-углерод, располо-
жены друг за другом. В заторможенной — атомы водорода одной
метильной группы максимально удалены от атомов водорода дру-
гой. Между заслоненной и заторможенной конформацией моле-
кула в процессе вращения принимает множество скошенных кон-
формаций.
Каждая из конформаций молекулы этана характеризуется раз-
личной потенциальной энергией. Заслоненная конформация имеет
максимальную энергию, а заторможенная — минимальную.
Энергетическая неравноценность различных конформаций
объясняется существованием в молекуле так называемого торси-
онного напряжения (напряжения Питцера), которое обусловлено
взаимодействием (отталкиванием) электронных облаков проти-
востоящих связей. В заслоненной конформации противостоящие
связи максимально сближены, поэтому взаимодействие между
ними наибольшее. Разность энергий заслоненной и заторможен-
ной конформаций называется энергетическим барьером вращения.
Для этана энергетический барьер невелик, он составляет около
12 кДж/моль и легко преодолевается молекулой при обычных тем-
пературах за счет энергии теплового движения.
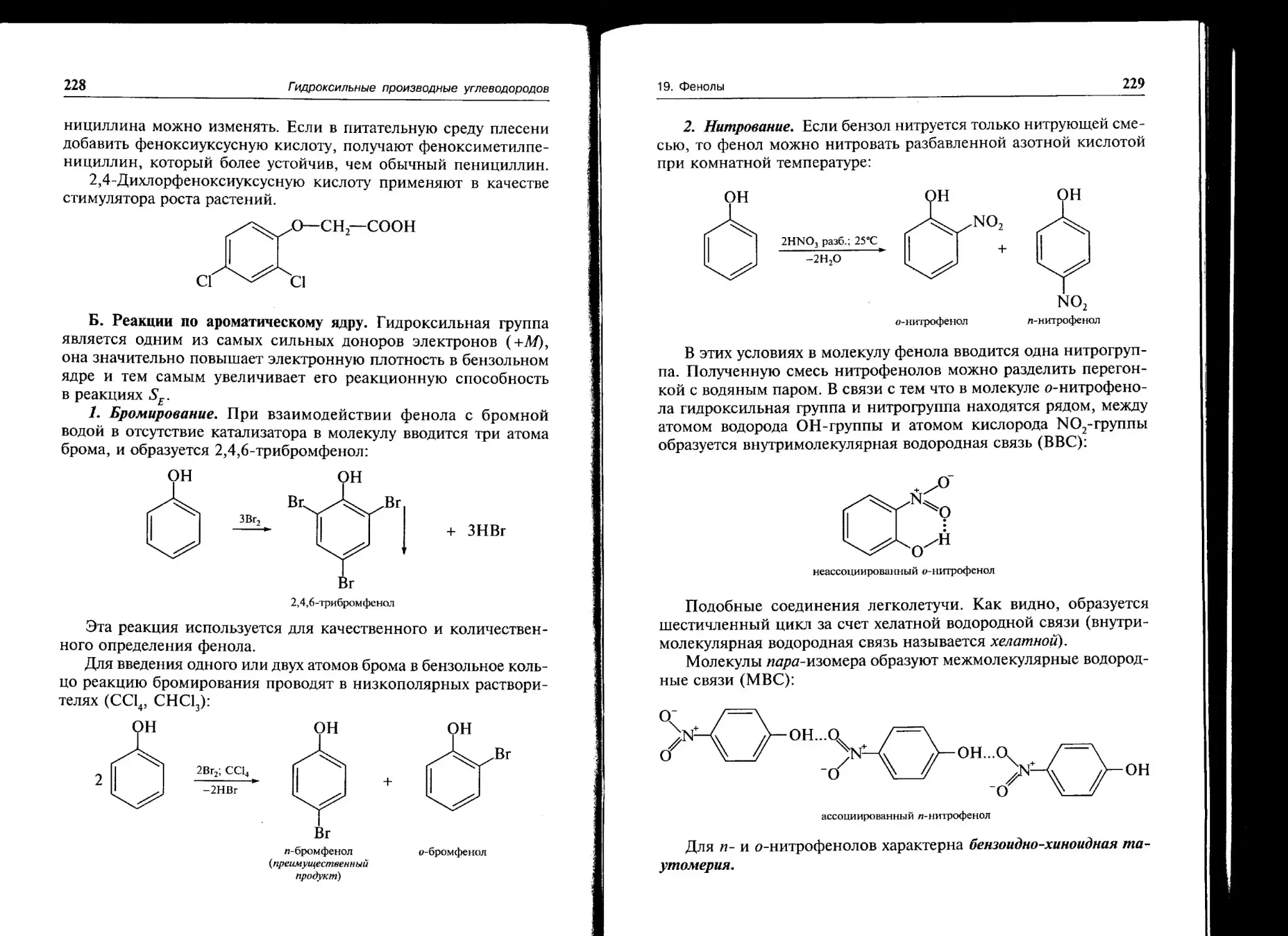
При вращении вокруг С2—С-связи в //-бутане возможны че-
тыре крайние конформации, из которых две заторможенные и две
заслоненные:
СН—СН—СН—СН.
3. Изомерия органических соединений. Пространственное строение молекул 49
заторможенные конформации
заслоненные конформации
Заторможенная конформация, в которой метильные группы
(объемные заместители) максимально удалены друг от друга, по-
лучила название анти -конформации. Другая заторможенная кон-
формация называется гош-конформацией.
Заторможенная год/-конформация обладает несколько боль-
шей потенциальной энергией (за счет метил-метильного взаимо-
действия), чем яятли-конформация (в ней взаимодействие между
метильными группами вообще отсутствует).
Хотя в молекуле н-бутана существует свободное вращение вок-
руг центральной С—С-связи, однако в каждый момент времени
большая часть молекул представлена наиболее энергетически вы-
годной конформацией.
Конформации с наименьшим запасом энергии называют кон-
формерами, или конформационными (поворотными) изомерами.
Так, я-бутан при 25 °C существует примерно на 70 % в форме
яштш-конформера и на 30 % — гош-конформера.
В отличие от конфигурационных изомеров конформеры пре-
вращаются друг в друга без разрыва химических связей и не под-
даются разделению. Они обнаруживаются только физико-хими-
ческими методами.
___________________4_____________________
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
И РЕАГЕНТОВ
Наиболее широко в органической химии используют класси-
фикацию химических реакций, основанную на представлениях об
их механизме. Учитываются способ разрыва химической связи,
природа интермедиатов, природа реагента и другие факторы.
В соответствии со способом разрыва связи реак-
ции делятся на гомолитические (симметричный разрыв двухэлек-
тронной ковалентной связи с образованием двух свободных ради-
калов А*|’В А* + В •), гетеролитические (несимметричный
разрыв связи, приводящий к появлению двух частиц с противо-
положными зарядами А: | В — А" + В+) и перициклические (моле-
кулярные) .
По природе интермедиатов реакции могут быть ион-
ными > радикальными и др.
Ионные реакции осуществляются при участии заряженных час-
тиц. К этому же типу относятся многие органические реакции,
интермедиатами в которых являются карбокатионы или карбани-
оны, образующиеся в результате гетеролитического распада ис-
ходных веществ.
Карбокатионами называют органические катионы, содер-
жащие положительно заряженный атом углерода. Атом угле-
рода в карбокатионе, несущий положительный заряд, находится
в sp1 -гибридном состоянии: три его о-связи расположены в одной
плоскости, а р-атомпая орбиталь является вакантной.
вакантная />А0
4. Классификация химических реакций и реагентов
51
Карбанионами называют органические анионы, содержащие от-
рицательно заряженный атом углерода, то есть трехвалентный атом
углерода с неподеленной парой электронов.
Неподеленная пара электронов находится на sp-гибридизи-
рованной атомной орбитали в случае карбанионов ряда алканов,
а карбанионы, в которых неподеленная пара электронов сопря-
жена с кратной связью, содержат эту пару электронов на р-атом-
ной орбитали.
Радикальные реакции протекают с участием свободных ради-
калов.
Свободными радикалами называют незаряженные частицы, со-
держащие неспаренный электрон (одноэлектронную атомную ор-
биталь).
Неспаренный электрон может находиться на зр3-гибридизиро-
ванной атомной орбитали или на р-атомной орбитали. В зависи-
мости от этого свободный радикал может иметь тетраэдрическое
или плоское строение.
Плоское строение имеют первичные алкильные радикалы (не-
спаренный электрон находится на р-АО).
Третичные алкильные радикалы имеют тетраэдрическое стро-
ение (неспаренный электрон занимает зр3-гибридную орбиталь).
метил
/пре/тт-бутил
Перициклические реакции протекают без образования проме-
жуточных активных частиц, в таких реакциях происходит син-
хронный разрыв старых и образование новых химических связей.
52
Например:
Реакции, протекающие по ионному механизму, делят на нук-
леофильные и электрофильные в зависимости от пр ир о д ы ата-
кующего реагента.
Нуклеофильными называют реагенты, которые предоставляют
электронную пару для образования химической связи с субстра-
том. К нуклеофильным реагентам относятся: молекулы, содержа-
щие хотя бы одну неподеленную пару электронов,
NH„ R—NFL, R—ОН и др.;
ионы, несущие отрицательный заряд (анионы),
ОН , CN , RO , С1 , Вг и др.;
молекулы, имеющие центры с повышенной электронной плотно-
стью,
алкены,
арены и др.
Нуклеофилы способны образовывать ковалентную связь с суб-
стратом, атакуя в его молекуле центры с пониженной электрон-
ной плотностью.
Электрофильными называют реагенты, принимающие элект-
ронную пару от субстрата при образовании с ним химической
связи. К электрофильным реагентам относят катионы (Н+, NO^Cl*
и др.), нейтральные молекулы, имеющие вакантную орбиталь
(А1С13, FeBr3 и др.), центры с пониженной электронной плот-
ностью,
галогены CL, Вг?, L (в присутствии кислот Льюиса).
4. Классификация химических реакций и реагентов
53
Электрофильные реагенты способны образовывать ковалент-
ную связь с субстратом, атакуя в его молекуле центры с повышен-
ной электронной плотностью.
Заслуживает внимания широко используемая в органической
химии классификация химических реакций по формальным
признакам:
1. Реакции присоединения обозначаются символом «А» (от англ.
addition — присоединение). Эти реакции характерны для соедине-
ний, имеющих кратные связи.
А=В + X—Y
Реакции присоединения могут протекать по следующим воз-
можным механизмам:
а) электрофильное присоединение АЕ;
б) нуклеофильное присоединение AN;
в) свободнорадикальное присоединение AR;
г) молекулярное (синхронное) присоединение.
2. Реакции замещения обозначаются символом «5>> (от англ.
substitution — замещение).
А—В + X—Y
* А~—X + В—Y
Они характерны для всех классов органических соединений
и могут протекать по следующим механизмам:
а) электрофильное замещение
б) нуклеофильное замещение
в) свободнорадикальное замещение SR.
3. Реакции отщепления (элиминирования) обозначаются симво-
лом «Е» (от англ, elimination — отщепление).
- А—В + X—Y
Реакции отщепления характерны для галогенопроизводных уг-
леводородов, спиртов, гетерофункциональных карбоновых кис-
лот (галогено-, гидрокси-, аминокислот).
4. Перегруппировки
X
X
54
Происходит переход (миграция) отдельных атомов или атом-
ных групп от одного фрагмента молекулы к другому.
5. Реакции окисления и восстановления. Сопровождаются из-
менением степени окисления атома углерода, являющегося реак-
ционным центром. Механизм реакции окисления органических
веществ достаточно сложен.
По количеству молекул, принимающих участие
в лимитирующей (скоростьопределяюшей) стадии, различают
мономолекулярные и бимолекулярные реакции (обозначают циф-
рами 1 и 2 соответственно). В лимитирующей (самой медленной)
стадии мономолекулярной реакции принимают участие молеку-
лы одного реагента, в бимолекулярной — молекулы двух реагентов.
Обширную группу химических реакций составляют каталити-
ческие реакции, осуществление которых возможно только в при-
сутствии катализатора.
Большое значение имеют реакции полимеризации, заключаю-
щиеся в образовании высокомолекулярных соединений (полиме-
ров) из низкомолекулярных веществ (мономеров).
кислотность и основность
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности со-
единений, в том числе и органических, применяют две теории:
теория Бренстеда и теория Льюиса. Теория Бренстеда (1923) яв-
ляется протолитической, или протонной теорией кислот и осно-
ваний, а теория Льюиса (1925) — апротонной, или электронной
теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение,
способное отдавать протон, то есть кислота — донор протона,
а основание — соединение, способное присоединять протон, то
есть основание является акцептором протона.
Теория Бренстеда называется протонной, или протолитиче-
ской теорией кислот и оснований, так как определенные кислота
и основание взаимосвязаны между собой процессом присоедине-
ния и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, мо-
жет быть представлен следующей схемой:
А—Н + В
кислота основание
сопряженное
основание
сопряженная
кислота
Кислота А—Н, теряя протон, превращается при этом в осно-
вание А-, которое называется сопряженным основанием данной
кислоты. Основание же В, присоединяя протон за счет неподе-
ленной пары электронов, превращается в кислоту ВН+, которая
является сопряженной данному основанию.
Таким образом, кислота А—-Н и сопряженное основание А",
основание В и сопряженная кислота ВН+ образуют две сопряжен-
ные кислотно-основные пары.
56
Кислотность и основность соединений — понятия относитель-
ные. Эти два свойства неразрывно связаны между собой и прояв-
ляются одновременно, то есть если одно соединение в данной
реакции выступает в роли кислоты, то другое обязательно — в ро-
ли основания. Определенное соединение может быть кислотой по
отношению к одному и основанием по отношению к другому со-
единению. Относительность этих понятий становится очевидной
при рассмотрении конкретного примера.
нон
* •
основание
СН-СОО-
сопряженное
основание
сопряженная
кислота
СН3СООН
кислота
основание
H2SO4
кислота
,о^н
Н3С-С^ + HSO7
ХН
сопряженное
сопряженная
основание
кислота
Уксусная кислота, которая в воде проявляет кислотные свой-
ства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с по-
мощью константы равновесия данной реакции. Величину кон-
станты равновесия чаще всего определяют в водной среде. Для
реакции:
RCOOH + НОН — RCOO’ + Н3О+
кислота основание сопряженное сопряженная
основание кислота
[RCOO][H3O+]
[RCOOH](H2O]
Учитывая то, что вода в данной реакции выступает в роли
растворителя, то есть концентрация ее практически не изменяет-
ся (55,6 моль/л), концентрацией воды можно пренебречь. В дан-
ном случае константу равновесия называют константой кислот-
ности или константой диссоциации Ка и выражают формулой:
[RCOO-][H3O+]
[RCOOH]
Любая протолитическая реакция обратима и характеризуется
константой диссоциации.
5. Кислотность и основность органических соединений
57
Большинство органических соединений, проявляющих кислот-
ные свойства, в водной среде являются слабыми кислотами, кон-
станты которых выражаются малыми величинами. Например, Ка
уксусной кислоты при 25 °C равна 1,76 • 10"5. Оперировать такими
малыми величинами в практической работе неудобно, поэтому
используют значения pAf — показатель константы — отрицатель-
ный логарифм константы диссоциации: рКа — -1g Ка (например:
рАГ для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Ка, рКа
и силой кислоты, следует отметить одну закономерность: чем боль-
ше величина Ка (константа кислотности), тем сильнее кислота,
чем больше величина рАГд, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величи-
ной Кь (константа основности), характеризующей легкость, с ко-
торой основание отрывает протон от воды:
R—NH2 + НОН R—NHJ + ОН-
[RNHt][OH ]
[RNHJ
Для удобства пользуются величиной рАГА:
pKb= -1g кь.
При этом, чем меньше рАГЛ, тем сильнее соответствующее ос-
нование. Однако намного удобнее выражать степень ионизации
кислот и оснований в одной шкале (в шкале рАГ) подобно тому,
как значение pH одинаково хорошо характеризует и кислотность,
и основность. Для основания величина рАГ обычно означает кис-
лотность сопряженной кислоты — протрнной формы основания
рАГвн+. Сопряженная кислота в виде R—NH3, отдавая протон, пре-
вращается в основание R—NH2.
Типы органических кислот. В зависимости от природы элемен-
та, который связан с атомом водорода, кислоты разделяют на че-
тыре основные группы:
1. ОН-кислоты*, карбоновые кислоты, спирты, фенолы и др.
2. SH-кислоты*. тиолы, тиоловые кислоты и др.
3. NH-кислоты*, амины, амиды, имиды и др.
4. СН-кислоты*. углеводороды и их производные.
Наряду с указанными типами кислот известны кислоты:
Si—Н, Р—Н, As—Н, то есть кислотой может быть любое соеди-
нение, содержащее связь А—Н и способное к отщеплению про-
58
тона. Теория Бренстеда применима к любым типам кислот, спо-
собным к диссоциации с разрывом связи элемент—водород.
Кислотность соединений в основном определяется устойчи-
востью образующегося аниона, которая обусловлена делокализа-
цией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота.
Устойчивость аниона определяется следующими факторами: при-
родой атома, связанного с атомом водорода (реакционный и кис-
лотный центр); электронодонорными или электроноакцепторны-
ми свойствами заместителя, связанного с реакционным центром,
и природой растворителя.
При равных других факторах устойчивость анионов, а следо-
вательно, и кислотность возрастают с увеличением электроотри-
цательности и поляризуемости атомов кислотного центра. С уве-
личением электроотрицательности увеличивается сила, с которой
атом может удержать пару электронов после отщепления прото-
на. Поскольку в пределах периода периодической системы элект-
роотрицательность атомов возрастает слева направо (поляризуе-
мость не меняется), то ОН-кислоты сильнее соответствующих
NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
ацетон
рА, = 20,0
уксусная кислота
ацетамид
ра; = 15,1
рА; = 4,7
В пределах группы периодической системы электроотрицатель-
ность атомов уменьшается сверху вниз, но увеличивается их объем,
а следовательно, возрастает поляризуемость, то есть возможность
делокализации внешнего электронного облака. Это способствует
повышению стабильности аниона и приводит к возрастанию кис-
лотности. Поэтому SH-кислоты обладают большей кислотностью,
чем ОН-кислоты, например:
СН— СН2— ОН СН3—СН—SH
этанол этантиол
рА, = 18,0 рАс = 10,5
Наличие электронодонорных заместителей (+1, +М) при кис-
лотном центре приводит к уменьшению кислотности, а присут-
ствие электроноакцепторных атомов или атомных групп (— I,
—М) повышает кислотные свойства.
5. Кислотность и основность органических соединений
59
ci- cir-c; нл-с'
он он
хлоруксусная кислота уксусная кислота
рКд = 2,9 рЛ; = 4,7
Наряду с природой кислотного центра и строением радикала
значительное влияние на проявление кислотных свойств оказы-
вает растворитель. Наиболее эффективным растворителем явля-
ется вода, она имеет высокую диэлектрическую постоянную
и способна связывать катионы и анионы за счет сольватации.
Эффект сольватации приводит к устойчивости образовавшегося
аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований. Согласно теории Бренстеда, лю-
бое соединение, способное присоединять протон, может высту-
пать в роли основания; это могут быть как нейтральные молеку-
лы, так и заряженные частицы. В нейтральных молекулах для
проявления основных свойств необходимо наличие атома с непо-
деленной парой электронов или наличие кратной связи. Основа-
ниями могут быть анионы: алкоксид-ион RO~; алкилмеркаптид-
ион RS", карбанион R3C~ (триалкилметанид-ион) и др.
Различают два типа оснований Бренстеда: «-основания, или
ониевые (наличие атомов с неподеленной электронной парой),
и л-основания (наличие л-связи).
В «-основаниях центром основности, или центром протониро-
вания (местом присоединения протона), чаще всего выступают та-
кие элементы, как азот, кислород, сера. В зависимости от центра
основности ониевые основания делятся на три основные группы:
1. Аммониевые, к которым относятся первичные (RNH2),
вторичные (R^NH) и третичные (R^N) амины, азометины
(RCH=NR), нитрилы (R—O=N) и азотсодержащие гетеро-
циклы;
2. Оксониевые, к которым относятся спирты (RQH), простые
эфиры (R—О—R), альдегиды (RCHQ), кетоны (RCQR') и функ-
циональные производные кислот (сложные эфиры, хлорангидри-
ды, амиды и др.);
3. Сульфониевые, к которым относятся тиоспирты (R—S—Н)
и тиоэфиры (R—S—R).
Основность органических соединений в основном определя-
ется устойчивостью образовавшегося катиона, которая обуслов-
лена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотри-
цательность и поляризуемость центра основности, электронодо-
60
норное или электроноакцепторное влияние радикала, связанного
с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра спо-
собствует более прочному удержанию им неподеленной электрон-
ной пары, то есть чем больше электроотрицательность атома,
тем меньше основность. Таким образом, аммониевые основания
проявляют более сильные основные свойства по сравнению с ок-
сониевыми. Увеличение же поляризуемости атома приводит
к уменьшению основности сопряженного основания и увеличе-
нию кислотности сопряженной кислоты. Поэтому сульфониевые
основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет
растворитель. Эффект сольватации способствует устойчивости об-
разовавшегося катиона, а следовательно, приводит к повышению
основности.
Центром основности л-оснований, к которым относятся алке-
ны, алкадиены и арены, является л-связь. В процессе взаимодей-
ствия протона с соединениями, содержащими кратную связь, про-
исходит частичное перекрывание свободной 5-орбитали протона
со связующей л-МО кратной связи, в результате чего образуется
короткоживущая частица — л-комплекс.
По сравнению с ониевыми л-основания являются слабыми ос-
нованиями.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Брен-
стеда, является более общей. Согласно этой теории основанием
считается любая частица (атом, молекула или анион), способная
отдавать электронную пару для образования ковалентной связи,
а кислотой — любая частица (атом, молекула, катион), способная
принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота —
акцептором пары электронов. Из приведенного определения вид-
но, что основания Льюиса тождественны основаниям Бренстеда.
Однако кислоты Льюиса охватывают более широкий круг соеди-
нений.
5. Кислотность и основность органических соединений
61
Кислотой Льюиса считается любая частица, имеющая вакант-
ную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только со-
единения, отщепляющие протон (протонные кислоты), но и дру-
гие вещества, имеющие вакантную орбиталь и способные прини-
мать пару электронов (апротонные кислоты). Кислотами Льюиса,
например, являются такие соединения, как BF3, А1С13, FeCl3, SbCl3,
ZnCl2, HgCl2 и др.
Кислотно-основный процесс по Льюису состоит в образова-
нии ковалентной связи между основанием и кислотой за счет элек-
тронной пары основания и вакантной орбитали кислоты. Так,
основания Льюиса, имеющие неподеленные пары электронов,
образуют с кислотами Льюиса «-комплексы:
CH— С1—А1С1з-------- СН3[Д1С14]
хлорметан
(основание
Льюиса)
алюминия
хлорид
(кислота
Льюиса)
«-комплекс
А основания, имеющие кратную связь, образуют л-комплексы:
основание
л-комплекс
Легкость протекания кислотно-основного взаимодействия по
Льюису определяется силой кислоты и основания.
УГЛЕВОДОРОДЫ
АЛКАНЫ
Алканами называют углеводороды алифатического ряда, в мо-
лекулах которых атомы углерода связаны между собой только про-
стыми и-связями.
Общая формула алканов — СлН2л+2. Алканы образуют гомоло-
гический ряд, в котором каждый последующий член гомологиче-
ского ряда отличается от предыдущего на группу —СН2—, кото-
рая называется гомологической разностью:
метан
бутан
гептан
декан
С,Н, этан
2 о
CSH19 пентан
.I. 2L
CgH18 октан
J о
с н
^6П14
с н
Vz91±2O
пропан
гексан
нонан
Номенклатура алканов. Первые четыре члена гомологического
ряда алканов — метан, этан, пропан и бутан — имеют тривиаль-
ные названия. Названия последующих углеводородов с нормаль-
ной углеродной цепью образуют от названия греческих числи-
тельных, указывающих количество атомов углерода в молекуле,
с добавлением суффикса -ан.
Названия алканов с разветвленной углеродной цепью образу-
ются согласно заместительной номенклатуре ИЮПАК следующим
образом:
1. Для построения названия выбирают наиболее длинную не-
разветвленную углеродную цепь (главную углеродную цепь); если
имеется несколько цепей одинаковой длины, выбирают ту, кото-
рая имеет наибольшее число разветвлений:
СН~СН2—сн^ Гсн^сн^сн',—СНн-СН—сн3
СН3 [CH-J-CH,
|сн3|
6. Алканы
63
2. Нумерацию атомов углерода главной цепи проводят с того
конца, к которому ближе заместитель:
12 3 4
сн—сн—сн—сн3
сн3
2-метилбутан
Если одинаковые заместители равно удалены от обоих концов
молекулы, начало нумерации определяется алфавитным поряд-
ком названия заместителей:
6 5 4 3 2 1
сн—сн—сн—сн—сн—сн3
сн2 сн3
СН3
З-метил-4-этилгексан
Если одинаковые заместители равно удалены от обоих концов
молекулы, нумерацию начинают с того конца, где число замести-
телей больше:
СН3
1 2 з| 4 5 6
СН—СН—С—СН—СН—сн3
сн3 сн3 сн3
2,3,3,5-тетраметилгексан
3. Составляют название соединения, учитывая следующие
правила:
— названия заместителей перечисляют в алфавитном порядке,
указывая цифровой локант, соответствующий положению каждо-
го заместителя в главной углеродной цепи;
— число одинаковых заместителей обозначают множительны-
ми приставками ди-, три-, тетра- и т. д.;
— затем называют углеводород, в основе которого лежит глав-
ная углеродная цепь — родоначальная структура.
Алкил — остаток углеводорода, образующийся в результате от-
щепления атома водорода.
Необходимо обратить внимание на то, что не следует путать
понятия «углеводородный радикал» как остаток алкана (R-) со
«свободным радикалом» (R •), который имеет неспаренный элек-
трон.
64
Углеводороды
Важно запомнить, что при переходе от алкана к алкилу следу-
ет заменить суффикс -ан на -ил. Для двухвалентных радикалов
с двумя свободными валентностями возле одного углеродного атома
суффикс -ан изменяется на -илиден, для трехвалентных радикалов
с тремя свободными валентностями возле одного углеродного атома
соответственно суффикс -ан изменяют на -илидин.
Наиболее часто встречающиеся радикалы:
СН3
метил
сн—сн,—
этил
изопропил
СН—СН—СН—СН — н-бутил
сн3
^СН СН,— изобутил
CHf
СН3—СН2—СН— вдюр-бутил
СН3
—СН2— метилен
СН3—СН^ этил идеи
СН3—СН2—СН^ пропилиден
—СН2—СН2—СН2— триметилен
ттр/2 метин;
11 \ метилидин
СН3--С~~ ЭТИЛИДИН
сн3—с—
сн3
/преги-бутил
По рациональной номенклатуре алканы рассматривают как про-
изводные метана, в молекуле которого один или несколько ато-
мов водорода замещены на углеводородные радикалы. Заместите-
ли вокруг «метанового» атома углерода перечисляют в порядке
увеличения сложности их строения:
СН3
3
-СН2—СН2
сн3
диметилэтилпропилметан
Изомерия. Структурная изомерия алканов обусловлена различ-
ной последовательностью связывания атомов углерода в молекуле
(изомерия цепи):
6. Алканы
65
СН
СН—CH2—СН—СН
сн3—сн—сн
изобутан,
2’Метилпропан
В ряду алканов, начиная с гептана С7Н16, возможно проявле-
ние оптической изомерии:
сн—сн—сн—сн—сн—сн
сн
сн3
сн3—сн2 х:н2—сн2—сн3
сн3—сн—Н2С
сн
сн—сн3
R- 3 - метилгекс ан
5-3-метил гексан
Способы получения алканов. Природными источниками алка-
нов являются нефть, газ, уголь, торф, сланцы и др. Основная цель
промышленного получения алканов — выделение различных фрак-
ций или индивидуальных соединений.
Синтетические способы получения. 1. Оксосинтез алканов (ме-
тод Фишера—Тропша). Каталитическое гидрирование углерода (II)
оксида позволяет получить алканы нормального строения (сос-
тав С6—С10). Смесь углерода (II) оксида и водорода пропускают
над катализатором Fe—Со при температуре 180—300 °C.
лСО + (2л + 2)Н
Fe, t
+ лН2О
Каталитическое гидрирование алкенов и алкинов. Присоедине-
ние водорода по месту разрыва кратной связи осуществляют в при-
сутствии катализаторов (тонко измельченных Pt, Pd или Ni).
[Hl [H]
нс=с—сн3 н2с=сн—сн3 —- н3с—сн—сн3
пропин
пропен
пропан
2. Взаимодействие галогеналканов с металлическим натрием (ре-
акция Вюрца). Используется для синтеза симметричных алканов.
СН,—I + 2Na + I—СН3 * СН—СН3 + 2NaI
метилиодид
этан
66
Углеводороды
Реакция Вюрца протекает в две стадии:
CH3I + 2Na
CHjNa + CH3I
- CH,Na + Nal
метилнатрий
- СН,—CH, + Nal
J
этан
Если в качестве исходных веществ используют два разных
галогеналкана, образуется смесь алканов, которую трудно разде-
лить:
СН—I + СН3СН — I + 2Na--
* СН — СН3 + СН—СН2СН3 + СН3СН —СН2СН3 + 2Nal
этан пропан бутан
3. Сплавление солей карбоновых кислот со щелочами. Соли ще-
лочных металлов карбоновых кислот при сплавлении со щелочью
образуют алканы:
СН3—COONa + NaOH
натрия ацетат
CH„f + Na2CO3
метан
4. Гидролиз металлорганических соединений. Действием воды на
алюминия карбид получают метан в лабораторных условиях:
А14С3 + 12Н2О
алюминия
карбид
- 3CH4t + ЗА1(ОН)3
5. Электролиз водных растворов солей карбоновых кислот (ре-
акция Кольбе). Чаще электролизу подвергают калиевые или на-
триевые соли карбоновых кислот:
ЛЭ
СН — СН — С^
ONa
натрия пропионат
лэ
СН— СН — сС + Na+
бутан
6. Алканы
67
На аноде анион карбоновой кислоты окисляется, образуя сво-
бодный радикал, который легко декарбоксилируется. Алкильные
радикалы вследствие рекомбинации превращаются в алкан. На
катоде образуется водород и соответствующий гидроксид щелоч-
ного металла.
Физические свойства. Первые четыре представителя гомоло-
гического ряда алканов — газы. Алканы нормального строения
состава С5—С17 — жидкости, С18 и выше — твердые вещества.
Физические константы t , t в гомологическом ряду алканов воз-
кип’ пл 1 J
растают с увеличением молекулярной массы.
Большое влияние на физические свойства алканов оказывает
строение углеродной цепи: температура кипения алканов развет-
вленного строения ниже, чем алканов нормального строения.
Алканы газообразные и твердые — без запаха, жидкие — обла-
дают характерным «бензиновым» запахом. Нерастворимы в воде,
хорошо растворимы в неполярных растворителях. Увеличение
молекулярной массы алканов приводит к уменьшению их раство-
римости.
Химические свойства. Предельные углеводороды называют па-
рафинами (от лат. parum affinitas — мало свойств), что указывает
на их сравнительно низкую реакционную способность. Алканы —
инертные, малоактивные соединения, устойчивы к действию кис-
лот, щелочей и окислителей.
Чем же обусловлена их химическая инертность? Следует от-
метить прочность (5-связей С—С и С—Н. Различие значений элек-
троотрицательности лр-гибридизированного атома углерода (2, 5)
и атома водорода (2, 1) незначительно. Поэтому о-связи С—С
и С—Н в алканах практически неполярны и не склонны к гетеро-
литическому разрыву.
Химические превращения алканов сопровождаются гомоло-
гическим разрывом связей, поэтому для них характерны реакции
свободнорадикального замещения SR. При высоких температурах
возможен гомолитический разрыв углерод-углеродных связей.
А. Реакции радикального замещения SR. 1. Галогенирование. Ал-
каны реагируют с галогенами с образованием моно- и полигало-
геналканов. Реакция протекает по свободнорадикальному меха-
низму, имеет цепной характер.
При взаимодействии метана с хлором, протекающем при
освещении или нагревании, происходит постепенное замеще-
ние атомов водорода атомами хлора:
СН4 + С12
hv
СН,С1 + но
хлорметан
68
Углеводороды
СН3С1 + С12
— СН2С12 + НС1
дихлорметан
СН2С12 + С12
— сна, + на
трихлорметан,
хлороформ
СНС13 + С12
СС14 + НС1
четыреххлористый углерод,
тетрахлорметан
Механизм данной реакции был изучен академиком, лауреа-
том Нобелевской и Государственной премий СССР Н. Н. Се-
меновым.
В цепной реакции выделяют три последовательные ста-
дии: инициирование, рост цепи и обрыв цепи.
Инициирование. Молекула галогена под действием квантов света
kv или при нагревании претерпевает гомолитический разрыв свя-
зи с образованием свободных радикалов:
С1^-С1
Av
201*
Рост цепи. Образовавшиеся свободные радикалы хлора атаку-
ют связь С—Н в молекуле СН4, отрывают атом водорода с образо-
ванием НС1 и свободного метильного радикала СН3.
CHd + Cl •
4
* СН • + НС1
Метильный радикал атакует молекулу хлора, отрывает атом
галогена и образует хлорметан СН3С1 и свободный радикал хлора:
С1 • • С1 + СН.
► СН,С1 + С1 •
Образовавшийся радикал СГ повторяет цикл указанных пре-
вращений, то есть происходит цепная реакция, в которой атом
хлора, прореагировавший на предыдущей стадии роста цепи, спо-
собствует высвобождению нового радикала хлора на последую-
щей стадии. Образуется смесь моно-, ди-, три- и тетрахлорпроиз-
водных метана.
Цепная реакция завершается только после исчезновения всех
образовавшихся в ходе превращений свободных радикалов.
6. Алканы
69
Обрыв цепи происходит в результате рекомбинации (димериза-
ции) свободных радикалов.
СН — СН,
-J к/
СН, + C1-
СН,С1
Следует обратить внимание на региоселективность (избира-
тельность) галогенирования (особенно бромирования) алканов.
В первую очередь замещается атом водорода при третичном угле-
родном атоме, затем — при вторичном и в последнюю очередь —
при первичном.
СН3 СН3
СН —CH—СН —СН3 + Вг2 СН,—С—СН,—СН, + НВг
Вг
2 -метил бутан 2 - бром- 2- метил бутан
Такую последовательность замещения определяет устойчивость
образующихся свободных радикалов. Региоселективность галоге-
нирования алканов возрастает при понижении температуры реак-
ции. Чем активнее галогенирующий реагент, тем ниже избира-
тельность процесса.
2. Нитрование алканов проводят разбавленной азотной кисло-
той при нагревании и повышенном давлении (реакция Конова-
лова) :
СН —СН3 + HNO3 разб.
сн—сн —no2 + Н2О
нитроэтан
Механизм 5 •
/1
НО-j-NO,
НО- + NO;
сн —сн3+но —- сн — СН2 + Н2О
сн — сн2 + но—no2 —* СН — СН— no2 + но
Следует отметить, что алканы в обычных условиях не взаимо-
действуют с концентрированной азотной кислотой.
3. Сульфохлорирование. Алканы при совместном действии се-
ры (IV) оксида и хлора в условиях УФ-облучения образуют ал-
кансульфонилхлориды R—SO,CL
70
Углеводороды
СН4 + SO, + Cl,
CH3SO,C1 + НС1
метансульфохлорид
Реакция протекает по свободнорадикальному механизму (5Л):
CI--C1 2С1-
СН4 + С1
CH3SO2 + С12
- НС1 + сн,
- CH3SO2
- CH3SO2C1 + Cl-
Сульфохлорирование алканов позволяет получить смесь пер-
вичных и вторичных алкансульфохлоридов. Третичные алкан-
сульфохлориды в силу пространственных препятствий не обра-
зуются .
Б. Окисление. Алканы в избытке кислорода или на воздухе
горят с выделением большого количества теплоты:
СН. + 2О7
U1
- СО, + 2Н О + Q
2 2 .
Окисление алканов в присутствии катализатора (соли марган-
ца, хрома и др.) и при нагревании (-150...200 °C) протекает по ра-
дикальному механизму и сопровождается разрывом С—С-связей.
сн,—сн,—сн, —-
Я—
—- сн—сн—сн3
о—он
пропан-2-пероксид
- сн—с—сн3
о
ацетон
ЛЭ
* сн3он + сн—с^
метанол Н
уксусный альдегид
[О]
I [О]
нсоон
муравьиная кислота
сн—соон
уксусная кислота
6. Алканы
71
В. Крекинг алканов — это процесс термического расщепления
алканов.
Термический крекинг проводят при t ~ 800 °C и выше, катали-
тический — при t = 450...550 °C в присутствии алюмосиликатных
катализаторов.
Метан при температуре 1400—1500 °C образует ацетилен.
2СН4 -00 — НОнСН + ЗН2
Этан при более низкой температуре претерпевает дегидроге-
низацию.
СН3—СН3 600~89j?-c> Н2 + СН2=СН2
Высшие алканы в условиях термического крекинга образуют
смесь низших алканов и алкенов.
с6н14-
► с2н6 + сн2=сн—сн—сн3
► с3н8 + сн2=сн—сн3
► сн4 + сн2=сн—сн — сн — сн3
- С4Н. + сн2=сн2
Крекинг-процесс имеет важное промышленное значение: полу-
чение высокооктановых бензинов, непредельных и ароматиче-
ских углеводородов.
ЦИКЛОАЛКАНЫ
Циклоалканами называют алициклические углеводороды, в ко-
торых углеродные атомы, образующие цикл, находятся в sp3-гиб-
ридизации.
Классификация циклоалканов. Циклоалканы классифицируют
по величине цикла, количеству циклов и способу соединения цик-
лов в молекуле.
По величине цикла различают:
циклоалканы с малыми циклами (трех- и четырехчленные);
— циклоалканы с обычными циклами (пяти-, шести- и семи-
членные);
— циклоалканы со средними циклами (от восьми- до один-
надцатичленных) ;
— макроциклы (двенадцатичленные и более).
В зависимости от количества циклов в молекуле вы-
деляют:
моноциклические;
бициклические;
- - полициклические.
Бициклические циклоалканы по способу соединения
циклов подразделяют на три группы:
— спираны (два цикла имеют один общий атом углерода);
— конденсированные (два цикла имеют два общих соседних ато-
ма углерода);
— мостиковые (два цикла имеют три и более общих атомов
углерода).
Номенклатура циклоалканов. Названия моноциклических цик-
лоалканов образуют в соответствии с правилами ИЮ ПАК путем
добавления к названию алкана с соответствующим количеством
атомов углерода префикса цикло-.
циклопропан циклобутан циклопентан циклогексан
7. Циклоалканы
73
Названия одновалентных радикалов образуют путем замены
в названии соответствующего циклоалкана суффикса -ан на -ил.
циклопропил
Бициклические циклоалканы называют в зависимости от чис-
ла углеродных атомов циклической системы и способа соедине-
ния циклов.
Спираны называют путем прибавления префикса спиро- к на-
званию алкана с соответствующим числом атомов углерода. Меж-
ду префиксом и корнем (названием алкана) в квадратных скобках
указывают в порядке возрастания число атомов углерода в каж-
дом из циклов, исключая общий. Нумерацию атомов углерода
спирановой системы начинают с меньшего цикла, с углеродного
атома, расположенного рядом с общим.
спиро{2.4]гептан
спиро[4.5]декан
Конденсированные и мостиковые бициклические циклоалка-
ны называют путем прибавления префикса бицикло- к названию ал-
кана с соответствующим числом углеродных атомов. В квадратных
скобках между префиксом и названием алкана в порядке убывания
указывают число углеродных атомов в каждой из трех цепей, со-
единенных общими узловыми (третичными) атомами углерода.
Нумерацию атомов углерода следует начинать с одного из узловых
атомов. В первую очередь нумеруют самую длинную углеродную
цепь, затем — более короткую. В мостиковых системах в заключе-
ние нумеруют самую короткую углеродную цепь — мостик:
5
бицикло[4.2.0]октан
бицикло[2.1.0] пентан
бицикло[2.2.1 ] гептан
Наряду с систематическими названиями многие бицикличе-
ские системы имеют тривиальные названия.
74
Углеводороды
4
камфан,
1,7,7-триметилбицикло[2.2.1 ]гептан
пинан,
2,6,6-триметилбицикло[3.1.1 ]гептан
Полициклические соединения содержат более двух циклов, со-
единенных мостиками. Названия каркасных полициклических уг-
леводородов происходят от эмпирических названий соответству-
ющих геометрических фигур, напоминающих их строение.
нс—!—сн
сн—сн
призман
кубан
Изомерия циклоалканов. Для циклоалканов характерны все виды
изомерии.
Структурная изомерия циклоалканов обусловлена величиной
цикла, природой и взаимным расположением заместителей:
а) изомерия размера цикла’.
метилциклопропан циклобутан
б) изомерия положения заместителей:
1,2~диметил циклогексан
сн
1,3-диметилциклогексан
7. Циклоалканы
75
в) изомерия боковых цепей:
пропил циклопропан изопропилпикл onponai [
Геометрическая изомерия циклоалканов обусловлена различ-
ным расположением заместителей относительно плоскости цикла.
транс-1,2-диметилциклобутан
(Z-изомер)
цис-1,2-диметилциклобутан
(Z-изомер)
Следует учитывать, что циклоалканы, как правило, имеют не
плоское (кроме циклопропана), а пространственное строение
в виде определенных конформаций.
При рассмотрении геометрических изомеров условно считают
строение циклоалканов плоским.
Оптическая изомерия характерна для циклоалканов, молекулы
которых не имеют плоскости симметрии.
Способы получения. Циклопропан, циклогексан и их гомологи
могут быть выделены в чистом виде из некоторых видов нефти.
Синтетические способы получения циклоалканов. 1. Взаимодей-
ствие а.,®-дигалогеналканов с металлическим натрием или цинком.
Данный метод — внутримолекулярный вариант реакции Вюрца,
позволяющий получить трех-, четырех- и пятичленные циклоал-
каны.
76
Углеводороды
+ 2Na
2
СН2 + 2NaBr
циклопропан
2. Пиролиз кальциевых, бариевых или ториевых солеи дикарбоно-
вых кислот. При пиролизе (сухой перегонке) солей дикарбоновых
кислот образуются циклические кетоны, которые затем восста-
навливают до соответствующих циклоалканов.
X)
сн—сн—с<0^ СН—СН2
-Сасо/
СНз—СНэ— СТ СНэ—СН,
сн— сн2
циклопентан
кальциевая соль
адипиновой кислоты,
адипинат кальция
циклопентанон
Этот метод позволяет получить пяти- и шестичленные цикло-
алканы.
3. Циклоприсоединение. Это процесс соединения двух или бо-
лее ненасыщенных молекул с образованием продукта цикличе-
ского строения. В зависимости от числа атомов, принимающих
участие в образовании цикла, различают [2+1]-, [2+2]- и [4+2]-
цикл©присоединение. Например, димеризация алкенов ([2+2]- цик-
лоприсоединение) позволяет получить циклобутан и его гомологи.
Н2С=СН2 Н2С—СН2
z f z п\> * I
>
Н2С=СН2 Н2С—сн2
этен циклобутан
Реакцию Дильса—Альдера (диеновый синтез) относят к реакци-
ям [4+2]-циклоприсоединения.
бутадиен-1,3
этен
циклогексен
циклогексан
Реакция широко используется для получения циклогексана
и его производных.
7. Циклоалканы
77
4. Электроциклические реакции. Электроциклической реакци-
ей замыкания цикла называют реакцию, в которой происходит
образование о-связи между концами открытой сопряженной сис-
темы молекулы.
гексатриен-1,3,5
циклогексадиен-1,3
[Н]
----►
циклогексан
Данный способ позволяет получить ненасыщенные алицик-
лические соединения, которые могут быть восстановлены до цик-
лоалканов.
Физические свойства. В обычных условиях циклопропан и цик-
лобутан — газы; циклоалканы, содержащие от 5 до 11 атомов угле-
рода в цикле,— жидкости; последующие представители — твер-
дые вещества.
Температуры кипения и плавления циклоалканов выше по срав-
нению с соответствующими алканами. Практически нераствори-
мы в воде.
Строение циклоалканов. Циклоалканы представляют собой
в определенной степени жесткие структуры.
Для циклоалканов характерны следующие виды напряжений:
— торсионное (Питцеровское) напряжение связано со взаим-
ным отталкиванием связей в заслоненной или частично засло-
ненной конформациях;
— напряжение Ван-дер-Ваалъса обусловлено взаимным оттал-
киванием заместителей при сближении на расстояние, близкое
сумме их ван-дер-ваальсовых радиусов;
— угловое (Байеровское) напряжение присуще отдельным цик-
лоалканам и связано с изменением величины валентного угла между
углерод-углеродными связями в цикле от тетраэдрического.
Теория напряжения циклов была предложена немецким хими-
ком-органиком А. Байером в 1885 году. Согласно этой теории
циклоалканы представляют собой плоские многоугольники. Един-
ственным фактором, определяющим прочность цикла, считалось
напряжение, вызванное отклонением внутренних валентных углов
цикла по сравнению с тетраэдрическим.
Если рассматривать форму циклоалканов в виде простых гео-
метрических фигур, имеющих плоское строение, то можно отме-
78
Углеводороды
тить, что при переходе от одного цикла к другому происходит
изменение валентного угла.
Чем значительнее отклонение, тем выше угловое напряжение
и менее устойчив цикл.
В соответствии с вышеприведенным трехчленный цикл менее
устойчив, чем четырехчленный, а последний — менее устойчив,
чем пятичленный. Эти представления подтверждались накоплен-
ным к тому времени экспериментальным материалом. Однако для
шестичленного цикла экспериментальные данные вступали в про-
тиворечия с теорией. Шестичленные циклы (внутренний угол 120°),
имеющие значительное отклонение валентных углов от тетраэд-
рического, оказались устойчивее пятичленных, в которых внут-
ренние углы наиболее близки к тетраэдрическим.
Причиной несоответствия теории Байера с эксперименталь-
ным материалом явилось ошибочное представление о плоском
строении циклов. В действительности же циклоалканы (исклю-
чая циклопропан) не имеют плоского строения.
Пространственное строение циклоалканов определяется раз-
ной конформационной подвижностью углеродных атомов, зави-
сящей от числа звеньев в цикле. Молекула любого циклоалкана
стремится принять в пространстве такую форму (конформацию),
в которой сумма углового, торсионного и ван-дер-ваальсового
напряжений была бы минимальной.
Наиболее жесткую структуру имеет циклопропан. В соответ-
ствии с правилами геометрии три точки всегда лежат в одной плос-
кости. Именно поэтому молекула циклопропана
С Л имеет плоское строение. Атомы водорода в дан-
2 ной молекуле находятся в заслоненной конфор-
мации, что и обусловливает сильное торсионное
напряжение. Свободное вращение вокруг углерод-
СН2 углеродных связей невозможно. Внутренние ва-
лентные углы в молекуле циклопропана сильно
отклонены от тетраэдрического, в результате чего и возникает боль-
шое угловое напряжение. Искажение валентных углов должно
составлять:
а = (109° 28’ - 60°): 2 = 24° 44’.
7. Циклоалканы
79
В действительности в молекуле циклопропана валентный угол
равен 106°. Согласно квантовохимическим представлениям изме-
нение угла является результатом изменения гибридизации атомов
углерода. Гибридизация орбиталей в молекуле циклопропана ближе
к sp чем к ^-гибридизации (промежуточное положение).
Вследствие взаимного отталкивания электронных облаков
углерод-углеродных связей максимальная электронная плотность
перекрывающихся орбиталей атомов углерода в молекуле цикло-
пропана расположена не по прямой, соединяющей центры свя-
занных атомов, а за пределами плоскости молекулы.
Образующиеся связи называют «банановыми», или т-(греч. «тау»)
связями. Они являются промежуточными между о- и л-связями.
Образование т-связей выгодно, так как валентные углы увеличи-
ваются до 106° (вместо теоретиче-
ски рассчитанных 60°), что приводит
к снижению углового напряжения
молекулы.
Четырехчленный цикл, в отли-
чие от трехчленного, все же облада-
ет незначительной гибкостью. Ва-
лентные углы искажены меньше, чем
в трехчленном цикле, несколько
ниже и угловое напряжение. Один
из углеродных атомов циклобутана
выходит из плоскости, что приво-
дит к уменьшению торсионного на-
пряжения цикла.
В пятичленном цикле практически отсутствует угловое напря-
жение (отклонение внутренних валентных углов от тетраэдриче-
ского составляет менее 1°). Однако в плоском пятичленном цикле
связи С—Н находятся в заслоненной конформации, что обуслов-
ливает значительное торсионное напряжение. Каждый из пяти
углеродных атомов циклопентана, стремясь уменьшить тор-
сионное напряжение в цикле, поочередно выходит из плоскости,
в которой расположены четыре оставшихся атома углерода. Цикл
находится в непрерывном волнообразном движении — псевдовра-
щении. Эта неплоская осциллирующая структура называется кон-
формацией «конверта». В конформации «конверта» угловое на-
пряжение увеличивается, однако это в полной мере компенсируется
снижением торсионного напряжения молекулы.
Если представить шестичленный цикл плоским, то его внут-
ренние валентные углы должны быть равными 120°, Это обусло-
Рис. 7.1. Образование
«банановых» связей
в молекуле циклопропана
80
Углеводороды
вило бы значительное угловое напряжение. Следует отметить, что
в плоской структуре появляются взаимодействия, связанные с за-
слонением С—Н-связей, то есть торсионное напряжение.
Однако циклогексан не является плоской структурой и суще-
ствует без углового напряжения, так как все валентные углы в нем
тетраэдрические (109° 28’).
До недавнего времени считали, что наиболее устойчивыми
структурами циклогексана являются две изомерные конформации,
взаимопревращающиеся друг в друга за счет поворота вокруг
о-связей без их разрыва: «кресла» С (от англ, chair — кресло)
и «ванны» В (от англ, boat — лодка).
С В
Более устойчивой является конформация «кресло», так как ли-
шена торсионного напряжения (все атомы углерода и водорода
находятся в заторможенной конформации). В конформации «ван-
на» происходит заслонение связей, расположенных вдоль двух
параллельных боковых сторон молекулы, что обусловливает тор-
сионное напряжение.
В настоящее время с помощью физико-химических методов
исследования установлено, что циклогексан может существовать
в различных конформациях: «кресло», теист-форма (искаженная
ванна), «полукресло», «ванна». Второй по устойчивости является
/явмсти-форма:
Она образуется в результате «скручивания» конформации
«ванна» в продольном направлении, что уменьшает напряжение
в цикле.
В обычных условиях преобладающая часть молекул циклогек-
сана (99,9 %) существует в конформации «кресло». В результате
вращения вокруг углерод-углеродных связей одна конформация
«кресло» переходит в другую, энергетически равноценную. Такой
процесс называют инверсией цикла.
7. Циклоалканы
81
конформация
«кресло»
конформация
«ванна»
твист-
конформация
конформация
«кресло»
Две конформации «кресло» могут взаимно превращаться как
с промежуточным образованием конформации «ванны», твист-
конформации, так и без прохождения через конформацию «ванна».
При изучении пространственного строения циклогексана было
установлено, что молекула циклогексана имеет в конформации
«кресло» два типа связей С—Н, одни шесть С—Н-связей распо-
ложены вдоль оси симметрии молекулы, а другие шесть — под
углом 109° 28’. Связи, параллельные оси симметрии, называют
аксиальными (обозначают символом «а»), а расположенные ради-
ально — называют экваториальными (обозначают символом «е»).
Каждый атом углерода имеет одну аксиальную, а вторую эква-
ториальную связь С—Н. При инверсии цикла (-100 000 раз в се-
кунду при 25 °C) все экваториально связанные атомы водорода
становятся аксиальными, а все аксиально связанные — экватори-
альными. Взаимопревращения в циклогексане протекают настолько
быстро, что все атомы водорода циклогексана становятся эквива-
лентными.
Две конформации «кресло» монозамещенного циклогексана
энергетически не равноценны. Более стабильной является кон-
формация с экваториальным положением заместителя. Аксиаль-
ное положение заместителя для циклогексана менее выгодно, так
как возникает стерическое отталкивание, обусловленное взаимо-
действием заместителя с аксиально расположенными атомами
водорода в положении 3 и 5.
82
Углеводороды
Химические свойства циклоалканов. Для циклоалканов, как
и для алканов, характерны реакции свободнорадикального замеще-
ния SB.
К
циклогексан
hv
hv
хлорциклопропан
+ НС1
бромциклогексан
+ НВг
Циклоалканы с малыми циклами проявляют своеобразные хи-
мические свойства, связанные с особенностями их строения. Из-за
значительного углового и торсионного напряжений трехчленный
и, в меньшей степени, четырехчленный циклы являются неустой-
чивыми. Именно поэтому для циклопропана и циклобутана наря-
ду с реакциями замещения характерны реакции присоединения, со-
провождающиеся раскрытием цикла.
1. Гидрирование
Н2; Ni; 50 °C
сн—сн—сн
циклопропан
пропан
Ni; 200 °C
-----* сн—сн2—сн—сн3
циклобутан
бутан
7. Циклоалканы
83
2. Галогенирование
+ Вг2
циклопропан
В г—СН — СН— СН — Вг
1,3-дибромпропан
Следует отметить, что циклобутан с Вг7 реагирует по меха-
низму SR.
3. Гидрогалогенирование
+ НВг
циклопропан
- СН,—СН,—СН,—Вг
с=/ X* -X
1 -бромпропан
Реакция присоединения галоген оводородов к алкилзамещен-
ным циклопропана протекает в соответствии с правилом Марков-
никова:
+ НВг
метилциклопропан
сн3—сн—сн2—сн3
2-бромбутан
Циклобутан с галогеноводородами не реагирует.
Для циклоалканов и их производных характерны реакции су-
жения и расширения циклов. Эти реакции являются каталитиче-
скими и протекают в присутствии кислот Льюиса:
A!Cl.„ t
.... ....
этилциклобутан
метилциклопентан
____________________8_____________________
АЛКЕНЫ
(ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, ОЛЕФИНЫ)
Углеводороды алифатического ряда, содержащие одну двой-
ную связь, называют алкенами.
71
Двойная связь с=С. состоит из о-связи, которая образо-
вана sp“-гибридизированными атомными орбиталями (АО) атома
углерода, и л-связи, образованной негибридизированными р-ор-
биталями. Строение двойной связи более подробно было рассмот-
рено ранее.
Общая формула алкенов СлН2и.
Номенклатура. Простейшим представителем углеводородов ряда
этилена является сам этилен, или этен (С2Н4, или Н2С=СН2).
Названия алкенов по заместительной номенклатуре ИЮПАК обра-
зуются путем замещения суффикса -ан в названии предельного
углеводорода на -ен, положение двойной связи указывается циф-
рой, при этом нумерация начинается с того конца цепи, к кото-
рому ближе расположена двойная связь:
Н7С=СН—СНа
н,с=сн—сн—сн,
4—г Jr
н,с—сн=сн—сн,
1 2 3 4 5
н3с—сн=сн—сн—сн3
пропен, или пропилен
бутен-1
бутен-2
4-метилпентен-2
СН3
Для низших членов гомологического ряда алкенов более упот-
ребимы тривиальные названия — этилен, пропилен, для осталь-
ных членов гомологического ряда применяют заместительную
номенклатуру.
Иногда используют рациональную номенклатуру. По этой но-
менклатуре углеводород рассматривают как производное этилена,
в молекуле которого атомы водорода замещены на радикалы.
8. Алкены (этиленовые углеводороды, олефины)
85
Например:
СН3—СН—СН=СН2
СН3
изопропилэтилен
сн—сн=сн2
метилэтилен
Если в молекуле этилена два атома водорода замещены на ра-
дикалы, то алкены рассматривают как симметричные или несим-
метричные.
н3с—сн=сн—сн3
симметричный
диметилэтилен
Н3С
''с СН,
Н3С
несимметричный
диметилэтилен
Название одновалентных радикалов алкенов получают добав-
лением к названию алкена суффикса -ил, атом углерода со свобод-
ной валентностью должен иметь наименьший номер, например:
3 2 1
н3с—сн=сн
пропен-1-ил
1 -метилэтенил
Для некоторых радикалов используются тривиальные названия:
Н2С=СН-
винил (этенил)
н2с=сн—сн2-
аллил (пропен-2-ил)
Изомерия. Для алкенов характерна изомерия углеродного ске-
лета, изомерия положения двойной связи и геометрическая
(цис-, транс-) изомерия:
изомерия положения
,ч
сн—сн—сн=сн2 сн—сн=сн—сн3
бутен-1 бутен-2
изомерия цепи
сн—сн—сн=сн2
бутен-1
сн3—с=сн2
сн3
2-метилпропен
Бутен-2 существует в виде двух пространственных изомеров:
86
Углеводороды
Имс-бутен-2
транс-бутен-2
Если у атомов углерода, связанных двойной связью, имеется
три или четыре разных заместителя, используют ^1Г-систему обо-
значений геометрических изомеров.
Способы получения. 1. Природные источники (нефть, природ-
ный газ).
2, Крекинг высших алканов, то есть термическое разложение
предельных углеводородов с образованием низкомолекулярных
предельных и непредельных соединений.
3, Дегидратация предельных одноатомных спиртов. Алкены легко
могут быть получены дегидратацией спиртов. В лабораторных ус-
ловиях в качестве водоотнимающего средства обычно используют
серную или фосфорную кислоты:
Н3С—СН—ОН —°* ~ H2C=CH2t + Н2О
этанол этилен
В промышленности применяют алюминия оксид. Пары спир-
та пропускают над катализатором при температуре 300—400 °C:
н3с—сн2—сн—он ' н3с—сн=сн2 + Н2О
пропанол-1 пропилен
Реакция протекает на границе раздела между твердой фазой
и газообразной (гетерогенный катализ).
Отщепление воды от спирта с разветвленной структурой под-
чиняется правилу А. Зайцева (1875), то есть при образова-
нии молекулы воды водород отщепляется от наименее гидрогенизи-
рованного атома углерода1.
СН3
н3с—сн—с—сн3 сн — сн=с—сн3 + Н2О
I “1—-I _| I
[рн_ Hi СН3
З-метилбутанол-2
З-метилбуген-2
4. Отщепление галогеноводородов от галогеналканов. При дей-
ствии спиртового раствора щелочи на моногалогенопроизводные
отщепляется галогеноводород, и образуются алкены.
н3с—СН2—Вг —Он -ирт' р'р- Н2С=СН2 + NaBr + Н2О
8. Алкены (этиленовые углеводороды, олефины)
87
5. Дегалогенирование дигалогеноалканов. Вицинальные дигало-
геноалканы (с атомами галогена у соседних атомов углерода) при
нагревании с Zn или Mg в водноспиртовом растворе отщепляют
два атома галогена, образуя алкены:
- Нзс— СН=СН, + ZnBr2
6. Дегидрирование алканов. Это промышленный метод полу-
чения алкенов. Реакцию проводят при температуре не выше
600 °C во избежание разрыва С—С-связей (крекинг). В качест-
ве катализатора используют мелкораздробленный никель, хро-
ма (III) оксид Cr-CL и др.
JLb w*
Н3С
сн—сн2
сн3
Сг2О3
300-400 °C
сн2=сн—сн2—сн3
бутен-1
сн—сн=сн—сн3
бутен-2
Физические свойства. Первые представители гомологического
ряда алкенов С2—С4 — газы; С5—С17 — жидкости; С18 и выше —
твердые вещества. С увеличением молекулярной массы увеличи-
ваются температура плавления, температура кипения, удельный
вес*. Алкены практически нерастворимы в воде, сами являются
хорошими растворителями. Они горят более коптящим пламенем,
чем алканы, что объясняется большим процентом содержания уг-
лерода.
Химические свойства. Химические свойства алкенов обуслов-
лены наличием двойной С=С-связи.
Двойная связь ^С=С^ значительно короче (0,134 нм) про-
стой о-связи. Энергия этой связи 611 кДж/моль, на разрыв о-свя-
зи приходится 339,6 кДж/моль, тогда энергия разрыва л-связи бу-
дет равна: 611 - 339 = 272 кДж/моль, то есть энергия л-связи
невелика. Этим объясняется легкость, с которой непредельные
углеводороды вступают в реакции присоединения.
Для алкенов характерны также реакции окисления, восстанов-
ления и полимеризации.
* Алкены с нормальным строением кипят при более высокой температуре,
чем их разветвленные изомеры. Температура кипения цис-изомеров выше, чем
/ираис-изомеров, а температура плавления — наоборот.
88
Углеводороды
L Гидрогенизация (гидрирование) — присоединение водорода
протекает в присутствии катализаторов (тонкоизмельченных Pt,
Pd или Ni).
Ni
СН =СН9 + н, —- сн —сн.
J- X J J
2. Присоединение галогенов (галогенирование). Алкены легко
присоединяют хлор и бром, труднее — йод, в результате образу-
ются вицинальные дигалогенопроизводные алканов.
Н2С=СН2 + Вг2
СН— СН2
Вг Вг
1,2-дибромэтан
Присоединение происходит по электрофильному механизму
Ае (присоединение электрофильное). Под влиянием п-электрон-
ной плотности двойной связи молекула брома поляризуется, при
этом образуется л-комплекс:
Н2С=СН2 + Вг2
сн,
сн2
5+ 6-
-Вг-*Вг
тг-комплекс
Электронодефицитный атом брома забирает пару электронов
л-связи на образование о-связи с атомом углерода, в результате
образуется о-комплекс:
СН2 5+ 8_
—-*Вг—Вг
СН2
ион карбония бромоний-катион
(а-комплекс)
а-Комплекс представляет собой равновесную систему, состоя-
щую из карбокатиона и бромоний-иона.
Взаимодействие о-комплекса с бромид-ионом происходит сте-
реоселективно, то есть бромид-ион атакует о-комплекс с проти-
воположной стороны от имеющегося галогена. Такое присоеди-
нение называется /лрянс-присоединением.
8. Алкены (этиленовые углеводороды, олефины)
89
Вг
- Н2С—СН2
Вг
Эта реакция имеет аналитическое значение для качественного
и количественного определения соединений, содержащих двой-
ную углерод-углеродную связь.
Направление реакции галогенирования может изменяться в за-
висимости от условий. Так, алкены с галогенирующими реагента-
ми (хлором, N-бромсукцинимидом) в присутствии инициаторов
процесса образования свободных радикалов (пероксидов, темпе-
ратуры, УФ-света) вступают в реакцию свободнорадикального за-
мещения. При этом атом водорода у атома углерода в а-положе-
нии к двойной связи замещается на галоген. Такое замещение
получило название аллильного.
Н2С=СН—СН3 + С12 500 600 Н2С=СН—СН —С1 + НС1
аллилхлорид
3. Присоединение галогеноводородов (гидрогалогенирование). Ал-
кены вступают в реакцию присоединения со всеми галогеноводо-
родами. В случае этилена или симметричных алкенов образуется
один продукт реакции независимо от того, к какому атому угле-
рода присоединяется водород или галоген:
СН2=СН2 + НВг
бромэтан
Н3С—СН=СН—СН3 + НВг —- н,с—сн —сн—сн,
Вг
2-бромбутан
Если галогеноводород присоединяется к несимметричному ал-
кену, то во время реакции могут образоваться два продукта, на-
пример:
Н3С—СН=СН2
НВг
сн—сн—сн3
Вг
2’бромпропан
СН3—СН2—СН,Вг
1-бромпропан
90
Углеводороды
В 1869 году русский химик В. В. Марковников на основании
экспериментальных данных установил закономерность в присо-
единении галогеноводородов и родственных им соединений не-
симметричным алкенам, известную под названием правила
Марковников а. Его сущность в следующем: при взаимодей-
ствии галогеноводородов и родственных им соединений с несиммет-
ричными алкенами атом водорода присоединяется к более гидрогени-
зированному атому углерода, то есть к атому углерода, содержащему
большее число атомов водорода.
Это — эмпирическое правило, а теперь, используя электрон-
ные представления, дадим пояснения к нему.
Направленность присоединения определяется поляризацией
алкена в нереагирующем состоянии. Вследствие -(-/-эффекта
и о,л-сопряжения со стороны алкильных групп л-электронная
плотность двойной связи смещена к более гидрогенизированному
атому углерода, что определяет наиболее вероятное место присо-
единения водорода.
Кроме того, из двух возможных вариантов присоединения пре-
имущественно реализуется тот, при котором в качестве промежу-
точного продукта присоединения образуется более устойчивый
карбокатион:
- н3с—с—сн,
** I **
сн3
третичный карбокатион (более устойчив)
Н3С
нс—сн2
Н3С
первичный карбокатион
4. Присоединение воды (гидратация). Гидратация алкенов идет
в присутствии минеральных кислот, чаще всего серной, и приво-
дит к образованию спиртов:
СН,—CH^CHj + НОН сн3—сн—снэ
он
пропанол-2
8. Алкены (этиленовые углеводороды, олефины)
91
Механизм реакции следующий:
н3с—сн=сн2 + н+ медленно - н3с—сн—сн3
изо пропил катион
быстро
н3с—сн—сн3
изопропилоксониевый катион
Н3С
сн
он
сн3 + н+
5. Присоединение гипогалогенных кислот (гипогалогенирование).
Гипогалогенные кислоты (НОС1; НОВг; HOI) присоединяются
к алкенам по двойной связи с образованием галогенгидринов.
Механизм реакции электрофильный:
Н2С=СН2 + НОС1
- Н2С—СН2
I I
она
этиленхлоргидрин
6. Озонирование алкенов. При взаимодействии алкенов с озо-
ном образуются перекисные соединения, которые называются озо-
нидами. При обработке цинком в уксусной кислоте озониды раз-
рушаются с образованием альдегидов или кетонов в зависимости
от строения алкена.
Н3С—СН=СН—СН3 + О3
бутен-2
*
сн3
сн/ \ СН
сн3
Zn; CH3COOH
----
Л)
- 2СН —
этаналь
Сопоставляя продукты реакции, можно судить о наличии и по-
ложении двойной связи в этиленовом углеводороде.
7. Окисление раствором калия перманганата (реакция Вагнера,
1888) — гидроксилирование. Большое значение имеет реакция
окисления алкенов КМпО4, которая известна как реакция Е. Ваг-
92
Углеводороды
нера. При взаимодействии алкенов с разбавленным водным рас-
твором КМпО4 в слабощелочной или нейтральной среде образу-
ются двухатомные спирты (гликоли):
КМпО4
Н2О
Н20; ОН"
СН2
он
+ МпО, + КОН
он
этиленгликоль
Эта реакция является качественной на кратные связи, по обес-
цвечиванию раствора калия перманганата можно судить о непре-
дельное™ соединения.
8. Полимеризация алкенов. Полимеризация является важным
свойством этиленовых углеводородов. Полимеризация — это об-
разование высокомолекулярных соединений (полимеров) из низ-
комолекулярных (мономеров) в результате соединения молекул
мономера.
лСН2=СН2
этилен
(мономер)
есн—сн2э-
полиэтилен
(полимер)
Группа -(“СН2—СН2-^- — это элементарное звено полимера,
то есть элементарный состав полимера не отличается от состава
мономера.
АЛКАДИЕНЫ
(ДИЕНОВЫЕ УГЛЕВОДОРОДЫ, ДИОЛЕФИНЫ)
Диеновые углеводороды — это углеводороды, содержащие в сво-
ей структуре две двойные связи. Общая формула — ЦН2л2.
Простейшим представителем алкадиенов является аллен, или
пропадиен Н2С=С==СН2.
Названия алкадиенов по заместительной номенклатуре
ИЮПАК образуют путем прибавления к корню предельного угле-
водорода суффикса -диен с указанием положения каждой из двой-
ной связи. Например:
1 2 3 4 1 2 3 4 5
н2с=сн—сн=сн2
Н2С—С—сн2—сн=сн2
бутадиен-1,3;
дивинил
сн3
2-метилпентадиен-1,4
Для некоторых алкадиенов сохранились тривиальные назва-
ния.
СН3
изопрен
В зависимости от взаимного расположения двойных
связей алкадиены делятся на три группы.
1. Алкадиены с кумулированными двойными связями — аллено-
вые углеводороды.
^с=с=с^
В алленовых углеводородах двойные связи находятся в поло-
жении 1, 2. Представителем является аллен.
аллен
94
Углеводороды
2. Алкадиены с изолированными двойными связями
Двойные связи находятся друг от друга на расстоянии больше
одной о-связи.
1 2 3 4 5 6
н2с=сн—сн2—сн2—сн—сн2
гексадиен-1,5
3. Алкадиены с сопряженными, конъюгированными двойными свя-
зями
^С==СН—Н С=С
Двойные связи разделяются одной о-связью. Первым пред-
ставителем этого ряда является дивинил, или бутадиен-1,3.
Н2С=СН—СН=СН2
дивинил
Строение алкадиенов. Строение алкадиенов с кумулированны-
ми двойными связями рассмотрим на примере аллена (рис. 9.1).
В его молекуле центральный атом углерода находится в ^-гиб-
ридизации, а атомы углерода метиленовых групп — в sp-гибри-
дизации. Все три атома углерода расположены в пространстве
линейно, а л-связи находятся в двух взаимно перпендикулярных
плоскостях.
Рис. 9.1. Строение молекулы аллена
В молекулах алкадиенов с сопряженными двойными связями
происходит дополнительное перекрывание р-электронных обла-
ков соседних л-связей (л,л-сопряжение) и образуется единая
л-электронная система. Ниже (рис. 9.2) показано образование еди-
ного л-электронного облака в молекуле бутадиена-1,3.
9. Алкадиены (диеновые углеводороды, диолефины)
95
бутадиен-1,3
я,л-сопряжение
Рис. 9.2. Строение молекулы аллена
делокализованная
л-система
В результате 71,71-сопряжения происходит укорачивание
су-связи.
Так, в молекуле бутадиена-1,3 длина связи С2—С3 составляет
0,148 нм, тогда как длина связи С—С в этане — 0,154 нм. Энергия
сопряжения бутадиена-1,3 составляет примерно 15 кДж/моль.
Алкадиены с изолированными двойными связями построены
аналогично алкенам.
Особенности строения алкадиенов различных типов сказыва-
ются на их реакционной способности. Диены с кумулированны-
ми и изолированными связями напоминают по химическим свой-
ствам алкены, вступая в реакции присоединения с участием двух
двойных связей самостоятельно.
Для сопряженных диенов характерны некоторые особенности
в химических свойствах.
АЛКАДИЕНЫ С СОПРЯЖЕННЫМИ СВЯЗЯМИ
Способы получения. 1. Каталитическое дегидрирование алканов .
и алкенов. Это промышленный метод получения дивинила (бута-
диена-1,3) и изопрена (2-метилбугадиена-1,3). Катализатором ре-
акции является смешанный оксидный алюмохромовый катализа-
тор СгСМАЦО,.
Н,С—СН2—СН—СН3 -]
ио ‘с- н2с=сн—сн=сн2
Н3С=СН—СН2—СН, -I "Нз бутадиен-1,3
96
Углеводороды
Н3С—сн—сн,—сн,
сн3
Н3С—сн—сн=сн2
5S0 °с
------>
н2с=с—сн—сн2
СН3
2-метил бутадиен-1,3
СН3
2. Способ С. В. Лебедева, По этому методу бутадиен-1,3 полу-
чают из этилового спирта путем одновременного каталитического
дегидрирования и дегидратации на смешанном цинкалюминие-
вом катализаторе:
2C2H5OH ZnO/A1:Oi- Н,С=СН—CH=CH, + 2Н,О + H,
Химические свойства. Сопряженные диены проявляют нена-
сыщенный характер. Наличие сопряженной системы в их молеку-
ле приводит к тому, что они присоединяют различные вещества
не только по месту одной двойной связи (1,2-присоединения), но
и к крайним атомам сопряженной системы с перемещением двой-
ной связи (1,4-присоединение). Соотношение этих продуктов за-
висит от условий проведения реакции и природы электрофильно-
го реагента.
1. Гидрирование, Водород в момент выделения образует с алка-
диенами-1,3 обычно продукты 1,4-присоединения, например:
н2с—сн—сн—сн2 -------------- н3с—сн—сн—сн3
2 2 2СН30Н + 2Na 3 3
бутен-2
В присутствии катализаторов (Ni, Pt) диены-1,3 присоединя-
ют водород в 1,2- и 1,4-положения с образованием соответствую-
щих алкенов, которые подвергаются дальнейшему гидрированию
до алканов:
г*Н3С
бутен-1
СН2-п
Н2С—СН
сн
сн2
н2; Kt
Н7; Kt
--Z----
Н3С—сн=сн
сн,—
яг
бутен-2
- н3с—сн2—СН2—СН3
бутан
2. Присоединение галогенов. Присоединение галогенов приво-
дит к образованию смеси продуктов 1,2- и 1,4-присоединения.
9. Алкадиены (диеновые углеводороды, диолефины)
97
Как правило, при повышении температуры и переходе от хлора
к йоду возрастает выход продукта 1,4-присоединения. Например,
в процессе бромирования бутадиена-1,3 при температуре —80 °C
образуется преимущественно продукт 1,2-присоединения, а при
40 °C — продукт 1,4-присоединения:
1,2-присоединение
н2с=сн—сн=сн2
] ,4-присоединение
Вг Вг
I I
Н2С—СН—сн=сн2
3,4-дибромбутен-1
Н2С—сн=сн=сн2
Вг Вг
1,4-дибромбутен-2
Присоединение галогенов к сопряженным алкадиенам проис-
ходит по электрофильному механизму. Особенность механизма
состоит в том, что электрофильная частица атакует концевой атом
углерода сопряженной системы, поскольку при этом образуется
мезомерно стабилизированный карбокатион, строение которого
можно представить граничными структурами I и II:
Н2С=СН—СН=СН2
Н2С=СН—СН=СН2 -г-
z I —иг
Т8+ 8-
Вг—-В г
л-комплекс
-н2с—сн—сн=сн2 -----*н2с—сн=сн—сн2
Вг Вг
I. II.
Последующая атака карбокатиона бромид-ионом приводит
к образованию продуктов 1,2- (III) и 1,4-присоединения (IV):
IV.
98
Углеводороды
3. Присоединение галогеноводородов. Присоединение гало-
геноводородов также происходит с образованием продуктов 1,2-
и 1,4-присоединения:
1,2-присоединение
Н2С=СН—СН=СН2
НВг
Вг
н3с—сн-—сн=сн2
З-бромбутен-1
1,4-присоединение
н3с—сн=сн—сн2
1-бромбутен-2 В Г
4. Реакция Дильса — Альдера (диеновый синтез). Реакция ос-
нована на взаимодействии сопряженных диенов с веществами,
имеющими в своем составе двойную или тройную углерод-угле-
родную связь (так называемыми диенофилами). В процессе реак-
ции диеновые углеводороды присоединяют диенофилы в положе-
ние 1,4 с образованием циклических структур:
бутадиен-1,3 малеиновый
ангидрид
ангидрид 1,2,3,6-тетра-
гидрофталевой кислоты
Эта реакция является качественной на соединения, содержа-
щие сопряженные двойные связи. Протекает по молекулярному
механизму, который характеризуется синхронным процессом раз-
рыва и образования связей в реагентах ([4+2]-циклоприсоеди-
нение).
5. Полимеризация. Важным свойством сопряженных диенов яв-
ляется их склонность к полимеризации, причем полимеризация
происходит предпочтительно по положениям 1 и 4 как по ионно-
му, так и по свободнорадикальному механизмам:
п Н2С=СН—НС=СН2
бутадиен-1,3
* -ен2с—сн=нс—сн2
1,4-полибутадиен
Реакция полимеризации широко используется в производстве
синтетического каучука.
9. Алкадиены (диеновые углеводороды, диолефины)
99
А что же такое натуральный каучук? Его получают из латекса
(млечный сок) тропического растения гевеи, произрастающей глав-
ным образом в Бразилии. Выделяющийся при подсочке деревьев
млечный сок содержит 20—60 % каучука, который осаждают до-
бавлением муравьиной или уксусной кислоты.
По химическому строению натуральный каучук представля-
ет собой линейный стереорегулярный полимер изопрена (поли-
изопрен), имеющий цис-конфигурацию изопреновых звеньев:
Молекулярная масса натурального каучука составляет в сред-
нем 100 000-150 000.
—____________10
АЛКИНЫ
(АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ)
Углеводороды алифатического ряда, содержащие одну трой-
ную связь, называют алкинами.
Алкины образуют гомологический ряд общей формулы СлН2й 2,
родоначальником ряда является ацетилен НСОСН. Как видно из
общей формулы, алкины являются изомерами алкадиенов.
Номенклатура и изомерия. По номенклатуре ИЮПАК назва-
ния алкинов образуют от названий соответствующих алканов, за-
меняя суффикс -ан на -ин с указанием положения тройной связи
в цепи углеродных атомов. Нумерацию углеродной цепи начина-
ют с того конца, к которому ближе расположена тройная связь.
Например,
СН
4-метилпентин-2
Согласно рациональной номенклатуре ацетиленовые углево-
дороды рассматривают как производные ацетилена, в молекуле
которого атомы водорода замешены на радикалы:
н3с—С^СН
н3с—СН— С=СН
н.с—ОС- СН.
«J J
метилацетилен
этилацетилен
диметилацетилен
Названия радикалов образуются путем добавления окончания
-ил к названию углеводорода:
НСОС—СН.
этинил
1-пропинил
2-пропинил (пропаргил)
Изомерия ацетиленовых углеводородов начинается с третьего
члена гомологического ряда.
10. Алкины (ацетиленовые углеводороды)
101
Для алкинов характерны структурная изомерия, которая обус-
ловлена различной структурой углеродной цепи, и изомерия по-
ложения тройной связи.
изомерия цепи
Н,С—СН—С-СН
п
сн3
З-метилбутин-1
изомерия положения
бутин-1
Н3С—сн — сн — с=сн
пентин-1
бутин-2
Способы получения. В промышленном синтезе широко исполь-
зуется ацетилен, для получения которого существует ряд спе-
цифических способов. Гомологи ацетилена чаще всего получают
дегидрогалогенированием дигалогеналканов и алкилированием
ацетиленидов.
А. Промышленные способы получения. 1, Карбидный метод.
При взаимодействии кальция карбида с водой образуется ацетилен:
СаС, +
2Н,О
НС=^СН + Са(ОН),
А»
2. Пиролиз метана или нефтяных фракций. Метан подвергают
действию высокой температуры в течение короткого времени и за-
тем быстро охлаждают с целью избежать дальнейшего расщепле-
ния ацетилена на углерод и водород:
2СН4 —°0-- НС&СН + ЗН2
Б. Лабораторные способы получения. /. Дегидрогалогенирование
дигалогеналканов и галогеналкенов. При нагревании вицинальных
или геминальных дигалогеналканов со спиртовым раствором ще-
лочи образуются алкины:
Н,С—СН, + 2NaOH С;Н,-Н • НС^СН + 2NaBr + 2Н2О
Z J । х.
Вг Вг
1,2-дибром эта и ацетилен
С н ОН
Н3С—СН2—СНВг2 + 2NaOH 2 5 - Н3С—С^СН + 2NaBr + 2Н2О
1,1 -дибромпропан пропин
102
Углеводороды
В аналогичных условиях алкины образуют также галогеналке-
ны, содержащие атом галогена у атома углерода с двойной связью.
2, Реакции алкилирования ацетиленов. При взаимодействии ме-
таллических производных ацетиленовых углеводородов с алкил-
галогенидами образуются алкины с большим числом атомов угле-
рода в молекуле:
с2н5—Вг
HC=CNa 2 ’ НС=С-С,Н.
-biaBr 2 3
ацетиленид бутин-1
натрия
Н3С—C^CMgl C”f-' » н,с—с=~-с—сн,
J - Mgl2 J
пропин и л магний- бутин-2
йодид
Физические свойства. Три первых представителя гомологиче-
ского ряда представляют собой газы, далее следуют жидкости
(С5—С15), а начиная с углеводорода С16Н30,—твердые вещества.
Изменения температур плавления и кипения в ряду алкинов под-
чиняются основным закономерностям, характерным для алканов
и алкенов.
Химические свойства. Химические свойства ацетиленовых уг-
леводородов обусловлены наличием в их структуре тройной свя-
зи. Атомы углерода, связанные тройной связью, находятся в со-
стоянии sp-гибридизации. Вы знаете, что тройная связь — это
сочетание одной о-связи и двух л-связей, расположенных во вза-
имно перпендикулярных плоскостях, ее длина около 0,120 нм,
энергия связи 812 кДж/моль. Для алкинов, как и для алкенов,
характерны реакции электрофильного присоединения. Но по срав-
нению с алкенами алкины менее активны, реакции протекают,
как правило, в две стадии. Это объясняется большей электро-
отрицательностью sp-гибридизированного атома углерода по
сравнению с sp'-гибридизированным атомом, что приводит
к уменьшению длины связи —С=С—. Этим объясняется и сла-
бый —СН-кислотный характер алкинов: R— С^С5 ^— Н5+.
Таким образом, наряду с реакциями присоединения для аце-
тиленовых углеводородов характерны и реакции замещения ато-
ма водорода концевой С—Н-группы. Наконец, аналогично алке-
нам алкины вступают также в реакции окисления, восстановления
и полимеризации.
А. Реакции присоединения. 1. Гидрирование. Присоединение во-
дорода проходит ступенчато по месту тройной связи в присут-
ствии катализаторов. Такой процесс называется стереоселектив-
ным гидрированием.
10. Алкины (ацетиленовые углеводороды)
103
бугин-2
[Н]; Li; NH
[HJ; Pd; С
цис -бутен-2
бутен-2
ЩЦ
н3с—н2с—сн—сн3
бутан
2. Галогенирование. Алкины довольно легко присоединяют по
месту тройной связи одну молекулу хлора или брома, в результате
образуется преимущественно /лранс-дигалогеналкен. Присоедине-
ние второй молекулы галогена идет труднее. Механизм реакции
аналогичен галогенированию алкенов АЕ.
транс-1,2-дибромпропен
Вт2
Вг Вг
Вг Вг
1,1,2,2-тетрабромпропан
Обесцвечивание бромной воды — качественная реакция на
тройную связь.
3. Гидрогалогенирование. Присоединение галогеноводородов
(НС1, НВг) происходит также в две стадии с образованием соот-
ветственно моногалогенозамещенных или геминальных дигалоген-
алканов.
Реакция может проходить по механизму электрофильного или
радикального присоединения. В первом случае соблюдается пра-
вило Марковникова. При галогенировании в условиях свободно-
радикального присоединения наблюдается противоположное
направление реакции:
Вг
НВг
3
Вг
НВг
Вг
НВт
2-бромпропен
2,2-дибромпропан
Н,С—СН=СНВг
—СНВг
3
2
1-бромпропен-1
1,1 -дибромпропан
104
Углеводороды
4. Гидратация (реакция Кучерова). Алкины очень легко при-
соединяют воду в кислой среде в присутствии солей ртути (II)
в качестве катализатора. Присоединение происходит в соответ-
ствии с правилом Марковникова. При этом из ацетилена образу-
ется уксусный альдегид, а также гомологи ацетилена — кетоны:
НС=СН + НОН
H2SO4
HgSO4
уксусный альдегид
H,SO4
HgSO4
виниловый спирт
* Н3С—С—СН3
О
ацетон
Гидратация алкинов протекает через стадию образования непре-
дельных спиртов, содержащих гидроксильную группу у атома уг-
лерода с двойной связью. Такие спирты неустойчивы. В процессе
образования они изомеризуются в карбонильные соединения. Эту
закономерность установил в 1877 году русский химик А. П. Эльте-
ков, и она получила название правила Эльтекова.
Реакция Кучерова лежит в основе производства уксусного аль-
дегида, уксусной кислоты и уксусного ангидрида.
5. Присоединение спиртов и кислот. Этим способом получают
эфиры не существующего в свободном состоянии винилового спир-
та. Реакция протекает по механизму нуклеофильного присоеди-
нения А '
RON а
нс=сн + С2Н5ОН----------* Н2С=СН—ОС2Н5
винилэтиловый эфир
Катализаторами нижеприведенной реакции являются соли
ртути (II), меди (I), кислоты Льюиса.
нс==сн +
Н3С
Hg2+
н2с=сн—о—с—сн3
виниловый эфир
уксусной кислоты
Виниловый эфир уксусной кислоты используется для произ-
водства полимера поливинилацетата (ПВА).
Б. Реакции замещения. 1. Образование ацетиленидов. Способ-
ность ацетиленов с концевой тройной связью отдавать протон
10. Алкины (ацетиленовые углеводороды)
105
позволяет говорить о них как о соединениях, проявляющих кис-
лотные свойства. И хотя их кислотность очень мала, тем не менее
алкины способны к реакциям замещения и реагируют с сильны-
ми основаниями, образуя при этом соли. Такие соли называют
ацетиленидами.
Если пропускать через аммиачный раствор солей одновалент-
ной меди или серебра ацетилен, из раствора выпадает соответ-
ственно красно-коричневый осадок меди ацетиленида или белый
осадок серебра ацетиленида:
НС^СН + 2[Ag(NH3)2]OH
НС^СН + [Cu(NH3)3]OH
- Ag—ОС-Ag + 4NH3 + 2Н2О
серебра ацетиленид
~ Си—С'^С—Си + 2NH3 + Н2О
меди ацетиленид
Ацетилениды тяжелых металлов в сухом виде чувствительны
к трению, удару и легко взрываются.
Ацетилениды натрия представляют особый интерес как про-
межуточные соединения для синтеза других алкинов. Они легко
вступают в реакцию нуклеофильного замещения с галогеналка-
нами:
НСОСН + 2NaNH2
* Na—СОС—Na + 2NH3
натрия ацетиленид
Na—ОС-Na + 2СН31 ------ Н3С—СОС—СН3 + 2NaI
Аналогично протекает реакция с реактивами Гриньяра (маг-
нийорганическими соединениями). Русскими учеными Чугаевым
и Церевитиновым был предложен способ определения подвиж-
ных атомов водорода с помощью магнийорганических соедине-
ний в органических соединениях:
НС^СН + 2CH3MgI --- IMgC=CMgI + 2CH4f
По количеству атомов водорода выделяется эквивалентное ко-
личество СН4. Метан собирают, определяют объем и рассчитыва-
ют число подвижных атомов водорода. Этот метод имеет анали-
тическое значение.
2. Замещение водорода при С на галоген. Атомы водорода при
углероде с тройной связью замещаются на атомы галогенов при
действии галогенов в присутствии щелочей.
нс=сн
Cl2; NaOH
-Н,О
нс^с—С1
CI2; NaOH
-н2о
С1—С^С- С1
хлорэтин
дихлорэтан
106
Углеводороды
В. Реакции окисления. Алкины, подобно алкенам, подверга-
ются окислению по месту тройной связи. Продуктами реакции
являются соответствующие карбоновые кислоты. В качестве окис-
лителей используют калия перманганат в нейтральной или ще-
лочной среде, озон и др.
НС^СН
[О]
КМпО4, н2о
* СО2! + Н
щавелевая кислота муравьиная кислота
При окислении ацетилена в нейтральной среде образуется ща-
велевая кислота, которая в этих условиях декарбоксилируется,
и конечным продуктом будет муравьиная кислота. Гомологи аце-
тилена окисляют в щелочной среде с разрывом по месту тройной
связи.
Н3С—СН2—С^С—СНз
пентин-2
[О]
КМпО4; ОЦ-
пропионовая кислота уксусная кислота
Реакция окисления алкинов используется для определения их
строения.
Г. Полимеризация алкинов (димеризация, циклотримеризация).
Алкины способны полимеризоваться в нескольких направлениях.
В присутствии меди (I) хлорида и аммония хлорида ацетилен ди-
меризуется с образованием винилацетилена:
CuCl; NH4C1
нс^сн + нс^сн —-—— н2с=сн—с^сн
винилацетилен
Винилацетилен является исходным продуктом в производстве
хлоропреновых каучуков.
При нагревании в присутствии активированного угля или ком-
плексных никельорганических катализаторов ацетилен циклотри-
меризуется с образованием бензола:
ЗНСт-СН
Это один из синтетических способов получения ароматиче-
ских углеводородов.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
(АРЕНЫ)
Ароматическими первоначально называли органические соеди-
нения, которые или сами имели приятный запах, или же их выде-
ляли из природных веществ, обладающих приятным запахом. Впо-
следствии среди них были обнаружены соединения с приятным
и неприятным запахами, а также соединения без запаха. Однако
название за большой группой органических соединений, прояв-
ляющих сходные с бензолом свойства, сохранилось.
К ароматическим углеводородам, или аренам, относятся со-
единения, молекулы которых содержат одно или несколько бен-
зольных колец.
В зависимости от количества бензольных циклов,
входящих в состав молекулы, различают одноядерные (моноцикличе-
ские) и многоядерные (полициклические) арены.
11
МОНОЯДЕРНЫЕ АРЕНЫ
Простейшим представителем одноядерных ароматических со-
единений является бензол С6Н6.
Впервые бензол был получен английским ученым М. Фара-
деем в 1825 году из светильного газа, образующегося в процессе
переработки каменного угля. Однако строение его молекулы в те-
чение многих лет оставалось загадкой для химиков. Несмотря на
то что формула С6Н6 предполагает достаточно выраженный нена-
сыщенный характер, бензол, в отличие от непредельных соедине-
ний, оказался относительно инертным веществом. Он сравнительно
устойчив к нагреванию и действию окислителей, практически не
108
Ароматические углеводороды (арены)
вступает в характерные для ненасыщенных соединений реакции
присоединения. Наоборот, для бензола более характерными ока-
зались не свойственные непредельным соединениям реакции
замещения.
Составу С6Н6 приписывались разные структурные форму-
лы, но все они не объясняли в полной мере химических свойств
бензола.
В 1865 году немецкий химик Кекуле предложил формулу
бензола, представляющую собой цикл из шести атомов углерода
с чередующимися простыми и двойными связями:
Формула Кекуле предполагает равноценность всех атомов
углерода и водорода в молекуле.
В соответствии с формулой Кекуле для дизамещенных произ-
водных бензола возможно существование таких двух изомеров:
Экспериментально же было установлено, что таких изомеров
не существует, то есть они существуют в виде одного соединения.
Для объяснения этого противоречия в 1872 году Кекуле вы-
двинул осцилляционную гипотезу, согласно которой двойные связи
в молекуле бензола не фиксированы, они непрерывно переме-
щаются (осциллируют):
Правильно отображая некоторые свойства бензола, формула
Кекуле, тем не менее, не согласовывалась с рядом установлен-
ных фактов. Все это возвращало химиков к пересмотру структуры
бензола.
В соответствии с современными представлениями, основан-
ными на данных квантовой химии и физико-химических иссле-
11. Моноядерные арены
109
дований, молекула бензола представляет собой правильный плос-
кий шестиугольник. Все углеродные атомы находятся в состоя-
нии sp2-гибридизации. За счет s/Лгибридизированных атомных
орбиталей каждый атом углерода образует три сг-связи (одну с ато-
мом водорода и две с соседними атомами углерода). Негибриди-
зированная р-атомная орбиталь участвует в образовании аромати-
ческого секстета. Облака л-электронов имеют форму объемной
восьмерки и расположены перпендикулярно плоскости цикла.
схема делокализации
я-електронов
Если посмотреть на проекцию л-электронной плотности сверху,
то мы можем увидеть такую картину:
Образование замкнутой сопряженной системы (ароматиче-
ского секстета) является для молекулы бензола энергетически вы-
годным. Экспериметально установлено, что сопряжение в цикле
приводит к уменьшению энергии на 150,7 кДж/моль по сравне-
нию с рассчитанной для циклогексатриена. Эта разность состав-
ляет энергию сопряжения.
В бензольном кольце нет простых и двойных связей в прямом
понимании этого слова. Такую связь называют ароматической.
по
Ароматические углеводороды (арены)
Если длина простой связи С—С в алканах составляет 0,154 нм,
длина двойной связи в алкенах — 0,134 нм, то длина С—С-связи
в молекуле бензола равна 0,140 нм, то есть является промежуточ-
ной между длиной одинарной и двойной связей.
Совокупность специфических свойств бензола — высокая ста-
бильность, инертность в реакциях присоединения, склонность
к реакциям замещения — получила общее название «ароматич-
ность», или «ароматические свойства».
Что же требуется для того, чтобы мы имели право отнести
соединение к ароматическому ряду?
а) молекула должна иметь замкнутую сопряженную систему;
б) для проявления ароматического характера молекула должна
прежде всего иметь плоское строение;
в) количество л-электронов должно соответствовать формуле
4и + 2, где п = 0; 1; 2; 3 и так далее (данная закономерность была
сформулирована в 1931 году немецким ученым Э. Хюккелем).
Номенклатура и изомерия. По заместительной номенклатуре
ИЮПАК одноядерные арены рассматривают как производные
бензола.
метилбензол,
толуол
этилбензол
сн~сн2
винил бензол,
стирол
Для однозамещенных производных бензола изомерия поло-
жения отсутствует, а возможна изомерия, связанная с разной струк-
турой заместителя.
н -пропил бензол
изопропилбензол
При наличии в молекуле бензола двух и более заместителей их
положение указывают цифрами. Нумерацию атомов углерода бен-
зольного кольца осуществляют таким образом, чтобы заместители
имели возможно меньшие номера.
11. Моноядерные арены
Ш
В дизамещенных производных бензола наряду с цифровым обо-
значением положений заместителей применяют приставки: орто-
(о-)положение — 1,2; л^/ла-(л/-)положение — 1,3 и пара-(п-)поло-
жение — 1,4.
СН
1,3-диметил бензол
л*-ксилол
1 - изопропил - 4-метил бензол
л-цимол
Кроме названий по заместительной номенклатуре, сохрани-
лись и тривиальные названия: толуол, ксилол, кумол и др.
Одновалентные радикалы аренов имеют общее название — ари-
лы Аг. Двухвалентные радикалы бензола называют фениленами
(о-, м-, п-):
фенил
о-толил
бензил
о-фенилен
Изомерия гомологов бензола обусловлена разными структура-
ми, числом и положением заместителей в бензольном кольце.
Дизамещенные производные бензола существуют в виде трех
изомеров, в зависимости от взаимного расположения в бензольном
кольце (изомеры положения).
1,2-диметил бензол,
о-ксилол
1,3-диметилбензол,
JW-КСИЛОЛ
1,4-диметилбензол,
л-ксилол
Для тризамещенных бензолов с одинаковыми заместителями
в бензольном кольце существуют также три изомера:
112
Ароматические углеводороды (арены)
1,2,3-триметилбензол,
рядовой триметилбензол,
вицинальный триметилбензол
1,2,4-асимметричный
три н и тробензол
1,3,5-триметилбензол,
симметричный триметилбензол
Способы получения аренов. 1. Циклотримеризация алкинов.
Ацетилен или его гомологи пропускают над активированным уг-
лем при повышенной температуре. Реакция была открыта Зелин-
ским.
ЗН(-СН
2, Обработка ацетона концентрированной серной кислотой
3, Дегидрогенизация алициклических соединений
циклогексан
Эта реакция показывает взаимосвязь между ароматическими
и алициклическими соединениями.
4. Реакция Вюрца—Фиттига
C6H5Br + CH3Br + 2Na
бромбензол
С6Н5СН,
метилбензол,
толуол
2NaBr
11. Моноядерные арены
113
Эта реакция чаще всего используется для получения гомоло-
гов бензола.
5. Алкилирование ароматических углеводородов по Фриделю —
Крафтсу
FeBr3
-НВг
этилбензол
Физические свойства. Бензол и его низшие гомологи пред-
ставляют собой жидкости, обладающие специфическим запахом.
Ароматические углеводороды нерастворимы в воде и хорошо рас-
творяются в органических растворителях. Многие из них сами
являются хорошими растворителями. Из-за высокого содержания
углерода горят коптящим пламенем.
Химические свойства. Реакционная способность бензола и его
гомологов определяется главным образом наличием в структуре
замкнутой л-электронной системы, которая является областью
повышенной электронной плотности. Ароматические углеводо-
роды, как и алкены, обладают нуклеофильным характером. Одна-
ко, в отличие от ненасыщенных соединений, при взаимодействии
с электрофильными реагентами арены более склонны к реакциям
замещения, а не присоединения, поскольку при этом сохраняется
их ароматический характер. Эти реакции носят название реакций
электрофильного замещения $Е.
Реакции присоединения для аренов менее характерны, так как
они приводят к нарушению ароматичности; с трудом вступают
ароматические углеводороды и в реакции окисления.
А. Реакции электрофильного замещения 5£. При атаке элект-
рофильной частицей л-электронной системы бензольного кольца
в результате электростатического взаимодействия образуется не-
устойчивый л-комплекс:
л-комплекс
Далее электрофил «вырывает» пару электронов из ароматиче-
ского секстета бензольного ядра, и между ним и одним из атомов
114
Ароматические углеводороды (арены)
углерода образуется ст-связь. Таким образом нарушается ароматич-
ность бензольного ядра, образуется карбокатион — о-комплекс.
Делокализацию положительного заряда в о-комплексе можно
представить с помощью резонансных структур (I—III):
л-комплекс
атом углерода
а-комплекс
L I. II. III.
Образование о-комплекса является наиболее высокоэнергетич-
ной стадией реакции, определяющей ее скорость. о-Комплекс
неустойчив, он отщепляет протон от атома углерода, связанного
с электрофилом, благодаря чему восстанавливается ароматичность
бензольного кольца.
К наиболее важным реакциям относятся реакции нитрова-
ния, сульфирования, галогенирования, алкилирования и ацили-
рования.
1, Нитрование. В качестве нитрующих агентов чаще исполь-
зуют концентрированную азотную кислоту или смесь концентри-
рованной азотной и серной кислот (нитрующая смесь):
TT-KTZ-X H2SO4 КОНЦ
+ HNO3 конц. "
NO,
нитробензол
11. Моноядерные арены
115
Атакующей электрофильной частицей в реакции является ион
нитрония NOj, который образуется в результате кислотно-основ-
ного взаимодействия между азотной и серной кислотами, где азот-
ная кислота играет роль основания:
HONO2 + H2SO4
NO2 + HSO;
протонированная
азотная кислота
н—о—NOj Н,О + NO,
I ион
и нитрония
Ион нитрония атакует л-электронную систему бензольного
ядра. В результате реакции образуется нитробензол:
4- NO2+
сг-комллекс
2, Сульфирование — это процесс замещения атома водорода
в бензольном ядре на сульфогруппу —SO3H. Для сульфирования
бензола и его гомологов применяют концентрированную серную
кислоту или олеум (раствор серы триоксида SO3 в серной кис-
лоте):
+ H2SO4 конц.
бензолсульфокислота
+ Н2О
Особенности механизма сульфирования аренов изучены недо-
статочно. Однако экспериментальные данные свидетельствуют
о том, что атакующей электрофильной частицей служит серы три-
оксид SO *
116
Ароматические углеводороды (арены)
2H,S0.
2 4
SO, + Н.0+ + HSO;
3 3 4
3. Галогенирование. Бензол и его гомологи хлорируются, бро-
мируются и йодируются. Замещение атома водорода в бензольном
ядре на атом хлора или брома осуществляют в присутствии ката-
лизаторов — кислот Льюиса (A1CL, FeBr,, ZnCl, и др.):
J Л—
хлорбензол
+ НС1
Под действием катализатора молекула галогена поляризуется.
Атакующей электрофильной частицей служит либо комплекс
поляризованной молекулы галогена с кислотой Льюиса, либо
катион галогена, образующийся в процессе ионизации данного
комплекса:
Cl—Cl + A1CL
8+ 3-
[С1— С1- • -А1С13]
СЦА1С14]"
4. Алкилирование по Фриделю — Крафтсу. Для введения алкиль-
ной группы в молекулу ароматического соединения в качестве
электрофильных реагентов чаще всего используют галогеналка-
ны. Взаимодействие происходит в присутствии катализаторов —
кислот Льюиса:
А1С1
хлорэтан
НС1
5
Атакующей электрофильной частицей является карбокатион,
который образуется при взаимодействии алкилирующего агента
и катализатора:
С2Н5—С1 + А1С13 —с2н; + А1С1;
карбокатион
Для алкилирования аренов также могут быть использованы
спирты (реакции протекают в присутствии кислот Льюиса или
11. Моноядерные арены
117
минеральных кислот — Н3РО4, H2SO4) или алкены (в этом случае
алкилирование требует присутствия кислот Льюиса и минераль-
ной кислоты как источника протонов).
По своему механизму реакция алкилирования аналогична ре-
акциям нитрования, сульфирования и галогенирования.
5. Ацилирование по Фриделю—Крафтсу, Ацилированием на-
зывают процесс введения в молекулу органического соединения
ацильной группы — R—С. •
Ацилирование бензола и его гомологов обычно осуществляют
галогенангидридами карбоновых кислот в присутствии кислот
Льюиса:
+ СН—С
ацетофенон,
метилфенилкетон
+ НС1
Электрофилом, атакующим бензольное кольцо, является
либо ацилиевый ион СН3—С—О, либо комплекс ацилгалогени-
да с катализатором СН3СОА1С17:
RCOC1 + А1С13 — RCOAlCi; —R—С=О + А1СЦ
Для введения ацильной группы могут быть использованы и ан-
гидриды карбоновых кислот.
Б. Реакции присоединения. Реакции присоединения не харак-
терны для аренов, они протекают в жестких условиях.
1. Гидрирование, При повышенных температуре и давлении,
в присутствии катализаторов (мелкопористый никель — никель
Ренея) бензол и его гомологи присоединяют три молекулы водо-
рода:
циклогексан
Остановить реакцию на стадии образования продуктов час-
тичного гидрирования невозможно, поскольку они гидрируются
значительно легче, чем сам бензол.
118
Ароматические углеводороды (арены)
2. Хлорирование. При интенсивном солнечном освещении или
под действием ультрафиолетового излучения бензол присоединя-
ет хлор. Реакция протекает по радикальному механизму с образо-
ванием гексахлорциклогексана:
гексахлорциклогексан
В. Реакции окисления. 1. Окисление бензольного цикла. Бензоль-
ное кольцо устойчиво к действию окислителей. В обычных усло-
виях ни калия перманганат, ни азотная кислота, ни хрома (VI)
оксид, ни другие сильные окислители не окисляют бензол. В жест-
ких же условиях, например при действии кислорода воздуха в при-
сутствии ванадия оксида V2O5 и при температуре 400—500 °C, бен-
зольное ядро окисляется, образуя малеиновый ангидрид:
малеиновый ангидрид
2. Окисление гомологов бензола. Алкилбензолы, в отличие от
незамещенного бензола, окисляются значительно легче. В этом
случае при действии сильных окислителей (КМпО4, К2Сг2О7 и дру-
гих) подвергаются окислению боковые цепи:
я-пропилбензол
^х^СООН
ГО]
+ 2COJ + ЗН2О
бензойная кислота
Af-КСИЛОЛ
^^СООН
+ 2Н2О
СООН
изофталевая кислота
11. Моноядерные арены
119
Продуктами реакции являются ароматические карбоновые кис-
лоты. Каждый алкильный радикал в бензольном кольце, независимо
от длины углеродной цепи, окисляется до карбоксильной группы.
3. Озонирование. Подобно алкенам, бензол и его гомологи ре-
агируют с озоном, образуя продукты присоединения— триозониды:
Триозониды взрывоопасны. Это маслянистые жидкости, они
нестойкие и под действием влаги разрушаются с образованием
дикарбонильных соединений и продуктов их дальнейшего окис-
ления — дикарбоновых кислот.
Правила ориентации в бензольном ядре. В молекуле незамещен-
ного бензола электронная плотность распределена равномерно,
поэтому электрофильный реагент может атаковать в равной сте-
пени любой из шести атомов углерода.
Если же в бензольном кольце содержится какой-либо замес-
титель, то под его влиянием происходит перераспределение
л-электронной плотности; новый заместитель вступает в опреде-
ленные положения по отношению к имеющемуся.
По влиянию на направление реакций электрофильного заме-
щения и реакционную способность бензольного кольца замести-
тели можно разделить на две группы — заместители I рода {орто-,
/шря-ориентанты) и заместители II рода (л/е/ла-ориентанты).
Заместители Iрода — атомы и атомные группы, проявляю-
щие положительный индуктивный (+/) или положительный ме-
зомерный (+М) эффекты (доноры электронов):
120
Ароматические углеводороды (арены)
—NR,; —NHR; — NH2; —ОН; —OR; —NHCOR;
—OCOR; —SH; —Aik; — Hal.
Заместители I рода (за исключением галогенов) увеличивают
электронную плотность в бензольном кольце, тем самым активи-
руют его в реакциях SE и направляют следующие заместители
в орто- и ллря-положения.
о-хлортолуол
м-хлортолуол
+ 2НС1
Заместители IIрода — группы, проявляющие отрицательный
индуктивный (-1) или отрицательный мезомерный (-М) эффекты
(эл е ктроноакцепторы):
NR • —NO,; — SO.H; —СН; —СНО; —COR;
-* Аг
—СООН; —COOR; —CCL.
Заместители II рода уменьшают электронную плотность в бен-
зольном ядре и снижают скорость реакций SE по сравнению с не-
замещенным бензолом. Вновь входящий заместитель направляет-
ся преимущественно в л/егая-положение.
-М
11. Моноядерные арены
121
м-бромнитробензол
+ НВг
При введении третьего заместителя необходимо учитывать при-
роду двух уже имеющихся в бензольном ядре.
Ориентация в дизамещенных производных бензола. В зависи-
мости от электронной природы заместителей и их взаимного рас-
положения различают согласованную и несогласованную ориен-
тации.
При согласованной ориентации оба заместителя направляют но-
вый заместитель в одни и те же положения бензольного кольца.
Согласованная ориентация характерна для дизамещенных произ-
водных бензола, в которых соблюдаются условия:
1) ориентанты одного и того же рода находятся в лге/пя-поло-
жении относительно друг друга:
*
.м-толуидин
2) заместители находятся в орто- или яя/ю-положении по от-
ношению друг к другу, но один из них является ориентантом
I рода, а другой — II рода\
*
о-нитрофенол
При несогласованной (несовпадающей) ориентации один из за-
местителей направляет новый заместитель в одни, а другой —
в иные положения бензольного кольца. Предпочтительное направ-
122
Ароматические углеводороды (арены)
ление замещения можно определить, используя следующие пра-
вила:
1) если один из заместителей является ориентантом I рода, он
определяет направление замещения:
ОН(-)
м -нитрофенол
2) если оба заместителя являются ориентантами I рода, на-
правление замещения определяется более сильным ориентантом:
о-толуидин
3) если оба заместителя являются ориентантами II рода, заме-
щение осуществляется с трудом, а место вхождения третьего за-
местителя определяется более сильным ориентантом:
СООН(-)
(*)O2N
*
о-нитробензойная кислота
Наряду с электронной природой заместителей на соотноше-
ние продуктов замещения оказывают влияние пространственные
факторы.
МНОГОЯДЕРНЫЕ АРЕНЫ
Ароматические углеводороды, содержащие два и более бен-
зольных ядер, относятся к многоядерным аренам.
В зависимости от того, каким образом связаны бензольные
кольца, многоядерные арены делятся на две группы:
— арены с конденсированными (анелированными) бензольны-
ми циклами;
— арены с неконденсированными (изолированными) бен-
зольными циклами.
__________________12____________________
МНОГОЯДЕРНЫЕ АРЕНЫ
С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ
Конденсированные многоядерные арены содержат в своем
составе два или более бензольных ядер, имеющих общие атомы
углерода.
Наиболее важными представителями конденсированных аре-
нов являются нафталин, антрацен и фенантрен.
нафталин
антрацен
фенантрен
НАФТАЛИН
Нафталин состоит из двух конденсированных бензольных ко-
лец. Два атома углерода (9 и 10) — общие для двух колец.
124
Многоядерные арены
В отличие от бензола атомы углерода в мо-
лекуле нафталина неравноценны. Положения
1, 4, 5, 8 равнозначны, их принято обозначать
буквой а и называть а-положениями. Поло-
жения 2, 3, 6 и 7 также равнозначны, их
обозначают буквой р и называют р-положе-
ниями.
Для монозамещенного нафталина возмож-
ны два изомера (а- и р-), а при наличии двух
одинаковых заместителей — 10 изомеров:
а-метилнафталин р-метил нафталин
В номенклатуре дизамещенных нафталинов наряду с цифро-
вым обозначением положений заместителей применяют также
и приставки: орто-положение — 1,2; мета — 1,3; пара — 1,4;
пери — 1,8; амфи — 2,6. Например:
1,2-диметилнафталин,
ор/по-диметилнафталин
2,6-диметилнафталин,
aw/jw-днметилнафталин
Радикалы нафталина называют нафтилами:
а- нафтил р -нафтил
Способы получения. /. Природные источники. В промышлен-
ности нафталин главным образом получают из каменноугольной
смолы, где его содержание составляет около 10 %. Наряду с на-
фталином из каменноугольной смолы выделяют также некоторые
его моно- и диметильные производные.
2. Получение нафталина из ацетилена. При пропускании аце-
тилена через нагретые до 700—800 °C трубки наряду с бензолом
образуется также и нафталин.
12. Многоядерные арены с конденсированными бензольными циклами
125
5СН=СН
700-800 °C
——►-
2
Физические свойства. Нафталин — бесцветное кристалличе-
ское вещество с характерным запахом, сублимируется при 81 °C.
Не растворяется в воде, растворяется в органических растворите-
лях. Применяется в быту для борьбы с молью, в химии красите-
лей, для получения лекарств, пластмасс, глифталевых смол.
Строение нафталина. Электронное строение нафталина сход-
но со строением бензола. Его молекула плоская. Дипольный мо-
мент равен нулю, но электронная плотность распределена не так
равномерно, как в молекуле бензола. Более высокая электронная
плотность а-положений нафталина делает их более реакционно-
способными по сравнению с р-положениями.
Длина связей в молекуле нафталина разная.
0,136 нм
0,143 нм
С—С (Балканах) 0,154 нм
С—С (в бензоле) 0,140 нм
Ct—С2 (в нафталине) 0,136 нм
С3—С4 (в нафталине) 0,143 нм
Химические свойства нафталина. Нафталин, как и бензол, про-
являет свойства ароматических соединений; для него характерны
прежде всего реакции электрофильного замещения, но он также
легко вступает в реакции присоединения и окисления.
А. Реакции электрофильного замещения. В реакции электро-
фильного замещения (нитрование, сульфирование, галогенирова-
ние) нафталин вступает значительно легче бензола. При этом об-
разуются в основном продукты «-замещения. Это обусловлено тем,
что в «-положении нафталинового ядра выше электронная плот-
ность и при атаке в «-положение образуется более стабильный
о-комплекс, чем в р-положении:
126
Многоядерные арены
Как видно, при атаке сс-положения делокализация положи-
тельного заряда в о-комплексе происходит с сохранением арома-
тичности одного из бензольных ядер в возможных резонансных
структурах.
В случае атаки электрофилом p-положения лишь в одном слу-
чае возможно сохранение ароматичности бензольного ядра. Следо-
вательно, замещение по a-положению энергетически более выгодно.
1. Нитрование. Нафталин довольно легко нитруется нитрую-
щей смесью с образованием в основном а-изомера:
NO, ’
HNO3; H2SO4; 60 °C
а-нитронафталин
2. Сульфирование, Для сульфирования нафталина исполь-
зуют концентрированную H2SO4, причем в зависимости от темпе-
ратуры, при которой проводится реакция, получают а- или
p-продукты замещения. При температуре 80 °C реакционной сре-
ды образуется а-нафталинсульфокислота, а при 160 °C — Р-нафта-
линсульфокислота:
-Н2О
а -нафталинсульфокислота
160 °C
160 °C
-Н20
Р -нафталинсульфокислота
При нагревании а-изомера до температуры 160 °C он полно-
стью превращается в р-нафталинсульфокислоту.
3. Галогенирование. При температуре 90—110 °C в присутствии
катализатора FeCl3 нафталин хлорируется с образованием преиму-
щественно а-хлорнафталина. Реакция протекает по механизму SF:
+ НС1
а -хл орнафталин
12. Многоядерные арены с конденсированными бензольными циклами
127
Галогенирование нафталина возможно и без катализатора. Тогда
вначале протекает реакция присоединения галогена, а затем от-
щепления галогеноводорода. Например, при взаимодействии брома
с нафталином бром присоединяется в положения 1 и 4, а затем
продукт присоединения отщепляет молекулу бромоводорода, об-
разуя а-бромнафталин:
1,4-дибром-
1,4-дигидронафталин
а-бромнафталин
Правила ориентации в нафталиновом ядре. Правила ориента-
ции в нафталиновом ядре имеют свои особенности.
Направление электрофильного замещения в монозамещенных
производных нафталина определяется электронной природой уже
имеющегося заместителя и большей реакционной способностью
«-положения.
При наличии в нафталиновом ядре элек-
тронодонорного заместителя электронная
плотность повышается прежде всего в том
кольце, с которым связан заместитель, и по-
этому реакция электрофильного замещения
происходит именно по этому кольцу. Заме-
щение прежде всего идет по положению 4
(а-положение).
Например, нитрование 1 -метилнафталина приводит к образо-
ванию 1 -метил-4-нитронафталина:
HNO3
Электроноакцепторный заместитель понижает электронную
плотность в нафталиновом ядре и прежде всего в том кольце,
с которым он связан. Поэтому реакции идут с участием атомов
углерода второго бензольного ядра.
128
Многоядерные арены
Так как «-положения более реакционноспо-
собны, то замещение происходит преимуществен-
но в положениях 5 и 8.
Например, нитрование 1-нитронафталина
нитрующей смесью приводит к образованию сме-
си изомеров:
NO2
1,5-динитро- 1,8-динитро-
нафталин нафталин
Б. Реакции присоединения. Реакция восстановления. Присо-
единение водорода идет вначале по а-положению. Затем образу-
ется 1,2,3,4-тетрагидронафталин, который при 200 °C гидрирует-
ся с образованием декагидронафталина — декалина:
1,4-дигидро-
нафталин
1,2,3,4-тетрагидро-
нафталин, тетралин
декагидронафта-
лин, декалин
Тетралин используется как топливо и растворитель для жиров
и смол. Декалин используется как растворитель для лаков, явля-
ется заменителем скипидара.
В. Реакции окисления. В отличие от бензольного нафталино-
вое ядро легко окисляется, и при окислении гомологов нафтали-
на окисляется прежде всего само ядро.
Например:
СгО3
СН3СООН
Р-метилнафталин
2-метил-1,4-нафтохинон
12. Многоядерные арены с конденсированными бензольными циклами
129
Окисление нафталина в присутствии V,O5 приводит к образо -
ванию фталевого ангидрида:
[О]
фталевый ангидрид
АНТРАЦЕН
Это многоядерное соединение, состоящее из трех линейно кон-
денсированных бензольных колец.
В молекуле антрацена нумеруются з 9 i
лишь атомы углерода, несущие водород.
Положения 1, 4, 5, 8 называют а-поло-
жениями; 2, 3, 6, 7 — p-положениями;
9, 10 — у-положениями или ц- (мезо— 5 ю 4
средний) положениями.
При одном заместителе в ядре возможно три изомера — а, р, у.
Способы получения. Антрацен находится в каменноугольном
дегте, а именно в антраценовом масле, в количестве 0,5 %, откуда
его и добывают промышленным способом.
В лаборатории можно получить антрацен по реакции Фриде-
ля-Крафтса из бензола и 1,1,2,2-тетрабромэтана в присутствии
А1Вг*
Физические свойства. Антрацен — это бесцветное кристалли-
ческое вещество, температура плавления 217 °C, перегоняющееся
с водяным паром, растворимо в бензоле, эфире, нерастворимо
в воде. Растворы обладают голубой флуоресценцией.
130
Многоядерные арены
Химические свойства. Антрацен обладает меньшей ароматично-
стью, чем бензол и нафталин. Он в большей мере «ненасыщенное»
соединение, и для него более характерны реакции присоединения,
чем электрофильного замещения. Наиболее реакционноспособ-
ными в молекуле антрацена являются .мезо-положения (положе-
ния 9 и 10).
1. Реакция восстановления. Антрацен легко присоединяет во-
дород с образованием 9,10-дигидроантрацена. Дальнейшее его гид-
рирование приводит к пергидроантрацену.
9,10-дигидроантрацен
пер гидроантрацен
2. Реакции замещения. Галогенирование антрацена происходит
по механизму присоединения-отщепления. Например:
9,10-дигидро-9, Ю-дихлор-
Нитрование антрацена азотной кислотой в среде уксусной кис-
лоты при комнатной температуре ведет к образованию 9-нитро-
антрацена. В результате сульфирования антрацена серной кисло-
12. Многоядерные арены с конденсированными бензольными циклами
131
той при нагревании образуются а- и p-изомеры, которые являют-
ся более устойчивыми, чем у-изомер.
а-антрацен-
сульфокислота
р-антрацен-
сульфокислота
3. Реакция окисления. Антрацен очень легко окисляется кон-
центрированной азотной кислотой или хромовой смесью до ант-
рахинона.
[О]; HNO3^
О
9,10-антрахинон
Антрахинон — это желтое кристаллическое вещество, облада-
ющее свойствами хинонов.
ФЕНАНТРЕН
Структурным изомером антрацена является фенантрен.
В антрацене три бензольных кольца соединены линейно, тог-
да как в фенантрене они соединяются ангулярно, то есть под углом.
фенантрен
132
Многоядерные арены
С увеличением числа ароматических колец в многоядерных
соединениях растет число монозамещенных изомеров: так, для
нафталина возможны два продукта (а, р), для антрацена — три,
для фенантрена — пять.
Цифрами обозначены положения, в которых могут находить-
ся заместители.
Получение. Получают фенантрен в основном из каменноуголь-
ной смолы.
Физические свойства фенантрена. Фенантрен — это твердое
кристаллическое вещество с гпя = 101 °C, /кип = 340,2 °C. Растворя-
ется в эфире, бензоле, трудно — в спирте. Растворы имеют голу-
бую флуоресценцию.
Химические свойства. Фенантрен, как и антрацен, обладает*
более слабым ароматическим характером, чем нафталин, и тем
более, чем бензол. Электронная плотность в его молекуле распре-
деляется неравномерно, ароматичность среднего бензольного коль-
ца здесь настолько нарушена, что связь между 9 и 10 атомами
углерода приобретает характер двойной связи. Реакции замеще-
ния протекают по механизму присоединения-отщепления.
Так, вначале присоединяется бром в положениях 9 и 10 с по-
следующим отщеплением НВг и образованием 9-бромфенантрена:
Вг
9-бромфенантрен
12. Многоядерные арены с конденсированными бензольными циклами 133
9,10-Дибром-9,10-дигидрофенантрен может быть выделен в сво-
бодном состоянии.
При окислении фенантрена образуется фенантренхинон. При
дальнейшем окислении идет разрыв связи С9—С10, и образуется
дифеновая кислота:
9,1О-фенантренхинон
дифеновая кислота
При восстановлении фенантрена образуется продукт, который
носит название пергидрофенантрен.
пергидрофенантрен
Конденсированная система пергидрофенантрена и циклопен-
тана называется циклопентанпергидрофенантреном, или стераном.
стеран,
циклопентанпергидрофенантрен
Данная структура лежит в основе стероидов.
_________________13____________________
МНОГОЯДЕРНЫЕ АРЕНЫ
С ИЗОЛИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ
Наиболее важными представителями этой группы соединений
являются бифенил, дифенилметан и трифенилметан.
бифенил
дифенилметан
трифенилметан
БИФЕНИЛ
Молекула бифенила содержит два бензольных кольца, соеди-
ненных о-связью. Нумерацию каждого бензольного ядра прово-
дят отдельно.
Способы получения. 1. Бифенил выделяют из каменноугольной
смолы, где он содержится в небольшом количестве.
2. Дегидрогенизация бензола. Пары бензола пропускают через
раскаленные трубки. Выход бифенила достигает 70 %.
Fe; 700—800 °C
13. Многоядерные арены с изолированными бензольными циклами
135
3. Реакция Ульмана. Нагревание йодбензола в присутствии по-
рошка меди:
и т Си; 200-250 °C
6Н61 ►
+ 2CuI
Физические свойства. Бифенил — твердое вещество с ?пл =
= 70 °C, легкорастворим в спирте, эфире.
Строение. Химические свойства. Два бензольных кольца в мо-
лекуле бифенила соединены между собой о-связью, длина кото-
рой (0,148 нм) несколько меньше длины углерод-углеродной свя-
зи в алканах (0,154 нм).
Вокруг о-связи в молекуле бифенила возможно свободное вра-
щение, при этом барьер вращения невелик. Но если в ор/ио-по-
ложениях обоих бензольных колец содержатся объемные замести-
тели, то из-за пространственных препятствий вращение вокруг
о-связи, соединяющей два цикла, сильно затрудняется или стано-
вится невозможным. Бензольные кольца располагаются под углом.
Если в рр/ио-положениях каждого бензольного ядра молекулы
бифенила находятся разные заместители, то такие соединения про-
являют оптическую активность. Обусловлено это тем, что эти со-
единения хотя и не содержат асимметрического атома углерода
(центра хиральности), но не имеют также и плоскости симмет-
рии. Их молекула асимметрична в целом.
Так, 6,6’-динитродифеновая кислота существует в виде двух
энантиомеров (зеркальных изомеров):
СООН NO2
NO, СООН
соон no2
Вид пространственной изомерии, обусловленный ограничением
свободного вращения вокруг простой связи, называется атропи-
зомерией (от греч. атрояо — нет поворота).
Для проявления атропизомерии необязательно наличие четы-
рех заместителей в ор/яо-положениях, иногда достаточно трех или
даже двух объемных заместителей.
Химические свойства. Химические свойства бифенила анало-
гичны свойствам моноядерных аренов. Для него характерны ре-
акции электрофильного замещения (нитрование, галогенирова-
136
Многоядерные арены
ние, сульфирование и т. д.). В эти реакции бифенил вступает лег-
че, чем бензол, при этом образуются преимущественно продукты
пара- и ppmo-замещения. Связано это с тем, что фенильные груп-
пы оказывают по отношению друг к другу слабые электронодо-
норные свойства, то есть одно из колец при этом выполняет роль
заместителя I рода.
HNO3; H,SO4
HNOji H2SO.
-НЮ
4-нитробифенил
4,4'-д и нитробифен ил 2,4’ -динитробифенил
Нитрогруппа в молекуле 4-нитробифенила уменьшает элект-
ронную плотность, прежде всего в бензольном кольце, в котором
она находится, поэтому вторая нитрогруппа вступает в незаме-
щенное ядро.
ДИФЕНИЛМЕТАН
В молекуле дифенилметана два бензольных цикла связаны че-
рез метиленовую группу. Нумерацию углеродных атомов в каж-
дом цикле проводят отдельно:
Способы получения. Дифенилметан получают по реакции Фри-
деля-Крафтса алкилированием бензола бензилхлоридом или ди-
хлорметаном:
бензилхлорид
13. Многоядерные арены с изолированными бензольными циклами
137
СН2С12
дихлорметан
Физические свойства. Дифенилметан — твердое кристалличе-
ское вещество с / = 26...27 °C и запахом герани, легкорастворим
в спирте, диэтиловом эфире, хлороформе.
Химические свойства. Для дифенилметана характерны реакции
с участием бензольных циклов и активной метиленовой группы.
Как ароматический углеводород дифенилметан вступает в ре-
акции электрофильного замещения, образуя 4,4’-дизамещенные
и 2,4,2',4’-тетразамещенные продукты:
HNO3»
-H2d*
HNO3; H2SO4
-н2о
4,4'_динитродифенилметан
МП МП
2,4,2\4'-тетранитродифенилметан
Атомы водорода метиленовой группы в молекуле дифенил-
метана подвижны вследствие электроноакцепторного действия
двух бензольных ядер. В результате дифенилметан легко окисля-
ется по положению 7:
дифенилкарбинол,
бензогидрол
бензофенон
138
Многоядерные арены
Бензогидрол является исходным продуктом при получении ди-
медрола (CvH-),CHOCH,CH?N(CH,)? • НС1 — антигистаминного
средства.
Водородные атомы метиленовой группы также легко замеща-
ются на галоген:
+ НВг
дифенилбромметан,
бромдифенилметан
Дифенилметан используется в парфюмерной промышленнос-
ти для отдушки мыл; некоторые его производные являются пес-
тицидами .
ТРИФЕНИЛМЕТАН
В молекуле трифенилметана три бензольных цикла связаны
через метиновую группу СН:
Способы получения. Трифенилметан получают по реакции
Фриделя—Крафтса из хлороформа и бензола:
13. Многоядерные арены с изолированными бензольными циклами
139
Физические свойства. Трифенилметан — кристаллическое ве-
щество с Гпл = 76 °C, труднорастворимое в воде, легко — в органи-
ческих растворителях.
Химические свойства. По химическим свойствам трифенилме-
тан во многом напоминает дифенилметан. Для него также харак-
терны реакции электрофильного замещения с участием бензольных
циклов и реакции с участием атома водорода группы СН.
Фенильные радикалы, проявляя -/-эффект, смещают на себя
электронную плотность с атома углерода СН-группы, вследствие
чего атом водорода этой группы приобретает подвижность и лег-
ко замещается на металлы и галогены. За счет метиновой группы
трифенилметан легко окисляется.
Так, при действии натрия амида в жидком аммиаке трифенил-
метан образует трифенилметилнатрий:
Трифенилметилнатрий окрашен в желтый цвет, он имеет ион-
ное строение, его эфирные растворы проводят электрический ток.
Стабильность трифенилметил-аниона и наличие окраски объяс-
няется тем, что в делокализации отрицательного заряда принима-
ют участие все три бензольных ядра:
трифенилметил-анион
При взаимодействии трифенилметана с хлором атом водорода
СН-группы замещается на хлор, продуктом реакции является три-
фенилхлорметан. Атом хлора в его молекуле очень подвижен. При
растворении трифенилхлорметана в жидком SO2 (растворитель
с высокой диэлектрической постоянной) в присутствии А1С13 про-
исходит его ионизация с образованием трифенилметил-катиона:
140
Многоядерные арены
трифенилхлорметан
SO, жидкA1CL
трифенилкарбокатион
+ А1С1;
При окислении трифенилметана образуется трифенилкарби-
нол, который подвергается ионизации в концентрированной сер-
ной кислоте:
трифенилкарбинол
+ HSO;
+ Н2О
13. Многоядерные арены с изолированными бензольными циклами
141
Устойчивость трифен ил метил-катиона также обусловлена учас-
тием бензольных колец в делокализации положительного заряда
за счет сопряжения:
трифенилметил-катион
При обработке трифенилхлорметана цинком в бензольном
растворе образуется свободный трифенилметильный радикал,
находящийся в равновесии со своим димером:
трифенилметил-радакал
производное циклогексадиена
Трифенилметильный радикал — это первый радикал, полу-
ченный в свободном виде. Он был получен в 1900 году американ-
ским химиком М. Гомбергом. Столь высокая устойчивость три-
фенилметила по сравнению с алкильными радикалами объясняется
значительной делокализацией неспаренного электрона по всем
бензольным кольцам.
142
Многоядерные арены
Свободный радикал трифенилметила окрашен в желтый цвет.
Красители трифенилметанового ряда. К красителям трифенил-
метанового ряда относятся бриллиантовый зеленый и фенолфта-
леин.
Бриллиантовый зеленый — представитель аминопроизводных
трифенилметана. Его получают конденсацией бензальдегида
с М,Т\Г-диэтиланилином в присутствии кислотного катализатора
(хлороводородной кислоты) согласно схеме:
N, N-диэтил анилин
бензальдегид
4,4'-^ис-(диэзиламино)трифенилметан,
лейкооснование бриллиантового зеленого
{бесцветное вещество)
13. Многоядерные арены с изолированными бензольными циклами
143
или
(C2H5)2N^^\ ^\^N(C2H5)2
ноос—СООН
4Л’-^-(диэтиламино)трифенилкарбинол,
карбинольное основание бриллиантового зеленого
(бесцветное вещество)
(С2н5)2
5)2
СООН
I
СОО-
хиноидная
группа
I ^^(С2Н5)
J
’ СООН
' СОО"
бриллиантовый зеленый
Бриллиантовый зеленый широко применяется в медицине
в виде 1—2 %-ных водных или спиртовых растворов как антисеп-
тическое средство, а также при изготовлении бактерицидных плас-
тырей.
Фенолфталеин является представителем гидроксипроизводных
трифенилметана. Получают фенолфталеин конденсацией фенола
со фталевым ангидридом в присутствии концентрированной сер-
ной кислоты:
144
Многоядерные арены
фталевый ангидрид
Фенолфталеин представляет собой белое кристаллическое
вещество с гпл = 259...263 °C, практически не растворяется в воде,
хорошо растворяется в этаноле. Фенолфталеин применяется в ана-
литической практике как кислотно-основный индикатор. В кис-
лой и нейтральной среде он находится в бесцветной лактонной
форме, в щелочной среде (при pH = 8,2... 10,0) приобретает мали-
новую окраску вследствие образования хиноидной структуры.
фенолфталеин
(бесцветная форма)
2NaOH
HC1
фенолфталеин
(форма с малиново-красной окраской)
pH = 8,2...10,0
2Н2О
NaOH
- ж-
ч
X/X-ONa*
О
pH > 12
(бесцветная форма)
Малиновая окраска исчезает в избытке щелочи.
Фенолфталеин применяется в медицине как слабительное сред-
ство при хронических запорах.
__________________14_____________________
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
К галогенопроизводным углеводородов относят соединения,
у которых один или несколько атомов водорода замещены на ато-
мы галогенов.
Галогенопроизводные углеводородов классифицируют в зави-
симости от природы углеводородного радикала (алифатические, али-
циклические и ароматические), количества атомов галогена в мо-
лекуле (моно-, ди-, три- и полигалогенопроизводные), характера
галогена (фторо-, хлоро-, бромо-, йодопроизводные), характера
атома углерода, с которым связаны атомы галогена (первичные,
вторичные и третичные галогенопроизводные).
Номенклатура. По заместительной номенклатуре ИЮПАК
названия галогенопроизводных углеводородов составляют анало-
гично названиям соответствующих углеводородов. Вначале циф-
рой указывают положение замещения (если это необходимо), за-
тем называют галоген (если нужно — перед ним количество атомов)
и прибавляют название родоначальной структуры (в алифатиче-
ских галогенопроизводных это главная углеродная цепь, в али-
циклических и ароматических — цикл).
Нумерацию начинают с ближнего к галогену конца углерод-
ной цепи.
Н3С
сн,—сн2
Вг
1 -бромпропан
1,2-дихлорциклогексан
хлорбензол
Простейшие галогенопроизводные называют также по радика-
ло-функциональной номенклатуре. Тогда названия составляют из
названия углеводородного радикала, связанного с галогеном, и суф-
фикса -фторид, -хлорид, -бромид или -йодид или прибавлением
слов: фтористый, хлористый, бромистый, йодистый.
14. Галогенолроиззодные углеводородов
147
С2Н-С1
этилхлорид,
хлористый этил
Н2С=СН—СН—Вг
аллилбромид,
бромистый аллил
С6Н5—СН2—С1
бензил хлорид,
хлористый бензил
За некоторыми галогенопроизводными сохранились тривиаль-
ные названия:
СНС13
хлороформ
хлоропрен
сн2
ГАЛОГЕНАЛКАНЫ
Общая формула: СН2и+1На1.
Способы получения. Существует много разнообразных мето-
дов введения галогена в молекулу соединения. Рассмотрим наи-
более общие.
7. Галогенирование алканов. Взаимодействие алканов с гало-
генами протекает по свободнорадикальному механизму SR при
УФ-облучении.
СН4 с1;’ > Н,с—CI -с'2’ — СН2С1 С':’Т’- СНС1
4 -HC1 3 -HC1 2 -HC1
Cl2, hv
-HC1 *
СС14
метан
хлорметан
дихлорметан трихлорметан тетрахлорметан
Недостатком этого способа является образование смеси мо-
но-, ди- и полигалогеналканов.
2. Присоединение галогеноводородов к алкенам. Реакция идет
обычно на холоде, способ особенно удобен для получения моно-
галогенопроизводных, так как реакция не сопровождается обра-
зованием побочных продуктов полигалогенопроизвоДных.
Н3С—НС=СН2 + НВг
пропен
Н3С
сн—сн,
I **
Вг
2-бромпропан
Механизм реакции АЕ — электрофильное присоединение.
3. Взаимодействие спиртов с галогенирующими реагентами. .Часто
галогенопроизводные получают замещением гидроксильной груп-
пы спиртов на галоген. Для этого используют галогеноводороды
(НС1, НВг, HI), галогениды фосфора (РС13, РС15, РВг3, РВг5), тио-
нилхлорид (SOCL).
148
Многоядерные арены
Взаимодействие спиртов с галогеноводородами протекает по
схеме:
С,Н,ОН + НС1
хлорэтан
Легче всего замещается на галоген гидроксильная группа у тре-
тичного атома углерода. Проводить реакцию с первичными спир-
тами необходимо в присутствии катализаторов: минеральных кис-
лот, галогенидов цинка и т. д.
С более высокими выходами галогеналканы образуются при
взаимодействии спиртов с галогенидами фосфора (III) или фос-
фора (V), а также тионилхлоридом:
С2Н5ОН + PCI,
С,Н,ОН + РС1,
С,Н5ОН + SOCI,
- С2Н5С1 + Н3РО3
- С2Н5С1 + POCL, + НС1
- С2Н5С1 + SO2 + НС1
4. Взаимодействие галогеналканов с солями галогеноводородных
кислот (реакция Финкельштейна). Реакцию используют для по-
лучения фтор- или йодалканов из более доступных хлоро- или
бромопроизводных:
C2H5Br + Nal ацет°н » C2H5I + NaBr
бромэтан йодэтан
Физические свойства. Низшие галогеналканы — газы или жид-
кости со своеобразным сладковатым запахом, средние — жидко-
сти, высшие — твердые вещества. Большинство из них практи-
чески нерастворимы в воде, но легко растворяются в органических
растворителях.
Химические свойства. Галогеналканы обладают высокой реак-
ционной способностью; для них характерны реакции нуклеофиль-
ного замещения 5^ элиминирования (отщепления) Е. Они также
вступают в реакции восстановления и взаимодействуют с не-
которыми металлами.
А. Реакции нуклеофильного замещения. Способность галоген-
алканов вступать в реакции SN обусловлена полярностью связи
углерод-галоген. Атом галогена, имея большую электроотрицатель-
ность, чем атом углерода, смещает на себя электронную плот-
ность связи С—Hal. В результате атом галогена приобретает час-
тичный отрицательный заряд S-, а атом углерода — частичный
положительный заряд 5+. Галогеналканы вступают в реакции
14. Галогенопроизводные углеводородов
149
с нуклеофильными реагентами, и при этом происходит замеще-
ние галогена на нуклеофил.
электр о фил ьный
центр
Nu + НаГ
галогеналкан нуклеофил
продукт уходяшая
замещения группа
В зависимости от строения галогеналкана, природы нуклео-
фила и растворителя реакции SN протекают по двум основным
направлениям: 5V1 и SN2.
Механизм SN2 (бимолекулярное нуклеофильное замещение)
По механизму SN2 реагируют первичные и несколько труднее —
вторичные галогеналканы. Реакция протекает в одну стадию через
образование переходного состояния. Вначале нуклеофил атакует
атом углерода, связанный с галогеном (электрофильный центр), со
стороны, противоположной связи С—Hal, то есть атака идет с тыла.
В результате происходит постепенное вытеснение нуклеофилом
галогенид-иона (уходящей группы). Этот процесс включает пере-
ходное состояние, то есть момент, когда связь С—Hal еще не ра-
зорвалась, а связь С—Nu еще не полностью образовалась.
Nu’ + —С—Hal
переходное состояние
- Nu—Cz— + НаГ
Образование переходного состояния сопровождается измене-
нием гибридного состояния атома углерода с sp1 на sp1. Одна доля
негибридизированной р-атомной орбитали атома углерода в пере-
ходном состоянии частично перекрывается с орбиталью атакую-
щего нуклеофила, а вторая — с орбита-
лью атома галогена.
Возвращение атома углерода в sp-
гибридное состояние после отщепления
галогенид-иона происходит с обраще-
нием конфигурации.
Протеканию реакции по механиз-
му 5Л2 способствуют активные нуклео-
фильные реагенты — они легче образу-
ют переходное состояние — и апротон-
150
Многоядерные арены
ные растворители, поскольку протонные полярные растворители
сольватируют нуклеофил, тем самым снижая его реакционную спо-
собность.
По предложению английского химика К. Ингольда описан-
ный механизм получил обозначение 5Л2. Буква 5 указывает на
замещение, N — на нуклеофильный тип реакции, а цифра 2 обо-
значает, что реакция является бимолекулярной, то есть в стадии,
определяющей скорость реакции в целом (в данном случае обра-
зование переходного состояния), участвуют два реагента (галоген-
алкан и нуклеофил). Скорость реакций, протекающих по меха-
низму 5Л.2, зависит от концентрации обоих реагентов.
Механизм SNI (мономолекулярное нуклеофильное замещение)
По этому механизму происходит нуклеофильное замещение
в третичных и, в определенных условиях, во вторичных галоген-
алканах. В молекуле третичных галогеналканов объемные замести-
тели при атоме углерода, связанном с галогеном, создают простран-
ственные препятствия для подхода нуклеофила к электрофильному
центру, и его атака с тыла становится невозможной. Вместе с тем
третичные галогеналканы способны в сильнополярных средах
к ионизации. По механизму реакция протекает в две стадии:
Стадия I
С—Hal
медленно
С + НаГ
карбокатион
Стадия II
+ Nu
быстро
С—Nu
На стадии I происходит диссоциация молекулы галогеналкана
при участии молекул протонного полярного растворителя. В ре-
зультате образуются карбокатион и галогенид-ион. Поскольку про-
цесс ионизации протекает медленно, то стадия I определяет ско-
рость всей реакции. На стадии II образовавшийся карбокатион
быстро реагирует с нуклеофилом.
Протеканию реакции по механизму 5V1 способствуют высокая
ионизирующая и сольватирующая способности растворителя, а так-
же стабильность образующегося карбокатиона. Устойчивость ал-
кильных карбокатионов обусловлена делокализацией положитель-
ного заряда за счет т/-эффекта алкильных групп и возрастает в ряду:
+ + сн3^ +
сн3 < сн3-*сн, < сн
сн/
14. Галогенопроизводные углеводородов
151
Поэтому третичные галогенопроизводные легче всего подвер-
гаются ионизации.
Механизм нуклеофильного замещения, протекающий по рас-
смотренной схеме, называется мономолекулярным, так как на ста-
дии, определяющей скорость всего процесса (стадия I), прини-
мает участие молекула только одного реагента — галогеналкана.
Такой механизм обозначают 5V1.
Таким образом, на основании вышеизложенного можно сделать
вывод, что первичные галогеналканы обычно реагируют по меха-
низму 5V2, третичные — по механизму 5^1. Вторичные галогенал-
каны, в зависимости от природы нуклеофила и растворителя, мо-
гут реагировать как по механизму SN2, так и по механизму 3^1.
1. Гидролиз галогеналканов. Галогеналканы гидролизуются до
спиртов. Реакцию обычно проводят в присутствии водных раство-
ров щелочей, так как с водой она протекает медленно и обратимо.
Н3С~С1 + NaOH —° - Н3С—ОН + NaCl
2. Реакция Вильямсона. Эта реакция является одним из лучших
способов получения простых эфиров. Она заключается во взаи-
модействии галогеналканов с алкоголятами или фенолятами.
Н3С—Вг +
NaOC2H5
- Н3С—О—С2Н5 + NaBr
метилэтиловый
эфир
3
+ NaBr
метилэтиловый
эфир
3. Взаимодействие с солями карбоновых кислот (ацидолиз). При
действии солей карбоновых кислот на галогеналканы образуются
сложные эфиры. Реакцию проводят в среде апротонного поляр-
ного растворителя.
СН3СН2—Вг + NaO—С—СН3
о
- СН.СН.О—с—СН, + NaBr
Z Д 11 к/
о
этилацетат
4. Взаимодействие с аммиаком, алкил- и ариламинами (аммо-
нолиз и аминолиз). При взаимодействии с аммиаком и аминами
галогеналканы алкилируют их с образованием смеси первичных,
152
Многоядерные арены
вторичных и третичных аминов, а также солей — четвертичных
аммониевых оснований. Например, первичный амин образуется
по схеме:
Н3С—I + NH3 ----- [CH3NH3]+F NH’- Н3С—NH3 + NH4I
5. Взаимодействие с солями циановодородной кислоты. Пер-
вичные и вторичные галогеналканы с калия или натрия цианидом
в среде апротонного полярного растворителя образуют нитрилы
(S.2):
СН3СН2—Вг + NaCN
- CHjCH —СЖ-N + NaBr
пропанонитрил
6. Взаимодействие с солями азотистой кислоты. Продукты, об-
разующиеся в результате этой реакции, зависят от условий ее про-
ведения, строения галогеналкана и соли.
Н5С — Вг + NaNO2
* Н5С —NO2 + NaBr
нитроэтан
Вг + AgNO2
'СН—о—N=O + AgBr
зС
изопропилнитрит
Б. Реакции элиминирования. Реакции элиминирования сопро-
вождаются отщеплением галогеноводорода от галогеналкана и при-
водят к образованию алкенов.
Н
/С—С------ ^Х=С^ + ЬГ + НаГ
Hal
Поскольку отщепление водорода происходит от }3-атома угле-
рода, то такие реакции называются |3- или 1,2-элиминированием.
Реакции элиминирования Е и нуклеофильного замещения 5^
конкурируют друг с другом, но в определенных условиях каждая
из них может стать доминирующей. Отщепление галогеноводоро-
да от галогеналкана становится основным процессом в присут-
ствии нуклеофильных реагентов, обладающих высокой основно-
стью. К ним относятся спиртовые растворы гидроксидов щелочных
металлов или алкоголяты щелочных металлов. Элиминированию
способствуют также повышение температуры реакционной смеси
14. Галогенопроизводные углеводородов
153
и концентрации реагентов. Так, при взаимодействии йодэтана
с водным раствором щелочи основным направлением реакции яв-
ляется нуклеофильное замещение, а продуктом реакции — этило-
вый спирт. При использовании спиртового раствора щелочи до-
минирующим процессом становится реакция элиминирования,
продуктом реакции — этилен.
н3с—сн2
NaOH; Н2О
‘ — —
нуклеофильное
замещение
Н,С—СН,—ОН + Nal
этанол
NaOH; C2HSOH
р - эл и ми нирование
Н2С=СН2 + Nal + Н2О
этен
Реакции элиминирования галогеналканов могут протекать по
мономолекулярному £1 и бимолекулярному £2 механизмам.
Механизм Е2 (бимолекулярное элиминирование)
В реакции отщепления по механизму £ 2 наиболее легко всту-
пают первичные галогеналканы.
* 4
В
переходное состояние
в—н
Hal-
Реакция отщепления, протекающая по бимолекулярному меха-
низму, требует присутствия основания, идет в одну стадию с об-
разованием переходного состояния, в формировании которого
принимают участие молекулы двух реагентов. И поэтому скорость
такой реакции зависит от концентрации обоих реагентов. Про-
цессы разрыва и образования связей в переходном состоянии про-
исходят синхронно.
В отличие от механизма Sv2 в механизме £2 частица с неподе-
ленной парой электронов или несущая отрицательный заряд дей-
ствует не как нуклеофил, а как основание, атакуя атом водорода
при p-углеродном атоме.
Механизм Е1 (мономолекулярное элиминирование)
Наиболее легко происходит элиминирование по данному ме-
ханизму у третичных галогеналканов. Реакция не требует основа-
ния как реагента, но для ее протекания необходим ионизирую-
щий растворитель. Процесс является двухстадийным.
154
Многоядерные арены
Стадия 1
Hal
галогеналкан
медленно
С—С + НаГ
Н
Стадия II
карбокатион
быстро
карбокатион
+ н
алкен
Стадией, определяющей скорость реакции, является образо-
вание карбокатиона. Вторая стадия включает в себя стабилиза-
цию карбокатиона путем отщепления протона.
Если в молекуле галогеналкана имеется несколько альтерна-
тивных путей отщепления галогеноводорода, то реализуется тот
из них, при котором двойная связь образуется у наиболее заме-
щенного атома углерода, то есть вместе с галогеном уходит водо-
род от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева:
СН3
н3с—сн—сн—сн,
—I
Вг
2-метилбутен-2
(основной продукт реакции)
NaOH; C2H5OH
-NaBr; -Н2О
2-бром - 3 - метилбуган
н3с—сн—сн=сн2
3-метилбутен-1
(побочный продукт реакции)
В. Взаимодействие с металлами. При взаимодействии галоген-
алканов с такими металлами, как магний, образуются магнийор-
ганические соединения — реактивы Гриньяра:
С2Н5Вг + Mg
эфир
C2H5MgBr
этилмагнийбромид
Магнийорганические соединения являются сильными нукле-
офильными реагентами и сильными основаниями. Их активность
обусловлена полярностью связи углерод-магний:
S 5 ।
Н3С—СН2- MgBr
14. Галогенопроизводные углеводородов
155
Г. Восстановление галогеналканов. При каталитическом гид-
рировании галогеналканов или действии на них водорода в мо-
мент выделения, а также йодоводородной кислоты происходит
замещение атома галогена водородом:
н.с,—а Нг; Kt • С,Н6 + НС1
н5с,—ci + hi —с,н6 + на + г
ДИГАЛОГЕНАЛКАНЫ
Дигалогеналканы — это углеводороды, содержащие в своем со-
ставе два атома галогена. В зависимости от их положения дигало-
геналканы делятся на три группы:
— геминальные дигалогеналканы, атомы галогена находятся
у одного и того же атома углерода:
^С1
н3с-~сн
4J
^С1
1,1 -дихлорэтан,
этилиденхлорид
Нередко в этом случае применяют приставку гем-,
— вицинальные дигалогеналканы, атомы галогена находятся
у соседних атомов углерода:
1,2-дихлорпропан
— атомы галогена разделены несколькими углерод-углерод-
ными связями:
Н2С
СН,—СН,
сн3
1,4-дихлорбутан,
тетраметиленхлорид
Способы получения. Геминальные галогенопроизводные полу-
чают при взаимодействии альдегидов и кетонов с пентагалогени-
дами фосфора (РС15, РВг5):
156
Многоядерные арены
Н3С
+ РС15
- Н,С—СНС1, + POCI,
уксусный альдегид
1,1 -дихлорэтан
Н3С—С—СН3 + РС15
bJ I | ч" fcX
о
ацетон
Н3С—с—СН3 + РОС1
С1 С1
2,2-дихлорпропан
Путем присоединения двух молекул галогеноводородов к ал-
кинам:
НС=СН 2Н- Н,С=СН—С1 2Н. Н,С—СНС1,
Вицинальные дигалогеналканы образуются в результате при-
соединения галогенов к алкенам:
НС=СН2 + Вг2
н3с—сн—сн2
** I I *
Вг Вг
1,2-дибромпропан
Дигалогенопроизводные с удаленными друг от друга атомами
галогенов получают при действии галогеноводородов, галогени-
дов фосфора, тионилхлорида на соответствующие двухатомные
спирты:
Н2С—СН—СН2 + РВг2
ОН он
1,3-пропандиол
* Н2С—СН2—СН2 + Н3РО3
Вг Вг
1,3-дибром пропан
Физические и химические свойства. Дигалогеналканы — тяже-
лые маслянистые жидкости или кристаллические вещества, нера-
створимые в воде. С введением второго атома галогена в молекулу
возрастают температуры кипения (кроме фторопроизводных).
Дигалогеналканы являются хорошими растворителями.
Химические свойства дигалогеналканов во многом сходны со
свойствами моногалогеналканов. Но есть и различия. При нагре-
вании геминальных и вицинальных дигалогеналканов со спирто-
вым раствором щелочи образуются алкины:
С н он
Н3С—СН2—СНС12 + NaOH -J-J—* Н3С—ОСН + NaCl + Н2О
1,1 -дихлорпропан пропин
14. Галогенопроизводные углеводородов
157
С н он
Н3С—СН—СН. + NaOH 2 5 - Н3С—С~СН + NaCI + Н2О
С1 С1
1,2’дихлорпропан пропин
Щелочной гидролиз вицинальных дигалогеналканов ведет
к образованию гликолей, а геминальных — альдегидов и кетонов:
1,2-дихлорпропан
NaOH; Н,0
-------J
Н3С
СН—СН2 + NaCI
в П
+ н2о
пропиленгликоль
С1 он
н3с-Сн Н.с-бн -----------
\С1 ^ОН ’Н2°
уксусный альдегид
гелгдиол
ГАЛОГЕНАЛКЕНЫ
Галогеналкенами называют производные алкенов, в молекуле
которых один или несколько атомов водорода замещены атомами
галогенов.
По взаимному расположению двойной связи и атома галогена
галогеналкены можно условно разделить на три группы:
— винилгалогениды — соединения, содержащие атом галогена
у углерода с двойной связью:
С1
I
Н2С=СН—С1 Н3С—НС=СН—Вг Н2С=С—СН3
винилхлорид 1-6 ром пропен-1 2-хлорпропен
— аллилгалогениды — соединения, в которых атом галогена
находится в «-положении к углероду, образующему двойную связь:
Н2С=СН—СН—С1
аллилхлорид
Н3С—НС—нс=сн2
С1
З-хлорбутен-1
— соединения, в которых атом галогена и атом углерода, об-
разующий двойную связь, разделены двумя и более простыми уг-
лерод-углеродными связями:
158
Многоядерные арены
Н2С=СН—СН —СН—Cl Н3С—НС=СН—СН—СН—CI
Л» JL<
4-хлорбутен-1 5-хлорпентен-2
Способы получения. Галогеналкены получают:
— гидрогалогенированием алкинов:
винилхлорид
— галогенированием алкенов в аллильное положение (аллиль-
ное галогенирование):
н2с=сн—СН3 + С12 5”“с• Н2С=СН—СН—С1 + HC1
аллилхлорид
— действием галогенирующих реагентов на непредельные
спирты:
Н2О=СН—СН2~ОН + SOC12
--- Н2С—СН—СН2—Cl + SO2 + НС1
аллилхлорид
Физические и химические свойства. Физические свойства в го-
мологическом ряду галогеналкенов подчиняются обычным зако-
номерностям.
Реакционная способность галогеналкенов зависит от взаим-
ного расположения двойной связи и атома галогена в молекуле.
Так, винилгалогениды характеризуются низкой реакционной спо-
собностью связи С—Hal. Причиной малой реакционной способ-
ности связи С—Hal является сопряжение неподеленной пары элек-
тронов атома галогена с л-электронами двойной связи.
НэС=СН-^На1
4-
-4 +л/
В результате сопряжения (+М-эффект) связь С—Hal укорачи-
вается и становится значительно прочнее, чем в галогеналканах.
Реакции нуклеофильного замещения для винилгалогенидов в боль-
шинстве случаев осуществить не удается.
Винилгалогениды под действием концентрированных раство-
ров щелочей превращаются в алкины; присоединяют галогены,
галогеноводороды (присоединение идет по правилу Марковнико-
ва); в присутствии катализатора они легко полимеризуются:
14. Галогенопроизводные углеводородов
159
NaOH спирт, р-р
НС=СН + NaCl + Н,0
ацетилен
Н2С=СН—С1
Н3С—СНС12
1,1 -дихлорэтан
-f-H2C—СН4-
Cl
поливинилхлорид
В молекулах алл ил галогенидов атом галогена обладает повы-
шенной подвижностью. Аллилгалогениды вступают в реакции нук-
леофильного замещения легче, чем галогеналканы.
Замещение, как правило, происходит по механизму 5^1, что
объясняется склонностью аллилгалогенидов к ионизации. При этом
образуется аллильный катион, повышенная стабильность которо-
го обусловлена делокализацией положительного заряда по сопря-
женной системе.
Н2С=СН—СН2—Hal —г Н2С=СН—СН2*—СН—НС=СН2
2 z -Hal
аллильный катион
Присоединение галогеноводородов в аллилгалогенидах также
протекает по правилу Марковникова:
Н2С=СН—СН2—С1
н3с—СН—сн2
аллилхлорид
С1 С1
1,2-дихлорпропан
В соединениях, в которых атом галогена и двойная связь раз-
делены большим числом простых С—С-связей, двойная связь
и галоген в химические превращения вступают независимо друг
от друга.
АРОМАТИЧЕСКИЕ ГАЛОГЕНОПРОИЗВОДНЫЕ
Ароматическими галогенопроизводными называют производные
ароматических углеводородов, у которых один или несколько ато-
мов водорода замещены атомами галогенов.
В зависимости от положения атомов галогенов различают две
группы галогенопроизводных ароматического ряда:
160
Многоядерные арены
— галогенарены — соединения, у которых атомы галогена не-
посредственно связаны с бензольным кольцом:
о-хлортолуол
бромбензол
— арилалкилгалогениды — соединения, содержащие атомы га-
логена в боковой цепи (алкильном радикале):
бензилхлорид,
фенилхлорметан
Способы получения. Для введения галогена в бензольное ядро
используют реакции галогенирования аренов и солей арилдиазо-
ния с галогенидами меди.
1. Галогенирование аренов. Реакция протекает по механизму SN
в присутствии кислот Льюиса (A1CL, FeBr,, SbCL):
W'
А1С13
хлорбензол
+ HC1
2. Реакция солей арилдиазония с галогенидами меди:
бензолдиазония
хлорид
CujCl,
хлорбензол
Для введения галогена в боковую углеродную цепь использу-
ют реакции галогенирования алкиларенов и хлорметилирования.
14. Галогенопроизводные углеводородов
161
1. Галогенирование алкиларенов. Реакция идет при нагревании
до высоких температур или при облучении УФ-светом. Механизм
радикальный:
НС1
бензилхлорид
Галогенированию подвергается в основном «-положение от-
носительно бензольного ядра, поскольку в этом случае образуется
устойчивый свободный радикал бензильного типа.
Cl2 2С1
*
С6Н5СН3 + сг
- С6Н5СН2 + НС1
С6Н5СН2С1 + С1
2. Реакция хлорметилирования. При действии на ароматиче-
ские углеводороды формальдегида и хлороводорода в присутствии
катализатора (А1С13, ZnCl2 ) атом водорода в кольце замещается
на хлорметильную группу:
Механизм этой реакции:
+ НС1
----- СН2ОН + СГ
гидроксиметил-
катион
+ СН2ОН
/Ч/сн^он
H2O; ZnCl,
-Zn(OH)Cl *
’i
I
£
162
Многоядерные арены
Физические свойства. Галогенопроизводные ароматического
ряда — это жидкие или кристаллические вещества. Температу-
ры кипения галогенаренов возрастают в ряду: фторо-, хлоро-,
бромо-, йодопроизводные. Соединения этого ряда нерастворимы
в воде, но легко растворяются в органических растворителях.
Химические свойства. Реакционная способность ароматических
галогенопроизводных зависит от положения галогенов. Для со-
единений, содержащих галоген в боковой цепи, характерны все
реакции галогеналканов.
Соединения, в которых галоген непосредственно связан с бен-
зольным ядром, характеризуются низкой реакционной способно-
стью связи С—Hal. Это обусловлено сопряжением неподеденной
пары электронов атома галогена с л-электронной системой бен-
зольного ядра:
-Г, +М
Галогенарены похожи в этом отношении на винилгалогениды.
В результате сопряжения происходит укорочение и уменьшение
полярности связи С—Hal. Поэтому реакции нуклеофильного за-
мещения идут лишь в очень жестких условиях:
NaOH; 300 °C
NU,; 200 °C
, .15"
| + NaCI
фенол
| + NH„C1
анилин
Подвижность атома галогена возрастает с введением в орто-
или лара-положения по отношению к галогену электроноакцеп-
торного заместителя в бензольное ядро, который увеличивает
дробный положительный заряд на атоме углерода связи С—Hal.
Реакция замещения галогена протекает в более мягких условиях
и идет по механизму 5V2:
14. Галогенопроизводные углеводородов
163
Образование о-комплекса является лимитирующей стадией ре-
акции.
По ароматическому ядру галогенарены вступают в обычные
реакции электрофильного замещения. Атом галогена, связанный
с бензольным ядром, проявляет — I и +М-эффекты.
Поскольку в статическом состоянии -/-эффект > +М-эффек-
та, то атом галогена проявляет электроноакцепторные свойства
и снижает реакционную способность бензольного ядра в реакци-
ях SE . В динамическом состоянии +Л/-эффект > -/-эффекта, по-
этому атомы галогена выступают как ориентанты I рода, направ-
ляя заместители в орто- и лара-положения. Например:
HNO3 конц.
H2SO4
-Н2О
С1
«-нитрохлорбензол
о -нитрохлорбензол
В результате реакции образуются два изомера: о-нитрохлор-
бензол и л-нитрохлорбензол.
НИТРОСОЕДИНЕНИЯ
Нитросоединениями называют производные углеводородов,
содержащие в своем составе одну или несколько нитрогрупп
—NO2.
Нитрогруппа имеет плоское строение, атомы азота и кислоро-
да находятся в состоянии sp2-гибридизации. Электронное строе-
ние нитрогруппы можно представить с помощью граничных
(резонансных) структур:
или
Один из атомов кислорода соединен с атомом азота двойной
связью, а другой — семиполярной связью (от англ, semi — наполо-
вину), то есть связь нитрогруппы является полуполярной.
В действительности оба атома кислорода в нитрогруппе рав-
ноценны, поэтому ее строение можно представить следующим
образом:
Вещества с семиполярными связями имеют довольно боль-
шой дипольный момент, они обычно кипят при более высоких
температурах, чем изомерные им вещества, в молекулах которых
семиполярная связь отсутствует.
Классификация и номенклатура нитросоединений. В зависимо-
сти от природы углеводородного радикала, с которым связана
нитрогруппа, различают алифатические и ароматические нитро-
соединения.
15. Нитросоединения
165
1. Алифатические нитросоединения бывают:
— насыщенные (нитроалканы):
нитрометан СН3—NO2, нитроэтан СН3—СН2—-NO2;
— ненасыщенные (нитроалкены, нитроалкины):
Н3С—СН=С—СН3
no2
2-нитробутен-2
нс=с—сн—сн — СН — сн3
NO,
3-нитрогексин-1
В зависимости от того, у какого (первичного, вторичного, тре-
тичного) атома углерода находится нитрогруппа, нитросоедине-
ния бывают первичные, вторичные или третичные.
сн — сн —no2
нитроэтан,
первичное
нитросоединение
сн—сн—сн3
no2
2 - нитропроп ан,
вторичное
нитросоединение
сн,
сн,—с—сн3
NO,
2-метил-2-нитропропан,
третичное
нитросоединение
2. Ароматические нитросоединения делятся на две группы: со-
единения, содержащие нитрогруппу, связанную с атомом углеро-
да ароматического ядра, и соединения, содержащие нитрогруппу
в боковой цепи:
нитробензол
фенилнитрометан
Названия нитросоединений образуют путем добавления пре-
фикса нитро- к названию соответствующего углеводорода с указа-
нием положения нитрогруппы:
СН—СН—СН2
no2
2-нитробутан
3-нитротолуол
166
Многоядерные арены
Нитроарены, содержащие нитрогруппу в боковой цепи, рас-
сматривают как производные предельных углеводородов, содер-
жащих в качестве заместителей ароматический радикал и нитро-
группу:
1 -нитро-2-фенилэтан
ch-no2
2-нитро-1-фенил пропан
НИТРОСОЕДИНЕНИЯ АЛИФАТИЧЕСКОГО РЯДА
Способы получения. 1. Нитрование алканов (реакция Конова-
лова). На предельный углеводород действуют разбавленной азот-
ной кислотой (10—25 %) при повышенной температуре и давле-
нии.
Н3С—СН — СН, + HNO3 разб. Н3С—СН—СН3 + Н2О
no2
пропан 2-нитропропан
2. Действие солей азотистой кислоты на галогенопроизводные
алканов:
Н3С—CHJ + NaNO2
йодэтан
- Н3С—СН,—NO, + Nal
нитроэтан
Данную реакцию целесообразно проводить в среде апротон-
ного растворителя для уменьшения образования побочных про-
дуктов — эфиров азотистой кислоты.
3. Окисление трет-алкиламинов. Этот способ используют только
для получения третичных нитросоединений:
СН
н3с—с—сн3 —* Н3С—с—сн3 + Н2О
v । J । J £.
nh2 no2
Нитроалканы по физическим свойствам — бесцветные жидко-
сти или вещества желтого цвета. Причиной окрашивания являет-
ся наличие хромофора — группы —NO,. Нитроалканы имеют при-
15. Нитросоединения
167
ятный запах, ядовиты. Малорастворимы в воде, растворимы в боль-
шинстве органических растворителей.
Химические свойства. Для нитросоединений характерны два
ряда реакций: реакции с участием нитрогруппы и реакции с учас-
тием подвижных атомов водорода при а-углеродном атоме.
Н3С
7. Таутомерия и образование солей. Благодаря наличию по-
движных атомов водорода при а-углеродном атоме первичные и вто-
ричные нитросоединения являются таутомерными веществами.
нитроформа
,ОН
R—CH=Nf
О
ацы-нитроформа
В растворе между этими формами устанавливается динами-
ческое равновесие. Такой вид таутомерии получил название «нитро-
аци нитро-таутомерия». В нейтральной среде равновесие почти
полностью смещено в сторону нитроформы. В щелочной среде
равновесие смещается в сторону бщм-нитроформы. Так, первич-
ные и вторичные нитроалканы растворяются в водном растворе
щелочи, образуя соли нитроновых кислот.
2-нитропропан натриевая соль
диметилнитроновой кислоты
Соли нитроновых кислот легко разрушаются минеральными
кислотами с образованием исходных нитроалканов.
Третичные нитросоединения ввиду отсутствия подвижных ато-
мов водорода при а-углеродном атоме не способны к таутомерии,
а следовательно, не взаимодействуют со щелочами.
2. Реакция с азотистой кислотой. Первичные, вторичные
и третичные нитросоединения по-разному относятся к действию
азотистой кислоты. В реакцию с HNO2 вступают только те нитро-
соединения, у которых есть подвижные атомы водорода при
а-углеродном атоме.
168
Многоядерные арены
Первичные нитропроизводные образуют алкилнитроловые
кислоты:
NO2 + O=N—ОН
-н,о
5+
* сн3—с—no2
N—ОН
метил нитроловая
кислота
нитрозонитросоединение
Нитроловые кислоты растворяются в щелочах, образуя соли,
окрашенные в красный цвет.
Вторичные нитросоединения с азотистой кислотой образуют
псевдонитролы (нитрозонитросоединения):
псевдонитрол,
2-нитрозо-2-нитропропан
Псевдонитролы — это бесцветные вещества, которые в крис-
таллическом состоянии являются ассоциированными соединени-
ями, в растворе или в расплаве ассоциаты разрушаются, и появля-
ется синее окрашивание.
Третичные нитросоединения не реагируют с азотистой кис-
лотой.
Реакцию с азотистой кислотой используют для отличия пер-
вичных, вторичных и третичных нитросоединений друг от друга.
3. Реакция конденсации с альдегидами и кетонами. За счет по-
движных атомов водорода в ос-положении нитросоединения спо-
собны в слабощелочной среде вступать в реакции конденсации
с альдегидами с образованием нитроспиртов (нитроалканолов):
этаналь
- Н3С—СН—СН—NO,
[он_ JHI
1 -нитропропанол-2
- н3с—сн=сн—no2
1-нитропропен-1
15. Нитросоединения
169
Нитроспирты легко дегидратируются с образованием непре-
дельных нитросоединений.
4. Реакция восстановления. При восстановлении нитроалканов
образуются алкилам ины:
зн
сн3—no2 —СН3—NH2 + 2Н2О
метиламин
Нитросоединения алифатического ряда обладают сильным
местным раздражающим действием и являются относительно ток-
сичными веществами. Они относятся к клеточным ядам общего
действия, особенно опасны для печени. Очень токсичны хлорсо-
держащие нитропарафины и непредельные нитросоединения.
НИТРОСОЕДИНЕНИЯ АРОМАТИЧЕСКОГО РЯДА
Способы получения. 1. Нитрование аренов. Нитросоединения,
содержащие нитрогруппу, связанную с ароматическим ядром, по-
лучают нитрованием аренов смесью концентрированных азотной
и серной кислот, называемой «нитрующей смесью». Реакция про-
текает по механизму электрофильного замещения SE.
бензол
HONO2; H2SO4; t
нитробензол
jw-динитробензол
HONO,; H,SO4; t
no2
1,3,5-тринитробензол
Максимально в бензольное ядро можно ввести три нитрогруп-
пы. Нитрогруппа настолько дезактивирует бензольное ядро, что
для введения второй нитрогруппы требуются более жесткие усло-
вия, а третья — вводится с большим трудом.
170
Многоядерные арены
2. Введение нитрогруппы в боковую цепь. Введение нитрогруп-
пы в боковую цепь осуществляется по реакции Коновалова раз-
бавленной азотной кислотой при повышенных температуре и дав-
лении. Реакция протекает по радикальному механизму SR.
толуол
фенилнитрометан
Другим способом введения нитрогруппы в боковую цепь яв-
ляется реакция взаимодействия алкиларилгалогенидов с солями
азотистой кислоты:
бензилхлорид
KNO,
KCI
фенилнитрометан
По физическим свойствам нитросоединения ароматического
ряда — это жидкие или кристаллические бесцветные либо окра-
шенные в желтый цвет вещества с приятным запахом горького
миндаля, нерастворимые в воде, имеют высокие температуры ки-
пения и плавления.
Химические свойства. Обладая электроноакцепторными свой-
ствами (—I, —М), нитрогруппа в целом понижает электронную
плотность бензольного ядра, тем самым уменьшает его реакцион-
ную способность в реакциях электрофильного замещения SE и соз-
дает возможность для протекания реакций, идущих по механизму
нуклеофильного замещения 5Л,.
Для нитроаренов возможны реакции по нитрогруппе и по аро-
матическому ядру.
А. Реакции с участием нитрогруппы. Реакция восстановления
(реакция Зинина). При восстановлении ароматических нитросо-
единений образуются ароматические амины. В зависимости от pH
реакционной среды процесс восстановления может идти по двум
направлениям, отличающимся образованием разных промежуточ-
ных продуктов.
В нейтральной и кислой среде (pH < 7) в качестве промежу-
точных соединений образуются ароматические нитрозосоедине-
ния и арил гидроксил амины:
15. Нитросоединения
171
О
нитробензол
нитрозобензол
фенил гидроксиламин
tH) _
-Н,0
анилин
В щелочной среде (pH >7) происходит конденсация образую-
щихся в процессе реакции нитрозосоединений с арилгидроксил-
амином, и образуются азоксисоединения. Последние присоеди-
няют водород и превращаются в гидразос©единения, которые,
в свою очередь, легко переходят в ариламины:
нитробензол нитрозобензол фенилгидроксиламин
азоксибензол
гидразобензол
анилин
Реакцию восстановления нитроаренов в щелочной среде
(pH > 7) можно остановить на любой из приведенных стадий. Она
служит основным способом получения азо- и гидразосоединений.
Реакция открыта в 1842 году русским ученым Н. Н. Зининым.
172
Многоядерные арены
Б. Реакции по ароматическому ядру. 1. Реакции электрофиль-
ного замещения S£, Под влиянием нитрогруппы (—/; —М) пони-
жается реакционная способность бензольного ядра в реакциях элек-
трофильного замещения. Так, нитробензол не алкилируется
в условиях реакции Фриделя—Крафтса, но может вступать в ре-
акции нитрования, галогенирования, сульфирования с образова-
нием мета-замещенных нитроаренов:
jw-хлорнитробензол
НС1
2. Реакции нуклеофильного замещения SN. Пониженная элект-
ронная плотность в ароматическом ядре нитроаренов создает воз-
можность для протекания реакций нуклеофильного замещения.
В реакциях SN нитрогруппа направляет заместитель в орто- и пара-
положения:
МО
+ КОН
калия орто-
нитрофенолят
NO
ОК
калия пара-
нитрофенолят
Соединения, содержащие две и более нитрогруппы, придают
повышенную подвижность атомам водорода, находящимся в орто-
и ля/га-положениях бензольного ядра. Так, сам нитробензол не
окисляется, а 1,3-динитробензол окисляется легко.
[01
ти-динитробензол
NO2
2,6-динитрофенол
15. Нитросоединения
173
По этой же причине легко замещается атом хлора в молекуле
о-нитрохлорбензола. Это позволяет получать различные нитро-
производные ароматического ряда:
При действии на 1,3,5-тринитробензол гидроксиламина атом
водорода легко замещается на аминогруппу:
NO2
2,4,6 - тринитробензол
В молекуле динитрозамещенного толуола две нитрогруппы ак-
тивируют атомы водорода метильной группы. Такие соединения
могут вступать в реакции конденсации с ароматическими альде-
гидами:
174
Многоядерные арены
/8+Н
2,4-динитротолуол 2,4-динитростильбен
Нитросоединения ароматического ряда имеют большое значе-
ние. Это исходные вещества в производстве синтетических краси-
телей, полимеров, моющих средств и ингибиторов коррозии. Ряд
нитросоединений находят применение в качестве биологически
активных веществ. Так, эфиры фосфорной кислоты, содержащие
нитроарильные фрагменты, являются инсектицидами, производные
2,4-динитрофенола — гербициды; на основе нитропроизводных,
обладающих антибактериальным действием, созданы лекарствен-
ные препараты (левомицетин, синтомицин, фуразолидон и др.).
Некоторые ароматические нитросоединения применяются как ду-
шистые вещества.
Ароматические нитросоединения угнетают нервную и особен-
но кровеносную системы, нарушая снабжение организма кисло-
родом.
Метаболизм нитросоединений связан с окислительно-вос-
становительными реакциями, в частности, с окислительным
фосфорилированием. Например, 2,4-динитрофенол — один из наи-
более мощных реагентов, разобщающих процессы окисления
и фосфорилирования в организме, что препятствует образованию
АТФ в клетке.
______________16________________
АМИНЫ
Амины — производные аммиака, в молекуле которого один,
два или три атома водорода замещены углеводородными радика-
лами. По числу углеводородных радикалов при атоме азота ами-
ны делятся на первичные, вторичные и третичные амины.
NH3
аммиак
*
н3с—nh2
первичный амин,
метиламин
Н3С
^NH
Н3С—СН2
вторичный амин,
метилэтиламин
Н3С
H3C^N
Н3С—сн2
третичный амин,
диметилэтиламин
Существуют и четвертичные аммониевые соли, например тет-
раметиламмония хлорид [(CH3)4N+]C1“, соответствующее ему осно-
вание — тетраметиламмония гидроксид [(CH3)4N+]OH-, который
представляет собой сильное основание, аналогичное гидроксидам
щелочных металлов. Это соединение имеет ионную связь.
В зависимости от природы углеводородных радикалов амины
подразделяются на алифатические, алициклические, ароматические
и смешанные (имеющие алифатический и ароматический ради-
калы):
Н3С—NH2
алифатический алициклический амин, ароматический амин, смешанный амин,
амин, метиламин циклогексиламин анилин 1Ч,М-диметиланилин
Названия простых по строению аминов образуют от названий
соответствующих углеводородных радикалов, связанных с атомом
азота, добавляя в конце суффикс -амин. Кроме того, многие аро-
матические амины имеют тривиальные названия.
176
Многоядерные арены
н3с—сн—сн3
nh2
изопропиламин,
2-аминопропан
Н,С
^NH
н3с—сн2—сн2
метилпропил амин
анилин, дифениламин
аминобензол
Производные толуола, содержащие аминогруппу в бензольном
ядре, называются толуидинами'.
о-толуидин
ГУ
nh2
JW-ТОЛУИДИН
п -толуидин
АМИНЫ АЛИФАТИЧЕСКОГО РЯДА (АЛКИЛАМИНЫ)
Способы получения. 1. Действием аммиака на галогенопроиз-
водные (реакция Гофмана).
+ NH,
Н3С—Cl + NH3 —— [Н3С—NH3]Cr —* H3C—NH2 + NH4C1
Первоначально аммиак с хлористым метилом образует соль,
которая под действием избытка аммиака превращается в первич-
ный амин.
Алкилирование может протекать и дальше. Образовавшийся
первичный амин реагирует со следующей молекулой галогенал-
кана. В результате образуется вторичный амин, затем — третич-
ный и соль четвертичного аммониевого основания:
Н3С—NH2 + Н3С—Cl
NH3
диметил аммония
хлорид
NH + NH4C1
диметиламин
16. Амины
177
NH + Н.С—Cl
триметил аммония
хлорид
NH3
H3C
H3C-^N + NH4C1
H3C
Н3С
H3C-^N + Н3С—Cl----
H3CZ
триметиламин
тетраметил аммония
хлорид
Преимущество этого метода — простота, недостаток — трудно
разделить образующиеся амины, однако для промышленного про-
изводства этот метод очень удобен.
2. Перегруппировка Гофмана. При обработке незамещенных
амидов карбоновых кислот натрия гипобромитом (или смесью бро-
ма с натрия гидроксидом) образуются первичные амины, при этом
углеродная цепь укорачивается на один атом:
СН3
+ NaOBr - а°Н - СН — NH2 + СО2| + NaBr
Механизм перегруппировки Гофмана
NaOH
NHBr
перегруппировка
бирадикал
бромамид
- Н3С—N=C=O Н3С
изоцианат
№=с—ой:
он
-СН— NH, + CO2t
Реакция протекает в две стадии. Первая стадия заключается
в образовании бромамида, устойчивого в отсутствие щелочи. При
нагревании бромамида в избытке щелочи происходит образование
очень активного бирадикала, который стабилизируется путем пе-
регруппировки (алкильный радикал переходит к атому азота). Об-
разовавшийся изоцианат при действии воды превращается в амин.
178
Многоядерные арены
Этот способ имеет большое значение и дает возможность по-
лучать чистые амины.
5. Способ Габриэля. Конденсацией калия фталимида с алкил-
галогенидами с последующим гидролизом получают только пер-
вичные алифатические амины:
калия фталимид
N-метил фталимид
фталевая кислота
+ H2N—сн3
метиламин
4. При восстановлении нитроалканов и нитрилов образуются пер-
вичные амины:
Н3С—СН — NO, н3с—сн —nh2
нитроэтан этанамин
Нзс—C=N Н3С—СН — NH2
ацетонитрил этанамин
Физические свойства. Низшие амины (метиламин и этил-
амин) — газы, с увеличением количества атомов углерода — жид-
кости, высшие амины — твердые вещества. Они обладают амми-
ачным запахом, а также запахом соленой сельди.
Низшие амины хорошо растворимы в воде, с увеличением
молекулярной массы растворимость снижается; высшие амины
нерастворимы в воде.
Химические свойства. Наличие неподеленной пары электро-
нов на атоме азота обусловливает основные свойства аминов.
Амины — типичные представители органических оснований.
За счет неподеленной пары электронов амины также являются
нуклеофильными реагентами.
16. Амины
179
Основность. Являясь производными аммиака, алкиламины по-
добно аммиаку проявляют ярко выраженные основные свойства,
которые обусловлены способностью атома азота с неподеленной
электронной парой к присоединению протона с образованием иона
замещенного аммония. При этом основность аминов в 10 раз силь-
нее, чем аммиака. Это связано с изменением электронной плот-
ности на атоме азота.
NH3 СН3—NH2
Алкильные радикалы увеличивают электронную плотность на
атоме азота за счет проявления +/-эффекта, что приводит к за-
метному усилению основности. Поэтому можно предположить,
что третичные алкиламины, имеющие три донорных заместителя,
будут более сильными основаниями, чем вторичные, а вторич-
ные, в свою очередь, — более сильными, чем первичные и аммиак:
СН3 СН3
CH,^N > ^NH > СН,—NH, > NH3
СН3 СН3
Такая закономерность изменения основности алкиламинов
наблюдается в газовой фазе и в неводных растворах. В водных
растворах наряду с электронными эффектами заместителей име-
ет место и сольватационный эффект растворителя. В результате
основность третичных аминов в водных растворах ниже основ-
ности первичных и вторичных:
сн3 сн3
> сн,—nh2 > chAn
kJ Jr
CH3 CH3
1. Водные растворы алкиламинов имеют щелочную среду:
R—NH2 + НОН ==— R—NH, + ОН-
2. С кислотами алкиламины образуют соли алкиламмония:
С,Н,—NH, + НС1
C2H5-”NH3]cr
этилами ония
хлорид
3. Взаимодействие с галогеналканами (реакция алкилирования).
C2H5NH2 + СН31
С2Н5—NH—СН3 + HI
метилэтиламин
180
Многоядерные арены
4. Взаимодействие аминов с ацилирующими реагентами (реак-
ция ацилирования). Первичные и вторичные алкиламины вступа-
ют в реакцию с функциональными производными карбоновых
кислот — галогенангидридами, ангидридами и сложными эфира-
ми, образуя N-замещенные амиды карбоновых кислот:
Н3С
X)
СН3 Н.С—<Х + НС1
HN—СН3
хлорангидрид метиламин
уксусной кислоты
N-метил амид
уксусной кислоты
В процессе реакции атом водорода при азоте в молекуле ами-
на замещается на остаток карбоновой кислоты. Третичные амины
не содержат при атоме азота водорода и поэтому в реакцию аци-
лирования не вступают.
5. Взаимодействие с азотистой кислотой. Реакция с HNO2 при-
меняется для идентификации алифатических аминов.
Первичные алкиламины под действием азотистой кислоты пре-
вращаются в спирты с выделением азота и воды:
Н3С—NH2 + НО—N=O
HC1
“ 2Н2О
Нзс—N=N СГ
Н2о
метилдиазония хлорид
(неустойчивое соединение)
---- Н3С—ОН + НС1 + Njt
Вторичные алкиламины в реакции с азотистой кислотой обра-
зуют N-нитрозоамины:
Н3С Н3С
J^NH + НО—N=O --- N=O + Н2О
Н3С Н3С
N -нитрозодиметиламин
(тяжелая маслянистая жидкость)
Третичные амины при обычной температуре с азотистой кис-
лотой не реагируют:
Н3С \
H3C^N + НО—N=O -Y*
Н3С
6. Изонитрильная реакция. Специфическая реакция обнаруже-
ния первичных аминов. При нагревании первичных алкиламинов
с хлороформом в присутствии щелочи в спиртовой среде образу-
ются изонитрилы (изоцианиды):
16. Амины
181
Н,С NH, + СНС1, + ЗКОН СдН5°”» Н3С—N=C" + ЗКС1 + ЗН2О
метиламин метилизоцианид
Изонитрилы имеют очень неприятный запах. Эта реакция очень
чувствительна.
7. Реакция окисления. Первичные алкиламины при окислении
озоном образуют нитроалканы:
Н3С—NH2 Н3С—NO2 + Н2О
метиламин нитрометан
Под действием сильных окислителей первичные алифатиче-
ские амины образуют смесь веществ, в которой преобладают аль-
дегиды, а вторичные — тетразамещенные гидразины.
При окислении третичных аминов действием Н2О2 или перо-
ксикислотами RCOOOH образуются N-оксиды аминов:
N-оксидтриметиламин
N-Оксиды аминов являются биологически активными соеди-
нениями.
АМИНЫ АРОМАТИЧЕСКОГО РЯДА (АРИЛАМИНЫ)
Способы получения. 1. Восстановление нитросоединений (реак-
ция Зинина).
нитробензол
анилин
2. Взаимодействие галогенопроизводных с аммиаком и аминами
хлорбензол
анилин
NH4C1
182
Многоядерные арены
При взаимодействии галогенаренов с ариламинами образуют-
ся вторичные и третичные ариламины:
хлорбензол
анилин
р ', Си
+ НС1
дифениламин
3. Алкилирование ариламинов
NH, + СН,С1
-на*
СН3
N-метиланилин
СН3С1
-НС1
N ,К-диметиланилин
Физические свойства. Ариламины представляют собой бесцвет-
ные высококипящие жидкости или твердые кристаллические ве-
щества со слабым неприятным запахом. Малорастворимы в воде,
сильно токсичны, окисляются кислородом воздуха, из-за чего при
хранении приобретают желтоватую окраску.
Химические свойства. Для ариламинов характерны реакции
с участием атома азота и реакции с участием атомов углерода аро-
матического ядра.
А. Основность. Ароматические амины обладают основным ха-
рактером. Однако по основности они слабее, чем амины жирного
ряда и даже слабее аммиака.
Снижение основности обусловлено сопряжением неподелен-
ной пары электронов атома азота с л-электронной системой аро-
матического ядра:
+ЛУ-эффект
16. Амины
183
Основные свойства падают в ряду:
СН3—NH2 » NH3 >
Являясь слабыми основаниями, ариламины образуют соли толь-
ко с сильными минеральными кислотами:
+ на
анилиния хлорид,
фениламмония хлорид,
солянокислый анилин
На основность ариламинов существенное влияние оказывают
заместители в бензольном кольце. Электронодонорные замести-
тели увеличивают основность, а электроноакцепторные — умень-
шают ее.
При переходе от первичных к третичным основность арома-
тических аминов снижается.
1. Реакция алкилирования. Первичные и вторичные ариламины
реагируют с галогеналканами, образуя N-алкил- и Ы,М-диалкил-
ариламины. Реакция протекает труднее ввиду снижения нуклео-
фильных свойств атома азота.
С6Н —NH2 + Н3С—I
C6H5—NH—CH3 + HI
N-метиланилин
С6Н5—NH—СН3 + Н3С— I
.СН.
С6Н,—Nf + HI
СН-
1Ч,ТЧ-диметиланилин
2. Реакция ацилирования. Первичные и вторичные амины при
взаимодействии с хлорангидридами или ангидридами карбоно-
вых кислот образуют N-замещенные амиды карбоновых кислот.
N-Ацильные производные анилина и его гомологов называют ани-
лидами.
184
Многоядерные арены
+ (СН3СО)2О
N-фениламид уксусной кислоты,
ацетанилид,
анилид уксусной кислоты
Амиды карбоновых кислот легко гидролизуются в кислой или
щелочной среде с образованием исходного амина и карбоновой
кислоты:
+ CHjCOOH
Способность ацильных производных легко подвергаться гид-
ролизу позволяет применять эту реакцию в органическом синтезе
для временной защиты аминогруппы от окисления и для умень-
шения ее донорских свойств.
Ацильные производные аминов имеют большое значение
как фармацевтические препараты. Например, ацетанилид — это
жаропонижающий препарат, который долгое время применялся
в медицинской практике, а в настоящее время — в ветеринарии.
3. Реакция образования изоцианидов (качественная реакция). Ана-
логично алифатическим аминам первичные ароматические ами-
ны при нагревании с хлороформом и щелочью в спиртовой среде
образуют изоцианиды — вещества с неприятным тошнотворным
запахом:
мц
+ СНС13 + зкон
с2н5он
+ ЗКС1 + ЗН2О
фенилизоцианид
16. Амины
185
4. Реакция взаимодействия с азотистой кислотой. Алифатиче-
ские и ароматические амины по-разному реагируют с азотистой
кислотой, эту реакцию можно использовать для отличия первич-
ных, вторичных и третичных аминов алифатического и аромати-
ческого рядов.
Первичные ароматические амины при действии азотистой кис-
лоты в присутствии сильной минеральной кислоты образуют соли
диазония. Эта реакция получила название реакции диазотирования.
бензолдиазония хлорид
Вторичные ариламины и N-алкилариламины в этих условиях
превращаются в N-нитрозоамины:
Н3С—N—N=O
I
+ Н2О
N - метил - N -нитрозоан ил ин
Третичные ароматические амины при взаимодействии с азо-
тистой кислотой нитрозируются по бензольному кольцу обычно
в лард-положение, а если ядра-положение занято, то нитрозогруп-
па занимает ор/ло-положение:
N, N-диметил анилин
л-нитрозо-?4,Ь1-диметиланилин
5. Реакция взаимодействия с ароматическими альдегидами. Пер-
вичные ароматические амины реагируют при нагревании с арома-
тическими альдегидами, образуя азометины (основания Шиффа):
186
Многоядерные арены
С6Н5
N-бензилиденанилин,
основание Шиффа
Б. Реакции с участием атомов углерода ароматического ядра. Для
ариламинов характерны реакции электрофильного замещения по
ароматическому ядру.
Аминогруппа проявляет +М-эффект и выступает в качестве
сильного электронодонора по отношению к бензольному кольцу,
тем самым активируя его в реакциях электрофильного замещения.
6. Реакция галогенирования. Анилин взаимодействует с бром-
ной водой в отсутствие катализатора, образуя 2,4,6-триброманилин:
Вг
2,4,6-триброманилин
Для введения хлора в ароматическое ядро требуются особые
условия (присутствие НС1, СС14, С2Н5ОН, 16 °C).
7. Реакция нитрования. Поскольку аминогруппа чувствительна
к действию окислителей, а ее влияние на ароматическое ядро обус-
ловливает сравнительно легкую окисляемость аренаминов до
хинонимина, нитрование ароматических аминов проводят, пред-
варительно их проацилировав. Это необходимо для защиты амино-
группы, а также для понижения реакционной способности арома-
тического ядра.
-сн3соон
NHCOCH,
(СН3СО)2О
HONO,
о-нитроацетанилид л-нитроацетанилид
о-нитроанилин
no2
л-нитроанилин
16. Амины
187
Образовавшееся ацильное производное подвергают гидролизу
и выделяют свободные нитроанилины.
8. Реакции сульфирования. При нагревании анилина с концен-
трированной серной кислотой образуется пяра-аминобензолсуль-
фокислота, которую чаще называют сульфаниловой кислотой. Ре-
акция протекает через стадию образования N-фенилсульфаминовой
кислоты, которая перегруппировывается в ля/^-аминобензолсуль-
фокислоту:
анилиния
гидросульфат
hso;
180 °C
-Н2О
N -фенилсульфаминовая
кислота
сульфаниловая
кислота
В сульфаниловой кислоте имеются две функциональные груп-
пы: —NH2 (основная) и —SO3H (кислотная). Это приводит к тому,
что сульфаниловая кислота существует в виде биполярного иона
(внутримолекулярной соли), называемого иногда цвиттер-ионом'.
NTT4
SO3
Именно этим объясняется ее высокая температура плавления.
Сульфаниловая кислота довольно сильная, с основаниями она
легко образует соли:
188
Многоядерные арены
SO; + NaOH
SO3Na + H2O
натрия
л-аминобензолсульфонат
Из-за биполярной структуры сульфаниловая кислота не спо-
собна образовывать соли с минеральными кислотами, то есть не-
смотря на наличие аминогруппы, она не обладает основными свой-
ствами.
Сульфаниловая кислота широко применяется в производстве
красителей и лекарственных средств. Наибольший интерес пред-
ставляет амид сульфаниловой кислоты (сульфаниламид, стрепто-
цид), структура которого лежит в основе сульфаниламидных пре-
паратов, составивших целую эпоху в лечении инфекционных
заболеваний.
2
SO2NH
'4
J
стрептоцид,
амид сульфаниловой кислоты
В качестве исходного вещества для получения стрептоцида ис-
пользуют анилин. Синтез осуществляют в четыре стадии:
анилин
(СН3С0)20
-сн3соон
ацетанилид
л-ацетаминобензол-
сульфохлорид
1
NHCOCH
SO-.NH
л-ацетамино-
бензолсульфамид
-сщсоон
SO2NH2
сульфаниламид,
амид сульфани-
ловой кислоты
16. Амины
189
В молекуле стрептоцида содержатся амино- и сульфамидная
группы. За счет МН2-группы стрептоцид растворяется в кислотах,
образуя соли, а за счет SO2NH2 — растворяется в щелочах, то есть
обладает амфотерными свойствами:
NaOH
hci
NH,CP
SO.NHNa
so2nh
SO2NH2
Стрептоцид был получен немецким студентом Гельмо. Но по-
требовалось 30 лет, чтобы его внедрить в медицинскую практику.
Стрептоцид и другие сульфаниламидные препараты действу-
ют на стрептококковые микроорганизмы, отсюда и произошло
название «стрептоцид». Однако сульфаниламиды действуют не бак-
терицидно, а бактериостатически, то есть задерживают рост мик-
роорганизмов.
В основе бактериостатического действия сульфаниламидов ле-
жит их сходство с л-аминобензойной кислотой (ПАВК), которая
участвует в биосинтезе фолиевой кислоты, необходимой для жиз-
недеятельности микроорганизмов.
\;ц
N1LT
СООН
SO2NH2
Подобие этих соединений как в структурном, так и в химиче-
ском отношении приводит к тому, что сульфаниламиды способ-
ны вступать в конкурентное замещение л-аминобензойной кис-
лоты, препятствуя синтезу фолиевой кислоты, что и подавляет
рост и размножение микроорганизмов.
Производные стрептоцида:
190
Многоядерные арены
альбуцид,
сульфацил
NTH
уросульфан
NIH
норсульфазол
NTU
букарбан
Конечно, нам не представляется возможным рассмотреть все
сульфаниламидные препараты. Более детально вы будете знако-
миться с ними в курсе фармацевтической химии, только помните
одно: что есть сульфамидные препараты и есть сульфаниламид-
ные. Сульфамиды — это общее понятие, а сульфаниламидные пре-
параты обязательно содержат 4-NH2—С6Н4—SO2—NHR.
Амины — промежуточные продукты в производстве красите-
лей, пестицидов, полимеров, ингибиторов коррозии, ПАВ, адсор-
бентов, лекарственных препаратов.
Алифатические амины поражают нервную систему, вызывают
нарушения проницаемости стенок кровеносных сосудов и кле-
точных мембран, функций печени и развитие дистрофии.
Ароматические амины вызывают образование метгемоглоби-
на, угнетающего центральную нервную систему. Некоторые аро-
матические амины — канцерогены.
ДИАЗО- И АЗОСОЕДИНЕНИЯ
ДИАЗОСОЕДИНЕНИЯ
Диазосоединениями называют органические вещества, содержа-
щие в своей структуре группировку из двух атомов азота, связан-
ную с углеводородным радикалом и остатком минеральной кис-
лоты.
По природе углеводородного радикала раз-
личают алифатические и ароматические диазосоединения.
Ароматические диазосоединения имеют общую формулу ArN2X,
где Аг — ароматический радикал, X — кислотный остаток.
Если X — остаток сильной минеральной кислоты (СГ, Вг",
HSO", NO"), диазосоединения имеют ионное строение и называ-
ются солями диазония (Аг—№NX"), а если X — остаток слабой
минеральной кислоты (CN~, HSO^, ОН", SH"), то они имеют ко-
валентное строение —Аг—N=N—X. Диазосоединения общей фор-
мулы Аг—N=N—О"М+, где М — металл, называют диазотатами.
В зависимости от pH среды эти формы способны взаимопре-
вращаться.
В кислой среде диазосоединения существуют в виде солей ди-
азония, в щелочной — в виде диазотатов, в близкой к нейтраль-
ной — в виде изомерных диазогидратов:
кислая среда
Ar—lij^NCl
NaOH
нейтральная среда
Ar—Sl=NOH"
арилдиазогвдроксид
—* Аг—N=N—ОН
NaOH
----
щелочная среда
Аг—N=N—ОЙа
натрия арилдиазотат
Номенклатура. Изомерия. По номенклатуре ИЮПАК названия
ароматических диазосоединений образуются путем прибавления
к названию углеводорода суффикса -диазо, а названия солей диа-
192
Многоядерные арены
зония — добавлением окончания -диазоний с последующим ука-
занием аниона.
N=N—CN
4-хл орбензолдиазо ци анид
С6Н5—N=N—ОН
бензолдиазогидроксвд
С6Н — N=N—O“Na+
N=NBr
4-метилбензолдиазония бромид
натрия бензолдиазотат
Поскольку ковалентно построенные диазосоединения в своем
составе содержат двойную связь, то для них характерна геомет-
рическая изомерия, или так называемая син-(цис-) и анти-
(я1раяс-)изомерия, например:
Но НО
сын-арилдиазогидроксид дялпи-арилдиазогидроксвд
Способы получения солей арендиазония. 1. Реакция диазотиро-
вания. В основе реакции лежит взаимодействие первичных аро-
матических аминов с азотистой кислотой в среде сильной ми-
неральной кислоты. Так как азотистая кислота неустойчива, то
в реакции используют ее соль. В реакции диазотирования на один
моль ароматического амина и один моль соли азотистой кислоты
используется не менее 2,5 моля минеральной кислоты: один моль
расходуется для вытеснения азотистой кислоты из ее соли, второй
моль — для образования соли диазония, а избыток кислоты необ-
ходим для создания кислой среды. Кислота также способствует
растворению ароматического амина. Необходимо отметить, что
в реакцию диазотирования вступает не соль амина, а свободный
амин, находящийся в равновесии с этой солью:
C6H5NH3Cr
C6H5NH2 + НС1
Реакцию проводят при охлаждении до 0—5 °C. Это связано
с тем, что диазотирование протекает с выделением тепла, а соли
диазония и азотистая кислота разлагаются уже при комнатной
температуре.
17. Диазо- и азосоединения
193
N=NC1
NaNO,; НС1 изб.
+ NaCI + Н2О
Механизм реакции. Кинетические исследования Ингольда по-
казали, что реакция протекает по ионному механизму. Диазо-
тирующим агентом является не азотистая кислота, а образующий-
ся нитрозоний-катион:
НО—N=O + Н+
N=О
N—О + Н2О
NO4
н—О—N=O
протонированная
азотистая кислота
О - i\ б—N=O
Н
нитрозоний-
катиом
азота (III)
оксид
Наиболее активным является нитрозоний-катион.
Вначале нитрозоний-катион образует с ароматическим ами-
ном N-нитрозоамин, который в кислой среде переходит в тауто-
мерную форму — диазо гидроксид. На завершающей стадии диа-
зогидроксид превращается в соль арилдиазония:
NH, + NO -
НС1
N-нитрозоамин
ди азогидрокс ид
соль диазония
Полученные водные растворы солей диазония, не выделяя, ис-
пользуют в дальнейших синтезах.
2. Взаимодействие ароматических аминов с алкилнитритами.
В среде этанола в присутствии минеральных кислот взаимодей-
ствие первичных ароматических аминов с эфирами азотистой кис-
194
Многоядерные арены
лоты приводит к образованию солей арилдиазония в кристалли-
ческом виде:
C6H5NH2 + С2Н5—ONO + НС1
- С6Н —N=NCf + С2Н5ОН + Н2О
соль диазония
В 96 %-ном спирте содержится 4 % воды, которая идет на гид-
ролиз эфира (алкилнитрата). Выделившаяся при этом азотистая
кислота диазотирует ароматический амин, а образовавшаяся соль
диазония, как плохо растворимая в спирте, выпадает в осадок.
Химические свойства солей диазония. Соли диазония являются
очень реакционноспособными соединениями. Их активность в хи-
мических превращениях связана с наличием диазокатиона. Ато-
мы азота в диазокатионе находятся в состоянии лр-гибридизации.
Один из них имеет неподеленную пару электронов, а второй со-
держит положительный заряд, который распределен в основном
между двумя атомами азота и частично по л-электронной системе
бензольного кольца. За счет делокализации каждый атом азота
приобретает частичный положительный заряд, что можно пред-
ставить в виде резонансных структур:
N=N
Все реакции солей диазония можно разделить на две группы:
реакции с выделением и без выделения азота.
А. Реакции с выделением азота. Эти реакции сопровождаются
разрывом связи С—N и замещением диазогруппы на другие атом-
ные группы.
От способа разрыва связи С—N замещение может происхо-
дить по механизму 5V1 или
По механизму 5у1 на первой, медленной стадии связь С—N
в диазокатионе разрывается гетеролитически. При этом выделя-
ется молекула азота, и образуется неустойчивый диазокатион, ко-
торый на второй стадии быстро взаимодействует с нуклеофилом:
Аг— N^NX
медленно
Аг+ + N2 + X"
арилкатион
Аг+ + Nu”
*- Аг—Nu
17. Диазо- и азосоединения
195
По радикальному механизму замещение диазогруппы про-
исходит в присутствии солей одновалентной или порошкообраз-
ной меди, которые являются донорами электронов. На первой
стадии Си+ отдает диазониевому катиону один электрон, превра-
щаясь в Си2+ (ион меди (II)). При этом образуется нестойкий ди-
азорадикал, который превращается в более стойкий арильный,
отщепляя молекулу азота. На второй стадии арильный радикал
отрывает атом галогена от меди (II) галогенида, регенерируя ме-
ди (I) галогенид:
С6Н —N=NC1" + CuCl rm С6Н— N=N------------------------*
диазорадикал
С6Н5- + Cl £ cu—С1 ----------- С6Н5С1 + CuCl
U J Jr я*
n2 +
c6H5-
арильный
радикал
1. Замещение диазогруппы, катализируемое солями одновалент-
ной меди (реакция Зандмейера). В присутствии солей одновалент-
ной меди диазогруппа замещается на атомы хлора, брома, нитро-,
циано-, хлорсульфонильную и другие группы:
KCN; CuCN; t
бензолдиазония
хлорид
C6H5CN + N2 + КС1
2. Замещение диазогруппы на гидроксигруппу. При нагревании
подкисленных водных растворов солей диазония образуются фе-
нолы:
С6Н5—N=NHSO; + Н2О
— С6Н5ОН + N2t + H2SO4
бензолдиазония
гидросульфат
3. Замещение диазогруппы на атом йода. При нагревании соли
диазония с натрия или калия йодидом образуются арилйодиды:
С6Н—N^NCl' + KI
C6H5I + N2 + KC1
Это наиболее удобный метод введения йода в бензольное
кольцо.
196
Многоядерные арены
4. Замещение диазогруппы на атом водорода. При взаимодей-
ствии солей диазония с восстанавливающими агентами (фосфор-
новатистой кислотой, формальдегидом, спиртами и др.) происхо-
дит замещение диазогруппы на атом водорода:
CJI,N=NCr + Н3РО2 Н;0;' С6Н6 + N2 + НС1 + Н3РО3
При использовании спирта в качестве восстановителя реак-
ция протекает в двух направлениях:
c6h5n
NCI' + С2Н5ОН
* С6Н6 + N2 + НС1 + СН3СОН
* С6Н5—О—С2Н5 + N2 + НС1
фенилэтиловый эфир
Как видно, диазогруппа — легкоуходящая группа, поэтому эту
реакцию часто используют для получения производных бензола,
которые иным способом получить не удается. Например:
ХП4
2,4,6-трибромбензолдиазония
хлорид
Вг
1,3,5-трибромбензол
Б. Реакции без выделения азота. 1. Образование диазопроизвод-
ных. Являясь электрофильными реагентами, соли диазония всту-
пают в реакции с нуклеофильными реагентами, образуя диазо-
производные, например:
2NaOH
с6н5
N=NC1"—
—NaCl; -H,O
NaCN
-NaCl
C6H5—N=N—ONa
натрия диазотат
C6H5—N=N—CN
бензолдиазоцианид
17. Диазо- и азосоединения
197
2. Восстановление солей диазония приводит к арил гидразинам:
С6Н5—N=NCf 1H|;SnC1-; 4НС|. C6H3NHNH2 • НС1 + 2SnCl4
В качестве восстановителей используют олова хлорид в НС1
или цинковую пыль в СН3СООН.
3. Реакция азосочетания. Соли арилдиазония вступают во взаи-
модействие с фенолами и ароматическими аминами, образуя азо-
соединения общей формулы Аг—N=N—Аг:
N=NCC
NTI4
4-аминоазобензол
N=NC1“
NaOH
-NaCl; -H2O
ОН
4- гидрокс иазобензол
Эти реакции называются реакциями азосочетания и протекают
по механизму электрофильного замещения SE.
Поскольку диазокатион является слабым электрофилом, то он
реагирует только с теми ароматическими соединениями, которые
имеют сильные электронодонорные заместители (—ОН; —NH2;
—NHR; —NI^ и др.). Замещение идет преимущественно в пара-
положении.
Соль диазония в реакциях азосочетания называют диазо-
составляющей (диазокомпонента), а фенол или ароматический
амин — азосоставляющей (азокомпонента).
Азосочетание с фенолами проводят в слабощелочной среде,
где они превращаются в более реакционноспособные феноляты:
он-
С ароматическими аминами реакцию проводят в слабокислой
среде.
198
Многоядерные арены
Сильнокислая среда недопустима, так как аминогруппа пре-
вращается в аммонийную, которая дезактивирует кольцо и умень-
шает нуклеофильность азосоставляющей.
Механизм реакции азосочетания. Являясь электрофильным ре-
агентом, катион арилдиазония образует с ароматическим ами-
ном или фенолом о-комплекс, который отщепляет протон и пре-
вращается в азосоединение:
N=N
N(CH3)
N(CH3)2
о-комплекс
N(CH3)
Следует помнить, что азосочетание с первичными или вто-
ричными аминами может привести к образованию диазоамино-
соединений (триазенам). Нагревание последних в кислой среде
приводит к азосоединениям:
N=NCP + H2N
“НС1
диазоаминосоединение
4-аминоазобензол
17. Диазо- и азосоединения
199
АЗОСОЕДИНЕНИЯ
Названия азосоединений с одинаковыми радикалами состав-
ляют из префикса азо- и названия углеводорода. Положение за-
местителей обозначается цифрами или локантами:
азобензол
4-амино-2 -гидроксиазобензол
В случае различных радикалов азосоединения рассматри-
вают как производные более сложного по структуре углеводо-
рода, который содержит в качестве заместителя ареназогруппу
Ar—N—N—:
2-бензолазонафталин
Азосоединения существуют в виде двух геометрических изо-
меров — син-(цис-) и анти-(транс-)\
син -азобензол
анти -азобензол
Химические свойства обусловлены наличием в структуре азо-
группы —N—N—. За счет наличия неподеленных пар электро-
нов на атомах азота азосоединения проявляют слабые основные
свойства:
с6н — n=n-c6h5 + НС1 -
- C6H-NH=N-C6H3 + Cl-
азобензола гидрохлорид
Образующиеся соли хорошо растворимы в соответствующих
кислотах.
С участием азогруппы азосоединения вступают в реакции окис-
ления и восстановления. Так, при действии пероксикислот про-
исходит окисление с образованием азоксисоединений:
200
Многоядерные арены
С„Н5—N=N—С6Н5
(О); СН
азоксибензол
Восстановление в мягких условиях приводит к гидразосоеди-
нениям, а действием олова (II) хлорида в среде хлороводородной
кислоты получают ариламины:
c6h5—n=n—с6н5
[Н]
(Zn + NaOH)
С6Н5—N Н~N Н—С6Н5
СН3
4-метилазобензол
SnCl4
SnCl2; НО изб.
Азосоединения представляют собой окрашенные кристалли-
ческие вещества, применяются как красители и лекарственные
препараты.
СООН
салазопиридазин
сала зод им етоксин
Химиотерапевтические средства салазопиридазин и сал азоди-
метоксин используют для лечения больных неспецифическим яз-
венным колитом.
ГИДРОКСИЛЬНЫЕ ПРОИЗВОДНЫЕ
УГЛЕВОДОРОДОВ. СПИРТЫ. ПРОСТЫЕ ЭФИРЫ.
ТИОЛЫ. ТИОЭФИРЫ. ФЕНОЛЫ
Гидроксильными производными называют производные углево-
дородов, в которых один или несколько атомов водорода замеще-
ны на гидроксильную группу.
Гидроксипроизводные углеводородов классифицируют в зави-
симости от типа гибридизации углеродного атома,
связанного с гидроксильной группой:
— спирты (гидроксигруппа расположена при лр3-гибридизи-
рованном углеродном атоме);
— фенолы (фенольный гидроксил связан с ^-гибридизиро-
ванным углеродным атомом ароматического кольца);
— енолы (гидроксигруппа находится при sp2-гибридизирован-
ном углеродном атоме двойной связи).
Следует отметить, что не известны гидроксипроизводные угле-
водородов, содержащие ОН-группу при др-гибридизированном
углеродном атоме.
18
СПИРТЫ
Гидроксипроизводные углеводородов, содержащие одну или
несколько гидроксильных групп при sp-гибридизованных угле-
родных атомах, называют спиртами.
В зависимости от количества гидроксильных
групп в молекуле различают одно-, двух-, трех- и полиатомные
спирты.
СН3—ОН Н2С—СН2 Н2С—СН—СН2 Н2С—(^Н—СН—^Н2
ОН ОН ОН ОН ОН ОН ОН ОН ОН
одноатомный двухатомный трехатомный четырехатомный
спирт спирт спирт спирт
202
Гидроксильные производные углеводородов
По природе углеводородного радикала спир-
ты делят на алифатические, алициклические и ароматические'.
сн3—ОН
н2с=сн—сн—он
алициклический
спирт
ароматический
спирт
алифатические
спирты
В зависимости от расположения гидроксигруппы
в углеводородной цепи молекулы выделяют первичные,
вторичные и третичные спирты. Первичные спирты содержат гид-
роксигруппу при первичном атоме углерода, вторичные и третич-
ные — соответственно при вторичном и третичном углеродных
атомах.
R—CH — ОН /СН—ОН
R’^
первичный
спирт
вторичный
спирт
R
R—С—ОН
R"
третичный
спирт
ОДНОАТОМНЫЕ СПИРТЫ
Одноатомными спиртами называют производные углеводоро-
дов, содержащие одну гидроксигруппу, связанную с ^-гибриди-
зированным углеродным атомом.
Одноатомные спирты классифицируют в зависимости от при-
роды углеводородного радикала:
— насыщенные (гидроксипроизводные алканов и цикло-
алканов);
— ненасыщенные (соединения, в молекулах которых содержится
кратная связь и гидроксильная группа, связанная с атомом угле-
рода в sp -гибридизации);
— ароматические (гидроксипроизводные ароматических угле-
водородов с группой —ОН в боковой цепи).
Номенклатура. По заместительной номенклатуре названия од-
ноатомных спиртов образуют из названия родоначального угле-
водорода, суффикса -ол и цифрового локанта, указывающего по-
ложение гидроксигруппы.
18. Спирты
203
сн—сн—он сн,—сн—сн—сн,
сн,—сн=сн—сн—он
этанол
он
бутанол-2
бутен-2-ол-1
циклогексанол
сн—сн2
он
2-фенил этанол
Для названия спиртов широко используют радикально-функ-
циональную номенклатуру, в соответствии с которой к названию
углеводородного радикала добавляют слово спирт.
аллиловый спирт
Н2С=СН—СН—ОН
ОН
изопропиловый спирт
ОН
бензиловый спирт
Рациональная (карбинольная) номенклатура спиртов исполь-
зуется в отдельных случаях для упрощения образования названий.
Спирты рассматривают как производные метилового спирта
СН3ОН, получившего название карбинол. Достаточно распростра-
ненными остаются тривиальные названия отдельных спиртов:
СН3ОН — древесный спирт, С2Н5ОН — винный спирт и др.
Изомерия. Структурная изомерия спиртов обусловлена различ-
ным строением углеводородного скелета и положением гидрокси-
группы в углеродной цепи:
— изомерия углеродного скелета
СН—СН—СН—СН2—ОН
бутанол-1
— изомерия положения
сн,—сн,—сн,—сн,—он
J Хг "
бутанол-1
н2с=сн—сн—сн2—он
СНз^сн—сн—он
сн^
2-метилпропанол-1
сн,—сн—сн2—сн,
он бутанол-2
сн,—сн=сн—сн2—он
бутен-З-ол-1
бутен-2-ол-1
204
Гидроксильные производные углеводородов
Геометрическая изомерия спиртов обусловлена наличием крат-
ной связи в углеводородном радикале.
ОН
Чмс,-буген-2-ол-1
/иранс-бутен-2-ол-1
ОН
Оптическая изомерия характерна для спиртов, содержащих
в своем составе асимметрический атом углерода.
*
он
пентанол-2
НО
2
сн3
/?-пентанол-2
5'-пентанол-2
Способы получения. Спирты получают различными синтети-
ческими способами.
1. Гидратация алкенов. При гидратации этилена получают пер-
вичный спирт, его гомологи образуют вторичные и третичные
спирты:
Н2С=СН2 + Н2О H;S0,;СН —сн —он
этилен этанол
н2с=сн—сн3 + н2о ;' - сн —сн—сн3
он
пропен пропанол-2
2. Гидрирование карбонильных соединений. При восстановлении
альдегидов, карбоновых кислот и сложных эфиров образуются пер-
вичные, а при восстановлении кетонов — вторичные спирты.
СН3—СН2
[Н]; Ni
пропаналь
буганон
[Н]; Pt^
СН— СН2—СН — он
пропанол-1
сн3—сн2—сн—сн3
бутанол-2
он
18. Спирты
205
Для получения ненасыщенных спиртов из соответствующих
альдегидов и кетонов в качестве мягкого селективного восстано-
вителя используют натрия борогидрид NaBH4 (не затрагивает крат-
ные углерод-углеродные связи).
JD NaBH4
н2с==сн—сн2—сС -------------- н2с=сн—сн2—он
'Н
бутен-3-аль пропен-2-ол-1
3. Гидролиз галогенопроизводных углеводородов. В присутствии
водных растворов щелочей при нагревании галогенопроизвод-
ные углеводородов подвергаются гидролизу с образованием спир-
тов (Svl или SNT).
R—Hal R—ОН + НаГ
4. Взаимодействие карбонильных соединений с магнийорганиче-
скими соединениями (реактивами Гриньяра). Магнийорганическое
соединение присоединяется к молекуле карбонильного соедине-
ния (альдегиды, кетоны, сложные эфиры) по месту разрыва
л-связи карбонильной группы. Образовавшийся алкоголят гидро-
лизуется до спирта.
формальдегид
+ СН3—MgBr
метилмагнийбромид
OMgBr + Н2О
сн
н—С—OMgBr
броммагнийалкоголят
- СН — СН2—ОН + Mg(OH)Br
этанол
Первичные спирты получают при действии магнийорганиче-
ских соединений на формальдегид, другие альдегиды образуют
вторичные спирты, а кетоны и сложные эфиры — третичные
спирты.
CH3MgBr
пропаналь
СН3
п
С2Н5—С—OMgBr
нон
—Mg(OH)Br
с2н5—с—он
н
броммагния
алкоголят
бутанол-2
206
Гидроксильные производные углеводородов
С2Н5— С—СН3 -'-н-м-’1!. с2н5
“ II i э
о
бутанон
сн,
С—OMgBr - “°" С2Н5
° —Mg(OH)Br z э
сн2
сн,
П w*
С—он
I
сн.
2-метилбутанол-2
5. Спиртовое брожение углеводов (глюкозы, фруктозы, крахма-
ла или целлюлозы) позволяет получить этиловый спирт:
СбН12О6
глюкоза
дрожжи
2С2Н5ОН + 2COJ
этиловый спирт
Физические свойства. Спирты — это жидкости или твердые
вещества, растворимы во многих органических растворителях.
Низшие спирты, в отличие от высших, хорошо растворимы в воде.
Спирты состава С,—С3 обладают характерным алкогольным запа-
хом, С4—С5 — неприятным «сивушным», высшие алканолы —
приятным фруктовым запахом.
Температура кипения спиртов значительно выше температу-
ры кипения соответствующих углеводородов и галогенопроиз-
водных. Это объясняется наличием водородных связей, которые
обусловливают образование ассоциатов:
Прочность водородных связей невелика, но для их разрыва
при переходе молекулы из жидкого состояния в газообразное тре-
буется дополнительная энергия.
Химические свойства. Химические свойства спиртов обуслов-
лены наличием полярных связей О—Н и С—О, а также неподе-
ленных электронных пар атома кислорода. Для спиртов характер-
ны реакции, протекающие с разрывом связи О—Н (образование
алкоголятов, эстерификация, окисление, дегидрирование, взаи-
модействие с реактивами Гриньяра и др.), с разрывом связи С—О
(нуклеофильное замещение ОН-группы, образование простых
эфиров, дегидратация).
1. Кислотность спиртов. Полярность связи О—Н в спиртах
определяет ее склонность к гетеролитическому разрыву.
Спирты как ОН-кислоты реагируют со щелочными металлами
с образованием алкоголятов.
18. Спирты
207
2С2Н5ОН + 2Na ------ 2C2H5ONa + H2t
натрия этилат;
натрия этокс ид
Алкоголяты легко разлагаются водой до исходных спиртов, что
подтверждает более низкую кислотность спиртов по сравнению
с водой:
CJTO Na+ + НОН QH.OH + NaOH
Из-за низкой кислотности спирты почти не вступают в реак-
цию со щелочами.
Кислотные свойства спиртов уменьшаются при переходе от
первичных спиртов к третичным:
5+ CH3sk6+ 8'+ СН3^8+ 8"+
сн,—о- Н > „СН—о—н > сн3—с—о—н
сн, сн;
Такая зависимость объясняется проявлением +/-эффекта со
стороны углеводородного радикала.
2. Основные свойства обусловлены способностью неподелен-
ной электронной пары атома кислорода гидроксигруппы спиртов
реагировать с протоном с образованием оксониевых солей. Ос-
новные свойства спиртов очень слабые.
, . 8+ 8-
R—О—Н + HHal
*
Алкилоксониевые соли во многих реакциях образуются в ка-
честве промежуточных продуктов.
3. Образование сложных эфиров. Спирты реагируют с карбоно-
выми и кислородсодержащими минеральными кислотами с обра-
зованием сложных эфиров.
H,SO4 кони.; /
сн — + НО—СН—СН3 СН—С^ + Н2О
он о—сн—сн3
уксусная кислота этиловый спирт этилацетат
СН3—СН2—[ОН+_HOj—NO2 — сн —сн—о—no2 + Н2О
этилнитрат
208
Гидроксильные производные углеводородов
4. Дегидратация спиртов. Для спиртов характерна межмолеку-
лярная и внутримолекулярная дегидратация.
В результате межмолекулярной дегидратации образуются про-
стые эфиры.
СН —СН — ОН + HOJ-CH — сн,
этанол —- сн—сн —о—сн —сн3 + Н2О
диэтиловый эфир
Межмолекулярная дегидратация становится доминирующей
при нагревании избытка спирта в присутствии каталитических
количеств минеральной кислоты при температуре 140—160 °C
и протекает по механизму 5V1 или 5Л2.
Первичные спирты вступают в реакцию межмолекулярной де-
гидратации по механизму 5^2, третичные — по механизму
а вторичные — как по 5У2, так и по 5^1.
Продуктами внутримолекулярной дегидратации являются ал-
кены.
Следует помнить, что в спиртах, в которых с атомом углерода,
несущим гидроксильную группу, связаны неравноценные атомы
углерода, отщепление молекулы воды происходит по правилу Зай-
цева, то есть водород уходит от соседнего, менее гидрогенизиро-
ванного атома углерода:
сн —сн — сн—сн—сн, сн3—сн,—сн=с—сн3
I | J —H2O J 4 । J
он сн3 сн3
2-метилпентен-2
Внутримолекулярная дегидратация становится доминирующей
реакцией при нагревании спиртов с избытком минеральной кис-
лоты при температуре выше 170 °C.
Следует отметить, что для спиртов более характерны реакции
отщепления, протекающие по механизму £1. Реакция протекает
через стадию образования карбокатиона.
18. Спирты
209
СН3
сн3—с—он
сн,
2-метилпропанол-2
СН
карбокатион
- сн
2-метиллропен
СН
/пре/п-бутилоксоний-
катион
5. Взаимодействие с галогеноводородными кислотами. При вза-
имодействии спиртов с галогеноводородными кислотами (НС1,
НВг, HI) гидроксильная группа замещается на атом галогена, и об-
разуются галогеноалканы. С первичными спиртами реакция про-
текает по механизму SN2, с третичными — по 5^1. Вторичные
спирты реагируют как по механизму SN2, так и по механизму 5^1.
Механизм 3L2:
j V
R—СН — ОН -2— R—СН2—6^ Н
переходное состояние
первичный спирт
алкилоксоний-катион
галогеналкан
Механизм 5Л,1:
R
R-—C— ОН
R
алкилоксоний -
катион
третичный
спирт
R. + „ _ R.
R--S— R-^C—Вг
-hiO R/ R/
карбокатион галогеналкан
С йодоводородной и бромоводородной кислотами реакция про-
текает легко, с хлороводородной — значительно труднее. Первич-
ные и вторичные спирты реагируют с хлороводородной кислотой
только в присутствии цинка хлорида (кислоты Льюиса).
Первичные, вторичные и третичные спирты при взаимодей-
ствии с реактивом Лукаса (эквимолярными количествами кон-
центрированной хлороводородной кислоты и цинка хлорида) с раз-
личной скоростью образуют галогенопроизводные углеводородов.
Проба Лукаса используется для распознавания первичных, вто-
ричных и третичных спиртов.
210
Гидроксильные производные углеводородов
6. Взаимодействие с галогенангидридами неорганических кислот.
Спирты взаимодействуют с галогенидами фосфора (РС13, РС15 и др.)
и тионилхлоридом SOCL с образованием галогеналканов:
ЗСН — ОН + РС13
СН — ОН + РС15
сн —ОН + SOC12
- ЗСН3—Cl + Н3РО3
- СН—С1 + РОС13 + НС1
* СН — С1 + SO2 + НС1
Реакция с тионилхлоридом протекает по механизму внутри-
молекулярного нуклеофильного замещения
СН—СН2—ОН + SOCL -------
2 -НС1
этанол
этиловый эфир
хлорангидрцда
сернистой кислоты
- СН,—СН—С1
хлорэтан
7. Окисление. Спирты окисляются под действием кислорода
воздуха в присутствии катализаторов (Си, СиО) и различных окис-
лителей — хрома (VI) оксида, хромовой смеси (калия дихромата
в серной кислоте), калия перманганата в серной кислоте и др.
Первичные спирты образуют альдегиды (при дальнейшем
окислении — карбоновые кислоты с тем же числом углеродных
атомов).
Н
R—С—ОН
I
Н
[О]
—Н2О
альдегид
[О]
карбоновая
кислота
Вторичные спирты окисляются до кетонов:
ОН
R
кетон
Третичные спирты более устойчивы к окислению. При дей-
ствии сильных окислителей происходит расщепление углеродно-
го скелета молекулы третичного спирта с образованием смеси кар-
боновых кислот и кетонов.
18. Спирты
211
В промышленности спирты превращают в альдегиды или ке-
тоны путем каталитического дегидрирования. При пропускании
паров спирта над катализатором (Zn, Си, Ag) при температуре
300 °C происходит отщепление водорода, и образуются альдегиды
или кетоны:
R— СН,—ОН R—С
н2
альдегид
R—СН—R’ R—С—R'
Н2 II
ОН о
кетон
8, Взаимодействие с магнийорганическими соединениями. Спир-
ты реагируют с реактивами Гриньяра. Атом водорода гидрокси-
группы замещается на магнийгалоген, и выделяется газообразный
углеводород.
R—ОН + CH3MgBr
- R—OMgBr + CH4t
магния
бромалкоголят
Измерив объем выделившегося газа, определяют количество
гидроксильных групп в молекуле спирта (реакция Чугаева—Цере-
витинова).
ДВУХ-, ТРЕХ- И ПОЛИАТОМНЫЕ СПИРТЫ
Спирты, содержащие две гидроксильные группы, называются
двухатомными спиртами, диолами или гликолями.
Классифицируют гликоли в зависимости от положения гидро-
ксильных групп:
R—СН—СН—R’
ОН ОН
а-гликоль
R— СН—СН— СН—R'
ОН ОН
Р-гликоль
R—СН—СН,—СН,—СН—R'
П П
он он
у-гликоль
Двухатомные спирты, содержащие две гидроксильные группы
при одном углеродном атоме, называются геминальными диолами.
Такие спирты в свободном состоянии не существуют, в момент
212
Гидроксильные производные углеводородов
образования спирта молекула воды отщепляется, и образуются аль-
дегиды или кетоны:
R. jOH R.
,(’ ----- .0=0
R ОН "н2° R'
гем-диол
По систематической номенклатуре названия гликолей образу-
ют от названия соответствующего углеводорода, добавляя суффикс
-диол и цифровые локанты, указывающие положение гидроксиль-
ных групп. По радикально-функциональной номенклатуре двух-
атомные спирты называют путем добавления к названию соответ-
ствующего двухатомного радикала суффикса -гликоль.
ОН ОН
этандиол-1,2;
этиленгликоль
н,с—сн—сн,
— 1| чА
ОН он
пропандиол-1,2;
пропиленгликоль
Спирты, содержащие три гидроксильные группы, называются
трехатомными спиртами, триолами или глицеринами. Названия
трехатомных спиртов образуют путем добавления к названию со-
ответствующего углеводорода суффикса -триол и цифровых ло-
кантов, указывающих положение ОН-групп:
н2с—сн—сн2
он он он
пропантриол-1,2,3;
глицерин
Спирты, содержащие более трех гидроксильных групп, назы-
вают многоатомными спиртами, или полиолами. Четырехатомные
спирты называют эритритами, пятичленные — пентитами, шес-
тичленные — гекситами и т. д.
Способы получения. Двух- и трехатомные спирты получают теми
же способами, что и одноатомные, используя в качестве исход-
ных веществ соответствующие полифункциональные производ-
ные. Существует ряд специфических способов получения.
1. Гидроксилирование алкенов (реакция Вагнера) позволяет по-
лучить а-гликоли:
ЗСН3—СН=СН, + 2КМпО4 + 4Н2О
пропен
18. Спирты
213
* ЗСН3—СН—СН2 + 2КОН + 2МпО2
ОН он
пропандиол-1,2
2. Гидратация оксирана и его производных проводится в кислой
среде и сопровождается раскрытием цикла:
оксиран
НО ОН
этиленгликоль
Данная реакция лежит в основе промышленного способа по-
лучения этиленгликоля.
3. Гидролиз жиров. Жиры, представляющие собой сложные эфи-
ры трехатомного спирта глицерина и высших карбоновых кислот,
в кислой и щелочной средах гидролизуются до глицерина.
зн,о
н+ или ОН"
триглицерид
н2с—ОН
I
нс—он
н2с—он
глицерин
+ 3R—СООН
В промышленности глицерин получают синтетически на ос-
нове нефтегазового сырья. Синтез глицерина окислением пропилена
считается наиболее перспективным:
О,; 270 °C
н2с=сн—сн3 -
пропилен
[Н]
- н2с=сн—сн —он
-°— н2с—сн—сн2
н2о
-НС1
С1 ОН ОН
аллиловый
спирт
З-хлорпропандиол-1,2
- н2с—СН—СН2
он он он
глицерин
Физические свойства. Двухатомные и трехатомные спирты
представляют собой жидкости или кристаллические вещества
с высокими температурами кипения и плавления (наличие водо-
214
Гидроксильные производные углеводородов
родных связей). Отличительной особенностью спиртов с несколь-
кими гидроксильными группами является их сладковатый вкус,
усиливающийся с увеличением числа ОН-групп.
Химические свойства. Двух- и трехатомные спирты вступают
в аналогичные одноатомным спиртам реакции. Однако различ-
ное количество гидроксильных групп в спиртах определяет и не-
которые их особенности.
7. Кислотные свойства. С увеличением числа гидроксильных
групп в молекуле кислотные свойства спиртов усиливаются. Это
связано с электроноакцепторным влиянием одной гидроксиль-
ной группы на другую (-/-эффект).
Гликоли являются более сильными ОН-кислотами, чем од-
ноатомные спирты. Они образуют алкоголяты (гликоляты) не толь-
ко со щелочными металлами, но и другими активными металла-
ми (Al, Mg и т. д.), а также со щелочами и гидроксидами тяжелых
металлов.
Н2С—ОН NaOH Н2С—ONa NaOH Н2С—ONa
► I - ►
Н,С—ОН “Н;О Н,С—ОН "Н2° Н,С—ONa
натрия натрия
моногликолят дигликолят
(неполный гликолят) (полный гликолят)
а-Гликоли способны реагировать с меди (II) гидроксидом
с образованием комплексных соединений, растворы которых
окрашены в синий цвет. Данная реакция является качественной
на спирты, содержащие ос-гликольный фрагмент.
и
н2с—он- 2 + |Си(ОН), — н2с—он- Н2С—он 1 2 НС—OH + Cu(OH)2 н2с—ОН н2с—о о—СН2 - + 2Н2О н2с—oz о—сн2 меди (II) гликолят но—сн2 Н2С—оч NaO—СН 2NaOH V-X -4Н2О' НС—ONa О—СН2 Н2С—ОН
глицерин
меди (II) глицерат
18. Спирты
215
2, Образование простых и сложных эфиров. При взаимодей-
ствии со спиртами гликоли образуют неполные и полные простые
эфиры.
Н2С—ОН R_pH. н. H2C-OR r—он; н*_ Н2С—OR
Н,с—ОН -Н2° Н2С—ОН ~Hi° Н2С—OR
простой эфир
Реакции с кислородсодержащими неорганическими или кар-
боновыми кислотами приводят к образованию полных и непол-
ных сложных эфиров.
Н2С—ОН
2 НС—ОН + 3HNO3
Н2С—ОН
h2so4
н2с—ono2
2 НС—ONO2 + ЗН2О
Н2С—ОН
2 НС—ОН + ЗНО—С^
^СН3
Н2С—ОН
н*
н2с—ono2
X-
тринитроглицерин
глицеринтриацетат
уксусная кислота
3. Окисление. Окисление гликолей в зависимости от природы
окислителя может протекать по-разному:
Н2С—ОН
Н2С—ОН
[О1
Н2С—ОН
гликолевый
альдегид
н2с—он
гликолевая
кислота
глиоксаль
СОПН
|О1 СООН
СООН
глиоксиловая щавелевая
кислота
кислота
216
Гидроксильные производные углеводородов
Для идентификации а-гликолей используют реакцию окисле-
ния йодной кислотой НЮ
НС—ОН + НЮ
4
СН
пропиленгликоль
метаналь
этаналь
При окислении происходит разрыв связи между углеродными
атомами а-гликольного фрагмента, и образуются соответствую-
щие карбонильные соединения. По продуктам окисления уста-
навливают положение диольного фрагмента в молекуле.
4. Дегидратация, Гликоли подвергаются внутри- и межмоле-
кулярной дегидратации. Направление реакций определяется ус-
ловиями их проведения.
Н2С—СН2
I I
он он
H2SO4 изб.; /
-НЮ
н2с=сн;
он
.он но.
Н2С сн,
“ I I
П,С' _СН2
ОН НО
ВИНИЛОВЫЙ
спирт
H2SO4; /
кат, к-во
уксусный
альдегид
диоксан
Глицерин подвергается внутримолекулярной дегидратации
с образованием непредельного альдегида акролеина:
Н2С—СН—СН2 KHS°4'' • Н,С—CH=CH-Q>—н
I z -Н20 z
он он он он
.о X)
- — Н2С—СН—Н2С=СН—CZ
_J__L н -н’°
|НО_ Hi акролеин
5. Поликонденсация, Этиленгликоль в результате реакции по-
ликонденсации способен образовывать полиэфир — полиэтилен-
гликоль НО—[—СН2—СН2—О—^Н.
Полиэтиленгликоль с молекулярной массой до 400 используют
в фармации в качестве растворителя лекарственных веществ, осно-
вы для мазей, связывающего вещества в производстве таблеток.
18. Спирты
217
АМИНОСПИРТЫ
Аминоспиртами называют производные углеводородов, содер-
жащие аминогруппу (замещенную или незамещенную) и спирто-
вый гидроксил.
Н2С—СН — ОН
nh2
2-аминоэтанол,
Р-аминоэтиловый спирт
н,с- сн2—он
N(C2H5)2
2 - N, N-диэтил ам иноэтанол
Получают аминоспирты путем аммонолиза и аминолиза окси-
рана и его производных, галогеноспиртов, а также восстановле-
нием соответствующих нитроспиртов.
NH3
-HjO
СН—СН2
NH2 ОН
2-аминоэтанол
сн,—сн2—он
С!
(CH3)2NH
-НС1
СН—СН—ОН
N(CH3)2
2-хлорэтанол
2-М,Ы-диметиламиноэтанол
сн,—сн—он » сн—сн2—он
I 2 -н2о I z z
no2 nh2
2-аминоэтанол
Простейшие аминоспирты — густые жидкости с аммиачным
запахом, растворимые в воде.
Важное биологическое значение имеют холин и ацетилхолин.
Холин — [2-(гидроксиэтил)-триметиламмония гидроксид]
[НО—СН,—СН— N+(CH3)3]OH-
играет важную роль в обмене веществ, входит в состав лецитинов,
содержится в нервных тканях, мозге, печени, почках, сердечной
мышце, участвует в построении клеточных мембран.
[ СН—С—О—СН —СН—N Н2(С Н3)3] О Н
О
Ацетилхолин является медиатором; он участвует в передаче
нервных импульсов.
218
Гидроксильные производные углеводородов
ПРОСТЫЕ ЭФИРЫ
Простыми эфирами называют органические соединения, в ко-
торых два углеводородных радикала соединены атомом кислорода.
Общая формула простых эфиров: R—О—R’, где R, R' — угле-
водородные радикалы.
Различают симметричные простые эфиры (содержат одинако-
вые углеводородные радикалы) и несимметричные или смешан-
ные (углеводородные радикалы различны).
По радикало-функциональной номенклатуре названия простых
эфиров образуют путем добавления к названию углеводородных
радикалов суффикса -овый и слова эфир. В смешанных простых
эфирах углеводородные радикалы перечисляют в алфавитном по-
рядке.
сн3—о—сн3
диметиловый эфир
сн3—о—с2н5
метилэтиловый эфир
По заместительной номенклатуре ИЮПАК простые эфиры рас-
сматривают как производные углеводородов, в которых атом во-
дорода замещен алкоксигруппой —OR. Более сложный по струк-
туре радикал принимают за родоначальную структуру.
СН3—СН2—О—СН2—СН2—СН3
1 -этоксипропан
Простые эфиры — бесцветные легколетучие жидкости с ха-
рактерным запахом, плохо растворимы в воде, хорошо раствори-
мы в органических растворителях.
Способы получения. 1. Межмолекулярная дегидратация спир-
тов. При нагревании спиртов в присутствии каталитических ко-
личеств концентрированной серной кислоты образуются простые
симметричные эфиры.
-------.
СН— сн24рн_+ но'-сн— СН3 .
- сн —сн —о—сн —сн3 + Н2О
диэтиловый эфир
2. Синтез Вильямсона. Алкилирование алкоголятов и феноля-
тов алкилгалогенидами позволяет получить несимметричные про-
стые эфиры.
18. Спирты
219
СН,—I + С2Н5—ONa -------* СН3—О—С2Н5 + Nal
метилэтиловый эфир
метилфениловый эфир,
метоксибензол
Химические свойства. Простые эфиры являются достаточно
инертными веществами.
1. Образование оксониевых солей. Наличие в молекуле просто-
го эфира атома кислорода со свободной электронной парой опре-
деляет их основные свойства. При взаимодействии простых эфи-
ров с концентрированными минеральными кислотами образуются
оксониевые соли.
2х х5 СГ
диэтиловый эфир
диэтилоксония
хлорид
2. Расщепление простых эфиров:
а) расщепление под действием щелочных металлов. Простые эфи-
ры под действием щелочных металлов (Na, К, Li) при нагревании
способны расщепляться с образованием алкоголятов и металлор-
ганических соединений.
С2Н5—О—С2Н5 + 2Na С2Н5—ONa + C2H5Na
натрия этилат этилнатрий
б) расщепление под действием кислот (ацидолиз). Простые эфи-
ры разлагаются концентрированной йодоводородной кислотой уже
на холоде с образованием алкилйодида и спирта.
С2Н5—О—С2Н5 + HI ------ С2Н5—ОН + С2Н5—I
диэтиловый эфир этиловый спирт этилйодид
Если реакцию проводят при нагревании, то образуется вторая
молекула этилйодида.
СН,—СН,—ОН — СН —ChJ-O—Н СН—СН —I + Н2О
220
Гидроксильные производные углеводородов
3. Окисление простых эфиров. Простые эфиры окисляются на
воздухе при нормальной температуре. Окисление протекает по
а-углеродному атому.
СН3—СН2—О—СН2—СН, + О,
сн— сн — о—сн—сн3
пероксид А—А—Н
Образующиеся пероксиды неустойчивы, легко взрываются. Ра-
ботать с эфирами необходимо с большой осторожностью, предва-
рительно убедившись в отсутствии пероксидных соединений.
ТИОЛЫ. ТИОЭФИРЫ
Тиолами (тиоспиртами, меркаптанами) называют соединения
общей формулы R—SH (тиоаналоги спиртов). Их можно рассмат-
ривать как производные сероводорода H2S, в которых один атом
водорода замещен углеводородным радикалом.
По систематической номенклатуре названия тиолов образуют
путем добавления к названию родоначального углеводорода суф-
фикса -тиол. Префикс меркапто- используют, если в молекуле
SH-группа не является старшей.
По рациональной номенклатуре тиолы называют меркаптанами.
СП— СН — SH
«J X#
— этил меркаптан, этантиол
Тиолы представляют собой жидкие или твердые вещества (за
исключением метантиола), с неприятным запахом, ядовиты.
Получают тиолы из сероводорода и его кислых солей реак-
цией алкилирования галогеналканами или спиртами.
H,S + С2Н,ОН Л1;О’'C.H.SH + Н,0
NaHS + C.H.Cl ------- C,H5SH + NaCl
Химические свойства. Тиолы во многом сходны со спиртами,
обладают более выраженными кислотными свойствами. Реакции
обусловлены поляризацией связи S—Н и нуклеофильными свой-
ствами атома серы.
1. Образование тиолятов (меркаптидов). Тиолы образуют соли
не только со щелочными металлами, но и их гидроксидами, а также
ионами тяжелых металлов.
C2H5SH + NaOH
C2H5SNa + Н7О
натрия этантиолят
18. Спирты
221
2. Ацилирование. Реакция аналогична этерификации карбоно-
вых кислот.
сн
+ НОН
он
этиловый эфир
тиоуксусной кислоты
3. Окисление. В отличие от спиртов тиолы окисляются не по
углеродному атому, а по атому серы. При окислении тиолов
в мягких условиях (Н2О2, СиС12 и др.) образуются диалкилдисуль-
фиды, в жестких (KMnO., HNO, или HOI) — сульфокислоты,
«г
диэтилдисульфид
2
S—он
этансульфокислота
Тиоэфирами (сульфидами) называют производные сероводоро-
да H2S, в которых два атома водорода замещены углеводородны-
ми радикалами. Их можно рассматривать как тиоаналоги простых
эфиров (R—S—R').
S—C2HS — метилтиоэтан, метилэтилсульфид
Получают сульфиды в результате алкилирования алкилгалоге-
нидами тиолятов и сульфидов щелочных металлов.
сн
115 и ^2 “5
этилтиоэтан,
диэтилсульф ид
Сульфиды — бесцветные вещества с неприятным запахом.
Практически нерастворимы в воде. При взаимодействии с кон-
центрированными минеральными кислотами образуют сульфони-
евые соли:
сн
сн,—S—сн
hso;
ди метил сульфония
гидросульфат
222
Гидроксильные производные углеводородов
Окисление сульфидов в зависимости от природы окислителя
и условий реакции протекает с образованием сульфоксидов R2SO
или сульфонов R2SO2.
СН—S—СН3
СН3—S—С2Н5
о
н,о2 II
-.- - СН—S—сн3
диметил сульфоксид
О
KMnO4 II
----- СН—S—СН—СН3
О
метилэтилсульфон
Сульфоксиды менее стабильны, чем сульфоны. Сульфоксиды
относительно легко окисляются до сульфонов и восстанавлива-
ются до сульфидов.
________________19__________________
ФЕНОЛЫ
Фенолами называют производные ароматических углеводоро-
дов, у которых один или несколько атомов водорода в аромати-
ческом ядре замещены на гидроксильную группу.
По количеству гидроксильных групп фенолы
делят на одно-, двух-, трех- и полиатомные.
ОДНОАТОМНЫЕ ФЕНОЛЫ
К одноатомным фенолам относятся гидроксилсодержащие аро-
матические соединения, имеющие в своем составе одну гидро-
ксильную группу:
ОН
фенол,
гидроксибензол
1 -гидроксинафталин
Для названия фенолов применяют заместительную номен-
клатуру, в этом случае перед названием арена ставится префикс
гидрокси-.
При наличии заместителей в ароматическом ядре за родона-
чальную структуру берут фенол.
Наряду с заместительной номенклатурой в ряду фенолов ши-
роко применяются тривиальные названия.
Метильные производные фенола называют крезолами, а 2-изо-
пропил-5-метилфенол называют тимолом.
Для некоторых фенолов чаще используют тривиальные на-
звания (ксилол, тимол и т. д.). Для названия гомологов фенола
в качестве основы используют слово фенол.
224
Гидроксильные производные углеводородов
о-крезол,
2-метил фенол
.и-крезол,
3-метил фенол
з
л-крезол,
4-метил фенол
тимол
Способы получения. 1. Природные источники. Фенол получают
при сухой перегонке каменноугольной смолы. Вторая фракция
с /кип = 150...230 °C содержит фенол. Впервые фенол был получен
таким способом Ф. Рунге в 1834 году.
2. При нагревании галогенопроизводных бензола со щелочами в при-
сутствии катализатора:
хлорбензол
8% NaOH, Си
300 °C, 200 атм
3. Сплавление натриевых солей сульфокислот со щелочами:
бензолсульфо-
кислота
NaOH
сплавл.
натриевая соль
бензолсульфокислоты
NaOH
сплавл.
натрия фенолят,
натрия феноксид
4. Разложение солей диазония. При нагревании водных раство-
ров солей выделяется азот, и образуется фенол:
бензолдиазония
хлорид
нон, t
+ N,t + на
19. Фенолы
225
5. Окисление кумола (кумольный способ). Это основной про-
мышленный способ получения фенола:
бензол
H,SO
фенол
ацетон
гидропероксид
кумола
Способ является экономически выгодным, так как позволяет,
кроме фенола, получить и другой важный продукт — ацетон.
Химические свойства. Для фенолов характерны два направле-
ния реакций: реакции по фенольному гидроксилу и по аромати-
ческому ядру.
В молекуле фенола имеет место сопряжение неподелен-
ной пары электронов атома кислорода гидроксильной группы
с л-электронами бензольного ядра. Это приводит к довольно силь-
ной поляризации связи О*-Н, что объясняет более выраженный
кислотный характер фенолов в сравнении со спиртами. Атомы
водорода гидроксильной группы приобретают подвижность и до-
вольно легко замещаются на другие атомы или атомные группы.
С другой стороны, наличие положительного мезомерного эф-
фекта приводит к укорачиванию связи С—ОН, что делает прак-
тически невозможными реакции замещения фенольного гидро-
ксила.
А. Реакции с участием группы ОН. 1. Кислотные свойства.
Фенолы обладают кислотным характером, они способны образо-
вывать соли при действии щелочей:
226
Гидроксильные производные углеводородов
ОН + NaOH
натрия фенолят
В водном растворе феноляты подвергаются частичному гидро-
лизу, так как образованы слабой кислотой и сильным основани-
ем. По этой причине их растворы имеют щелочную реакцию.
Минеральные кислоты, в том числе и угольная, вытесняют фено-
лы из их солей.
На кислотность фенола оказывают влияние заместители в аро-
матическом ядре. При наличии в «-положении электроноак-
цепторных заместителей (—NO2, —Cl, —CN и др.) кислотные
свойства усиливаются. Если в «-положение ввести электронодо-
норные заместители (—NH2, —ОСН3 и др.), то происходит сни-
жение кислотных свойств, поскольку уменьшается поляризация
О—Н-связи, что затрудняет отрыв протона:
-I, +м
2. Образование простых и сложных эфиров. Простые эфиры
фенола непосредственно из фенола получить не удается. Для их
получения используют реакцию Вильямсона: взаимодействие на-
трия феноксида с галоидными алкилами или арилами.
О—СНо—СН
фенилэтиловый эфир
(фенетол)
При взаимодействии фенолятов с галогенаренами образуются
ароматические простые эфиры:
Вг
дифениловый эфир
Дифениловый эфир имеет запах герани.
19. Фенолы
227
Ароматические простые эфиры имеют схожие химические свой-
ства с простыми эфирами алифатического ряда. Они не взаимо-
действуют со щелочами, разложить их можно только йодоводо-
родной кислотой.
Взаимодействие фенолятов с галоген ангидридами карбоновых
кислот приводит к образованию сложных эфиров:
СН3
-NaCI
ацетилхлорид
фен ил ацетат
Аналогичные продукты также получают по реакции ацилиро-
вания самих фенолов ангидридами карбоновых кислот:
уксусный ангидрид
Такая реакция называется О-a пилированием.
В отличие от спиртов фенолы не этерифицируются непосред-
ственно карбоновыми кислотами.
3. Взаимодействие фенолята натрия с хлоруксусной кислотой.
Примером реакции О-алкилирования является реакция получе-
ния феноксиуксусной кислоты:
ONa + С1СН2СООН
СООН + NaCI
феноксиуксусная кислота
Феноксикислоты являются кристаллическими веществами
с точно фиксированной температурой плавления и служат для
идентификации фенолов. Феноксиуксусная кислота имеет боль-
шое значение в синтезе фармацевтического препарата фенокси-
пенициллина. Пенициллин — это природный антибиотик, кото-
рый образуется в результате размножения плесени. В настоящее
время пенициллин получают в медицинской промышленности
в больших чанах, где произрастает плесень. Однако природу пе-
228
Гидроксильные производные углеводородов
нициллина можно изменять. Если в питательную среду плесени
добавить феноксиуксусную кислоту, получают феноксиметилпе-
нициллин, который более устойчив, чем обычный пенициллин.
2,4-Дихлорфеноксиуксусную кислоту применяют в качестве
стимулятора роста растений.
СН—СООН
Cl'^Cl
Б. Реакции по ароматическому ядру. Гидроксильная группа
является одним из самых сильных доноров электронов (+М),
она значительно повышает электронную плотность в бензольном
ядре и тем самым увеличивает его реакционную способность
в реакциях SE.
1. Бромирование. При взаимодействии фенола с бромной
водой в отсутствие катализатора в молекулу вводится три атома
брома, и образуется 2,4,6-трибромфенол:
2,4,6-трибромфенол
+ ЗНВг
Эта реакция используется для качественного и количествен-
ного определения фенола.
Для введения одного или двух атомов брома в бензольное коль-
цо реакцию бромирования проводят в низкополярных раствори-
телях (СС14, СНС13):
Вг
л-бромфенол о-бромфенол
{преимущественный
продукт)
19. Фенолы
229
2. Нитрование. Если бензол нитруется только нитрующей сме-
сью, то фенол можно нитровать разбавленной азотной кислотой
при комнатной температуре:
2HNO3 разб.; 25°С
—2Н,О
о-нитрофенол
no2
л-нитрофенол
В этих условиях в молекулу фенола вводится одна нитрогруп-
па. Полученную смесь нитрофенолов можно разделить перегон-
кой с водяным паром. В связи с тем что в молекуле о-нитрофено-
ла гидроксильная группа и нитрогруппа находятся рядом, между
атомом водорода ОН-группы и атомом кислорода NO2-группы
образуется внутримолекулярная водородная связь (ВВС):
неассоциированный о-нитрофенол
Подобные соединения легколетучи. Как видно, образуется
шестичленный цикл за счет хелатной водородной связи (внутри-
молекулярная водородная связь называется хелатной}.
Молекулы лоро-изомера образуют межмолекулярные водород-
ные связи (МВС):
ассоциированный л-нитрофенол
Для л- и о-нитрофенол ов характерна бензоидно-хиноидная та-
утомерия.
230
Гидроксильные производные углеводородов
бензоидная форма
я-нитрофенола
хиноидная форма
л-нитрофенола
Метла-нитрофенолы не являются таутомерными веществами,
так как в молекулах этих соединений нет сопряжения между ОН-
и МО2-группами.
Свободные нитрофенолы — бесцветные вещества или имеют
желтую окраску. При добавлении щелочей образуются нитрофе-
ноляты, окрашенные в ярко-желтый цвет.
При действии концентрированной азотной кислоты на фенол
образуется осадок 2,4,6-тринитрофенола:
ОН
3HNO3 конц,
-ЗН2О
2,4,6 -тринитрофенол,
пикриновая кислота
2,4,6- Тринитрофенол называется пикриновой кислотой, по кис-
лотности он приближается к серной кислоте.
3. Сульфирование. Сульфирование фенола проходит очень легко
и в зависимости от температуры приводит к о- или л-изомерам:
л-гидроксибензол -
сульфокислота
19. Фенолы
231
4. Алкилирование и ацилирование. Реакции алкилирования и аци-
лирования по бензольному кольцу (С-алкилирование и С-аци-
лирование фенолов) проводят в условиях реакции Фриделя-
Крафтса:
+ 2СН.ОН
«Г
BF,
-2Н2о"
^^'''сНз сщЧ/
о-метилфенол л-метилфенол
2 - гидроксиацетофенон
4-гид роксиацетофенон
5. Азосочетание. Фенолы в качестве азосоставляющей в слабо-
щелочной среде вступают в реакцию азосочетания с солями диа-
зония с образованием азосоединений:
4-гид роксиазобензол
6. Синтез фенолкарбоновых кисло/n (реакция Кольбе—Шмит-
та). При пропускании углекислого газа через раствор натрия фе-
нолята образуется натрия салицилат, который при действии ми-
неральных кислот образует салициловую кислоту.
NaOH
-Н2О
125 °C;р
232
Гидроксильные производные углеводородов
ОН
натрия
салицилат
салициловая
кислота
7. Гидроксиметилирование, При обработке фенолов формаль-
дегидом в кислой или щелочной среде образуется смесь о- и л-гид-
роксиметилфенолов. Реакция протекает по механизму SE, элект-
рофильной частицей в условиях кислотного катализа является
гидроксиметил-катион +СН,ОН:
5+ 3— тт+ +
>С—О -2— сн,он
н
формальдегид гидроксиметилкатион
сн,он
2-гидрокси- 4-гидрокси-
метилфенол метилфенол
В присутствии минеральных кислот гидроксиметилфенол всту-
пает в реакцию конденсации с молекулой фенола:
2,2’-дигидрокси-
дифенилметан
19. Фенолы
233
В более жестких условиях образуются высокомолекулярные
продукты поликонденсации — фенолоформальдегидные смолы.
В результате такой реакции поликонденсации могут образо-
вываться смолы линейного или сетчатого строения.
В. Реакции восстановления и окисления. При каталитическом
гидрировании (восстановлении) фенола образуется циклогексанол:
ЗН2
> р, Ni, > t
,сн2
н,с "сн—он
I п
н,с _сн2
СН2
циклогексанол
Циклогексанол является исходным продуктом в синтезе кап-
рона и нейлона. Цинковая пыль может восстановить фенол даже
до циклогексана:
CJLOH + Zn
О J
ZnO + С,Н„
о 1Z
Фенолы легко окисляются кислородом воздуха. Наличие при-
месей приводит к ускорению процесса окисления. Очищенный
фенол — бесцветное вещество, а окисленный — красновато-розо-
вого цвета.
л-хинон
234
Гидроксильные производные углеводородов
В зависимости от природы окислителя фенолы могут образо-
вывать разные продукты.
В щелочной среде фенолы окисляются в большей степени, чем
в нейтральной, это связано с образованием феноксид-иона. В ре-
зультате сопряжения увеличивается электронная плотность на бен-
зольном ядре, и оно становится еще более чувствительным к дей-
ствию окислителей.
При окислении калия фенола персульфатом K2S2Og в щелоч-
ной среде образуется гидрохинон (реакция Эльбса):
ОН
ОН
гидрохинон
ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ
Двухатомные фенолы содержат в своей структуре две группы
ОН, трехатомные — три группы ОН.
пирокатехин,
1,2-дигидроксибензол
резорцин,
1,3-дигидроксибензол
ОН
он
пирогаллол,
1,2,3 -тригидроксибензол
он
гидрохинон,
1,4-дигидроксибензол
оксигидрохинон,
1,2,4-григидроксибензол
флороглюцин,
1,3,5 -тригидроксибензол
19. Фенолы
235
Способы получения. Двухатомные фенолы получают теми же
способами, что и одноатомные, но используют для этой цели
дизамещенные производные бензола.
1. Сплавление натриевых солей арендисульфокислот со щелочами:
я -бен золдисул ьфо-
кислота
s'
NaOH; t
ONa
резорцин
Этим способом чаще всего получают резорцин.
2. Взаимодействие галогенозамещенных фенолов или дигалогено-
производных бензола со щелочами:
н+
гидробензол-
хлорид
пирокатехин
Эта реакция применяется для получения пирокатехина.
3. Восстановление хинонов:
ХИНОН
он
гидрохинон
Химические свойства. Для многоатомных фенолов характерны
те же реакции, что и для одноатомных. Они могут галогениро-
ваться, нитроваться, сульфироваться.
С увеличением в молекуле количества ОН-групп усиливаются
кислотные свойства фенолов. Но несмотря на это, двух- и трех-
атомные фенолы уступают по кислотности угольной кислоте.
Двухатомные фенолы образуют соли не только со щелочами,
но и с тяжелыми металлами:
236
Гидроксильные производные углеводородов
(СН3С00)2РЬ
-2СН3СООН
При окислении пирокатехина и гидрохинона образуются со-
ответствующие о- и л-хиноны.
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ МНОГОАТОМНЫХ ФЕНОЛОВ
Гидрохинон (п-дигидроксибензол). Является сильным восста-
новителем, очень легко окисляется, в том числе и раствором FeCl3.
ОН
[О]
ОН
гидрохинон
л-бензохинон
В результате окисления образуется л-хинон.
Гидрохинон применяется как проявитель в фотографии. Встре-
чается в природе в виде гликозида арбутина, который содержится
в растении толокнянка.
Пирокатехин (о-дигидроксибензол) легко окисляется, являясь
хорошим восстановителем. Восстанавливает аммиачный раствор
Ag2O, при нагревании восстанавливает раствор Фелинга:
пирокатехин
о-бензохинон
Монометиловый эфир пирокатехина — гваякол применяется
в синтезе ванилина (4-гидрокси-З-метоксибензальдегида), арома-
тических и лекарственных веществ.
Резорцин (л-дигидроксибензол). Кристалли-
ческое вещество, хорошо растворяется в воде,
| ^=110 °C.
.. Применяется в медицине как эффективный ан-
тисептик в составе примочек и мазей; в производ-
Qpj стве красителей и резорциноформальдегидных
19. Фенолы
237
смол. Раствор резорцина в соляной кислоте используют в качестве
реактива на фруктозу (реактив Селиванова).
Пирогаллол (от греч. пирос — огонь), или
1,2,3-тригидроксибензол. Белое кристалличе-
ское вещество с / = 134 °C, растворяется
в воде и спиртах.
Получают при декарбоксилировании гал-
ловой кислоты:
СООН
галловая кислота пирогаллол
Пирогаллол является сильным восстановителем. Серебряные
соли пирогаллола легко восстанавливаются до металлического се-
ребра, поэтому он используется в фотографии. Щелочные раство-
ры пирогаллола хорошо поглощают кислород, что используется
для количественного определения его содержания в газовой смеси.
Флороглюцин (1,3,5-тригидроксибензол). Кристаллическое
вещество с = 223 °C, возгоняется, растворимое в спиртах, пло-
хо — в воде.
Получают при нагревании водных растворов 1,3,5-триамино-
бензол а в кислой среде.
CO2t + NH3|
СООН
НОН; Н+; 10043 | |
Для флороглюцина возможна кето-енольная таутомерия:
цикл огексантрион-1,3,5
238
Гидроксильные производные углеводородов
Наличие гидроксильных групп доказывают реакцией с FeCl3
(образуется темно-фиолетовое окрашивание). Наличие кето групп
подтверждают реакцией с NH2OH с образованием триоксима.
Флороглюцин используется в аналитической практике для ко-
личественного определения пентоз. При нагревании пентоз обра-
зуется фурфурол, который с флороглюцином дает окрашенный
продукт конденсации.
АМИНОФЕНОЛЫ
Лмшюфенолами называют производные ароматических угле-
водородов, содержащие в своем составе фенольный гидроксил
и аминогруппу.
По взаимному расположению —ОН- и —NH2-групп в амино-
фенолах возможны три изомера:
ОН
о-аминофенол
.и-аминофенол
Аминофенолы можно получить из соответствующих нитрофе-
нолов путем восстановления, при взаимодействии двухатомных
фенолов с аммиаком или при электролитическом восстановлении
нитробензола в присутствии концентрированной H2SO4 (промыш-
ленный способ).
Химические свойства аминофенолов обусловлены наличием
двух функциональных групп — фенольного гидроксила и арома-
тической аминогруппы.
Аминофенолы проявляют как основные свойства (за счет
NH2-rpynnbi), так и кислотные свойства (за счет ОН-группы),
и в целом являются амфотерными соединениями.
п -гидроанилиния
хлорид
п-аминофенол натрия
п-аминофенолят
19. Фенолы
239
Аминофенолы вступают в реакцию ацилирования, причем
реакция происходит по NH2-rpynne как более нуклеофильному
центру.
(СН3СО)2О
NHCOCHj
NTTJ
ОН
л-аминофенол
л-ацетиламинофенол,
парацетамол
и-Ацетиламинофенол, известный как лекарственный препа-
рат парацетамол, применяется как жаропонижающее и болеуто-
ляющее средство.
Метиловый эфир (анизидин) и этиловый эфир л-аминофено-
ла (фенетидин) используются в синтезе лекарственных препара-
тов и красителей.
метиловый эфир
л-аминофенола,
л-анизидин
этиловый эфир
л-аминофенола,
л-фенетидин
Лекарственный препарат фенацетин является ацетильным про-
изводным л-фенетидина и находит применение как жаропонижа-
ющее и антиневрологическое средство.
фенацетин
п- и о-Аминофенолы легко окисляются с образованием хино-
ниминов.
240
Гидроксильные производные углеводородов
о-аминофенол
о-хинонимин
Восстанавливающая способность аминофенолов используется
в фотографии.
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегидами и кетонами называют производные углеводоро-
дов, содержащие в своем составе карбонильную группу ^С=О-
Поэтому их еще называют карбонильными соединениями.
В альдегидах карбонильная группа связана с углеводородным
радикалом и атомом водорода. Общая формула альдегидов
R—, группа —получила название альдегидная группа.
В кетонах карбонильная группа связана с двумя углеводород-
ными радикалами.
Общая формула кетонов с • Карбонильную группу в ке-
тонах часто называют кетогруппой.
В зависимости от природы углеводородного ра-
дикала альдегиды и кетоны подразделяют на алифатические, али-
циклические и ароматические. Среди алифатических альдегидов и
кетонов различают насыщенные и ненасыщенные (предельные и не-
предельные).
____________20_____________
АЛЬДЕГИДЫ И КЕТОНЫ
АЛИФАТИЧЕСКОГО РЯДА
НАСЫЩЕННЫЕ АЛЬДЕГИДЫ И КЕТОНЫ
Номенклатура альдегидов и кетонов весьма многообразна. Ис-
пользуют как тривиальные названия, так и номенклатуру ИЮПАК.
242
Альдегиды и кетоны
Поэтому многие карбонильные соединения имеют несколько на-
званий.
Тривиальные названия альдегидов происходят от названия кис-
лот, в которые они превращаются при окислении. По замести-
тельной номенклатуре ИЮПАК названия альдегидов образуют от
названия углеводородов с тем же числом атомов углерода (вклю-
чая углерод альдегидной группы), прибавляя суффикс -аль. Ну-
мерацию главной углеродной цепи начинают с атома углерода
альдегидной группы.
муравьиный альдегид,
формальдегид,
метаналь
уксусный альдегид,
ацетальдегид,
этаналь
н3с—сн—сн.
изовалериановый альдегид,
3 -метилбутаналь
масляный альдегид,
бутаналь
Нередко в названиях альдегидов положения заместителей ука-
зывают греческими буквами а, р, у и т. д. При этом буквой
а обозначают атом углерода, соединенный с альдегидной группой:
₽ а
сн — сн—с
м I
сн3
он
у-тдроксивалериановый альдегид
а-метилмасляный альдегид
Кетонную группу по заместительной номенклатуре обознача-
ют суффиксом -он и цифрой обозначают атом углерода, входя-
щий в кетогруппу. Нумерацию проводят таким образом, чтобы
атом углерода карбонильной группы получил меньший номер:
4 3
СН—СН2
СН3
12 3 4 5 6 7
н3с—сн,—с—сн,—сн,—сн,—сн,
** । । Ла Ла Ла Д
О
4-метилпентанон~2
гептанон-3
По радикало-функциональной номенклатуре названия кето-
нов состоят из названия углеводородных радикалов в алфавитном
порядке и слова кетон.
20. Альдегиды и кетоны алифатического ряда
243
Н3С
с—сн,
। । j£r
О
СН3
метилфенилкетон
метил этилкетон
Способы получения. 1. Реакция окисления спиртов. Первичные
спирты окисляются до альдегидов, а вторичные — до кетонов.
Н3С—-СН—ОН
этанол
[О]г
-Н2О
этаналь
сн—он
[О],
Н,0
пропанон
пропанол-2
2. Реакция гидратации алкинов (реакция Кучерова). В услови-
ях реакции Кучерова из ацетилена образуется уксусный альдегид,
все гомологи ацетилена дают кетоны.
НС=СН
НОН; Hg2*;
H2SO4
этаналь
Н3С
ацетилен
Н3С—СН — ОСН
бутин-1
HOH; Hg2+; H2SO4
-сн2-
бутанон
3. Реакция гидролиза дигалогеналканов. При гидролизе геми-
нальных дигалогеналканов с атомами галогена у первичного ато-
ма углерода образуются альдегиды, а у вторичного — кетоны:
С1
НОН; ОН
1,1 -дихлорпропам
лропаналь,
пропионовый альдегид
2НС1
2,2-дихлорпропан
НОН; ОН’
—---- »
Н.С
с—сн,
II **
о
+ 2НС1
пропанон, ацетон
4. Реакция термического разложения солей карбоновых кислот.
Из смешанной соли муравьиной и другой карбоновой кислоты
244
Альдегиды и кетоны
при термическом разложении (пиролизе) получают альдегиды,
а в остальных случаях образуются кетоны:
кальциевая соль
уксусной и муравьиной кислот
кальциевая соль
уксусной кислоты
ЛЭ
— Н3С— CCf + СаСО2
этаналь
о
С + СаСО2
Н,С СН,
чД чД
пропанон
5. Реакция прямого карбонилирования (оксосинтез). В промыш-
ленности альдегиды получают взаимодействием алкенов с угле-
рода (II) оксидом и водородом при повышенной температуре
и давлении в присутствии катализатора. При этом происходит уве-
личение количества атомов углерода в молекуле образовавшегося
альдегида.
2Н3С—НС~СН2 + 2СО + 2Н2-------*
пропен Л) Н3С ,0
---- Н3С—СН— СН — СГ + >н2—сс
ХН Н3СГ ХН
бутаналь 2-метилпропаналь
Основным продуктом реакции является альдегид нормального
строения.
Физические свойства. Насыщенные альдегиды и кетоны явля-
ются бесцветными жидкостями со своеобразным запахом (фор-
мальдегид — газ с острым запахом). Карбонильные соединения
имеют более низкие температуры кипения, чем соответствующие
спирты, так как не способны образовывать водородные связи.
Кетоны являются хорошими растворителями. Высшие альде-
гиды обладают цветочным запахом и широко применяются в пар-
фюмерии.
Альдегиды раздражают слизистые оболочки глаз и верхних ды-
хательных путей, пагубно влияют на нервную систему. С увеличе-
нием количества атомов углерода в молекуле раздражающее дей-
ствие ослабевает. Ненасыщенные альдегиды обладают более
сильным раздражающим действием, чем насыщенные.
20. Альдегиды и кетоны алифатического ряда
245
Химические свойства. Химические свойства альдегидов и ке-
тонов определяются наличием в их молекуле полярной карбониль-
ной группы, которая легко поляризуется.
Карбонильная группа образована из двух атомов с различной
электроотрицательностью. Атом углерода карбонильной группы
находится в состоянии sp2-гибридизации. Негибридизированная
р-орбиталь атома углерода перекрывается с р-орбиталью атома кис-
лорода, образуя л-связь.
Атом кислорода, как более электроотрицательный элемент,
притягивает к себе о- и л-электроны. В результате этого двойная
связь карбонильной группы сильно поляризована, на атоме кис-
лорода возникает частичный отрицательный заряд, а на атоме уг-
лерода — частичный положительный:
Благодаря такой поляризации альдегиды и кетоны способны
вступать в реакцию с нуклеофильными реагентами, которые ата-
куют атом углерода карбонильной группы. Альдегиды, как прави-
ло, более реакционноспособны, чем кетоны. Поскольку алкиль-
ные радикалы за счет +/-эффекта уменьшают положительный заряд
на атоме углерода карбонильной группы, наличие в молекуле ке-
тона двух алкильных групп приводит к большему понижению
положительного заряда, чем в молекуле альдегида.
Все реакции альдегидов и кетонов условно можно разделить
на следующие группы:
— реакции нуклеофильного присоединения AN;
— реакции присоединения-отщепления;
— реакции с участием а-углеродного атома;
— реакция конденсации;
— реакции восстановления и окисления;
— реакции полимеризации.
А. Реакции нуклеофильного присоединения. 1. Присоединение
синильной кислоты. Синильная (циановодородная) кислота при-
соединяется к карбонильным соединениям, образуя циангидри-
ны или ос-гидроксинитрилы:
ОН
N
* н3с—сн—с-\
нитрил а-гидрокси-
пропионовой кислоты
246
Альдегиды и кетоны
Кетоны также образуют а-гидроксинитрилы:
пропанон
ОН
I
- Н С с—с=\
сн3
нитрил а-метил-а-гидрокси-
пропионовой кислоты
Образующиеся нитрилы можно легко гидролизовать до соот-
ветствующих а-гидроксикислот, что используется в синтезе этих
кислот. Реакция проводится в присутствии оснований.
2, Присоединение натрия гидросульфита. Альдегиды и кетоны
с формулой Н3С—СО—R реагируют с натрия гидросульфитом (би-
сульфитом), образуя бисульфитные соединения.
б+
СН3
он
- Н3С—С—SO;Na+
J I J
н
бисульфитное соединение
уксусного альдегида
Бисульфитные соединения — твердые вещества, трудно рас-
творимые в воде, легко образуются, поэтому применяются для
качественного обнаружения альдегидов, а также для выделения
альдегидов из реакционной среды.
3. Присоединение воды. Растворение альдегидов в воде сопро-
вождается образованием гидратов. Реакция представляет собой
оборотный процесс. Продукты реакции гидратации обычно неус-
тойчивы и выделить их практически невозможно:
СН3
он
I
+ НОН — н3с—с—он
гидрат уксусного
альдегида (геи-диол)
4. Присоединение спиртов. В спиртовом растворе альдегиды об-
разуют полуацетали, а в присутствии следов минеральных кис-
лот — ацетали:
20. Альдегиды и кетоны алифатического ряда
247
ОН
полуацеталь
ацеталь
Кетоны из-за низкой реакционной способности и простран-
ственных препятствий со спиртами не взаимодействуют.
Б. Реакции присоединения-отщепления. Альдегиды и кетоны
взаимодействуют с азотистыми основаниями с образованием не-
устойчивых продуктов нуклеофильного присоединения, которые
стабилизируются за счет отщепления молекулы воды. Эта группа
реакций получила название реакций присоединения-отщепления.
1. Взаимодействие с аммиаком. Альдегиды, присоединяя мо-
лекулу аммиака, образуют альдимины. В процессе реакции
вначале образуется неустойчивый аминоспирт, от которого затем
отщепляется вода.
. pt-..
СН — С*" + ':NH3
Н
Н3С
Н3С—CH=NH +
этанимин,
ацетальдимин
Н2О
Альдимины — неустойчивые соединения и очень легко цик-
лизуются (тримеризация) с образованием альдегиде аммиаков:
ЗН3С—CH=NH
сн3
альдегидоаммиак
Альдегидоаммиаки являются конечными продуктами реакции
взаимодействия альдегидов с аммиаком.
248
Альдегиды и кетоны
Кетоны также взаимодействуют с аммиаком, но при этом об-
разуются продукты более сложного строения.
2. Взаимодействие с аминами. Альдегиды взаимодействуют
с аминами, образуя азометины, или основания Шиффа. Продук-
ты конденсации устойчивы только в том случае, если они образу-
ются из ароматических альдегидов и аминов:
3, Взаимодействие с гидроксиламином. Продукты конденсации
альдегидов и кетонов с гидроксиламином называют альдоксима-
ми и кетоксимами.
Т)
СН3—+ H2N—ОН
Н
- Н3С—CH=N—ОН
оксим ацетальдегида
н3с—с—сн3
Н3С
+ h,n—он
N—ОН
оксим ацетона
Реакцию образования оксимов используют для выделения
и идентификации альдегидов и кетонов.
4. Взаимодействие с гидразином. Реакция взаимодействия аль-
дегидов и кетонов с гидразином, фенилгидразином, семикар-
базидом, тиосемикарбазидом протекает легко, с образованием
соответственно гидразонов, фенилгидразонов, семикарбазонов,
тиосемикарбазонов:
C=N—NH
H.N—NH2
гидразин
-Н2О
H2N—NH—С—NH2
семикарбазид
-Н3О *
C=N—NH—С—NH 2
гидразон
R'
семикарбазон
R'
s
^C=N—NH—С6Н5
R фен ил гидразон
фенил гидразин
12*^
тиосем и карбазид
>>=N—N Н—С—NH,
R’ II
S
тиосемикарбазон
2
2
2
20. Альдегиды и кетоны алифатического ряда
249
Образующиеся производные представляют собой кристалли-
ческие вещества с четкими температурами плавления. Эти реак-
ции используются для идентификации исходных альдегидов и ке-
тонов.
В. Реакции с участием а-углеродного атома. Электроноакцеп-
торное влияние карбонильной группы приводит к повышению
подвижности атомов водорода, находящихся при а-углерод ном
атоме (СН-кислоты):
5-
5+
К числу реакций, протекающих с участием а-углеродного ато-
ма, относятся реакции альдольной и кротоновой конденсации
и реакция галогенирования.
Г. Реакция конденсации. 1. Альдольная конденсация. Альдеги-
ды и кетоны, содержащие атомы водорода у а-углеродного атома,
в присутствии каталитических количеств основания способны всту-
пать в реакцию конденсации, называемую альдольной кон-
денсацией. При этом молекулы альдегидов соединяются друг
с другом посредством связей С—С и образуют альдоль — р-гид-
роксиальдегид:
ОН'
ОН
3 - гидроксибутаналь,
р-оксимасляный альдегид,
альдоль
Рассмотрим механизм реакции в условиях основного катали-
за. В слабощелочной среде гидроксид-ион (катализатор) отщеп-
ляет протон от а-углеродного атома альдегида с образованием ено-
лят-аниона:
5+
он~
2
енолят-анион
На следующей стадии енолят-анион, который является нукле-
офилом, атакует электронодефицитный атом углерода карбонил ь-
250
Альдегиды и кетоны
ной группы другой молекулы альдегида с образованием соответ-
ствующего аниона, который под действием воды превращается
в альдоль:
альдоль,
р-оксимасляный альдегид,
3 -гидроксибутаналь
При нагревании Р-оксиальдегиды легко теряют воду, превра-
щаясь в а, р-ненасыщенные альдегиды.
Н3С—НС=СН
+ Н,0
м
кротоновый альдегид,
бутен-2-аль
Реакция конденсации альдегидов, содержащих подвижные ато-
мы водорода при а-углеродном атоме с образованием непредель-
ного альдегида, получила название кротоновая конден-
сация.
Легкость, с которой происходит отщепление воды, объясняет-
ся подвижностью а-водородного атома и образованием сопряжен-
ной системы двойных связей.
2. Реакция галогенирования. Альдегиды и кетоны легко вступают
в реакции с галогенами с образованием а-галогенопроизводных:
Н3С
пропионовый
альдегид
оебромпропио-
новый альдегид
а-Галогенопроизводные альдегидов и кетонов проявляют
слезоточивое действие и называются лакриматорами (от лат. lacri-
ma — слеза).
При галогенировании соединений типа СН3—СО— в щелоч-
ной среде образуются тригалогенокарбонильные соединения, ко-
20. Альдегиды и кетоны алифатического ряда
251
торые затем расщепляются с образованием карбоксильного анио-
на и тригалогеналкана СННа13. Например, в случае йодирования
в щелочной среде происходит выделение желтых кристаллов йо-
доформа:
I,; он~
------------
Л
- R—+ СН13|
О йодоформ
Реакция образования йодоформа (йодоформная проба) исполь-
зуется в аналитической практике.
3. Сложноэфирная конденсация (реакция Тищенко). При на-
гревании альдегидов в присутствии алюминия этилата образуют-
ся сложные эфиры карбоновых кислот:
2Н3С
(С2Н5О)3А1
СН— СН3
этилацетат
В этой реакции одна молекула альдегида восстанавливается до
спирта, а вторая — окисляется до кислоты. Такая реакция само-
окисления-самовосстановления получила название диспропорци-
онирования или дисмутации.
Д. Реакции восстановления и окисления. 1, Реакции восста-
новления, Реакцию восстановления альдегидов и кетонов широко
используют для получения спиртов. Карбонильные соединения
восстанавливаются и при каталитическом гидрировании, и при
действии таких восстановителей, как алюмогидрид лития LiAlH4.
Альдегиды восстанавливаются до первичных спиртов:
н3с—сн — сС — - н3с—сн — сн— он
н
Кетоны восстанавливаются до вторичных спиртов:
L1A1H,
н3с—с—сн3 ----------- Н3С—СН—СН3
о он
пропанон, пропанол - 2
ацетон
2, Реакции окисления. Альдегиды и кетоны по-разному отно-
сятся к действию окислителей.
Альдегиды очень легко окисляются, даже при действии сла-
бых окислителей (ионы Ag+, Си ).
252
Альдегиды и кетоны
2.1. Реакция «серебряного зеркала». При действии на альдегид
аммиачного раствора серебра (реактив Толлеса) происходит окис-
лительно-восстановительная реакция. Альдегид окисляется до со-
ответствующей кислоты, а катион серебра восстанавливается до
металлического серебра, которое дает блестящий налет на стен-
ках пробирки.
X)
СНз-СГ + 2[Ag(NH3)JOH ----
Н
--- 2Agt + СН3—С^ + Н2О + 3NH3
onh;
Эта реакция является качественной для обнаружения альде-
гидной группы.
2.2. Реакции взаимодействия альдегидов с медно-виннокислым
комплексом. Альдегиды также восстанавливаются реактивом Фе-
линга (смесь раствора меди сульфата со щелочным раствором на-
трийкалиевой соли виннокаменной кислоты):
CuSOd + 2NaOH
*Т
- Cu(OH) + Na,SO.
COOK
I
HC—OH
2 I
HC—OH
I
COONa
сегнетова соль
Cu(OH)2
COO. NaOOC
HC—QH\ HO—CH
I ZsCuc z
HC—OH \HOCH
COOK X)OC
медно-виннокислый комплекс
COO. NaOOC
HC—QH\ ЦО—CH ^>0 0H_
2 | Z=Cu=Z | + H3C—C^ ------
HC—OH \ HO—CH H
COOK 4)OC COOK
HC—OH
-- H3C—C^ + 2CuOH + 2H2O + 2 I
O“Na+ HC—OH
I
COONa
2CuOH Cu20| + H2O
20. Альдегиды и кетоны алифатического ряда
253
Кетоны к действию этих окислителей инертны. Не окисляют-
ся они и кислородом воздуха. Только при действии более сильных
окислителей кетоны удается окислить. При этом происходит раз-
рыв углерод-углеродной связи между атомами углерода карбониль-
ной группы и углеводородного радикала, и образуется смесь кислот.
Е. Реакции полимеризации. Альдегиды, в отличие от кетонов,
способны полимеризоваться. Реакция полимеризации протекает
в обычных условиях и ускоряется в присутствии минеральных кис-
лот. При хранении 40 %-ного водного раствора формальдегида
(формалина), особенно при температуре ниже 9 °C, наблюдается
выпадение белого осадка продукта линейной полимеризации (па-
раформа):
лН—С
+ Н2О
НО—СН— (ОСН2)— он
параформ
Уксусный альдегид в присутствии следов серной кислоты и в за-
висимости от условий образует два циклических продукта — пар-
альдегид и метальдегид:
лН3С—С
.сн о
о—сн метальдегид
сн3
Паральдегид — жидкость, метальдегид — твердое вещество,
используется в быту как сухое горючее под названием «сухой
спирт».
254
Альдегиды и кетоны
НЕПРЕДЕЛЬНЫЕ АЛЬДЕГИДЫ
В непредельных альдегидах карбонильная группа связана с угле-
водородным радикалом, содержащим кратную связь. Положение
двойной связи в углеводородном радикале относительно альде-
гидной группы обозначают греческими буквами. В соответствии
с этим различают а, р- или |3, у- и т. д. непредельные альдегиды:
а
2
аД-непредельный альдегид
Р,у-непредельный альдегид
Наибольший интерес представляют а, p-непредельные альде-
гиды, у которых двойная связь сопряжена с карбонильной груп-
пой:
кротоновый альдегид,
бутен-2-аль
акролеин,
пропен-2-аль
Для непредельных альдегидов характерны реакции карбониль-
ных соединений и ненасыщенных углеводородов.
Альдегиды, в молекулах которых альдегидная группа входит
в сопряженную систему, имеют ряд особенностей, отличающих
их от других непредельных альдегидов. Присоединение галогено-
водородов и воды протекает против правила Марковникова.
акролеин,
пропен-2-аль
НВг
СН
Вг
3-бромпроланаль
Непредельные альдегиды используются в синтезе ряда соеди-
нений, в том числе и лекарственных препаратов.
__________________21____________________
АЛЬДЕГИДЫ И КЕТОНЫ
АРОМАТИЧЕСКОГО РЯДА
АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ
Ароматические альдегиды — это производные ароматических
углеводородов, которые содержат в своей структуре альдегидную
группу:
Различают две группы этих соединений: альдегиды, содержа-
щие альдегидную группу в бензольном ядре, и альдегиды, у кото-
рых альдегидная группа содержится в боковой цепи.
Простейшие представители:
бензальдегид,
бензойный
альдегид
л-толу иловый
альдегид
jw-хлорбензойный
альдегид
о-нитробензойный
альдегид
о-гидрокси-
бензальдегид,
салициловый
альдегид
256
Альдегиды и кетоны
Альдегиды, содержащие альдегидную группу в боковой цепи,
называют как производные альдегидов жирного ряда:
фенилуксусный
альдегид
Способы получения ароматических альдегидов. Ароматические
альдегиды можно получить теми же способами, что и жирные.
7. Окисление спиртов. Как все первичные спирты, бензиловый
спирт легко окисляется с образованием бензальдегида:
С6Н5СН2ОН
бензиловый
[О]
спирт
В качестве окислителей чаще всего используют хрома (VI) ок-
сид, хромовую смесь и др.
2. Перегонка кальциевых солей (соль ароматической кислоты
и муравьиной). При сухой перегонке смешанных кальциевых со-
лей ароматических кислот и муравьиной кислоты легко образу-
ются ароматические альдегиды:
.О
СаСО, + н.с,—с;
3. Из дигалогенозамещенных — путем омыления. Гидролиз ге-
минальных галогенаренов, содержащих атомы галогена у первич-
ных атомов углерода (в боковой цепи), приводит к получению
ароматических альдегидов:
бензилиденхлорид
NaOH; Н,О
+ NaCl
21. Альдегиды и кетоны ароматического ряда
257
Но есть и специфические способы получения ароматических аль-
дегидов.
1. Окисление ароматических углеводородов. При окислении
толуола и других соединений, содержащих метильную группу, свя-
занную с бензольным ядром, довольно легко образуются арома-
тические альдегиды. При использовании в качестве окислителя
хрома (VI) оксида реакцию проводят в среде уксусного ангидрида:
геи-диацетат
толуола
Образовавшееся диацетатное производное толуола не способ-
но к окислению, а при его гидролизе легко образуется бензальде-
гид.
2. Способ Гаттермана—Коха (реакция карбонилирования).
Прямое введение в молекулу альдегидной группы позволяет по-
лучать замещенные ароматические альдегиды:
си
+ СО + НС1
А1С13; Си2С12
л-толуиловый
альдегид
Физические свойства. Ароматические альдегиды — это жид-
кие или кристаллические вещества нейтрального характера, труд-
норастворимые в воде, легко — в органических растворителях.
Они очень легко окисляются кислородом воздуха.
Бензойный альдегид имеет запах горького миндаля.
Химические свойства ароматических альдегидов. Ароматические
альдегиды во многом повторяют свойства альдегидов жирного ряда:
258
Альдегиды и кетоны
— дают реакцию «серебряного зеркала»;
— восстанавливаются до спиртов;
— присоединяют натрия бисульфит с образованием бисуль-
фита ого производного;
— присоединяют HCN с образованием циангидринов.
— с фен ил гидразином образуют гидразоны;
— с гидроксиламином образуют альдоксимы.
Однако ароматические альдегиды проявляют ряд специфиче-
ских свойств:
1. Ароматические альдегиды не способны вступать в альдольную
конденсацию. Как вы помните, для того чтобы осуществилась эта
реакция, необходимо наличие подвижного атома водорода при
а-углеродном атоме. В ароматическом альдегиде такого атома во-
дорода нет.
2, Взаимодействие с аммиаком. Реакция ароматических альде-
гидов с аммиаком — одна из отличительных реакций альдегидов
этого ряда.
альдимин
c6h5ch=n.
/СН—С6Н
С6Н5СН=1'Г
гидробензамид
В этой реакции три молекулы бензальдегида взаимодействуют
с двумя молекулами аммиака. Реакция протекает через стадию
образования альдимина, который вступает в реакцию с альдеги-
дом с образованием гидробензамида.
21. Альдегиды и кетоны ароматического ряда
259
3. Реакция Канниццаро—Тищенко. В присутствии сильных ос-
нований или концентрированных щелочей ароматические альде-
гиды вступают в реакцию диспропорционирования (самоокисле-
ния -самовосстановления).
NaOH ~ +
s C6H5COONa + С6Н5СН2ОН
Механизм реакции:
ОН
— С6Н5СООН
8+
н
С6Н5СОО-
+ С6Н5СН2ОН
Реакция протекает с переносом гидрид-иона Н.
Одна молекула альдегида восстанавливается, а другая — окис-
ляется, и образуются ароматический спирт и кислота.
4. Действие галогена на альдегид (реакция галогенирования).
В отличие от альдегидов жирного ряда, которые образуют в этих
условиях а-галогеносодержащие альдегиды, ароматические аль-
дегиды образуют галогенангидриды ароматических карбоновых
кислот:
С6н5
- С6Н5—CZ + на
XI
хлорангидрид
бензойной кислоты
5. Бензоиновая конденсация. Альдегиды, которые содержат аль-
дегидную группу в бензольном ядре, способны под действием со-
лей циановодородной кислоты вступать в реакцию бензоиновой
конденсации с образованием бензоина (кетоноспирта):
бензоин (кетоноспирт)
260
Альдегиды и кетоны
6, Реакция конденсации ароматических альдегидов с альдегида-
ми жирного ряда. В присутствии оснований ароматические альде-
гиды вступают в реакцию конденсации с альдегидами или кето-
нами жирного ряда, содержащими подвижные атомы водорода
при а-углеродном атоме.
Эта реакция подобна альдольной конденсации и называется
перекрестной альдольной конденсацией. Она протекает по тому
же механизму.
5
ОН
3 - гидрокси - 3 - фен ил пропанал ь
(альдоль)
- С6Н— сн=сн
коричный альдегид
Образовавшийся в этой реакции альдегидоспирт (альдоль) легко
теряет воду, превращаясь в непредельный ароматический альде-
гид 3-фенилпропеналь (коричный альдегид).
7. Конденсация альдегидов ароматического ряда с ангидридами
карбоновых кислот жирного ряда в присутствии натрия ацетата —
реакция Перкина.
фенилакриловая кислота,
коричная кислота
Реакция протекает при длительном нагревании, в результате
реакции образуются а,р-непредельные кислоты.
Механизм реакции'.
СН3СОО
О + СН3СООН
21. Альдегиды и кетоны ароматического ряда
261
О О
смешанный ангидрид коричной и уксусной кислот
С6Н5СН=СНСООН + СНзСООН
Смешанный ангидрид коричной и уксусной кислот выделить
невозможно, он моментально гидролизуется с образованием со-
ответствующих кислот.
8. Реакции по бензольному ядру. В реакции электрофильного за-
мещения SE альдегиды вступают в соответствии с правилами ори-
ентации. Альдегидная группа — электроноакцепторная группа, она
проявляет —Z; —Л/-эффекты и относится к л/е/ид-ориентантам.
Например:
jw -формил бензол сульфоки слота
лг-нитробензальдегид
262
Альдегиды и кетоны
АРОМАТИЧЕСКИЕ КЕТОНЫ
Соединения, содержащие карбонильную группу, связанную
с двумя углеводородными радикалами, называют кетонами.
У нас речь будет идти об ароматических кетонах.
Ароматические кетоны делятся на две группы:
а) жирно-ароматические — это кетоны, у которых карбониль-
ная группа связана с ароматическим и жирным радикалами.
СН
метил фенилкетон,
ацетофенон
б) чисто ароматические — это кетоны, у которых карбониль-
ная группа связана с двумя ароматическими радикалами.
дифенил кетон,
бензофенон
В названии ароматических кетонов часто наряду с системати-
ческим названием используют тривиальные.
Получение. Ароматические кетоны можно получить теми же
методами, что и жирные. Например:
1. Окисление вторичных спиртов.
2. Перегонка кальциевых солей соответствующих кислот и др.
Чаще всего для получения ароматических кетонов применяют
реакцию ацилирования по Фриделю—Крафтсу.
3. Реакция Фриделя—Крафтса (реакция ацилирования). На
ароматический углеводород действуют хлорангидридом кислоты
в присутствии алюминия хлорида, это обычная реакция ацили-
рования в ароматическом ряду.
А1С13
-----
+ НС1
21. Альдегиды и кетоны ароматического ряда
263
Физические и химические свойства кетонов. Ароматические
кетоны — это твердые или жидкие вещества, растворяющиеся
в органических растворителях.
В химическом отношении обладают всеми свойствами ке-
тонов.
Из отдельных представителей нас будет интересовать ацето-
фенон.
Это жидкость с запахом черемухи, обладает снотворным дей-
ствием. Используется в парфюмерии.
Атомы водорода в группе СН3 подвижны и легко замещаются
на атомы хлора.
©-хлорацетофенон
+ НС1
Символ со обозначает, что хлор находится в крайнем положе-
нии боковой цепи.
Атом хлора обладает значительной подвижностью и легко за-
мещается на другие атомы или атомные группы.
Производным ацетофенона является л-нитроацетофенон,
который используют как полупродукт для синтеза антибиотиков
синтомицина и левомицетина.
мп
и-нитроацетофенон
264
Альдегиды и кетоны
ФЕНОЛОАЛЬДЕГИДЫ
Соединения, содержащие в своей структуре фенольный гид-
роксил и альдегидную группу, связанную с бензольным ядром,
называются фенолоальдегидами. Их называют как производные
альдегидов. Кроме химических названий, для этих соединений
распространены и тривиальные.
Например:
салициловый альдегид,
(?-оксибензойный
альдегид
.м-оксибензойный
альдегид
ванилин,
д-окси-л1-метоксибензальдегид,
4-гидрокси-З-метоксибензальдегид
Способы получения фенолоальдегидов. 1. Способ Реймера—Ти-
мана. Это один из способов получения ароматических о-оксиаль-
дегидов. Примером является получение салицилового альдегида.
Реакция проводится при нагревании фенола и хлороформа
в присутствии щелочи.
ОН
Г, CHC13; NaOH
+ NaCl + Н2О
Механизм реакции. При взаимодействии хлороформа со ще-
лочью образуется дихлоркарбен, представляющий собой биради-
кал, имеющий вакантную атомную орбиталь.
CHCL + NaOH
- DCC1, + NaCl
дихлоркарбен
н2о
Дихлоркарбен — сильный электрофильный реагент, он легко
взаимодействует с феноксид-ионом, который образовался при вза-
имодействии фенола со щелочью.
21. Альдегиды и кетоны ароматического ряда
265
+ 2НС1
Дихлоркарбен легко присоединяется в о-положении бензольно-
го ядра. Образовавшийся карбанион стабилизируется за счет от-
щепления протона от ядра и присоединения его к атому углерода
с отрицательным зарядом. о-Дихлорметилфеноксид-ион под дей-
ствием воды в условиях реакции превращается в салициловый
альдегид.
2. Способ получения п-оксибензальдегида. 4-Гидроксибензальде-
гид получают действием на фенол циановодородной и хлороводо-
родной кислот.
-на
хлорангидрид имино-
муравьиной кислоты
имин и-оксибенз-
альдегида
Предполагают, что реакция протекает через стадию образова-
ния хлорангидрида иминомуравьиной кислоты. Образующийся
имин п-оксибензальдегида при действии воды гидролизуется с
образованием и-оксибензальдегида.
Химические свойства фенолоальдегидов. Фенолоальдегиды
обладают свойствами как фенолов, так и альдегидов. Введение
альдегидной группы в молекулу фенола повышает кислотные свой-
ства последнего, так как альдегидная группа проявляет электро-
ноакцепторные свойства.
266
Альдегиды и кетоны
Наличие гидроксильной группы, проявляющей +Л/-эффект,
в молекуле л-оксибензальдегида приводит к уменьшению степе-
ни электрофильности альдегидной группы, так как электрофиль-
ность определяется величиной 5+ на атоме углерода карбониль-
ной группы.
Интересно отметить, что электрофильные свойства о-окси-
бензальдегида значительно выше, чем у л-изомера.
Это связано с тем, что у о-изомера имеет место внутримолеку-
лярная водородная связь, которая увеличивает 5+ на углеродном
атоме карбонильной группы.
КАРБОНОВЫЕ КИСЛОТЫ
Карбоновыми кислотами называют производные углеводоро-
дов, которые содержат в своем составе карбоксильную группу.
По природе углеводородного радикала раз-
личают алифатические, алициклические, ароматические, гетероцик-
лические карбоновые кислоты и др. По количеству карбо-
ксильных групп они делятся на моно-, ди-, три-
и поликарбоновые. Алифатические карбоновые кислоты по мере
насыщенности углеводородного радикала раз-
деляют на насыщенные и ненасыщенные.
МОНОКАРБОНОВЫЕ КИСЛОТЫ
Монокарбоновыми кислотами называют производные углево-
дородов, содержащие в своем составе одну карбоксильную группу
НАСЫЩЕННЫЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ
Номенклатура и изомерия. Для кислот более употребимы три-
виальные названия, которые связаны с нахождением их в приро-
де или источником получения. Например, муравьиная кислота
впервые выделена из муравьев, а уксусная кислота получается в ре-
зультате уксуснокислого брожения сахаристых веществ.
Положение заместителей относительно карбоксильной груп-
пы в тривиальных названиях обозначают греческими буквами
а, р, у и т. д.:
268
Карбоновые кислоты
сн,—сн,—сн—соон
•-Г 4 I
сн3
а-метилмасляная кислота
сн —сн—соон
Вг
p-бромпропионовая кислота
По заместительной номенклатуре ИЮПАК названия кислот
образуют из названий углеводородов с таким же числом атомов
углерода, включая и атом углерода карбоксильной группы, при-
бавлением суффикса -овая и слова кислота.
НСООН
сн— сн— соон
муравьиная кислота,
метановая кислота
пропионовая кислота,
пропановая кислота
сн3—сн—соон
СН3
изомасляная кислота,
2-метилпропановая
кислота
Остаток карбоновой кислоты, образующийся при отщеплении
протона карбоксильной группы, называется ацилоксигруппой
R С. . Название ее образуют от тривиального названия кис-
О—
лоты и суффикса -ат:
формиат
ацетат
сн3
пропионат
При отнятии атома водорода от карбоксильной группы обра-
зуется ацильная группа R—С
. Ее название образуют от триви-
ального названия кислоты и суффикса -ил. По заместительной
номенклатуре названия ацильных групп образуют от названия кис-
лоты и замены -овая кислота на суффикс -оил:
формил,
метаноил
а пе т и; I,
этаноил
сн3
изобутирил,
2-метилпропаноил
Изомерия насыщенных монокарбоновых кислот обусловлена
строением углеводородного радикала (структурная изомерия), на-
чинается с четвертого представителя гомологического ряда:
22. Монокарбоновые кислоты
269
сн,—сн,—сн,—соон снэ—сн—соон
X X
сн,
масляная кислота изомасляная кислота
Количество изомеров увеличивается по мере возрастания дли-
ны углеводородного радикала.
Способы получения. 1. Окисление первичных спиртов и аль-
дегидов
R—СН2—ОН
[О]
-Н2О
альдегид
[О]
карбоновая кислота
первичный спирт
В качестве окислителей используют К,Сг,О7, КМпО. в кислой
X X / "т
среде и др.
2. Гидролиз геминальных тригалогенопроизводных углеводородов.
Реакция протекает в кислой или щелочной среде с образованием
промежуточной ортокислоты, которая в свободном состоянии не
существует. Она легко теряет молекулу воды, превращаясь в кар-
боновую кислоту.
тригалогено-
производное
ортокислота
3. Гидролиз нитрилов. Нитрилы при нагревании с водным
раствором кислоты или щелочи гидролизуются до карбоновых
кислот:
нитрил
н2о
ОН- или Н+
амид карбоновой
кислоты
нон
0Н~ или Н+
R
R—С—ОН
карбоновая
кислота
Реакция протекает через стадию образования амидов.
4. Взаимодействие магнийорганических соединений с углерода (IV)
оксидом. При взаимодействии магнийорганических соединений
с углерода (IV) оксидом получают соли карбоновых кислот, при
подкислении которых выделяют соответствующие кислоты:
R—MgCl + СО2
R ^OMgCl
соль карбоновой
кислоты
R—+ MgCl,
ОН
карбоновая
кислота
270
Карбоновые кислоты
5. Гидрокарбоксилирование алкенов. Карбоновые кислоты обра-
зуются также при нагревании алкенов с углерода (II) оксидом
в присутствии кислотного катализатора и повышенном давлении:
СНу=СН
СН
этен
10 и выше — твердые вещества. Низшие карбоновые кисло-
1,
2
2—СООН
пропионовая кислота
Полученные кислоты содержат на один углеродный атом боль-
ше, чем исходный алкен.
Физические свойства. Кислоты с количеством атомов углерода
не более трех представляют собой жидкости с острым запахом.
Кислоты с С4—С9 — маслянистые жидкости с неприятным запа-
хом; С
ты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде
уменьшается.
Температура кипения кислот выше температуры кипения спир-
тов с тем же количеством атомов углерода в молекуле, что свиде-
тельствует о большей степени ассоциации кислот.
В результате образования межмолекулярных водородных свя-
зей карбоновые кислоты образуют как линейные, так и цикличе-
ские ассоциаты, существующие в виде димеров.
Химические свойства. Реакционная способность карбоновых
кислот характеризуется наличием карбоксильной труппы, внутри
которой осуществляется сопряжение между неподеленной парой
электронов атома кислорода с л-электронами карбонильной группы
(р,л-сопряжение).
-С^. 8+
Вследствие этого связь О—Н становится полярной, и водород
способен отщепляться в виде протона, что обусловливает кислот-
ный характер карбоновых кислот. Смещение электронной плот-
ности к атому кислорода JX=O группы приводит к возникнове-
нию 5+ на атоме углерода карбоксильной группы; чем больше
22. Монокарбоновые кислоты
271
величина 5+, тем более реакционноспособны карбоновые кис-
лоты .
Основные реакции карбоновых кислот условно можно разде-
лить на группы:
— с участием связи ОН (кислотные свойства);
— нуклеофильное замещение с участием атома углерода кар-
боксильной группы;
— замещение атома водорода при а-углеродном атоме;
— окисление и восстановление.
Кислотные свойства. В водных растворах карбоновые кислоты
диссоциируют с образованием карбоксилат-иона:
R
карбоксилат-
ион
ион
ГИДрОКСОНИЯ
Строение карбоксилат-иона можно представить с помощью
двух граничных структур:
или
В карбоксилат-ионе оба атома кислорода равноценны, отри-
цательный заряд равномерно распределен между ними.
Сила карбоновых кислот зависит от стабильности образовав-
шегося карбоксилат-иона и степени делокализации отрицатель-
ного заряда в нем.
На силу карбоновых кислот оказывает влияние структура уг-
леводородного радикала и природа заместителей в нем. Электро-
нодонорные заместители дестабилизируют карбоксилат-ион
и ослабляют кислотные свойства. Электроноакцепторные замес-
тители способствуют делокализации отрицательного заряда в кар-
боксилат-ионе, повышая его устойчивость, что приводит к повы-
шению кислотных свойств.
1. Образование солей. При взаимодействии с активными метал-
лами, основными оксидами, гидроксидами и карбонатами щелоч-
ных металлов карбоновые кислоты образуют соли:
СН,—~ СООН + NaOH
СНСООН + NaHCO, -
- СН,—COONa + Н,0
- СН—COONa + CO,t + Н,0
272
Карбоновые кислоты
Взаимодействие с натрия гидрокарбонатом является простей-
шей качественной реакцией на карбоксильную группу.
Названия солей образуются от названий анионов карбоновых
кислот:
ONa
натрия формиат
СН3
калия ацетат
Соли пропионовой кислоты — пропионаты, масляной — бути-
раты и т. д.
2. Реакции нуклеофильного замещения. Благодаря наличию дроб-
ного положительного заряда на атоме углерода карбоксильной
группы карбоновые кислоты способны вступать в реакции нукле-
офильного замещения 5^.
3. Взаимодействие со спиртами (реакция этерификации). Кар-
боновые кислоты реагируют со спиртами при нагревании в кис-
лой среде. Реакция протекает с образованием сложных эфиров:
уксусная
кислота
+ Н,0
метанол
метил ацетат
осн
Реакция этерификации обратима, и чтобы сместить равнове-
сие в сторону образования сложного эфира, необходим избыток
спирта или кислоты или же удаление воды.
Механизм реакции этерификации:
H3C—С—О—СН3
Т 54-
ОН н
к /
осн
метилацетат
+ Н2О + н+
Карбоновая кислота на первой стадии протонируется по ато-
му кислорода карбонильной группы с образованием карбокатио-
на, электрофильные свойства которого значительно выше, чем
у исходной кислоты.
22. Монокарбоновые кислоты
273
Карбокатион присоединяет молекулу спирта за счет неподе-
ленной пары электронов атома кислорода гидроксильной группы
с образованием оксониевого иона, который стабилизируется пу-
тем отщепления молекулы воды и протона. В результате образу-
ется сложный эфир.
4. Взаимодействие с галогенирующими реагентами. При дей-
ствии на карбоновые кислоты фосфора (III) и (V) хлоридов, фос-
фора (III) бромида или тионилхлорида образуются галогенангид-
риды карбоновых кислот:
пропионовая кислота
ЕТС—СООН + SOC1
С1
хлорангвдрид
пропионовой кислоты,
пропионилхлорид
Л)
С—+ SO2t + HClf
хлорангидрид С1
уксусной кислоты,
ацетилхлорид
Галогенангидриды кислот используются как ацилирующие ре-
агенты.
5. Взаимодействие с аммиаком и аминами. При взаимодействии
карбоновых кислот с аммиаком, первичными или вторичными
аминами образуются аммониевые соли, которые
превращаются в амиды:
при пиролизе
Н..С С'"
"onh; ,,2°
аммония ацетат
NH2
ацетамид
6. Образование ангидридов кислот. При действии водоотнима-
ющих средств, таких как фосфора пентаоксид Р2О5 или трифтор -
уксусный ангидрид (CF3CO)2O, образуются ангидриды карбоно-
вых кислот:
2Н,С
-Н3РО4
ангидрид
уксусной кислоты
Ангидриды карбоновых кислот являются активными ацилиру-
ющими средствами.
7. Замещение водорода при ^-углеродном атоме (реакция Гел-
ля—Фольгарда—Зелинского). Под влиянием карбоксильной труп-
274
Карбоновые кислоты
ггы, которая проявляет отрицательный индуктивный эффект (—7),
увеличивается подвижность атомов водорода при а-углеродном
атоме.
При взаимодействии карбоновых кислот с галогенами в при-
сутствии фосфора тригалогенидов атом водорода при а-углерод-
ном атоме замещается на галоген.
пропионовая
кислота
РВг3
CH—сн-—СООН + НВг
Вг
а-бромпропионовая
кислота
В результате реакции образуются галогенокарбоновые кисло-
ты. Реакция протекает через стадию образования галогенангидри-
дов, которые галогенируются легче, чем кислоты:
РВг3
-н3ро3
СН3—СН2
Вг2
-НВг”
Вг
бромангидрид
а-бромпропионовой
кислоты
нон
-НВг”
СН,—СН
Вг
а-бромпропионовая
кислота
8. Окисление, Монокарбоновые кислоты устойчивы к действию
окислителей, кроме муравьиной кислоты, которая легко окисля-
ется КМпО4 и другими окислителями с образованием угольной
кислоты:
н—соон —
муравьиная кислота
В связи с особенностью строения муравьиная кислота облада-
ет восстанавливающей способностью. Она подобно альдегидам дает
реакцию «серебряного зеркала»:
1Н-
+ 2[Ag(NH3)JOH
НО—С—ОН + 2Ag| + 4NH
Н2О
22. Монокарбоновые кислоты
275
Отличительной реакцией муравьиной кислоты является также
реакция ее разложения при нагревании с концентрированной H2SO4.
H,SO4 кони.; z
иН
cot + н,о
JLV
В результате выделяются углерода (II) оксид и вода.
НЕНАСЫЩЕННЫЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ
К ненасыщенным карбоновым кислотам относятся кислоты,
которые содержат в углеводородном радикале кратную связь.
Номенклатура и изомерия. В номенклатуре ненасыщенных кар-
боновых кислот широко применяются тривиальные названия:
СН,=СН—СООН
сн2=с—соон
акриловая кислота
сн3
метакриловая кислота
сн2=сн—сн—соон
нс^с—соон
винилуксусная кислота пропиоловая кислота
По номенклатуре ИЮПАК названия образуют аналогично на-
сыщенным кислотам, используя суффикс -ей или -ин для обозна-
чения соответственно двойной или тройной связи с цифровым
указанием положения этой связи в углеводородном радикале:
сн2=сн—сн—соон
буген-3-овая кислота
В зависимости от положения кратной связи относительно карбо-
ксильной группы различают а,р-; Р,у-кислоты и другие, например:
СН2=СН—СООН СН2=СН—СН—СООН
а,р-ненасыщенная р,у-ненасыщенная
кислота кислота
Для ненасыщенных карбоновых кислот характерна структур-
ная изомерия, изомерия положения кратной связи и геометри-
ческая изомерия:
33 Л)
сн3—сн=сн—с^ сн2=сн—сн—с^
^он ^он
бутен-2-овая кислота бутен-3-овая кислота
изомеры положения
276
Карбоновые кислоты
СООН
н
СООН
г<1/с-бутен-2-овая кислота
лирляе-бутен-2-овая кислота
з
Способы получения. В синтезе ненасыщенных карбоновых кис-
лот используют ненасыщенные соединения, например окисление
в мягких условиях ненасыщенных спиртов и альдегидов, гидролиз
нитрилов и др. Кроме этих используют также и специфические
методы получения.
1. Гидрокарбоксилирование алкинов (реакция Реппе). В присут-
ствии карбонатов алкины с углерода (II) оксидом и водой образу-
ют а,р-ненасыщенные монокарбоновые кислоты:
СН=СН + СО + Н2О
- СН2=СН—СООН
акриловая кислота
2. Элиминирование $-галогена- и $-гидроксикарбоновых кислот.
При нагревании с водой p-галогенокарбоновые кислоты отщеп-
ляют галогеноводород и превращаются в а,Р-ненасыщенные кис-
лоты :
СН,—СН,—СООН —СН,=СН—СООН + НС1
I-Ья X*
акриловая кислота
С1
Р-Гидроксикарбоновые кислоты при нагревании отщепляют
воду и также образуют в а,р-ненасыщенные кислоты:
СН3—СН—СН—СООН
ОН
СН3—СН=СН—СООН + Н2О
кротоновая кислота
Физические свойства. Ненасыщенные монокарбоновые кислоты
представляют собой бесцветные жидкости или кристаллические
вещества. Низшие представители хорошо растворяются в воде;
с увеличением молекулярной массы растворимость уменьшается.
Высшие ненасыщенные кислоты в воде не растворяются, но хо-
рошо растворимы в органических растворителях.
Химические свойства. Реакционная способность ненасыщен-
ных карбоновых кислот обусловлена наличием карбоксильной
группы и кратной связи.
За счет карбоксильной группы они образуют соли, галогенан-
гидриды, ангидриды, сложные эфиры, амиды, то есть вступают
в реакции, характерные для карбоновых кислот.
22. Монокарбоновые кислоты
277
По кратной связи ненасыщенные карбоновые кислоты всту-
пают в реакции присоединения, окисления, полимеризации. Так,
они обесцвечивают раствор КМпО4, раствор бромной воды.
Необходимо отметить, что присоединение галоген о водородов
к а,|3-ненасыщенным кислотам проходит против правила Мар-
ковникова, что объясняется отрицательным мезомерным (-М)
и отрицательным индуктивным (— /) эффектами карбоксильной
группы:
3+ 8-
+ НВг
ЛЭ
сн2—сн—ССГ
| ^он
Вг _ _
р-бромпропионовая
кислота
В сравнении с соответствующими насыщенными кислотами
а,р-ненасыщенные кислоты проявляют более сильную кислотность,
что объясняется повышением устойчивости образующегося анио-
на за счет делокализации заряда по сопряженной системе.
Полимеризацией метилового эфира метакриловой кислоты по-
лучают полиметилакрилат — органическое стекло или плексиглас.
п СН2
п
полиметилметакрилат
Плексиглас — небьющееся, обладающее большой прочностью
стекло.
Примером взаимного превращения геометрических изомеров
в ряду ненасыщенных карбоновых кислот служит олеиновая кис-
лота, которая при действии азотистой кислоты или УФ-облуче-
ния изомеризуется в элаидиновую кислоту, являющуюся транс-
изомером:
СН3~(СН2)7
сн
НООС—(СН2)7
сн
СН— (СН2)7— сн
НС—(СН2)7—СООН
олеиновая кислота,
цис- изомер
элаидиновая кислота,
транс-изомер
278
Карбоновые кислоты
Олеиновая кислота — это жидкость, а элаидиновая — крис-
таллическое вещество. Смесь этиловых эфиров олеиновой (около
15 %), линолевой (около 15 %) и линоленовой кислот (около 57 %)
входит в состав препарата «линетол», который применяется для
профилактики и лечения гипертонии и атеросклероза.
АРОМАТИЧЕСКИЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ
Ароматическими карбоновыми кислотами называют соедине-
ния, в молекулах которых карбоксильная группа связана с бен-
зольным кольцом.
СООН
бензойная
кислота
СООН
СООН
-сн3
3-этилбензойная
кислота
^^^СНз-СН,
2-метил-5-этил-
бензойная кислота
Метилбензойные кислоты называются толуиловыми кислотами:
^^^^соон
я-толуиловая
кислота
СООН
м-толу иловая
кислота
jw-толуиловая
кислота
Физические свойства. Ароматические карбоновые кислоты
представляют собой бесцветные кристаллические вещества, рас-
творимые в этаноле и эфире.
Химические свойства. Химические свойства ароматических
карбоновых кислот обусловлены наличием карбоксильной груп-
пы и бензольного ядра.
По карбоксильной группе ароматические карбоновые кисло-
ты образуют соли, галогенангидриды, ангидриды, эфиры и т. д.
Например:
22. Монокарбоновые кислоты
279
NaOH
-Н3РО3
бензоилхлорид,
хлорангидрид
бензойной кислоты
Кислотность ароматических кислот превышает кислотность
алифатических (кроме муравьиной кислоты) и ненасыщенных кар-
боновых кислот, это объясняется делокализацией отрицательного
заряда бензоат-иона по сопряженной системе бензольного кольца.
За счет бензольного кольца они вступают в реакции электро-
фильного замещения SE (нитрование, сульфирование, галогени-
рование). Карбоксильная группа, являясь ориентантом второго
рода, дезактивирует бензольное кольцо в реакциях SE и направля-
ет заместители в мета-положение. Например:
zvC00H
бензойная
кислота
конц. HNO3
конц. H2SO4
хч^соон
+ Н2О
м -нитробензойная
кислота
При нагревании выше 200 °C ароматические карбоновые кис-
лоты в присутствии катализатора декарбоксилируются:
бензойная
кислота
бензол
+ co2t
Бензиловый эфир бензойной кислоты входит в состав перуан-
ского бальзама. Натриевая соль бензойной кислоты (натрия бен-
зоат) применяется как отхаркивающее средство при бронхитах.
____________23____________
ДИКАРБОНОВЫЕ КИСЛОТЫ
Дикарбоновыми кислотами называют производные углеводо-
родов, содержащие в своем составе две карбоксильные группы.
НАСЫЩЕННЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
По заместительной номенклатуре название дикарбоновых кис-
лот строят, исходя из соответствующих углеводородов с добавле-
нием множительной приставки ди-, суффикса -овая и слова
кислота. Наряду с заместительной номенклатурой широко приме-
няются тривиальные названия.
НООС—СООН
НООС—СН,—СООН
щавелевая кислота,
этандиовая кислота
малоновая кислота,
пропандиовая кислота
янтарная кислота,
бутандиовая кислота
Для дикарбоновых кислот характерна структурная изомерия.
Физические свойства. Дикарбоновые кислоты представляют
собой кристаллические вещества. Низшие гомологи хорошо рас-
творимы в воде. С увеличением молекулярной массы раствори-
мость уменьшается.
Способы получения. Дикарбоновые кислоты получают теми же
методами, что и монокарбоновые кислоты, используя в качестве
исходных веществ соответствующие бифункциональные соедине-
23. Дикарбоновые кислоты
281
1. Окисление двупервичных гликолей, диальдегидов и гидрокси-
кислот:
НО—СН,—СН,—СН2—ОН
пропандиол-1,3
НООС—сн,—соон
малоновая кислота
НО—СН,—СН,—СООН
p-гидроксипропионовая кислота
!°U
НООС—СН,—СООН
малоновая кислота
2. Реакция омыления динитрилов является одним из важных
способов получения дикарбоновых кислот:
N=C—СН— СН— ON
динитрил янтарной кислоты
НОН; 1Г- НООС—сн—сн— СООН
янтарная кислота
Химические свойства. Имея в своем составе две карбоксиль-
ные группы, дикарбоновые кислоты диссоциируют ступенчато,
образуя анион (рА^) и дианион (рХ2).
Высокая кислотность по первой ступени объясняется влияни-
ем второй карбоксильной группы, которая способствует делока-
лизации образующегося отрицательного заряда карбоксилат-иона
и тем самым повышает его устойчивость. По мере удаления кар-
боксильных групп друг от друга ослабевает их взаимное влияние,
и кислотность по первой ступени падает. Отрыв протона от вто-
рой карбоксильной группы происходит труднее вследствие низ-
кой стабильности дианиона, поэтому кислотность дикарбоновых
кислот по второй ступени значительно ниже, чем по первой.
При максимальном удалении карбоксильных групп взаимное
влияние ослабевает, и через 5—6 связей каждая из них ведет себя
независимо.
По химическим свойствам дикарбоновые кислоты так же, как
и монокарбоновые, способны образовывать одни и те же функци-
ональные производные. Только в зависимости от того, одна или
две карбоксильные группы участвуют в реакции, получают кис-
лые или средние соли, полные и неполные эфиры, галогенангид-
риды, амиды и др. Например:
282
Карбоновые кислоты
2С,Н<0Н
2
диэтиловый эфир
щавелевой кислоты
(полный эфир)
-2НэО
NL°a - НООС—COONa
2
-ноос—соон-
мононатриевая соль
щавелевой кислоты,
кислый натрия оксалат
он
моноэтиловый эфир
щавелевой кислоты
(неполный эфир)
2NaOH
_2н2о * NaOOC—COONa
динатриевая соль
щавелевой кислоты
натрия оксалат
Вместе с тем следует отметить, что дикарбоновые кислоты про-
являют и ряд специфических свойств. В частности, они по-разно-
му относятся к нагреванию.
7. Отношение дикарбоновых кислот к нагреванию. Щавелевая
и малоновая кислоты при нагревании выше температуры плавле-
ния отщепляют углерода (IV) оксид и превращаются в монокар-
боновые кислоты:
НООС—СООН
ЭЛЛ of'1
НСООН + COJ
J—I1
муравьиная
кислота
НООС—СН,—СООН
А-
150 °C
НС3—СООН + co2t
уксусная
кислота
При нагревании янтарной и глутаровой кислот, у которых сла-
бее взаимное влияние карбоксильных групп, декарбоксилирова-
ние не происходит, а осуществляется процесс внутримолекуляр-
ной дегидратации с образованием циклических ангидридов:
Н2С—СООН
I
Н2С—СООН
янтарный ангидрид
янтарная кислота
23. Дикарбоновые кислоты
283
СН—СООН
н2с<
СН2—СООН
Хи
глутаровая кислота
-Н2О
глутаровый ангидрид
Адипиновая кислота в этих условиях подвергается декарбо-
ксилированию и дегидратации с образованием циклического ке-
тона — циклопентанона:
Н2С сн2-~.соон
н2с—СНГСООН
-Н20; -СО*
НГ—СН
циклопентанон
адипиновая кислота
2. Образование циклических имидов. При нагревании янтарной
и глутаровой кислот или их ангидридов с аммиаком образуются
циклические имиды:
СН2—СН —ccf + NH3
_ Xr ___ _
НСГ X)H
t
янтарная кислота
сукцинимид
О
янтарный ангидрид
Важное значение в органическом синтезе имеет диэтиловый
эфир малоновой кислоты, или малоновый эфир:
В результате электроноакцепторного влияния двух сложно-
эфирных групп за счет -/-эффекта возрастает подвижность ато-
мов водорода метиленовой группы, что обусловливает наличие
СН-кислотного центра. При действии на малоновый эфир натрия
алкоголята образуется натриймалоновый эфир, который взаимо-
действует с электрофильными реагентами. Так, при алкилирова-
нии малонового эфира образуется алкилмалоновый эфир, кото-
284
Карбоновые кислоты
рый, гидролизуясь, дает алкилмалоновую кислоту. Последняя легко
декарбоксилируется и образует монокарбоновую кислоту:
C2H5O“Na*
—с2н5он
натриймалоновый эфир
нс—сн
Н,О; Н*
-2С2Н5ОН
СН—СН,
«г
П
L ?р1н
-со,
Xf
метилмалоновый эфир метилмалоновая кислота
сн3—сн2
пропионовая кислота
Алкилированию может подвергаться и второй атом водорода
метиленовой группы, что дает возможность осуществлять синтез
разнообразных монокарбоновых кислот.
При ацилировании натриймалонового эфира сс-галогенкарбо-
новыми кислотами образуются различные дикарбоновые кислоты.
НЕНАСЫЩЕННЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
Простейшими представителями этого класса являются малеи-
новая и фумаровая кислоты — геометрические изомеры 2-бутен-
диовой кислоты:
ноос
СООН
СООН
ноос
малеиновая кислота,
^i/c-бутендиовая кислота
фумаровая кислота,
/лраяс-бугендиовая кислота
23. Дикарбоновые кислоты
285
Способы получения. Малеиновую кислоту можно получить
дегидратацией яблочной кислоты с последующей гидратацией об-
разующегося малеинового ангидрида:
НООС—СНэ—СН—СООН
-2Н2О
ОН
яблочная кислота,
гидроксиянтарная кислота
СН
малеиновый
ангидрид
СН—СООН
СН—СООН
малеиновая
кислота
Фумаровая кислота получается конденсацией
лоты с малоновой кислотой:
глиоксалевой кис-
ноос—с
глиоксалевая
кислота
СООН
СООН
он-
2
2
СООН
НООС—CH=Q
^соон
СООН
ноос н
фумаровая кислота
2
или изомеризацией малеиновой кислоты:
НООС
СООН
малеиновая кислота
150 °C
изомеризация
фумаровая кислота
СООН
Химические свойства. По сравнению с насыщенными дикар-
боновыми ненасыщенные дикарбоновые кислоты являются более
сильными кислотами. Это объясняется взаимным влиянием двух
карбоксильных групп.
Реакционная способность ненасыщенных дикарбоновых кис-
лот обусловлена наличием двух карбоксильных групп и кратной
связи. По кратной связи протекают реакции электрофильного
присоединения и реакции окисления. Например:
286
Карбоновые кислоты
НООС—СН—СН—СООН
янтарная кислота
НООС—сн—сн—соон
Вг Вг
ди бром янтарная кислота
HClH н +
I— > НООС—СН—СН—СООН
СООН
он
яблочная кислота
НООС—СН—СН—СООН
С1
хлорянтарная кислота
сн
I
соон
L- ' •-» НООС—сн—сн—соон
он он
виноградная кислота
По карбоксильной группе образуются кислые и средние соли,
неполные и полные сложные эфиры, амиды и т. д.
Особенностью малеиновой кислоты является ее способность
при нагревании образовывать циклический ангидрид. Фумаровая
кислота в аналогичных условиях ангидрида не образует по причи-
не пространственной удаленности карбоксильных групп.
малеиновый ангидрид
НС—СООН
НС—СООН
малеиновая кислота
АРОМАТИЧЕСКИЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
Ароматическими дикарбоновыми кислотами называют произ-
водные ароматических углеводородов, содержащие две карбоксиль-
ные группы, непосредственно связанные с ароматическим ядром.
Важными представителями этого класса являются фталевая,
изофталевая и терефталевая кислоты:
/^СООН
соон
\^соон
соон
соон
фталевая кислота, изофталевая кислота,
1,2-бензолдикарбоновая 1,3-бензолдикарбоновая
кислота кислота
терефталевая кислота,
1,4-бензолдикарбоновая
кислота
23. Дикарбоновые кислоты
287
Они имеют общее название — фталевые кислоты.
Способы получения. Основным способом получения аромати-
ческих дикарбоновых кислот является каталитическое окисление
ксилолов кислородом воздуха.
Так, при окислении п-ксилола получают терефталевую кис-
лоту:
СН, СООН
терефталевая кислота
Фталевую кислоту получают из о-ксилола или нафталина:
о-ксилол
нафталин
/^.СООН
фталевая кислота
Физические и химические свойства. Фталевые кислоты пред-
ставляют собой кристаллические вещества с высокими темпера-
турами плавления. Фталевая и терефталевая кислоты малораство-
римы в воде, в то время как изофталевая кислота в воде легко
растворима.
По степени кислотности они превышают бензойную кислоту.
Арендикарбоновые кислоты образуют кислые и средние соли,
полные и неполные сложные эфиры и амиды и т. д. Фталевая
кислота в отличие от своих изомеров при нагревании легко теряет
молекулу воды с образованием ангидрида, который при взаимо-
действии с аммиаком образует фталимид:
288
Карбоновые кислоты
/^х:оон
2
СООН
фталевая кислота
Фталимид широко используется в органическом синтезе.
_________________24____________________
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
КАРБОНОВЫХ КИСЛОТ
К важнейшим функциональным производным карбоновых кис-
лот относятся: галогенангидриды, ангидриды, сложные эфиры,
амиды, гидразиды, гидроксамовые кислоты, нитрилы и др.
ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
(АЦИЛГАЛОГЕНИДЫ)
Ацилгалогениды — это производные карбоновых кислот, в мо-
лекулах которых гидроксильная группа, входящая в состав кар-
боксильной, замещена на атом галогена:
Номенклатура. Названия ацилгалогенидов образуют из назва-
ний соответствующих кислот или ацильных групп и названий га-
логенов:
хлорангидрид уксусной
кислоты, ацетилхлорид
хлорангидрид бензойной
кислоты, бензоилхлорид
Способы получения. Хлор- и бромангидриды могут быть полу-
чены при действии галогенирующего реагента на карбоновые кис-
лоты:
290
Карбоновые кислоты
+ Н3РО3
+ poci3 + ней
+ на) + so2t
Л*
Иодопроизводные карбоновых кислот получают действием йода
в присутствии фосфора:
Н3С
+ Р + 12
X)
* н3с—сГ + Н3РО3
ч
Физические свойства. Низшие галогенангидриды карбоновых
кислот — жидкости с резким запахом, раздражающие слизистые
оболочки.
Химические свойства. Галогенангидриды — силь-
ные электрофильные реагенты, сильнее карбоновых
кислот. Галоген в этих соединениях обладает ис-
ключительно большой подвижностью.
Электрофильные свойства подобных соединений зависят от
величины дробного положительного заряда 5+ на углероде карбо-
нильной группы. Со стороны атома галогена проявляется ярко
выраженный -/-эффект, поэтому на атоме углерода карбониль-
ной группы возникает довольно большой заряд 5+, что и обуслов-
ливает сильные электрофильные свойства галогенангидридов. Они
легко вступают в реакции нуклеофильного замещения:
О
2NH
NH
амид кислоты
NH-.OH
NHOH
гидроксамовая кислота
-НС1
2NH2NH2
НОН
-NaCI
карбоновая кислота
сложный эфир
кгихттт -NH,NH2-HC1
NHNHo "
ангидрид кислоты
гидразид кислоты
24. Функциональные производные карбоновых кислот
291
Высокая реакционная способность галогенангидридов позво-
ляет использовать их в качестве ацилируюпшх реагентов для вве-
дения в молекулу ацильной группы R—, поэтоглу такие ре-
акции называют реакциями ацилирования, а галогенангидриды
карбоновых кислот — ацилирующими агентами,
Галогенангидриды в силу своей высокой активности нашли
чрезвычайно большое применение в органическом синтезе.
АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
Ангидридами называют производные карбоновых кислот, в мо-
лекулах которых атом водорода карбоксильной группы замещен
на ацильную группу. Они могут иметь линейное и циклическое
строение. Циклические ангидриды в основном образуют дикар-
боновые кислоты.
линейный ангидрид циклический ангидрид
Номенклатура. Названия ангидридов образуют из тривиальных
названий соответствующих кислот:
уксусный ангидрид, малеиновый ангидрид,
ангидрид уксусной кислоты ангидрид малеиновой кислоты
Способы получения. 1, Дегидратация карбоновых кислот. При
пропускании паров кислоты над соответствующим водоотнимаю-
щим средством (фосфора пентаоксидом, трифторуксусным ангид-
ридом) происходит выделение воды — реакция дегидратации:
Н3С— ОН] Р2< 'бн| Н3С— — о ,о э., н3с—(Г — /О + 2НРО3 Н,С—Cf ^цл***,. уксусный ангидрид
292
Карбоновые кислоты
2. В промышленном масштабе ангидриды получают взаимо-
действием галогенангидридов с безводными солями карбоновых кис-
лот:
натрия ацетат
-ИасГ
уксусный ангидрид
3. Взаимодействие карбоновых кислот с кетенами (промышлен-
ный метод получения уксусного ангидрида):
Физические свойства. Ангидриды — кристаллические вещества
или жидкости, малорастворимые в воде, обладают резким запа-
хом.
Химические свойства. Ангидриды карбоновых кислот имеют
менее выраженный электрофильный характер, чем галогенангид-
риды, но больше, чем соответствующие карбоновые кислоты,
поскольку неподеленная пара электронов атома кислорода со-
пряжена с двумя карбонильными группами одновременно, что
приводит к уменьшению заряда 5+ на углероде карбонильной
группы по сравнению с галогенангидридами, но он, естественно,
больше по сравнению с кислотами:
5+ > 6+' > 8+"
Ангидриды карбоновых кислот легко вступают в реакции
нуклеофильного замещения и используются как ацилирующие
реагенты:
24. Функциональные производные карбоновых кислот
293
НОН; t
2RCOOH
+ RCOOH
NH2CH3
+ RCOOH
C2HSOH
NHCH
янтарный
ангидрид
^C—CH—CH—C^
НСГ OC2H5
неполный эфир (моноэфир)
RNH,
<х.
j;c—сн — сн — с^
НО ^NHR
неполный амид (моноамид)
Уксусный ангидрид используется в синтезе синтетических во-
локон, фармацевтических препаратов (ацетилсалициловая кислота).
СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры — производные карбоновых кислот, в моле-
кулах которых гидроксильная группа, входящая в состав карбо-
ксильной группы, замещена на остаток спирта или фенола —OR':
Номенклатура. Сложные эфиры называют по исходным кис-
лоте и спирту или фенолу:
этиловый эфир
уксусной кислоты,
уксус ноэтиловый эфир,
этилацетат, этилэтаноат
фениловый эфир
уксусной кислоты,
фенилацетат,
фенилэтаноат
294
Карбоновые кислоты
Способы получения. 1. Взаимодействие галогенангидридов
и ангидридов карбоновых кислот со спиртами и феноксидами ще-
лочных металлов'.
С2Н5ОН
C6HSO-Na;
-NaCl
этилацетат
С2Н5ОН
"-СН3СООН
фенилацетат
C6H5O"Na+
-CH3COONa
2. Взаимодействие карбоновых кислот со спиртами (реакция
этерификации):
X)
R—С^______+_ I1
н________!
H2SO
Реакция этерификации обратима. Для смещения равновесия
в сторону образования конечных продуктов отгоняют получен-
ный эфир или берут какое-либо из исходных веществ в избытке.
Физические свойства. Сложные эфиры — жидкости с прият-
ным запахом, чаще нерастворимы в воде. По сравнению с соот-
ветствующими кислотами и спиртами у них более низкие темпе-
ратуры кипения, так как их молекулы не ассоциированы.
Химические свойства. Сложные эфиры относятся к электро-
фильным реагентам, но их электрофильные свойства менее выра-
жены по сравнению с галогенангидридами и ангидридами карбо-
новых кислот:
R' = алкильный радикал
Электрофильность эфиров увеличивается, если углеводород-
ный радикал сложноэфирной группы образует с атомом кислоро-
да сопряженную систему.
24. Функциональные производные карбоновых кислот
295
ариловый эфир
виниловый эфир
Такие эфиры называют активированными эфирами.
Сложные эфиры вступают в реакции нуклеофильного заме-
щения.
1. Гидролиз сложных эфиров проходит как в кислой, так и в ще-
лочной среде.
Кислотный гидролиз сложных эфиров — это реакция, обратная
реакции этерификации:
сложный эфир
+ Н2О
Т)
R—+ R’OH
О—Н
карбоновая кислота
Механизм этой реакции включает протонирование атома кис-
лорода карбонильной группы с образованием карбокатиона, ко-
торый реагирует с молекулой воды:
нон
,-- *-
перегруп-
пировка
О:
R—С—ОН
R'-^O—Н
разложение
Т)
R—C^ + R'-—ОН
"ОН
Как видно из механизма, кислотный гидролиз обратим.
Щелочной гидролиз. Гидролиз в присутствии водных растворов
щелочей проходит легче, чем кислотный, потому что гидроксид-
анион более активный и менее объемный нуклеофил, чем вода.
В отличие от кислотного, щелочной гидролиз необратим:
+ NaOH
R—cf + R’OH
ONa
296
Карбоновые кислоты
Щелочь выступает не в роли катализатора, а в роли реагента.
Гидролиз начинается с нуклеофильной атаки гидроксид-ионом
атома углерода карбонильной группы. Образуется промежуточ-
ный анион, который отщепляет алкоксид-ион и превращается
в молекулу карбоновой кислоты. Алкоксид-ион, как более силь-
ное основание, отрывает протон от молекулы кислоты и превра-
щается в молекулу спирта:
X)
- R—+ R’O-
он
+ R’OH
Щелочной гидролиз необратим потому, что карбоксилат ани-
он имеет высокую делокализацию отрицательного заряда и не вос-
приимчив к атаке спиртового гидроксила.
Часто щелочной гидролиз сложных эфиров называют омыле-
нием. Термин произошел от названия продуктов щелочного гид-
ролиза жиров — мыла.
2. Взаимодействие с аммиаком (аммонолиз) и его производными'.
NH—ОН
R’OH
гидроксиамид
3. Реакция переэтерификации (алкоголиз сложных эфиров) ка-
тализируется как минеральными кислотами, так и щелочами:
24. Функциональные производные карбоновых кислот
297
н,с—+ с2н5он -*и—°- Н3С—cf + СН3ОН
ОСН, ОС2Н5
Для смещения равновесия вправо отгоняют более летучий
спирт.
4. Сложноэфирная конденсация Кляйзена характерна для эфи-
ров карбоновых кислот, содержащих атомы водорода в a-положе-
нии. Реакция протекает в присутствии сильных оснований:
О
С Н O_Na+ II
2Н3С—— Н3С—С—СН— + С2Н5ОН
ОС2Н5 „ . ОС2Н5
z 3 ацетоуксусный эфир
(р-кетоэфир)
Алкоксид-ион отщепляет протон от а-углеродного атома моле-
кулы эфира. Образуется мезомерно стабилизированный карбани-
он (I), который, выступая в роли нуклеофила, атакует атом угле-
рода карбонильной группы второй молекулы эфира. Образуется
продукт присоединения (II). Он отщепляет алкоксид-ион и пре-
вращается в конечный продукт (III). Таким образом, всю схему
механизма реакции можно разделить на три стадии:
X) Jd
1) Н3С—+ С2Н5О“ — “СН — сГ + С2Н5ОН
ОС2Н5 ОС2Н5
(I)
(II)
О
(III)
Если в реакцию вступают два сложных эфира, содержащие
а-атомы водорода, то образуется смесь четырех возможных про-
дуктов. Реакция используется для промышленного получения
ацетоуксусного эфира.
298
Карбоновые кислоты
5. Действие магнийорганических соединений с последующим гид-
ролизом приводит к образованию третичных спиртов:
OMgl
н3с—с—сн3
ос,н5
OMgl
н3с—с—сн3
сн3
нон
-Mg(OH)I
CH3MgI
-C,HsOMgI
он
I
Н3С—С—СН3
сн3
Сложные эфиры имеют большое значение как ацилирующие
реагенты, растворители, используются для синтеза альдегидов,
кетонов, полимеров («органическое стекло» — плексиглас), ле-
карственных веществ: этилформиат — для производства витами-
на Вг Бензилбензоат используют для лечения чесотки. Сложные
эфиры известны как отдушки в парфюмерии (этилформиат, этил-
ацетат) и компоненты пищевых эссенций: грушевой — изоамил-
ацетат, яблочной — изоамилвалериат, ромовой — этилформиат,
ананасовой — этилбутират.
АМИДЫ КАРБОНОВЫХ КИСЛОТ
Амидами называют производные карбоновых кислот, в моле-
кулах которых гидроксильная группа карбоксила замещена на ами-
ногруппу:
Эти соединения можно рассматривать как ацильные произ-
водные аммиака, первичных и вторичных аминов.
Номенклатура. Названия амидов образуют от названий соот-
ветствующих кислот и аминов. В большинстве случаев использу-
ют тривиальные названия ацилов, заменяя суффикс -ил на -амид.
Согласно заместительной номенклатуре ИЮПАК в названиях со-
ответствующих кислот часть -овая кислота заменяется на суффикс
-амид. Символом N обозначают положение заместителей у атома
азота амидной группы:
24. Функциональные производные карбоновых кислот
299
амид
уксусной кислоты,
ацетамид
NHCH
метиламид уксусной кислоты,
N-метил этан амид,
N-метилэтаномид
N(CH3)
ди метиламид
уксусной кислоты,
N, N -дим етил ацетам ид
Способы получения. Амиды получают в результате взаимодей-
ствия галоген ан гидридов, ангидридов или сложных эфиров кар-
боновых кислот с аммиаком, первичными или вторичными ами-
нами; при нагревании аммонийных солей карбоновых кислот; при
гидролизе нитрилов:
NH
-на
а
ацетилхлорид
I
-Н2О
(Н3ССО)2О
NH
1 амид
н3с—
onh;
аммония ацетат
Н2О; H,SO4
-СН3СООН
уксусный ангидрид
NH
-сн3он
метилацетат
ацетонитрил
Физические свойства. Амиды — кристаллические вещества или
жидкости, растворимые в воде и органических растворителях. Это
ассоциированные соединения, способность к ассоциации которых
связана с тем, что л-электроны карбонильной группы смещаются
к наиболее электроотрицательному атому кислорода, а неподелен-
ная пара электронов азота сопряжена с карбонильной группой. За
счет этого водород, находящийся при атоме азота, обладает способ-
ностью к образованию водородной связи с другой молекулой амида:
Поскольку амиды являются ассоциированными, то они имеют
более высокие, по сравнению с соответствующими карбоновыми
кислотами, температуры плавления и кипения.
300
Карбоновые кислоты
Химические свойства. Амиды — очень слабые электрофилы.
За счет сопряжения неподеленной пары электронов атома азота
(+А/-эффект) с карбонильной группой частичный положитель-
ный заряд на атоме углерода С=О-группы в амидах меньше, чем
у галогенангидридов, ангидридов и сложных эфиров:
5+ > 5+' > 8+" > 8+"'
Вследствие такого электронного строения амиды практически
не вступают в реакции с нуклеофильными реагентами.
7. Амфотерность амидов. Амиды — нейтральные вещества. Они
проявляют амфотерный характер.
Основные свойства. Амиды можно рассматривать как произ-
водные аммиака, у которого атом водорода замещен на ацильный
остаток. Но ацильный остаток содержит карбонильную группу,
находящуюся в сопряжении с неподеленной парой электронов
атома азота, поэтому основные свойства ТЧН2-группы значитель-
но понижены:
Амиды образуют соли лишь с сильными минеральными кис-
лотами:
Соле образование наступает в отсутствие влаги. Эти соли легко
гидролизуются, так как образованы слабым основанием и силь-
ной кислотой.
Кислотные свойства. По сравнению с аммиаком амиды обла-
дают большей кислотностью. В молекулах незамещенных и N-за-
мещенных амидов атомы водорода связи N—Н приобретают по-
24. Функциональные производные карбоновых кислот
301
движность за счет сопряжения неподеленной пары электронов ато-
ма азота с л-электронами карбонильной группы.
Незамещенные и монозамещенные амиды проявляют свойства
NH-кислот:
NaNH,
NHj
NHNa
2. Гидролиз амидов. В нейтральной среде амиды гидролизуются
значительно труднее, чем другие функциональные производные
карбоновых кислот. Катализируют этот процесс кислоты или ще-
лочи:
5+
NaOH
ONa
QNH2
NH, !
ONa
OH
I
нбн
Cnh2
NH2
протонированная
форма амида
NH
I
о
R—С—-ОН
OH
NH
3. Дегидратация, При нагревании незамещенных амидов
с сильными водоотнимающими средствами (Р2О5 или РОС13) об-
разуются нитрилы:
I ।
nih2;
г2'-'5> '
- Н2О
302
Карбоновые кислоты
4. Расщепление незамещенных амидов до первичных аминов. Ре-
акция открыта в 1881 году немецким химиком А. В. Гофманом,
получила название «перегруппировка Гофмана»:
СН
NaOBr
(Вг, + NaOH)*
Н3С—СН,—NH, + CO,t + NaBr
этиламин
5. Восстановление амидов под действием лития алюмогидрида
LiAlH4 идет до образования аминов:
[H]; LiAlH4
н3с—сн2—ch2~nh2 + но2
н-пропиламин
N-замещенные амиды дают вторичные или третичные амины.
6. Замещение атома водорода в группе NH2 на галоген. Реакция
обычно проходит в присутствии оснований:
+ С12
Л)
* Н3С— + НС1
NHC1
Полученные N-галогенамиды — нестабильные соединения со
свойствами окислителя. Они используются в качестве галогени-
рующих реагентов.
Амиды карбоновых кислот находят широкое применение как
растворители (формамид, диметилформамид и др.) в производ-
стве синтетических волокон, лакокрасочных материалов, биоло-
гически активных веществ. Они довольно часто используются для
идентификации кислот. Идентифицировать получение различными
способами той или иной кислоты можно по ее производным,
в том числе амидам. Например, точно выраженная температура
плавления амида масляной кислоты часто служит для однознач-
ного решения вопроса о получении соответствующей кислоты,
которая при нормальных условиях представляет собой жидкость.
ГИДРАЗИДЫ КАРБОНОВЫХ КИСЛОТ
Гидразиды — производные карбоновых кислот, в молекулах ко-
торых гидроксильная группа карбоксила замещена на остаток гид-
разина, алкил- или арилгидразина:
24. Функциональные производные карбоновых кислот
303
NH
Номенклатура. Названия гидразидов образуют от названий
соответствующих карбоновых кислот и гидразинов.
NH—NH
гидразид масляной кислоты
N'-фенилгидразид уксусной кислоты
н3с—
^NH—N(CH3)2
N,N-диметилгидразид
уксусной кислоты
Способы получения. Гидразиды получают при действии гидра-
зина, алкил- или арилгидразинов на хлорангидриды, ангидриды,
эфиры карбоновых кислот:
ацетилхлорид
nh2nh2
-НС1
(Н3ССО)2О
уксусный ангидрид
метилацетат
nh2nh2
-CH3COOH
NH2NH2
-СН3ОН
NH—NH
гидразид уксусной кислоты
Физические свойства. Гидразиды — кристаллические вещества
с точно выраженной температурой плавления, что позволяет ис-
пользовать их для идентификации карбоновых кислот.
Химические свойства. По химическим свойствам гидразиды
во многом напоминают амиды. В молекуле гидразида имеется
два атома азота:
С—NH
N. , неподеленная пара электронов
304
Карбоновые кислоты
а-атома азота сопряжена с карбонильной группой, а неподелен-
ная пара электронов р-атома азота не участвует в сопряжении,
поэтому гидразиды обладают более выраженными основными
и нуклеофильными свойствами, чем амиды. Они образуют соли
с разбавленными минеральными кислотами, алкилируются, аци-
лируются, взаимодействуют с карбонильными соединениями и азо-
тистой кислотой:
НС1
NH—NH,CF
N-ацетил гид разина гидрохлорид
8-
NH—NH
снл
3
NH—NH—СН
N -метилгидразид уксусной кислоты
СН3СОС1
-НС1
(СН3СО)2О
-сн,соон
'кн—nF?
N ,N ’-диацетилгидразин
NH—N=CH—СН
этилиденгидразид уксусной кислоты
hno2
-2Н2О
N—N=N
азид уксусной кислоты
Гидразиды находят широкое применение в синтезе лекарствен-
ных веществ.
НИТРИЛЫ (ЦИАНИДЫ)
Нитрилы — органические соединения, содержащие одну или
несколько цианогрупп
дикалом:
C=N, связанных с углеводородным ра-
N
24. Функциональные производные карбоновых кислот
305
Номенклатура. Названия нитрилов образуют из тривиальных
названий ацильных остатков соответствующих кислот или систе-
матических названий карбоновых кислот, имеющих то же коли-
чество атомов углерода, с последующим добавлением суффикса
-нитрил:
ацетонитрил, этанонитрил,
нитрил уксусной кислоты
С,Н,—СН,—(-N
6 5 2
фенилацетонитрил,
фен ил этан о нитр ил,
нитрил фенилуксусной кислоты
Способы получения. 1. Дегидратация амидов сильными водо-
отнимающими средствами:
Р,О5; *
Н3С—» Н3С— CSN + Н2о
NiHj
2. Взаимодействие галогеналканов с солями циановодородной кис-
лоты (цианидами):
Н3С—I + KG^N ---- Н3С—C^N + KI
Физические свойства. Нитрилы — жидкие или твердые веще-
ства, не растворяющиеся в воде, но растворимые в органических
растворителях нейтрального характера.
Химические свойства. Цианогруппа, проявляя отрицательный
индуктивный эффект, увеличивает подвижность атомов водорода
при а-углеродном атоме; и за счет этого возможны реакции кон-
денсации; по месту разрыва тройной связи нитрилы вступают
в реакции нуклеофильного присоединения.
а 3+ <\S-
R— CH-*C=N
1
Н5+
1. Присоединение нуклеофильных реагентов. Гидролиз нитри-
лов проходит при нагревании с водными растворами кислот или
щелочей с образованием амидов, которые дальше могут гидроли-
зоваться до кислот:
Н3С— C=N
НОН (Н+ или ОН-)
Н3С
НОН (Н+ или ОН-)
+ NH,!
306
Карбоновые кислоты
2. Реакция с участием а-углеродных атомов. Конденсация нит-
рилов (реакция Торпа) проходит в присутствии оснований: калия
или натрия амидов, алкоксидов металлов. Реакция аналогична аль-
дольной конденсации:
р-иминонитрил
3. Восстановление лития нитрилов алюмогидридом или водоро-
дом протекает до соответствующих аминов:
Н3С—C^N tH|; кат- Н3С—СН—NH2
Нитрилы широко используются в органическом синтезе. Мно-
гие реакции органических соединений с нитрилами применяются
для наращивания углеродной цепи. Ацетонитрил — хороший рас-
творитель для жирных кислот, используется в производстве вита-
мина Вг Кристаллическое вещество малонодинитрил легко всту-
пает в реакции конденсации, широко используется для получения
гетероциклических соединений — витаминов Вр В6, пестицидов,
красителей.
ЖИРЫ
Жиры (триацилгли церины, триацилглицериды) — сложные
эфиры трехатомного спирта глицерина и высших алифатических
кислот. Общая формула жиров:
О
Н2С—О—С—R
О
НС—О—С—R'
О
Н2С—О—С—R"
В состав жиров преимущественно входят одноосновные кис-
лоты с неразветвленной цепью, которые содержат четное число
углеродных атомов от 4 до 26.
24. Функциональные производные карбоновых кислот
307
По кислотному составу триацил глицериды подраз-
деляют на простые, содержащие остатки одинаковых кислот
(R=R — R"), и смешанные, в составе которых — разные кислот-
ные остатки.
Природные жиры — чаще смешанные триацилглицерицы. Кис-
лотный состав жиров человеческого организма главным образом
представлен стеариновой, пальмитиновой кислотами, которые
поступают как с пищей, так и образуются путем биосинтеза в ор-
ганизме. Ненасыщенные жирные кислоты: олеиновая, линолевая,
арахидоновая — не образуются в организме человека, а лишь по-
ступают с пищей. Они получили название незаменимые.
Номенклатура. По систематической номенклатуре ИЮПАК для
жиров вначале перечисляют в алфавитном порядке названия жир-
ных кислот, а затем указывают родоначальную структуру — гли-
церин. Согласно тривиальной номенклатуре в жирах часть назва-
ния жирных кислот -иновая заменяют суффиксом -ин:
трипалъмитоилглицерин,
трипальмитин
1-лауроил-2-пальмитоил-3-стеароилглицерин,
1 -лауриноил-2-пальмитостеарин
Получение. Для синтеза триацил глицеринов можно использо-
вать реакции О-ацилирования глицерина (этерификация, взаи-
модействие натрия глицератов с хлорангидридами кислот):
О
Н2С—ONa Cl—С—(СН2)14
О
НС—ONa + Cl—С—(СН2)14
О
СН3
сн3
Н2С—ONa Cl—С—(СН2)14—СН3
308
Карбоновые кислоты
о
Н2С—о—С—(СН2),4—сн3
о
НС—О—С—(СН,),4—СН, + 3NaCl
о
Н2С—О— С— (СН2)14—сн.
трипальмитин,
трипальмитоилглицерин
Синтетические способы получения жиров из глицерина
не имеют промышленного значения. Чаще триацилглицерины
выделяют из измельченных растительных и животных тканей
экстракцией, прессованием, вытапливанием.
Физические свойства. Жиры — твердые или жидкие, но не га-
зообразные вещества. Консистенция жиров зависит от их кислот-
ного состава. Твердые триацилглицерины, как правило, содержат
остатки насыщенных жирных кислот, это чаще жиры животного
происхождения. В состав жидких жиров, которые называют мас-
лами, входят в основном остатки ненасыщенных кислот. Расти-
тельные жиры, как правило,— жидкие. Исключение составляют
масло какао, которое при нормальных условиях — твердое веще-
ство, и рыбий жир — жидкость.
Природные жиры являются смесями триацилглицеринов, по-
этому не имеют четких температур плавления. Жиры нераствори-
мы в воде, но хорошо растворяются в органических растворите-
лях: углеводородах, эфире, хлороформе.
Химические свойства. Как сложные эфиры жиры способны
к гидролизу, а при наличии в их структуре ненасыщенных кислот
триацилглицериды проявляют свойства алкенов.
1. Гидролиз жиров катализируют разбавленные растворы кис-
лот или щелочей:
Н2С—О—СО—(СН2)14—СН3
НС—О—СО—(СН2)14~СН3
Н2С—О—СО—(СН2) 14—сн3
НОН (Н* или ОН~)
трипальмитин
Н2С—он
► НС—ОН + ЗН,С—(СН2)14—СООН
Н2С—ОН
глицерин
пальмитиновая кислота
24. Функциональные производные карбоновых кислот
309
В промышленности гидролиз ведут при нагревании с водой
в присутствии сульфокислот или нагреванием паром. Нередко для
гидролиза используют фермент липазу.
При взаимодействии жиров с водными растворами щелочей
образуется смесь глицерина и натриевых (калиевых) солей жир-
ных кислот, которые называют мылами. Сам процесс щелочного
гидролиза триацилглицеридов, ведущий к получению мыла, име-
ет название омыление. Этим же термином часто обозначают реак-
ции щелочного гидролиза других соединений.
Полученную в результате гидролиза смесь пальмитиновой
и стеариновой кислот используют для изготовления свечей.
Остановимся на качестве жиров. В аналитической практике
реакция омыления жиров используется для установления их ка-
чества. Определяют так называемое число омыления — количество
мг КОН, расходуемых на гидролиз 1 г жира.
Избыток калия гидроксида нагревают с триацилглицеридом
и методом обратного титрования определяют количество щелочи,
которая ушла на нейтрализацию кислот. Таким образом опреде-
ляют общее содержание как свободных, так и связанных в три-
глицериды кислот.
2. Гидрогенизация жиров — присоединение водорода по месту
разрыва двойных связей в остатках ненасыщенных кислот. Про-
цесс проходит в присутствии никелевого или платинового ката-
лизатора при повышенной температуре и давлении:
Н2С—О—СО—(СН2)7—НС=СН—(СН2)7—СН3
НС—О—СО—(СН2)~НС=СН—(СН2)7—СН3
Н2С—О—СО—(СН2)7—НС=СН—(СН2)7—сн3
триолеоилглицерин, жидкий жир, масло
н2с—о—со—(сн2)|6—сн3
- НС—О—СО—(СН2)16—сн3
Н2С—О—СО—(СН2),—сн3
тристеарин
Гидрогенизации подвергаются в основном растительные жиры
и жиры морских животных. Этот процесс лежит в основе произ-
310
Карбоновые кислоты
водства маргарина, мыла. Жидкие жиры омыляют, получают гли-
церин и непредельные кислоты, которые восстанавливают, а из
них получают мыло.
Маргарин — пищевой жир с добавлением вкусовых веществ
и отдушек, например диацетила со вкусом и цветом сливочного
масла. Промышленные жиры, полученные в результате гидроге-
низации, называют саломасами.
3. Присоединение галогенов к жирам имеет большое аналити-
ческое значение. Остатки ненасыщенных кислот в структуре жира
обнаруживают по обесцвечиванию бромной воды.
Н2С—О—СО—(СН2)7—НС=СН—(СН2)7—СН3
НС—О—СО—(СН2)7—НС=СН—(СН2)7—СН3
Н2С—о—СО— (СН2)7—НС=СН—(СН2)7—сн3
триолеин
ЗВг2
Н 2С—О—СО—(CH2)7—СН Bi—CHBi—(СН2) —сн3
- НС—о—СО— (СН2)7—СНВг— СНВг— (СН2) — сн3
Н2С—О—СО—(СН2)7—СНВг—СНВг—(СН2)7—сн3
три(9,10-дибромстеароил)глицерин
4. Окисление жиров. Наличие двойных связей в молекулах
жиров способствует легкой окисляемости, что ведет к «прогорка-
нию».
Различают два типа «прогоркания»: гидролитическое — расщеп-
ление до свободных кислот с короткой цепью, которое происхо-
дит под действием ферментов либо микроорганизмов, и окисли-
тельное.
Окисление жиров ведет к образованию альдегидов и кетонов
с короткой цепью, имеющих неприятный запах и вкус:
Н,С—О—СО—(СН2)7—НС=СН—(СН2)7—СН3
I
I
24. Функциональные производные карбоновых кислот
311
НС—СН—(СН2)
нон
пелларгоновый альдегид
Жиры, образованные насыщенными жирными кислотами, при
окислении образуют кетоны.
____________25_____________
ГЕТЕРОФУНКЦИОНАЛЬНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
К гетерофункциональным карбоновым кислотам относятся про-
изводные карбоновых кислот, в углеводородном радикале кото-
рых один или несколько атомов водорода замещены на другие
атомы или атомные группы: галоген, гидрокси группу, альдегид-
ную группу, кетонную группу, аминогруппу. Гетерофункциональ-
ные карбоновые кислоты — это бифункциональные соединения:
они обладают свойствами карбоновых кислот и свойствами того
класса органических соединений, который определяет замести-
тель в углеводородном радикале.
ГАЛОГЕНОКАРБОНОВЫЕ КИСЛОТЫ
Галогенокарбоновыми кислотами называют производные кар-
боновых кислот, молекулы которых в углеводородном радикале
содержат один или несколько атомов галогена.
По природе углеводородного радикала различают алифатиче-
ские, алициклические и ароматические галогенокарбоновые кислоты.
Алифатические галогенокарбоновые кислоты по взаимному рас-
положению атома галогена и карбоксильной группы делятся на
а-, Р-, у-, 5-кислоты и т. д.
Например:
а Ра ура
Н3С—СН—СООН Н,С—СН,—СООН Н,С—сн,—сн,—соон
ос-хлорпропионовая
кислота,
2-хлорпропановая
кислота
Р-хлорпропионовая
кислота,
3-хлорпропановая
кислота
у-хлормасляная
кислота,
4-хлорбутановая
кислота
Способы получения. 1. Действие галогенов на карбоновые кис-
лоты:
25. Гетерофункционал ьные карбоновые кислоты
313
СООН + НС1
В этом случае, как правило, получают а-галогеносодержащие
карбоновые кислоты.
2. Реакция Гелля—Фольгарда—Зелинского, Этот способ имеет
большое значение. Он заключается в действии галогена на пре-
дельные карбоновые кислоты в присутствии фосфора.
РВг3
(Вг2+Р)
-Н3РО3
бромангидрид
уксусной кислоты
Вг,
НОН
-НВг
Вг
бромуксусная
кислота
бромангидрид
бромуксусной
кислоты
Реакция Гелля—Фольгарда—Зелинского осуществляется зна-
чительно легче, чем в предыдущем случае. На первой стадии об-
разуется бромангидрид уксусной кислоты. Атом брома в силу своей
електроотрицательности в значительной степени усиливает
смещение электронной плотности от а-углеродного атома. Во-
дороды при а-углеродном атоме становятся более подвижны
и легко замещаются на галоген. Образовавшийся бромангидрид
бромуксусной кислоты при взаимодействии с водой образует бром-
уксусную кислоту.
3. Действие галогеноводородов на непредельные карбоновые кис-
лоты:
акриловая кислота
иН
р - бромпро п и оновая
кислота
314
Карбоновые кислоты
Реакция присоединения протекает против правила Марков-
никова.
Физические свойства. Галогенокарбоновые кислоты — это бес-
цветные жидкости или кристаллические вещества, хорошо раство-
римые в воде; с увеличением молекулярной массы растворимость
кислот в воде уменьшается.
Химические свойства. Галогенокарбоновые кислоты более силь-
ные кислоты, чем карбоновые. Введение галогенов в молекулу
увеличивает силу кислот.
уксусная
кислота
монохлоруксусная
кислота
CL
С1
трихлоруксусная
кислота
дихлоруксусная
кислота
Сила кислот зависит от величины дробного положительного
заряда на атоме углерода карбоксильной группы. А величина 5+
увеличивается с введением галогенов, которые обладают отрица-
тельным индуктивным эффектом. Например, трихлоруксусная
кислота по силе приравнивается к серной кислоте. Значит, сила
кислоты зависит от количества атомов галогена в углеродном ра-
дикале. Кроме того, сила кислоты зависит от положения галогена
в цепи. Поскольку индуктивное смещение эффективно на протя-
жении четырех-пяти о-связей, то а-галогенокарбоновые кислоты
более сильные, чем Р-, а р— сильнее, чем у-галогенокарбоновые
кислоты.
Для галогенокарбоновых кислот характерны реакции по кар-
боксильной группе и реакции с участием атома галогена.
По карбоксильной группе они образуют все функциональные
производные карбоновых кислот: соли, сложные эфиры, ангид-
риды, галогенангидриды, амиды и др.
Например:
25. Гетерофункционал ьные карбоновые кислоты
315
а-хлорпропионовая
кислота
NaOH
-Н-,0
•I*
SOC1,
-SO2; -HCI
С2Н5ОН; Н+; t
-н,о
Н,С—СН—COONa
ж I
он
натриевая соль
а- гидроксипропионовой кислоты
хлорангидрид
а-хлорпропионовой кислоты
С1
этиловый эфир
а-хлорпропионовой кислоты
Алифатические галогенокарбоновые кислоты, подобно гало-
геналканам, вступают в реакции замещения галогена по механиз-
му нуклеофильного замещения SN. Причем подвижность галогена
зависит от взаимного расположения галогена и карбоксильной
группы. Карбоксильная группа, как электроакцепторная группа,
увеличивает подвижность атома галогена в молекуле:
Больше всего галоген будет подвижен при а-углеродном атоме.
Подвижность атома галогена можно подтвердить целым рядом ре-
акций:
.0
СН,—СН—С^ + NaCI
| ^ОН
ОН
молочная кислота
СН3—СН—СООН
C-N
нитрил метилмалоновой кислоты,
а-цианопропионовая кислота
сн,—сн—coonh,
•л I
nh2
аммонийная соль
а-аминопропионовой кислоты
Галоген в (3-положении менее подвижен, а в у-положении влия-
ние карбоксильной группы практически не сказывается.
316
Карбоновые кислоты
Галогенокарбоновые кислоты находят широкое применение
для получения окси- и аминокислот, широко используются
в органическом синтезе лекарственных препаратов, например уре-
ид-сс-бромизовалериановой кислоты, или бромизовала (снотвор-
ный препарат).
ГИДРОКСИКИСЛОТЫ
(СПИРТОКИСЛ ОТЫ, ФЕНОЛОКИСЛ ОТЫ)
Гидроксикислоты — это производные карбоновых кислот,
в молекуле которых, помимо карбоксильной группы, содержится
одна или несколько гидроксильных групп. Для них вводятся поня-
тия основность и атомность. Основность определяется числом кар-
боксильных групп в молекуле, а атомность — общим числом гид-
роксильных групп, включая гидроксильную группу карбоксила.
Например:
сн2—с<
| ОН
он
гидроксиуксусная кислота
(одноосновная, двухатомная)
Для названия гидроксикислот наряду с заместительной номен-
клатурой широко применяются тривиальные названия. По замес-
тительной номенклатуре ИЮПАК за родоначальную структуру
принимается кислота, а положение гидроксильной группы в мо-
лекуле обозначают буквами греческого алфавита или цифрами.
По положению гидроксильной группы относительно карбо-
ксильной гидрокислоты делятся на а-, 0-, у-кислоты и т. д.
ОН
а-гидроксипропионовая кислота,
2-гидроксипропановая кислота,
молочная кислота
3 2 I^>0
сн,—сн,—cf
|Р « \он
он
Р-гидроксипропионовая кислота,
3-гидроксипропановая кислота
Способы получения. 1. Окисление гликолей. Для проведения этой
реакции берется такое количество окислителя, чтобы не затро-
нуть вторую гидроксильную группу.
25. Гетерофункциональные карбоновые кислоты
317
СН2ОН
СН2ОН
[О]
СН2ОН
гликолевый
альдегид
[О]
СН2ОН
гидроксиуксусная
кислота
2. Гидролиз галогенокарбоновых кислот
СН—СООН
С1
НОН; NaOH
ОН
гликолевая кислота
NaCl
Эти способы дают возможность получать а-, р-, у-, 5-оксикис -
лоты.
3. Омыление циангидринов альдегидов и кетонов
ОН
. H3c-i-^N
циангидрин уксусного альдегида,
нитрил молочной кислоты
ДЭ
* Н3С—СН—С^ + NH3
I ОН
ОН
молочная кислота
Обычно этим способом получают а-оксикислоты.
4. Восстановление кетонокислот
пировиноградная кислота
[Н]
ОН
молочная кислота
Физические свойства. Это вязкие бесцветные жидкости или
кристаллические вещества, хорошо растворимые в воде.
Химические свойства. Гидроксикислоты обладают более силь-
ными кислотными свойствами по сравнению с незамещенными
карбоновыми кислотами.
318
Карбоновые кислоты
Сила кислоты зависит от положения гидроксильной группы
в молекуле и уменьшается в следующем порядке: а>р>у>8,
то есть а-гидроксикарбоновые кислоты более сильные, чем (3-,
ар— сильнее, чем у-гидроксикарбоновые, и т. д.
НО—СН
-I
Со стороны гидроксильной группы проявляется -/-эффект.
За счет этого увеличивается заряд 8+ на углероде карбоксильной
группы. По мере удаления гидроксильной группы от карбоксиль-
ной снижается ее влияние, и сила кислоты уменьшается.
Оксикислоты образуют все производные по карбоксильной
группе и вступают в реакции с участием спиртового гидроксила.
Кто хорошо знает свойства спиртов и кислот, тот легко усвоит
свойства оксикислот. К примеру, по СООН-группе гидроксикис-
лоты образуют хлорангидриды, сложные эфиры, соли, ангидриды
И др.:
NaOH
ОН
натриевая соль
гликолевой кислоты
+ Н2О
CH3OH; Н+; t
метиловый эфир
гликолевой кислоты
CH3OH; Н+; t
-н,о
О—СН3
сн3
диметиловый эфир
гликолевой кислоты,
метиловый эфир
метоксиуксусной кислоты
2
В реакцию со спиртами прежде всего вступает карбоксильная
группа, и образуется сложный эфир, затем может вступить
и ОН-группа с образованием диэфира.
С участием гидроксильной группы гидроксикислоты алифа-
тического ряда вступают в реакции, характерные для спиртов:
25. Гетерофункциональные карбоновые кислоты
319
он
СН3СОС1
С—СГ + НС1
I х)н
ОСОСН1
ацетоксиуксусная кислота
НС1
ОН
он
С1
хлоруксусная кислота
[О]
2
он
глиоксалевая кислота
В результате взаимного влияния гидроксильной и карбоксиль-
ной групп появляются и новые свойства у оксикислот.
Специфические свойства оксикислот. 1. Отношение оксикислот
к нагреванию. Оксикислоты в зависимости от положения ОН-груп-
пы по-разному ведут себя при нагревании. Это позволяет отли-
чить а-, р-, у-оксикислоты и другие из этого ряда друг от друга:
а) а-гидроксикислоты
гликолевая кислота
лактид гликолевой кислоты
В случае а-оксикислот происходит взаимодействие между двумя
молекулами кислоты, при этом выделяются две молекулы воды,
и образуется циклический сложный эфир, который называется
лактидом}
б) р-гидроксикислоты
акриловая кислота
На сс-углеродном атоме электронная плотность уменьшается,
вследствие чего водород становится подвижен,— отщепляется мо-
320
Карбоновые кислоты
лекула воды и образуется непредельная кислота. Таким образом
р-оксикислоты образуют а,р-непредельные кислоты;
в) у-гидроксикислоты
но
сн2
о—
у-гидроксимасляная
кислота
лактон гидроксимасляной
кислоты
При нагревании у-гидрокси кислоты претерпевают внутримо-
лекулярную циклизацию с образованием циклических сложных
эфиров, которые называются лактонами.
2. Расщепление а-гидроксикислот, Для ос-оксикислот характерна
еще одна специфическая реакция. При действии концентриро-
ванной серной кислоты а-оксикислоты разлагаются с разрывом
С—С-связи:
СН3
он
H2SO4kohh.; > t
конц. H2SO4; > t
cot + н2о
В этих условиях, как правило, образуются муравьиная кислота
и соответствующий альдегид или кетон. Образовавшаяся муравьи-
ная кислота при действии концентрированной серной кислоты
и нагревании разлагается с выделением углерода (II) оксида и воды.
Эта реакция используется для определения а-гидрокси кислот.
Несколько слов о молочной кислоте, так как из а-гидрокси-
кислот она имеет наиболее важное значение.
Молочная кислота (а-оксипропионовая кислота)
Содержится в кислом молоке, откуда
СН3—СН—СООН и получила свое название. В промышлен-
I ности молочную кислоту получают молоч-
ОН нокислым брожением углеводов:
С6Н12О6 -* 2СН—СН—СООН
глюкоза
ОН
25. Гетерофункционал иные карбоновые кислоты
321
Получают молочную кислоту и при восстановлении пирови-
ноградной кислоты:
СН — С—СООН — СН3—СН—СООН
о он
В молекуле молочной кислоты содержится один асимметри-
ческий атом углерода. Поэтому она существует в виде двух опти-
ческих изомеров:
СООН
Н--------ОН
СН3
D(-)-молочная кислота
СООН
но---------н
сн,
£(+)-молочная кислота
Представителями двухосновных гидроксикислот являются яб-
лочная (оксиянтарная) кислота и винная (диоксиянтарная) кислота.
Яблочная кислота
СООН
*СНОН
Яблочная кислота — это двухосновная трехатомная
кислота. Молекула яблочной кислоты содержит один
асимметрический атом углерода, поэтому существует
в виде двух оптических изомеров и оптически неактив-
ной рацемической форме:
СООН
СООН
Н--------ОН
СН2СООН
Д(+)-яблочная кислота
СООН
но---------н
сн2соон
£(-)-яблочная кислота
В природе встречается L(—^-яблочная кислота.
СООН
I
*снон
I
*снон
СООН
Винная кислота
Винная кислота — двухосновная, четырехатомная.
Молекула винной кислоты содержит два асимметри-
ческих атома углерода и существует в виде трех стерео-
изомеров: D-винная кислота, £-винная кислота и ме-
зовинная кислота.
322
Карбоновые кислоты
СООН
н—он
но—н
СООН
D-винная кислота
СООН
но---Н
н—он
СООН
£-винная кислота
СООН
Н—-ЮН
н—он
СООН
мезовинная кислота
При хранении вина она выделяется в виде нерастворимой кис-
лой калиевой соли (калий виннокислый).
Лимонная кислота
СН2СООН
пн
с<
СООН
СН2СООН
Это четырехатомная, трехосновная кислота. От-
носится к а-гидроксикислотам. Как и все а-окси-
кислоты, лимонная кислота при нагревании с кон-
центрированной серной кислотой разлагается.
В этом случае выделяются муравьиная и ацетонди-
карбоновая кислоты; ацетондикарбоновая кислота
при нагревании декарбоксилируется с образовани-
ем ацетона:
СН2СООН
/ОН
с<
СООН
СН2СООН
КОНЦ.
H2SO4
> Г
КОНЦ.
H2SO4
СН2СООН
+ с=о -
СН2СООН
ацетонд икарбо новая
кислота
сн,
1 ь/
► 2CO,f + С=О
сн,
ацетон
cof + н.о
Соли лимонной кислоты называют цитратами. Лимонная кис-
лота так же, как и винная, относится к пищевым кислотам. На-
трия цитрат используют при консервировании крови.
ФЕНОЛОКИСЛОТЫ
Фенолокислотами называют производные аренкарбоновых кис-
лот, у которых один или несколько атомов водорода в аромати-
ческом ядре замещены на гидроксильную группу, то есть это со-
единения, которые содержат фенольную и карбоксильную группы.
Например:
25. Гетерофункционал ьные карбоновые кислоты
323
СООН
СООН
СООН
он
о-гидроксибензойная кислота, jw-гидроксибензойная
кислота
л-гидроксибензойная
кислота
салициловая кислота
3,4,5-тригидроксибензойная кислота,
галловая кислота
/Ч/он
2-гидроксикоричная
кислота
Даже если карбоксильная группа находится в боковой цепи,
но в молекуле содержится фенольный гидроксил,— это тоже фе-
нолокислоты.
Способы получения. 1. Сплавление сульфобензойных кислот со
щелочами:
NaOH; сплавл.
СООН
NaHSO3
2. Карбоксилирование фенолов углерода (IV) оксидом (реакция
Кольбе — Шмитта). Нагревание фенолов в щелочной среде с угле-
рода (IV) оксидом приводит к образованию салициловой кислоты:
• О—
_НС1
-КасГ
COONa
СООН
324
Карбоновые кислоты
Для двухатомных фенолов присоединение СО2 идет более
легко:
+ со2
он
р-резорциновая кислота
Физические свойства. Фенолоксикислоты — кристаллические
вещества, труднорастворимые в воде, перегоняются с водяным
паром. Они более сильные кислоты, чем бензойная, с железа (III)
хлоридом дают фиолетовое окрашивание.
Химические свойства. В химическом отношении это бифунк-
циональные соединения, обладают свойствами фенолов и карбо-
новых кислот.
о
NaHCO,
натрия салицилат
ОН
2NaOH
о
/^r-ONa
динатриевая соль
салициловой кислоты
2Н2О
В реакцию с натрия гидрокарбонатом вступает только карбо-
ксильная группа, и как следствие — образуется мононатриевая соль
салициловой кислоты, а при действии щелочей — динатриевая соль
салициловой кислоты.
Благодаря близости двух функциональных групп в молекуле
салициловая кислота, в отличие от своих изомеров, взаимодей-
ствует с меди (II) гидроксидом:
25. Гетерофункциональные карбоновые кислоты
325
+ Си(ОН)2
меди салицилат
С участием карбоксильной группы протекают реакции со спир-
тами, галогенирующими реагентами:
С2Н5ОН; н+
+ Н,0
4-
SOC1-,
о
\^''ОН
этилсалицилат
+ SO.t + HClt
хлорантидрид
салициловой кислоты
При взаимодействии салициловой кислоты с уксусным ангид-
ридом образуется ацетилсалициловая кислота:
(СН3СО)2О
соон
+ СНдСООН
Салициловая кислота по кислотным свойствам превосходит
бензойную кислоту, а также о- и л-гидроксибензойные кислоты.
Это можно объяснить тем, что происходит дополнительная ста-
326
Карбоновые кислоты
билизация салицилат-иона за счет образования внутримолекуляр-
ной водородной связи:
При нагревании салициловая кислота легко декарбоксили-
руется:
+ CO2t
Применение. Производные салициловой кислоты используются
в качестве анальгетических, жаропонижающих и противовоспа-
лительных средств.
Например:
натрия салицилат
^^.соосн,
м етилсал ицил ат
Х^соон
ацетилсалициловая кислота
(аспирин)
о-Оксикоричная кислота
Содержит в своей структуре непредельную связь, карбоксиль-
ную группу в боковой цепи и фенольный гидроксил.
Получают по реакции Перкина:
(СН3СО)2О; /;
CH3COONa
салициловый
альдегид
^^.СН=СН—СООН
о-Оксикоричная кислота
25. Гетерофункциональные карбоновые кислоты
327
Для о-гидроксикоричной кислоты известны два изомера цис-
и транс-.
/иранс-изомер
о-кумаровая кислота
цис-изомер
кумариновая кислота
Из полигидроксикарбоновых кислот отметим протокатехино-
вую и галловую кислоты.
Протокатехиновая кислота
(3,4-дигидроксибензойная кислота)
Протокатехиновая кислота — производное пи-
рокатехина. В реакции с железа (III) хлоридом дает
сине-зеленую окраску, входит в состав дубильных
веществ.
СООН
он
Галловая кислота
(3,4,5-тригидроксибензойная кислота)
Кислоту получают при гидролизе танина — СООН
это промышленный способ ее получения из J
дубильных веществ. С железа (III) хлоридом 6г^'ч'\2
дает сине-черное окрашивание. Щелочные
растворы галловой кислоты являются силь-
ными восстановителями: восстанавливают се- '
ребро из серебра нитрата, поэтому применя- он
ются как проявитель в фотографии. Галловая
кислота легко декарбоксилируется при нагревании:
СООН
+ CO2f
328
Карбоновые кислоты
ОКСОКИСЛОТЫ
К оксокислотам относятся альдегидо- и кетонокислоты. Уже
само название указывает на то, что в структуру соединений вхо-
дят карбоксильная и альдегидная или кетонная группы. В зависи-
мости от взаимного расположения функциональных групп разли-
чают а-, р-, у-оксокислоты и т. д.
Наиболее важными представителями альдегидо- и кетонокис-
лот являются:
Н—С—СООН
О
глиоксиловая кислота,
глиоксалевая кислота
СН,—С—СООН
fc* I
о
пировиноградная кислота,
2-оксопропановая кислота
СН3—С—СН— СООН
О
ацетоуксусная кислота,
3-оксобутановая кислота
Способы получения. Оксокислоты получают окислением гидро-
ксикислот. При окислении гидроксикислот, содержащих первич-
ный спиртовой гидроксил, образуются альдегидокислоты, а при
окислении гидроксикислот со вторичным спиртовым гидрокси-
лом образуются кетонокислоты:
,О
СН — СН—с^
I ^он
он
молочная кислота
[О]
пировиноградная кислота
Пировиноградную кислоту получают также из виноградной,
то есть из рацемической смеси винных кислот, при нагревании (от
греч. пирос — нагревание).
СООН
СНОН
СНОН
I
СООН
сн.он
СО2 + СНОН
СООН
глицериновая
кислота
СООН
Вначале происходит декарбоксилирование, и образуется гли-
цериновая кислота, которая теряет воду с образованием непре-
дельной оксикарбоновой кислоты как промежуточного соедине-
ния. В свободном состоянии такая кислота существовать не может.
25. Гетерофункциональные карбоновые кислоты
329
Согласно правилу Эльтекова, гидроксильная группа не может на-
ходиться при углероде с двойной связью в открытой цепи, так как
имеет место сопряжение неподеленной пары электронов атома
кислорода с л-электронами двойной связи. Атом водорода стано-
вится протонированным и переходит к атому углерода СН2-груп-
пы, при этом образуется пировиноградная кислота.
а-Оксикислоты легко декарбоксилируются в присутствии кон-
центрированной серной кислоты, превращаясь при этом в альде-
гиды:
СН3
пировиноградная кислота
Н,SO. конц. л .
-2—1—- сн,—с. + co,t
'll
Пировиноградная кислота применяется в синтезе гетероцик-
лов и целого ряда фармацевтических препаратов (атофан). Это
жидкость не очень приятного запаха.
Ацетоуксусная кислота относится к Р-оксокислотам, обладает
свойствами кетонов и свойствами карбоновых кислот.
р-кетомасляная кислота
Если сравнивать рКа пировиноградной кислоты и ацетоуксус-
ной, то следует отметить, что рХ^ пировиноградной кислоты выше,
чем ацетоуксусной. Это объясняется удаленностью С—О-группы
от СООН в ацетоуксусной кислоте.
Второе свойство этой кислоты — легкое декарбоксилирование:
Декарбоксилирование происходит уже при комнатной темпе-
ратуре или при незначительном нагревании. В отличие от кислот,
сложные эфиры р-кетонокислот являются устойчивыми соедине-
330
Карбоновые кислоты
ниями. Этиловый эфир р-кетомасляной кислоты называют ацето-
уксусным эфиром:
СН3
сн2—с
с
о
Ацетоуксусный эфир получают по реакции Кляйзена. Исход-
ным продуктом в этой реакции является этиловый эфир уксусной
кислоты. Катализирует этот процесс натрия алкоголят. Эта реак-
ция походит на альдольную конденсацию. Натрия этилат реаги-
рует с этиловым эфиром уксусной кислоты:
C,HsONa — Na+ + CJLO"
c2Hso-
Л)
C,HSOH + CH2—CZ
c OC2H
карбанион
Образовавшийся карбанион реагирует с молекулой сложного
эфира по карбэтоксильной группе:
анион, который стабилизируется
за счет отщепления этоксид-иона
Ацетоуксусный эфир — таутомерное соединение; для него ха-
рактерна кетоенольная таутомерия, которая обусловлена наличи-
ем подвижных атомов водорода метиленовой группы:
кетонная форма (93 %)
8-
енольная форма (7 %)
Между этими двумя формами устанавливается динамическое
(подвижное) равновесие. Кетонная форма более выгодна в энер-
гетическом отношении, и поэтому ее значительно больше.
25. Гетерофункционал ьные карбоновые кислоты
331
Наличие кетонной и енольной форм доказывается с помощью
химических реакций. Кетоформа ацетоуксусного эфира взаимо-
действует с гидроксиламином с образованием оксима; восстанав-
ливается водородом в момент выделения и дает другие реакции
кетонов:
NH,OH
сн3—с—сн
л
сн3—с—сн2—сг
II ^ОС2Н
N—ОН
оксим ацетоуксусного эфира
[Н]
Л)
сн,—сн—сн,—сГ
I ^ОС2Н
он
этиловый эфир
0-гидроксимасляной кислоты
Существование енольной формы доказывается образованием
красного окрашивания с FeCL, обесцвечиванием бромной воды:
В реакцию вступает енольная форма ацетоуксусного эфира.
Для ацетоуксусного эфира характерно два типа расщеплений:
кетонное и кислотное.
Кетонное расщепление протекает под влиянием разбавленных
кислот или щелочей. Называется кетонным, так как образуются
при этом кетоны:
СН
Н+ или ОН";
-С2Н5ОН
СН
с—chHcoojh 4^
о
В этих условиях происходит гидролиз по сложноэфирной груп-
пе, образуется ацетоуксусная кислота, которая декарбоксилирует-
ся с образованием ацетона.
Кислотное расщепление протекает под влиянием концентри-
рованных растворов щелочей.
332
Карбоновые кислоты
он
карбанион
2СН,СОО“ + С2Н5ОН
НОН; ОН’
ос,н5
Подвижность атомов водорода метиленовой группы позволяет
использовать ацетоуксусный эфир для получения различных ке-
тонов и карбоновых кислот через натриевое производное ацето-
уксусного эфира. Натрийацетоуксусный эфир получают действи-
ем металлического натрия или натрия этоксида непосредственно
на ацетоуксусный эфир. В реакцию вступает енольная форма
ацетоуксусного эфира. Например:
СН3
с=
I
он
C2H5O Na
сн3
с=сн—с
ONa
натрийацетоуксусный эфир
- сн3
метилацетоуксусный эфир
метилнатрийацетоуксусный эфир
I
- сн
I
NaOH конц.
кислотное
расщепление
сн3
НОН; Н+ или ОН~
кетонное
расщепление
сн-
сн3
Л)
cf + с2н5он
ONa
диметилацетоуксусный эфир
сн — с—сн—сн, + со? + С,Н5ОН
э
о сн3
25. Гетерофункциональные карбоновые кислоты
333
Таким образом, из ацетоуксусного эфира мы получили натри-
евую соль изомасляной кислоты и метилизопропилкетон.
Ацетоуксусный эфир широко применяется в синтезе многих
лекарственных препаратов.
АМИНОКИСЛОТЫ
Аминокислоты — это производные органических кислот, в мо-
лекуле которых один или несколько атомов водорода в радикале
замещены на группу NHr По положению NHj-группы отно-
сительно карбоксильной группы они делятся на а-, р-, у-амино-
кислоты и т. д.
СН2—СООН
nh2
аминоуксусная кислота,
глицин
Р а
СН,—СН—СООН
п
nh2
а-аминопропионовая кислота,
а-аланин
Р а
СН—СН—СООН
nh2
0-аминопропионовая кислота,
р-аланин
СН,—СН,—СН,—СООН
। X X х
nh2
у-аминомасляная кислота
Ароматические аминокислоты бензольного ряда рассматрива-
ют как производные бензойной кислоты:
СООН
NH2
л-аминобензойная кислота,
4-аминобензойная кислота
.^ГООН
"'nh2
Л*
антраниловая кислота,
о-аминобензойная кислота,
2-аминобензойная кислота
Способы получения. 1. Гидролиз белков. Таким способом полу-
чают 31 аминокислоту, в том числе 30 а-аминопропионовых кис-
лот и одну Р-аминопропионовую.
334
Карбоновые кислоты
2, Действие NH3 на галогенокарбоновые кислоты. В этом случае
добывают различные (а-, |3-, у-) аминокислоты в зависимости от
положения галогена.
3. Метод Зелинского—Стадникова. В процессе реакции обра-
зуется 2-аминопропанонитрил, который гидролизуется до амино-
кислоты:
nh4cn
ацетальдегид
Н2О + СН3—СН—( А
nh2
2-аминопропанонитрил
НОН; Н* или ОН
* СН — СН—СООН + NH3
NH,
а-аминопропионовая кислота
Этим способом получают только «-аминокислоты.
4. Присоединение NH3 к непредельным карбоновым кислотам.
Реакция присоединения протекает против правила Марковникова.
СН2=СН—СООН + SiH3
акриловая кислота
сн—сн—соон
nh2
Av
Р-аминопропионовая кислота
5. Восстановление нитробензойных кислот
СООН
NO2
[Н]
-н,о
Л*
СООН
nh2
л-нитробензойная кислота
л-аминобензойная кислота
В молекуле аминокислоты содержатся кислотный центр
—С^ -группа и основный центр —
^ОН
ЫН2-группа, поэтому
аминокислоты кристаллизуются из водных растворов в виде внут-
римолекулярных солей:
25. Гетерофункциональные карбоновые кислоты
335
R—CH
В химическом отношении аминокислоты обладают свойства-
ми карбоновых кислот и первичных аминов. Они взаимодейству-
ют и с кислотами, и со щелочами, то есть проявляют амфотерные
свойства:
NaOHr
СН3
сн-
nh2
HC1
ЛЭ
CH—CH—+ H2O
| XONa
NH2
натриевая соль ct-аланина
сн,—сн—с;
+ I он
NH,C1
хлороводородная соль а-аланина
Специфические свойства аминокислот. 1. Отношение к нагрева-
нию. В этом аминокислоты напоминают оксикислоты.
а-Аминокислоты образуют дикетопиперазин (межмолекуляр-
ный циклический диамид):
дикетопиперазин
Р-Аминокислоты при нагревании отщепляют аммиак и обра-
зуют непредельные кислоты:
сн,—сн,—с^ сн2=сн—СООН + NH3
v>ii акриловая кислота
nh2
у-Аминокислоты претерпевают внутримолекулярную дегидра-
тацию с образованием циклических амидов — лактамов:
336
Карбоновые кислоты
сн,
nh2
сн—сн2
сн2
сн — сн2
—NH---
у-лакггам
2. Для a-аминокислот характерно образование комплексных со-
единений с ионами меди (II).
СН2
NH,
СООН + Си2+
При этом образуется растворимый в воде устойчивый комп-
лекс интенсивно синего цвета. Только а-аминокислоты дают по-
добную синюю окраску.
Значение аминокислот заключается в том, что они являются
исходными веществами при построении белковых молекул.
В состав белка входит 31 аминокислота, из них 30 «-амино-
кислот и одна р-амино кислота.
Отметим некоторые из аминокислот.
Гликоколл (глицин, аминоуксусная кислота)
Относится к «-аминокислотам.
СН2—СООН
I *
NH,
Аланин (а-аминопропионовая кислота)
Различают а- и Р-аланины, которые входят в состав белка:
а-аминопропионовая кислота,
а-аланин
сн2
I №
NH2
сн2—с
он
p-аминопропионовая кислота,
р-аланин
Молекула а-аланина содержит асимметричный атом углерода
и существует в виде пары энантиомеров.
25, Гетерофункциональные карбоновые кислоты
337
СООН
СООН
nh2
h2n
сн.
сн3
D-аланин
Т-аланин
В построении молекулы белка принимает участие только
£-аланин.
у-Аминомасляная кислота (ГАМК)
ГАМК содержится в клетках мозга и участвует в процессах
торможения.
сн,—сн,—сн,—с
nh2
Полипептиды
Полипептиды — это продукты конденсации аминокислот. По
количеству остатков аминокислот различают ди-, три- и поли-
пептиды.
СН2—С
I "
он
hnhch2cooh
-НЮ
СН—С—NH—СН—СООН
nh2
2 глицил-глицин (гли-гли)
дипептид
Полипептиды — соединения нейтрального характера. Харак-
терной реакцией на полипептиды является реакция гидролиза,
в результате чего образуются аминокислоты.
Когда говорят о полипептидах, то имеют в виду высокомоле-
кулярные соединения, содержащие большое количество пептид-
ных связей.
ПРОИЗВОДНЫЕ УГОЛЬНОЙ кислоты
^о
Угольная кислота Н—О—С^ в свободном состоянии
"ОН
не существует, разлагается на СО2 и Н2О. Как двухосновная кис-
лота она может образовывать ряд функциональных производ-
ных: неполные и полные галогенангидриды, сложные эфиры, ами-
ды и др.
ХЛОРАНГИДРИДЫ
НО—-С—С1
о
О
С1
дихлорангидрид
угольной кислоты,
фосген
монохлорангидрид
угольной кислоты,
хлоругольная кислота
Фосген — полный хлорангидрид угольной кислоты, в перево-
де означает — рожденный светом. Получают при смешивании га-
зов углерода (II) оксида и хлора. Реакция идет только при облуче-
нии УФ-светом:
СО + С12 -------
Фосген — это газ удушающего действия с fKiin = 7,8 °C, облада-
ет запахом свежепрелого сена. Его пары тяжелее воздуха, раздра-
жающе действуют на легкие, вызывая отек.
Химические свойства. 1, Взаимодействие с Н2О. Как хлоран-
гидрид легко разлагается водой с образованием угольной и хло-
роводородной кислот.
СГ
"Х=Ю + нон
сг
но.
/С=О + 2НС1
НО |
н2о + со21
26. Производные угольной кислоты
339
2, Взаимодействие с аммиаком
СГ
JC=O + 2NH3
Cl
Н2ЬГ
^С=О + 2НС1
нХ
мочевина — полный амид
угольной кислоты
3. Взаимодействие со спиртами
СГ
JC=O + 2С2Н5ОН
СГ
С2Н5О.
/С=О + 2НС1
С2Н5О
диэтиловый эфир
угольной кислоты,
диэтил карбонат
АМИДЫ УГОЛЬНОЙ кислоты
Неполный амид угольной кислоты называется карбаминовой
кислотой:
ОН
Карбаминовая кислота нестойкая и не встречается в свобод-
ном состоянии, так как легко разлагается при комнатной темпе-
ратуре:
X)
H2N—----------- COJ + NH3t
Х)Н
Производные карбаминовой кислоты тоже легко разлагаются.
Нагревание карбаминовокислого аммония ведет к разложению
его до мочевины и Н9О:
h2n—с—onh4
о
!-+ h2n—с— nh2 + Н2О
о
Эфиры карбаминовой кислоты называются уретанами. Общая
формула уретанов:
H2N—С—OR
О
340
Карбоновые кислоты
Получают их из фосгена и соответствующего спирта с после-
дующим действием аммиака:
+ С2Н5ОН
или из диэтилового эфира угольной кислоты — реакцией с амми-
аком:
С2Н5О.
/С=О + NH3
С2Н5О
+ С2Н5ОН
Уретаны — вещества с четкими температурами плавления
и служат для идентификации спиртов. Находят применение как
снотворные препараты.
Мочевина
Мочевина — диамид угольной кислоты:
h2n—с—nh2
II *
о
Мочевина является конечным продуктом распада белков. Она
имеет большое биохимическое значение.
Впервые мочевина была получена Велером в 1828 году из ам-
монийной соли циановой кислоты:
NH4d--C=N —- h2n— с—nh2
I I
о
В промышленности мочевину получают из СО? и NH •
Jw J
СО, + 3NH, ><>р» H2N—с— NH, + Н2О
О
Мочевина — это бесцветное кристаллическое вещество, хоро-
шо растворимое в воде, нейтрального характера.
Химические свойства. Z. Взаимодействие мочевины с кисло-
тами. Протонирование мочевины происходит по атому кисло-
рода, поскольку основность групп —NH2 значительно понижена
в результате сопряжения:
26. Производные угольной кислоты
341
5+ j-..
С—NH
+ HNO3
h2n
с— nh2
он
NO3
нитрат мочевины
2
2. Гидролиз мочевины. Мочевина при нагревании легко гидро-
лизуется водой или водными растворами кислот и щелочей.
i
H2N. I
/С=О + 2Н2О ------- 2NH3t + CO2t
H2N
3. Взаимодействие с азотистой кислотой. При взаимодействии
с азотистой кислотой мочевина разлагается с выделением азота,
углерода (IV) оксида и воды:
2НО
НО—N=N—С—N=N—ОН
НО—С—ОН + 2NJ
CO2t + Н2О
4. Отношение мочевины к нагреванию. При нагревании моче-
вины образуется биурет.
О
NH2
h2n
С—NH—С—NH, + NHJ
II II
О биурет О
Биурет хорошо растворяется в воде.
Дальнейшее нагревание приводит к образованию циануровой
кислоты:
ОН
циануровая кислота
342
Карбоновые кислоты
Циануровая кислота не растворяется в воде, с раствором CuSO4
в присутствии NH3 образует комплексное соединение, окрашен-
ное в сиреневый цвет.
5. Мочевина взаимодействует с ацилирующими реагентами
с образованием ацилмочевины. N-Ацильные производные мочеви-
ны называются уреидами.
-нсГ
.О
сн3-сС
^NH—С—NH2
О
уреид уксусной кислоты
Мочевина и ее производные широко используются в синтезе
лекарственных препаратов.
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклическими соединениями называют большую группу
органических соединений циклического строения, циклы кото-
рых содержат в своем составе, кроме атомов углерода, атомы дру-
гих элементов. Эти атомы называют гетероатомами (от древне-
греческого гетерос — иной, другой).
Гетероатомами могут быть многие элементы, но особый инте-
рес представляют гетероциклы с атомами кислорода, азота, серы.
Гетероциклические соединения имеют чрезвычайно важное зна-
чение: они входят в состав витаминов, хлорофилла, гемоглобина,
нуклеиновых кислот, пигментов, алкалоидов и др. Более полови-
ны лекарственных препаратов как растительного, так и синтети-
ческого происхождения содержат в своей структуре гетероцикли-
ческие фрагменты.
Классификация гетероциклов. В основе классификации гете-
роциклов лежат различные признаки:
— величина цикла;
— природа гетероатома;
— количество гетероатомов;
— степень насыщенности гетероцикла.
В особую группу выделяют конденсированные гетероциклы.
Первичным в классификации гетероциклов является размер
цикла, который определяется количеством атомов, входящих
в цикл.
По величине цикла различают трех-, четырех-, пяти-, шести-,
семичленные гетероциклы.
азиридин
азетидин
пиррол
пиридин
344
Гетероциклические соединения
По природе гетероатомов выделяют кислород-, азот-, серо-
содержащие гетероциклы:
фуран
N S
пиррол тиофен
По количеству гетероатомов различают гетероциклы, содер-
жащие один, два, три и более гетероатомов.
фуран
оксазол
оксадиазол
По степени насыщенности гетероциклы делятся на насыщен-
ные, ненасыщенные и ароматические'.
пиридин
(ароматический)
тетрагидрофуран
(насыщенный)
пирролин
(ненасыщенный)
Примерами конденсированных гетероциклических соединений яв-
ляются хинолин, пурин и др.
хинолин
Номенклатура гетероциклов. Для гетероциклических соедине-
ний, используют тривиальные и систематические названия. Три-
виальные названия допускаются номенклатурой ИЮПАК и явля-
ются наиболее употребительными.
В систематических названиях гетероциклов отражают приро-
ду, количество и положение гетероатомов, размер и степень на-
сыщенности цикла.
27. Трех- и четырехчленные гетероциклические соединения с одним гетероатомом 345
В названии выделяют префикс, корень и суффикс. В префик-
се отражают природу и количество гетероатомов, в корне — раз-
мер цикла, а степень насыщенности — в суффиксе. Для обозначе-
ния гетероатомов используют префиксы окса- (кислород), тиа-
(сера) и аза- (азот).
Размер цикла обозначается корнями -ир- (трех-), -ет- (четы-
рех-), -ол- (пяти-), -ин- (шести-), -еп- (семичленный), а степень
насыщенности — суффиксами -идин (насыщенный цикл с атомом
азота), -ан (насыщенный гетероцикл без атома азота), -ин (нена-
сыщенный цикл).
Для частично восстановленных соединений используют при-
ставки дигидро-, тетрагидро- с указанием номеров атомов, к кото-
рым присоединен водород. Если атом водорода присоединен только
к одному атому цикла, то в названии указывается номер гидриро-
ванного атома и буква Н. В шести- и семичленных азотсодержащих
гетероциклах полная насыщенность цикла обозначается пристав-
кой пергидро-. Количество гетероатомов одного вида указывается
в названии с помощью множительных приставок ди-, три-, тетра-
и т. д. При наличии в молекуле гетероцикла различных гетероато-
мов их нумерация определяется старшинством: О > S > NH > N.
При составлении названий делается ряд упрощений. Например:
оксиран
окса
префикс
ир
корень
ан
суффикс
ТРЕХ- И ЧЕТЫРЕХЧЛЕННЫЕ
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ОДНИМ ГЕТЕРОАТОМОМ
Большой практический интерес для фармации представляют
трех- и четырехчленные кислород- и азотсодержащие гетероциклы:
NH
оксиран
оксетан
азиридин
азетидин
346
Гетероциклические соединения
ОКСИРАН И ОКСЕТАН
оксиран,
этиленоксид,
эпоксиэтан
оксетан
Оксиран — бесцветный, очень ядовитый газ с эфирным запа-
хом, Гкип = 10,7 °C. Хорошо растворим в воде и органических рас-
творителях.
Оксетан - жидкость с /кип = 47,8 °C. Хорошо растворяется
в воде, этаноле и диэтиловом эфире.
Способы получения. 1. Циклизация $-галогеноспиртов под
действием концентрированных растворов щелочей (реакция Габ-
риэля) .
а
+ NaCl + Н2О
оксиран
+ NaOH
2-хлорэтанол,
p-хлорэтиловый спирт
Использование у-галогеноспиртов в условиях реакции Габ-
риэля позволяет получить оксетан и его производные:
а Р У
НГ Л^тт
z 11ч х—-'X
|__________L + NaOH
ОН_________C1I
3-хлорпропанол,
у-хлорпропиловый спирт
+ NaCl + Н2О
оксетан
Образование четырехчленного гетероцикла, в отличие от трех-
членного, протекает труднее из-за удаленности реакционных цен-
тров.
2. Окисление этилена кислородом воздуха при температуре 300—
400°С над серебряным катализатором (промышленный способ
получения оксирана).
Н2С
СН2 + О,
*₽ -Ь-
300-400 °C; Ag
Химические свойства. Оксиран и оксетан являются реакцион-
носпособными соединениями. Их рассматривают как произвол-
27. Трех- и четырехчленные гетероциклические соединения с одним гетероатомом 347
ные циклопропана и циклобутана, в молекулах которых одна груп-
пировка —СН2— замещена на гетероатом. Высокая реакционная
способность оксирана и оксетана обусловлена наличием углового
и торсионного напряжений (подобно малым циклоалканам)
и полярных связей С—О. Большинство реакций сопровождаются
раскрытием цикла по месту разрыва связи углерод-кислород
и протекают в условиях кислотного катализа.
/. Реакции, катализируемые кислотами. Оксиран легко про-
тонируется за счет неподеленной пары электронов гетероатома:
протонированный
оксиран
Образовавшийся протонированный оксиран гораздо легче под-
вергается действию нуклеофильных реагентов: 5+’ > 5+.
этандиол-1,2;
этиленгликоль
2-этоксиэтанол;
этилцеллозольв
ОН С1
2-хлорэтанол;
этиленхлоргвдрин
2. Реакции взаимодействия оксирана с сильными нуклеофилами
(аммиаком, аминами, металлорганическими соединениями).
Оксиран с аммиаком в зависимости от соотношения реаген-
тов образуют моно-, ди- и триэтаноламины:
nh3
НО—СН—СН2—NH2
этаноламин,
2-аминоэтанол
Н,С—СН2
НО—СН — СН2. ' у
\NH ---------
но—сн—сн2
диэтаноламин
Н2С—СН2
О
но—сн—сн2
но—сн,—chAn
Jr
но—сн— сн2
триэтаноламин
348
Гетероциклические соединения
Оксиран реагирует с алифатическими аминами с образовани-
ем N-алкиламиноэтанолов:
НО—СН—СН—NH—R
N - алкилам иноэта нол
3. Взаимодействие оксирана с реактивами Гриньяра. С магний -
органическими соединениями оксиран образует продукты присо-
единения, легко гидролизующиеся до спиртов.
СН3—MgBr
Н2С—СН2
НОН; Н+
-Mg(OH)Br
BrMgO СН3
пропанолятбромидмагний
- сн,—сн—сн,—он
пропанол-1
4. Полимеризация оксирана. Возможна в присутствии сильных
оснований с образованием полиэтиленоксида (полиэтиленгликоля):
основание
полиэтиленоксид
Полиэтиленоксид (ПЭО) содержит различное количество мо-
номерных звеньев и может иметь различные агрегатные состоя-
ния. ПЭО находит широкое применение в качестве вспомогатель-
ных веществ в приготовлении лекарственных форм (основы
мазей и суппозиториев, связывающие вещества в производстве
таблеток).
Оксетан по химическим свойствам сходен с оксираном. Мень-
шая степень напряжения в четырехчленном цикле оксетана спо-
собствует тому, что реакции присоединения с раскрытием цикла
протекают гораздо медленее. Многие реакции оксетана приводят
к образованию 1,3-дизамещенных пропана.
Оксиран, оксетан и их производные имеют широкое практи-
ческое применение. Оксиран обладает дезинфицирующим дей-
ствием, широко используется в промышленном органическом
синтезе (производство этиленгликоля, этаноламинов, эпоксидных
смол, растворителей, пластификаторов, эмульгаторов). Оксиран
и оксетан входят в состав антибиотиков.
27. Трех- и четырехчленные гетероциклические соединения с одним гетероатомом 349
АЗИРИДИН И АЗЕТИДИН
Н2С—СН2
NH
NH
азиридин,
этиленимин
Н2С—СН2
Н2С—NH
азетидин,
триметиленимин
NH
Азиридин — бесцветная жидкость с /кип = 55 °C. Хорошо рас-
творяется в воде и органических растворителях.
Азетидин — бесцветная жидкость с аммиачным запахом,
4ип = 63 °C. Хорошо растворяется в воде и спиртах.
Способы получения. 1, Циклизация галогенаминов в присутствии
щелочи (общий способ получения азиридина и азетидина).
а р
н,с—сн2
| т + NaOH
NH2C1
0-хлорэтиламин
н2с—сн—сн2
| Т + NaOH
NH2 Вг
у-бромпропиламин
+ NaCI + Н2О
азшшрин
азетидин
+ NaBr + Н2О
2. Взаимодействие 1,2-дихлорэтана с аммиаком в присутствии
кальция оксида СаО (промышленный способ получения).
Н2С—СН2
| | +NH3
Cl Cl
СаО
н2с—сн2
NH
+ СаС12 + Н2О
Химические свойства. Азиридин и азетидин по химическим
свойствам сходны с кислородсодержащими гетероциклами —
оксираном и оксетаном.
1. Реакции, сопровождающиеся раскрытием цикла. Азиридин
и азетидин вступают в реакции присоединения, протекающие по
месту разрыва связи углерод — азот.
NH3
RNH
нон
HCL
H2N—СН—СН—NH2
этандиамин-1,2
R—NH—СН—СН—NH2
N-алкилэтандиамин-1,2
но—сн—сн—nh2
2-аминоэтанол
С1— сн — сн— nh2
2-хлорэтанамин
350
Гетероциклические соединения
2. Реакции, протекающие с сохранением цикла. Азиридин
и азетидин представляют собой вторичные циклические амины
и вступают в реакции алкилирования, ацилирования и нитрози-
рования. Наличие неподеленной пары электронов на атоме азота
азиридина и азетидина обусловливает их основные свойства.
N—СН3
О
N—С—СН3
N—N=O
N-метил азиридин
N - ацетилазирид ин
N-нитрозоазиридин
азиридиния хлорид
Производные азиридина применяются в промышленности при
производстве пестицидов, инсектицидов, полимерных материа-
лов, компонентов ракетного топлива. В медицинской практике
производные азиридина нашли применение как эффективные про-
тивоопухолевые препараты (тиофосфамид и бензотэф).
Из производных азетидина важное значение имеет азетиди-
нон-2 (Р-лактам), входящий в состав антибиотиков группы пени-
циллина:
HN—С
___________________28_____________________
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ОДНИМ ГЕТЕРОАТОМОМ
Важнейшими представителями этой группы соединений явля-
ются пиррол, фуран и тиофен:
пиррол,
азол
фуран,
оксол
тиофен,
тиол
Названия одновалентных радикалов приведенных гетероцик-
лов образуют с помощью суффикса -ил, указывая цифрой или
буквой греческого алфавита положение свободной валентности:
сс-пиррил, р-пиррил,
2-пиррил 3-пиррил
а-фурил,
2-фурил
Р-фурил,
3-фурил
а-тиенил, р-тиенил,
2-тиенил 3-тиенил
Способы получения. В производстве химических веществ — со-
единений пятичленных гетероциклов с одим гетероатомом —
пользуются как общим способом получения для всех представи-
телей этой группы соединений, так и специфическими способами
для отдельных из них.
А. Общим способом получения пиррола, фурана и тиофена яв-
ляется циклизация 1,4-дикарбонилъных соединений (синтез Паале —
Кнорра). При действии на 1,4-дикарбонильные соединения водо-
отнимающих реагентов (концентрированной H2SO4, Р2О5) полу-
чают фуран и его производные, при использовании аммиака —
пиррол и его гомологи, фосфора пентасульфида P2S5 — тиофен
и его производные.
352
Гетероциклические соединения
Б. Специфические способы получения. /. Получение пиррола:
а) из природных источников путем перегонки каменноугольной
смолы, а также из богатых белками материалов (костей, костного
мозга ит. п.);
б) синтетическим путем при нагревании диаммонийной соли
слизевой кислоты:
н н
НО. I I‘он
н —с н
/с/ сС
h4nooc V 7 coonh4
он но
__________£________
-2CO2; -4H2O; -NhJ"
пиррол
диаммонийная соль слизевой кислоты
в) при перегонке сукцинимида в присутствии цинковой пыли:
сукцинимид
+ 2ZnO
пиррол
2. Получение фурана:
а) в лабораторных условиях сухой перегонкой слизевой кислоты'.
слизевая кислота
дегидрослизевая кислота
28. Пятичленные гетероциклические соединения с одним гетероатомом
353
2
СООН
пирослизевая кислота
фуран
б) в промышленности фуран получают из альдопентоз, кото-
рые при нагревании с водоотнимающими средствами подверга-
ются внутримолекулярной дегидратации.
Образовавшийся фурфурол окисляют до пирослизевой кис-
лоты, термическое декарбоксилирование которой приводит к фу-
рану:
пирослизевая кислота фуран
3. Получение тиофена. В промышленности тиофен получают
двумя методами:
а) при парофазной циклизации бутана с серой',
б) по реакции Чичибабина при пропускании смеси ацетилена
с сероводородом над катализатором А12О3:
700 °C
-3H2S
тиофен
[ai2o31;
400—500 °C
-Н2
НС сн
///
нс + сн
Физические свойства. Пиррол — бесцветная жидкость с запа-
хом, напоминающим запах хлороформа; /кип =130 °C; малораство-
рим в воде, хорошо растворим в этаноле и бензоле. На воздухе
темнеет и осмоляется.
Фуран — бесцветная жидкость со своеобразным запахом, на-
поминающим запах хлороформа; ^кип = 32 °C; нерастворим в воде,
хорошо растворяется в этаноле и диэтиловом эфире.
354
Гетероциклические соединения
Тиофен — бесцветная жидкость со слабым запахом сернистых
соединений; Гкип = 84 °C; нерастворим в воде, хорошо растворим
в этаноле, эфире и бензоле. Устойчив к высокой температуре.
Окисляется на свету.
Химические свойства. Ароматичность пятичленных гетеро-
циклов с двумя тг-связями обусловлена тем, что в сопряжение
с л-электронами двойных связей вступает неподеленная пара элек-
тронов гетероатомов О, N или S. Образуется замкнутая, сопря-
женная система, в которой число обобщенных электронов отве-
чает правилу Хюккеля (4л + 2).
В молекуле пиррола атомы углерода и атом азота находятся
в состоянии sp -гибридизации. За счет ^-гибридизированных ор-
биталей каждый атом, входящий в состав цикла, образует три о-свя-
зи, расположенные в плоскости кольца.
При этом у атомов углерода и атомов
азота остается по одной негибридизиро-
ванной /?-атомной орбитали, которые
расположены параллельно друг Другу
Н в плоскости, перпендикулярной плос-
кости кольца. Каждая из р-атомных
орбиталей атомов углерода имеет один
электрон, а на /j-орбитали атома азота на-
ходится неподеленная пара электронов. При перекрывании р-ор-
биталей образуется единый ароматический секстет, охватывающий
все атомы цикла.
Атом азота в sp2-гибридизации, имеющий электронную конфигу-
рацию, в которой неподеленная пара электронов занимает негибри-
дизированную р-атомную орбиталь, называется пиррольным.
По аналогии с пирролом гетероатом, вносящий в л-электрон-
ную систему два электрона, занимающих /?-АО, и образующий
с другими атомами только о-связи, называется гетероатомом пир-
рольного типа.
Реакционная способность пиррола, фурана и тиофена опреде-
ляется наличием в их структуре цикла с л-электроноизбыточной
ароматической системой (шесть л-электронов приходится на пять
атомов цикла). Степень ароматичности указанных гетероциклов
ниже, чем у бензола, и зависит от природы гетероатома. Тиофен по
своему химическому поведению в наибольшей степени напоминает
бензол. Фуран имеет наименее выраженный ароматический харак-
тер. В некоторых реакциях фуран ведет себя как ненасыщенное
28. Пятичленные гетероциклические соединения с одним гетероатомом
355
(диеновое) соединение. Пиррол занимает промежуточное поло-
жение.
Вследствие различной электроотрицательности гетероатома в
молекулах пиррола, фурана и тиофена, в отличие от бензола, элек-
тронная плотность распределена неравномерно. Следует отметить,
что на атомах углерода в a-положении электронная плотность
выше, чем в p-положении, что и определяет направленность про-
текания реакции электрофильного замещения.
А. Общие химические свойства пиррола,
фурана и тиофена.
1, Взаимодействие с минеральными кислотами. Фуран и пиррол
проявляют высокую реакционную способность в реакциях даже
с таким слабым электрофилом, как протон. В присутствии мине-
ральных кислот они подвергаются протонированию, которое осу-
ществляется преимущественно по a-положению. Процесс прото-
нирования сопровождается потерей ароматичности.
ф<
I. II.
где X = О; NH.
Образовавшиеся структуры (I) и (II) лишены ароматичности,
и в дальнейшем происходит либо разрыв цикла с образованием
полимера (наиболее вероятный процесс для фурана), либо поли-
меризация с сохранением цикла.
Присоединение протона может происходить и по гетероатому
с образованием фуроксониевых и пирролиевых солей с последу-
ющей их полимеризацией:
пирролиевый
катион
полимер
Таким образом, фуран и пиррол в присутствии минеральных
кислот осмоляются, образуя полимерные продукты темного цве-
та. Такое отношение к кислотам называется ацидофобностъю, от
латинского acidum — кислота и греческого фобос — страх.
Введение в фурановое и пиррольное кольца электроноакцеп-
торных заместителей (—NO2, —СООН, —СОН и др.) приводит
к снижению ацидофобности.
356
Гетероциклические соединения
Тиофен из-за своей жесткой ароматической структуры не об-
ладает ацидофобностыо. Это связано со способностью атома серы
в данных условиях изменять свою гибридизацию и неспособнос-
тью образовывать сульфониевые соли.
2. Реакции электрофильного замещения SE. Как отмечалось ранее,
электронная плотность в молекулах фурана, пиррола и тиофена рас-
пределена неравномерно, что связано с наличием и природой
гетероатома. Пара электронов гетероатома сопряжена с я-электро-
нами кольца, электронная плотность на гетероатоме понижается,
а в а-положениях — повышена (аналогично влиянию донорных за-
местителей в од/ло-положен иях аренов).
В первую очередь замещается атом водорода при а-углерод-
ном атоме; если это положение занято, то замещение протекает
по р~положению. Такая направленность замещения обусловлена
тем, что при участии а-углеродных атомов образуется более ус-
тойчивый о-комплекс, благодаря большей возможности для дело-
кализации положительного заряда.
атака
а-положения
х = о, s, NH
атака
Р-положения
Сульфирование, При проведении реакций необходимо пом-
нить об ацидофобности и высокой реакционной способности фу-
рана и пиррола.
Для сульфирования фурана и пиррола используют мягкий суль-
фирующий реагент — пиридинсульфотриоксид:
X = О; NH
пиридин-
сульфотриоксид
фуран-2-сульфокислота (X = О);
пиррол-2-сульфокислота (X - NH)
пиридин
Пиридинсульфотри оке ид не обладает кислотными свойства-
ми, но сохраняет сульфирующее действие.
28. Пятичленные гетероциклические соединения с одним гетероатомом
357
Тиофен легко сульфируется концентрированной серной кис-
лотой на холоде:
тиофен
конц. H2SO4
SO3H
Н2О
ти офе н - 2-сульфокисл ота
Нитрование. Нитрование фурана, пиррола и тиофена прово-
дят ацетилнитратом — продуктом взаимодействия азотной кисло-
ты с уксусным ангидридом:
+ hono2
сн3—
о—no2
сн.соон
ацетилнитрат
X = О; S; NH
сн3—cf° —- / V + сн3соон
О—NO2 Ххх N°2
2-нитрофуран (X = О);
2-нитропиррол (X = NH);
2-нитротиофен (X = S)
Нитрование тиофена можно проводить концентрированной
азотной кислотой, однако предпочтение отдают ацетилнитрату.
Ацилирование. При ацилировании ацидофобных гетероциклов
в качестве ацилирующих реагентов используют ангидриды карбо-
новых кислот в присутствии катализаторов — кислот Льюиса (олова
тетрахлорид, цинка хлорид и др.). Тиофен ацилируют хлорангид-
ридами карбоновых кислот в присутствии катализатора — алюми-
ния хлорида А1С1 •
J
(СН3СО)2О
X = О; NH
о + СН3СООН
2-ацетиллиррол (X - NH)
СН
+ СН.СООС1
А1С13
2-ацетилфуран (X = О);
+ НС1
2-ацетилтиофен
358
Гетероциклические соединения
Галогенирование. Прямое галогенирование фурана и пиррола
протекает очень бурно, реакция поддается контролю с трудом
и может привести к разрушению гетероциклических ядер.
Галогенирование осуществляют с помощью сульфурил хлорида
SO2C12. Происходит постепенное замещение атомов водорода
на галогены.
X = О; NH
2-хлорпиррол
(X = NH);
2-хлорфуран
(Х = О)
2,5 -дихлорпиррол
(X = NH);
2,5 -дихлорфуран
(Х = О)
тетрахлорпиррол
(X = NH);
тетрахлорфуран
(Х = О)
Тиофен галогенируется на холоде непосредственным дейст-
вием галогена (хлора или брома). Образуются моно-, ди-, три-
и тетразамещенные производные тиофена:
тиофен
2-хлортиофен
2,5-дихлортиофен
тетрахлортиофен
Ракция с йодом протекает медленно в присутствии катализа-
тора HgO.
3. Реакции присоединения. Для пятичленных гетероциклов ре-
акции присоединения менее характерны, чем реакции электро-
фильного замещения. Рассмотрим реакции восстановления, окис-
ления и диеновый синтез.
Реакции восстановления. Восстановление фурана происходит
при высоких температуре (140 °C) и давлении 10—15 МПа (100—
150 атм) в присутствии катализатора (никеля Ренея, палладия).
фуран
Ni
тетрагидрофуран
(оксолан)
Восстановление тиофена происходит легко при комнатной тем-
пературе и давлении в присутствии катализатора — палладия.
28. Пятичленные гетероциклические соединения с одним гетероатомом
359
тиофен
тетрагидротиофен
Частичное восстановление пиррола с образованием 2,5-дигид-
ропиррола (пирролина) происходит при действии цинка в уксус-
ной кислоте (водородом в момент выделения). Полное восстанов-
ление пиррольного цикла до тетрагидропиррола (пирролидина)
осуществляют в условиях каталитического гидрирования над пла-
тиновым или палладиевым катализатором.
пирролин
[Н]; Zn + CH3COOH
2H2; Pt
пирролидин
Реакции окисления. Фуран и пиррол чрезвычайно чувствитель-
ны к действию окислителей, они легко окисляются даже кисло-
родом воздуха. В зависимости от условий окисление может про-
ходить с разрывом гетероциклического ядра и образованием
пиррольных и фурановых полимерных смол. Пропускание смеси
фурана с воздухом над катализатором V2O5 при температуре 320 °C
приводит к образованию малеинового ангидрида:
фуран
[О];у2о5
малеиновый ангидрид
При окислении пиррола хромовой кислотой образуется имид
малеиновой кислоты.
пиррол
[О]; Н2Сг2О4
малеинимид
Тиофен окисляется с большим трудом.
Диеновый синтез. Занимая промежуточное положение между
ароматическими соединениями и 1,3-диенами, фуран вступает
в характерную для сопряженных диенов реакцию Дильса — Аль-
дера:
360
Гетероциклические соединения
фуран малеиновый ангидрид
диенофила
1,2,3,6-тетрагидро-3,6-
эпоксифталевый ангидрид
4. Взаимные превращения пятичленных гетероциклов с одним
гетероатомом. Советский химик-органик Ю. К. Юрьев в 1936 году,
учитывая высокую реакционную способность гетероциклов, по-
казал возможность взаимных превращений фурана, пиррола
и тиофена. Реакцию проводят при температуре 450 °C в присут-
ствии катализатора А1,0 •
5, Методы идентификации пятичленных гетероциклов с одним
гетероатомом. Для обнаружения фурана и пиррола применяют
очень простой и доступный метод — окрашивание сосновой лучины.
сосновая лучина, смоченная хлороводородной кислотой и фура-
ном, окрашивается в интенсивно-зеленый цвет; в парах пиррола
она приобретает ярко-красную окраску.
Тиофен открывают индофениновой пробой: смесь изатина с кон-
центрированной серной кислотой в присутствии даже следов
тиофена окрашивается в синий цвет.
Б. Специфические химические свойства пиррола. Пиррол отно-
сится к природным соединениям. Это бесцветная жидкость с тем-
пературой кипения 130 °C, малорастворимая в воде.
Отметим свойства, характерные для пиррола и не отмеченные
в общей характеристике реакционной способности пятичленных
гетероциклов.
1. Кислотно-основные свойства пиррола и продуктов его вос-
становления, которые не свойственны фурану и тиофену.
28. Пятичленные гетероциклические соединения с одним гетероатомом
361
пиррол проявляет
слабокислые свойства
пирролин проявляет свойства
непредельных соединений
и вторичных аминов
пирролидин проявляет
свойства вторичных
циклических аминов
Пиррол — слабая NH-кислота (рК= 17,5), пара электронов
атома азота вступает в сопряжение с тс-электронами, что приво-
дит к поляризации NH-связи и увеличению подвижности атома
водорода.
пиррил магния йодид
2. Соли пиррола являются реакционноспособными веществами
и широко применяются в органическом синтезе для введения в мо-
лекулу пиррола алкильных, арильных и ацильных заместителей.
Направление реакции зависит от температурного режима:
N -ацетилпиррол
2-метилпиррол
2 - ацетил пиррол
362
Гетероциклические соединения
3. В условиях реакции Кольбе — Шмитта натрия пирролид кар-
боксилируется углерода (IV) оксидом'.
натрия пирролид
натриевая соль
пиррол-2-карбоновой кислоты
СООН
пиррол-2-карбоновая
кислота
4, Натрия пирролид формилируется в условиях реакции Райме-
ра — Тимана'.
+ СНС13 + NaOH
натрия пирролид
2-формилпиррол
+ Н,О + NaCl
5. И, наконец, еще одна особенность — пиррол вступает в ре-
акцию азосочетания.
[C6H~№N] Cl-
пиррол бензолдиазония хлорид
+ НС1
бензолазопиррол
ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ
С ОДНИМ ГЕТЕРОАТОМОМ
ПРОИЗВОДНЫЕ ФУРАНА
Тетрагидрофуран (ТГФ, оксолан)
ТГФ — это жидкость с - 60 °C, хорошо растворяется
в воде, имеет приятный запах. По химическим свойствам
он напоминает простые эфиры.
Широко применяется как растворитель в магнийор-
ганическом синтезе.
28. Пятичленные гетероциклические соединения с одним гетероатомом
363
Фурфурол (фуран-2-карбальдегид)
Фурфурол представляет собой бесцветную
q жидкость с ?кип =162 °C. На воздухе быстро тем-
неет в результате окисления.
^Н Впервые он был выделен из отрубей, назва-
ние происходит от латинского furfur — отруби.
В промышленности фурфурол получают путем кислотного гид-
ролиза полисахаридов, в частности пентозанов, содержащихся
в соломе, кукурузных початках, шелухе подсолнечника, хлопко-
вых коробочках и др.
альдопентоза
Н+; t
-ЗНЮ
♦
фурфурол
Качественная реакция на фурфурол: образование красного окра-
шивания с анилином в среде уксусной кислоты.
Химические свойства. 1. Реакции по альдегидной группе:
СУ-
О
СН2ОН +
фурфуриловый спирт пирослизевая кислота
г—. ОН
C~SO3Na
N—ОН
гилросульфитное
производное
фурфурола
фурфурола оксим
364
Гетероциклические соединения
2. Реакции по фурановому кольцу. Фурфурол легко вступает
в реакции SE (преимущественно по положению 5). Поскольку
нельзя провести нитрование непосредственным действием кон-
центрированной азотной кислоты, используют концентрирован-
ную азотную кислоту в среде уксусного ангидрида:
(trvndwn пл пия петят
5-нитрофурфуролдиацетат 5-нитрофурфурол
Введение двух ацетильных остатков, обладающих электроак-
цепторными свойствами, увеличивает устойчивость фурфурола
в кислой среде.
Фурфурол применяется как исходный продукт в производстве
ряда медицинских препаратов: фурацилина, фурадонина, фуразо-
л ид она и др.
о
5-нитрофурфурол фурацилин,
5-нитрофурфурола семикарбазон
фурадонин,
1 -^-<5-нитрофурфурилиден)амино] -
гидантоин
фуразолидон,
3-[М-(5-нитрофурфурилиден)амино]-
оксазолидон-2
28. Пятичленные гетероциклические соединения с одним гетероатомом
365
Препараты нитрофуранового ряда обладают высокой антибак-
териальной активностью. Особенно ценным их свойством являет-
ся способность проявлять эффект против устойчивых к сульфа-
ниламидам и антибиотикам форм возбудителей.
ПРОИЗВОДНЫЕ ПИРРОЛА
Соединения, содержащие пиррольные ядра, синтезируются
в процессе жизнедеятельности животных и растений. Важное зна-
чение имеют относящиеся к а-аминокислотам гетероцикличе-
ского ряда пролин и оксипролин. Они содержат в своей структуре
пирролидиновое кольцо.
пролин,
пирролидин-
2-карбоновая кислота
оксипролин,
4-гидроксипирролидин-
2-карбоновая кислота
Производные пиррола входят в состав полимеров, используе-
мых в медицинской и фармацевтической промышленности (пир-
ролидон-2, поливинилпирролидон):
у-бутиролактон пирролидон-2 у-аминомасляная
кислота
пирролидон-2 Х-винилпирролидон-2 поливинилпирролидон,
ПВП
Низкомолекулярный ПВП, молекулярная масса полимера
12 000—13 000, образует коллоидные растворы в воде и применя-
ется для изготовления кровезаменителя «Гемодез»; среднемолеку-
лярный ПВП (35 000—40 000) используют в фармации как связы-
вающее средство в производстве пилюль и таблеток.
366
Гетероциклические соединения
Сополимеризацией акриламида,
винилпирролидона и этилакрилата
получают биорастворимый полимер
для глазных пленок, обеспечивающих
продолжительное действие лекар-
ственных веществ.
Продолжая рассматривать боль-
шую значимость производных пир-
рола, отметим структуру порфина, со-
стоящую из четырех пиррольных
колец, соединенных между собой ме-
тановыми группами. Структура порфина входит в состав таких
производных соединений, как гемоглобин и хлорофилл. В сво-
бодном состоянии в природе порфин не встречается, но широко
представлены его производные, которые называют порфиринами.
ПРОИЗВОДНЫЕ ТИОФЕНА
О
Находят широкое практическое при-
менение в производстве красителей,
пластмасс, инсектицидов.
Витамин Н (биотин) содержит в сво-
ей структуре гидрированный тиофен.
КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СИСТЕМЫ С ОДНИМ ГЕТЕРОАТОМОМ
Кумарон (бензо(/>]фуран) — система, состоящая из бензола
и фурана.
кумарон, бензо [Z>] фуран
Кумарон — жидкость с Гкип =174 °C, встречается в каменно-
угольной смоле. Кумарон легко полимеризуется, применяется для
приготовления лаков.
28. Пятичленные гетероциклические соединения с одним гетероатомом
367
Индол (бензо [#]пиррол) — конденсированная гетероцикличе-
ская система, состоящая из бензольного и пиррольного колец.
индол, бензо[6]пиррол
Индол — кристаллическое вещество с /ПЛ=-52°С, обладает
неприятным запахом. Содержится в выделениях человека как
продукт белкового обмена. В малых концентрациях имеет прият-
ный запах и применяется в парфюмерии (масло жасмина).
Способы получения. 1, Индол может быть выделен в чистом
виде из каменноугольной смолы (до 3—5 %).
2. Циклизация N-формил-о-толуидина. Относится к реакциям
конденсации кротонового типа, осуществляется в присутствии
сильного основания:
N -формил-о-толуидин
NaNH2
3. Реакция Чичибабина (конденсация анилина с ацетиленом):
4. Перегруппировка фенилгидразонов альдегидов или кетонов аро-
матического ряда в присутствии кислотного катализатора (метод
Фишера). Используют для получения гомологов индола с алкиль-
ными заместителями в пиррольном ядре.
2-метилиндол
ацетона фенилгидразон
368
Гетероциклические соединения
Химические свойства. Индол является ароматическим соедине-
нием. По химическим свойствам он напоминает пиррол. Ацидофо-
бен, под действием минеральных кислот осмоляется. Подобно
пирролу индол является слабой NH-кислотой, реагирует с сильны-
ми основаниями (щелочными металлами, щелочами, алкоксидами
металлов, магнийорганическими соединениями):
и идол калий
индол
индолмагния йодид
Индол вступает в реакции электрофильного замещения SE.
В отличие от пиррола реакции SE для индола протекают по
P-положению. Это объясняется преимущественным образовани-
ем более устойчивого о-комплекса. Образовавшийся о-комплекс
по p-положению энергетически более выгоден, так как сохраня-
ется ароматичность бензольного ядра. В другом случае аромати-
ческий характер бензольного кольца нарушен, следовательно, энер-
гетический запас молекулы существенно возрастает, что и обу-
словливает нестойкость такой частицы:
28. Пятичленные гетероциклические соединения с одним гетероатомом
369
Индол восстанавливают водородом в присутствии платины:
Н,: Pt
2,3 -дигидроиндол
ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ ИНДОЛА
Наибольший интерес представляют производные индола, об-
разующиеся в живом организме или применяющиеся в качестве
лекарственных препаратов.
Ивдоксил
(3-гидроксииидол; 3-оксоицдолин)
Индоксил — желтое кристаллическое вещество с сильным фе-
нольным запахом, = 85 °C. Существует в двух таутомерных фор-
мах — кетонной и енольной (кето-енольная таутомерия):
енольная форма
3-гидроксииндол
кетоформа
3-оксодигидроиндол
В промышленности индоксил получают при взаимодействии
анилина с натриевой солью хлоруксусной кислоты. Последующее
нагревание промежуточного продукта — натриевой соли N-фенил-
уксусной кислоты — с амидом натрия приводит к индоксилу.
ClCH,COONa
NaNH
180-200
натриевая соль
N-фениламиноуксусной кислоты
индоксил
анилин
Индоксил вступает в реакции, характерные для карбонильных
соединений. О наличии енольной формы (фенольного гидрокси-
370
Гетероциклические соединения
ла) свидетельствуют растворимость индоксила в щелочах, обра-
зование кристаллических солей со щелочными металлами и окра-
шенных комлексов с FeCl3.
Производные индоксила широко распространены в природе
в качестве метаболитов растительных и животных организмов.
Индоксил в щелочной среде легко окисляется кислородом воз-
духа до красителя индиго:
индоксил
индиго
Индиго
Индиго — темно-синее с медным отливом кристаллическое ве-
щество с = 390...392 °C (с разложением).
Это один из самых древних органических красителей. Харак-
теризуется яркой окраской, высокой светоустойчивостью. Был
известен еще древним египтянам и народам Индии (от португаль-
ского in digo — индийский), выделен из растений-индигоносов.
В настоящее время широкое распространение получил способ
получения индиго, основанный на взаимодействии анилина с натрие-
вой солью хлоруксусной кислоты с последующим окислением образо-
вавшегося индоксила кислородом воздуха (см. «Индоксил»).
Индиго синее легко восстанавливается глюкозой или натрия
тиосульфатом с образованием бесцветного лейкооснования — ин-
диго белого, которое в отличие от синего хорошо растворимо
в воде. На воздухе очень легко идет обратный процесс — индиго
белое окисляется до синего.
индиго синее
индиго белое
28. Пятичленные гетероциклические соединения с одним гетероатомом
371
Индиго синее имеет /дрш/с-строение, при таком расположе-
нии колец относительно двойной связи образуются ВВС между
карбонильными и NH-группами.
Сульфирование индиго приводит к образованию индигокарми-
на (динатриевая соль индиго-5,5'-дисульфокислоты).
NaO3S
SO3Na
Индигокармин используется в пищевой промышленности как
краситель, в аналитической практике — как индикатор.
При окислении индиго азотной или хромовой кислотами об-
разуется изатин:
индиго изатин
Изатин
Изатин — ярко-красное кристаллическое вещество с = 203 °C.
По строению представляет собой внутримолекулярный цикличе-
ский амид (лактам) изатиновой кислоты. Об этом свидетельствует
реакция изатина со щелочью:
изатин
NaOH
на
/^,0—С ONa
Ст
натриевая соль
изатиновой кислоты
Нагревание натриевой соли изатиновой кислоты с хлороводо-
родной кислотой приводит к образованию изатина.
372
Гетероциклические соединения
Для изатина характерна лактам-лактимная таутомерия с пре-
обладанием лактимной формы.
Н—
лактамная форма
лактимная форма
В молекуле изатина имеются две карбонильные группы. Бо-
лее реакционно-способной является С=О-группа в р-положении
(кетонный карбонил). а-Амидный карбонил сопряжен с неподе-
ленной парой электронов атома азота. Сопряжение приводит к по-
вышению электронной плотности на а-атоме углерода, а следова-
тельно, и к уменьшению ее реакционной способности в реакциях
с нуклеофильными реагентами.
изатина оксим изатина фенилгидразон
Атом водорода группы NH в молекуле изатина подвижен
и может замещаться на металл.
Изатин широко применяется в органическом синтезе, а также
как аналитический реагент для фотометрического определения
примеси тиофена в бензоле (индофениновая реакция).
Триптофан
[2-амино-З-(р-индолил)пропионовая кислота]
Триптофан относится к незаменимым а-аминокислотам, вхо-
дящим в состав белка.
28. Пятичленные гетероциклические соединения с одним гетероатомом
373
СН—СООН
NH,
Его молекула содержит асиммет-
рический атом углерода, вслед-
ствие чего проявляет оптическую
активность. Природный трипто-
фан является левовращающим со-
единением.
Серотонин
[5-гидрокси-3-(Р-аминоэтил)индол]
Серотонин является биоген-
ным амином. Это гормонопо-
добное вещество, способству-
ет передаче нервных импуль-
сов, вызывает сокращение
гладкой мускулатуры внутрен-
них органов и сужение сосудов, участвует в регуляции многих жиз-
ненно важных функций организма. Нарушение обмена серотони-
на в организме приводит к такому заболеванию, как шизофрения.
р-Индолилуксусная кислота
(гетероауксин)
СН2—СООН Гетероауксин — это природный гормон
роста (стимулятор роста) растений.
Применяется в сельском хозяйстве для
ускорения роста растений.
На основе индолил-3-уксусной кис-
лоты создан противовоспалительный нестероидный лекарственный
препарат индометацин:
СН—СООН
индометацин,
2-метил-5-метокси-1-(л-хлорбензоил)индолил-3-уксусная кислота
___________________29_____________________
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ДВУМЯ ГЕТЕРОАТОМАМИ
В этой лекции будут рассмотрены пятичленные ароматиче-
ские гетероциклические соединения, содержащие два гетероато-
ма, один из которых — обязательно атом азота. Следовательно,
такие гетероциклические соединения объединены под общим на-
званием — азолы. Другим гетероатомом может быть азот N, кис-
лород О, сера S.
Какие из азолов будут иметь для нас практический интерес?
Это прежде всего:
пиразол,
1,2-диазол
н
имидазол,
1,3-диазол
тиазол,
1,3-тиазол
оксазол, изоксазол,
1,3-оксазол 1,2-оксазол
Приведенные гетероциклы обладают ароматическим харак-
тером. Постоянным гетеро фрагментом азолов является так на-
зываемый «пиридиновый» атом азо-
та, который для образования аро-
матического секстета предоставляет
лишь один л-электрон. Неподелен-
Рис. 29.1. Электронное строе-
ние молекулы 1,2-азола (X =
= NH, О, S)
ная электронная пара «пиридино-
вого» атома азота расположена на
sp-гибридизированной атомной ор-
битали и находится в плоскости
гетероциклического ядра. Второй
гетероатом на образование аро-
матического секстета предостав-
ляет пару электронов, которая рас-
положена на р-атомной орбитали
(рис. 29.1).
29. Пятичленные гетероциклические соединения с двумя гетероатомами
375
Таким образом, вклад каждого гетероатома в образование еди-
ной тг-электронной системы различен.
Азолы — соединения с высокими температурами плавления
и кипения, хорошо растворимые в полярных растворителях и пло-
хо — в неполярных.
Рассмотрим некоторые особенности азолов.
Кислотность и основность. Все азолы обладают слабыми ос-
новными свойствами за счет неподеленной пары электронов ато
ма азота пиридинового типа. При взаимодействии с минеральны-
ми кислотами они образуют соли.
Например:
тиазол тиазолия хлорид
При присоединении протона к молекуле азола образуется ка-
тион, в котором сохранена ароматическая структура, а положи-
тельный заряд равномерно распределен по всей молекуле — этим
можно объяснить то обстоятельство, что азолы не ацидофобны
и не окисляются в присутствии сильных минеральных кислот.
В ряду азолов пиразол и имидазол, помимо основных свойств,
проявляют и слабокислотные свойства за счет атома азота пир-
рольного типа. Следовательно, пиразол и имидазол являются ам-
фотерными соединениями и способны вступать в реакции как
с минеральными кислотами, так и со щелочами, образуя при этом
соли, например:
имидазолин
хлорид
имидазол
имидазол-
калий
Аналогично протекают реакции и для пиразола.
Азольная таутомерия. В ряду пятичленных гетероциклов с двумя
гетероатомами для пиразола и имидазола характерна азольная та-
утомерия. Азольная таутомерия обусловлена перемещением ато-
ма водорода NH-группы к атому азота пиридинового типа:
376
Гетероциклические соединения
положения 3 и 5 равноценны
положения 4 и 5 равноценны
В молекулах диазолов постоянно происходит миграция водо-
рода; и определить, у какого из атомов азота находится водород,
не представляется возможным.
В результате таутомерных превращений положения 3 и 5 в мо-
лекуле пиразола становятся равноценными, 3-метилпиразол и 5-ме-
тилпиразол являются таутомерными формами одного и того же
соединения:
з I, э) «метил пиразол
А в случае имидазола равноценными являются положения 4 и 5:
4(5)-мети лимидазол
Миграция водорода происходит настолько быстро, что выделить
индивидуальные таутомеры не представляется возможным. По-
этому эти соединения так и называют: 3(5)-метилпиразол и 4(5)-ме-
ти л имидазол.
29. Пятичленные гетероциклические соединения с двумя гетероатомами
377
ПИРАЗОЛ
Пиразол (1,2-диазол) — это кристаллическое вещество
с температурой плавления 70 °C, температурой кипе-
ния 187 °C; легкорастворимое в воде, растворимое
в спирте, эфире, бензоле; обладающее запахом пири-
дина.
Способы получения. 1. Присоединение диазоалканов к алкинам.
Реакцию используют для получения пиразола и его производных.
Пиразол получают в результате реакции присоединения диа-
зометана к ацетилену:
ацетилен диазометан
пиразол
2. Взаимодействие гидразина, алкил-, арилгидразинов с 1,3-ди-
карбонильными соединениями. Этот способ чаще применяют для
получения гомологов пиразола. Например, при взаимодействии
гидразина с ацетилацетоном образуется»3,5-диметилпиразол:
ацетилацетон,
пентандион-2,4
NH2
+ 2Н2О
3,5-диметилпиразол
Химические свойства. 1, Кислотность и основность. Пиразол
проявляет амфотерные свойства, благодаря наличию в его струк-
туре атомов азота пиридинового и пиррольного типов.
КИСЛОТНЫЙ
центр
основный
центр
378
Гетероциклические соединения
За счет атома азота пиридинового типа пиразол проявляет
основные свойства, а за счет атома азота пиррольного типа — сла-
бые кислотные свойства:
пиразолия хлорид
НС1
КОН
-Н2О*
пиразол-калий
2. Реакции с электрофильными реагентами. Направление
реакции с электрофильными реагентами существенным образом
зависит от природы атакующего реагента и условий их проведения.
Алкилирование и ацилирование пиразола протекают обычно
с образованием продуктов N-замещения. Так, при взаимодействии
пиразола с йодистым метилом в нейтральной или щелочной среде
образуется N-метилпиразол:
пиразол
-HI
N-метилпиразолия
йодид
N-метилпиразол
Реакции электрофильного замещения с участием атомов угле-
рода пиразольного цикла возможны только с сильными электро-
фильными реагентами (нитрование, сульфирование, галогениро-
вание).
Это объясняется наличием в молекуле атома азота пиридино-
вого типа, обладающего электроноакцепторными свойствами, что
приводит к понижению реакционной способности азолов в реак-
циях 5£по сравнению с фураном, пирролом и тиофеном. Замеще-
ние происходит преимущественно по положению 4 (наиболее уда-
ленному от атомов азота положению).
Поскольку пиразол не обладает ацидофобными свойствами,
его нитрование и сульфирование проводят концентрированными
азотной и серной кислотами соответственно. Обе реакции проте-
кают через стадию образования неактивного катиона пиразолия,
что значительно затрудняет протекание реакции:
29. Пятичленные гетероциклические соединения с двумя гетероатомами
379
пиразол - 4 -сульфокислота
Галогенирование пиразола происходит сравнительно легко:
-нсГ
пиразол 4-хлорпиразол
3. Реакции восстановления. В зависимости от условий восста-
новления пиразола образуется частично гидрированный продукт —
пиразолин или полностью восстановленное производное — пира-
золидин:
пиразолидин
2Н2; Pt
2Н; C,H5OH + Na
пиразол
пиразолин-2
ПРОИЗВОДНЫЕ ПИРАЗОЛА
Из производных пиразола нас будет интересовать
пиразолон-5, структура которого лежит в основе
многих лекарственных препаратов.
Пиразолон-5 — таутомерное вещество и может
существовать в СН,-, ОН- и NH-формах:
(СН2-форма)
пиразолон-5
н
(ОН-форма)
5-гидроксипиразол
(NH-форма)
пиразолон-3
380
Гетероциклические соединения
В приведенном равновесии существенно преобладает
СН2-форма, поэтому предпочтение отдают названию пиразолон-5.
Важнейшим производным пиразолона-5 является 3-метил-1-
фенилпиразолон-5, который является полупродуктом для полу-
чения ряда лекарственных препаратов жаропонижающего и боле-
утоляющего действий — антипирина, амидопирина, анальгина.
3-Метил-1-фенилпиразолон-5 впервые был синтезирован
в 1883 году немецким химиком Людвигом Кнорром из ацето-
уксусного эфира и фенил гидразина:
СН,
1
СН2
j, KHJNHN—С6Н5
''"ОС,Н5
этиловый эфир
3-фенилгидразономасляной кислоты
ацетоуксусный фенилгидразин
эфир
3-метил-1 -фенилпиразол он-5
3-Метил-1-фенилпиразолон-5 существует также в трех тауто-
мерных формах:
СН2-форма ОН-форма NH-форма
Антипирин
Получают метилированием 3-метил-1-фенилпиразолона-5
(в NH-форме):
1
й
29. Пятичленные гетероциклические соединения с двумя гетероатомами
381
3-метил-1 -фенилпиразолон-5
снл
-HI
антипирин,
2,3 -диметил-1 -фенилпиразол он - 5
Антипирин — препарат жаропонижающего действия.
Амидопирин
Амидопирин получают по следующей схеме: антипирин нит-
розируется натрия нитритом в присутствии хлороводородной кис-
лоты, затем восстанавливают 4-нитрозоантипирин до 4-аминоан-
типирина, последний алкилируют йодистым метилом.
HONO
-----»
антипирин
4-нитрозоантипирин
{зеленого цвета)
4-аминоантипирин
амидопирин,
2,3-диметил-4-диметиламино-1 -фенилпиразолон-5,
4- (N ,М-диметиламино)анти1 шрин
Образование 4-нитрозоантипирина, вещества изумрудно-зеле-
ного цвета, является качественной реакцией на антипирин.
Анальгин
В химическом отношении анальгин представляет собой про-
изводное антипирина.
382
Гетероциклические соединения
NaO3S
СН2
анальгин,
натрия 2,3-диметил-4-метиламино-1-фенилпиразолон-5-М-метансульфонат
Качественной реакцией, позволяющей отличить антипирин,
амидопирин и анальгин друг от друга, является их взаимодей-
ствие с железа (III) хлоридом.
образуется комплекс,
окрашенный
в красный цвет
образует фиолетовое
окрашивание, исчезающее
при добавлении
минеральной кислоты
образует фиолетовое
окрашивание, не исчезающее
при добавлении
минеральной кислоты
Для лекарственных препаратов этого ряда характерно сочета-
ние жаропонижающего и болеутоляющего действий.
ИМИДАЗОЛ
Имидазол (1,3-диазол) — бесцветное кристалличе-
ское вещество с tm = 91 °C и /кип = 256 °C, растворимое
в воде, спирте и эфире.
Способы получения. Получают имидазол из глиокса-
ля, аммиака и формальдегида. Поэтому имидазол иног-
да еще называют глиоксамином.
глиоксаль
формальдегид
имидазол
29. Пятичленные гетероциклические соединения с двумя гетероатомами
383
Химические свойства. Для имидазола характерны такие же
реакции, как для пиразола. Имидазол проявляет амфотерные
свойства:
имидазол- имидазолин
калий хлорид
Алкилирование и ацилирование протекают по пиридиновому
атому азота:
имидазол N-метилимидазолия N-метилимидазол
бромид
Нитрование и сульфирование протекают преимущественно по
положению 4. Реакции протекают в жестких условиях, вследствие
образования в кислой среде малоактивного катиона имид-азолия.
Н
2,4,5-трибромимидазол
имидазол-4-
сульфокислота
384
Гетероциклические соединения
С бромом в воде или хлороформе имидазол легко образует
трибромпроизводное.
Имидазольный цикл устойчив к действию окислителей и вос-
становителей. Однако под действием Н2О2 происходит разруше-
ние цикла с образованием оксамида:
оксамид,
диамид щавелевой кислоты
БЕНЗИМИДАЗОЛ
4
Бензимидазол представляет собой конденсированную гетеро-
циклическую систему, которая состоит из имидазольного и бен-
зольного ядер.
Способ получения. Бензимидазол и его производные получают
реакцией конденсации о-фенилендиамина с кислотами:
^^nh2
о-фенилендиамин
+ нсоон
-2Н,О
По химическим свойствам бензимидазол подобен имидазолу.
Он проявляет амфотерный характер, для него характерна азоль-
ная таутомерия, реакции алкилирования протекают по «пириди-
новому» атому азота. А вот реакции нитрования и сульфирования
бензимидазола идут с участием бензольного ядра (в положении 5).
Производным бензимидазола является такой лекарственный
препарат, как дибазол. Его получают взаимодействием о-фени-
лендиамина с фенилуксусной кислотой:
29. Пятичленные гетероциклические соединения с двумя гетероатомами
385
о-фенилендиамин фенилуксусная кислота
-2Н,О
НС1
2-бензилбензимидазол
дибазол,
2-бензилбензимидазола гидрохлорид
• НС1
Дибазол обладает сосудорасширяющим, спазмолитическим
и гипотензивным действиями.
ТИАЗОЛ
Тиазол (1,3-тиазол) — это бесцветная жидкость с не-
приятным запахом и = 117 °C. Тиазол в своей струк-
туре содержит два гетероатома — азот и серу.
Способы получения. Основным методом синтеза ти-
азола и его замещенных является взаимодействие а-галогенокар-
бонильных соединений с амидами тиокислот (синтез Ганча).
Взаимодействие амида тиомуравьиной кислоты с хлоруксус-
ным альдегидом ведет к образованию тиазола:
хлоруксусный
альдегид
тиоформамид
е нол ьная ти ол ьная
форма форма
1,3 -тиазол
386
Гетероциклические соединения
Химические свойства. Наличие атома азота пиридинового типа
сообщает тиазолу основные свойства (взаимодействие с НС1), по
этому же атому происходит алкилирование тиазольного ядра; ре-
акции электрофильного замещения протекают по положению 5,
а реакции нуклефильного замещения протекают по положению 2.
2-аминотиазол
N-метилтиазолия
йодид
Тиазол трудно окисляется и восстанавливается.
ПРОИЗВОДНЫЕ ТИАЗОЛА
Важное значение имеет 2-аминотиазол как полупродукт в син-
тезе лекарственных препаратов.
хлоруксусный
альдегид
h2n
JC—nh2—-
s
тиомочевина
2-аминотиазол
2-Аминотиазол проявляет более выраженные основные свой-
ства по сравнению с тиазолом. Центром основности по-прежне-
му остается циклический атом азота, так как пара электронов
Т4Н2-группы сопряжена с ароматической системой.
Алкилирование протекает по циклическому атому азота, а ре-
акции ацилирования — по аминогруппе. 2-Аминотиазол вступает
в реакцию диазотирования:
29. Пятичленные гетероциклические соединения с двумя гетероатомами
387
2-имино-З-метилтиазол ин
2-Аминотиазол широко используется в производстве лекар-
ственных препаратов. Производными 2-аминотиазола являются
сульфаниламидные препараты норсульфазол и фталазол, которые
обладают антимикробным действием:
SO2
норсульфазол
NH
фталазол
Особую значимость имеет также продукт полного восстанов-
ления тиазола — тиазолидин, который входит в состав антибиоти-
ков пенициллинового ряда общей формулы:
НООС
0-лактамный цикл
388
Гетероциклические соединения
ОКСАЗОЛ И ИЗОКСАЗОЛ
Оксазол и изоксазол — бесцветные жидкости, температура
кипения которых равна 69 и 95 °C соответственно.
оксазол,
1,3-оксазол
изоксазол,
1,2-оксазол
Оксазол и изоксазол проявляют ароматические свойства. Ре-
акции электрофильного замещения протекают преимущественно
по положению 4. Оба гетероцикла проявляют слабые основные
свойства.
Ядро изоксазола входит в состав противотуберкулезного пре-
парата — циклосерина:
циклосерин
Среди производных оксазола известны вещества, обладаю-
щие антибактериальным, жаропонижающим, анальгетическим
и снотворным действиями.
__________________30______________________
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ С ОДНИМ ГЕТЕРОАТОМОМ
К наиболее распространенным представителям этой группы
соединений относятся гетероциклы, содержащие в качестве гете-
роатома атом азота (азины):
пиридин хинолин изохинолин акридин
и неароматические кислородсодержащие гетероциклические со-
единения, такие как:
а-пиран
у-пиран
ПИРИДИН
Пиридин — бесцветная жидкость с характерным за-
пахом, смешивается с водой и эфиром во всех со-
отношениях. Образует азеотропную смесь состава
C5H5N • ЗН2О.
Положения 2 и 6 в молекуле пиридина называют
а,а’-положениями, положения 3 и 5 обозначают — р,р’, а положе-
ние 4 — у-положение.
а-этилпиридин,
2 -этилпиридин
Р-этилпиридин, у-этилпиридин,
З-этилпиридин 4-ЭТИЛПИрИДИН
390
Гетероциклические соединения
Способы получения. Пиридин и его монометильные про-
изводные — а-, р-, у-пиколины получают из каменноугольной
смолы.
Кроме того, существуют синтетические методы получения:
1. Взаимодействие ацетилена с синильной кислотой'.
сн=сн
+ N=CH
СН=СН
2. Конденсация ацетальдегида и формальдегида с аммиаком:
О
2СН
+ ЗН2О + H2t
3. Нагревание до 400 °C уксусного альдегида с аммиаком в при-
сутствии А12О3 приводит к образованию смеси метильных произ-
водных пиридина (пиколинов):
6СН3—С—Н + 2NH3
О
а-пиколин
у-пиколин
4. При нагревании акролеина с аммиаком получается р-пиколин:
Н2С=СН
+ NH3
Р-ПИКОЛИН
Используя другие альдегиды и их смеси, получают различные
алкилпиридины.
Строение и химические свойства. Пиридин относится к арома-
тическим соединениям. Его молекула имеет плоское строение.
Атомы углерода и азота находятся в состоянии sp-гибридизации.
В образовании ароматического секстета принимают участие пять
р-атомных орбиталей атомов углерода и одна-/?-атомная орбиталь
атома азота. Неподеленная пара электронов атома азота занимает
sp -гибридную орбиталь и не принимает участия в образовании
30. Шестичленные гетероциклические соединения с одним гетероатомом
391
ароматического секстета, что сообщает пиридину основные свой-
ства. Атом азота такой конфигурации получил название пиридино-
вого. Атом азота, обладая большей электроотрицательностью, по-
нижает электронную плотность на атомах углерода в молекуле
пиридина. В меньшей степени затрагиваются положения 3 и 5
(Р-положения), и максимальная электронная плотность сосредо-
точена на атоме азота.
Влияние атома азота на электронную плотность пиридиново-
го ядра сравнимо с влиянием нитрогруппы на бензольное кольцо
в молекуле нитробензола, но более сильное.
Гетероциклы, в которых гетероатом понижает электронную
плотность на атомах углерода ароматического кольца, называют
тс- дефицитными. То есть пиридин является тс-дефицитной арома-
тической системой.
Характерные для пиридина реакции можно разделить на три
группы реакций:
а) протекающие с участием гетероатома;
б) замещение атомов водорода пиридинового ядра;
в) восстановление и окисление.
А. Реакции, протекающие с участием гетероатома. 7. Взаимодей-
ствие с кислотами. За счет неподеленной пары электронов атома
азота пиридин проявляет слабые основные свойства (рХВ1Г = 5,25).
При взаимодействии с сильными минеральными и органичес-
кими кйслотами он образует хорошо растворимые пиридиниевые
соли:
I + НВг ------ I I ВГ
"'Г
Н
пиридиния бромид
2. Реакция с серы (VI) оксидом. С участием неподеленной пары
электронов атома азота пиридин легко реагирует с серы триокси-
дом, образуя донорно-акцепторный комплекс:
392
Гетероциклические соединения
пиридинсульфотриоксид
3. Взаимодействие с алкил- и ацилгалогенидами. В этих реакци-
ях пиридин образует четвертичные соли N-алкил- и N-ацилпири-
диния соответственно.
йодид хлорид
Реакции взаимодействия пиридина с алкил- и ацилгалогени-
дами указывают на нуклеофильные свойства пиридинового атома
азота. Соли N-ацилпиридиния используются как ацилирующие
реагенты.
Б. Реакции замещения атомов водорода пиридинового ядра. Для
пиридина характерны как реакции электрофильного замещения
SE, так и нуклеофильного замещения SN.
1. Реакции электрофильного замещения Sr Электроноакцептор-
ное влияние атома азота в молекуле пиридина приводит к тому,
что реакции электрофильного замещения для пиридина протека-
ют с трудом.
Реакции нитрования, сульфирования и галогенирования про-
ходят медленно в жестких условиях и с низкими выходами. При
этом электрофильный реагент направляется в р-положение:
З-нигропиридин
3 - п иридинсул ьфокислота
30. Шестичленные гетероциклические соединения с одним гетероатомом
393
2. Реакции нуклеофильного замещения SN. Пиридин легко всту-
пает в реакции нуклеофильного замещения. Замещение проте-
кает по положениям 2, 4, 6; легче всего нуклеофильный реагент
вводится в положения 2, 6 (а-положения).
Ярким примером реакции этого типа является аминирование
пиридина натрия амидом по Чичибабину.
Реакция протекает по механизму SN2:
NaNH2
о-комплекс
2-аминопиридин,
а-аминопиридин
NaH
Аналогично протекает гидроксилирование:
КОН; зоо °с
калия
2-гидроксипиридинолят
2-гидроксипиридин,
а- гидроксипиридин
В. Реакции восстановления и окисления. 1. Восстановление. Пи-
ридин восстанавливается легче, чем бензол. В зависимости от при-
роды восстановителя и условий проведения реакции образуются
различные продукты.
6Н
Na + С2Н50Н
ЗН2
Pt; Pd; Rh
4Н2
Ni; 180 °C
н
пиперидин
сн,—сн,—сн — сн— сн — nh2
пентанамин-1
Реакция с раскрытием пиридинового цикла протекает при вы-
сокой температуре в присутствии никелевого катализатора.
2. Окисление. Пиридиновое ядро устойчиво к действию окис-
литилей. Ал кил пиридины, подобно алкилбензолам, окисляют-
ся легко с образованием соответствующих пиридинкарбоновых
кислот:
394
Гетероциклические соединения
р-пиколин
[О]
/Ч^соон
N
никотиновая кислота
При действии пероксикислот пиридин окисляется по атому
азота с образованием N-оксида.
сн3сооон
(Н2О2 + СН3СООН)
+ СН3СООН
пиоидина N-оксид
Пиридина N-оксид и его производные легко восстанавлива-
ются:
РС13
POC1,
Следует отметить, что пиридина N-оксид в отличие от пири-
дина довольно легко вступает в реакции электрофильного заме-
щения. Это обусловлено электронодонорным влиянием атома кис-
лорода. В результате смещения электронной плотности от атома
кислорода в ядро на атомах углерода в а- и у-положениях элект-
ронная плотность повышается.
Замещение идет легче по у-положению, так как оно простран-
ственно не затруднено. К тому же рядом стоящий атом азота по-
нижает электронную плотность в а-положениях.
При нитровании пиридина N-оксида азотной кислотой с вы-
соким выходом образуется 4-нитропиридина N-оксид:
30. Шестичленные гетероциклические соединения с одним гетероатомом
395
NO2
0“ О“
4-нитропиридина N-оксид
Пиридина N-оксид используют для получения у-замещенных
производных пиридина:
^оксид-4-хлорпиридин
4-хлорпиридин
Алкилирование и ацилирование N-оксида проходят по атому
кислорода с образованием солей N-алкокси- и N-ацилоксипири-
диния соответственно:
N-метоксипиридиния
йодид
N -ацетоксипиридиния
хлорид
Для пиридина N-оксида характерны также реакции нуклео-
фильного замещения, протекающие по положениям 2, 4 и 6
(а- и у-положениям).
396 Гетероциклические соединения
ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ ПИРИДИНА
Пиколины
Пиколинами называют монометильные производные пиридина:
а-пиколин,
2-метилпиридин
Р-пиколин,
2-метилпиридин
у-пиколин,
2-метилпиридин
По химическим свойствам пиколины сходны с пиридином.
Они образуют соли с сильными кислотами и алкилгалогенидами,
окисляются до N-оксидов, восстанавливаются до производных
пиперидина, аналогично метил производным бензола окисляются
до пиколиновой, никотиновой и изоникотиновой кислот.
Например, при окислении 0-пиколина образуется никотино-
вая кислота:
[О]
ХХ^СООН
никотиновая кислота
В молекулах а- и у-пиколинов водородные атомы в метильных
группах подвижны (о,л-сопряжение), поэтому они в отличие от
Р-пиколинов вступают в реакции конденсации с альдегидами аро-
матического ряда.
а-стирилпиридин,
1 -(2-пиридил)-2-фенилэтен
Гидроксипиридины
В зависимости от положения гидроксильной группы различа-
ют три изомера:
30. Шестичленные гетероциклические соединения с одним гетероатомом
397
а-гидроксипиридин
Р-гидроксипиридин
он
у-гидроксипиридин
Гидроксипиридины представляют собой кристаллические
вещества, хорошо растворимые в этаноле, ацетоне, малораство-
римые в диэтиловом эфире и бензоле.
Особенностью а- и у-изомеров является то, что они существу-
ют в двух таутомерных формах:
2-гидроксипиридин,
пиридинол-2
{гидроксиформа)
пиридон-2
{оксоформа)
4-гидроксипиридин,
пиридинол-4
{гидроксиформа)
пиридон-4
{оксоформа)
В молекуле p-гидроксипиридина отсутствует сопряжение
неподеленной пары электронов атома кислорода гидроксильной
группы с гетероатомом, что делает невозможным таутомерию.
р-Гидроксипиридины в водных растворах существуют в нейт-
ральной и биполярной формах в соотношении 1:1.
нейтральная
форма
н
биполярная
форма
Гидроксипиридины являются бифункциональными соедине-
ниями, они проявляют свойства пиридина и фенола. Так, с вод-
ным раствором FeCl3 все они образуют пурпурную окраску раз-
личной интенсивности. Свойства фенола в большей степени
проявляет 3-гидроксипиридин, гидроксильная группа которого
не сопряжена с гетероатомом.
398
Гетероциклические соединения
С алкилгалогенидами 2- и 4-гидроксипиридины образуют
N-алкилпиридоны, а 3-гидроксипиридин дает соли N-ал кил пи-
ридиния:
N-метилпиридон-2
сн3
З-гидроксипиридин, N-метил-З-гидрокси-
пиридинол-3 пиридиния йодид
2-гид роксипиридин,
пиридинол-2
Из производных гидроксипиридинов от-
метим пиридоксин (витамин В6).
Применяется пиридоксин в виде соли
с хлороводородной кислотой при В6-ги-
повитаминозе, токсикозе, анемиях, лей-
копениях и заболеваниях нервной сис-
темы.
Аминопиридины
В зависимости от положения аминогруппы различают:
а-аминопиридин,
2-аминопиридин,
пиридиламин-2
КТ 14
р-аминопиридин,
3-аминопиридин,
пиридиламин-3
у-аминопиридин,
4-аминопиридин,
пиридил амин-4
Аминопиридины — белые кристаллические вещества, легко рас-
творимые в воде, этаноле и других органических растворителях.
Аминопроизводные пиридина обладают более сильными ос-
новными свойствами по сравнению с пиридином и анилином.
Они содержат в своем составе два основных центра — атом азота
пиридинового типа и атом азота аминогруппы.
В молекулах а- и у-аминопиридинов аминогруппа находится
в сопряжении с гетероатомом, что приводит к понижению основ-
ных свойств аминогруппы. Поэтому 2 и 4-аминопиридины обра-
зуют соли только с одним эквивалентом кислоты:
30. Шестичленные гетероциклические соединения с одним гетероатомом
399
4-аминопиридиния
хлорид
В молекуле p-аминопиридина аминогруппа не сопряжена
с гетероатомом, поэтому он образует соли с двумя эквивалентами
кислоты:
2НС1
3-аминопиридиния
дихлорид
а- и у-Аминопиридины являются таутомерными веществами
и существуют в аминной и иминной формах (амино-иминная тау-
томерия):
4-аминопиридин пиридинимин-4
Химические свойства аминопиридинов зависят от положения
аминогруппы. Так, 3-аминопиридин проявляет свойства арома-
тических аминов, легко вступая в реакции алкилирования, аци-
лирования, диазотирования по аминогруппе с образованием ус-
тойчивых солей диазония.
400
Гетероциклические соединения
2- и 4-Аминопиридины алкилируются по циклическому атому
азота, а ацилируются по атому азота аминогруппы:
4-ацетаминопиридин
4-аминопиридин
\|Ц
4-амино- 1-метил-
пиридиния йодид
Пиридинкарбоновые кислоты
В зависимости от положения карбоксильной группы в моле-
куле различают а-, |3- и у-пиридинкарбоновые кислоты:
/^СООН
СООН
пиколиновая кислота,
2 - пириди нкарбоновая
кислота
никотиновая кислота
3 - пириди нкарбоновая
кислота
изоникотиновая кислота
4-пиридинкарбоновая
кислота
Пиридинкарбоновые кислоты представляют собой белые кри-
сталлические вещества, способные возгоняться, растворимые в го-
рячей воде. Их получают окислением соответствующих пиколинов.
По карбоксильной группе они образуют соли, сложные эфи-
ры, галогенангидриды, амиды, гидразиды и другие функциональ-
ные производные. Для них характерны реакции декарбоксилиро-
вания, причем а-кислоты декарбоксилируются легко, а у— только
при нагревании со щелочью. Вследствие наличия кислотного и ос-
новного центров пиридинкарбоновые кислоты проявляют амфо-
терные свойства и реагируют с кислотами и щелочами:
NaOH
/^СООН
НС1
Г^Ч1/СООН
С1~
натрия никотинат
3-карбоксипиридиния
хлорид
30. Шестичленные гетероциклические соединения с одним гетероатомом
401
В кристаллическом состоянии и частично в растворах они
существуют в виде внутримолекулярных солей (цвиттер-ионы).
цвиттер-ион
никотиновой кислоты
Пиридинкарбоновые кислоты в результате электроноакцептор-
ного влияния атома азота являются более сильными кислотами,
чем бензойная.
Кислотность а- и у-пиридинкарбоновых кислот выше, чем
Р-кислоты, так как в а- и у-пиридинкарбоновых кислотах карбо-
ксильная группа находится в сопряжении с атомом азота, что при-
водит к усилению ее депротонизации.
Никотиновая кислота и ее амид (никотинамид) известны
в медицине как витамин РР (кислота — провитамин, а ее амид —-
витамин). При недостатке витамина РР развивается заболевание
кожи — пеллагра, поэтому его называют антипеллагрическим.
1Ч,М-Диэтиламид никотиновой кислоты под названием кор-
диамин (25 %-ный водный раствор) применяется как средство,
стимулирующее центральную нервную систему.
Схема синтеза амида и М,М-диэтиламида никотиновой кис-
лоты:
никотиновая
кислота
-SO2; -НС1
ххЧ>хсоон
Т soci
хлорангидрид
никотиновой кислоты
(C,H5)2NH
амид никотиновой кислоты
никотинамид
N
N,N-диэтиламид
никотиновой кислоты
N
Производные изоникотиновой кислоты применяются в меди-
цине как противотуберкулезные средства:
402
Гетероциклические соединения
гидразид
изоникотиновой кислоты,
изониазид
С—NHN=CH
N
ОН
фтивазид
Изониазид и фтивазид применяют для лечения различных форм
туберкулеза.
Пиперидин
Пиперидин (гексагидропиридин) — бесцветная жидкость
с резким аммиачным запахом, смешивается с водой
и большинством органических растворителей. Обладает
свойствами вторичных аминов и является более силь-
ным основанием, чем пиридин (р^вн+ = 11,22).
Образует соли с кислотами, с HNO2 — N-нитрозопроизводное,
вступает в реакции алкилирования и ацилирования по атому азо-
та и др.:
СОСН3
N-ацетилпиперидин
СН31
-HI
N-метилпиперидин
КИСЛОРОДСОДЕРЖАЩИЕ ШЕСТИЧЛЕННЫЕ
ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ
а-пиран,
2Н-пиран
у-пиран,
2Н-пиран
30. Шестичленные гетероциклические соединения с одним гетероатомом
403
а- и у-Пираны представляют собой неустойчивые соединения.
В отличие от ос- и у-пирана, их оксопроизводные являются
довольно устойчивыми ароматическими соединениями.
а-пирон
у-пирон
а-Пирон — бесцветная жидкость с запахом свежего сена,
у-пирон — бесцветное кристаллическое вещество.
В молекулах а- и у-пиронов неподеленная пара электронов
циклического атома кислорода находится в сопряжении с л-элек-
тронами двойной связи оксогруппы.
Делокализацию электронной плотности в их молекулах мож-
но представить в виде резонансных структур:
у-Пирон проявляет слабые основные свойства и при взаимо-
действии с минеральными кислотами и алкилгалогенидами обра-
зует соли пирилия:
Пирилиевый катион содержит замкнутую л-электронную сис-
тему из шести электронов и обладает ароматическим характером,
у-Пирон не вступает в характерные для кетонов реакции.
404
Гетероциклические соединения
Кумарин
Кумарин (бензо[#]пирон-2) представляет со-
бой конденсированную систему, состоящую
из бензольного и а-пиронового циклов. По
строению он является лактоном цис-о-гид-
роксикоричной кислоты (кумариновой кис-
лоты).
Синтетический кумарин получают по реакции Перкина из са-
лицилового альдегида:
(СН3СО)2О
салициловый
альдегид
CH3COONa
180 °C
+ СН3СООН
Химические свойства кумарина обусловлены наличием лак-
тонного и бензольного колец. При нагревании со щелочами обра-
зуется соль о-гидроксикоричной кислоты, при подкислении ко-
торой происходит быстрая рециклизация в кумарин:
кумарин
ONa
динатриевая соль
кумариновой кислоты
По бензольному кольцу кумарин вступает в реакции электро-
фильного замещения (нитрование, сульфирование) по положе-
нию 6:
6-нитрокумарин
6-кумаринсульфокислота
30. Шестичленные гетероциклические соединения с одним гетероатомом
405
На основе производных кумарина созданы лекарственные пре-
параты, проявляющие антикоагулянтную активность,— неодику-
марин, фепромарон, синкумар и др.
Хромой
Хромон представляет собой конденсированную
гетероциклическую систему, которая состоит из
бензольного и у-пиронового циклов. По хими-
ческим свойствам хромон сходен с у-пироном,
при обработке сухим НС1 он образует соль бен-
зопирилия:
хромон
он
4-гидроксихромония
хлорид
Реакции электрофильного замещения по бензольному кольцу
для хромона затруднены и протекают лишь при наличии в моле-
куле электронодонорных заместителей.
Широко распространенными в природе производными хро-
мона являются хромон и изофлавон, называемые флавоноидами.
изофлавон,
2-фенилхромон
В растениях они находятся в виде гликозидов, проявляют био-
логическую активность.
КОНДЕНСИРОВАННЫЕ ШЕСТИЧЛЕННЫЕ
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ОДНИМ ГЕТЕРОАТОМОМ
Важнейшими пиридинсодержащими конденсированными сис-
темами являются хинолин, изохинолин, акридин.
ХИНОЛИН
изохинолин
акридин
ХИНОЛИН
Хинолин (бензо [6] пиридин) представляет со-
бой бициклическую систему, содержащую
конденсированные пиридиновое и бензольное
кольца. Его также можно рассматривать как
гетероциклический аналог нафталина (1-аза-
нафталин).
В пиридиновом кольце положения обозначаются греческими
буквами «-(положение 2), Р (3), у (4). Хинолин — бесцветная жид-
кость с неприятным запахом, /кип = 237 °C, хорошо смешивается
с водой, этанолом, диэтиловым эфиром, перегоняется с водяным
паром.
Способы получения. Хинолин и его метильные производные
получают из продуктов перегонки каменноугольной смолы.
Среди синтетических способов получения хинолина и его про-
изводных важнейшими являются синтез Скраупа и синтез Дебне-
ра — Миллера.
1. Синтез Скраупа. Для получения хинолина по методу Скра-
упа анилин нагревают с глицерином и концентрированной H2SO4
в присутствии слабого окислителя — нитробензола:
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 407
СН,—ОН
СН—ОН
сн—он
конц. H2SO4; C6HsNO2; t
Механизм реакции включает три последовательные стадии.
На первой стадии глицерин под действием концентриро-
ванной H2SO4 подвергается дегидратации с образованием акро-
леина:
СН,—ОН
СН—ОН
H2SO4; t
-2H2O
СН — ОН
СН2
11
сн
| ЛЭ
с
акролеин
На второй стадии образовавшийся акролеин вступает в реак-
цию конденсации с анилином:
З-анилинопропаналь карбокатион
1,2-дигидрохинолин
408
Гетероциклические соединения
На третьей стадии реакции 1,2-дигидрохинолин окисляется
нитробензолом в хинолин:
Для получения производных хинолина, содержащих замес-
тители в бензольном кольце, вместо анилина используют его
соответствующие производные со свободным ортио-положением.
Реакция была открыта в 1881 году австрийским химиком-орга-
ником 3. X. Скраупом. В литературе эту реакцию иногда называ-
ют скраупированием.
2. Синтез Дебнера—Миллера, Реакция открыта в 1881 году и яв-
ляется модификацией синтеза Скраупа.
Синтез Дебнера — Миллера применяют для получения произ-
водных хинолина, содержащих алкильный заместитель в пириди-
новом кольце.
В качестве исходных веществ используют ароматический амин
и альдегид, который может вступать в реакцию кротоновой кон-
денсации. Синтез проводят в присутствии цинка хлорида, хлоро-
водородной или другой минеральной кислоты.
Например, для получения 2-метилхинолина (хинальдина)
используют анилин и ацетальдегид.
На первой стадии происходит кротоновая конденсация двух
молекул альдегида с образованием а,р-ненасыщенного альдегида:
2СН
НС1; t
-ЩО
сн3
сн=
кротоновый альдегид,
бутен-2-аль
Далее происходит взаимодействие кротонового альдегида
с анилином. В данном случае окислителями выступают азомети-
ны С,Н-—N=CH—R, которые образуются в процессе реакции:
3-анилинобутаналь
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 409
2-метил-1,2-дигидрохинолин
2-метилхинолин,
хинальдин
Химические свойства. Хинолин является ароматическим соеди-
нением: его молекула имеет плоское строение и единую сопря-
женную 10 л-электронную систему.
По химическим свойствам хинолин схож с пиридином. Для
него характерны реакции:
— с участием гетероатома;
— электрофильного и нуклеофильного замещения;
— окисления;
— восстановления.
1. Реакции по гетероатому. Наличие в молекуле хинолина ато-
ма азота пиридинового типа обусловливает основные свойства.
Как основание хинолин немного слабее пиридина (рХвн+ хиноли-
на в Н2О равен 4,94, a рХ'вн+ пиридина — 5,25).
Хинолин образует соли с сильными кислотами, алкил- и ацил-
галогенидами:
хинолиния
хлорид
N -метил хинол иния
йодид
N - ацетилхинолиния
хлорид
410
Гетероциклические соединения
2. Реакции электрофильного и нуклеофильного замещений, В ре-
зультате электроноакцепторного влияния гетероатома электрон-
ная плотность в молекуле хинолина распределена неравномерно:
в пиридиновом кольце она ниже, чем в бензольном. Поэтому при
действии электрофильных реагентов замещение проходит по бен-
зольному кольцу, а нуклеофильное — по пиридиновому.
Реакции электрофильного замещения в молекуле хинолина про-
текают преимущественно по положению 5 и 8.
При обработке нитрующей смесью образуются 5- и 8-нитро-
хинолины. Сульфирование концентрированной серной кислотой
при температуре 220 °C приводит к образованию 8-хинолинсуль-
фокислоты, а при 300 °C — 6-хинолинсульфокислоты (в этих ус-
ловиях происходит перегруппировка 8-изомера в более термоди-
намически выгодный 6-изомер):
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 411
В реакции нуклеофильного замещения хинолин вступает значи-
тельно легче, чем пиридин. При этом реакции протекают по по-
ложению 2.
2-аминохинолин
2-гидроксихинолин
3. Реакции восстановления и окисления. При восстановлении
хинолина в первую очередь восстанавливается пиридиновое ядро.
Образование продуктов реакции зависит от катализатора и усло-
вий проведения.
1,2,3,4-тетрагидрохинолин
Окисление калия хинолина перманганатом в щелочной среде
приводит к расщеплению бензольного кольца и образованию хи-
нолиновой (2,3-пиридиндикарбоновой) кислоты. В присутствии
пероксикислот хинолин образует N-оксид:
хинолина N-оксид
НООС
+ 2СО,1 + Н,0
ноос'^г
хинолиновая кислота,
2,3-пиридиндикарбоновая кислота
412
Гетероциклические соединения
ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ ХИНОЛИНА
Хинолиновое ядро является структурным фрагментом многих
алкалоидов и лекарственных препаратов.
8-Гидроксихинолин
8-Гидроксихинолин — бесцветное кристалличе-
ское вещество с /п1 = 75...76 °C и характерным за-
пахом, малорастворимый в воде, диэтиловом
эфире, бензоле. Его получают нагреванием орто-
аминофенола с глицерином в присутствии кон-
центрированной серной кислоты (синтез Скрау-
па) или сплавлением 8-хинолинсульфокислоты со щелочью:
HC1
-NaCI
С катионами многих металлов (Mg2+, Al3+, Zn2+ и т. д.)
8-гидроксихинолин способен образовывать нерастворимые коор-
динационные комплексы — хелаты, используемые в качественном
анализе:
Это свойство 8-гидроксихинолина также лежит в основе его
применения в медицине.
Множество производных этого соединения (хинозол, нитро-
ксолин (5-НОК), энтеросептол) обладают антибактериальной
и противогрибковой активностью.
•I
1
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 413
ХИНОЗОЛ,
8-гидроксихинолиния
сульфат
иитроксолин (5 HOK),
8-гидрокси-5-нитро-
хинолин
энтеросептол,
8-гидрокси-7-йод-5-хлор-
хинолин
Хинолин-4-карбоновая (цинхониновая) кислота
СООН
Из производных цинхониновой кислоты
следует отметить лекарственный препарат сов-
каин, который является местным анестетиком.
CONH(CH2)2N
5
ОСН2СН2СН2СН
гидрохлорид диэтиламиноэтиламида
2-л-бутоксицинхониновой кислоты
ИЗОХИНОЛИН
является изомером хинолина,
от него циклы соединены вдоль
пиридинового кольца и поэтому
бензо [с] пиридином. Нумерацию
Изохинолин
но в отличие
связи С3—С4
его называют
атомов в молекуле изохинолина проводят как
в конденсированных аренах, с учетом положения гетероатома.
Изохинолин — это бесцветное кристаллическое вещество
с t = 24,6 °C и запахом, напоминающим запах хинолина, раство-
ряется в воде и большинстве органических растворителей.
Способы получения. Изохинолин содержится в хинолиновой
фракции каменноугольной смолы (1%).
В лаборатории синтез изохинолина и его производных осуще-
ствляют по реакции Бишлера—Напиралъского.
414
Гетероциклические соединения
При взаимодействии (3-фенилэтанамина с хлорангидридами
карбоновых кислот образуется N-ацил-р-фенилэтанамин, кото-
рый при действии водоотнимающих средств РОС13, Р2О5 или по-
лифосфорной кислоты подвергается циклодегидратации с обра-
зованием замещенных 3,4-дигидроизохинолина.
Последующее дегидрирование приводит к образованию изо-
хинолина.
р-фенилэтиламин
-HC1
R
N-ацил-р-фенилэтиламин
Р2О5
-Н2О
I - Я-замеи[енный
3,4-дигидроизохинолин
Pd
-н2
1 -Jf-замещенный
изохинолин
Химические свойства. По химическим свойствам изохинолин
во многом напоминает хинолин. За счет гетероатома он прояв-
ляет слабооснбвные свойства, взаимодействуя с сильными кис-
лотами. Как основание изохинолин немного сильнее хинолина
(pAgH+ изохинолина равен 5,14; хинолина — 4,94). Алки-
лирование и ацилирование протекают по гетероатому с образова-
нием солеобразных продуктов присоединения.
Изохинолин вступает в реакции электрофильного замещения,
как и хинолин, в положениях 5 и 8 бензольного кольца.
Нуклеофильное замещение протекает в положении 1.
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 415
1-аминоизохинолин изохинолон-1 1-гидроксиизохинолин
Изохинолин труднее восстанавливается, чем хинолин.
1,2,3,4-тетрагидроизохинолин
При окислении изохинолина щелочным раствором КМпО4
окислению подвергаются оба ядра, и в результате образуется смесь
фталевой и 3,4-пиридиндикарбоновой кислот.
КМпО4; ОН~
СООН НООС^/^
^Ч/"Х:ООН HOOC'^\^'N
фталевая кислота
3,4- п ириди нди карбон овая
кислота
416
Гетероциклические соединения
Подобно хинолину при действии пероксикислот изохинолин
образует изохинолина N-оксид.
Производными изохинолина являются многие алкалоиды изо-
хинолинового ряда — морфин, папаверин, наркотин и др.
АКРИДИН
Акридин (дибензо [Z?,e]пиридин) пред-
ставляет собой конденсированную сис-
тему из двух бензольных и одного пи-
ридинового циклов. Акридин подобен
антрацену, в котором группа =СН— за-
мещена на атом азота (10-азаантрацен).
Нумерацию атомов проводят таким образом, чтобы азот получил
наибольший номер — 10. Положения 9 и 10 называют мезо-поло-
жениями.
Акридин — это светло-желтое кристаллическое вещество
с = 111 °C и характерным запахом, легко возгоняется. Хорошо
растворяется в органических растворителях, малорастворим в воде.
Разбавленные растворы имеют синюю флуоресценцию. Растворы
солей обладают зеленой флуоресценцией, при разбавлении водой
происходит гидролиз, и зеленая флуоресценция переходит в синюю,
характерную для свободного акридина. Акридин оказывает на сли-
зистые оболочки и на кожу раздражающее воздействие, вызывает
чувство жжения, откуда и произошло его название acris — едкий.
Способы получения. Акридин выделяют из антраценовой фрак-
ции каменноугольной смолы.
Чаще акридин получают синтетическим путем, используя
реакции конденсации и циклизации.
1. Конденсация дифениламина с карбоновыми кислотами. Ак-
ридин получают по способу Бернтсена при нагревании дифенил-
амина с одноосновными карбоновыми кислотами в присутствии
цинка хлорида как водоотнимающего средства:
дифениламин
ZnCl,
+ 2Н,О
акридин
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 417
2, Циклизация N-фенилантраниловой кислоты по реакции Дроз-
дова—Магидсона—Григоровского:
N-фенилантраниловая
кислота
хлорангидрид
N-фенил антраниловой
кислоты
акридон-9
ОН
акридол-9
РОС13
9-хлоракридин
9,10-дигидроакридин,
акрилан
акридин
В молекуле 9-хлоракридина атом хлора проявляет большую
подвижность, поэтому его используют для получения производ-
ных по положению 9:
418
Гетероциклические соединения
С1 ОН о
Химические свойства. 1. Реакции с участием гетероатома. Ак-
ридин является слабым основанием. Он обладает более слабыми
основными свойствами, чем пиридин и хинолин.
Акридин, подобно пиридину, взаимодействует с кислотами,
образуя соли, которые называются акридиниевыми. С надкислота-
ми образует акридина N-оксид:
акридина N-оксид
N-метилакридиния йодид
С электрофильными реагентами акридин взаимодействует
с большим трудом и неоднозначно.
2. Реакции нуклеофильного замещения для акридина идут дос-
таточно легко по положению 9. Например, при действии на акри-
дин натрия амида образуется 9-аминоакридин:
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 419
9-аминоакридин
Акридин достаточно устойчив к действию окислителей.
При действии калия дихромата в уксусной кислоте акридин
окисляется в акридон-9, который является таутомерным веществом:
ОН
9-гидроксиакридин,
акридол-9
9-оксоакридин,
акридон-9
Хотя в акридоне-9 и содержится группа С=О, однако она
не обладает кетонным характером. Это объясняется тем, что не-
обобщенная электронная пара атома азота сопряжена с карбони-
лом, что снижает ее электрофильные свойства.
Молекулы акридона-9 благодаря межмолекулярным водород-
ным связям образуют димеры. Акридон-9 в свободном состоянии
представляет собой димер с высокой температурой плавления:
При окислении акридина в жестких условиях (КМпО4 в ще-
лочной среде) затрагивается одно из бензольных ядер с образова-
нием хинолин-2,3-дикарбоновой кислоты:
420
Гетероциклические соединения
2CO,t
А"
хинолин-2,3-дикарбоновая кислота,
акридиновая кислота
Восстановление акридина происходит подобно антрацену
по наиболее активным лгезо-положениям. Так, при действии
натрия в спиртовом растворе или при каталитическом гидрирова-
нии акридин легко восстанавливается в 9,10-дигидроакридин (ак-
ридан):
9,10-дигидроакридин,
акридан
Акридан обладает очень слабыми основными свойствами.
Так же, как и у дифениламина, неподеленная электронная пара
атома азота участвует в сопряжении с двумя бензольными ядрами.
Только с сильными минеральными кислотами он образует соли,
которые легко гидролизуются.
ВАЖНЕЙШИЕ ПРОИЗВОДНЫЕ АКРИДИНА
9-Аминоакридин
9-Аминоакридин — желтое кристалличе-
ское вещество с /пл = 236...237 °C, рас-
творяется в этаноле, ацетоне; является
более сильным основанием, чем акридин.
Несмотря на то что в нем имеются два
основных центра, соль образуется только
по кольцевому атому азота. Пара элект-
ронов аминогруппы вступает в сопряжение с л-элекгронами пири-
динового кольца, смещаясь к кольцевому атому азота и повышая
на нем электронную плотность. В результате этого аминогруппа
утрачивает способность к образованию солей.
31. Конденсированные шестичленные гетероциклические соединения с одним гетероатомом 421
Ацилирование протекает по аминогруппе:
9 -N-ацетиламиноакридин
хлористоводородная соль
9-аминоакридина
Из производных акридина отметим лекарственные препараты
акрихин и риванол:
акрихин,
9(4'-диэтиламино- Г-метилбутиламино)-
2-метокси-6-хлоракридина дигидрохлорид
риванол,
6,9-диамино-2-этоксиакридина лактат,
этакридина лактат
СООН
•снон
I
сн3
Акрихин нашел применение при лечении малярии, риванол
бактерицидный препарат.
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ.
ПУРИН И ЕГО ПРОИЗВОДНЫЕ. АЛКАЛОИДЫ
Ароматические шестичленные гетероциклические соединения,
содержащие в своей структуре в качестве гетероатомов два атома
азота, назв1ваются диазинами.
1,2-диазин,
пиридазин
1,3-диазин,
пиримидин
1,4-ди азин,
пиразин
Для этих соединений чаще применяют тривиальные названия:
пиридазин, пиримидин, пиразин. Как видно из приведенных фор-
мул, эти три диазина являются изомерами.
Существуют также шестичленные гетероциклы, содержащие
в своей структуре в качестве гетероатомов атомы азота и кислоро-
да или азота и серы, например:
оксазин тиазин
Оксазин и тиазин не обладают ароматическим характером
и по своим свойствам напоминают ациклические соединения,
содержащие аналогичные функциональные группы.
Пиридазин, пиримидин и пиразин представляют собой арома-
тические соединения, во многом напоминающие пиридин. Наличие
в молекулах двух атомов азота пиридинового типа, которые дезак-
тивируют друг друга, приводит к тому, что эти гетероциклические
соединения являются более слабыми основаниями, чем пиридин.
Несмотря на наличие двух основных центров в молекуле, диазины
образуют соли с одним эквивалентом минеральной кислоты:
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 423
пиримидин пиримидиния хлорид
В реакции электрофильного замещения эти гетероциклы
вступают с трудом. Реакции SE возможны только при наличии
в молекуле сильных электронодонорных заместителей, таких как
—NH2-rpynna, —ОН-группа и другие, способных проявлять
+ Л/-эффект.
Реакции же нуклеофильного замещения SN протекают легко.
ПИРИДАЗИН
Пиридазин (1,2-диазин) — это бесцветная жидкость
с - 207 °C. Пиридазин и его производные получа-
ют реакцией конденсации гидразина с 1,4-дикарбо-
нильными соединениями (предельными или непре-
дельными):
малеиндиальдегид
+ h2n—nh2
пиридазин
гидразин
С минеральными кислотами и алкилгалогенидами пиридазин
образует соли по одному атому азота:
HC1
пиридазиния хлорид
СН31
N-метилпиридазиния йодид
424
Гетероциклические соединения
Подобно пиридину при действии пероксикислот образует
N-оксид:
сн,—сооон
J
СН3СООН
пиридазина N-оксид
При восстановлении или каталитическом гидрировании про-
исходит раскрытие цикла и образуется тетраметилендиамин:
h2n—сн — сн— СН — сн— nh2
Производные пиридазина применяются в качестве лекарствен-
ных препаратов и гербицидов.
ПИРАЗИН
Пиразин (1,4-диазин) — бесцветное кристаллическое
вещество с tm = 57 °C. Пиразин и его производные по-
лучают реакцией конденсации 1,2-диаминов с 1,2-ди-
карбонильными соединениями:
этилендиамин
глиоксаль
2,3-дигидропиразин
пиразин
На первой стадии образуется 2,3-дигидропиразин, который лег-
ко окисляется до пиразина.
Как и пиридазин, пиразин является слабым основанием
и образует соли с кислотами по одному атому азота, при взаимо-
действии с пероксикислотами окисляется до N-оксида:
пиразиния бромид
сн,сооон
пиразина N-оксид
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 425
При восстановлении пиразина водородом в момент выделе-
ния образуется циклический диамин — пиперазин:
пиразин пиперазин
Пиперазин — сильное основание, обладающее свойствами вто-
ричных алифатических аминов, образует соли с двумя эквивален-
тами кислоты. Пиперазина адипинат применяют как глистогон-
ное средство.
Из производных пиперазина отметим циклические амиды
а-аминокислот, которые называют дикетопиперазинами.
дикетопиперазин
а-аминоуксусная кислота
Восстановлением дикетопиперазина получают пиперазин.
ПИРИМИДИН
Пиримидин (1,3-диазин) — кристаллическое вещество
с L = 225 °C, легкорастворимое в воде, этаноле. Об-
разует соли с одним эквивалентом сильных кислот:
пиримидиния бромид
426
Гетероциклические соединения
Реакции электрофильного замещения протекают с большим
трудом, только при наличии в молекуле электронодонорных
заместителей, при этом реакция SE протекает по положению 5:
ОН
+ HNO3kohh.
\n^'-nh2
2-амино-4-гидроксипиримидин
H2SO4 конц.
2-амиио-4-гидрокси-5-нитропиримидин
Атомы азота пиридинового типа, вследствие электроноакцеп-
торного действия, обусловливают общее уменьшение электрон-
ной плотности и прежде всего в положениях 2, 4, 6, что способ-
ствует протеканию реакций нуклеофильного замещения
+ NaNH2
2 -ам инопиримидин
Пиримидин получают реакцией взаимодействия мочевины
с малоновым эфиром по следующей схеме:
малоновый эфир мочевина
барбитуровая кислота
(оксоформа)
гидроксиформа
пиримидин
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 427
Барбитуровая кислота (2,4,6-тригидроксипиримидин) являет-
ся производным пиримидина, и из нее можно его получить, дей-
ствуя трихлороксидом фосфора с последующим восстановлением.
Барбитуровая кислота
Важнейшее производное пиримидина. Это
циклический уреид малоновой кислоты, мало-
нилмочевина. Представляет собой бесцветное
кристаллическое вещество, легко растворяется
в теплой воде, трудно — в холодной. В резуль-
тате щелочного гидролиза барбитуровая кисло-
та разлагается, образуя малоновую кислоту,
NH3h СО2. Эта реакция свидетельствует о не-
ароматическом характере соединения.
CO,t + NH3t + НООС—сн,—соон
н
Группа —СН2— (метиленовая группа) в положении 5 обладает
высокой реакционной способностью. Метиленовая группа в бар-
битуровой кислоте фланкирована с обеих сторон кетогруппами,
которые повышают подвижность атомов водорода.
Барбитуровая кислота — это таутомерное вещество. Для нее
характерны два вида таутомерии: кето-енольная и лактам-лактим-
ная.
кето-енолъная туатомерия
кетонная форма енольная форма
428
Гетероциклические соединения
лактам-лактимная туатомерия
лактамная форма
лактимная форма
Таким образом, барбитуровая кислота существует в двух тау-
томерных формах: триоксоформе и тригидроксиформе:
Говоря о барбитуровой кислоте, следует отметить, что она
в 5—6 раз сильнее, чем уксусная. Кислотность барбитуровой кис-
лоты обусловлена существованием подвижных атомов водорода
в 5 положении. Если один из атомов водорода замещен на ради-
кал, то сила кислоты несколько уменьшается, при замене же двух
атомов водорода сила кислоты резко снижается.
Используя в качестве исходных продуктов производные мало-
новой кислоты, можно получить реакцией конденсации с моче-
виной целый ряд фармацевтических препаратов.
К примеру:
R = R' = С2Н5 — барбитал (5,5-диэтилбарбиту-
ровая кислота);
R = С2Н5, R’ = С6Н5 — люминал, или фенобар-
битал (5-фенил-5-этилбарбитуровая кислота).
К производным пиримидина следует отнести аллоксан, кото-
рый получается при конденсации мезоксалевой кислоты и моче-
вины.
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 429
СООН HNH
I I
с=о + с=о
СООН HNH
мезоксалевая мочевина
кислота
—2Н,0
Важными производными пиримидина являются пиримидино-
вые основания, которые входят в состав нуклеиновых кислот:
ОН
урацил,
2,4-дигидроксипирим иди н
тимин,
2,4-дигидрокси-5-метилпиримидин
ЪП4
цитозин,
4-амино-2-гидроксипиримидин
ПУРИН И ЕГО ПРОИЗВОДНЫЕ
Группа пурина включает природные продукты, не менее важ-
ные для физиологии животных и растений, чем моносахариды
или аминокислоты.
430
Гетероциклические соединения
Пурин
Пурин (имидазо[4,5-б0пиримидин) — бицикли-
ческая система, состоящая из пиримидинового
и имидазольного колец. Пурин представляет со-
бой бесцветное кристаллическое вещество ней-
трального характера, легкорастворимое в воде.
Образует соли как с кислотами, так и со щело-
чами, обладает ароматическим характером.
Амфотерность пурина связана с наличием в его структуре ими-
дазольного ядра.
HC1
NaOH
N
пурин ия хлорид
натриевая соль
пурина
Слабые кислотные свойства пурин проявляет за счет атома
азота пиррольного типа, а основные — за счет атома азота пири-
динового типа в имидазольном фрагменте молекулы.
Как и для имидазола, для пурина характерна азольная тауто-
мерия:
Важнейшими производными пурина являются оксо- и ами-
нопроизводные. К оксопуринам относятся мочевая кислота, ксан-
тин и гипоксантин.
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 431
мочевая кислота,
2,6,8-триоксолурин
ксантин,
2,6-диоксопурин
гипоксантин,
6-оксопурин
Мочевая кислота
В нормальной моче человека и животных содержится незна-
чительное количество мочевой кислоты. Основным продуктом азо-
тистого обмена является мочевина. При некоторых заболеваниях,
в частности при подагре (откладывание мочевой кислоты в виде
Na солей в суставах), увеличивается количество мочевой кислоты.
У птиц и змей мочевая кислота является главной составной час-
тью экскрементов (у змей до 90 %).
Мочевая кислота — бесцветное кристаллическое вещество,
труднорастворимое в воде, нерастворимое в этаноле и эфире. Мо-
чевая кислота — очень слабая кислота; ее нельзя обнаружить при
помощи обычных индикаторов, так как она не изменяет их цвет.
Она образует соли с одним или двумя эквивалентами однова-
лентных металлов.
Для мочевой кислоты характерна лактам-лактимная таутоме-
рия.
оксоформа, лактамная форма
гидроксиформа, лактимная форма
В кристаллическом состоянии мочевая кислота находится
в лактамной (оксо-) форме, а в растворе между лактамной и лак-
тимной формами устанавливается динамическое равновесие,
в котором преобладает лактамная форма.
432
Гетероциклические соединения
Мочевая кислота является двухосновной кислотой. Кислот-
ные свойства мочевой кислоты определяются лактимной формой.
Солеобразующими являются гидроксильные группы, находящие-
ся в положении 2 и 8. Как двухосновная мочевая кислота образует
два ряда солей — кислые и средние.
мононатриевая
соль мочевой кислоты
динатриевая
соль мочевой кислоты
Соли мочевой кислоты называются уратами. Средние соли
хорошо растворимы в воде, из кислых наиболее растворим лития
урат. Поэтому для лечения подагры применяют соли лития.
Из мочевой кислоты получают пурин.
2,6,8-триоксипурин 2,6,8-трихлорпурин
пурин
1. Строение мочевой кислоты установлено при помощи реакций
окисления'.
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 433
а) окисление азотной кислотой'.
аллоксан мочевина
Таким образом, при окислении азотной кислотой сохраняет-
ся пиримидиновое ядро, и раскрывается имидазольный цикл.
б) окисление калия перманганатом в нейтральной или щелочной
среде'.
КМпО4
+ со.
Лиг
NH
аллантоин
Эта реакция доказывает наличие в мочевой кислоте пятичлен-
ного имидазольного цикла.
2. Мурексидная проба — качественная реакция на мочевую кис-
лоту. Мочевую кислоту нагревают с концентрированной азотной
кислотой и добавляют концентрированный раствор аммиака —
наблюдается пурпурно-фиолетовое окрашивание. При этом образу-
ется аммонийная соль пурпурной кислоты следующего строения:
пурпурная кислота
мурексид,
аммонийная соль пурпурной кислоты
При частичном восстановлении мочевой кислоты образуется
ксантин.
434
Гетероциклические соединения
2,6 -диоксопурин
ксантин
Ксантин проявляет амфотерные свойства. Для него характер-
на лактам-лактимная и азольная таутомерия.
оксоформа, гидроксиформа,
лактамная форма лактимная форма
лактам-лактимная таутомерия ксантина
азольная таутомерия ксантина
Из аминопроизводных пурина отметим аденин или 6-амино-
пурин, который входит в состав нуклеиновых кислот, содержится
в печени. Окисляется азотистой кислотой до 6-оксипурина (ги-
поксантина):
ын
6-аминопурин,
HONO
аденин
ОН
6-гидроксипурин,
гипоксантин
32. Шестичленные гетероциклические соединения с двумя гетероатомами. Пурин. Алкалоиды 435
В природе встречаются N-метильные производные ксантина.
теофиллин
теобромин кофеин
Теофиллин, теобромин и кофеин относятся к алкалоидам.
Теофиллин (1,3-диметилксантин). Этот алкалоид содержится
в листьях чая. Для него возможна азольная таутомерия. Он прояв-
ляет основные свойства за счет атома азота пиридинового типа
имидазольного цикла. Применяется как диуретическое средство,
стимулятор ЦНС.
Теобромин (3,7-диметилксантин). Раньше для медицинских
целей теобромин получали из плодов дерева какао, в настоящее
время применяется синтетический теобромин. Это соединение
обладает амфотерными свойствами; основные свойства обуслов-
лены атомом азота пиридинового типа имидазольного цикла,
а лактимная форма теобромина проявляет кислотный характер.
Кофеин (1,3,7-триметилксантин). Кофеин получают из отхо-
дов при производстве чая. Он содержится в листях чая и зернах
кофе. В промышленных масштабах кофеин получают при мети-
лировании мочевой кислоты диметилсульфатом. Кофеин возбуж-
дает ЦНС, повышает кровяное давление, стимулирует сердечную
деятельность, обладает мочегонным действием.
АЛКАЛОИДЫ
Что такое алкалоиды?
Алкалоиды — это группа азотсодержащих органических соеди-
нений, преимущественно растительного происхождения, облада-
ющих основными свойствами и высокой биологической активно-
стью.
По строению большинство алкалоидов относится к гетероцик-
лическим соединениям.
Алкалоиды широко распространены в растительном мире.
Алкалоидов в алкалоидоносных растениях может содержаться
до 2 и более процентов. Они могут содержаться в различных час-
436
Гетероциклические соединения
тях растений: в коре и корневищах, листьях и цветках, а также
в стеблях и плодах.
Некоторые семейства являются наиболее богатыми по содер-
жанию алкалоидов: такие как кутровые (Аросупасеае), маковые
(Papaveraceae), бобовые (Fabaceae), сложноцветные (Asteraceae) и др.
Интересно, что некоторые семейства не содержат алкалоидов,
такие как розовые (Rosaceae), губоцветные (Lamiaceae) и др. Со-
держание алкалоидов в растениях может изменяться в процессе
роста.
Алкалоиды в растениях содержатся в большинстве случаев
в виде солей органических (реже минеральных) кислот. Чаще ал-
калоиды образуют соли со следующими кислотами: яблочной,
винной, лимонной, молочной, янтарной, роданистоводородной,
фосфорной, серной или с танином.
Алкалоиды — это кристаллические вещества, не растворимые
в воде, растворимые в органических растворителях. Они облада-
ют основными свойствами, с минеральными кислотами образуют
соли. Соли хорошо растворяются в воде и плохо в органических
растворителях. Природные алкалоиды — оптически активные со-
единения, вращают плоскость поляризованного луча влево. Обла-
дают горьким вкусом, некоторые алкалоиды применяются как
лекарственные средства.
В настоящее время из растений выделено свыше 5000 различ-
ных алкалоидов.
Для алкалоидов принята химическая классификация, в основу
которой положена природа гетероцикла, входящего в состав алка-
лоидов.
Существуют следующие основные группы алкалоидов: произ-
водные пиридина и пиперидина, хинолина, изохинолина, индо-
ла, пурина и др. Таким образом, теофиллин, теобромин и кофеин
относятся к алкалоидам группы пурина.
УГЛЕВОДЫ (САХАРА)
Понятие об углеводах впервые было введено в 1844 году рус-
ским химиком К. Г. Шмидтом. Углеводы — это соединения, ко-
торые наиболее широко представлены в природе. Они образуются
в зеленых частях растений в результате фотосинтеза — сложного
биохимического процесса, который сопровождается усвоением
солнечной энергии, воды и углекислого газа в присутствии хло-
рофилла.
СО2 + 2Н2О
- (Н—С-ОН) + Н2О + О2
Молекулы углеводов состоят из атомов углерода, водорода
и кислорода, причем соотношение атомов водорода и кислорода
такое, как в молекуле воды [Cv(H2O)J. Например, в молекуле глю-
козы С6Н12О6 [С6(Н2О)6].
Однако дальнейшее изучение строения этих соединений
и открытие веществ с составом, который не соответствует эмпи-
рической формуле, показали, что отнесение их к гидратам угле-
рода является только формальным, но принятое название углево-
ды сохранилось.
С 1927 года к углеводам относят многочисленную группу при-
родных и синтетических веществ, которые являются по химиче-
скому строению полигидроксильными соединениями, содержат
альдегидную или кетонную группы или же образуют их при гид-
ролизе.
Углеводы делятся на моносахариды — монозы (простые са-
хара), которые не гидролизуются водой, и полисахариды (слож-
ные сахара) — соединения, способные гидролизоваться до моноса-
харидов.
438
Углеводы (сахара)
Сложные углеводы, в свою очередь, классифицируются на оли-
госахариды, которые образуют при гидролизе от двух до десяти
молекул моносахаридов, и полисахариды (полиозы), которые при
гидролизе образуют более 10 молекул моносахаридов.
МОНОСАХАРИДЫ
Моносахариды представляют собой полигидроксильные соеди-
нения, которые содержат альдегидную или кетонную группы.
Их еще называют монозами, или простыми углеводами (сахарами).
Классификация и номенклатура. Моносахариды классифици-
руют с учетом двух признаков — характера оксогрупп (альдегид-
ная или кетонная) и длины углеродной цепи.
В зависимости от наличия в структуре моносахаридов альде-
гидной или кетонной групп их делят на альдозы и кетозы.
В зависимости от числа атомов углерода в молекуле среди
моносахаридов различают:
триозы (С3); пентозы (С.);
тетрозы (С4); гексозы (С6) и т. д.
Большинство природных моносахаридов являются пентозами
и гексозами.
С учетом обоих классификационных признаков существуют:
альдопеннозьг, альдогексозы;
кетопентозы; кетогексозы.
В названиях моносахаридов, как правило, используют триви-
альную номенклатуру, в которой все тривиальные названия име-
ют окончания -оза (глюкоза, фруктоза, галактоза, рибоза и т. д.).
Номенклатура ИЮ ПАК для названия углеводов не использу-
ется.
Стереоизомерия. Моносахариды — оптически активные соеди-
нения, для их классификации применяют D- и Z-стереохимиче-
скую систему названий. Принадлежность к D- или Z-стереохими-
ческому ряду определяют по конфигурации асимметрического
атома углерода, максимально удаленного от альдегидной или ке-
тонной группы (для пентоз — С4, для гексоз — С5).
Моносахариды, которые имеют сходное строение с D-глице-
риновым альдегидом, относят к D-ряду, если со строением £-гли-
церинового альдегида, то к £-ряду.
33. Моносахариды
439
[h_--ohJ
сн.он
Д'
Л-глицериновый
альдегид
ОН
IH---OHI
СН2ОН
D-глюкоза
СН2ОН
I
с=о
но—н
н—он
сн2он
Л-фруктоза
СН2ОН
/.-глицериновый
альдегид
ОН
Hl
Z-арабиноза
НО
(но
СНоОН
СН2ОН
с=о
но—н
н—он
Cho^hj
СН2ОН
£-сорбоза
Пространственные D- и L-изомеры являются энантиомерами
(оптическими антиподами). Большинство природных моносаха-
ридов относится к D-ряду.
Рассмотрим важнейшие — пентозы и гексозы.
ПЕНТОЗЫ
Л2>
сГ
J н
снон
*снон
*снон
сн,он
Среди пентоз наиболее распространенными в природе
являются альдопентозы. Общая формула альдопентоз:
Как видно из формулы, пентозы имеют 3 асиммет-
рических атома углерода. Следовательно, количество
оптических изомеров будет: 23 = 8 или они должны
иметь 4 пары антиподов.
Важнейшие представители альдопентоз:
НО----Н
НО----Н
СН2ОН
НО
—он
СН2ОН
СН2ОН
Л-рибоза
ОН
ОН
СНэОН
£-арабиноза
D-ксилоза
2 -дезокси- Л-рибоза
440
Углеводы (сахара)
ГЕКСОЗЫ
Общая формула гексоз:
СНОН
СНОН
СНОН
СНОН
СН2ОН
Гексозы содержат в структуре 4 асимметрических атома угле-
рода, то есть имеют 2=16 оптических изомеров или 8 пар энан-
тиомеров.
Важнейшие представители гексоз:
Н----ОН
Н----ОН
СН2ОН
Д-глюкоза
н—он но—Н
н—он н—он
сн2он сн2он
Р-манноза
Р-галакгоза
сн2он
Р-фруктоза
СН2ОН
£-сорбоза
альдогексозы
кетогексозы
Пространственные изомеры моносахаридов, которые отлича-
ются конфигурацией одного или нескольких асимметрических
атомов углерода, называются диастереомерами.
Диастереомеры, которые отличаются конфигурацией только
одного асимметрического атома углерода, называются эпимерами.
Сравним строение D-глюкозы и D-маннозы. Эти моносахари-
ды отличаются конфигурацией только одного — верхнего асим-
метрического атома углерода, то есть являются эпимерами.
Эпимерами также являются: £-арабиноза и D-ксилоза, D-кси-
лоза и D-рибоза, D-глюкоза и D-галактоза.
33. Моносахариды
441
6сн2он
Строение моносахаридов. Длительное время в науке существо-
вало представление, что моносахариды являются соединениями
только с открытой углеродной цепью.
Однако при более глубоком изучении их строения было уста-
новлено, что цепные формулы не объясняют некоторых химиче-
ских свойств и не объясняют таких фактов:
1. Почему моносахариды не присоединяют натрия бисульфит?
2. Почему они не дают окрашивания с фуксинсернистой кис-
лотой?
3. Чем обусловлены превращения маннозы, глюкозы и фрук-
тозы друг в друга под действием щелочей?
4. Почему у моносахаридов появляется мутаротация, которая
связана с изменением угла вращения при стоянии свежеприго-
товленных растворов? Если приготовить раствор глюкозы и по-
местить в поляриметр, то угол вращения равен 113°. Глюкоза от-
клоняет плоскость поляризованного луча света на 113°, через
2 часа—на 90°, через 3 часа — на 60° и окончательно — на 52,5°.
5. Почему при рассмотрении формулы глюкозы в ней можно
насчитать пять гидроксильных групп и только одна отличается
своей реакционной способностью?
Чтобы ответить на эти вопросы, надо познакомиться с двумя
видами таутомерии: карбонильно-ендиольной и циклооксотауто-
мерией.
Углеродный скелет молекулы моносахаридов может изгибать-
ся, приобретая форму «ухвата» (клешни). При этом альдегидная
группа и гидроксильные группы при С4 или С5 находятся на рас-
стоянии, равном примерно одной ковалентной связи, и между
ними происходит химическое взаимодействие, подобно реакции
между альдегидами и спиртами:
+ R—ОН
.ОН
R—С—OR
442
Углеводы (сахара)
Продуктами реакции являются полуацетали.
В соответствии с теорией напряжения циклов наиболее
выгодно взаимодействие, приводящее к образованию пяти- или
шестичленных циклов.
Шестичленный цикл образуется при взаимодействии альде-
гидной группы с гидроксильной группой при С5 альдогексоз или
С6 кетогексоз. Такой цикл называется пиранозным.
СН2ОН
р- D- глюкопираноза,
циклическая форма
н
но
н
н
сн.он
Ал
D-глюкоза,
оксоформа
сн2он
a-D-глюкопираноза,
циклическая форма
При взаимодействии альдегидной группы с гидроксильной
при С4 альдогексоз или С5 кетогексоз образуется пятичленный
цикл, который называется фуранозным.
СН2ОН
p-D-глюкофураноза
СН2ОН
D-глюкоза
н—он
СН2ОН
a - D-гл юкофураноза
Так образуются полуацетальные циклические формы глюко-
зы. Приведенные циклические формы моносахаридов называют-
ся формулами Колли — Толленса.
Внутримолекулярное образование полуацеталя приводит
к тому, что атом углерода карбонильной группы превращается
33. Моносахариды
443
в асимметрический. Этот новый хиральный центр называется ано-
мерным. При этом образуются два новых стереоизомера, которые
получили названия а- и Р-аномеров.
Гидроксильная группа при аномерном центре называется
полуацетальной, или гликозидной.
Формулы Колли — Толленса неудобны для изображения цик-
лических структур, более удобны для написания и понимания
проекционные формулы Хеуорса. В этом случае цик-
лические формы моносахаридов изображаются в виде плоских мно-
гоугольников с атомом кислорода в цикле.
Для того чтобы перейти от формул Колли — Толленса к фор-
мулам Хеуорса, необходимо учитывать такие правила:
1. Заместители, расположенные в формуле Колли — Толленса
слева, в формуле Хеуорса изображаются над плоскостью, а замес-
тители, расположенные справа,— под плоскостью цикла.
2. У альдоз D-ряда в пиранозной форме группа —СН2ОН,
а в фуранозной — группа —СН(ОН)СН2ОН всегда расположены
вверху, над плоскостью цикла.
СН.ОН
полуацетальный
гидроксил
°сн.он
но-
4
lOHj
он
ОН
р - D- глюкофураноза
а - D- гл юкопираноза
Аналогично изображаются с помощью формул Хеуорса пира-
нозные и фуранозные формы кетогексоз.
ОН Н
а-/)-фрукто пираноза
он н
р - D- фруктофураноза
Для изображения смеси а- и p-аномеров в формуле Хеуорса
расположение полуацетального гидроксила показывают волнистой
линией.
444
Углеводы (сахара)
ГЦ AU
н ОН
Д-глюкопираноза
Таутомерия. Циклооксотаутомерия. Моносахариды являются
таутомерными веществами. В кристаллическом состоянии они
имеют циклическое строение. В водном растворе циклическая
форма через открытую оксоформу превращается в другие цикли-
ческие формы —• пиранозные и фуранозные. Циклооксотаутоме-
рия объясняет отсутствие некоторых реакций на альдегиды.
Таким образом, в водном растворе моносахариды существу-
ют в виде пяти таутомерных форм: открытой, а- и р-пиранозных
и а- и р-фуранозных.
Такой вид таутомерии называется циклооксотаутомерией, или
кольчато-цепной.
Переход одной формы в другую происходит непрерывно.
В определенный момент наступает динамическое равновесие, при
котором количество всех форм становится постоянным.
НО
СН2ОН
a- D- глюкофураноза
СН2ОН
а-Д-глюкопираноза
p-D-глюкофураноза
сн,он
р - D- глюкопираноза
В равновесной смеси преобладают пиранозные формы: ~ 63 %
Р-Р-глюкопиранозы и 36 % a-D-глюкопиранозы. Фуранозные фор-
33. Моносахариды
445
мы и открытая форма присутствуют в очень маленьких количе-
ствах.
Способность моносахаридов к циклооксотаутомерии объясняет
явление мутаротации.
Мутаротация — это изменение величины угла удельного вра-
щения свежеприготовленных растворов оптически активных со-
единений.
Вначале в свежеприготовленном растворе глюкозы наблюда-
ется величина угла удельного вращения 113° (a-D-глюкопирано-
за), через некоторое время величина угла становится равной +52,5°
и остается неизменной, что есть результатом установившегося
динамического равновесия между пятью таутомерными формами
моносахаридов.
Карбонильно-ендиольная таутомерия. Как известно, альдегид-
ная группа проявляет электроноакцепторные свойства (— I-
и -ЛУ-эффекты), это вызывает поляризацию связи С\—С2, атом
водорода при С2 становится подвижным и мигрирует к атому кис-
лорода карбонильной группы. При этом образуется ендиольная
форма.
НО
ОН
ОН
ОН
СН2ОН
Д-глюкоза,
карбонильная форма
ендиольная
форма
ОН
он
СН2ОН
D-манноза
Такие превращения протекают в слабощелочной среде. В ен-
диольной форме при двойной связи имеются две равноценные
гидроксильные группы. Согласно правилу Эльтекова, гидроксиль-
446
Углеводы (сахара)
ная группа не может находиться при атоме углерода с двойной
связью, вследствие р, тг-сопряжения. В зависимости от того, ка-
кой гидроксил в данный момент времени будет вступать в сопря-
жение, образуются либо альдегидная, либо кетонная формы мо-
носахаридов. Ендиольная форма является общей для эпимеров.
Она едина для эпимерных моносахаридов D-глюкозы и D-манно-
зы и изомерной им D-фруктозы.
Физические свойства. Моносахариды — это бесцветные крис-
таллические вещества, растворимые в воде, спирте, не растворя-
ются в эфире. Большинство из них сладкие на вкус, но встреча-
ются и горького вкуса.
Способы получения. 1. Кислотный гидролиз полисахаридов яв-
ляется важнейшим способом получения моносахаридов:
лН,0; Н+
(С6Н|0О;)„ —:------ лС6Н12О6
крахмал глюкоза
2. Окисление многоатомных спиртов. При окислении пятиатом-
ных спиртов образуются пентозы, а шестиатомных — гексозы.
СН2ОН
I А.
(СНОН)4
СН2ОН
гексит
(СНОН)4
СН2ОН
альдогексоза
Химические свойства моносахаридов. Являясь полигидроксикар-
бонильными соединениями, моносахариды проявляют свойства
карбонильных соединений, многоатомных спиртов и цикличе-
ских полуацеталей.
Химические превращения в ряду моносахаридов можно ус-
ловно разделить на две группы:
— реакции при участии открытых форм моносахаридов;
— реакции при участии циклических форм.
А. Реакции открытых форм моносахаридов. 1. Общая реакция
на углеводы (проба Молиша). При действии на углеводы концен-
трированной H2SO4 и а-нафтола образуется фиолетовое окраши-
вание.
2. Отношение к действию минеральных кислот (внутримолеку-
лярная дегидратация). Альдопентозы при нагревании с минераль-
ными кислотами (НС1, H,SO.) образуют фурфурол, который
*т
33. Моносахариды
447
с анилином дает красное окрашивание, а с флороглюцином —
кристаллический осадок.
альдопентоза
HC1; t
-ЗН,О
фурфурол
При взаимодействии альдогексоз с минеральными кислотами
выделяется 3 молекулы Н2О, и образуется нестойкий 5-гидрокси-
метилфурфурол, который разлагается с образованием муравьиной
и левулиновой кислот:
HCl; t
ГЛ
ЧЮНХ'^'су '
альдогексоза
2
- нсоон + сн3
муравьиная
кислота
С—СН— СН — СООН
о
левулиновая кислота
5-Гидроксиметилфурфурол дает красное окрашивание с резор-
цином. Данная реакция имеет аналитическое значение и позво-
ляет отличить пентозы от гексоз.
3. Специфическая реакция на кетозы (реакция Селиванова).
Кетозы легче, чем альдозы, превращаются в 5-гидроксиметил-
фурфурол, который является нестойким соединением. Он взаи-
модействует с резорцином в среде хлороводородной кислоты
в момент выделения (реакция in statum nascendi) с образованием
вишнево-красного окрашивания.
Альдозы эту реакцию дают, но в течение длительного времени.
4. Окисление. Моносахариды легко окисляются, но, в зависи-
мости от природы окислителя и условий окисления, образуются
разные продукты.
Окисление в кислой и нейтральной средах. При действии слабых
окислителей (бромной воды или разбавленной азотной кислоты)
альдозы окисляются до одноосновных альдоновых кислот.
448
Углеводы (сахара)
но
но
ОН
он
он
сн.он
Вг2+Н2О
(НВгО)
НО
он
ОН
ОН
СНэОН
D-глюкоза
D-глюконовая кислота
Сильные окислители, такие как концентрированная азотная
кислота, окисляют в молекуле альдоз альдегидную группу и пер-
вичный спиртовый гидроксил с образованием дикарбоновых гид-
роксикислот, которые называются альдаровыми, или сахарными
кислотами:
НО
--он
—он
сн.он
HNO3 конц.
но
СООН
он
он
он
СООН
D-глюкоза
D-глюкаровая кислота,
D-сахарная кислота
При избирательном окислении в молекуле альдозы первичной
спиртовой группы без участия очень склонной к окислению аль-
дегидной группы образуются уроновые кислоты.
Окисление в этом случае проводят, предварительно защитив
альдегидную группу.
Окисление в щелочной среде. Подобно альдегидам, моносахариды
окисляются аммиачным раствором серебра оксида (реактив Тол-
ленса), меди (II) гидроксидом в щелочной среде (реактив Тромме-
ра) или же реактивом Фелинга. При окислении в щелочной среде
моносахариды расщепляются до смеси продуктов окисления.
альдоза
+ [Ag(NH3)JOH
реактив Толленса
Agl
продукты
окисления
альдоза
+ Си2+ (комплекс)
Си3О| +
продукты
окисления
реактив Фелинга
Эти реакции являются качественными на альдозы и кетозы.
33. Моносахариды
449
5. Восстановление. При восстановлении моносахаридов водо-
родом в присутствии катализатора (Ni, Pd) образуются многоатом-
ные спирты.
Из D-глюкозы образуется D-сорбит, из D-маннозы — D-ман-
нит, из D-ксилозы — D-ксилит и т. д.
НО
ОН
СН2ОН
он
[Н]
он
он
СНэОН
НО
ОН
он
сн.он
Д-глюкоза
D-сорбит
Фруктоза при восстановлении образует смесь двух шестиатом-
ных спиртов D-сорбита и D-маннита.
СН2ОН
I *
с=о
но-1- н
н—он
СН2ОН
—ОН
[Н]
НО
СНЮН
но
но
н-^-он
сн2он
—ОН
—он
СН2ОН
D-сорбит
он
он
СН2ОН
D-маннит
6. Реакции с участием оксогруппы. Альдозы, подобно альдеги-
дам, легко вступают в реакцию с циановодородной кислотой
с образованием циангидринов. При взаимодействии с гидроксил-
амином образуются оксимы.
HC=N—ОН
НО
ОН
ОН
ОН
СНэОН
NH,OH
-н2о
HCN
—он
—он
СН2ОН
Н—|—ОН
СН2ОН
циангидрин
(гидроксинитрил)
глюкозы
ОКСИМ
глюкозы
глюкоза
450
Углеводы (сахара)
Взаимодействие с фенилгидразином (образование озазона). При
нагревании моносахаридов с фенилгидразином в соотношении
1 : 3 образуются бмс-фенилгидразоны, которые получили назва-
ние озазонов:
HC=N—NH—С6Н5
C=N—NH—C6H5
НО
—ОН
—ОН
СН.ОН
3C6H5NHNH2
-C6H5NH2; -NH3;
-2Н,О
НО--Н
ОН
H-j-OH
СН2ОН
Н
Р-глюкоза
но
ОН
н c6h-nhnh2 но
ОН
ОН
сн.он
-Н2О
озазон глюкозы
н
он
но
D-глюкоза
ОН
ОН
СН2ОН
ОН
он
СНоОН
фенилгидразон глюкозы
HC=NH
HC=N—NH—CH
но—н
—он
—он
СНоОН
2С6Н5—NHNH,
-H2O; -NHj
НО
моноимин
ОН
ОН
СН2ОН
озазон
Эпимеры D-глюкоза и D-манноза и изомерная им фруктоза
образуют один и тот же озазон.
Образование озазона используется для определения подлин-
ности моносахаридов.
Б. Реакции при участии циклической формы. 1. Образование
гликозидов. Моносахариды, являясь циклическими полуацеталя-
33. Моносахариды
451
ми, реагируют в присутствии кислотного катализатора со спирта-
ми и фенолами с образованием циклических ацеталей —- глико-
зидов.
СНпОН
сн.он
a-D-глюкопираноза
метил-а-Л-глюко-
пиранозид
СН2ОН
н 2—°чосн3
|/Н \|
|\ОН н/
НО ]—f Н
н он
метил-р - Л-ряюко-
лиранозид
Называют гликозиды по названию циклических форм моно-
сахаридов с изменением окончания -оза на -озид. Например, глю-
копиранозид, глюкофуранозид.
Гликозиды построены по типу простых эфиров. Молекулы гли-
козидов состоят из сахарной части и агликона (несахарная часть).
Гликозиды широко представлены в растительном мире, являются
важными биологически активными соединениями. Примером
могут быть сердечные гликозиды, флавоноиды и др.
В названии гликозида должно быть отражено все: исходный
моносахарид, величина цикла, конфигурация, радикал (несахар-
ная часть), его расположение.
Например:
несахарная часть (агликон)
НО
ОН !
сахарная часть
СН2ОН
° ОСН
ОН 1
НО
СН.ОН I
ОН
метил-a-D- глюкопиранозид
метил-р-Л-глюкопиранозид
Окончание -ид указывает на отсутствие в молекуле свободного
полуацетального гидроксила.
Гликозиды фуранозного строения приблизительно в 100 раз
менее стойки, чем гликозиды пиранозного строения.
Гликозиды устойчивы к действию щелочей, но в водных рас-
творах кислот они гидролизуются.
452
Углеводы (сахара)
СН2ОН
Н+; НОН
-СН3ОН
ГН пн
Н ОН
При гидролизе происходит расщепление гликозида на агликон
и сахарный компонент и образуется смесь а- и p-аномеров глю-
копиранозы.
Гликозиды не способны мутаротировать.
В природе встречаются самые различные гликозиды. В каче-
стве агликонов могут быть кислородсодержащие соединения, сте-
роиды и моносахариды. Связь агликона с аномерным атомом уг-
лерода осуществляется через атом кислорода, поэтому такие
гликозиды называются О-гликозидами. N-гликозиды содержат
в качестве агликона остатки алифатических, ароматических ами-
нов или N-содержащих гетероциклических аминов. S-гликозиды —
производные тиоспиртов и тиофенолов.
2. Алкилирование. При взаимодействии моносахаридов с гало-
геналканами или диметилсульфатом (CH3)2SO4 алкилированию
подвергаются все гидроксильные группы, включая и полуацеталь-
ный гидроксил. В кислой среде такие соединения гидролизуются
только по гликозидной связи:
сп пц
а-Л-глюкопираноза
5CH3I
BaO
сн,осн
ОСН, н
осн
оснз“БГБЙ
метил -2,3,4,6-тетраметил-Д- глюко-
пиранозид
СН2ОСН3
2,3,4,6-тетраметил-Д-глюко-
пираноза
3. Ацилирование. При ацилировании моносахаридов ангидри-
дами карбоновых кислот легко образуются сложные эфиры по всем
гидроксильным группам:
33. Моносахариды
453
СН2ОН
5(СН3СО)2О
CH^COONa
a-D- глюкопиран оза
СН.ОАс
ОАс + 5СН,СООН
АсО
Н ОАс
пентаацетилглюкопираноза
где Ас = CFLCO.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
К производным моносахаридов относятся аскорбиновая кис-
лота (витамин С) и глюкозамин — представитель аминосахаров.
Витамин С (аскорбиновая кислота). В промышленности ас-
корбиновую кислоту получают из D-глюкозы.
D-глюкоза
[Н]
СН2ОН
н—он
СН2ОН
н—I—он
но—н
н—он
н—он
СН2ОН
[О]
но
он
с=о
СН2ОН
D-сорбит
£-сорбоза
но
н
но
сн2он
с=о
—н
— он
— н
сн2он
но——н
СН2ОН
2 - кето-Z - гул оновая
-Н2О
О
С____
аС—ОН
₽ С—ОН I
I
уСН---
£-сорбоза
но
СН2ОН
аскорбиновая кислота
кислота
Для удобства формулу аскорбиновой кислоты принято изоб-
ражать таким образом:
454
Углеводы (сахара)
кислотный
центр
Аскорбиновая кислота представляет собой-у-лактон-2,3-дигид-
ро-£-гулоновой кислоты. Соединение проявляет кислотый харак-
тер за счет одной из ОН-групп.
Витамин С содержится в шиповнике, лимонах, капусте, апель-
синах и других продуктах, играет большую роль в жизнедеятель-
ности организма.
Потребность в витамине С для человека — 50—70 мг в сутки.
Его недостаток в организме снижает сопротивляемость к инфек-
ционным заболеваниям.
Глюкозамин (2-дезокси-2-аминоглюкопираноза). Это основная
часть полисахарида хитина. Из этого полисахарида построены
панцири черепахи, рака и др. Он входит в состав антибиотика
стрептомицина.
Это сильное основание, которое с минеральными кислотами
образует соли.
ДИ- И ПОЛИСАХАРИДЫ
ДИСАХАРИДЫ
Дисахаридами называют углеводы, молекулы которых состоят
из двух остатков моносахаридов одинаковой или разной приро-
ды, соединенных между собой гликозидной связью.
Дисахариды легко гидролизуются в кислой среде с образова-
нием двух молекул моносахаридов. В зависимости от способа об-
разования гликозидной связи, дисахариды разделяют на две груп-
пы — восстанавливающие и невосстанавливающие.
В восстанавливающих дисахаридах гликозидная связь образу-
ется с участием полуацетального гидроксила одной молекулы
моносахарида и спиртового гидроксила другой молекулы, чаще
всего при С4. Таким образом, дисахарид имеет свободную глико-
зидную гидроксильную группу и, следовательно, обладает вос-
станавливающими свойствами. В свежеприготовленных растворах
таких дисахаридов наблюдается явление мутаротации. Предста-
вителями восстанавливающих дисахаридов является мальтоза, цел-
лобиоза, лактоза.
Номенклатура дисахаридов является сложной. Название обра-
зуется по типу О-замещенных производных моносахаридов, исходя
из названия восстанавливающего звена с указанием всех имеющих-
ся заместителей. Наиболее употребительны тривиальные названия
дисахаридов, обычно связанные с источником их получения.
Мальтоза
Молекула мальтозы (солодового сахара) состоит из двух остат-
ков a-D-глюкопиранозы, связанных 1,4-гликозидной связью.
СН,ОН СН.ОН
а- D-гл юкоп ираноза
а-мальтоза,
4-О-(а-2)-глюкопиранозидо)а-£>-глюко-
пираноза
456
Углеводы (сахара)
В растворе мальтоза существует в нескольких таутомерных
формах — а- и ^-циклической и альдегидной. По свойствам маль-
тоза напоминает глюкозу. Она мутаротирует, дает положитель-
ную реакцию с реактивом Толленса и реактивом Фелинга. С уча-
стием альдегидной формы вступает в реакции с фенилгидразином,
гидроксиламином, циановодородной кислотой. При окислении
бромной водой превращается в мальтобионовую кислоту.
СН2ОН СН2ОН
5 " 4ы*
н он н он
мальтоза
СН2ОН СН2ОН
н он н он
мальтобионовая кислота
За счет полуацетального гидроксила мальтоза образует гли-
козиды.
СН2ОН
Н ОН
СН2ОН
н он
он
сн2он СН2ОН
Н он н он
метилмальтозид
мальтоза
С участием циклических форм мальтоза, аналогично моноса-
харидам, образует простые и сложные эфиры по всем гидроксиль-
ным группам.
СН2ОСН3 СН2ОСН3
Н ОАс Н ОАс
34. Ди- и полисахариды
457
Целлобиоза
Целлобиоза — это изомер мальтозы, состоящий из двух остат-
ков P-D-глюкопиранозы, связанных гликозидной связью в поло-
жении 1,4.
Н ОН Н ОН
р-Д-глюкопираноза
н он н он
Р-целлобиоза,
4- О - (р - D- глюкопиранозидо) р - Д-гл юко -
пираноза
В растворе целлобиоза существует в нескольких таутомерных
формах — а- и ^-циклической и альдегидной. Целлобиоза — восста-
навливающий дисахарид (дает реакцию с раствором Толленса и Фе-
линга). Для нее характерны реакции с фенилгидразином, гидро-
ксиламином, циановодородной кислотой. При окислении в мягких
условиях превращается в целлобионовую кислоту. За счет полуаце-
тального гидроксила образует гликозиды. По всем гидроксильным
группам образует простые и сложные эфиры.
Целлобиоза и мальтоза имеют разное пространственное стро-
ение. В молекуле целлобиозы один остаток глюкозы по сравне-
нию с мальтозой повернут на 180°.
Целлобиоза легко растворяется в воде, но не расщепляется
в организме человека и поэтому не может быть использована
в качестве продукта питания.
Лактоза
Молекула лактозы (молочного сахара) состоит из остатков
р-D- галакто пиранозы и D- глюкопиранозы, связанных 1,4-глико-
зидной связью.
СН7ОН СНэОН СНэОН СН.ОН
н ОН н ОН н ОН н он
р- D- галактопираноза р-Д- глюкопираноза
Р-лактоза,
4-0’(р-Д-галактопиранозидо)р-Д-глюко-
пираноза
458
Углеводы (сахара)
В растворе существует в нескольких таутомерных формах —
а- и p-циклической и альдегидной. Лактоза восстанавливает рас-
твор Фелинга и реактив Толленса. Ряд реакций обусловлен также
наличием потенциальной альдегидной группы: образование фе-
нилгидразона и других производных. При окислении концевой
альдегидной группы лактозы образуется лактобионовая кислота.
Лактоза гидролизуется под влиянием кислот и ферментов —
р-галактозидаз (лактаз), содержащихся в некоторых видах бакте-
рий и грибов, а также в кишечнике млекопитающих. Спиртовому
брожению лактоза не подвергается, она сбраживается молочно-
кислыми бактериями, под влиянием которых вначале гидролизу-
ется, а затем превращается в молочную кислоту. Лактоза является
важнейшим углеводным компонентом молока млекопитающих.
В коровьем молоке содержится до 4,5 % лактозы, в женском
молоке — до 7,5 %. Производят лактозу из молочной сыворотки,
которая является отходом при изготовлении масла и сыра. При-
меняют лактозу в технологии лекарств как наполнитель в порош-
ках, таблетках и экстрактах. Сладость в 4—5 раз меньше, чем
у сахарозы, и как заменитель сахара ее не используют.
В невосстанавливающих дисахаридах гликозидная связь обра-
зуется за счет полуацетальных (гликозидных) гидроксилов обоих
моносахаридов.
Эти дисахариды не имеют свободного полуацетального гидро-
ксила. Поэтому в растворах они существуют только в цикли-
ческой форме, их растворы не мутаротируют и не обладают вос-
станавливающими свойствами (не дают реакцию «серебряного
зеркала»).
Такие дисахариды не дают реакций по альдегидной группе
и гликозидному гидроксилу. Они способны лишь к образованию
простых и сложных эфиров. Представителем невосстанавливаю-
щих дисахаридов является сахароза.
Сахароза
Молекула сахарозы (тростникового или свекловичного саха-
ра) состоит из остатков oc-D-глюкопиранозы и р-Р-фруктофура-
нозы. Гликозидная связь в сахарозе соединяет аномерные атомы
углерода обоих сахаров, причем гликозидный гидроксил у глюко-
зы находится в a-положении, а у фруктозы — в р-положении.
Сахароза не образует анамеров.
34. Ди- и полисахариды
459
6сн2он
ОН Н
сахароза
Исходя из химической структуры, сахарозу можно назвать как
a-D-глюкопиранозидо-р-Л-фруктофуранозид.
Сахароза содержится в сахарной свекле, сахарном тростнике,
в соках различных плодов, откуда ее и получают. В растениях
сахароза служит растворимым резервным сахаридом, а также той
транспортной формой, которая легко переносится по растению.
Растворы сахарозы оптически активны [а^° = +66,5°], мутаро-
тации не наблюдается, и они не проявляют восстанавливающих
свойств.
Сахароза при кипячении водных растворов в присутствии кис-
лот или при действии ферментов гидролизуется с образованием
смеси глюкозы и фруктозы. При этом происходит изменение зна-
ка удельного вращения, то есть характерное для сахарозы враще-
ние плоскости поляризации вправо [ос = +66,5°] изменяется на
левое вращение [а20 = -39,5°]. Процесс изменения знака удельно-
го (оптического) вращения по величине и знаку в процессе гид-
ролиза называется инверсией. Образующаяся в процессе гидроли-
за смесь равных количеств D-глюкозы и D-фруктозы называется
инвертным сахаром. Инвертный сахар является основной частью
пчелиного меда.
Сахароза легко расщепляется ферментативно в организмах че-
ловека и животных под действием фермента сахаразы.
Сахароза является ценным пищевым продуктом и исходным
сырьем для получения этилового спирта. В виде стеарата сахароза
нашла применение как эмульгатор и стабилизатор лекарственных
препаратов.
460
Углеводы (сахара)
ПОЛИСАХАРИДЫ
К полисахаридам относятся соединения, молекулы кото-
рых содержат более десяти моносахаридных звеньев, связанных
О-гликозидной связью.
Чаще всего полисахариды состоят из нескольких сотен и даже
тысяч моносахаридных остатков, образующих линейные или раз-
ветвленные полимерные цепи.
Полисахариды, построенные из моносахаридных звеньев одного
типа, называются гомополисахаридами (гомогликанами), а постро-
енные из различных моносахаридных звеньев — гетерополисаха-
ридами (гетерогликанами). Оба полимера могут быть линейными
или разветвленными.
Гомополисахариды (гомогликаны), построенные из остатков пен-
тоз, называются пентозанами, из остатков гексоз — гексозанами.
Подавляющее большинство природных полисахаридов —- гексо-
заны. К ним относятся крахмал, целлюлоза, гликоген, декстра-
ны и др.
Крахмал
Крахмал является неоднородным полисахаридом, состоит из
20 % растворимой в воде фракции, называемой амилозой, и около
80 % нерастворимой фракции, называемой амилопектином. Они
отличаются друг от друга химическим строением.
Амилоза — линейный полимер, в котором а-7)-глюкопираноз-
ные остатки связаны а-1,4-гликозидной связью, состоит из 200—
350 мономерных звеньев:
СН ПП Г'Ы пи
34. Ди- и полисахариды
461
Амилопектин — полимер разветвленной структуры, который мо-
жет содержать 1000 и более остатков D-глюкозы в молекуле.
В цепи полисахарида остатки глюкозы соединены а-1,4-гли-
козидными связями, а боковые ответвления связаны с основной
цепью а-1,6-гликозидными связями.
Амилоза при действии 12 образует комплексное соединение,
окрашенное в синий цвет. На этом свойстве крахмала основано
использование его в качестве индикатора.
Амилопектин связывает 12 в незначительных количествах
с образованием красного окрашивания.
Крахмал в воде набухает, но не растворяется. При нагревании
крахмала с разбавленной H2SO4 образуется a-D-глюкопираноза:
(С6Н10О5)„
(С6Н10О5)х—»-С12Н22ОИ
С6Н12О6,
декстрин
мальтоза а-Д-глюкопираноза
где п = 6000, М м. = 1 000 000.
Декстрин — это растворимый крахмал, он восстанавливает ре-
актив Фелинга.
Крахмал служит основным источником резервной энергии в рас-
тениях; встречается главным образом в семенах, клубнях, корнях.
В природе встречается животный крахмал, который называет-
ся гликогеном. Этот полисахарид снабжает организм глюкозой при
повышенных физических нагрузках и в промежутках между при-
емами пищи. Гликоген построен так же, как и растительный крах-
мал, но он на 100 % состоит из амилопектина и представляет
собой еще более разветвленную структуру. Гликоген — важней-
ший резервный полисахарид животного мира. Он содержится
в печени и мышцах.
Целлюлоза
Молекула целлюлозы (клетчатки) представляет собой линей-
ную цепь, состоящую из остатков ₽-D-глюкопиранозы, связан-
ных между собой |3-1,4-гликозидной связью:
Г'Ы ПИ ГН пи
Н ОН
ОН
р-Л-глюкопираноза
462
Углеводы (сахара)
сн,он
СНэОН
СНпОН
но
он
он
он
п
Целлюлоза — широко распространенный в природе полисаха-
рид, являющийся составной частью оболочек растительных клеток.
Крахмал — это энергетический материал, клетчатка — опор-
ный материал. Чистая целлюлоза — это молодые клетки. В про-
цессе старения клеток в них появляются пектиновые вещества,
лигнин и др.
В клеточных стенках растений целлюлоза составляет 40—50 %,
а в таком важнейшем сырье, как хлопковое волокно, — 98 %.
Природная целлюлоза обладает высокой механической проч-
ностью, устойчива к химическому и ферментативному гидролизу.
Клетчатку7 получают из древесины, обрабатывая ее кальция
бисульфитом или щелочью. Все сопутствующие вещества раство-
ряются в щелочах, а клетчатка как гликозид, стойкий к щелочам,
остается в неизменном виде, ее промывают водой и сушат.
Клетчатка не растворяется ни в воде, ни в органических рас-
творителях, но растворяется в аммиачном растворе меди гидро-
ксида (реактив Швейцера — Cu(NH3)4(OH)2).
Клетчатка с 12 не дает окрашивания. Растворяется в растворах
сильных кислот, таких как H2SO4 и Н3РО4. Если сернокислый
раствор вылить в воду, то образовавшаяся масса, называемая ами-
лоидом, уже будет давать с 12 окрашивание. На этом свойстве ос-
нован способ получения пергамента. Обыкновенную бумагу опус-
кают в 70 %-ный раствор H2SO4, а затем в Н2О. Образовавшийся
амилоид затягивает поры бумаги, и образуется водонепроницае-
мая бумага.
При гидролизе целлюлозы водным раствором серной кислоты
получают раствор глюкозы, который после связывания серной
кислоты используют для получения этилового спирта (гидролиз-
ный спирт).
(С6Н|0О5)„ (С6Н10О5),„ — С|2Н22О„ С6Н12О6
амилоид целлобиоза р-Л-глюкопираноза
В качестве пищевого продукта целлюлоза не может быть ис-
пользована, так как в организме человека отсутствуют ферменты,
34. Ди- и полисахариды
463
расщепляющие целлюлозу до глюкозы. В этом состоит принци-
пиальное отличие целлюлозы от крахмала.
Бактерии, живущие в пищеварительном тракте жвачных жи-
вотных (коров, овец и др.), вырабатывают фермент, расщепляю-
щий целлюлозу до глюкозы. Поэтому жвачные животные могут
питаться продуктами, содержащими целлюлозу.
Целлюлозу используют для изготовления различных сортов бу-
маги (в том числе фотографической) и картона, химической пере-
работки на искусственные волокна (ацетатные, вискозные, мед-
ноаммиачные), пластмассы (этролы), пленки полимерные, кино-,
фотопленки, лаки и эмали, бездымный порох, моющие средства.
К гомополисахаридам относится декстран — полисахарид бак-
териального происхождения, построенный из остатков а-Л-глю-
копиранозы. Получают декстран из сахарозы при участии бакте-
рий Leoconostoc mesenteroides. Частично гидролизованные декстраны
используют в фармации в производстве плазмозаменителей поли-
глюкин и реополиглюкин.
Инулин
Инулин — полигликан глюкозы, содержится в клубнях слож-
ноцветных и других растений. Молекула инулина имеет линейное
строение и состоит из остатков 0-D-фруктофуранозы. Использу-
ется как заменитель крахмала в питании диабетиков.
ТЕРПЕНЫ
Терпены — группа липидов или жироподобных веществ при-
родного происхождения, которая включает в себя терпеновые уг-
леводороды и их кислородсодержащие производные (спирты, аль-
дегиды, кетоны), называемые терпеноидами.
Терпеновые углеводороды построены из фрагментов изопрена:
СН3
СН2; (С5Н8)„,
где п — число изопреновых фрагментов, которых обычно бывает
от 2 до 8.
Связывание молекул изопрена происходит по принципу «го-
лова к хвосту» (изопреновое правило, сформулирован-
ное в 1921 году Л. Ружичкой), которое позволило выяснить строе-
ние многих терпенов и родственных им соединений.
СН
изопрен
оцимен
Натуральный каучук также можно считать терпеном. Однако
изопрен, который является родоначальником класса терпенов (п = 1),
не принято относить к терпенам.
Классификация терпенов. 1. По количеству изопреновых звеньев
терпены подразделяют на следующие ряды:
— монотерпены, или собственно терпены (п = 2; соединения,
содержащие 2 изопреновых фрагмента);
35. Терпены
465
— сесквитерпены (п = 3, название произошло от сескви — пол-
тора) ;
— дитерпены (п = 4);
— тритерпены (п = 6);
— тетратерпены (п = 8);
— политерпены (л > 8).
2. По наличию или отсутствию циклов, по количеству имею-
щихся циклов каждый из вышеприведенных рядов подразделяется
на следующие группы:
Природные источники терпенов. В природе терпены встречают-
ся в растениях и входят в состав эфирных масел. Кроме терпенов
в эфирных маслах находятся вещества самой разнообразной струк-
туры: спирты, альдегиды, сложные эфиры и др.
По консистенции эфирные масла походят на масла, хотя по хи-
мическому строению таковыми не являются. В отличие от жирных
масел, эфирные масла — летучие жидкости. Они полностью испа-
ряются, не оставляя жирных пятен. Свое название эфирные мас-
ла получили благодаря их свойству обладать приятным запахом.
АЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
В основе углеродного скелета ациклических терпенов лежат
структуры изомерных димеров изопрена — оцимена и мирцена:
9 7 6 5 4 3 2 1
Н7С=С-СНт-СНгСН=С-СН=СН2
2 I 2 1 । А
сн. сн3
8 3
оцимен,
3,7’диметилоктатриен-1,3,7
466
Углеводы (сахара)
мирцен,
СН
7-метил-З-метиленоктадиен-1,6
При написании терпеноидов широко применяются общепри-
нятые формулы, в которых показан только углеродный скелет без
отражения алкильных заместителей.
Мирцен содержится в эфирном масле лавра благородного и хме-
ля обыкновенного, а оцимен — в эфирном масле базилика обык-
новенного, васильков и др.
Производные этих монотерпенов — гераниол и нерол — со-
держатся в эфирном масле розы и герани и являются геометри-
ческими изомерами. При их окислении получают альдегиды —
цитраль А и цитраль В — природные компоненты лимонного масла.
В кислой среде нерол легко циклизуется в а-терпинеол:
гераниол,
цыс-3,7-диметилоктадиен-2,6-ол-1
СН2ОН
нерол,
т/?онс-3,7-диметилоктадиен-2,6-ол-1
[О]
-Н,0
а-терпинеол
цитраль А, гераниаль, цитраль В, нераль,
1{ыс-3,7-диметил-2,6-октадиеналь /п/?д//с-3,7-диметил-2,6-октадиеналь
Смесь цис- и мрднс-изомеров цитраля — желтая маслянистая
жидкость с антисептическим, болеутоляющим, противовоспали-
тельным действиями, используется в офтальмологии; наряду с ге-
35. Терпены
467
раниолом и неролом применяется как отдушка в парфюмерно-
косметической промышленности.
Цитраль отпугивает некоторые виды муравьев, используется
как репеллент (лат. repello — отпугиваю).
МОНОЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
Лимонен и ментан — наиболее важные представители моно-
циклических терпенов.
МЕНТАН
7
4
8СН
ю / \ 9
сн3 сн3
или
Ментан — родоначальник группы моноциклических терпено-
идов, в природе в свободном виде не встречается. Он может быть
получен гидрированием лимонена или л-цимола. Ментан — жид-
кость со свойствами предельных циклических углеводородов.
ЛИМОНЕН
или
Лимонен — жидкость, обладающая
свойствами непредельных углеводо-
родов. (-)-Лимонен и его рацемат
входят в состав скипидара, эфирных
масел хвойных деревьев, (+)-лимо-
нен — в эфирное масло цитрусовых
(до 90 %), бергамота, тмина, сель-
дерея. Лимонен обусловливает запах
лимонного масла, из которого и был впервые получен.
Лимонен имеет один асимметрический атом углерода и суще-
ствует в виде двух зеркальных изомеров. Рацемическую форму —
(±)-лимонен (дипентен) — получают изомеризацией изопрена
468
Углеводы (сахара)
1 11 — "Ч
(С. В. Лебедев, 1908-1913 гг.) или при сухой перегонке каучука.
При 500—700 °C происходит обратный процесс — крекинг дипен-
тена.
Получение:
изопрен
150 °C; р
•*—
500-700 °C
лимонен,
ментадиен-1,8
Химические свойства. Как ненасыщенное соединение лимонен
способен вступать в реакции гидратации, гидрирования. При де-
гидратации лимонена образуется и-цимол (4-изопропилтолуол).
Pd
-2Н
терпингидрат,
ментадиола-1,8 моногидрат
ментан,
1 -изопропил-4-метилциклогексан
гексагидроцимол
При нагревании терпина в присутствии кислоты образуются
изомерные а- и р-терпинеолы:
35. Терпены
469
терпин
а-терпинеол,
ментен-1 -ол-8
₽-терпинеол,
ментен-8-ол-1
Ментадиол — двухатомный спирт, его моногидрат под назва-
нием терпингидрат проявляет антисептическое, слабое мочегон-
ное действие, используется как отхаркивающее средство.
В парфюмерно-косметической промышленности используют-
ся а-терпинеол с запахом сирени и р-терпинеол с запахом ландыша.
МЕНТОЛ
Из кислородсодержащих про-
изводных ментана большое
значение имеет ментол (л-мен-
танол-3) — основной ком-
ОН понент эфирного масла мяты
перечной. Соединение имеет
три асимметрических центра
и может существовать в виде
восьми оптических изомеров. Наибольшее значение из изомеров
имеет (-)-ментол, у которого гидроксильная, метильная и изопро-
пильная группы размещены экваториально. Такой изомер обладает
специфическим запахом, антисептическим действием и вызывает
характерное чувство холода при действии на кожу.
Получение. Ментол можно получить вымораживанием мятно-
го масла или восстановлением (-)-ментона, содержащегося до
20 % в эфирном масле мяты:
ментон
[Н]
ментол
(±)-Ментол в промышленности получают алкилированием
л/-крезола по реакции Фриделя—Крафтса с последующим катали-
тическим гидрированием образующегося тимола:
470
Углеводы (сахара)
^w-крезол тимол, (±)-ментол
2-изопропил-4-метилфенол
Химические свойства. Ментол — вторичный циклический спирт,
при взаимодействии с изо валериановой кислотой образует слож-
ный эфир:
ментилизовалерианат,
ментиловый эфир изовалериановой кислоты
Ментол — твердое кристаллическое вещество с запахом мяты,
используется как слабое антисептическое, успокаивающее, обез-
боливающее средство в составе лекарственных веществ (боромен-
тол, пектусин и др.), 30%-ный раствор ментола в ментилизовале-
рианате под названием валидол используют при стенокардии.
Ментол применяют в кондитерской и парфюмерно-косметиче-
ской промышленности.
БИЦИКЛИЧЕСКИЕ ТЕРПЕНЫ
Чаще всего в основе строения терпеноидов этой группы лежат
четыре структуры:
пинан,
2,6,6-триметил-
бицикл о [ 3.1.1 ] гептан
камфан, борнан,
1,7,7-триметил-
бицикло[2.2.1 ]гептан
каран,
4,7,7-триметил-
бицикло[4.1.0] гептан
1 -изопропил-4-метил-
бицикло[3.1.0]гексан
35. Терпены
471
Производные туйана (туйон) и карана (карены) содержатся
в эфирном масле шалфея. а-Пинен — ненасыщенное производ-
ное пинана — наиболее распространенный в природе представи-
тель этой группы.
а-ПИНЕН
или
а-Пинен находится в различных
эфирных маслах, но основная мас-
са — до 75 % в скипидаре (терпен-
тинном масле). Это жидкость, ко-
торая не смешивается с водой.
Молекула а-пинена содержит два асимметрических центра
и обладает оптической активностью. Левовращающий а-пинен
преобладает в сосне приморской {Pinus pinaster), а правовращаю-
щий — в сосне лесной {Pinus sytvestris).
Химические свойства. а-Пинен — типичное непредельное со-
единение с присущими этому классу свойствами.
7. Взаимодействие с разбавленными кислотами. При нагрева-
нии с разбавленными кислотами (азотной, серной) а-пинен пре-
вращается в а-терпинеол и терпин.
лимонен а-терпинеол терпин
2. Окисление. Пинен и скипидар окисляются кислородом, пре-
вращаясь в а-пероксид.
472
Углеводы (сахара)
а-пинен
[О]
пероксид
вербеной
Полученный а-пероксид можно обнаружить по окислитель-
ным свойствам. Если к крахмалу добавить KI, а затем скипидар,
то при взбалтывании образовавшийся пероксид а-пинена вытес-
няет 12 из KI и окрашивает крахмал в синий цвет.
Воздух вокруг хвойных деревьев озонирован. Это связано
с тем, что в составе их эфирных масел в большом количестве со-
держится образующий пероксиды а-пинен. Пероксиды разлага-
ются с образованием атомарного кислорода, который, соединяясь
с кислородом воздуха, образует озон.
3. Взаимодействие с хлороводородом. а-Пинен с НС1 образует
борнилхлорид — твердое вещество с запахом камфоры, которое
используется для синтеза камфоры:
перегруппировка
ней о °с
борнилхлорид
4. Взаимодействие с органическими кислотами. Органические
кислоты, присоединяясь к а-пинену, с небольшим выходом дают
сложные эфиры борнеола:
ОН
борнилацетат
а-Пинен и скипидар используют как растворители, ускорите-
ли затвердевания (высыхания) красок за счет пероксидов. Скипи-
дар применяют в медицине как местнораздражающее, обезболива-
ющее и антисептическое средство. а-Пинен и борнеол используют
для синтеза камфоры.
35. Терпены
473
БОРНЕОЛ
(борниловый спирт, камфанол-2)
СН Это спирт камфанового ряда,
ОН имеющий за счет трех асиммет-
рических атомов углерода опти-
ческие изомеры: энантиомеры,
диастереомеры борнеола и изо-
борнеола. Свое название борне-
ол получил от борнейского лавра, из эфирного масла которого он
был впервые получен на острове Борнео.
Это кристаллическое вещество с температурой плавления 204—
208,5 °C, температурой кипения 212 °C, растворим в спирте и не
растворим в воде.
Химические свойства. Борнеол обладает свойствами вторичных
спиртов, вступает в реакции окисления с образованием кетона —
камфоры, в реакции замещения ОН-группы на галоген образует
сложные эфиры с органическими кислотами.
камфора
С1
борнилхлорид
ососн
борнеола ацетат,
борнил ацетат
камфан
При кипячении с металлическим натрием в ксилоле происхо-
дит взаимное превращение друг в друга изоборнеола и борнеола.
Борнеол и его эфиры используют как душистые вещества в мы-
ловарении, парфюмерной, кондитерской промышленности. Они
понижают кровяное давление.
474
Углеводы (сахара)
КАМФОРА
(камфара; 2-борнанон; 1,7,7-триметилбицикло[2.2.1]гептан-2-он)
Камфора является бицикличе-
ским кетоном на основе камфана
(борнана). В структуре молеку-
лы содержатся два асимметри-
ческих атома углерода, но вмес-
то четырех ожидаемых изомеров
камфора существует только в ви-
де двух энантомеров. Отсутствие диастереомеров объясняется тем,
что асимметрические атомы жестко связаны между собой тремя
углеродными цепями, это исключает возможность иной конфигу-
рации.
Получение камфоры. 1. Из природных источников. D-камфору
получают из 60—100-летних деревьев камфорного дерева, которое
произрастает во Вьетнаме, Китае, Японии, на Тайване, а также
культивируется в тропиках. Камфора содержится в эфирных мас-
лах камфорного лавра, сибирской пихты, базилика, полыни, кам-
форного шалфея.
Природные источники не удовлетворяют потребности в кам-
форе, поэтому используются полусинтетические и синтетические
способы получения.
2. Получение из борнилацетата (метод Н. В. Вершинина). Этот
метод получения камфоры из пихтового масла, содержащего 30—
40% борнилацетата, имеет промышленное значение. Борнилаце-
тат отделяют, подвергают омылению и полученный (-)-борнеол
окисляют хромовой смесью в (-)-камфору.
3. Получение рацемической камфоры из а-пинена (синтез В. Е. Ти-
щенко):
борнилацетат
ОН
борнеол
[О]
Н,0; ОН"
снхоон
камфора
35. Терпены
475
Камфора — бесцветное кристаллическое вещество (?пл = 178 °C)
с резким характерным запахом, флуоресцирует в УФ-свете, рас-
творима в спирте, малорастворима в воде. Вращение и хаотиче-
ское движение кристаллов по поверхности воды связаны с тем,
что камфора летуча (легко сублимируется). Упругость ее паров на
разных поверхностях кристалла неодинакова, вследствие этого крис-
талл с разными гранями с различной силой отталкивается от по-
верхности пленки воды, что и вызывает его вращение.
Химические свойства. Камфора — типичный кетон. С участи-
ем оксогруппы она образует оксимы, семикарбазоны, фенилгид-
разоны.
7. Взаимодействие с гидроксиламина гидрохлоридом:
+ NH.OH НС1
N—ОН
НС1 + Н2О
камфора оксим камфоры
Реакция применяется для количественного определения кам-
форы по выделяемому эквивалентному количеству НС1.
2. Окисление и восстановление камфоры:
борнеол
[О]
HNO3
СООН
соон
камфорная
кислота
3, Взаимодействие с бромом. Карбонильная группа активирует
атомы водорода в а-положении, метиленовая группа проявляет
С—Н-кислотный характер, в результате чего возможно замеще-
ние на галоген:
Вг2
СС14
3 -бромкамфора,
а-бромкамфора
НВг
В медицине камфору используют как кардиотоническое, ана-
лептическое, местнораздражающее и антисептическое средство,
в промышленности — как пластификатор, компонент бездымно-
го пороха, репеллент. Бромкамфору применяют при заболеваниях
центральной нервной системы как успокаивающее средство.
ОБ АВТОРЕ
Валентин Петрович Черных родился 5 января 1940 года в се-
ле Речица Орловской области.
В 1959 году с отличием закончил Харьковское медицинское
училище, в 1964-м — Харьковский фармацевтический институт.
После окончания аспирантуры ХФИ служил в армии.
В 1968 году защитил кандидатскую диссертацию, в 1977-м —
диссертацию на ученую степень доктора фармацевтических наук,
в 1990 году стал доктором химических наук, в 1997-м — членом-
корреспондентом НАН Украины, в 2001-м — лауреатом Государ-
ственной премии Украины.
С 1980 года заведует кафедрой органической химии.
Прошел школу административного управления: в 1971 —
1974 годах — декан, 1976—1980 — проректор по учебной работе,
с 1980-го — ректор Национального фармацевтического универ-
ситета.
Автор 544 научных статей, 15 монографий, 8 учебных пособий,
практикума и учебника по органической химии в трех книгах.
За 40 лет научно-педагогической деятельности им подготовле-
ны тысячи высококвалифицированных специалистов для фарма-
цевтической отрасли, высшего образования. Научной школой
В. П. Черных подготовлено 13 докторов и 39 кандидатов наук.
Автор 16 оригинальных лекарственных препаратов. На 34 ле-
карственных препарата-генерика разработана научно-техническая
документация и освоен их промышленный выпуск. Получено
57 патентов и 306 авторских свидетельств.
Основное научное направление: целенаправленный синтез
новых биологически активных веществ — производных дикарбо-
новых кислот и гетероциклических структур, изучение их реакци-
онной способности, механизмов химического взаимодействия;
разработка оптимальных препаративных методов получения ле-
карственных субстанций, установление закономерностей связи
477
между химической структурой, физико-химическими свойствами
и биологической активностью; создание экологически чистых тех-
нологий получения лекарственных субстанций; исследование пу-
тей циклизации многофункциональных реагентов.
Удостоен почетных званий — заслуженный изобретатель Ук-
раины, заслуженный деятель науки и техники Украины, лауреат
Государственной премии Украины 2001 года. Награжден ордена-
ми Украины «За заслуги» II и III степени, орденами Трудового
Красного Знамени и «Знак Почета», медалями, почетными гра-
мотами.
СОДЕРЖАНИЕ
Предисловие..................................................3
1. Классификация и номенклатура органических соединений...5
2. Химическая связь. Взаимное влияние атомов в органических
соединениях.............................................13
3. Изомерия органических соединений. Пространственное
строение молекул........................................32
4. Классификация химических реакций и реагентов........ 50
5. Кислотность и основность органических соединений......55
Углеводороды................................................62
6. Алканы................................................62
7. Циклоалканы...........................................72
8. Алкены (этиленовые углеводороды, олефины).............84
9. Алкадиены (диеновые углеводороды, диолефины)..........93
10. Алкины (ацетиленовые углеводороды)...................100
Ароматические углеводороды (арены).........................107
11. Моноядерные арены....................................107
Многоядерные арены.........................................123
12. Многоядерные арены с конденсированными бензольными
циклами.................................................123
13. Многоядерные арены с изолированными бензольными
циклами.................................................134
14. Галогенопроизводные углеводородов....................146
15. Нитросоединения..................................... 164
16. Амины................................................175
17. Диазо- и азосоединения...............................191
Гидроксильные производные углеводородов. Спирты.
Простые эфиры. Тиолы. Тиоэфиры. Фенолы.....................201
18. Спирты...............................................201
19. Фенолы...............................................223
Альдегиды и кетоны.........................................241
20. Альдегиды и кетоны алифатического ряда.............. 241
21. Альдегиды и кетоны ароматического ряда...............255
Карбоновые кислоты.........................................267
22. Монокарбоновые кислоты...............................267
23. Дикарбоновые кислоты................................ 280
24. Функциональные производные карбоновых кислот.........289
25. Гетерофункциональные карбоновые кислоты..............312
26. Производные угольной кислоты.........................338
Гетероциклические соединения...............................343
27. Трех- и четырехчленные гетероциклические соединения
с одним гетероатомом.....................................345
28. Пятичленные гетероциклические соединения с одним
гетероатомом.............................................351
29. Пятичленные гетероциклические соединения с двумя
гетероатомами............................................374
30. Шестичленные гетероциклические соединения с одним
гетероатомом.............................................389
31. Конденсированные шестичленные гетероциклические
соединения с одним гетероатомом..........................406
32. Шестичленные гетероциклические соединения с двумя
гетероатомами. Пурин и его производные. Алкалоиды........422
Углеводы (сахара)..........................................437
33. Моносахариды.........................................438
34. Ди- и полисахариды...................................455
35. Терпены..............................................464
Об авторе..................................................476