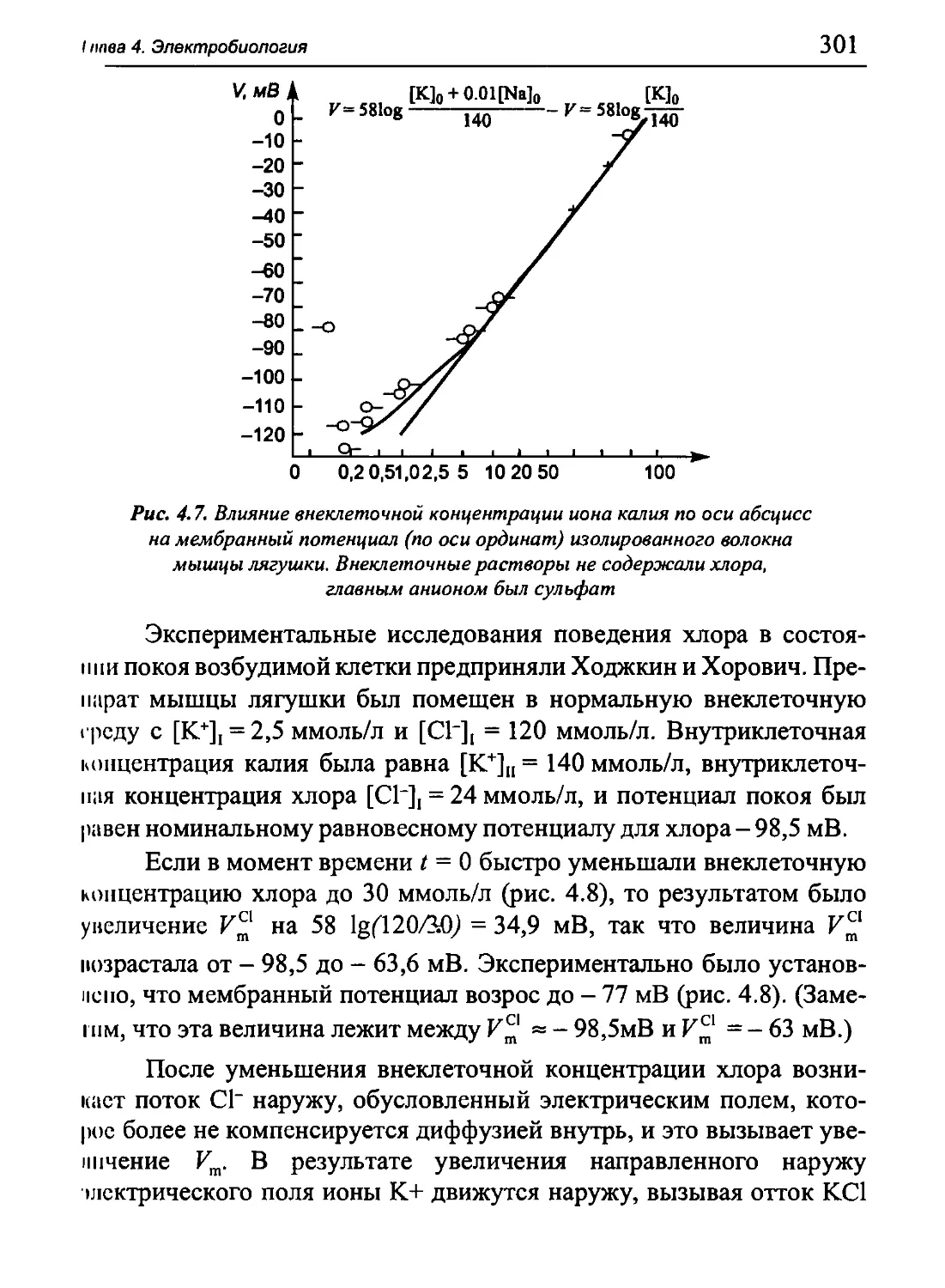
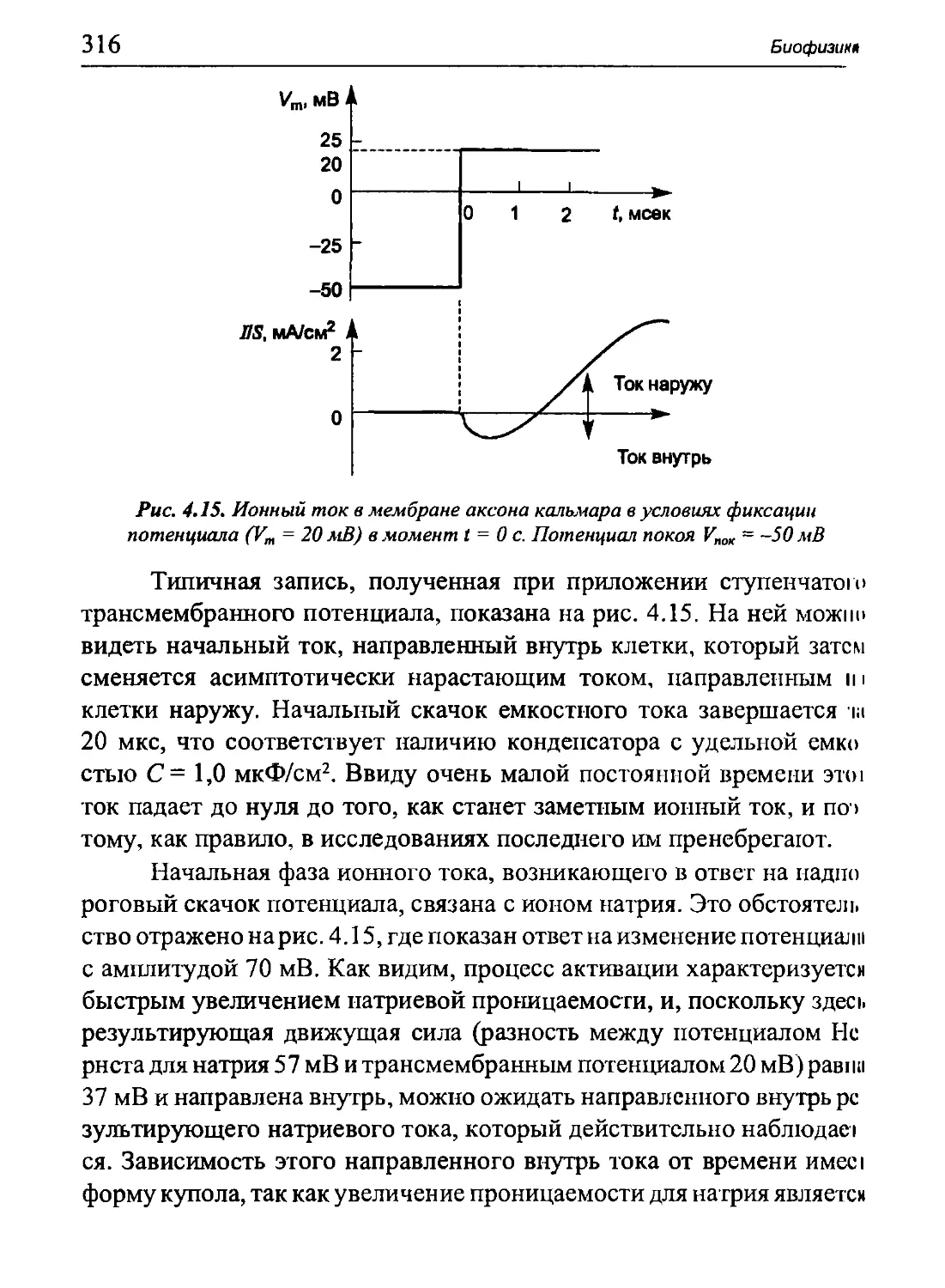
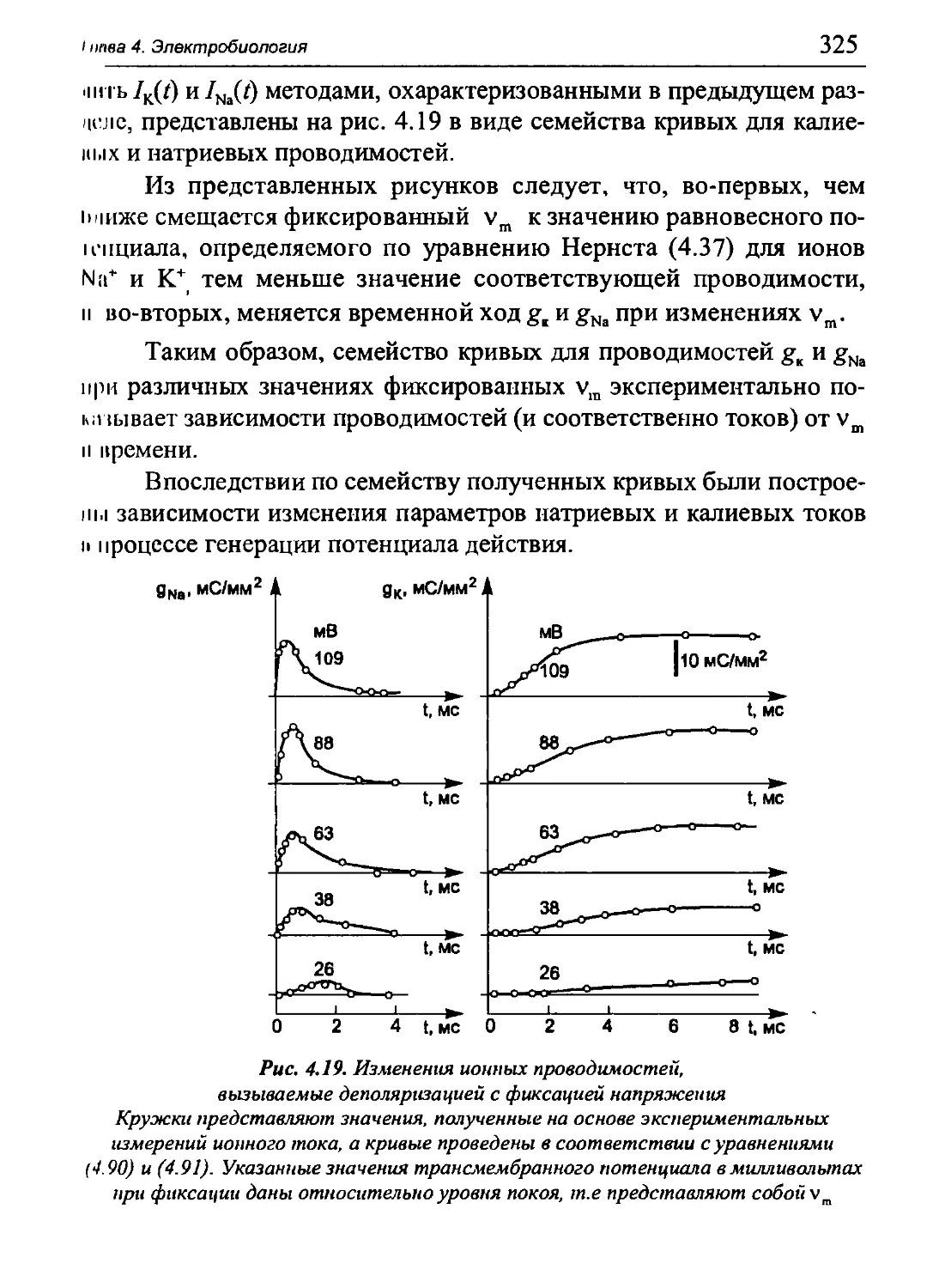
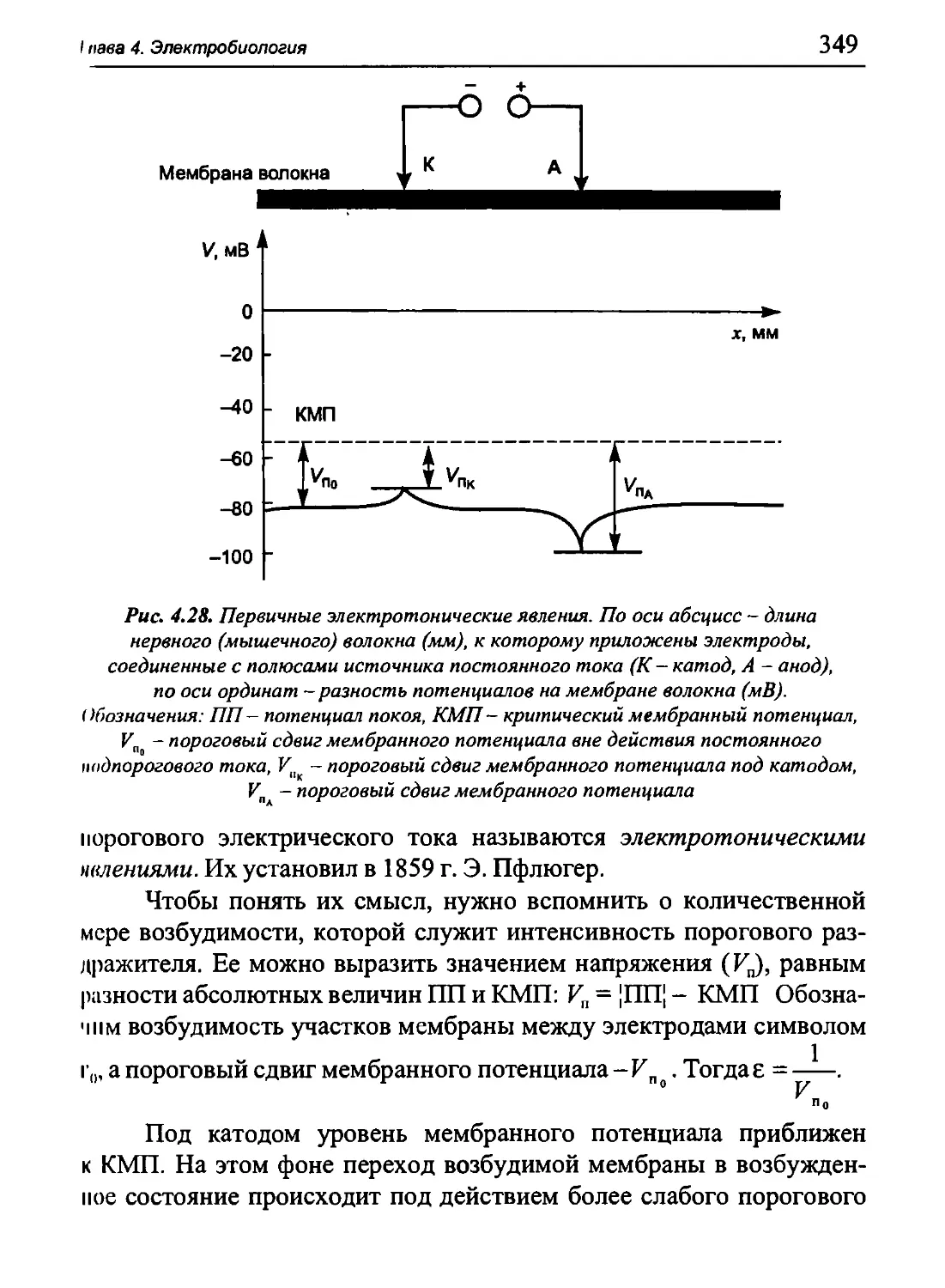
Author: Бигдай Е.В. Вихров С.П. Гривеннаи П.В. Редькин В.М. Самийлив В.В. Чигирев Б.И.
Tags: науки о земле геологические науки общая биофизика инженерия биофизика биомеханика
ISBN: 978-5-9912-0048-6
Year: 2008
*
I I
~ lOMl
t
μ
Ε
Ε. В. Ьигдай, С.П.Вихров, П. В. Гривеиваи,
В. М. Редькин, в. В. Самойлов, Ь. и. Чнгарев
БИОФИЗИКА
ДЛЯ ИНЖЕНЕРОВ
Под редакцией
С. П. Вихрова и В. О. Самойлова
В 2 томах
Гои 1. Ьюэнергешка, бнтемвранюмшя
* бммшаширшшш
Рекомендовано УМО по образованию
в области радиотехники, электроники, биомедицинской
техники и автоматизации для студентов
высших учебных заведений, обучающихся
по направлению подготовки дипломированных
специалистов 653900 - «Биомедицинская техника»
и направлению подготовки бакалавров
и магистров 553400 - «Биомедицинская инженерия»
Москва
Горячая линия - Телеком
2008
УДК 557.3
ББК 28.071
Б63
Рецензент: доктор биолог, наук, профессор Е. В. Чурносов
Авторы: Е. В. Бпгдай, С. П. Вихров, Н. В. Гривенная, В. М. Редькии,
В. О. Самойлов, Б. И. Чигирев
Б63 Биофизика для инженеров: Учебное пособие. В 2 томах. Том 1. -
Биоэнергетика, биомембранология и биологическая электродинамика /
Е. В. Бигдай, С. П. Вихров, Н. В. Гривенная и др. Под ред. С. П. Вихрова
и В. О. Самойлова. - М.: Горячая линия-Телеком, 2008. - 496 с: ил.
ISBN 978-5-9912-0048-6.
В учебном пособии систематизированы сведения о физических и физико-
химических процессах, лежащих в основе жизнедеятельности организмов на
всех уровнях их организации, необходимые для инженеров и специалистов,
занимающихся разработкой и обслуживанием биомедицинской техники.
В первом томе двухтомного пособия изложены основы биоэнергетики и
термодинамики биологических процессов, рассмотрены структура, свойства
и функции биологических мембран и биоэлектрогенез. Второй том посвящен
биофизическим основам двигательной активности человека, информационных
и регуляторных процессов в биологических системах, а также общим
принципам функционирования сенсорных систем.
Для студентов, обучающихся по направлению «Биомедицинская техника»,
будет полезна инженерам и специалистам, занимающимся моделированием
физиологических процессов и разработкой аналитической, диагностической и
лечебной аппаратуры.
ББК 28.071
Адрес издательства в Интернет WWW.TECHBOOK.RiI
ISBN 978-5-9912-0048-6 (Т. 1) © Е. В. Бигдай, С. П. Вихров,
ISBN 978-5-9912-0050-9 Η. В. Гривенная и др., 2008
© Оформление издательства
«Горячая линия-Телеком», 2008
Условные сокращения
АДФ - аденозиндифосфат
АКМ - альвеоло-капиллярная мембрана
АМФ - аденозинмонофосфат
АО - атомные орбитали
АРФ - абсолютно рефрактерная фаза
АСУ - автоматизированная система управления
АТВМ - атипичные волокна миокарда
АТФ - аденозинтрифосфат
АЧХ - амплитудно-частотная характеристика
БМ - биомембрана
БП - биопотенциалы
БР - бактериородопсин
ΒΑΧ - вольт-амперная характеристика
ВПСП - возбуждающий постсинаптический потенциал
ВЭКС - векторэлектрокардиоскопия
ГМК - гладкомышечные клетки
ГП - генераторный потенциал
ДК - дыхательный коэффициент
ДСК - дифференциальная сканирующая микроскопия
ДСЛ - диффузионная способность легких
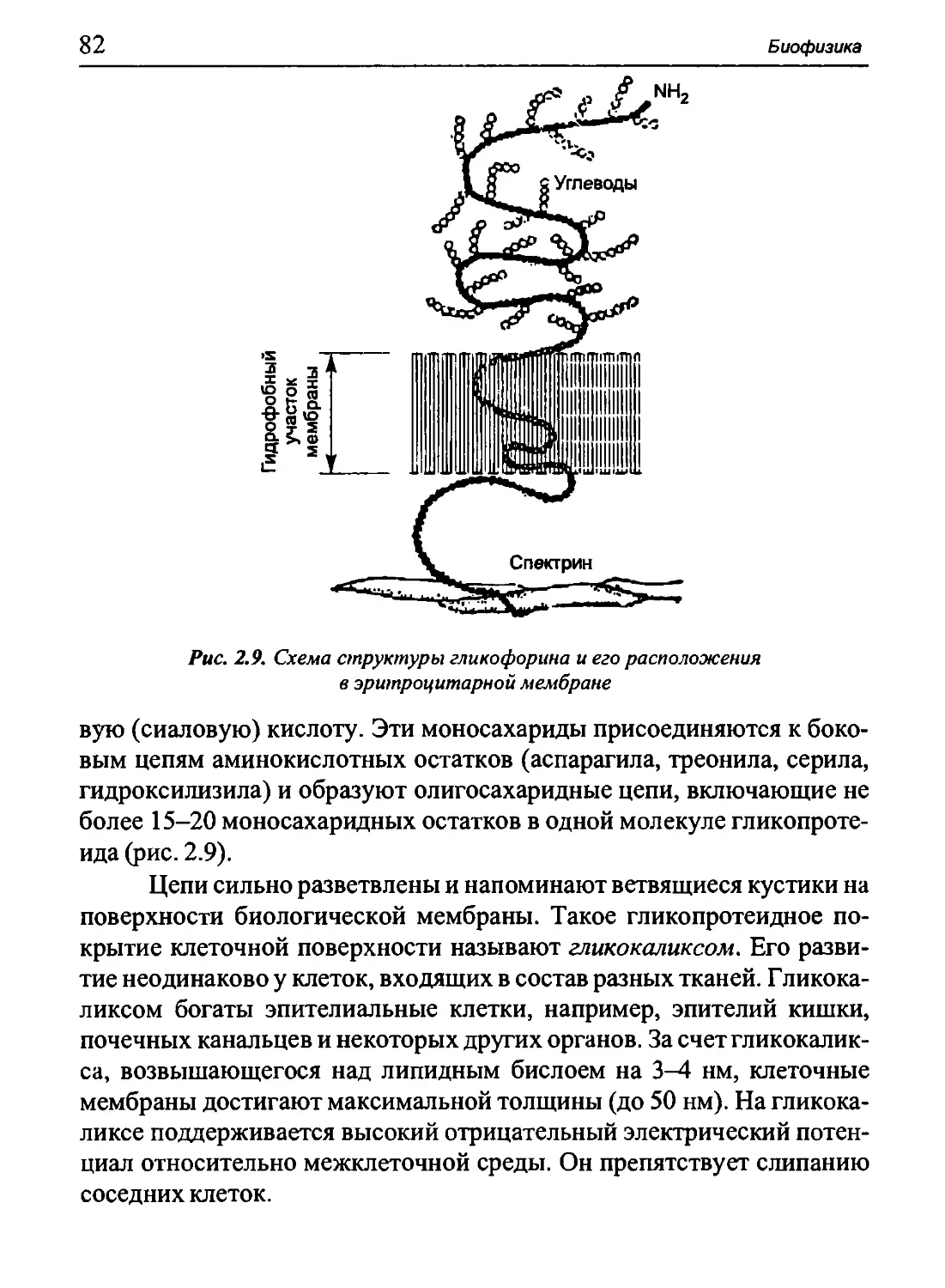
ДЦ - дыхательная цепь
ЖК - жидкие кристаллы
ИНТ - инкапсулированное нервное тельце
ИЭВС - интегральный электрический вектор сердца
КГР - кожно-гальваническая реакция
КД - кровяное давление
КМП - критический мембранный потенциал
Кр - креатин
КрФ - креатинфосфат
4
Биофизика
КУ - корректирующее устройство
КУД - критический уровень деполяризации
КФК - креатинфосфокиназа
МДП - максимальный диастолический потенциал
МДС - магнитодвижущая сила
Метод ЛКАО - метод линейной комбинации атомных орбиталей
МО - молекулярные орбитали
МОД - минутный объем дыхания
МП - магнитная составляющая электромагнитного поля
МКЦ - мукоцилиарный клиренс
МЦТ - мукоцилиарный транспорт
НАД - никотинамидадениндинуклеотид
НС - наружный сегмент палочки (фоторецептора)
ОД - облегченная диффузия
ОР - объект регулирования
ОРФ - относительно рефракторная фаза
ОС - обратная связь
ОЦ - окислительная цепь
ПКП - потенциал концевой пластинки
ПП - потенциал покоя
Ρ - регулятор
РП - рецепторный потенциал
САР - система автоматического регулирования
СКФ - скорость клубочковой фильтрации
СНО - свободные нервные окончания
СОЭ - скорость оседания эритроцитов
СПС - саркоплазматическая сеть
СФ - сопрягающий фактор
ТК - твердый кристалл
ТМВ - типичные миокардиадальные волокна
ТПСП - тормозной постсинаптический потенциал
ТЭА - тетраэтиламмоний
УЗД - уровень звукового давления
ФЛ - фосфолипиды
ФМН - флавинмононуклеотид
ФОС - фосфорогранические соединения
Условные сокращения
5
ФП - флавопротеиды
ФС - фотосистема
ФЭ - фаза экзальтации
цАМФ - циклический аденозинмонофосфат
ЦВД - центральное венозное давление
ЦНС - центральная нервная система
ЩК - щелевой контакт
ЭДС - электродвижущая сила
ЭКГ - электрокардиограмма
ЭКП - эндокохлеарный потенциал
ЭМВ - электромагнитная волна
ЭМГ - электромиограмма
ЭМП - электромагнитное поле
ЭП - электрическая составляющая электромагнитного поля
ЭПР - электронный парамагнитный резонанс
ЭС - элемент сравнения
ЭТЛ - эластическая тяга легких
ЭЭГ - электроэнцефалограмма
ЯМР - ядерный магнитный резонанс
Н-АТФаза - водород-активируемая АТФаза (протонная помпа)
Са-АТФаза - кальций-активируемая АТФаза
Na-K-АТФаза - натрий-калий-активируемая АТФаза
Н-К-АТФаза - водород-калий-активируемая АТФаза.
ПРЕДИСЛОВИЕ
Биофизика является областью науки, которая изучает
физические и физико-химические процессы, лежащие в основе
жизнедеятельности организмов. По природе объектов исследования биофизика
является типичной биологической наукой, а по методам изучения и
анализа результатов исследования относится к физике.
Биофизические методы базируются на физических и физико-химических
методах изучения природы. По мере того как наши знания и представления
о процессах, имеющих место в природе, расширяются, усложняется
методология, применяемая для объяснения процессов, происходящих
в живых объектах, испытывающих воздействия изменяющейся
окружающей среды.
В последние годы опубликовано несколько учебников по
биофизике (например, В.О. Самойлов «Медицинская биофизика», 2004,
А.Б. Рубин «Биофизика», 2000, В.Ф. Антонов, A.M. Черныш и др.
«Биофизика», 1999 и другие). Эти издания написаны для студентов
и специалистов, которые совершенствуют свои знания в области
медицины или биологии. При создании данного учебного пособия
авторы ориентировались на студентов, обучающихся по направлению
«Биомедицинская техника», а также на специалистов, которые
совершенствуют свои знания в области разработки и обслуживания
биотехнической и медицинской аппаратуры. Определенный интерес
учебное пособие может представлять также для студентов и
аспирантов медицинских и биологических вузов, а также для физиков и
математиков-прикладников .
Данное учебное пособие состоит из семи глав (главы 1-4
включены в первый том, а главы 5-7 - во второй). Первая глава посвящена
термодинамике биологических процессов. Показано, каким образом
выводы и следствия из первого и второго законов термодинамики
могут быть применены при описании физико-химических процессов,
Предисловие
7
протекающих в биологических объектах. Во второй главе
рассмотрены структура, свойства и функции биологических мембран. Особое
внимание уделено биофизическим механизмам транспорта веществ
(массопереноса) через биомембраны. Третья глава посвящена кван-
товомеханическим основам биоэнергетики. Показаны механизмы
переноса энергии и заряда в биомолекулярных системах и
возможности применения квантовой биофизики для новых диагностических
технологий. В четвертой главе обсуждаются вопросы, связанные
с биоэлектрогенезом (уравнения Нернста - Планка, Гольдмана - Ход-
жкина - Хаксли, потенциалы покоя и действия, распространение
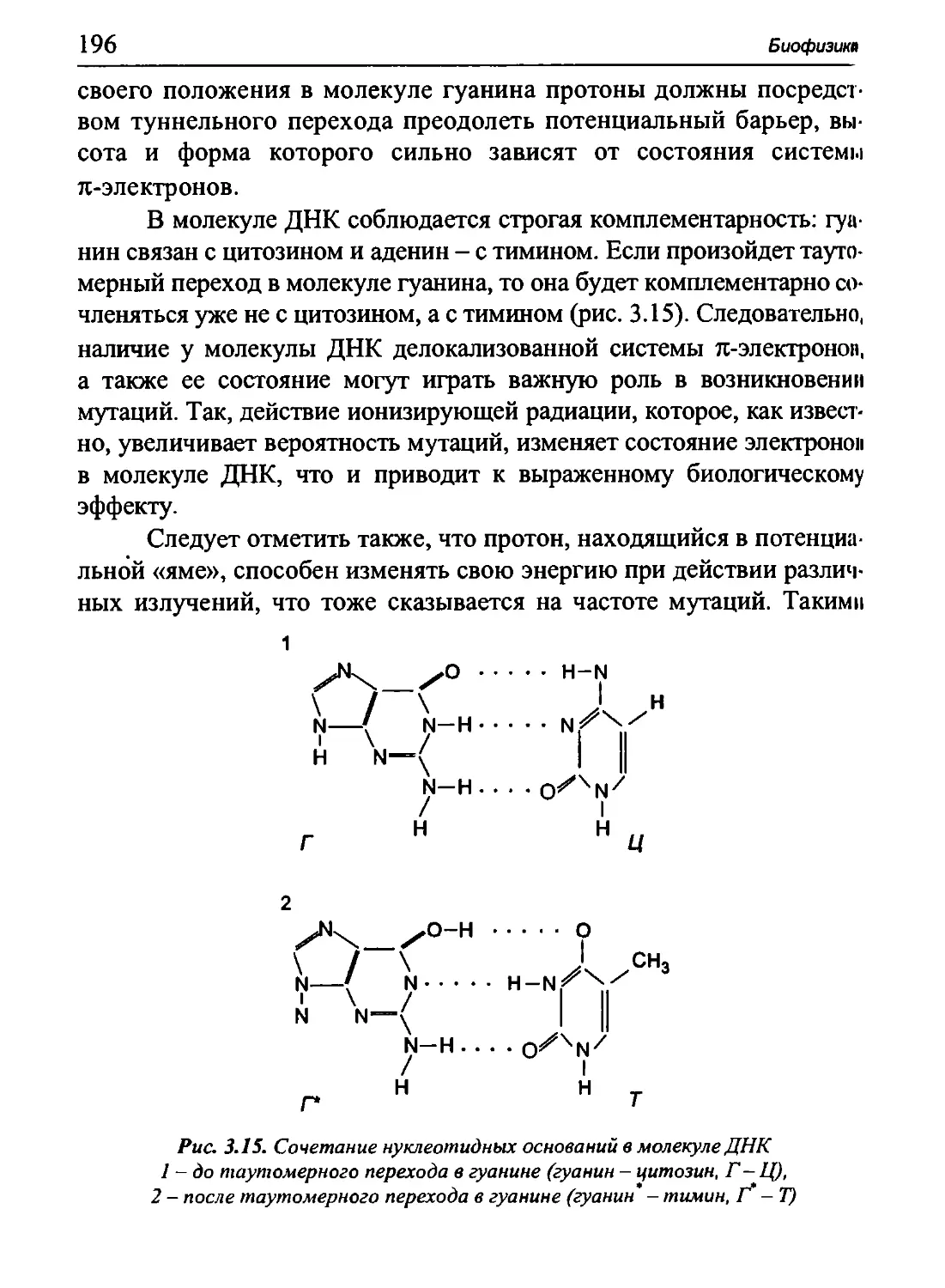
потенциала действия по нервному волокну). Глава 5 посвящена
биофизическим основам двигательной активности человека и животных.
Определенное внимание уделено моделированию и методам
исследования электрических полей в организме. В шестой главе рассмотрены
общие принципы функционирования сенсорных систем, передача
и переработка информации в нервных центрах, биофизические
основы зрительной, слуховой, обонятельной и вкусовой рецепции. Глава 7
посвящена биофизическим основам информационных и регулятор-
ных процессов в биологических системах. После каждой главы
приведен список использованной литературы.
Авторы считают, что основным результатом изучения данного
учебного пособия должно быть получение знаний о биофизических
процессах, протекающих в живых организмах на всех уровнях их
организации. Эти знания необходимы будущим инженерам и
специалистам при моделировании физиологических процессов и при
разработке новой аналитической, диагностической и лечебной аппаратуры.
При написании учебного пособия авторы исходили из того, что
читатель имеет определенные знания по биологии, биохимии,
математике, физике и химии в пределах программ, предусмотренных
государственными образовательными стандартами по направлению
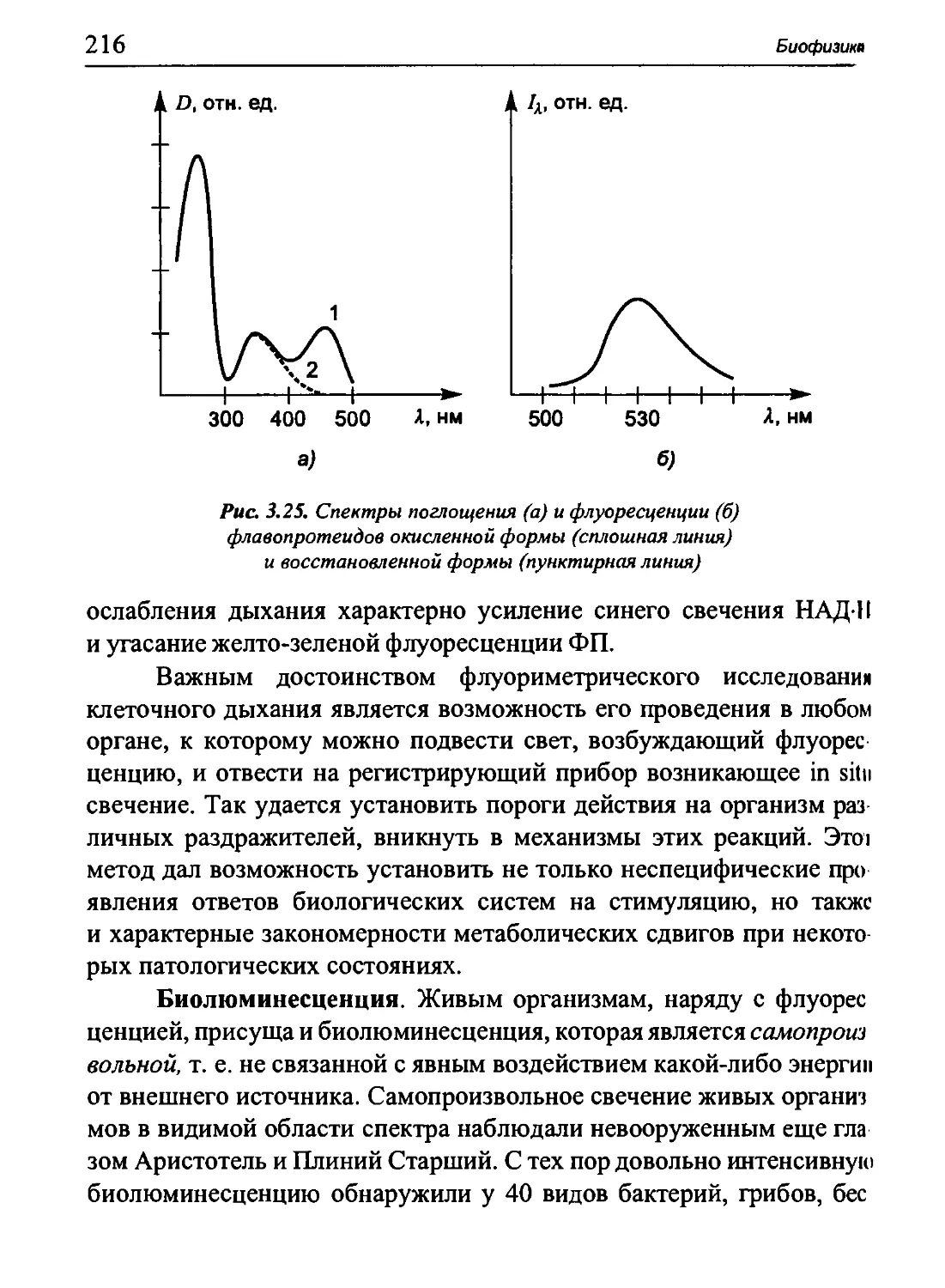
«Биомедицинская техника».
Работа над книгой была распределена между авторами
следующим образом: Е.В. Бигдай (гл. 2, 5, 6), СП. Вихров (гл. 1, 4, 6, 7),
Н.В. Гривенная (гл. 1, 4, 5, 7), В.Н. Редькин (гл. 4), В.О. Самойлов
(гл. 1-7), Б.И. Чигирев (гл. 4,6).
8
Биофизике
Авторы выражают глубокую благодарность профессору Е.П. По-
печителеву и рецензенту профессору Е.В. Чурносову за ценные
замечания, пожелания и советы, которые позволили существенно улучшить
содержание книги, а также А.Н. Комарову за помощь в подготовке
компьютерного варианта рукописи.
ВВЕДЕНИЕ
Учебное пособие состоит из двух томов. В первом томе (гл. 1-
4) изложены общие и квантовомеханические основы биоэнергетики,
а также структура, свойства и функции биологических мембран.
Жизненные процессы при всем своем многообразии имеют и общие
черты. Любой из процессов требует затрат энергии. В этой связи важным
направлением биофизики является изучение преобразования энергии
в живых системах. Процессы энергообеспечения организма за счет
внешних ресурсов составляют предмет исследования биоэнергетики.
В разработке биоэнергетических проблем можно выделить два
подхода. С одной стороны, исследуются механизмы энергетических
процессов, протекающих на субмикронном уровне. Их изучение
является важной задачей квантовой биофизики. С другой стороны,
особенности биологических процессов рассматриваются на основе общих законов
превращения энергии без детального изучения их субмолекулярных
механизмов. Второй подход связан с исследованиями в области
биологической термодинамики. Изучение глубинных механизмов биоэнергетики
связано, прежде всего, с применением к живым системам законов и
методологии квантовой механики. Квантовая биофизика позволяет глубже
познать не только электронную структуру биологически важных
молекул и механизмы межмолекулярного переноса электронов, но и пути
превращения энергии возбужденных молекул в энергию их продуктов.
Биофизика вносит фундаментальный вклад в изучение процессов
в клетке, что позволило понять особенности биологических явлений
путем раскрытия их молекулярных механизмов. В этом томе рассмотрены
основы процессов, протекающих в клетках живого организма, и ггоед-
ставлены данные о структурно-функциональной организации
биологических мембран. Специальное внимание уделено биофизике процессов
транспорта веществ через биологические мембраны. Рассмотрены
процессы транспорта неэлектролитов и ионов по каналам, а также основы
биоэлектрогенеза.
Глава 1. ТЕРМОДИНАМИКА
БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
Жизнь в ее многообразных проявлениях связана с высокой
пространственной упорядоченностью молекулярных структур и строгой
временной координацией сложных физико-химических явлений в
клетках. Поддержание такого состояния зависит от непрерывного обмена
веществ, энергии и информации между клеткой или организмом и
окружающей средой. Это одно из характерных и универсальных свойств
живых образований.
Клетка - живая высокоорганизованная сложная «машина», для
работы "которой необходима энергия. Энергия расходуется на синтез
биоорганических соединений и поддержание осмотических и
электрических потенциалов. Превращение одного вида энергии в другой
происходит в таких сложных физиологических процессах, как зрение, слух,
хеморецепция, биолюминесценция. При двигательной активности
клеток, обусловленной как актин-миозиновой, так и тубулин-динеиновой
молекулярными системами, за счет химической энергии выполняется
механическая работа.
Термодинамика - это наука, изучающая наиболее общие
законы превращения различных видов энергии в системе. Она дает
макроскопическое описание энергетических изменений и превращений
без рассмотрения молекулярного строения системы. Законы
термодинамики являются наиболее общими. Они имеют универсальный
характер и выполняются независимо от того, где происходит процесс -
в живой или неживой материи.
Термодинамическая система представляет собой часть
пространства с материальным содержимым, ограниченную оболочкой.
Область вне оболочки системы представляет окружающую среду.
В зависимости от того, как термодинамическая система связана с
окружающей средой, выделяют три типа систем: изолированные,
замкнутые и открытые.
Глава 1. Термодинамика биологических процессов
11
Изолированная термодинамическая система не обменивается
с внешней средой ни веществом, ни энергией. Замкнутая (закрытая)
система обменивается энергией, но в ней нет обмена веществом. В
открытых термодинамических системах происходит обмен с
окружающей средой и веществом, и энергией.
Термодинамическая система характеризуется определенными
термодинамическими параметрами. Экстенсивные параметры
зависят от общего количества вещества в системе, это, например, масса
(/и), объем (V), а интенсивные, например, давление (р), температура
(7), молярная концентрация (Л/) не зависят от массы системы.
Изменение любого из параметров вызывает изменение состояния системы.
Переход термодинамической системы из одного состояния в другое
происходит в результате различных процессов. Если в естественном
(без поступления энергии извне) циклическом процессе состояние
системы не изменяется, такой процесс называется обратимым. Если
в результате такой последовательности переходов в системе
изменения происходят, процессы называются необратимыми. Реальные
процессы в природе всегда необратимые.
Термодинамика возникла более 150 лет назад и с самого
начала становления в ней использовались данные о теплопродукции
мелких животных, получаемые с помощью калориметрии. Классическая
термодинамика изучает перепады энергии и определяет направление
возможных изменений. Наиболее серьезное ограничение при
использовании классической термодинамики состоит в том, что она изучает
системы в установившися режимах, оставляя без внимания
переходные режимы.
Жизненные процессы, при всем многообразии, имеют и общие
черты, в частности, любой из процессов требует затрат энергии.
Поэтому важным направлением биофизических исследований является
изучение преобразования энергии в биологических системах.
Процессы энергообеспечения организма за счет внешних энергетических
ресурсов составляют предмет исследования биоэнергетики. В
биоэнергетике выделены два подхода:
1) исследуются механизмы энергетических процессов,
протекающих в организме на клеточном, молекулярном и
субмолекулярном уровнях;
12
Биофизика
2) изучаются особенности биологических процессов на основе
общих законов превращения энергии без детального изучения их
молекулярных механизмов. Это составляет содержание биологической
термодинамики.
1.1. Первый закон термодинамики
1.1.1. Общие сведения
Основная задача термодинамики состоит в том, чтобы найти
такие величины, которые однозначно определяют изменение
состояния термодинамической системы при переходе из одного состояния
в другое. Опыт показал, что такой величиной является внутренняя
энергия U. Она является функцией состояния системы и зависит от
термодинамических параметров: U=f(m,p, V, Τ). Ее изменение AU
не зависит от пути перехода из одного состояния в другое.
Внутренняя энергия - это сумма кинетической и потенциальной энергии всех
атомов и молекул термодинамической системы.
Изменение внутренней энергии AU в замкнутой системе
можно определить, измеряя поглощенную (выделившуюся) теплоту Q
и выполненную работу А; экспериментально установлено, что
изменение В1гутренней энергии равно
MJ = UX-U2=Q-A. (1.1)
Какими бы путями этот переход не осуществлялся и как бы не
изменялись по величине Q и А, всегда сохраняет постоянное
значение разность
Q'-A'=Q"-A». (1.2)
Это значит, что в замкнутой системе изменение внутренней
энергии AU = const.
Первый закон термодинамики (закон сохранения энергии)
гласит: в изолированной термодинамической системе полный запас
энергии есть величина постоянная, и возможны только превращения
одного вида энергии в другой в эквивалентных соотношениях:
Глава 1. Термодинамика биологических процессов
13
U = const; AU=0. (1.3)
В замкнутой системе изменение внутренней энергии при
переходе из одного состояния в другое определяется количеством
переданной теплоты и величиной выполненной работы:
AU=Q±A. (1.4)
Знак (-) означает, что работа выполняется системой против
внешних сил, (+) - работа выполняется над системой.
В дифференциальной форме первый закон термодинамики
запишется в следующем виде:
dU=dQ+dA. (1.5)
Значки д обозначают частное дифференцирование: теплота Q
и работа А не являются функциями всех параметров состояния и,
следовательно, они не могут быть полными дифференциалами.
Важное свойство функции состояния заключается в том, что
для циклических процессов
q>itt/=0. (1.6)
В системе СИ энергия измеряется в джоулях (Дж). 1 Дж =
= 0,239 кал = 6,25 · 1018 эВ, а 1 ккал =4,19 кДж.
При фиксированном давлении (р) можно ввести вместо
внутренней энергии (U) новую функцию состояния, которая будет
хорошо описывать термодинамическую систему. Она важна для изучения
химических реакций в клетке, протекающих ггои ρ = const. Работа по
изменению объема V при постоянном давлении ρ запишется как
AP=PAV. (1.7)
Тогда запись первого закона термодинамики будет иметь вид:
Q=AU + рЬУ =Δ([/ + pV) = AH. (1.8)
Новая функция состояния - энтальпия (Н) (от греческого -
«нагреваю»):
14
Биофизика
H=U+pV. (1.9)
Энтальпию называют теплосодержанием системы. В
дифференциальной форме
dH=dU+pdV при ρ = const. (1.10)
Введенная таким образом новая функция состояния лежит
в основе закона Гесса: тепловой эффект химической реакции Q не
зависит от пути реакции и от исходных веществ к продуктам реакции,
а определяется только разностью энтальпий конечных и исходных
веществ:
2 = ая = £я,;. -£#,„, (1.П)
где Σ^ι к ~ сумма энтальпий всех продуктов реакции; ^Н.ш -
сумма э'нтальпий исходных веществ.
Закон Гесса - прямое следствие первого закона
термодинамики. Следует отметить важное свойство этой новой функции
состояния: поскольку изменение энтальпии (теплосодержания) системы
соответствует величине поглощенной или выделенной теплоты, то ее
можно точно определить калориметром.
Пример. Рассмотрим окисление (при постоянном давлении)
1 моля глюкозы:
С6Н1206 + 602 -> 6С02 + 6Н20 - Q (1.12)
Q=6(Hco,_ +Нн2о)-(Нс6н12о6 +6Я0з) = -2810 кДж-моль-'.
Такое же количество теплоты выделяется при окислении
глюкозы в организме животных, когда в результате сложных химических
превращений образуется множество промежуточных продуктов.
Теплота сгорания Q веществ, в том числе пищевых продуктов,
определяется в калориметрических бомбах. Если система переходит из
состояния 1 в состояние 2 с изменением объема АКпри постоянном
давлении р, то при этом, согласно (1.7), будет выполняться работа Л^.
Глава 1. Термодинамика биологических процессов 15
Полная работа
Α=Αρ+Α0ι (1.13)
где А0 - полезная работа. Она может представлять собой работу,
совершаемую в процессе мышечного сокращения или при переносе
зарядов через мембрану. Подставив (1.13) в (1.4), получим
AU=Q-A = Q-Ap-A0=Q-pAA0,
MJ +pAA0=Q-A0,
а из (1.9) получим
AH=Q-A0. (1.14)
1.1.2. Свободная и связанная энергия.
Обратимые и необратимые процессы
Движение частиц в любом теле может быть упорядоченным и
неупорядоченным. Например, у всех молекул газа (или воды), когда
он (или она) течет по трубе, есть общая составляющая скорости,
которая определяет движение газа как целого. Такое движение называют
упорядоченным. Кроме того, молекулы газа участвуют в
непрерывном неупорядоченном тепловом движении. Электрический ток-
упорядоченное движение, а тепловые перемещения электронов газа -
неупорядоченное.
Между упорядоченным и неупорядоченным движениями
существует принципиальное различие: упорядоченное движение может
полностью превратиться в неупорядоченное, а переход из
неупорядоченного движения в упорядоченное никогда не бывает полным.
Причина различия между ними связана с неодинаковой
вероятностью каждого из них. Для обеспечения упорядоченного движения
необходимо, чтобы все частицы имели в данный момент одинаковые
по величине и направлению составляющие скорости, а когерентные
волны должны иметь одинаковую частоту и фазу. Такое состояние
менее вероятно, чем то, при котором скорости частицы или фазы волн
различны.
16
Биофизика
Внутренняя энергия в идеальном газе полностью, а в других
телах частично связана с неупорядоченным тепловым движением
молекул. В то же время, совершение работы всегда требует переноса
вещества (или заряда), т. е. упорядоченного движения. Поэтому
принципиально невозможно всю внутреннюю энергию тела
использовать для совершения работы. Только ту часть внутренней энергии
системы, которую в данных условиях в принципе можно
использовать для совершения работы, называют свободной энергией G.
Остальную часть внутренней энергии нельзя превратить в работу, и ее
называют связанной энергией (^св„):
U=G+WCBn. (1.15)
Следовательно, работа А, совершенная системой в любом
процессе, не может быть больше, чем изменение G этой системы:
A<AG. (1.16)
Те процессы, в которых А = AG, называются обратимыми, так
как, пустив такой процесс в обратном направлении и затратив
работу, можно вернуть систему в исходное состояние. Таких процессов в
природе не существует. Все реальные процессы необратимы.
Иными словами, AG не может быть полностью преобразовано в А. При
таком преобразовании часть G обязательно превращается в тепло.
Для достижения максимальной степени обратимости
термодинамических процессов нужно добиваться минимальной разности между
AG и Л.
И в технике, и в биологии представляет интерес в первую
очередь работа А, совершенная системой, поэтому важно знать не
столько полную энергию U системы, сколько ее свободную энергию G.
И та, и другая являются функцией тех условий, в которых находится
система. Их наиболее важными параметрами являются: температура,
давление, число молей вещества, а при наличии электрического поля
и его напряженность (£). Тогда
G =/(7\ ρ, ν, Ε).
(1.17)
Глава 1. Термодинамика биологических процессов
17
Во многих системах, в частности, в живых организмах,
наиболее важным источником G является химическая энергия молекул,
входящих в систему. В этой связи вводится понятие химического
потенциала:
μ, = ^- (1.18)
а\
Химический потенциал системы по отношению к конкретному
веществу равен приросту G системы при увеличении количества
этого вещества на один моль
Δσ=μ,Δν. (1.19)
Более подробно понятие химического потенциала будет
рассмотрено в 1.2.3.
1.1.3. Применение первого закона термодинамики
к живым организмам
В отличие от тепловых машин живые организмы производят
работу не за счет тепловой энергии, а за счет использования
химической энергии пищевых продуктов, усвоенных ими. Уравнение,
согласно которому изменение энергии U системы равно ее обмену
энергии с окружающей средой, имеет вид:
AU = Wmuill-Q-A, (1.20)
Wmm=AU+Q+A. (l.2l)
Организм гомойотермных животных имеет постоянную
температуру, и химический состав его в среднем не изменяется, поэтому U
такого организма практически постоянна. Следовательно, изменение
Δ£/= Ο. Тогда уравнение (1.21) принимает вид:
Wn^=Q+A. (1.22)
Поскольку существует множество видов работ и обмена тепла
с окружающей средой, то уравнение можно представить так:
2 - 9843
18
Биофизика
Wmwi = Σ^< + Σ^; ~ пеРвь™ закон термодинамики
применительно к живым организмам.
Следует заметить, что источником энергии для всех процессов
на Земле служит Солнце. Мощность солнечного излучения составляет
примерно 1026 Вт, но только небольшая ее часть, примерно 2 · 1017 Вт
достигает поверхности Земли, а из этой части 0,02% поглощается
зелеными растениями и запасается ими в процессе фотосинтеза.
Следовательно, поток энергии, извлекаемый зелеными растениями из
солнечного света, составляет примерно 4 · 1013 Вт. За счет этой энергии
работают все тепловые машины и осуществляются все процессы
жизнедеятельности.
Однако способы преобразования в работу солнечной энергии
Wc, аккумулированной зелеными растениями в форме химической
энергии, в принципе не одинаковы в тепловых машинах и
биологических системах. Различия термодинамических процессов можно
представить следующей схемой:
В тепловой машине:
^ ФОТОСИНТЕЗ )Утоц 02Е yQ_^AU +A
В биологической системе:
1тг ФОТОСИНТЕЗ ^ ixr биологическое окисление Ot . д г j . л , f\
Как уже отмечалось, источником энергии G для всех живых
существ служит Солнце. Земные растения (аутотрофы) за счет
фотосинтеза создают в течение года примерно 1010 тонн питательных
веществ. Гетеротрофы сами не могут питаться светом, они получают
энергию G, поедая друг друга или питаясь растениями. Пищеварение
обеспечивается поступлением в клетки продуктов гидролиза пищи,
т. е. углеводов, белков, жиров, в которых заключена энергия G
солнечного света.
Основным способом использования энергии G питательных
веществ организмом является их биологическое окисление. Оно
происходит главным образом на внутренней мембране митохондрий, где
сосредоточены ферменты, катализирующие биологическое окисле-
Глава 1. Термодинамика биологических процессов
19
ние (клеточное дыхание). Поэтому митохондрии часто называют
энергетическим цехом клетки.
Энергия, извлекаемая из химических связей питательных
веществ при их биологическом окислении, в некоторых случаях может
быть непосредственно использована для осуществления
жизнедеятельности, но основная ее часть идет на синтез так называемых макро-
энергетических соединений (макроэргов), среди которых наиболее
важным является АТФ.
Энергия, запасенная в макроэргах, используется организмом
для совершения различных видов работ, причем механическая
(мышечная работа) не является самой энергоемкой. В жизни человека
огромные затраты энергии G идут на синтез сложных биомолекул.
Так, для синтеза одного моля белка, требуется от 12 до 200 тыс. кДж
свободной энергии. В «сборке» одной молекулы белка участвуют от
1 до 16 тыс. молекул АТФ (КПД примерно 40%). Для синтеза
молекулы РНК необходимо примерно 6 тыс. молекул АТФ, еще большей
энергии требуется для образования ДНК. Так, на создание одной
молекулы ДНК тратится 12 · 107 молекул АТФ. Однако количество
синтезирующихся молекул белка значительно больше, чем нуклеиновых
кислот, в силу разнообразия его функций и постоянного быстрого
обновления. В результате именно синтез белка в организме наиболее
энергоемок по сравнению с другими биосинтетическими
процессами. В течение каждого часа жизни у млекопитающих белок стромы
обновляется примерно на 1%, а белки-ферменты - на 10%. У
человека массой 70 кг ежечасно обновляется примерно 100 г белка.
Другой важной «статьей» расхода G в организме является
поддержание физико-химических градиентов на клеточных мембранах.
Внутри живой клетки концентрация ионов и вещества отличается от
их концентрации в межклеточной среде, т. е. на клеточной мембране
существует градиент концентрации. Различия концентрации ионов
и молекул приводят к появлению и других градиентов:
осмотического, электрического, фильтрационного и т. д. Наличие градиентов
вызывает непрерывный перенос вещества через мембраны клеток
(пассивный транспорт). Пассивный транспорт должен был бы уменьшить
величину градиентов, т. е. выровнять концентрацию и другие
физико-химические параметры. Однако в нормальных условиях
функционирования клетки градиенты на мембране стабильно поддер-
20
Биофизике
живаются на определенном уровне, что обусловлено способностью
биологической системы переносить вещества в обратном
направлении (в направлении, противоположном градиентам). Такой транспорт
называется активным транспортом. Активный транспорт нуждается
в затратах свободной энергии, которая в большинстве случаев
черпается из АТФ. Следовательно, активный транспорт представляет
собой одну из форм работы биологической системы с КПД примерно
20-25%. КПД мышечного сокращения организма не превышает 20%.
Наряду с совершением работы организм преобразует
свободную энергию питательного вещества в тепло. В конечном итоге вся
энергия, полученная организмом с пищей, кроме той части, которая
идет на механическую работу, превращается в тепловую, и в виде
тепла отдается организмом в окружающую среду. Принято выделять
два этапа в этом теплообразовании.
1. Прежде всего, тепловые потери присущи биологическому
окислению питательных веществ, в ходе которых синтезируется
АТФ. Выделяющаяся при этом тепловая энергия называется
первичным теплом.
2. Остальное теплообразование происходит при гидролизе
АТФ и называется вторичным теплом. К ним относят тепло при
синтезе макромолекул (кроме АТФ); при поддержании градиентов за
счет активного транспорта; при мышечном сокращении; при трении
мышц, кровеносных сосудов, суставов и т. д.; при распаде белков
и других макромолекул.
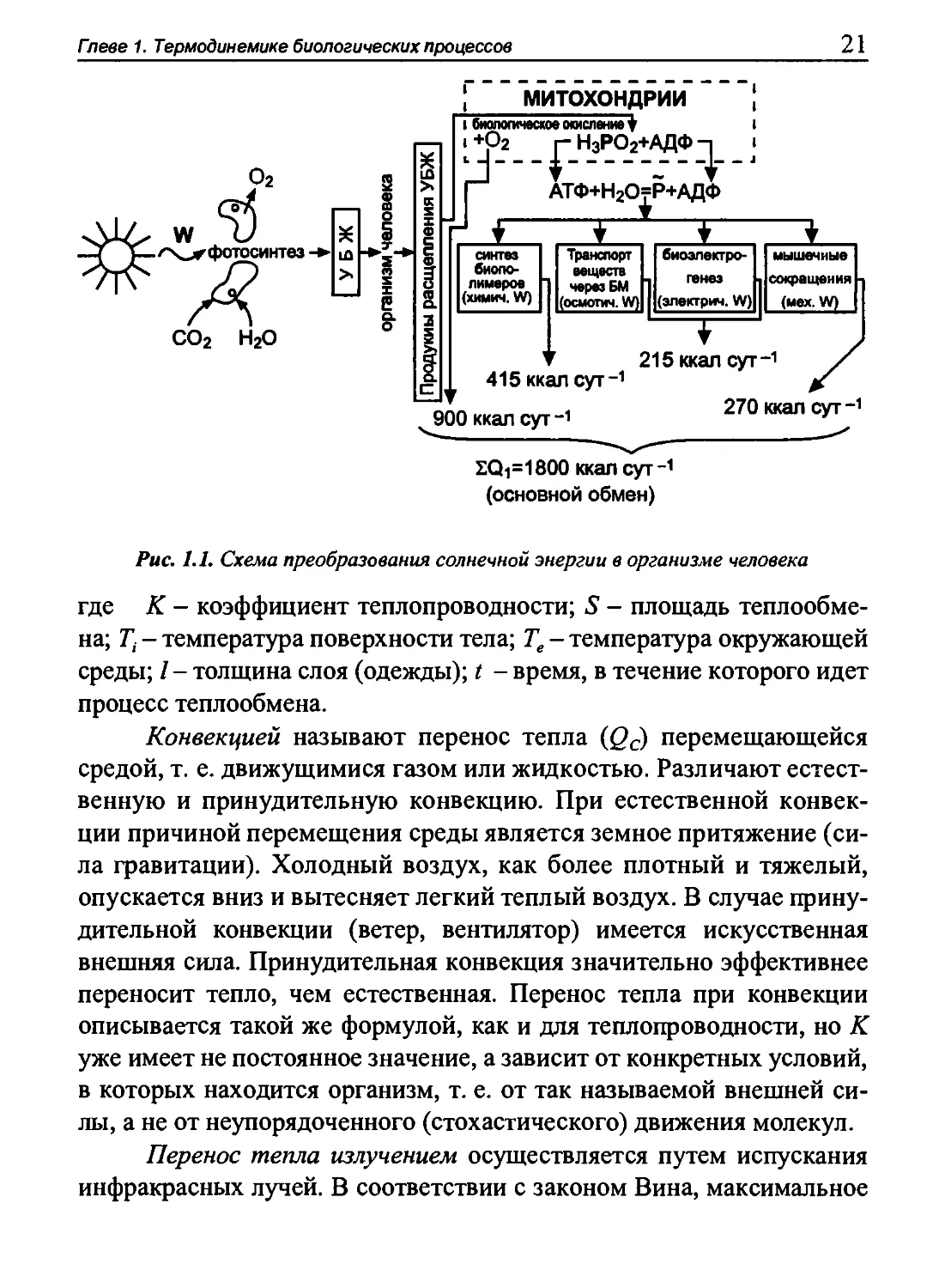
На рис. 1.1 показана схема преобразования солнечной энергии
в организме человека.
Вся тепловая энергия, образующаяся в организме человека,
уходит из него. Теплообмен осуществляется на поверхности тела,
при этом различают четыре основных способа: теплопроводность
(βτ); конвекция (Qc); излучение (QR), испарение (QE).
Теплопроводность играет основную роль в переносе тепла
через одежду. Тепловая энергия, переносимая посредством
теплопроводности, может быть вычислена по следующей формуле:
QT=KS?L^-t, (1.23)
Глеве 1. Термодинемике биологических процессов
21
ч5
_. J)OTOC
W
/"\jr фотосинтез -»►
С02 Н20
2
влове
♦;■*
ζ
ганиз
а.
о
X
1Δ
>
К
S
X
φ
Ё
φ
расщ
дукиы
\ МИТОХОНДРИИ
ι биологическое окисление t
ι +р2 г Н3Р02+АДФ
F
синтез
биополимеров
(химич. W)
Г-ПзГи2+АДФТ
АТФ+Н20=Р+АДФ
Транспорт
веществ
через БМ
(осмотич. W)
биоэлектро-
генеэ
(злектрич. W)
η генеэ ι
I (злектрич. W)
мышечные
сокращения
(мех.УУ)
415 ккал сут-
900 ккал сут ~1
215 ккал сут-1
270 ккал сут-1
1(^=1800 ккал сут~1
(основной обмен)
Рис. 1.1. Схема преобразования солнечной энергии в организме человека
где К - коэффициент теплопроводности; S - площадь
теплообмена; Т, - температура поверхности тела; Те - температура окружающей
среды; /-толщина слоя (одежды); t - время, в течение которого идет
процесс теплообмена.
Конвекцией называют перенос тепла (Qc) перемещающейся
средой, т. е. движущимися газом или жидкостью. Различают
естественную и принудительную конвекцию. При естественной
конвекции причиной перемещения среды является земное притяжение
(сила гравитации). Холодный воздух, как более плотный и тяжелый,
опускается вниз и вытесняет легкий теплый воздух. В случае
принудительной конвекции (ветер, вентилятор) имеется искусственная
внешняя сила. Принудительная конвекция значительно эффективнее
переносит тепло, чем естественная. Перенос тепла при конвекции
описывается такой же формулой, как и для теплопроводности, но К
уже имеет не постоянное значение, а зависит от конкретных условий,
в которых находится организм, т. е. от так называемой внешней
силы, а не от неупорядоченного (стохастического) движения молекул.
Перенос тепла излучением осуществляется путем испускания
инфракрасных лучей. В соответствии с законом Вина, максимальное
22
Биофизика
излучение при средней температуре поверхности человеческого тела
33-34 °С приходится на длину волны около 10 мкм (точнее, 9,4 мкм).
Величину энергии, излучаемую телом, можно приблизительно найти
по формуле, полученной из закона Стефана-Больцмана:
QR=aS(T;-Te4)t, (1.24)
где σ = 5,8 · Ю-8 Вт/м2 · К4, так как для данной инфракрасной (ПК)
области спектра человек представляет собой абсолютно черное тело.
Тепло, отводимое от организма путем испарения,
рассчитывается по формуле:
QE=Lm, (1.25)
где L - скрытая (удельная) теплота испарения Z,H 0 =
= 2^5 106 Дс/кг, а т - масса жидкости, испаряемая с поверхности
тела. ·
Теплоотдача осуществляется только при испарении жидкости
с поверхности тела. Если человек выделяет много пота, но условий
для его испарения нет, то теплоотдача не происходит. Так, при
100% относительной влажности (паровая баня) испарение
полностью прекращается. С кожных покровов человека испаряется не
только вода, но и межклеточная жидкость. За сутки с поверхности
кожи испаряется примерно 0,4-0,6 л жидкости. Жидкость
испаряется не только с кожи, но и со слизистых оболочек. Так, у человека
в сутки испаряется 0,3-0,4 л жидкости со слизистых оболочек
дыхательных путей.
Испарение является наиболее эффективным способом
теплообмена организма при высокой температуре и низкой влажности
внешней среды. Все остальные способы теплоотдачи
функционируют только тогда, когда температура окружающей среды ниже, чем
температура кожи человека, в противном случае они превращаются в
механизм дополнительного нагрева организма. Это обстоятельство
учитывается уравнением теплового баланса организма человека,
которое имеет вид:
M±QT±Qc±QR-QE=0, (1.26)
Глава 1. Термодинамика биологических процессов
23
где Μ - теплопродукция (количество тепла, которое образуется
в организме). В уравнении знак «+», если температура окружающей
среды больше Т„ т. е. Те > Т„ а знак «-», если Т, > Те.
Процессы теплообмена очень важны для жизнеобеспечения
организма. Поддержание постоянства температуры организма
является необходимым условием жизни человека. Поэтому все процессы,
отображенные в уравнении теплового баланса, имеют надежную
регуляцию. Различают механизмы химической и физической
терморегуляции.
Под химической терморегуляцией понимают усиление или
ослабление теплопродукции (Л/) за счет изменения интенсивности
процессов. Сам по себе метаболизм очень важен для организма, и его
изменение в условиях поддержания определенной температуры
крайне нецелесообразно.
В условиях температурного комфорта основным способом
поддержания температуры является физическая терморегуляция, т. е.
регуляция температуры за счет отмеченных механизмов теплоотдачи:
Gr,Gc. Qr'Qe-
Теплообмен организма с окружающей средой (так называемый
внешний поток тепловой энергии) происходит на поверхности тела.
Коэффициент теплопроводности живых тканей имеет низкое
значение, поэтому роль теплопроводности в отведении тепловой энергии
от внутренних органов к поверхности кожи и к слизистым оболочкам
(внутренний поток тепловой энергии) невелика. Основное значение
в этом процессе, т. е. в обеспечении терморегуляции внутренних
органов, принадлежит конвекции, обеспечиваемой кровообращением.
Теплоемкость крови достаточно большая (как у воды), и нормальный
кровоток достаточен для эффективного отвода тепла от внутренних
органов к поверхности тела. Регуляция такого теплопереноса
осуществляется главным образом за счет усиления или ослабления
кровотока (посредством сосудистых реакций). При необходимости отдать
большее количество тепла кровеносные сосуды кожи и слизистых
оболочек расширяются, что приводит к значительному увеличению
массы циркулирующей в них крови, имеющей температуру
внутренних органов, при этом возрастает и теплоотдача. Для уменьшения
теплоотдачи происходит сужение кровеносных сосудов.
24
Биофизика
У человека значительные потери тепла происходят через кисти
рук и стопы ног. Так, при переходе от холода к теплу,
кровообращение в руке человека увеличивается в 30 раз, а в пальцах - примерно
в 600 раз.
Испарение является наиболее эффективным способом
теплообмена организма при высокой температуре. Следовательно,
физическое терморегулирование является многофакторной системой,
которая весьма эффективно обеспечивает постоянство температуры
организма. Многофакторность позволяет регулировать температуру
тела в различных условиях. При исключении одних механизмов
работают другие.
В биофизике, физиологии и медицине выделяемое организмом
тепло принято называть энерготратами организма. Энерготраты
сильно изменяются в зависимости от условий, в которых находится
организм, и в зависимости от характера его деятельности, так как все
это влияет на обмен веществ. Для оценки функционального
состояния организма необходимо создание стандартных условий при
измерении его энерготрат, т. е. при измерении величины тепловой
энергии, выделяемой организмом в окружающую среду. За стандартные
условия приняты такие, при которых энерготраты организма
минимальны. Для этого нужно исключить влияние тех факторов, которые
усиливают энергообмен мышечной работы, приема пищи,
эмоционального напряжения, отклонения температуры и влажности за
пределы зоны комфорта и т. д.
Величину основного обмена (энерготрат) измеряют в
состоянии бодрствования (не во время сна), но пациент должен спокойно
лежать в постели. Процедуру проводят рано утром (в 5-6 часов
утра), когда, в соответствии с суточным ритмом, интенсивность
метаболизма самая низкая. Измерение проводят натощак, т. е. через 12-
14 ч после последнего приема пищи, при этом температура в
помещении должна быть в пределах 20-22 °С, а относительная
влажность - 50-60%. Величина теплопродукции измеряется несколько
раз для получения статистически достоверного результата.
Так, у здорового мужчины в возрасте 20-30 лет при
средней масссе тела 70 кг основной обмен составляет 7800 кДж или
1800 ккал за сутки (1-1,2 ккал/кг · ч), что соответствует мощности
Глава 1. Термодинамика биологических процессов
25
90 Вт. Величина основного обмена в расчете на единицу площади
поверхности человеческого тела составляет примерно 37 ккал/м2 · ч,
или 150 кДж/м2 · ч. У женщин основной обмен на 7-10% меньше.
Основной обмен сильно зависит от возраста. На Х-ХП-е сутки
после рождения человека, он достигает 300 кДж/м2 · ч, а к 70-80 годам
понижается до 120 кДж/м2 · ч.
Для определения энерготрат необходимо измерить количество
тепла, выделяемое организмом в окружающую среду за
определенный промежуток времени. Для этого применяют два метода: прямую
и непрямую физиологическую калориметрию (биокалориметрию).
В методе прямой калориметрии используются специальные
физиологические калориметры, сконструированные таким образом,
что в них можно помещать на нужное время животных или
человека. Однако далеко не всегда можно реализовать прямую
калориметрию. В частности, при изучении энерготрат в ходе трудовой
деятельности.
Чаще используют непрямую калориметрию. Этот метод
основан на исследовании газообмена организма. Установлено, что между
объемом потребляемого организмом кислорода и энерготратами
существует линейная зависимость при фиксированных условиях.
Коэффициентом служит так называемый калорический эквивалент
кислорода, равный количеству тепла, которое образуется в организме
при использовании 1 л 02 для окисления питательных веществ.
Калорический эквивалент неодинаков при окислении жиров,
белков и углеводов. То, какие вещества преимущественно
окисляются в каждом конкретном случае, можно определить по дыхательному
коэффициенту (ДК), который определяется как отношение объема
выделяемого углекислого газа к объему поглощенного кислорода за
один и тот же промежуток времени:
ДК=-^ (1.27)
ог
Так, при преимущественном окислении углеводов
дыхательный коэффициент стремится к 1, а при окислении жиров он имеет са-
26
Биофизика
мые низкие значения, примерно 0,7. Существуют специальные
таблицы и номограммы, при помощи которых можно определить
величину кислородного эквивалента по найденному значению
дыхательного коэффициента.
Таким образом, посредством газоанализа измеряются объемы
поглощенного кислорода и выделяемого углекислого газа за одно и то
же время. Взяв отношение второго к первому рассчитывают ДК. По
ДК находят калорический эквивалент. Умножив его на объем
поглощаемого кислорода, определяют энерготраты за время эксперимента.
В таком расчете нередко пользуются средним значением
калорического эквивалента (20,2 кДж/л): энерготраты = 20,2 · F0 . Тогда
погрешность не выходит за пределы ±4% при том, что погрешность
метода непрямой калориметрии составляет 5-8%.
1.2. Второй закон термодинамики
1.2.1. Общие сведения
Первый закон термодинамики определяет энергетические
преобразования и энергетический баланс в термодинамической системе,
но он не позволяет установить, в каком направлении текут
естественные термодинамические процессы.
Необходим дополнительный принцип, который позволяет
судить о направленности процессов. Именно второй закон
термодинамики определяет это направление и эффективность преобразования
энергии в работу. На основании наблюдений и повседневного опыта
было предложено несколько эквивалентных формулировок второго
закона термодинамики:
1. Р. Клаузиус (1850): теплота не может самопроизвольно
передаваться от более холодного к более нагретому телу.
2. У. Томпсон (1851): невозможно построить периодически
работающее устройство, которое выполняло бы работу за счет тепла,
отбираемого из одного теплового резервуара, имеющего во всех
частях одинаковую температуру. Иначе говоря, невозможно построить
«перпетуум-мобиле второго рода». Оказалось, что для обратимых
процессов отношение теплоты dQ к температуре Τ есть постоянная
Глава 1. Термодинамика биологических процессов
27
величина, и это отношение не зависит от того, каким образом
проходит процесс:
^=5,-^=/^ = }^· (1-28)
ι 1 ι 1
Новая функция состояния системы есть энтропия (S) (от
греч. - «изменение», «превращение»). При бесконечно малых
изменениях состояния закрытой системы изменение энтропии будет
иметь вид:
dSJ-&*L>*Q. (1.29)
Τ Τ
В изолированной термодинамической системе δβ = 0 и
изменение энтропии dS > 0. Знак (=) соответствует идеализированным
обратимым процессам, а знак (>) - реальным самопроизвольным
необратимым процессам. Для необратимых процессов в закрытых
системах неравенство σο > —— можно представить как
*-&+*&, (1.зо)
Τ Τ
где δζλ - теплота, возникающая в самой системе за счет
необратимых процессов.
Фактически уравнения (1.29) и (1.30) представляют собой
математическую запись второго закона термодинамики. Согласно
этому закону, в изолированной системе энтропия сохраняет постоянное
значение для обратимых процессов (S = const), возрастает при
необратимых процессах и достигает максимального значения при
термодинамическом равновесии (S -» max).
Необратимые процессы всегда протекают в направлении
возрастания энтропии. Таким образом, энтропия является количественным
показателем способности системы к самопроизвольным изменениям
термодинамических процессов. Энтропия измеряется в Дж · К-1 или
в энтропийных единицах (э. ед.). Образное выражение Р. Эмдена
28
Биофизика
(1933) отражает сущность первого и второго законов термодинамики:
«В гигантской фабрике естественных процессов энтропия занимает
место директора, который предписывает характер и способ ведения
всех сделок, в то время как закон сохранения энергии - всего лишь
«бухгалтер», приводящий в равновесие дебет и кредит».
В чем же физическая сущность понятия энтропии?
Термодинамика имеет дело с макроскопическими системами и
поэтому она не может дать никакой информации о молекулярных
механизмах, которые вызывают направленное изменение
макроскопических функций системы. Л. Больцман впервые дал физическую
трактовку энтропии исходя из понятий статистической физики.
Энтропия является мерой неупорядоченности в организации системы.
Следовательно, возрастание энтропии отображает возрастающую
дезорганизацию системы. Больцману удалось это доказать,
предположив, что энтропия каждого макроскопического состояния связана
с вероятностью реализации этого состояния. Одно и то же
макросостояние реализуется огромным числом микросостояний. Это число
микросостояний называется термодинамической вероятностью (W).
В отличие от математической вероятности, термодинамическая
вероятность - очень большая величина. Для термодинамической
вероятности справедливо соотношение
W= — , (1.31)
Ni\-N2\-Ni\...Nl\
где N=N, + N2 + N3+.. .+Nf - общее число молекул в системе; N, -
число молекул в г'-м фазовом объеме.
Термодинамическая вероятность W- это число способов,
которыми N молекул можно расположить в i ячейках системы. Л.
Больцман связал энтропию с термодинамической вероятностью:
S=klnW, (1.32)
где к - постоянная Больцмана (к = 1,38 · Ю-23 Дж · К-1); R -
универсальная газовая постоянная (R = к- Na= 1,38 · 10~23 · 6,02 · 1023моль-1 =
= 8,31 Дж· моль-'-К-').
Глава 1. Термодинамика биологических процессов
29
о о I
00
0 0
°1о
0 I
е)
<
0 0 | 0 |о 0
0 |0 0| 0
б)
!ооо'
Pool
в)
>min
Рис. 1.2. Распределение молекул между тремя отсеками:
а - начальное состояние системы; б -равновесное состояние системы
с максимальной энтропией Sm,a; в - неравновесное состояние системы
с минимальной энтропией Sm^' I - самопроизвольный процесс;
2 - несамопроизвольный процесс
Рассмотрим идеальный газ в сосуде, разделенном
перегородками на три отсека. Представим, что в начальном состоянии (рис. 1.2)
молекулы газа распределены различными способами. Схематически
9 молекул в начальном состоянии распределены в трех отсеках так:
6, 2 и 1 молекула. Подсчитаем, согласно (1.31) и (1.32),
термодинамическую вероятность и энтропию начального состояния. Возможны
две крайние ситуации для перехода системы из этого состояния: все
молекулы равномерно распределяются в трех отсеках (3, 3, 3)
(рис. 1.2, б) и все молекулы попадают только в один отсек (0, 9, 0)
(рис. 1.2, в). Термодинамические вероятности для этих двух
ситуаций: й^6=1680;^в=1.
В предельном случае, когда все молекулы распределены
равномерно по ячейкам, термодинамическая вероятность W имеет
максимальное значение. Это равновесное состояние системы с
максимальной энтропией Smax. Переход системы в равновесное состояние
будет самопроизвольным и наиболее вероятным процессом. Вторая
крайняя ситуация соответствует состоянию системы, когда все
молекулы сосредоточены только в одной ячейке. Термодинамическая
вероятность W этого состояния имеет наименьшее значение. Это
наиболее упорядоченное состояние с минимальной энтропией Sm31l,
самопроизвольный переход в которое менее всего вероятен.
Таким образом, энтропия, согласно трактовке Больцмана,
является мерой неупорядоченности системы. В результате
самопроизвольных процессов изолированная система переходит в состояние
30
Биофизика
Smax
ί
Рис. 1.3. Изменение энтропии S изолированной системы при достижении
состояния термодинамического равновесия: ί - время
термодинамического равновесия, которое характеризуется
максимальной энтропией (рис. 1.3). При равновесии происходят флуктуации,
которые вызывают локальное уменьшение энтропии dS < 0, но в
системе возникают такие изменения, которые возвращают ее в
равновесное состояние с Smax. Следовательно, стремление энтропии к Smax
является главным эволюционным принципом изолированной
термодинамической системы.
Второй закон термодинамики указывает, что не все виды
энергии эквивалентны. Л. Бриллюэн разделил по качеству все виды
энергии и сязал их с величиной энтропии. Энергиям, которые наиболее
эффективно превращаются в другие виды энергии, соответствует
наименьшее значение энтропии. Это энергии «высшего качества» (класс А).
В этот класс отнесены гравитационная, ядерная, световая,
электрическая энергии. В класс В отнесена химическая энергия «среднего
качества». Энергией «низкого качества» с максимальной энтропией
является тепловая энергия (класс С). Таким образом, согласно трактовке
Бриллюэна, второй закон термодинамики для изолированной
системы означает постоянную деградацию энергий «высшего качества» в
энергию «низкого качества», т. е. в тепловую энергию.
1.2.2. Особенности живых организмов
как термодинамических систем
При применении термодинамики к биологическим системам
необходимо учитывать особенности организации живых систем:
Глава 1. Термодинамика биологических процессов
31
1) биологические системы открыты для потоков вещества и энергии;
2) процессы в живых системах, в конечном счете, имеют
необратимый характер; 3) живые системы далеки от равновесия; 4)
биологические системы гетерофазны, структурированы, и отдельные фазы
могут иметь небольшое число молекул.
Это все в корне отличает биологическую систему от
изолированных, близких к равновесию систем. Для изучения используется
теория термодинамики необратимых процессов. Для более
адекватного описания свойств биологических систем во многих случаях
полезно применение термодинамики необратимых процессов,
основателями которых считают Л. Онзагера и И. Пригожина. В
термодинамике необратимых процессов рассматривается ход процессов во
времени и стационарное состояние системы.
Вот пример зависимости процесса от времени: концентрация
ионов Na+ снаружи клетки обычно на порядок больше, чем внутри
клетки. Градиент концентрации и разность потенциалов приводят
к постоянному «просачиванию» ионов Na+ внутрь клетки. Но
концентрация постоянна за счет насосов, выкачивающих Na+ и
работающих за счет гидролиза ATOi
В отличие от термодинамического равновесия, стационарное
состояние характеризуется:
Постоянным притоком веществ в систему и удалением
продуктов обмена.
Постоянной затратой свободной энергии, которая
поддерживает постоянство концентраций вещества в системе.
Постоянством термодинамических параметров (включая
внутреннюю энергию и энтропию) системы, находящейся в
стационарном состоянии.
В стационарном состоянии открытая система может
существовать только за счет потоков вещества и электрических зарядов.
1.2.3. Термодинамические потенциалы
Второй закон термодинамики позволяет установить
направленность изменений в системе, однако по изменению термодинамических
функций А£/и AS нельзя оценить величину производимой работы.
32
Биофизика
Объединим первый (1.5) и второй (1.29) законы
термодинамики следующим образом:
TdS=dU+dA. (1.33)
С учетом (1.13) получаем:
TdS=dU +дАр+дА0, (1.34)
где ЪАр = pdV. Тогда полезная работа будет записываться так:
-dAp=dU +PdV-TdS. (1.35)
Введем две новые функции состояния системы F и G. Если
процессы осуществляются при постоянной температуре (Г= const)
и постоянном объеме (V= const), то максимальная полезная работа
в системе выполняется за счет изменения свободной энергии Гель-
мгольца (F) (изохорно-изотермический потенциал). В этом случае
pdV=0u
-A0=dU -TdS=d(U-TS) = dF, (1.36)
где F=U-TS.
В дифференциальной форме изменение свободной энергии Ге-
льмгольца запишется так:
dF = dU-TdS. (1.37)
Если Τ = const и р = const, то максимальная полезная работа
выполняется за счет изменения свободной энергии Гиббса (G) (изо-
барно-изотермический потенциал):
-дАр =dU + pdV -TdS =dH -TdS =d(H -TS) = dG, (1.38)
где G = H-S.B дифференциальной форме:
dG=dH-TdS. (1.39)
Новые термодинамические потенциалы позволяют сделать ряд
важных заключений.
Глава 1. Термодинамика биологических процессов
33
1. Выполнение полезной работы при осуществлении
необратимых процессов всегда сопровождается рассеянием энергии, величину
которой определяет TdS. Чем больше эта величина, тем более
необратим процесс. Таким образом, изменение энтропии dS характеризует
необратимость процесса. Только для абсолютно обратимых
процессов рассеяние энергии отсутствует: TdS - 0.
2. По величине и знаку изменения термодинамического
потенциала можно судить о направленности процессов. Если в результате
определенных процессов термодинамические потенциалы
понижаются {dF < 0 или dG < 0), такие процессы являются самопроизвольными.
Они проходят с выделением энергий и называются экзергоническими.
Процессы, которые идут с увеличением термодинамических
потенциалов {dF > 0 или dG > 0), являются несамопроизвольными. Такие
процессы называют эндергоническими. Они требуют поступления в
термодинамическую систему дополнительной энергии из внешней
среды.
3. При достижении равновесия термодинамические
потенциалы стремятся к минимальным значениям: F —» min, dF=0; G —» min,
dG = 0.
В биологических системах процессы текут при ρ - const,
поэтому в термодинамических оценках преимущественно используется
свободная энергия по Гиббсу - потенциал G. Поскольку все функции
состояния являются полными дифференциалами, то
"ШМ*1-Н£\*·· 0'40>
где ν, - число молей г'-го компонента в реакции. Но исходя из
выражения
G=H-TS=U+pV-TS,
получим:
dG=dU +PdV+Vdp-TdS-SdT. (1.41)
1 - 9843
34
Биофизика
Подставим выражение TdS =dU + pdV, которое справедливо
для равновесных процессов при отсутствии выполнения полезной
работы, в (1.41). Тогда
dG = TdS + VdP - TdS - SdT = Vdp - SdT. (1.42)
Сравнивая (1.40) и (1.42) при условии ν, = const, имеем
(fl,- И,,
=-s.
(1.43)
Рассмотрим еще один термодинамический потенциал -
химический потенциал (μχ), который представляет собой изменение
любой термодинамической функции U, Н, F, G, отнесенной к
количеству молей вещества:
-
(ди]
-
(дн]
-
(dF)
Г.У
(до)
k J
μ,
В случае изменения энтропии
(1.44)
Т,Р
(1.45)
Тогда изменение свободной энергии по Гиббсу (1.40) с учетом
химических реакций и (1.43) и (1.45) будет иметь вид:
dG = Vdp - SdT + ]Г μΧι </ν,..
(1.46)
1.2.4. Изменение стандартной свободной энергии.
Константа равновесия и электрохимический потенциал
Изменение свободной энергии AG зависит от условий
(температуры, давления, концентрации реагирующих веществ), в которых
текут химические реакции, но это затрудняет сравнение
химических преобразований различных веществ. Тогда изменение свобод-
Глава 1. Термодинамика биологических процессов
35
ной энергии AG представляют в стандартных условиях (для 1 Μ
водных растворов при давлении 1 · 102 кПа (1 атм.), рН = 7,0, Т=
298 °К) и эту величину называют изменением стандартной
свободной энергии (AG°).
Определим изменение свободной энергии для одного моля
идеального газа при постоянной температуре Τ = const. Запишем
уравнение состояния одного моля идеального газа:
PV=RT. (1.47)
RT
Тогда V =— подставляем в (1.43) и находим изменение сво-
Р
бодной энергии
dG=RT^-. (1.48)
Ρ
Величину свободной энергии G получим, интегрируя (1.40) от
/Ί Лор2:
G=RT\^- = RT\np2-RT\npv (1.49)
Если допустить, что исходное состояние системы находится в
стандартных условиях, т. е. при/?, = 1-102 кПа, так что оно
соответствует стандартному состоянию G°, тогда G2=G° +RT\np2. В
общем виде величина свободной энергии будет составлять:
G=G° +RTlnp. (1.50)
С определенным приближением (для разбавленных растворов
давление ρ определяется концентрацией вещества с) уравнение (1.50)
можно представить так:
G2=G° +RT)nc.
(1.51)
36
Биофизика
Рассмотрим простую химическую реакцию: А <-» 2?, где [А]
и [В] - концентрации реагирующих веществ. Согласно (1.51),
изменение свободной энергии AG в этой реакции будет
AG=GB -GA =(G°B +RTlnB^-(G°A +RTlnA^ =
4-"·«ίίβ)
(1.52)
= Gl -G° + i?rin- = AG"
" A A {A}
При достижении равновесия (AG = 0) получаем изменение
стандартной свободной энергии
[В]
AG0 =-RT\n """ (1.53)
И]рави
Ρ
Отношение равновесных концентраций веществ —^L = k
называется константой равновесия. Тогда
AG0 =-RTlnkp. (1.54)
Это - уравнение Вант-Гоффа. Оно чрезвычайно важно,
поскольку позволяет, измеряя экспериментально k, находить величину
AG°.
Подходы равновесной термодинамики могут быть
использованы при решении задач о переносе заряженных и нейтральных
веществ через клеточные мембраны.
Как было показано ранее, изменение свободной энергии AG
выражается уравнением (1.46). В клетке химические превращения и
перенос веществ происходят при Τ = const H/> = const; тогда (1.46)
упрощается:
Λ?=5Χ</νΓ (1.55)
ι
При одном обороте реакции количество молекул исходных
веществ и продуктов пропорционально соответствующим стехиомет-
Гпава 1. Термодинамика биопогических процессов
37
рическим коэффициентам β так, что изменение числа молей Δν, = β,.
Это справедливо, когда в результате одного оборота реакции число
превращенных молекул существенно меньше общего числа молекул
реагентов в смеси. Тогда выражение (1.55) запишется так:
Λ? = 5χβ, (1.56)
(β < 0 для исходных веществ и β > 0 для продуктов реакции).
Рассмотрим перенос вещества через мембрану из одной фазы в
другую, если фазы отличаются химическими потенциалами μχ u[ix .
Согласно (1.56), изменение свободной энергии выражается
уравнением:
ΔΟ=μχβΑ+μχβΒ. (1.57)
Так как β^ =ββ =β,το
Δσ=β,(μ,<|-μ„) = βΔμ,. (1.58)
При равновесии AG = 0, а значит, (μχ -μχ )=0ΗΠΗμ, =μχ .
В более общем случае между двумя фазами, разделенными
мембраной, могут происходить перенос незаряженных частиц
благодаря разности концентраций сА и св (осмотическая работа) и перенос
ионов (электрическая работа). Тогда, в отличие от (1.58), изменение
снободной энергии определяется разностью электрохимических
потенциалов (Δμ):
Δϋ=βΔμ. (1.59)
Электрохимический потенциал - это полный потенциал,
учитывающий химический потенциал μχ системы и электрическую рабо-
iy ΑΊη по переносу заряженных частиц:
μ=μ,+Λ;
(1.60)
38
Биофизика
По аналогии с выражением для G (1.51), химический
потенциал можно представить так:
μx=μ0x+RTL·c, (1.61)
где μ° - стандартный химический потенциал; с - концентрация
вещества. Электрическая работа
Ам =zF<p, (1.62)
где ζ - валентность иона; F = 96500 Кл · моль-1 - число Фарадея;
φ - потенциал на границе раздела «фаза - окружающая среда». Для
случая переноса через мембрану из фазы А в фазу В нейтральных
веществ и ионов изменение электрохимического потенциала будет
иметь вид:
Δμ = Δμ, +Α„ =< -μ!, +RTlnc + zFtop. (1.63)
Условием равновесия является AG = 0. Тогда в общем случае,
когда имеется перенос нейтральных частиц и ионов, равновесие
будет определяться равенством электрохимических потенциалов Δ μ =0
йлиц^ =μβ.
1.3. Термодинамика необратимых процессов
Классическая термодинамика разработана для закрытых и
изолированных систем и в основном имеет дело с равновесными
состояниями. В открытых системах непрерывно происходит обмен с внешней
средой энергией и веществом и вместо термодинамического равновесия
устанавливается стационарное состояние. Сходство равновесия и
стационарного состояния состоит в том, что большинство параметров
системы не изменяется во времени. Однако имеются принципиальные
отличия. При равновесии не происходит изменения свободной энергии
Гиббса (AG = 0), а энтропия стремится к максимальному значению
(S —» шах). В стационарном состоянии изменение свободной энергии
поддерживается на постоянном уровне (AG = const) и значение энт-
Гпаеа 1. Термодинамика биологических процессов
39
ропии отличается от максимального значения. В открытых системах
приходится иметь дело и с неравновесными состояниями, и с
реальными необратимыми процессами. Эти вопросы рассматривает
термодинамика необратимых процессов.
1.3.1. Изменение энтропии в открытых системах
и диссипативная функция
Основы линейной неравновесной термодинамики были
заложены Л. Онзагером и в дальнейшем развиты И. Пригожиным.
Линейная неравновесная термодинамика рассматривает процессы вблизи
равновесия, когда между скоростями и силами, которые вызывают
процессы, существуют линейные зависимости.
Если в открытой системе проходят необратимые процессы, то
изменение энтропии представляется как в (1.30). Это значит, что
общее изменение энтропии в открытой системе, обменивающейся
с внешней средой энергией и веществом, можно представить так:
dS=^ + O- = deS+d.S, (1.64)
Τ Τ '
где άβ - изменение энтропии за счет обмена с внешней средой;
<Ιβ - изменение энтропии в системе вследствие необратимых
процессов в ней. Согласно второму закону термодинамики, άβ>0. Для
адиабатических изолированных систем άβ > О и άβ > 0.
Определим величину άβ в системе, если в ней текут
химические реакции.
Изменение массы /-го компонента при химическом преобразо-
нании запишется так:
dm, =Р,.шД; dv, = ^=β;ίξ, (1.65)
где β, - стехиометрический коэффициент; М, - молекулярная
масса; άν, - число молей вещества; ξ - степень прохождения реакции,
показывающая изменение количества молей вещества, приведенное
к стехиометрическому коэффициенту.
40
Биофизика
Энтропия является полным дифференциалом и для
определенного количества компонент ν,, которые преобразуются в химических
реакциях, изменение энтропии запишется так:
^=Σ
f ds^
К9** J
dvr (1.66)
Изменим запись (1.66) с учетом формулы для химического
потенциала (1.45):
^=-^ΣΜν.· о·67)
* i
Если подставить (1.65) в выражение (1.67), то получим:
^=^ΣΜ.^· о·68)
Де-Донде ввел новое понятие - сродство химической реакции:
*=ΣΜ.· о·69)
I
Подставив (1.69) в (1.68), получим выражение для продукции
энтропии, когда в системе проходят химические реакции:
d,S= — d$. (1.70)
Общее изменение энтропии в открытой системе с учетом
обмена энергией с внешней средой имеет вид:
dS = ?Q-+ — ί/ξ. (1.71)
Τ Τ
Одно из наибольших достижений термодинамики
необратимых процессов, в отличие от равновесной термодинамики, состоит
в том, что она вводит понятие времени и рассматривает изменение
энтропии во времени.
Глава 1. Термодинамика биологических процессов
41
Скорость изменения энтропии для открытой системы
запишется в общем виде так:
dt dt dt
Общая скорость изменения энтропии равна сумме потока энт-
'd S\
и продукции энтропии в сис-
ропии через открытую систему
(d,S'
теме
dt
\ dt )
Для химических реакций в системе:
*£ = *£=£у, (1.73)
dt Τ dt T
где ν-скорость реакции.
Возникает вопрос, возможно ли использование понятия
энтропии, введенного в равновесной термодинамике, для описания
процессов в неравновесных ситуациях. В термодинамике необратимых
процессов допускается, что хотя система в целом неравновесна,
каждая из подсистем, выделенная в элементарном объеме, находится
и состоянии равновесия (принцип локального равновесия). Вводится
нажное понятие - локальная продукция энтропии σ в элементарном
объеме dV. Тогда продукция энтропии:
ί£- = \σάν. (1.74)
dt I
Так как d,S > 0, то и локальная продукция энтропии будет
о>0.
Перенесем в уравнении (1.73) температуру Тъ левую часть и по-
пучим
T^l=Kv. (1.75)
dt
42
Биофизика
Правая часть этого выражения представляет собой
произведение двух величин, одна из которых является причиной или силой
(химическое сродство - К), вызывающей химическую реакцию,
а вторая представляет собой следствие (скорость реакции ν)
действия данной причины.
Рассмотрим несколько конкретных примеров, подтверждаю-
d.S
щих правильность заключения, что Т—— является универсальной
dt
характеристикой и представляет собой всегда произведение силы на
скорость процесса. При перемещении тела на расстояние χ под
действием силы F выполняется механическая работа A=Fx. Мощность
процесса:
N = - = F- = Fv, (1.76)
t t
где t - время действия силы; ν - скорость движения тела в
направлении силы. При прохождении электрического тока мощность будет:
ΛΤ = Δφ/, (1.77)
где Δφ - разность потенциалов.
Таким образом, в наиболее общей феноменологической форме
любой процесс можно характеризовать произведением обобщенной
силы Х(причина) на обобщенный поток J (скорость процесса). В
зависимости от процесса обобщенная сила X может иметь разную
природу: в химических реакциях - химический потенциал, в механических
процессах - сила, в электрических явлениях - напряженность, в
процессах диффузии - градиент концентраций, в процессах
теплопроводности - градиент температуры.
Посмотрим, как передается мощность в открытой системе при
осуществлении необратимых процессов. По аналогии с
техническими устройствами, в биологических системах происходит
преобразование одного вида энергии в другой - химической в электрическую
(нерв), в механическую (мышца) и в световую (биолюминесценция
светляка); световой в химическую (хлоропласт) и в электрическую
I пава 1. Термодинамика биологических процессов
43
(сетчатка глаза); механической в электрическую (улитка внутреннего
уха). Важной характеристикой любого преобразователя энергии,
нключая и биологический, является изменение мощности на входе
(/VBX) и выходе (Naux) открытой системы. В общем виде изменение
мощности можно записать так:
NM-Nmx=^-T. (1.78)
at
d.S
Произведение —'— Τ называется диссипативной функцией. Для
dt
неравновесных систем основной характеристикой выступает
локальная продукция энтропии σ, и поэтому диссипативная функция
запишется так:
Γσ=ΣΛ. о·79)
если в открытой системе проходит к процессов. Выражение (1.78)
показывает, что протекание необратимых процессов в открытой
системе всегда сопровождается диссипацией (рассеянием) энергии. Во
iiccx преобразователях входная мощность превышает выходную
мощность, а это значит, что происходит преобразование энергии
высокого качества (электрической, световой, химической) в тепловую
•пергию. Диссипативная функция Τσ = О только в случае идеальных
обратимых процессов.
1.3.2. Основные положения линейной
неравновесной термодинамики
Возникает вопрос, какие причинно-следственные связи
существуют между потоками J и обобщенными силами X. В общем виде
можно считать, что поток J зависит от силы X: J = f (X). Разложим
,/ (X) вряд Маклорена вблизи точки равновесия
J(X) = J(0)+J'^-X+J"^-X2+..., (1.80)
44
Биофизика
где Х= О и J (О) = О - точка равновесия. Производные в точке
равновесия обозначим постоянными феноменологическими
коэффициентами: J'(0) = L, L"(0) = L', и т. д. С учетом этих обозначений и
пренебрегая членами выше первого порядка, получим
J=LX. (1.81)
В приближении, что система находится вблизи состояния
равновесия, получается линейная связь между потоком и силой.
Экспериментальным подтверждением основных положений
линейной неравновесной термодинамики является ряд эмпирических
законов, которые устанавливают линейные соотношения вида (1.81).
Поток вещества при диффузии описывается законом Фика:
dm _ dc ,. _..
— = -Ds—, (1.82)
dt dx
а в обобщенной форме:
где т - масса вещества; D - коэффициент диффузии; s - площадь
переноса вещества; градиент концентрации. Линейная связь
dx
между потоком вещества Jc и обобщенной силой Хс осуществляется
через феноменологический коэффициент Lc = - Ds.
Поток тепла описывается законом Фурье:
d-Q=-ksd-l, (1.83)
dt dx
где к - коэффициент теплопроводности; градиент темпе-
dx
ратуры.
В обобщенной форме закон Фурье выражается следующим
уравнением:
\J >р ~~ ■"Τ ^*· Τ *
Глава 1. Термодинамика биологических процессов
45
Объемный поток жидкости через трубку характеризуется
законом Пуазейля:
*?- = *!±±, (1.84)
dt 8η/ dl
где V - объем жидкости; г - радиус трубки; / - длина трубки; η -
коэффициент вязкости; Δρ - перепад гидростатического давления.
В обобщенной форме закон Пуазейля выражается следующим
уравнением:
Ρ Ρ Ρ
Закон Ома устанавливает линейную зависимость между
потоком электрических зарядов je и напряженностью электрического
поля Е:
Л=4 = ЛА (1.85)
at dx
где — - электрический ток, Л - удельная электропроводность сре-
dt
d<p
ды, s - площадь сечения, —- - градиент электрического потенциала
dx
(напряженность электрического поля).
В обобщенной форме закон Ома выражается следующим
уравнением:
В биологической системе протекает одновременно много
процессов, которые между собой могут быть взаимосвязаны.
Рассмотрим два взаимосвязанных потока Jk и Jn. Если бы поток Jk не был
сопряжен с потоком Jn, он бы зависел только от обобщенной силы Хк,
ι. с. Jk = L/jJCb. Но поскольку он сопряжен с потоком Jn, то зависит
также и от силы Х„, и эту связь устанавливает линейный
коэффициент взаимосвязи Z,b. Тогда для двух сопряженных потоков запишем:
46
Биофизика
\Jn=LntXt+LimXn
(1.86)
Если поток Jk взаимосвязан с и потоками, тогда в общем виде
Л =Σ^Χη- (1-87)
л
В линейной неравновесной термодинамике особое значение
приобретает соотношение взаимности Онзагера (Lh, = L„k),
показывающее, что если поток Jk, соответствующий необратимому процессу
к, испытывает действие силы другого необратимого процесса η через
коэффициент Ьы , то и поток Jn также испытывает влияние силы Хк
через тот же коэффициент Lkn.
Подставив (1.86) в диссипативную функцию (1.79),получим
основное феноменологическое уравнение линейной неравновесной
термодинамики:
γ.=Σα**.*.·
(1.88)
Рассмотрим пример применения соотношения взаимности
Онзагера для анализа сопряженных необратимых процессов, которые
имеют место в биологических системах. Водный раствор сахарозы
находится в двух отсеках А и В, разделенных мембраной (рис. 1.4).
Мембрана частично проницаема для молекул сахарозы и полностью
проницаема для молекул растворителя (воды). В результате на
мембране устанавливаются два встречных потока - растворенного веще-
-;
А ■ .
сА
J
:>]
-
■
а
_ - ι
_-
-■' в
с. _ .
с* '"'
УС ■
-
"_- - -.
Рис. 1.4. Пассивный транспорт веществ через мембрану М: Ар -
гидростатическое давление; Jc и J„ - потоки растворенного вещества (сахарозы) и
растворителя (воды) соответственно; сс - концентрация сахарозы; сАс > свс; А и В- отсеки
Глава 1. Термодинамика биологических процессов
47
ства Jc и воды Je. Используя (1.78), запишем диссипативную
функцию для этих двух потоков так:
Ta=JcXc+JeXe. (1.89)
В изотермических условиях движущая сила для обоих потоков
будет состоять из двух составляющих:
Χ = νΑρ + Αμχ, (1.90)
где Ар - разность гидростатических давлений в двух отсеках; Αμχ -
разность химических потенциалов вещества по обе стороны
мембраны; V - парциальный молярный объем вещества. Тогда
Ta ^^Ap + Ap^+J^Ap + A^ (1.91)
или
Тв =(jcFc+JeFe)Ap+J^x +7.Δμ„. (1.92)
Разность химических потенциалов Δμ^ связана с
осмотическим давлением Aposm, которое компенсирует разность концентраций
растворов по обе стороны мембраны. Согласно закону Вант-Гоффа:
Aposm=RT(cl +свс). (1.93)
Найдем дифференциал от химического потенциала (1.61):
άμχ =φ° +RTd(\nc) = RT — , (1.94)
с
где άμ°χ = 0.
Представим άμχ через небольшое приращение химического
потенциала:
Δμ, = RT^-, (1.95)
с
48
Биофизика
где сс - средняя концентрация сахарозы в системе
Подставив в уравнение (1.95) из формулы (1.93) Ар05т,
получим
Δμ,
АР0
(1.96)
Связь двух сопряженных встречных потоков растворенного
вещества и растворителя подчиняется уравнению Гиббса-Дюгема:
£«Δμ,, +€ΒΔμχ> =0.
Из этого уравнения находим, что
(1.97)
Δμ,. =^Δμ
с.
(1.98)
Подставив (1.96) в (1.98) и заменив V\ = —, получим
с.
-Δμ =-У Ар .
т*хл в г asm
Теперь подставим Δμ, (1.95) и Αμχ (1.99) в (1.92):
Ta=(Jevc+J.r.)*p +
ЬРо
(1.99)
(1.100)
Таким образом, в рассмотренном процессе диссипативная
функция Та представлена новыми обобщенными силами (Aposm и Δρ)
и новыми потоками:
J =J V +J V
ρ с с ев
J.
J-^-J V
(1.101)
Гпава 1. Термодинамика биологических процессов
49
где Jp - объемный поток; Ja - диффузионный поток.
С учетом новых обозначений
Ta=JpAp+JaAposm. (1.102)
Для сопряженных потоков Jp и Ja в соответствии с
феноменологическими уравнениями (1.86) имеем
F,-V*+V*-t (U03)
|/д =LaPAP+LLLAPosm
где Lpp, LpJX, Lj^, LLL - матричные коэффициенты.
Определим смысл феноменологических коэффициентов в
предложенном модельном опыте.
1. Наложим следующее ограничение на нашу систему: концен-
|рация сахарозы одинакова по обе стороны мембраны: сЛ =св. Зна-
,|ИТ. ДРо», =0· Подставив в (1.103) Aposm =0, получим Jp = LppAp и
./ J( = ЬДрАр. Таким образом, разность гидростатических давлений Ар
нызывает объемный поток Jp и добавочный диффузионный поток Ja,
который приводит к перераспределению сахарозы. Появляется снова
разность концентраций сахарозы. Это явление известно как
ультрафильтрация. Lfy - коэффициент ультрафильтрации.
2. Выравниваем гидростатическое давление, Ар = 0, тогда
./,, =LpRAposm и Уд =LLLApasm, где LLL соответствует коэффициенту
проницаемости вещества через мембрану. Добавочный объемный
поток Jp называют осмотическим потоком, где LpR - коэффициент
осмотического потока. Используя соотношение взаимности Онзаге-
ра, получим следующую связь между потоками:
LpH ~LPp
Ар
f τ \
J
P
Δρ„„ V "osm J
(1.104)
Δρ
Теперь можно по феноменологическим коэффициентам
определить свойства мембраны. Рассмотрим возможное стационарное
состояние, когда объемный поток Jp - 0. Тогда из (1.103) находим
■I 4843
50
Биофизика
LppAp = -LpaAposm. (1.105)
Введем новую постоянную, которая называется
коэффициентом отражения (константой Ставермана):
σ = 25-. (1.106)
LPp
Коэффициент отражения σ зависит от свойств мембраны.
Запишем объемный поток с учетом коэффициента отражения:
Jp=Lpp(Ap-oAposm). (1.107)
Теперь можно определить идеальную полупроницаемую
мембрану, для которой σ = 1 и растворенное вещество совсем не
проникает через мембрану (полностью «отражается» на мембране).
Полностью проницаемая мембрана характеризуется σ = 0 и Jp =LppAp.
Таблица 1.1
Коэффициенты отражения для различных мембран
Мембрана
Эритроциты человека
Nftella transcullens
Кожа жабы
Вещество
Мочевина
Этиленгликоль
Этанол
Метанол
Мочевина
Ацетамид
Тиомочевина
σ
0,62
0,63
0,44
0,60
1,00
0,89
0,98
Коэффициент отражения σ в (1.106) показывает механизм
переноса вещества через мембрану: σ = 0, когда LpA = 0. Это значит,
что нет сопряжения между потоками JpuJa, т. е. поток
растворителя совершается независимо от потока растворенного вещества.
В реальных ситуациях σ < 1, LpR Φ 0, что указывает на связь между
потоками Jp и Уд. Это существенное обстоятельство, которое часто
игнорируется, когда рассматривают процессы переноса воды и
веществ в клетку независимо друг от друга. Только применение
положений линейной неравновесной термодинамики и использование
Глава 1. Термодинамика биологических процессов
51
соотношения взаимности Онзагера к явлениям переноса через
клеточные мембраны позволяют правильно количественно описывать
фанспорт веществ в клетку.
Измеренные коэффициенты отражения представлены в табл. 1.1.
Данные показывают, что различные клеточные мембраны существенно
различаются по проницаемости веществ.
1.3.3. Теорема Пригожина
Наиболее важным результатом линейной неравновесной
термодинамики явилось определение критерия стационарного
состояния. Как было показано ранее, основным критерием равновесной
термодинамики является стремление энтропии к максимальному
значению -SmM (см. рис. 1.3).
Рассмотрим открытую систему, в которой проходят два
необратимых сопряженных потока - теплоты У, и вещества J2. Согласно
(1.102), с точностью до постоянного множителя Г локальная
продукция энтропии σ запишется так:
a=JiXi +J2X2>0, (1.108)
а сопряженные потоки
U,=LnXx+LnX2,
[j2=L2lXl+L22X2.
Тогда
<*=(*!,*, +LnX2)X, +{L2iX, +L22X2)X2 =
= LnX] +L]2X2X] +L2]X]X2+L22X2.
Учитывая соотношение взаимности Онзагера Li2 = L2l, полу
ΊΙΙΜ
o = LuXf +2Ll2X2X, +L22Xl>0, (1.110)
ι де Ζ,,, > 0, Z,22 > 0 и Li2 > 0.
52
Биофизика
Допустим, что в открытой системе устанавливается
стационарное состояние и количество вещества, поступающее в систему, равно
количеству вещества, выходящего из системы, в результате чего
поток вещества J2 = 0. Исследуем на экстремум величину σ в
стационарном состоянии. Находим производную от σ по Х2 при Xi = const:
J5-=2LI2X, +2L22X2 =2(Z,12X, +L22X2)=2J2 =0. (1.111)
Это соответствует экстремальной точке. Вторая производная
οτσ:
^-H.=2L„>0. (1.112)
дх\
Таким образом, экстремальная точка соответствует минимуму
функции σ. Справедлива теорема Пригожина: в стационарном
состоянии при фиксированных внешних параметрах локальная
продукция энтропии в открытой системе постоянна и стремится к
минимальному значению:
a-»min (1-113)
или для конечного объема V продукция энтропии в системе
стремится к минимальному значению:
^-->min. (1.114)
dt
Теорема Пригожина о минимуме продукции энтропии в
стационарном состоянии определяет эволюцию открытой
термодинамической системы: открытая линейная система, если она не находится
в стационарном состоянии, будет изменяться до тех пор, пока
продукция энтропии в ней не приобретет минимальное значение из всех
возможных, т. е. пока система не достигнет стационарного состояния.
Теорема Пригожина показывает, что в стационарном
состоянии диссипация свободной энергии происходит с меньшей скоро-
Глава 1. Термодинамика биологических процессов
53
стью, чем в любых других состояниях. Следовательно, в
стационарном состоянии свободная энергия системы расходуется наиболее
экономно и поэтому требуется минимальная компенсация ее затрат,
т. е. КПД системы максимален.
Важно заметить, что теорема Пригожина справедлива только
для таких состояний, которые мало отличаются от стационарных.
В этом случае скорости всех процессов выражаются линейными
уравнениями, поэтому соответствующие системы называют
линейными. С учетом этого обстоятельства следует отметить, что теорема
Пригожина дает термодинамический критерий эволюции только
линейных систем.
1.4. Энтропия и биологическая информация
1.4.1. Устойчивость стационарного состояния
Системы в термодинамическом равновесии или в стационарном
состоянии являются устойчивыми. В равновесной термодинамике
хорошо известен принцип устойчивости Ле-Шателье: всякая система,
находящаяся в состоянии химического равновесия и отклонившаяся
от этого состояния под воздействием внешнего возмущения,
стремится самопроизвольно вернуться в равновесное состояние за счет
изменения параметров в направлении, противоположном тому, которое
вызвало возмущение.
Для анализа устойчивости вблизи равновесия введем в систему
небольшое возмущение, т. е. выведем систему из равновесия.
Математическая запись соответствует тому, что производится разложение
■штропии в ряд вблизи равновесия:
S=SmM+dS+±(d2S)+... (1.П5)
Поскольку разложение S происходит вблизи экстремальной
точки SmM, то член первого порядка малости dS обращается в нуль и,
таким образом, устойчивость термодинамического равновесия
определяется знаком члена второго порядка малости (cKS).
54
Биофизика
Переход закрытой системы в равновесное состояние
определяется стремлением энтропии к максимальному значению dfs>0 и
S, —> max.
Устойчивость термодинамического равновесия определяется
условиями:
S2S<0 и l±(d>s)=^ = ZJnXn>°- О·116)
£* (ЛЬ И* η
Основным критерием перехода открытой системы в
стационарное состояние является стремление локальной продукции
энтропии σ к минимальному значению:
-£<0 и a->min. (1.117)
dt
Устойчивость стационарного состояния определяется
условиями:
1^(525) = Ха/л5Хл>0. (1.118)
Величина ^dJndXn называется избытком продукции энтро-
η
пии, a dJn и дХп - отклонениями от значений Jn и Хп в стационарном
состоянии под действием внешнего возмущения.
Принцип стремления системы к минимуму продукции
энтропии определяет авторегуляцию открытой системы: если открытая
система в результате внешнего возмущения выведена из стационарного
состояния, то в ней возникают силы, которые будут так влиять на
нее, пока локальная продукция энтропии σ не примет минимального
значения, т. е. пока система не перейдет в состояние наименьшей
диссипации энергии.
В предыдущих разделах изложены основные положения
феноменологической термодинамики необратимых процессов, главным
образом в применении к анализу химических реакций или к таким
изменениям в открытых системах, для которых можно использовать
Глава 1. Термодинамика биологических процессов
55
понятие скорости реакций и химического потенциала. Важно
подчеркнуть, что попытки применить такой подход для анализа не
отдельных процессов метаболизма, а общих свойств целостных
биологических систем встречает ряд принципиальных трудностей.
В самом деле, вычисление диссипативных функций
непосредственно основано на уравнениях кинетики, которые дают значения
скоростей и движущих сил процессов.
Однако имеющиеся математические модели биологических
систем с использованием дифференциальных уравнений могут отра-
чить лишь отдельные стороны клеточного метаболизма, но не
описывают всей совокупности сложных реакций, лежащих в основе
важнейших биологических процессов роста, развития, адаптации
к внешним воздействиям, эволюции.
Выше был рассмотрен критерий устойчивости стационарного
состояния в виде положительного характера величины избыточной
продукции энтропии при небольшом возмущении системы:
ΣΜηδΧη >0.
η
Отрицательное значение этой величины указывает на
неустойчивость стационарной (особой) точки. Вблизи равновесия критерий
устойчивости ^YdJndXn >0 совпадает с теоремой о минимуме про-
л
дукции энтропии в стационарном состоянии. Что касается
термодинамических критериев эволюции открытых систем, то эта задача
решена только для состояний, близких к стационарному.
Указанная особенность биологической организации вызывает
фудности в использовании понятия устойчивости применительно
к биологическим системам.
В неустойчивых процессах исчезающе малая «причина» может
привести к «большому» следствию. В результате в системе наступает
состояние глобальной неустойчивости, в силу чего состояние систем
н целом становится случайным. В противоположность этому в
реальных системах могут наблюдаться только устойчивые решения любой
динамической задачи.
Неустойчивые степени свободы определяют число возможных
различных состояний, которыми может быть осуществлено данное
56
Биофизика
макроскопическое состояние. Именно с числом этих
микросостояний, или термодинамической вероятностью (w), и связана энтропия
системы. Согласно формуле Больцмана, энтропия определяется как
логарифм термодинамической вероятности (1.32).
В полностью устойчивых системах реализуется только
единственное динамическое решение. Поэтому и число способов, или
микросостояний, которыми осуществляется единственное
макросостояние, равно единице (w= 1), а следовательно, энтропия равна нулю.
В реальных системах энтропия характеризует устойчивые степени
свободы, и именно к ним применимо это понятие. В этом случае
говорят о термодинамическом равновесии по неустойчивым степеням
свободы. Однако по детерминистским (механическим) степеням
свободы система не находится в состоянии термодинамического
равновесия. Строго говоря, применять понятие энтропии можно лишь к тем
степеням свободы, по которым развивается неустойчивость за время
наблюдения за системой. Стабильные степени свободы не дают
вклада в термодинамическую вероятность системы и не учитываются в ее
общей энтропии. Именно поэтому характеризовать в целом
поведение биологической системы с помощью понятия энтропии
неправильно. Его можно принять только по отношению к конкретным
метаболическим процессам. Пренебрежение этим обстоятельством
создает причины серьезных ошибок при попытках дать чисто
термодинамическую трактовку жизненных явлений. В этом плане следует
рассматривать и проблему биологической информации.
1.4.2. Связь энтропии и биологической информации
Связь этих понятий раскрывается по мере изучения
информационных процессов в биологии. Как известно, на всех уровнях
биологической организации существуют информационные системы, в
которых производится, запасается, передается, перерабатывается и
воспринимается информация. Когда исследователь получает
информацию о действительном состоянии системы, то первоначальная
неопределенность, которой характеризовались его знания о системе,
уменьшается. Очевидно, количество полученной информации в этой
ситуации будет тем больше, чем больше была исходная неопреде-
Глава 1. Термодинамика биологических процессов
57
лснность в состоянии системы. Пусть число микросостояний,
которыми можно осуществить данную систему, равно w, а вероятность
каждого из них равна ρ = \lw.
Допустим, что в простейшем случае получаем сообщение
о единственном и реальном состоянии системы. Количество
информации /, содержащееся в этом сообщении, будет равно, согласно
теории информации,
I=-log2p, (1.119)
где р- статистическая (математическая) вероятность сообщаемого
события.
За единицу количества информации (бит) принимается
информация, содержащаяся в достоверном сообщении, когда число исход-
пых возможных состояний равно двум, т. е. априорная вероятность
события равна 42{р- 1/2), т. е.
/ = -1оё21 = 1бит. (1.120)
Такое количество информации содержится, например, в
сообщении о том, на какую сторону упала при бросании в воздух монета.
Аналогично, информация о том, какая из 64 клеток шахматной доски
чанята, содержит / = -log, — = 6 бит.
64
Сопоставление формул (1.119) и (1.32) устанавливает связь
между энтропией и информацией: S (э. е.) = 2,3 · 10~24 = 1 бит.
Следовательно, одна энтропийная единица (4,2 Дж/К) соответствует 2 · Ю-24 бит,
или 1 бит информации эквивалентен к- 1п2= Ю-24Дж/К. Величина
>нтропии, выраженная в битах, составит S = S(k In 2)_1, где (S -
термодинамическая энтропия, выраженная в энтропийных единицах).
Совпадение (с точностью до множителя) выражений для
энтропии и информации имеет глубокий смысл. Энтропия системы
и информация о системе взаимосвязаны. Полагают, что энтропия
есть недостающая информация для полного описания системы или
информация есть недостающая энтропия, т. е. разность между макси-
58
Биофизика
малыш возможной энтропией системы и той энтропией, которой на
самом деле обладает система, что выясняется после получения о ней
информации.
Формулы (1.119) и (1.32) свидетельствуют о том, что
формально величины 1и S идентичны. Считают, что эквивалентность / (бит)
и S (Дж/К) в некотором смысле подобна эквивалентности массы
и энергии по закону Эйнштейна.
Это соотношение между энтропией и информацией было
выявлено Бриллюэном и сформулировано в виде негэнтропийного
принципа информации. Однако сказанное справедливо лишь по отношению
к микроинформации, т. е. информации о реализации в данный момент
одного из возможных микросостояний системы. Микроинформация в
принципе не может быть «запомнена», поскольку любое из
микросостояний скоро переходит в другое из-за сильной неустойчивости
микроскопических движений (тепловые флуктуации). Реально в
биологии, так же как и в технике, системой запоминается макроинформация,
свойства которой будут описаны ниже. Здесь необходимо лишь
отметить, что макроинформация не связана с физической энтропией
соотношением Бриллюэна.
Формула (1.119) получена для упрощенной ситуации, когда
может произойти w равновероятных событий. В более общем случае,
когда исходно имеется N событий с набором вероятностей Ρ\,ρν·.,ρη,
количество информации, соответствующей этой ситуации, равно:
I = -ipjlo&2Pr (1-121)
Выражения (1.119) и (1.121) были получены К. Шенноном для
оценки абсолютного количества информации при передаче
сообщения о событии, которое априори может произойти с некоторой
вероятностью.
1.4.3. Количество биологической информации
Используя формулы теории информации, можно оценить,
какое количество информации содержится в организме, составными
Глава 1. Термодинамика биологических процессов
59
шементами которого являются отдельные клетки. В теле человека
содержится ~ 10'3 клеток. Будем считать, что все они уникальны и их
нельзя менять местами без нарушения целостности организма.
Априори число способов, которым может быть осуществлена эта
структура, составит w = 1013!, а количество информации, необходимое для ее
построения,есть
/ = log2(1013!) = 1013 log21013 =41014 бит. (1.122)
Понижение энтропии при построении упорядоченного
организма человека из системы хаотически расположенных 1013! клеток
составит:
AS=23-l(T24-4-10,4=l(r93.e. = 4-l(r9^. (1.123)
К
Количество необходимой информации увеличится, если учесть
уникальность расположения аминокислотных остатков в белках в теле
взрослого человека. Тогда общее количество информации,
соответствующее их регулярному расположению, составит /= 1,3 · 1026 бит, что
жвивалентно понижению энтропии на AS = 300 э. е. = 1200 Дж/К.
Это понижение энтропии при возникновении сложнейшей
биологической организации - организма человека - на самом деле
незначительно. По величине оно равно, например, уменьшению
энтропии при конденсации 170 см3 паров воды. В процессах метаболизма
понижение AS на 300 э. е. с легкостью может компенсироваться
увеличением энтропии при окислении 900 г глюкозы.
Таким образом, формальное применение выражения (1.123)
показывает степень упорядоченности и, следовательно, количество
информации, содержащееся в биологических системах, мало и не
превышает таковую в твердом теле той же массы.
До сих пор в предыдущих рассуждениях не учитывался
структурный характер организации биологической системы: считалось, что
упорядоченность элементов имеет одинаковое значение во всей
системе для ее построения. Однако на разных уровнях организации биоло-
60
Биофизика
гической системы ценность информации, закодированной в
биологических структурах, может быть различной.
Увеличение сложности биологической системы происходит за
счет увеличения числа разнородных элементов системы и связей
между ними. Если на данном уровне возрастает незаменимость
элементов системы, то это означает увеличение ценности содержащейся
в нем информации. Однако на данном уровне ценностью обладает
лишь неизбыточная информация, связанная с незаменимыми
элементами. Избыточная информация - это повторная информация, которая
играет роль, уменьшая вероятность разрушения ценной информации
из-за шума при ее передаче. С этой точки зрения апериодическая
система содержит значительно большее количество незаменимых
элементов, а следовательно, большее количество ценной неизбыточной
информации, чем эквивалентная периодическая система, где
элементы взаимозаменяемы.
. Ценность информации можно определить по степени
неизбыточности, или незаменимости, сообщения. Например, количество
информации, закодированной последовательностью из общего типа η
нуклеотидов (аденин, гуанин, тимин, цитозин), в цепи ДНК равно
/, =log2 4" =2и бит.
Однако на следующем уровне в белковой цепи количество
содержащейся информации уменьшается по сравнению с уровнем
ДНК. В самом деле, каждый из аминокислотных остатков кодируется
тремя нуклеотидами, так что количество информации в
синтезированной на η нуклеотидах белковой цепи равно/,= log 220л/3 =
= 1,44л бит.
Таким образом, первоначальное количество информации
низшего уровня (ДНК) уменьшается на более высоком уровне (белок).
В данном случае это обусловлено вырождением триплетного кода,
когда один и тот же аминокислотный остаток кодируется разными
кодонами: общее число кодонов 43 = 64 больше числа аминокислот
(20). На следующем уровне возможны замены некоторых
аминокислот другими без изменения свойств белка. Тем самым количество
действительно незаменимых аминокислот уменьшается (N < 20),
а количество информации / на этом уровне соответственно падает:
Глава 1. Термодинамика биологических процессов
61
/3=log2n',/3<log220''/\ /,</2.
Так, на участке ДНК из 600 нуклеотидов заключена
информация 1днк= log24600 = 1200 бит, а информация в первичной
последовательности белка, синтезированной на этом участке и содержащей 200
аминокислот, уже меньше и составляет 1б = log220200 = 860 бит.
Разница в 340 бит является избыточной и самостоятельной
ценности не представляет. Таким образом, на каждом следующем
уровне количество необходимой информации уменьшается. Отсюда
следует, что на более высоких уровнях организации возрастает
ценность содержащейся в их элементах информации по сравнению
с первоначальной информацией низшего уровня. Это уменьшение
информации 1-го низшего уровня можно заменить уменьшением
числа элементов следующего уровня. Тем самым ценность элемента
информационного сообщения на более высоком уровне повышается
по сравнению с низшим, что может быть определено как повышение
степени незаменимости этого элемента.
1.4.4. Рецепция и возникновение информации
Результаты приведенных расчетов, основанных на
представлениях теории информации, подтверждают сделанный выше вывод о
том, что специфика информационных процессов в биологии
определяется не повышенной информационной емкостью молекулярных
структур, а особенностями самих информационных процессов. Речь
идет о характеристиках процессов рецепции, запоминания и
передачи информации другим акцепторным системам организма.
Основным условием восприятия информации является
способность рецепторной системы переходить в одно из возможных
устойчивых состояний вследствие полученной информации. Иными
словами, информационная система должна быть мулътистационарной, а
число устойчивых стационарных состояний N определяет
информационную емкость системы, т. е. максимальное количество
информации /тах, которое система может акцептировать:
'max=lOg2tf.
(1.124)
62
Биофизика
Принципиальное различие формул (1.120) и (1.124) состоит
в том, что в (1.120) характеристика микросостояний w включает
мгновенные значения координат и импульсов всех атомов системы.
Информация, связанная с w, называется микроинформацией Imic,
и именно для нее выполняется принцип Бриллюэна эквивалентности
информации и физической энтропии:
Smax=/™=log2vv; S^/-=£.„=/*, (1.125)
где S =S(£lg2)-1 - энтропия, выраженная в битах. В такой
системе, однако, информация не может запоминаться и храниться
сколько-нибудь длительное время, поскольку, попав в любое из
микросостояний, система тут же выйдет из него в результате
неустойчивости.
Между тем, в биологии особую важность приобретает
запоминание и хранение информации в молекулярных системах, обладающих
макроскопическими размерами, где при нормальных температурах
тепловые флуктуации вызывают неустойчивость микроскопических
движений. Поэтому для рецепции, запоминания и хранения информации
необходимо произвести определенную работу, за счет которой система
перейдет в одно из устойчивых состояний, потеряв часть энергии в
процессах диссипации. В результате затраты энергии повысится энтропия
всей системы на величину, превышающую количество запомненной
информации. Таким образом, информационные системы обладают дис-
сипативными свойствами, за счет которых происходит переход на
выделенные детерминистские степени свободы, сохраняющие свои
значения в течение длительного времени. Именно здесь и осуществляется
превращение микроинформации (/ mic) в макроинформацию (/ тас),
которую система запоминает и затем может передать другим
акцепторным системам. В реальных информационных системах характерное
время запоминания зависит от их конструкции, температуры и
свободной энергии.
Таким образом, информационная система должна включать
статистическую и динамическую подсистемы. С ними
соответственно связаны термодинамическая энтропия как мера множества незапо-
I паве 1. Термодинемике биологических процессов
63
мипаемых системой микросостояний и макроинформация как мера
множества тех состояний, о пребывании в которой система должна
помнить.
Принцип запоминания «случайного выбора» лежит в основе
шппикновения биологической информации. Но организм может от-
(шрать информацию, необходимую для его жизнедеятельности, из
ипсшней среды. Это достигается соответствующим устройством ре-
цспторных систем, которые пропускают только ценную
информацию и предотвращают ненужные ответные реакции организма, не
пропуская информацию, лишенную для него ценности.
Глава 2. БИОФИЗИКА
КЛЕТОЧНЫХ МЕМБРАН
2.1. Структура, свойства и функции
биологических мембран
Термин мембрана используют в биологии более века, обозначая
им клеточную границу, которой свойственна полупроницаемость
(легкость проникновения сквозь нее одних веществ при невозможности
преодоления ее другими). В 1851 г. физиолог X. Моль описал плазмолиз
растительных клеток и предположил, что клеточным стенкам присущи
свойства мембран. Ботаник К. Негели (1855) выделил из этих свойств
полупроницаемость в качестве главного условия поддержания
нормального осмотического давления внутри клеток. В 1877 г. В. Пфеффер
опубликовал фундаментальный труд «Исследования осмоса», в
котором создал умозрительную модель клеточной мембраны, подметив
структурное сходство между клетками и осмометрами, имеющими
искусственные полупроницаемые мембраны. Представления о мембране
как непременном и важнейшем компоненте клетки не случайно
развивались в прошлом веке ботаниками, а не исследователями животного
мира. Под микроскопом хорошо была видна стенка растительной
клетки, тогда как оболочку животной клетки увидеть не удавалось.
Некоторые ученые (например, К. Бернар) предполагали, что она существует, но
большинству исследователей клетки животных представлялись в виде
«комочков живого вещества», не имеющих оболочки.
Электронная микроскопия развеяла заблуждения. При
достаточном увеличении стали видны не только клеточные стенки
растений, но и истинные наружные мембраны растительных и животных
клеток (рис. 2.1). Каждая клетка окружена наружной оболочкой,
которую называют плазматической мембраной (плазмолеммой, цито-
леммой). Ей придают первостепенное значение в организации жизни:
I пава 2. Биофизика клеточных мембран
65
Рис. 2.1. Схема строения клетки, реконструированная по данным электронной
микроскопии. Слева - клетка животных, справа - клетка растений, в верхнем
углу - бактерия (Б) и вирус (В), обладающий липопротеидной оболочкой
Обозначения: 1 - плазматическая мембрана; 2 - мембрана мезосомы;
.1 клеточная стенка; 4 - оболочка вируса; 5 - нуклеотид; 6 - митохондрии;
' шероховатая эндоплазматическая сеть; 8 - гладкая эндоплазматическая сеть;
') комплекс Гольджи; 10- лизосома; 11 - ядро; 12 - тонопласт; 13 - вакуоль;
14 - хлоропласт
« . .только после образования мембраны вокруг всей клетки мы дей-
• ι mi гсльно имеем то, что с полным правом может быть названо орга-
Iмимом» (Дж. Бернал, 1968).
Вместе с тем и цитоплазма буквально «нафарширована» мемб-
рнпами, так как каждый клеточный органоид окружен своей оболоч-
holi. В середине XX века клетку стали воспринимать как обширную
• πι. мембранных систем, составляющих важнейший элемент
клеточной организации. Соотношение между плазмолеммой и внутрикле-
I очными мембранами неодинаково в разных клетках. Так, в клетках
ΊΗ I I
66
Биофизика
хрусталика глаза нет других мембран, кроме плазматической, тогда
как в печеночных клетках (гепатоцитах) ее площадь составляет всего
6,5% поверхности, образуемой всеми мембранами клетки.
Суммарная масса внутриклеточных мембран достигает 2/3
общей массы обезвоженной клетки. Эти мембраны образуют огромную
поверхность. Так, печень крысы, имеющая массу около 6 г, обладает
столь обширной сетью внутриклеточных мембран, что их суммарная
площадь достигает тысячи квадратных метров. Немало органов,
в клетках которых этот показатель еще более впечатляющий.
Замечено, что по мере увеличения отношения суммарной площади мембран
к объему клетки повышается интенсивность обменных процессов
в ней. Наибольшей мембранной поверхностью обладают клетки с
интенсивным метаболизмом.
2.1.1. Структурно-молекулярная организация
биологических мембран
2.1.1.1. Электронная микроскопия
Электронная микроскопия нативных клеточных мембран не
позволяет их увидеть, так как они состоят из тех же химических
элементов, что и цитоплазма. Для получения четкой электронограммы клетки
ее мембраны контрастируют, осаждая на них вольфрам, осмий и
другие элементы, которые хорошо поглощают и рассеивают электроны.
На таких препаратах любая биомембрана (БМ) выглядит трехслойной:
между парой темных полос расположено светлое пространство
(рис. 2.2). Следовательно, компоненты промежуточной (средней)
части БМ слабо связывают металлы, входящие в состав «электронных
красителей». Суммарная толщина трехслойной структуры варьирует
от 7 до 15 нм, причем разная величина присуща различным клеточным
мембранам. Во многих из них наблюдается асимметрия трехслойной
организации: темные полосы различаются по ширине и плотности.
Асимметричное строение большинства БМ продемонстрировано
особенно наглядно посредством своеобразного приема электронной
микроскопии - метода замораживания-скалывания, о котором будет
рассказано ниже.
I пава 2. Биофизика клеточных мембран
67
10 нм
Рис. 2.2. Трехслойное изображение биомембраны на электронограмме
Более детальные сведения о молекулярной структуре
клеточных мембран получены методами рентгеноструктурного и рентге-
носпектрального анализов, электронного парамагнитного и ядерного
магнитного резонанса (ЭПР и ЯМР), люминесцентного анализа,
дифференциальной сканирующей микрокалориметрии (ДСК) и др.
Все клеточные мембраны построены в основном из липидов,
Iicjikob и углеводов, причем последние образуют соединения с
белками (гликопротеиды) и липидами (гликолипиды). Органические веще-
t гна образуют соли с различными ионами, которые вместе с тем
присутствуют в виде водных растворов внутри мембранных каналов.
2.1.1.2. Мембранные липиды
Структурной основой БМ служит липидный бимолекулярный
ι ■■/!«/. Его образование обусловлено особенностями взаимодействия
ι' подой мембранных липидов. На их долю приходится от 15 до 50%
ι ухой массы разных клеточных мембран. Мембранные липиды отно-
tшея к трем основным классам: 1) фосфолипидам, 2) гликолипидам
и .1) стероидам. Среди них преобладают фосфолипиды (ФЛ), в
молекуле которых условно выделяют три части (рис. 2.3.): головку, тело
(шейку) и хвосты (в большинстве мембранных ФЛ их два). Площадь
участка, занимаемого головкой, составляет 0,6 нм2, а на хвосты при-
кпдится 0,2-0,3 нм2. Вертикальный размер головки не превышает 1/4
68
Биофизика
It-
Рис. 2.3. Схема фосфолипида:
1 - полярная (гидрофильная) часть; 2 - неполярная (гидрофобная) часть
длины всей молекулы. Головки разных ФЛ образованы азотистыми
(этаноламин, холин) или безазотистыми (серии, инозин, треонин)
основаниями. Им присуща довольно высокая степень полярности.
Посредством ортофосфорной кислоты головка соединяется
с телом, которое представляет собой один из двух многоатомных
спиртов: глицерин или сфингозин (ненасыщенный аминоспирт).
В зависимости от спирта, составляющего тело, все ФЛ
подразделяются на глицерофосфатиды (глицерофосфолипиды) и сфингофосфо-
липиды.
К глицерину или сфингозину присоединяются хвосты -
неполярные СН-цепи жирных кислот, содержащие от 14 до 24 атомов
углерода. У двуцепочечных фосфолипидов один из хвостов
представлен насыщенной, а второй - ненасыщенной кислотой. К первым
относятся стеариновая (18:0)', пальмитиновая (16:0), миристиновая
(14:0), а ко вторым - олеиновая (18:1), линолевая (18:2), линоленовая
(18:3), арахидоновая (20:4), докозогексаеновая (22:6) кислоты. За
счет разной комбинации перечисленных компонентов существуют
десятки различных фосфолипидов. Из них в биологических
мембранах чаще встречаются фосфатидилэтаноламин, фосфатидилхолин
1 18 - число атомов С в жирнокнслотной цепи, 0 - число двойных связей
между атомами С.
I нпва 2. Биофизика клеточных мембран
69
а) б) е) г) д)
Рис. 2.4. Структурные формулы мембранных липидов
а - фосфатидилэтаноламин; б - фосфатидилсерин;
в - фосфатидилхолин (лецитин); г - кардиолипин; д - холестерин
(нецитин), сфингомиелин, фосфатидилинозитол, дифосфатидилгли-
цсрнн (кардиолипин), фосфатидилсерин.
Для лучшего понимания структурной организации молекулы
•I'll рассмотрим схему строения глицерофосфолипидов. Их тело
(шейку) образует трехатомный спирт глицерин, у которого две гидроксиль-
ш.ю группы этерифицированы жирными кислотами, причем первая
ι И l-ipynna обычно этерифицирована насыщенной, а вторая -
ненасыщенной жирными кислотами, третья гидроксильная группа образует
ι ножную эфирную связь с ортофосфорной кислотой (Н3Р04),
соединяющей тело с головкой - один из атомов кислорода фосфорной кисло-
11.1 связан с определенным азотистым (или безазотистым) основанием.
И молекуле лецитина (рис. 2.4) головкой служит холин, соединяю-
щпнея ортофосфатом с глицерином (телом), который через гидроксил
и первом положении связан с насыщенной жирной кислотой (стеари-
ноион), а через гидроксил во втором положении - с ненасыщенной
||1111'11НОВОЙ).
Важнейшее физико-химическое свойство фосфолипидов - ам-
фчфнльность (амфопатичность) за счет гидрофильности головки
π ι пдрофобности жирнокислотных хвостов. Благодаря этому в воде
70
Биофизика
Ж
ж
Рис. 2.5. Бимолекулярный фосфолипидный слой
при соблюдении определенных условий молекулы фосфолипидов
самопроизвольно выстраиваются так, что их гидрофобные
углеводородные цепи оказываются укрытыми от воды, а полярные головки
вступают во взаимодействие с нею. В результате при агрегации
молекул создается конструкция, поперечник которой включает две
молекулы фосфолипидов, повернутых друг к другу жирнокислотными
хвостами и обращенных к обеим наружным поверхностям
гидрофильными головками (рис. 2.5). Так образуется довольно устойчивая
динамическая структура - сплошной бимолекулярный
фосфолипидный слой (бислой), который и служит своеобразным каркасом
биологической мембраны. Для создания 1 м2 такой поверхности хватает
1 мг липида. На каждом 1 мкм2 клеточной мембраны сосредоточено
примерно 4 · 106 липидных молекул (по 2 миллиона в каждом из
монослоев бислойной структуры).
Способность формировать в водной среде бимолекулярный
слой присуща разным ФЛ в неодинаковой степени. Она наиболее
выражена у фосфатидилхолина (лецитина), который в обширном
диапазоне температур и ионных концентраций существует в водной среде
непременно в виде бислоя. К тому же в его присутствии и у других
фосфолипидов эта способность усиливается.
Лецитин образуется из фосфатидилэтаноламина посредством
метилирования азота в азотистом основании, образующем головку
(рис. 2.6). Этот процесс произошел у эукариот около 100 миллионов
I пава 2. Биофизика клеточных мембран
71
I ?">
■»► — С—N+—СИ
Рис. 2.6. Метилирование фосфатидилэтаноламина с образованием лецитина
пет назад и обеспечил важную ступень эволюции биосферы.
Упорядоченность молекулярной организации биологической мембраны со-
щистся без каких-либо управляющих воздействий - вследствие
гидрофобного взаимодействия молекул ФЛ. Можно сказать, что вода
принуждает фосфолипиды образовывать упорядоченную структуру.
Плотность упаковки ФЛ в липидном каркасе зависит от того,
какие жирные кислоты входят в состав фосфолипида - чем больше
ц мойных связей между атомами углерода в СН-цепях, тем больше
промежуток между соседними молекулами в мембранном каркасе,
что, в свою очередь, уменьшает его жесткость и усиливает
проницаемость мембраны для веществ.
Вместе с тем на плотность упаковки фосфолипидов влияет хо-
истерин- стероид, в молекуле которого четыре кольца: три 6-член-
■ п.)χ и одно 5-членное. Крайнее из шестичленных колец соединено
ι ι ндроксильной группой и служит гидрофильной головкой молеку-
IIM. К наиболее удаленному от головки пятичленному кольцу
присоединена углеводородная цепочка, содержащая 8 атомов углерода. Хо-
тхтсрин способен встраиваться в фосфолипидный бислой клеточной
мембраны (рис. 2.7). При этом мембрана уплотняется.
По мере повышения содержания в БМ холестерина площадь,
шпнмаемая фосфолипидами, сокращается до того, пока на 1 молеку-
иу холестерина будет приходиться 2 молекулы фосфолипида. Эффект
ι окращения площади, приходящейся на молекулу фосфолипида, обу-
I иовлен тем, что изменяется наклон его углеводородных цепей к по-
иерхпости бислоя. По мере увеличения содержания холестерина в БМ
пни стремятся встать перпендикулярно мембранной поверхности,
it результате чего укладка фосфолипидов приобретает большую ком-
пиигность, и мембрана уплотняется. Она становится более вязкой
и менее проницаемой для многих веществ. Обычно это соотношение
н
I I
С—Ν+—Η
Η
72
Биофизика
сн2-СНз
сн>сн*
сн<снг г»
СН2>сн2 снз
сн<сн* снС^Нэ
сн2>СНг сн<СНг
СН2>СНг сн<СНг сн,^72
СН2
о=с
Фосфолипид о^ О Холестерин
СН<СН^.СНз
^•N<CH3
+ СНз
Рис. 2.7. Холестерин в биомембране
меньше, чем 1:2. Так, на 1 моль ФЛ в плазмолемме эритроцита прихо
дится 0,37, а во внутренней митохондриальной мембране - 0,03 мол^
холестерина. В одной из самых «жидких» биологических мембран
фоторецепторной на 1 молекулу холестерина приходится 15 молеку
фосфолипидов.
Содержание холестерина в клеточных мембранах зависит от об
щего холестеринового обмена в организме, подверженного сильном}
влиянию пищевого рациона. Добавление к искусственной липидной
мембране компонентов клеточных мембран, взятых у животных, в пи
ще которых долгое время поддерживается избыток холестерина, рез
ко повышает степень ее жесткости и уменьшает проницаемость.
Третий класс мембранных липидов - гликолипиды - играет
важную роль в предотвращении слипания соседних клеток. Эти ли
пиды обеспечивают существование на клеточной поверхности οτρι
цательных электрических зарядов, создающих электростатическо
отталкивание. Однако при избыточном содержании гликолипидо
(например, ганглиозидов) в плазматических мембранах клетки слип,
ком сильно разобщаются и настолько отодвигаются друг от друг
что информационное взаимодействие нарушается.
/ пава 2. Биофизика клеточных мембран
73
Таблица 2.1
Липидный состав
Мембранные
липиды
Холестерин
Фосфатидил-
наноламин
•Росфатидилсерин
•Росфатидилхолин
•Росфатидилинозит
(:фингомиелин
1 (ореброзид
биологических мембран (в%)
Мембраны животных клеток
Миелиновая
оболочка
25
14
7
11
0
6
21
Плазмолемма
эритроцита
25
20
11
23
2
18
0
Внутренняя ми-
тохондриапьная
мембрана
5
28
0
48
8
0
0
Мембрана
бактерии
(Е. coli)
0
100
0
0
0
0
0
Установлены значительные различия липидного состава
разных биологических мембран (табл. 2.1). Кроме сведений, представ-
нспных в этой таблице, полезно иметь в виду данные о липидном со-
сгаве различных мембран крысиных гепатоцитов. Фофолипиды
(оставляют около 60% липидного каркаса плазмолеммы и аппарата
I ольджи, 85% мембранных липидов ядер и эндоплазматической сети,
hojice 90% липидов внутренней митохондриальной мембраны. Гли-
колипиды присутствуют только в плазмолемме. Более того, одна и та
те мембрана содержит различные липиды в каждой половине
липидного бислоя. В связи с этим обстоятельством говорят о гетерогенно-
ι in липидного состава биологических мембран.
Однако избыточное поступление в организм человека и
животных фосфолипазы А2, например, при укусах некоторых ядовитых
1мсй, приводит к столь сильному разрушению клеточных мембран,
чк» оно становится не совместимым с жизнью. Попутно заметим, что
цругой фермент, влияющий на фосфолипиды, - фосфолипаза С, вы-
цсляемая некоторыми микроорганизмами (в частности холерным
ппПрионом), разрушает липидный каркас клеточных мембран,
«откусывая» полярные головки фосфолипидов.
Важные сведения получены при исследовании липидного ста-
iyca плазмолеммы раковой клетки. Оказалось, что при малигнизации
и мембране не образуются какие-то новые липиды. Однако фосфоли-
74
Биофизика
пидные спектры двух половин бислоя становятся более однородными
(эффект выравнивания фосфолипидных спектров). К глицеролу
ненасыщенные жирные кислоты присоединяются в первом, а не во втором
положении, а насыщенные - во втором. Следствием этого является,
во-первых, повышение жесткости клеточных мембран и ухудшение
их проницаемости, а, во-вторых, нарушение синтеза простагланди-
нов, поскольку фосфолипаза А2 не может расщеплять арахидоновую
кислоту, присоединенную к глицеролу в первом положении.
Нарушение фосфолипидного состава плазмолеммы при малиг-
низации измененяет активность многих мембранных ферментов, что
приводит к существенным сдвигам метаболизма. Наконец,
повышение содержания ганглиозидов в плазмолемме усиливает ее
отрицательный заряд, вследствие чего клетки разобщаются, и каждая из них
начинает жить сама по себе, а не в ладу с соседями.
2.1.1.3. Мембранные белки
В липидный каркас клеточной мембраны встроены ее белковые
компоненты (протеины). На клетку приходится в среднем 10 пг
мембранных протеинов. Различают периферические и собственные
(интегральные) белки биомембран. Белки первого типа расположены на
поверхности липидного бислоя. Связь между липидными и
белковыми молекулами осуществляется здесь электростатическим
взаимодействием между противоположными полюсами полярных групп
этих веществ. Мембранные протеины второго типа взаимодействуют
своими гидрофобными участками с углеводородными цепочками ли-
пидов за счет ван-дер-ваальсовых сил. Из-за большой прочности
таких связей интегральный белок можно выделить из БМ только при
разрушении липидного бислоя. Следовательно, собственные белки
являются жирорастворимыми. Это «антибелок», по образному
выражению Ю.А. Овчинникова, так как у интегрального протеина, в
отличие от водного раствора белка, все гидрофильные области спрятаны
внутри молекулы, а наружу направлены неполярные группы.
Поэтому собственные белки погружены в липидный слой БМ полностью
или частично, причем крупные белковые молекулы пронизывают его
насквозь. В этом случае с одной молекулой протеина
непосредственно взаимодействует огромное количество липидных молекул.
/ пава 2. Биофизика клеточных мембран
75
Первичная структура мембранных белков. Все белки
постам ^-мн2
роены из 20 аминокислот. Им присуща общая структура: r^ ^соон ,
а различия определяются радикалом (R). Например, в глицине R-атом
иодорода (Н), в аланине - метильная группа (СН3). В других аминокис-
иотах R имеет более сложную структуру (с большей массой). Поэтому
средняя молекулярная масса аминокислотного остатка в молекуле
белка около 120 Да1.
Генетические коды всех аминокислот хранятся в ДНК. В 1961 г.
расшифровали код фенилаланина, а к 1963 г. - коды всех аминокислот.
14 аминокислотных остатков в молекуле белка электронейтра-
ш.пы, но обладают неодинаковой степенью полярности. Она высока
V глицила и аланила (дипольный момент 12-15 D2). 3
аминокислотных остатка (аспартил, глутамил, тирозил) обладают свойствами
аннона, а другие 3 (гистидил, лизил, аргинил) - свойствами катиона.
' )лсктрические свойства аминокислотных остатков предопределяют
многое в поведении мембранных белков, в частности от них зависят
ш'оричная, третичная и четвертичная их структуры.
Первичная структура белка (полипептидная цепь),
представляющая собой последовательность аминокислотных остатков в белко-
ιιοι'ί молекуле3, формируется путем поликонденсации аминокислот
с образованием между ними пептидных (амидных) связей. Все
атомы (Η, Ν, С, О), участвующие в пептидной связи, лежат в одной
и носкости, следовательно, она имеет плоское строение. Атомы азота
1 Да - 1 дальтон - единица измерения молекулярной массы: i Да = 1 а.е.м. =
1.66-10"27 кг.
2 1 D - 1 дебай - единица измерения дипольного момента: 1 D = 0,33 · 10"29 Кл · м.
И имбораторных исследованиях мерой полярности, а следовательно, гидрофильно-
11 и, служит изменение свободной энергии, приходящейся на радикал аминокислоты
мри переносе ее из этилового спирта в воду. У молекулы воды - вещества с сильной
ппиирностью - дипольный момент составляет 1,84 D, у неполярных веществ (СОг,
ипи'мя) - на 5-6 порядков меньше. Вещества, молекулы которых обладают высоким
||>ишльным моментом, имеют большую диэлектрическую проницаемость (ε).
3 При соединении в полипептидную цепь менее 100 аминокислотных остат-
кпи принято говорить о полипептиде, тогда как белком считается молекула, содер-
«И111ИЯ более 100 аминокислотных остатков в полипептидной цепи.
76
Биофизика
и углерода соединены ковалентной связью, и ее энергия составляет
336 кДж · моль-1. Это минимальная энергия, достаточная для
разрыва пептидной связи.
Первичная структура установлена для многих сотен белков,
включая и мембранные. Она определяет биологическое
функционирование белка. Вместе с тем функции белковой молекулы зависят
также от ее вторичной, третичной и четвертичной структур.
Вторичная, третичная, четвертичная структуры
мембранных белков. Из-за плоского строения каждой пептидной связи
плоская конформация' всей полипептидной цепи не стабильна. В таком
виде первичная структура белка напряжена и потому полная энергия
цепи отнюдь не минимальна, а именно минимум энергии определяет
стабильность конформации белковой молекулы.
Наибольшей стабильностью полипептидная цепь обладает при
двух способах укладки аминокислотных остатков. Им соответствуют
два типа вторичной структуры белка: α-спираль и β-складчатость
(β-спираль). Такие конформации образуются за счет нековалентных
связей, а также гидрофобного взаимодействия между боковыми
группами аминокислотных остатков, принадлежащих белковой
молекуле. Они в 10-20 раз слабее ковалентных связей - их энергия
находится в диапазоне 15-30 кДж · моль-1.
Гидрофобные группы аминокислотных остатков белковой
молекулы при встраивании ее в липидный каркас биологической
мембраны стремятся собраться на поверхности белка, а гидрофильные
(полярные) «прячутся» внутри молекулы. Если полярность таких
аминокислотных остатков достаточно высока, то полипептидная цепь
свертывается в β-складчатость с образованием внутри поры,
заполненной водой, с которой взаимодействуют гидрофильные
аминокислотные остатки. Так белки образуют каналы в биологических мембранах.
Другой тип вторичной структуры белка - α-спираль
располагается в плоскости биологической мембраны, причем на каждое
пептидное звено приходится поворот полипептидной цепи на 100° отно-
Конформацией называют определенный вариант взаимной ориентации
атомов в пространстве молекулы.
I пава 2 Биофизика клеточных мембрен
77
Рис 2.8. Схема расположения молекулы родопсина в биологической мембране
(а-спиралъ, пронизывающая 7раз фосфолипидный каркас)
11ИСЛЫЮ нормали к мембранной поверхности и перемещение вдоль
нем молекулы на 0,15 им. Если вспомнить, что толщина биологиче-
ι кой мембраны порядка 10 нм, то нетрудно представить себе, как
крупный белок, имеющий вторичную структуру α-спирали,
несколько раз пронизывает мембрану. Например, молекула родопсина дела-
14 > ι о 7 раз - говорят, что она образует в фоторецепторной мембране
(мембране диска палочки в сетчатке глаза) 7 столбов (рис. 2.8).
Вместе с тем α-спирали и β-складчатости в белковой молекуле
перемежаются участками с неупорядоченным расположением поли-
ιιιίι ι идной цепи. В них имеются вакансии для образования дополни-
lein.iibix связей, прежде всего за счет гидрофобных взаимодействий.
I l|)ii реализации такой возможности молекула сворачивается в глобу-
iy становится шарообразной, приобретая третичную структуру.
ι )ц.| характерна для ферментов
Кроме того, отдельные белковые глобулы могут объединяться
между собой в белковые комплексы, образуя четвертичную струк-
ш ι ρ\· белка. Она присуща многим мембранным белкам.
Механизмы образования третичной и четвертичной структур
ΐιι'ΐΐκη можно представить себе в соответствии с гипотезой Фишера,
ι Ί и IMCHO ей, если число гидрофильных участков в вакантных боковых
ι руинах полипептидной цепи достаточно, чтобы покрыть всю поверх-
И1 it п. сферического гидрофобного ядра, сформированного при обра-
ишипии вторичной структуры, то в водной среде глобула (третичная
78
Биофизика
структура) имеет форму сферы. Если гидрофильных участков больше,
то глобула - эллипсоид, а при их недостатке относительно ядра
отдельные глобулы слипаются между собой и образуют четвертичную
структуру. На самом деле образование третичной и четвертичной
структур происходит сложнее - прежде всего потому, что у разных
аминокислотных остатков неодинакова степень гидрофильности.
Каждый тип белка образует в клеточной мембране только одну
из возможных форм, поскольку в ходе эволюции отбирается такая
структура каждого белка, у которой при данной конформации
достигается максимум боковых связей. Дело в том, что единичная нековалент-
ная связь слишком слаба (15-30 кДж · моль-1), чтобы противостоять
броуновскому движению молекул. Только за счет образования
большого количества слабых связей между частями белковой молекулы
или комплексами белков они образуют стабильную молекулярную
структуру.
Механизм функционирования мембранных белков.
Синфазное образование большого количества слабых связей между
молекулой мембранного белка с взаимодействующими с ней другими
молекулами (как в мембране, так и на мембранной поверхности)
является необходимым условием такого взаимодействия и,
следовательно, функционирования белковых компонентов биологической
мембраны.
Взаимодействующие молекулы должны войти в тесное
соприкосновение, а для этого их поверхностям необходимо скрепиться.
Чтобы скрепить поверхности двух молекул, нужно достичь их
точного соответствия в пространстве - только тогда может быть обеспечено
условие образования многих слабых связей между ними.
Взаимодействие белковой молекулы с другими веществами определяет
химические реакции, в которые вступает данный белок. Поэтому химические
свойства мембранного белка определяются главным образом теми
аминокислотными остатками, которые находятся (экспонированы) на
его поверхности. Они образуют активный центр (центр связывания)
белковой молекулы.
В активном центре аминокислотные остатки расположены
строго упорядоченно, причем они обычно принадлежат удаленным
/ /ιβββ 2. Биофизике клеточных мембран
79
друг от друга участкам первичной структуры (полипептидной цепи)
и составляют небольшую часть белковой молекулы. Ее остальная
часть образует своеобразный каркас, обеспечивающий нужную
форму поверхности активного центра белка.
Свойства активного центра зависят от того, какие аминокис-
иогные остатки его образуют, а также от их пространственной орга-
шпации. Этим определяется стереоспецифичность активного центра.
(' данным белком могут взаимодействовать только те вещества,
которые по стереоструктуре полностью или своими частями соответст-
иуют его активному центру (говорят, конгруэнтны ему).
Конгруэнтность обеспечивает оптимальную величину энергии взаимодействия
молекул.
Активный центр образован преимущественно неполярными
иминокислотными остатками. Поэтому среда активного центра имеет
м;шую диэлектрическую проницаемость (ε). То же присуще и
сильным органическим растворителям, чем они отличаются от воды,
обладающей высоким дипольным моментом и, следовательно, большой ε.
la счет малой ε органические растворители гораздо слабее воды
экранируют электрические заряды взаимодействующих веществ и обеспе-
чпнают возможность их электростатического взаимодействия.
Согласно гипотезе М.Ф. Перутца, удостоенного в 1962 г. Но-
Ислсвской премии «за исследования структуры глобулярных бел-
кон», активный центр белковой молекулы, имея слабую полярность,
обеспечивает ее «эквивалентом сильного органического растворите-
||н», благодаря чему создает условия для лучшего взаимодействия
ι· другими веществами, причем строгая локализация и небольшие
ршмеры (укромность) активного центра ограничивают область дей-
г гния такого сильного «растворителя», и он не разъедает биологиче-
гкпс молекулы вокруг себя. Вместе с тем электростатическое
взаимодействие белка с другими веществами вносит основной вклад
и преодоление потенциального барьера химических реакций
фермента с субстратом, а также мембранного переносчика с транспор-
шрусмым через мембрану веществом и мембранного рецептора
г его химическим стимулом (гормоном или другим физиологически
нктивным веществом).
80
Биофизика
Функции мембранных белков довольно разнообразны.
Во-первых, они обеспечивают транспорт гидрофильных веществ через
биологические мембраны посредством двух механизмов: работая
переносчиком или образуя в мембране канал (со вторичной структурой
типа β-складчатости). Следует отметить обязательное участие белков
в системах активного транспорта. Во-вторых, протеины
биологических мембран служат катализаторами химических реакций, причем
ферменты, встроенные в биомембраны, как правило, активнее
катализаторов в растворе. Установлено, что большая часть всех
биохимических реакций в организме животных и человека протекает на
клеточных мембранах. К примеру, плазмолемма печеночной клетки
(гепатоцита) содержит более 20 различных ферментов. Во
внутриклеточных мембранах их содержание еще богаче. Изучение биомембран
как пористых катализаторов явилось одним из эффективных
направлений бионики в целях разработки технологических процессов,
аналогичных биомембранным химическим реакциям.
В-третьих, все мембранные протеины усиливают прочность
липидного каркаса и тем самым выполняют функцию структурного
компонента биомембраны.
В-четвертых, белки клеточных мембран несут рецепторную
функцию. Они столь же разнообразны, сколь разнообразны стимулы,
воспринимаемые рецепторными белками. Так, восприятие света
обеспечивается пигментами, в составе которых наряду с белком
присутствуют те или иные хромофорные группы с определенными спектрами
поглощения. Таким пигментом является, к примеру, родопсин, который
обеспечивает реакции на свет палочек - светочувствительных клеток
сетчатки глаза. Многие белки-рецепторы ответственны за восприятие
химических агентов. В основе функционирования такого белка-химио-
рецептора лежит прежде всего стереохимическое взаимодействие с
соответствующим химическим веществом. Мембранные белки-химиоре-
цепторы обеспечивают обонятельную и отчасти вкусовую рецепцию,
будучи сосредоточены в плазмолемме химиочувствительных клеток
соответствующих органов чувств. Вместе с тем значение
белков-рецепторов не ограничивается участием в функционировании органов
чувств. Они участвуют в синаптической передаче сигналов,
присутствуют в мембранах любой клетки, осуществляя как ее взаимодействие с
I пава 2. Биофизика клеточных мембран
81
питерстицием (межклеточной средой), так и обмен информацией
между органоидами внутри отдельной клетки. К рецепторам относятся
антитела, способные связывать специфический антиген (определенный
мембранный белок бактерии, токсин и т. и.) и вызывать иммунный
отпет клетки, в плазмолемме которой они сосредоточены.
В различных биомембранах белки распределены среди липидов
по-разному. В плазмолемме их распределение довольно равномерное.
Для специализированных внутриклеточных мембран характерно
существование участков с высокой концентрацией особых белков и даже
ансамблей протеиновых молекул со строго упорядоченной
последовательностью компонентов. Примером может служить цепь транспорта
электронов во внутренней митохондриальной мембране.
2.1.1.4. Углеводы биологических мембран
В биологических мембранах углеводы присутствуют
преимущественно в виде сложных соединений с белками (гликопротеиды) и
липидами (гликолипиды). Они являются теми молекулярными
структурами, которые обеспечивают рецепцию вирусов, антигенов,
токсинов, гормонов и множества других физиологически активных
веществ, у которых выражена стереоспецифичность (специфичность
пространственной структуры молекул). Типом углеводного остатка,
присоединенного к белку плазмолеммы эритроцита, определяется
фупповая принадлежность крови человека. У людей с группой
кропи I (0) в эритроцитарной плазмолемме присутствует так
называемый Η-антиген (гликопротеид определенной структуры). Антиген II
(Λ) группы отличается от предыдущего только тем, что на конце
цепи имеет дополнительный остаток аминосахара (N-ацетилгалактоза-
мина). Отличием антигена III (В) группы является присутствие на
пом месте галактозы. У людей с IV (АВ) группой крови к Н-антиге-
пу присоединены оба названных остатка.
Белки-рецепторы (точнее гликопротеиды-рецепторы),
находящиеся в плазматических мембранах животных и растительных клеток,
обычно содержат только 9 из более чем 100 известных моносахаридов.
Глюкоза встречается редко. Весьма распространены галактоза и ман-
поза. Кроме них следует назвать аминосахара (N-ацетилглюкозамин
и N-ацетилгалактозамин), пентозы (арабинозу и ксилозу), нейрамино-
I, '«43
82
Биофизика
Рис. 2.9. Схема структуры гликофорина и его расположения
в эритроцитарной мембране
вую (сиаловую) кислоту. Эти моносахариды присоединяются к
боковым цепям аминокислотных остатков (аспарагила, треонила, серила,
гидроксилизила) и образуют олигосахаридные цепи, включающие не
более 15-20 моносахаридных остатков в одной молекуле гликопроте-
ида (рис. 2.9).
Цепи сильно разветвлены и напоминают ветвящиеся кустики на
поверхности биологической мембраны. Такое гликопротеидное
покрытие клеточной поверхности называют глшокаликсом. Его
развитие неодинаково у клеток, входящих в состав разных тканей. Гликока-
ликсом богаты эпителиальные клетки, например, эпителий кишки,
почечных канальцев и некоторых других органов. За счет гликокалик-
са, возвышающегося над липидным бислоем на 3^4 нм, клеточные
мембраны достигают максимальной толщины (до 50 нм). На гликока-
ликсе поддерживается высокий отрицательный электрический
потенциал относительно межклеточной среды. Он препятствует слипанию
соседних клеток.
/ пава 2. Биофизика клеточных мембран
83
В плазмолемме эпителиальных клеток углеводы составляют до
10% ее сухой массы, причем олигосахаридные боковые цепи гликоп-
ротеидов и гликолипидов локализованы исключительно в наружной
половине липидного бислоя.
2.1.1.5. Вода и соли в биологических мембранах
Воде принадлежит важная роль в структурировании
компонентов биомембраны, поскольку существенным фактором упорядочения
молекул в ней служит межмолекулярное гидрофобное взаимодейст-
iiiic. Вода стремится вытеснить гидрофобные группы липидов и
белков, нарушающие сеть, которую обычно «плетут» молекулы воды за
счет водородных связей между собой. Вытесняя гидрофобные
группы, вода объединяет их в локальных участках и таким образом
сводит к минимуму их влияние на собственную сеть.
Внутри мембранных каналов находится свободная вода,
молекулы которой образуют сеть. Кроме того, отдельные (одиночные) мо-
искулы воды встречаются в углеводородной зоне мембраны, образуя
ι пдратные оболочки вокруг полярных групп фосфолипидов и белков.
Гикая вода называется связанной. И, наконец, между липидными сло-
нмп биомембраны может присутствовать в небольшом количестве
ι :ικ называемая захваченная вода.
Соли содержатся главным образом в водных растворах,
заполняющих ионные каналы в клеточных мембранах.
Особенности молекулярной структуры биомембран предопре-
целяют их физические и физико-химические свойства.
2.1.2. Физические и физико-химические свойства
биологических мембран
В живых клетках БМ пребывает в жидкокристаллическом
состоянии. В жидком кристалле сочетаются свойства кристалла (дальний поря-
цок организации и двулучепреломление) и жидкости (текучесть и обра-
юшщие капель), что приводит к возникновению качественно новых
ι пойств, о которых пойдет речь ниже. Термин «жидкий кристалл» суще-
ιΐ пуст в науке с конца XIX века. В 1888 г. ботаник Ф. Райнитцер синте-
шровал эфир холестерина (холестерилбензоат) и изучил его свойства.
84
Биофизика
Оказалось, что при температуре (7) ниже 145 °С он был твердым
кристаллом, при Т> 178 °С - прозрачной жидкостью, а в промежутке
между этими температурами - мутной жидкостью. В следующем году
физик О. Леман при исследовании мутной жидкости холестерилбензоата
(при 145 °С< Т< 178 °С) в поляризационном микроскопе обнаружил
анизотропию (типичное свойство кристалла) и назвал это
промежуточное (между кристаллом и жидкостью) состояние холестерилбензоата
жидкокристаллическим. Позднее оно было обнаружено у многих
веществ при разных температурах и других параметрах (pH,posm и т.д.).
Бимолекулярный слой фосфолипидов, образующий
биомембраны, в физиологических условиях (при температуре тела, нормальных
рН и ионном составе интерстиция и цитозоля) представляет собой
жидкий кристалл. При понижении температуры и под влиянием ряда
других факторов фосфолипидный каркас биомембран приобретает
свойства твердого (димерного) кристалла, сохраняя бимолекулярную
(в профиле) структуру. В обоих состояниях молекулы фосфолипида
имеют гексагональную упаковку в плоскости биомембраны, но
плотность их упаковки различна. Например, молекула лецитина занимает
в твердокристаллическом состоянии поверхность в 0,46-0,48 нм2,
а в жидкокристаллическом - 0,6-0,8 нм2. Следует заметить, что чем
больше двойных связей в ненасыщенных жирных кислотах,
входящих в состав фосфолипидов, тем ниже температура, при которой они
становятся твердыми кристаллами.
В физиологических условиях текучесть биологических мембран
уменьшается при повышении в них содержания холестерина, ионов
кальция и магния. Двухвалентные ионы в зависимости от
концентрации нейтрализуют в той или иной степени отрицательный заряд на
головках фосфолипидов и ослабляют их взаимное отталкивание, что
приводит к более плотной упаковке молекул в биомембране. Местные
анестетики (новокаин и родственные ему соединения) повышают
степень текучести клеточных мембран, влияя на их
жидкокристаллическое состояние. Оно изменяется при росте и развитии клеток, а также
при некоторых патологических состояниях (раке, дистрофиях и др.).
Характерным свойством жидких кристаллов (ЖК) является их
способность к фазовым переходам, т. е. к преобразованию в твердые
кристаллы (ТК) и возвращению в прежнее состояние (ЖК <-» ТК) при
Гпава 2. Биофизика клеточных мембран
85
определенных условиях. В биологических мембранах фазовые
переходы происходят в физиологических условиях под действием ряда
агентов (раздражителей). Важно, что это может совершиться не во
исем объеме мембраны, а в небольших ее участках (там, где
появляются такие агенты).
Фазовый переход представляет собой кооперативный процесс.
Он подчиняется закону «все или ничего»: при плавном (градуальном)
изменении силы раздражителя (S) физико-химические свойства
биомембраны (вязкость, энергия активизации и другие) изменяются
скачком. При S < Sllop сохраняется жидкокристаллическое
состояние, а при S>Smp небольшой участок биологической мембраны
становится твердым кристаллом. Аналогично совершается обратный
фазовый переход, когда твердая фаза сменяется жидкой (с более
низкой вязкостью, в частности). Величина Sli0p для фазовых переходов
и клеточных мембранах может быть очень малой. Они совершаются,
например, при ничтожных концентрациях (менее 10"" моль · л~')
некоторых физиологически активных веществ и фармакологических
препаратов. Фактические данные о фазовых переходах в клеточных
мембранах оживили давний интерес к гомеопатии.
Фазовый переход: ЖК —»ТК в фосфолипидном каркасе сущест-
пепно изменяет свойства ферментов, каналов, переносчиков и других
функционально значимых компонентов биомембраны, находящихся
и том ее участке, где совершается кооперативный процесс. Там изме-
пнется проницаемость, нарушаются биохимические реакции, рецеп-
юрные и другие процессы, которые приводят к сдвигам в
физиологическом состоянии организма. Кстати говоря, самим мембранным
ι юлкам также свойственно жидкокристаллическое состояние, и они
Μοιγτ испытывать фазовый переход.
Количество молекул, образующих участок биомембраны, где
ι опершается кооперативный процесс, называется размером
кооперативной единицы. В однородной среде он больше, чем в неоднородной.
Iicjikh и холестерин, встроенные в более или менее однородный фос-
фолипидный каркас, нарушают его однородность и тем самым
уменьшают размер кооперативной единицы. Так обеспечивается
высочайшим степень локальности фазовых переходов в клеточных мембранах.
86
Биофизика
Природа жидкокристаллического состояния биомембран
обусловлена необычайно высокой подвижностью мембранных
компонентов.
Подвижность молекулярных компонентов биомембран.
Основными формами молекулярного движения в БМ являются
латеральная миграция (перемещение молекул в плоскости мембраны, т. е.
в пределах одной стороны бимолекулярного слоя) и вращение молекул
вокруг собственной оси (например, родопсин вращается вокруг оси,
перпендикулярной плоскости мембраны). Скорости обоих процессов
примерно такие же, как скорость свободной диффузии в вязкой среде.
Большой свободой движения обладают липиды. Среднее время
пребывания фосфолипидной молекулы в данном пункте мембраны
не более 10~7 с. Следовательно, мембранные липиды за счет
латеральной миграции беспрестанно меняются местами, причем каждая
молекула меняет своих соседей миллион раз в секунду,
передвигаясь со скоростью 5-10 мкм -с-1. В жидкокристаллической
структуре молекулярные перемещения совершаются скачками. Между
частотой (ν) таких перескоков, площадью (S), занимаемой молекулой
в (например, у лецитина S = 0,6-0,8 нм2), и средним расстоянием (х),
проходимым молекулой за время t, установлены следующие
соотношения: v = 2V3— и 3c=V4D7 , где D [м2 · с-1] - коэффициент латера-
льной миграции (диффузии) молекул. Его величина у мембранных
фосфолипидов достигает (6-12) · Ю-12 м2 · с-1.
Примерно те же значения D характерны и для латеральной
миграции некоторых мембранных белков (например, родопсина). Однако у
большинства из них частота перескоков меньше. Так, коэффициент
латеральной диффузии антигенов по плазмолемме лимфоцитов не более
10~14 м2 · с-1, что соответствует скорости около 0,2 мкм · с-1. Изучение
подвижности протеинов в БМ осложняется тем, что часть мембранных
белков «заякорена» в определенных местах как гликопротеидами
самих мембран, так и цитоплазматическими ультраструктурами
(микротрубочками, микрофиламентами и т. п.). Есть и такие протеины,
которые строго фиксированы в мембране (например, бактериородопсин
в плазмолемме галобактерии).
I'пава 2. Биофизика клеточных мембран
87
Скорость вращательного движения мембранных молекул
относительно нормали к поверхности мембраны довольно велика. Так,
поворот на 1 радиан фосфолипид совершает примерно за Ю-9 с,
родопсин - за 10^с, цитохромоксидаза (фермент дыхательной цепи
митохондрий) - за 10^ с. Эта величина называется временем корреляции
вращательного движения.
В отличие от вращения и латеральной миграции, перемещения
молекул поперек мембраны (с одной стороны липидного бислоя на
другую) совершаются очень редко. Такой вид молекулярного
движения называют флип-флоп-перемещениями (или перескоками типа
сальто-мортале). В искусственных мембранах «флип-флоп»-переме-
щсния липидов происходят не чаще одного раза за несколько часов.
1'хть данные, что в БМ частота «флип-флопа» выше, но и там
переходы молекул из слоя в слой совершаются гораздо реже, чем их
латеральная миграция. Разница в вероятности этих видов молекулярного
движения в клеточных мембранах обеспечивает постоянное
поддержание их асимметрии, которая состоит в неодинаковом липидном
и белковом составе их внутренней и наружной сторон.
В плазмолемме всех клеток млекопитающих наружная сторона
насыщена холинфосфатидами (фосфатидилхолин, сфингомиелин),
а внутренняя - аминофосфатидами (фосфатидилэтаноламин, фосфа-
гпдилсерин). По-видимому, вследствие асимметрии липидов в БМ ее
наружная и внутренняя поверхности деформируются в неодинаковой
степени при изменении температуры и под влиянием химических
игентов. В результате таких воздействий может измениться кривизна
клеточной мембраны.
Еще более выражена асимметрия в распределении мембранных
протеинов и углеводов. Внутренняя сторона БМ, как правило,
свободна от углеводов. Гликопротеиды сосредоточены преимущественно на
наружной стороне плазмолеммы, обеспечивая рецепторную
функцию. Напротив, основная часть ферментов, присущих
плазматической мембране большинства клеток, встроена во внутреннюю
половину липидного бислоя. Однако из этого правила есть исключения. Так,
наружная сторона плазмолеммы кишечного эпителиоцита,
обращенная в полость кишки, богата гидролитическими ферментами, которые
обеспечивают важнейший элемент пищеварительного процесса -
88
Биофизика
пристеночное пищеварение, открытое A.M. Уголевым в середине XX
века и называемое теперь мембранным пищеварением.
Асимметрия клеточных мембран имеет важное значение и в
переносе через них различных веществ. Асимметричная ориентация
белков и липидов, обеспечивающих мембранный транспорт,
обусловливает векторные свойства биомембраны, т. е.
однонаправленный перенос веществ через нее. Одни вещества (например, глюкоза)
проходят только из полости кишки в кишечный эпителиоцит, но не
идут в противоположном направлении. Продукты выделения
транспортируются главным образом из клеток наружу.
Приведенные факты хорошо иллюстрируют основную
особенность жидкокристаллического состояния - сочетание высокой
упорядоченности с большой подвижностью молекулярных компонентов
БМ. Диалектика взаимоотношений между этими, казалось бы, трудно
сочетаемыми свойствами состоит в том, что сама лабильность жидких
кристаллов обеспечивает поддержание стабильности образуемых ими
структур в открытой системе при меняющихся условиях ее
существования. Например, на разных стадиях развития клетки ферментный
состав некоторых ее органоидов (в частности эндоплазматической сети)
должен изменяться. Эти изменения еще более выражены в
неблагоприятных условиях существования клетки. Приспособление
молекулярного состава БМ к таким условиям позволяет клетке сохранить
жизнедеятельность. Говорят, что жидкокристаллическое состояние
клеточных мембран способствует «затуханию беспорядка» в них
вскоре после его возникновения. До сих пор не понято значение
недавно обнаруженного феномена выравнивания липидного состава
мембран разных типов в некоторых клетках злокачественных опухолей.
Лабильность БМ проявляется не только в значительной
подвижности их молекулярных компонентов, но и в высоких темпах
обновления, оцениваемых временем полужизни каждого из них.
Среднее значение этого показателя различно у белков в разных
мембранах: в плазмолемме и мембранах эндоплазматической сети- 50 ч,
в митохондриальных мембранах - 110 ч, в ядерной мембране - 120 ч.
Липиды также обновляются довольно быстро: у разных фосфолипи-
дов время полужизни колеблется от 15 до 80 ч, а у холестерина - от
24 до 140 ч. Следовательно, в течение жизни клетки ее мембранные
I пава 2. Биофизика клеточных мембран
89
компоненты многократно обновляются. Однако это не приводит
к замене целых мембранных систем, так как скорости обновления
молекул разных типов в одних и тех же БМ варьируют в широких
пределах.
Данные об изменчивости физико-химических свойств
клеточных мембран позволяют считать их весьма динамичными
структурами. Они могут перемещаться, исчезать, возникать вновь. В клетке
непрерывно происходит своеобразный мембранный обмен.
Биологическим мембранам присущи и такие свойства, как
значительная прочность на разрыв, упругость (эластичность), поверхно-
tnioe натяжение, вязкость, электрострикция и флексоэлектрический
•ффект (способность генерации электрических потенциалов на
мембране при ее деформации). Из перечисленных свойств два последних
гнязаны с наличием поверхностного заряда на БМ.
Поверхностный заряд на клеточной мембране.
Поверхностный заряд создается полярными головками фосфолипидов, гликоп-
ротсидами (главным образом карбоксильными группами сиаловой
кислоты и аминокислотными остатками), гликолипидами. За счет
mix веществ поверхность БМ заряжена отрицательно.
Поверхностный заряд плазмолеммы играет важную роль в межклеточных
взаимодействиях. Он способствует стабильности мембранных структур,
к также связыванию ионов, находящихся в межклеточной среде. От
поверхностного заряда плазмолеммы зависит ионный состав при-
мембранных слоев межклеточной среды, что оказывает влияние на
многие внутриклеточные обменные процессы.
Существование заряженных групп на БМ приводит к
образованию диффузионного двойного электрического слоя, в котором фиксиро-
иинный отрицательный заряд клеточной поверхности уравновешен по-
иожительным зарядом, создаваемым межклеточной средой за счет
попов. Разность потенциалов между частями двойного электрического
ι-ίοη называют электрокинетическим потенциалом (или дзета-потенци-
ihiom). Это ничто иное, как потенциал внешней поверхности БМ относи-
I (Ч |ыю интерстиция. Толщина двойного электрического слоя и величина
и in а-потенциала зависят от природы электролита и концентрации его
попов. При уменьшении концентрации хлорида натрия в межклеточной
ι роде в 200 раз толщина двойного слоя возрастает в 5 раз, а дзета-потен-
90
Биофизика
циал связан с этой толщиной экспоненциальной зависимостью. При
высокой концентрации электролита дзета-потенциал стремится к нулю.
Когда в межклеточной среде присутствуют двухвалентные катионы,
избыток положительных зарядов может стать настолько значительным,
что дзета-потенциал изменит свой знак. Снижение дзета-потенциала и,
тем более, изменение его знака на противоположный сопровождается
слипанием плазматических мембран соседних клеток. Так бывает при
избытке Са2+ в межклеточной среде, а также при перестройках
клеточных мембран, сопровождающихся сдвигами дзета-потенциала.
Подобный эффект имеет некоторые особенности у клеток крови (например,
эритроцитов), у которых дзета-потенциал может падать за счет
нарушения не только солевого, но и белкового состава кровяной плазмы. Это
явление лежит в основе изменения скорости оседания эритроцитов
(СОЭ), измерения которой широко используют в диагностических
целях. За счет дзета-потенциала имеет место электролиз клеток - в
электрическом поле они движутся к аноду.
Дзета-потенциал, измеренный на поверхности разных клеток,
варьирует от -10 до -30 мВ. Его величина спадает в интерстиции
и цитозоле по экспоненте с увеличением расстояния от наружной
и внутренней поверхностей БМ. Для оценки декремента (затухания)
дзета-потенциала служит так называемый радиус экранировки Де-
бая - расстояние, на котором потенциал падает в е раз. В интерстиции
он равен 0,8 нм, т. е. составляет примерно десятую часть толщины
биомембраны. Следовательно, дзета-потенциал действует на очень
малом расстоянии, но оказывает существенное влияние на размеры
межклеточных пространств, противодействуя силам притяжения
Ван-дер-Ваальса. Наименьшее расстояние между клетками
составляет 10-20 нм. При таком расстоянии существует энергетическая яма во
взаимодействии кулоновских и ван-дер-ваальсовых сил. Однако те
ткани, клетки которых обладают большим дзета-потенциалом, имеют
более протяженные (до 10 мкм) межклеточные промежутки. В
большинстве тканей просвет между клеточными поверхностями
составляет от 100 нм до 1 мкм.
В последние годы достигнуты немалые успехи в изучении
поверхностного заряда как плазмолеммы, так и внутриклеточных мембран.
Они связаны прежде всего с применением специальных люминофо-
Глава 2. Биофизика клеточных мембран
91
ров - флуоресцентных зондов, интенсивность свечения которых
определяется величиной мембранного заряда.
Липидная часть БМ обладает свойствами диэлектрика.
Диэлектрическая проницаемость гидрофобной зоны составляет 2,0-2,2,
тогда как у гидрофильной зоны она гораздо выше (10-20). Электрическая
емкость полярных головок фосфолипидов достигает 30 мкФ · см"2,
а жирнокислотные хвосты имеют С = 0,5-0,9 мкФ · см~2, причем она
обратно пропорциональна числу атомов углерода в углеводородной
цепи липида. Общая емкость клеточной мембраны не может
превосходить наименьшую С ее компонентов, так как они образуют цепь
с последовательным включением конденсаторов. Поэтому
электрическая емкость БМ имеет порядок 1 мкФ · см-2.
Благодаря существованию в клеточной мембране заряженных
ipynn ей присуща выраженная электрострикция: по мере повышения
фансмембранной разности потенциалов мембрана сжимается, что
приводит к утончению гидрофобной зоны и, следовательно, к
увеличению С клеточной мембраны. Возрастание дзета-потенциала
сопровождается увеличением поверхности клетки.
Механические свойства биомембран. Механические свойства
клеточных мембран весьма своеобразны. Величина модуля Юнга
и поперечном направлении достигает 108— 109 Па. Вместе с тем
устойчивость к деформации сдвига примерно на 4 порядка меньше,
('ила, достаточная для разрушения БМ на участке в 1 мкм,
оценивается в Ю-11 Н. Основной вклад в механическую прочность клеточной
мембраны вносят белки, о чем свидетельствует сопоставление этих
свойств у нее и искусственной липидной мембраны. Так, модуль
упругости плазмолеммы эритроцита на 1-2 порядка больше, чем у
искусственной липидной мембраны. Значительный вклад в повышение
упругости и прочности эритроцитарной мембраны по сравнению
с чисто липидной мембранной структурой вносят не только белки,
встроенные в липидный бислой, но также довольно густая сеть, обра-
юванная мембранными белковыми молекулами и актиновыми
нитями непосредственно под плазмолеммой в цитоплазме.
Вязкость биомембран. Биомембрана как
жидкокристаллическая структура с присущей ей текучестью характеризуется определен-
92
Биофизика
ной вязкостью, которая измерена методами ЭПР и дифференциальной
сканирующей микрокалориметрии (ДСК). Результаты измерений
вязкости разными методами совпали. Вязкость БМ составляет от 0,03 до
0,1 Па · с (30-100 мПа · с = 30-100 сП), т. е.в30-100разбольше,чему
воды, и примерно такая же, как у оливкового масла.
При изменении температуры, молекулярного состава и других
параметров БМ меняется ее вязкость вследствие возникновения
фазового перехода: жидкий кристалл —»твердый кристалл (структура в
виде относительно жестких вытянутых палочек). При температуре 310—
311 °К фосфолипиды с ненасыщенными углеводородными цепями
пребывают в жидкокристаллическом состоянии, а при замене на
полностью насыщенные цепи они образуют двумерный кристалл.
Регулируя молекулярный (прежде всего, фосфолипидный) состав
клеточных мембран, живой организм может изменять их фазовые состояния
при постоянной температуре и, напротив, сохранять
жидкокристаллическое состояние при понижении температуры. Последнее
свойственно бактериям и растениям, заменяющим в своих клеточных
мембранах насыщенные липиды на ненасыщенные при охлаждении. Так они
сохраняют жидкокристаллическое состояние, а значит, нормальную
вязкость и зависящую от нее проницаемость мембран при низкой
температуре окружающей среды Смена фосфолипидного состава БМ на
«морозоустойчивый» присуща и пойкилотермным животным,
которые используют этот механизм для адаптации к холоду. Строгое
постоянство температуры тела гомойотермных животных избавляет их
от необходимости осуществлять столь серьезные молекулярные
перестройки своих клеточных мембран. Из сказанного следует, что одним
из важных достоинств гомойтермии (постоянства температуры)
является постоянное поддержание БМ в жидкокристаллическом
состоянии, обеспечивающем стабильность транспорта веществ через них.
Интересно, что у пингвинов температура нижних конечностей падает
в дистальном направлений и соответственно мембраны клеток все
более обогащаются ненасыщенными жирными кислотами (в тканях
стопы их гораздо больше, чем в тканях бедра).
Вязкость БМ претерпевает существенные изменения при
многих заболеваниях, а также под действием электромагнитных
излучений (особенно ионизирующих), ряда фармакологических препаратов,
I пава 2. Биофизика клеточных мембран
93
гормонов и некоторых других факторов. Во многих случаях влияние
пи вязкость клеточных мембран опосредовано изменением
содержания в них холестерина. При нормальной температуре тела повышение
содержания холестерина в БМ увеличивает их вязкость, а понижение -
уменьшает ее. В этом причина разжижения мембран в клетках
злокачественных опухолей (например, лейкоцитарных мембран при лейко-
ic). Вязкость всех клеточных мембран падает при тиреотоксикозе,
ίΐ также под действием наркотических веществ (например, хлорофор-
Μίΐ). Возможно, что наркотический эффект непосредственно связан
с изменением физико-химических свойств биомембран. Так,
головастик, помещенный в раствор хлороформа, утрачивает двигательную
нктивностъ и способность реагировать на стимуляцию. Его удается
«оживить», уплотнив клеточные мембраны путем повышения
атмосферного давления. Однако при слишком высоком давлении
головастик снова теряет подвижность и чувствительность. Их можно
восстановить, добавив в среду наркотик. Известно, что дыхательная смесь,
содержащая наряду с кислородом газ, оказывающий на организм
наркотизирующее воздействие при атмосферном давлении, теряет этот
м|»фект на большой глубине.
Приведенный пример позволяет сделать вывод, что
жизнеспособность организма страдает как при понижении, так и при
повышении мембранной проницаемости, которая, в свою очередь, зависит от
ншкости БМ. Ее оптимальные значения поддерживаются в
клеточных мембранах, пребывающих в жидкокристаллическом состоянии.
Молекулы, образующие жидкий кристалл, обладают значительной
подвижностью.
2.1.3. Функции биологических мембран
Физические, химические и физико-химические свойства БМ
обеспечивают выполнение ими определенных функций, без которых
невозможна жизнедеятельность организма. В самом общем виде и
применительно к мембранам всех типов многообразие этих функций
можно свести к трем основным: механической, барьерной и матричной.
Механическая функция заключается в поддержании морфоло-
тческой целостности и относительной автономности как клетки
94
Биофизика
в целом, так и внутриклеточных органоидов. Она основана прежде
всего на механических свойствах мембранных структур.
Под барьерной функцией понимают создание биомембраной
препятствий для свободного переноса веществ через нее. Выше говорилось
о том, что для одних агентов БМ является непреодолимым
препятствием, другие легко проходят сквозь нее, причем, как правило, только в
определенном направлении, как того требуют векторные свойства
мембраны. Скорости мембранного транспорта разных веществ далеко не
одинаковы. Следовательно, с барьерной функцией БМ
непосредственно связана ее избирательная (селективная) проницаемость.
Мембраны не только отделяют клетки друг от друга, но также
разделяют цитоплазму на ряд замкнутых отсеков (компартментов),
каждый из которых выполняет свою специфическую задачу. В такой
трактовке клеточные органоиды рассматриваются в качестве
компартментов. Принцип компартментализации (разбиения
цитоплазмы на компартменты) признан сейчас одиним из важнейших в
организации биологических систем. Благодаря компартментализации
в клетке пространственно разобщены и изолированы друг от друга
биохимические процессы, совместное течение которых невозможно.
Например, синтез жирных кислот происходит в цитоплазме, а
окисление - в митохондриях; синтез белка - на рибосомах, а деградация -
в лизосомах. Между содержимым органоидов и цитозоля имеются
существенные различия в химическом составе, чем обусловлены
высокие концентрационные градиенты на внутриклеточных мембранах.
На плазмолемме также поддерживаются значительные
физико-химические градиенты. Они служат главной движущей силой
трансмембранного переноса веществ.
Преимущества компартментализации связаны не только с
барьерной, но и с матричной функцией клеточных мембран. БМ служит
матрицей для белков-рецепторов, ферментов и других
физиологически активных веществ, обеспечивая пространственную организацию
рецепторных взаимодействий, метаболических реакций, переноса
энергии и других мембранных процессов. Так, биомембраны
объединяют встроенные в них ферменты в единый конвейер, где каждый из
них действует строго согласованно с остальными. Среди мембранных
/ пава 2. Биофизика клеточных мембран
95
ферментов выделяют так называемые векторные, которые пронизы-
пшот БМ и принимают субстраты на ее одной стороне, чтобы выделить
продукты реакции на противоположной. Реакции, катализируемые
такими ферментами, имеют векторный характер. Мембранным фермен-
I ам присуще явление аллопии, заключающееся в том, что при отделе-
iiiiii от БМ они полностью или частично утрачивают свою активность.
Различные клеточные мембраны, выполняя механическую,
барьерную и матричную функции, осуществляют также ряд
специфических функций, присущих не всем, а только определенным мембранам.
Μ мембранах эндоплазматической сети идет синтез белков, фосфоли-
индов и других соединений. На внутренней митохондриальной мемб-
piiue происходит биологическое окисление и синтез АТФ (клеточное
пихание), представляющее собой многоэтапный ферментативный
процесс. Все специфические функции органоидов неразрывно
связаны с их мембранами.
Обращаясь к характерным функциям плазмолеммы, следует
нашить и механическую защиту клетки, и обеспечение межклеточных
шапмодействий, и электрическую изоляцию, и экранировку клеток от
ипешних электромагнитных полей, и биоэлектрогенез. На их основе
и плазматических мембранах клеток разных типов формируются еще
iiiuice специфические и сложные функции, обеспечивающие опреде-
иеппые физиологические свойства: в нейронах - генерация нервных
импульсов и их проведение по нервным волокнам, в рецепторах
органон чувств - преобразование разнообразных раздражителей в нер-
нную импульсацию, в мышечных волокнах - генерация мышечных
>центрических импульсов и сокращение, в кишечных эпителиоци-
I их - переваривание пищи и всасывание ее компонентов. Перечень
подобных примеров должны продолжить сами учащиеся.
2.1.4. Модели биологических мембран
Существует несколько гипотез о структурной организации
к неточных мембран. Их принято называть моделями биомембран.
В основу первой модели были положены экспериментальные
исследования плазмолеммы эритроцита. Эту клетку не зря называют
ра(ючсй лошадкой мембранологов. Помещая эритроциты в гипото-
96
Биофизика
нический раствор соли, ученые давно получили их мембраны в таких
количествах, которые были достаточны для проведения с ними
химических и физико-химических работ.
Мембраны гемолизированных клеток крови получили название
теней (или привидений) эритроцитов. В конце 20-х годов И. Гортер
и А. Грендел экстрагировали липиды из теней эритроцитов и в
специальном приборе (ванне Ленгмюра) измерили площадь, образованную
ими на поверхности ванны. Она оказалась примерно вдвое больше
площади, которую образовывали липиды, находясь в эритроцитар-
ной мембране. Последовал вывод о бислойной организации липидов
в БМ. Позднее результаты измерений И. Гортера и А. Грендела были
уточнены: площадь липидного бислоя составляла не 100%, а только
75% поверхности эритроцита. Тогда предположили, что мембрана
построена не из одних липидов. В 1931 г. Н. Девсон и Р. Даниелли
предложили модель сэндвича (бутерброда), согласно которой
среднюю часть БМ образует бимолекулярный липидный слой, а на его
обеих поверхностях расположены белки. Поперечное расположение
осей липидных молекул к мембранной поверхности было
установлено в 1936 г. P.O. Шмиттом при исследовании поляризации и
дифракции рентгеновых лучей на мембранах зрительного нерва.
Другая модель БМ называется мозаичной (или жидкостно-мо-
заичной). Она предложена в 1972 г. С. Синджером и Г. Николсоном,
которые предположили, что с белками взаимодействуют не
отдельные липидные молекулы, а их комплексы - мицеллы и что только
около 30% липидных молекул вступают в непосредственные связи
с белками. Мембрана представляется липидным бислоем, в который
вкраплены протеиновые молекулы и их комплексы (белковые
глобулы). Перед мысленным взором одного из авторов мозаичной модели
клеточная мембрана предстала в виде липидного океана, в котором
плавают белковые айсберги разной величины. Взглянув на схему
мозаичной модели (рис. 2.10), можно понять, что образ океана с
айсбергами отражает вид БМ только со стороны одной поверхности. Он не
учитывает, что высота отдельных айсбергов больше глубины океана,
и они выходят за пределы его дна. С учетом этих замечаний
мозаичная модель представляется вполне реальной.
I nuaa 2. Биофизика клеточных мембран
97
Рис. 2.10. Мозаичная модель биомембраны
I - белковые глобулы; 2 -липидное «озеро»
Интересные факты в подтверждение основной идеи мозаичной
модели получены посредством метода «замораживания-травления»
(пли «замораживания-скалывания»). Изучаемые ткани очень быстро
ихлаждают в жидком азоте, благодаря чему внутриклеточная вода не
кристаллизуется, а переходит в стекловидное состояние, не разрушая
к истки. Замороженные таким образом клетки под действием ультра-
мпкротомного ножа не разрезаются, а раскалываются. Линия скола
нередко проходит вдоль зоны расположения углеводородных цепей
шшидного бислоя. Скол мембраны при низкой температуре
помещают в вакуум. По мере того как вода возгоняется из стекловидной
фирмы, поверхность разлома «протравливается», и на ней рельефно
иыделяются крупные молекулы и их комплексы. На
«протравленную» поверхность напыляют покрытие из платины и углерода,
формируя реплику (своеобразный слепок) исследуемого скола. При
помещении ткани в дистиллированную воду комнатной температуры
реплика всплывает. Она служит препаратом для электронной микро-
I мшии. На электронограмме получается изображение внутренней
ι фуктуры клеточной мембраны. На нем хорошо видны как
отдельные частицы (крупные молекулы и их комплексы), так и вмятины от
них. Если сделать реплики с обеих половин одного скола, то на
одной из них можно увидеть выступающие частицы, а на другой -
точно соответствующие им вмятины (рис. 2.11).
■IK-I !
98
Биофизика
Рис. 2.11. Эпектронограмма поверхностей скола биомембраны
(метод «замораживания-скалывания») Выступам (1-5) на левой поверхности
соответствуют вмятины (Г- 5') на правой и наоборот
. Метод «замораживания-травления» позволил установить, что
в плазматической мембране бактериальной клетки между соседними
белковыми глобулами, пронизывающими ее насквозь, расположено
примерно 300 липидных молекул. При изучении обеих половин скола
эритроцитарнои мембраны рассмотрели 4200 белковых частиц на
1 мкм2 поверхности, что соответствует 6 · 105 таких частиц во всей
плазмолемме эритроцита. Следовательно, белки занимают около 25%
поверхности эритроцитарнои мембраны, «плавая» в липидах.
Плазмолемма эритроцита в высшей степени асимметрична, что
проявляется прежде всего в различном составе молекулярных
компонентов ее наружной и внутренней сторон, а также в их неодинаковой
толщине. Общая площадь мембраны эритроцита достигает 140 —
150 мкм2, а масса-(1,1-1,2) · Ю-12 г. В эритроцитарнои мембране 50%
белков, 40% липидов, 10% углеводов. Среди липидов 42%
холестерина, 17% фосфатидилхолина (лецитина), 15% фосфатидилэтаноламина,
13% сфингомиелина, 8% фосфатидилсерина и фосфатидилинозита,
3-5% нейтральных липидов.
Из белков, схематично изображенных на рис. 2.12, а, хорошо
изучены спектрин и гликофорин. Первый из них относится к
периферическим белкам, причем расположен на цитоплазматической
стороне плазмолеммы, образуя там сеть, выстилающую мембрану изнутри
7
(пива 2. Биофизика клеточных мембран
99
Рис. 2.12. Схематическое изображение эритроцитарной мембраны
и - схема расположения важнейших полипептидов; б - схема расположения
сети спектрина, обеспечивающей структурную жесткость мембраны
I - гликофорин; 2 - спектрин (тектин А), образующий сеть
под внутренней поверхностью мембраны; 3 - миозиноподобный белок
(обеспечивает подвижность мембраны); 4 — гликопротеиды
(некоторые из них являются АВО-изоантигенами и ответственны
за групповую принадлежность крови); 5 - компонент «а»
(предположительно он образует канал для анионов) — туннельный белок.
(рис. 2.12, б). Спектрин обеспечивает жесткость и прочность эрнтро-
iiii ι ирной мембраны, благодаря чему эритроцит при движении по кро-
шчюсным сосудам может испытывать значительную деформацию, не
|ш фушаясь при этом. Молекула спектрина состоит из двух полипеп-
И1ДПЫХ цепей (с молекулярными массами около 220 и 240 кДа). Они
шлицуют длинные гибкие стержни длиной от 100 до 200 нм. На 1
||нироцит приходится примерно 216тысяч молекул спектрина. Ре-
ик' ι ка из них образует каркас, на который «натянута» остальная часть
пмолеммы. Со спектрином связаны актиновые нити (микрофила-
чгнты), входящие в состав цитоскелета. Кроме того, в спектринном
ьнркнсе фиксированы некоторые интегральные белки, внедряющиеся
и мембрану и пронизывающие ее насквозь.
100
Биофизика
Одним из интегральных белков эрнтроцитарной мембраны
является гликофорин (см. рис. 2.9). Он представляет собой гликопротеид с
молекулярной массой около 55 кДа. Плазмолемму одной клетки
пронизывает около полумиллиона его молекул. Каждая из них образована
полипептидной цепью, включающей до 200 аминокислотных остатков.
К ней прикреплено множество олигосахаридных цепочек (как
коротких - из 4 моносахаридов, так и длинных - из 8-12 моносахаридов), на
долю которых приходится около 60% всей молекулы. Большая часть
таких цепочек («сахарных кустиков») увенчана остатками сиаловой
кислоты, присоединенной к галактозе. Сиаловая кислота придает
поверхности эритроцита отрицательный заряд, предохраняющий клетки от
слипания. Эритроцит живет в среднем 120 суток, в течение которых
содержание сиаловой кислоты в гликофорине постепенно уменьшается,
что приводит к обнажению галактозных остатков. С ними
взаимодействуют- белки-рецепторы, сосредоточенные на плазматических
мембранах клеток печени и селезенки, входящих в ретикулоэндотелиальную
систему. В результате такого взаимодействия состарившиеся
эритроциты разрушаются и выводятся из кровеносного русла.
Гликопротеиды эрнтроцитарной плазмолеммы определяют
также групповую принадлежность крови, обеспечивают рецепцию
некоторых вирусов (в том числе вируса гриппа), фитогемагглютини-
нов, гормонов и других физиологически активных веществ.
Данные об организации эрнтроцитарной плазматической
мембраны, считающейся одной из простых мембранных систем, говорят
о том, что даже в ней присутствуют элементы и мозаичной, и
бутербродной моделей. Некоторые черты ее строения не укладываются
в рамки их обеих. Каждая из моделей лишь частично отображает
молекулярную структуру реальных клеточных мембран. Бутербродная
модель хорошо соответствует структуре миелиновых оболочек
нервных волокон. В них содержание липидов в 2,5 раза превосходит
содержание белков. В других БМ найдено иное соотношение основных
мембранных компонентов, причем в клеточных мембранах разных
типов процентное содержание белков и липидов характеризуется
большими различиями (табл. 2.2). При более широком рассмотрении
этого вопроса, с учетом сведений о клеточных мембранах не только
/ нова 2. Биофизика клеточных мембран
101
животных, но также растений и бактерий, можно прийти к выводу,
что соотношение белков и липидов различно - от 1:4 до 4:1.
Таблица 2.2
Состав различных клеточных мембран млекопитающих
Ткани, клетки и клеточные
органеллы млекопитающих
Ткани головного мозга быка
Миелиновая оболочка человека
Эритроциты быка
Эритроциты человека
Митохондрии бычьего сердца
Внутренние мембраны митохондрии из
сирдца быка
Содержание липидов и белков, %
лип иды
18-23
70-72
30-40
40
20-50
25
белки
77-82
28-30
60-70
60
50-80
75
Различия в содержании мембранных компонентов свидетельству-
пи, очевидно, о существовании разных типов структурной организации
КМ. По-видимому, ближе к истине синтетическая модель, включающая
ι цементы каждой из рассмотренных выше и допускающая ряд других
гпособов взаимодействия в мембране белков и липидов (например,
переплетение углеводородных цепей липидов с гидрофобными областями
Гн'лковых молекул наподобие нитей в ковре). И все же в основу синте-
шческой модели положена мозаичная, хотя в некоторых случаях в ли-
ПИД110М «океане» больше белковых «айсбергов», чем липидов, да и не
псе липиды образуют в мембране бимолекулярный слой. Так, липидные
молекулы, непосредственно связанные с интегральными белками, не
учпетвуют в создании бислоя. Их называют аннулярными липидами.
Вместе с тем синтетическая модель предусматривает
возможность существования различных способов взаимодействия белков
π липидов не только в мембранах разных типов, но и в разных уча-
I ικιιχ одной и той же биомембраны. Более того, синтетическая мо-
ншь допускает изменчивость мембранной структуры в зависимости
иг функционального состояния клеток. Возможность такой пере-
г|ройки была подтверждена при использовании метода «заморажи-
102
Биофизика
вания-травления». При изучении мембранных сколов, полученных
из клеток, пребывающих в разных функциональных состояниях,
оказалось, что в одних условиях белковые частицы распределены
в мембране равномерно, а в других - группируются в крупные
конгломераты.
Таким образом, прежнее стремление исследователей к
созданию унитарной модели биомембраны сменилось убеждением в том,
что представление о ее молекулярной организации должно строиться
на основе принципа гетерогенности биологических систем.
2.1.5. Искусственные мембраны
В русском языке слово «модель» употребляется в нескольких
значениях. Используя его в предыдущем параграфе, мы
подразумевали под этим понятием абстрактный образ
структурно-функциональной организации биомембраны, соответствующий современным
сведениям о ней. Вместе с тем моделями БМ в литературе нередко
называют системы, имитирующие строение и работу клеточных
мембран. Такое применение слова «модель» допускается методологией
биофизики, но чаще подобные модели именуются искусственными
мембранами. Их использование не ограничивается задачей
моделирования БМ в познавательных целях. Искусственные мембраны нашли
широкое применение в химической технологии и других отраслях
промышленности. Заметим, кстати, что представление о биомембране
как неотъемлемом компоненте биологической системы стало
развиваться только после создания искусственных мембран.
Первые искусственные мембраны изготовил в 1870-е годы
М. Траубе из осадочного ферроцианида меди. Они обладали
свойством полупроницаемости, пропуская сквозь себя воду и препятствуя
прохождению растворенных в ней веществ. Поэтому их использовали
в осмометрах - приборах для измерения осмотического давления.
В 1890 г. В. Оствальд, разработавший теорию полупроницаемых сред,
предположил, что и клеточным мембранам присуща селективная
проницаемость. Позднее были созданы селективные стеклянные
мембраны, на которых моделировались некоторые свойства БМ, включая
трансмембранный перенос ионов.
/ нова 2. Биофизика клеточных мембран
103
2.1.5.1. Стеклянные мембраны
В стеклянных мембранах присутствуют поры, диаметр
которых примерно равен кристаллическому диаметру пропускаемого ими
попа. Он составляет у лития 0,12 нм, у натрия 0,19 нм, у кальция -
0.198 нм, у калия - 0,266 нм, у цезия - 0,338 нм, у хлора - 0,362 нм.
') ι и ионы окружены гидратными оболочками, толщина которых тем
(юльше, чем мельче ион. Так, диаметр гидратированного К+ равен
0,5-0,6 нм, а гидратированного Na+ - более 0,65 нм. Свободная энер-
I пи гидратации (кДж · моль-1) составляет у Li - минус 481,3, у Na+ -
минус 376,7, у калия - минус 309,7, у рубидия - минус 283,5, у це-
П1Я - минус 255,4, у хлора - минус 353,6.
Ион способен пройти через более крупную пору, чем его крис-
шллический диаметр, но более мелкую, чем диаметр его гидратной
оСюлочки, в том случае, если какие-то силы «сорвут» с него молеку-
иы воды, разрушив водородные связи. Источник таких сил должен
находиться в самой мембране, чтобы непосредственно контактиро-
нать с ионами, ибо электростатическое взаимодействие ослабевает
пропорционально квадрату расстояния между зарядами.
Работу по дегидратации ионов в стеклянных мембранах
выполняют так называемые лигандные группы (лиганды),
вступающие с ионами в ион-ионные или ион-дипольные взаимодействия.
II стекле роль лиганд по отношению к катионам выполняют
анионные группы SiO" или AlOSi-. Для перехода иона из водного
раствори в мембранные поры необходимо, чтобы энергия связывания его
шпандами превосходила энергию гидратации. Надежное электро-
( гптическое взаимодействие гидратированного иона с лигандами
Оывает тогда, когда он входит в мембранную пору, размеры и
конфигурация которой ему соответствуют. На этом основана избира-
н-льная проницаемость той или иной стеклянной мембраны по
отношению к определенному иону. Вода не проходит через поры
и пекле, так как в обычных условиях ее молекулы образуют тетра-
«дрические ассоциаты, состоящие из 5 молекул и имеющие
диаметр около 0,5 нм.
Согласно гипотезе Муллинза, лучше всего проходят через
поры тс ионы, радиус которых (в окружении одного слоя молекул во-
104
Биофизика
ды) близок к радиусу пор. В случае натриевого канала в возбудимой
мембране перенос ионов происходит через «горловину» поры, в
которой находится группа - СОО~. Чем выше сродство иона к этой
группе, тем выше будет его поток через канал и мембрану в целом
(гипотеза Хилле). В самом деле, если константы сродства канала
к двум ионам равны К, и К2, то из предыдущего ясно, что
"l "*2 (~2k ^2'^2
где Р] и Р2 - коэффициенты проницаемости ионов через
мембрану, У, и J2 - плотности потоков ионов через мембрану, С, и С2 -
концентрации ионов в водной среде, С]к и С2к - концентрации ионов
в канале.
В настоящее время при рассмотрении проблемы ионной
избирательности нередко используют электростатическую теорию
Эйзенмана. Для объяснения физико-химических механизмов
избирательности стеклянных электродов Эйзенман рассматривал
энергетику ионного обмена.
Последовательность избирательности ионообменной
реакции с случае большого радиуса иона будет соответствовать
первому ряду Эйзенмана. Она по сути соответствует
последовательности подвижности гидратироваиных ионов в водном растворе. При
малом кристаллическом радиусе последовательность
избирательности ионообменной реакции соответствует XI ряду Эйзенмана.
Для промежуточных случаев имеется 9 последовательностей
избирательности.
Таким образом, теория Эйзенмана предсказывает 11
последовательностей избирательности для 5 ионов щелочных металлов.
Именно такие последовательности обнаружены в природе:
I. Cs>Rb>K>Na>Li, VII. Na>K> Rb>Cs>Li,
П. Rb>Cs>K>Na>Li, VIII. Na>K>Rb>Li> Cs,
III. Rb>K>Cs>Na>Li, IX. Na>K>Li> Rb> Cs,
IV. K>Rb>Cs>Na>Li, X. Na>Li>K> Rb>Cs,
V. K>Rb>Na>Cs>Li, XI. Li>Na>K> Rb>Cs.
VI. K>Na>Rb>Cs>Li,
I /шва 2. Биофизика клеточных мембран
105
Для характеристики ионной избирательности мембран нередко
ι ^пользуются коэффициенты проницаемости, полученные прирасче-
1нх, основанных на теории постоянного поля Гольдмана-Ходжкина-
Кагца.
В работах со стеклянными мембранами были объяснены неко-
трые закономерности ионного транспорта через мембранные поры
(каналы), в частности роль лиганд в этом процессе. Знания о
механизмах действия стеклянных мембран использованы в
формировании гипотез о природе проницаемости, свойственной клеточным
мембранам. Однако значение исследований стеклянных мембран как
моделей биологических довольно ограничено.
2.1.5.2. Искусственные липидные мембраны
Значительный прогресс в биомембранологии связан с
введением в экспериментальную практику искусственных липидных мемб-
Ι'ιΐιι. Они применяются в трех основных вариантах: I) монослои липи-
нои на поверхности раздела вода - воздух или вода - масло, 2)
плоские бимолекулярные фосфолипидные мембраны, 3) липосомы. Из
них наиболее интересны два последних.
Создание бимолекулярных плоских липидных мембран связано
t именем П. Мюллера и его сотрудников, разработавших в 60-е годы
методы получения их в лаборатории. Капля фосфолипида в органиче-
i ком растворителе (например, гептане) наносится на тефлоновую пла-
г ι инку, в которой сделано отверстие диаметром около I мм.
Пластинки встраивается в качестве перегородки между двумя сосудами
ι подой. Под действием поверхностного натяжения из капли образует-
t и пленка, состоящая из двойного слоя липидных молекул (рис. 2.13).
lie толщина (6-7,5 нм) меньше длин волн видимого света, поэтому его
не отражает такая мембрана и она представляется абсолютно черным
icjiom. Ее нередко называют черной мембраной. Каждый из ее слоев
может быть построен как из одинаковых, так и разных липидов,
симметрично или асимметрично. В них удается внедрять (инкорпориро-
ппть) белковые молекулы.
Липосомами называют липидные пузырьки, получаемые встря-
чннанием сухих липидов в водно-солевом растворе. При обработке
106
Биофизика
Рис. 2.13. Искусственная плоская липидная мембрана («черная мембрана»)
а-в процессе формирования; б - сформировавшаяся
суспензий ультразвуком образуются пузырьки со стенками,
состоящими из бимолекулярного липидного слоя (рис. 2.14, а). Путем
наслоения таких бислоев друг на друга возникают многослойные пузырьки
диаметром от 5 до 50 мкм (рис. 2.14, б). В них толщина каждого
бимолекулярного липидного слоя составляет 6-7,5 нм, а водное
пространство между слоями - 1,5-2 нм. Размеры и форма многослойных липо-
сом зависят от рН среды, ее солевого состава и других факторов.
Диаметр однослойной липосомы равен 25-30 нм, его треть
приходится на внутреннее водное пространство, а две трети - на
концентрическую липидную оболочку.
В мембрану липосомы научились встраивать белки. По
терминологии В. П. Скулачева инкрустированные протеиновыми молекулами
пузырьки называются протеолипосомами. Они начинают применяться
в медицине. При введении в организм человека протеолипосомы
поглощаются клеточными мембранами. Так, в составе протеолипосом
клеточные мембраны получают вещества, не способные проникнуть
в них сами по себе. Сливаясь с БМ, липосомы изменяют их состав по
усмотрению врача. В плазмолемму одной клетки можно включить 300
миллионов липидных молекул и изменить таким образом основные
ι нпва 2. Биофизика клеточных мембран
107
а) 6)
Рис. 2.14. Липосомы
α - однослойная; б - многослойная
спойства клеточных мембран (вязкость, проницаемость, ферментную
и иммунную способности и т. д.). Важным достоинством подобного
имешательства является то, что протеолипосомы встраиваются не во
нес клетки организма, а именно в те, которые нуждаются в лечебном
иощействии. Целенаправленная терапия на клеточном уровне
обеспечивается разными способами, в частности введением в липосомы
специфических белковых компонентов клеток-мишеней. Без таких мер
шпюсомы концентрируются преимущественно в печени и
селезенке. Протеолипосомы как лекарственное средство (точнее, официна-
ш.пая форма) нетоксичны, полностью усваиваются организмом
и способны преодолевать многие «барьеры». Первые удачные резу-
ниаты достигнуты в химиотерапии злокачественных
новообразовании, в компенсации некоторых форм ферментной недостаточности,
и иммунизации. Сейчас перспективы применения протеолипосом
и медицине ошеломляют. Ближайшее будущее покажет степень со-
I ιоятельности сегодняшних прогнозов.
В искусственных мембранах липиды пребывают в жидкокри-
I ι пллическом состоянии, подобном тому, какое им свойственно в БМ.
Ннутри каждого из двух слоев лнпидные молекулы беспрестанно
меняются местами за счет латеральной диффузии. Этот процесс,
напоминающий игру в чехарду, идет со скоростью 5-10 мкм · с-1. Много общего
ν искусственных и биологических мембран в физических и
физико-химических свойствах. Проницаемость тех и других мембран для многих
108
Биофизика
молекул определяется большей или меньшей легкостью разрыва
водородных связей, образованных ими ранее. Иными словами, чем ниже
энергия дегидратации веществ, тем легче они преодолевают липидный
бислой. Поэтому через биологические и искусственные липидные
мембраны хорошо проникают жирорастворимые вещества.
Несмотря на существование аналогии многих свойств этих
мембран, между ними больше различий, чем сходства (табл. 2.3).
Так, искусственные липидные мембраны обладают низкой ионной
проницаемостью и, следовательно, высоким сопротивлением
постоянному и переменному (низкочастотному) электрическому току. Оно
на 4—5 порядков превышает электрическое сопротивление клеточных
мембран. У БМ гораздо выше проницаемость для воды.
Таблица 23
Сравнение свойств бислойиых липидиых и биологических мембран
Свойства
Толщина, нм
Емкость, пФ · см"2
Сопротивление, Ом · см2
Напряжение пробоя, мВ
Поверхностное натяжение, Η · см"1
Проницаемость для воды, мкм · с'1
Энергия активации для транспорта
воды, кДж · моль"1
Биологические
мембраны
7-15
0,5-1,3
102-105
100
10"5-3 · Ю-2
до 400
40,3
Искусственные
липидные мембраны
6-7,5
0,38-1,0
106-109
150-200
2 ■ 10_5-5 · 10-1
31,7
53,3
Пытаясь устранить различия между биологическими и
искусственными липидными мембранами, исследователи ввели в
липидный бислой ряд веществ, моделирующих присутствие в БМ их
второго молекулярного компонента - белка.
Добавление к липидным мембранам белков, выделенных из
бычьих эритроцитов, понизило их электрическое сопротивление в 200-
500 раз. Весьма интересные результаты получились при включении
в фосфолипидные бислой молекул некоторых антибиотиков. С ними
искусственные мембраны приобрели не только хорошую
электропроводность, но и избирательную проницаемость, напоминающую в ряде
/ пава 2. Биофизика клеточных мембран
109
случаев селективность клеточных мембран. Липидные бислои,
включающие антибиотики, моделируют транспорт веществ как через
мембранные каналы, так и посредством подвижных переносчиков. Эти работы
приносят большую пользу практической медицине. Их результаты по-
шоляют находить новые направления в синтезе антибиотиков с опреде-
исиными свойствами. В плазмолемму бактерии встраиваются только те
иптибиотики, которые взаимодействуют с мембранными
компонентами. Зная особенности клеточных мембран тех или иных
микроорганизмов, а также тканей человека, осуществляют целенаправленный синтез
антибиотиков, губительных для одних и интактных для других микро-
(юв, но, что важнее всего, безвредных для человека.
Искусственные липидные мембраны, включающие
разнообразные антибиотики и другие пептидные соединения, позволили моде-
нпровать многие свойства биомембран. Экспериментальные модели,
котя они еще далеки от полного воспроизведения того, что приобрел
организм при возникновении и развитии клеток, не только позволяют
понять функционирование клеточных мембран, но и проливают свет
ни многие проблемы патологии и терапии.
Так, одним из важнейших механизмов губительного действия
щи ибиотиков на микроорганизмы является внедрение их в
плазматические мембраны бактерий (грамицидин, аламетицин и др.) и грибов
(нмфотерицин, нистатин и др.), вследствие чего нарушается транспорт
иеществ (прежде всего ионов), изменяется химический состав цито-
пиазмы и падают электрохимические градиенты на клеточных мемб-
рииах микроорганизмов, становясь непосредственной причиной их
ι иГ)сли. Многие яды (в частности, яды некоторых змей) нарушаютнор-
мнльную проницаемость биомембран для ионов, отчего наступают
ι ι радания и даже смерть человека. Подобный механизм губительного
цойствия на организм человека и животных присущ многим токсинам.
Очень перспективно применение искусственных мембран в ин-
I сресах бионики. Ограничимся только двумя примерами. Благодаря
и ведению в липидный бислой молекул хлорофилла получен
высокочувствительный фотоэлемент, а зависимость свойств липидов от
ионного состава среды используется в создании ион-селективных
высокочувствительных датчиков.
по
Биофизика
Успехи в изучении искусственных мембранных систем служат
хорошей предпосылкой выяснения молекулярных механизмов
транспорта веществ через клеточные мембраны.
2.1.6. Биофизические механизмы транспорта
вещества [массоперенос) через биомембраны
Принято различать пассивный и активный транспорт веществ
через клеточные мембраны. К первому из них относят
трансмембранный массоперенос, происходящий в направлении действия
концентрационного, электрического, осмотического и фильтрационного
(гидростатического) градиентов. Так как по отношению к одному и тому же
веществу они могут быть направлены противоположно, то при
анализе такого массопереноса необходимо учитывать термодинамическое
сопряжение всех физико-химических градиентов (см. 2.2.2).
• Активным транспортом называют перенос вещества в
направлении, противоположном тому, которое предопределено
термодинамическим сопряжением перечисленных выше градиентов. Движущей
силой активного транспорта служит химический потенциал,
обусловливающий в БМ течение ферментативных реакций, поставляющих
свободную энергию для преодоления градиентов.
Концентрационный, электрический, осмотический и
фильтрационный градиенты имеют неодинаковое значение в переносе
веществ через клеточные мембраны. Массоперенос, происходящий
в результате суммарного действия осмотического и
гидростатического градиентов, принято называть конвекционным (конвективным)
потоком. Им определяется прежде всего траисмембрапный ток воды
вместе с растворенными в пей веществами.
2.2. Кинетика биофизических процессов
массопереноса
2.2.1. Уравнения массопереноса
При исследовании кинетики биофизических процессов
измеряют скорости их протекания в различных условиях. При описании
любого явления переноса обобщенными координатами скорость про-
/ ппва 2. Биофизика клеточных мембран
111
цосса выражают в виде производной соответствующей обобщенной
координаты (х)1 по времени —- . Во многих явлениях природы
скорости процессов прямо пропорциональны соответствующим
обобщенным силам (ХУ, характеризующим причины возникновения
соответствующего процесса:
%.Л,.Х„ (2.1)
ι дс Ai - коэффициент пропорциональности.
Рассмотрим несколько примеров.
Диффузия состоит в молекулярном движении вещества из об-
иисти с большей концентрацией (С,) в область, где его концентрация
ниже (С2). При переносе молекул через слой (мембрану) толщиной /
и площадью s уравнение переноса, определяющее скорость диффу-
ш и, имеет вид:
*!=_/).,.ΙΰηΕυ^Ι, (2.2)
dt '-о /
ι де D- коэффициент диффузии. Запишем уравнение (2.1) с учетом
ιοίΌ, что обобщенной координатой в нем является масса
переносимою вещества (я, = /и), а обобщенной силой - градиент концентра-
( С -С Л
нпи Xj - lim— = gradC , и обозначим произведение D на s ве-
||ичитюйЛ0:
— = AD- gradC. (2.2')
dt
1 χ - обобщенная координата - величина, характеризующая перемещение
пин мереное.
2 Xi - обобщенная сила - величина, характеризующая причину перемещения
пи» переноса.
112
Биофизика
В. Нернст установил, что для молекул сферической формы
зависимость D от силы трения (F^,) выражается следующим образом:
D = , где R - универсальная газовая постоянная (R =
А тр
8,32 · 103 ДжК-1 · кмоль-1), Τ - абсолютная температура, Л^ - число
Авогадро.
По закону Стокса: F = 6кг\г,гд.е η - вязкость среды, г-
эффективный раднус диффундирующей молекулы (радиус Стокса-Эйнштей-
на), представляющий собой радиус не реальной молекулы, а
эквивалентной сферической частицы, имеющей тождественную диффузионную
способность.
Из формул Нернста и Стокса следует формула Стокса-Эйнш-
тейна:
D=- RT
6π· vr · ΝΛ
где размерность D есть [м2 -с-1].
Уравнение (2.2), к которому эмпирически пришел физиолог
А. Фик в 1855 г. (поэтому основной закон диффузии носит его имя),
лежит в основе биофизических механизмов транспорта веществ в
организме. Уравнение Фика с успехом применяется в технике при
решении многих задач, связанных с переносом газов и жидкостей. Закон
Фика является основой конструирования ряда биотехнических
систем. Например, в аппаратах экстракорпорального кровообращения по
формуле Фика рассчитывают диффузию газов в оксигенаторе, а в
приборе «искусственная почка» - диффузию веществ через мембрану
ионообменника.
При движении электрических зарядов за обобщенную
координату принимают величину заряда (х, = q), а за обобщенную силу -
градиент потенциала (напряженность) электрического поля (Xi =
grad U = Ε). Скорость переноса зарядов (электрический ток)
выражается уравнением:
^-=Л„-gradf/=/L-£, (2.3)
dt
/ шюа 2. Биофизика клеточных мембран
113
ι не Аэ - Л · s. Зная, что удельная электропроводность (Л) определя-
г ι си через сопротивление (R): Λ = , а напряженность - через раз-
Rs
посгь потенциалов: Е-—.убеждаемся в тождественности уравне-
шι» (2.3) закону Ома: / = —.
R
В процессе теплопроводности обобщенной координатой
(переносимой величиной) является количество тепла (х, = Q), а
обобщенной силой (причиной переноса) - градиент температуры (Xt =
e.iad T). Скорость переноса тепла определяется выражением:
dQ__
dt
^=Ae-gradT, (2.4)
ι не AQ = К · s, а К - коэффициент теплопроводности us - площадь,
через которую переносится тепло. Это закон Джоуля - Ленца.
Скорость химической реакции, протекающей в системе, описы-
iiii ют числом молей вещества, вступивших в реакцию за единицу
времени. Обобщенной координатой является число молей, вступивших
и реакцию fa = ν), обобщенной силой - химический потенциал {Xt =
|i,), представляющий собой изменение свободной энергии системы
при изменении количества данного вещества на 1 моль. Скорость
химической реакции описывается уравнением:
^=Αμ-μχ, (2.5)
at
где коэффициент Αμ носит название химического сродства.
2.2.2. Кинетика сопряженных процессов массопереноса
Обычно процессы массопереноса происходят под действием
сразу нескольких обобщенных сил. Например, при переносе
заряженных частиц через клеточную мембрану имеют место и диффузия,
и шектрический ток. В этом случае происходит так называемое
термодинамическое сопряжение между диффузией и электрическим то-
« П43
114
Биофизика
ком, и скорость каждого из этих процессов зависит не только от
«своей» обобщенной силы, но и от всех обобщенных сил,
действующих в системе. С учетом термодинамического сопряжения массопе-
ренос в таком случае описывается системой уравнений переноса:
^- = Au-Xi+Al2-X2+...+Aln-Xn,
at
dx
2 =А2] -Х{ +А22-Х2+...+А2п Хп, (26)
i dt
dx'
dt
ъ =А. X, + An2-X2+...+Ann ·Χη
Рассмотрим несколько примеров термодинамического
сопряжения.
Если в системе (например, в газе) поддерживаются
одновременно градиенты температуры и концентрации, то уравнения
переноса следует записать так:
— =AU gradC +Ап gradr,
• dt
— =A2l -gradC +A21 gradr.
. dt
(2.7)
Градиенты концентрации и температуры выполняют роль
обобщенных сил, а обобщенными координатами служат масса
вещества и количество тепла, переносимые в системе из одной точки
пространства в другую. Из уравнений следует, что транспорт вещества
в такой системе определяется не только градиентом концентрации,
но и градиентом температуры.
Если в какой-то части системы как концентрация вещества, так
и температура выше, чем в другой, то grad С и grad Г имеют
одинаковые знаки, и процессы, происходящие под действием их, усиливают
друг друга - массоперенос больше, чем в условиях существования
только одного из градиентов. Если же grad С и grad Гразнонаправле-
ны (имеютразные знаки) n\At] grad С] « ]А)2 grad Г„ то —< 0,что
dt
I пава 2. Биофизика клеточных мембран
115
о'шачает перенос вещества вопреки действию градиента
концентрации. В таком случае под действием разности температур в двух частях
системы вещество будет перемещаться из области, где его
концентрация низка, в область высокой концентрации. Данное явление
называют термодиффузией. Оно, в частности, используется в атомной
промышленности - посредством термодиффузии разделяют изотопы,
например 235U и 238U. Это возможно потому, что коэффициенты А для
»ι их изотопов урана различны, причем система уравнений (2.7) позво-
ияст рассчитать те условия, при которых потоки легкого и тяжелого
ιпотопов направлены в противоположные стороны. Из уравнений
(2.7) видно, что термодиффузия всегда сопровождается переносом
1спла, т. е. диссипацией свободной энергии. Поэтому для
осуществления термодиффузии необходимы значительные затраты свободной
шсргии. В транспорте веществ через клеточные мембраны
термодиффузия отсутствует, поскольку grad Г на мембране равен нулю.
Другим примером может быть система, в которой существуют
как градиент концентрации, так и градиент осмотического давления.
Такой системой является живая клетка в солевом растворе. Можно
подобрать условия, при которых вода пойдет против осмотического
ι радиента благодаря термодинамическому сопряжению. Так, иногда
кистки в культурах тканей при помещении в раствор соли не отдают
иоду, как требует теория осмоса, а набухают за счет поступления в них
йоды из окружающего раствора, осмотическое давление которого
выше, чем в цитоплазме. На сильно засоленных почвах живут
своеобразные растения - солянки, в корни которых вода поступает вопреки дей-
IIнию градиента осмотического давления. Такие факты ставили
апологов в тупик: некоторые ученые-виталисты даже рассматривали
ич как доказательство существования особой «жизненной силы», не
подчиняющейся физическим законам. Использование теории термо-
нииамического сопряжения позволило дать всем этим явлениям как
•шчественное, так и количественное объяснение; понятие «жизненной
силы» оказалось, как и во всех прочих случаях, ненужным.
Транспорт веществ через клеточные мембраны также осущест-
нпястся благодаря термодинамическому сопряжению разнообразных
процессов. Только в тех случаях, когда молекулы транспортируемо-
ю вещества не имеют заряда, химически и осмотически инертны,
116
Биофизике
процесс массопередачи сводится к простой диффузии и подчиняется
уравнению Фика. Практически такими свойствами обладают в
организме только азот и инертные газы; очень приблизительно -
кислород и углекислый газ. Во всех остальных случаях (при транспорте
воды, солей, углеводов, жирных кислот, пептидов и других веществ)
вместе с градиентом концентрации действуют и другие. Например,
при транспорте многих ионов идут, по меньшей мере, два процесса:
диффузия вещества и перенос заряда, а значит, взаимодействуют
градиенты концентрации и электрического потенциала. В этом случае
система уравнений переноса записывается так:
— =ЛМ gradC +А]2 -gradt/,
\ * (2.8)
—-Л2| -gradC +А22 -gradt/.
I A
При активном транспорте ионов необходимо фосфорилирова-
ние переносчика за счет концевой фосфатной связи АТФ,
отщепляющейся при химической реакции гидролиза АТФ, активируемой
ферментом - транспортной АТФазой. В этом случае к вышесказанным
двум обобщенным силам добавляется третья - химический
потенциал (μχ), и система уравнений массопереноса приобретает вид:
ι — =Ап gradC +An -gradt/ +Λ13 μ,
' dt
\^1 =
A2] -gradC +A22 -gradC/ +A2i μχ, (2.9)
dt
— =A3i -gradC +A32 -gradt/ +An μχ.
. dt
Здесь обобщенными координатами являются масса
переносимых ионов, их заряд, число молей вещества, вступающего в
реакцию для энергетического обеспечения транспорта (обычно число
молей АТФ).
/ пава 2. Биофизика клеточных мембран
117
На самом деле число уравнений больше трех, так как одно-
ирсменно переносятся ионы разных веществ и к тому же механизмы
их транспорта взаимодействуют между собой. Написанная система
уравнений отображает перенос через биологические мембраны
иона одного сорта (например, иона натрия). Из системы уравнений
(2.9) следует, что скорость химической реакции определяется не
только химическими свойствами реагирующих веществ (их сродст-
но выражается величиной химического потенциала как обобщенной
силы), но также градиентами концентрации и электрического
потенциала. Конкретно при отщеплении фосфатной группы от АТФ
термодинамическое сопряжение происходит при участии фермента
ЛТФазы, активность которого изменяется в зависимости от
концентрации переносящих веществ, в частности ионов. Электрический
гок через мембрану клетки зависит не только от разности потенциа-
iioB на ней, но и от диффузионных и химических процессов,
протекающих в клетке. Поэтому мембрана нелинейна по своим
электрическим свойствам.
Величины коэффициентов Aik можно определить расчетным
путем или экспериментально. Тогда решение системы уравнений
(2.9) позволяет предсказать, как повлияет на исследуемый процесс
(например, на транспорт веществ через мембрану клетки) любое
изменение условий, в которых он протекает.
В заключение обратим внимание на то, что уравнения (2.6),
описывающие кинетику процессов, являются линейными, т. е. все
иеличины входят в них в первой степени. Оказывается, это
справедливо только для систем, не слишком далеких от равновесия. В живых
организмах такое условие далеко не всегда выполняется. Ранее уже
указывалось, что в клетках поддерживаются очень большие значения
градиентов; некоторые биохимические реакции протекают с высокой
екоростью - эти и многие другие процессы нельзя считать близкими
к равновесным. Поэтому для более успешного развития биофизики
приходится обращаться к нелинейной термодинамике, в уравнениях
которой учтены не только члены первой степени. В работах
последних лет показано, что нелинейная термодинамика может объяснить
ряд явлений, специфичных для живых организмов.
118
Биофизика
2.2.3. Сопряженный массоперенос заряженных частиц
[ионов) через биологическую мембрану
Как уже говорилось, при транспорте ионов через
плазматическую мембрану имеет место термодинамическое сопряжение
градиентов grad С и grad U:
— = Ап -gradC + А]2 -gradU,
у dt
— =A2l gradC +A22 gradt/.
Здесь An=AD = Ds, A22 =АЭ= s, An =A2i = = и CzFs,
л · Τ
где D - коэффициент диффузии [м2-с_|], - удельная
электропроводность [См · м-1], и = подвижность [м2 · моль · Дж~' · с-1], С - мо-
л · Τ
лярная концентрация переносимого вещества [моль · м~3], F - число
Фарадея (заряд 1 моля одновалентного иона), F = 9,65 · 104 Кл · моль-1,
ζ - валентность, s - площадь поверхности массопереноса [м2].
Решая систему уравнений (2.8), приходим к следующему
выражению:
— = -£>gradC-MCzFgradC/. (2.10)
dt
В этом уравнении поток вещества; знаки «минус» в пра-
dt
вой части отражают то обстоятельство, что масса вещества при его
транспорте убывает там, где она больше.
Перейдем от потока вещества к плотности потока вещества:
τ dm 1 г τ π ъ
I = [моль · м'1 ■ с-1 ]. Эту величину называют также интенсивно-
dt s
стью массопереноса:
7 = -£>gradC-MCzFgradt/. (2.11)
/ пива 2. Биофизика клеточных мембран
119
Электродиффузионное уравнение Нернста-Планка (2.11) по-
шоляет рассчитать интенсивность массопереноса в однородных (гомо-
юиных) средах (например, в растворах). Присутствие биологических
мембран между растворами (в частности, между цитозолем и интер-
сгицием) искажает результаты таких расчетов, поскольку по
физико-химическим свойствам мембраны отличаются от водных растворов
(чшей. Для учета поправок на эту неоднородность введено понятие
проницаемости биомембраны.
2.2.4. Проницаемость клеточных мембран
Проницаемостью биологической мембраны называют ее
способность пропускать сквозь себя определенные вещества в той или
иной степени.
Расчет мембранной проницаемости, точнее коэффициента
проницаемости (р), проводят по формуле: ρ = , где Ь - толщина
Ъ
(шомембраны, D - коэффициент диффузии, β - коэффициент распре-
щдсния того или иного вещества между водой и липидом: β = е кТ ,
ι де AW - разность энергий, которыми обладает частица (молекула)
шитого вещества в воде и липиде.
У ионов эта энергия находится в сильной зависимости от диэ-
пскфической проницаемости (ε) сред, в которых они присутствуют-
ι |»сда с большей ε сильнее взаимодействует с ионами: W = fle). В по-
I юяином электрическом поле ε и 0 =81,аглипнлов =2-3.
Следовательно, разность энергий ( W), которыми обладает молекула данного
вещества в воде и липиде, тем больше, чем больше разница
дтлектрической проницаемости (Δε) воды и липида. А поскольку
W в формуле входит в показатель степени при основании
натуральных логарифмов, то Δε на β влияет очень сильно.
Электрическую энергию, которую нужно преодолеть для
переноса 1 иона из интерстиция в бимолекулярный липидный каркас
Ппомсмбраны, рассчитывают по формуле Борна:
120
Биофизика
AW= z e (ε~] -ε"1 ϊ
? l· Т\ липидо" a 1.0)
где ζ - валентность иона, е - заряд электрона, г - радиус иона, к =
= 1,38 · 10~23 Дж · К-1 (постоянная Больцмана), Т- абсолютная
температура.
Расчет свидетельствует, что для переноса через биомембрану
одновалентного иона, имеющего радиус 0,2 нм, необходимо затратить
энергию (AJF), равную 70 · кТ, чему соответствует β = 10~20. Это
означает, что переход ионов и других гидрофильных веществ через липид-
ный мембранный каркас невозможен. У гидрофобных веществ β на
много порядков больше, и они растворяются в мембранных липидах.
Поэтому механизмы переноса гидрофильных и гидрофобных
веществ через биологические мембраны различаются коренным
образом.
2.2.5. Транспорт липофильных веществ
через биологические мембраны
В 1895 г. Э. Овертон установил, что вещества тем легче
проникают в клетку, чем выше их растворимость в липидах, а она высока у
неполярных агентов. Липофильные соединения проходят через БМ,
растворяясь в ее липидах и двигаясь по законам диффузии в вязкой среде.
Такой транспорт зависит от величины и формы проникающих
молекул, а также от вязкости мембраны. Естественно, что скорость
трансмембранного переноса жирорастворимых веществ сильно зависит от
температуры. Определив зависимость мембранной проницаемости для
тех или иных агентов от температуры (рис. 2.15), находят энергию
активации (Wa) транспорта их через БМ. Оказалось, что величины Wa
для этиленгликоля (60 кДж · моль-1), глицерина (77 кДж · моль-1),
эритрита (87 кДж · моль-1) близко совпадают с энергией
дегидратации этих спиртов. По-видимому, прежде чем войти в липидный слой
мембраны, молекулы неэлектролитов подвергаются дегидратации.
Только после освобождения от водной оболочки они внедряются
в жидкокристаллическую структуру БМ и диффундируют в ней.
Глава 2. Биофизика клеточных мембран
121
igPii
1 »-
1/Т
Рис. 2/5. Зависимость проницаемости биомембраны
от обратной температуры.
По оси абсцисс - величина, обратная абсолютной
температуре; по оси ординат -логарифм проницаемости
Интересно, что транспорт глицерина через плазмолемму
эритроцитов человека и крысы отличается высокой скоростью и гораздо бо-
исс низкой Wa по сравнению с энергией дегидратации. По-видимому,
|дссь нет нужды в предварительной дегидратации и, следовательно,
ι лицерин не диффундирует сквозь липидный бислой эритроцитарных
мембран человека и крысы. Вероятно, в них присутствуют
специальные переносчики глицерина. Любопытно, что их, очевидно, нет даже в
ι толь близких мембранных системах, как плазмолемма эритроцитов
еппиьи, овцы, коровы. У этих животных экспериментальные значения
\\\, фанспорта глицерина через эритроцитарные мембраны соответст-
nyior энергии его дегидратации.
Вспомним, что молекулярные компоненты клеточной
мембраны непрерывно перемещаются в пределах своего слоя (латеральная
диффузия), задерживаясь на одном месте около 10~7 с. Поэтому
существуют мгновения, когда освободившееся место оказывается еще
ικ· шнятым соседними молекулами мембраны. Этот процесс анало-
i пчен возникновению «вакансий» в кристаллической решетке.
Однако и жидких кристаллах вероятность образования вакансий на не-
i колько порядков выше, чем в твердых.
Молекулы неэлектролитов могут занять под действием
физики химических градиентов возникшую на миг вакансию в липидном
ι нос БМ. Разумеется, такое вторжение в ее жидкокристаллическую
122
Биофизика
структуру возможно только в том случае, если диффундирующая
молекула по геометрическим параметрам укладывается в размеры
вакантного места (ячейки). Если же калибр проникающих молекул
приходится на диапазон от одного до двух диаметров ячейки, то для
продвижения на 1 шаг такая молекула должна выждать момент,
когда одновременно станут свободными две соседние ячейки, смежные
с тем местом, где она находится. Подобное событие совершается
значительно реже, чем образование одиночной вакансии, но в жидком
кристалле оно вероятно. Еще меньшую, но реальную вероятность
имеет одномоментное возникновение трех смежных вакансий по
соседству с местонахождением диффундирующей молекулы, размеры
которой втрое больше диаметра одиночной ячейки.
Следовательно, чем крупнее частицы проникающего через
мембрану вещества, тем меньше вероятность его проникновения
сквозь нее (при одинаковых прочих условиях). Это отражается на
скорости трансмембранного переноса веществ: крупные молекулы
дольше ждут того момента, когда смогут продвинуться на один шаг,
и поэтому проходят БМ медленнее. У низкомолекулярных
неэлектролитов скорость мембранного транспорта обратно
пропорциональна квадратному корню, а у высокомолекулярных - кубическому
корню из молекулярной массы. Показателем скорости перемещения
веществ через БМ служит коэффициент диффузии (D). Поэтому
указанные зависимости проницаемости от молекулярной массы (А/)
обычно выражают так: для мелких молекул (от водорода до трисаха-
ι_ ι
ридов): DM2 = const, а для более крупных молекул DM3 = const.
Частицы диффундирующего вещества перемещаются в БМ не
непрерывно, а дискретно - скачками (от одного вакантного места к
другому, выжидая его образование), в силу чего изложенная схема
транспортного процесса получила название гипотезы скачков. Она
основана на положениях статистической физики. В зарубежной
литературе эта схема фигурирует под названием гипотезы кинков.
Кинками называют лабильные (временно существующие) и не»
прерывно перемещающиеся структурные дефекты в углеводородной |
части БМ. Ими определяется наличие в мембране свободных
объемов (вакансий, временных дырок). Согласно гипотезе кинков, в Tat
/ пава 2. Биофизика клеточных мембран
123
кую вакансию могут встраиваться мелкие молекулы неэлектролитов
(и том числе ассоциаты воды) и мигрировать вместе с нею. Поэтому
о кинках говорят как о «кинетических каналах» мембраны.
Коэффициент диффузии кинков вместе с захваченными ими молекулами
проникающего вещества довольно высок - до 10~9 м2 с-1. Следовате-
11ЫЮ, кинки обеспечивают быструю диффузию.
Между гипотезами скачков и кинков (в их классических
вариантах) все же есть небольшие различия в деталях (например, относите-
iiMio возможности транспорта воды), но в принципиальных
положениях они сходны и объясняют механизм трансмембранного переноса
жирорастворимых соединений.
2.2.6. Транспорт гидрофильных веществ
через биологические мембраны
Гидрофильные вещества не способны перейти из водного рас-
imipa (интерстиция или цитозоля) в липидный каркас клеточной
мембраны. Для трансмембранного переноса у них есть две
возможности:
1) одеться в гидрофобный «чехол» и в таком виде раствориться
и лппидной фазе мембраны (наподобие транспорта ионов калия вали-
иомицином) - так происходит транспорт гидрофильных веществ при
помощи переносчиков;
2) пройти через такие места в биомембране, где ε велика; заме-
1им, что такую же величину, как в интерстиции и в цитозоле, ε имеет
и сквозных порах, заполненных водой, т. е. в мембранных каналах -
hi к происходит транспорт гидрофильных веществ по каналам в
биомембране.
2.2.6.1. Транспорт с участием переносчиков
Транспорт многих гидрофильных веществ (моносахаридов,
аминокислот, некоторых ионов и др.) обеспечивают подвижные
переносчики. В 1971 г. группа американских ученых обнаружила в БМ пептид,
имеющий циклическую структуру (наподобие валиномицина) и
οποί о(шый селективно переносить ионы. Эта находка не подтвердилась, но
поиск подобных мембранных переносчиков продолжается. Интерес
124
Биофизика
к циклическим полипептидам подогревается тем, что макроцикличе-
ские антибиотики способны встраиваться не только в искусственные,
но и в клеточные мембраны, изменяя их ионную проницаемость. Так,
при добавлении валиномицина к суспензии эритроцитов наблюдается
утечка ионов К+ из клеток. Кроме того, валиномицин вызывает приток
К+ внутрь изолированных митохондрий.
Преимущества транспорта гидрофильных веществ при
помощи переносчиков по сравнению со свободной диффузией через ли-
пидный бислой клеточной мембраны иллюстрирует перенос
глюкозы из плазмы крови в эритроцит. У глюкозы пять гидроксильных
групп, способных образовывать водородные связи. Теоретически Wa
переноса глюкозы из водного раствора в гидрофобную область БМ
должна составлять около 80 кДж · моль-1. В эксперименте Wa
транспорта глюкозы через эритроцитарную мембрану составляет всего
16 кДж · моль-1. Облегчение трансмембранного переноса
обусловлено тем, что глюкоза преодолевает плазмолемму не путем свободной
диффузии через липидный бислой, а при помощи переносчика.
Поэтому движение глюкозы сквозь мембрану эритроцита происходит
примерно в 10 тысяч раз быстрее, чем можно было ожидать при ее
свободной диффузии в мембранных липидах.
Из эритроцитов человека выделен специфический переносчик
глюкозы, оказавшийся интегральным белком плазмолеммы.
Искусственные липидные мембраны, в которые его встраивают, приобретают
селективную проницаемость, свойственную клеточным мембранам
человека и животных: через них с большой скоростью переносится
только D-глюкоза, тогда как L-глюкоза практически не проникает.
В плазматической мембране бактериальной клетки - кишечной
палочки (Е. coli) обнаружено несколько десятков транспортных
белков, каждый из которых переносит определенное вещество, причем
для каждого из Сахаров есть специфический переносчик.
По-видимому, переносчики в БМ могут работать, используя
разные способы перемещения (миграционный, ротационный,
сдвиговый и т. д.). Представляя себе миграцию переносчика в клеточной
мембране, полезно вспомнить гипотезу о механизме валиномицино-
вого транспорта в искусственной мембране. Среди мигрирующих
переносчиков можно выделить две разновидности. Одни транспортеры
I пава 2. Биофизика клеточных мембран
125
мигрируют внутри мембраны, взаимодействуя с переносимым
веществом только на ее поверхностях. Этот механизм транспорта
называют малой каруселью. Другие мигрирующие переносчики способны
покидать биомембрану и выходить в примембранное пространство
и поисках транспортируемого агента. Поиск направляется действием
>лектростатических сил и химическим взаимодействием. Вместе с
переносимым веществом транспортер второго типа возвращается в БМ,
проходит ее насквозь, выходит в противоположное примембранное
пространство и оставляет там свой «багаж». В этом случае говорят
0 большой карусели. Тип «карусели» зависит от поверхностноактив-
пых свойств и растворимости самого переносчика. По механизму
малой карусели работают транспортеры, плохо растворяющиеся в воде
и являющиеся поверхностноактивными веществами.
Миграционный механизм присущ переносчикам, размеры
которых меньше, чем толщина БМ (рис. 2.16, а). Вместе с тем
транспортерами могут служить крупные белковые молекулы и их комп-
иексы, прободающие насквозь липидный бислой. Они переносят
пещества через БМ посредством ротации или сдвига на расстояние,
равное толщине мембраны.
Ротационный механизм (рис. 2.16, б) заключается в перевороте
крупной молекулы переносчика вокруг оси, лежащей в плоскости
мембраны, в результате чего транспортируемое вещество,
посаженное на один конец такой молекулы, оказывается на
противоположной стороне БМ. Ротационный перенос требует значительных затрат
шергии и может оказаться эффективным только в том случае, если
1 молекула переносчика транспортирует одномоментно (за один
попорот) много молекул переносимого вещества.
Более выгодным в энергетическом отношении является меха-
похимический процесс в молекуле переносчика, заключающийся не
и полном ее перевороте, а в сдвиге отдельных областей относительно
неподвижной части, причем вместе с участком переносчика,
уходящим с поверхности в глубь мембраны, в нее погружается и транспор-
шруемое вещество (рис. 2.16, в). Это напоминает движение ленты
финспортера.
По-видимому, в разных БМ и при транспорте различных
веществ работают разнообразные переносчики: одни мигрируют сквозь
126 Биофизика
а)
■·■··: Π .'.··.·'
О
~Ыщ
о
ш -ΐ^γ·-—
Рис. 2.76. Схема работы мембранных переносчиков разных типов
а - миграция; б -ротация; в - сдвиг. Обозначения: S - переносимое вещество
до переноса, S'- переносимое вещество после переноса; Π - переносчик;
Л-липидные компоненты мембраны; I- состояние до начала переноса;
II- процесс переноса; III - состояние после переноса
мембрану, другие - переворачиваются, третьи - претерпевают кон-
формационные перестройки со сдвигом активных, т. е.
взаимодействующих с транспортируемым веществом групп относительно
неподвижных. Очевидно, перечислены не все механизмы работы
мембранных переносчиков. Будущие исследования откроют еще
неизвестные. Перспективным направлением в изучении этой проблемы
является выяснение «машинных» свойств белковой молекулы (Блю-
менфельд Л. Α., 1977).
Изучая молекулярные машины живой клетки, Л.А. Блюмен-
фельд стремился учесть не только статистические, но и механические
принципы работы биологических молекул. Характерной особенно-
6)
в)
ι ппво 2. Биофизика клеточных мембран
127
111.ю белков является существование кинетической неравновесности
ни уровне вторичной и третичной структур, в силу чего многие
химические реакции, в которые вступают белковые молекулы, сопровож-
цшотся конформационными перестройками (изменениями
геометрической формы молекулы за счет свободного вращения отдельных ее
фрагментов относительно простых углерод-углеродных связей).
Такие изменения вторичной и третичной структур белковой молекулы
приводят к изменению ее пространственных координат, т. е. к
механическому перемещению. Молекула переносчика, вступив в реакцию
ι фанспортируемым веществом и посадив его на себя, испытывает
«информационные превращения, выражением чего может быть тот
пип иной механизм перемещения ее в биомембране. Конкретные
примеры работы мембранных переносчиков приведены в 2.3.
2.2.6.2. Транспорт по мембранным каналам
Гипотеза о существовании в живых тканях пор, заполненных
нодой, по которым осуществляется массоперенос, была сформулиро-
инна Брюкке в 1842 г. при исследовании транспорта воды через
стенку мочевого пузыря. Однако только через столетие - во второй поло-
iiiiне XX века гипотеза Брюкке стала общепринятой концепцией,
чему способствовали работы Ходжкина и Хаксли (1952), Девсона
н Даниелли (1955) и исследования свойств грамицидинового канала,
исфоенного в искусственный липидный бислой (Хладни, Хайдон,
Ι·>70, 1972).
Согласно современной концепции, мембранный канал пред-
е ι авляет собой интегральный белок (белковый комплекс) или глико-
протеид, встроенный в липидный бимолекулярный каркас мембраны,
пронизывающий ее насквозь и обеспечивающий перенос веществ че-
реч нее в сторону более низкого электрохимического потенциала.
I h оричная структура компонентов мембранного белкового комплек-
πι имеет характер β-складчатости с цилиндрической порой внутри,
заполненной водой. Коэффициент проницаемости ионных каналов
составляет Ю-8—10-9 м · с-1, что на 5-6 порядков меньше скорости
переноса ионов при свободной диффузии в водной среде. Замедление
обусловлено тем, что движение иона по каналу представляет собой
128
Биофизика
последовательное замещение молекул воды гидратной оболочки ионп
на полярные группы, выстилающие полость канала.
Хилле в 1977-1984 гг. предложил функциональную модел1.
ионного канала, согласно которой в нем имеются два основных ком
понента: селективный фильтр и воротный механизм. Первый имеем
жесткую структуру, т. е. в этой части белковый комплекс,
образующий канал, не может изменять размеры поры внутри него и регули
ровать проницаемость мембраны. Функция селективного фильтра
пропускать через канал определенное вещество или группу сходных
с ним веществ, т. е. отбирать их из других.
Регулирование мембранной проницаемости обеспечивается
так называемыми воротными процессами. Они осуществляются «во
ротами канала», которые представляют собой части белкового коми
лекса, способные «раскручиваться» и «скручиваться» в ходе их меха
но-химических реакций и благодаря этому создавать просвет внутри
белкового комплекса или перекрывать его (сжимать или восстанан
ливать пору).
Профиль просвета имеет размер, соизмеримый с размером про
пускаемого вещества (десятые доли нанометра). Поэтому движение
веществ по каналу однорядное и, следовательно, канал может пребы
вать только в одном из двух противоположных состояний: закрытом
или полностью открытом, при котором достигается максимальная
скорость транспорта. Например, скорость движения натрия и каль
ция через соответствующие потенциалзависимые каналы составляем
107 ионов в секунду и не может быть меньшей или большей. Канал
либо совсем не пропускает вещества (в закрытом состоянии ворог),
либо пропускает их с определенной скоростью. Приведенная выше
скорость ионного транспорта обеспечивает электропроводность оди
ночного канала, равную примерно 40 пСм.
Из сказанного следует, что проницаемость мембраны для дан
ного вещества определяется не степенью раскрытия одной поры (оип
либо сжата, либо полность раскрыта), а числом открытых каналов и
даный момент. Поэтому мембранную проницаемость (р) при переио
л. π2£>
се веществ по каналам рассчитывают по формуле: ρ = η , где η
число открытых каналов на единице поверхности мембраны, г - ри
' /мяя 2. Биофизика клеточных мембран
129
циус канала, D - коэффициент диффузии вещества в воде, / - длина
tun шла (примерно равна толщине мембраны).
Переход канала из закрытого состояния в открытое и обратно
осуществляется под действием определенных стимулов. Если таким
11 имулом служит сдвиг мембранного потенциала, то канал относится к
ι руппе потенциалзависимых ионных каналов. В них важным компонен-
iiiM поротного механизма является сенсор напряжения, образованный
полипными зарядами, которыми обладают аминокислотные остатки
Пенкового комплекса, составляющего канал. Например, в потенциалза-
шк'пмом натриевом канале сенсор напряжения, как полагают, образо-
М1Ш катионными аминокислотными остатками (гистидилом, лизилом,
Н|)| И11ИЛОМ).
Вторую группу каналов составляют потенциалнезависимые ка-
тпы. Они управляются не сдвигами мембранного потенциала, а стиму-
ιιιιμιι других модальностей: химическими, механическими, световыми
н др. Потенциалнезависимые каналы обычно функционируют во
взаимодействии с мембранными рецепторами, воспринимающими соответ-
11 иующие стимулы. Посредниками между рецепторами и каналами
тужат, как правило, внутриклеточные сигнальные системы.
Подразделение всех каналов на эти две группы - не единствен-
ιιιιη их классификация. Существуют классификации и по другим при-
HliiKiiM, но приведенная классификация очень актуальна, поскольку
ι функционированием потенциалзависимых ионных каналов связано
инжпейшее свойство живых тканей - возбудимость.
Кинетика и энергетическое обеспечение трансмембранного
переноса гидрофильных веществ через каналы и посредством
переносчиков существенно различны. Так, скорость транспорта ионов
по каналам, как уже говорилось, составляет 107 ионов в секунду,
и посредством переносчиков - 104 ионов · с-1, т. е. в тысячу раз
меньше. Потенциальный барьер канального массопереноса менее
I \ кДж · моль-1, а транспорта с участием переносчика - более
Λ 7 кДж · моль-1. Коэффициент Вант-Гоффа (β,0), равный
соотношению скоростей процесса при температурах, отличающихся на 10 °С
ν
Urn с г+1° > ПРИ движении веществ по каналам составляет чуть
vr /
130
Биофизика
больше единицы, тогда как переносчик обеспечивает транспорт
с Ql0 более 2.
По каналам мембрану преодолевают главным образом ионы,
а переносчики транспортируют как ионы, так и моносахариды,
и аминокислоты. Нередко переносчики образуют тройные
комплексы: с моносахаридом и ионом натрия или с аминокислотой и ионом
натрия.
Подытоживая сложившиеся взгляды на механизмы
транспорта веществ через клеточные мембраны, нельзя не отметить
единодушного мнения о разнообразии транспортных процессов:
диффузия сквозь липидный бислой, движение по мембранным
каналам, перемещение в комплексе с переносчиком. Очевидно,
перечисленные механизмы не исчерпывают гетерогенности мембранного
транспорта, тем более что в пределах каждого из них существует
большое разнообразие конкретных способов реализации общего
принципа. Многие вещества могут транспортироваться разными
способами (например, для ионов натрия есть и переносчики, и
каналы, работающие одновременно и согласованно). Многообразие
вариантов переноса является основой селективной (избирательной)
проницаемости разных БМ по отношению к тем или иным
веществам. Она зависит от того, какие механизмы и в какой степени
сформированы в данной мембране. Так, в одних БМ нет переносчиков
моносахаридов, а в других они есть, причем в разных мембранах
в неодинаковых количествах; в одних БМ присутствуют только по-
тенциалнезависимые ионные каналы, а в других - как потенциалне-
зависимые, так и потенциалзависимые. Подобным примерам нет
конца. С некоторыми из них читатель встретится на последующих
страницах пособия.
В целом при пассивном транспорте селективность БМ
определяется коэффициентом распределения вещества между липидом
и водой, а в еще большей степени - избирательностью каналов и
переносчиков по отношению к определенным агентам. Вместе с тем
избирательная проницаемость клеточных мембран тесно связана с
работой так называемых биологических насосов, которым посвящен
следующий раздел.
ι imnn 2. Биофизика клеточных мембран
131
2.3. Биологические насосы
Термин «биологические насосы» живет в биологической
литера ι уре с прошлого века. Он появился еще до возникновения взгляда
ми биомембрану как на важнейший функциональный компонент
мички. Смысл этого термина неоднократно изменялся. Вначале под
апологическими насосами понимали какие-то неизвестные
механизмы, которые обеспечивают массоперенос в организме вопреки
элементарным законам физики и химии.
В середине прошлого века после блистательных успехов
физики химического изучения жизнедеятельности появились факты, сви-
цс гсльствующие о том, что всасывание веществ в пищеварительном
фикте, мочеобразование и лимфоотделение только отчасти сводятся
h процессам фильтрации и диффузии. Это установил Р. Гейденгайн,
подвергший критике механистические представления своих предше-
• ι пенников. «Такая критика Гейденгайна как выдающегося предста-
ΐιιι геля науки, - писал И.П. Павлов, гордившийся тем, что был его
учеником, - дала повод некоторым людям с метафизическими
Halt иопностями утверждать неприложимость физико-химической точки
•рения к анализу жизненных явлений и необходимость обратиться
при изучении жизни к особенному, жизненному духовному началу».
11рсдставления Р. Гейденгайна о физико-химической природе жизне-
ui· нгельности в силу их диалектического характера были глубже, чем
■мшьшинства его современников.
Позднее ученые разобрались во многих недоразумениях
примитивного приложения законов физики и химии к объяснению
явлений жизни. Однако термин «биологические насосы» продолжает
*нгь в биологии. В последние годы с ними зачастую отождествляют
шитые насосы - системы активного транспорта Na+, K+, Са2+, Н+
иттрий-калиевую, кальциевую, протонную помпы).
2.3.1. Активный транспорт [общие положения)
Активным транспортом называют трансмембранный
перенос веществ в направлении, противоположном транспорту,
который должен был бы происходить под действием физико-химических
ι рндиентов (прежде всего концентрационного и электрического). Он
132
Биофизика
направлен в сторону более высокого электрохимического
потенциала и необходим как для накопления в клетках (или определенных
органоидах) веществ, в которых они нуждаются, даже из среды с их
низкой концентрацией, так и для выведения из клеток (органоидов)
тех агентов, содержание которых там должно поддерживаться на
низком уровне, даже при повышении его в окружающей среде.
Свойства систем активного транспорта. Из определения
активного транспорта следует, что его важнейшим свойством является
перенос веществ вопреки действию физико-химических градиентов
(вопреки электродиффузионному уравнению Нернста-Планка), т. е.
в сторону более высокого электрохимического потенциала благодаря
термодинамическому сопряжению концентрационного и
электрического градиентов с расходованием свободной энергии организма.
Поэтому система уравнений переноса выглядит так:
1-^=4, grade +Al2gradU +Αι3μχ,
at
\-^- = A2l -grade+ЛИ-grad£/+ΛΜ·μ,,
at
— =Λ3Ι grade +An -gradt/+Λ33 -μ,.
.at
Химический потенциал (μ,) количественно характеризуем
вклад ферментативных реакций в свободную энергию биомембраны,
необходимую для преодоления сопряженного действия
концентрационного и электрического градиентов. Если изменения свободной
энергии клетки, обеспечивающие активный транспорт через
мембрану, обусловлены макроэргами (АТФ), то в этих уравнениях: ν -
число молей АТФ, затраченных на массоперенос, а μ, равен приросту
свободной энергии клетки при гидролизе 1 моля АТФ (в
стандартных условиях это составляет 31,4 кДж · моль-1).
Сказанное позволяет сформулировать второе характерное
свойство систем активного транспорта - необходимость
энергетического обеспечения за счет свободной энергии, выделяющейся либо
непосредственно в ходе окислительно-восстановительных реакций
> immi 2. Биофизика клеточных мембран
133
(|ΐι··ιι> идет о так называемой редокс-помпе), либо при гидролизе мак-
ршргов, синтезированных впрок при тех же реакциях. Необходимо
подчеркнуть, что свободная энергия, обеспечивающая активный
(рннспорт, черпается биомембранами в ходе химических процессов,
• шгшпных непосредственно с переносом веществ через них, т. е. из
химических реакций, в которых участвуют сами мембранные компо-
■11-11 ты систем активного транспорта. В этом состоит коренное отличие
ни ι iiBHoro транспорта от других способов транспорта веществ через
ΙιΜ, также нуждающихся в затратах свободной энергии. Оно станет
понятнее после рассмотрения облегченной диффузии (см. 2.3.4).
Свободная энергия (AG), затрачиваемая на трансмембранный
перенос одного моля вещества в направлении более высокого
электрохимического потенциала, рассчитывается по формуле:
AG =R ■ Τ- ln^-L-,где С, > С2.
С2
У человека в покое примерно 30-40% всей энергии,
образующейся в ходе метаболических процессов, расходуется на активный
ι рннспорт. В некоторых случаях на его обеспечение может затрачи-
1ии1.ся почти вся свободная энергия, вырабатываемая клеткой.
Ткани, в которых активный транспорт особенно интенсивен, потребляют
много кислорода даже в покое. Например, масса мозга человека со-
I пшляет только 1/50 массы тела, но в условиях мышечного покоя
ik л ни мозга поглощают около 1/5 всего кислорода, усвоенного орга-
шпмом. Общая мощность всех ионных насосов человеческого мозга
примерно 1 Вт. Почки при угнетении в них активного транспорта
попов снижают свою потребность в кислороде на 70-80%.
Третье свойство систем активного транспорта заключается
и их специфичности: каждая из них обеспечивает перенос через БМ
тлько данного вещества (или группы их) и не переносит другие.
11равда, активный транспорт ионов натрия бывает сопряжен с
пассивным переносом в том же направлении других веществ (например
ι шокозы, некоторых аминокислот и т. д.). Это явление называют сим-
ниртом. Некоторые системы активного транспорта переносят одно
ипцество в данном направлении, а другое - в противоположном. Так,
134
Биофизика
калий-натриевая помпа закачивает калий из межклеточной среды в
цитоплазму и откачивает натрий из клетки. Такой вид транспорта
называют антипортом.
Когда эти ионы начинают перемещаться через БМ в
направлении более низкого электрохимического потенциала, то
натрий-калиевая помпа становится генератором АТФ. Это явление получило
название эффекта обращения систем активного транспорта: на
перекачивание ионов в сторону более высокого электрохимического
потенциала насосы затрачивают свободную энергию, гидролизуя
АТФ, тогда как при движении ионов в противоположном направлении
они преобразуют энергию градиентов в энергию макроэргической
связи АТФ, синтезируя его из АДФ. Специфичность систем активного
транспорта служит одним из самых действенных механизмов
селективной проницаемости клеточных мембран и придания им векторных
свойств.
Компоненты систем активного транспорта. В составе
любой системы активного транспорта веществ через БМ можно
выделить три основных компонента: источник свободной энергии,
переносчик данного вещества, сопрягающий (регуляторный) фактор.
Последний сопрягает работу переносчика с источником энергии. Вес
компоненты систем активного транспорта образуют сложный
молекулярный комплекс в клеточной мембране.
В большинстве известных систем активного транспорта
непосредственным источником свободной энергии служит АТФ. За счет
присоединения его концевой фосфатной группы, предварительно
оторванной при гидролизе, к мембранному переносчику последний фосфо-
рилируется и приобретает дополнительную энергию, достаточную для
преодоления физико-химических градиентов, препятствующих дви-
жеию переносимого вещества. Следовательно, фосфорилированный
комплекс переносчика с транспортируемым веществом способен
преодолеть потенциальный барьер, неприступный для него до фосфорили-
рования. Отдавая перенесенное вещество на противоположной стороне
БМ, молекулы переносчика дефосфорилируются и теряют энергию.
Реже свободная энергия черпается системами активного
транспорта непосредственно из окислительно-восстановительных реакций,
I пива 2. Биофизика клеточных мембран
135
ι сиз цепи переноса электронов. Систему активного транспорта с
таким источником энергии называют редокс-помпой. Примером может
ι нужить перенос Н+-ионов через внутреннюю мембрану
митохондрии, обеспечивающий создание протондвижущей силы, при
клеточном дыхании.
О переносчиках, обеспечивающих активный транспорт, известно
пока немногое. По-видимому, в разных системах активного транспорта
рнбота переносчиков осуществляется посредством различных
механизмов. Во-первых, переносчиками могут быть сравнительно мелкие
белковые молекулы, присутствующие в БМ. В этом случае молекула
переносчика, приняв транспортируемое вещество, проходит всю толщу
(нюмембраны, работая по типу малой или большой карусели.
Во-вторых, переносчиками могут служить крупные молекулы мембранных
полков, насквозь пронизывающие фосфолипидный бислой. Им,
вероятно, свойственны такие механизмы, как ротация или сдвиг.
Третий компонент системы активного транспорта обеспечивает
сопряжение работы переносчика с источником энергии. Такое
сопряжение может заключаться в переносе фосфатной группы с АТФ на
ιΐι-реносчик. Чтобы фосфорилировать переносчик, нужно прежде
ι пдролизовать АТФ. Гидролиз АТФ достаточно эффективен только
ι» присутствии специальных ферментов, называемых АТФазами.
()ии-то и служат фактором, сопрягающим работу переносчика с
источником энергии в основных системах активного транспорта (натрий-ка-
ипсвой и кальциевой помпах). Название этой ферментной системы
употреблено во множественном числе не случайно. Для активного
фаиспорта каждого вещества в тех случаях, когда источником энер-
1 nil является АТФ, обнаружена специфическая АТФаза. Каждая из
ι рлпепортных АТФаз активируется именно тем веществом, чей
активный транспорт она обеспечивает. Например, Са-активируемая АТФа-
III переходит в активное состояние только тогда, когда концентрация
( и2' в примембранном пространстве достигает определенного уровня,
при котором необходим активный транспорт этого иона.
Все транспортные АТФазы связаны с клеточными мембранами
и проявляют высокую специфичность, катализируя реакции, течение
которых строго зависит от направления подхода κ БМ транспортиру-
гмых веществ. Так, Na-K-активируемая АТФаза приобретает актив-
136
Биофизика
ность при взаимодействии с нею натрия внутри клетки, а калия -
снаружи. Она не активируется при самых значительных концентрациях
натрия в межклеточной среде и калия - в цитозоле.
Зависимость потока (Ф) переносимого вещества через
клеточную мембрану от его концентраций по обе ее стороны (С, и Се) при
участии транспортной АТФазы описывается уравнением:
^ С, -р
ф-—ά—L·
f С, С ^
kl+C, ke+Ce,
где СА - концентрация АТФазы в
биомембране, ρ - проницаемость мембраны для комплекса
«переносимое вещество - фермент», ki ике- константы диссоциации этого
комплекса на внутренней и наружной поверхностях БМ.
В клеточной мембране постоянно присутствуют и переносчики,
и транспортные АТФазы, в примембранном пространстве клетки
находится АТФ, выходящий из митохондрии, - и все они подтягиваются
к местам -активного транспорта. Однако вся система не работает до
появления определенного стимула, которым обычно служит нарастание
концентрации вещества, подлежащего активному транспорту. Это
вещество активирует специфическую АТФазу, которая, в свою очередь,
катализирует гидролиз АТФ с отщеплением концевой фосфатной
группы. Присоединяясь к переносчику, она фосфорилирует его. При фосфо-
рилировании переносчик приобретает дополнительную свободную
энергию, необходимую и достаточную для трансмембранного переноса
вещества вопреки действию физико-химических градиентов.
Так, внутри клетки повышение содержания Na+ выше
определенного уровня активирует Na-K-активируемую АТФазу, а она -
реакцию гидролиза АТФ:
Να-
Ι
Να-К-активируемая АТФаэа
АТФ + Н20 l ^>АДФ+Н3Р04.
2.3.2. Системы активного транспорта
Системы активного транспорта ионов (ионные насосы, ионные
помпы) обеспечивают неравновесное распределение этих агентов
между клеткой и межклеточной средой, а также среди различных органои-
ι пит) 2. Биофизика клеточных мембран
137
nthi. Постоянство ионного состава (изоиония) цитозоля и содержимого
органоидов является необходимым условием поддержания жизни.
Ι Ιπιιι,ι входят в состав всех биологически важных молекул, регулируют
проективность обмена веществ. Все превращения энергии, включая об-
|игювание и использование макроэргов, контролируются ионами. В ор-
I ниизме они составляют сложные тонко сбалансированные внутрикле-
шчную и внеклеточную ионные системы. Малейшее их нарушение
игичбежно приводит к нарушению жизнедеятельности. Например, весь
к ниточный метаболизм чрезвычайно чувствителен к изменению
содержания Na+ в цитозоле. При его повышении угнетается синтез белка
и усиливается образование липидов. При сохранении высокой концент-
риции Na+ в цитозоле в течение длительного времени синтез белка
такте усиливается. Следовательно, ионы натрия выступают в роли регуля-
I ира метаболической активности клетки. Подобная функция присуща и
другим ионам (табл. 2.4).
Таблица 2.4
Содержание ионов в иитерстиции и цитозоле.
Клеточные
структуры
Кирдиомиоциты
млекопитающих
Аксон кальмара
Ионы
Na+
К+
Са2+
ci-
Na+
К+
Концентрации ионов, мм о ль· л"1
В интерстиции
145
4
2
120
450
20
В цитозоле
15
150
10-4 - в покое
10"2 - 10"1 - при сокраще! 1ии
6
50
400
Изменения содержания в цитозоле водорода, калия, кальция,
магния и других катионов сигнализируют ее метаболическим
системам о малейших нарушениях клеточной целостности, которая
достигается относительной обособленностью химического состава клетки
при наличии многообразных связей со средой ее обитания.
В организме человека 50% ионов натрия содержится в
межклеточной среде (интерстиции), 40% - в костях и только 10% - внутри
клеток. В интерстиции натрию сопутствуют анионы хлора и бикарбо-
138
Биофизика
ната, концентрации которых там значительно выше, чем в цитозоле.
В отличие от ионов натрия, а также кальция, катионы калия и магния
сосредоточены преимущественно внутри клеток. Из 160 г
ионизированного калия, входящего в состав тела человека среднего роста и
массы, только 3 г приходится на межклеточную среду. В цитозоле
Са2+ присутствует в ничтожной концентрации (около 10~8 моль · л-1)
даже в мышечных волокнах, где его содержание довольно велико, но
там он сосредоточен не в цитозоле, а в цистернах саркоплазматиче-
ской сети, мембрана которой в несокращающихся мышцах служит
непреодолимым препятствием для перемещения этого иона.
Стабильное поддержание ионного неравновесия, а также
перемещение ионов через клеточные мембраны в сторону более высокого
электрохимического потенциала для осуществления многих
физиологических процессов обеспечивается работой ионных насосов.
2.3.2.1. Калий-натриевый насос
Только благодаря системе активного транспорта Na+ и К+
поддерживаются стабильные и весьма высокие градиенты концентраций
этих ионов на плазмолемме любой клетки Разница в их молярных
концентрациях между цитозолем и интерстицием достигает 10-20,
причем калия больше в цитозоле, а натрия - в межклеточной среде.
Под действием концентрационных градиентов К+ выходит из клетки,
a Na+ входит в нее. Пассивный транспорт привел бы к ликвидации
ионного неравновесия, но этому мешает работа калий-натриевого
насоса. Он беспрестанно откачивает натрий из цитозоля в интерстиций
и закачивает К+ в клетку. Установлено, например, что через каждый
1 см2 плазмолеммы нервного волокна кальмара ежесекундно
проходит 1010 ионов натрия, на что расходуется пятая часть всей
свободной энергии, образующейся у кальмара за счет клеточного дыхания.
Следовательно, калий-натриевый насос - весьма энергоемкая
система. Энергия затрачивается на антипорт натрия и калия.
Компонетами калий-натриевой помпы являются АТФ
(источник энергии) и натрий-калий-активируемая АТФаза (сокращенно -
Na-K-АТФаза), которая, по-видимому, служит одновременно и
сопрягающим фактором, и переносчиком. Этот фермент был открыт
в 1957 г. при исследовании активного транспорта натрия через мемб-
/ нова 2. Биофизика клеточных мембран
139
рипы нерва краба, и с тех пор о Na-K-АТФазе получено сведений
оольше, чем обо всех мембранных транспортных системах вместе
шитых. Созданы антитела к ней.
В состав наиболее высокоочищенных препаратов Na-K-АТФа-
1ы, выделенной из почки собаки, входят 2 главных полипептида. Пер-
иый из них - интегральный протеин с неполярными боковыми
цепями - имеет молекулярную массу около 135 кДа и, по-видимому, на-
гкнозь пронизывает биомембрану. Второй полипептид является сиа-
иогликопротеидом с молекулярной массой 40 кДа. Им образованы
икгивные центры, с которыми вступают во взаимодействие
переносимые ионы. Na-K-АТФаза не активна в отсутствие ионов магния,
не работает без липидов. Ее активность зависит также от рН вблизи
активного центра, на котором адсорбируются ионы натрия. С АТФ
таимодействует высокомолекулярный полипептид, при фосфори-
ппровании которого вся молекула фермента претерпевает механо-хи-
мпческие превращения. По приблизительным оценкам они могут
носспечить как сдвиг подвижных групп молекулы АТФазы относите-
iii.no ее неподвижной структуры, так и ротацию всей молекулы в
биомембране.
Молекулярный механизм использования энергии АТФ для ра-
(юты калий-натриевого насоса еще не вскрыт. В самом общем виде его
(формулировал Д. Скоу в 1957 г. Он предполагал, что на внутренней
(■троне БМ находятся молекулярные комплексы, способные фосфори-
ипроваться за счет присоединения концевой фосфатной группы АТФ,
отщепляющейся при его гидролизе. Фосфорилированный
транспортный комплекс переносит связанный с ним Na+ на наружную сторону
клеточной мембраны, где обменивает его на К\ Приняв ионы калия, он
ι ранспортирует их внутрь клетки, после чего дефосфорилируется. Для
следующего транспортного цикла ему необходимо новое фосфорили-
рование за счет гидролиза АТФ. С тех пор как были высказаны общие
положения о работе калий-натриевого насоса, появилось много гипо-
ICI, конкретизирующих участие в ней Na-K-АТФазы. Ни одна из них
не является общепринятой, но все модели активного транспорта
натрия и калия предусматривают конформационные превращения
ι ранспортной АТФазы, сопровождающиеся ее перемещениями в
пространстве биомембраны. Некоторые исследователи полагают, будто
140
Биофизика
Цитозоль
а)
Плазмолемма
Интерстиций
[Na+j], ммоль-л-1
50
АТФ+Н20 -» АДФ+Р-
- NaK-АТФаза
4
./
.&
[K*i = 400 ммоль л-1
[Na+|] = 50 ммоль-л-1
[К+е] = 20 ммоль л"1
6) [Na+β] = 450 ммоль л-1
ΓΊ
Е>
NB-K-АТФаза
Плазмолемма:
Рис. 2.17. Схема работы натрий-калиевого насоса
а — состояние до транслокации ионов, 6 — состояние после транслокации ионов
калий-натриевая помпа действует по принципу перистальтического
насоса, который попеременно открывает и закрывает натриевые и
калиевые каналы, расположенные в БМ по соседству с Na-K-АТФазой.
Ее конформационные перестройки, обусловленные чередованием
фосфорилирования и дефосфорилирования, вызывают изменение
проницаемости ионных каналов, работающих в противофазе: когда
натриевый канал открыт, калиевый — закрыт, и наоборот. Согласно
этой гипотезе, Na-K-АТФаза служит не переносчиком ионов, а
своеобразным клапаном в ионных каналах.
/ пава 2. Биофизика клеточных мембран
141
Другая гипотетическая схема действия калий-натриевой помпы
и юбражена на рис. 2.17. Предполагается, что транспортная АТФаза ра-
(ютает как переносчик. Молекула фермента пронизывает плазмолемму,
ионтактируя одним полюсом с цитоплазмой, а другим- с межклеточной
средой. В примембранных участках цитоплазмы скапливаются
митохондрии, из которых выходят молекулы АТФ, вступая в
непосредственный контакт с мембраной и, следовательно, с Na-K-АТФазой.
Содержание ионов натрия в цитоплазме поддерживается на строго постоянном
уровне. Так, в аксоплазме нервного волокна кальмара концентрация Na+
составляет 50 ммоль · л-1, а в интерстиции - 450 ммоль· л-1.
Концентрационный градиент на мембране волокна достигает 4 · 10|3мольл~' · м-1.
()п заставляет ионы натрия диффундировать внутрь волокна. Этому же
способствует и электрический градиент, обусловленный
существованием трансмембранной разности потенциалов, причем цитоплазма не-
(π отрицательный потенциал относительно интерстиция.
Если вследствие пассивного транспорта ионы натрия войдут
и цитоплазму и их содержание там превысит 50 ммоль л-1, то они
пдеорбируются на Na-K-АТФазе и переводят ее в активное
состояние. Активированная АТФаза катализирует гидролиз АТФ, в резуль-
I hi с чего от АТФ отщепляется концевая фосфатная группа, которая
снизывается с β-карбоксильной группой L-аспарагиновой кислоты,
иходящей в состав Na-K-АТФазы, и переносит на нее свободную
шергию. Фосфорилированная и энергизованная молекула фермента
претерпевает конформационную перестройку, следствием чего
буку ι ротация или сдвиг ее в плазмолемме. Перемещения в мембране
Λ ГФазы вместе с адсорбированными на ней ионами натрия обеспе-
чппают перенос их из цитоплазмы наружу - в сторону более высоко-
ю шектрохимического потенциала. Оказавшись на внешней стороне
пиазмолеммы, Na+ покидает транспортную АТФазу, которая после
^информационной перестройки дефосфорилируется. Из
межклеточной среды на нее адсорбируются ионы калия, а дефосфорилирован-
ιιιΐΗ АТФаза приобретает исходную конформацию, вследствие чего
re ннешние участки с находящимся там К+ поворачиваются к цито-
ппазме. Таким образом ионы калия переносятся из интерстиция
инугрь клетки тоже вопреки действию концентрационного градиен-
142
Биофизика
200
150
100
50
0 50 100 150 Сна
-.«η τη « J + ММОЛЬ
150 100 50 0 Ск
Рис. 2.18. Зависимость активации Na-К-активируемой АТФазы
от концентрации Να* в цитоплазме и К* во внеклеточной среде
активность АТФазы выражена фосфатом (в мкмоль),
освободившимся за 1 ч. (на 1 мг белка)
та. Отдав К+ цитоплазме, транспортная АТФаза готова к новому
циклу работы, но для этого она должна быть снова фосфорилирована.
Na-K-АТФаза активируется и натрием, и калием, но проявляет
при этом ярко выраженную векторность: натрий действует на нее
только со стороны цитоплазмы, а калий - из межклеточной среды
(рис. 2.18). Вместе с тем ее специфичность по отношению к натрию
выше, чем к калию. Для включения в действие Na-K-АТФазы натрий
незаменим, тогда как вместо калия можно использовать любой
одновалентный катион, причем с рубидием транспортная система
функционирует даже лучше, чем с калием. По-видимому, для фермента
характерны разные механизмы распознавания натрия на цитоплазма-
тической стороне плазмолеммы и других катионов на ее наружной
поверхности.
Установлено, что за счет гидролиза одной молекулы АТФ
осуществляется активный транспорт 3 ионов натрия и 2 ионов калия, т. е. их
сопряженному трансмембранному переносу (антипорту) свойственна
стехиометрия. Она сохраняется независимо от величины и
направления концентрационного и электрического градиентов. Стехиометрией
обусловлены электрогенные свойства калий-натриевого насоса.
Перенося 2 К+ внутрь клетки и выводя из нее 3 Na+, он создает небольшую
Активность (Р- мкмоль ■ ч"1 на 1 мг белка)
/ пава 2. Биофизика клеточных мембран
143
разность потенциалов на плазмолемме, причем цитоплазма приобретает
шрицательныи потенциал относительно интерстиция. Электрогенность
ионного насоса подтверждена в эксперименте на искусственных
мембранах. Очищенный препарат Na-K-АТФазы, встроенный в липидный
омелой, вызывает появление электрического тока через искусственную
мембрану. Ток прекращается при добавлении в раствор, омывающий
мембрану, специфического ингибитора этого фермента.
В опытах на липидных мембранах, инкрустированных Na-K-AT-
Фазой, установлен также эффект обращения действия ионного насоса.
()п состоит в том, что при трансмембранном переносе Na+ и К+ в
направлении низких электрохимических потенциалов каждого из этих
пинов АТФаза начинает работать в качестве АТФсинтетазы, т. е. ката-
иизировать не гидролиз АТФ, а его синтез из АДФ и ортофосфата.
И этом случае калий-натриевый насос служит генератором свободной
•пергии (в форме АТФ). Об эффекте обращения протонной помпы речь
пойдет при рассмотрении ионного транспорта у галобактерии,
фотосинтеза и клеточного дыхания.
Калий-натриевый насос присутствует в плазматических
мембранах почти всех клеток животных организмов, но в разных клетках
сю активность неодинакова (табл. 2.5).
Таблица 2.5
Активность Na-K-АТФазы и интенсивность активного транспорта ионов
натрия в разных биообъектах
Клетки, ткани и органы,
из которых выделен
фермент
Эритроциты
Скелетные мышцы
Головной мозг
Корковое вещество почки
Электрический орган рыб
Активность
фермента
+
++
++++
+++++
++++++
Интенсивность
активного транспорта
Na+
+
++
++++
+++++
++++++
В плазмолемме человеческого эритроцита выявлено от 100 до 300
таких молекулярных «насосиков», а в мембранах почечных эпителио-
цитов их примерно на три порядка больше. Содержание Na-K-АТФазы
144
Биофизика
в эрнтроцитарной мембране не достигает и одного процента общего
белка, тогда как в мембранах почечных клеток - более 10%, а в
электрическом органе рыб - еще выше. Очень высока концентрация этого
фермента в клетках солевой железы альбатроса. Пожалуй, ни одна птица не
может улетать от берега так далеко, как альбатрос, и столь дальние
полеты над морем доступны ему только благодаря способности пить
морскую воду. В клетках специального органа происходит ее
опреснение за счет работы мощного калий-натриевого насоса, локализованного
в плазматических мембранах. Лишняя соль выбрасывается из солевой
железы в море. Значительна роль калий-натриевой помпы кожи
лягушки в жизни этого животного, вышедшего из водной среды на сушу. Она
перекачивает ионы натрия из окружающей среды в межклеточную
жидкость лягушки даже тогда, когда концентрация натрия в пресном
водоеме на четыре порядка ниже, чем в интерстиции животного.
. Учитывая многообразие физиологических процессов,
обеспечиваемых работой калий-натриевого насоса, можно думать, что
существуют разные формы этой транспортной системы в различных
органах и у разных представителей животного мира. Полагают, к примеру,
что в почках млекопитающих наряду с системой активного антипорта
натрия и калия присутствует другой натриевый насос,
обеспечивающий симпорт натрия и хлора.
Калий-натриевый насос угнетается различными агентами, из
которых наиболее активны сердечные гликозиды, избыток Са+
внутри клетки, а также дыхательные яды. Последние блокируют
окислительное фосфорилирование в митохондриях и, нарушая синтез АТФ,
лишают ионный насос источника энергии. Понятно, что
дыхательные яды останавливают работу любых систем активного транспорта,
т. е. в их действии нет специфичности.
Специфическим блокатором калий-натриевого насоса служит
строфантин Г (уабаин), который является ингибитором Na-K-АТФа-
зы. Даже в концентрации 10-7 моль · л-1 уабаин подавляет ее
активность на 50%. Заметим, что лечебный эффект сердечных гликозидов
(строфантина и дигитонина), применяемых при сердечной
недостаточности, обусловлен их действием на калий-натриевый насос плаз-
молеммы миокардиальных волокон.
I пава 2. Биофизика клеточных мембран
145
Из года в год медицина узнает все больше о вкладе нарушений
функции калий-натриевого насоса в патогенез различных заболеваний.
Например, эрнтроцитоз (наследственная болезнь системы крови) раз-
пиается в результате резкого усиления активности Na-K-АТФазы
и )ритроцитарной мембране, а в патогенезе
маниакально-депрессивного психоза важную роль играет ослабление работы калий-натриевого
насоса, из-за чего в цитозоле нервных клеток повышается содержание
натрия. Применение солей лития, под действием которых возрастает
активность Na-K-АТФазы в клеточных мембранах, оказывает лечебный
эффект как в маниакальную, так и в депрессивную стадии болезни.
Во многих клеточных мембранах функционируют и другие
системы активного транспорта. Долгое время думали, что сущест-
иуют насосы, переносящие моносахариды и аминокислоты в
сторону более высокого электрохимического потенциала. Это предпо-
пожение не подтвердилось. Напротив, гипотеза о существовании
ряда ионных насосов находит все большее подтверждение. Однако
π и этих представлениях нет полного единодушия. Одни исследо-
иатели допускают присутствие в БМ систем активного транспорта
чуть ли не для каждого иона. Так, в литературе по биофизике и
фитологии почек фигурируют хлорные, бикарбонатные, магниевые
π другие насосы. По мнению других мембранологов, организм
имеет только четыре системы активного транспорта: калий-натри-
сиый и кальциевый насосы, а также две протонные помпы (в одной
in них Н+-ионы переносятся через внутреннюю мембрану
митохондрий и создают протондвижущую силу за счет электронного
фанспорта при окислительно-восстановительных реакциях, во
шорой - перенос Н+-ионов осуществляют Независимые АТФазы
клеточных мембран).
2.3.2.2. Кальциевый насос
Кальциевый насос обеспечивает стабильно низкий уровень
('а2' в цитозоле. В отличие от калий-натриевого насоса, он выводит
in цитозоля избыток ионов не в межклеточную среду, а в органоиды
(главным образом, в эндоплазмагическую сеть). Поэтому основная
иокализация кальциевого насоса в большинстве типов клеток - внут-
146
Биофизике
риклеточные мембраны, а не плазмолемма. Детальные исследования
кальциевой помпы проведены в мембране саркоплазматической сети
миоцитов, где ее активность особенно высока.
Источником энергии для системы активного транспорта
кальция служит АТФ. Вторым компонентом насоса является Са2+-акти-
вируемая АТФаза (сокращенно - Са-АТФаза). Она состоит из одной
полипептидной цепи с молекулярной массой около 100 кДа. В ней
преобладают аминокислотные остатки с неполярными боковыми
цепями. Это липидзависимый фермент, причем вокруг каждой его
молекулы находится примерно 35 молекул фосфолипидов, содержащих
ненасыщенные жирнокислотные остатки. Особенно сильным
активирующим действием обладают жирные кислоты с одной
ненасыщенной связью. Кроме того, для работы Са-АТФазы необходимы
ионы магния.
В саркоплазматической сети на долю Са-АТФазы приходится
60% общего мембранного белка. По-видимому, в мембране
саркоплазматической сети нет другого интегрального белка, кроме
Са-АТФазы. Остальные 40% мембранных протеинов составляют
периферические белки. На активный транспорт двух молей Са2+ затрачивается
один моль АТФ, но при преодолении очень высоких
физико-химических градиентов соотношение Са2+ и АТФ снижается с 2 : 1 до 1 : 1.
Механизм действия кальциевой помпы установлен благодаря
изучению кинетики ее работы. В этом процессе выделяют три
ступени (этапа). Сигналом к активному транспорту служит превышение
допустимого уровня Са2+ в цитозоле. Показано, что константа
связывания ионов кальция Са-АТФазой имеет порядок 107 л · моль-1, т. е.
адсорбция кальция на транспортном ферменте происходит уже при
концентрации Са2+ в цитозоле около 10~7 моль · л-1 Заметим, что
в покоящемся мышечном волокне содержание кальция в цитозоле
примерно на порядок ниже.
Са-АТФаза связывает не только Са2+, но и АТФ в комплексе
с ионами магния. Центры связывания Са2+ и АТФ локализованы на
той поверхности фермента, которая обращена к цитозолю, но это
разные центры. Активированная кальцием транспортная АТФаза
катализирует гидролиз АТФ, что и составляет основное событие второго
этапа в работе кальциевой помпы. При гидролизе от АТФ отщепляет-
ι ппва 2. Биофизика клеточных мембран
147
гн концевая фосфатная группа, присоединяясь затем к Са-АТФазе, ко-
к»рая приобретает при этом дополнительную свободную энергию,
рапную энергии гидролиза АТФ (примерно 31,4 кДж · моль-1). За счет
ной энергии образуется фермент-фосфатный комплекс (Ф~Р).
Трети этап работы кальциевого насоса включает переход Са2+ на проти-
иоположную сторону мембраны, что обеспечивается изменением кон-
формации Са-АТФазы, приводящим к перемещению молекулы
фермента в пространстве БМ. Полагают, что происходит сдвиг по-
/шпжных групп Са-АТФазы, на которых адсорбирован Са2+, относите-
ιιι,ιιο неподвижной части молекулы. На внешней стороне БМ
транспортная АТФаза освобождается от Са2+, поскольку комплекс Ф~Р
ι пдролизуется после того как затрачивает полученную ранее энергию
ми активный транспорт ионов. Вслед за гидролизом
фермент-фосфатного комплекса происходит дефосфорилирование фермента.
Возвращение Са-связывающих центров в исходное состояние является след-
с гнием восстановления той конформации молекулы Са-АТФазы,
которая свойственна ей в нефосфорилированном состоянии.
В сокращенном виде схема активного транспорта кальция
иыглядит следующим образом:
Μζ I этап: 2Са »+ + АТФ+Ф, Са 2 - Φ, ~ Ρ + АДФ,
М^ II этап: Са2Ф, ~Р 2Са2с+пс+Р+Ф2,
-> III этап: Φ, Φ..
Обозначения в схеме: Са2/ - кальций в цитоплазме, Са^с - ка-
щ.ций в саркоплазматической сети, Ρ - ортофосфат, Ф, - неэнергизо-
инпная конформация Са-АТФазы, Ф2 - энергизованная конформация
ι н-АТФазы.
Кальциевый насос, в отличие от калий-натриевого, не проявляет
шектрогенных свойств - активный транспорт Са2+ не сопровождается
образованием разности потенциалов на мембране саркоплазматиче-
148
Биофизика
ской сети. Неэлектрогенность кальциевой помпы обусловлена
высокой проницаемостью этой мембраны для многих ионов. Поэтому
мембранный потенциал, создаваемый переносом Са2+, сразу падает из-за
утечки других ионов.
К работе кальциевого насоса необходимо обратиться повторно
при изучении механизма мышечного сокращения. Что же касается
протонных помп, то некоторые их особенности можно понять при
рассмотрении таких вопросов, как ионный транспорт у галобакте-
рии, фотосинтез, клеточное дыхание.
2.3.3. Ионный транспорт у галобактерии
Галофильная (солелюбивая) бактерия (Halobacterium halobium)
является обитателем неглубоких тропических водоемов,
содержащих насыщенный раствор поваренной соли при высокой
температуре (до 57 °С) и низком напряжении кислорода. Жизнь в гипоксиче-
ском рассоле привела к выработке у галобактерии мощной системы
активного транспорта, благодаря которой концентрация ионов
натрия в цитоплазме поддерживается на низком уровне несмотря на
колоссальный концентрационный градиент Na+ на клеточной мембране.
Гипоксическая среда не позволяет галобактерии использовать
биологическое окисление в качестве поставщика свободной энергии для
ионного транспорта и других процессов жизнедеятельности. В ходе
эволюции этого микроорганизма вырабатывались своеобразные
механизмы преобразования солнечной энергии во все формы полезной
работы организма.
Посредником синтеза АТФ под действием солнечной энергии
служит концентрационный градиент Н+-ионов на плазмолемме
галобактерии. Он создается и поддерживается системой активного
транспорта Н+-ионов (протонной помпой), переносящей их из окружающей
среды в цитоплазму. За счет работы протонной помпы уровень рН
в цитозоле стабилен, очень низок (около 3,0) и мало зависит от
кислотности водоема, где рН может достигать 12,0.
Солнечный свет служит не только источником энергии для
галобактерии, но и регулятором чередования активного и пассивного
транспорта протонов через ее клеточную мембрану. В ней различают
I пава 2. Биофизика клеточных мембран
149
участки пурпурного и красно-оранжевого цветов. Совокупность пер-
пых называют пурпурной мембраной, вторые объединены под
названием красная мембрана. Структурную основу мембран обоих типов
(.оставляет бимолекулярный фосфолипидный слой. Однако в
пурпурной мембране содержание липидов невелико - около 25% всех ее
компонентов. Почти отсутствуют там и углеводы. 75% массы
пурпурной мембраны приходится на одно-единственное вещество
белковой природы - бактериородопсин (БР). По структуре и свойствам
он сходен с родопсином (зрительным пигментом животных) и
представляет собой комплекс ретиналя (альдегида витамина А) с
мембранным липопротеидом (опсином). Благодаря светопоглощающим
спойствам бактериородопсина пурпурная мембрана улавливает
солнечный свет, чтобы использовать его энергию для преобразования
и различные формы полезной работы галобактерии.
БР чрезвычайно устойчив к высокой температуре, кислотам,
щелочам, фотоокислению, годами не утрачивает биологическую
активность при хранении в холодильнике. Его молекулярная масса
около 27 кДа. Ю. А. Овчинников и его сотрудники установили
полную последовательность всех 348 аминокислотных остатков, обра-
|ующих опсин. Ретиналь присоединен к аминогруппе лизила,
стоящего сорок первым в этой последовательности1. Ковалентная связь
между углеродом (С) ретиналя и азотом (N) лизила называется шиф-
фовым основанием. Все молекулы БР ориентированы в плазмолем-
ме галобактерии одинаково. По дифракции электронов на элементах
пурпурной мембраны реконструировали трехмерную структуру БР.
Иго полипептидная цепь 7 раз пересекает пурпурную мембрану.
Следовательно, в молекуле БР можно выделить 7 спиральных участков
(см. рис. 2.8). Длина каждого из них примерно совпадает с толщиной
мембраны. Молекулы БР объединены в триады, которые, в свою
очередь, образуют правильные шестиугольники, что придает
пурпурной мембране структуру правильной гексагональной
кристаллической решетки. Это жесткая мембрана, плохо проницаемая для
многих веществ.
1 Отсчет порядкового номера аминокислотного остатка ведется от N-конца
нплипептидной цепи.
150 Биофизика
150
100
50
400 500 600 700 800 λ, нм
Рис. 2.19. Спектр поглощения бактериородопсина
по оси абсцисс - длины волн β.); по оси ординат - коэффициент
поглощения (ajj. Выше спектра поглощения приведен спектр
солнечного излучения (интенсивность излучения -
в относительных единицах)
Молекулы БР образуют в ней каналы для Н+-ионов, которые
сосредоточены внутри триад, смыкающихся в темноте и расходящихся
под действием света. Первое состояние соответствует закрытию
протонных каналов, а второе - их открытию. Каналы открываются за
счет того, что при освещении спиральные участки опсина,
обрамляющие канал внутри триады, испытывают изменение конформации
и удаляются друг от друга на расстояние до 1 нм. Канал заполнен
водой. Разные участки солнечного спектра не в одинаковой степени
влияют на мембранные процессы у галобактерии, что обусловлено
особенностями спектральных характеристик бактериородопсина.
Максимум в видимой области спектра поглощения БР приходится на
568 нм (рис. 2.19). Под действием света пигмент обесцвечивается,
точнее, теряет пурпурный цвет (λ^ сдвигается к 412 нм). Однако
в течение нескольких миллисекунд после обесцвечивания пурпурная
мембрана самопроизвольно приобретает прежнюю окраску. Эти
быстрые обратимые переходы (рис. 2.20) вызваны перестройками
конформации бактериородопсина, происходящими, как выяснилось, за
счет отдачи или приема им протонов.
k Οχ, Л · ММОЛЬ-1· СМ-1
ι nana 2. Биофизика клеточных мембран
151
А Активность (Р - мкмоль · ч"1 на 1 мг белка)
200
150
100
50
150 CNa
Ск
ммоль
Рис 2.20. Цикл превращений бактериородопсина
Под действием света шиффово основание разрывается, и рети-
HIUIL· отходит от опсина. Происходит депротонирование шиффова осно-
шшия - от аминогруппы лизила, участвовавшего в образовании этого
in пования, отделяется протон (Н+). Отделившись, он поступает в канал,
образованный в плазмолемме галобактерии триадой (3 молекулами
ΙίΙ1), растворяется там в воде и выходит в окружающий раствор
пассивно (в сторону более низкого электрохимического потенциала).
Вакантное место в шиффовом основании (в аминогруппе лизила) занимается
ионом ΙΓ, поступающим к бактериородопсину из цитоплазмы
бактерии. Он перемещается вдоль цепи Η-связей структурированной воды,
находящейся в канале (внутри триады). Предполагают, что Н""
перемещается в составе гидроксония Н30*, но возможно замещение вакансии
и шиффовом основании ионами Н+ из ближайших диссоциированных
молекул воды, находящихся в канале. Таким образом, протоны выхо-
/|и ι из цитоплазмы галобактерии в окружающий раствор по эстафете
и дна такта: один Н+ выходит из шиффова основания (из мембранного
lil') в раствор, окружающий бактерию, а другой Н+ поступает из циго-
пиазмы бактерии в мембрану, заполняя вакансию в шиффовом
основании - при его восстановлении. В целом создается впечатление о
сквозном прохождении одного протона (Н+) из цитоплазмы бактерии
и окружающую среду с отставанием от него аниона гидроксила (ОН-),
который задерживается в цитоплазме. Происходит пространственное
152
Биофизика
разобщение разноименных электрических зарядов (ионов Н+ и ОН") на
мембране с образованием разности потенциалов между цитоплазмой
и раствором, окружающим бактерию. Ее принято называть протонным
потенциалом. Он достигает 60 мВ в ответ на 1 квант солнечного света.
Так галобактерия преобразует солнечную энергию в электрическую,
которая, в свою очередь, обеспечивает синтез АТФ, т. е. преобразуется
в химическую энергию.
Установлено, что галобактерия синтезирует АТФ на свету,
причем только в том случае, если не нарушен протонный транспорт и
существует разность электрических потенциалов на ее плазматической
мембране. По-видимому, в плазмолемме наряду с протонными
каналами есть протонная помпа, осуществляющая активный транспорт
Н+-ионов. Ее важнейшим компонентом является транспортная
Независимая АТфаза (сокращенно Н-АТФаза). Как и другие ионные насосы,
протонная помпа обладает эффектом обращения: при активном
транспорте Н+ транспортная Н-АТФаза гидролизует АТФ, извлекая из него
свободную энергию для обеспечения этого процесса, тогда как при
пассивном транспорте Н+ она катализирует синтез АТФ, являясь АТФ-
синтетазой. Поэтому солнечный свет, затрачивая свою энергию на
изменение конформации молекулы БР, открывает протонные каналы
в молекулах Н-АТФазы для пассивного транспорта Н+-ионов, что
приводит к обращению действия Н-АТФазы и синтезу АТФ. Так световая
энергия аккумулируется концевой фосфатной группой АТФ.
Промежуточной формой энергетических преобразований (между солнечной
и химической) служит энергия протонного градиента на плазмолемме
галобактерии, поскольку пассивный транспорт Н+ невозможен в его
отсутствие. Энергию протонного потенциала можно рассматривать в
качестве осмотической энергии протонного градиента на плазмолемме.
В определенном смысле это эквивалентные понятия.
В темноте система активного транспорта протонов
восстанавливает нормальный протонный градиент на плазматической
мембране галобактерии. Энергетическое обеспечение протонного насоса
осуществляет АТФ, синтезированный на свету. Кроме того, АТФ
поставляет свободную энергию для активного транспорта натрия и
калия, а также для других процессов жизнедеятельности галофильной
бактерии.
/ пива 2. Биофизика клеточных мембран
153
Белково-липидные комплексы, входящие в системы активного
фанспорта Н+, К+, Na+, сосредоточены не в пурпурной, а в красной
мембране. Там же, по-видимому, синтезируется АТФ. Кроме того,
к красной мембране содержатся каротиноиды - пигменты, обуслов-
шшающие ее цвет. Функция каротиноидов, в отличие от бактериоро-
кшеина, состоит не в усвоении солнечной энергии для обеспечения
'мгши галофильной бактерии, а в защите от солнца ферментов и дру-
(их мембранных компонентов.
Следовательно, галобактерии присуща специализация
различных участков плазмолеммы. Этим, очевидно, компенсируется почти
чинное отсутствие внутриклеточных мембран. Пурпурная и красная
мембраны своеобразно сопряжены в функционировании: первая усва-
ипаст солнечную энергию, вторая накапливает и реализует ее в
процессах жизнедеятельности галобактерии.
В последние годы научились включать систему бактериородоп-
| una в искусственные липидные мембраны, что способствует проник-
мписнию в тайны ионного транспорта через биологические мембраны.
11 месте с тем работы с бактериородопсином преследуют цель создания
необычайно эффективных фотоэлементов в надежде на
принципиально новые решения проблем промышленной энергетики и
предупреждение энергетического кризиса.
Известный биоэнергетик Э. Рэкер и один из первых исследова-
и'ней мембранных процессов у галобактерии В. Штокениус в совме-
■ той работе создали липосому, в состав которой вошли вещества,
и in тые у представителей трех царств живой природы (бактерии, рас-
leiniH, животного). Липидный бислой был образован фосфолипидами
HiifioB. В него встроили бактериородопсин галобактерии и АТФсинте-
m ι у из митохондрий бычьего сердца. Такая протеолипосома
синтезирует АТФ при освещении. Она получила название химеры (монстра)
1'жсра
2.3.4. Облегченная диффузия
Облегченной диффузией (ОД) называют транспорт веществ че-
|ич клеточные мембраны, который происходит в том же
направлении, что и свободная диффузия, но гораздо быстрее. Следовательно,
154
Биофизика
С,, ммоль ,
0.3
0,3
0
5 10 Се, ммоль
Рис. 2.21. Зависимость концентрации С-глюкозы в цитоплазме
эритроцита человека (Су от ее содержания во внеклеточной среде (CJ
при транспорте по механизму облегченной диффузии.
Значения, установленные в эксперименте, показаны кружками.
Непрерывная кривая получена расчетным путем
из уравнения Михаэлиса-Ментен (X. Иост, 1975)
ОД относится к механизмам пассивного транспорта. Ее движущей
силой служит электрохимический потенциал на биомембране.
Скорость свободной диффузии вещества в водном растворе
зависит прежде всего от числа водородных связей, образованных его мо
лекулами с водой. Когда происходит облегченная диффузия, такой
расчет дает заниженные результаты. Так, скорость транспорта глюко
зы через эритроцитарную мембрану на два порядка выше расчетной
Другим важным отличительным признаком ОД является эффект на
сыщения (рис. 2.21), не свойственный свободной диффузии. По дости
жении определенной концентрации вещества в примембранном про
странстве скорость его переноса через мембрану устанавливается нп
постоянном уровне и не нарастает при дальнейшем повышении кон
центрации. Этот признак служит надежным критерием ОД, так как эф
фект насыщения довольно легко выявляется при проведении опытов.
Облегченная диффузия характеризуется рядом свойств, кото
рые типичны для ферментативных процессов. Ее температурный ко
эффициент Qio такой же, как у ферментативных реакций. Ей свойст
венны различия в скорости транспорта оптических изомеров, а также
конкурентное и неконкурентное ингибирование (конкурентные инги-
' nana 2. Биофизика клеточных мембран
155
Пи юры снижают скорость трансмембранного переноса только струк-
ινριιο близких соединений, тогда как неконкурентные - самых
разных веществ).
Системами ОД обладают почти все растительные и животные
h истки. Между тем, далеко не все вещества транспортируются таким
ни разом. ОД установлена для моносахаридов, аминокислот и
некоторых ионов. Все они хорошо растворяются в воде. Очевидно, клетка
иг пользует ОД для трансмембранного переноса тех ингредиентов,
которые она черпает из окружающей ее среды. Механизм ОД
присущ многим клеткам млекопитающих по отношению к тем вещест-
iiiiM, которые поступают к ним из плазмы крови. Промежуточные
продукты обмена (фосфорилированные сахара, макроэрги, продукты
метаболизма аминокислот и др.) не способны к ОД в организме.
I lo-видимому, это продиктовано потребностью задерживать их
внутри клеток (или определенных органоидов) до завершения
метаболических процессов.
Кинетика облегченной диффузии отображается следующим
С
уравнением: 1 = 1м -—,где /- плотность потока вещества че-
Се +К
ре ι биомембрану, 1и - максимальное значение этой величины, Се -
концентрация диффундирующего вещества вне клетки (или органои-
цц), К - константа, характеризующая способность данного вещества
проникать через биомембрану (равна концентрации вещества вне
клетки или органоида, при которой величина I равна половине
максимально возможной плотности потока, т. е. К = Се, при которой / =
- 0,5 · 1М). Эта формула тождественна традиционной форме записи
уривнения Михаэлиса-Ментен для ферментативных реакций, чем
подтверждается представление о глубокой связи ОД с кинетикой
ферментативных процессов. Экспериментальные данные (рис. 2.21)
шкже подтверждают правоту такой интерпретации облегченной
ннффузии.
Если значение А" намного превосходит величину Се, то
функциональная зависимость плотности потока (7) от концентрации вещества
((',.) имеет линейный характер. При малых концентрациях
переносимого вещества изучение кинетики транспорта не позволяет отличить
156
Биофизика
облегченную диффузию от свободной. При высоких Се величина /
определяется в основном значеним 1М, так как знаменатель дроби
(Се + К) мало отличается от Се. Этому соответствует участок
насыщения (рис. 1.21), отображающий отсутствие зависимости /от Се.
ОД обеспечивается нередко переносчиками, которые
связываются с молекулами транспортируемого вещества, образуя соединение,
подобное фермент-субстратному комплексу. В этом случае величина
К характеризует сродство транспортируемого вещества к
переносчику, в чем отображается степень специфичности их взаимодействия.
При транспорте с участием переносчика эффект насыщения
обусловлен, как правило, вовлечением в транспортный процесс всех молекул
переносчика, присутствующих в биомембране.
Для осуществления ОД необходимо беспрестанно снижать
концентрацию переносимого вещества внутри клетки (или
органоида), поддерживая ее фактически на нулевом уровне. Тогда при
относительно постоянном и даже понижающемся значении Се
устанавливается так называемый благоприятный концентрационный
градиент транспортируемого вещества на биомембране. Это
достигается включением перенесенного агента в разнообразные
метаболические процессы. Примерами могут служить полимеризация
мономеров (глюкоза —» гликоген, аминокислоты —» пептиды), превращение
одного мономера в другой (преобразование одной аминокислоты
в другую аминокислоту или в кетокислоту), образование комплексом
(например, аминокислота-тРНК). Перечислены далеко не все
подобные процессы, но даже из приведенных примеров можно понять, что
благоприятный градиент поддерживается благодаря ферментативной
активности внутриклеточных систем обмена веществ.
Все перечисленные реакции нуждаются в затратах свободной
энергии. Она необходима для синтеза полимеров, для образования
комплексов, для взаимных превращений мономеров. Поэтому ОД
всегда требует энергоснабжения, осуществляемого макроэргически-
ми соединениями. Этим она отличается от свободной диффузии
и проявляет определенное сходство с активным транспортом. Однако
при активном транспорте свободная энергия выделяется в ходе
химических реакций, в которых непосредственно участвуют компоненты
(пива 2. Биофизика клеточных мембран
157
фанспортной системы, тогда как при ОД затраты свободной энергии
//«' связаны непосредственно с транспортом веществ. Она тратится на
ιчидание и поддержание благоприятных градиентов, а не на фосфо-
рплирование переносчика, который при ОД не преодолевает
потенциальный барьер, так как транспортирует вещество в соответствии
ι действием физико-химических градиентов, а не вопреки им.
Зачастую благоприятные градиенты существуют за счет рабо-
и.1 систем активного транспорта. Например, в кишечном эпителиоци-
I с калий-натриевый насос сосредоточен только в той части
плазматической мембраны, которая покрывает базальный полюс клетки, тогда
кик апикальный участок плазмолеммы лишен Na-K-АТФазы. Поэтому
иппы натрия активно откачиваются из цитоплазмы через базальный
участок плазматической мембраны в межклеточное пространство,
откуда они поступают в кровь. Транспорт Na+ из полости кишки в эпи-
н'лиоцит происходит пассивно, но это не свободная, а облегченная
нпффузия. Благоприятный градиент концентрации ионов натрия на
иипкальном участке плазмолеммы кишечного эпителиоцита
поддерживается благодаря удалению их из клетки системой активного
фанспорта, работающей в мембране, покрывающей базальный
поите эпителиоцита. В подобных случаях особенно трудно разобраться
и различиях между облегченной диффузией и активным транспор-
IHM. Облегченную диффузию, для которой благоприятные градиен-
I μ создаются за счет работы систем активного транспорта, принято
шпывать вторично-активным транспортом. Однако следует
помнить, что сама по себе ОД, включая и ее вариант под названием
шорично активного транспорта, относится к механизмам пассивно-
и>транспорта.
2.3.5. Специальные механизмы
трансмембранного массопереноса
Кроме свободной и облегченной диффузии, а также активного
фанспорта веществ, в клетках существуют особые механизмы,
обеспечивающие как поглощение, так и удаление различных химических
ι пединений, имеющих не только малую, но и большую
молекулярную массу.
158
Биофизика
2.3.5.1. Поглощение клетками нуклеиновых кислот
и специфических белков
Установлено, что перенос генетической информации,
заключенной в ДНК, на способные к рецепции бактериальные клетки
происходит путем непосредственного проникновения этой нуклеиновой
кислоты через их плазматическую мембрану. Такой
трансмембранный перенос свободных молекул ДНК через плазмолемму
бактериальной клетки бывает при трансформации и трансфекции. В первом
случае проникающая молекула ДНК была прежде выделена другой
бактерией, а во втором - фагом. Достигнув плазматической
мембраны реципиента, молекула ДНК адсорбируется на ее поверхности.
Процесс адсорбции осуществляется без затрат энергии и необратим.
Затем адсорбированная молекула ДНК втягивается внутрь плазмо-
леммы бактерии, на что расходуется свободная энергия
бактериальной клетки. Если ДНК гомологична бактерии, то по проникновении
в цитоплазму она встраивается в хромосому. Весь процесс протекав!
за несколько секунд, максимум - за минуты. Его молекулярные
механизмы пока не раскрыты. Полагают, что аналогичный транспорт
ДНК присущ и некоторым животным клеткам.
Кроме нуклеиновых кислот, бактерии поглощают подобным
же образом ряд белков (например, колицин, интерферон), но только
при наличии в плазматической мембране специфических рецепторов,
взаимодействующих с этими белками. В результате такого
взаимодействия происходит локальная перестройка клеточной мембраны,
благодаря чему сквозь нее проникают макромолекулы.
По-видимому, вирусы попадают внутрь клеток, используя подобный механизм
преодоления клеточных мембран.
Поскольку макромолекулы и вирусы связываются с
подвижными мембранными рецепторами, процессы переориентации и
вращения всего комплекса протекают очень быстро. Для веществ с
молекулярной массой 50 кДа характеристическое время релаксации
молекул в фосфолипидном бислое составляет 10~5-10~* с. Примерно
такое же время свойственно и повороту на I радиан рецепторного
комплекса в биомембране.
Проникновение макромолекул через клеточные мембраны по
механизму рецепторного поглощения свидетельствует лишний раз
/ ппва 2. Биофизика клеточных мембран
159
it необычайной динамичности мембранных структур. В данном слу-
чие она регулируется сигналами, возникающими при взаимодействии
иысокомолекулярных агентов с мембранными рецепторами. Природа
ι in налов, изменяющих за доли секунды и на доли секунды (или
минуты) проницаемость биомембраны, пока неизвестна.
2.3.5.2. Фагоцитоз и пиноцитоз
Существует и другой способ проникновения через клеточные
мембраны макромолекул. Для него характерно образование
мембраны вокруг проникающих веществ. Эта мембрана, покрывающая капли
жидкости или скопления плотных веществ, создается за счет мемб-
рнпных структур той клетки, через плазмолемму которой осуществля-
сгся такой транспорт. Его называют фагоцитозом, когда в клетку
проникают твердые частицы, и пиноцитозом - при прохождении
ι кнозь клеточную мембрану пузырьков с жидким содержимым.
Пузырек (везикула) имеет липидиую оболочку, организованную по типу
(шмолекулярного слоя. Под оболочкой находится капля жидкости,
имеющая микроскопические размеры. В ней растворены различные
иещества, в том числе макромолекулы. Обнаружено движение
везикул как в клетку, так и из нее. В первом случае говорят об эндоцитозе,
и по втором - об экзоцитозе (его иногда называют обратным пиноци-
Ш'ДОМ).
Примером экзоцитоза может служить выделение веществ из
клеток желез внешней (рис. 2.22) и внутренней секреции, синаптиче-
ская передача и т. п. Сигналом к началу экзоцитоза медиатора, посред-
с гвом которого осуществляется синаптическая передача, служит
изменение разности электрических потенциалов на пресинаптической
мембране, вслед за чем повышается содержание Са2+ в пресинапсе,
иызывая мембранную перестройку. Именно при изучении синаптиче-
ской передачи обнаружено, что пиноцитоз протекает с высокой
скоростью, сравнимой со скоростями более простых механизмов трансмем-
Оранного переноса веществ, вплоть до свободной диффузии.
Эндоцитоз особенно развит у простейших, но существует
и в клетках высших животных. Так происходит, например, реабсорб-
цня белков в почках из первичной мочи в кровь. Посредством эндо-
цнтоза в клетки поступают пептидные гормоны (в их числе инсулин),
160
Биофизика
200 нм
Рис. 2.22. Выход гранулы фермента (Ф) из клетки поджелудочной железы
в проток по механизму пиноцитоза (экзоцитоза): виден контакт плазмолеммы
(ПМ) с мембраной гранулы
липопротеиды крови, некоторые иммуноглобулины и другие
вещества. Схема мембранного транспорта по механизму эндоцитоза
изображена на рис. 2.23. Сначала поглощаемые частицы адсорбируются на
определенном участке клеточной мембраны (а), который затем
впячивается (инвагинируется) в цитоплазму (б), причем края инвагини-
рованного участка смыкаются, образуя эндоцитозную везикулу (в),
Она отрывается от плазмолеммы и углубляется в цитоплазму (г), где
входит в контакт с лизосомами. Под действием лизосомальных
ферментов везикулярная мембрана распадается, выпуская содержимое
везикулы в цитоплазму (д).
Адсорбция на биомембране поглощаемых частиц происходи!
без затрат свободной энергии, но они необходимы для образования
везикулы и отрыва ее от плазмолеммы. Энергообеспечение
пиноцитоза осуществляют макроэрги. Поэтому введение АТФ способствует
образованию и инвагинации везикул, а при нарушении клеточного
дыхания эндоцитоз прекращается.
В клетках с выраженным эндоцитозом значительная часть
плазмолеммы перемещается в цитоплазму. Они становятся округлыми
ι ими 2. Биофизика клеточных мембран
161
Рис. 2.23. Схема эндоцитоза
и ирсменно утрачивают способность к пиноцитозу. В течение
последующих нескольких часов происходит существенная перестройка как
ηп.пмолеммы, так и инвагинированных везикулярных мембран. В них
ι ущсственно изменяется состав фосфолипидов, хотя соотношение их
и чилестерина сохраняется прежним. Среди липидов обнаруживается
in юлецитин, формирующий монослойные участки мембран,
отличающиеся большей подвижностью и лабильностью по сравнению с бис-
11П1МИ. В них выше вероятность слияния биомембран. Через 4-10 ч
nutлс эндоцитоза плазмолемма восстанавливается. В клетках,
лишенных холестерина, восстановительный процесс невозможен. Поэтому
микрофаги, выращенные в среде, лишенной холестерина, не способны
фи и (цитировать.
Эндоцитоз и экзоцитоз занимают в мембранном транспорте не
меньшее место, чем другие механизмы. Для одноклеточных организ-
мпи )то очевидный факт. Например, амеба благодаря пиноцитозу еже-
•iiii'iio поглощает такое количество белка, которое достигает 25% ее
ι irfiei венной массы. Хорошо известна роль фагоцитоза, осуществляе-
мin и лейкоцитами, в защите организма человека от возбудителей
мши их болезней (И. И. Мечников, 1892). Велико значение экзоцитоза
к ιткреторных актах. Вместе с тем открываются все новые факты уча-
■ щи ииноцитоза в обеспечении многих обменных процессов,
например, обмена веществ между нейронами и глией.
162
Биофизика
Рис. 2.24. Опосредованный рецепторами эндоцитоз
А - лиганды связываются с рецепторами; Б - загруженные лигандами
рецепторы собираются в области «окаймленных» углублений;
В - «окаймленное» углубление превращается в глубокую инвагинацию;
Г— инвагинация отделилась, превратившись в «окаймленную» везикулу,
которая находится в процессе сбрасывания своего окаймления
Принято различать неспецифический (или объемный, или жид·
кофазный) и специфический (опосредованный мембранными
рецепторами) эндоцитоз. Различие между ними состоит в том, что
специфическому эндоцитозу свойственно присутствие в клеточных мембранах
рецепторов, с которыми взаимодействуют вещества, проникающие
в клетку. При специфическом эндоцитозе цепь процессов,
изображенная на рис. 2.23, развивается только после взаимодействия
проникающего вещества с соответствующим мембранным рецептором (рис. 2.24).
Такие рецепторы обнаружены для инсулина, эпидермального фактор»
роста, трийодтиронина, о^-макроглобулина, ряда токсинов и некоторых
других агентов. Для многих веществ, пиноцитируемых клетками,
мембранные рецепторы не найдены. В этих случаях происходит,
по-видимому, неспецифический эндоцитоз, при котором сигналом к перо·
t пина 2. Биофизика клеточных мембран
163
ι ι |>ойке мембраны служит, очевидно, изменение ее физико-химических
ι noiicTB. Важнейшая роль в неспецифическом эндоцитозе принадлежит
ι инпгам поверхностного заряда плазмолеммы.
2.3.5.3. Щелевые межклеточные контакты
Во многих тканях обмен веществ между клетками осуществля-
|к я через так называемые щелевые контакты. Там, где они возника-
|пι, происходит перестройка молекулярной структуры плазматических
мембран взаимодействующих клеток, что выражается в появлении
ι иибулярных белковых комплексов (коннексонов), которые
располагать в мембране упорядочение, образуя гексагональные структуры
шин пчелиных сот. Они пронизывают клеточную мембрану насквозь,
"Опадают латеральной диффузией, в которой участвует и гндрофиль-
πικι пора, находящаяся внутри каждого коннексона. Пора является
мембранным каналом, заполненным водой.
При сближении плазмолемм соседних клеток на расстояние 2-
I им между стенками таких каналов происходит взаимодействие, при-
ипдищее к объединению коннексонов, принадлежащих мембранам
|ш шых клеток с образованием сквозного гидрофильного канала меж-
uv их цитоплазмами (рис. 2.25), причем гидрофобные стенки каждого
шкого канала изолируют его от окружающей среды. Совокупность
миалов, образованных коннексонами двух соседних клеток в месте
пч тесного соприкосновения, представляет собой наиболее важный
функциональный элемент щелевого контакта (ЩК). В области одного
ЩК может быть до 50 коннексонов и, следовательно, столько же
ι киозных межклеточных каналов. Весь процесс формирования ЩК
шинмает от 5 до 40 мин. Просуществовав некоторое время, ЩК исче-
1йст, а потом может возникнуть вновь. Это весьма динамичная струк-
I ура, возникающая в зависимости от потребности клеток во взаимном
иомене.
Общая толщина контакта, включающего две соседние плазмо-
1гммы, достигает 15 нм, а диаметр одного коннексона - 6 нм. Диа-
Mi-ip просвета в канале, находящемся внутри коннексона, составля-
■ ι 1,4-1,6 нм. По нему могут перемещаться из клетки в клетку, не
пипадая в межклеточную среду, не только ионы, но и органические
164
Биофизик»
Рис. 2.25. Модель соединения плазматических мембран
соседних клеток при помощи щелевых контактов (gap junction)
Обозначения: 1 и 2 - плазмолеммы двух соседних клеток,
вступающих в контакт, 3 - коннексоны
(сквозные межклеточные каналы)
вещества с молекулярной массой до 1,8 кДа (аминокислоты,
низкомолекулярные пептиды, сахара, нуклеотиды и т. п.). В то же время
для ДНК, РНК, белков, гликопротеидов, фосфолипидов и других
макромолекул каналы, сосредоточенные в ЩК, являются
непреодолимым препятствием.
Каналы, принадлежащие ЩК в течение его существования, мо
гут пребывать как в открытом, так и в закрытом состояниях, что рс
гулируется перестройками конформации коннексонов, приводящими
к их сдвигам относительно оси канала и изменениям просвета свое
образной щелевой диафрагмы (рис. 2.26).
' пава 2. Биофизика клеточных мембран
165
а) 6)
Рис. 2.26. Схема функционирования щелевых контактов в мембранах
взаимодействующих клеток при переходах между открытым (а)
и закрытым (б) состояниями за счет конформационных перестроек
Щелевые контакты обеспечивают эффективный обмен веществ
μι·жду соседними клетками. Кроме того, им принадлежит важная роль
и межклеточном электрическом взаимодействии. Оно будет охаракте-
|ш ювано на примере проведения возбуждения по волокнам сердечной
мишцы, образующим так называемую непрерывную возбудимую сре-
му функциональный синцитий. В нем отдельные кардиомиоциты со-
|Ц||"яются друг с другом электрическими синапсами - нексусами,
и каждом из которых находится до 50 коннексонов.
Глава 3. КВАНТОВОМЕХАНИЧЕСКИЕ
ОСНОВЫ БИОЭНЕРГЕТИКИ
Изучение глубинных механизмов биоэнергетики связано преж
де всего с применением к биологическим системам законов и методе
логии квантовой механики. Квантовая биофизика все глубже познаем
не только электронную структуру биологически важных молекум
и механизмы межмолекулярного переноса электронов, но и пути прс
вращения энергии возбужденных молекул в энергию их продуктов
Настоящая глава посвящена изложению современных представлений
о квантовомеханической природе переноса энергии и заряда в
биомолекулярных системах. Этому предпослано рассмотрение основных
понятий квантовой механики и квантовомеханических особенностей
строения биологически важных молекул.
3.1. Основные понятия квантовой механики
Квантовая механика представляет собой раздел физики,
содержанием которого являются общие закономерности движении
и взаимодействия микрочастиц. Возникновение специальной теории,
устанавливающей законы движения в микромире, обусловлено тем,
что законы классической механики и классической электродинамики
оказались непригодными для описания поведения отдельных атомов,
молекул, атомных ядер и элементарных частиц.
В классической механике четко разграничиваются два вида
движения: корпускулярное и волновое. Для корпускулярного движении
характерно, что объект движется по вполне определенной траектории
и в каждый момент времени имеет четкую локализацию в простран=
стве. Для волнового движения, наоборот, характерна делокализаци»
в пространстве. Применительно к волне нельзя сказать, что она
находится в данной точке пространства, не имеет также смысла говорить
ι нййл 3. Квантовомеханические основы биоэнергетики
167
ι· 1|»;1сктории волны. В рамках классических представлений корпу-
ι к ула и волна представляют собой исключающие друг друга противо-
пнпожности. Однако применительно к микрообъектам это четкое
иртивопоставление не имеет смысла. Один и тот же микрообъект
и одних условиях проявляет волновые свойства, а в других - корпу-
'кулирные. Применительно к микрообъектам на смену противопос-
I пилению приходит диалектическое единство частицы и волны, т. е.
имеет место корпускулярно-волновой дуализм.
Первоначально идея дуализма была развита применительно
ь шектромагнитному излучению и связана, главным образом, с рабо-
ΐιΐΜΐι Μ. Планка и А. Эйнштейна. По мнению Эйнштейна, введенные
Ишшком кванты излучения энергии можно рассматривать как своего
рода частицы, позднее названные фотонами. Как всякая частица,
фи юн помимо энергии обладает импульсом. Если энергия фотона:
W=h\ = h-, (3.1)
Λ
iti импульс определяется формулой:
Λν h ,. «.
р=— = -. (3.2)
с λ
Следующий шаг в развитии идеи корпускулярно-волнового дуа-
шпма заключался в распространении этой идеи на частицы вещества.
И 1924 г. Л. де Бройль высказал мысль, что с каждым микрообъектом
ι иедует связывать как корпускулярные характеристики (энергия,
импульс), так и волновые (частота, фаза, длина волны). Л. де Бройль
допустил, что соотношения (3.1) и (3.2) справедливы не только для фото-
luiii, но и для любых микрообъектов, даже для тех, которые ранее
ι рактовались только как частицы (электроны, протоны, нейтроны
и др.). Тогда для свободно движущихся частиц формулу (3.2) можно
шнисать следующим образом:
λ= — . (3.3)
168
Биофизик»
Следовательно, любой частице массой т, движущейся со
скоростью υ, соответствует некоторый волновой процесс, длина волны
которого может быть найдена по формуле де Бройля (3.3).
Экспериментальное подтверждение применимости идеи кор-
пускулярно-волнового дуализма к частицам было дано в 1927 г
К.Д. Дэвиссоном и Л. Джермером, а несколько позже П.С. Тартаков-
ским. Их опытами было убедительно доказано наличие волновых
свойств у пучка свободно движущихся электронов.
Таким образом, волновые свойства присущи любым
движущимся частицам, а формула де Бройля для вычисления длины волны
имеет универсальный характер. В принципе можно приписать
некоторую длину волны любому движущемуся телу, но в случае
макрообъектов она будет чрезвычайно мала. Например, для летящей пули
длина волны оказывается порядка 10~32 м и, следовательно, волновые
свойства .пули дифракционными методами обнаружены быть не
могут. Поэтому можно считать, что у макроскопических тел волновые
свойства практически отсутствуют.
Волне де Бройля, наряду с длиной волны, можно приписать
и амплитуду. Каков же ее физический смысл? Ответить на этот
вопрос можно, рассматривая явление дифракции частиц, например,
электронов. В результате дифракции на экране образуется картина,
представляющая собой чередование дифракционных максимумом
и минимумов. С волновой точки зрения, наличие максимумов
означает наибольшую интенсивность волн де Бройля на определенных
участках, а интенсивность волны пропорциональна квадрату
амплитуды. С другой стороны, интенсивность волны де Бройля в данной
точке пространства, очевидно, связана с числом электронов,
попадающих в эту точку в единицу времени. Попадание же электронов в ту
или иную точку пространства характеризуется определенной
вероятностью. Следовательно, квадрат амплитуды волны де Бройля в
данной точке пространства является мерой вероятности того, что
частица находится в данной точке.
Для описания распределения вероятности нахождения частицы
в данный момент времени в некоторой области пространства в
квантовой механике вводится специальная функция, называемая волно-
ι «βηιι 3. Квантовомеханические основы биоэнергетики
169
щи) функцией. Эта функция обозначается греческой буквой «пси»
и И1НИСИТ от координат пространства и времени: ψ (χ, у, ζ, t). Смысл
in ι ΐι повой функции заключается в следующем: вероятность (w) того,
■ми микрообъект в данный момент времени (t) находится внутри
нестрого объема (ΔΚ), равна произведению квадрата модуля волно-
III ili функции на этот объем:
\ν=\Ψ\2-άν. (3.4)
Величину |Ψ| называют плотностью вероятности:
Описание состояния микрообъекта с помощью волновой
функции подчеркивает статистический характер квантовой механики. Это
шпачает, что применительно к микрообъектам не имеет смысла го-
нприть об их координатах или траекториях движения, а можно лишь
ι помощью ψ-функции оценить вероятность их нахождения в той
и ни иной области пространства.
Волновая функция, являющаяся основным носителем
информации обо всех свойствах микрочастицы, не может быть непо-
| родственно измерена. Поэтому должен существовать специальный
кинематический аппарат для ее определения. Создание такого мате-
митического аппарата связано с именем Э. Шрёдингера, который
и 1926 г. предложил уравнение, позволяющее определять волновую
функцию микрообъекта в конкретных условиях. В квантовой
механике уравнение Шрёдингера играет такую же важную роль, как второй
ткон Ньютона в классической механике и уравнения Максвелла
и шсктродинамике. Подобно закону Ньютона, оно не выводится,
и постулируется. Уравнение Шрёдингера в квантовой механике явля-
С1ся исходным, основополагающим, и поэтому не может быть выве-
цсно из других соотношений. Справедливость этого уравнения дока-
п.шается тем, что выводы, полученные с его помощью, находятся
и хорошем соответствии с экспериментальными данными.
Для стационарных состояний, когда отсутствует зависимость
иг времени, уравнение Шрёдингера имеет вид:
170
Биофизике
¥Σ+¥Σ+¥Σ+*ΞΪΞ(ιν-υ)ψ=ο. (3.5)
дх2 ду2 dz2 h2 K '
где W - полная энергия микрочастицы, Ό - ее потенциальная
энергия, т - масса частицы, h - постоянная Планка. В случае
нестационарных состояний ψ является функцией и пространственных координат,
и времени. Ввиду значительной сложности уравнения Шредингера,
записанного с учетом зависимости ψ от t, в дальнейшем будет
рассматриваться только уравнение (3.5), не содержащее времени.
Решение этого уравнения в условиях конкретных физических
задач приводит к весьма важному выводу - о дискретности величин,
характеризующих микрообъекты. В уравнение Шредингера входит
полная энергия микрочастицы W. Решение уравнения показало, что
только, свободно движущиеся частицы могут иметь любую энергию,
Что же касается связанных частиц, т. е. частиц, движущихся в
ограниченном пространстве (например, в пределах атома или молекулы),
то решение уравнения Шредингера для этого случая возможно
только при некоторых определенных значениях энергии. Это означает,
что связанная частица может иметь только дискретные значения
энергии, называемые собственными значениями. Решения уравнения
Шредингера, соответствующие собственным значениям энергии,
называются собственными функциями. Таким образом, дискретность
энергии, а также и других характеризующих частицу величин
непосредственно вытекает из решения уравнения Шредингера.
Решение этого уравнения предполагает нахождение
собственных значений энергии и собственных волновых функций
микрочастицы, если известна ее потенциальная энергия. Как правило, эта
задача сопряжена с очень большими математическими трудностями,
и точное решение может быть получено только в некоторых,
наиболее простых случаях.
Частица в одномерной потенциальной яме с бесконечно
высокими стенками. Термин «одномерная потенциальная яма»
означает, что частица, например электрон, может перемещаться
только вдоль оси χ в интервале 0 < χ < I (рис. 3.1). Поскольку в
указанном интервале на частицу не действуют силовые поля, ее потен·
«ι 3. Квантовомеханические основы биоэнергетики
171
t t
I I
υ
Рис. 3.1. Одномерная прямоугольная потенциальная яма
с бесконечно высокими стенками
шьная энергия равна нулю. За пределами интервала частицы нет,
ι тому ее потенциальная энергия вне интервала бесконечно велика
hi с бесконечно высокими стенками). Частица заключена в некото-
I области пространства, ограниченной идеально отражающими
ι псами. Модель потенциальной ямы используется применительно
|»|ду систем, например, для описания электронов в металле или
июнов в ядре.
Так как яма одномерная, а потенциальная энергия частицы рав-
пулю, уравнение Шредингера принимает вид:
32Ψ 8π2/κ
дх2 + h2
W4 = 0.
(3.6)
Введем обозначения:
8п2тГТ, 2
——W=(u.
(3.7)
Тогда уравнение (3.6) примет вид:
32Ψ
дх:
■+ω2Ψ=0.
(3.8)
Решение этого уравнения можно записать следующим образом:
Ψ = Λ·5ΐη(ωχ+φ0).
(3.9)
172
Биофизика
Значения ω и <р0 можно найти, учтя граничные условия:
1) при χ = 0 —» ψ = 0. Так как А не может быть равно нулю,
можно написать, что sin (ω 0 + <р0) = 0, откуда следует, что φ0 = 0;
2) при х = Ι ψ также равна нулю и, следовательно, sin ω/ = 0
Из этого равенства видно, что (О/ может принимать значения только
кратные π: ω/ = ηπ, где η = 1, 2, 3,..., а
ω=™. (3.10)
Подставив это значение ω в формулу (3.7), получим:
А2 /2
откуда
2 τ 2
W=^—. (3.12)
8м/2
По этой формуле можно найти собственные значения энергии
частицы. Наличие в формуле (3.12) целого числа η означает, чти
энергия частицы, находящейся в потенциальной яме, может прини
мать только дискретные (квантованные) значения. Число η называс!
ся главным квантовым числом.
Набор собственных значений энергии образует энергетический
спектр частицы, который может быть представлен в виде системы
энергетических уровней (рис. 3.2). Состояние частицы с наименьшей
возможной энергией (и = 1) называются основным. Все остальные со
стояния называются возбужденными. Разность энергий двух соседних
уровней зависит от ширины потенциальной ямы / и от массы частицы
Так, для электронов при / порядка 10~10 м (размер атома) А^оказыва·
ется около 100 эВ. Но при / = 0,1 м Δ ^для электрона оказывается
порядка 10~16 эВ, т. е. при данной ширине потенциальной ямы энергии
изменяется практически непрерывно, и такой электрон можно счи·
тать свободным (например, электрон в электронно-лучевой трубке),
(imea 3. Квантовомеханические основы биоэнергетики
173
nW
/7 = 4
-νν„
л = 3
■W,
л = 2
л = 1
-W,
■W,
Рис. 3.2. Энергетические уровни частицы, находящейся в потенциальной яме
Подставив значения ω в уравнение (3.9), найдем собственные
функции:
Ψ =^sin
кпх
(3.13)
Константа А не зависит от квантового числа и и определяется
шириной потенциальной ямы. Не приводя соответствующего расче-
III, отметим, что
<4
. С учетом этого соотношения получаем
окончи ι сльное выражение для собственных функций частицы,
находящейся в потенциальной яме-
.т/ 12 . πηχ
Ψ, = - sin .
" V/ /
(3.14)
Плотность вероятности нахождения частицы в разных точках
потенциальной ямы можно найти, рассчитав |ψ|2 при разных
значениях х. Зависимость |ψ]* от χ при разных квантовых числах η пред-
I ганлена на рис. 3.3. Из рисунка видно, что вероятность нахождения
шсктрона в разных местах потенциальной ямы существенно различ-
174
Биофизике
М2А
п = 4
\r\/\r\r\j
п = 3
Рис. 3.3. Плотность вероятности нахождения частицы
в разных точках потенциальной ямы
на, в частности вероятность нахождения частицы в некоторых точках
вообще равна нулю. Такое распределение вероятности нахождения
частицы в различных точках лишний раз подчеркивает, что поведс
ние микрочастицы несовместимо с представлением о траектории
движения.
Прохождение частиц через потенциальный барьер
(туннельный эффект). Существует целый ряд процессов, осуществление
которых связано с преодолением частицами некоторого потенциаль
ного барьера. Если высота барьера U больше, чем энергия частицы W
(рис. 3.4), то, с точки зрения классической механики, прохождение
этой частицы через барьер абсолютно невозможно, что не
соответствует эксперименту. Объяснение этого несоответствия дает квантован
теория. Движению микрочастицы соответствует волновой процесс,
называемый волной де Бройля. На границе с потенциальным
барьером волна де Бройля должна вести себя подобно электромагнитной
волне на границе двух сред с различными показателями
преломления. Электромагнитная волна в этом случае частично отражается,
а частично проходит через границу. Волна де Бройля на границе с по·
тенциальным барьером также испытывает не только отражение, но
и частично проходит в область за пределами барьера. Это означает,
что имеется определенная вероятность обнаружить частицу по дру»
гую сторону барьера. Этот специфический квантовый эффект называ·
ι imea 3. Квантовомеханические основы биоэнергетики
175
υ η
υο-
w
Рис. 3.4. Туннельный эффект
•чтя туннельным эффектом. Вероятность прохождения частицы
ι к иозь потенциальный барьер характеризуется величиной D, которая
тпывается коэффициентом прозрачности барьера. Решение
уравнении Шредингера для случая прямоугольного потенциального барьера
ι шлсотой £/и шириной L приводит к следующему выражению:
D = e
-Ljlm(U-W)
(3.15)
ι цс т - масса частицы, W- энергия частицы.
Туннельный эффект играет важную роль в целом ряде физиче-
| к их явлений, таких, как холодная эмиссия электронов из металлов,
||Щ.(|)а-распад и др. Очевидно, что вероятность прохождения частицы
'ii'|)c-j барьер достаточно велика только в том случае, если размеры
||м|и,сра соизмеримы с атомными размерами. При L порядка 10~10 м
(|Ш1мер атома) и (U - W) = 10 эВ, D ~ е~] = 0,37. При переходе
* идсрным масштабам (Z, порядка Ю-15 м) вероятность прохождения
'шпицы через барьер достигает значения е'1 при разности энергий
(/' W) = 10 МэВ, что делает возможным альфа-распад. В
макроскопической области (L порядка 10~2 м) вероятность прохождения части-
через потенциальный барьер ничтожно мала (D « е"10 ), т. е.
» ном случае туннельный эффект практически невозможен.
Атом водорода. Решение уравнения Шредингера примените-
ίμιο к атомам и молекулам является достаточно сложным. Наиболее
176
Биофизика
простыми системами являются атом водорода и водородоподобныс
атомы, например, ионизированный атом Не и другие.
Атом водорода представляет собой систему, состоящую из про
тона и электрона, между которыми существует электрическое притя
жение. Из-за большой разности масс этих частиц протон можно
считать неподвижным. Потенциальная энергия электрона в поле ядра по
закону Кулона равна:
е2
U= —. (3.16)
4де0г
Уравнение Шредингера для атома водорода имеет вид:
^.d^.d^^m_f+^^0 (317)
I 4ке0г
■ + + +-
дх2 ду2 Ъг1
-|f=o.
Как и для электрона, находящегося в потенциальной яме,
решение уравнения Шредингера для электрона в атоме из-за наличия
граничных условий возможно только при некоторых определенных
значениях энергии W. Но, в отличие от одномерной потенциальной
ямы, состояние электрона в атоме характеризуется не одним, а
несколькими квантовыми числами.
Потенциальное поле, действующее на электрон в атоме
водорода, центрально-симметрично, поэтому удобнее вместо
прямоугольной системы координат использовать сферическую (полярную).
В этой системе положение точки задается радиусом-вектором (г)
и двумя углами: Θ и φ (рис. 3.5).
Связь между прямоугольной и сферической системами
координат дается формулами:
χ =r sinOcoscp,
у = rsin©sin<p, (3.18)
ζ = r- cos Θ.
При использовании сферических координат переменные в
уравнении Шредингера разделяются, и ψ-функция может быть представлс·
I imea 3. Квантовомеханические основы биоэнергетики
177
Рис. 3.5. Сферическая система координат
пи как произведение трех функций, каждая из которых зависит только
ш одной координаты:
Ψ(Γ,φ,Θ)=/ι·(0/2·(φ)/3·(Θ).
(3.19)
Каждая из этих функций может принимать только дискретные
ишчения и связана с определенным квантовым числом. Функция fx(r)
снизана с главным квантовым числом и, которое определяет уровни
шергии электрона:
W=-
meAz2
8ε2Λ2η2
(3.20)
Функция /2(φ) связана с орбитальным квантовым числом I.
)лсктрон, двигаясь в поле ядра, обладает моментом импульса,
который обычно называют орбитальным моментом. В классической ме-
кипике момент импульса частицы, двигающейся по орбите радиусом
;, определяется по формуле М = т · г и представляет собой вектор,
направленный перпендикулярно плоскости орбиты. Согласно
законам квантовой механики, точное направление орбитального момента
микрочастицы не может быть задано. Можно только определить ве-
I ι ΊΚ43
178
Биофизика
личину орбитального момента Μ и значение его проекции на
какое-то направление, например, на ось ζ (Μ2).
Из решения уравнения Шредингера следует, что орбитальный
момент электрона в атоме может принимать только дискретные
значения, определяемые орбитальным квантовым числом I:
М=/ц//(/ + 1), (3.21)
где / = 0, 1,2... (й-1),й = А.
2π
При заданном главном квантовом числе и орбитальное
квантовое число может принимать значения от 0 до (и - 1).
Проекция орбитального момента на направление ζ также
квантована и может принимать лишь значения, кратные й:
Mz=m,-h. (3.22)
Целое число /и, называется магнитным квантовым числом.
Термин «магнитное» определяется тем, что механический момент
импульса электрона всегда связан с его орбитальным магнитным
моментом рт, поскольку электрон заряжен. Поэтому в качестве
направления ζ обычно выбирают направление внешнего магнитного поля, в
котором находится атом. При заданном η число mt принимает (2/ + 1)
значений.
Таким образом, каждому значению главного квантового числа
η соответствует несколько волновых функций, описывающих
состояние электрона в атоме. Волновые функции, описывающие состояние
атома при определенных значениях квантовых чисел, Ψη, щ
называются орбиталями. В зависимости от значений квантового числа /
различают орбитали разных типов. При / = 0 имеем s-орбиталь, при
1=1 это/>-орбиталь, при 1 = 2 это ίΖ-орбиталь.
Квантовая теория отрицает существование электронных орбит
в атоме. Решая уравнение Шредингера и находя волновые функции,
получаем лишь суждение о вероятности нахождения электрона в том
или ином месте. Вспомним, что квадрат модуля волновой функции
\\\f\2 определяет вероятность нахождения электрона в объеме AV.
Произведение заряда электрона е на |ψ|2, т. е. е \\у\2, представляет со-
i niwa 3. Квантовомеханические основы биоэнергетики
179
■ίου среднюю плотность заряда в этом элементарном объеме. Зная
|i|/|; в разных точках атома, можно представить статистическое
распределение заряда в атоме для данного квантового состояния. При
мим получается, что заряд электрона «размазан» с различной
плотностью по всему атому, образуя электронное облако. Размер, форма
и расположение этого облака в пространстве определяются видом
шшповой функции и значениями квантовых чисел.
Многоэлектронные атомы. Точное решение уравнения Шре-
инпгера для атома, содержащего несколько электронов, не получено.
При распределении электронов по орбиталям необходимо учиты-
iiii п., что электроны, как и другие микрочастицы, обладают спином.
ι пин представляет собой собственный момент импульса частицы, не
ι пи чанный с ее перемещением в пространстве. Со спином связано на-
инчпе у электрона собственного магнитного момента μ3. Проекция
ι шшового момента импульса на выбранное направление ζ может
принимать только дискретные значения, определяемые спиновым
ынштовым числом ms. Для электрона число ms принимает два
значении: ms =±1/2.
Четверка квантовых чисел (и, /, /и,, ms) характеризует квантовое
11 it тояние отдельного электрона. Принцип Паули гласит, что в атоме
in· может быть двух электронов, находящихся в одном и том же кван-
им состоянии, характеризуемом определенным набором кванто-
Ш.1Х чисел п, I, т, и ms. Электроны с одинаковым η образуют слой (К,
I. Μ, Ν, ...), а электроны с одинаковыми η и / образуют оболочки (15,
\2р...).
3.2. Испускание и поглощение энергии
атомами и молекулами
Уровни энергии в атомах. Любой комбинации квантовых чи-
| πι и, /, т, соответствует определенный энергетический уровень. На
рис. 3.6 представлена в качестве примера система энергетических
уршшей атома водорода. Поглощение и испускание энергии атомом
ι мн 1ано с переходом электрона между энергетическими уровнями.
Гпкис переходы называются чисто электронными переходами.
\\ случае многоэлектронных атомов и молекул следует говорить об
180
Биофизика
энергетических уровнях атома или молекулы, а не об уровнях
отдельных электронов, так как энергию поглощают или испускают атом
или молекула в целом. Если все электроны в атоме находятся на
своих основных уровнях, то атом находится в основном состоянии.
Если один из электронов находится на более высоком энергетическом
уровне, то атом находится в возбужденном состоянии.
В многоэлектронных атомах испускание света связано с
переходами валентных электронов. Переходы более близких к ядру
электронов приводят к возникновению рентгеновского излучения.
Длина волны излучения может быть определена по формуле:
с
h\ = h — = Wk -Wn где WK и Wt — энергии соответствующих уровней.
λ
Так как система энергетических уровней у атомов каждого элемента
своя, спектр атомов имеет линейчатый характер и является
характерным для данного элемента.
Однако детальное изучение линейчатых спектров различных
элементов показало, что в ряде случаев линия не является единичной,
а состоит из нескольких близко расположенных компонент.
Например, характерная для натрия желтая линия на самом деле состоит из
двух близких линий с длинами волн 589 нм и 589.6 нм. Сложные линии
называются мулыпиплетами. Число компонентов в мультиплете может
быть равно двум (дублеты как у натрия), трем (триплеты), четырем
(квартеты) и т. д. Расщепление спектральных линий на мультиплеты
обусловлено, очевидно, расщеплением энергетических уровней.
Система энергетических уровней, представленная на рис. 3.6, получена
путем решения уравнения Шрёдингера без учета спина электрона.
Само понятие спина и было введено для объяснения расщепления
энергетических уровней.
Для многоэлектронных атомов энергетические уровни можно
классифицировать в зависимости от суммарного спина атома. В
атомах с четным числом электронов при антипараллельной ориентации
электронных спинов суммарный спин 5-0. Примером может служить
основное состояние атома Не. Такому состоянию атома соответствует
вполне определенное значение энергии. Подобный энергетический
уровень называется синглетным. Его мультиплетность равна единице.
I пава 3. Квантовомеханические основы биоэнергетики
181
IV, эВ
13,53
11--
10,15
9--
8--
7--
6--
5--
4
3
2--
1--
0
1
Рис. 3.6. Энергетические уровни атома водорода
Если в атоме имеется один неспаренный электрон, то
суммарный спин атома может принимать одно значение s = 1/2. Проекция
спина принимает два значения -ms = ±1/2. При них энергия атома бу-
цс г немного различаться, а это означает, что соответствующий энерге-
I нчсский уровень расщепляется на два близких подуровня. Такой уро-
iici ib называется дублетным. В спектре ему соответствуют две близкие
пинии. Дублетные уровни характерны для всех щелочных металлов.
При наличии в атоме двух неспаренных электронов суммарный
ι мин может принимать два значения: s, = 0 (спины антипараллельны,
t ппглетное состояние) и s2 = 1 (спины параллельны, триплетное со-
I юяние). В первом случае ms - 0, во втором - ms = 0, +1, -1, т. е.
проекция полного спина принимает три значения. Триплетному
состоянию в спектре соответствуют три близкие линии. Мультиплетность
спектральных линий, связанная со спином, называется тонкой
ι труктурой спектра.
Правила отбора, метастабильные уровни. Система
энергетических уровней атома является достаточно сложной и состоит из
Гншыиого числа различных переходов. Однако далеко не все
переходы возможны. Существуют специальные правила отбора, которые
182
Биофизика
определяют, какие квантовые переходы являются разрешенными
(вероятность перехода велика), а какие запрещены. Запрет может быть
строгим (вероятность перехода равна нулю) и приближенным
(вероятность перехода мала, но отлична от нуля). Правила отбора
определяют возможные изменения квантовых чисел при переходе,
поскольку состояния атома характеризуются с помощью этих чисел. Так, при
испускании или поглощении кванта света возможен только такой
переход электрона с одного уровня на другой, при котором орбитальное
квантовое число изменяется на единицу: Δ/ = ±1. Поэтому, электрон
не может перейти с уровня s (/ = 0) на уровень d (I = 2), а может
перейти на уровень ρ (I = 1). Это правило отбора является следствием
закона сохранения момента импульса. Дело в том, что фотон имеет
собственный момент импульса (спин), равный единице. При испускании
кванта фотон уносит из атома этот момент, а при поглощении его
привносит.
Другое правило отбора связано с изменением мультиплетности
состояния. Разрешенными являются переходы, при которых общий
спин атома не изменяется: As = 0. В соответствии с эгим правилом
переход из синглетного состояния в триплетное (или наоборот)
является запрещенным. Однако этот запрет не является строгим, просто
вероятность такого перехода очень мала. Уровень, переход с
которого на более низкие уровни имеет малую вероятность (запрещен),
называется метастабильным. Вследствие малой вероятности перехода
в основное состояние атомы могут находиться в метастабильном
состоянии значительно дольше, чем в любом другом возбужденном
состоянии.
Уровни энергии в молекулах. Схема уровней энергии
молекул является гораздо более сложной, чем у атомов. Это связано с тем,
что в молекулах возможны помимо движения электронов также
колебательное и вращательное движения При колебательном
движении периодически изменяется относительное расположение ядер
в молекуле. При вращательном движении изменяется положение
в пространстве всей молекулы целиком. Полная энергия молекулы
складывается из трех частей:
W= W3n + WKOn + Wt
(3.23)
(пива 3. Квантовомаханические основы биоэнергетики
183
А
W
А
W
"коп
а) б)
Рис. 3.7. Энергетические уровни молекул
a - электронные и колебательные уровни;
б - колебательные и вращательные уровни
Вклад каждого вида движения в полную энергию молекулы яв-
иистся существенно различным: \¥Ίη > WKon > WBp. Энергия колебате-
ш.пого движения частицы также квантуется, поэтому колебательная
•псргия молекул принимает только дискретные значения, характери-
|усмые квантовым числом .
В квантовой механике показано, что и энергия вращающейся
микросистемы (ротатора) квантуется. Следовательно, вращательная
•псргия молекулы тоже принимает дискретные значения,
определяемые квантовым числом j. При поглощении молекулой энергии могут
тменяться все виды энергии. Поэтому полное изменение энергии
молекулы равно:
Δ^=Δ^ + Δ^κοη + Δ^Βρ, (3.24)
причем Δ0;„>Δ0;ωι>Δ0;ρ.
Система энергетических уровней молекулы представляет собой
ι оиокупность далеко отстоящих друг от друга электронных уровней
шергии. Каждому электронному уровню соответствует набор более
Оинзко расположенных колебательных уровней (рис. 3.7, а), а
каждому колебательному уровню соответствует совокупность еще более
н'спо расположенных вращательных уровней (рис. 3.7, б). Такая сис-
I сма энергетических уровней определяет значительно более сложный
чнрактер молекулярных спектров по сравнению с атомными.
Изменение W3ll (электронный переход) связано с поглощением или испускани-
184
Биофизика
ем кванта в видимой или ультрафиолетовой области. Но наряду с Ww
при этом процессе могут измениться WK0„ и WKp. Поэтому данному
электронному переходу в спектре соответствует не одна линия, а ряд
близко расположенных линий, образующих полосу. В случае простых
молекул при исследовании спектра при помощи приборов с большей
разрешающей способностью видны линии, составляющие полосу.
В спектре сложных молекул обычно наблюдается одна или несколько
довольно широких сплошных полос. Такие спекгры называются
электронно-колебательно-вращательными. Они, как правило,
характеризуют молекулу в целом и служат для идентификации веществ.
При поглощении молекулой небольшой порции энергии не
изменяется W^, тогда как колебательная и вращательная энергии могуч
возрасти. При поглощении энергии в дальней инфракрасной области
(λ = 0,1-1 мм) изменяется только вращательная энергия молекул,
и имеет место чисто вращательный спектр. Колебательным
переходам соответствует поглощение в ближней и средней инфракрасной
области (λ= 1-100 мкм). При данном ΔΨΚ0Π в спектре получается
полоса, состоящая из близко расположенных вращательных линий -
колебательно-вращательный спектр. Эти спектры широко
применяются для изучения структуры сложных молекул. Многие группы,
входящие в сложные молекулы (гидроксильная, карбонильная и
карбоксильная группы, водородная связь и др.), характеризуются
вполне определенными частотами колебательных переходов. Наличие
в инфракрасном спектре поглощения полос, соответствующих этим
частотам, говорит о присутствии в молекуле определенных групп.
В молекуле, как и в атоме, различные переходы имеют разную
вероятность, и существуют определенные правила отбора.
Электронные состояния молекулы, как и атома, могут быть
классифицированы в зависимости от суммарного спина молекулы. Два электрона,
соответствующие одной молекулярной орбитали, имеют
антипараллельные спины. При переходе одного из этих электронов с основного
энергетического уровня на более высокий антипараллельная
ориентация спинов обычно сохраняется. Такое возбужденное состояние
называется синглетным, а переход - синглет-синглетиым переходом.
Однако возможны случаи, когда электрон при переходе изменяет
первоначальную ориентацию спина на противоположную. В результате
ι ппва 3. Квантовомеханические основы биоэнергетики
185
пи иысшем энергетическом уровне появляется электрон, не спаренный
ι питавшимся на основном уровне. Такое возбужденное состояние
наминается триплетным. Непосредственный переход из основного со-
ι п)яиия в триплетное запрещен, но возможен процесс, изображенный
ми рис. 3.8: электрон из основного состояния переходит в первое воз-
пуждснное синглетное состояние. Находясь в возбужденном
состоянии, молекула взаимодействует с соседними молекулами и безызлуча-
I πιыю теряет часть своей энергии; в результате этого взаимодействия
шскгрон оказывается на триплетном уровне Т, который является мета-
(ι абильным, так как переход между триплетным и синглетным
состояниями запрещен. Молекула может находиться в таком состоянии до-
нплыго долго, но поскольку запрет является не строгим, электрон
способен в конце концов перейти с уровня Г на основной уровень.
У свободных радикалов, имеющих один неспаренный элект-
|ни1, суммарный спин равен ±1/2 и для них характерны дублетные
(истояния. Следует отметить, что молекулы, находящиеся в триплет-
мим состоянии, имеют два неспаренных электрона и могут
рассматриваться как бирадикалы. Молекулы в дублетном и триплетном со-
гшиииях обладают повышенной химической активностью.
Время жизни возбужденного состояния. Если вещество под-
игргается воздействию определенной энергии, то часть его атомов
пни молекул перейдет в возбужденное состояние или, иначе говоря,
уисличится заселенность высших энергетических уровней. Затем
число возбужденных атомов или молекул будет постепенно самопро-
п шольно (спонтанно) уменьшаться. Число атомов dNki, перешедших
ш ирсмя dt из состояния к в состояние i, пропорционально заселенно-
ι'ι и уровня к (NJk может быть выражено формулой:
S*
So
Рис. 3.8. Синглетные (S) и триплетныеуровни (Г) в молекуле
и схема переходов между ними
186
Биофизик»
-dNu =AkiNkidt, (3.25)
где Аш - коэффициент Эйнштейна для спонтанного излучения. Ои
определяет вероятность того, что атом в течение 1 с самопроизволь
но перейдет из состояния к в состояние i. Запишем формулу (3.25) и
следующем виде:
dN
к±=А.Ж (3.26)
Nk
Проинтегрировав это выражение, получим формулу:
Nk=Nka-e-A»·, (3.27)
которая позволяет определить, сколько атомов или молекул осталось
в возбужденном состоянии по прошествии времени t.
Вместо коэффициента Ак1 часто пользуются величиной ,
которая носит название среднего времени жизни возбужденного
состояния. Величины и Аы связаны соотношением:
— =τ. (3.28)
Λ,
Введя величину , можно формулу (3.27) записать следующим
образом:
Nk=Nko.e~*. (3.29)
Из формулы (3.29) становится ясным физический смысл
Очевидно, это время, в течение которого количество возбужденных
атомов или молекул за счет спонтанного излучения уменьшается в с
раз. Для разрешенных переходов среднее время жизни возбужденно
го состояния составляет порядка 1(Н-10"9с. В метастабильном со
стоянии атом или молекула могут находиться значительно дольше,
так как переход из метастабильного состояния в основное имеет
малую вероятность. Поэтому в веществах, атомы или молекулы кото-
/ пяле 3. Квантовомеханические основы биоэнергетики
187
|н.1х имеют метастабильные уровни, электроны задерживаются на
них уровнях, и в веществе создается повышенная (инверсная) засе-
шипость высших энергетических уровней.
3.3. Квантовомеханические особенности
строения биомолекул
Живые системы на 99% состоят из атомов водорода, углерода,
к in га и кислорода. Большую роль в биохимических процессах игра-
mi также атомы фосфора и серы. Для атомов С, N, О, S и Ρ
характерно наличие «неподеленной пары электронов» и способность легко
ииразовывать кратные связи.
Состояние электронов в атоме описывается волновыми
функциями - атомными орбиталями (АО), которые классифицируются
и твисимости от значения орбитального квантового числа ($-, р-,
ι/ орбитали). АО, которые используются для образования связей, на-
п.жаются валентными орбиталями.
Орбитали рассчитывают по законам квантовой механики. Поэ-
юму раздел биофизики, который посвящен изучению поведения элек-
I роиов в биологических системах, называется квантовой биофизикой.
()п получил импульс развития в работах Альберта Сент-Дьердьи, ко-
трый называл эту область знаний биоэлектроникой и под таким на-
шаиием опубликовал в 1969 г. свою замечательную книгу. Она имела
подзаголовок: «Исследование в области клеточной регуляции,
защитных механизмов и рака».
Электроны в атоме, орбитали которых имеют форму сферы, на-
1ынаются5-электронами (рис. 3.9, а). Ур-электронов (рис. 3.9, б, в, г)
орбитали гантелевидной формы (точнее, формы объемных
восьмерок), расположенные в трех взаимно-перпендикулярных
направлениях. Такие электроны отсутствуют у важнейшего элемента
биологических систем водорода, но зато все другие элементы (С, Ν, Ο, Ρ, S),
составляющие вместе с атомом Η львиную долю биологических
молекул, содержатр-электроны. Углерод имеет 2 неспаренных/>-электрона
пи втором энергетическом уровне (2рх и 2/>у-орбитали). У азота 3 не-
птренных />-электрона на втором энергетическом уровне (2/?х, 2ру,
ili,). У кислорода 2 спаренных (2рх) и два неспаренных (2ру и 2pz)
188
Биофизика
. Рис. 3.9. Атомные орбитали: s- (а), р- (б, в, г), d- (д) электронов
р-электрона на втором энергетическом уровне. Фосфор и сера
содержат />-электроны не только на втором, но и на третьем энергетических
уровнях. Так, у фосфора 6 спаренных (2рх, 2ру, 2р^} /(-электронов на
втором энергетическом уровне и 3 неспаренных (Зрх, Ърг Ър^) р-элект-
рона на третьем энергетическом уровне. Сера имеет 8 спаренных (2/>„,
2ру, 2pz, Зрх) и 2 неспаренных (Зру, Зр^р-эпектронов.
Более сложные орбитали у d- (рис. 3.9, д) и ^электронов в
атоме, причем в основном состоянии ни один из перечисленных выше
элементов (Н, С, N, О, Р, S) таких электронов не имеет.
Однако при возбуждении (рис. 3.10, Р*) один из двух s-элект-
ронов фосфора с третьего энергетического уровня (35) переходит на
вакантную Зй?-орбиталь и тогда у фосфора на третьем
энергетическом уровне оказывается 5 неспаренных электронов: один s-элект-
рон, три /(-электрона, один й?-электрон. В этом случае валентность
фосфора равна не трем (как в покое), а пяти. Для возбуждения серы
(рис. 3.10, S*, S**) также характерно заполнение вакантных 3ί/-ορ6Η-
талей, причем как одной, так и двух. В первом случае (рис. 3.10, S*)
один из двух электронов переходит с 3/\-орбитали на З^-орбиталь,
и сера из двухвалентной становится четырехвалентной (с четырьмя
неспаренными электронами на третьем уровне). Во втором варианте
ι ипва 3. Квантовомеханические основы биоэнергетики
189
u
2β 2рх 2ру 2рж 3s 3pr 3py Зр,
3d
ρ и о или на
-И О ПЛИ Щ
1
Is
2s гр, 2^ 2рж 3s Зрж Зру Зр,
3d
и иппо
И ОИШ
И И ИЛИ
И О, ,
и с;·;.
1
ос; ;·
МММ
"
I
ч
Aic. 3.7ft Квантовые ячейки атомов фосфора (Ρ, Ρ ) и серы (S, S , S )
в основном состоянии (Р, S) и при возбуждении (Р , S, S )
тома серы (рис. 3.10, S**) на З^-орбиталь переходят два электрона:
шиш - с Зрх (как и в первом варианте), а второй с З^-орбитали, и
таким сера шестивалентна (с шестью неспаренными электронами на
фсгьем энергетическом уровне). Следовательно, за счет
распаривании электронов сера, в отличие от кислорода, может быть не только
пиух-, но также четырех- и шестивалентной.
Состояние электрона в молекуле также может быть описано
ι помощью волновой функции, именуемой в данном случае не атом-
iinii, а молекулярной орбиталъю (МО). Волновые функции,
описывающие состояние электронов в молекулах, подчиняются уравнению
111рсдингера, однако решение его оказывается чрезвычайно сложным.
11|щ учете межэлектронного отталкивания невозможно разделить
переменные в уравнении Шредингера ни в какой системе координат.
I In»тому даже для двухэлектронной задачи не найдена точная
волнении функция. На практике расчет молекулярных орбиталей осуществ-
'шется различными приближенными методами, среди которых наибо-
nt'c распространенным является метод ЛКАО (линейной комбинации
томных орбиталей). Этот метод основан на предположении, что на
190
Биофизика
электрон, когда он находится в молекуле вблизи ядра какого-либо
атома, в основном действуют силы со стороны данного ядра и других
электронов, расположенных вблизи от этого ядра. По-видимому, эти
силы не очень отличаются от сил, действующих на электрон в
соответствующем атоме, и можно предположить, что МО электрона,
находящегося вблизи ядра какого-либо атома в молекуле, должна напоми
нать АО электрона в данном атоме. Поэтому МО электрона можно
представить в виде линейной комбинации атомных орбиталей.
Рассмотрим образование и свойства МО молекул, содержащих
атомы С, N, О. Валентными орбиталями этих атомов являются орби-
тали 2s и 2р Так как различные 2/>-орбитали по-разному ориентиро
ваны в пространстве, необходимо выбрать систему координат. В ка
честве единой оси для всех молекул выбирается ось Ζ В данной
системе координат различают 2рх-, 2ру- и 2/7,,-орбитали, обладающие
разными свойствами. Молекулярные орбитали будут получаться пу
тем комбинации атомных орбиталей, способных перекрываться меж
ду собой. В зависимости от того, какие АО образуют данную МО,
различают молекулярные σ-орбитали и π-орбитали.
Молекулярные σ-орбитали создаются при перекрытии двух
5-орбиталей (рис. 3 11, a), s- и/>-орбиталей, двух р-орбиталей на оси
Z, вдоль которой два атома взаимодействуют друг с другом
(рис. 3.11,6).
Молекулярные π-орбитали возникают при взаимодействии
р-орбиталей двух атомов вдоль осей X или У, перпендикулярных осп
Ζ (рис. 3 11, в)
Молекулярная σ-орбиталь (рис. 3 11, а, б) имеет форму эллин
соида, который обхватывает ось Ζ и «покоится» на ней. Атомы, объе
диненные σ-связью, обладают свободой вращения вокруг нее (т. с
относительно оси Ζ), поскольку облаку эллипсоидальной формы
присуща осевая симметрия. В химических формулах σ-связь обозна
чается одной чертой (одиночная или ординарная связь).
Молекулярная π-орбиталь (рис. 3.11, в) представляет собой
двойное двухдольное облако (в разрезе - форма фасоли), которое на
подобие манжеты «парит» над осью Ζ Заряд каждого π-электрона
распределен симметрично вокруг оси, перпендикулярной направлс-
(пива 3. Квантовомеханическив основы биоэнергетики
191
Рис. 3.11. Образование молекулярных орбиталей - а-орбиталей
(а, б) и π-орбиталей (в)
■■ню одиночной связи (оси Z). Поэтому π-электроны находятся всег-
411 вне плоскости молекулы, образуя двойные связи между атомами
и обусловливая высокую реакционную способность при химическом
и ыимодействии.
Молекуле, обладающей π-электронами, присущи нелокализо-
напные многоцентровые орбитали, принадлежащие не отдельным
α сомам, а всей молекуле в целом. Единое облако π-электронов по-
шоляет им мигрировать не только в пределах своей молекулы, но
и переходить с молекулы на молекулу, если они структурно
объединены в ансамбли. Явление межмолекулярного переноса было откры-
III Дж. Вейсом в 1942 г., а квантовомеханическая модель это процес-
■ и разрабатывалась Р. Малликеном в 1952-1964 гт.
Находясь в клетке, биомолекулы «живут», обмениваясь энер-
I ней и зарядами, а значит, информацией благодаря развитой системе
^локализованных π-электронов. В клетках строгая упорядоченность
молекул обеспечивается прежде всего биологическими мембранами.
Вместе с тем важнейшая миссия π-электронов в биологических
процессах связана не только и не столько с их делокализацией,
сколько с особенностями энергетического статуса: разность энергий
in пивного и возбужденного состояний значительно меньше, чем
г а-электронов (рис. 3.12), и, что особенно важно, примерно равна
ч/гргии фотона (hv) в видимой области электромагнитного спект-
192
Биофизике
π·
AWa
ΔΜι
С
Рис. 3.12. Энергетические уровни σ-электронов (в покое σ и при возбуждении σ )
и π-электронов (в покое π и при возбуждении π )
pa: Α1¥π и Λν. Поэтому молекулярным системам, обладающим π-элек
тронами, присуще эффективное поглощение энергии солнечного из
лучения в видимом диапазоне.
Благодаря этому именно π-электроны способны аккумулиро
вать (конвертировать) солнечную энергию, за счет чего с ними
связано все энергообеспечение биологических систем. Поэтому
π-электроны принято называть электронами жизни.
Определение энергий π-электронов в исследуемой системе
важнейшая задача квантовомеханических расчетов молекулярных
орбиталей. В этих расчетах устанавливают также характер
распределения плотности заряда по скелету молекулы и распределение орби
тали в пространстве и во времени.
Выше было сказано, что для атомов О, N, S, Ρ характерно
наличие неподеленных пар электронов. Дело в том, что электроны, спа
ренные на одной орбитали, не имеют возможности образовывать
связи с электронами других атомов, и валентность атома определяется
числом его неспаренных электронов. Однако электронные пары,
которые в изолированном атоме занимают орбитали в той же оболочке
или подоболочке, что и валентные электроны, сильно влияют на об-
I /мая 3. Квантовомеханические основы биоэнергетики
193
|мювание связей и свойства молекул. Такие электронные пары назы-
ишотся неподеленными парами. Азот и фосфор имеют по одной не-
III>деленной паре, кислород и сера - по две.
Делокализация электронов в сопряженных системах. Все
многоатомные молекулы могут быть разделены на две большие
ι |)уппы: несопряженные системы и сопряженные системы.
Несопряженные системы содержат только ординарные связи
пин же в них имеются изолированные кратные связи, отделенные
ц|>уг от друга или от атомов с неподеленной парой электронов, по
крайней мере, одним атомом с насыщенной валентностью. Такие
мопс кулы можно рассматривать как составленные из примыкающих
пру г к другу и почти не зависящих друг от друга связей, каждая из ко-
трых описывается локализованной двухцентровой МО, аналогичной
МО в двухатомной молекуле. Свойства образующих молекулу связей
I шсргии связей, длины связей и т. д.) постоянны, и для одной и той
*ι· связи, входящей в разные молекулы, изменяются незначительно.
Сопряженные системы представляют собой молекулы,
содержащие несколько кратных связей, в которых участвуют соседние
iiuiMbi или же молекулы, в состав которых входят атомы с
неподъемными электронными парами, расположенные рядом с кратной
ι μίμο. Для таких систем характерны нелокализованные многоцент-
рмиые МО, относящиеся к молекуле в целом или, по крайней мере,
ь большей ее части. Рассмотрим более подробно сопряженную сис-
и-му на примере молекулы бутадиена: СН2 = СН - СН = СН2. В этой
молекуле ординарные связи С - С и С - Η расположены компланарно
Ipnc. 3.13, а), тогда как 2/?г-орбитали атомов углерода ориентированы
параллельно друг другу и перпендикулярно к плоскости молекулы
(рис. 3.13,6).
Такая ориентация способствует максимальному перекрыванию
прГшталей и обеспечивает наибольшую устойчивость всей системы.
7',-орбиталь атома С2 может одинаково хорошо перекрываться
ι .'/^-орбиталью как атома С,, так и атома Сз. Вследствие этого нельзя
ι читать, что />-электрон атома С2 образует связь лишь с р-электрона-
ми атома С, или атома С3, т. е. нельзя говорить о строгой локализации
/' электронов между двумя соседними атомами. Это означает, что
игщ.зя говорить о существовании изолированных двойных связей;
ι ι ΊΚΊ3
194
Биофизика
Η Η
а) б)
Рис. 3.13. Структурная формула молекулы бутадиена (а) и расположение
2рх-орбиталей атомов углерода в молекуле бутадиена (б)
двойные связи в данном случае делокализованы. Четыре 2/^-орбитали
образуют единое облако π-электронов, определенным образом рас
пределенное по всей молекулярной структуре. Следовательно, нес
электроны бутадиена можно разделить на 2 группы: σ-электроны, ко
торые образуют скелет локализованных связей, и π-электроны, обрп
зующие единую подвижную систему, простирающуюся вдоль вест
скелета σ-связей.
Если молекула с сопряженными связями содержит атомы, of)
ладающие неподеленными электронными парами, то электроны этих
пар могут включаться в общую систему π-электронов.
Существование делокализованных π-электронов является важ
нейшим свойством молекул с сопряженными связями. Основные хи
мические, физико-химические и биохимические свойства таких сие
тем определяются π-электронами, так как они гораздо подвижнее
σ-электронов и с большей легкостью вступают в химические реакции
Все наиболее важные биомолекулы, с которыми связаны осноп
ные функции живой материи, представляют собой полностью или
частично сопряженные системы. Так, наиболее важными составляю
щими частями нуклеиновых кислот являются сопряженные гетеро
циклы - пуриновые и пиримидиновые основания. Белки содержат изо
лировапные сопряженные участки (пептидные связи), но, возможно,
что их вторичная и третичная структуры предрасполагают к общей дс-
локализации электронов. Большинство ферментов проявляет
каталитическую активность только в сочетании с коферментами, которые
практически все представляют собой сопряженные системы. В
богатых энергией фосфатах подвижные электроны концевой фосфатной
' nunr 3. Квантовомеханические основы биоэнергетики
195
ι руины взаимодействуют с электронами других фосфатных групп
и с электронами органического радикала.
Делокализация электронов придает молекуле дополнительную
ι шбильность, например, устойчивость к действию излучений, и
обеспечивает возможность протекания таких реакций, которые не харак-
|||>пы для молекул других типов, а именно, возможность переноса
искфонов и энергии между молекулами, объединенными в ансамб-
ш (прежде всего, в биологических мембранах).
Приведем пример, иллюстрирующий значение строения моле-
куны для ее биологической функции. Нуклеотиды, входящие в со-
I ми) молекулы ДНК, могут существовать в различных формах,
отличи ющихся стереоструктурой - положением водорода в молекуле.
I |1кие формы называются таутомералш, а переход из одной формы
it другую - таутомерным переходом. Так, для гуанина переход
I > 2 (Г-Г*) связан с переносом протона от атома азота к атому кис-
К1|юда (рис. 3.14).
Обе таутомерные формы устойчивы, что отображает энерге-
шческая диаграмма. Уровни энергии протона в обеих формах ле-
•ιηιι в соответствующих потенциальных «ямах». Для изменения
^А
Рис. 3.14. Схема, иллюстрирующая таутомерный переход (I —> 2)
с переносом протона от атома азота к атому кислорода в молекуле гуанина
196
Биофизик»
своего положения в молекуле гуанина протоны должны
посредством туннельного перехода преодолеть потенциальный барьер,
высота и форма которого сильно зависят от состояния системы
π-электронов.
В молекуле ДНК соблюдается строгая комплементарность:
гуанин связан с цитозином и аденин - с тимином. Если произойдет тауто-
мерный переход в молекуле гуанина, то она будет комплементарно
сочленяться уже не с цитозином, а с тимином (рис. 3.15). Следовательно,
наличие у молекулы ДНК делокализованной системы π-электроноп,
а также ее состояние могут играть важную роль в возникновении
мутаций. Так, действие ионизирующей радиации, которое, как
известно, увеличивает вероятность мутаций, изменяет состояние электронои
в молекуле ДНК, что и приводит к выраженному биологическому
эффекту.
Следует отметить также, что протон, находящийся в
потенциальной «яме», способен изменять свою энергию при действии
различных излучений, что тоже сказывается на частоте мутаций. Такими
1
^м_/ N-H н/\'
H-N
Η
Η Ν—'χ
Ν-Η 0^4Ν/
/ Ι
Η Η
2
уч_/°-н <j>
Ν—{ Ν Η-Ν^γ-0"3
Ν Ν~{ | ||
Ν-Η 0^4Ν/
/ Ι
Η Η τ
Рис 3.15. Сочетание нуклеотидных оснований в молекуле ДНК
1 -до таутомерного перехода в гуанине (гуанин - цитозин. Г— Ц),
2 - после таутомерного перехода в гуанине (гуанин - тимин, f-T)
• та» 3. Квантовомеханические основы биоэнергетики
197
'|ш к горами могут являться электромагнитные поля радиочастотного
шнпазона, ультрафиолетовое и рентгеновское излучения.
Существование в молекуле ДНК подвижной системы π-элект-
||||||ов играет важную роль и в механизмах передачи генетической ин-
'||ц|>мации - в репликации ДНК. Этот процесс начинается с того, что
тмплементарные нуклеотидные основания одной из пар расходятся,
•IIit невозможно без затрат свободной энергии. Один из возможных
in ι очников - энергия электростатического отталкивания облака элек-
φιιιιΟΒ, поляризованного под действием электрического поля среды,
шфужающей молекулу ДНК. Вероятность подобного механизма
увенчивается при возбуждении π-электронов и при ионизации нуклео-
шдов. Поэтому репликация ДНК может начаться под действием тех
*с факторов, которые вызывают мутации.
Спектры поглощения сложных молекул. Важнейшим
источником информации о структуре сложных молекул являются их спект-
|ΐι.ι поглощения. Изучение спектров поглощения в ультрафиолетовой
и ппдимой областях позволяет получить сведения о системе
электронных энергетических уровней молекулы и о вероятности переходов
и г жду ними. В основном состоянии молекулы все ее электроны
распределены по низшим молекулярным орбиталям (МО), выше которых
располагается ряд свободных орбиталей с более высокой энергией.
Птшее возбужденное состояние соответствует переходу электрона
ι и исшей заполненной на низшую свободную орбиталь.
Классификации электронных переходов в сложных молекулах связана с типами
М(), между которыми происходит переход. Система МО сложных ор-
I иппческих и биологически важных молекул состоит из локализован-
χ σ-орбиталей, локализованных и делокализованных π-орбиталей,
и шкже и-орбиталей, на которых находятся электроны неподеленных
ип|| атомов О, N, S. Заполненные орбитали обозначаются символами
it, π, η, а свободные - символами σ* и π*. Порядок возрастания энер-
I ни орбиталей обычно бывает таким: σ<π</?<π*<σ* (рис. 3.16).
И биологически важных макромолекулах возможен целый ряд пере-
нодов, обозначаемых символами σ —» σ*, π —» π*, η —» π* η —»σ*. Сре-
ιιιι )тих переходов наибольший интерес представляют π —» к*-перехо-
щ.1. Соответствующие этим переходам полосы в спектрах поглощения
198
Биофизик»
σ—» σ- π—» σ-
π—>π· η—>π·
;ι
11
Αια З./tf. Гилы электронных переходов в сложной органической молекуле
обычно имеют довольно большую интенсивность и лежат в ближней
ультрафиолетовой или видимой областях спектра. Полосы, соответег
вующие σ—» а*-переходам, обычно лежат в далекой ультрафиолете
вой части спектра. При η —»π*- или η —» а*-переходах один из элект
ронов неподеленной пары переходит соответственно на π*- или
а*-орбиталь. Полосы, соответствующие этим переходам, имеют, ки»
правило, малую интенсивность.
Для π —» π*-переходов характерно то, что при наличии системы
сопряженных связей поглощенная энергия кванта света передается не
отдельному электрону, а всей коллективизированной π-электронной
системе. Поэтому наличие у молекул делокализованных π-электроно»
может быть обнаружено по присутствию характерных полос в
спектрах поглощения этих молекул. Рассмотрим два примера.
В состав белков входят остатки таких аминокислот:
триптофан, тирозин, фенилаланин, которые поглощают энергию в
ультрафиолетовой части спектра. Несмотря на довольно значительные
различия в структуре, спектры этих молекул сходны между собой
Наличие у всех этих молекул развитой системы делокализованных
π-электронов приводит к появлению в их спектрах широкой полосы
поглощения в области 260-280 нм, обусловленной π —»71*-переходв-
ми (рис. 3.17).
Резюмируя сказанное, можно отметить, что существование dt·
локализованных п-орбиталей является, по-видимому, важнейшим
свойством биологических молекул. Чрезвычайная подвижность π-элек·
тронов обусловливает большую реакционную способность таких мо·
' мяля 3. Квантовомеханические основы биоэнергетики
199
Η ΝΗ,
I I
— с—с—соон
>^ч -С-С
1 > ι
^ 1 J н н
'' D, oth. ед.
Η ΝΗ2
2 HO<f *>С— С— СООН
Η Η
Η ΝΗ,
3 <\ZZ^>C— С— СООН
Η Η
240
260
280
λ, нм
Рис. 3.17. Структурные формулы и спектры поглощения ароматических
аминокислот: 1 — триптофана, 2 — тирозина, 3 - фенилаланина
ΝΗ,
1
14
ι;
ю
η
η
4
1
η
ι D, oth. ед.
2
1
1 I
Ν
С \
Ι йн
Η
Ο
2 Ι
^CX.^Nv
СН
ο
3 Ι
ΗΝ С— СН3
Η
ΜΙΝ
ΝΗ2
ΗΝ С \ Ν
Η Ι
Ν СН
Ι
СН
Ν-"
Η
220
240 260 280 300 λ, нм
Рис. 3.18. Структурные формулы и спектры поглощения пуриновых
ι/ пиримидиновых оснований: 1 — аденина, 2 - гуанина, 3 — тимина, 4 — цитозина
200
Биофизика
лекул и делает возможным перенос энергии и заряда по цепи сопря
женных связей. Поэтому можно сказать, что молекулы в клетке
«живут», обмениваясь энергией и зарядом, а сделать это им позволя
ет наличие развитой системы делокализованных π-электронов. На
существовании сопряженных связей в биологически важных
молекулах базируется динамичность жизненных процессов.
Молекула ДНК содержит 4 нуклеотидных основания - аденин,
тимин, гуанин и цитозин, которые различаются по структуре. Однако
в спектрах поглощения этих оснований много общего (рис. 3.18). Вес
они имеют максимум, близкий к 260 нм, поскольку за поглощение
ультрафиолетового излучения у них ответственна в основном систе
ма π-электронов.
3.4. Механизмы переноса энергии и заряда
в биомолекулярных системах
Наличие у биологически важных молекул
коллективизированной системы π-электронов, способных принимать и отдавать энергию
и заряд, позволяет им активно участвовать в разнообразных
процессах жизнедеятельности. Здесь уже на квантовом уровне сталкиваемся
с проявлением диалектического единства структуры и функции. Оно
отображается так называемой «электронной схемой жизни»,
иллюстрирующей значение коллективизированной системы π-электроноп
биомолекул в фотосинтезе и клеточном дыхании. При переносе
подвижного электрона по цепи структурно связанных между собой
макромолекул происходит преобразование солнечной энергии во вес
формы работы, совершаемой биологическими системами.
Для сложных органических молекул характерны
внутримолекулярный и межмолекулярный переносы энергии и заряда. Так,
каждая из двух или более автономных систем π-электронов молекулы
может проявлять спектральную независимость и вместе с тем
взаимодействовать с другими. Взаимодействие π-электронных систем
внутри молекулы связано с миграцией энергии по ней, т. е. с переносом
энергии между разными функциональными группами этой молекулы.
Например, в молекуле, представляющей собой гибрид антрацена
(nana 3. Квантовомеханические основы биоэнергетики
201
w
^^^i^^V^^4^— сн2— сн2— сн2—fi[^
\
t
Рис. 3.19. Внутримолекулярный перенос энергии возбуждения.
Направление переноса показано пунктирной стрелкой
и нафталина, метиленовые группы «разобщают» коллективирован-
lii.io части молекулы (рис. 3.19). Однако эти группы не препятствуют
трсносу энергии внутри молекулы, о чем свидетельствует появление
пюминесценции антрацена при возбуждении молекулы в полосе по-
I иощения нафталина.
Чрезвычайно важной для жизнедеятельности является
способность биомолекул передавать энергию. Под миграцией энергии
понимается безызлучательный обмен энергией между электронно-воз-
(■ужденной молекулой - донором (D) и молекулой в основном
ι исгоянии - акцептором {A): D* + А —»D + А*.
Миграция энергии - физический процесс, не
сопровождающийся химическим изменением вещества. Она может происходить
кик между одинаковыми, так и между разными молекулами в
направивши от более высокого к более низкому или одинаковому
энергетическому уровню. Известно несколько механизмов миграции энергии:
индуктивно-резонансный, обменно-резонансный, полупроводнико-
1ши и экситонный. Рассмотрим кратко эти механизмы.
Индуктивно-резонансная миграция энергии. Исходным фак-
itiM, который заставил принять концепцию индуктивно-резонансной
миграции энергии, было явление сенсибилизированной
флуоресценции красителей, т. е. эффективное возбуждение флуоресценции
молекул акцептора светом, поглощаемым молекулами донора. При
определенных условиях к акцептору безызлучательным путем передавалась
202
Биофизике
практически вся энергия донора через большие межмолекулярные
расстояния (порядка 2-10 нм). Такая ситуация наблюдается только в
тех случаях, когда спектр флуоресценции донора и спектр поглощения
акцептора перекрываются. Эффективность миграции прямо
пропорциональна площади перекрытая, т. е. чем больше одинаковых для
переходов D* —>D и А —>А* частот, тем выше вероятность резонанса.
Однако этот процесс представляет собой более сложное явление, чем
простая реабсорбция молекулой акцептора светового кванта,
излученного молекулой донора. При классическом рассмотрении можно
считать, что электронные системы молекул D* и А представляют собой
механические осцилляторы (наподобие маятников), способные
колебаться с одинаковой частотой и взаимодействующие друг с другом,
Когда молекула Л оказывается поблизости от молекулы D*,
появляется определенная вероятность того, что молекула/)* прежде чем
испустить фотон, передаст акцептору свою энергию возбуждения.
Такому процессу присущи две важные особенности.
Во-первых, перенос энергии происходит с очень высокой скоростью.
Во-вторых, перенос энергии может происходить на довольно
значительные расстояния. Например, эффективный перенос энергии в
растворах наблюдается на расстояниях, превышающих 10 нм, причем
для миграции энергии не требуется высокоупорядоченной
организации молекул, участвующих в нем.
Обменно-резонансная или триплет-триплетная миграция
энергии. Перенос энергии по триплетиым уровням молекул был
впервые обнаружен А.Н. Терениным и В.Л. Ермолаевым в 1952 г.
При обменно-резонансной миграции энергия переносится с трип-
летного уровня молекулы D на триплетный уровень молекулы
A(3D + ]А —»D + гА) не в результате индуктивно-резонансного
взаимодействия молекул, а при прямом перекрывании «триплетных»
электронных орбиталей (электронных облаков) за счет
электростатических взаимодействий электронов донора и акцептора. Чем
больше объем области перекрытия, тем вероятнее перенос, при котором
партнеры обмениваются электронами: акцептор получает богатый
энергией электрон донора, отдавая ему свой бедный энергией
электрон. Отсюда возник и сам термин «обменно-резонансный» перенос.
1 иялн 3. Квантовомеханические основы биоэнергетики
203
Полупроводниковая миграция энергии (зонная
проводимость). Как известно, в твердых телах энергетические уровни
валентных электронов образуют энергетические зоны, внутри которых могут
перемещаться электроны и дырки. Таким образом, в
противоположность другим механизмам миграции энергии, полупроводниковый
I нпшый) перенос энергии связан с переносом зарядов, что делает
возможным пространственное разделение окислителя (дырки) и восста-
шшителя (электрона), а также длительное запасание энергии в ловуш-
кпх электронов, в качестве которых могут выступать примеси.
С вопросом о миграции энергии и зарядов внутри молекул
тесни связан вопрос о полупроводниковых свойствах биологически
ни жмых макромолекул. Так, π-электронное взаимодействие между
основаниями в молекуле ДНК приводит к тому, что эту гигантскую
молекулу можно рассматривать как одномерное твердое тело и
изучить с позиций зонной теории. Проводимость кристаллов ДНК возра-
II нет при облучении светом, что отвечает переходу электронов из
заполненной валентной зоны в свободную зону. Не известно, правда,
к какому типу полупроводников (и или р) можно отнести ДНК. Ис-
ι очником электронов, осуществляющих проведение тока, служат,
по-видимому, примеси. Возможность движения электронов вдоль
молекулы ДНК между нуклеотидными основаниями появляется бла-
тдаря перекрыванию π-электронных систем этих оснований.
Экситонная миграция. При образовании пары электрон -
цырка в кристаллах, когда электроны переходят из валентной в
свободную зону, возникают так называемые экситоны. Они образуются
м тех случаях, когда энергия возбуждения меньше, чем ширина
запрещенной зоны. При этом электрон и дырка не могут независимо
перемещаться в кристалле, а будучи связанными друг с другом, обра-
|уют электрически нейтральную квазичастицу — экситон.
Перемещаясь по кристаллу, экситон переносит энергию, но не
переносит электрического заряда. Экситоны возникают обычно в мо-
некулярных кристаллах, в которых внутримолекулярные связи значи-
и'льно сильнее, чем связь молекул между собой. Такой тип миграции
шергии часто наблюдается, например, в препаратах ДНК и белков,
•по подтверждает возможность необычайно быстрого и эффективно-
к) переноса энергии в высокоорганизованных молекулярных систе-
204
Биофизики
мах. Время экситонного переноса энергии составляет 10й с. Таким
высокая скорость миграции позволяет полностью избежать ποτερι.
энергии возбуждения молекул. Экситонный перенос является одним
из возможных механизмов переноса энергии при фотосинтезе.
Перенос заряда. Важным свойством сложных биомолекул, об
ладающих развитой системой двойных связей и делокализованноп
π-электронной системой, является их способность к межмолекуляр
ному переносу заряда.
Рассмотрим кратко комплексы с переносом заряда. Комплекс
это пара взаимодействующих молекул, одна из которых отдает элект
роны (донор), а другая - принимает их (акцептор). Перекрывание мо
лекулярных волновых функций, а с ним и вероятность переноса заряди
сильно зависят от положения энергетических уровней донора и акцеп
тора, в соответствии с чем различают несколько вариантов переноса.
• Так, слабый перенос не может идти без поглощения квантоп
света. Условно здесь можно выделить два крайних случая. Первый
изних:Л+£> ),v >A...D^A-...D + .
Молекулы А и D слабо взаимодействуют в основном состоя
нии. При возбуждении светом происходит фотоперенос электрона г
заполненной молекулярной орбитали донора на свободную орбиташ.
акцептора, что проявляется в существовании у комплекса А ... D ха
рактеристической полосы поглощения, отсутствующей в спектрах
изолированных молекул AuD (рис. 3.20, а). Такая полоса называете»!
полосой переноса заряда (ПЗ). Ее максимум приходится на обласп,
более длинных волн, чем максимум полосы поглощения донора. По
еле облучения комплекса в полосе ПЗ донор и акцептор представля
ют собой своеобразную ионную пару, т. е. в возбужденном состоя
нии комплекс практически ионизируется под действием света.
Второй случай слабого переноса заряда можно изобразить так
A + D—^->(Л...£>)*.
При электронном возбуждении одного из компонентов комп
лекса образуется его связь с другим компонентом. В этом процессе
можно выделить два этапа. Вначале донор при поглощении света пере
ходит в возбужденное состояние: D ———> £>*. В возбужденном состо
янии D* взаимодействует с А и образует комплекс D* + А —» {А ... D)*
I /шва 3. Квантовомеханические основы биоэнергетики
205
a) hv
—О ■
А
б) Λν
-о о-
А
в)
О О--^
D
—о о—
А
Рис. 3.20. Схема, иллюстрирующая образование комплекса с переносом заряда
а, б- слабый перенос, в - сильный перенос
(хша уровней, между которыми происходит электронный перенос,
показана на рис. 3.20, б.
Сильный перенос электрона может происходить в темноте
(рис. 3.20, в). Здесь при переходе электрона с орбитали донора на
акцепторную орбиталь энергия выделяется, а не поглощается. Если она
достаточна для преодоления электростатического притяжения
электрона к донору, то электрон переносится на акцептор без освещения
комплекса. Комплекс, образующийся при сильном переносе, способен
ипссоциировать в растворителе на два свободных радикала. Они ин-
I снеивно поглощают свет разных длин волн, в силу чего раствор
приобретает окраску. Важно отметить, что перенос электронов по
макромолекулам, сопровождающийся во многих случаях образованием
('нободных радикалов, имеющих высокую реакционную способность,
ииляется обязательным предшественником большинства
биохимических реакций.
Способность к передаче энергии и заряда - очень важное свой-
II во биомолекул, определяемое во многом особенностями их строе-
206
Биофизике
ния. Рассмотрим конкретный пример переноса энергии и заряда в би-ι
ологической системе.
Перенос энергии и заряда при прямом действии
ионизирующей радиации на белки и нуклеиновые кислоты. В результате
одиночного взаимодействия кванта ионизирующего излучения с мо«
лекулой белка или нуклеиновой кислоты эти молекулы могут
утратить свои функциональные свойства, если процесс идет с
поглощением энергии порядка 60-70 эВ. Между воздействием излучения на
макромолекулу и ее инактивацией происходит ряд последовательных
физико-химических процессов. Кроме того, установлено, что
инактивация белков и нуклеиновых кислот нередко связана с повреждением
структуры макромолекулы, которое возникает не в любом, в
определенном ее участке. Селективность действия облучения объясняют
миграцией поглощенной энергии по макромолекуле с локализацией
ее в определенном «слабом» звене, в котором и произойдут
дальнейшие химические изменения. Таким «слабым» звеном может быть
один из аминокислотных остатков, составляющих молекулу белка,
или одно из нуклеотидных оснований, входящих в молекулу ДНК.
Рассмотрим некоторые закономерности ионизации и миграции
энергии и заряда в молекулах белков. Эти молекулы имеют огромное ι
количество химических связей и по структуре напоминают скоревП
«малые кристаллы», чем молекулы. В полипептидной цепи белка ато·]
мы «соединены» ковалентными связями, обусловленными обменом]
электронов между двумя соседними атомами. В образовании таких]
связей участвуют как σ-, так и π-электроны.
Предположим, что под действием гамма-кванта атом углерода^
показанный справа на рис. 3.21, а, теряет электрон, который обеспв*|
чивал связь этого атома с соседними.
В малой молекуле подобное событие привело бы к ее распада
тогда как в ионизированной макромолекуле атом, потерявший электч
рон, остается на своем месте (по крайней мере, в течение долей се^|
кунды), но несет теперь положительный заряд. Ч
Он эквивалентен дырке в полупроводнике. Поэтому электро!
соседнего атома стремится перейти к атому с дыркой. Такое движв
ние электрона соответствует перемещению дырки в противополозю
ном направлении, например, к атому азота и далее (даже в боковун
/ ппва 3. Квантовомеханические основы биоэнергетики
207
Рис. 3.21. Действие ионизирующего излучения на белки (а)
и нуклеиновые кислоты (б). Направление миграции дырок в молекуле указано
стрелками. Стрелка в кружке обозначает неспаренный электрон. £J и Ег-
локальные напряженности электрического поля
цепь - R - SH). Каждый такой «шаг» заряда занимает время, необхо-
нпмое для одного электронного перехода (порядка 10~15 с). Миграция
шряда по цепи равносильна переносу «избыточной» энергии возбуж-
нения. Благодаря миграции энергии и заряда дырка достигает любого
цоступного места цепи в течение примерно 10~12 с. Мигрирующий
заряд, если на его пути встречается «слабое» звено, локализуется там,
прекращая дальнейшее перемещение. Локализация положительного
шряда у определенного атома, например, у атома серы в группе - SH,
приводит к разрыву в этом месте химической связи и образованию
иеспаренного электрона в атоме серы и атоме водорода. Возникает
сложный биологический радикал белка, включающего серу, и малый
208
Биофизика
радикал водорода. Неспаренные электроны могут образоваться
и в других атомах, например, в атомах азота и углерода. Белковая
молекула в свободнорадикальном состоянии обладает повышенной
реакционной способностью. Поэтому такие белки-радикалы мгновенно
вступают в разнообразные химические реакции (например, реакции
присоединения). Это в конечном итоге приводит к изменению
структуры белковой молекулы и потере ею биологической функции.
Аналогичный механизм ионизации и миграции дырки присущ
нуклеиновым кислотам при действии на них ионизирующего
излучения. Так, дырка, возникшая при поглощении энергии ионизирующей
радиации в определенном месте молекулы ДНК и создавшая там
электрическое поле напряженностью Ev движется вдоль оси молеку
лы и локализуется у пары азотистых оснований (нуклеотидов), где
напряженность поля Е2 выше, чем Ei. Если Е2 становится достаточ
ной для разрыва химических связей и разделения пары основании
из-за сильной поляризации π-орбитали, то следствием локализации
дырки будет расплетеиие ДНК (рис. 3.21, б) и утрата биологической
функции.
Миграции заряда по молекулам белков и нуклеиновых кисло!
способствует перекрывание π-орбиталей в них. Потенциальные энер
готические барьеры, встречающиеся на пути движения зарядов, прс
одолеваются, по-видимому, с помощью туннельного эффекта.
3.5. Люминесценция биологических систем
В люминесцентном исследовании биологических систем наи
большее значение имеют фото- и химиолюминесценция. При этом
важно помнить, что флуоресценция и фосфоресценция как два вид;|
фотолюминесценции различаются не только длительностью свече
ния, но и механизмами происхождения. Зная о существовании сипг
летных (S) и триплетных (7) возбужденных состояний, нетрудно по
пять из схемы электронных переходов в биомолекуле (рис. 3.22), что
испускание квантов флуоресценции имеет место в тех случаях, когда
молекула переходит из синглетного возбужденного состояния (5*)
в основное (S0): 5* —> S0 +hv. .
ι пива 3. Квантовомеханические основы биоэнергетики
209
w
W,
щ
wa
ι
s2[U]
s:[u]
r[tt]
ablti]
Рис. 3.22. Энергетические уровни биомолекулы
и возможные переходы между ними
С определенной вероятностью в молекуле могут иметь место
и другие процессы преобразования избыточной энергии с возбужден-
ишо уровня S*, а именно: а) образование тепловой энергии S* —> S0;
ii) фотохимическая реакция; в) передача энергии возбуждения другой
молекуле; г) переход в триплетное состояние (Г) с обращением спина
(Iicj излучения): S,* —> Т.
Переход молекулы из возбужденного триплетного состояния
(I) в основное состояние S0 может сопровождаться испусканием
киапта фосфоресценции по схеме: Τ —> S0 + Н\>ф0сфоресц, но
длительность фосфоресценции гораздо больше длительности
флуоресценции, так как этот переход запрещен правилами отбора, и в природе
una встречается гораздо реже, чем флуоресценция. Кроме
фосфоресценции, существуют и другие процессы превращения избыточной
тергии молекулы с триплетного уровня: а) безызлучательный
перечил с обращением спина: Г—> S0; б) фотохимическая реакция; в) пере-
шча возбужденной молекулой избыточной энергии другой молекуле.
210
Биофизик»
Из сказанного следует, что в люминесценции отображаются
процессы превращения энергии в молекулах, чему посвящены прс
дыдущие параграфы. Поэтому люминесцентный анализ биообъек
тов служит одним из способов экспериментального изучения биоз
нергетики.
Одной из важнейших характеристик флуоресценции являете*
спектр излучения, т. е. распределение интенсивности излучаемого
света по частотам (ν) или длинам волн (λ): / -f(k) или I=f(\), где /
интенсивность флуоресценции (Вт · м~2). Обычно спектр флуорес
ценции состоит из относительно широких сплошных полос и при
этом наблюдается характерное изменение спектрального состава ис
пускаемого света по сравнению с поглощенным. В большинстве слу
чаев выполняется правило Стокса: длина волны флуоресценции
больше, чем длина волны возбужденного света, т. е. спектр фотолю
минесценции сдвинут в сторону длинных волн относительно спектро
светового излучения, возбудившего эту люминесценцию.
Другой характеристикой флуоресценции служит спектр
возбуждения, т. е. зависимость интенсивности флуоресценции от длины
волны возбуждающего света.
Важнейшими параметрами флуоресценции являются ее
квантовый (φ) и энергетический (η) выходы. Квантовый выход
флуоресценции представляет собой величину, равную отношению числа
испущенных квантов иИС11 к числу поглощенных квантов и110П1, а
энергетический выход η равен отношению энергии флуоресценции W>
η W
к поглощенной энергии возбуждения Wmrsi: φ = —'^2-; η = ——.
η W
ПОГЛ ПОГЛ
Энергетический выход флуоресценции пропорционален
квантовому выходу, но в отличие от него зависит от длины волны
возбуждающего света.
Флуоресценция обусловлена переходами внешних валентных
электронов, за счет которых образуются химические связи между
атомами и молекулами. Поэтому возникновение новых связей в
молекуле и динамика ее взаимодействия со средой приводят к
изменениям энергетических уровней, в силу чего существует зависимость
основных характеристик флуоресценции от физико-химического со-
' mm/I 3. Квантовомеханические основы биоэнергетики
211
> шииия молекул вещества. Характеристики и параметры
флуоресценции изменяются при сдвигах температуры, рН и ионной силы
• реды, в которой находятся излучающие молекулы. С этим обстояте-
1Ы' ι ном связана высокая информативность флуоресцентного анализа
^ скулярной структуры вещества и ее динамики.
Ткани организма содержат вещества (витамины, сложные белки
■ хромофорными коферментными группировками и т. д.), способные
флуоресцировать под действием света. Такая флуоресценция
называйся собственной. Наряду с исследованием собственной
флуоресценции клеток и тканей широко используется метод флуоресцентных
ιιΐκΰαβ. Он основан на том, что существует ряд люминесцентных кра-
• п ι слей (люминофоров), которые избирательно взаимодействуют с о-
ιΐ|>ι·деленными компонентами клетки, не нарушая их
функционировании. Комплекс флуоресцентного зонда и выявляемого с его помощью
нпцества имеет более интенсивную флуоресценцию, чем сам краси-
iriii.. Свечение этого комплекса под действием света называют
вторичной флуоресценцией. Применение вторичной флуоресценции
пони лило, в частности, изучить распределение ионов кальция в клетке и
о |>;ι шичных органах, а также его изменение в процессе
жизнедеятельности организма. Широкое распространение в качестве
флуоресцентного зонда на кальций нашел хлортетрациклин. Он образует сложный
комплекс с ионами кальция, связанными биомембранами, который
фнуоресцируеттем интенсивнее, чем больше кальция адсорбировано
iii» биомембранах. Есть красители (например, фура), которые выявля-
и и цитозольную фракцию Са2+. Синтезированы флуоресцентные
зонам па нуклеиновые кислоты, белки, липиды и многие другие вещест-
iiii С помощью флуоресцентных зондов оценивают поверхностные
шряды клеточных мембран.
Собственную и вторичную флуоресценцию биологических
синем не следует смешивать с биолюминесценцией (или биохимиолю-
минесценцией). Под этим термином понимают те виды
люминесценции живых тканей, которые не связаны с явным воздействием на
ι кань какой-либо внешней энергии. Биолюминесценция обусловлена
определенными химическими процессами, протекающими в живых
метках, и, следовательно, является разновидностью химиолюминес-
чгнции.
212
Биофизии*
Собственная флуоресценция биомолекул и живых тканей
При облучении клеток позвоночных и беспозвоночных животных
а также растений и микроорганизмов коротковолновым ультрафио
летом (λ = 250-280 нм) можно зарегистрировать флуоресценции
с максимумом в области 330-350 нм.
Собственная ультрафиолетовая флуоресценция живых тканей
обусловлена, главным образом, свечением белков, причем этот про
цесс в различных ультраструктурах клетки имеет характерные отли
чия в разных органах и тканях. Изучение флуоресценции белкои
в растворах показало, что их ультрафиолетовая флуоресценция, ка>
и поглощение ими излучения в области 240-300 нм, определяете»
ароматическими аминокислотами: триптофаном, тирозином и фени·
лаланином.
В клетках человека и животных содержится много белков, в
состав которых входят триптофан, тирозин и финилаланин. Это актин,
миозин, ферменты типа дегидрогеназ, фосфатаз, оксидаз, некоторые
гормоны, ферменты пищеварительной системы, альбумины и
глобулины плазмы крови и другие вещества. Собственная
ультрафиолетовая флуоресценция этих белков зависит, главным образом, от
содержания в них триптофана. Для нейтрального водного раствора
триптофана при комнатной температуре характерна флуоресценции
с максимумом около 350 нм и квантовым выходом φ = 0,2. Спектры
флуоресценции указанных выше белков сдвинуты в
коротковолновую область на 10-25 нм относительно спектра флуоресценции
раствора триптофана. Разные белки имеют максимум свечения при
неодинаковых длинах волн, хотя разница между ними невелика
(в пределах 10-15 нм). Есть различия и в квантовом выходе
флуоресценции триптофансодержащих белков.
Белки, содержащие тирозин, в отсутствие триптофана
флуоресцируют примерно так же, как тирозин. Такие спектры
флуоресценции свойственны РНКазе, коллагену, инсулину и ряду других
веществ. Их максимум излучения приходится на ту же длину волны,
при которой имеет место максимум флуоресценции водного
раствора тирозина (λ = 304 нм). Квантовый выход флуоресценции таких
белков порядка 0,04-0,05.
/ ппав 3. Квантовомеханические основы биоэнергетики
213
Свечение фенилаланина выявляется только у некоторых уника-
ш.пых белков, содержащих его в значительных количествах при отсут-
I шии других ароматических аминокислот. Примером таких белков
миляются кальцийсвязывающие миогены, содержащиеся в мышцах
|Η.ι6. Молярный показатель поглощения ультрафиолета фенилалани-
miM в 30 раз меньше, чем у триптофана и почти в 7 раз меньше, чем
ν тирозина.
Спектры собственной ультрафиолетовой флуоресценции раз-
мпчиых клеток имеют сходную форму (рис. 3.23), хотя одни из них
шстятся сильнее, другие - слабее. Вместе с тем неодинаково
флуоресцируют разные ультраструктурные компоненты одной и той же
клетки. Наиболее яркая ультрафиолетовая флуоресценция присуща
ι ократительному аппарату клетки, митохондриям и ядрышкам.
Для живых тканей характерна также флуоресценция в красной,
желто-зеленой и синей областях видимой части спектра.
Флуоресценция в красной области присуща прежде всего порфиринам. Порфири-
повая структура свойственна цитохромам, пероксидазе, каталазе, ге-
300
400
λ, нм
Рис. 3.23. Спектры ультрафиолетовой флуоресценции мышечных волокон (1),
нейронов (2), эритроцитов (3)
214
Биофизик»
моглобину, миоглобину. Однако в гемопорфиринах флуоресценции
«потушена» атомами железа, что ограничивает возможности ее ие
следования в живых тканях. При обработке ткани некоторыми веще
ствами атом железа отрывается от простетической группы внутри·
клеточных гемопорфиринов, и тогда выявляется характерная красная
флуоресценция порфиринов. Этим приемом пользуются судебные
медики для обнаружения отдельных эритроцитов по их порфирит»
вой флуоресценции после обработки исследуемого объекта серноИ
кислотой.
Флуоресценция живых тканей в синей и желто-зеленой облас
тях связана с наличием в клетках восстановленной формы пиридин
нуклеотидов (НАД · Η и НАДФ · Н) и окисленной формы флавопротс
идов (ФП). Эти вещества участвуют в таких процессах, как гликолш,
пентозный цикл, цикл Кребса, окисление жирных кислот и, что осо
бенно важно, клеточное дыхание. Поэтому практически любые сдвиги
в клеточном метаболизме отображаются в динамике флуоресценции
НАД · Η и ФП, а она, в свою очередь, может быть выявлена при люми
несцентном анализе живых тканей.
НАД · Η обладает характерным спектром поглощения, вклю
чающим две полосы в ультрафиолетовой части спектра с максиму
мом в области 260 нм и 340 нм, а также собственной синей флуорес
ценцией с максимумом в интервале 465-480 нм. Переход НАД · 11
в окисленное состояние сопровождается потерей одной полосы (при
λ = 340 нм) в спектре поглощения и утратой способности флуореецн
ровать (рис. 3.24).
Среди флавопротеидов (ФП) наибольший интерес
представляют собой производные рибофлавина. В окисленном состоянии фла·
вопротеиды обладают характерным спектром поглощения и собст
венной желто-зеленой флуоресценцией с максимумом в области
530 нм, обусловленной рибофлавином (рис. 3.25). При
восстановлении флавопротеиды утрачивают собственную флуоресценцию
Неодинаковая флуоресценция пиридиннуклеотидов и флавоп
ротеидов в восстановленной и окисленной формах лежит в основе ис
пользования флуоресцентного анализа для количественной оценки
клеточного дыхания живых тканей. Усиление клеточного дыхания с»
ι пййи 3. Квантовомеханические основы биоэнергетики
215
иршюждается изменением соотношения восстановленных и
окисленных форм компонентов дыхательной цепи в сторону преобладания
ишрых над первыми. Угнетение дыхания приводит к
противоположному эффекту. Поэтому при усиленном дыхании клетки в ней
нарастет желто-зеленая и затухает синяя флуоресценция, тогда как для
-NH,
НАД Η
(2)
он он
А О, отн. ед
300
а)
X, нм
Α Ά
400
500
б)
X, нм
I'uv. 3.24. Структурные формулы и спектры поглощения (а) и флуоресценции (б)
ннкотинамидадениндинуклеотида (НАД): окисленной формы (сплошная линия)
и восстановленной формы (пунктирная и штрих-пунктирная линии)
216
Биофизика
/λ, отн. ед.
ι ι ι ι ι ι ι ►
300 400 500 А, нм 500 530 λ, нм
а) 6)
Рис. 3.25. Спектры поглощения (а) и флуоресценции (б)
флавопротеидов окисленной формы (сплошная линия)
и восстановленной формы (пунктирная линия)
ослабления дыхания характерно усиление синего свечения НАДИ
и угасание желто-зеленой флуоресценции ФП.
Важным достоинством флуориметрического исследовании
клеточного дыхания является возможность его проведения в любом
органе, к которому можно подвести свет, возбуждающий флуорес
ценцию, и отвести на регистрирующий прибор возникающее in situ
свечение. Так удается установить пороги действия на организм раз
личных раздражителей, вникнуть в механизмы этих реакций. Этт
метод дал возможность установить не только неспецифические про
явления ответов биологических систем на стимуляцию, но также
и характерные закономерности метаболических сдвигов при некото
рых патологических состояниях.
Биолюминесценция. Живым организмам, наряду с флуорес
ценцией, присуща и биолюминесценция, которая является самопрош
вольной, т. е. не связанной с явным воздействием какой-либо энергии
от внешнего источника. Самопроизвольное свечение живых органич
мов в видимой области спектра наблюдали невооруженным еще гла
зом Аристотель и Плиний Старший. С тех пор довольно интенсивную
биолюминесценцию обнаружили у 40 видов бактерий, грибов, бес
11 D, отн. ед.
' "пли з. Квантовомеханические основы биоэнергетики
217
1ШИЮН0ЧНЫХ животных, рыб. Высшим растениям, птицам, млекопи-
I тощим такое свечение не свойственно. В силу уникальности этого
«мнения его иногда называют «экзотической» биолюминесценцией.
11|ш се изучении французский ученый Р. Дюбуа (1887 г.) установил,
ί κι и вытяжке фотофоров светлячков содержатся два вещества, смесь
мпорых дает биолюминесценцию. Одно из них, представляющее со-
Unii субстрат реакции, получило название люциферина, а второе ока-
iiinocb ферментом реакции окисления люциферина и было названо
цнциферазой. Люциферин и люцифераза позднее были выделены и из
φνιιιχ светящихся организмов (ракушечного рачка ципридины, раз-
шчиых видов светящихся рыб). Реакция окисления люциферина
воспроизведена в пробирке
В ходе ферментативного окисления люциферина выделяет-
• и шачительная энергия (170-340 кДж · моль-1), под действием
мморой промежуточный продукт реакции переходит в
возбужденное состояние. Возвращаясь в основное состояние, его моле-
• ν пи излучает квант света. В целом «экзотическая»
люминесценции возникает как следствие двухступенчатого процесса:
фермент
Ι ι И ™ч»№"3" )С*+Д, С*-» С +Λν(люминесценция).
Вместе с тем биолюминесценция присуща многим предста-
шислям животного и растительного миров, но, в отличие от «экзо-
|ц||сской», она очень слаба по интенсивности (обнаруживается не
ми |уально, а только при помощи высокочувствительных приборов)
и простирается за пределы видимого света в инфракрасную и
ультрафиолетовую области. Такая биолюминесценция получила название
• »\'\>хслабого свечения живых тканей. Его изучением занимался со-
шчский биолог А.Г. Гурвич, который в 1923 г. обнаружил
стимулирующее влияние патологически измененных, в том числе раковых,
и иктивно развивающихся тканей на расположенные поблизости
почкующиеся клетки дрожжей и корешков лука. Оно выражалось в уси-
ичши митотической активности клеток. А.Г. Гурвич полагал, что
понужденные и активно развивающиеся ткани генерируют какое-то
ш'пплимое излучение, способное усиливать митозы в окружающих
• инках. Поэтому он назвал гипотетическое излучение митогенети-
ίιί мши лучами.
218
Биофизик»
Сотрудники А.Г. Гурвича Г.М. Франк и С.Ф. Родионов, а также
Б. Раевский зарегистрировали в начале 30-х годов XX века сверхсли
бое свечение живых тканей в тех же условиях, в которых А.Г. Гурвич
наблюдал митогенетический эффект. Регистрирующим прибором
служил видоизмененный счетчик Гейгера-Мюллера. Б.Раевский об
наружил очень слабое излучение на длине волны 265 нм у прорасти
ющих корешков лука. Г.М. Франк и С.Ф. Родионов зарегистрировали
подобный эффект в работающей мышце. Тогда же было показано,
что отмирающие клетки (независимо от причины их гибели) по срав
нению с клетками, возбуждаемыми при жизни, испускают фотоны
с более высокой энергией.
В 1950-е годы было обнаружено сверхслабое свечение прорас
тающих корешков злаковых растений не только в ультрафиолетовой,
но и в видимой области. В конце 1960-х годов область сверхслабо!ν
свечения была распространена и на инфракрасный диапазон - от О,)
до Юмкм.
Таким образом, наряду с биолюминесценцией, видимой глазом
и известной с незапамятных времен, уже более полувека изучаете»
сверхслабое свечение биообъектов в видимой, ультрафиолетовой
и инфракрасной областях электромагнитного спектра. Оно присущ»
и бактериям, и растениям, и животным, включая человека.
В изучение биофизических механизмов сверхслабого свеченш
биообъектов большой вклад внесли работы Г.М. Франка, Ю.Б. Хари-
тона, Б.Н. Тарусова, Ю.А. Владимирова, И.И. Гительзона и другм
отечественных ученых. Было показано, что такая биолюминесцеН'
ция - неотъемлемое свойство живых клеток самых различных τκι
ней. Она возникает при не ферментативном окислении их химич··
ских ингредиентов, включая липиды биологических мембран
Сверхслабое свечение сопровождает в основном так называемые/?*
акции цепного типа, в ходе которых образуются свободные радикали
(соединения, обладающие неспаренными электронами). Показано,
что возбуждение происходит за счет энергии, высвобождающейся при
их рекомбинации, а интенсивность свечения пропорциональна скоро·
сти рекомбинации. Особенно подробно изучен механизм химиолюми-
несценции в реакциях с участием углеводородных радикалов и
радикалов липидов R:
(ιιηιιβ 3. Квантовомеханические основы биоэнергетики
219
R+02 ->R02;
R +R —» углеводород (R - R) + Λν (люминесценция);
R +R02 —» перекись (ROOR) + Λν (люминесценция);
R02 +R02 —» спирт+ карбонильное соединение +
+ Ог + Λν (люминесценция).
Максимальное свечение имеет место при рекомбинации ради-
ш нов типа R02.
Наиболее исследованным и притом универсальным
механизмом сверхслабой биолюминесценции в видимой области можно
ι читать химиолюминесценцию перекисей липидов, накопление ко-
ц||>ых связано с окислительным фосфорилированием в
митохондрии χ . В вакууме образование свободных радикалов прекращается,
и Гшолюминесценция затухает. Ингибиторы свободных радикалов
||1-ионол, α-нафтол) также гасят сверхслабое свечение.
При сопоставлении механизмов «экзотической»
биолюминесценции и сверхслабого свечения можно сделать вывод, что они
имеют общие черты, хотя и существенно отличался друг от друга.
Подобно «экзотической» биолюминесценции сверхслабое свечение
мископитающих нуждается в кислороде, усиливается субстратами
к неточного окисления и угнетается цианидами. Биолюминесценция
иОоих типов связана с транспортом электронов в биосистемах. Поэ-
тму в ней отображаются квантовомеханические основы биоэнер-
Н'ГНКИ.
В заключение заметим, что исследование квантовомеханиче-
• ной природы переноса энергии и заряда в биомолекулярных систе-
мнх (т. е. различные пути превращения энергии возбужденного со-
| тяния молекул в энергию их продуктов) составляет существенную
чисть предмета квантовой биофизики. К этому разделу биофизики
шносится также изучение электронной структуры биологически
ил «пых молекул, их донорно-акцепторных свойств, электронных
переходов в них при поглощении и излучении света, механизмов сво-
220
Биофизик»
боднорадикальных процессов и др. Многие аспекты этих вопросом
выходят за рамки проблемы биоэнергетики.
3.6. Электронная схема жизни
Схема энергообеспечения процессов жизнедеятельности жи
вотных и человека представлена на рис. 3.26. Она складывается m
двух процессов: фотосинтеза и клеточного дыхания, которые
обеспечивают кругооборот электронов в биосфере, и поэтому называется
электронной схемой жизни.
Сгорание Η
в термоядерных
реакциях
Усвоение
пищи
О''
Μ
V
АТФ
Хлорофилл
Н+
02
Н20 АДФ + Н3РО4
со2
ФОТОСИНТЕЗ
в хлоропластах
КЛЕТОЧНОЕ ДЫХАНИЕ
{биологическое окисление и
фосфорилироввние - синтез АТФ)
в митохондриях
Рис. 3.26. Электронная схема жизни
У—углеводы. Ж - жиры, Б - белки МС - моносахариды,
ЖК - жирные кислоты, АК- аминокислоты
3.6.1. Биофизические механизмы фотосинтеза
Транспорт возбужденных π-электронов, обеспечивающий ак
кумулирование (конвертирование) солнечной энергии в макроэнер-
гетических связях АТФ, свойствен хлорофиллсодержащим
бактериям и зеленым растениям.
Хлорофилл обладает уникальной способностью быть как
донором, так и акцептором электронов в зависимости от действия на него
ι ιιβββ 3. Квантовомеханические основы биоэнергетики
221
ι иииечного света. В исходном состоянии (когда на него не действует
ι utvr) хлорофилл служит донором электронов. Поглотив фотон в
винимой области спектра солнечного излучения, этот пигмент теряет
шсктрон, окисляется и приобретает акцепторные свойства.
Приникши электрон от сопряженных с ним веществ, он снова испытывает
m ^становление и становится готовым отдать электроны, если на не-
||| шювь подействует свет. Такая цикличность в работе хлорофилла
ни июляет называть его «электронным насосом», приводимым в дей-
| шие и регулируемым солнечной энергией. Это важнейшее свойство
ымсчательного пигмента открыто в 1948 г. академиком А. А. Красно-
Ni ким. Его открытие вошло в науку под названием реакции обрати-
мню фотохимического восстановления хлорофилла (реакции Крас-
inmcKoro).
3.6.1.1. Фотосинтез у хлорофиллсодержащих бактерий
У хлорофиллсодержащих бактерий хлорофилл сосредоточен
м илазмолемме. Там же присутствуют и другие вещества,
участвующие в переносе электронов, которые возбуждаются энергией
солнечник) света в молекуле хлорофилла и покидают ее. Мембрана обеспе-
'шиает тесное взаимодействие всех компонентов фотосинтетического
симплекса. Благодаря его упорядоченной мембранной организации
промежутки между соседними компонентами этого комплекса имеют
порядок I нм, что обеспечивает миграцию возбужденных π-электро-
ιΐιιιι между молекулами по резонансному механизму.
Фотон видимого света, поглощаясь молекулой хлорофилла,
тпГ)уждает в ней электрон, который переносится на феофитин,
ί ι пего - яй убихинон и далее - на цитохром с. Убихинон
сосредоточен на внутренней стороне плазмолеммы, а цитохром с - на наруж-
inili. Расстояние между ними более 2,5 нм. Чтобы передать электрон
шпохрому с убихинон должен пересечь плазмолемму. Для этого он
прекращается в убихинол, присоединив вместе с парой электронов
<1Ш1 протона, которые мембрана черпает из цитоплазмы. Убихинол
перемещается от внутренней стороны плазмолеммы к наружной и,
щ давая там электроны цитохрому с, окисляется с отдачей 2Н+ и
выделением их в окружающую среду. Поглощение одного фотона в ви-
222
Биофизт
димой области спектра обеспечивает перенос одного Н+-иона черм
плазматическую мембрану хлорофиллсодержащей бактерии. Зам*
тим, что содержание Н+ в цитоплазме выше, чем в окружающей ср··
де. Следовательно, система электронного транспорта в фотосинтети»
ческом комплексе плазмолеммы хлорофиллсодержащей бактерии
обеспечивает то же, что и бактериородопсин в плазматической мем№
ране галобактерии, - трансмембранный перенос Н+-ионов в соотвот»
ствии с их концентрационным градиентом.
Пассивный транспорт протонов приводит к эффекту обращу
ния протонной помпы, сосредоточенной также в плазмолемм·.
В результате Независимая АТФаза (Н-АТФаза), являющаяся гла>
ным компонентом протонного насоса, катализирует не гидроли
АТФ, а его синтез из АДФ и ортофосфата, т. е. выполняет роль АТФ·
синтетазы. За счет АТФ осуществляются все процессы жизнедеят!·
льности хлорофиллсодержащей бактерии, включая поддержаш
ионных градиентов на ее плазматической мембране.
Такие микроорганизмы не способны синтезировать углеводу
за счет работы фотосинтетического комплекса, поскольку возбу*
денные электроны, отдав феофитину, убихинону и цитохрому к}
быточную энергию, возвращаются с цитохрома с на молекулу хл*
рофилла:
Αν
ι
Хлорофил—^—»Феофитин———»Убихинол—^-»Цитохром
ΐ !l I
Итак, фотосинтез хлорофиллсодержащих бактерий ограничв
образованием АТФ за счет реализации протонного градиента на пл#
матической мембране. Дальнейшая эволюция жизни связана с пояшф
нием у зеленых растений способности использовать фотосинтез Щ
созидания углеводов и других высокомолекулярных органических Ц
ществ. Клетки зеленых растений (аутотрофов) обеспечивают за аЩ
фотосинтеза питательными веществами, а значит, и свободной энф
гией как самих себя, так и гетеротрофов. Для синтеза углеводов эло#
ι iwoa 3. Квантовомеханические основы биоэнергетики
223
роим, возбужденные светом в хлорофилле, должны не только регули-
||||иать трансмембранный перенос Н+-ионов, но и переноситься на
иругие вещества, вплоть до С02, а не возвращаться в молекулы,
которым они прежде принадлежали. Для этого цепь переноса
возбужденных электронов, замкнутая у хлорофиллсодержащих бактерий, ста-
1ИИ1НТСЯ разомкнутой у зеленых растений.
3.6.1.2. Фотосинтез у зеленых растений
Энергия фотонов в видимой области электромагнитного спект-
1>н преобразуется в энергию химических связей синтезируемых
органических веществ:
nhv
I
С02+Н20 *" )(СН20)+02 +477 кДжмоль"',
ι цс Λν - квант света, и - число фотонов, (СН20) - фрагмент моле-
► умы углевода (рис. 3.27).
Скорость фотосинтеза измеряется количеством кислорода,
выпоенного за единицу времени. Она зависит от интенсивности
поглощенного света. Максимальная скорость фотосинтеза при постоянном
ι ппьном освещении достигает одной молекулы 02 (на одну молекулу
U, в
-0,4
-0,1
+0,2
+0,5
+0,8
С02 ► (СН20)
Н20 *- 02
Рис 3.27. Схема фотосинтеза
224
Биофизш»
хлорофилла) за 50 с. Источником всего атмосферного кислорода слу
жит вода, участвующая в реакциях фотосинтеза
При восстановлении углекислого газа до углевода осуществл»
ется перенос 4 атомов водорода с Н20 на С02. Изменение свободной
энергии в реакциях фотосинтеза при образовании одной молекулы (>
составляет около 500 кДж · моль-1, на что затрачивается 8 кванк*
света с суммарной энергией примерно 1470 кДж · моль1. Следован'
льно, коэффициент использования солнечной энергии при фотосии
тезе достигает 34%. Примерно к такому же КПД можно прийти путсы
другого расчета - при сопоставлении энергии, заключенной в 8 фот
нах, с энергией, затрачиваемой на синтез углеводов. Так, восстанопи
тельные потенциалы редокс-пар: -02/Н20 и С02/СН20 составляим
соответственно +0,81 В и -0,43 В. Последний является эквивалент im
самой высокой энергии, приобретенной электроном в хлорофилт
под действием квантов видимого света. Следовательно, перенос a in
мов водорода с Н20 на С02 сопровождается транспортом 4 электри
нов против разности потенциалов, равной +0,81 - (-0,43) = 1,24 В. II»
него затрачивается свободная энергия в 4,92 эВ, что эквивалент'
примерно 480 кДж · моль-1.
Эта свободная энергия черпается из фотохимических проно
сов, в которых участвует хлорофилл. Каждая молекула хлорофилл»
тесно связана с донором (Д) и акцептором (А) электронов. Поэтом*
при ее фотовозбуждении происходят следующие превращена
д д Д+ д*
Хл —» Хл * —» Хл+ —» Хл. Акцептор принимает электрон от возбу*
А А А" А"
денного хлорофилла и превращается в А". Место этого электрон?
в хлорофилле занимает другой, принимаемый им от донора. Элем
рон не может перейти с донора на акцептор непосредственно, так м»
они пространственно разобщены и не взаимодействуют между си
бой. Пространственное разобщение их обеспечивается тем, что до
нор и акцептор являются компонентами биологической мембраш.
и фиксированы в ее определенных точках. Не взаимодействуя межл)
собой, А- и Д+, образовавшиеся под действием света при учасци·
хлорофилла, могут участвовать в других окислительно-восстаноип
f/мня 3. Квантовомеханические основы биоэнергетики
225
ичп.иых реакциях с теми мембранными компонентами, которые
тесни контактируют с ними. Вне биомембраны фотосинтез не
осуществит* ι си.
Местом фотосинтеза в зеленых растениях являются
мембранные системы хлоропластов. В этом специализированном органоиде,
кроме двойной наружной мембраны, содержится сложно организо-
импиая сеть внутренних мембран, образующих многослойные
структуры, упакованные в пачки (граны). Внутренние мембраны ограничи-
Niiiti г замкнутые объемы в виде уплощенных пузырьков - тилакоидов.
II ы1ждом хлоропласте примерно 1000 тилакоидов, а в одной клетке -
•it Μ) до 200 хлоропластов. В мембранах тилакоидов протекают свето-
ишисимые фотосинтетические реакции, так как там сосредоточены
хромофоры - молекулы, поглощающие световую энергию. К ним
относится хлорофилл а, хлорофилл Ъ, каротиноиды и другие пигмен-
Μ.Ι Их спектры поглощения изображены на рис. 3.28. Они свидетель-
1'iiiyioT, что хлорофилл поглощает свет наиболее интенсивно в синей
и крпсной, но отражает в зеленой и желтой областях. Этим
определяет и челеный цвет растений. На 1 хлоропласт приходится примерно
10* молекул хлорофилла.
Две разновидности хлорофилла (а и Ь), имея незначительные
рщличия в химическом строении, существенно отличаются по
физическим свойствам и биологической активности. О коренных отличиях
• механизмах переноса энергии свидетельствует наличие
флуоресценции у хлорофилла а (с квантовым выходом около 0,2) при ее
отсутствии у хлорофилла Ь. Последний сам по себе непосредственно не
участвуя в фотосинтетических превращениях, но он входит в состав
1»0Шособирающей пигментной матрицы, помогающей улавливать
ннппечную энергию. После фотовозбуждения хлорофилл Ъ быстро
передаст свою избыточную энергию хлорофиллу а, который при этом
ян Нуждается и принимает непосредственное участие в фотосинтезе.
·* ипрофилл а может возбуждаться светом и без посредника, но участие
ышрофилла Ь повышает коэффициент использования солнечной энер-
itiii, Он повышается также благодаря присутствию в светособираю-
ιιΐυίΙ матрице других пигментов (каротиноидов и фикобилинов). Сопо-
нышв спектры поглощения хлорофилла и каротиноидов (рис. 3.28),
«μ ι рудно убедиться, что хлорофилл поглощает энергию ограниченно-
226 Биофизика
150
100
50
400 500 600 600 600 Д. нм
Рис. 3.28. Спектры поглощения пигментов, присутствующих в мембране
тилакоида. Обозначения: I - хлорофилл а, 2- хлорофилл Ь, 3 - каратиноидЫ,
4 - спектр солнечного излучения (интенсивность излучения -
в относительных единицах)
го участка солнечного спектра. Однако фотосинтез идет под дейстнн
ем почти всей видимой области электромагнитного спектра. Зеленый
свет хорошо поглощают каротиноидами, входящими в светособираш
щую матрицу. Кроме того, каротиноиды защищают хлорофилл от фо
тоокисления при избыточном освещении.
Перенос энергии от различных пигментов этой матрицы и»
хлорофилл а осуществляется по резонансному механизму. В конце
концов энергия фотовозбуждения достигает реакционного центра
в котором сосредоточено несколько молекул хлорофилла а, ориси
тированных определенным образом в тилакоидной мембране. Здси
начинается первая стадия фотохимического процесса. Совокупной к
реакционного центра и светособирающей матрицы называется фи
тосинтетической единицей (рис. 3.29). Каждая из них включает при
близительно 300 молекул хлорофилла.
Фотосинтетическая единица входит в состав фотосистемы
компонентами которой являются также интегральные белки тила
коидной мембраны. Мембранные протеины фиксируют многие мол»
кулы хлорофилла на одной полипептидной цепи, создавая тем самым
необходимую ориентировку пигмента. Комплекс «хлорофилл а
[ αλ, л-ммоль-1-см-
' iiiicia 3. Квантовомвханические основы биоэнергетики
227
Свет (hv)
Γν. /ТНесколько молеку
^ C/t—>vj|..ij|
as
Несколько молекул
хлорофилла -
ловушек энергии
τ
Рис. 3.29. Схема фотосинтетической единицы.
Волнистыми стрелками показан перенос энергии возбуждения
по механизму резонансного взаимодействия
(Р. Чанг, 1980)
«пмбранный белок» служит главным узлом фотогенератора, как ино-
| hi называют фотосистему.
Функциональным элементом тилакоидной мембраны считает-
• и квантосома, в состав которой входят две фотосистемы с разными
• шшствами. В каждой ФС есть собственная фотосинтетическая
единица, причем относительное содержание хлорофилла а в ФС I много
нише, чемв ФС II. Обе фотосистемы поглощают свет с длинами
нипи короче 680 нм, но только ФС I способна возбуждаться и более
пшиноволновым светом, причем ее максимум поглощения прихо-
■II юн на 700 нм. Поэтому хлорофилл а, входящий в разные фотосис-
м мы, имеет различные наименования: в ФС I его называют пигмен-
iiiM P700, а в ФС II - пигментом Р680. Различия определяются не
hi (Ценностями молекулярной структуры пигментов (она
одинаково, а специфическим мембранным окружением хлорофилла а
и ФС I и ФС II (вероятно, составом мембранных белков,
фиксирующих молекулы пигмента). В целом молекулярная масса квантосомы
н!Г1игает2 · 106дальтон.
Между молекулами хлорофилла, принадлежащими разным
■И' и одной квантосоме, расположены молекулы других веществ,
•молящих в ее состав и выполняющих функцию переноса электро-
1ИИ1. Поэтому говорят, что ФС I и ФС II разобщены в пространстве
иншкоидной мембраны, но сопряжены между собой системой пере-
228-
Биофизш*
носа электронов, причем они переносятся с ФС II на ФС I, и обрш
ный переход невозможен (рис. 3.30).
В темноте молекула хлорофилла а пребывает на нижнем си ι и
летном уровне. Световая энергия по резонансному механизму персик
дит его электроны на более высокий энергетический уровень. Полосы
поглощения хлорофилла (см. рис. 3.28) соответствуют переходи"
S0 —» S{' (в красной области спектра) и\-) S2* (в синей области)
рис. 3.31. Раствор хлорофилла a in vitro флуоресцирует за счет обр» ι
ного перехода электронов с S* на S0 (заметим, что обратный персхп»
с S2' на St' безызлучательный). С уровня S,* возможен также безьшу
чательный переход на метастабильный триплетный уровень Т. Нахп
дясь на нем, электроны хлорофилла могут перейти под действием cm
та на уровень Г* что означает возбужденное триплетное состоят»
хлорофилла. Именно такой переход присущ хлорофиллу in vivo, κοι
да он встроен в тилакоидную мембрану. С уровня Г электроны μοι ν ι
U, В
-0,6
0,4
-0,1
0,0
+0,2
+0,4
+0,6
+0,8
'1 (зферредоксин
Н ЪНАДФ* ^
е- НАДФН
J\ Пласта кинон
^ЦитохромЬ
С02
Ци гохром f
Г пастоцианин
hv
Н20
ФСП
Рис. 3.30. Схема переноса электронов при фотосинтезе у высших растений
U - восстановительный потенциал
' 'inna 3. Квантовомеханическив основы биоэнергетики 229
τ Г
Фотосинтез
Τ
Рис. 3.31. Схема электронных уровней хлорофилла (по А.А. Красновскому)
им тратиться и на уровень S0, что сопровождается
фотолюминесценцией. Поэтому хлорофилл а люминесцирует не только в пробирке, но
и и хлоропластах. Однако его квантовый выход in v/vo только 0,03-
",()(>, тогда как in vitro - 0,2. Из сопоставления этих величин ясно, что
п.ниная доля энергии, выделяющейся при электронных переходах
и мблученной молекуле хлорофилла я, находящейся в тилакоидной
мембране, идет на фотосинтез.
Фотосинтез осуществляется за счет перехода возбужденных
шсктронов с Г на Г* при котором изменяется их спин. Появление же
in ι паренных электронов приводит к образованию свободных ради-
чпов. Возникновение свободных радикалов при фотосинтезе
доказано методом ЭПР.
Полный цикл фотосинтетических превращений начинается
■ ||кг1 овозбуждения хлорофилла а в ФСII (Р680). Возбужденный элек-
I рои переносится с Р680 на акцептор, тесно контактирующий с хлоро-
Iiiiijiom в тилакоидной мембране (рис. 3.30). По-видимому,
акцептором служит цитохром 555 (Q). На переход затрачивается энергия
ин Суждения электрона, так как он преодолевает восстановительный
ни ι сициал в 1,24 В (идет «в гору»). Приняв электрон, акцептор восста-
ишвается, а в молекуле хлорофилла, отдавшей его, возникает дыр-
»и Она заполняется электроном воды, которая расщепляется в
прочите фотосинтеза с образованием кислорода, протонов и электронов,
ι In иидимому, расщепление воды (точнее, ее окисление до 02) произ-
нмцит не сам возбужденный хлорофилл, а некое промежуточное окис-
иипое соединение, образующееся при возбуждении Р680. Окисление
230
Биофизит
воды, приводящее к выделению кислорода, катализируется фермам
ной системой, содержащей трехвалентный ион марганца.
Присоединив электрон, хлорофилл (Р680) восстанавливаете»
и к нему возвращается способность возбуждаться новыми квантами
света. Кислород выделяется в атмосферу. Протоны закисляют содер
жимое тилакоидов, поддерживая там более высокую концентрации!
Н+ по сравнению с цитозолем. Такова судьба всех продуктов расщеп
ления воды при фотосинтезе. А теперь снова обратимся к электри
нам, покинувшим молекулы хлорофилла (Р680) и восстановившим
вещество Q. Проследим их миграцию по цепи переноса ФС П. С не
щества Q они последовательно переходят от одного компонент
транспортной цепи к другому в направлении более высокого поло
жительного восстановительного потенциала («с горы») - к пластохи
нону и далее к пластоцианину. Свободная энергия, выделяющая).«
при этом ступенчато (дискретно), запасается тилакоидной мембри
ной и обеспечивает синтез АТФ из АДФ и ортофосфата (о механизме
преобразования энергии возбужденных электронов в химическую
энергию макроэргической связи речь пойдет ниже). Так как скоросн
переноса электронов по транспортной цепи ФС II не зависит от тем
пературы, то возникло предположение о туннельном механизме мш
рации электронов между окислительно-восстановительными коми»
нентами этого каскада. Последним из них в ФС II является Р700, т. с
хлорофилл а, принадлежащий другой фотосистеме (ФС I) в данной
квантосоме.
Однако Р700 приобретает способность принять электроны in
ФС II только после того, как сам поглотит свет, возбудится и потерно
свой электрон, который поступит в транспортную цепь ФС I. При по
тере электрона в молекуле Р700 возникает дырка, которую и занимас!
электрон, пришедший сюда из ФС II (с пластохинона). Следователь
но, возбужденный хлорофилл, входящий в состав ФС II, восстанавли
вает пластохинон (до гидрохинона), а возбужденный хлорофилл, при
надлежащий ФС I, окисляет гидрохинон до пластохинона, возвращии
ему способность принимать новые электроны от Р680. Еще раз напом
ним, что такое сопряжение в работе двух фотосистем осуществляете»
в пределах одной квантосомы. В ней между молекулами хлорофиллн,
принадлежащими разным фотосистемам, иными словами, между
' imaa 3. Квантовомеханические основы биоэнергетики
231
1'<>К0 и Р700, расположено примерно 5 молекул пластохинона. Пиг-
μιίγγΡ700, приняв электроны от компонентов ФС II, восстанавливает-
| и, и к нему возвращается способность возбуждаться светом.
В ФС I пока не идентифицировано вещество с большим отрица-
п'пьным восстановительным потенциалом, на которое переходят
возбужденные электроны с Р700. На схеме (см. рис. 3.30) оно обозначено
о ук вой X. Приняв электрон от возбужденного хлорофилла, X стано-
иигся сильным восстановителем (Х~), с которого начинается второй
каскад переноса электрона в сторону более высокого положительного
писстановительного потенциала. Последним компонентом цепи
цшпспорта электронов в ФС1 является НАДФ+, восстанавливаемый
но И АДФ-Н (см. рис. 3.30). Донором водорода служит вода,
расщепившаяся под действием света при участии хлорофилла (Р680) еще на
перин ίί стадии фотосинтеза.
Конечным акцептором электронов, прошедших
последовательно ФС II и ФС I, является С02. Перенос на него электронов с
pern жс-пары НАДФ+/НАДФ · Η (восстановительный потенциал равен -
и, <24 В) осуществляется сложной ферментной системой, входящей
о гак называемый цикл Кальвина - последовательность химических
|1гакций, протекающих в 13 стадий (рис. 3.32). Энергия, выделяемая
при транспорте электронов с названной редокс-пары на С02, недоста-
ui'iua для его восстановления до углеводов. Дополнительная энергия,
необходимая для синтеза углеводов, поступает в цикл Кальвина
и форме АТФ. Так, образование одной молекулы гексозы из 6
молекул С02 обеспечивается не только переносом электронов с НАДФ · Η
пи С02, но еще и 18 молекулами АТФ. Этот макроэрг образуется так-
*с в реакциях фотосинтеза посредством преобразования солнечной
шергии, поглощенной хлорофиллом. Синтезу АТФ служит
транспорт в квантосоме (в ФС II и ФС I) до этапа восстановления НАДФ\
Механизм фотосинтеза АТФ будет рассмотрен ниже.
За счет поглощения двух квантов света двумя молекулами хло-
цифилла (Р680 и Р700), принадлежащими одной квантосоме, проис-
кидит перенос одного электрона на С02. Кроме того, энергия этих
ипух фотонов обеспечивает перенос одного электрона с воды на Р680.
Рассматривая процессы электронного транспорта в ФС II и ФС I в со-
232
Биофизик»
н
I
и— с—оро|-
I
2Н—С—ОН
«Ао
Фосфоглицериновал
кмслот* -
Η
н—с—оро;
I
С—О
-Н
: ατ^φ 1адФ1Надфн 2НАДФ
со,-
н
Η
с—ою|··
I
с—о
— Н—с—ОН
I
н—с—он
н—с—оро!·
I
Η
Рнбулоэодифосфп
Фотохимические
системы I и II
| ОН-С-
н—с—оро;· I
| Н—С—ОН
-2Н—С—ОН - I —
| Н—С—ОН
/ V н-с-он
ОН О |
Трнозофосфат Η
Фрунтозаднфосфп
АДФ АТФ
Η
I
Η—С—ОН
Η
I
С—О
-с—он
I
н—с—он
I
н—с—оро;~
I
Η
Рибулюодифосфат
Ряд 5-, 6- и 7-
углеродных
промежуточных
соединений
-► сно
I
н—с—он
I
н—с—н
н—с—он
I
-с-
I
сн,он
Глюывл
Η
-он
Рис. 3.32. Связь между фотосистемами и циклом Кальвина
вокупности, можно заключить, что поглощение двух квантов свети
двумя молекулами хлорофилла приводит к переносу одного
электрона с Н20 на С02, из которого синтезируются углеводы.
В ходе двухтактного (в ФС II и ФС I) фотоэлектронного
преобразования возникают молекулярный кислород, НАДФН
(восстановленный НАДФ), а также АТФ. Это единственная, хотя и сложна»
(многоступенчатая) световая реакция в процессе фотосинтеза.
Дальнейшие аутотрофные биосинтетические реакции не нуждаются в
свете. Они происходят в зеленых растениях за счет энергии, заключен·
ной в электронах, принадлежащих НАДФН и АТФ.
Лучше других реакций фотосинтеза изучен процесс
образования шестиуглеродной молекулы глюкозы из 6 молекул С02 и 6 моло-
кул Н20 (реакция фиксации углекислого газа). 12 пар возбужденных
электронов, необходимых для осуществления этой реакции,
поступают от НАДФН. Дополнительным поставщиком свободной энергии
служат 18 молекул АТФ. Вклад НАДФН и АТФ в фотосинтез мола
глюкозы составляет соответственно 660 и 252 ккал.
Аналогично углеводам происходит фотосинтез всех
биологически важных макромолекул. И здесь нужно еще раз подчеркнуть,
ι nmia 3. Квантовомеханические основы биоэнергетики
233
■mi для созидания углеводов, белков, жиров, нуклеиновых кислот
и других высокомолекулярных органических соединений из двуоки-
| и углерода, воды, нитратов, сульфатов и прочих сравнительно про-
I ii.ix веществ необходим колоссальный приток к ним возбужденных
нн'ктронов.
Углеводы, белки, жиры служат основными питательными
веществами для гетеротрофов. В ходе катаболических процессов, также
ιιΐιι-спечиваемых электрон-транспортными системами, освобождают-
11| шсктроны примерно в таком же количестве, в каком они захваты-
iniiiiicb органическими веществами при их фотосинтезе. Электроны,
• и побеждающиеся при катаболизме, переносятся на молекулярный
нклород дыхательной цепью митохондрий. Здесь окисление сопря-
+eiio с фосфорилированием - синтезом АТФ посредством присоеди-
1н пня к АДФ остатка фосфорной кислоты (т. е. фосфорилирования
\ДФ). Этим обеспечивается энергоснабжение всех процессов жизне-
ini'1'сльности животных и человека.
Химиоосмотическая гипотеза фотофосфорилирования. Раз-
шжение воды и синтез АТФ происходят на свету. Для остальных ре-
1МЦ1Й, в ходе которых фотосинтетические комплексы поглощают из
шидуха С02 и синтезируют из него углеводы, свет не требуется. Поэ-
н>му их называют темповыми реакциями. Они обеспечиваются сво-
чидиой энергией, запасенной в световую фазу (стадию). Детали све-
1И1И.1Х и темновых процессов излагаются в курсе биохимии. Здесь
уместно рассмотреть только химиоосмотическую гипотезу фотофос-
||нфилирования. Фотофосфорилированием называют синтез АТФ из
ЛД(Г> и ортофосфата, происходящий под действием света в мембра-
ιΐιιχ, содержащих хлорофилл.
Катализатором фотосинтеза АТФ служит ферментная система,
м(||>азующая протонный насос, который наряду с квантосомой сосре-
IIIючен в тилакоидной мембране. Эта ферментная система (Н-зави-
■ имня АТФаза) сопрягает электронный транспорт в квантосоме
• конвертированием свободной энергии в концевой фосфатной связи
ΛΓΦ. Поэтому ее называют сопрягающим фактором (CF). В этом
мшрижении участвует также концентрационный градиент Н+-ионов
(протонный градиент) на тилакоидной мембране. Из рис. 3.33 видно,
■но энергия, переносимая возбужденными электронами по квантосо-
234
Биофизика
Рис. 3.33. Схема механизма фотофосфорилирования
F0 —субъединицы НАТФазы, образующие канал во внутренней
митохондриальноймембране, CF' ,-субъединщы Н-АТФазы,
образующие ее «головку» а магприксе митохондрии
ме, отчасти расходуется на создание и поддержание протонного
градиента посредством расщепления воды внутри тилакоида, где всегдп
рН ниже, чем в цитозоле. Как полагают, протонный градиент на ти
лакоидной мембране поддерживается и посредством работы про
тонного насоса, который в темноте обеспечивает активный
транспорт Н+-ионов через нее. Источником энергии для переноса Н+ щ
цитозоля в тилакоид служит АТФ, гидролиз которого активируется
Н-АТФазой. В свою очередь, протонный градиент на тилакоидной
мембране является движущей силой пассивного транспорта Н+ черс ι
нее. При таком движении протонов Н-АТФаза катализирует не
гидролиз АТФ, а синтез его из АДФ и ортофосфата, т. е. служит АТФ·
синтетазой. Происходит обращение протонной помпы. Следователь
но, энергия протонного градиента является промежуточной формоП
преобразования солнечной энергии в химическую энергию макроэр
гических связей АТФ.
Существование протонного градиента на тилакоидной мембра
не подтверждено прямыми измерениями. При длительном освещении
ι ικιιΐο 3. Квантовомеханические основы биоэнергетики
235
нпсных растений рН внутри тилакоидов становится на 3,5 единицы
ниже, чем в цитозоле. В обычных условиях на свету эта разница
меньше, но существует всегда. Транспорт одного электрона по обеим
фотосистемам (ФС II и ФС I), принадлежащим одной квантосоме,
приводит к образованию внутри тилакоида одного протона. Следова-
iciii.HO, протонный градиент на тилакоидной мембране непосредст-
iiiniio обеспечивается энергией, освобождающейся при переносе воз-
иужденных электронов между ее молекулярными компонентами.
За счет протонного градиента на мембране тилакоида поддер-
лмиается разность потенциалов (Δ£7) порядка 100 мВ. Именно
электрическая энергия, заключенная в разности потенциалов на тилакоид-
iinii мембране (как в конденсаторе), видимо, является промежуточной
фирмой преобразования свободной энергии при фотосинтезе: солнеч-
iiiim энергия —» энергия возбужденных электронов —» электрическая
шергия на тилакоидной мембране —»химическая энергия макроэрги-
•и'ских связей АТФ. Однако электрическую энергию мембраны, обу-
| повленную разобщением Н+-ионов и анионов на ней, можно рас-
| матривать как эквивалент осмотической энергии, заключенной
ι» концентрационном градиенте протонов. Это, по существу,
эквивалентные понятия. Поэтому промежуточную форму энергетических
преобразований при фотофосфорилировании можно называть и
осмотической энергией протонного градиента, как было сказано выше.
I In >тому гипотеза называется химиоосмотической.
При падении AU на тилакоидной мембране синтез АТФ угне-
шегся, а при увеличении - усиливается. Другим подтверждением
участия протонного градиента в образовании макроэрга является
шпможность синтеза АТФ в темноте, если на тилакоидной мембране
ι очдается и поддерживается градиент Н+-ионов путем искусственно-
I и ощелачивания среды вокруг тилакоида.
Несмотря на многие аргументы, подтверждающие роль
пропитого градиента (и ΔΙΤ) на тилакоидной мембране в энергетиче-
| ком сопряжении электронного транспорта в квантосоме с синтезом
Λ ΙΦ, не все согласны с химиоосмотической гипотезой. Есть мнения,
что перенос возбужденных электронов по квантосоме сопряжен
ι образованием макроэнергетических связей не электрической (осмо-
236
Биофизик»
тической), а химической или механической энергией. Однако все пи
вые и новые факты подтверждают химиоосмотическую гипотечу
Важные аргументы в ее пользу дает и рассмотрение эволюции биоч
нергетичесикх процессов.
Эволюция биоэнергетических процессов. Большой взрын,
который привел к образованию Вселенной, произошел предположи
тельно 15 миллиардов лет назад. Более 10 миллиардов лет Земля
пребывала в предбиотическом периоде, но уже около 4,5 миллиардов jiei
она является очагом органического синтеза, причем более 3 миллиар
дов лет на ней живут организмы с клеточной организацией. Так думн
ют те, кто не принял гипотезу направленной панспермии Сванте Ар
рениуса и Фрэнсиса Крика.
Первые клеточные системы развивались в атмосфере, обладап
шей восстанавливающими свойствами. В ней отсутствовал молеку
лирный кислород при наличии азота, окиси углерода, газообразно! и
водорода, сернистых паров. Из этих веществ зарождающаяся бни
сфера извлекала высокоэнергетические электроны.
В ходе биохимической эволюции давно возник и сохранило!
до сих пор такой тип метаболизма, при котором электроны с оргапи
ческих субстратов переносятся на связанный кислород, входящий
в состав нитратов, сульфатов, карбонатов и других соединений. Эш
вещества могут окислять субстраты сами, без участия молекулярное*
кислорода.
Бактерии, обладающие таким метаболизмом, имеют элем
рон-транспортные системы, в состав которых входят, как правило,
цитохромы. Поскольку здесь окисление органических субстратом
происходит в анаэробных условиях, то его называют анаэробны·»
дыханием. В зависимости от того, какие вещества вместо 02 служи ι
акцепторами электронов в таких системах, говорят о следующих вн
дах анаэробного дыхания: нитратном, сульфатном, карбонатном,
серном, фумаратном, железном.
Так, например, при восстановлении нитрата до аммиака или
сульфита до сульфида в анаэробных условиях необходимо перенести
на соответствующие акцепторы по 6 электронов. При карбонатном
дыхании анаэробных бактерий из органических веществ образуется
ι untie 3. Квантовомеханические основы биоэнергетики
237
мгган, причем конечным акцептором электронов могут служить
лиги · двуокись углерода, либо ацетат.
Результатом работы электрон-транспортных цепей при всех
ипдах анаэробного дыхания является выведение из микробных кле-
1 тс протонов, что создает на клеточной мембране протонный
потенциал, обеспечивающий сопряжение переноса электронов с синтезом
Λ'Ι'Φ (фосфорилированием). Такое энергообразование гораздо
эффективнее брожения (анаэробного гликолиза). По-видимому, термо-
ципамическая целесообразность мембранных электрон-транспорт-
пых систем была важнейшим фактором, определившим эволюцию
процессов энергообеспечения биосферы.
Дальнейшее развитие жизни оказалось неизбежно связанным
ι использованием энергии солнечного света. Однако фотоны приоб-
I и· II и возможность возбуждать электроны биологических систем
тлько после образования в биосфере фотоэлектронных единиц.
Уникальным компонентом таких единиц стали хлорофиллы. Они-то
π обеспечили фотоэлектронным единицам возможность выполнить
m повную функцию - принимать электроны от донора с низким энер-
ишческим уровнем и за счет энергии Солнца возбуждать их на-
| ишько, чтобы они могли перейти на вещество, обладающее более
ni.ieoKHM электронным потенциалом, чем донор. Хлорофиллы служат
промежуточной ступенькой в потенциальной яме между донором
и икцептором электронов и вместе с тем, будучи пигментами, -
мощным приемником солнечного света, который используется для
возбуждения электронов.
Первыми представителями живой природы, которые приобре-
III фотоэлектронные единицы с хлорофиллами, стали представители
прокариот - цианобактерии (так называемые синезеленые водорос-
п/). Предполагают, что они живут на Земле уже 2,5-3,2 миллиарда
it-г. Покрыв всю Землю, цианобактерии господствовали на ней
.' миллиарда лет. Их жизнедеятельность, в ходе которой выделяется
молекулярный кислород, преобразила атмосферу Земли. Примерно
I 1,5 миллиарда лет назад образовались хлоропласты в клетках
зеленых растений. Постепенно развилась аэробная жизнь с
преобразованием архаичного фотофосфорилирующего аппарата в дыхательную
пень.
238
иофиз м
3.6.2. Электрон-транспортная цепь
внутренней мембраны митохондрии
Клеточное дыхание происходит в митохондриях (рис. 3.34). Ни
внутренней мембране этого органоида сосредоточены электрон-трат
портная (дыхательная) цепь, обеспечивающая межмолекулярный ир
ренос электронов с субстратов клеточного дыхания на молекулярный
кислород (процесс биологического окисления), и система сопряжс
ния окисления с фосфорилированием (синтез АТФ из АДФ).
Типичной ошибкой является представление биологическом!
окисления следующей реакцией: 2Н2 + 02 -> 2Н20. Это реакци·
взрыва гремучего газа. Ошибка в том, что в живых клетках окисл·
ются не молекулы, а атомы водорода, поставляемые в реакцию ορι и
ническими веществами. Их называют субстратами клеточного ды
хания. К ним принадлежат продукты расщепления углеводом
жиров и белков, усвоенных организмом при пищеварении. В эти»
веществах заключена солнечная энергия, аккумулированная ими
благодаря фотосинтезу. Окисление освобождает энергию, заклш
ченную в химических связях субстратов клеточного дыхания м
3
5
1
6 7
2
б)
\ _
а)
Рис. 3.34. Схема митохондрии
а — общий вид (трехмерное изображение), б - мембранная организация
митохондрии. 1 — наружная митохондриалъная мембрана, 2 — межмембранн
пространство, 3 - внутренняя митохондриалъная мембрана 4 — кристы
(гребешки), 5 — грибовидные выросты, 6-цитозоль, 7—матрикс митохондри
ι пяла 3. Квантовомеханические основы биоэнергетики
239
»чет существования у них коллективизированной системы π-элект-
|||июв. Важно, что при биологическом окислении свободная энергия
ib частично превращается в тепло. Большая часть
«раскрепощенной» свободной энергии идет на синтез АТФ (конвертируется
н химических связях макроэргов). АТФ синтезируется при взаи-
W "действии АДФ с ортофосфатом. Следовательно, биологическое
(ииутримитохондриальное) окисление сопряжено с фосфорилирова-
1ШСМ АДФ (синтезом АТФ). Реакция фосфорилирования идет с
преодолением потенциального барьера, на что и затрачивается энергия,
иг побеждающаяся при окислении продуктов расщепления
питательных веществ. В дальнейшем клетки используют энергию,
заключенную (аккумулированную, конвертированную) в концевой фосфатной
ι тии АТФ, на совершение различных форм полезной работы.
Таким образом, клеточное дыхание состоит в сопряжении
Hhi юления органических веществ с синтезом АТФ. Окислительное
фисфорилирование - многоступенчатый процесс, осуществляемый
посредством транспорта электронов по макромолекулам, которые
шередоточены в биологической мембране. Благодаря мембранной
организации эти макромолекулы образуют строго упорядоченную
ι нстему переноса электронов и протонов, называемую дыхательной,
пин окислительной, цепью (ДЦ или ОЦ). Только у примитивно орга-
шгюванных бактерий клеточное дыхание происходит в плазмолем-
мг. У подавляющего большинства представителей живой природы
1{\\ локализована во внутренней мембране митохондрии - клеточной
органеллы, специально приспособленной к окислительному фосфо-
|шлированию. Важно подчеркнуть, что существенным звеном
сложного процесса клеточного дыхания является активный транспорт
IГ-ионов в цитозоль из митохондрии. Заметим, что к изучению кле-
шчного дыхания нужно приступать после хорошего усвоения
современных представлений о квантовомеханических механизмах перено-
м1 энергии и заряда в биомолекулярных системах, а также основ
мембранологии с учетом специфических особенностей митохондри-
•шьпых мембран.
Особенности митохондриальных мембран. Каждая
митохондрия имеет две мембранные системы: наружную и
внутреннюю (рис. 3.34). Межмембранное пространство достигает несколь-
240
Биофизика
ких нанометров. Наружная мембрана гладкая, в ней примерно
поровну представлены липиды и белки. Ее структуре лучше дру
гих соответствует бутербродная модель. Наружная мембрана обла
дает хорошей проницаемостью для ионов, метаболитов и даже
макромолекул.
Строение внутренней митохондриальной мембраны наиболее
адекватно отображает мозаичная модель. По структуре и функции
эта мембрана принадлежит к наиболее сложным типам мембранных
систем. В ней множество складок, называемых гребешками (криста
ми), за счет которых происходит существенное увеличение мемб
ранной поверхности. В расчете на одну митохондрию гепатоциш
крысы она составляет в среднем 16 мкм2, тогда как площадь наруж
ной мембраны, имеющей больший периметр, - около 13 мкм2. Заме
чено, что с метаболической активностью клетки хорошо коррелиру
ют складчатость и, следовательно, величина площади внутренней
митохондриальной мембраны. В печени млекопитающих суммарна*
площадь внутренних митохондриальных мембран составляет 40 кг
в расчете на 1 г белка, тогда как в летательных мышцах насекомых,
где обмен веществ и энергии гораздо интенсивнее, этот показател!,
достигает 400 м2.
Во внутренней митохондриальной мембране сосредоточены
белковые комплексы, образующие дыхательную цепь, по которой
электроны переносятся с субстратов клеточного дыхания на молеку
лярный кислород (рис. 3.35).
Важную роль в клеточном дыхании играет транспорт протонон
через внутреннюю митохондриальную мембрану, который лини·
условно можно назвать трансмембранным переносом. Этот тране
портный процесс вместе с переносом электронов по дыхательной це
пи митохондрии обеспечивает достижение конечной цели всего
дыхания - преобразование солнечной энергии в химическую энергию
макроэргических соединений, которая в организме превращается ни
все виды полезной работы.
Молекула АТФ впервые была выделена Фиске и Субарроу m
экстрактов скелетных мышц в 1929 г. Через 2 года отечественны!!
биохимик В.А. Энгельгардт обнаружил связь между синтезом АТФ
и клеточным дыханием. Еще через 10 лет Липман сформулировал
I пиве 3. Кеантовомехенические основы биоэнергетики
241
Внутренняя
Межмембранное митохондриальная Митохондриальный
пространство мембрана метрике
2Н+
Fo
ι
g.HAflH
ОН"
2Н+ θ Η+
•Q
2Н+ Н4
ι .
и*
е~
ОН"
►о2 н2о
Рис. 3.35. Схема дыхательной цепи во внутренней мембране митохондрий
Положение о том, что АТФ является универсальной «энергетической
млютой» в организме человека и животных, поскольку выполняет
1ссию посредника между внешним источником энергии (Солнцем)
юлезной работой биологических систем.
Схема электрон-транспортной цепи и системы сопряжения
МГисления с фосфорилированием, сосредоточенных в митохондрии,
Мображена на рис. 3.36.
242
Биофизика
протеины липиды
ν углеводы '
МАТРИКС
МИТОХОНДРИИ
Hjo:
.он-
ЗАД»> + 3Φ»-+3Η*-3ΛΤ·* *Hfl
Внутренняя
митахондриальная
мембрана
h
г
Жвпмо-
СВРНЫЙ
Л
+
ίΉ* +н· !
КоО(2Н)
и
аа
ЦХЬ.с,
F·»
it
F«a»
J·-
ЦХс
F·»
:1
F·»
а»
--·
Цттароы-
F.J..CUJ*
it
W. Cu+
■
#
...
Межмембранное пространство
Наружняя митохоидриальная мембрана
«.
.А»'..
О
—-i!i·- -н
Цитозоль
Рис. J.36. Осела клеточного (митохондриального) дыхания
Θ
3.6.2.1. Биологическое окисление
Все субтраты клеточного дыхания, являющиеся продуктами
расщепления углеводов, белков и жиров, поставляют в митохондрии
протоны (Н+) и π-электроны, которые на пути к кислороду должны
передаваться по эстафете от одного вещества другому в митохондри
альной дыхательной цепи. В таком путешествии электроны отдаю ι
свою энергию на синтез АТФ не одномоментно и не в одном пункте,
а порциями на ступенях каскада молекул, стоящих в мембране
в строгом порядке, предопределенном их восстановительными
потенциалами, т. е. сродством к электронам (чем больше величина
положительного восстановительного потенциала, тем выше степень
сродства к электронам).
Рис. 3.37 иллюстрирует каскад переноса π-электронов по дыха
тельной цепи митохондрий. Каждый ее компонент (кофермент или
Uuma 3. Квантовомеханические основы биоэнергетики
243
-0,32. I НАД*
67,55 кДжмоль-1
42,46 кДж-моль-1
+0,29
+0,62
Восстановительные
потенциалы
Fe2*
102,29 кДжмоль-1
Fe2*
^н2о
Свободная энергия
1'нс. 3.37. Схема межмолекулярного переноса π-электронов по дыхательной цепи
митохондрий. Слева — восстановительные потенциалы редокс-пар компонентов
дыхательной цепи, справа — перепады свободной энергии на каждом
из трех этапов выброса протонов в цитозоль
ьофактор макромолекулы), а их более 15 (на схеме показаны не все),
ш падает свойствами окислительно-восстановительной пары.
И окисленном состоянии такая молекула является акцептором
электронов, причем они поступают на нее не в одиночку, а попарно. Приняв
пиру электронов, молекула восстанавливается и приобретает свойства
ιιΐι-ΚΊройного донора. Так, окисленный иикотинамидадениндинукле-
ш ид (НАД+), приняв пару электронов, восстанавливается до НАД · Η
и iciiepb служит основным донором электронов для дыхательной
цепи. В реакциях, в которых образуется НАД · Н, от молекулы субстрата
нщювременио отнимаются 2 атома Н, которые дают 1 гидрид-ион
lui ом водорода с добавочным электроном - Нг) и 1 протон. Кроме
НАД · Н, поставщиками электронов в дыхательную цепь могут быть
ι укцинат, глицерофосфат и другие вещества, но тогда синтезируется
меньше молекул АТФ (рис. 3.38).
При переносе одной пары электронов с НАД · Η на кислород
образуются 3 молекулы АТФ, причем электронный транспорт по
дыми слыюй цепи начинается с того, что у НАД · Η отбирается
гидрид-ион (Нг). При этом регенерируется НАД+, а гидрид-ион
превращается в№и 2ег.
244
Биофизик*
Η* Η* Η* Цитоэоль
ι Ι Наружняя
ι ' ■ ·--· ■-■■-- ■ ■ ■: ■ ■ -..··. ι митохондриальнм
мембрана
Межмембранноа
пространство
Изоцитрат ► НАД -► ФП,—► KbQ -* цит b -» цит ct —* цит с -* цит а,+ а3—► 02
Рис 3.38. Различия в выбросе протонов в цитозоль из митохондрии
(и, следовательно, в синтезе АТФ) при использовании разных доноров %-электроит
НАД · Η - довольно устойчивое соединение. Для отрыва от ι к·
го электронов необходима большая сила. Такой силой служит ра ι
ность восстановительных потенциалов между редокс-парами: нико
тинамидадениндинуклеотида (НАД7НАД · II) и первого компонент
дыхательной цепи - флавопротеида (его коферментом служит фла
винмононуклеотид - ФМН). У этого вещества стандартный воссш
новительный потенциал редокс-пары составляет - 0,30 В, тогда как
у НАД+/НАД · Η он равен - 0,32 В. Разница составляет всего 0,02 И,
но расстояние между соседними молекулами, образующими дыха к·
льную цепь во внутренней мембране митохондрии, не более 2,5 им
Поэтому напряженность электрического поля между НАД · Η и окис
ленным ФМН очень большая (порядка 107 В · м-1), причем ФМН име
ет более положительный потенциал, чем предыдущая редокс-парн,
и «стягивает» на себя π-электроны с НАД · Н.
Отдав электроны, НАД ■ Η окисляется до НАД1", и теперь эта ре
докс-пара готова принять новую пару электронов, а окисленный
ФМН, отобравший электроны от НАД · Н, восстанавливается. Но по
коя ему не дает следующий компонент электрон-транспортной цепи
(на рис. 3.37- коэнзим Q, молекула которого имеет «хвост» из 10 изои
ФП«
Малат
1ляпа 3. Квантовомеханические основы биоэнергетики
245
реповых единиц, который удерживает ее во внутренней мембране ми-
шхондрий; эта молекула обладает свойствами редокс-пары,
стандартный восстановительный потенциал которой составляет + 0,07 В).
1,1 гественно, что он отбирает пару электронов от ФМН и восстанавли-
иистся, а его предшественник при этом окисляется и снова становится
ilk ι ротором π-электронов.
За коэизимом Q в митохондриальной мембране стоят иеско-
niiKO цитохромов (Ь, с,, с, a + a3). Цитохромы Ъ, с,, с содержат в
качестве кофактора ион железа, способный совершать превращения
и ι окисленной (Fe3+) в восстановленную (Fe2+) форму и обратно.
Комплекс цитохромов (а + а3) называется цитохромоксидазой
и содержит не только железо, но и медь. Чем дальше стоит цито-
ιριΐΜ от коэнзима Q, тем все более положителен восстановительный
потенциал его редокс-пары: от цитохрома в (+0,12 В) до цитохро-
моксидазы (+0,55 В). С цитохромоксидазы пара π-электронов
постужам па кислород и восстанавливает его до воды. Стандартный вос-
| in новотельный потенциал редокс-пары: 02/Н20 равен +0,82 В, т. е.
ι >, обладает наибольшим сродством к электронам.
Таким образом, при переносе пары π-электронов с НАД на
и, разность восстановительных потенциалов составляет 1,14 В
(hi - 0,32 В до + 0,82 В). Между перепадами стандартного восстано-
иительного потенциала (AU) и изменениями свободной энергии сис-
н-мы (AG) существует прямо пропорциональная зависимость: AG -
и ■ F ■ AU, где η - количество переносимых электронов (и = 2),
/ число Фарадея (F = 96484 Кл · моль1).
Согласно расчету, изменение свободной энергии π-электронов
при их межмолекулярном переносе от НАД до 02 составляет -
).Н) кДж-моль-1. Знак минус означает, что переносимые π-электроны
1Сряют в дыхательной цепи свою энергию. Но она тратится не
понапрасну. Львиная доля (от 43% до 60%) идет на синтез АТФ, в тепло
преобразуется сравнительно небольшая ее часть (15-25%), а за счет
остальной энергии работают системы активного транспорта в мито-
ышдриальной мембране.
Сопоставляя шкалы восстановительных потенциалов
компонентов систем фотосинтеза и дыхательной цепи, нетрудно убедиться
246
Биофизик»
в том, что солнечная энергия, конвертированная π-электронами при
фотосинтезе, затрачивается преимущественно на клеточное дыхание
(на синтез АТФ). За счет поглощения двух фотонов обеими
фотосистемами (ФС II и ФС I) π-электроны переносятся от Р680 до ферредокси
на, увеличивая свою свободную энергию примерно на 241 кДжмоль '
Ее небольшая часть расходуется при переносе π-электронов в зеленых
растениях с ферредоксина на НАДФ+. В результате синтезируются вс
щества, которые затем становятся пищей для гетеротрофов и превра
щаются в субстраты клеточного дыхания. В начале дыхательной цепи
запас свободной энергии π-электронов составляет 220 кДжмоль'.
Значит, до этого энергия π-электронов, аккумулировавших солнечную
энергию, понизилась всего на 21 кДжмоль-1. Следовательно, более
90% солнечной энергии, запасенной в зеленых растениях, доносится
возбужденными π-электронами до дыхательной цепи митохондриП
животных и человека.
.Конечным продуктом окислительно-восстановительных реак
ций в дыхательной цепи митохондрий является вода. В ходе
биологического окисления у человека в покое за сутки образуется около
300 мл так называемой эндогенной воды окисления. При усилении
метаболизма образование эндогенной воды окисления усиливается
Ее объем определяется массой окисленных субстратов клеточного
дыхания: при окислении 100 г жира образуется примерно 100 мл во
ды, тогда как окисление 100 г белка и 100 г углеводов дает
соответственно 40 и 50 мл воды.
Вода обладает наименьшей свободной энергией из всех
биологически важных молекул. Говорят, будто с водой организм выделяа
электроны, лишенные энергии в процессах жизнедеятельности. Ни
самом деле запас энергии в воде отнюдь не нулевой, но вся энергии
заключена в σ-связях и не может быть использована для химических
превращений при температуре тела и других физико-химических
параметрах организма животных и человека. В этом смысле
химическую активность воды принимают за точку отсчета (нулевой уровень)
на шкале биосферной химической активности, поскольку у воды ее
считают нулевой и утверждают, что «Н20 - mater et matrix жизни ни
Земле», ибо она очень комфортная и совсем не агрессивная среда (ко·
(пава 3. Квантовомеханические основы биоэнергетики
247
иыбель) для процессов жизнедеятельности. В таких рассуждениях,
правда, не учитывается высокая степень полярности молекул воды
II ряд других свойств, которые делают ее не такой уж безобидной.
Из всех биологически важных веществ вода обладает самым
нысоким ионизационным потенциалом (<рц). Эта физическая
величина представляет собой энергию, необходимую для преодоления сил
притяжения электрона к ядру. Она измеряется в электронвольтах
()В). Чем больше <рц электронов, входящих в состав того или иного
нтома или молекулы, тем ниже их реакционная способность, причем
под ионизационным потенциалом многоэлектронной системы подра-
|умевают <ри того ее электрона, у которого он наименьший.
Например, <ри атома водорода совпадает с φ„ его единственно-
к) электрона и равен 13 эВ. У всех молекул биосферы диапазон
ионизационных потенциалов разнится в пределах 1 эВ (между 11,3
и 12,56 эВ). Наибольшая из этих величин (12,56 эВ) присуща воде.
Энергия орбиталей - это энергия образующих их электронов.
Поэтому если у воды <рц = 12,56 эВ, а <рц электрона, принадлежащего
какому-либо другому веществу, равен, допустим, 12 эВ, то энергия
οιό орбитали относительно воды составляет 0,56 эВ, что является ко-
инчественной мерой более высокой реакционной способности
данного вещества по сравнению с водой.
Если принять <рц воды за точку отсчета реакционной
способности всей биосферы, то шкале ионизационных потенциалов будет
соответствовать шкала так называемых биопотенциалов - БП. Обе
шкалы изображены на рис. 3.39. Биопотенциал каждого
органического вещества имеет вполне определенное биологическое значение -
он соответствует энергии, которая освобождается при окислении
данного соединения до воды, нулевой БП которой отображает самую
низкую реакционную способность Н20 из всех биомолекул.
Размерность БП на рис. 3.39 - это размерность свободной энер-
I пи соответствующих веществ (в ккал). При переходе от шкалы <рц
к шкале БП нужно учитывать число Фарадея (F) и разность стандарт-
пых восстановительных потенциалов (AU) между редокс-парой
данного вещества и редокс-парой 02/Н20 (U = +0,82 В): AG = F-AU. По-
>гому у ферредоксина, у которого относительно воды AU = - 1,25 В
248
Биофизик*
в)
О
1
2
3
4
5
6
7
8
9
10
11
12
13
Ф„.эВ
<Рц, эВ БП, ккал
-40
11.06-
11.56-
12,06
} Биосфера
JH20
12,56
30
20
10
- Ферредоксин
НАД
- Рибофлавин
■ Желтый фермент
■£о
- Аскорбиновая кислота
- Цитохром с
0 Вода
б)
Рис. 3.39. Шкалы ионизационных потенциалов (φ,,} и биопотенциалов (БП). Левам
шкала, на б- φ„ (эВ), свойственные биосфере, правая шкала на б- БП (ккал) ряди
биоорганических соединений. /н 0 - потенциал воды (12,56 эВ), принятый за
нулевой уровень БП, Е0- восстановительный потенциал водородного электрода отно
сительного кислородного электрода при полярографии (принимается
за нулевой уровень восстановительного потенциала (вещества, расположенные
на шкале БП выше Ε о, имеют отрицательный восстановительный потенциал,
а вещества, расположенные ню/се Ε о, - положительный U)
(так как U = - 0,43), БП достигает 28,8 ккал · моль-1, а у никотиннп
мидадениндинуклеотида (НАД), у которого относительно воды Δί/ -
1,14 В (так как U = - 0,32 В), БП составляет 26,2 ккал · моль-1.
Электроны воды «оживляются» в процессе фотосинтеза, по
полняя электронный фонд хлорофилла Р680 по мере потери им
своих π-электронов под действием Солнца, а клеточное дыхание снови
порождает воду, электроны которой не способны придать ей
химическую активность в организме животных и человека. Этот
кругооборот электронов называют «электронным чертовым колесом био
сферы»: от воды к жизни через фотосинтез и обратно к воде черм
клеточное дыхание. Только крутит электронное колесо биосферы не
черт, а Солнце.
Для окислительного фосфорилирования важна мембранная
организация системы клеточного дыхания, обеспечивающая строгую
/ пмва 3. Квантовомехенические основы биоэнергетики
249
упорядоченность взаимного расположения молекул, образующих ка-
гкад электрон-транспортной цепи и весь молекулярный ансамбль
сопряжения процессов окисления и фосфорилирования. Реконструкция
чихательной цепи была безуспешной до тех пор, пока Э. Рэкер не до-
шдался расположить ее компоненты (переносчики π-электронов)
и митохондриальной мембране асимметрично. На рис. 3.35 видно,
ίιο одни переносчики сосредоточены на наружной стороне
внутренней митохондриальной мембраны, другие - на внутренней, третьи
(цитохромоксидаза) - пронизывают ее насквозь, а протонная помпа
(I) не только «прошивает» всю мембрану, но и выступает в матрикс.
Искторные структурно-топографические особенности молекулярной
организации внутренней мембраны митохондрий являются необхо-
нимым условием для превращения энергии возбужденных π-электро-
IIDI) в свободную энергию концевой фосфатной связи АТФ.
Электронные токи между молекулами ансамбля дыхательной
цепи могут, по мнению А. Сент-Дьердьи, обусловить полупроводни-
Ktuibie свойства биологических систем, хотя до сих пор живые ткани
риссматриваются только как диэлектрики и проводники.
Электропроводность связывают с ионами, входящими в состав биологиче-
| кпх электролитов. Электронная проводимость биологических сис-
ιι·μ не изучена.
Можно полагать, что поведение электронов в ансамблях
молекул, встроенных в биологические мембраны, имеет важные особенно-
11 и, связанные прежде всего с ограничением числа степеней свободы
и строго упорядоченной системе переноса. В электронике это
присуще так называемым системам пониженной размерности.
Техническая реализация систем пониженной размерности в полупроводнико-
иых гетероструктурах привела к развитию квантовомеханической
инженерии, обеспечившей значительный прогресс в
информационных технологиях. Речь идет прежде всего об изобретении быстродей-
• твующего транзистора, без которого не было бы мобильной связи и
спутникового телевидения, о разработке технологии высокоэффек-
ишных фотоэлементов, обеспечившей производство гетерострук-
шурных солнечных элементов для космических батарей, о создании
полупроводникового лазера, который стал «иголкой» в CD-проигры-
нп гелях, рабочей частью лазерных принтеров, источником излучения
250
Биофизика
в волоконно-оптических линиях связи. За решающий вклад в физику
полупроводниковых гетероструктур Ж. И. Алферов и Г. Кремер были
удостоены Нобелевской премии в 2000 г. Анализ работы элск ι
рон-транспортных систем организма с позиций теории гетерострук
тур может оказаться полезным для открытия пока неизвестных мехи
низмов информационных процессов в биологических системах.
Вместе с тем существует мнение, что ферментные комплексы
дыхательной цепи свободно перемещаются во внутренней митохопл
риальной мембране с помощью латеральной диффузии. В таком слу
чае передача электронов от доноров к акцепторам - результат слу
чайных столкновений взаимодействующих молекул. Эта гипотеш
была сформулирована до разработки в физике теории межмолску
лярного переноса электронов. По мере развития этой теории остасп и
все меньше сторонников концепции электронного транспорта в ми
тохондриях, основанной на законах статистической физики. Струк
турная упорядоченность электрон-транспортной цепи митохондрии
является, по-видимому, одним из примеров построения «порядка и ι
хаоса» (термин И.Р. Пригожина).
3.6.2.2. Сопряжение окисления и фосфорилирования
Кроме π-электронов, транспортируемых от молекулы к моле
куле по дыхательной цепи вдоль внутренней мембраны митохопл
рий, через нее (поперек) переносятся некоторые частицы: элементар
ные (протоны) и гораздо более крупные (молекулы АТФ, например)
Транспорт протонов обеспечивает сопряжение окисления и фосфо
рилирования. Важнейшая роль в этом процессе принадлежит Η-ΑΊ
Фазе (протонной помпе), встроенной во внутреннюю митохондрии
льную мембрану.
За счет свободной энергии, выделяемой при транспорте по Д11
пары электронов, образуются 3 молекулы АТФ. В так называемы»
стандартных условиях, когда концентрации АТФ, АДФ и ортофос
форной кислоты равны 1 моль · л-1, величину изменения свободной
энергии (AG) при гидролизе АТФ называют изменением стандарт
ной свободной энергии для данной реакции (AG°) - оно равим
31,4 кДж · моль-1. В других условиях AG отличается от AG°. Так, при
i imea 3. Квантовомеханические основы биоэнергетики
251
концентрациях АТФ, АДФ и Н3Р04, свойственных клеткам в физио-
1101 ических условиях, энергия гидролиза АТФ (равно как и энергия
синтеза АТФ из АДФ и Н3Р04) может достигать 45 кДж ■ моль-1.
Число молекул АТФ, синтезированных при окислении того или
иного вещества, определяется количеством пар электронов,
поставляемых им в ДЦ. В целом восстановление 02 до Н20 может быть пред-
11 авлено в виде реакций: 02 + 4Н —» 2Н20 или 02 + 4Н+ + 4е~ —» 2Н20.
Значит, в ДЦ с предшествующих этапов расщепления органиче-
I κιIX веществ в клетке должны поступать атомы водорода, являющие-
| и непосредственными источниками электронов, переносимых по
ncii. По утверждению А. Сент-Дьердьи, «водород - это топливо
жизни, и ни один электрон в живых системах не способен двигаться, если
π о не сопровождает водород». В конечном счете все субстраты
клеточного дыхания поставляют в ДЦ протоны и электроны. Они обра-
|уются главным образом при расщеплении воды, катализируемом
ι псциальными ферментными системами. Среди них важнейшая роль
и качестве предварительной стадии окислительного фосфорилирова-
мпн принадлежит так называемому циклу Кребса (см. рис. 3.36). От не-
II) начинаются пути многих биосинтетических процессов (синтез угле-
иодов, липидов, белков и других сложных органических соединений).
Имеете с тем он служит основным поставщиком электронов и
протонов на НАД\ В реакциях цикла Кребса образуются С02, Н+ и
электроны, восстанавливающие НАД+ до НАД · Н.
В курсе биохимии цикл Кребса изучается детально. Здесь сле-
цует подчеркнуть его основное назначение в клеточном дыхании, ил-
шострируемое таким примером. Окисление одной молекулы пирови-
ппградной кислоты без участия в этой реакции цикла Кребса дает
I протона и 4 электрона, перенос которых по ДЦ обеспечивает синтез
d молекул АТФ. При участии цикла Кребса в расщеплении молекулы
ппрувата дыхательная цепь получает 10 протонов и 10 электронов, за
ι чет чего синтезирует 15 молекул АТФ. Следовательно, основное на-
пшчение цикла Кребса в клеточном дыхании состоит в повышении
иыхода свободной энергии из органических соединений путем ката-
шпа расщепления воды для образования большего количества
протонов и электронов, поставляемых далее в ДЦ.
252 Биофизикп
Для получения общего представления о значимости окислите
льного фосфорилирования в энергетическом обеспечении организмп
полезно количественно оценить синтез АТФ при расщеплении глш
козы. В ней заключена свободная энергия в 2879 кДж · моль-1 (при
мерно 685 ккал · моль-1). Первой стадией расщепления глюкозы слу
жит гликолиз, в ходе которого каждая молекула распадается на днг
молекулы пировиноградной кислоты. При этом потребляются днг
и синтезируются четыре молекулы АТФ. Суммарно в результате прс
вращения одного моля глюкозы в пируват организм получает два мо
ля АТФ. Процесс идет в анаэробных условиях. В отсутствие кислоро
да пировиноградная кислота затем восстанавливается до молочной,
которая выводится из организма. Огромная энергия, заключеннлн
в этом веществе, не используется организмом. Эффективность испо
льзования энергии при анаэробном гликолизе ничтожна - около 2%.
В аэробных условиях 2 молекулы пировиноградной кислоты,
образовавшиеся при распаде молекулы глюкозы, не восстанавливн
ются, а окисляются далее до С02 с участием цикла Кребса и дыхатс
льной цепи. В цикле Кребса синтезируются еще 2 молекулы АТФ
Далее в ДЦ поставляются 12 пар электронов, но две из них поступи
ют не на НАД+, а через ФП на кофермент Q, обеспечивая синто
двух, а не трех молекул АТФ в расчете на пару электроном
(см. рис. 3.36). Следовательно, за счет транспорта по ДЦ этих дву*
пар электронов, миновавших НАД*, синтезируются 4 молекулы
АТФ. Остальные 10 пар электронов переносятся по ДЦ от НАД · II
до 02, и за счет них синтезируются 30 молекул АТФ.
В целом при окислении 1 моля глюкозы происходит образова
ние 38 молей АТФ. Эффективность использования свободной энер
гии при аэробном окислении глюкозы составляет при таком расчете
около 42%: КПД = 31,4 кДж-моль--38 ш% _т
2879 кДжмоль"1
Это нижняя граница возможных значений. Если же принять во
внимание физиологические концентрации различных ингредиенто!
окисления и фосфорилирования, то энергия гидролиза АТФ в клетке,
как уже говорилось, достигает не 31,4, а 45 кДж · моль4, и
эффективность использования свободной энергии при синтезе АТФ в ход|
ι пива 3. Квантовомеханические основы биоэнергетики
253
•пробного окисления глюкозы оценивается в 60%. Вместе с тем не
мся остальная энергия (40%) рассеивается в виде тепла. Много энер-
11И1 затрачивает митохондрия на активный транспорт веществ через
it мембраны, т. е. преобразуется также в один из видов полезной ра-
Гшты организма. В сумме синтез АТФ и трансмембранный перенос
ипцеств используют более 75% (до 85%) свободной энергии,
освобождающийся при биологическом окислении глюкозы.
При окислении жиров образуется больше АТФ, чем при окис-
испии углеводов. Например, окисление 1 моля пальмитиновой кис-
ио'гы дает 129 молей АТФ, но на это уходит гораздо больше кислоро-
|щ, чем на окисление глюкозы. Чтобы синтезировать 1 моль АТФ
и миокарде посредством окисления жирной кислоты нужно затра-
нпь на 17% кислорода больше, чем в аналогичном процессе с учас-
шсм глюкозы. КПД окислительного фосфорилирования при метабо-
1ише жиров значительно ниже, чем при метаболизме углеводов.
Ключевой проблемой окислительного фосфорилирования
остается механизм сопряжения транспорта электронов поДЦ и
фосфорилирования, т. е. синтеза АТФ, в митохондриях. Каким образом
шсргия, переносимая электронами по ДЦ, преобразуется в энергию
химических связей макроэргов? Что является посредником такого
преобразования? Существуют 3 основные гипотезы сопряжения
икисления и фосфорилирования: химическая, механохимическая, хи-
миоосмотическая.
Согласно первой из них, посредниками между переносом элек-
I ронов по ДЦ и синтезом АТФ служат неизвестные пока химические
пещества, которые принимают на себя возбужденные электроны
и чатем переносят их на АДФ или ортофосфат для синтеза АТФ при
их взаимодействии. Предпосылкой химической гипотезы явилось об-
ниружение таких «первичных макроэргов» в процессе синтеза АТФ
при анаэробном гликолизе. В митохондриях ничего подобного не на-
IIIни, хотя тщательно искали. Химическая гипотеза становится все
менее популярной.
В соответствии с механохимической гипотезой перенос
электронов дыхательными ферментами создает их напряженную конфор-
мацию, т. е. сжимает молекулу фермента наподобие пружины. Далее
шсргия, накопленная такой макромолекулой, предается в форме ме-
254
Биофизии»
ханической деформации компонентам протонной помпы, образую
щим с дыхательными ферментами прочные комплексы. При после
дующем расслаблении напряженных молекул накопленная ими
энергия идет на синтез АТФ. Авторы механохимической гипотсш
видят подтверждение ее основных положений в том, что перст»
электронов по ДЦ сопровождается деформациями митохондриаль
ных крист. Однако эти изменения происходят довольно медленно
Большинство исследователей считают их не причиной, а следствием
окислительного фосфорилирования.
Основной постулат хшшоосмотической гипотезы состош
в том, что энергия, освобождающаяся при окислении, вначале накам
ливается в форме электрического и концентрационного градиентов
на внутренней мембране митохондрии, а уже они непосредствепни
обеспечивают преодоление энергетического барьера в реакции фог
форилирования АДФ: АДФ + Н3Р04 —> АТФ + Н20. Химиоосмотичс
екая гипотеза со времени создания ее П. Митчеллом в 1961 г. не опро
вергнута ни одним экспериментом, но и не приобрела вес»
необходимых прямых доказательств. И все же из года в год накаплп
ваются аргументы в ее пользу.
Важно подчеркнуть, что П. Митчелл создал свою гипотезу,
преодолев ограниченность сугубо биохимического подхода к
проблеме сопряжения окисления и фосфорилирования. Он объединил в хн
миоосмотической гипотезе идеи биохимии и биофизики. По образно
му выражению В. П. Скулачева, внесшего огромный вклад в развитие
этой гипотезы, биохимики до П. Митчелла рассматривали биомемО
рану в качестве штатива для пробирок с ферментами и полагали, буд
то они действуют только на ее поверхности. П. Митчелл «заглянул»
в глубь внутренней митохондиральной мембраны и учел наряду с хи
мическими физические и физико-химические процессы,
разыгрывающиеся в ней при транспорте электронов и протонов. Он понял, что
окислительное фосфорилирование не чисто биохимический, а элект·
робиохимический (или осмобиохимический) мембранный процесс
Потенциальный барьер в реакции фосфорилирования АДФ
преодолевается за счет работы внутренней митохондриальной мембраны, ко·
торая преобразует перепад восстановительного потенциала между
начальным и конечным компонентами ДЦ в осмотическую энергию
' /шва 3. Квантовомеханические основы биоэнергетики
255
ф.шсмембранного градиента Н+-ионов и в электрическую энергию
|ш июсти потенциалов между цитозолем и митохондриальным мат-
|>ИКСОМ.
Основную идею гипотезы П. Митчелла подтверждает факт
нарушения окислительного фосфорилирования при снижении разности
потенциалов на митохондриальной мембране и падении разности рН
мгжду цитозолем и матриксом. Именно так действуют агенты, разоб-
иниощие окисление и фосфорилирование. Будучи слабыми липофиль-
Ш.1МИ кислотами, они способны переносить протоны (Н+) через ли-
1ШД11ЫЙ каркас внутренней митохондриальной мембраны, минуя
ипал в Н-АТФазе. Важным аргументом в пользу химиоосмотической
ишотезы служат также экспериментальные данные о быстром заще-
ычивании матрикса митохондрии и закислении окружающей их сре-
41.1 при резком усилении клеточного дыхания. Следовательно, пере-
III ic электронов по ДЦ сопровождается выходом из внутренней
митохондриальной мембраны ионов Н+ в цитозоль, а ОН" - в матрикс
митохондрии. Транспорт обоих ионов происходит вопреки действию
фшико-химических градиентов, на что и затрачивается свободная
шергия, выделяющаяся при окислении субстратов клеточного
дыхания. Поддержание определенного концентрационного градиента Н+
па митохондриальной мембране - необходимое условие сопряжения
нкпеления и фосфорилирования, которое нарушается не только при
по падении, но и при избыточном повышении. Во втором случае
фанспорт электронов по ДЦ тормозится, вплоть до полной
остановки, а на некоторых участках они идут вспять, создавая обратный элек-
фонный поток. По-видимому, в результате переноса электронов по
ДЦ во внутренней мембране митохондрии образуется не вода, а Н+
и ОН", которые благодаря векторным свойствам этой мембраны выде-
инются из нее по разные стороны - в разные компартменты (матрикс и
межмембранное пространство) митохондрии (рис. 3.40). Вследствие
иысокой проницаемости наружной митохондриальной мембраны
11 '-ионы легко выходят в цитозоль, создавая там более низкий рН, чем
и матриксе, куда протоны не могут проникнуть из-за крайне слабой
проницаемости внутренней митохондриальной мембраны для них.
Окисление концентрирует Н+ в одном из компартментов, разде-
нсиных митохондриальными мембранами, и, стало быть, совершает
256
Биофизика
Η / синтетазв
1АДФ+"НзР04
Рис. 3.40. Модель механизма транспорта протонов через внутреннюю
митохондриальную мембрану
осмотическую работу Осмотическая энергия накапливается в виде
градиента Н+-ионов (протонного градиента) на этой мембране. Один
акт восстановления молекулы 02 до Н20 приводит к выделению 4 Η'
в цитозоль и 4 ОН" в матрикс. Избытки ионов противоположного зна
ка по обе стороны мембраны создают на ней разность потенциалоп
порядка 200-250 мВ, причем митохондриальный матрикс приобрел!
ет отрицательный потенциал относительно цитозоля. Так митохонд
рия накапливает электрическую энергию. Митохондрии, на мембране
которых поддерживается протонный градиент, называются энергизо
ванными.
Таким образом, энергия возбужденных электронов
преобразуется на внутренней мембране митохондрии в осмотическую и
электрическую, вследствие чего создается протондвижущая сила, которая
стремится обеспечить трансмембранный перенос Н+-ионов для
выравнивая их концентрации внутри и вне митохондрии, но этому
препятствует внутренняя митохондриальная мембрана.
Транспорт протонов, создающий протондвижущую силу,
реализующуюся затем при синтезе АТФ, происходит, вероятно в 2 такта:
1) Н+, покинувший какую-либо молекулу во внутренней мембране
митохондрии под действием энергии переносимых электронов,
выходит из нее в межмембранное пространство и далее в цитозоль; 2) hi
его место приходит Н+ из матрикса. Следовательно, протоны
проходят мембраны не насквозь, а передаются по эстафете - по аналогии
I пава 3. Квантовомеханические основы биоэнергетики
257
с процессом в плазмолемме галобактерии, но с той разницей, что
свободную энергию на выброс Н+ галобактерии получают при непосред-
tiвенном поглощении фотонов, а митохондрии - от π-электронов,
побужденных Солнцем в молекуле хлорофилла и сохранивших
возбужденное состояние в биомолекулах (субстратах клеточного
дыхания), катаболизирующих в организме до атомарного водорода (про-
юна и электрона).
За счет энергии, выделяющейся в ходе биологического
окисления, протоны выходят из компонентов внутренней митохондриаль-
пой мембраны в межмембранное пространство и далее в цитозоль,
преодолевая электрохимический потенциал. Вакансии,
образовавшиеся в химических веществах мембраны при отдаче Н+, заполняются
протонами из матрикса. При таком транспорте от Н+ отстают анионы
ι пдроксила, в результате чего на митохондриальной мембране
разобщаются разноименные заряды (катионы и анионы), и между матрик-
ιом и цитозолем формируется разность потенциалов.
Предполагают, что выход протонов из внутренней
митохондриальной мембраны в цитозоль происходит в трех участках дыхате-
иыюй цепи: 1) между НАД · Η и коэнзимом Q; 2) между цитохромами
/ι и с,; 3) между цитохромом с и цитохромоксидазой (см. рис. 3.38).
1';1ньше эти участки считались пунктами синтеза АТФ, что и обозна-
ч;июсь на схемах клеточного дыхания.
Современная схема окислительного фосфорилирования,
происходящего в митохондриях, изображена на рис. 3.41. Ее важнейшим
щементом, наряду с дыхательной цепью, является сложный молеку-
нярный комплекс Н-АТФазы, которая здесь выполняет функцию
синтеза АТФ и поэтому называется Н-АТФсинтетазой (или Н-АТФ-
пштазой).
Состав, структурные и топографические свойства этого
фермента хорошо изучены (с разрешением в 0,28 нм). В нем выделили
пне части: 1) мембранную - гидрофобный белковый комплекс, обра-
|ующий канал для Н+ во внутренней митохондриальной мембране
(I·'„) и 2) матричную - гидрофильный фактор сопряжения,
выступающий из мембраны в матрикс. Весь фермент по своему строению по-
кож на гриб, ножку которого образует F0, а сферическую головку -
258
Биофизик»
6 Η*
2Н+ 2Н + 2Н+
t °t
НАД* НАДН
2 Η* 2Η+
Fo
Цитозоль
Наружняя
митохондриальная
мембрана
Межмембранное
пространство
Внутренняя
митохондриальная
мембрана
Митохондриальный
Fi) матрикс
3 АТФ+НгО
Рис. 3.41. Общая схема окислительного фосфорилирования
F,..3a успехи в изучении этого молекулярного комплекса Д. Уоксру
и П. Бойеру была присуждена в 1997 г. Нобелевская премия по хи
мии. В нобелевской речи П.Бойер заявил, что Н-АТФсинтетаза - сд
ва ли не самый красивый, необычный и важный из всех ферментов
организма. Ежесуточно он нарабатывает такое количество АТФ, ко
торое сопоставимо с массой тела взрослого человека. Ничто в соврс
менной технике не может сравниться с этой молекулярной машиной,
сочетающей недосягаемые технические показатели и эффективное!и
(например, КПД= 100%) с завораживающей красотой внешнего оо
лика и работы. Познакомимся с этой пленительной своим изящеа
вом конструкцией.
Ферментный комплекс F, (рис. 3.42) состоит из 9 субъединии
пяти типов: α, β, γ, δ, ε. Β комплексе по три а- и β-субъединицы и по
одной γ, δ, ε. Каждая из α- и β-субъединиц образует глобулярную
третичную структуру, и такие 6 глобул объединены в гексамер, кото
рый напоминает тороид (тело наподобие бублика), но с очень узким
отверстием внутри и мало отличающимися друг от друга размерами
высоты (8 нм) и ширины (10 нм).
В отверстии гексамера расположена γ-субъединица, образован
ная двумя полипептидными цепями и похожая на изогнутый стер
жень длиной около 9 нм. Ее нижняя часть (3 нм) выступает из торой
I ппва 3. Квантовомехенические основы биоэнергетики
259
ADP
PU-*·
,1"Ч
Рис, 3.42. Схема расположения Н-АТФсинтетазы во внутренней
митохондриапъной мембране. Пояснения в тексте
iiii в сторону F0. Она, а также ε-субъединица, будучи подвижными,
| рмируют своеобразный ротор, который может вращаться внутри
ι подвижного гексамера, выполняющего функцию статора в этом
•мсктромоторе.
Мембранный комплекс F0 образован полипептидными субъе-
II шипами трех типов: а, Ь, с. Молекулярная масса первой из них (гид-
||цфобной) около 20 кДа, второй - примерно 30 кДа, третьей - от 6 до
11 кДа. В F0 входят одна α-субъединица, две 6-субъединицы, от 9 до
I.' идентичных с-субъединиц. Полипептидная цепь а-субъединицы
имеет 6 спиральных участков, пересекающих внутреннюю митохонд-
1>нильную мембрану. Первичная структура 6-субъединицы включает
один сравнительно короткий -спиральный участок, погруженный
и ну мембрану, а остальная часть выступает в сторону F, и
закрепляйся за его δ-субъединицу. Что же касается с-субъединиц, то каждая
и ι них состоит из двух гидрофобных α-спиралей, соединенных
короткой гидрофильной петлей, и напоминает шпильку. Все 9-12 таких
•шпилек» формируют единый ансамбль в форме цилиндра,
погруженный во внутреннюю митохондриальную мембрану. Внутри этого
цилиндра располагается γ-субъединица комплекса F, Она достаточно
прочно зацеплена, как полагают, за «шпильки».
ЗН4
АТР
' S А ,\ ,
ЗН*
■1
260
Биофизик»
Комплексы F0 и F, связаны между собой неподвижным «крон
штейном», образованным а- и Ь-субъединицами первого из них
и -субъединицей второго, и подвижной γ-субъединицей (рис. 3.43)
Как уже говорилось, Н-АТФсинтетаза представляется электромото
ром. Его статор включает части обоих комплексов: F, (гексамер и ι
3-й зр-субъединиц, а также -субъединицу) и F0 (а- и Ь-субъедини
цы). В состав ротора, диаметр которого составляет 1 нм, входят γ
и ε-субъединицы комплекса F, и цилиндр из с-субъединиц комплексн
F0. Идет спор о том, вращается этот цилиндр (как маховое колесо)
вместе со стержнем (γ-субъединицей) и примыкающей к нему
ε-субъединицей или нет.
Можно считать доказанным, что ферментативная активность
Н-АТФсинтетазы непосредственно связана с вращением ее γ-субъс
диницы в полости гексамера. При таком повороте изменяется кон
формация всех трех каталитических (т. е. катализирующих реакции·
АДФ + Н3Р04 —» АТФ + Н20) β-субъединиц комплекса F,, что и обсс
печивает активирование фермента. Он работает как электромотор,
подвижная часть которого вращается при пропускании
электрического тока через обмотку. В отличие от технических электромоторов,
в Н-АТФсинтетазе ток через обмотку статора обусловлен потоком не
электронов, а протонов. Движущей силой протонного электротоки
через канал в F0 служит разность электрохимических потенциалои
Н+-ионов на внутренней митохондриальной мембране. Поэтому ее
и называют протондвижущей силой. Она образуется за счет
активного транспорта протонов из мембраны в цитозоль - в сторону более
высокого электрохимического потенциала, т. е. вопреки
сопряженному действию концентрационного и электрического градиентов.
Механизм трансмембранного переноса Н+-ионов, который
обеспечивается энергией возбужденных π-электронов при их движении от
одной редокс-пары электрон-транспортной цепи к другой, был
рассмотрен выше. Такой источник энергии для систем активного
транспорта называют редокс-помпой.
В результате активного транспорта ионов водорода в
межмембранное пространство и далее - в цитозоль рН цитозоля ниже, чем рН
митохондриального матрикса. Разность концентраций Н+-ионов меж·
ι паве 3. Квантовомехенические основы биоэнергетики
261
Ш1
Рис. J.4J. Упрощенная схема Н-АТФсинтетазы Пояснения в тексте
ну цитозолем и матриксом может достигать трех порядков. Чем она
Польше, тем выше степень энергизованности митохондрий. В
обычных условиях на мембранах дышащей митохондрии гепатоцита про-
тпдвижущая сила (μ +) находится в линейной зависимости от
изменения свободной энергии при активном транспорте протонов (AGW.).
1;сли выразить протондвижущую силу в мВ, a AG И. - в ккал · моль-1,
ι о AGU + = -0,023 · \ιπ.. При μ/7. = 220 мВ изменение свободной энер-
I ни при активном транспорте 3 протонов составляет 5,06 ккал · моль-1.
()днако даже очень большая протондвижущая сила не обеспечивает
ι пнтез АТФ если ее потенциальные возможности не будут
реализованы, т. е. если под действием протондвижущей силы Н+-ионы не станут
перемещаться из цитозоля в митохндриальный матрикс через
протонный канал в F0. Пока он закрыт, протондвижущая сила не реализуется.
Если Н+-ионы пойдут из цитозоля в матрикс не по каналу в F0,
и иначе, то АТФ не синтезируется даже при весьма интенсивном
транспорте электронов по дыхательной цепи и обусловленным им выбросе
II '-ионов в цитозоль (с закислением его). Такое состояние возникает не
юлько под действием искусственных протонофоров (например, ди-
иптрофенол, аспирин и другие слабые липофильные кислоты) Оно
имеет место в естественных условиях в так называемом буром жире.
'ha ткань присутствует у эмбрионов и новорожденных детей, а также
у животных, впадающих в зимнюю спячку. Во внутренних мембранах
262
Биофизика
митохондрий клеток бурого жира при охлаждении синтезируется оси
бый транспортный полипептид с молекулярной массой 32 кДа (естсс!
венный протонофор), который позволяет Н+-ионам свободно перехо
дить в сторону более низкого электрохимического потенциала in
цитозоля в митохондриальный матрикс, минуя канал F0. В результаю
клетки бурого жира весьма интенсивно окисляют жир, но энергия
возбужденных π-электронов преобразуется преимущественно в тепло,
а не в химическую энергию синтеза АТФ. Это важный механизм защн
ты организма от переохлаждения во время зимней спячки.
Протонный канал в F0 состоит из 2 частей (полуканалов), одна m
которых находится около межмембранного пространства, где концеи
трация Н+-ионов высока, а другая примыкает к матриксу. Между полу
каналами нет соосности. Главная роль в работе канала принадлежи!
аминокислотным остаткам а- и с-субъединиц F0, содержащим прото
нируемые карбоксильные группы, поскольку они способны взаимо
действовать с протонами и передавать их друг другу. В F0 такой спо
собностью обладают аспарагил, аргинил, гистидил и глютамил.
Предполагают, что сигналом к переходу протонного канала и ι
закрытого в открытое состояние служит уменьшение в клетке вели
чины соотношения концентраций АТФ и АДФ, т. е. повышение
содержания АДФ и ортофосфорной кислоты. Это происходит при
усиленном гидролизе АТФ, в результате чего возрастает потребность
в активизации его синтеза.
Как только протонный канал в F0 открывается, в него
устремляются ионы водорода из цитозоля - возникает протонный
электрический ток в «обмотках» молекулярного электромотора (Н-АТФсин·
тетазы). Поток заряженных частиц (Н+) приводит в движение еги
ротор (γ-субъединицу комплекса F,). Заметим, что блокада движения
Н+-ионов через канал дициклокарбодиимидом, специфическим
ингибитором аспарагила в осубъединице комплекса Р0,останавливасг
вращение ротора, а вместе с ним и синтез АТФ, поскольку фосфори-
лирование АДФ с образованием АТФ активизируется посредством
так называемого вращательного катализа (rotary catalysis).
Вращение γ-субъединицы в статоре Н-АТФсинтетазы происходит скачками
(дискретно) с шагом в 120°. Для совершения ротором такого шага чс-
/ пива 3. Квантовомеханические основы биоэнергетики
263
реч канал должны пройти 2-3 иона водорода. При каждом скачке
|ш шивается усилие в 40 пиконьютонов и синтезируется 1 молекула
Л'ГФ. Полный оборот ротора происходит за 3 скачка - при этом обра-
|уются 3 молекулы АТФ. Если сравнить механические силы, возни-
шиощие при работе Н-АТФсинтетазы и актомиозинового комплекса,
κι первая из них на порядок больше.
Таким образом, синтез АТФ связан не только с теми преобразо-
ииииями энергии, которые постулировал П. Митчелл в своей химио-
исмотической гипотезе. Цепь энергетических превращений включает
солнечную энергию, заключенную в π-электронах, участвующих
и химических связях многих органических веществ, осмотическую
шергию переносимых Н+-ионов, электрическую энергию
мембранного потенциала в митохондриях, механическую энергию ротора,
нращающегося в статоре Н-АТФсинтетазы и накопление химической
шергии в концевой фосфатной связи АТФ.
Скорость работы Н-АТФсинтетазы зависит не только от
величины протондвижущей силы, но и от концентрации субстратов
синтеза АТФ, т. е. от концентрации АДФ и Н3Р04. По мере усиления
наработки АТФ фермент снижает свою активность, тем более что при
его активной работе падает градиент Н+-ионов на митохондриальных
мембранах. Такая ситуация служит сигналом к повышению скорости
переноса электронов по электрон-транспортной цепи митохондрий.
('ледовательно, между биологическим окислением и фосфорилиро-
ианием при их сопряжении в митохондриях существует сложная
система обратных связей.
Протондвижущая сила на митохондриальных мембранах
обеспечивает не только фосфорилирование АДФ как таковой, но также
ι рансмембранный перенос ортофосфата из цитозоля в матрикс.
Транспорт фосфата, а также пирувата через внутреннюю митохондриаль-
иую мембрану осуществляется посредством симпорта с Н+. Для Са2+
и мембране есть специальный транспортный белок, но он не
работает, если падает трансмембранный электрический градиент, обычно
поддерживаемый выбросом Н+ в цитозоль. Только тогда в матриксе
создается отрицательный потенциал относительно цитозоля. Он-то
и притягивает к себе катионы кальция, а переносчик обеспечивает их
массивный транспорт.
264
Биофизик»
3.6.2.3. Антипорт АТФ и АДФ
через митохондриальные мембраны
АТФ после синтеза в митохондрии покидает ее, выходя черс ι
мембраны в цитозоль. В обратном направлении транспортируете*
АДФ, из которого синтезируются новые порции АТФ. Их антипор!
обеспечивается переносчиком. Важно отметить, что АТФ - четы
рех-, а АДФ - трехвалентные анионы. Их сопряженный транспорч
экономит энергию, поскольку перенос заряженных частиц -
весьма энергоемкий процесс, а встречное движение четырех- и трехза
рядных частиц одного знака равнозначно преодолению мембраны
однозарядной частицей. У человека оборачиваемость молекулы АТФ
на митохондриальной мембране составляет ЮМ О4 раз в сутки.
В результате концентрация АТФ в 5-10 раз, превосходит содержание
АДФ в клетке.
Выйдя в цитозоль, АТФ взаимодействует с креатином (Кр),
в результате чего образуется креатинфосфат (КрФ) и АДФ (рис. 3.44).
АДФ транспортируется в митохондриальный матрикс в обмен на
АТФ, а КрФ мигрирует по цитозолю к тем частям клетки, где нужна
свободная энергия в данный момент. Там КрФ вступает в реакцию
с АДФ, продуктами которой служат АТФ и Кр. По мере надобности
АТФ гидролизуется и дает возбужденный ортофосфат для фосфори-
лирования и, благодаря этому, для энергизации функциональных
биомолекул, что позволяет им преодолеть потенциальный барьер
реакций, в которые они вступают. Креатин же мигрирует к
митохондрии, где вступает в реакцию с АТФ для повторения цикла. Как синтез,
так и распад креатинфосфата катализируется креатинфосфокиназой
(КФК). Эти данные были получены В. Н. Смирновым, который
вместе с Е.И. Чазовым и рядом других сотрудников был удостоен
Ленинской премии.
В курсе биохимии рассматриваются химические свойства всех
компонентов системы окислительного фосфорилирования, а также
реакции, идущие как в митохондриях, так и в цитозоле. Для
глубокого изучения этих вопросов необходимо учитывать биофизические
аспекты клеточного дыхания. Во-первых, клеточное дыхание
непосредственно связано с наличием у биологически важных молекул,
/ пава 3. Квантовомеханические основы биоэнергетики
265
Матрикс
митохондрии
АДФ3- '
АТФ*--
Цитоплазма
Переносчик
КФК
I
Митохондриальные
мембраны
-+АТФ*~+Креатин —i-
(Кр)
■ КрФ+АД<&-
I
КФК
Крф+АДФ —*—► АТФ+Кр
Миграция к митохондрии
Рис. 3.44. Схема транспорта АТФ через
митохондриальные мембраны и по цитоплазме
Кр - креатин, КФК- креатинфосфокиназа, КрФ - креатинфосфат
участвующих в нем, коллективизированной системы π-электронов,
способных принимать и отдавать энергию. Во-вторых, перенос
возбужденных электронов по дыхательной цепи, сосредоточенной во
ипутренней митохондриальной мембране и определенным образом
ориентированной в ней, осуществляется под действием перепада
носстановительного потенциала между редокс-парами: НАД7НАДН
и 02/Н20. В-третьих, электронный транспорт сопряжен с переносом
питонов из мембраны в цитозоль, вследствие чего на ней создаются
и поддерживаются концентрационный и электрический градиенты,
пыполняющие роль промежуточного звена (интермедианта) в
энергетических преобразованиях. В-четвертых, фосфорилирование АДФ
происходит за счет протондвижущей силы, которая обращает работу
протонной помпы (Н-АТФазы), делая ее генератором АТФ (Н-АТФ-
синтетазой). В-пятых, окислительное фосфорилирование протекает у
животных только на специализированной (сопрягающей)
мембранной системе, которая присуща митохондрии.
3.6.2.4. Законы биоэнергетики клетки
(по В. П. Скулачеву)
I закон. Живая клетка избегает использования энергии
внешних ресурсов для совершения полезной работы непосредственно.
266
Биофизик»
Прежде чем эта энергия будет использована (утилизирована)
клеткой, она должна превратиться в одну из 3 конвертируемых форм:
АТФ, протонный потенциал на мембране, натриевый потенциал ни
мембране. Их можно уподобить валютам в экономических
отношениях. Продолжая подобную аналогию, можно сказать, что в энергетике
клетки нет бартера.
II закон. Любая живая клетка располагает, по меньшей мерс,
двумя (из трех перечисленных в первом законе) конвертируемыми
формами энергии: а) АТФ (в цитозоле), б) протонным или
натриевым потенциалом (в мембране).
Например, кишечная палочка (Е. coli) обычно использует вес
три конвертируемые формы энергии, но при низкой концентрации Н'
в окружающей щелочной среде переходит преимущественно на
натриевую энергетику. При этом содержание Na-K-АТФазы в
плазмолемме возрастает в 40 раз. Благодаря эффекту обращения Na-K-AT-
Фаза работает как АТФсинтетаза. Так энергетические потребности
этой бактерии удовлетворяются двумя конвертируемыми формами:
натриевым потенциалом на плазмолемме и АТФ в цитозоле.
В клетках растений натриевый потенциал в обычных условиях
не вносит существенного вклада в энергетику. Она обеспечивается
АТФ и протонным потенциалом на тилакоидной мембране.
В клетках животных конвертированными формами энергии
служат АТФ в цитозоле и протонный потенциал на митохондриаль-
ной мембране.
III закон. Клетка способна удовлетворить все свои потребности
в энергии, если за счет внешних ресурсов, источником которых
является Солнце, образуется хотя бы одна из трех конвертируемых форм
энергии, поскольку из нее в клетке могут образовываться другие.
Например, морская бактерия Propinigenium modestus имеет
единственную конвертируемую форму энергии - натриевый
потенциал на плазмолемме, но путем обращения K-Na-помпы возможен
синтез АТФ, вследствие чего клетка использует две формы энергии.
Заметим, кстати, что у морских бактерий доминирует натриевая
энергетика. Это не свойственно другим бактериям, а также клеткам
растений и животных.
/ пава 3. Квантовомеханические основы биоэнергетики
267
3.6.2.5. Прижизненная флуориметрия компонентов
дыхательной цепи
Для оценки клеточного дыхания существует несколько
методов. Среди них преобладают биохимические. Остановимся на биофи-
шческой методике прижизненной флуориметрии НАД · Η и
окисленных флавопротеидов (ФП), которая была предложена Бриттеном
11ансом в начале 60-х годов XX века.
Эта методика основана на способности НАД · Η и ФП люми-
иссцировать при воздействии на них света. Важно, что для их
флуоресценции не нужны люминофоры. Поэтому такое свечение было на-
шано собственной флуоресценцией. Максимальная флуоресценция
НАД · Η приходится на λ = 460 нм (синий свет) и, согласно правилу
Стокса, для ее возбуждения ткань нужно облучать светом с более
короткой длиной волны. Для этого используется ближний
ультрафиолет (λ = 365 нм). Максимальная флуоресценция ФП обнаружена на
λ = 520-530 нм (желто-зеленая область спектра), причем это
свечение возникает также под влиянием ультрафиолета (λ = 365 нм), хотя
Гюлее эффективно оно возбуждается синим светом.
Из сказанного следует, что освещенная ультрафиолетом (λ =
365 нм) живая ткань дает свечение в видимой области. В нем
преобладает синий свет с примесью желто-зеленого. Для выделения
полос флуоресценции НАД · Η и ФП из смешанного света применяется
техника спектрального анализа. Основу монохроматора составляют
либо интерференционные светофильтры (в насадке ФМЭЛ-1), либо
дифракционная решетка (в насадке СФН-10).
На рис. 3.45 представлена схема одноволнового спектрофлуори-
мстра-микроскопа. Свет от ртутной лампы, из которого светофильтром
ныделена полоса в области λ = 365 нм, поступает через апак-иллюмина-
тор на микроскопируемый объект и возбуждает в нем люминесценцию
НАД · Η и ФП. Их свечение улавливается объективом и направляется
и монохроматор (в данном случае СФН-10), который разлагает
смешанный свет в спектр. Излучение на каждой из длин волн,
присутствующих в спектре, направляется в фотоэлектронный умножитель,
преобразуется им в электрический сигнал, усиливается и обрабатывается
компьютером, на экране которого наблюдается весь спектр флуорес-
268
Биофизик»
Рис. 3.45. Схема одноволнового микроспектрофлуориметра и спектры
собственной флуоресценции медуллярных химиорецепторов кошки в покое
(верхняя кривая) (1) и под действием кислотного раздражителя
(нижняя кривая) (2)
ценции исследуемой клетки. В нем измеряется интенсивность флуи
ресценции на λ = 460 нм и на λ = 530 нм. Первая отображает содержи
ние в клетке НАД · Н, а вторая - ФП. Еще раз отметим, что в это11
донорно-акцепторной паре донор π-электронов флуоресцирует в вое
становленной форме (НАД · Н), а акцептор - в окисленной (ФП). Естс
ственно, что в покое преобладают восстановленные формы (кривая I),
а при усилении окислительных процессов - окисленные (кривая 2).
Изменения метаболической активности хорошо отображает та»
называемый параметр ξ, равный отношению интенсивности свечения
ФП к НАД · Н. т. е. соотношению содержания окисленных и восста
новленных компонентов дыхательной цепи в каждый момент времени
Этот параметр, величина которого прямо пропорциональна скоросш
переноса электронов с НАД · Η на ФП, был предложен В.Н.
Карнауховым и широко используется в наших исследованиях. Для точного
определения параметра ξ необходимо одномоментно (с точностью
порядка 1 мс) измерять интенсивности свечения и НАД · Н, и ФП
Одноволновая установка мало пригодна для этого. Поэтому в нашей
лаборатории был разработан двухволновой спектрофлуориметр
(рис. 3.46).
Он одномоментно выделяет из смешанного излучения клетки
флуоресценцию только на двух интересующих нас длинах волн (460
I пива 3. Квантовомеханические основы биоэнергетики
269
^nW^
ФП„
НАД Η
О
■I
Рис. 3.46. Схема двухволнового микроспектрофлуориметра и осциллограмма
параметра
н ЯО нм) и разводит два луча к разным фотоэлектронным умножите-
ϋΐΐΜ. На экране компьютера регистрируются три кривые,
отображающие динамику свечения НАД · Η, ΦΠ, а также изменения ξ. Заметим,
•и о ξ=_21; где 1Ш - интенсивность свечения ФП на λ = 520 нм,
1 460
/.,„„ - интенсивность свечения НАД · Η на λ = 460 нм.
Флуориметрический анализ клеточного дыхания проведен
и нейронах, волокнах поперечно-полосатых и гладких мышц, карди-
ммпоцитах, эпителии кожи, слизистых оболочек органов
желудочно-кишечного тракта и дыхательных путей, в лейкоцитах, маргина-
ш.иых клетках сосудистой полоски внутреннего уха, каротидных,
икусовых, обонятельных, медуллярных рецепторах. Оказалось, что
самым интенсивным клеточным дыханием у млекопитающих
облапают маргинальные клетки сосудистой полоски внутреннего уха.
Рис. 3.47 иллюстрирует соотношения флуоресценции НАД · Η и ФП
м любой из исследованных тканей в покое, активном состоянии, при
ишемии, некрозе, озлокачествлении. На рис. 3.47 представлены
н обобщенном виде результаты нескольких тысяч экспериментов
и клинических наблюдений, проведенных многими сотрудниками
Носнно-медицинской Академии. К представленным данным следует
добавить, что при воспалении изменения клеточного дыхания харак-
1сризуются чередованием стадий угнетения и активизации, причем
2 О
υοφια м«
Покой Активное спокойствие
100 100
во
во
40
20
о
во
60
40
20
о
Ишемия Злокачественная опухоль
100 100
во во
60 ВО
40 40
20 20
О О
Некроз
100
80
60
40
20
О
Рис. 3.47. Соотношения флуоресценции НАД Η (левые столбики) и ФП
(правые столбики) в разных состояниях биологических тканей
зоны с активным и угнетенным дыханием со временем меняются
местами, создавая картину динамичной мозаики.
Благодаря тому, что биоэнергетические процессы, по словам
И.М. Сеченова, составляют «дно жизни», их количественные флуори-
метрические показатели весьма информативны для интегральной оцев>
ки функционального состояния организма. Не случайно Н.Н. Савицкий
выводил должные величины минутных объемов дыхания и
кровообращения из параметров биоэнергетики. Уровень метаболизма служит, на
языке кибернетики, уставкой всем вегетативным процессам.
Параметр ξ стал в наших исследованиях высоко
чувствительным индикатором реакций организма на различные воздействия
внешней среды: неионизирующие излучения (во всем диапазоне
электромагнитного спектра) и токсические факторы (включая
ксенобиотики) Наибольшей чувствительностью обладает методика исследова-
ι mum 3. Квантовомеханические основы биоэнергетики
271
ими реакций клеточного дыхания на стандартный раздражитель,
предъявляемый на фоне действия изучаемого фактора внешней среды.
Прижизненная флуориметрия компонентов дыхательной цепи
митохондрий сделала клеточное дыхание объектом исследований
||ш'1Иологов и клиницистов. Физиолог и специалист функциональной
щшгностики приобрели возможность изучать все этапы дыхания,
м не два из трех.
Важной особенностью работ по флуориметрии живых тканей
милястся возможность проводить ее in situ - в условиях нормальной
иннервации и хорошего кровоснабжения при минимальном
травмировании изучаемых тканей. Ради этого мы не ограничились
прижизненной микроскопией и использовали эндоскопы-флуориметры. Они
ипелужили базой новых медицинских технологий, обеспечивающих
рпннюю диагностику рака желудка и кишечника.
3.6.2.6. Новые диагностические технологии,
основанные на достижениях квантовой биофизики
(биоэлектроники)
В злокачественной опухоли, как установил О. Варбург, ана-
цюбный гликолиз конкурирует с клеточным дыханием. Клеточное
дыхание в раковой клетке угнетено, причем ослабляется
флуоресценция и НАД · Н, и ФП, но ФП - в большей степени (рис. 3.47). При
шдоскопическом исследовании флуоресценции это видно даже на
ι паз (рис. 3.48).
В конце 70-х годов XX века были созданы гастроскоп-флуори-
метр (рис. 3.49) и колоноскоп-флуориметр, которые позволяют
измерить интенсивность свечения НАД · Η и ФП при обычных
эндоскопических процедурах в амбулатории и стационаре.
Метод оказался весьма чувствительным и обеспечил раннюю
диагностику злокачественных заболеваний желудочно-кишечного
ι ракта. Результаты совместных работ с врачами терапевтической кли-
ппки, возглавляемой тогда в Военно-медицинской Академии В.А.
Лисовским, и с сотрудниками ГОИ изложены в книге «Люминесцентный
нпализ в гастроэнтерологии», увидевшей свет в 1984 г
Кроме эндоскопов, разработаны интраоперационные
люминесцентные щупы (рис. 3.50), позволяющие измерить интенсивность
272
Биофизш*
ί
Рис. 3.48. Собственная флуоресценция шейки матки в норме и при патологии
I - норма, 2 и 3 - переходные состояния (развитие патологического процесса)
4 - опухоль
а)
20 13
те-—
If 9 101112
Рис. 3.49. Принципиальная схема (а) и общий вид (б) гастроскопа-флуориметра
для исследования собственной флуоресценции живых тканей
Обозначения: 1 — источник ультрафиолетового излучения, 2 и II - коллекторы,
3 и 4 -светофильтры для выделения возбуждающего излучения ( = 365 нм),
5 - кварцевый световод, 6 - гастроскоп, 7 - световод, 8 - объектив,
9 - осветительный световод для обычной гастроскопии, 10 — светофильтр,
12 —лампа накаливания, 13 - светоделитель, 14 —линза, 15 - световод,
16-заслонка, 17, 18, 20 — запирающие светофильтры, 19 — ФЭУ
1 '««in 3. Квантовомеханические основы биоэнергетики
273
фпуоресценции НАД · Η и ФП в тех органах и тканях, которые до-
11УШ1Ы врачу при хирургических операциях (например, лимфатиче-
| шс узлы для выявления метастазов рака) и без них (например, ко-
*ii) Щупы принесли большую пользу врачам при первичной
хирургической обработке огнестрельных ран и минно-взрывных
фиш, когда для экономной резекции тканей необходима оценка их
+п шсспособности.
Биофизические исследования и новые медицинские техноло-
(Ш1, в которых применяется флуориметрическое изучение транспор-
III шектронов в молекулярных ансамблях живых клеток, хорошо
"(испечены метрологически. Прижизненная флуориметрия дает, кро-
-13
Рис. 3.50. Микрофлуориметр двуволновой
для исследования клеточного дыхания у человека
1 - лампа ртутная ДРШ 250-2, 2 - коллектор 4-х линзовый,
3 - кювета водная, 4 - светофильтр СЗС 24, 5 - светофильтр ЭФС 6,
6 — объект, 7 - жгут волоконнооптический осветительный,
8 - жгут волоконнооптический воспринимающий,
9- коллиматор, Ю- пластина светоделительная,
11- светофильтр запирающий для ФП, 12 - светофильтр
274
Биофитм
ме статических показателей, динамические характеристики биол(и и
ческих систем, так как позволяет проводить функциональные npoftu
и исследовать зависимости типа «доза-эффект». Это обеспечиинп
в клинике надежную диагностику заболеваний и вместе с тем служи ι
инструментом экспериментального изучения интимных механизма
и патогенеза у больного, а не только на экспериментальных модели*
3.6.2.7. Новые лечебные технологии, основанные на
достижениях квантовой биофизики (биоэлектроники)
Достижения квантовой биофизики уже сейчас служат базой ш
только диагностических, но и лечебных технологий. Их реализащн
опирается на тот факт, что акцепторы электронов служат эффектин
ными регуляторами клеточной активности, поскольку малейшие ιι ι
менения содержания акцепторов электронов в клетке приводят к зпи
чительным сдвигам ее метаболизма. В частности, по утверждению Λ
Сент-Дьердьи, «для остановки онкороста нужно непрерывно поддср
живать в клетке определенный уровень акцепторов электронов». I In
с одной стороны, жизнь не совместима с сильными акцепторами
электронов, а с другой стороны, перенос электронов со слабых допо
ров на слабые акцепторы возможен только на свету, так как связии
с поглощением фотона, а этой способностью не обладают неокр»
шенные вещества. Поскольку большинство веществ в организме ι и
обладает цветом и почти все биохимические реакции темновые, жи
вые ткани вынуждены продуцировать не слабые и не сильные, а уме
ренные акцепторы электронов, причем делать это непрерывно, регу
лируя темп их наработки по мере надобности. Главным акцептором
электронов является карбонил, причем его активность может повы
шаться при увеличении фонда π-электронов. В дыхательной цени
митохондрий конечный акцептор π-электронов - молекулярный кис
лород, поступающий в клетки из атмосферы благодаря внешнему
дыханию и кровообращению.
Однако для лечения многих заболеваний приходится использо
вать и другие экзогенные акцепторы электронов. К ним, очевидно,
относится препарат глутоксим, разработанный Л.А. Кожемякиным
Это лекарство, проникая в клетку, сохраняется в окисленном состоя
' ними 3. Квантовомеханические основы биоэнергетики
275
ими несколько десятков минут и принимает на себя избыток электро-
IIIт. Глутоксим хорошо зарекомендовал себя в комплексной терапии
мшних болезней, включая и рак.
Мощным акцептором электронов являются фуллерены - шаро-
щцшные молекулы, состоящие из большого количества атомов угле-
||цда. Их терапевтический эффект только начинает изучаться.
Все большее распространение находит фотодинамическая
тершая рака. Она основана на том, что в раковой клетке повышено со-
щ'ржание порфиринов, а при внутривенном введении этих веществ
ими их предшественников раковые клетки насыщаются ими. Порфи-
|П1иы избирательно поглощают излучение на λ = 620 нм. Такое
излучение дает лазер на парах золота. При подведении к опухоли низко-
шергетичных световых импульсов на этой длине волны (λ = 620 нм)
рпковые клетки погибают, а нормальные - преимущественно
сохраняются. Избирательное воздействие лазера обеспечивает лечебный
н|н|>ект.
3.6.2.8. Экологические аспекты квантовой биофизики
Движение электронов в электрон-транспортных цепях пред-
I швляет собой электрический ток и потому может быть мишенью
ипсшних электромагнитных полей. ЭМП каких частот могут влиять
на межмолекулярный транспорт π-электронов в дыхательной цепи?
Известно, что слабые электронные взаимодействия, энергия
3
которых меньше -кТ, происходящие с частотой, равной обратному
примени химической реакции, связанной с переносом электронов,
могут обеспечить ее осуществление. По данным Л.А. Блюменфельда
п П.Г. Плешанова, время восстановления НАД+ занимает 10,3 мс,
и обратная реакция - 2,5 мс.
Следовательно, характеристическая частота прямой реакции
около 15 Гц, а обратной - около 62 Гц. Результаты расчета сейчас
проверяются в нашей лаборатории в эксперименте с действием
магнитной составляющей низкочастотного ЭМП на перенос электронов
и митохондриях. О результатах опытов говорить еще рано, но факт
нлияния магнитной составляющей ЭМП расчетных частот на пере-
276
Биофизик*
нос π-электронов с НАД · Η на ФП можно считать установленным
На его основе стали понятнее данные шведских эпидемиологи»
о канцерогенном действии токов промышленной частоты, которое
они связывают именно с магнитной составляющей ЭМП.
Вместе с тем мишенью сверхнизкочастотных ЭМП могут бы 11
электрон-транспортные цепи не только митохондрий. Наше вними
ние давно привлекает система НАДФН-оксидазы, сосредоточении»
в плазматической мембране альвеолярных макрофагов. НАДФН-ок
сидаза образована каскадом молекул, каждая из которых является рс
докс-парой. В отличие от дыхательной цепи, здесь электроны идут ш
парами, а поодиночке, и на выходе молекулярный кислород воссш
навливается не до воды, а до супероксида (Ό2~). Эта активная форм»
кислорода обеспечивает инактивацию частиц, поглощенных макро
фагами в ходе иммунных реакций. Как ослабление, так и усилеши
синтеза свободных радикалов, если эти сдвиги чрезмерны, чрева in
многими неблагоприятными последствиями для организма, включи»
нарушения иммунитета. Проникновение в механизмы этих наруик·
ний на электронном уровне организации биосферы может обеспечи 11.
успех в предупреждении тяжких недугов. Очевидно, подобные mcx.i
низмы повреждения биологических систем лежат в основе неблаго
приятного действия ЭМП не только на человека, но также на весь жи
вотный и растительный миры. Для изучения электрон-транспортноП
цепи, сосредоточенной в плазмолемме альвеолярных макрофагом
применяются не только флуоресцентный, но и биохимиолюминс»
центный анализы.
Глава 4. ЭЛЕКТРОБИОЛОГИЯ
4.1. Ионные равновесия
Генерация и распространение электрических потенциалов -
иижнейшее физическое явление в живых клетках и тканях, лежащее
и основе возбудимости, регуляции внутриклеточных процессов,
информационных процессов в нервной системе, мышечного
сокращении и других биологических явлений.
Изучение механизма возникновения клеточных биопотенциа-
■и>и стало возможным прежде всего благодаря применению методов
меточной электрофизиологии, в развитии которых важную роль
ι играли:
• разработка техники микроэлектродных отведений,
• создание специальных усилителей биопотенциалов,
обладающих высоким входным сопротивлением (до 1010 Ом), малой
постоянном времени (от 10 мс) и высокой чувствительностью (токи от 10~12 А),
• выбор удачных объектов исследования, начиная от гигант-
I кого аксона кальмара и гигантских нейронов пресноводных
моллюсков и кончая разнообразными модельными мембранами.
Использование результатов электрофизиологических опытов
и сочетании с физическим и математическим моделированием
транспортных процессов лежит в основе современных теорий электроге-
1кча в клетках.
4.1.1. Электродиффузное уравнение Нернста-Планка
В покоящейся, нормально функционирующей живой клетке
игегда имеется разность потенциалов между цитоплазмой и
окружающей средой, называемая потенциалом покоя. Существование
ποια щиала покоя связано с неравенством концентрации ионов внутри
278
Биофизит
клетки и в окружающей среде и неодинаковой проницаемостью кле
точных мембран для разных ионов.
Неравенство концентраций ионов во внутри- и внеклеточном
пространстве вызывает диффузию ионов из области высокой концсп
трации в область низкой концентрации. Скорость диффузии завист
от градиента концентраций ионов и проницаемости мембраны дл»
них. Поскольку ионы - электрически заряженные частицы, а мембрн
на характеризуется определенной электрической емкостью, то зари
ды накапливаются на ней. Это приводит к возникновению разнос ι ιι
потенциалов на мембране и электрического поля в ее толще, чи>
в свою очередь порождает силы, действующие на все заряженные чи
стицы внутри мембраны.
Чтобы количественно оценить мембранный потенциал покой,
необходимо изучить движение ионов в результате диффузии и пол
действием электрического поля, а также вывести фундаментальны!
уравнения для описания этого движения ионов.
Диффузия возникает из-за наличия у молекул тепловой энср
гии и происходит в направлении уменьшения концентрации - поши
направлен против градиента концентрации (в сторону более низкой
концентрации).
Количественно диффузия описывается законом Фика:
]<=-DVc, (4.II
где с - концентрация некоторого вещества как функция прострап
ственных координат я D - коэффициент пропорциональности (ни
стоянная Фика, или коэффициент диффузии) Плотность потока )4
представляет собой число частиц (ионов), проходящих за единиц)
времени через единичную площадку.
Ионы в растворе также подвержены диффузии. Поскольку ион
ные среды вне и внутри возбудимых клеток сильно различаются, диф
фузия неизбежно является важным фактором, определяющим трапе
мембранный ток, по крайней мере для ионов, движущихся сквои.
мембрану.
На ионы также действуют силы со стороны электрического пи
ля. Интенсивность возникающего в результате этого потока ионов
ι паев 4. Электробиология
279
ишисит от подвижности ионов данного типа. Подвижность
характеризуется величиной и - дрейфовой скоростью, достигаемой под дей-
I шием поля единичной напряженности. Если валентность иона обо-
ишчить Z, то плотность ионного потока описывается формулой
^=~"ШсУ(р' (4'2)
ι цс Уф - напряженность электрического поля, — - знак силы, дей-
П
II кующей на ион данного типа; знак положительный для положите-
iii.no заряженных ионов (катионов) и отрицательный для отрицатель-
пи заряженных ионов (анионов). Таким образом, выражение
Ζ
и — V<p дает среднюю скорость ионов. Выражение в правой части
уравнения (4.2) - это произведение концентрации иона на его
скорость. Оно дает поток ионов через единичную площадку. Обычно
нпотность потока выражается в молях на единицу площади
поверхности за секунду. Сравнив уравнение (4.2) с законом Ома,
подвижность и можно интерпретировать как величину, пропорциональную
V цельной электропроводности. Ионная подвижность зависит от
размера иона и его заряда. Существует связь между подвижностью
ионов и коэффициентом диффузии. Эта связь, найденная
Эйнштейном (и носящая его имя), описывается формулой
w
ι дс и - подвижность, Τ - абсолютная температура, F - число Фара-
цен, R - универсальная газовая постоянная. При наличии как диффу-
шонных сил, так и сил электрического поля полная плотность ионов
шитого вида равна у =jD +je. Уравнение (4.4) известно как
уравнении Нернста-Планка:
] = -D\ Vc + i^-Уф I (4.4)
'HlH
280
Биофизин
Уравнение (4.4) описывает плотность потока ионов даннои
типа под действием диффузии и электрического тока. Обычно еди
ница измерения этой физической величины - моль на единицу пли
щади поверхности за единицу времени. Из плотности ионного поте
ка можно получить плотность электрического тока:
J = -DF%Vc +—V<p I (4:
где J - плотность тока, выраженная в кулонах на м2 в секунд
(А · м-2).
Выражение для плотности тока можно записать и по-другому
7 = -I uRT^- Vc + и\ Z| cFVy 1 (4.1
Плотность электрического тока в электролите, возникающего
результате движения иона под действием электрического поля и
пряженностью Ε = -V<p согласно уравнению (4.6), равна:
Je =-u\2tcFVq>. (4
Верхний индекс е здесь означает, что ток обусловлен исклю1и
тельно электрическим полем. Например, для КО полная плотное!
тока записывается так:
Jkc,=Fckci(uk +иаУ > (4
где учтены вклады в ток зарядов как от К+, так и от С1~ ; концентр
ции К+ и С1~ считаются равными ска в предположении полной дисс
циации. Если учесть, что J =aE, где σ - эффективная удельная пр
водимость, из уравнения (4.8) следует, что
<*=FcKa(uK +"c/)· (4
Пусть через мембрану движется один тип ионов. Если поте:
циал внутри мембраны меняется линейно в одном направлении,
1 нппв 4. Электробиология
281
\Ί|) =——, где Δφ - разность потенциалов на мембране. Введем без-
Ах
|щ 1мсрный потенциал
φ=ϋ?^. (4.10)
D
Подставляя (4.10) в (4.4), получаем
-j = -D*-D±. (4.11)
dx Αχ
Введем новую переменную
t = ±+*-. (4.12)
D Ах
Подставляя (4.12) в (4.11), находим :
< = -£■ (4-13)
ах
Разделяя переменные в уравнении (4.13) и находя интегралы от
ниш"! и правой частей, имеем
&Х CIIM J
jdx=j—, (4.14)
' l(' cim> спм ~ концентрации частиц в мембране у ее границы
снаружи и внутри клетки (рис. 4.1).
При постоянной плотности потока частиц через мембрану диф-
|ц'|1спциал dt будет иметь вид dt = — dc.
Αχ
Заменим пределы интегрирования в (4.14) и проинтегрируем:
,1=1+£]мФ, , =Ι + £βμ£, (4.15)
1 D Ах " D Ах
282
Биофинш»
Вне
клетки 1Н
Внутри
клетки
Рис. 4.1. Движение иона через поляризованную мембрану
. Ах t dt Ах , t,.
Ах= — = -—ln-ϋ-.
Φ it φ ί,
(4.16)
Следовательно:
t =t е"ф
(4.17)
Коэффициентом распределения вещества называется
отношение концентрации вещества в мембране у ее границы к концентрации
вещества в среде у границы с мембраной:
ρ _ cim _ ciim
(4.18)
cib снв
где с1в, смв - концентрации частиц в растворе у мембраны снаружи
и внутри клетки.
Подставив в (4.15) выражение (4.18), получим:
/.=i+*!si
D Ах
(4.19)
' чвва 4. Электробиология
283
Введем понятие коэффициента проницаемости мембраны для
/in щц:
DP
Рм = ^-. (4.20)
Ах
Тогда для величины (4.19) получим :
<..=^(/+Л,с|1вф). (4.21)
Подставляя формулы (4.21) в (4.17) и находя из этого уравне-
1ш и плотность потока вещества, получаем
1-е ψ
Величина, обратная коэффициенту проницаемости, носит на-
иишие сопротивление потоку вещества
**=J- (4·23)
У наружной и внутренней стороны мембраны имеются примем-
Оранные слои. В примембранных слоях концентрация снижена из-за
инличия малоподвижных интегрированных в мембрану белков.
Концентрация частиц в примембранных слоях внутри клетки
уменьшается от значения ст до значения сп на толщине слоя /в а снаружи от
значения с, до значения сш на толщине слоя 1И (рис. 4.1).
Наружный и внутренний примембранные слои обладают
сопротивлением потоку вещества /?, и Ra. Следовательно, общее сопро-
швление потоку вещества и общий коэффициент проницаемости
R0=Ri+RH+RMy (4.24)
Po=i~ (4-25)
Следовательно, формулы (4.21) и (4.22) примут вид :
284
Биофизш*
] = -/>0фС" С[в , (4.2ΛΙ
1-е φ
J' = n(c,-cH), (4.?/'
В норме наблюдается циркуляция межклеточной жидкости и
цитоплазмы клеток. Это понижает общее сопротивление потоку иг
щества R0 за счет уменьшения сопротивлений Л, и Rn . При некоторы·
патологических процессах циркуляция может замедляться, что при
водит к увеличению R0, уменьшению Р0 и соответственно снижении·
плотности потока ионов j. Это ведет к снижению метаболизма клетои
4.1.2. Потенциал покоя. Потенциал Нернста
В покое цитоплазма клеток организма проницаема для ионии
калия К+ и плохо проницаема для других ионов. Эволюционно сложи
лось так, что внутри клетки ионов К+ значительно больше чем снару
жи. Именно эти ионы компенсируют заряд отрицательно заряженпы»
остатков органических молекул, необходимых для функциониронк
ния клетки.
Потенциал покоя - стационарная разность электрических ни
тенциалов, регистрируемая между цитозолем и межклеточной ере
дой (интерстицием) в невозбужденном состоянии.
Клеточная мембрана обладает свойством избирательной при
ницаемости, т. е. ионы некоторых типов легко проходят сквозь мемГ>
рану, в то время как ионы других сортов проходят с большим трудим
или совсем не проходят. Поскольку ионные составы внутри и вш
клетки сильно различаются, имеет место начальное диффузионно·
движение ионов, результатом чего является накопление заряда на см
кости и как следствие возникновение электрического поля в мембрй
не. Адекватным выражением для рассчета интенсивности массоперг
носа, включая и перенос электрических зарядов, через биологически)
мембраны является уравнение Нернста-Планка.
Начнем с рассмотрения концентрационного элемента. Концси
трационный элемент показан на рис. 4.2. Это система из двух отсеков
Iimta 4. Электробиопогия
285
p+ Q+ i P+
ΟΙ I II
Рис 4.2. Концентрационный элемент
рпчделенных избирательно проницаемой мембраной. Предположим,
Ί го концентрация некоторого иона Р+ в отсеке I превышает его
концентрацию в отсеке II. Мембрана непроницаема для другого иона Q-.
Ион Р+ будет диффундировать из I в II.
Диффузия ведет к накоплению положительного заряда в отсеке
II. Заряд, благодаря электростатическим силам, собирается на мемб-
рнне справа и оставляет в отсеке I избыток отрицательного заряда (на
Мембране слева). Это приводит к образованию электрического поля,
Шшравленного от II к I и возрастающего по величине по мере
диффузии ионов Р+ из I в II. Возрастающее электрическое поле препятству-
П диффузии до тех пор, пока не наступит равновесие.
При равновесии сила электрического поля (направленная влево)
К точности компенсирует диффузионную силу (направленную впра-
№>). При этих условиях из уравнения (4.5) получаем
=o=-dfz!
7=0 =
Vc+—V<p
RT
(4.28)
Vc = -—V<p.
RT
(4.29)
Предположим, что все величины изменяются линейно только в
Одном направлении. Обозначим эту координату х. Тогда уравнение
(4,29) имеет вид:
dc _ _ ZcF cftp
dx RT dx
(4.30)
Преобразование дает
286
Биофизик*
dc
"(Sh
(4.311
Проинтегрируем (4.31) по толщине мембраны от отсека I дм
отсека II:
г dc ZF t ,
В результате получим
In
[с]
VL-J) J
ZF г л
=-^{(р..-φ.}·
(4.321
(4.3 \
Разность потенциалов на мембране Vm равна
ZF
[с], J
(4.34)
При комнатной температуре (Т = 25 °С) уравнение (4.34) спи
дится к выражению
'МЛ
m z
или
ν 58,
Μ. J
M.J
mB
(4.3 ^i
mB.
(4.3fti
Потенциал Нернста - это потенциал, при котором ион данмп
го типа находится в равновесии с действующей на него диффузиоп
ной силой. Заметим, что в уравнениях (4.35) и (4.36) Vm представляй
собой оценку разности потенциалов между отсеком, концентрацп»
в котором входит в знаменатель, и отсеком, концентрация в котором
входит в числитель, для катионов.
/ tinea 4. Электробиология
287
Для живых клеток трансмембранный потенциал принято
определять как разность внутреннего и наружного потенциалов. Реально
через мембраны клеток наблюдаются в основном потоки ионов К+,
Νιι' и С1~, для которых имеем:
К =-—In
F
Г [К*],
[К+]„
<о,
RT
К =Ψπ "Φι =-="1η
[Na·], "I
[Na+]
>0,
RT,
V" = -—In
'[СГ], Ч
[СГ]„
II /
<0.
(4.37)
(4.38)
(4.39)
ГК+1 1
В нервных клетках теплокровных отношение - = —. При-
[К+]„ 28
нимая температуру тела Τ = 310 °К и валентность ионов Ζ = 1, полу-
.|„см Vm =-90мВ.
Принимая для нервных клеток теплокровных отношение
[Na+]„
[Na+],
=9,7,имеем V™ =+60мВ.
Для хлора эта величина равна - 70 мВ. Именно эта величина
|более близка к суммарному равновесному потенциалу на
мембране или потенциалу покоя. Но потенциал на мембране определяется в
■ц'иовном не ионами С1~, а ионами К+. Они стремятся диффундиро-
[К+],
ми II, из клетки, чтобы увеличить отношение
[К+]„
примерно до
1/14 и, следовательно, приблизить Vm к - 70 мВ. Сохранение суще-
шующего отношения
[К+]
ι _
1
[К+]„ 28
•ι* ι ивного транспорта (Na+-K+-Hacoca)
обеспечивается работой системы
288
Биофизик»
Если в формуле Нернста перейти от натурального логарифма»
десятичному, то для положительного одновалентного иона (Z = -III
получим:
rm=f^ig
(\ 1 \
(4.40)
RT
Примем температуру Τ = 300 °К, тогда — 23 = 60 мВ.
Согласно Бернштейну (1902, 1910), причина мембранного по
тенциала покоя - диффузия ионов калия из клетки наружу при шш
хой проницаемости плазмолеммы для высокомолекулярных анионов
(белков), образующих в цитозоле калиевые соли.
гс]
• Примем в формуле Нернста —- =100, что по порядку вели
[с],
чины соответствует экспериментальным данным для калия (см
табл. 4.1):
Гс1
lg ±-^- = lg 100=2, и мембранный потенциал Vm = 0,06 · 2=0,12 И -
[с],
= 120 мВ, что несколько больше модуля экспериментально измеренных
значений потенциала покоя, и, пользуясь формулами электростатики
оценим, какое количество ионов должно перейти из цитоплазмы по
внеклеточную среду, чтобы создать такую разность потенциалов. 1'н
диус клетки г= 10 мкм= 10~5 м. Удельная электроемкость мембраны
(емкость на единицу площади) Суд = 10~2 Ф/м2. Площадь мембраны
4π = 10~9 м2. Тогда емкость мембраны будет равна С = Суд S = 10-1' Ф.
Абсолютная величина заряда каждого знака на поверхносш
мембраны, если ее представить себе как конденсатор, | q\ = САф
-12 Ч Ю"|2Кл
= 10 Кл, что соответствует —=—-. ■ = 10 моль ионов.
3 F 105Кл/моль
Изменение концентрации ионов в клетке вследствие выхода и ι
клетки Ю-17 моль ионов составит
ι пива 4. Электробиология
289
м3 литр
литр
Это ничтожное изменение концентрации по сравнению с
изменением концентрации ионов калия внутри клетки (см. табл. 4.1), со-
I шнляет всего 10^% от концентрации калия внутри клетки. Для
приведенного выше примера можно показать, что равновесие
обычно достигается в результате перемещения относительно малого
количества заряда. Как уже отмечалось, этот заряд скапливается на
внешних поверхностях разделяющей отсеки мембраны.
Можно считать, что в любой конечной области электролита
тнцая концентрация анионов равна общей концентрации катионов.
) ю условие известно как условие электронейтральности. Электро-
пейтральность сохраняется потому, что любой нескомпенсирован-
иый заряд ведет к возникновению больших электростатических сил,
которые стремятся восстановить условие нулевого суммарного заря-
НИ. Упомянутое выше движение заряда ввиду его относительной ма-
пости не нарушает условия электронейтральности внутриклеточных
и инеклеточных электролитов нигде, за исключением тонкой области
молекулярных размеров вблизи мембраны.
Чтобы убедиться, что количество перенесенного заряда
обычно относительно мало, рассмотрим аксон радиусом 500 мкм. Полный
перемещенный заряд, соответствующий условию равновесия для ак-
еопа длиной 1 см, равен Q = ЗД4210-8Кл при С =1 мкФ/см2 и V=
1110 мВ (эти величины являются типичными).
При внутриклеточной концентрации калия 400 моль/л имеем
[π(0,05)2·ΐ]
Q =0,4 -Ь '- · 96487 =0303 Кл.
|_ ЮОО j
Таким образом, относительное истощение заряда составляет
иссго около Ю47. Чтобы создать равновесный нернстовский мемб-
рнпный потенциал, через мембрану должно пройти пренебрежимо
милое количество ионов по сравнению с общим их количеством
к клетке.
ΙΊ 9843
290
Биофизик»
В табл. 4.1 приведены значения мембранного потенциала, piu
считанного по формуле Нернста для различных клеток и для разлнч
ных ионов, и экспериментально полученные значения потенции им
покоя для этих клеток.
Таблица 4,1
Содержание ионов К*, Na+, СГ,
равновесные потенциалы и потенциалы покоя некоторых клеток
Объект
Гигантский
аксон
Мышца
лягушки
Концентрация,
м моль/л
[К]
вн.
360
125
нар.
10
2,5
[Na]
вн.
70
15
нар.
420
125
[CI]
вн.
160
11
нар.
500
120
Vm,MB
По формуле
Нернста
К*
-90
-98
Na*
50
60
СГ
-30
-87
Vm,MB
Эксперимвн
-60
-94
Из сравнения рассчитанных и экспериментальных значении
мембранного потенциала видно, что потенциал покоя на самом дслг
ближе к потенциалу, рассчитанному по формуле Нернста для К'
Причина расхождения экспериментальных и теоретических значс
ний в том, что не учтена проницаемость мембраны для других ионон
4.1.3. Доннановское равновесие
и потенциал Доннана
Доннановское равновесие устанавливается между клеткоП
и окружающей средой, если клеточная мембрана хорошо проницас
ма для неорганических ионов, но непроницаема для белков, нуклс
иновых кислот и других крупных органических ионов. Наиболее
характерно равновесие Доннана для мертвых клеток или для кле
ток с ослабленным метаболизмом. На рис. 4.3 мембрана отделяа
внутренний отсек II от наружного отсека I. Предполагается, что
мембрана проницаема для ионов калия и хлора, но непроницаеми
для крупных анионов (белков), сосредоточенных внутри клетки.
Если предположить, что первоначально концентрации KCI по обе сто·
ι mine 4. Электробиология
291
K+ СГ
K+
ΑΠ
Κ+
ci-
I
Рис. 4.3. Ионная система из двух камер,
иллюстрирующая доннановское равновесие
ромы мембраны были равны, то присутствие К+ и А" вносит
возмущение в условие равновесия, так [К+]ц > [К+],, что ведет к диффузии
млня наружу.
Вследствие выхода калия возникает электрическое поле,
направленное снаружи клетки внутрь. Это поле заставляет ион хлора
ципгаться из отсека II в отсек I, что вместе с выходом калия порожда-
11 движение КС1 из левого в правый отсек на рис. 4.3.
Действительно, условие электронейтральности не допускает никаких
крупномасштабных перемещений К+ без сопутствующего движения О" . Поток
К( Ί наружу со временем приводит к существенному
перераспределению этих ионов и изменению их концентраций во внутри- и внекле-
К1Ч ном отсеках.
Движение КС1 прекратится, когда система достигнет статиче-
| кого равновесия, т. е. диффузионные силы и силы электрического
пиля будут уравновешены как для К+, так и для О-. Так как
трансмембранные потенциалы (и связанные с ними электрические поля)
одинаковы для К+ и С1~, то потенциалы Нернста этих ионов
(являющиеся электрической мерой диффузионной силы) тоже должны быть
пдинаковы (и равны общему трансмембранному потенциалу) при
равновесии. Следовательно, из уравнения (4.34) находим:
F„K = —In
= va =_^ln
[СГ],
[СП,,
(4.41)
Отсюда следует:
[К+], _[СГ]„
[К+]„ [СГ],
(4.42)
|Ί·
292
Биофизик»
Вначале [К+]„ > [К+], и [С1~]„ < [С1~], но со временем концентрп
ция [К+]ц уменьшается, а концентрация [С1~], увеличивается до урон
ней, когда выполняется (4.42). Это условие для находящихся в равно
весии ионов известно как доннановское равновесие.
Приведенное выше описание может быть обобщено на случиН.
когда имеется более двух сортов ионов, проходящих через мембрану
Таким образом, в системе, состоящей из проходящих через мембрану
ионов К+, Na+ и С1~, все они будут иметь одинаковый потенциал Нг
рнста, если
[КП,_[С1-3„_[Ка+3„_г
[К+]„ [СГ], [Na+],
и доннановский равновесный трансмембранный потенциал V° задн
ется выражением
RT
FmD=^-lnr, (4.44I
F
где величина г определяется уравнением (4.43).
В предположении электронейтральности окончательное put
пределение ионов К+ и С1~ в системе, представленной на рис. 4.3, мо
жет быть найдено из следующих условий равновесия:
[Κ+], = [α-],. (4.4Μ
В предположении, что А" одновалентен (хотя он обычно мш>
говалентен), имеем:
[К+]п = [С1-]„ + [А-]. (4.46)
Использование уравнения (4.42) дает для [К+]„ квадратног
уравнение, решением которого является
[A-] + ([A-]2+4[K+tfV [на+]
[К+]..= ^ iZ_ = L1Nd J" =r (4.471
2 [Na+],
Отсюда, используя уравнение (4.41),получаем
/ nuea 4. Электробиология
293
V ° = -— In Ь XJ—. (4.48)
F 2[K+],
Анализ выражения (4.48) показывает, что потенциал будет
нужным, если [А] = 0, и отрицательным при [А"] > 0. Укажем также
соотношения
[К+]„>[К+], (4.49)
[С1-]„ + [А-] =[К+]„ > [К+], = [С1-],, (4.50)
и ι которых следует неравенство
[К+]„ = [С1-]„ + [А-] >[К+], + [С1-],. (4.51)
Таким образом, осмотическая концентрация в отсеке II превос-
чпдит осмотическую концентрацию в отсеке I, и при наличии
возможности вода будет двигаться из I в II, изменяя концентрации и
нарушая доннановское равновесие. Приток воды стремится разбавить
концентрацию А", в результате чего равновесие смещается в направ-
иеиии уравнения внутри- н внеклеточной концентрации КС1.
Как подтверждают данные табл. 4.1, ионный состав, соответст-
иующий рис. 4.4, представляет собой более реалистическую модель
(ишлогической системы, чем случай, представленный на рис. 4.3.
Ητοι ιΐ,ι полностью соответствовать биологическим условиям,
внеклеточная концентрация NaCl должна быть высокой, как и внутриклеточная
концентрация К+ и А", в то же время внеклеточная концентрация КС1
цолжна быть низкой. Если бы мембрана была непроницаемой для на-
I рия, то равновесие достигалось бы при выполнении условия (4.43),
ι, с. имело бы место доннановское равновесие.
Такие условия могут возникнуть в случае, показанном на
рис. 4.4, при этом будет также удовлетворено и условие
осмотического равновесия. В исследованиях Бойла и Конвея мышцу лягушки
помещали в различные внеклеточные растворы КС1 и оставляли на
.'.4 ч для достижения равновесия. Результаты показаны в табл. 4.2, из
которой видно, что уравнение (4.43) приближенно выполняется, если
|К'],> 10ммоль/л.
294
Биофизике
К* СГ I К* Ог
К+ A" J Na+ Cr
II ! I
Рис. 4.4. Двухкамерная система, моделирующая внутриклеточное и внеклеточное
пространство, разделенное биологической мембраной
Таблица 4.1
Равновесная внутриклеточная концентрация КС1 как функция
внеклеточной концентрации КО (ионная концентрация в ммоль/л)
[К4],
6
12
18·
30
90
120
150
.210
300
[СП,
82
88
94
106
166
196
226
286
376
[Юн
92
101
107
120
184
212
240
282
353
[СП.,
7,2
9,9
16,1
24,9
86,0
144,2
143,1
186,7
308,0
[К*]|[СП,
[К*1,|[СП„
0,74
1,05
0,98
1,06
0,94
0,97
0,99
1,14
1,05
Хотя для натрия проницаемость в покое мала, она не равна
нулю, как предполагалось выше, и возбудимые мембраны не достигают
доннановского равновесия. В то же время красная кровяная клетка
представляет собой систему, через мембрану которой свободно
проходят и вода, и фактически анионы (но не белок), и ионы CI
и НОС~ъ близки к доннановскому равновесию.
4.1.4. Уравнение Гольдмана - Ходжкина - Катца
Трудность применения уравнения Нернста - Планка (4.4)
к биологической мембране (даже в случае одномерного ее описания)
состоит в том, что изменения величин с или φ внутри мембраны
неизвестны и зависят от существующих пространственных
электрических зарядов. Однако поскольку мембрана тонка, в качестве хороше
i tinea 4. Электробиология
295
vmk
II
внутриклеточная
среда
толщина
мембраны
Ф(<0
I
X
внеклвто
Рис. 4.5. Одномерная модель мембраны с линейным изменением
трансмембранного потенциала для вывода
уравнения Гольдмана - Ходжкина - Катца
ίο приближения можно взять линейный закон изменения φ внутри
мембраны.
Это предположение было использовано Гольдманом, чтобы
проинтегрировать уравнение Нернста - Планка. Проделаем это для
мембраны в стационарных условиях, например, для мембраны в
состоянии покоя. В одномерном случае, представленном на рис. 4.5,
и стационарных условиях имеем
<*ψ_φ(</)-φ(0)_ Ут
dx d d
(4.52)
ι лс Vm - трансмембранный потенциал и d - толщина мембраны.
Для простоты рассмотрим одновалентные катионы.
Поскольку V<p = ——, Vc = —, из уравнения (4.4) получаем
dx dx
для потока иона данного сорта через единицу площади поверхности
еледующее выражение:
rJ dc cF ί/φ]
j=-D\ — + -i- .
Idx RT dx J
(4.53)
В частности, для иона калия при допущении постоянства поля
(4.53) получим:
296
Биофизик»
dx Dv RTdL J
(4.54)
Преобразование уравнения (4.53) дает
4K+]
^4К*]
= dx.
(4.55)
Dv
RTd
Теперь произведем интегрирование по толщине мембраны οι
ее левого края (х = 0) до правого края (х = d). Поскольку величина^
постоянна в силу условия стационарности, а величина DK просто
предполагается постоянной, в левой части уравнения (4.56) перемен
ной является ск(х). Следовательно,
RTd
VF
In
m
RTd
Γκ+1 -Α.
L Jim η
F„F,
Γκ+1 -Α.
RTdL J|1M Dv
= d.
(4.56)
Решение уравнения (4.57) относительно jK дает
d ν fTk+1 -Γκ+1 e
.'-'к* тг L Jim L Jiim
RT
Jk =
_~_K"_m*
RTd
\-eRT
(4.57)
Концентрация калия в общей объемной среде связана с
концентрацией внутри мембраны через посредство коэффициентов
распределения β. В уравнении (4.58) имеются ввиду внутримембранныс
концентрации. Предполагается, что коэффициенты β на обеих
поверхностях раздела одинаковы. Следовательно, если обозначим
индексом «0» поверхность мембраны, контактирующую с
внутриклеточным пространством, а индексом d - поверхность в контакте
с внеклеточной средой (см. рис. 4.5), то
I пава 4. Электробиология
297
где [К+] - концентрация калия в общей объемной среде.
Учитывая, что 7к =/ (/к) и введя определение проницаемости
дня калия Рк как
Рк=^, (4.59)
a
пч уравнения (4.58) находим:
А^[к+],-[к+]„*
\-eRT
Уд,?
Л =-JL-J2—-—J1 L „ Г · (4·6°)
Чдесь индексы I и II относятся соответственно к вне- и
внутриклеточной концентрациям.
Аналогичные выражения можно получить для 7Na и Ja -
плотностей натриевого и хлорного токов, которые вместе с калиевым играют
пажную роль в функционировании биологических мембран.
Выражение для JQ несколько отличается, поскольку речь идет об анионе. Пол-
пая плотность ионного тока равна сумме отдельных ионных
компонент, т. е.
J=Jk+J*>+Jv (4-61)
Уравнение (4.61) можно переписать в виде
Ρ V F2 ГК+1 "ГК+1 е
RT
RT
J= Krl ' у, > С4·62)
\-eRT
где
^Μ,+^-Μ,+^α],,. (4.63)
298
Биофизик»
"κ *κ
В общем случае биологическая мембрана не может быть
β равновесии для всех ионов. Если вычислить потенциалы Нернсти
для К, Na, C1 при их обычных концентрациях, то полученные вели
чины окажутся различными. Таким образом, никакой трансмемб
ранный потенциал не может одновременно уравновесить все ионы
Условие покоя может быть охарактеризовано только как стационар
dV
ное состояние (—— =0). При этом требуется выполнение равенст
ва J= 0 и подразумевается, что w-ye RT =0. Последнее условие по
зволяет найти решение для трансмембранного потенциала покоя
У F
— W
eRT =-, (4.65)
У
v RT. w RT.
Vm = In—= In
m F у F
^к[К+],+/?Na[Na*],+/?cl[Cl"3„
A[K+]ll+/>Na[Na+]11+/}cl[Cr]J
(4.66)
Уравнение (4.66) называется уравнением Гольдмана -Ходжки
на -Катца. Будем применять его как к невозбудимой, так и к
возбудимой мембране, но лишь при условии, что 7=0.
В случае, когда проницаемость мембраны для ионов натрия
и хлора значительно меньше проницаемости для калия Рш < Рк
и Ра < />к из этого уравнения получим уравнение Нернста для
мембранного потенциала покоя:
Km=-^Iln^!!-. (4.67)
F [К+],
Таким образом, уравнение Нернста - частный случай
уравнения Гольдмана - Ходжкина - Катца. Мембранный потенциал, рассчи-
I пава 4. Электробиология
299
пшный по этому уравнению, ближе к его экспериментальным
значениям в крупных клетках. И формула Нернста, и уравнение Гольдмана
не учитывают активного транспорта ионов через мембрану, наличия
и мембранах электрогенных (вызывающих разделение зарядов, а
следовательно, и возникновение разности потенциалов) ионных насосов,
играющих важную роль в поддержании ионного равновесия в мелких
клетках. С учетом работы электрогенных ионных насосов для
мембранного потенциала было получено уравнение Томаса:
где т - отношение количества ионов натрия к количеству ионов
камня, перекачиваемых ионными насосами через мембрану. Чаще всего
№+-К+-АТФаза работает в режиме, когда т - 3/2; т всегда больше 1.
(Нет ионных насосов, перекачивающих С1~, поэтому в уравнении
Томаса отсутствуют члены Ра[С1~]).
Коэффициент т > 1 усиливает вклад градиента концентрации
калия в создание мембранного потенциала, поэтому мембранный
потенциал, рассчитанный по Томасу, больше по абсолютной величине,
чем мембранный потенциал, рассчитанный по Гольдману, и дает
совпадение с экспериментальными значениями для мелких клеток.
Нарушение биоэнергетических процессов в клетке и работы
№+-К+-АТФазы приводят к уменьшению Vm, в этом случае
мембранный потенциал лучше описывается уравнением Гольдмана.
В создании потенциала покоя роль иона хлора по сравнению
с ролью иона калия представляется второстепенной. Это связано
с тем, что внутриклеточная концентрация хлора очень мала и при
малом притоке или оттоке ионов подвергается большим
относительным изменениям хлора (для калия дело обстоит иначе).
Следовательно, можно ожидать, что движения иона хлора будут приводить
его концентрации по обе стороны мембраны в соответствие с
практически фиксированным отношением концентраций нона калия,
т. е. будут направлены на выравнивание потенциалов Нернста. Два
отношения ионных концентраций согласуются друг с другом, если
тРк\К+Ъ +/>Na[Na+],
т^ГКа+^рЧаЧ.]
(4.68)
300
Биофизикш
К+
CI-
,! Вне клетки
Na+
Мембрана>
Внутри клетки
Рис. 4.6. Направление ионных потоков в мембране
[К+]„ [С1"]„ = [К+], [С1~]„ что одновременно является условием донна-
новского равновесия.
Связь трансмембранного потенциала покоя Vm с внеклеточной
концентрацией калия экспериментально исследовали Ходжкин и Хо-
рович. Эта связь воспроизводится на рис. 4.7. Заметим, что для
[К+], > 10 ммоль/л существует линейная зависимость Vm от
логарифма [К+]„ как и предсказывает уравнение Нернста для калия (4.69).
Для [К+], < 10 ммоль/л отмечено расхождение между
экспериментом и расчетами по уравнению (4.35). Его можно объяснить,
обратившись к уравнению Гольдмана (4.66) в предположении, что ионы
хлора находятся в равновесии или отсутствуют (рис. 4.6). В этом
случае имеем
γ -RT\n [K*],+a[Na+],
m F Ьи^РПи+«[№♦]„]
, где α =^-. (4.69)
Если α = 0, то как и можно было ожидать, (4.69) сводится
к (4.37). Более реалистическим значением α является 0,01. Учитывая
это и данные табл. 4.1 при анализе уравнения (4.69), можно показать,
что величина [Na+], /[K+], < 20 (заметим, что величина [Na+]„,
очевидно, пренебрежимо мала). Тем не менее, если [К+], < 10 ммоль/л,
данное упрощение перестает быть приемлемым, и в соответствии
с (4.69) вклад [Na+], в потенциал покоя необходимо учитывать.
Результат показан на рис. 4.7. Кривая, построенная по уравнению (4.69),
согласуется с экспериментальными данными достаточно хорошо
даже при [К+], < 10 ммоль/л.
/ ппва 4. Электробиология
301
V,mB
о
-10
-20
-30
^10
-50
-60
-70
-80
-90
-100
-110
-120
О 0,2 0,51,02,5 5 10 20 50 100
Рис. 4.7. Влияние внеклеточной концентрации иона калия по оси абсцисс
на мембранный потенциал (по оси ординат) изолированного волокна
мышцы лягушки. Внеклеточные растворы не содержали хлора,
главным анионом был сульфат
Экспериментальные исследования поведения хлора в
состоянии покоя возбудимой клетки предприняли Ходжкин и Хорович.
Препарат мышцы лягушки был помещен в нормальную внеклеточную
греду с [К+], = 2,5 ммоль/л и [С1~], = 120 ммоль/л. Внутриклеточная
концентрация калия была равна [К+]„ = 140 ммоль/л,
внутриклеточная концентрация хлора [С1~], = 24 ммоль/л, и потенциал покоя был
равен номинальному равновесному потенциалу для хлора - 98,5 мВ.
Если в момент времени t - 0 быстро уменьшали внеклеточную
концентрацию хлора до 30 ммоль/л (рис. 4.8), то результатом было
увеличение V® на 58 Igfl20/3i0) = 34,9 мВ, так что величина V^
иозрастала от - 98,5 до - 63,6 мВ. Экспериментально было установ-
испо, что мембранный потенциал возрос до - 77 мВ (рис. 4.8).
(Заметим, что эта величина лежит между V" ~ - 98,5мВ и V^ = - 63 мВ.)
После уменьшения внеклеточной концентрации хлора
возникает поток С\~ наружу, обусловленный электрическим полем, кото-
рос более не компенсируется диффузией внутрь, и это вызывает уве-
ничение Vm. В результате увеличения направленного наружу
шектрического поля ионы К+ движутся наружу, вызывая отток КС1
[K]0 + 0.01[Na]0 [К]0
V= 581og J4Q V- 581ogW
302
Биофизик»
2,5 ммоль
п. 120 ммоль „_.
ΙΊ 1 30 ммоль
120 ммоль
-К
CI
V, мВ
-60
-70
-80
-90
-100
-110
-120
U^
J I L
J ι ι
10
15 20 25 30 /, мин
Рис. 4.8. Влияние внезапного уменьшения внеклеточной концентрации хлора
на мембранный потенциал изолированного волокна мышцы лягушки
из клетки. Фактически, как видим, лишь очень малый поток одного
иона может иметь место без возникновения дополнительных (уран
новешивающих) полей. Иллюстрацией этого положения может слу
жить наблюдаемый здесь поток, который по существу электронсй
трален, с равными количествами ионов калия и хлора.
Чтобы установились равные потоки калия и хлора, силы, лей
ствующие на каждый из ионов, должны быть обратно пропорциони
льны проводимостям. Таким образом, поскольку AV^ =(98,5-77)
движущая сила для калия (разность между Vm и V* при ί = 0),
a AV^ =(77-63,6)-движущая сила для хлора (Fm-F^'), то для про
стоты полагаем, что
gK _AFmK _(77-63,6)_Q62
gcl AV° 98,6-77 ' ·
(4.70)
Результатом оттока КС1 является очень слабое уменьшение
концентрации [К+]„ (от 140 до 138 ммоль/л) и, следовательно, очеш.
небольшое изменение V^ Тем не менее, концентрация [С1~]м подвер
гается большому относительному изменению В конце концов (при
мерно за 15 мин) V^ уменьшается до уровня, определяемого
величиной V* (по мере того как [С1~], уменьшается из-за оттока хлора).
/ пава 4. Электробиология
303
Если предположить, что значение Vm = - 98,5 мВ и остается
неизменным, концентрация [О-],, должна упасть в 4 раза, чтобы
компенсировать уменьшение [Сг~], в 4 раза (от 120 до 30 ммоль/л). Это
равновесие достигается, когда [С1~]„ падает до 0,6 ммоль/л с
начального уровня 2,4 ммоль/л - снижение на 1,8 ммоль/л. Таким образом,
шток КС1 составляет 1,8 ммоль/л, тогда как внутриклеточная
концентрация калия уменьшается от 140 до 138 ммоль/л, что, как уже
отмечалось, пренебрежимо мало влияет на V^. Следовательно, оказы-
иается, что и, в самом деле, хлор подстраивается к изменившимся
уеловиям и остается в равновесии, а задание уровня потенциала
покоя приходится на долю калия.
Почему считается, что выход 1,8 ммоль/л не влияет на
значение [К+],. Потому, что внеклеточное пространство содержит очень
(юльшой объем электролита, и выходящие ионы оказывают лишь
гиабое влияние на общую концентрацию в этом пространстве.
Большой внеклеточный объем резко отличается от ограниченного
внутриклеточного пространства.
4.2. Потенциал действия
4.2.1. Происхождение и характеристики
потенциала действия
При возбуждении нервных и мышечных клеток между
внутриклеточной средой и межклеточной жидкостью возникает
изменение мембранного потенциала, называемое потенциалом действия
(рис. 4.9). Трансмембранный потенциал действия, показанный на
рис. 4.9, типичен для потенциалов, наблюдаемых в эксперименте на
нерве и мышце (хотя и существуют отличия в некоторых деталях).
Мо всех случаях в покое мембрана имеет отрицательный потенциал
и пределах 60-100 мВ. Процесс активации вызывает внезапное и бы-
11 рое увеличение этого потенциала с изменением полярности до
пиковых значений, достигающих 40 мВ.
После активации следует фаза реполяризации,
восстанавливающая состояние покоя. Потенциал, однако, может на некоторое время
Ш.1ЙТИ на гиперполяризационный или деполяризационный, по сравне-
304
Биофизик*
50
0
-50
а)
ι
10
Пик
б)
*)
+40мВ
Фаза нарастания
Подножие
-бОмВ
Деполяризационный след
Гиперполяризационный след
Рис. 4.9. а, б, в — виды потенциалов действия, г - терминология, применяемая
для описания потенциала действия и сопровождающих его следовых потенциален
нию с потенциалом покоя, уровень. Эти следовые потенциалы, поки
занные на рис. 4.9, могут присутствовать или отсутствовать, причем и
первом случае обычно можно наблюдать только один из них.
Потенциалом действия (ПД) называется электрический им
пульс, обусловленный изменением ионной проницаемости мембра
ны. С ним связано распространение по нервам и мышцам волны во ι
буждения.
Опыты по исследованию потенциала действия вначале были
проведены на гигантских аксонах кальмара при помощи микроэлек ι
родов с использованием высокоомных измерителей напряжения,
а также методом меченых атомов. На рис. 4.10 показаны схема опы
тов и результаты исследований.
В опытах по исследованию потенциала действия использовали
три микроэлектрода, введенных в аксон. На микроэлектрод Э1 поди
ется импульс с амплитудой V от генератора Г прямоугольных импу
льсов, меняющий мембранный потенциал. Мембранный потенциал
ι mioa 4. Электробиология
305
в)
о
1/2 м
о
о
ТГ
/л
Δί
50 " "Г/" ~t
ν„Τ·
-60
I
ι/ Ρ»
Γ"
ι
I ^nop
■
"νί
υ
7
χ 71
-
J t
t
б)
Рис. 4.10. Исследование потенциала действия
а - схема опыта; б - потенциал действия (V£ - потенциал покоя,
V£* - потенциал реверсии, V£ - амплитуда потенциала действия,
^т°Р ~ пороговый потенциал). Г- генератор, Э - электрод,
'.Ю - заземленный электрод, У-усилитель, О - осциллограф, Η-нервное
нервное волокно
306
Биофиэикш
измеряется при помощи второго Э2 и третьего ЭЗ микроэлектродои
высокоомным регистратором напряжения О.
Возбуждающий импульс вызывает лишь на короткое время смс
щение мембранного потенциала, который быстро пропадает и восстанан
ливается потенциал покоя. В том случае, когда возбуждающий импульс
смещается еще дальше в отрицательную сторону, он сопровождается πι-
перполяризацией мембраны. Также не формируется потенциал
действия, когда возбуждающий импульс положительный
(деполяризующий), но его амплитуда меньше порогового значения V™9. Однако,
если амплитуда положительного деполяризующего импульса окажется
больше значения V™p, то Vm становится больше V™9 и в мембране
развивается процесс, в результате которого происходит резкое
повышение мембранного потенциала и мембранный потенциал Vm даже менян
свой знак - становится положительным (рис. 4.10, б).
Достигнув некоторого положительного значения V^a -
потенциала реверсии, мембранный потенциал возвращается к значению
потенциала покоя V£, совершив нечто вроде затухающего
колебания. В нервных волокнах и скелетных мышцах длительность
потенциала действия около 1 мс (а в сердечной мышце около 300 мс).
После снятия возбуждения еще в течение 1-3 мс в мембране
наблюдаются некоторые остаточные явления, во время которых
мембрана рефрактерна (невозбудима).
Новый деполяризующий потенциал Vm > V™9 может вызвать
образование нового потенциала действия только после возвращения
мембраны в состояние покоя, причем амплитуда потенциала действия:
Vя =\vn\ + V"* (4.71)
не зависит от амплитуды деполяризующего потенциала (если только
Vm > V™p )· Если в покое мембрана поляризована (потенциал
цитоплазмы отрицателен по отношению к внеклеточной среде), то при
возбуждении происходит деполяризация мембраны (потенциал
внутри клетки положителен), и после снятия возбуждения происходит ре-
поляризация мембраны.
Как было указано выше, ответ в возбудимых мембранах не
возникает, пока стимул не достигнет некоторого уровня, называемого
/ пива 4. Электробиология
307
пороговым потенциалом. Для всех надпороговых стимулов,
приложенных к клетке, потенциалы действия одинаковы
Чтобы стимулирующий ток возбудил мембрану, он должен иметь
достаточно большую интенсивность и нужную полярность, причем
стимулирующий импульс должен также иметь достаточную
длительность.
Ответы трансмебранного потенциала на импульсы
стимулирующего тока для аксона краба показаны на рис. 4.11. Здесь за нулевой,
или опорный, потенциал принят потенциал покоя. Отмеченная на
рисунке длительность стимулирующего импульса поддерживалась
неизменной, в то время как его амплитуда и знак изменялись.
О стимуле, который заставляет трансмембранный (внутрикле-
I очный минус) потенциал становиться более отрицательным, чем он
(>ыл в покое, говорят, что он гиперполяризует мембрану. При
гиперполяризации возбужение не возникает, сколь бы велик ни был
стимул, хотя, как видно на рис. 4.11, пассивный ответ увеличивается
с увеличением силы стимула. С другой стороны, для
деполяризующих стимулов с увеличивающейся амплитудой достигается уровень,
мри котором возникает ответ С, показанный на рис. 4.11. На кривой
ответа видна нижняя часть вызванного потенциала действия, что
свидетельствует о достижении порогового условия.
Рассмотрение ответов на подпороговые импульсы показывает,
ч го они в принципе аналогичны тем, которые можно ожидать от
пассивной электрической RC-цепочки. Симметричны ли ответы на
стимулы противоположной полярности на рис. 4.11, например, ответы a
и b. В случае деполяризации в ответ на потенциалы, составляющие
от 80 до 100% порога, ответ не является зеркальным отражением
отпета на гиперполяризующий стимул той же амплитуды и
длительности, но противоположной полярности.
Таким образом, ответ не строго пассивен. Отсутствие
симметрии свидетельствует о том, что в ответе должна присутствовать
нелинейная активная компонента.
Приведенные выше соображения нашли отражение также на
рис. 4.12, который базируется на рис. 4.11 и представляет собой
график напряжения, измеренного спустя 0,29 мке после стимула. Напря-
308
Биофизик»
+0,4 -
-0,4 I-
Рис 4.11. Подпороговые ответы, записанные внеклеточно от аксона краба
в окрестности стимулирующих электродов. Аксон был помещен в парафиновое
масло, и, следовательно, измеренный внеклеточный потенциал прямо связан
с трансмембранным потенциалом. Черный прямоугольник указывает период
действия стимула, длительность которого составляла около 50 мкс. По оси
ординат - шкала напряжений; максимальная амплитуда потенциала
действия принята за единицу
жение выражено в долях пиковой амплитуды потенциала действия
и представлено в виде функции от амплитуды стимула.
Отметим, что зависимость линейна для всех гиперполяризую-
щих стимулов, как можно было бы ожидать при линейной пассивной
системе. Линейность наблюдается также для малых
деполяризующих сигналов, следовательно, в этой области система тоже может
описываться пассивной цепью. Для стимулов с большей амплитудой
наблюдаемое поведение становится нелинейным, поэтому она
должно рассматриваться как активная.
При выводе уравнения Гольдмана для потенциала покоя (4.66)
ключевым было допущение о существовании стационарного состоя-
ι imaa 4. Электробиология
309
ι
-1,0
ι
-0^
А
0,3
0,2
0.1
-0,1
-
-
-
ι
0,5
I
1.0
Рис. 4.12. Связь между стимулом и ответом для аксона краба. Этот рисунок
настроен на основе кривых рис. 4.11. По оси абсцисс отложена интенсивность
стимула, измеренная в долях порогового стимула, по оси ординат - потенциал,
записанный через 0,29 мс после стимула и измеренный в долях
пиковой амплитуды потенциала действия
пня, в котором полная плотность трансмембранного ионного тока
цолжна быть равна нулю. Можно считать, что полученное уравнение
цаст оценку трансмембранного потенциала как взвешенного среднего
потенциалов Нернста для натрия, калия и хлора. Если исследуется
потенциал действия в препарате с «пространственной фиксацией»
(и нем все характеристики во всех точках изменяются синхронно), то
полная плотность трансмембранного тока (ионная плюс емкостная)
цолжна равняться нулю (условия разомкнутой цепи). Следовательно,
ми пике потенциала действия, когда —— =0 и соответственно
плотей
мость емкостного тока равна нулю, плотность полного трансмемб-
ринного ионного тока тоже должна быть равна нулю. Таким образом,
иыражения для постоянного поля оказываются применимыми и для
иого момента времени. Однако при пиковом значении потенциала
действия проницаемости мембраны отличаются от проницаемости
и покое.
Экспериментально установлено, что пик потенциала действия
приближается к потенциалу Нернста для натрия, но никогда не пре-
иышает его. Этот результат согласуется с возможным повышением
310
Биофизина
натриевой проницаемости. Ходжкин и Катц показали, что хоронит
совпадение теории с экспериментом достигается, если взять
Рк : PNa: РС1 = 1,0 : 0,04 : 0,45 для мембраны в покое,
Рк : PNa: Ρα = 1.0 : 10,0 : 0,45 для активной мембраны.
Отметим, что натриевая проницаемость меняется почти на три
порядка.
Уже отмечалось, что влиянием хлора на поведение мембраны
можно пренебречь. В результате в качестве первого приближении
можно положить, что
Vm=V* = — In ϋ^ϋ- в покое, (4.7?)
Г[к+],1
"[Na+],"
_[Na+]„.
Vm=Vl*= — ln-^-ϋ- на пике. (4.73)
Характерные свойства потенциала действия:
1) наличие порогового значения деполяризующего потенциала.
2) закон «все или ничего», т. е., если деполяризующий потен
циал больше порогового, развивается потенциал действия, амплиту
да которого не зависит от амплитуды возбуждающего импульса, и
нет потенциала действия, если амплитуда деполяризующего
потенциала меньше пороговой;
3) есть период рефрактерное™ (невозбудимости) мембраны B(i
время развития потенциала действия и остаточных явлений после
снятия возбуждения;
4) в момент возбуждения резко уменьшается сопротивление
мембраны (у аксона кальмара от 0,1 Ом · м2 в покое до 0,0026 Ом · ы1
при возбуждении).
Все приведенные выше теоретические и экспериментальные
результаты дают в общих чертах следующее объяснение
происхождения потенциала действия. В покое мембрана преимущественно
проницаема для калия и Vm приближается к потенциалу Нернста дли
калия. На пике потенциала действия мембрана преимущественно про-
иицаема для натрия и Vm близок к потенциалу Нернста для натрия.
пиша 4. Электробиология
311
Приведенный выше материал позволяет понять
фундаментальную природу импульса потенциала действия, объясняя
происхождение потенциала покоя и пикового потенциала. Однако этого недоста-
I и'шо для объяснения полного временного хода потенциала действия.
Для ответа на вопрос о временном ходе потенциала действия
фебуются более сложные модели поведения мембраны. Соответст-
иующее подробное описание будет дано далее и будет включать сле-
иующие части:
Во-первых, электрическую модель мембраны - модель парал-
мельных проводимостей. Эта модель положена в основу анализа
многокомпонентных ионных токов.
Во-вторых, описание результатов экспериментов с фиксацией
мембранного потенциала. Как было отмечено выше, фиксация
потенциала представляла собой ключевую экспериментальную методику,
позволившую оценить индивидуальные ионные токи.
В-третьих, уравнения Ходжкина-Хаксли. Эти уравнения
обобщают экспериментальные данные, полученные в экспериментах
с фиксацией мембранного потенциала. Кроме того, они способны
описывать поведение мембраны в условиях, когда напряжение на
ней не остается постоянным. Фактически уравнения Ходжкина-Хак-
1ли оказались поразительно эффективными для объяснения самых
разнообразных потенциалов действия, а также для описания соответ-
с гвующих движений индивидуальных ионов.
Анализ временного хода потенциала действия облегчается
введением дополнительного варианта определения трансмембранного
потенциала. Как и раньше, символ Vm с использованием прописной
Пуквы V будет применяться для обозначения трансмембранного
потенциала, измеренного как разность потенциалов на внутренней по-
иерхиости мембраны и на ее внешней поверхности, так что Vm = φ„ -
φ,. Однако, кроме этого, в последующем изложении для обозначения
изменения трансмембранного потенциала по сравнению с его
величиной в покое будет использоваться символ vm со строчной буквой v.
Иначе говоря,ут определяется как vm(t) = Vm (t) - Vm. Заметим, что
математически vra отличается от Vm только на постоянную величину. Это
означает, что производные по времени или по пространственным ко-
312
Биофизит
наружная среда
- ύ* $Ь JL*
0-
"■Tf *Т
Na
/?ci
внутренняя среда
Рис. 4.13. Модель параллельных проводимостей для мембраны нервного волокна,
в которой предполагается наличие независимых проводящих каналов для 1С, Να'
и СГ. Разные полярности батарей отражают тот факт, что потенциалы φΑ
и ψα являются отрицательными, а фм, - положительным
ординатам от Vm(t) равны соответствующим производным vm; они
в некоторых случаях лучше характеризуют то, что представляет наи
больший интерес - величину и направление отклонений трансмемб
ранного потенциала от его «естественного» уровня в состоянии покоя
Простое описание участка мембраны в виде электрической цс
пи дано на рис. 4.13. Это описание известно как модель параллельных
проводимостей. Каждая из ветвей цепи отражает вклад какого-либо
одного сорта ионов в общий трансмембранный ток. Например, если
трансмембранный потенциал равен Vm, то результирующая движуща*
сила для калия равна (Vm - V*), что соответствует отклонению от
равновесного состояния. Поскольку плотность калиевого тока
пропорциональна напряжению (Vm — V*), коэффициент пропорциональности
имеет размерность удельной проводимости. Он называется калиевой
проводимостью gK значение которой зависит от Vm и t, так что
к \т mJ^'
(4.74)
где 1К - плотность калиевого ионного тока. Если Vm>V*, то
направленные наружу диффузионные силы не полностью
уравновешиваются электрическим полем. В результате возникает
некомпенсированный поток калия наружу и, следовательно, электрический
ток. Заметим, что величина /к в уравнении (4.74) имеет
положительный знак.
I nnaa 4. Эпектробиопогия
313
По аналогии с уравнением (4.74) для иона хлора получаем
1а=(Гш-У?)Яа, (4.75)
Если Vm> V^, диффузия хлора внутрь не уравновешивается
полностью и возникает некомпенсированный поток внутрь. Поско-
|||.ку этот поток состоит из ионов с отрицательным зарядом, он
сошлет электрический ток, направленный наружу; величина /а долж-
1ш быть положительной, как и следует из (4.75)
Наконец, для иона натрия:
'Na.=(>m-C>Na, (4-76)
Здесь, если Vm > V™a, то, поскольку величина V™*
положительна потенциал Vm должен быть тоже положительным и большим по
причине. Результатом является поток ионов натрия, направленный
инружу, несмотря на направленные внутрь диффузионные силы.
Уравнение (4.76) снова дает правильный знак для величины /Na
Чтобы завершить список компонент трансмембранного тока,
рассмотрим емкостной ток (или ток смещения), плотность которого
равна просто
г cdVm
I = -Ш—ш-. (4.77)
dt
dV
В покое, т.е. в стационарном состоянии, / = 0, —— = 0.
dt
В стационарных условиях /=/к +/Na +/cl =0. Это условие
позволяет приравнять нулю сумму (4.74) - (4.76), в результате
покупаем:
(Vm ~V*)gK + (vm -Vcj)ga +(Vm -C)gNa =0. (4.78)
Выразив Vm в стационарном состоянии из (4.78), получим
К уС\ ,
m "*" & CI n» '
gK+ga +8
s VK +ε Va +ε VN*
у _°K m °СГ m ° Na m /л ПО\
314
Биофизит
Уравнение (4.79) известно как уравнение параллельных пронп
димостей. В соответствии с ним Vm представляет собой взвешсппш
среднее величин V*, V®, F^a, зависящее от относительных удел ι.
ных проводимостей. Это выражение справедливо только для стации
нарных условий, принятых при выводе уравнения (4.78).
Ввиду электронейтральности считаем, что потоки наружу
ионов калия и хлора равны. Следовательно, их токи имеют равпмг
абсолютные величины, но противоположны по знаку и дают нулевой
результирующий ток. Используя уравнения (4.74) и (4.75), получим
(Vm-VZ)g*=(Vm-V")ga- (4.80)
Таким образом, искомое отношение равно:
SjL=lm ^ (48|)
&CI ' m — ' m
Из уравнения (4.81) получаем соотношение (4.70).
4.2.2. Фиксация потенциала
Метод фиксации потенциала был ключевым эксперименталь
ным средством, использованным для оценки временного изменении
ионных токов в процессе потенциала действия.
Компоненты трансмембранного тока во время потенциала
действия включают поток ионов и емкостной (заряжающий емкость)
ток. Поскольку емкость мембраны постоянна, последний легко
оценить - его плотность Ст · dVm Idt. Если создать электрическую схему,
подающую на мембрану ступенчатое напряжение (т. е. постоянный
трансмембранный потенциал), то емкостная составляющая будет
отсутствовать, благодаря чему упростится анализ тока, который в
данном случае будет состоять только из ионных компонент.
Основываясь на описанном выше поведении иона хлора, Ход-
жкин и Хаксли заключили, что вкладом этого иона в полный ток
можно пренебречь. Таким образом, осталось только разделить
полный поток на его натриевую и калиевую составляющие. Оказалось,
ι titKia 4. Электробиология
315
а
Аксон кальмара
Изоляция
©
ρ
Генератор
тока
Изоляция
Управление V-V0
1=^
г
ч>
V0 (опорный потенциал)
Записывающее устройство
Рис. 4.14. Схема установки для фиксации потенциала
Ток пропускается между электродами А и Е; потенциал измеряют электроды В
и ('. Трансмембранный ток определяется по потенциалу между электродами CuD
и полному сопротивлению между соответствующими концентрическими
цилиндрическими поверхностями. Трансмембранное напряжение V сравнивается
с заданным напряжением фиксации Vo (опорный потенциал), и их разность
мставляет трансмембранный ток меняться так, чтобы обеспечить (V-Vq) —> О
что такое разделение облегчается, если проводить измерения тока
и условиях постоянного трансмембранного потенциала. В соответст-
ιιιιιι с этими требованиями был разработан прибор для фиксации
потенциала, показанный на рис. 4.14.
При фиксации потенциала для поддержания
трансмембранного потенциала на заданном уровне используется простая схема
пропорционального управления. Трансмембранным потенциалом
управляют путем регулирования тока, протекающего между аксиальным
электродом А, введенным в аксоплазму нерва, как показано на
рис. 4.14, и электродом Е. Последний представляет собой
концентрический электрод в форме цилиндра. Система управления жестко
удерживает трансмембранный потенциал, измеряемый между
электродами В и С, на заданном уровне.
На рис. 4.14 можно видеть, как формируется и подается на
генератор тока сигнал ошибки V— V0. Результирующее изменение
пропускаемого тока уменьшает величину V— V0 до нуля. Радиальный
(трансмембранный) ток измеряется между электродами С и D,
причем известная проводимость среды используется для калибровки
измеренных разностей напряжения.
316
Биофизик*
О 1 2 t, мсек
US, мА/см2
2
О
Рис. 4.15. Ионный ток в мембране аксона кальмара в условиях фиксации
потенциала (Vm = 20 мВ) β момент I = 0 с. Потенциал покоя У„ж - -50 мВ
Типичная запись, полученная при приложении ступенчатою
трансмембранного потенциала, показана на рис. 4.15. На ней можмп
видеть начальный ток, направленный внутрь клетки, который затем
сменяется асимптотически нарастающим током, направленным и ι
клетки наружу. Начальный скачок емкостного тока завершается ш
20 мке, что соответствует наличию конденсатора с удельной емко
стыо С= 1,0 мкФ/см2. Ввиду очень малой постоянной времени это ι
ток падает до нуля до того, как станет заметным ионный ток, и по»
тому, как правило, в исследованиях последнего им пренебрегают.
Начальная фаза ионного тока, возникающего в ответ на надпо
роговый скачок потенциала, связана с ионом натрия. Это обстоятель
ство отражено нарис. 4.15, где показан ответ на изменение потенциалп
с амплитудой 70 мВ. Как видим, процесс активации характеризуете»
быстрым увеличением натриевой проницаемости, и, поскольку здесь
результирующая движущая сила (разность между потенциалом Не
рнста для натрия 57 мВ и трансмембранным потенциалом 20 мВ) равпн
37 мВ и направлена внутрь, можно ожидать направленного внутрь рс
зультирующего натриевого тока, который действительно наблюдав
ся. Зависимость этого направленного внутрь тока от времени имее1
форму купола, так как увеличение проницаемости для натрия являетси
25
20
0
-25
-50
| Ток наружу
Ток внутрь
ι пава 4. Электробиология
317
143 мВ
^""^. 130 мВ
—^^. 117 мВ
■"-"^Ζ- 104 мВ
*~^Ζ· 91 мВ
J »►
1 2 3 4 '·мс
Рис. ¥.7с». Ионный ток в мембране аксона кальмара
после фиксации потенциала с указанными уровнями
Потенциал Нернста для натрия достигается при скачке
потенциала на 117 мВ, так как потенциал покоя равен - 60 мВ и V"' - 57 мВ
преходящим. Фактически, по мере того как падает натриевая
проницаемость, возрастает и остается повышенной проницаемость для калия,
и этим объясняется «стационарный», или «поздний», ток,
направленный наружу (поскольку направленная наружу движущая сила для
камня при Vl = -50 мВ равна 20 - (-50) = 70 мВ).
Природу раннего мембранного тока можно исследовать путем
фиксации потенциала на уровне Vm = V™3. В этом случае нет никакой
результирующей силы, которая заставляла бы течь натриевый ток.
Таким образом, в течение короткого интервала времени ток отсутст-
IIуст (несмотря на то, что, как известно, в эту раннюю фазу потенциа-
па действия натриевая проницаемость необычайно сильно
увеличите гея). На рис. 4.16 показаны трансмембранные токи, записанные
к серии экспериментов с фиксацией потенциала на разных уровнях
относительно потенциала покоя - 60 мВ. График включает результа-
i ы фиксации потенциала на уровне vm = 117 мВ, что соответствует
условию равновесия для натрия. (Напомним, что vra - значение по
отношению к потенциалу покоя - соответствует Vm = 117 - 60 = 57 мВ,
где Vm = vm + Vnot. и представляет собой потенциал Нернста для на-
||>ия.) Эта кривая отражает полное отсутствие раннего тока. Такое
отсутствие подтверждает, что ранний ток обусловлен именно ионами
иагрия. При vm > 117 мВ результирующая сила, действующая на нат-
г, мА/см2 ι *
4
3
2
1
-
-
-
\L·-
318
Биофизик*
рий (Vm-V^*), направлена наружу. Отметим, что в этих условия ι
«горб» тока направлен наружу.
Серия опытов с последовательно увеличивающимся (деполн
ризующим) фиксированным потенциалом показывает, что после ирг
вышения порога амплитуда пикового тока, направленного внутрь,
круто уменьшается и проходит через нуль. Этот потенциал реверсии
равен значению зафиксированного потенциала, при котором ранпмн
ток внутрь клетки равен нулю. Из приведенных выше рассуждепп11
следует, что потенциал реверсии равен потенциалу Нернста для пи
трия. Это равенство оказывается всего лишь приближением. Факт
чески в этой ситуации применимо уравнение постоянного поля, так
как суммарный ионный и емкостной ток равен нулю. Уравнение даа
более точную оценку потенциала реверсии V^". Так, поскольку
dVJdt = 0, то ^1 =0,и, полагая вклад хлора пренебрежимо малым,
можно получить
Fpca=^Tln
F
[К], +-^[Na],
Ρ*
[K]„ +^[Na]„
(4.82)
Это выражение позволяет учесть малый, но не всегда пренс
брежимый эффект, связанный с наличием калиевой компоненты ион
ного тока.
Кривые зависимости ток-напряжение (вольт-амперные харак
теристики) представляют собой один из способов описания условий
работы мембраны Примеры таких кривых показаны на рис. 4.17.
Положенные в их основу данные получены в экспериментах с
фиксацией потенциала, проведенных в широком диапазоне трансмембрап-
ных потенциалов Vm, причем пиковые плотности тока внутрь (/, ни
рис. 4.17) и тока наружу (/2 на рис. 4.17) взяты в качестве
независимых переменных. Пересечение кривой зависимости /, от Vm с гори
зонтальной осью (/ = 0) дает потенциал реверсии. Из определения
величин gK и gNa в уравнениях (4.74) и (4.76) следует, что эти
проводимости всегда положительны. Их можно графически найти т
ι ппва 4. Электробиология
319
1 /. мА/см2
^0^40^20 2JJ/40 60 Vm, мВ
Рис. 4.17. Вольт-амперные характеристики (ΒΑΧ) аксона кальмара
I/ - пиковая плотность тока внутрь клетки в зависимости от фиксированного
трансмембранного потенциала Vm после предварительного пребывания
в состоянии покоя; 1г -установившийся ток наружу после перехода
от условий покоя к потенциалу Vm. Величина потенциала Vm, задаваемого
при фиксации, отложена по оси абсцисс
рис. 4.17, и ясно, что они представляют собой обычные удельные
проводимости, определяемые как коэффициенты пропорционально-
11 и Интересно отметить, что в диапазоне -75 мВ < Vm < —45 мВ
дифференциальная натриевая проводимость на рис. 4.17 отрицательна.
Уровень мембранного потенциала, который соответствует из-
иому на ΒΑΧ, называют критическим мембранным потенциалом
(КМП). ΒΑΧ свидетельствует о том, что деполяризация возбудимой
мембраны, начиная с уровня КМП, вызывает изменение мембраной
шсктропроводности. ΒΑΧ возбудимой БМ имеет iV-образную
форму, при этом, особое внимание заслуживает второй участок ΒΑΧ.
I'm называют участком отрицательного дифференциального сопро-
ипшения (ОДС), поскольку при падении абсолютного значения U
иж /может нарастать только в том случае, если изменение
напряжения сопровождается понижением сопротивления. Такая аномалия
Ι1ΛΧ возбудимой мембраны обусловлена присутствием в ней
потенциал зависимых ионных каналов. Дело в том, что плотность транс-
мембранного ионного тока может определяться, в принципе, только
цнумя факторами: 1) числом открытых каналов; 2) электропроводно-
ι' ι ью каждого из них.
Известно, что электропроводность отдельного канала равна ли-
Г)о 0 (при закрытых воротах), либо максимальному значению, порядка
320
Биофизии»
1-10 пСм, что соответствует переносу 107—108 ионов за 1 секунд ν
(при открытых воротах). Не бывает промежуточных значений элск ι
ропроводности отдельного канала. Поэтому изменение сопротивлс
ния возбудимой мембраны зависит от количества открытых каналом
при данном уровне мембранного потенциала. Сенсоры напряжении
различных потенциалзависимых ионных каналов, даже если они при
надлежат одному типу, обладают неодинаковой чувствительность!!'
к сдвигам трансмембранной разности потенциалов, то есть, у них пси
динаков порог срабатывания. Поэтому в разных каналах воротим*
процессы включаются при различном уровне мембранного потенции
ла. Очевидно, что КМП соответствует такой деполяризации, при ко
торой начинают открываться наиболее чувствительные потенциалш
висимые натриевые каналы данной БМ. Начавшееся по ним движет к
ионов Na+ усиливает деполяризацию, которая, по мере нарастания, οι
крывает все новые и новые потенциалзависимые натриевые каналы дн
тех пор, пока все они не перейдут в открытое состояние.
На участке отрицательного дифференциального сопротивлс1
ния ΒΑΧ потенциалзависимые натриевые каналы работают как сие
темы с положительной обратной связью по току. Стоит запустим.
в действие наиболее чувствительные компоненты такой системы
чтобы в дальнейшем вся она вовлеклась в электрогеиез. Это свойстни
любой возбудимой мембраны. Однако конкретные значения мем()
раипых потенциалов, соответствующие началу и концу действия пи
ложительной обратной связи, в разных мембранах различны.
После того как все каналы откроются интересно узнать, чему
соответствует максимальное значение тока ионов Na+ через возбуди
мые мембранные ворота натриевых каналов; оказывается, они начи
нают закрываться, и ток падает до определенного значения.
Эксперимент с фиксацией потенциала, представленный им
рис. 4.18, проведен при vm = 56 мВ (или Vm = - 60 + 56 мВ = - 4 мВ)
Возникающий трансмембранный ток показан на рис. 4.18 (кривая А)
В соответствии со сказанным выше он содержит раннюю, направлен
ную внутрь клетки компоненту, обусловленную преимущественно
натрием. Он также содержит поздний, стационарный, направленны!!
наружу ток, создаваемый преимущественно калием.
ι пива 4. Электробиология
321
/, мА/см2 ..
1 *
Потенциал внутри
клетки
(Плотность тока
при уменьшении
содержания Na)
A-/Na+/K (Плотность тока
при 460 мМ Na)
Т. с
Рис 4.18. Анализ ионного тока в мембране
аксона кальмара Loligo во время фиксации потенциала
Кривая А показывает ответ на импульс деполяризации с амплитудой 56 мВ,
когда аксон находится β морской воде; кривая В - ответ аксона в растворе,
содержащем 10% морской воды и 90% изотонического раствора хлористого
холина; кривая С —разность между кривыми А и В Нормальное значение
KJJ1* = 57мВ; β морской воде с уменьшенным содержанием натрия V*' = - 1 мВ
Чтобы иметь возможность промоделировать каждую ионную
компоненту, необходимо разделить натриевый и калиевый токи. Это
осуществляют при помощи следующей процедуры: приготавливают
к ι орую внеклеточную среду, в которой 90% обычного внеклеточного
шприя заменено холином - веществом, не обладающим
электрическим зарядом (он вводится просто для сохранения изотоничности).
Ι'ϋΚΗΜ образом, внеклеточная концентрация натрия снижается
к 10 раз. Исходное значение V"a -51 мВ. Уменьшение внеклеточного
ширия должно снизить потенциал Нернста на 58lg 10 = 58 мВ, так что
новое значение V"3 --1 мВ. Соответственно, если повторить
эксперимент с фиксацией потенциала (при том же значении vm = 56 мВ)
к морской воде, содержащей 10% от обычного количества натрия, то
практически натрий будет находиться в равновесии, и трансмембран-
322
Биофиита
ный ток будет создаваться только калием. Эта ситуация показана ни
рис. 4.18 (кривая В).
Ходжкин и Хаксли сделали ключевое предположение о том, ч ι и
потоки ионов натрия и калия независимы друг от друга (принцип иг
зависимости). В соответствии с этим принципом калиевая компонсн
та для кривой А должна быть в точности такой же, как и для кривой II
так что вычитание кривой В из кривой А должно дать плотность и к»
лированного натриевого тока. Эта разностная кривая также показами
на рис. 4.18 - кривая С, и ее поведение очень хорошо согласует·»
с ожидаемым влиянием натрия на исследуемые характеристики.
Ходжкин и Хаксли провели серию экспериментов с фиксацисИ
потенциала при увеличивающихся уровнях деполяризации. Для каж
дого значения фиксированного потенциала проводились два эксперн
мента: первый - в морской воде нормального состава, а второй - в мор
ской воде с уменьшением содержания натрия (90% натрия было
заменено холином). Во втором эксперименте, показанном на кривой И
(рис. 4.18), возникает только калиевый ток, так что с учетом принцип»
независимости разбить ток на /к и /№ относительно просто. Однако
в общем случае зафиксированное напряжение во втором эксперимен ι г
не совпадает с потенциалом Нернста для натрия, и наряду с калиевым
существует и натриевый ток. Ниже штрихами будут отмечены токи,
которые возникают во втором варианте эксперимента с фиксацией по
тенциала - при низком содержании натрия. Ходжкнн и Хаксли пред
ложили метод, базирующийся на следующих трех предположениях.
1. /к = 0 при t = 0 и для малых величин t (примерно в течение
1/3 времени до пика тока, направленного внутрь клетки). Иначе гово
ря, предполагается, что при подаче сигнала благодаря более быстро
му ответу натриевой системы по сравнению с калиевой начальный
ток, если он существует, обусловлен натрием.
2. /'Na(0/ /Na(0 = К (константа). Это означает, что для двух
экспериментов при одном и том же зафиксированном потенциале
движущая сила изменяется от (Vm-V^) до (Vm-V^). В каждом
случае движущая сила постоянна, хотя и различна в разных
опытах. Было сделано предположение, что временной ход натриевой
проводимости gNll(t) одинаков в обоих случаях, поскольку в каждом
I nuea 4. Электробиология
323
случае производится фиксация при одном и том же уровне потен-
»"ала: /Na(i) =gNa(0(^m - <pNa) и /'Na(0 = &*,(')( ^m - V™), поэтому
/Νη(')//'Ν.(0 = (Ул- VT)l(Vm - О = К (константа)
3. rK(t)/IK(f). Здесь Ходжкин и Хаксли предположили, что кали-
гиый ток (при одинаковых уровнях зафиксированного потенциала) в
нормальной морской воде тот же, что и в морской воде с 10% натрия;
иначе говоря, они использовали принцип независимости.
Эти предположения используются следующим образом.
Сначала исследуют раннюю часть кривой плотности трансмембранного
нжа при обычной фиксации потенциала Im(t) и при фиксации
потенциала в среде с пониженным содержанием натрия I'm(t). Если
предположить, что калий отсутствует, то отношение Im(t)U'JJ) дает то же
шачение постоянной К, что и в приведенном выше
предположении 2. (Можно построить график этого отношения для малых t и
убедиться в его постоянстве.) Для последовательных моментов времени,
скажем для любого t = tx имеем:
U',)=/k('.)+'n.('.). (4·83)
ΓΜ=ΐ'Μ+ΐ'Μ)· (4·84)
Тогда использование предположений 2 и 3 вместе с
уравнением (4.84) дает
7'm(il)=K(/^(i|) + /^(il)). (4.85)
Из уравнений (4.83) и (4.85) можно исключить либо /к, либо
/Na, чтобы получить желаемые величины. Они таковы:
^,(0-/m(V"^(0. (4-86)
I — К.
IAtl) = KIm(ti;~IKm(t,)> (4-87)
Селективное (избирательное) и неодновременное изменение
ионной проницаемости возбужденной мембраны - сначала для Na+,
it потом для К+ - объясняется тем, что в мембране имеются специаль-
.'!·
324
Биофизик»
ные ионные каналы. Существуют отдельно натриевые и калиевые
потенциалзависимые каналы, которые открываются и закрываются
во время прохождения через данный участок мембраны нервного им
пульса. В первой фазе открываются натриевые каналы, во второй φίΐ
зе - калиевые. Соответственно и закрываются сначала натриевые к;\
налы, а затем калиевые. Открывание и закрывание ионных каналом
вызывается изменением мембранного потенциала.
4.2.3. Уравнение Ходжкина - Хаксли
Факты, установленные Ходжкином и Хаксли в их эксперимеп
тах с фиксацией потенциала на аксоне кальмара, легли в основу ко
личественной модели. Модель не только воспроизводит сами дан
ные, полученные в экспериментах с фиксацией потенциала, но с сг
помощью оказалось возможным моделировать распространяющийся
потенциал действия. Структура модели связывает ионные токи
с соответствующими движуи(ими силами. Последние описываются
как разности между трансмембранным потенциалом и потенциалами
Нернста для ионов соответствующих типов. Эта формулировка том
но соответствует математическим выражениям (4.74) и (4.76) для κίΐ
лиевого и натриевого ионных токов (хлором пренебрегают по причи
нам, указанным ранее).
Главным достижением Ходжкина и Хаксли была их схема для
оценки удельных проводимостей gK(t) и gNa(0- Такая оценка очень
проста при использовании данных по фиксации потенциала, так как
преобразование уравнений (4.74) и (4.76) дает
gK(0 = , /k(°kV (4-88)
«*«)=, /Na(0NV (4·89>
Поскольку при фиксации потенциала знаменатели в выражени
ях (4.88) и (4.89) постоянны, gK (t) ~ /к(0 и gNa(t) ~ /Na(f)· Результаты
серии экспериментов с фиксацией потенциала, позволяющие опредс·
/ ипва 4. Электробиология
325
нить IK(t) и /Na(0 методами, охарактеризованными в предыдущем раз-
wjic, представлены на рис. 4.19 в виде семейства кривых для калие-
ιιι,ιχ и натриевых проводимостей.
Из представленных рисунков следует, что, во-первых, чем
ι > ниже смещается фиксированный vm к значению равновесного по-
кчщиала, определяемого по уравнению Нернста (4.37) для ионов
Na+ и К+ тем меньше значение соответствующей проводимости,
и во-вторых, меняется временной ход g. и gNa при изменениях vm.
Таким образом, семейство кривых для проводимостей gK и gNa
при различных значениях фиксированных vm экспериментально
покапывает зависимости проводимостей (и соответственно токов) от vm
и иремени.
Впоследствии по семейству полученных кривых были
построены зависимости изменения параметров натриевых и калиевых токов
и процессе генерации потенциала действия.
дМа,мС/мм2 η
t, мс
8 t, MC
Рис. 4.19. Изменения ионных проводимостей,
вызываемые деполяризацией с фиксацией напряжения
Кружки представляют значения, полученные на основе экспериментальных
измерений ионного тока, а кривые проведены в соответствии с уравнениями
(4.90) и (4.91). Указанные значения трансмембранного потенциала в милливольтах
при фиксации даны относительно уровня покоя, т.е представляют собой ν
326
Биофизик»
Ходжкин и Хаксли построили математическую модель, coai
ветствующую данным рис. 4.19.
Предполагается, что ионы калия могут проходить через канал,
если к его участку под действием электрического поля подойдут од
новременно четыре однозарядные частицы. Обозначим η - верояг
ность прихода одной такой частицы. Калиевая проводимость gK(/,
vm) была положена равной максимальному фиксированному значс
нию gK , умноженному на параметр и (0 < η < 1), возведенный в чс1
вертую степень. Четвертая степень при η определялась эмпирически
Величина и4 объяснялась как вероятность нахождения одновременно
четырех активирующих частиц в некотором определенном участке
мембраны.
Для натриевых ионных токов используется тот же общий под
ход, который был описан выше для калия. Однако изменение прово
димости для ионов Na+ описывалось более сложным выражением
Для'натриевого канала предполагалось, что он открывается, если
одновременно в данный участок попадают три активирующие
частицы и удаляется одна блокирующая. Тогда, обозначив т - вероят
ность прихода активирующей частицы, а А - вероятность удалении
блокирующей, получаем:
£кОт) = £ки"0,Ут), (4.90)
*Ν,('.νη) = gNy(t,vm)h(t,vm), (4.91)
где gK , gNa - максимальные калиевые и натриевые проводимости
соответственно; п,т- параметры активации (0 < т, η < 1), a h -
параметр инактивации (0 < h < 1). Поскольку, как видно из рис. 4.19, для
gK(t) и gNa(i) характерно поведение кривых первого порядка, в
качестве п, т и h было выбрано решение дифференциальных уравнений
1-го-порядка:
άηίί,νΛ , . ,
\;/-*.кх1-я)-р.Ыя» (4·92)
= am(vm)(l-m)-pm(vm)m) (4.93)
dt
dt
/ шва 4. Электробиология
327
-4^Z = ab(vm)0-/l)-Pb(vm)A- (4-94)
Константы скорости α^ βη am pm, a^ ph зависят только от
фапсмембранного потенциала Vm. Соответственно для эксперимента
ι фиксацией потенциала они являются постоянными, что позволяет
решить уравнения (4.92), (4.93), (4.94) аналитически. Данные
дифференциальные уравнения первого порядка с постоянными
коэффициентами имеют решение:
n(t) = n„-(n„-n0)eJ*, (4.95)
-I
Ht) = m„ -(iHe -m0)eJ" , (4.96)
-ι
h(t) = h„-(h„-h0)eJ\ (4.97)
У°=7 Ц-Тия-=> α"~ »' (4·98)
(a. +P„)
У»=7 ЦгТИт°°=- ~\ х, (4.99)
У. = ί и и, = ^ . (4.100)
(ah+ph) (ah+Ph)
Для i-й фиксации потенциала v^ можно подобрать J n,Jm,Jh,
Оптимальным значениям ^„(v^), ^(v^), ./„(v^),
"οο(νπύ )»^οοΓν,,ύ), ^„(v^ ) соответствуют оптимальные константы
скорости. Эти константы скорости находят путем совместного
решения пар уравнений (4.90) и (4.98), (4.91) и (4.99) ,(4.92) и (4.100).
В результате получаются выражения:
(а
(а
η+β„
ш+β,
)'
J
328
Биофизик*
ttn(Vmi) =
α„(0 =
Jn,iVmi)
■MO
P„(0 =
P„(0 =
P„(0 =
Jm(v )
/π ν mi /
л,(о
MO
(4.101)
(4.102)
(4.103)
Для каждого напряжения фиксации vm и соответствующей
экспериментальной кривой gK , gNa можно подобрать такие значении
^n(vmj )^m(vmi ),Jh(vmj ),»„(vmi ),m„(vmi ),A„(vmi), что они
будут наилучшим образом соответствовать экспериментальным
данным. Таким образом, для множества значений напряжения фиксации
vm получается множество значений параметров ^„(vmi), ^m(vmj \
^h(Vmi)»"»(Vmi).W»(Vmi)';i»(Vn.i)·
Из них путем преобразования (4.101) - (4.103) вычисляется
набор констант скорости:
а„ =
0,01(Ю -ν„
ехр
"Ю-v "
)
-1
β„ = 0Д25ехр|-^
Ня ^80
а.
_ 0,01(25 -vm)
ехр
25-v.
аА =0,07 ехр
10
-v.
20
-1
,"Pm=4exp|^
-v.
иРА=Ьхр
зо-у„
10
+1.
(4.104)
(4.105)
(4.106)
(4.107)
где vm выражено в мВ.
ι пава 4. Электробиология
329
Рис. 4.20. Кривая инактивации натрия
По оси абсцисс отложено отклонение от потенциала покоя \т.
Точки - экспериментальные данные; кривая удовлетворяет
уравнению (4.108) при vm* = +2,5 мВ
Для получения этих результатов необходимо было найти
значения для всех (v m) (даже для vm < 30 мВ), и это было сделано в
отдельной серии экспериментов, график результата которого
представлен на рис. 4.20. Для обычных условий покоя h = 0,6, в то время как
для гиперполяризации до 30 мВ или больше h = 1,0, т. е. своему
максимальному значению. Это означает, что самые большие потенциалы
действия вызываются после такой гиперполяризации. От уровня
покоя, существовавшего непосредственно перед фиксацией
потенциала, величина h(t =0" \ которую можно найти из графика рис. 4.20,
переходит на уровень hAt =0+ \ отсюда ясно, как найти h0 в (4.101).
Ходжкин и Хаксли предложили аналитическое выражение,
которое аппроксимирует данные рис. 4.20:
А„Нехр
ν„ -ν
mh
+ 1
(4.108)
где ν„,, - значение vm при А„ =0,5, v,^ = 2,5 мВ.
Таким образом, Ходжкин и Хаксли обосновали ионную
теорию возбудимых мембран и смогли удовлетворительно описать
330
Биофизик»
а; б) в)
Рис. 4.21. Зависимости констант скоростей α„, β„, ат, β„, α*, β*
от мембранного потенциала в гигантском аксоне кальмара
V- смещение разностей потенциалов на мембране
относительно уровня потенциала покоя (мВ)
в рамках этой теории изменение ионной проводимости и процесс
генерации потенциала действия нервной клетки.
Изменение проницаемости мембраны при первоначальной
деполяризации приводит к изменению потенциала (4.65), что
сопровождается изменением параметров αη, βη, am, pm, ah, βΗ. График
изменения констант скоростей представлен на рис. 4.21.
Зная величины gNa gK и gL (gL - удельная проводимость «утечки»,
т. е. всех остальных ионов), а также емкость мембраны Ст(Ф ■ м~2),
можно теперь найти общий ток через мембрану в каждый момент времени:
r, dx2 dt *№ V m m ) (4.109)
■^K»4(ve-^)+gL(v.-^),
где V* , V^, V™*, - равновесные потенциалы для К\ Na+ и всех
остальных ионов. Как показали вычисления, полученные кривые
изменения тока во времени при правильно подобранных параметрах αη,
βη, am, Pm, ah, βΗ практически совпадают с экспериментальными при
всех использованных в опытах концентрациях внутри- и
внеклеточного калия и натрия.
Вся совокупность уравнений, описывающих ионные токи через
возбудимые мембраны при изменении потенциала на величину V,
называется уравнениями Ходжкина—Хаксли. Использование этих урав-
/ пива 4. Электробиология
331
^10
-60 Η
Рис. 4.22. Математическое моделирование нервного импульса
Здесь jua Jk jc, Jl - плотности натриевого, калиевого, емкостного тока
и тока утечки (А/м ); V - потенциал действия (мВ)
мсний позволяет математически описать не только ионные токи при
фиксированном потенциале, но и изменения потенциала в
функционирующем нервном волокне. Изменения проницаемости мембраны при
первоначальной деполяризации мембраны приводят к изменению
потенциала, что сопровождается изменением параметров α и β,
следовательно, изменением проводимости и проницаемости, новым
изменением потенциала и т. д. В результате получается та сложная по форме
кривая изменения во времени потенциала на мембране, которая и
представляет собой потенциал действия. Расчет этой кривой (и кривых
одновременного изменения ионных токов) хотя и очень трудоемок, но может
быть осуществлен с использованием уравнений Ходжкина-Хаксли.
В настоящее время такие расчеты для разных возбудимых структур
проводятся с использованием ПЭВМ. Один из примеров
рассчитанных кривых приведен на рис. 4.22. Хорошее совпадение рассчитанных
332
Биофизшш
и измеренных в опыте потенциалов действия (здесь они не приводя ι
ся) еще раз подтверждает правильность математической модели Ход»
кина-Хаксли. Она нашла весомое подтверждение в работах по исследо
ванию молекулярных основ биоэлектрогенеза, в результате κοτοροι о
была сформулирована концепция потенциалзависимых ионных канн
лов в плазмолемме нервных и мышечных клеток.
4.2.4. Роль ионных каналов в биоэлектрогенезе
Объяснение процессов перехода от покоя к возбуждению и об
ратно простой констатацией фактов об изменении мембранной про
ницаемости для ионов является феноменологическим и не проливаем
свет на молекулярную природу биоэлектрогенеза. Более глубокое
проникновение в нее связано с изучением биофизических механю
мов транспорта ионов сквозь биомембраны.
Ионы гидрофильны. Поэтому они могут преодолевать
клеточную мембрану либо по каналам в ней, либо при помощи
переносчиков. Изучение кинетики трансмембранного перемещения ионов при
биоэлектрогенезе привело к выводу, что они движутся по каналам.
Так, скорость проникновения Na+ в аксоплазму при деполяризации
достигает 107-108 ионов в 1 с, а температурный коэффициент Ql0
этого процесса невелик (1,2-1,3). Именно такие скорость и QiQ присущи
канальному механизму, тогда как транспорт посредством
переносчика происходит гораздо медленнее (скорость порядка 10" ионов в 1 с)
и его Qi0 достигает 2,4. Низкое значение Qi0, свойственное
трансмембранному переносу ионов при биоэлектрогенезе, свидетельствует,
что они преодолевают сравнительно невысокий потенциальный
барьер (ниже 13 кДж ■ моль-1). При транспорте ионов с участием
переносчика он составлял бы не менее 67 кДж · моль-1.
4.2.4.1. Потенциалзависимые натриевые каналы
Потенциалзависимые натриевые каналы в плазматических
мембранах различных клеток представлены тремя типами. В 1984 г. Нода
с сотрудниками установили первичную структуру такого канала,
находящегося в электрической пластине угря. Сложный белковый
комплекс с молекулярной массой около 230 кДа имеет 4 гомологичных до-
ι пива 4. Электробиология
333
мена и 1 характерный сегмент с сильным положительным зарядом.
Ионная пара в таком комплексе образуется при свертывании гомоло-
I кчных доменов в β-складчатость цилиндрической формы (т. е. при
формировании вторичной структуры типа β-спирали). Внутрь ионной
поры, заполненной водой, обращены гидрофильные группы белково-
I о комплекса, а гидрофобные группы взаимодействуют с
окружающими липидами, причем с протеиновыми компонентами одного
канала образуют связи от 6 · 104доЗ · 105 липидных молекул.
При возбуждении ионы Na+ движутся из интерстиция в
цитоплазму, растворяясь в воде, заполняющей ионную пору. Этим
обусловлена более высокая скорость ионного транспорта по каналу
и сравнении с диффузией комплекса «переносчик-ион» сквозь ли-
иидный бислой, обладающий в 30-100 раз большей вязкостью, чем
иода. Вместе с тем транспорт ионов по каналу происходит
медленнее, чем их свободная диффузия в воде, занимающей
неограниченный объем. Диаметр ионной поры обеспечивает только однорядное
движение Na+, поскольку два иона не помещаются в просвете канала.
На схеме ионного канала, участвующего в биоэлектрогенезе
(рис. 4.23), выделены два основных функциональных элемента -
селективный фильтр и воротный механизм (ворота). Селективный
фильтр («горловина») канала осуществляет отбор тех ионов, для
чранспорта которых предназначен данный канал. Избирательность
фильтра основана как на его геометрических особенностях, так и на
электрических свойствах. Прежде всего ионы не должны быть
крупнее размеров селективного фильтра. Вместе с тем он должен быть
достаточно узким не только для различения ионов, но и для
обеспечения тесного контакта гидратной оболочки иона со стенками поры,
чтобы они взаимодействовали непосредственно с нею и частично
дегидратировали каждый проходящий ион благодаря образованию
водородных связей. По-видимому, это обеспечивают карбоксильные
группы белковых молекул, выстилающих узкую пору.
Следовательно, селективный фильтр по отношению к крупным ионам действует
как сито, не пропуская их, тогда как отбор среди мелких ионов
происходит за счет их неодинакового взаимодействия с выстилкой поры.
Чем выше сродство иона к карбоксильной группе, тем больше его
334
Биофизик»
Рис 4.23. Схема ионного потенциалзависимого канала
Обозначения: 1 - белковый комплекс, образующий канал; 2 - селективный
фильтр; 3 - ворота; 4 - сенсор напряжения; 5 - мембранные липиды
поток через канал. Миновав фильтр, частично дегидратированный
ион восполняет потерянные молекулы Н20 за счет той воды, которой
заполнен канал в более широкой части.
Избирательность канала каждого типа не абсолютна. Так,
через потенциалзависимый натриевый канал проходят в той или иной
степени 11 различных катионов, причем литий даже лучше, чем
натрий. Легко проникаетСа2+, аК+-примерно в 12 раз хуже натрия. Для
рубидия и цезия натриевый канал - непреодолимая преграда. То же
можно сказать в отношении анионов, даже очень мелких, так как
отрицательный заряд селективного фильтра отталкивает их. Например,
в натриевом канале Рш*'-Ра- =100:1.Б. Хилле установил, что
поперечное сечение селективного фильтра натриевого канала напоминает
эллипс (0,3x0,5 нм). Эта узкая пора находится на дне камеры
(своеобразного преддверия) размерами 0,9x1,0 нм, расположенной на
внешней стороне биомембраны (см. рис. 4.23).
Изменения мембранной проницаемости для ионов связаны
с функционированием ионных каналов. Так как движение ионов по
каналу однорядное, то невозможно регулировать ионный поток в
отдельном канале за счет градуального увеличения или уменьшения
размеров его поры. Отдельный канал может находиться только в од-
Глава 4. Электробиология
335
пом из двух состояний: закрытом или открытом. В первом случае он
вообще не пропускает ионы, и его электропроводность (G) равна
нулю, во втором - обеспечивает максимально возможный поток,
предопределенный сопряженным действием концентрационного и
электрического градиентов. Во втором случае электропроводность канала
достигает 40 пСм. Поскольку G может иметь только одно из двух
шачений (0 или 40 пСм), тот или иной уровень ионной
проницаемости мембраны и, следовательно, трансмембранный натриевый ток
определяются числом открытых каналов.
Выяснилось, что селективный фильтр обладает «жесткой»
структурой, т. е. не изменяет свой просвет в разных условиях. Переходы
капала из открытого состояния в закрытое и обратно связаны с работой не
селективного фильтра, а воротного механизма. Под воротными
процессами, происходящими в той части ионного канала, которая
называется «воротами», понимают всякие изменения конформации белковых
молекул, образующих канал, в результате которых его пора может
сжиматься или разжиматься. В первом случае «ворота» закрыты, а во
втором - открыты. Следовательно, «воротами» принято называть те
функциональные группы белковых молекул, которые обеспечивают
поротные процессы. Важно, что «ворота» приводятся в движение
физиологическими стимулами, т. е. такими, которые присутствуют в
естественных условиях. Среди физиологических стимулов особую роль
играют сдвиги мембранного потенциала.
Существуют каналы, которые управляются разностью потенци-
iuioB на мембране, будучи открытыми при одних значениях
мембранного потенциала и закрытыми - при других. Такие каналы
называются потенциалзависимыми. Ввиду их особой роли в биоэлектрогенезе
нее ионные каналы биомембран подразделяют на 2 типа: потенциалза-
нисимые и потенциалнезависимые. Естественными стимулами,
управляющими движением ворот, в каналах второго типа служат не
сдвиги мембранного потенциала, а другие факторы. Например, в хи-
миочувствительных каналах роль управляющего стимула
принадлежит химическим веществам. Генерация потенциала действия (ПД)
обеспечивается только потенциалзависимыми ионными каналами.
Существенным компонентом потенциалзависимого ионного
канала является сенсор напряжения. Так называют группы белковых
336
Биофизика
молекул, способные реагировать на изменения электрического mum
Пока нет конкретных сведений о том, что они собою представляин
и как расположены, но понятно, что электрическое поле может вши
модействовать в физической среде только с зарядами (либо свобод
ными, либо связанными). Поначалу предполагали, что сенсором ни
пряжения служит Са2+ (свободные заряды), так как изменения 11 я
содержания в межклеточной жидкости приводят к таким же послед
ствиям, как и сдвиги мембранного потенциала. Например, десяти
кратное снижение концентрации ионов кальция в интерстиции экий
валентно деполяризации плазматической мембраны приблизительно
на 15 мВ. Однако в дальнейшем оказалось, что Са2+ необходим дли
работы сенсора напряжения, но сам не является им. ПД генерируется
даже тогда, когда концентрация свободного кальция в межклеточной
среде падает ниже 10~8 моль.
Очевидно, сенсором напряжения служат связанные заряды
группы белковых молекул, обладающие большим дипольным момсн
том. Они погружены в липидный бислой, которому свойственны до
вольно высокая вязкость (30-100 мПа ■ с) и низкая диэлектрический
проницаемость. К такому заключению привело изучение кинетичс
ских характеристик движения сенсора напряжения при сдвигах
мембранного потенциала. Это движение представляет собой ток смещения
Его измерили в 1973 г. в гигантском аксоне кальмара (К. Армстрош
и Ф. Безанилла, а также Р. Кейнес и Э. Рохас) и в поперечно-полосн
том мышечном волокне лягушки (М. Шнейдер и В. Чэндлер). С тех
пор исследование воротных токов, под которыми понимают
движения диполей, с которыми связаны открывание и закрывание ворог,
служит одним из наиболее эффективных методов изучения ионных
каналов в плазмолемме многих клеток и волокон.
Сенсор напряжения натриевого канала реагирует на сдвиг
мембранного потенциала от уровня ПП (примерно - 90 мВ) до - 55 мВ,
т. е. порог активации (перевод канала из закрытого в открытое
состояние) составляет около 35 мВ.
Рис. 4.24 дает некоторые представления о свойствах воротного
тока натриевого потенциалзависимого канала в аксоне кальмара (а),
Во-первых, он предшествует ионному (натриевому) току через канал
(б), во-вторых, направлен противоположно натриевому току, в-тре-
/ пива 4. Электробиология
337
а)
10 мкАхм-2
^(MaWh&^ti...-
500 мкАсм-2
Рис. ¥.24. Мембранные токи при деполяризации
а - воротный ток; б - натриевый трансмембранный ток (В. Алмерс, 1981 г.)
ι i.hx, гораздо слабее его. Заметим, что на α и б разная калибровка оси
ординат (на а - мкВ, на б- мВ) и, кроме того, график тока на α
является результатом суммирования воротных токов, возникающих в
отпет не на один, а на сто стимулов; следовательно, истинные значения
поротного тока примерно на 2 порядка меньше того, что изображено
на рис. 4.24, а. В расчете на 1 см2 биомембраны воротный ток
переносит заряд от 14,5 до 32 нКл. Между воротными токами в аксолем-
ме и сарколемме имеется качественное сходство, но в аксоне
воротный ток спадает в 20-100 раз быстрее, чем в мышце.
Современная функциональная модель натриевого потенциал-
швисимого канала предусматривает существование в нем двух типов
порот, работающих в противофазе. Они отличаются инерционными
свойствами. Более подвижные (легкие) названы m-воротами, более
инерционные (тяжелые) - А-воротами.
В покое (рис. 4.25, а) А-ворота открыты, m-ворота закрыты,
и движение Na+ по каналу невозможно. При деполяризации плазмо-
леммы ворота обоих типов приходят в движение, но в силу
неодинаковой инерции m-ворота успевают открыться раньше, чем закроются
Λ-ворота (рис. 4.25, б). В этот миг натриевый канал открыт и Na+
устремляется по нему в клетку. Запаздывание движения А-ворот
относительно m-ворот соответствует длительности деполяризационной
фазы ПД. Когда же Α-ворота закроются (рис. 4.25, в), поток Na+
сквозь мембрану прекратится и начнется реполяризация. Затем про-
338
Биофизшш
U, мВ η
t, мс
^л
Рис. 4.25. Функциональная модель потенциалзависимого
натриевого канала (его работа показана в динамике
относительно развития ПД, изображенного на верхней кривой)
Обозначения: т — т-ворота; h — h-eopoma
исходит возврат т- и А-ворот в исходное состояние (рис. 4.25, г), но
это не сопровождается изменениями мембранного потенциала.
Для приведения в движение ворот, принадлежащих одному
натриевому каналу, необходим заряд порядка 10~18 Кл, причем он должен
быть приложен столь быстро, чтобы проявилась разница в инерции т-
и А-ворот. При медленном воздействии на мембрану даже очень
большого заряда ворота обоих типов приходят в движение одновременно
(синфазно) и не возникает состояние, изображенное на рис. 4.25, б.
В этом случае ПД не образуется. Следовательно, потенциалзависи-
мые натриевые каналы активируются (включаются) при быстрой
(скачкообразной) деполяризации плазматической мембраны.
Число потенциалзависимых натриевых каналов, приходящихся
на 1 мкм2 поверхности мембраны, неодинаково в разных волокнах
(табл. 4.3). Следует отметить вариабельность этого показателя, так
как изменения функционального состояния сопровождаются перс-
стройками структуры биомембраны, включая и компоненты каналов.
Так, при денервации скелетной мышцы число потенциалзависимых
ионных каналов в плазмолемме ее волокон уменьшается в полтора
раза. Этот процесс сопровождается увеличением количества
мембранных каналов, чувствительных к ацетилхолину. Происходит
замена потенциалзависимых каналов на химиочувствительные.
Изучение натриевых каналов оказалось очень полезным для
медицины, особенно токсикологии и фармакологии. Выяснилось,
что тетродотоксин и сакситоксин, которые считаются самыми
I пава 4. Электробиология
339
ι ильными из известных ядов небелковой природы, приводят к гибе-
ΙΜΙ человека и животных, блокируя потенциалзависимые натриевые
наиалы плазматических мембран нервных волокон. Тетродотоксин
годержится в коже, яичниках, печени и кишечнике морской рыбы -
нпонского иглобрюха (фугу), а также в тканях калифорнийского
тритона, австралийского осьминога, одного из видов африканских
лягушек, головоногих и брюхоногих моллюсков. Сакситоксин
продуцируется некоторыми жгутиковыми водорослями и концентрируется
II тканях моллюсков, питающихся ими.
Таблица 4.3
Распределение потенциалзавнеимых натриевых каналов
в мембранах нервных и мышечных волокон разных животных
Волокна
. Нервные (аксоны)
1) безмякотные
а) у кальмара (гигантский аксон)
б) у омара
в) у панцирной рыбы
г) у кролика
2) мякотные
а) у кролика (блуждающий нерв)
б) у крысы
в) у лягушки
. Мышечные
а) у лягушки (портняжная мышца)
б) у крысы (диафрагма)
Плотность распределения (на 1 мкм2)
в плазмолемме
175-550
13-90
35
110
Не более 75
380
210
в перехаатах
Ранвье
104-1,2·104
До 1,2 · 104
2 - 103-5- 103
Оба яда - водорастворимые гетероциклические соединения,
содержащие гуанидиновые группировки (рис. 4.26). По-видимому, гуа-
иидиновая группировка, несущая положительный заряд и имеющая
поперечное сечение около 0,3 нм, может входить в селективный
фильтр натриевого канала, притягиваясь к его карбоксильным
группам электростатическими силами. Остальная часть молекулы яда
фиксируется в преддверии фильтра за счет образования водородных
340
Биофизит
h£n=>
СН2ОН
r10-10"2HM
8
•6
4
2
0
HjN
ΗΝ
HjN
a;
κι Ν
Ν Η
НО
НО
СТ
η£ν
β;
Рис. 4.26. Структурные формулы (а) тетродотоксина (ТТ) и сакситоксина (СТ)
и схема механизма их действия на ионный канал (б)
атомы С - черные, Н— белые, О - отмечены точками по краю,
Ν- отмечены штрихом по краю. Заштрихована часть белкового комплекса,
образующая селективный фильтр натриевого канала
связей с компонентами канала (см. рис. 4.26). Закупоривая горловину
канала, яд полностью блокирует транспорт Na+ сквозь плазмолеммы
нервных волокон, лишая их способности генерировать ПД и,
следовательно, проводить нервные импульсы. В концентрации 10~9 моль · л '
сакситоксин выключает половину всех натриевых каналов, причем I
молекула яда блокирует 1 канал. Тетродотоксин и сакситоксин,
предотвращая натриевый трансмембранный ток, совершенно не влияют ни
воротные процессы. В отравленном волокне регистрируются
воротные токи, когда на него действуют естественные стимулы. Подобный
эффект блокады натриевого тока присущ и Н+-ионам, действие
которых на ионный канал обусловлено блокированием кислотной
группировки селективного фильтра. Если рН межклеточной среды
понижается до 5,0, то натриевый ток падает в два раза, а при рН 4,0 - не
определяется вовсе, хотя воротный ток не изменяется.
I пава 4. Электробиология
341
Напротив, местные анестетики угнетают трансмембранный
натриевый ток, нарушая воротные процессы. Обладая свойствами
органических катионов, они вытесняют Са2+ из участков его
связывания на сенсоре напряжения натриевого канала, но сами оказываются
неспособными выполнить его миссию в механизме «отпирания»
т-ворот.
Широко известный инсектицид ДЦТ замедляет процесс
закрытия натриевых каналов в нервных волокнах. Открывшись под дейст-
иием первого стимула и обеспечив тем самым генерацию ПД, каналы
остаются открытыми и не могут отвечать на новые раздражители.
I) результате нарушается проведение нервных импульсов, что может
привести к гибели животных.
4.2.4.2. Калиевые каналы
Калиевые каналы более многообразны, чем натриевые.
Изучены пять типов потенциалзависимых калиевых каналов, причем они
расположены не только в плазмолемме, но и в некоторых
внутриклеточных мембранах. Активируются при деполяризации мембраны
и обеспечивают ее реполяризацию.
Кроме потенциалзависимых, существуют калиевые каналы,
активируемые ионами Са2+ при повышении их концентрации от 10~7 до
I О-5 Μ (кальций-чувствительные калиевые каналы). В кардиомиоци-
iax есть калиевые каналы, одни из которых открываются при
повышении содержания натрия в миоплазме до 20 мМ
(натрий-чувствительные калиевые каналы), а другие - при снижении там отношения
АТФ к АДФ (АТФ-чувствительные калиевые каналы). Они очень
чувствительны к гипоксии.
Потенциалзависимые калиевые каналы аксолеммы обладают
более высокой селективностью по сравнению с натриевыми. Кроме
К+, они пропускают всего 4 катиона, причем Na+ практически не
диффундирует по ним. Сечение селективного фильтра калиевого канала
имеет форму круга диаметром около 0,3 нм, что и предопределяет его
большую избирательность по сравнению с натриевым каналом.
Воротные процессы в калиевом канале весьма инертны. Он открывается
примерно в 10 раз медленнее, чем закрываются А-ворота натриевого
канала, которые сами гораздо инертнее m-ворот. На 1 мкм2 плазмолем-
342
Биофизии»
мы гигантского аксона кальмара приходится около 50 калиевых капп
лов. В поперечно-полосатом мышечном волокне лягушки этотпокази-
тель еще ниже (10-20). Калиевые каналы блокируются почти всеми
катионами (за исключением Rb+, NH4+> Т1+), действующими изнутри
волокна. Самым сильным блокатором служат производные тетраэти-
ламмония (ТЭА), действующие со стороны интерстиция. При полной
блокаде потенциалзависимых калиевых каналов почти не изменяется
уровень потенциала покоя (он образуется за счет трансмембранного
переноса ионов калия либо по потенциалнезависимым калиевым каналам,
либо при помощи мембранных переносчиков), а потенциалы действия
генерируются, но их длительность увеличивается (импульсы
удлиняются). При образовании ПД под действием естественных стимулон
натриевые и калиевые потенциалзависимые каналы аксолеммы
взаимодействуют следующим образом: сначала открываются ти-вороти
натриевых каналов, затем закрываются их А-ворота и, наконец, откры
ваются ворота калиевых каналов. Последний процесс вносит свою
лепту в восстановление исходного ПП, т. е. в реполяризацию.
4.2.4.3. Кальциевые каналы
Еще большее разнообразие по сравнению с натриевыми и ка
лиевыми присуще кальциевым каналам. Среди них есть много потеп-
циалнезависимых (рецептор-управляемых) и, по крайней мере,
четыре типа (только у млекопитающих) потенциалзависимых кальциевых
каналов: L, Τ, Ν, Р. Рассмотрим только один из них, весьма
распространенный в тканях млекопитающих. Это канал L-типа (от
английского long-lasting - долгоживущий). Название обусловлено тем, что
в открытом (активированном) состоянии кальциевый канал L-типи
пребывает около 500 мс1.
Кальциевый канал L-типа образован 5 белковыми
субъединицами (а,, с^, β, γ, δ). Из них субъединица а, гомологична натриевому
каналу. Следовательно, кальциевый канал L-типа представляет
собой гораздо более крупную (громоздкую) молекулярную структуру
по сравнению с натриевым.
1 Вспомним, что время открытого состояния потенциалзависимого
натриевого канала имеет порядок 1 мс.
ι ппва 4. Электробиология
343
Как и в натриевом, в кальциевом потенциалзависимом канале 2
шпа ворот: легкие (d) и тяжелые (/), работающие в противофазе -
когда одни из них открыты, другие закрыты. В покое с/-ворота закры-
ii.i, а/-ворота - открыты. При возбуждении, приводящем ворота в
диижение, возникает ситуация, когда с/-ворота уже открылись, а/-во-
рога еще не успели закрыться, вследствие их большей инерционно-
ггк. Интервал между открытием с/-ворот и закрытием/-ворот состав-
пиет в кальциевом канале L-типа примерно 500 мс. Такое состояние
канала называется активированным (табл. 4.4).
Кроме сходной схемы функционирования потенциалзависи-
Μΐ.ιχ натриевых и кальциевых каналов, они имеют и другие одинако-
и ме свойства. Ионы Са2+ также идут по каналу в один ряд, поскольку
диаметр ионной поры соизмерим с размером гидратированного иона.
11оэтому трансмембранный кальциевый ток зависит только от числа
открытых (активированных) кальциевых каналов, а не от
электропроводности каждого из них (она равна либо нулю, либо
максимальной величине - около 40 пСм). У кальциевых потенциалзависимых
каналов также есть сенсор напряжения.
Таблица 4.4
Ворота кальциевого канала в его разных состояниях
Ворота
d
f
Состояние кальциевого канала
Покой
3
О
Активация
О
О
Инактивация
О
3
О - ворота открыты, 3 - ворота закрыты
Вместе с тем между натриевым и кальциевым каналами есть
существенные различия.
Во-первых, селективный фильтр кальциевого канала
отличается очень высокой избирательностью: ρ *.:р :р ,= 100 : 1 : 1.
Во-вторых, воротные процессы, как уже говорилось, более
инерционны, и ток через кальциевый канал (кальциевый ток) течет
дольше (около 500 мс). Он называется медленным входящим током и
обозначается символом /si. Следует заметить, что этот термин не
344
Биофизик»
очень точен. Ионы Са2+ движутся по своему каналу, как и ионы NU
по своему, со скоростью ЮМ О8 ионов в 1 секунду. По этому
критерию кальциевый ток не медленнее, чем натриевый. В термин
«медленный» здесь вкладывается другой смысл - кальциевый ток болм
продолжителен (течет дольше), чем натриевый.
В-третьих, для приведения в движение ворот кальциевых канн·
лов L-типа требуется больший сдвиг мембранного потенциала. Так,
в кардиомиоците, имеющем потенциал покоя около -90 мВ, для от
крытия натриевого канала требуется сдвиг мембранного потенциал»
до -55 мВ, а для активации кальциевого канала - до -35 мВ.
В-четвертых, передний фронт потенциала действия, обуслон
ленного кальциевым током, имеет меньшую крутизну (V max). Так,
Fmax у натриевого ПД достигает 150-600 В · с-1, а у кальциевого
10-15 В с"1. Поскольку скорость распространения возбуждения
пропорциональна квадратному корню из V max, она на порядок меньше
для ПД, генерируемых при активации кальциевых каналов, чем дли
ПД, генерируемых натриевыми каналами. Так, в кардиомиоците они
составляет для первых 0,04 м · с-1, а для вторых - до 1 м · с-1.
В-пятых, потенциалзависимые кальциевые каналы реагирую!
(открываются) на сдвиг мембранного потенциала только в фосфори-
лированном состоянии, т. е. при связывании с белковым комплексом
канала ортофосфата, освободившегося при гидролизе АТФ. Схема
такого фосфорилирования выглядит следующим образом:
Аденилатциклаза фосфодиэстераза
А ТФ - > цАМФ 1- >
I
активация
протеинкиназа
ι
фосфорилирование кальциевого канала
Согласно схеме, количество потенциалзависимых кальциевых
каналов, способных открываться при сдвиге мембранного потенциа-
/ пива 4. Электробиология
345
ни, а также время их открытого (активированного) состояния зависят
οι уровня цАМФ в клетке.
С этим свойством кальциевых каналов связана их
управляемость естественными регуляторными агентами организма, поскольку
нервные влияния, гормоны и другие физиологически активные веще-
u на имеют своей мишенью либо аденилатциклазу, либо фосфоди-
ic геразу, и путем активации или ингибирования этих ферментов
изменяют содержание в клетке цАМФ и тем самым усиливают или
пелабляют трансмембранный кальциевый ток. Так, повышение
активности симпатического отдела вегетативной нервной системы, а также
адреналин, гистамин и многие другие вещества активируют
аденилатциклазу, а парасимпатические влияния и ацетилхолин - ее угнетают.
И первом случае кальциевый ток усиливается, а во втором -
ослабляется (что приводит к определенным физиологическим реакциям:
изменениям двигательной активности, секреции и т. д.). Фосфодиэсте-
раза ингибируется кофеином и другими метилксантинами, что
приводит к усилению трансмембранного кальциевого тока.
Из других факторов, оказывающих влияние на кальциевые
каналы и посредством этого на многие физиологические процессы,
отмстим холерный токсин, ацидоз, метаболические яды (цианиды,
например), Со2+, Cd2+, Ni2+, Mn2+, La3+, а также большую группу
фармакологических препаратов, объединенных общим термином:
кальциевые антагонисты. Они, в отличие от двухвалентных
катионов, блокируют кальциевые каналы временно и потому
используются в лечебной практике.
В различных мембранах выявлена довольно пестрая мозаика
распределения разных потенциалзависимых ионных каналов. Так,
и аксолемме присутствуют главным образом натриевые и калиевые
каналы. В сарколемме поперечно-полосатого мышечного волокна
к ним присоединяется небольшое количество кальциевых каналов.
Их значительно больше в плазмолемме кардиомиоцита, а в мембране
ι ладкомышечного волокна они преобладают. Соотношением каналов
разных типов в плазматической мембране той или иной клетки
определяются параметры генерируемых ими потенциалов действия. Более
подробно это будет рассмотрено при характеристике мембранных
потенциалов кардиомиоцита, миоцитов скелетных и гладких мышц.
346
Биофизин
4.2.5. Реакция невозбудимых и возбудимых мембран
на раздражители, градуальность и закон «всё или ничего»
Исследование сдвигов мембранных потенциалов под действнгм
раздражителей позволяет подразделить все клеточные мембраны ни
возбудимые (электрогенные) и невозбудимые (неэлектрогенныс)
Приведенные в скобках синонимы могут ввести в заблуждение, если
думать, будто неэлектрогенные мембраны вовсе не способны к био ι
лектрогенезу. На самом деле они генерируют потенциал покоя, кот
рый под действием разражителей изменяется градуально (пропорции
нально силе раздражителя). В отличие от них, возбудимые мембраны
способны создавать не только ПП, но и ПД, возникающий при стиму
ляции. Указанное различие обусловлено присутствием в возбудимы»
мембранах потенциалзависимых ионных каналов. В невозбудимм*
мембранах находятся только потенциалнезависимые ионные каналы
, В физиологии свойство возбудимости не ограничивают мемГ>
ранами, а распространяют на ткани, подразделяя их на возбудим мг
и невозбудимые. Можно считать возбудимыми такие ткани, клеточ
ные структуры которых обладают возбудимыми мембранами. К ним
относят нервную и мышечную ткани. Только в них под действием
раздражителей возникают ПД, которые сопровождают целый комм
леке других процессов, также развивающихся в ответ на стимуляцию
Способность возбудимой ткани изменять свои свойства или
состояние под действием раздражителей называют возбудимо
стью (ε). Ее количественной мерой служит интенсивность порогово
го раздражителя (Уп), т. е. самого слабого стимула, в ответ на кото
рый возникает ПД, а вслед за ним и специфическая реакция. Чем
ниже Jn, тем выше возбудимость. Следовательно, между Jn и ε имеа
ся обратно пропорциональная зависимость: ε =—.
Реакция возбудимой ткани на раздражитель называется вол
буждением. У него много разнообразных проявлений (изменении
в возбужденной ткани обмена веществ, температуры, электрического
импеданса, рассеяние света, флуоресценция, двулучепреломленис,
а также развитие специфических реакций - нервной импульсации
и мышечного сокращения), но одним из важнейших является ПД, по·
Itmea 4. Электробиология
347
скольку он служит непременным звеном развития любой из
специфических реакций.
Плазматические мембраны нейрона и мышечного волокна воз-
Лудимы не на всем протяжении. На поверхности этих микроструктур
участки возбудимых и невозбудимых мембран чередуются, так как не
истце в плазмолемму встроены потенциалзависимые ионные каналы.
11апример, мембраны нейрона и мышечного волокна под синаптиче-
скими окончаниями лишены таких каналов. Эти участки плазмолем-
мы являются невозбудимыми, хотя они изменяют свой мембранный
потенциал под действием химических веществ (медиаторов)
благодаря присутствию в них химиочувствительных ионных каналов.
Однако сдвиги мембранного потенциала, происходящие в результате ра-
Гюты химиочувствительных каналов, не обладают свойствами ПД.
Под действием многих раздражителей изменяется уровень
мембранного потенциала. Такая реакция невозбудимых мембран свя-
шна, как правило, с изменением их ионной проницаемости за счет
открывания или закрывания неспецифических потенциалнезависи-
мых каналов. Между сдвигом мембранного потенциала
невозбудимой мембраны и интенсивностью раздражителя, вызвавшего его,
существует линейная зависимость. Это свойство получило название
градуалъности. Оно присуще невозбудимой мембране во всем
диапазоне изменений разности потенциалов на ней.
Градуальность свойственна и возбудимой мембране, но только
в том случае, если трансмембранная разность потенциалов,
изменяясь под действием раздражителя, не достигает КМП. Такие
раздражители, не доводящие деполяризацию до КМП, и, следовательно, не
вызывающие ПД, называются подпороговыми для возбудимой ткани
(рис. 4.27, кривые 1 и 2). Стимул, вызывающий сдвиг мембранного
потенциала до КМП, считается пороговым, поскольку под действием
его возникает ПД (возбуждение; кривая 3 на рис. 4.27).
Раздражитель может иметь разную природу (механическую,
химическую, электрическую и т. д.), но пороговым он будет тогда,
когда сдвинет уровень мембранного потенциала от ПП до КМП:
УП =|ПП|-|КМП|. Надпороговые (более сильные) раздражители
возбудимой мембраны тем более вызывают ПД.
348
Биофизик»
V, мВм
Рис. 4.27. Генерация потенциала действия при сдвиге мембранного потенциала
от ППдо КМП. По оси абсцисс - время (мс), по оси ординат -разность
электрических потенциалов на возбудимой мембране (мВ). Пояснения β тексте
Понятно, что градуальность характерна и для отклонении
трансмембранной разности потенциалов (от уровня ПП) в сторону,
противоположную деполяризации (в аксоне кальмара от -85 до
90 мВ и более). Такой сдвиг мембранного потенциала называют ги
перполяризацией. Следовательно, градуальность присуща возбуди
мой мембране при любой ее гиперполяризации и при подпороговой
(до КМП) деполяризации.
Иллюстрацией сказанному служит реакция возбудимой
мембраны на пропускание через нее слабого постоянного электрического
тока (рис. 4.28). Под катодом развивается деполяризация, а под
анодом - гиперполяризация. Де- и гиперполяризационные сдвиги
мембранного потенциала равны по абсолютной величине. Они тем больше,
чем сильнее пропускаемый ток. Однако градуальность деполяризаци-
онных ответов под катодом свойственна только подпороговым
электрическим стимулам, не приводящим к возбуждению. Не вызывая воч-
буждения, подпороговый электрический ток изменяет возбудимосп·
возбудимой мембраны. Изменения возбудимости под действием под-
/ пава 4. Электробиология
349
Мембрана волокна
V, мВ'
0
-20
-40
-60
-80
-100
,
- кмп
- 1
А а
1^"
X, ММ
Рис. 4.2& Первичные электротонические явления. По оси абсцисс - длина
нервного (мышечного) волокна (мм), к которому приложены электроды,
соединенные с полюсами источника постоянного тока (К - катод, А - анод),
по оси ординат -разность потенциалов на мембране волокна (мВ).
Обозначения: ПП- потенциал покоя, КМП- критический мембранный потенциал,
V„ - пороговый сдвиг мембранного потенциала вне действия постоянного
иодпорогового тока, Va - пороговый сдвиг мембранного потенциала под катодом,
Va - пороговый сдвиг мембранного потенциала
порогового электрического тока называются электротоническими
нвлениями. Их установил в 1859 г. Э. Пфлюгер.
Чтобы понять их смысл, нужно вспомнить о количественной
мере возбудимости, которой служит интенсивность порогового
раздражителя. Ее можно выразить значением напряжения (Vn), равным
разности абсолютных величин ПП и КМП: Vn = |ПП| - КМП
Обозначим возбудимость участков мембраны между электродами символом
г0, а пороговый сдвиг мембранного потенциала - Vn . Тогда ε = .
п0
Под катодом уровень мембранного потенциала приближен
к КМП. На этом фоне переход возбудимой мембраны в
возбужденное состояние происходит под действием более слабого порогового
350
Биофизик»
раздражителя (Vn < Vn ). Следовательно, возбудимость под катодом
повышена (εκ > ε0). Под анодом уровень мембранного потенциала о ι
дален от КМП (Vn > Vn ), вследствие чего εΑ < ε0. Повышение возбу
димости под катодом называют катэлектротоном, а понижение π
под анодом - анэлектротоном. Катэлектротон и анэлектротон в со
вокупности составляют электротонические явления. В них проявля
ется возможность управления возбудимостью тканей организма при
помощи подпорогового электрического тока. Эта физиотерапевтичс
екая процедура называется гальванизацией.
Ее выполнение требует большой осторожности, поскольку ка
тэлектротон и анэлектротон существуют в нервной и мышечной тка
нях только при недолгом воздействии постоянного подпорогово1 о
электрического тока. При продолжительном действии тока живам
ткань реагирует на него извращением возбудимости, катэлектротон
сменяется катодической депрессией (понижением возбудимости под
катодом), а анэлектротон - анодической экзальтацией (повышением
возбудимости под анодом). Эти так называемые вторичные электро
тонические изменения возбудимости обнаружил в 1883 г. Б.Ф. Верп
го, ученик И.М. Сеченова. Их возникновение обусловлено изменени
ем свойств потенциалзависимых ионных каналов под действием
электрического тока. Механизмом катодической депрессии являете н
ослабление проницаемости потенциалзависимых натриевых каналом
и усиление проницаемости калиевых каналов.
При неправильном проведении процедуры гальванизации
можно, к примеру, достичь под анодом не ослабления боли, а усилс
ния ее.
Как уже говорилось, под действием порогового и надпорогово-
го раздражителей возбудимая мембрана генерирует ПД. Для этого
процесса характерен закон «всё или ничего». Он является антитезой
градуальное™. Смысл закона состоит в том, что параметры ПД (амп
литуда, длительность, фронты) не зависят от интенсивности
раздражителя. Как только достигается КМП, изменения разности потенциа
лов на возбудимой мембране определяются только свойствами ее
потенциалзависимых ионных каналов, которые обеспечивают
входящий ток (из межклеточной среды в цитоплазму). Среди них внешний
(iiaea 4. Электробиология
351
сгамул открывает только самые чувствительные. Другие
открываются за счет предыдущих, уже независимо от раздражителя. Говорят
о спонтанном (самопроизвольном) характере процесса вовлечения
м трансмембранный перенос ионов все новых потенциалзависимых
ионных каналов. Поэтому амплитуда, длительность, крутизна
переднего и заднего фронтов ПД зависят только от ионных градиентов на
клеточной мембране и кинетических характеристик ее каналов.
Закон «всё или ничего» - характернейшее свойство одиночных
клеток и волокон, обладающих возбудимой мембраной. Большинст-
иу многоклеточных образований он не свойствен, поскольку разные
клетки даже в одном органе имеют неодинаковый порог
возбуждения. Чем больше клеток вовлекают в возбуждение, тем сильнее ответ
многоклеточной структуры. Исключение составляют структуры,
организованные по типу синцития. Их возбуждение подчиняется
закону «всё или ничего».
В потенциалзависимых натриевых каналах аксолеммы порого-
иый сдвиг мембранного потенциала (VJ составляет 30-35 мВ, тогда
как амплитуда ПД достигает 140-150 мВ. Сопоставление этих чисел
свидетельствует о том, что возбудимая мембрана является
усилителем, если считать сдвиг мембранного потенциала до уровня КМП
нходным сигналом, а ПД - выходным. В возбудимой мембране
слабый входной сигнал управляет значительной энергией на выходе.
Следовательно, энергия, заключенная в раздражителе, гораздо
меньше энергии, которой обладает ПД. Это обстоятельство подчеркнул
лауреат Нобелевской премии Г. Уолд, утверждая, что существо
проблемы возбуждения состоит в способности возбудимой мембраны
генерировать «большой ответ в результате минимального стимула».
По мнению Г. Уолда, «проблема возбуждения является центральной
проблемой современной биологии», а возбудимость -
фундаментальное свойство биологической системы.
4.2.6. Рефрактерность
Процесс возбуждения сопровождается изменением
возбудимости. Таков смысл свойства рефрактерности. Это слово, в переводе
означающее невпечатлительность, ввел в науку Э.Ж. Марей, обнару-
352
Биофизик»
0 12 3 t
Рис. 4.29. Динамика возбудимости при возбуждении (рефрактерные фазы)
Обозначения: 1 — абсолютно рефрактерная фаза; 2 — относительно
рефрактерная фаза; 3 - фаза экзальтации. По оси абсцисс - время (ι); по оси
ординат -уровень возбудимости г; г0- исходный уровень возбудимости
живший в 1876 г. угнетение возбудимости миокарда в момент его
возбуждения. Позднее рефрактерность была выявлена во всех возбу
димых тканях. В 1908 г. Н.Е. Введенский установил, что вслед за уг
нетением наступает некоторое повышение возбудимости возбужден
ной ткани.
Рефрактерность - изменение возбудимости при возбуждении.
Выделяют три основные стадии. Их принято называть фазами
(рис. 4.29).
Развитие возбуждения вначале сопровождается полной утратой
возбудимости (ε = 0). Это состояние называют абсолютно рефрак
терной фазой (АРФ). Она соответствует времени деполяризации воз
будимой мембраны. В течение АРФ возбудимая мембрана не можем
генерировать новый ПД, даже если на нее подействовать сколь угод
но сильным раздражителем (J„ —> °о). Природа АРФ состоит в том,
что во время деполяризации все потенциалзависимые ионные каналы
находятся в открытом состоянии, и дополнительные стимулы не
могут вызвать воротный процесс (им просто не на что действовать).
АРФ сменяется относительно рефрактерной фазой (ОРФ),
в течение которой возбудимость от нуля возвращается к исходному
уровню (ε0). ОРФ совпадает с реполяризацией возбудимой мембра
ны. С течением времени во все большем числе потенциалзависимых
ионных каналов завершаются воротные процессы, с которыми было
связано предшествующее возбуждение, и каналы вновь обретаю!
способность к следующему переходу из закрытого в открытое состо-
I пава 4, Электробиология
353
мпие под действием очередного стимула. Во время ОРФ пороги
возбуждения постепенно снижаются (j <Jn<co\ и, следовательно,
нозбудимость восстанавливается до исходного уровня (0 < ε < ε0).
За ОРФ следует фаза экзальтации (ФЭ), для которой характер-
па повышенная возбудимость (ε > ε0). Она, очевидно, связана с
изменением свойств сенсора напряжения во время возбуждения. За счет
перестройки конформации белковых молекул изменяются их дипо-
ньные моменты, что приводит к повышению чувствительности
сенсора напряжения к сдвигам мембранного потенциала (КМП
приближается к ПП).
Разным возбудимым мембранам присуща неодинаковая
продолжительность каждой фазы рефрактерности. Так, в скелетных
мышцах АРФ длится в среднем 2,5 мс, ОРФ - около 12 мс, ФЭ -
приблизительно 2 мс. Миокард отличается гораздо более продолжительной
ЛРФ: 250-300 мс, что обеспечивает четкую ритмичность сердечных
сокращений и является необходимым условием жизни. В типичных
кардиомиоцитах ОРФ длится около 50 мс, а в сумме
продолжительность АРФ и ОРФ примерно равна длительности потенциала дейст-
иия. Различия в длительности рефракторных фаз обусловлены
неодинаковой инерционностью потеициалзависимых ионных каналов.
№ тех мембранах, где возбуждение обеспечивается натриевыми
каналами, рефрактерные фазы наиболее быстротечны и ПД наименее
продолжителен (порядка единиц миллисекунд). Если же за возбуждение
ответственны кальциевые каналы (например, в гладких мышцах), то
рефрактерные фазы затягиваются до секунд. В сарколемме кардиоми-
оцитов присутствуют и те, и другие каналы, вследствие чего
длительность рефрактерных фаз занимает промежуточное значение (сотни
миллисекунд).
4.2.7. Аккомодация возбудимых тканей
Возбуждение возникает при деполяризации возбудимых
мембран. Следовательно, оно связано с поляризационными процессами
и электролитах. Примером подобных процессов служит электролиз.
Согласно закону Фарадея (1833), масса т вещества, выделившегося
па электроде при электролизе, определяется величиной заряда q, про-
354
Биофизик»
шедшего через электролит: т = q, где А - атомная масса эле
ζ F
мента, ζ - его валентность, F - число Фарадея.
Из этого можно было предположить, что при использовании
электрического стимула в качестве раздражителя возбудимых тканей
его пороговое значение следует измерять величиной заряда qn, кого
рая, как известно, равна произведению амплитуды тока / на времн
его действия L Если применяются прямоугольные электрические им
пульсы, то q соответствует площади, занимаемой импульсом на гра
фике. Очевидно, можно достичь одинакового q за счет большого /
при малом t и малого / при большом t (рис. 4.30, б), если соблюдается
равенство: I, ■ t, - I2-12.
Однако первые попытки применения закона поляризации
к возбудимым тканям оказались безуспешными. Более того, законо
мерности процесса возбуждения вошли в противоречие с ним: bo:i
буждение возникало по достижении током определенной амплитуды
/„ независимо от времени его действия на ткань. Был сделан вывод,
что возникновение возбуждения определяется не количеством элекг
ричества, прошедшего через ткань, а только амплитудой тока
(Э. Дюбуа-Реймон, 1843). Позднее это положение Э. Дюбуа-Реймо
на, получившее название закона раздражения, было опровергнуто.
Оказалось, что возбудимые ткани подчиняются закону Фарадея, но
только при непродолжительном действии на них электрического
тока, тогда как при удлинении этого воздействия они словно бы
приспосабливаются к нему. Данный феномен Крис назвал в 1884 г.
«вкрадыванием тока», но позднее за ним закрепился термин
«аккомодация», предложенный Нернстом.
Э. Дюбуа-Реймон ошибся потому, что не имел
электростимулятора, который мог генерировать короткие импульсы. Их минимальная
длительность у применяемого им стимулятора (катушки Дюбуа-Рей-
мона) составляла 100 мс. Позднее выяснилось, что в
нервно-мышечном препарате лягушки, на котором Э. Дюбуа-Реймон проводил
эксперименты, время наступления аккомодации ограничено 10 мс. Это
означает, что возникновение возбуждения подчиняется закону
Фарадея при использовании в качестве раздражителя электрических
импульсов, длительность которых короче 10 мс. В других тканях времн
I лаве 4 Электробиология
355
'хр чюл *■мс 'хр 'поп t "С
в) б)
Рис 4.30. Кривая «сипа-длительность»
(а) - семейство точек, образованное правыми верхними углами пороговых
прямоугольных электрических импульсов (б). На обоих графиках по оси
абсцисс - длительности импульсов, по оси ординат —электрический ток,
1„ -реобаза, t^», - полезное время, ί^,-хронаксия
развития аккомодации иное. Например, в гладких мышцах оно дости-
I аст нескольких секунд.
В конце XIX и начале XX веков основные недоразумения были
устранены, и исследования возбудимых тканей, основанные на их
аккомодационных свойствах, удалось внедрить в клиническую
практику (Г. Вейс, Л. Гоорвег, Л Лапик, Ю.М. Уфлянд). Всем возбудимым
гканям свойственна так называемая кривая «сила - длительность»
(рис 4.30, а), представляющая собой гиперболу аппроксимируемую
уравнением: / = — + Ъ, где /и t - амплитуда и длительность порогово-
t
ι о импульса электрического тока (их произведение дает qn), а и Ъ -
консганты: —»0 и I = b при длительных стимулах (теоретически
t
t -> оо, а практически — t— время, в течение которого развивается
аккомодация). Следовательно, Ъ - пороговая амплитуда электрическо-
I о тока /п, вызывающего возбуждение независимо от
продолжительности воздействия. Эту величину принято называть реобазой. При
очень коротких стимулирующих импульсах (t -> 0) отношение a/t
много больше Ъ Считая Ъ бесконечно малой величиной, можно
принести уравнение к такому виду: I = а/1,откуда a—1-t. Следователь-
?т
356
Биофизик»
но, а представляет собой пороговый заряд qn при чрезвычайно скоро
течном действии электрического стимула. С учетом сказанною
кривая «сила - длительность» может быть описана выражением
/ = «JL+/n.
Иногда это соотношение называют функциональной зависимо
стью тока от времени, что искажает суть аппроксимируемого
процесса. В уравнении аргументами являются как t, так и /. Функцией
служит пороговое возбуждение: Vnop =f(I, i). Такая форма записи
означает параметрическое задание функции, в которой параметром
служит пороговое возбуждение. Его можно вызвать, изменяя / и /
электрического импульса, несущего пороговый заряд. Вся кривая
«сила - длительность» является семейством точек, образованным
верхними правыми углами пороговых импульсов прямоугольной
формы (с разными / и t). Если при данных / и t правый верхний угол
импульса точно ложится на кривую, то возникает пороговое (едва
заметное) возбуждение многоклеточной (многоволоконной) структуры
(нерва или мышцы). Если этот угол оказывается ниже и слева от
кривой, то ткань таким импульсом не возбуждается, а если выше и
правее ее, то возбуждение будет сильнее, чем под влиянием порогового
стимула.
Заметим, что понятие силы возбуждения, бессмысленное по
отношению к отдельной клетке, правомочно применять к органу.
В нем разные клетки имеют неодинаковые пороги возбуждения. По
мере нарастания заряда, проходящего через многоклеточное
образование, эффект возбуждения усиливается за счет вовлечения в него
все большего количества клеток. Так, мышца сокращается все
сильнее по мере того, как верхний правый угол раздражающего импульса
«отходит» от кривой «сила - длительность» кверху и вправо. О
пороге в данном случае судят по едва заметному сокращению целой
мышцы (или даже группы мышц), что связано с возбуждением
самых возбудимых ее волокон. Если же верхний правый угол
стимулирующего импульса попадает правее кривой «сила - длительность»,
то возбуждаются и менее возбудимые волокна. Следовательно, в
отличие от отдельной клетки, орган не подчиняется закону «все или
ничего».
/пава 4. Электробиология
357
Функцию, заданную параметрически, обычно анализируют,
фиксируя один из аргументов и варьируя другим до того уровня, при
котором функция достигает своего параметрического значения. Так
поступают в неврологической клинике с кривой «сила -
длительность» при диагностике заболеваний, например, вялых параличей.
Во-первых, фиксируют t. Обычно выбирают такую
длительность электрического импульса, при которой гипербола (см.
рис. 4.30, б) асимптотически приближается к прямой, параллельной
оси абсцисс и проходящей через /п (на оси ординат). Такой ход кривой
соответствует аккомодации ткани к электрическому току (исчезает
зависимость эффекта возбуждения от изменения длительности
импульса), причем минимальное /, с которого начинается аккомодация,
называют полезным временем (tU0J.
Изменяя / в электрическом импульсе с фиксированной
длительностью (практически t > tm„), находят реобазу (/п) и оценивают
возбудимость по формуле ε =1/ /. (чем меньше реобаза, тем выше
возбудимость).
Во-вторых, фиксируют /. Экспериментально найдено, что кри-
иая «сила - длительность» имеет наиболее крутой участок на уровне
двух реобаз (/ = 2 · /п). Поэтому фиксируют / импульса амплитудой в
две реобазы и находят его минимальную продолжительность, при
которой возникает возбуждение. Минимальная длительность
прямоугольного электрического импульса амплитудой в две реобазы,
выбывающего едва заметное возбуждение, называется хронаксией (ίχρ).
Измерив хронаксию, определяют возбудимость по формуле: ε =1/ ίχρ
(чем короче хронаксия, тем выше возбудимость).
Гиперболический характер кривой «сила - длительность»
присущ всем возбудимым тканям, но конкретные значения tmn, ίχρ, /π в
разных тканях различны. Л. Лапик был убежден, что временные
параметры возбуждения служат своеобразным хронометром, посредством
которого каждая ткань отсчитывает свое время. Отсюда и
происхождение термина «хронаксия» (цена времени). Для практической
медицины более важным является исследование процесса возбуждения не
и разных тканях, а в одном и том же органе при изменении его
функционального состояния. При утомлении, а также при многих
заболеваниях возбудимость нервов и мышц падает. Важно не просто констатиро-
358
Бисхритт
вать угнетение возбудимости, а количественно оценивать его степень
Мерой изменения возбудимости нервов и мышц при развитии патолн
гического процесса или утомления служит динамика /п и txp.
Наряду с кривой «сила - длительность» проявлением аккомоди
ции возбудимых тканей к электрическому току служит так назыппг
мый минимальный градиент. Этот термин предложен в 1907 г. К. Jim
касом. Под ним подразумевают минимальную крутизну переднею
фронта порогового электрического импульса, имеющего форму трсу
гольника или трапеции. Если импульсу присущ слишком пологий
фронт, то возбуждение под его действием не возникает при сколь
угодно большой амплитуде стимула.
Явление аккомодации свидетельствует, что для возникновении
возбуждения необходимо не просто приложить к возбудимой мембри
не заряд определенной величины, но и сделать это достаточно быстр»
В рамках современных представлений о воротных процессах в потен
циалз'ависимых каналах аккомодацию объясняют неодинаковой
инерционностью легких и тяжелых ворот. Только быстрые изменения
заряда способны обеспечить запаздывание движения тяжелых βορσι
относительно легких ворот. При медленных сдвигах мембранного
потенциала они приводятся в движение одновременно, и не возникас!
состояние, когда легкие ворота уже открылись, а тяжелые - еще не
закрылись. Механизм аккомодации аксона заключается в инактивации
натриевой проницаемости при медленном воздействии стимула,
причем не только электрического. Аккомодация развивается к
раздражителям любой модальности.
4.2.8. Лабильность возбудимых тканей
В естественных условиях по аксонам распространяются не
одиночные потенциалы действия, а серии их. В разных нервных
волокнах частота следования ПД различна. Она определяется скоростью
изменений ионной проницаемости, которая, в свою очередь, зависит
от продолжительности реактивации потенциалзависимых каналов
(в аксонах - натриевых, в миоцитах - натриевых и кальциевых).
Способность разных возбудимых тканей воспроизводить ПД
с неодинаковой частотой обнаружил Н. Е. Введенский в конце XIX в.
(пава 4. Эпектробиопогия
359
()п назвал это свойство лабильностью и ввел ее количественную меру.
11абильность измеряется максимальной частотой потенциалов дейст-
мия, которые данная возбудимая ткань может генерировать в точном
соответствии с частотой стимуляции. Наибольшая лабильность
присуща слуховому нерву - до 1 кГц, тогда как в симпатических нервах
ома составляет всего 20 Гц.
Весьма характерно влияние на лабильность местных
анестетиков. Они замедляют скорость реактивации потенциалзависимых
ионных каналов, воздействуя на сенсор напряжения. Анестетики в
высоких концентрациях блокируют проведение возбуждения по нервным
иолокнам, а в низких дозах исключают возможность проводить
высокочастотные сигналы при сохранении проводимости потенциалов
действия, генерируемых с низкой частотой. Анестезированное нер-
нное волокно, подвергнутое воздействию высокочастотных
электромагнитных импульсов, зачастую проводит только первый импульс,
а остальные блокируются в нем. В определенных условиях аксон под
анестезией осуществляет так называемую трансформацию ритма,
блокируя каждый второй стимул, - частота генерируемых ПД
оказывается вдвое меньше частоты стимуляции.
4.3. Распространение возбуждения
Возбудимая мембрана относится к нелинейным и активным
средам. Активной называют среду, которая генерирует
электромагнитную энергию под действием внешних стимулов. Способность
к образованию ПД отображает активный характер возбудимой
мембраны. Он проявляется и в наличии участка «дифференциального
отрицательного сопротивления» на ее вольт-амперной характеристике.
Она же свидетельствует о нелинейности возбудимой мембраны,
поскольку отличительным признаком нелинейной среды служит
нелинейность функциональной зависимости потоков от сил, которые их
вызывают. Применительно к электрическим процессам это означает
нелинейную зависимость тока от напряжения, выявляющуюся в
нелинейной вольт-амперной характеристике среды.
Законы классической электродинамики описывают
исчерпывающим образом распространение ЭМП в линейных и неактивных ере-
360
Биофизик»
дах. Теория Максвелла оказывается недостаточной для анализа повс
дения электромагнитных волн в активных и нелинейных среднх
Речь идет о лампах бегущей волны, обширном классе плазменных
устройств, оптических квантовых генераторах, полупроводниковых
и сверхпроводящих туннельных диодах, нейристорах (искусствен
ных нервных волокнах) и некоторых других электронных устройа
вах, а также о возбудимых мембранах. Для некоторых из перечислен
ных систем решены волновые уравнения в частных производных, по
общей теории ЭМП для нелинейных и активных сред пока не
существует. Ее разработка - одна из актуальных задач современной
физики. Отметим, что нервное волокно явилось первой нелинейной и ак
тивной системой, для которой удалось решить волновое уравнение
ЭМП в частных производных. Это сделали А. Ходжкин и А. Хаксли,
опубликовавшие в 1952 г. серию работ, в которых на базе детального
изучения электрических свойств гигантского аксона кальмара были
рассчитаны форма и скорость нервного импульса. Авторы этих
выдающихся исследований стали лауреатами Нобелевской премии.
Нервные и мышечные волокна, будучи генераторами
электромагнитной энергии, вместе с тем обладают пассивными
электрическими свойствами. Они характеризуют способность живых тканей
поглощать энергию внешнего ЭМП, затрачиваемую на их
поляризацию. Характеризуя потери электромагнитной энергии в тканях,
говорят о декременте (затухании) в них электрического потенциала,
которым обладало ЭМП до взаимодействия с ними. Закономерности
затухания идентичны для потенциалов, приложенных извне и
генерируемых самими живыми тканями. Степень декремента зависит от
их сопротивления (R) и емкости (Q. В электротехнике R и С (вместе
с индуктивностью) называются пассивными свойствами
электрических цепей.
Пассивные электрические свойства клеток, в первую очередь,
нервных и мышечных волокон, определяющие декремент
потенциала на них, в биофизике принято называть кабельными свойствами,
поскольку живую клетку, особенно нервное или мышечное волокно,
можно уподобить электрическому кабелю, помещенному в
электропроводящую среду.
Глава 4. Электробиология
361
4.3.1. Кабельная теория распространения
потенциала действия
Нервные и мышечные волокна представляют собой
цилиндрические проводники. Их внутреннее содержимое, обладающее
относительно низким удельным сопротивлением (по данным разных
авторов, оно может быть в пределах от 30 до 200 Ом · см), изолиро-
иано от наружной хорошо проводящей среды мембраной,
являющейся изолятором. Согласно ориентировочным расчетам А. Ходж-
кина, удельное сопротивление комплекса структур, образующих
мембрану, достигнет 2 · Ю9Ом · см. В этом отношении свойства
нервных и мышечных волокон напоминают свойства морского
подводного кабеля.
Электрическая емкость плазматической мембраны различных
клеток равна приблизительно I мкФ/см2. Электрическая емкость
чистого бимолекулярного липидного слоя составляет 0,8 мкФ/см2.
Зная диэлектрическую проницаемость той части липидного
бислоя, которая состоит из углеводородных цепей, можно рассчитать
толщину изолирующей части с/, используя формулу плоского
конденсатора:
С=^^-, (4. НО)
d
где С - электрическая емкость; ε - относительная диэлектрическая
проницаемость изолирующей части бислоя;ε0 -диэлектрическая
проницаемость вакуума; А - площадь. Если Ст составляет 0,8 мкФ/см2,
а ε составляет 2, то d будет равно 2,2 нм.
Электрическая емкость биологических мембран представляет
собой важный параметр, который необходимо учитывать при
количественной оценке электрических сигналов, регистрируемых на
мембране. Зная емкость мембраны, можно рассчитать минимальное
количество зарядов (ионов), необходимых для возникновения
рассматриваемого смещения мембранного потенциала. Измерение
электрической емкости плазматической мембраны позволяет
ориентировочно оценить площадь поверхности клетки, допуская, что емкость,
рассчитанная на единицу площади, составляет I мкФ/см2.
362
Биофизиня
Неружная среда (большой объем, малое сопротивление)
\
/
/
\ Тт
Вг
Чг
-ЛЛЛЛг-
0
-WW
5·
\ %гЛ+ xmll =г
-wv-
5·
-Л/ИЛг
Внугреннее пространство
(малый объем, большое
сопротивление)
Источник,
тока ♦
6)
Внутренний
токовый электрод
\_1
Потенциал
Рис 4.31. Кабельная структура (Катц, 1966)
а - электрическая схема, соответствующая распределенным
сопротивлению и емкости мембраны, а также сопротивлению
аксоплазмы. В нижней части рисунка показан внутриклеточный
электрод. Стрелки указывают направление тока (скачок тока, и вызванные
1ш изменения мембранного потенциала (электротонический потенциал)
на разных расстояниях от электрода (б). Расстояния указаны возле
каждой кривой. Они выражаются в постоянных длины
Волокно можно представить в виде электрической цепи с
рассредоточенными параметрами. Для удобства рассмотрения и
количественного описания такой цепи допускают, что если волокно
погружено в большой объем жидкости, то проводимость наружной среды
достаточно велика, и в эквивалентной электрической цепи
пренебрегают ее сопротивлением. На рис. 4.31 представлена схема кабельной
структуры. Потенциал внеклеточной среды рассматривают как
нулевой. Падение напряжения Гна сопротивлении мембраны при пропу-
Глава 4. Электробиология
363
екании тока через кабельную структуру называют
электротоническим потенциалом.
Используя закон Ома, можно записать следующее выражение
для тока, текущего по осевому цилиндру:
ЭК
дх
^- = -r,/2. (4·111)
где 12 - ток, текущий по осевому цилиндру; jc - расстояние от
источника тока, см; г, - сопротивление аксоплазмы, рассчитанное на
единицу длины осевого цилиндра, Ом · см-1.
Ток, текущий через мембрану 1т, рассчитанный на единицу
длины кабеля, может быть выражен следующим образом:
?Г=-'-· (4·112)
дх
Из (4.111 ) и (4.112) следует
1 d2V
г, дх
Ток /т состоит из двух компонентов: емкостного тока 1С и
ионного тока /,:
/-=/е+Л=Сп^ + /|, (4.114)
где Ст - электрическая емкость мембраны на единицу длины. Из
(4.113) и (4.114) получим:
"Г.," (4.115)
г, дх2 т dt
Умножая обе части уравнения на гт, получаем
rmd2V „ dV
= rmCm^- + rmL, (4.116)
г. дх2 т т dt
364
Биофизик»
где гт - сопротивление мембраны кабельной структуры, рассчн
тайное на единицу длины, Ом · см-1. Заменяем — на λ2, гтСт ι
г.
ι
где τ - постоянная времени, и rmIj = V. В этом случае (4.116) приоО
ретает вид
d2V dV
— =J — + V.
дх2 dt
(4.117)
Если продолжительность прямоугольного скачка тока прспы
шает 3 τ, то Vпрактически достигает стационарного уровня, в этом
dV
случае — =0.При этом (4.117) приобретает следующий вид:
dt
д2У
дх1
= V.
(4.11 Η)
Общее решение этого дифференциального уравнения имса
вид
V =Аехр
-х
ч . г> j
+ 5ехр
С \
-х
v.r< /
(4.119)
Используем граничные условия для нахождения постоянных А
и В. Так как V- 0 при jc = <», следовательно, 5 = 0. При jc = 0 имеем
V= V0 и А = V0 Подставив постоянные А и В в (4.119), получим
решение:
V=V0exp
-χ
(4.120)
ν V '< )
Гпава 4. Электробиология
365
Рис. 4.32. Декремент электрического потенциала вдоль мембраны
По оси абсцисс - расстояние χ от точки с максимальным уровнем потенциала Vo;
по оси ординат -уровень электрического потенциала V;
γ
λ - константа длины; —- = 0,37Г0.
е
Это выражение показывает, что электротонический потенциал
^экспоненциально затухает с увеличением расстояния χ (рис. 4.32).
Длину кабеля х, когда электротонический потенциал затухает в е раз,
называют константой длины и обозначают λ =
При рассмотрении зависимости λ от параметров кабельной
структуры гт выражают через Rm - сопротивление мембраны,
рассчитанное на единицу площади, а г, через Л, - удельное сопротивление
цитоплазмы:
m
nD
(4.121)
К =-
4^
nD7
(4.122)
где D - диаметр волокна. Следовательно, λ=-
1 \DR,
R
т. е. она
пропорциональна корню квадратному из диаметра волокна.
В табл 4.5 приведены кабельные константы нервных волокон.
Распространение потенциала действия происходит благодаря
возникновению локальных токов между возбужденным и покоящими-
366
Биофптч
А Б В
Выходящий
ток
Внутренняя
сторона
Мембрана
Рис 4.33. Изменение мембранного потенциала Vm и натриевой, и калиевой
проводимости мембраны вдоль кабельной структуры во время
распространяющегося потенциала действия, а также токи, текущие через
различные участки мембраны (Нобл, 1966): Л - ток, текущий по ионным каналам
1С - емкостный ток, 1т - суммарный ток (1т = /; + IJ. На нижней диаграмме
показаны локальные токи в области возбужденного участка. Потенциал дейстпи»
распространяется справа налево (направление его распространения указано
стрелкой). Штриховые вертикальные линии позволяют сопоставить события,
происходящие в точках, где мембранный потенциал достиг пулевого уровня
и максимума, а также в точке, где изменяется направление мембранного тока 1„
во время нисходящей фазы потенциала действия. А-В - возбужденный участок
мембраны, Б-максимум мембранного потенциала
/ пина 4. Электробиология
367
ι и участками нервного или мышечного волокна. На рис. 4.33 приведена
ι м-ма Д. Нобла, иллюстрирующая изменения мембранного потенциала
м локальные токи при проведении потенциала действия в кабельной
11 руктуре (направление распространения - справа налево).
Таблица 4.5
Кабельные константы нервных волокон (при Т~ 293 °К)
Волокно
:он кальмара
юн омара
:он краба
волокна,
о.
fc
2
й
ct s
500
75
30
Η
αι 2
га длины
ьшом объ
й среды),
ζ ^ о
η о ζ
Ρ ю *
ζ δ о.
О г Я
Stf -Ε z
5
2.5
2.5
ни,
ная време
ζ
к
о
о о
С S
0,7
2
5
мб-
вление ме
х
fc w
2 - s
m
υ α. О
700
2000
5000
О
мембрань
JCM
ι- S
й о
II
Ш S
1
1
1
а
5
е сопроти
плазмы
о о
X t
δ αι t
?ιΟ
30
60
60
A -
5 3
e сопроти
жной срер
° ff
1 S-
л ™ s
ς x о
αι αι ^
as*
ΧιΟ
22
22
22
Здесь же представлены кривые, характеризующие трансмемб-
рлиные токи (ток, входящий в волокно, - отрицателен, а выходящий из
тшокиа - положителен), изменения мембранного потенциала вдоль
подокна и проводимости мембраны для ионов натрия и калия в опреде-
юпный момент потенциала действия. Длина участка волокна, где
существует потенциал действия, зависит от скорости проведения.
Таким образом, τ и λ являются основными параметрами кабе-
11>ных свойств биомембран. Они количественно характеризуют
декремент потенциала как во времени, так и в пространстве (вдоль
координаты jc). Для уяснения механизмов распространения возбуждения
оеобенно важное значение имеет λ волокон, обладающих
возбудимой мембраной.
4.3.2. Бездекрементное распространение возбуждения
по возбудимой мембране
Анализ кабельных свойств нервных и мышечных волокон
свидетельствует об их крайне низкой электропроводности. Так, аксон
368
Биофизик*
диаметром 1 мкм и длиной 1 м имеет R, порядка 1012 Ом. Такое со
противление присуще телевизионному кабелю длиной 10" км, <ин
в тысячу раз превосходит расстояние от Земли до Солнца. Поэтому
в клетках всякий сдвиг электрического потенциала должен быстро
затухать в окрестностях места возникновения, что соответствует 111
кабельным свойствам.
Однако в возбудимой мембране этим дело не ограничивается
Если затухающий потенциал достаточен для включения воротного
процесса в потенциалзависимых ионных каналах, обеспечивающих
входящий катионный ток, то на удалении от первичного очага возбуж
дения возникнет новый ПД. Для этого должно соблюдаться условие
Vx > V„ = |ПП| - |КМП|. Регенерированный ПД также будет распро
страняться с декрементом, но, угасая сам, возбудит последующий учи
сток волокна. В силу огромной скорости декрементного распростра
нения потенциала электроизмерительные приборы не способны
зарегистрировать угасание каждого предыдущего ПД на последую
щих участках мембраны. Вдоль всей возбудимой мембраны при рас
пространении по ней возбуждения приборы регистрируют одинако
вые по амплитуде потенциалы действия, поскольку генерация
каждого из них подчиняется закону «все или ничего». Распространс
ние возбуждения напоминает горение бикфордова шнура. Создается
впечатление, будто электрический потенциал распространяется но
возбудимой мембране без декремента.
На самом деле бездекрементное движение ПД по возбудимой
мембране является результатом взаимодействия двух процессов:
1) декрементного распространения потенциала (от предыдущего ПД)
со скоростью электромагнитной волны и 2) генерации нового ПД
(этот процесс называют регенерацией или ретрансляцией ПД).
Первый из них протекает на несколько порядков быстрее, чем второй.
Поэтому скорость проведения возбуждения по волокну тем выше,
чем реже приходится ретранслировать ПД, что, в свою очередь,
зависит от декремента потенциала вдоль мембраны, который
предопределен величиной λ. Волокна, обладающие большей λ, быстрее
проводят импульсы возбуждения.
В физиологии принята иная терминология для описания
распространения возбуждения по нервным и мышечным волокнам. Она
I лава 4. Электробиология
369
была предложена Л. Гермашюм, сформулировавшим в 1879 г.
теорию локальных токов. Согласно теории Германна, между
возбужденным и невозбужденным участками волокна течет электрический ток,
поскольку внутренняя поверхность первого из них обладает
положительным потенциалом относительно второго и между ними сущест-
иует разность потенциалов (рис. 4.34, а). Токи, возникающие в жи-
II ых тканях вследствие возбуждения, называются локальными, так
как распространяются на незначительное расстояние от
возбужденного участка. Их ослабление обусловлено затратами энергии на
заряд мембраны и на преодоление сопротивления цитоплазмы волок-
па. Локальный ток служит раздражителем для покоящихся участков,
непосредственно прилежащих к месту деполяризации. В них
развивается возбуждение, а значит, и новая деполяризация. Она приводит
к установлению разности потенциалов между вновь
деполяризованным и покоящимся (последующим) участком волокна, вследствие
чего возникает локальный ток в следующем микроконтуре.
Следовательно, распространение возбуждения представляет собой
многократно повторяющийся и охватывающий соседние участки
возбудимой мембраны процесс ретрансляции ПД и движения локальных
токов от деполяризованных к покоящимся пунктам волокна.
Нетрудно понять, что приведенные описания биофизических
механизмов распространения возбуждения по возбудимым
мембранам тождественны друг другу. Теория локальных токов
подразумевает, что ретрансляция ПД происходит гораздо медленнее, чем течет
электрический ток. Поэтому скорость распространения возбуждения
тем выше, чем больше расстояние от места возникновения
предшествующего ПД, на котором локальный ток способен возбудить
последующий участок возбудимой мембраны. Идентичное свойство
отображает константа длины волокна (λ). Она возрастает по мере понижения
сопротивления цитоплазмы и уменьшения емкости клеточной
мембраны. Следовательно, и скорость проведения возбуждения по
нервным и мышечным волокнам тем выше, чем меньше Rt и См.
Сопротивление определяется по известной формуле: R = ,
σ, s
где σ, - удельная электропроводность цитоплазмы, / - длина волокна,
370
Биофизик*
}.
+ + ++++ 4— ^г!—'Ν- + + + + +
ν.:■_>оjr
1 2 1
τ τ τ- ψ-+—'+—% ' ττττττ
a;
2 -:::—:-~::::-Г
* ,..._.. -"
6)
Рис. 4.34. Схема, иллюстрирующая механизм бездекрементного
распространения возбуждения по возбудимым мембранам
безмякотного (а) и мякотного (б) нервных волокон
1 - невозбужденные участки; 2 - возбужденные участки.
Стрелками показано движение локальных токов
s - площадь его поперечного сечения. Следовательно, толстые
волокна обладают сравнительно низким R, и, вследствие этого, быстрее
проводят возбуждение. В ходе эволюции некоторые животные
приобрели способность к быстрой передаче нервных импульсов за счет
образования у них толстых аксонов путем слияния многих мелких
в одно крупное. Примером может служить гигантское нервное
волокно кальмара. Его диаметр достигает 1-2 мм, тогда как обычные
аксоны имеют толщину порядка 1-10 мкм.
Способ повышения скорости распространения возбуждения
посредством утолщения волокон пригоден для животных, у которых
немного быстропроводящих коммуникаций. Если же животному
необходимы нервы с большим количеством волокон с быстрым
проведением импульсов, то на возможности их утолщения накладывают
ограничения допустимые размеры. Например, зрительный нерв
человека содержит 106 волокон, по которым импульсация проводится
быстро. Если бы они имели такой же калибр, как гигантские аксоны
кальмара, то образованный ими нерв походил бы на ствол могучего
дерева более чем метрового диаметра.
Глава 4 Электробиология
371
4.3.3. Сальтаторное проведение нервного импульса
Эволюция животного мира привела к использованию другого
пути повышения скорости передачи нервной импульсации - умень-
I ению емкости аксолеммы. Так появились нервные волокна,
покрытые миелиновой оболочкой. Они называются мякотными, или миели-
повыми Миелиновая оболочка образуется в процессе наматывания на
аксон окружающих его шванновских клеток (рис. 4.35)
В центральной нервной системе функцию шванновских клеток
выполняет олигодендроглия. Оболочка представляет собой много-
м мбранную систему, включающую от нескольких десятков до двух
сотен элементарных клеточных мембран, прилегающих друг к другу,
причем внутренний их слой тесно контактирует с аксолеммой
Толщина всей миелиновой оболочки сравнительно невелика (единицы
б)
Рис 4.35. Схема образования миелиновой оболочки на аксоне (а)
и электронограмма поперечного среза развивающегося
мякотного (миелинового) нервного волокна (б) (препарат Η С. Косицына)
Обозначения- А - аксон (осевой цилиндр),
ШК - цитоплазма шванновской клетки (леммоцита) Μ—миелиновая оболочка
372
Биофизик»
микрометров), но этого достаточно для значительного пониженно
емкости мембраны, так как миелин служит превосходным изолято
ром (удельное сопротивление миелиновой оболочки составляет 500
800 МОм ■ см). Емкость мембраны миелинового аксона примерим
в 200 раз меньше емкости аксолеммы безмякотного волокна (соо'1
ветственно 0,05 и 1,0 мкФ · см-2).
Диффузия ионов через миелиновую оболочку практически не
возможна. Кроме того, в участках аксона, покрытых ею, отсутствую!
потенциалзависимые ионные каналы. Поэтому в мякотном нервном
волокне генерация ПД сосредоточена только там, где миелинован
оболочка отсутствует (рис. 4.36). Эти места в мембране миелинового
аксона называются перехватами Ранвье, или активными узлами. От
перехвата к перехвату нервные импульсы проводятся за счет декре-
ментного распространения ЭМП. Расстояние (/) между соседними
перехватами составляет в среднем 1 мм, но зависит от диаметра (d)
аксона. У гомойотермных животных эта зависимость выражается так:
/ ~ 100 ■ d. У пойкилотермных отношение //ί/имеет большую
величину (200-300). Значит, у теплокровных животных межперехватные
участки короче. Перехваты Ранвье занимают около 0,02% общей длины
нервного волокна. Площадь каждого из них приблизительно 20 мкм2.
Время проведения возбуждения между соседними активными
узлами составляет 5-10% длительности ПД. Поэтому преодоление
сравнительно большого пути (порядка 1 мм) между следующими друг за
другом участками ретрансляции потенциала действия с ν = 108 м · с1
обеспечивает высокую скорость проведения нервного импульса на
протяжении всего волокна.
Важно отметить, что локальные токи, достаточные для
регенерации ПД, могут протекать даже через 2-3 последовательно
расположенных перехвата Ранвье. Более частое, чем необходимо для
обеспечения нормального распространения возбуждения, расположение
активных узлов в мякотных аксонах служит повышению надежности
нервных коммуникаций в организме. У гомойотермных животных
надежность выше, чем у пойкилотермных.
В безмякотных аксонах ретрансляция ПД должна происходить
значительно чаще. Там генераторы ПД распределены вдоль всей дли-
Глава 4. Электробиология
373
Рис. 4.36. Схема нейрона с миелиновым аксоном, иннервирующим мышцу
Обозначения: 1 - тело нейрона; 2 - аксон; 3 - миелиновая оболочка; 4 - перехваты
Ранвье; 5 - концевые моторные пластинки; б - мышечные волокна
ны волокна в непосредственной близости друг от друга (на
расстоянии порядка 1 мкм). Этим обусловлена сравнительно низкая скорость
проведения возбуждения по мембранам мышечных и безмякотных
нервных волокон. В отличие от них, миелиновые аксоны за счет
малой емкости межперехватных участков приобрели высокую скорость
передачи нервных импульсов (до 140 м ■ с-1).
Вследствие относительно большой протяженности участков
аксона между соседними активными узлами проведение нервного
импульса в мякотном нервном волокне происходит скачками и поэтому
называется сальтаторным (от латинского слова saltus - скачок).
Сальтаторное проведение обеспечивает существенную
экономию энергии. Так, потребление кислорода при нем в 200 раз меньше,
чем при непрерывном распространении нервных импульсов по без-
374
Биофизик»
мякотным аксонам. Разницу между сальтаторным и непрерывным
проведением импульсов иллюстрирует следующий пример: миели
новое волокно подкожного нерва кошки диаметром 4 мкм проводи ι
возбуждение примерно с такой же скоростью (25 м · с-1), что и безмя-
котный гигантский аксон кальмара диаметром около 1 мм. В безмя-
котных нервных волокнах диаметром 5-10 мкм скорость проведения
импульсов не превышает 0,5-0,7 м · с~'.
Наибольшая скорость распространения возбуждения
наблюдается в мякотных аксонах, диаметр которых составляет 10-15 мкм,
а толщина миелиновой оболочки достигает 30-50% общего диаметри
волокна. Скорость υ проведения нервных импульсов в миелиновых
аксонах прямо пропорциональна их диаметру, тогда как в безмякот-
ных - квадратному корню из диаметра. Для непрерывного
распространения возбуждения по безмякотным волокнам справедлива фор-
• Η lr-σ,
мула: ν = I -, где г - радиус волокна, См - удельная емкость
мембраны, RM - удельное сопротивление мембраны, σ, - удельная
электропроводность цитоплазмы, Н- «фактор надежности»
(отношение амплитуды ПД к Un, т. е. к разности абсолютных значений ΠΓΙ
иКМП); в разных волокнах величина Η неодинакова, но не выходит
за пределы 2-4.
4.3.4. Синаптическая передача
Механизм распространения возбуждения, рассмотренный в
предыдущих параграфах, присущ непрерывной возбудимой мембране,
принадлежащей отдельной клетке. Функциональный межклеточный
контакт, обеспечивающий переход возбуждения с одной клетки на
другую, получил название синапса. Этот термин ввел в науку Ч. Шер-
рингтон в 1897 г., образовав его от греческого глагола «синапто» -
смыкать.
Вначале полагали, что передача возбуждения между клетками
осуществляется посредством локальных токов. Сейчас установлено,
что такая (электрическая) синаптическая передача действительно
существует в организме. В некоторых органах (например, в сердце) ей
Глава 4. Электробиология
375
принадлежит важнейшая функциональная роль. Однако не она служит
основной формой межклеточного взаимодействия при
распространении возбуждения в нервной системе. Чаще встречается химическая си-
паптическая передача. Ее признают более поздним эволюционным
приобретением животного мира по сравнению с электрическими
синапсами.
Электрическая синаптическая передача возможна при очень
тесном соприкосновении взаимодействующих клеток - при
расстоянии между ними не более 10-20 нм (часто 2-4 нм). Только тогда
кабельные свойства синапса допускают переход возбуждения с одной
клетки на другую посредством локальных токов, под действием
которых происходит ретрансляция ПД на мембране второй из них.
Этому способствует существование щелевых контактов между пре- и по-
стсинаптическими мембранами электрического синапса. Хотя они
занимают не более 1-3% поверхности контакта, его электрическое
сопротивление, а значит, и декремент потенциала значительно
меньше, чем в других местах. Такие синапсы между кардиомиоцитами
называются нексусами.
Электрическое сопротивление нексусов регулируется
посредством изменения содержания Са2+ и Н+ в цитозоле. Так, в миокарде
оно увеличивается при повышении [Са2+], и снижении рН;, а также при
ишемии. В торцевых контактах между отдельными кардиомиоцитами
плотность нексусов выше, чем при соприкосновении боковых
поверхностей. Это сказывается на константе длины межклеточного
распространения возбуждения. Так, в волокнах Пуркине λ передачи сигнала
при торцевых контактах равна 1,9 мм (при длине клетки в 125 мкм),
т. е. примерно такая же, как при проведении потенциала в пределах
клетки, но эта величина почти на порядок больше, чем при контактах
кардиомиоцитов боковыми поверхностями.
Медиаторная передача («химический синапс»). Во многих
синапсах промежуток между контактирующими клетками
(синаптическая щель) превышает 20 нм. Там возбуждение может
передаваться при помощи химических посредников (медиаторов). Гипотеза о
химической синаптической передаче возбуждения с нерва на мышцу
предложена А.Ф. Самойловым в 1924 г. Она получила
подтверждение в экспериментах, проведенных О. Леви и Г. Дейлом на сердце.
376
Биофизши
Рис. 4.37. Схема синапса
Обозначения: 1 - пресинапс; 2 - синоптическая щель; 3 - субсинаптическая
мембрана; 4 - внесинаптические участки постсинаптической мембраны;
5 - гранулированные порции медиатора; 6 - митохондрия
Синапс состоит из трех основных частей: пресинаптической
структуры, синаптической щели и постсинаптической мембраны
(рис. 4.37). Первая из них является местом высвобождения медиаторн,
который непрерывно медленно диффундирует в синаптическую щель
и через нее поступает к постсинаптической мембране. Сквозь преси-
наптическую мембрану медиатор проникает посредством пиноцитозп
(экзоцитоза). Однако медленный поток медиатора к
постсинаптической мембране не возбуждает клетку, которой она принадлежит.
Темпы выброса медиатора из пресинаптической структуры
резко возрастают, когда сюда приходят нервные импульсы,
деполяризирующие пресинаптическую мембрану. Деполяризация открывает
кальциевые каналы в ней, что приводит к поступлению Са2+ внутрь
пресинаптической структуры из межклеточного пространства.
Избыток Са2+ понижает поверхностный заряд мембран, покрывающих
вакуоли и гранулы с содержащимся в них медиатором, и тем самым
способствует слиянию их с пресинаптической мембраной. Последняя
мгновенно перестраивается, пропуская сквозь себя порции
медиатора, включающие многие тысячи его молекул. Следовательно, нервные
импульсы, поступающие к синапсу, усиливают экзоцитоз медиатора.
За несколько микросекунд он достигает постсинаптической
мембраны и начинает взаимодействовать с тем ее участком, который
расположен непосредственно в проекции пресинаптической структуры.
Такой участок называют субсинаптической мембраной.
(iiaea 4. Эпектробиопогия
377
Субсинаптическая мембрана существенно отличается от
остальных участков постсинаптической мембраны, в состав которой она
входит. Во-первых, она не обладает возбудимостью, тогда как остальная
часть постсинаптической мембраны возбудима благодаря присутствию
иотенциалзависимых ионных каналов. Субсинаптическая мембрана
таких каналов не содержит. Зато она имеет химиочувствителъные ионные
каналы, которые открываются под действием медиатора. Сенсором
медиатора служат мембранные белки-рецепторы (точнее, гликопротеид-
иые комплексы субсинаптической мембраны). Между молекулами
медиатора и мембранного рецептора существует стереосоответствие,
обеспечивающее высокую селективность их взаимодействия. Сущест-
нование химиочувствительных ионных каналов - вторая важнейшая
особенность субсинаптической мембраны. Третьей ее особенностью
является присутствие ферментов, расщепляющих комплекс медиатора
с мембранным рецептором или сам медиатор.
При взаимодействии медиатора с мембранным рецептором
изменяется конформация рецепторных молекул и связанных с ними
других компонентов субсинаптической мембраны, включая потенци-
алнезависимые (химиочувствительные) ионные каналы. Связь между
рецепторами и каналами осуществляют, как правило,
внутриклеточные посредники (вторичные мессенджеры). Если в результате этого
открываются натриевые каналы, то возникает входящий ток
катионов, поскольку [Na* ]>[Na*], и развивается градуальная
деполяризация субсинаптической мембраны. При повышении проницаемости
для К+ (при открывании калиевых каналов) мембрана
гиперполяризуется, так как [К*]>[К*]. В силу невозбудимости
субсинаптической мембраны ее де- и гиперполяризационные реакции на медиатор
градуальны (их амплитуда прямо пропорциональна дозе медиатора).
Деполяризация при определенных условиях, о которых будет
сказано ниже, обеспечивает передачу возбуждения через синапс.
Гиперполяризация, напротив, затрудняет синаптическую передачу, т. е.
вызывает торможение постсинаптической деятельности (проведения
нервных импульсов, мышечного сокращения, секреции и т. д.).
Поэтому все синапсы с химической передачей подразделяют на две
группы: возбуждающие и тормозные. В первых из них медиатор вы-
378
Биофизик»
зывает деполяризацию постсинаптической мембраны, во вторых
гиперполяризацию.
При деполяризации субсинаптической мембраны на ней
возникает возбуждающий постсинаптический потенциал (ВПСП). Он
создается за счет входящего тока Na+ через потенциалнезависимые
натриевые каналы. В некоторых синапсах такие каналы образованы
белками самих мембранных рецепторов. Это показано на примере
холинорецепторов, присутствующих в синапсах, где медиатором
служит ацетилхолин. Адсорбция ацетилхолина на холинорецепторс,
приводящая к возникновению их комплекса, вызывает конформаци-
онную перестройку рецепторных молекул, вследствие чего внутри
них открывается пора, через которую диффундируют ионы. В других
синапсах, где рецепторные молекулы не обладают вторичной
структурой типа β-спирали (с полостью внутри себя), изменения конфор-
мации белков рецепторов, происходящие под действием медиатора,
вызывают механохимический процесс в соседних с рецептором
молекулах, которыми образованы ионные каналы. В передаче сигнала
от рецептора к каналу участвуют внутриклеточные сигнальные
системы. Нередко эту роль играет система цАМФ. Так медиатор
открывает ионные каналы и обеспечивает ток ионов через субсинаптиче-
скую мембрану.
В большинстве синапсов поток ионов сквозь каналы,
открывшиеся в субсинаптической мембране под влиянием медиатора,
продолжается в течение 1 мс. За это время комплекс медиатора с рецептором
разрушается специфическим ферментом, что приводит к закрытию
ионных каналов. Ионная проницаемость субсинаптической мембраны
резко падает, входящий ионный ток прекращается, и ВПСП исчезает.
Субсинаптическая мембрана не может генерировать ПД, но
ВПСП распространяется с декрементом на соседние с нею
возбудимые участки постсинаптической мембраны, деполяризуя их. Если
ВПСП имеет такую амплитуду, что даже при декременте доводит
уровень ПП возбудимого участка постсинаптической мембраны до
КМП (это происходит когда остаточный потенциал от ВПСП - Vx >
V„ = |ПП| - |КМП|), то возникает ПД. Он распространяется без
декремента по всей клетке, которой принадлежит данная постсинаптиче-
ская мембрана. В нейроне ПД распространяются по аксолемме до
Глава 4. Электробиология
379
следующего нейрона, на котором его аксон образует следующий
синапс, чтобы вызвать там новую синаптическую передачу. В
мышечном волокне ПД вызывают сокращение.
Вся последовательность процессов, обеспечивающих
синаптическую передачу с участием медиаторов, занимает большее время по
сравнению с проведением возбуждения по непрерывной возбудимой
мембране и через электрический синапс. Это время получило
название синоптической задержки. Она занимает 0,2-0,3 мс у
млекопитающих и 0,3-1,0 мс у пойкилотермных животных.
На субсинаптической мембране тормозных синапсов
возникает не ВПСП, а ТПСП - тормозный постсинаптический потенциал.
Он представляет собой зеркальное отражение ВПСП, т. е.
гиперполяризацию мембраны. Гиперполяризационный сдвиг мембранного
потенциала распространяется с декрементом на соседние участки по-
стсинаптической мембраны и понижает их возбудимость (подобно
анэлектротону). Такое влияние называют тормозным, поскольку для
возбуждения гиперполяризованной клетки требуется более сильный
стимул, чем при обычной поляризации (исходном уровне ПП), а
естественные (адекватные) раздражители оказываются не в состоянии
ее возбудить.
Цепи событий в возбуждающих и тормозных синапсах можно
представить в виде схемы, в которой Μ - медиаторы, R - рецепторы
субсинаптических мембран.
Возбуждающий синапс Тормозный синапс
М, + R, М2 + R,
4- 4-
открытие потсициалиезависимых каналов открытие потсициалиезависимых каналов
для катионов, входящих в клетку для катионов, выходящих из клетки
(например, для Na*) (например, для СГ)
4- 4-
ВПСП ТПСП
(деполяризация) (гиперполяризация)
4- 4-
возбуждение или торможение или
повышение возбудимости (понижение возбудимости)
постсииаптичсской структуры постсииаптической структуры
380
Биофизике
Одни и те же медиаторы в разных субсинаптических мембри
нах могут вызвать образование как ВПСП, так и ТПСП, но постси
наптические мембраны определенной клетки при взаимодействии
с данным медиатором дают всегда однозначный эффект - либо
деполяризацию, либо гиперполяризацию. Например, ацетилхолин βοί-
буждает скелетные мышцы, органы желудочно-кишечного тракта, но
тормозит деятельность миокарда и гладкомышечных элементов
стенок кровеносных сосудов.
С одной клеткой могут контактировать пресинаптическис
структуры, выделяющие разные медиаторы. Некоторые из них
деполяризуют, а другие гиперполяризуют плазмолемму одной и той же
клетки (например, нейрона). Результирующий эффект определяется
алгебраической суммой сдвигов мембранного потенциала,
вызываемых возбуждающими и тормозными синапсами в том месте нейрона,
где генерируется ПД (в аксонном холмике). Именно такое
суммирование'имеют в виду, когда называют нервную клетку интегрирующим
устройством. На теле нейрона присутствует несколько тысяч
синапсов (например, на клетке Пуркине мозжечка их число превосходи!
3 · 108). Среди них встречаются и возбуждающие, и тормозные
синапсы . Суммируя многочисленные ВПСП и ТПСП, нейрон приходит либо
в возбужденное, либо в тормозное состояние. В первом случае он
проводит нервные импульсы, во втором - останавливает (прерывает)
реакции, протекающие с его участием. Такова основа сложнейших
механизмов деятельности мозга.
Нервно-мышечная передача - переход возбуждения с нерва на
мышцу, следствием чего является сокращение, также подчиняется
общим закономерностям синаптической передачи. Синапс между
аксоном и мышечным волокном называется моторной концевой
пластинкой. Во всех скелетных мышцах медиатором служит
ацетилхолин. Он сосредоточен внутри синаптических пузырьков диаметром
30-60 нм. При деполяризации пресинаптической мембраны под
действием ПД, поступающих сюда из центральной нервной системы, си-
наптические пузырьки перемещаются к щели и выходят в нее по
механизму пиноцитоза (экзоцитоза). Достигнув субсинаптической
мембраны, ацетилхолин взаимодействует с ее холинорецепторами
(рис. 4.38).
Глеев 4. Электробиология
381
Рис. 4.38. Схема макромолекулярной организации
субсинаптической мембраны холинэргического синапса (по де Робертису)
Обозначения: АХ- ацетилхомин; ХР - холинорецептор
(при взаимодействии с АХ испытывает изменение конформации,
приводящее к образованию в нем ионного канала);
АХЭ - ацетилхолинэстереза; Л - бимолекулярный липидный слой биомембраны
Холинорецептор мембраны мышечного волокна (сарколеммы)
иыделен, очищен и охарактеризован биохимически,
фармакологически, иммунологически. На каждый 1 мкм2 субсинаптической
мембраны приходится около 104 холинорецепторов. Каждый из них образован
девятью или десятью белковыми субъединицами и представляет собой
круглую конструкцию наподобие розетки со средним диаметром 8-
9 нм, длиной 9-12 нм, насквозь пронизывающую субсинаптическую
мембрану. Комплексы макромолекул образуют в этой мембране
упорядоченную решетчатую структуру, в которой постоянная решетки
составляет 9-10 нм. Около 50% частиц, входящих в состав
субсинаптической мембраны, имеют диаметр 8-9 нм (как и холинорецептор), что
позволяет предположительно считать их холинорецепторами.
Действие некоторых ядов на организм человека обусловлено их
конкуренцией с ацетилхолином за холинорецептор. Они связывают хо-
линорецепторы и не позволяют им образовывать комплексы с
ацетилхолином, нарушая тем самым синаптическую передачу возбуждения
382
Биофизик»
с нерва на мышцу. Так действуют кураре и курареподобные
препараты, применяемые в медицине для расслабления скелетных мышц. Эти
вещества связывают холинорецепторы временно, благодаря чему
вызывают обратимый эффект, что позволяет использовать их в качестве
фармакологических агентов. Существуют конкуренты ацетилхолина,
связывающие холинорецепторы необратимо. Таков а-бунгаротоксип
(полипептид с молекулярной массой 8 кДа, содержащийся в змеином
яде, выделенном от тайваньского ленточного крайта). Он относится
к группе сильнейших ядов, ничтожные дозы которых смертельны.
Ацетилхолин поступает в синаптическую щель моторной
концевой пластинки даже в отсутствие нервных импульсов на пресинап-
тической мембране, но при этом его концентрация около холинорс-
цепторов не повышается более 10~18 моль · л-1. Образуется комплекс
медиатора с мембранным рецептором, вследствие чего возникают
миниатюрные потенциалы концевой пластинки, но они имеют
амплитуду около 0,4 мВ и быстро угасают. Мышца не реагирует на них
сократительной реакцией. Поступление нервных импульсов к
синапсу меняет дело: ацетилхолин начинает выходить в синаптическую
щель гораздо интенсивнее и частота выделения порций медиатора
повышается в тысячу раз. Каждый нервный импульс вызывает
выброс нескольких миллионов молекул ацетилхолина, причем не по
отдельности, а в виде «пакетов», включающих много его молекул,
которые заключены в одной везикуле (пузырьке). Для возбуждения
мышечного волокна достаточно 10~15-10~16 моль ■ л-1 ацетилхолина.
Взаимодействие ацетилхолина с холинорецептором вызывает
деполяризацию субсинаптической мембраны. Освобождение
содержимого одного ацетилхолинового пузырька обусловливает открытие
двух тысяч ионных каналов в ней. Через каждый канал за время его
существования в открытом состоянии (3 с) внутрь мышечного
волокна проникает 1,2 · 10" ионов натрия. С натриевым током связана
деполяризация субсинаптической мембраны, называемая потенциалом
концевой пластинки (ПКП). Он аналогичен описанному выше ВПСП
и возникает примерно через 1 мс от начала интенсивного выброса
ацетилхолина пресинаптической мембраной. ПКП градуален - его
амплитуда зависит от темпа поступления медиатора к холинорецепторам.
Глеве 4. Эпектробиопогия
383
По субсинаптической мембране ПКП распространяется с
декрементом, но даже в нескольких миллиметрах от места своего
возникновения он способен вызвать возбуждение возбудимого участка
постсинаптической мембраны мышечного волокна. Там возникают
потенциалы действия, распространяющиеся по сарколемме и
обеспечивающие начало сократительного процесса.
ПКП существует до тех пор, пока не будет полностью гидролизо-
ван ацетилхолин в субсинаптической мембране. Для его инактивации
там присутствует специальный фермент - ацетилхолинэстераза. Без
нее невозможна нормальная мышечная деятельность. В естественных
условиях к мышечному волокну поступают не отдельные нервные
импульсы, а серии их, причем оно должно реагировать на каждый импульс
в серии. Однако сарколемма, деполяризованная предыдущей порцией
ацетилхолина, становится нечувствительной к следующей порции.
Чтобы нервные импульсы, поступающие чередой к мышце из мозга,
могли осуществлять возбуждающее действие, необходимо удалить
предшествующую порцию ацетилхолина к моменту прихода каждого
следующего импульса. Это делает ацетилхолинэстераза. При
угнетении ее активности синаптическая передача, осуществляемая с
участием ацетилхолина, резко нарушается. Ингибиторами этого фермента
служат фосфорорганические соединения (ФОС) (некоторые из них
относятся к боевым отравляющим веществам - табун, зарин, зоман и д-
ругие). Важно отметить, что они прежде всего парализуют нервную
деятельность, так как холинергическая передача (синаптическая
передача с участием ацетилхолина в качестве медиатора) свойственна не
только моторной концевой пластинке, но и многим синапсам в
центральной и вегетативной нервной системе.
Кроме градуальности и электротонического характера
распространения, ПКП имеет еще ряд отличий от ПД (табл. 4.6).
Цепь событий, происходящих в мышце при поступлении к ней
управляющего сигнала (нервных импульсов) из мозга, можно
представить в виде схемы: нервный импульс —> деполяризация пресинаптиче-
ской мембраны —» открытие в ней кальциевых каналов —» ускорение
экзоцитоза ацетилхолина из пресинаптической структуры —»
взаимодействие его с холинорецептором субсинаптической мембраны —»
384
Биофизиня
открытие потенциалнезависимых ионных каналов —> повышение при
ницаемости субсинаптической мембраны для ионов —> возникновсши·
ПКП —> его электротоническое распространение (с декрементом) пи
субсинаптической мембране —> деполяризация внесипаптических
участков сарколеммы —> открытие в ней потенциалзависимых ионных
каналов -> генерация ПД (мышечного импульса) -> распространсши·
мышечного импульса по сарколемме —> активация сократительных
элементов (миофибрилл) —> мышечное сокращение.
Таблица 4.0
Сравнение кабельных свойств субсинаптнческих и внесипаптических
участков сарколеммы, а также потенциала концевой пластинки
и потенциала действия портняжной мышцы лягушки (при 15-20 °С)
Сопоставляемые
показатели и процессы
Емкость - См, мкФ · см-2
Сопротивление в покое - RM,
кОм · см2
Постоянная времени, мс
Постоянная длины, мм
Причина возникновения
потенциалов
Характер распространения
потенциалов
Амплитуда потенциала
Скорость деполяризации
(крутизна переднего фронта -
Vmax), В · с"1
Время деполяризации
(от 20 до 100% амплитуды), мс
Время реполяризации
(от 100 до 50% амплитуды), мс
Субсинаптическая
мембрана и ее
потенциал (потенциал
концевой пластинки)
6,0
4,0
21-27
*
2,5
Ацетилхолин
Электротонический
(с декрементом)
Градуальна,
достигает 30-40 мВ
220
1,5-2,1
3,8
Внесинаптические
(возбудимые) участки
сарколеммы и их
потенциалы
(потенциалы действия]
5,0
4,0
17
1,9
Локальный ток
(остаточный потенциал от ПКП)
Бездекрементный со
скоростью 1 м с "1
Подчиняется закону «все
или ничего»,
превосходит ПП (-90 мВ) по
модулю на 20-30 мВ
650
0,45
2,0
Глава 4. Электробиопогия
385
4.4. Особенности мембранных потенциалов
кардиомиоцитов
В состав миокарда входит несколько типов клеток,
отличающихся структурой и функцией. Это мышечные клетки рабочего
миокарда - предсердий и желудочков, выполняющие сократительную
функцию миокарда, волокна проводящей системы и клетки синус-
по-предсердиого и предсердно-желудочкового узлов.
Мышечные клетки рабочего миокарда - кардиомиоциты -
обладают поперечной исчерченностью, они ветвятся и отделены друг
от друга вставочными пластинками, или дисками, что говорит о
клеточном, а не синцитиальном строении миокарда. Вставочные диски
образованы плазматическими мембранами соседних клеток, которые
разделены межклеточной щелью размером около 20 нм (рис. 4.39).
Кардиомиоцит окружен плазматической мембраной толщиной
7,5 нм, к которой снаружи примыкает базальная мембрана толщиной
50 нм. Вместе они образуют наружную оболочку мышечной клетки -
сарколемму. Сарколемма имеет пальцевидные впячивания -
поперечные трубочки, или Т-систему.
Рис. 4.39. Типы миокардиальных клеток
а - мышечные клетки рабочего миокарда; б - проводящие вопокна (волокна Пуркине);
в—клетки синусно-предсердного узла: г - клетки предсердно-желудочкового узла;
1 - ядра; 2 - поперечная исчерченность; 3 - интеркалярные диски
386
Биофизик»
Кардиомиоцит содержит одно или несколько ядер. Важными
структурами кардиомиоцитов являются миофибриллы, митохондрии
и саркоплазматический ретикулум, имеющие прямое отношение к со
кращению кардиомиоцитов. Мышечные клетки предсердий харакгс
ризуются рядом структурных особенностей, отличающих их от мм
шечных клеток желудочков. Они меньше размерами (диаметр 5-6 мкм
вместо 10-12 мкм кардиомиоцитов желудочков), Т-система развит»
слабо.
Морфологическая обособленность кардиомиоцитов не
исключает тесного функционального взаимодействия между ними
благодаря электрической связи между клетками посредством вставочных
дисков (электрический синцитий). Электрические параметры этого
синцития имеют важное значение для понимания природы
возникновения и распространения возбуждения в сложной и гетерогенной
в структурно-функциональном отношении системе, какой является
миокард.
Электрические параметры миокарда как синцития
(электрического) существенно влияют на физиологические характеристики
самого миокарда. Во-первых, миокардиальную ткань трудно
возбудить, если стимулирующее воздействие является точечным,
локальным. Действительно, благодаря тому что входное
сопротивление (i?in) синцития очень мало, для создания на таком сопротивлении
пороговой деполяризации требуется сильный раздражающий
электрический ток. Во-вторых, крутой спад потенциала при удалении от
возбужденной точки приводит к тому, что возбуждением будет
охвачена лишь малая область и оно не сможет перерасти в
регенеративный распространяющийся процесс. Все это делает миокард
помехоустойчивым, и при ограниченных нарушениях в нем ритмическая
работа его не нарушается. Надежность же и синхронность
распространения возбуждения с проводящей системы на рабочий миокард,
например, желудочков осуществляется развитой сетью проводящих
сердечных миоцитов (волокон Пуркине).
Потенциал покоя и потенциал действия клеток миокарда.
Потенциал покоя клеток рабочего миокарда лягушки составляет -90
... 95 мВ, теплокровных животных -75... 85 мВ. Эта величина являет-
Глеве 4. Эпектробиопогия
387
ся стабильной, не обнаруживает спонтанных колебаний и близка
к калиевому равновесному потенциалу (V,).
Потенциал покоя клеток - водителей ритма, как правило,
заметно выше (-60 мВ), проявляет спонтанные колебания и намного
меньше калиевого равновесного потенциала. Это связано главным
образом с большой исходной натриевой проводимостью мембраны
этих клеток (Рк: PNa: Ра = 1,0 : 0,58 : 0,02). Поэтому нормальная рит-
моводящая активность относительно слабо чувствительна к
изменению наружной концентрации ионов К+.
Миокардиалъные волокна способны генерировать два
принципиально различных вида потенциалов действия:
1. Быстрые потенциалы действия проводящих сердечных мио-
цитов и рабочего миокарда желудочков и предсердий.
2. Медленные потенциалы действия специализированных
волокон сердца (синусо-предсердного и предсердно-желудочкового
узлов) и деполяризованных волокон рабочего миокарда (рис. 4.40, А).
Конфигурация быстрых потенциалов действия проводящих
миоцитов считается «типичной» формой потенциала действия
миокарда. Проводящие миоциты характеризуются большим
потенциалом покоя (от -80 до -90 мВ) при максимальной диастоле и
начальной быстрой фазой нарастания потенциала действия (фаза 0). Как
видно на рис. 4.40, А, а эта фаза потенциала действия имеет овершут
(+20 мВ), за которым следует преходящая ранняя фаза быстрой репо-
ляризации (фаза 1), продленная фаза плато медленной реполяриза-
ции (фаза 2) и конечная фаза быстрой реполяризации (фаза 3). После
окончания потенциала действия в проводящих миоцитах часто
наблюдается спонтанная деполяризация во время диастолы (фаза 4).
В быстрых потенциалах действия волокон желудочков фаза 1
менее выражена, а фаза 4 не обнаруживает спонтанную диастоличе-
скую деполяризацию (рис. 4.40, А, б).
Медленные потенциалы действия возникают при меньшей
исходной диастолической величине потенциала покоя (около - 60 мВ),
фаза их нарастания (фаза 0) очень медленная, фаза 1 отсутствует, а
фаза 2 обычно не выражена (рис. 4.40, А, в), в фазе 4 появляется
спонтанная диастолическая деполяризация.
25·
388
Биофизии»
мВ
+50
-50
-100
I О '
ι ι ι ι
[L^
ι °
Г^2 2
, 500 мс,
Рис. 4.40. Величина и форма потенциалов действия (А), а также входящие ионные
токи (Б) миокардиальных клеток. А: быстрые потенциалы действия проводящих
волокон (волокон Пуркине) (а) и желудочков рабочего миокарда (б); медленные
потенциалы действия синусно-предсердногоузла (в); цифры обозначают
отдельные фазы потенциалов действия; Б: разделение входящих ионных токов
в изолированном миокардиоците желудочка. Потенциал покоя поддерживается
на уровне 0 мВ. а - деполяризующее ступенчатое смещение потенциала до - 50 мВ
(верхняя кривая) сопровождается возникновением начального быстрого (InJ
и последующего медленного (lea) входящего тока (нижняя кривая); б - первое
ступенчатое деполяризующее изменение потенциала до - 50 мВ сопровождается
возникновением быстрого входящего натриевого тока (1ца). который быстро
инактивируется, а потому последующее смещение потенциала до 0 мВ вызывает
только медленный входящий кальциевый ток; в - быстрый выходящий натриевый
ток заблокирован тетродотокенном и не возникает в ответ на первую
ступенчатую деполяризцию
В рабочем миокарде начальный быстрый компонент
потенциала действия (фаза 0) имеет натриевую, тогда как последующее плато
(фаза 2) - кальциевую природу. Поэтому удаление из омывающего
раствора ионов Na или действие тетродотоксина угнетают фазу 0,
а удаление наружных ионов кальция или действие блокаторов
кальциевого тока (ионы Cd2+, Co2+, верапамил, Д600) угнетают плато
потенциала действия. Ионы К+ в основном лишь модулируют форму,
амплитуду и продолжительность потенциала действия.
Глава 4. Электробиология
389
В условиях фиксации потенциала в проводящих сердечных ми-
оцитах и рабочем миокарде в ответ на сверхпороговую ступенчатую
деполяризацию возникает сложный трансмембранный ионный ток,
состоящий из нескольких компонентов. В начале деполяризации
появляется кратковременный ток, называемый быстрым входящим
током (рис. 4.40, Б). Пороговая деполяризация для активации этого тока
составляет около 15 мВ, достигает своего максимума он при
потенциале на мембране -20 мВ (рис. 4.41), а при потенциале на мембране,
равном примерно +50 мВ (потенциал реверсии), он становится
равным 0. Имеется ряд доказательств того, что рассматриваемый ток
имеет натриевую природу: его амплитуда зависит от концентрации
ионов Na+ в наружном растворе, а тетродотоксин эффективно и
обратимо блокирует этот ток. С функциональной точки зрения наиболее
важным является то, что натриевые каналы полностью инактивиру-
ются уже при уменьшении потенциала покоя миоцитов рабочего
миокарда и проводящих миоцитов до -50 мВ.
Как видно из рис. 4.40, Б, спад быстрого входящего тока в
конце замедляется, что связано с развитием так называемого медленного
входящего тока. Этот ток можно обнаружить в чистом виде,
зафиксировав предварительно быстрый входящий натриевый ток.
Порог активации медленного входящего тока составляет -
45...-40 мВ (рис. 4.41). Этот ток достигает максимума при
потенциале около 0 мВ и стремится к 0 при +50...+60 мВ (потенциал
реверсии). Медленный входящий ток имеет преимущественно кальциевую
природу.
Во время ступенчатой деполяризации в кардиомиоцитах
наряду с входящими натриевым и кальциевым токами появляется также
большой выходящий калиевый ток (/к) (рис. 4.41). Этот ток имеет
сложную природу и кинетику. В нем можно выделить, по крайней
мере, три компонента, а именно: задержанный потенциалозависи-
мый, кальцийиндуцируемый и ранний инактивирующийся
выходящий ток.
Выходящие калиевые токи блокируются ионами ТЭА, Cs+, Ba2+
и 4-аминопиридином.
Автомашин — это способность клеток спонтанно
деполяризоваться до порога генерации потенциала действия (рис. 4.42). Эта спо-
390
Биофизик*
-80
а)
Рис. 4.41. Вольт-амперные (а) и стационарные
активационно-инактивационные (б) характеристики
трансмембранных ионных токов мышечных клеток рабочего миокарда
а - вольт-амперные характеристики для 1ца- /с» 1к> б - стационарная
активация (т ) и инактивация (h ) входящего натриевого тока;
стационарные активация (d ) и инактивация (f) входящего
кальциевого гока. На оси абсцисс отложены величины потенциала покоя
собность присуща лишь относительно малодифференцированным
(атипичным) мышечным волокнам сердца. Эти волокна богаты
саркоплазмой, бедны миофибриллами, в них плохо выражена
поперечная исчерченность. Атипичные мышечные клетки сосредоточены
в главных очагах автоматии - синусно-предсердном и предсерд-
но-желудочковом узлах - и рассеяны в миокарде предсердий и
желудочков (проводящие сердечные миоциты). Они являются водителем
ритма, т. е. генератором автоматических импульсов,
распространяющихся по миокарду и вызывающих в нем возбуждение.
Глава 4. Электробиология
391
мВ 100 мс -
о =fVf
-40
-80
Г,
мВ
О
-40
-80
Рис. 4.42. Изменение частоты возбуждения в водителе ритма сердца
а - изменение частоты (увеличение частоты показано стрелкой), связанное
с различной скоростью нарастания медленной диастолической деполяризации:
1 - медленное нарастание деполяризации: 2 - быстрое нарастание деполяризации;
б - изменение частоты в результате изменения величины порога возбуждения.
Порог обозначен прерывистой линией (изменение порога показано стрелкой):
1 - выше порог возбуждения, 2 - ниже порог возбуждения.
Т— период возбуждения сердечного ритма
Возникшее в синусно-предсердном узле возбуждение
распространяется на мышечную ткань предсердий и по
специализированным проводящим путям переходит к предсердно-желудочковому
узлу, откуда распространяется по предсердно-желудочковому пучку
и проводящим сердечным миоцитам к волокнам сократительного
миокарда желудочков. В проводящих миоцитах пейсмекерная
деполяризация (рис. 4.40, А, а) генерируется неспецифическим входящим
током и главное участие в переносе этого тока принимают ионы Na+.
В волокнах синусно-предсердного узла пейсмекерная
деполяризация обусловливается, главным образом, уменьшением
задержанной калиевой проводимости мембраны. Чем больше скорость этой
деполяризации, тем быстрее достигается порог генерации
медленного потенциала действия и тем, следовательно, выше частота
возбуждения и наоборот.
392
Биофизик»
На частоту возбуждения в пейсмекерных клетках влияет также
величина порога одинаковой скорости нарастания диастолической
деполяризации. Чем выше порог, тем больше времени требуется для
его достижения. В этом случае период возбуждения водителя ритма
Г, увеличивается, а следовательно, уменьшается частота
возбуждения. Если порог снижается, это вызывает уменьшение периода Т,
и увеличение частоты возбуждения сердечного ритма. Скорость
распространения возбуждения в синусно-предсердном узле составляег
0,1-0,2 м/с.
Из синусно-предсердного узла возбуждение
распространяется на правое предсердие, затем по специальному пучку - в левое
предсердие и одновременно по межузловому тракту к предсерд-
но-желудочковому узлу. Отсюда возбуждение переходит на пред-
сердно-желудочковый пучок и его ножки, которые образуют связи
с проводящими сердечными миоцитами (волокнами Пуркине),
расположенными субэндокардиально в левом и правом желудочках.
Проводящие миоциты в различных участках желудочков проводят
возбуждение к клеткам рабочего миокарда. Так обеспечивается
строгая синхронность возбуждения во всей массе ткани
желудочков. В желудочках скорость распространения возбуждения
составляет от 0,5 до 1 м/с.
4.5. Собственные электромагнитные поля
организма человека
Вокруг любого тела существуют различные физические поля,
определяемые процессами, происходящими внутри него.
Физические поля, которые генерирует организм в процессе
функционирования, называют собственными физическими полями организма
человека.
Вокруг человека существуют электромагнитные и
акустические поля. Выделяют три диапазона электромагнитного излучения
(низкочастотное, сверхвысокочастотное, оптическое, включая
инфракрасное и ультрафиолетовое) и три диапазона акустического
излучения (низкочастотные колебания, кохлеарная акустическая эмиссия
и ультразвуковое излучение).
Глава 4. Электробиология
393
4.5.1. Пассивные электрические свойства живых тканей
Согласно закону Ома сила тока пропорциональна разности
потенциалов V на концах проводника:
I=CV, (4.123)
где σ - коэффициент пропорциональности, называемый
электропроводностью.
При пропускании постоянного тока через живые клетки и
ткани сила тока не остается постоянной, а сразу же после наложения
потенциала начинает непрерывно падать до тех пор, пока не
установится на уровне, который во много раз ниже, чем исходный. Это связано
с тем, что при прохождении постоянного тока через ткань в ней
возникает нарастающая до некоторого предела ЭДС противоположного
направления. Такую встречную ЭДС легко обнаружить, если быстро
переключить электроды с источника напряжения на
микроамперметр. При этом будет зарегистрирован ток обратного направления,
который спадает во времени. С существованием встречной ЭДС
связано невыполнение закона Ома в диапазоне частот от нуля
(постоянный ток) до I кГц для биологических тканей и жидкостей. Формула
закона Ома для данного случая
/=а(У-ЭДС). (4.124)
В связи с этим практически все измерения проводятся на
частотах более I кГц. В случае измерений в диапазоне 0-1 кГц
используют малые измерительные токи (ΙΟ^-ΙΟ-8 А) и напряжение порядка
Ю-3 В, а также специальные приемы обработки поверхности
электродов, например платинирование.
Электрическое сопротивление величина, обратная
электропроводности:
R=-. (4.125)
σ
В физическом смысле сопротивлением называется
идеализированный элемент электрической цепи, приближенно заменяющий
резистор, в котором происходит необратимый процесс преобразования
электрической энергии в тепловую.
394
Биофизиня
Удельное электрическое сопротивление (табл. 4.7). Сопри
тивление R проводника длиной / и площадью поперечного сечения λ
выражается формулой
R=l
(4.12н)
где ρ - коэффициент, характеризующий свойства проводника и па
зываемый удельным электрическим сопротивлением:
I
Р=-
(4.127)
Таблица 4.7
Зависимость удельного электрического сопротивления
некоторых тканей человека от частоты (/) при температуре
Ткань
Жир
Легкое
Мышцы
Печень
Сердечная мышца
Ρ
37 °С
р, Ом · см, при f, Гц
10
-
1120
965
840
965
20
-
1040
414
-
-
100
-
950
880
403
800
925
1000
1500-5000
830
395
765
845
10000
760
375
685
600
Практически во всех измерениях определяют сначала
измеряемое сопротивление R, а затем пересчитывают его в удельное
электрическое сопротивление ρ с учетом геометрических размеров
электродов - площади электрода S расстояния между электродами /. На
рис. 4.43 приведена зависимость R от площади электродов для кожи
и от способа предварительной обработки кожи.
Удельная электропроводность - величина, обратная
удельному электрическому сопротивлению:
Р
(4.128)
Выбор межэлектродного расстояния и площади электродов
определяется частотой измерения, удельным элеюрическим
сопротивлением и диэлектрической проницаемостью.
ι пава 4. Электробиология
395
R, Ом
3
2
1
4 8 12 S.o?
Рис. 4.43. Зависимость активного сопротивления R кожи от площади электродов
S при частоте 0,1 Гц: 1 - без предварительной обработки кожи; 2 - использование
электролита для смачивания прокладок между кожей и электродом;
.? - обработка кожи наждачной бумагой 00 и смачивание электролитом прокладок
Диэлектрическая проницаемость, электрическая
постоянная, абсолютная диэлектрическая проницаемость (табл. 4.8).
Таблица 4.8
Диэлектрическая проницаемость (ε) и удельная электропроводность (Л)
некоторых тканей человека при различной частоте (/)
f, мГц
25
50
100
200
400
700
1000
1500
3000
5000
7000
8500
Кожа
е
150
100
75
57
48
45
44
43,5
42
40,5
39
37
Л,Си- м~1
0,65
0,70
0,75
0.80
0,85
0,95
1,10
1,3
2.4
4,0
5,0
7,0
Жир
е
27
125
7,5
6,5
6,0
6,0
6,0
6,0
6,0
5,5
4,95
4,5
Л, См · м-1
0,020
0,029
0,033
0,050
0.059
0,067
0,100
0,1 11
0,167
0,222
0,333
0,370
Мышцы
е
115
90
73
56
53
52,5
50,5
50,0
47,0
44,0
42,0
40,0
Л , См · м-1
0,666
0,768
0,87
1,0
1,14
1,31
1,35
1,42
2,22
4,35
6,67
8,33
Два точечных заряда qlnq2, находящихся в точках 1 и 2 на
расстоянии / друг от друга, взаимодействуют друг с другом с силой F,
направленной по прямой, соединяющей эти заряды:
J I I L
396
Биофизик*
F= Ч{4\, (4.12У)
4πε0ε/
где ε0 - электрическая постоянная вакуума (ε0 = 8,8542 · ΙΟ-12 Φ · м '),
ε - диэлектрическая проницаемость среды - безразмерная величипи,
которая показывает, во сколько раз сила взаимодействия между заря
дами в данной среде меньше, чем в вакууме. Относительную проии
цаемость ε рассчитывают по результатам измерения емкости С.
Комплексная диэлектрическая проницаемость. В природе
идеальных диэлектриков не существует, и всякая среда обладает
некоторой электропроводностью. Поэтому для удобства описания рас
пространения электромагнитных волн в исследуемых средах исполи
зуют комплексную диэлектрическую проницаемость εκ.
_Λ
2π/
zk =ε -je =ε -j^;, (4.130)
где ε и ε - действительная и мнимая части проницаемости^' -
мнимая единица, Λ - удельная электропроводность среды; / - частот
электромагнитных волн. Величина ε' представляет собой «истинную»
диэлектрическую проницаемость, а ε" учитывает частичное
преобразование электромагнитных волн в тепло из-за наличия
электропроводности, Тангенс угла диэлектрических потерь - отношение ε" κ ε':
tgb=^=-^. (4.131)
ε 2π/ε
Электрическая емкость. Потенциал V заряженного
уединенного проводника (на который действуют внешние электромагнитные
поля) пропорционален его заряду q. Величина
С=1 (4.132)
называется емкостью. В физическом смысле емкость - это
идеализированный элемент электрической цепи, приближенно заменяющий
конденсатор, в котором накапливается энергия электрического поля.
Глава 4. Электробиология
397
2 tgf(ί,κΓυ)
Рис. 4.44. Зависимость емкости кожи от частоты тока и площади электродов
1-S = 12cm2;2-S = 4cm2
Ниже даны формулы для расчета емкостей конденсаторов, наиболее
часто применяемых в исследованиях. Емкость плоского конденсатора:
εε^
где S - площадь пластин конденсатора или меньшей из них; d -
расстояние между пластинами.
Зависимость измеренной емкости от площади электродов
показана на рис. 4.44. Емкость цилиндрического конденсатора и
коаксиального кабеля определяется формулой
2πεε0/
ln(</2/</,)'
(4.133)
где d2, ί/, - диаметры внешнего и внутреннего цилиндров; / - длина
цилиндра.
Емкость двухпроводной линии
С=-
πεε0/
ln[(d-d0)/d0]
(4.134)
398
Биофизика
n g, be См
8 tgf (Л кГц)
Рис 4.45. Частотная зависимость удельной электропроводности (1), емкостной
проводимости (2) и поляризационной емкости (3) в системе «электрод - тело
человека - электрод» (данные для варианта наложения электродов на верхние
и нижние конечности при пропускании тока через все течо)
где / - длина линии; d - расстояние между осями проводов, d0 -
диаметр провода.
Количество электричества, накапливающееся в живых
системах, обусловлено не только статической емкостью. Так как
биологические ткани способны поляризировать ток, то измеряемая емкость
клеток и тканей определяется не только приведенными выше
формулами, но и так называемой поляризационной емкостью Си:
С - Г Ш
(4.135)
где R - сопротивление ткани; / - сила тока; /0 - начальная сила то-
I
ка; /, - конечное значение силы тока, причем Г Idt = q, где q - количе-
0
ство электричества, накапливаемое за время t. Зависимость
поляризационной емкости от частоты для тела человека показана на
рис. 4.45.
Электрический импеданс (полное сопротивление
переменному электрическому току). При последовательном соединении
резистора и конденсатора электрический импеданс рассчитывают по формуле:
Глава 4. Эпектробиопогия
399
где ω - круговая частота (ω = 2π/); Хс - емкостное сопротивление.
При параллельном соединении резистора и конденсатора
электрический импеданс рассчитывают по формуле:
7= 1 (4.137)
Частотные зависимости электрического импеданса и его
составляющих показаны на рис. 4.46 и 4.47.
Значения удельного импеданса Zy приведены в табл. 4.9.
Таблица 4.9
Удельный импеданс Zy тканей головного мозга
при частоте 1 кГц (униполярный способ)
Ткань
Здоровая ткань больших полушарий
То же на расстоянии 1-2 см от опухоли
Здоровая ткань мозжечка
То же на расстоянии I - 2 см от опухоли
Zy, Ом см
286 ±8
284 ±6
385 ±3
382 ± 12
Считают, что Хс ~ 0 в диапазоне 1-100 кГц и импеданс
определяется только сопротивлением R. Соответственно расчет ведется по
формуле:
Zy =η~. (4.138)
Этот параметр используется в медико-биологических
исследованиях (см. табл. 4.7) в тех случаях, когда измерительная схема не
позволяет разделить активную и емкостную составляющие объекта.
Фаза, фазовый сдвиг. Если синусоидальное напряжение и =
F^sin (ш + φ) подвести к резистору R, то через сопротивление
пройдет синусоидальный ток силой
V
/ = _!!Lsin(uJi+(p) = imsin(atf+(p). (4.139)
400
Биофизики
AtgZiZ.KOM)
3 4 5 6 tgfftKTu)
Рис. 4.46. Зависимость импеданса Ζ кожи от частоты и способа обработки кожи
(обозначения те же, что на рис. 4.43)
Следовательно, напряжение на зажимах резистора и ток,
проходящий через это сопротивление, имеют одинаковую начальную
фазу, или, как говорят, совпадают по фазе. Они одновременно
достигают своих амплитудных значений Vm и /ш и соответственно
одновременно проходят через нуль. Разность начальных фаз двух синусоид,
имеющих одинаковую частоту, называется фазовым сдвигом. В
данном случае фазовый сдвиг φ между мгновенными значениями
напряжения и тока / равен нулю:
φ=φ„-φ, =о,
(4.140)
где φα, (pj - сдвиг фазы при синусоидальных напряжении и токе
соответственно. Изменения напряжения на емкости С создают в
электрической цепи ток, сила которого
dq _ CdVc
dt dt
(4.141)
Если к емкости С подвести синусоидальное напряжение и
Vmsin (ω t + φ), то сила тока / будет записываться выражением:
ι=-
CdV,
dt
=G>CVmcos(a>t +(p) = /msin
ωί+φ+-|, (4.142)
Глава 4. Электробиология
401
А Поглощение, %
40
3D
?П
10
V,-~ 1 ^^
>^ 2 ^ /^
""""" -». N /
100 200 400 Θ00 800 1000 2000 4000 10000 20000 f, МГц
Рис. 4.47. Частотная зависимость доли поглощенных электромагнитных волн
(в процентах к мощности облучения) в структурах мозга человека (3), кролика (2)
и крысы (1) при облучении головы: поглощается в коже;
■ поглощается в коре головного мозга; - - - проникает
до подкорковых структур мозга
т. е. она отражает сдвиг приложенного напряжения на π/2 (рис. 4.47).
Физически это объясняется тем, что когда электрический заряд и
соответственно напряжение V = q/C достигают максимальных значений
(положительных или отрицательных), сила тока i = 0. Под фазовым
сдвигом тока относительно напряжения здесь также подразумевается
разность начальных фаз напряжения и тока, т. е.
<Р=<Ри -Φι =
π
(4.143)
Длина электромагнитной волны λ в воздухе (или вакууме)
связана с частотой/следующим отношением:
Л = -
/
(4.144)
где с - скорость света.
Длина волны в среде и, в частности, в биологических тканях λτ
определяется диэлектрическими свойствами среды и отличается от λ:
λΓ=7ντ
(4.145)
402
Биофизик»
0.6
0,6
0.4
0.2
100 200 300 1000
2000
10000 25000 / МГц
Рис. 4.48. Частотная зависимость коэффициента отражения
электромагнитных волн (г) от поверхности тела человека
Глубина проникновения в ткани электромагнитной волны (Δ) -
расстояние в направлении распространения волны, на котором
амплитуда вектора напряженности убывает в е раз.
Коэффициентом отражения г называется отношение
мощности электромагнитной волны, отраженной от поверхности
биообъекта W0Tp, к полной мощности волны, падающей на его поверхность
W :
W„
г=-
W_
(4.146)
Частотная зависимость коэффициента отражения от
поверхности тела человека показана на рис. 4.48.
Коэффициент поляризации (коэффициент Тарусова). На
рис. 4.49 показана характерная частотная зависимость
электрического импеданса биологической ткани.
Для оценки физиологического состояния биообъектов Б.Н. Та-
русов в 1938 г., предложил коэффициент поляризации Кп. Для
мышечной ткани его определяют по формуле:
К =
_ 10*
Z,o«
(4.147)
где Z, и Ζ 6 - сопротивление скелетной мышцы на частотах 102
и 106 Гц соответственно. После отмирания ткани значение Кп
приближается к единице.
Глава 4. Электробиология
403
Я, Ом, ι
1000 - 1
Рис. 4.49. Частотная зависимость электрического импеданса биологической
ткани в норме и при отмирании: 1 - норма; 2 - нагревание при температуре 50 °С
в течение 2 мин; 3 - то же в течение 4 мин; 4 - кипячение в течение 20 мин
4.5.2. Электростимуляция органов и тканей
Электростимуляция - дозированное воздействие
электрическим током на органы или системы организма для стимуляции их
деятельности. Осуществляется при помощи электронных
стимуляторов. Наибольшее распространение получила электростимуляция
скелетных мышц и нервных стволов, а также сердечной мышцы при
нарушениях ритма ее деятельности. При электростимуляция мышц
и нервных стволов (электрогимнастике) ток подводят через
электроды, располагаемые в наиболее возбудимых (двигательных) точках
мышцы или нерва, и периодически прерываемым электрическим
раздражением вызывают поочередное их сокращение и расслабление.
При лечебном воздействии на сильно пораженную скелетную
мускулатуру используют ритмические импульсы с постепенно
нарастающей интенсивностью. При неполной потере способности
пораженных мышц к сокращению применяют активную электростимуляцию,
при которой электрическое раздражение дополняет (усиливает)
действие естественных механизмов, вызывающих сокращение пораженных
мышц, и способствует восстановлению их функции. В современной
диагностике поражений мышечной и нервной систем, приводящих
к нарушению движений, электростимуляцию сочетают с регистрацией
токов действия мышц.
Электростимуляцию сердца проводят прямым и непрямым
способами. При первом способе раздражающие импульсы подаются не-
404
Бисх/ш·"··
посредственно на сердце, при втором - через накожные элааршт
и иглы-электроды и др. Применение вживляемых под кожу элск ι |нш
ных кардиостимуляторов, подающих через определенный инп-рии ι
времени после сокращения левого предсердия искусственные ими\
льсы для прямой стимуляции левого желудочка, позволяет создании
нормальную проводимость возбуждения в сердце.
В хирургической клинике применяют электростимулящи"
внутренних органов при поражениях спинного мозга. Электросшму
ляцию используют для восстановления нормальной функции мочпш
го пузыря и его сфинктера, секреторной и моторной функций жоп
дочно-кишечного тракта, а также для восстановления питания ткаигН
пораженных при пролежнях. Электростимуляция помогает боротьси ι
атрофией, вызванной длительным неиспользованием мышц. Тамч
тренировка позволяет увеличить силу сокращения мышцы до уроним,
необходимого для выполнения бытовых операций. Кроме того, элск ι
ростимуляция повышает устойчивость мышцы к утомлению.
При электростимуляции и электротерапии используются ρηι
личные электроды для того, чтобы добиться возбуждения потенции
лов действия в нужном нерве (в то же время другие, соседние нерпы
не должны возбуждаться). Для этого необходимо учесть влияние рач
меров, формы и расположения электрода (электродов). Все миостп
мулирующие электроды можно разделить на две группы:
1) Поверхностные электроды накладываются на кожу над ис
следуемой (стимулируемой) мышцей.
2) Внутримышечные электроды вводятся в соответствии с рач
личными методиками непосредственно в мышцу.
На поверхности раздела между электродом и тканью
происходит электрохимический процесс, благодаря которому тип
проводимости меняется с электронного (в металле) на ионный (в растворе).
Важно, чтобы эта реакция не сопровождалась образованием
продуктов, оказывающих токсическое действие на ткани или разрушающее
действие на сам электрод.
При выборе материала для электродов учитывают следующие
факторы:
1) пассивная биологическая совместимость материала с тканью,
2) механическая совместимость материала с тканью.
/ nnaa 4. Электробиология
405
Наиболее широко применяются платина, платино-иридиевый
ι плав и нержавеющая сталь.
4.5.3. Характеристики электрогенных свойств
живых тканей
Электрическим током называется всякое упорядоченное
движение носителей электрических зарядов (ионов, электронов) в той
или иной среде. Если находящееся в объеме, ограниченном
поверхностью S, некоторое количество электричества (или заряд) q со
временем уменьшается, то сила электрического тока /, протекающего
через поверхность S, определяется выражением
1=-^-. (4.148)
dt
Электрический ток положителен в случае, когда заряд q в
объеме уменьшается со временем вследствие перемещения зарядов во
инешнее пространство, и наоборот, ток отрицателен при увеличении
тряда q в объеме. Плотность тока (/') - отношение силы тока к
площади поперечного сечения S проводника, по которому протекает ток,
определяется формулой:
J = -j- (4-149)
Поверхностная плотность заряда (а) — отношение заряда (q)
к площади поверхности S, на которой заряд распределен,
определяется так:
α=ί. (4.150)
S
Один или несколько зарядов, расположенных произвольным
образом в некотором объеме, вызывает в пространстве появление
электрического поля. Взаимодействие между неподвижными электрически
заряженными частицами или телами осуществляется через
электростатическое поле. Последнее представляет собой стационарное, т. е.
406
Биофизики
не изменяющееся или очень медленно изменяющееся во времени,
электрическое поле, создаваемое неподвижными зарядами (телами),
и является частным случаем электромагнитного поля, которое
создается ускоренно движущимися заряженными частицами (телами).
Силовой характеристикой электрической составляющей
электромагнитного поля служит электрическая напряженность (Е). В
любой точке электромагнитного поля она численно равна и совпадает по
направлению с силой F, действующей со стороны поля на помещенный
в эту точку единичный положительный пробный точечный заряд (q):
Е = — . (4.151)
Ч
Электрическая напряженность системы точечных зарядов
равна векторной сумме напряженностей полей, создаваемых каждым из
этих зарядов в отдельности - принцип суперпозиции зарядов.
Энергетической характеристикой поля является потенциал. Потенциалом
в данной точке поля называется величина, численно равная
потенциальной энергии Wn единичного положительного заряда,
помещенного в эту точку:
φ= , (4.152)
где q - заряд, создающий поле. Результаты исследования
биопотенциалов приведены в табл. 4.10 и на рис. 4.50 - рис. 4.52.
Таблица 4.10
Биоэлектрические потенциалы ( ) кожи
в биологически активных точках у здоровых людей
Биологически
активные точки
Изянь-чжун-шу (п)
Изянь-чжун-шу (п)
Ин-сян (л)
Ин-сян (п)
φ, мВ
430 ± 81
421 ± 30
517 ±30
512 ±36
Биологически
активные точки
Инь-тан
Хэ-гу (л)
Хэ-гу (п)
φ, мВ
514 ±34
552 ± 33
522 ±34
Примечание: л - левая, π - правая.
Глава 4. Электробиология
407
1
60
40
20
1 /~^ 1 \/
2А
■^v
/^^^. t
-
\:
г-
100
90
80
70
10
12
14
16 ί
б;
Рис. 4.50. Временная динамика разности потенциалов квазипостоянного
биоэлектрического поля на расстоянии 10 см от туловища человека
- динамика потенциала обследуемого; 2 - динамика частоты сердечных
сокращений ЧСС; 3 - поля в экранированной камере: а - измерения от 04.07.75;
б - измерения от 07.07.75 (относительная влажность воздуха 50%;
трибоэлектричеекие заряды устранялись)
у>, мВ<
160
120
80
40
η
ι
■
•\
ι ι ι ι ι w-
10
30
50
70 90
/, см
Рис. 4.51. Зависимость потенциала внешнего электрического поля человека от
расстояния I до поверхности кожи (датчикразмещен над областью сердца)
408
Биофизика
75 мВ
б)
Рис. 4.52. Сравнение потенциала внешнего электрического поля (а)
с потенциалом электрокардиограммы (б)
4.5.4. Низкочастотные и сверхвысокочастотные
электромагнитные поля биологических объектов
Магнитные поля. На рис. 4.53 показано место магнитных
сигналов человека в шкале величин магнитного поля (В). Магнитная
индукция измеряется в теслах (1 Тл = 10 Гс), но поскольку
биомагнитные сигналы очень слабые, для их оценки применяются такие
единицы как нанотесла, пикотесла, фемтотесла.
Биомагнитные сигналы могут быть как квазипостоянными (они
порождаются ферромагнитными примесями, токами в коже, мышцах
внутренних органах, постоянными токами глаза), -так и быстро
меняющимися. Периодические или быстропеременные сигналы
генерируются сердцем, мышцами, глазом, мозгом. На рис. 4.53 показаны
характерные частотные диапазоны для магнитных сигналов от разных
источников в организме. Здесь же показаны уровни магнитных шумов
в окружающем пространстве, которые обычно затрудняют
проведение измерений, а также порог чувствительности к магнитному полю
существующих сквид-магнитометров. Видно, что обычно
присутствующие внешние возмущения на несколько порядков сильнее
магнитных полей человека.
Магнитные поля, порождаемые электрическими токами,
протекающими внутри организма при его жизнедеятельности, называют
биомагнитными. Биотоки возникают как следствие электрической
активности клеток, главным образом мышечных и нервных.
Электрически активной частью клетки, преобразующей химическую энер-
Глава 4. Элвктробиология
409
В.Тл |
ю-5
1-7
10ΙΟ"9
ю-
10"
1-11
> Поле Земли
Ферроматитные
частицы в организме
Глаза
I Ритмы мозга I
I Отклики мозга I
Порог чувствительности сквидов
КГ1
10
103
*ГЦ
Рис. 4.53. Место биомагнитных сигналов
организма человека в шкале магнитных полей
Показаны также характерные уровни помех и частотные диапазоны сигналов
гию в электрическую, является клеточная мембрана. Процессы,
протекающие в ней, определяют картину биомагнитных полей, или, как
говорят, биомагнитных сигналов. Рассмотрим, в каких случаях и
каким образом эти процессы вызывают появление биомагнитных
полей в окружающем тело пространстве.
В дальнейшем будем опираться на данные о свойствах нервных
клеток - нейронов, но в принципе электрические процессы
протекают аналогично и в других клетках, таких как глиальные клетки мозга
или мышечные клетки (последние отвечают на электрическое
возбуждение еще и сокращением). Мембрана имеет толщину всего
около 5 нм и в основном состоит из липидов - веществ, по
электрическим свойствам прекрасных изоляторов. В нее вкраплены белковые
410
Биофизика
комплексы, среди которых можно выделить два электрически
активных тела. Во-первых, это калий-натриевые насосы, которые
расходуют метаболическую энергию (энергию химических веществ,
преобразуемых в процессе жизнедеятельности), поддерживают ионную
среду внутри клетки, отличной от межклеточного пространства. В
результате концентрация ионов натрия в клетке оказывается в 20 раз
ниже, чем вне ее, ионы Na «выкачиваются» наружу. Во-вторых, это
ионные каналы, по которым осуществляется пассивный транспорт
ионов сквозь мембрану под действием электрического поля. Этот
транспорт ионов избирателен. Благодаря различию в концентрациях
ионов по разные стороны полупроницаемой мембраны возникает
разность потенциалов, при которой поток ионов данного типа сквозь
мембрану равен нулю:
Δφίοη=^1η£ΐ. (4.153)
q с,
Здесь с0 и с, суть концентрации данного иона вне и внутри
клетки, кБТ - произведение постоянной Больцмана на абсолютную
температуру, q - заряд иона.
Само по себе наличие трансмембранного потенциала и даже его
импульсное или градуальное (плавное) изменение не связаны с
появлением токов во внеклеточном пространстве. Электрические токи
текут сквозь мембрану, заряжая и разряжая ее как конденсатор, что
можно обнаружить лишь при регистрации потенциала
внутриклеточным электродом.
Как следствие трансмембранных токов могут возникнуть
макроскопические («объемные») токи во внеклеточном пространстве, но
клетка вызывает объемные токи лишь тогда, когда ее мембрана
поляризована неоднородно вдоль своей поверхности. Тогда имеются
части мембраны, потенциал которых в одном месте выше, а в другом
ниже среднего. Эти места служат соответственно источником и
стоком внеклеточных токов, замыкающихся внутри клетки. Такие токи
уже можно обнаружить при внеклеточной регистрации.
Если появление неоднородной поляризации в разных клетках
не скоррелировано, то результирующие внеклеточные токи взаимно
Глава 4. Электробиология
411
компенсируются, если скоррелировано - получаются вполне
заметные макроскопические токи. В отличие от колебаний
внутриклеточного потенциала, внеклеточные токи, обычно измеряемые на
удалении от клетки-источника, отражают интегральную активность
группы клеток или органа в целом. Эти токи проявляют себя двояко.
Во-первых, из-за того, что все ткани организма проводят
электричество, между различными точками кожи возникают разности
потенциалов 1-1000 мкВ. Во-вторых, токи в теле порождают магнитные
поля, простирающиеся за пределы организма. Регистрация
поверхностных потенциалов называется электрографией (кардио-, энцефа-
ло-), регистрация магнитных полей - магнитографией.
Распределение и колебания потенциалов и магнитных полей однозначно
определяются распределением и колебаниями токов внутри тела.
Магнитный сигнал от источника регистрируется в некоторой
точке одним датчиком, электрический же сигнал может быть
измерен лишь в виде разности потенциалов между двумя точками, и для
получения строгого соответствия между потенциалом в точке и
током в источнике необходим тщательный выбор места крепления
второго, «нейтрального» электрода. Можно применить и два близко
расположенных электрода («биполярное отведение»), но в этом случае
сильнее проявляется различие электрографии и магнитографии,
заключающееся в том, что вторичные источники обычно слабее
проявляют себя в магнитных сигналах. Действительно, магнитный датчик
главным образом реагирует на сильные токи, текущие в активной
области и в меньшей степени на ослабленные слабопроводящей
преградой (например, костями черепа) токи в поверхностных слоях тела.
В то же время именно распределение слабых поверхностных токов
влияет на картину электрических потенциалов. Например, изменение
распределения этих слабых токов с помощью закорачивания двух
точек биполярного отведения, что зануляет электрографический
сигнал, не окажет заметного влияния на магнитный сигнал.
Дополняющий друг друга характер электрических и магнитных
данных можно проиллюстрировать на двух примерах (рис. 4.54).
Информацию о расположении изолированного витка с током внутри
некоторого тела и значениях этого тока можно получать лишь
магнитографически, так как виток не создает разности потенциалов на
412
Биофизика
а) 6)
Рис. 4.54. Примеры, иллюстрирующие взаимно дополняющий характер
магнитоэлектрографических данных
а - изолированный виток с током внутри шара создает магнитное поле вне шара,
но не вызывает разности потенциалов на его поверхности; информация
о таком витке может быть получена лишь магнитографически; б - дипольный
источник тока в центре шара вызывает распределение потенциалов на его
поверхности, но магнитное поле порождаемых им токов равно нулю вне
шара; такой диполь регистрируется только электрографически
поверхности тела. Наоборот, дипольный источник тока («токовый
диполь» - рис. 4.54, б), помещенный в центр проводящего шара
вызывает токи, о которых можно судить только по распределению
потенциалов на поверхности шара. Магнитное поле снаружи
тождественно равно нулю, независимо от тока в источнике и его ориентации.
В концепции полей отведения существенным является то, что
она позволяет довольно просто оценивать эффективность той или иной
системы датчиков (отведения) для приема сигналов от определенного
распределения сторонних токов в теле. Сигнал определяется видом
поля отведения только в районе источников и производится лишь
компонентой, параллельной полю. Если рассматривается сравнительно
протяженный источник, такой как сердце, для которого следует построить
магнитный вектор, то желательно иметь три отведения, поля которых
взаимно перпендикулярны и однородны в объеме сердца.
Сердце - не единственный источник биомагнитных сигналов.
В других органах (например, скелетных мышцах, мозге)
электрическая активность не так сильно скоррелирована, чтобы всему органу
можно было приписать единый электрический или магнитный вектор.
Глава 4. Эпектробиопогия
413
Более детальным модельным источником сигналов является токовый
диполь, показанный на рис. 4.54, б. Он представляет собой своего рода
миниатюрную батарейку с близкорасположенными электродами,
помещенную в проводящую среду. Казалось бы, магнитографические
данные имеют не большую ценность, чем электрографические, так как
являются следствием тех же токов, которые фиксируются электро-
граммой. Методика электрографии, существующей уже около 100 лет,
разработана весьма подробно, а получение магнитограмм требует
более сложного оборудования с применением жидкого гелия. Из
изложенного следует, однако, что магнитные и электрические данные
дают разную информацию о токах в организме, и связь между ними (или
отсутствие таковой) определяется структурой источников токов.
Поэтому электро- и магнитография - это не конкурирующие, а
дополняющие друг друга методы исследования организма. Несмотря на
большую сложность аппаратуры, у биомагнитографии есть определенные
принципиальные преимущества:
- бесконтактность, что позволяет вести измерения через
повязку или даже через стенку;
- возможность измерять квазипостоянные сигналы, которые на
электрограммах часто маскируются из-за электрической активности
кожи;
- следующая из бесконтактности возможность легко и быстро
передвигать магнитный датчик для поиска того или иного вида
активности удобна для точной локализации сигнала;
- большая локализация биомагнитного сигнала вблизи
источника активности, так как магнитный датчик менее чувствителен к
объемным токам и позволяет точнее определять местоположение того или
иного источника, а это очень важно, особенно в энцефалографии;
- с помощью магнитографии можно определять наличие
магнитных включений в организме и наблюдать их поведение;
- магнитографически можно измерять магнитную
восприимчивость органов и тканей.
Для многих клинических применений точное описание
внутренних процессов не является необходимым. Большую ценность
имеет уже сравнительное наблюдение биомагнитных сигналов в норме
и патологии. Биомагнитография сейчас находится в стадии экспери-
414
Биофизик»
ментальных исследований, преследующих цель накопления
статистических данных о значении и виде биомагнитных сигналов
здоровых людей и изменениях в магнитограмме при разных нарушениях,
Магнитография применяется для исследования сердца (кардио-),
скелетных мышц (мио-) плода, глаза (окуло-), мозга (энцефалография),
магнитных загрязнений легких, постоянных токов в теле человека
и для ряда других задач.
Электромагнитные волны СВЧ-диапазона. Интенсивность
излучения волн СВЧ-диапазона за счет теплового движения
ничтожна. Как можно рассчитать непосредственно из формулы Планка, при
перепаде температуры относительно окружающей среды на 1°К она
составляет всего 2 · Ю-13 Вт/м2. Как заметил академик Ю.В. Гуляев,
это соответствует по своей интенсивности свету свечи, помещенной
на расстояние свыше 10 км. Эти волны в теле человека затухают
слабее, чем инфракрасное излучение. Поэтому с помощью приборов для
измерения слабых электромагнитных полей этого диапазона частот,
так называемых СВЧ-радиометров, можно измерить температуру
в глубине тела человека.
Волны из тела человека принимают посредством контактной
антенны - аппликатора. Дистанционные измерения в этом
диапазоне, к сожалению, практически невозможны, так как волны,
выходящие из тела, сильно отражаются обратно от границы тело-воздух.
Главная трудность при анализе измерений глубинной
температуры тела по радиотепловому излучению на его поверхности состоит
в том, что трудно локализовать глубину источника температуры. Для
ИК-излучения эта проблема не возникает. Излучение поглощается на
глубине 100 мкм, так что его источником однозначно является
поверхность кожи. Радиоволны СВЧ-диапазона поглощаются на
расстоянии, которое составляет несколько сантиметров (рис. 4.55).
Средняя глубина, с которой измеряется температура,
определяется глубиной проникновения υ. Она зависит от длины волны и типа
ткани. Чем больше в ткани воды (электролита), тем с меньшей
глубины можно измерить температуру: в жировой ткани с низким
содержанием воды υ = 4-8 см, а в мышечной ткани (с высоким
содержанием воды) эта величина уменьшается до значений υ = 1,5-2 см.
Глава 4. Электробиология
415
υ, см
6
6
4
2
20 40 60 /, см
Рис. 4.55. Зависимость глубины проникновения (\) дециметровых волн от длины
волны в свободном пространстве для тканей, содержащих много электролита
(мышцы) и мало (жировая ткань)
4.5.5. Электромагнитные излучения инфракрасного
и оптического диапазонов
Инфракрасное излучение (диапазон 1012-10м Гц). Любое
нагретое тело излучает электромагнитные волны за счет преобразования
энергии теплового движения частиц тела в энергию излучения.
Поверхность тела человека, его органы и ткани, имеющие температуру
жизнедеятельности 28-42 °С, испускают тепловое излучение в инфракрасном
диапазоне. Максимум излучения (если считать среднюю температуру
кожи 33-34 °С) соответствует, согласно закону Вина, длине волны
9,6 мкм. Точнее можно охарактеризовать распределение энергии,
испускаемой телом человека в инфракрасном диапазоне, следующими
цифрами: на область длин волн 0,8-5 мкм приходится всего 1% излучения,
5-9 мкм - 20%, 9-16 мкм - 38% и от 16 мкм и выше - 41%. По другим
данным, спектральное распределение энергии таково: диапазон 3-
6 мкм-4%, 6-12 мкм-37%, 12-24 мкм-41%, 24-50 мкм-14%.
В длинноволновой области спектра (5-25 мкм) кожа человека
излучает практически как абсолютно черное тело, независимо от
расовой принадлежности, степени пигментации и других
индивидуальных анатомо-физиологических особенностей. Абсолютно черным
телом называется тело, поглощающее полностью все падающие на
него электромагнитные волны при любой собственной температуре.
416
Биофизика
Реальные тела не являются абсолютно черными, однако некоторые
из них по оптическим свойствам близки к таковым - сажа,
платиновая чернь, черный бархат в области видимого света.
В среднем 1 см2 кожного покрова человека излучает поток
энергии около 40 Вт. Инфракрасное излучение различных участков
поверхности тела определяется тремя факторами: особенностями ва-
скуляризации поверхностных тканей, уровнем метаболических
процессов в них и различиями в теплопроводности. Последние
обусловлены в основном разным развитием жировой клетчатки.
При соблюдении стандартных методических условий
регистрируемая топография излучения характерна для данного человека и
воспроизводится от наблюдения к наблюдению. Топография излучения
для всех здоровых людей имеет много общего. Наиболее
существенной чертой является симметрия излучения поверхности тела
срединной линии.
• Нарушения инфракрасного излучения могут наблюдаться в
следующих случаях:
1) необычные структурные соотношения сосудистой сети -
врожденные аномалии, сосудистые опухоли;
2) изменения тонуса сосудов - нарушения вегетативной
иннервации, рефлекторные изменения тонуса;
3) местные расстройства кровообращения - травмы, тромбоз,
склероз сосудов;
4) нарушения венозного кровотока - застой, обратный ток
крови при недостаточности клапанов вен;
5) локальные изменения теплопродукции - воспалительные
очаги, опухоли, ревматический артрит;
6) изменения теплопроводности тканей - отек, уплотнения
тканей, изменения содержания жира.
Излучение в видимой и ультрафиолетовой областях спектра.
Оптическое излучение тела человека надежно регистрируется с
помощью фотометров, работающих в режиме счета квантов. В этих
устройствах используют высокочувствительные фотоэлектронные
умножители (ФЭУ), способные выдавать на выходе
кратковременные импульсы тока, которые затем считаются с помощью
специальных электронных счетчиков.
Глава 4. Электробиология
417
Измерения, проведенные в ряде лабораторий, показали, что
1 см2 кожи человека за 1 с спонтанно излучает во все стороны 6-
60 квантов, главным образом, в сине-зеленой области спектра.
Светимость различных участков кожи неодинакова: наиболее сильное
излучение исходит от кончиков пальцев, гораздо слабее, например,
от живота или предплечья. Это свечение не связано с наличием
загрязнений на коже и зависит от функционального состояния
пациента, снижаясь в покое и повышаясь с усилением его активности.
Можно индуцировать свечение кожи, например, с помощью
обработки ее перекисью водорода или предварительной засветкой
кожи. Излучение на длине волны 254 нм, соответствующее пику
поглощения ДНК, вызывает фосфоресценцию. Предварительная
засветка вызывает усиление свечения в тысячи раз, которое затем
спадает во времени по сложной кинетической кривой с несколькими
постоянными времени от единиц до десятков минут.
Оптическое излучение кожи не является тепловым.
Интенсивность теплового излучения в оптическом диапазоне ничтожна: с 1 см2
поверхности тела один квант в среднем может излучаться лишь за
много секунд.
Наиболее вероятный механизм спонтанного свечения - это хе-
миолюминесценция, вызванная перекисным окислением липидов,
которое сопровождается появлением свободных радикалов. При
взаимодействии таких молекул в определенном проценте случаев
происходит излучение света. При индуцированном свечении
возможны и другие механизмы, например, измерено излучение, связанное
с генерацией активных форм кислорода при активации нейтрофилов.
Практически в основе всех излучений тканей организма в
видимой и ультрафиолетовой областях спектра лежит та или иная
разновидность люминесценции (рис. 4.56).
Разновидностью электролюминесценции является эффект
Кирлиана (автоэлектронная эмиссия, автоионная эмиссия) -
возбуждение люминесценции в электрическом переменном поле частотой
10-100 кГц при напряжении на обкладках конденсатора от 5 до 30 кВ.
Эффект наблюдается на живых и мертвых биообъектах, а также на
неорганических образцах самого разного характера. В биологии
и биофизике исследования эффекта имеют прикладной характер, но
27-9843
418
Биофизик»
Интенсивность,
имп. в мин.
10
5
1
12 3 4 е, кВт/см
Рис 4.56. Зависимость интенсивности хемилюминесценции
(температура 36 °С. видимая область спектра)
от напряженности электростатического поля Ε
• - 5% концентрация эритроцитов в физиологическом растворе;
А - плазма крови
получаемые результаты являются чисто качественными, так как
регистрация ведется либо визуально, либо с помощью фотографирования.
Кожа лица взрослого человека, облучаемая фиолетовым светом
с длиной волны 400-410 нм, флуоресцирует красным светом.
Светящиеся красные точки соответствуют устьям волосяных фолликулов.
Флуоресцентные методы исследования применяются в различных
областях медицины для решения задач экспресс-диагностики при тех
или иных патологических состояниях. Так, в офтальмологии
используется флуоресцентная ангиоскопия глазного дна, в стоматологии -
диагностика начального кариеса, в онкологии - флуоресцентная
диагностика гиперплазии молочной железы.
В биообъектах наряду с индуцированной физическими
факторами люминесценцией имеет место и биохемеолюминесценция, энергию
которой поставляют специфические эндогенные химические и
биохимические реакции.
...:/^^-^
Глава 4. Электробиология
419
Ультрафиолетовое излучение тканей и клеток организма лежит
в области длин волн 190-340 нм. Его субстратом служат белки,
полипептиды и углеводы, оно полностью отсутствует у жиров.
Относительно интенсивности излучения можно привести следующие
экспериментальные данные. При сильной тетанизации портняжной мышцы
лягушки 1 см2 поверхности мышцы излучает 600-2000 квантов в
секунду, 1 см2 поверхности сердца лягушки в среднем излучает 400
фотонов в секунду, а за период систолы - 800-1200 фотонов в секунду.
По другим данным интенсивность ультрафиолетового свечения
тканей составляет 10-700 фотонов с 1 см2 в секунду .
Ультрафиолетовое излучение проявляется в трех основных
биологических эффектах.
1. Цитопэтический зеркальный эффект - дистантная передача
информации от одной герметически изолированной культуры клеток
к другой через кварцевую пластинку толщиной 0,2-2 мм. Если
первую культуру клеток подвергнуть действию поражающего агента
(вирус Коксаки А-В, вирус классической чумы птиц, аденовирус-5,
токсическая доза дихлорида ртути, летальная доза ультрафиолетовой
радиации), то в интактной культуре развивается поражение по
морфологической картине, близкое к поражению образца, непосредственно
контактирующего с поражающим агентом. Обязательные условия
реализации эффекта:
а) вращение камер с культурами клеток со скоростью 25 об/ч;
б) полное затемнение камер (на свету эффект не проявляется);
в) экспозиция камер не менее 4 ч;
г) использование только кварцевого стекла.
Эффект предложено использовать для более
целенаправленного отбора препаратов при хемиотерапии опухолей .
2. Некробиотический эффект - испускание растительными
и животными тканями ультрафиолетового излучения в момент
гибели под действием химических агентов.
3. Эффект стимуляции клеточного деления эндогенным
ультрафиолетовым излучением. Считают, что это излучение является
необходимым условием митоза, в связи с чем оно получило название
митогенетического.
420
Биофизика
4.6. Электрическая активность органов
4.6.1. Биофизические принципы исследования
электрических полей в организме
Электрическая активность отражает уровень активности
клеток, тканей и органов. Регистрация и анализ электрической
активности позволяют проводить биофизические и медико-биологические
исследования с целью изучения функциональной активности органов
и тканей, а также для проведения клинической диагностики.
При переходе от клеточного уровня на органный возникает
задача описания распределения электрических потенциалов на
поверхности этого органа в результате последовательного возбуждения
отдельных его клеток. В процессе жизнедеятельности состояние органа,
а следовательно, и его электрическая активность меняются с течением
времени. Это вызвано прежде всего распространением возбуждения
по нервным и мышечным волокнам. В исследовательских целях
можно измерять разность потенциалов непосредственно на поверхности
или на внутренних структурах изучаемого органа (сердца, мозга
и др.). Однако в клинической практике такое прямое измерение
разности потенциалов на органе трудно осуществимо.
Для оценки функциональной активности органа посредством
исследования электрических процессов используется принцип
эквивалентного генератора. Он состоит в том, что изучаемый орган
представляется моделью единого эквивалентного генератора.
Считается, что этот эквивалентный генератор находится внутри организма
и создает на поверхности тела электрическое поле, которое
изменяется в соответствии с изменением электрической активности
изучаемого органа.
В теории Эйнтховена, сердце, клетки которого возбуждаются
в сложной последовательности, представляется токовым диполем
(эквивалентный генератор). Аналогично сердцу рассматриваются
и другие органы, для которых характерно возбуждение (головной
мозг, скелетные мышцы и др.). Кривую, отображающую изменение
во времени разности потенциалов на поверхности органа, ткани,
всего тела человека или животного, происходящие вследствие
возбуждения соответствующих органов и тканей, называют электрограммой.
Глава 4. Электробиология
421
По названию электрограммы можно судить об органах и
тканях, возбуждение которых приводит к появлению регистрируемых
изменений разности потенциалов: сердца - ЭКГ
(электрокардиограмма), сетчатки глаза - ЭРГ (электроретинограмма), головного мозга -
ЭЭГ (электроэнцефалограмма), скелетных мышц - ЭМГ (электро-
миограмма), кожи - КГР (кожногальваническая реакция по И.Р.
Тарханову).
Потенциалы и токи внутри и на поверхности биологических
объектов являются непрерывными функциями положения точки
в пространстве. Клетки, ткани и органы в процессе возбуждения
являются источниками электрических полей. Поэтому система из двух
электродов, приложенных к разным участкам тела, и вольтметра
позволяет зарегистрировать разность потенциалов двух точек
пространства. Электрическое поле описывается напряженностью Е, которая
определяется как градиент скалярного потенциала Ф, взятый с
отрицательным знаком:
E = -V<P. (4.154)
Согласно закону Ома, плотность электрического тока J
и электрическая напряженность Ε связаны следующим соотношением:
у=Л£=-ЛУФ, (4.155)
где А-удельная электропроводность среды, через которую течет
ток. Это уравнение показывает, что плотность тока J совпадает по
направлению с электрической напряженностью Е, если удельная
электропроводность Λ является скалярной величиной. В то же время
величина У при заданной величине Ε может быть больше или меньше
в зависимости от значения удельной электропроводности.
Если в пространстве объемом ν имеются области с плотностью
источников тока /ν (χ, у, ζ), то для них можно записать уравнение
VJ=/V, (4.156)
так как дивергенция вектора, определяющая суммарный поток
на единицу объема, равна плотности источников. Если
рассматривается произвольная область пространства, то возможны различные ситуа-
422
Биофизика
ции. Одна из возможностей - отсутствие какого-либо тока в данной
области, при этом обе части уравнения (4.156) равны нулю. Другая
возможность состоит в том, что ток в данной области существует,
однако суммарный втекающий в нее ток точно равен вытекающему.
В этом случае обе части уравнения (4.156) по-прежнему равны нулю.
Третья возможность - возникновение некоторой части тока внутри
самой области и наличие соответствующего вытекающего из нее тока;
тогда обе части уравнения (4.156) оказываются положительными
величинами. Наконец, четвертая возможность состоит в наличии части
тока, только втекающей в данную область и не вытекающей наружу;
соответственно при этом обе части уравнения (4.156) отрицательны.
Выведем уравнения, связывающие потенциал непосредственно
с интенсивностью порождающих его истоков и стоков тока.
Вычисление дивергенции от уравнения (4.155) дает с учетом уравнений
(4.156) и (4.154)
VJ = IV=-AV2<P. (4.157)
Таким образом, для области, имеющей постоянную удельную
проводимость и содержащей источники тока с плотностью /,
потенциал Φ описывается уравнением Пуассона
У2Ф = -^. (4.158)
Л
Частным случаем является равенство нулю плотности
источников / в рассматриваемой области, т. е. область однородна с точки
зрения электропроводности. Этот случай однородной
электропроводной области, не содержащей источников, характеризуется
условием сохранения тока VJ = 0. Уравнение (4.157) с требованием
равенства нулю / дает уравнение
ν7 = -Λν2Φ = 0. (4.159)
При этих же условиях уравнение (4.158) превращается в
уравнение с частными производными, получившее название уравнения
Лапласа:
Глава 4. Электробиология
423
V2<Z>=0. (4.160)
Решение уравнения Пуассона (4.158) для потенциала Φ можно
записать в интегральной форме
* = -τί—· (4Л61)
где V- объем сферического пространства, г - радиус сферы.
В том, что последнее выражение является решением уравнения
(4.157), можно убедиться, вычисляя лапласиан от обеих частей
уравнения (4.161). Заметим, что уравнение (4.161) выражает
электрический потенциал Ф, создаваемый заданным источником с
интенсивностью /, тогда как уравнения (4.155)—(4.158) дают возможность
определить плотность источников / по известному электрическому
потенциалу Ф.
Уравнения, представленные выше, аналогичны уравнениям,
используемым при исследовании задач электростатики.
Основные уравнения для электростатического поля имеют
следующий вид:
Е = -УФ, (4.162)
D=e£, (4.163)
ν2Φ = -£, (4.164)
ε
0 = J_fP^, (4.165)
4πεJ г
где ρ - плотность зарядов (источников) и ε - диэлектрическая
проницаемость. Для электрического смещения (электрической
индукции) D можно записать следующее уравнение:
VD=p.
(4.166)
424
Биофизика
Уравнение (4.165) можно рассматривать как обобщение закона
Кулона, причем оно в то же время является решением уравнения
Пуассона (4.164) в интегральной форме.
Далее, уравнение (4.162) идентично вышеприведенному
уравнению (4.154), а уравнения (4.163), (4.164) и (4.166) в точности
совпадут с соответствующими уравнениями (4.155), (4.158) и (4.156),
если осуществим следующую замену величин:
ε-» Л, (4.167)
D^J, (4.168)
р-»/„. (4.169)
Это соответствие представляет собой одно из проявлений
принципа двойственности.
Таким образом, результаты, полученные в одной области
(например, в физике), можно непосредственно перенести на другую
область (например, на электрофизиологию). Однако важно иметь в
виду, что двойственность еше не означает полной эквивалентности,
ибо удельная проводимость Л имеет совершенно иной физический
смысл, чем диэлектрическая проницаемость ε.
Как уже говорилось, при изучении механизма возникновения
электрограмм ткани и органы как источники электрического поля
представляют в виде эквивалентного электрического генератора.
Почти во всех существующих моделях электрическую активность
органов и тканей сводят к действию определенной совокупности
токовых электрических генераторов, находящихся в объемной
электропроводящей среде. Эквивалентная схема токового
генератора в проводящей среде представлена на рис. 4.57. Токовый
генератор имеет высокое внутреннее сопротивление R, во много раз
превосходящее сопротивление внешней нагрузки (среды) R0. По закону
Ома для полной электрической цепи / = /о = ЭДС/(7? + Rq), где /
и 10 - сила тока в генераторе и суммарного тока в среде; ЭДС -
электродвижущая сила генератора. Поскольку R» Rq, I = I0 ~ ЭДС/R.
Согласно этому соотношению, сила тока в генераторе и суммарного
тока во внешней среде (нагрузка) не зависит от сопротивления
Глава 4. Электробиология
425
[К
-О-
б
Рис. 4.57. Эквивалентная электрическая схема токового электрического
генератора и внешней проводящей среды; а, б- полюсы генератора
внешней среды. Для токовых генераторов выполняется правило
суперпозиции электрических полей: потенциал поля совокупности
генераторов равен алгебраической сумме потенциалов полей,
создаваемых отдельными генераторами.
Пространственная структура электрического поля,
создаваемого во внешней среде генератором, определяется положением его
полюсов. Для расчета потенциалов этого поля генератор представляют
в виде токового электрического диполя - системы из
положительного полюса (истока электрического тока) и отрицательного полюса
(стока), расположенных на небольшом расстоянии друг от друга.
Важнейший параметр токового электрического диполя -
электрический дипольный момент р. Это векторная величина,
определяемая соотношением p = Id,где /-ток в диполе (равный суммарному
току во внешней среде), d - вектор расстояния между полюсами.
Направление вектора дипольного момента принимается от
отрицательного полюса к положительному (совпадает с направлением тока
внутри диполя).
Диполи в зависимости от их размера разделяют на два типа:
точечные и конечные. Точечным называют диполь, который занимает
бесконечно малый объем пространства (с/—» 0). Теоретически
рассматривают также электрическое поле отдельных полюсов диполя,
которые в таком случае называются монополями.
В дальнейшем будем принимать, что окружающая токовые
диполи среда однородна в электрическом отношении, ее удельная
электропроводность по всем направлениям одна и та же. В организме
окружающая токопроводящая среда имеет конечную протяженность,
426
Биофизика
так как ограничена по поверхности тела изолятором (воздухом). Это
ограничение среды оказывает влияние на структуру внешних
электрических полей тканей и органов. В ряде случаев механизм генези
этих полей изучают при допущении, что окружающая генератор
среда бесконечна.
4.6.2. Поле монополя
Монополъ - это одиночный полюс, который в теории поля токов
представляет собой уединенный (точечный) источник или сток тока
в электропроводной среде. При постановке и решении
электробиологических задач чрезвычайно редко используется понятие монополя,
так как все биоэлектрические источники содержат совокупность
источников и стоков. Тем не менее, соотношения между полями
потенциала и тока монополя имеют важное значение, поскольку монополь
является элементом, используемым при формировании более
сложных и близких к реальным условиям конфигураций источника тока.
Кроме того, источники искусственного происхождения могут на
самом деле создавать в ограниченной области пространства структуры
поля, соответствующие монополю.
Пусть точечный источник электрического тока - монополь -
помещен в однородную и бесконечно протяженную
электропроводную среду с удельной электропроводностью Λ. Положение
источника определяется координатами (х, у, ζ), как показано на рис. 4.58.
Вследствие однородности среды ток течет по радиальным
направлениям, причем плотность тока на каждой из концентрических сфер
постоянна. Вследствие непрерывности тока значение полного тока,
пересекающего сферическую поверхность с любым значением
радиуса г, должно равняться одной и той же величине /0. Поэтому
плотность тока (J) равняется току /0, разделенному на площадь сферы
с радиусом г. Чтобы получить выражение для этой величины как
векторного поля J, нужно дополнительно указать, что она направлена
радиально. В итоге получим
J=^ar, (4.170)
4π
Глава 4. Электробиология
All
Μ *",/.*·)
*-^. -'
Рис. 4.S8. Течение тока от точечного источника (монополя)
где аг - единичный вектор, направленный по радиусу от центра к
периферии, и
г2 =(х -х')2 +(у-у')2 +(ζ - ζ')2 (4.171)
где (х\у',ζ')- координаты положения точки пространства, в
которой определяется (наблюдается) плотность тока.
Теперь можно получить уравнение для потенциала
электрического поля, подставляя уравнения (4.155) и (4.154) в уравнение
(4.170):
УФ = --Атаг, (4.172)
4πΑτ
откуда
άΦ I
о
dr 4лАг2
(4.173)
Интегрирование последнего уравнения по г приводит к
выражению для скалярного электрического потенциала Ф, создаваемого
монополем, или точечным источником тока:
4пАг
428
Биофизика
4.6.3. Поле диполя
Диполь - это совокупность точечного источника и точечного
стока, расположенных предельно близко один от другого. Наиболее
простой формой представления биоэлектрических источников
является именно диполь. Например, ток может вытекать из мембраны
клетки возбудимой ткани в одной точке и втекать обратно в
мембрану в другой, соседней точке.
Предположим, что в начале координат помещены точечный
источник с интенсивностью /0 и точечный источник с
интенсивностью - /0. Эти источники взаимно компенсируются, и
результирующий потенциал их поля будет равен пулю. Если же /0 смещен в
пространстве на малое расстояние d, то компенсация будет неполной.
Теперь суммарное поле в точности равняется изменению поля,
обусловленному смещением источника /0 на расстояние d, и его
потенциал выражается как Φά ={<3[/0 / 4πΛ;-] Idd\d, где г = [(х -х')2 +
+0,-/)2+(ζ-ζ')2Γ·
Тот же самый результат можно получить при помощи более
формального подхода, учитывая, что расстояние от стока до
наблюдаемой точки поля равно ;·, а расстояние от источника до этой точки
(4.175)
Соответствующие геометрические соотношения показаны на
рис. 4.59.
Если расстояния гиг, велики по сравнению со смещением d,
то величину г,, можно выразить через величшгу ;· как
1 1 -М1.Ъ. (4.176)
равно г,, так что
φ = Ό 1 + '. 1
4πΛ г 4πΛ /·,
Л+А
г dd
"Г
г
Теперь потенциал поля диполя Φ можно выразить, объединяя
уравнения (4.175) и (4.176):
Γπβββ 4. Электробиология
429
ФУХ)
Рис. 4.59. Построение диполя как предельный переход при сближении двух равных
по абсолютной интенсивности 10 и противоположных по полярности точечных
источников (d —> 0; lgd —>p и остается конечной величиной)
Ф,
4πΛ dd
d.
(4.177)
В уравнение (4.177) входит производная по направлению от
функции Уг, определяемая уравнением
д
3d
Г1Ί
г
= V
Г Π
_/·_
- а,
(4.178)
где ad - единичный вектор, ориентированный в направлении
смещения d. Левая и правая части последнего уравнения тождественны
Г
это вектор, направленный в сторону макси-
между собой, ибо V
мальной скорости возрастания величины Уг, а скалярное умножение
на ad дает компоненту вектора в направлении смещения d.
Следовательно,
Φ
4πΛ[
a.\d = l°_
d{ 4πΛ
(4.179)
430
Биофизика
if./.*')
Рис. 4.60. Поле диполя
Источник находится в точке (ζ, у, ζ), поле наблюдается в точке (х\ у\ ζ')
Поле двух равных по абсолютной величине и
противоположных по полярности точечных источников, разделенных малым
расстоянием, обычно называют полем диполя. Хотя эти соотношения
широко используются во всех случаях, когда величина d мала по
сравнению с г, для математически корректного определения диполя
необходимо перейти к пределу при d -> °о и сохранении постоянного
и конечного значения произведения I0d - р. Тогда уравнение (4.179)
можно записать в следующем виде:
Ф,=
4πΛ
1
(4.180)
где ρ - дипольныи момент.
На рис. 4.60 иллюстрируется диполь с моментом р,
расположенный в точке (х, у, ζ), и точка (х',у\ ζ'), в которой наблюдается поле
диполя. Расстояние между указанными точками равно г.
Оператор градиента в уравнении (4.180) предусматривает
вычисление частных производных по координатам точки расположения
источника (символы без штрихов) в соответствии с тем, как этот
оператор был введен для замены дифференцирования по направлению в
точке источника. Используя выражение для расстояния /·
r=[0c-;ty+(>'-/r+(z-z')2]
(4.181)
и выполняя операцию градиента с учетом формулы (4.178), получим
Глава 4. Электробиология
431
1
—
г
д
=
ох
1
—
г
- д
ar н
ду
1
—
г
- д
av н
' dz
1
—
Г
— а, =
1
X -X - у -V - Z-Z -
г г г
(х -х')ах +(у -у')ау +(z - z')a
(4.182)
или
(4.183)
где аТ - единичный вектор, направленный от точки источника к
точке наблюдения. Следовательно, выражение (4.18Θ) можно
записать как
Ф,=
аг-Р
ΛπΑτ2
(4.184)
где ρ = /0 d и ρ = аг · р. Во многих случаях бывает удобно
направить ось координат ζ вдоль вектора р, тогда
_ pcosQ
φ =,
ΛπΑτ
так как аг ■ az =cos9 (где θ - полярный угол).
(4.185)
4.6.4. Эквивалентный электрический
генератор сердца
В возбужденном миокарде всегда имеются много диполей
(назовем их элементарными). Потенциал поля каждого диполя в
неограниченной среде подчиняется уравнению (4.185) и именуют диполь-
ным потенциалом (потенциалом точечного диполя). Отметим, что
этот потенциал любого /-го элементарного диполя пропорционален
Pj cos θ, {pj - модуль вектора Pj, т. е. проекция вектора дипольного
432
Биофизика
момента на прямую, соединяющую начало диполя и точку измерения
потенциала).
Потенциал (Ф0) электрического поля сердца складывается из
дипольных потенциалов элементарных диполей. Поскольку в
каждый момент кардиоцикла возбуждается сравнительно небольшой
участок миокарда, расстояния от всех диполей до точки измерения
потенциала примерно равны друг другу, и Ф0 приближенно
описывается выражением:
φο=-7Τ-τί>>ς05θ;' (4-186)
в котором г - одинаковое для всех диполей расстояние до точки
измерения потенциала, т - количество диполей. Сумму проекций в этом
выражении можно рассматривать как проекцию вектора дилольного
момента (р0) одного токового диполя, у которого р0 = jT ρ .. Этот ди-
поль называют эквивалентным диполем сердца. Таким образом,
потенциал внешнего электрического поля сердца можно представить
в виде дипольного потенциала одного эквивалентного диполя:
ф·'^· <4187>
где θ - угол между р0 и направлением регистрации потенциала;
р0 - модуль вектора pQ.
Задача осложняется тем, что сердце функционирует в среде,
ограниченной поверхностью организма. Трудно учесть влияние этой
границы ввиду сложности ее геометрической конфигурации. Часто
поверхность организма рассматривают как поверхность простого
геометрического тела, например, шара, в центре которого располагают
отрицательный полюс эквивалентного диполя сердца. Специальные
расчеты показывают, что тогда
p0cosQ rp ocos0
4πΛτ2 2π/\3Λ
0o=t^+2^L, (4.188)
Глеев 4. Электробиология
433
где гс - радиус шара.
При измерении потенциала на поверхности такого шара, когда
Зр0 cos θ
4π/-2Λ
Ф0 =-^pL. (4.189)
Из уравнений (4.187) и (4.188) видно, что ограничение среды
сферической поверхностью приводит к увеличению дипольного
потенциала, но характер его зависимости о г г и θ сохраняется прежним.
Однако если точка регистрации находится на большом расстоянии от
поверхности (гс > г), то в уравнении (4.188) вторым членом в правой
части можно пренебречь и ограничивающая поверхность уже мало
сказывается на величине дипольного потенциала.
Модель, в которой электрическая активность миокарда
заменяется действием одного эквивалентного точечного диполя и
потенциалы внешнего поля описываются выражениями (4.187) или (4.188) -
(4.189), называют диполъным эквивалентным электрическим
генератором сердца.
Рассчитать теоретически абсолютное значение Ф0 не
представляется возможным, поскольку в данной модели конкретная природа
диполя, а следовательно, и величина дипольного момента р0
неизвестны. Справедливость уравнения (4.186) подтверждается тем, что
измеряемые на поверхности тела потенциалы в фиксированный
момент кардиоцикла оказываются приближенно пропорциональными
cos θ и обратно пропорциональными г2.
При исследовании зависимости потенциалов от /· на небольшом
удалении от сердца обнаруживается, что регистрируемые величины
уменьшаются с ростом /· значительно резче, чем это должно быть по
уравнению (4.187). Это объясняется тем, что в теории для небольших
θ и ;· потенциал элементарных конечных диполей сердца занижен
в процессе упрощения выражения (4.188). Для более точного
описания внешнего электрического поля сердца необходимо учитывать
другие члены мультиполыюго разложения (4.188). Второй член этого
разложения называется квадрупольным потенциалом, следующий
член, пропорциональный //г4, - октупольным потенциалом и т. д. Эти
434
Биофизик»
члены существенны только при малых значениях г, поскольку они
гораздо более резко падают с увеличением расстояния, чем дипольный
потенциал. Квадрупольный и последующие члены мультипольного
разложения потенциала имеют более сложную зависимость от θ по
сравнению с первым дипольным членом [см. уравнение (4.188)].
Квадрупольный, октупольный и другие члены
рассматриваемого мультипольного разложения потенциала можно получить в виде
потенциала внешнего электрического поля более сложных, чем диполь,
электрических генераторов: точечных квадруполя, октуполя и т. д.
Наиболее простой из таких мультиполей - квадруполь. Если
провести расчет потенциала этого квадруполя в неограниченной
среде в точке В, как это описано выше в случае диполя, можно показать,
что дипольные потенциалы двух диполей в составе квадруполя
в сумме дают нуль. Потенциал, создаваемый квадруполем,
оказывается равным удвоенному второму квадрупольному члену в правой
части выражения (4.188). Квадруполи иной структуры отличаются
по зависимости от Θ.
Физико-математическая модель, описывающая потенциал
внешнего электрического поля сердца мультипольным разложением
типа выражения (4.188), в котором каждый член соответствует
потенциалу точечного мультиполя, называется мультипольным
эквивалентным электрическим генератором сердца. На практике оказывается
достаточным принимать в расчет только дипольный и
квадрупольный члены.
К настоящему времени разработаны модели электрической
активности сердца с целью рассчитать ЭКГ человека с учетом
морфологических, цитологических и физиологических параметров миокарда.
Такие модели описывают электрические свойства сердца
совокупностью большого числа токовых диполей и поэтому называются много-
дипольными эквивалентными электрическими генераторами. При
исследовании этих моделей исходят из того, что в конечном счете
источниками тока в миокарде являются мембраны возбудимых клеток
сердечной мышцы.
Полное описание электрического состояния сердца,
математическое описание распределения мембранных потенциалов по всему
Глава 4. Электробиология
435
объему сердца в каждой клетке и описание изменения этих
потенциалов во времени практически невозможно.
Исследуя изменения разности потенциалов на поверхности
человеческого тела, можно судить о проекциях дипольного момента
сердца, следовательно, о биопотенциалах сердца. Эта идея положена
в основу модели Эйнтховена, голландского ученого, создателя
электрокардиографии, нобелевского лауреата 1924 г.
Основные постулаты этой модели:
1. Электрические поле сердца представляется как
электрическое поле точечного токового диполя с дипольным моментом,
называемым интегральным электрическим вектором сердца (ИЭВС)
(складывается из диполей разных частей сердца: ρ = ^ρ .).
2. ИЭВС находится в однородной изотропной проводящей
среде, которой являются ткани организма.
3. ИЭВС изменяется по величине и направлению. Его начало
неподвижно и находится в атриовентрикулярном узле, а конец
описывает сложную пространственную кривую, проекция которой на
фронтальную плоскость образует за цикл сердечной деятельности
(в норме) три петли: Р, QRS и Т.
Очевидно, в этом случае в разных точках поверхности грудной
клетки человека в некоторый момент времени будут возникать
различные но величине и знаку электрические потенциалы. В
следующий момент времени распределение этих потенциалов на
поверхности тела изменится (рис. 4.61).
Приблизительно 2/3 карты соответствуют поверхности груди,
а оставшаяся треть справа - спины. Распределение потенциалов
показано для некоторого момента времени, отмеченного черточкой на
комплексе QRS опорной ЭКГ, показанной внизу. Сплошными
линиями отмечены изопотенциальные кривые для положительных
потенциалов, прерывистыми - для отрицательных. Толстой линией отмечена
кривая нулевого потенциала. Значения наибольшего и наименьшего
потенциалов, наблюдающиеся в данный момент времени, приведены
снизу под картой, а положения максимума и минимуму отмечены на
карте большими знаками «+» и «-». Возникновение такого
распределения можно объяснить, полагая, что области отрицательного
потенциала проецируются на те участии желудочков сердца, которые уже
436
Биофизика
Грудь [— Спина
Рис 4.61. Распределение (карта) электрических потенциалов на поверхности
тела в момент формирования комплекса QRS
возбуждены, а положительные потенциалы - на участки миокарда,
где продолжает развиваться возбуждение.
Изменение величины и направления вектора ρ за один цикл
сокращения сердца объясняется последовательностью распространения
волн возбуждения по сердцу: волна начинает распространяться от
синусового узла по предсердиям (петля Р), атриовентрикулярному узлу,
по ножкам пучка Гиса к верхушке сердца и далее охватывает
сократительные структуры к базальным отделам комплекса QRS. Петле Τ
соответствует фаза реполяризации миокарда желудочков.
Эйнтховен предложил измерять разности потенциалов между
двумя из трех точек, представляющих вершины равностороннего
треугольника, в центре которого находится начало ИЭВС (рис. 4.62).
В практике электрокардиографии разности потенциалов
измерялись между левой рукой (ЛР) и правой рукой (ПР) - I отведение,
между левой ногой (ЛН) и правой рукой (ПР) - II отведение, между
левой ногой (ЛН) и левой рукой (ЛР) - III отведение. Руки и левая
нога рассматривались как проводники, отводящие потенциалы от
вершин треугольника Эйнтховена. На правую ногу накладывался
электрод заземления.
Электрокардиограмма - это кривая, отображающая изменение
во времени разности потенциалов в соответствующем отведении,
Глава 4. Эпектробиопогия
437
Рис. 4.62. Схема регистрации комплекса QRS электрокардиограммы
в трех стандартных отведениях. Знаки «+» и «-» соответствуют
знакам на осях ЭКГ в соответствующих отведениях
а значит, и временную зависимость проекции ИЭВС на линию
отведения (рис. 4.62).
Электрокардиограмма представляет собой сложную кривую
с пятью основными зубцами: Р, Q, R, S, Τ и тремя интервалами
пулевого потенциала. Для любого выбранного момента времени
направление и модуль интегрального электрического вектора сердца имеют
определенную величину, но проекции этого вектора на три
отведения различны. Поэтому ЭКГ в I, во II и в III отведениях имеют
разные амплитуды одноименных зубцов.
Гармонический спектр электрокардиограммы - набор
синусоидальных колебаний (гармоник), на которые, согласно теореме Фурье,
можно разложить сложное колебание, в покое содержит частоты от О
до 120 Гц. При повышении частоты сердечных сокращений высшие
гармоники приобретают большее значение.
438
Биофизика
Три отведения не дают полной информации о работе сердца.
Поэтому современная кардиология использует 12 стандартных
отведений и ряд специальных.
Однако модель Эйнтховена не является строгой. Она имеет ряд
допущений:
1. Организм не является однородной электропроводной
средой: кровь, лимфа, сосуды, мышцы и другие ткани имеют различные
удельные электропроводности. Кроме того, проводимость меняется
со временем, например, при вдохе и выдохе.
2. Вектор р, вращаясь, создает сложную объемную фигуру, а не
проекцию лишь на одну плоскость, и начало его может смещаться.
3. Не представляется возможным точно описать изменения ρ
сердца только изменением момента одного точечного диполя.
Однако медицинская практика доказывает, что эти недостатки
не столь существенны. Модель Эйнтховена успешно используется
в электрокардиографии.
В научных исследованиях разработана более точная мультипо-
льная модель сердца, учитывающая то, что сердце имеет конечные
размеры. В этой модели сердце представляется не одним, а многими
диполями.
Модель Миллера и Гезелоувитца, на которой они
проанализировали генез желудочковых компонентов ЭКГ, основывается на двух
главных положениях.
1. В отношении генеза ЭКГ сердце представляет собой
систему токовых электрических диполей; окружающая сердце
проводящая среда считается однородной.
2. Миокард представляет собой электрический синцитий, в
котором ток может протекать из клетки в клетку через щелевые
контакты, обладающие довольно высокой электропроводностью, и тем
самым создавать электрические диполи.
Дипольный момент ρ токового диполя, возникающего в
данном участке миокарда, можно найти приближенно из характеристик
электрического поля внутри клеток синцития. Выделим в миокарде
объем в виде прямоугольного параллелепипеда, ребра которого
параллельны координатным осям на расстояниях дг, у, ζ (рис. 4.63).
Положительные направления осей системы координат, определяющих
Глава 4. Эпектробиопогия
439
пространственное положение р, выберем одинаковыми с
положительными направлениями осей jc, у, ζ. Центр вектора ρ находится
в геометрическом центре Ε выбранного объема. Любой вектор в
трехмерном пространстве представляет собой сумму своих
геометрических проекций (рх, ру, рг)т координатные оси (в данном случае на
оси, проходящие через центры противоположных граней). Эту сумму
удобно записать в виде p = pxi + pyj + pzk,гдерх и др. - проекции;
i, j ,k - единичные (основные) векторы расстояния, показывающие
положительное направление и единицу масштаба осей х, у, ζ.
Вектор данной проекции можно считать вектором дипольного
момента токового диполя, расположенного параллельно
соответствующей оси расстояния. Полюсы такого диполя - грани объема,
перпендикулярные оси расстояния. Следовательно,
P = lxdj+Iydyj+I:dj (4.190)
где 1Х,1 ,1г - сила токов, протекающих внутри объема
параллельно осям jc, у, z, a dx,dy,d2 - расстояния между полюсами диполей
(между центрами противоположных граней): от В до N, от Ρ до С
и от Μ до А (рис. 4.63).
Величины 1Х,1' , Iг могут быть положительными или
отрицательными в соответствии со знаком рх, ру, р2. По закону Ома для
токов имеем выражения:
j _SX{0N-0B) t __Sy(0c-0P)
Ρ,Α ' ' Ρ«Λ ' (4.191)
J,(0A-0U)
г~ Pod. '
в которых Фм, Ф, и др. - потенциалы внутреннего поля на
поверхностях граней с центрами N, В и т. д.; р0 - удельное электрическое
сопротивление среды внутри объема (внутри клеток синцития); Sx, Sy
и Sz, - площади граней, перпендикулярных осям jc, у, ζ. Отметим, что
£х, Sy и Sz и, следовательно, dx,dy, d2 должны быть достаточно не-
440
Биофизика
Рис. 4.63. Схема к выводу формулы для расчета дипольных моментов
элементарных объемов миокарда
большими, чтобы потенциал в пределах данной грани можно было
считать постоянным.
При подстановке выражений (4.191) в уравнение (4.190)
окончательно получаем
-P--L·.
Φ., "Φ- Τ Фг. -Фв - Φ , -Φ
I +-
Р j+- A
(4.192)
где V0 = Sxdx = Svdy = Szdz величина объема.
Процедура моделирования включала следующие этапы.
Вначале желудочки равномерно разбивали на элементарные объемы. Затем
дипольный момент каждого элементарного объема рассчитывали по
уравнению (4.192). Этот расчет производился для последовательных
моментов времени через интервалы 10 мс исходя из
экспериментальных данных о форме потенциала действия мышечных клеток
желудочков и о распространении возбуждения по миокарду. В результате
электрическая активность желудочков была представлена в виде
совокупности около 4000 токовых диполей с моментами,
изменяющимися во времени в ходе кардиоцикла.
Глава 4. Электробиология
441
Поскольку расчет внешнего суммарного поля такого числа
диполей трудоемок и сложен, элементарные объемы при дальнейших
расчетах объединяли в 23 более обширных блока. Для каждого блока
определяли дипольный момент как сумму моментов составляющих
элементарных объемов. Такой суммарный дипольный момент
помещали в центр блока.
Наконец, для указанных 23 диполей из анатомических данных
находили расстояния до точек отведения ЭКГ на поверхности тела.
Рассматривалась поверхность тела от шеи до пояса. Эту поверхность
представляли в виде 1426 треугольных элементарных участков
непроводящей среды, чтобы учесть влияние ограничения на дипольные
потенциалы. Разность потенциалов между данными участками
поверхности тела рассчитывали как результат сложения внешних
полей диполей с помощью вычислительной машины.
Анализировались эквипотенциальные линии (линии с
одинаковым потенциалом) на поверхности тела в разные моменты кардиоцик-
ла и электрограммы желудочков для ряда отведений; точки
регистрации потенциалов указаны на рис. 4.64. Точки R, L и F, эквивалентные
точкам отведения по Эйтнховену (правая рука, левая рука и левая
нога) в практической электрокардиографии, располагались на торсе.
Расположение других точек отведения было обычным, как принято
в электрокардиографии. Были рассчитаны электрограммы
желудочков для 12 стандартных отведений: отведения I, II и III - разность
потенциалов соответственно между точками L и R,R и F,L и F; отведения
aVR, aVL, aVF - разность потенциалов соответственно между точкой
R и закороченными точками LF, между L и RF, F и LR, как показано на
рис. 4.64 для отведения aVR; отведения V1-V6 - разность
потенциалов между точками 1-6 и закороченными точками RLF, как это
изображено на рис. 4.64 для отведения V4. Оказалось, что рассчитанные
электрограммы желудочков (рис. 4.65), а также эквипотенциальные
линии на поверхности тела близки к тем же параметрам внесердечно-
го поля, непосредственно измеряемого на поверхности тела. Таким
образом, в теории многодипольного эквивалентного электрического
генератора сердца удается рассчитывать собственно
электрокардиограммы и объяснить механизм их генеза на уровне электрической
активности клеток миокарда.
442
Биофизика
а) 6)
Рис. 4.64. Схема расположения точек на поверхности тела человека,
для которых рассчитывались потенциалы внешнего поля желудочков
в модели многодипольного генератора сердца (ключ К замыкается при измерении
ЭКГ в отведении V4: а, б- виды спереди и сбоку соответственно)
На основе описанной модели были рассчитаны электрограммы
желудочков, содержащих очаги ишемического поражения. Было
показано, что известные из экспериментов электрокардиографические
признаки инфаркта миокарда и других ишемических поражений хорошо
воспроизводятся на модели. При этом выяснилось, что наблюдаемые
при инфаркте миокарда изменения электрограмм могут происходить
в результате уменьшения модуля потенциала покоя кардиомиоцитов,
увеличения времени деполяризации при генерации потенциалов
действия, уменьшения амплитуды и длительности потенциалов
действия и некоторых других сдвигов в электрической активности клеток.
Векторэлектрокардиография заключается в измерении вектора
дипольного момента эквивалентного диполя сердца на протяжении
кардиоцикла. Этот вектор называется интегральным электрическим
вектором сердца или просто вектором сердца. Его измерение
основано на том, что электрическое поле на поверхности тела, создаваемое
сердцем, определяется уравнениями типа (4.190)-(4.192). Измеряя
потенциалы Ф0 на поверхности тела и определяя соответствующим
образом г и а, легко определить электрический вектор р0 сердца, хотя
действительные значения / и d этого вектора остаются неизвестными.
Глава 4. Элвктробиология
443
-J^SK-
°-4с I > °-6с| > ,
Рис. ^.65. Пример ЭКГ здорового человека (1) и расчетные электрограммы
желудочков сердца человека (2) при нескольких отведениях
V- разность потенциалов в относительных единицах; t - время
По данным таких измерений максимальное значение модуля вектора
сердца составляет около 2 · Ю-5 А · м.
В векторэлектрокардиографии регистрируются два вида
кривых, характеризующих вектор дипольного момента эквивалентного
диполя сердца:
1) пространственная векторэлектрокардиограмма (ВЭКГ),
представляющая собой траекторию конца вектора pQ в трехмерном
пространстве в течение одного кардиоцикла;
2) плоские векторные электрокардиограммы (петли) - кривые,
описываемые в течение кардиоцикла концом проекции вектора
дипольного момента эквивалентного диполя на какую-либо плоскость
(рис. 4.66). На практике имеют дело в основном с плоскими ВЭКГ.
Для исследования ВЭКГ человека разработано несколько
систем отведении потенциалов, отличающихся по числу и расположению
отводящих электродов на поверхности тела, выбору плоскостей для
получения плоских ВЭКГ. Плоские ВЭКГ чаще всего анализируют
в декартовой системе координат с началом, расположенным в
геометрическом центре желудочков сердца или в центре среднего
горизонтального (трансверсального) сечения грудной клетки. Направление осей
координат относительно тела испытуемого: jc - справа налево; у -
сверху вниз; ζ - спереди назад. Плоские ВЭКГ получают в проекциях
на горизонтальную, фронтальную и сагиттальные плоскости. Пример
444
Биофизика
f
I
ю I
I
,
in
in —
£
QRS
in
i
I
1
§53. 1
S β β
S8*ifr
ί
S 5
* a-
4
8.3
1 |a
>4. ^ Ό *=
I
I
SI
δ δ λ ο
S*8 §£з
■β §\¥
* A- o
та
ь
ι
о 5Г
м с
з ι Ι <υ з
у >з s ^ ε
з <u ? о з·
5
?! 3
5. Ό α
а4 о з- §
§ 8 5 §
I N § $
s S * s
■1:1 »
§ §
? '
О I
0 §.
«) С"
1 sj
β з
§■
о
β
Глава 4. Электробиология
445
плоских ВЭКГ здорового человека приведен на рис. 4.66 (петли Ρ
волны не изображены). Хотя вид петель ВЭКГ несколько меняется от
индивидуума к индивидууму, их общая форма при этом сохраняется
(сравните кривые 2 и 4). При многих болезнях сердца форма плоских
ВЭКГ резко трансформируется, и это используется в диагностических
целях. Например, при инфаркте переднего участка межжелудочковой
перегородки и смежной передней стенки левого желудочка в QRS-пет-
ле ВЭКГ в проекции на горизонтальную плоскость отсутствует
нижняя часть (рис. 4.66, график 5).
4.6.5. Электрическая активность головного мозга
Экспериментальные данные свидетельствуют, что генез ЭЭГ
определяется в основном электрической активностью коры больших
полушарий головного мозга, а на уровне клеток - активностью ее
пирамидных нейронов. У этих нейронов выделяют два типа
электрической активности: импульсный разряд (потенциал действия)
длительностью около 1 мс и более медленные электротонические (градуальные)
колебания мембранного потенциала - тормозные и возбуждающие
постсинаптические потенциалы: соответственно ТПСП и ВПСП.
Тормозные ПСП пирамидных клеток генерируются в основном в теле
нейрона, а ВПСП - преимущественно в дендритах. Правда, на теле
нейрона имеется определенное количество возбуждающих синапсов,
и соответственно этому тело (сома) пирамидных нейронов способно
генерировать также и ВПСП. Длительность ВПСП и ТПСП
пирамидных клеток по крайней мере на порядок больше продолжительности
импульсного разряда.
Изменения мембранного потенциала обусловливают
возникновение в пирамидных клетках двух токовых диполей, отличающихся по
локализации (рис. 4.67). Один из них - соматический диполь с диполь-
ным моментом рси. Он формируется при изменении мембранного
потенциала тела нейрона. Ток в диполе и во внешней среде протекает
между сомой и дендритным стволом. Вектор дипольного
момента ~рт при импульсном разряде или генерации в теле нейрона ВПСП
направлен от сомы вдоль дендритного ствола, а ТПСП создает
соматический диполь с противоположным направлением дипольного момен-
446
Биофизика
та. Другой диполь, называемый дендритным, возникает в результате
генерации ВПСП на ветвлении апикальных дендритов в первом, плек-
симорфном слое коры; ток в этом диполе течет между дендритным
стволом и указанным ветвлением. Вектор дипольного момента рСД
дендритного диполя имеет направление в сторону сомы вдоль
дендритного ствола.
Черные прямоугольники показывают участки, в которых
генерируются постсинаптические потенциалы. Знаки «+» и «-»
обозначают полярность некоторых участков внешней поверхности клетки,
между которыми во внешней среде протекает ток, рСИ, рСТ, рсд, ркп -
векторы соматического диполя при импульсном разряде,
соматического диполя при генерации ТПСП, дендритного диполя при
генерации ВПСП и диполей квадруполя, образующегося при генерации
ВПСП на дендритном стволе.
Образование ВПСП в районе дендритного ствола без ветвления
приводит к появлению квадруполя, поскольку при этом от частично
деполяризованного участка ток внутри клетки распространяется
в двух противоположных направлениях, в результате чего
формируются два диполя с противоположным направлением дипольных
моментов ркп (рис. 4.67). Так как диполи малы по сравнению с
расстояниями до точек отведения ЭЭГ, внешним полем квадрупольного
генератора пирамидных клеток можно пренебречь.
Важное значение для выяснения механизма генеза ЭЭГ имеет
вопрос о том, какой тип электрической активности (потенциалы
действия или постсинаптические потенциалы) дает наибольший вклад
в потенциал внешнего поля головного мозга. Ясно, что для генеза
ЭЭГ наиболее существенна та электрическая активность, при
которой возникает диполь с большим дипольным моментом.
Практически электроэнцефалография осуществляется наложением на
поверхность черепа металлических пластинчатых электродов, которые
соединяют проводами со входом аппарата. Величину этого
дипольного момента можно оценить по протяженности внеклеточного поля,
например, по расстоянию, на котором потенциал падает до очень
малых значений или же в определенное число раз. К.Ю. Богданов
и В.Б. Головчинский рассчитали пространственное распределение
внеклеточного электрического поля пирамидных нейронов коры при
Глава 4. Элвктробиология
447
Рис 4.67. Возникновение токовых диполей в пирамидном нейроне новой коры
С, А, БД, ДС, АД-сома (тело), аксон, базальные дендриты, дендритный ствол
и дендриты апикального ветвления (соответственно). Ιο - локальные токи
448 Биофизика
V
3
2
1
О
-1
Рис. 4.68. Пространственная структура внешнего электрического
поля больших пирамидных нейронов коры головного мозга кошки
при импульсной (1) и градуальной (2) электрической активности
V- потенциал, относительные единицы; г -расстояние от тела
нейрона вдоль дендритного ствола, мм
импульсной активности и при градуальном изменении мембранного
потенциала сомы, обусловленном ВПСП. Этот расчет проводился на
основе кабельной теории при условии, что величина потенциала
действия на порядок превышает ВПСП.
На рис. 4.68 изображена полученная пространственная
структура электрического поля вдоль дендритного ствола и вокруг на
расстоянии около 0,01 мм от продольной оси этого ствола. Оказалось,
что внешнее поле пирамидного нейрона при импульсном разряде
очень резко уменьшается вдоль дендритного ствола и уже на
расстоянии около 0,3 мм потенциал падает практически до нуля. В
противоположность этому внеклеточное поле ВПСП характеризуется гораздо
большей протяженностью (примерно на порядок), и, следовательно,
при этой активности пирамидные клетки имеют гораздо более
высокий дипольный момент. Это различие находит объяснение при
рассмотрении пассивных электрических свойств дендритного ствола.
г, мс
Глава 4. Электробиология
449
По отношению к потенциалу действия ввиду его
кратковременности мембрана дендрита ведет себя как емкость, обладающая
низким сопротивлением току высокой частоты. Поэтому ток,
обусловленный импульсной активностью, циркулирует на небольшом
расстоянии от тела клетки. Емкость мембраны шунтирует отдаленные
участки ствола. Действительно, по данным микроэлектродных
исследований, внешнее электрическое поле пирамидных нейронов,
генерируемое потенциалом действия, не обнаруживается уже на расстояниях
более 0,1 мм. Таким образом, ЭЭГ должна в основном создаваться
«медленным» соматическим и дендритным диполями, возникающими
при генерации ТПСП и ВПСП. При изучении внешнего
электрического поля мозга регистрируют и интерпретируют переменный сигнал
ЭЭГ, а постоянную составляющую, как правило, не принимают во
внимание.
Как видно на рис 4.69, ЭЭГ фоновой активности мозга
представляет собой весьма сложную зависимость разности потенциалов
от времени и выглядит как совокупность случайных колебаний
разности потенциалов. Для характеристики таких неупорядоченых
колебаний используют параметры, известные из теории вероятностей:
среднюю величину и стандартное отклонение σ от средней
величины. Чтобы найти σ, выделяют участок на ЭЭГ, который разбивают на
небольшие равные интервалы времени, и в конце каждого интервала
(ίι, tjt tm на рис. 4.69) определяют напряжение V(VU V-,
^.Стандартное отклонение рассчитывают по обычной формуле:
σ=·ρ , (4.193)
I m-\
где V - среднеарифметическое значение разности потенциалов,
т - число отсчетов V. При отведении ЭЭГ от твердой мозговой
оболочки величина σ для фоновой активности составляет 50-100 мкВ.
Аналогичная характеристика (стандартное отклонение)
используется и для описания градуальной активности отдельных нейронов
(атд). При изучении ритмических ЭЭГ, характеризующихся опреде-
450
Биофизика
Рис. 4.69. Фрагмент фоновой ЭЭГ;
V-разность потенциалов, t - время
ленной амплитудой и частотой изменения разности потенциалов,
показателем величины ЭЭГ может служить амплитуда этих колебаний.
Регистрация и анализ временных зависимостей разностей
потенциалов, созданных мозгом на поверхности головы, используется
для диагностики различных видов патологии нервной системы: травм,
эпилепсии, психических расстройств, нарушений сна.
Электроэнцефалография применяется в медицине для определения области
опухоли мозга, для оценки функционального состояния мозга до и после
введения лекарственного препарата.
Регистрируемые разности потенциалов в 100 раз слабее, чем
в ЭКГ: 0,1-5 мВ в ЭКГ; 0,001-0,05 мВ в ЭЭГ. Поэтому усилители
биопотенциалов ЭЭГ должны иметь достаточно большие
коэффициенты усиления: 103-104 - в ЭКГ; 105-106 - в ЭЭГ.
ЭЭГ отражает интегральную активность огромного числа
нейронов коры головного мозга и распространение возбуждения в
нейронных сетях. Она имеет вид сложных регулярных колебаний с
различными частотами и амплитудой. Для исследования электрической
активности мозга при различных функциональных состояниях обычно
рассматриваются спектральные составляющие (простые
синусоидальные колебания различных частот и амплитуд, на которые, согласно
теореме Фурье, можно разложить сложное колебание -
электроэнцефалограмму).
Глава 4. Электробиология
451
У взрослого бодрствующего человека доминирует α-ритм -
колебания с частотой 8-13 Гц. Кроме того, при исследовании
электрической активности головного мозга наблюдается β - ритм с частотой
14-35 Гц, γ-ритм - 35-7Θ Гц. Выделяют также δ-ритм - θ,5-3 Гц,
θ-ритм - 4-7 Гц и др. По виду электроэнцефалограмм, по появлению
или исчезновению определенных ритмов можно судить о характере
и степени изменения функциональных свойств нервных структур
головного мозга, о динамике изменений, обнаруживать область коры
головного мозга, где изменения наиболее выражены. Так, при переходе
от бодрствования ко сну α и β-ритмы замещаются существенно более
медленными (δ и θ-ритмами). Существенно меняется спектральный
состав ЭЭГ при наркозе различной глубины и физической нагрузке.
В неврологической клинике спектральный анализ электрической
активности мозга широко используется для оценки патологических
состояний. Основные ритмы ЭЭГ отсутствуют или меньше
проявляются при тяжелых формах эпилепсии, опухолях коры больших
полушарий и др.
В настоящее время для моделирования электрической
активности коры головного мозга в качестве эквивалентного генератора
выбирают системы, состоящие из большого количества токовых
диполей, причем учитываются некоторые виды взаимодействия диполей
между собой и геометрия их расположения.
Анализ реализации ЭЭГ представляет собой сложную задачу.
Для сжатия информации и представления ее в удобном для
понимания виде строят частотные спектры сигналов в некотором
информативном интервале. После этого частотные спектры можно развернуть
во времени и получить временной «ландшафт». В настоящее время
в исследованиях ЭЭГ для моделирования электрической активности
коры головного мозга рассматривают поведение совокупности
токовых электрических диполей отдельных нейронов. Предложено
несколько таких моделей, позволяющих объяснить отдельные
особенности ЭЭГ. Рассмотрим модель М.Н. Жадина, которая на примере
генеза ЭЭГ при отведении с твердой мозговой оболочки позволяет
выявить общие закономерности возникновения суммарного
внешнего электрического поля коры.
452
Биофизике
Основные положения модели: 1) внешнее поле головного мозга
в некоторой точке регистрации - интегрированное поле, генерируемое
токовыми диполями нейронов коры; 2) генез ЭЭГ обусловлен
градуальной электрической активностью пирамидных нейронов; 3)
активность разных пирамидных нейронов в определенной степени
взаимосвязана (скоррелирована); 4) нейроны распределены по коре
равномерно и их дипольные моменты перпендикулярны к
поверхности коры; 5) кора плоская, имеет конечную толщину Λ, а ее остальные
размеры бесконечны; со стороны черепа мозг 01раничеи плоской
бесконечной токопроводящей средой. Обоснование первых двух
положений рассмотрено выше. Остановимся на других положениях модели.
Большое значение для генеза ЭЭГ имеет взаимосвязь
электрической активности пирамидных нейронов. Если бы градуальное
изменение мембранного потенциала во времени происходило в каждом
нейроне совершешю независимо от остальных клеток, переменная
составляющая потенциала их суммарного внешнего электрического
поля была бы небольшой, так как увеличение потенциала за счет
усиления активности одного нейрона в значительной мере скомпенсиро-
валось бы неупорядоченным снижением активности других
нейронов. Сравнительно высокая величина регистрируемой в опыте ЭЭГ
заставляет предположить, что между активностями пирамидных
нейронов существует положительная корреляция. Количественно это
явление характеризуют коэффициентом корреляции RK. Этот
коэффициент равен нулю при отсутствии связи между активностями
индивидуальных нейронов и был бы равен единице, если бы изменения
мембранного потенциала (дипольных моментов) клеток
происходили совершенно синхронно. Наблюдаемое в действительности
промежуточное значение RK свидетельствует о том, что деятельность
нейронов синхронизована лишь частично.
Интегрированное поле множества диполей-нейронов было бы
очень слабым при высоком уровне синхронизации, если бы векторы
дипольных моментов элементарных источников тока были
ориентированы в коре хаотически. В этом случае наблюдалась бы
значительная взаимная компенсация полей индивидуальных нейронов. В
действительности же, согласно цитологическим данным, дендритные
стволы пирамидных клеток в новой коре (эти клетки составляют 75%
Глава 4. Электробиология
453
от всех клеток коры) ориентированы практически одинаково,
перпендикулярно поверхности коры. Поля, создаваемые диполями
таких одинаково ориентированных клеток, не компенсируются, а
складываются.
Расчеты, произведенные на основании всех этих положений,
показали, что σ для ЭЭГ, отводимой от твердой мозговой оболочки,
будет равно:
a=khaHp^jR^, (4.194)
где к - коэффициент, численно равный средней плотности
пирамидных нейронов в коре; ρ - удельное сопротивление коры; σΗ -
среднее стандартное отклонение изменения во времени дипольного
момента нейронов; RK - средний попарный коэффициент корреляции
активности нейронов. Из независимых опытов можно найти
параметры, входящие в формулу (4.194). Так, для кролика h « 0,0017 м, ρ «
« 3 Ом · м, к к 4 · 1013. Если принять RK = 0,003, то рассчитанная на
основании этих данных по формуле (4.194) стандартная амплитуда
ЭЭГ будет около 70 мкВ, т. е. очень близко к действительным
величинам. Принятое значение коэффициента корреляции RK (а иногда
и во много раз больше) наблюдается в опытах при исследовании
различных типов электрической активности мозга.
Таким образом, внешнее электрическое поле головного мозга,
обнаруживаемое в виде ЭЭГ, можно рассматривать как результат
сложения полей пирамидных нейронов нервной коры. Важное
условие такого генеза ЭЭГ - одинаковая ориентация диполей нейронов
и наличие положительной корреляции в их градуальной
электрической активности. При этом достаточен даже очень низкий уровень
попарной корреляции.
Все большее значение для клиники приобретает регистрация
электрической активности глубоких отделов мозга - электросубкор-
тикография, которая осуществляется как во время
нейрохирургических операций, так и через вживленные в мозг на длительный срок
электроды. Телеэлектроэнцефалография позволяет регистрировать
электрическую активность головного мозга на расстоянии. Матема-
454
Биофизиня
тические, количественные приемы описания записей ЭЭГ, спектр»
льный, корреляционный и другие методы статистического аналши.
составление топографических карт потенциальных полей мозга
уточняют простую визуальную оценку ЭЭГ и дают возможность
извлечения из ЭЭГ новой, ранее скрытой для исследователя информации.
4.6.6. Электрическая активность скелетных мышц
Электромиография - метод исследования биоэлектрических
потенциалов, возникающих в скелетных мышцах животных и
человека при возбуждении мышечных волокон. У человека осуществлена
впервые в 1907 г. немецким ученым Г. Пипером. Амплитуда
колебаний потенциала мышцы обычно не превышает нескольких
милливольт, а их длительность - 20-25 мс, поэтому электромиографию
проводят с помощью усилителя и малоинерционного регистратора.
Кривая, записанная на фотобумаге, фотопленке и т. п., называется
электромиограммой (ЭМГ) (рис. 4.70).
В электромиографии могут быть выделены 3 основных
направления исследования. Первое - электростимуляция с помощью
введенных в мышцу игольчатых электродов, которые вследствие небольшой
отводящей поверхности улавливают колебания потенциала,
возникающие в отдельных мышечных волокнах или в группе мышечных
волокон, иннервируемых одним мотонейроном. Это позволяет исследовать
структуру и функцию двигательных единиц. Второе направление -
электростимуляция с помощью накожных электродов, которые
отводят так называемую суммарную ЭМГ, образующуюся в результате
интерференции колебаний потенциала многих двигательных единиц,
находящихся в области отведения. Такая ЭМГ отражает процесс
возбуждения мышцы как целого. Третье направление это так называемая
стимуляционная электромиография — регистрация колебаний
потенциала, возникающих в мышце при искусственной стимуляции нерва
100 мс
Рис. 4.70. Электромиограмма
Глава 4. Электробиология
455
или органов чувств. Таким образом исследуется нервно-мышечная
передача, рефлекторная деятельность двигательного аппарата,
определяется скорость проведения возбуждения по нерву. Электромиография
дает возможность судить о состоянии и деятельности не только мышц,
но и нервных центров, участвующих в осуществлении движений. ЭМГ
применяют в физиологии при изучении двигательной функции
животных и особенно человека, а также в прикладных науках - физиологии
труда и спорта, в инженерной психологии (например, при
исследовании утомления, выработки двигательного навыка). ЭМГ как
эффективный метод диагностики ряда нервно-мышечных заболеваний широко
применяется в невропатологии и некоторых других областях
медицины. ЭМГ используется также для оценки функционального состояния
двигательного аппарата при восстановлении нарушенной
двигательной функции в ортопедии и протезировании.
4.7. Моделирование электрического источника
одиночного волокна
Ранее обсуждалось возникновение локальных токов как
следствие возбуждения мембраны и роль этих токов в процессе
распространения возбуждения. Поскольку локальные токи текут отчасти во
внеклеточной среде, они могут быть обнаружены при помощи
внеклеточных электродов или даже электродов, расположенных на
поверхности тела. Примером служит электрокардиограмма: измеряемые на
поверхности тела электрокардиографические потенциалы
обусловлены совокупностью токов действия большого числа клеток ткани
сердца. Цель этого раздела - описание математических соотношений
между клеточным потенциалом действия и полями в объемном
проводнике, которые связаны с потенциалом действия. Такие
количественные связи позволяют изучать «обратную задачу»,
предусматривающую определение характеристик функционирования возбудимых
клеток по данным внеклеточных измерений. Решение обратной
задачи важно как для фундаментальных научных исследований, так и для
клинической диагностики.
Дальнейшее изложение материала ограничено рассмотрением
одиночного цилиндрического волокна. Раньше уже отмечалась ти-
456
Биофизике
пичность такой геометрической формы для нервов и мышц. Кроме
того, полученные для нее результаты часто удается обобщить на
более сложные формы. Решающим фактором, определившим выбор
для исследования именно этой модели, является простота ее
математического описания.
4.7.1. Основные математические формулировки
Ниже будут обсуждены следующие вопросы: какие токи
вытекают из цилиндрического волокна, когда по нему распространяется
потенциал действия? Какие потенциалы обусловлены этими токами
в окружающем пространстве?
Модель электрического источника одиночного волокна.
Рассмотрим цилиндрическое волокно, находящееся в однородной
электропроводной среде большого объема; предположим, что вдоль
этого волокна (в направлении оси координат х) распространяется
потенциал действия, как показано на рис. 4.71 вверху. Форма
монофазного потенциала действия Vm в пространстве иллюстрируется на
рис.4.71 внизу.
iV./.zO
^
'«.<&
S*
I (х.у. *)
Рис. 4.71. Схематическое изображение возбудимого волокна, по которому
распространяется потенциал действия в направлении положительной оси
координат χ (вверху). Волокно находится в бесконечно протяженной однородной
среде.Необходимо определить поле, порождаемое в точке Ρ с координатами
(х', у', ζ') токами действия элемента волокна, расположенного в точке
с координатам (х, у, ζ). Стрелками показан ток imdx, истекающий из элемента
волокна длиной dx. Внизу приведена волна монофазного потенциала действия
Глеве 4. Электробиология
457
Показанный на рис. 4.71 элемент волокна находится внутри
области, совпадающей с пространственной протяженностью
потенциала действия. Электрический ток истекает из этого
дифференциального элемента волокна во внеклеточное пространство, и его можно
определить как трансмембранный ток единицы длины волокна im,
умноженный на длину элемента волокна dx. Приближенно можно
считать, что этот ток истекает из некоторой точки в неограниченное
пространство (если не учитывать область, занимаемую самим
волокном), т. е. он аналогичен точечному источнику тока, находящемуся
в электропроводящей среде большого объема.
Потенциалы элементарных источников. Ток течет от
точечного источника радиально и равномерно распределен по всем
направлениям, поэтому Фе = Ι014πΛ,, /·, где /· - расстояние от
источника до точки наблюдения поля, Лс - удельная электропроводность
пространства и /0 = imdx. Таким образом, приходим в точности
к тем условиям, для которых справедливо уравнение поля монопо-
ля. Учитывая, что ток, истекающий из элемента волокна длиной dx
(имеющий значение imdx), представляет собой точечный
источник, можем записать следующее выражение для потенциала,
являющегося вкладом данного элементарного источника в общий
потенциал:
аФе =Jss^L. (4.195)
4пАег
Если элементарный источник с током im dx расположен в точке
с координатами (х, у, ζ), а потенциальное поле наблюдается в точке с
координатами (х', у', ζ'), то
r = [(x-x'Y+(y-y'Y+(z-z')2f-$ (4.196)
Обычно начало координат выбирают на оси волокна, где у -
= ζ = 0. Суммарное поле всего волокна можно найти путем
интегрирования по оси х, т. е. суммирования вкладов в потенциал всех
элементарных источников тока. Выражение для этой величины
имеет вид:
458
Биофизика
Фе=\ ^^ г, (4.197)
4пАег((х-х')2 +У'2 +z'2)2
где Л - удельная электропроводность.
Выражение для потенциала через величину Vm. При
обсуждении модели с проводящим сердечником отмечалось, что в том
случае, когда внеклеточная область имеет большой объем, можно учесть
условие ге < г, и выбрать ге = 0; тогда Фе < Ф„ Фе = 0. Следовательно,
Vm =Фе-Φι и кабельные уравнения, описывающие линейную
модель с электропроводным сердечником, примут вид:
■ψ-'л: %—>.■ (4.198)
αχ αχ
В результате подстановки уравнения (4.198) в уравнение
(4.197) с учетом вышеуказанных упрощений получим
,..J.»U..L»2V (4.199)
" г,' дх' г,1 дх'
Дня аксонов в форме круглого цилиндра осевое сопротивление
на единицу длины (при допущении равномерного распределения
внутриклеточного тока) выражается следующей простой формулой:
г,=-Ц-, (4-200)
πα
где a - раднус аксона и р, - удельное сопротивление аксоплазмы
(в единицах Ом ■ см). Теперь уравнение (4.199) можно записать в виде
,..»!££.„.А, £* (4.20,)
р,- дх2 дх2
где Λ = удельная проводимость аксоплазмы (в единицах си-
Р,
менс/сантиметр). Подставляя уравнение (4.201) в уравнение (4.197),
получим искомое выражение
Глава 4. Электробиология
459
д2Ут
Фе =u-ArJkL<&. (4.202)
4Ле J r
д2Ут
Плотность монопольных источников. Величину JS- в урав-
дх
нении (4.202) можно рассматривать как некоторую функцию
плотности источников, распределенных на оси х. Например, если в
электростатике имеется распределенный на линии заряд с плотностью р,(х)
Кл/длина, то потенциал электрического поля выражается как
Фе=— {^-dx. (4.203)
4πε J r
Поскольку в электростатической задаче величина
представляет собой плотность распределения заряда вдоль линии
(выраженную, например, в единицах кулон/сантиметр), вторую производную
d2Vm
^- можно аналогично рассматривать как плотность распределе-
дх
ния источников тока вдоль оси, т. е. линейную плотность.
Сопоставляя уравнения (4.202) и (4.203), фактически определяем
линейную плотность источника тока как
Id=na2Ai^f. (4.204)
αχ
где величина Id имеет размерность тока на единицу длины. В
дальнейших выкладках можно использовать для описания плотности ис-
<*2vm
точников величину —, не обращая внимания на постоянный
коих2
эффициент.
Указанную величину плотности источников иногда называют
плотностью монопольных, или униполъных (одиночных) источников
в отличие от плотности дипольных (двойных) источников, которая
обсуждается ниже. Элементарный одиночный источник, который
был уже рассмотрен, - это точечный источник, или монополъ.
460
Биофизика
Плотность дипольных источников. Если представить
уравнение (4.202) в следующем виде:
_α2Λ, f d\dVm]l
4Λ
»
и проинтегрировать по частям, то получится новое выражение для
потенциала Фе:
Φ = Li UL_- _L UL \dx ι
e 4Λ. ax r J л L Эх J
L J_ (4-2°6)
.1
a2 A,, г 7ГЭКт1,
4Ле J <ic L uc J
которое можно записать в иной форме, используя свойства
производной по направлению:
Ф =
аЧгГ ЭКШ_1 fjlll
4Л.
^L-^'-JWir*-
При получении этого результата использовался тот факт, что
проинтегрированная часть выражения обращается в нуль, так как на
отдаленном левом конце волокна (х —> -°°) и на отдаленном правом
его конце (х —> «>)) мембрана находится в состоянии покоя, и
дх2
Для интеграла (4.207) возможна физическая интерпретация,
если принять во внимание, что диполь, ориентированный в
направлении х(р = рах), создает в окружающей однородной
электропроводной среде поле, выражается как
ρ-νϊΐ/Α pa -νΓΐ/rl
Фе = -—ί ± = — != i. (4.208)
4πΛ„ 4πΛ„
Глава 4. Электробиология
461
В соответствии с уравнением (4.207) элемент волокна dx
вносит следующий вклад в суммарный потенциал:
••■%№Ш¥ (4-209)
4Л
φ-^1-ίγΓ-Λτϊ (4·210)
Таким образом, сравнение уравнения (4.209) с уравнением
(4.207) позволяет рассматривать величину ι — \dxax как диполь-
L дх \
ный момент осевого элементарного диполя. Фактически для
обеспечения математической строгости при сопоставлении уравнений
(4.209) и (4.207) необходимо выбрать в качестве линейной плотности
дипольного момента
Ji=-^a2Al^-^ax (4.211)
дх
в осевом направлении величину, имеющую размерность тока (ток.
dV
длина/длина). Величину — можно в принципе использовать как
дх
меру плотности осевого дипольного момента, причем любое
количественное рассмотрение требует также учета коэффициента перед
этой величиной в уравнении (4.210). Следует отметить, что при поло-
„ dVm
жительных значениях производной —— соответствующий диполь-
дх
ный момент ориентирован в отрицательном направлении оси х.
Выше было принято допущение, что волокно имеет
пренебрежимо малую площадь поперечного сечения, т. е. что источники
фактически находятся только на его оси и являются линейно
распределенными. При более строгом анализе можно показать, что по отношению
к внешнему полю искомые источники целесообразно представить как
распределенные по всему внутреннему объему волокна, и для точек
поля, расположенных на малом расстоянии от волокна, такую струк-
462
Биофизика
туру распределения источников следует учитывать. По каждому
поперечному сечению этот эквивалентный источник имеет равномерное
распределение. Поскольку площадь поперечного сечения волокна
равна πα2, из уравнения (4.210) получим следующее более общее
выражение для характеристики источника Jy, называемой объемной
плотностью дипольных источников:
jy =-^p^ax. (4.212)
αχ
В этом случае каждый осевой элемент волокна представлен
как источник в форме диска.
4.7.2. Модели источников тока дипольного типа
для возбудимого волокна
Распространяющийся по нервному волокну потенциал
действия, а также его производные первого и второго порядков
изображены на рис. 4.72.
Как было указано выше, потенциал действия распространяется
вдоль оси волокна с постоянной скоростью. Поэтому все изменения
величин, представленные на рис. 4.72, могут быть формально
описаны в виде функции бегущей волны f(x - Qt), где θ - скорость
распространения возбуждения. На рис. 4.72 иллюстрируется
пространственная форма функции Vm(x); здесь левая часть кривой характеризует
возбуждение (деполяризацию), а правая - восстановление (реполя-
ризацию) мембраны, поэтому волна возбуждения должна распро-·
страняться в отрицательном направлении оси х. Как уже было
объяснено в предыдущем параграфе, интенсивность эквивалентного
источника в форме двойного слоя пропорциональна величине —,
дх
а интенсивность эквивалентного источника в форме простого слоя -
величине ^-. Эти функции также представлены на рис. 4.72 (вни-
дх
зу дано схематическое изображение соответствующих
эквивалентных источников).
Глава 4. Элвктробиология
463
Потенциал (отн. ед.)
— 4^2' Осевая
координата
(см)
d2Vjd?
Распределенные двойные слои
Сосредоточенные диполи
+ + + ++++ +
+ + + ++++ +
+ + + ++++ +
+ + + ++++ +
+ ++ + + + + +
+ ++ + + + + +
+ ++ + + + + +
+ ++ + + + + +
Распределенные простые слои
+ _ +
М\ Мг Мз
Сосредоточенные монополи
Рис. 4.72. Монофазный потенциал действия Vu его производные первого
и второго порядков по осевой координате г. Соответствующие эквивалентные
источники в виде распределенных двойных слоев (маленькие стрелки) и простых
слоев (маленькие плюсы и минусы) схематически показаны в нижней части
рисунка. Под изображением волокна показаны эквивалентные источники в виде
сосредоточенных диполей (большие стрелки) и монополей (большие плюсы
и минусы); расположение сосредоточенных источников дано приближенно
464
Биофизика
Диполи деполяризации и реполяризации. Суммарная
величина дипольного момента, обусловленная дипольными эквивалентными
источниками на любом οι резке волокна от jc, долг2, выражается в виде:
DJ-^LLdx=Vm(Xl)-Vm(x2). (4.213)
i, dx
На одном конкретном участке волокна между началом области
деполяризации и максимумом потенциала действия все
элементарные диполи ориентированы в отрицательном направлении оси jc (как
показано на рис. 4.72); следовательно, суммарная (отрицательная)
величина дипольного момента для одиночного диполя,
характеризующего этот участок волокна, выражается как
^- ~^покой ~^mnc (отрицательная величина). (4.214)
Отрицательное значение D_ соответствует отрицательной ве-
dV
личине -—— на рассматриваемом участке. Согласно принятому
дх
здесь правилу знаков, элементарные диполи направлены в
отрицательную сторону оси х. Нетрудно заметить, что аналогичным образом
все элементарные дипольные источники на участке,
соответствующем фазе восстановления потенциала действия, имеют
положительное значение, и сумма их дипольных моментов выражается просто
как £>+ ~VmK -Vn0Kofl (положительная величина). Из этого следует,
что дипольные моменты волокна в фазах деполяризации и
реполяризации равны по абсолютной величине и противоположны по знаку.
Квадрупольный источник. Каждое из рассмотренных
дипольных распределений, как положительное, так и отрицательное, можно
аппроксимировать одиночным (сосредоточенным) диполем. Эти
эквивалентные диполи имеют равные абсолютные величины, но
противоположные знаки дипольных моментов, т. е. направлены в
противоположные стороны. Если поместить каждый эквивалентный диполь
в «центр тяжести» соответствующего распределешюго дипольного
источника, то суммарное поле этих диполей может служить
приближенным описанием для истинного электрического поля вне волокна.
Глава 4. Эпектробиология
465
Интуиция подсказывает, что такая аппроксимация будет тем точнее,
чем дальше от возбуждающейся области волокна находятся точки
наблюдения поля.
Квадруполъный источник состоит из двух диполей,
направленных противоположно, имеющих стремящуюся к бесконечности
абсолютную величину дипольного момента и разделенных стремящимся
к нулю расстоянием при условии, что произведение дипольного
момента исходных диполей на расстояние между ними остается
конечным. Это определение аналогично определению диполя,
получаемого в результате предельного перехода при сближении двух точечных
монопольных источников, равных по абсолютной величине, но
противоположных по знаку, при бесконечном увеличении их
интенсивности и бесконечном уменьшении расстояния между ними. Различие
состоит в том, что получается источник более высокого порядка.
Квадрупольный источник, как и все другие источники мультиполь-
ного типа, находится в некоторой точке пространства.
Поле двух рассмотренных сосредоточенных диполей
возбуждающегося волокна представляет собой поле квадруполя. Поскольку
точность дипольной аппроксимации повышается при увеличении
расстояния от волокна до точки наблюдения поля, можно ожидать,
что при удалении с волокна поле этих диполей будет
асимптотически приближаться к истинному, т. е. квадрупольному полю.
Прямоугольная волна потенциала действия. Предположим,
что волна потенциала действия имеет прямоугольную форму с
амплитудой, равной максимальному значению Vm (см. рис. 4.72). Тогда
распределенный (истинный) источник будет состоять из направленного
отрицательно сосредоточенного диполя в области деполяризации
и направленного положительно сосредоточенного диполя с такой же
абсолютной величиной дипольного момента в области реполяриза-
ции. Их дипольные момент выражаются уравнением (4.214). Таким
образом, приближенное представление источников в виде
сосредоточенных диполей для условий, иллюстрируемых на рис. 4.72, можно
рассматривать как точное для приближенного описания потенциала
действия в виде волны прямоугольной формы (моменты наступления
деполяризации и реполяризаци соответствуют вышеуказанным
«центрам тяжести» источников для эти областей).
466
Биофизика
4.7.3. Модели источников тока монопольного типа
для возбудимого волокна
Суммарная монопольная интенсивность источников,
распределенных в интервале от jc, до х2, выражается как интеграл от функции
плотности источников в пределах этого интервала:
М=]-К^ = ^(*2)-Ц^(х>)· (4-215)
* дх дх дх
Полученный результат представляет собой просто разность
между первыми производными потенциала на концах
рассматриваемого интервала. Поскольку вторая производная имеет трехфазную
форму, можно определить три соответствующие области с
распределенными монопольными источниками: центральную область с
отрицательными источниками и расположенные по обеим сторонам
от нее области с положительными источниками. Обозначим через
Amix величину положительного экстремума производной —— и через
дх
-Втах величину отрицательного экстремума (Лтах и -Втах -
положительные числа), как показано на рис. 4.73. Тогда из (4.215) получаем
следующие выражения для интенсивностей монополей М1,М2иМ3:
М, = Атах, Мг = Втт, Мг =-{Атах + Втах). (4.216)
Дискретные одиночные или монопольные источники
расположены в соответствующих «центрах тяжести» распределенных
источников. Такая модель трипольного источника, состоящая из трех
монопольных составляющих Мк Мг и Мъ, часто используется для
практического описания реальных источников тока, обусловленных
распространением потенциала действия по волокну.
Количественные характеристики для моделей элементарных
генераторов в виде сосредоточенных монополей или диполей можно
получить, рассматривая строгие выражения для потенциала поля,
порождаемого каждой областью волокна с источниками одного и того
же знака. Например, если jc,, - координата левой границы кривой
Глава 4. Электробиология
467
dV^/dz
Рис. 4.73. Потенциал действия V, аппроксимирующий его треугольный
потенциал действия Vlm. и первые производные этих функций по осевой
координате г (для треугольного потенциала действия производная имеет форму
двух прямоугольных волн: положительной и отрицательной)
Указаны протяженности восходящего (Dt) и нисходящего (D2)
участков треугольного потенциала действия
d2V d2V
-^, где ^- = 0, и х2 - координата точки, расположенной правее,
дх дх
где эта функция вновь принимает нулевое значение, то участок
волокна, ограниченный этими точками и содержащий положительные
источники, вносит следующий вклад в суммарный потенциал в
соответствии с уравнением (4.202):
д2Ут
4Л
ч-
(4.217)
Для точки наблюдения поля, находящейся на расстоянии г, от
середины рассматриваемой области волокна при условии, что это
расстояние намного больше длины участка х2-Х\, при помощи
теоремы о среднем значении можно получить следующее приближенное
выражение:
Φ =
ζ2Λ
1 xid2V„
4Л.
к i
дх7
-dx.
(4.218)
468
Биофизика
Сюда входит точно такой же интеграл, как и в уравнение
(4.215). С учетом этого получается следующее выражение:
Ф\ =
а2Л..
4Ле u .,
max
(4.219)
которое определяет поле монополя, обсужденное выше. В итоге имеем
(4.220)
ф: =■
4Л„
А Л +R В
max _ ■" max max . max
г,
e L Ί '2 'Э -I
где г1гг2ит3- расстояния от точки наблюдения поля до середины
области распределения отрицательных источников и до середины
второй области распределения положительных источников
соответственно. О качестве аппроксимации поля при помощи
сосредоточенных источников можно судить на основе интуиции, однако возможны
и количественные оценки при сравнении уравнений (4.217) и (4.218).
Треугольная волна потенциала действия. На рис. 4.73
изображен тот же импульс потенциала действия со своей первой
производной, что и на рис. 4.72. Кроме того, здесь представлена треугольная
волна, у которой наклон участка, соответствующего деполяризации,
равен максимальной крутизне восходящего участка кривой Vm, а
наклон участка, соответствующего реполяризации, равен минимальной
крутизне нисходящего участка кривой Vm. Следовательно, первая
производная треугольного потенциала действия представляет собой
двухфазную прямоугольную волну с амплитудой положительной фазы Лтах
и с амплитудой отрицательной фазы Втах. Как показано на рис. 4.73,
протяженность восходящей фазы треугольного потенциала действия
равна D,, а протяженность нисходящей фазы равна D2. Эти
характеристики влияют на форму потенциала Ф^ так как они обратно
пропорциональны амплитудам АтахиВтах,согласно соотношениям
Л-х^Г'СГ.»)™,, 5mix=D2-|(^)m«· (4-221)
Эквивалентный источник монопольного типа треугольной
волны потенциала действия состоит из трех отдельных монополей со
следующими интенсивностями и локализациями: монополь с интен-
Глава 4. Электробиология
469
сивностью AmaJi расположен у «левой» вершины треугольника, моно-
поль с интенсивностью Втах - у «правой» вершины треугольника
и монополь с интенсивностью - (Атах + Втах) - у основания высоты,
опущенной из третьей вершины треугольника. Эти монополи
образуют точный эквивалентный источник в случае треугольного импульса
потенциала действия. В то же время они обеспечивают
аппроксимацию для реальной волны потенциала действия, рассмотренной выше.
Потенциал создаваемого ими поля можно выразить как
Ф. =■
4Л„
Л 4* /? /?
"■ max D max ■ D max
Г\ Г2 ГЪ J
(4.222)
где Г|,г2и г3- расстояния от точки наблюдения поля до
сосредоточенных источников с интенсивностями Атах , - (Атах + Втах) и Втах
соответственно.
Обычно волна потенциала действия, представленная в виде
треугольника, дает эквивалентные источники, поле которых более
точно аппроксимирует истинное поле по сравнению с
аппроксимацией, в основу которой положено описание потенциала действия при
помощи прямоугольников. Последний подход обеспечивает
достаточно высокую точность в асимптотике, когда поле наблюдают на
больших расстояниях от волокна, а первый целесообразно применять
при средних расстояниях наблюдения для типичных форм импульса
потенциала действия.
Квадрупольная аппроксимация. На больших расстояниях от
волокна, по которому распространяется потенциал действия,
внеклеточный потенциал в пределе имеет типичное пространственное
распределение, соответствующее источнику в форме осевого квадруполя.
Это распределение является симметричным, трехфазным и
выражается как
<2<p,Jc) = -?-Ag(3cos2e+l)(p2 -χ2)'2, (4.223)
где Q - интенсивность квадруполя, θ = arctg(p/x); p, jc -
цилиндрические координаты (х - осевая координата), штрихи в обозначениях
470
Биофизика
координат опущены. Потенциал имеет отрицательный экстремум
при jc = 0 и положительные экстремумы при jc = :Ц/1,5р. Следует
отметить, что расстояние между максимумами потенциала в
направлении оси jc линейно увеличивается при увеличении радиального
расстояния от точки наблюдения поля до волокна. Для треугольной
волны потенциала действия имеем
Подставляя это выражение в уравнение (4.223), можем
вычислить соответствующий потенциал.
Для немиелинизированного нервного волокна с радиусом α
скорость распространения возбуждения пропорциональна величине
να. Следовательно, при увеличении радиуса α вдвое скорость
увеличится в V2pa3. Если допустить, что при этом величина Vm(t) остается
неизменной (это соответствует действительности, когда не
изменяются свойства мембраны), то параметры D, и D2 треугольного
потенциала действия также увеличатся в V2 раз. Принимая во внимание
наличие коэффициента а2 в уравнении (4.202), а также уменьшение
потенциала приблизительно в V2 раз из-за распределенности
источников, получим в итоге, что потенциал, измеряемый у поверхности
волокна, возрастает в 4 раза. Однако при наблюдении поля на большом
удалении от волокна интенсивность квадрупольного источника в
данном случае увеличивается в V2 раз, и потенциал возрастает
соответственно в 4 и 2 раза.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Антонов В.Ф., Черныш A.M., Пасечник В.И., Вознесенский
С.А., Козлова Е.К. Биофизика: Учебник. - М.: Гуманит. изд. центр
ВЛАДОС, 1999. - 288 с.
2. Биофизика / Под общей редакцией академика АН СССР
П.Г.Костюка. - К.: Выща школа, 1988. - 504 с.
3. Биологические мембраны / под ред. С. Парсонса. - М.: Ато-
миздат, 1978.
4. Вестерхофф Х.В., Ван Дам К. Термодинамика и регуляция
превращений свободной энергии в биосистемах. М.: Мир, 1992.
5. Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я.,
Деев А.И. Биофизика. - М.: Медицина, 1983. - 272 с.
6. Волобуев А.Н. Биофизика. - Самара: «Самар. Дом печати»,
1999.-168 с.
7. Волькенштейн М.В. Биофизика. - М.: Наука, 1981. - 586 с.
8. Иванов К.П. Основы энергетики организма. Л.: Наука, 1990.
9. Карнаухов В.Н. Люминесцентный спектральный анализ
клетки. - М.: Наука, 1978. -209 с.
10. Люминесцентный анализ в гастроэнтерологии. -Л.: Наука,
1984.-236 с.
П.Плонси Р., Барр Р. Биоэлектричество: Количественный
подход: Пер. с англ. - М.: Мир, 1991. - 366 с, ил.
12. Пюльман Б., Пюльман А. Квантовая биохимия. -М.: Мир,
1965.
13. Рубин А.Б. Биофизика. М., 2000. - 468 с.
14. Самойлов В.О. Медицинская биофизика. - С-Пб.: «Спец-
Лит», 2004. - 495 с.
15. Самойлов В.О. Элементы квантовой биофизики. - СПб. -
Изд-во СПбГТУ, 2001. - 44 с.
472
Биофизика
16. Сент-Дьердьи А. Биоэнергетика. - М.: Гос. изд-во физ-мат.
литературы, 1960. - 165 с.
17. Сент-Дьердьи. Введение в субмолекулярную биологию. -
М.: Наука, 1964. -138 с.
18. Сент-Дьердьи А. Биоэлектроника. -М.: Мир, 1971. - 80 с.
19. Теренин А.Н. Фотоника молекул красителей и родственных
органических соединений. -Л.: Наука, 1967.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
а-бунгаротоксин 382
Са2+-активируемая АТФаза 146
А
Абсолютная диэлектрическая проницаемость 395
Абсолютно рефрактерная фаза 352
Абсолютно черное тело 415
Автоматия 389
Активный транспорт 110,131
Активные узлы 372
Аллопия 95
Анаэробное дыхание 236
Анаэробные условия 252
Аннулярные липиды 101
Анодическая экзальтация 350
Антипорт 134
Анэлектротон 350
Асимметрия 87
Атомные орбитали 187
АТФаза 135
Ацетилхолинэстераза 383
Б
Бактериородопсин 149
Барьерная функция 94
474
Биофизика
Бимолекулярный фосфолипидный слой 70
Биолюминесценция (или биохимиолюминесценция) 211
Биоэлектроника 187
Бирадикалы 185
Ближняя и средняя инфракрасная область 184
Большая карусель 125
Бурый жир 262
Быстродействующий транзистор 249
В
Валентность 192
Валентные орбитали 187
Вектор сердца 442
Внутренняя энергия 12
Внутримолекулярный и межмолекулярный
переносы энергии и заряда 200
Возбудимость 346, 129
Возбудимые (электрогенные) 346
Возбуждающий постсинаптический потенциал 378
Возбужденное состояние 180
Волновая функция 169
Волной де Бройля 174
Волоконно-оптическая линия связи 250
Воротный механизм 128, 335
Воротный ток 336
Вращательный катализ 262
Вращательный спектр 184
Вращение 86
Время корреляции вращательного движения 87
Время полужизни 88
Вторично активный транспорт 157
Предметный указатель
475
Вторичная флуоресценция 211
Вторичные электротонические изменения возбудимости 350
Второй закон термодинамики 26
Выравнивание липидного состава мембран 88
Вязкость биомембран 91
Г
Гальванизация 350
Гетероструктурные солнечные элементы 249
Гипотеза Хилле 104
Гипотеза Муллинза 103
Главное квантовое число 172, 177
Гликокаликс 82
Гликолипиды 81
Гликопротеиды 81
Глутоксим 274
Градуальность 347
д
Движение электрических зарядов 112
Движение электронов 182
Декремент 360
Диполь 428
Дипольный потенциал 431
Дискретность 170
Дискретные значения 170
Диссипативная функция 43
Диффузия 111
Диэлектрическая проницаемость 91, 395
Доннановское равновесие 292
Дыхательная, или окислительная, цепь 239
476
Биофизика
Ж
Жидкий кристалл 84
Э
Закон «всё или ничего» 85, 350
Закон Джоуля - Ленца 113
Закон сохранения энергии 12
Закона Гесса 14
Закона раздражения 354
Закон Стефана - Больцмана 22
Закон Пуазейля 45
Закон Фика 44, 278
Закон Фурье 44
Закон Вант-Гоффа 47
Закон Фарадея 353
Захваченная вода 83
И
Избыток продукции энтропии 54
Изменение мембранного потенциала 324
Изменение стандартной свободной энергии 35, 250
Изобарно-изотермический потенциал 32
Изоиония 137
Изохорно-изотермический потенциал 32
Импульсный разряд 445
Инсектицид ДДТ 341
Интегральный электрический вектор сердца 435, 442
Интегрирующие устройство 380
Интенсивность 118
Ионизационный потенциал 247
Искусственные мембраны 102
Предметный указатепь
477
Искусственные липидные мембраны 105
Испарения 22
Источник энергии 146
К
Кабельные свойства 360
Калиевая проводимость 312
Канал 123, 150
Катализатор 80
Катодическая депрессия 350
Катушки Дюбуа-Реймона 354
Катэлектротон 350
Квантовая механика 166
Квантовая биофизика 187, 219
Квантосома 227
Кинетика облегченной диффузии 155
Кинетика ПО
Кинки 122
Классическая механика 166
Клетка 10, 64
Колебательно-вращательный спектр 184
Колебательное и вращательное движение 182
Комплекс 204
Комплексная диэлектрическая проницаемость 396
Конвекция 21
Конвекционный (конвективный) поток ПО
Коннексон 163
Константа равновесия 36
Константа Ставермана 50
Концентрационный элемент 284
Кооперативный процесс 85
478
Биофизика
Корпускулярно-волновой дуализм 167
Корпускулярный 166
Коэффициент поляризации 402
Коэффициент Тарусова 402
Коэффициент проницаемости 119, 283
Коэффициент корреляции 452
Коэффициент отражения 402
Коэффициент распределения вещества 282
Красная мембрана 149
Креатин 264
Креатинфосфокиназой 264
Л
Лабильность 359
Линейчатый характер 180
Липидный бимолекулярный слой 67
Липосома 105
Люцифераза 217
Люциферин 217
Μ
Магнитное квантовое число 178
Магнитография 411
Макромолекула 206
Максимальная частота 359
Малая карусель 125
Матричная функция 94
Межмолекулярнвй перенос заряда 204
Мембрана 64
Мембранная система хлоропластов 225
Местные анестетики 341
Предметный указатель
479
Метастабильный 182
Метод флуоресцентных зондов 211
Механизм пассивного транспорта 154
Механическая функция 93
Механические свойства биомембран 91
Механохимическая гипотеза 253
Миграция энергии 201
Микроинформация 62
Миниатюрный потенциал концевой пластинки 382
Минимальный градиент 358
Мобильная связь 249
Модель Миллера и Гезелоувитца 438
Модель параллельных проводимостей 312
Модель сэндвича 96
Молекулярный кислород 236
Молекулярная орбиталь 189
Монополь 425
Моторная концевая пластинка 380
Мультиплет 180
Η
Н-АТФсинтетаза 257
Нексус 165,375
Неподеленные пары 193
Несопряженные системы 193
Неспаренный электрон 181
О
Облегченная диффузия 153
Опсином 149
Орбитальное квантовое число I 177
480
Биофизика
Орбитальный момент 177
Осмотический поток 49
Осмотическая энергия протонного градиента 235
Основное состояние 180
Относительно рефрактерная фаза 352
Π
Первый закон термодинамики 12
Перенос тепла излучением 21
Перехваты Ранвье 372
Переходы валентных электронов 180
Пиноцитоз 159
Плазмолемма 64
Плотность потока вещества 118
Плотность тока 405
Плотность электрического тока 421
Плотность вероятности 169
Поверхностная плотность заряда 405
Поверхностный заряд на клеточной мембране 89
Подвижность молекулярных компонентов биомембран 86
Полезное временя 357
Положительная корреляция 452
Полупроводниковый лазер 249
Потенциал Нернста 286
Потенциал покоя 284
Потенциалзависимые ионные каналы 129
Потенциалнезависимые каналы 129
Потенциал действия 303
Потенциал концевой пластинки 382
Потенциал покоя 277
Поток вещества 118
Предметный указатель
481
Правило Стокса 267
Принцип компартментализации 94
Принцип Паули 179
Принцип суперпозиции зарядов 406
Принцип устойчивости Ле-Шателье 53
Прозрачность барьера 175
Проницаемость 119
Проницаемость биологической мембраны 119
Протеолипосом 106
Протондвижущая сила 256, 260
Протонный канал 261
Протонный потенциал 152
Пурпурная мембрана 149
Ρ
Радиус экранировки Дебая 90
Размер кооперативной единицы 85
Реакция цепного типа 218
Реакционный центр 226
Реакция фиксации углекислого газа 232
Регенерация 368
Редокс-помпа 135, 260
Ретрансляция 368
Рефрактерность 352
Рецепторная функция 80
Родопсин 149
Ротор 259
Ряд Маклорена 43
С
Сакситоксин 338
31 -9843
482
Биофизика
Светособирающая пигментная матрица 225
Свободная вода 83
Свободная энергия 16
Свободная энергия Гиббса 38
Свободный радикал 185, 229
СВЧ-радиометр 414
Связанный кислород 236
Селективный фильтр 128, 333
Сенсор напряжения 335
Симпорт 133
Синоптическая задержка 379
Синезеленые водоросли 237
Система пониженной размерности 249
Система уравнений переноса 114
Скалярный потенциал 421
Скорость 154
Слабый перенос 204
Собственный магнитный момент 179
Собственная желто-зеленая флуоресценция 214
Собственная синяя флуоресценция 214
Собственная флуоресценция 267
Собственные значения 170
Собственные физические поля организма 392
Собственная функция 170
Соль 83
Соотношения взаимности Онзагера 46
Сопротивление потоку 283
Сопрягающий фактор 233
Спектр возбуждения 210
Спектр излучения 210
Спектр поглощения 214
Предметный указатель
483
Специфический блокатор 144
Специфический рецептор 158
Спин 179
Спиновое квантовое число ms 179
Спутниковое телевидение 249
Среднее время жизни возбужденного состояния 186
Сродство химической реакции 40
Статор 259
Стеклянная мембрана 103
Стереоспецифичность 79
Стимуляционная электромиография 454
Структурная компонента биомембраны 80
Схема активного транспорта кальция 147
Τ
Таутомер 195
Таутомерный переход 195
Темновые реакции 233
Теория локальных токов 3 69
Тепло 22
Теплопроводность 20, 113
Термодинамика 10
Термодинамическая система 10
Термодинамическое сопряжение 113
Термодиффузия 115
Тетродотоксин 338
Тилакоид 225
Тонкая структура спектра 181
Тормозный постсинаптический потенциал 379
Транспорт 80
Трансформация ритма 359
31·
484
Биофизика
Триплетный 185
Туннельный механизм 230
Туннельный эффект 175
У
Убихинон 221
Удельная электропроводность 394
Удельная электропроводность среды 421
Удельное электрическое сопротивление 394
Ультрафильтрация 49
Упорядоченный 15
Уравнение Вант-Гоффа 36
Уравнение Нернста - Планка 277
Уравнение параллельных проводимостей 314
Уравнение Томаса 299
Уравнение Фика 112
Уравнение Шрёдингера 169
Уравнение Гольдмана - Ходжкина - Катца 298
Уравнение Пуассона 422
Уравнение Гиббса - Дюгема 48
Уравнение Лапласа 422
Уравнение Ходжкина - Хаксли 330
Условие электронейтральности 289
Φ
Фагоцитоз 159
Фаза экзальтации 353
Фазовый переход 84
Фазовый сдвиг 400
Феофитин 221
Флип-флоп-перемещения 87
Предметный указатель
485
Формула Борна 119
Фосфорорганические соединения 383
Фотодинамическая терапия рака 2 75
Фотон 167
Фотосинтетическая единица 226
Фотофосфорилирование 233
Фуллерены 275
Функциональная модель
натриевого потенциалзависимого канала 337
X
Химеры (монстра) Рэкера 153
Химиолюминесценция 211
Химиоосмотическая гипотеза 254
Химический потенциал 17
Химическое сродство 113
Химическая гипотеза 253
Химическая реакция 113
Холестерилбензоат 83
Холестерин 71
Холинорецептор 381
Хромофоры 225
Хронаксия 357
ц
Цианобактерии 237
Цикл Кальвина 231
Цикл Кребса 251
Цитолемма 64
Цитохром 221
Цитохромоксидаза 245
486
Биофизика
ч
Черная мембрана 105
Ш
Шиффовое основание 149
Шкала ионизационных потенциалов 247
щ
Щелевые контакты 163
э
Эквивалентный генератор 420
Эквивалентный диполь сердца 432
Экзоцитоза 159
Экситоны 203
Электрическая емкость 396
Электрическая напряженность 406
Электрическая постоянная 395
Электрический импеданс 398
Электрический ток 405
Электрическое поле 405
Электрическое смещение 423
Электрическое сопротивление 393
Электрограмма 420
Электрография 411
Электродиффузионное уравнение Нернста-Планка 119
Электрокардиограмма 436
Электрокинетический потенциал 89
Электромиография 454
Электронная схема жизни 220
Электропроводность 393
Предметный указатель
487
Электростатическая теория Эйзенмана 104
Электростимуляция 403
Электрострищия 91
Электротонические явления 350
Электротонический потенциал 363
Эндогенная вода окисления 246
Эндоцитоз 159
Энергетические выходы 210
Энтальпия 13
Эффект Кирлиана 417
Эффект насыщения 154
Эффект обращения 134
ОГЛАВЛЕНИЕ
Том I. БИОЭНЕРГЕТИКА, БИОМЕМБРАНОЛОГИЯ
И БИОЛОГИЧЕСКАЯ ЭЛЕКТРОДИНАМИКА 1
Условные сокращения 3
Предисловие 6
Введение 9
Глава 1. Термодинамика биологических процессов 10
1.1. Первый закон термодинамики 12
1.1.1. Общие сведения 12
1.1.2. Свободная и связанная энергия.
Обратимые и необратимые процессы 15
1.1.3. Применение первого закона термодинамики
к живым организмам 17
1.2. Второй закон термодинамики 26
1.2.1. Общие сведения 26
1.2.2. Особенности живых организмов
как термодинамических систем 30
1.2.3. Термодинамические потенциалы 31
1.2.4. Изменение стандартной свободной энергии.
Константа равновесия и электрохимический потенциал 34
1.3. Термодинамика необратимых процессов 38
1.3.1. Изменение энтропии в открытых системах
и диссипативная функция 39
1.3.2. Основные положения линейной
неравновесной термодинамики 43
1.3.3. Теорема Пригожина 51
Оглавление 489
1.4. Энтропия и биологическая информация 53
1.4.1. Устойчивость стационарного состояния 53
1.4.2. Связь энтропии и биологической информации 56
1.4.3. Количество биологической информации 58
1.4.4. Рецепция и возникновение информации 61
Глава 2. Биофизика клеточных мембран 64
2.1. Структура, свойства и функции
биологических мембран 64
2.1.1. Структурно-молекулярная организация биологических мембран . 66
2.1.1.1. Электронная микроскопия 66
2.1.1.2. Мембранные липиды 67
2.1.1.3. Мембранные белки 74
2.1.1.4. Углеводы биологических мембран 81
2.1.1.5. Вода и соли в биологических мембранах 83
2.1.2. Физические и физико-химические свойства
биологических мембран 83
2.1.3. Функции биологических мембран 93
2.1.4. Модели биологических мембран 95
2.1.5. Искусственные мембраны 102
2.1.5.1. Стеклянные мембраны 103
2.1.5.2. Искусственные липидные мембраны 105
2.1.6. Биофизические механизмы транспорта веществ
(массопереноса) через биомембраны ПО
2.2. Кинетика биофизических процессов массопереноса ПО
2.2.1. Уравнения массопереноса 110
2.2.2. Кинетика сопряженных процессов массопереноса 113
2.2.3. Сопряженный массоперенос заряженных частиц
(ионов) через биологическую мембрану 118
2.2.4. Проницаемость клеточных мембран 119
490 Биофизика
2.2.5. Транспорт липофильиых веществ
через биологические мембраны 120
2.2.6. Транспорт гидрофильных веществ
через биологические мембраны 123
2.2.6.1. Транспорт с участием переносчиков 123
2.2.6.2. Транспорт по мембранным каналам 127
2.3. Биологические насосы 131
2.3.1. Активный транспорт (общие положения) 131
2.3.2. Системы активного транспорта 136
2.3.2.1. Калий-натриевый насос 138
2.3.2.2. Кальциевый насос 145
2.3.3. Ионный транспорт у галобактерии 148
2.3.4. Облегченная диффузия 153
2.3.5. Специальные механизмы трансмембранного массопереноса. . . 157
2.3.5.1. Поглощение клетками нуклеиновых кислот
и специфических белков 158
2.3.5.2. Фагоцитоз и пиноцитоз 159
2.3.5.3. Щелевые межклеточные контакты 163
Глава 3. Квантовомеханические основы биоэнергетики 166
3.1. Основные понятия квантовой механики 166
3.2. Испускание и поглощение энергии атомами и молекулами 179
3.3. Квантовомеханические особенности строения биомолекул 187
3.4. Механизмы переноса энергии и заряда
в биомолекулярных системах 200
3.5. Люминесценция биологических систем 208
3.6. Электронная схема жизни 220
3.6.1. Биофизические механизмы фотосинтеза 220
3.6.1.1. Фотосинтез у хлорофиллсодержащих бактерий 221
3.6.1.2. Фотосинтез у зеленых растений 223
Оглавление 491
3.6.2. Электрон-транспортная цепь
внутренней мембраны митохондрии 238
3.6.2.1. Биологическое окисление 242
3.6.2.2. Сопряжение окисления и фосфорилирования 250
3.6.2.3. Антипорт АТФ и АДФ
через митохондриальные мембраны 264
3.6.2.4. Законы биоэнергетики клетки (по В. П. Скулачеву) 265
3.6.2.5. Прижизненная флуориметрия компонентов
дыхательной цепи 267
3.6.2.6. Новые диагностические технологии,
основанные на достижениях квантовой
биофизики (биоэлектроники) 271
3.6.2.7. Новые лечебные технологии, основанные
на достижениях квантовой биофизики
(биоэлектроники) 274
3.6.2.8. Экологические аспекты квантовой биофизики 275
Глава 4. Электробиология 277
4.1. Ионные равновесия 277
4.1.1. Электродиффузное уравнение Нернста-Планка 277
4.1.2. Потенциал покоя. Потенциал Нернста 284
4.1.3. Доннановское равновесие и потенциал Доннана 290
4.1.4. Уравнение Гольдмана-Ходжкина-Катца 294
4.2. Потенциал действия 303
4.2.1. Происхождение и характеристики потенциала действия 303
4.2.2. Фиксация потенциала 314
4.2.3. Уравнение Ходжкина-Хаксли 324
4.2.4. Роль ионных каналов в биоэлектрогенезе 332
4.2.4.1. Потенциалзависимые натриевые каналы 332
4.2.4.2. Калиевые каналы 341
4.2.4.3. Кальциевые каналы 342
Биофизика
4.2.5. Реакция невозбудимых и возбудимых мембран
на раздражители, градуальность и закон «всё или ничего» .... 346
4.2.6. Рефрактерность 351
4.2.7. Аккомодация возбудимых тканей 353
4.2.8. Лабильность возбудимых тканей 358
4.3. Распространение возбуждения 359
4.3.1. Кабельная теория распространения потенциала действия 361
4.3.2. Бездекрементное распространение возбуждения
по возбудимой мембране 367
4.3.3. Сальтаторное проведение нервного импульса 371
4.3.4. Синаптическая передача 374
4.4. Особенности мембранных потенциалов кардиомиоцитов 385
4.5. Собственные электромагнитные поля организма человека 392
4.5.1. Пассивные электрические свойства живых тканей 393
4.5.2. Электростимуляция органов и тканей 403
4.5.3. Характеристики электрогенных свойств
живых тканей 405
4.5.4. Низкочастотные и сверхвысокочастотные
электромагнитные поля биологических объектов 408
4.5.5. Электромагнитные излучения инфракрасного
и оптического диапазонов 415
4.6. Электрическая активность органов 420
4.6.1. Биофизические принципы исследования
электрических полей в организме 420
4.6.2. Поле монополя 426
4.6.3. Поле диполя 428
4.6.4. Эквивалентный электрический
генератор сердца 431
4.6.5. Электрическая активность головного мозга 445
4.6.6. Электрическая активность скелетных мышц 454
Оглавление
493
4.7. Моделирование электрического источника
одиночного волокна 455
4.7.1. Основные математические формулировки 456
4.7.2. Модели источников тока дипольного типа
для возбудимого волокна 462
4.7.3. Модели источников тока монопольного типа
для возбудимого волокна 466
Список использованной литературы 471
Предметный указатель 473
Адрес издательства в Интернет WWW.TECHBOOK.RL)
Учебное издание
Бигдай Елена Владимировна
Вихров Сергей Павлович
Гривенная Наталья Владимировна
Редькин Владимир Михайлович
Самойлов Владимир Олегович
Чигирев Борис Иванович
БИОФИЗИКА ДЛЯ ИНЖЕНЕРОВ
Учебное пособие
В 2 томах
Том 1. - Биоэнергетика, биомембранология и биологическая электродинамика
Редактор И. М. Андреева
Компьютерная верстка О. В. Ушакова
Обложка художника В. Г. Ситникова
Подписано в печать 04.04.08. Формат 60x90 1/16. Усл. печ. л. 31. Изд. № 848 Тираж 1000 экз.
ООО «Научно-техническое издательство «Горячая линия-Телеком». Заказ № 9843.
Отпечатано с готовых диапозитивов в ОАО ордена «Знак Почета»
«Смоленская областная типография им. В. И. Смирнова·.
214000. г. Смоленск, проспект им. Ю. Гагарина, 2.
В издательстве Горячая линия-Телеком
вышла в свет и поступила в продажу книга:
Биомедицинское материаловедение. Учебное пособие для
вузов / С. П. Вихров, Т. А. Холомина, П. И. Бегун, П. Н. Афонин -
М.: Горячая линия-Телеком, 2006-383 с: ил., ISBN 5-93517-230-5.
Изложены на современном уровне основные разделы
материаловедения Проведен анализ свойств и
особенностей применения в медицине и приборостроении
проводниковых, полупроводниковых и диэлектрических материалов.
я Сформулированы и обоснованы требования, предъявляемые к
материалам, предназначенным для биомедицинского
применения: биологическая совместимость с живыми организмами,
стабильность функциональных свойств, возможность стери
МАКРИШИЩНИЕ лизационной обработки термическим, химическим или ра-
иационным методами. Рассмотрены особенности
применения различных материалов для внутритканевого
протезирования. Предпринята попытка представления живого организма в качестве объекта
материаловедения.
Книга рекомендована УМО по образованию в области радиотехники,
электроники, биомедицинской техники и автоматизации в качестве учебного пособия для
студентов высших учебных заведений, обучающихся по направлению подготовки
дипломированных специалистов 6S3900 - «Биомедицинская техника», может быть
полезна аспирантам, инженерам, медицинским и научным работникам,
специализирующимся в облвсти биомедицинского материаловедения.
Оглавление
Предисловие
Словарь основных медицинских терминов
Глава 1. Общие свойства материалов
Глава 2. Металлы и сплавы
Глава 3. Применение твердых проводниковых материалов в медико
биологической практике
Г ава 4. Полупроводниковые материалы
Глава 5. Применение диэлектрических материалов в медико-биологической
практике
Глава 6. Свойства живых тканей
Глава 7. Совместимость материалов с биологическими средами
Глава 8. Материалы для внутритканевого протезирования
Справки по телефону: (495) 737-39-27, WWW.TECHBOOK.RU
Вышли в свет и имеются в продаже:
Штовба С. Д. Проектирование нечетких систем средствами MATLAB. -
М.: Горячая линия - Телеком, 2007.-288 с, ил., ISBN 5-93517-359-Х.
Рассмотрены вопросы проектирования нечетких систем в пакете Fuzzy Logic
Toolbox вычислительной среды MATLAB. Даны необходимые сведения в области
теории нечетких множеств и нечеткой логики. Приведен теоретический материал по
проектированию нечетких систем. Изложены теория нечеткой идентификации,
методы нечеткой кластеризации и их применение для экстракции нечетких правил, а
также метод принятия решений в нечетких условиях на основе слияния целей и
ограничений. Рассмотрены авторские расширения пакета для проектирования нечетких
классификаторов, построения иерархических нечетких систем, обучения нечетких
баз знаний типа Мамдани, а также для логического вывода при нечетких исходных
данных. Книга может использоваться как учебное пособие к университетским курсам
по интеллектуальным системам, искусственному интеллекту, теории принятия
решений н методам идентификации.
Для проектировщиков систем, будет полезна научным сотрудникам, аспирантам
и студентам старших курсов, интересующимся применением теории нечетких
множеств в управлении, идентификации, обработке сигналов, а также разработчикам
интеллектуальных систем поддержки принятия решений в медицине, биологии,
социологии, экономике, политике, спорте и в других областях.
Нейронные сети. STATISTICA Neural Networks: Методология и технологии
современного анализа данных / Под редакцией В. П. Боровикова. - 2-е
изд., перераб. и доп. - М.· Горячая линия - Телеком, 2008. - 392 с, ил., ISBN
978-5-9912-0015-8.
Изложены нейросетевые методы анализа данных, основанные на использовании
пакета STATISTICA Neural Networks (фирма производитель StatSoft), полностью
адаптированного для русского пользователя. Даны основы теории нейронных сетей;
большое внимание уделено решению практических задач, всесторонне рассмотрена
методология и технология проведения исследований с помощью пакета STATISTICA
Neural Networks - мощного инструмента анализа н прогнозирования данных,
имеющего широкие применения в бизнесе, промышленности, управлении, финансах.
Книга содержит множество примеров анализа данных, практические рекомендации по
проведению анализа, прогнозирования, классификации, распознавания образов,
управления производственными процессами с помощью нейронных сетей.
Для широкого круга читателей, занимающихся исследованиями в банковской
сфере, промышленности, экономике, бизнесе, медицине, биологии, геологоразведке,
управлении, транспорте и других областях.
Справки по телефону: (495) 737-39-27, WWW.TECHBOOK.RU
е ез
Ε. .Ьиг , СП hip, Шпшна,
Ι.Μ Реяыии,!. .Сам нлии, И.Чип ей
б о зикд
ДЛЯ ИНЖЕНЕРОВ
1м 1 Бмжркщ кжйрммп к тмпмеш злепр ка
В учебном пособии систематизированы с ния о физических
и физико-химических процессах лежащих в основ жизнед ятель
ности организмов на всех уровнях их организации, н обходимы для
инженеров и специалистов занимающихся разработкой и об лужи
ванием биомедицинской техники
В первом томе двухтомного пособия изложены основы био
энергетики и термодинамики биологических проц ссов рассмотрены
структура свойства и функции биологических мембран и биоэлектро
генеэ Второй том посвящен биофизическим основам двигательной
активности человека информационных и регуляторных процессов
в биологических системах, а также общим принципам функционирова
ния сенсорных систем
Для студентов обучающихся по направлению «Биомедицинская
техника», будет полезна инженерам и специалистам занимающимся
моделированием физиологических процессов и разработкой анали
тической, диагностической и лечебной аппаратуры
ISBN 978 5 9912-0048-6
'
9I785991M200486