Author: Коровин Н.В. Камышева В.К. Удрис Е.Я.
Tags: химия общая и неорганическая химия неорганическая химия общая химия
ISBN: 978-5-406-04140-6
Year: 2015
Text
БАКАЛАВРИАТ
НВ. Коровин
В.К. Камышова
Е.Я. Удрис
ОБЩАЯ ХИМИЯ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Под общей редакцией Н.В. Коровина
Учебное пособие
КНОРУС • МОСКВА • 2015
Knorusfhedie
УДК 54(075.8)
ББК 24.1я73
К68
Рецем гейты:
Н.В. Кулешов, заведующий кафедрой химии и электрохимической энергетики НИУ
МЭИ. д-р техн. наук, проф ,
Е.В. Стенина, проф кафедры электрохимии химического факультета МГУ
им. Ломоносова, д-р хим. наук
Коровин Н.В.
К68 Общая химия Лабораторный практикум учебное пособие/Н.В. Ко-
ровин, В.К. Камышева, Е.Я. Харис; иод общ. ред. Н В. Коровина. — М :
КНОРУС. 2015. — 336 с. — (Бакалавриат)
ISBN 978-5-406-04140-6
DOI 10.15216/978-5-406-04140-6
Предназначено для проведения лабораторных работ по курсу общей химии
в вузах технических направлений обучения Содержит подробные, пошаговые
указания для студентов и преподавателей по проведению химического экспери-
мента как в рамках традиционного оснащения лабораторного практикума, так
и с использованием цифровой лаборатории Шифровая лаборатория включает в себя
компьютер, цифровые датчики и их программное обеспечение. Описание каждой
работы состоит из теоретической части с минимальным справочным материалом,
необходимым для выполнения работы, вопросов и задач для самоконтроля, описа-
ния оборудования и реактивов, пошаговых указаний по выполнению хода работы
и обработке результатов
Соответствует действующему Федеральному государственному образователь-
ному стандарту высшего образования нового поколения.
Для студентов вузов технического профиля.
УДК 54(075.8)
ББК 24.1я73
ISBN 978-5-406-04140-6
© Коровин Н В, Камышева В.К., Удрис Е.Я , 2015
© ООО «Издательство «КноРус». 2015
ОГЛАВЛЕНИЕ
Предисловие 5
Глава 1. Общие правила работы в практикуме.
Лабораторное оборудование....................
1.1. Общие правила поведения в химической лаборатории . . 7
1.2. Основные правила техники безопасности..................... 8
1.3. Общие требования к выполнению лабораторных работ. . 8
1.4. Лабораторное оборудование и техника выполнения основных
операций....................................................... 9
15. Масса и количество вещества. Концентрация................. 26
Работа 1. Основные методы выполнения лабораторного эксперимента 27
Глава 2. Стехиометрические законы 48
Работа 2. Определение выхода реакции . ............ 51
Работа 3. Определение молярной массы диоксида углерода .... 52
Работа 4. Эквивалент и молярная масса эквивалентов вещества. 56
Работа 5. Определение содержания кристаллизационной воды
в кристаллогидрате карбоната натрия........................... 68
Глава 3. Строение вещества ... 71
Работа 6. Электронные структуры ... ...... ... 73
Работа 7. Влияние типа кристаллической решетки на физико-
химические свойства веществ . . . . 76
Работа 8. Строение атомов металлов и их химические свойства . . 85
Глава 4. Тепловые эффекты химических реакций ................. 90
Работа 9. Определение теплоты нейтрализации сильного основания
сильной кислотой ........................................... 95
Работа 10 Определение энтальпии реакции образования
кристаллогидрата . ... 100
Глава 5. Химическое равновесие............................... 103
Работа 11 Смещение химического равновесия.... 106
Работа 12. Исследование равновесия гомогенной реакции 108
Работа 13 Определение константы нестойкости комплекса меди(П)
и его состава.............................................. 114
Работа 14. Адсорбционное равновесие. . 120
Глава 6. Кинетика химических реакций ....... 130
Работа 15 Исследование кинетики гетерогенной химической реакции 134
Работа 16 Исследование кинетики гомогенной реакции .......... 139
Работа 17 Определение кинетических характеристик реакций
колориметрическим методом ................................... 143
Работа 18. Зависимость скорости реакции разложения тиосерной
кислоты от температуры....................................... 147
4 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 19 Исследование зависимости скорости реакции окисления
от температуры. ........................... ............ 150
Работа 20. Катализ. .... .... .... (55
Работа 21 Исследование кинетики каталитического разложения
пероксида водорода.... ...... ......... .... 157
Глава 7. Вода и водные растворы.............................. 163
Работа 22. Концентрация и плотность растворов. . . ....... 164
Работа 23. Определение концентрации растворенного кислорода в воде 169
Работа 24. Определение температуры замерзания (кристаллизации)
водных растворов ...................... .... .... 175
Работа 25. Исследование водных растворов сильных электролитов
кондуктометрическим методом.................................. (83
Работа 26. Исследование водных растворов слабых электролитов
кондуктометрическим методом............................... 189
Работа 27. Исследование растворов сильных электролитов методом
рН-метрии.................................................... 194
Работа 28. Исследование растворов слабых электролитов методом РН-
метрии.................................................... 20 (
Работа 29. Гидролиз солей. Исследование растворов солей методом
рН-метрии.................................................... 207
Работа 30. Определение энтальпии реакции гидролиза карбонатов
щелочных металлов.......................................... 218
Работа 31. Влияние температуры на смещение гидролитического
равновесия . ... . . . 220
Работа 32. Исследование буферных растворов .... 225
Работа 33. Малорастворимые электролиты....................... 233
Работа 34. Определение произведения растворимости Са(ОН),. 237
Работа 35. Определение жесткости воды........................ 243
Работа 36. Умягчение воды методом ионного обмена 252
Глава 8. Окислительно-восстановительные и электрохимические
процессы .... ... ............................. 258
Работа 37. Исследование окислительно-восстановительных систем
с помощью редокс-электродов........ .................. 260
Работа 38. Электродвижущая сила и напряжение гальванического
элемента. . . .... ................ 274
Работа 39. Концентрационный гальванический элемент.... 286
Работа 40. Электролиз водного раствора сульфата натрия....... 288
Работа 41 Определение числа Фарадея и числа Авогадро с помощью
электролиза................................................ 294
Работа 42. Электролитическое рафинирование меди 297
Работа 43. Электрохимическая коррозия металлов. . 300
Работа 44. Защита металлов от коррозии. ... И 6
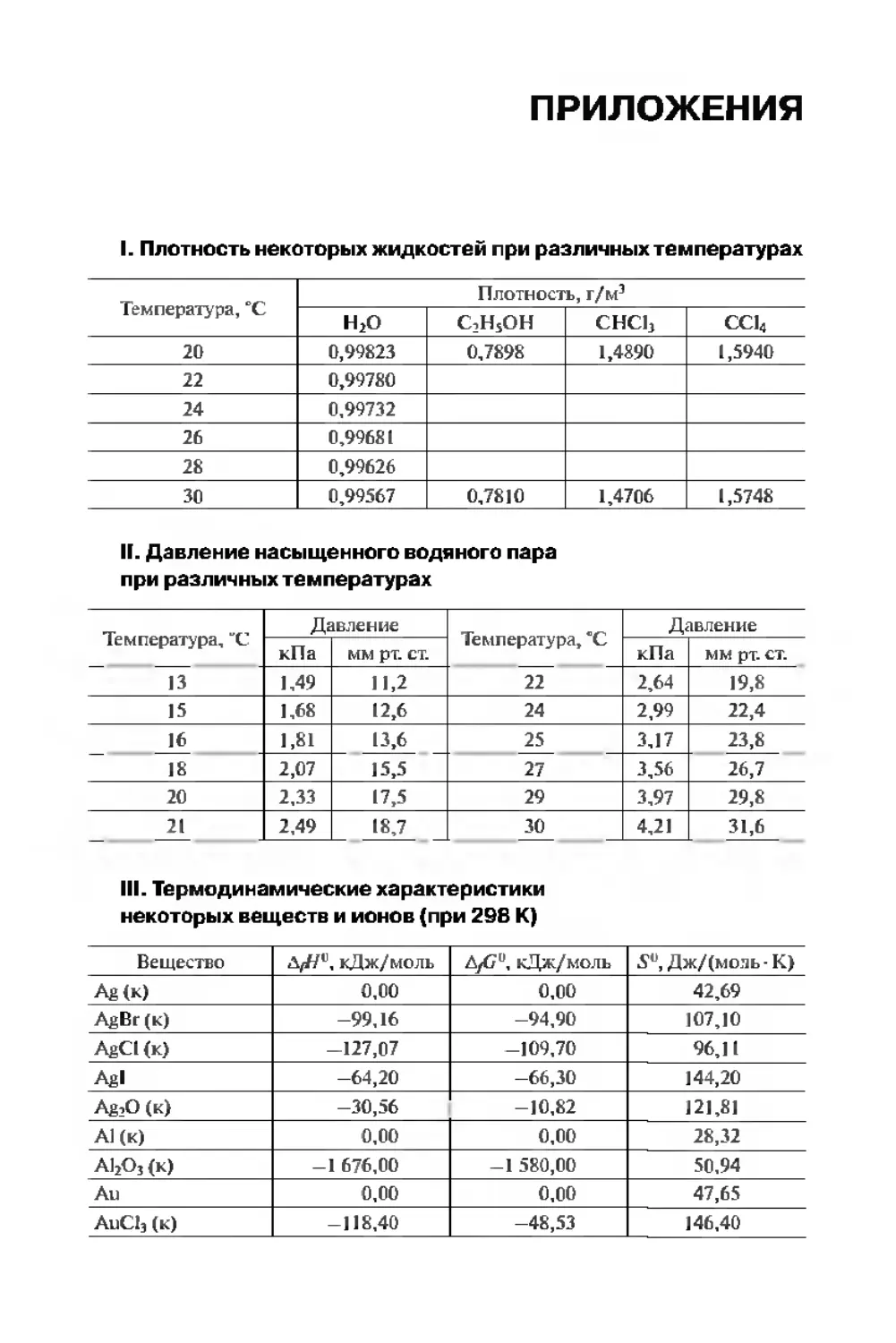
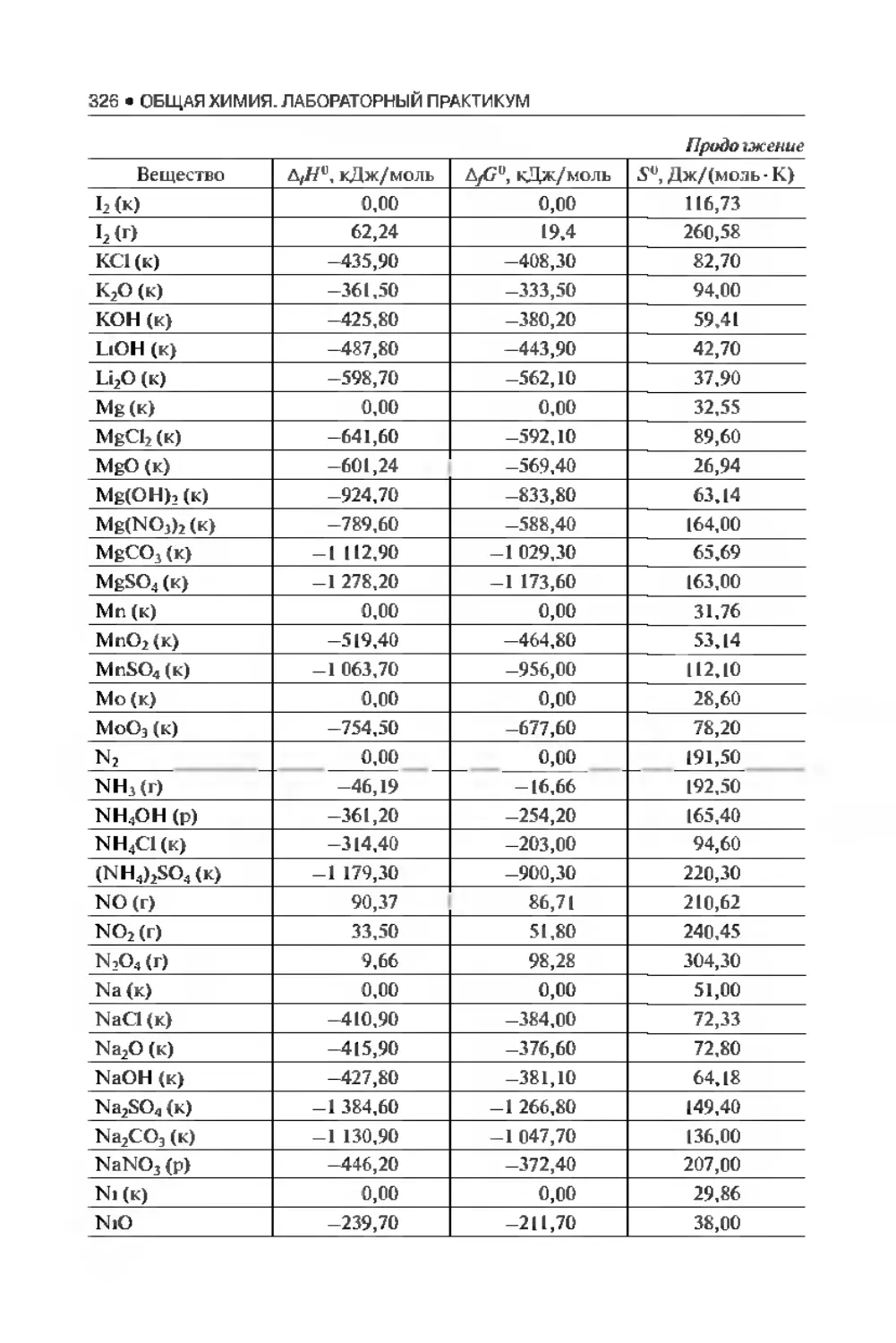
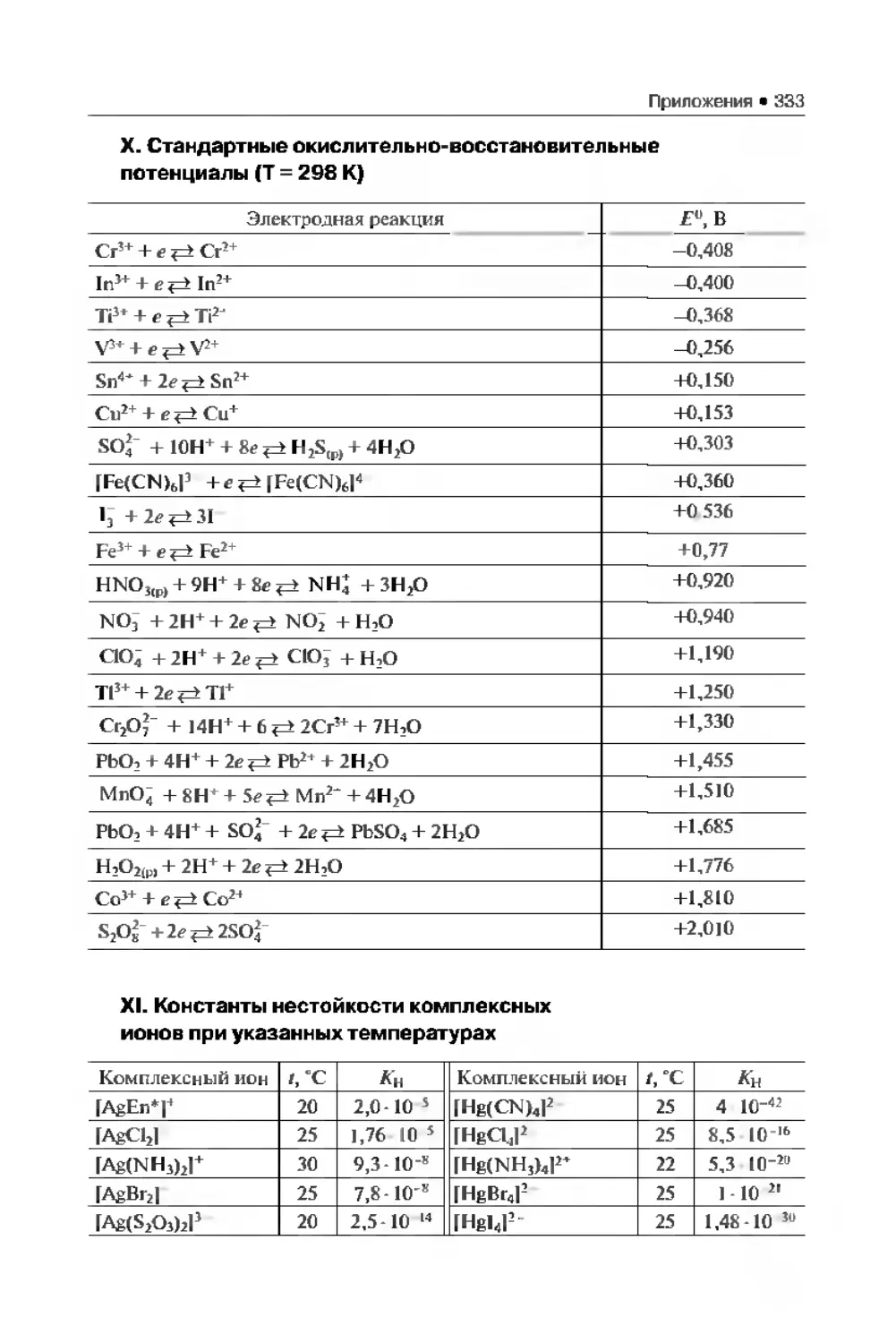
Приложения . . 323
Библиографический список..................................... 335
ПРЕДИСЛОВИЕ
Учебное пособие «Общая химия. Лабораторный практикум» пред-
назначено для выполнения лабораторных работ по химии в вузах тех-
нического профиля. Практикум отвечает современным государствен-
ным образовательным стандартам и учебным программам по химии
для технических вузов и охватывает все основные разделы курса об-
щей химии, включая строение вещества, энерге>ику химических про-
цессов, химическую кинетику и равновесие, растворы, окислитель-
но-восстановительные и электрохимические процессы, коррозию
металлов. Теоретический материал и порядок представления работ
соответствует учебнику Н.В. Коровина «Общая химия», выдержавше-
му более десятка изданий. Указанный учебник, настоящий практи-
кум и «Сборник задач и упражнений» под редакцией Н.В. Коровина
составляют единый учебно-методический комплекс, позволяющий
осуществлять изучение дисциплины на современном уровне, предус-
матривающем широкое использование инновационных методов обу-
чения. современного оборудования, информационно-коммуникаци-
онных технологий (МКТ) и увеличение доли самостоятельной работы
студента.
Архитектура настоящего учебного пособия построена так, что
предусматривает возможность выполнения большинства лаборатор-
ных работ в двух вариантах: с применением традиционных методов
исследований и с использованием современного инструментального
оборудования — цифровой лаборатории.
Цифровая лаборатория представляет собой набор цифрового обо-
рудования (датчиков), непосредственно подключаемых к компьюте-
ру, и компьютерную программу, управляющую этим оборудованием,
сбором и сохранением данных. Совокупность цифровых датчиков
по большому раду измеряемых параметров позволяет решать широ-
кий спектр экспериментальных задач от опытов начального уровня
до современных учебно-исследовательских работ. Лабораторные рабо-
ты с использованием цифровой лаборатории разработаны и успешно
внедрены на кафедре химии и электрохимической энергетики НИУ
«МЭИ». Цифровое оборудование и необходимое для него программ-
ное обеспечение созданы компанией ООО «Научные развлечения»
(www.nau-ra.ru).
Задачей авторов было показать, как можно сочетать классические
методы (подходы, методики) с использованием современного цифро-
вого оборудования и компьютерной обработкой данных.
6 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Описание каждой работы включает в себя теоретическую часть
и вопросы для самоконтроля, достаточные для осмысленного выпол-
нения работы, экспериментальную часть с подробными, пошаговы-
ми указаниями по проведению эксперимента, указания по обработ-
ке результатов как компыигерным, так и традиционным способом.
Применяемая компьютерная программа согласуется с большинством
стандартных программ по работе с числовыми данными и позволяет
проводить обработку результатов в зависимости от уровня подготовки
и предпочтений учащихся.
Таким образом, настоящий практикум предоставляет широкие
возможности выбора для преподавателей способов проведения экс-
перимента и способов обработки экспериментальных данных,- воз-
можность постановки эксперимента разного уровня сложности в за-
висимости от подготовки учащихся и развития лабораторной работы
до более высокого уровня; возможность одновременного выполнения
нескольких различных лабораторных работ группами учащихся или
выполнение фронтальной работы с ее индивидуализацией и возмож-
ность отказа от бумажных лабораторных журналов в пользу электрон-
ных. Большая самостоятельность в подготовке и выполнении экспе-
римента, возможность компьютерной обработки полученных данных
делаю г практикум более современным, динамичным, а значиц и более
интересным для учащихся.
Внедрение цифровой лаборатории и компьютерной обработки
эксперимента в традиционный лабораторный практикум позволя-
ет наряду с формированием у студентов необходимых компетенций
и практических навыков использовать преимущества информацион-
ных технологий в образовательном процессе, осуществлять более ши-
рокие межпредметные связи при обучении. Современная техническая
оснащенность химических лабораторных практикумов позволяет рас-
ширить как число исследуемых объектов, так и объем получаемой ин-
формации.
ГЛАВА
ОБЩИЕ ПРАВИЛА
РАБОТЫ В ПРАКТИКУМЕ.
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
1.1. Общие правила поведения
в химической лаборатории
При работе в химическом лаборатории студент должен соблюдать
следующие правила:
1) Пройти инструктаж по технике безопасности и строго соблю-
дать правила.
2) Работать на закрепленном за ним рабочем месте и оборудова-
нии.
3) Работать аккуратно, следить за порядком на своем рабочем
месте.
4) Работать согласованно с другими студентами.
5) Приходить подготовленным к выполнению работы, быть гото-
вым к обсуждению хода работы с преподавателем.
6) Записывать результаты и наблюдения в заранее подготовленные
таблицы, не делать записи в черновиках и на отдельных листочках.
7) Пи окончании работы убрать рабочее место, вымыть посуду, вы-
ключить электрические приборы и дать преподавателю на под-
пись свой журнал.
8) Не блокировать пространство между столами сумками и верх-
ней одеждой.
9) Не бегать, не разговаривать громко, не принимать пишу.
10) Не подносить близко к лицу пробирки, стаканы, колбы с реа-
гентами.
11) Не переносить неизрасходованные реактивы в тот же сосуд, от-
куда они были взяты.
12) Не проводить непредусмотренные учебным планом опыты.
13) Не расходовать реактивы и воду в излишних количествах.
8 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
1.2. Основные правила техники безопасности
Работая в химической лаборатории, студент должен соблюдать все
правила по технике безопасности:
1) Аккуратно наливать, насыпать и переливать реактивы.
2) Если кислота или щелочь попали на кожу или одежду, необходи-
мо быстро смыть большим количеством воды и далее обратиться
за помощью к преподавателю.
3) Разбавляя концентрированные кислоты (особенно серную),
осторожно вливать кислоту в воду.
4) Не работать с легковоспламеняющимися жидкостями вблизи
нагревательных приборов.
5) Не нагревать в закрытых сосудах газообразные вещества, при
нагревании жидкостей в пробирках держать их в сторону от себя
и товарищей, горячие предметы брать специальными щипцами.
6) Опыты с опасными и сильно пахнущими веществами проводить
в вытяжном шкафу, проверив, хорошо ли работает тяга.
7) Остатки агрессивных веществ сливать только в специальную по-
суду.
8) После работы в лаборатории обязаюльно вымыть руки.
1.3. Общие требования к выполнению
лабораторных работ
Каждая лабораторная работа представлена в виде пошаговой по-
следовательности необходимых действий по подготовке и проведе-
нию эксперимента, иллюстрируется рисунками установок. В первых
работах подробно изложены действия с датчиками и программой
практикума. В последующих работах описание дается более кон-
спективно.
Прежде всего следует внимательно ознакомиться с теоретической
частью, ответить на вопросы для самоконтроля, попытаться решить
предложенные задачи.
Получить у преподавателя конкретное задание. Внимательно про-
читать перечень оборудования и реактивов, необходимых для выпол-
нения работы, и только после этого приступать к приготовлению рас-
творов и сборке экспериментальной установки.
Внимательно ознакомиться с ходом выполнения работы. Сформи-
ровать таблицы исходных и экспериментальных данных.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 9
Эксперимент выполнять строго в изложенной последовательности
действий.
После окончания эксперимента следует провести обработку полу-
ченных данных в соответствии с указаниями и сделать выводы
1.4. Лабораторное оборудование и техника
выполнения основных операций
Мерная химическая посуда
Мерной называют посуду, применяемую для измерения объемов
жидкости. Мерная посуда градуирована в миллилитрах, реже в литрах.
К ней относятся цилиндры, пипетки, бюретки и мерные колбы. Для
правильного измерения объемов необходимо, чтобы глаз наблюдателя
находился на одной горизонтальной линии с нижним мениском жид-
кости, по которому делается замер (рис. 1.1).
Мерные цилиндры (рис. 1.2а) применяют в тех случаях, когда изме-
рение объема жидкости не требует большой точности. Емкость цилин-
дров бывает от 5 мл до 1 л.
Чтобы отмерить нужный объем жидкости, ее наливают в мерный
цилиндр до тех пор, пока нижний мениск не достигнет уровня нужно-
го деления.
10 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Пипетки (рис. 1.26) служат для отмеривания и переноса опреде-
ленного объема жидкости. Обычные пипетки представляют собой
стеклянные трубки небольшого диаметра с расширением посредине
и оттянутым нижним концом. Пипетки бывают вместимостью от 0,1
до 100 мл. В верхней части пипетки имеется метка, до которой наби-
рают жидкость. Широко применяют также градуированные пипет-
ки с делениями. Для наполнения нижний конец пипетки опускают
в жидкость до дна сосуда. С помощью груши набирают жидкость, сле-
дя, чтобы кончик пипетки все время находился в жидкости. Жидкость
набирают так, чтобы она поднялась на 2—3 см выше метки, затем бы-
стро закрывают верхнее отверстие указательным пальцем. Ослабляя
нажим указательного пальца, позволяют жидкости опустится до мет-
ки и снова зажимают палец. Введя пипетку в сосуд, в который нужно
перенести жидкость, отнимают указательный палец и дают жидкости
стечь по стенке сосуда (рис. 1.3)
Выдувать жидкость из пипетки не следует, так как пипетка отграду-
ирована с учетом оставшейся в ней капли.
Бюретки позволяют точно отмерить любой объем жидкости в пре-
делах ее вместимости. Объемные бюретки (рис. 1.2в) представляют
собой стеклянные градуированные трубки, снабженные притертым
краном или стеклянным капилляром, присоединенным к бюретке
с помощью резиновой трубки. Внутрь резиновой трубки закладывают
стеклянный шарик, закрывающий выход жидкости из бюретки. Для
вытекания жидкости резиновую трубку оттягивают от шарика. Бю-
ретку заполняют жидкостью через воронку, при этом должен быть за-
полнен и стеклянный капилляр. Если в капилляре остается пузырек
воздуха, резиновую трубку изгибают так, чтобы кончик капилляра был
направлен вверх, и вытесняют жидкостью весь воздух (рис. 1.4).
/
Рис. 1.3. Выливание
раствора из пипетки
Рис. 1.4. Удаление воздуха
из капилляра бюретки
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 11
Мерные колбы применяют для приготовления заданного объема рас-
твора. Они представляют собой плоскодонные сосуды различной вме-
стимости (рис. 1.2г). На горлышке колбы имеется метка, а на самой
колбе указана ее вместимость в миллилитрах при определенной темпе-
ратуре. Для приготовления раствора в колбу наливают немного виды,
вносят вещество и растворяют его в этой воде. Потом добавляют воды
на 0.5—1,0 см ниже метки, после чего доводят до метки, добавляя воду
по каплям из пипетки. Затем плотно закрывают колбу пробкой и тща-
тельно перемешивают раствор, переворачивая колбу несколько раз.
Цифровой датчик объема жидкого реагента
В цифровой лаборатории вместо бюретки для отмеривания точного
объема жидкости используется цифровой датчик объема жидкого ре-
агента (рис. 1.5), подсоединяемый кабелем к USB-порту компьютера,
на экране которого отображается либо зависимость объема от време-
ни, либо зависимость какого-либо параметра от объема добавленного
реагента.
Рис. 1.5. Датчик объема жидкого реагента.
Г — электронный блок, 2 — корпус датчика; 3 — колесико
толкателя, 4 — шприц; 5 — соединительный кабель
Датчик измеряет объем реагента, который выпускается с помощью
шприца
Шприц объемом от 2 до 20 мл вставляется в датчик, и вращени-
ем колесика толка!ели выдавливается определенная порция (объем)
жидкого реагента. Длина пути, пройденного толкателем, измеряется
и пересчитывается в объем реагента.
Чувствительность датчика равна 0,02 мл. Погрешность измерений
составляет 2%.
12 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Фильтрование — процесс механического разделения твердых и жид-
ких компонентов смеси. Жидкость с находящимися в ней частицами
твердого вещества пропускают через фильтр, задерживающий твердую
фазу.
Наиболее распространенными являются бумажные фильтры. Ког-
да целью фильтрования является выделение твердого осадка, фильтро-
вание проводят через простой, гладкий фильтр (рис. 1.6»)
Рис. 1.6. Изготовление фильтров
а — простого, б — складчатого
Простой фильтр готовят из куска фильтровальной бумаги, пере-
гибая его дважды так, чтобы он плотно прилегал к стенкам ворон-
ки. Воронку помешают в кольцо штатива, подставляют под нее ста-
кан. Не взмучивая осадка, сливают жидкость по стеклянной палочке
на фильтр Затем в стакан с осадком вливают небольшое количество
чистого растворителя, перемешивают и вновь сливают жидкость
по палочке на фильтр. Образовавшийся на фильтре осадок промывают
2—3 раза чистым растворителем.
Если целью фильтрования является получение жидкости, то при-
меняют складчатый фильтр. Для его изготовления простой (круглый)
фильтр складывают пополам, как указано на рис. 1.66, а затем склады-
вают по радиусу то в одну, то в другую сторону так, чтобы получилась
гармошка, которую раскрывают в виде конуса и вставляют в воронку.
Взятие реактивов. Сухие вещества следует брать шпателем, раство-
ры — пипеткой. Категорически запрещается использовать для разных
реактивов один и тот же шпатель или одну и ту же пипетку. Внося сухие
вещества или растворы в рабочую емкость, не следует опускать конец
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 13
шпателя или пипетки глубоко в пробирку, а также касаться ее внутрен-
них стенок во избежание загрязнения исходных реактивов.
Измельчение твердых веществ производят пестиком в фарфоровой
ступке
Работа с газообразными веществами
При получении газов исходные вещества помещают в реакционный
сосуд — колбу или пробирку. Если газ исследуют непосредственно при
его выделении, отмечая его цвет и запах, то получение газа можно вести
в открытой пробирке. Запах определяют, направляя легким движением
руки струю газа к себе. Если же газ требуется пропустить через какой-
либо раствор (рис. 1.7), то сосуд (2), в ко-
тором происходит реакция, укрепляют
в лапке штатива. Конец газоотводной
трубки (3) опускают в газоприемник (/).
Наполнение сосудов газом часто про-
изводят методом вытеснения воздуха
(рис. 1.8).
В этом случае пробирку-приемник за-
крепляют в штативе вертикально, отвер-
стием вверх — для газов тяжелее воздуха
(рис. 1.8а) или вверх дном — для газов
легче воздуха (рис. 1.86). Газы с плот-
ностью, близкой к плотности воздуха,
и практически нерастворимые в воде, со-
бирают над водой методом вытеснения
(рис. 1.9). Если использовать градуиро-
ванную пробирку, то можно определить
объем выделяющегося газа.
Рис. 1.7. Прибор для
получения газа и исследования
взаимодействия его
с раствором.
1 — газоприемник, 2 — колба,
3 — газоотводная трубка
Рис. 1.8. Прибор для собирания газа-
а — тяжелее воздуха; б — легче воздуха
14 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Цифровой датчик объема газа с контролем температуры
Датчик объема газа с контролем температуры (рис. 1.10) предна-
значен для измерения изменения объема газа с одновременным кон-
тролем температуры во внутреннем объеме датчика. Датчик подсоеди-
няется кабелем к LJSB-порту компьютера. Компьютерная программа
практикума осуществляет сбор данных и вывод их на экран в виде за-
висимостей объема и температуры от времени.
Рис. 1.10. Датчик объема газа с контролем температуры'
1 — полиэтиленовый резервуар с гофрированными стенками,
2 — электронный блок, 3 — штуцер для присоединения резиновых
или пластиковых трубок, 4 — пластина из стеклотекстолита
Диапазон измерения объема газа от 0 до 400 мл. Погрешность изме-
рения объема не более ±5 мл. Диапазон температур исследуемого газа
от Одо + 100 °C. Погрешность измерения температуры не более ± 2 °C.
Датчик состоит из цилиндрического полиэтиленового резервуара
с гофрированными стенками (/), объем которого изменяется при пе-
ремещении одного из оснований цилиндра вдоль его оси. Изменение
объема происходит под действием разности давлений внутри и снару-
жи цилиндра, не превышающей 2 кПа (2°i> от атмосферного давления).
Подвижное основание гофрированного цилиндра связано с пластиной
из стеклотекстолита (4), на которую нанесены штрихи. Электронный
блок (2) на основе оптоэлектрических датчиков и микроконтроллера
контролирует перемещение пластины и таким образом осуществляет
измерение объема Внутри гофрированного цилиндра помещен дат-
чик температуры на основе терморезистора. Датчик имеет входной
штуцер для присоединения резиновых или пластиковых трубок (5).
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 15
При работе не допускается: а) чрезмерное наполнение датчика га-
зом, б) воздействие агрессивных газов и паров, в) нагрев цилиндра
выше 60 'С.
Подготовка и порядок работы
1. Закрепите датчик в штативе. Убедитесь, что коническая проб-
ка надежно вставлена в горловину подвижного основания цилиндра
с гофрированными стенками.
2. С помощью кабеля подключите датчик к USB-порту компьюте-
ра, запустите программу проведения практикума.
3. Перед началом измерений осуществите настройку датчика:
плавно сожмите резервуар с гофрированными стенками до упора,
а затем отпустите его, при этом должен загореться второй светодиод
на торие корпуса датчика, что будет означать готовность его к работе.
4. С помощью трубки соедините датчик с экспериментальной уста-
новкой.
5. Для измерения объема газа, поступившего в резервуар, необхо-
димо нажать на экране кнопку «>0<». При этом текущее значение объ-
ема будет принято за нулевое.
Взвешивание. Весы
В гависимости от точности взве-
шивания весы подразделяют на тех-
нические для грубого взвешивания
(точность до 1 г), на технические
для точного взвешивания (точность
до 0,01 г), на аналитические (точность
10’4—10-6 г. и специальные (пробир-
ные, торсионные).
До недавнего времени самыми рас-
пространенными техническими весами
в учебных химических лабораториях
были технохимические весы, или техни-
ческие весы для точного взвешивания,
представленные на рис. 1.11.
Технохимические весы состоят
из коромысла (2), на котором укрепле-
ны три стальные или агатовые призмы:
две на концах, обращенные ребром
вверх, и одна посередине, обращенная
Рис. 1.11. Технохимические весы
/ — балансировочные гайки.
2— коромысло, 3— отвес,
4 — чашки, 5— установочные
винты, 6 — шкала; 7— ручка
арретира; 8 — стрелки
16 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ребром вниз. Коромысло своей средней призмой опирается на по-
душку, укрепленную на центральной колонке весов. Чашки весов (4)
посредством серег подвешены на концевые призмы. Для определения
состояния равновесия служит длинная стрелка (5) и шкала с деления-
ми (б). Весы имеют арретир (7), т.е. приспособление, дающее возмож-
ность прекращать качания коромысла и связанной с ним стрелки.
Арретир приподнимает коромысло и чашки весов и тем самым ос-
вобождает призмы от контакта с пластинками, что предохраняет при-
змы от преждевременного изнашивания. Неработающие весы всегда
должны быть арретированы.
Для взвешивания на технических весах применяют стограммовый
разновес, представляющий собой набор граммовых и миллиграммо-
вых гирь-разновесок. Взвешиваемое вещество помещают на левую
чашку весов, а на правую — разновески в нисходящем порядке, на-
чиная с самых крупных.
Электронные технические весы
Рис. 1.12. Весы цифровые’
1 — кабель питания, 2 —
платформа, 3 — кнопка On/Off,
4— индикатор, 5— кнопка
сброса тары, 6 — компьютер
В современных учебных лабораториях используют более компакт-
ные, удобные и простые в эксплуатации электронные весы различных
моделей. Одна из моделей представлена на рис. 1.12. Конструктивно
весы устроены по-разному, однако обязательно имеют корпус, плат-
форму (2), индикатор (4), кнопку вкл./выкл., или On/Off(3) и кнопку
сброса тары (5). Платформа может быть как съемной, так и несъемной.
Иногда в нижней части весов есть крюк, позволяющий подвешивать
взвешиваемые тела к ним снизу.
Используемые в данной цифро-
вой лаборатории весы имеют сетевой
кабель и адаптер для подключения
к компьютеру через LJSB-порт. Сен-
сор электронных весов представляет
собой так называемую тензобалку —
металлическую балку, на которой
закреплены элементы, меняющие
свое сопротивление при растяжении
и сжатии. Предел взвешивания —
200 г. чувствительность — 0,01 г.
Для взвешивания следует нажать
кнопку включения. На индикаторе
при этом сначала высвечивается тех-
ническая информация, а потом выво-
дится значение «0.00». Взвешиваемый
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 17
объект ставят на платформу. При этом на индикатор выводится зна-
чение массы в граммах. При необходимости обнулить тару (т.е. сде-
лать так, чтобы вес тары при взвешивании не учитывался) ее ставят
на платформу и нажимают соответствующую кнопку (5).
В комплект весов обычно входят калибровочные гири, применяе-
мые для проверки правильности взвешивания. Категорически не сле-
дует прикладывать к весам нагрузки, превышающие максимальный
предел взвешивания. Просыпанные или пролитые на весы реактивы
следует убирать сразу после взвешивания.
Более подробно правила обращения с весами, их возможные неис-
правности и методы их устранения, а также принципы калибровки из-
ложены в руководстве по пользованию конкретной моделью.
Определение оптической плотности. Фотоколориметр
Фотоколориметр предназначен для определения оптической плот-
ности окрашенных сред. В разных учебных лабораториях применяют
фотоколориметры разных моделей, поэтому при работе с приборами
следует пользоваться прилагаемыми инструкциями.
Принцип действия фотоколориметра основан на поглощении мо-
лекулами окрашенного вещее tea части свеювий энергии. Чем больше
в растворе окрашенных молекул, тем больше световой энергии будет
поглощено.
Поглощение света веществом находится в прямой зависимости
от концентрации растворенного окрашенного вещества и от толщины
слоя раствора. Эта зависимость описывается законом Бугера — Ламбер-
та — Бера'.
P = lg(4/7) = E - с -
где /и — интенсивность светового излучения на входе в раствор; I — интен-
сивность светового излучения на выходе из раствора; е — коэффициент экс-
тинкции (молярный коэффициент светопоглощения), зависящий от природы
вещества и длины волны света; с — молярная концентрация окрашенного ве-
щества в растворе; 1 — толщина слоя раствора.
Молярный коэффициент светопоглощения представляет собой по-
стоянную величину для данного окрашенного соединения.
Логарифм отношения 1g— называется оптической плотностью
раствора D
Из закона Бугера — Ламберта — Бера следует, что оптическая плот-
ность раствора прямо пропорциональна концентрации окрашенного
раствора и толщине слоя раствора.
18 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Основные правила работы на фотоколориметре
1. Налить в кювету исследуемый раствор до метки и протереть тор-
цевые стенки кюветы фильтровальной бумагой.
2. Поместить кювету в свободную ячейку правого кюветодержате-
ля и передвижением рукоятки на правой стенке прибора установить ее
на пути светового потока.
3. Перекрыть световые потоки, переместив вправо рукоятку
на верхней панели прибора.
4. Установить стрелку микроамперметра на «О» с помощью рукоят-
ки, расположенной на левой стенке прибора.
5. Установить правый и левый измерительные барабаны отсчета
0—100.
6. Открыть световые потоки, переместить влево рукоятку на верх-
ней панели
7. Установить стрелки микроамперметра на «0» вращением левого
измерительного барабана.
S. Передвинуть правый кюветодержатель так, чтобы световой по-
ток проходил через растворитель.
9. Установить стрелки микроамперметра на «0» вращением право-
го измерительного барабана.
10. Отсчитать значение оптической плотности по красной шкале
правого барабана.
11 Вынуть кювету, вылить раствор и сполоснуть дистиллирован-
ной водой.
Цифровой датчик оптической плотности
Датчик оптической плотности (рис. 1.13) предназначен для измере-
ния оптической плотности окра-
Рис. 1.13. Цифровой датчик
оптической плотности.
1 — электронный блок,
2 — кювета, 3 — разъем USB
шенных сред.
Цифровой датчик оптической
плотности имеет П-образный кор-
пус. В нем смонтированы источник
и приемник света на основе свето-
и фотодиодов, а также электрон-
ная схема с микроконтроллером,
обеспечивающая измерение и учет
фоновой освещенности на протя-
жении всего опыта, определение
уровня сигнала при отсутствии по-
глощения при настройке датчика,
измерение уровня сигнала, прохо-
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 19
дяшего через кювету при выполнении эксперимента, и расчет опти-
ческой плотности. Конструкция корпуса датчика соответствует форме
кюветы (2). Датчик имеет винт, с помощью которого он фиксируется
на кювете. Датчик подключается к LJSB-порту компьютера с помошью
соединительного кабеля и имеет разъем для его подключения (5).
Диапазон измерений оптической плотности 0—2. Время установ-
ления показаний не более 1 секунды. Следует предохранять датчик
от попадания на него жидких и твердых реактивов и не допускать ис-
пользования датчика с растворами, температура которых превышает
60 "С.
Подготовка и порядок работы с датчиком
1. Вставить кювету в корпус датчика и зафиксировать ее с помо-
щью винта.
2. С помошью соединительного кабеля подключить датчик к USB-
порту компьютера.
3. Запустить программу проведения практикума.
4. Перед началом работы следует выполнить настройку датчика.
Для этого необходимо заполнить кювету дистиллированной водой
(не менее чем на 2/3 объема), после чего в окне работы с датчиком
на экране нажать кнопку «Настройка».
5. При выполнении работ необходимо обращать внимание на чи-
стоту стенок кюветы.
6. Если излучатель не светится, следует проверить надежность под-
ключения датчика к компьютеру.
7. Если величина оптической плотности заметно меняется во вре-
мени, это означает, что имеются либо 1вердые включения, либо пу-
зырьки газа. Необходимо заменить раствор или дождаться удаления
пузырьков газа.
Измерение электрической проводимости. Кондуктометр
Кондуктометр предназначен для определения удельной электриче-
ской проводимости жидких сред.
Удельной электрической проводимостью раствора (о. См - м_|) на-
зывается электрическая проводимость столба жидкости длиной 1 м
при поперечном сечении 1 м2
Удельная электрическая проводимость ст есть величина, обратная
удельному сопротивлению (р): о = 1/р.
Так как перенос электричества через раствор электролита осущест-
вляется ионами, то удельная электрическая проводимость зависит
от концентрации, заряда ионов и скорости их движения. В разных ла-
20 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
бораториях применяют кондуктометры разных моделей, поэтому при
работе с приборами следует пользоваться прилагаемыми инструкциями.
Общие правила работы на кондуктометре
1. Налить в стакан (на '/2 его объема) анализируемым раствор и по-
местить в него измерительный электрод, предварительно протерев его
фильтровальной бумагой.
2. Поворотом винта на передней панели прибора подобрать такой
диапазон для измерения, чтобы стрелка гальванометра при измерении
отклонилась примерно до середины шкалы.
3. Рассчитать величину удельной электрической проводимости
раствора, приняв всю шкалу равной указанному диапазону измеряе-
мой величины.
4. Вынуть из раствора измерительный электрод и тщательно про-
мыть его.
Цифровой датчик электропроводности
Цифровой датчик электропроводности (рис. 1.14) предназначен
для измерения удельной электропроводности жидких сред. Датчик
подключают к (JSB-порту компьютера с помощью соединительного
кабеля и запускают программу практикума. Компьютерная программа
выводит данные на монитор в виде зависимости электропроводности
от времени.
Рис. 1.14. Цифровом датчик электропроводности
/ — щуп с двумя электродами, 2— электронный блок
Датчик обеспечивает измерение удельной электропроводности
жидких сред в двух диапазонах: 0—1 мСм/см и 0—12 мСм/см. Чув-
ствительность измерения 0,002 мСм/см. Время установления показа-
ний не более 5 с.
Цифровой датчик включает в себя щуп с двумя электродами (7)
и электронный блок (2), выполненный в пластиковом корпусе. При
включении датчика на электроды подается переменное напряжение.
Между электродами возникает падение напряжения, обратно пропор-
циональное электропроводности, которое и измеряют.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 21
Щуп датчика погружают в изучаемый раствор так, чтобы раствор
залил электроды. Необходимо убедиться, что внутри между электрода-
ми нет пузырьков воздуха, а сам шуп должен отстоять от стенок сосуда
не менее чем на 2 см. После каждого использования шуп необходимо
ополаскивать дистиллированной водой и протирать фильтровальной
бумагой. Если на электродах щупа появляется налет, его необходимо
счистить салфеткой из жесткой ткани.
Запрещается погружать датчик в растворы сильных кислот и осно-
ваний с концентрацией более 1 моль/л и температурой выше 60 °C.
Перед началом работы рекомендуется выдержать шуп датчика в дис-
тиллированной воде в течение 0.5 часа.
Измерение водородного показателя среды.
pH-метр — милливольтметр
pH-метр — милливольтметр предназначен для определения водо-
родного показателя среды (pH) и разности потенциалов. Действие
прибора основано на измерении разности потенциалов двух электро-
дов — измерительного и вспомогательного, помешенных в исследуе-
мый раствор. В качестве измерительного электрода при определении
pH раствора используют стеклянный электрод. В качестве вспомога-
тельного электрода обычно применяют проточный хлорсеребряный
электрод.
Перед каждым погружением электродов в анализируемый раствор
их необходимо тщательно промыть дистиллированной водой, после
чего промокнуть фильтровальной бумагой. По окончании измерений
промыть электроды и погрузить их в дистиллированную воду.
Правила работы с различными моделями pH-метров подробно из-
ложены в прилагаемых инструкциях.
Цифровой датчик pH
Цифровой датчик pH (рис. 1.15) предназначен для определения
водородного показателя среды (pH) и состоит из стеклянного комби-
нированного электрода (/), который с помощью кабеля с разъемом со-
единен с электронным блоком (2).
Электрод представляет собой пластмассовую трубку, внутри кото-
рой заключена трубка из стекла, в которой находится хлорсеребряный
электрод сравнения. Электрод сравнения погружен в 3 М раствор КО.
На конце стеклянной трубки находится стеклянный шарик — чувстви-
тельный элемент (3), на поверхности которого сорбируются ионы во-
дорода, вследствие чего возникает разность потенциалов, зависящая
22 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
от pH. Пластмассовый корпус имеет выступы, предохраняющие ша-
рик от механических воздействий. Шарик закрыт защитным колпач-
ком (4), в котором находится насыщенный раствор КС1 Потенциал
стеклянной мембраны прямо пропорционален pH. Измерение потен-
циала мембраны происходит относительно хлорсеребряного электро-
да сравнения.
Рис. 1.15. Цифровом датчик pH.
/ — стеклянный комбинированный электрод, 2 — электронный
блок, 3 — стеклянный шарик — чувствительный элемент.
4 — защитный колпачок с насыщенным раствором КС!
Датчик подключается к USB-порту персонального компьютера.
Получение данных и вывод их на экран в виде временной зависимости
измеряемой величины осуществляет компьютерная программа.
Диапазон измерения pH при температуре раствора 20 °C равен
0—14.
Погрешность (при температуре раствора 20 ’С) составляет не более
+0,1 единицы pH.
Чувствительность равна 0,01 ед. pH. Диапазон температур исследу-
емых растворов: от 10 до 80 'С.
Общие правила работы сдатчиком
1. Снять с электрода защитный колпачок, ополоснуть его дистил-
лированной водой и промокнуть фильтровальной бумагой. Электрод
должен быть погружен в исследуемый раствор на глубину не менее
10 мм.
2. По окончании измерений следует промыть электрод дистил-
лированной водой до установления показаний pH 5—8, промокнуть
фильтровальной бумагой и закрыть защитным колпачком.
3. Не применять датчик в растворах, содержащих фторид-ионы
и вещества, образующие осадки и пленки на поверхносги электрида.
4. Не следует прикасаться шариком датчика к твердым поверхно-
стям.
5. Не допускается попадание жидкости в корпус электронного бло-
ка датчика.
Глава 1-Общие правила работы в практикуме. Лабораторное оборудование • 23
Цифровой датчик температуры
1. Термопарный датчик температуры (рис. 1.16а) измеряет темпе-
ратуру в пределах 0—1000 °C с точностью до 1 °C. Показания устанав-
ливаются не более чем за 1 секунду.
Рис. 1.16. Датчики температуры
а — термопарный, б — терморезисторный
Датчик применяется для измерения температуры пламени, раство-
ров и расплавов солей, щелочей и металлов.
Чувствительным элементом датчика является термопара — спай
двух разных металлов, который находится на кончике датчика. Прин-
цип действия термопары основан на том, что если металлы имеют нео-
динаковую температуру и замкнуты в электрическую цепь, то на спаях
возникает электродвижущая сила, зависящая от разности температур
Датчик подключается к USB-порту компьютера. Получение дан-
ных и вывод их на экран в виде временной зависимости осуществляет
компьютерная программа.
После подключения датчика к компьютеру и запуска программы
кончик чувствительного элемента вносят в исследуемую среду. После
работы с расплавами солей и щелочей датчик промывают дистиллиро-
ванной водой, после работы с расплавленным металлом необходимо
его стряхнуть до того, как он застынет. Не следует измерять датчиком
температуру кислот и расплавов, имеющих кислую среду.
2. Терморезиеторный датчик температуры (рис. 1.176) измеря-
ет температуру в пределах —40—180 °C. Точность датчика составляет
0,25 °C. Чувствительный элемент — терморезистор изготовлен из тон-
конапыленной платины и находится на самом кончике датчика.
Принцип действия датчика заключается в том, что электрическое
сопротивление терморезистора линейно растет с увеличением тем-
пературы. После подключения датчика к компьютеру и запуска про-
граммы кончик чувствительного элемента вносят в исследуемую среду.
Следует избегать длительного нахождения датчика в агрессивных сре-
дах, особенно в сильнокислых растворах. По окончании работы дат-
24 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
чик необходимо промыть дистиллированной водой и высушить филь-
тровальной бумагой.
Ознакомление с цифровой лабораторией
и компьютерной программой практикума
Оборудование измерительной системы цифровой лаборатории со-
стоит из комплекта цифровых датчиков, подключаемых к компьюте-
ру, который служит для визуализации, хранения и обработки данных.
Первичный сбор, визуализация и сохранение данных выполняется
специальной программой, которая поставляется в комплекте с циф-
ровой лабораторией. Программа сохраняет результаты в графическом
и текстовом формате. Результаты в текстовом формате могут быть об-
работаны в любой nput рамме для работы с электронными таблицами
(например, OpenCalc или Microcofl Excel). Интерфейс программы
«Практикум» представлен на рис. 1.17.
Рис. 1.17. Интерфейс программы «Практикум»:
1 — ярлык программы «Практикум»; 2 — шаблон графика, 3 — код датчика;
4 — переустановка датчика. 5 — пределы измерений по оси Х'.б — пределы
измерений по оси У; 7 — различные режимы измерений. S — «Запустить
измерение», 9— «Остановить измерение»; 10— «Вывод табличных данных»,
Н — «Экспорт данных во внешний файл», 12 — «Продолжить график»
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 25
Общий порядок действий при работе с цифровой лабораторией
I. Включить компьютер.
2. Подсоединить нужные датчики с помошью соединительных
кабелей к USB-портам компьютера. Допускается одновременное ис-
пользование четырех датчиков, подключение которых производится
с помощью разветвителя.
3. Установить с диска программу практикума, следуя указаниям
компьютера.
4. После установления программы нажатием на соответствующий
ярлык «Практикум» (7) на рабочем столе запустить программу.
5. После запуска программа произведет опрос портов компью-
тера на предмет наличия подключенных датчиков. Если датчи-
ки не подключены, на экране всплывает окно, информирующее
об этом. Необходимо нажать кнопку «ОК», подключить датчики
и следовать указаниям программы по подключению оборудования.
Если датчик подключен, то программа автоматически распознает
его, при этом в верхней левой части интерфейса на белом поле под
панелью управления отображается код датчика (3). Одновременно
открывается окно измерения с шаблоном графика зависимости со-
ответствующего параметра от времени (2). Если подключен не один,
а несколько датчиков, на экране появится соответствующее число
шаблонов временных зависимостей для каждого из измеряемых па-
раметров.
6. С помощью кнопок «X» и «Г» (5) и (6) на панели управления
(над шаблоном графика) переустановить необходимые пределы из-
мерений.
7. Если целью измерения является получение зависимости одно-
го параметра от другого, следует выбрать режим «зависимость одного
от другого» или «зависимость одного от другого по нажатию» (7). По-
сле возникновения на экране шаблона графика зависимости одного
параметра от другого следует установить требуемые пределы измере-
ния параметров по осям координат.
8. Для начала работы нужно нажать кнопку «Запустить измерение»
(8). На экране начинается построение графика (или графиков) зави-
симости измеряемого параметра от времени либо зависимости изме-
ряемых параметров друг от друга. Пол графиком на экране отражается
цифровое значение параметров.
9. Для прекращения измерений нужно нажать кнопку «Остановить
измерение» (9).
10. При необходимости продолжить измерение нужно нажать
кнопку «Продолжить график» (72).
26 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
11. После остановки измерений становятся активными кнопки об-
работки данных. При нажатии кнопки «Вывод табличных данных» (10]
результаты эксперимента отображаются в виде таблицы на экране.
12. С помощью кнопки «Экспорт данных во внешний файл» (11)
текстовые и табличные результаты сохраняются в виде файлов в вы-
бранном месте, например в созданной папке «Лабораторный журнал».
1.5. Масса и количество вещества.
Концентрация
Единицей массы вещества в системе СИ является 1 кг, единицей
количества вещества — 1 моль. Моль — количество вещества, которое
содержит столько определенных структурных единиц (молекул, ато-
мов, ионов, эквивалентов и тд.), сколько содержится атомов в 0.012 кг
изотопа углерода |2С, т.е. ~6,022 • 1023 атомов углерода (постоянная
Авогадро). Таким образом, моль — это такое количество вещества, ко-
торое содержит 6,022 • 10а его структурных единиц.
Относительной атомной массой Аг химического элемента назы-
вается величина, равная отношению средней массы атомов элемента
(с учетом процентного содержания его изоюнов в природе) к */12 мас-
сы атома изотопа углерода ,2С. Например, Ar( Li) = 6,941.
Относительной молекулярной массой Mr вещества называется от-
ношение массы его молекулы к */12 массы атома изотопа углерода ,2С.
Например, Л/г(СН4) = 16,043.
Масса одного моля вещества X называется молярной массой М (X)
и представляет собой отношение массы т вещества (X) к его количе-
ству я:
М(Х) = кг/моль (или г/моль).
«(А)
Например, молярная масса лития М (Li) = 6.941 г/моль. молярная
масса метана Л/(СН4) = 16,043 г/моль.
Отношение количества или массы вещества, содержащегося в си-
стеме, к объему или массе этой системы называют концентрацией. Из-
вестно несколько способов выражения концентрации.
Молярная концентрация с — отношение количества вещества я, со-
я
держащегося в растворе, к объему L этого раствора: с=—, моль/м3
или моль/л. Например, с (H2SO4) = 1 моль/л или 1 М раствор H2SO4.
Работа 1 • 27
Молярная концентрация эквивалентов сэ (нормальная концентра-
ция) — отношение количества вещества эквивалентов пэ к объему
К раствора. д, = ^-, моль/м3 или моль/л. Например, c,(^H2SO4^ =
= 1 моль/л, c^-AlChj = 1 моль/л или 1 н. раствор А1С13.
Молягьная концентрация {моля гьность) ст — отношение количества
растворенного вещества и (моль) к массе т растворителя: сга =-,
моль/кграстворителя. Например, = 2 моль/кг Н2О.
Молярная доля xj — отношение количества вещества данного ком-
понента nj, содержащегося в растворе, к общему количеству вещества
Иу
всех компонентов: Х.- =—•
Lw
Молярная доля может быть выражена
в долях единицы, процентах (%), промилле (тысячная часть %) и мил-
лионных долях (млн — 1).
Массовая доля со — отношение массы данного компонента, содер-
"'в-ва
жашегося в системе, к обшей массе этой системы: <о=-- Массовая
«р-ра
доля может быть выражена в долях единицы, процентах (%), промилле
и миллионных долях.
Титр раствора Т — масса вещества, содержащегося в одном куби-
ческом сантиметре или в одном миллилитре раствора. Единица изме-
рения титра — г/см3, г/мл.
Работа 1. Основные методы выполнения
лабораторного эксперимента
Цель работы. ознакомление с основными методами химического
практикума: взвешиванием, измерением объемов жидкостей и газов,
титрованием и др.
Вопросы и задачи для самоконтроля
1. Для какой навески: 30 г или 150 г относительная ошибка при
одинаковой точности взвешивания будет больше?
2. В каких случаях используется мерная посуда?
3. Как определяют объем растворов?
4. В чем заключается метод титрования?
28 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 1. Взвешивание веществ на электронных весах
Нель опыта: определение массы веществ и ошибки эксперимента.
Выполнение работы возможно с помощью весов различных мо-
делей. Использование современных электронных весов значительно
ускоряет выполнение работы (рис. 1.12).
Экспериментальная часть
Контрольное взвешивание
1. Сформируйте табл. 1.1, как показано ниже
Таблица 1.1
№ ~|~ Won» г 1 /пист, г Де 8, %
2. Получите у лаборанта предмет для контрольного взвешивания
(например, металлическую пластинку).
3. Убедитесь в правильной установке весов, после чего подключите
их через адаптер в сеть.
4. Нажмите кнопку включения «Оп/Off». На индикаторе высвечи-
вается техническая информация, а потом выводится значение «0.00».
5. Положите объект на платформу и запишите показания индика-
тора mv„ в табл .1.1.
6. Узнайте у лаборанта истинную массу пластинки тип и запишите
в табл. 1.1.
Обработка экспериментальных данных
1. Рассчитайте абсолютную и относительную погрешности взве-
шивания. Запишите в таблицу
Абсолютная погрешность Де при определении массы представляет
собой разность между истинной массой т„„ и полученной опытным
путем moll, взятую по модулю. Таким образом, абсолютная ошибка всегда
положительная:
Ae = |m,Krr-mull|. (1.1)
Относительная погрешность 6 равна отношению абсолютной по-
грешности к истинной массе и выражается в процентах:
8 = — 100%.
(1-2)
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 29
Взвешивание сыпучих веществ
1. Убедитесь в правильной установке весов, после чего подключите
их через адаптер в сеть.
2. Получите задание у преподавателя.
3. Нажмите кнопку включения. После появления значения «0.00»
положите лист бумаги (тару) на платформу.
4. Если вес тары при взвешивании учитывать не надо, ее обнуляют
нажатием соответствующей кнопки.
5. Насыпьте соль небольшими порциями на тару.
6. Запишите показания индикатора (массу в граммах) в журнал.
7. Из бумаги (тары) сделайте пакетик, напишите на нем массу на-
вески и химическую формулу взвешенной соли и сдайте лаборанту
(навеска будет использована в других лабораторных работах).
Опыт 2. Определение плотности жидких веществ
Цель опыта: определение плотности некоторых не легкокипящих
и не очень вязких жидкостей.
Теоретическая часть
Плотностью вещества (р) называется масса (т) единицы объема
(F) этого вещества:
Для нахождения плотности жидкого вещества необходимо изме-
рить массы определенных объемов этого вещества и построить график
зависимости т = f(V). Тогда тангенс угла наклона этой линеаризован-
ной зависимости будет равен плотности данного вещества.
Экспериментальная часть с использованием
цифровой лаборатории
Использование цифровой лаборатории позволяет непосредственно
на экране компьютера получать зависимости «масса жидкости — объ-
ем». Массу измеряют с помошью электронных весов, а объем — с по-
мощью датчика объема жидкого реагента, подключаемых к компьюте-
ру. Температура фиксируется датчиком температуры. Использование
цифровой лаборатории позволяет определять плотность жидкости
в отсутствие ареометров, лучше ощутить физический смысл понятия
плотности, позволяет сохранить экспериментальные данные в графи-
30 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ческом и цифровом виде на любом электронном носителе и провести
обработку данных в любой стандартной программе.
Оборудование: компьютер, электронные весы, датчик объема жидко-
го реагента, терморезисторный датчик температуры, шприц на 10 мл.
химический стакан на 50 мл, химический штатив.
Реактивы: вода Н2О, этиловый спирт С2Н5ОН, треххлористый ме-
тан СНС13, четыреххлористый метан (хлороформ) ССЦ.
Ход работы
I. Получите у преподавателя один из вариантов заданий, предло-
женных в табл. 1.2.
Таблица 1.2
№ варианта
Вещество
Вода Н2О
Этиловый спирт С2Н5ОН
Треххяористый метан СНС13
Четыреххлористый метан СО^
2. Соберите установку, как показано на рис. 1.18.
Рис. 1.18. Установка для определения плотности жидкого вещества
/ — датчик жидкого реагента; 2 — шприц, 3 — весы, 4 — компьютер
3. Включите весы в сеть и нажмите кнопку «Оп/Off». Посгавьте
химический стакан на платформу весов. Обнулите показания, чтобы
не учитывать массу стакана в дальнейшем
4. Наберите полный шприц (10—12 мл) исследуемого вещества,
наденьте на иглу защитный колпачок, чтобы избежать случайных ка-
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 31
пель. Вставьте шприц в датчик жидкого реагента и подведите толкатель
вплотную к поршню шприца (несколько капель кислоты может вытечь
в защитный колпачок). Игла шприца должна быть направлена в стакан.
5. Подключите к USB-порту компьютера весы и датчик объема
жидкого реагента.
6. Включите компьютер и запустите программу «Практикум».
7. После обнаружения программой датчика и весов на экране по-
явятся два шаблона графиков: «Зависимость массы от времени» и «За-
висимость объема добавленного реагента от времени». Обнулите по-
казания датчика объема жидкого реагента кнопкой «Настройка».
8. В окне измерений выберите режим «Зависимость одного от дру-
гого по нажатию». При этом должен появиться шаблон графика «За-
висимость массы от объема».
9. Установите пределы измерений по абсциссе X — (0—12) мл,
по ординате Y— (0—15) г для вар. 1,2 и (0—150) г для вар. 3, 4.
10. Запустите измерение и зафиксируйте первую точку на графике,
нажав клавишу «Пробел».
11. Вращая колесико датчика объема, добавьте в стакан ~0,5 мл ве-
щества. После стабилизапии показания массы зафиксируйте вторую
и третью точки клавишей «Пробел».
Следующие точки фиксируйте, добавляя примерно по 1 мл
12. Остановите измерение, когда все вещество будет добавлено
и экспортируйте данные во внешний файл, создав папку «Плотность».
13. Опустите в стакан терморезисторный датчик температуры.
Подключите его к компьютеру и после идентификации датчика из-
мерьте температуру опыта.
14. Повторите измерения для новой порции вещества, выполняя
пункты 1—13.
Обработка экспериментальных данных
1. Откройте файл с табличными результатами измерений. В нем
содержатся два столбца: первый — объем введенного вещества, вто-
рой — масса этого объема.
2. Постройте на одном графике тависимости массы от объема
по результатам двух измерений и линеаризуйте его прямой.
3. Найдите тангенс угла наклона полученной общей прямой, кото-
рый будет равен плотности исследуемого вещества: Igсе=р = —— г/мл.
4. Отметьте температуру, при которой проводился эксперимент.
5. Сравните полученный результат с табличными данными (см.
приложение I).
32 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 3. Определение концентрации
раствора по калибровочной кривой
колориметрическим методом
Цель опыта' ознакомление с колориметрическим методом (color —
цвет), определение неизвестной концентрации раствора по его опти-
ческой плотности с использованием предварительно построенного
калибровочного графика.
Колориметрическим методом называется определение количества
вещества по интенсивности окрашивания раствора. Для нахождения
неизвестной концентрации раствора предварительно определяют оп-
тическую плотность растворов с разной, но известной концентраци-
ей и строят график зависимости D = то есть калибровочную кри-
вую. Полученную зависимость аппроксимируют прямой (рис. 1.19),
которая отвечает математической функции D = кс + в, где с — кон-
центрация; D— плотность; к — постоянная для данной зависимости,
равная тангенсу угла ее наклона; в — отрезок, отсекаемый прямой
на оси ординат.
Рис. 1.19. Зависимость оптическом плотности от концентрации раствора
Измерив оптическую плотность раствора неизвестной концентра-
ции, по калибровочному графику или по формуле находят концен-
трацию.
Вопросы и задачи для самоконтроля
1. Сформулируйте закон Бугера — Ламберта — Бера. Для каких
растворов он применим?
2. Почему внешние стенки кюветы должны быть сухими и чи-
стыми?
3. Как по калибровочной кривой определить неизвестную концен-
трацию раствора?
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 33
Экспериментальная часть
Оборудование: фотоколориметр, мерная колба на 50 мл — 5 шт., бю-
ретка, мерная пипетка на 10 мл.
Реактивы: 0,5 М растворы CuSO4, NiSO4, СоС12 дистиллированная
вода.
Ход работы
1. Получите у преподавателя вариант задания (табл. 1.3) и колбу
с раствором заданного вещества неизвестной концентрации.
Таблица 1.3
№ варианта 0,5 М раствор вещества
CuSO4
2 NiSO4
3 CoCIj
2. Приготовьте пять растворов соли с концентрацией в 50, 20, 10,
6,25 и 5 раз меньше исходного раствора. Для иого налейте исход-
ный раствор в бюретку и установите ее в рабочее положение. Налей-
те из бюретки в первую колбу 1 мл, во вторую — 2,5, в третью — 5,
в четвертую — 8, в пятую — 10,0 мл. Долейте водой до метки, закройте
пробками и тщательно перемешайте.
3. Измерьте на фотоколориметре оптическую плотность приготов-
ленных растворов, начиная с раствора меньшей концентрации, как
описано в разделе 1.4. Для раствора CuSO4 используйте светофильтр
№ 7, для раствора NiCl2 — № 8 и № 9 — для раствора СоС12.
4. Запишите в ст. 4 табл. 1.4 полученные значения оптической
плотности растворов.
5. Возьмите колбу с неизвестной концентрацией, долейте водой
до метки, закройте пробкой и тщательно перемешайте.
6. Измерьте оптическую плотность приготовленного раствора.
Значение оптической плотности Dx запишите в ст. 4 табл. 1.4.
Обработка экспериментальных данных
1. Сформируйте табл. 1.4, как показано ниже
Таблица 1.4
№ колбы с2, моль/л D
1 2 3 4
1 1,0
S4 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Окончание
I 2 3 4
2 2,5
3 5,0
4 8,0
5 10,0
6 Контрольная лроба <х = Р,=
2. Рассчитайте концентрации с2 всех пяти приготовленных раство-
ров по формуле
C|.F1 = c2-r2,
где С| = 0,5 моль/л и сг - концентрации приготовленных растворов, моль/л;
О', — объем исходного раствора, мл; V2 = 50 мл — объем приготовленного рас-
твора. Результаты запишите в ст. 3 табл. 1.4
3. Постройте график зависимости оптической плотности раствора
от его концентрации, который будет являться калибровочной кривой,
и линеаризуйте его.
4. Определите концентрацию пробы: а) по калибровочному графи-
ку; б) по уравнению
D-e
С~ к '
где A-tg —.
Ас
5. Проверьте правильность определения концентрации пробы
у преподавателя.
Экспериментальная часть с использованием
цифровой лаборатории
При выполнении данного опыта с использованием цифровой ла-
боратории вместо фотоколориметра применяют датчики оптической
плотности и объема жидкого реагента, что позволяет существенно
упростить эксперимент. Компьютерная регистрация объема добав-
ленного реагента и соответствующей оптической плотности позволяет
устранить субъективные ошибки измерений. Калибровочная кривая
получается непосредственно в виде зависимости оптической плотно-
сти D от объема К добавленного реагента. Описание эксперименталь-
ной части приводится достаточно подробно, поскольку впервые рас-
сматриваются опыты с подобным оборудованием.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 35
Оборудование: компьютер, светодиодная линейка, датчики оптиче-
ской плотности (400, 475. 525, 595 нм), датчик объема жидкого реа-
гента, шприц на 10 мл, кювета, магнитная мешалка. 2 мерные колбы
на 100 мл, мерная пипетка на 10 мл.
Реактивы: 0,5 М растворы CuSO4, NiSO4, CoCI2; 0,1 М раствор
H2SO4, дистиллированная вода.
Ход работы
1. Получите у преподавателя вариант задания (табл. 1.5) и пробу
с неизвестной концентрацией заданного вешества.
Таблица 1.5
№ варианта Исходный раствор Фоновый раствор*
1 0,5 М CuSO4 0,1 М H2SO4
2 0,5 М NiSO4 0,1 М H2SO4
3 0,5 М СоС12 0,1 М H2SO4
' Фоновый раствор — водный раствор реагента без определяемого вещества
2. Для колориметрического анализа длину волны подбирают так,
чтобы поглощение проходящего светового потока через раствор окра-
шенного вешества было максимальным.
В сухую кювету налейте 90 мл фонового раствора и 10 мл исходного
раствора. Поставьте рядом с кюветой светодиодную линейку и вклю-
чите ее. Смогря на светящиеся диоды через кювету с раствором, опре-
делите, какой свет проходит через раствор хуже всего (максимальное
поглощение). Руководствуясь ниже приведенной табл. 1.6, выберите
датчик с соответствующей длиной волны и используйте его в работе.
Раствор из кюветы вылейте. Кювету промойте дистиллированной во-
дой и вытрите фильтровальной бумагой.
Таблица 1.6
Светодиод | | Красный | Желтый | Зеленый Синий | Фиолетовый
Длина волны, нм | 660 | 595 | 475 | 400
3. Соберите установку, как показано на рис. 1.20.
4. Поставьте кювету на магнитную мешалку, наденьте на нее дат-
чик оптической плотности. Старайтесь не касаться руками поверхно-
стей кюветы, через которые будет проходить свет.
5. Налейте 100 мл фонового раствора в кювету и включите пере-
мешивание.
36 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
6. Заправьте полностью шприц исходным раствором и установите
его в датчик жидкого реагента так, чтобы он оказался над кюветой.
Рис. 1.20. Установка для определения оптической
плотности окрашенных растворов.
1 — кювета; 2 — магнитная мешалка, 3 — датчик оптической
плотности. 4 — шприц, 5 — компьютер; 6 — колесико толкатели,
7 — датчик жидкого реагента: 8 — светодиодная линейка
7. Подключите датчики оптической плотности и жидкого реагента
к компьютеру.
8. Включите компьютер и запустите программу «Практикум». По-
сле обнаружения программой датчиков на экране появятся 2 шаблона
графиков: «Зависимость оптической плотности от времени» и «Объ-
ем добавленного реагента от времени». Обнулите датчики нажатием
кнопки «Настройка».
9. В окне измерений выберите режим «Зависимость одного от дру-
гого по нажатию», при этом появляется шаблон графика, отображаю-
щий зависимость текущего значения оптической плотности от объема
добавленного раствора.
10. Установите пределы измерений: по абсциссе X — (0—12) мл,
по ординате У — (0—1).
11. Начните измерение и зафиксируйте первую точку клавишей
«Пробел», которая будет соответствовать К= 0 мл. Вращая колесико
датчика жидкого реагента, добавляйте из шприца раствор. После до-
бавления каждой порции и стабилизации оптической плотное!и отме-
чайте точку клавишей «Пробел». Начинайте с объема порядка 0,1 мл.
Добавляйте раствор, пока не будет израсходован весь объем шприца.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 37
12. Остановите измерение и экспортируйте данные во внешний
файл. Выберите место его сохранения, например создайте папку «Ка-
либровка».
13. Вылейте содержимое кюветы, промойте ее дистиллированной
водой и протрите фильтровальной бумагой.
14. Налейте 100 мл раствора неизвестной концентрации в сухую
чистую кювету. Наденьте на нее датчик оптической плотности и запи-
шите его показание в табл. 1.7
Обработка экспериментальных данных
1. Сформируйте табл. 1.7, как показано ниже
Таблица 1.7
с, моль/л
Д =
2. Откройте файл с результатами измерений. В нем содержатся два
столбца: первый — объем добавленного раствора, второй — оптиче-
ская плотность полученных растворов.
3. Рассчитайте концентрацию полученных растворов (с) по формуле:
е-(И0+П=е0 F,
где — концентрация исходного раствора (табл. 1.5), моль/л; = 100 мл —
начальный объем фонового раствора в кювете; V— объем раствора, добавлен-
ного в кювету, мл.
4. Далее проводите обработку данных, как описано в традицион-
ном варианте опыта в п. 3—5.
Опыт 4. Определение концентрации
раствора по калибровочной кривой
кондуктометрическим методом
Цем опыта', ознакомление с методами измерения электропровод-
ности, определение концентрации раствора электролита по его удель-
ной электропроводности по полученному калибровочному графику.
Теоретическая часть
Кондуктометрическим называется метод, основанный на изме-
рении электропроводности растворов (conductivity — электропровод-
38 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ность). Электропроводность раствора зависит от температуры, от при-
роды и концентрации растворенного вещества.
Количественной мерой способности электролита проводить элек-
трический ток служит удельная электропроводность, величина, обрат-
ная удельному сопротивлению.
Удельной электропроводностью называется электропроводность
столба жидкости длиной 1 м при поперечном сечении (5) 1 м2. В систе-
ме СИ эта единица получила название сименс (См) на метр (м) и обо-
значается буквой о (См • м—1 = Ом-1 -м—'). В химии чаше используют
размерность величины о (См см-1) или ст (мСм - см-1).
Чем больше переносчиков заряда, то есть ионов в растворе, тем
больше его электрическая проводимость. Удельная проводимость о
возрастает практически линейно с ростом с0 примерно до 0,01 М. При
более высоких концентрациях уже становятся существенными силы
межионного взаимодействия, которые уменьшают подвижность ионов.
Кроме того, в концентрированных растворах возрастает вязкость сре-
ды, а в растворах слабых электролитов к тому же уменьшается степень
диссоциации и замедляется рост количества ионов. Все эти факторы
приводят к тому, что удельная электропроводность проходит через мак-
симум и начинает снижаться с ростом концентрации (рис. 1.21).
Концентрация, моль/л
1 - NaOH
2-КОН
3 - H2SO4
4 - MaCI
Рис. 1.21. Зависимость удельной электропроводности
от концентрации электролита
Для определения неизвестной концентрации раствора сначала
строят калибровочный график, го есть определяют электропровод-
ность растворов известных концентраций. Полученную зависимость
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 39
аппроксимируют прямой. Затем, измерив электропроводность рас-
твора неизвестной концентрации, по калибровочному графику или
формуле находят концентрацию, которая соответствует найденному
значению электропроводности.
Вопросы для самоконтроля
1. В каких единицах измеряется удельная электропроводность?
2. Каков вид зависимости электропроводности разбавленных рас-
творов сильных электролитов от концентрации?
Экспериментальная часть
Оборудование: кондуктометр, мерная колба на 50 мл — 5 шт., бюрет-
ка, мерная пипетка на 10 мл.
Реактивы: 0,1 М растворы H2SO4, HCI, ВаС12 NaCI, дистиллиро-
ванная вода.
Ход работы
1. Получите у преподавателя вариант задания (табл. 1.8) и пробу
с раствором неизвестной концентрации заданного вешества.
Таблица 1.8
№ варианта 0,1 М раствор вещества
1 H2SO4
2 НС1
3 BaCl;
4 NaCI
2. Приготовьте в колбах на 50 мл пять растворов с концентрациями
в 50,20, 10,6,25 и 5 раз меньше исходного раствора. Для этого налейте
исходный раствор в бюретку и установите ее в рабочее положение. На-
лейте из бюретки в первую колбу — 1; во вторую — 2,5; в третью — 5;
в четвертую — 8; в пятую — 10 мл. Долейте водой до метки, закройте
пробками и тщательно перемешайте.
3. Измерьте на кондуктометре удельную электрическую проводи-
мость приготовленных растворов, начиная с раствора меньшей кон-
центрации, как указано в разделе 1.4.
4. Запишите в ст. 4 табл. 1.9 полученные значения удельной элек-
трической проводимости растворов.
5. Измерьте удельную электрическую проводимость пробы неиз-
вестной концентрации и запишите значение а, в ст. 4 табл. 1.9.
40 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
1. Сформируйте табл. 1.9. как показано ниже
Таблица 1.9
№ колбы 1ц, мл с, моль/л о, мСм м"1
1 2 3 4
1 1.0
2 2,5
3 5.0
4 8.0
5 10.0
6 Контрольная проба ( = а, =
2. Рассчитайте концентрации (е) всех пяти приготовленных рас-
творов по формуле
V '
где с0 = 0,1 моль/л — концентрация исходного раствора; Vu —объем исходного
раствора, мл; V= 50 мл — объем приготовленного раствора.
Результаты запишите в ст. 3 табл. 1.9.
3. Постройте калибровочную кривую зависимости удельной элек-
трической проводимости от концентрации электролита. Полученную
зависимость аппроксимируйте прямой.
4. Определите концентрацию пробы с„ которая отвечает измерен-
ному значению а) по калибровочному графику; б) по уравнению
с = (о - в)/к.
5. Проверьте правильность определения концентрации пробы
у преподавателя.
Экспериментальная часть с использованием
цифровой лаборатории
При выполнении данного опыта с использованием цифровой лабо-
ратории вмесго кондуктометра применяют датчики электропроводно-
сти и объема жидкого реагента, что позволяет существенно упростить
эксперимент. Калибровочная кривая получается непосредственно
в виде зависимости электрической проводимости от объема добавлен-
ного реагента. Компьютерная регистрация объема добавленного реа-
гента и электропроводности позволяет устранить субъективные ошиб-
ки измерений.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 41
Оборудование: компьютер, датчик электропроводности, датчик объ-
ема жидкого реагента, шприц на 10 мл, стакан на 100 мл, магнитная
мешалка, мерная колба на 100 мл — 2 шт., мерная пипетка на 10 мл.
Реактивы: 0,1 М растворы H2SO4, НС1. ВаС12, NaCI, дистиллиро-
ванная вода.
Ход работы
1. Возьмите у преподавателя вариант задания (табл. 1.8) и колбу
с пробой неизвестной концентрации.
2. Соберите установку, как показано на рис. 1.22. Поставьте стакан
на магнитную мешалку и, отмерив цилиндром 50 мл дистиллирован-
ной воды, вылейте ее в стакан. Включите мешалку.
3. Закрепите датчик электропроводности в штативе для электродов
и опустите в стакан с водой так. чтобы он не касался ни стенок, ни дна
стакана.
Рис. 1.Z2. Установка для определения электропроводности*
1 — датчик жидкого реагента: 2 — колесико толкателя, 3 — датчик
электропроводности. 4 — компьютер, 5 — магнитная мешалка
4. Заправьте полностью шприц исходным раствором, вставьте
в датчик жидкого реагента и установите над стаканом.
5. Подключите к компьютеру датчики электропроводности и жид-
кого реагента.
6. Включите компьютер и запустите программу «Практикум». По-
сле обнаружения датчиков на экране появятся два шаблона графиков:
«Зависимость электропроводности от времени» и «Объема добавлен-
ного реагента от времени». В окне измерений выберите режим «Зави-
симость одного от другого по нажатию», при этом появится шаблон
42 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
графика, отображающий зависимость текущего значения электропро-
водности от объема добавленного раствора.
7. Установите пределы измерений: по абсциссе А' — (0—10) мл,
по ординате У — (0—10) мСм - см-1.
8. Включите измерение и зафиксируйте первую точку клавишей
«Пробел». Далее, вращая колесико датчика жидкого реагента, добав-
ляйте в стакан определенные объемы раствора. После добавления
каждой порции и установления стабилизации показания электропро-
водности отмечайте точку клавишей «Пробел». Начинайте добавлять
с объема порядка 0,1 мл. Добавляйте раствор, пока не будет израсходо-
ван весь объем шприца.
9. Остановите измерение.
10. Экспортируйте данные во внешний файл. Выберите место его
сохранения, например создайте папку «Электропроводность».
II. Вылейте содержимое стакана, промойте его и щуп датчика
электропроводности дистиллированной водой.
12. Налейте 50 мл раствора неизвестной концентрации в чистый
стакан и измерьте электропроводность раствора.
13. Запишите результат в табл. 1.10.
Обработка экспериментальных данных
1. Сформируйте табл. 1.10, как показано ниже.
Таблица 1.10
о, мСм-м-1
с, моль/л
2. Откройте файл с результатами измерений, в нем содержатся два
столбца: первый — объем добавленного раствора, второй — значение
электропроводности полученных растворов.
3. Рассчитайте концентрации (с) полученных растворов по формуле
с (У0+Ю = с0-У,
где «о = 0,1 моль/л — концентрация исходного раствора; I'o = 50 мл — объем
воды в стакане; V — объем раствора кислоты, добавленного в стакан.
Запишите в ст. 3 табл. 1.10.
4. Далее проводите обработку данных, как описано в традицион-
ном варианте опыта в п. 3—5.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 43
Опыт 5. Определение концентрации раствора
щелочи методом титрования
Цель опыта: ознакомление с методом титрования; определение
концентрации раствора шелочи.
Теоретическая часть
Титрование — метод, применяемый для определения концентра-
ции растворов, основанный на использовании эквивалентных соот-
ношений вступающих в реакцию реагентов. Точный объем раствора
неизвестной концентрации помещают в коническую колбу (рис. 1.23).
Другой раствор известной концентрации (титрант) добавляют в колбу
небольшими порциями из бюретки. Конец титрования — точку экви-
валентности определяют обычно по изменению окраски индикатора.
Объем израсходованного на титрование раствора должен состав-
лять примерно */3 — 2/з объема используемой бюретки. Чем точнее
фиксируется точка эквивалентности, тем точнее определение концен-
трации.
Экспериментальная часть
Оборудование: бюретка, колба на 50 мл, коническая колба.
Реактивы: 0,1 М стандартный раствор НС) (приготовленный
из фиксанала), раствор NaOH неизвестной концентрации, фенолфта-
леин, дистиллированная вода.
Ход работы
1. Соберите установку, как показано
на рис. 1.23.
2. Получите у лаборанта в пронумерован-
ной мерной колбе на 50 мл некоторое количе-
ство шелочи и приготовьте ее водный раствор,
доведя дистиллированной водой до метки
3. Отберите пипеткой 10 мл приготовлен-
ного раствора щелочи в коническую колбу
и добавьте 1 —2 капли фенолфталеина.
4. Налейте в бюретку раствор соляной
кислоты и приведите бюретку в рабочее по-
ложение.
5. Начните титрование, добавляя в колбу
раствор HCI. Конец титрования определяй-
44 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
те по исчезновению окраски фенолфталеина. Титрование проведите
не менее двух раз Результаты титрования должны отличаются друг
от друга не более чем на 0,1 мл. В противном случае титрование по-
вторите.
6. Результа! титрования запишите в таблицу 1.11.
Обработка экспериментальных данных
1. Сформируйте табл. 1.11. как показано ниже.
Таблица 1.11
№ колбы Vщелочи, ми с (НС1), моль/л J(HC1), мл с (NaOH), моль/л
2 среднее
2. Рассчитайте молярную концентрацию раствора щелочи с“
из формулы
ргЩ — J/ К
где с, — молярная концентрация эквивалентов соляной кислоты, равная
0,1 моль/л; Кш = 10 мл; — средний объем кислоты, пошедшей на титрование.
3. Напишите уравнение реакции кислотно-основного титрования.
Экспериментальная часть с использованием
цифровой лаборатории
Выполнение данного опыта с применением цифровой лаборатории
позволяет лучше понять суть самого эксперимента. Вместо визуально-
го способа определения объема щелочи, пошедшего на титрование
(точки эквивалентности), применяемого в традиционном методе ти-
трования, в цифровой лаборатории используют датчики электропро-
водности (рис. 1.14) и объема жидкого реагента (рис. 1.5). С помощью
компьютерной программы идет непрерывная регистрация объема до-
бавленного реагента и соответствующее ему изменение электропро-
водности раствора Кондуктометрический метод позволяет устранить
субъективную ошибку эксперимента, определить с большей точно-
стью точку эквивалентности и сделать эксперимент более наглядным.
Кондуктометрическим титрованием называется метод определения
точки эквивалентности по изменению электропроводности раствора
в ходе опыта. Метод заключается в том, что в точно отмеренный объ-
ем анализируемого раствора постепенно приливают известный объем
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 45
титранта и при этом измеряют электропроводность раствора. Титро-
вание прекращают по достижении точки эквивалентности, когда все
анализируемое вещество прореагирует. При этом электропроводность
достигает наименьшего значения.
При титровании сильного основания сильной кислотой в начале
эксперимента (рис. 1.24) электропроводность раствора высокая, по-
скольку щелочь практически полностью диссоциирована. Известно,
что наибольшей подвижностью обладают ионы Н+ и ОН’. В процессе
титрования происходит замещение ионов гидроксида менее подвиж-
ными ионами хлора, при этом количество ионов ОН" уменьшается
за счет связывания с ионами водорода в мало диссоциированные мо-
лекулы воды: Н+ + ОН = Н2О. При дальнейшей нейтрализации элек-
тропроводность раствора постепенно убывает, до тех пор пока щелочь
не будет полностью нейтрализована.
Объем титранта, мл
Рис. 1.24. Изменение электропроводности при кондуктометрическом
титровании сильного основания сильной кислотой
Минимальное значение электропроводности, соответствующее
полной нейтрализации щелочи кислотой, называется точкой эквива-
лентности. При дальнейшем приливании кислоты ионы Н+ переста-
ют связываться, общее число ионов увеличивается, и электропровод-
ность начинает расти. Подъем линии электропроводности (рис. 1.24)
после точки эквивалентности более крутой, т.к. подвижность ионов
Н+ больше, чем ионов ОН’.
Оборудование: компьютер, датчик электропроводности, датчик объ-
ема жидкого реагента, магнитная мешалка, мерный цилиндр на 100 мл,
шприц на 10 мл, химический штатив, штатив для электродов, химиче-
ский стакан на 50 мл.
Реактивы: 0,1 М стандартный раствор кислоты HCI, раствор щело-
чи NaOH неизвестной концентрации, раствор фенолфталеина.
46 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. Возьмите у преподавателя склянку с раствором шелочи неиз-
вестной концентрации.
2. Соберите установку для кондуктометрического титрования, как
показано на рис. 1.22.
3. Закрепите датчик объема жидкого реагента в лапке химического
штатива.
4. Отберите мерным цилиндром 30 мл щелочи и перенесите в ста-
кан на 50 мл. Поставьте стакан на магнитную мешалку и добавьте
1—2 капли фенолфталеина.
5. Заполнит е шприц полностью |итрантом — кисло гой и устано-
вите в датчик объема жидкого реагента. Подкручивая колесико в дат-
чике, подведите толкатель к поршню шприца.
Установите датчик так, чтобы игла шприца была направлена в ста-
кан с кислотой.
6. Закрепите в держателе штатива для электродов шуп датчика
электропроводности и опустите его в стакан с кислотой, так чтобы он
не касался ни стенок, ни дна.
7. Подключите датчики к LISB-портам компьютера.
8. Включите компьютер и запустите программу «Практикум». По-
сле обнаружения датчиков на экране появятся два шаблона графиков
зависимостей объема добавленной шелочи и электропроводности
от времени.
Установите пределы измерений для первого графика по абсциссе
X — (0—300) с, по ординате У — (0— 15) мл, для второго графика по аб-
сциссе X — (0—300) с, по ординате У — (0—10) мСм-см-1. Выберите
режим «Зависимость одного от другого по нажатию».
9. Включите магнитную мешалку.
10. Запустите измерение и начните добавлять в стакан с помощью
датчика жидкого реагента определенные объемы титранта, начиная
с 0,2—0,3 мл. Титруйте до тех пор, пока электропроводность не начнет
увеличиваться, а раствор не начнет обесцвечиваться
11. Первое титрование является прикндочным. На основании его
результатов оптимизируйте условия следующего точного титрования
Титруйте вблизи точки эквивалентности с шагом 0,1—0,2 мл. Закон-
чите титрование, добавив 2—3 мл титранта после точки эквивалентно-
сти. Результаты титрования должны отличаться друг от друга не более
чем на 0,1 мл. В противном случае титрование повторите.
12. Остановите измерение и экспортируйте данные во внешний файл.
13. Вылейте содержимое стакана, ополосните шуп датчика элек-
тропроводности, шприц и стакан дистиллированной водой.
Глава 1. Общие правила работы в практикуме. Лабораторное оборудование • 47
Обработка экспериментальных данных
1. Откроите файл с результатами измерении. В нем содержатся два
столбца: первый — объем добавленной кислоты, второй — электро-
проводность при этом объеме.
2. Постройте график зависимости электропроводности раствора
от объема добавленной кислоты (рис. 1.24).
3. Определите точку эквивалентности, проведя аппроксимирую-
щие прямые на графике до их пересечения. По оси абсцисс определи-
те объем, соответствующий точке пересечения и запишите значение V
(НС1)втабл. 1.11.
4. Далее ведите обработку аналогично пунктам 2, 3 традиционного
варианта обработки экспериментальных данных.
ГЛАВА
СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
Теоретическая часть
Стехиометрия — раздел химии, изучающий количественные соот-
ношения между веществами, претерпевающими химические превра-
щения.
К стехиометрическим относятся законы сохранения массы веще-
ства, постоянства состава, эквивалентов, кратных отношений, объем-
ных отношений и закон Авогадро.
Стехиометрия в переводе с греческого — составная часть, измеряю.
Закон сохранения массы вещества (М.В. Ломоносов, 1748 г.) (со-
временная формулировка закона): масса веществ, вступивших в реак-
цию, равна массе веществ, образующихся в результате реакции. С точки
зрения атомно-молекулярного учения это означает, что атомы в ходе
реакции не создаются и не разрушаются, они просто перегруппиро-
вываются, создавая новые образования — их количество остается не-
изменным до и после реакции.
Закон постоянства состава (Ж. Пруст, 1799 г.): каждое химиче-
ски чистое вещество независимо от места нахождения и способа по-
лучения имеет один и тот же состав Современная формулировка
закона: соединения с молекулярной структурой, независимо от способа
их получения, всегда имеют постоянный качественный и количествен-
ный состав.
Закон эквивалентов (И. Рихтер, 1792 г.): вещества взаимодей-
ствуют между собой в количествах, пропорциональных их химиче-
ским эквивалентам. Более подробно закон эквивалентов рассмо-
трен ниже.
Закон объемных отношений {Гей-Люссак 1805 г.): объемы вступаю-
щих в реакцию газов относятся друг к другу, а также к объемам получа-
ющихся газов как небольшие целые числа (при постоянных температуре
и давлении). Например, 2 л водорода соединяются с 1 л кислорода, об-
разуя 2 л водяных паров в объемных отношениях 2:1:2
Закон парциальных давлений (Д. Дальтон 1801 г.): общее давление
смеси газов, химически не взаимодействующих друг с другом, равно сумме
парциальных давлений газов, составляющих смесь.
Глава 2. Стехиометрические законы • 49
Парциальное давление газа в смеси равно давлению, которое произ-
водило бы это же количество данного газа, если бы он занимал при
этой же температуре весь объем, занимаемый смесью.
Закон А. Авогадро (1811 г.): в равных объемах различных газов при оди-
наковых ус говиях (температуре и давлении) содержится одинаковое чис-
ло молекул.
Два следствия из закона Авогадро
1. Один моль любого газа при одинаковых ус ювиях занимает один
и тот же объем.
Известно, что один моль любого газа при нормальных ус юви-
ях (Т = 273,15 К, р = 1,01325-105 Па) занимает объем, равный 22,4 л.
Этот объем называется молярным объемом газа: V = 22.4 л/моль =
= 22,4 м'/кмоль.
2. Отношение масс равных объемов различных газов равно отно-
шению их молекулярных масс: /»|//я2 = MJМг.
Объединенный газовый закон. Для идеальных газов справедливо со-
отношение, называемое математическим выражением объединенного
газового закона:
где Vu,Po, Tv — объем, давление и температура при нормальных условиях; V, р,
Т — те же параметры данного количества газообразного вещества при других
условиях.
При подстановке значений для 1 моля газа при и.у. отноше-
ние ----- принимает постоянное значение и называется универ-
сальной газовой постоянной, равной R = 8,314 Дж/(моль-К) =
~ 0,0821 (л - атм)/(моль - К).
Для и-числа молей идеального газа выражение (2.1) преобразовы-
вается в уравнение Клапейрона — Мендезеева:
pV = nRT = — RT, (2.2)
М
которое широко применяется для определения молярных масс газоо-
бразных веществ.
Абсолютной плотностью газа р называется масса единицы объема
газа при н.у.
р = т/ V.
(2.3)
50 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Зная абсолютную плотность газа при н.у., можно рассчитать его мо-
лярную массу: а) по формуле М = 22,4р; 6} по уравнению Клапейро-
на — Менделеева:
mRT pRT
М=-—^--------- (2.4)
V р р
Кроме того, молярную массу газа можно определить исходя из от-
носительной плотности. Относительной плотностью d первого газа
по второму называют отношение абсолютных плотностей этих газов:
d = Pi/p2, (2.5)
где pi, Р2 - абсолютные плотности первого и второго газов.
Это отношение можно заменить отношением масс ihjob, содержа-
щихся в одинаковых объемах при одинаковой температуре:
d = Р1/Р2 = = М1/М2, (2.6)
где Ш], tn, — массы первого и второго газов, Mt, М2 — молярные массы первого
и второго газов, откуда Mj = M2d.
Истинной массой газа называется масса газа в вакууме. Она отлича-
ется от массы, измеренной в атмосфере воздуха. По закону Архимеда
тела, находящиеся в какой-либо среде, теряют в своем весе столько,
сколько весит вытесненная ими среда. Следовательно, для определе-
ния истинной массы газа необходимо к измеренной массе на воздухе
прибавить поправку Ат, называемую приведением массы к вакууму:
(2.7)
где V — объем сосуда, Рвоащхг — плотность воздуха, которую можно рассчи-
тать из уравнения (2.4) с учетом средней молярной массы воздуха, равной
28,9 г/моль.
Вопросы и задачи для самоконтроля
1. Что называют абсолютной и относительной плотностью газа?
2. Масса колбы с воздухом равна 63,872 г. После замещения воз-
духа газом масса колбы оказалась равной 64,182 г. Вместимость колбы
470 мл, температура 15 °C, давление 102,66 кПа. Рассчитайте относи-
тельную плотность газа по воздуху и его молярную массу.
3. Масса 1 л газа при 21 °C и 96,26 кПа равна 2,52 г. Рассчитай ie от-
носительную плотность газа по водороду и его молярную массу.
4. Рассчитайте молярную массу газа, если масса 1 мл его равна
1,96 мг (н.у.).
5. Рассчитайте массу 10 л азота при нормальных условиях.
Глава 2. Стехиометрические законы • 51
Работа 2. Определение выхода реакции
Цель работы: проверка закона сохранения массы веществ в ходе ре-
акции на примере реакции разложения гидрокарбоната натрия.
Теоретическая часть
Полнота протекания любой реакции определяется ее выходом. Вы-
ходом реакции называется отношение количества вещества, получен-
ного в ходе эксперимента, к теоретически рассчитанному значению.
Например, экспериментально определено, что при взаимодействии
100 г карбоната кальция СаСО3 с соляной кислотой НС1 выделилось
20,1 л (н.у.) углекислого газа CQ?- Рассчитаем, сколько теоретически
должно выделиться газа по уравнению реакции:
СаСО3 + 2HCI = СаС12 + Н2О + СО,.
Из стехиометрии реакции видно, что из 1 моля (Л/ = 100 г/моль)
карбоната кальция СаСО3 образуется 1 моль СО2, т.е. 22,4 л, следова-
тельно, выход реакции будет равен:
20 |
В(СО,) =-----100% = —— 100 = 89,7%.
К™ 22,4
Вопросы для самоконтроля
1. Что такое выход реакции?
2. Может ли быть выход больше 100%?
3. На каком стехиометрическом законе базируется написание
уравнений химических реакций?
Экспериментальная часть
Оборудование: весы, горелка, штатив с кольцом и треугольником,
фарфоровая чашка.
Реактивы: навеска гидрокарбоната натрия МаНСО3.
Ход работы
1. Получите у преподавателя навеску соли
2. Включите весы через адаптер в сеть и нажмите кнопку включе-
ния. На индикаторе весов высвечивается техническая информация,
а затем появляется «0.00».
3. Поставьте фарфоровую чашку на платформу весов. Индикатор
покажет массу т чашки в граммах. Результат запишите в табл. 2.1
52 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Насыпьте в чашку выданную навеску и запишите массу /л,
в табл. 2.1.
5. Поставьте чашку в треугольник, находящийся на кольце, кото-
рый закреплен в лапке штатива, и начинайте нагревать в течение 10—
15 минут.
6. После того как чашка остынет, взвесьте ее и результат /я2 запи-
шите в табл. 2.1.
7. Снова нагрейте чаш ку в течение 5— 10 минут и пос ле охлаждения
взвесьте т3. Если результаты двух взвешиваний совпадут, эксперимент
прекратите. В противном случае прокаливание и последующее взве-
шивание повторите еще раз.
Обработка экспериментальных данных
1. Сформируйте таблицу 2.1. как показано ниже.
Таблица 2.1
Масса
Граммы
Масса чашки tn
Масса чашки + навеска до опыта — т.
Масса чашки + навеска после 1 го нагрева — тг____________________
Масса чашки + навеска после 2-го нагрева — т3
Масса навески после 1-го нагрева — «м
Масса навески после 2-го нагрева — ms
Теоретическое значение массы — т,^
Выход реакции
2. Рассчитайте массу навески после каждого прокаливания tnt и т$.
3. Напишите уравнение реакции разложения гидрокарбоната на-
трия
4. Рассчитайте но уравнению реакции теоретическое значение
массы /птсир твердого вещества, оставшегося после разложения.
5. Рассчитайте выход реакции.
Работа 3. Определение молярной
массы диоксида углерода
Цель работы: определение молярной массы диоксида углерода СО2
по плотности газа и на основе уравнения Клапейрона — Менделеева.
Глава 2. Стехиометрические законы • 53
Экспериментальная часть
Оборудование: аппарат Киппа с промывными склянками (рис. 2.1),
технохимические весы, пластиковая бутылочка объемом 0,5 л. мерный
цилиндр.
Реактивы: мраморная крошка СаСО3, раствор 4 М НО, дистилли-
рованная вода.
Ход работы
1. Соберите установку для получения СО2. как показано на рис. 2.1.
Раствор гндрокарбоната натрия NaHCO, необходим для поглощения
брызг соляной кислоты, а концентрированная серная кислота — для
поглощения паров воды.
NaHCOj H2SO4
2. Взвесьте пластиковую бутылочку и результат = /и6уТ + ливощ за-
пишите в табл. 2.2
3. Откройте краны и в течение 3—4 минут наполняйте бутылочку
диоксидом углерода.
4. Перекройте оба крана и взвесьте бутылочку с СО2. Полученное
значение т2 = й%уГ+«Исо> запишите в ст. 6 табл. 2.2.
5. Снова подсоедините бутылочку к установке, откройте кра-
ны и опять в течение 3—4 минут наполняйте бутылочку диоксидом
углерода. Наполнение и взвешивание бутылочки проведите 2—3 раза
до постоянной массы, так чтобы результаты отличались не более чем
на 0.01 г.
6. Определите объем V бутылочки, заполнив ее водой и перелив
воду в мерный цилиндр, результат запишите в ст. 1 табл. 2.2.
7. Определите по термометру температуру, давление по барометру
и запишите в ст. 3,4 табл. 2.2.
54 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
I. Сформируйте табл. 2.2, как показано ниже
Таблица 2.2
2. Рассчитайте объем газа Ии в бутылочке при нормальных условиях
по формуле (2.1).
3. Рассчитайте поправку Д« (приведение массы газа к вакууму)
по формуле (2.7), принимая, что плотность воздуха при н.у. равна
1,293 г/л.
4. Рассчитайте истинную массу диоксида углерода в объеме буты-
лочки:
«СО; ~ («2 — «1) + Д«-
5. Рассчитайте абсолютную плотность диоксида углерода р по фор-
муле (2.3).
6. Рассчитайте молярную массу диоксида углерода: а) по абсо-
лютной плотности по формуле (2.3); б) по относительной плотности
по формуле (2.6), считая, что молярная масса воздуха равна 28,9 г/моль;
в) по уравнению Клапейрона — Менделеева (2.4)
7. Определите абсолютную и относительную погрешности опыта
по формулам (1.1) и (1.2)
8. Запишите уравнения реакций, протекающих в аппарате Киппа
и промывных склянках
Экспериментальная часть с использованием
цифровой лаборатории
Использование электронных весов, способных обнулять тару и не-
прерывно регистрировать изменение массы выделяющегося газа,
существенно облегчает и ускоряет выполнение эксперимента и рас-
четной части работы. Подключение весов к компьютеру делает экс-
перимент более наглядным, поскольку момент стабилизации массы
выделяющегося газа визуально наблюдается на мониторе компьютера.
Оборудование: компьютер, электронные весы, термометр, барометр,
штатив, аппарат Кирюшкина, Г-образная стеклянная трубочка, пла-
стиковая бутылочка объемом 0,5 л, мерный цилиндр.
Реактивы: мраморная крошка СаСО}, раствор 4 М НО, дистилли-
рованная вода.
Глава 2. Стехиометрические законы • 55
Ход работы
1. Поместите в аппарат Кирюшкина около 2 г кусочков мрамора
и закрепите его в лапке штатива.
2. Поставьте пластиковую бутылочку на весы.
3. Опустите в бутылочку Г-образную стеклянную трубочку, не ка-
саясь ни стенок, ни дна.
4. Включите весы и обнулите тару.
5. Подключите весы соединительным
кабелем к USB-порту компьютера.
6. Включите компьютер и запустите
программу «Практикум». После обнаруже-
ния весов на экране появится шаблон гра-
фика зависимости массы от времени.
Установите пределы измерений по аб-
сциссе X — (0—300) с, по ординате Y — (0—
2,0) г.
7. Запустите измерение, вылейте рас-
твор соляной кислоты в аппарат Кирюш-
кина и откройте кран.
8. Остановите измерение, когда изме-
нение массы бутылочки прекратится.
9. Экспортируйте данные во внешний
файл. Выберите место сохранения файла,
Рис. 2.2. Установка для
получения СО>.
I — аппарат Кирюшкина,
2 — пластиковая
бутылочка, 3— компьютер,
4— электронные весы
например создав папку «СО2».
10. Определите объем пластиковой бутылочки, для чего заполните
бутылочку полностью водой, затем вылейте воду в мерный цилиндр
и запишите объем Ивет. 1 табл. 2.3.
11. Определите температуру Ггомн опыта по термометру, давление р
по барометру и запишите в ст. 4, 3 табл. 2.3.
12. После окончания эксперимента вылейте содержимое из аппа-
рата Кирюшкина в специальную сливную емкость и тщательно про-
мойте дистиллированной водой.
Обработка экспериментальных данных
1. Сформируйте табл. 2.3, как показано ниже
Таблица 2.3
К л *о.л р, кПа У'ком. °C tn., г Ди. г «сог Г р, г/см3 М, г/моль
1 2 3 4 5 6 7 8 9
56 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Далее ведите обработку экспериментальных данных, как пред-
ложено в традиционном варианте работы, за исключением п. 4, в кото-
ром расчет истинной массы исо> выделившегося углекислого 1аза
провести по формуле тсо> = m, + Am.
Работа 4. Эквивалент и молярная масса
эквивалентов вещества
Теоретическая часть
Химическим эквивалентом Э(В) называется условная или реальная
частица, равная или в целое число раз меньшая соответствующей ей
формульной единице:
Э(В) =---- В,
Z(B)
(2.8)
где В — формульная единица вещества — реально существующая частица, та-
кая как атом (Си, Na, С), молекула (N2, KOH, A12(SO4)}, СО2), ион (ОН ,
SO4 , Си2+), радикал (-NO2, С2Н;-), условные молекулы кристаллических ве-
ществ и полимеров и другие частицы вещества.
Эквивалентное число Z(B) показывает, какое число эквивалентов ве-
щества В условно содержится в данной формульной единице этого ве-
щества. Величина обратная эквивалентному числу =/^ки называ-
ли»)
ется фактором эквивалентности. Эквивалентное число Zвсегда больше
или равно 1 и является безразмерной величиной: при Z= 1 эквивалент
соответствует формульной единице вещества.
Расчет эквивалентного числа различных формульных единиц пред-
ставлен в табл. 2.4.
Величина эквивалентного числа, а следовательно, и эквивалента
зависят от химической реакции, в которой участвует данное вещество.
Например, для реакции H2SO4 + 2КОН -> K2SO4 + 2Н2О эквивалент-
ное число Z(H2SO4) = й(Н+) = 2, т.к. в реакции участвуют два иона Н+
серной кислоты, и, следовательно, эквивалентом H2SO4 будет являть-
ся условная частица ’/jH^SC^ (3(H2SO4) = l/2H2SO4).
В реакции H2SO4 + КОН —> KHSO4 + Н,О замещается только один
ион водорода Н+, и поэтому Z(H2SO4) = и(Н+) = 1, а эквивалентом кис-
лоты является частица H2SO4 (3(H2SO4) = 1H2SO4).
Глава 2. Стехиометрические законы • 57
Таблица 2.4
Частица Эквивалентное число Z Пример
Элемент Z(3) - В(Э), где В(Э) — валент- ность элемента =6 г(Ос0з=4
Простое вещество Х(в-ва) = я(Э) • В(Э), где л(Э) — число атомов элемента; В(Э) — ва- лентность элемента Z(O2) = 2-2 = 4
Z(CI,)=2 1 = 2
Оксид Z(32OV) = л(Э) В(Э), где /1(3) — число атомов элемента; В(Э) — на- лентность элемента Z(H2O)=2 1=2
Z(SO,) = 1-4 = 4
Z(ABOj) = 2-3 = 6
Кислота Z(k-th) = и( Н+), где я(Н+) — число отданных в ходе реакции ионов Н ' (основность кислоты) Z(H2SO4) = 1 — основность равна 1
Z(HjSO4) = 2 — основность равна 2
Основа- Z(ocH-fi) = я(ОН ). где/ДОН ) — число отданных в ходе реакции гидроксид ионов ОН (кислот- ность основания) Z(Ca(OH)2) = 1 — кислот- ность равна 1
Z(Ca(OH)2) =2 — кислот- ность равна 2
Соль Z(coan) = л(Ме) • В(Ме) = = л(А) • В(А), где л(Ме), В(Ме) — число атомов металла и его валент- ность; и(А), В(А) — число кислот- ных остатков и их заряд Z(Na2SO4) = 2 -1 = 1 2 = 2
Z(A12(COj)j) = 2 - 3 = 3 - 2 = 6
Частица в ОВР Z(4acTHUbi) = пг, где пг — число электронов, участвующих в про- цессе, на одну формульную еди- ницу SO4 + 2H* + 2e-> -» SOf + H2O
Z(SO?) =2.Z(H+)= 1
2СГ —2e->Cb
Z(CI )= l,Z(Cl2) = 2
Йон Z(Hona) = к, где п — заряд иона Z(SO4~) = 2
Эквивалент как частица может быть охарактеризован молярной
массой Л/ДВ), молярным объемом ЕД В) и определенным количеством
вещества (В).
Количество вещества эквивалентов п, (В) вещества В равно:
яДВ) = Z(B)-и(В) (2.9)
Масса одного моля эквивалентов вещества В называется молярной
массой эквивалентов вещества Л/ Д В) и равна:
Л/Д В) = т(В)/иДВ)
58 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ИЛИ
Л/ДВ) = (г/моль, кг/моль). (2.10)
Например, (ИДКОН) = A/(KOH)/Z(KOH), где Z(KOH) = и(ОН) =
1. следовательно. Л/Д КОН) = 56/1 = 56 г/моль.
Молярным объемом эквивалентов газообразного вещество 1Д В) назы-
вается объем одного моля эквивалентов газообразного вешества*
К, (газа) = V^Jn.,
или
ИД газа) = KM/Z(B) = 22,414/Z(B) (л/моль). (2.11)
В химических реакциях вещества взаимодействуют согласно закону
эквивалентов (И. Рихтер 1792 г.): в реакциях всегда участвуют равные
количества вещества эквивалентов всех реагентов.
Например, для реакции аА + вВ сС + dD будут справедливы ра-
венства:
п,(А) = ИДЯ) = лДС) = яДР) (2.12)
или
т(А) _ т(В) _ т(С) т(Р)
МЭ(А) МЭ(В) М3(С) М3(Р) ( '
Если вещества газообразные, то закон эквивалентов принимает вид
и(Л) = И(Д) = И(С) = И(Д)
Иэ(/1) ИЭ(Я) ИЭ(С) ИЭ(Л)’ '
Закон эквивалентов для реагирующих веществ, находящихся в рас-
творе, выражается уравнением:
сДА) ТР.ра(А) = еДВ) - Ирра(В), (2.15)
яД«)
где c3(i) = ——— (моль/л) — молярная концентрация эквивалентов раствора
^.(0
/-го вещества.
Молярную массу эквивалентов Meia_i.ia можно определить, напри-
мер, измерив объем водорода, выделившегося в ходе реакции взаи-
модействия известной массы активного металла с соляной кислотой
М + хНС1 -> МС1А + (х/2)Н2.
По закону эквивалентов из соотношения
т(М) /и(Н.)
иДМ) = лДН2) или = ‘ (2.16)
л/э(М) лгэ(Н2)
можно вычислить молярную массу эквивалентов металла МДМ).
Глава 2. Стехиометрические законы • 59
Вопросы и задачи для самоконтроля
1. Что называют эквивалентом вещества?
2. К раствору, содержащему 1 г соляной кислоты, прибавили рас-
твор, содержащий 1 г гидроксида натрия. Будет ли полученный рас-
твор нейтральным, кислым или щелочным? Ответ подтвердите рас-
четом.
3. Сколько молей эквивалентов нинка вступило в реакцию с кис-
лотой, если при этом выделилось 2,8 л водорода при н.у.?
Вычислите молярную массу эквивалентов металла, если
1,168 • 10-3 кг его вытесняют из кислоты 438 • 10-3 м3 водорода, изме-
ренного при 17 °C и давлении 98642 Па.
4. При взаимодействии 6,75 г металла с серой образовалось 18,75 г
сульфида. Рассчитайте молярную массу эквивалентов металла.
Опыт 1. Определение молярной массы
эквивалента металла (Mg, Al, Zn)
по объему выделившегося газа
Цель опыта', ознакомление с понятием эквивалента вещества и ме-
тодикой расчета молярной массы эквивалентов вещества, основанной
на законе эквивалентов.
Метод основан на измерении объема водорода, который выделяет-
ся при взаимодействии избытка кислоты с известной навеской метал-
ла. Объем выделившегося водорода опреде-
ляют с помощью волюмометрической
установки (рис. 2.3) по разности уровней
воды в бюретке до и после опыта при давле-
нии в закрытой бюретке, равном атмосфер-
ному. Давление газа в закрытой бюретке
равно атмосферному, если вода в обеих бю-
ретках находится на одном уровне.
Экспериментальная часть
Оборудование: барометр, термометр, во-
люмометрическая установка (рис. 2.3),
двухколенная пробирка Оствальда, две бю-
ретки, укрепленные на штативе и соеди-
ненные резиновой трубкой.
Реактивы: раствор соляной кислоты
НС1, металлы: Zn, Mg, AL
Рис. 2.3.
Волюмометрическая
установка для определения
объема выделяющегося газа
60 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. Получите навеску металла у лаборанта и запишите массу тМс
в ст. 1 табл. 2.5.
2. Запишите в табл. 2.5 комнатную температуру Г, К (ст. 8), атмос-
ферное давление рэтм (ст. 2) и давление насыщенных водяных паров
Рн,о (ст. 3) (см. приложение II).
3. В одно колено пробирки Оствальда налейте соляной кислоты
-10—15 мл, в другое поместите навеску металла и закройте пробирку
пробкой с отводной трубкой от бюретки.
4. Проверьте герметичность прибора. Для этого, не трогая бюрет-
ку с пробиркой, переместите другую бюретку вместе с лапкой штатива
так, чтобы уровень воды в ней стал на 5—10 см выше, чем в первой бю-
ретке. Если разница в уровнях не изменяется, прибор исправен («дер-
жит»); если уровни в бюретках выравниваются, прибор негерметичен,
пропускает воздух, о чем следует заявить лаборанту.
5. Приведите воду в бюретках к одному уровню и запишите в ст. 5
табл. 2.5 уровень воды до опыта. Отсчет произведите по нижнему ме-
ниску жидкости.
6. Перелейте кислоту в колено, где находится металл. Наблюдайте
выделение водорода и вытеснение воды из бюретки.
7. По окончании реакции дайте пробирке охладиться на воз-
духе, после чего снова приведите воду в бюретках к одинаковому
уровню и запишите в ст. 6 табл. 2.5 новый уровень воды в бюретке
после опыта.
8. После окончания эксперимента вылейте содержимое пробирки
в специальную сливную емкость и тщательно промойте дистиллиро-
ванной водой.
Обработка экспериментальных данных
1. Сформируйте табл. 2.5 экспериментальных и расчетных данных,
как показано ниже.
Таблица 2.5
Глава 2. Стехиометрические законы • 61
2. Рассчитайте объем выделившегося водорода по разности уров-
ней воды до и после реакции, результат занесите в ст. 5 табл. 2.5.
3. Рассчитайте давление водорода, исходя из формулы. =Ратм —
/’п,_о> результат занесите в ст. 4 табл. 2.5.
4. Рассчитайте массу /»н2 выделившегося объема водорода по фор-
муле (2.2). Результат занесите в ст. 9 табл. 2.5.
5. Рассчитайте молярную массу эквивалентов водорода Л/..(Н2)
по формуле (2.11). Результат занесите в ст. 10 табл. 2.5.
6. Рассчитайте экспериментальное значение молярной массы эк-
вивалентов металла Л/,(Ме) по формуле (2.13), результат занесите
в ст. 11 табл. 2.5.
7. Напишите три уравнения реакций взаимодействия возможных
металлов с кислотой.
8. Рассчитайте теоретические значения молярных масс эквивален-
тов трех металлов — Zn, Mg, Al по формуле (2.10).
9. Проведите идентификацию металла, сравнивая эксперимен-
тально полученное значение молярной массы эквивалентов металла
с теоретически рассчитанными.
10. Рассчитайте абсолютную и относительную ошибки определе-
ния Л/,(Ме) по формулам
— абсолютная ошибка:
Д= |М-7о₽(Ме)-ЛСс,,(Ме)|-; (2.17)
— относительная ошибка:
8^|л/^(Ме)-МГ"(Ме)|10^
| Л/этсо₽(Ме) |
11. Является ли молярная масса эквивалента вещества постоянной
величиной?
12. Определите количество вещества эквивалентов кислоты, из-
расходованное в ходе изученной реакции.
Экспериментальная часть опыта
с использованием цифровой лаборатории
Выполнение данного эксперимента возможно в условиях современ-
ной цифровой лаборатории. Схема установки приведена на рис. 2.4.
Разница методик заключается в фиксации объема выделяющегося
газа. Использование в цифровой лаборатории датчика объема газа
и компьютерной регистрации его объема и температуры позволяет ис-
62 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ключить субъективную ошибку эксперимента, упростить проведение
самого эксперимента, что соответствует современному уровню прове-
дения эксперимента в учебной химической лаборатории Подробное
описание датчика объема газа приведено в разделе 1.4.
Оборудование: компьюгер, электронные весы, датчик объема
газа с контролем температуры, двухколенная пробирка — пробирка
Оствальда, химический стакан, барометр, химический штатив.
Реактивы: раствор соляной кислоты НО, металлы: Zn, Mg, Al, дис-
тиллированная вода.
Ход работы
I. Взвесьте кусочек металла и запишите в ст. I табл. 2.6 массу т( Me).
2. Соберите установку, как показано на рис. 2.4.
Рнс. 2.4. Установка для определения объема выделившегося газа*
/ — пробирка Оствальда, 2 — датчик объема газа, 3 — гофра датчика, 4— пробка
с газоотводной трубкой; 5 — химический стакан с холодной водой
3. Поместите в одно колено пробирки Оствалвда ( 7) навеску метал-
ла, в другое аккуратно налейте ~ 10 мл кислоты.
4. Подключите датчик объема газа соединительным кабелем
к USB-порту компьютера.
5. Включите компьютер и запустите программу «Практикум».
После обнаружения датчика на экране появятся два шаблона гра-
фиков зависимости объема и температуры выделившегося газа
от времени.
6. Установите пределы измерений объема: по абсциссе X - (0—
300) с, по ординате Y — (0—450) мл, температуры — по абсциссе X —
(0—300) с, по ординате Y — (15—35) °C.
Глава 2. Стехиометрические законы • 63
7. Сожмите гофру (3) датчика до минимального остаточного объ-
ема. При этом должен загореться второй светодиод на торце корпуса
датчика, что будет означать готовность датчика к работе. Закройте
плотно пробирку пробкой с газоотводной трубкой (4).
8. Нажмите экранную кнопку «Настройка» для обнуления исход-
ного значения объема.
9. Запустите измерение и перелейте аккуратно (не нарушая герме-
тичности установки) кислоту в колено, где находится металл. Колено
поместите в стакан с холодной водой (5).
10. Остановите измерение, когда изменение объема прекратится.
11. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например создав папку «Эквивалент».
12. Запишите в табл. 2.6 объем и температуру Г, К выделивше-
гося газа, атмосферное давление />етм.
13. После окончания эксперимента вылейте содержимое пробирки
в специальную сливную емкость и тщательно промойте дистиллиро-
ванной водой.
Обработка экспериментальных данных
1. Сформируйте табл. 2.6 экспериментальных и расчетных данных,
как показано ниже.
Таблица 2.6
м(Ме). г Дим. Па Л Г. К «н,. г Л/3(Н2), г/моль Л/э(Ме), г/моль Д. г/моль 8. %
1 2 3 4 5 6 7 8 9
2. Рассчитайте массу выделившегося объема водорода тн, по урав-
нению Клапейрона — Менделеева (2.2), результат занесите в ст. 5
табл. 2.6
3. Далее ведите обработку данных аналогично пунктам 5—10 тра-
диционного описания опыта и соответствующие результаты заносите
в табл. 2.6.
4. Объясните, почему одно колено пробирки Оствальда опускают
в холодную воду?
Развитие эксперимента
Целью опыта может быть определение молярной массы металла
и его идентификация. Из уравнения реакции Me + xHCl = МеС1х +
64 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
+ (х/2)Н2 следует, что из 1 моля металла образуется х/2 молей водо-
рода, тогда из п молей металла будет образовываться у молей водоро-
да, т.е. я{Ме) —— >(Н2) =-—----= Величина х соот-
2 А/(Ме) 2 RT
ветствует валентности металла. Среди предложенных металлов (Mg,
Zn, Al) валентности могут быть 2 или 3, подставляя их в выше выве-
денную формулу, получаем значение молярной массы металла. Срав-
нивая полученное опытным путем значение молярной массы металла
с теоретическими значениями (Mg, Zn, Al) можно идентифицировать
металл.
Опыт 2. Определение молярной массы эквивалентов
вещества в реакциях обмена
Цель опыта: определение молярной массы эквивалентов кислоты
(НО, H2SO4 или HNO4) методом титрования щелочью. Идентифика-
ция кислоты.
Теоретическая часть
Определение молярной массы эквивалентов одной из кислот (НО,
H2SO4 или HNOj) возможно на основании результатов, полученных
в ходе реакции нейтрализации методом титрования, который подроб-
но рассмотрен в разделе 1.5. Точка эквивалентности, т.е. точка дости-
жения эквивалентности титранта и анализируемого вещества, опреде-
ляется по появлению устойчивой слабо-розовой окраски индикатора
фенолфталеина. Зная объем раствора исследуемой кислоты К(к), объ-
ем раствора щелочи, пошедший на титрование К(щ), ее исходную кон-
центрацию с,(щ), можно по закону эквивалентов
я* = я“ или < Ик = -И„, (2.19)
вычислить молярную концентрацию эквивалентов кислоты сэ(к).
Если к тому же известна масса растворенной кислоты (например, титр
Т — m/V, г/мл), можно найти ее молярную массу эквивалентов.
Молярная масса эквивалентов кислоты может быть вычислена
из соотношений
к _ йз _ тк _ Л Ук |03
М* Ук ~ М* Ик
откуда
(2.20)
Оборудование: конические колбы, бюретки, воронка, мерный ци-
линдр на 100 мл.
Глава 2. Стехиометрические законы • 65
Реактивы-, растворы кислот (НС1, H.SO4, HNO3) с указанным значе-
нием титра, титрант—раствор щелочи КОН или NaOH с, = 0,1 моль/л,
раствор фенолфталеина.
Ход работы
1. Получите у преподавателя склянку с раствором неизвестной
кислоты и запишите значение указанного титра в ст. 1 табл. 2.7.
2. В бюретку налейте раствор щелочи и приведите ее в рабочее по-
ложение (рис. 1.23).
3. Пипеткой отберите 10 мл раствора кислоты и перенесите в ко-
ническую колбу.
4. Добавьте в колбу 1—2 капли фенолфталеина.
5. Оттитруйте раствор кислоты, приливая из бюретки по каплям
раствор щелочи при непрерывном помешивании до появления слабой
розовой окраски.
6. Запишите результат титрования в ст. 2 табл. 2.7.
7. Повторите титрование еще два раза. Результаты не должны отл 11 -
чаться более чем на 0,1 мл, в противном случае титрование повторяют.
Обработка экспериментальных данных
1. Сформируйте табл. 2.7 экспериментальных и расчетных данных,
как показано ниже.
и ионном виде.
NaOH + НС1
NaOH + H2SO4 -»
NaOH + HNOj ->
3. Рассчитайте теоретические значения молярных масс эквивален-
тов трех кислот по формуле (2.10), результаты запишите в ст. 6
табл. 2.7.
66 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Рассчитайте значение молярной концентрации эквивалентов
выданной кислоты по уравнению (2.19). результат запишите в ст. 4
табл. 2.7.
5. Рассчитайте значение молярной массы эквивалентов Л/*ЗК(:11
выданной кислоты из экспериментальных данных по уравнению
(2.20), результаты запишите в ст. 5 табл. 2.7.
6. Сравните экспериментальное значение с теоретиче-
скими течениями и на основании сравнения идентифицируйте
кислоту.
7. Рассчитайте абсолютную и относительную ошибки определе-
ния Л/Э(к) по формулам (2.17) и (2.18). Результаты запишите в ст. 7 и 8
табл. 2.7.
Экспериментальная часть опыта
с использованием цифровой лаборатории
Выполнение данной работы с применением цифровой лаборато-
рии основано на методе кулонометрического титрования, который
подробно описан в разделе 1.5 опытах 4 и 5.
Теоретическая часть
При титровании сильной кислоты сильным основанием (титран-
том) в начале эксперимента (рис. 2.5) электропроводность раствора
уменьшается, так как количество ионов Н+ снижается за счет связы-
вания с ионами гидроксида в мало диссоциированные молекулы воды:
н+ + он =Н2О.
Рис. 2.5. Изменение электропроводности при кондуктометрическом
титровании сильной кислоты сильным основанием
Глава 2. Стехиометрические законы • 67
Минимальное значение электропроводности соответствует полной
нейтрализации кислоты шелочыо. При дальнейшем приливании ще-
лочи ионы ОН перестают связываться, общее число ионов увеличи-
вается и электропроводность начинает расти. Подъем линии электро-
проводности (рис. 2.5) после точки эквивалентности менее крутой, т.к.
подвижность ионов ОН меньше, чем ионов Н
Оборудование: компьютер, датчик электропроводности, датчик объ-
ема жидкого реагента, магнитная мешалка, мерный цилиндр на 100 мл,
шприц на 10 мл. химический штатив, штатив для электродов, химиче-
ский стакан на 50 мл.
Реактив: растворы кислот (НС1, H2SO4, НЬ1О3) с указанным зна-
чением титра, Т г/мл, титрант — раствор щелочи КОН или NaOH
е, ~ 0.3 моль/л. спиртовой раствор фенолфталеина.
Ход работы
1. Возьмите у преподавателя склянку с раствором кислоты, титр
которого запишите в ст. 1 табл. 2.7.
2. Соберите установку для кондуктометрического титрования, как
показано на рис. 1.22.
3. Закрепите датчик объема жидкого реагента в лапке химического
штатива.
4. Отберите мерным цилиндром 30 мл кисло гы с заданным титром
и перенесите в стакан на 50 мл, который поставьте на магнитную ме-
шалку. Добавьте в стакан 1—2 капли фенолфталеина.
5. Заполните шприц полностью титрантом и установите в датчик
объема жидкого реагента. Подкручивая колесико в датчике, подведи-
те толкатель к поршню шприца. Установите датчик так, чтобы игла
шприца была направлена в стакан с кислотой.
6. Закрепите в держателе штатива для электродов шуп датчика
электропроводности и опустите его в стакан с кислотой, так чтобы он
не касался ни стенок, ни дна.
7. Подключите датчики к LJSB-портам компьютера.
8. Включите компьютер и запустите программу «Практикум». По-
сле обнаружения датчиков, на экране появятся два шаблона графиков
зависимости объема добавленной щелочи и электропроводности рас-
твора от времени.
Установите пределы измерений для первого графика по абсциссе
X — (0—300) с, по ординате Y — (0—15) мл, для второго графика по аб-
сциссе X— (0—300) с, по ординате У — (0—10) мСм - см-1.
9. Выберите режим «Зависимость одного от другого по нажатию».
Включите магнитную мешалку.
68 • ГЛАВА 2. СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
10. Запустите измерение и начинайте добавлять в стакан с помо-
щью датчика жидкого реагента определенные объемы титранта, начи-
ная с 0,1 мл. Титруйте до тех пор, пока электропроводность, которая
вначале падала, не будет увеличиваться и раствор не приобретет устой-
чивый бледно-розовый пвет.
11. Первое титрование является прикидочным. На основании его
результатов оптимизируйте условия следующего точного титрования.
Титруйте вблизи точки эквивалентности с шагом 0,1—0,2 мл и закан-
чивайте титрование на 2—3 мл больше, чем необходимо в точке экви-
валентности. Результаты двух титрований не должны отличаться более
чем на 0,1 мл.
13. Остановите измерение и экспортируйте данные во внешний файл.
17. Вылейте содержимое стакана. Ополосните щуп датчика элек-
тропроводности, шприц и стакан дистиллированной водой
Обработка экспериментальных данных
1. Откройте файлы с результатами измерений, в них содержатся
два столбца: первый — объем введенной щелочи, второй — электро-
проводность соответствующая этому объему.
2. Постройте график зависимости электропроводности от объема
добавленной щелочи (см. рис. 2.5).
3. Определите ючку эквивалентности, проведя аппроксимирую-
щие прямые на графике до их пересечения. Запишите объем щелочи
Г, , в ст. 2 табл. 2.7
4. Далее ведите расчеты аналогично пунктам 1—7 традиционного
варианта описания обработки экспериментальных данных и соответ-
ствующие результаты заносите в табл. 2.7
Работа 5. Определение содержания
кристаллизационной воды
в кристаллогидрате карбоната натрия
Цель работы'. Установление формулы кристаллогидрата исходя
из результатов титрования его раствора кислотой.
Оборудование-, технохимические весы, мерные колбы на 50 мл. пи-
петки объемом 10 мл, конические колбы.
Реактивы: кристаллический кристаллогидрат карбоната натрия,
стандартный 0.1 М раствор НС1, индикатор метиловый оранжевый,
дистиллированная вода.
Глава 2. Стехиометрические законы • 69
Экспериментальная часть
1. Получите у преподавателя навеску кристаллического кристалло-
гидрата карбоната натрия и взвесьте на технохимических весах, массу
/Я] запишите в ст. 1 табл. 2.8.
2. В мерной колбе на 50 мл приготовьте раствор кристаллогидрата.
3. Отберите пипеткой 10 мл приготовленного раствора в чистую
коническую колбу и прибавьте 1—2 капли индикатора метилового
оранжевого.
4. Налейте в бюретку раствор HCI и установите ее в рабочее поло-
жение (рис. 1.23).
5. Оттитруйте отобранную пробу соли раствором НС1. Для это-
го из бюретки по каплям приливайте раствор кислоты в коническую
колбу до изменения окраски раствора от желтой до оранжевой, сверяя
цвет с эталоном. Результат титрования FK запишите в ст. 2 табл. 2.8.
6. Титрование повторите. Если результаты отличаются друг от дру-
га не более чем на 0,1 мл, титрование можно закончить.
Обработка экспериментальных данных
1. Сформируйте табл. 2.8, как показано ниже
концентрацию эквивалентов с,, приготовленного раствора карбоната
натрия и запишите в ст. 3 табл. 2.8.
3. Напишите уравнение реакции титрования в молекулярном
и ионном видах.
4. Рассчитайте количество молей эквивалентов карбоната натрия
лэ в приготовленном растворе (в объеме колбы) по формуле п, = с, - V
и запишите в ст. 4 табл. 2.8.
5. Рассчитайте массу т безводною карбоната нагрия в пригоюв-
ленном растворе по формуле (2.10), в которой Удля безводного карбо-
ната натрия равно 2.
70 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
6. Рассчитайте массу воды /я(Н2О), содержащейся в навеске кри-
сталлогидрата:
/п(Н2О) = /Н| — т.
7. Рассчитайте число молей безводного карбоната натрия и.
8. Рассчитайте число молей воды и(Н2О).
9- На основании расчетов выведите молекулярную формулу кри-
сталлогидрата карбоната натрия.
Экспериментальная часть с использованием
цифровой лаборатории
В рамках цифровой лаборатории данный опыт выполняется анало-
гично опыту 2 в работе 4 на установке рис. 1.22. В стакан наливают
30 мл приготовленного раствора соли и добавляют 1—2 капли индика-
тора. Шприц заправляют стандартным раствором кислоты, вставляют
в датчик жидкого реагента и титруют раствор, следя за изменением ве-
личины электропроводности раствора в зависимости от объема добав-
ленной кислоты. Обработка результатов такая же, как в традиционном
варианте выполнения работы 5.
ГЛАВА
СТРОЕНИЕ ВЕЩЕСТВА
Теоретическая часть
Энергетическое состояние любого электрона в атоме можно оха-
рактеризовать набором из четырех квантовых чисел, вытекающих
из решений квантовомеханических уравнений.
Главное квантовое число п характеризует энергетический уровень,
на котором находится электрон в атоме, его общую энергию и размер
электронного облака, я может принимать целые положительные зна-
чения от 1 до эо. Первому энергетическому уровню соответствует наи-
меньшее значение энергии.
Орбитальное квантовое число / характеризует энергетический по-
дуровень, на котором находится электрон в атоме, определяет форму
электронного облака. / может принимать целочисленные значения в ин-
тервале от 0 до (я - 1) Число подуровней, на которые расщепляется
энергетический уровень, равно номеру уровня. Для обозначения энерге-
тических подуровней используют строчные буквы латинского алфавита:
Значение /| 0 | 1 | 2 3 | 4 | 5
Магнитное квантовое число mt определяет пространственную ори-
ентацию электронного облака и может принимать значения от —I
до +1, включая нуль.
Спиновое квантовое число ли» характеризует собственный момент ко-
личества движения электрона и может принимать только два значе-
ния: + ’/2 и —'/г-
Совокупностью значений трех квантовых чисел: n,l,mt можно оха-
рактеризовать атомную орбиталь. Число орбиталей в атоме на одном
энергетическом уровне равно я2, на одном энергетическом подуров-
не-(2/+ 1).
Графически атомная орбшаль (АО) изображается в виде клеточки.
В соответствии с принципом Паули в атоме не может быть двух электро-
нов с одинаковым набором четырех квантовых чисел, то есть на одной
орбитали может находиться только два электрона с разными значениями
спинового квантового числа и антипараллельными спинами: (? или •!•).
72 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таким образом, максимальное число электронов в атоме на одном
энергетическом уровне равно 2м2, на одном энергетическом подуровне
равно 2 (2/ + 1)
Используя цифровые значения п и буквенные обозначения /, мож-
но составить электронную формулу аюма любого элемента. Исполь-
зуя графическое изображение орбитали, можно изобразить графиче-
скую электронную конфигурацию.
Для составления электронных конфигураций многоэлектронных ато-
мов в основном состоянии (в состоянии наименьшей энергии) необходи-
мо учитывать основные принципы заполнения орбиталей электронами.
Принцип минимальной энергии: орбитам заполняются в порядке по-
вышения их энергии: ls<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<
< 4f< 5d<6p<7s< 5f< 6d.
Правило Клечковского: заполнение орбиталей происходит в порядке
возрастания суммы (п + /), а при равной сумме — в порядке возрастания
значения п.
Например, для ЗгЛорбиталей сумма « + /=3 + 2 = 5, для 4s — п + /=
=4+0=4, следовательно, сначала заполнится подуровень 4s, а затем 3d.
Принцип Паули: изложен выше.
Правило Хунда: на одном энергетическом подуровне электроны рас-
пределяются так, чтобы суммарное значение спиновых чисел было мак-
симальным. Например, три электрона на р- подуровне распределятся
следующим образом
Общее число электронов в атоме равно порядковому номеру эле-
мента в Периодической системе Д. И. Менделеева. Например, в атоме
фосфора пятнадцать электронов, его порядковый номер в периодиче-
ской системе 15 и электронная формула имеет вид Js22s22/>63sJ3/>3
Сокращенная, или валентная, электронная формула содержит толь-
ко валентные электроны, то есть наиболее активные электроны, кото-
рые в принципе могут принимать участие в образовании химической
связи. Валентными являются все электроны внешнего энергетическо-
го уровня и электроны формирующихся d- или f-подуровней.
Последний электрон в формирующемся подуровне атома называ-
ется формирующим электроном. Например, для атома фосфора форми-
рующим электроном является Зр3-электрон, то есть третий электрон,
находящийся на Зр-подуровне; для атома марганца формирующий —
3</5-электрон, то есть пятый электрон на 3d- подуровне.
Элементы со сходной валентной электронной конфигурацией, от-
личающейся только значением главного квантового числа, называют-
Глава 3. Строение вещества • 73
ся электронными аналогами. Так, например, азот N (L. -2л22/»3) и фосфор
Р (к’^г'З/гЗ.г’З//) — электронные аналоги с обшей валентной форму-
лой п$-пр\ Электронные аналоги находятся в периодической таблице
в одной подгруппе
Вопросы и задания для самоконтроля
1. Определите значения главного, орбитального и магнитного кван-
товых чисел, характеризующих атомную орбиталь 9-го электрона в ато-
ме серы.
2. Какие значен ия магнитного квантового числа характеризуют со-
стояния /^электронов?
3. Охарактеризуйте четырьмя квантовыми числами электрон
4^-орбитали.
4. Какие значен ия магнитного квантового числа характеризуют со-
стояния /-электронов?
5. Какому химическому элементу отвечает формула атома
6. Какому элементу отвечает сокращенная электронная формула
4d55s2?
7. Атому какого элемента отвечает сокращенная электронная фор-
мула 4у24р|?
8. Напишите полную и сокращенную электронную формулу атома
Se и иона Se2-.
9. Найдите в Периодической таблице Д.И. Менделеева элементы,
которые являются электронными аналогами гафния. Запишите об-
щую сокращенную электронную формулу атомов этих элементов.
10. Охарактеризуйте четырьмя квантовыми числами формирую-
щий электрон атома вольфрама W.
11. Напишите краткую электронную формулу элемента с форми-
рующим электроном 3d8.
Работа 6. Электронные структуры
Опыт 1. Электронная структура атомов
и одноатомных ионов металлов
Цель опыта: получить навыки составления электронных формул
атомов и одноатомных ионов металлических элементов, показать из-
менения, происходящие в ходе реакции, в электронных структурах ча-
стиц на примере окислительно-восстановительных процессов.
74 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Атомы металлов в окислительно-восстановительных реакциях вы-
ступают в качестве восстановителей, поэтому в ходе процесса окисле-
ния число электронов в их электронной оболочке уменьшается. В ре-
зультате образуются ионы с положительным зарядом. Например:
А1-3«? —»А13+,... 3s23p' - Зе ->... З/Зр0.
Экспериментальная часть
Оборудование: штатив для пробирок, пробирка — 4 шт., стеклянная
ложечка.
Реактивы: 0,1 М раствор нитрата свинца Pb(NO3)2, кусочки метал-
лов Fe, Mg, Zn.
Ход работы
1. Налейте раствор нитрата свинца Pb(N О3)2 в три пробирки (на */3
объема).
2. Отберите ложечкой немного каждого металла и опустите в пер-
вую пробирку железо, во вторую — цинк, в третью — магний.
3. Отметьте через несколько минут изменения, которые произош-
ли на поверхности металлов, помещенных в раствор нитрата свинца.
Обработка экспериментальных данных
1. Составьте уравнения реакций в молекулярной и ионной форме
между нитратом свинца и исследованными металлами
2. Опишите свои наблюдения. Заполните табл. 3.1, приведенную
ниже.
Таблица 3.1
До реакции После реакции
Химический знак атома или иона металла Краткая элек- тронная формула атома или иона Химический знак атома или иона металла Краткая элек- тронная формула атома или иона
Fe
Mg
Zn
Pb2'
3. Приведите схему распределения электронов по атомным орби-
талям (АО), отвечающих кратким электронным формулам атомов маг-
ния, железа, цинка и свинца в основном и возбужденном состоянии.
Глава 3. Строение вещества • 75
4. Определите возможные валентности рассматриваемых атомов.
5. Охарактеризуйте квантовыми числами (л, / и т,) атомную орбиталь
формирующего электрона в атомах магния, железа, цинка и свинца.
6. Найдите в периодической системе электронные аналоги свинца
и запишше их общую краткую элек] ройную формулу.
Опыт 2. Электронная структура атомов
и одноатомных ионов неметаллов
Цель опыта: получить навыки составления электронных формул
атомов и одноатомных ионов неметаллических элементов, показать
изменения, происходящие в ходе реакции, в электронных структурах
частиц на примере окислительно-восстановительных процессов.
При восстановлении атомов неметаллов число электронов в элек-
тронной оболочке возрастает и образуются ионы с отрицательным за-
рядом. Например:
С! + ё -> С1 или ...Зл’Зр5 + ё -^ ... 3s23pb.
Экспериментальная часть
Оборудование: аппарат Киппа, штатив для пробирок, две пробирки.
Реактивы: растворы 0,1 М сульфида натрия Na2S и иодида натрия
Nal, кристаллы перманганата калия KMnOd, раствор 1 М соляной кис-
лоты НС1.
Ход работы
1. Опыт проводится под тягой! Заполните аппарат Киппа перман-
ганатом калия и налейте в верхнюю воронку соляную кислоту.
2. Налейте в одну пробирку (на */3 объема) раствор сульфида на-
трия, во вюрую — раствор иодида натрия.
3. Опустите в пробирку (сначала в первую, а затем во вторую) газо-
отводную трубку от аппарата Кипа, откройте кран воронки и добавьте
несколько капель кислоты к перманганату. Пропустите медленный ток
хлора через раствор соли.
Обработка экспериментальных данных
1. Составьте уравнения реакций, протекающих в аппарате Киппа
и в пробирках.
2. Опишите свои наблюдения.
3. Заполните ниже приведенную табл. 3.2.
76 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 3.2
_________До
Химический
знак атома или
иона неметалла
реакции
Краткая элек-
тронная формула
атома или иона
Химический
знак атома или
иона неметалла
После реакции
Краткая элек-
тронная формула
атома или иона
С1
4. Приведите схему распределения электронов по АО, отвечающих
сокращенным электронным формулам атомов серы, хлора и иода в ос-
новном и возбужденном состояниях.
5. Определите возможные валентные состояния атомов серы, хло-
ра и иода.
6. Охарактеризуйте квантовыми числами (л, I и тх) атомную орби-
таль формирующего электрона в атомах серы, хлора и иода.
7. Найдите в Периодической системе Д.И. Менделеева элемент,
электронная формула которого 4№4р4. Какими значениями кван-
товых чисел (главного и орбитального) характеризуются внешние
р-электроны в атоме этого элемента?
8. Определите возможные валентные состояния найденного в п. 7
элемента.
Работа 7. Влияние типа кристаллической
решетки на физико-химические
свойства веществ
Цель работы', сравнительное исследование температуры плавле-
ния, кипения, электропроводности некоторых веществ с разным ти-
пом кристаллической решетки.
Теоретическая часть
В соответствии с природой частиц в узлах кристаллической решет-
ки и типом взаимодействия между ними различают четыре основных
типа кристаллических веществ: молекулярные, ионные, атомные и ме-
тал гические.
В узлах кристаллических решеток молекулярных кристаллов нахо-
дятся индивидуальные молекулы, которые связаны между собой от-
носительно слабыми силами Ван-дер-Ваальса — ориентационными.
Глава 3. Строение вещества • 77
индукционными, дисперсионными, а иногда — водородными связями.
Примерами могут являться твердые О2, СО2, СН4, SiCl4, НС1, Н2О,
многие органические кристаллы, кристаллические решетки благород-
ных одноатомных газов (Аг, Хе) и многие другие.
Молекулярные кристаллы характеризуются низкими энергиями
кристаллических решеток, малой механической прочностью, низки-
ми температурами плавления, особенно у неполярных молекул, от-
сутствием электрической проводимости. В ряду вешеств-аналогов
(например в ряду предельных и непредельных углеводородов и др.)
с ростом молекулярной массы энергия кристаллической решетки воз-
растает в связи с увеличением дисперсионной составляющей сил Ван-
дер-Ваальса. Соответственно растут температуры плавления и кипе-
ния веществ. В случае полярных молекул характерны более высокая
прочность и температура плавления вследствие наличия ориентаци-
онной составляющей сил Ван-дер-Ваальса. Наличие между молекула-
ми в кристалле водородных связей (Н2О, NH3, HF, спирты, карбоновые
кислоты) также приводит к увеличению энергии кристаллической ре-
шетки, ее прочности и температуры плавления и кипения. Так, в ряду
одноосновных карбоновых кислот первые члены гомологического
ряда (муравьиная и уксусная кислоты) — жидкости при комнатных
температурах, а следующие представители — уже твердые вещества.
Например, температура плавления шестнадцатого члена этого ряда —
пальмитиновой кислоты — равна 62,8 °C, а восемнадцатого — стеари-
новой кислоты — 69,4 °C. Молекулы сахаров обладают высокой моле-
кулярной массой и так же, как карбоновые кислоты, связаны между
собой не только силами Ван-дер-Ваальса, но и водородными связя-
ми. 1люкоза общей формулы С6Н|2О6 плавится при 150 °C, а сахароза
состава С|2Н22Оц — уже при 186 °C, причем в последнем случае еще
до достижения этой температуры наблюдается потемнение сахарозы
в связи с частичным разложением вещества
В узлах кристаллических решеток ионных кристаллов находятся по-
ложительные и отрицательные ионы, связанные между собой ионной
связью с достаточно высокой энергией. Вследствие ненаправленности
и ненасыщаемости ионной связи расположение ионов в кристалличе-
ской решетке зависит только от размеров ионов и величины их заря-
да. Типичными представителями ионных соединений являются соли
(NaCI, KNO3), оксиды щелочных и щелочноземельных металлов (К2О,
СаО), гидроксиды и другие вещества. Относительно высокие значе-
ния энергии ионной кристаллической решетки обусловливают высо-
кие температуры плавления таких соединений. Ионные кристаллы —
твердые, но хрупкие являются диэлектриками. Многие из них хорошо
78 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
растворимы в воде с полной диссоциацией на ионы. Растворы таких
соединений обладают высокой электрической проводимостью.
В узлах атомных, или ковалентных, кристаллических решеток
располагаются атомы, связанные прочными ковалентными свялячи.
Такие кристаллы обладают высокими энергией кристаллической ре-
шетки, твердостью и температурой плавления К атомным кристал-
лам принадлежат такие вещества, как алмаз, имеющий в узлах sp3-
гибридизованный атом углерода, кремний, оксид кремния (SiO2),
силицид кремния (SiC), некоторые нитриды, например нитрид бора
(BN). Ковалентные соединения могут быть как диэлектриками (ал-
маз). так и полупроводниками (кремний, германий). Вещества с атом-
ной кристаллической решеткой в воде не растворяются.
В узлах металлических решеток расположены атом-ионы метал-
лов, которые связаны между собой метал шческой связью. Металли-
ческая связь осуществляется путем взаимодействия большого числа
обобществленных свободных, делокализованных электронов внеш-
них электронных оболочек. Металлы отличаются характерным ме-
таллическим блеском, высокой тепло- и электропроводностью, пла-
стичностью при механических деформациях. Энергия металлической
связи занимает промежуточное значение между энергией межмолеку-
лярного взаимодействия и энергией ковалентной или ионной связи.
Аналогично меняются и энергии кристаллических решеток: энергия
металлической кристаллической решетки меньше, чем ковалентной,
но больше молекулярной. Специфика свойств d- и /-металлов по срав-
нению с s- и p-металлами объясняется возможностью взаимодействия
электронов предвнешнего (d или f) энергетического уровня с сосед-
ними атом-ионами решетки и повышением таким образом энергии
кристаллической решетки. В связи с этим температуры плавления ме-
таллов колеблются в широком диапазоне.
Кристаллические вещества переходят из твердого состояния в жид-
кое при определенной температуре, которая называется температурой
плавления ГИ1ЯИ. При нагревании вещества его температура постепенно
повышается, но, достигнув Тпяавя, температура некоторое время не из-
меняется, поскольку все подводимое тепло расходуется на разрыв свя-
зей в решетке. После перехода вещества из кристаллического состояния
в жидкое его температура вновь начинает расти вплоть до достижения
точки кипения. Однако далеко не все кристаллические вещества мож-
но нагреть до температуры кипения. В какой-то момент в веществе до-
стигается тепловой баланс: скорость подвода тепла становится равной
скорости его рассеивания. В таком состоянии теплового равновесия
у вещества устанавливается определенная температура. Она заведомо
Глава 3. Строение вещества • 79
меньше, чем температура пламени, за счет рассеивания тепла. Чтобы
достичь более высоких температур, следует увеличить интенсивность
нагрева. Например, при нагревании пробирки с веществом на откры-
том пламени может быть достигнута более высокая температура, чем
при нагревании вещества в фарфоровой чашке через асбестовую сетку.
Вопросы и задачи для самоконтроля.
1. К какому типу явлений — физическому или химическому — от-
носятся плавление, кипение, растворение, электролитическая диссо-
циация, дегидратация9
2. Почему на кривой нагревания вещества появляется плато с по-
стоянной температурой?
3. С чем связано установление теплового баланса при нагревании
вещества на пламени спиртовки?
4. Объясните на основе электронных структур атомов различие
в температурах плавления металлов: олова — 232 "С, цинка — 419 "С,
алюминия — 660 °C, меди — 1083 °C, свинца — 327,5 °C.
5. Почему ионные кристаллические решетки хрупкие, а металли-
ческие — пластичные?
6. С чем связана электропроводность металлов в твердом состоянии?
7. Почему ионные соединения в твердом состоянии — изоляторы,
а в растворенном — проводники?
Экспериментальная часть
Выполнение данной работы возможно каке использованием обыч-
ных лабораторных термометров различной градуировки, так и с ис-
пользованием датчика температуры (термопарным и терморезистор-
ным), который подключается к компьютеру. На мониторе компьютера
можно наглядно наблюдать изменение температуры в ходе того или
иного процесса. Использование датчика электропроводности в ходе
эксперимента позволяет наглядно и быстро оценить и сравнить элек-
тропроводимость исследуемых растворов.
Оборудование-, компьютер, датчик температуры термопарный, датчик
температуры терморезисторный, датчик электропроводности, спир-
товая горелка, штатив химический, фарфоровый треугольник, кольцо
с асбестовой сеткой, фарфоровая чашка и ложка, ступка с пестиком.
Реактивы-, измельченный лед. приготовленный из дистиллирован-
ной воды, стеариновая кислота, пальмитиновая кислота, сахароза (са-
хар), глюкоза, промытый речной песок (или SiO2), металлы Sn, Pb, Zn,
Mg, Al, безводные соли NaCI, KCI, Na2CO3.
80 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
Получите у преподавателя один из вариантов задания, приведен-
ных ниже в табл. 3.3.
Таблица 3.3
SiO2
S1O;
S1O;
S1O;
ство Д
NaCl
KCI
КС1
Na2COj
NaCl
Опыт 1. Температурные зависимости
при нагревании веществ
1. Соберите установку, как показано на рис. 3.1. Поставьте фар-
форовую чашку (3) на сетку, находящуюся на кольце, которое закре-
плено в лапке штатива (4). Поместите под чашку спиртовку (5). Для
веществ А и Б опыт можно проводить в пробирке, которую следует на-
клонно закрепить в лапке штатива.
Рис. 3.1. Установка для измерения температуры нагрева
и плавления твердых веществ.
I — электронные весы. 2 — датчик температуры термопарный
(или терморезисторный): 3 — фарфоровая чашка, 4 — кольцо
с асбестовой сеткой, 5— спиртовая горелка
Глава 3. Строение вещества • 81
2. Закрепите в штативе датчик температуры терморезисторный для
веществ А и Б и термопарный для веществ В, Г и Д. Подключите дат-
чик температуры к USB-порту компьютера.
3. Опустите чувствительный элемент датчика — резистор, находя-
щийся на кончике щупа, в вещество так, чтобы кончик не касался дна
фарфоровой чашки.
4. Включите компьютер и запустите программу «Практикум». По-
сле обнаружения программой датчика на экране должен появиться
шаблон графика «Зависимость температуры от времени». Установите
пределы измерений для датчика по абсциссе X — (0—300) с, по орди-
нате У — (—10—110) °C для вещества А, (20—180) °C для вещества Б,
и (20—1000) °C для веществ В, Г и Д.
5. Включите измерение и начните нагрев. Наблюдайте за измене-
нием состояния вещества и ходом температурной зависимости при на-
гревании.
6. Выключите нагрев для вещества А после начала кипения воды;
веществ Б и Г — после подъема температуры на 10—15 градусов выше
Ги1ЯИ. Если наблюдается стабилизация температуры, а точка плавле-
ния не достигнута, попробуйте увеличить интенсивность нагрева (убе-
рите сетку из-под фарфоровой чашки). Если температура повысится
и вновь стабилизируется, а плавления при этом не наблюдается, через
20—30 секунд остановите нагрев. В случае веществ В и Д остановите
нагрев после достижения теплового баланса, то есть стабилизации
температуры на графике.
7. Остановите измерение и экспортируйте данные во внешний
файл. Выберите место сохранения файла, например создав папку На-
грев N-вещества.
Обработка экспериментальных данных
1. Сформируйте табл. 3.4, как показано ниже
Таблица 3.4
|тип Вещество кристаллической решетки (экспериментальные) Уплам (табличные*)
1 1 2 3 4
А ,
Б
В ±
I 1
д
' Табличные данные возьмите из Приложения II.
82 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Откройте сохраненные файлы и выпишите из них температуру
плавления или температуру установления теплового баланса и занеси-
те в ст. Зтабл. 3.4.
3. Укажите тип кристаллической решетки для каждого вещества
и занесите в ст. 2 табл. 3.4.
4. Рассчитайте абсолютную и относительную ошибки опыта при
определении ?„«,„ веществ.
5. Чем объясняется появление плато постоянной температуры при
нагревании вещества?
6. У веществ с каким типом кристаллической решетки наблюдает-
ся более высокая температура плавления?
7. Почему органические кристаллы плавились при более высокой
температуре, чем кристаллическая вода?
8. Удалось ли вам расплавить металл, соль? Если нет, то почему?
9. До какой температуры удалось нагреть вещество на спиртовой
горелке?
10. Объясните, почему для диоксида кремния температура стаби-
лизируется до достижения температуры плавления.
Опыт 2. Изучение растворимости веществ
и их механических свойств
1. Возьмите - (1—3) г вещества А и попробуйте размельчить (рас-
толочь) его в фарфоровой ступке с помощью фарфорового пестика.
Запишите результат в ст. 7 табл. 3.5
2. Взвесьте чистую фарфоровую чашку и результат запишите
в ст. 4 табл. 3.5.
3. Поместите -1 г вещества А в чашку, стоящую на весах, и запи-
шите точную массу вещества с чашкой т2 в ст. 4 табл. 3.5.
4. Налейте в чашку ~20—30 мл дистиллированной воды и переме-
шивайте стеклянной палочкой в течение 2—3 минут. Если наблюда-
ется растворение вещества, продолжите перемешивание. Образовав-
шийся раствор слейте в стакан на 50 мл, промаркируйте и оставьте для
дальнейших исследований
5. Если явного растворения не происходит (визуально масса ве-
щества в чашке не меняется), после отстаивания слейте воду над ве-
ществом в стакан на 50 мл, промаркируйте и оставьте для дальнейших
исследований.
6. Удалите остатки влаги из вещества путем нагревания и выпари-
вания на спиртовке.
7. После охлаждения чашки с веществом проведите взвешивание.
Запишите массу чашки с веществом после выпаривания в ст. 5 табл. 3.5.
Глава 3. Строение вещества • 83
8. Повторите измерения п. I —7 для других веществ варианта.
9. Сравните массу изученных веществ до и после обработки водой.
Сделайте вывод о способности этих веществ к растворению.
Обработка экспериментальных данных
1. Сформируйте табл. 3.5, как показано ниже
Таблица 3.5
Веще- Тип кристалли- ческой решетки «|,Г m2, г до об- работки nti, г после обработки Дт, г Механиче- ские свойства
1 2 3 т 5 6 7
А
2. Рассчитайте изменение массы вещества &т до и после обработ-
ки его дистиллированной водой, результат запишите в ст. 6 табл. 3.5.
3. Сделайте вывод о способности вещества к растворению.
4. Сформулируйте выводы о механических свойствах веществ:
I) мягкие, пластичные (деформируются в ступке без усилий);
2) мягкие, хрупкие (измельчаются в ступке без усилия);
3) твердые, пластичные (деформируются в ступке с трудом без
измельчения);
4) твердые, хрупкие (измельчаются в ступке с усилием);
5) твердые (не измельчаются в ступке).
5. Отметьте, вещества с каким типом кристаллической решетки хо-
рошо растворимы в воде? Как это можно объяснить?
6. Вещества с каким типом кристаллической решетки плохо рас-
творимы в воде?
7. Почему ионные кристаллические решетки хрупкие, а металли-
ческие — пластичные?
Опыт 3. Определение электропроводности
веществ и их растворов
1. Насыпьте в стакан на 50 мл 3—5 г вещества А.
2. Закрепите в штативе датчик электропроводности и подключите
его с помощью кабеля к LISB-порту компьютера.
3. Опустите шуп датчика в вещество гак, чтобы он не касался дна
стакана.
4. Включите компьютер и запустите программу «Практикум». По-
сле идентификации программой датчика на экране появится шаблон
графика «Зависимость электропроводности от времени».
84 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
5. Установите пределы измерений по абсциссе X — (0—30) с, по ор-
динате Y— (0—2) мСм/см.
6. Начните измерение и через 15—20 секунд остановите измерение.
7. Повторите измерения п. 2—6 для других веществ варианта (кро-
ме металлов).
8. Повторите измерения п. 2—7 для растворов, полученных в опы-
те 2. Начните измерения с дистиллированной воды.
9. Сохраните графические и табличные данные в папке «Электро-
проводность», создав файл «Растворы».
Обработка экспериментальных данных
1. Сформируйте табл. 3.6, как показано ниже
Таблица 3.6
Веще- Тип кристалли- ческой решетки Электропроводность твердого вещества Электропроводность раствора
1 2 3 4
2. Данные по электропроводности металлов в твердом состоянии
возьмите из справочных данных и запишите в ст. 3 табл. 3.6
3. Определите электропроводность остальных веществ из получен-
ных зависимостей и запишите в табл. 3.6.
4. С чем связана высокая электропроводность металлов в твердом
состоянии? Почему в твердом состоянии ионные соединения — изо-
ляторы, а в растворенном — проводники?
5. Почему раствор поваренной соли проводит электрический ток,
а раствор глюкозы не проводит?
6. Почему удельная электропроводность водопроводной воды
на несколько порядков выше, чем дистиллированной?
7. Сформируйте сводную табл. 3.7, как показано ниже.
Таблица 3.7
Веще- Тил кристал- лической решетки г™™ Электро- провод- Раство- римость вводе Электро- проводность раствора Механи- ческие свойства
1 2 3 4 5 6 7
д
Б
В
г
Д
Глава 3. Строение вещества • 85
Работа 8. Строение атомов металлов
и их химические свойства
Цель работы-, изучение некоторых химических свойств металлов
и установление зависимости этих свойств от электронного строения ато-
мов и их положения в Периодической системе химических элементов
Теоретическая часть
Металлы составляют большинство элементов Периодической си-
стемы. К металлам относятся почти все s-элементы (кроме Н и Не),
некоторые p-элементы и все «(-элементы. Краткая электронная фор-
мула s-металлов ns'- (например, Na, Mg), p-металлов ллглр1-2 (напри-
мер, AI, РЬ) и «(-металлов (л — (^-“’ns*1’ (Cr, Fe, Zn).
Металлические свойства элементов можно объяснить наличием
небольшого числа электронов во внешнем электронном слое ато-
мов при сравнительно больших радиусах. Это обусловливает низкую
энергию ионизации, склонность к отдаче электронов и. соответствен-
но, значительную восстановительную способность. Незавершенный
«(-подуровень предвнешнего электронного уровня у металлов побоч-
ных подгрупп объясняет многообразие их валентных состояний и на-
личие большого числа соединений.
Соединения, в которых металл находится в низшем валентном со-
стоянии, обычно проявляют восстановительные свойства (Мп2* — 2е —>
—» Мп4+), а соединения с высшей степенью окисления металла—окисли-
тельные свойства. По восстановительной способности металлы распола-
гаются в известный ряд напряжений: слева стоят металлы, проявляющие
большие восс|ановительные свойства, чем стоящие справа. Металлы,
стоящие в ряду напряжений левее водорода вытесняют его из кислот
(HCI. разб. H2SO4), стоящие правее — не вытесняют. Щелочные и ще-
лочноземельные металлы активно реагируют не только с кислотами,
но и с водой, образуя основные гидроксиды- Только Be проявляет слабые
амфотерные свойства, все остальные — только основные. По сравнению
с s-металлами восстановительная способность p-металлов и «/-металлов
существенно слабее, многие гидроксиды являются амфотерными,
то есть могут диссоциировать и как кислоты, и как основания. Основ-
ные и восстановительные свойства металлов, как правило, усиливаются
сверху вниз по группе и ослабевают вдоль по периоду.
Характерной особенностью ионов переходных металлов является
их склонность к комплексообразованию, что связано с наличием у них
достаточного числа вакантных орбиталей на предвнешнем и внешнем
В6 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
электронных уровнях, s- и р-элементы либо не обладают такой способ-
ностью, либо проявляют ее в гораздо меньшей степени.
Так, металл Zn активно реагирует со щелочами с выделением теп-
ла и образованием гидроксокомплекса [Zn(OH)4]2-. Металлический
AJ также реагирует со щелочами с выделением тепла и образованием
комплекса |А1(ОН)4] :
2AI + 2NaOH + 6Н2О -> 2Na[Al(OH)4] + ЗН2.
Малорастворимые гидроксиды алюминия и цинка растворяются
в щелочах с образованием гидроксокомплексов. Большинство гидрок-
сидов d-металлов легко растворяются в растворе аммиака с образова-
нием аммиачных комплексов.
Вопросы и задачи для самоконтроля
1. Найдите мешллы, общая сокращенная электронная формула
которых:
а) tirtip1,
б) (л - l)rfl(W,
в) их1. Укажите формирующие электроны атомов этих металлов.
2. Углерод и свинец имеют общую валентную формулу (какую?).
Почему один из них (какой?) относится к неметаллам, а дру-
гой — к металлам?
3. Восстановительные свойства какого из металлов Mg или Na вы-
ражены сильнее?
4. Основные свойства какого из гидроксидов Zn(OH)2 или Cd(OH )>
выражены сильнее?
5. Составьте уравнения реакции AI с соляной кислотой и гидрок-
сидом натрия. Укажите окислитель и восстановитель в этих ре-
акциях. Какие свойства проявляет алюминий в этих реакциях?
6. Составьте уравнения реакций образования из солей гидроксидов
цинка и кадмия и их растворения в водном растворе аммиака.
По какому механизму происходит образование химических свя-
зей в аммиачных комплексах этих металлов? Какой из комплек-
сов более устойчивый?
7. Рассмотрите структуру комплекса, образующегося при реакции
HHTpaia серебра с избытком иодида калия.
Экспериментальная часть
Опыты данной работы могут выполняться как традиционным клас-
сическим способом, так и с применением оборудования цифровой ла-
боратории.
Глава 3. Строение вещества • 87
Оборудование: компьютер, датчик температуры терморезисторный,
датчик электропроводности, штатив химический, стакан на 50 мл —
2 шт., пробирки.
Реактивы: металлы Sn, Pb, Zn, Mg, Al Cd; растворы 0,1 M: Pb(NO3)2,
CuSO4, FeCl3, ZnSO4. CdSO4. NiSO4, CoSO4; 1 M: NaOH. NH3 H2O,
HC1.
Опыт 1. Восстановительные свойства металлов
и окислительные свойства ионов металлов
Ход работы
1. Получите у преподавателя один из вариантов задания, приве-
денных в табл. 3.8.
Таблица 3.8
№ варианта Вещество А Вещество Б Вещество В
1 Mg, Al Pb(NO,)2 ZnSO4
2 Zn, Си Pb(NO3)2 Си SO.,
3 Mg, Pb CuSO4 NiSO4
4 Zn, Cd CuSO4 CdSO4
5 Sn, Си FeClj CoSO4
2. В пробирку налейте 2—3 мл раствора соляной кислоты НО.
3. Закрепите в лапке штатива датчик температуры и опустите его
в пробирку, не касаясь стенок и дна. Подсоедините датчик к USB-
порту компьютера.
4. Включите компьютер и запустите программу «Практикум». По-
сле идентификации датчика, установите пределы измерений: по аб-
сциссе X— (0—300) с, по ординате Y— (15—50) °C.
5. Начните измерение, поместив в пробирку небольшое количе-
ство 1-го металла. Наблюдайте за изменениями в пробирке и ходом
температуры.
6. Через 2—3 минуты остановите измерение. Вылейте содержимое
пробирки в специальную емкость, промойте пробирку водой.
7. Повторите действия пунктов 1—6 с другим металлом.
8. Налейте в пробирку 2—3 мл раствора NaOH.
9. Повторите действия пунктов 1—6 для вашей пары металлов
с раствором щелочи.
10. Повторите действия пунктов 1—6 для вашей пары металлов
с раствором вещества Б.
68 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
1. Сформируйте табл. 3.9, как показано ниже
Таблица 3.9
Металл Уравнение реакции Признаки реакции
1 HCI+Me,
NaOH + Me,
Раствор вещества Б + Me,
2 НС1+Ме2
NaOH + Ме2
Раствор вещества Б + Ме2
2. Сделайте вывод относительно восстановительных свойств рас-
смотренных металлов по отношению к окислителю Б.
3. Покажите, как изменяется электронная структура атомов метал-
лов в ходе реакции.
Опыт 2. Комплексные соединения металлов
Ход работы
1. В две пробирки налейте?—3 мл раствора вещества В (см.табл. 3.8).
2. Прибавьте в I -ю пробирку две капли раствора гидроксида аммо-
ния NH3 - Н2О, наблюдайте выпадение осадка основной соли. Отметь-
те цвет осадка и запишите в табл. 3.10.
3. Добавьте в пробирку избыток гидроксида аммония, встряхивая
пробирку, до полного растворения осадка. Отметьте цвет раствора
и запишите в табл. 3.10.
4. Во 2-ю пробирку капните одну каплю раствора NaOH, запишите
наблюдения.
5. Добавьте в пробирку избыток раствора щелочи. Запишите на-
блюдения.
Обработка экспериментальных данных
1. Сформируйте табл. 3.10, как показано ниже.
Таблица 3.10
Уравнение реакции Признаки реакции
вещество В + NH3 - Н2О
вещество В + NaOH
Глава 3. Строение вещества • 89
2. Запишите в табл. 3.10 уравнения реакций и признаки реакции.
В качестве признаков реакции отметьте: выпадение осадка, изменение
цвета раствора, растворение осадка.
3. Почему растворяются осадки солей при добавлении избытка ам -
миака?
4. В каких случаях и почему растворения осадка не произошло?
5. Укажите комплексообразователь, его заряд, лиганды и коорди-
национное число в образовавшихся комплексах.
6. Определите структуру образовавшихся комплексов, вид гибри-
дизации атомных орбиталей комплексообразователя и магнитные
свойства комплексного иона.
7. Сделайте общий вывод по работе.
ГЛАВА
ТЕПЛОВЫЕ ЭФФЕКТЫ
ХИМИЧЕСКИХ РЕАКЦИЙ
Теоретическая часть
Химические реакции часто протекают либо при постоянном давле-
нии, и тогда процесс называется изобарным, либо при постоянном объ-
еме, и тогда процесс называется изохорным. В обоих процессах соблю-
дается закон сохранения энергии* теплота Q, подведенная к системе,
расходуется на увеличение ее внутренней энергии Яи на совершение си-
стемой работы над внешней средой (первый закон термодинамики):
(? = ДГ+ Ж.
Если химическая реакция протекает в открытом сосуде при посто-
янной температуре (р, Т=const) и единственным видом совершаемой
работы является работа расширения (Ж=рДЕ), то тепловой эффект
этой реакции равен изменению энтальпии системы Н («энтальпо» —
нагреваю; нидерлаид. уч. Хейке Оннес 1909 г.):
Qp &Н,
гдеЯ= U + pV.
При ДЯ > 0 (теплота подводится к системе из окружающей среды
Qt < 0.) реакцию называют эндотермической, а при ДЯ < 0 (теплота
выделяется в окружающую среду QT> 0) — экзотермической.
Уравнения химических реакций, в которых указаны их тепловые
эффекты и агрегагные состояния всех веществ, называются термохи-
мическими уравнениями, например:
С6Н6>К + 7,5О2 , = 6СО2 г + ЗН2ОХ;
Д,Я° = —3267,7 кДж/моль С6Н6 ж.
Тепловые эффекты химических реакций и фазовых переходов под-
чиняются основному закону термохимии — закону Гесса: тепловой эф-
фект процесса, протекающего в условиях р.Т= const или V, Т— const,
не зависит от пути его протекания, а определяется природой и физиче-
ским состоянием исходных веществ и продуктов реакции.
Глава 4. Тепловые эффекты химических реакций • 91
Для сравнения тепловых эффектов введено понятие стандартного
состояния вещества, что отвечает нахождению твердых и жидких ве-
ществ в идеальном состоянии при относительном атмосферном дав-
лении. равном 1. газообразных веществ в виде идеальных газов с от-
носительным парциальным давлением, равным 1, растворов в виде
идеальных растворов с концентрацией 1 моль/л.
Стандартная энтальпия образования i-вещества (/-forma-
tion) — это тепловой эффект (энтальпия) реакции образования 1 моля
вещества из простых веществ, находящихся в стандартном состоянии.
Стандартные энтальпии образования табулированы и, как правило,
отнесены к 298 К (Ду J/®29g). Стандартная энтропия образования про-
стых веществ принята равная С, например, Ду^гмик = О
Если исходные вещества и продукты реакции находятся в стандарт-
ном состоянии, то тепловой эффект реакции называется стандартной
энтальпией реакции б,гН°Ти рассчитывается по следствию из закона lecca:
«4-1J
где v, j — стехиометрические коэффициенты в уравнении реакции
Например, стандартная энтальпия реакции Na2OK + Н,ОХ =
— 2NaOHK при Т = 298 К равна:
ДХ<® = 2Д,Я^ои -(Д/WJUo + Д/№2о>-
= 2(—426,60)—(—430,60) +(-285,84) = -136,76 кДж.
Одной из движущих сил химической реакции является уменьшение
энтальпии системы. Однако условие Д/7 < 0 не может быть критерием
самопроизвольного течения химических реакций. Например, само-
произвольное растворение некоторых солей (KCI, NH4NO() в воде
протекает с Д/7 > 0.
Кроме энтальпийного фактора имеется другая движущая сила са-
мопроизвольного процесса — стремление частиц (молекул, ионов,
атомов) к хаотичному движению, а системы — к переходу от более упо-
рядоченного состояния к менее упорядоченному.
Мерой неупорядоченности состояния системы служит термодина-
мическая функция, получившая название энтропии S.
Изменение стандартной энтропии реакиии при 298 К (Дг5^>8) как
функции состояния системы рассчитывается на основе следствия
из закона Гесса по разности суммарной стандартной энтропии продук-
тов реакции и суммарной стандартной энтропии исходных веществ:
92 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
~ У. V<^298j продуктов ~ У V i^29S.i иск веществ» (4-2)
с использованием табулированных значений стандартных энтропий
образования веществ (см. Приложение III).
Функцией состояния системы, учитывающей совместное влияние
этих факторов, является энергия Гиббса, или свободная энергия'. G=H —
TS.
Уменьшение энергии Гиббса химической реакции
ДХ7 = Д.Я - T&S < 0 (4.3)
является однозначным критерием возможности самопроизвольного
протекания реакции в прямом направлении в изобарно-изотермических
условиях, поскольку либо оба фактора действуют в пользу процесса
(АГН < 0 и ArS > 0), либо действующий в пользу процесса фактор яв-
ляется преобладающим и определяет знак Д/7 и направление процесса
в целом.
Для измерения тепловых эффектов используют приборы, назы-
ваемые калориметры, схема и фото которых приведены на рис. 4.1.
Калориметр состоит из калориметрического стакана, помещенного
в наружный сосуд с теплоизолирующей прокладкой. В зависимости
от изучаемой реакции калориметрический стакан может быть сте-
клянный, пластиковый или металлический В крышку могут быть
вмонтированы: мешалка, термометр или датчик температуры, во-
ронка и электрический нагреватель. Исследуемые реагенты помеша-
ют в калориметрический стакан и измеряют изменение температуры
в ходе процесса. Теплота, выделяющаяся или поглощающаяся в кало-
риметрической установке Онроцкса. вычисляется по формуле
О=СК-ДТ, (4.4)
где ДГ — изменение температуры в ходе эксперимента; Ск — средняя тепло-
емкость всей калориметрической установки.
Суммарная теплоемкость калориметрической установки Ск — это
константа данной калориметрической установки, которая зависит
от ее материала и конструкции, массы реагентов и равна количеству
теплоты, необходимой для нагревания установки на один градус.
Определяют Ск либо как сумму теплоемкостей калориметрической
жидкости и всех соприкасающихся с ней частей калориметра: стака-
на, мешалки, термометра и др.: Ск = С] -»»| + С2-т2 + ..., либо опыт-
ным путем. Экспериментально константу калориметра Ск определяют
двумя способами. Во-первых можно измерить изменение температу-
Глава 4. Тепловые эффекты химических реакций • 93
ры А Г при пропускании через калориметрическую систему опреде-
ленного количества электричества с помощью электрического нагре-
вателя, вмонтированного во внутренний стакан калориметрической
установки. Тогда Ск = (I2 Rf)/ts.T (Дж/К), где I — ток, прошедший
через систему; R — сопротивление спирали нагревателя; г — время
протекания тока. Другой способ определения Ск состоит в измерении
изменения температуры ДУ при протекании какого-либо стандарт-
ного процесса, тепловой эффект Q (кДж/моль) которого известен.
В этом случае
(4.5)
где л — количество растворенного стандартного вещества (моль).
Рис. 4.1. Калориметрическая установка*
У — мешалка, 2 — воронка, 3 — калориметрический стакан, 4 — наружный сосуд
(стакан); 5— крышка,- 6 — термометр или датчик температуры: 7 — нагреватель,
8— теплоизолирующая прокладка; 9— электронный блок датчика температуры
В качестве стандарта часто используют теплоты растворения хло-
рида калия КС1 Напомним, что теплотой растворения называется
тепловой эффект реакции растворения одного моля вещества в очень
разбавленном растворе. Постоянство теплоты растворения обычно
наблюдается, когда на 1 моль растворенного вешества приходится бо-
лее 200 молей растворителя (воды).
Изменение температуры в ходе калориметрического эксперимента
происходит как за счет теплового эффекта самого изучаемого процес-
са, так и вследствие теплообмена с окружающей средой и нагревания
при перемешивании. Следовательно, измеренное изменение темпе-
ратуры АГИЖ = Унач - Укон отличается от истинного ДУ, отвечающе-
го теплоте изучаемого процесса. Поэтому при расчетах температуры
94 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
A7i,1M вводят поправки на теплообмен. Одним из способов введения
температурной поправки на теплообмен является графический метод
Ланге — Мищенко.
В ходе калориметрического опыта записывается изменение тем-
пературы во времени (рис. 4.2). Сам калориметрический опыт делит-
ся на три периода: предварительный (~5 минут) отрезок АВ, главный
(время протекания изучаемого процесса), отрезок ВС, и заключитель-
ный (не менее 5 минут), отрезок CD. Для определения температурной
поправки необходимо спроектировать точки С и В (рис. 4.2) на ось
ординат, найти середину отрезка KL и провести линию MN. Через
точку Р провести вертикаль. Далее (рис. 4.2) экстраполируют линей-
ные участки АВ и CD (пунктирные линии на графике) до пересечения
с вертикалью в точках Ен F Отрезок EF~ АТявляется истинным зна-
чением температуры с учетом поправки на теплообмен.
Рис. 4.2. Температурная зависимость от времени
в ходе калориметрического опыта
Вопросы и задачи для самоконтроля
1. Какие реакции называют экзотермическими? Рассчитайте при
298 К стандартные энтальпию, энтропию и энергию Гиббса про-
цессов:
а) 2С6Н6(Ж> + 1502(1) = 12СО2(1) + 6Н2О(ж,;
б) 2C(1PJ + H2(IJ = С2Н2(1>.
2. Напишите уравнение химической реакции, тепловой эффект
которой соответствует стандартной энтальпии образования
твердого карбоната кальция при 298 К.
3. Энтальпия нейтрализации сильной кислоты сильным основани-
ем при стандартных состояниях и 298 К равна Дг^298 —
Глава 4. Тепловые эффекты химических реакций • 95
= —55,9 кДж/(моль Н2О). Вычислите, сколько теплоты выде-
лится при смешении 100 мл 0,5 М раствора НС1 с 100 мл 0,5 М
раствора NaOH.
4. Будет ли самопроизвольно протекать процесс 2 Н С1(р р) +
—> MgCl2(p.p) + Н2(1) при 285 К и стандартных состояниях всех
компонентов реакции?
5. Определите возможность самопроизвольного протекания про-
цесса 2SO2, + О2, = 2SO3, при 900 К, если давления реагирую-
щих веществ были p(SOi) = 3-104 Па, p[Oj) = 104 Па, pjSOj) —
= 1,5 104Па.
Работа 9. Определение теплоты
нейтрализации сильного
основания сильной кислотой
Цель работы', освоить методику калориметрических измерений
и термодинамических расчетов реакции нейтрализации и растворения
соли.
Термохимическое уравнение реакции нейтрализации сильной
кислоты сильным основанием имеет вид Н+(р-р) + ОН_(р-р) =
= Н2О(ж) + Q. Тепловой эффект реакции взаимодействия разбавлен-
ных растворов сильных кислот и сильных оснований рассчитывается
на основе данных по изменению температуры в ходе опыта, получен-
ных с помощью калориметрических измерений.
Экспериментальная часть
Оборудование: калориметрическая установка со стеклянным стака-
ном, два мерных цилиндра на 100 мл.
Реактивы: растворы: 1 М КОН или NaOH; 1 М H2SO4 или HNO3
Ход работы
1. Получите у преподавателя задание и запишите объемы кисло-
ты V* и щелочи в ст. 2 табл. 4.1. Для реакции берут равные объемы
(oi 50 до 100 мл) растворов кислоты и щелочи.
2. Взвесьте сухой калориметрический стакан (с точностью до 0,1 г),
результат пц запишите в ст. 1 табл. 4.1.
3. Соберите калориметрическую установку (рис. 4.1) и поставьте
на магнитную мешалку.
96 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Измерьте цилиндром заданный объем I М раствора шелочи
и через воронку перелейте его в калориметрический стакан. Включите
мешалку.
5. Измерьте термометром температуру раствора шелочи и запи-
шите в ст. 3 табл. 4.1.
6. Налейте в мерный цилиндр такой же объем 1 М раствора кислоты
7. Измерьте температуру раствора Тк и запишите в ст. 4 забл. 4.1.
8. Запишите начальную температуру смеси кислоты и щелочи Г,,
которая рассчитывается как среднее арифметическое Гш и Гк и запи-
шите в ст. 5 табл. 4.1.
9. Вылейте кислоту при работающей мешалке в калориметриче-
ский стакан.
10. Отметьте самую высокую стабильную температуру Т2, которую
покажет термометр, и запишите в ст. 6 табл. 4.1
Обработка экспериментальных данных
1. Сформируйте табл. 4.1, как показано ниже
Таблица 4.1
/и., кг К, Ущ, мл гщ.к 7k, К 71, К Тг, К Д7', К ск &Н-/, кДж/моль
1 2 3 4 5 6 7 8 9
2. Рассчитайте теплоемкость калориметрической системы Ск =
= Ci - nti + С2 - т2, где С| = 0,75 -103 Дж/(кг - К) — удельная теплоемкость
стекла, С2—4,18 103 Дж/(кг - К) — удельная теплоемкость раствора; т1 —
масса калориметрического стакана, кг; т2 — масса жидкости в калори-
метрическом стакане, кг (считать плотность жидкости равной единице).
3. Определите подъем температуры в ходе опыта ДГ= (Т2 — Г1).
4. Рассчитайте количество теплоты ((?), выделившееся в ходе опы-
та по формуле (4.4).
5. Рассчитайте число молей нейтрализованной кислоты (шелочи)
или число молей полученной воды ян,о.
6. Рассчитайте энтальпию нейтрализации &ГНТ -—
(кДж/МОЛЬ Н,О).
7. Запишите термохимическое уравнение проведенной реакции
нейтрализации
8. Рассчитайте стандартную энтальпию Д,//?98< энтропию Д,5’г98
и энергию Гиббса &rG24lt изучаемой реакции и по полученным величи-
нам сделайте выводы.
Глава 4. Тепловые эффекты химических реакций • 97
Экспериментальная часть с использованием
цифровой лаборатории
Химический практикум по общей химии, как правило, не оснащен
необходимыми для калориметрических измерений термометрами Бек-
мана, поэтому обычно используют лабораторные спиртовые термоме-
тры. При выполнении эксперимента замер температуры производят
по команде другого студента, следящего за временем. При подобных
измерениях погрешность определения достигает 30—40*%. Немалую
долю вносит грубое определение константы калориметрической уста-
новки, не учитывающее теплоемкость всех ее составляющих. В случае
применения цифровой лаборатории проведение самого эксперимента
упрощается, становится более наглядным и точность эксперимента
существенно повышается. С помощью датчика температуры и ком-
пьютерной программы производится непрерывная фиксация темпе-
ратуры, и полученная зависимость сохраняется в табличном и графи-
ческом виде. Далее из всего массива точек выбирают отдельные точки,
по которым строят точный график для определения изменения темпе-
ратуры в ходе опыта. Константа калориметра определяется из опыта,
в котором проводится стандартный процесс, тепловой эффект кото-
рого известен.
Оборудование-, электронные весы, компьютер, датчик температуры
терморезисторный, калориметр со стеклянным внутренним стаканом,
мерный цилиндр на 50 мл, мерная пипетка (2—5 мл), штатив.
Реактивы- оттитрованный раствор кислоты (НС1, H2SO4) с, =
= 2 моль/л, раствор щелочи (NaOH или КОН) С, = 0,1 моль/л, мелко-
кристаллический хлорид калия КС1, дистиллированная вода.
Ход работы
1. Соберите калориметрическую установку, как показано
на рис. 4.1 Следите, чтобы датчик температуры не касался стенок
и дна внутреннего стакана.
2. Насыпьте хлорид калия в какую-либо тару и взвесьте. Запишите
суммарную массу навески и тары в ст. 1 табл. 4.2.
3. Отмерьте мерным цилиндром 50 мл щелочи и вылейте в калори-
метрический стакан.
4. Подключите да«чик температуры через LJSB-разъем к ком-
пьютеру.
5. Включите компьютер и запустите программу «Практикум».
6. После обнаружения датчика температуры на экране появится
шаблон графика зависимости температуры от времени. Установите
98 ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
пределы измерений по абсциссе X — (0—800) с, по ординате У — (15—
40) °C.
7. Начните измерение и в ючение 3 минут, перемешивай, следите
за ходом температуры.
8. После установления температуры (-3 минут) добавьте в ка-
лориметрический стакан 2 мл кислоты, не прекращая перемеши-
вания.
9. Следите за графиком, после окончания главного периода про-
должайте измерение температуры еще минут пять.
На этом заканчивается эксперимент по определению теплоты ней-
трализации и начинается эксперимент по определению теплоемкости
всей калориметрической установки. Обратите внимание, что заключи-
тельный период эксперимента по опреде гению теплоты нейтрализации
является предварительным периодом опыта по опреде гению теплоемко-
сти (константы) калориметрической установки.
10. Быстро перенесите в калориметрический стакан приготовлен-
ную навеску хлорида калия KCI. Не забудьте интенсивно перемеши-
вать. Наблюдайте за изменением температуры по графику.
11 После окончания главного периода продолжайте следить за из-
менением температуры еще минуты три, после чего остановите изме-
рение.
12. Взвесьте тару, в которой находилась навеска KCI и запишите т2
в ст. 2 табл. 4.2.
13. Экспортируйте данные во внешний файл. Выберите место
сохранения файла, например создайте папку «Теплота нейтрали-
зации».
14. После окончания эксперимента вылейте содержимое калори-
метрического стакана в отведенную тару и промойте его дистиллиро-
ванной водой.
Обработка экспериментальных данных
I. Сформируйте табл. 4.2 экспериментальных и расчетных данных,
как показано ниже.
Таблица 4.2
ть г г»2, г zw(KCI), г Ск, кДж/К дг,. к ДГьК кДж/моль АЛ. кДж/моль
2 3 4 5 6 7 8
Глава 4. Тепловые эффекты химических реакций • 99
2. Откройте файл с результатами измерений. В нем содержатся два
столбца: первый — время эксперимента, второй — температура в этот
момент времени
3. Постройте график временной зависимости температуры, выбрав
15—20 точек из всего массива точек. Выберите масштаб по оси ординат
максимально возможный.
4. С помошью метола Ланге — Мишенко. описанного в тео-
ретической части, определите истинное изменение температуры
AT, в результате реакции нейтрализации и ЛТ2 при растворении
КС1.
5. Рассчитайте концентрацию раствора с„ (КО) моль/1 кг Н2О
и по справочным данным (см. Приложение IV) найдите интегральную
теплоту растворения соли АЯ®.
6. Рассчитайте теплоемкость калориметрической системы по фор-
муле
^(кДж/К),
ДГ2
где АЯ“ — интегральная теплота растворения КС1 (см. Приложение V);
я = м(КС1)/Л/(КС1) — количество вещества KCI (моль); /п(КС1) = mt — m2;
— изменение температуры в ходе второго эксперимента
Результат запишите в ст. 4 табл. 4.2.
7. Рассчитайте ян,о — количество вещества Н2О (моль). По закону
эквивалентов яэ (кислоты) = яэ (щелочи) = я, (НЭО), а я, (Н2О) =
= я(Н2О), т.к. в данной реакции Z(H2O) = 1.
8. Рассчитайте энтальпию реакции нейтрализации по формуле
„ Ск ЛТ.
ЛГН =-------(кДж/моль).
ин,о
9. Напишите термохимическое уравнение рассматриваемой реак-
ции и рассчитайте стандартную энтальпию АГЯ298, энтропию ^rS24i
и энергию Гиббса ArG298 изучаемой реакции (см. приложение IV, V)
и по полученным величинам сделайте выводы.
10. Что собой представляет константа калориметра и как она опре-
деляется?
11. Что учитывает метод Ланге — Мишенко?
12. Почему не надо обнулять тару при взвешивании КО?
100 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 10. Определение энтальпии реакции
образования кристаллогидрата
Цель работы: применение закона Тесса для определения тепловых
эффектов реакций, экспериментальное определение тепловых эффек-
тов которых затруднено.
Теоретическая часть
Как известно, тепловой эффект (изменение энтальпии) реакции
определяется только начальным и конечным состояниями системы
и не зависит от пути перехода системы из одного состояния в другое.
Например, образование углекислого газа СО2 может быть осуществле-
но двумя путями, отображенными на следующей схеме:
Из закона Гесса следует, что энтальпия образования 1 моля СО3
по первому пути Д//( должна равняться второму пути, состоящему
из двух процессов (ДЯ2 + ДЯ3) 11 приводящих также к образованию
1 моль СО2 из тех же исходных веществ. Таким образом, ДЯ, =
= ДЯ2 + ДЯ3. Осуществить экспериментальное определение измене-
ния энтальпии первого С113 + О2(1) —> СОао, ДЯ] и третьего СО(Г) г-
2
—> СО2{Г), ДЯ3 процессов в реальных условиях возможно.
а определить ДЯ2 второго процесса практически нереально. Однако
энтальпия второго процесса С1Р + О2(г) СО(1) +
можно рас-
считать как разность ДЯ> = АЯ, — ДЯ3 экспериментально полученных
значений и ДЯ3.
Целью предлагаемой работы является определение энтальпии об-
разования кристаллогидрата сульфата меди CuSO4(K) + 5Н2О(Ж)
—> CuSO4 - 5Н,О(К( ДгЯ3 экспериментальное определение которой за-
труднительно. Но возможно в реальных условиях определить энталь-
пии двух других реакций:
1) реакции растворения кристаллического безводного сульфата меди
CuSO4<K) + лН2О(к, -> CuSO4(p р), Д,Я,1;.
Глава 4. Тепловые эффекты химических реакций • 101
2) реакции растворения пятиводного сульфата меди
CuSO4 • 5Н,О(К) + (л - 5)Н2О(ж) -> CuSO4(p р), ДГЯ,°.
Экспериментальная часть
Работа может быть проведена как с использованием лабораторного
термометра, так и датчика температуры. Выполнение работы в тради-
ционном варианте и с применением цифровой лаборатории аналогич-
но работе 9.
Оборудование: компьютер, терморезисторный датчик температуры,
калориметрический стакан, магнитная мешалка, мерный цилиндр
(50 мл), штатив.
Реактивы: мелкокристаллический хлорид калия КО (~| г), суль-
фат меди CuSO4 (-4 г), кристаллогидрат сульфата меди C11SO4 - 5Н2О
(~6 г), дистиллированная вода.
Ход работы
1. Взвесьте навески хлорида калия КО, сульфата меди CuSO4
и кристаллогидрата CuSO4 5Н2О и полученные значения масс запи-
шите в табл. 4.3.
2. Для определения изменения температуры в ходе реакции рас-
творения безводного сульфата меди и теплоемкости калориметриче-
ской системы проведите действия аналогичные п. 1—15 эксперимен-
тальной части работы 9 цифрового варианта, за исключением того что:
а) в п. 3 в калориметрический стакан налейте 100 мл Н?О. б) в п. 9 до-
бавьте навеску безводною сульфата меди CuSO4.
3. Далее для определения изменения температуры в ходе реакции
растворения пятиводного сульфата меди проведите действия, анало-
гичные п. 1 — 10 экспериментальной части работы 9 цифрового вари-
анта, за исключением того что: а) в п. 3 в калориметрический стакан
налейте 100 мл Н2О, б) в п. 9 добавьте навеску пятиводного сульфата
меди CuSO4 - 5Н2О
Обработка экспериментальных данных
I. Сформируйте табл. 4.1, как показано ниже
2. Далее действуйте, как написано в п. 2—6 работы 9 в части «Об-
работка экспериментальных данных» в варианте с цифровой лабора-
торией. Запишите найденное значение теплоемкости всей калориме-
трической системы в ст. 4 табл. 4.3.
102 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 4.3
Вещество
т, г ДГ, К Ск, Дж/К Д,Д, кДж/моль
2 3 4 5
КС1___________
CuSO^k,_______
CuSO4 5H;OtK,
ДТ,
Д7~> =
3. Докажите, что ЛН2 = ДHt — ДЯ3.
4. Рассчитайте теоретическое значение стандартной энтальпии ре-
акции образования кристаллогидрата сульфата меди Дгя£, если спра-
вочные данные по энтальпиям растворения следующие: стандартная
энтальпия растворения CuSO4 ДГЯ|° = —66,1 кДж/моль, стандартная
энтальпия растворения CuSO4- 5Н2О Д,Я3 =11,5 кДж/моль.
5. Рассчитайте экспериментальное шачение энтальпии реакции
растворения CuSO4 \Hi'.
, ,, ск а/.
&,НХ=--------, кДж/моль,
WCuSO4
где С„ — теплоемкость калориметрической системы Дж/К; «cuso, — количе-
ство вещества CuSO4, моль; ДГ( — изменение температуры в ходе опыта 1.
Результат запишите в ст. 5 табл. 4.3.
6. Рассчитайте энтальпию реакции растворения CuSO4-5H2O
дгЯ3°:
„ Ск -Д7\
=, кДж/моль,
ЯСч5О4 5Н2О
где С, —теплоемкость калориметрической системы Дж/К; ^си$о45н,о — ко-
личество вещества CuSO4 5Н2О, моль; АТ3 — изменение температуры в ходе
опыта 3.
Результат запишите в ст. 5 табл. 4.3.
7. Рассчитайте энтальпию реакции образования кристаллогидрата
сульфа!а меди
ДЯ2 = ДЯ, - ДЯ,.
8. Сравните теоретическое значение с полученным из экспе-
риментальных данных.
ГЛАВА
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Теоретическая часть
Если при некоторой температуре наблюдается уравнивание эн-
тальпийного ДЯ и энтропийного 7Д5 факторов, говорят об установ-
лении в системе состояния химического равновесия, которому отвечает
равенство
дДг=о.
(5-1)
В состоянии равновесия свободная энергия системы минимальна,
а возможность протекания прямой и обратной реакции равновероят-
на, при этом в единицу времени образуется столько же продуктов ре-
акции, сколько их расходуется в обратной реакции образования исход-
ных веществ. В таких условиях парциальные давления и концентрации
всех компонентов реакции постоянны во времени и во всех точках си-
стемы и называются равновесными давлениями и концентрациями
Химическое равновесие является динамическим, т.е. его установ-
ление не означает прекращение реакции. Подвижность равновесного
состояния системы означает, что оно самопроизвольно восстанавли-
вается после снятия внешнего воздействия, вызвавшего отклонение
от положения равновесия.
В общем случае для гомогенной обратимой реакции (ID + bB^±lL +
тМ, независимо от ее механизма, стандартная энергия Гиббса равна:
(5.2)
или для реакций в конденсированной фазе
где Pp_t, РрМ' PpDi Рр.в — равновесные относительные парциальные дав-
ления соответствующих компонентов ( р/ = pt /ро, где р0 — стандартное давле-
ние, равное 1,01 • 10s Па или 101 кПа или I атм), [£], [Л/], |'2)|, [£] — равновес-
104 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ные относительные концентрации соответствующих веществ
| [£! =----— ----I, !,m,dub—показатели степени, равные стехиометри-
е0 = 1 моль/л )
ческим коэффициентам.
Безразмерные выражения под знаком логарифма называются кон-
стантами химического равновесия Кр или Кс:
к _ р[±р7м_ к ДЦ* [МГ
' pde»PbeJ>’ ‘
(5.4)
и являются вариантами математического выражения закона действу-
ющих масс.
Чем больше величина константы равновесия, тем больше выход
продуктов реакции, т.е. степень превращения исходных реагентов
в продукты.
Подставляя выражение константы равновесия в уравнения (5.2)
и (5.3), получим:
AGr = —ЯПп Кр = -2,ЗЯТ1£ КР, (5.5)
AG“ = -ЯЛп Кс = -2,ЗЯТ1е Кс. (5.6)
В случае гетерогенного химического равновесия в выражение за-
кона действующих масс входят только равновесные концентрации
(давления) газообразных и растворенных веществ. Например, для ре-
акции 4СиО(.гв) <=» 2Cu2O(tb) + О2(1) выражение константы равновесия
будет иметь вид: ^С=[О2) или Кр-рО1.
При условии подчинения газообразных компонентов равновесия
законам идеальных газов связь между Кр и Кс выражается уравнением
КР = КАВТ)^, (5.7)
где Av = (I + tn) — (d + b) — изменение числа молей газов в результате реак-
ции, а Я имеет размерность 0.082 л - атм • К 1. Например, для реакции СН4, +
+ 2Н2Ог <=* СО2 г + 4Н2 г изменение числа молей газов Av = (1 4) - (1 2) =
= 2иKf = Kc (RT)1.
Качественно смещение химического равновесия определяется
принципом Ле Шателье — Брауна: если на систему, находящуюся в со-
стоянии истинного химического равновесия, воздействовать извне
и тем самым изменить условия равновесия, то в системе усилится тот
процесс, течение которого ослабит влияние этого воздействия, и в ре-
зультате равновесие сместится в том же направлении.
Глава 5. Химическое равновесие «105
Количественной формой выражения подвижности химического
равновесия (при условии независимости ДЯС и Д5° от температуры)
является температурная зависимость константы равновесия — уравне-
ние изобары Вант-Гоффа:
d\nKf
dT R Т2
(5-8)
Как видно из уравнения изобары (5.8), константа равновесия с по-
вышением температуры в случае экзотермических реакций (ДЯ < 0)
уменьшается, т.е. относительное содержание продуктов понижается,
а для эндотермических (ДЯ > 0) Кр возрастает, т.е. относительное со-
держание продуктов повышается. Чем больше значение энтальпии ре-
акции, тем сильнее влияние температуры на величину Кр.
Константа химического равновесия может быть рассчитана, если
известно стандартное значение энергии Гиббса реакции, по формулам
(5.5) и (5.6). Используя закон действующих масс (5.4), можно рассчи-
тать равновесные концентрации или парциальные давления реагиру-
ющих веществ и, наоборот, по известным равновесным концентра-
циям реагирующих веществ можно определить константу равновесия
и соответственно стандартную энергию Гиббса химической реакции.
Вопросы и задачи для самоконтроля
1. Какое состояние обратимой реакции называется химическим
равновесием?
2. Что является количественной характеристикой химического
равновесия?
3. Напишите выражение константы равновесия для следующих си -
стем:
a) CuO(K) + Н2([) Си<к| + H2O(rt;
б) SO2(I) + Н2О)ж) H2SOJ(K,.
4. Рассчитайте константу равновесия Кр реакции (а) задания 3 при
температуре 350 °C.
5. Углекислота Н2СО3 способствует химическому разрушению
(коррозии) металла и может быть удалена из воды по реакции:
Н2СОз1Р) СО2(Г, + Н2О(Ж), (ЬН > 0).
Если система находится в равновесии, то какие внешние воз-
действия будут способствовать разложению Н2СО3?
6. Вычислите равновесные концентрации всех компонентов газо-
фазного равновесия
А + В С + Д, если смешали 0,2 моль А и 0,6 моль В в растворе
объемом 1 л. Константа равновесия равна 0.2.
106 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 11. Смещение химического равновесия
Цель работы, изучение влияния различных факторов на смещение
химического равновесия.
Опыт 1. Влияние концентрации веществ
на химическое равновесие
Цель опыта:
В данном опыте изучают обратимую реакцию взаимодействия хло-
рида железа(Ш) FeCI3 с роданидом аммония NH4NCS:
FeCl3 + 3NH4 SCN Fe(SCN)3 + 3NH4Cl
Образующийся в результате реакции роданид железа Fe(SCN )3 при-
дает раствору красно-коричневую окраску. По изменению интенсив-
ности окраски можно судить об изменении концентрации Fe(SCN)3,
т.е. о смешении равновесия в ту или иную сторону.
Экспериментальная часть
Оборудование: пробирки — 4 шт., стеклянная ложечка и палочка.
Реактивы: разбавленные и концентрированные растворы FeCl,
и NH4SCN, кристаллический NH4C|.
Ход работы
I. Внесите в пробирку по -20 мл разбавленных растворов трихло-
рида железа FeCl3 и тиоцианата аммония NH4SCN. Легким встряхива-
нием пробирки размешайте раствор.
2. Разлейте приготовленный раствор поровну в четыре пробирки.
3. Поставьте все пробирки в штатив.
4. В первую пробирку добавьте несколько кристаллов хлорида ам-
мония NH4CI, во вторую — 2—3 капли концентрированного раствора
роданида аммония NH4SCN, в третью — 2—3 капли концентрирован-
ного раствора хлорида железа FeCl,. четвертую пробирку оставьте для
сравнения.
5. Растворы размешайте энергичным встряхиванием или стеклян-
ной палочкой.
6. Запишите в таблицу изменение интенсивности окраски в каж-
дой пробирке.
Глава 5. Химическое равновесие «107
Обработка экспериментальных данных
1. Сформируйте табл .5.1, как показано ниже
Таблица 5.1
Добавленный реагент Изменение окраски Смещение равновесия
NH4C1
nh4ncs
FeClj
2. Напишите выражение константы равновесия данной реакции.
3. Объясните смещение равновесия в каждом случае.
4. Сформулируйте принцип Ле Шателье — Брауна для частного
случая — изменения концентрации реагентов.
Опыт 2. Влияние температуры
на химическое равновесие
Цель опыта:
В данном опыте изучают реакцию димеризации диоксида азота
2NO? <=> N2O4, в которой происходит изменение окраски от темно-бу-
рого цвета (NO2) до бледно-желтого (N2O4).
Диоксид азота ЫО2 относится к классу опасных веществ, и поэтому
работу с ним необходимо проводить в вытяжном шкафу.
По изменению окраски газовой смеси можно судить о концентра-
ции ее компонентов, т.е. о смещении равновесия в сторону прямой или
обратной реакции.
Оборудование: круглодонная колба, LJ-образная трубка, химические
стаканы на 500 мл — 2 шт.
Реактивы: кристаллический Pb(NO3)2, лед, горячая вода.
Экспериментальная часть
1. Получите диоксид азота разложением нитрата свинца по ре-
акции:
2Pb(NO3)2 = 2РЬО + 4NO3 + О2
2. Подберите для U-образной трубки резиновые пробки.
3. Заполните диоксидом азота LJ -образную трубку.
4. Закройте плотно пробками оба конца U-образной трубки. Пере-
верните трубку концами вниз и поместите одно колено в стакан с го-
рячей водой, другое — в стакан с ледяной водой (холодную и горячую
воду приготовьте заранее).
108 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
5. Наблюдайте изменение окраски в том и другом колене
U-образной трубки.
6. Выньте трубки из стаканов, и то колено, коюрое были в холод-
ной воде, опустите в горячую воду, а колено из горячей воды — в хо-
лодную.
7. Наблюдайте вновь изменение окраски в каждом колене.
Обработка экспериментальных данных
1. Напишите выражение для константы равновесия изучаемой ре-
акции.
2. Рассчитайте стандартную энтальпию реакции Дг//298-
3. Запишите, в каком направлении происходит смещение равно-
весия данной реакции: а) при нагревании, б) при охлаждении исходя
из наблюдаемого изменения окраски в ходе эксперимента.
4. Объясните смещение равновесия исходя из уравнения изобары
Вант-Гоффа.
5. Сформулируйте принцип Ле Шателье — Брауна для частного
случая — изменения температуры равновесной системы.
Работа 12. Исследование равновесия
гомогенной реакции
Цель работы, изучение химического равновесия гомогенной реак-
ции и расчет константы равновесия.
Теоретическая часть
Химическое равновесие в системе вода — йод, рассматриваемое
в данной работе, можно записать следующим образом:
12 + Н2О Н' + 1~ 4 ню,
и его константа имеет вид:
(5.9)
(5.10)
где с(|., с(_. сжо, с|; — относительные равновесные концентрации компо-
нентов равновесия.
Глава 5. Химическое равновесие «109
Для расчета константы равновесия и определения степени превра-
щения исходных веществ необходимо знать равновесные концентра-
ции компонентов (cj,, сн,, cj-) системы.
Равновесную концентрацию ионов водорода Н+ определяют с по-
мощью метода pH-метрии. В теории растворов существует понятие
«показатель ионов водорода», который обозначается как pH и равен:
pH = -lgeH*. (5.11)
Концентрацией ионов водорода, образующихся за счет диссоци-
ации кислоты НЮ, можно пренебречь, т.к. НЮ относится к слабым
электролитам (Ка = 10-11).
Общее содержание йода I, в системе (5.9) определяется колориме-
трическим титрованием тиосульфатом натрия Na2S2Oj по реакции:
I2 + 2S2O^=2F + S«Og. (5.12)
В качестве индикатора используется раствор крахмала, который
прибавляют в конце титрования, когда йода остается мало, и титруе-
мый раствор становится бледно-желтым. Образуемый комплекс йода
с крахмалом окрашивает раствор в синий цвет, который в конце титро-
вания от одной капли тиосульфата исчезает. Концентрация оттитро-
ванного йода с,(12) рассчитывается по закону эквивалентов:
K(l2) -^(k) = K(Na2S2Oj) - c3(Na2S2OJ), (5.13)
где 1'(Ь) — объем пробы исходного раствора, мл; I'iNajS/)-,) — объем титран-
та в точке эквивалентности, мт, c,(l2), c3(Na2S2Oj) — молярные концентрации
эквивалентов растворов йода и тиосульфата соответственно
Молярная концентрация оттитрованного йода будет равна с(|2) -
= 0,5сэ(12), т.к. эквивалентное число йода 2.
Необходимо учесть, что определяемая титрованием концентрация
йода С|2, складывается из равновесной концентрации йода С|2фаън
и того количества, которое образуется за счет сдвига равновесия (5.9)
влево при прибавлении титранта. Согласно стехиометрии реакции
(5.9) общая молярная концентрация оттитрованного йода будет равна.
=cW3»H+0-5cHio + 0-5cr. (5.14)
Учитывая, что равновесные концентрации компонентов правой ча-
сти равновесия равны между собой сн, =^ню=сг, равновесная кон-
центрация йода в системе (5.9) равна:
(5.15)
110» ОБЩАЯ ХИМИЯ-ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Подставляя выражения (5.11) и (5.15) в выражение (5.10), полу-
чим формулу для расчета константы равновесия по измеренному
значению pH:
Экспериментальная часть
Оборудование: фотоколориметр, pH-метр, химический стакан
на 50 мл, конические колбы на 50, 100 мл — 3 шт., пипетка на 20 мл,
бюретка.
Реактивы: раствор сэ = 10_J моль/л йода 12 в воде, раствор сэ =
= 0,01 моль/л тиосульфата натрия NajSjOj, раствор 0,03*4 крахмала
Ход работы
1. Отберите в химический стакан -30—40 мл раствора йода и опре-
делите значение водородного показателя (pH) с помощью pH-метра,
как описано в разделе 1.4. Результат запишите в ст. 2 табл. 5.2.
2. Внесите пипеткой в коническую колбу 20 мл раствора йода.
3. Заполните бюретку раствором тиосульфата натрия и приведите
ее в рабочее положение (рис. 1.23).
4. Начните титрование. Когда раствор приобретет бледно желтую-
окраску, добавьте 2—3 капли раствора крахмала.
5. Титруйте до исчезновения синей окраски. Запишите объем тио-
сульфата pNa,s2O3. пошедший на титрование, в табл. 5.2.
6. Повторите титрование еще два раза. Первое титрование являет-
ся прикидочным. При втором и третьем титровании проводите более
точное титрование вблизи точки эквивалентности (точка изменения
цвета раствора). Результаты титрования не должны отличаться друг
от друга более чем на 0,1 мл.
7. Приготовьте раствор йода, разбавленный по сравнению с исход-
ным в пять раз.
8. Проделайте аналогичные действия п. 3—5 для разбавленного
раствора йода.
9. Вылейте содержимое стакана и колбы в отведенную посуду
и промойте их дистиллированной водой
Обработка экспериментальных данных
1. Сформируйте табл. 5.2 опытных и расчетных данных, как пока-
зано ниже.
Глава 5. Химическое равновесие • 111
2. Запишите в ст. 4 табл. 5.2 результаты трех титрований и рассчи-
тайте их среднее значение.
3. Рассчитайте по формуле (5.11) концентрацию и запишите
в ст. 3 табл. 5.2.
4. Рассчитайте по закону эквивалентов (5.13) концентрацию отти-
трованного иола сь и запишите в ст. 5 табл. 5.2.
5. Рассчитайте равновесную концентрацию йода «\.равн по форму-
ле (5.15) и запишите в ст. 6 табл. 5.2.
6. Рассчитайте константу равновесия системы йод — вода
по формуле (5.16) и запишите в ст. 7 табл. 5.2.
7. Рассчитайте энергию Гиббса реакции по уравнению (5.6) и тео-
ретическое значение. Сравните полученные значения
8. Сделайте вывод по полученным значениям константы равнове-
сия и энергии Гиббса.
Экспериментальная часть с использованием
цифровой лаборатории
В учебных лабораториях по общей химии практически отсутству-
ют фотоколориметры, которые обычно используются в лабораториях
по физической химии. Использование таких приборов для студентов
первого курса достаточно затруднительно. Применяемые в цифровой
лаборатории датчики оптической плотности (рис. 1.13) компактны,
удобны и не требуют особых навыков в эксплуатации. Точка эквива-
лентности определяется не визуально, как это делается в традицион-
ном варианте, а фиксируется на компьютере в табличном и графи-
ческом виде. Добавление титранта в колбу происходит с помощью
112» ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
датчика жидкого реагента, а компьютерная программа записывает
зависимость изменения величины оптической плотности раствора
от объема добавленного реагента.
Оборудование: компьютер, датчик оптической плотности 595 нм,
кювета, магнитная мешалка, датчик объема жидкого реагента,
шприц (10 мл), датчик pH, штатив химический, штатив для элек-
тродов.
Реактивы: раствор cs = 10_J моль/л йода 12 в воде, раствор с., =
= 0,01 моль/л тиосульфата натрия NajSjCh. раствор О.ОЗ^с крахмала
Ход работы
1. Поставьте кювету на магнитную мешалку и налейте в нее 80 мл
раствора йода.
2. Снимите с датчика pH защитный колпачок и поместиie в стакан
с дистиллированной водой.
3. Подключите датчик pH к компьютеру.
4. Включите компьютер и запустите программу «Практикум».
5. Опустите датчик pH в кювету и определите pH. которое запиши-
те в ст. 2 табл. 5.2.
6. Выключите программу и уберите из раствора датчик pH. Спо-
лосните его дистиллированной водой, промокните фильтровальной
бумагой и закройте колпачком.
7. Соберите установку, как показано на рис. 1.20.
8. Заполните шприц раствором титранта — тиосульфатом натрия
и заправьте его в датчик объема жидкого реагента так, чтобы толкатель
вплотную подходил к поршню шприца. (Появившуюся каплю на кон-
це иглы уберите фильтровальной бумагой.) Настройте датчик объема
жидкого реагента так, чтобы шприц находился примерно по центру
кюветы.
9. Подключите к компьютеру через LJSB-порт датчики оптиче-
ской плотности и объема жидкого peaieHTa. Включите перемеши-
вание.
10. Включите компьютер и запустите программу «Практикум». П о-
сле обнаружения программой датчиков на экране появятся два шабло-
на графиков: зависимость оптической плотности от времени и объема
добавленного реагента от времени. Обнулите датчик нажатием кнопки
«Настройка». В окне измерений выберите режим «Зависимость одного
от другого по нажатию», при этом появляется шаблон графика, ото-
бражающий зависимость текущего значения оптической плотности
от объема добавленного реагента.
Глава 5. Химическое равновесие «113
11. Установите пределы измерений по абсциссе X — (0—12) мл,
по ординате Y— (0—1).
12. Начните измерение и зафиксируйте первую ючку клавишей
«Пробел», которая будет соответствовать И= 0 мл. Вращая колесико
датчика жидкого реагента, добавляйте из шприца раствор. После до-
бавления каждой порции и стабилизации и показания датчика отме-
чайте точку клавишей «Пробел». Добавляйте раствор, пока не будет
израсходован весь объем шприца или значение оптической плотности
не достигнет 1.
13. Остановите измерение. Выключите магнитную мешалку.
14. Сохраните результаты, экспортируя графические и табличные
данные во внешний файл папки « Равновесие».
15. Быстро вылейте раствор йода в специальную емкость, сполос-
ните кювету дистиллированной водой и протрите фильтровальной бу-
магой.
16. Повторите титрование еще два раза. Первое титрование явля-
ется прикидочным. При втором и третьем титровании проводите бо-
лее точное титрование вблизи точки эквивалентности (точка измене-
ния цвета раствора). Результаты титрования должны отличаться друг
от друга не более чем на 0,1 мл.
17. Приготовьте раствор йода, разбавленный по сравнению с ис-
ходным в пять раз.
18. Проделайте аналогичные действия п. 1—16 для разбавленного
раствора йода.
Обработка экспериментальных данных
1. Сформируйте табл. 5.2 опытных и расчетных данных, как пока-
зано в традиционном варианте.
2. Откройте файлы с результатами измерений. В каждом файле
содержатся два столбца. В первом — объем титранта, мл, во втором —
значения оптической плотности при этом объеме.
3. Постройте графики зависимости D = f(V). Группу точек
до и после перегиба аппроксимируйте прямыми. Определите объем
титранта соответствующий точке пересечения прямых (эк-
вивалентности).
4. Запишите в ст. 4 табл. 5.2 результаты трех титрований для двух
концентраций йода и рассчитайте их среднее значение.
5. Далее делайте обработку данных в соответствии с п. 5—10 тради-
ционного варианта.
114 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 13. Определение константы
нестойкости комплекса
меди(И) и его состава
Цель работы: исследование термодинамики процесса комплексоо-
бразования методом колориметрии.
Теоретическая часть
Комплексные соединения меди — это окрашенные соединения,
поэтому для их изучения хорошо подходит колориметрический метод,
основы которою изложены в опыте 3 лабораюрной работы 1.
Для определения состава окрашенного комплексного соединения
применяется метод изомолярных растворов. Для комплексных соеди-
нений изомолярными называются растворы, содержащие разное
мольное соотношение комплексообразователя (пА) и лиганда (пв),
но постоянную молярную (суммарную) концентрацию компонентов.
На рис. 5.1 показана зависимость оптической плотности D окрашен-
ных изомолярных растворов от мольной доли лиганда NB =-----—
при образовании комплекса состава АВ?. Па Пв
Рис. 5.1. Зависимость оптической плотности изомолярных
растворов от мольной доли лиганда
Экспериментальная зависимость представляет собой плавную кри-
вую (кривая 1) с размытым максимумом. Такой характер обусловлен
частичной диссоциацией в растворе внутренней сферы многих ком-
плексов. Если провести две касательные к обеим сторонам экспери-
Глава 5. Химическое равновесие «115
ментальной кривой, то получим теоретическую зависимость (кри-
вая 2) без учета диссоциации комплекса.
Максимум на кривых зависимости D =f(NB) сиитветсгвуе! стехио-
метрическому составу комплекса. Например, если максимум отвечает
NB — 0,8, то мольное отношение компонентов пА1пв можно рассчитать
следующим образом: NB = пв/(пА + ив) = 0,8, тогда пв = 0,8(и^ + пв),
откуда пА/пв — 0,2/0,8, т.е. в комплексе nA/nB = 1/4 и, соответственно,
состав комплекса — ЛВ4.
Определив по графику разницу значений максимумов =
- ~ теоретической и практической оптической плотности,
можно рассчитать степень диссоциации комплекса, которая равна от-
ношению той части концентрации комплекса, которая распалась
на составные части, к его обшей концентрации
Процесс распада (диссоциации) комплекса на составные части яв-
ляется равновесным и выражается уравнением: |Cu(NH3)4]2+ <=* Си2+ +
+ 4NH3.
По закону Бугера — Ламберта — Бера оптическая плотность
окрашенного раствора пропорциональна его концентрации, сле-
довательно, степень диссоциации (а) комплекса можно рассчитать
по формуле
Если известны общие концентрации исходных компонентов
сс(Си2+) и c0(NH3) при образовании комплекса Cu2+ + 4NH3 >
—» |Cu(NHi)4]2+, то исходная концентрация самого комплекса, соглас-
но стехиометрии, будетe0(|Cu(NH3)4]2+) = c0(Cu2+) — ^с0 (NH3).
Константа равновесия процесса диссоциации комплекса называет-
ся константой несюйкости комплекса и выражается:
c(Cu2+)-c4(NH3)
c([Cu(NH3)4]2+) ’
(5.18)
где <?[Cu(NH,)4] . tlCu2*) и dNH>) — относительные равновесные
концентрации компонентов.
Зная степень диссоциации, можно рассчитать константу равнове-
сия. Для этого составим таблицу материального баланса:
116 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
конц. [Cu(NHj)4]2+ КОНЦ. Cu2+ конц. NH3
С1К\ си(Си2+)или — c0(NHs) C fl
Дс a-c0(Cu2+) или — cu(NH}) a a.-c0(Cu2+) a-Cu(NH3)
Сравн cu(Cu2+) — a C(j(Cu2+) или |cn(NH,)-Lv,(NH,) a a c0(Cu2+) a-CjINHj)
Подставим в выражение константы значения равновесных концен-
траций компонентов ср!18„:
к _Г(Сиг<)ё(МН»)* _.i r,«ii*'M7,.,)‘lMli)_
(?(|Cii<Mt,)„f') <i(Cuz*>-<x^(Cuz*)
» r„<Cn' ) (arcr(NH3)
' (t,,(MI,)-' <„„(NIt,)
4 4
После преобразований константа равновесия приобретает вид:
_as-(e0)’(NHJ)_a5 c0(Cuz+)-(c0)J(NH3)
лн — , - I -
1-0. .
Определив экспериментально степень диссоциации комплекса
по (5.16) и зная общие концентрации комплексообразователя и ли-
ганда, можно рассчитать константу равновесия К„ по уравнению
(5.18).
Исходя из уравнения (5.6), можно рассчитать энергию Гиббса об-
разования комплекса:
ДХ7° = -/?ЛпК, (5.20)
где К= \/К„ — константа устойчивости комплекса
Вопросы и задачи для самоконтроля
1. Какие растворы называются изомолярными?
2. Как соотносятся константа нестойкости и константа устойчиво-
сти комплексов?
3. Напишите диссоциацию комплекса [Cu(NH3)4]24 по ступеням.
Если известны константы равновесия каждой ступени
то чему равна константа суммарного уравнения?
Глава 5. Химическое равновесие «117
4. Как будет изменяться константа нестойкости комплекса с уве-
личением температуры, если процесс комплексообразования
экзотермический?
5. Рассчитайте концентрацию ионов меди Си2+ в 0,01 М раство-
ре комплекса fCu(NH3)4|2+, если константа нестойкости равна
2,14-10-13.
Экспериментальная часть
Данная работа выполняется идентично как традиционными ме-
тодами, так и с применением цифровой лаборатории с тем отличи-
ем, что в традиционном варианте используется фотоколориметр,
а в цифровом — датчик оптической плотности, подключенный
к компьютеру.
Оборудование: компьютер, светодиодная линейка, датчик оптиче-
ской пло|ности, кювета, магнитная мешалка, бюретка — 2 шъ, мерная
колба на 100 мл — 11 шт.
Реактивы: растворы: 0,05 М и 0,1 М нитрата меди Cu(NO3)2; 0,1 М
этилендиамина (Еп)
NH,-CH2-CH,-NH,
Ход работы
1. Подберите датчик оптической плотности для колориметриче-
ских измерений. Порядок действий по подбору датчика подробно опи-
сан в работе 1 опыт 3. В качестве фонового раствора для данной работы
возьмите 50 мл 0,1 М раствора Еп и 50 мл 0,05 М раствора нитрата меди
Cu(NO3)2.
2. Вылейте раствор из кюветы, промойте ее дистиллированной во-
дой и вытрите фильтровальной бумагой.
3. Заправьте две бюретки растворами. В первую бюретку налейте
0,05 М раствора нитрата меди Cu(NO3)2, во вторую - 0.1 М раствора
Еп и приведите бюретки в рабочее положение.
4. Приготовьте серию изомолярных растворов, содержащих нитрат
меди Cu(NO3)2 и ЭДА, общей концентрацией 0,1 моль/л в соответ-
ствии с указаниями столбцов 2 и 3 табл. 5.3.
Для приготовления растворов № 2—10 возьмите мерную колбу
на 100 мл, добавьте из бюретки объем 0,1 М раствора Cu(NO3)2, ука-
занный в ст. 2 табл. 5.3, и доведите до метки 0,1 М раствором Еп из вто-
рой бюретки, хорошо перемешайте.
118* ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 5.3
№ раствора И0,1М Cu(NOjh. мл И0.1 М Еп, мл Ав> мольная доля лиганда
1 2 3 4
— 100 1.0
2 10 90 0,9
3 20 80 0,8
4 30 70 0.7
5 40 60 0.6
6 50 50 0.5
7 60 40 0,4
8 70 30 0.3
9 80 20 0,2
10 90 10 0,1
11 100 — 0,0
5. Наденьте на кювету датчик оптической плотности и вылейте
в нее 100 мл раствора № 1.
6. Подключите датчик оптической плотности через LJSB-порт
к компьютеру.
7. Включите компьютер и запустите программу «Практикум».
8. После обнаружения программой датчика оптической плотности
на экране появится шаблон графика «Зависимость оптической плот-
ности от времени». Установите параметры измерений по абсциссе X—
(0—200) сек. по ординате Y — (0—1).
9. Обнулите датчик оптической плотности, нажав кнопку «На-
стройка» в окне эксперимента и включите измерение.
10. Остановите измерение, когда значение оптической плотности
стабилизируется.
11. Нажмите кнопку «Экспортировать данные во внешний файл».
Выберите место сохранения файла, например создайте папку «Кон-
станта нестойкости».
12. Вылейте содержимое кюветы, промойте ее дистиллированной
водой и протрите фильтровальной бумагой.
13. Проделайте аналогичные действия п. 4—12 для растворов
№ 2-11.
Обработка экспериментальных данных
1. Откройте файлы с результатами измерений и сформируйте
табл. 5.4, как показано ниже.
Глава 5. Химическое равновесие «119
Таблица 5-4
№ Ns, мольная доля лиганда D е0(Еп), моль/л
1 2 3 4
1 1.0
2 0,9
3 0,8
4 0,7
5 0.6
6 0.5
7 0,4
8 0,3
9 0,2
10 0,1
11 0,0
2. Рассчитайте исходную общую концентрацию лиганда для каж-
дого раствора по формуле
гдеяЭДА— Сддд- Гэдд, —0,1 л; сЭдд—0,1 моль/л.
3. Постройте график зависимости оптической плотности изомо-
лярных растворов от мольной доли лиганда. Проведите касательные
к правой и левой частям экспериментальной кривой до их пересече-
ния. Определите по абсциссе значение мольной доли лиганда (Л'™’’),
соответствующее максимуму кривой (см. рис. 5.1), по ординате опре-
делите максимальные значения теоретической и практической опти-
ческой плотности и
4. Определите состав комплекса (см. пример в теоретической ча-
сти работы) Чему равно координационное число’ Какова дентатность
лиганда?
5. Рассчитайте степень диссоциации комплекса по формуле (5.17).
6. Выведите формулу для выражения константы нестойкости най-
денного комплекса через степень диссоциации а и общие концентра-
ции Сц лиганда и комплексообразователя (см. пример в теоретической
части работы).
7. Рассчитайте константу нестойкости комплекса К„ и сравните
с табличным значением.
120 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
8. Рассчитайте абсолютную и относительную ошибки определе-
ния К„.
9. Рассчитайте изменение энергии Гиббса в процессе образования
комплекса по формуле (5.20) и сделайте вывод.
Работа 14. Адсорбционное равновесие
Цель работы: изучение адсорбции органических веществ на акти-
вированном угле и применимости изотермы Лэнгмюра.
Теоретическая часть
Процесс поглощения одного вещества другим называется сорбцией.
Различают абсорбцию — поглощение вещества всем объемом другого ве-
щества (гомогенный процесс), и адсорбцию — изменение концентрации
вещества на границе раздела фаз по сравнению с объемом (гетероген-
ный процесс). Процесс, обратный адсорбции, называется десорбцией.
Вещество, способное поглощать, адсорбировать другое вещество
своей поверхностью, называется адсорбентом', вещество, которое мо-
жет адсорбироваться, — адсорбтиеом, уже адсорбированное вещество
называется адсорбатом
Адсорбция обозначается буквой Г и имеет размерность моль/м2
или моль/г. т.е. единицей измерения адсорбции является количество
поглощенного вещества (моль), отнесенное к единице площади по-
верхности (м2) или массе (г) адсорбента.
В зависимости от природы сил взаимодействия адсорбата с адсор-
бентом различают физическую и химическую адсорбцию, но провести
четкую грань между ними достаточно трудно. Химическая адсорбция
(хемосорбция) — поглощение вещества твердыми или жидкими по-
глотителями, сопровождающееся образованием химических соедине-
ний. Например, адсорбция углекислого газа на поверхности гидрокси-
да кальция:
СО2 г + Са(ОН)2 к -> СаСОз к + Н,Ож.
Физическая адсорбция обусловлена силами межмолекулярного вза-
имодействия, относится к обратимым процессам и характеризуется
теплотой адсорбции Q < (30 ч- 40) кДж/моль. Если Q > 40 кДж/моль,
говорят о химической адсорбции.
Процесс сорбции является самопроизвольным AajlG < 0. Измене-
ние энтропии отрицательно при физической адсорбции, т.к. проис-
ходит упорядочение адсорбированных частиц на поверхности адсор-
Глава 5. Химическое равновесие «121
бента, но при хемосорбции может быть и положительным. Поэтому
энтальпия Д.исЯ физической адсорбции всегда отрицательна, а хими-
ческой — может быть и положительна.
Когда скорости адсорбции и десорбции становятся равными, на-
ступает равновесие.
Зависимость адсорбции от концентрации (давления) адсорбтива из-
учается при постоянстве температуры и поэтому носит название изо-
термы адсорбции'. Г = Др)т = const, Г = /(с)т = const. Графический вид
изотермы адсорбции представлен на рис. 5.2а. Как видно из рис. 5.2«,
в области малых концентраций наблюдается прямая пропорциональ-
ность (участок I), при дальнейшем увеличении концентрации адсорбти-
ва адсорбция увеличивается, но уже в меньшей степени (участок II). При
больших концентрациях кривая переходит в прямую, параллельную оси
абсцисс (участок III). Такой вид кривой обусловлен постепенным на-
сыщением поверхности адсорбента ддсорбтивом. С момента полного
насыщения (Г — Г, — участок III) увеличение концентрации на количе-
ство адсорбированного вещества уже не влияет. Величина Г, называется
предельной адсорбцией (момент полного насыщения поверхности).
Рис. 5.2. Зависимость*
а — адсорбции от равновесней концентрации адсорбата, б — обратной
величины адсорбции от обратной величины равновесной концентрации
Простейшее уравнение изотермы было выведено Лэнгмюром
для процесса монослойной адсорбции на поверхности твердого тела
в предположении, что все адсорбционные центры энергетически од-
нородны и равномерно распределены по поверхности. Уравнение изо-
термы Ленгмюра имеет вид:
(5.21)
где Г. — предельная адсорбция, то есть адсорбция при максимальном моно-
слойном заполнении поверхности адсорбента (емкость монос.зоя), е(р) — рав-
122 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
новесная концентрация (парциальное давление) адсорбата; А”а,с - константа
адсорбционного равновесия, характеризует поверхностную активность ад-
сорбата.
В случае монослойной адсорбции удобно использовать величину,
называемую степенью заполнения поверхности (0), которая определя-
ется как отношение адсорбции при данной концентрации (давлении)
к предельной адсорбции Г/Г„ = 0, т.е. можно считать, что 0 — это
мольная доля заполненных центров адсорбции. Тогда уравнение (5.21)
может быть преобразовано следующим образом:
Из формул (5.21) и (5.22) следует, что при малых концентра-
циях (парциальных давлениях) с(р) —> 0 адсорбция и шепень за-
полнения прямо пропорциональны концентрации (парциальному
давлению):
Г = САГа1Л.-е; Г = Г^-р; (5.23)
0-^-с; 0 = Л\,с-р. (5.24)
При высоких концентрациях (парциальных давлениях) е(р) —* ос,
когда К.^ - с » 1, наступает насыщение адсорбционного слоя и Г = Г»,
0=1. Аналогичные выводы были сделаны и при анализе изотермы
(рис. 5.2а). Величины Г.,, и К:ж зависят от природы адсорбата и адсор-
бента и от температуры. Поскольку физическая адсорбция — экзотер-
мический процесс, при увеличении температуры константа адсорб-
ционного равновесия уменьшается. Таким образом, вещество можно
адсорбировать при невысокой температуре и десорбировать при более
низкой температуре.
Уравнение (5.21) можно записать как линейное соотношение меж-
ду обратными величинами
Так как — и ———--------константы, то в координатах 1/Г, 1/еравн
Г Г . Ч
функция (5.25) имеет вид линейной зависимости (рис. 5.26). При этом
1
отрезок, отсекаемый прямой на оси ординат, равен величине р— от-
куда можно рассчитать значение предельной адсорбции Г„.
Глава 5. Химическое равновесие • 123
Рассчитав из графика тангенс угла наклона прямой как отношение
b/а (рис 5.26), можно определить константу адсорбционного равно-
весия Кя :
Зная параметры адсорбционного равновесия, можно оценить вели-
чину адсорбции для любой концентрации адсорбата
В настоящей работе адсорбцию определяют по разности молярных
концентраций адсорбата (органической кислоты) до и после его ад-
сорбции на активированном угле. Величину адсорбции рассчитывают
в молях на единицу массы адсорбента. Молярную концентрацию орга-
нической кислоты в растворе определяют методом титрования.
Вопросы и задачи для самоконтроля
1. Что называют адсорбцией, десорбцией?
2. Какова природа сил, вызывающих физическую и химическую
адсорбцию?
3. Теплота адсорбции аммиака на порошке железа составляет 71,1
кДж/моль. Рассчитайте, сколько теплоты выделится при погло-
щении порошком железа 5,6 л аммиака (н.у.).
4. Покажите графически зависимость степени заполнения поверх-
ности угля от равновесной концентрации уксусной кислоты
6 =/(<?равн)
5. Рассчитайте по уравнению Лэнгмюра величину адсорбции уксус-
ной кислоты (CHjCOOH) активированным углем (Г, моль/м3),
если константа адсорбции Ка — 2,5 10-4 м3/моль, адсорбция при
максимальном заполнении Гк = 10-4 моль/м3, равновесная кон-
центрация адсорбата с = 103 моль/м3.
6. Как экспериментально можно показать, что адсорбция уксусной
кислоты на активированном угле является физической? Уменьшит-
ся или увеличится такая адсорбция с повышением температуры?
7. Рассчитайте степень заполнения поверхности адсорбента
молекулами адсорбата, равновесная концентрация которо-
го е = 10-5 моль/л. Константа адсорбционного равновесия
~ 100 м3/моль.
Экспериментальная часть
Оборудование: технохимическиевесы, коническая колба на 100 мл —
4 шт., коническая колба на 50 мл — 1 шт, мерный цилиндр на 50 мл,
мерная пипетка на 10 мл.
124 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Реактивы', активированный уголь, четыре раствора уксусной кис-
лоты СН3СООН разных концентраций, раствор сэ = 0,1 моль/л NaOH.
Ход работы
1. Взвесьте по 1 г четыре раза активированного угля и внесите на-
вески в чистые сухие колбы. Пронумеруйте колбы.
2. Влейте в колбы мерным цилиндром по 50 мл раствора уксусной кис-
лоты: в первую колбу — раствор 1, во вторую — раствор 2 и тд. Продол-
жительность контакта угля с раствором кислоты -15—20 минут. Периоди-
чески взбалтывайте содержимое колб для ускорения процесса адсорбции.
3. Отберите пипеткой /0 мл раствора / уксусной кислоты в кониче-
скую колбу и добавьте 1—2 капли фенолфталеина.
4. Заполните бюретку раствором NaOH до нулевого деления
(рис. 1.20).
5. Начинайте титрование, для чего приливайте из бюретки по ка-
плям раствор щелочи в кислоту до тех пор. пока от одной капли избыт-
ка раствора щелочи анализируемый раствор не окрасится в розовый
цвет, не исчезающий при перемешивании. Результат титрования Уош
запишите в табл. 5.5.
6. Повторите титрование. Результаты двух титрований не должны
отличаться друг от друга более чем на 0,1 мл.
7. Аналогично проанализируйте исходные растворы 2, 3 и 4 и ре-
зультаты титрования Уош внесите в табл. 5.5.
8. Через 20—25 минут после начала адсорбции отфильтруйте рас-
творы через бумажный фильтр в конические колбы.
9. Отберите пипеткой 10 мл фильтрата / в коническую колбу и до-
бавьте 1—2 капли фенолфталеина и повторите действия п. 4—7. Ре-
зультаты титрования Уш запишите в табл. 5.5.
Обработка экспериментальных данных
1. По результатам титрования сформируйте таблицу 5.5, как пока-
зано ниже.
Таблица 5.5
№ титро- вания 1 колба 2 колба 3 колба 4 колба
КГ до ад- сорб- по- сле ад- ИГ ДО ад- сорб- К, по- сле ад- ИГ до ад- сорб- Кц по- сле ад- КГ до ад- сорб- Кц по- сле ад-
1
2
Глава 5. Химическое равновесие «125
Окончание
№ титро- вания 1 колба 2 колба 3 колба 4 колба
КГ до ад- сорб- Кц по- сле ад- КГ* до ад- сорб- ции Уш по- сле ад- сорб- ции КГ ДО ад- сорб- Ущ по- сле ад- КГ до ад- сорб- Ущ по- сле ад-
3
3. Рассчитайте молярную концентрацию растворов уксусной кисло-
ты до адсорбции Cps и после адсорбции е*раон по закону эквивалентов
сщ.р'щ=ск Кк
где с?1, с‘ —молярные концентрации эквивалентов растворов щелочи и кис-
лоты, =0,1 моль/л; Уш, Ук — объемы растворов щелочи и кислоты,
Уц =Рк=10 мл (эквивалентное число для NaOH и CHjCOOH равно Z= 1,
и, следовательно, с(растворов) = еэ(растворов)).
4. Рассчитайте число молей кислоты в объеме колбы (50 мл) до ад-
сорбции (л0) и после адсорбции (и).
5. Рассчитайте величину адсорбции Г = (п0 — п)/т, моль/г, где
т = 1 г.
6. Рассчитайте значения обратных величин концентраций 1/с,
моль — 1 л и адсорбции 1/Г.
7. Постройте два графика зависимости адсорбции от концентра-
ции СНЗСООН в растворе в координатах: 1) Г — с; 2) 1/Г — 1/с.
8. Из второго графика определите величину 1 /Гос (см. теоретическую
часть работы) и рассчитайте максимальное значение адсорбции Гео.
126 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
9. Рассчитайте константу адсорбционного равновесия КлЛ по урав-
нению (5.26).
10. Рассчитайте энергию Гиббса процесса адсорбции и сделайте
выводы.
11. Рассчитайте степень заполнения поверхности адсорбата для
каждой концентрации по формуле Г/Гх = 0 и покажите графически
зависимость степени заполнения поверхности угля от равновесной
концентрации уксусной кислоты в = /(срав„).
12. Сделайте вывод, насколько хорошо можно описать процесс ад-
сорбции предложенной кислоты изотермой Лэнгмюра.
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, электронные весы, датчик электропро-
водности, датчик объема жидкого реагента, шприц на 10 мл, магнит-
ная мешалка, штатив химический, стакан химическй на 100 мл — 5 шт.,
мерный цилиндр, бюретка, мерная колба на 100 мл— 5 шт.
Реактивы: активированный уголь, растворы органических кислот.
0,2 М раствор NaOH, раствор фенолфталеина, дистиллированная вода.
Ход работы
1. Получите у преподавателя один из вариантов задания табл. 5.7.
Таблица 5.7
№ ва- рианта Кислота Исходная концен- трация, сэ, моль/л
1 Уксусная кислота CHiCOOH 1.0
2 Муравьиная кислота НСООН 1.0
3 (Ацетил) салициловая кислота С6Н4(ОН)СООН 0,1
2. Приготовьте в мерных колбах на 100 мл пять растворов вы-
данной кислоты различной концентрации из исходного раствора.
Для этого рассчитайте по закону эквивалентов сЭ| - = с.л • V2 объем
(Кк.1Ы = Г'|) исходного раствора кислоты е.„ необходимый для приго-
товления V2 — 100 мл кислоты концентраций, указанных в табл. 5.8
Запишите рассчитанный объем К ш в табл. 5.8. Отмерьте в мерную
колбу (100 мл) из бюретки рассчитанный объем кислоты. Долейте
дистиллированной воды до метки и, закрыв колбу пробкой, переме-
шайте. Пронумеруйте колбы, начиная с более разбавленного раст-
вора.
Глава 5. Химическое равновесие *127
Таблица 5.8
№ колбы 1 2 3 .J 5
Концентрация кислоты, <£, моль/л 0,025 0,05 0,07 0,10 0,12
KKIU, мл
о, мСм/см, до адсорбции
о, мСм/см, после адсорбции
3. В пяти стаканах на 100 мл взвесьте на весах по 1,0 гактивирован-
ного угля. Обнуляйте показания тары перед каждым взвешиванием.
Пронумеруйте стаканы.
4. Отмерьте цилиндром по 50 мл приготовленных растворов кис-
лоты различной концентрации и вылейте в подготовленные стаканы
с углем: в первый стакан — раствор № 1, во второй — раствор № 2 и т.д.
Содержимое каждого стакана перемешивайте каждые 5 минут. Продол-
жительность контакта угля с раствором кислоты не менее 20—25 минут.
5. Соберите установку для кондуктометрического титрования, как
показано на рис. 1.22.
6. Пока устанавливается адсорбционное равновесие, определите
точную концентрацию приготовленных растворов кислоты кондукто-
метрическим методом (см. раб 1 опыт 4).
Отберите пипеткой в стакан на 50 мл 20 мл раствора № 1, добавьте
1—2 капли фенолфталеина.
7. Поставьте стакан на магнитную мешалку. Закрепите датчик
электропроводности в штативе для электродов и опустите его в стакан
так, чтобы он не касался ни дна, ни стенок
8. Заполните шприц NaOH. вставьте его в датчик объема жидкою
реагента так, чтобы толкатель датчика подходил к поршню шприца,
а игла шприца была направлена в стакан.
9. Подключите датчики электропроводности и объема жидкого ре-
агента к USB-разъемам компьютера.
10. Включите компьютер и запустите программу «Практикум#».
Убедитесь, что программа идентифицировала датчики, после чего
в окне измерений выберите режим «Зависимость одного от другого
по нажатию#». На экране должен появиться шаблон графика «Электро-
проводность — объем раствора».
11. Установите пределы измерений по абсциссе X — (0—10) мл,
по ординате Y — (0— 1) мСм • см-1
12. Начните измерение. Клавишей «Пробел» нанесите первую точ-
ку на график, которая будет соответствовать электрической проводи-
мости раствора при нулевом объеме щелочи.
128 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
13. Добавляйте по 0,2—0,5 мл NaOH из шприца, каждый раз от-
мечая новую точку клавишей «Пробел» после стабилизации значения.
Наблюдайте за окраской раствора. Продолжай ie измерение до пере-
лома на графике (точки эквивалентности) и начала подъема электро-
проводности. Убедитесь, что перегиб на графике совпал с изменением
цвета индикатора и образованием устойчивой малиновой окраски рас-
твора. Нанесите еше 5—6 точек на график после начала перелома.
14. Остановите измерение и сохрани ie результаты в соответствую-
щем файле.
15. Вылейте оттитрованный раствор, сполосните стакан и повто-
рите титрование еще раз, выполняя п. 8—14. Старайтесь в районе точ-
ки эквивалентности наносить точки на график более часто. Результаты
титрований не должны отличаться более чем на 0,1 мл.
16. Аналогично (п. 6—15) проанализируйте исходные растворы
№ 2-5.
17. Через 20—25 минут после начала адсорбции отфильтруйте рас-
творы через бумажный фильтр в чистые сухие стаканы.
18. Отберите пипеткой в стакан на 50 мл 20 мл фильтрата № 1
и измерьте его электропроводность. Подобные действия сделайте
с фильтратами № 2—5. Не забудьте после каждого измерения промы-
вать стакан и щуп датчика электропроводности дистиллированной
водой и вытирать фильтровальной бумагой. Результаты запишите
в таблицу 5.9.
Обработка экспериментальных данных
1. Сформируйте табл. 5.9 результатов титрования исходных раство-
ров кислоты, как показано ниже.
Таблица 5.9
титро-
вания
Объем щелочи пошедший на титрование кислоты, мл
1 колба 1 колба 3 колба 4 колба 5 колба
3
2. Откройте файлы с результатами измерений. В них содержатся
два столбца. В первом — объем титранта (шелочи), мл, во втором —
значения электропроводности при этом объеме.
Глава 5. Химическое равновесие «129
3. Постройте графики зависимости а ~ f(V}. Группу точек (~10)
до и после перегиба аппроксимируйте прямыми линиями. Определите
объем титранта Го“, соответствующий точке пересечения прямых —
точке эквивалентности.
4. Запишите найденные объемы щелочи в табл. 5.9, рассчитайте
среднее значение двух-трех титрований одной концентрации и пере-
несите Росред в ст. 2 табл. 5.10.
Таблица 5.10
Номер колбы мл моль/л моль/з «0. моль моль Г, моль 1/Г, моль
1 2 4 5 6 7 8 9 10
1
2
3
4
5. Рассчитайте точное значение Сц концентрации исходных рас-
творов кислоты по закону эквивалентов
с“-К“*=< Гк.
где С^*, С* — молярные концентрации эквивалентов исходных растворов ще-
лочи и кислоты (е^ = 0,2 моль/л); 1'ш, Гк — объемы растворов щелочи и кис-
лоты (Го* =20 мл).
6. Постройте калибровочный график о =/(<?*) зависимости элек-
тропроводности от концентрации исходных (до опыта) растворов
кислоты.
7. Определите по калибровочному графику концентрации Сравн
растворов № 1—5 после адсорбции, исходя из значений электропро-
водности о этих растворов (см. табл. 5.8). Значения запишите в ст. 5
табл. 5.10.
8. Далее делайте обработку данных в соответствии с п. 3— 11 тради-
ционного варианта.
ГЛАВА
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Теоретическая часть
Скоростью реакции называется количество вещества, изменяю-
щееся в единице реакционного объема (для гомогенной реакции)
или на единице поверхности раздела фаз (для гетерогенной реакции)
в единицу времени.
Различают среднюю и мгновенную скорости реакции. Средняя
скорость реакции равна
оср = ±(с2 - с,)/(т2 - Т]) = + Ас/Ат, (6.1)
где С; и г, - концентрации исходного вещества (продукта) в момент времени
т2 и Т]. Знак минус означает, что концентрация исходного вещества уменьша-
ется, а знак плюс — если определятся скорость по увеличению концентрации
образующихся продуктов реакции
Скорость реакции в данный момент времени, или мгновенная (ис-
тинная) скорость реакции, равна
и = ± dc/dx, |моль-м-1-с_|], [моль-л 1 - с '|. (6.2)
Зависимость скорости от концентрации реагирующих веществ описы-
вается основным постулатом химической кинетики — законом действую-
щих масс, или основным кинетическим уравнением: скорость химической
реакции в каждый момент времени пропорциональна текущим концен-
трациям реагирующих веществ, возведенным в некоторые степени.
Например, скорость необратимой реакции ЬВ + dD -ь IL + тМ:
v=kxcnBBxcnDD, (6.3)
где к — константа скорости реакции; пв и пи — коэффициенты, называемые
порядками реакции по реагентам Ви D, которые могут быть любыми небольши-
ми числами (целыми или дробными, или, в особых условиях, равными нулю).
Для элементарных реакций (реакций, идущих в одну стадию) по-
рядки реакции по веществам совпадают со стехиометрическими ко-
эффициентами. Сумма порядков реакции по реагентам называется
общим порядком реакции п:
Глава 6. Кинетика химических реакций «131
Константа скорости реакции к не зависит от концентрации реаген-
тов, но зависит от их природы и температуры. При cD = св = 1 моль/л
константа скорости реакции численно равна скорости реакции к — и.
Зависимость концентрации реагента от времени протекания реак-
ции, иначе говоря кинетическая кривая, зависит от порядка реакции
(см. табл. 6.1). Уравнение кинетической кривой получают, разделяя
переменные в кинетическом уравнении и интегрируя левую и правую
часть полученного уравнения. Кинетические зависимости для реак-
ций разных порядков представлены в табл. 6.1.
Таблица 6.1
По- рядок Кинетическое уравнение Уравнение кинетической кривой Координаты графика TO.S
аб- сцисса орди- ната
0 de/dx=к с = с0—кх т с - _1 ’°5-* т
1 dc/dx = ke с = са е-*г, 1пс = 1пс0 — к т Т In с In 2 t0S=-F
2 dcldx = kcl с = !/«' + к т), 1/с= 1/со + А х 1Д 1 1 4i~k се
3 dc!dx = k-<? + 2 * И, - 1/с’ ” 1
Критерием скорости реакции также является время полупревраще-
ния г0 5 — время, за которое концентрация реагента уменьшается вдвое
по сравнению с начальной концентрацией, т.е. с05 = с0/2. Расчетные
формулы времени полупревращения для реакций разных порядков
представлены в таблице 6.1. Как видно из таблицы, для реакции пер-
вого порядка время полупревращения реагента не зависит от его на-
чальной концентрации.
При повышении температуры на 10° скорость большинства хими-
ческих реакций возрастает в 2—4 раза. Это утверждение известно как
правило Вант-Гоффа. Оно применимо к реакциям, протекающим при
невысоких температурах (273—373 К).
(6.4)
где ъц и U2 — скорости реакции при температурах 7'1 и 7j; у — температурный
коэффициент скорости реакции {коэффициент Вант-Гоффа),
132 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
На основании экспериментальных данных показано, что число ак-
тивных частиц, а следовательно, скорость и константа скорости, воз-
растаете температурой по экспоненциальному закону—уравнение Ар-
рениуса:
k = kB-e^IRT\ (6.5)
где к — константа скорости реакции; к0 — предэкспоненциальный множитель;
R — универсальная газовая постоянная (8,3] Дж/моль К); Ег — энергия акти-
вации, постоянная для данной реакции
Уравнение (6.5) можно представить в логарифмическом виде
In к = In к0 — EJ(RT). (6.6)
Графическое изображение уравнения (6.6) приведено на рис. 6.1,
из которого можно рассчитать энергию активации как tga = —
£а/(/?Г)=Д1пА/Д(1/П
1пЛ 1 '
1пА0
Рис. 6.1. Зависимость логарифма константы скорости
реакции от обратной температуры
Если известны скорости (константы скорости) реакции при двух
температурах, то энергию активации можно определить по уравнению*
<6.7,
Катализом называется процесс, в котором изменение скорости
реакции происходит за счет введения дополнительных веществ — ка-
тализаторов (при прочих равных условиях). Существуют гомогенный
и гетерогенный катализ.
Гомогенный катализ — процесс, в котором катализатор и все реаген-
ты находятся в одной фазе (одном агрегатном состоянии). Например,
разложение пероксида водорода существенно ускоряется, если доба-
вить раствор НI:
Н2О2 Н| *' >Н2О+-О2
Глава 6. Кинетика химических реакций «133
Самыми активными катализаторами в растворах являются ионы Н
и ОН .
Гетерогенный катализ — процесс, в котором катализатор и реаген-
ты находятся в разных фазах, и потому процесс происходит на поверх-
ности раздела фаз.
Например, для той же реакции разложения пероксида водорода ка-
тализатором может выступать поверхность металлической платины:
Скорость гетерогенного катализа зависит от площади поверхности
взаимодействия катализатора с реакционной средой.
Катализаторы участвует в реакции, т.е. они с реагентами образуют
промежуточные нестойкие соединения (активированные комплексы),
которые в конце реакции распадаются на продукты и катализатор.
Энергия активации Ея каталитической реакции всегда меньше
энергии активации Еа некаталитической реакции, поэтому скорость
резко увеличивается.
Катализаторы не влияют на изменение энтальпии (ArfT> и энергии
Гиббса (ДХ7) реакции: ЛгСяскг =ArG^t. Исходя из соотношения АХ?0 =
= —RTlnKp, можно сделать вывод, что катализаторы не влияют и на рав-
новесие, они только ускоряют его достижение, т.к. в одинаковое число
раз изменяют как скорость прямой реакции, так и скорость обратной
реакции.
Скорость гомогенного катализа зависит не только от концентрации
реагентов, но и от концентрации катализатора. Поэтому в кинетиче-
ское уравнение включается концентрация и реагентов, и катализатора.
Гомогенные катализаторы достаточно дешевые и доступные, их не-
достатком является то, что они остаются в реакционной среде, откуда
их надо извлекать.
Действие гетерогенных катализаторов сильно зависит от способа
их получения и присутствия других веществ (активаторов, каталити-
ческих ядов). В ходе катализа происходит уменьшение и загрязнение
поверхности катализатора, что является недостатком гетерогенного
катализа.
Вопросы и задачи для самоконтроля
1. От каких факторов зависит скорость реакций?
2. Напишите кинетическое уравнение всего процесса, если меха-
низм реакции NO2 + СО -> NO + СО2 состоит из следующих
стадий:
134 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
1) NO2 + NO2 —» NOj + NO (медленная стадия);
2) NO3 + СО -> NO2 + СО2 (быстрая стадия).
Реакция в растворе метанола С2Н4Вг2 + 3KI = С2Н4 + 2КВг +
+ К13 ускоряется в 3 раза при увеличении концентрации С2Н4Вг2
в 3 раза и в 4 раза при увеличении концентрации К] в 4 раза.
Определите общий порядок реакции и размерность к скорости.
Определите время полупревращения реакции NO2 —> NO + — О3,
если при некоторой температуре ее константа скорости равна
0,037 л/(моль-с), а начальная концентрация NO2 составляла
0.06 моль/л.
Для реакции N2O5 = N2O4 + 0,5О2 при Т = 293 К константа ско-
рости к = 1,72-10-5 с-1, а при Т = 323 К константа скорости
к = 7,59 -10-4 с-1. Рассчитайте энергию активации реакции.
Какое влияние и почему оказывает катализатор на скорость хи-
мической реакции?
Работа 15. Исследование кинетики
гетерогенной химической реакции
Цель работы: изучение скорости гетерогенной реакции взаимодей-
ствия металла с кислотой.
Теоретическая часть
Удельной скоростью гетерогенной реакции называется количество
вещества (v), изменяющееся на единице поверхности (У) раздела фаз
в единицу времени (т):
Скорость реакции взаимодействия металла с кислотой 2Ме +
+ 2хНС1 = 2МеС1т + хН2 зависит от площади поверхности металла
и концентрации реагента. Металл берут в виде проволоки диаметром d
и длиной /, тогда площадь поверхности будет равна: 5 = л - d -I.
О скорости судят по количеству выделяющегося входе реакции во-
дорода vH,. Основное кинетическое уравнение рассматриваемой ре-
акции имеет вид.
где k* = k S.
Глава 6. Кинетика химических реакций • 135
Из графика зависимости vH, = f(x) определяют начальную ско-
рость, вернее, произведение и-5 как тангенс угла наклона прямой.
Имея данные по начальным скоростям реакции при различных исход-
ных концентрациях реагента, из графической зависимости In и =
/(lncK_ld) согласно логарифмическому виду кинетического уравнения
In о = In к1 + т 1пск_Т11, можно определить порядок реакции т по кисло-
те и константу скорости к*.
Опыт 1. Зависимость скорости реакции
от природы реагирующих веществ
Экспериментальная часть
Оборудование: круглодонная колба, эксикатор, пробирка, газоот-
водные трубочки.
Реактивы: растворы 0,1 М уксусной СН3СООН и соляной НС! кис-
лот, кусочки металлического цинка Zn и магния Mg.
Ход работы
I. Получите у преподавателя вариант задания в соответствии
с табл. 6.2.
Таблица 6.2
Вариант Металл Кислота
1 2 3
1 Zn на. снзсоон
2 Mg на, cHjCoon
3 Zn, Mg на
4 Zn, Mg CHjCOOH
2. Соберите прибор для сбора газа над водой, как показано
на рис. 1.9. В кристаллизатор налейте воды; пробирку доверху запол-
ните водой. Закройте отверстие пробирки пальцем и, перевернув ее
вверх дном, опустите в кристаллизатор с водой. Под водой осторожно
откройте пробирку.
3. Укрепите в штативе колбу и налейте в нее на 2 3 4 5/4 объема раствор
кислоты.
4. Промойте водой 2—3 маленьких кусочка металла, вытрите
их фильтровальной бумагой и опустите в колбу с кислотой.
5. Колбу закройте пробкой с отводной трубкой, конец которой
опустите в воду, и подведите под пробирку.
136 » ОБЩАЯ ХИМИЯ-ЛАБОРАТОРНЫЙ ПРАКТИКУМ
6. Запишите время полного заполнения пробирки газом.
7. Вылейте кислоту из колбы, промойте металл и высушите его
фильтровальной бумагой.
8. Проведите аналогичный опыт (п. I—7), налив в колбу раствор
другой кислоты (в соответствии с вариантом), и запишите время пол-
ного заполнения пробирки газом или проведите аналогичный опыт (п.
I—7), но опустите в колбу с кислотой другой металл (в соответствии
с вариантом).
Обработка экспериментальных данных
I. Напишите уравнения проведенных реакции.
2. Сравните время полного заполнения пробирки водородом. Объ-
ясните зависимость скорости выделения газа от природы металла или
кислоты.
Экспериментальная часть с применением
цифровой лаборатории
В традиционном варианте выполнения работы предлагается ка-
чественное исследование зависимости скорости взаимодействия ме-
талла с кислотой от природы реагентов. Выполнение эксперимента
с использованием цифровой лаборатории позволяет с помощью ком-
пьютерной программы сохранить экспериментальные данные в гра-
фическом и цифровом видах на любом электронном носителе и про-
вести дальнейшую количественную обработку экспериментальных
данных или по графикам качественно (наглядно) оценить и сравнить
время выделения одинаковых объемов газа. Появляется возможность
развития эксперимента, например определение порядка реакции
и константы скорости.
Оборудование: электронные весы, компьютер, барометр, датчик
объема газа с контролем
температуры, двухколенная пробирка — пробирка Оствальда,
штангенциркуль.
Реактивы: растворы соляной кислоты НО 3 М для опыта с цинком
и I М для опыта с магнием, навеска Zn - 0,2 г. Mg ~ 0,05 г
Ход работы
1. Взвесьте навеску металла на электронных весах.
2. Рассчитайте площадь поверхности металла.
3. Далее эксперимент для цинка и магния выполняют аналогично
как в работе 4 опыт 1 (вариант с цифровой лабораторией).
Глава 6. Кинетика химических реакций «137
Обработка экспериментальных данных
1. Откроите файлы с результатами измерений. В них содержатся
три столбца: в первом — время, во втором — значения объема выде-
лившегося водорода, в третьем — температура. Выберите 10—15 точек
из всего массива и сформируйте табл. 6.3—6.4), как показано ниже,
для каждого металла. Запишите в ст. 5 табл. 6.3 атмосферное давление
р(Па).
Таблицы 6.3—6.4
^Н,’ моль
р, Па
2. Рассчитайте для выбранных точек по уравнению Менделеева —
Клапейрона pV= vRTколичество выделившегося водорода vHj и за-
несите в ст. 4 табл. 6.3—6.4.
3. Постройте два графика зависимости vHj =/(т) и по тангенсу
Д1’Нг
угла наклона прямой tga=----= и определите начальную скорость
дт
реакции.
4. Сделайте вывод, как зависит скорость реакции от природы ме-
талла.
Опыт 2. Зависимость скорости гетерогенной
реакции от концентрации реагента
Цель опыта'. изучение зависимости скорости гетерогенной реакции
взаимодействия цинка с соляной кислотой Zn + 2НС1 = ZnCl2 + Н2
от концентрации кислоты.
Экспериментальная часть
Оборудование, реактивы, ход работы — все аналогично опыту 1
(цифровой вариант) за исключением того, что проводят три экспери-
мента с одним и тем же металлом (цинком), но с разной концентра-
цией соляной кислоты. В первый раз в пробирку Оствальда наливают
2 М раствор соляной кислоты, второй раз — 2,5 М и третий раз — 3 М
раствор.
138 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
1. Откроите файлы с результатами измерений. В них содержатся
три столбца: в первом — время, во втором — значения объема выде-
лившегося водорода, в третьем — температура. Выберите 10—15 точек
из всего массива и сформируйте три таблицы 6.5—6.7 (для каждой кон-
центрации).
2. Рассчитайте по уравнению Менделеева — Клапейрона pV ~
= vRT количество выделившегося водорода vHi и занесите в ст 4
табл. 6.5—6.7.
Таблицы 6.5—6.7
3. Постройте общий график зависимости vHj = /(т) для трех ис-
ходных концентраций соляной кислоты.
Д»’н.
4. По тангенсу угла наклона tgcc ~ц трех прямых определи-
те скорость и запишите в табл. 6.8.
Таблица 6.8
5. Рассчитайте логарифм начальной концентрации соляной кис-
лоты In св на и логарифм начальной скорости In о.
6. Постройте график зависимости In о = /(lnc0Hci) для кинетиче-
скою уравнения о = к ’с”та, In о ~ In к1 + т In ск та.
7. Определите порядок реакции т по соляной кислоте как тангенс
угла наклона прямой Д(1пи)/Д(1псо) = tga = tn.
8. Определите константу к1 из графика (п. 6) — отрезок на оси ор-
динат отсекаемый прямой.
Обратите внимание, что коне ганта к' зависит от плошади исполь-
зуемого кусочка металла, и поэтому она постоянна только для каждого
отдельного опыта.
Глава 6. Кинетика химических реакций • 139
9. Как зависит скорость исследованной реакции от концентрации НО?
10. Напишите основное кинетическое уравнение для изучаемой
реакции.
Работа 16. Исследование кинетики
гомогенной реакции
Цель работы: изучение влияния изменения концентрации реаген-
тов на скорость гомогенной реакции на примере реакции разложения
тиосерной кислоты:
H2S2O, = SO2 + S + Н2О.
Тиосерная кислота относится к неустойчивым соединениям, и по-
этому для изучения подобных вешесгв необходимо их получать непо-
средственно в ходе эксперимента. Реакция взаимодействия тиосуль-
фата натрия с серной кислотой
Na2S2Oj + H2SO4 - Na2SO4 + H2S,O3,
в результате которой образуется тиосерная кислота H2S,O3, протекает
мгновенно и на общую скорость всего процесса не оказывает влияния.
Для изучения кинетики реакции, а именно общего порядка реакции,
определяю! частные порядки по реа1ентам. Один из способов опреде-
ления частного порядка по реагенту заключается в том, что один из ре-
агентов берется в избытке (в 10 и более раз), и тогда скорость реакции
будет зависеть только от концентрации другого реагента. В данной ра-
боте концентрация серной кислоты берется в избытке и, поэтому ско-
рость реакции будет иметь выражение и = /^т—к cHjS,o, На-
чальная концентрация тиосерной кислоты в реакции соответствует
начальной концентрации тиосульфата натрия.
Признаком реакции является помутнение раствора вследствие об-
разования суспензии серы. Отсчет времени реакции производится
с появлением первых признаков помутнения раствора, т.е. можно счи-
тать, что в каждом опыте происходит одинаковое изменение концен-
трации Ach.Sjo3 ~ const. При таких условиях для расчета скорости ре-
акции можно воспользоваться пропорциональной величиной 1/Лт.
Экспериментальная часть
Оборудование: секундомер, бюретка — 3 шт., пробирка — 3 шт., ко-
ническая колба — 3 шт.
140 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Реактивы: растворы: с.л = 1 моль/л H2SO4, с, = 0,05 моль/л Na2S2O3,
дистиллированная вода.
Ход работы
1. Заполните три бюретки: первую — раствором H2SO4, вторую —
раствором Na2S2O3, третью — водой. Приведите бюретки в рабочее по-
ложение.
2. Налейте в три пробирки из бюретки по 5 мл H2SO4.
3. Налейте из бюреток в три конические колбы: в первую — 5 мл
раствора Na2S2O} и 10 мл воды; во вторую — 10 мл раствора Na2S2O3
и 5 мл воды; в третью — 15 мл раствора Na2S2O3. Пронумеруйте колбы
(см. табл. 6.9).
4. Прилейте в колбу 1 из пробирки 5 мл отмеренного раствора сер-
ной кислоты и одновременно включите секундомер.
5. Помешивая полученную смесь, наблюдайте за появлением пер-
вых признаков помутнения раствора. Отметьте время начала помутне-
ния раствора т, с и результаты запишите в табл. 6.9.
6. Быстро вылейте раствор из колбы и промойте ее дистиллирован-
ной водой.
7. Проделайте аналогичные действия п. 4—6 с колбами 2 и 3. Ре-
зультаты опыта (т, с) внесите в табл. 6.9.
Обработка экспериментальных данных
1. Сформируйте табл. 6.9, как показано ниже
том разведения при сливании растворов, по формуле
где си„ = 0,05 моль/л; = 20 мл; Рна25»о3 — берут из ст. 3 табл. 6.9. Результа-
ты впишите в ст. 6 табл. 6.9.
Глава 6. Кинетика химических реакций • 141
3. Рассчитайте скорость реакции о как 1/Дт и запишите в ст. 8
табл. 6.9.
4. Рассчитайте порядок реакции (я) по тиосерной кислоте, для чего
кинетическое уравнение v = к представьте в логарифмическом
виде inu = In A i «lneHjSjO]. Рассчитайте 1пи как Inl/Дт и lncH1S;Oj.
Значения запишите в ст. 9,10 табл. 6.9. Постройте график зависимости
1п(1/Ат) = /0псн25,О1) Определите порядок реакции по тиосерной
кислоте как л = tga = A(lnl/Ar)/A(lneHjSjO! j.
5. Запишите кинетическое уравнение с учетом найденных кинети-
ческих параметров.
Экспериментальная часть с использованием
цифровой лаборатории
Критерием начала реакции служит появление помутнения раство-
ра вследствие образования суспензии серы. Визуальное определение
времени начала помутнения раствора вносит большую ошибку в ко-
нечный результат. Использование в цифровой лаборатории датчика
мутности позволяет получать непрерывную зависимость мутности
раствора от времени протекания реакции. Увеличение мутности (М]
раствора пропорционально плотности (количеству) суспензии серы,
образующейся в ходе реакции. Скорость реакции будет пропорцио-
АЛ/
нальна---- Мутность измеряют в ЕМ/л (единицы мутности на литр).
Ат
Оборудование: компьютер, датчик мутности (турбидиметр), кювета,
магнитная мешалка, мерный ци-
линдр — 3 шт.
Реактивы: растворы: с, = 1 моль/л
H2SO4, сэ = 0,05 моль/л Na2S2O3, дис-
тиллированная вода.
Ход работы
1. Соберите установку как показа-
но на рис. 6.2.
2. Отберите отдельными цилин-
драми в соответствии с эксперимен-
том № 1 (см. табл. 6.10) 20 мл раство-
ра тиосульфата, 20 мл раствора H2SO4
и 40 мл воды.
142 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
3. Наденьте на кювету датчик мутности и поставьте кювету на маг-
нитную мешалку. Вылейте в кювету раствор тиосульфата и воду. Вклю-
чите мешалку.
4. Подключите датчик мутности к компьютеру. Включите компью-
тер и запустите программу «Практикум»
5. После обнаружения датчика мутности нажмите кнопку «Настро-
ить датчик». Установите пределы измерений по абсциссе X — (0—250)
с, по ординате Y — (0—200) ЕМ/л
6. Начните измерение и быстро вылейте в кювету из цилиндра рас-
твор Na2S2O3. Проводите измерения в течение 3 минут
7. Остановите измерения и выключите магнитную мешалку.
8. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например создайте папку «Скорость».
9. После окончания эксперимента быстро вылейте содержимое
кюветы, промойте ее дистиллированной водой и протрите фильтро-
вальной бумагой.
10. Проделайте аналогичные действия п. 2—9 для опытов 2 и 3
табл. 6.10. Обратите внимание, что в кювету выливают раствор тио-
сульфата и воду, а после включения программы «Практикум» — рас-
твор кислоты
Обработка экспериментальных данных
1. Откройте три файла с результатами измерений, в каждом файле
содержатся два столбца: в первом — время, во втором — значения мут-
ности (Л/).
2. Постройте три графика зависимости мутности (концентрации
образующейся серы) от времени протекания реакции, взяв примерно
10—15 первых точек
3. Определите по каждому графику начальную скорость реакции
онич = dM/dx —hM/hx и запишите в табл. 6.10.
4. Далее обработку продолжают аналогично п. 2, 4 и 5 традицион-
ного варианта обработки данных.
Глава 6. Кинетика химических реакций «143
Работа 17. Определение кинетических
характеристик реакций
колориметрическим методом
Цель работы, изучение зависимости скорости реакции окисления
сульфита натрия йодатом от концентрации реагентов
5Na2SO3 + 2КЮ3 + H,SO4 5Na2SO4 + K,SO4 + I2 + Н2О,
5SO3- + 2IO3 +2Н+—» 5SOJ- + I2+ Н2О.
Определение кинетических характеристик реакции.
Реакция окисления сульфита натрия йодатом относится к слож-
ным реакциям и состоит из нескольких стадий. Образующийся в ходе
исследуемой реакции один из продуктов — йод 12 является окрашен-
ным веществом и, как известно, с раствором крахмала образует соеди-
нение ярко-синего цвета.
Отсчет времени реакции производится от начала сливания раство-
ров до появления синего окрашивания раствора, т.е. можно считать,
что в каждом эксперименте образуется одинаковое количество йода
ДС|2 = const. При таких условиях можно считать, что средняя скорость
реакции пропорциональна величине 1/Дт.
Экспериментальная часть
Оборудование-, секундомер, пробирки, мерные пипетки на 1 мл.
Реактивы-, растворы: 0,01 М сульфита натрия Na2SO3; 0,01 М йода-
та калия К1О3; 0,2 М H2SO4,1% раствор крахмала.
Ход работы
1. Притт овьте три пробирки и пипетками отберите (см. табл. 6.8)
в первую пробирку 2 мл раствора Na2SO3 и 2 капли раствора крахмала;
во вторую — I мл раствора Na2SO3, 2 мл Н,О и 2 капли раствора крах-
мала; в третью — 0,5 мл раствора Na2SO3, 3 мл Н2О и 2 капли раствора
крахмала. Пронумеруйте пробирки
2. Возьмите другие три пробирки. В первую пробирку пипеткои от-
берите 2 мл раствора КЮ3 и 2 мл раствора H2SO4, во вторую — 1 мл
раствора К1О3 и 2 мл раствора H2SO4 и в третью — 0.5 мл раствора КЮ>
и 2 мл раствора H2SO4. Пробирки пронумеруйте.
3. Слейте растворы из двух пробирок под номером № 1 и сразу
включите секундомер.
144 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Измерьте время (т, с) от сливания до появления синего окраши-
вания и запишите в ст. 6 табл. 6.11.
5. Аналогичные действия сделайте с пробирками 2 и 3.
Обработка экспериментальных данных
1. Сформируйте табл .6.11, как показано ниже.
Таблица 6.11
№ про- бирки I'kio,» МЛ 1'Н.О, МЛ Со, моль/л Дт, с 1/Дт, 1пе0 In 1/Дт
1 2 3 4 5 6 7 8 9
1 2,0 2,0 —
2 1,0 1,0 2,0
3 0,5 0,5 3,0
2. Рассчитайте исходные молярные кониентраиии сульфита и йо-
дата после сливания растворов по формуле:
_ Сисх ’^Na,SO,
C<J — '
где смск = 0,01 моль/л; К>Бщ = 6 мл.
3. Рассчитайте скорость окисления как 1/Дт и запишите результа-
ты в ст. 7 табл. 6.11
4. Скорость исследуемой реакции выражается уравнением
v = dcli/dT=kxe^la^Oi xe^ioj- Начальные кониентраиии реагентов
равны, следовательно,
цнач=Ахсол+т,
или
In Онач — In к + (И + ffi)ln Cu.
Рассчитайте значения 1псс и |пинач (1/Дт) и занесите результаты
в таблицу 6.11.
5. Постройте график зависимости In иивч =/(1п с0). Найдите тангенс
угла наклона этой зависимости Д(1пииач)/Д(1пе0) — tga — и + т и опре-
делите общий порядок реакции.
6. Определите по оси ординат величину отрезка, равного In А,
и определите константу скорости.
7. Рассчитайте время полупревращения т0 5. Зависит ли время по-
лупревращения исследованной реакции от исходной концентрации
реагентов?
Глава 6. Кинетика химических реакций «145
8. Как изменяется скорость реакции при увеличении концентра-
ции реагентов? Напишите основное кинетическое уравнение исследо-
ванной реакции с учетом найденных параметров.
Экспериментальная часть с использованием
цифровой лаборатории
По закону Бугера — Ламберта — Бера (см. раздел 1.5) D ~ ехсх.1
оптическая плотностью D раствора прямо пропорциональна концен-
трации вещества, поглощающего свет. Измеряя изменение оптической
плотности раствора во времени, судят об изменении концентрации
окрашенного вещества в ходе реакции и, следовательно, о скорости
d£>
реакции
Изменение оптической плотности в исследуемой реакции проис-
ходит за счет увеличения концентрации продукта реакции (12), имею-
щего окраску красно-бурого цвета.
Оборудование-, компьютер, датчик оптической плотности 525 нм,
шприц на 3 (10) мл, кювета, магнитная мешалка, мерные колбы на 50 мл.
Реактивы-, растворы: 0,01 М сульфита натрия Na2SO3; 0,01 М йода-
та калия КЮ3; 1М H2SO4.
Ход работы
1. Приготовьте исходные растворы сульфита натрия и йодата калия
Для этого возьмите две мерные колбы на 50 мл. Добавьте в первую кол-
бу объем 0,01 М раствор Na2SO3, указанный в ст. 3 табл. 6.12, а во вто-
рую колбу такой же объем 0,01 М раствора К1О3. Доведите дистиллиро-
ванной водой до метки, хорошо перемешайте. Аналогичные действия
сделайте для следующих трех концентраций. Пронумеруйте колбы.
2. Поставьте кювету на магнитную мешалку и наденьте на нее дат-
чик оптической плотности.
3. В кювету налейте по 50 мл обоих реагентов концентрации № 1
и включите перемешивание.
Таблица 6.12
№ колбы (Na2SO3, КЮ3), моль/л I ', мл 0,01 М р-ра
1 2 3
1 0.0025 12,5
2 0.0050 25,0
3 0,0075 37,5
4 0,0100 —
146 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Подключите через USB-разъемы к компьютеру датчик оптической
плотности. Включите компьютер и запустите программу «Практикум».
5. Отберите в шприц 3 мл раствора H2SO4.
6. После обнаружения датчика оптической плотности на экране по-
явится шаблон графика зависимости оптической плотности от времени.
Установите пределы измерений по абсциссе X — (0—300) с, по ор-
динате Y— (0—1).
7. Начните измерение и быстро вылейте в кювету из шприца рас-
твор серной кислоты H2SO4.
8. Следите за изменением оптической плотности во времени. Пре-
кратите измерения, когда оптическая плотность достигнет значения
0,5—0,6.
9. Остановите измерение и выключите магнитную мешалку.
10. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например, создайте папку «Кинетика».
11. После окончания эксперимента быстро вылейте содержимое
кюветы, промойте ее дистиллированной водой и протрите фильтро-
вальной бумагой.
12. Аналогичные действия (п. 1—12) проделайте для концентраций
2—4.
Обработка экспериментальных данных
1. Откройте четыре файла с результа|ами измерений, в каждом со-
держатся два столбца: в первом — время, во втором — значения опти-
ческой плотности (концентрации йода).
2. Постройте четыре линеаризованных графика зависимости оп-
тической плотности (концентрации образующегося йода) от времени
протекания реакции, взяв примерно 10—15 первых точек. Суть коло-
риметрических измерений подробно изложена разделе 1.5.
3. Определите по каждому графику начальную скорость реакции
онач = dD/dx, tsDIЛт = tg а и запишите в табл. 6.13.
4. Далее обработку данных осуществляют аналогично обработке
в традиционном варианте в п. 4—8, за исключением того что рассчи-
танные значения 1пс0 и 1пинач, и занося гея в табл. 6.13
Таблица 6.13
са (Na2SO3, КЮ3)
0.0025
0.0050
0,0075
0.0100
Глава 6. Кинетика химических реакций «147
Работа 18. Зависимость скорости реакции
разложения тиосерной
кислоты от температуры
Цель работы: изучение зависимости скорости реакции от темпе-
ратуры на примере реакции разложения тиосерной кислоты H2S2O3 =
SO2 + S + Н2О. Проверка правила Вант-Гоффа и расчет энергии акти-
вации реакции.
Тиосерную кислоту получают (см. работу 16) непосредственно
в ходе эксперимента по реакции взаимодействия тиосульфата натрия
с серной кислотой Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3. Реакция про-
текает мгновенно, и поэтому концентрация тиосерной кислоты в ре-
акции соответствует концентрации тиосульфата натрия.
Признаком реакции является помутнение раствора вследствие об-
разования суспензии серы. Отсчет времени реакции производится
от момента сливания растворов до появления первых признаков по-
мутнения — образования одного и того же количества суспензии серы,
т.е. можно считать, что в каждом эксперименте разлагается одинако-
вое количество тиосерной кислоты, т.е. ЛСц>5го, = const. При таких ус-
ловиях для расчета скорости реакции можно использовать пропорци-
ональную величину 1/Дт.
Экспериментальная часть
Оборудование: секундомер, три бюретки, три пробирки, три кони-
ческие колбы.
Реактивы: растворы: сэ = 1 моль/л H2SO4; сэ = 0,U5 моль/л bJa2S2O3,
дистиллированная вода
Ход работы
1. Приведите бюретки с растворами H2SO4, Na2S2O3 и водой в ра-
бочее положение. В три пробирки из бюретки прилейте по 5 мл H2SO4.
2. Прилейте из бюреток в три конические колбы по 5 мл раствора
Na2S2O3 и по 10 мл воды.
3. Возьмите первую колбу и одну из пробирок. Вылейте кислоту
в колбу и одновременно включите секундомер. Определите время по-
мутнения раствора при комнатной температуре и запишите в таблицу.
4. Поместите вторую колбу и вторую пробирку в термостат с тем-
пературой на 10° выше комнатной. Через 3—4 минуты, когда растворы
нагреются до нужной температуры, вылейте кислоту в колбу и одно-
148 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
временно включите секундомер. Определите время начала помутне-
ния раствора и запишите в таблицу.
5. Поместите третью колбу и пробирку в термостат с температу-
рой на 20' выше комнатной. Через 3—4 минуты смешайте растворы
и определите время начала помутнения. Результат запишите в таблицу.
Обработка экспериментальных данных
1. Сформируйте табл. 6.14, как показано ниже.
Таблица 6.14
№ колбы мл МЛ ^Н,О> мл К Дт,е 1/Г, к-1 1/Дг, 1п(1/Дт)
1 5 5 10
2 5 5 10
3 5 5 10
2. Рассчитайте скорость (о ~ 1/Дт) реакции при трех температурах.
3. Если при изменении температуры концентрация реагентов оста-
ется постоянной, то зависимость скорости реакции от температуры
(уравнение Аррениуса) описывается уравнением
и = DGexp[—Еа/(ЛГ)|
или
In и = 1пи0— Еа/(ЙГ).
Рассчитайте обратные величины температуры 1/Ги логарифм ско-
рости 1п(1/Дт). Результат запишите в табл. 6.14.
4. Постройте график зависимости 1п( 1/Дт) от обратной температу-
ры 1/ Г и рассчитайте энергию активации как tg а = Д1п( 1/Дт)/Д( 1/Г).
5. Рассчитайте значения температурного коэффициента у„ракт
по уравнению (6.4).
6. Рассчитайте энергию активации по уравнению (6.7), исходя
из экспериментальных данных.
7. Сравните значения энергии активации, полученные из графика
и по уравнению (6.7).
8. Сделайте вывод о зависимости скорости реакции разложения
тиосерной кислоты от температуры.
Особенности использования цифровой лаборатории
Преимущества использования цифровой лаборатории для кинети-
ческого исследования рассматривались в работе 16. Помимо раннее
перечисленных преимуществ, в данной работе упрощается момент
Глава 6. Кинетика химических реакций • 149
термостатирования. Вместо больших термостатов применяются ком-
пактные электронные термостатирующие устройства, которые надева-
ются на кювету и достаточно быстро выходят на рабочий режим.
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, датчик мутности, термостатирующее
устройство, мерные цилиндры на 50 мл, кювета, магнитная мешалка.
Реактивы: растворы: сэ = 1 моль/л H2SO4; сэ = 0,05 моль/л T4a2S2O3,
дистиллированная вода.
Ход работы
1. Соберите установку, как показано на рис. 6.2.
2. Отберите отдельными цилиндрами 20 мл раствора тиосульфата,
20 мл раствора H2SO4 и 40 мл воды.
3. Наденьте на кювету датчик мутности и термостатирующее
устройство. Поставьте кювету на магнитную мешалку и вылейте в нее
раствор тиосульфата и воду. Включите мешалку.
4. Подключите термостатирующее устройство к блоку питания.
Блок питания включите в сеть и установите напряжение 10 В.
5. Подключите через USB-разъемы к компьютеру датчик мутности
и термостатирующее устройство.
6. Включите компьютер и запустите программу «Практикум».
7. После обнаружения программой термостатирующего устройства
установите температуру термостата 20 °C, причем необходимо указать
диапазон, например 19.9—20,1.
8. Термостат включается, загорается лампочка — нагреватель.
По достижении нужной температуры раствора лампа выключается
9. После обнаружения датчика мутности на экране появится ша-
блон графика зависимости мутности от времени.
Установите пределы измерений по абсциссе X — (0—300) с, по ор-
динате Y— (0—1).
Обнулите датчик мутносги, нажав на рабочей панели кнопку «На-
стройка».
10. После установления температуры в термостате нажмите кноп ку
«Начать измерение» и быстро вылейте в кювету приготовленный рас-
твор H2SO4.
11. Одновременно на блоке питания переключите напряжение на 4,5
В, чтобы свет от лампы не мешая измерению оптической плотности.
12. Когда значение мутности достигнет величины 0,5—06, нажми-
те кнопку «Остановить измерение»
150 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
13. Выключите магнитную мешалку и блок питания. Нельзя остав-
лять включенный термостат вне раствора!
14. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например создайте папку «Кинетика — температура».
15. Быстро вылейте содержимое кюветы, промойте ее дистиллиро-
ванной водой и протрите фильтровальной бумагой.
16. Далее повторите еще два раза действия п. 1—15, но для темпе-
ратур 30 и 40 ”С.
Обработка экспериментальных данных
1. Сформируйте таблицу 6.15, как показано ниже.
Таблица 6.15
N. экс- мента МЛ ^NajSjO,» МЛ >н,о> мл мл /, г.е
1 20 20 40 80 20 1,00 1
2 20 20 40 80 30 1,80
3 20 20 40 80 40 3,24
2. Откройте три файла с результатами измерений, в каждом содер-
жатся два столбца: в первом — время, во втором — значения мутности
3. Постройте три графика зависимости мутности (концентрации
образующейся суспензии серы) от времени протекания реакции, взяв
примерно 10—15 первых точек.
4. Определите по каждому графику начальную скорость реакции
инич =dM/fhи запишите в табл. 6.15.
5. Далее обработку продолжают аналогично п. 3—7 традиционного
варианта обработки данных.
Работа 19. Исследование зависимости скорости
реакции окисления от температуры
Цель работы: изучение скорости реакции окисления сульфита на-
трия йодатом
5Na2SO, + 2КЮ3 + H2SO4 -> 5Na2SO4 + K,SO4 + I2 + H,O:
5SOj“ +2107 + 2H+ -> 5SO4“ + l2 + H.O
при различных температурах методом титрования. Расчет температур-
ного коэффициента Вант-Гоффа и энергии активации.
Глава 6. Кинетика химических реакций • 151
Исследуется зависимость скорости данной реакции от времени ее
протекания. Отсчет времени реакции производится от начала слива-
ния исходных растворов до момента появления синего окрашивания
раствора. т.е. в каждом эксперименте будет образовываться одинако-
вое количество иода Дсь = const. Поэтому можно считать, что средняя
скорость реакции пропорциональна величине 1 /Ат.
Экспериментальная часть
Оборудование: секундомер, пробирки, мерные пипетки на I мл.
Реактивы: растворы 0,01 М сульфита натрия Na2SO>: 0.01 М йодата
калия К1О3,0,2 М H2SO4, 1%-ный расiвор крахмала.
Ход работы
1. Приготовьте три пробирки и пипетками отберите (см. табл. 6.16)
в каждую 1 мл раствора Na2SO3,1 мл Н2О и 2 капли раствора крахмала.
2. Возьмите три другие пробирки и в каждую добавьте 2 мл раство-
ра К1О3 и 2 мл раствора H2SO4.
3. Слейте раствор пробирки № 1 с раствором (KIO, + H2SO4) и сра-
зу включите секундомер.
4. Измерьте время (т, с) от сливания растворов до появления сине-
го окрашивания и результат запишите в ст. 7 табл. 6.16.
5. Поместите вторую пробирку с раствором Na2SC>3, и Н2О и вторую
пробирку со смесью (К1О3 + H2SO4) в термостат с температурой на 10"
выше комнатной. Через 3—4 минуты, когда растворы нагреются до нуж-
ной температуры, слейте их и одновременно включите секундомер. Опре-
делите время появления синего окрашивания и запишите в табл. 6.16.
6. Поместите третьи пробирки в термостат с температурой на 20"
выше комнатной. Через 3—4 минуты смешайте растворы и определите
время появления синего окрашивания. Результат запишите в таблицу.
Обработка экспериментальных данных
1. Сформируйте табл. 6.16, как показано ниже.
Таблица 6.16
№ про- бирки ^a=SO>’ Пооз- ^н,о> 6t)Na2SO3> моль/л Г, К Ат, с 1/Дт 1п(1/Дт)
1 2 3 4 5 6 7 8 9
1 1,0 2,0 1,0
2 1,о 2,0 1,0
3 1,0 2,0 1,о
152 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Рассчитайте молярную концентрацию сульфита после сливания
растворов по формуле
_ Сиск ' ^NaiSOj
С° ~ Кйш
где еиск = 0,01 моль/л; К>Бш = 6 мл.
3. Рассчитайте скорость реакции и как 1 / Дт при трех температурах.
4. В проведенных экспериментах концентрация реагентов остава-
лась постоянной, поэтому зависимость скорости реакции от темпера-
туры (уравнение Аррениуса) можно записать как о = иоехр| -Еа/(/?Г))
или In о = In и0 — Еа/(ЛГ).
Рассчитайте обратные величины температуры 1/Г и логарифма
скорости 1п(1/Дт). Результат запишите в табл. 6.16.
5. Постройте график зависимости 1п( 1/Дт) от обратной температу-
ры 1/ГирассчитайтеэнергиюактивацииЕакак1£а=Д1п(1/Дт)/Д(1/Г).
6. Рассчитайте значения температурного коэффициента уир.1КТ
по уравнению (6.4) для каждого интервала температур и их среднее
значение.
7. Рассчитайте энергию активации по уравнению (6.7), исходя
из экспериментальных данных, и сравните с величиной, полученной
из графика.
8. Сделайте вывод о зависимости скорости окисления сульфита
натрия йодатом от температуры.
Экспериментальная часть с применением
цифровой лаборатории
Оборудование: компьютер, датчик оптической плотности 525 нм,
термостатируюшее устройство, шприц на 3 (10) мл, кювета, магнитная
мешалка, мерные колбы на 50 мл — 8 шт., пипетка — 2 шт.
Реактивы: растворы: 0,01 М сульфита натрия Na2SO3; 0,01 М йода-
та калия К1О3; 1 М H2SO4.
Ход работы
1. Пригоювьте в четырех мерных колбах на 50 мл исходный рас-
твор сульфита натрия с = 0,0050 моль/л. Для этого добавьте в мерную
колбу на 50 мл пипеткой 25 мл 0,01 М раствора Na2SO3, доведите объ-
ем раствора дистиллированной водой до метки и перемешайте. Точно
так же приготовьте в трех мерных колбах на 50 мл исходный раствор
йодата калия с = 0,0050 моль/л.
2. Соберите установку, как показано на рис. 6.3.
Глава 6. Кинетика химических реакций «153
3. Поставьте кювету на магнитную мешалку, наденьте на нее дат-
чик оптической плотности и термостатирующее устройство. Вылейте
в кювету 50 мл раствора Na2SO3 и 50 мл раствора К1О3. Включите пере-
мешивание.
4. Включите термостатирующее устройство в сеть и установите на-
пряжение 10 В.
5. Подключите через USB-разъемы к компьютеру датчик оптиче-
ской плотности и термостатирующее устройство.
6. Включите компьютер и запустите программу «Практикум».
7. После обнаружения программой термостатирующего устройства
установите температуру термостата 20 °C. причем необходимо указать
диапазон, например 19,9—20,1.
Рис. 6.3. Установка для определения оптической плотности
окрашенных растворов при различных температурах
8. Термостат включается, загорается лампочка — нагреватель.
По достижении нужной температуры раствора лампочка выключается.
9. Отберите в шприц 3 мл раствора H2SO4.
10. После обнаружения датчика оптической плотности на экране
появится шаблон графика зависимости оптической плотности от вре-
мени. Установите пределы измерений по абсциссе X — (0—300) с,
по ординате Y— (0—1).
11. После установления температуры в термостате нажмите кноп-
ку «Начать измерение» и быстро вылейте из шприца в кювету раствор
H2SO4
12. Одновременно на блоке питания переключите напряжение
на 4,5 В. чтобы свет от лампы не мешал измерению оптической плот-
ности.
13. Когда оптическая плотность достигнет значения 0,5—06, оста-
новите измерение.
14. Выключите магнитную мешалку и блок питания. Нельзя остав-
лять включенный термостат вне раствора!
154 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
15. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например создайте папку «Кинетика 12 — темпера-
туры».
16. Быстро вылейте содержимое кюветы, промойте ее дистиллиро-
ванной водой и протрите фильтровальной бумагой.
17 Далее повторите еще три раза действия пунктов 3—16, но для
температур 30.40 и 50 °C.
Обработка экспериментальных данных
1. Сформируйте табл. 6.17, как показано ниже.
2. Откройте файлы с результатами измерений. В них содержат-
ся три столбца: в первом — время, во втором — значения оптической
плотности, в третьем — температура. Таких таблиц четыре — для каж-
дой температуры.
Таблица 6.17
№ опыта 7~.К | У 1п и 1/Г
1 2 ! 3 4 5 6 7
1 Y1-2
2 Ум
3 УЗ-4
4 У1-4
। УМ
Уч> =
3. Рассчитайте из табличных данных среднее значение темпера-
туры для каждого из четырех экспериментов. Результаты запишите
в табл. 6.17.
4. Постройте общий график зависимости оптической плотности
(концентрации йода) от времени протекания реакции, взяв примерно
10— 15 первых точек из общего массива для каждой температуры.
5. Определите из графиков начальную скорость реакции для каж-
дой температуры, как
инач = dD/dx = &D/kx, ДО/Дт = tga.
Результаты запишите в табл. 6.17.
6. Сделайте вывод о зависимости начальной скорости от темпе-
ратуры.
7. Рассчитайте по формуле (6.4) температурный коэффициент ско-
рости реакции для каждого интервала температур и их среднее значе-
ние. Результаты занесите в табл. 6.17.
Глава 6. Кинетика химических реакций «155
8. Сделайте вывод, во сколько раз увеличивается скорость реакции
при увеличении температуры на 10°.
9. Рассчитайте энергию активации в каждом интервале температур
и ее среднее значение по формуле
1пу = М—-11.
R V Т} Т2)
10. Определите графически энергию активации Еа по уравнению
Аррениуса и = ииехр[—Еа/(Й7")| или 1пи = 1пи0 — Еа/(Я7’), представ-
ляя экспериментальные данные в координатах 1п и — 1/71
а) Рассчитайте обратные величины температуры l/T’ и логарифм
скорости In и. Результат запишите в табл. 6.17.
б) Постройте график зависимости In и от обратной температуры
I / Т и рассчитайте энергию активации как tg а = Д1п и/Д( 1 / Т).
11. Сравните значения энергии активации, полученные графиче-
ским способом и расчетным
Работа 20. Катализ
Опыт 1. Гомогенный катализ
1.1. Каталитическое ускорение реакции разложения пероксида водо-
рода.
1) Налейте в пробирку 10 мл З^-ного (по массе) раствора перок-
сида водорода.
2) Опустите в пробирку тлеющую лучину, не касаясь раствора.
Объясните, почему лучина не вспыхивает?
3) В коническую колбу налейте 10 мл 0,01 М раствора молибда-
та натрия Na2MoO4 и затем постепенно из пробирки прилейте
10 мл пероксида водорода.
4) Наблюдайте изменение окраски раствора и момент начала вы-
деления пузырьков кислорода. Для завершения реакции смесь
слегка нагрейте. Убедитесь в наличии кислорода в колбе при по-
мощи тлеющей лучины.
5) Объясните наблюдения, приняв во внимание следующий ме-
ханизм реакции разложения пероксида водорода: 2Н2О2 ->
-> 2Н2О + О2.
1 стадия: 4Н2О2 + Na2MoO4 -> Na2MoOs + 4Н2О.
2 стадия: Na2MoOs -» Na2MoO4 + 2О2.
156 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Какую роль играет молибдат натрия?
1.2. Каталитическое ускорение реакции окисления. Окисление сое-
динении марганца! II) до марганца(УП) в растворе легко наблюдать,
так как ион Мп2+ практически бесцветный, а ион МпО4 окрашен
в фиолетово-красный цвет
1) Внесите в две пробирки по 3—4 капли сульфата MnSO4 или ни-
трата Мп (NO3) 2 марганца (но не МпС12, так как ионы хлора ме-
шают проведению реакции) и по 3—4 капли 2 н раствора азот-
ной кислогы.
2) Добавьте в одну из пробирок одну каплю раствора нитрата сере-
бра AgNO3.
3) Внесите в обе пробирки по одному шпателю пероксодисульфата
аммония (NH4)2S2Os.
4) Поместите обе пробирки в водяную баню.
5) Отметьте, в какой пробирке быстрее изменилась окраска.
Реакция протекала по уравнению
2MnSO4 + 5(NH4)2S2Og + 8Н,О -» 2НМпО4 + 5(NH4)2SO4+ 7H2SO4.
Азотная кислота в реакции не расходовалась, а добавлялась для соз-
дания определенной кислотности среды в начале реакции. В качестве
промежуточных быстро протекающих процессов происходило восста-
новление иона серебра марганцем! II) к обратное окисление серебра
пероксодисульфатом аммония. Какой ион является катализатором
в данном процессе?
Опыт 2. Гетерогенный катализ
2.1. Каталитическое действие диоксида свинца на разложение пе-
роксида водорода
1) Налейте в пробирку 5—8 капель ЗО'й-ного (по массе) раствора
пероксида водорода.
2) Опустите в пробирку тлеющую лучину, не касаясь раствора.
Объясните, почему лучина не вспыхивает?
3) Внесите в раствор на кончике шпателя диоксид свинца РЬО2 или
диоксид марганца МпО2 и наблюдайте выделение газа.
4) Напишите уравнение разложения пероксида водорода.
2.2. Каталитическое действие воды (опыт проводят под тягой}}
1) Смешайте в фарфоровой чашке два шпателя порошка алюми-
ния AI и один шпатель кристаллического йода 12. Протекает ли
реакция между алюминием и йодом?
Глава 6. Кинетика химических реакций «157
2) В полученную смесь добавьте одну каплю воды. Наблюдайте
бурную реакцию образования трийодида алюминия АИ3, сопро-
вождающуюся большим выделением теплоты, за счет которой
происходит возгонка непрореагировавшего йода. — появляются
пары фиолетового цвета
Работа 21. Исследование кинетики
каталитического разложения
пероксида водорода
Цель работы: изучение скорости реакции разложения пероксида
водорода при комнатной температуре с участием гомогенного катали-
затора.
Теоретическая часть
Катализаторы в ходе реакции взаимодействуют с исходными реа-
гентами с образованием промежуточных неустойчивых частиц, кото-
рые в результате реакции распадаются на продукты, а катализатор при
этом восстанавливается.
Скорость гомогенного катализа зависит не только от концентрации
реагентов, но и от концентрации катализатора Поэтому в кинетиче-
ское уравнение включается концентрация и реагентов, и катализатора.
Реакция разложения пероксида водорода существенно ускоряет-
ся при добавлении гомогенных катализаторов — растворов К2Сг2О7,
CuSO4, (NH4)2SO4 и других. Например, разложение пероксида водо-
рода с участием дихромата калия К2Сг2О7
Н2О2 >H2O+|oz
протекает через неустойчивый промежуточный продукт ион пероксо-
дихромат Cr2Of2 :
Сг2О7 +5Н2О2 = Сг2о£ +5Н2О;
Сг2О?2 —— О2+Сг2О2
Кинетическое уравнение данной реакции может быть выражено
следующим образом:
158 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Количество пероксида водорода Н2О2, разложившегося к данному
моменту времени, определяют газометрически по количеству выде-
лившегося кислорода
Из уравнения реакции следует, что начальная концентрация Н2О2
(с0) пропорциональна объему кислорода Кк, который выделится при
полном разложении Н2О2, а концентрация Н2О2 (ст) к моменту време-
ни т пропорциональна — V„ где V* — объем кислорода, выделив-
шийся к этому времени. Для определения порядка реакции применя-
ют два метода — графический и аналитический (метод подстановок).
1рафический метод состоит в построении кинетических кривых.
По экспериментальным данным строят графики различных кинетиче-
ских зависимостей. В таблице 1 теоретической части главы 6 указано,
в каких координатах необходимо строить графики для определения
того или иного порядка реакции. В какой системе координат получит-
ся линейная зависимость, делают вывод о порядке данной реакции.
По этому же графику определяют константу скорости как тангенс угла
наклона прямой. В данной работе графики зависимостей = /(т),
ln(FK— J<) =/(т), —-— = /(т) являются частными случаями построе-
ния кинетических кривых в координатах с =f(x), Inc =f(t) и —=/(т)
для реакций нулевого, первого и второго порядков.
Аналитический метод заключается в последовательной подстанов-
ке значений е,()<) и г в выражение константы скорости реакций раз-
личных порядков. По какому уравнению получится постоянное значе-
ние константы скорости, по нему и делают вывод о порядке реакции.
Экспериментальная часть
Оборудование: двухколенная пробирка — пробирка Оствальда, мер-
ная пипетка на 10 и I мл, химический стакан на 500 мл.
Реактивы: растворы 0.5 М Н2О2: 0.2 М К2Сг2О-?.
Ход работы
I. Соберите установку, как показано на рис. 6.4.
2. Налейте пипетками в одно колено пробирки Оствальда 3 мл
Н2О2, в другое — 0,5 мл раствора К2Сг2О7 и присоедините пробирку
к прибору
3. Проверьте герметичность прибора. Для этого, не трогая бюретку
с пробиркой, переместите другую бюретку вместе с лапкой штатива так,
чтобы уровень воды в ней стал на 5—10 см выше, чем в первой бюрет-
Глава 6. Кинетика химических реакций «159
Рис. 6.4. Волюмометрическая
установка для определения
кислорода при разложении
пероксида водорода
ке. Если разница в уровнях не изменяется,
прибор исправен («держит»); если уровни
в бюретках выравниваются, прибор негер-
метичен, пропускает воздух. Найдите при-
чину негерметичности и устраните ее.
4. Приведите уровень воды в бюрет-
ках к одному значению и запишите в ст.
3 табл. 6.15 уровень воды (начальный от-
счет), в ст. 2 — время (т, мин).
5. Перелейте пероксида водорода
в другое колено, где находится дихромат
калия К2СГ2О7, и включите секундомер.
6. В начале реакции, когда скорость
процесса велика, измерения проводите
через 2 минуты, затем интервалы времени
могут быть увеличены до 5 минут.
7. Проводите измерение объема вы-
тесненной воды в каждый момент времени т при одинаковых уровнях
воды в бюретках. Результаты занесите в ст. 3 табл. 6.18.
8. Прекратите измерение, когда уровни воды в бюретках практиче-
ски будут оставаться неизменными.
9. Для измерения объема кислорода К. соответствующему полно-
му разложению HiOj, опустите пробирку Оствальда в стакан с горячей
водой на 5 минут (для ускорения процесса разложения пероксида).
Выньте пробирку и после остывания до комнатной температуры при-
ведите воду в бюретках к одному уровню и сделайте замер. Результат
запишите в ст. 2 табл. 6.18 — оо, в ст. 4 — Кк.
10. После окончания эксперимента вылейте содержимое пробирки
в специальную сливную емкость и тщательно промойте дистиллиро-
ванной водой.
Обработка экспериментальных данных
1. Сформируйте табл. 6.18, как показано ниже.
Таблица 6.18
Уровень
воды, мл
№ за-
160 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Окончание
2. Рассчитайте объем кислорода К(О2), выделившийся к моменту
времени т.
3. Определите порядок реакции и константу скорости по методу
подстановок.
Если считать, что реакция нулевого порядка, то рассчитайте кон-
станту скорости по формуле ки = —, если первого порядка — по фор-
муле — In к у и если второго порядка - по формуле
Л2=—|— ------— Постоянство значений константы будет указы -
V.-П V*)
вать на порядок реакции. Рассчитайте среднее значение константы.
4. Определите порядок реакции и рассчитайте константу скорости,
используя графический метод.
а) Постройте три графика по полученным данным. Для реакции
нулевого порядка в координатах — т, для первого порядка —
в координатах 1п(Рк — Ит) — т и для второго порядка — в коорди-
1
натах ————т.
б) Определите порядок реакции по линейной зависимости
в) Определите константу скорости из графика, который показыва-
ет линейную зависимость как тангенс угла наклона прямой.
5. Сравните константу скорости, полученную графическим мето-
дом с рассчитанной по уравнению.
6. Рассчитайте время полупревращения исследованной реакции
7. Наблюдая за протеканием реакции, как вы считаете, реакция эк-
зотермическая или эндотермическая?
8. Нарисуйте энергетическую диаграмму хода реакции с катализа-
тором и без него с учетом знака теплового эффекта.
Экспериментальная часть с применением
цифровой лаборатории
Проведение эксперимента данной работы в рамках цифровой ла-
боратории позволяет следить за изменением объема выделяющегося
Глава 6. Кинетика химических реакций «161
кислорода в ходе опыта как непрерывно, так и, включая измерение
в любой момент времени, что существенно облегчает выполнение са-
мого эксперимента, а непосредственное его наблюдение многократно
повышает интерес и качество усвоения материала.
Оборудование: компьютер, датчик объема газа с контролем темпера-
туры, двухколенная пробирка — пробирка Оствальда, мерная пипетка
на 10 и 1 мл, химический стакан на 500 мл.
Реактивы: растворы 4 М Н2О2; 0,2 М К2Сг2О7.
Ход работы
1. Соберите установку, как показано на рис. 2.4.
2. Налейте в одно колено пробирки Оствальда 10 мл Н2О2, в дру-
гое — 0,5 мл раствора К2Сг2О7.
3. Сожми ie датчик объема так, чтобы объем 1аза был мини-
мальным.
4. Закройте пробирку пробкой, к которой подсоединен соедини-
тельный шлаге датчиком объема.
5. Перелейте аккуратно (не нарушая герметичности установки) пе-
роксид водорода в колено, где находится дихромат
6. Подключите через USB-разъем к компьютеру датчик объема
газа.
7. Включите компьютер и запустите программу «Практикум».
8. После обнаружения датчика на экране появится шаблон графи-
ка зависимости объема выделившегося газа от времени Установите
пределы измерений по абсциссе X — (0—6001 с. по ординате Y— (С—
500) мл и начните измерение.
9. Остановите измерение, когда изменение объема практически
прекратится.
10. Для измерения объема кислорода VK, соответствующему полно-
му разложению Н2О2, опустите пробирку Оствальда в стакан с горячей
водой на 5 минут (для ускорения процесса разложения пероксида).
Выньте пробирку и после остывания до комнатной температуры вновь
включите измерение и полученный объем VK запишите в ст. 3 табл. 6.19.
11. После окончания эксперимента вылейте содержимое пробирки
в специальную сливную емкость и тщательно промойте дистиллиро-
ванной водой.
12. Экспортируйте данные во внешний файл. Выберите место со-
хранения файла, например создайте папку «Н^Ог».
13. Вылейте содержимое пробирки и промойте ее дистиллирован-
ной водой.
162 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
1. Откроите файлы с результатами измерений. В них содержатся
три столбца: в первом — время, во втором — значения объема выде-
лившегося кислорода, в третьем — температура.
2. Выберите из всего массива экспериментальных точек 8—10 то-
чек и запишите в ст. 2 и 3 табл. 6.19.
Таблица 6.19
3. Проводите далее обработку экспериментальных данных как
в традиционном варианте обработки в п. 3—8
Развитие эксперимента
Исследовательскую работу по изучению кинетики реакции разло-
жения пероксида водорода можно продолжить. Например, провести
исследования по зависимости скорости реакции от концентрации как
самого реагента — пероксида водорода, так и от концентрации гомо-
генного катализатора. Ниже прилагается табл. 6.20 исходных объемов
реагентов для проведения предлагаемого исследования.
Таблица 6.20
№ опыта 1 2 3 4 5 6 7 8 9 10
^Н/>2» МЛ 10 10 10 10 10 10 + ЗН2О 10 + 4,5Н2О 10 + 6Н2О 10 + 7,5Н2О 10 + 9Н2О
ИуСцО» МЛ 0,2 0,4 0,5 0,6 0,8 0,5 0,5 0,5 0,5 0,5
ГЛАВА
ВОДА И ВОДНЫЕ РАСТВОРЫ
Теоретическое введение
Вода играет исключительно важную роль на Земле — в приро-
де, в жизни растений, животных и человека. Велико значение воды
в технике и промышленности, сельском хозяйстве и быту. Необыч-
ные свойства воды, как известно, обусловлены полярным харак-
тером молекул, наличием неподеленных пар электронов у атома
кислорода и образованием водородных связей. Вследствие своей
полярности вода хорошо растворяет вещества с полярными и ион-
ными связями. Образование водородных связей обусловливает от-
носи i ел ьн о высокие 1емпературы плавления и парообразования
воды, ее высокую диэлектрическую проницаемость и особую струк-
туру льда.
Природная вода находится в непрерывном взаимодействии с окру-
жающей средой, реагирует с атмосферой, почвой, минералами. В та-
кой воде содержатся многочисленные органические и неорганические
примеси. Неорганические примеси находятся в основном в виде ионов
и молекул растворенных газов. Применение воды в промышленности
требует ее предварительной очистки. Техническая вода характеризу-
ется рядом технологических показателей, в том числе жесткостью,
солесодержанием, реакцией среды, содержанием растворенного кислоро-
да и др.
Растворы представляю! собой гомогенные многокомпонентные си-
стемы.
Водные растворы — наиболее распространенный вид раство-
ров, в которых растворителем является вода, а в качестве раство-
ренных веществ могут выступать как твердые вещества, так газы
и жидкости.
Основные способы выражения концентрации растворов были даны
в разделе 1.5. Наряду с концентрацией важными характеристиками во-
дных растворов являются реакция среды (водородный показатель pH),
электрическая проводимость, растворимость, окислительно-восстано-
вительный потенциал (ОВП), которые будут рассмотрены в приведен-
ных ниже работах.
164 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 22. Концентрация и плотность
растворов
Цель работы-, получение навыков приготовления растворов задан-
ной концет рации; определение концен грации раствора по получен-
ной калибровочной кривой.
Теоретическая часть
Методы определения плотности жидкостей непосредственно
с помощью ареометров и по графической зависимости «масса жид-
кости — объем» были рассмотрены в работе 1 (опыт 2). Плотность р
разбавленных водных растворов твердых веществ близка к 1,0 г/см3
(то есть к плотности чистой воды) и увеличивается с ростом кон-
центрации. Существенные отклонения от единицы начинаются при
концентрациях более 8—10% (Приложение V), поэтому при расчетах
в случае разбавленных растворов плотность принимают равной 1,0
г/см3. Зная плотность раствора, можно рассчигагь массу вещества
и объем воды для приготовления раствора любой заданной концен-
трации.
Пример 1. Рассчитайте массу и объем воды, необходимые для приготовле-
ния I л ЗО'о-го раствора NaOH.
Решение
1. По табличным данным (Приложение V) для 30*о-го раствора NaOH
р = 1,33 г/см3
2. Масса 1 л раствора: /яр.ра = рр.ра • Pp.p, = 1,33 1000 = 1330 г.
3. Масса растворенного вещества составляет 30*Ъ.*/н№Он = 1330 0,3 = 399 г.
4. Масса воды- mBonu = 1330 — 399 = 931 г. Увояи = 931 мл.
Пример 2. Для 30*о-го раствора NaOH рассчитайте молярную концентра-
цию, молярную концентрацию эквивалента, моляльность и молярную долю
растворенного вещества
Решение
1. По определению, в 100 г раствора /йнвон = 100 0,3 = 30 г.
Это составляет:
2. Объем 100 г раствора.
JU’75’18 мл=0.°7518 л.
Глава 7. Вода и водные растворы «165
3. По определению молярной концентрации раствора:
откуда
£ __ ?iNaOH
к
’р-ра
с=—-------=9,98 моль/л.
0.07518
4. По определению молярной концентрации эквивалентов раствора:
„ ЛЭИаОН
о,.
где «э = Z- п;/= 1; сэ = с = 9,98 моль/л.
5. Масса воды в 100 г раствора:
mH:O =*»р.ра -mNaOH = 100 -30 = 70 г = 0,07 кг.
6. По определению моляльности (модальной концентрации) раствора:
.----иНаОН---- Моль/кг; с„ = ^^=10,71 мозь/кг
«’раст1Ор11тмя 0-07
7. По определению молярной доли:
---7—-----=3.89 моль;
18 г/моль
——-------=0,162.
0.75+3.89
Вопросы и задачи для самоконтроля
1. Рассчитайте объем полученного 20%-го раствора AI2(SO4)j и ко-
личество воды в нем, если масса растворенной соли 50 г.
2. Рассчитайте молярную концентрацию, молярную концентра-
цию эквивалента и молярную долю 28%-го раствора H2SO4.
3. Для растворов HNO3 экспериментально получено:
Массовая доля, % | 20 50 70 90
Пютность | LukJ 1,310 I 1,413 | 1,483
Постройте по этим данным калибровочную зависимость плотности
от массовой доли кислоты и определите, какой концентрации соответ-
ствует плотность раствора 1,26 г/см3.
4. Определите плотность 25%-го раствора NaOH, используя ниже-
приведенные данные.
Объем раствора, мл 1 °-5 2.0 5,0 15.0 19,0
Масса раствора, г | 0,64 | 6,35 I'M 24,3
166 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Экспериментальная часть
Оборудование: технохимические весы, набор ареометров, термо-
метр, цилиндр на 100 мл, химический стакан на 200 мл, стеклянная
палочка, фарфоровая ложечка.
Реактивы: кристаллические NaCI, NH4CI, А12(8О4)з, КС1,
(NH^jSOj, Na2SOa, дистиллированная вода
Ход работы
I. Получите у преподавателя вариант задания в соответствии с при-
веденной ниже табл. 7.1 и контрольный раствор (пробу) неизвестной
концентрации.
Таблииа 7.1
№ варианта Вещество О, % № варианта Вещество <о,Й
1 2 3 1 2 3
1 NaCI 5,10,15, 20 4 KCI 5, 10,15,20
2 NH4CI 6,10,18,25 5 (NH4y>SO4 6,10, 15,20
3 Al2(SO4h 7,14.20, 25 6 Na2SO4 5,10,15,18
2. Сформируйте табл. 7.2 опытных и расчетных данных в соответ-
ствии со своим заданием, как показано ниже.
3. Рассчитайте массу соли и объем воды, необходимые для приго-
товления 100 г раствора с заданными массовыми долями растворенно-
го вещества (см. пример в теоретической части). Запишите значения
в ст. 3 и 4 табл. 7.2.
Таблииа 7.2
Веще- co, % соли, воды, г/см^ Р К моль моль моль *
1 2 3 4 5 6 7 8 9 10 11
проба
4. Взвесьте на технохимических весах в пластиковом стакане
на 100 мл рассчитанную массу соли с точностью до 0,01 г. Отмерьте ци-
линдром рассчитанный объем воды и постепенно перелейте ее в ста-
Глава 7. Вода и водные растворы «167
кан при постоянном перемешивании стеклянной палочкой. Продол-
жите перемешивание до полного растворения соли.
5. Перелейте раствор в цилиндр и опустите в него ареометр. Запи-
шите показания ареометра в ст. 5 таблицы 7.2
6. Опус гиге в цилиндр термометр и измерьте температуру раствора.
Запишите значение в ст. 7 табл. 7.2.
7. Проделайте аналогичные действия (п. 3—6) с оставшимися тре-
мя растворами и контрольной пробой неизвестной кониентраиии.
Обработка экспериментальных данных
1. Занесите в ст. 6 табл. 7.2 табличные значения плотностей приго-
товленных растворов (Приложение V). Отметьте, при какой темпера-
туре даны табличные данные. Сравните экспериментальные и таблич-
ные данные.
2. Постройте по оп ытным данным на миллиметровой бумаге кали-
бровочную кривую — график зависимости плотности раствора от массо-
вой доли растворенного вешества
3. Определите по калибровочному графику концентрацию кон-
трольного раствора (пробы). Результат запишите в ст. 2 табл. 7.2.
4. Рассчитайте молярную концентрацию с, молярную концентра-
цию эквивалентов сэ, моляльность с,„ и молярную долю х приготовлен-
ных растворов (см. пример в теоретической части работы). Получен-
ные значения запишите в табл. 7.2. Приведиге все расчеты в отчете.
Экспериментальная часть с использованием
цифровой лаборатории
В условиях цифровой лаборатории плотность каждого раствора
определяют как тангенс угла наклона зависимости «масса раство-
ра — объем», при этом график зависимости получают непосред-
ственно на экране компьютера, измеряя массу с помошью электрон-
ных весов, а объем — с помощью датчика объема жидкого реагента,
подключаемого к компьютеру. Температура фиксируется датчиком
температуры. Затем, как и в традиционном варианте, строят кали-
бровочную кривую зависимости плотности раствора от концентра-
ции, по которой определяют концентрацию контрольного раствора.
Использование цифровой лаборатории позволяет лучше ощутить
физический смысл понятия плотности, позволяет сохранить экс-
периментальные данные в графическом и цифровом виде на любом
электронном носителе и провести обработку данных в любой стан-
дартной программе.
168 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Существенно облегчается и упрощается процесс взвешивания и из-
мерения температуры, появляется возможность развития эксперимен-
та, например определения растворимости веществ при различных тем-
пературах.
Оборудование: компьютер, электронные весы, датчик объема жид-
кого реагента, шприц на 10 мл, датчик температуры терморезистор-
ный, штатив химический, химические стаканы на 50 мл — 5 шт., бю-
ретка на 50 мл.
Реактивы: кристаллические вещества NaCI, b)H4CI, A12(SO4)3, KCI,
(NH4)2SO4, Na2SO4, дистиллированная вода
Ход работы
1. Получи ie у преподавателя вариант задания в соответствии с при-
веденной выше табл. 7.1 и контрольный раствор (пробу) неизвестной
концентрации.
2. Сформируйте таблицу 7.2 опытных и расчетных данных в соот-
ветствии со своим вариантом, как показано выше.
3. Рассчитайте массу соли и объем воды, необходимые для приго-
товления по 40 г растворов соли четырех разных концентраций в со-
ответствии с заданием (см. пример в теоретической части). Запишите
значения в ст. 3 и 4 табл. 7.2.
4. Приготовьте растворы заданных концентраций. Для этого взвесь-
те на электронных весах рассчитанную массу соли в стакане на 50 мл,
обнулив предварительно массу стакана. Добавьте, не снимая с весов,
в стакан из бюретки рассчитанный объем воды (контролируйте пра-
вильность приготовления раствора по суммарной массе системы). Сни-
мите стакан с весов, тщательно перемешайте смесь стеклянной палоч-
кой до полного растворения соли и образования раствора. Приготовьте
аналогичным образом остальные растворы, пронумеруйте стаканы
5. Подключите к компьютеру датчик температуры, включите ком-
пьютер и проведите измерение температуры приготовленных рас-
творов в течение 1—1,5 минуты, фиксируя временную зависимость.
Зависимость сохраните, экспортировав во внешний файл. Значения
температуры Т запишите в табл. 7.2. После этого датчик отключите.
6. Проведите измерения по определению плотности всех приготов-
ленных растворов, как это описано в работе I опыт 2 (рис. 1.18) с ис-
пользованием цифровой лаборатории. Сохраните данные во внешних
файлах папки «Плотность».
7. Получите у преподавателя контрольную пробу неизвестной кон-
центрации и проведите аналогичные измерения для нее. Сохраните
данные во внешнем файле.
Глава 7. Вода и водные растворы «169
Обработка экспериментальных данных
1. Аппроксимируйте прямой полученные зависимости «масса—объ-
ем раствора» для каждой из изученных концентраций и для контрольной
пробы. Определите тангенс угла наклона полученных зависимостей либо
с помощью стандартной компьютерной программы, либо как отноше-
ние двух катетов выбранного треугольника. (Внимание: величину от-
резков катетов следует определять в соответствующих единицах: г и мл.)
Значение плотности получите в г/см3 и запишите в ст. 6 табл. 7.2
2. Далее обработку результатов проводите так же, как указано выше
в п. 1—4 обработки данных для традиционного варианта опыта.
Работа 23. Определение концентрации
растворенного кислорода в воде
Цель работы, определение содержания растворенного кислорода
в водопроводной или природной воде.
Выполнение работы возможно как традиционным методом йодо-
метрического титрования, так и с использованием цифрового обору-
дования. Описание эксперимента дано для двух вариантов.
Теоретическая часть
Природная вода представляет собой сложную многокомпонент-
ную систему, содержащую растворенные примеси — твердые вещества
и газы, среди которых одним из важнейших является кислород. С од-
ной стороны, растворенный кислород определяет скорость процессов
химического и биохимического окисления в водоемах, необходим для
жизни в воде рыб и других организмов, его недостаток ведет к их гибели.
С другой стороны, кислород является сильным окислителем и ускоряет
процесс коррозии металлического оборудования, поэтому вода с повы-
шенным содержанием кислорода недопустима д ля применения в техни-
ке и энергетике. Так, например, для воды тепловых электрических стан-
ций (ТЭС) содержание кислорода не должно превышать 5—40 мкг/кг
в зависимости от типа парогенератора. Тогда как в чистой воде, насы-
щенной кислородом, его содержание при 20 °C равно ~ 9.2 мг/кг.
Для удаления кислорода из воды используются различные методы:
нагревание, продувка неагрессивными газами (азотом, водяным па-
ром), добавление восстановителей. В качестве последних широко ис-
пользуются сульфит натрия Na2SO3 — для обработки водопроводной
170 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
воды, и гидразин (N2H4) — для водоподготовки в теплоэнергетике.
Указанные реагенты количественно связывают кислород в воде:
2Na2SOj I Оз = 2Na2SO4,
N2H4 + О2 = N2 + 2Н,О.
Для контроля и определения концентрации растворенного кис-
лорода в лаборатории применяют различные аналитические методы.
Наиболее распространенный йодометрический метод основан на спо-
собности соединений двухвалентного марганца количественно связы-
вать кислород в щелочной среде. Например,
МпС12 + 2КОН = Мп(ОН), + 2КС1
и далее под действием растворенного кислорода
Mn(OH)2 + jO2 + Н3О = MnO2 2Н2О-
Соединение МпО2-2Н2О (дигидрат диоксида марганца), которое
выпадает в результате в виде коричневого осадка, является сильным
окислителем. Оно образуется по указанной выше реакции в количестве,
эквивалентном содержанию растворенного кислорода. Таким образом,
определив количество образовавшегося дигидрата диоксида марганца,
можно рассчитать концентрацию кислорода в исследуемой воде. Коли-
чественное определение MnO2 - 2Н.О основано на его взаимодействии
с К1 в кислой среде с выделением свободного йода по реакции
МпО, - 2Н2О + 2К1 + 2HjSO4 = MnSO4 + K2SO4 + 12 + 4Н2О.
Йод образуется в количестве, эквивалентном количеству дигидрата
и, следовательно, эквивалентном количеству растворенного кислоро-
да. Количество 12 определяют титрованием его раствором тиосульфата
натрия Na2S2Oj в присутствии крахмала до исчезновения синей окра-
ски. Реакция протекает по уравнению
2Na2S2Oj + 12 - Na2S4O6 + 2Nal
Количество израсходованного на титрование тиосульфата эквива-
лентно количеству свободного йода. Таким образом, концентрацию
растворенного кислорода можно рассчитать по закону эквивалентов:
ГЛ1=ГА2,
где И, — объем пробы исследуемой воды, сэ1 — молярная концентрация экви-
валентов растворенного кислорода = —О2 J; И2 — объем раствора Na;S2O3,
Глава?. Вода и водные растворы «171
пошедшим на титрование; сэ2 молярная концентрация эквивалентов раство-
ра Na2S2O3
Согласно уравнениям вышеприведенных реакций: 3(Na2S2O3) =
= 1 Na2S2O3. Следовательно, с.л = с (молярной концентрации раствора
Na2S2Oj).
В последнее время для быстрой оценки содержания О2 в различных
водных средах все чаще используют электронные датчики. Цифровой
датчик растворенного кислорода, применяемый в настоящей работе,
измеряет концентрацию кислорода в единицах ppm (миллионных до-
лях). Для водных растворов обычно принимают, что 1 ppm = I мг/л.
Вопросы и задачи для самоконтроля
1. Зачем при определении содержания кислорода в воде необходи-
мо измерять температуру?
2. Чем вызвана необходимость контроля содержания кислорода
в воде на тепловых электрических станциях?
3. Для удаления кислорода из воды использовали способ обработ-
ки сульфитом натрия и гидразином (см. теоретическую часть).
Рассчитайте количество гидразина без избытка, которое необ-
ходимо ввести в 1 л обрабатываемой воды, содержащей 4,8 мг/л
кислорода, для полного его удаления, если в воду предваритель-
но ввели 18,9 мг Na2SO3.
4. Напишите уравнения реакции, протекающих при йодометриче-
ском методе определения растворенного О2. Как устанавливают
точку эквивалентности при титровании свободного йода рас-
твором тиосульфата натрия?
Экспериментальная часть
Опыт 1. Определение содержания
растворенного кислорода методом
йодометрического титрования
Оборудование: коническая колба на 200—250 мл с пробкой, пипетка
на 1 мл — 2 шт., бюретка на 25 мл — 2 шт., термометр.
Реактивы: водопроводная или природная вода, предварительно от-
стоявшаяся в открытом сосуде, 2 М раствор МпС12 или MnSO4; 1 М
H2SO4; 0,01 н. раствор Na2S2O3; раствор KI в КОН (700 г КОН + 150 г
KI в 1 л раствора), 0,5%-ный водный раствор крахмала, дистиллиро-
ванная вода.
172 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. Отмерьте мерным цилиндром 100 мл отстоявшейся водопрово-
дной воды и вылейте ее в коническую колбу на 250 мл. Добавьте в кол-
бу пипеткой 1 мл раствора хлорида или сульфата марганца (МпСЬ или
MnSO4) и 1 мл щелочного раовора йодида калия (KI + КОН) Закрой-
те колбу пробкой и осторожно перемешайте раствор
2. Оставьте колбу на 3—4 минуты, в течение которых наблюдайте
за происходящими в ней процессами. Запишите наблюдения и опи-
шите признаки протекающих реакций.
3. Добавьте в колбу из бюретки 3 мл раствора серной кислоты, за-
кройте колбу пробкой и, аккуратно помешивая, добейтесь полного
растворения осадка.
4. Оставьте колбу на 2—3 минуты. Запишше наблюдения и опи-
шите признаки протекающей реакции.
5. Заполните бюретку раствором тиосул ьфата натрия, приведите ее
в рабочее положение (рис. 1.23) и начните титрование приготовленной
пробы. Добавляйте раствор тиосульфата по каплям при перемешива-
нии до тех пор, пока цвет раствора не станет бледно-желтым. После
этого внесите в колбу несколько капель раствора крахмала и продол-
жите титрование до исчезновения синей окраски. Запишите объем из-
расходованного раствора тиосульфата в табл. 7.3.
6. Повторите титрование с другой пробой воды. Запишите резуль-
тат второго титрования в табл. 7.3. В случае если значения двух титро-
ваний отличаются друг от друга более чем на 0,2 мл, проведите анализ
еще раз.
Обработка экспериментальных данных
1. Сформируйте табл. 7.3 опытных и расчетных данных, как по-
казано ниже. (Объем анализируемой пробы воды и концентрация ти-
транта могут варьироваться.)
Таблица 7.3
Объем
раствора
тиосульфа-
та Г1р, мл
Молярная кон-
центрация экви-
валентов раство-
ра тиосульфата
cM2,, моль/л
Объем ана-
лизируемой
пробы
И>н,о> мл
Молярная кон-
центрация эквива-
лентов О2 в пробе
сэо,. моль/л
Содер-
жание О?
в пробе,
мкг/л
Глава 7. Вода и водные растворы «173
2. Составьте уравнения протекающих реакций на всех стадиях йо-
дометрического метода.
3. Найдите средний объем раствора тиосульфата натрия, израсхо-
дованный на титрование пробы. 1'р по результатам всех титрований
Запишите в ст. 1 табл. 7.3.
4. Рассчитайте молярную концентрацию эквивалентов растворен-
ного кислорода в воде по закону эквивалентов (см. теоретическую
часть работы). Запишите значение С,о, в ст. 4 табл. 7.3.
5. Пересчитайте содержание кислорода в воде в мкг/л, зная его мо-
лярную концентрацию эквивалентов и учитывая, что Э(О2) = —О,
и МЭ(О2) = 8 г/моль. Запишите значение в ст. 5 табл. 7.3. Сделайте вы-
вод о соответствии содержания кислорода техническим нормам в ис-
следованной воде.
Экспериментальная часть с использованием
цифровой лаборатории
В условиях цифровой лаборатории определение растворенною
кислорода осуществляют непосредственно с помощью цифрового дат-
чика кислорода. Использование цифрового оборудования позволяет
кардинально облегчить и упростить эксперимент, обойтись без много-
численных реактивов, исключить процессы приготовления растворов
и титрования, избежать ошибок эксперимента, неизбежных в много-
стадийных процессах; позволяет сохранить экспериментальные дан-
ные в графическом и цифровом виде на любом электронном носителе
и провести компьютерную обработку данных.
Появляется возможность значительного развития эксперимента,
например определения содержания кислорода после различной обра-
ботки воды, после добавления различных солей, определения раство-
римости кислорода при различных температурах, изучения изменения
растворимости газа в динамике.
Оборудование: компьютер, датчик кислорода, датчик темпера-
туры. конические колбы на 200—250 мл — 3 шт., химические ста-
каны на 50 мл, цилиндр на 50—100 мл, химический штатив, элек-
тронные весы, магнитная мешалка, спиртовка (или электрическая
плитка).
Реактивы: водопроводная или природная вода, предварительно от-
стоявшаяся в открытом сосуде, дистиллированная вода, кристалличе-
ский сульфит натрия Na2SOj.
174 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. Возьмите 0,6—1 л воды для исследования. Разлейте воду в три
конические колбы. Первую колбу оставьте для исследования исходной
воды. Во второй колбе воду прокипятите в течение 1—2 минут, закрой-
те пробкой и оставьте охлаждаться. (Для более быстрого охлаждения
можно поместить колбу в емкость с холодной водой.) В третью колбу
добавьте навеску (2—3 г. Na2SO3) и перемешайте до полного растворе-
ния соли. Закройте колбу пробкой.
2. Отмерьте в химический стакан на 100 мл цилиндром 50 мл ис-
следуемой воды из первой колбы. Закрепите в штативе (рис. 7.1) дат-
чики кислорода и температуры и опустите в стакан на глубину 3—4 см,
не касаясь дна и стенок
3. Подсоедините к компьютеру датчики кислорода и температу-
ры. Включите компьютер и запустите программу «Практикум». После
идентификации программой датчиков на экране должны отобразить-
ся два шаблона графиков зависимости
температуры и содержания кислорода
от времени.
4. Запустите измерение. Фиксируй-
те зависимость температуры и концен-
трации кислорода от времени до стаби-
лизации показаний датчиков.
5. Остановите измерение и экс-
портируйте графические и табличные
результат во внешние файлы папки
«Кислород».
6. Вылейте воду из стакана, датчик
кислорода поместите в стакан с дис-
тиллированной водой.
7. Повторите измерение (п. 2—6)
с новой порцией воды из первой колбы.
8. Проведите аналогичные измерения
(п. 2—7) воды из второй и третьей колб
Обработка экспериментальных данных
1. Сформируйте табл. 7.4 опытных и расчетных данных, как пока-
зано ниже.
2. Запишите в соответствующие столбцы табл. 7.4 значения темпе-
ратуры и содержания кислорода в ppm и мг/л, полученные из компью-
терных зависимостей для всех проб воды, принимая, что 1 ppm = 1 мг/л.
Глава 7. Вода и водные растворы «175
Таблица 7.4
№ из-
мере-
Содержание
Oj, ppm, в ис-
ходном воде
Содержание
Oj мкг/л (ис-
ходная вода)
Содержание О2
мкг/л (обра-
ботка NajSOj)
Содержание
О2 мкг/л
(кипячение)
6
Среднее
3. По результатам двух измерений всех проб воды в трех колбах
определите средние показания концентрации кислорода и запишите
в табл. 7.4.
4. Сравните полученные значения. Приведите уравнение хими-
ческой реакции, идущей при добавлении сульфита натрия в воду,
содержащую кислород. Сделайте вывод об изменении растворимо-
сти кислорода с температурой. Сделайте вывод о соответствии со-
держания кислорода техническим нормам в исходной и обработан-
ной воде.
Работа 24. Определение температуры
замерзания (кристаллизации)
водных растворов
Цель работы: получение экспериментальных кривых охлажде-
ния чистого растворителя — воды, водных растворов неэлектролитов
и электролитов, определение температуры их кристаллизации (замер-
зания), криоскопической константы воды и изотонического коэффи-
циента Вант-Гоффа.
Теоретическая часть
Для растворов характерны некоторые общие (ко.чигатиеные)
свойства, которые зависят от концентрации и практически не за-
висят от природы растворенных веществ. Согласно закону Рауля,
с увеличением содержания нелетучего растворенного компонента
давление пара растворителя над раствором уменьшается. Пониже-
ние давления насыщенного пара растворителя А над раствором Ддд
пропорционально молярной доле растворенного нелетучего веще-
ства хв:
176 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ДРа =Ра-Ра=Ра-^в. (7.1)
где рХ и Ал — давления насыщенного пара растворителя над чистым раство-
рителем и над раствором, соответственно
Из закона Рауля вытекают два следствия. Согласно первому — тем-
пература кипения раствора выше температуры кипения чистого раство-
рителя', согласно второму — температура замерзания (кристаллизации)
раствора низке температуры замерзания (криста злизации) чистого рас-
творителя.
Повышение температуры кипения ДГКИ11 пропорционально мо-
ляльности раствора с„:
^Ткш=К3-с„, (7.2)
где К, — эбуллиоскопическая постоянная растворителя.
Понижение температуры замерзания (кристаллизации) Д7^ам также
пропорционально моляльности ст (моляльной концентрации) раствора:
ЛТ,м = Кк-ст, (7.3)
где А*к — криоскопическая постоянная растворителя
Значения постоянных К.3 и Кк зависят от природы растворителя
и не зависят от природы растворенного нелетучего вешества. Напри-
мер, для воды К3 = 0,52; Кк = 1,85.
Определив экспериментально изменение температуры кипения
или замерзания раствора ДГ по сравнению с растворителем, можно
рассчитать молярную массу Мв растворенного вещества по уравнению:
103К тя
мв = —-------[г/моль]. (7.4)
ДТ /иА
где К=К, или К= К*, тв и — массы растворенного вещества и растворителя,
соответственно.
В растворах электролитов вследствие распада молекул на ионы об-
щее число частиц, влияющих на изменение 7^Я11 и Г3.1М, существенно
выше, чем в растворах неэлектролитов. Вант-Гофф ввел поправочный
коэффициент /, получивший название изотонического коэффициента,
который при его подстановке в соответствующие уравнения позволяет
использовать их для разбавленных растворов электролитов. Например,
формулы (7.2) и (7.3) для раствора электролита будут иметь вад:
^ТК1ЛП = з-К.3-ет, (7.2а)
Глава 7. Вода и водные растворы «177
и
Д7’11И = /-Ад-ега. (7.3а)
Указанные свойства подчиняются приведенным закономерностям
в полной мере только в идеальных растворах. Идеальным называют
раствор, в котором нет взаимодействий химической природы, я силы
межмолекулярного взаимодействия между компонентами одинаковы.
Чтобы использовать для реальных систем уравнения и формулы, опи-
сывающие свойства идеальных растворов, вводят формальную вели-
чину, называемую активность. Относительная активность а связана
с относительной концентрацией с соотношением
« = Т-ё, (7.5)
где у — коэффициент активности, который формально учитывает все виды вза-
имодействия частиц в данном растворе, приводящие к отклонению от свойств
идеального раствора, у определяют по экспериментальным данным
Определение температур кристаллизации растворителя или рас-
твора чаще всего проводят, изучая изменение температуры жидкостей
(/ °C — т) под воздействием охлаждающих смесей, т.е. так называе-
мые кривые охлаждения. Примерный вид кривых охлаждения показан
на рис. 7.2. Как следует из рис. 7.2, кривая охлаждения воды (t °C — т),
содержит участок АВ — охлаждения жидкой воды до О °C, участок ВС,
соответствующий ее охлаждению ниже О °C (переохлаждению). После
появления первых кристаллов льда температура воды немного повы-
шается — участок CD, а затем остается постоянной до тех пор, пока вся
вода не замерзнет (участок /)£). Далее происходит постепенное охлаж-
дение кристаллов льда до температуры охлаждающей смеси (участок
EF). Температуре кристаллизации Тм„ растворителя отвечает темпера-
тура плато DE.
Рис. 7.2. Кривые охлаждения растворителя (с) и раствора (б).
(Пунктирная линия соответствует температуре охлаждающей смеси)
17В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
На кривой охлаждении раствора неэлектролита (рис. 7.26) также
имеют место участки его переохлаждения (ВС) и повышения темпера-
туры раствора после начала его кристаллизации (CD). Однако раствор
замерзает не при постоянной температуре, а в некотором температур-
ном интервале (£>£), поскольку в процессе кристаллизации сначала
из раствора удаляется растворитель и повышается концентрация рас-
творенного вешества. Затем начинают одновременно кристаллизо-
ваться вода и растворенное вещество, поэтому температура раствора
остается постоянной (участок
Рис. 7.3. Прибор для определения Т
замерзания жидкостей.
1 — внутренний сосуд. 2 — пробка;
3 — длинный шуп датчика
температуры; 4 — электронный блок
цифрового датчика, 5 — внешний
сосуд, 6 — химический стакан
с охладительной смесью; 7—
исследуемая жидкость; 8 — крышка
EF). Далее температура понижается
до Т охлаждающей смеси (участок
FG). Температуре замерзания рас-
твора данной концентрации соот-
ветствует точке D.
Прибор для криоскопических ис-
следований (рис. 7.3) состоит из двух
цилиндрических сосудов (пробирок)
разного диаметра и высоты (У) и (5),
которые вставляют один в другой
и помещают в стакан с охлаждаю-
щей смесью. Стакан должен иметь
крышку с отверстием для внешнего
сосуда. Исследуемый раствор нали-
вают во внутренний сосуд (У). В него
вставляется длинный щуп датчика
температуры (3) или лабораторный
термометр. Для обеспечения равно-
мерного охлаждения жидкости необ-
ходимо перемешивание. Допустимо
производить перемешивание щупом
датчика температуры, в таком случае
мешалка не требуется. Если для из-
мерений используется стеклянный
термометр, то во внутреннюю про-
бирку дополнительно вводят мешал-
ку из металлической проволоки.
Вопросы и задачи для самоконтроля
1. С чем связано понижение Т^м и повышение ГКИ|| в растворах
по сравнению с чистым растворителем?
2. Почему ДГММ и ЛГкИ|1 больше в растворах электролитов, чем
в растворах неэлектролитов одинаковой моляльной концентрации?
Глава 7. Вода и водные растворы «179
3. Укажите, для каких из приведенных ниже веществ в водных рас-
творах изменение температуры замерзания и кипения при одинаковой
молярной концентрации будет наиболее существенным: этиловый
спирт С2Н5ОН. глюкоза С6Н|2О6, KI, Na2CO3.
4. Насколько повысится ТК1П, и понизится Тмм раствора по срав-
нению с чистой водой, если в 100 г воды растворить 60 г сахарозы
С|2Н22О„?
5. В каком объемном соотношении следует смешать воду и эти-
ленгликоль С2Н4(ОН)2 (р = 1,116 г/см3) для приготовления антифриза
с 7^-25’С?
Экспериментальная часть с использованием
цифровой лаборатории
Выполнение эксперимента возможно как традиционным спосо-
бом, так и с использованием цифрового оборудования. В первом слу-
чае кривую охлаждения получают с помощью лабораторного термо-
метра, фиксируя значения температуры каждые 15—20 с и записывая
показания в лабораторный журнал. Затем строят кривую охлаждения
на миллиметровой бумаге. Во втором случае используют цифровой
датчик температуры и компьютер. Кривую охлаждения получают не-
посредственно на экране компьютера. Использование цифрового обо-
рудования позволяет упростить эксперимент, получить более точную
кривую охлаждения, избежать субъективных ошибок при измерении
температуры, дает возможность сохранить экспериментальные дан-
ные в графическом и цифровом виде на любом электронном носите-
ле и провести их компьютерную обработку. Появляется возможность
развития работы например, изучить кривые охлаждения для растворов
разных концентраций, для растворов электролитов различной приро-
ды, провести определение молярных масс растворенных веществ, по-
лучить кривые плавления и определить температуры плавления.
Поскольку ход опыта и обработка данных в целом идентичны для
обоих вариантов, описание дано на примере использования цифрово-
го оборудования.
Оборудование: прибор для криоскопии (рис. 7.3), компьютер, датчик
температуры |ерморезисторный с длинным щупом (или |ермомегр),
весы, стакан химический на 50 мл, бюретка или пипетка на 10 мл, сте-
клянная палочка.
Реактивы: кристаллические вещества — глюкоза, сахароза, моче-
вина, хлориды натрия, магния и алюминия; дистиллированная вода.
Охлаждающая смесь: мелко колотый лед (3 части) и хлорид натрия
(1 часть).
1S0 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 1. Получение кривой охлаждения
воды и определение Тзам воды
Ход работы
1. Охладите дистиллированную воду, необходимую для исследова-
ний, в холодильнике или в охлаждающей смеси.
2. Подготовьте установку (рис. 7.3). Для этого в пустой сосуд боль-
шего диаметра вставьте пробирку меньшего диаметра с надетым на нее
резиновым кольцом. Заполните толстостенный химический стакан
охлаждающей смесью на 3/4 объема. Внешний сосуд поместите в ста-
кан со смесью так, чтобы он не касался его дна.
3. Включите компьютер, подключите к нему датчик температуры,
закрепленный в лапке штатива. Запустите программу «Практикум».
После идентификации датчика выберите режим «Зависимость тем-
пературы от времени», установите пределы измерений по шкале X —
(0-600) с. а по оси Г— (-10 — +20) "С.
4. Отмерьте во внутреннюю пробирку с помощью бюретки или
мерной пипетки 10 мл охлажденной дистиллированной воды. Уровень
воды должен быть ниже уровня охлаждающей смеси. Стакан закройте
крышкой.
5. Вставьте в отверстие в крышке щуп датчика температуры, опу-
стите его во внутреннюю пробирку с водой, закрепив его в штативе
по центру пробирки.
6. Запустите измерение и наблюдайте за ходом температуры
на экране компьютера, не трогая датчик. Когда температура достигнет
примерно + 1 °C, начните аккуратно перемешивать воду с помощью
щупа датчика температуры, пока не начнется кристаллизация. Пока
вся вода не замерзнет, температура должна оставаться примерно по-
стоянной. После начала понижения температуры продолжите измере-
ние еще 1,5—2 минуты.
7. Остановите измерение и сохраните графическую и табличную
зависимости, экспортируя их во внешний файл созданной папки
«Криоскопия».
8. Выньте внутреннюю пробирку вместе с датчиком и перенеси-
те их в химический стакан с теплой водой (около 30 °C). После того
как весь лед растает, повторите измерение, выполняя п. 6—7 еще раз,
не меняя содержимого пробирки.
Обработка экспериментальных данных
1. Постройте по полученным компьютерным данным двух изме-
рений кривую охлаждения воды на миллиметровой бумаге, усреднив
Глава 7. Вода и водные растворы «181
данные двух измерений и выбрав подходящий масштаб графика. Для
построения выберите 25—30 точек из всего диапазона температур.
2. Определите температуру кристаллизации воды Гям как среднюю
на плато кривой охлаждения (участок DEрис. 7.2а).
3. Сравните полученный результат с истинным значением. Сде-
лайте вывод.
Опыт 2. Определение криоскопической
постоянной воды
1. Получите у преподавателя вариант задания (табл. 7.5).
Таблица 7.5
рианта Вещество А Вещество Б № ва- рианта Вещество А Вещество Б
1 2 3 1 2 3
1 глюкоза NaCl 4 мочевина AlClj
2 мочевина КС1 5 глюкоза MgClj
3 сахароза СаС12 6 сахароза NaCl
2. Сформируйте табл. 7.6 опытных и расчетных данных, как пока-
зано ниже.
Таблица 7.6
Вещество А '"н;О> Г »1Л,Г Тим Н2о Гмм раствора дгмм ст а; Ошибка опыта, %
1 2 3 4 5 6 7 8 9
3. Проведите измерение по получению кривой охлаждения 10 мл
дистиллированной воды, как описано в опыте 1. Цифровые и графи-
ческие данные сохраните во внешней папке «Криоскопия». Выньте
внутреннюю пробирку вместе с датчиком и перенесите их в химиче-
ский стакан с теплой водой. Запишите массу 10 мл воды тн,о в ст.
2 табл. 7.6, принимая плотность равной 1 г/см3.
4. Взвесьте на электронных весах в стакане на 50 мл навеску ве-
щества А, обнулив массу тары. Запишите массу вещества тА в ст. 3
табл. 7.6 Перенесите навеску в пробирку с дистиллированной водой
и растворите ее, перемешивая стеклянной палочкой.
5. Поместите пробирку с раствором во внешнюю, пустую пробир-
ку, находящуюся в стакане с охлаждающей смесью. Следите, чтобы
1S2 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
уровень раствора был ниже уровня охлаждающей смеси. Стакан за-
кройте крышкой.
6. Вставьте в отверстие в крышке длинный шуп датчика темпера-
туры и опустите его во внутреннюю пробирку с раствором, закрепив
в штативе по центру пробирки.
7. Проведите измерение для получения кривой охлаждения раство-
ра также, как для воды в п. 3. Наблюдайте за постепенным понижением
температуры раствора в процессе его замерзания. Фиксируйте зависи-
мость, пока весь раствор не замерзнет, после чего продолжите измере-
ние, наблюдая за понижением температуры еще около двух минут.
8. Остановите измерение. Сохраните графическую и табличную за-
висимости. экспортируя их во внешние файлы созданной папки «Кри-
оскопия».
9. Выньте внутреннюю пробирку вместе с датчиком и перенесите
их в химический стакан с теплой водой (около 30 °C). После того как
все кристаллы расплавятся, повторите измерение (п. 5—8) еше раз.
не меняя содержимого пробирки.
Обработка экспериментальных данных
1. Определите температуру кристаллизации воды Гаам какописано
в опыте 1. Запишите результат в табл. 7.6.
2. Постройте по полученным компьютерным данным двух измере-
ний кривую охлаждения раствора на миллиметровой бумаге, усреднив
данные двух измерений и выбрав подходящий масштаб графика. Для
построения выберите 25—30 точек из всего диапазона температур.
3. Определите по полученной кривой охлаждения раствора темпе-
ратуру начала кристаллизации раствора Tilv раствора. За температуру
замерзания раствора примите точку D пересечения двух линеаризо-
ванных участков кривой замерзания (рис. 7.26). Результат запишите
в ст. 5 табл. 7.6.
4. Рассчитайте понижение температуры кристаллизации ДГ,ам рас-
твора по сравнению с чистым растворителем Н,О как разницу двух
значений, полученных выше. Запишите в ст. 6 табл. 7.6.
5. Рассчитайте моляльность раствора по известной навеске раство-
ренного вещества (см. пример 2 теоретической части). Значение запи-
шите в ст. 7 табл. 7.6.
6. Рассчитайте значение криоскопической постоянной воды Кк
по формуле (7.3), используя значение ДТ(ам, полученное в п. 4. Резуль-
тат запишите в ст. 8 табл. 7.6.
7. Сравните полученное значение Кк с истинным (см. теоретиче-
скую часть). Рассчитайте относительную погрешность опыта. Запи-
шите в ст. 9 табл. 7.6. Сделайте вывод по работе.
Глава 7. Вода и водные растворы «183
Опыт 3. Определение изотонического
коэффициента раствора электролита
Ход работы
1. Сформируйте табл. 7.7 опытных и расчетных данных, как пока-
зано ниже.
Таблииа 7.7
Вещество Б "Чо’ г Тмм Н2О Тзам раствора Д7^опыт i
1 2 3 4 5 6 7 8
2. Проведите измерение для получении кривой охлаждения 10 мл
дистиллированной воды, как описано выше в опыте 1. Цифровые
и графические данные сохраните во внешней папке «Криоскопия».
Выньте внутреннюю пробирку вместе с датчиком и перенесите их в хи-
мический стакан с теплой водой. Запишите массу 10 мл воды /лн,о
в ст. 2 табл. 7.7, принимая плотность равной 1 г/см3.
3. Взвесьте на электронных весах в стакане около 0,5 г вещества Б
(табл. 7.5) или получите готовую навеску у преподавателя. Запишите
массу /иБ вещества Б в ст. 3 табл. 7.7.
4. Далее действуйте, как указано в п 4—9 экспериментальной ча-
сти опыта 2.
Обработка экспериментальных данных
1. Проведите обработку экспериментальных данных, как описано
в п. 1—5 обработки данных опыта 2, записывая результаты в соответ-
ствующие столбцы табл. 7.7.
2. Рассчитайте изотонический коэффициент Вант-Гоффа по форму-
ле (7.3а). Результат запишите в ст. 8 табл. 7.7. Сделайте вывод по работе.
Работа 25. Исследование водных растворов
сильных электролитов
кондуктометрическим методом
Цель работы, измерение электрической проводимости растворов
сильных электролитов разных концентраций, проведение расчетов
по полученным данным.
184 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Теоретическая часть
Жидкие растворы подразделяют на растворы электролитов, кото-
рые проводят электрический ток, и растворы неэлектролитов, которые
ток не проводят. Носителями заряда в растворах электролитов являют-
ся ионы. Электрическая проводимость растворов, в отличие от прово-
димости металлов, растет с ростом температуры, поскольку при этом
возрастает подвижность ионов.
Процесс распада электролита на ионы происходит под действи-
ем растворителя и называется электролитической диссоциацией. Ко-
личественно диссоциация характеризуется степенью диссоциации а,
которая равна отношению молярной концентрации молекул, рас-
павшихся на ионы с, к общей концентрации растворенного электро-
лита с0:
« = —- (7.6)
со
По величине а электролиты делятся на две группы: слабые с а < 1
и сильные с а » 1. Таким образом, слабые электролиты при растворении
распадаются на ионы не полностью (обратимо), а сильные — практи-
чески полностью (необратимо). Для неэлектролитов, соответственно,
а = 0. Для наглядности необратимый процесс диссоциации сильного
электролита принято записывать с использованием односторонней
стрелки, например:
NaCl -> Na* + СГ,
обратимый процесс диссоциации слабого электролита — с использо-
ванием двусторонней стрелки, например:
NH4OH^NH4+ ЮН
Молекулы воды, участвующие в образовании гидратированных ио-
нов, как правило, опускают.
К сильным электролитам в водных растворах принадлежит по-
давляющее большинство солей, щелочи, кроме Mg(OH)2 и Ве(ОН)2,
а также такие кислоты, как HNO3, H2SO4, НС1, HBr, HI, HC1O4 и др.
К слабым электролитам относят воду, многие органические и неорга-
нические кислоты, основания р-, <1- и /-элементов.
Количественной характеристикой способности электролита
к переносу заряда является величина, называемая электрической
проводимостью, или электропроводностью. Различают удельную о,
молярную Л и эквивалентную электрическую проводимость. Опре-
Глава 7. Вода и водные растворы «185
деление удельной электрической проводимости о (См м_|), ее за-
висимость от концентрации растворов и методы ее измерения были
рассмотрены в работе 1 (опыт 4). Поскольку в 1 м3 растворов разных
электролитов содержится разное количество ионов растворенно-
го вещества, сравнивать их свойства, в частности подвижность ио-
нов, по удельной проводимости невозможно. Для этого используют
молярную электрическую проводимость А (См - м2 - моль-1), которая
представляет собой проводимость объема раствора, в котором со-
держится 1 моль растворенного вещества. Более корректно электри-
ческую проводимость относить к единице заряда иона, то есть при-
менять так называемую эквивалентную электрическую проводимость
Лэ, равную проводимости объема раствора, в котором содержится
1 моль эквивалентов электролита. Между Л и Лэ существует простая
взаимосвязь:
A = Z-A3, (7.7)
где Z — эквивалентное число.
Очевидно, что для 1,1-зарядных электролитов Z= 1 и Л — А,.
Удельная электрическая проводимость связана с молярной и экви-
валентной проводимостями простым соотношением:
A = Z-A3=—, (7.8)
Со
где — молярная концентрация электролита, выраженная в моль/м3, а вели-
чины электропроводности также выражены в единицах системы СИ (См - м''
и См м2 - моль как указано выше.
Если при расчетах использовать концентрацию в моль/л или
моль/дм3, то вычисления следует вести по формуле
A = Z-Аэ= 1000—, (7.8а)
Ci
В химическом эксперименте удобнее выражать удельную прово-
димость в мСм/см (миллисименс на сантиметр) или даже мкСм/см
(микросименс на см).
В отличие от удельной электропроводности молярная и эквива-
лентная проводимости возрастают с разбавлением раствора, то есть
с уменьшением с0, и стремятся к предельным значениям, Аг и Аэ„,
соответственно. Это так называемые электрические проводимости при
бесконечном разбавлении, которые являются постоянными величинами
при определенной температуре.
186 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Эквивалентная электропроводность сильных электролитов в об-
ласти малых концентраций описывается эмпирическим уравнением
Кольрауша (уравнением квадратного корня):
(7.9)
где Аэ — эквивалентная электрическая проводимость при данной концентра-
ции е0; а — эмпирическая константа
Предельную эквивалентную проводимость Лэ,- с достаточной точ-
ностью можно определить экспериментально, экстраполируя прямой
опытную зависимость Лэ = до пересечения с осью ординат
(Со - 0).
Для растворов слабых электролитов зависимость Лэ =
не линейная и асимптотически приближается к ординате при е0 —» 0.
Для слабых электролитов величину Лээ нельзя определить экспери-
ментально, ее рассчитывают теоретически.
Вопросы и задачи для самоконтроля
1. За счет чего электролиты проводят электрический ток?
2. Что называют степенью диссоциации электролита? Чему равна
степеньдиссоциацииасильногоэлектролитавводномрастворе?
3. Укажите, какие из приведенных ниже веществ в водных раство-
рах являются: а) сильными электролитами и б) слабыми элек-
тролитами:
KI, Са(ОН)2. НЕ НЫОч. ЫН4ОН. АИОНК Н2СО,. LiOH. HNO2.
HBr.
4. Как можно экспериментально определить предельную эквива-
лентную электропроводность сильного электролита?
5. В чем отличие хода зависимостей эквивалентной и удельной
электропроводности от концентрации?
Экспериментальная часть
Выполнение работы возможно как традиционным методом, так
и с использованием цифрового оборудования. В первом случае для
измерения удельной электропроводности используют кондуктометр
(раздел 1.4), для измерения температуры — термометр. Во втором
случае используют цифровые датчики электропроводности и темпе-
ратуры. Получают зависимость электропроводности от объема добав-
ленного реагента непосредственно в ходе опыта как в виде графика
на экране компьютера, так и в виде цифровой таблицы. Использова-
Глава 7. Вода и водные растворы «187
ние цифрового оборудования позволяет сделать эксперимент более
наглядным, значительно упростить и ускорить его, избежать субъек-
тивных ошибок при измерении параметров.
Появляется возможность развития эксперимента, например изуче-
ние электропроводности при разных температурах, изменения элек-
тропроводности в динамике.
Оборудование: кондуктометр, термометр, мерные колбы на 50 мл —
5 шт., бюретка на 50 мл, химический стакан на 100 мл, штаг ив хими-
ческий.
Реактивы: растворы 0,1 М КС1, 0,1 М NaCl, 0,1 М NaOH, 0,1 М
КОН, 0,1 М НО, 0,1 М HNOj в соответствии с заданием.
Ход работы
1. Получите у преподавателя вариант задания в соответствии
с табл. 7.8. где V)— объем исходного 0,1 М раствора для приготовления
разбавленных растворов.
Таблица 7.8
№ ва- рианта Электролит Vt, мл № ва- рианта Электролит К- мл
1 КС1 1;2.5; 5; 7,5; Ki 4 КОН 1; 2,5; 5; 7.5, 10
2 NaCl 1;2,5; 5; 7,5; 1(1 5 НС1 1; 2,5; 5; 7,5; 10
3_, NaOH 1;2,5; 5; 7,5; 10 6 HNO} t; 2,5; 5; 7,5,10
2. Сформируйте табл. 7.9 опытных и расчетных данных, куда запи-
шите формулу заданного электролита (ст. 2) и объемы У,- (ст. 3)
Таблица 7.9
№ колбы Электролит К, мл Cj, моль/л °измер Г, К Л, Лээил,
1 2 3 4 5 6 7 8 10
3. Приготовьте пять растворов заданного электролита меньших
концентраций. Для этого налейте в колбы на 50 мл из бюретки объ-
емы 0,1 М раствора, указанные в табл. 7.8. Добавьте дистиллированной
воды до метки. Тщательно перемешайте, закрыв колбу пробкой и не-
сколько раз перевернув ее. Колбы пронумеруйте.
4. Подготовьте кондуктометр к работе в соответствии с инструкци-
ей. Включите в сеть, опустите электрод в стакан с дистиллированной
водой, дайте прибору прогреться.
188 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
5. Начните измерение с раствора наименьшей концентрации. Вы-
лейте 1-й раствор в стакан на 100 мл. Опустите в стакан термометр,
значение температуры Тзапишите в ст. 7 табл. 7.9.
6. Поместите в 1-й раствор измерительный электрод кондуктоме-
тра, протерев его предварительно фильтровальной бумагой. Измерьте
удельную электрическую проводимость раствора, как указано в разде-
ле 1.4. Запишите результат в ст. 6 табл. 7.9.
7. Вылейте раствор в сливную емкость. Сполосните стакан неболь-
шим количеством 2-го раствора.
8. Налейте в стакан 2-й раствор и измерьте его электрическую
проводимость, повторяя действия п. 5—7. Запишите результат
в табл. 7.9.
9- Проведите аналогичным образом измерения о остальных трех
растворов. Результаты запишите в табл. 7.9.
Обработка экспериментальных данных
1. Рассчитайте молярную концентрацию ct всех приготовленных
растворов по формуле:
е, = 0,1 V, (мл)/50 (мл)
и величину -Тс- Запишите значения в столбцы 4 и 5 табл. 7.9.
2. Рассчитайте эквивалентную электропроводность Аэ по формуле
(7.8а), подставляя о в См/см. Результаты занесите в ст. 8 табл. 7.9.
3. Постройте графики зависимости ст от с,- и Лэ от х/с. Сделайте вы -
вод о справедливости отнесения данного вешества к сильным электро-
литам.
4. Экстраполируйте полученный график прямой до пересече-
ния с осью ординат и определите величину ЛЭ5Г. Результат занесите
в табл. 7.9.
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, датчик электропроводности, датчик объ-
ема жидкого реагента, шприц на 10 мл, магнитная мешалка, датчик
температуры терморезисторный, химический стакан на 100 мл, бюрет-
ка или цилиндр на 50 мл. штатив химический.
Реактивы: растворы 0,1 М КС1, 0,1 М Ь)аС1, 0,1 М NaOH, 0,1 М
кон, 0,1 м на, 0,1 м hnOj.
Глава 7. Вода и водные растворы «189
Ход работы
1. Соберите установку для измерения электропроводности, как по-
казано на рис. 1.22. Подсоедините сначала датчик температуры к USB-
порту компьютера.
2. В стакан на 100 мл с помощью мерной посуды (бюретка, ци-
линдр) отмерьте (по указанию преподавателя) 60, 75 или 80 мл дистил-
лированной воды. Поставьте стакан на магнитную мешалку и опустите
датчик температуры.
3. Включите компьютер, запустите программу «Практикум». После
идентификации датчика запустите измерение и запишите температуру Т
после ее стабилизации. После этого отключите датчик температуры.
4. Проведите измерение электропроводности растворов заданного
электролита, добавляя из шприца постепенно 0,1 М исходный раствор,
как описано в опыте 4 раздела 1.5 с применением цифрового оборудова-
ния. Данные сохраните в компьютерной папке «Электропроводность».
Обработка экспериментальных данных
1. Сформируйте табл. 7.9 опытных и расчетных данных, как пока-
зано выше.
2. Постройте график зависимости ст от объема добавленного элек-
тролита Vf. Для этого выберите из экспериментальной таблицы (о — И)
15—20 точек во всем диапазоне измерений. Значения V/ и соответству-
ющие им значения о для этих точек внесите в столбцы табл. 7.9.
3. Для каждой выбранной экспериментальной точки i рассчитайте
молярную концентрацию раствора с,- по формуле
с,-=е0-Р</(Г0+1<), (7.10)
где Г'о — исходным объем воды; V, — объем добавленного раствора электролита
исходной концентрации rD (здесь 0,1 М).
Результаты занесите в ст. 4 табл. 7.9-
4. Далее обработку данных проводите, как указано выше в п. 1—4
обработки данных для опыта с кондуктометром.
Работа 26. Исследование водных
растворов слабых электролитов
кондуктометрическим методом
Цель работы-, определение зависимости электрической проводимо-
сти от концентрации раствора слабого электролита. Определение сте-
пени и константы диссоциации слабого электролита.
190 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Теоретическая часть
В растворе слабого электролита устанавливается равновесие между
образовавшимися ионами и недиссоциированными частицами, кото-
рое характеризуется константой диссоциации. Например, для реакции
диссоциации слабой кислоты НА Н+ + А выражение для термо-
динамической константы диссоциации имеет вид:
где он, и «А — равновесные относительные активности отдельных ионов
и молекул, безразмерные величины: а = а (моль/л)/1 моль/л.
Концентрация ионов в растворах слабых электролитов мала, поэ-
тому межионным взаимодействием можно в первом приближении
пренебречь. В связи с этим коэффициенты активности в растворах
слабых электролитов считают равными единице и вместо активностей
в расчетные формулы подставляют относительные концентрации: с =
с (моль/л)/1 моль/л.
Например, для слабой кислоты выражение для константы диссо-
циации имеет вид:
Лс = *д-С|'1':* , <7.11а>
где с,,, и сНА —равновесные относительные концентрации ионов и молекул.
Для слабого основания, которое диссоциирует как
ROH R- + ОН :
Кс = Ка = С«'_С™ .
(7.116)
Константы диссоциации являются безразмерными величинами
и зависят от природы электролита и от температуры, но не зависят
от концентрации раствора. Чем больше константа диссоциации при
прочих равных условиях, тем больше способность электролита распа-
даться на ионы при растворении. В настоящем пособии значения /С,
для некоторых слабых электролитов приведены в Приложении VI
Степень диссоциации а и константа диссоциации слабого электро-
лита Кя связаны между собой и исходной концентрацией раствора с0
зависимостью
ct2ca2 _ а2с0 _ а1
ёа(1-а) 1-а (1-а)Г’
(7.12)
Глава 7. Вода и водные растворы «191
где V - \/сй — так называемое «разведение» раствора.
Уравнение (7.12) называется законом Оствальда.
В случае а « 1 уравнение упрощается:
ЛГд-а2^ и а~^Ка/с0. (7.13)
Из уравнения (7.13) следует, что степень диссоциации уменьшается
с увеличением концентрации слабого электролита.
Между эквивалентной электрической проводимостью слабых элек-
тролитов и их степенью диссоциации а существует простая, но важная
взаимосвязь:
а = Л3/ЛЭ5С. (7.14)
Таким образом, чтобы определить степень диссоциации в раство-
ре заданной концентрации при данной температуре, необходимо из-
мерить удельную проводимость этого раствора, затем рассчитать мо-
лярную Л и эквивалентную Лэ проводимости по уравнениям (7.8) или
(7.8а). Зная предельную эквивалентную проводимость электролита
при данной температуре, можно затем определить а по формуле (7.14).
Определив степень диссоциации в растворе заданной концентра-
ции при данной температуре, можно оценить константу диссоциации
электролита при этой температуре по уравнению Оствальда (7.12)
Вопросы и задачи для самоконтроля
1. В чем отличие сильных и слабых электролитов?
2. Что называют степенью диссоциации электролита? В каких пре-
делах может меняться степень диссоциации а слабого электро-
лита в водном растворе?
3. Укажите, какие из приведенных ниже веществ в водных раство-
рах являются: а) сильными электролитами и б) слабыми элек-
тролитами:
Nal. Ва(ОН)2, HCN, HNO2, А1(ОН)л, HI, NaOH, H2SO3, НЕ
4. Вычислите концентрацию ионов Н + в 0,5 М растворе СН3СООН
и эквивалентную электрическую проводимость этого раствора
при 298 К, если Лэ„ = 390,7 см2 - См - моль-1.
5. Выведите формулу зависимости константы диссоциации слабого
электролита от величины его эквивалентной электропроводности.
6. Предложите опыт по определению Л.зх слабого электролита при
некоторой температуре, если известна константа его диссоциа-
ции при этой температуре.
192 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Экспериментальная часть
Выполнение работы возможно как традиционным методом, так
и с использованием цифрового оборудования. В первом случае для
измерения удельной электропроводности используют кондуктометр
(раздел 1.4), для измерения температуры — термометр. Во втором слу-
чае используют цифровые датчики электропроводности и температу-
ры. Получают зависимость электропроводности от объема добавлен-
ного реагента как в виде графика на экране компьютера, так и в виде
таблицы непосредственно в ходе опыта.
Появляется возможность развития эксперимента, например опре-
деление констант диссоциации различных слабых электролитов при
разных температурах.
Оборудование: кондуктометр, стакан на 100 мл, термометр, мерные
колбы па 50 мл — 5 шт., бюретка на 50 мл.
Реактивы: 1 М растворы СН,СООН и NH^OH.
Ход работы
1. Получите у преподавателя вариант задания в соответствии
с табл. 7.10.
Таблица 7.10
№ ва- рианта Электролит Vt, мл № ва- рианта Электролит К, мл
1 CHjCOOH 1;5;10; 12,5; 20 4 Ь1Н4ОН 1,5; 10; 12,5; 20
2 СНэСООН 2,5; 5,7,5; 10; 15 5 nh4oh 2,5; 5; 7,5; 10; 15
3 СНзСООН 4; 6; 12; 15; 20 6 nh4oh 4,6; 12; 15; 20
2. Приготовьте пять растворов исходного электролита меньших
концентраций. Для этого заполните бюретку 1 М раствором и отмерь-
те в пять колб на 50 мл объемы Vh указанные в табл. 7.10, доведите
дистиллированной водой до метки, закройте пробкой и перемешайте.
Колбы пронумеруйте.
3. Сформируйте таблицу 7.11 опытных и расчетных данных в соот-
ветствии со своим вариантом.
Глава 7. Вода и водные растворы «193
4. Подготовьте кондуктометр к работе в соответствии с инструкци-
ей. Включите в сеть, опустите электрод в стакан с дистиллированной
водой, дайте прибору прогреться.
5. Начните измерение с раствора наименьшей концентрации. Вы-
лейте 1-й раствор в стакан на 100 мл. Опустите в стакан термометр, из-
мерьте температуру раствора. Значение Тзапишите в ст. 11 табл. 7.11.
6. Поместите в 1-й раствор измерительный электрод кондуктоме-
тра, протерев его предварительно фильтровальной бумагой. Измерьте
удельную электрическую проводимость раствора, как указано в разде-
ле 1.4. Запишите результат в ст. 6 табл. 7.11.
7. Вылейте раствор в сливную емкость. Сполосните стакан неболь-
шим количеством 2-го раствора.
8. Налейте в стакан 2-й раствор и измерьте его электрическую про-
водимость, повторяя действия п. 5—7. Запишите результат в табл. 7.11.
9. Проведите аналогичным образом измерения ст остальных трех
растворов. Результаты запишите в табл. 7.11.
Обработка экспериментальных данных
1. Рассчитайте молярную концентрацию с,- каждою из пяти при-
готовленных растворов по формуле:
с, = 1 - ГДмл)/50 (мл).
Запишите значения в ст. 4табл. 7.11.
2. Рассчитайте молярную и эквивалентную электропроводность Л
и Л3 по формуле (7.8а). Результаты занесите в ст. 7 табл. 7.11.
3. Постройте по опытным данным графики зависимости ст от и Л3
от х/е7- На основании хода этой зависимости сделайте вывод о справед-
ливости отнесения данного вешества к слабым электролитам.
4. Рассчитайте степень диссоциации а электролита в раство-
ре данной концентрации по формуле (7.14). При расчете учтите, что
предельная эквивалентная электрическая проводимость Лэж раство-
ра CHjCOOH при 291 К равна 350,0 см2-См-моль-1, а при 298 К —
390,7 см2-См-моль-1; Л,, раствора NH4OH при 291 К — равна
238,0 см2 См - моль-1, а при 298 К — 271,4 см2 - См - моль-1. Запишите
полученные значения а в ст. 8 табл. 7.11.
5. Рассчитайте по закону Оствальда (7.12) АдрЛ1Ч для каждой из кон-
центраций и запишите в ст. 9 табл. 7.11. вычислите усредненное значе-
ние АГд1РС4Н, запишите результат в ст. 10 табл. 7.11.
6. Рассчитайте относительную погрешность в определении Кд
в сравнении с табличными значениями (Приложение VI)
194 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование-, компьютер, датчик электропроводности, датчик
объема жидкого реагента, шприц на 10 мл, датчик температуры тер-
морезисторный, магнитная мешалка, химический стакан на 100 мл,
штатив.
Реактивы'. 1 М растворы СН3СООН, NH4OH.
Ход работы
1. Получите вариант задания у преподавателя (табл. 7.10)
2. Проведите измерение электропроводности раствора сла-
бого электролита в зависимости от концентрации на установке
(рис. 1.22), как описано в работе 25 для растворов сильных электро-
литов, с тем шличием, что добавляйте из шприца 1 М исходный рас-
твор электролита.
Обработка экспериментальных данных
1. Сформируйте таблицу 7.11 опытных и расчетных данных в соот-
ветствии со своим заданием, как показано выше.
2. Постройте график зависимости ст от объема добавленного элек-
тролита Vj. Для этого выберите из экспериментальной таблицы 15—
20 точек во всем диапазоне измерений. Значения Vt и соответствую-
щие им значения о для этих точек внесите в табл. 7.11.
3. Для каждой выбранной экспериментальной точки рассчитай-
те молярную концентрацию раствора с,- по формуле (7.10), с учетом
с0 = 1 моль/л. Результаты занесите в ст. 4 табл. 7.11.
4. Далее обработку данных проводите, как указано в п. 2—6 обра-
ботки данных для опыта с кондуктометром.
Работа 27. Исследование растворов
сильных электролитов
методом рН-метрии
Цель работы: получение зависимостей водородного показателя
среды pH от концентрации растворов сильных электролитов, прове-
дение расчетов по опытным данным, определение концентрации рас-
твора по измеренному значению pH.
Глава 7. Вода и водные растворы «195
Теоретическая часть
Важнейшей количественной характеристикой водного раствора
служит водородный показатель pH, который, по определению, равен
pH = -lgoH., (7.15)
где — относительная активность ионов Н+ в данном растворе
В соответствии с определением активности (7.5) активность ио-
нов Н
"н^нА- <716)
Полярные молекулы воды являются очень слабым электролитом.
В воде и растворах незначительно идет обратимый процесс Н2О +
Н2О <=* HjO+ + ОН ", который называется самоионизаиией. Диссоциа-
цию воды обычно записывают в более простом виде.
Н2О<=» Н+ + ОН
Константа диссоциации этого процесса при 298 К равна
= =1 8 10-i6 (7 17)
ЙН2О
Активность воды можно считать постоянной, примерно равной от-
носительной концентрации:
йн2о = гн2о = 1000/18 = 55.5.
Тогда
Л”в = йн* йон- = Лд-55.5. (7-18)
Таким образом, произведение относительных активностей ионов
Н+ и ОН’ есть величина постоянная для данной температуры и назы-
вается ионным произведением воды (АГВ). При 298 К ионное произведе-
ние Кв = Ю-14. С ростом температуры Кв увеличивается, так как само-
ионизация — эндотермический процесс. Для воды и нейтральных
растворов при 298 К ан. = = V^b = Ю-7; для кислых сред — ан. >
10~7, <. 10-7; для основных — йон > 10 7, аИ. < 10~’ В соответ-
ствии с определением (7.15) при 298 К pH нейтральных растворов ра-
вен 7, для кислых растворов pH < 7 и для основных сред pH > 7.
По аналогии с водородным показателем введен показатель гидрок-
сид-ионов:
pOH=-lgaOH.. (7.19)
196 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Подставляя в выражение ионного произведения воды (7.18) пока-
затели pH и рОН, получим для 298 К соотношение:
pH + рОН = 14. (7.20)
Коэффициенты активности у, отражают все имеющие место межи-
онные взаимодействия в растворе. Чем слабее взаимодействие между
частицами в растворе, тем ближе значение у к единице. В области раз-
бавленных растворов (ниже 0,1 моль/л) коэффициенты активности
зависят главным образом от концентрации и заряда ионов и мало за-
висят от природы растворенных веществ. Эта закономерность полу-
чила название правила ионной силы: ионы одного заряда, независимо
от их природы, в разбавленных растворах с одинаковой ионной силой име-
ют одинаковые коэффициенты активности.
Ионной силой раствора называется полусумма произведений кон-
центраций всех типов ионов, присутствующих в растворе, на квадрат
их заряда:
7=0,5 (7.21)
Зная ионную силу, можно определить коэффициенты активности
отдельных ионов, например по табличным данным (Приложение VII).
Для расчета pH растворов сильных кислот и оснований следует сна-
чала записать необратимое уравнение электролитической диссоциа-
ции и определить ионный cociaB раствора. Затем рассчитать ионную
силу раствора по уравнению (7.21) и определить коэффициенты ак-
тивности ун. или уон (Приложение VII). Далее для кислот нужно
рассчитать активность по уравнению (7.16), для оснований — ак-
тивность ионов ОН" по формуле (7.5):
аон — ^он ’сон
Наконец, для кислот рассчитать pH по уравнению (7.15); для ос-
нований рассчитать рОН по формуле (7.19) и pH по уравнению (7.20)
Вопросы и задачи для самоконтроля
1. Почему расчет водородного показателя среды для очень разбав-
ленных растворов сильных кислот можно проводить по прибли-
женной формуле
pH=-lgcH,?
2. Рассчитайте активности ионов Н+ и ОН - в некотором растворе,
если его pH = 13,23.
Глава 7. Вода и водные растворы «197
3. Рассчитайте ионную силу раствора, содержащего смесь электро-
литов 0,02 М H,SO4 и 0,03 М K2SO4.
4. Рассчитайте pH 0,001 М раствора Ва(ОН)2.
5. Рассчитайте молярную концентрацию раствора Са(ОН)2. если
его pH = 10,5.
Экспериментальная часть
Выполнение работы возможно как традиционным методом, так
и с использованием цифрового оборудования. Описание эксперимен-
та и обработки данных даны для обоих вариантов.
В первом случае для измерения водородного показателя pH ис-
пользуют лабораторный pH-метр (раздел 1.4). Каждый студент готовит
и исследует один-два раствора разных концентраций. Затем данные
объединяют для получения зависимости. Во втором случае использу-
ют цифровой датчик pH и цифровой датчик объема жидкого реагента.
Каждый студент получае! свою зависимость водородного показателя
pH от объема добавленного реагента на экране компьютера непосред-
ственно в процессе опыта.
Использование цифрового оборудования позволяет упростить
и ускорить эксперимент, максимально индивидуализируя его. Про-
грамма «Практикум» позволяет сохранить экспериментальные дан-
ные в графическом и цифровом виде на любом электронном носителе
и провести компьютерную обработку данных.
Появляется возможность значительного развития эксперимента,
например изучение водородного показателя pH широкого круга рас-
творов электролитов при разных температурах, изменения pH в дина-
мике — в ходе химической реакции.
Оборудование: лабораторный pH-метр, химический стакан
на 100 мл — 2 шт., мерные колбы на 100 (или 50) мл, магнитная мешал-
ка, tuiaiив химический, штагив для электродов, бюретка на 25 мл (или
мерная пипетка).
Реактивы: стандартный 1 М раствор соляной кислоты НО.
Ход работы
1. Из 1 М стандартного раствора НО приготовьте в мерной колбе
100 мл (или 50 мл) раствора меньшей концентрации. Значения объ-
емов 1 М кислоты для приготовления разбавленного раствора получи-
те у преподавателя и занесите их в ст. 2 табл. 7.12. Отмерьте заданный
объем в мерную колбу из бюретки. Доведите раствор до метки дистил-
лированной водой, закройте колбу пробкой и тщательно перемешайте.
198 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Измерьте pH приготовленного раствора с помощью pH-метра
в соответствии с его инструкцией, как описано в главе I. Запишите ре-
зультат в ст. 3 табл. 7.12.
3. Получите у преподавателя раствор кислоты неизвестной кон-
центрации. Проведите измерение pH с помощью pH-метра, как опи-
сано выше. Запишите установившееся значение pH раствора в ст. 3
табл. 7.12.
Обработка экспериментальных данных
1. Сформируйте табл. 7.12 опытных и расчетных данных, как по-
казано ниже.
Таблица 7.12
Кислота рн„змер с,-, моль/л рНрзсч ДрН
1 3 4 5 7 8 9 10
pH, г.
2. Рассчитайте молярную концентрацию раствора кислоты с,- для
каждого из заданных «-объемов по формуле ef = (1 Vj)/ Vv, где — объ-
ем добавленной 1 М кислоты; 10 — объем приготовленного раствора
(50 или 100 мл). Занесите значения в ст. 4 табл. 7.12.
3. Определите активность ионов водорода по измеренному pH
и коэффициент активности ун, по формуле (7.16). Запишите значе-
ния тн, в ст. 5 табл. 7.12.
4. Для каждой из концентраций с,- рассчитайте и запишите
в табл. 7.12:
• ионную силу раствора / по формуле (7.21) — ст. 6;
• коэффициенты активности Тн, (Приложение VII) — ст. 7;
• активность ан ионов Н+ по формуле (7.16) — ст. 8;
• pH раствора по формуле (7.15) — ст. 9;
• ошибку опыта ДрН = |рНрасч — рНизмср| — ст. 10.
5. Постройте на одном графике зависимости измеренного и рас-
считанного pH от с,-, используя данные других членов бригады.
6. Определите концентрацию контрольного раствора кислоты сх
по полученной в п. 5 экспериментальной зависимости.
Глава 7. Вода и водные растворы «199
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, датчик pH, датчик объема жидкого реа-
гента, химический стакан на 100 мл — 2 шт., мерная колба на 100 мл,
магнитная мешалка, штатив химический, штатив для электродов, бю-
ретка на 25 мл (или мерная пипетка), шприц на 10 мл.
Реактивы: стандартный 1 М раствор соляной кислоты НС1.
Ход работы
1. Соберите установку для pH-метрических измерений, как пока-
зано на рис. 7.4. В лапке химического штатива закрепите датчик объе-
ма жидкого реагента. Под датчиком расположите магнитную мешалку.
2. Снимите аккуратно с электрода датчика pH сосуд для хранения,
в котором находится раствор КС1. Поместите электрод в стакан с дис-
тиллированной водой, в котором датчик будет находиться, пика со-
бирается установка.
3. Заполните шприц на 10 мл 1 М стандартным раствором соляной
кислоты, наденьте на иглу защитный колпачок, чтобы избежать слу-
чайных капель. Вставьте шприц в датчик жидкого реагента так. чтобы
толкатель вплотную подходил к поршню шприца. (При этом несколь-
ко капель кислоты может вытечь в защитный колпачок.)
4. Приюювьте исход-
ный раствор 0,01 М соляной
кислоты: в мерную колбу
на 100 мл отмерьте точное по-
мощью бюретки или пипетки
1 мл 1 М раствора НС1, дове-
дите до метки дистиллирован-
ной водой, закройте пробкой
и перемешайте
5. Вылейте весь приготов-
ленный раствор в химический
стакан на 100 мл и поставьте
его на магнитную мешалку.
Включите мешалку и уста-
новите равномерный режим
перемешивания.
6. Опустите в стакан с ис-
следуемым раствором элек-
трод датчика pH, предвари-
Рис. 7.4. Установка для исследования
зависимости pH от концентрации раствора.
/ — электронный блок датчика жидкого
реагента, 2 — датчик жидкого реагента:
3— электрод датчика pH. 4— электронный
блок датчика pH, 5 — магнитная мешалка
20D • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
тельно промокнув его фильтровальной бумагой и закрепив в держателе
штатива для электродов. Электрод датчика pH не должен касаться сте-
нок и дна стакана, при этом игла шприца датчика жидкого реагента
должна быть направлена в стакан.
7. Подсоедини1е дагчики с помощью кабелей к USB-nopiaM ком-
пьютера.
8. Включите компьютер, запустите программу «Практикум». Убе-
дитесь, что программа идентифицировала оба датчика. При этом
на экране должны появиться шаблоны двух графиков: «Зависимость
pH от времени» и «Зависимость объема добавленного раствора от вре-
мени». Обнулите показания датчика объема жидкого реагента кноп-
кой «Настройка» в окне измерений.
9. На панели управления выберите режим «Зависимость одного
от другого по нажатию». При этом на экране должен появиться ша-
блон графика, отображающий зависимость текущего значения pH
от объема добавленного раствора.
Установите пределы измерений по осям координат: по абсциссе
X — (0—10) мл, по ординате Y — (0—4).
10. Начните измерение. После стабилизации значения датчика pH
(контролируют по цифровому показанию) нажмите клавишу «Про-
бел» на клавиатуре компьютера и нанесите на график первую точку,
отвечающую pH исходного 0,01 М раствора кислоты.
11. Аккуратно снимите защитный колпачок с иглы шприца. До-
бавьте из шприца около 0,1 мл (2 капли) раствора в стакан. После ста-
билизации показания датчика pH нанесите на график 2-ю точку, на-
жав клавишу «Пробел». Добавьте следующую порцию (около 0,2 мл)
раствора электролита и после стабилизации значения pH снова от-
метьте точку на графике. После этого объем добавляемого раствора
можно увеличить до 0,3—0,5 мл. Добавляйте электролит в стакан, пока
не израсходуется все содержимое шприца, каждый раз отмечая точки
на графике клавишей «Пробел» после стабилизации pH. После этого
остановите измерение.
12. Сохраните результаты, экспортировав графические и таблич-
ные данные во внешние файлы папки «Водородный показатель».
13. Получите у преподавателя контрольный раствор кислоты неиз-
вестной концентрации. Проведите измерение pH контрольной пробы
до стабилизации показания датчика pH Сохраните резулыагы, экс-
портировав графические и табличные данные во внешние файлы пап-
ки «Водородный показатель».
14. По окончании всех измерений промойте электрод датчика pH
дистиллированной водой и наденьте на него защитный сосуд для хра-
Глава 7. Вода и водные растворы • 201
нения. Кислоту из стакана слейте в специальную емкость. Тщательно
промойте стаканы и колбу водой.
Обработка экспериментальных данных
1. Сформируйте табл. 7.12 опытных и расчетных данных, как по-
казано выше.
2. Из всего диапазона полученных компьютерных табличных дан-
ных выберите 10— 15 значений и pH и вставьте их в ст. 2 и 3 табл. 7.12.
Запишите значение pH контрольного раствора в ст. 3 табл. 7.12.
3. Рассчитайте молярную концентрацию раствора кислоты с,- для
каждой выбранной точки по формуле: cf = (0,01 К, + 1 - Vi)/(V0 + Ю,
где Уо — исходный объем 0,01 М раствора кислоты (здесь 100 мл); Vt —
объем добавленного 1 М раствора НС1 из шприца. Занесите значения
в ст. 4 таблицы 7.12.
4. Далее проведите обработку данных, как указано выше в п. 3—6
обработки данных опыта с использованием pH-метра.
Развитие опыта
Аналогичный опыт можно провести для других доступных сильных
кислот и оснований таких как, HNO3, H,SO4, Hl, HCIO4, NaOH, КОН,
LiOH, сравнить полученные зависимости pH от с0 для сильных элек-
тролитов разной природы, сравнить коэффициенты активностей для
сильных электролитов разной природы в растворах с одинаковой ион-
ной силой, оценить границы применимости правила ионной силы.
Работа 28. Исследование растворов слабых
электролитов методом рН-метрии
Цель работы-, определение зависимости водородного показате-
ля среды и степени диссоциации от концентрации раствора слабого
электролита.
Теоретическая часть
(см. также теоретическую часть к работам 26 и 27)
При расчете pH растворов слабых электролитов обычно пренебре-
гают межионным взаимодействием и допускают, что = ен_. Тогда
pH = -lgcH, (7.22)
202 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
pOH=-lgcOH (7.22а)
Для расчета pH таких растворов следует сначала записать обра-
тимое уравнение электролитической диссоциации, определить
константу диссоциации электролита по справочным данным (При-
ложение VI); далее рассчитать степени диссоциации а по уравне-
нию (7.12) или (7.13). Наконец, для кислот рассчитать концентра-
цию ионов водорода по формуле ен- = а-са и pH по уравнению
(7.22); для оснований рассчитать концентрацию ионов гидроксида
по формуле еон- -а-с0, рОН — по формуле (7.22а) и pH — по урав-
нению (7.20)
Поскольку pH раствора слабого электролита при постоянной тем-
пературе однозначно определяется его концентрацией, можно опыт-
ным путем решать обратную задачу — определять концентрацию рас-
твора с помощью измерения его pH. Например, если раствор
CHjCOOH неизвестной концентрации с0 имеет опытное значение
pH = А, то относительная равновесная концентрация ионов Н+ равна
10-А: сн+ = 10 А. Составим табл. 7.13 материального баланса для реак-
ции диссоциации уксусной кислоты CHjCOOH СН3СОО_ + Н
в растворе с концентрацией с0
Таблица 7.13
Концентрация CHjCOOH CHjCOO Н*
Сисх Ai 0 0
Ас 10 л ю-л 10 л
Ср» «и Q 10-л 10 л Юл
Запишем выражение для константы диссоциации СН3СООН:
сн* ссн3соо Ю А Ю А
QsHjCooh Ci— Ю
(7-23)
Из уравнения (7.23) можно легко определить неизвестную концен-
трации раствора е0, используя табличное значение константы диссо-
циации и опытное значение pH = А.
Вопросы и задачи для самоконтроля
1. Как определить степень диссоциации слабого электролита ме-
тодом рН-метрии?
Глава 7. Вода и водные растворы • 203
2. Почему расчет водородного показателя среды для растворов сла-
бых кислот и оснований можно проводить по приближенной
формуле: pH = ?
3. Рассчитайте концентрации ионов Н+ и ОН в некотором раство-
ре слабого электролита, если его pH = 10.2.
4. Вычислите константу диссоциации Лд цианистоводородной
кислоты HCN, если степень диссоциации ее в 0,01 М водном
растворе равна 2,83 -10-4.
5. Можно ли использовать приближенную формулу для оценки
степени диссоциации a HNO2 в 10-3 М растворе?
6. Рассчитайте молярную концентрацию раствора NH4OH, если
его pH = 9,5.
Опыт 1. Определение зависимости водородного
показателя среды и степени диссоциации
от концентрации раствора слабой кислоты
Выполнение опыта возможно как традиционным методом, так
и с использованием цифрового оборудования. В первом случае для
измерения водородного показателя pH используют лабораторный pH -
метр (раздел 1.4). Во втором случае используют цифровой датчик pH
и цифровой датчик объема жидкого реагента.
Экспериментальная часть
Оборудование: лабораторный pH-метр. химический стакан
на 100 мл, мерная колба на 50 (100) мл с пробкой — 3 шт., бюретка
на 25 мл (или мерная пипетка).
Реактивы: 1 М раствор уксусной кислоты СН3СООН.
Ход работы
Опыт рекомендуется выполнять бригадой из 2—3 человек для объеди-
нения данных и построения зависимости.
1. Получите у преподавателя задание: 2—3 объема V, (мл) 1 М кис-
лоты для приготовления 50 или 100 мл растворов меньшей концен-
трации.
2. Сформируйте табл. 7.14 опытных и расчетных данных, как по-
казано ниже. Запишите задание в табл. 7.14.
3. Заполните бюретку 1 М раствором уксусной кислоты СН (СООН,
отмерьте заданные объемы 1 М раствора в мерные колбы на 50 или
100 мл. Доведите объем раствора до метки дистиллированной водой.
204 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Плотно закройте колбы пробкой и хорошо перемешайте. Пронуме-
руйте колбы.
4. Измерьте pH растворов с помощью pH-метра, как описано в раз-
деле 1.4. Результаты запишите в ст. 3 табл. 7.14.
5. Получюе контрольный раствор СН3СООН, измерьте его pH. За-
пишите результат контрольного опыта в табл. 7.14.
Обработка экспериментальных данных
1. Рассчитайте молярную концентрацию раствора кислоты о для
каждого из заданных объемов по формуле с,- = (1 V,)/ Уо, где У; — объем
добавленной 1 М кислоты; Уо — объем приготовленного раствора (50
или 100 мл). Занесите значения в ст. 4 табл. 7.14.
Таблица 7.14
Кислота И рНизмер С. сн а рЦрасч дрН
1 2 3 4 5 6 7 8 9
2. Для каждой из концентраций с, определите и запишите
в табл. 7.14:
• концентрацию сн+ на основе измеренного pH по формуле: сн. ~
= ю-ph _ ст. 5;
• степень диссоциации а на основе измеренного pH по формуле
— ст. 6;
• степень диссоциации, исходя из приближенной формулы
Оствальда (7.9) и табличной константы диссоциации — ст. 7;
• теоретическое значение pH по формуле (7.22) — ст. 8;
• ошибку опыта: ДрН = |рНр.„;Ч — рНИ1Н<ф| — ст. 9
3. Постройте на одном графике две зависимости: измеренного
и рассчитанного водородного показателя pH от концентрации кисло-
ты Сделайте вывод о характере этих зависимостей и соответствии
их друг другу.
4. Определите концентрацию контрольного раствора кислоты
по экспериментальной зависимости, полученной в п. 3.
5. Постройте на одном графике две зависимости: эксперименталь-
ной и рассчитанной степени диссоциации а от концентрации кислоты
е,-. Сделайте вывод о характере этих зависимостей и соответствии их друг
другу. С чем может быть связано наблюдаемое различие? Сделайте вы-
вод о применимости приближенной формулы (7.13) в вашем случае.
Глава 7. Вода и водные растворы • 205
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, датчик pH, датчик объема жидкого реа-
гента, два химических стакана на 100 мл, мерная колба на 100 мл, маг-
нитная мешалка, штатив химический, штатив для электродов, бюрет-
ка на 25 мл (или мерная пипетка), шприн на 10 мл.
Реактивы: I М раствор уксусной СН3СООН или муравьиной НСООН
кислот.
Ход работы
1. Проведите измерение pH, выполняя п. 1 — 14 эксперименталь-
ной части работы 25 с использованием цифровой лаборатории с тем
отличием, что вместо соляной кислоты используйте 1 М раствор ук-
сусной или муравьиной кислоты.
2. Контрольный опыт. Получите у преподавателя раствор СН3СООН
или НСООН неизвестной концентрации Проведите измерение pH
с помощью датчика pH. как описано выше. Сохраните результат, экс-
портировав данные во внешние файлы
Обработка экспериментальных данных
1. Сформируйте табл. 7.14 опытных и расчетных данных, как по-
казано выше.
2. Из всего диапазона полученных компьютерных табличных дан-
ных выберите 10—15 значений V/ и pH и вставьте их в ст. 2 и 3 табл. 7.14.
Запишите значение pH контрольного раствора в ст. 3 табл. 7.14
3. Рассчитайте молярную концентрацию раствора кислоты с,- для
каждой выбранной точки по формуле: ct = (0,01 - Vo + 1 - И;)/(1о + I’),
где Уо — исходный объем 0,01 М раствора кислоты (здесь 100 мл); —
объем добавленного 1 М раствора кислоты из шприца. Занесите значе-
ния в ст. 4 таблицы 7.14.
4. Далее проведите обработку данных, как указано в п. 2—5 обра-
ботки данных опыта 1 с использованием рН-метра.
Развитие опыта
Аналогичный опыт можно провести для других доступных слабых
кислот и оснований таких как, HNO2, H2SO3, Н3ВО3, Н2С2О4, Н3РО4,
NH4OH. Определение степени диссоциации для разных электролитов
одинаковой концентрации. Сравнение силы электролитов.
206 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 2. Определение константы диссоциации
слабой кислоты методом pH-метрии.
Идентификация кислоты
Выполнение опыта возможно как традиционным методом,
так и с использованием цифрового оборудования. В первом слу-
чае для измерения водородного показателя pH используют ла-
бораторный pH-метр (раздел 1.4). Во втором случае используют
цифровой датчик pH и цифровой датчик объема жидкого реаген-
та (рис. 7.4) Поскольку ход опыта и обработка данных в целом
идентичны, описание дано на примере использования цифрового
оборудования
Оборудование: компьютер, датчик pH, химический стакан
на 100 мл — 2 шт., мерная колба на 50 мл — 2 шт., магнитная мешал-
ка, штатив химический, штатив для электродов, бюретка на 25 мл (или
мерная пипетка), шприц на 10 мл.
Реактивы: растворы 0,1 М слабых кислот: CHjCOOH. HNO2,
НСООН, Н2С2О4, Н3РО4 и др., дистиллированная вода.
Ход работы
1. Получите у преподавателя 0,1 М раствор неизвестной слабой
кислоты.
2. Приготовьте два раствора меньшей концентрации: 0,02 М
и 0,002 М последовательным разбавлением (Концентрации могут
варьироваться.) Для этого в первую мерную колбу на 50 мл отмерьте
из бюретки 10 мл 0,1 М исходного раствора, долейте дистиллирован-
ной водой до метки, перемешайте раствор. Во вторую мерную колбу
отмерьте пипеткой 5 мл приготовленного 0,02 М раствора, долейте
дистиллированной водой до метки, перемешайте
3. Проведите измерение pH трех растворов до стабилизации по-
казания датчика pH, как описано выше в опыте 1 с использованием
цифровой лаборатории. Начинайте измерение с наиболее разбавлен-
ного раствора.
4. Сохраните результаты, экспортировав графические и табличные
данные во внешние файлы папки «Водородный показатель».
Обработка экспериментальных данных
1. Сформируйте табл. 7.15 опытных и расчетных данных, как по-
казано ниже.
Глава 7. Вода и водные растворы • 207
• рассчитайте концентрацию сн, на основе измеренного pH
по формуле сн< = 10 рн и запишите результат в ст. 4 табл. 7.15;
• рассчитайте значение Кд из выражения, аналогичного (7.23), за-
пишите в ст. 5 табл. 7.15.
3. Рассчитайте среднее значение Ка. Результат запишите в ст. 6
табл. 7.15.
4. Из Приложения VI выберите значение Кд, наиболее близкое
к полученному в п. 3. Идентифицируйте кислоту, запишите вывод
в ст. 7 табл. 7.15.
Развитие опыта
Измерение pH растворов слабых электролитов при различных тем-
пературах с использованием термостатируюшего устройства. Опреде-
ление зависимости констант диссоциации от температуры.
Работа 29. Гидролиз солей. Исследование
растворов солей методом рН-метрии
Цель работы-, измерение водородного показателя растворов гидро-
лизующихся солей, установление зависимости pH и степени гидроли-
за от концентрации растворов, определение концентрации раствора
и степени гидролиза соли по измеренному pH.
Теоретическая часть
Гидролизом солей называют реакции обмена между водой и раство-
ренными солями. Практически все соли являются сильными электро-
литами, в воде они полностью диссоциированы на ионы, которые мо-
гут подвергаться гидролизу. Все соли можно разделить на 4 типа.
20В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
1) Соли, образованные сильными кис ютами и слабыми основаниями
(например, N H4NO3, AgNO3, AICI3 CuSO4 и др.), при растворении
в воде дают кислую реакцию среды (pH < 7). С молекулами воды
взаимодействует катион соли, в результате чего образуется слабое
основание и некоторый избыток ионов водорода, например:
NH4 + H2O<z±NH4OH+Нч.
2) Соли, образованные слабыми кислотами и сильными основаниями
(например, K2SiC>3, Na2S, Ва(СН3СОО)2 и др.), при растворении
в воде дают основную реакцию среды (pH > 7). С молекулами воды
взаимодействует анион соли, в результате чего образуется слабая
кислота и некоторый избыток гидроксил-ионов. например:
СН3СОО- + Н2О СН3СООН + ОН-
3) Соли, образованные сильными кислотами и сильными основания-
ми (например, KI, NaBr, CsCI, RbNOj и др.), при растворении
в воде образуют нейтральный раствор (pH = 7), поскольку ни ка-
тионы, ни анионы таких солей не вступают в обменные реакции
с водой.
4) Соли, образованные слабыми кислотами и слабыми основаниями
(NH4CN, РЬСОз, AI2Sj и др.), при растворении в воде образу-
ют либо слабокислые, либо слабоосновные, либо нейтральные
растворы. С молекулами воды взаимодействуют одновременно
и катион, и анион соли. Реакция среды для таких солей опреде-
ляется соотношением констант диссоциации продуктов гидро-
лиза.
Гидролиз многозарядных ионов протекает ступенчато, например:
Fe3+ -1- FeOH2+ + Нт (1-я ступень): (7.24а)
FeOH3+ + Н2О Fe(OH)| + Н3 (2-я ступень); (7.246)
Fe(OH)| + Н2О Fe(OH)3 + Н+ (3-я ступень). (7.24в)
В растворе присутствуют все типы гидролизованных частиц, но ги-
дролиз по 1-й ступени всегда сильно преобладает.
Количественной характеристикой глубины протекания гидролиза
является степень гидролиза р:
Р=—, (7.25)
с0
где <т — равновесная концентрация гидролизованных ионов; сс — исходная
концентрация ионов соли, подвергающихся гидролизу.
Глава 7. Вода и водные растворы • 209
Характеристикой гидролитического равновесия является констан-
та гидролиза КГ, которая равна отношению относительных равновес-
ных активностей продуктов гидролиза и негидролизованных ионов
и является безразмерной величиной. При расчетах для упрощения
вместо активностей в формулы подставляют относительные равновес-
ные концентрации. Например, в случае равновесия (7.24а) выражение
для константы гидролиза приближенно можно записать как
(7.26)
Нетрудно показать, что в общем случае константа гидролиза соли
по определенной ступени равна ионному произведению воды Кв, де-
ленному на константу диссоциации слабого электролита Кд, образую-
щегося по данной ступени гидролиза:
Кг
(7.27)
Степень гидролиза р связана с константой гидролиза КТ и исходной
относительной концентрацией гидролизующихся ионов соотноше-
нием, аналогичным закону Оствальда:
, _р2
г~1-р
Если р << 1, то можно считать, что
*Гг-р2-с0 и ₽»7АГг/с0.
(7.28)
(7.29)
Из формулы (7.29) следует, что с уменьшением концентрации рас-
твора соли степень ее гидролиза увеличивается.
Пример. Рассчитайте величины Кг> Р и pH для 0,01 М раствора FeClj
Решение.
1. Рассчитаем для первых двух ступеней гидролиза (7.24а-б) константы
по формуле (7.27), используя табличные значения Ад Ре(ОН)}из Приложения V:
10 14
1,35 10
Величина Кг. более чем на порядок меньше КГ<, поэтому в первом при-
ближении 2-й ступенью гидролиза можно пренебречь. Гидролиз по 3-й ступе-
ни можно тем более не учитывать.
210 * ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Рассчитаем степень гидролиза р по 1-й ступени по формуле (7.28), по-
лучим: р 0,57 Более половины всех ионов гидролизовано. Следовательно,
приближенную формулу (7 29) в этом случае использовать нельзя
3. Из уравнения гидролиза (7.24а) следует, что относительные равновес-
ные концентрации:
По определению, р = Fc°H—, откуда Сн- = Р-си = 0,57 10 2 =
= 5,7 10-\
Тогда pH = —lgcH, = —lg5,7 10” =2,24, что соответствует кислой среде.
Константу гидролиза можно определить экспериментально, изме-
рив pH раствора соли известной концентрации сь. Например, если из-
меренный pH раствора FeCl3 равен А, то равновесные концентрации:
V -И) *
Тогда для равновесия (7.24а) имеем
Определив /^Г| > можно далее рассчитать константу диссоциации
слабого электролита — продукта гидролиза по формуле (7.27).
С другой стороны, рассчитав АТГ| по формуле (7.27) с использова-
нием табличного значения Ка и измерив pH раствора неизвестной
концентрации, можно определить по уравнению (7.30) исходную мо-
лярную концентрацию со раствора гидролизующейся соли.
Степень гидролиза можно также определить опытным путем, изме-
рив pH раствора соли известной концентрации с0, и рассчитать, исходя
изопределения (7.25).
Например, для равновесия (7.24а) и pH = А, по определению:
с ,. с * I о-А
p = _F£eL=_H_ = l^_ (73|)
с0 с0 <?0
Таким образом, метод pH-метрии оказывается очень информатив-
ным при исследовании растворов гидролизующихся солей.
Вопросы и задачи для самоконтроля
I. Какие из перечисленных ниже солей в водном растворе дают:
а) кислую среду; б) основную среду; в) нейтральную среду — Nal,
Глава 7. Вода и водные растворы «211
CdBr,, KNO3, NaNO2, ZnCl2, BaCI2, CuSO„, NaF, CH4COONH4, K,CO3,
Na2SiOj?
2. Напишите выражения для констант гидролиза иона SO3 по 1-й
и 2-й ступеням, рассчитайте значения этих констант, используя та-
бличные значения Кд.
3. Почему при расчете pH рас i воров i идролизующихся солей мож-
но не учитывать 2-ю ступень гидролиза? Сравните константы гидро-
лиза K2SO3 по 1-й и 2-й ступеням
4. Чему равна степень гидролиза no 1 -й ступени соли K2S в раство-
ре с концентрацией 10-J моль/л?
5. Чему равен pH 0,05 М раствора ZnSO4? (учитывать только 1-ю
ступень гидролиза).
6. Увеличится или уменьшится степень гидролиза р при увеличе-
нии концентрации раствора ZnSO4?
7. Рассчитайте молярную концентрацию раствора СН3СООК, если
его водородный показатель pH равен 8,5.
8. Рассчитайте константу гидролиза некоторой соли по 1-й ступе-
ни, если pH 0.5 М раствора равен 9.0.
Опыт 1. Получение зависимости pH и степени
гидролиза от концентрации раствора
гидролизующейся соли
Экспериментальная часть
Выполнение опыта возможно как традиционным методом, так
и с использованием цифрового оборудования. Описание эксперимен-
та и обработка данных приведены для обоих вариантов.
В первом случае рекомендуется проводить работу бригадой
из 2—Зстудентов. Каждый студент исследует два-три раствора одной
соли разной концентрации. Затем данные объединяются для получе-
ния зависимости.
Оборудование: лабораторный pH-метр, электронные весы, мер-
ная колба на 100 мл, мерные колбы на 50 мл — 2 шт., мерная пипетка
на 5 мл, стаканы химические на 50 мл — 2 шт.
Реактивы: кристаллические соли A12(SO4)j, РеС1з, ZnSO4, CuSO4,
РЬ(ЫОз)2 — в соответствии с заданием, дистиллированная вода.
Ход работы
1. Получите задание у преподавателя — значение концентрации
раствора соли, который следует приготовить. Запишите формулу соли
в ст. I, а концентрацию С] — в ст. 4 табл. 7.16.
212 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Рассчитайте массу навески т соли, необходимую для приго-
товления 100 мл раствора Ns 1 заданной молярной концентрации о
по формуле:
т =
где т — искомая масса соли, г; М — молярная масса соли, г/моль; V— объем
раствора (здесь 0,1 л).
Значение массы запишите вст. 2 табл. 7.16.
3. Взвесьте рассчитанную массу соли в стаканчике на электронных
весах, предварительно обнулив массу тары (как описано в разделе 1.5).
4. Приготовьте из этой массы 100 мл раствора. Для этого в ста-
канчик добавьте примерно */4 объема дистиллированной воды, раз-
мешайте стеклянной палочкой, аккуратно перелейте в мерную колбу
на 100 мл. Если соль не растворилась до конца, операцию повторите.
После растворения сполосните стакан дистиллированной водой и этот
смыв вылейте в колбу. Следите, чтобы суммарный объем воды не пре-
высил 100 мл. Доведите объем в колбе до ме|КИ, аккуратно доливая
воду из стакана. Тщательно перемешайте, закрыв колбу пробкой и не-
сколько раз перевернув ее.
5. Приготовьте растворы Ns 2 и 3 меньшей концентрации после-
довательным разбавлением в 10 раз. Для получения раствора Ns 2 от-
берите мерной пипеткой 5 мл исходного раствора № 1, перенесите
в мерную колбу на 50 мл, добавьте дистиллированной воды до метки,
перемешайте. Для получения раствора № 3 отберите пипеткой 5 мл
раствора N® 2, перенесите в мерную колбу на 50 мл, добавьте дистил-
лированной воды до метки, перемешайте. Запишите концентрации с2
и е3 растворов Ns 2 и 3 в ст. 4 табл. 7.16.
6. Подготовьте лабораторный pH -метр к работе и измеры е pH при-
готовленных растворов, как описано в разделе 1.4 и работах 28, 29. За-
пишите значения pH„JMCp в табл. 7.16.
Глава 7. Вода и водные растворы • 213
2. Составьте уравнение реакции гидролиза исследуемой соли
по всем ступеням.
3. Напишите выражение для константы гидролиза по 1-й ступени
Л Г| и рассчитайте ее значение по формуле (7.27) (см. теоретическую
часть работы). Занесите полученное значение в ст. 6 табл. 7.16.
4. Рассчитайте для каждой концентрации с степень гидролиза р
по формуле (7.29). Результаты занесите в ст. 7 табл. 7.16. По получен-
ным данным сделайте вывод о возможности использования прибли-
женной формулы в каждом случае.
5. Рассчитайте pH раствора для каждой концентрации с соли, учи-
тывая только 1-ю ступень гидролиза (см. пример в теоретической ча-
сти работы). Запишите значения в ст. 8 табл. 7.16
6. Рассчитайте ДрН (абсолютную ошибку опыта) как разницу рас-
считанного и измеренного значений pH. Запишите в ст. 9 табл. 7.16.
7. Объедините данные всех членов бригады. Постройте на одном
графике зависимости рассчитанного и опытного pH от концентрации
с исследуемой соли. Сделайте вывод по характеру зависимостей.
8. Постройте зависимость р от с и сделайте вывод по зависимости.
Экспериментальная часть с использованием
цифровой лаборатории
В данном случае используют цифровой датчик pH и цифровой дат-
чик объема жидкого реагента. Каждый студент получает свою зависи-
мость водородного показателя pH от объема добавленною реагента,
состоящую из большого числа точек, непосредственно в процессе
опыта.
Использование цифрового оборудования позволяет упростить
и ускорить эксперимент, делая его очень компактным и максимально
индивидуализируя его. Можно обойтись без стационарного рН-метра,
избежать субъективных ошибок при измерении параметров. Програм-
ма «Практикум» позволяет сохранить экспериментальные результа-
ты в графическом и цифровом виде на любом электронном носителе
и провести компьютерную обработку данных.
Оборудование: компьютер, электронные весы, датчик pH, датчик
объема жидкого реагента, химический стакан на 100 мл — 2 шт., мер-
ная колба на 50 мл — 2 шт., магнитная мешалка, штатив химический,
штатив для электродов, бюретка на 25 мл или мерная пипетка, шприц
на 10 мл, стеклянная палочка.
Реактивы: кристаллические соли A12(SO4)j, FeCl}, ZnSO4, CuSO4,
Pb(NOj)2 — в соответствии с заданием, дистиллированная вода.
214 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ХОД работы
1. Получите у преподавателя некоторую массу одной из указанных
солей.
2. Взвесьте выданную соль на электронных весах и запишите ее
массу в ст. 2 табл. 7.17.
3. Из этой навески приготовьте 50 мл раствора № 1, как описано
выше в пункте 4 традиционною варианта настоящего опыта.
4. Из раствора № 1. полученного в п. 3, приготовьте разбавленный
раствор № 2. Для этого в мерную колбу на 50 мл отмерьте с помощью
бюретки или пипетки 1 мл раствора № 1, доведите до метки дистилли-
рованной водой, закройте пробкой и перемешайте.
5. Соберите установку для измерения pH растворов, как показано
на рис. 7.3. Налейте в стакан 100 мл раствора № 2 и поставьте на маг-
нитную мешалку. Заправьте шприц раствором № 1.
6. Проведите измерение pH растворов, выполняя п. 1—14 экспе-
риментальной части работы 28 с использованием цифровой лаборато-
рии. Установите пределы измерений по осям координат: по абсциссе
X — (0—10) мл, по ординате Y — (2—7).
7. Сохраните результаты, экспортировав графические и табличные
данные во внешние файлы папки «Гидролиз».
8. Вылейте исследованный раствор из стакана и налейте в него
оставшийся раствор № 1. Запустите измерение и зафиксируйте значе-
ние pH раствора, после чего остановите измерение.
9. Сохраните данные, экспортируя их во внешний файл папки «Ги-
дролиз».
10. После окончания измерений ицательни промойте да|чик pH
дистиллированной водой и наденьте на электрод защитный сосуд для
хранения.
Глава 7. Вода и водные растворы • 215
2. Рассчитайте молярную концентрацию с, раствора № 1 по фор-
муле с, = т/(MV), где т — масса соли, г; М — молярная масса соли,
г/моль; V — объем приготовленного раствора (50 мл). Результат запи-
шите в ст. 5 табл. 7.17.
3. Рассчитайте молярную концентрацию с2 раствора № 2, получен-
ного разбавлением, по формуле
С|И = ^2И2,
где И, = 1 мл — объем раствора № 1 с концентрацией с,; Уг = 50 мл — объем
приготовленного раствора № 2.
Запишите значение с2 в ст. 5 табл. 7.17
4. Из всего диапазона полученных компьютерных табличных дан-
ных выберите 10—15 значений Vt и соответствующих им значений pH
и запишите их в ст. 4 и 6 табл. 7.17.
5. Рассчитайте молярную концентрацию раствора соли с; для каж-
дой точки по формуле
Ci = (t2-hCi+e1Pi)/(h+ К),
где l'j = 50 мл; с2 — концентрация раствора № 2, Ц — объем добавленного
из шприца раствора № 1 концентрации et
Занесите полученные значения в ст. 5 табл. 7.17.
6. Далее обработку данных проводите, как описано выше для вари-
анта опыта с использованием рН-метра.
Опыт 2. Определение концентрации раствора
гидролизующейся соли и ее степени
гидролиза методом рН-метрии
Экспериментальная часть
Оборудование: лабораторный pH-метр, химический стакан
на 50 мл — 2 шт., мерная колба на 50 мл, стеклянная палочка.
Реактивы: кристаллические соли AI2(SO4)3, FeClj, ZnSO4, CuSO4,
Ph(NOj)2 — в соответствии с заданием, дистиллированная вода.
Ход работы
1. Получите у лаборанта навеску одной из перечисленных солей
и приготовьте в мерной колбе на 50 мл раствор соли, как описано выше
в п. 4 традиционного варианта опыта 1 настоящей работы. Массу на-
вески т и объем V приготовленного раствора запишите в соответству-
ющие ст. 2 и 3 табл. 7.18.
216 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Измерьте pH полученного раствора, используя pH-метр, как
описано в разделе 1.4 и работах 28, 29. Полученное значение рНизм за-
пишите в ст. 5 табл. 7.18.
Обработка экспериментальных данных
1. Сформируйте табл. 7.18 опытных и расчетных данных.
Таблица 7.18
Соль т. г И мл Со рас,, моль/л рН„з„ «Оизм, МОЛЬ/Л ₽
1 2 3 4 5 6 7
2. Вычислите молярную концентрацию приготовленного раствора
^отсор, исходя из массы навески. Полученное значение запишите в ст. 4
табл. 7.18.
3. Запишите уравнение реакции гидролиза по 1-й ступени
и вычислите молярную концентрацию соли с0изм в растворе на ос-
новании найденного значения водородного показателя среды pH
по уравнению, аналогичному (7.30). Полученное значение с0 тк
запишите в ст. 6 табл. 7.18. Сравните оба значения сп- Сделайте
вывод.
4. По рассчитанной в п. 3 концентрации е0 язм и измеренному
значению pH рассчитайте степень гидролиза соли р по формуле
(7.31). Полученное значение запишите в ст. 7 табл. 7.18. Сделайте
вывод.
Экспериментальная часть с использованием
цифровой лаборатории
Оборудование: компьютер, электронные весы, датчик pH. химиче-
ский стакан на 50 мл — 2 шт., мерная колба на 50 мл, магнитная ме-
шалка, штатив химический, стеклянная палочка.
Реактивы: кристаллические соли АЬ(8О«)з, FeCh, ZnSO4, CuSO4,
Pb(NOj)3, дистиллированная вода.
Ход работы
1. Получите у преподавателя некоторую массу одной из возмож-
ных солей. Определите массу выданной соли, взвесив ее в стаканчике
на электронных весах, предварительно обнулив массу тары (как опи-
сано в разделе 1.5). Запишите значение в ст. 2 табл. 7.18.
Глава 7. Вода и водные растворы • 217
2. Приготовьте из этой массы 50 мл раствора, как описано в пун-
кте 4 традиционного варианта опыта 1 настоящей работы.
3. Снимите с электрода датчика pH сосуд дли хранении, сполосни-
те его дистиллированной водой и опустите электрод в стакан с дистил-
лированной водой на время подготовки к измерениям.
4. Подключите датчик pH к компьютеру. Включите компьютер, за-
пустите программу «Практикум». После идентификации программой
датчика выберите на панели управления режим «Зависимость от вре-
мени». Установите пределы измерений по осям координат: по абсцис-
се X — (0—100) с. по ординате Y — (2—7).
5. Налейте в стакан на 50 мл исследуемый раствор примерно до по-
ловины, поставьте стакан на магнитную мешалку, включите переме-
шивание, опустите в раствор pH-электрод, закрепленный в лапке шта-
тива.
6. Начните измерение. Снимайте зависимость pH от времени в те-
чение 1—2 минут до стабилизации цифрового значения pH. Запишите
его в ст. 5 табл. 7.18.
7. Остановите измерение и сохраните результаты, экспортировав
их во внешний файл папки «Гидролиз».
8. Сполосните стакан и pH-электрод дистиллированной водой.
Наденьте на электрод сосуд для хранения.
Обработка экспериментальных данных
1. Сформируйте табл. 7.18 опытных и расчетных данных, как по-
казано выше.
2. Рассчитайте молярную концентрацию приготовленного раство-
ра <*отсор> исходя из массы навески. Запишите в ст. 4 табл. 7.18.
3. Напишите уравнения гидролиза заданной соли по всем ступе-
ням в молекулярном и ионном виде и выражения для констант гидро-
лиза по отдельным ступеням.
4. Рассчитайте константу гидролиза по 1-й ступени KTl по форму-
ле (7.27). (Пример расчета см. в теоретической части работы.)
5. Рассчитайте молярную концентрацию раствора Co»™ по из-
меренному значению pH по формуле, аналогичной (7.30). Запиши-
те значение е0изм в ст. 6 табл. 7.18. Сравните значения, полученные
в п. 3 и 5.
6. Рассчитайте степень гидролиза р соли по измеренному pH
и определенной в п. 5 молярной концентрации по формуле (7.31). За-
пишите в ст. 7 табл. 7.18. Сделайте общий вывод.
218 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 30. Определение энтальпии
реакции гидролиза карбонатов
щелочных металлов
Цель опыта: провести калориметрические измерения и с помощью
термодинамических расчетов по закону Лавуазье — Лапласа найти эн-
тальпию реакции, прямое экспериментальное определение которой
затруднено.
Теоретическая часть
Тепловые эффекты некоторых реакций по тем или иным причинам
прямым путем измерить невозможно. Например, определение тепло-
ты реакции гидролиза карбонат иона СО3~ по 1-й ступени
К2СО3{р.р) + Н2О(Ж) —> KHCOjlp.p) + КОН(Р.Р,,
или
СОз(Р-р) + Н2О(Ж> НСО3(р.р) + ОН(р р)
достаточно сложно, поскольку одновременно в той или иной степени
протекает и вторая стадия гидролиза. То есть при прямом определении
будет измеряться суммарный тепловой эффект двух стадий При этом
тепловой эффект обратной реакции нейтрализации гидрокарбоната
КНСОз щелочью:
КНСОз(р.р) + КОН1р.р(—» КэСОз(Р.р) + Н2О(Ж)
НСО3(р.р> + ОН (р р) —» СО3(р.р( + Н2О(Жj, Д/7н
измерить в реальных условиях вполне возможно.
Из термохимического закона Лавуазье — Лапласа следует, что те-
пловой эффект прямой реакции равен тепловому эффекту обратной
реакции, взятому с противоположным знаком. Тйким образом, опре-
делив энтальпию реакции нейтрализации ДЯН тидрокарбонага, мож-
но найти энтальпию реакции гидролиза карбоната (в расчете на 1 моль
соли): ДЯН = — ДЯГ.
Энтальпия реакции нейтрализации гидрокарбоната (с учетом доли
ионов, подвергшихся гидролизу) рассчитывается по уравнению
где л — число молей соли КНСО3, взятой для нейтрализации, л(КНСО3) =
= л(НСО3)=и(СО3); р — степень гидролиза иона СО]', которая рассчитыва-
ется исходя из формул (7.29) и (7.27).
Глава 7. Вода и водные растворы • 219
Вопросы и задачи для самоконтроля
1. Рассчитайте константу и степень гидролиза иона СО? по пер-
вой ступени в 0,1 М растворе К2СО3.
Экспериментальная часть
с использованием цифровой лаборатории
Работа может быть выполнена на калориметрической установке
с использованием как датчика температуры, так и лабораторного тер-
мометра. как описано в работе 9. Ввиду идентичности эксперимента
и обработки данных описание дано на примере применения цифрово-
го оборудования.
Оборудование: компьютер, электронные весы, датчик температуры,
калориметрическая установка, мерная колба на 50 мл, мерная пипетка
на 5 мл, химический стакан, штатив.
Реактивы: 2,5 М раствор КОН (или NaOH), кристаллический хло-
рид калия КС1, кристаллический гидрокарбонат калия КНСО3 (или
NaHCO3), дистиллированная вода.
Ход работы
1. Приготовьте 50 мл 0,25 М раствора КНСО3, как описано в пун-
кте 4 опыта 1 работы 30, предварительно рассчитав необходимую массу
соли /я. Значение запишите в ст. 1 табл. 7.19
2. Далее проводите действия, аналогичные п. 1—16 эксперимен-
тальной части цифрового варианта работы 9, за исключением того, что
в пункте 3 в калориметрический стакан вылейте весь приготовленный
раствор (50 мл) гидрокарбоната калия, а в пункте 9 добавьте с помо-
щью пипетки 5 мл 2,5 М раствора КОН.
Обработка экспериментальных данных
1. Сформируйте табл. 7.19 опытных и расчетных данных, как по-
казано ниже.
Таблица 7.19
«ксь г 1 ДГ| ЛГ3 кДж/К кДж/моль АЯгтеор. кДж/моль АЯгэксп, кДж/моль Д 8. %
1 2 ' 3 4 5 6 7 8 9 10
L
220 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Далее действуйте, как указано в п. 2—6 обработки данных циф-
рового варианта работы 9.
3. Рассчитайте теплоту реакции нейтрализации по формуле:
Си = ск-дт|.
4. Рассчитайте p-степень гидролиза иона СО, по первой ступени
по формуле (7.29).
5. Рассчитайте энтальпию реакции нейтрализации гидрокарбоната
ДЯН по формуле (7.32) и запишите в ст. 6 табл. 7.19.
6. Определите энтальпию гидролиза карбонат-иона ДЯр^,, 11 за-
пишите в ст. 8 табл. 7.19.
7. Определите теоретическое значение энтальпии ДЯртеор гидро-
лиза карбонат-иона COjjp.p, + НгО(Ж)-> HCOJ(p.p> + ОН(р_р, и запиши-
те в ст. 7 табл. 7.19.
8. Рассчитайте стандартную энтропию Д-У° и энергию Гиббса ДДС
реакции гидролиза по табличным данным (Приложение III) и на ос-
новании результатов сделайте вывод.
9. Рассчитайте абсолютную и относительную ошибки определения
Д Яг по формулам (I. I) и (1.2.). Запишите в столбцы 9 и Ю табл. 7.19-
Ю. Почему трудно определить тепловой эффект реакции гидроли-
за карбонат иона непосредственным измерением?
Работа 31. Влияние температуры на смещение
гидролитического равновесия
Цель работы: проведение измерения pH растворов гидролизую-
щихся солей при различных температурах; определение зависимости
константы гидролиза от температуры.
Теоретическая часть
Константа гидролиза, как любая константа равновесия, определяется
природой реакции и зависит от температуры. Из химической термоди-
намики известно, что эту зависимость можно выразить изобарой Вант-
1оффа, koi оран для случая гидролитическою равновесия будет иметь вид.
^1пЛ:г ДЯ°
(IT RT2’
(7.33)
где А) — константа гидролиза; А//'1 — стандартная энтальпия реакции гидро-
Глава 7. Вода и водные растворы • 221
Поскольку гидролиз — процесс эндотермический, то есть ДЯ° > 0.
с ростом температуры Кг увеличивается, выход продуктов гидролиза
растет.
Принимая в первом приближении независимость ДЯ" от темпера-
туры, уравнение (7.33а) можно записать в интегральной форме:
In——
ДЯ‘7 1 1 А
r [т; т;/
(7-34)
Таким образом, измерив pH растворов гидролизующейся соли
для нескольких температур и рассчитав соответствующие константы
гидролиза, можно определить тепловой эффект реакции гидролиза
по уравнению (7.34).
Вопросы и задачи для самоконтроля
1. Увеличивается или уменьшается pH раствора ZnSO4: а) при по-
вышении 1емпературы; б) при увеличении концентрации рас-
твора ZnSO4? Ответьте на основании принципа Ле Шателье.
2. Рассчитайте тепловой эффект реакции гидролиза, если pH 0,5 М
раствора соли увеличился с 9,0 при 298 К до 9,5 при 328 К
3. При нагревании 0,1 М раствора соли его pH увеличился с 10,5
до 11. Во сколько раз изменятся степень гидролиза и константа
гидролиза соли?
Экспериментальная часть
Выполнение работы возможно как традиционным способом, так
и с использованием цифрового оборудования Описание эксперимен-
та дано для обоих вариантов
Оборудование: лабораторный pH-метр, термометр, магнитная ме-
шалка с нагревом или термостат, мерная колба на 50 (100) мл — 2 шт.,
бюретка на 50 мл.
Реактивы: 1 М раствор ацетата калия СН^СООК или натрия
CHjCOONa, фенолфталеин.
Ход работы
1. Получите задание у преподавателя в соответствии с табл. 7.20.
2. Приготовьте растворы заданной концентрации из исходного 1 М
раствора. Для этого рассчитайте объемы к'о исходного раствора соли
концентрации е0 = 1 моль/л, необходимые для приготовления 50 или
222 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
100 мл растворов № 1 и № 2 указанной в ст. 2 и 3 концентрации с. Ре-
зультат запишите в ст. 4 и 5 табл. 7.20. Отмерьте из бюретки в колбу
на 50 (100) мл рассчитанный объем Уо, долейте до метки дистиллиро-
ванной водой, закройте пробкой и перемешайте, несколько раз пере-
вернув колбу.
Таблица 7.20
№ варианта с, моль/л мл ,,-с
Р-р№ 1 Р-р №2 Р-р№1 Р-р №2
1 2 3 4 5 6
1 0,5 0,05 25; 40; 70
2 0,2 0,02 25; 50; 75
3 0,1 0,01 30; 45; 65
4 0,4 0,04 1 25; 50; 70
3. Измерьте pH приготовленных растворов с помощью рН-метра.
а температуру Т} растворов с помощью термометра. Запишите резуль-
таты в ст. 2 и 3 табл. 7.21.
4. Стакан с раствором № 1 поставьте на магнитную мешалку, вклю-
чите перемешивание и нагрев. Внесите в стакан 1—2 капли фенол-
фталеина. Опустите в раствор термометр и при достижении заданной
температуры (температура может на 1—2 градуса отличаться) снимите
стакан с мешалки и переместите его на столик рН-метра.
5. Измеряйте pH в течение одной минуты, контролируя одновре-
менно температуру раствора термометром. Запишите установившееся
значение pH и соответствующую ему температуру Т2 в табл. 7.21. От-
метьте цвет раствора.
6. Повторите действия п. 4—5, произведя нагрев до более высокой
заданной температуры Ту. (Температура может на 1—2 градуса отли-
чаться от заданной). Запишите результаты в табл. 7.21.
7. Если цвет раствора не изменился, продолжите нагрев до тех пор,
пока раствор не порозовеет. Отметьте температуру.
8. Повторите действия п. 4—7 с раствором № 2. Запишите резуль-
таты измерений в табл. 7.21.
Обработка экспериментальных данных
1. Сформируйте таблицу 7.21 опытных и расчетных данных.
2. По измеренному pH и известным концентрациям раствора рас-
считайте Кт по формуле (7.30а) для всех трех температур и двух кон-
центраций. Запишите значения в ст. 5 и 6 табл. 7.21.
Глава 7. Вода и водные растворы • 223
Таблица 7.21
Соль 1 К pH р-р № 1 pH р-р № 2 Аграсч Р-Р № 1 Аррасч Р-Р №2 Арсреди ДЯ,
1 2 3 4 5 6 7 8
т,
т
т}
3. Усредните значения, полученные для одной температуры для
двух разных концентраций, запишите значение Аг средн в ст. 7 табл. 7.21.
4. Рассчитайте ДЯГ по изобаре Вант-1оффа (7.34). Запишите значе-
ние в ст. 8 табл. 7.21.
5. Сделайте вывод о зависимости Кг от Т.
6. Составьте уравнение реакции гидролиза соли. Объясните на-
блюдаемое изменение окраски раствора при повышении температуры.
Сделайте вывод о смешении гидролитического равновесия при нагре-
вании.
Экспериментальная часть
с использованием цифровой лаборатории
В данном случае вместо стационарного pH-метра и термоста-
та используют цифровой датчик pH и цифровое термостатирующее
устройство.
Использование цифрового оборудования позволяет упростить
и ускорить эксперимент, сделать его более компактным, точным, из-
бежать субъективных ошибок при измерении температуры. Програм-
ма «Практикум» позволяет сохранить экспериментальные результа-
ты в графическом и цифровом виде на любом электронном носителе
и провести компьютерную обработку данных.
Появляется возможность развития эксперимента, например из-
учение pH различных солей при разных температурах, изменение pH
в динамике — в ходе смешения гидролитического равновесия.
Оборудование: компьютер, датчик pH, датчик температуры, термо-
статирующее устройство, кювета, магнитная мешалка, две мерные
колбы на 100 мл, бюретка на 50 мл.
Реактивы: 1,0 М раствор ацетата калия СНЯСООК или натрия
CHjCOONa, фенолфталеин.
Ход работы
1. Получите задание у преподавателя (табл. 7.20).
224 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Приготовьте по 100 мл растворы заданной концентрации из ис-
ходного 1 М раствора, как описано выше для традиционного опыта
3. Соберите установку для измерения pH с термостатирующим
устройством, как показано на рис. 7.4.
4. Снимите с электрода датчика pH сосуд для хранения и опусти-
те электрод в стакан с дистиллированной водой, где сохраняйте его
до проведения измерений.
5. Поставьте кювету на магнитную мешалку, наденьте на кювету
термостатирующее устройство (рис. 7.5).
6. Налейте в кювету 100 мл приготовленного раствора меньшей
концентрации № 2, капните 3—4 капли индикатора и включите маг-
нитную мешалку.
Рис. 7.S. Установка для pH-измерении с термостатирующим устройством
1 — кювета, 2 — магнитная мешалка. 3 — электронный блок датчика
pH, 4 — термостатирующееустройство, 5 — рН-электрод
7. Подключите термостатирующее устройство к блоку питания.
Блок питания включите в розетку сети
8. Подключите к USB-портам компьютера датчик pH и термоста-
тирующее устройство
9. Опустите в кювету электрод датчика pH, закрепив его в лапке
штатива над кюветой.
10. Включите компьютер и запустите программу «Практикум».
11. После обнаружения программой термостатирующего устрой-
ства установите наименьшую заданную температуру термостата, на-
пример 25 °C. Для лог о в рабочем окне необходимо указа1ь 1емпера-
турный интервал, например 24,9—25,1.
12. После обнаружения датчика pH на экране появится шаблон
графика зависимости pH от времени. Установите пределы по осям ко-
ординат: по абсциссе X — (0—120) с, по ординате У — (7—11).
Глава 7. Вода и водные растворы • 225
13. Включите термостат и перемешивание, при этом загорится
лампочка — нагреватель. По достижении нужной температуры раство-
ра лампа выключится.
14. После установления температуры в термостате введите темпе-
ратурную поправку для датчика pH в окне измерения и запустите из-
мерение.
15. Фиксируйте зависимость «pH — время» до стабилизации
pH, после чего остановите измерение. Запишите значение pH в ст. 3
табл. 7.21. Отметьте цвет раствора.
16. Сохраните данные, экспортировав их во внешний файл. Выбе-
рите место сохранения файла, например в папке «Гидролиз».
17. Далее повторите еще два раза действия п. 10—16, задавая дру-
гие температуры на термостате и вводя каждый раз температурную по-
правку для датчика pH.
18. После окончания опыта вы кл юч ите магнитную мешалку и блок
питания. (Нельзя оставлять включенный термостат вне раствора!)
Вылейте содержимое кюветы, промойте ее дистиллированной водой
и протрите фильтровальной бумагой.
19. Повторите действия п. 5—18 для раствора № 2 большей кон-
центрации.
Обработка экспериментальных данных
1. Сформируйте табл. 7.21 опытных и расчетных данных, как по-
казано выше.
2. Из полученных компьютерных зависимостей определите pH для
всех трех температур и обеих концентраций раствора и запишите зна-
чения в ст. 3 и 4 табл. 7.21.
3. Далее проводите обработку данных, как указано выше в п. 2—6
обработки данных для традиционного опыта. Результаты заносите
в табл. 7.21.
Работа 32. Исследование буферных растворов
Цель работы: приготовление буферных растворов с заданным pH
и определение их буферной емкости, определение константы диссо-
циации слабого электролита
Теоретическая часть
Буферными называют растворы, pH которых относительно мало ме-
няется при добавлении небольших количеств кислот или оснований.
226 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Как правило, они представляют собой смесь слабой кислоты и ее соли,
например СН3СООН и СН3СООК, или слабого основания и его соли,
например bJH4OH и МН4С1. В таких растворах соль диссоциирована
полностью, а слабый электролит диссоциирован в очень малой степе-
ни, так как равновесие его диссоциации практически полностью сме-
щено влево. Например, в ацетатном буфере:
СН3СООН снчсоо- + Н
CHjCOOK -> СН3СОО- + к
При добавлении какой-либо кислоты в такой буферный раствор
ее ионы водорода связываются в слабую кислоту буфера ионами соли*
Н + + СН3СОО- СН3СООН
При добавлении в буферный раствор основания его гидроксид-ион
связывается ионами Н+ буфера в слабый электролит — воду: ОН ‘ +
+ н+ - н,о.
Образование слабых электролитов и обусловливает устойчи-
вость pH.
Запишем выражение для константы диссоциации уксусной кислоты:
°сн,соои °сн,соон
Преобразовав это выражение относительно и логарифмируя
его, получаем:
pH „у, , , (7.36)
°СИ3СООН
гдерХд = -1g Ад.
Так как соль полностью диссоциирована, а доля диссоциированной
кислоты ничтожно мала, можно считать, что концентрация аиетат-ио-
нов в буферном растворе равна концентрации соли: tcn>coc>- ~ с««и-
Поскольку диссоциация кислоты подавлена, можно принять, что кон-
центрация недиссоциированной кислоты равна исходной концентра-
ции кислоты: ^chjCooh = скммоты- В первом приближении можно заме-
нить активности концентрациями в выражении (7.36). В результате
получаем:
°СН3СОО~ CCHjCOO *40111)
йСН!СООП CCHjCOOH ^кислоты
Глава 7. Вода и водные растворы • 227
Соответственно имеем приближенное выражение для расчета pH
буферного раствора:
рН = рЛд + 1ёг£^- (7-37)
Аналогичным образом для pH буфера, состоящего из слабого осно-
вания и его соли, получим:
pH -14 - рЛ-д + 1gС°—™ (7.38)
Как видно из формул (7.37) и (7.38), при равных концентрациях
соли и слабого электролита в буфере
pH = рКя = — lg Ka — для кислоты
и
pH = 14 — рКл — для слабого основания. (7.39)
В данной работе выражения (7.37) и (7.38) используются для рас-
чета количеств слабого электролита и его соли, необходимых для при-
готовления буферных растворов с заданным pH, а также для расчета
константы диссоциации слабого электролита по измеренному pH
Область pH, в которой буфер эффективен, обычно составляет +1
отрКд.
Под буферной емкостью £2 обычно понимают чувствительность pH
буфера к добавлению сильной кислоты или шелочи и определяют как
где Дс — количество добавленных к буферу ионов Н* или ОН в пересчете
на моль/л; ДрН — изменение pH при этом.
Из формулы (7.40) вытекает менее строгое, но более наглядное тол-
кование буферной емкости как количества кислоты или щелочи, кото-
рое нужно добавить к 1 л раствора, чтобы изменить (снизить или уве-
личить) его pH на единицу.
Например, если при добавлении к 50 мл ацетатного буфера 2 мл
0,5 М раствора НО значение pH буферного раствора изменится на 0,4,
то Ас = (0.5 - 0,002)/(50 + 2) -10 3 = 1,9 |<Н моль/л; £2 = 1,9 10~2/0,4 =
= 0,0475 (моль/л).
Во многих природных системах буферы играют важную роль. На-
пример, плазма крови является бикарбонатным буфером и поддержи-
вает pH крови в пределах 7,2—7,6
228 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Вопросы и задачи для самоконтроля
1. Рассчитайте pH буферного раствора на основе НСООН и ее
соли, если смешали 40 мл 0,1 М НСООК и 60 мл 1 М НСООН.
2. Рассчитайте, как изменится pH приведенного выше раство-
ра, если в него добавить: а) кислоты НС! до концентрации
10_J моль/л; б) шелочи КОН до концентрации 10-2 моль/л.
3. Чему будет равен pH ацетатного буфера, для приготовления ко-
торого растворили 8,2 г CHjCOONa в 100 мл 1 М СН3СООН?
4. Чему равна буферная емкость раствора, если при добавлении
к 50 мл буфера 2 мл 0.5 М НС1 его pH изменился на 0.4 единицы?
Экспериментальная часть
с использованием цифровой лаборатории
Работу можно выполнять с использованием как лабораторного pH -
метра, так и цифровой лаборатории. В последнем случае опыты значи-
тельно проще и быстрее. Кривые титрования буфера получаются не-
посредственно на экране компьютера, что делает эксперимент очень
наглядным. Использование цифровой лаборатории позволяет сохра-
нить данные на любом электронном носителе и провести компьютер-
ную обработку данных.
В связи с идентичностью основных операций и обработки данных
описание дано на примере использования цифровой лаборатории.
Опыт 1. Приготовление буферного раствора
с заданным pH. Определение буферной
емкости приготовленного раствора
Оборудование: компьютер, весы, датчик pH. датчик объема жидкого
реагента, два шприца на 10 мл. магнитная мешалка, две мерные колбы
на 100 мл, мерная пипетка на 10 мл, бюретки на 25 мл, стеклянная па-
лочка, шпатель.
Реактивы: растворы 1 М и 0,1 М СН3СООН. 1 М и 0,1 М ЫН4ОН,
0,5 М NaOH, 0,5 М HCI, кристаллические ацетат натрия CH3COONa
и хлорид аммония N Н4С1
Ход работы
1. Получите у преподавателя вариант задания в соответствии
с табл. 7.22.
2. Сформируйте таблицу 7.23 опытных и расчетных данных, как
показано ниже.
Глава 7. Вода и водные растворы • 229
Таблица 7.22
№ ва- рианта Буфер 1 Буфер 2
Состав pH V, мл Состав pH V. мл
1 0,1М CHjCOOH + + CHjCOONa 4 100 1 M CHjCOOH + + CHjCOONa 4 100
2 0,1 М CHjCOOH + + CHjCOONa 5 100 1 M CHjCOOH + + CHjCOONa 5 100
3 0,1 MNH4OH + NH4CI 9 100 1 M NH4OH + NH4C1 9 100
4 0,1 M NH.,OH + NH4Cl 10 100 1 M NH4OH + NH4CI 10 100
Таблица 7.23
Буфер I Буфер 2
Состав буферного раствора тсолн, г
V буферного раствора, мл 100 100
с слабого электролита, моль/л 0,1 1,0
pH исходного буфера
1иаон Для подъема pH на 2 ед
Phci Для снижения pH на 2 ед.
Буферная емкость О, моль/л
3. Рассчитайте массу соли тм„ CHjCOONa или NH4C1, необходи-
мую для добавления к 0,1 М раствору слабого электролита для приго-
товления 100 мл буфера 1 с заданным pH. Для этого рассчитайте кон-
центрацию соли есоаи по формулам (7.37) и (7.38). Рассчитайте /я€ОЛИ,
которая содержится в 100 мл раствора концентрации ссоли. (Изменени-
ем объема при добавлении твердого вещества в раствор пренебречь.)
Значение »?€О,И запишите в табл. 7.23. Расчет приведите в отчете.
4. Аналогично п. 3 рассчитайте массу/я€1Ю,„ CHjCOONa или NH4C1,
необходимую для добавления к 1,0 М раствору для приготовления
100 мл буфера 2 с заданным pH. Полученное значение опишите
в табл. 7.23.
5. Приготовьте буферный раствор 1. Для этого взвесьте рассчи-
танную массу соли тстк на весах в стакане на 50 мл, добавьте в стакан
0,1 М раствор слабого электролита примерно до половины объема,
перемешайте стеклянной палочкой до растворения осадка. Аккурат-
но перелейте в мерную колбу на 100 мл. Сполосните стакан раство-
ром слабого электролита и так же слейте в колбу. Доведите раствором
слабого электролита до метки, закройте колбу пробкой и перемешайте
несколько раз, переворачивая ее.
230 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
6. Аналогично п. 5 приготовьте 100 мл буферного раствора 2,
растворив взвешенное количество соли в 1 М растворе слабого
электролита.
7. Проведите испытания буфера 1 по отношению к щелочи. За-
полните шприц на 10 мл раствором 0,5 М NaOH. Вставьте его в дат-
чик объема жидкого реагента. Отмерьте с помощью бюретки 20 мл
буфера 1 в стакан на 50 мл. Стакан поставьте на магнитную мешал-
ку так, чтобы шприц был направлен в центр стакана Подключите
к LISB-портам компьютера датчик pH и датчик объема жидкого реа-
гента. Включите компьютер, запустите программу «Практикуме. По-
сле идентификации датчиков обнулите показания датчика жидкого
реагента кнопкой «Настройка». Выберите на панели управления ре-
жим «Зависимость одною от друюю по нажатию». Установи!е пре-
делы измерений: по абсциссе У — (0—10) мл, по ординате Y— (2—12).
Опустите электрод датчика pH в раствор и включите перемешивание.
Запустите измерение. Дождитесь стабилизации значения pH и, нажав
клавишу «Пробел» на клавиатуре, зафиксируйте первую точку на гра-
фике, соответствующую значению pH исходного буфера 1. Добавьте
около 0,2 мл раствора NaOH из шприца, дождитесь стабилизации
показания датчика pH и отметьте следующую точку на графике кла-
вишей «Пробел». Продолжайте добавлять раствор щелочи примерно
по 0,2—0,3 мл. каждый раз отмечая новую точку на графике после
стабилизации pH. Задача — добиться повышения pH точно на две
единицы. При приближении к этому значению уменьшите объем до-
бавляемого раствора до 0,1 мл. Сохраните результаты в графической
и текстовой форме, экспортировав их во внешний файл созданной
папки «Буферы». Вылейте раствор. Промойте стакан и датчик pH
дистиллированной водой. Погрузите электрод датчика pH в с|акан
с дистиллированной водой.
8. Проведите испытания буфера 1 по отношению к кислоте. За-
полните шприц раствором 0,5 М НС1 и проведите титрование 20 мл
буфера 1 раствором кислоты, как это указано выше для щелочи, ста-
раясь добиться точною снижения pH буфера на две единицы по срав-
нению с исходным значением. Сохраните результаты в графической
и табличной форме, экспортировав их во внешний файл созданной
папки «Буферы».
9. Проведите испытания буфера 2 по отношению к шелочи и кис-
лоте, как описано в п. 7—8. Сохранит е результаты в графической и та-
бличной форме, экспортировав их во внешний файл созданной папки
«Буферы».
Глава 7. Вода и водные растворы • 231
Обработка экспериментальных данных
1. Из полученных компьютерных зависимостей определите pH
исходных буферов 1 и 2, объемы ИцаО1| для подъема pH буферов 1 и 2
на 2 единицы, объемы ^на для снижения pH буферов 1 и 2 на 2 едини-
цы. Полученные значения запишите в табл. 7.23.
2. Сравните исходные pH приготовленных буферов со значениями
табл. 7.22. С чем может быть связано некоторое различие?
3. Рассчитайте буферную емкость Q буферов 1 и 2 по формуле
(7.40) (пример в теоретической части работы). Результаты запишите
в табл. 7.23. Сравните между собой емкости буферов 1 и 2 и объясните
различие.
4. Напишите уравнения реакций для объяснения того, как работа-
ет изученный буфер (реагирует с основанием и кислотой). Сделайте
общий вывод.
Опыт 2. Определение константы диссоциации
слабого электролита
Дем опыта: приготовить буферные растворы с эквивалентным со-
отношением сильного и слабого электролита; оценить константу дис-
социации слабого электролита по измеренному значению pH.
Оборудование: компью|ер, датчик pH, магнитная мешалка, химиче-
ский стакан на 100 мл — 2 шт., мерная колба на 50 мл — 2 шт., бюретки
на 50 мл — 4 шт.
Реактивы: 1 М растворы CHjCOOH, CHjCOONa, NH„OH. NH4C1
Ход работы
Таблица 7 24
рианта Буфер 1 Буфер 2
Состав р’мл Состав J/ мл
1 0.1М CHjCOOH + + 0.1 М CHjCOONa 100 IMCH3COOH + + IM CHjCOONa 100
2 0.1 М CHjCOOH + + 0.1 М CHjCOONa 80 IM CHjCOOH + + IM CHjCOONa 80
4 0,1М NH4OH + 0,1М NH4Cl 60 imnh4oh + imnh4ci 60
6 0.1 М NH4OH + 0,1 М NH4C1 80 ]MNH4OH+ imnh4ci 80
1. В соответствии с полученным вариантом задания (табл. 7.24)
приготовьте по 50 мл 0,1 М растворов сильного и слабого электролита
из соответствующих 1 М растворов. Заполните бюретки 1 М раствора-
232 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ми заданных электролитов. Отмерьте в мерные колбы на 50 мл из бю-
реток но 5 мл соответствующих растворов, долейте дистиллированной
воды до метки, закройте пробкой и тщательно перемешайте, несколь-
ко раз переворачивая колбу.
2. Приготовьте заданный объем Ибуфера 1 путем смешивания рав-
ных объемов 0,1 М растворов сильного и слабого электролита. Указан-
ные объемы реагентов отмерьте как можно точнее с помощью бюреток
в стакан на 100 мл
3. Измерьте pH приготовленного буфера 1, как описано в опыте
1 настоящей работы. Сохраните результаты в графической и таблич-
ной форме, экспортировав их во внешний файл созданной папки
«Буферы».
4. Приготовьте заданный объем буфера 2 путем смешивания рав-
ных объемов 1 М растворов сильного и слабого электролита. Указан-
ные объемы реагентов отмерьте как можно точнее с помощью бюреток
в стакан на 100 мл
5. Измерьте pH приготовленного буфера 2, как описано в опыте
1 настоящей работы. Сохраните результаты в графической и таблич-
ной форме, экспортировав их во внешний файл созданной папки
«Буферы».
Таблица 7.2S
Состав буфера
pH буфера! pH буфера 2 рнс|ка11 Ац опыт
2 3 4 5
Обработка экспериментальных данных
1. Сформируйте таблицу 7.25 опытных и расчетных данных.
2. Из полученных компьютерных зависимостей определите pH ис-
ходных буферов 1 и 2. Запишите установившиеся значения pH в ст. 2
и 3 табл. 7.25.
3. Рассчитайте среднее значение измеренного pH для буферов 1
и 2. Запишите в ст. 4 табл. 7.25. Объясните, почему значение pH для
обоих буферов должно быть одинаковое.
4. Определите величину АСД слабого электролита по формуле (7.39),
используя усредненное значение pH. Запишите в ст. 5 табл. 7.25. Срав-
ните полученную величину Ка с табличной из Приложения VI.
5. Рассчитайте относительную ошибку 8, % опыта. Запишите в ст.
7 табл. 7.25. Сделайте общий вывод.
Глава 7. Вода и водные растворы • 233
Работа 33. Малорастворимые электролиты
Цель работы: изучение некоторых свойств малорастворимых элек-
тролитов.
Теоретическая часть
Растворение твердых веществ в воде происходит самопроиз-
вольно до образования насыщенного раствора. Насыщенным на-
зывается раствор, в котором при данных условиях (температуре
и давлении) дальнейшее самопроизвольное растворение невоз-
можно. Значение концентрации насыщенного раствора при опре-
деленных условиях называют растворимостью вещества в данных
условиях, ср. Растворимость вещества определяется его природой,
природой растворителя и является функцией температуры, а если
растворяемое вещество газообразное, то и функцией давления газа
над раствором. Величина растворимости определяется экспери-
ментально.
В насыщенных растворах сильных электролитов между кристал-
лической фазой и ионами, перешедшими в раствор, устанавливается
равновесие.
А„Ви(к) нА'п+<р) + жВ" (р). (7.41)
Этот процесс является гетерогенным, так как протекает на по-
верхности раздела двух фаз. Величина константы равновесия та-
кого процесса определяется только произведением активностей
ионов в растворе и не зависит от активности твердого компонен-
та, которая является постоянной величиной. Практическое значе-
ние имеет величина константы равновесия для малорастворимых
электролитов. В этом случае она называется произведением раство-
римости ПР и записывается как произведение относительных ак-
тивностей ионов в насыщенном растворе в степенях их стехиоме-
трических коэффициентов. Для равновесия (7.41) выражение для
П Р имеет вид
К = ПРД.В. (7.42)
Как всякая константа равновесия, ПР зависит от природы электро-
лита и растворителя и от температуры и не зависит от активностей ио-
нов. В Приложении VIII приведены значения произведений раствори-
мости некоторых малорастворимых электролитов в водных растворах
при 25 “С.
234 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
В растворах малорастворимых солей с незначительной ионной си-
лой (в отсутствие других электролитов) можно принять у”+ =Ув = I
и заменить в выражении (7.42) активности ионов их концентрациями.
В друшх случаях для расчетов коэффициентов активности отдельных
ионов следует применять правило ионной силы.
Поскольку растворимость вещества ср равна концентрации его на-
сыщенного раствора, то в насыщенном растворе сильного электролита
(7-41):
< = иср и Св" = тсо.
Связь между ПР и растворимостью имеет вад
ПР = (тГ)" МТ «"•«” (7.42а)
где Ср — относительная растворимость (безразмерная величина).
Для случая у —> I
ср = "Ч/ПР/И" и" (7.43)
Таким образом, зная ПР, можно оценить растворимость соответ-
ствующего электролита по уравнению (7.43), и, наоборот, зная величи-
ну ср, легко рассчитать ПР малорастворимой соли по формуле (7.42а)
Зная величину ПР, нетрудно также оценить, можно ли приготовить
раствор электролита требуемой концентрации. Для этого необходимо
рассчитать произведение активностей ПА ионов для заданной кон-
центрации по формуле, аналогичной (7 42), и полученное значение
сравнить с табличной величиной ПР. Осадок выпадет, если получен-
ное значение ПА превысит табличное ПР:
Ъ >ПРА.В_. (7.44)
Растворение осадков малорастворимых электролитов (то есть смеще-
ние равновесия (7.41) вправо) возможно в результате образования очень
слабых электролитов (например, Н2О), удаления анионов в виде газов
(например. СО2), образования прочных комплексных соединений.
Вопросы и задачи для самоконтроля
1. Запишите уравнение (молекулярное и ионное) реакции выпаде-
ния осадка малорастворимого электролита Са3(РО4)2 и выраже-
ние произведения растворимости для этого электролита.
2. Рассчитайте активность иона хрома( III) в насыщенном растворе
гидроксида хрома. Во сколько раз эта активность меньше йон-?
Глава 7. Вода и водные растворы • 235
Определите pH насыщенного раствора Сг(ОН)3, принимая пол-
ную диссоциацию электролита на ионы.
3. По табличной величине произведения растворимости гидрокси-
да кальция вычислите растворимость этого гидроксида при за-
данной температуре (моль/л). Примите коэффициенты актив-
ности ионов равными 1. Определите, растворимость ср какого
из веществ больше: Са(ОН)2 или CaF2?
4. Объясните, почем) при пропускании сероводорода через
раствор сульфата меди выпадает осадок CuS, а при пропу-
скании того же газа через раствор сульфата железа(П) осадок
FeS не образуется. (Для ответа используйте табличные зна-
чения ПР.)
5. В каком объеме воды можно полностью растворить 10 гСа(ОН)2?
6. Рассчитайте ПР соли СаСО3, если ее растворимость равна
6.93- КГ4 г/100 г Н2О.
7. Выпадет ли осадок при сливании 10 мл насыщенных растворов
СаСО3 и Са(ОН)2?
Опыт 1. Полнота осаждения иона
Экспериментальная часть
Оборудование: мерный цилиндр или пипетка на 10 мл, пипетка
на 1—2 мл — 2 шт., пробирка — 3 шт., коническая колба на 50 мл, сте-
клянная воронка, бумажный фильтр.
Реактивы: 0,25 М раствор РЬ(ЫО3)2; 0,5 М раствор КО; 0,5 М рас-
твор KI.
Ход работы
1. В пробирку отмерьте пипеткой (или цилиндром) около 10 мл
раствора нитрата свинца и медленно по каплям добавляйте к нему рас-
твор хлорида калия до прекращения образования осадка.
2. Отфильтруйте осадок (см. раздел 1.4).
3. Фильтрат разлейте в две пробирки. В одну из пробирок добавьте
пипеткой 2—3 капли исходного раствора хлорида калия КС1. а в дру-
гую — 2—3 капли йодида калия KI. Запишите свои наблюдения.
Обработка экспериментальных данных
1. Составьте молекулярное и ионное уравнения реакции нитрата
свинца с хлоридом калия. Укажите признак реакции.
236 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Составьте ионное уравнение реакции образования осадка
в фильтрате при добавлении йодида калия. Укажите признак реакции.
Образуется ли осадок в фильтрате при добавлении хлорида калия?
Объясните исходя из условий выпадения осадка.
3. Сделайте вывод о сравнительной величине растворимости и про-
изведений растворимости хлорида и йодида свинца на основе опыт-
ных данных. Приведите табличные значения ПР (Приложение VIII)
и проверьте по ним свое заключение.
Опыт 2. Условие образования и растворения
осадков малорастворимых электролитов
Оборудование: мерный цилиндр на 5—10 мл — 2 шт., пипетка
на 1—2 мл — 2 шт., пробирки.
Реактивы: растворы — 0,2 М соль Мора [(NH4)2Fe(SO4)?6H2<)|,
0,2 М CuSO4, 2 М (NH4)2S, 2 М HCL
Ход работы
1. В одну пробирку цилиндром отмерьте приблизительно 5 мл рас-
твора соли Мора, в другую — 5 мл раствора сульфата меди(П).
2. В каждую пробирку пипеткой добавьте по 1 мл 2 М раствора
сульфида аммония (NH4)2S (опыт проводите под тягой). Отметьте по-
явление осадков
3. Дайте осадкам осесть, после чего раствор над осадками акку-
ратно слейте в указанное место. К осадкам сульфидов железа и меди
добавьте по 2 мл 2 М соляной кислоты, перемешайте Наблюдения
опишите.
Обработка экспериментальных данных
1. Запишите ионные уравнения реакций получения сульфидов же-
леза и меди и соотношение (7.44). являющееся условием выпадения
осадков.
2. Составьте уравнение реакции растворения осадка (молекуляр-
ное и ионное). В какой пробирке осадок не растворился? Запишите
условие растворения осадка.
3. Объясните, почему один из сульфидов растворился в соляной
кислоте, а другой — нет. Для ответа используйте табличные значения
ПР сульфидов (Приложение V111) и соотношения, являющиеся усло-
вием выпадения и растворения осадков.
Глава 7. Вода и водные растворы • 237
Опыт 3. Растворение осадков малорастворимых
электролитов при химических взаимодействиях
Оборудование: мерный цилиндр на 5—10 мл, пипетка на 1—2 мл —
2 шт., пробирка — 3 шт., коническая колба на 50 мл, стеклянная во-
ронка, бумажный фильтр, стеклянная палочка.
Реактивы: растворы — 0,25 М MgSO4; 0,5 М NaOH; 2 М НС1; 2 М
NH4C1
Ход работы
1. В пробирку цилиндром отмерьте приблизительно 5 мл раство-
ра сульфата магния и прилейте по каплям раствор гндрокснда натрия
до прекращения образования осадка.
2. Полученный осадок разделите в две пробирки на две равные ча-
сти, как можно точнее.
3. Добавьте к осадку в первой пробирке одну каплю раствора 2 М
НС1 и перемешайте содержимое пробирки стеклянной палочкой, затем
вторую каплю и гд. Сосчитайте и запишите число капель раствора НО,
при котором произошло полное растворение осадка гидроксида магния.
4. К осадку во второй пробирке добавляйте по каплям 2 М раствор
хлорида аммония. Запишите число капель раствора NHjCI, при кото-
ром произошло растворение осадка.
Обработка экспериментальных данных
1. Запишите молекулярное и ионное уравнения реакции получе-
ния гидроксида магния.
2. Составьте и запишите молекулярное и ионное уравнения реак-
ции растворения осадка гидроксида магния в НС1.
3. Составьте и запишите молекулярное и ионное уравнения реак-
ции растворения осадка гидроксида магния в NH4C1
4. Сравните количество раствора электролита, пошедшее на рас-
творение осадка. Объясните, почему в одном случае растворение осад-
ка произошло раньше.
Работа 34. Определение произведения
растворимости Са(ОН)2
Дем работы: ознакомление с методами определения произведения
растворимости, определение ПР Са(ОН)2различными методами.
23В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Теоретическая часть
(см. также теоретическую часть к работе 34)
Величину ПР можно определить экспериментально. В настоящей
работе проводится определение ПР малорастворимого в воде гидрок-
сида кальция Са(ОН)2. В насыщенном водном растворе Са(ОН)2 уста-
навливается равновесие между твердой фазой и ионами в растворе:
Ca(OH)!TB .-CaJ' + 2ОНР. (7.45)
Выражение для произведения растворимости, имеет вид:
ПР-»с.- “он- "‘с.- - <’-«)
Как следует из уравнений (7.45) и (7.46), определив активность или,
в первом приближении, молярную концентрацию ионов ОН и ионов
Са2+ в насыщенном растворе Са (ОН) 2, можно рассчитать ПР. Ак-
тивность ионов ОН можно оценить путем непосредственного изме-
рения pH насыщенного раствора с помощью pH-метра или датчика
pH При этом активность ионов Са2+ можно приближенно оценить
исходя из стехиометрии реакции (7.45). Для более точного определе-
ния концентрации ионов ОН- можно провести кислотно-основное
титрование насыщенного раствора Са(ОН)2 стандартным раствором
сильной кислоты с установлением точки эквивалентности разными
способами. Еще одним методом является непосредственное определе-
ние активности ионов Са2+ в насыщенном растворе с помощью ионо-
селективного электрода (Са-ИСЭ). Поскольку величина ПР зависит
от температуры, последнюю контролируют либо термометром, либо
с помощью датчика температуры. В первом приближении можно взять
Т комнатную.
Опыт 1. Определение произведения растворимости
Са(0Н)2 методом рН-метрии
Экспериментальная часть
Оборудование: лабораторный pH -метр, термометр, стакан на 50 мл -
2 шт., стакан на 100 мл.
Реактивы: свежеприготовленный насыщенный раствор Са(ОН)2.
Ход работы
1. Налейте по 30 мл свежеприготовленного насыщенного раствора
Са(ОН)2 едва стакана на 50 мл.
Глава 7. Вода и водные растворы • 239
2. Измерьте температуру раствора с помощью термометра. Значе-
ние 7^„ыта запишите в ст. 1 табл. 7.26.
3. Измерьте pH) первой порции раствора до стабильного значения
на лабораторном pH-метре, как описано в разделе 1.4. Значение pH,
запишите в ст. 2 табл. 7.26.
4. Повторите измерение pH со второй порцией раствора. Запишите
значение рН2 в ст. 3 табл. 7.26.
2. Определите среднее значение pH насыщенного раствора
Са(ОН)2 приданной температуре. Запишите результат в ст. 4 табл. 7.26.
3. Рассчитайте рОН и ^OH_, исходя из среднего значения pH. За-
пишите значение йон в ст. 5 табл. 7.26.
4. Напишите выражение для ПР Са(ОН)> и рассчитайте ПР
Са(ОН)2, учитывая стехиометрию реакции (7.45) и принимая актив-
ности ионов равными их концентрациям. Запишите результат в ст.
табл. 7.26.
5. Сравните полученное значение ПР с табличным. Рассчитайте
абсолютную и относительную ош ибки опыта по формулам (1.1) и (1.2).
Объясните причины расхождения значений.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик pH, датчик температуры, магнит-
ная мешалка, стакан на 50 мл — 2 шт., стакан на 100 мл, химический
штатив.
Реактивы: насыщенный раствор Са(ОН)2.
Ход работы
1. Возьмите около 60 мл свежеприготовленного насыщенного рас-
твора Са(ОН)2. Отфильтруйте, если требуется, полученный реагент
240 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
через воронку с бумажным фильтром в стакан на 100 мл, как описано
в главе 1. Налейте по 30 мл свежеприготовленного насыщенного рас-
твора Са(ОН)2 в два стакана на 50 мл.
2. Снимите с электрода датчика pH сосуд для хранения и опусти-
те электрод в стакан с дистиллированной водой на время подготовки
к измерениям.
3. Подключите датчик pH и датчик температуры к LJSB-портам
компьютера. Включите компьютер, запустите программу «Практи-
кум». После идентификации датчиков установите пределы по осям
координат на шаблонах графиков временной зависимости: по абсцис-
се X — (0—100) с. по ординате У — (10—13) для pH и (20—30) °C для
температуры.
4. Установите первый стакан на магнитную мешалку. Опустите дат-
чики pH и температуры в раствор таким образом, чтобы они не меша-
ли перемешиванию, закрепив их в лапках штатива. Включите пере-
мешивание.
5. Запустите измерение и фиксируйте зависимости pH от времени
и температуры от времени в течение 1—1.5 минуты до стабилизации
значения pH. Запишите установившееся значение pH в ст. 2 табл. 7.26,
а установившееся значение температуры Гв ст. 1 табл. 7.26.
6. Остановите измерение. Сохраните результаты в графической
и табличной форме, экспортировав их во внешний файл созданной
папки «ПР».
7. Повторите измерение pH со второй порцией раствора до ста-
билизации показания датчика, выполняя действия п. 3—6. Запишите
установившееся значение pH в ст. 3 табл. 7.26
Обработка экспериментальных данных
Обработку данных проводите, как указано выше в п. 1—6 обработ-
ки данных традиционного варианта настоящего опыта.
Опыт 2. Определение произведения
растворимости Са(ОН)2 с помощью
Са-ионоселективного электрода
Теоретическая часть
Ионоселективный электрод (ИСЭ) — электрод, потенциал кото-
рого зависит от активности данного иона, в этом выражается его из-
бирательность — селективность. Указанная зависимость имеет ло-
гарифмический характер, поэтому удобно пользоваться величиной
Глава 7. Вода и водные растворы • 241
«показателя» активности t-иона, то есть отрицательного логарифма
активности этого иона:
ра = —IgOj. (7-47)
Функцию высокоомного вольтметра, коюрый измеряет разность
потенциалов между ионоселективным электродом и электродом срав-
нения, в цифровой лаборатории выполняет приставка-переходник для
электродов. В качестве электрода сравнения в настоящей работе ис-
пользуется хлорсеребряный электрод. Разность потенциалов преобра-
зуется датчиком в значение рСа = Р2^*» которое и фиксируется
на мониторе компьютера. При прямом измерении активности ионов
Са2+ программа «Практикум» дает временную зависимость показателя
активности ионов рСа от времени.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, Са-ИСЭ, электрод сравнения хлорсе-
ребряный, приставка-переходник для подключения электродов, дат-
чик температуры терморезисторный, магнитная мешалка, штатив для
электродов, два химических стакана на 100 мл.
Реактивы: насыщенный раствор Са(ОН)2.
Ход работы
1. Налейте по 30 мл свежеприготовленного насыщенного раствора
Са(ОН)2 в два стакана на 50 мл.
2. Подключите датчик температуры и приставку-переходник для
электродов к USB-портам компьютера. Закрепите электроды в штати-
ве для электродов и подключите к разъему 1 приставки-переходника
Са-ИСЭ, к разъему 2 — электрод сравнения.
3. Поставьте 1 -й стакан на магнитную мешалку. Опустите в раствор
датчик температуры, Са-ИСЭ и электрод сравнения.
4. Включите компьютер, запустите программу «Практикум». Убе-
дитесь, что программа идентифицировала датчики. Установите преде-
лы измерений: по абсциссе X — (0—100) с, по ординате Y — (2—6) —
для рСа и (20—30) °C — для температуры
5. Включите перемешивание и начните измерение. Фиксируй-
те зависимости рСа от времени и температуры от времени в течение
2—2,5 минуты до стабилизации цифровых показаний датчиков.
6. Закончите измерение и сохраните данные в графической и таблич-
ной форме, экспортировав их во внешний файл созданной папки «ПР».
242 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
7. Повторите измерение рСа со второй порцией раствора до стаби-
лизации показаний датчиков, выполняя действия п. 3—8.
8. После окончания эксперимента промойте посуду и электрод во-
дой. Осушите фильтровальной бумагой электрод, наденьте на него за-
щитный колпачок.
2. Занесите в ст. 1 табл. 7.27 значения показателя активности
рСа, определенные из двух компьютерных зависимостей, и усред-
ненное значение, а в ст. 2 — измеренное значение температуры рас-
твора.
3. Рассчитайте по формуле (7.47) и запишите в ст. 3 табл. 7.27.
4. Рассчитайте для концентраций Са(ОН)2, равных 10-5, 10-4,
10 3, 10-2, 5-10-2 М ионную силу и определите коэффициенты ак-
тивности ионов Са2+ и ОН по табличным данным (Приложе-
ние VII). Данные расчетов запишите в табл. 7 28 и постройте по ним
калибровочную кривую — график зависимости раСа от рсСа, где
Р<-С.=
5. По полученному в п. 4 калибровочному графику определите мо-
лярную концентрацию Са2+, которой соответствует измеренная вели-
чина раса- Запишите полученное значение в ст. 4 табл. 7.27.
6. Рассчитайте молярную концентрацию ионов ОН на основа-
нии стехиометрии уравнения диссоциации и активность ионов ОН-,
* Учитывая YOH из табл. 7.28. Результат запишите в ст. 5
табл. 7.27.
7. Рассчитайте П Р Са(ОН)2 по формуле (7.46). Запишите втабл. 7.27
полученное и табличное значения.
8. Рассчитайте относительную ошибку 8, % опыта, запишите в ст. 8
табл. 7.27. Объясните возможные причины ошибки.
Глава 7. Вода и водные растворы • 243
Цель работы, определение общей жесткости методами комплексо-
нометрического титрования с контролем по индикатору и с помощью
Са-ионселективного электрода (Са-ИСЭ); определение карбонатной
жесткости методами кислотно-основного и кондуктометрического ти-
трования.
Теоретическая часть
Одним из важных технологических показателей природной воды яв-
ляется ее жесткость, которая представляет собой суммарную концен-
трацию в воде ионов Са2+ и Mg2+. РазличаютобкотоЖо, карбонатную
и некарбонатную Жнк жесткость. Концентрация ионов Са2+ и Mg2+, эк-
вивалентная содержанию ионов HCOJ, (то есть фактически молярная
концентрация эквивалентов Са(НСО3)2 и Mg(HCO3)2), определяет кар-
бонатную жесткость. Концентрация ионов Са2+ и Mg24, эквивалентная
всем прочим анионам ( SO4-. О и др. — например, соли CaSO4, MgCI2
и др.), определяет некарбонатную жесткость. Сумма карбонатной и не-
карбонатной жесткости составляет общую жесткость воды:
жи = жк + жнк.
(7.48)
Единица измерения жесткости Ж — миллимоль эквивалентов ио-
нов жесткости на 1 л или дм3, ммоль экв/л, или на 1 кт воды, ммоль
экв/кг. Также жесткость выражают в градусах жесткости. Считается,
что 1 ммоль экв/л равен 1 градусу жесткости. При расчетах, связанных
с жесткостью воды, следует учитывать, что Э(Са2+) = —Са2+, 3(Mg2+) =
jMg2*, молярные массы эквивалентов соответственно равны:
244 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Л/э(Са2+) = 1л/(Са2+) = 20 г/моль, Af,(Mg2+) = yM(Mg2+) = 12 г/моль,
где М — молярная масса иона.
В технике имеет месю следующим классификация жесткости.
Жц < 1,5 — малая, Жо = 1,5—3 — средняя, Жо = 3—6 — повышенная,
Ж„ = 6—12 — высокая, Ж<> > 12 — очень высокая.
Общую жесткость Ж,,, как правило, определяют методом комплек-
сонометрического титрования. Метод заключается в титровании про-
бы исследуемой воды раствором трилона Б (комплексона Ш). Это
органическое соединение представляет собой двузамещенную натрие-
вую соль этилендиаминтетрауксусной кислоты (ЭДТА):
NaOOCCH, CH,COONa
\ /
N -CHj-CH, N
НООССн/ V.H2COOH
которая в щелочной среде связывает ионы Са2+ и Mg2+ в прочный вну-
трикомплексный ион
ООССН2ч xCHjOOC
n-ch2—ch2-n
ООССН2 / \сн2оос
--—— Са ---- ~~
В качестве индикаторов используют обычно кислотный хром
темно-синий или эриохром черный Т в среде аммиачного буфера
(pH = 10). В присутствии ионов жесткости Са2+ и Mg2+ эти индика-
торы имеют розовую окраску, в отсутствие — голубую, поэтому при
достижении точки эквивалентности раствор меняет цвет с розового
на голубой.
При использовании цифровой лаборатории точку эквивалентности
определяют с помощью Са-ионоселективного электрода (Са-ИСЭ).
ИСЭ не может определить химически связанные ионы, поэтому при
их полном связывании в соединение (в точке эквивалентности) на гра-
фике монотонной зависимости наблюдается скачок. Помимо ионов
кальция Са-ИСЭ чувствителен к ионам Mg2+. Поэтому на кривой ти-
трования наблюдаются два скачка потенциала: первый менее четкий —
для Са2+, второй более ясно выраженный — для суммы Са2+ и Mg2+
Общей жесткости будет соответствовать второй скачок потенциала.
Применение аммиачного буфера негативно сказывается на мембране
Са-электрода, поэтому в данном методе лучше использовать другой
Глава 7. Вода и водные растворы • 245
буфер, например глициновый (pH 9,7). Общую жесткость воды Ж„,
определяемую титрованием, рассчитывают по закону эквивалентов:
Жо = сэТБ - РтБ - 1000/Кв, ммоль экв/л, (7.49)
где сэте — молярная концентрация эквивалента трилона Б, моль/л; — объ-
ем раствора тритона Б, пошедшего на титрование, мл, 1'в — объем пробы воды,
мл; 1000 коэффициент перевода моль/л в ммоль/л.
Определение карбонатной жесткости Жк своди юн к определению
концентрации в воде гцдрокарбонат-иона и эквивалентной этим ио-
нам концентрации ионов Са2+ и Mg2+. Анализ проводят путем титро-
вания исследуемой воды раствором сильной кислоты, например HCI.
В классическом варианте достижение точки эквивалентности опреде-
ляют по переходу окраски индикатора метилового оранжевого от жел-
той в оранжевую. «Перетитрованный» раствор будет иметь красную
окраску.
Поскольку в природной воде растворяются как диоксид углеро-
да атмосферы, так и карбонаты литосферы, то в ней устанавливается
углекислотное равновесие:
СО, + Н;О^ Н2СОч^ И' + НСО ^2Н++СО’ . (7.50)
В обычных условиях преобладающими в воде являются гидрокарбо-
нат-ионы. Анионы HCOf частично гидролизуются: НСО3 + н,О
HjCOj + ОН-. Следовательно, если Жк > 0, то природная и водопро-
водная вода имеют слабоосновную реакцию и в присутствии метило-
ранжа окрашивается в желтый цвет. При титровании HCI протекает
реакция нейтрализации и ионы Н+ связывают количество ионов ОН-,
эквивалентное количеству НСО3 в молекулы воды: ОН- + Н+ — Н2О.
Значение карбонатной жесткости воды Жк рассчитывают по закону
эквивалентов:
Жк=сэНс1- ^hci- 1000/К, ммольэкв/л, (7.51)
где сэ на — молярная концентрация эквивалента раствора соляной кислоты,
моль экв/л; Г нс, — объем раствора соляной кислоты, пошедшего на титрова-
ние, мл; 14 — объем пробы анализируемой воды, мл.
Некарбонатную жесткость Ж„к находят по разности обшей и карбо-
натной жесткости:
Жнк — Ж„ — Жк. ммоль экв/л. (7.52)
При использовании цифровой лаборатории точку эквивалент-
ности при титровании можно определять с помощью различных
246 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
датчиков: датчика электропроводности (кондуктометрическим ти-
трованием); датчика pH (pH-метрическим титрованием); датчика
оптической плотности с добавлением метилоранжа (фотометриче-
ским тированием).
В настоящей работе используется кондуктометрический метод (см.
1лава 1 работа 1). При титровании воды соляной кислотой НС1 ионы
НС€>7 замещаются в воде на противоионы С1_, близкие к ним по под-
вижности. Поэтому пока все гидрокарбонат-ионы не свяжутся (то есть
до точки эквивалентности), электропроводность воды будет меняться
незначительно. По достижении точки нейтрализации ионы Н+ пере-
станут связываться и электропроводность начнет резко увеличиваться.
Точка пересечения линеаризованных участков кривой кондуктоме-
трического титрования будет являться точкой эквивалентности.
Вопросы и задачи для самоконтроля
1. Какие катионы называют ионами жесткости?
2. Какой технологический показатель качества воды называют
жесткостью?
3. Почему жесткую воду нельзя применять дли генерации пара
на тепловых и атомных электростанциях?
4. Как определяют общую жесткость воды?
5. Как определяют карбонатную жесткость воды?
6. На титрование 200 мл Н2О израсходовано 8 мл 0,1 н. раствора
комплексона. Вычислите общую жесткость воды.
7. Определите карбонатную жесткость, если на титрование 200 мл
Н2О израсходовано 8 мл 0,05 н. раствора НО.
8. Вычислите общую, карбонатную и некарбонатную жесткость
воды, если: а) на титрование 200 мл Н2О израсходовано 7,6 мл
0,05 и. комплексона III; б) на титрование 100 мл Н.О — 1,5 мл
0,1 н. НО.
Опыт 1. Определение общей жесткости воды методом
комплексонометрического титрования
Экспериментальная часть
Оборудование: штатив химический, коническая колба на 200 мл,
мерный цилиндр на 100 мл, бюретка на 25 мл — 2 шт
Реактивы: индикаторы — кислотный хром темно-синии или эри-
охром черный Т; растворы — 0,1 н. (0,05 М) трилон Б, аммиачный бу-
фер (pH = 10), вода природная или отстоявшаяся водопроводная.
Глава 7. Вода и водные растворы • 247
Ход работы
1- Получите у преподавателя колбу воды с номером варианта.
Сформируйте табл. 7.29 опытных и расчетных данных, как показано
ниже.
2. Подготовьте установку для титрования (рис. 1.24), заполнив бю-
ретку раствором трилона Б.
3. Отмерьте цилиндром 100 мл исследуемой воды в коническую
колбу на 200 мл и добавьте несколько капель раствора хрома темно-си-
него или кристалликов эриохрома черного Т. Внесите 5 мл аммиачною
буферного раствора из бюретки. Отметьте окраску исходного раствора.
4. Оттитруйте приготовленную пробу раствором трилона Б, добав-
ляя титрант по каплям из бюретки при постоянном перемешивании
до перехода розовой окраски индикатора в голубую. Результат титро-
вания запишите в ст. 4 табл. 7.29.
5. Повторите титрование еще раз. Если результаты двух титрова-
ний совпадут (ДУ< 0,1 мл), закончите титрование. В противном случае
проведите еще одно титрование
Таблица 7 29
№тирования 1' пробы воды сэ три тона Б 1'трилона Б Жо
1 2 3 4 5
1
2
Среднее
Обработка экспериментальных данных
1. Усредните данные двух титрований и рассчитайте общую жест-
кость воды по уравнению (7.49). Полученное значение запишите в ст.
5 табл. 7.29.
2. Сделайте вывод о величине жесткости исследованной воды
по шкале жесткости.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, приставка-переходник для злектродов,
Са-ионоселективный электрод, электрод сравнения, датчик объема
жидкого реагента, шприц на 10 мл, магнитная мешалка, штатив хими-
ческий, штатив для электродов, стакан химический на 200 мл, мерный
цилиндр на 100 мл.
24В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Реактивы: индикаторы — кислотный хром темно-синий или эри-
охром черный Т; растворы — 0,1 н. (0,05 М) трилон Б, глициновый
буфер (2 М глицин + 1 М NaOH), вода природная или отстоявшаяся
водопроводная
Ход работы
1. Получите у преподавателя пробу воды с номером варианта.
2. Соберите установку для потенциометрического титрования, как
показано на рис. 7.6. Электрод сравнения и Са-ИСЭ закрепите в шта-
тиве для электродов, а датчик объема жидкого реагента — в лапке хи-
мического штатива.
Рис. 7.6. Установка для определения жесткости и умягчения воды.
1 — электрод сравнения; 2 — Са-ионселективный электрод. 3 — датчик
объема жидкого реагента; 4 — магнитная мешалка, 5 — приставка
переходник для электродов; 6 — колонка с катионитом
3. Отберите мерным цилиндром 100 мл пробы воды в химический
стакан на 200 мл и добавьте несколько капель раствора хрома темно-
синего или кристалликов эриохрома черного. Внесите 5 мл глицино-
вого буферного раствора из бюретки. Отметьте окраску исходного рас-
твора.
4. Поставьте стакан на магнитную мешалку.
5. Заполните шприц на 10 мл раствором 0,05 М трилона Б, на иглу
наденьте защитный колпачок. Вставьте шприц в датчик объема жидко-
го реагента так, чтобы толкатель датчика плотно подходил к поршню
шприца, а игла шприца была направлена в стакан.
6. Опустите Са-ИСЭ и электрод сравнения в стакан с раствором.
7. Подключите к разъемам приставки-переходника для электродов
Са-ИСЭ и электрод сравнения.
Глава 7. Вода и водные растворы • 249
8. Подключите с помощью кабелей к одному из USB-портов ком-
пьютера приставку-переходник для электродов, к другому — датчик
объема жидкого реагента
9. Включите компьютер. Запустите программу «Практикум» Убе-
дитесь, что программа идентифицировала датчики. При этом на экра-
не должны появиться шаблоны двух графиков: «Зависимость рСа
от времени» и «Зависимость объема добавленного раствора от вре-
мени». Обнулите значения датчика жидкого реагента. В окне измере-
ний выберите режим «Зависимость одного от другого по нажатию».
На экране появится шаблон графика «рСа — объем добавленного рас-
твора». Установите пределы измерений: по абсциссе X — (0—12) мл,
по ординате У— (1—7).
10. Включите перемешивание и запустите измерение. После стаби-
лизации цифрового значения показателя рСа клавишей «Пробел» на-
несите на график первую точку.
11. Начните титрование, добавляя по 0.2—0.5 мл трилона Б
из шприца. После стабилизации рСа каждый раз наносите новую точ-
ку на график клавишей «Пробел». Продолжайте опыт до выраженного
скачка рСа (точки эквивалентности), после чего нанесите на график
еще 2—3 точки. Закончите титрование. Убедитесь, что наиболее резкое
изменение рСа совпало с изменением цвета индикатора.
12. Закончите измерение. Сохраните графические и табличные ре-
зультаты, экспортировав их во внешний файл папки «Жесткость».
13. Вылейте раствор, сполосните стакан для титрования и по-
вторите титрование пробы воды еще раз (п. 3—12), стараясь более
точно описать кривую титрования в районе точки эквивалент-
ности. Для этого при приближении к ней добавляйте как можно
меньший объем трилона Б из шприца и наносите точки на график
более часто.
Обработка экспериментальных данных
1. Сформируйте табл. 7.30 опытных и расчетных данных, как по-
казано ниже.
2. По полученным компьютерным кривым двух титрований
определите объем трилона Б, при котором произошли скачки по-
тенциала (наиболее резкое изменение рСа) Запишите значения в ст.
2 и 3 табл. 7.30. По результатам двух титрований определите среднее
значение объема штранта >тБср. Запишите в ст. 4 табл. 7.30. Сравните
полученную величину с объемом трилона Б, при котором произошло
изменение окраски индикатора. Совпадают ли эти значения?
250 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 7 30
N° варианта 1-тб,. мл Нъ,- МЛ ^ТБср> МЛ Жцср, ммоль экв/л
1 2 3 4 5
3. Рассчитайте общую жесткость исследуемой воды по формуле
(7.49). Запишите полученный результат в ст. 5 табл. 7.30. Сделайте вы-
вод о величине жесткости исследованной воды по шкале жесткости.
Опыт 2. Определение карбонатной и некарбонатной
жесткости воды методом кислотно-
основного титрования
Экспериментальная часть
Оборудование: колба коническая на 200 мл, мерный цилиндр
на 100 мл, бюретка на 25 мл, штатив химический
Реактивы: вода природная или отстоявшаяся водопроводная, ин-
дикатор метилоранж, 0,05 М раствор HCI.
Ход работы
1. Отберите мерным цилиндром 100 мл воды и перенесите ее в ко-
ническую колбу для титрования. Добавьте к исследуемой воде несколь-
ко капель метилового оранжевого. Отметьте окраску раствора в колбе
2. Заполните бюретку 0,05 М раствором НС1 и оттитруйте пробу,
добавляя кислоту по каплям при перемешивании, до перехода желтой
окраски индикатора в оранжевую (но не розовую!). Результат титрова-
ния Vi запишите в ст. 4 табл. 7.31.
3. Повторите титрование еще раз. Результат титрования за-
пишите в ст. 5 табл. 7.31. Если результаты двух титрований совпадут
(ДР < 0,1 мл), закончите опыт. В противном случае оттитруйте еще
одну пробу воды.
Обработка экспериментальных данных
1. Сформируйте табл. 7.31 опытных и расчетных данных, как по-
казано ниже.
2. Рассчитайте карбонатную жесткость исходной воды по формуле
(7.51), используя усредненный объем кислоты двух титрований. Запи-
шите результат в ст. 6 табл. 7.31.
Глава 7. Вода и водные растворы • 251
Таблица 7.31
№ ва- рианта МЛ моль/л 1'lHCb мл I'jhci, МЛ Жк, моль экв/л Жик, моль
1 2 3 4 5 6 7
3. Рассчитайте некарбонатную жесткость исходной воды по фор-
муле (7.52). Полученное значение запишите в ст. 7 табл. 7.31.
4. Рассчитайте, какой процент от общей жесткости составляет кар-
бонатная жесткость.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик электропроводности, датчик объ-
ема жидкого реагента, шприц на 10 мл, магнитная мешалка, штатив
химический, штатив для электродов, стакан химический на 200 мл,
мерный цилиндр на 100 мл, бюретка на 25 мл.
Реактивы: вода природная или отстоявшаяся водопроводная, ин-
дикатор метилоранж. 0.05 М раствор HCI.
Ход работы
1. Получите у преподавателя пробу воды с номером варианта.
2. Отмерьте 100 мл природной или водопроводной воды с помо-
щью мерного цилиндра в стакан для титрования, добавьте 2—3 капли
индикатора метилоранжа, отметьте цвет раствора.
3. Проведите кондуктометрическое титрование пробы воды 0,05 М
раствором НС1 на установке (рис. 1.22), как описано в работе 1. Титро-
вание проведите два раза. Отметьте объем кислоты в точке перехода
окраски индикатора из желтой в оранжевую. Сохраните табличные
и графические данные во внешних файлах папки «Жесткость».
Обработка экспериментальных данных
1. Сформируйте табл. 7.31 опытных и расчетных данных, как по-
казано выше.
2. На основе компьютерных кривых кондуктометрического ти-
трования постройте график и определите точку эквивалентности как
точку пересечения двух линеаризованных участков, (см. работу 1). За-
пишите результаты 1-го и 2-го титрования в ст. 4 и 5 табл. 7.31.
3. Далее обработку данных проводите, как указано выше в п. 2—4
обработки данных традиционного варианта настоящего опыта.
252 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Развитие опыта
Можно провести титрование с использованием датчика опти-
ческой плотности в присутствии кислотно-основного индикатора.
В этом случае фиксируют зависимость оптической плотности от объе-
ма добавляемого титранта. В точке эквивалентности индикатор меняет
свой цвет, при этом происходит изменение оптической плотности, что
отражается в виде перегиба на кривой фотометрического титрования.
По этому перелому и визуальному контролю за сменой окраски опре-
деляю! объем титранта в точке эквивалентности.
Можно провести титрование с использованием датчика pH. При до-
бавлении сильной кислоты в воду ее pH сначала будет меняться незначи-
тельно вследствие буферных свойств последней. При достижении точки
эквивалентности все ионы НСО^ будут нейтрализованы и pH начнет
резко падать. Скачок на кривой pH-метрического титрования будет со-
ответствовать точке эквивалентности. Используя несколько датчиков,
можно одновременно получать кривые фотометрического и кондукто-
метрического или фотометрического и потенциометрического титрова-
ния.
Работа 36. Умягчение воды методом
ионного обмена
Цель работы: проведение умягчения воды методом Н-катиониро-
вания. определение остаточной жесткости воды и обменной емкости
катионита.
Теоретическая часть
Для приведения качества воды в соответствие с технологическими
нормами проводится водоподготовка. Одним из основных процессов
водоподготовки является умягчение воды — удаление из нее катионов
Са2+ и Mg2+. Одним из наиболее современных и широко применяемых
способов умягчения воды является метод ионного обмена, который по-
зволяет добиться наиболее глубокого умягчения воды. Ионный обмен
протекает на ионитах, представляющих собой химически устойчивые
твердые синтетические высокомолекулярные соединения, обладаю-
щие ионообменными свойствами. Ионы одного знака в этих соеди-
нениях закреплены на твердой полимерной матрице, а ионы другого
знака, слабосвязанные с матрицей, способны переходить в раствор
Глава 7. Вода и водные растворы • 253
и замещаться на другие ионы того же знака. В зависимости от того,
какие ионы переходят в раствор, различают катиониты, обратимые
по катионам R"~nKt\ и аниониты, обратимые по анионам Rn*nAn~.
Для умягчения воды используют катиониты. Воду пропускают че-
рез слой зернистого катионита, и ионы жесгкости Са2+ и Mg2+ обмени-
ваются на ионы катионита (Н+, Na4-, реже NHJ). Реакцию ионного
обмена при использовании Н-катионита можно схематично предста-
вить уравнениями:
2Я"-лН+ + «Са2+ ЛГлСа2’ + 2иН*
?!
2Ял~яН+ + яМе2+^/Jp*Mg2+ +2яН+. (7.53)
При Н-катионировании из воды удаляются ионы жесткости Са2+
и Mg2+, а также все другие катионы солей, т.е. происходит умягчение
и снижение солесодержания воды. Однако при этом вода обогащается
ионами водорода Н+, уменьшается ее pH, она становится более корро-
зионно-агрессивной. Поэтому Н-катионирование воды обычно про-
водят в сочетании с ОН-анионированием, что позволяет практически
полностью обессолить воду.
Максимальное количество молей эквивалентов ионов, поглоща-
емое 1 г катионита, называют его обменной емкостью е, ммоль экв/г.
Обменную емкость катионита определяют из соотношения:
£ = ДЖо- Ив//иА„ (7.54)
где Иц — объем воды, пропущенной через катионит, л; /я*-, — масса катионита,
г; ДЖ,, — жесткость, поглощенная катионитом
Если умягченная вода имеет некоторую остаточную жесткость Ж<> ост,
ТО: ДЖ,, = Ж<> — Жо ост, ммоль экв/л.
В настоящей работе исходную воду определенного объема пропу-
скают с небольшой скоростью через колонку ионообменного фильтра,
содержащего Н-катионит известной массы. После Н-катионирования
проводят определение остаточной общей жесткости воды методом ти-
трования трилоном Б с Са-ИСЭ и контролем по индикатору, как опи-
сано в лабораторной работе 36.
Вопросы и задачи для самоконтроля
1. Можно ли обессолить воду с помощью ионного обмена?
2. Какой процесс следует проводить для умягчения воды: катио-
нирования или анионирования? Составьте уравнения реакций,
протекающих при умягчении воды с помощью ионного обмена.
254 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
3. Общая жесткость воды равна 4 ммоль/л. Через ионнообменный
фильтр пропущено 100 л Н2О. Сколько молей ионов Са2+ и Mg2+
задержано фильтром, если известно, что жесткость снизилась
до 0,5 ммоль/л?
Экспериментальная часть
Оборудование: бюретка на 25 мл, колонка с Н-катионитом или Na-
катионитом известной массы, стакан химический на 500 мл, мерный
цилиндр на 100 мл, колба коническая.
Реактивы: вода природная или отстоявшаяся водопроводная, 0,1 н.
(0,05 М) раствор трилона Б, аммиачный буфер (pH = 10), раствор ин-
дикатора кислотного хром темно-синего или кристаллический эриох-
ром черный Т.
Ход работы
1. Сформируйте табл. 7.32 экспериментальных и расчетных дан-
ных, как показано ниже.
Таблица 7.32
Емкость
катионита е,
мольэкв/г
2. Получите у преподавателя пробу воды (около 0,5 л) для анализа
и колонку с катионитом известной массы тК1, которую запишите в ст.
1 табл. 7.32.
3. Проведите определение общей жесткости Жо исходной воды
комплексонометрическим методом, как описано в — п. 2—5 традици-
онного варианта опыта 1 лабораторной работы 35. Результаты двух ти-
трований запишите в ст. 2 табл. 7.32.
4. Проведите умягчение воды, пропустив оставшуюся воду (около
300 мл) через колонку с катионитом. Вода должна вытекать из колонки
со скоростью менее 1 капли в секунду.
5. Измерьте точно объем умягченной воды с помощью мерного ци-
линдра и запишите значение в ст. 6 табл. 7.32.
6. Коническую колбу на 200 мл и мерный цилиндр ополосните
умягченной водой. Определите общую остаточную жесткость умяг-
Глава 7. Вода и водные растворы • 255
ченной воды, аналогично тому, как была определена Жо исходной
воды в п. 3. Результаты двух титрований запишите в ст. 4 табл. 7.32.
7. Если при добавлении индика гора в умягченную виду раствор
сразу принял голубоватую окраску, то произошло полное умягчение
воды: Vrt, = 0 и Ж„ = 0.
Обработка экспериментальных данных
1. Определите среднее значение объема титранта Jztp по результатам
двух титрований исходной воды. Результат запишите в ст. 2 табл. 7.32.
2. Рассчитайте общую жесткость исходной воды по формуле (7.49),
исходя из усредненного объема титранта. Запишите полученный ре-
зультат в ст. 3 табл. 7.32.
3. По результатам двух титрований умягченной воды определите
среднее значение Уср объема титранта, пошедшего на титрование умяг-
ченной воды. Результат запишите в ст. 4 табл. 7.32.
4. Рассчитайте остаточную общую жесткость умягченной воды
Жи „г по формуле (7.49). Запишите полученный результат в ст. 5
табл. 7.32.
5. Рассчитайте по формуле (7.54) минимальную обменную емкость
е катионита для умягчения измеренного объема исследуемой воды
до Ж„,иг Результат запишите в ст. 7 табл. 7.32. Сделайте вывод об эф-
фективности использованного катионита.
6. Запишите реакции, идущие на Н-катионите при умягчении
воды
Экспериментальная часть
с использованием цифровой лаборатории
В данном опыте точка эквивалентности при титровании трилоном
Б определяется по скачку потенциала Са-ИСЭ, а объем титранта —
по датчику жидкого реагента. Кроме того, добавляется индикатор, по-
этому одновременно фиксируется и объем щелочи, при котором про-
исходит смена окраски. Двойной контроль делает эксперимент более
точным, позволяет уменьшить ошибки измерения.
Оборудование: компьютер, приставка-переходник для электродов,
ионоселективный электрод Са-ИСЭ, электрод сравнения, датчик объ-
ема жидкого реагента, шприп на 10 мл. магнитная мешалка, штатив
химический, штатив для электродов, стакан химический на 200 мл,
мерный цилиндр на 100 мл, бюретка на 25 мл, колонка с Н-катионитом
или Na-катионитом известной массы.
256 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Реактивы-, вода природная или отстоявшаяся водопроводная, 0,1 н.
(0,05 М) раствор трилона Б, глициновый буфер (2 М глицин + 1 М
NaOH), раствор индикатора кислотного хром темно-синего или кри-
сталлический эриохром черный Т
Ход работы
1. Подучиie у преподавателя объем воды (около 0,5 л) для анализа
и колонку с катионитом известной массы mAn которую запишите в ст. 1
табл. 7.32.
2. Проведите определение общей жесткости Жс исходной воды
комплексонометрическим методом на установке (рис. 7.5), как опи-
сано в п. 2—13 опыта 1 лабораторной работы 35 с использованием
цифровой лаборатории. Результаты двух титрований запишите в ci. 2
табл. 7.32. Отметьте объем добавленного трилона Б, при котором про-
изошло изменение окраски индикатора.
3. Проведите умягчение воды, пропустив оставшуюся воду (около
300 мл) через колонку с катионитом. Вода должна вытекать из колонки
со скоростью не более 1 капли в секунду.
4. Измерьте точно объем умягченной воды с помошью мерного ци-
линдра и запишите значение в ст. 6 табл. 7.32.
5. Проведите определение остаточной обшей жесткости Ж,, ост
умягченной воды комплексонометрическим методом на установке
(рис. 7.5). аналогично тому, как была определена Ж„ исходной воды
в п. 2. Отметьте объем добавленного трилона Б. при котором произо-
шло изменение окраски индикатора.
6. Если при добавлении индикатора с буфером в умягченную воду
раствор сразу принял голубоватую окраску, то произошло полное
умягчение воды. То есть РТЪ — 0 и Ж,, ост = 0.
Обработка экспериментальных данных
1. Сформируйте табл. 7.32 экспериментальных и расчетных дан-
ных по результатам двух титрований.
2. По полученным компьютерным кривым двух титрований исход-
ной воды определите объем трилона Б, при котором произошли скач-
ки потенциала (наиболее резкое изменение рСа). Запишите значения
в ст. 2 табл. 7.32. По результатам двух титрований определите среднее
значение объема титранта Рср. Запишите в ст. 2 табл. 7.32.
3. Рассчитайте общую жесткость исходной воды по формуле (7-49).
Запишите полученный результат в ст. 3 табл. 7.32.
Глава 7. Вода и водные растворы • 257
4. По полученным компьютерным кривым двух титрований умяг-
ченной воды определите объем трилона Б, при котором произошли
скачки показателя рСа. Запишите значения в ст. 4 табл. 7.32. По ре-
зультатам двух титрований определите среднее значение объема ти-
транта Р^р. Запишите вс 1.4 табл. 7.32. Отметьте, совпадает ли значение
объема, полученного в п. 4 с объемом, при котором произошла смена
окраски индикатора.
5. Рассчитайте остаточную общую жесткость умягченной воды
Жо л, по формуле (7.49). Запишите полученный результат в ст. 5
табл. 7.32.
6. Рассчитайте по формуле (7.54) обменную емкость е катионита,
необходимую для умягчения измеренного объема исследуемой воды
до Жв.ят Результат запишите в ст. 7 табл. 7.32. Сделайте вывод об эф-
фективности ионного обмена на данном катионите.
7. Запишите реакции, идущие на Н -катионите при умягчении
воды.
ГЛАВА
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Теоретическая часть
Окислительно-восстановительные реакции (ОВР) — это реакции,
при которых происходит перемещение электронов от одних частиц
к другим с изменением степени окисления частиц, входящих в состав
реагирующих веществ. Воображаемый заряд атома в соединении, рас-
считанный в предположении, что соединение состоит из ионов, назы-
вают степенью окисления. Степень окисления бывает положительной,
если электроны смешены от частицы, и отрицательной, если они сме-
щены к частице.
Любая окислительно-восстановительная реакция представляет
собой сумму двух полуреакций: окисления и восстановления, которые
протекают одновременно. Окисление — процесс отдачи электронов
частицей, восстановление — процесс присоединения электронов. Ве-
щество, отдающее электроны, называют восстановителем. При окис-
лении степень окисления восстановителя увеличивается. Вещество,
принимающее электроны, называют окислителем. При восстановле-
нии степень окисления окислителя уменьшается.
Типичными восстановителями являются простые вещества, атомы
которых имеют небольшую электроотрицательность (металлы, водород
и др.), некоторые анионы с отрицательной степенью окисления (I-, S2
и др.), многозарядные катионы с низшей степенью окисления (Fe2+,
Мп2+ и др.), соединения углерода, азота и тд. Типичными окислителя-
ми являются неметаллы, атомы которых имеют высокую электроотри-
цательность (элементы VI. VII групп и др.), некоторые анионы ( NO7,
МпО^ и др.), многозарядные катионы с высшей степенью окисления
(Pb4+, С1*+ и др.), высшие оксиды и тд, Каждая из полуреакций харак-
теризуется величиной окислительно-восстановительного потенциала
(ОВП), или редокс-потенциала, который определяет ее окислительно-
восстановительную способность. В общем виде обратимую полуреак-
цию восстановления — окисления можно записать уравнением
Ох + tie Red. (8.1)
где Ох — окисленная форма вещества; Red — восстановленная форма вещества.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 259
Зависимость редокс-потенциала (EOx/Keit) от природы системы (8.1)
и активности компонентов описывается уравнением Нернста
0 2, ЗЯ Г йо,
"F «ы
где Eox/«ed — стандартный окислительно-восстановительный потенциал (при
активности окисленной и восстановленной форм равной единице), аОх,
Ofad — относительные активности окисленной и восстановленной форм, со-
ответственно, которые представляют собой безразмерные величины: а =
= а (моль/л)/1 моль/л.
Значения стандартных редокс-потенциалов некоторых полуреак-
ций восстановления приведены в Приложении X. Окислительная спо-
собность системы тем выше, чем более положительный ее редокс-по-
тенциал Как видно из таблицы, наиболее сильными окислителями
являются ионы S2Or-, Со3+. МпО4, диоксид свинца РЬО2. В соответ-
ствии с уравнением Нернста (8.2) окислительно-восстановительная
способность систем зависит от активности окисленной и восстанов-
ленной форм веществ. Если в уравнение ОВР входят ионы ОН- или
Н+, значения ОВП раствора зависят и от pH. Например, для реакции
NO, + ЗН+ + 2e?+ HNOj + Н,О
уравнение Нернста (8.2) имеет вид
0 , 2.3Я7,4-4
CNOJ/HNO, ^NOJ/HNO, J р ~ ’ (О.2а)
zr “UNO,
Для определения направления ОВР следует сравнить редокс-потен-
циалы EOx/Rea двух составляющих ее полуреакций. При этом следует по-
нимать, что редокс-потенциал полуреакции восстановления равен ре-
докс-потенциалу обратной полуреакции окисления, взятой
с противоположным знаком. Реакция будет протекать в направлении,
в котором сумма Д£ положительна, то есть реакция идет самопроиз-
вольно от более сильного окислителя к более слабому. Такому направ-
лению отвечает отрицательная энергия Гиббса реакции: ДДЗ < 0. На-
пример, реакция Sn2+ + 2Fe34 Sn4* + 2Fe2+ при стандартном
состоянии компонентов =aFcJ* =44+ =42* самопроизвольно
может идти в прямом направлении, так как Fe3+ является более силь-
ным окислителем, чем Sn4+ и = + (-£®n4»/Sn,*) = 0.771 т
+ (-0,15)= 0,62 В >0.
260 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Вопросы и задачи для самоконтроля
1. Определите степень окисления серы в соединениях: H3S,
Na2S2O,, H2SO3, H3SO4.
2. Определите, возможно ли протекание реакции 2Fe2+ + 2Hg2' -»
-> 2FeJ+ + Hg2+ в прямом направлении при 298 К и стандартных
состояниях компонентов.
3. От каких факторов зависит окислительно-восстановительный
потенциал раствора? Напишите уравнение для pacseia окисли-
тельно-восстановительного потенциала реакции
[Co(NH3)6]J+ + е [Co(NH3)6]2+.
Рассчитайте значения потенциала при 298 К для случаев, ког-
да относительные активности окисленной и восстановленной
форм вещества равны: 1) 0,01 и 1,0; 2) 1,0 и 0,01.
4. Напишите уравнение для расчета потенциала реакции Сг2О?~ +
+ 14Н4 + бе <=* 2CrJ+ + 7Н2О. Рассчитайте значения ОВП этой
системы при 298 К для случаев, когда относительные активно-
сти окисленной и восстановленной форм вещества равны 1,
а ионов водорода: 1) 10-2; 2) 10-6; 3) 10-10.
5. Рассчитайте, при каком соотношении компонентов реакнии
(8.3) возможно протекание ее в обратном направлении
6. Напишите уравнение Нернста для расчета ОВП системы: Sri** +
+ 2е <=> Sn2*. Рассчитайте ОВП раствора при соотношении
активности окисленной и восстановленной форм вешества:
1) I0-2:2) 102. В каком случае окислительная способность выше?
Работа 37. Исследование окислительно-
восстановительных систем
с помощью редокс-электродов
Теоретическая часть
Для измерения ОВП раствора, содержащего окислительно-вос-
становительную пару, требуется редокс-электрод, который состоит
из металлического проводника, контактирующего с раствором, со-
держащим окислители и восоановители. В качестве Mei алл а в ре-
докс-электродах обычно используют платину. Она инертна, то есть
не принимает непосредственного участия в электродных реакциях.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 261
и хорошо адсорбирует ионы из раствора, поэтому возникающий
на ней потенциал прямо отражает ОВП раствора. Однако, как извест-
но, абсолютное значение скачка потенциала на границе электрод —
раствор измерить невозможно. На практике измеряют разность
потенциалов между редокс-электродом и электродом сравнения.
В Приложении X приведены редокс-потенция ты относительно стан-
дартного водородного электрода (с. в. э.), потенциал которого услов-
но принят равным нулю. В настоящей работе в качестве электрода
сравнения используется хлорсеребряный электрод (х. с. э.), потен-
циал которого относительно с. в. э. равен 0,221 В. Чтобы пересчи-
тать потенциал относительно с. в. э.» нужно к измеренному значению
прибавить 0,221 В.
Уравнение Нернста (8.2) позволяет рассчитать ОВП раствора, со-
держащего редокс-пару. Однако не для всех пар измеренный ОВП бу-
дет соответствовать рассчитанному по уравнению Нернста, поскольку
большинство редокс-пар практически необратимы. На величину из-
меряемого ОВП могут также влиять различные примеси. Если в рас-
творе присутствует несколько редокс-пар, они либо сразу прореаги-
руют друг с другом (например, система (8.3)), либо, при медленном
протекании реакции, значение потенциала будет определяться наибо-
лее обратимой парой.
Опыт 1. Определение окислительно-
восстановительного потенциала раствора
с помощью редоке-электрода
Цель опыта: измерить редокс-потенциалы ряда систем; сравнить
с теоретически рассчитанными значениями по уравнению Нернста;
охарактеризовать обратимость и окислительно-восстановительные
свойства изученных систем.
Экспериментальная часть
Оборудование: платиновый редокс-электрод, хлорсеребряныи элек-
трод сравнения, высокоомный вольтметр, стакан на 100 мл. мерные
колбы на 50 мл, мерная пипетка на 5 мл — 2 шт., штатив для электро-
дов, бюретка на 25 мл — 2 шт.
Реактивы: растворы в соответствии с табл. 8.1: 1) 0,1 М K3[Fe(CN)6]
и 0,1 М КДРе(СЫ)6]; 2) 0,1 М [Co(NH3)6]CI3 и 0.1 М [Со(ЫН3)6]С12;
3) 0,1 М [(NH4)2Fe(SO4)2-6H2O] (соль Мора) и 0,1 М FeCl3; 4) 0,01 М
12 и 0,1 М KI.
262 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
Таблица 8.1
№ варианта | § i Окисленная форма Восстановленная форма
Вещество Концен- трация, моль/л s 5 о Вещество Концен- трация, моль/л Объем, мл |
1 1 K3|Fe(CN)J 0,1 25 K4|Fe(CN)6| 0,1 25
2 (Co(NH?)t]Clj 0,1 25 |Co(NH3)6|Cl3 0,1 25
3 FeClj 0,1 25 |(NH4),Fe(SO4), 6Н,О[ 0,1 25
4 I2 0,01 25* KI 0,1 25*
2 1 K3|Fe(CN)t| 0.01 25 K4|Fe(CN)J 0,01 25
2 |Co(NHs)6]Clj 0,01 25 |Co(NHj)t|Cl2 0,01 25
3 Fed, 0.01 25 |(NH4)2Fe(SO4),-6H2O| 0,01 25
4 I2 0,001 25 KI 0,01 25
* Для измерений берут 50 мл раствора 0,01 М 12 в О, I М KI
1. Получите задание у преподавателя (табл. 8.1). Заполните две бю-
ретки растворами системы 1. Если исходные 0.1 М растворы требуют
десятикратного разбавления (вариант 2), то отберите в мерные колбы
на 50 мл по 5 мл соответствующих 0.1 М растворов, доведите до метки
дистиллированной водой, перемешайте.
2. Отмерьте в стакан на 100 мл с помощью бюреток указанные
в табл К. 1 объемы растворов окисленной и восстановленной форм
Поместите стакан на магнитную мешалку и включите перемеши-
вание.
3. Опустите редокс-электрод и электрод сравнения в стакан, закре-
пив электроды в штативе для электродов и подсоединив их к клеммам
высокоомного вольтметра или к pH-метру.
4. Сразу же проведите измерение напряжения в соответствии с ин-
струкцией для данной модели вольтметра или рН-метра. Запишите
начальное значение потенциала относительно электрода сравнения
в ст. 2 табл. 8.2.
5. Оставьте систему на 3 минуты, после чего запишите новое значе-
ние потенциала в ст. 3 табл. 8.2.
6. Выньте электроды из раствора, промойте дистиллированной во-
дой и осушите фильтровальной бумагой. Раствор вылейте, тщательно
промойте стакан дистиллированной водой.
7. Повторите измерения со следующей редокс-системой, выпол-
няя действия п. 1—6.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 263
Обработка экспериментальных данных
1. Сформируйте таблицу 8.2 опытных и расчетных данных в соот-
ветствии со своим заданием, как показано ниже.
Таблица 8.2
ма№ ОВП, В.ОТН.Х.С. э. через время ОВП, В, отн. с. в. э. через 3 мин Потенциал £. В расчет по (8.2) Выводы
20 с 3 мин
1 2 3 4 5 6
2. Сравните значения ОВП в ст. 2 и 3. Если они отличаются не бо-
лее чем на 5 мВ, то их усредните. При различии больше чем на 5 мВ
систему можно считать необратимой.
3. Пересчитайте измеренные через 3 минуты значения ОВП от-
носительно стандартного водородного электрода (с. в. э.). Запишите
значения в ст. 4 табл. 8.2.
4. Рассчитайте концентрацию потенциалопределяюших ионов
в растворе (моль/л) с учетом увеличения общего объема при смеши-
вании.
5. Запишите уравнение Нернста для редокс-потенциалов изучае-
мых систем. Рассчитайте значение ОВП, используя табличные величи-
ны стандартных потенциалов (Приложение X), принимая активности
ионов окисленной и восстановленной форм равными их концентра-
циям. Результаты запишите в ст. 5 табл. 8.2.
6. Сравните измеренные и рассчитанные значения ОВП. Сделайте
вывод об обратимости изученных окислительно-восстановительных
систем и запишите его в ст. 6 табл. 8.2.
7. Сравните окислительную способность изученных редокс-си-
стем. Какая из них является наиболее сильным окислителем? Вывод
запишите в ст. 6 табл. 8.2.
Экспериментальная часть
с использованием цифровой лаборатории
В данной работе вместо высокоомного вольтметра используется
приставка-переходник для электродов, которая непосредственно
подсоединяется к компьютеру. Использование цифровой лаборато-
рии упрощает процесс измерения и делает его более наглядным, по-
зволяет следить за динамикой изменения потенциала на экране ком-
пьютера.
264 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Оборудование: компьютер, платиновый редокс-электрод, хлорсере-
бряный электрод сравнения, приставка-переходник для электродов,
стакан на 100 мл. мерные колбы на 50 мл, мерная пипетка на 5 мл —
2 шт., штатив для электродов, бюретка на 25 мл — 2 шт.
Реактивы: растворы в соответствии стабл. 8.1: 1)0.1 М K3[Fe(CN)6]
и 0,1 М КДРе(СЫ)6]; 2) 0,1 М [Co(NH3)6]CI3 и 0.1 М [Со(ЫН3)6]С12;
3) 0,1 М [(NH4)2Fe(SO4)2-6H2Ol (соль Мора) и 0,1 М FeCl3; 4) 0,01 М
12 и 0,1 М KI.
Ход работы
1. Получите задание у преподавателя (табл. 8.1). Заполните две бю-
ретки растворами первой системы. Если исходные растворы требуют
десятикратною разбавления (вариан] 2). то отберите в мерные колбы
на 50 мл по 5 мл соответствующих 0.1 М растворов, доведите до метки
дистиллированной водой, перемешайте.
2. Соберите установку для измерения ОВП (рис. 8.1). Подключите
приставку-переходник для электродов (3) к USB-порту компьютера.
К разъему 1 приставки-переходника подключите редокс-электрод (7),
к разъему 2 — электрод сравнения (2), закрепив электроды в штативе
для электродов.
Рис. 8.1. Установка для измерения окислительно-восстановительных потенциалов:
1 — редокс-электрод, 2 — электрод сравнения.
3 — датчик — переходник для электродов
3. Включите компьютер, запустите программу «Практикум». Убе-
дитесь, что программа идентифицировала электроды и на экране
появился шаблон зависимости потенциала от времени. Установите
пределы измерений по осям координат: по абсциссе X — (0—200) с,
по ординате У — (—1 1) В.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 265
4. Отмерьте с помощью бюреток указанные объемы растворов
окисленной и восстановленной форм вешества первой редокс-систе-
мы в стакан на 100 мл, поместите стакан на магнитную мешалку.
5. Опустите редокс-электрод и электрод сравнения в стакан, вклю-
чите перемешивание.
6. Сразу же запустите измерение и снимайте зависимость потенци-
ала от времени в течение 3 минут.
7. Остановите измерение. Сохраните графические и цифровые
данные, экспортировав их во внешний файл.
8. Выньте электроды из расiвора, промойте дистиллированной во-
дой и осушите фильтровальной бумагой. Раствор вылейте, тщательно
промойте стакан дистиллированной водой.
9. Повторите измерения со следующей редокс-системой, выпол-
няя действия п. 1—8.
Обработка экспериментальных данных
1. Сформируйте табл. 8.2 опытных и расчетных данных, как пока-
зано выше.
2. На основании полученных компьютерных зависимостей ре-
докс -потенциалов от времени определите значения потенциалов через
20 секунд и через 3 минуты после начала измерения. Запишите вели-
чины в ст. 2 и 3 табл. 8.2. Если они отличаются не более чем на 5 мВ
то их усредните. При различии более чем на 5 мВ, систему можно счи-
тать необратимой.
3. Далее обработку данных проведите так же, как указано выше в п.
3—6 традиционного варианта настоящего опыта.
Опыт 2. Зависимость окислительно-
восстановительного потенциала
от концентраций окисленной
и восстановленной форм редокс-системы
Цель опыта', изучение зависимости ОВП раствора от концентраций
окисленной и восстановленной форм вещества; проведение расчетов
по уравнению Нернста.
Эксперимент можно выполнить как обычным способом, измерив
разность потенциалов с помощью высокоомного вольтметра или рН-
метра, так и в условиях цифровой лаборатории (рис. 8.1) с использо-
ванием приставки-переходника для электродов. Методика измерения
ОВП для обоих случаев описана выше в опыте 1.
266 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Оборудование: рН-метр-милливольтметр или высокоомный воль-
тметр, платиновый редокс-электрод, хлорсеребряный электрод срав-
нения, бюретка на 50 мл — 4 шт., химический стакан на 50 мл — 3 шт.,
мерная колба на 50 мл — 2 шт., магнитная мешалка.
Реактивы: 0,1 М раствор K3[Fe(CN)6] и 0,1 М раствор K4|Fe(CN)6].
Ход работы
1. Заполните одну бюретку раствором 0,1 М К3| Fe(CN )6 [, другую -
раствором 0,1 М K4[Fe(CN)6]. Приготовьте 0,01 М растворы из исход-
ных 0,1 М растворов путем десятикратного разбавления. Для чего от-
берите из бюреток в мерные колбы на 50 мл по 5 мл соответствующих
0,1 М растворов, доведите до метки дистиллированной водой, переме-
шайте. Заполните бюретки приготовленными растворами.
2. В 1-й стакан на 50 мл отмерьте из соответствующих бюреток
по 10 мл 0,1 М растворов Kj|Fe(CN)J и K3|Fe(CN)6|.
во 2-й стакан отмерьте из соответствующих бюреток 10 мл 0,1 М
раствора Kj|Fe(CN)6| и 10 мл 0,01 М раствора K3(Fe(CN)6];
в 3-й стакан отмерьте из соответствующих бюреток 10 мл 0,1 М рас-
твора K3|Fe(CN)6J и 10 мл 0,01 раствора Kj[Fe(CN)6J. Стаканы прону-
меруйте.
3. Опустите редокс-электрод и электрод сравнения в стакан
№ 1, закрепив электроды в штативе для электродов и подсоединив
их к клеммам высокоомного вольтметра.
Поместите стакан на магнитную мешалку и включите перемеши-
вание.
4. Сразу же проведите измерение ОВП в соответствии с инструк-
цией для данной модели вольтметра (или рН-метра). Запишите уста-
новившееся значение потенииала в табл. 8.3.
5. Выньте электроды из раствора, промойте дистиллированной во-
дой и осушите фильтровальной бума!ой.
6. Проведите измерения в стаканах № 2 и 3, повторяя действия п.
3—5. Запишите установившиеся значения потенциалов для систем 2
и 3 в табл. 8.3.
Обработка экспериментальных данных
1. Сформируйте табл. 8.3 опытных и расчетных данных, как пока-
зано ниже
2. Рассчитайте концентрацию потенциалопределяюших ионов
(окисленной и восстановленной формы), учитывая, что раствор каж-
дой соли при смешении разбавляется вдвое.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 267
3. Рассчитайте редокс-потенциал системы |Fe(CN)6]'_ + е
|Fe(CN)6]4- для различного соотношения концентраций окисленной
и восстановленной форм по уравнению (8.2), используя табличное
значение стандартного потенциала (Приложение X) и принимая, что
активности ионов равны их концентрациям. Запишите результаты
(Ержч) в табл. 8.3.
4. Рассчитайте экспериментальное значение ОВП относитель-
но стандартного водородного электрода (с. в. э.) (см. теоретическую
часть). Результаты расчета (Ежси) запишите в табл. 8.3.
5. Рассчитайте относительную ошибку опыта Результат запишите
в табл. 8.3.
6. Сделайте вывод о характере зависимости редокс-потенциала
раствора от соотношения концентраций окисленной и восстановлен-
ной форм.
Таблица 8.3
№ ста- Концентрация исходных растворов, моль/л ОВП, В (х. с э.) ОВП систе- мы, В (с. в. э.) Относит. ошибка, °о
IQ|Fe(CNM Kj|Fe(CN J £г^и £wm
1 0,10 0,10
2 0,10 0,01
3 0,01 0,10
Экспериментальная часть
с использованием цифровой лаборатории
При выполнении данного опыта в условиях цифровой лаборатории,
кроме приставки-переходника для электродов, удобно использовать
также датчик объема жидкою реагента, чтобы изменять концентра-
цию окисленной и восстановленной форм вещества непосредственно
в процессе измерения. Это ускоряет эксперимент и делает его более
точным.
Оборудование: компьютер, платиновый редокс-электрод, хлорсе-
ребряный электрод сравнения, приставка-переходник для электро-
дов, датчик объема жидкого реагента, шприц на 10 мл — 2 шт., стакан
на 100 мл. мерные пипетки на 1 и на 10 мл, штатив для электродов,
бюретка на 25 мл — 2 шт., мерная колба на 100 мл — 2 шт., магнитная
мешалка.
Реактивы: 0,1 М раствор Kj|Fe(CN)6] и 0,1 М раствор K4Fe(CN)6].
26В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 8.4
№ вар-та Окисленная форма Восстановленная форма
Вещество Концен- трация, моль/л Объ- ем, мл Вещество Концен- трация, моль/л Объ- ем, мл
1 K}{Fe(CN)J 0.001 25 K,|Fe(CN)fc| 0,001 25
2 K3[Fe(CN),| 0.01 25 KJFe(CN)fc| 0.01 25
3 K3[Fe(CN)J 0.01 25 KJFe(CN)b| 0.001 25
4 K3|Fe(CN)6| 0,001 25 KJFe(CN)b| 0,01 25
Ход работы
1. Получите задание у преподавателя в соответствии с табл. 8.4
2. Из имеющихся 0,1 М растворов окисленной и восстановленной
форм в соответствии с заданным вариантом приготовьте в мерных
колбах по 100 мл 0,001 М или 0,01 М соответствующих растворов раз-
бавлением в 100 или 10 раз.
3. Подключите к USB-порту компьютера приставку-переходник
для электродов. К разъему 1 приставки-переходника подключите ре-
докс-электрод, к разъему 2 — электрод сравнения, закрепив электро-
ды в штативе для электродов. Ко второму USB-порту компьютера под-
ключите датчик объема жидкого реагента, закрепив его в химическом
штативе.
4. Заполните шприц на 10 мл 0,1 М раствором K3[Fe(CN)6| (окис-
ленная форма), наденьте на иглу защитный колпачок. Вставьте шприц
в датчик объема так, чтобы поршень шприца вплотную подходил
к толкателю датчика, а игла шприца была направлена в стакан для из-
мерений.
5. Включите компьютер, запустите программу •• Практикум». Убе-
дитесь, что программа идентифицировала электроды и датчики и что
на экране появились два шаблона графиков: зависимости потенциала
от времени и объема реагента от времени. Обнулите показания датчи-
ка объема жидкого реагента экранной кнопкой «Настройка».
6. Выберите режим «Зависимость одного от другого по нажатию».
Выберите параметр «Объем» по оси абсцисс.
7. Приготовьте исходную редокс-систему в соответствии с табл .8.4*
быстро отмерьте указанные объемы растворов окисленной и восста-
новленной форм веществ из бюреток в стакан на 100 мл. Поместите
стакан на магнитную мешалку.
8. Опустите редокс-электрод и электрод сравнения в стакан, вклю-
чите перемешивание.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 269
9. Сразу же начните измерение. Отметьте первую точку на графи-
ке клавишей «Пробел» после стабилизации значения потенциала. До-
бавьте 2—3 капли раствора из шприца (около 0,1 мл) и нанесите вторую
точку на график клавишей «Пробел» после стабилизации значения по-
тенциала. После чего объем добавляемого раствора можно увеличить
до 0,5 мл. Продолжайте добавлять раствор примерно по 0,5 мл в стакан,
пока не израсходуется все содержимое шприца, каждый раз фиксируя
новую точку на графике после стабилизации значения потенциала.
10. Остановите измерение. Сохраните графические и табличные
данные, экспортировав их во внешний файл папки «ОВП».
11. Вылейте раствор, промойте стакан и электроды дистиллиро-
ванной водой и осушите фильтровальной бумагой.
12. Зарядите чистый шприц на 10 мл исходным 0,1 М раствором
Kj[Fe(CN)fc| (восстановленная форма), вставьте в датчик объема. Еше
раз приготовьте исходную редокс-систему своего варианта (табл. 8.4)
и повторите измерения, выполняя п. 3—10, но уже с добавлением рас-
твора восстановленной формы из шприца.
Обработка экспериментальных данных
1. Сформируйте табл. 8.5 опытных и расчетных данных для двух
измерений.
Таблица 8.5
Объемы до-
бавленных
растворов
Концентрация рас-
творов с учетом
добавок, моль/л
овп113Н,
мВ отно-
сительно
ОВП,мВ
относитель-
Относит.
ошиб-
ка,^
2. Откройте файлы сначала 1-го, затем 2-го измерений. Выберите
10—15 точек из всего диапазона измерений. Запишите значения объ-
емов (И] — для 1-го измерения, Уг — для 2-го измерения) в соответ-
ствующие столбцы 1 и 2 табл. 8.5. Отвечающие этим объемам значения
окислительно-восстановительных (редокс-) потенциалов, измерен-
ных относительно хлорсеребряного электрода (х. с. э.), занесит е в ст. 5
табл. 8.5.
3. Пересчитайте значения редокс-потенциалов из ст. 5 относитель-
но стандартного водородного электрода (см. теоретическую часть). За-
пишите значения в ст. 7 табл. 8.5.
270 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Для всех выбранных точек рассчитайте концентрацию окислен-
ной со, и восстановленной cKcd форм вещества, учитывая изменение
объема при смешивании и добавленный объем из шприца.
Формула для расчета при добавлении окисленной формы вещества
(1-е измерение):
Со. = (Ю-1 Уо + 10-' У,)/(2У0 + У,у, cRed = (10-3- y0)/(2V0 + У,).
Формула для расчета при добавлении восстановленной формы ве-
щества (2-е измерение):
Он = (10 ’ К0)/(2К0 + К2); cRld= (IO"1 Го+ 10"' - Иг)/(2Гв + К2),
где Уи— исходный объем (здесь 25 мл); Vt —добавленный объем 0,1 М раство-
ра окисленной формы; У2 — добавленный объем 0.1 М раствора восстановлен-
ной формы.
Запишите рассчитанные значения в ст. 3 и 4 табл. 8.5.
5. Запишите уравнение Нернста для ОВП изученной системы. Для
всех выбранных точек рассчитайте окислительно-восстановительный
потенциал для концентраций окисленной и восстановленной форм
вещества, определенных в п. 4, используя табличную величину стан-
дартного электродного потенциала и принимая активности ионов
равными их концентрациям. Запишите значения в ст. 6 табл. 8.5.
6. На основании опытных и расчетных данных, полученных выше,
постройте графики зависимости: 1) измеренного редокс-потенциала
и 2) рассчитанного редокс-потенциала от соотношения концентра-
ций окисленной и восстановленной форм вещества. Сделайте вывод
об их соответствии. Объясните причины несовпадения.
Развитие опыта
Аналогичный опыт может быть проведен для других окислительно-
восстановительных систем (например, из опыта 1), потенциалы кото-
рых находятся в рамках допустимого диапазона измерений с помощью
приставки-переходника.
Опыт 3. Зависимость окислительно-
восстановительного потенциала
от водородного показателя среды
Цель опыта: изучение влияния pH раствора на ОВП реакции
Сг2О2~ । 14Н' i fte <=> 2Сг‘' + 7Н2О.
Глава 8. Окислительно-восстановительные и электрохимические процессы «271
Экспериментальная часть
Оборудование: лабораторный рН-метр-милливольтметр, платино-
вый редокс-электрод; хлорсеребряный электрод сравнения, стакан
на 50 мл — 3 шт., магнитная мешалка, бюретка на 25 мл — 3 шт., мер-
ный иилиндр или пипетка на 10 мл.
Реактивы: 0,005 М раствор Cr2(SO4)3; 0,01 М раствор К2Сг2О7; 2 М
раствор H2SO4.
Ход работы
1. Сформируйте табл. 8.6 опытных и расчетом* данных, как пока-
зано ниже
2. Заполните 3 бюретки растворами 0,005 М Сг2(5О4)з, 0,01 М
К2Сг2О7 и 2 М H2SO4.
3. Приготовьте из 2 М раствора H2SO4 в колбе на 50 мл 1,0 М рас-
твор H2SO4 разбавлением в два раза, в другой колбе на 50 мл — 0,5 М
раствор H2SO4 разбавлением в четыре раза.
4. В три стакана вместимостью 50 мл отмерьте из одной бюретки
10 мл 0,01 М раствора К2Сг2О7, из второй бюретки 10 мл 0,005 М рас-
твора Cr2(SO4)3. В первый стакан отмерьте цилиндром или пипеткой
10 мл 0,5 М раствора H2SO4, во второй стакан — 10 мл 1,0 М раствора
H2SO4, в третий — 10 мл 2 М раствора H2SO4. Стаканы пронумеруйте.
5. Проведите измерения редокс-потенциалов растворов в трех
стаканах на pH-метре в режиме измерения напряжения, как описано
в опытах 1 и 2 настоящей работы. Результаты занесите в табл. 8.6.
6. Проведите измерение pH всех трех растворов на pH-метре в ре-
жиме измерения pH. Результаты занесите в табл. 8.6.
Таблица 8.6
№ Концентра- ция, моль/л рНизмр Активность ОВПизме||, мВ ОВПрзс, мВ Относит, ошибка, %
Сг2О? СР* йн_, моль/л Е Е
1
2
3
Обработка экспериментальных данных
1. Рассчитайте концентрацию потенциалопределяюших ионов
в измеряемой системе с учетом разбавления исходных растворов
в 3 раза. Запишите значения в табл. 8.6.
272 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2. Рассчитайте активность ионов водорода в каждом стакане, ис-
ходя из измеренного pH. Запишите результаты в табл. 8.6.
3. Приведите уравнения для расчета ОВП изучаемой системы,
рассчитайте значения потенциалов относительно с. в. э., используя
табличное значение стандартною потенциала (Приложение X), при-
нимая активности ионов равными их концентрациям.
4. Постройте график зависимости редокс-потенпиала исследован-
ной системы от pH.
Экспериментальная часть
с использованием цифровой лаборатории
При выполнении данного опыта в условиях цифровой лаборато-
рии. кроме приставки-переходника для электродов, используется так-
же цифровой датчик pH, что позволяет изменять pH и фиксировать
изменение ОВП непосредственно в процессе эксперимента. Это дает
возможность получить наглядные компьютерные зависимости, уско-
рить и упростить эксперимент, провести компьютерную обработку ре-
зультатов
Оборудование: компьютер, датчик pH, приставка-переходник для
электродов, платиновый редокс-электрод, хлорсеребряный электрод
сравнения, стакан на 100 мл, магнитная мешалка, бюретка на 25 мл —
2 шт., мерные пипетки на 1 и 5 мл
Реактивы: 0,005 М раствор Cr2(SO4)3; 0,01 М раствор К2Сг2О7; 2 М
раствор HjSOa.
Ход работы
1. Соберите установку для измерения ОВП (рис. 8.1), подклю-
чив дополнительно к одному из LJSB-портов компьютера датчик pH.
К разъему 1 приставки-переходника подключите редокс-электрод,
к разъему 2 — электрод сравнения. Все электроды закрепите в штативе
для электродов. Электрод датчика pH на время подгоювки к измере-
ниям сохраняйте в стакане с дистиллированной водой.
2. Включите компьютер, запустите программу « Практикум». Убеди -
тесь, что программа идентифицировала датчики и на экране появились
два шаблона графиков: зависимости потенциала (напряжения) от вре-
мени и pH от времени. Установите пределы измерений по оси абсцисс
X: время — 0—500 с: по оси ординат Y: pH — (0—7) иЕ — (0—1,5) В.
3. Заполните две бюретки на 25 мл 0,01 М раствором К2Сг2О7
и 0,005 М раствором Cr2(SO4)3. В стакан на 100 мл отмерьте из бюреток
по 25 мл 0,01 М раствора К2Сг2О7 и 0,005 М раствора Cr2(SO4)3
Глава 8. Окислительно-восстановительные и электрохимические процессы • 273
4. Поставьте стакан на магнитную мешалку опустите в него элек-
трод датчика pH, редокс-электрод и электрод сравнения. Включите
перемешивание.
5. Сразу же запустите измерение при нажатой экранной кнопке
«Продолжить график». Фиксируйте графики временной зависимости
в течение 1—1,5 минуты до стабилизации значений потенциала и pH
Остановите измерение при нажатой кнопке «Продолжить график».
6. Добавьте аккуратно при перемешивании в раствор из пипетки
1 мл 2 М H2SO4. Запустите измерение — графики продолжатся от пре-
дыдущей зависимости. Фиксируйте графики временной зависимости
в течение 1—1,5 минуты до стабилизации значений потенциала и pH.
Остановите измерение при нажатой кнопке «Продолжить график».
7. Добавьте аккуратно при перемешивании в раствор из пипетки
2 мл 2 М H2SO4 и повторите действия п. 6. Затем добавьте 5 мл 2 М
H2SO4, а потом еще 5 мл, каждый раз повторяя действия п. 6.
8. Сохраните графические и табличные данные, экспортировав
их во внешний файл папки «ОВП».
9. Вылейте раствор в сливную емкость (в раковину не сливать!),
промойте стакан и электроды дистиллированной водой и осушите
фильтровальной бумагой. Наденьте на электрод датчика pH сосуд для
хранения, на другие электроды — защитные колпачки.
Обработка экспериментальных данных
1. Сформируйте табл. 8.6 опытных и расчетных данных, как пока-
зано выше.
2. Рассчитайте концентрацию потенциалопределяюших ионов
в растворе (моль/л) с учетом увеличения общего объема для каждого
из пяти измерений. Результаты запишите в табл. 8.6.
3. Рассчитайте активность ионов водорода в каждом случае, исходя
из измеренного pH. Результаты запишите в табл. 8.6.
4. Рассчитайте измеренные значения ОВП растворов относительно
стандартного водородного электрода. Результаты запишите в табл. 8.6.
5. Приведите уравнение Нернста для расчета редокс-потенциала
изучаемой системы.
Рассчитайте значения ОВП для всех значений pH, используя та-
бличное тначение стандартного потенциала системы (Приложение
X), принимая активности ионов окисленной и восстановленной форм
равными их концентрациям. Результаты запишите в табл. 8.6.
6. Постройте на одном чертеже графики зависимости ОВП из-
ученной системы от pH по экспериментальным и расчетным данным.
Сравните. Сделайте вывод.
274 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Развитие работы
Аналогичным образом можно исследовать другие доступные ре-
докс-смете мы, ОВП которых зависят от pH и потенциалы которых на-
ходятся в рамках допустимого диапазона измерений с помощью при-
ставки-переходника.
Работа 38. Электродвижущая сила и напряжение
гальванического элемента
Цель работы-, овладение методикой измерения электродвижущей
силы (ЭДС) и напряжения гальванических элементов (ГЭ). исследо-
вание зависимости ЭДС и напряжения ГЭ от активности потенциало-
пределяюших ионов и плотности тока.
Теоретическая часть
Окислительно-восстановительные реакции могут протекать
по электрохимическому механизму. Особенностью электрохимических
ОВР является то, что стадии окисления и восстановления разделе-
ны пространственно, происходят на разных участках поверхности
или на отдельных электродах, а переход электронов осуществляется
по внешней цепи. Электроды, на которых идут процессы восстанов-
ления, называют катодами, а сами процессы катодными. Электроды,
на которых идут процессы окисления, называют анодами, а сами про-
цессы анодными.
Гальваническим элементом (ГЭ) называется электрохимическая си-
стема, в которой химическая энергия непосредственно превращается
в электрическую. Простейший ГЭ (рис. 8.2) состоит из двух электро-
дов (У) и (2) (катода и анода), погруженных в растворы электролитов
(5) и (б), находящихся в отдельных сосудах (3) и (4), разделенных либо
электролитическим ключом (7), либо диафрагмой, проницаемой для
ионов. Внешняя цепь (S) может включать в себя потребитель энергии,
измерительные приборы, металлические проводники. При разом-
кнутой цепи в ГЭ на обоих электродах устанавливается равновесие,
характеризуемое величиной соответствующих равновесных потенци-
алов Е”.
Для мета гшческих электродов, находящихся в растворах собствен-
ных солей, потенциалопределяюшей является реакция:
М^ + пе<=> Мк.
(8-3)
Глава 8. Окислительно-восстановительные и электрохимические процессы • 275
Рис. 8.2. Устройство классического гальванического элемента'
1,2 — электроды, 3,4 — сосуды для электролита, 5,6 — растворы
электролитов, 7— электролитический ключ, 8— внешняя цепь
Уравнение Нернста (8.2) для расчета потенциала такого металличе-
ского электрода имеет вид
где Ем-*'М — равновесный потенциал металлического электрода; Е—
стандартный потенциал =1) (Приложение IX); (ли„«) — относительная
активность потенциалопределяющих ионов металла
Активность твердой фазы принимают равной единице. При 298 К
уравнение (8.4) принимает вид:
<»*>
В ГЭ процессы идут самопроизвольно, поэтому при замыкании
цепи отдавать электроны будет электрод с более отрицательным по-
тенциалом (анод), а принимать — электрод с более положительным
потенциалом (катод). Разность равновесных потенциалов катода
и анода называют электродвижущей силой (ЭДС) гальванического
элемента £э:
£э = £₽-£₽. (8.5)
Разность стандартных электродных потенциалов называют стан-
дартной ЭДС ГЭ:
£® = £^-£^. (8.5а)
276 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Поскольку £к >£а, то ЭДС ГЭ есть величина положительная,
Еэ > 0. Суммарная электродная реакция в ГЭ является суммой полу-
реакций. идущих на аноде и на катоде, и называется токообразующей
реакцией (ТОР).
Электродвижущая сила элемента связана с энергией Гиббса ТОР,
ДСТОР уравнением
где п — число электронов, участвующих в токообразующей реакции
В общем случае, для токообразуюшей реакции ЬВ + dD — IL + тМ
стандартную энергию Гиббса AG?Op при Т — 298 К можно рассчитать
по табличным значениям (Приложение III) по уравнению
Д6?ор г + m&G°f м -(b&G°f B + d&G°fD), (8.7)
где b, d.Ltn — стехиометрические коэффициенты TOP.
Стандартную ЭДС ГЭ, можно определить двумя способами:
1) по уравнению (8.5а), используя табличные значения стандарт-
ных потенциалов;
2) по уравнению (8.6), подставляя значение Дб?ОР, рассчитанное
по уравнению (8.7):
го _ Afirop
А, =---------- (8.6а)
nF
ЭДС гальванического элемента при активности ионов, отличных
от 1. рассчитывается из выражения
или для Т — 298 К
(8.8а)
" “м)
где ав — относительные активности веществ ТОР.
Максимальная электрическая работа ГЭ (в отсутствие других видов
полезной работы) определяется соотношениями
РК™’=«£-£, и JCa,=-ACToP. (8.9)
Глава 8. Окислительно-восстановительные и электрохимические процессы • 277
Наиболее простой, хотя и не слиш-
ком точный метод экспериментально-
го определения ЭДС ГЭ заключается
в прямом измерении разности потен-
циалов между электродами с помощью
вольтметра (или pH-метра), имеющего
высокое внутреннее сопротивление.
В цифровой лаборатории роль высо-
коомного вольтметра выполняет дат-
чик электрохимического потенциала.
Вследствие высокого сопротивления
сила тока, протекающая через элемент,
незначительна, поэтому измеряемое
напряжение мало отличается от равно-
весной величины, ю есть ЭДС.
При измерении ЭДС на установке,
схема которой приведена на рис. 8.3,
Рис. 8.3. Электрическая схема
установки для измерения ЭДС
и напряжения ГЭ*
1,3,8—ключи, 2 - реостат, 4 —
амперметр; 5 — милливольтметр.
6 — исследуемый элемент,
7 — высокоомный вольтметр
замыкают ключ (5) при разомкнутых ключах (/) и (8) и по шкале воль-
тметра (7) находят ЭДС.
При работе ГЭ и протекании в цепи юка происходит поляризация
электродов, то есть отклонение их потенциала от равновесного значе-
ния. Потенциал катода становится менее положительным, потенциал
анода — менее отрицательным. Кроме того, имеет место омическое
падение напряжения между электродами. Таким образом, напряжение
работающего гальванического элемента всегда меньше ЭДС на вели-
чину поляризации электродов и омических потерь
U= Е, - 1г-ЕЕ-,,
(8-Ю)
где 1 — ток; г — омическое сопротивление внутренней и внешней цепи; д£э —
поляризация элемента, равная сумме поляризаций катода и анода.
С увеличением плотности тока поляризация и омическое падение
напряжения возрастают, а напряжение ГЭ падает. Кривая зависимости
напряжения элемента от силы или плотности тока получила название
волыпамперной кривой. По мере работы элемента (разряда) уменьша-
ется концентрация исходных реагентов и увеличивается концентра-
ция продуктов реакции, поэтому в соответствии с уравнением Нерн-
ста ЭДС элемента уменьшается. Кроме того, возрастает поляризация
элемента, поэтому при разряде элемента его напряжение постепенно
падает. Кривая изменения напряжения ГЭ во времени в процессе раз-
ряда называется разрядной кривой.
278 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Для измерения напряжения и получения вольтамперных или раз-
рядных кривых можно использовать установку, схема которой приве-
дена на рис. 8.3. Для этого замыкают ключи (1) и (8) при разомкнутом
ключе (3). Ток в цепи измеряют с помощью амперметра (4), величину
тока регулируют с помощью переменного сопротивления (2). Воль-
тметр (5) служит для прямого измерения напряжения на клеммах
элемента.
Вопросы и задачи для самоконтроля
1. Какое уравнение выражает связь между термодинамическими
функциями реакции и ЭДС гальванических элементов?
2. Как устроен Cd/Ag гальванический элемент? Какие электроли-
ты можно использовать в этом элементе? Какие процессы идут
на катоде и аноде при работе Cd/Ag ГЭ? Напишите токообразу-
юшую реакцию
3. Какие факторы влияют на потенциал металлического электро-
да? Чему равна ЭДС серебряно-кадмиевого гальванического
элемента при 298 К и активностях потенциалопределяющих ио-
нов, равных 0,1? Каким образом можно увеличить ЭДС Cd/Ag
гальванического элемента?
4. Определите значение энергии Гиббса, протекающей в Cd/Ag
элементе реакции при заданных выше активностях.
5. Как измерить ЭДС гальванического элемента?
6. В чем различие понятий «ЭДС» и «напряжение» ГЭ? Почему на-
пряжение в работающем ГЭ всегда меньше ЭДС?
7. От каких факторов зависит напряжение гальванического эле-
мента?
Опыт 1. Определение электродвижущей силы
(ЭДС) гальванических элементов. Влияние
концентрации растворов электролитов
на ЭДС гальванического элемента
Экспериментальная часть
Оборудование: высокоомный вольтметр или рН-метр-милливольт-
метр, стакан на 100 мл — 2 шт., электролитический мостик — стеклян-
ная (J-образная трубка, заполненная загущенным раствором хлорида
калия, пипетка на 10 мл с дозирующим устройством (или бюретка
на 25 мл), мерная колба на 100 (50) мл — 2 шт.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 279
Реактивы-, растворы в соответствии с вариантами табл. 8.7: 1 М
CuSO4 (или 1 М Cu(NO3)2); 1 М ZnSO4 (или 1 М Zn(NO3)2): 1 М
Pb(NO3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3)2); 1 М NiSO4 (или
1 М Ni(NO3)2); 1 М SnSO4; дистиллированная вода; металлические
стержни или пластины из Си, Zn, Pb, Ag, Ni, Sn с токоотводами.
Ход работы
1. Получите у преподавателя вариант гадания в соответствии
с табл. 8.7.
Таблица 8.7
№ вари- анта № рения троды ГЭ 1/2 Растворы 1/2 Соотноше- ние концен- траций Ci! Ci £p, в ЭДС. ЭДС,
1 2 3 4 5 6 7 8 9 10 11 12
1 | Cu/Zn CuSO4/ZnSO4 1/0,01 0,01/1
2 1/0,1 0,1/1
3 1/1 1/1
2 1 Zn/Cd ZnSO4/CdSO4 1/0,01 0,01/1
2 1/0,1 0,1/1
3 1/1 1/1
3 1 Pb/Ag Pb(NO3)2/AgNO3 1/0,01 0,01/1
2 1/0,1 0,1/1
3 1/1 1/1
4 ] Cd/Ni CdSO4/NiSO4 1/0,01 0,01/1
2 1/0,1 0,1/1
3 1/1 1/1
5 1 Sn/Cu SnSO4/CuSO4 1/0,01 0,01/1
2 1/0,1 0,1/1
3 1/1 1/1
2. Из 1 М исходного раствора заданной соли 2 приготовьте по 100
(или 50) мл растворов концентрации 0,1 Ми 0,01 М последовательным
разбавлением.
Для приготовления 100 мл 0.1 М раствора отберите пипеткой (или
точно отмерьте из бюретки) 10 мл соотвеютвуюшего 1 М раствора, пе-
ренесите его в мерную колбу на 100 мл, долейте до метки дистиллиро-
ванной водой, закройте пробкой и перемешайте, переворачивая колбу.
Если для работы даны колбы на 50 мл, то отберите пипеткой 5 мл 1 М
раствора, перенесите в колбу, доведите до метки водой и перемешайте.
280 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Для приготовления 100 мл 0,01 М раствора отберите пипеткой
10 мл приготовленного 0,1 М раствора, перенесите в мерную колбу
на 100 мл, доведите до метки дистиллированной водой, закройте проб-
кой и перемешайте. Для приготовления 50 мл возьмите соответствен-
но 5 мл 0,1 М раствора.
3. Соберите гальванический элемент, как показано на рис. 8.4
на примере цинк-медного ГЭ, из двух металлических пластинок (в со-
ответствии с заданием), которые поместите в два отдельных стакана.
Металлические пластинки предварительно зачистите наждачной бу-
магой, промойте проточной водой, промокните фильтровальной бу-
магой. В стаканы налейте примерно на 2/з их объема растворы солей
соответствующих металлов концентрации 1 и 0,01 М в соответствии
с табл. 8.7. Стаканы предварительно ополосните раствором заданной
концентрации и соедините между собой электролитическим ключом,
заполненным загущенным раствором электролита (хлорида калия).
Обе пластины погрузите примерно на одинаковую глубину, при этом
места кон 1 акта пластин с токоотводом не должны касаться раствора.
4. Токоотводы от электродов подсоедините к клеммам высокоом-
ного вольтметра или pH-метра и произведите измерение напряжения
в соответствии с инструкцией для данной модели прибора и указа-
ниями преподавателя. Приборы следует включить в сеть и прогреть
заранее. В первой серии опытов меняйте в соотвегствии с табл. 8.7
концентрацию раствора 2 при постоянной концентрации (1 М) рас-
твора 1. Проведите три измерения ЭДС с разными концентрациями
раствора 2, повторяя действия п. 3—4. Запишите показания вольтме-
тра в ст. 11 табл. 8.7.
5. Во второй серии опытов меняйте концентрацию раствора 1 в со-
ответствии со ст. 6 табл. 8.7. Проведите три измерения ЭДС с раство-
рами разных концентраций, повторяя действия п. 3—4. Запишите по-
казания вольтметра в ст. 12 табл. 8.7.
Обработка экспериментальных данных
1. Выпишите табличные значения стандартных потенциалов для
заданных электродов (Приложение IX).
2. Принимая активности потенциалопределяюших ионов равны-
ми их концентрациям, рассчитайте равновесные потенциалы £р элек-
тродов 1 и 2 по уравнению (8.4а). Запишите значения, соответственно,
в ст. 7 и 8 табл. 8.7.
3. Определите анод и катод ГЭ. Запишите уравнения анодного
и катодного процессов и токообразующую реакцию ГЭ.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 281
4. Рассчитайте ЭДС (£эра<.ч) Cu/Zn — гальванического элемента
для всех соотношений <?|/с2 по уравнению (8.5) или (8.8). запишите
значения в ст. 9 и 10 табл. 8.7.
5. По экспериментальным и расчетным данным постройте гра-
фики зависимости ЭДС гальванического элемента от соотношения
концентраций С]/с2 (активностей) потенциалопределяюших ионов.
Сделайте вывод о влиянии активности потенциалопределяюших ио-
нов на ЭДС. Объясните, почему измеренные величины ЭДС могут от-
личаться от рассчитанных значений.
6. Рассчитайте энергию Гиббса ТОР по уравнению (8.6) на основе
опытных данных, и максимальную электрическую работу, которую
может совершить данная электрохимическая система по уравнению
(8.9). Сделайте вывод по полученным значениям.
Экспериментальная часть
с использованием цифровой лаборатории
В цифровой лаборатории для измерения ЭДС вместо высокоомно-
го вольтметра используется датчик для измерения электрохимических
потенциалов, который непосредственно подсоединяется к компью-
теру (рис. 8.4) Использование цифрового оборудования упрощает
процесс измерения и делает его более наглядным, позволяет следить
за динамикой изменения потенциала на экране компьютера при из-
учении влияния различных факторов.
Рмс. 8.4. Установка для измерения ЭДС цинк-медного ГЭ.
1 — стакан с раствором ZnSO4;
2 — стакан с раствором CuSO4,3 — Си-пластина,
Zn-лластина, 5—датчик электрохимического потенциала;
6 — токоотводы, 7—электролитический мостик
282 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Оборудование: компьютер, датчик для измерения электрохимиче-
ских потенциалов, стаканчик на 100 мл — 2 шт, электролитический
мостик — стеклянная Ll-образная трубка, заполненная затушенным
раствором хлорида калия, пипетка на 10 мл или бюретка на 25 мл. мер-
ная колба на 100 (50) мл — 2 шт.
Реактивы: растворы в соответствии с вариантами табл 8.7: 1
М CuSO4 (или 1 М Cu(NO3)2); 1 М ZnSO4 (или 1 М Zn(NO3)2); 1 М
Pb(NO3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3)2); 1 М NiSO4 (или
1 М Ni(NO3)2); 1 М SnSO4, дистиллированная вода; металлические
стержни или пластины из Си, Zn, Pb, Ag, Ni, Зпстокоотводами.
Ход работы
1. Получите у преподавателя вариант «адания в соответствии
с табл. 8.7.
2. Приготовьте растворы меньших концентрации последователь-
ным разбавлением в соответствии с заданием
3. Соберите гальванический элемент, как указано выше в традици-
онном варианте настоящего опыта.
4. Подсоедините токоотводы от датчика электрохимического по-
тенциала к пластинам электродов, как показано на рис. 8.4, причем
красный токоотвод — к катоду ГЭ.
5. Подсоедините датчик для измерения электрохимического по-
тенциала с помощью кабеля к U SB-порту компьютера. Включите ком-
пьютер, запустите программу «Практикум». Убедитесь, что программа
идентифицировала датчик. При этом на экране должен появиться ша-
блон графика зависимости потенциала от времени. Установите преде-
лы измерений по осям координат: по абсциссе X — (0—100) с, по орди-
нате У — (0—1,5) В.
6. Запустите процесс измерения и следите за ходом потенциала
в течение 1—1,5 минуты.
7. Закончите измерение после стабилизации цифрового значения
потенциала. Сохраните результаты и экспортируйте их во внешний
файл папки «(альванический элемент», созданной для работы.
8. Замените раствор 2 в стакане, предварительно сполоснув его за-
меняемым раствором. Проведите 2-е и 3-е измерение ЭДС с раство-
рами других концентраций, повторяя действия п. 4—5.
9. Замените раствор 1 в стакане, предварительно сполоснув его за-
меняемым раствором. Проведите 4-е и 5-е измерение ЭДС с раство-
рами других концентраций, повторяя действия п. 4—5.
10. По окончании измерений отсоедините токоотводы от пластин,
промойте стаканы и металлические пластины.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 283
Обработка экспериментальных данных
1. Определите экспериментальные величины ЭДС (£э Ли,) из по-
лученных компьютерных графиков по установившемуся шачению
разности потенциалов и запишите в ст. 11 и 12 табл. 8.7.
2. Далее обработку данных проведите, как указано в п. 1—6 тради-
ционного варианта настоящего опыта.
Опыт 2. Получение вольтамперной кривой
гальванического элемента
Цель опыта: получить зависимость напряжения от тока в ГЭ, про-
следить влияние концентрации растворов электролитов на напряже-
ние гальванического элемента.
Экспериментальная часть
Оборудование: вольтметр, амперметр, реостат (0—6 Ом), стакан
на 100 мл — 2 шт., электролитический мостик—стеклянная U-образная
трубка, заполненная загущенным раствором хлорида калия, пипетка
на 10 мл с дозирующим устройством (или бюретка на 25 мл), мерная
колба на 100 (50) мл — 2 шт.
Реактивы: растворы в соответствии с вариантами табл. 8.7: 1 М
CuSO4 (или 1 М Cu(NO3)2); 1 М ZnSO4 (или 1 М Zn(NO3)2); 1 М
Pb(NO3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3)2); 1 М NiSO4 (или
1 М Ni(NO3)2); 1 М SnSO4; дистиллированная вода; металлические
стержни или пластины из Си, Zn, Pb, Ag, Ni, Sn с токоотводами.
Ход работы
1. Получите у преподавателя вариант задания (табл. 8.7). Для 1-го
измерения приготовьте по 100 мл 0.01 М растворов 1 и 2. Соберите
гальванический элемент, как описано выше в опыте 1.
2. Соберите внешнюю цепь ГЭ в соответствии со схемой рис. 8.3,
исключив высокоомный вольтметр (7). С помощью вольтметра (5)
проведите определение напряжения элемента при разомкнутой внеш-
ней цепи (измерение 1). Для этого замкните ключ (8) при разомкнутом
ключе (7). Запишите результат в табл. 8.8.
3. Установи ie максимальное сопротивление реостата (2). Ключом
(7) замкните внешнюю (поляризующую) цепь. Постепенно повышай-
те ток, уменьшая сопротивление до тех пор, пока напряжение элемен-
та не приблизится к нулю. Зафиксируйте 10—15 значений тока и на-
пряжения, записывая их в табл. 8.8.
284 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Замените разбавленные 0,01 М растворы на 1 М растворы элек-
тролитов и повторите измерение вольтамперной зависимости.
Таблииа 8.8
Система 1/2 Концентрация рас- твора 1/2, моль/л № измерения Ток, А Напряжение, В
0,01 0,01 1
I.O0 1,00 1
Обработка экспериментальных данных
1. По данным табл. 8.8 постройте на одном чертеже две кривые за-
висимости напряжения элемента oi силы тока (вольтамперные кри-
вые) для двух концентраций. Объясните, почему напряжение элемента
не равно ЭДС и уменьшается при повышении плотности тока. При-
ведите соответствующую формулу.
2. Сравните две вольтамперные кривые для разных концентраций
растворов. Объясните различия.
Экспериментальная часть
с использованием цифровой лаборатории
При выполнении работы с использованием цифровой лаборатории
на установке, схема которой показана на рис. 8.3, вольтметры (7) и (5)
и амперметр (4) заменяют на датчики электрохимического потенци-
ала, напряжения и тока, соответственно, которые непосредственно
подключаю! к компьютеру. Использование цифровой лаборатории
позволяет существенно упростить эксперимент, сделать его более
наглядным, компактным, сразу же в процессе измерений получить
вольтамперные кривые, сохранить данные на электронном носителе
и провести их компьютерную обработку.
Оборудование: компьютер, датчик тока, датчик напряжения, реостат
(0—6 Ом), стаканчик на 100 мл — 2 шт., электролитический мостик —
стеклянная U-образная трубка, заполненная загущенным раствором
хлорида калия, пипетка на 10 мл с дозирующим устройством (или бю-
ретка на 25 мл), мерная колба на 100 (50) мл — 2 шт.
Реактивы: растворы в соответствии с вариантами табл. 8.7: 1 М
CuSO4 (или 1 М Cu(NO3)2); 1 М ZnSO4 (или 1 М Zn(NO3)2); 1 М
Глава 8. Окислительно-восстановительные и электрохимические процессы • 285
РЬ(ЫО3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3),); 1 М NiSO4 (или
IM Ni(NO3)2); 1 М SnSO4; дистиллированная вода; металлические
стержни или пластины из Си, Zn, Pb, Ag, Ni, Sn с токоотводами.
Ход работы
1. Получите у преподавателя вариант задания (табл. 8.7). Соберите
гальванический элемент, как описано выше в опыте 1 настоящей работы.
2. Соберите внешнюю цепь. Для этого подсоедините токоотводы
отдатчика напряжения к пластинам электродов, а датчик тока, реостат
и замыкающий ключ подключите последовательно в катодную часть
измерительной цепи, как показано на схеме (рис. 8.3).
3. Подсоедините датчики напряжения и тока к USB-портам ком-
пьютера. Включите компьютер, запустите программу «Практикум».
Убедитесь, что программа идентифицировала датчики напряжения
и тока. При этом на экране должны появиться шаблоны графиков
зависимости напряжения от времени и тока от времени Установите
пределы измерений для зависимости напряжения от времени: по аб-
сциссе X — (0—100) с, по ординате Y — (0—1.5) В. Установите пре-
делы измерений для зависимости тока от времени: по абсциссе X —
(0—100) с, по ординате Y — (0—2) А. Установите режим «Зависимость
одного от другого по нажатию». Выберите «Напряжение» по ордина-
те Ки «Ток» — по абсциссе X.
4. Установите максимальное сопротивление peociaTa (2). Ключом
(/) замкните внешнюю (поляризующую) цепь. Запустите измерение.
Нанесите 1-ю точку на график после стабилизации показания датчика
напряжения, нажав клавишу «Пробел». Постепенно повышайте ток,
уменьшая сопротивление реостата, каждый раз фиксируя значения
тока и напряжения клавишей «Пробел» после стабилизации значений.
Снижайте сопротивление реостата до тех пор, пока напряжение эле-
мента не приблизится к нулю. Зафиксируйте последнюю точку и оста-
новите измерение.
5. Сохраните табличные и графические данные, экспортировав
их во внешний файл папки «Вольтамперные кривые».
6. Замените разбавленный 0,01 М раствор на I М раствор электро-
лита и снимите вольтамперную кривую для такого ГЭ, повторяя дей-
ствия п. 5—7.
Обработка экспериментальных данных
1. По полученным табличным данным постройте на одном графи-
ке две кривые зависимости напряжения элемента от силы тока (воль-
286 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
тамперные кривые) для двух кониентраиии либо в программе Excel,
либо на миллиметровой бумаге. Объясните, почему напряжение эле-
мента не равно ЭДС и уменьшается при повышении силы тока. При-
ведите соответствующую формулу.
2. Сравните две вольтамперные кривые для разных концентраций
растворов. Объясните различия.
Работа 39. Концентрационный
гальванический элемент
Теоретическая часть
Концентрационный гальванический элемент — это элемент, у которо-
го электроды имеки одинаковую природу, но различную концентрацию
потенциалопределяющих ионов. В этом случае ГЭ работает за счет вы-
равнивания концентраций растворов. При этом ЭДС элемента зависит
только от соотношения активностей потенциалопределяющих ионов,
так как стандартные потенциалы обоих электродов одинаковы:
Очевидно, что Е3 > 0, если а' > а". То есть анодом будет электрод
в растворе с меньшей активностью (концентрацией) потенциалопре-
деляющих ионов л". При 298 К
Вопросы и задачи для самоконтроля
1. Почему различны значения потенциалов электродов в концен-
трационном ГЭ?
2. Рассчитайте равновесные потенциалы двух медных электродов,
у которых активности ионов меди соответственно равны 1,0
и 10-’ моль/л. Определите ЭДС ГЭ, составленного из этих элек-
тродов. напишите уравнения катодного и анодного процессов.
Укажите, какой из электродов будет катодом, а какой анодом.
Экспериментальная часть
Оборудование: высокоомный вольтметр (pH-метр), стакан
на 100 мл—2 шт., электролитический мостик—стеклянная U-образная
Глава 8. Окислительно-восстановительные и электрохимические процессы • 287
трубка, заполненная затушенным раствором хлорида калия, пипетка
на 10 мл с дозирующим устройством (или бюретка на 25 мл), мерная
колба на 100 (50) мл
Реактивы-, растворы в соответствии с вариантами табл. 8.9: 1 М
CuSO4 (или 1 М Cu(NO3)2), 1 М ZnSO4 (или 1 М Zn(NO3)2), 1 М
Pb(NO3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3)2); 1 М NiSO4 (или
1 М Ni(NO3)2); 1 М SnSO4; дистиллированная вода; металлические
стержни или пластины из Си, Zn, Pb, Ag, Ni, Sn с токоотводами.
Ход работы
1. Получите у преподавателя вариант задания (табл. 8.9).
Таблииа 8.9
№ варианта Электроды Раствор C|/Cj, моль/л Езрж, В
1 2 3 4 5 6
1 Си CuSO4 1/0.001
2 Zn ZnSO4 1/0.001
3 Cd CdSO4 1/0.001
4 Pb Pb(NO3)3 1/0.001
5 Ag AgNO3 1/0.001
6 Ni NiSO4 1/0.001
7 Sn SnSO4 1/0.001
2. Из 1 М исходного раствора заданной соли приготовьте 100 (50) мл
раствор меньшей концентрации в соответствии с заданием (табл. 8.9)
последовательным разбавлением, как описано в опыте 1 работы 38.
3. Соберите гальванический элемент, как описано выше в опыте 1
работы 38. Внимание: оба электрода в данном опыте имеют одинако-
вую природу, но различные концентрации ионов в растворе.
4. Проведите измерение ЭДС гальванического элемента, как опи-
сано в традиционном варианте опыта 1 работы 38 (п. 3—4).
Обработка экспериментальных данных
1. Сформируйте табл. 8.9 опытных и расчетных данных, как пока-
зано выше, в соответствии со своим вариантом
2. Запишите в ст. 6 табл. 8.9 измеренное значение ЭДС, E3tave]>.
3. Рассчитайте ЭДС (£э ра€Ч) концентрационного гальванического
элемента по уравнению (8.11а), принимая активности ионов равны-
ми их концентрациям. Запишите результат в ст. 5 табл. 8.9. Сравните
опытные и рассчитанные значения. Сделайте вывод.
288 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Запишите уравнения анодного, катодного процессов, токообра-
зующую реакцию в ГЭ.
5. Рассчитайте энергию Гиббса реакции (AGT0P) по уравнению
(8.6). используя измеренную величину ЭДС
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик электрохимического потенциала,
стаканчик на 100 мл — 2 шт., электролитический мостик — стеклян-
ная U-образная трубка, заполненная загущенным раствором хлори-
да калия, пипетка на 10 мл с дозирующим устройством (или бюретка
на 25 мл), мерная колба на 100 (50) мл — 2 шт.
Реактивы: растворы в соответствии с вариантами табл. 8.9: 1 М
CuSO4 (или 1 М Cu(NO3)2); 1 М ZnSO4 (или 1 М Zn(NO3)2); 1 М
Pb(NO3)2; 1 М AgNO3; 1 М CdSO4 (или 1 М Cd(NO3)2); 1 М NiSO4 (или
1 М Ni(NO3)2); 1 М SnSO4; дистиллированная вода; металлические
стержни или пластины из Си. Zn. Pb. Ag. Ni. Зпстокоотводами.
Ход работы
1. Получите у преподавателя вариант задания (табл. 8.9).
2. Приготовьте раствор меньшей концентрации в соответствии
с заданием последовательным разбавлением, как описано в традици-
онном варианте опыта 1 работы 38.
3. Соберите гальванический элемент, как указано в п. 3 опыта 1 ра-
боты 38. Внимание: оба электрода в данном опыте имеют одинаковую
природу, но различные концентрации ионов в растворе.
4. Проведите измерение ЭДС гальванического элемента, как опи-
сано выше в опыте 1 работы 38 с использованием цифровой лаборато-
рии (п. 4—7).
Обработка экспериментальных данных
Проведите обработку данных, как указано выше для традиционно-
го варианта опыта настоящей работы
Работа 40. Электролиз водного раствора
сульфата натрия
Цель работы: ознакомление с процессами, протекающими на рас-
творимых и нерастворимых электродах при электролизе водных рас-
Глава 8. Окислительно-восстановительные и электрохимические процессы • 289
творов электролитов, с расчетами количества электричества, выхода
по току.
Теоретическая часть
Электролизом называются процессы, происходящие на электродах
под действием электрического тока, подаваемого от внешнего источни-
ка. При электролизе происходит превращение электрической энергии
в химическую. Электролиз проводится в электролизерах, основными
составными частями которых являются два электрода и ионный прово-
дник (электролит) между ними. На отрицательном электроде электро-
лизера (катоде) происходит процесс восстановления, на положитель-
ном электроде (аноде) — процесс окисления. На катоде в первую очередь
идут процессы, характеризуемые наиболее положительным потенциа-
лом. т.е. в первую очередь восстанавливаются наиболее сильные окис-
лители. На аноде в первую очередь идут процессы, характеризуемые
наиболее отрицательным потенциалом, т.е. в первую очередь окисляют-
ся более сильные восстановители. Некоторые аноды при электролизе
не рас1воряются из-за положительного значения их потенциала или об-
разования на поверхности защитных, пассивных пленок. К нераствори-
мым анодам относятся платиновые металлы, графит, титан, тантал и не-
которые другие. В других случаях анод в большей или меньшей степени
окисляется (частично растворяется) при электролизе, как, например,
никелевый электрод, используемый в настоящей работе. К активным
(растворимым) анодам относятся медь, серебро, цинк, олово и др. Ак-
тивность анода во многом зависит от природы электролита.
Если потенциалы двух или нескольких электродных реакций близ-
ки по величине, то эти реакции протекают на электроде одновремен-
но. При этом проходящее через электрод электричество расходует-
ся на все эти реакции. Доля количества электричества, расходуемая
на превращение одного из веществ (В,), называется выходом по току
этого вещества:
в/
=^%,
Q
(8-12)
где Qj — количество электричества, израсходованного на превращение
/-вещества; Q — общее количество электричества, прошедшего через раствор
электролизер.
Теоретическое соотношение между количеством прошедшего
электричества и количеством вещества, испытавшего превращения
на электроде, определяется законом Фарадея, согласно которому для
290 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
окисления или восстановления одного моля эквивалентов любого ве-
щества требуется одинаковое количество электричества. Эта величина
называется постоянной Фарадея Fи равна заряду 1 моля электронов:
1 f= Na • qc = bfill - 10й -1,602 -10-1’ =
= 96 484 « 96 500 КлДмольэкв), (8.13)
где — число Авогадро.
Поскольку массы превращенных веществ на электродах пропорци-
ональны количеству прошедшего электричества Q, то
где tnj — масса превращенного/-вещества, г; — молярная масса эквивален-
тов /-вещества, г/моль; Q= bt — количество прошедшего электричества, Кл;
/ — ток, А; I — время, с; и — число молей электронов, необходимых для пре-
вращения 1 моля /-вещества; Bj — выход по току.
При проведении электролиза с растворимым анодом масса анода
в ходе опыта уменьшается. Определив изменение массы электрода
за время электролиза и измерив силу тока, прошедшего через систему,
по уравнению (8.14) можно найти выход по току В; для анода в данных
условиях.
Напряжение электролизера слагаеюя из разности равновесных по-
тенциалов электродов (t/miri), поляризации катода и анода (Д£) и оми-
ческого падения в проводниках первого и второго рода /(г, + г,) :
: f/mln +ДЕ+/(/-,+г2).
Вопросы и задачи для самоконтроля
1. Что называют электролизом? Какие факторы влияют на напря-
жение электролизера?
2. Что такое постоянная Фарадея? Сформулируйте объединенный
закон Фарадея.
3. Какова последовательность электродных процессов на катоде
при электролизе расплава смеси солей А1С13, MgCl2, КО?
4. Какова последовательность электродных процессов на аноде при
электролизе водного раствора хлорида меди с медным анодом?
5. Что такое выход вещества по току и от каких факторов он за-
висит?
6. Рассчитайте ток в цепи и массу вещества, которое подверглось
разложению при электролизе водного раствора сульфата калия
с нерастворимым анодом, если на катоде выделилось 0,224 л во-
Глава 8. Окислительно-восстановительные и электрохимические процессы • 291
дорода, измеренного при нормальных условиях, за 1 час элек-
тролиза.
7. Рассчитайте, сколько литров кислорода при нормальных усло-
виях выделилось в результате реакции 2Н,О = О2 + 4Н+ + 4е при
прохождении через электрохимическую систему 1 F электриче-
ства и выходе кислорода по току, равном 0,5.
Экспериментальная часть
Для определения количества электричества в настоящей рабо-
те используют газометрический метод. Электролиз водного раствора
сульфата натрия с никелевыми электродами проводят в электролизере
(рис. 8.5). Он представляет собой химический стакан, в который по-
гружены две опрокинутые вверх дном градуированные бюретки или
пробирки (2). Внутрь пробирок введены никелевые электроды (5).
Токоотводы от электродов (4) подключают к положительному (анод)
и отрицательному (катод) полюсам источника постоянного тока.
Оборудование: источник постоянного тока (12 В), прибор для элек-
тролиза с Ni-электродами (рис. 8.5), соединительные провода, термо-
метр, барометр.
Реактивы: 1 М раствор Na2SO4, метиловый оранжевый.
Ход работы
1. Получите у лаборанта электроли-
зер, бюретки (пробирки) которого за-
полнены раствором Na2SO4 с добавлен-
ным метиловым оранжевым и в которые
подведены Ni-электроды, как показано
на рис. 8.5. Внимание: пробирки не при-
поднимать!
2. Подсоедините электроды с помо-
щью проводов к источнику постоянного
тока.
3. Замкните цепь и начните отсчет
времени начала опыта.
4. Наблюдайте за выделением газов
и изменением окраски индикатора. На-
блюдения запишите
5. Отключите электролизер от ис-
точника тока, когда меньший объем вы-
делившегося газа составит не менее 3 мл.
Рис. 8.5. Схема установки для
электролиза с измерением
объема выделяющихся газов.
1 — раствор электролита;
2 — бюретки; 3 — электроды;
4 — проводники первого рода
292 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Запишите время электролиза, объемы выделившихся газов и цвет рас-
твора в бюретках в табл. 8.10 опытных данных.
6. Запишите в соответствующие столбцы табл. 8.10 температуру
опыта Т. атмосферное давление ра1М и давление насыщенных паров
рн,о при температуре опыта (Приложение II)
Таблица 8.10
Время опыта, с 1’,, мл, цвет V2, мл, цвет Гопыта, К 1 ратм Рн,о
1 2 3 4 | 5 6
Обработка экспериментальных данных
1. Сформируйте табл. 8.11 расчетных данных, как показано ниже.
Таблица 8.11
1ц , мл мл /«, А Со2
1 2 3 4 5 6 7
2. Определите ионный состав электролита, равновесные потенци-
алы возможных катодных и анодных реакций Запишите уравнения
реакций, протекающих на никелевых (частично растворимых) элек-
тродах при прохождении постоянного тока через раствор Na2SO4. обо-
сновав их значениями потенциалов. Объясните, почему изменилась
реакция среды у катода и анода.
3. Приведите объем выделившихся газов к нормальным условиям
по формуле
К- 273рГ,
" (273+0101,3’
где р давление газа, кПа: р =рх[м - Рн2о ~Рь\ Pmt — давление, определяемое
по барометру, кПа; Рн.о — давление насыщенного водяного пара, кПа; рь —
поправка на гидростатическое давление столба жидкости в бюретке, кПа, ко-
торой пренебрегают, t — температура опыта, °C.
Температуру газа и раствора в бюретке условно принимают равной
температуре окружающего воадуха.
Полученные значения запишите в ст. 1 и 2 табл. 8.11.
4. Определите количество прошедшего через систему электриче-
ства по объему выделившегося водорода по закону Фарадея, принимая
Глава 8. Окислительно-восстановительные и электрохимические процессы • 293
выход водорода по току на катоде равным 1005- Результат запишите
в ст. 3 табл. 8.11.
5. Рассчитайте средний ток в цепи, зная Qo и время электролиза.
Результат запишите в ст. 4 табл. 8.11.
6. Определите количество электричества, пошедшее на выделение
кислорода, по закону Фарадея, учитывая К,о, = 5,6 л (н.у.). Результат
запишите в ст. 5 табл. 8.11.
7. Определите выход по току кислорода по формуле (8.12) и коли-
чество электричества, пошедшее на окисление никеля, принимая, что
на аноде протекают только два процесса. Полученные значения запи-
шите в табл. 8.11.
8. Объясните, почему выход кислорода по току не равен 1005. Сде-
лайте вывод, какое вещество в основном подверглось разложению при
электролизе.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, источник постоянного тока (12 В), дат-
чик объема газа с контролем температуры — 2 шт., прибор для электро-
лиза (рис. 8.5), соединительные провода, барометр.
Реактивы: 1 М раствор Na2SO4, метиловый оранжевый.
Ход работы
Проведите электролиз рас хвора Na2SO4, как описано выше для тра-
диционного варианта опыта с тем отличием, что каждую из бюреток
с открытыми кранами подсоедините кдатчикам объема газа (рис. 1.10).
Подключите датчики к компьютеру и подготовьте их к работе, как
описано в разделе 1.4 Замкните цепь электролизера и одновременно
запустите измерение на экране компьютера. Остановите измерение,
выключив одновременно электролизер, когда меньший объем выде-
лившегося газа составит не менее 20 мл. Данные сохраните, экспорти-
ровав их во внешний файл.
Обработка экспериментальных данных
1. Определите объем выделившихся газов по разности началь-
ного и конечного показаний датчиков объема. Значения запишите
в табл. 8.11. Запишите значение температуры газов по показаниям дат-
чиков объема
2. Далее обработку данных проведите, как указано выше в тради-
ционном варианте настоящего опыта (п. 2—7).
294 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Работа 41. Определение числа
Фарадея и числа Авогадро
с помощью электролиза
Цельработы: провести электролиз с определением средней величи-
ны тока и изменения массы анода, рассчитать числа Фарадея и Авога-
дро по полученным данным.
Теоретическая часть
При проведении электролиза с активным анодом масса анода
в ходе опыта уменьшается. Если выбрать анод и раствор электроли-
та. для которых все остальные побочные реакции, кроме окисления
электрода, сведены к минимуму, то можно принять выход окисле-
ния анода Bj равным 1. Тогда, определив изменение массы электро-
да за время электролиза и измерив силу тока, прошедшего через
систему, можно оценить опытным путем значение числа Фарадея F
по формуле (8.14), а затем по уравнению (8.13) рассчитать число
Авогадро Na.
В настоящей работе проводят элекгролиз на медном аноде в раство-
ре H2SO4 и определяют изменение массы анода. Можно также исполь-
зовать Ag-анод. Главное, чтобы процесс растворения анода в кислоте
не был самопроизвольным Тогда можно принять, что все количество
электричества, прошедшее через анод, пошло на окисление металла
по реакции: М -> Л/"’1 + не.
В качестве катодного материала можно взять такие металлы, как
Си, Sn, Pb, Zn, Fe и другие, а также графит. На катоде вначале выделя-
ется водород: 2Н+ + 2е —> Н2, а когда в растворе накопится достаточное
количество ионов меди (или серебра), то преобладающим процессом
станет восстановление ионов металла: Си24- + 2е —> Си.
Экспериментальная часть
с использованием цифровой лаборатории
Эксперимент можно провести как с использованием традицион-
ного оборудования (амперметра), так и цифрового датчика тока. По-
скольку в остальном ход опыта и обработка данных идентичны, описа-
ние дано на примере использования цифрового оборудования.
Оборудование: компьютер, электронные весы, датчик тока, ис-
точник постоянного тока (не менее 1,5 В), соединительные провода,
Cu-пластина (или Ag-пластина), графитовый стержень или метал-
Глава 8. Окислительно-восстановительные и электрохимические процессы • 295
лические пластинки из Си, Sn, Pb, Zn, Fe и др., химический стакан
на 200- 250 мл с крышкой из оргстекла и токоотводами.
Реактивы-. 1 М раствор H2SO4.
Ход работы
1. Подготовьте электроды: зачистите наждачной бумагой, промой-
те водой, промокните фильтровальной бумагой, высушите.
2. Взвесьте Cu-пластину на электронных весах, запишите ис-
ходную массу (mcu nJ в ст. 2 табл. 8.12; измерьте размеры (длину
и ширину) пластины с помощью линейки или штангенциркуля,
рассчитайте ее приблизительную площадь, учитывая обе стороны
и пренебрегая толщиной, полученное шачение запишите в ст. 4
табл. 8.12.
3. Соберите установку для электролиза, как показано на рис. 8.6.
Для этого: прикрепите подготовленные электроды к токоотво-
дам на крышке стакана; подключите датчик тока последовательно
в анодную часть цепи, красный разъем датчика тока подключите
к положительному полюсу источника постоянного тока; токоотвод
от графитового стержня подключите к отрицательному полюсу ис-
точника постоянного тока, сделав, таким образом, этот электрод ка-
тодом. Подсоедините датчик тока с помощью кабеля к USB-порту
компьютера.
Рис. 8.6. Установка для электролиза с растворимым анодом.
/ — стакан — электролизер; 2— Cu-лластина (анод), 3 — графитовый
стержень (катод); 4— датчик тока, 5 — положительный полюс источника
тока. 6 — ручка регулятора напряжения, 7— ручка регулятора тока,
8 — тумблер включения/выключения источника постоянного тока
296 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
4. Рассчитайте приблизительную силу тока в цепи с учетом площа-
ди медной пластины и плотности тока порядка 100 А/м2:I = i-S.
5. Включите компьютер, запустите программу «Практикум». Убе-
дитесь, что программа идентифицировала датчик, при этом на экране
появится шаблон графика «Зависимость тока от времени». Установите
пределы измерений по оси абсцисс X — (0—1500) с, по оси ординат
У-(0-2) А.
6. Налейте в стакан-электролизер на три четверти объема 1 М рас-
твор H2SO4. Поместите электроды в раствор. Cu-пластина должна
быть погружена полностью (рис. 8.6).
7. Установите ручку регулятора напряжения (6) источника тока
в крайнем положении вращения по часовой стрелке, а ручку регулято-
ра тока (7) — в крайнем положении против часовой стрелки.
8. Запустите измерение на компьютере и одновременно включите
источник постоянного тока, установив как можно быстрее нужную
силу тока в цепи вращением ручки регулятора тока по часовой стрелке
(Положение регулятора напряжения не меняйте.)
9. Проведите электролиз, фиксируя ток в течение 20—30 минут.
10. Выключите источник тока и остановите измерение. Сохраните
табличную и графическую зависимости, экспортировав их во внеш-
ний файл папки «Электролиз».
11. Выньте электроды из раствора, аккуратно промойте их и про-
сушите фильтровальной бумагой.
12. Проведите взвешивание Cu-анода после высушивания. Запи-
шите полученную массу (/ис„ кон) в ст. 3 табл. 8.12.
13. Повторите опыт еще раз (п. 1—12) с тем же медным анодом (из-
мерение 2). Результаты измерений запишите в табл. 8.12.
Обработка экспериментальных данных
1. Сформируйте табл. 8.12 опытных и расчетных данных, как по-
казано ниже.
2. Определите по полученному на компьютере графику сред-
нее значение тока и время электролиза, результаты занесите в ст. 5
и 6 табл. 8.12.
3. По уравнению Q = /ср - г рассчитайте общее количество электри-
чества. затраченное на электролиз.
4. Рассчитайте потерю массы анода: Д/я = /яС11|ИЯ1 — /яСи кон.
5. Напишите уравнения возможных реакций, которые протекали
на аноде и катоде при электролизе, обосновав их значениями электро-
дных потенциалов и собственными наблюдениями.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 297
Таблица 8.12
6. Определите постоянную Фарадея по уравнению (8.14). Результат
занесите в ст. 7 табл. 8.12.
7. Рассчитайте число Авогадро по уравнению (8.13). Результат за-
несите в ст. 8 табл. 8.12.
8. Сравните полученное значение числа Авогадро с известной фи-
зической постоянной. Сделайте вывод по работе.
Работа 42. Электролитическое
рафинирование меди
Цель работы: ознакомление с процессами электролитического ра-
финирования металлов, проведение электрорафинирования меди,
определение выхода мешила по юку и расхода энергии на единицу
массы очищенной меди.
Теоретическая часть
Электролиз используют для рафинирования (очистки, металлов:
меди, серебра, свиниа и др. Анодом при рафинировании служит
очищаемый металл. На аноде окисляются основной металл и при-
меси с более отрицательным потенциалом, чем у основного метал-
ла: М -» М"++ пе Примеси с более положительным потенциалом
не растворяются и выпадают из анода в осадок. На катоде вначале
выделяется водород: 2Н+ + 2е -> Н2, а когда в растворе накопит-
ся достаточное количество ионов очищаемого металла, например
меди, то преобладающим процессом станет восстановление ионов
металла: Си2+ + 1е —> Си. Примеси с более отрицательным потенци-
алом остаются в растворе. В настоящей работе проводят электролиз
на медном аноде и графитовом катоде в растворе H2SO4 на установке
(рис. 8.6), определяют изменение массы анода и катода, количество
электричества, прошедшее через систему, и расход энергии. Расход
энергии на электрохимическое получение 1 кг металла вычисляют
по уравнению
29В » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
»^=
ioWu
МВ}
\&FU
Втч/кг’
(8-15)
где F — постоянная Фарадея (26,8 А ч); U — напряжение на электролизере,
В; В,- — выход металла по току, М? = М/п — молярная масса эквивалентов
металла, г/моль, М — молярная масса металла, г/моль; п — число электронов,
принимаемых ионом металла при электроосаждении.
Вопросы и задачи для самоконтроля
1. Какие процессы могут протекать на катоде и аноде при электро-
рафинировании меди с примесями олова и серебра в 1 М раство-
ре H2SO4? Напишите уравнения процессов.
2. Рассчитайте расход энергии для получения 10 кг чистого Zn
при выходе его на катоде 5()'т и напряжении на электролизере
10 В.
3. Почему напряжение на электролизере всегда существенно боль-
ше минимального напряжения разложения вещества?
Экспериментальная часть
Эксперимент можно провести как с использованием традицион-
ного оборудования (амперметра, милливольтметра), так и цифровых
датчиков тока и напряжения. Поскольку в остальном ход опыта и об-
работка данных идентичны, описание дано на примере использования
цифровой лаборатории. При использовании цифрового оборудования
непосредственно в процессе опыта получают компьютерные зависи-
мое! и тока и напряжения от времени, по которым легко вычислить
средний заряд и среднее напряжение процесса, а значит точно опреде-
лить выход по току и затраты энергии.
Оборудование-, компьютер, источник постоянного тока, датчик тока
(или амперметр), датчик напряжения (или милливольтметр), весы,
химический стакан на 200 мл, медная пластина из технической меди,
графитовый стержень, провода, зажимы «крокодилы».
Реактивы-. 1 М раствор H2SO4.
Ход работы
1. Подготовьте электроды к работе: зачистите наждачной бумагой,
промойте водой, осушите и взвесьте на электронных весах. Массы ка-
тода и анода запишите в табл. 8.13. Оцените площадь пластины с по-
мощью штангенциркуля или линейки.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 299
2. Налейте в химический стакан на 200 мл 1 М раствор H2SO4 и по-
грузите медную пластину, содержащую примеси других металлов (со-
став узнайте у преподавателя).
3. Соедините медный электрод с положительным полюсом внеш-
него источника постоянного тока (рис. 8.6). В анодную цепь подклю-
чите цифровой датчик тока (или амперметр), как описано в работе 41.
4. В этот же стакан погрузите графитовый стержень и соедините
его с отрицательным полюсом источника постоянного тока (рис. 8.6).
К электродам с помощью зажимов подключите параллельно датчик на-
пряжения (красный провод — к медной пластине) или милливольтметр.
5. Включите компьютер, запустите программу «Практикум», по-
сле нахождения программой датчиков установите пределы измерения
по оси абсцисс X — (0—600) с, по осям ординат Y — (0—1,5) В и (0—2) А.
5*. (Если опыт проводится традиционным способом, то включи-
те источник тока и начните отсчет времени. Установите как можно
быстрее силу тока из расчета анодной плотности тока 100—200 А/м2.
Электролиз проведите в течение 20—30 минут, фиксируя ток и напря-
жение через каждые 3—5 минут. Если величины тока и напряжения
существенно менялись во времени, усредните значения за все время
опыта. Запишите время электролиза, среднюю силу тока и напряже-
ние на электролизере в табл. 8.13).
6. Запустите измерение, включите источник тока и установите как
можно быстрее силу тока из расчета анодной плотности тока 100—
200 А/м2. Электролиз проведите в течение 20—30 минут, после чего
остановите измерение. Запишите, что вы наблюдали на электродах
(газовыделение, осаждение металла).
7. После отключения электролизера удалите электроды из раство-
ра, опустите в стакан с дистиллированной водой, затем осторожно осу-
шите фильтровальной бумагой и определите их массу. Массы катода
и анода после электролиза запишите в табл. 8.13.
8. Сохраните табличные и графические данные, экспортировав
их во внешний файл.
Обработка экспериментальных данных
1. Сформируйте табл. 8.13 опытных и расчетных данных, как по-
казано ниже.
2. Рассчитайте средний ток I, время / и количество электриче-
ства Q, прошедшее через систему, на основе полученной компьютер-
ной зависимости тока от времени. Запишите полученные значения
в соответствующие столбцы табл. 8.13.
300 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Таблица 8.13
А Время троли- чество электри- чества С, А ч tn като- да, г /п анода, г Вси(Ч) Среднее напря- жение электро- лиза 1/, В Расход Вт ч/кг
3 S о z к о
I 2 3 4 5 6 7 8 9 10
»'2 ли. tn4
3. Рассчитайте среднее напряжение на электролизере U на основе
полученной компьютерной зависимости напряжения от времени. За-
пишите значение в табл. 8.13.
4. Определите количество осажденного металла по привесу катода:
Дли = (/и2 — »й|), а теоретическую массу выделившейся меди Дттгар —
по закону Фарадея на основании рассчитанного в п. 2 количества
электричества Q. Рассчитайте выход меди потоку по формуле =
= (Дли - 100)/ДллТ1.ор. Запишите значение в ст. 8 табл. 8.13.
5. Рассчитайте потенциалы возможных равновесных электродных
процессов и определите реакции, которые протекали на электродах.
Запишите уравнения.
6. Объясните механизм электрохимического рафинирования
(очистки) меди и причину расхождения между напряжением электро-
лизера и разностью равновесных потенциалов электродов.
7. По уравнению (8.15) рассчитайте расход энергии на получение
1 кг рафинированной меди при условиях опыта. Полученное значение
запишите в ст. 10 табл. 8.13. Укажите пути снижения расхода энергии.
Работа 43. Электрохимическая
коррозия металлов
Цель работы: изучение условий возникновения электрохимиче-
ской коррозии металлов, влияния среды и окислителя на скорость
коррозии.
Теоретическая часть
Коррозия — это необратимое самопроизвольное разрушение ме-
талла в результате его физико-химического взаимодействия с окру-
жающей средой. По механизму протекания различают химическую
Глава 8. Окислительно-восстановительные и электрохимические процессы • 301
и электрохимическую коррозию. Химическая коррозия металла пред-
ставляет собой гетерогенную окислительно-восстановительную ре-
акцию, которая наблюдается в средах, не проводящих электриче-
ский ток. Например, химическая коррозия протекает в результате
прямою взаимодействия металла с сухим i азом-окислителем при
высокой температуре или в среде агрессивной жидкости, не явля-
ющейся электролитом. Электрохимическая коррозия характерна
для сред, имеющих ионную проводимость, и представляет собой
гетерогенную окислительно-восстановительную реакцию, проте-
кающую по электрохимическому механизму. Электрохимическая
коррозия может иметь место: 1) в водных растворах солей, кислот,
щелочей, в морской воде; 2) в атмосфере влажного газа; 3) в почве.
При электрохимической коррозии на энергетически неоднородной
поверхности металла или сплава возникает множество локальных
микрогальванических элементов, в которых катодные и анодные
участки находятся в непосредственном контакте. На участках с бо-
лее отрицательным потенциалом — анодных — идет окисление
(анодное растворение) металла, а на участках с более положитель-
ным потенциалом — катодных — происходит восстановление окис-
лителя (Ох):
на анодных учас1ках;
М —> М“+ + пе,
на катодных участках:
Ох + пе —> Red.
Термодинамическим критерием возможности протекания корро-
зии является условие ДСкир < 0. что в случае электрохимической корро-
зии соответствует выполнению неравенства:
(«.is,
где Ещ/м —равновесный потенциал окислителя в данной среде, -
равновесный потенциал металла в данной среде.
Таким образом, чтобы коррозия происходила, потенциал окисли-
теля должен быть положительнее потенциала разрушаемого метана.
Окислителями при электрохимической коррозии чаще всего являются
молекулы кислорода воздуха и ионы водорода (или молекулы воды)
из коррозионной среды. При коррозии с участием кислорода, назы-
ваемой коррозией с поглощением кислорода, или коррозией с кие юродной
деполяризацией, на катодных участках протекает процесс:
302 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
О2 + 4Н+ + 4с -> 2Н2О при pH < 7,
О2 + 2Н,О + 4ё -> 4ОН при pH >7. (8.17)
Равновесный потенциал окислителя О? при 298 К описывается
уравнением
£о,/он- = Ь227 + 0,0147 lgpOi - 0.059рН (8.18)
При коррозии с участием ионов водорода, называемой коррози-
ей с выделением водорода, или коррозией с водородной деполяризацией,
на катодных участках протекает процесс:
2Н+ + 2ё -> Н2 при pH < 7,
2Н2О + 2ё -> Н2 + 2ОН при pH > 7. (8.19)
Равновесный потенциал окислителя Н+ при 298К описывается
уравнением
£н*/н, =_0,059рН +0,02951g рщ. (8.20)
Различные металлы корродирую! по-разному, в зависимости
от их стандартного потенциала и pH среды:
а) если потенциал металла положительнее потенциала кислород-
ного электрода в данной среде, то коррозия металла термодина-
мически невозможна. Например, золото, платина не могут кор-
родировать ни с поглощением О2, ни с выделением Н2;
6) если потенциал металла положительнее потенциала водородно-
го электрода и отрицательнее потенциала кислородного элек-
трода в данной среде, то коррозия возможна с поглощением
кислорода и невозможна с выделением водорода, например:
^Cu’vcu < £О,/Н2О
И
Еа‘ /с. "= £и-/н,-
в) если потенциал металла отрицательнее потенциала водородного
электрода, то возможна коррозия как с поглощением кислорода,
так и с выделением водорода. Например, щелочные, щелочнозе-
мельные металлы, магний, алюминий, цинк и др.
На практике скорость коррозии выражают либо через потерю мас-
сы образца в единицу времени на единицу площади поверхности,
либо через уменьшение толщины металла в единицу времени. В ла-
бораторных исследованиях скорость также выражают через плотность
Глава 8. Окислительно-восстановительные и электрохимические процессы • 303
тока анодного окисления металла. Скорость коррозии может зависеть
от pH среды, от концентрации окислителя, наличия веществ-акти-
ваторов или пассиваторов, от температуры и состава самого металла.
Скорость коррозии определяется (лимитируется) либо стадией катод-
ного восстановления кислорода, либо стадией выделения водорода,
либо анодным растворением металла.
Скорость катодного выделения водорода возрастает с увеличением
концентрации ионов водорода, то есть со снижением pH. На скорость
катодного выделения водорода заметное влияние оказывает природа
катодных участков. Некоторые металлы, находящиеся в составе ос-
новного металла, например платина, кобальт, никель и др., катали-
зируют выделение водорода, и катодный процесс на них протекает
с высокими скоростями. Другие металлы, например ртуть, свиней,
кадмий, не катализируют и даже замедляют кагодное выделение водо-
рода. Таким образом, скорость коррозии с выделением водорода мо-
жет быть замедлена снижением температуры и увеличением pH среды,
очисткой металла от примесей, катализирующих выделение водорода,
а также изоляцией поверхности металла. Перемешивание раствора
практически не влияет на скорость коррозии с выделением водорода.
Если скорость коррозии лимитируется реакцией катодного вос-
становления кислорода, то она ограничена скоростью диффузии рас-
творенного кислорода к поверхности металла, которая возрастает при
перемешивании раствора, увеличении концентрации растворенного
кислорода и повышении температуры.
В некоторых случаях скорость электрохимической коррозии мо-
жет лимитироваться анодной реакцией окисления металла. Обычно
это наблюдается на металлах, способных пассивироваться, таких как
хром, алюминий, титан, цирконий, никель, тантал и др. Пассивностью
металла называется состояние его повышенной коррозионной устой-
чивости, вызванное образованием на его поверхности защитных ок-
сидно-солевых слоев. В пассивное состояние при контакте с сильным
окислителем способны переходить многие металлы: хром, никель,
алюминий, железо и другие.
Вопросы и задачи для самоконтроля
1. В чем отличие электрохимической коррозии от химической?
2. Каковы причины возникновения коррозионных микрогальва-
нических элементов на поверхности металла?
3. Как определить термодинамическую возможность протекания
электрохимической коррозии?
4. От каких факторов зависит скорость коррозии?
304 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
5. Как можно замедлить скорость коррозии с поглощением кисло-
рода?
6. Какие факторы влияют на скорость коррозии с выделением во-
дорода?
7. Почему в атмосферных условиях медь корродирует, а золото нет?
8. Возможна ли коррозия железа с выделением водорода в раство-
ре, в котором активность ионов Fe2+ равна 10-’ моль/л, а pH сре-
ды равен 3?
Опыт 1. Коррозия железа в контакте с углеродом
Теоретическая часть
В настоящее время основным конструкционным материалом про-
должает оставаться углеродистая сталь — сплав железа с углеродом
сложного состава. В данной работе исследуются условия возникно-
вения микрогальванических коррозионных элементов на поверхно-
сти углеродистой стали и моделируется ее коррозия путем короткого
замыкания железного анода и графитового катода гальванического
элемента в водном растворе хлорида натрия NaCl. Метод заключает-
ся в прямом измерении разности потенциалов на клеммах указанного
гальванического элемента с помощью вольтметра или датчика элек-
трохимического потенциала. При коротком замыкании электродов ГЭ
происходит выравнивание потенциалов между электродами, при этом
через систему протекает значительный ток. то есть скорость коррози-
онных процессов становится ощутимой.
В соответствии с уравнениями реакций (8.17) и (8.19) среда около
катода должна подщелачиваться. За изменением реакции среды у ка-
тода можно судить по изменению окраски индикатора фенолфталеи-
на, который в кислом и нейтральном растворах бесцветен, а в щелоч-
ном имеет малиновую окраску. На аноде идет окисление железного
электрода и накапливаются ионы Fe2+. О коррозии железного стерж-
ня можно судить по изменению окраски раствора в присутствии
гексацианоферрата(Ш) калия K3[Fe(CN)6|, который с ионами Fe2+ об-
разует прочное комплексное соединение синего цвета KFe[Fe(CN)6J:
K3[Fe(CN)6] + Fe2+ = KFe[Fe(CN)6] + 2K+ (8.21)
Добавление в прикатодное пространство пероксида водорода HjO2,
который является более сильным окислителем, чем Н+ и О2,
(^н2ог/н,о = 1,776 В) приводит к резкому увеличению разности потен-
циалов между электродами ГЭ и, как следствие, к увеличению скоро-
сти коррозии.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 305
Экспериментальная часть
Оборудование: милливольтметр, U-образная стеклянная трубка, же-
лезный и графитовый стержни с токоотводами.
Реактивы: растворы 0,5 М NaCI; 0,1 М Kj[Fe(CN)6]; 1 М Н2Оэ, фе-
нолфталеин.
Ход работы
1. Сформируйте табл .8.14 экспериментальных данных.
Таблица 8.14
Показания вольтметра или датчика
потенциала
2. Соберите установку для изучения электрохимической кор-
розии, как показано на рис. 8.7. Заполните LJ-образную трубку 0,5
М раствором хлорида натрия на 2/з объема. Зачистите и промой-
те проточной водой графитовый и железный стержни, осушите
их фильтровальной бумагой. Опустите в одно колено U-образной
трубки железный стержень и добавьте 3—4 капли раствора 0.1 М
гексацианоферрата(Ш) калия K3|Fe(CN)6[, во второе колено погру-
зите графитовый стержень и добавьте 3—4 капли раствора фенол-
фталеина.
Рис. 8.7. Установка для моделирования коррозии углеродистой стали.
I — U-образная трубка, 2 — железный электрод 3 — графитовый
электрод, 4— катод (красный токоотвод),' 5— анод (черный
токоотвод), б — датчик электрохимического потенциала
306 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
3. Замкните внешнюю цепь через милливольтметр, подсоединив
токоотвод от графитового электрода к положительному полюсу воль-
тметра, а токоотвод от железного электрода — к отрицательному по-
люсу. Запишите в табл. 8.14 значение установившейся разности потен-
циалов С/|.
4. Отключите вольтметр, замкните электроды медным проводни-
ком. моделируя работу накоротко замкнутого микрогальванического
элемента. Наблюдайте за работой элемента, запишите, как меняется
окраска раствора в катодном и анодном пространствах.
5. Через 15—20 минут после начала опыта аккуратно разомкни-
те электроды, вновь замкните внешнюю цепь через милливольтметр
и запишите новое показание прибора U2.
6. Не размыкая внешней цепи, добавьте в катодную зону несколь-
ко капель раствора пероксида водорода Н2О2. Запишите показания
прибора (t/j) в табл. 8.14.
Обработка экспериментальных данных
1. Рассчитайте по уравнениям (8.18) и (8.20) равновесные потенци-
алы возможных катодных процессов с учетом pH среды в начале опыта
(раствор NaCI), принимая относительное давление кислорода равным
0,21, а относительное давление выделяющегося водорода равным 1.
2. Определите, выполняется ли условие возможности протекания
электрохимической коррозии при условиях опыта (8.16), принимая
потенциал электрода — анода — равным стандартному.
3. Напишите уравнения реакций, протекающих на аноде и катоде
гальванического элемента, обосновав их потенциалами, и суммарное
уравнение коррозионного процесса.
4. Объясните причину изменения окраски раствора около анода
и катода после короткого замыкания ГЭ. Обоснуйте уравнениями ре-
акций.
5. Объясните причину уменьшения напряжения U2 после работы
ГЭ при коротком замыкании по сравнению с начальным значением t'|.
6. Объясните причину возрастания напряжения U3 при добавлении
пероксида водорода в прикатодную область
Экспериментальная часть
с использованием цифровой лаборатории
При использовании цифрового оборудования разность потенци-
алов между электродами измеряют с помощью датчика электрохи-
мического потенциала, подключаемого к компьютеру, что позволяет
Глава 8. Окислительно-восстановительные и электрохимические процессы • 307
следить за изменением напряжения на электродах в динамике при
изменении условий коррозии, сохранять получаемые зависимости
на любом электронном носителе, проводить компьютерную обработку
данных.
Оборудование: компьютер, датчик для измерения электрохимиче-
ского потенциала, (J-образная стеклянная трубка, железный и графи-
товый стержни, зажимы «крокодил».
Реактивы: 0,5 М раствор NaCl; 0,1 М раствор K,[Fe(CN)6|; I М рас-
твор Н2О2; раствор фенолфталеина.
Ход работы
1. Сформируйте табл. 8.14 экспериментальных данных, как пока-
зано выше.
2. Соберите установку для изучения электрохимической коррозии,
как показано на рис. 8.7.
3. Подсоедините красный токоотвод от датчика электрохимиче-
ского потенциала к графитовому электроду а черный токоотвод —
к железному. Датчик электрохимического потенциала подсоедините
с помощью кабеля к (JSB-порту компьютера.
4. Включите компьютер, запустите программу «Практикум». Убеди-
тесь, что программа идентифицировала датчик, при этом на экране дол-
жен появиться шаблон графика зависимости потенциала от времени.
5. Установите пределы измерений по осям координат: по оси аб-
сцисс X — (0—600) с, по оси ординат Y — (0—2,0) В.
6. Запустите измерение при нажатой экранной кнопке «Продол-
жить график».
7. Остановите измерение после стабилизации потенциала (через
1—1,5 минуты). Запишите в табл. 8.14 значение установившейся раз-
ности потенциалов Ut.
8. Не отключая датчик, замкните электроды накоротко с помощью
зажимов, моделируя работу накоротко замкнутого микрогальваниче-
ского элемента. Снова запустите измерение при нажатой экранной
кнопке «Продолжить график». График продолжится от ранее получен-
ной зависимости. Убедитесь, что разность потенциалов между элек-
тродами стала равна нулю.
9. Остановите измерение и оставьте систему, не размыкая электро-
ды, на 10—15 минут.
Наблюдайте за изменением окраски индикаторов в приэлектрод-
ных пространствах, запишите свои наблюдения.
10. Через 15—20 минут после короткого замыкания аккуратно ра-
зомкните электроды, не перемешивая раствор. Запустите измерение
308 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
при нажатой экранной кнопке «Продолжить график». График продол-
жится от ранее полученной зависимости.
11. Запишите в табл. 8.14 начальное значение разности потенция -
лов U2 между электродами после прекращения короткого замыкания
Продолжайте фиксировать зависимость в течение 1 — 1,5 минузы.
12. Не размыкая внешней цепи и не останавливая измерения, до-
бавьте в колено с графитовым стержнем несколько капель 1 М раство-
ра пероксида водорода Н2О2 и перемешайте раствор электродом. На-
блюдайте за изменением хода зависимости.
13. Остановите измерение через 1—1,5 минуты. Запишите в табл. 8.14
последнее установившееся значение разности потенииалов U3-
14. Сохраните табличные и графические данные, экспортируя
их во внешний файл папки «Коррозия».
15. Вылейте раствор из U-образной трубки, промойте трубку
и электроды проточной водой.
Обработка экспериментальных данных
Проведите обработку полученных данных, как указано выше
для традиционного варианта опыта с использованием вольтметра
(п. 1-6).
Опыт 2. Влияние pH и природы электролита
на скорость коррозии железа
Цель опыта-, исследовать скорость коррозии железа в различных
средах, проследить влияние pH и активирующее действие ионов
хлора.
Эксперимент может быть выполнен как традиционным способом,
так и с использованием цифровой лаборатории.
Экспериментальная часть
Оборудование: химический стакан на 100 мл — 4 шт., цилиндр
на 50—100 мл, мерная пипетка на 1 мл, пластина из углеродистой ста-
ли (20 х 50 мм) — 4 шт.
Реактивы: растворы 0,05 М H3SO4; 0,1 М NaCI; 0,1 М NaNO3; 0,1 М
NaOH; 0.1 М Kj[Fe(CN)6].
Ход работы
1. В четыре стакана на 100 мл налейте по 50 мл растворов: 1) 0,05 М
H2SO4; 2)0,1 М NaCI; 3) 0,1 М NaNO3; 4) 0,1 М NaOH. Пипеткой до-
Глава 8. Окислительно-восстановительные и электрохимические процессы • 309
бавьте в каждый стакан по 0,5 мл 0,1 М K3[Fe(CN)6]. Стаканы прону-
меруйте.
2. Опустите в каждый стакан одновременно пластины из углероди-
стой стали и заметьте время начала эксперимента. Следите за процес-
сами в с гаканах. изменением окраски, i азовыделением на поверхности
пластины. Запишите свои наблюдения в ст. 4 табл. 8.15. Эксперимент
ведите в течение 5 минут при периодическом перемешивании раство-
ров.
3. По окончании эксперимента запишите в ст. 3 табл. 8.15 окраску
раствора в каждом стакане и ее интенсивность.
Таблица 8.15
№ стакана pH раствора (рассчитан ный) Интенсивность окраски раство- ра или оптическая плотность Наблюдения
1 2 3
Обработка экспериментальных данных
1. Рассчитайте pH растворов в стаканах по известной концентра-
ции раствора. Результаты запишите в ст. 2 табл. 8.15.
2. Сравни] е окраску в растворах с различными значениями pH по-
сле 5 минут коррозии. Запишите уравнение качественной реакции ио-
нов железа Fe2+ с гексацианоферратом калия K3[Fe(CN)6|. Объясните,
как интенсивность окраски связана со скоростью коррозии. Сделай-
те вывод, в каком из растворов скорость коррозии была наибольшая.
Произошло ли изменение окраски в стакане с раствором щелочи?
3. Объясните причину различного поведения углеродистой стали
в растворах с различными значениями pH. Запишите условие возмож-
ности электрохимической коррозии, уравнения анодных и катодных
процессов, предварительно рассчитав их равновесные потенциалы
в предположении = 10-3и ро, =0,21.
4. Объясните различную скорость коррозии в нейтральных раство-
рах NaCI и NaNO}. Сделайте вывод о влиянии ионов хлора на скорость
коррозии.
5. Объясните отсутствие видимых изменений в растворе щелочи.
Экспериментальная часть
с использованием цифровой лаборатории
В данном случае измеряют оптическую плотность разных раство-
ров с помощью датчика оптической плотности после 5 минут корро-
310 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
зионных испытаний. Использование цифрового оборудования позво-
ляет провести количественное сравнение скорости коррозии в разных
средах и компьютерную обработку данных.
Оборудование: компьютер, датчик оптической плотности 475 нм:
кювета, химический стакан на 100 мл — 4 шт., цилиндр на 100 мл, мер-
ная пипетка на 1 мл, пластина из углеродистой стали (20 х 50 мм) —
4 шт.
Реактивы: растворы 0,05 М H2SO4; 0,1 М NaCl; 0,1 М NaNO3; 0,1 М
NaOH; 0,1 М KJFeCCN)»,].
Ход работы
1. В четыре стакана на 100 мл налейте по 100 мл растворов: 1) 0,05 М
H,SO4; 2)0,1 М NaCl; 3)0,1 М NaNO3; 4) 0,1 М NaOH. Пипеткой до-
бавьте в каждый стакан по 1 мл 0,1 М K3[Fe(CN)6]_
Стаканы пронумеруйте.
2. Опустите в каждый стакан одновременно пластины из углероди-
стой стали и заметьте время начала эксперимента. Следите за процес-
сами в стаканах: изменением окраски, газовыделением на поверхности
пластины. Запишите свои наблюдения в ст. 4 табл. 8.15. Эксперимент ве-
дите в течение 10 минут при периодическом перемешивании растворов
3. Через 10 минут выньте одновременно пластины из стаканов,
сполосните водой.
Растворы сохраните
4. Вылейте весь раствор из стакана № 1 в кювету. Наденьте на кю-
вету с раствором датчик оптической плотности. Подключите датчик
оптической плотности к компьютеру. Установите пределы измерений
по оси абсцисс X — (0—100) с; по оси ординат Y — (0—2,0).
5. Запустите измерение и снимите зависимость оптической плот-
ности от времени в течение 1—2 минут.
6. Остановите измерение. Сохраните данные во внешнем файле
папки «Коррозия».
7. Вылейте содержимое кюветы в сливной стакан (!), тщательно
промойте кювету и железную пластину проточной водой, ополосните
дистиллированной водой и протрите фильтровальной бумагой. Ис-
пользуйте их для следующих измерений.
8. Проведите аналогичные действия (п. 4—6) с другими растворами.
Обработка экспериментальных данных
1. Запишите значения оптической плотности в растворах с раз-
личными значениями pH после 10 минут измерений в ст. 3 табл. 8.15.
Глава 8. Окислительно-восстановительные и электрохимические процессы «311
Значения определите из компьютерных графиков временной зависи-
мости. Сравните значения. Объясните, как оптическая плотность свя-
зана со скоростью коррозии. Оцените, как изменяется скорость кор-
розии при переходе от одного раствора к другому, считая ее обратно
пропорциональной времени достижения соответствующего значения
оптической плотности.
2. Дальнейшую обработку данных и оформление отчета проведите
так же, как указано выше для традиционного варианта (п. 1—4).
Опыт 3. Исследование поведения пассивного
и активного железа в коррозионно
агрессивных средах
Оборудование-. милливольтметр, мерная колба или цилиндр на 100 мл,
мерная пипетка на 2 мл или бюретка, пластина из углеродистой стали
(20 к 50 мм) — 2 шт., провод с зажимом «крокодил».
Реактивы-, растворы 0,05 М H2SO4; 0,1 М NaCI; 0,1 М Kj[Fe(CN)6];
0,5 М НО; концентрированная HNO(, концентрированная Н3РО4.
Ход работы
1. Сформируйте табл .8.16 опытных данных, как показано ниже.
Таблица 8.16
Материал Раствор pH расчет 1/, В Окраска Наблю- дения
1 2 3 4 5 6
Углеродистая сталь, обработанная НС1 H2SO4
NaCI
Углеродистая сталь, обработан- ная кони. HNO3 или кони. Н3РО4 H2SO4
NaCI
2. Подготовьте стальные пластинки для работы: поместите 1-ю
пластину на 2—3 минуты в 0,5 М НО; 2-ю пластину — на 2—3 минуты
в дымящую азотную кислоту HNO3 (или концентрированную Н3РО4).
(Обработка в концентрированных кислотах проводится под тягой!)
После обработки тщательно промойте все пластины проточной водой
и осушите фильтровальной бу Mai ой.
3. Погрузите 1-ю пластинку и графитовый электрод в стакан
с 0,05 М раствором H2SO4. Замкните внешнюю цепь через милли-
312 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
вольтметр, подсоединив с помощью проводов и зажимов графи-
товый электрод к положительному полюсу вольтметра, а желез-
ную пластину — к отрицательному полюсу. Запишите в табл. 8.16
значение установившейся разности потенциалов Ut. Добавьте
в С|акан 3—4 капли раствора 0,1 М гексацианоферрата(П1) калия
Kj[Fe(CN)6|, замкните электроды между собой и оставьте систему
на 5 минут при периодическом помешивании. После этого запи-
шите в табл. 8.16 интенсивность окраски раствора, наличие газовы-
деления, вылейте раствор в указанное место, электроды тщательно
промойте и осушите.
4. Повторите действия пункта 3 с 1-й пластиной в 0,1 М растворе
NaCl. Запишите в табл. 8.16 значение установившейся разности потен-
циалов иг и интенсивность окраски раствора после 5 минут выдержки
при замыкании электродов.
5. Повторите действия (п. 3—4) со 2-й пластиной. Результаты из-
мерений напряжения и свои наблюдения запишите в табл. 8.16.
Обработка экспериментальных данных
1. Сравните интенсивность окраски после коррозионных ис-
пытаний для разной предобработки стальных пластин и выдержки
их в разных растворах. Укажите, в каком случае интенсивность окра-
ски наибольшая и как это связано со скоростью коррозии. Запишите
уравнение качественной реакции ионов железа Fe?' с гексацианофер-
ратом калия K3[Fe(CN)6J.
2. Запишите уравнения возможных анодных и катодных корро-
зионных процессов, предварительно оценив pH растворов H2SO4
и NaCl и рассчитав равновесные потенциалы в предположении, что
= 10 3 и ра2 =0,21. Какой катодный процесс и почему являет-
ся основным в 0,05 М растворе H2SO4 и какой в 0,1 М растворе
NaCl?
3. Сравните значения разности потенциалов U (ст. 4 табл. 8.16)
в случае различной предобработки пластин. Объясните различия. Как
влияет на скорость коррозии железной пластинки разность потенци-
алов между катодными и анодными участками поверхности?
4. Меняется ли интенсивность выделения газа на поверхности же-
лезной пластины после ее различной обработки? Изменяется ли при
этом скорость коррозии металла?
5. Объясните разницу коррозионного поведения стальных пластин
в 0,1 М растворе NaCl после их выдержки в разбавленной соляной
и в концентрированных азотной и фосфорной кислотах.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 313
6. Что такое пассивность металла? Что при этом происходит с по-
тенциалом поверхности материала? Как пассивация влияет на ско-
рость коррозии? Обоснуйте ваши выводы с помошью измеренных
значений потенциалов и визуальных наблюдений.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик оптической плотности 475 нм.
датчик электрохимического потенциала, кювета, магнитная мешалка,
мерная колба или цилиндр на 100 мл, мерная пипетка на 2 мл или бю-
ретка, пластина из углеродистой стали (20 к 50 мм) — 2 шт.
Реактивы: растворы 0,05 М H2SO4; 0,1 М NaCl; 0,1 М K3[Fe(CN)6|;
0,5 М НС1; концентрированная HNO3, концентрированная Н3РО4.
Ход работы
1. Сформируйте таблицу 8.16 опытных данных, как показано выше
2. Подготовьте две пластины из углеродистой стали для исследова-
ния, проведя предобработку, как описано в п. 2 традиционного вари-
анта настоящего опыта.
3. Подсоедините токоотводы от датчика электрохимического по-
тенциала: красный — к графитовому стержню, а черный — к обра-
ботанной пластинке, закрепив электроды в лапках штатива. Датчик
электрохимического потенциала подсоедините с помошью кабеля
к USB-порту компьютера.
4. Включите компьютер, запустите программу «Практикум». Убе-
дитесь. что программа идентифицировала датчик для измерения элек-
трохимического потенциала. Установите пределы измерений по осям
координат: по оси абсциссX— 0—300 с, по оси ординат Y— 0—2,0 В.
5. Отмерьте в стакан на 100 мл с помощью цилиндра не менее 60 мл
0,05 М раствора H2SO4. Добавьте в стакан 3—4 капли 0.1 м К, [Fe(CN)6]
Погрузите исследуемую пластинку и графитовый электрод в стакан,
поставьте стакан на магнитную мешалку и включите перемешивание.
6. Сразу же запустите измерение. Снимайте зависимость напряже-
ния от времени втечение 5 минут, после чего остановите измерение. По-
лученные данные экспортируйте во внешние файлы папки «Коррозия».
7. Весь раствор перелейте в кювету и измерьте оптическую плот-
ность с помошью датчика оптической плотности, какописано в опыте
2 настоящей работы с использованием цифровой лаборатории.
8. Слейте отработанный раствор H2SO4 в указанное место, сполос-
ните пластину и кювету, осушите их фильтровальной бумагой.
314 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
9. Повторите действия (п. 3—8) с пластиной, обработанной в кон-
центрированной HNO, или НЧРО4.
Обработка экспериментальных данных
1. Запишите в ст. 4 табл. 8.16 значения установившейся разности
потенциалов между пластиной и графитовым электродом, определен-
ные из компьютерных зависимостей для двух пластин.
2. Запишите в ст. 5 табл. 8.16 значения оптической плотности D
растворов после 5 минут коррозионных испытаний, определенные
из компьютерных зависимостей.
3. Сравните значения оптической плотности для стальной пла-
стинки разной предобработки. Укажите, в каком случае интенсив-
ность окраски и оптическая плотность наибольшая и как это связано
со скоростью коррозии.
4. Далее обработку данных проведите, как указано в п. 1—6 для
традиционного варианта настоящего опыта.
Опыт 4. Влияние состава металла на скорость коррозии
Экспериментальная часть
Оборудование: химический стакан на 200 мл — 3 шт., градуирован-
ная пробирка или бюретка — 3 шт.
Реактивы: 0,1 М раствор H2SO4; образцы цинка разной степени чи-
стоты: № 1 — высокой чистоты, № 2 — содержащий примеси металлов
с низким перенапряжением водорода (Ni, Pd, Pt), № 3 — содержащий
примеси металлов с высоким перенапряжением водорода (Pb, Hg, Cd).
Ход работы
1. В три стакана, заполненных 0,1 М раствором H2SO4, погрузите
опрокинутые вверх дном градуированные пробирки или бюретки, за-
полненные тем же раствором.
2. В стаканы под пробирки поместите по кусочку цинка разной
степени чистоты по возможности одинаковой массы: Ns 1 — цинк вы-
сокой чистоты; № 2 — цинк, содержащий примеси металлов с низким
перенапряжением водорода; № 3 — цинк, содержащий примеси ме-
таллов с высоким перенапряжением водорода.
3. Следите за скоростью выделения водорода в пробирках, за-
писывая в течение 30 минут показания шкалы через каждые 5 минут
в табл. 8.17.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 315
Обработка экспериментальных данных
1. Запишите уравнения анодной, катодной и суммарной реакций
и приведите схемы коррозионных микроэлементов.
2. Рассчитайте по закону эквивалентов приблизительную массу т
растворившеюся цинка в каждый отмеченный момент времени /, до-
пуская, что побочные процессы отсутствуют, не приводя объем водо-
рода к нормальным условиям. Найдите среднюю скорость коррозии ъср
для каждого из образцов за промежутки времени 5 минут (в мг/мин).
Запишите данные в табл. 8.17.
3. Объясните причину различной скорости выделения газов и раз-
личной скорости коррозии металла.
Экспериментальная часть
с использованием цифровой лаборатории
В данном случае объем выделяющегося водорода измеряют с по-
мощью датчика объема газа, как описано в работе 15. Использование
цифрового оборудования позволяет точно фиксировать изменение
объема в каждый момент времени, одновременно контролируя тем-
пературу газа. Возможно сохранение данных на любом электронном
носителе и их компьютерная обработка.
Оборудование: компьютер, датчик объема газа с контролем темпера-
туры, двухколенная пробирка Оствальда.
Реактивы: 0,1 М раствор H2SO4; образцы цинка разной степени чи-
стоты: № 1 — высокой чистоты; № 2 — содержащий примеси металлов
с низким перенапряжением водорода (Ni, Pd, Pt): № 3 — содержащий
примеси металлов с высоким перенапряжением водорода (Pb, Hg, Cd).
Ход работы
Проведите измерение скорости выделения водорода для трех об-
разцов цинка разной С1епени чисюты с помощью датчика объема газа,
как описано в работе 15. Компьютерные данные сохраните во внеш-
нем файле.
316 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Обработка экспериментальных данных
Обработку экспериментальных данных проведите, как указано
выше для традиционного варианта настоящего опыта (п. 1—3), за ис-
ключением того, что, зная температуру газа, следует привести его объ-
ем к нормальным условиям.
Развитие работы
Количественное определение скорости коррозии металлов разной
природы и разной степени чистоты.
Работа 44. Защита металлов от коррозии
Цель работы: ознакомление с наиболее важными методами зашиты
металлов от коррозии — легированием, защитными металлическими
покрытиями, пассивацией поверхности металла, протекторной заши-
той, ингибиторной зашитой.
Теоретическая часть
Снизить скорость коррозии металлического материала можно раз-
личными способами. Выбор способа защиты определяется условиями
работы и экономической целесообразностью.
Коррозионную стойкость металла можно повысить путем легиро-
вания, т.е. введения в состав сплава компонента, который уменьшает
скорость или даже предотвращает коррозию. При легировании в со-
став сплавов вводят компоненты, вызывающие пассивацию металла,
т.е. образование на его поверхности защитных пленок. К числу таких
компонентов относятся хром, никель, титан, вольфрам и др.
Эффективным способом защиты металла от коррозии является на-
несение на его поверхность различных покрытии. В качестве защитных
используются металлические, оксидные, силикатные, керамические,
лакокрасочные и другие покрытия. В основе их действия лежит изоля-
ция металла от окислителя. Выбор вида покрытия зависит от условий,
в которых используется металл. Металлические покрытия подразде-
ляют на катодные и анодные. Анодным является покрытие, потенциал
которого отрицательнее потенциала защищаемого металла. При на-
рушении целостности такого покрытия (например, из-за появления
трещин) происходит растворение металла покрытия, а на основном
металле в месте контакта с агрессивной средой идет восстановление
Глава 8. Окислительно-восстановительные и электрохимические процессы • 317
окислителей. Например, алюминиевое или цинковое покрытие желе-
за. Катодным называется покрытие, потенциал которого положитель-
нее потенциала защищаемого металла. При нарушении целостности
такого покрытия может корродировать основной металл. К катодным
относят, например, медное или оловянное покрытие железа. Потен-
циалы металлов зависят от состава растворов, поэтому при изменении
состава раствора может меняться и характер покрытия. Так, покрытие
стали оловом в растворе H2SO4 — катодное, а в растворе органических
кислот — анодное.
Скорость коррозии можно снизить путем торможения анодных или
катодных реакций за счет изменения потенциала этих реакций; такой
способ защиты металла называют электрохимическим. К электрохими-
ческим методам относят протекторную, катодную и анодную защиты.
При протекторной защите к защищаемому изделию присоединяют ме-
таллический протектор, потенциал которого значительно отрицатель-
нее потенциала металла изделия. В качестве материала протекторов
используют сплавы алюминия, магния и цинка. В коррозионной среде
металл протектора растворяется, а на защищаемом металлическом из-
делии восстанавливается окислитель. Катодный метод защиты заклю-
чается в подключении защищаемого изделия к отрицательному полюсу
внешнего источника постоянного тока. К положительному полюсу ис-
точника тока подсоединяют вспомоги! е льны й электрод — «жертвен-
ный анод». В этом случае на защищаемом изделии идет восстановление
окислителей, а анод окисляется. При анодной защите изделие из ме-
талла, способного легко пассивироваться, подключают к положитель-
ному полюсу внешнего источника тока, при этом происходит анодная
поляризация металла и переход его в пассивное состояние. Металл при
этом покрывается пассивной оксидной пленкой, например:
2Сг + ЗН2О - бе -> Сг2О3 + 6Н+.
Коррозию можно замедлить, воздействуя на коррозионную среду:
уменьшая концентрацию окислителей О2 и Н+ (деаэрацией, восста-
новлением, подщелачиванием) или вводя ингибиторы — вешества, при
добавлении которых в коррозионную среду значительно снижается
скорость коррозии металла.
Вопросы и задачи для самоконтроля
I. Какими способами можно снизить скорость коррозии металлов?
2. Приведите примеры анодных защитных покрытий на железе,
катодных покрытий на меди.
318 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
3. К какому типу покрытий относится олово на стали и на меди’
Какие процессы будут протекать при атмосферной коррозии лу-
женых стали и меди в нейтральной среде при 298 К? Напишите
уравнения катодных и анодных реакций.
4. В чем состоит сущность катодной зашиты металла? Как можно
защитить цинковую трубу с помощью катодной зашиты в во-
дном растворе с pH = 10 в контакте с воздухом? Напишите урав-
нения реакций протекающих процессов.
5. В чем заключается сущность протекторной защиты металлов
от коррозии? Приведите пример протекторной защиты железа
в электролите, содержащем растворенный кислород. Составьте
уравнения анодного и катодного процессов.
6. Приведите примеры протекторов для олова.
7. Какие вещества называют ингибиторами коррозии?
Опыт 1. Защита легированием. Коррозия
углеродистой и нержавеющей стали
Эксперимент может быть выполнен традиционными методами
и с помощью цифрового оборудования. В последнем случае скорость
коррозии материала оценивают на основе измерения оптической
плотности коррозионной среды, pH раствора измеряют датчиком pH
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик оптической плотности 475 нм,
кювета, магнитная мешалка, химические стаканы на 100 мл, цилиндр
на 100 мл, мерная пипетка на 2 мл или бюретка, пластины из угле-
родистой и нержавеющей стали идентичного размера (примерно
20 к 50 мм).
Реактивы: 0.05 М раствор H,SO4:0.1 М раствор NaCl: 0.1 М раствор
K3[Fe(CN)6J.
Ход работы
1. Проведите измерения, аналогичные таковым в опыте 3 ра-
боты 43 в растворах H2SO4 и NaCl с пластинками из углеродистой
и нержавеющей стали идентичного размера. Наблюдения запишите
в табл. 8.18.
2. Сохраните табличные и графические данные, экспортировав
их во внешние файлы папки «Защита от коррозии».
Глава 8. Окислительно-восстановительные и электрохимические процессы • 319
Обработка экспериментальных данных
1. Сформируйте табл .8.18 опытных и расчетных данных.
Таблица 8.18
Материал Раствор pH расчет Оптическая ПЛОТНОСТЬ Наблюдения
1 2 3 4 5
Углеродистая сталь H2SO, NaCI
Нержавеющая сталь H2SO4 NaCI
2. Запишите значения оптической плотности для двух разных пла-
стин после 10 минут выдержки их в разных растворах в ст. 4 табл. 8.18.
Сравните и объясните, как интенсивность окраски связана со скоро-
стью коррозии. Запишите уравнение качественной реакции ионов же-
леза Fe2+ с гексацианоферратом калия K3|Fe(CN)6]
3. Оцените значение pH коррозионной среды по известной кон-
центрации раствора. Значения запишите в ст. 3 табл. 8.18.
4. Запишите уравнения анодных и катодных коррозионных про-
цессов, предварительно рассчитав их равновесные потенциалы в пред-
положении = 10_J. Объясните причину различного поведения
двух пластин в изученных условиях
5. Объясните механизм защиты от коррозии легированием. Срав-
ните коррозионную стойкость материалов в коррозионно активной
среде. Сделайте вывод.
Опыт 2. Катодные и анодные защитные покрытия
Цель опыта', изучение поведения различных металлических покры-
тий на железе в коррозионно-агрессивных средах.
Экспериментальная часть
с использованием цифровой лаборатории
Оборудование: компьютер, датчик оптической плотности 475 нм:
кювета, магнитная мешалка, мерная колба или цилиндр на 100 мл,
мерная пипетка на 2 мл или бюретка, пластина из луженого железа,
пластинка из оцинкованного железа идентичного размера.
Реактивы: 0,05 М раствор H2SO4; 0,1 М раствор NaCI; 0,1 М
K3|Fe(CN)6J.
320 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. Проведите измерении, аналогичные таковым в опыте 2 рабо-
ты 43 с использованием шифрового оборудования, для пластин из лу-
женого и оцинкованного железа идентичного размера в растворах
H2SO4 и NaCl.
2. Сохраните текстовые и графические данные, экспортировав
их во внешние файлы папки «Зашита от коррозии».
Обработка экспериментальных данных
1. Сформируйте табл .8.19 опытных и расчетных данных.
Таблица 8.19
Материал
Раствор
Оптическая плотность
3
Наблюдения
Луженое железо
Оцинкованное
железо
NaCl
2. Запишите значения оптической плотности для разных материалов
и растворов через 5 минут после начала коррозии в ст. 3 табл. 8.19. Зна-
чения определите из компьютерных графиков временной зависимости.
3. Запишите ваши наблюдения за материалами в процессе экспе-
римента в ст. 4 табл. 8.19 и объясните их. Отметьте различия.
4. Запишите уравнения анодных и катодных процессов для железа
без покрытия и с покрытиями, предварительно рассчитав их равновес-
ные потенциалы в предположении = 10-3. pH оцените с помо-
щью расчета.
5. Запишите уравнение качественной реакции ионов железа Fe2+
с гексацианоферратом калия K3[Fe(CN)6|. Объясните причину разли-
чия в окраске и оптической плотности растворов в случае луженого
и оцинкованного железа.
Опыт 3. Протекторная защита
Экспериментальная часть
с использованием цифровой лаборатории
1. В кювету налейте 100 мл 0,1 М раствора H,SO4 и добавьте 0,5 мл
0,1 М раствора K3[Fe(CN)6|. Поставьте кювету на магнитную мешалку,
наденьте на нее датчик оптической плотности.
Глава 8. Окислительно-восстановительные и электрохимические процессы • 321
2. Подключите к компьютеру датчик оптической плотности. За-
пустите программу «Практикум». После идентификации программой
датчика обнулите начальное показание датчика кнопкой «Настройка».
Установите пределы измерений: по оси абсписс X — (0—300) с. по оси
ординат Y— (0—1).
3. Включите перемешивание и запустите измерение. Как можно
быстрее погрузите в кювету зачищенную наждачной бумагой и про-
мытую дистиллированной водой пластинку углеродистого железа
измеренной площади. Наблюдайте за изменением оптической плот-
ности на графике и за изменением цвета раствора. Отметьте, проис-
ходит ли выделение газа на поверхности пластинки.
4. Через 5 минут остановите измерение Сохраните график и та-
блицу цифровых данных во внешних файлах папки «Протектор».
5. Вылейте содержимое кюветы в сливной стакан (!), тщатель-
но промойте кювету и металлическую пластинку проточной водой,
ополосните дистиллированной водой и протрите фильтровальной
бумагой.
6. Проделайте аналогичный опыт (п. 1—5), но уже с пластинкой
из углеродистой стали, такого же размера в контакте с цинком (метал-
лы соедините скрепками). Сохраните текстовый и графический фай-
лы. Запишите наблюдения.
Обработка экспериментальных данных
1. Сравните значения оптической плотности растворов в первом
и втором опыте после 5 минут измерений. Отметьте разницу. Запишите
уравнение качественной реакции ионов железа Fe2 + с гексацианофер-
ратом калия K3[Fe(CN)6|.
2. Объясните ваши наблюдения, запишите уравнения анодных
и катодных коррозионных процессов в первом и втором случае, пред-
варительно рассчитав равновесные потенциалы в предположении
pH = 1,5 и oFr,. = 10-3. Объясните принцип протекторной защиты
и различное поведение материалов в растворе кислоты.
Опыт 4. Ингибиторная защита металла
Экспериментальная часть
Оборудование: пробирки — 2 шт., пипетка на 1 мл, полоска из угле-
родистой стали (20 х 5 мм) — 2 шт., фарфоровая ложечка.
Реактивы: 0,1 М раствор H2SO4; 0,1 М Kj[Fe(CN)6]; кристалличе-
ский уротропин.
322 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Ход работы
1. В две пробирки налейте до половины 0,1 М раствора серной
кислоты. В одну из пробирок добавьте четверть ложечки уротропина
и 0,5 мл 0,1 М раствора K3|Fe(CN)6].
2. Поместите в каждую пробирку полоску из углеродистого железа.
Оставьте пробирки на 3—5 минут. Наблюдайте за происходящими из-
менениями в пробирках (газовыделением, изменением окраски).
Обработка экспериментальных данных
1. Наблюдения запишите и объясните.
2. На основании наблюдений запишите уравнения катодных
и анодных процессов, идущих на поверхности железа в отсутствие
и в присутствии ингибитора.
3. Запишите уравнение качественной реакции ионов железа Fe2'
с гексацианоферратом калия K3[Fe(CN)6J.
Экспериментальная часть
с использованием цифровой лаборатории
При проведении настоящего опыта с использованием цифрового
оборудования измеряют оптическую плотность раствора после испы-
таний железной пластинки в отсутствие и в присутствии ингибитора.
Обработку данных проводят, как в опыте 3 настоящей работы.
ПРИЛОЖЕНИЯ
I. Плотность некоторых жидкостей при различных температурах
Температура, С Плотность, г/мэ
Н2О С,Н5ОН CHClj CCL.
20 0,99823 0,7898 1,4890 1,5940
22 0,99780
24 0,99732
26 0,99681
28 0,99626
30 0,99567 0,7810 1,4706 1,5748
II. Давление насыщенного водяного пара
при различных температурах
Температура, С Давление Температура, С Давление
кПа мм рт. ст. кПа мм рт. ст.
13 1,49 11,2 22 2,64 19,8
15 1,68 12,6 24 2,99 22,4
16 1,81 13,6 25 3,17 23,8
18 2,07 15,5 27 3,56 26,7
20 2,33 17,5 29 3,97 29,8
21 2,49 18,7 30 4,21 31,6
III. Термодинамические характеристики
некоторых веществ и ионов (при 298 К)
Вещество АДЛ, кДж/моль Д/G0, кДж/моль S'", Дж/(моль К)
Ай(к) 0,00 0,00 42,69
AgBr(K) -99,16 -94,90 107,10
AgCI(K) -127,07 -109,70 96,11
Agl -64,20 -66,30 144,20
Ag,O (к) -30,56 -10,82 121,81
Al (к) 0,00 0,00 28,32
A12O} (к) -1 676,00 -1 580,00 50,94
Au 0,00 0,00 47,65
AuClj (к) -118,40 -48,53 146,40
324 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Продолжение
Вещество кДж/моль Д/7”, кДж/моль S'0, Дж/(моль-К)
Ва 0,00 0,00 66,94
ВаО (к) -557,90 -528,40 I- 70,29
ВаСО3 (к) -1 202,00 -1 139,00 112.10
BaSO., (к) -1 352,00 -1 465,00 131,80
Be 0,00 0,00 9,54
ВеО (к) -598,70 -581,60 14.10
Bi 0,00 0,00 56,90
BlClj (к) -379,10 -18,90 189,50
Вг2 (ж) 0,00 0,00 152,30
Вг2 (г) 30,92 3,14 245,35
С (алмаз) 1,83 2,85 2,380
С (графит) 0,00 0,00 5,740
СО (г) -110,50 -137,14 197,54
СО2(г) -393,51 -394,38 213,68
СОС12 (Г) -219,50 -205,30 283,60
СН«(г) -74,85 -50,79 186.19
С2Н2(г) 226,75 209,20 200,80
С2Н.(г) 52,28 68,11 219,40
C2Ht(r) -84,68 -32,89 229,50
CjHt(r) 20,42 62,70 226,90
CjHt(r) -104,00 -23,49 269,90
С4Н1в(г) -124,70 -17,15 310,00
C6Ht(r) 82,93 129,70 269,20
C6Ht(x) 49,03 124,50 172,80
CH3OH (ж) -238,60 -166,23 126,80
C2H5OH (ж) -277,70 -174,76 160,70
Са(к) 0,00 0,00 41,42
СаСОэ (к) -1 207,10 -1 128,76 92,88
СаС12 (к) -785,80 -750,20 113,80
СаО (к) -635,50 -604,20 39,70
Са(ОН)2(к) -986,20 -898,50 83,40
CaSO4 (к) -1 424,00 -1 318,30 106,70
CaSO3 - 2Н2О (к) -1 762,30 -1 565,20 184.10
Cd (к) 0,00 0,00 Н” 51,76
CdO (к) -256,10 -225,00 54,80
Cd(OH)2 (к) -553,20 -470,20 95,40
Приложения • 325
Продолжение
Вещество &iHv, кДж/моль Д/G0, кДж/моль 5°, Дж/(мояь-К)
С12(г) 0,00 0,00 222.96
Сг(к) 0,00 0,00 23,76
Cr2Oj (к) -1 141,00 -1 058,00 81.10
CrOj (к) -594,50 -505,80 72,00
CuCl (к) -133,60 -116,00 91,20
СиС12 (к) -172,40 -131,40 118,80
СиО (к) -165,00 -127,00 42,64
CuS (к) -48,51 -48,91 66,50
CuSO4(k) -771,10 -661,90 113,30
F2(r) 0,00 0,00 202,90
Fe(K) 0,00 0,00 27.15
FeCI2 (к) -341,00 -301,70 120.10
FeClj (к) -390,80 -328,70 Н” 154,40
FeO (к) -263,80 -244,30 58,79
Fe2O3 (к) -822, ]6 -740,98 89.96
Fe3O4 (к) -1 117,70 -1 014,20 146,40
FeS (к) -95,10 -97,60 67,40
Н(г) 217,94 203,26 114,60
Н2(г) 0,00 0,00 130,58
НВг (г) -35,98 -53,50 198,50
на (г) -92,30 -95,27 186.69
НС1(р) -166,90 -131,20 56,50
HF(D -268,61 -270,70 173.51
HI (г) 25,94 1,58 206,30
НЫО3(ж) -174,30 -80,30 156,60
Н,О(г) -241,82 -228,61 188,70
Н2О (ж) -285,84 -237,20 70,08
Н,О (к) -291,85 -235,50 44.10
Н2О2 (ж) -187,80 -120,40 109,60
H,S(r) -20,17 -33,01 205,60
H2SO4 (ж) -811,30 -690,30 156,90
НЭРО4 (ж) -1 271,90 -1 147,25 200,80
Нё(ж) 0,00 0,00 77,40
HgO(K) -90,80 -58,30 70,30
Hga2 (к) -230,10 -185,80 144,35
Hg2ci2 (к) -264,85 -210,70 185,80
326 « ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Продолжение
Вещество кДж/моль A/Gu, кДж/моль S'0, Дж/(моль-K>
Ь (к) 0,00 0,00 116,73
12(г) 62,24 19.4 260,58
КС1 (к) -435,90 -408,30 82,70
К2О (к) -361,50 -333,50 94,00
КОН (к) -425,80 -380,20 59,41
LiOH (к) -487,80 -443,90 42,70
Li2O (к) -598,70 -562,10 37,90
Mg (к) 0,00 0,00 32,55
MgClj (к) -641,60 -592,10 89,60
MgO (к) -601,24 -569,40 26,94
Mg(OH)2 (к) -924,70 -833,80 63.14
Mg(NOj)2 (к) -789,60 -588,40 164,00
МеСО3(к) -I 112,90 -1 029,30 65.69
MgSO4 (к) -I 278,20 -I 173,60 163,00
Мп (к) 0,00 0,00 31,76
МпО2(к) -519,40 -464,80 53.14
MnSO4 (к) -1 063,70 -956,00 112.10
Мо (к) 0,00 0,00 28,60
MoOj (к) -754,50 -677,60 78,20
n2 0,00 0,00 191,50
NHj(f) -46,19 -16,66 192,50
NH4OH (р) -361,20 -254,20 165,40
NH4C1(k) -314,40 -203,00 94,60
(NH4)2SO4(k) -1 179,30 -900,30 220,30
NO (г) 90,37 86,71 210,62
NO2(r) 33,50 51,80 240,45
N,O4(r) 9,66 98,28 304,30
Na (к) 0,00 0,00 51,00
Nad (к) -410,90 -384,00 72,33
Na2O (к) -415,90 -376,60 72,80
NaOH (к) -427,80 -381,10 64.18
Na2SO4 (к) -1 384,60 -1 266,80 149,40
Na2CO3 (к) -1 130,90 -1 047,70 136,00
NaNO3 (p) -446,20 -372,40 207,00
Ni (к) 0,00 0,00 29,86
NiO -239,70 -211,70 38,00
Приложения • 327
Продолжение
Вещество кДж/моль Д/G0, кДж/моль S'0, Дж/(моль-К)
О2 (г) 0,00 0,00 205,04
О}(г) 142,30 163,40 238,80
О (г) 247,50 230,10 161,00
Р (к, белый) 0,00 0,00 41.10
РС1э(г) -306,50 286,30 311,70
РС15(г) -592,00 -545,20 324,60
РЬ(к) 0,00 0,00 64,90
РЬО (к) 217,90 -188,50 69,45
PbSO., (к) -918,10 -811,20 147,28
РЬО2 (к) -276,60 -219,00 76,44
Pt (к) 0,00 0,00 41,55
PtCI2(K) -106,69 -93,35 219,79
PtCL, (к) -229,28 -163,80 267,88
S (к, ромб.) 0,00 0,00 31,88
SO2(r) -296,90 -300,40 248.10
SOs(D -395,20 -370,40 256,23
SO2C12 (ж) -389,10 -315,80 217,20
Si (к) 0,00 0,00 18,70
SiO2 (а-кварц) -859,40 -805,20 41,84
S1CI4 (г) -609,60 -569,90 331,40
SiH4 (г) -61,90 -39,30 203,80
Sn (к) 0,00 0,00 51,55
SnO2 (к) -580,70 -418,40 52,30
Ti(K) 0,00 0,00 30,60
TiCL,(D -758,90 -714,00 353,10
T1CI4 (ж) -800,00 -124,00 252,7
TiO, (к) -941,00 -881,60 50,20
W(k) 0,00 0,00 33,50
WOj(k) -840,30 -763,40 83,30
Zn (к) 0,00 0,00 41,59
ZnO (к) -349,00 -318,20 43,50
ZnClj (к) -415,90 -369,20 108,40
ZnS (к) -201,00 -239,80 57,70
ZnSO4 (к) -978,20 -870,20 124,60
Zr(K) 0,00 0,00 38,40
ZrOj (к) -1 762,30 -1 565,20 184,10
328 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Окончание
Вещество &iHv, кДж/моль Д/G0, кДж/моль S'", Дж/(моль-К)
Ag+(p) 105,90 77,10 72,60
АР* (р) -529,69 -489,80 -301,20
Ва2+ <р> -524,05 -547,50 8,79
Вг (р) -121,50 -104,04 82,84
СН}СОО (р) -488,87 -375,37 87,60
CN (р) 150,62 171,58 95,45
со; (р) -676,26 -528,10 -56,00
Са3+ (р> -542,96 -553,14 -56,50
Cd!*(p> -75,31 | -77,65 -70,90
а <р) -167,47 -131,17 56,50
Ci3* (р) -235,98 -215,36 -215,50
Си2+ (р) 66,94 65,03 -92,70
Fei+ (р) —87,86 -84,88 -130,90
Fe*(p) -47,70 -10,54 -309,00
Н*(р) 0,00 0,00 0,00
НСОО (р) -691,11 -587,06 90.81
НСО3 (р> -410,00 -334,70 92,60
I (Р) -55,94 -51,67 111,40
К*(р) -252,17 -282,22 100,90
Li* (р) -278,45 -297,79 10,50
Mg}+ (р) -461,95 -455,98 -133,90
Мп2+ (р) -220,50 -221,71 -62,30
МпО; (р) -518,40 -425,10 196,20
nh; (р) -132,80 -79,50 114,30
NO, (р) -206,57 : -110,80 147,20
Na* (р) -239,66 -261,85 58,90
Nf*(P> -53,14 -48,24 -126,0
он (Р) -229,94 -157,35 -10,90
POj- (Р) -1 284,10 -1 025,50 -221,40
РЬ2* (р) 1,63 -24,30 13,00
S2* (P) 41,80 92,62 -14,50
Sn’* (р) -10,23 -26,24 -22,70
soj* (р) -907,51 -742,99 18,00
Zn2* (р) -153,64 -147,16 -110,60
Приложения • 329
IV. Интегральная теплота растворения KCI в воде при 25 °C
п, моль KCI на 1 кг Н2О ДН„, кДж/моль п, моль КС1 на 1 кгН2О ДНп, кДж/моль
0,00 17,23 1,00 17,28
0.01 17,39 2.00 16.72
0.02 17,44 3.00 16,17
0.03 17,46 4,00 15,75
0,04 17,49 5.00 —
0.05 17,51 6.00 —
0,10 17,57 7,00 —
0.20 17,55 8.00 —
0.30 17,50 9,00 —
0,40 17,28 10,00 —
0,50 17,43 Насыщенный раствор 15,45
V. Плотность растворов некоторых электролитов, г/см3 (20 "С)
Массовая ДОЛЯ, °о КС1 NaCl NaOH Na2SO4 NH4Cl (NH4)2SO4 A1,(SO4)j
1 1,005 1,007 1,010 1.007 1.001 1,004 1.009
2 1,011 1,014 1,021 1,016 1.004 1,010 1,019
4 1,024 1,029 1,043 1,035 l.OU 1,022 1,040
6 1,030 1,036 1,065 1,053 1.017 1,034 1,061
8 1,050 1,058 1,087 1,072 1.023 1,046 1.083
10 1,063 1,073 1,109 1,091 1.029 1,057 1,105
12 1,077 1,089 1,131 1,111 1.034 1,06 1.129
14 1,090 1,104 1,153 1,131 1.040 1,081 1,152
16 1,104 1,119 1,175 1,141 1.046 1,092 1.176
18 1,113 1,135 1,197 1.051 1,104 1,201
20 1,133 1,151 1,219 1.057 1,115 1.226
21 1,140 1,159 1,230 1.059 1,121 1.239
24 1,263 1,067
26 1,285 1.073
28 1,306
330 » ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
VI. Константы диссоциации слабых электролитов
в водных растворах при 25 °C
Электролит Электролит Ад
Азотистая кислота HNO? *, = 5,6-10 4 Аммония гидроксил NHj Н2О *1 = 1,8 10 '
Алюминиевая кислота НА1О? К, = 6 ю-13 Вода Н2О *1 = 1,8 10-“
Бензойная кислота С6Н5СООН *, = 6.3-10 5 Алюминия гидроксид А1(ОН)3 *,= 1.38 10“9
Борная кислота H3BOj *, = 5,8-10 10 *2= 1,3 IO’4
*2= 1,8-10 13 Железа( II) гидроксид Fe(OH)2
*,= 1,6-1014
Кремниевая кислота HjSiOj *1 = 2,2-10 10 Жепеза(Ш) гидроксид Fe(OH)j *2= 1,8 10"
*2= 1,6-10 12 *з= 1,3 1012
Муравьиная кислота нсоон *,= 1,8 -10 4 Меди гидроксид Сн(ОН)2 *2 = 3,4-10 ’
Сернистая кислота H2SOj *,= 1,4-10 2 Никеля гидроксид *2 = 2,5-1О-3
*2 = 6.3 -10 8 Ni(OH)j
Сероводородная кислота H2S *.= 1,1 10-’ Серебра гидроксид А = 1,1-10 4
*2=1 10 14 AgOH
Угольная кислота Н,СОЭ *1=4.5-10 ’ Свинца гидроксид *i=9,6 10-4
*2 = 4,7-10 11 РЬ(ОН), *2 = 3 10-*
Уксусная кислота СН3СООН *,= 1,8 -10 5 Хрома гидроксид Сг(ОН)3 *3 = 1 10 10
Фосфорная кислота Н,РО4 *, = 7.1 10 3 Цинка гидроксид *1=4,4 10 5
*2 = 6,3-10е Zn(OH)2 *2 = 1,5 10-’
*3= 1,3-10-'2
Фтороводородная кислота HF *, = 6.6-10 4 Кобальта гидроксид Со(ОН)2 *2 = 5.20 10 5
Циановодородная кислота HCN *=7.9 10 10 Щавелевая кислота Н2С2О4 *,=6,5 IO"2
*2 = 5,3210 s
Приложения • 331
VII. Приближенные коэффициенты активности
ионов в водном растворе при 298 К
Ионы Коэффициент активности для ионной силы
0,001 0,005 0,01 0,02 0,05 0,07 0,1
Водорода 0,98 0,95 0,92 0,90 0,88 0,86 0,84
Однозарядные 0.98 0,95 0,92 0,89 0,85 0,83 0,80
Двухзарядные 0,77 0,65 0,58 0,50 0,40 0,36 0,30
Трехзарядные 0,73 0,55 0,47 0,37 0,28 0,25 0,21
VIII. Произведения растворимости
малорастворимых соединений при 25 °C
Вещество ПР Вещество ПР
AgCI 1,56 10 10 NiS* 1,1-10 27
AgBr 4,4-IO"13 PbCl2 2,12 IO"S
Agl 9,7 10-'7 Pbl2 9,8 10-’
Ag2SO4 7,7 10-5 PbSO, 1,6 IO"8
Ag,S 1,6 10 м PbS 3.6 10"29
BaCOj 8.1 10 ’ ZnS 7.4 IO’27
BaSOj 1.08 10 10 AgOH 1,93 IO-8
MgCOj 1,0 10 5 AI(OH)3 5,1-IO"33
CaCOj 4,8 10 ’ Cr(OH)j 6,7 IO"31
CaSO4 6,1 10"s Cu(OH),* 5,0 Ю-”
Ca3(PO4)2 1,0 10 25 Fe(OH)2 1,65 10,s
Cds 1,2 10-» Fe(OH)3 3,8 10-38
CuS 4,0 IO38 Mg(OH)2 5.5 IO"12
FeS 3,7-IO-» Ni(OH)j 1.6IO"M
Fe2S3* 1,0 io-88 Pb(OH)2 1.0-10-“
MnS 2,0 10-'5 Zn(OH)2 1,3-IO"17
* ПР определены при 20 'С
332 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
IX. Стандартные потенциалы металлических
и газовых электродов (Т = 298 К)
Электрод Электродная реакция £",B
Li/Li Li+ + e«=»Li -3,045
к/к К’ + e К -2,925
Ва2+/Ва Ba2* + 2e<=»Ba -2,906
Са2+/Са Ca2+ + 2e<=>Ca -2,866
Na*/Na Na* + e<+Na -2,714
Mg’+/Mg Mg2+ + Mg -2,363
А1}+/А1 AP+ + 3e<z+Al -1,662
Ti27Ti Ti2++ 2<> <z+Ti -1,628
Mn2+/Mn Mn2+ + 2e«=*Mn -1,180
Zn27Zn Zn2* + 2e^+Zn -0,763
Cr,+/Cr Cr’* + 3e«=>Cr -0,744
Fe2+/Fe Fe2+ + 2e«=>Fe -0,440
Cd2+/Cd Cd2+ + 2e<z+Cd -0,403
Co2+/CO Co2+ + 2e<z+Co -0,277
Ni2+/Ni Ni2+ + 2e<z+Ni -0,250
Sn27Sn Sn2+ + 2e«^Sn -0,136
Pb2"/Pb Pl? l 2t ^>PI -0,126
H+/H2 н* + г<=>1н2 +0,000
Cu2+/Cu Cu2+ + 2e^Cu +0,337
O2/OH ^O2 + H2O+ 2f<^2OH +0,401
Ag+/Ag Ag* +e<=»Ag +0,799
Hg2/Hg Hg2+ + 2e^Hg +0,854
Pd2+/₽d Pd2+ + 2e«^Pd +0,987
Br2/Br —Br2 lt(dBr +1,065
Pt2+/Pt Pt2+ + 2e<^Pt +1,200
O2/H,O O2 + 4H- + 4e«^2H2O + 1,229
C12/CI |ci2 +е«^С1- +1,359
AuJ+/Au AuJ+ + 3e^Au + 1,498
f2/f jF2 +e<^F +2,866
Приложения • 333
X. Стандартные окислительно-восстановительные
потенциалы (Т = 298 К)
Электродная реакция £°, В
Сг3+ + е^+Сг2+ -0,408
Inw + ef+In2+ -0,400
Ti3* + е «=» Ti2' -0,368
V^ + e^V1* -0,256
Sn4" + 2e^± Sn2+ +0,150
Cu2+ + e±± Cu+ +0,153
SO2 + 10H+ + 8<? ^+ H2S(p) + 4HjO +0,303
[Fe(CN)6p + e?=»fFe(CN)6|4 +0,360
lj + 2*?=>3I +0 536
Fe3+ + e^+Fe2+ +0,77
HNOJlp) + 9H+ + 8e NH4 + 3H2O +0,920
NOj + 2H+ + 2e^+ NO2 + H2O +0,940
C1O4 + 2H+ + 2e^± CIO, + H,O +1,190
TI3+ + 2e?+Tl+ +1,250
CfjOj" + 14H+ + 6 f+ 2Cru + 7HiO +1,330
PbO, + 4H+ + 2e ^+ Pb2" + 2H2O +1,455
MnO4 + 8H ‘ + Se^± Mr2' + 4H}O +1,510
PbO, + 4H+ + SO4 + 2e*± PbSO4 + 2H2O +1,685
HjOkp, + 2H+ + 2e <=> 2H,O +1,776
Co’+Te^Co2" +1,810
S2O2 +2e^2SOf +2,010
XI. Константы нестойкости комплексных
ионов при указанных температурах
Комплексный ион t ”C Mi Комплексный ион i X Mt
[AgEn*|' 20 2,0-10 5 fHg(CN)4|2 25 4 IO’42
(AgCy 25 1,76 10 5 (HgClJ2 25 8,5 IO '6
fAg(NH3)2]+ 30 9.3-10-8 [Hg(NH,)4|2" 22 5,3 IO’20
!AgBr2| 25 7,8-KT* [HgBr4]2 25 ] -10 21
fAg(S2Oj)2P 20 2,5-10 14 IHgl4P 25 1,48-10 30
334 • ОБЩАЯ ХИМИЯ. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Окончание
Комплексный ион i *C A’h Комплексный ион t °C Kh
[Ag(CN)2| 18 8-10"22 fNi(En)2]2+ 25 8,32-IO"'5
rcdtNH^r 25 7,56 IO"8 [Ni(CN)4]2' 25 1,8 10 14
[Cd(En)2]2+ 25 6-io-11 [Ni(NH3)4|2+ 25 1,12-10-*
[CdtcNhr 25 1,41 IO-'9 |PbBr<|! 25 1 10 3
fCo(NHj)4]2'* 30 2,8-10 6 fPbhl 25 2,22-10-s
ГСн(Р2О7),]‘ 25 1,0-10 9 [РЬ(Р207)2|‘- 25 4,74-Ю-6
fCii(En)2]2+ 25 7,41 10 21 fZn(P2O7)j|6 25 3,4 IO-7
[Cu(NH3)4]2* 30 2,14 t0-n IZn(NH3)4]2- 30 3,46 10 10
[Fe(CN)6]3 25 i-io-5' fZn(En)2]2+ 25 8,5 10 12
fHgCl4p 25 8,5-10-16 fZn(OH)4l2 25 3,6 10 16
[Cu(CN)4|2 25 9,6-10 » fZn(CN)4|2 18 1,3 10 17
fFe(CN)6|4 25 1 io-24 [Al(OH)|2+ 25 1.39 10-9
* Еп — этилсндиамин NH2-CH2-CH,-NH2
БИБЛИОГРАФИЧЕСКИМ СПИСОК
1. Коровин Н.В. Общая химия. М : Издательский центр «Академия», 2011. —
496 с.
2. Коровин Н.В Лабораторные работы по химии / Н В. Коровин, Э. И. Мин-
гулина, Н. Г Рыжова. М : Высшая школа, 2007. — 2S6 с.
3. Задачи и упражнения по общей химии: учеб. пособие / под ред. Н. В. Ко-
ровина. М : Высшая шкода, 2008. — 2S5 с.
ТЕМАТИЧЕСКАЯ ПОДБОРКА
ИЗДАТЕЛЬСТВА «КНОРУС»
1. Глинке Н.Л. Задачи и упражнения по общей химии : учеб, пособие. М. •
КНОРУС, 2014.
2. Глинка Н.Л Общая химия : учеб, пособие. М.: КНОРУС, 2014.
3. Дмитриев Е.В. Основы общей и биоорганической химии : учеб, пособие.
М.: КНОРУС, 2015.
4. Никанорова И.Е. Химия : учебник. М-: КНОРУС, 2014.